
添付ファイル10.1の実行バージョン本文ファイルで括弧で表記されているいくつかの情報は省略されている。これらの情報(I)は実質的ではないので、(Ii)は会社によってプライベートまたは機密とみなされる。1改訂と再記述許可協定本改訂と再記述許可協定(“協定”)は2023年12月11日(“改訂発効日”)に締結され、Arrohead PharmPharmticals,Inc.はGlaxoSmithKline知的財産権(第3号)有限会社と締結され、Arrohead PharmPharmticals,Inc.はデラウェア州会社であり、営業場所はアメリカカリフォルニア州パサディナ東コロラド大通り177号、郵便番号:91105である。矢印とグラクソ·スミスクラインは、本稿では単独で“当事者”と呼ばれ、総称して“当事者”と呼ばれることがある。矢印がオリゴヌクレオチドとオリゴヌクレオチド構造に関連するいくつかの情報、材料と知的財産権を持っていることから、臨床開発においてARO-HBVと呼ばれる許可構造を含み、この構造はB型肝炎ウイルスの発現を抑制することができる;グラクソ·スミスクラインは直接、そのいくつかの付属会社を通じて薬物と生物製品の開発と商業化の面で広範な経験と専門知識を持ち、そしてこの領域の薬物と生物製品の開発と商業化に役立つ情報、材料と知的財産権を持っているか、あるいは他の方法で制御する。矢印とヤンソン製薬会社(“ヤンソン”)は、2018年10月3日(“元の実行日”)である特定ライセンス契約を締結し、(A)矢印とヤンソンとの間で2018年12月18日に達成されたライセンス契約の特定改正案1に基づいて改正された。(B)矢印とヤンソンとの間で2019年2月4日に署名されたライセンス協定のいくつかの修正案(総称して元の合意と呼ぶ)によると、矢印は、他の事項を除いて、矢印知的財産権の項で説明されているライセンス建築およびライセンス製品を開発および商業化するためにヤンソンに独占ライセンスを付与する。グラクソ·スミスクラインとヤンソンが2023年10月30日のこの特定資産購入プロトコル(“APA”)を締結したことを考慮して、この合意によると、他の事項を除いて、成約時(定義は“APA”参照)、Janssenは矢印の同意を経て、元のプロトコル、元のプロトコルの下、および元のプロトコルのすべての権利、所有権および権益、ならびにいくつかの他の購入された資産(“APA”参照)をGSKに譲渡した。元の合意の17.6条に基づいて,双方は現在,本合意の条項と条件に基づいて,元の合意を修正して本合意に再記入し,改訂後の発効日から発効することを希望している。したがって、現在、以下の相互約束とチノ、および他の良好かつ価値のある対価格を考慮して、ここでは、それが受信され、十分であることを確認する--双方は以下のように同意する

2第1条:定義は、文意に加えて、本プロトコルの最初の大文字の用語は、以下に説明する意味または本プロトコルの全行程に示されている場所で指定された意味を有するべきである。1.1“参入地域”とは、表1.1に列挙された国を指す。1.2“会計基準”は、関連する時間において関連会社の組織全体にわたって一般的かつ一貫して適用される法律を遵守するGAAPまたはIFRSを意味する(場合に応じて)。1.3“買収業務”は、12.3節に規定する意味を有する。1.4“取得された通常の矢印特許権”は、10.2.3節に規定する意味を有する。1.5“取得した特定の矢印特許権”の意味は10.2.3節で述べたとおりである.1.6“取得側”を総称して“制御権変更”定義で指す第三者とその関連先と呼ぶが,“制御権変更”定義に適用される第三者とその関連先を除いて,その制御権変更が終了する直前に決定する.1.7“訴訟”とは、任意の政府当局が提起した任意のクレーム、訴訟、訴訟理由または訴訟(契約、侵害または他の態様を問わず)、訴訟(法的にも衡平法上も、民事でも刑事でも)、論争、評価、仲裁、調査、聴聞、告発、クレーム、要求、通知、または訴訟を意味する。1.8“活性成分”とは、医薬または生物学的製品において薬理活性を提供する臨床活性物質(コーティング、安定剤、賦形剤または溶媒、アジュバントまたは制御放出技術などの製剤成分を含まない)を意味する。1.9指定された締約国またはエンティティについて、“付属会社”とは、締約国またはエンティティによって制御されるか、または締約国またはエンティティと共同で制御される任意のエンティティを意味する。本定義だけで言えば、“制御”とは、(A)エンティティが会社のエンティティである場合、そのエンティティの取締役を選挙する権利がある株式または株式の50%以上を直接または間接的に所有し、(B)エンティティが会社の実体でない場合、議決権を有する証券によって、契約を通過するか、または他の方法を通過するか、またはそのようなエンティティの管理または政策を指導する権利を直接または間接的に指導または指導する権限を有することを意味する。明確にするために、1つのエンティティは、1つの締約国または別のエンティティのアクセサリ機関であってもよく、締約国または別のエンティティのアクセサリ機関となってもよく、任意の期間内に、エンティティは、もはや締約国または他のエンティティのアクセサリ機関ではなくてもよい。双方は、本合意の場合、Visirna Treateutics,Inc.は矢印の付属会社であってはならないことを認めている。1.10“プロトコル”は、上記の前文に示された意味を有する

3 1.11“プロトコル知的財産権”は、プロトコルノウハウおよびプロトコル特許権と総称される。1.12“プロトコルノウハウ”とは、一方の当事者(またはその任意の関連側、許可者、再許可者または下請け業者)の1(1)名または複数の人員(またはその任意の関連側、許可者、再許可者または下請け者)が、本プロトコル項目の下の活動を履行する際に、最初に発見、開発、生成、発明、派生、創造、創造、発想、または実践された任意およびすべての独自技術を意味する。明確にするために,本定義の目的のみであり,“当事者”がGSKであれば,GSKの利益の前身としてJanssenを含むべきである.1.13“合意特許権”とは、(A)優先日が元の発効日の後であり、(B)任意の合意ノウハウを要求または開示する任意およびすべての特許権を意味する。1.14“連合マネージャ”の意味は3.13節を参照。1.15“改訂発効日”は、上記の前文に示された意味を有する。1.16“反腐敗法”とは、米国の“反腐敗法”と関連法規、及びその他の司法管轄区域に適用される法律下の同等の反賄賂法律及び法規をいう。1.17“行政手続き法”という言葉の意味は上記と同様である.1.18“適用法律”とは、GCP、GLPおよびGMPを含む任意の国、超国、地域、州および地方の法律、条約、法規、規則、条例、行政法規、指導意見、条例、判決、法令、命令、禁止、命令、許可、ならびに任意の裁判所、仲裁人、監督当局または政府当局のこの事項に関連する司法管轄権の適用条項を意味する。1.19“抗レトロウイルス-B型肝炎ウイルス”は、1.123(A)節に規定された意味を有する。1.20“矢印”という語の意味は、上記の序文の意味と同じである。1.21“矢印プロトコル知的財産権”は、総称して“矢印プロトコル特許権”および“矢印プロトコルノウハウ”と呼ばれる。1.22“矢印プロトコルノウハウ”は、8.2.3(C)節で規定された意味を有する。1.23“矢印合意特許権”は、第8.2.3(D)節に規定する意味を有する。1.24“矢印除外ノウハウ”は、矢印またはその任意のアクセサリが、修正された発効日後に有効期間内に制御される任意およびすべての独自技術(矢印プロトコルとしての任意の新たに出現する独自技術を含む)と総称される

4独自技術)は、それぞれの場合、(A)CMCに関連して、許可された構造または許可された製品を製造するために使用されるが、製造許可の構造または許可された製品に必要ではない。または(B)(I)RNAi分子配列選択および化合物設計プロセスを具現化し、(Ii)矢印は、3.4節に従ってGSKに開示されていない(ただし、この条項(B)は、構築物またはライセンス製品の臨床開発、製造または商業化を許可するために必要ないかなる独自技術も含まない)、各場合((A)または(B))には、GSK 1(1)または複数の担当者(またはその付属会社、許可者、ライセンス者または下請け業者)(任意の共同プロトコル独自技術またはそのような任意の新しい独自技術を含む)単独または共同発明の任意の独自技術は含まれていない[***]独自技術)。1.25“矢印除外特許権”とは、任意の矢印除外ノウハウを主張または開示する任意の特許権を意味するが、それぞれの場合、(A)任意の矢印独自技術または(B)任意の共同プロトコル固有技術を主張または開示する任意の特許権は含まれない。1.26“矢印知的財産権”は、総称して(A)矢印特許権、(B)矢印ノウハウ、および(C)共同プロトコル知的財産権における矢印の権益と呼ばれる。1.27“矢印発明”は、8.1節に規定する意味を有する。1.28“矢印技術ノウハウ”は、任意の時間に矢印またはその任意の関連会社によって制御される、任意の許可建築を開発するための可能性のある製品((A)すべてのCMCノウハウ;および(B)すべての矢印プロトコル固有技術を含む)が、必要または合理的に有用な任意のノウハウであることを意味するが、いずれの場合も、(I)いかなる矢印も独自技術または(Ii)任意の共同プロトコル独自技術を含まない。1.29“矢印特許権”とは、(A)任意の矢印専用技術を要求または他の方法で開示することを含む、矢印またはその任意のアクセサリによって制御される任意の特許権を意味し、または(B)任意のライセンス構造可能な製品をカバーするか、または任意のライセンス構造が製品の開発を可能にするかもしれない((I)すべての一般矢印特許権、(Ii)すべての特定の矢印特許権、および(Iii)すべての矢印プロトコル特許権を含む)を含むが、いずれの場合も(A)または(B)任意の矢印は、特許権または(B)任意の共同プロトコル特許権を排除するものではない。オリジナルプロトコルの添付ファイルBとして、(1)元の実行日までのいくつかの矢印特許権リストは、ARO−B型肝炎ウイルスの開発、または(2)ARO−B型肝炎の開発を含む改訂発効日を含み、添付表1.29として本プロトコルの後に添付される。明確にするために、一般的な矢印特許権および特定の矢印特許権は、元のプロトコル添付ファイルB内の元の実行日(X)または改訂発効日(Y)(適用状況に応じて)に(X)として表示される。1.30“矢印プラットフォーム技術”は、矢印またはその任意の付属会社によって制御される標的RNAi分子技術を意味し、最初の実行日からまたは有効期間内に、標的リガンドを介したRNAi送達を利用して、矢印によってそのTRiMTMプラットフォームとして指定される

5.31“矢印サード·パーティ·プロトコル”は、節6.5.3(A)に規定されている意味を有する。1.32“被監査者”の意味は7.5.2節で述べたとおりである.1.33“審査現場”とは、一方またはその任意の関連会社、第三者が許可可能な者、または本協定の下の第三者請負業者または下請け業者(具体的な場合に応じて)が、任意の臨床試験または人の使用のための許可製品を生産する任意の場所または施設を意味し、その場所または施設は、規制機関または本契約項に規定する一方の検査または監査を受けている。1.34“監査側”の意味は7.5.2節である.1.35“破産者側”は13.3.1節で規定した意味を持つ.1.36“破産”締約国については、(A)締約国が管轄権を有する裁判所が破産または破産を宣言したこと、(B)任意の破産法または破産法(“破産法”を含む)に基づいて任意の管轄権のある裁判所に自発的または非自発的な保護請願書を提出し、提出後40(40)営業日以内にこのような請願書を解除または却下しなかったか、(C)締約国が債権者の利益のために実質的にすべての資産の譲渡を行ったか、(D)債務構成または債務延長に関する書面合意を提出したか、を意味する。(E)締約国の任意の解散または清算を提案または参加すること、または(F)一般的なプロセスで満了する義務を履行することができないことを書面で認める。1.37“破産法”とは、時々改正または置換可能な米国法第11章を意味する。1.38“破産発効日”は、13.3.2節に規定する意味を有する。1.39“違約者”は13.2.1節で規定した意味を持つ.1.40“営業日”とは、米国およびイギリスの土曜日、日曜日または公衆休暇以外の日、すなわち米国およびイギリスの銀行が正常に営業している日を指すが、12月24日から1月2日までグラクソ·スミスクラインの会社事務所が営業を停止している期間は含まれていない。1.41“カレンダー四半期”とは、任意のカレンダー年度の1月1日、4月1日、7月1日または10月1日からの3(3)ヶ月毎の期間を意味するが、条件は、(A)期限の最初のカレンダー四半期は、改訂された発効日からその後の最初の完全なカレンダー四半期まで延長されなければならないことであり、(B)期限の最後のカレンダー四半期は、本契約の満了または終了時に終了しなければならない。1.42“暦年”とは、同年1月1日から12月31日までの期間を意味するが、条件は、(A)本合意期間の最初の暦は、改訂された発効日から同年12月31日まで終了すること、(B)本合意期限の最後の日付は、本合意の終了または満了した例年1月1日から開始し、本合意の終了または終了の発効日に終了することである

6.43“CAPA”とは、書面による回復計画または是正および予防措置の提案を意味する。1.44“制御権変更”とは、一方については、(A)当該側が第三者と合併又は合併し、直前に償還されていない当該側の議決権を有する証券、又は当該等の議決権を有する証券が変換又は交換された任意の証券であり、当該合併又は合併の直後に、存続実体又は存続実体親会社の合併投票権の少なくとも50%(50%)を占めなくなることを意味する。当該当事者が発行した証券総投票権の50%(50%)以上の直接または間接実益所有者となるか、または(C)当該当事者およびその制御された関連会社の全部またはほぼすべての資産を第三者に売却または譲渡する。上記の規定にもかかわらず、適用側の業務に資金を提供するか、または当該一方の組織形態または管轄権を変更するために行われる任意の取引または一連の取引は、本プロトコルが指す“制御権変更”とみなされてはならない。1.45“臨床調査法”は、21 C.F.R.第50、54、56および312部分、および当時の“良好な臨床実践”のようなヒトの臨床調査に関連する適用法を意味し、各法律は有効であり、時々改正される。1.46“臨床試験”とは、任意の第1段階臨床試験、第2段階臨床試験、第3段階臨床試験、上場後研究、またはそのような複数の(1)段階を含む任意の第1段階臨床試験、第3段階臨床試験、上場後研究またはそのような複数の(1)段階を含む治療製品の安全性または有効性を測定するために、機関審査委員会または道徳委員会(誰に適用されるかによって決定される)によって承認されたヒト臨床試験を意味する。1.47“CMC”は、(A)製品の製造およびプロセス開発記録、および(B)製品の製造に必要または合理的に有用なすべての化学、製造および制御プログラムを含む製品に関連する化学、製造および制御を意味する。1.48“CMCノウハウ”とは、任意の試験方法開発および安定性試験、プロセス開発、プロセス検証、プロセス拡大、レシピ開発、配信システム開発、品質保証および品質管理開発、および他の関連活動によって生成されるデータ、プログラム、技術および情報を含むARO-HBVCMC、任意のライセンス構造または任意のライセンス製品に関連する矢印技術ノウハウを意味する。1.49“協調活動”とは、双方が本合意項の下で行う活動を意味する(直接行われるか、または本合意が許可された場合、その関連会社、第三者によって第三者または第三者請負業者または下請け業者が双方を代表して行われる)。1.50“組合せ製品”とは、(A)その有効成分として単一の医薬製剤、(I)1つ以上の許容構造、および(Ii)許可構造以外の1つまたは複数の活性成分を含み、(B)(I)少なくとも1つの許可構造を含む1つまたは複数の単一の医薬製剤からなる製品バンドル、および(Ii)1つまたは複数の他の治療有効または予防活性製品を意味する

7(A)、(B)または(C)の場合、それぞれの場合(A)、(B)または(C)は、それぞれの場合、(A)、(B)または(C)は、すべての剤形、製剤、説明書、製品ライン延および包装構成の形態で、各場合((A)、(B)または(C))は、21 C.F.R.§3.2(E)に従って“組合せ製品”として定義される許可製品またはその海外同等製品(ただし、デバイス、薬物送達担体、アジュバント、可溶化剤および賦形剤を含まない)で定義される。1.51“商業化”または“商業化”とは、任意の製品について、商業製造、製品の発売、任意のマーケティング後の研究、市場参入活動、価格制定および価格交渉活動、保健契約販売の管理、医療事務活動、およびこれらの活動を支援するための流通および輸入活動を含む、監督管理部門が製品の任意の薬品申請を承認する前および後に行われる、販売、普及、輸入または輸出のための任意のおよびすべての活動を意味する。1.52“商業的に合理的な努力”とは、任意の締約国が任意の目標のために行った努力について、その目標を達成するための合理的、勤勉、誠実な努力を意味し、同様の場合にある製薬またはバイオテクノロジー会社が、その合理的な商業裁量権を行使する際に、通常、このような努力を利用して類似の目標を達成することを意味する。建築が可能な製品を研究、開発、製造するか、またはそれを商業化することができるかもしれない任意の目標について、商業的に合理的な努力とは、すべての関連要因を考慮した後、類似した立場にある製薬またはバイオテクノロジー会社が、その所有または制御された製品に対して合理的な商業的考慮権を行使する際に一般的に使用される努力および資源、またはその締約国が同様の権利を有する、類似した製品の特徴を有する、類似した市場潜在力を有する、許可製品に類似した開発または生命段階にある努力および資源を意味する。1.53“競合製品”は、12.1節に規定する意味を有する。1.54“機密情報”の意味は9.1.1節で述べたとおりである.1.55“構築物”は、RNAiトリガーの少なくとも1つの鎖に連結された任意の標的リガンドを意味する。1.56任意の特許権、ノウハウ、規制承認、規制届出または材料については、一方またはその関連会社(所有権(単独または連合)によって直接または第三者から取得された許可または再許可、または第三者から所有権、許可または再許可を取得する関連会社によって間接的に所有(当該当事者またはその関連会社の場合、許可、再許可または本プロトコルに従って付与された(ただし譲渡ではない)の他の権利)によって他方に許可、再許可、アクセス権を付与する能力を意味する。または、(A)本プロトコルの下で第三者またはその関連者が、そのような許可、再許可、アクセス権、または他の権利の付与を要求されたときに、第三者と既存の任意の合意または他の手配の条項に違反することなく、またはそのような特許権、ノウハウ、規制承認、規制届出または材料下の他の権利を違反することなく、および(B)第三者に不受けを生じる

8双方が本プロトコルに従ってまたは他の方法で書面で合意された分配(第6.5.3節を含む)であり、プロトコルまたは他の配置が存在する場合、(I)矢印については、(A)元の発効日または(B)元の発効日の後、矢印が合意または他の構成に従って、このような特許権、独自技術、規制承認、規制届出または材料の権利を初めて取得した場合;または(Ii)グラクソ·スミスクラインの場合、(A)改正された発効日または(B)改正された発効日の後、(B)第2条の場合)グラクソ·スミスクラインは、この合意または他の構成に従って、そのような特許権、ノウハウ、規制承認、規制文書または材料の権利を初めて取得する。本協定にはいかなる逆の規定があるにもかかわらず、一方またはその関連側は、(1)買収側が所有または許可するこのような特許権、独自技術、規制届出または材料が当該買収側の従業員またはコンサルタントによって生成されることを制御しない限り、(1)買収側が所有または許可するこのような特許権、独自技術、規制届出または材料が、制御権の変更後に本プロトコルの下で許可された建築または任意の許可製品に関連する開発、製造または商業化活動を促進するために、(2)任意の特許権、ノウハウ、規制承認、許可を促進するものとみなされるであろう。制御権変更が完了する前に、被買収者またはその任意の関連会社が、本契約の下の許可建築または任意の許可製品に関連する開発、製造または商業化活動を実行する際に所有または許可された規制届出または材料、または(3)当該制御権変更が完了する前に、当該買収側またはそれらの任意の関連会社も、特許権、ノウハウ、規制承認を制御している。買収側が所有または許可する規制届出または材料は、それぞれの場合((1)~(3))であり、買収側が所有または許可する特許権、ノウハウ、規制承認、規制届出または材料は、買収者またはその付属会社によって制御されるとみなされる。1.57“カバー”とは、物質、化合物、構造または製品(任意の許可された構造または許可された製品を含む)の所与の化学成分、ならびにある特定の国または他の司法管轄区域の特許権の既定の主張について、特許権を所有していない場合、または特許権付与許可に基づいて、その物質、化合物、構造または製品を製造、販売、販売、または輸入または使用する化学成分が、その国またはその活動で発生する他の司法管轄区域における特許権の任意の主張を侵害することを意味する。1.58“CPR調停プログラム”は、14.2節に規定された意味を有する。1.59“CPRルール”は、14.3節で規定された意味を有する。1.60“治癒期”は、13.2.1節に規定された意味を有する

9.61“開発”とは、候補薬物または製品を研究し、規制承認を得た後に行われる任意の臨床前、臨床および他の活動を意味し、毒理学とADME試験、分析方法開発、安定性試験、過程開発と改善、過程検証、初回規制承認前の過程拡大、製剤開発、輸送システム開発、品質保証と品質制御開発、統計分析、承認前と承認後の臨床試験、監督事務、監督管理活動とこれらの活動を支持する製造活動を含む商業化のために使用される。明確にするために、“開発”の定義は、開発計画の下でのすべての活動を含むべきであるが、すべての商業化活動は含まれていない。“発展”、“発展”、“発展活動”は相互に関連する意味を持つ。1.62“開発計画”とは、添付表3.2として本文書の後に添付された許可された製品(S)の改訂発効日までの開発計画を記述することを意味する。1.63“マント”は、9.1.1節に規定された意味を有する。1.64“係争”とは、本プロトコルの任意の条項の解釈、適用、違反、終了、または有効性を含む、本プロトコルによって引き起こされる、または本プロトコルに関連する任意の論争、クレームまたは論争を意味する。1.65“薬品申請”は、ある特定の司法管轄区域の監督管理当局に提出された薬品または薬品の上場承認を指す秘密協定、MAAまたは同様の申請である。1.66“薬品管理法”とは、“連邦食品、薬品と化粧品法”、“アメリカ法典”第21編、第301条などの薬品と薬品を管理する適用法律を指す。“1987年処方薬営業法”、“制御物質法”を参照して、“米国法”第21編801節に掲載されている。シリアル番号、およびFDAによって発表された政策は、各政策が有効であり、時々修正される。1.67“欧州薬品管理局”とは、欧州薬品管理局またはEUの任意の後続機関を意味する。1.68“欧州連合”または“EU”とは、修正された発効日に構成され、修正された発効日の後に時々修正される可能性があるので、欧州経済地域の国を意味する。1.69“排他的条項”は12.1節で規定された意味を持つ.1.70“行政者”とは、(A)矢印に対して、行政総裁によって任意の特定の事項について権限を伝達することを意味し、(B)グラクソ·スミスクラインにとって、グラクソ·スミスクライン首席科学官またはグラクソ·スミスクライン首席科学官によって任意の特定の事項について転授する任意の権力を意味する。本章1.70で決定された執行幹事のいずれかが存在しなくなった場合は、会社再編、会社再編等により確定されたポストのキャンセル又は修正が生じた場合は、適用される実行幹事を別の上級管理者が置換しなければならない

10人の職責および経歴が、撤去または修正されたポストに相当する役人。1.71“既存の臨床データ”は、8.2.2節で規定された意味を有する。1.72“既存のセキュリティ協定”とは、(A)グラクソ·スミスクライン有限責任会社と矢印会社との間で2023年6月21日に署名されたいくつかの秘密開示協定、および(B)グラクソ·スミスクライン、ヤンソンおよび矢印の間で2023年7月19日に署名された秘密開示協定のいくつかの共同協定を意味する。1.73“既存の発明”は、8.2.2節に規定された意味を有する。1.74“既存の共同協定特許権”とは、(A)改正発効日よりも優先日が早い任意の合意特許権、および(B)(I)矢印(またはその任意の付属会社)および(Ii)グラクソ(Janssenとして譲渡が許可された)共同発明を要求または他の方法で公開する任意の既存発明(登録された出発材料のみに関連するか否かにかかわらず)を意味する[***])は、別表1.74に記載されている特許権を含む。1.75“利用”とは、研究、開発、商業化、登録、製造、製造、保有または保存(処分の有無にかかわらず)、使用、輸出、輸送、流通、または他人による配布、普及、販売、販売、または他の方法での処分または要約販売、およびエンドユーザ使用権の譲渡または付与を含む、製造、製造、輸入、使用、販売、または要約販売を意味する。“搾取”と“搾取”にはそれぞれ関連の意味がある。1.76“反海外腐敗法”系は米国“反海外腐敗法”(“米国法典”第15編78 dd-1節など)を指す。番号)は、関連時間に改訂することができる。1.77“FDA”は、米国食品医薬品局または米国におけるその任意の後続機関を意味する。1.78“領域”は、ヒトまたは動物に対するすべての治療、予防および診断用途を意味する。1.79“初商業販売”とは、ある特定の国のある特定の許可製品について、ライセンス製品と国別に行われる初の商業販売、すなわち、その国で許可製品の適用規制許可を受けた後、売り手またはその代表がその国で第三者購入者に行う貨幣価値による第1回商業販売をいう。しかしながら、最初の商業販売は、(A)GSKまたは任意の他の販売者またはそれらのそれぞれの任意の第三者下請け業者(例えば、契約製造業者、サプライヤーまたは流通業者など、そのような譲渡が卸売業者または小売業者に譲渡されていない場合)間または間の任意の譲渡、または(B)患者支援、慈善または販売促進目的のために、臨床試験または任意の他の合理的に必要な試験または研究のための任意の適用可能な法律または規制当局の要求を遵守するための許可製品(A)を含むべきではない。また,定義1.184節で規定されている特許権使用料条項のみであれば,譲渡する

11上記(A)又は(B)項に掲げる譲渡は、考慮されていない場合にのみ、譲渡を行う場合には、本契約項の下での初商業販売の定義から除外されなければならない。1.80“フルタイム”とは、適格従業員または代理人が適用活動に従事する1年間に相当するフルタイム(1,800(1,800)労働時間に相当)を意味する。明確にするために、個人の毎年の労働時間は、1,800(1,800)時間(または12(12)ヶ月未満の時間で同等の割合で計算される)を超えてはならず、この人がその間にどの程度の追加の作業時間に貢献したかにかかわらず、本契約項の任意の精算可能なFTEコストを計上してはならない。個人が毎年貢献する労働時間は1,800(1,800)時間未満であり、比例的には全時間労働の一部とみなされるべきである。1.81“全時間当量費用”とは、全時間当量費用に財政適用中にかかる全時間当量費用数を乗じることを意味する。FTEコストは、本プロトコルの適用活動を実際に実行するのにかかる時間(比例FTE計算)に基づいて決定され、本プロトコルが別途明示的に規定されていない限り、当事者が事前に書面で同意しておく必要がある。1.82“FTE料率”とは、修正発効日から双方に別の約束の時間があるまでの期間である[***]毎年、2025年1月1日からの年間増加を条件に、米国都市の平均消費価格指数のパーセント増加を反映しており、この割合は労働統計局が前の暦年に隣接して計算され、その後の暦年で同様の方法で年々増加している。1.83“G 5国”とは、フランス、ドイツ、イタリア、スペイン、連合王国を指す。1.84“公認会計原則”とは、一致した基礎の上で適用されるアメリカ公認会計原則を指す。1.85“一般矢印特許権”の意味は8.3.3(B)節で述べたとおりである.1.86“汎用競合”の意味は,6.4.5(C)節で述べたとおりである.1.87“汎用バージョン”は、特定の国の特定のライセンス製品について、GSKの再許可者ではなく、GSKまたはその任意の対応する販売者を含む流通チェーンで製品を購入していない第三者によって商業化された製品を意味し、適用された規制機関によって、適用された規制機関によって、適用規制機関によって決定された許可製品の事前承認(または以前の承認を支援するために提出されたセキュリティまたは効果データに基づいて)によって承認されている。米国連邦食品、医薬品及び化粧品法(USC 21第355条)第505条(J)条に基づいて米国で販売を許可されている任意の製品を含む。(B)議会第10、10 aまたは10 b条の規定および改正された理事会第2001/83/EC号命令(議会第6.1条および理事会第726/2004号に従って提出された出願を含み、その内容は、任意のこのような規定に依存する)、または(C)任意の外国等価物またはその継承者

12.88“良好な臨床実践”或いは“GCP”は薬品と生物製品の臨床試験の現行標準、例えば無形文化遺産ガイドライン及び公布された適用法規に掲載され、そして時々改訂され、そしてEUとその他の政府当局が許可製品の販売を許可する国で要求される良好な臨床実践標準を指し、これらの標準がアメリカの良好な臨床実践標準より厳しくない限り。1.89“良好な実験室規範”または“GLP”は、FDAの“良好な実験室規範”または時々改訂された経済協力開発組織の“良好な実験室規範”に列挙された薬物および生物製品の実験室活動の現行標準、ならびにEUおよび許可製品の販売を計画している国の他の政府当局によって要求される良好な実験室規範の基準を意味するが、これらの標準の厳格さは米国の良好な実験室規範を下回ってはならない。1.90“良好な製造規範”又は“GMP”とは、現行の品質保証基準を意味し、21 C.F.R.第210及び211節、欧州指令2003/94/EC、Eudralex第4巻及び他の司法管轄区域に適用される米国、EU、カナダ及び無形文化遺産ガイドライン又は同等の法律で定義されたその期待用途に適した品質基準を確保し、薬品及び生物製品を厳密に一致して生産及び制御することを意味する。1.91“政府医療保健計画”とは、米国連邦医療保険計画(“社会保障法”第18章)、米国医療補助計画(“社会保障法”第19章)、TRICARE計画、米国連邦従業員健康福祉計画、その他の外国、連邦、州と地方政府の医療計画と計画を指す。1.92“政府命令”とは、任意の政府当局または任意の政府当局によって締結された任意の命令、令状、判決、強制令、法令、規定、裁定、裁定または裁決を意味する。1.93“政府当局”とは、米国連邦、州または地方政府または米国政府以外の任意の政府、またはその政治的分岐、または政府の代わりに許可された任意の国際組織または当局、または任意の行政、行政、司法、立法、警察、規制、定価または課税権力または権力を行使する権利を有する任意の機関、機関または委員会、任意の裁判所または仲裁庭(またはその任意の部門、局または支部)、または任意の政府仲裁人または政府が許可する仲裁機関を意味する。1.94“GSK”は、前文で説明された意味を有する。1.95“GSKプロトコル知的財産権”は、GSKプロトコルノウハウおよびGSKプロトコル特許権と総称される。1.96“グラクソ·スミスクライン·プロトコル·ノウハウ”は、8.2.4(A)節に規定された意味を有する。1.97“GSKプロトコルLC/LP知的財産権”は、GSKプロトコルLC/LPノウハウおよびGSKプロトコルLC/LP特許権と総称される

13.98“GSKプロトコルLC/LPノウハウ”は、GSK(またはその任意の関連会社)が以下の期間内に制御される任意のGSKプロトコル独自技術を意味する:(A)GSK(またはその任意の関連会社)は、任意の許可建築可能製品の開発、製造、または商業化のために実際に使用される。(B)および(B)は、そのような許可構造物を開発するために必要かもしれないが、それぞれの場合、(A)および(B)は、(I)組合せ製品としての任意の許可製品、許可構造物(またはその開発、製造または商業化)または(B)非許可製品の任意の化合物、構造物または製品(またはその開発、製造または商業化)に関連する任意のノウハウ、および(Ii)任意のGSK排除のノウハウを含まない。1.99“GSKプロトコルLC/LP特許権”は、以下の期間内にGSK(またはその任意の関連会社)によって制御される任意のGSKプロトコル特許権を意味する:(A)任意のGSKが独自技術に復帰することを必要とする。または(B)任意の許可構造物は、(またはその開発、製造または商業化)可能であるかもしれないが、各場合((A)または(B))は、(I)組合せ製品の許可製品、非許可構造物(またはその開発、製造または商業化)に属する組合せ製品の任意の有効成分、または(B)非許可製品(またはその開発、製造または商業化)を任意の同時要求または他の方法で開示する任意の化合物、構造物または製品、および(Ii)任意のGSK排除特許権を含まない。1.100“グラクソ·スミスクライン協定特許権”を総称して(A)第8.2.4(B)節に規定するすべての合意特許権、及び(B)ヤンソン許可特許権と呼ぶ。1.101“グラクソ·スミスクラインには独自技術が含まれていない”[***]それは.1.102“グラクソ·スミスクライン排除特許権”系[***]それは.1.103“GSKコピー知的財産権”を総称してGSKコピーノウハウおよびGSKコピー特許権と呼ぶ。1.104“GSK逆転独自技術”とは、矢印が13.2.2条に従って本プロトコルを終了するか、または13.5条に従って本プロトコルを終了する日に、GSK(またはその任意の関連会社)によって制御される任意のGSKプロトコルノウハウまたは共同プロトコルノウハウを意味し、両方の場合、(A)GSK(またはその任意の関連会社)が製品の開発、製造、または商業化において実際に使用されるGSKプロトコル独自技術または共同プロトコルノウハウを停止することを意味する。および(B)終了製品の開発に必要であるが、それぞれの場合(A)および(B)には、(I)および(A)を組み合わせた製品としての任意の終了製品、許可構造物(またはその開発、製造または商業化)以外の任意の有効成分または(B)非終了製品(またはその開発、製造または商業化)の任意の化合物、構造物または製品に関連する任意のノウハウ、および(Ii)任意のGSK排除の独自技術は含まれていない。1.105“GSK返還特許権”とは、発効日からGSK(またはその任意の関連会社)によって制御される任意のGSKプロトコル特許権または共同協定特許権を意味する

14矢印13.2.2条またはグラクソ·スミスクラインに従って第13.5条に従って本協定を終了する日:(A)グラクソ·スミスクラインの独自技術への回帰があると主張する。または(B)は、任意の終了製品(またはその開発、製造または商業化)をカバーするが、各場合((A)または(B))は、(A)組合せ製品に属する任意の終了製品、その組合せ製品中の非許可構造物(またはその開発、製造または商業化)に属する任意の有効成分、または(B)非終了製品(またはその開発、製造または商業化)を要求または開示する任意の化合物、構造物または製品、および(Ii)任意のGSK排除の特許権を含まない。1.106“B型肝炎”という言葉の意味は、上記と同じである。1.107“丁型肝炎ウイルス”とは、丁型肝炎ウイルスを意味する。1.108“医療保健法”とは、米国連邦医療保険および医療補助計画(医療補助リベート計画を含む)に関する連邦および州適用法、連邦従業員健康福祉計画およびTRICARE計画に関連する連邦適用法、および連邦従業員健康福祉計画およびTRICARE計画に関する連邦および州適用法を含む政府医療計画、個人医療計画、患者健康情報および人体生体材料のプライバシーおよび秘密に関する適用法である。医療詐欺及び乱用、リベート、医師自己推薦及び虚偽クレームに適用される連邦及び州適用法(米国連邦法典“第42編1320 a−7 a節、第42米国法典第1320 a−7 b節、第42米国法典第1395 nn節及び連邦”民事虚偽精算法“第31編3729節を含む)。(以下参照);1996年の“健康保険携帯性および責任法”、および45 C.F.R.第46部分、および領土内の同様の適用法は、各法律が有効であり、時々改正される。1.109“ヒト生体試料”は、器官の任意の部分、任意の組織、皮膚、骨、筋肉、結合組織、血液、脳脊髄液、細胞、デオキシリボ核酸などのサブ細胞構造、または幹細胞または細胞系のような任意の生体材料の任意の誘導体材料、ならびに髪、爪の破片、歯、尿、糞便、母乳および汗を含むがこれらに限定されない任意のヒト生体材料を意味する。1.110“無形文化遺産”は統一人用薬品登録技術要求国際会議を指す。1.111“国際財務報告基準”とは、一致に基づいて採用された国際財務報告基準を指す。1.112“ライセンス内の矢印特許権”は、10.2.3節で与えられた意味を有する。1.113“IND”は、米国食品医薬品局に提出された研究用新薬出願、または臨床試験申請または臨床試験免除、または任意の関連する規制提出、許可または許可のような臨床試験開始を要求する同様の申請を米国以外の規制機関に提出することを指す。1.114“保障された者”は、11.1節に規定される意味を有する

15.115“保障された者”は、一方の場合、その当事者およびその関連会社、ならびにその任意のまたはそれらのそれぞれの上級者、取締役、従業員、または代理人を意味する。1.116“慰謝者側”は、11.1節に規定する意味を有する。1.117“ヤンソン”という言葉の意味は,上記のセッションにおける意味と同じである.1.118“ヤンソン許可特許権”は、総称して(A)付表1.118に列挙された特許権と呼ばれ、(B)ヤンソンが“特許協定”またはその付属プロトコルに従ってGSKに付与された非排他的許可に従って、有効期間内にGSK(またはその関連会社)によって制御される任意および他のすべての特許権と呼ばれる。1.119“共同プロトコル知的財産権”は、総称して共同プロトコルノウハウおよび共同プロトコル特許権と呼ばれる。1.120“共同プロトコルノウハウ”は、8.2.5(A)節に規定されている意味を有する。1.121“共通合意特許権”は、第8.2.5(B)節に規定する意味を有する。1.122“技術的ノウハウ”とは、一般に一般的に知られていない任意およびすべてのノウハウ、科学および他のノウハウ(特許出願の有無にかかわらず)、データ、結果および他の情報、ならびに発見、発明、商業秘密、研究開発データ、データベース、計画、実践、プログラム、実験技術、規程、材料規範およびアッセイまたは試験手順を含む任意の有形または無形の材料を意味し、生物、化学、薬理、毒性、製薬、臨床前、臨床、安全および品質管理データおよび情報。方法およびプロセス(製造方法および処方を含む);および分子、化学実体、試薬、出発材料、反応中間体、Bricks、合成製品、送達システム、賦形剤、成分、配合、配合および物質の組成;症例報告表、医療記録、データ分析、報告、研究およびプログラム、試験および試験の設計、試験および試験の結果(任意の開発活動の結果を含む)、道徳委員会または監督機関に提出された要約および情報、ならびに道徳委員会または監督当局に提出された情報。物品が公衆に知られている事実は、物品を含むアセンブリまたはその物品に関連する開発を公衆が知らない可能性を排除するとみなされてはならない。明確にするために、“ノウハウ”は、そのようなノウハウを保護する任意の権利(特許権を除くが、著作権、データベース、または設計権を含む)を含む。1.123“許可建造”系は、(A)付表1.123(A)(“aro-B型肝炎”)に列挙されている“aro-B型肝炎”と呼ばれる物質の化学成分を指す[***](C)任意の塩、水和物、溶媒酸塩、エステル、代謝産物、中間体(登録原料を含む)[***])、立体異性体、結晶形態、錯体、共結晶、誘導体、および上記(A)または(B)のいずれかの組成物の配合物。1.124“ライセンス製品”とは、任意の改善を含む任意の剤形および剤形、剤形または投与方法の任意およびすべての製品を意味する

16許可構造物を有効成分として、唯一の有効成分としても、許可構造物以外の1種以上の活性成分としての組合せ製品であっても。1.125“損失”とは、第三者(またはxi条項に規定される他の賠償者)が訴訟請求によって生じる損害、損失、責任、費用(調査および弁護費用を含む)、罰金、罰金または費用(合理的な弁護士、専門家費用、および支出を含む)を意味する。1.126“MAA”とは、(A)集中EMA届出手続に従ってEMAに提出されたマーケティング許可出願、または(Ii)集中EMA届出手続を使用せずに、EUの任意の国の監督管理当局に提出されたマーケティング許可申請、または(B)任意の他の同等または関連する規制が提出され、いずれの場合も、EUのどの国で医薬品または生物製品を販売するかの承認を得るためのものであり、いずれの場合も、疑問を回避するための修正および補充出願を含む。1.127“製造”とは、製品を製造するための原料および中間体の製造および製造、充填、整理、包装、ラベル付け、品質保証試験および排出の実行、および製品の輸送および貯蔵を含む、製品をエンドユーザの最終形態に製造するための活動を意味する。1.128“厚生労働省”系とは、日本の厚生労働省とその任意の後続機関を指す。1.129“秘密保持協定”とは、米国の規制部門の新薬の承認を得るために、(生物学的疑問を免除するための)改訂および補充出願を含む特定の適応を得るために、米国食品·薬物管理局に提出された新薬申請または生物製品許可証申請を意味する。1.130“純売上”とは、ライセンス製品について、公正な取引において第三者(いずれの売り手間の取引に関連する販売、卸売業者および流通業者の販売を含まないが、いずれの売り手と流通業者の販売を除く)に請求書を発行するか、またはその関連会社または再許可者(それぞれ“売り手”)が公平な取引において第三者(ただし、いかなる売り手間の取引に関連する販売、卸売業者および流通業者の販売を除く)に請求書を発行するかの販売総額から、当該売り手が一貫して適用される適用会計基準に基づいて決定されたこのような総額の次の控除を差し引くことを意味する。特定および唯一第三者に割り当てられた許可製品を販売し、販売に関連する販売総価格における善意の推定に基づいて、実際に取得、支払い、累算、許可、含まれるまたは分配の範囲内(以下に述べるように一致して適用される)(A)通常および慣行貿易、現金または数量割引、手当、卸売業者および薬局費用、および許可または支払いの信用であって、その形態は、許可製品の販売に対して実際に許容または実際に支払う控除(請求書金額に反映されていない範囲)であり、商業化手数料を含まない

17(B)払戻できない販売税、付加価値税および間接税、およびそのような特許製品の販売に直接関連する他の税種は、請求書総額に含まれ、(C)価格に含まれ、請求書価格に個別に記載された出国運賃、輸送および保険料、(D)任意の国または地方健康保険計画または同様の計画のために、適用法に従って政府当局(またはその代理人)に支払われるそのような特許製品の販売強制支払いおよび現金リベートは、法律適用によって政府当局によって徴収される費用を含む。(E)リコールまたは破損した貨物および請求書エラーを含む、このような特許製品が拒否または返品されたときに実際に与えられるトレーサビリティのある値下げ、相殺または手当、(F)管理されている保健機関、薬局福祉マネージャー(またはその等価物)、連邦、州/省、地方または他の政府当局またはその機関または調達者、販売者または貿易顧客のリベート、返金および割引(またはその等価物);(G)共通支払カードに関連するクーポンまたは割引/リベート;および(H)売り手は、その一致して適用される会計基準に基づいて、その財務諸表に報告された実際に請求書販売総額から差し引かれた任意の他の項目。いずれの場合も、純売上高を算出する際には、以上で決定したいずれの特定の金額も1回以上控除されることはない(すなわち、控除を“重複計算”しない)。任意の販売者が許可製品を販売または処分する際に現金以外の対価格を受信した場合、純売上高は、許可製品が前の特許使用料中に徴収された平均価格(例えば、適用される)から計算されるか、またはそのような販売がない場合には、許可製品に対する売り手の公平な市場価値の合理的な決定に基づく。上記1.130(A)節から1.130(H)節までに許可された控除額は、許可製品に公平に割り当てられ、許可製品と売り手の他の製品またはサービスとの間で不適切な割り当ては行われない。販売者は、販売者に支払われるべき任意の許可された製品の賠償を第三者から本合意の下で矢印に印税を支払う必要がない別の製品またはサービスに移転することによって、本合意の下で矢印に支払うべき正当な賠償を低減しようとしてはならない。純売上高の定義:本契約項の下の任意の許可製品が組合せ製品の形態で販売され、許可製品と組合せ製品に含まれる任意の他の有効成分(S)とが別々に販売されている場合、任意の時期における組合せ製品の純売上は、乗じることによって決定されるべきである

18この期間における組合せ製品の純売上(定義本節1.130参照)にスコアA/(A+B)が乗算され、ここで、Aは、許可製品がその間に完成品で個別に販売されたときの特定の国での加重平均販売総価格であり、Bは、その期間中の他の有効成分(S)の同国における加重平均販売総価格であり、この期間における他の有効成分(S)の加重平均販売総価格で完成品の形態で個別に販売される。ある期間における許可製品の加重平均販売毛価格を決定することができるが、他の有効成分(S)の加重平均販売毛価格を決定することができない場合、許可製品のその間の純売上には、その間の組合せ製品の純売上にA/Cを乗じなければならず、Aは、その期間に許可製品が単独で完成品で販売されたときの加重平均販売総価格であり、Cは、その期間における組合せ製品の加重平均販売総価格である。ある期間における他の有効成分(S)の加重平均株価を決定することができるが、その期間における許可製品の加重平均販売毛価格を決定することができない場合、許可製品の期間の純売上には、(1)B/Cを減少させることによって決定されるスコアを乗じなければならない。ここで、Bは、その期間に他の有効成分(S)が単独で完成品形態で販売されたときの加重平均販売毛価格であり、Cは、その期間における組合せ製品の加重平均販売毛価である。許可製品および組合せ製品中の他の有効成分(S)の加重平均販売毛価格が一定期間内に決定できない場合、その期間における許可製品の純売上高は、各成分が貢献する相対的価値に基づくべきである。グラクソ·スミスクライン(又は適用される他の販売者)は、当該ライセンス製品及び当該組み合わせ製品中の他の有効成分(S)の加重平均販売総価格について価値を提案しなければならない。グラクソ·スミスクラインが自身または適用される他の販売方向矢印社を代表してこの提案を提出してから20(20)営業日以内に、双方は会議を開催し、合理的かつ誠実な方法で議論し、この許可製品とその組み合わせ製品中の他の有効成分(S)との間の加重平均販売総価格について合意しなければならない(無理に差し押さえてはならない)。当該等の許可製品、当該等の他の有効成分(S)又は当該等の組合せ製品(誰が適用するかに依存する)のこの期間の加重平均販売毛価格は、例年毎に1回計算され、次の例年のすべての適用報告期間内に使用されるべきである。許可製品、任意の他の有効成分(S)または任意の組合せ製品の一定期間内の加重平均販売総価格を決定する際に、加重平均販売総価格の計算方法は、この許可製品、当該他の有効成分(S)または組み合わせ製品が前の例年12(12)ヶ月(または一部の例年の販売月数)内に販売された有効成分単位を売上高(ドルに換算)で割ることである。最初の例年には、この特許製品、この他の活性成分(S)または組み合わせ製品は、予測された加重平均販売総価格を採用する。加重平均毛数と実際の加重平均毛数との差を予測するために余分に支払うか少ないかのいずれか

19販売価格は、次のカレンダー年度の最初の支払いが適用されたときに支払うか、または貸方に記入します。GSKと任意の他の販売者との間で許可製品(任意のそのような販売者によってGSKまたは他の販売者に販売されることを含む)が販売され、エンティティによって第三者に転売され、本定義に関する販売とみなされるべきではないが、本定義の場合、エンティティは、許可製品を第三者(譲渡者を除くが、卸売業者および流通業者を含む)に転売するものとみなされるべきである。GSKまたはその任意の関連会社または再許可者が、許可製品であるエンドユーザの販売者から許可製品を購入する場合、純売上は、(I)許可製品が販売中に支払う実際の価格または(Ii)許可製品の販売時の公平な市場価値(双方が合理的かつ誠実に行動する)のうちのより高い者によって計算された販売価値を含むべきである。任意の許可製品の譲渡または処置:(A)患者援助計画に関連する、(B)慈善または販売促進目的のための、(C)臨床前、臨床、規制または政府目的のための、またはいわゆる“患者の命名”または他の限られたアクセス計画の下で、または(D)臨床試験を含む任意の適用法律、法規または規制当局の要求を遵守するために合理的に必要な任意の試験または研究のために使用され、いずれの場合も、(A)~(D)は、この“純売上”の目的で許可製品を販売するとみなされてはならない。1.131“新たに出現した技術的ノウハウ”とは、改訂発効日または後の任意の時間に、一方(またはその任意の関連側、許可者、再許可者または下請け業者)の1(1)名または複数の担当者(またはその代表)が、単独または他方(またはその任意の関連側、許可者、再許可者、再許可者または下請け業者)の1(1)名または複数の担当者(またはその任意の関連側、被許可者、再許可者または下請け業者)と、本プロトコルの下での活動を履行する際に、有効期間内に有効期間内に発見、開発、生成、発明、創造、発想、または独自に実践された任意およびすべての技術を意味する。新しい1.132インチ[***]IPは総称して新しいものと呼ぶ[***]独自技術と新技術[***]特許権です。新しい1.133インチ[***]ノウハウ“は,8.2.3(A)節で規定した意味を持つ.新しい1.134インチ[***]特許権“は,第8.2.3(B)節に規定する意味を持つ.1.135“非破産者側”は、13.3.1節に規定された意味を有する。1.136“非違約者”は、13.2.1節に規定する意味を持つ。1.137“クレーム通知”は、11.2.1節に規定する意味を有する。1.138“元のプロトコル”の意味は、上記と同じである。1.139“元の有効日”とは、2018年10月29日を意味します

20.140“予定されていた実行日”の意味は、上述したものと同じである。1.141“既製コスト”とは、第三者が本プロトコルの下での適用活動を直接サポートするために提供されるサービスまたは材料のために、任意の第三者に支払われる費用および支出を意味する。明確にするために、自己支払い費用には、支払い側またはその付属会社の内部賃金または福祉、施設、光熱費、一般オフィスまたは施設用品、保険または情報技術、資本支出などが含まれていない。1.142“所有する汎用矢印特許権”は、10.2.3節に規定する意味を有する。1.143“所有する特定矢印特許権”は、10.2.3節に規定する意味を有する。1.144“当事者”および“当事者”の意味は、前文で述べたとおりである。1.145“特許論争”とは、本契約の下の任意の特許権、独自技術または他の知的財産権の有効性、範囲、実行可能性、特許性、発明性または所有権に関連する問題に関連する限り、本契約項の任意の起訴活動に関連する任意のそのような問題を含む、双方間の任意の論争を意味する。1.146“特許料”とは、一方の当事者(例えば、指定された付属会社)またはその代表によって、適用特許権を起訴する際に合理的に発生するすべての実際の費用を意味する。1.147“特許庁”とは、米国特許商標局、欧州特許庁、または1つの国、地域または超国家管轄範囲内で特許出願の審査または他の特許権の付与を担当する他の政府機関を意味する。1.148“特許権”とは、指定された発明について、その発明を要求するすべての元(優先権確立)特許出願を意味し、一時的および非一時的出願、およびその後に提出されるすべての関連出願は、任意の継続、部分的継続、分割または代替出願、任意のそのような特許出願に基づいて発行または付与された任意の特許、および任意のそのような特許の任意の再発行、再審査、更新または延期(任意の補足保護証明書を含む)、および任意のそのような特許に基づく任意の確認特許または登録特許または増加した特許を意味する。任意の国または司法管轄区域におけるすべての外国対応者または前述の任意の等価者とを含む。1.149“特許期間延長”とは、米国1984年の“米国医薬品価格競争および特許期間回復法”、EU加盟国補充保護証明書、または任意の他の国または司法管轄区の任意の同様の法律または法規に従って付与された任意の発行された特許の有効期間の延長、またはそのような延長と同等の保護権を意味する。例えば、特許庁への出願又は特許庁の承認により任意の特許の期限を延長することにより得られた小児科延長は、特許期間延長とみなされる。1.150“特許ワーキンググループ”は、8.8節に規定された意味を有する

21.151“レジ”は、節7.3に規定する意味を有する。1.152“支払先”は、7.3節で規定された意味を持つ。1.153“人”とは、任意の自然人、会社、商号、商業信託、合弁企業、協会、組織、会社、共同企業または他の商業エンティティ、または任意の政府、機関、またはその政治的分岐を意味する。1.154“人員”とは、誰にとっても、その高級職員、取締役、従業員、労働者、請負業者、コンサルタント、コンサルタント、代理人、または他の代表を意味する。1.155“薬物警戒プロトコル”の意味は、3.6.4節で述べたとおりである。1.156“第1段階臨床試験”とは、米国連邦法規第21 C.F.R.第312.21(A)節に記載された許可製品の臨床試験を指す。1.157“第2段階臨床試験”は、米国連邦法規第21 C.F.R.第312.21(B)節に記載された許可製品の臨床試験を意味する。1.158“第3段階臨床試験”は、米国連邦法規第21 C.F.R.第312.21(C)節に記載されたライセンス製品の臨床試験を意味する。1.159“上場後研究”とは、許可製品の規制承認を受けた後に、許可製品に対して任意の臨床試験を行うことを意味し、これらの臨床試験は、許可製品に対するマーケティングまたは科学的知識を強化することを目的としており、規制当局が要求するものでもなく、規制部門が許可製品を許可するための新たな適応または製品ラベルの他の重大な変化を支援するためでもない。1.160“第三者から取得された予め存在する権利”とは、矢印会社と任意の第三者との間で達成され、最初に署名された日から有効な任意およびすべての合意を意味し、この合意に基づいて、第三者譲渡(“譲渡”という言葉を使用するか否かにかかわらず)矢印会社の任意の第三者特許権またはノウハウを意味し、これらの特許権またはノウハウの全部または一部は、任意の許可製品の開発、製造または商業化に必要または有用である。改訂された発効日までに,本来第三者から取得した権利は付表1.163第III部に記載されている。1.161“第三者からの予め存在する許可”とは、矢印会社と任意の第三者との間で締結された、最初の実行日から有効な任意およびすべての合意を意味し、この協定によれば、第3の方向または任意の第三者の特許権または独自技術の下で(“許可”という言葉が使用されるか否かにかかわらず明示的な条項の形態で付与される)任意の許可または再許可(または使用または他の利用)権利を意味し、これらの権利の全部または一部は、任意の許可製品の開発、製造または商業化に必要または有用である。改訂発効日から、第三者からの予め存在するライセンスは、別表1.163第I部分に記載されている。1.162“第三者の事前存在の許可”は、矢印と任意の第三者との間で達成された、最初の実行日から有効な任意およびすべてのプロトコルを意味する

22矢印またはその付属会社は、任意の矢印知的財産権またはその下の任意の許可または再許可(または使用または他の利用)に対する権利を第三者に付与する(“許可”という言葉を使用するか否かにかかわらず)権利を明示する。改訂発効日から、第三者に発行される予め存在するライセンスは、別表1.163第I部分に記載されている。1.163“先行する第三者プロトコル”とは、(A)第三者の以前に存在する許可、(B)第三者からの以前に存在する許可、(C)第三者から以前に取得された権利、および(D)ライセンス製品、ARO-B型肝炎ウイルスまたは任意の許可構造の開発、製造または商業化に関連する任意の条項を含む矢印またはその付属会社と第三者との間で有効な任意の他のプロトコルを意味する。(I)最初の契約日に限り、元の第三者プロトコルは、元のプロトコルの添付ファイルEに列挙され、または(Ii)修正された発効日には、以前に存在した第三者プロトコルは、別表1.163に列挙される。1.164個人保健計画とは、保険会社、健康維持組織、および他の管理保健組織、ブルークロスおよびブルーシールド計画、および自己損益を含む非政府第三者保健支払人および計画を意味する。1.165“製品侵害”は、第8.4.2(A)節に規定された意味を有する。1.166“製品商標権”とは、任意の許可製品に固有であり、本契約の次の当事者によって制御される任意の商標権を意味する。1.167“予防活性製品”は、ヒトまたは動物のB型肝炎ウイルスまたは丁型肝炎ウイルス感染に関連するか、またはそれによって引き起こされる任意の疾患、状態または症状を予防する製品を意味する。1.168“起訴”とは、指定特許権を参照して、任意の特許庁に届出するために、または任意の特許庁手続中または特許庁裁決の控訴において、任意の特許庁の任意の許可後手続き、補充審査、許可後再審、当事当事者間の審査、再審、再発行、妨害または反対手続を含む、任意の特許庁の任意の許可後手続、補充審査、許可後再審、当事当事者間の審査、再審、再発行、妨害または反対手続を含むために、申請書に特許権を準備することを意味する。疑問を生じないために、検察側は、特許権侵害訴訟又は他の特許権強制執行の法的行動、宣言的判決訴訟又は第三者が法廷で特許権の有効性又は実行可能性に挑戦する他の法的行動を含まない。“起訴”と“起訴”にはそれぞれ関連の意味がある。1.169“起訴側”とは、現在、第8.3節に規定する適用特許権を起訴する権利がある側をいう。1.170“起訴連絡先”とは、他方への通知(随時更新可能)において指定された一方が指定された特許代理人または代理人を意味し、双方の間で任意の矢印特許権を起訴することについてコミュニケーションを行う連絡先を意味する。1.171“受信側”は、9.1.1節で規定した意味を有する

23.172“登録開始品目([***])“とは矢印の特許のことです[***]ARO-B型肝炎ウイルスの生産に使われています1.173“規制承認”とは、国または管轄区域で薬品をマーケティングおよび販売するために必要な適用規制当局の承認(補充、改訂、承認前および承認後の承認を含む)、許可証、登録または許可を意味し、国または司法管轄区で薬品を発行するために必要な任意およびすべての価格および清算承認を含む(国または司法管轄区で発行されても法律上このような承認は必要ない)。説明のために、薬品申請を承認する以外に、フランスの監督管理承認は薬品申請を承認し、公式定期刊行物に精算価格レベルを公表し、聖霊経済委員会(または後続機関)またはその代表によって精算リストに登録することを含む;イタリアの監督管理承認は(Agenzia Italiana del Farmacoまたは後続機関)政府“官報”で公表されることを含む;ドイツの監督管理許可は疾病基金責任者協会(GKV-Spitzenverband、Gesetzlichen Krankenversicherungまたは後続機関)との契約を実行することを含む。スペインの規制承認(La Comisión Inter部間de Precios de los MedicamentosまたはLa Comisión Nacional Parel Uso Rational de Los Medicamentosまたは後続機関の許可を含む)は、全国の患者が政府当局またはその代表の清算を得ることを可能にし、連合王国の監督許可は国家健康と看護卓越研究所(または後続機関)が広範な市場参入を実現するために強制資金の許可を得ることを含む。1.174“規制機関”とは、米国のFDA、EUのEMA、および日本のMHLWのような、米国のFDA、EUのEMA、および日本のMHLWのような任意の連邦、国、州、省または地方の規制機関、部門、局、または医薬製品を登録または許可またはマーケティングおよび販売する権利を有する他の政府エンティティを意味する。1.175“規制排他的権利”とは、FDAによって付与された新しい分子実体、新しい用途または適応排他性、新しい処方排他性、特許とは無関係な小児科排他性または孤児薬物排他性のような、規制当局がグラクソ·スミスクライン以外の人(またはその任意の関連会社または分割許可者)によって提出された薬品出願を阻止または承認するために、司法管轄区域内の製品についてマーケティングまたはデータ排他性を提供することを意味する。またはEU指令2004/27/ECおよび2001/83/ECおよび条例726/2004/ECにおけるデータ独占条項に基づいて、または条例1901/2006に基づいて、または“食品および薬物法案”第505 A(A)条に基づいて付与された小児科研究市場独占販売権。1.176“規制届出”とは、INDS、臨床計画を支援する支援文書、薬物申請、安全および有害事象報告、および任意の規制当局との任意の許可製品に関するすべての通信を含む任意の監督当局に提出された任意の文書およびすべての支援データを含む任意の規制当局に提出された任意の記録または申請を含む任意の文書、または任意の監督管理当局に提出された任意の文書およびすべての支援データを含む任意の文書を意味する

24(任意の規制当局との任意の会議、電話会議、または議論の記録を含む)。1.177“関連要因”とは、安全、耐性、有効性または安定性の実際および潜在的な問題、予想および実際の製品プロファイル(製品形態、カテゴリおよび作用メカニズムを含む)、または他の製品およびプログラムの概要と比較すること、開発段階またはライフサイクル状態、実際および予想される開発、規制承認、製造および商業化コスト、スケジュールおよび予算;許可製品製造に関連する任意の問題;このような許可製品が規制される可能性;このような規制承認の時間;そのような許可製品および類似製品の規制承認の現在の指導および要求、および現在および予想される規制状況;そのような許可製品のラベルまたは予想ラベル;当時の現在の競争環境と市場参入が予想される場合に可能な競争環境;そのような許可製品または類似製品の過去の表現;現在と将来の市場潜在力、または関連するポートフォリオまたはチャネルを考慮した;現在および将来の関連患者集団;既存または予想される価格設定、販売、精算、投資リターンおよび収益力、関連国の価格決定または清算変化;特許地位、特許保護の強度および期限、予想される排他性および経営自由障害、法的問題、および他の関連する科学、技術、運営、商業または経済的要因。1.178“代表”の意味は9.1.1節を参照。1.179“参照権”は、21 C.F.R.(314.3(B)節)においてこの用語のために規定された意味、または米国以外の任意の他の司法管轄区域において、任意の適用法に従って規定される同等の閲覧権または参照権を有する。1.180“リボ核酸干渉トリガー”は、B型肝炎ウイルスゲノムとハイブリダイズし、B型肝炎ウイルスゲノム転写を妨害することによってサイレンシングを達成することを目的とする1本のリボ核酸または化学修飾リボ核酸からなるオリゴヌクレオチドを意味する。1.181“[***]“は1.182節で規定された意味を持つ.1.182“[***]“という意味です[***]. 1.183 “[***]“節で規定された意味を持つ。1.184“特許使用料条項”とは、ライセンス製品及び国/地域に基づいて、販売者又はその代表が当該特定のライセンス製品を当該国で初めて商業販売した日から(A)最後の有効クレームが満了した日を意味する[***]その中には[***](B)ライセンス製品を保護する国/地域における規制排他的権利の終了または満了;または(C)[***]この許可製品が同国で初めて商業販売された日から数年

25 1.185“Sトリガ·ターゲット·シーケンス”シリーズ[***]それは.1.186“証券化取引”の意味は15.1.2節を参照。1.187“売り手”は、1.130節で規定された意味を持つ。1.188“特定矢印特許権”の意味は、8.3.3(A)節で述べたとおりである。1.189“従属許可者”とは、本プロトコルによって許可された場合、グラクソ·スミスクラインまたはその任意の関連会社が、第2.1.1節または第2.1.2節に従ってGSKの任意の権利または許可(および第三者の任意のさらなる再許可者(そのような権利を起訴しない階層、階層またはレベルにかかわらず)に従って任意の従属許可を付与または付与する任意の第三者を意味するが、適用される場合、“従属許可者”は、GSKまたはその付属会社またはGSKまたはその付属会社によって活動する流通業者および下請け業者を排除しなければならない。1.190“標的配列”は、B型肝炎ウイルスゲノムまたはB型肝炎ウイルスゲノム転写産物(S)の配列を意味し、リボ核酸干渉トリガーの誘導鎖は、それとハイブリダイズしようとしている。1.191“標的リガンド”は、RNAi治療薬の肝細胞への送達を標的とするのに適した化合物または一部を意味する。1.192“税”とは、連邦、州、現地または非米国収入、総収入、許可証、賃金総額、雇用、消費税、解散費、印紙税、職業、保険料、暴利、環境税、関税、株式、特許経営権、利益、源泉徴収、社会保障、失業、障害、不動産、個人財産、販売、使用、譲渡、登録、付加価値税および間接税、代替または追加の最低、推定またはその他の任意の種類の税を意味し、議論の有無にかかわらず、任意の利息、罰金または付加税を含む。1.193“用語”は、13.1節で規定される意味を有する。1.194“終了製品”とは、矢印が13.2.2条またはGSKに従って13.5条に従って本プロトコルを終了する場合、発効日を終了する前に、GSK(またはその任意の関連会社)またはGSK(またはその任意の関連会社)を代表して積極的に開発または商業化された任意の許可製品を意味するが、終了製品は、GSK(またはその任意の関連会社)またはGSK(またはその任意の関連会社)を表すGSK(またはその任意の関連会社)によってそのように開発または商業化されたライセンス製品の形態のみを意味する。1.195“領土”とは、そのすべての国とその属地と領土を含む世界全体を意味する。1.196“サード·パーティ”または“サード·パーティ”は、本プロトコルの当事者またはその任意の関連する当事者以外の任意の個人、エンティティ、または他の当事者を意味する。1.197“第三者行為”は、8.7.1節に規定された意味を持つ

26.198“第三者支払い”は、第6.4.5(D)節に規定される意味を有する。1.199“商標権”とは、すべての登録および未登録商標(そのすべての一般法の権利を含む)、サービスマーク、商号、ブランド名、標識、スローガン、スローガン、証明マーク、インターネットドメイン名、商業外観、会社名、商業名および他の原産地標識、ならびに上記の任意の内容に関連する商標、ならびに世界各地で行われるすべての出願、登録、延期および更新、ならびに国際条約および条約によって付与されたすべての権利を意味する。1.200“アメリカ”“アメリカ”または“アメリカ”アメリカ合衆国を指し、その領土と財産を含む。1.201“有効な特許請求”とは、管轄権を有していない裁判所または政府主管部門の裁決によって執行不可能または無効と判断されたか、または控訴が許可された時間内に上訴されず、再発行、免責または他の方法で無効を放棄または承認したか、または実行不可能である特許庁が発行または付与された任意の未満期特許権の権利要件を意味する。又は(B)誠実に起訴されている特許権は、控訴又は再提出出願の可能性がない場合には放棄されていないか、又は最終的に却下されておらず、未解決の時間よりも少ない[***]何年もです。1.202“付加価値税および間接税”とは、任意の関連する司法管轄区域に適用可能な任意の付加価値税、販売税、購入税、営業税または消費税を意味し、増値税共通制度の実施に関するEU理事会の第2006/112/EC号命令に従って徴収されるべき付加価値税を含むが、これらに限定されない。1.203“Xトリガ·ターゲット·シーケンス”シリーズの意味[***]それは.第二条:ライセンス付与2.1付与。2.1.1開発ライセンス。本協定の条項及び条件によれば、矢印によりグラクソ·スミスクラインに独占的に付与され(矢印であっても、矢印が本合意の下の権利を明示的に保持又は明示的に付与されない限り)グローバルライセンスは、第2.1.3節に従って矢印知的財産権項の下で再ライセンスを行い、地域内のこの分野のライセンス建築及びライセンス製品を研究及び開発し、そのための建築及びライセンス製品の製造及び製造、製造及び製造、使用、使用及び輸入を許可する権利がある。本2.1.1節により付与された許可権は,改訂後の発効日から開始し,本契約の全期間内に有効でなければならないが,第XIII条下の終了条項の制約を受けなければならない。2.1.2ビジネスライセンス。本協定の条項および条件によれば、矢印はグラクソ·スミスクラインに独占的権利を付与する(矢印の独占的権利であっても、矢印が明示的に保持されていない限り、または明確に権利が付与されていない

27本協定によれば、グローバルライセンスは、第2.1.3節によれば、矢印知的財産権の項の下で、商業化及び商業化、販売及び販売を提供し、当該領土の現場での使用のための販売及び販売許可製品を提供する権利があり、これらの目的のために製造、製造、使用、使用及び輸入、許可建築可能製品を輸入することができるかもしれない。本2.1.2節により付与された許可権は、改正された発効日から発効し、異なる製品及び国/地域に基づいて、本協定の全期間内に継続しなければならないが、第XIII条の下の終了条項を遵守しなければならない。2.1.3再許可。GSKが2.1節でGSKの許可権を付与された任意の再許可に従って任意の関連会社または任意の第三者に付与される場合、GSKは、本プロトコルの下での義務に引き続き責任を負い、関連する再被許可者の履行および再許可者が本協定の条項および条件を遵守することに責任を負う場合、矢印会社は、第1に二次被許可者を訴訟する必要がなく、GSKを直接訴訟する権利があるであろう。GSKは、本2.1節に従って任意の二次被許可者に付与された任意の再許可は、本プロトコルを参照しなければならず、本プロトコルの下でのGSKの義務と衝突してはならず、守秘、不開示および使用の義務、および本プロトコルに規定されているものと少なくとも同様に制限または保護された秘密情報および知的財産権(GSKプロトコルIP、矢印プロトコルIPおよび共同プロトコルIPを含む)に関する知的財産権を割り当てる義務を含む。GSKは、第三者に任意のライセンス製品を開発または商業化する排他的権利を付与することを含む任意のそのような従属ライセンス者について、そのような従属ライセンスを付与した後の合理的な時間内に、本プロトコルにおけるGSKおよび従属ライセンス者の義務を決定することとは無関係な任意の条項を省略するように編集され得る従属ライセンスプロトコルのコピーを矢印に提供する。2.2ライセンスは破産法に基づいて知的財産権を構成する。一方が本合意のいずれかの部分に基づいて他方のすべての権利及び許可を付与することは、本プロトコル第2.1節を含み、破産法第365(N)節(又は他の管轄区の類似法律規定)については、破産法第101(35 A)節(又は他の管轄区法律の類似規定)で定義された“知的財産権”の権利であり、そうでなければ“知的財産権”権利とみなされなければならない。各当事者は、それ自体及びその付属会社を代表して、“破産法”による知的財産権“実施”には、(A)ライセンス製品の研究及び開発データ、(B)ライセンス構造及びライセンス製品サンプル及び在庫、(C)ライセンス製品レシピ、(D)任意のライセンス構造が製品可能かもしれない研究に関する実験室ノート及び記録、(E)ライセンス製品及びそのライセンス製品の臨床試験結果、(F)ライセンス製品に関する規制届出及び規制承認、を含むことを認めている。(G)特許製品に関するマーケティング、広告、宣伝材料

28 2.3組合せ製品の権利。本プロトコルの下の任意の許可付与または約束には、任意の条項があるにもかかわらず、一方が本プロトコルに従って他方に譲渡または付与されてはならない:(A)任意の組合せ製品の有効成分は、開発中であっても商業化されていてもよく、有効成分が許可構築物でない場合、(B)複合製品の製品は許可製品ではない、または(C)臨床前研究、臨床試験、または承認された製品ラベルに従って許可製品と組み合わせて使用される有効成分(許可構築物を除く)。2.4他の権利はありません。本プロトコルに明示的に規定されている権利を除いて、一方は、本プロトコル項の下の他の権利を他方に付与することができず、黙示、反論禁止、または他の方法で任意の特許権、独自技術または他の知的財産権に関する追加の権利を付与するものと見なすこともできない。第三条:発展3.1選択権開発計画を完成させる。双方は、改正された発効日までに、(A)Janssenが元の合意第4.1節に基づいて矢印会社に通知を行い、2021年9月15日にオプションの行使を開始し、オプション開発期間(それぞれ定義は元の合意を参照)、(B)Janssenはその後、オプション開発計画項下の活動(元の合意で定義される)を終了し、オプション開発期間は元の合意第4.7条に従って2023年1月25日に終了することを確認し、同意する。(C)改正された発効日に、グラクソ·スミスクラインは、Arrohead(またはその任意の共同事業会社)に対して責任がない(I)元の合意第4.7条に従ってArroheadに支払われた任意の金、および(Ii)Arrohead(またはその任意の共同事業会社)またはその代表が、株式購入開発計画に従って任意の研究または他の開発活動を行うことによって生じる任意の費用または支出、または元の合意第IV条下の任意の他の活動の実行に関連する任意の費用または支出。3.2開発。本合意にさらに明確な規定があることに加えて、グラクソ·スミスクラインは、地域内の任意の許可建築に対して、GSK(またはその任意の関連者または許可者)が適切であると考える任意の非臨床研究または臨床試験を行って、地域内の許可製品のすべての開発活動に対して、GSK(またはその任意の関連者または許可者)が適切であると考える任意の非臨床研究または臨床試験を行うことを含む、グラクソ·スミスクライン(その1つまたは複数の関連者または再許可者、または上記のいずれかの選択された任意の第三者下請け業者によって直接またはその1つまたは複数の関連者または再許可者によって)を有することができるかもしれない製品のすべての開発活動に対して独占的な権利、唯一の責任、および一意の決定権を有するであろう。双方は、付表3.2が本協定改正発効日に添付されている“開発計画”が初歩的であることを認め、改訂発効日までの領土内の任意の特許製品の開発活動の高度な計画を提供し、矢印会社のみの参考に供する。双方はさらに確認し、同意した:(A)明確にするために、“開発計画”は、GSK(またはその任意の関連会社または分割ライセンシー)が、以下の任意の許可建築について製品が任意の開発活動を展開することができるかもしれない権利を制限または制限すべきではない

29 GSKは、3.2節の規定に基づいて、領土内の任意の許可建築が可能かもしれない製品の開発計画の実施または任意の他の開発活動についてすべての決定を下す権利がある。上述した規定にもかかわらず、グラクソ·スミスクラインは、開発計画の任意の更新または改訂を矢印会社に通知することができるが、第3.7条の規定によれば、グラクソ·スミスクラインは、矢印会社に開発計画の任意の更新または改訂を提供する義務がない。3.3発展が勤勉である。3.3.1グラクソ·スミスクラインの発展は勤勉である。発効日を改訂した後、グラクソ·スミスクラインは、(A)米国、EU、中国、および日本の許可製品に対する少なくとも1つの指示の規制承認申請を支援するために必要な開発活動を展開するために、商業的に合理的な努力をすべきである;(B)このような開発活動が成功し、そのような開発活動の既存データに基づいている場合、少なくとも1つの指示について、米国、EU、中国、日本のこの許可製品の規制承認を求める。本合意にはいかなる逆の規定があるにもかかわらず、矢印社は、本条項3.3.1項の下でのGSKの職務義務は、GSKを要求するものとしていかなる方法でも解釈してはならないことを認め、同意する[***]それは.3.3.2コンプライアンスを開発します。グラクソ·スミスクライン及びその共同会社、再許可者及びその第三者下請け業者は、任意の適用環境、安全、工業衛生、臨床調査法律、良好な実験室実践、良好な臨床実践又は薬物警戒要求を含む良好な科学的方法及び適用法律を遵守しなければならないが、本協定の下でそれぞれの開発活動を展開すべきであるが、当該当事者が合理的に決定し、そのような開発活動に従事することが任意の適用法律に違反し、又は臨床試験被験者に対して受け入れられない安全リスクとなる場合、当該人は、いかなる許可製品に関連する開発活動に従事するか、又は継続する義務はない。3.4ノウハウの譲渡。グラクソ·スミスクラインの合理的な要求に基づいて、任意の許可製品の開発または規制承認をサポートするために、矢印はGSKに提供され、グラクソ·スミスクラインが任意の形態で記録された矢印独自技術(実験室ノートエントリ、データベースエントリ、専門書、報告、およびスライドプレゼンテーションを含む)を自費コピーすることを可能にしなければならず、進行中の1/2期研究(例えば、元のプロトコルで定義されている)によって生成されたすべての臨床データを含む。本プロトコルは、任意の反対の条項を有するにもかかわらず、矢印は、選択または許可構造設計のみをトリガすることに関連する商業秘密をGSKに提供または他の方法で開示する義務がない。グラクソ·スミスクラインは清算される[***]本3.4節の規定によれば,矢印の全時間当量費用とそのような活動を実行することによる現金外コストを評価するが,矢印がどのような活動を開始する前に,双方が共通して予算を合意しなければならない

30 3.5規制の承認と届出。3.5.1新しい臨床研究および他の規制文書のインデックス。改正発効日以降、グラクソ·スミスクラインは、地域内の任意の許可製品のすべての規制事項に対して、(A)地域内の任意の許可製品のための登録戦略を制定することを含む、その1つまたは複数の関連会社またはライセンス受領者、または上記のいずれかの選択された任意の第三者下請け業者によって、地域内の任意の許可製品のすべての規制事項に対して独占的な権利、一意の責任、および一意の決定権を有する。(B)改正施行日後に開始された任意の許可製品の任意の臨床試験のすべてのINDおよび他の規制届出、(Ii)改正発効日後の任意の許可製品のすべての他の規制届出、(Iii)前述の(I)および(Ii)項に記載の届出によって生成されたすべての承認または認可、任意の許可製品のすべての規制承認を含む、(B)規制当局とのすべての相互作用、および(C)任意の許可製品の開発、製造または商業化に関連するすべての規制届出または規制承認を含む規制当局とのすべての相互作用。3.5.2ヘルプ。(A)グラクソ·スミスクラインの合理的な要求に応じて、グラクソ·スミスクラインに追加料金を支払うことなく、その関連会社がグラクソ·スミスクライン(またはその指定者)に矢印またはその任意の関連会社によって所有または制御された任意の文書または他の材料を提供して、グラクソ·スミスクライン(またはその任意の関連会社またはライセンス所有者)が地域内でそのようなライセンス製品の規制承認を得るように構成されなければならない。(B)第3.5.2(A)節に限定されることなく、グラクソ·スミスクラインの合理的な要求に応じて、合理的に必要な場合には、グラクソ·スミスクライン(またはその任意の関連会社)に合理的な支援を提供して、任意の許可製品およびその支援活動の規制承認を得るべきである。しかし、グラクソ·スミスクラインは清算すべきである[***]このようなサポート活動の実行に生じるコスト、矢印会社の全時間当量費用、および既製コストは、本3.5.2(B)節(ただし、明確にするために、第3.5.2(A)節に従って提供される文書または他の材料を除く)に従って実行されるが、矢印会社がそのようなサポート活動を開始する前に、予算は双方で合意されなければならない。(C)本プロトコルは、任意の反対の条項を有するにもかかわらず、矢印は、選択をトリガすることができるかもしれない建築設計に関連する商業秘密のみをGSKに提供する義務がないか、または他の方法で開示する義務がない。3.6規制レポート。3.6.1責任。本契約には別に明文の規定がある以外は,改正発効日からそれ以降,いかなる者にも

31規制機関の任意の許可製品の任意の開発活動は、薬物警戒協定の条項および条件に基づいてグラクソ·スミスクラインによって完全に行われなければならない。GSK(またはその任意の関連者または再許可者)が、任意の許可製品について任意の規制機関にそのような報告を提出することは、矢印からの情報を必要とする場合、GSKの合理的な要求に応じ、矢印は、GSK(またはその任意の関連者または再許可者)が報告を作成し、領域内で適用される規制機関によって合理的に必要とされ、GSKに任意の追加料金を支払うことなく、GSKに任意の追加料金を支払うことなく、その関連する方向GSK(またはその指定された関連者またはその指定された関連者)に矢印またはその任意の関連当事者によって所有または制御される任意の情報を提供させるべきである。本プロトコルは、任意の反対の条項を有するにもかかわらず、矢印は、選択または許可構造設計のみをトリガすることに関連する商業秘密をGSKに提供または他の方法で開示する義務がない。3.6.2有害事象の報告。一方がライセンス製品に関連する任意の臨床試験における任意の深刻な有害事象を知った後、直ちに他方に通知しなければならず、その通知側は、その後、他方がすべての適用法律(証券法律又は法規及び任意の公開証券取引所の適用規則を含む)を遵守するために必要な情報を含む、当該深刻な有害事象に関連する補足情報を他方に提供し続けるべきである。矢印は、グラクソ·スミスクラインが本協定項のいずれかの許可製品を保有する権利がある任意の薬品申請の一方として、各監督管理機関に許可製品に関する情報及び報告を提出する必要がある可能性があることを認め、同意する。グラクソ·スミスクラインの合理的な要求に応じて、矢印は、その関連会社がグラクソ·スミスクラインに追加費用を支払わないように促すべきであり、(A)矢印またはその任意の関連会社によって所有または制御された任意の臨床前実験室、動物毒理学または薬理学的研究または臨床試験のすべての有害事象情報および安全関連データをGSKに提供するべきであり、これらの情報は、GSK(またはその任意の関連会社または再許可者)がライセンス製品に関連するすべての適用法によって合理的に必要または予想されるものである可能性がある。(B)GSK(またはその任意の関連会社または再許可保持者)がすべての適用法律を遵守することができるように、何らかの方法および時間でGSKにそのような情報を報告および提供することと。各当事者は、本プロトコルの下の任意の許可製品の開発および商業化の過程で得られたすべての深刻な有害事象、情報、および他のセキュリティデータを、すべての適用法に従って処理しなければならない。3.6.3グローバルセキュリティデータベース。双方の間で、グラクソ·スミスクラインは、本プロトコルに従って開発された各ライセンス製品のためのグローバルセキュリティデータベースを構築し、グローバルセキュリティデータベースにおいて、矢印独自技術において可能なセキュリティデータを含む他の有害事象に関連する任意の他の情報、ならびにGSK(またはその任意の付属会社または分割ライセンシー)が合理的に決定して格納された他の有害事象に関連する任意の他の情報を維持しなければならない。グラクソ·スミスクライン(およびその任意の付属会社またはライセンス所有者)は、このデータベースを使用して監督報告を行い、監督管理当局の安全問い合わせに応答する。会議が終わったらすぐに

32修正された発効日および期間内に、矢印は、そのグローバルセキュリティデータベースに格納するために、その付属会社および第三者請負業者に、または彼らが所有するライセンス製品の臨床使用のための有害事象および妊娠報告に関するすべての情報をGSKに開示させなければならない。3.6.4薬物警戒プロトコル。本合意期間内に,いずれか一方が合理的に確定すれば,本協定項の義務を履行する際には,双方が建築許可や許可製品の有害事象反応に関する安全なデータ交換プロセスやプログラムを決定するために書面薬物警戒協定を締結する必要があり,当該側が要求した場合には,双方が善意に基づいて交渉し,相互に同意し,このような薬物警戒協定(“薬物警戒協定”)を締結すべきである。“薬物警戒協定”は、このような安全データ交換過程を規範化し、いかなる許可製品についても、各締約国及びその関連者及び下請け業者又は再被許可者(場合によっては)が薬品安全及び薬物警戒の適用に関する法律の要求を遵守することを許可するのに十分であり、適用範囲内には、規制当局が規定する衛生保健法に記載されている義務を含む。薬物警戒協定は、双方の間で、グラクソ·スミスクラインは、人間が許可地域の任意の場所で任意の許可製品を使用することを防止するために、有害事象、妊娠報告、および世界のどこでも報告された他の安全データを含む包括的(グローバル)安全データベースを所有し、維持すべきであることを反映すべきである。3.7進捗報告。改正された発効日の後、(A)(I)は、第1の許可製品がそれぞれになるまで、少なくとも6(6)ヶ月毎に1回である[***](Ii)第1の許可製品が#年に規制承認を受けた日後[***]GSKは、グラクソ·スミスクライン、その関連会社およびその再許可者が、地域内のすべての許可製品に関連するすべての開発活動を少なくとも12(12)ヶ月停止する前に、任意のライセンス製品開発に関する前回の3.7節に基づいて提出されて以来、グラクソ·スミスクラインおよびその関連会社または再許可許可者の任意の許可製品開発における活動および進捗を示す合理的な高度な書面要約を矢印連合マネージャーに提供する。しかしながら、本プロトコルにはいかなる逆の規定もあるにもかかわらず、GSKは、いずれの場合も、本プロトコルに従って矢印会社に開示する義務はなく、または他の方法でGSK(またはその任意の関連会社または分割ライセンシー)に関する任意の他の構造、化合物または製品の非許可構造、任意の組み合わせ製品中の非許可構造に関する任意の他の有効成分を含む製品の任意のデータ、材料または他の情報を提供する義務はない。疑問を生じないように,GSKが3.7節で提供した任意の上位要約や他の情報をGSKの秘匿情報と見なすべきであることを認め同意した

33 3.8監査。(A)任意の規制当局が、任意の許可建築について、地域内での製品の不適切な開発、製造、または商業化の疑いについて矢印会社(またはその任意の付属会社)に連絡することができるかもしれない場合、(B)矢印会社またはその付属会社は、地域内で任意の許可建築が製品可能かもしれない施設を開発または製造するために使用されるか、またはその意図の通知を出す;または(C)Arrohead(またはその連属会社、許可者または再許可者、場合に応じて)の任意の活動に対して任意の他の規制行動をとるか、またはその意図された任意の他の規制行動を発行し、その行動が領土内の任意の許可建築が製品の任意の開発、製造、または商業化に悪影響を及ぼすと予想される理由があれば、Arroheadはそのような連絡、検査、または通知を直ちにGSKに通知する。3.8.1コンプライアンスチェック。本合意に従って、矢印会社、その任意の付属会社、またはその第三者(分)請負者が、人間が使用するための臨床用品を製造する任意の施設または場所を含む任意の製造、臨床または規制(例えば、GLP、GCPまたはGMP)開発活動を行う場合、グラクソ·スミスクラインは、第三者(分)請負者と達成された任意の適用可能な合意によって許可される権利がある場合、または適用される第三者(分)請負者が明確に許可された条項および条件の制約の下で、矢印会社に合理的な書面通知を出した後(適用される場合、適用される場合、当該等の付属会社又は第三者(下請け業者)は、通常営業時間内に、毎年1回又は複数回、当該施設又は場所及び任意の関連記録を検査して、矢印会社が本協定の条項及びGLP、GCP及びGMP、並びに現在の薬物警戒実践基準を含むすべての適用法律を確認するために、当該施設又は場所及び任意の関連記録を検査することができる。このような検査は第9条に規定された秘密規定を遵守しなければならない。このような検査により、第9条に掲げる機密規定によって保護されていない機密情報が漏洩する場合には、適切な秘密協定が締結されなければならない。このような検査の後、グラクソ·スミスクラインは矢印会社に書面の意見を提供しなければならない。本合意条項や適用法律を遵守していないことが観察された場合,矢印は直ちに商業的に合理的な努力をとったり,適用された第三者に必要な行動を迅速に促してこのような不遵守行為を救済し,GSKの連合マネージャにそのような行動を通報すべきである.矢印は、その第三者(下請け業者)との任意の契約または他の書面配置において、グラクソ·スミスクラインが第3.8.1節に規定する権利を行使することを可能にする条項を含む商業的に合理的な努力を使用することに同意する。3.8.2規制監査。規制当局が本合意に基づいて、矢印またはその代表によって臨床試験または生産許可製品を行う任意の場所を検査する場合、審査会場が矢印またはその付属会社、請負業者または下請け業者の場所であり、第三者と達成された任意の適用可能な合意の条項および条件に適合するか、または第三者が明確に許可する他の条項および条件を適用する場合、矢印は誠実に協力すべきである。矢印は通知を受けてから2営業日以内にグラクソ·スミスクラインに通知しなければならない

34規制当局が、許可製品の臨床試験または許可製品を生産する臨床用品を実施する任意の場所で行われる、許可製品の臨床試験に関連するか、または合理的に許可製品または臨床試験に関連する可能性のある検査。GSKは、適用される規制機関が提供する時間及び通知、並びに第三者と合意された任意の適用協定の条項及び適用された法律を考慮して、適切な場合には、任意の規制機関が審査現場の任意の検査に参加し、検査終了時に監督機関と総括又は総括会議を行うために、適切な機会に審査現場の準備を支援すべきである。このような出席が、本プロトコルの主題とは無関係な矢印会社、その関連会社、または第三者の機密情報漏洩をもたらす場合、そのような無関係な主題をカバーする適切な秘密保護プロトコルを締結しなければならない。いずれかの審査現場で1つ以上の適用法律、良好な実験室規範、良好な臨床実践、良好な製造規範、または現在の薬物警戒実践基準に適合していないことが発見された場合、矢印は、このような違反通知を受けてから20(20)営業日以内に迅速にGSKにCAPA計画を提出し、提出後に商業的に合理的な努力でCAPA計画に適合しないこのサイトに直ちにCAPA計画を実施させなければならない。矢印は、改正発効日後にそれが適用される第三者請負業者または下請け業者(場合に応じて)に達成された任意の合意または他の書面配置に、グラクソ·スミスクラインが本第3.8.2節に規定する権利を行使することを可能にする条項を含む商業的に合理的な努力に同意する。3.9参照権およびデータ取得の権利。矢印これは、GSK(またはその任意の付属会社または再ライセンシー)が、本プロトコルに従って任意のライセンス製品の開発および商業化中に使用するために、矢印会社によって制御される任意のライセンス製品に関連するIND、医薬品マスタファイル(ある場合)、および任意の他の規制ファイル(本プロトコルの期限の前または期間中に作成された場合にかかわらず)を参照する権利があるグラクソ·スミスクラインに付与される。したがって、本プロトコルに従って開発されている許可製品に関連する任意の規制届出を考慮する規制当局は、このようなINDまたは他の規制届出における適用情報を依存して使用することを許可されなければならない。グラクソ·スミスクラインが要求を出した場合、矢印またはその付属会社は、21 C.F.R.第314.50(G)(3)節または世界の任意の他の国または地域の要件に従って署名された声明を提供するか、または他の方法で適用される規制機関にグラクソ·スミスクラインのそのような権利に関する適切な通知を提供しなければならない。グラクソ·スミスクライン(直接またはその任意の付属会社または分割ライセンシーを介して)は、そのような規制届出ファイルおよびその中の任意の独自技術(データを含む)のコピーを審査、取得および要求する権利を有し、GSK義務を履行し、本プロトコルの下の権利を行使する際に、そのようなノウハウを自身の特許製品規制届出ファイルに組み込むことを含むそのようなノウハウを使用する権利がある。3.10安全上の理由で臨床試験を一時停止する。本プロトコルに何らかの逆の規定があっても,独立した安全委員会が確定すれば,開発計画に基づいて許可製品に対するいかなる臨床試験も

35臨床試験を行う側は、研究に参加した任意の対象または患者において、臨床試験を継続する義務はない。いずれの側も,その側またはその代表が行っているライセンス製品が行っている臨床試験に関する任意の開発活動を延期または一時停止することができ,このような臨床試験が受け入れられない安全リスクとなると考える理由があることを前提としている。3.11記録。3.11.1研究記録のメンテナンス。各当事者は、適用法(GCP、GLPおよびGMPの要件を含む、それぞれの場合に適用される)およびそれに一致する会社記録保持政策の要件に適合するように、その関連会社、分割許可者、および第三者(分)請負者によって、それぞれの協力活動の記録を保存または保存しなければならない。このような記録は、完全かつ正確であり、任意の規制目的に適用される方法で、協力活動の実行中に達成されたすべての作業および取得された成果を全面的かつ適切に反映し、本合意が適用および許可された場合に、特許権起訴に使用されなければならない。このような記録は、(A)保留側の会社の記録保持政策要件の期限、(B)法律が要求可能な期限を適用すること、または(C)一方が最初にそのような記録を他方に渡して保存することを提出し、そのような記録を廃棄または処理する前に、それが合理的に要求される可能性のある任意の記録を他方に渡すことを最初に提出しない限り、より長い時間保持されなければならない。3.11.2記録を参照します。各当事者は、平日の正常営業時間内に、合理的な通知の下で、双方が合意した時間内に、他方から第3.11.1節に保存された記録による他方のアクセスおよび複製(自費)を取得する権利があり、本プロトコルの任意の許可製品または任意の開発、製造または商業化活動に関連する記録、または本プロトコルに従って許可または取得された任意の知的財産権または関連権利の範囲に限定され、以下の場合に有用または必要である:(A)請求側が法律または本合意の要求に基づいて、請求側が責任を負うことをもたらす可能性のある事項を合理的に調査することができるようにする。または、事実、状況、または事件が発生して、請求側がそのような責任を負うことができたと信じているか、またはそのような責任を負う可能性があると信じている場合には、そのような責任について抗弁する。(B)規制当局への義務を履行するか、またはライセンス製品に関連する適用法律を遵守すること、(C)本プロトコル項目の任意の特許権を起訴または実行すること、または(D)本プロトコルの下の任意の権利を他の方法で利用すること、3.12に条件付き下請けがある。一方は、本条第III号の下の任意の他の権利または他の義務を含むGSKの下の任意の開発活動(またはGSKに関して(直接またはその1つまたは複数の関連会社または分割許可者を介して)を任意の第三者に下請けすることができる;前提は、締約国が第三者下請け業者と書面協定に署名することであり、この協定は、すべての実質的な態様において本協定項の下で適用される義務および契約を含む、秘密、秘密および使用義務を含む

36機密情報と、少なくとも本プロトコルに規定されているように、GSKプロトコルIP、矢印プロトコルIP、および連携プロトコルIPを含む機密情報および知的財産権の割り当てを制限または保護する。上述したように、改正発効日以降、グラクソ·スミスクラインの事前書面で同意されていないにもかかわらず、矢印は、本条第3条または第5.2節に規定するいかなる義務を第三者に下請けすることも許されない。本プロトコル3.12節によれば、任意の第三者下請け業者を採用する側は、本プロトコルの下での義務の履行に責任を負い、当該第三者下請けが本プロトコルに適用される実質的な条項を遵守することを含む、当該第三者下請け業者が本プロトコルの下での義務を履行する行為に責任を負うべきである。3.13連合マネージャ。各締約国は、本合意で想定される任意の活動について双方が行うインタラクションの調整を担当する連盟マネージャー(“連盟マネージャー”)を指定しなければならない。連盟管理者は、本協定の下での双方の活動を世界的に調整し、双方間の日常的なコミュニケーションに協力する。連合管理者は、このプロジェクトの管理職責を担当する管理者に適応した経験と知識を持たなければならない。各当事者は、書面で他方に通知した後、その指定された連合マネージャを時々交換することができ、この通知は、連合マネージャの連絡先(電子メールアドレスを含む)を提供すべきである。第四条:商業化4.1商業的職務遂行調査。グラクソ·スミスクラインがこの地域の特定の国または管轄区域で初めて許可製品の監督管理許可を得た後、グラクソ·スミスクラインは商業的に合理的な努力を尽くし、監督管理の許可を得た国または司法管轄区で許可製品を商業化しなければならない。4.2商業化の責任。改正施行日以降、グラクソ·スミスクラインは、地域内での登録許可製品のすべての販売を含む、その1つまたは複数の連属会社または再取得許可者、または上記のいずれかによって選択された任意の第三者下請け業者(その1つまたは複数の連属会社または再取得許可者を介して)を、地域内での任意の許可製品のすべての商業化活動に関する独占的権利、唯一の責任、および唯一の決定権を有する。明確にするために、4.1節の規定によれば、任意の特定の国または地域の司法管轄区域で任意の特定の許可製品が発売されるかどうかは、GSKによって自己決定されなければならない(直接または1つまたは複数の付属会社または再許可者を介して)。矢印社は、本条項は、プロジェクトまたは人道主義的または慈善目的の取得のために、グラクソ·スミスクラインが合理的かつ慣例的な特許製品を寄付することを禁止しないことを認めている。4.3商標および国際的に固有の名称。グラクソ·スミスクライン(直接またはその1つまたは複数の付属会社または分割ライセンシーを介して)は、自己の商標を選択しなければならず、これらの商標の下で、本プロトコルの下のライセンス製品を商業化し、それに関連する商標権を有するであろう。グラクソ·スミスクライン(直接またはその1つまたは複数の関連会社または分割許可者、または上記のいずれかの選択による任意の第三者下請け業者)には、

37任意のライセンス製品に関連する国際非特許名の出願を個別に担当し、それによって世界保健機関とのコミュニケーションを担当する。4.4条件付きパケットがあります。グラクソ·スミスクライン(直接またはその1つまたは複数の付属会社または再ライセンシーを介して)は、その任意の商業化活動または本条項第4条の下の任意の他の権利または他の義務を任意の第三者に下請けすることができる;GSKが第三者下請け業者と書面協定に署名することを前提とする。この協定は、すべての実質的に本プロトコルに規定されている適用義務および契約を含む。グラクソ·スミスクラインは、本プロトコルの下の義務の履行に責任を負い、当該第三者下請けが本プロトコルに適用される実質的な条項を遵守することを含む、当該第三者下請けが本プロトコルの下の義務を履行することに責任を負う。第五条:製品製造及び供給5.1製造責任。改訂発効日以降、GSKは、地域内の任意の許可建築可能製品に関連するすべての製造活動の独占的権利、唯一の責任、および一意の決定権(直接またはその1つまたは複数の関連会社または分割許可受容者、または上記の任意の選択された任意の第三者下請け業者によって)を有し、(A)GSK(またはその任意の関連企業または分許可受容者によって)またはそれを代表して行われる臨床試験のための許可建築可能製品を臨床的に供給することができるかもしれない、または(B)建築を許可することができるかもしれない製品を、他の方法で開発または商業化することができるかもしれない。5.2技術移転。GSKの合理的な要件によれば、矢印はGSKに提供されるべきであり、(A)GSK複製(A)任意の許可建築可能製品を製造すること、または(Ii)地域内で任意の許可製品の規制承認を得ること、および(B)GSKが“APA”に従ってJanssenから承認を得る権利がないように、GSK複製(A)が矢印またはその任意の関連会社によって所有または制御される任意のCMC独自技術を許可すべきである。本プロトコルは、任意の反対の条項を有するにもかかわらず、矢印は、選択をトリガすることができるかもしれない構造設計に関連する商業秘密のみをGSKに開示する義務はない。グラクソ·スミスクラインは清算される[***]本5.2節の規定によれば,矢印の全時間当量費用とそのような活動を実行することによる現金外コストを評価するが,矢印がこのような活動を開始する前に双方が共通して予算を合意しなければならない.矢印はここでグラクソ·スミスクラインに示され、改訂発効日から、同社はすべての実質的な面で元の合意第7.4節に規定された義務、すなわち元合意第7.4節の条項に従ってCMCノウハウをJanssenに譲渡することを保証している

38.3品質保証とコンプライアンス。矢印は、本明細書で宣言され、GSKに保証され、改訂発効日から、矢印が元のプロトコルに従ってJanssen(またはその任意の関連会社または他の指定者)に提供される使用のための任意の許可製品は、元のプロトコル7.5節の条項に従って製造および供給されるように構成されてもよいかもしれない。第六条:財務規定6.1前払い。グラクソ·スミスクラインの権利およびライセンスが矢印に付与された部分として考えられ、改訂発効日およびGSKが7.1節に従って有効な請求書を受信してから10(10)営業日以内に、グラクソ·スミスクラインは矢印に使い捨て、返却不可、貸記できないものを支払わなければならない[***]それは.6.2元のプロトコルの下の支払い。6.2.1前払い料金。双方は、改正発効日前に、Janssenが元の合意の条項に従ってArroheadに1.75億ドル(175,000,000ドル)の払戻不能金を一度に支払ったことを認め、同意した。6.2.2オプション支払い。契約側は、改訂発効日前に、Janssenが購入権及びArroheadを行使してJanssenと株式購入発展計画に署名した場合、Janssenは元の合意条項及びこのような条項に従って原始合意に定義され、Arroheadに三百万ドル(3,000,000ドル)の払戻不可金を一度に支払うことに同意した。6.2.3元のプロトコルでのマイルストーン支払い。双方は、改正された発効日の前に、(A)Janssen(またはその関連会社または分割ライセンシーのうちの1つ)が、以下のマイルストーンイベントを実現し、(B)Janssenが、元の合意の条項(A)および(B)に基づいて、このようなマイルストーンイベントについて矢印に対応するマイルストーン金額を支払うことに同意した。元の合意の条項に基づいて、CAMキュー内の5人目の患者(定義は元のプロトコル参照)が5人目の患者に投与した場合、マイルストーンイベントマイルストーン金額(ドル)$25,000,000
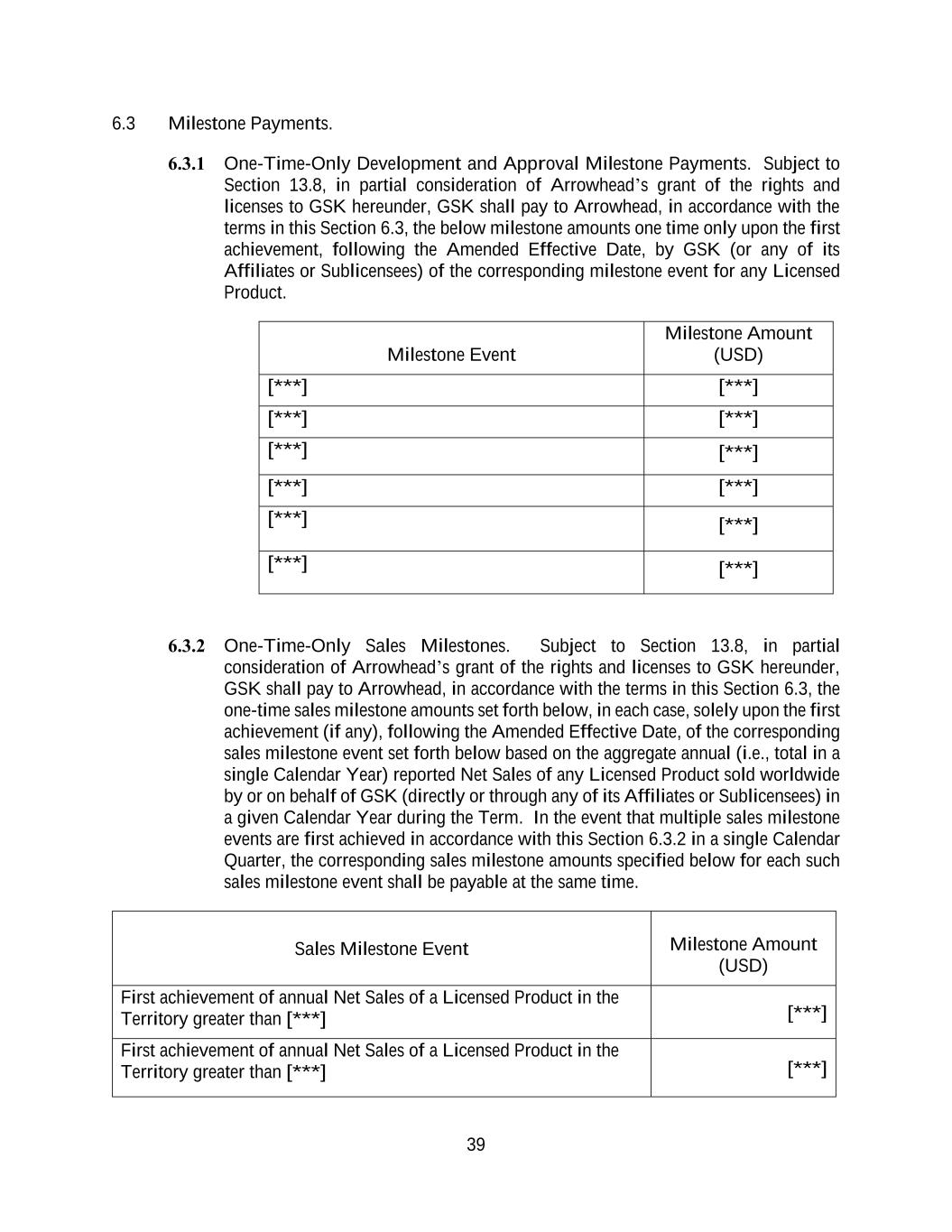
39.3マイルストーン支払い。6.3.1一括開発と承認マイルストーンの支払い。第13.8節の制約の下で、グラクソ·スミスクラインの権利および許可を矢印に付与する部分として、グラクソ·スミスクラインは、本節6.3の条項に従って矢印に次のマイルストーン金額を1回支払わなければならず、修正発効日後にGSK(またはその任意の関連会社または分割ライセンシー)が、任意のライセンス製品の対応するマイルストーンイベントが初めて実現されたときに1回のみ支払わなければならない。マイルストーン事件のマイルストーン金額(ドル)[***][***][***][***][***][***][***][***][***][***][***][***]6.3.2一括払いの販売マイルストーン。第13.8節の制約の下で、グラクソ·スミスクラインの権利と許可を矢印に付与する部分として、グラクソ·スミスクラインは、本節6.3の条項に基づいて、以下の一度の販売マイルストーン金額を矢印に支払うべきであり、いずれの場合も、改訂発効日後の販売マイルストーン事件の改訂発効日後の最初の達成(ある場合)のみに基づいて、年間合計(すなわち、)に基づいている。GSK(直接またはその任意の関連会社または再許可者を介して)特定のカレンダー年度内に全世界で販売される任意の許可製品の純売上。1つのカレンダー四半期内に初めて第6.3.2節の規定に従って複数の販売マイルストーンイベントが実現された場合、以下にこのような販売マイルストーンイベント毎に指定された対応する販売マイルストーン金額を同時に支払う必要がある。マイルストーン事件のマイルストーン金額(ドル)ライセンス製品の販売地域での年間純売上高が初めて上回った[***][***]許可製品のこの領土での年間純売上高が初めて上回った[***][***]

40ライセンス製品のこの領土での年間純売上高が初めて超えた[***][***]許可製品のこの領土での年間純売上高が初めて上回った[***][***]6.3.3マイルストーンごとに金額を支払います。本節6.3に規定される特定のマイルストーンイベントに到達した場合、GSKは、(A)そのようなマイルストーンイベントを達成する他のライセンス製品の数にかかわらず、または(B)所与のライセンス製品がそのようなマイルストーンイベントを達成する回数(他の指示を含む)にかかわらず、そのような各マイルストーンイベントに対応するマイルストーン金額を矢印に1回だけ支払うべきである。6.3.4マイルストーンイベントの通知。グラクソ·スミスクラインは、本第6.3節に規定する特定マイルストーン事件の完了状況を書面で矢印会社に通知しなければならない:(A)第6.3.1節に規定する特定マイルストーン事件については、[***]グラクソ·スミスクラインまたはその任意の関連会社が、第6.3.1節に従ってマイルストーンイベントを実施した後の営業日(または、マイルストーンイベントが従属譲受人またはその代表である場合[***]グラクソ·スミスクラインは、当該譲渡先が当該マイルストーンイベントの実現に関する通知を受けてからの営業日)、または(B)第6.3.2節に規定する特定のマイルストーンイベントについて、[***]このマイルストーンイベントの適用カレンダー四半期が終了した数日後の6.3.2節(場合別適用)により,この通知は,7.2節で交付された印税報告とともに提供することができる.6.3.5マイルストーン金額の支払い。6.3.1節または6.3.2節(具体的な状況に応じて)によれば、あるマイルストーンイベントの完了に関する通知を第6.3.4節に記載された後、このマイルストーンイベントの対応するマイルストーン金額(例えば、第6.3.1節または第6.3.2節(適用に準ずる))は、グラクソ·スミスクラインによって存在しなければならない[***]グラクソ·スミスクラインが7.1節に規定された有効な領収書を受け取ってから数日後。6.4特許使用料の支払い。6.4.1印税条項。この期間において、本節6.4に規定するライセンス製品の印税は、当該販売国のライセンス製品が適用される印税期間内に、ライセンス製品及び国/地域に基づいて支払わなければならない。第6.4.2節または6.4.3節(適用状況に応じて)によって特定のカレンダー年度の印税閾値が達成されたかどうかを決定するためには、ライセンス製品の印税期限が満了した国/地域での販売による純売上高は純売上高に計上されないべきである。地域の特定販売国において,特定ライセンス製品の印税期限が満了した後,第2.1条によりGSKが付与されたライセンスは,矢印知的財産権項の全額,免印税,取消不可,永久,非独占及び再許可(多層による許可を含む)に自動的に変換されなければならない

41このような特許製品の当該国における財産の開発、製造、商業化。6.4.2印税税率。GSKは、6.4.1節、6.4.3節、6.4.4節、13.8節、および6.4.5節または6.4.5節で明確に許可された任意の調整(Arroheadが当地域の特定の国/地域でGSKに付与された権利および許可を部分的に考慮することを考慮すると)、GSKは、表に示す所与のカレンダー年度内にGSK、その関連側および再許可者が地域で販売するすべての許可製品の報告純売上の段数を考慮して、印税料率でArroheadに印税を支払うべきである。例年のライセンス製品のこの地域における合計年間純売上高印税税率(パーセント)現在及び当該例年のライセンス製品の年間純売上高を含む部分[***][***]この例年の特許製品の年間純売上高の部分は[***]至れり尽くせり[***][***]この例年の特許製品の年間純売上高の部分は[***]至れり尽くせり[***][***]この例年の特許製品の年間純売上高の部分は[***][***]6.4.3地域への特許使用料。GSKが参入地域の1つまたは複数の国で許可製品を商業化することを意図している場合、双方は、許可製品がこれらの国またはこれらの国で報告された総純売上に適用される特許使用料率を公平に低減することを合意するために、直ちに誠実な交渉を行わなければならない。したがって、グラクソ·スミスクラインは、6.4.5節または13.8節(場合に応じて)が明確に許容される任意の調整に適合することを前提として、合意された特許使用料率を地域内の各国から報告された許可製品の適用純売上に使用する権利がある。6.4.4印税は1回だけ支払うだけです。本協定で規定されている印税の支払い義務は、同一単位の許可製品に1回のみ適用される。6.4.5印税調整。(A)有効な申告索がない.第6.4.5(E)節に別段の規定がある場合を除き,地域内で与えられた国/地域の特定許可製品の適用許可使用料期間内のいずれかにおいて,当該許可製品中の許可構造の物質組成(又は当該許可製品における許可構造に含まれる適用対象配位子)が有効請求範囲内でない場合[***]この国/地域では、GSKは、第6.4.2節または第6.4.3節に基づいて支払われる適用特許使用料

42適用され、減算されます[***]このような特許製品はこの国/地域で購入されている。(B)強制許可。国/地域の特定の許可製品の適用特許権使用料の期間内の任意の時間が地域内で与えられた場合、当該国内の主管政府当局の政府命令によって、第三者に使用、販売(または要約販売または契約販売)、輸入、輸出、または他の方法で商業化される許可または他の権利が付与され、許可使用料率がGSKよりも低い場合、第6.4.2節または第6.4.3節(場合に応じて)に支払われるべき特許権使用料は、グラクソ·スミスクライン(またはその任意の関連会社または他の再ライセンシー)によって販売されているそのようなライセンス製品の同国での純売上については、本合意に相反する規定があっても、双方は、GSK及びその関連会社及び第三者再ライセンシーが第6.4.2条又は第6.4.3条(場合により適用される)に従って当該国で支払われるこのようなライセンス製品の純売上高を考慮し、当該強制ライセンス又は第三者に当該第三者の使用権を付与する他の権利に応じて支払われるべき特許権使用料を付与し、適用される特許権使用料料率を公平に低減することを誠実に協議しなければならない。ライセンス製品は、国/地域で販売(または要約販売または販売契約を締結)、輸入、輸出、または他の方法で商業化され、強制許可または他の権利自体が有効である限り、有効である。(C)後発薬競争。6.4.5(E)節の制約の下で、許可製品および国/地域に基づいて、許可製品の1つまたは複数の汎用バージョンが、許可製品の適用印税期間内の任意のカレンダー四半期内に1つまたは複数の第三者によって国/地域でマーケティングおよび販売されている場合、ライセンス製品の非特許バージョン(S)の市場シェアは、より大きい[***]この国(“汎用競争”)(カレンダー四半期内にその国で販売されている許可製品および模倣バージョン(S)の総単位数に基づいて、合理的かつ誠実に行動する当事者(例えば、IQVIA)によって合意された有名な報告サービス機関報告)は、当該カレンダー四半期から、第6.4.2節または第6.4.3節(状況に応じて)に適用される特許使用料料率を減少させるべきである[***]この模造薬競争がその国で持続的に存在する限り、その許可製品はその国に存在し続ける。(D)第三者支払いの相殺。6.4.5(E)節の制約の下で、(I)(A)GSKが、ライセンス製品の開発または商業化が特許権侵害に関する疑いを解決または防止するために第三者特許権またはプロトコル下の許可を必要とすることを適宜決定した場合、または(B)GSKは、6.5.3(C)節に従って矢印の第三者合意下の従属許可を受け入れることを選択し、双方は、任意の支払いにおけるGSKの割合割合を共同で合意している

43第6.5.3(B)節の規定によれば、GSK(またはその任意の関連会社または再ライセンシー)またはGSK(またはその任意の関連会社または再ライセンシー)を代表して任意のライセンス建築物を開発、製造または商業化することができるかもしれないという点において、GSKには、ライセンス者としてGSKに適用される義務があり、各場合((A)または(B))において、GSKは、本合意に従って矢印会社に支払われるべき適用ライセンス製品の使用料から差し引く権利がある[***]GSKは、ライセンスまたはプロトコルに従って、矢印のサード·パーティ·プロトコルについて第三者または矢印(またはサード·パーティ)に実際に支払う任意の特許権使用料、マイルストーン支払い、ライセンス料または他の支払い、ならびに(Ii)[***]((I)または(Ii),総称して“第三者支払い”と呼ぶ).(E)最低下限.前述の6.4.5(A)節、6.4.5(C)節、および6.4.5(D)節には逆の規定があるが、第6.4.5(A)節、6.4.5(C)節、または6.4.5(D)節の単独または合併実行は考慮されていないが、第6.4.5(B)節または第138節によるいかなる削減も考慮されていない。適用される場合)は、所与のカレンダー四半期において、所与の国/地域の所与の許可製品の純売上が矢印に支払う特許権使用料金額の減少を超えることを引き起こさない[***]第6.4.2節または第6.4.3節(状況に応じて定める)によれば、当該カレンダー四半期内に、当該許可製品の当該国/地域における純売上高が支払うべき印税額[***]それは.6.5サードパーティの義務。6.5.1下請け業者。一方またはその指定された関係者が、本契約の下の任意の下請け協力活動を実行するために第三者と任意の下請け契約を締結する場合(当該第三者の従業員または代理人が適用法に従ってその発明の補償、報酬または支払いを得る権利がある任意の司法管轄区域内を含む)は、第三者の従業員または代理人への任意の補償、報酬または支払いに対処するために、第三者下請け契約の下の任意のそのような活動を履行するために、第三者の従業員または代理人への任意の補償、報酬または支払いを独自に担当するように商業的に合理的な努力を取らなければならない。任意の当事者が任意のライセンス製品に対して本プロトコルの下の任意の権利を行使することによって、特定の国/地域での法律の適用によって生じる可能性のある任意の支払い義務を含み、これらのライセンス製品は、そのような任意の第三者従業員または代理人によって、そのような活動を実行する際に全部または部分的に発明される。一方がどの第三者とのいずれかの下請け契約契約にそのような義務を含まない場合、その当事者は、生じる可能性のある任意のそのような支払い義務に関連する任意の費用を負担しなければならない。6.5.2[***]

44.6.5.3その他の第三者義務。(A)期限内に、矢印会社(またはそのいずれかの関連会社)が第三者と合意する前に、矢印会社(またはその関連会社)は、矢印会社(またはその関連会社)が第1.56(B)節の要件でない場合は、矢印知的財産権の任意の独自技術または特許権とみなされる(この合意が矢印会社またはその関連会社によって第6.5.3(C)節に従って締結された“矢印第三者合意”に基づく場合)、矢印会社は、矢印会社(またはその関連会社)が当該提案に意図的に参加する矢印第三者合意に関する書面通知をグラクソ·スミスクラインに提供する。提案された財務条項に関する合理的な詳細情報と、提案の矢印サード·パーティプロトコルの下に適用される従属許可者の任意の他の実質的な条項と、第三者によって所有または他の方法で制御される関連するノウハウまたは特許権とと共に、GSKが第6.5.3(C)節に従って選択された矢印の第三者プロトコルについて従属許可を受け入れる場合、第三者が所有または他の方法で制御する関連するノウハウまたは特許権は、矢印知的財産権に含まれるであろう。(B)そのような提案のいずれかの矢印第三者合意に署名する前に、双方は、特許ワーキンググループを介して協議し、双方が本合意に基づいて地域内で建築および許可製品を開発、製造および商業化するそれぞれの権利について、双方の最適な利益に適合するかどうかについて、矢印(またはその付属会社)が提案の第三者合意を締結させるべきである。矢印(またはその関連会社)は、矢印に従って第2.1節に従ってグラクソ·スミスクラインに付与された権利および許可と実質的に一致する商業的に合理的な努力をしなければならない(ただし、いずれの場合も、提案された矢印第三者プロトコルの財務条項は、提案された矢印第三者プロトコルの任意の許可構造と比較して、任意の他の化合物または製品に比例しない悪影響を与えないかもしれない)。しかし、このような矢印の第三者プロトコルに署名する前に、GSKが矢印第6.5.3(C)節に従って矢印の第三者プロトコルの下で再許可を受けることを選択した場合、GSKが矢印の第三者プロトコルの下での再許可を受け入れることを選択したとき、GSKが矢印の第三者プロトコルに従って再許可を受けることを選択した場合、GSKが再許可者としてGSK(またはその任意の関連会社または再許可者)の任意のライセンス建築物の開発、製造、または商業化可能な範囲内で、GSKが矢印の第三者プロトコルの下での任意の支払い義務について合理的かつ誠実に協議し、相互に同意しなければならない

45(C)第6.5.3(B)節の規定によれば、矢印会社(またはその関連会社)が適用される矢印第三者プロトコルに従ってそのような再許可可能な権利または許可を得ることに成功した場合、GSKは、矢印会社に通知を送信することによって、矢印会社(またはその関連会社)が矢印第三者合意に従って許可された関連するノウハウまたは特許権の下で再許可を受けることを選択する権利があり、この場合、GSKは遵守に同意し、その関連会社および再許可者に遵守を促す。この“矢印第三者プロトコル”によれば、GSK(またはその関連者または再許可者)に適用される任意の義務は、GSK(またはその関連者または再許可者)に適用され、GSKは、第6.5.3(C)節に従ってGSKがそのような選択を行う前に、第6.5.3(B)節に従って双方が共同で合意した任意の許可建築物に従って製品の開発、製造、または商業化が可能であるかもしれない任意の義務を含むGSKに書面で通知される。第七条:一般支払条件7.1請求書。グラクソ·スミスクラインは、別表7.1に該当する有効な請求書を受け取った後、本プロトコルに従って矢印会社(または15.1.2節の証券化取引により指定された第三者譲受人、場合によっては)に支払われるすべての係争なし金額は、本第VII条の適用条項に従って支払わなければならない。7.2特許使用料レポートおよび支払い。支払うべき特許使用料はドルで支払わなければならない[***]印税適用期限内のカレンダー四半期ごとの終了後の日数。本合意に基づいて支払われるべき各特許権使用料には、(A)GSK、その関連会社および再許可許可者によるライセンス製品の純売上高(ドルで表される)が許可製品および国/地域に記載されている特許権使用料報告が添付され、(B)6.4.5節の条項による減税または相殺(ある場合)の適用を含む、そのような純売上高から計算される特許権使用料の総額が添付される。7.3送金。一方(“支払側”)が他方(“レジ”)に支払ったすべての金は、必要金額のドルを電子送金で入金し、即時利用可能資金を受取側が時々合理的に指定した銀行口座に直接送金しなければならない。本協定項の下でドル建てでない支払金に対して、支払人はその適用会計基準に符合する標準換算方法を用いて適用される外貨金額をドルに換算し、換算方式は支払人がその一致して適用される監査財務報告を作成する際に使用する慣例と常習換算プログラムと一致しなければならない;前提はこれらのプログラムが広く受け入れられている公表為替レート源を使用することである。ドルで計算された最終売上高に基づいて、当時適用された特許権使用料を計算しなければならない。双方の同意により、双方はいつでも本協定に規定されている支払い方法を変更することができ、いかなる変更も支払いまたは送金地に適用される法律と一致しなければならない

46 7.4税。7.4.1各締約国は、本協定の下での双方の協力努力によって直接的または間接的に生成されたその収入シェアに課されたすべての税金の支払いに個別に責任を負わなければならない。7.4.2 GSKが本プロトコルに従って支払う任意の金額(任意のマイルストーンまたは特許権使用料支払いを含む)が任意の源泉徴収または同様の税金を支払う必要がある場合、GSKは、少なくとも15(15)営業日前であることを矢印会社に事前に通知し、(A)源泉徴収または同様の税金を適切な税務政府当局に支払い、矢印会社に支払い証明を提供し、(B)GSKによって支払われた任意の等の源泉徴収または同様の税金を差し引いた後、これらの金額の残りの金額を矢印会社に送金しなければならない。双方は、互いに協力し、GSKが本プロトコルに従って矢印に支払う任意の支払いまたは特許使用料の源泉徴収税または同様の義務を低減またはキャンセルするために合理的な努力をすることに同意する。矢印は、グラクソ·スミスクラインが適用される二国間所得税条約に基づいて税金を源泉徴収しないか、またはより低い税率で税金を源泉徴収するために、グラクソ·スミスクラインに任意の合理的に必要な納税表を提供する。締結双方は、法律の許可が適用された場合に、本協定に従って支払われたお金によって発生した源泉徴収税、付加価値税および間接税または同様の債務を回収して、そのような源泉徴収税または付加価値税および間接税を負担する側が利益を得るように、相手に合理的な協力を提供しなければならない。上記の規定にもかかわらず、いずれか一方またはその付属会社の訴訟(本契約の下の任意の権利または義務の許可または再許可、適用課税管轄区域の変更、または適用法律または届出または記録保留要求を遵守できなかった行為を含む)が、新たなまたは増加した源泉徴収責任をもたらす場合、そのような行動なしにこれらの責任は適用されない。新たなまたは増加した源泉徴収責任をもたらした一方は、他方およびその関連会社が追加または増加した源泉徴収の金額を賠償し、損害を受けないようにしなければならない(他方またはその関連会社が当該等の源泉徴収税を返還する権利がある限り、またはその等の源泉徴収税を当該他方またはその関連会社が本来支払う必要がある税金を相殺する権利がある限り)。修正された本プロトコルの発効日から5(5)営業日以内に、矢印は、適用される法律の要件に基づいて更新および更新されなければならない正確で完全な国税局W−9テーブルをGSKに提出する。7.4.3本プロトコルの項目または本プロトコルに関連するすべての対応金額には、付加価値税および間接税は含まれていません。本プロトコルに従って支払われるべき任意の金額が支払うべき任意の付加価値税および間接税は、関連する対価格を支払いまたは提供しながらGSKによって支払われるべきであるが、7.1節の規定に従って付加価値税および間接税の有効な領収書を提示しなければならない。各当事者は、(A)徴収すべき付加価値税および間接税の金額を決定するために、他方の合理的な要求の範囲内で、その制御範囲内の任意の情報および任意の文書のコピーを他方に提供することに同意する

47本協定によれば、(B)“付加価値税供給地”を決定するか、または(C)その付加価値税および間接税申告または会計義務を履行する。7.4.4英国と米国の二重課税協定の条項によると、矢印は税務目的について米国に居住しており、英国所得税の猶予を得る権利があることを保証している。矢印がこれ以上このような救済を受ける権利がない場合、矢印は直ちにグラクソ·スミスクラインに書面で通知しなければならない。7.5記録と審査権。7.5.1レコードのメンテナンス。矢印は、グラクソ·スミスクラインが本合意の下で満了した金額および生成されたコストを決定するために、会計基準に従って詳細に保存されなければならない(およびその付属会社および適用される第三者(子)請負業者に保存されなければならない)完全、真および正確な帳簿および記録を決定しなければならない。グラクソ·スミスクラインは、特許使用料計算および本プロトコル項目の純売上高計算に関連するGSK財務記録の正確性を確認することができるように、会計基準に従って保存されなければならない(そして、その付属会社および分被許可者に保存されなければならない)完全、真実かつ正確な帳簿および記録を保存しなければならない。各当事者は,適用法律に基づいてこのような帳簿や記録を保存し,少なくとも3(3)年保存し,その所属支払の日から計算しなければならない。グラクソ·スミスクラインが既製費用または他の費用を矢印会社に返済することを要求された場合、グラクソ·スミスクラインの要求に応じて、矢印会社はグラクソ·スミスクラインにこのような費用の証明を提供しなければならない。7.5.2監査権。一方(状況に応じて、“監査側”)の書面の要求に応じ、他方(“監査側”)は2(2)の日毎に例年1回を超えてはならず、監査側が選定した、監査側に合理的に受け入れられた国際的に公認された地位を有する独立公認会計士事務所が正常営業時間内に被監査者及びその適用関連会社又は第三者が許可可能な側又は下請け業者の記録を秘密裏に訪問することを許可すべきであり、その唯一の目的は、本合意に基づいて支払われたいかなる金の正確性を確認することであり、当該期間の締め切りが当該請求の提出日の3(3)年を超えないことである。明確にするために、グラクソ·スミスクラインが被監査側であれば、アクセス権限は、本プロトコル項下の特許使用料と純売上高計算を検証するために合理的に必要な記録に限定されるべきである。特定の暦年に関する記録の監査は一度を超えてはならない。会計士事務所は、監査側と報告を共有する前に、被監査側にその報告書の写しを提供し、被監査側は、監査側と報告を共有する前に、会計士事務所が単独で適宜会計士事務所に報告に含めるための正当な意見を提供しなければならない。会計士事務所は、監査の最終結果を正確かつ完全にまとめた最終報告書のコピーを同時に各当事者に提供しなければならず、この報告書は、監査側の秘密情報とみなされるべきである。監査側はその会計士事務所に被監査側の情報を秘密にし,要求に応じなければならない

48監査対象者は、このような監査を開始する前に、監査側の会計士事務所に合理的な秘密保護協定に署名するように促すべきである。7.5.3監査費用。一方、第7.5.2節により招聘された会計士事務所により徴収された費用は、監査側が支払わなければならない。ただし、監査により、(A)監査側であるグラクソ·スミスクラインが議論の余地のない支払義務を少なく払っていることが発見された場合、又は(B)監査側の矢印として(A)又は(B)を超え、(A)又は(B)を超える[***]百分率([***]%)の場合は、会計士事務所の費用は、監査対象者によって支払われなければなりません。監査または他の方法で発見された任意の追加金は、グラクソ·スミスクラインが任意の後続の支払い中に支払うべき金額と、第7.6節に従って計算された利息とに完全に計上されなければならない。監査やその他の方法で発見されたいかなる少額もGSKが[***]グラクソ·スミスクラインは、第7.1節に基づいて会計士事務所の報告及び矢印会社の有効領収書を受け取り、領収書は当該会計士事務所が被監査側に当該会計士事務所の書面報告又は双方が別途約束した書面報告を提出した後に交付し、第7.6節により計算された利息を加えなければならない。7.6超過支払いの利息。支払者は、本契約に規定する支払期限が満了した日又はそれまでに支払われていない何の争議もない支払の利息を支払先に支払うことができ、金利は[***]毎年または(低い場合)法的に規定された最高法定金利が適用され、延滞金の総日数で計算されるが、明確にするために、Arroheadが第7.1条に従ってGSKに有効な請求書を交付することができなかった場合、またはそのような支払い条項に関するGSKの説明または論争の通信に他の方法で応答できなかった場合、GSKは、このような遅延支払いについて利息を支払うことができないからである。第八条:知的財産権事項8.1矢印発明を報告する。矢印は、その任意の従業員または代理またはその付属会社または第三者下請け業者の従業員または代理が、許可製品またはその任意の構成をカバーする任意の重大な発明をグラクソ·スミスクラインの検察側連絡先に直ちに報告しなければならない(“矢印発明”)。8.2知的財産権の所有権を合意します。8.2.1総則。第8.2節に別の規定がある以外に、いかなる合意知的財産権の所有権は、米国特許法の原則に基づいて決定された発明権に従わなければならない。8.2.2既存の発明;既存の臨床データ。双方が認めて同意した場合は,原協定第10.2条はいずれにも適用される

49改正発効日の前に、元の合意項の下の任意の活動によって生成された発明(各発明は“既存の発明”である)は、その中またはその上の任意の特許権と共に、しかし、本プロトコルまたは元の合意には逆の規定があるにもかかわらず、双方の間で、グラクソ·スミスクライン(本プロトコルの下でのJanssenの許可譲渡者として)は、任意およびすべての発明のすべての権利、所有権、および利益を単独で所有しなければならない[***]しかし、元のプロトコル10.2.2節に従って矢印に割り当てられた任意の既存の発明(このようなプロトコルノウハウ、“既存の臨床データ”)は含まれていない。8.2.3矢印プロトコルIP。本プロトコルに従ってグラクソ·スミスクラインに明示的に付与された任意の権利または許可(第2.1.1節および第2.1.2節によるグラクソ·スミスクラインの許可を含む)によって明示的に付与された制約の下で、双方の間で、矢印は、任意およびすべての権利、所有権、および利益を個別に所有すべきである:(A)発明の有無にかかわらず、登録された出発材料のみと新たに生成されたノウハウ([***])(“新”[***]専有技術“;(B)協定特許権は,発明にかかわらず,任意の新しいもののみを要求する[***]ノウハウ(“新技術”)[***]特許権“;(C)は、(1)名または複数の矢印(またはその任意の付属会社、再ライセンシーまたは下請け業者)またはその代表によって、発見、開発、生成、発明、派生、創造、発想、または実践の新しい出現に還元される独自技術であるが、(I)のいかなる新しいものも含まれていない[***]独自技術および(Ii)任意の共同プロトコルノウハウ(本第8.2.3(C)節に規定するこのような新しい出現ノウハウ、および任意の新しいもの[***]矢印による独自技術および任意の既存の発明(それらが登録された出発材料のみに関連しているか否かにかかわらず([***])と、(D)(I)第8.2.3(C)節に記載された任意の矢印プロトコルノウハウまたは(Ii)矢印によって独占的に所有されている任意の既存発明(登録された出発材料のみに関連するか否かにかかわらず)を必要とするプロトコル特許権とを備える[***])しかし、各場合((I)または(Ii))、(A)任意の共同協定特許権および(B)要求または他の方法で開示されることは含まれない(1)任意の既存の臨床データまたは(2)GSK(Janssenの許可譲受人として)によって独占的に所有されている任意の既存発明の任意の他の合意特許権(このような合意特許権は、本第8.2.3(D)節で規定するこのような合意特許権および任意の新しいものを含む[***]特許権は,総称して“矢印合意特許権”と呼ばれる).8.2.4 GSKプロトコルIP。双方の間で、グラクソ·スミスクラインは、以下の任意およびすべての権利、所有権、および利益を単独で有するであろう:(A)発見、開発、生成、発明、派生、創造、発想、または実践された新たな出現を表す独自技術

GSK(またはその任意の関連会社、ライセンシー、再ライセンシーまたは下請け業者)一(1)名または複数の人員のうちの50人は、(I)いかなる新しいものも含まない[***](Ii)任意の既存の臨床データおよびGSK(本プロトコルの下の許可譲受人として)によって独占的に所有されている任意の他の既存の発明と共に、任意の既存の臨床データおよび(本プロトコルの下の許可譲受人として)GSK(本プロトコルの下の許可譲受人として)によって独占的に所有されている任意の他の既存の発明と共に、(Ii)任意の共同プロトコル固有技術(第8.2.4(A)節に規定されているこのような新たに出現したノウハウ。(B)(I)第8.2.4(A)節に規定する任意のGSKプロトコルノウハウを必要とするプロトコル特許権、(Ii)任意の既存の臨床データ、または(Iii)GSK(本プロトコルの下でJanssenの許可譲受人として)によって独占的に所有されている任意の既存発明を必要とするが、それぞれの場合((I)、(Ii)または(Iii))は、(A)いかなる新しいものも含まない[***]特許権は、(B)任意の共同協定特許権及び(C)矢印によって独占的に所有されている任意の既存発明の任意の他の合意特許権を要求又は他の方法で開示する。8.2.5共同協定知的財産権。本合意に従って他方の任意の権利または許可(第2.1.1節および第2.1.2節によるGSKの許可を含む)が一方によって明示的に付与された制約の下で、双方は、任意の人およびすべての所有者のすべての権利、所有権および利益を含む平等および不可分に基づいて共有されなければならない:(A)(I)GSKを代表する(1)名または複数の人員(またはその任意の付属会社、ライセンサー、再ライセンシーまたは下請け業者)による共同発見、開発、生成、発明、派生、創造、発想、または実践の新たな出現を低減する独自技術;一態様では、(Ii)矢印の(1)名または複数の人員(またはその任意の付属会社、ライセンシー、再ライセンシーまたは下請け業者)は、いかなる新しいものも含まない[***]独自技術(第8.2.5(A)節に規定するこのような新たに出現したノウハウは、ArroheadおよびGSK(本プロトコル下の許可譲受人として)によって共通して所有される任意の既存発明と共に、総称して“共同プロトコルノウハウ”と呼ばれる)、および(B)(I)既存の共同プロトコル特許権および(Ii)任意の共同プロトコルノウハウを要求するプロトコル特許権(“共同プロトコル特許権”)である。8.2.6さらに保証します。(A)有効期間内に、各当事者は、以下の事項に関連するすべての発明開示または他の類似文書を他方に迅速に開示しなければならない:(I)GSKについては、任意の新しいもの[***]発見、開発、生成、発明、派生、作成、アイデアまたはGSK(またはその任意の関連会社、許可者、再許可者または下請け業者)の1つ(1)または複数の人、または実践を代表するそれらのIPまたは共同プロトコルIP、ならびに(Ii)矢印の場合、発見、開発、生成、発明、派生、作成、構想または実施された任意の矢印プロトコルIPまたは共同プロトコルIP

51は、矢印会社の(1)名または複数の人員(またはその任意の付属会社、ライセンシー、再ライセンシーまたは下請け業者)またはその代表(場合に応じて)によって実際に簡略化される。各締約国はまた、他方からの開示、文書又は出願に関連する補足情報の合理的な要求に迅速に応答しなければならないが、(A)グラクソ·スミスクラインは、当該等の要求に対する補足情報が新しいものであることのみを義務化しなければならない[***](B)矢印は、要求された補足情報が“矢印協定”または“共同協定”ノウハウに含まれている場合にのみ応答する義務がある。(B)第2.1.1節および第2.1.2節によるGSKの付与の許可を含み、本条第VIII条の残りの部分に基づいて双方がそれぞれ享受する権利を含む、本協定に適合する場合には、一方の権利または許可を明示的に付与することを前提として、(I)GSKは、ここで(およびその付属会社)を任意の新しいものにしなければならない[***]GSKの1人または複数の人員(またはその任意の関連会社、ライセンシー、再ライセンシーまたは下請け業者)またはその代表によって発見、開発、生成、発明、派生、作成、構想または簡略化された知的財産権、および(B)任意の共同プロトコル知的財産権において、任意の共同プロトコル知的財産権および任意の共同協定知的財産権項目における共通の平等および不可分の権益は、それぞれの場合((A)または(B))、矢印会社は、そのような譲渡を受ける。(Ii)矢印会社は、任意の既存の臨床データおよびそれ以下のすべての権利、所有権および権益をGSK(A)に譲渡し、これらの権利、所有権および権益は、(1)名または複数の矢印会社(またはその任意の付属会社、許可者、分割許可者または下請け業者)またはその代表によって発見、開発、生成、発明、派生、作成、構想または還元され、(B)任意の共同プロトコル知的財産権において、任意の共同プロトコルIPの下、および様々な場合((A)または(B))、GSKはこのような譲渡を受け入れる;(Iii)各当事者は、他方を計算または義務する必要がなく、または他方の同意を要求することなく、許可、許可、譲渡、および他の方法で任意の共同協定独自技術または共同協定特許権を処理する権利を有し、各当事者は、任意の司法管轄区域の法律に従って所有可能な任意のそのような同意または計算を要求する任意の権利を放棄する(または、その免除が任意の司法管轄区域で無効である場合、各当事者は、他方に計算することなく、任意の第三者に任意の許可を付与することに同意する)。(C)期限内に、各締約国は、その関連会社、ライセンシー、再ライセンシー、及び下請け業者が、任意の開発活動に参加又は実行している任意の者及び所有者から書面合意を取得することを確実にする

52本のプロトコルの下の当事者またはその代表は、本プロトコルによって規定され、(I)現在、その人の任意のプロトコルの相手側の権利、所有権、および利益を、そのようなプロトコルである相手側の一方に譲渡し、それぞれの場合、そのような人がそのような開発活動を行う前に、(Ii)そのような合意である相手側に任意のプロトコルの知的財産権を迅速に報告することを要求し、(Iii)そのような人に、そのような合意の当事者の任意の特許権を起訴および実行することを要求する。そして(Iv)これらの者に本協定の義務及び目的を履行するために必要なすべての行為及び署名、署名、承認及び交付のいずれか及びすべての文書を要求する。双方は、この発明譲渡プロトコルが本プロトコルを参照する必要がないことを理解し、同意する。8.3特許権の起訴。8.3.1通信。各当事者は、本8.3節に規定する当事者間のすべての通信を検察側連絡先によって処理し、その弁護士-依頼人の特権的な地位を保護するために、そのような通信を厳密に秘密にしなければならない。8.3.2ファイルのレポートを申告します。第8.3.3節の規定によれば、本協定項の矢印特許権又は共同協定特許権の範囲内で任意の優先権確立特許出願又はオリジナル特許出願(各場合、特許明細書に記載されている任意の特許請求又は新たな事項に関する)を提出することが計画されている一方は、提案された起訴が特許庁に提出される前に少なくとも30(30)日(例えば、出願草案又は正式訴訟に対する応答)のような合理的な早期時間を他方に提供し、その当事者に連絡してこの件についてコメントする機会を他方に提供しなければならない。8.3.4(G)の制約の下で、それぞれの側は、提出後に、特許庁に提出された矢印特許権、GSKプロトコルLC/LP特許権または共同プロトコル特許権内の各優先権確立特許出願またはオリジナル(一時的または非一時的であるか否かにかかわらず)特許出願のコピーと、各実質的に起訴された出願の写し(矢印特許権、GSKプロトコルLC/LP特許権または共同プロトコル特許権内に提出された任意の他の特許出願を含む)とを迅速に他方に提供しなければならない。8.3.3矢印特許権および共同協定特許権の起訴責任および調整。(A)(I)任意のライセンス構造が可能かもしれない製品を要求または他の方法で開示する任意の矢印特許権については、任意のライセンス構造が製品の開発、製造、または商業化に必要かもしれない任意の矢印特許権を要求または他の方法で開示することを含むが、矢印プラットフォーム技術を明示的に要求するか、または(Ii)任意のライセンス構造に適用可能かもしれない製品に特化した矢印プラットフォーム技術を主張または他の方法で開示する任意の矢印特許権は含まれない

53その開発、製造または商業化((Ii)または(Ii)、“特定の矢印特許権”)を含み、双方の間で、期間内に、グラクソ·スミスクラインは、主に特定の矢印特許権を起訴する責任を負わなければならない。しかし、その間、グラクソ·スミスクラインは、8.3.3(A)節(8.3.2節の規定を含む)に従って、このような任意の特定の矢印特許権のすべての実質的な事項を起訴するGSKを合理的に矢印会社に通報し、任意の継続出願、支部出願、または他の持続的な出願の提出に関する意見、請求、および提案を含む矢印会社の特定の矢印特許権を起訴する戦略に関するコメント、請求および提案を誠実に考慮すべきである。改訂発効日までの特定の矢印特許権は、本プロトコル付表1.29である第1の部分、第3の部分、および第5の部分において決定される。その間、矢印は速やかにグラクソ·スミスクラインに書面通知を出し、特定の矢印特許権の任意の変化を通知しなければならない。(B)特定の矢印特許権以外の任意の矢印特許権(“一般矢印特許権”)については、双方の間で、任期中、矢印は、主に一般矢印特許権を起訴する責任を負うべきであり、これは、双方が受け入れ可能であり、矢印によって招聘された外部特許弁護士を使用して起訴することを含むことができる(第三者が任意の以前に存在する第三者合意に従って任意の一般矢印特許権の起訴を制御する権利がある場合、第三者が起訴中に代表される)。しかし、有効期間内に、矢印会社は、適用された第三者(ある場合)が以前に存在する第三者合意に制限または義務がある場合には、矢印会社が第8.3.3(B)節(第8.3.2節を含む)に従って提起された任意のこのような矢印特許権の起訴に関連するすべての実質的な事項を合理的に理解させ、このような汎用矢印特許権を提訴する戦略に関するグラクソ·スミスクラインのコメント、請求、提案を誠実に考慮するであろう。継続的に申請することができます上記の規定があるにもかかわらず、矢印はグラクソ·スミスクラインが合理的な要求を提出し、それと協議した後、商業上の合理的な努力を取って、特許製品に対する特許出願を提出し、特許製品に対する全体的な特許保護を最適化すべきである。明確にするために、改訂発効日までの一般的な矢印特許権は、本プロトコル付表1.29である第2の部分、第4の部分、および第5の部分において決定される。その間、矢印は直ちにグラクソ·スミスクラインに書面通知を出し、汎用矢印特許権の任意の変化を通知しなければならない。(C)いかなる共同協定特許権についても,双方は双方が共同で選択して招聘した外部特許弁護士を通じて主要な責任を分担し,この共同協定特許を起訴しなければならない

54権利。改訂発効日までの既存の共同プロトコル特許権は、本プロトコル別表1.74において決定される。(D)各当事者は、本合意条項に適合する任意の矢印特許権または共同協定特許権を起訴するために、任意の特許庁に提出された起訴文書(機関訴訟に対する回答草案を含む)、適用法律を遵守し、および本合意条項に適合する所有権を反映するために、任意の特許庁に提出された起訴文書(機関訴訟に対する回答草案を含む)をタイムリーに完了させることを含む、本合意条項に適合する任意の矢印特許権または共同協定特許権を起訴するために、他方の要求するすべての合理的な協力を提供しなければならない。本合意項の下の任意の矢印特許権又は共同協定特許権を起訴する一方は、任意の特許庁に提出又は任意の特許庁から受信したすべての実質的な起訴文書の写しを他方に提供するために合理的な努力をしなければならない。本合意項の下の任意の矢印特許権または共同協定特許権を起訴する一方は、任期中に毎年他方に報告書を提供し、主に起訴を担当する任意のこのような適用特許権の状況を決定しなければならないが、任意の共同協定特許権については、双方は協力してこの状況報告を共同で作成しなければならない。(E)双方は、FDAによって維持される“オレンジブック”に含まれる任意の矢印特許権または任意の共同合意特許権、または領土内の他の国または地域ライセンス製品の類似または同等の特許リストまたはリンクソース(ある場合)を誠実に議論し、矢印のコメントを誠実に考慮した後、グラクソ·スミスクラインは、どの矢印特許権または共同合意特許権が含まれるかを決定する唯一の権利を有するであろう。矢印はグラクソ·スミスクラインが合理的に要求する可能性のある上場関連の協力を提供するだろう。(F)任意の矢印特許権の起訴を担当する当事者は、そのような特許権によって生成されたすべての特許費用を個別に起訴する責任を負わなければならない。すべての側が負担しなければならない[***]すべての共同協定特許権によって発生した特許費用を起訴する。それにもかかわらず、いずれか一方が任意の特定の矢印特許権(付表1.29~第3の部分に列挙された任意の取得された特定の矢印特許権を除く)、または任意の特許庁に係わっている任意の共同プロトコル特許権の失効または放棄(任意の可能な国または地域での欧州特許庁が係属する可能性のある許可された多司法管轄区域特許出願を含む)を許容することを意図している場合、当該当事者は、少なくともこのような意図を他方に通知しなければならない[***]数日前(または、実行できなければ、提供します[***]すなわち、当該特許権が失効又は放棄される日までの他の実行可能な時間内)であり、かつ、当該矢印特許権のいずれかの場合にのみ、任意の以前に存在する第三者合意において禁止されていない範囲において、当該他方は、当該適用された矢印又は共同合意特許権をさらに起訴する責任を負う権利があるが義務がない

55(およびこれに基づく任意の継続的な出願)およびそれに関連するすべての特許費用は、この場合、譲渡者は、合理的に協力して、特許権の起訴を迅速に他方に譲渡しなければならない。8.3.4 GSKプロトコルLC/LP特許権の起訴責任と調整。(A)双方の間で、グラクソ·スミスクラインは、費用を自ら負担し、GSKプロトコルLC/LP特許権の範囲内の任意の特許出願の準備および提出を自己負担し、指導する唯一の権利を有するが、第8.3.4(G)節に該当する条件下で、提出後の有効期間内に、GSKは、第8.3.2節に従って矢印会社に任意の優先権を提供して、特許出願または元(一時的または非一時的であるかにかかわらず)特許出願の写しを確立しなければならない。(B)双方の間で、グラクソ·スミスクラインは、任意のGSKプロトコルLC/LP特許権の任意の他の起訴を自費および適宜決定し、指導する権利がある(GSKプロトコルLC/LP特許権内のいかなる特許出願の準備および提出も含まれておらず、GSKは第8.3.4(A)節に従ってこの特許権利に対して唯一の制御権を有する)。しかし、8.3.4(G)節に違反することなく、グラクソ·スミスクラインは、第8.3.4(B)節に従ってGSKによって起訴された任意のこのようなGSKプロトコルLC/LP特許権の起訴に関連するすべての実質的な事項を有効期間内に矢印会社に合理的に通知し、矢印会社のこのようなGSKプロトコルLC/LP特許権起訴戦略に関するコメント、請求、および提案を誠実に考慮しなければならない。(C)第8.3.4(G)節に別の規定があることに加えて、第8.3.4(B)節の規定があるにもかかわらず、グラクソ·スミスクラインが有効期間内に任意の特許庁で議決されることを許容する任意の特定のGSKプロトコルLC/LP特許権の失効または放棄(検証不能により許可された多司法管区特許出願、例えば任意の可能な国または地域の欧州特許庁が係属中である可能性のある特許出願を含む)を含む場合、GSKは、少なくともこのような意図を矢印会社に通知しなければならない[***]数日前(または、実行できなければ、提供します[***]その特許権が失効または放棄される日までの他の実行可能な時間内である)。したがって、矢印は、適用されるGSKプロトコルLC/LP特許権(および特許に基づく任意の継続的出願)およびそれに関連するすべての特許費用をさらに起訴する責任を負う義務はないが、この場合、GSKは合理的に協力して、GSKプロトコルLC/LP特許権の起訴を矢印に迅速に譲渡しなければならない。矢印は、GSKプロトコルLC/LP特許権のさらなる起訴に関連するすべての実質的な事項をGSKに合理的に通知しなければならない

56第8.3.4(C)節については、任意の継続出願、支部出願、または他の連続出願の提出に関する意見、請求、および提案を含むグラクソ·スミスクラインのこのようなGSKプロトコルLC/LP特許権起訴戦略に関するコメント、請求、および提案が誠実に考慮されるであろう。疑問を生じないために、矢印会社(またはその任意の付属会社)は、(I)国家段階非仮特許出願またはPCT特許出願が提出された任意のGSKプロトコルLC/LP特許権に関連しない限り、GSKプロトコルLC/LP特許権の範囲内で任意の特許出願の準備または提出を継続または指示する権利を有しておらず、(Ii)矢印会社は、本条項8.3.4(C)節に従って、さらなる起訴責任を負う権利を行使している。(D)各当事者は、任意の特許庁に提出された起訴文書(機関訴訟に対する回答草案を含む)をタイムリーに完了し、適用法を遵守することを含む、第8.3.4節の条項に適合する任意のGSKプロトコルLC/LP特許権を起訴するために、他方に要求されるすべての合理的な協力を提供しなければならない。任意のGSKプロトコルLC/LP特許権を第8.3.4(B)節または第8.3.4(C)節(場合によっては適用)に従って起訴する一方は、任意の特許庁に届出または任意の特許庁から受信したすべての重要な起訴文書のコピーを他方に提供するために合理的な努力をしなければならない。(E)双方の間で、グラクソ·スミスクラインは、どのGSKプロトコルLC/LP特許権がFDAによって維持される“オレンジブック”または領土内の他の国の類似または同等の特許リストまたはライセンス製品のリンク元に組み込まれるかを決定する権利がある。(F)第8.3.4節の規定により、GSKプロトコルLC/LP特許権の起訴を担当する側は、当該特許権を起訴して発生したすべての特許費用を独自に負担しなければならない。(G)本プロトコルにはいかなる逆の規定もあるにもかかわらず、双方は、Janssenが“APA”に基づいてGSKの非排他的許可を付与することに基づいて、いくつかのGSKプロトコルLC/LP特許権を有効期間内にGSK(またはその関連者)によって制御することができ、GSKおよびその任意の関連者が“APA”によってJanssenから許可された任意の特許権を起訴、強制または弁護する権利がないため、これらの特許権は、第8.3節および第10.9節の条項および条件には適用されない。8.4特許法執行。8.4.1通知。(A)各当事者は、第三者による任意の矢印特許の任意の表面、脅威、または実際の侵害について直ちに他方に通知しなければならない

57締約国が知っている権利または共同協定特許権、または任意の矢印専用技術または共同協定ノウハウを流用する。通知側は、このような侵害または流用行為に関するすべての既知の詳細または証拠を直ちに他方に提供しなければならない。(B)各当事者は、1984年の“医薬品価格競争及び特許期限回復法”に従って、本法案第101及び103項による通知を含む任意の矢印特許権又は共同協定特許権に関連する任意の第三者通信を他方に迅速に通知しなければならない。これらの通知は、簡略化秘密協定(ANDA)又は書面守秘協定を提出した者から、又は領土上同様のこのような法律に基づいている。8.4.2アクションの実行。(A)双方の間で、契約期間内に、グラクソ·スミスクラインは、(I)第三者が(A)任意の特定の矢印特許権を侵害する疑いがある、または(B)任意の共同協定特許権、または(Ii)第三者が任意の矢印専有技術または共同協定ノウハウを流用する疑いがある、(I)第三者が、地域内の任意のそのような許可製品に任意の規制排他的権利を提供する権利を有する権利が、自分の名義(または法律が適用可能な矢印の名義)で提起される権利を有する。(各((I)または(Ii)),“製品侵害”)は,各ケースにおいて,それ自身が選択した弁護士である。グラクソ·スミスクラインが本条項8.4.2(A)項に従って開始した任意のこのような訴訟が、グラクソ·スミスクラインによる費用の支払いがこのような訴訟の当事者となることを含む場合、GSKはGSKの合理的な要求に従ってGSKと協力するが、GSKはそのような協力の提供に関連する合理的な費用を返済しなければならない。もしGSKが増加した製品侵害行為に対してこのような法執行を拒否すれば[***]製品侵害に関する通知を受けた営業日内に、GSKは、第8.4.1節に従って矢印会社に通知されるべきであり、この場合、GSKがGSKによって提供されるGSKがなぜこのような行動を選択しないのかに関するいかなる理由およびGSKの書面同意(無理に拒否することはできない)をGSKと議論し、誠実に考慮しなければならない。その後、矢印会社は、その選択された弁護士によってこのような訴訟を開始する権利があり、矢印会社の費用でこのような訴訟の当事者となることを含む矢印会社の合理的な要求に従って協力しなければならない。矢印会社はグラクソ·スミスクラインがこのような援助を提供することによって合理的に発生した既製費用を補償しなければならない。(B)双方の間で,期限内に,矢印会社は自分の名義で,自費で第三者の侵害行為について任意の侵害訴訟又はその他の強制執行訴訟を提起する権利がある

58任意の一般矢印特許権の締約国は、それ自身によって選択された弁護士。グラクソ·スミスクラインは、矢印会社が第8.4.2(B)節で開始された任意のそのような訴訟の合理的な要求に従って、そのような訴訟の当事者となることによって、費用を矢印会社が負担することを含むが、矢印社は、そのような援助の提供によってGSKが合理的に生成した現金外費用を補償しなければならない。矢印会社が矢印の特許権を大幅に侵害する行為に対してこのような強制行動をとることを拒否した場合[***]当該告発された第三者侵害行為に関する通知を受けた営業日(又はそれ以下の期間[***]8.4.1節によれば、矢印はグラクソ·スミスクラインに通知すべきであり、この場合、矢印は矢印と議論し、矢印がなぜその行動を取らないことを選択した任意の理由、および矢印の書面同意(無理に拒否してはならない)を誠実に考慮し、その後、グラクソ·スミスクラインはその選択された弁護士によって訴訟を開始する権利があり、矢印はグラクソ·スミスクラインの費用が訴訟の当事者となることを含むGSKと協力しなければならない。グラクソ·スミスクラインは矢印会社がこのような援助を提供することによって合理的に発生した既製費用を返済しなければならない。(C)当事者が本条項8.4.2節に従って提出した和解または同意判決または訴訟の他の自発的最終処分は、他方の同意なしに達成することができるが、このような和解、同意判決または他の処置は、他方が所有または制御する任意の特許権の無効または実行不可能性を認めない。また、第三者に付与される任意の権利は、訴訟の対象となる第三者の製品または活動に限定されなければならない。(D)一方が8.4.2節で提起した任意の訴訟で返送された損害賠償金と判決された任意の他の金額は(I)まず分配しなければならない[***](Ii)の後,[***]それは.8.4.3法執行活動における協力。各当事者は、GSKが2.1節で許可された任意の矢印特許権または任意の共同合意特許権の任意の第三者侵害行為に従って提起された侵害訴訟または他の法執行行動の結果が、潜在的な第三者侵害に関連する、特許権の範囲、有効性、または実行可能性に悪影響を及ぼす可能性があることを認めている。したがって、双方は、任意の第三者が任意の矢印特許権または任意の共同協定特許権を侵害するために提起された任意の侵害訴訟または他の法執行行動について合理的に協力しなければならない。明確にするために、矢印会社およびグラクソ·スミスクラインは、第8.4.2節の規定によれば、いかなる第三者侵害行為に対しても、いかなる矢印特許権または任意の共同協定特許権を強制的に実行する必要はない

59.5ビジネスの自由を維持する。双方は“開発計画”に基づいていかなる開発活動を展開する際にも、商業上合理的な努力を尽くし、いかなる第三者の特許権を侵害しないようにすべきである。各当事者は、任意の第三者の特許権が双方の任意の開発活動に関連する可能性があることを知っている場合、直ちに検察側連絡先に通知しなければならない。8.6特許期間が延長されます。有効期間内には、グラクソ·スミスクラインの書面請求(ライセンス製品の適用規制承認日及び出願特許期限延長の締め切りを通知することにより)、検察側は、任意のこのようなライセンス製品が規制承認を受けた各国又は司法管区内、及び当該国又は司法管轄区域の適用法律が特許期間の延長を許可した場合は、グラクソ·スミスクラインが指定した特許弁護士の合理的な指示の下で、矢印特許権範囲内の特許出願特許期間を延長しなければならない。どの特許があるか(ある場合)は,グラクソ·スミスクライン特許弁護士が特許期間を延長する資格があるかどうかについての意見を考慮して合理的に判断しなければならない。グラクソ·スミスクラインには、(A)薬物出願中の任意の特許権リストにおいて、GSKが適切に適用されると合理的に考えられる矢印特許権を決定する権利と、(B)8.4.2節で許可された適用法に従って、そのような任意の矢印特許権の任意の製品侵害に対して訴訟を提起する権利と、(C)GSKが本協定に従って商業化された承認された許可製品に関連する任意の矢印特許権の特許期間の延長を申請することを含む、特許所有者が合理的に適用可能であると判断する任意の権利とを有する権利がある。GSKが第8.6節の許可を行使する際に提出された合理的な要求によれば、矢印は、GSKおよびその付属会社および分割許可者との協力に同意し、矢印は、GSKが要求を提出した場合、矢印が本プロトコル8.4.2節に規定された条項および条件に従って提起された任意の製品侵害訴訟に参加することを可能にすることを含む、GSKが合理的に要求する可能性のある関連文書を実行し、これに関連する追加の行動を取らなければならないが、GSKは、このような行動をとることによって生じるすべての合理的な現金外費用を償還しなければならない。8.7第三者の行動に対する抗弁。8.7.1任意の当事者またはその任意の関連会社が、第三者が任意の当事者(またはそのそれぞれの関連会社)に対して開始または脅威の任意の訴訟を認識している場合、この訴訟は、任意の許可構造が、製品またはその開発、製造、または商業化が第三者の特許権を侵害しているか、または第三者のノウハウを流用しているかもしれないと主張している(ただし、第三者の基礎主張が組合せ製品に関連する任意の他の活性成分(許可構造を除く)の範囲内で、第三者の任意のこのような訴訟を除く)(これらのいずれかの訴訟、すなわち“第三者訴訟”)である。当事者または関連会社は、特許ワーキンググループを介して、その当事者または関連会社が合理的に入手可能な特許請求または行動に関するすべての詳細を他方に迅速に通知しなければならない。8.7.2双方の間で、第11.1節に規定する双方のそれぞれの賠償義務を遵守する場合、グラクソ·スミスクラインは、唯一かつ独自の権利とを有するべきである

60グラクソ·スミスクラインは、領土内の任意の特許製品の任意の第三者訴訟を自己決定し、自費で弁護士を選択し、妥協または和解する権利があるが、いずれの場合も、矢印の事前書面の同意を得ず、グラクソ·スミスクラインは、矢印またはその任意の付属会社に任意の費用または責任を負わせ、または矢印またはその任意の付属会社の任意の承認に関連する任意の第三者訴訟を和解または他の方法で妥協してはならない。グラクソ·スミスクラインの要求と費用に応じて、矢印及びその付属会社はこのような第三者訴訟の弁護に合理的に協力しなければならない。疑問を免れるために、第三者訴訟においてグラクソ·スミスクラインまたはその任意の関連会社に対して判決を下し、双方の間で控訴する場合、GSKは唯一かつ排他的な権利を有するべきであり(ただし義務ではない)、自ら決定して自費で控訴することができ、法律が適用されて矢印会社またはその任意の関連会社が控訴に参加することを要求する場合、矢印またはその関連会社は控訴の名目の側であり、グラクソ·スミスクラインの要求および費用はGSKおよびその関連会社に合理的な協力を提供しなければならない。8.8特許ワークグループ。双方は、各当事者それぞれの起訴連絡先を含む各当事者最大3人の代表からなる特許ワーキンググループ(“特許ワーキンググループ”)を設立しなければならない。その唯一の目的は、矢印特許権および共同合意特許権の起訴および実行に対する双方の責任、または双方が互いに合意する可能性のある任意の他の特許権事項を含む、本条第8条下の活動を調整することである。特許ワーキンググループは適宜会議を開催することができ、各場合の特許事項を検討することができ、その頻度、時間、場所、および方法は、当事者それぞれの検察側連絡先によって共同で合意することができる。8.9共通利益協定。双方の間または一方の外部特許弁護士と他方との間で交換される矢印特許権、共同合意特許権、または任意の許可構造が製品に関連するかもしれないすべての非公開情報、ならびに第三者特許権またはノウハウに関する分析または意見に関するすべての共有情報は、秘密情報とみなされるべきである。双方は、彼らが放棄していないことを同意し、認め、本プロトコルのいかなる内容も、共通利益原則および類似または関連原則の下の特権を含む、このような特許権、独自技術、または機密情報の任意の法的特権の放棄を構成しない。上記の状況をさらに説明するために、双方がこの了解を記念するために単独で合意することに同意した場合、双方は、許可製品に関する任意の製品責任を含む、この了解を反映した共通利益協定または双方が達成可能な任意の他の共通利益協定を交渉し、達成すべきである。8.10製品商標。矢印は、本明細書でGSKに表され、GSKに保証され、元の発効日(元の合意に従って当時発効された条項のような)および修正された発効日から、任意の商標出願または登録またはドメイン名を含むライセンス構造に関連する任意の製品商標権を有しているか、または他の方法で制御されていない。グラクソ·スミスクラインは

61(その関連会社および再許可者によってライセンス製品を商業化する)は、その適宜選択された商標および商標を適宜使用して、許可製品にブランドを付与する権利があり、製品商標権を適宜申請し、取得し、維持し、それ自身の名義で費用を支払う権利がある。本プロトコルは、明示的であっても黙示されていても、本プロトコルまたは他の態様を履行するために、他方の名称または任意の他の商号または商標を任意の方法で使用する権利を付与していない。8.11グラクソ·スミスクライン特許権。双方の疑問を生じることを回避するために、GSKプロトコルLC/LP特許権の起訴に関する第8.3.2節または第8.3.4節の明確な規定に加えて、GSKは、GSKまたはその任意の付属会社が本プロトコルを履行する際に使用する任意のGSKプロトコル特許権または任意の他の特許権(本プロトコルによって付与された任意の権利は除外可能かもしれない)に対して起訴、強制実行または他の行動を行い、自ら費用を負担し、適宜他の行動をとる権利がある。第9条:秘密と公開9.1秘密情報。9.1.1この合意が別の明確な許可を有することに加えて、当事者は、任期内およびその後10(10)の年内に、その締約国およびその関連する当事者、取締役、従業員、労働者、請負業者、コンサルタント、コンサルタント、代理人または他の代表(“代表”)が、他のまたはそれらの任意の関連側(“マント”)との業務、運営、技術または科学活動、化合物または製品に関連するすべての非公開または機密情報を秘密に保持し、任意の独自技術を含むことを確実にしなければならない。本プロトコル(または既存のセキュリティプロトコルに関しては、場合に応じて)は、締約国またはその任意の関連会社(“受信者”)またはその任意の代表、またはその受信者またはその任意の代表によって知られた情報(総称して“秘密情報”と呼ばれる)に提供される。受信者は、開示者の任意の秘密情報を任意の第三者に開示してはならないが、その代表またはその任意の分割許可者には、そのような使用または開示は、本プロトコルの下での受信者の義務を履行するために、またはその権利を行使するためであり、本プロトコルに規定されているものと実質的に同様の不使用および不開示義務の制約を受けることを前提としているかもしれない。受信者は、上述した代表がその義務に違反して開示または開示者秘密情報を使用する任意の行為に責任を負うべきである。受信側は暴露側の秘密情報を保護すべきであり,その慎重さは自身の機密情報に対する慎重さよりも低くないが,いつでも少なくとも合理的な慎重さをとるべきである.各当事者は、(A)不正アクセス、開示、または他方の秘密情報の使用を防止するために、適切なセキュリティ対策を実施し、維持し、(B)不正アクセスまたは他方の開示を他方に迅速に通知しなければならない

62秘密情報;および(C)このような許可されていないアクセスまたは開示のいずれかを調査および修復する点で、他方と協働する。9.1.2本プロトコルには逆の規定があるにもかかわらず、(A)[***]GSKは秘密情報とみなされるべきであり,GSKは暴露者とみなされ,矢印はこれに関連する受信者とみなされるべきであり,(B)(I)本プロトコルの存在および本プロトコルの条項および条件および(Ii)[***]いずれの場合も((B)(I)または(B)(Ii))は、すべての場合、双方の共同セキュリティ情報とみなされるべきであり、双方は、そのような情報が、第9.3節または第9.4節(場合により適用される)に従って許容される任意のニュース原稿、プレゼンテーション、または他の形態の開示開示において開示されない限り、そのようなセキュリティ情報の受信者とみなされる。9.1.3上記9.1節で受信者に開示および使用された開示者の秘密情報の制限は、(A)受信者が本プロトコルの下で開示される前に受信者に知られていた限り、(受信者の書面記録または他の合格証拠によって証明された)、(B)受信者が本プロトコルに違反していないため、または公共分野の一部となる限り、特定の秘密情報に適用されない。(C)合法的な権利を有する第三者によって開示される第三者は、開示者に対して第三者が負ういかなる守秘義務または不使用義務にも違反することなく、制限されずに開示されるか、または(D)受け手の者によって独立して開発され、マント側の秘密情報に依存またはアクセスしない(受信者の書面記録または他の合格証拠によって証明される)。9.2使用および開示が許可されます。9.2.1第9.1条の規定があるにもかかわらず、本9.2条の規定に適合する場合、受領側は、その義務を履行し、又はその権利を行使し、本協定項の義務を履行する際に、(A)第8条に基づいて特許権を起訴すること、(B)起訴又は弁護訴訟を含む開示者の秘密情報を開示することができる

63(C)本プロトコルに従って任意のライセンス製品の臨床前研究または臨床試験を実施すること、(D)本プロトコルに従って任意のライセンス製品の規制承認を求めるか、または(E)受信者の実際または潜在的パートナー、買収者、融資源、ライセンシー、(二次)被許可者およびそれらのそれぞれの人員に許可を提供し、各人が開示前に同様の守秘義務を遵守しなければならず、使用されない範囲は少なくとも第9.1節に規定されたものと同じである。9.2.2上記9.2.1(A)節から第9.2.1(D)節までに記載された任意の開示を行う際には、受信者は、合理的に実行可能な場合には、開示側に関連する合理的な開示要求の事前通知を発行し、その合理的な努力を尽くして開示者と協力して、開示すべき秘密情報が秘密に処理されることを保証しなければならない。さらに、いずれかの政府当局への本契約の提出が許可された場合、受信側は、(A)経済、商業秘密情報、および開示者が要求する可能性のある他の情報の秘密処理を得るために努力し、(B)開示者がコメントを提出する合理的な時間内に開示者に提案された秘密処理要求を提供し、受信者は、秘密処理要求を提出する際にこれらのコメントを誠実に考慮し、組み込むべきであり、(C)可能な限り合理的で実行可能な場合(いずれの場合も下回ってはならない)書面で開示者に提案された開示を提出すべきである[***]開示日が予想される前の営業日)は、このような意見を発表するための合理的な機会を提供するために、受け入れられる側は、そのような意見を誠実に組み込むべきである。9.2.3第9.1条の規定にもかかわらず、(A)受信者は、法律または裁判所の命令要求が適用された範囲内で開示者の秘密情報を開示することができる。しかし、受信者は、まず、そのような開示に関する事前通知を開示者に提供し、命令を撤回するために、または命令の標的または開示要求に属する機密情報および文書が裁判所または政府当局によって秘密にされることを要求するために、または開示されるように、または開示されるように、命令を発行するために、または適用された法律に従って開示を要求するためにのみ使用される合理的な機会を開示するべきである。さらに、命令されるべきか、または適用されるべき法律の要求に従って開示される機密情報は、命令またはその適用法律に戻るために法的に開示を要求する情報に限定されるべきであり、(B)受領側は、開示された側の機密情報を開示することができ、受け入れ側の弁護士が、そのような開示のいずれかが適用される法律または受領側証券上場が存在する証券取引所の規則に従って要求されると考える限り、(または)

64上場申請が提出された場合)、その弁護士が、受け入れ側が、適用された法律またはその証券取引所にある証券取引所の規則(または上場申請が提出された証券取引所の規則)に基づいて開示を行うと考える場合、受信者は、合理的で実行可能な範囲内で、合理的な機会を提供して開示についてコメントするために、合理的な実行可能な範囲内で可能な限り事前に開示者に提案開示を提出しなければならない。9.3宣伝。9.3.1最初のプレスリリース。各当事者は、修正された発効日後にそれぞれのプレスリリースを発行することができ、本協定(いくつかの条項を含む)が本協定別表9.3.1に添付されていることを宣言することができる。9.3.2さらなる宣伝。(A)第9.2節の許可または第9.3.1節、第9.3.2(A)節、第9.3.2(B)節または第9.4節に明確に規定された適用条項を除いて、いずれの当事者も、双方、本合意または本プロトコルで行われる取引または本合意条項に関する情報を開示するために、いかなるニュース原稿または公開声明を発行してはならない。または(B)他方の事前書面の同意を得ていない場合、(A)または(B)は、矢印のように、領土内で任意の許可された建築または許可された製品を開発、製造または商業化する。一方が、本9.3.2節の規定に基づいて、(例えば、関連会社を介して)任意のこのような公告を直接または間接的に発行することを望む場合、他方の同意を得る必要がある場合、締約国は、公告の性質、テキスト、および時間についてコメントを発表するための合理的な機会を他方に提供し、公告は短く真実であるべきである。(B)第9.3.2(A)節の規定にもかかわらず、グラクソ·スミスクラインは、矢印会社の書面による同意を事前に得ることなく、任意の許可建築物の開発、製造、または商業化に関する情報を開示する権利がある。(C)第9.3.2(A)節の規定があるにもかかわらず、矢印が第9.2節の権利を制限しない場合、矢印は、GSKの事前書面同意を必要とすることなく、いかなるプレスリリースも発行する権利があるが、本9.3.2(C)節の条項に適合すべきであり、それぞれの場合に限り、領土内の任意の許可建築が製品の開発、製造または商業化に関する情報を開示することができる事実陳述に限定され、このような情報がGSKまたはその任意の付属会社または所有者によって発行可能なプレスリリース(このような情報の前に公表されていることを前提とする

65情報(I)グラクソ·スミスクラインまたはその任意の関連会社または分割許可者がこの初期プレスリリースで提供した実質的な情報は変更されていない、(Ii)まだ正確かつ非誤解的とみなされている、(Iii)矢印(またはその任意の関連会社)によって知られている他の後続情報によって置換されていない、またはグラクソ·スミスクラインまたはその任意の関連会社または再許可者によって他の方法でその後に開示されていない)、ただし、第9.3.2(C)節に従って任意のそのような原稿を発行する前に、矢印は、合理的に実行可能な場合には、可能な限り書面でGSKに提案されたプレスリリースを提出しなければならない(いずれの場合もいかなる場合もそのような原稿を発表してはならない)[***]GSKがこれを検討およびレビューする合理的な機会を得るために、発行日の前の営業日)が予期され、GSKの要求に応じて、矢印は、(A)GSK(またはその任意の関連会社)の任意の機密情報をプレスリリースから削除し、(B)適用された場合、GSKのこれに対する任意の他の合理的なコメントを誠実に組み込むべきである。9.4出版物。改訂された発効日の後、矢印社は、GSKの事前承認なしに、任意の許可建築が製品の開発または商業化が可能であるかもしれない任意の出版物を地域内で発行する権利がなく、任意の許可建築に対して可能かもしれない製品のための任意の臨床試験または他の開発活動の任意の結果を発表することを含む。本協定には、疑問を免れるために、グラクソ·スミスクラインSが、グラクソ·スミスクラインSが製薬会社が後援した当時の臨床試験結果登録および報告に関する現行政策によって合理的に必要とされた任意の機密情報を含む、グラクソ·スミスクラインSが製薬会社が後援した臨床試験結果登録および報告に関する現行政策によって合理的に必要とした任意の機密情報を遵守することを含む、任意の相反する規定があるにもかかわらず、グラクソ·スミスクラインSが臨床試験の開示を含む、少なくとも矢印会社にこのような出版物を提出しなければならない[***]矢印の審査のために出版または提出される予定の前の営業日;(B)以下の場合、矢印は、グラクソ·スミスクラインに、いかなる具体的で合理的な、この出版物に反対する意見を通知する[***]グラクソ·スミスクラインは、前述の条項(A)に従って出版物を矢印会社に提出した後の営業日に、矢印会社(またはその任意の関連会社)の任意の機密情報の特定の開示に対する懸念に基づいて、任意のそのような機密情報を削除し、必要または好ましくは提案出版物から任意の他の情報を削除するかどうかを含む合理的かつ誠実な行動で任意の他のこのような反対意見を考慮し、(C)矢印会社の要求に応じて、矢印会社(またはその任意の関連会社)の任意の機密情報の特許性を保持するために、必要に応じてそのような出版物またはプレゼンテーションを延期しなければならない。また,矢印がGSKに書面通知を送信することで,この出版物の審査期間を最大1回延長することを選択することができる場合[***]矢印(またはその関連会社)のセキュリティ情報に関連する任意のそのような特許出願の準備および提出を許可するために必要な範囲内にのみ存在する。矢印は、グラクソ·スミスクラインに提供し、その適用を促す下請けに、そのような政策要件を満たすことに関連する合理的な要求の協力を提供することに同意する

66.9.5公平救済。秘密情報の独特な性質により、一方が他方の機密情報に関する第9条のいかなる行為に違反したり、違反したりするかは、他方に経済的損失を与えるだけでなく、補うことのできない損害をもたらすだけでなく、金銭的損害は十分な救済措置ではないことに同意する。したがって、他の任意の法律または平衡法救済に加えて、他方は、実際の損害を証明したり、いかなる保証書を送付したりすることなく、当該側の任意のこのような違約または脅威に対して禁止令または同様の衡平法救済を求める権利がある。第十条:陳述と保証10.1相互陳述と保証。矢印およびグラクソ·スミスクラインは、それぞれ宣言し、他方に保証する:(A)矢印の場合、元の実行日および元の発効日(元の合意に従って当時有効な条項のような)、および(B)各当事者について、改訂発効日から:10.1.1それは、本プロトコルを締結し、それぞれの本プロトコルの下でのそれぞれの義務を履行し、本プロトコルに従って付与されたライセンスおよび再ライセンスを他方に付与する権利がある。10.1.2規制部門の任意の承認(ライセンス製品の開発、製造または商業化に必要な定価または精算承認、製造承認または同様の承認を含む)に加えて、取得する必要があるすべての政府部門および他の人員のすべての必要な同意、承認および許可:(A)矢印について、最初の発効日まで(元の合意の際に有効な条項に従って)、および(B)各当事者について、改訂発効日までに、本協定の署名、交付および履行に関連するすべての必要な同意、承認および許可がその日前に得られた。10.1.3本プロトコルには何らかの逆の規定があるにもかかわらず、保証者は、本プロトコルに署名および交付する際に、本プロトコルの項目の下の義務を履行しなければならない(予想されるように(A)矢印に関して、元のプロトコルが発効した日から(元のプロトコルに従ってその時点で有効な条項);(B)各当事者について(改訂された発効日に)、かつ、締約国が本合意に従って付与される許可および再許可(I)既存の適用法律のいかなる要件とも衝突または違反しない、(A)矢印について、元の発効日、または(B)各当事者について、各場合において、改正された発効日は、締約国に適用され、(Ii)当該当事者またはその任意の付属会社の任意の契約義務と衝突、違反、違反、または違約を構成しない。元の発効日から、又は(B)各締約国については、改訂された発効日を基準とする。各締約国は、その付属会社が開発、製造、商業化に関連するすべての適用法律を遵守するように促すべきである

適用される医薬品管理法、臨床調査法、および医療保健法を含む67個の許可製品。10.1.4本プロトコルは、保証者に拘束力のある法的および有効な義務であり、その条項に従って強制的に実行することができる。10.2矢印の他の陳述および保証。Arroheadは、ここで宣言し、GSKに保証する:(A)最初の契約日(元の合意の際に有効な条項に従って行われたように)、および(B)修正された発効日において、Arroheadは、それに対するいかなるクレームがあるかを知らない(A)任意の矢印特許権または既存の共同協定特許権の無効、誤用、登録不可、強制実行または非侵害を主張するか、または(B)Arroheadの任意の矢印特許権または既存の共同協定特許権の所有権または許可権を疑問視する。10.2.2矢印特許権及び既存の共同協定特許権(改訂発効日まで)は、いかなる留置権、課金及び財産権の負担も受けない(矢印により第三者に付与された一般的な矢印特許権の下の非独占的許可を除く)、この等の付与は、(A)元の署名日に妨げられない。Janssenは、元の合意に従ってJanssenに許可を付与することができるすべての範囲を有してはならない;又は(B)改訂発効日において、グラクソ·スミスクラインは、改訂発効日後に本合意に従ってGSKに付与された許可の全ての範囲を使用してはならない。矢印会社によれば、矢印会社およびその任意の付属会社またはそのそれぞれの現職または前任社員は、いかなる第三者から矢印会社のいかなるノウハウを流用してもおらず、矢印会社も、このような流用行為が発生したと主張する第三者がいることを知らない。10.2.3矢印会社によれば、(A)(I)元のプロトコルの添付ファイルB-1およびその提供された任意の更新は、元の実行日までに矢印会社によって独占的または共通に所有されているすべての特定の矢印特許権を示し、(Ii)付表1.29-第1の部分は、改訂発効日までに矢印会社によって単独または共通に所有されているすべての特定の矢印特許権(総称して“所有特定矢印特許権”と呼ばれる)を示している。(B)(I)元プロトコル添付ファイルB-2及びその提供された任意の更新は、最初の実行日までに矢印会社によって独占的または共通に所有されているすべての一般矢印特許権を示し、(Ii)付表1.29-第2の部分は、改訂発効日までに矢印会社によって単独または共通に所有されているすべての一般矢印特許権(総称して“所有されている一般矢印特許権”と総称される)を示す。(C)(I)元プロトコル添付ファイルB-3及びその提供された任意の更新は、最初の実行日矢印までに第三者から取得されたすべての特定矢印特許権を示し、(Ii)付表1.29-第3の部分は、改訂発効日矢印までに第三者から取得されたすべての特定矢印特許権(総称して“取得特定矢印特許権”と総称される)を示す

元のプロトコルの68 B−3およびその提供された任意の更新は、元の実行日までに矢印によって第三者から取得されたすべての汎用矢印特許権を示し、(Ii)付表1.29~第4の部分は、修正発効日までに矢印によって第三者から取得されたすべての汎用矢印特許権(総称して“取得された汎用矢印特許権”と総称される)を示す。(E)(I)元プロトコル添付ファイルB-4及びその提供された任意の更新は、元の実行日までにArroheadによって第三者から許可されたすべての特定矢印特許権および一般矢印特許権を示し、(Ii)付表1.29~第5の部分には、修正発効日までにArroheadによって第三者から許可されたすべての特定矢印特許権および一般矢印特許権(総称して“ライセンス中の矢印特許権”と呼ばれる)、および(F)付表1.74に、改訂発効日までのすべての既存の共同合意特許権が示されている。いずれの第三者も、取得された特定の矢印特許権、取得された一般的な矢印特許権、または既存の共同合意特許権において平等で不可分な利益を有していない。Arroheadによれば、(A)Arroheadが元の署名日またはそれ以前の任意の時間に所有または合理的に取得可能なすべての記録に従って、発行された各発行された矢印特許権における元の署名日までの発明量は正しいであり、(B)Arroheadが改訂発効日または前の任意の時間に所有または合理的に取得可能なすべての記録に従って(誰が適用されるかに応じて)、各発行された矢印特許権または既存の共同協定特許権に列挙された改訂発効日に列挙された発明の量は(誰が適用されるかに応じて)正しい。10.2.4矢印会社によれば、任意の許可建築可能製品の開発、製造、または商業化に関する任意の予め存在する第三者合意に従って、矢印会社またはその任意の付属会社または第三者請負者に、任意の第三者の特許権を侵害することを書面で提出または脅したことはない。10.2.5矢印社によれば、矢印社は、最初の実行日までに、ARO-B型肝炎ウイルスまたはARO-B型肝炎ウイルスに関連する第三者をカバーするすべての特許権をヤンソンに開示している。10.2.6各ケースにおいて、最初の実行日まで、Arroheadまたはその関連会社、Arroheadまたはその関連会社が参加した判決または和解、またはArroheadに知られている限り、任意の許可構造が製品に関連するかもしれない係属中の訴訟または書面脅威訴訟はない。10.2.7矢印会社によれば、矢印会社およびその任意の第三者ライセンス者または任意の矢印知的財産権の譲渡者は、米国連邦政府またはその機関と合意された任意の合意の一方ではないか、またはこの合意に基づいて、米国連邦政府またはその機関は、任意の許可建築可能製品に関連する任意の研究または開発作業に資金を提供する(例えば、贈与または契約に従って)

69 10.2.8最初の実行日まで、矢印会社は、矢印社によって所有および制御されたすべての重要な情報をJanssenに提供し、矢印社に知られているように、これらの情報は、任意の許可建築可能製品に関連するかもしれない、または最初の実行日までに矢印会社によって所有および制御された以下の(ある場合)の完全および正しいコピーを含む、(A)有害事象データおよび報告;(B)すべての決定されたデータ、観察結果、分析、結論、要約および報告、ならびに(C)規制機関の検査報告、不良発見通知、警告手紙、規制届出および手紙、ならびに任意の規制機関に関連する任意の許可構築物または許可製品に関連する他の通信を含む、臨床試験報告および研究データ。10.2.9矢印グループによれば、元の契約日の前に、または矢印グループ(またはその任意のアクセサリ会社)またはその代表が、元のプロトコルに従って行われた任意の許可に従って、可能であろう製品のすべての研究および試験(任意の臨床前研究および臨床試験を含む)が、実質的に適用可能な法律に適合することが知られている。10.3矢印は、以前に存在するサード·パーティ·プロトコルについて提案されたさらなる陳述および保証を示す。矢印は、本明細書でグラクソ·スミスクラインに宣言し、保証する:(A)元の契約日(当時、元の合意の当時有効な条項に従って行われたような)、および(B)改訂発効日、10.3.1矢印が元の実行日の前に、(A)Janssenに提供または他の方法で提供されたこと、および(B)グラクソ·スミスクラインが、改訂発効日の前に、添付表1.163に規定されたすべての以前に存在する第三者合意(それに対する任意の修正を含む)の完全、正確、真実、合理的な編集のコピーを提供したことを保証する。10.3.2添付表1.163は、以前に存在したすべてのサード·パーティプロトコルを、修正を含むすべてのリストに示している。改訂発効日までに、(A)付表1.163第I部分は、第三者に提供されるすべての以前に存在する許可のリストであり、(B)添付表1.163の第II部分は、第三者から取得されたすべての以前に存在する許可のリストであり、(C)添付表1.163の第III部分は、第三者から取得されたすべての以前に存在する権利のリストである。10.3.3矢印によれば、既存のサード·パーティ協定のいずれの条項も、いかなるライセンス製品の開発または商業化にも重大な悪影響を与えない。別表1.163に別の説明があることに加えて、添付表1.163に列挙されている以前に存在するすべてのサード·パーティ合意は、最初の実行日または修正された発効日(誰が適用されるかに応じて)に十分な効力および効力を有し、その知る限り、矢印および各サード·パーティ取引相手は、すべての重大な態様で合意の条項を遵守している。矢印は、それは商業上の合理的な努力を尽くし、いかなる行動も取らないか、または行動しないことを約束し、以前に存在したいかなる第三者合意の採択に違反することを構成する

70修正された発効日および本プロトコルの有効期間内に、矢印は、修正された発効日または本プロトコルの有効期間内に、以前に存在した第三者プロトコルのいずれの修正も行われないことに同意し、いずれの場合も、違反または修正は、本プロトコル項目で予想される任意の許可製品の開発または商業化に重大な悪影響を及ぼす。期限内に、矢印は、グラクソ·スミスクラインに任意のそのような違約事件が発生したことを直ちに通知しなければならない(またはそのような違約疑惑の通知を受信する)。10.3.4矢印本プロトコルの第2.1.1節および第2.1.2節に従って付与されたライセンスおよび権利は、以前に存在したサード·パーティプロトコルによって制限されない。別表1.163に記載されているこのようなプロトコルの条項は、(A)元の実行日からヤンソン、または(B)改訂発効日から、グラクソ·スミスクライン(場合によっては)が、本プロトコルの第2.1.1節および第2.1.2節に従って付与された許可および権利のすべての範囲を十分に利用することを妨げないか、または阻止しない。10.3.5矢印会社によれば、この章の第2の文に記載されていることに加えて、改訂発効日まで、矢印は、任意の第三者といかなる合意も締結されておらず、これによれば、(A)Janssenは、元のプロトコルまたは(B)GSKに従って、修正発効日後に、本プロトコルに従って任意の特許権使用料またはマイルストーン支払いまたは他の支払いを第三者に支払うべきであり、それぞれの場合、JanssenまたはGSK(場合によっては)が任意のライセンス製品を商業化するため、またはJanssenまたはGSK(場合に応じて)によって任意のライセンス製品を商業化する。10.3.6矢印は、任意の第三者に対して選択権、第1の要件、または交渉権利または同様の義務がなく、許可建築可能製品(ARO-B型肝炎を含む)に関連し、そのような義務が存在した場合、義務をトリガする条件が満たされていないか、または完全に満たされていないか(場合に応じて)、矢印が元の合意に従ってARO-B型肝炎を(A)Janssenまたは(B)修正された発効日後の本合意項目の下のGSKに独占的に許可することを可能にする。10.3.7 ARO-B型肝炎ウイルスは、第三者の特許権またはノウハウを使用して開発されたものではない[***]それは.10.3.8 Arroheadは、第三者にArrohead特許権、Arroheadノウハウ、既存の臨床データ、または既存の共同プロトコル特許権の下の任意の許可または権利を付与していない(A)Arroheadが本プロトコル2.1.1節および第2.1.2節に従って付与された任意の許可または権利と競合していないか、または(B)任意の分野で提供、販売、または他の方法で商業化された任意の分野の任意の許可構造は、最初の実行日または修正の発効日までに満了または終了していない可能性がある製品であるかもしれない(場合によって決定される)。10.4改正発効日から、矢印の他の陳述、保証、およびチェーノ。改正発効日から、矢印はグラクソ·スミスクラインに宣言し、保証した

71 10.4.1添付表10.4.1に記載されている範囲に加えて、Janssenは、元のプロトコル第10.2.2節に従って、元のプロトコル項目の下の任意の活動(またはその中の任意の特許権)によって生成された発明をArroheadに譲渡しない。10.4.2矢印知的財産権のすべての場合、(A)矢印およびその付属会社は、書面合意または適用法の実施に従って、発明または創作に参加するすべての従業員および独立請負業者から、矢印知的財産権のすべての所有権の譲渡を取得し、(B)そのすべての従業員、高級管理者、請負業者およびコンサルタントは、適用可能な法律に従って合意に署名するか、または既存の義務を負うことができ、本合意中および本合意のためになされた発明および発明のすべての権利、所有権および利益を矢印またはその付属会社に譲渡することを要求する。(C)矢印またはその付属会社の上級職員または従業員は、任意の他の第三者と達成された任意の合意の制約を受けず、これらの高級職員または従業員は、任意の矢印知的財産権の任意の権益を任意の第三者に譲渡しなければならない。10.4.3矢印またはその任意のアクセサリまたはその任意のアクセサリ(元の効力発生日前または改訂発効日前の元の合意期間内)に任意のライセンス製品の臨床試験を行う際に収集または使用される任意のヒト生物サンプルについて、(A)改訂発効日まで、矢印またはその任意のアクセサリまたはその代表によって行われる任意のライセンス建築が、製品の開発、製造、または商業化によって使用されることができるかもしれない任意のそのようなヒト生物サンプルが取得され、保存され、譲渡され、すべての実質的な態様において、人体組織の収集、使用、輸送および処置に関する適用法律および任意の公認された道徳的基準に従って使用および処置する。(B)患者、ヒト対象ボランティアまたは他のドナーから得られた改訂発効日に矢印またはその任意の付属会社またはその代表によって行われる任意の許可構造が、製品の開発、製造または商業化に関連するかもしれない任意のヒト生物サンプルを使用することができるように、倫理委員会のすべての承認を得た。(C)矢印またはその任意のアクセサリまたはその任意のアクセサリによって行われる任意の許可構築物またはライセンス製品の開発、製造または商業化において、そのような任意のヒト生物サンプルを使用すること。(D)改正施行日まで、矢印またはその任意の連合会社またはその代表による任意の特許建造または特許製品の開発、製造または商業化のためのヒト胚または胎児由来材料(細胞系を含む)は存在しない。10.5保証なし。本協定には他に明文の規定があるほか,いずれの当事者も以下の各当事者にいかなる陳述やいかなる形式の明示的または黙示保証を提供しない

72その他の当事者は、各当事者は、適切性および特定の用途への適用性のすべての黙示保証を放棄する。各方面はいかなる陳述や保証も行わず、本協定の許可による建設が可能な製品の開発、製造と商業化が成功するかもしれないことを保証せず、許可製品に関連するいかなる特定の販売レベルが達成されるかも保証しない。10.6弁護士資格を取り消す必要はありません。いずれの当事者も、改正された発効日まで、GSKおよびその任意の付属会社は禁止または禁止されておらず、いずれの当事者またはその付属会社も、米国連邦食品、薬物および化粧品法案第306条によって禁止されているいかなる人、または外国と同等の人、またはこの条項に記載された有罪判決対象を、いかなる製品の開発、製造または商業化においても使用しないことを示し、保証する。各当事者は、その本人または本協定の下で活動する者が禁止されている場合、または米国連邦食品、医薬品および化粧品法第306条または任意の外国等価物に記載された有罪判決を受けた場合、または任意の訴訟、訴訟、クレーム、調査または法律または行政訴訟が行われている場合、またはその当事者の知る限り、脅威を受けており、その当事者またはその任意の付属会社が任意の身分で使用されている任意の人と、任意の許可構造が製品の開発、製造または商業化に関連するかもしれない資格剥奪または有罪判決に関連している場合、直ちに他方に書面で通知することに同意する。10.7反腐敗適用法を遵守する。各締約国は、各関連会社、第三者下請け、および許可者が本協定の下で活動を展開する際に反腐敗法を遵守するように促すべきである。10.8矢印社の知的財産権を維持します。契約期間内に、グラクソ·スミスクラインの事前同意を得ず、矢印は、(A)譲渡、(任意の留置権、担保、担保権益、担保または同様の訴訟によって)、または任意の第三者と任意の合意を達成して、任意の矢印知的財産権を譲渡、担保または処分するために、任意の第三者といかなる合意を達成することができない。または(B)通常の業務中に適用法(A)または(B)に従って任意の矢印知的財産権を保持しておらず、任意の場合(A)または(B)、本プロトコルに従ってGSKに付与された任意の権利または許可(第2.1.1節および第2.1.2節を含む)とGSKとの任意の方法で衝突、制限範囲、または任意の実質的な点で悪影響を及ぼす。その間、矢印会社(それ自体およびその付属会社を代表する)は、任意の矢印会社の知的財産権が矢印会社(またはその付属会社)によって制御され、それによって制御され続けることを保証するために契約を締結し、したがって、矢印会社は、第2.1.1節および第2.1節の規定を含む、グラクソ·スミスクラインに矢印知的財産権を付与する権利および許可の全ての権利を保持する。10.9 GSKプロトコルLC/LP IPのメンテナンス。第8.3.4(G)節に該当する規定の下で、グラクソ·スミスクラインは有効期間内に(関連会社にも)(A)譲渡を促してはならない

73(任意の留置権、担保、担保権益、担保または同様の訴訟によって)または任意の第三者と任意のプロトコルを締結して、GSKプロトコルLC/LPの任意の知的財産権の譲渡、担保または処置(留置権、担保、担保権益、担保または同様の訴訟によって)または任意の第三者に処置するために、矢印の事前同意なしに、(任意の留置権、担保、担保または同様の訴訟によって)または任意の第三者に処置するために、または任意の第三者に処理するために、矢印の事前同意なしに、(任意の留置権、担保、担保または同様の訴訟によって)または任意の第三者に処理するための任意のプロトコルを締結する。または(B)通常のトラフィック中に適用法(A)または(B)に従って任意のGSKプロトコルLC/LP IPを保持することができず、任意の場合(A)または(B)、本プロトコルに従って矢印に付与された任意のGSKプロトコルLC/LP IPの任意の権利または許可と任意の方法で衝突し、制限範囲、または任意の実質的な点で悪影響を与えることができ、(適用状況に応じて)終了時に任意のこのようなGSKプロトコルLC/LP IPに従って矢印の許可を付与することを含む、または(B)通常のトラフィック中に適用される法律(A)または(B)に従って任意のGSKプロトコルLC/LP IPを保持することができない。しかしながら、第10.9節のいずれの規定も、GSK(またはその任意の関連会社)の権利を制限または制限するとみなされてはならない:(I)GSKプロトコルLC/LP IPの起訴、強制実行または弁護第VIII条に従って、(Ii)有効期間内にGSKプロトコルLC/LP IP項の下の任意の第三者に許可または再許可(複数のレベルを介して含む)を付与するが、本プロトコル項の下の矢印の権利および許可(13.6.2節の許可を含む)によって制約されるか、または(Iii)他の方法で使用または実行されるGSKプロトコルLC/IPのいずれかを使用するか、または実施する。本プロトコルの下の任意の許可建築が可能かもしれない製品の開発、製造、商業化、または他の利用に関連するものを含む。Xi:賠償保険第11条賠償義務。各当事者(“補償者”)は、他方およびその被補償者(“被補償者”と総称される)を弁護し、賠償し、補償された第三者が提起された任意の訴訟によって受ける可能性のある任意およびすべての損失から補償しなければならない。このような損失が、以下の理由によって引き起こされるか、または引き起こされる限り、(A)補償者またはその任意の補償者が、本合意項の下の権利を行使する際、またはその義務を履行する際の深刻な不注意または故意の不正行為;(B)補償者は、本合意の下での任意の陳述および保証、契約、合意または義務に違反し、(C)補償者またはその任意の被補償者は、補償者の権利を行使するか、または本合意の下での補償者の義務を履行する際に適用法に違反し、(D)補償者またはその任意の関連会社、分被許可者または(分)許可者またはその任意またはその請負者によって、本合意項下の任意の許可を開発または製造することができるかもしれない。および(E)GSKが補償者として機能する場合、GSKまたはその任意の関連会社またはその再ライセンス者またはその任意の請負者またはGSKまたはその任意の関連会社またはその再実施許可者またはその任意の請負者を代表して任意のライセンス製品を商業化し、各場合(A)~(E)は、そのような損失が本第11.1項に従って他方によって負担されない限り(場合に応じて)補償義務によって補償される。明確にするために、本11.1節では、任意の一方(またはその任意の関連者またはそのそれぞれの二次実施許可者、(二次)被許可者または請負者)は、いずれの場合も、他方(またはその任意の関連者、それらまたはそれぞれの二次許可者、(二次)被許可者または請負者)を代表して行動するとみなされてはならない

74.11.2賠償要求。11.2.1通知。第11.1項によれば、補償者が被補償者に対して法的責任を有するいかなる訴訟であっても、被補償者は、実際に実行可能な場合には、速やかに書面で当該訴訟を補償者に通知しなければならない(“クレーム通知”)。未通知または遅延通知補償者は、このような失敗または遅延が補償者にその行為に関連する実際の損害をもたらす場合に限り、補償者の被補償者に対するいかなる責任も免除すべきではない。クレーム通知は、補償者またはその任意の補償者が、第11.1条に従って提起される賠償または補償請求に関連する訴訟を意図していることを合理的に詳細に説明しなければならない。このような合理的な詳細が提供されていない場合は、補償者が補償者に対して負う可能性のあるいかなる責任も免除されず、このような詳細が提供されていない限り、補償者がそのような行為に関連する実際の損害をもたらす程度に限定される。保障された方は,当該訴訟で送達されたすべての書類の写し(あれば)を申索通知書に添付しなければならない.補償された当事者がクレーム通知を受けた日から30(30)日以内に通知を出し、その訴訟およびその選択された弁護士のために弁護する権利を放棄することを示しない限り、補償された側は、その訴訟の弁護、和解、または他の処置を負担しなければならない。補償者が第11.2節の規定により訴訟を弁護する権利を放棄した場合、第11.2.3節の規定により、補償者は、当該訴訟の弁護、和解、又は他の方法で当該訴訟を処理する義務がある。11.2.2連携。各当事者は、本条項の条項に基づいて、誠実に対応し、抗弁し、和解するか、または他の方法でこのような訴訟を処理しなければならないが、(A)補償された側は、第11.2.3条に規定された任意の訴訟について任意の判決または和解を行う義務がないか、または同意しなければならない。また、(B)いかなる場合においても、補償を受ける側は、補償された側が第11.2.2条の規定に従って協力できなかったために、その違約行為が実際に被補償者の利益を損なわない限り、その義務を解除してはならない。双方はまた、どのような弁護においても協力し、法律の適用によって許容される範囲内で、相手がそれに関連するすべての非特権情報に合理的にアクセスすることを可能にしなければならない。11.2.3賠償側のコントロール。もし補償側が第11.2.1節に基づいて訴訟を引き継ぐ場合、(A)補償された側は自費で単独の協力弁護士を招聘し、訴訟の弁護に参加することができるが、補償側は訴訟の調査、弁護と和解を引き続きコントロールすべきであり、(B)補償側は事前に書面で同意されていないので、補償側は無理に抑留、条件を付加したり、遅延したりしてはならない。訴訟について任意の判決を下すことに同意するか、または任意の和解を達成することに同意するが、条件は、その判決または和解(I)が、補償された側またはその任意の被補償者に衡平救済(または任意の他の純粋な金銭的損害以外の済助)を与えることを規定するか、または補償者が負うことができない責任または義務を提供することである

75判決または和解が発効すると同時に、(Ii)賠償側はいかなる金銭的救済も完全に解除されないことを規定し(補償された者およびその被補償者にいかなる追加請求も提起しない)、(Iii)訴訟中のすべてのクレーム(または判決または和解に関連する部分)について補償者およびその被保障者を完全かつ無条件に解放するか、または(Iv)被補償者またはその補償者によって誤りを認められる条項を含む。11.2.4臨時規制。ある特定の訴訟に対して賠償者が確定するまで(ある場合)、その訴訟の影響を受ける一方は、その訴訟を弁護および制御する権利があるが、他方の事前書面による同意なしに、その訴訟について任意の判決を下すか、またはその訴訟について任意の和解を達成することに同意する権利はない(同意は無理に拒否されてはならない、条件を付加し、または遅延されてはならない)。11.2.5不法居住区。補償者が事前に書面で同意しておらず(無理な拒絶、追加条件または遅延に同意してはならない)、被補償者は、本契約の下で賠償を求めるいかなる訴訟についてもいかなる判決またはいかなる和解を行うことにも同意しない。この補償者は、補償者によって事前に書面で同意されずに達成された任意の和解または任意の判決について被補償者に賠償または補償を行う義務はない。11.2.6割り当て。本条xiに基づいて提起された任意の訴訟において、被補償者が発生した金額には、被補償者に賠償する義務がある損失と、そのような賠償に含まれない損失が含まれている場合、管轄権のある裁判所が別途決定していない範囲内で、双方は善意に基づいて行動し、その合理的な努力を尽くしてこのような損失の公平で合理的な分配を決定することに同意する。このような損失のいずれかの当事者間の分配は,管轄権のある裁判所によって他の方法で決定されていない場合は,各当事者がこのような分配について書面で合意していない場合は,第14.3条に基づいて仲裁により決定し,当事者又は仲裁人(場合によっては)は本条xiに規定する賠償及び補償原則に基づいて分配しなければならない。上記の規定にもかかわらず、いずれか一方がこのような損失に対する責任が当該訴訟(または当該第1の訴訟に拘束力のある任意の他の訴訟)において論争がある場合、双方は、第11.2.6節で行われた訴訟によって引き起こされる任意の損失争議を仲裁に提出する権利がない。11.3緩和。補償を受ける側は、補償された人がすべての状況下で合理的なステップをとることを促し、彼らが以下の原因で被ったいかなる損失を軽減しなければならない

76は、本合意に従って他方の賠償を要求する任意の訴訟に関連する。11.4保険です。11.4.1各締約国は、期限内および期間内に本プロトコルの義務および責任を負うのに十分な十分な有効な保険(または実質的に同じレベルおよびタイプの保護を提供するのに十分な自己保険)を自費で購入し、維持しなければならない[***]数年後、似たような状況の会社の正常なビジネス慣行と一致した。このような保険は、いずれか一方の本協定項における賠償義務の責任を制限するものと解釈されるべきではないことを双方は理解している。11.4.2本プロトコルに従って任意の臨床試験または関連開発活動を開始する前に、適用活動を担当する側は、臨床試験を行う地域の適用法律に適合する臨床試験保険(任意の自己保険手配を含む)を確保および維持し、全費用を自己負担しなければならない。11.4.3双方は上記のすべてまたは一部の限度額を自己保証することを選択する権利がある。書面の請求により、締結双方は、締結他方に、本協定項の下で必要な保険範囲を証明する保険証明書を提供しなければならない。また、締結側が契約期間内のいつでも、当該協定項の下で負担する義務について同じ保険レベルを維持しなければならない場合、当該締結他方は、この状況を直ちに他方に通知しなければならない。上記の規定にもかかわらず、いずれか一方が十分な保険を維持できなかったことは、本プロトコルで規定されている義務を解除しない。11.5責任制限。本合意に相反する規定があっても、法律で許容される最大範囲内であっても、(A)当事者は、第11.1条に基づいて第三者が提起したクレームによるまたは発生した損失に対してそれぞれの賠償義務がある場合を除く。(B)一方の深刻な不注意、故意の不正行為または詐欺。または(C)いずれか一方が第9条の機密および非使用義務に違反し、いずれの場合も、任意の一方またはその任意の関連会社が、他方またはその任意の関連会社に対して、任意の間接、懲罰的、特殊、付随、懲罰的または後の結果的損害(収入損失および利益損失(直接的または間接を含む)を含む)、責任理論(契約、侵害行為、不注意、厳格な責任またはその他を含む)にかかわらず、いずれの場合も、本合意、本合意に予想される取引または本合意違反に関連するいかなる行為にもかかわらず、当事者またはその当事者の任意の代表が通知されたかどうか、または他の方法でそのような損失または損害が予見される可能性があるかどうか、またはそのような損失または損害が合理的に予見可能であるか否かにかかわらず

77第12条:排他性12.1排他性。改訂された発効日から現在まで[***]周年記念(“排他的条項”)は、矢印は、以下の方法で沈黙を実現するために、B型肝炎ウイルスゲノムとハイブリダイズすることを意図して、その付属会社(A)単独または任意の付属会社または第三者との共同開発、製造、または商業化を促進すべきではなく、以下の方法で沈黙を実現する二本鎖RNAiトリガーである[***](B)任意の第三者と合意または他の手配を締結し、合意または手配に従って、矢印またはその付属会社は、第三者に任意のライセンスまたは他の権利を付与して、開発、製造または商業化の分野内の競合製品(場合によっては(A)または(B))を付与する。12.2変更例外を制御します。第12.1条の規定にもかかわらず、排他的期間内に、矢印又はその任意の付属会社が制御権変更が発生し、買収側がいかなる競合製品の許可又は他の権利を所有しているか、そうでなければ、矢印が第12.1条の排他的義務に違反する場合は、その買収者及びその任意の付属会社(制御権変更前の矢印及びそのすべての付属会社は含まれていない)は開発を禁止されない。矢印が第12.1条に従って負担する排他的義務に従って競合製品を製造または商業化するので、12.2.1当該買収者(および任意の関連会社)がGSKの任意の共同プロトコルIP、GSKプロトコルIP、または競合製品の開発、製造または商業化に関連する任意の他のセキュリティ情報を使用、アクセス、または参照しない限り、12.2.2このような買収側機関(それ自体およびそのような関連会社の場合)は、(A)本プロトコルの下で任意の活動を行う任意の人員、または任意の共同プロトコルIP、GSKプロトコルIPまたはGSKの任意の他の機密情報にアクセスすることができる者、および(Ii)本プロトコルの下で任意の活動を展開する任意の人員、または任意の共同プロトコルIP、GSKプロトコルIPまたはGSKプロトコルの任意の他の機密情報にアクセスすることができる者を含む、商業的に合理的な技術および行政保障措置をとる。および(B)本協定項目の各活動およびこのような競合製品に関する活動について、実験室ノートと記録および単独の作業者を単独で保存する。12.3買収ビジネス例外。第12.1条の規定にもかかわらず、排他的期間内に、矢印またはその任意の関連会社が任意の資産または業務を買収した場合、合併、業務合併、資産購入、株式購入、または他の方法で完了した場合(“買収事業”)であり、買収直前に所有、所有、または任意の競合製品を含む任意の許可または他の権利を有し、そうでなければ、矢印が第12.1条の排他的義務に違反する場合、矢印は(A)これらの情報をGSKに通知する

78書面の競合製品よりも遅くありません[***](B)第12.3.1節に基づいて競合製品の開発を終了するか、又は第12.3.2条に従って競合製品を剥離する(ただし、矢印は、上記(A)項に従って提供された通知において、次のいずれを実行するかを具体的に説明し、この決定は最終決定であり、矢印及びその付属会社に対して拘束力を有するものとする)。また,矢印およびその関連会社は,12.3.1節の任意の終了または12.3.2節の資産剥離(場合によって決定される)による懸案期間中にも,12.2.1節および12.2.2節に規定された要求を遵守し,必要な融通を行う:12.3.1矢印は,その競合製品の開発を選択的に終了することができ,この場合,矢印とその関連会社は,合理的で実行可能な範囲内でその競合製品のすべての開発をできるだけ早く停止する[***]このような買収業務が完了してから数日以内に、道徳的関心および法律適用の要求および第三者との任意の合意を適切に考慮しなければならないが、矢印は、グラクソ·スミスクラインの完了した終了を書面で通知しなければならない;または12.3.2矢印は、そのような競合製品自体を剥離することを選択し、GSKが完了した剥離を書面で通知することができるが、このような剥離は、[***]この買収業務が完了してから数ヶ月後です。12.4非制御トラフィック異常。疑問を生じないために、本プロトコルにいかなる逆の規定があっても、第12.1節の任意の規定は、矢印またはその任意の関連会社が、任意の競合製品の任意のライセンスまたは他の権利を所有または所有する任意の人の非持株権を買収または所有することを禁止するものと解釈することはできないが、取引または関連取引の一部として、(A)矢印または関連会社は、競合製品の任意の所有権、許可、選択権、または他の権益または権利を付与されていない。(B)矢印または関連会社は、個人またはそのような競合製品の開発、製造または商業化の管理を示すために、任意の議決権席または任意の他の権利を付与しておらず、(C)当該関係者は、GSKの任意の共同プロトコルIP、GSKプロトコルIP、または任意の他の機密資料を使用して、競合製品を開発、製造または商業化するために、任意の許可または権利を付与していない。12.5黙示の排他性はない.本プロトコルに明示的に規定されている制限(第12条に規定する制限および第2.1.1節または第2.1.2節に従ってGSKの独占的許可が付与されていることを含む)を除いて、本プロトコルの任意の内容は、ヤンソンまたは矢印またはその任意の関連会社が任意の分野で許可製品と直接または間接的に競合する任意の製品を開発および商業化する権利を含む、任意の当事者またはその任意の関連会社が世界の任意の場所で任意の商業活動、投資または他の機会に従事する権利を制限するものと解釈されてはならない

79第13条:期限と終了13.1プロトコルの期限。第XIII条に基づいて早期に終了しない限り、本協定の期限(“期限”)は、改正された発効日から始まり、国毎及び個々のライセンス製品に基づいて、その国に適用されるライセンス製品の印税期限が満了するまで全面的に有効でなければならないが、本プロトコルは、本契約項の下のすべてのライセンス製品の印税期限が満了した後の最終日に全て終了しなければならない。13.2契約違反のため、契約を早期に終了します。13.2.1契約違反通知および救助期間。一方(“違約側”)が本合意に実質的に違反した場合,他方(“非違約側”)は違約側に通知し,このような実質的な違約の性質を説明する権利がある.もし本協定に違反する行為が是正可能であれば,違約側は一定期間を要するべきである[***]通知を受けた日から数日(“治療期”)は、重大な違約が非違約者に与える損害を有効に救済する方式でこのような重大な違約を救済する。上述したように、このような違約の性質は是正可能であるが、治療期間内に合理的に治癒することができない場合、このような違約が本契約項目の支払い義務でない限り、違約方向が違約でない方がこのような違約を是正する書面計画を提供し、この書面計画に従って商業的に合理的な努力をしてこのような違約を救済する場合は、その救済期間を延長すべきであるが、超えてはならない[***]日数(合計延長に対する治療期間[***]日数)は,非違約者の同意を得なかった。明確にするために、本条項は、任意の他の違約行為を他方に通知するか、または任意の他の違約行為を是正することを要求する権利を、任意の方法で制限すべきではない。13.2.2違約停止権。非違約者は、書面で違約者に通知して直ちに本合意を終了する権利がある:(A)違約者が救済期限(第13.2.1条による延長)内に重大な違約を是正しない場合、または(B)重大な違約が修復できない場合。上記の規定があるにもかかわらず、一方の善意が第14条下の紛争解決手続きに基づいて、違約の存在、重要性、または任意のこのような違約の救済措置が十分であるか、または第13.2項によって終了する権利に基づいて論争が生じなかった場合、このような終了は、第14条の紛争解決手続きによって終了し、治癒されていない実質的な違約が存在すると判定された場合にのみ有効である(または、より早い場合、違約者のために当該紛争を放棄する)。しかし、適用される治療期間は、任意のこのような紛争が未解決の期間中に費用を徴収し、第14条に基づいてこのような紛争を最終的に解決した後に再開しなければならない。疑問を生じないために,非違約者は本第13.2項に基づいて停止権を行使し,次の理由で損害賠償又は任意の他の救済措置を求める権利を損害してはならない

80違約者の実質的な違約は法律上または衡平法で得ることができるが、本契約条項の制限を受ける。13.3破産を早期に終了する。13.3.1一方(または本プロトコルの譲渡が許可された場合、その権益相続人)(“破産者”)が破産した場合、他方(“非破産側”)は、破産者に直ちに本プロトコルを終了するように書面で通知することができる。13.3.2一方が本合意に従って他方に付与されたすべての許可及び他の権利は、破産法第365(N)条(又は他の管轄区域法律の類似規定)については、破産法第101条(又は他の管轄区域適用法律の類似規定)によって定義された“知的財産権”権利の許可であり、そうでなければ、破産法第365(N)条(又は他の司法管区法の類似規定)とみなされる。本協定には相反する規定があるにもかかわらず、破産者が破産法(又は他の管轄区域適用法の類似規定)に基づいて破産手続を開始するか、又は破産手続に関連する済助命令(総称して“破産開始日”と総称する)を発行した後、(A)第13.3.1条の規定に従って本協定を終了する破産者から任意の権利を取得(又は再許可)する非破産者の代わりに、当該非破産者は、本合意の下で破産側のこのような権利の許可者である。破産者側が破産した後、破産法(又は他の管轄区域の類似適用法)下のすべての権利及び選択権を保持し、十分に行使することができる。又は(B)第13.3.1条に規定する権利又は本協定に規定する他の権利を除いて、非破産者は、当該非破産者が許可又は本プロトコルの下で他の権利を付与されているいずれかの当該知的財産権及び当該知的財産権のすべての具現化された完全コピー又は完全アクセス権(例えば、非破産者が適切と考えられる)を取得する権利があり、当該知的財産権がその手に入っていない場合は、速やかに非破産者に交付しなければならない:(I)当該等の破産発効日の後、非破産者の書面請求を受けてから10(10)営業日以内に、破産者が非破産者側がこのような書面請求を受ける前に本協定を負担していない限り、又は(Ii)上記(I)項に基づいて交付されていない場合は、本協定を拒否することを許可された事項に管轄権を有する裁判所が命令を下したとき又は前に。破産者(債務者占有を含む任意の身分で)およびその相続人および譲受人(任意の受託者を含む)は、本プロトコルに従って、そのような知的財産権およびそのような知的財産権のアバタに対するその権利および許可を行使することに関与しないことに同意する。さらに、破産側は、破産法第363節に基づいても、第11章の計画に基づいても、非破産者によるこのような知的財産権の権利および許可を受けることなく、適用法が許容される最大範囲で、その知的財産権資産(任意の特許権を含む)を売却する任意の権利およびすべての権利を放棄する。本協定により非破産者側に

81本プロトコルで規定される任意の特許権、ノウハウまたは他の知的財産権(第2.2節または本13.3節に規定する特許権、ノウハウまたは他の知的財産権を含む)は、代替ではなく、破産者および非破産者に対して適用法に基づいて破産手続を開始する際に、適用法または平衡法に基づいて現在または後に存在する任意および他のすべての権利、権力および救済措置の補充であり、代替ではなく、本協定で明確に規定されている権利、権力および救済措置である。他のすべての権利と権力を行使する権利があり、この場合には法律または平衡法上現在または今後存在するすべての他の救済策に訴える権利がある。13.4安全の観点から、グラクソ·スミスクラインは契約を終了した。グラクソ·スミスクラインがその好意的判断に基づいて、許可製品の持続的な開発または商業化が安全に関連する原因によって不道徳または不合理であると判断した場合、例えば、GSKが関連データに対する好意的評価に基づいて、人間が許可製品の使用を継続することが安全または耐性発現の発生をもたらしたと考えられる場合、それにより、許可製品の対象集団に対する臨床的利益に対する重大な懸念(例えば、損害が許容可能な副作用プロファイルを著しく超える)を引き起こす場合、GSKは直ちに書面矢印で本プロトコルを終了することができる。このような終了はグラクソ·スミスクラインが書面で通知した後に直ちに施行されなければならない。13.5グラクソ·スミスクラインは適宜終了します。便宜上,グラクソ·スミスクラインは随時書面通知で本プロトコルを終了する権利があり,終了は有効である(A)[***]その通知が、任意の許可製品の最初の商業販売の前に発行された場合、その通知の日から発効する;および(B)[***]この通知が任意の許可製品の最初の商業販売後に発行された場合は,その通知の日から発効する。13.6早期終了の結果。本協定の早期終了の発効日には、以下の規定が適用されなければならない。13.6.1権利と義務の終了。各当事者は、一方が第2条に他方の許可および他の権利を付与することを含み、自動的に終了しなければならず、適用された終了発効日からさらなる効力および効力を有さないが、各当事者は、第13.9条、13.6条または双方による任意の書面合意を含む、本プロトコルの終了後に明示的に規定され得る任意の義務を履行することができるように、本合意の終了後の任意の権利を行使することを含む、本プロトコルの項目の下でそれぞれの権利、許可および義務を含む。13.6.2ライセンス付与を再開します。(A)[***]適用終了の発効日から、グラクソ·スミスクラインは、それ自身とその関連会社を代表して矢印およびその関連会社に付与される(矢印会社が後続の行動をとる必要はない)[***]GSK復刻IP開発を許可しました

82領土内の現場で終了した任意の製品を商業化し、他の方法で利用するが、上記のライセンスが[***]このGSK Reversion IPに含まれる任意のJanssenについて特許権を許可する.(B)任意のGSK排除ノウハウ又はGSK排除特許権については,矢印会社の要求に応じて,双方は誠実に交渉しなければならない[***]このようなGSK排除されたノウハウまたはGSKによって排除された特許権によって得られた許可は、矢印会社がこれについてGSKに支払う商業的に合理的な財務条項を含むべきである。13.6.3特許問題。(A)グラクソ·スミスクラインがグラクソ·スミスクラインに対して起訴を担当する任意の矢印特許権の起訴、弁護、および実行は、GSKによって独占的に担当される。矢印会社の要求に応じて、グラクソ·スミスクラインは合理的に協力し、起訴、弁護、およびそのような矢印特許権を実行する責任を矢印会社に渡し、矢印会社にそれが所有する任意の要求されたこれに関連する文書のコピーを提供しなければならず、費用は矢印会社が負担する。(B)(I)矢印が13.2.2条に従って本合意を終了し、又は(Ii)グラクソ·スミスクラインが第13.5条に従って本合意を終了した場合にのみ、各場合((I)又は(Ii))は、矢印の要求に応じて、双方がGSKが特許権を回復することについて交渉し、条項について合意することを誠実に行い、その中のいかなるJanssen特許権許可を含まない場合にのみ、(A)GSKが不起訴(又は起訴を継続することを選択した場合、特許権の発行前に特許権の優先権を要求する特許権を提出することを含む)のようなGSKは、特許権を回復する権利があり、矢印会社は、その特許権に対する起訴責任を単独で負う権利がある。(B)グラクソ·スミスクラインが、製品の製品侵害の終了に関連するいかなる行動も、GSK回復特許権の強制執行、またはGSK回復特許権のいずれかに挑戦する第三者訴訟を弁護しない場合、矢印は、強制執行訴訟を提起する権利があるか、または第三者訴訟を弁護する権利がある。13.6.4 GSK復帰ノウハウの譲渡[***]その後、有効日の終了後、グラクソ·スミスクラインは、双方が合意した方法およびフォーマットに従って、有効日の終了直後に任意のGSK回復ノウハウのコピーを矢印に提供しなければならず、各場合、有効日の終了に限定され、これらのコピーは、GSK(またはその関連会社)によって所有および制御され、GSK(またはその関連会社)が使用可能なフォーマットを採用するが、そのようなGSK回復ノウハウについては、(A)は、新しいものを構成する

83ノウハウを生成し、(B)特に任意の終了製品の製造に関連している場合、GSKは、矢印会社にそのようなコピーを直接提供するのではなく、Arroheadによって選択され(かつGSKが合理的に受け入れられる)Arroheadによって選択された(およびGSKによって合理的に受け入れられる)第三者商業製造業者にGSK回復ノウハウのコピーを提供することを自ら決定する権利がある。また、矢印は、このような第三者商業製造業者が終了後に本協定の関連条項および条件を遵守して責任を負うことに対応し、このような第三者商業製造業者に書面協定を締結し、第3.12節に規定された第三者下請け業者の要求(必要な修正を加える)を遵守することを要求しなければならない。明確にするために[***]この条項13.6.4については、グラクソ·スミスクラインが合理的に受け入れられる第三者商業製造業者とみなされなければならない[***]それは.13.6.5届出および規制承認の譲渡および譲渡を規制する[***]法律が適用され、適用法が許容される範囲内で、グラクソ·スミスクラインは、迅速に矢印会社(またはその指定者)に譲渡および譲渡を促進し、または譲渡および譲渡を促進しなければならない:(A)地域内で製品の任意およびすべての規制承認を終了し、(B)各場合(A)または(B)、終了発効日にGSKまたはその付属会社によって所有および制御される、GSKまたはその付属会社によって所有および制御される任意の重大な規制届出および規制承認、矢印は、このような規制届出および規制承認にすべての責任を負うべきである。しかしながら、いずれの場合も、グラクソ·スミスクラインは、(I)任意の組み合わせ製品の終了製品または(Ii)非終了製品の任意の化合物、構造または製品に関連する任意の規制承認または任意の規制届出を譲渡または譲渡する義務がない。グラクソ·スミスクラインがそのような規制記録または規制承認を矢印会社(またはその指定者)に譲渡し、発効終了日に発効できない場合、グラクソ·スミスクラインは、その関連会社を代表して、矢印会社に独占的、全額、印税免除、撤回不可能、永久的、再許可可能、世界的許可および参照権を同意し、付与することができ、これらの規制届出および規制(再許可およびより多くの参照権を付与する権利)は、この分野内で開発、製造、商業化終了する必要がある。しかしながら、GSK(またはその関連会社)が、本プロトコルの終了後に明確に規定された任意の義務を履行することができるように、GSK(またはその関連会社)が、本プロトコルの終了後に明確に規定された任意の義務を履行することを可能にするために、そのような規制届出および規制承認下のライセンス、参照権、または他の権利を保持しなければならない(場合に応じて)。13.6.6残りの在庫。グラクソ·スミスクライン(その付属会社および分割可人)は、矢印会社の同意を得た後、許可製品の任意の残りの在庫を販売または販売する権利がある

84本プロトコルの終了の発効日は、第VI条の下で適用される支払いおよび報告義務に依存する。13.6.7臨床研究。任意の許可製品の臨床試験が終了後も行われている場合、各当事者は、その関連会社、(分)請負業者または再許可者を規制スポンサーとして自費で臨床試験を継続し、関連する臨床試験に参加する被験者の安全、健康または福祉を保護するために、合理的な医学判断に基づいて必要と考えられる場合にのみ、またはより早い場合、研究を終了することを決定するか、または他の方法で研究を停止することを決定することは道徳的である。13.6.8秩序的に風下する。早期終了時には、双方は誠実に調整し、市場から任意の許可製品を撤回し、最終的に本協定の下で満期になったすべての支払いを入金することを含む、本合意項の下で発効日に行われている任意の許可製品の中止に関する開発、製造、商業化活動を段階的に終了しなければならない。13.6.9契約違反による契約終了を放棄しません。重大な違約により本協定を終了した被害者は、このような重大な違約と(生の疑問を免れるため)任意の他の本協定に違反する行為について損害賠償と他の救済を求めることもできる。13.7機密情報の返却。本プロトコルの満了または早期終了時には、受信者は、他方の要求(法律が適用可能な範囲内で)廃棄、修正または返却し、その関連会社、第三者下請け業者、および再被許可者に、その所有および制御された他方の秘密情報を含むすべての記録およびすべての材料を廃棄、修正または返還させ、このような廃棄、修正または返却の書面証明を提供することを要求しなければならない。ただし、(A)受信者は、受信者が合法的にアーカイブするために、他方の機密情報のコピーを厳密に秘密に保持することができる。(B)上記の廃棄、編集または返却の要求は、本プロトコルまたは双方(またはそれぞれの関連側)間の任意の他の書面プロトコルが、一方がそのようなセキュリティ情報を使用する権利を保持することを明示的に規定する限り、(例えば、共通所有者であるため、または本プロトコルの満了後(早期終了せずに)後に、グラクソ·スミスクラインのS許可権が継続して存在する限り、開示側のどのようなセキュリティ情報にも適用されない)。13.8終了プロトコルにおけるグラクソ·スミスクラインのいくつかの追加的な修復措置。GSKが13.2.2項に従って本プロトコルを終了する権利がある場合、GSKは、第13.2.2項に従って本プロトコルを終了するのではなく、GSKが第13.2.2条に従って本プロトコルを終了する代わりに、GSKが第13.2.2条に従って本プロトコルを終了する代わりに、GSKが本プロトコルを終了する代わりに矢印会社に書面通知を提供することを選択することができるが、GSKがこのように本プロトコルを継続することを選択した場合、GSKが本通知を矢印社に渡した後、[***].

85 13.9生存。本プロトコルの満了または何らかの理由で終了した場合、(A)第1条(定義)(それぞれの場合、存続条項にのみ使用される明確な用語)の規定、(B)第2.2条(破産法、ライセンスによる知的財産権の構成)、第2.3条(組合せ製品の権利)および第2.4条(他の権利なし)の規定、(C)第3.11条(記録);(D)節3.4(専有技術移転)および5.2節(技術移転)(それぞれの場合、本プロトコルの満了または終了前に発生したが支払われていない任意の支払い義務についてのみ);(E)3.6.2節(有害事象報告)(GSKおよび本プロトコルの満了または終了前に発生した深刻な有害事象についてのみ);(F)第6.3節(マイルストーン支払い)、第6.4節(特許権使用料支払い)、第6.5節(第三者債務)、および第7条(一般支払い条件)(場合によっては、本契約の満了または終了前に発生したが未払いのいずれかの支払義務についてのみ);(G)8.2節(合意知的財産権の所有権)、8.3.3(A)節、8.3.3(C)節、8.3.3(D)節、および8.3.3(F)節(特許権の起訴)(いずれの場合も、共同協定特許権のみについて)、(H)第8.9節(共通利益協定);(J)第10.5条(無担保);(K)xi(賠償及び保険);(L)第13.3.2条(破産早期終了)、第13.6条(早期終了の結果)、第13.7条(機密情報の返還)、及び第13.9条(生存);(M)第14条(紛争解決);(N)それぞれの場合において、第15条(雑項)及びその性質及び文脈から明らかに継続又は保留を意図している規定(例えば、説明目的のため)の規定は、引き続き有効でなければならない。また,疑問を生じないように,本プロトコルの満了または何らかの理由で本プロトコルを終了する場合には,いずれも本プロトコルの期限終了前に生じるいかなる義務も解除することはできない.したがって、本プロトコルは、本プロトコルによって付与された任意の許可権の放棄を含む任意の理由で全部または部分的に終了または満了し、本プロトコルの下で満了した任意のお金(いつ支払われてもよい)および任意の違約によって生じる任意およびすべての損害賠償を含む終了または満了前に生じるいかなる義務にも影響を与えない。さらに、終了または終了前に発生した任意の支払いは、終了または終了の有効日、または本契約にさらに規定されたより早い時間に支払われなければならない。第14条:紛争解決14.1は実行幹事に提出される。紛争が発生すれば、特許論争を除いて、いずれか一方がこの件を双方の執行官に提出して解決を試みることができる。執行幹事は、その法律顧問がその場にいる場合には、交渉によるいかなる紛争の解決を誠実に試みるべきである。執行幹事が提出後10(10)営業日以内(又は当事者が書面で合意した他の期間)内に彼らに提出された紛争を解決することができず、本協定の任意の他の規定に適合する場合には、当該争議は以下の第14条に規定する方法で解決されなければならない。14.2調停。実行幹事が提出後10(10)営業日(または双方の書面で合意された他の期限)内に第14.1条に基づいて彼らに提出された争議を解決できない場合は,双方はまず有益な試みを行わなければならない

86仲裁を開始する前に、国際紛争予防および解決研究所当時の調停手続き(“CPR調停プログラム”)(www.cPradr.org)に従って、秘密調停によって任意の紛争を解決すると信じられている。“CPR調停プログラム”は制御すべきであるが,本規定に抵触する場合を除き,この場合,本規定はその制御を受ける.調停者の選択はCPR調停手順に従って行われるべきである.調停はニューヨークニューヨークで行われなければならない。いずれの当事者も書面で他方に調停を開始することができる。双方は通知が出されてから20(20)日以内に調停者を選定することに同意し,調停作業は選定直後に開始することに同意した。調停は、仲裁者またはいずれか一方が紛争を解決する権利のある上級ビジネスマンが各側を代表して出席する実質的な調停会議が終了した後、一日前に書面で宣言されるまで継続され、紛争は調停によって解決できない。しかしいずれの場合も、当事者が書面でこの期間を延長することに同意しない限り、調停は、一方が最初に瞑想開始の通知を出してから六十(60)日を超えてはならない。調停開始から調停終了までの間に満了しなければならない任意の期限は、調停終了後20(20)日まで延長されなければならない。第14.1条または本14.2条の規定により紛争解決を試みた当事者間の議論は、争議仲裁において受け入れられてはならない。14.3仲裁。もし当事者が第14.2条に基づいて調停により解決策を達成できず,当事者が論争の解決を求めることを希望した場合,係争は当事のいずれか一方が当時の“CPR非管理仲裁規則”(“CPR規則”)(www.cPradr.org)に基づいて仲裁解決を提出しなければならないが,本規定に抵触する場合を除き,この場合は本規定を基準とする。14.3.1仲裁はニューヨークで行われる。仲裁のすべての側面は機密として扱われなければならない。14.3.2仲裁人は、双方ともそのグループにいない候補者を承認しない限り、CPR傑出中立者グループから選択される。仲裁人は弁護士でなければならず、少なくとも15(15)年に法律事務所または公司法部門で働いた経験があるか、または一般管轄権裁判所の裁判官を務めたことがある。紛争が特殊な専門知識を必要とする場合、当事者は選択手順が開始される前にCPRに通知する。14.3.3仲裁廷は3人の仲裁人から構成されなければならず、各当事者は“仲裁規則”第5.4条に規定する“スクリーニング”指定手続に従って仲裁人を指定しなければならない。議長はCPR規則6.4に従って選択されるだろう。しかし、当事者が求める裁決総額が500万ドル(500万ドル)未満であり、衡平法救済を求めていない場合は、“仲裁規則”に基づいて仲裁人を選択すべきである。14.3.4仲裁職の候補者(S)は、選択する前に当事各方面の代表が面談することができ、すべての当事者が代表を持つことが条件となる。14.3.5双方は、仲裁開始後45(45)日以内に仲裁人(S)を選択することに同意した。公聴会は9月中に終了する

87仲裁人(S)の選択および裁決は、公聴会終了後60(60)日以内に行われるか、または任意の公聴会後ブリーフィングが終了した後、双方は公聴会終了後45(45)日以内にプレゼンテーションを完了する。もし双方がスケジュールについて合意できなければ、仲裁人(S)は上記の期限に従ってスケジュールをできるだけ厳格に制定すべきである。14.3.6当事者が別途書面合意を持っていない限り、当事者が当時の“連邦民事訴訟規則”に基づいて聴聞前証拠を実行し、強制執行する権利がある場合。当事者が別途書面合意を持っていない限り、仲裁手続きによって行われるすべての証拠の表示は、当時の連邦民事訴訟規則によって管轄される。14.3.7公聴会は、10(10)以下の公聴会日に終了する。可能な限り多くの公聴会日が連続的に配置されるだろう。公聴会で提出された証言の調書を作成し、それをすべての当事者に提供しなければならない。14.3.8仲裁人(S)は、本協定に適用される法律に基づいて、他の法律の引用を招く可能性のある紛争法律原則は適用されない。仲裁人(S)は、“親しみやすい”や“自然公正と公平”などの原則を適用してはならない。14.3.9仲裁人(S)は、いかなる開廷前にも不公正動議を裁く権利があることを明確にし、その実体法が管轄する司法管区内の米国地域裁判所裁判官のように、このような動議について裁決を行うように努力すべきである。14.3.10仲裁人(S)は書面で意見を提出し、裁決に根拠する理由を説明しなければならない。双方は、これらの規定を実行するために、米国地域裁判所の仲裁の所在地域に対する管轄権に同意し、本合意によるいかなる裁決に対しても判決を下すことに同意した。もしこのような裁判所がどんな理由でも管轄権がなければ、管轄権のあるいかなる裁判所も同じ方法で行動することができる。14.3.11各当事者は、差し押さえ、予備禁止、再保証など、補うことのできない損害を回避し、現状を維持し、または紛争の標的を保全するために、適切な裁判所に一時的な救済方法を求める権利がある。CPR規則14条はこの協定には適用されない。14.4陪審裁判を放棄する。本協定の当事者はすべて放棄する:第14.2条または第14.3条の範囲内で、論争に関連するいかなる問題についても陪審員が裁判を行う権利。14.5一時救済または一時救済。第11.5条を含む本協定のいずれの条項も、一方が他方と紛争が発生する前又は期間に関連する臨時制限令、予備禁止又は他の仮平衡法救済を含む任意の管轄権のある裁判所が一時的又は一時的救済を求めることを妨げることはない

88当該当事者の利益を保護するために、本条第14条に規定する紛争解決手続。14.6司法管轄権に同意する。各当事者は、第14.3項に従って裁決を強制的に実行するため、又は第14.5項に記載の一時的又は一時的救済を求めるために、いかなる論争のある本合意違反行為についても、この目的のために任意の州又は連邦裁判所が開廷した任意の訴訟、訴訟又は訴訟の場所にいかなる異議を提起しないことに同意し、当該等の訴訟、訴訟又は他の手続が不便な裁判所で提起されたいかなる主張を撤回することができず、さらに当該訴訟、訴訟又は他の手続について反対する権利を放棄することができない、すなわち当該裁判所は当該側に対していかなる管轄権も持たない。いずれかの法律手続書類,伝票,通知又は書類を本協定に規定されている当事側の通知先に書留郵送で送達すること,すなわち,裁判所が第14.6節で提出した管轄権のいずれかの事項について裁判所で行われた任意の訴訟,訴訟又は訴訟手続が法的手続文書に有効に送達されることにも同意する。14.7従業員に対するクレームはありません。各当事者は、本プロトコルまたはその標的について、他方の取締役、役人、従業員、または代理人に対してクレームを提起しないことを約束し(詐欺または意図的な不正行為に基づくクレームは除く)、本プロトコルまたはその標的に対して訴訟を提起しない。この約束は個人の保護を目的としている:一方の当事者が他方の当事者に主張する可能性のあるいかなる権利も損なわない。14.8知的財産権紛争。本プロトコルには何らかの逆の規定があるにもかかわらず,本プロトコルの下で特許論争が発生した場合,その特許論争は,その特許論争の対象を付与または生成する適用特許権,ノウハウまたは他の知的財産権が司法管轄区域にある管轄権を有する裁判所に提出され,第14.2条下の調停または第14.3条下の仲裁を受け入れてはならない.第十五条:雑項15.1譲渡;相続人。15.1.1本プロトコルに明示的に規定されていない限り、他方の事前書面で同意されていない限り、本プロトコルまたは本プロトコルの下の任意の権利または義務は、自発的であっても法的に実施されてもよい(無理に抑留または延期されてはならない)。他方の同意なしに、各当事者は、本プロトコルの下でのその任意の権利および義務を任意の付属会社に譲渡または譲渡することができ、または任意の第三者に譲渡することができ、第三者は、本プロトコルに関連する許可建築および許可製品の全部または実質的にすべての資産または業務(資産または株式の売却、合併、合併、再編、または他の方法によっても)を取得することができる。このような譲渡又は譲渡のいずれかの後,各譲渡先は直ちに他方に書面通知を出さなければならない。第15.1項のいずれの譲渡も、譲渡先の本条項の下でのいかなる責任又は義務も解除せず、譲渡の条件として、譲受人は、本条項の下で譲渡先のすべての義務の制約を受けることに書面で同意しなければならない。本契約は相続人に拘束力があります

89および当事者の許可譲渡。本第15.1条の規定に適合しない譲渡又はその他の譲渡は,いずれも無効である。15.1.2節または本プロトコルの他の部分には相反する規定があるが、15.1.2節の制約の下で、矢印会社は、6.3.1節および6.3.2節に従って支払われた任意または全部の記念碑的支払い、および第6.4.2節および第6.4.3節に従って支払われた任意または全ての特許権使用料の権利を第三者に譲渡することができ、費用および費用は矢印会社によって負担される(各譲渡は“証券化取引”である)。しかしながら、(A)任意のこのような証券化取引が完了した後(ただし、いずれの場合も、少なくともそのような支払権譲受人である第三者に最初の適用支払請求書を交付する前の40(40)営業日)、矢印は、本プロトコルに従って第三者の納税住所を含む任意の支払いを受ける権利がある適用第三者を指定すべきであるという通知をGSKに提供すべきである。および(B)GSKの要求に応じて、矢印は、第3の方向GSKが、(I)第7節(必要に応じて修正される)に従って矢印によって提供されるべきそのような支払いに関する任意の情報、および(Ii)GSKが合理的に要求する任意の他の情報を要求して、第三者に支払われる任意のそのような支払いを処理することを要求すべきである。予想される証券化取引については、第三者とのいずれかのこのような証券化取引が完了した後、矢印は、GSKとの事前書面同意なしに、第7.2条に規定する特許権使用料報告を第三者に開示することができ、これらの報告は、GSKの秘匿情報を含むが、合理的に必要な範囲内で、第三者が証券化取引機会を評価することができるようにすることができる(ただし、このような報告および計画に含まれるセキュリティ情報には、9条の条項よりも厳格ではないが、同様の目的のために締結された秘密協定における常習期間内であることを前提とする)。そして、第三者が適用された場合に、証券化取引に関する権利を行使することができるようにする。すべての完了した証券化取引の一部として、矢印は、グラクソ·スミスクラインの事前書面の同意なしに、7.2節、7.5.2節、および第7.5.3節に従ってそれぞれ特許権使用料報告を受信し、監査を行う権利を証券化取引中の第三者に譲渡し、各場合において本プロトコルの適用条項および条件に従ってその権利を行使することを可能にすることができる。15.2免除。いずれの当事者も、本プロトコルの下の権利を主張することができず、または本プロトコルの任意の条項または条件を遵守することを主張することができず、その権利を放棄することを構成すべきではなく、他方がその後、同様にそのような条項または条件を履行できなかった口実を構成するべきでもない。書面で提出され、棄権を与えられた側によって署名されない限り、いかなる棄権も無効だ。一方が他方が違約した場合に本プロトコルで規定される任意の権利を行使することは、修復方法を選択すること、または任意またはすべての他の権利の行使を阻止することを構成しない(すべての権利および修復方法は累積されている)

90 15.3法律の選択。本プロトコル及びその解釈、解釈及び履行、並びに本プロトコルによって付与された権利及び生成された義務は、アメリカ合衆国ニューヨーク州法律の管轄及び解釈を受け、その訴訟時効を含むが、その法的衝突規則は含まれない。もしアメリカと外国の適用法律の間に何か衝突があれば、アメリカの適用法律を基準としなければならない。国連国際貨物販売契約条約は本協定には適用されない。15.4通知。いずれか一方が本プロトコルに従って他方に送信するすべての通知は、英語の書面(電子メールを含まない)を採用し、本プロトコルに特に言及し、自ら送達し、国によって認可された隔夜宅配便を送信するか、または書留または書留、前払い郵便、返送を要求する方法で以下のそれぞれのアドレスに送信しなければならない(または関連する当事者は時々通知によって指定された他のアドレス)に送信しなければならない。注意:総法律顧問がコピーを持って(通知を構成すべきではない)致:Gibson Dunn&Crutcher 555使命街、Suite 3000 San Francisco,CA 94105注意:ライアン·メルル致グラクソ·スミスクライン:グラクソ·スミスクライン知的財産権(第3号)有限会社グラクソ·スミスクライン薬物研究センターGunnels Wood Road Stevenage,SG 1 2 NYイギリス受取人:上級副総裁業務発展コピー(通知を構成しない)による:グラクソ·スミスクラインイギリスMiddlesex GW 8 9 Gs受信者:副総裁兼法律業務発展と会社責任者15.4.1実際に通知を発行し、受信した任意の早い時間に影響を与えることなく、いずれの場合も、アドレスの正しい通知は受信したとみなされるべきである:(A)送達時、受信者の正常営業時間内に直接送達される場合;(B)国によって認可された隔夜宅配便が送信され、配信証明が取得された場合、出荷後の第2営業日と、(C)郵送に合格した場合、郵送日後の第3営業日とになる

91 15.4.2本プロトコルの下の任意の仲裁または管轄権のある裁判所が訴訟手続を開始した場合、訴訟手続中に発行された任意の文書は、訴訟手続中に文書を送達することを管轄する手続規則に従って送達される。15.4.3本条項15.4は、本協定の一方の方向の通知を要求する場合に適用されます。双方間の他のルーチン通信、例えば連盟管理者間で彼らが本協定に規定する正常動作中に行われている活動に関する通信を、電子メールで行うことができるようにする。本プロトコルおよび双方間のすべての通知および通信の公式言語は英語でなければならない。15.5分割可能性。本プロトコルの全てまたは任意の条項が任意の理由で任意の司法管轄区域において無効、不正、または実行不可能と認定された場合、適用法によって許容される最大範囲内で、(A)本プロトコルの全条項が不正、無効、または実行不可能である場合、本プロトコルは関連司法管轄区域で終了すべきである。(B)本協定のいずれかの条項が合法的でないか、無効であるか、または実行できない場合、その部分は、関連する管轄区域において本協定から分離されなければならない(ただし、他のすべての管轄区域において完全に有効かつ有効であることが維持されなければならない)、および(I)本協定の他のすべての条項は、関連する管轄区域で十分な効力および効力を維持し、各当事者の意図を可能な限り達成するために自由に解釈されなければならず、(Ii)双方は、関連する管轄区域の適用法に適合し、実現するために、無効、不法または実行不可能と認定された条項の代わりに合理的な努力をすることに同意する。それに対する当事者の初心にできるだけ近い。15.6統合;改訂。双方は同意し、認めた:(A)修正された発効日から、本協定は元の合意を完全に修正し、再確認し、元の合意は本協定によって置換され、置換され、改訂の発効日からその後、双方の権利と義務は本合意の条項と条件によって管轄されるべきである。(B)改正の発効日の前に、矢印及びヤンソンの権利及び義務(並びにヤンソンの許可譲受人であるグラクソ·スミスクラインの権利)は、本合意が別途明確に規定されていない限り、元の合意の条項及び条件によって管轄されなければならない(第8.2.2節で述べたことを含む)。前述の規定に加えて、本合意は、本合意に添付されている付表、元の合意(添付ファイルとともに)および“薬物警戒協定”(あれば)と共に全体的な合意を構成し、既存の秘密協定を含む、双方が以前に本合意のテーマについて合意したすべての合意(書面でも口頭でも)の代わりになる。本協定の規定を除いて、本協定に書面で言及され、双方の正式に許可された官によって署名されない限り、本協定の任意の条項の放棄、修正、または修正は無効である。本プロトコルの添付表または他の付録のいずれかの条項が本プロトコルの本文と衝突した場合、本プロトコルの本文を基準とする

92 15.7拘束力がある;独立請負者;代理機関がない。改正発効日から、本協定は、双方及びそのそれぞれの許可相続人及び許可譲受人の利益に拘束力を有し、その利益に合致する。本合意が明確に規定されている以外に、双方及びそのそれぞれの関連先及び本プロトコル項の下で許可された譲受人を除いて、誰も本合意項の下の期待受益者とみなされてはならず、また、本合意を実行する権利を有するいかなる義務もあってはならない。どちらも、他方の従業員または代理人を雇用、解雇または補償するいかなる従業員福祉にもいかなる責任も負っていない。いずれか一方の従業員または代表は、コスト合意を制約または責任する権利のない他方が任意の金を支払うか、または任意の方法で、または他方に任意の契約または他の責任を生成または適用する権利がある。財務、税務、法律又はその他の目的から、本協定中のいかなる内容も意図せず、双方間のパートナーシップ、代理関係、合弁企業又は雇用主-従業員関係を構成するとみなされてはならない。15.8関連会社の業績。本プロトコルが明確に禁止されていない限り、いずれか一方は、その1つまたは複数の関連会社を使用して、本プロトコル項の下での義務および義務を履行することができるが、一方は、本プロトコル項の下でのすべての義務および義務をタイムリーに支払い、履行することに対応している。15.9不可抗力。いずれの当事者も、本プロトコルの履行が失敗または遅延または履行されなかった任意の条項によって本合意に違反または違反するとみなされてはならないが、本プロトコルの下の任意のお金の支払いは除外され、この未履行または遅延が、火災、洪水、禁輸、不足、流行病、検疫、戦争、戦争行為(宣戦の有無にかかわらず)、テロ、反乱、暴動、内乱、天災または任意の政府当局の行為、不作為または遅延を含む、非履行または遅延によって引き起こされる場合。不良側は不可抗力発生後5(5)営業日以内に他方に書面通知を行い、事件の性質、予想持続時間、及びその影響を回避又は減少させるための任意の措置を説明しなければならない。一時停止履行の範囲および持続時間は、必要な範囲を超えてはならず、一時停止履行期間全体にわたって、不履行者は、履行できない行為を救済するために商業的に合理的な努力をすべきである。しかし、不可抗力発生日後、一時停止履行が90(90)日継続した場合、双方は、本協定の目標を達成するためにどのように継続するかを誠実に議論する会議を開催すべきである。また,不可抗力発生日後に継続して1(1)年を超える履行を一時停止すると,(A)GSKが不履行側であれば,または(B)GSKが不履行側であれば,GSKは不履行側に通知した後に本プロトコルを終了する権利がある.本協定の場合、不可抗力は、本協定または一般市場または経済的条件に基づく活動のために十分な資金または他の資源を投入していないことを含むべきではない。15.10構築。本プロトコルで使用されるタイトルは参考と便宜のみであり,本プロトコルの解釈には適用できない.逆の明文規定がある以外に,(A)節,1つまたは一覧表に言及すると,すなわち1節または1条を指す

第93条または本協定およびそのすべてのサブ項の付表は、別の規定がない限り、(B)その項のすべての規則および条例、および当時有効な任意の後続法規、規則または条例を含むある特定の法規または条例に言及され、(C)単数または複数の形態の語は、それぞれ複数の形態および単数形態を含む。(D)本プロトコルで明示的に定義されていない本プロトコルで定義されている大文字用語の必然的な結果(複数および時制変化のような)の大文字用語は、対応する意味を有するべきである:(E)文脈が異なる解釈を必要としない限り、“または”という語は、一般的にフレーズ“および/または”に関連する包含的な意味を有し、(F)本プロトコルで使用される“含む”、“含む”、“例えば”および“例えば”などの用語は、そのような用語の以前の任意の説明を含む一般的な意味を意味し、“ただし限定されない”とみなされる。(G)本プロトコルが日数に言及する限り、この数字は、営業日が明確に規定されない限り、日歴日を意味し、(H)“本プロトコル”、“本プロトコル”、“本プロトコル”などは、それらが出現する特定の条項または条項ではなく、本プロトコルの全体を指すものと理解されるべきであり、(I)本プロトコルが禁止されていない範囲内で、ある人への言及は、その人の相続人および譲受人を含み、(J)本プロトコルで使用されるすべての言葉は、状況に応じて必要な性別または数として解釈されるべきである。(K)“人”への言及は、個人、法人団体(どこに登録されて設立されても)、非法人団体、共同企業を含む。(1)“含む”、“含む”、“含む”などの言葉は、オープンで非限定的な形で使用され、明確に説明されていなくても、“限定されない”などの言葉を含むと理解されるべきである。(M)“ドル”、“ドル”または“ドル”に言及する場合は、いずれもドルを指す。(N)“すべき”という言葉は、“すべき”という言葉と同じ意味および効力を有すると解釈されるであろう。(O)本プロトコルにおける任意のプロトコル、文書または他の文書の任意の定義または言及は、時々修正、追加、または他の方法で修正されるプロトコル、文書または他の文書(本プロトコルに規定されているこのような修正、補足または修正された任意の制限を受けることを意味する)と解釈され、(P)“通知”という言葉は、本プロトコル15.4条に従って交付されるべき任意の書面または通信を含む書面通知(明示されているか否かにかかわらず)を意味する。(Q)1つ以上の締約国が“同意”、“同意”または“承認”または同様の意味を要求する条項は、書面合意、書簡、承認された議事録または他の方法にかかわらず、そのような合意、同意または承認が具体的な書面であることを要求し、(R)本協定におけるGSK“二次被許可者”への任意の言及は、二次被許可者を含むと解釈されるべきである。本プロトコルおよび双方間のすべての通信の公用語は英語でなければならない.各締約国は、本協定について法律顧問によって代表され、本協定の起草作業に関与していることを認めた。本協定の条項及び規定を解釈及び適用する際には,双方は同意し,いずれの推定も当該等の条項及び規定を起草する側には適用されない。文意が別に指摘されている以外に,国は領土を含まなければならない.15.11さらに行動します。各当事者は、このような他の文書の署名、確認、交付に同意し、本協定の目的と意図を実現するために、すべての必要または適切な行動をとる。15.12料金です。本協定には別に規定があるほか、準備に関連するすべての費用、コスト、支出(任意の法律、会計、銀行費用を含む)、

94本のプロトコルの交渉、実行および交付、および本プロトコルを達成するために意図された取引は、それによって生成された費用、コスト、および支出が本プロトコル側によって支払われる。15.13コピーに署名し、ファックスで署名します。本プロトコルは、コピーに署名することができ、各コピーは、署名および交付時に正本とみなされるべきであり、すべてのコピーを加算することは、双方が同じコピーに署名していなくても同じ文書を構成しなければならない。一方は、本契約をファックスまたは携帯ファイルフォーマット(すなわち、.pdf)で署名および交付すること、すなわち、締約国の合法的、効果的、拘束力のある署名および交付プロトコルを構成する[本ページの残りはわざわざ空にしておく]

改訂と再署名された許可協定の署名ページは、各当事者がその許可代表に以下の日に本協定に正式に署名するように促したことを証明する。著者:S/クリストファー·アンダーソン名:クリストファー·アンズノ博士名:社長兼最高経営責任者グラクソ·スミスクライン知的財産権(第3号)有限会社作者:S/ジル·アンダーソン名前:ジル·アンダーソン

96