

別紙99.1 がん治療のための精密医薬品の開発 KOMET-007の暫定データ — 2024年1月30日

ようこそとはじめにトロイ・ウィルソン博士、法務博士 — 社長 兼最高経営責任者、クラ・オンコロジー担当

将来の見通しに関する記述このプレゼンテーションには、将来の見通しの に関する記述が含まれています。このような記述には、当社の研究、前臨床および臨床開発活動、ジフトメニブ、ティピファルニブ、KO-2806の計画と予定スケジュール、規制当局への提出に関する計画、競合治療法と比較した製品候補の相対的な利点に関する期待、製品候補の治療および商業的可能性に関する期待、キャッシュ ランウェイに関する期待などが含まれますが、これらに限定されません、そして私たちの純収入の使用目的に関する私たちの期待は2024年1月26日に終了した私募です。 「信じる」、「できる」、「すべき」、「見積もる」、「約束する」、「計画する」、「続ける」、「予想する」、「意図する」、「期待する」、「潜在的な」、および同様の表現(否定的な表現を含む)は、将来の見通しに関する記述を識別することを目的としています。そのような記述はリスクと不確実性の影響を受けやすいため、実際の結果は、そのような将来の見通しに関する記述によって明示または暗示されているものと大きく異なる場合があります。将来の見通しに関する記述の の不確実な性質の一因となるリスクには、当社の前臨床試験と臨床試験が成功しない可能性がある、米国食品医薬品局(FDA)が当社の 製品候補の臨床試験から得られたデータの解釈に同意しない場合がある、またはFDAが追加の臨床試験の実施または進行中の臨床試験の変更を決定したり、FDAから要求されたりする場合などがあります。 製品候補の臨床試験の開始、登録、完了、または分析、または当社の臨床試験デザインの妥当性または臨床試験の実施に関して重大な問題が発生する可能性があり、その結果、コストや遅延が増加したり、規制当局の承認を得ることが制限されたり、臨床試験の開始、登録、完了、およびそれらからのデータの報告が制限されたりする可能性があります。COVID-19パンデミックは、当社の臨床の遅延やその他の混乱を含め、当社および当社が依存している第三者の事業に混乱をもたらす可能性があります治験と前臨床研究、製造とサプライチェーン、または障害のある従業員生産性; 当社の製品候補は、規制当局の承認を受けなかったり、商品化に成功したりする可能性があります。製品候補の予期しない副作用や 不適切な治療効果により、規制当局の承認や商品化が遅れたり妨げられたりする可能性があります。追加の資金調達ができない場合があります。市場の状況や私募に関連するクロージング条件の充足に関連するリスク、現金ニーズに関連するリスク、および当社の事業と財務に関連するリスクと不確実性一般的に。追加のリスクや不確実性が時折発生する可能性があり、Kuraの経営陣がすべてのリスク要因と不確実性を予測することは不可能です。このプレゼンテーションに含まれるすべての将来の見通しに関する記述は、それらが作成された日付の時点でのみ述べられています。 当社に影響を及ぼすその他のリスクと不確実性は、証券取引委員会への提出書類に詳しく記載されています。私たちは、そのような記述が行われた日以降に発生した出来事や状況を反映するように更新する義務を負いません。このプレゼンテーション には、第三者から入手して作成した統計データや臨床データも含まれています。受取人は、そのような開示を過度に重視しないように注意してください。当社も他の人物も、そのようなデータの正確性や 完全性について一切の表明を行わず、この提示日以降にそのようなデータを更新する義務も負いません。3
基礎変異を標的とすることで、致命的な血液の がんが慢性疾患に変わりました。急性前骨髄球性白血病急性前骨髄球性白血病(APL)• APLは、AMLのメニン-KMT2A複合体と機構的に類似したPML/RARαと呼ばれる異常な融合タンパク質から生じます。• ATRA/ATO療法は、オールトランス型レチノイン酸(ATRA)と三酸化ヒ素(ATO)の併用療法です。• ATRA/ATO療法の作用機序は、前骨髄球、未熟白血球の分化です。• ATRA/ATO の組み合わせは、APLの治療を根本的に変えました。ATRA/ATOの併用は、10年で全生存率89%という治癒の可能性を示しています。グルナリ:小児APL、精密医療と化学療法フリーセラピーのモデル:IJMS 2021 4
基礎変異を標的とすることで、致命的な血液の がんが慢性疾患である多発性骨髄腫に変わりました • 2000年代まで、多発性骨髄腫の治療法の選択肢はほとんどなく、生存期間の中央値は2〜3年でした。• 2000年代に免疫調節薬(IMID)と プロテアソーム阻害薬(PI)が登場したことで、患者の治療成績は大幅に改善しています。• 多くの患者が10年以上自分の病気で生活できるようになりました。• IMIDは 多発性骨髄腫患者の治療の基礎となっており、次の目的で併用されています病気のすべての段階。iMidの組み合わせにより、5年間のOSが35%から65%以上に増加しました。クラスはピーク時に約150億ドルの収益を生み出しました。ホルスタインとマッカーシー、ドラッグ(2017)77(5)、505-520バード、S.、ポーリン、C. Blood(2023)142(2):131-140 5

ジフトメニブの機会とKOMET-007研究者の紹介 スティーブン・デール、医学博士 — クラ・オンコロジー最高医療責任者

ジフトメニブは、AML治療の基礎となる可能性を示しています は、AML症例の最大50%の中核にある基礎変異を標的としています • 説得力のある臨床データが最前線の機会を裏付けています • 優れた忍容性プロファイルにより、SOCとの併用による継続的な投与が可能 • の併用は分化症候群のリスクを軽減するようです • 薬物間相互作用は観察または予測されていません • 臨床活動の予備的証拠が有望です • 研究間の登録が迅速であることからもわかるように、研究者の強い熱意 • 最初の20人KOMET-007併用試験に4か月未満で登録された患者 • 2024年半ばまでに登録が完了する見込みのKOMET-001単剤療法登録試験 7

KOMET-007 研究者 Amir Fathi、MD Amer Zeidan、MBBS • 白血病センタープログラムディレクター • マサチューセッツ総合病院がんセンター悪性腫瘍血液科暫定主任、イェールがんセンター血液学早期治療研究部長 • ハーバード大学医学部 医学准教授 • 医学(血液学)准教授、イェール大学 8

単剤療法としてのジフトメニブ/併用療法の機会アミール・ファティ、医学博士 — マサチューセッツ総合病院

KOMET-001再発/難治性AML におけるジフトメニブの第1/2相試験フェーズ1aフェーズ1bフェーズ2フェーズ1b用量漸増拡大登録を可能にする検証コホート(進行中)完了 600mgの継続的な拡張が完了しました QDコホート1:200 mg QD 50 mg 100 mg 1000 mg 600 mgQD QD コホート2:600 mg QD nPM1-M、Kmt2a-R、その他のnPM1-m nPM1-M nPM1-mまたはKMT2a-R目標 • 安全性と忍容性フェーズの継続登録 • 主要エンドポイント:• 安全性と忍容性 • cR/cRH • 薬物動態1b検証 コホート • 薬物動態学 •FDAのプロジェクトと一致する抗腫瘍の初期証拠 • 臨床活性 • 副次評価項目:アクティビティオプティマス • CR/cRHの持続時間 • 安全性と忍容性 • 輸血非依存性 • 薬物動態 • CR/CRH MRD陰性 • 有害事象 • 臨床活性 CR、完全寛解、部分的な血液学的回復を伴うcRH、米国食品医薬品 の投与; MRD、測定可能な残存病変、R/R、再発/難治性、RP2D、推奨第2相用量。10 ~
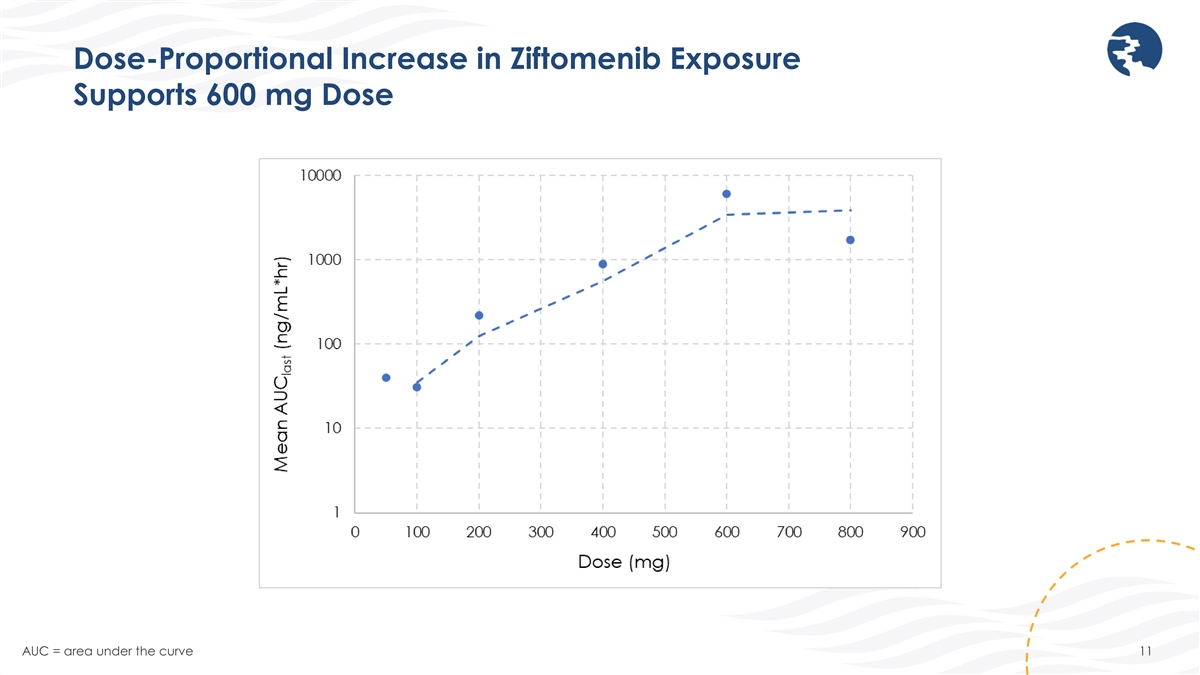
ジフトメニブ曝露量の用量比例増加は600mgの用量を支えます AUC = 曲線下面積 11

ジフトメニブはフェーズ1bで有望な安全性を示します• 分化症候群(DS)は、緩和戦略によりnPM1-M単剤療法患者で管理可能と思われます • 軽度から中等度のDSの発生率は、20% •KMT2a-R単剤療法患者のDS率は200mgで38.5%、600mgで37.5%でした。併用で緩和する可能性のある • DSは標的となるAEであり、証拠となります臨床活動 • 薬物誘発性QTc延長の報告はありません • カウントの回復が維持されていると、薬物誘発性の骨髄抑制はないことが示唆されます。Fathi et al.EHA 2023 #LB2713 (2023年4月12日現在の暫定データ) 12

ジフトメニブは高度に分化した単剤療法活性が最も高い 反応全体で最も良い のnPM1-mフェーズ1a+1b(n=20)のSOCに対する600mgの差別化CR率。NPM1の重度前治療を受けた患者の40%、CR 7(35.0)は、CRc 8(40.0)の前経過中に中央値cR/cRH 7(35.0)の突然変異 CR % mDor CRを達成しました npm1m 8.2 mo* 35% 研究ジフトメニブ 1 MRD 陰性 4 (50.0) Flt3m-3 33% 600mg QD IDH 1/2-50% ORR 9 (45.0) ジルテリチニブ Flt3m 14.2% 14.8 mo 1 kmt2a-R フェーズ 1a + 1b (n=18) エナシデニブ IDH2 19% 8.% 2 mo 2 cr/CrH 2 (11.1) イボシデニブ IDH1 25% 10.1 mo 2 CRc 3 (16.7)) *HSCT MRD陰性度3(100.0)で検閲しない場合のCrCのDoR中央値(100.0)出典:USPIのORR 3(16.7)(2023年4月10日現在の暫定データ)Ø高い活性で持続的な反応が得られ、良好なプロファイルから、ジフトメニブがAMLケアの継続期間全体にわたって 基幹療法になる可能性が示唆されています。1 MRDは6/8 cRで評価されました cの患者。検査を受けた6人の患者のうち4人(67%)はMRD陰性でした。13のCrCにはCR、cRH、cRI、CRpが含まれます。ORRにはCR、cRH、cRI、CRP、MLFSが含まれます
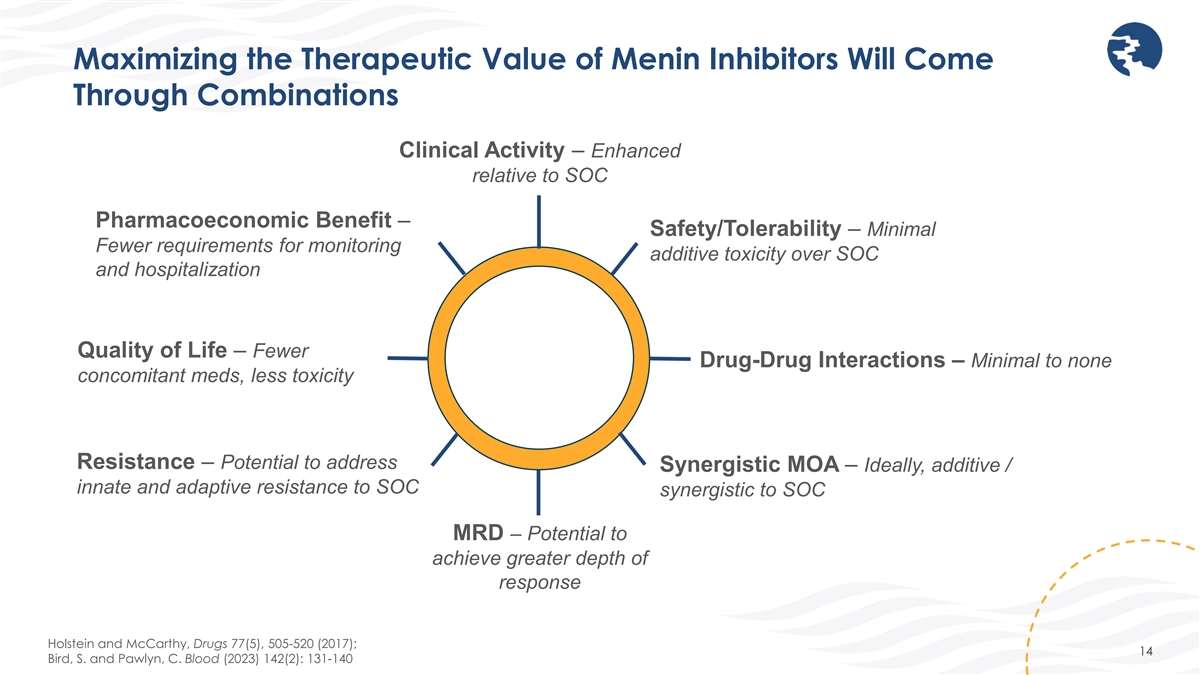
メニン阻害剤の治療的価値の最大化は の組み合わせによって実現します臨床活動 — SOCの薬理経済的利益と比較して強化 — 安全性/忍容性 — SOCに対する添加物毒性と入院生活の質のモニタリング要件の最小化 — 薬物相互作用が少ない — 併用薬が最小限またはまったくない、毒性耐性が低い — 相乗的MOAに対処する可能性 — 理想的には添加剤/SOC MRDとの相乗効果によるSOCに対する生来の適応抵抗力 — はより深い反応を実現する可能性がありますホルスタインとマッカーシー、ドラッグ77(5)、505-520(2017); 14 バード、S.、ポーリン、C. ブラッド(2023)142(2):131-140

KOMET-007 TRIAL Amer Zeidan、MBBS —イェールがんセンターからの暫定的な組み合わせデータ開示:Kura Oncologyが提供する謝礼金または相談料

KOMET-007: の新規診断を受けた患者、またはR/R AMLジフトメニブ/シタラビン/ダウノルビシン(7+3)の併用患者を対象としたジフトメニブの第1相併用試験 • ジフトメニブの投与は8日目のサイクル1日目から開始し、その後継続的に投与されます • シタラビンはC1日目1〜7日目に投与されます。投与 をC1骨髄生検の結果に基づいて追加サイクルします • ダウノルビシンはC1の骨髄生検の結果に基づいて1日目から3日目に投与されます。C1骨髄生検の結果に基づいて追加サイクルを投与します • の有害リスクがある患者には用量の漸増を実施します* *年齢 >60年および/または治療関連のAMLおよび/またはELNあたりの有害リスク細胞遺伝学 16 DL = ジフトメニブの用量レベル; zifto = ジフトメニブ; 7+3 = シタラビン/ダウノルビシン; RP2D = 推奨第2相用量; 1L = 一次投与; IC = 集中的 化学療法
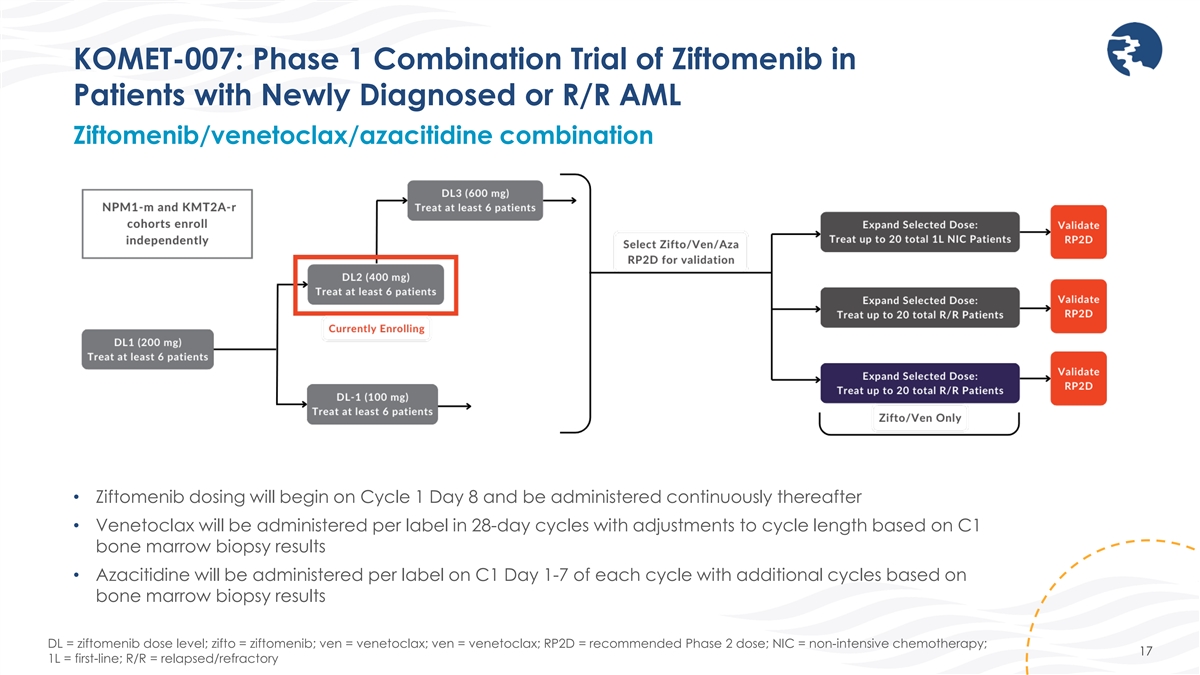
KOMET-007:新たに診断された 患者、またはR/R AML患者、またはR/R AMLの併用患者を対象としたジフトメニブの第1相併用試験 • ジフトメニブの投与は、8日目のサイクルで1日目から開始し、その後継続的に投与されます • ベネトクラックスは、ラベルごとに28日周期で投与され、 はサイクル長に基づいて 調整されます C1骨髄生検結果 • アザシチジンは、各サイクルのC1日目1〜7日目にラベルごとに投与されます。骨髄生検の結果に基づいて追加のサイクルを行います。DL = ジフトメニブの用量レベル; zifto = ジフトメニブ; ven =ベネトクラックス; ven = ベネトクラックス; RP2D = 推奨第2相用量; NIC = 非集中化学療法; 17 1L = 一次治療; R/R = 再発/難治性
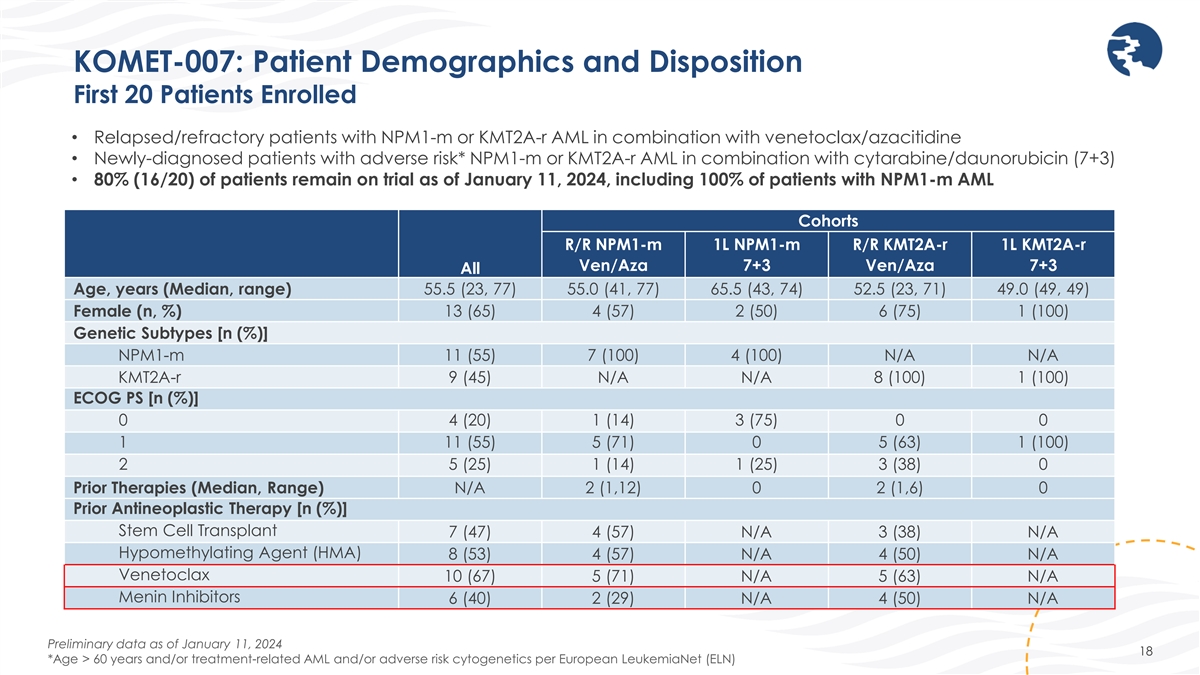
KOMET-007:患者の人口統計と傾向最初の20人の患者 が登録されました • ベネトクラックス/アザシチジンと併用したNPM1-MまたはKMT2A-R AMLの再燃/難治性患者 • 新たに有害リスクがあると診断された患者* nPM1-MまたはKMT2a-R AMLとシタラビン/ダウノルビシンの併用(7++)3) • 2024年1月11日現在、nPM1-M AMLコホート R/R nPM1-M 1L nPM1-M 1L nPM1-M R/R kmt2a-R 1L Ven/Aza 7+3 Ven/Aza 7+3 全年齢、年(中央値、範囲)55.5(23、77)の患者さんを含め、患者の 100% が試験中です。) 55.0 (41, 77) 65.5 (43, 74) 52.5 (23, 71)) 49.0 (49, 49) 13 (65) 4 (57) 2 (50) 6 (75) 1 (100) 女性 (n,%) 遺伝的サブタイプ [n (%)]npm1-m 11 (55) 7 (1004) (100) N/A N/A KMT2A-R 9 (45) N/A N/A 8 (100) (100) ECGO PS [n (%)]0 4 (20) 1 (14) 3 (75) 0 0 1 11 (55) 5 (71) 0 5 (63) 1 (100) 2 5 (25) 1 (25) 3 (38) 0 以前の治療法 (中央値、範囲) N/A 2 (1,12) 0 2 (1,6) 0 以前の抗腫瘍療法 [n (%)]幹細胞移植 7 (47) 4 (57) N/A 3 (38) N/A 低メチル化剤 (HMA) 8 (53) 4 (57) N/A 4 (50) N/A ベネトクラックス 10 (67) 5 (71) N/A 5 (63) N/A メニン阻害剤 6 (40) 2 (29) N/A 4 (50) N/A 1月11日現在の暫定データ 2024 18 *60歳以上および/またはヨーロッパ白血病ネット (ELN)による治療関連のAMLおよび/または有害リスクの細胞遺伝学

KOMET-007:有望な安全性と忍容性のプロファイルは、分化症候群(DS)グレード3以上のTEAE(≥10%)n(%)グレード3以上のジフトメニブ関連AE(すべて)n(%)グレードが3以上のTEAEの患者 18(90)グレードが3以上のジフトメニブ関連AEの患者 6(30)血小板数が6減少しました(30) 血小板数の減少 3 (15) 熱性好中球減少症 5 (25) 貧血 1 (5) 白血球数の減少 4 (20) 熱性好中球減少症 1 (5) 肺炎 3 (15) 白血球減少症 1 (5) 低酸素症 2 (10) 好中球数 1 (5) 好中球数減少 2(10)血小板減少症 1(5)敗血症 2(10)• DSイベントは報告されていません • 血液学的カウントの回復が遅れるなど、用量制限毒性(DLT)はこれまでに観察されませんでした • QTc の延長は見られませんでした • 基礎疾患と骨格療法と一致するTEAE 2024年1月11日現在の暫定データ 19 TEAE = 治療によって生じる有害事象
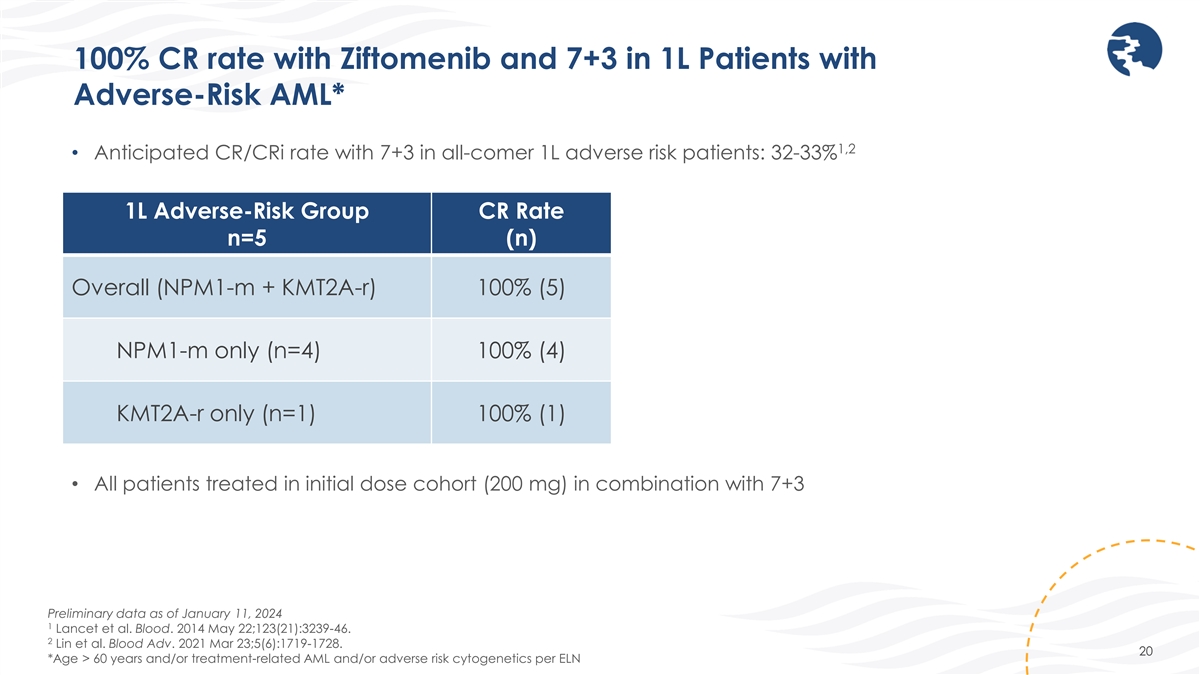
ジフトメニブによる100%のCR率と副リスク AMLの1L患者における7+3のCRI率* 1,2 • 全来者の1L有害リスク患者における7+3の予想CR/CRI率:32-33% 1L有害リスクグループのCR率 n=5(n)全体(nPM1-m + kmt2a-R)100%(5)NPM1-Mのみ (n=4) 100% (4) KMT2a-Rのみ (n=1) 100% (1) • すべての患者 を初回投与コホート (200mg) で7+3の予備データと組み合わせて治療を受けたすべての患者 を、2024年1月11日現在の暫定データと組み合わせて治療しました 1 Lancetら。血。2014 年 5 月 22 日; 123 (21): 3239-46。2 リンら。Blood Adv. 2021 年 3 月 23 日; 5 (6): 1719-1728。20 *年齢が60歳以上および/または 治療関連のAMLおよび/またはELNごとの有害リスク細胞遺伝学

メニン阻害薬 ナイーブ患者に顕著な活性を示すジフトメニブ+ Ven/Aza 1 • ベン-ナイーブの再発/難治性患者では、約35〜45%のcr/CRIが予想されます 2 • KMT2a-R再発/難治性AMLの予想奏率
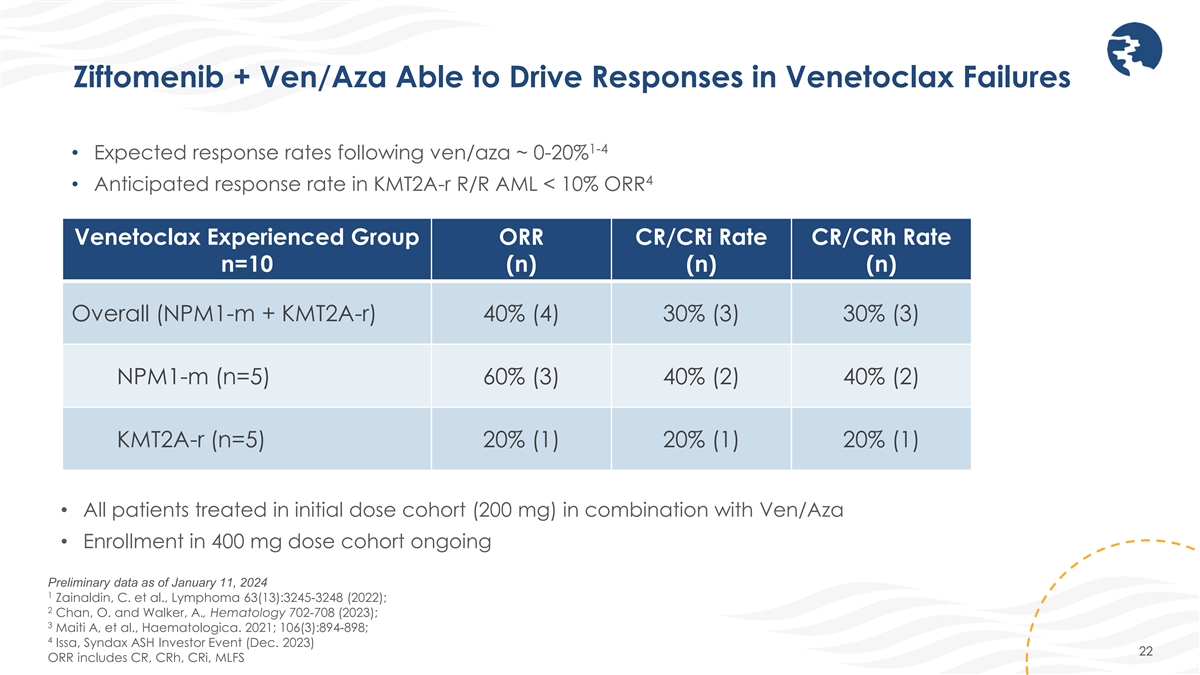
ジフトメニブ+Ven/Azaはベネトクラックス障害の対応を促進できます1-4 • ven/azaに続く期待回答率 ~ 0-20% 4 • KMT2A-R R/R AML での予想回答率
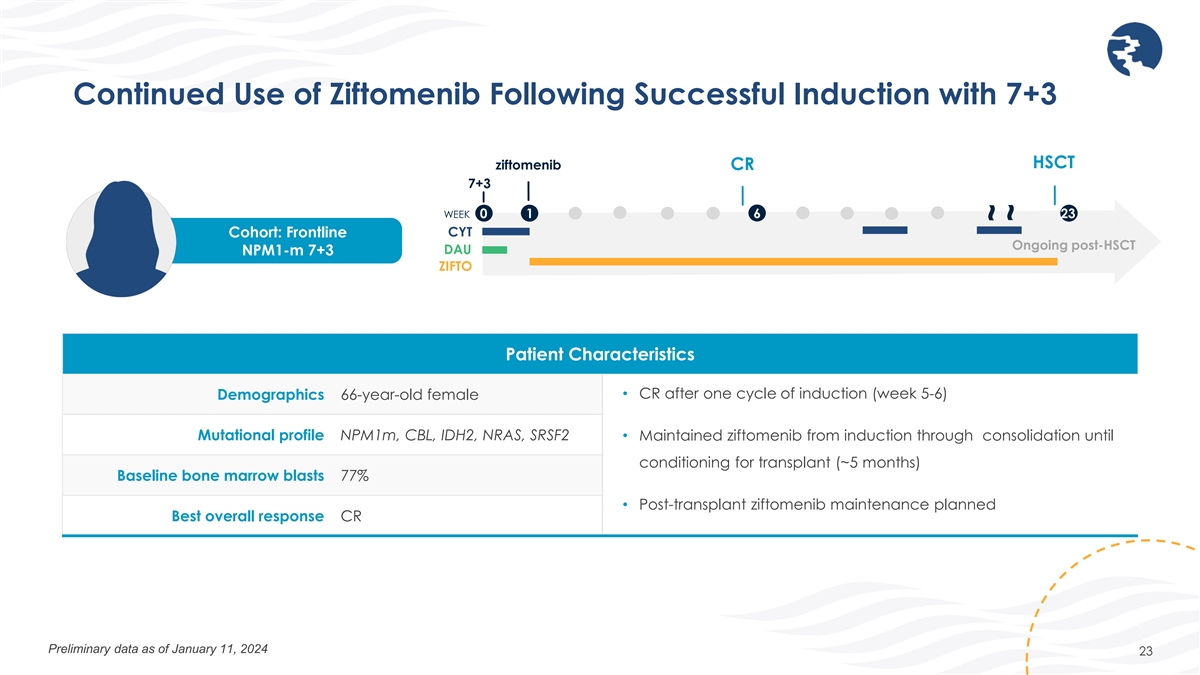
7+3 HSCTによる導入が成功した後もジフトメニブの継続使用ジフトメニブCR 7+3週目 0 1 6 23 CYTコホート:HSCT後の最前線で継続しているDAU nPM1-M 7+3 ZIFTO患者の特徴 • 導入1サイクル後のCR(5-6週目)人口統計 66歳女性変異プロファイル nPM1m、CBL、IDH2、NRAS、 SRSF2 • 導入療法から固結から移植のためのコンディショニングまで、ジフトメニブを維持しました(約5か月)。ベースラインの骨髄芽細胞:77% •移植後のジフトメニブの維持計画全体的に最も良い反応CR 1月11日現在の暫定データ 2024 23 ~~
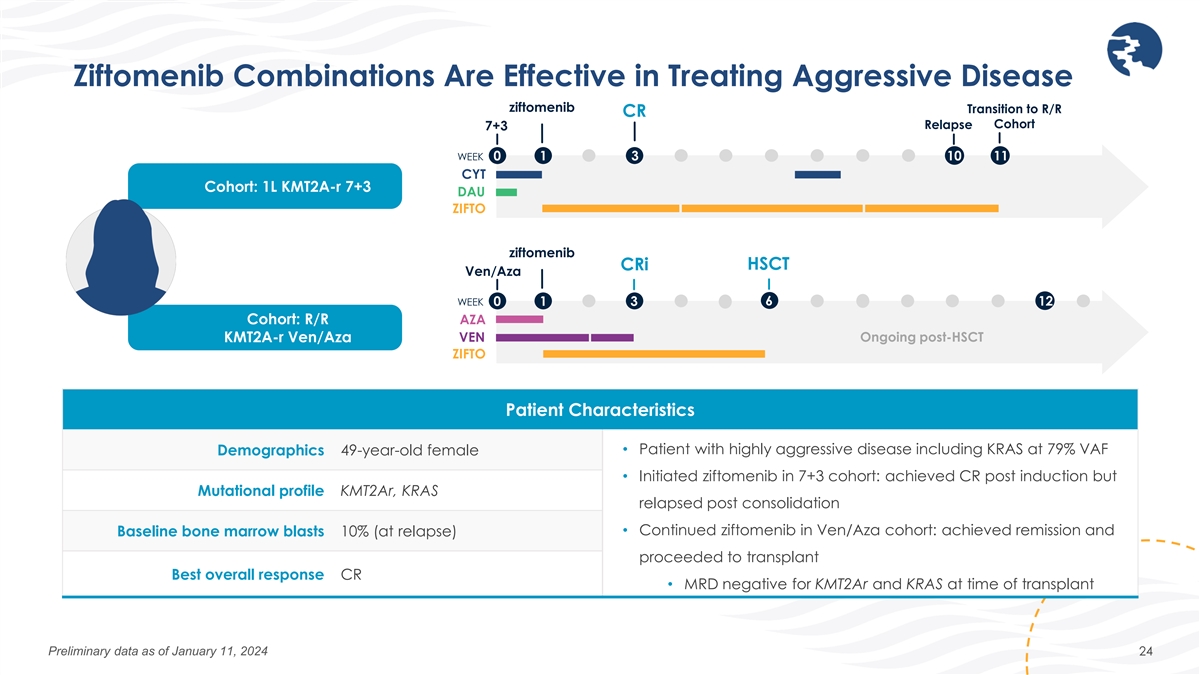
ジフトメニブの併用は侵攻性疾患の治療に効果的です ジフトメニブR/R CR再発コホート 7+3 週 0 1 3 10 11 CYT コホート:1L kmt2a-R 7+3 DAU ジフトメニブ CRi HSCT Ven/Aza 6 週 0 1 3 12 コホート:R/R AZA KMT2A-R Ven/Aza VEN HSCT後の継続的なZIFTO患者の特徴人口統計 49歳女性 • KRASを含む非常に侵攻性の高い疾患の患者(VAF)79% • 7+3コホートでジフトメニブを開始:導入後にCRを達成したが、変異プロファイルKmt2ar、KRASは統合後に再発した •Ven/で継続した ジフトメニブAzaコホート:寛解を達成し、ベースラインの骨髄芽球で10%(再発時)が移植に進みました。全体的に最も良い反応を示しました。CR • 移植時のKMT2ARとKRASのMRD陰性、2024年1月11日現在の予備データ
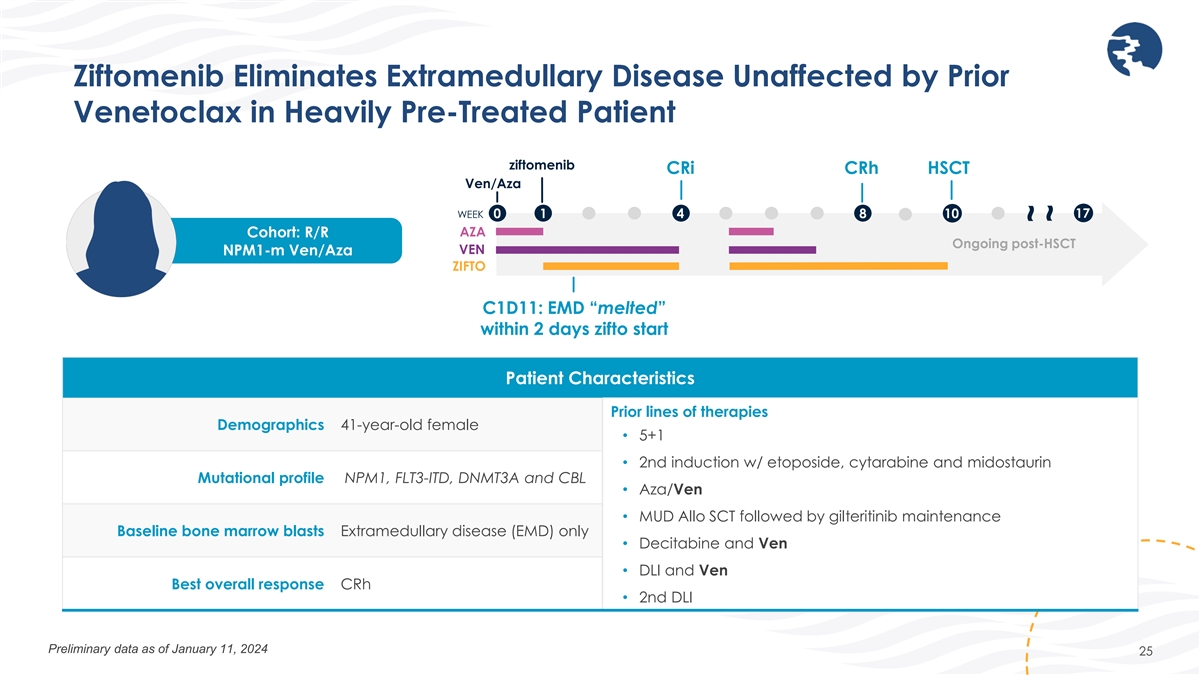
ジフトメニブは、重度の前治療を受けた患者の以前の ベネトクラックスの影響を受けない髄外疾患を排除します。ジフトメニブ CrI CrH HSCT Ven/Aza 17 週 0 1 4 8 10 AZA コホート:HSCT後に継続中 VEN NPM1-M Ven/Aza ZIFTO C1D11:EMDは2日以内に「溶けた」患者特徴 療法の以前のラインナップ人口統計 41歳女性 • 5+1 • エトポシド、シタラビン、ミドスタウリンによる2回目の導入療法突然変異プロファイル NPM1、FLT3-ITD、DNMT3A、CBLによる突然変異プロファイル • アザ/ベン • MUDアロSCTとそれに続くギルテリチニブのメンテナンスベースライン 骨髄芽球病気(EMD)のみ • デシタビンとヴェン • DLIとベンベストの総合反応cRH • 2nd DLI 2024年1月11日現在の暫定データ 25~~

臨床開発計画 Mollie Leoni、M.D. — 臨床開発担当副社長

ジフトメニブ臨床開発経路開発アプローチ計画研究 スタートアップフェーズ1登録指向試験 NPM1変異型急性骨髄性白血病(AML)単剤療法非NPM1-M/KMT2A-R AML(再発/難治性)KMT2A-再構成されたNPM1変異型AMLベネトクラックス+アザシチジンKMT2A-再配列されたAML (再発/難治性、最前線)NPM1変異型AMLシタラビン+ダウノルビシン(7+3)KMT2A再構成型AMLとの併用(再発/難治性、最前線)ギルテリチニブ、NPM1変異型AML FLAG-IDA、LDAC KMT2A再構成型AMLとの併用 (再発しました/難治性)NPM1変異型AML研究者 /会社-移植後の維持管理支援研究 KMT2A-再構成型AML小児AMLおよびALLとFLAとの併用研究医師が後援する研究小児ALLとBV-DAMとの併用 27

市場機会と今後のマイルストーントロイ・ウィルソン博士、J.D. — Kura Oncology社長兼最高経営責任者

ジフトメニブは、AML分野で数十億ドル規模の機会をもたらし、それ以降も継続的なケア全体でアウトカムを変える可能性を秘めています • 初期承認は、潜在的な患者の 30% が再発したことになります。• COMET-001 FDA完全承認のための登録指向研究、難治性 • 1L AMLおよびメンテナンスの最前線での大きな機会/• 収益を 50% 以上増やす可能性メンテナンス • 安全性、耐容性、臨床活性の抗薬 SOCやメンテナンス表示との組み合わせには理想的です • AML以外にも魅力的な の新たな機会他にも数十億ドル規模の潜在的な適応症を提供しています • 早期の翻訳データは、固形腫瘍と非腫瘍の適応症の可能性を裏付けています 29

急性白血病におけるジフトメニブの今後のマイルストーン推定時間 達成マイルストーン FLT3阻害剤ギルテリチニブ、2024年第1四半期 LDACおよびFLAG-IDAと組み合わせたKOMET-008試験の最初の患者、移植後の維持プログラムの開始 2024年第1四半期ジフトメニブの開発を急性リンパ芽球 白血病(ALL)に拡大します(Q1)2024 2024年半ばに85人の患者をKOMET-001登録指向試験に完全登録 2024年半ばにven/azaと組み合わせて推奨第2相用量を決定 1Lのven/azaと組み合わせて用量の検証/拡張を開始してください AML 2024年半ばに次回のKOMET-007コンビネーションアップデートを提供 • 5億7000万ドルのプロフォーマキャッシュ*が2027年への道筋となり、ジフトメニブやその他のパイプライン 資産の価値を最大化するための積極的な研究、開発、および商業化前の活動が可能になります。* 23年12月31日現在の4億2400万ドルの現金、現金同等物、短期投資、および146ドルの募集費用を差し引いた推定収益を含みます私募から、2024年1月26日に終了しました30

がん治療のための精密医薬品の開発 KOMET-007からの暫定的な データ — 2024年1月30日