エキシビション 99.2

免疫療法を増幅するためにリンパ節を標的にする 2024年1月

免責事項将来の見通しに関する記述このプレゼンテーションには、改正された1933年の証券法のセクション27A、改正された1934年の証券取引法のセクション21E、およびPSLRAとして知られる1995年の民間証券訴訟改革法で定義されている将来の見通しの
記述が含まれています。
このプレゼンテーションの、純粋に歴史的なものではない記述は、将来の見通しに関する記述です。このような将来の見通しに関する記述には、とりわけ、計画中の臨床試験
および製品候補の可能性、製品候補の満たされていないニーズと潜在的な対応可能な市場、製品候補の潜在的な臨床的有用性、潜在的な利点と市場での受け入れ、既存の治療法および/または競合他社の製品候補に対する潜在的な
の製品候補の潜在的な
優位性、臨床データの受領予定日、タイミングに関する記述が含まれます私たちの始まり臨床試験の計画、および
開発プログラム全般の推進と資金提供。実際の結果は、さまざまな要因により、将来の見通しに関する記述で予測されたものと異なる場合があります。このような要因には、とりわけ、
が事業および製品開発計画を継続するために必要となる追加資金を調達する能力、予想される収益の使い方、新製品や技術の開発や開発段階の企業としての運営に関連する不確実性(他の関係者との協力を含む)、製品候補の開発、臨床試験の完了、承認の取得、商品化の能力などがあります。私たちの研究に患者を募集して登録する能力。私たちの米国食品医薬品局またはその他の規制当局からの要求、知的財産への依存、事業を展開する業界における競争、COVID-19または地政学的問題(ウクライナと中東の紛争を含む)による遅延または混乱、および市場の状況に
対処する能力。これらの将来の見通しに関する記述は、このプレゼンテーションの日付の時点で作成されたものであり、法律で義務付けられている場合を除き、将来の見通しに関する記述を更新したり、
が実際の結果が将来の見通しに関する記述で予測されたものと異なる可能性がある理由を更新したりする義務を負いません。ここに記載されているすべての情報を参照し、www.sec.govで入手可能な証券取引委員会(SEC)に提出する報告書およびその他の文書に記載されているリスク要因
の開示も参照してください。これには、2023年6月2日に提出されたフォーム8-K形式の会社の最新報告書、2023年6月30日および9月に終了した四半期の
社のフォーム10-Qの四半期報告書が含まれますが、これらに限定されません。30、2023、および当社が随時SECに提出するその他の書類。2

会社概要臨床段階のバイオテクノロジー先駆的な新しいリンパ節標的がん
免疫療法への3つの新しいアプローチ両親媒性または「AMP」プラットフォームは、ペイロードをリンパ節に輸送して強力な免疫反応を生み出します。ELI-002:固形腫瘍の約25%を引き起こす7つのKRAS変異
を標的とするように設計されたユニークなリンパ節標的ワクチン。最初の焦点は、ELI-002が対処できるPDACです。転移腫瘍の 88% フェーズ1a臨床データ 84% の患者がT細胞反応を示し、T細胞数は平均58倍に増加しました。患者の 84%
は腫瘍バイオマーカーの減少、24%が完全クリアランス大細胞奏効を達成した患者は、進行または死亡のリスクが86%減少します。予想される短期触媒継続中:2024年から2025年まで、追加の
データを利用した2件の第1相試験、第2相PDAC単剤療法の開始 2024年第1四半期

パイプライン満たされていない
の重要なニーズに対応するがん免疫療法の革新的なパイプライン 4つのCRC:結腸直腸がん | PDAC:膵管腺がん mKRA:変異型キルステンラット肉腫 | mbRAF:急速加速線維肉腫の変異?$#@$ログB | MTP53:変異腫瘍タンパク質
p53候補目標適応症前臨床フェーズ 1 フェーズ 2 フェーズ 3 ELI-002 mKRAS PDAC、CRC ELI-007 mBraf 消化管腫瘍 ELI-008 MTP53 消化管腫瘍 PDAC PDAC 計画中

Elicio:増幅免疫療法

AMPプラットフォーム
免疫療法のためのリンパ節の未開拓の可能性を利用します 6 ほとんどの免疫細胞はリンパ節にありますが、これらの重要な部位は従来の免疫療法では関与していません。AMPは「アルブミンヒッチハイク」を介してリンパ節へのペイロードのターゲットを絞った送達を促進します。AMPは、免疫反応の大きさ、効力、持続性を高めるリンパ節のユニークな生物学です
血液リンパ小分子大分子(アルブミンなど)血管リンパ管リンパ節血液循環組織
注射部位リンパ節の免疫をターゲットにしています

ELI-002 組成AMP-ペプチドと
AMP-CpGからなるリンパ節標的治療ワクチン 7 G12X G13X D R V C S A D ELI-002 リンパ節を標的とするリンパ節用アルブミン結合脂質:CpG DNA:TLR-9 アゴニスト X X アルブミン結合脂質(リンパ節を標的とする mkRas ペプチド PEG リンカー)• 2つまたは7つのAMPペプチド • CD8と
CD4エピトープ • 強力な TLR-9 免疫活性化因子 AMP-mkras ペプチド抗原 AMP-CpG アジュバント NH O O
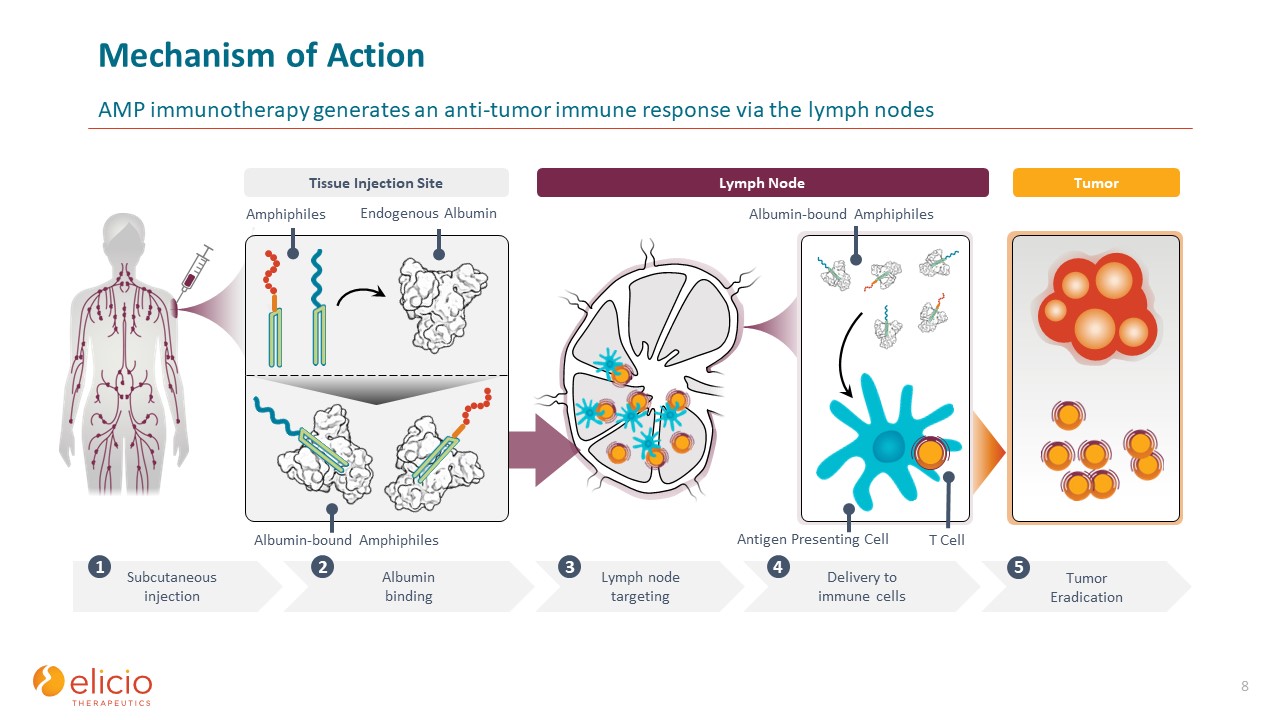
ActionAmp免疫療法は
リンパ節を介して抗腫瘍免疫反応を起こします 8 腫瘍根絶 5 皮下注射 1 リンパ節リンパ節を標的とする 3 抗原提示細胞への細胞送達 4 アルブミン結合両親媒性菌内因性
アルブミン両親媒性菌組織注射部位アルブミン結合 2 腫瘍T細胞
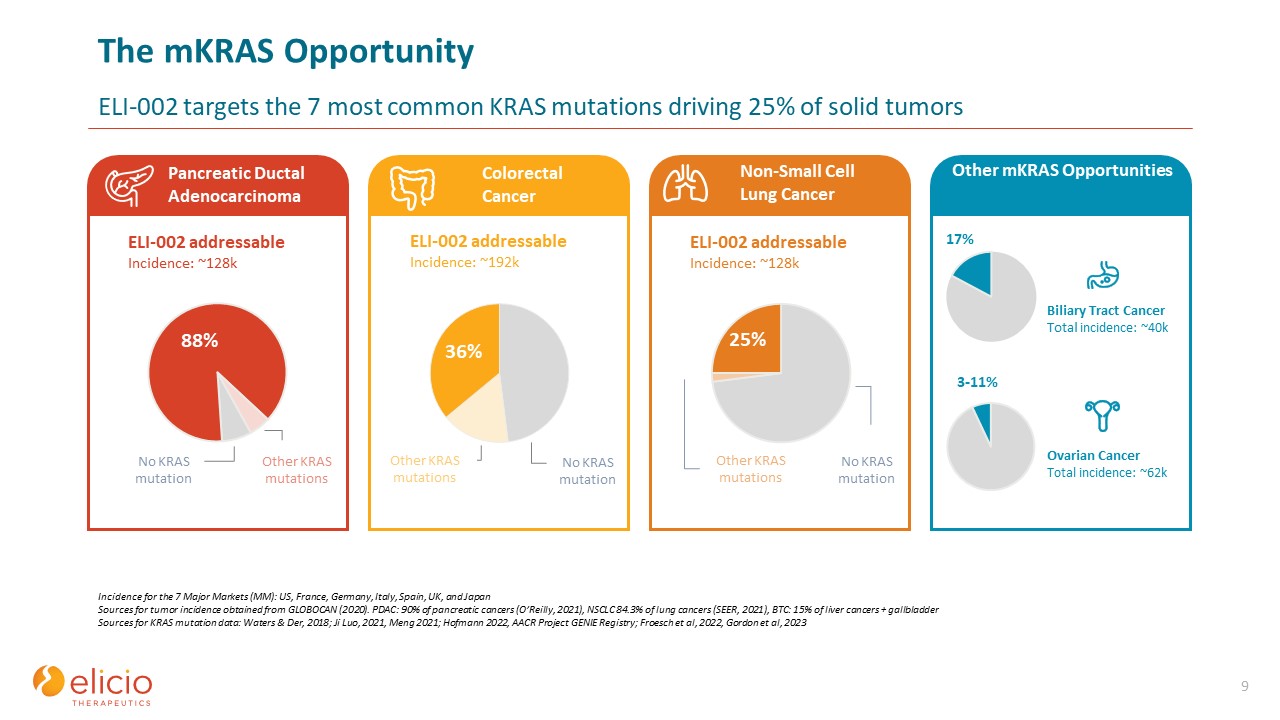
MKRAS OpportunityELI-002は、
固形腫瘍の 25% を引き起こす最も一般的な7つのKRAS変異を対象としています。9つの主要市場(MM)での発生率は、米国、フランス、ドイツ、イタリア、スペイン、英国、日本、GLOBOCAN(2020)から得られた腫瘍発生率の情報源です。PDAC:膵臓がんの 90%(オライリー、2021年)、NSCLC 肺
がんの84.3%(SEER、2021年)、BTC:肝臓がんの 15% + 胆嚢KRAS変異データの出典:Waters & Der、2018; Ji Luo、2021、Meng 2021; ホフマン2022、AACR Project Genie Registry; Froesch et al、2022、ゴードンら、2023 ELI-002の対処可能な発生率:約128k その他のKRAS変異 88% 膵管腺がん ~ 88% 結腸直腸がん ~ 88% 非小細胞肺がんその他のMKRAS 機会 36% その他のKRAS変異 25% 17% 3-11% KRAS
変異なし ELI-002 対処可能な発生率:〜192k いいえKRAS変異 ELI-002で対処可能発生率:約128k KRAS変異なし ~ 88% 胆道がん総発生率:約4万卵巣がん総発生率:約6万件のその他のKRAS変異
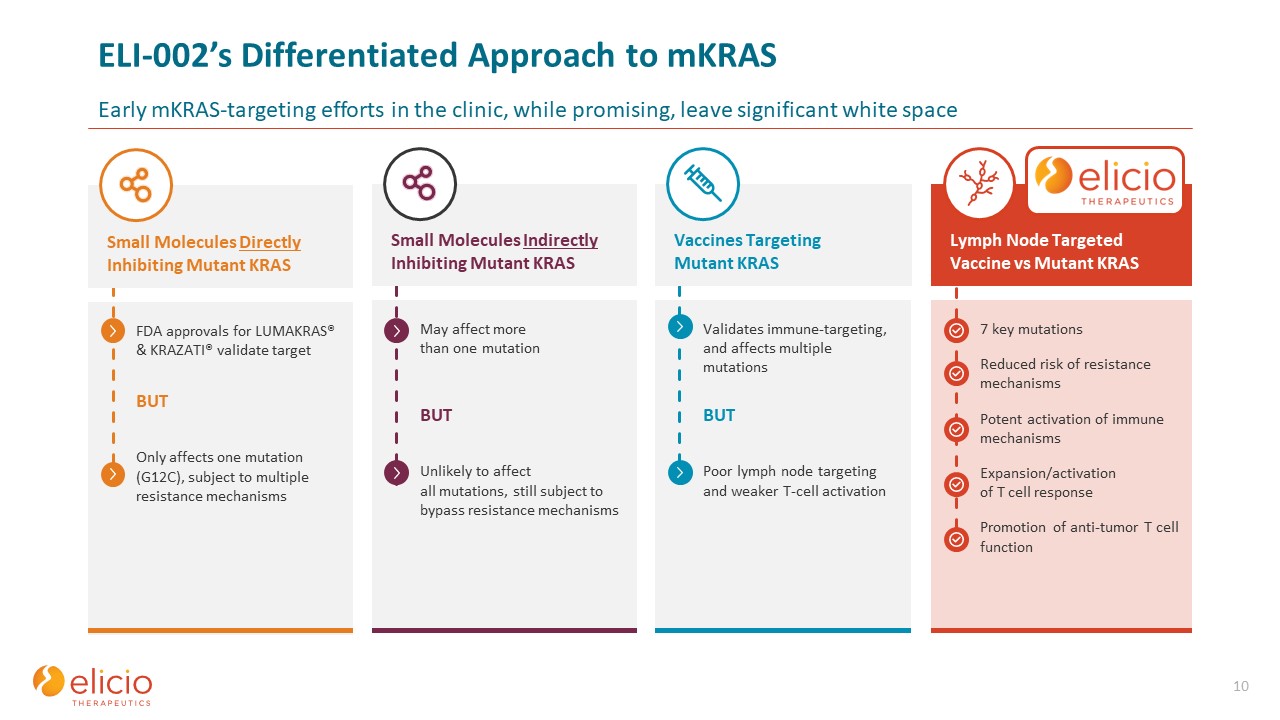
ELI-002のmkRASに対する差別化されたアプローチクリニックでの初期のMKRASターゲティングの取り組みは、有望ではありますが、大きな空白を残す10個の重要な突然変異耐性メカニズムのリスクの軽減免疫機構の強力な活性化 T細胞応答の強力な活性化
免疫ターゲティングの促進
免疫ターゲティングを検証し、複数の突然変異に影響しますが、リンパ節のターゲティングが不十分でT細胞の活性化が弱いと、さらに影響する可能性があります複数の突然変異ですが、すべての突然変異に影響する可能性は低く、それでもバイパス耐性メカニズムのFDA
承認が必要ですLUMAKRAS® とKRAZATI® の検証ターゲットですが、複数の耐性メカニズムの影響を受けますが、1つの突然変異(G12C)にのみ影響します。リンパ節標的ワクチンと変異KRASワクチンは突然変異KRAS小分子を標的とする変異KRAS小分子を間接的に
阻害し、突然変異KRASを直接阻害します

ELI-002: 臨床開発プログラム

ELI-002
AMPプラットフォームのリンパ節ターゲティングデザインを活用して強力なT細胞活性を誘発するAT-a-GlancemKras免疫療法は、臨床的概念実証のためにフェーズ1のAMPLIFY-201で使用された12 2ペプチド(2P)および7ペプチド(7P)製剤2Pを活用しています。一方、7P CMCの最終プログラムは、
効果を最大化するために、完全な7P製剤に切り替わりました機会 AMPLIFY 臨床プログラム進行中 AMPLIFY-201は腫瘍陽性で、作用機序(T細胞)バイオマーカーの反応が臨床成績と相関し、第1/2相のAMPLIFY-7P登録が報告されました進行中、2024年に開始予定のPDACのランダム化フェーズ2は、ドライバーの突然変異や「市販」のワクチンなど、同等のワクチンと比較して明確な臨床的および運用上の利点です
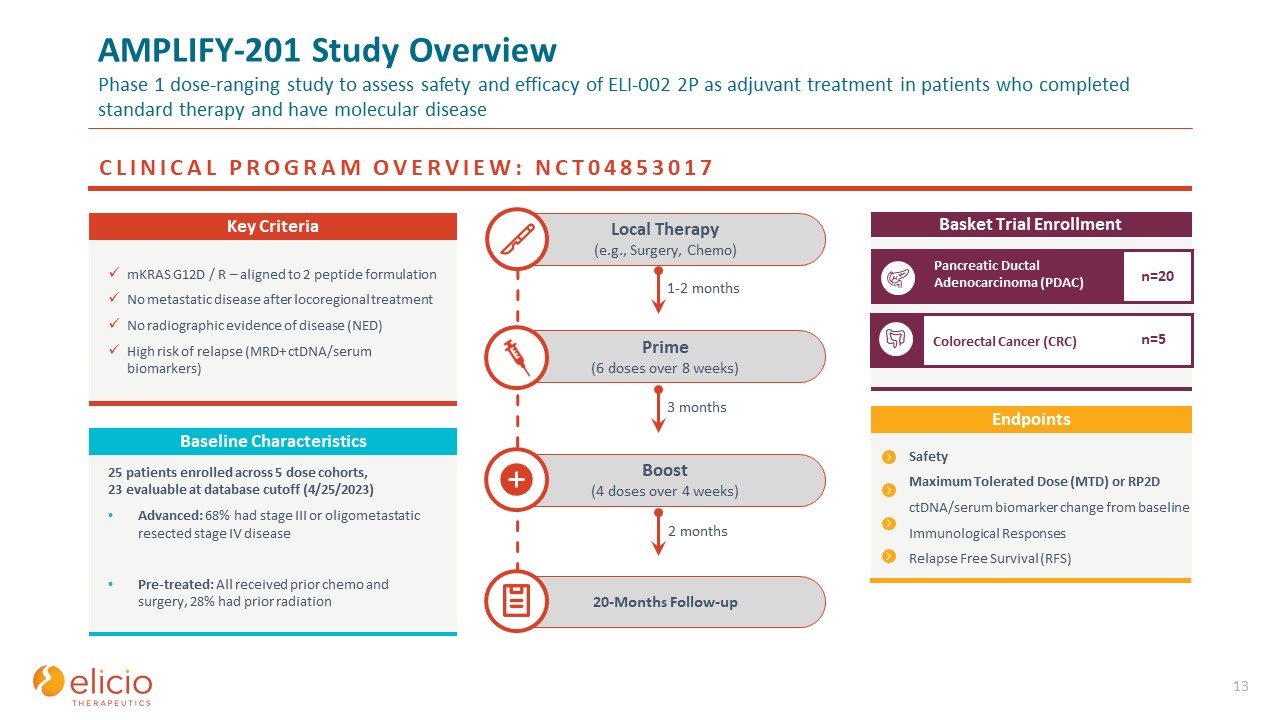
AMPLIFY-201研究の概要標準治療を完了し、分子疾患を患っている患者を対象とした補助療法としての
ELI-002 2Pの安全性と有効性を評価するための第1相用量決定試験 13 20か月のフォローアップブースト(4週間にわたって4回の投与)プライム(8週間にわたって6回投与)局所療法(手術、化学療法など)臨床プログラム
概要:NCT04853017バスケットトライアルロールメント膵管腺がん(PDAC)結腸直腸がん(CRC)n=20 n=5 mKRAS G12D/R — 2ペプチド製剤アラインメント局所治療後の転移性疾患はありません局所領域治療後の転移性疾患はありません
X線撮影なし病気の証拠(NED)再発リスクが高い(MRD+ ctDNA/血清バイオマーカー)主な基準 1〜2か月 3か月 3か月 2か月安全最大耐量(MTD)またはRP2D ctDNA/血清バイオマーカーのベースラインからの変化免疫学
反応無再発生生存(RFS)エンドポイント 25人の患者が5つの用量コホートに登録され、23人がデータベースカットで評価可能 FF(2023年4月25日)進化:68%がステージIIIまたはオリゴメタスタティックで切除されたステージIVの疾患を前治療していました:全員が
前に化学療法と手術を受け、28%が以前に放射線ベースライン特性を示していました
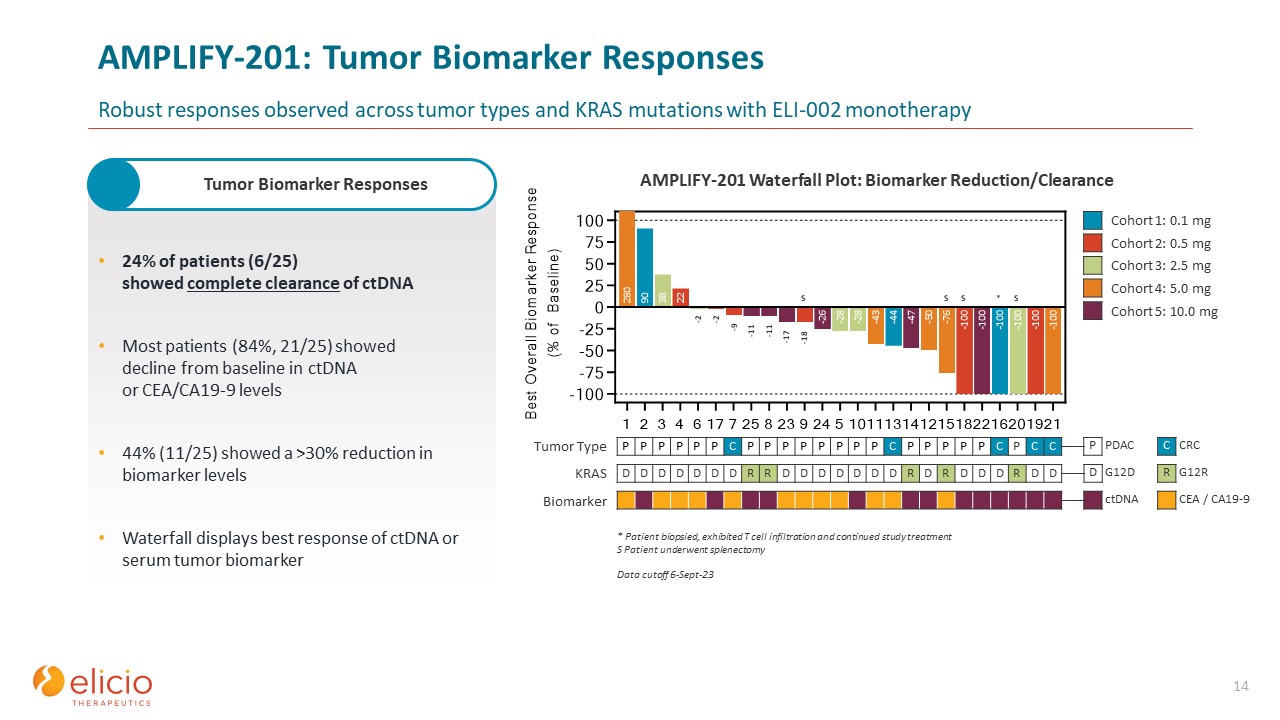
AMPLIFY-201:腫瘍バイオマーカーの反応 ELI-002単剤療法では、腫瘍の種類と
KRAS変異全体で強力な反応が観察されました 14 24%の患者(6/25)がctDNAの完全なクリアランスを示しました。ほとんどの患者(84%、21/25)は、ctDNAまたはCEA/CA19-9レベルのベースラインからの低下を示しました 44%(11/25)はバイオマーカー
レベルが30%以上低下しましたウォーターフォールは、ctDNAまたは血清腫瘍バイオマーカーの最良の反応を示します。* 患者の生検を行い、T細胞浸潤を示し、治療を継続しました。S 患者は脾摘出術を受けました。データカットオフ
6-Sept-23 P P P P P P P P P P P P P PP C P P P P P P C P C C 腫瘍タイプ D D D D D R D D D D D R D D R D D D R D D D R D D D R D D D R D D D R D D D R D D D R D D D R D D D R D D D D D D D D D D D D D D D D D D D D D D D D D R D R D D D R D D D R D D D R D D D R D D D R D D D D D D D D D D D D D D D D D D R D D D D D D D D D D D D D D R D D D D D D D D D D D D D D D D D D D D D R D D D D D D D D D D D D D D D D D D D D D D 私のコホート3:2.5 mg コホート4:5.0 mg コホート5:10.0 mg AMPLIFY-201ウォーターフォールプロット:バイオマーカーの減少/クリアランス腫瘍バイオマーカー反応

AMPLIFY-201:84%の患者がMKRAS特異的T細胞を生成しました 15 84%の患者が、RP2D(10 mg)を含む2つの高用量コホートでT
細胞反応を100%示しました。ベースラインからのT細胞数の平均倍率変化(中央値13倍、範囲2〜423x)は、標準の指向性生体フルオロスポットとフローサイトメトリー、
で検出可能です。必要なAMP-CpG用量レベル生体外T細胞反応(n、%)平均倍率変化 0.1 mg 2/3(67%)30 0.5 mg 4/6(67%)101 2.5 mg 4/5(80%)113 5.0 mg 5/5(100%)19 10.0 mg 6/6(100%)36合計21/25(84%)58件の応答示されているのは、評価期間中の任意の時点における各患者のベースラインに対する全体的な反応の最良値です。データカットオフ-9月6日-23日中央値 = 13x AMPLIFY-201 T細胞の倍率-用量レベルによる変化 mKRAS T細胞
応答ベースライン最大応答ベースライン最大応答量レベルごとのDirect Ex Vivo T細胞応答量
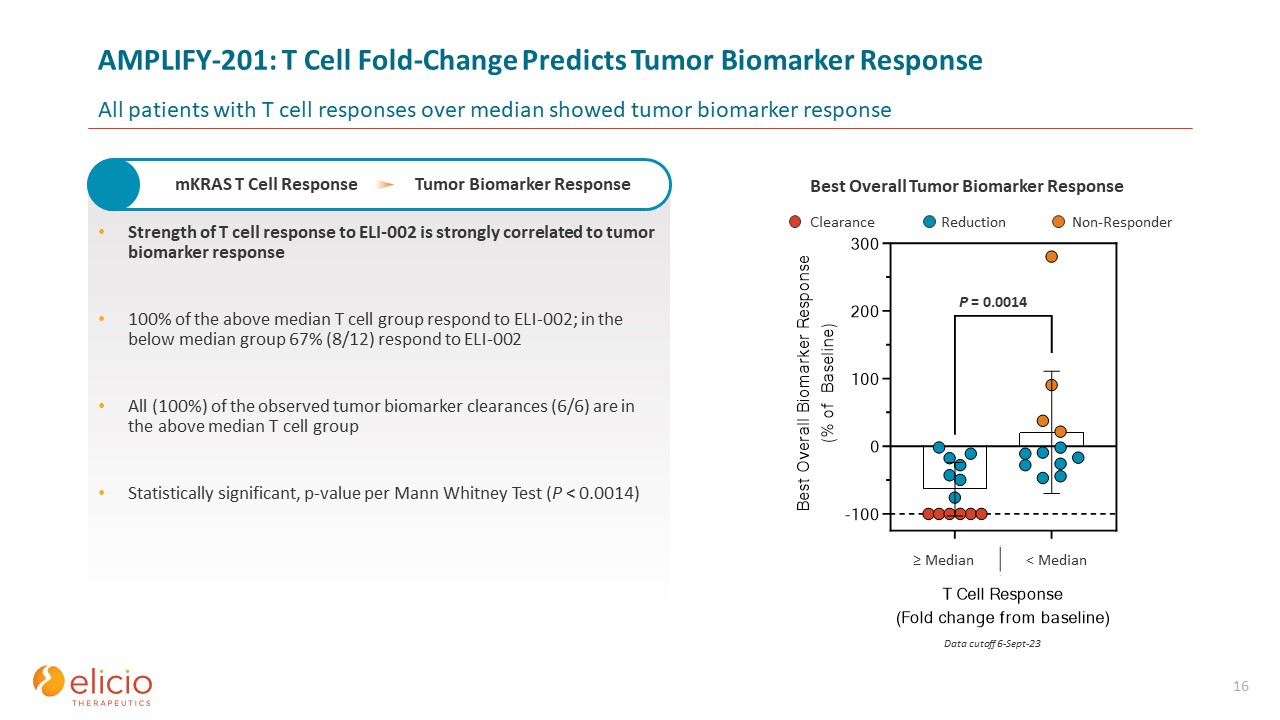
クリアランス低減ノンレスポンダー AMPLIFY-201:T細胞の折り目変化が腫瘍の
バイオマーカー反応を予測します。中央値を超えるT細胞反応を示したすべての患者は、腫瘍バイオマーカー反応を示しました 16 ELI-002に対するT細胞反応の強さは腫瘍バイオマーカーの反応と強く相関しています。中央値より低いグループでは、67%(8/12)がELI-002に反応します I-002 観察された腫瘍バイオマーカークリアランス(6/6)のすべて(100%)は、上記のT細胞グループの中央値にあります。マンホイットニー検定(P
)あたりの統計的に有意なp値
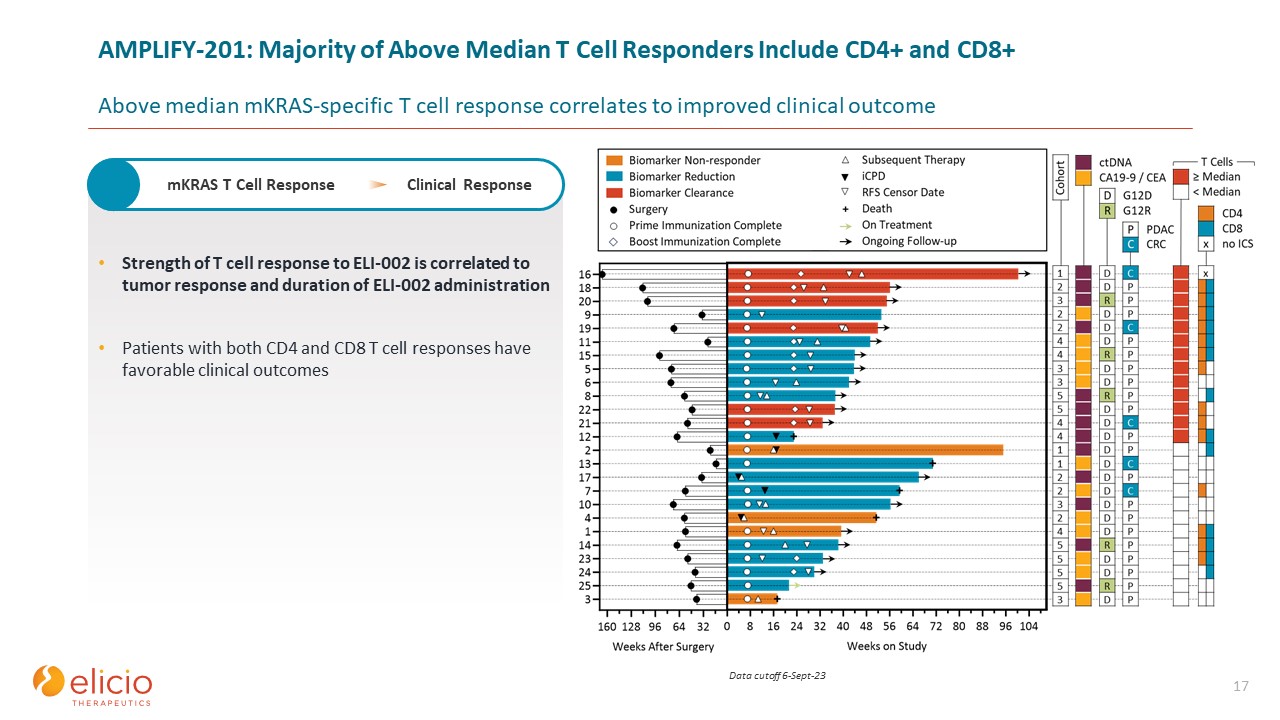
17 ELI-002に対するT細胞反応の強さは、腫瘍反応とELI-002投与の期間
と相関しています。CD4とCD8 T細胞反応の両方を示す患者の臨床成績は良好です。mKRAS T細胞反応臨床反応 AMPLIFY-201: 中央値を超えるT細胞反応の大多数はCD4+とCD8+を含みます中央値
を超えるmKRAS特異的T細胞反応は、臨床転帰の改善と相関しています。9月6日-23日
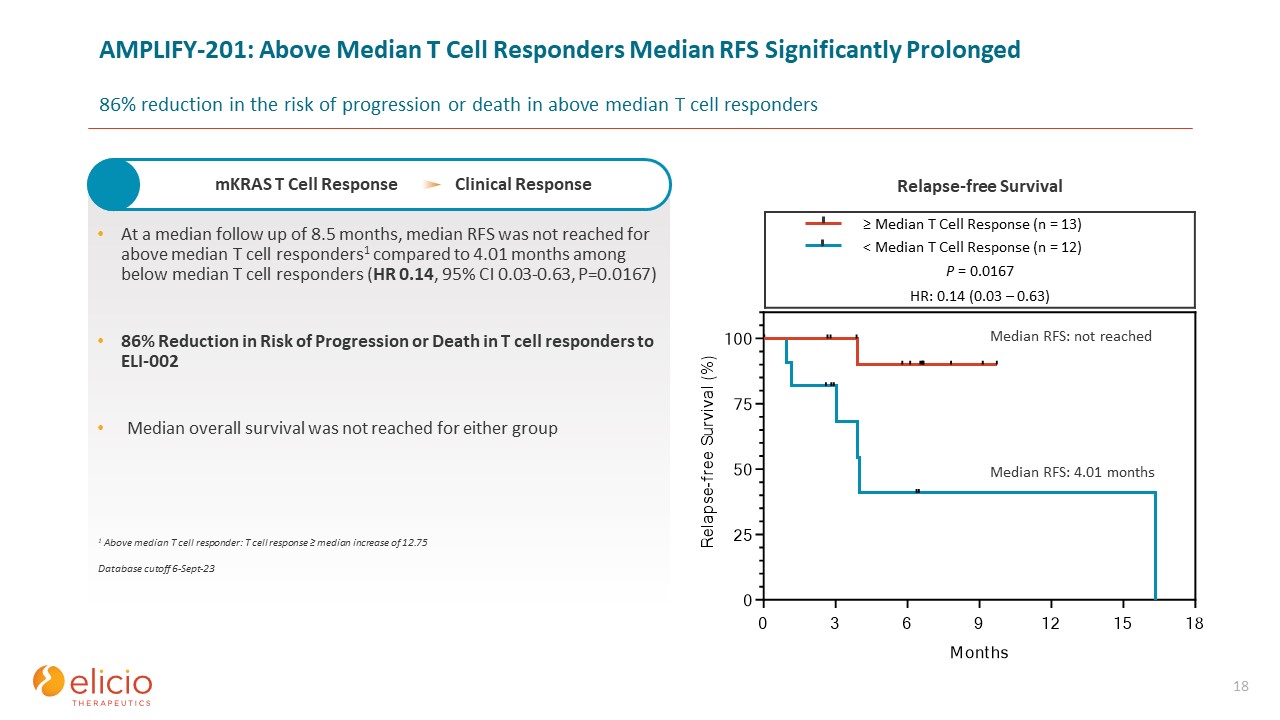
AMPLIFY-201:中央値以上のT細胞応答者中央値RFSは、中央値を超えるT細胞反応者の進行または死亡リスクの 86%
低下を有意に延長しました 18 中央値を8.5か月追跡したところ、中央値を下回るT細胞反応者のRFS中央値は4.01か月でしたが、中央値を下回るT細胞応答者では4.01か月でした(HR 0.14、95%CI 0.03-0.63、P = 0.016 7) ELI-002に反応したT細胞患者の進行または死亡のリスクが86%低下どちらのグループでも、全生存期間の中央値には達しませんでした(n = 13)
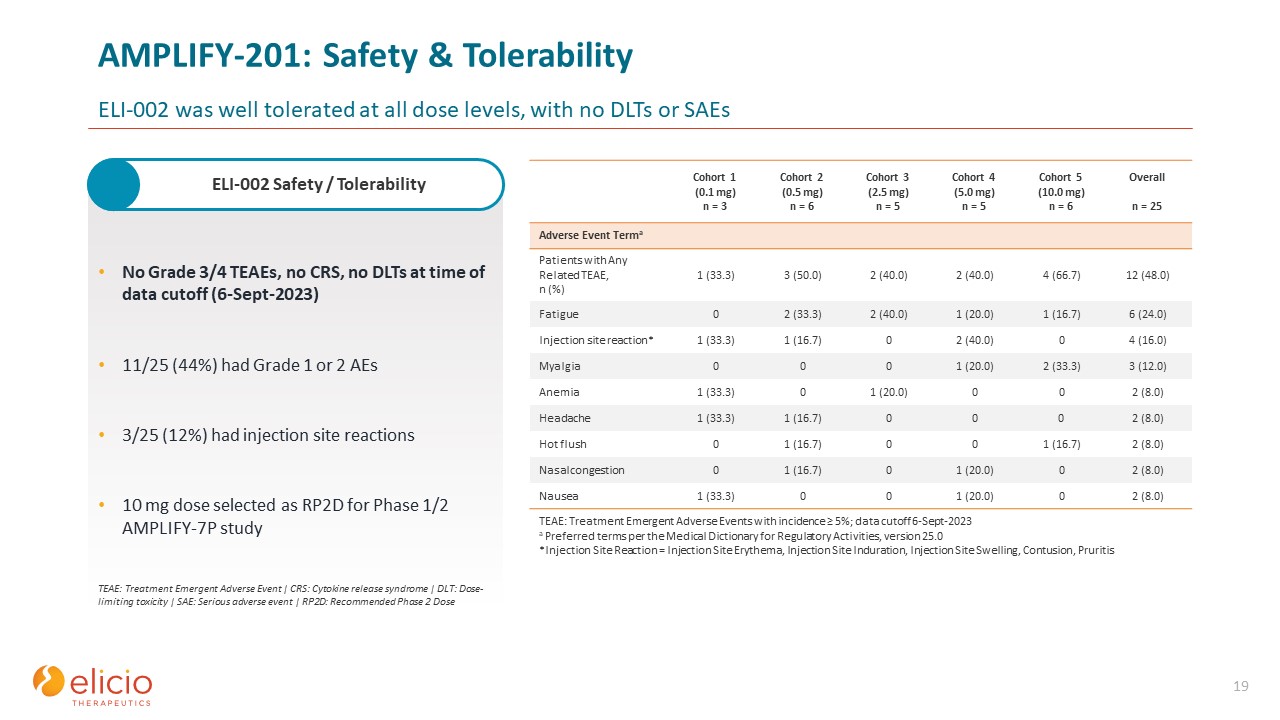
AMPLIFY-201:安全性と耐容性ELI-002はすべての用量レベルで良好な耐容性を示しました。
DLTまたはSAEなし、19 グレード3/4のTEAE、CRSなし、データカットオフ時(2023年9月6日)にDLTなし(2023年9月6日)、11/25(44%)はグレード1または2のAE 3/25(12%)で注射部位反応を示しました。フェーズのRP2Dとして10mgの用量が選択されました 1/2 AMPLIFY-7P 研究 TEAE:
治療の緊急有害事象 | CRS: サイトカイン放出症候群 | DLT: 用量制限毒性 | SAE: 重篤な有害事象 | RP2D: 推奨フェーズ 2 用量コホート 1 (0.1 mg) n = 3 コホート 2 (0.5 mg) n = 6 コホート 3 (2.5 mg) n =
5 コホート 4 (5。0 mg) n = 5 コホート 5 (10.0 mg) n = 6 全n = 関連するTEAEを持つ有害事象テルマ患者25人、n (%) 1 (33.3) 3 (50.0) 2 (40.0) 2 (40.0) 4 (66.7) 12 (48.0) 疲労 0 2 (33.3) 2 (40.0) 1 (20.0) 1 (16.7) 6 (24.0) 注射部位の反応* 1 (33.3) 1 (16.7) 0 2 (40.0) 4 (16.0) 筋肉痛 0 0 0 1 (20.0) 2 (33.3) 3 (12.0) 貧血 1 (33.3) 0 1 (20.0) 0 2 (8.0) 頭痛 1 (33.3) 1 (16.7) 0 0 2 (8.0) ホットフラッシュ 0 1 (8.0) 16.7) 0 0 1 (16.7) 2 (8.0) 鼻づまり 0 1 (16.7) 0 1 (20.0) 0 2 (8.0) 吐き気 1 (33.3) 0 0 1 (20.0) 2 (8.0) TEAE:緊急有害治療発生率が5%以上のイベント。データ締め切り
2023年9月6日~規制活動のための医学辞典による推奨用語、バージョン25.0*注射部位の反応 = 注射部位の紅斑、注射部位硬結、注射部位の腫れ、挫傷、そう痒症 ELI-002の安全性/
耐性
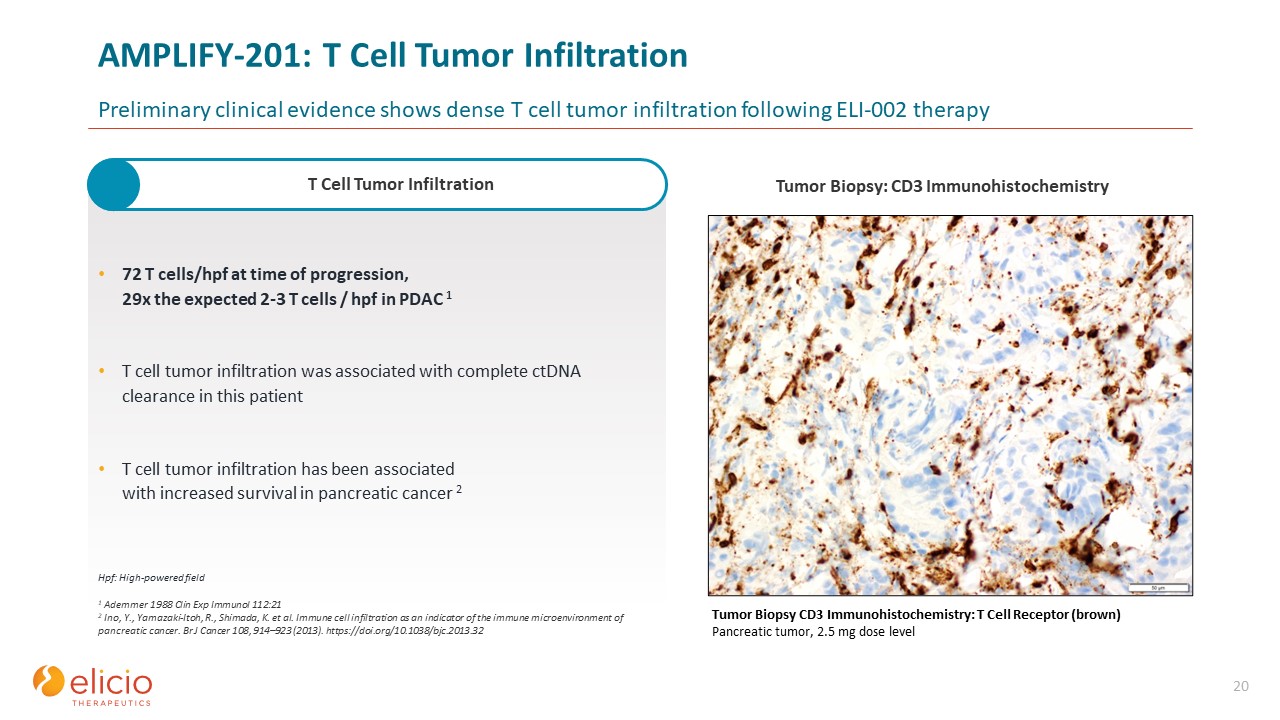
AMPLIFY-201: T細胞腫瘍への浸潤 ELI-002療法後の高密度T細胞
腫瘍の浸潤を示す予備的な臨床的証拠によると、進行時に2072個のT細胞/hpf、PDACで予想される2〜3個のT細胞/hpfの29倍 T細胞腫瘍の浸潤は、この患者の完全なctDNAクリアランスに関連していました。T細胞腫瘍
浸潤は生存率の向上と関連しています膵臓がん 2 腫瘍生検 CD3 免疫組織化学:T細胞受容体(茶色)膵臓腫瘍、2.5 mg用量レベル1 Ademmer 1988 Clin Exp Immunol 112:21 2 Ino、Y.、
山崎-伊東さん、R.、島田、K. 他膵臓がんの免疫微小環境の指標としての免疫細胞浸潤。Br J Cancer 108, 914—923 (2013). https://doi.org/10.1038/bjc.2013.32 Hpf: 高出力野T細胞腫瘍
浸潤腫瘍生検:CD3免疫組織化学

AMPLIFY-201: 臨床データの概要YELI-002単剤療法は、臨床的利益と相関する強力な免疫反応を生みます。21耐性が高い用量制限毒性なしグレード3/4のTEAE、CRSなし、DLTなし。11/25(44%)はグレード1または2のAEでした。有望な予備データ:大きなT細胞反応による進行または
死のリスクの大幅な低下腫瘍バイオマーカーの減少、クリアさまざまな腫瘍タイプとKRAS変異にわたって T細胞の反応は、腫瘍バイオマーカーの減少/クリアランスおよび無再燃生存率と強く相関しています。Robust
mkRAS T細胞反応 AMPLIFY-201で観察されたT細胞反応と腫瘍浸潤は、歴史的にPDACでの生存と関連していました。大きなT細胞反応を示す患者の大多数で、KRAS特異的なCD4+とCD8+応答を生成できます
評価可能な患者のうち、100%の患者がブースト後もKRAS特異的T細胞反応の上昇を維持しました。90%の患者が2つ以上のKRAS抗原に対してT細胞応答を発症しました RP2D SELECTED AMPLIFY-7P IDMCは、研究の次の部分(2024年第1四半期)のELI-002 7P ランダム化PDACの第2相投与
を開始することを推奨しています

ELI-002の差別化*同等の
がんワクチンと比較した明確な臨床的および運用上の利点 22 ELI-002 SLATE-KRAS--GRANITE------**-Autogene-Cevumeran---**-免疫応答の強化、脾臓の要件なしドライバー変異に対する適用範囲が最も広い、抵抗力の制限が早い、
予測可能、コストが低く、製造リスクはありません*** 腫瘍ネオ抗原に対する免疫原性は、まだ強いまま免疫系を活性化します 4 7 抗腫瘍免疫反応臨床プログラム初期疾患におけるリンパ節の関与はKRASのみを対象としています
突然変異「市販の」共有KRASネオ抗原ワクチン個別化ネオ抗原ワクチン*公開されている情報に基づいています** パーソナライズネオ抗原ワクチンは、KRASネオ抗原を含む場合と含まない場合がある複数のネオ抗原をコードしますが、KRASドライバー変異のみを対象としていません。***入手可能性に影響を及ぼす「ジャストインタイム」製造に関連するリスクはありません。製品候補は直接研究で評価されていません。比較
公開情報に基づくKRAS変異が対象:Elicio 7P:G12D、G12R、G12V、G12C、G12A、G12S、G13D、スレート:G12C、G12D、G12V、Q61H

2024年までの継続的な実行の勢い 23 AMPLIFY-201更新臨床データ
(1Q-2024) AMPLIFY-7P PDACフェーズ2開始 (1Q-2024) AMPLIFY-7Pフェーズ1aデータ (1H-2024) AMPLIFY-201臨床免疫 (1H-2024) 対応フォローアップ 2024年の予想マイルストーン 2023年の業績 AMPLIFY-201フェーズ1aを完了しました
登録 AMPLIFY-7Pが開始した第1a相試験 AMPLIFY-201は、第1a相試験(ASCO)からの暫定的な安全性、免疫、およびバイオマーカー反応データを発表しました p53/BRAFプログラムへの資金提供のために2回目のGIRF助成金を受け取りました AMPLIFY-201はT細胞
反応と再発を発表しました無料の生存データ(AACR特別会議膵臓)は、p53/BRAFプログラム(SITC)の前臨床データが陽性でした。AMPLIFY-201免疫応答耐久性データ(SITC)を発表しました

免疫療法を増幅するためにリンパ節を標的にする 2024年1月