
エキシビション 99.2

GSBR-1290総合プログラムアップデート2023年12月18日、秘密です

2人の出席者 • レイモンド・スティーブンス博士、最高経営責任者 • マーク・バッハ医学博士、最高医療責任者 • ブレ・コル医学博士、臨床開発担当副社長 • ジュン・ユン、最高財務責任者 • ダニエル・キートリー、インベスター・リレーションズ・コンフィデンシャル

3 将来の見通しに関する記述このプレゼンテーションには、1995年の民間証券訴訟改革法の「セーフハーバー」条項の意味における「将来の見通しに関する記述」が含まれています。歴史的事実の記述以外のすべての記述は、将来の見通しに関する記述と見なすことができる記述です。これには、会社の将来の計画と見通しに関する記述、GSBR-1290および2DM患者を対象としたGSBR-1290の第2a相試験のトップラインと暫定臨床データに基づいて開発中のその他の候補物の安全性、有効性、または忍容性に関する期待が含まれますが、これらに限定されません。肥満(治療期間が長くなっても有効性が維持または増加する可能性を含む)、GSBR-1290の2型糖尿病、肥満、または関連する適応症を治療する能力、2型糖尿病と肥満の患者を対象としたGSBR-1290に関する当社の第2b相試験の計画的な開始と研究デザインとそのタイミング、GSBR-1290の薬物動態(PK)/製剤研究の最新情報とその予定時期、会社の予定時期のデータ結果とGSBR-190と次世代コンビネーションGLP-1R候補の継続的な開発、およびGLP-1Rをターゲットとする新しい錠剤製剤に関する期待。さらに、このプレゼンテーションで「かもしれない」、「できた」、「すべき」、「予想する」、「信じる」、「見積もる」、「期待する」、「意図する」、「計画する」、「考える」、「考える」、「考える」、「理解する」という言葉を使用すると、将来の見通しに関する記述が識別される場合があります。将来の見通しに関する記述は、歴史的な事実でも、将来の業績を保証するものでもありません。当社は、そのような将来の見通しに関する記述に反映されている期待は妥当であると考えていますが、そのような期待が正しいという保証はできません。読者は、実際の結果、活動レベル、安全性、業績または状況は、さまざまなリスクと不確実性により、会社の将来の見通しに関する記述で表明または暗示されているものと大きく異なる可能性があることに注意してください。これには、調査の長さとサンプルサイズによる結果の暫定的な性質に関連するリスクと不確実性が含まれますが、リスクは、盲検化されていないデータが次のものと一致しないことです。盲検データ、臨床試験の中間結果が最終結果を予測しないリスクと特定の患者の治療成績のフォローアップが継続し、より多くの患者データが入手可能になるにつれて、GSBR-1290、LTSE-2578、ANPA-0073およびその他の治療候補を進歩させ、規制当局の承認を得て、最終的に商品化するにつれて、患者の登録が継続され、データのより包括的なレビューが続くにつれて、臨床成績の1つ以上が大きく変化する可能性があります治療法の候補、前臨床試験と臨床試験のタイミングと結果、でのデータ収集漏れの影響当社の臨床試験サイトのいずれか、当社の開発活動への資金提供と開発目標の達成能力、コンプは、世界的なパンデミック、インフレ、サプライチェーンの問題が会社の事業に与える影響、知的財産を保護する能力、その他のリスク、および会社で説明されている不確実性を常に完全に制御できるとは限らない臨床研究機関、製造業者、サプライヤー、協力者などの第三者への依存証券取引委員会(SEC)への申請2023年3月30日にSECに提出された2022年12月31日に終了した年度のフォーム10-Kに関する会社の年次報告書、2023年11月17日にSECに提出された2023年9月30日に終了した四半期のフォーム10-Qの四半期報告書、および当社が随時SECに提出する可能性のある将来の報告書が含まれます。このプレゼンテーションに含まれるすべての将来の見通しに関する記述は、作成日の時点でのみ述べられており、その日付における経営陣の仮定と見積もりに基づいています。当社は、法律で義務付けられている場合を除き、そのような記述が行われた日以降に発生した出来事または状況を反映するようにそのような記述を更新する義務を負わないものとします。

4つの議題 • 開会の辞と概要(レイ・スティーブンス)• GSBR-1290プログラムの更新(Blai Coll)-フェーズ2aの安全性と忍容性の要約-フェーズ2a-有効性の要約-フェーズ2b-研究を可能にする-日本のブリッジング研究-6ヶ月と9か月の毒性学の更新 •全体的なプロファイルと次のステップ(マーク・バッハ)•GSBR-1290閉会(レイ・スティーブンス)• 質疑応答 A 機密

5 GSBR-1290プログラムの更新と第2a期の概念実証データの要約 • 有望な有効性、安全性、忍容性の結果 • 一般的に忍容性が高く、最大12週間、薬物に関連する重篤な有害事象(SAE)がなく、中止率も非常に低い • 2型糖尿病(T2DM)と肥満の安全性と耐容性の両方で1日1回の投与が可能で、過半数報告されたすべての有害事象(AE)のうち、軽度または中等度でした • 120 mgまでの治験薬に関連するSAEがなく、一般的に忍容性が高く、•次の理由による研究の中止はありませんでしたフェーズ2a肥満コホートのAE • フェーズ2a T2DMコホートの治験薬に関連するAEによる研究の中止1件の有効性 •臨床的に有意なフェーズ2a型糖尿病データ(n = 54、12週間)− 12週間でのHbA1cと体重の統計的に有意な減少•臨床的に有意な第2a相肥満データ(n = 40、暫定8週間)− 統計的に有意 8週間で体重が減り、12週まで続く研究フェーズ2bの研究が可能に •臨床的に意味のあるフェーズ1の日本のリーンヘルシーボランティアブリッジングデータ(n = 18、4週間)-実質的4週間で体重が減りました • 6か月のげっ歯類と9か月の霊長類の研究で大きな発見はありません—長期のフェーズ2bプログラムが可能になりました。機密

6 GSBR-1290プログラムの更新 Blai Coll、医学博士、臨床開発担当副社長(機密)
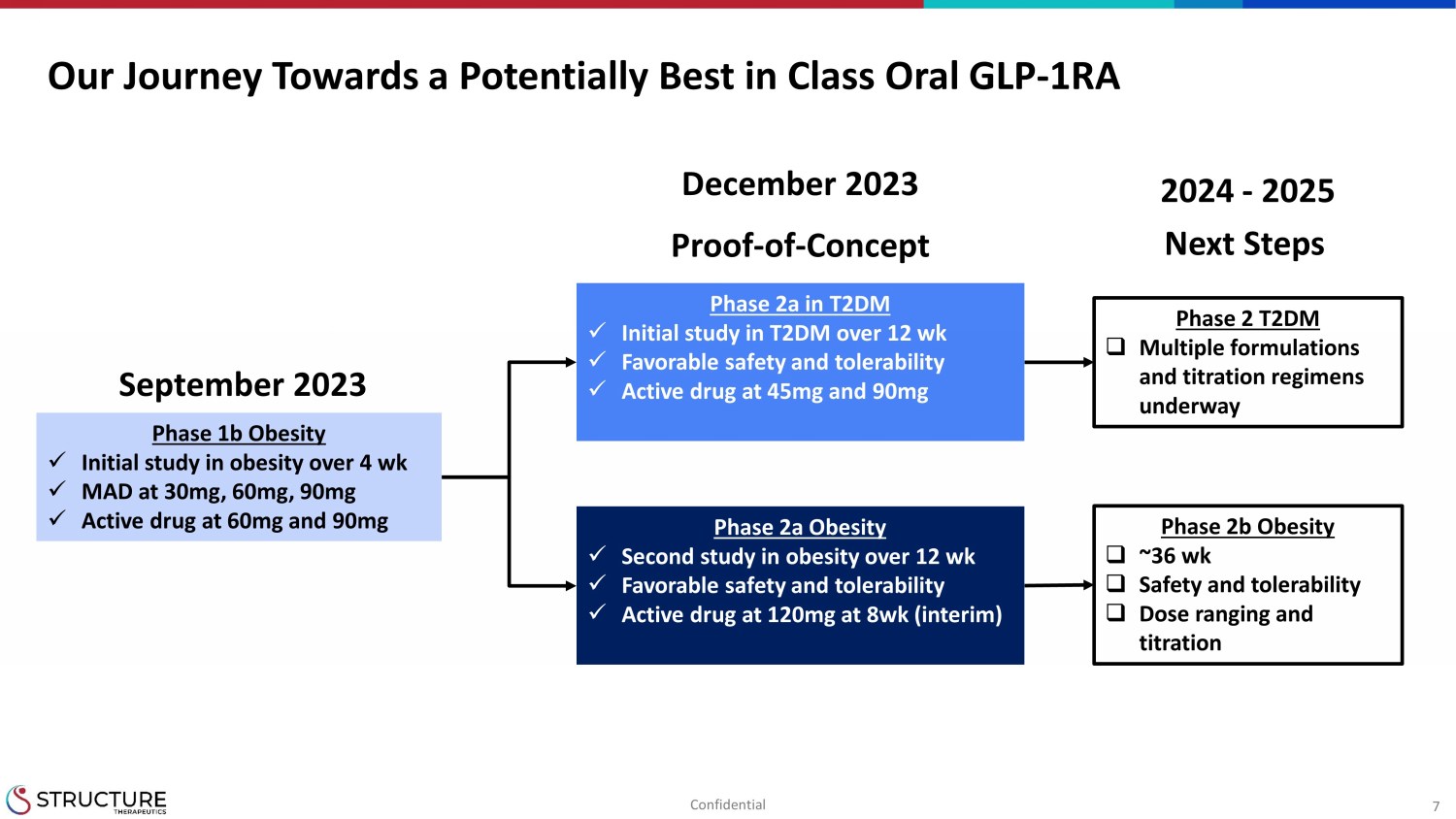
7 潜在的に最高の経口GLPへの道のり-T2DMの1RAフェーズ2a x 12週を超えるT2DMでの最初の研究x安全性と忍容性x45mgおよび90mgの活性薬物フェーズ2a肥満 x 12週を超える肥満に関する2回目の研究 x安全性と忍容性が良好x8週で120mgの活性薬剤(暫定)肥満 x肥満の初期研究 30mg、60mg、90mg、4週以上、60mg、90mg以上の有効薬 2023年9月の概念実証-2023年12月の第2フェーズ T2DM □ 複数の製剤と滴定レジメンが進行中肥満 □ ~36wk □ 安全性と忍容性 □ 用量調整と滴定 2024-2025 次のステップ機密

8 GSBR-1290 T2DMと肥満に関する第2a相試験デザイントップラインデータ主要評価項目:安全性と忍容性:HbA1cの減少を実証:HbA1cの減少を実証 8週間/ 12週間で中間結果:安全性と耐容性副次的エンドポイント:体重減少を実証する2型糖尿病の主要な適格基準 •T2DM 成人6か月以上の男性と女性 • BMIが27.0以上40.0 kg/m2以下 • メトホルミンの安定投与量 • HbA1cが7.0%以上以下10.5% • 18歳以上75歳以下の健康な太りすぎ/肥満の主な資格基準 •健康的な太りすぎ/肥満の成人男性と女性 • BMIが27.0以上40.0 kg/m2以下 • HbA1c ≤ 6.5% • 18歳以上75歳以下機密

9 フェーズ 2a (12 週) フェーズ 2a (12 週) 特性 N (%) T2DM T2DMなしの肥満 45 mg (N=10) 90 mg (N=26) プラセボ (N=18) 120 mg (N=24) プラセボ (N=16) 年齢、60.5 (7.5) 55.9 (11.0) 59.4 (9.3) 45.8 (14) 46 (14) 性別、女性 N (%) 4 (40) 12 (46) 7 (39) 13 (54) 4 (25) ヒスパニック系またはラテン系、N (%) 8 (80) 19 (73) 12 (66) 10 (41) 7 (43) 体重、キログラム 94.3 (13.7) 90.5 (13.6) 92.8 (15.8) 90.3 (11.4) 93.4 (13.9) BMI、kg/m 2 33.7 (4.7) 32.6 (3.5) 34 (4.2) 31.5 (3.4) 31.2 (3.2) 糖尿病の持続期間、12歳 11.6 12.7 —-メトホルミンの投与量、ミリグラム/日 1490 (561) 1796 (400) 1563 (611)--HbA1c,% 8.08 (0.95) 7.98 (0.83) 7.96 (0.86) 5.5 (0.3) 5.4 (0.4) 空腹時血漿グルコース、mmol/L 9.61 (2.23) 8.76 (1.86) 9.43 (2.65) 5.3 (0.4) 5.1 (0.4) 心拍数、BPM 67.1 (9.2) 72.3 (13) 73.1 (11) 68.1 (9.3) 70.6 (6.3) 収縮期血圧、mmHg 124.3 (14) 124 (11) 124.8 (10.7) 127.8 (12.6) 拡張期血圧、mmHg 75.4 (8.9) 76.3 (6.3) 76.7 (6.8) 80.1 (7.6) 83.1 (8) GSBR-1290フェーズ2a調査:人口統計とベースライン特性データは、特に明記されていない限り、平均(SD)です。機密

10 GSBR-1290フェーズ2a研究:参加者の処分フェーズ2a(12週間)フェーズ2a(12週間)N(%)T2DMなしの肥満 45 mg(N=10)90mg(N=26)プラセボ(N=18)120mg(N=24)プラセボ(N=24)プラセボ(N=16)AEによる研究の中止 2 (20) * 0 0 0 0 治験薬 1 (10) ** 0 0 0 0 0 0 0 0 用量中止、減量滴定、保留 4 (40) 11 (42) 0 9 (37) 0 完了、研究 8 (80) 26 (100) 17 (89.5) 継続中の研究 GSBR-1290 フェーズ 2a ランダム化 (N = 54) GSBR-1290 フェーズ 2a 肥満研究ランダム化(N=40)暫定* 1被験者COVID-19のため中止され、1つの被験者が消化器関連のAEのために中止されました。** 1つの被験者は消化管関連のAEのために研究を中止しました。

11 GSBR-1290プログラム更新の安全性と忍容性の概要フェーズ2a — T2DMフェーズ2aの最初の研究からのトップラインデータ — 肥満コンフィデンシャルの中間結果
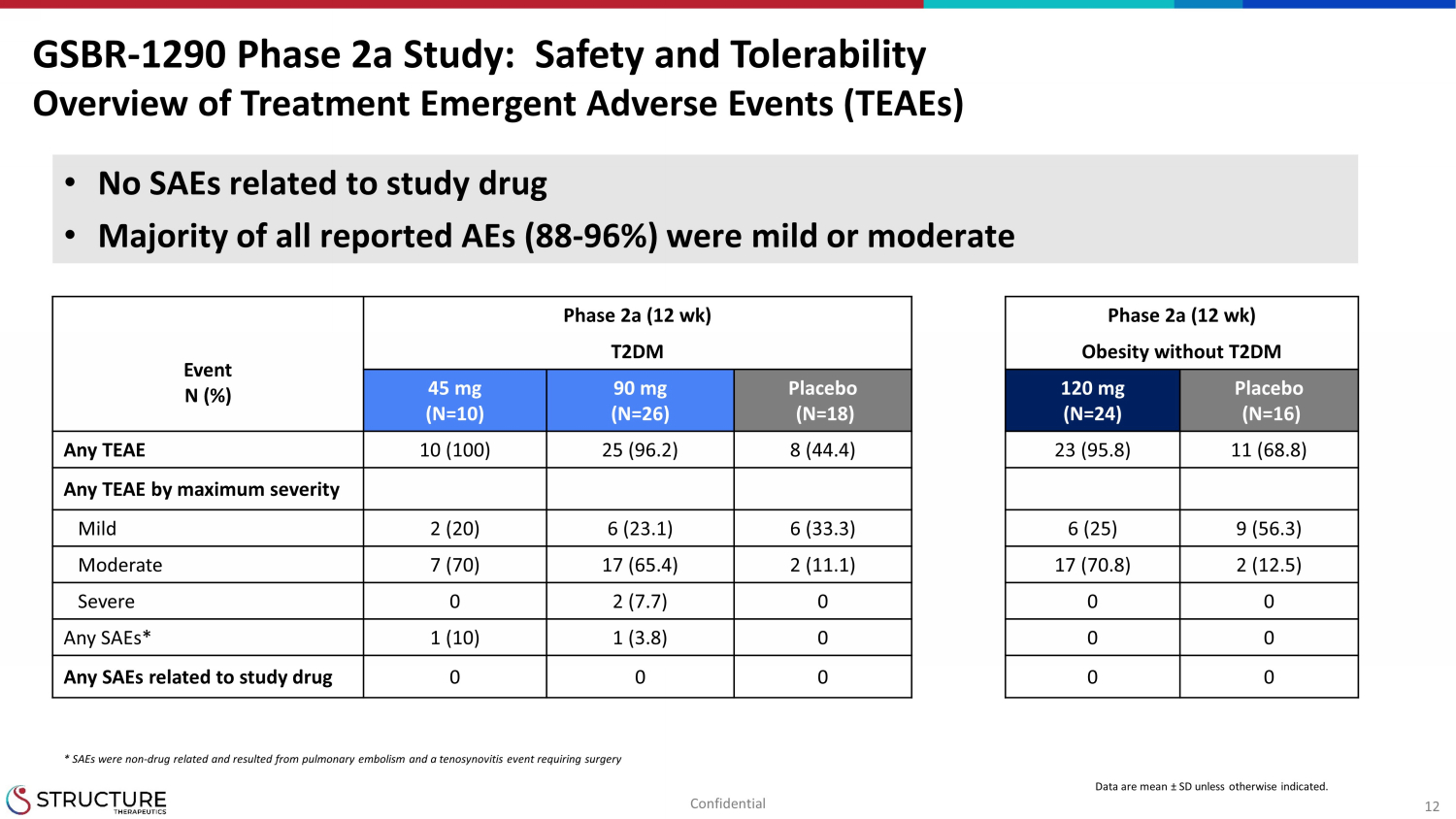
12 フェーズ 2a (12 週) フェーズ 2a (12 週) イベント N (%) T2DMなしの肥満 45 mg (N=10) 90 mg (N=26) プラセボ (N=18) 120 mg (N=24) プラセボ (N=16) 任意のお茶 10 (100) 25 (96.2) 8 (44.4) 23 (95.8) 11 (68.8) 最大重症度別のあらゆるTEAE軽度(20)6(23.1)6(33.3)6(25)9(56.3)中等度 7(70)17(65.4)2(11.1)17(11.1)17(70.8)2(7.7)0 0 0 任意のSAE* 1(10)1(3.8)0 0 0 0 治験薬に関連するすべてのSAES 0 0 0 0 SBR-1290フェーズ2a試験:治療の安全性と忍容性の概要緊急有害事象(TEAE)データは、特に明記されていない限り、平均±SDです示されました。• 治験薬に関連するSAEなし • 報告されたすべてのAEの大部分(88-96%)は軽度または中等度でした。* SAEは非薬物関連で、肺塞栓症と手術を必要とする腱滑膜炎が原因でした。機密
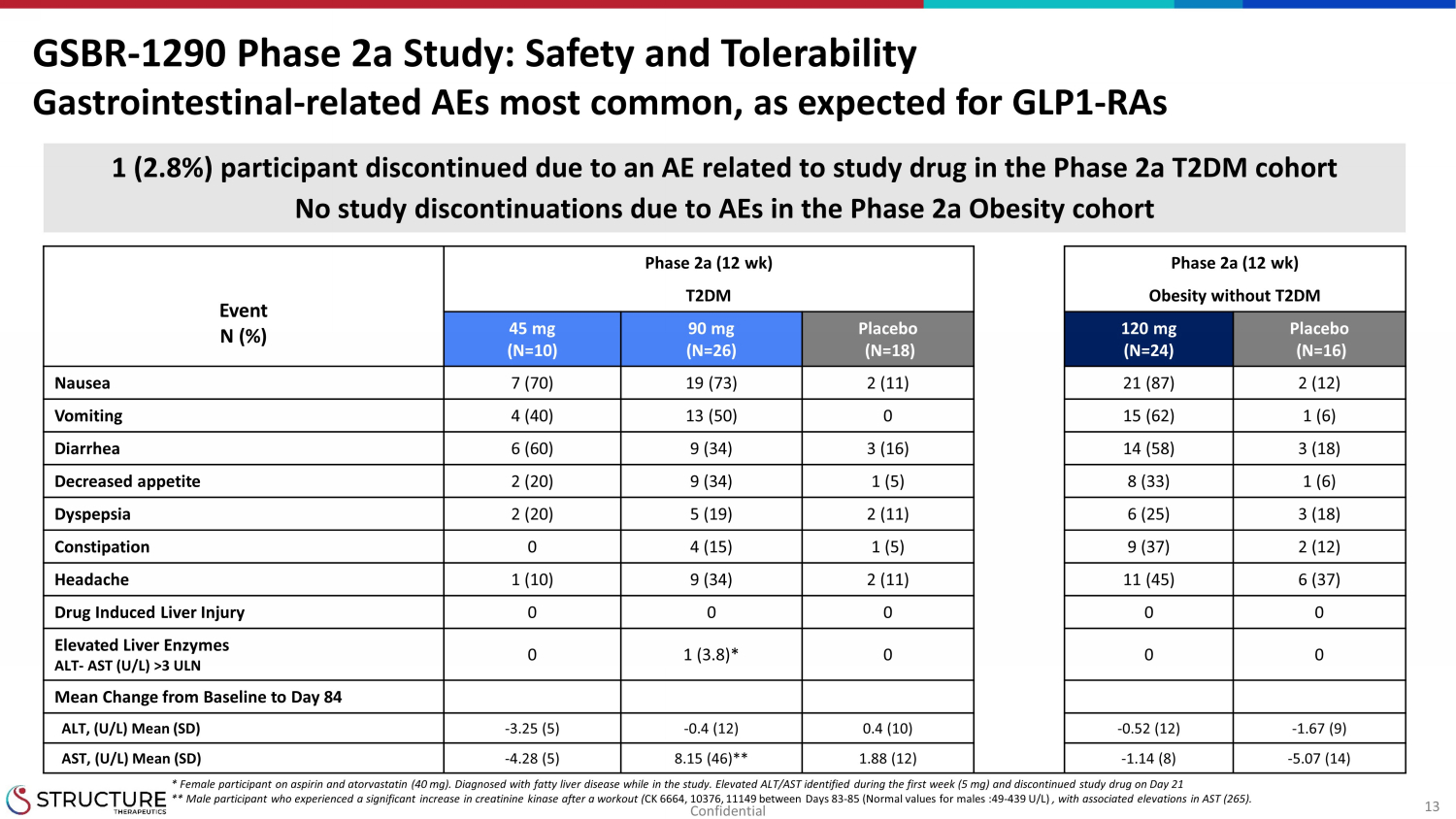
13 フェーズ 2a (12 週) フェーズ 2a (12 週) イベント N (%) T2DM T2DMなしの肥満 45 mg (N=10) 90 mg (N=26) プラセボ (N=16) プラセボ (N=16) 吐き気 7 (70) 19 (73) 2 (11) 21 (87) 2 (12) 嘔吐 4 (40) 13 (50) 0 15 (62) 1 (6) 下痢 6 (60) 9 (34) 3 (16) 14 (58) 3 (18) 食欲減退 2 (20) 9 (34) 1 (5) 8 (33) 1 (6) 消化不良 2 (20) 5 (19) 2 (11) 6 (25) 3 (18) 便秘 0 4 (15) 9 (37)) 2 (12) 頭痛 1 (10) 9 (34) 2 (11) 11 (45) 6 (37) 薬物誘発性肝障害 0 0 0 0 0 肝臓酵素の上昇 ALT-AST (U/L) >3 ULN 0 1 (3.8) * 0 0 0 平均変化ベースラインからALT84日目まで、(U/L) 平均 (SD) -3.25 (5) -0.4 (12) 0.4 (10)-0.52 (12) -1.67 (9) AST、(U/L) 平均 (SD) -4.28 (5) 8.15 (46) ** 1.88 (12) -1.14 (8) -5.07 (14) GSBR-1290 フェーズ 290 a 研究:安全性と忍容性 GLP1に予想されるように、胃腸関連のAEが最も一般的です-フェーズ2a T2DMコホートの治験薬に関連するAEのためにRA1(2.8%)の参加者が中止されました。フェーズ2a肥満コホートのAEによる研究中止はありません* アスピリンとアトルバスタチン(40 mg)を服用している女性参加者。研究中に脂肪肝疾患と診断されました。最初の週にALT/A STの上昇(5 mg)が確認され、21日目に治験薬が中止されました。** 運動後にクレアチニンキナーゼの有意な増加(CK 6664、10376、11149(男性の正常値:49〜439 U/L)を経験し、関連するASTの上昇(265)を経験した男性参加者。機密
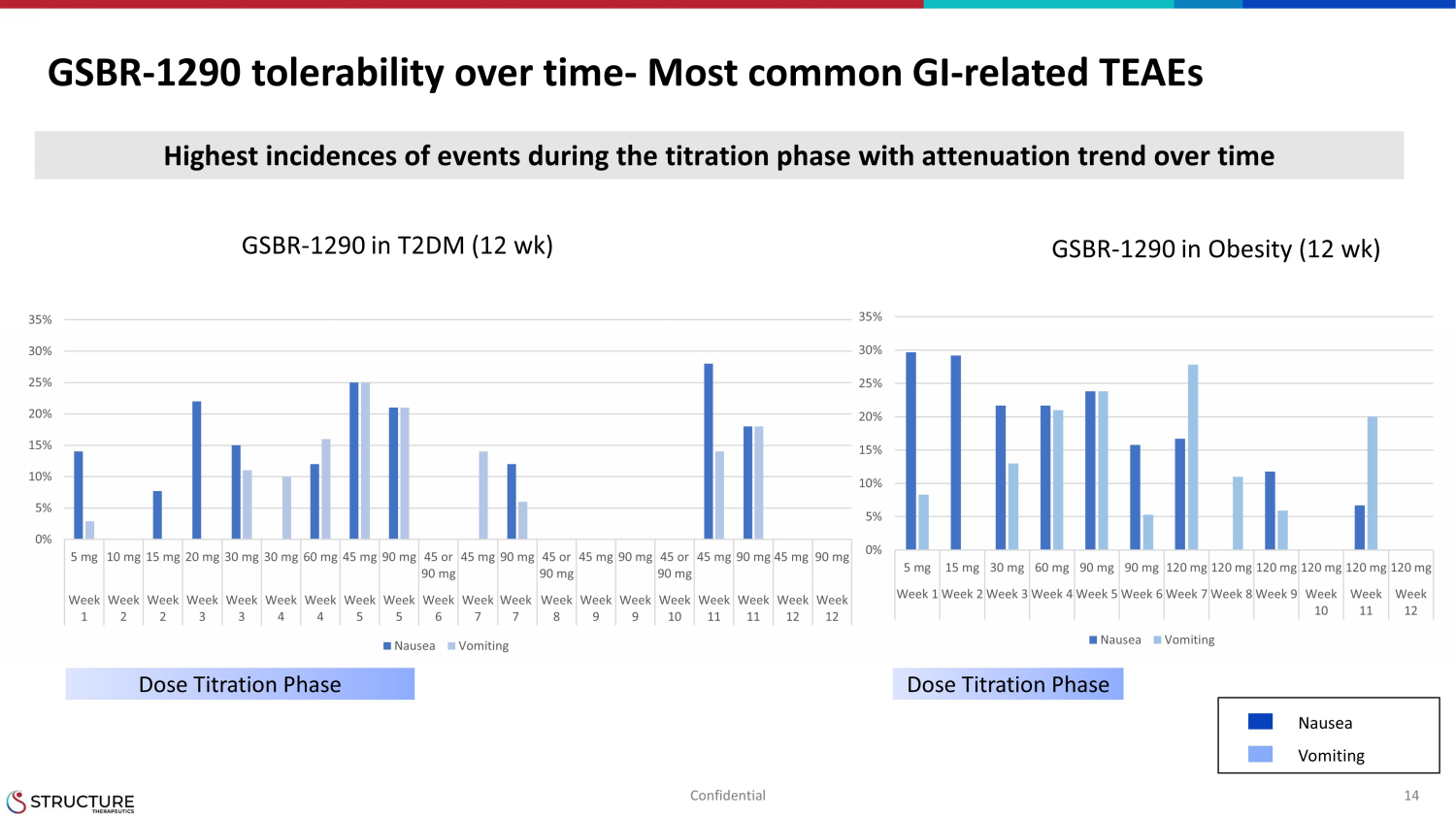
GSBR-長期にわたる耐容性1290%-最も一般的な消化管関連のTEAE 14の機密:時間の経過に伴う減衰傾向を伴う滴定段階でのイベントの発生率が最も高い GSBR-1290 T2DM(12週間)GSBR-1290% 肥満(12週間)用量滴定段階用量滴定段階吐き気嘔吐 0% 5% 10% 15% 20% 25% 30% 35% 5 mg 15 30 mg mg 60 mg 90 mg 90 mg 120 mg 120 mg 120 mg 120 mg 120 mg 週 1 週 2 週 3 週 4 週 5 週 6 週 7 週 8 週 9 週 10 週 11 週 12 吐き気嘔吐 0% 10% 15% 20% 25% 30% 35% 5 mg 10 mg 15 mg 20 mg 30 mg 30 mg 30 mg 30 mg 60 mg45 mg 90 mg 45 または 90 mg 45 mg 90 mg 45 または 90 mg 90 mg 90 mg 45 mg 90 mg 45 mg 90 mg 45 mg 90 mg 90 mg 週 1 週 2 週 3 週 4 週 4 週 5 週 5 週 6 週 7 週 7 週 8 週 9 週 10 週 11 週 11 週 12 週 12 吐き気嘔吐

GSBR-1290第2a相試験(12週間):心拍数の変化15非公開 •GSBRでより高い脈拍数(5〜8 bpm)が観察されました-クラスで予想どおり1290 •他のGLPと一致した増加-1RA、2、2 Granhall C、Donsmark M、Blicher TMなどコリン・ファーマコキネット。2019年; 58 (6): 781-791。プラットE、Ma X、Liu R、他。糖尿病と肥満の男性のタブです。2023; 25:2634 — 2641。1分あたりの拍数(BPM)0 1 2 3 4 5 6 7 8 9 GSBR-1290 45 mg GSBR-1290 90 mg GSBR-1290 120 mg HR(bpm)のベースラインから12週目に変更、プラセボ調整済みT2DM肥満(T2DMなし)

16 GSBR-1290プログラム更新の有効性概要フェーズ2a — 2型糖尿病患者を対象とした最初の研究のトップラインデータフェーズ2a — 肥満患者を対象とした中間結果機密
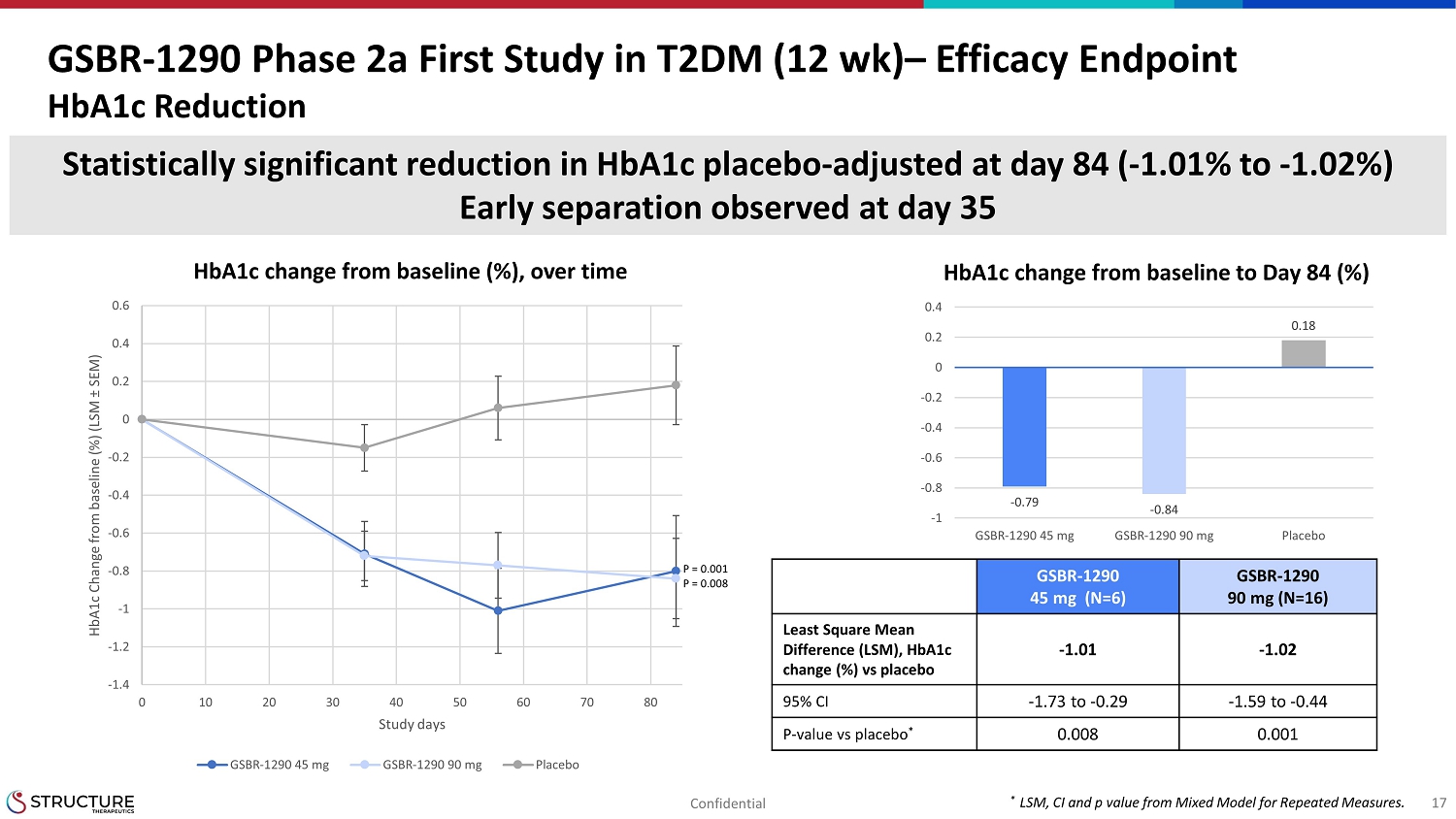
GSBR1290フェーズ2a T2DMに関する最初の研究(12週)有効性エンドポイントHBA1cの削減84日目に調整されたHbA1cプラセボの統計的に有意な減少(1.01%から1.02%)3517日目に観察された早期分離(ベースラインから84日目への変化(%)HbA1cのベースラインからの変化(%)、時間の経過に伴う1.4-1.2cの変化 -1-0.8-0.6-0.4-0.200.20.40.60 10 20 30 40 50 60 70 80hba1c ベースラインからの変化 (%) (LSM SEM) 研究日GSBR-1290 45 mg GSBR-1290 90 mg プレースボグSBR129045 mg (N=6) GSBR129090 mg (N=16) 最小二乗平均差 (LSM), HbA1cChange (%) 対プラセボ-1.01 -1.0295% CI-1.73から 0.29 -1.590.44P値対プラセボ0.0080.001*LSM、CIおよびp値を繰り返し測定しました。-0.79-0.840.18-1-0.8-0.6-0.4-0.200.20.4gsbr-1290 45 mg GSBR-1290 90 mg プラセボ、N=17P = 0.001P = 0.008機密

18GSBR129045 mg (N=6) GSBR129090 mg (N=16) 最小二乗平均差 (LSM)、プラセボ-3.51に対するBW (%) の変化 -3.2695% CI-5.58から1.43 -5.17から1.36P値対プラセボ 0.00190.0013ベースラインからの体重変化 (kg)、時間の経過に伴うベースラインからの体重変化 (%)、84日目からの体重変化 *反復測定のための混合モデルからのLSM、CI、p値-3.32 -3.220.04-3.50-3.00-2.50-1.00-0.500.000.50GSBR-1290 45 mg GSBR-1290 90 mg プラセボ 84日目にプラセボの統計的に有意な減少(3.26%から3.51%)84日目に体重の継続的な減少(3.26%から3.51%)まずT2DM(12週)の研究有効性エンドポイント/体重減少-5-4-3-2-10120 10 20 30 40 50 60 70 80ベースラインからの体重変化(kg)(LSM SEM)研究日GSBR-1290 45 mg GSBR-1290 90 mg プラースボップ = 0.0005P = 0.0007機密

-1.61-1.281.21-2.00-1.50-1.00-0.500.000.501.001.50GSBR 45 mg GSBR 90 mg プラセボ-4-3-2-10120 20 40 60 80ベースラインからの空腹時血漿グルコース変化 (mmol/L) (LSM SEM) 研究日GSBR1290 45 mg GSBR-1290 90 mg プラセボグSBR1290 フェーズ 2a: 最初の研究 T2DM(12週)の有効性エンドポイント空腹時血漿グルコースの統計的に有意な減少19ベースラインからの空腹時血漿グルコースの変化(mmol/L)、84日目ベースラインからの空腹時血漿グルコース変化(mmol/L)、時間の経過に伴うGSBR129045 mg(N = 6)GSBR129090 mg(N = 16)最小二乗平均違い(LSM)、FPGの変化(mmol/L) 対プラセボ-2.70-2.5095% CI-4.82~0.56 -3.90から1.08P値対プラセボ 0.010.0008P = 0.0008P = 0.01*反復測定のための混合モデルからのLSM、CI、p値機密

GSBR-1290フェーズ2a:T2DMに関する最初の研究(12週間)— 有効性エンドポイント混合食事耐性試験プラセボで84日目(LSM)のBLからの変化(LSM)GSBR-1290で食後グルコース、インスリン、インスリン抵抗性マーカー(mmol/L*Hour)、AUC 0-4 インスリン(mIU/l*hour)の改善が示されました、AUC 0-4 HOMA-IR、AUC 0-4-19.4-113.7-78.3-20.4-47.5-49.0 -120 -100 -80 -60 -40 -20 0 GSBR-1290 45 mg、N=6 GSBR-1290 90 mg、N=16 P 値 = 0.0008 P 値 = 0.02 P 値 = 0.05 P 値 }
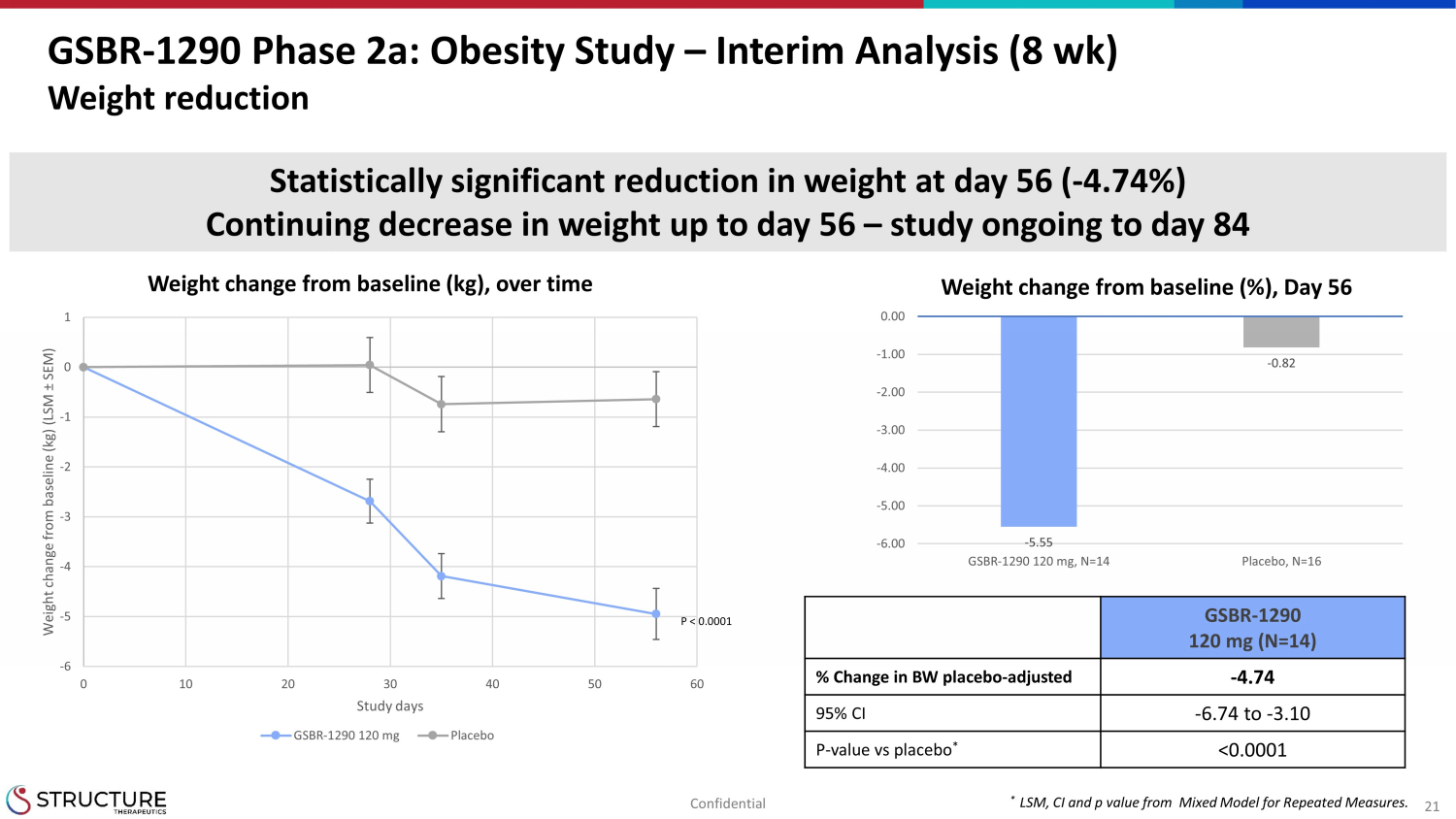
21 GSBR-1290 フェーズ 2a: 肥満研究 — 中間分析 (8 週間) 体重減少ベースライン (kg) からの体重変化、経時変化* 反復測定のための混合モデルからのLSM、CI、p値。-6 -5 -4 -3 -2 -1 0 1 0 10 20 30 40 50 60 ベースラインからの体重変化 (kg) (LSM ± SEM) 研究日 GSBR-1290 120 mg プラセボ-5.55-0.82 -6.00 -5.00 -4.00 -3.00 -2.00 -1.00 0.00 GSBR-1290 120 mg、N=14プラセボ、N=16 ベースラインからの体重変化(%)、56日目での体重の統計的に有意な減少(-4.74%)56日目までの体重の継続的な減少(-4.74%)56日目まで体重の継続的な減少-研究中84日目までのGSBR-1290 120 mg (N=14)% BWプラセボの変化-調整後-4.74 95% CI-6.74から-3.10 P-プラセボとの比較 *

22 GSBR-1290 体重減少の要約 2DMと肥満で観察された臨床的に有意で統計的に有意な体重減少ベースラインから22%の変化 -6 -5 -4 -3 -2 -1 0 1 10 20 30 40 50 60 70 80 90 ベースラインからの体重変化(%)肥満 90mg(pH1b)肥満120mg(pH2a)研究日以外-T2DM プラセボ(pH2a)) プラセボ (pH1b) プラセボ (pH2a肥満) プラセボ (ジャパニーズ・ブリッジング) 肥満30mg (pH1b) プラセボT2DM 90mg (pH2a) 90mg (pH2a) リーンノン-ジャパニーズ60mg (ブリッジング) リーンジャパニーズ60mg (ブリッジング) 肥満60mg (pH1b)

経口小分子 GLP 1RA-14-12-10-8-6-4-2020.0 4.0 8.0 12.0 16.0 20.0 24.0 28.0 32.0 36.0 ベースラインからの体重変化 (%) 研究時間 (週) ベースラインからの体重変化 (%) GSBR1290 120mgObesityGSBR1290 45/90mgT2Dmorforglipr24/45mg2肥満またはフォルグリプロン12mg1T2Dまたはフォルグリプロン 12mg2肥満、またはホルグリプロン24/45mg1T2DM、プラセボグ(BR1290)、肥満の120mgは、肥満のオルフォルグリプロンに対して8週間で競争力があります。1 ランセット(https://doi.org/10.1016/S0140 6736(23)01302)8)と2 ニューイングランド・ジャーナル・メディスン 10.1056/NejmoA2302392*頭なしGSBR 1290と、ここに含まれるオルフォルグリプロンを比較して、先ほどの研究が行われました。研究デザインと条件には違いがあり、研究間でデータを比較する場合は注意が必要です

GSBR-1290プログラム更新フェーズ2b-活動の有効化フェーズ1 — 日本のブリッジング研究前臨床GLP-毒性学研究 24 機密

25 GSBR-1290フェーズ1(4週間):日本人と日本以外の架け橋研究 • 参加者全員が研究を完了した • 中止または減量なし • SAEなし N(%)日本人コホート日本人以外のコホート 60mg(N=9)プラセボ(N=3)60mg(N=6)吐き気6(66.70)0 3(50.0)食欲減退6(66.7) 0 1 (16.7) 早期満腹感 3 (33.3) 0 1 (16.7) 嘔吐 3 (33.3) 0 0 0 下痢 1 (11.1) 0 0 0 肝臓酵素の上昇 0 0 0-0-3.91-5.13-1.67 -6 -5 -4 -3 -2 -1 0 GSBR-1290 60mg 日本人 (n=9) GSBR-1290 60mg 非日本人 (n=6) 日本製 EBO (N=3) -3.5 -3 -2.5 -2 -1.5 -1-0.5 0 0 5 10 15 20 25 30 ベースラインからの平均体重変化 (kg) 研究日数 GSBR-1290 日本人 (n=9) GSBR-1290 非日本語 (n=6) 日本のプラセボ (N=3) 健康なボランティアで4週間後に観察された有意な体重減少 (%) ベースラインから28日目までの体重変化 (%) 秘密参加者 • ベースラインのBMIが22~23 kg/m 2 • 年齢:34歳から46歳 • 主に女性(67%)

26 6/9か月のGLP-毒物学研究の予備結果 x げっ歯類を対象とした6か月間の研究(N = 216)• 6か月間(10、100、1000 mg/kg/日)毎日経口投与、さらに1か月間の回復 • グループあたりの動物(治療+回復):N=15+5/グループ/性別 •NOAELは1000 mg/kg/日で、120 mgの治療で100倍以上の安全ウィンドウにつながります用量 • ALT/ASTの増加なし、検査なし-記事関連の肝臓の変化×健康なn匹の霊長類(N = 60)での9か月間の研究(N = 60)•毎日9か月間経口投与(3、10、30 mg/kg/日)、さらに1か月の回復期間•1グループあたりの動物(治療+ 回復):N=5+4/グループ/性別(高用量)およびN=4+2/グループ/性別(その他の用量)•用量依存性体重減少ベースラインと比較して最大-20%減少 •ALT/ASTの増加も検査もなし-物品関連の肝臓の変化 NOAEL:副作用は観察されませんレベル機密

27 GSBR-1290全体のプロフィールと次のステップ:マーク・バッハ、医学博士、CMO機密

28 GSBR-1290 — フェーズ2aの臨床データの有効性の概要:毎日120 mgを服用して8週間で統計的に有意な体重減少(4.74%)。研究は12週間にわたって続きます。安全性:SAEなし。最大12週間のAEによる中止なし忍容性:ほとんどのAE(96%)軽度から中等度の機密肥満:1日1回の経口療法としてクラス最高の2型糖尿病:HbA1cの有効性の促進 T2DMの有効性における減量を最適化するためのさらなる評価:HbA1c(1.02%)と体重(3.51%)の統計的に有意な減少 12週目安全性:SAEなし。治験薬関連のAEによる1回の中止は最大12週間耐容性:ほとんどのAE(88— 90%)軽度—中等度x6および9か月の前臨床毒性試験より高い用量とより長い治療期間をサポートします

29 次のステップ:製剤間の橋渡しと滴定の最適化カプセルから錠剤への製剤化を研究し、追加の滴定スキームを検討します。パート2:• 錠剤を使用したさまざまな滴定スキームでの耐容性を評価するには •治療用量(60 mg)でのカプセルと錠剤のバイオアベイラビリティの比較を研究します。ステータス:プロトコルの最終決定予測スケジュール:-24年第2四半期のスクリーニングチェックによるトップライン結果-投与チェック中-電話での問い合わせコールチェック-投与中チェック-アウトフォローアップコール EOS訪問PK評価 PK評価日-28-2-1 1 2 3 4 5 7 8 9 10 1117 ////カプセルタブレットカプセル研究監禁期間研究外来期間健康太りすぎ/肥満参加者 N= 54 コホート3 12:3 スクリーニング 5mg 15mg 30mg 60mg カプセル 60mg タブレット 60mg カプセル 60mg タブレットフォローアップ 60mgカプセル-4-3-2-1 0 1 2 3 4 6 7 8 9 10 11 12 13 14 コホート 2 12:3 スクリーニング 15mg 60mg 90mg 120mgフォローアップコホート1 12:3 スクリーニング 10mg 20mg 30mg 60mg 90mg 120mg フォローアップパート1:カプセルと錠剤(10 mg用量)のPKを比較するには、N = 16 x 登録完了 □ トップライン-2024年第2四半期に予想される12週間の研究結果(機密)

30 GSBR-1290クロージングレイモンド・スティーブンス博士、CEOコンフィデンシャル

31 GSBR-1290:2023年のプログラムの進捗状況と予想されるマイルストーン 2024 x フェーズ1b/MADデータ(4週間)• N=24、健康な太りすぎ/肥満の参加者、最大90 mg • 有害事象なし-関連の中止は最大90 mg • 60mgおよび90mg xフェーズ2a T2DMでの統計的に有意な体重減少(プラセボ調整後)データ(12週間)• N=54、T2D参加者、最大90mg • 治験薬に関連するAEによる研究の中止1回(2.8%)• 45mgおよび90mg xフェーズ2aでの体重の統計的に有意な減少(プラセボ調整後最大3.51%)肥満データ(暫定8週間)• N=40、健康な太りすぎ/肥満の参加者、最大120 mg • 有害事象なし-関連の中止は最大120 mg • 8週間で120 mgで統計的に有意な体重減少(プラセボ調整後4.74%)x 日本 PK/エスノ-ブリッジングデータ(4週間)• N=18 非肥満、健康な成人、日本人以外の参加者、最大60 mg • 有害事象なし-関連の中止は最大60 mg • 4週間で60 mgで体重の大幅な減少(3.91%から5.13%、プラセボではない-調整)xクリーンな6/9か月のGLP-毒性報告 □ フェーズ2a 肥満データ(12)wk) • N=64人の参加者、最大120 mg • 24人の代替参加者の登録 • 2024年第2四半期に完了予定の □カプセルから錠剤へのPK/製剤データ(12週間)• N = 54人の参加者、最大120 mg • 2024年第2四半期に完全登録および完了が予定されている □ 肥満INDの提出 • 慢性体重管理のためのINDを2024年第2四半期にFDAに提出する □ 第2b相肥満臨床試験(~36 wk) • 忍容性を最適化するための用量滴定法の変更 • 米国とヨーロッパで約275人の参加者 • 2024年下半期に開始予定 □ 第2相T2DM臨床試験の追加 •目標用量の患者の割合を増やすための高用量、長期滴定、2型糖尿病における有効性を最適化するための代替製剤の使用の可能性を評価してください。•2024年下半期に開始予定(機密)

32 潜在的に最高の経口GLPに向けた私たちの旅-1Rアゴニストxフェーズ2a T2DM(12週間)xフェーズ2a肥満(暫定)xフェーズ1b MAD(4週間)2023年9月フェーズ2b肥満(約36週)概念実証フェーズ2b T2DM(約26週)用量-範囲発見/最適化フェーズ3 肥満(>>>肥満)52wk)フェーズ3 T2DM(52週以上)重要な研究/隣接する適応症 2023年12月、2024年〜2025年、2026年以降、追加の製剤、滴定、投与計画を含む M ASH 慢性腎臓病心不全依存症アルツハイマー病フェーズ2 T2DM 増加の大きな機会アクセシビリティと2型糖尿病と肥満の治療* 注:会社が現在予想している将来の開発計画を表しています。これらの計画は、研究結果などに基づいて変更される可能性があります。機密
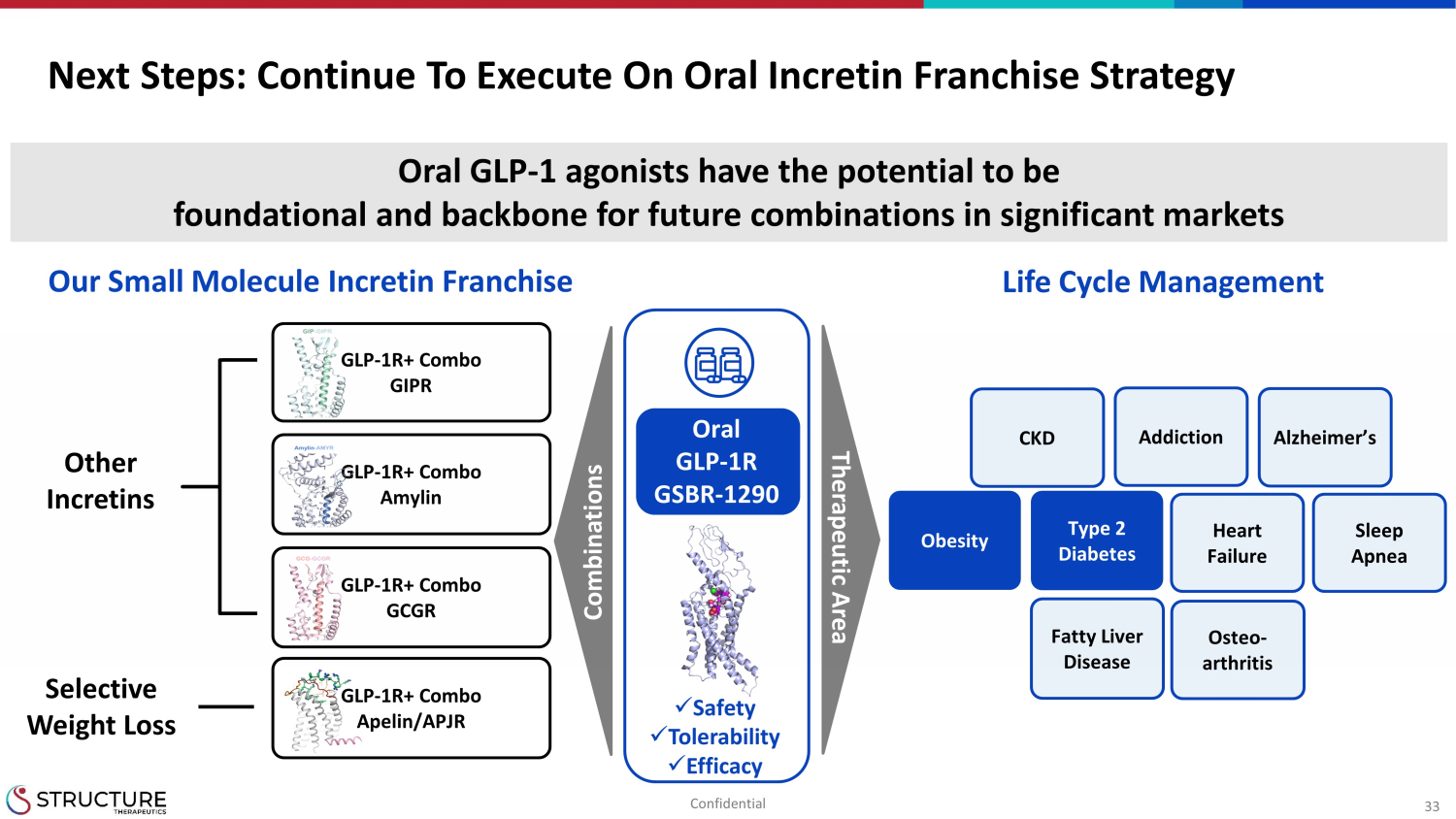
33 次のステップ:経口インクレチンフランチャイズ戦略の実行を続けてください GLP-1R+コンボ GIPR GLP-1R+ コンボアミリン GLP-1R+ コンボアペリン/APJR GLP-1R+ コンボ GCGR オステオ-関節炎、脂肪肝疾患、肥満 2 型糖尿病、アルツハイマー病、心不全、睡眠時無呼吸、その他のインクレチン、選択的減量 x 安全性 x 耐容性x有効性依存症経口GLP-1つのアゴニストは、重要な市場での将来の組み合わせの基礎およびバックボーンとなる可能性があります。組み合わせ治療領域のライフサイクル管理当社の小分子インクレチンフランチャイズ経口GLP-1R GSBR-1290コンフィデンシャル

34GSBR-1アゴニスト・イン・コンテキスト • 肥満、2型糖尿病、慢性腎臓病、MASHなどの心臓代謝性疾患を治療するための経口GLP-1アゴニストの重要な将来の市場機会 •経口GLP-1アゴニストは、将来の組み合わせの基礎およびバックボーンとなる可能性があります。安全性と耐容性は、さまざまな作用機序と組み合わせて、治療の有効性を最適化するための重要な要件です、安全性と忍容性-有望なメカニズムには、他のインクレチンや筋肉維持目標が含まれます。•今日に基づいて総合的な更新、GSBR-1290は、この重要な市場で有望な経口GLP-1アゴニストの特徴を備えているようです x 一般的に忍容性が高く、最大120 mgまでの治験薬に関連する重篤な有害事象(SAE)はありません x フェーズ2a肥満研究でのAEによる研究中止なし x 1件の研究中止(2.8%)、第2a相2型糖尿病研究における治験薬に関連するAEによる研究の中止なし(2.8%)x 6か月のげっ歯類と9か月の霊長類の研究で大きな発見はありませんでした—フェーズ2bプログラムでの長期的な評価を可能にします x臨床的に意味があり、肥満と2型糖尿病における統計的に有意な体重減少 x 将来の第2b相試験で追加の投与と滴定を行うことで、有望な安全性、忍容性、有効性プロファイルを最適化します。機密

ありがとうございます!追加情報についてはお問い合わせください:電子メール:ir@structuretx.com http://www.structuretx.com 機密