

LYFGENIA™ 2023年12月8日 8日ナスダック:ブルーエグジビット99.1

これらのスライドとそれに付随する 口頭でのプレゼンテーションには、改正された1933年の証券法のセクション27Aおよび改正された1934年の証券取引法のセクション21Eの意味における将来の見通しに関する記述が含まれており、リスクと 不確実性を伴う特定の記述が含まれています。これには、LYFGENの商業的開始に関するものを含む、当社の事業計画と期待に関する記述が含まれますが、これらに限定されません。IAとLYFEGNIAの潜在的に参入可能な市場。 の終了、会社の優先審査の売却バウチャー、2023年の革新的な支払いの実証に関する期待、および会社のQTCネットワークの予想される成長とその時期。「期待」、 「予想する」、「信じる」、「かもしれない」、「する」などの言葉を使った記述も、将来の見通しに関する記述です。このような記述には、会社の 製品の の商品化と製造の遅れや課題など、多くのリスクと不確実性が伴います。継続的かつ計画的な活動に必要な内部および外部のコスト、および結果として生じる費用と現金の使用への影響は、予想よりも高く、将来的には予想よりも高くなる可能性があります。これにより、 会社は現金をより早く使用するようになり、将来的にはそうなる可能性があります。予想以上にか、計画の一部を変更または縮小するか、あるいはその両方です。それに関してはかなりの疑問があります会社の存続能力は継続的な懸案事項です。計画の変更や実際の出来事が想定と異なる場合、 会社の過去および進行中の臨床試験から得られる有効性と安全性が継続されないリスク、製品候補で治療された他の患者で継続または確認されないことなど、経費、現金使用量、および現金需要に関する 会社の期待が正しくないことが判明する可能性があります。レンチウイルスベクター、薬物 製品、または骨髄アブレーションに関連する遺伝性またはその他の報告可能な事象。Skysona、Zynteglo、Lyfgeniaなど、会社の製品または製品候補の1つ以上が正常に商品化されないリスク、およびその他のリスクは、 当社のフォーム10-Kの年次報告書、フォーム10-Qの四半期報告書、および証券取引委員会に提出されたその他の報告書に随時詳述されています。法律で義務付けられている場合を除き、当社は、新しい情報、将来の発展、またはその他の結果として、このプレゼンテーションに含まれる の将来の見通しに関する記述を改訂したり、このプレゼンテーションの日付以降に発生した出来事や状況を反映するように更新したりする義務を負わないものとします。将来の見通しに関する記述

歓迎と開会の挨拶 Andrew Obanshain、最高経営責任者臨床データとラベルのハイライトリッチ・コルビン、MD、PhD、最高医療責任者、コマーシャル・ローンチ計画、トム・クリマ、最高商務責任者兼執行責任者、クロージング・アンドリュー・オベンシャイン、最高経営責任者 質疑応答

LYFGENIA:今、FDAは承認しました

LYFGENIAの臨床データとラベル のハイライトリッチ・コルビン、医学博士、最高医療責任者

SCDの成人のうち、末端臓器の損傷があり、24%が複数の臓器の損傷を経験しており、死亡年齢の中央値がわずか45歳であるにもかかわらず、直接医療費として4人に1人、SCD患者の3%が病気のために仕事を辞めたと報告しています4 1.チャトゥルヴェーディSら。私はヘマトールです。2018 3; 2.加藤GJ、ピクセルFB、リードCDなど。鎌状赤血球症。Nat Rev ディスク入門書。2018; 4:18010. 3.ギャラガーMEら、Jメッド・エコノ。2022年1月から12月4日。ホールドフォードら2021年のSCD患者は、452歳までに脳卒中を起こします。患者の平均は4〜600万ドル〜65% 50%から60%
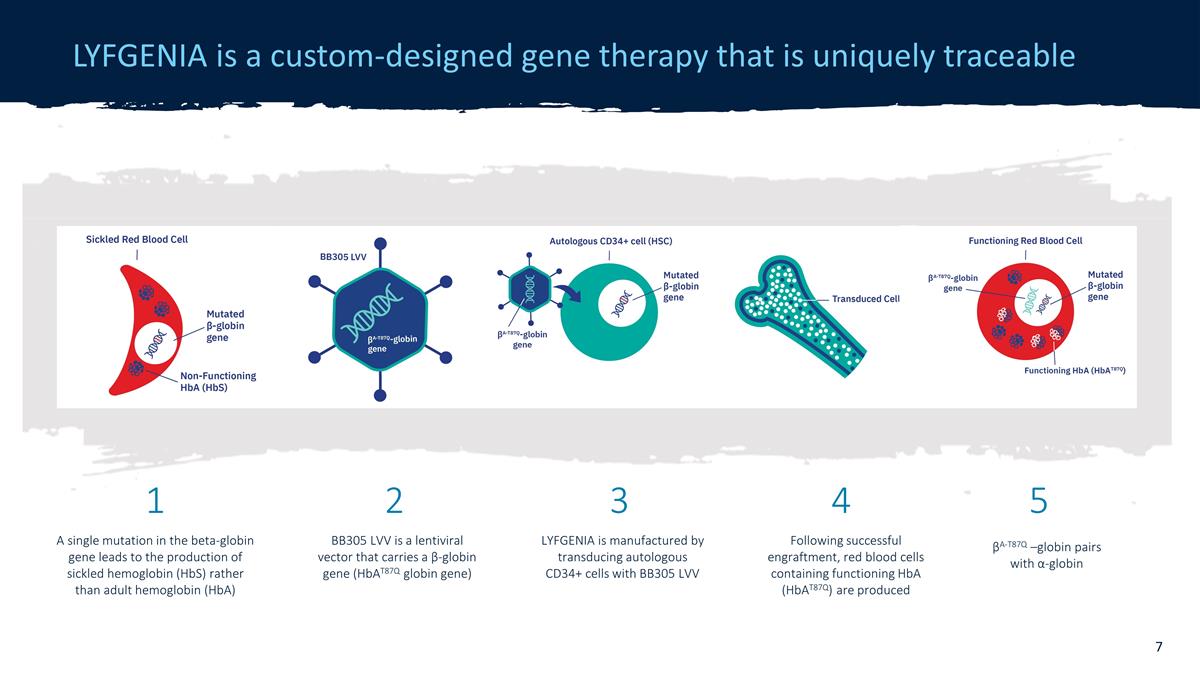
LYFGENIAは、独自に追跡可能なカスタム設計の遺伝子 療法です。β-グロビン遺伝子の単一の変異により、成体ヘモグロビン(HbA)ではなく鎌状ヘモグロビン(HbS)が生成されます。LYFGENIAは、自家CD34+細胞をBB305 LVV βA-T87q —グロビンと形質導入することによって製造されます。α-グロビンとのペア生着が成功すると、機能するHBa(HBat87q)を含む赤血球が生成されます。BB305 LVVは、β-グロビン遺伝子(HBAT87qグロビン遺伝子)を運ぶレンチウイルスベクターです 1 2 3 4 5
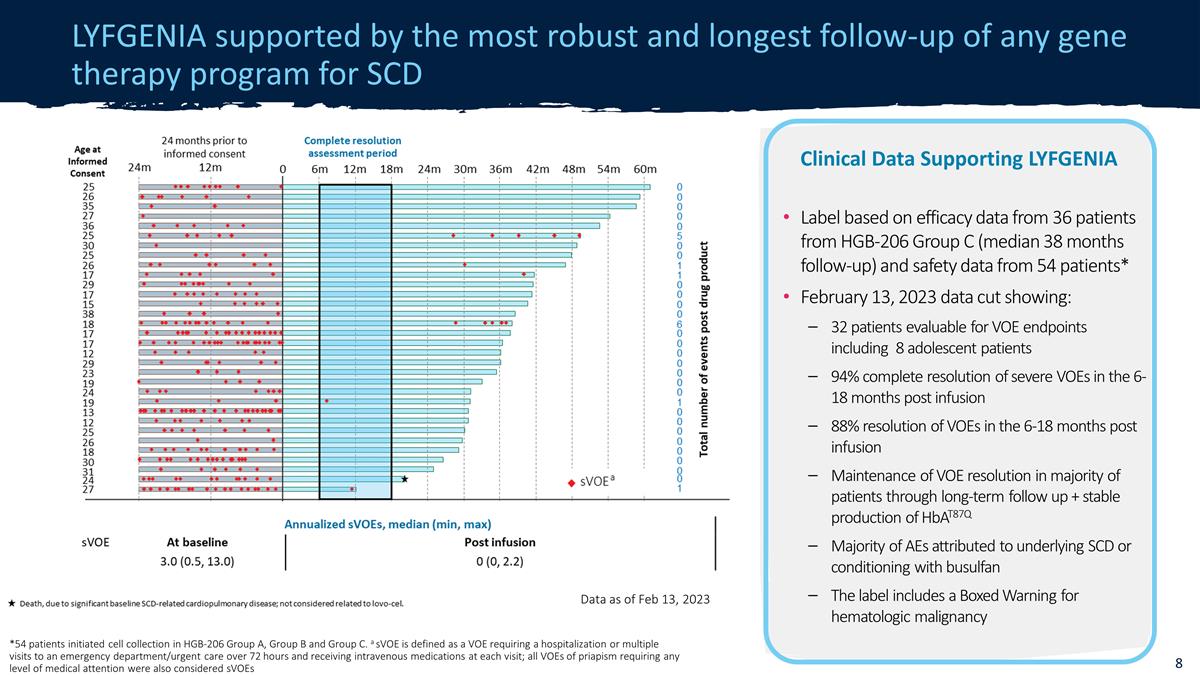
LYFGENIAは、2023年2月13日現在、SCDデータの遺伝子治療プログラムの中で最も堅牢で最長のフォローアップに支えられています。*54人の患者がHGB-206グループA、グループB、グループCで細胞採取を開始しました。SVoEは、72時間以上にわたって入院または 救急科/救急科への複数回の通院を要求し、それぞれに静脈内投薬を受けることを要求するVOEと定義されています。訪問; あらゆるレベルの治療を必要とする持続?$#@$症のすべてのVOEも、HGB-206の36人の患者からの有効性 データに基づいて、LYFGENIAラベルを裏付けるSVOEの臨床データと見なされましたグループC(フォローアップ中央値38か月)と54人の患者からの安全性データ* 2023年2月13日のデータカットによると、8人の思春期患者を含む32人の患者、注入後6〜18か月で重度 VOEの94%、注入後6〜18か月でVOEの88%、長期間のフォローアップによるVOE解像度の維持+ HBAT87の安定した生産により、大多数の患者のVOE解像度の維持 Q AEの大多数は、基礎となる SCDまたはブスルファンによるコンディショニングに起因します。ラベルには、血液悪性腫瘍に関する箱入りの警告が記載されています。

商用ローンチ計画、Tom Klima、 最高商務責任者兼執行責任者
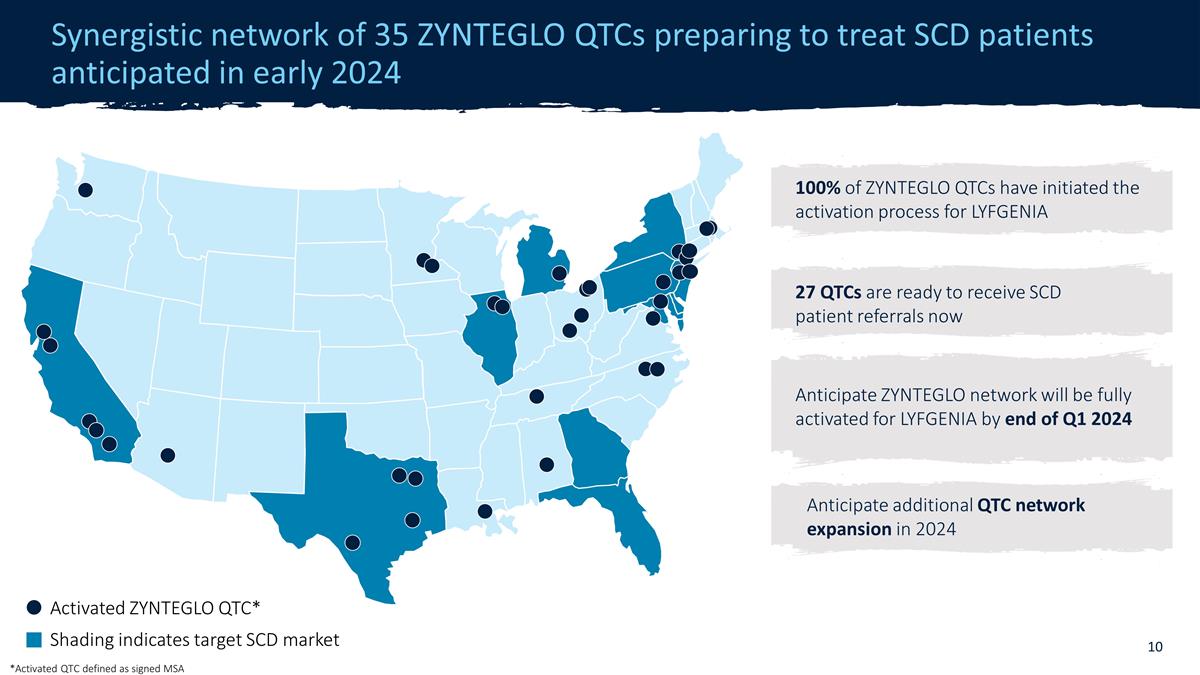
2024年初頭に予定されている35のZYNTEGLO QTCの相乗的ネットワーク、2024年初頭に予定されている27のQTCがSCD患者の紹介を受ける準備ができました ZYNTEGLO QTC* シェーディングはターゲットのSCD市場を示します 2024年にはさらにQTCネットワークが拡大することを予測しています。ZYNTEGLO QTCの100%がLYFGENの活性化プロセスを開始しました IA 2024年第1四半期の終わりまでに、ZYNTEGLOネットワークがLYFGENIA向けに完全にアクティブ化されると予想しています。*アクティブ化されたQTCは、署名されたMSAとして定義されています
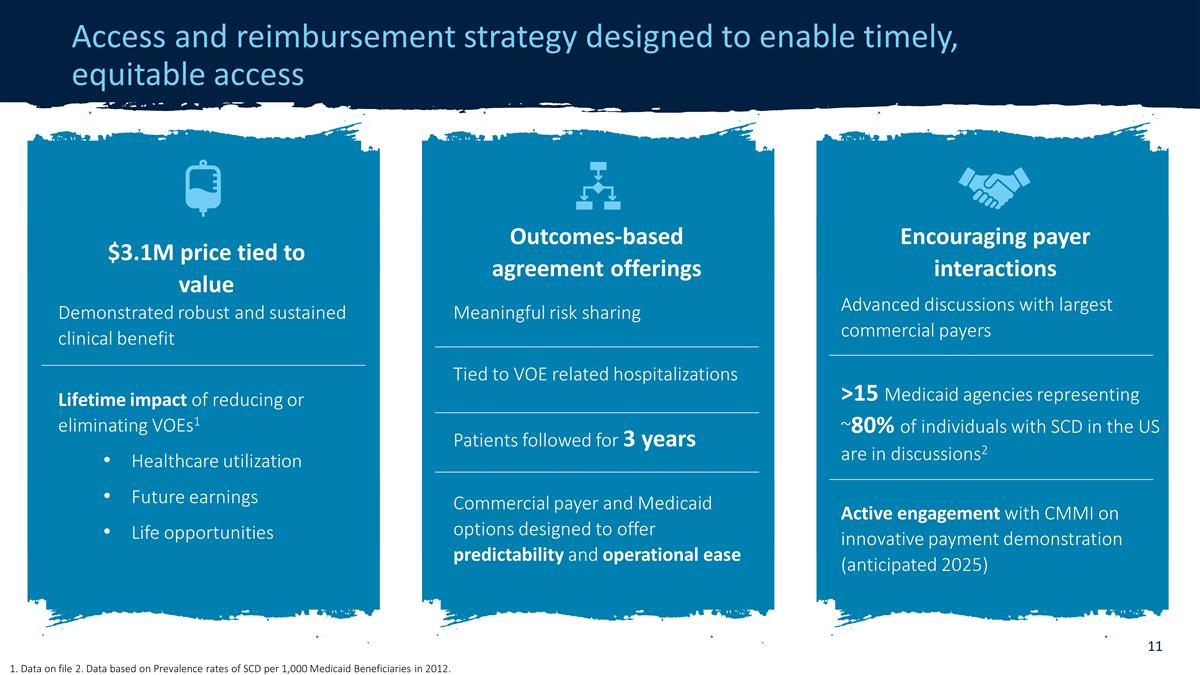
タイムリーで公平なアクセスを可能にするために設計されたアクセスと償還戦略 米国ではSCD患者の約80%を占める15以上のメディケイド機関と事前に話し合っています。2 革新的な支払い の実証に関するCMMIとの積極的な関与(2025年予定)支払者との相互作用の促進強力で持続的な臨床上のメリット実証済み強力で持続的な臨床上のメリット実証1 医療利用の削減または廃止による生涯にわたる影響将来の収益機会 310万ドルの価格は価値に結びついています 有意義なリスク分担 VOEに結びついています関連する入院患者を3年間追跡し、予測可能性と運用が容易になるように設計された商業支払者およびメディケイドのオプション、成果に基づく協定の提供 1.ファイル 2 のデータ。2012年のメディケイド受益者1,000人あたりのSCDの有病率に基づく のデータです。
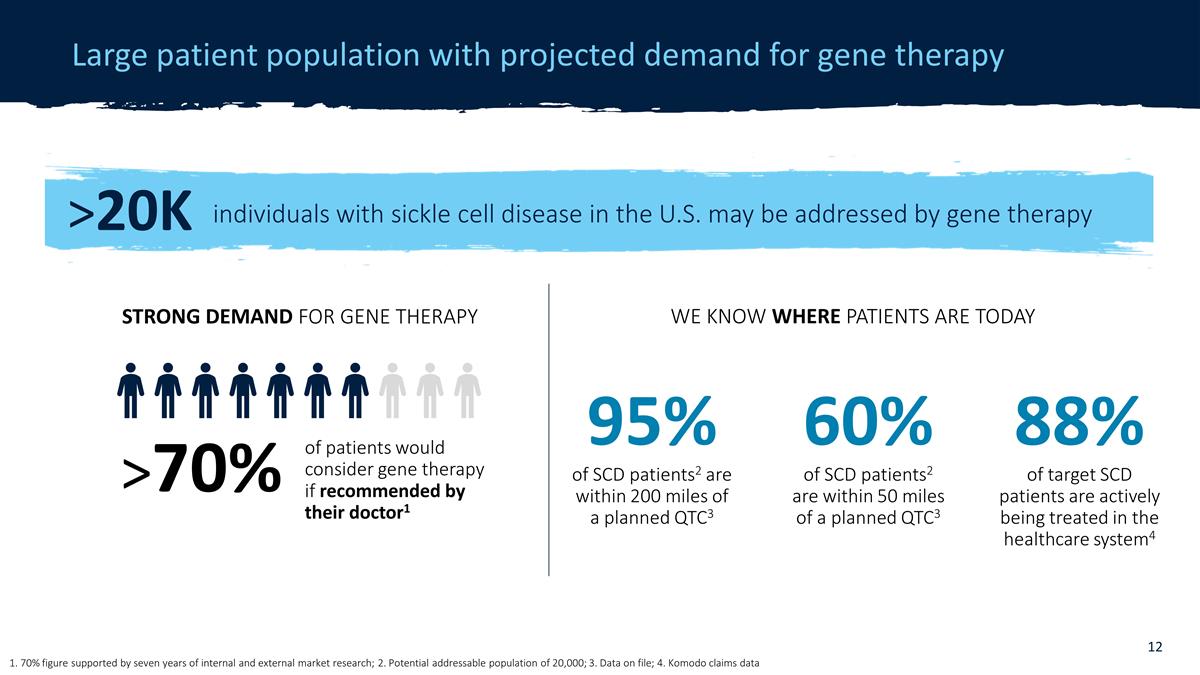
遺伝子治療の需要が予測される大規模な患者集団 1. 7年間の内部および外部の市場調査によって裏付けられた70%の数字。2.20,000人の潜在的な対応可能人口; 3.ファイル上のデータ; 4.Komodoは、データ 米国で2万人を超える鎌状赤血球症の患者が、医師の勧めがあれば遺伝子治療を検討する患者であれば、遺伝子治療によって対処できる可能性があると主張しています1 > 70%以上の遺伝子治療の需要現在、患者はどこにいるかわかっています。SCD患者の60%は 計画されたQTC3から50マイル以内です2、SCD患者の95%は計画されたQTC3から200マイル以内です3 88% 対象となるSCD患者のうち、医療制度で積極的に治療を受けている人の数4

2 米国に2万人の対応可能な患者がいることで、数十億ドル規模の 機会が生まれる可能性があります。強力な商業戦略と予測される患者と医師の需要経験豊富な商業用遺伝子治療チームは、ZYNTEGLOの発売上の大きな相乗効果を活用して、LYFGENIA™ 18か月の商用ヘッドスタート を立ち上げるのに適した立場にあります。同じ治療を行う医師、同じ治療センター、同じ支払者を期待できます。1 3 製造経験を含む遺伝子治療の幅広い専門知識確立された商用 インフラストラクチャ
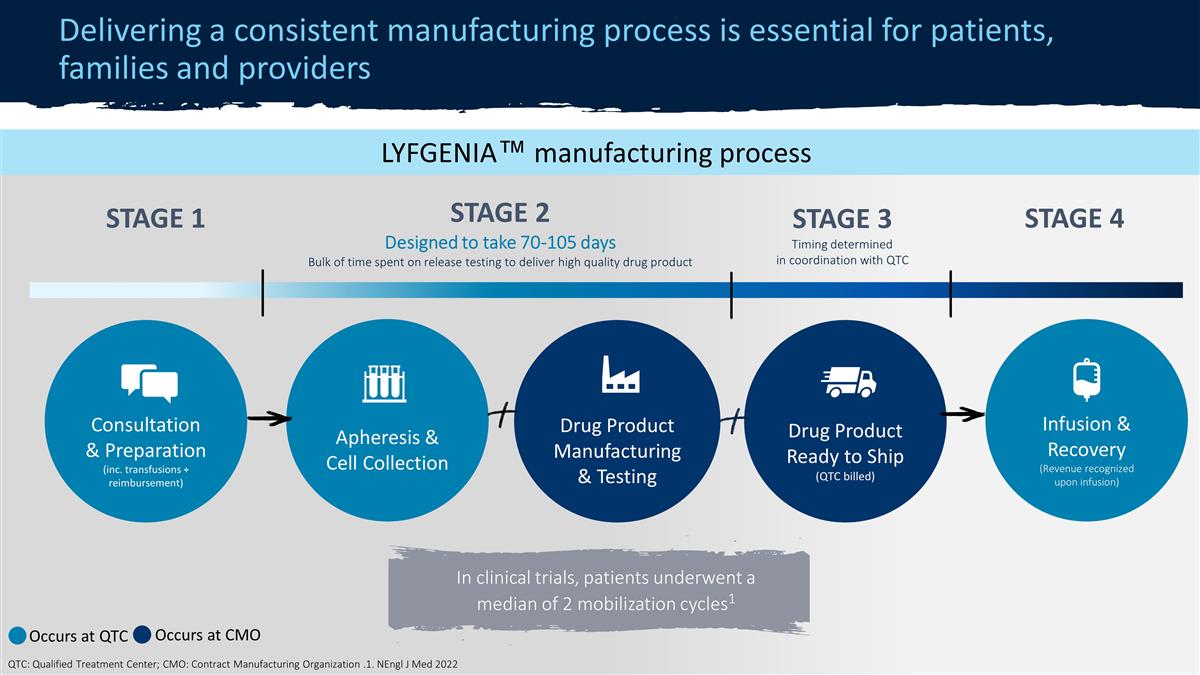
ZYNTEGLO® 製造 プロセス一貫した製造プロセスを提供することは、患者、家族、医療提供者にとって不可欠です。ステージ2◇ 70-90日高品質の医薬品であるアフェレーシスおよび細胞採取薬 製品の製造とテスト医薬品の製造とテスト(QTC請求)輸液と回収(注入時に計上される収益)相談と準備(ハイパー輸血を含む)+ 再投与支払い確認) ステージ 1* ステージ 3* * QTCで発生 ◇CMO で発生 QTC: 認定治療センター; CMO: 契約製造組織臨床試験では、症例の約20%で想起が見られました。商業環境では、すべての患者が [完成した]想起の後の 治療過程。LYFGENIA™ 製造プロセスステージ2 70〜105日かかるように設計されています。高品質の医薬品であるアフェレシスと細胞採取医薬品を提供するためのリリーステストに多くの時間を費やしました 出荷準備が整った医薬品の製造とテスト(QTC請求)輸液と回収(注入時に計上された収益)相談と準備(輸血を含む+償還)ステージ1 ステージ4 臨床試験では、患者は 2つの動員サイクルの中央値1はQTCで発生し、CMO QTC:認定治療センター、CMO:受託製造組織で発生します。1.NenGL J Med 2022ステージ3 QTCと連携してタイミングが決定されました

株主価値の拡大を目指す遺伝子治療リーダー 確立された臨床的リーダーシップの確立 10年以上の遺伝子治療研究 180人以上の患者を治療しました 8件の臨床試験経験豊富なチームが米国での遺伝子治療の商業化に100%注力 実証済み規制上の成功 LVVプラットフォームの実績確立 3 FDA承認遺伝子治療商業用遺伝子治療リーダー 3つの商業的発売移植および細胞療法のインフラストラクチャー証明された償還実績

このマイルストーンを可能にしてくれたSCD戦士、介護者、 支持者、医療提供者、治験医、医療従事者、そして私たちのブルーバードチームに。

リッチ・コルビン、医学博士、主任医療 責任者アンドリュー・オベンシャイン最高経営責任者、トム・クリマ、最高商務責任者兼執行責任者