米国
証券取引委員会
ワシントンD.C. 20549
フォーム
(マークワン)
四半期終了時
______ から ______ への移行期間中
コミッションファイル番号:
(憲章に明記されている登録者の正確な名前)
(法人または組織の州またはその他の管轄区域) |
|
(IRS雇用者識別番号) |
|
|
|
(主要執行機関の住所) |
|
(郵便番号) |
(登録者の電話番号、市外局番を含む)
同法第12条 (b) に従って登録された証券:
各クラスのタイトル |
トレーディングシンボル |
登録された各取引所の名前 |
登録者が、(1)1934年の証券取引法第13条または第15条(d)で提出が義務付けられているすべての報告書を過去12か月間(または登録者がそのような報告を提出する必要があったよりも短い期間)に提出したか、(2)過去90日間にそのような提出要件の対象であったかどうかをチェックマークで示してください。
登録者が、過去12か月間(または登録者がそのようなファイルの提出を求められたより短い期間)に、規則S-Tの規則405(本章の§232.405)に従って提出が義務付けられているすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「優先申告者」、「小規模報告会社」、「新興成長企業」の定義を参照してください。
大型加速フィルター |
☐ |
|
アクセラレーテッド・ファイラー |
☐ |
☒ |
|
小規模な報告会社 |
||
|
|
|
新興成長企業 |
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(取引法規則12b-2で定義されている)かどうかをチェックマークで示してください。はい
2023年11月1日現在の登録者の発行済み普通株式の数だった
ウェーブ・ライフサイエンス株式会社
四半期報告書(フォーム10-Q)
目次
|
|
ページ |
パート I-財務情報 |
|
5 |
アイテム 1.財務諸表 |
|
5 |
未監査の連結貸借対照表 |
|
5 |
未監査の連結営業報告書と包括利益(損失) |
|
6 |
シリーズA優先株式および株主資本(赤字)の未監査連結計算書 |
|
7 |
未監査の連結キャッシュフロー計算書 |
|
9 |
未監査の連結財務諸表に関する注記 |
|
10 |
アイテム 2.経営陣による財政状態と経営成績に関する議論と分析 |
|
20 |
アイテム 3.市場リスクに関する定量的・質的開示 |
|
33 |
アイテム 4.統制と手続き |
|
33 |
パート II-その他の情報 |
|
34 |
アイテム 1.法的手続き |
|
34 |
アイテム 1A.リスク要因 |
|
34 |
アイテム2。株式の未登録売却、収益の使用、および発行者による株式の購入 |
|
34 |
アイテム 3.シニア証券のデフォルト |
|
34 |
アイテム 4.鉱山の安全に関する開示 |
|
34 |
アイテム 5.その他の情報 |
|
34 |
アイテム 6.展示品 |
|
35 |
2
フォーム10-Qのこの四半期報告書で使用されているように、特に明記されていない限り、「Wave」、「会社」、「私たち」、「私たち」、「私たち」、または同様の用語はWave Life Sciences Ltd. および当社の完全子会社を指します。
将来の見通しに関する記述に関する特記事項
フォーム10-Qのこの四半期報告書には、改正された1933年の証券法(「証券法」)のセクション27A、および改正された1934年の証券取引法(「取引法」)のセクション21Eの意味における、将来の出来事または当社の将来の事業または財務実績に関連する将来の見通しに関する記述が含まれています。将来の見通しに関する記述には、既知および未知のリスク、不確実性、および当社の実際の結果、活動レベル、業績、または成果が、そのような将来の見通しに関する記述によって明示または暗示される将来の結果、活動レベル、業績、または成果と大きく異なる原因となる可能性のあるその他の要因が含まれます。場合によっては、将来の見通しに関する記述は、「予測する」、「信じる」、「継続する」、「できる」、「見積もる」、「期待する」、「将来」、「目標」、「意図する」、「可能性が高い」、「かもしれない」、「継続的」、「客観的」、「計画」、「可能性」、「予測」、「プロジェクト」、「求める」、「すべき」という言葉で識別されます。、」「戦略」、「目標」、「意志」、「する」、またはこれらの用語の否定語、または将来に関する記述を識別することを目的としたその他の同等の用語。ただし、すべての将来の見通しに関する記述にこれらの識別語が含まれているわけではありません。将来の見通しに関する記述には、歴史的事実の記述以外に、とりわけ以下に関する記述が含まれます。 将来の事業に資金を提供する能力、財政状態、収益、費用、経費、現金の使用、資本要件、追加の資金調達の必要性、または既存の現金資源が事業要件を満たすのに十分である期間、研究開発活動、前臨床研究および臨床試験の成功、進展、数、範囲、費用、期間、時期、または結果(前臨床試験の開始または完了、または結果の入手のタイミングを含む)臨床研究と臨床試験、または規制当局への申請の提出、審査、または承認、当社の製品候補について規制当局の承認を取得および維持するタイミング、製品候補のいずれかから得られる潜在的な利益、当社の戦略、展望、計画、目標、期待、予測、または目的、第三者とのコラボレーションの成功、協力パートナーが当社に対して行う可能性のある支払い、新製品候補を特定して開発する当社の能力、私たちの知的財産の地位、私たちの商品化、マーケティングおよび製造能力と戦略、将来の費用と追加資金調達の必要性に関する当社の見積もり、販売およびマーケティング能力の開発能力、主要な人材の特定、採用、維持能力、財務実績、業界の競合他社に関連する動向と予測、流動性と運転資本の要件、新しい会計基準の予想される影響。そして、コロナウイルス(「COVID-19」)とその亜種が当社の事業に与える影響(研究開発活動、前臨床研究と臨床試験、医薬品の供給、労働力など)に関する私たちの期待です。
このレポートに含まれる将来の見通しに関する記述にはそれぞれ合理的な根拠があると考えていますが、これらの記述は、既知および未知のリスクや不確実性、および将来の見通しに関する記述で表明または暗示される実際の結果、活動レベル、業績、または成果が異なる原因となる可能性のあるその他の重要な要因の影響を受ける将来の見積もりまたは予測に基づいていることに注意してください。これらのリスク、不確実性、その他の要因には、とりわけ、当社の重要な会計方針、グローバルな臨床試験申請の提出に役立つ十分なデータを生成する前臨床試験の能力とその時期、目標を達成するために必要な企業インフラと人材を引き続き構築および維持する能力、製品候補のさらなる開発をサポートしない可能性のある臨床結果とプログラムの時期、それらに影響を与える可能性のある規制機関の措置が含まれます開始、タイミング、臨床試験の進展、現在および将来の臨床試験と規制プロセスの管理における当社の有効性、実行可能な候補の特定における当社のプラットフォームの成功、医薬品の一種としての核酸治療薬の継続的な開発と承認、複数の治療法にわたる候補を開発する能力など、臨床試験においてステレオピュア候補の治療効果を実証する能力、知的財産を取得、維持、保護する能力、特許を行使する能力に対して侵害者であり、第三者からの異議申し立てに対する特許ポートフォリオの防御、事業に資金を提供し、必要に応じて追加資本を調達する能力、同様の用途の治療法を開発している他社との競争、COVID-19のパンデミック、ロシアとウクライナが関与する紛争、中東での紛争、世界経済の不確実性、インフレ率の上昇、金利の上昇、または市場の混乱の結果として、または関連する当社の事業への影響、 また、フォーム10-Qのこの四半期報告書および当社が証券取引委員会(「SEC」)に提出するその他の書類に含まれる「リスク要因」というキャプションの下にあるその他のリスクと不確実性についても同様です。
3
このレポートに含まれる将来の見通しに関する記述は、当社が現在知っている事実と要因、および将来への期待の組み合わせに基づいており、確信が持てません。これらの要因の結果として、フォーム10-Qのこの四半期報告書の将来の見通しに関する記述が正確であることを保証することはできません。さらに、将来の見通しに関する記述が不正確であることが判明した場合、その不正確さは重大なものになる可能性があります。これらの将来の見通しに関する記述には重大な不確実性があることを踏まえると、これらの記述は、特定の期間内に、またはまったく目的や計画を達成することを、当社または他の個人が表明または保証するものと見なすべきではありません。将来の見通しに関する記述に過度に依存しないように注意してください。
さらに、このレポート内の将来の見通しに関する記述は、このレポートの日付における私たちの見解のみを表しており、それ以降の日付における私たちの見解を表すものとして信頼すべきではありません。その後の出来事や進展により、私たちの見方が変わるかもしれないと私たちは予想しています。将来のある時点でこれらの将来の見通しに関する記述を公に更新することを選択する場合がありますが、適用法で義務付けられている場合を除き、新しい情報、将来の出来事、その他の結果として、将来の見通しに関する記述を公に更新する義務を負いません。当社の将来の見通しに関する記述は、当社が行う可能性のある将来の買収、合併、処分、合弁事業または投資の潜在的な影響を反映していません。
ウェーブ・ライフサイエンス株式会社とウェーブ・ライフサイエンス株式会社フォーム10-Qのこの四半期報告書に記載されているWave Life Sciences Ltd. の名前、Wave Life Sciencesマーク、PRISM、およびその他の登録済みおよび保留中の商標、商号、サービスマークは、Wave Life Sciences Ltdの所有物です。フォーム10-Qのこの四半期報告書には、Wave Life Sciences Ltdおよびその他の企業が所有するその他の商号、商標、サービスマークも含まれています。私たちは、他者の商標、商号、またはサービスマークの使用または表示を暗示することを意図しておらず、そのような使用または表示は、これらの他の当事者との関係、またはこれらの第三者による当社の支持または後援を意味するものと解釈されるべきではありません。便宜上、フォーム10-Qのこの四半期報告書の商標と商号は® と記号なしで表記されていますが、そのような言及は、それぞれの所有者が適用法の下で最大限の範囲でそれに対する権利を主張しないことを示すものとして解釈されるべきではありません。
4
パートI-財務すべての情報
アイテム 1.財務すべてのステートメント
ウェーブ・ライフサイエンス株式会社
未監査の連結TED貸借対照表
(千単位、株式金額を除く)
|
|
2023年9月30日 |
|
|
2022年12月31日 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金および現金同等物 |
|
$ |
|
|
$ |
|
||
売掛金 |
|
|
|
|
|
— |
|
|
前払い経費 |
|
|
|
|
|
|
||
その他の流動資産 |
|
|
|
|
|
|
||
流動資産合計 |
|
|
|
|
|
|
||
長期資産: |
|
|
|
|
|
|
||
資産および設備、累積減価償却費を差し引いた金額 |
|
|
|
|
|
|
||
オペレーティングリースの使用権資産 |
|
|
|
|
|
|
||
制限付き現金 |
|
|
|
|
|
|
||
その他の資産 |
|
|
|
|
|
|
||
長期資産合計 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債、シリーズAの優先株と株主資本(赤字) |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
買掛金 |
|
$ |
|
|
$ |
|
||
未払費用およびその他の流動負債 |
|
|
|
|
|
|
||
繰延収益の現在の部分 |
|
|
|
|
|
|
||
オペレーティング・リース負債の現在の部分 |
|
|
|
|
|
|
||
流動負債合計 |
|
|
|
|
|
|
||
長期負債: |
|
|
|
|
|
|
||
繰延収益、当期分を差し引いたもの |
|
|
|
|
|
|
||
オペレーティング・リースの負債、当期分を差し引いたもの |
|
|
|
|
|
|
||
その他の負債 |
|
|
— |
|
|
|
|
|
長期負債合計 |
|
|
|
|
|
|
||
負債総額 |
|
$ |
|
|
$ |
|
||
シリーズAの優先株、 |
|
$ |
|
|
$ |
|
||
株主資本(赤字): |
|
|
|
|
|
|
||
普通株式、 |
|
$ |
|
|
$ |
|
||
追加払込資本 |
|
|
|
|
|
|
||
その他の包括損失の累計 |
|
|
( |
) |
|
|
( |
) |
累積赤字 |
|
|
( |
) |
|
|
( |
) |
株主赤字総額 |
|
$ |
( |
) |
|
$ |
( |
) |
負債総額、シリーズAの優先株と株主の赤字 |
|
$ |
|
|
$ |
|
||
添付の注記は、未監査の連結財務諸表の不可欠な部分です。
5
ウェーブ・ライフサイエンス株式会社
未監査の連結は営業報告書と包括利益(損失)
(千単位、1株あたりの金額を除く)
|
|
9月30日に終了した3か月間 |
|
|
9月30日に終了した9か月間 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
収益 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
営業経費: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
一般と管理 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
営業費用の合計 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
事業からの収益(損失) |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
その他の収益(費用)、純額: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
配当収入と利息収入、純額 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
その他の収益(費用)、純額 |
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|||
その他の収益(費用)の合計、純額 |
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|||
所得税控除前利益(損失) |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
所得税制上の優遇措置(規定) |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
当期純利益 (損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
控除:に帰属する純利益 |
|
$ |
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
経常利益に帰属する純利益(損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
に帰属する1株当たりの純利益(損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
で使用された加重平均普通株式 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
に帰属する1株当たりの純利益(損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
で使用された加重平均普通株式 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
その他の包括利益 (損失): |
|
|
|
|
|
|
|
|
|
|
|
|
||||
当期純利益 (損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
外貨翻訳 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
包括利益 (損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
添付の注記は、未監査の連結財務諸表の不可欠な部分です。
6
ウェーブ・ライフサイエンス株式会社
シリーズの未監査の連結財務諸表 A 優先株と株主資本(赤字)
(千単位、株式金額を除く)
|
|
シリーズ A |
|
|
|
普通株式 |
|
|
[追加] |
|
|
累積 |
|
|
累積 |
|
|
合計 |
|
||||||||||||||
|
|
株式 |
|
|
金額 |
|
|
|
株式 |
|
|
金額 |
|
|
資本 |
|
|
収益 (損失) |
|
|
赤字 |
|
|
資本 (赤字) |
|
||||||||
2021年12月31日時点の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||||||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
RSUの権利確定 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
オプション演習 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
その他の包括損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年3月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
||||||
普通株式の発行、 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
事前資金によるワラントの発行、 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
RSUの権利確定 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
その他の包括損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年6月30日時点の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
RSUの権利確定 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
オプション演習 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
その他の包括損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年9月30日時点の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|||||
添付の注記は、未監査の連結財務諸表の不可欠な部分です。
7
ウェーブ・ライフサイエンス株式会社
シリーズAの優先株式と株主資本(赤字)の未監査の連結計算書(続き)
(千単位、株式金額を除く)
|
|
シリーズ A |
|
|
|
普通株式 |
|
|
[追加] |
|
|
累積 |
|
|
累積 |
|
|
合計 |
|
||||||||||||||
|
|
株式 |
|
|
金額 |
|
|
|
株式 |
|
|
金額 |
|
|
資本 |
|
|
収益 (損失) |
|
|
赤字 |
|
|
資本 (赤字) |
|
||||||||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|||||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
RSUの権利確定 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
オプション演習 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
その他の包括損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2023年3月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|||||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
RSUの権利確定 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
オプション演習 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
その他の包括損失 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2023年6月30日の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|||||
普通株式の発行 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
株式ベースの報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
RSUの権利確定 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
オプション演習 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
その他の包括損失 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
当期純利益 |
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
2023年9月30日の残高 |
|
|
|
|
$ |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|||||
添付の注記は、未監査の連結財務諸表の不可欠な部分です。
8
ウェーブ・ライフサイエンス株式会社
未監査の連結はキャッシュフロー計算書
(千単位)
|
|
9月30日に終了した9か月間 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
営業活動によるキャッシュフロー |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失を営業活動によって提供された(使用された)純現金と調整するための調整: |
|
|||||||
使用権資産の償却 |
|
|
|
|
|
|
||
資産および設備の減価償却 |
|
|
|
|
|
|
||
株式ベースの報酬費用 |
|
|
|
|
|
|
||
営業資産および負債の変動: |
|
|
|
|
|
|
||
売掛金 |
|
|
( |
) |
|
|
— |
|
前払い経費 |
|
|
|
|
|
( |
) |
|
その他の資産 |
|
|
( |
) |
|
|
|
|
買掛金 |
|
|
( |
) |
|
|
|
|
未払費用およびその他の流動負債 |
|
|
( |
) |
|
|
( |
) |
繰延収益 |
|
|
|
|
|
( |
) |
|
オペレーティングリース負債 |
|
|
( |
) |
|
|
( |
) |
その他の非流動負債 |
|
|
( |
) |
|
|
— |
|
営業活動によって提供された(使用された)純現金 |
|
|
|
|
|
( |
) |
|
投資活動によるキャッシュフロー |
|
|
|
|
|
|
||
資産および設備の購入 |
|
|
( |
) |
|
|
( |
) |
不動産と設備の売却による収入 |
|
|
— |
|
|
|
|
|
短期投資の購入 |
|
|
— |
|
|
|
( |
) |
短期投資の満期による収入 |
|
|
— |
|
|
|
|
|
投資活動に使用された純現金 |
|
|
( |
) |
|
|
( |
) |
財務活動によるキャッシュフロー |
|
|
|
|
|
|
||
普通株式の発行による収入、募集費用を差し引いたもの |
|
|
|
|
|
|
||
事前に積立されたワラントの発行による収入、提供費用を差し引いたもの |
|
|
— |
|
|
|
|
|
に基づく普通株式の発行による収入 |
|
|
|
|
|
|
||
株式オプションの行使による収入 |
|
|
|
|
|
|
||
ESPPからの収入 |
|
|
|
|
|
|
||
財務活動による純現金 |
|
|
|
|
|
|
||
外国為替レートが現金、現金同等物、制限付現金に及ぼす影響 |
|
|
( |
) |
|
|
( |
) |
現金、現金同等物および制限付現金の純増額(減少) |
|
|
|
|
|
( |
) |
|
現金、現金同等物および制限付現金、期初 |
|
|
|
|
|
|
||
現金、現金同等物および制限付現金、期末 |
|
$ |
|
|
$ |
|
||
キャッシュフロー情報の補足開示 |
|
|
|
|
|
|
||
オペレーティングリースの使用権資産の増加と |
|
$ |
— |
|
|
$ |
|
|
添付の注記は、未監査の連結財務諸表の不可欠な部分です。
9
ウェーブ・ライフ・サイエンス株式会社
未監査の詐欺に関するメモ連結財務諸表
1。会社
組織
Wave Life Sciences Ltd.(およびその子会社とともに「Wave」または「当社」)は、壊滅的な病気と闘う人々の人生を変える治療法を提供することに取り組んでいる臨床段階のRNA医薬品会社です。Waveは、新しいステレオピュアオリゴヌクレオチドの正確な設計、最適化、製造を可能にするWave独自の発見および医薬品開発プラットフォームであるPRISMを使用して、トランスクリプトーム(ヒトゲノムから生成されるリボ核酸(「RNA」)分子のフルセット)を標的とするクラス初または最高の医薬品の開発に取り組んでいます。
当社は2012年7月23日にシンガポールで設立され、米国本社はマサチューセッツ州ケンブリッジにあります。当社は、2012年9月13日に設立されたデラウェア州の企業であるウェーブ・ライフ・サイエンスUSA, Inc.(「Wave USA」)(旧Ontorii, Inc.)と、日本の法律に基づいて組織されたウェーブ・ライフサイエンス・ジャパン株式会社(「ウェーブ・ジャパン」)の2つの株式を統合する目的で設立されました。2016年5月31日、ウェーブ・ライフ・サイエンス・アイルランド・リミテッド(「ウェーブ・アイルランド」)が全面的に設立されました-ウェーブ・ライフ・サイエンス社の所有子会社。2017年4月3日、ウェーブ・ライフサイエンス・UKリミテッド(「ウェーブUK」)が完全子会社として設立されました-ウェーブ・ライフサイエンス株式会社の所有子会社
創業以来の当社の主な活動は、オリゴヌクレオチド治療薬の設計、開発、商品化のためのPRISMの開発と進化、会社の差別化されたポートフォリオの推進、会社の研究、開発、製造能力の構築、臨床へのプログラムの進展、そのような臨床段階プログラムの臨床開発の促進、会社の知的財産の構築、およびこれらの活動を支援するための十分な資本の確保でした。
流動性
創業以来、当社は製品収益を生み出しておらず、経常的な営業損失を被っています。これまで、当社は主に、負債および株式の私募投資、株式の公募およびその他の登録公開、および第三者との協力を通じて事業資金を調達してきました。会社が製品の販売から大きな収益を生み出すことができるようになるまで、当社は、パブリックエクイティ、プライベートエクイティ、または負債による資金調達またはその他の資金調達(第三者との協力による前払いやマイルストーン支払いなど)の組み合わせを通じて事業資金を調達し続けることを期待しています。適切な追加資金が許容できる条件では提供されない場合もあれば、まったく提供されない場合もあります。必要なときに資本を調達できないと、会社の財政状態と事業戦略を追求する能力に悪影響を及ぼします。
2023年9月30日の時点で、会社の現金および現金同等物はドルでした
リスクと不確実性
当社は、バイオテクノロジー業界の企業に共通するリスクにさらされています。これには、新しい技術革新、専有技術の保護、社内製造能力の維持、主要人材への依存、政府規制の遵守、追加の資金調達の必要性などが含まれますが、これらに限定されません。当社の治療プログラムは、製品候補を商品化する前に、広範な前臨床試験、臨床試験、規制当局の承認など、大幅な追加研究開発努力が必要になります。これらの取り組みには、多額の追加資本、適切な人材インフラ、および広範なコンプライアンス報告機能が必要です。会社の研究開発努力が成功すること、会社の知的財産が適切に保護されること、開発された製品が必要な政府規制当局の承認を得ること、または承認された製品が商業的に実行可能であるという保証はありません。会社の製品開発努力が成功したとしても、会社がいつ製品の販売から大きな収益を生み出すかは不明です。当社は、技術の急速な変化と、製薬会社やバイオテクノロジー企業との激しい競争の激しい環境で事業を展開しています。
10
プレゼンテーションの基礎
当社は、米国で一般に認められている会計原則(「米国会計基準」)に従い、米ドルで添付の連結財務諸表を作成しました。
2.重要な会計方針
2022年12月31日に終了した年度の会社の監査済み財務諸表とその注記に記載されている重要な会計方針とその注記は、修正された2023年3月23日に証券取引委員会(「SEC」)に提出された2022年12月31日に終了した年度のフォーム10-Kの年次報告書(「フォーム10-Kの2022年年次報告書」)に含まれていますが、その間に重大な変更はありませんでした以下で説明する場合を除き、2023年9月30日に終了した9か月です。
見積もりの使用
会社の連結財務諸表は、米国会計基準に従って作成されています。会社の財務諸表および関連する開示を作成するには、会社は報告された資産、負債、収益、費用と費用、および関連する開示額に影響を与える見積もりと仮定を行う必要があります。経営陣は、適切な財務会計方針を選択したり、財務諸表の作成に使用される見積もりや前提条件を作成したりする際に、多くの要素を考慮します。経営陣は、このプロセスにおいて重要な判断を下さなければなりません。当社は、収益認識方針、特に(a)履行義務の数の評価、(b)取引価格の決定、(c)契約における履行義務への取引価格の配分、(d)履行義務の履行に関する見積もりを含む履行義務の履行パターンの決定、および当社が委託研究機関(「CRO」)との契約および受託製造に関する分析に使用される仮定と見積もりを決定することを信じています。組織(「CMO」)から契約費用の見積もりには、より高度な判断が必要です。したがって、会社はそれらを重要な会計方針と見なしています。当社は、見積もりと仮定を継続的に評価しています。会社の実際の業績は、さまざまな仮定や条件の下で、これらの見積もりと異なる場合があります。
未監査の中間財務データ
添付の2023年9月30日現在の中間連結貸借対照表、2023年9月30日および2022年9月30日に終了した3か月間の関連する中間連結営業利益および包括利益(損失)、シリーズA優先株式および株主資本(赤字)の連結計算書、2023年3月31日、6月30日、および2023年9月30日までの3か月間の連結キャッシュフロー計算書、終了した9か月間の連結キャッシュフロー計算書 2023年9月30日、2022年9月30日、およびメモに含まれる関連する暫定情報未監査の連結財務諸表は、SECの中間財務情報に関する規則および規制に従って作成されています。したがって、これらには、完全な財務諸表を作成するために米国会計基準で要求されるすべての情報と注記が含まれているわけではありません。これらの注記に記載されている2023年9月30日および2022年9月30日に終了した3か月と9か月に関する財務データおよびその他の情報は、未監査です。経営陣の見解では、未監査の中間連結財務諸表には、2023年9月30日および2022年9月30日までの3か月と9か月間の会社の財政状態と経営成績の公正な提示に必要な、通常の調整と定期的な調整からなるすべての調整が反映されています。中間期の経営成績は、必ずしも2023年12月31日に終了する年度に予想される業績を示すものではありませんまたはその他の暫定期間または将来の年または期間。
3。未払費用およびその他の流動負債
未払費用とその他の流動負債には次のものが含まれます。
|
|
2023年9月30日 |
|
|
2022年12月31日 |
|
||
|
|
(千単位) |
|
|||||
未払報酬 |
|
$ |
|
|
$ |
|
||
CROとCMOに関連する未払費用 |
|
|
|
|
|
|
||
未払費用およびその他の流動負債 |
|
|
|
|
|
|
||
未払費用およびその他の流動負債の合計 |
|
$ |
|
|
$ |
|
||
11
4。株式ベースの報酬
Wave Life Sciences Ltd. の2021年株式インセンティブプランは、会社の株主によって承認され、2021年8月10日に発効し、2022年8月9日と2023年8月1日に発効しました(修正されたとおり、「2021年プラン」)。2021年プランは、修正されたWave Life Sciences Ltd. の2014年株式インセンティブプラン(「2014年プラン」)の後継であり、2014年プランに基づいて付与された未払いの報奨には引き続き2014年プランの条件が適用されますが、2021年8月10日以降は2014年プランに基づく報奨を行うことはできません。2021年プランに基づいて報奨の発行が承認された普通株式の総数は、当初
2021年プランは、取締役会または取締役会の委員会に、とりわけ、制限付株式および制限付株式ユニット(「RSU」)を含む制限付アワード、および会社の適格従業員および取締役への業績賞を付与することを承認します(および2014年のプランでは以前に承認されました)。当社は、非従業員取締役への助成金を従業員への助成金として計上しています。
オプションは通常、次の期間にわたって有効です に
2023年9月30日に終了した9か月間に、当社は合計で次の金額を付与しました
2023年9月30日の時点で,
以下の表は、現在のオプションと未解決のRSUを示しています 2023年と2022年9月30日。
|
|
9月30日現在、 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
普通株を購入するオプション |
|
|
|
|
|
|
||
RSU |
|
|
|
|
|
|
||
修正されたWave Life Sciences Ltd. の2019年従業員株式購入プラン(「ESPP」)では、フルタイムおよび特定のパートタイムの従業員が、公正な市場価値に対して割引価格で会社の普通株式を購入することができます。対象となる従業員は、毎年1月15日と7月15日から始まる6か月の募集期間に登録できます。普通株は次のような価格で購入されます
5。コラボレーション契約
GSKのコラボレーションと株式契約
2022年12月13日、Wave USAとWave UKはグラクソ・スミスクライン知的財産(第3号)(「GSK」)とコラボレーションおよびライセンス契約(「GSKコラボレーション契約」)を締結しました。GSK協力契約に基づき、WaveとGSKは、WVE-006の独占グローバルライセンスを含め、オリゴヌクレオチド治療薬の研究、開発、および商業化について協力することに合意しました。創薬コラボレーションコンポーネントは、最初の4年間の研究期間で、Wave独自の創薬および医薬品開発プラットフォームであるPRISMと、人類遺伝学からのGSK独自の洞察とそのグローバルな開発および商業能力を組み合わせたものです。2023年1月27日、GSKコラボレーション契約が発効し、GSKはWaveに$の前払い金を支払いました
GSKコラボレーション契約の締結と同時に、Waveは2022年12月13日に、GSKの関連会社であるグラクソ・グループ・リミテッド(「GGL」)と株式購入契約(「SPA」)を締結し、これに従ってWaveは売却に合意しました。
GSKコラボレーション契約には3つの要素があります。
12
GSKコラボレーション契約に基づき、各当事者は、相手方がGSKコラボレーション契約に基づく義務を履行し、権利を行使できるように、コラボレーション製品の特定のライセンスを相手方に付与します。これには、各当事者がGSKコラボレーション契約の条件に従って研究、開発、および商業化活動を行えるようにするためのライセンス付与が含まれます。両当事者の相互の独占的義務は、コラボレーションの対象に関して対象ごとに制限されています。GSKは、便宜上、GSKコラボレーション契約の全部または対象ごとに終了することがあります。特定の例外を除いて、相手方または関連当事者が、GSKコラボレーション契約の対象となる製品を対象とするライセンス技術内の特許性、執行可能性、または有効性に異議を申し立てた場合、特定の例外を除いて、各当事者はターゲットごとにGSKコラボレーション契約を終了する権利を有します。一方の当事者によるGSKコラボレーション契約の重大な違反があった場合、是正権を条件として、他方の当事者は、違反がすべてのターゲットに関連する場合はGSKコラボレーション契約全体を終了することができます。違反が特定のターゲットに関連する場合はターゲットごとに終了することができます。GSKとその関連会社が、GSKコラボレーション協定の対象となる特定のターゲット向けの化合物または製品に関する開発、製造、および商品化活動を中止した場合、会社はそのようなターゲットに関するGSKコラボレーション契約を終了することがあります。いずれの当事者も、相手方の破産を理由にGSKコラボレーション契約を終了することができます。特定の解雇状況下では、会社はGSKから特定の製品の研究、開発、製造を継続するためのライセンスを受け取ります。
GSKコラボレーション契約は、早期に終了しない限り、(i)検証ターゲットに関しては、その検証ターゲットがコラボレーションプログラムに進められない日、または(ii)コラボレーションターゲットに関しては、該当するコラボレーションターゲットに向けられたすべてのコラボレーション製品のロイヤルティ期間が満了した日まで継続されます。GSKコラボレーション契約には、研究期間をさらに最大3年間延長するオプションが含まれています。これにより、両当事者が利用できるプログラムの数が増えます。当社は、治験中の新薬(「IND」)を可能にする研究に至るまで、GSKと当社の共同プログラムのすべての前臨床研究を主導します。当社は、INDを可能にする研究、臨床開発、および会社のコラボレーションプログラムの商業化を主導します。GSKのコラボレーションプログラムは、INDを可能にする研究、臨床開発、商業化のためにGSKに移管されます。
GSKコラボレーション契約は、両当事者が平等に代表される合同運営委員会によって管理されています。さらに、AATDコラボレーションは共同開発委員会によって監督され、共同特許委員会は知的財産活動について助言し、ディスカバリーリサーチコラボレーションは共同研究委員会によって監督されます。これらの委員会には両当事者が平等に代表され、合同運営委員会に報告されます。
当社は、ASCトピック606「顧客との契約による収益」(「ASC 606」)に従ってこの取り決めを評価し、契約相手であるGSKは、GSKがオプションを行使する前のAATDコラボレーション、および目標検証研究期間中のディスカバリー研究コラボレーションプログラムの顧客であると結論付けました。当社は、この取り決めの下で、次の重要な約束を確認しました。(1)WVE-006の独占的グローバルライセンス、(2)フェーズ1/2研究を通じたWVE-006の研究開発サービス、(3)ターゲット検証プログラムを実施するためのディスカバリー研究コラボレーションに基づく創薬研究サービス、(4)ディスカバリー研究コラボレーションの研究開発ライセンス、(5)候補者の完成までのGSKコラボレーションプログラムの研究開発サービス選択。WVE-006の研究開発サービスは、独占的なグローバルライセンスと区別されないと判断されたため、AATDコラボレーションの単一の履行義務にまとめる必要があります。ディスカバリー・リサーチ・コラボレーションの研究開発サービスは、ディスカバリー・リサーチ・コラボレーションの研究開発ライセンスと区別されないと判断されたため、1つの履行義務にまとめる必要があります。さらに、当社は、ディスカバリー・リサーチ・コラボレーションによる最大8つのプログラムを進めるオプションは公正価値に基づく価格設定であり、GSKに重要な権利を与えていないと判断しました。
これらの評価に基づいて、当社はGSKコラボレーション契約において2つの履行義務を特定しました。(1)WVE-006のフェーズ1/2研究および研究開発ライセンスの完了までの研究開発サービスで構成されるAATDコラボレーション、および(2)ターゲットを検証するための研究開発サービスとターゲットの研究開発ライセンスのライセンスで構成されるディスカバリーリサーチコラボレーション。
取り決め当初、取引価格にはドルの固定対価が含まれていました
13
それから 固定対価を比較的独立した販売価格ベースで履行義務に割り当てました。当社は、GSKコラボレーション契約には重要な資金調達要素が含まれていないと判断しました。GSKコラボレーション協定の開始時にすべてのマイルストーンの金額が完全に制限されていたため、GSKコラボレーションプログラムの研究と前臨床開発のためのプログラム開始費用と追加の潜在的なマイルストーン支払いは取引価格から除外されました。当社は、各報告期間の終わりに取引価格を再評価し、不確実な出来事が解決されたり、状況にその他の変化が生じた場合は、取引価格の見積もりを調整します。
当社は、AATDコラボレーションの下で、割引キャッシュフローモデルを使用して、WVE-006のグローバルライセンスの推定スタンドアロン販売価格を作成しました。ディスカバリー・リサーチ・コラボレーションに基づく研究開発サービスおよびAATDコラボレーションに基づくWVE-006の研究開発サービスに関連する履行義務について、当社は、利益率を反映するように調整されたサービスと供給の予想される内部および外部コストを含む、研究開発サービスを実施するための費用の見積もりを使用して、独立販売価格を決定しました。研究開発サービスの推定総費用は、実施するサービスの性質と、サービスの実施に必要な時間の長さに関する会社の最善の見積もりを反映しています。
研究開発サービスは、履行義務を履行するために発生した費用と発生すると予想される総費用に応じて、インプットメジャーを使用して提供されるため、AATDコラボレーション履行義務に関連する収益が計上されています。研究開発サービスは、履行義務を履行するために発生した費用と発生すると予想される総費用に応じて、インプットメジャーを使用して提供されるため、ディスカバリーリサーチコラボレーションの履行義務に関連する収益が計上されています。まだ収益として認識されていない受領金額は、会社の連結貸借対照表の繰延収益に計上されます。Discovery Research Collaborationに関連する当社の研究活動に関連する追加資金は、契約上執行可能な場合は売掛金として計上され、繰延収益として、またはサービスが提供されたときの収益として計上されます。
2023年9月30日に終了した3か月と9か月の間に、当社は次の収益を計上しました $
2023年9月30日に会社の未履行および一部未履行の履行義務に割り当てられ、繰延収益に記録された取引価格の総額はおよそです $
武田薬品工業のコラボレーションとエクイティ契約
に
Wave USAおよびWave UKが武田薬品とのコラボレーションおよびライセンス契約(「武田コラボレーション契約」)を締結したのと同時に、当社は武田薬品と株式購入契約(「武田株式契約」、武田協業契約と合わせて「武田契約」)を締結し、それに基づいて武田薬品に売却することに合意しました
カテゴリー1プログラムに関しては、当社は、そのような製品の最初のメカニズム実証研究を完了するまで、カテゴリー1プログラムの製品およびコンパニオン診断の研究と開発を担当します。武田薬品は、各ターゲットおよびすべての関連製品に対する独占オプションと、そのようなターゲットのコンパニオン診断を行います。メカニズム実証研究が完了するまではいつでも実施できます。武田薬品がこのオプションを行使した場合、当社はオプトイン支払いを受け取り、製造および共同臨床共同開発活動を主導し、武田薬品は米国での共同商業活動と米国外でのすべての商業活動を主導します。グローバルなコストと潜在的な利益は分担されます
14
カテゴリー2のプログラムに関して、当社は、武田薬品に対し、期間中に複数の前臨床プログラムを独占的にライセンスする権利を付与しました
武田協業協定の下で、各当事者は、武田協業協定の条件に従って研究、開発、商業化活動を行うことを可能にするライセンス付与を含む、相手方が武田協業契約に基づく義務を果たし、権利を行使できるようにするための特定の知的財産ライセンスを相手方に付与しました。
武田薬品工業協定の期間が始まりました
武田薬品は、便宜上、武田薬品とのコラボレーション契約を終了することがあります
タケダコラボレーションは、両当事者が平等に代表される合同運営委員会によって運営されています。合同運営委員会は、各カテゴリー1プログラムと、改正前(後述)カテゴリー2プログラムの科学的進歩を監督する任務を負っています。
当社はこの取り決めをASC 606に従って評価し、契約相手である武田薬品は、武田薬品がオプションを行使する前のカテゴリー1プログラムの顧客であり、カテゴリー2の研究期間中のカテゴリー2プログラムの顧客であると結論付けました。当社は、この取り決めの下で、以下の重要な約束を示しました:(1)各カテゴリー1プログラムの非独占的でロイヤリティフリーの研究開発ライセンス、(2)最初のメカニズム実証研究の完了までの各カテゴリー1プログラムの研究開発サービス、(3)各カテゴリー1プログラムのライセンス、共同開発、および共同商業化の独占的オプション、(4)カテゴリー2プログラムの独占的ライセンス権、および(5)研究およびINDの修了までのカテゴリー2プログラムの前臨床開発サービス-研究を可能にします。各カテゴリー1プログラムの研究開発サービスは、研究開発ライセンスと区別されないと判断されたため、カテゴリー1プログラムごとに1つの履行義務にまとめる必要があります。カテゴリー2プログラムの研究および前臨床開発サービスは、カテゴリー2プログラムの独占ライセンスと区別されないと判断されたため、1つの履行義務にまとめられました。
さらに、当社は、各カテゴリー1プログラムの独占オプションは割引価格であると判断しました。そのため、武田薬品は3つの個別の履行義務に相当する重要な権利を武田薬品に提供します。これらの評価に基づいて、当社はタケダコラボレーション契約において7つの履行義務を特定しました。(1)HDの最初のメカニズム実証および非独占的な研究開発ライセンスの完了による研究開発サービス、(2)ALSとFTDの最初のメカニズム証明および非独占的な研究開発ライセンスの完了による研究開発サービス、(3)最初のメカニズム証明および非独占的な研究開発ライセンスの完了による研究開発サービス、(3)最初のメカニズム実証および非独占的な研究開発ライセンスの完了による研究開発サービスにとってSCA3;(4)HDのライセンス、共同開発、共同商品化の独占オプションに提供される物質的権利、(5)ALSとFTDのライセンス、共同開発、共同商業化の独占オプションに提供される物質的権利、(6)SCA3のライセンス、共同開発、共同商業化の独占オプションに提供される物質的権利、(7)研究および前臨床開発サービス、およびカテゴリー2プログラムの独占的ライセンス権。
15
取り決め当初、取引価格にはドルが含まれていました
当社は、比較的独立した販売価格ベースで、取引価格を履行義務に割り当てました。HDの最初のメカニズム実証および非独占的な研究開発ライセンスの完了による研究開発サービスに関連する履行義務、ALSとFTDの最初のメカニズム実証および非独占的な研究開発ライセンスの完了による研究開発サービス、SCA3の最初のメカニズム実証および非独占的な研究開発ライセンスの完了による研究開発サービス、および研究および前臨床開発サービスおよび権利についてカテゴリー2のプログラムを独占的にライセンスする場合、当社は、研究開発サービスを実施するための費用の見積もりを使用して、独立販売価格を決定しました。これには、サービスと消耗品の予想される内部および外部費用が含まれており、利益率を反映するように調整されています。研究開発サービスの推定総費用は、実施するサービスの性質と、サービスの実施に必要な時間の長さに関する会社の最善の見積もりを反映しています。HDのライセンス取得、共同開発、共同商品化の独占オプションに規定される物質的権利、ALSとFTDのライセンス、共同開発、共同商品化の独占オプションに提供される物質的権利、およびSCA3のライセンス、共同開発、共同商品化する独占オプションに規定される物質的権利に関連する履行義務について、当社は、調整された市場評価アプローチを利用して各カテゴリー1プログラムをライセンスするオプションの独立した公正価値を見積もり、次のように判断しました。単独の公正価値を超えるもの各オプションに関連して武田薬品が支払う金額のうち、重要な権利に相当します。
カテゴリー1プログラム履行義務ごとの研究開発サービスに関連する収益は、各カテゴリー1プログラムで発生した費用と、各カテゴリー1プログラムの履行義務を履行するために発生すると予想される総費用に応じて、研究開発サービスがインプットメソッドを使用して提供されるため、計上されています。改正(以下に定義)以前は、カテゴリー2プログラムの研究および前臨床開発サービスに関連する収益は、カテゴリー2プログラムで発生した費用と、履行義務を履行するために発生すると予想される総費用に応じて、研究および前臨床開発サービスがインプットメソッドを使用して提供されるものとして認識されていました。カテゴリー1プログラムの各オプションに物質的権利に割り当てられた金額は、武田薬品がそれぞれのオプションを行使した日、または各オプションが行使されずに失効した時点で直ちに認識されます。まだ収益として認識されていない受領金額は、会社の連結貸借対照表の繰延収益に計上されます。
オン
2023年5月、当社は、カテゴリー1プログラムの1つであるC9ORF72関連ALSおよびFTD(「C9 for ALS/FTD」)用のWVE-004の臨床開発を中止する決定を発表しました。2023年7月、タケダコラボレーションを管理する合同運営委員会は、コラボレーションのターゲット(「C9ターゲット」)としてのC9 for ALS/FTDを終了しました(「C9ターゲット」)。その結果、タケダとタケダコラボレーションに基づく当社の権利と義務は、C9ターゲットに関して終了しました。ALS/FTDカテゴリー1プログラムのC9が終了した結果、会社は$を認識しました
2023年9月30日に終了した3か月間、当社は、HDカテゴリー1プログラムに関連する開発上のマイルストーンを達成しました。これは、非ヒト霊長類(「NHP」)を対象としたWVE-003の非臨床試験の肯定的な結果に関するものでした。マイルストーンを達成した結果、会社は$を認定しました
2023年9月30日まで、会社は約$の収益を認識しています
16
2022年12月31日現在、会社の未履行および一部未履行の履行義務に割り当てられ、繰延収益に記録された取引価格の総額はドルでした。
6。普通株1株あたりの純利益(損失)
シリーズA優先株式は参加証券であるため、当社は、普通株主に帰属する1株あたりの基本および希薄化後の純利益(損失)の計算に2クラス法を適用しています。2クラス方式は、参加証券を、そうでなければ一般株主が利用できるはずの収益に対する権利を持っているものとして扱う収益配分方式です。
2023年9月30日の時点で、あります
1株当たりの基本損失は、普通株主と事前積立保証保有者に帰属する純利益(損失)を、普通株式と未払いの前積立ワラントの加重平均数で割って計算されます。
普通株式、RSU、およびシリーズA優先株式を購入するための発行済み株式オプションを含む、当社の潜在的に希薄化する可能性のある株式は、普通株式同等物と見なされ、その効果が希薄化される場合にのみ、希薄化後の1株当たり純利益(損失)の計算に含まれます。
17
2023年と2022年9月30日の時点で、ありました
以下の表は、普通株主に帰属する会社の基本および希薄化後の純利益(損失)の計算を示しています。
|
|
9月30日に終了した3か月間 |
|
|
9月30日に終了した9か月間 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
|
|
(千単位、1株あたりのデータと1株あたりのデータを除く) |
|
|||||||||||||
分子 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
当期純利益 (損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
控除:に帰属する純利益 |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
経常利益に帰属する純利益(損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
分母 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
で使用された加重平均普通株式 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
従業員株式制度の効果 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
で使用された加重平均普通株式 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
に帰属する1株当たりの純利益(損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
に帰属する1株当たりの純利益(損失) |
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
以下の表は、希薄化後の収益の計算から除外されたアワードをまとめたものです。これらを含めると、希薄化防止効果が期待できるからです。
|
|
9月30日に終了した3か月間 |
|
|
9月30日に終了した9か月間 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
普通株を購入するオプション |
|
|
|
|
|
|
|
|
|
|
|
|
||||
RSU |
|
|
|
|
|
|
|
|
|
|
|
|
||||
7。所得税
2023年9月30日に終了した3か月と9か月の間に、 会社は$の所得税優遇措置を記録しました
当社は、2023年9月30日および2022年9月30日に終了した3か月と9か月間、評価引当金を全額維持しました。将来の課税所得に関する不確実性のため、すべての法域で。
18
8。地理データ
2023年9月30日と2022年12月31日の時点で、会社の長期資産の実質的にすべてが米国にありました.
9。関連当事者間の取引
当社は以下の関連当事者取引を行いました。
19
アイテム 2.経営陣の議論と分析財政状態と経営成績
当社の財政状態と経営成績に関する以下の議論と分析は、修正された2023年3月23日に証券取引委員会(「SEC」)に提出された、フォーム10-Qのこの四半期報告書および2022年12月31日に終了した年度のフォーム10-Kの年次報告書(「フォーム10-Kの2022年年次報告書」)の他の場所に記載されている財務諸表および関連注記と併せて読む必要があります。この議論と分析に含まれる情報、またはフォーム10-Qのこの四半期報告書の他の場所に記載されている情報には、当社の事業計画と戦略に関する情報を含め、リスクと不確実性を伴う将来の見通しに関する記述が含まれています。フォーム10-Qのこの四半期報告書の「リスク要因」セクションに記載されている要因を含む多くの要因の結果として また、フォーム10-Kの2022年年次報告書の「リスク要因」セクションでは、実際の業績は、これらの将来の見通しに関する記述に記載されている、または暗示されている結果と大きく異なる可能性があります。
[概要]
私たちは、壊滅的な病気と闘う人々の人生を変える治療法を提供することに尽力している臨床段階のRNA医薬品会社です。新しいステレオピュアオリゴヌクレオチドの正確な設計、最適化、生産を可能にする独自の発見および医薬品開発プラットフォームであるPRISMを使用して、トランスクリプトーム(ヒトゲノムから生成されるリボ核酸(「RNA」)分子のフルセット)を標的とするクラス初または最高の医薬品の開発に取り組んでいます。
当社のRNA標的オリゴヌクレオチドは、病気の原因となる突然変異を矯正し、タンパク質活性を調節し、機能性タンパク質の産生の回復、または疾患を促進するRNAまたはタンパク質の発現を減らすように設計されています。現在進行中の臨床試験と前臨床試験のデータから、競合他社の化学物質と比較して、PRISMによって設計されたオリゴヌクレオチドの効能、耐久性、および分布が大幅に改善されていることが示されています。これらのデータは、RNAを標的とする医薬品の設計と最適化においてクラス最高のプラットフォームである当社のプラットフォームを裏付けています。
創業以来、遺伝子治療やDNA編集など、他の核酸治療薬と比較して、RNAを標的とする医薬品を開発することの価値を見てきました。RNAレベルで介入することで、発現レベルやスプライシングなど、トランスクリプトームを調節してRNAに影響を与えることができます。また、用量を滴定し、効果の持続時間を調節し、永続的なオフターゲットの遺伝的変化のリスクや、DNA編集や遺伝子治療アプローチに関連するその他の課題を回避する能力を維持しながら、小分子や生物製剤では治療がこれまで困難であった病気に対処できる可能性もあります。オリゴヌクレオチドには、複数の種類の組織にアクセスできることや、投与頻度を調節して長期にわたって組織内に広く分布させることができることなど、治療クラスとしての利点もあります。オリゴヌクレオチドには、数十年にわたる改善に基づいて確立された製造プロセスと検証済みの試験方法があり、規制、アクセス、および償還の経路も確立されています。
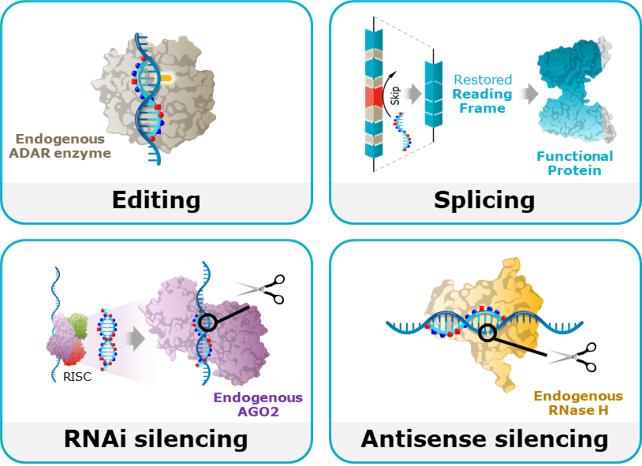
私たちのアプローチは、ヒトの病気に対処するために必要な生物学的機構はすでにヒトの細胞に存在し、適切なツールを使用して治療目的に利用できるという科学的洞察に基づいています。私たちは、複数の治療法で構成されているため、業界で最も用途の広いRNA医薬品プラットフォームを構築できたと信じています。これにより、疾患生物学の新しい分野にアクセスできるような、目的に合った分子を柔軟に設計できます。これらのモダリティは、RNA編集、スプライシング、RNA干渉(「RNAi」)、アンチセンスサイレンシングであり、これらはすべて、当社の治療用オリゴヌクレオチドの薬理学的特性を最適化するための独自の新しい化学物質を取り入れています。

20
当社には、ファーストインクラスまたはクラス最高のプログラムとなる可能性のある、強固で多様なパイプラインがあります。私たちの臨床プログラムは、筋肉、肝臓、中枢神経系(「CNS」)など、影響の大きい遺伝病を治療するように設計されています。これらのプログラムには以下が含まれます:
また、全額出資の前臨床試験も進めています N-肥満などの代謝障害のインヒビンβE(「INHBE」)を標的とするアセチルガラクトサミン(「GalNAc」)-共役RNAiプログラム。また、新しいRNA編集オリゴヌクレオチドのパイプラインを構築します。
過去数年にわたって、私たちは最先端のRNA編集機能を構築してきました。当社のA-to-I RNA編集オリゴヌクレオチド(「AIMer」)は、他の治療法では実現できない疾患生物学の分野へのアクセスを可能にします。私たちの編集機能により、希少疾患だけでなく、大規模な患者集団に影響を与える疾患の両方に巧みに対処することができます。
AIMerは、RNA転写物の単一塩基を標的にし、ADAR(RNAに作用するアデノシンデアミナーゼ)酵素と呼ばれる体内に存在するタンパク質を動員するように設計されています。ADAR(RNAに作用するアデノシンデアミナーゼ)酵素は、自然にアデニン(A)をイノシン(I)に変える能力を有し、細胞はグアニン(G)と読み取ります。このアプローチにより、G点からA点への変異の修正と、RNAの調節によるタンパク質発現のアップレギュレーション、タンパク質間相互作用の修正、またはRNAの折り畳みとプロセシングの変化の両方が可能になります。AIMERは、デリバリーを簡素化し、ゲノムへの永続的な変化やDNAターゲティングアプローチによる不可逆的なオフターゲット効果のリスクを回避できます。AIMerは長さが短く、完全に化学的に改変されており、独自のPNバックボーン修飾やキラル制御などの新しい化学的性質を使用しているため、他のADARを介した編集アプローチとは異なります。
私たちのPRISMプラットフォームは、オリゴヌクレオチド治療薬の薬理学的特性を調整する大きな機会が存在するという認識に基づいて構築されました。それは、配列、化学、立体化学という分子の3つの重要な機能を活用することです。立体化学を制御する当社独自の能力は、薬理学的プロファイルを最適化し、ステレオピュアオリゴヌクレオチドを開発および製造するために必要な解像度を提供します。ステレオピュアオリゴヌクレオチドは、各結合部に原子が正確かつ意図的に3次元配向に配置された分子で構成されています。これらは、現在市場に出ている、または他社が開発中の混合物ベースのオリゴヌクレオチドとは異なります。さらに、薬理学的リスクと潜在的な製造上の課題を軽減するために、私たちのアプローチは、複雑な送達手段を必要としない、短い化学修飾オリゴヌクレオチドを設計することに重点を置いています。また、オリゴヌクレオチド製造の革新を続けながら、原薬のサプライチェーンの管理と可視性を高めるために、社内の現在の適正製造基準(「cGMP」)製造能力を確立し、引き続き強化しています。
PRISMには、独自の新しいPNバックボーン化学修飾も組み込まれています。これは、さまざまなモダリティにわたって効果の効力、分布、および持続性を高めることが前臨床的および臨床的に示されています。PNケミストリーは、現在の臨床、前臨床、発見段階のプログラムのすべてに組み込まれています。
2022年12月、WVE-006を含む革新的なオリゴヌクレオチド治療を発展させるために、グラクソ・スミスクライン知的財産(第3号)(「GSK」)との戦略的提携を発表しました。このコラボレーションは、人類遺伝学におけるGSKの独自の洞察、グローバルな開発および商業能力と、当社のPRISMプラットフォームとオリゴヌクレオチドの専門知識を組み合わせたものです。このコラボレーションにより、クラス初のオリゴヌクレオチドベースの治療薬のパイプラインを構築し続け、疾患生物学の新しい分野を切り開くことができます。また、肝臓と肺の症状の両方に同時に対処できる可能性のあるAATDのクラス最高の治療法としてのWVE-006の価値を最大限に引き出すことができます。
GSKのコラボレーションには3つの要素があります。
2023年5月23日、私たちは第1b/2a相FOCUS-C9試験のトップライン結果と、C9ORF72関連筋萎縮性側索硬化症(「ALS」)と前頭側頭型認知症(「FTD」)(「C9-ALS/FTD」)に対するWVE-004の臨床開発を中止する決定を発表しました。研究の結果から、WVE-004は一般的に安全でWVE-004の用量にわたって耐容性が高く、ほとんどの有害事象は軽度の強度で示されたことが示されました。重要なのは、脳脊髄液(「CSF」)では、ベースラインからのポリ(GP)ジペプチドタンパク質の強力で持続的な減少が観察され、最大平均で48%の減少が見られました(p
21
バイオマーカー効果。しかし、24週目で臨床的有益性の傾向は観察されず、ポリ(GP)の減少は機能的転帰の安定化または改善と相関していませんでした。これらのデータに基づいて、そして臨床転帰を予測する可能性がかなり高いバイオマーカーがないため、WVE-004の開発を中止しました。2023年7月、ALS/FTDのC9はコラボレーションに基づくターゲット(「C9ターゲット」)として終了しました。その結果、タケダとタケダコラボレーションに基づく当社の権利と義務はC9ターゲットに関して終了しました。
現在のプログラム

当社の鉛治療プログラムに関するその他の詳細は以下に記載されています。
デュシェンヌ型筋ジストロフィー(「DMD」)
DMDでは、ジストロフィン遺伝子内のエクソン53をスキップするように設計されたWVE-N531を進めています。これは、DMD症例の約8〜10%に対処する治療アプローチです。WVE-N531は、mRNA前の処理中に細胞スプライシング機構がこのエクソンをスキップするように設計されています。これにより、ジストロフィンmRNAのリーディングフレームが復元され、切断されたが機能的なジストロフィンタンパク質の生成が可能になります。エクソンスキッピングは、天然の遺伝子調節エレメントの制御下で、内因性ジストロフィン遺伝子(ベクターから発現されるマイクロジストロフィンやミニジストロフィンではありません)からジストロフィンを生成し、正常に発現します。WVE-N531は、私たちの最初のスプライシング候補であり、臨床で評価されるPN化学を組み込んだ最初の全身投与候補でもあります。
2022年12月(データ締切:2022年12月6日)、私たちは、エクソン53スキップの影響を受けやすいDMDの3人の少年を対象としたWVE-N531のフェーズ1b/2a概念実証試験のパートAからの肯定的な更新を発表しました。10 mg/kgで隔週の複数回投与を開始してから6週間後に、高い筋肉濃度のWVE-N531とエクソンスキッピングが観察され、試験での概念実証が達成されました。WVE-N531も安全で耐容性が高いように見えました。
ジストロフィンタンパク質の回復を評価するために、オープンラベル試験(「パートB」)の第2相部分であるFORWARD-53のWVE-N531を調査しています。2023年に投与を開始し、最大10人の男児を登録する予定です。男児には隔週で10 mg/kgを投与し、24週間と48週間後にジストロフィンタンパク質を評価する予定です。主要評価項目はジストロフィンタンパク質レベルで、試験では薬物動態、デジタル評価項目と機能性評価項目、安全性と忍容性も評価されます。2024年にFORWARD-53からのデータを配信する予定です。この試験で肯定的な結果が出るまで、より多くのDMDの男児に新しい治療オプションを提供することを目的として、他のエクソンをスキップするためのPN修飾スプライシングオリゴヌクレオチドを使用して、より広範なDMDパイプラインを進めることを計画しています。
アルファ1アンチトリプシン欠乏症(「AATD」)
私たちのAATDプログラムは、私たちの新しいRNA編集機能を最初に活用し、臨床的に証明されたGalNAC共役AIMerを皮下投与で使用しています。Pi*zzのAATD症例の大部分を引き起こす単一RNA塩基変異を修正することによって
22
表現型(米国とヨーロッパでは約20万人)、RNA編集は、野生型アルファ1アンチトリプシン(「AAT」)タンパク質の循環レベルを高め、肝臓での変異タンパク質の凝集を減らすための理想的なアプローチを提供して、肺と肝臓の両方の症状に同時に対処できる可能性があります。
2022年の第3四半期に、AATDの開発候補としてWVE-006を発表しました。WVE-006はAATDの業界初であり、オリゴヌクレオチドを使用して内因性酵素を利用してRNA編集を行うという現在開発中の最も進んだプログラムです。2023年の第4四半期に、アルファ1アンチトリプシン欠乏症(「AATD」)の治療薬としてWVE-006を調査するRestoraAtion臨床プログラムの開始と、WVE-006の複数の臨床試験申請(「CTA」)の承認を発表しました。RestoraAtionの臨床プログラムには、健康なボランティア(Restoraation-1)と、?$#@$接合型のPizZ変異(Restoraation-2)を持つAATD患者の両方が参加し、血清中の野生型α-1アンチトリプシン(「M-AAT」)タンパク質の回復によって測定されるメカニズム証明への効率的な方法を提供するように設計されています。2023年の第4四半期に健康なボランティアにWVE-006の投与を開始し、2024年にAATD患者のメカニズム証明データを提供する予定です。
GSKの協力のもと、GSKはWVE-006の独占グローバルライセンスを取得しました。最初の臨床試験が完了すると、臨床開発と商業的責任はGSKに移管されました。コラボレーションの条件に基づき、WVE-006の開発、発売、販売関連のマイルストーンとして最大5億2,500万ドルのほか、10代後半までの純売上高に占める2桁の段階的ロイヤルティを受け取る資格があります。
前臨床データによると、WVE-006による治療により、確立されたAATDマウスモデル(NSG-Piz)では、13週間でSERPINA1転写産物の約50%のRNA編集が行われ、AATタンパク質レベルが約7倍高くなった(予測される保護閾値の11uMをはるかに上回る)。WVE-006はまた、血清中の約50%の野生型M-AATタンパク質が回復し、好中球エラスターゼ阻害活性が3倍に増加しました。これは、回復したM-AATタンパク質が機能していたことを示しています。ウェーブのAATDエイマーはセルピナ1 RNAに非常に特異的です インビトロそして インビボ トランスクリプトーム全体の分析に基づいています。
WVE-006の臨床で成功すれば、AATDに対する臨床的アプローチを検証するだけでなく、ヒトにおけるRNA編集の実現可能性も検証できます。
ハンチントン病(「HD」)
HDでは現在、WVE-003を開発しています。これは、病気の原因となる変異ハンチンチン(「mHTT」)内のmRNA転写産物に関連する未公開の一塩基多型(「SNP」)「mHTT SNP3」を選択的に標的にするように設計されたステレオピュアアンチセンスオリゴヌクレオチドです。 ハンティンティンです (「ハット」) ジーン。出版された文献によると、HD人口の約40%がSNP3を持っています(Carrollら、分子療法、2011年)。
WVE-003には、当社の新しいPNケミストリーと、第1世代のHDプログラムから学んだことが組み込まれています。SNP3でmRNAを標的にすると、健康な転写産物を比較的そのまま残したまま、変異対立遺伝子からの転写産物の発現を低下させることができます。これにより、神経機能に重要な野生型(健康な)ハンチンチン(「wTHTT」)タンパク質が維持されます。私たちの対立遺伝子選択的アプローチにより、将来、症状が現れる前、つまり無症状のHD患者集団に対処できるようになるかもしれません。前臨床試験では、WVE-003はmHTT mRNAの用量依存的かつ選択的な減少を示しました インビトロ、そしてmHTT mRNAとタンパク質の強力で耐久性のあるノックダウン インビボ マウスモデルで。
SELECT-HD試験は、早期症状のHD患者に対して髄腔内投与されたWVE-003の安全性と忍容性を評価するための、多施設、無作為化、二重盲検、プラセボ対照の第1b/2a相臨床試験です。その他の目的には、mHTTおよびwTHTTタンパク質の測定、および探索的薬物動態学、薬力学、臨床および磁気共鳴画像法(「MRI」)のエンドポイントが含まれます。SELECT-HD試験は、用量レベルと投与頻度は独立した委員会によって指導され、適応的になるように設計されています。
2022年9月(データ締め切り:2022年8月29日)、試験参加者が30mgまたは60mgのWVE-003の単回投与を受けた後、脳脊髄液(「CSF」)中のmHTTタンパク質の減少が観察されたことにより、SELECT-HDからの肯定的な更新を発表しました。さらに、wTHTTのタンパク質レベルは対立遺伝子選択性と一致しているように見えました。WVE-003の単回投与(30 mg、60 mg、および90 mg)は、一般的に安全で耐容性が高いようです。SELECT-HDのデータに基づいて、単回投与コホートを拡大するように試験を調整しました。複数回投与の部分も進行中です。
8週間ごとに投与されるWVE-003の用量を評価している30 mgの複数回投与コホートへの登録を完了しました。患者を単回投与コホートからロールオーバーし、30 mgの複数回投与コホートを完全に登録したので、完成した単回投与コホートと複数回投与コホートを同時に評価します。2024年の第2四半期に、フォローアップを延長した30 mgの複数回投与コホートのデータと、すべての単回投与データを報告する予定です。これらのデータは、プログラムに関する意思決定を可能にし、タケダのオプトインパッケージをサポートすることが期待されています。
2023年の第3四半期に、私たちは武田薬品との共同研究において画期的な成果を達成しました。これは、非ヒト霊長類(「NHP」)を対象としたWVE-003の非臨床試験の肯定的な結果に関するもので、2023年の第4四半期にWaveに700万ドルの支払いが行われました。この研究では、線条体を含む脳深部領域でのWVE-003の有意な組織曝露レベルが示され、オリゴヌクレオチドがHDにとって重要な中枢神経系の領域に分布する能力を確認する既存のデータセットが強化されました。
23
肥満を含む代謝障害
2023年9月、研究開発(「研究開発」)デーに関連して、GSKとのコラボレーションから生まれた最初の完全所有プログラムを発表しました。これは、肥満などの代謝障害に対してINHBEを標的とするGalNAC共役siRNAサイレンシングプログラムです。米国とヨーロッパには、肥満を含む代謝障害を患っている人が約4,700万人おり、GLP-1受容体アゴニスト以外の治療オプションが必要です。GLP-1受容体アゴニストは、筋肉を犠牲にして体重減少をもたらし、一般的な報酬系を抑制し、耐容性プロファイルが悪く、1年後に68%低下します。INHBEの機能喪失ヘテロ接合型ヒトキャリアは、腰と腰の比率の低下、2型糖尿病と冠状動脈疾患の確率の低下など、健康的な代謝プロファイルを示します。INHBEが50%以上減少すると、健康的な代謝プロファイルが回復すると期待されます。研究開発デーに関連して、私たちは共有しました インビボ概念実証データにより、50%の治療閾値をはるかに超えるINHBEサイレンシングを達成しました。これにより、食事誘発性肥満マウスの体重が大幅に減少し、内臓脂肪が減少しました。これらは、INHBEサイレンシングを実証した最初のデータです インビボヘテロ接合性機能喪失担体の表現型と一致しています。強力で非常に具体的なリードを特定し、2024年の第4四半期にINHBEの臨床候補を選択する予定です。
ディスカバリーパイプライン
私たちは、オリゴヌクレオチドが複雑な送達手段なしでさまざまな組織や細胞に分布できることを示す説得力のある前臨床データに照らして、複数の疾患分野で新しい標的を開発しています。AATDでは、タンパク質の機能を回復または修正することで、単一遺伝子疾患を修正するように編集できることを実証しました。2023年9月、研究開発デーに関連して、RNAを編集してmRNA転写物の安定性をアップレギュレートまたは高め、それによって内因性タンパク質の産生を増加させることで、AATDに関する研究をさらに発展させてより大きな病気に対処できることを実証しました。遺伝子データセットとディープラーニングモデルを活用した独自の「edit-verse」を利用して、新しいRNA編集ターゲットを特定し、サイトを編集することを発表しました。これらのターゲットは、簡単にアクセスできるバイオマーカーを活用し、人間の概念実証への効率的な道筋を提供し、有意義な商業的機会をもたらします。これらの新しいターゲットのいくつかに関する前臨床概念実証データを実証し、肝臓と腎臓のターゲットで少なくとも2倍のmRNAアップレギュレーション、肝臓と肺のターゲットで60%以上のmRNA補正を達成しました。また、研究開発デーでは、2025年末までにINHBEを含む5つの新しい臨床候補を選択する予定であることを発表しました。
2023年4月、私たちは新しい低分子干渉RNA(「siRNA」)フォーマットの前臨床データが核酸研究誌に掲載されたことを発表しました。前臨床データでは、GalNAc-siRNAの単回皮下投与後に前例のないアルゴノート2(「Ago2」)負荷がかかり、効力と耐久性が向上したことが示されました。 インビボ対コンパレータsiRNAフォーマット。
また、siRNAが肝外組織の標的をサイレンシングする可能性も実証しました。2023年の第1四半期に、最初の四半期からのデータを発表しました インビボ中枢神経系(「CNS」)でのsiRNA研究では、私たちの非共役siRNAコンストラクトが、脳室内(ICV)の単回投与後、8週間でマウスCNSの6つの脳領域で70〜90%のAppサイレンシングを示しました。2023年9月、研究開発デーに関連して、CNSで16週間にわたって少なくとも75%のアプリサイレンシングが続いていることを示す最新データを発表しました。 インビボ私たちの非共役siRNAの単回投与後の研究。
GSKとのコラボレーションを通じて、私たちは独自の遺伝的洞察にアクセスして、完全所有のパイプラインを拡大しています。さらに、私たちとGSKは、GSKが提携しているプログラムのための複数のターゲット検証プログラムに積極的に取り組んでいます。その費用と費用はすべてGSKが前払いしています。
金融業務の概要
私たちは利益を上げたことがなく、創業以来、多額の営業損失を被っています。2023年9月30日に終了した3か月間の純利益は730万ドル、2022年9月30日に終了した3か月間の純損失は3,900万ドルでした。2023年9月30日と2022年に終了した9か月間の純損失は、それぞれ4,130万ドルと1億1,810万ドルでした。2023年9月30日と2022年12月31日の時点で、私たちの累積赤字はそれぞれ10億860万ドルと9億6,730万ドルでした。当面の間、多額の費用と営業損失が続くと予想しています。
収益
私たちは、2023年1月に発効したGSKコラボレーション契約と、2018年4月に発効したタケダコラボレーション契約(フォーム10-Qの他の箇所に記載されている連結財務諸表の注記5-コラボレーション契約で定義されています)に基づいて計上しています。私たちは創業以来、製品収益を生み出しておらず、当面の間、製品の販売から収益を生み出すとは考えていません。
営業経費
創業以来の当社の運営費は、主に研究開発費と一般管理費で構成されてきました。
24
研究開発費用
研究開発費は主に、発見活動を含む研究活動、および製品候補の開発にかかった費用で構成されます。これには次のものが含まれます。
研究開発費は発生したものと認識しています。私たちは、ベンダーから提供された情報を使用して、特定のタスクが完了するまでの進捗状況を評価して、外部開発コストを計上します。これらの活動に対する支払いは、個々の契約の条件に基づいており、発生した費用のパターンとは異なる場合があり、前払い費用または未払費用として財務諸表に反映されます。
創業以来、私たちの主な研究開発の焦点は、独自の創薬および医薬品開発プラットフォームであるPRISMの開発でした。私たちは、新しいPNバックボーン化学修飾を含むPRISMを使用して、RNA編集、スプライシング、サイレンシングを使用してRNAを標的とする核酸治療候補の幅広いパイプラインを設計、開発、商品化しています。
当社の研究開発費は、報酬関連費用、社内製造費、施設関連費用、その他の一般的な運営費に加えて、主にCRO、CMO、コンサルタント、その他の外部ベンダーに関連する費用、および臨床試験を実施するために世界の規制機関に支払われる手数料で構成されています。これらの費用は、研究開発の取り組み、当社の前臨床試験および臨床試験に関連して発生します。特定の外部経費をプログラムごとに追跡しています。ただし、報酬関連費用、内部製造費、機器の修理および保守費、施設関連費用、またはその他の運営費を特定のプログラムに割り当てることはありません。これらの費用は、プログラムごとに配分されるわけではなく、当社の創薬および開発プログラム、プラットフォーム開発、潜在的な創薬候補の特定に関連するその他の外部費用とともに、「PRISMおよびその他の研究開発費」カテゴリに含まれます。
臨床開発の後期段階にある製品候補は、一般に臨床開発の初期段階の製品よりも開発コストが高くなります。これは主に、後期段階の臨床試験の規模と期間が増加するためです。既存の臨床試験を管理し、特定の製品候補について追加の臨床試験を開始し、特定の製品候補について臨床開発の後期段階を追求し、製造能力を維持し、複数の治療分野で追加の製品候補を発見して開発し続けるため、近い将来、多額の研究開発費が引き続き発生すると予想しています。
一般管理費
一般管理費は、主に、役員、財務、企業、法務、管理職の職員の給与、賞与、株式ベースの報酬、その他の関連福利厚生、および取締役会の報酬関連費用を含む報酬関連費用で構成されています。一般管理費には、弁護士費用、上場企業であることに関連する費用、会計、監査、税務、コンサルティングサービスの専門家費用、保険費用、旅費、その他の運営費、施設関連費用も含まれます。
その他の利益、純額
その他の収入、純額は、主に配当収入と税務当局からの返金可能な税額控除で構成されています。返金可能な税額控除の要件を遵守し、返金可能な税額控除を受けることが合理的に保証されている場合に、返金可能な税額控除を認めます。
25
所得税
私たちは、米国およびその他のさまざまな法域で課税対象となるシンガポールの多国籍企業です。
重要な会計方針と重要な判断と見積もり
当社の連結財務諸表は、米国で一般に認められている会計原則に従って作成されています。財務諸表および関連する開示を作成する際には、報告された資産、負債、収益、費用、費用、および関連する開示額に影響する見積もりと仮定を行う必要があります。経営陣は、適切な財務会計方針を選択したり、財務諸表の作成に使用される見積もりや前提条件を作成したりする際に、多くの要素を考慮します。経営陣は、このプロセスにおいて重要な判断を下さなければなりません。私たちの収益認識方針、特に(a)履行義務の数の評価、(b)取引価格の決定、(c)契約における履行義務への取引価格の配分、(d)履行義務を履行するための見積もりを含む履行義務の履行パターンの決定、および契約費用を見積もるためにCROやCMOとの契約分析に使用される仮定と見積もりには、より深い意味合いがあると考えています。判断力があるので、私たちは彼らを次のように考えますが私たちの重要な会計方針です。私たちは、見積もりと仮定を継続的に評価しています。私たちの実際の結果は、さまざまな仮定や条件の下でこれらの見積もりと異なる場合があります。
業務結果
2023年9月30日に終了した3か月と2022年9月30日の比較
|
|
9月30日に終了した3か月間 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
変更 |
|
|||
|
|
(千単位) |
|
|||||||||
収益 |
|
$ |
49,214 |
|
|
$ |
285 |
|
|
$ |
48,929 |
|
営業経費: |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
31,642 |
|
|
|
27,575 |
|
|
|
4,067 |
|
一般と管理 |
|
|
13,128 |
|
|
|
11,609 |
|
|
|
1,519 |
|
営業費用の合計 |
|
|
44,770 |
|
|
|
39,184 |
|
|
|
5,586 |
|
事業からの収益(損失) |
|
|
4,444 |
|
|
|
(38,899 |
) |
|
|
43,343 |
|
その他の収益(費用)の合計、純額 |
|
|
2,131 |
|
|
|
(105 |
) |
|
|
2,236 |
|
所得税控除前利益(損失) |
|
|
6,575 |
|
|
|
(39,004 |
) |
|
|
45,579 |
|
所得税制上の優遇措置(規定) |
|
|
677 |
|
|
|
— |
|
|
|
677 |
|
当期純利益 (損失) |
|
$ |
7,252 |
|
|
$ |
(39,004 |
) |
|
$ |
46,256 |
|
収益
2023年9月30日に終了した3か月間の収益は4,920万ドルで、GSKコラボレーション契約とタケダコラボレーション契約に基づいて獲得されました。2022年9月30日に終了した3か月間の収益は30万ドルで、主にGSKコラボレーション契約が2023年1月に発効したタケダコラボレーション契約に基づいて獲得されました。前年比の収益の増加は、C9プログラムの終了に関連する2,800万ドルの収益と、武田薬品共同契約に基づく開発マイルストーンの達成に関連する700万ドルの収益、および2023年1月に発効したGSKコラボレーション契約に基づいて得られた収益によるものです。
26
研究開発費用
|
|
9月30日に終了した3か月間 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
変更 |
|
|||
|
|
(千単位) |
|
|||||||||
ALSとFTDプログラム |
|
$ |
2,564 |
|
|
$ |
3,153 |
|
|
$ |
(589 |
) |
HDプログラム |
|
|
2,873 |
|
|
|
1,732 |
|
|
|
1,141 |
|
DMD プログラム |
|
|
1,528 |
|
|
|
796 |
|
|
|
732 |
|
AATDプログラム |
|
|
2,204 |
|
|
|
281 |
|
|
|
1,923 |
|
PRISMおよびその他の研究開発費 (1) |
|
|
22,473 |
|
|
|
21,613 |
|
|
|
860 |
|
研究開発費の合計 |
|
$ |
31,642 |
|
|
$ |
27,575 |
|
|
$ |
4,067 |
|
2023年9月30日に終了した3か月間の研究開発費は3,160万ドルでしたが、2022年9月30日に終了した3か月間の研究開発費は2,760万ドルでした。約410万ドルの増加は、次の理由によるものです。
一般管理費
一般管理費は、2023年9月30日に終了した3か月間で1,310万ドルでしたが、2022年9月30日に終了した3か月間は1,160万ドルでした。この増加は主に、外部の一般管理費の増加によるものです。
その他の収益(費用)、純額
2023年9月30日に終了した3か月間のその他の純利益は210万ドルで、主に配当収入でした。2022年9月30日に終了した3か月間のその他の費用は、為替差損およびその他の費用で構成され、配当収入と推定返金可能な税額控除によって一部相殺されました。その他の収益の前年比の増加は、主に配当収入の増加と為替差損の減少によるものです。
所得税制上の優遇措置 (規定)
2023年9月30日に終了した3か月間に、研究開発費の資本化に関する最近の米国の税制上のガイダンスに関連する還付調整引当金により、70万ドルの所得税上の優遇措置を記録しました。2022年9月30日に終了した3か月間、所得税の優遇措置または引当金を計上しませんでした。
将来の課税所得に関する不確実性のため、2023年9月30日および2022年9月30日に終了した3か月間、すべての法域で評価引当金の全額を維持しました。
27
2023年9月30日に終了した9か月と2022年9月30日の比較
|
|
9月30日に終了した9か月間 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
変更 |
|
|||
|
|
(千単位) |
|
|||||||||
収益 |
|
$ |
84,249 |
|
|
$ |
2,410 |
|
|
$ |
81,839 |
|
営業経費: |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
95,935 |
|
|
|
84,778 |
|
|
|
11,157 |
|
一般と管理 |
|
|
37,628 |
|
|
|
36,789 |
|
|
|
839 |
|
営業費用の合計 |
|
|
133,563 |
|
|
|
121,567 |
|
|
|
11,996 |
|
事業からの収益(損失) |
|
|
(49,314 |
) |
|
|
(119,157 |
) |
|
|
69,843 |
|
その他の収益(費用)の合計、純額 |
|
|
7,380 |
|
|
|
1,043 |
|
|
|
6,337 |
|
所得税控除前利益(損失) |
|
|
(41,934 |
) |
|
|
(118,114 |
) |
|
|
76,180 |
|
所得税制上の優遇措置(規定) |
|
|
677 |
|
|
|
— |
|
|
|
677 |
|
当期純利益 (損失) |
|
$ |
(41,257 |
) |
|
$ |
(118,114 |
) |
|
$ |
76,857 |
|
収益
2023年9月30日に終了した9か月間の収益は8,420万ドルで、GSKコラボレーション契約とタケダコラボレーション契約に基づいて獲得されました。2022年9月30日に終了した9か月間の収益は240万ドルで、主にGSKコラボレーション契約が2023年1月に発効したタケダコラボレーション契約に基づいて獲得されました。前年比の収益増加は、2023年1月に発効したGSKコラボレーション契約に基づいて得られた4,740万ドルの収益、C9プログラムの終了に関連して計上された2,800万ドルの収益、およびタケダコラボレーション契約に基づく開発マイルストーンの達成に関連する700万ドルによるものです。
28
研究開発費用
|
|
9月30日に終了した9か月間 |
|
|
|
|
||||||
|
|
2023 |
|
|
2022 |
|
|
変更 |
|
|||
|
|
(千単位) |
|
|||||||||
ALSとFTDプログラム |
|
$ |
8,614 |
|
|
$ |
8,240 |
|
|
$ |
374 |
|
HDプログラム |
|
|
10,290 |
|
|
|
5,178 |
|
|
|
5,112 |
|
DMD プログラム |
|
|
4,097 |
|
|
|
1,613 |
|
|
|
2,484 |
|
AATDプログラム |
|
|
5,930 |
|
|
|
2,133 |
|
|
|
3,797 |
|
PRISMおよびその他の研究開発費 (1) |
|
|
67,004 |
|
|
|
67,614 |
|
|
|
(610 |
) |
研究開発費の合計 |
|
$ |
95,935 |
|
|
$ |
84,778 |
|
|
$ |
11,157 |
|
2023年9月30日に終了した9か月間の研究開発費は9,590万ドルでしたが、2022年9月30日に終了した9か月間の研究開発費は8,480万ドルでした。約1,120万ドルの増加は、次の理由によるものです。
一般管理費
一般管理費は、2023年9月30日に終了した9か月間で3,760万ドルでしたが、2022年9月30日に終了した9か月間は約3,680万ドルでした。80万ドルの増加は、主に外部の一般管理費の増加によるものです。
その他の収益(費用)、純額
2023年9月30日に終了した9か月間のその他の純利益は740万ドルで、主に配当収入と推定還付可能な税額控除で構成されていました。2022年9月30日に終了した9か月間のその他の純収入は100万ドルで、主に推定還付可能な税額控除に関連していました。前年比の増加は、主に配当収入の増加によるものです。
所得税制上の優遇措置 (規定)
2023年9月30日に終了した9か月間に、研究開発費の資本化に関する最近の米国の税制上のガイダンスに関連する還付調整引当金により、70万ドルの所得税上の優遇措置を記録しました。2022年9月30日に終了した9か月間、所得税の優遇措置または引当金を計上しませんでした。
将来の課税所得に関する不確実性のため、2023年9月30日および2022年9月30日に終了した9か月間、すべての法域で評価引当金の全額を維持しました。
29
流動性と資本資源
創業以来、製品の収益は発生しておらず、経常的な営業損失も発生しています。これまで、私たちは主に、普通株式の公募およびその他の登録公開、第三者との協力、および負債および株式の私募を通じて事業資金を調達してきました。2023年9月30日までに、これらの取引から合計で約11億9,430万ドルの純収入を受け取りました。これには、普通株式の公募およびその他の登録募集からの純収入6億3,400万ドル、コラボレーションによる4億7,100万ドル、および当社の負債および株式の私募による純収入8,930万ドルが含まれます。
2023年9月30日の時点で、現金および現金同等物は合計1億3,990万ドル、制限付現金は370万ドル、累積赤字は10億860万ドルでした。
私たちは、既存の現金および現金同等物で、少なくとも今後12か月間は、事業資金を調達するのに十分であると予想しています。この予想は、不正確であることが判明する可能性のある仮定に基づいており、現在の予想よりも早く利用可能な資本リソースを使い果たす可能性があります。さらに、現在または将来の事業計画に十分な資金があると予想される場合でも、市場の状況や戦略的検討により資金調達の条件が良好であれば、必要になる前に追加の資金を調達することを選択できます。
2023年9月30日現在のオペレーティングリースのコミットメントは合計で約3,990万ドルで、そのうち150万ドルは2023年の支払いに関連しており、3,840万ドルは2023年以降の支払いに関連しています。
製品の販売から大きな収益を生み出すことができるまでは、パブリックエクイティ、プライベートエクイティ、デットファイナンス、または第三者とのコラボレーションを含むその他の資金源の組み合わせを通じて事業資金を調達し続けることを期待しています。2019年5月、私たちはフォームS-3ASRで棚登録届出書をSECに提出しました。そこに基づいて、普通株式、負債証券、ワラント、権利、および/または単位の任意の組み合わせを、当社が決定する価格と条件で、不確定な金額の売買登録を行いました。フォームS-3ASRの棚登録届出書には、2019年5月にジェフリーズと締結した、2020年3月と2022年3月に改正された公開市場販売契約(改正された「売買契約」)に従って、販売代理店として活動するジェフリーズLLC(「ジェフリーズ」)を通じて随時発行および売却できる、総額2億5,000万ドルの普通株式を対象とする目論見書も含まれていました。」)、私たちの「市場の」株式プログラム用です。2019年12月31日に終了した年度の年次報告書をフォーム10-Kに提出した時点で、当社は「有名なベテラン発行者」としての資格を失ったため、以前は棚登録届出書を修正して、普通株式、負債証券、ワラント、権利、および/または単位の任意の組み合わせを、250.0ドルを含め、当社が決定できる価格と条件で最大5億ドルの売却を登録するようにしました。当社の「市場投資」株式プログラムに従って随時発行および売却する可能性のある数百万株の普通株式。この登録届出書(「2019年フォームS-3」と呼びます)は、2022年フォームS-3(以下に定義)が2022年5月4日に発効すると宣言されるまで有効でした。その後、2019年のフォームS-3に基づく証券の提供または売却はできなくなります。
2022年3月3日、私たちはフォームS-3でSECに新しいユニバーサルシェルフ登録を提出しました。この登録は、2022年5月4日にSECによって発効が宣言されました。これに基づいて、普通株式、負債証券、ワラント、権利、および/またはユニットの任意の組み合わせを、当社が決定する価格と条件で最大5億ドルの売却を登録しました。これを「2022フォームS-3」と呼びます。2022年のフォームS-3には、ジェフリーズとの売買契約に基づいてまだ発行または売却されていない、最大約1億3,200万ドルの普通株式を対象とする目論見書が含まれています。2023年9月30日に終了した9か月間に、市場株式プログラムの下で751,688株の普通株式を売却し、総収入は330万ドルでした。2023年9月30日現在、2022年のフォームS-3に基づいて発行可能な有価証券は4億2,670万ドルです。これには、市場株式プログラムの下で発行可能な約1億2,870万ドルの普通株式が含まれます。
適切な追加資金が、受け入れ可能な条件では提供されない場合もあれば、まったく提供されない場合もあります。必要なときに資本を調達できないと、財政状態と事業戦略の遂行能力に悪影響を及ぼします。収益を上げるには多額の収益を上げる必要がありますが、決してそうしないかもしれません。
30
キャッシュフロー
次の表は、当社のキャッシュフロー活動をまとめたものです。
|
|
9月30日に終了した9か月間 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
|
|
(千単位) |
|
|||||
営業活動によって提供された(使用された)純現金 |
|
$ |
13,808 |
|
|
$ |
(94,341 |
) |
投資活動に使用された純現金 |
|
|
(759 |
) |
|
|
(26,095 |
) |
財務活動による純現金 |
|
|
38,572 |
|
|
|
67,133 |
|
外国為替レートが現金、現金同等物、制限付現金に及ぼす影響 |
|
|
(153 |
) |
|
|
(304 |
) |
現金、現金同等物および制限付現金の純増額(減少) |
|
$ |
51,468 |
|
|
$ |
(53,607 |
) |
営業活動
2023年9月30日に終了した9か月間、営業活動により1,380万ドルの現金が提供されました。これは、4,130万ドルの純損失と、1,450万ドルの非現金費用と4,060万ドルの営業資産および負債の変動によって相殺されました。最大の非現金費用は、740万ドルの株式報酬でした。営業資産と負債の最大の変化は、主に2023年1月に発効したGSKコラボレーション契約による繰延収益の6,230万ドルの増加でした。これは、営業資産と負債の2番目に大きな変化であるタケダコラボレーション契約に基づくマイルストーンの達成に関連する売掛金の700万ドルの増加によって相殺されました。
2022年9月30日に終了した9か月間、営業活動は9,430万ドルの現金を使用しました。これは主に株式ベースの報酬費用と減価償却費からなる2,190万ドルの非現金費用によって一部相殺されました。
投資活動
2023年9月30日に終了した9か月間、投資活動には資産と設備の購入に関連して80万ドルの現金が使用されました。
2022年9月30日に終了した9か月間、投資活動には2,610万ドルの現金が使用されました。そのうち7,500万ドルは短期投資の購入に関連し、5,000万ドルはその後満期になり、110万ドルは不動産と設備の購入と売却に関連しました。
資金調達活動
2023年9月30日に終了した9か月間、財務活動によって提供された純現金は3,860万ドルでした。これは主にGSKの株式投資(フォーム10-Qのこの四半期報告書の他の場所に記載されている連結財務諸表の注記5-協力契約で定義されています)によるものでした。
2022年9月30日に終了した9か月間、財務活動によって提供された純現金は6,710万ドルでした。これは主に、普通株式の売却と事前積立ワラントで構成された、以前に開示した2022年6月の引受募集からの純収入によるものです。
資金要件
継続的な研究開発活動と社内のcGMP製造活動に関連して、引き続き多額の費用が発生すると予想しています。さらに、次のような場合には、経費は引き続き変動すると予想しています。
31
試験の失敗、複雑な結果、安全性の問題、その他の規制上の問題など、上記のいずれかで遅延や問題が発生する可能性があります。
医薬品候補の開発には数多くのリスクと不確実性が伴い、製品候補の開発のために第三者とどの程度協力できるかが不明であるため、治療プログラムの研究開発の完了に関連する将来の資本支出と運営費を見積もることはできません。私たちの治療プログラムに対する将来の資本要件は、次のような多くの要因によって決まります。
潜在的な製品候補を特定し、前臨床試験と臨床試験を実施することは、時間と費用がかかり、不確実なプロセスであり、完了するまでに何年もかかり、販売承認を得て製品の販売を達成するために必要なデータや結果を生成できない場合があります。さらに、当社の製品候補は、承認されても商業的に成功しない可能性があります。当社の製品収益は、もしあれば、たとえ何年もの間市販されないと予想される製品の販売から得られます。したがって、事業目標を達成するには、多額の追加資金を調達する必要があります。
必要なときに、十分な追加資金が受け入れ可能な条件で入手できない場合や、まったく提供されない場合があります。現在、タケダまたはGSKとのコラボレーションによる将来の支払いを除いて、確約された外部資金源はありません。株式または転換社債の売却を通じて追加資本を調達する限り、既存の株主の所有権は希薄化され、条件には株主の権利に悪影響を及ぼす清算またはその他の優遇措置が含まれる場合があります。追加のデット・ファイナンスや優先株式融資(可能な場合)には、追加債務の負担、設備投資、配当の申告など、特定の行動を取る能力を制限または制限する契約が含まれる場合があり、ワラントの発行が必要になる場合があります。これにより、株主の所有権が希薄化する可能性があります。
第三者とのコラボレーション、戦略的提携、ライセンス契約を通じて追加の資金を調達した場合、技術、将来の収益源、研究プログラム、製品候補に対する貴重な権利を放棄するか、私たちにとって不利な条件でライセンスを付与しなければならない場合があります。必要に応じてエクイティファイナンスまたはデットファイナンスで追加の資金を調達できない場合、製品開発プログラムまたは将来の商品化努力を延期、制限、削減、または終了するか、そうでなければ自社で開発して販売したい製品候補を開発および販売する権利を付与する必要があります。
32
アイテム 3.定量的・質的市場リスクに関する開示
市場リスクとは、金融市場の価格と金利の不利な変化により、当社の財政状態に影響を与える可能性のある損失のリスクです。私たちの市場リスクは、主に金利と為替レートの変動、そして程度は低いがインフレと資本市場リスクの結果です。
金利リスク
私たちは通常の事業過程で金利リスクにさらされています。当社の現金および現金同等物は、当座預金口座とマネーマーケット口座に保管されている資金で構成されています。
外貨リスク
米国外での事業のため、外貨為替レートの変動に関連する市場リスクにさらされています。これまで、私たちは外貨エクスポージャーをヘッジしていません。通貨の相対価値の変動は定期的に発生し、場合によっては、当社の事業、財務状況、経営成績、またはキャッシュフローに重大な悪影響を及ぼす可能性があります。2023年9月30日と2022年に終了した3か月と9か月間、外貨為替レートの変動は、当社の過去の財政状態、事業、財政状態、経営成績、またはキャッシュフローに重大な影響を及ぼしませんでした。
インフレリスク
過去2年間、インフレが当社の事業、財政状態、経営成績、またはキャッシュフローに重大な影響を及ぼしたとは考えていません。世界的なインフレ傾向が続くと、臨床試験、人件費、その他の運営費が大幅に増加すると予想されます。
資本市場リスク
現在、製品収入はなく、他の資金源から調達した資金に依存しています。考えられる資金源の1つは、さらなる株式公開です。この方法で資金を調達できるかどうかは、世界経済の不確実性が資本市場に与える影響を含め、株価に影響を与える資本市場の力にかかっています。
アイテム 4.コントロール と手順
開示管理と手続きの評価
当社の経営陣は、最高執行責任者と最高財務責任者の参加を得て、2023年9月30日現在の開示管理と手続きの有効性を評価しました。取引法の規則13a-15(e)および15d-15(e)で定義されている「開示管理および手続き」という用語は、取引法に基づいて提出または提出する報告書で企業が開示する必要のある情報が、SECの規則および書式で指定された期間内に記録、処理、要約、報告されることを保証するために設計された企業の統制およびその他の手続きを意味します。開示管理と手続きには、企業が取引法に基づいて提出または提出する報告書で開示する必要のある情報を蓄積し、必要な開示に関するタイムリーな意思決定を可能にするために、必要に応じて主要役員や主要財務責任者を含む経営陣に伝達されるように設計された管理と手続きが含まれますが、これらに限定されません。経営陣は、統制と手順がどれほどうまく設計され運用されても、その目的を達成するための合理的な保証しか提供できないことを認識しており、経営陣は、可能な統制と手順の費用便益関係を評価する際に必ずその判断を適用します。2023年9月30日現在の当社の開示管理と手続きの評価に基づいて、当社の最高執行責任者と最高財務責任者は、その日付の時点で、当社の開示管理と手続きは合理的な保証レベルで有効であると結論付けました。
財務報告に関する内部統制の変更
2023年9月30日に終了した3か月間に発生した、取引法の規則13a-15(d)および15d-15(d)で義務付けられている内部統制の評価に関連して、財務報告に対する内部統制に重大な影響を及ぼした、または重大な影響を与える可能性が合理的に高いと思われる変更は、財務報告に対する内部統制に確認されました。
33
パートII — その他R 情報
アイテム 1.リーガル 議事録
私たちは現在、重要な法的手続きの当事者ではありません。
アイテム 1A.Riスカイファクター
フォーム10-Qのこの四半期報告書に記載されている他の情報に加えて、フォーム10-Kの2022年年次報告書の項目1Aに記載されている「リスク要因」というキャプションに記載されている要因を慎重に検討する必要があります。
アイテム 2.株式の未登録売却y証券、収益の使用、および発行者による株式の購入
最近の株式の未登録売却
[なし]。
発行者による株式の購入
2023年9月30日に終了した3か月間、私たちは株式を買い戻しませんでした。
アイテム 3.デフォルト:時シニア証券
[なし]。
アイテム 4.マインセーフ各種情報開示
該当しません。
アイテム 5.その他[情報]
[なし]。
34
アイテム 6.E展示品
示す 番号 |
|
展示品の説明 |
|
提出 これで 報告書 |
|
によって法人化されました ここでの参考文献 フォームから、または スケジュール |
|
ファイリング 日付 |
|
秒 ファイル/登録。 番号 |
|
|
|
|
|
|
|
|
|
|
|
10.1+ |
|
2023年8月7日から発効する非従業員取締役報酬方針 |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10.2+ |
|
ウェーブ・ライフサイエンス株式会社、修正された2021年の株式インセンティブ・プラン |
|
|
|
フォーム 8-K (別紙10.1) |
|
08/07/2023 |
|
001-37627 |
|
|
|
|
|
|
|
|
|
|
|
10.3+ |
|
ウェーブ・ライフサイエンス株式会社の2019年従業員株式購入計画、修正されました |
|
|
|
フォーム 8-K (別紙10.2) |
|
08/07/2023 |
|
001-37627 |
|
|
|
|
|
|
|
|
|
|
|
31.1 |
|
規則13a-14 (a) /15d-14 (a) 最高経営責任者の証明書 |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
31.2 |
|
規則13a-14 (a) /15d-14 (a) 最高財務責任者の証明書 |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
32* |
|
第1350条最高執行責任者および最高財務責任者の認定 |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
101.インチ |
|
インラインXBRLインスタンスドキュメント-インスタンスドキュメントは、インラインXBRLタグがインラインXBRLドキュメントに埋め込まれているため、インタラクティブデータファイルには表示されません |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
101.SCH |
|
インライン XBRL タクソノミー拡張スキーマドキュメント |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
101.CAL |
|
インライン XBRL タクソノミー拡張計算リンクベースドキュメント |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
101.DEF |
|
インライン XBRL タクソノミー拡張定義リンクベースドキュメント |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
101.LAB |
|
インライン XBRL タクソノミー拡張ラベルリンクベースドキュメント |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
101.PRE |
|
インライン XBRL タクソノミー拡張プレゼンテーションリンクベースドキュメント |
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
104 |
|
表紙インタラクティブデータファイル(インライン XBRL でフォーマットされ、別紙101に含まれています) |
|
X |
|
|
|
|
|
|
(*) フォーム10-Qのこの四半期報告書に添付されている別紙32に添付されている証明書は、一般的な法人化に関係なく、証券取引委員会に提出されたものとみなされず、改正された1933年の証券法または改正された1934年の証券取引法(フォーム10-Qの日付より前または後に作成されたかを問わない)に基づくWave Life Sciences Ltd. の提出書類に参照して組み込まれることはありません。そのようなファイリングに含まれる言語。
35
署名
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
|
ウェーブ・ライフサイエンス株式会社 |
||
|
|
|
|
日付:2023年11月9日 |
作成者: |
|
/s/ ポール・B・ボルノ、医学博士、経営学修士 |
|
|
|
ポール・B・ボルノ、医学博士、経営学修士 |
|
|
|
社長兼最高経営責任者 |
|
|
|
(最高執行役員) |
|
|
|
|
日付:2023年11月9日 |
作成者: |
|
/s/ カイル・モラン |
|
|
|
カイル・モラン |
|
|
|
最高財務責任者(最高財務責任者および最高会計責任者) |
36