

別紙99.2 INVIVYD 2023年第3四半期の財務結果とビジネスのハイライト 2023年11月9日 © 2023 Invivyd, Inc. InvivydとInvivydのロゴはInvivyd, Inc.の商標です。このプレゼンテーションのすべての商標は、それぞれの所有者の財産です。

将来の見通しに関する記述に関する注意事項このプレゼンテーション には、1995年の米国民間証券訴訟改革法の意味における将来の見通しに関する記述が含まれています。歴史的事実の記述ではないこのプレゼンテーションの記述は、将来の見通しに関する記述です。 「かもしれない」、「する」、「すべき」、「期待する」、「計画する」、「予測する」、「求める」、「できた」、「意図する」、「目標とする」、「狙う」、「計画する」、「推定」、「信じる」、「予測」、「可能性」、「続く」などの言葉、またはこれらの用語の否定的表現やその他の類似の表現は 将来の見通しに関する記述を識別することを目的としています。ただし、すべての将来の見通しに関する記述にこれらの識別語が含まれているわけではありません。将来の見通しに関する記述には、とりわけ、VYD222に関する継続的な研究と 臨床開発活動の進捗状況と時期、CANOPY第3相ピボット臨床試験から予想される初期主要評価項目データのタイミング、VYD222緊急使用許可(EUA)提出の可能性に関する臨床データの迅速な生成への期待、EUAの申請書を提出する計画などが含まれます。米国はできるだけ早く、将来EUAを無事提出できるかどうか、そしてそのようなEUA提出の結果、対象患者集団の規模と製品候補の潜在的な市場機会に関する 社の期待、ウイルスの脅威に対処するための新しい 抗体を迅速かつ連続的に生成する同社のINVYMABプラットフォームアプローチの可能性、COVID-19を防ぐための追加の治療オプションに対する免疫不全患者の必要性に関する私たちの信念、COVID-19の状況の未来、規模に関する私たちの期待対象となる 人の患者集団と潜在的な市場当社の製品候補にとっての機会、市場での地位、CANOPYの臨床試験デザイン、承認されれば米国でのVYD222の商業化の可能性、既存の の現金資源は、2024年の第4四半期に予想されるキャッシュランウェイを支えるのに十分であるという私たちの信念、および歴史的事実ではないその他の記述。私たちは、 の将来の見通しに関する記述で開示されている計画、意図、期待を実際には達成できない可能性があります。私たちの将来の見通しに関する記述に過度に頼るべきではありません。これらの将来の見通しに関する記述にはリスクと不確実性が伴い、実際の結果が将来の見通しに関する記述に記載または暗示されている結果 と大きく異なる可能性があります。これには、発見、前臨床、および臨床開発活動のタイミングと進捗状況、VYD222へのEUA提出の可能性を裏付けるためにCANOPY 臨床試験から必要なデータを迅速に生成する能力、できるかどうかなどが含まれますが、これらに限定されません。今後、EUAを正常に提出すること、およびそのようなEUA提出の結果は、前臨床試験または 臨床試験中に観察された予想外の安全性または有効性のデータ、前臨床試験での中和活性に基づくVYD222または他の製品候補の臨床的成功の予測可能性、さまざまなアッセイ、 で試験された製品候補の中和活性の潜在的な変動、前臨床研究または臨床試験の結果が将来の予測を予測できないリスク現在または将来の臨床試験に関連する結果。使用したモデルの結果のばらつき懸念されるSARS-CoV-2変異株に対する活性を予測すること、予想されるまたは既存の競合の変化、規制環境の変化、規制承認プロセスの不確実性とタイミング、当社のプラットフォームアプローチにより がウイルスの脅威に対処するための新しい抗体を迅速かつ連続的に生成できるかどうか、VYD222または他の製品候補が優勢なSARS-CoV-2に対して中和活性を示し、維持できるかどうか特にウイルスの進化に直面した場合の変種、そしてそれに対応するための十分な資金があるかどうか将来の運営費と資本支出の要件。実際の業績がこのプレゼンテーションの将来の見通しの 記述で表明または暗示されているものと大きく異なる原因となる可能性のあるその他の要因は、証券取引委員会(SEC)に提出された2022年12月31日に終了した年度のフォーム10-Kの最新の年次報告書、およびSECに提出され入手可能なその他の 提出書類の「リスク要因」という見出しの下に記載されています。www.sec.govで。このプレゼンテーションに含まれる将来の見通しに関する記述は、この日付の時点で作成されたものであり、適用法で義務付けられている場合を除き、新しい情報、将来の出来事、その他の結果であるかどうかにかかわらず、そのような情報を更新する義務を負いません。© 2023 Invivyd、Invymab、およびInvivydのロゴはInvivyd, Inc.の商標です。このプレゼンテーションのすべての商標は財産です のそれぞれの所有者です。2

アジェンダ 1.はじめに/概要-デーブ・ヘリング、最高経営責任者 オフィサー 2.キャノピー試験と最新のVYD222体外中和データ-ピート・シュミット医学博士、最高医療責任者 3.市場機会と商業的準備 − 最高執行責任者兼商務責任者、ジェレミー・ガウラー 4.Q3財務レビュー − ビル・デューク、最高財務責任者 5.質疑応答 3

最近のビジネスのハイライトと主な成果症候性COVID-19の予防のためにVYD222を調査するCANOPY第3相重要な臨床試験への登録が完了しました 会社は、2023年後半または2024年第1四半期初頭までに、CANOPYの主要エンドポイントの初期データを取得する予定です。会社は、実行可能になり次第、米国での緊急 使用許可(EUA)の申請書を提出することを目指しています。TM社はINVYMABの推進を続けています。ウイルスの脅威に対処するための新しい抗体を迅速に連続生成するように設計された独自のプラットフォームアプローチ 4

免疫不全の個人をCOVID-19から保護する必要性は明らかで緊急です オミクロン時代の米国の大規模人口における免疫不全集団に対するCOVID-19の影響におけるCOVID-19のリスクとコストの評価:2 1商業保険健康保険からの洞察: EPOCH-USスタディ観察型人口ベースのINFORM調査 •英国の約1,200万人のサンプルでは、3.9%が• 米国の大規模な商業免疫不全症(IC)健康保険プランに加入している約1700万人のうち、2.7%がIC • わずか3人でしたが人口の.9%、ICの人々•ICの人々の約14%がCOVID-19と診断され、COVID-19による入院の22%を占め、そのうち24%が入院しました。ただし、IC•ICの人々の80%以上が長期入院し、費用のかかる高額な集団で、COVID-19に関連するCOVID-19ワクチンを3つ以上接種していました。平均費用は、•特定のIC関係者(固形臓器など)および幹細胞移植 患者1人あたり64,029ドル、レシピエントの平均滞在期間(および最近血液がんの治療を受けた患者)、15日間の入院滞在はこれらの症状のない人と比較してリスクが10倍以上増加ワクチンが入手可能であるにもかかわらず、 免疫不全の人々は依然としてCOVID-19の重篤な転帰のリスクが高く、COVID-19を防ぐための追加の治療オプションが必要です 1.エバンス・ランセット・レグ 2023; 2.ケトカー・カー・メッド・レッド・オピン 2023 5

VYD222は、 さまざまなプレオミクロンおよびオミクロンのバリアントに対して、幅広い体外中和活性を示しています。1バリアントサブリネージVYD222 WT(D614G)✓ デルタB.1.617.2 ✓ BA.1 ✓ BA.4/5 ✓ BA.4.6 ✓ BF.7 ✓ オミクロンXBB.1 ✓ XBB.1.5 ✓ XBB.1.5.5.10とEG.5(米国の優勢な変異体の1つ )は、XBB.1.16 ✓ と同じスパイク糖タンパク質配列を持つXBB変異体で、XBB.1.5.10/EG.5 2-3 ✓ の現在のCDC追跡変異体の約80%に見られるF456L変異が含まれます。参考文献:1.疑似ウイルスSARS-CoV-2中和を使用してCROによって生成されたVYD222データ ✓ 標準化されたインビトロアッセイ抗体アッセイにおける中和活性; 2. https://covid.cdc.gov/covid-data-tracker/#variant-proportions (2023年10月30日アクセス); 3. CovSpectrum.org 6
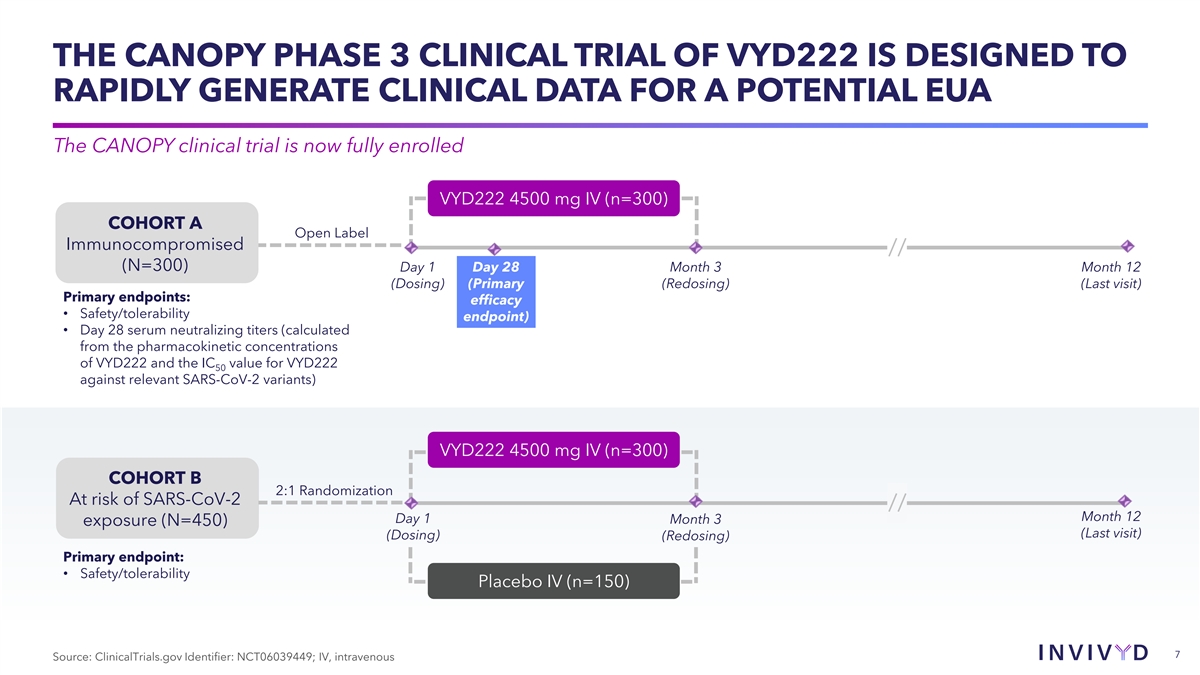
VYD222のキャノピー第3相臨床試験は、潜在的なEUAの臨床データを迅速に 生成するように設計されています。キャノピーの臨床試験は現在完全に登録されています。VYD222 4500 mg IV(n=300)コホートAオープンラベル免疫不全症//(N=300)1日目 28か月3月(一次(再投与)(最終訪問)プライマリ エンドポイント:有効性 • 安全性/忍容性のエンドポイント) • 28日目の血清中和力価 (VYD222の薬物動態濃度と関連するSARS-CoV-2変異体に対するVYD222 50のIC値から計算) VYD222 4500 mg IV (n=300)コホートB 2:1 ランダム化 SARS-CoV-2のリスクがある//12か月目1か月3日の曝露(N=450)(最終訪問)(投与)(再投与)主要評価項目:•安全性/耐容性プラセボIV(n=150)7 出典:ClinicalTrials.gov 識別子: NCT06039449; IV、静脈内
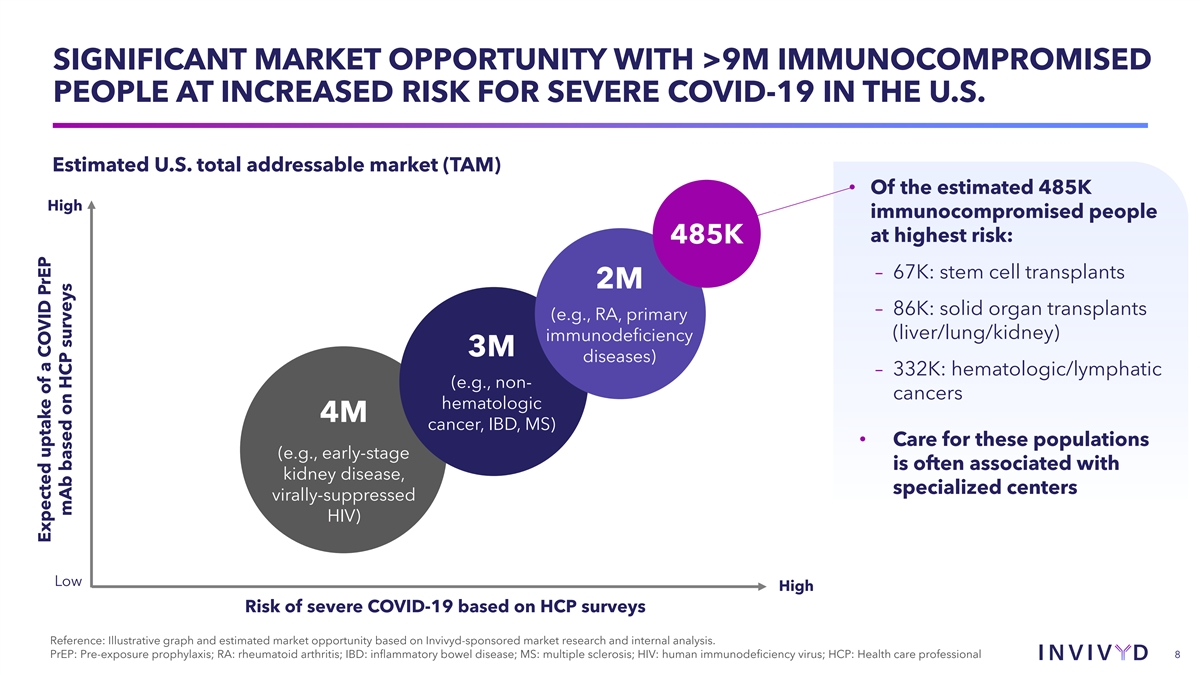
米国では、免疫不全の人が900万人を超え、重篤なCOVID-19のリスクが高いため、大きな市場機会があります。米国の対処可能な総市場(TAM)•最もリスクが高いと推定される48万5,000人の高免疫不全患者のうち、48万5千人-67万人:幹細胞移植 200万〜86K:固形臓器移植 (例、RA、原発性(肝臓/肺/腎臓)免疫不全3M疾患)— 332K: 血液/リンパ系(例、非がん、血液型4Mがん、IBD、MS)•これらの集団のケア(例えば、初期段階は腎臓 病と関連していることが多い)、専門センターウイルス抑制(HIV):HCP調査に基づく重症COVID-19のリスクは低い参考文献:Invivydが後援する市場調査と内部分析に基づく実例グラフと推定市場機会。PrEP: 暴露前予防; RA: 関節リウマチ; IBD: 炎症性腸疾患; MS: 多発性硬化症; HIV: ヒト免疫不全ウイルス; HCP: 医療従事者 8 HCP調査に基づくCOVIDPrEP mAbの予想摂取量

市場開拓計画(市場調査、市場規模/細分化、ブランド戦略、フィールドフォースサイジングなど)が許可されていれば、米国でのVYD222の発売の可能性に備えて、商品化の準備が進行中です。市場アクセス活動(例、支払者/価格調査、流通チャネル)の製造初期商用 在庫商業段階への移行をサポートするために必要な内部システムと技術の確立商業的準備は、豊富な経験を持つ経験豊富なチームが主導しています {内での製品の商品化に成功しましたbr} 感染症スペース、例えば:9

2023年第3四半期の主な財務状況2024年第4四半期まで続くと予想されるキャッシュランウェイは、現金、 現金同等物、および商業証券からの潜在的な貢献を除いた有価物で、mAb候補が2023年9月30日に承認または承認された場合、製品収益の2億6,490万ドルでした。mAb:モノクローナル抗体 10

ありがとうございます