
| 目論見書 | ルール424(B)(3)に従って提出する |
| 登録番号:333-268934 |
ZYVERSA治療会社

5,858,714株普通株式
723,234株普通株ベースシリーズB優先株
4,878,875株普通株関連管状株式承認証
5,825,358株普通株式関連公開株式証明書
240,204株普通株式関連私募株式証明書
誘導権証の基礎となる7,121,213株
本募集説明書は、本募集説明書の中で指名された売却証券保有者(“売却証券保有者”) が時々保証人とある他の投資家に最大24,647,598株の私たちの普通株(“普通株”)を発行し、額面は1株当たり0.0001ドルであり、最大 (I)5,858,714株を含み、保証人や他の投資家に各種非公開配給方式で保証人や他の投資家に発行する。Larkspur IPOおよび後続時間(“私募”)は、35,000株のAシリーズ優先株(“Aシリーズ優先株”)を含み、新たな株式交換価格で1株2.00ドルで17,500株の普通株(以下、定義参照)、および25,000株のAシリーズ優先株に変換される。(Ii)4,878,875株は、PIPE引受契約により署名側投資家に発行された発行価格11.50ドルの非公開株式権証(“PIPE承認株式証”)により、4,878,875株当社普通株を発行することができる;(3)あるコンサルタントに723,234株自社Bシリーズ転換可能優先株(“B株”)を発行し、サービスと引き換えに、この等優先株の価格は1株1,000ドルであり、当社普通株に変換でき、価格は7.00ドルに転換できる(ベストエフォート発売後に調整後);(Iv)いくつかの行使価格11.5ドルの公開株式証明(“株式公開承認証”)を行使した後に発行可能な5,825,358株式会社の普通株であり、これらの株式証とLarkspur A類普通株は単位形式で投資家に発行され、Larkspur Health Acquisition Corp.のS初公開(“Larkspur IPO”)は2021年12月23日に完成し、購入価格は単位当たり10.00ドルである。(V)引受権証を行使した後に発行可能な240,204株の普通株、使用価格は11.50ドルであり、業務合併の完成と関係があり、行使可能なLarkspur A類普通株(“私募株式承認証”)の代わりに、単位形式でLarkspur A類普通株と一緒に保証人 とある他の投資家に発行するとともに、単位当たり10.00ドルの購入価格でLarkspur IPOを買収する。および (Vi)7,121,213株自社普通株の誘導権証(“誘導権証”)は、使用価格が0.1357ドルであり、その中で発行された引受権証は、以前に発行された引受証と交換され、その条項は、当該他の以前に交換された引受証の条項と同じである。
私たちは、Larkspur IPOと業務合併に関連するいくつかの登録権を満たすために、これらの証券の発売と販売を登録しています。売却証券保有者は、現行の市場価格または合意価格で、ここに公開登録または個人取引方式で登録された証券の全部または一部を発売、販売または流通することができる。私たちが株式承認証を行使する際に受け取った金額 を除いて、私たちの普通株を売却した株式から何の収益も得ません。私たちは、国家証券または“青空”法律の遵守に関する費用を含む、これらの証券の登録に関連するすべてのコスト、費用、および費用を負担する。売却証券保有者は、私たちの普通株または株式承認株の売却によって生じるすべての手数料とbr割引を負担します。タイトルを見て“配送計画“ は本募集説明書163ページから始まります。
2022年12月12日、我々は、Larkspur Health Acquisition Corp.,我々の前身会社Larkspur(“Larkspur”)、フロリダ州ZyVersa治療会社(“Old ZyVersa”)、その中で指名されたOld ZyVersa株主代表(“証券所有者代表”)、Larkspur Health Acquisition Corp.,我々の前身会社(“Larkspur”)、ZyVersa治療会社(“OZld yVersa”)、指名されたOld ZyVersa代表(“証券所有者代表”)とLarkspur SuSuSub Merge Inc.“(20年7月に締結された特定業務統合協定”)を完了した。デラウェア州の会社とLarkspurの直接完全子会社(“連結子会社”)である。業務合併協議が予想していたように、LarkspurはZyVersa治療会社と改称され、Old ZyVersaはZyVersa治療会社の完全子会社となった。業務合併の完了に伴い、Larkspurの既存株主は7,667,029株のLarkspur A類普通株、または当時発行されたLarkspur A類普通株の約99%を選択した。
業務合併の完了については,吾らは複数の投資家( 社の複数の関連会社を含む)(“管路投資家”)と業務合併が終了するとともに,私募方式で複数の投資家(“br}社の複数の連属会社を含む)(”管路投資家“)と期日2022年7月20日の随時改訂されたいくつかの株式購入協定(”管路引受協定“)を締結し,これにより,吾らは管投資家に(I)A系列転換優先株 株を発行し,1株の額面価値は0.0001ドル(“管道株”)であり、購入価格は1株1,000ドルであり、初歩的に私たちの普通株に変換でき、転換価格は10ドルであり、Aシリーズ指定証明書によって調整することができる。 及び(Ii)普通株引受権証(それぞれ“PIPE株式承認証”)は最も多くの目的普通株を購入することができ、PIPE投資家が発行したもの及びPIPE株式に変換して発行及び発行可能な普通株式に相当する。Aシリーズ指定証明書には、発行者がその時点で発行されたパイプ株の発行価格の120%でこのような株を償還する権利が含まれている。
また,2023年1月27日に米国証券取引委員会に提出した改訂されたS-1フォーム登録声明(文書番号333-269442)(“ベストエフォート発売”)に基づき,Aシリーズ指定証明書に基づいて基本的にすべてのPIPE 株式を償還した.パイプ株とBシリーズ株の転換価格 はそれぞれパイプ株2.00ドルとBシリーズ株7.00ドルの適用底価格にリセットされます。 また、パイプ承認株式証の取引価格は2.00ドルの底値にリセットされます。PIPE株式承認証の行使により、発行可能普通株の株式数は、PIPE株式転換時に発行可能普通株の100%に相当するように調整される。ベストエフォート発売後、ベストエフォート発売で得られた金とともに償還されていないPIPE株式は、普通株1株当たり2.00ドルの底値で変換されており、詳細は以下の通りです。
我々普通株の市場価格が水管権証の発行価格やBシリーズ株の転換価格よりも高い場合、そのような証券の保有者は、そのような証券を行使または変換し、普通株の対象株を利益で売却することができる。一般的に、私たちの普通株の市場価格が株式所有者承認証の使用価格より低い場合、所有者が株式承認証を行使する可能性はあまりないので、会社はこのような行使から何の収益も得られません。当社はBシリーズ株転換から何の収益も得られません。
私たちの普通株はナスダック世界市場のナスダック株式市場有限責任会社(“ナスダック”)に上場し、コードは“ナスダック”。2023年10月23日、ナスダックで報告された私たちの普通株の最終見積もりは0.12ドルです。管状株式承認証、私募株式証及び公開株式証の行使価格は当社の普通株の現在の市価より高いため、この等株式証が行使される可能性はあまりないため、当社は短期的にこの等株式証を行使することによっていかなる収益も得られないことを期待している。
連邦証券法の定義によると、我々は“新興成長型会社”であるため、いくつかの低下した上場企業の将来届出時の報告要求を遵守することを選択する可能性がある。
私たちの証券に投資することは高度な危険と関連がある。どんな証券を購入する前に、タイトルをよく読まなければなりません“リスク要因“本募集説明書12ページ目から始めます。
あなたは、本募集説明書または本募集説明書の任意の追加または修正に含まれる情報のみに依存しなければなりません。私たちは誰でもあなたに違う情報を提供することを許可していません。
Br証券取引委員会およびどの州証券委員会もこれらの証券を承認または承認しておらず、本入札説明書が真実または完全であるかどうかも決定されていない。どんな反対の陳述も刑事犯罪だ。
本募集説明書の日付は2023年10月20日です。
カタログ表
| ページ | |
| 本募集説明書について | 1 |
| 商標 | 2 |
| 個の定義が選択された | 3 |
| 前向き陳述に関する警告的声明 | 4 |
| 募集説明書 概要 | 6 |
| 製品 | 10 |
| リスク要因 | 12 |
| 収益を使用する | 64 |
| 普通株と配当情報の市場価格 | 65 |
| 商売人 | 66 |
| 経営陣の財務状況と経営結果の検討と分析 | 101 |
| 管理する | 117 |
| 役員報酬 | 122 |
| 利益を得る証券所有権 | 137 |
| 証券売却所持者 | 139 |
| ある関係は関係者と取引しています | 142 |
| 私たちの証券説明 | 149 |
| われわれの証券転売に対する証券の制限 | 162 |
| 流通計画 | 163 |
| 法務 | 166 |
| 専門家 | 167 |
| ここで詳細な情報を見つけることができます | 168 |
| 財務諸表インデックス | F-1 |
あなたはこの目論見書に含まれている情報だけに依存しなければなりません。本入札明細書に含まれる情報 とは異なる情報を提供することは誰にも許可されていません。本募集説明書の日付は、本募集説明書の表紙に記載されている日付である。本入札明細書に含まれる情報が、その日付以外のどの日付でも正確であると仮定するべきではありません。
| i |
本募集説明書について
本目論見書は,我々が“棚上げ”登録フローを用いて証券取引委員会(“米国証券取引委員会”)に提出した S−1表登録説明書の一部である。保留登録手続きによれば、売却証券所有者は、本明細書に記載された証券を時々販売することができる。当社は、当該等売却証券保有者から、本募集説明書に記載された証券のいかなる収益も売却しない。本目論見書は、当社が引受権証を行使する際に発行可能な普通株式についても言及します。私たちは現金と交換するために株式承認証を行使した任意の収益から収益を得るつもりだ。
本募集説明書又は任意の適用される目論見書増刊又は吾等又は吾等を代表して作成された任意の無料で書かれた目論見定款、又はわれわれが閣下に推薦した目論見を除いて、吾等及び売却証券保有者は、誰も閣下にいかなる資料を提供したり、いかなる陳述を行うことを許可していない。他の人があなたに提供する可能性のある任意の他の情報の信頼性については、私たちも販売証券保有者も責任を負いませんし、brのいかなる保証も提供できません。我々も販売証券所持者も このような要約や販売を許可しない司法管轄区でこれらの証券を要約販売することはない.任意の取引業者、販売者、または他の人員は、任意の情報または本募集説明書、任意の適用可能な入札説明書の付録、または任意の関連する無料で募集説明書に含まれていない任意の内容を提供する権利がない。本募集説明書または任意の目論見書付録に示されている情報は、これらの文書の正面の日付のみが正確であると仮定しなければならない。本募集説明書または任意の適用される入札説明書付録の交付時間がいつであっても、証券のいかなる 販売状況にもかかわらず。それ以来、私たちの業務、財務状況、運営結果、見通しが変化した可能性があります。
売却証券所持者とその譲渡許可者は,本棚を用いて声明を登録し,タイトルで“と登録することができる配送計画。“証券保有者およびその譲受人によって提供および販売が許可された任意の証券のより具体的な条項は、提供された証券の具体的な金額および価格および発行条項が記載された目論見明細書の付録に提供されることができる。
また、本募集説明書に含まれる情報を追加、更新、または変更するために、登録説明書に対して株式募集説明書 の補充または発効後の改訂を提供することも可能である。本募集説明書については、本募集説明書に含まれる任意の陳述は、株式募集説明書の付録または発効後の改訂に含まれる陳述が修正または置換されている限り、修正または置換されているとみなされるであろう。 の任意のこのような修正された陳述は、そのように修正された本募集説明書の一部のみとみなされ、そのように置換された任意の陳述は、非構成コスト募集説明書の一部とみなされるであろう。本募集説明書と任意の適用可能な目論見書の付録または登録説明書の発効後の改訂、および本募集説明書のタイトルがbrである章で推奨される他の情報を読まなければなりません“そこでもっと多くの情報を見つけることができます”
本入札明細書は、本明細書に記載された部分文書に含まれるいくつかの条項の要約を含むが、完全なbr}情報を取得するために実際の文書を参照する。すべての要約は実際の文書によって完全に限定されている本募集説明書 が指すいくつかのファイルのコピーは、アーカイブされているか、アーカイブされているか、または参照によって登録説明書の証拠物として統合されており、以下に説明されるように、これらのファイルのコピーを得ることができるそこであなたはもっと多くの情報を見つけることができます。”
明確な説明または文脈に別の要求がある以外は、本明細書で言及されている“会社“The”登録者は” “私たちは,” “アメリカです。“と”我々の“ZyVersa(および旧ZyVersaの業務を指し,業務統合が発効した後, がZyVersaの業務となる).
| 1 |
商標
本 文書は,他のエンティティに属する商標やサービスタグへの参照を含む.便宜上、本入札明細書に記載されている商標および商品名は、ラベルまたは記号を有しない可能性があるが、このような参照は、 適用許可者が適用法に従ってこれらの商標および商品名に対する権利を最大限に主張しないことをいかなる方法でも示していない。私たちは、他の会社との関係を示唆するために、または他の会社によって裏書されたり、賛助されたりするために、他の会社の商号、商標、またはサービスマークを使用または展示することを意図していません。
| 2 |
個の定義が選択された
本募集説明書に他の説明または文脈に別の要求がある場合を除いて、:
“業務グループ “企業合併”とは、“企業合併協定”が行う予定の合併やその他の取引を含む企業合併を意味する
“業務 統合プロトコル“2022年7月20日のある業務合併協定を意味し、証券所有者がZyVersa、Larkspur、および合併子会社を代表して締結され、時々修正される
“終業する“ は企業合併の完了を意味する;
“締め切り “企業合併が完了した日、すなわち2022年12月12日のこと
“普通株 株“普通株のことで、額面は0.0001ドル
“初公募株“Larkspurの初公募株が2021年12月23日に完成したこと。
“ラクスプ は業務合併を実施する前のデラウェア州会社Larkspur Health Acquisition Corp
“合併する は、SubとOld ZyVersaを合併し、ZyVersaの完全子会社としてOld ZyVersaに統合されたことを意味する
“子会社を合併する“Larkspur Health Merge Sub,Inc.のことです。同社はデラウェア州の会社で、Larkspurの完全子会社でもあります
“古い ZyVersa“ZyVersa治療会社フロリダ州の会社は業務合併が発効した後
“古いZyVersa保証“Old ZyVersa承認持分証所有者に発行されたOld ZyVersa承認持分所有者として、Old ZyVersaの各発行された株式承認証の一部として、Old ZyVersaの各発行済株式証の一部として、Old ZyVersaをログアウトおよび変換することができる引受権証を意味する。
“パイプ投資家”PIPE引受契約に署名した投資家を指す
“パイプ株“PIPE投資においてPIPE投資家に売却されるLarkspur Aシリーズ転換可能優先株の株式を意味する
“パイプ 購読プロトコル“Larkspurとパイプ投資家の間で締結された証券購入契約を指し、日付は2022年7月20日であり、改訂された(そしてその条項によって時々さらに修正、修正、補充または免除される可能性がある)、これにより、Larkspurは1株1,000ドルの購入価格でパイプ投資家に合計12,500株のLarkspur Aシリーズの転換優先株と引受権証を発行することに同意し、金額はこのAシリーズ優先株をパイプ投資家に転換した後に発行できる普通株の100%に相当する
“パイプ 授権書“PIPE株と共にPIPE投資におけるPIPE投資家に売却される私募権証を意味する
“パイプ.パイプ“ または”パイプ投資PIPE引受契約に規定されている条項と条件に基づいて、PIPE投資家が総額8,635,000ドルの私募を購入し、PIPE引受協定に規定されている成約直前および条件でのLarkspur Aシリーズ優先株および引受権証の株式と交換することを意味する
“公共株式証明書“とは、初公募に関連して投資家に発行される株式公開証をいう
“証券保有者 代表“は、企業統合プロトコルで指定されたOld ZyVersaの株主代表を意味します
“系列 A優先株35株A系列優先株を17,500株普通株 に変換し、転換価格は1株2.00ドル/株、および25,000株が独立所有者が保有するA系列優先株のうち転換されていない普通株を指す。
“B株シリーズ “LarkspurのBシリーズ転換可能優先株を5,062株といい、Larkspurの普通株に変換して、ある債務と取引コストを返済するために所有者に発行することができる
“スポンサー?スポンサー“デラウェア州有限責任会社Larkspur Health LLCのこと
“ZyVersa“ または”会社“ZyVersa治療会社、デラウェア州会社のことで、業務合併を実施した後 です。
| 3 |
前向き陳述に関する警告的声明
この目論見書には展望的な陳述が含まれているので、歴史的事実ではない。これには、財務状況、業務戦略、および私たちの将来の運営に関する管理計画と目標に関する陳述が含まれているが、これらに限定されない。これらの陳述 は予測,予測,前向き陳述を構成しており,業績の保証ではない.そのような陳述は、それらが歴史的または現在の事実と厳密に関連していないという事実によって識別することができる。本明細書で使用される言葉は、“予想”、“信じる”、“継続”、“可能”、“推定”、“予想”、“予定”、“可能”、“可能”、“計画”、“可能”、“可能”、“潜在”、“予測”、“プロジェクト”、“ ”、“努力すべき”、“努力する”、“そうする”および同様の表現が前向き陳述を識別する可能性がある。しかし がこれらの語を持たないことは,宣言が前向きでないことを意味するわけではない.本募集説明書および本明細書に参照されて本明細書に入る任意の文書における前向きな説明は、例えば、以下のようなことを含むことができる
| ● | 我々の業務統合が期待する収益を実現する能力; | |
| ● | 私たちの業務に関する コスト; | |
| ● | 私たちの財務と業務業績、財務予測と業務指標を含む | |
| ● | 私たちは将来収益性を実現し維持しています | |
| ● | ビジネスの能力を効果的に増加させ拡張することができます | |
| ● | 現在の計画と運営を中断するリスク; | |
| ● | 現在と未来の流行病による中断、例えば新冠肺炎の大流行を含む商業または経済中断の潜在的な可能性; | |
| ● | 私たちの証券がナスダックに上場する能力と、私たちの証券の潜在的な流動性と取引を維持する | |
| ● | Brは私たちの業務の期待収益の能力を認識しており、これは私たちの研究開発と臨床活動を増加と管理し、肝心な従業員を維持する能力の影響を受ける可能性がある | |
| ● | 法律や法規の変更の影響を適用する | |
| ● | 私たちの将来の資本需要と将来の資本源や資金調達能力を含む現金の供給源と用途 | |
| ● | 私たちのネットワークの実力、私たちの技術の有効性、私たちのプラットフォームを通じて提供される製品の品質 | |
| ● | 私たちのビジネスのために予測された財務情報、成長率、戦略、そして市場機会 | |
| ● | 既存のライセンスプロトコルおよび他の連携スケジュールの能力を維持しています | |
| ● | 私たちは、候補製品の規制承認と、将来の任意の承認された製品の任意の関連する制限および制限を得ることができ、維持することができる | |
| ● | 私たちの研究開発戦略と活動の成功、コスト、タイミング | |
| ● | 私たちが候補製品を発売して市場に受け入れられる能力に成功しました | |
| ● | 私たちの競争相手との能力評価戦略 |
| 4 |
| ● | 私たちの人材を引きつけて維持する能力と私たちの報酬戦略とリーダーシップの有効性 | |
| ● | 私たちは私たちの免許を維持し、厳格に規制された製薬業界で運営することができます | |
| ● | ネットワークセキュリティ攻撃を防ぐ能力は | |
| ● | 支払い、ネットワーク、モバイルオペレーティングシステム、ソフトウェア、背景調査、br、および保険は第三者サービスプロバイダに一方的に依存しています | |
| ● | 私たちは効果的な財務報告書の内部統制制度を構築して維持することができる | |
| ● | 私たちに提起された任意の私たちの業務に影響を与える可能性のある法的訴訟の結果を含む、任意の事件、変化、または他の状況の発生を含む任意の既知および未知の訴訟および規制手続きの結果 | |
| ● | 私たちのブランドと知的財産権を維持し保護する能力と | |
| ● | その他 タイトルは“リスク要因.” |
これらの展望的陳述は、本募集説明書が発表された日までに得られる情報と現在の予想、予測と仮定に基づいて、大量の判断、リスクと不確定性に関連する。したがって、展望的陳述は、任意の後続の日付における私たちの観点を代表するものとみなされてはならず、私たちは、それらが作られた日後のイベントまたは状況を反映するために前向き陳述 を更新する義務を負いません。新しい情報、未来のイベント、または他の理由によっても、証券法が適用されない限り、 は別の要求があります。
| 5 |
募集説明書 概要
この 要約は、この募集説明書中の精選情報を重点的に紹介しており、あなたへの投資決定 が非常に重要なすべての情報が含まれていない可能性があります。当社の証券に投資する前に、株式募集説明書に含まれる財務諸表および関連説明書、および本募集説明書の他の部分の“リスク要因”、“br}”業務“および”経営層の財務状況および経営結果の議論および分析“ タイトルに以下に示す情報を含む株式募集説明書全体をよく読まなければなりません。また、“どこでより多くの情報を見つけることができるか”というタイトルの小節を参照してください。明確な説明や文意が別に指摘されているほか、本募集説明書の“会社”、“登録者”、“当社”、“当社”および“当社”はいずれもZyVersa(およびOld ZyVersaの業務を指し、業務合併発効後にZyVersaの業務となる)を指す。
概要
われわれbrは臨床段階の生物製薬会社であり,ノウハウを用いて慢性腎臓疾患や炎症性疾患を有する患者のための薬剤を開発しており,これらの患者の医療ニーズは満たされていない。私たちの使命は,健康結果を最適化し,患者の生活の質を向上させる薬剤の開発である。
私たちのbrは2つの世界的に許可された特許薬物開発プラットフォームを持っており、すべてのプラットフォームはマイアミ大学ミラー医学院(以下、マイアミ大学)の研究科学者によって発見された。これらの開発プラットフォーム には:
| ● | コレステロール流出調節剤TMVAR 200(2−ヒドロキシプロピル−β−シクロデキストリン又は“2 HPβCD”)は、臨床開発における腎臓疾患治療の注射用薬剤である。VAR 200は2015年12月15日にL研究有限責任会社から許可を得た。L研究会社はマイアミ大学の研究科学者によって設立され,VAR 200が腎臓疾患に用いられていることが発見された。 | |
|
|
● | IC 100は,炎症性疾患の治療のための臨床前開発における単抗炎症症体ASC阻害剤である。IC 100は2019年4月18日にInflamaCore,LLCから許可を得た。InflamaCore,LLCはマイアミ大学の研究科学者によって作成され,IC 100を発明した。 |
私たちのすべての候補製品はそれぞれの治療分野で多様な適応を治療する潜在力があると信じています。私たちの戦略は適応拡張に集中して、ビジネスの潜在力を最大限に発揮することだ。
私たちの腎臓管は最初はまれな慢性糸球体疾患に集中していた。VAR 200に対する主な特徴は焦点性分節性糸球体硬化(FSGS)である。2020年1月21日,我々はVAR 200の新薬研究申請(“IND”)を提出し,米国食品医薬品局(“FDA”)は活性成分(2 HPβCD)のリスク/利益プロファイルに基づいてFSGS患者 で2 a期試験を行うことを許可した。FSGS患者に対する2 a期試験を開始する前に,2024年第1四半期にオープンラベル概念検証試験をサポートする予定であり,そこで糖尿病腎症患者8名のデータを得る予定である。これは,患者が治療を行う際に薬物効果 を評価することができ,我々の2 a段階レジメンの開発に知見を提供する。VAR 200は,FSGS,Alport症候群,糖尿病腎症を代表する動物モデルの薬理学的概念検証データを有しており,いずれも我々の適応拡張戦略に基づいて開発可能である。
| 6 |
われわれの炎症体ASC阻害剤計画IC 100は臨床前開発段階にある。我々の重点は、1 C 100が2024年第2四半期に現在のbr計画のINDを提出し、その後、第1段階試験を開始することである。IC 100は、急性呼吸窮迫症候群(ARDS)および多発性硬化症(MS)を代表する動物モデルの薬理学的概念検証データを有している。br}我々は、免疫グロブリンA(“IgA”)腎症、パーキンソン病、早期アルツハイマー病、ハンチントン病、うっ血性心不全など、次の臨床前開発において6種類までの適応の追加動物研究を行う予定である。IC 100の1つまたは複数のパイロット適応は,われわれの臨床前計画のデータに基づいて選択されると予想される。
私たちのbrパイプ
われわれのチャネルの目標は,高度に満たされていない医療ニーズを有する腎臓や炎症適応に対して,我々の行動機序で解決できると信じている。我々は,VAR 200やIC 100のための多様な適応,および潜在的な腎臓や抗炎症候補製品の許可を開発することにより,我々の製品組み合わせをさらに強化し拡大する予定である。
業務 戦略
私たちは、有力と認められているバイオ製薬会社を求め、満足されていない医療ニーズの高い患者に革新を提供しています。バイオ製薬製品を開発することで健康を回復し、患者の生活を変えることに取り組んでいます。私たちの戦略は:
| ● | VAR 200のさらなる発展. | |
| ● | 私たちのIC 100臨床前計画を進めて. |
| ● | 我々の適応拡張戦略を利用して,それぞれの治療分野で複数の適応を開発することで,個々の製品プラットフォームのビジネス潜在力を最大限に発揮する. |
| ● | 私たちの候補製品の開発と商業化の権利を維持する. | |
| ● | 私たちの候補製品の組み合わせを拡張します . | |
| ● | 私たちの知的財産権の組み合わせを強化し、拡大していきます. |
前述に反映された 日付およびイベントは推定のみであり、含まれるイベントが提供された予想されるタイムライン内で完了するか、または完了が全く保証されない保証はない。さらに、私たちが私たちの任意の候補製品の開発に成功すること、または私たちが将来開発する可能性のある任意の他の製品または候補製品、または私たちが将来開発する可能性のある任意の候補製品がFDAによって承認される任意の適応が保証されない。
市場とビジネスチャンス
私たちの主要な候補製品は、(I) 我々の主要な腎臓候補製品VAR 200を含む重大な医療需要が満たされていない疾患を治療する潜在力があると信じており、病巣セグメント性糸球体硬化症(FSGS)、Alport症候群(孤児適応)および糖尿病腎症などの多種の腎臓適応の治療に使用されている可能性があり、(Ii)我々の主要な抗炎症候補製品IC 100は、多発性硬化症と急性呼吸窮迫症候群を含むが、これらに限定されない多種類の炎症性疾患の治療に使用されている。VAR 200は、FSGSまたはAlport症候群に対するFDAの孤児薬物指定を受けていない。
| 7 |
リスク要因
私たちの業務はタイトルを含む多くのリスクと不確実性の影響を受けています“リスク要因“br”は、この目論見書の要約に続いて、私たちの戦略的およびビジネス成長を成功させる上で直面している課題を明らかにします。以下の考慮事項は、私たちの競争優位性を相殺したり、私たちの業務戦略にマイナスの影響を与える可能性があります。これは、私たちの証券の株価下落を招き、あなたのすべてまたは一部の投資損失を招く可能性があります。
| ● | 私たちの現在または未来の候補製品は決して承認されないかもしれないし、商業市場の承認を得られないかもしれない | |
| ● | 私たちは発展段階にある会社で、経営の歴史が限られていて、収入がなく、多くの要素が私たちの業務の将来性に影響を与える可能性があります | |
| ● | 今まで、私たちは規制部門が私たちの薬品を承認することを支持していません。私たちはいかなる製品も司法管轄区域で商業販売を許可されていません。私たちは製品販売から何のbr収入も得ていません | |
| ● | 私たちは私たちの候補製品を開発して商業化するために追加的な資金が必要になるだろう。もし私たちが十分な資金を集めることができなければ、私たちは私たちの製品開発計画を延期、減少、またはキャンセルすることを余儀なくされるだろう | |
| ● | 私たちの業務は、私たちの候補製品の成功した開発、規制承認、商業化、特にVAR 200およびIC 100に依存します | |
| ● | 私たちの候補製品が承認されれば、激しい競争に直面し、効果的な競争ができなかったことは、著しい市場浸透を阻害する可能性がある | |
| ● | 私たちは私たちの業務の期待収益を実現できないかもしれません。いかなる買収、戦略関係、合弁あるいは投資は私たちの業務を乱し、私たちの経営業績と財務状況を損なう可能性があります | |
| ● | もし私たちが私たちの成長を管理し、私たちの業務を拡大することに成功できなければ、私たちの名声、ブランド、業務、運営結果は損害を受ける可能性があります | |
| ● | 私たちのbrは競争の激しい人材市場において、肝心な管理メンバーと他の肝心な人員に依存し、合格した人材を誘致、維持、育成するリスクがある | |
| ● | 私たちは訴訟のリスクに直面する可能性があり、したがって、責任と私たちの専門的な名声に対する損害に直面する可能性がある | |
| ● | 私たちの業務は広範な国内と海外の法規によって制限されており、これは私たちを巨大なコストとコンプライアンスの要求に直面させるかもしれない | |
| ● | 私たち は、私たちの新興成長型会社としての地位に関するリスクに直面している可能性があり、これは1933年の“証券法”(以下、“証券法”)が指す | |
| ● | 財務報告の効果的な内部統制を実現し維持することができなかったことは、私たちの財務状況や経営結果を正確にまたはタイムリーに報告できなくなる可能性があり、これは私たちの業務および株価に大きな悪影響を及ぼす可能性がある | |
| ● | 私たちは継続的に経営する企業として続けることができないかもしれない。 | |
| ● | もし私たちの重要な会計政策の見積もりや判断が正しくないことが証明されたら、私たちの経営業績は不利な影響を受ける可能性があります | |
| ● | 上場企業としての要求は、私たちの資源を緊張させ、訴訟を招き、経営陣の注意を分散させる可能性がある | |
| ● | 私たちの普通株の活発な取引市場は決して発展や持続しないかもしれない | |
| ● | 私たちの普通株の価格は変動する可能性があり、これは投資家に大きな損失を与える可能性がある |
| 8 |
| ● | 私たちの総流通株の大部分は即時転売が制限されていますが、近い将来市場に売却される可能性があります。たとえ私たちの業務が良好であっても、私たちの普通株の市場価格は大幅に下落する可能性があります | |
| ● | パイプライン権証または公共株式証明書は、その行使可能な時に現金にあることを保証することはできない;それらは期限が切れた場合には一文の価値もない可能性があるので、私たちは行使権証から現金収益を得ることができないかもしれない | |
| ● | 第三者は、私たちが彼らのノウハウを侵害または乱用することは、私たちに重大な責任を負わせるかもしれないと主張し、私たちのサービスと製品を再設計したり、重大なコストを発生させたりする可能性があります | |
| ● | もし私たちが私たちの知的財産権を効果的に保護できなければ、私たちの業務は損害を受けるだろう。 |
企業情報
2022年12月12日(“締め切り)、吾らは、この特定業務合併協定のbr条項に基づいて、証券所有者がOld ZyVersa、Larkspurおよび合併子会社を代表して先に公表された業務合併を完了する。業務統合プロトコルの条項(および業務統合プロトコルの他のすべての条件が満たされたり放棄された場合)に基づいて、締め切り(I)Larkspurを“ZyVersa Treateutics,Inc.”と改称し、(Ii)連結子会社をOld ZyVersaに合併する(“ZyVersa Treateutics,Inc.”)合併する“),Old ZyVersaは合併中に存在する会社 であり,合併が発効すると,Old ZyVersaはZyVersaの完全子会社となる.
私たちの主な実行事務室はフロリダ州33326、ウェストン、208室北商業大通り2200号にあります。私たちの電話番号は(754231-1688)です。私たちのサイトの住所はhttp://www.zyversa.comです。本募集説明書には、本入札明細書に含まれる情報や、本サイトを介して他の方法で取得された情報は含まれていない。
| 9 |
製品
| 発行人 | ZyVersa(Br)治療会社 | ||
| 普通株式発行 | 24,647,598 | ||
| 我々が発行する普通株 株 | 株式承認証を行使する際には、最大18,065,650株の普通株式を発行することができる | ||
| ● | 最大5,825,358株の普通株式は、公共株式権証を行使することによって発行することができる | ||
| ● | 最大4,878,875株の普通株式は、発行時に ; | ||
| ● | 私募株式証明書の行使により、最大240,204株の普通株式を発行することができる | ||
| ● | 最大7,121,213株普通株は、誘導権証の行使によって発行することができる。 | ||
| 本募集説明書の期日までの発行済み普通株 | 43,515,401株。 | ||
| 私募株式証と公開株式証価格を行使する | 1株11.50ドルで、本稿で述べたように調整できます | ||
| 管路承認株式証価格 を実行する | 1株2.00ドルで、本稿で述べたように調整することができます |
| 普通株転売 | |||
| 証券保有者が発行する普通株を売る | 最大24,647,598株の普通株式を保有することができる | ||
| ● | 特定投資家に発行される私募とAシリーズ優先株に関する普通株は、最高5,858,714株に達する | ||
| ● | Bシリーズ株関連普通株は723,234株に増加した | ||
| ● | 公共株式証明書を行使する際には、最大5,825,358株の私たちの普通株を発行することができる | ||
| ● | パイプ承認証を行使する時、最大4,878,875株の私たちの普通株 を発行します | ||
| ● | 私募株式承認証を行使した後、最大240,204株の私たちの普通株を発行することができる | ||
| ● | 最大7,121,213株普通株は、誘導権証の行使によって発行することができる。 | ||
| 製品条項 | 証券保有者は、本募集説明書に登録された普通株式をいつ及びどのように処理して転売するかを決定する。次の表には,ここで発売された普通株に関する情報が含まれており,売却証券所有者ごとにその証券に支払われる購入価格,その等の証券に関する潜在利益および株式承認証の使用価格 を含む. | ||
| 10 |
| 証券 | 株式数: 普通株 株/ 標的 普通株 | 購入/ 1株当たり換算価格(1) | 変換/ を行使して価格(2)を調整 | 単位あたりの潜在利益
共有(3) | ||||||||||||
| 保税人株/Aシリーズ優先株 | 5,858,714 | $ | (4 | ) | 0.66 | $ | 0 | (4) | ||||||||
| Bシリーズ優先株 | 723,234 | $ | (5 | ) | $ | 7.00 | $ | 0 | ||||||||
| パイプ 授権書 | 4,878,875 | (6 | ) | $ | 2.00 | $ | 0 | |||||||||
| 公共株式証明書 | 5,825,358 | (7 | ) | $ | 11.50 | $ | 0 | |||||||||
| 私募株式証 | 240,204 | (8 | ) | $ | 11.50 | $ | 0 | |||||||||
| 誘因 株式証 | 7,121,213 | (9 | ) | $ | 0.1357 | $ | 0 | |||||||||
| (1) | 普通株を代表する1株当たりの初期購入または転換価格。 |
| (2) | 本募集説明書までの日付の有効な転換と行権価格を代表して、 Bシリーズ株と管路承認株式証の底価格に基づく適用調整を含む。 |
| (3) | 本欄で示した1株当たりの潜在利益は、2023年10月23日の我々の普通株の終値と、本募集説明書日までに発効した各証券の適用転換および/または行権価格に基づいている。表に潜在利益が反映されていない場合、証券に含まれる行権または転換価格は、2023年10月23日の我々普通株の終値よりも高い。 |
| (4) | Larkspur初公募株に関するあるbr}株の1株当たりの支払価格を計上したところ, 保険者株の加重平均コストベースは0.66ドルであった。1株0.01ドルで保険者に1,941,790株の保険者株を発行し、私たちの普通株の2023年10月23日の終値によると、このような株は1株0ドルで売ることができる。Larkspur初公募株終了と同時に320,272株の保証人株が発行され,Larkspur承認株式証は1単位10.00ドルで販売された。残りの保証人株式は私募方式でbr取引所である投資家に発行し、このような投資家に適用されるロック期間を延長し、追加費用を徴収せず、私たちの普通株の2023年10月23日の市場価格に基づいて計算すると、1株当たりの潜在利益は0ドルである。 |
| (5) | Bシリーズ株は1株当たり1,000ドルで発行され、1株10.00ドルの初期転換価格で普通株 に変換することができ、Larkspur IPOに関連する繰延費用を含むいくつかのサービスプロバイダの費用と交換することができる。 |
| (6) | PIPE権証は1株1,000ドルでPIPE投資家に売却され、初歩的な行使価格は1株11.50ドルであり、普通株に変換することができる。 |
| (7) | 公開株式証はLarkspur初公募株で発行され,Larkspur普通株はLarkspur単位で1単位10.00ドルで販売されている。 |
(8) |
私募株式証明書はLarkspur初公開と同時に発行され,Larkspur普通株はLarkspur単位で1単位10.00ドルで販売されている。 |
| (9) | 当社が発行した7,121,213株の普通株は、以前に発行された引受権証と交換するために誘導権証を行使することができ、その条項は以前に交換された引受権証と同じである。誘引権証の現行行権価は$である普通株は1株当たり0.1357ポンドです。 |
| 収益を使用する | 私たち は、証券保有者が普通株式を売却することから何の収益も得られません。 および株式承認証が行使された場合、私たちは 引受権証が無現金で行使されていない範囲での収益を得ることになります。株式承認証 が行使されることは保証されず,どのような行使でもいかなる収益も得られる保証はない.パイプ株式証、私募株式証、公開株式証、誘導権証の行使、およびこれらの株式承認証の行使から得られる可能性のある任意の収益。私たちの普通株の価格と、その等承認株式証の行権価格と行権時の私たちの普通株の市場価格との価格差に大きく依存します。私たちはこのような株式承認証を行使することからどんな現金収益も得られないかもしれない | |
| ロック 制限 | 適用される販売禁止期間が終わるまで、私たちの一部の株主は譲渡の面で一定の制限を受けています。 のタイトルを見て“特定の関係は関係者と取引する | |
| リスク要因 | のタイトルを見て“リスク要因“および本入札明細書に含まれる他の情報は、私たちの証券への投資を決定する前によく考慮すべき要因を検討するために使用されます。 | |
| ナスダック記号 | 私たちの普通株はナスダックに看板を掲げて取引して、コードは“ZVSA”です。 |
| 11 |
リスク要因
私たちの証券に投資することは高いリスクと関連がある。投資決定を下す前に、あなたは以下に紹介するリスクを慎重に考慮しなければならない。私たちの業務、見通し、財務状況、または経営業績は、これらのリスクの損害を受ける可能性があり、私たちは現在知らないか、または現在どうでもいいと思っている他のリスクを受けています。上記のいずれかのリスクにより、私たち証券の取引価格が下落する可能性がありますので、あなたは投資の全部または一部を損失する可能性があります。“リスク要因”のいくつかの陳述は展望的な陳述だ。“前向きな陳述に関する警告声明”を参照してください
私たちの業務、財務状況、資金需要に関連するリスク
私たちの現在と未来の候補製品は絶対に承認されたり、商業市場の承認を得られないかもしれない。
私たちの成功は市場の自信に依存して、即ち私たちは高度に満足されていない医療需要の患者のために候補製品を開発し、 の健康結果を最適化し、患者の生活の質を高めることができる。私たちが現在と未来の候補製品や私たちの協力者と共同開発した製品が予想通りに開発または実行されなければ、私たちの業務に深刻な影響を与える可能性があります。私たちと私たちのパートナーは、私たちの現在または未来の候補製品の商業市場受容度を達成することができないかもしれません
| ● | 製品革新やビジネス成長への投資の影響は | |
| ● | 私たちは学術機関、生物製薬会社、医学界に、私たちのプラットフォームの効用と既存技術に対する潜在的な優位性の能力を示した | |
| ● | 私たちと私たちの協力者がFDAと他の規制要件を遵守する能力は | |
| ● | 私たちの候補製品の開発速度と学術機関、重要なオピニオンリーダー、提唱団体での名声。 |
また、研究開発計画の変化、財務制限、規制環境、私たちの候補製品に関する否定的な宣伝や競争製品、これらは私たちがコントロールできない状況なので、私たちの業務はマイナスの影響を受ける可能性があります。私たちはこれらや他の市場が私たちの候補製品や技術的受容に影響を与える可能性のある要素を解決することができないかもしれません。 もし私たちの候補製品が開発され、承認され、市場の商業的承認を得られなければ、私たちの業務、財務状況、運営結果に深刻な損害を与える可能性があります。
私たちのbrは発展段階にある会社で、運営歴史が限られていて、収入がなく、多くの要素が私たちの将来性に影響する可能性があります。
私たちbrは発展段階にある製薬会社で、経営歴史が限られており、収入がありません。私たちの業務計画の成功可能性は、早期業務の発展と拡大、そして私たちが置かれている規制や競争環境の面でよく遭遇する問題、巨額の費用、困難、合併症、遅延を考慮しなければならない。br製薬とバイオ製薬製品開発は投機性の高い仕事であり、大きなリスクに関連しており、資本集約型業務である。したがって,わが社など発展段階にある製薬会社がよく遭遇するコスト,不確実性,遅延,困難に基づいて我々の将来性を考慮すべきであり,これらのリスクに成功することを保証することはできないことに注意されたい。
これまで,我々の業務は主に我々の組織や融資活動に限られており,我々の許可プロトコルの交渉,VAR 200やIC 100の開発活動が行われてきた.大規模な重要な臨床試験を成功させ、監督管理の承認を得て、商業規模の製品を製造したり、第三者代表を手配したり、製品の商業化に成功するために必要な販売とマーケティング活動を展開したり、運営中の上場企業を管理したりする能力があることはまだ証明されていません。私たちの経営の歴史が限られているため、当社の業務の傾向に出現し、影響する可能性のある洞察力は限られており、これらの傾向や発展段階の製薬会社(わが社のような)が直面している他の挑戦に対応する方法を策定する際にミスする可能性があります。これらの傾向や挑戦に十分に対応できなければ、私たちの業務、運営結果、財務状況の損傷や失敗を招く可能性があります。さらに、私たちの限られた経営の歴史は、私たちの株主が私たちの未来の成功や生存の可能性を何も予測することを難しくするかもしれない。
| 12 |
私たちの見通しに影響を与える可能性のある私たちのビジネスに関連する要素 は、例えば、他の要因を含むことができます
| ● | 私たちは候補製品を開発し商業化するために追加資金を得ることができます | |
| ● | 私たちの開発計画の規制審査と承認を実施する上で何の遅延もあります | |
| ● | 臨床試験の開始、登録と時間手配を延期する | |
| ● | 私たちの臨床前と臨床試験は臨床前と臨床発展のすべての段階で成功した | |
| ● | 規制部門が私たちの候補製品を審査して承認することにはどんな遅延がありますか | |
| ● | 私たちはアメリカと外国の管轄区域で開発された候補製品が規制部門の承認を得て維持する能力を求めています | |
| ● | 私たちの候補製品の潜在的な副作用は商業化を延期または阻止し、私たちの候補製品の適応を制限する可能性があり、 が承認された場合、リスク評価と緩和策(“REMS”)を確立する必要があり、承認された薬物の市場からの撤退、または罰金と処罰、および第三者のクレームに直面させる必要がある | |
| ● | 市場はもし私たちの製品が発売を許可されたら、私たちの候補製品を受け入れます | |
| ● | 私たちは第三者に依存して候補製品を製造し供給しています | |
| ● | 著者らは臨床研究機関(CRO)の臨床試験への依存を行った | |
| ● | 私たちは臨床と商業化のために代行組織(“CMO”)に依存して製品を生産しています | |
| ● | 協力、許可、または他の手配を確立または維持する能力を確立または維持する | |
| ● | 私たちは他の業務、製品および/または技術を識別、買収、統合する能力 | |
| ● | 私たちのbrは、ビジネスインフラを作成することによって、または戦略的協力によって効果的な販売およびマーケティングインフラを確立し、維持する能力を確立し、維持する | |
| ● | 既存の製品または出現する可能性のある新製品からの競争; | |
| ● | 患者や医療提供者が私たちの候補製品をカバーしたり、十分な精算を受けることができるかどうか | |
| ● | 私たちの能力と私たちの許可者が私たちの業務に非常に重要な知的財産権を獲得、維持、擁護、実行する能力 | |
| ● | 私たちは、私たちのパートナーのノウハウプラットフォームを利用して、他の候補製品を発見し、開発することができます | |
| ● | 私たちは私たちの業務を効率的に管理するために、重要な人員を引き付けて維持する能力がある | |
| ● | 私たちは運営中の上場企業の能力とbrを管理して、引き続きアメリカ証券取引委員会の規則と要求、そしてそれに基づいて公布された規定、およびナスダックの上場要求を守っています | |
| ● | 私たちは私たちの金融インフラを建設し、私たちの会計システムと制御を改善することができる | |
| ● | 潜在的な製品責任クレーム; | |
| ● | 危険物質に関する潜在的な責任; | |
| ● | 私たち は適切な保険証書を取得して維持する能力を持っている。 |
| 13 |
私たちは利益を上げたことがありません。今まで、私たちは規制部門が私たちの候補薬物製品を承認することを支持していませんでした。私たちはいかなる製品も司法管轄区域で商業販売を許可されていません。私たちは製品販売から何の収入も得ていません。したがって、私たちは損失を減らし、利益を達成する能力が実証されておらず、私たちは永遠に利益を達成したり維持することができないかもしれない。
私たちは利益を上げたことがなく、予測可能な未来でも利益を上げないだろう。2023年6月30日現在、私たちの累計純損失は前の時期を含めて約8700万ドルです。私たちは、私たちの組織と融資活動、および私たちの許可合意の交渉、および他の戦略的パートナー関係と協力のために、大部分の財務資源を使用しています。私たちはマーケティングの承認を受けることでいかなる候補製品の開発も完了していないので、私たちは製品販売から何の収入も得ていません。薬品開発に関連する多くのリスクと不確実性のため、費用を増加させる時間や金額、または私たちがいつ、または利益を達成または維持できるかどうかを正確に予測することはできない。VAR 200の臨床開発やbr}IC 100の臨床前開発を継続するとともに,開発された他の候補製品を求める可能性があり,米国やbr}の他の場所で市場から承認された製品を求める可能性があり,より多くの費用が生じると予想される。臨床試験を開始し、VAR 200およびIC 100および開発が求められる可能性のある他の候補製品 の開発を継続するために、より多くのインフラ(より多くの人員を雇用することを含む)に関連する費用が増加することも予想される。したがって、予測可能な未来には、純損失と負のキャッシュフローが引き続き出現することが予想される。これらの純損失と負のキャッシュフローは、すでに私たちの株主権益や運営資本に悪影響を与え続ける。
これまで、私たちは株式証券を売却することで私たちの運営に資金を提供してきた。私たちの未来の純損失額は私たちの未来の支出の成長率と私たちが収入を作る能力にある程度依存するだろう。私たちが単独でまたはパートナーと開発および商業化できない場合、VAR 200、IC 100、または開発された任意の他の候補製品を求めることができない場合、またはマーケティング承認された任意の候補製品の収入が不足している場合、追加資金を集めることができず、利益を得ることができないかもしれない。たとえ私たちが利益を達成したとしても、私たちは収益性を維持したり向上させることができないかもしれない。
私たち は経営を続けられないかもしれません。
私たちbrは発展段階にある製薬会社で、商業製品はありません。我々の主要な候補製品はbr開発過程中であり、大量の追加の臨床前と臨床開発と投資が必要であり、 の商業化が可能である。そのため、設立以来、運営から何の収入も生じておらず、これまで大量の純損失が発生してきた。また、私たちの現金状況は、私たちの業務計画を支援するのに十分ではなく、これらの計画を実施するために多くの追加資金が必要になり、私たちの主要な候補製品の研究と開発、これらの候補製品のための規制許可を求め、アメリカや他の市場で商業化することを含む。我々が独立して登録した会計士事務所の報告には解釈的段落が含まれており,継続的な経営を継続する企業としての能力があるかどうかを疑うことを示している.これらのことは、私たちが経営を続ける企業として継続する能力を大きく疑わせています。特に、私たちの現在の現金と現金等価物は、2023年第3四半期までの予想される現金需要を満たすのに十分だと信じています。もし私たちが経営を続けることができなければ、私たちは私たちの資産を清算しなければならないかもしれません。私たちが清算や解散で得た資産の価値は、私たちの財務諸表に反映された価値よりも大きく低いかもしれません。また、私たちは現金資源が不足しており、私たちは持続的な経営企業として続けることができない可能性があり、これは私たちの株式価値や私たちが新しい資本を調達したり、第三者と重要な契約関係を構築する能力に重大な悪影響を及ぼすかもしれない。
私たちは私たちが財務報告書の内部統制に重大な弱点を持っていることを発見した。もし私たちが重大な弱点を補い、他の方法で効果的な財務報告内部統制システムを維持できなければ、私たちの財務報告の信頼性、投資家の私たちに対する自信、そして私たちの普通株価値は不利な影響を受ける可能性がある。
上場企業として、財務報告の内部統制を維持し、このような内部統制におけるいかなる重大な弱点も報告しなければならない。サバンズ·オキシリー法第404条(“第404条”)は、財務報告の内部統制の有効性を評価し、決定し、財務報告の内部統制の管理報告書を提供することを要求する。重大な欠陥とは、財務報告の内部制御に欠陥或いは欠陥の組み合わせが存在し、年度或いは中期財務諸表の重大なミス報告が適時に予防或いは発見と是正されない可能性がある。
2022年度の監査では、重大かつ複雑な非通常取引の会計処理の効率的な制御を設計および実施していないため、財務報告の内部統制に重大な欠陥があることが分かった。
我々のbr経営陣は、財務報告の内部統制に対する私たちの有効性を継続的に監視し、評価し、さらなる行動を取り、必要な強化や改善を実施するためのプログラムを構築する計画である。経営陣は、2023年にその財務報告の内部統制の設計と運営有効性の評価を完了すると予想している。しかし, t適用された制御措置が十分に長時間実行され、管理層がテストによりこれらの制御措置が有効に動作していると結論するまで、これらの重大な欠陥が修復されたとは考えられない。
もし私たちの措置が重大な弱点を補うことに成功し、他の方法で有効な財務報告内部制御システム を構築し、維持するのに十分でなければ、私たちの財務報告の信頼性、投資家の私たちに対する自信、そして私たちの普通株の価値は重大な悪影響を受ける可能性がある。効率的な財務報告内部統制は、信頼性かつタイムリーな財務報告を提供するために必要であり、適切な開示制御およびプログラムと共に設計され、詐欺を合理的に発見し、防止する。必要な新しいまたは改善された制御措置を実施できなかったか、または実施中に遭遇した困難は、私たちの報告義務を履行できない可能性がある。私たちが米国証券法で規定されている“小さな報告会社”である限り、私たちの独立公認会計士事務所は、第404条による財務報告に対する内部統制の有効性を証明する必要はありません。財務報告書の内部統制の有効性を独立して評価することで、我々の経営陣の評価では発見できない可能性のある問題を発見することができる。財務報告書の内部統制 では発見されていない重大な欠陥が財務諸表の再記述を招く可能性があり、救済費用が発生することを要求しています。
さらに、私たちは財務報告書の開示統制や内部統制がすべてのミスとすべての詐欺を阻止しないと予想している。制御システムは、設計や動作がどんなに良くても、絶対的な保証ではなく、合理的な保証しか提供できず、制御システムの目標が実現できることを確保する。また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.すべての制御システムの固有の限界により、すべての制御問題および不正事例が検出されたことを絶対的に保証することはできない。もし私たちの統制システムがミスや詐欺を防ぐことができなかったら、私たちに実質的な悪影響を及ぼすかもしれない。
| 14 |
私たちは私たちの候補製品を開発して商業化するために追加の資金が必要になるだろう。もし私たちが十分な資金を集めることができなければ、私たちは私たちの製品開発計画を延期、減少、またはキャンセルすることを余儀なくされるだろう。
臨床前研究や臨床試験を含めた医薬製品の開発は高価である。われわれの研究開発費は,われわれが行っている活動により増加することが予想され,特にVAR 200の臨床試験開始やIC 100の臨床前開発を行った場合である。私たちは、VAR 200、IC 100、または私たちが開発を求める可能性のある他の候補製品の開発および商業化努力を支援するために、任意の追加の資金を約束または手配していません。VAR 200、IC 100、および開発を求める可能性のある他の任意の候補製品を開発し、商業化するために、多くの追加資金を調達する必要があるだろう。VAR 200やIC 100の開発成功が確定していないため、その開発および商業化に必要な実際の資金を推定することはできない。
VAR 200、IC 100、または開発を求める可能性のある任意の他の候補製品から十分な収入を得ることができる前に、公開または私募株式発行、債務融資、または会社の協力および許可手配によって将来の現金需要に資金を提供する予定です。 私たちが追加的な資金が必要な時、私たちは私たちが受け入れられる条項でこのような資金を得ることができないかもしれない。十分な資金がなければ、私たちは私たちの業務を延期、縮小、または削減することを要求されるかもしれない。私たちが株式証券を発行したり、株式証券に変換可能な証券を発行して追加資金を調達する程度については、当時の既存株主の所有権が希釈される可能性があり、希釈度が大きくなる可能性があり、具体的には証券を売却できる可能性のある価格に依存する。さらに、もし私たちが債務を生成することによって追加資本を調達する場合、私たちは私たちの業務活動を制限する追加契約の制約を受ける可能性があり、債務ツールの所有者は私たちの株式投資家よりも優先する権利と特権を持っている可能性があり、そのような債務ツールの下でのbr利息および元金返済義務を返済することは、研究開発、臨床、または商業化活動を支援するために本来使用可能な資金を移す可能性がある。したがって、私たちは私たちが構築しようとしている協力に参加できないかもしれない。もし私たちが協力および許可手配によって追加資金を調達する場合、私たちの技術または候補製品に対するいくつかの権利を放棄するか、または私たちに不利になる可能性のある条項で許可を付与する必要があるかもしれない。条件が有利である限り、私たち は公共資本市場や個人資本市場への進出を求めることができるかもしれません。たとえ私たちが当時 の追加資本を切実に必要としていなくても。本登録声明に登録されている証券は、このような証券が希釈効果を有するので、割引条項で追加資本を調達する能力を制限する可能性がある。また、我々普通株式の価格が本登録声明に登録されている引受権証の発行価格よりも低い場合、保有者はその等株式権証を行使することができないので、その行使から何の収益も得られないであろう。
私たちの未来の最近と長期的な資金需要は多くの要素に依存するだろうが、これらに限定されない
| ● | 私たちの候補製品の臨床前と臨床試験の開始、進捗、時間、コストと結果 | |
| ● | FDAは、私たちが開発を求めている候補製品の予想以上の追加研究を要求するかどうか | |
| ● | 私たちが未来に構築する可能性のある任意の協力、許可、または他の計画の条項と時間 | |
| ● | 規制承認の結果、時間、コスト | |
| ● | 競争の技術と市場発展の影響 | |
| ● | ビジネス規模のアウトソーシング製造能力を確立するコストとタイミング | |
| ● | もし私たちが規制部門の承認を得たら、私たちの候補製品を受け入れるだろう | |
| ● | もし私たちが監督部門の承認を得たら、私たちの候補製品のための販売、マーケティング、および流通能力を確立するコスト; と | |
| ● | 私たちは事業、製品、または技術の程度に買収、許可、または投資する。 |
私たちbrはアメリカの様々な反腐敗法律と他の反賄賂と反リベート法律法規の制約を受けている。
我々brは,米国で1977年に改正された“反海外腐敗法”(以下,“反海外腐敗法”と呼ぶ)と,我々が業務を展開している司法管轄区の他の反腐敗,反賄賂,反マネーロンダリング法の制約を受けている。これらの法律は、一般に、私たちおよび私たちの従業員が業務を獲得または保持するために、業務を誰に向けるか、または任意の不正な利益を得るために、政府関係者または商業団体に不正な方法で影響を与えることを禁止している。“海外腐敗防止法”や他の適用される反賄賂や反腐敗法律も、私たちを代表して行動する第三者業務パートナー、代表者、代理人が実施する腐敗や賄賂行為に責任を負うことが求められる可能性があります。我々の第三者業務パートナー、代表および代理は、政府機関または国有または付属実体の役人および従業員と直接的または間接的な相互作用がある可能性があり、私たちは、明確に許可されていなくても、これらの第三者業務パートナーおよび仲介、ならびに従業員、代表、請負業者および代理の腐敗または他の不正活動のために責任を負わなければならないかもしれない。これらの法律はまた、このような行為を防止するために、正確な帳簿と記録を保存し、内部統制とコンプライアンス手続きを維持することを要求している。このような法律のコンプライアンス問題を解決するための政策や手続きがありますが、従業員や代理店が私たちの政策や法律に違反する行為をしないことを保証することはできません。最終的にはそのために責任を負うかもしれませんし、国際業務の拡張と外国司法管轄区での販売と運営が増加するにつれて、これらの法律違反によって直面するリスクが増加します。“海外腐敗防止法”または他の適用される反賄賂、反腐敗および反マネーロンダリング法律に違反するいかなる行為は、告発者の苦情、メディア不利な報道、調査、巨額の法的費用の徴収、輸出特権の喪失、厳しい刑事または民事制裁または米国政府契約の資格の一時停止または取り消し、深刻な“br”移転管理層の注意力、株価下落または私たちの業務全体への悪影響を招く可能性があり、これらはすべて私たちの名声、業務、財務状況および経営業績に悪影響を及ぼす可能性がある。
| 15 |
私たちの財務状況と運営結果は新冠肺炎の疫病の悪影響を受けるかもしれない
疫病や流行病の発生は,その規模によっては,我々が業務や候補製品を開発している地域,州,地方経済に異なる程度の破壊を与える可能性がある。現在の新冠肺炎疫病はすでに著者らの業務価値、経営業績と財務状況に実質的な不利な影響を与える可能性がある。国際、br連邦、州と地方公共衛生と政府当局が新冠肺炎の全世界の各地区での爆発と伝播を制御と対抗するために取った非常な行動は、旅行禁止、隔離、“家にいる”命令、利息累算の一時停止とある連邦が支持する学生ローンに対するbrの徴収及び多くの個人と企業が日常活動を大幅に制限する類似命令 を含み、全体的に消費者活動の減少を招いた。新冠肺炎疫病による経済減速と高い失業率の程度と持続時間は現在まだ確定しておらず、特に新しいウイルス株が出現し、ワクチン接種に潜在的な挑戦を構成している状況下で、しかし持続的な著しい経済減速は著者らの財務状況、流動性と運営結果に重大な不利な影響を与える可能性がある。
開発、規制承認、商業化に関するリスク
大流行、流行病や伝染病(例えば新冠肺炎)の発生は、私たちの候補製品の開発を中断する可能性があります。
大流行や流行のような公衆衛生危機は私たちの業務に悪影響を及ぼすかもしれない。2019年12月、SARS-CoV-2(重症急性呼吸症候群コロナウイルス2)と呼ばれる新しいウイルス株 が武漢、中国と に出現し、全世界的に伝播した。コロナウイルスの大流行は変化しており、これまでに政府が強制的に実施した隔離、旅行制限、その他の公衆衛生安全措置を含む様々な対応措置が実施されてきた。我々や第三者パートナーの業務(我々の臨床前研究や臨床試験運営を含む)に対するコロナウイルスの影響の程度 は将来の発展にも依存し,これらの事態の発展は高度に不確実であり,爆発の持続時間,出現するコロナウイルスの重症度に関する新たな 情報,コロナウイルスの制御やその影響を制御する行動 などを自信を持って予測できない。新冠肺炎の全世界での持続的な伝播はアメリカと海外での臨床前或いは臨床試験運営に不利な影響を与える可能性があり、著者らは患者と主要な研究者及び現場スタッフを募集と維持する能力を含み、彼らは医療保健提供者として、brはすでに新冠肺炎への接触を増加させたかもしれない。例えば,他の生物製薬会社と同様に,現在および/または計画中の臨床試験を登録する際に遅延に遭遇する可能性がある。新冠肺炎は影響を受けた地域に位置する第三者CROの従業員にも影響を与える可能性があり、著者らはこれらのCROに依存して臨床試験を行った。また,我々のLeadや他のコア候補製品に対する患者群 は特に新冠肺炎の影響を受けやすい可能性があり,将来の臨床試験に参加できる患者を識別することが困難であり,登録された患者がこのような試験を完了する能力に影響を与える可能性がある。新冠肺炎が患者の登録または治療または私たちの候補製品の実行に与えるいかなる負の影響も臨床試験活動の費用の高い遅延を招く可能性があり、これは私たちの監督機関が私たちの候補製品の承認を得てそれを商業化する能力に悪影響を与え、私たちの運営費用を増加させ、私たちの財務業績に実質的な悪影響を与える可能性がある。
| 16 |
また、計画中の臨床試験が適時に登録できるかどうかは臨床試験地点に依存し、これらの地点は全世界の健康問題の不利な影響、例えば流行病を受ける可能性がある。我々は現在コロナウイルスの影響を受けている地域で我々の候補製品の臨床試験を行う予定である。コロナウイルス爆発のいくつかの要素は、候補製品の臨床試験および私たちの業務に不利な影響を与えるか、または他の方法で私たちの候補製品の臨床試験に不利な影響を与えるだろう
| ● | Brは、私たちの臨床試験調査員である医師、私たちの臨床試験場所である病院、そして期待される臨床試験を支持する病院スタッフの関心を含む、臨床試験を行うことから大流行に注目することに医療資源を移す可能性がある | |
| ● | 臨床試験場所の開始および監視、従業員、請負業者または患者の臨床試験場所への国内旅行および国際旅行、政府によって実施される任意の旅行制限または隔離を含む、重要な試験および業務活動を中断する可能性のある旅行制限または隔離は、患者、従業員または請負業者が私たちの臨床試験場所に行く能力または意思 またはビザまたは入国許可を得ることに影響を与え、潜在的なパートナーとの対面会議および他の相互作用を失い、任意の は、私たちの予想される臨床試験の進行または進行に悪影響を及ぼす可能性がある; | |
| ● | は、私たちの第三者製造業者の運営に潜在的な負の影響を与えます | |
| ● | 世界的な輸送中断br、私たちの製品の原材料、臨床試験材料(例えば患者サンプル)、研究薬品と調理薬、そして私たちの未来の臨床試験で使用される他の供給の輸送に影響を与える; | |
| ● | ビジネスの潜在的な職場、実験室およびオフィス閉鎖、ならびに在宅勤務者への依存増加による中断、行われている実験室実験および動作の中断または遅延、人員不足、出張制限、または公共交通中断、 これらのいずれも、私たちの業務運営に悪影響を及ぼす可能性があり、または現地の監督管理機関、道徳委員会および他の重要機関および請負業者との必要な相互作用を遅延させる可能性がある。 |
我々は、ウイルスの従業員に対するリスクを最小限に抑えることを目的とした一時的な予防措置を講じており、私たちのすべての従業員が遠隔勤務し、世界各地での従業員のすべての不要な旅行を一時停止し、業界活動や仕事に関する対面会議に参加することを奨励していないことは、私たちの業務に負の影響を与える可能性がある。現在、企業や政府機関(例えば、米国証券取引委員会や食品·医薬品局)の計画や潜在的な閉鎖や中断の範囲や深刻さを予測することはできない。
我々の業務は、我々の候補製品の成功した開発、規制承認および商業化、特にVAR 200およびIC 100に依存する。
私たちの事業の成功は、当社に資金を提供し、将来的に任意の収入を創出する能力を含み、主に候補製品の開発成功、規制承認、商業化、または協力にかかっています。将来、私たちの候補製品はまた、私たちの1つの候補製品、または私たちが許可、買収または開発する可能性のある任意の未来の候補製品に依存するかもしれません。私たちの候補製品の臨床前、臨床、およびビジネス成功は、以下の要素を含む多くの要素に依存します
| ● | 許容可能な条件または追加資本を調達することができない能力で; | |
| ● | タイムリーに私たちの臨床前と臨床試験を完成させることは、私たちが現在予想している速度よりもはるかに遅いか、またはコストが高いかもしれません。これは、第三者請負業者の表現に大きく依存します | |
| ● | FDAまたは同様の外国の規制機関は、私たちの候補製品または任意の未来の候補製品の承認および商業化を支援するために、追加の臨床前または臨床試験を要求するかどうか | |
| ● | FDAと類似した外国規制機関は,我々の提案適応と我々の候補製品の提案適応に関する主な終点評価を受けている | |
| ● | 私たちはFDAおよび類似の外国規制機関に私たちの候補製品または任意の未来の候補製品の安全性と有効性を証明することができます |
| 17 |
| ● | 薬物動態研究で検出可能な活性化合物を識別する能力; | |
| ● | 私たちの候補製品または将来承認された製品に関連する潜在的副作用の罹患率、持続時間、および重症度(ある場合) | |
| ● | FDAと同様の外国規制機関の必要な上場承認を適時に受ける | |
| ● | 実現し、維持し、適用された場合、私たちの第三者請負者が、私たちの契約義務および私たちの候補製品または任意の未来の候補製品または承認されたbr製品に適用されるすべての法規要件を達成し、維持することを保証し、維持する | |
| ● | 私たちと契約して、私たちの候補製品または任意の未来の候補製品の臨床試験と商業用品を生産する第三者の能力は、監督管理機関と良好な関係を維持し、現在の良好な製造実践またはcGMPまたは良好な農業と採集業実践またはGACPに適合する商業的に実行可能な製造技術を開発、検証し、維持する | |
| ● | 臨床前および臨床開発中、ならびに私たちの候補製品または任意の未来の候補製品が承認された後、brは許容可能なセキュリティプロファイルを維持し続ける | |
| ● | 私たちは、アメリカと国際で私たちの候補製品または任意の未来の候補製品を商業化することに成功しています。もし承認されれば、単独で、または他の会社と協力して、これらの国や地域でマーケティング、販売、流通を行うことができます | |
| ● | 医師、患者、および支払人は、代替療法および競合療法に関連するものを含む、私たちの候補製品または任意の未来の候補製品の利益、安全性および有効性(承認された場合) を受け入れる | |
| ● | 私たちは多くの承認後の法規要求を守ることができます | |
| ● | 私たちのbrと私たちのパートナーは、私たちの候補製品または任意の未来の候補製品において知的財産権を確立し、実施する能力; | |
| ● | 私たちと私たちのパートナーが第三者特許干渉または知的財産権侵害請求を回避する能力; | |
| ● | 私たち は、開発と商業化に成功できると考えられる他の候補製品や商業段階製品を許可または取得することができます。 |
Var 200はFDA指定のFSGS孤児薬を得ることができない可能性がある。FDAは2018年9月17日に私たちの孤児薬物指定申請を受けた。孤児薬物指定は、(1)申請を支援するためのFSGS臨床前モデルが、VAR 200の推奨適応であるFSGSの治療ではなく予防を反映しているため、(2)FDAは、使用の仮定および計算によって提供される流行率推定値が過小評価されていると考えているからである。VAR 200の臨床データが利用可能な場合に孤児薬物指定を再申請し,他の情報を用いてFSGSの罹患率をサポートする予定である。
上記の1つまたは複数の要因(その多くは制御できない)をタイムリーにまたは根本的に実現できなければ、私たちは重大な遅延やコスト増加に遭遇したり、規制部門の承認を得たり、私たちの候補製品を商業化することができない可能性があります。規制部門の承認を得ても、私たちの任意の候補製品を商業化することに成功することはできません。したがって、私たちはあなたに保証することはできません。私たちは私たちの候補製品または任意の未来の候補製品を販売することによって、運営を継続するために十分な収入を生成することができます。
| 18 |
我々の候補製品IC 100の臨床前薬物開発は非常に高価で、時間がかかり、不確定である。我々の臨床前試験は、関心のある治療領域の薬理活性を十分に示すことができない可能性がある;他の身体システムにおいて予期しない短期または長期的な影響をもたらすか、または変化またはリスク利益が評価される可能性のある意外毒性を産生する。IC 100の作用機序を反映する化合物類はまだ臨床試験に入っておらず、薬理類の効果はまだ不明である。これらの と他の要素はさらなる発展を阻害したり延期したりする可能性がある。
我々が候補製品を開発·開発する基礎を構成する科学的発見は比較的新しい. 我々の手法に基づく開発エージェントの実行可能性を支援する科学的証拠は初歩的であり,限られている.IC 100は1種の新しい治療方式を代表し、成功の開発には更に多くの研究と努力が必要であり、その治療潜在力を最適化するかもしれない。IC 100は、実験室または臨床前研究において、患者においてその治療特性を証明することができず、予測不可能、無効、さらには有害な方法でヒト生物システムと相互作用する可能性がある。もし私たちがIC 100の開発に成功して商業化できなければ、私たちは永遠に利益を上げないかもしれません。私たちの株の価値は下がるかもしれません。
IC 100は、開発およびその後に規制承認される時間およびコスト(あれば)を予測することを困難にする比較的新しい技術である。
われわれの研究と開発努力は,限られた数の初期目標疾患適応に集中している。 は,現在や将来の適応を開発する際に問題や遅延に遭遇しない保証はなく,このような問題や遅延が意外なコストにならない保証もなく,どのような開発問題も解決できる保証はない.IC 100上で生成された臨床前データおよび提案された臨床開発計画は、FDAが調査性新薬申請による審査と許可を行う必要がある。brわれわれはこのような申請を支持するデータを生成しておらず、臨床前研究の結果はFDAが臨床研究を開始する前に審査する必要があり、臨床研究は承認されない可能性がある。
我々 は,我々の開発プラットフォームを用いて拡張して候補製品チャネルを構築する努力は成功しない可能性がある.
我々IC 100戦略の1つの重要な要素は、私たちの経験豊富な管理と科学チームを利用して広範な人類疾患brの範囲内でIC 100を評価して、候補製品導管を構築することである。私たちのこれまでの研究と開発は潜在的な候補製品を生み出してきたにもかかわらず、他の候補製品を識別し、開発し続けることができないかもしれません。私たちが私たちのルートを構築することに成功しても、私たちが決定した潜在的な候補製品は臨床開発に適していないかもしれません。例えば、これらの潜在的な候補製品は、市場の承認を得ることができず、市場承認を得ることができないことを示す有害な副作用または他の特徴を示す可能性がある。私たちの方法に基づいて候補製品の開発に成功して商業化しなければ、将来的に製品収入を得ることができなくなり、私たちの財務状況に大きな損害を与える可能性があります。著者らの臨床前と臨床発展が成功することを保証することはできず、いずれにしても、監督管理の許可を得る過程は大量の時間と財力の資源が必要である。
私たちの候補製品の臨床薬物開発は非常に高価で、時間がかかって確定できない。私たちの臨床試験は私たちの候補製品の安全性と有効性を十分に証明できない可能性があり、これは規制部門の承認と商業化を阻止または延期する可能性がある。
我々の候補製品の臨床薬物開発は非常に高価で,時間がかかり,設計と実施が困難であり,その結果自体が不確定である。候補製品の商業販売に対する規制機関の承認を得る前に、候補製品が目標適応に使用されることは安全かつ有効であることを臨床試験により証明しなければならず、予測不可能である。臨床試験を開始した候補製品の多くは規制部門の商業化承認を得たことがない。我々の候補製品は異なる開発段階にあり,任意の試験段階あるいはbr試験過程のいつでも,複数の臨床試験に失敗する可能性がある。これらの候補製品の臨床試験は数年継続することが予想されるが,達成には予想以上の時間がかかる可能性がある。私たちのすべての候補製品が人体テストを経ているわけではなく、初めて人体で使用すると思わぬ効果が生じる可能性があります。私たちはまだ私たちの候補製品の承認を得るためにすべての臨床試験を終えていない。
| 19 |
我々の候補製品が行われていることや将来の臨床試験で遅延に遭遇する可能性があり,将来の臨床試験が時間どおりに開始されるかどうか,再設計が必要かどうか,時間どおりに十分な数の患者を募集する必要があるかどうか,あるいは予定通りに完了するかどうかが分からない。さらに、私たち、現在または将来協力する可能性のある任意のパートナー、FDA、機関審査委員会(“IRB”) または他の規制機関、州および地方機関、および外国の対応機関を含み、様々な理由で随時一時停止、延期、修正または終了を要求する可能性がある
| ● | 研究参加者が経験した深刻なまたは予期しない毒性または副作用、または他の許容できない健康リスクまたは他の安全問題への曝露などの安全または耐性の問題を発見する; | |
| ● | 臨床試験中、任意の候補製品は有効性が不足しているか、または私たちの候補製品は指定された終点に到達できなかった | |
| ● | 被験者の募集および登録率が予想されるbr速度を下回ったり、同じ適応の候補製品に対する他社の臨床試験や、患者が治療の適応をあまり求めない臨床試験を含む十分な数の患者を募集および登録できない原因が多い | |
| ● | 新冠肺炎の疫病による隔離或いはその他の制限により、著者らの臨床試験は遅延或いは困難が発生した | |
| ● | すでに臨床試験を開始したが、治療の不良副作用のため随時退出する可能性のある被験者を保留することは困難であり、brの治療効果が不足し、臨床試験過程に疲労を感じる或いは任意の他の原因である | |
| ● | 各臨床試験地点で行われた研究はIRBの承認を得ることが困難であった | |
| ● | 十分な数の臨床試験に必要な材料の製造を遅延させるか、または製造することができないか、または得ることができない | |
| ● | 私たちの製造プロセスや製品のレシピや配送方法には不足や変更があります | |
| ● | 適用される法律、法規、規制政策を変更する; | |
| ● | 遅延または予期される契約研究機関、臨床試験場所、および他の第三者請負業者と臨床試験契約または合意における許容可能な条項について合意することができなかった | |
| ● | 十分な数の臨床試験サイトを増加させることはできない | |
| ● | 適切な配合および用量に関する不確実性 ; | |
| ● | 私たち、私たちの従業員、私たちのCRO、または彼らの従業員、または他の第三者請負業者は、契約および適用された法規要件を遵守できなかったか、またはタイムリーまたは許容可能な方法でそのサービスを履行できませんでした | |
| ● | 私たち、私たちの従業員、私たちのCROまたは彼らの従業員、または私たちが協力する可能性のある任意のパートナー、または彼らの従業員は、臨床試験または処理、貯蔵、安全および記録保存に関する適切なFDAまたは他の規制要件を遵守できなかった | |
| ● | スケジュールは参加した臨床医や臨床機関と衝突しています | |
| ● | 適切な臨床試験案を設計できなかった | |
| ● | データが不足していて、規制部門の承認を支持できない | |
| ● | 医療研究者は私たちの臨床計画に従ってはいけません | |
| ● | 治療中または治療後に被験者との連絡を維持することは困難であり、データが不完全である可能性がある。 |
| 20 |
私たちのbrや私たちが協力する可能性のある任意のパートナーは、製薬やバイオテクノロジー業界の多くの他の会社の経験のように、早期の試験でもエキサイティングな結果を得ているかもしれません。もし私たちまたは私たちの潜在的なパートナーが私たちの候補製品に関連する臨床開発を放棄または遅延した場合、私たちは私たちの業務計画を効果的に実行できないかもしれません。私たちの業務、財務状況、経営業績、および将来性は損なわれます。
候補製品の製造または処方を変更する方法 は、追加のコストまたは遅延をもたらす可能性がある。
候補製品が臨床前研究から後期臨床試験までを通じて潜在的な承認と商業化を得ることに伴い、開発計画の各方面(例えば製造方法と調合)はこの過程で変更することは非常によく見られる は過程と結果の最適化に努力する。このような変化はこのような期待された目標を達成できない可能性がある。これらの変更のいずれも、候補製品の表現が異なることをもたらし、計画中の臨床試験または変更された材料を用いた他の臨床試験の結果に影響を与える可能性がある。このような変更はまた、追加のテスト、FDA通知、またはFDA 承認を必要とする可能性がある。これは臨床試験の完成を遅らせる可能性があり、接続臨床試験或いは1つ以上の臨床試験を繰り返す必要がある。
適用される法規要件によると、私たちの早期候補製品VAR 200またはIC 100に対する規制承認を得ることができない可能性があります。br}FDAと外国の監督管理機関は、承認過程において、候補製品の承認を延期、制限、または拒否する権利を含む大きな裁量権を持っています。どんな規制承認の遅延、制限、または拒否は商業化に悪影響を与え、私たちは収入の潜在力、私たちの業務と私たちの経営業績を創造します。
私たちのbrは現在販売が許可されていない製品で、私たちは決して監督部門の許可を得ないかもしれません。私たちの現在または未来のいかなる候補製品も商業化できません。著者らの薬品に関連する研究、テスト、製造、安全監督、治療効果、品質管理、記録、ラベル、包装、許可、販売、マーケティング、流通、輸入、輸出とその他の発売後の情報の安全とその他の発売後の情報は、アメリカと国外でFDAとその他の監督管理機関の広範な監督管理を受けており、これらの監督管理規定は国によって異なる。FDAのセキュリティプロトコル、BLA、または他の適用規制文書の承認を得るまで、現在の任意の候補製品 を米国で販売することは許可されていません。私たちまたは私たちのパートナーがこれらの国/地域関連規制機関の必要な承認を得るまで、私たちはどの国/地域でも現在の任意の候補製品を販売することを許可しません。許可された発売VAR 200或いはIC 100などの新薬を獲得するためには、FDAと/或いは外国の監督管理機関は必ず臨床前と臨床データを獲得し、薬品の安全性、純度、効力、有効性とコンプライアンス生産がNDA、BLA或いはその他の適用監督申告文書中の申請の期待適応に符合することを十分に証明しなければならない。新薬製品の開発と承認は長い、高価で不確定な過程に関連し、どの段階でも遅延或いは失敗が発生する可能性がある。製薬と生物製薬業界の多くの会社は非臨床開発、臨床試験(第三段階の臨床開発を含む)において重大な挫折を経験し、早期の臨床前研究或いは臨床試験においても満足できる結果を得た。これらの挫折の原因としては,臨床試験が行われている期間の発見と,臨床試験で行われた安全性や有効性観察があり,これまで報告されていなかった有害事象が含まれている。臨床試験の成功は今後の臨床試験の成功を保証するものではなく,非臨床研究会の成功も保証されない。他側の臨床試験結果は,われわれやわれわれのパートナーが行う可能性のある試験の結果を代表しない可能性がある。
FDAと外国の監督管理機関は薬品開発と審査プロセスの中でかなりの自由裁量権を持っており、多種の原因で薬品開発を延期、制限或いは許可候補製品を制限或いは拒否できることを含む。FDAまたは適用される外国の規制機関は:
| ● | 1つまたは複数の臨床試験の設計または実施に同意しない | |
| ● | 候補製品がその提案の適応によって安全に有効であるとは考えられないか、または候補製品の安全性または他の知覚可能なリスクがその臨床的または他の利益を超えると考えられる可能性がある | |
| ● | 臨床前研究と臨床試験のデータは承認を支持するのに十分ではないか、あるいは臨床試験の結果はFDA或いは適用された外国の監督管理機関が承認を要求する統計或いは臨床意義レベルに適合しない可能性がある |
| 21 |
| ● | 私たちまたは第三者による臨床前研究または臨床試験データの解釈に同意しないか、または私たちが協力する可能性のある任意のパートナーの解釈に同意しない | |
| ● | 前臨床試験または臨床試験から収集されたデータは、INDまたはNDAの提出、または他の適用可能な規制申告をサポートするのに十分ではない可能性があると判断する | |
| ● | 追加的な前臨床研究や臨床試験が必要です | |
| ● | 製剤、品質管理、ラベル、または仕様における現在または将来の候補製品の不足点を決定すること | |
| ● | 薬物により敏感な集団の薬物動態または安全性を決定するために、小児科患者において臨床試験を行うことが要求される | |
| ● | 承認は高価な承認後の追加臨床試験の表現に依存する | |
| ● | 私たちが最初に要求したよりも限られた適応またはより狭い患者集団(Br)または市場に影響を与える可能性のある強い警告を有するように、私たちの現在または任意の未来の候補製品を承認する; | |
| ● | 私たちの候補製品の商業化に成功することが必要または望ましいと考えているラベルを承認しない | |
| ● | 当社と契約した第三者製造業者または試験実験室の製造プロセス、制御、または施設を承認しません | |
| ● | 私たちの製品を設備と見なして、異なる承認プロセスと生産需要を必要とする薬物ではありません | |
| ● | 追加の臨床試験または各研究が患者の数を増加させる単一の薬剤を必要とするのではなく、私たちの製品のうちの1つを組み合わせ製品と見なす;または | |
| ● | 私たちの承認政策を変更したり、新しい法規を採用したりして、私たちの臨床データや監督文書が承認に足りないようにします。 |
私たちの任意の候補製品のどのような規制承認に適用されるいかなるbrの遅延、制限、または拒否は、私たちの候補製品の商業化に不利な影響を与え、私たちの業務、財務状況、経営業績、および見通しを損なうだろう。
私たちの現在の候補製品または任意の未来の候補製品が規制部門の承認を得ても、彼らは医師や患者が商業的成功に必要なbrを広く採用し、使用することができないかもしれない。
私たちの現在または未来の任意の候補製品の商業成功は、承認されれば、商業的に成功しないかもしれないが、医師、患者、および支払人が承認された適応において結果製品の広範な採用およびbr使用に大きく依存するであろう。承認された場合、私たちの現在または未来の候補製品の採用程度および採用率は、複数の要素に依存する
| ● | この製品が承認された臨床適応およびこれらの適応の治療に対する患者の承認製品の需要 | |
| ● | 他の治療法と比較して私たちの製品の有効性は | |
| ● | Br管理医療計画および他の医療支払者は、承認される可能性のある任意の候補製品に保険と十分な精算を提供する | |
| ● | 代替療法に関連する我々の候補製品の治療コストおよび患者は製品に支払いたい(承認されれば) ; | |
| ● | 医師、診療所の主要な経営者と患者はこの製品を安全かつ有効な治療方法である |
| 22 |
| ● | 医師および患者は、承認された適応を治療するために他の利用可能な治療法ではなく、新しい療法を望んでいる | |
| ● | 承認された適応治療に対する医師または患者の可能性のある特定の療法に対する任意の偏見を克服する; | |
| ● | 医師や医療関係者が私たちの製品候補者の適切な訓練と管理を行っています | |
| ● | 患者は私たちの候補製品の結果と管理と全体的な治療体験に満足している | |
| ● | 代替療法と比較して、私たちの候補製品は医師に収入と収益を提供するかもしれない | |
| ● | 副作用の罹患率と重症度 | |
| ● | FDAによって承認された候補製品ラベルに含まれる制限 または警告; | |
| ● | FDAは、リスク評価および緩和戦略またはREMSの任意の要件を実施することを要求する | |
| ● | 私たちの販売、マーケティング、流通の有効性 | |
| ● | 私たちは需要を満たすために十分な供給量を維持することができる | |
| ● | 私たちの候補製品に対する否定的な宣伝や競争製品への肯定的な宣伝; | |
| ● | 潜在的な 製品責任クレーム。 |
現在または将来の任意の候補製品の使用が許可されているが、ビジネス成功に必要な医師および患者の広範な採用に達していない場合、私たちの運営結果および財務状況は悪影響を受け、brを延期、阻止、または収入を創出し、業務を継続する能力を制限する可能性がある。
私たちの候補製品が承認されれば、激しい競争に直面し、効果的な競争ができなければ、著しい市場浸透を阻害する可能性がある。
Br製薬業界の特徴は技術が急速に進歩し、競争が激しいことであり、特許療法の開発を高度に重視している。多くの製薬会社、模倣薬会社、バイオテクノロジー会社、学術および研究機関は医療製品の開発、特許出願、製造、マーケティングに従事しており、Travere、ファイザー、Goldfinch Bio、ベーリンガー-インゲルハイム、アストラ-ジェリコン、セノフィ、ノワール、ロー氏、他の会社を含む競争力を持っている。私たちの多くの競争相手は、より強力な財務資源、マーケティング能力、販売チーム、製造能力、研究開発能力、臨床試験専門知識、知的財産権の組み合わせ、特許と監督管理の承認を得た経験、製品候補およびその他の資源の承認を持っている。競合製品を提供する会社の中には、幅広い他の製品、膨大な直販チーム、そして私たちのターゲット医師との長期顧客関係を持っており、市場浸透努力を阻害する可能性があります。また、もし私たちのいくつかの候補製品が承認されれば、いくつかの患者の自由支配可能な予算シェアと競争し、臨床実践の中で医師の関心を獲得する可能性がある。
私たちの候補製品が規制部門の承認を得たら、他の承認からのbr療法の激しい競争に直面すると予想されています。承認されれば、私たちの候補製品はまた、規制されていない、承認されていない、ラベル外、および非処方薬と競争する可能性があります。もし承認された場合、私たちのいくつかの候補製品は、承認された適応に対して新しい治療法を提案し、brを既存の治療法と競合し、いくつかの治療法が知られており、医師および患者に受け入れられている。この市場で競争に成功するためには,我々が承認した製品の相対コスト,安全性,有効性(あれば)が既存療法と他の新しい療法の魅力的な代替案であることを証明しなければならない。このような競争は私たちの候補製品の市場シェアを減少させ、私たちの候補製品の定価に下振れ圧力を与える可能性があり、これは私たちの業務、財務状況、経営業績と将来性を損なう可能性があります。
| 23 |
私たちの候補製品は汎用または類似のタイプの製品競争に直面することが予想され、これは私たちの業務、財務状況、経営業績、将来性に悪影響を及ぼす可能性があります。
私たちの任意の候補製品の特許保護の満了または喪失時、または私たちの任意の候補製品の特許保護が満了または失われた場合、私たちの任意の候補製品の模倣薬競争相手は、模倣薬またはその等価物に対して未解決の特許侵害訴訟を提起したにもかかわらず、その製品は承認されており、その販売価格は私たちが承認した製品 よりも著しく低い可能性があり、私たちは短時間で製品の大部分の売上を損失する可能性があり、これは私たちの業務、財務状況、運営結果、および将来性に悪影響を及ぼすだろう。
私たちは商業化された任意の候補製品、または私たちがそれと協力する可能性のある任意のパートナーは、持続的なbrと持続的な規制審査を受けるだろう。
私たちまたは私たちのパートナーがアメリカの規制機関の候補製品の承認を得た後も、私たちまたは私たちのパートナーは規制審査とコンプライアンス義務を受け続けます。例えば、我々の候補製品について、FDAは、製品が発売される可能性のある承認の指定された用途または承認条件に重大な制限を加える可能性がある。候補製品の承認は、製品の安全性および有効性を監視するための第4段階の臨床試験またはREMSを含む可能性の高い承認後の研究および監視の要件を含む可能性がある。私たちはまた、FDAの義務と継続的な規制審査を受け、私たちの候補製品の製造、加工、ラベル、包装、流通、有害事象報告、貯蔵、広告、販売促進、記録などに関連する。これらの要件は、安全性および他の上場後の情報および報告の提出、登録、およびcGMP要件、FDAの良好な臨床実践、またはGCP、または良好な農業および収集規範またはGACP、要件および良好な実験室仕様またはGLP要件を継続的に遵守することを含み、これらの要件は、FDAが臨床および臨床前開発においてすべての候補製品および承認後に実施した任意の臨床試験に対して実行される法規およびガイドラインである。候補製品が他の国/地域で販売が許可された場合、私たちは、これらの国/地域の法律および政府規制機関によって適用される同様の制限および要求を受ける可能性がある。
もし私たち、私たちのパートナー、私たちの候補製品、あるいは私たちの候補製品の製造施設が適用される規制要求を遵守できなければ、規制機関は:
| ● | 製品の販売または製造に制限を加え、製品の承認または取り消しに必要な許可証を一時停止または撤回する | |
| ● | 宣伝材料の修正や医療従事者への正確な情報提供を要求しています | |
| ● | 様々な罰金の適用、検査費用の精算、具体的な行動に必要な締め切り、および規定を遵守しないことに対する処罰が含まれる可能性がある、私たちまたはパートナーに同意法令を締結することを要求します | |
| ● | 警告状を発行すること、原因通知を表示すること、または違反の疑いがあることを説明する無見出し手紙を開示することができる | |
| ● | 刑事捜査と起訴を展開する | |
| ● | 禁止、一時停止、または必要な承認またはその他の許可を強制的に実施する | |
| ● | その他の民事または刑事罰を加える; | |
| ● | 現在行われている臨床試験を一時停止します | |
| ● | 私たちまたは私たちの潜在的パートナーが提出した係属中の出願または承認された出願を承認することを延期または拒否する追加出願; | |
| ● | 医薬品または易製毒化学品の米国への輸出を許可するか、または米国からの輸出を拒否する | |
| ● | コストの高い新しい製造要件を含む運営を一時停止するか、または運営に制限を加える |
| ● | 製品を差し押さえたり差し押さえたりしたり、私たちまたは私たちのパートナーに製品のリコールを開始することを要求します。 |
| 24 |
FDAおよび他の適用政府機関の法規、政策または指導意見は変化する可能性があり、私たちの候補製品の規制承認を阻止または延期するために、新しいまたは追加の法規または政府法規を公布するか、または承認後の活動をさらに制限する可能性がある。米国や海外の将来の立法や行政行動によって生じる可能性のある不利な政府規制の可能性、性質、程度を予測することはできない。もし私たちが規制コンプライアンス を達成し、維持することができなければ、私たちは私たちの候補製品のマーケティングを許可されないかもしれません。これは私たちの収益力 を達成し、収益性を達成または維持することに悪影響を与えます。
我々のbrは将来的に米国やFDA以外で候補製品の臨床試験を行う可能性があり,適用される外国の規制機関はこのような試験のデータを受け入れない可能性がある。
私たちのbrは将来、カナダ、ヨーロッパ、南アメリカを含む米国以外で1つ以上の臨床試験を行うことを選択するかもしれない。FDAまたは適用される外国規制機関は、米国または適用司法管轄区域外で行われた臨床試験からのデータを受け入れることができるが、FDAまたは適用される外国規制機関は、このような研究データをいくつかの条件によって制限される可能性がある。外国の臨床試験のデータを米国の上場承認の基礎として利用しようとすれば,FDAは外国のデータのみに基づいて申請を承認することはなく,これらのデータが米国の人口や米国の医療実践に適用されない限り,研究は公認能力のある臨床研究者が行うことができ,またデータはbrが有効であると考えられ,FDAによる現場検査を必要としない,あるいはFDAがこのような検査を行う必要があると考えた場合,FDAは現場検査や他の適切な方法でデータを検証することができる。多くの外国の監督管理機関は類似した要求を持っている。また、このような外国の研究は、研究を行っている外国の管轄区域に適用される現地法律の制約を受ける。FDAや適用された外国の規制機関が米国や適用司法管轄区域以外で行われた試験データを受け入れることは保証されない。FDAや適用される外国の規制機関がこのようなデータを受け入れない場合、追加の試験が必要になる可能性があり、これは高価で時間がかかり、私たちの業務計画の様々な側面が遅延する可能性がある。
私たちのbr候補製品は、不良副作用や他の予期しない特性を引き起こす可能性があり、その規制 の承認を遅延または阻止し、承認されたラベルのビジネスイメージを制限したり、承認後の規制行動を招いたりする可能性がある。
私たちの任意の候補製品は、臨床開発中または承認された製品が発売された後に予見できない副作用が出現する可能性がある。候補製品によって引き起こされる副作用は、私たち、私たちが協力する可能性のある任意のパートナーまたは規制機関の中断、修正、遅延、または臨床試験の一時停止をもたらす可能性があり、より厳しいラベルまたはFDAまたは同様の外国機関の規制承認遅延 をもたらす可能性がある。臨床試験の結果は深刻かつ受け入れられない副作用の重症度と流行率を明らかにする可能性がある。この場合、試験は一時停止または終了される可能性があり、FDAまたは同様の外国規制機関は、任意またはすべての目標適応の候補製品のさらなる開発を停止するか、または承認を拒否するように、我々または我々の潜在的パートナーに命令することができる。薬物に関連する副作用は、患者の募集或いは入選患者の試験を完成する能力に影響し、或いは製品責任クレームを招く可能性がある。これらの状況のいずれも、私たちの業務、財務状況、経営業績、および見通しを損なう可能性があります。
さらに、もし私たちまたは他の人が、私たちの候補製品がアメリカまたは外国の規制機関の許可または同じまたは関連する活性成分を含む他の製品を獲得した後に引き起こされる不良副作用または他の以前に未知の問題を発見した場合、いくつかの潜在的な負の結果をもたらす可能性がある
| ● | 規制部門は製品の承認を撤回するかもしれない | |
| ● | 規制当局は製品のリコールを要求するかもしれないし、私たちまたは私たちの潜在的なパートナーは自発的に製品をリコールするかもしれない | |
| ● | 規制当局は、製品ラベルに警告や禁忌症を増加させ、製品ラベルの適応範囲を縮小したり、医師や薬局に現場警報を発したりすることを要求することができる |
| 25 |
| ● | 私たちは、患者に配布するために、またはREMSを確立するために、このような副作用のリスクを概説するための薬物ガイドラインを作成する必要があるかもしれない | |
| ● | 私たちは製品をどのように普及させるかに制限があるかもしれない | |
| ● | 私たちbrは、製品の投与方法を変更するか、または他の方法で製品を修正することを要求される可能性があり、FDAまたは適用される外国の規制機関は、製品の安全性または有効性を監視するために、追加の臨床試験または高価な発売後試験および監視を要求する可能性がある | |
| ● | FDAまたは適用される外国の規制機関は、製品の安全性または有効性を監視するために、追加の臨床試験または高価な上場後試験および監視を必要とする可能性がある | |
| ● | この製品の売上高は大幅に低下する可能性がある | |
| ● | 私たちは起訴され、患者への傷害に責任を負うかもしれない | |
| ● | 私たちのブランドと名声は影響を受けるかもしれない。 |
不良副作用または他の以前に未知の問題に起因する上記のイベントは、私たちまたは私たちの潜在的パートナー が影響を受けた候補製品に対する市場の受け入れを達成または維持することを阻止する可能性があり、私たちの候補製品の商業化コスト を大幅に増加させる可能性がある。
私たち は製品責任リスクに直面する可能性があります。もし私たちのクレームが成功すれば、私たちがこれらのクレームに提供する保険 のカバー範囲が十分でなければ、私たちは重大な責任を招く可能性があります。
私たちの候補製品の臨床テストのため、私たちは固有の製品責任リスクに直面しています。もし私たちがどんな製品を商業化すれば、私たちはもっと大きなリスクに直面します。製品がFDAによって商業販売のために承認され、FDAまたは適用される外国規制機関の許可および規制された施設で生産されても、このようなリスクは存在する。私たちの製品と候補製品 は重要な身体機能と過程に影響を与えることを目的としています。私たちの候補製品に関連するどんな副作用、製造欠陥、誤用、または乱用は、患者の負傷や死亡を招く可能性がある。私たちが将来製品責任訴訟に直面しないことを保証することもできませんし、私たちの保険カバー範囲がこのような状況での私たちの責任をカバーするのに十分であることを保証することもできません。
また、私たちの候補製品がただダメージを与えているように見えても、私たちに責任を請求する可能性があります。製品br消費者、ヘルスケア提供者、製薬会社、または他の販売、または他の方法で私たちの候補製品と接触した人は、私たちに責任を請求する可能性があります。もし私たちが製品責任クレームを自己弁護することに成功できなければ、私たちは重大な責任と名声の損害を招くだろう。さらに、製品責任クレームは、是非曲直や最終結果にかかわらず、以下のようになる可能性がある
| ● | 臨床試験参加者は脱退しました | |
| ● | 臨床試験場所や試験項目全体を中止し | |
| ● | 私たちの候補製品に対する規制部門の承認を得ることができません | |
| ● | 私たちの候補品を商業化することはできません | |
| ● | 私たちの候補製品への需要を減らしました | |
| ● | 営業権が損なわれる; | |
| ● | 製品 のリコールまたは市場からの撤回、またはラベル、マーケティング、または販売促進制限; | |
| ● | 関連した訴訟や同様の紛争の巨額の費用 | |
| ● | 経営陣の関心と他の資源を私たちの主要業務から分離します | |
| ● | 私たちの患者または他のクレーム者に保険範囲内にない可能性のある巨額の金銭賠償を支払う;または |
| ● | 収入損失 。 |
| 26 |
私たち は現在製品責任保険範囲を維持していますが、これは私たちの製品責任に関連するすべての費用 または損失をカバーするのに十分ではないかもしれません。私たちが受ける可能性のあるいかなる費用や損失も含まれていないかもしれません。さらに、保険範囲はますます高くなり、将来、私たちは製品責任による損失から私たちを保護するために、合理的なコスト、十分な金額、あるいは十分な条項で保険範囲を維持できないかもしれない。もし私たちの候補製品が規制機関の承認を得たら、私たちは私たちの製品責任保険 を増加させる必要があり、これは高価になり、私たちは商業的に合理的な条項で増加した製品責任保険 を得ることができないか、あるいは全く得られないかもしれない。成功した製品責任クレームあるいは私たちに対する一連のクレームは私たちの株価を下落させる可能性があります。もし判決が私たちの保険範囲を超えたら、私たちの現金を減少させ、私たちの業務、財務状況、経営業績と将来性を損なう可能性があります。
もし私たちの任意の候補製品が発売を許可され、私たちは不正な方法でラベル外用途を普及させることが発見された場合、あるいは医者が私たちの製品を乱用したり、ラベルの外で私たちの製品を使用したりすれば、私たちは製品販売やマーケティングの禁止、製品責任クレームと巨額の罰金、処罰と制裁を受ける可能性があり、私たちのブランドと名声は損なわれる可能性があります。
FDAおよび他の規制機関は、医薬品および生物製品に関するマーケティングおよび販売促進声明を厳格に規範化する。特に、製品は、FDAまたは他の規制機関によって許可されていない用途または適応に使用されてはならない。製品が承認されたラベルに反映されているように、直接比較された臨床データがなければ、相対安全性または有効性宣言を行うことはできない。もし私たちが任意の候補製品のラベル外使用を普及させることが発見された場合、私たちは警告または無タイトル手紙を受け取り、重大な責任を負うことができ、これは私たちの業務に実質的な損害を与えるだろう。連邦政府も州政府も不正販売促進の疑いのある会社に巨額の民事と刑事罰金を科し、いくつかの会社がラベル外販売促進に従事することを禁止している。もし私たちが私たちのマーケティングと販売促進慣行に基づくこのような調査または起訴の目標になれば、私たちは同様の制裁に直面する可能性があり、これは私たちの業務に実質的な損害を与えるだろう。また、経営陣の注意は私たちの業務運営から移行する可能性があり、巨額の法的費用が発生し、私たちのブランドや名声を損なう可能性があります。FDAはまた、企業に同意法令または永久禁止を締結し、これらの法令または永久禁止に基づいて、特定の販売促進行為を変更または制限することを要求する。もし私たちがFDAによってラベルの外で使用されて私たちの製品を普及させると認定されたら、私たちは無見出しの手紙、警告状、禁止、差し押さえ、民事罰金、刑事罰を含むFDA規制または法執行行動の影響を受けるかもしれない。他の連邦、州、または外国の法執行機関が、私たちの業務活動が普及ラベルの外使用を構成していると考えている場合、刑事、民事または行政処罰、損害賠償、罰金、返還、政府医療計画から除外され、私たちの業務を削減または再編成するなどの重大な処罰を招く可能性もあります。
しかし,われわれbrは医師が彼や彼女が適切と考えている場合に,これらの適応以外に我々の候補製品を使用することを阻止することはできない。医師はまた、私たちの候補製品を乱用したり、不適切な技術を使用したりする可能性があり、不良結果、副作用或いは傷害を招く可能性があり、それによって製品責任クレームを招く可能性がある。もし私たちの製品br候補製品が誤用されたり、不適切な技術が使用されたりすれば、私たちは医者や彼らの患者から高価な訴訟を受けるかもしれない。また,FDAで承認された適応以外に我々の候補製品を使用するとこのような疾患を有効に治療できない可能性があり,医師や患者における私たちの名声を損なう可能性がある。
私たち は、開発中または承認後のいつでも、私たちの任意の候補製品を開発または商業化しないことを選択することができ、これは、これらの候補製品に対する私たちの潜在的な投資リターンを減少または除去することになります。
いつでも、私たちは様々な理由で、私たちの製品を時代遅れにする新しい技術、競争相手製品からの競争、または適用される法規要件を変更または遵守しないことを含む、任意の候補製品の開発を停止するか、または承認された1つまたは複数の候補製品を商業化し続けることを決定することができるかもしれない。もし私たちが大量の資源を投入した計画 を終了すれば、私たちは投資から何の見返りも得られず、私たちはこれらの資源を潜在的により効率的な用途に割り当てる予想される機会 を逃すだろう。
| 27 |
私たちの現在と未来のパートナーは、私たちの現在と未来のパートナーが製品リコールの影響を受ける可能性があり、これは私たちのブランドと名声を損なう可能性があり、 は私たちの業務に負の影響を与えるかもしれない。
もし私たちの候補製品が発売を許可され、規格に適合していない場合、または怪我や病気を引き起こすと考えられている場合、または製造、ラベル、販売促進、販売または流通に関連する法規を含むbr政府法規に違反していると告発された場合、私たちbr、または私たちの現在および潜在的なパートナーは、製品のリコール、撤回、または差し押さえの影響を受ける可能性がある。将来のいかなるリコール、撤回、または差し押さえは、消費者が私たちのブランドの自信に重大なマイナス影響を与える可能性があり、私たちが許可した製品に対する需要の減少を招く可能性がある。また、私たちが承認した任意の製品のリコール、撤回、または差し押さえには、経営陣の高い関心が必要となり、巨額と予期せぬ支出を招き、私たちの業務、財務状況、運営結果を損なう可能性があります。
もし私たちまたは私たちが協力する可能性のある任意のパートナーが、私たちの規制によって承認された任意の候補製品、または商業化された任意の製品の達成を求め、カバー範囲と十分な精算レベルを維持できない場合、彼らの商業的成功は深刻に阻害される可能性がある。
処方によってしか得られない任意の候補製品について、私たちまたは私たちが協力する可能性のある任意のパートナーの成功的な販売は、第三者支払者が保険を提供し、十分な精算を提供するかどうかに依存する。病状を治療するために処方された患者は通常,第三者支払者によってbr処方薬に関する費用の全部または一部を精算する。政府医療計画(MedicareやMedicaidなど)や個人第三者支払者が提供する保険範囲と十分な精算は、新製品の受け入れ度に重要である。カバー範囲の決定は臨床および経済基準に依存する可能性があり、より成熟またはより低コストの治療代替案が利用可能である場合、またはその後に利用可能である場合、これらの基準は新薬製品をサポートしない。もし私たちの候補製品が魅力的な効能プロファイルを示さなければ、彼らは保険と精算を受ける資格がないかもしれません。特定の製品の保険を受けても,それによる精算支払率が十分でない可能性があり,あるいは患者が受け入れられないと考えて受け入れられないほど高い共同支払いが必要である可能性がある。患者は私たちの製品を使用する可能性がありません。保険を提供しなければ、私たちの製品の大部分のコストを支払うのに十分な費用を精算します。
また、私たちの候補製品の市場は、第三者支払者の薬物処方や第三者支払者が保証と精算の薬物リストを提供することに大きく依存するだろう。業界競争はこのような 配合に組み入れられ、よく製薬会社に下行定価圧力をもたらす。さらに、価格の低い模倣薬または他のbr代替品がある場合、第三者支払者は、その処方に特定のbrブランド薬を含むことを拒否するか、または他の方法で患者のブランド薬の使用を制限することができる。
また,第三者支払者は,海外でも国内でも,政府的にも商業的にも,ますます複雑な方法を開発して医療コストを抑えている。また,米国では,個人第三者支払者は連邦医療保険に従う傾向にあるにもかかわらず,第三者支払者間には統一された薬品保険や精算政策がない。そのため、薬品br製品の保証範囲と精算範囲は支払人によって異なる。そのため、保証範囲の確定過程は通常時間がかかり、コストの高い過程であり、各支払人にそれぞれ科学と臨床支持を提供し、著者らの候補製品を使用する必要があり、保証範囲と十分な精算を保証することができない。
また,将来の保険や精算は米国や国際市場でより多く制限される可能性があると考えられる。私たちが規制承認を受ける可能性のある任意の候補製品の第三者保険および精算は、米国や国際市場で十分な補償を受けることができないか、または十分な補償を受けることができない可能性があり、これは私たちの業務、財務状況、運営業績、および将来性を損なう可能性がある。
最近発表された医療と未来の医療は政府による価格設定や精算の制限を含む立法や規制改革措置は、上場承認の難しさやコストを増加させる可能性があり、私たちの業務や運営結果に悪影響を及ぼす可能性がある。
アメリカと一部の外国司法管轄区では、すでに医療保健システムに関する多数の立法と法規変更及び 提案された変更が継続され、これらの変更は候補製品の上場承認を阻止或いは延期し、承認後の活動を制限或いは監督し、そして利益方式でマーケティング審査を獲得した候補製品を販売する能力に影響を与える可能性がある。
立法と規制brは、薬品の承認後の要求を拡大し、販売と販売促進活動を制限することを提案します。 私たちは、より多くの立法変更が公布されるかどうか、あるいはFDAの法規、ガイドライン、解釈が変更されるかどうか、あるいはこれらの変更が私たちの候補製品の発売承認にどのような影響を与えるかもしれません。また、アメリカ議会がFDA審査手続きの審査を強化することは上場承認を大幅に延期或いは阻止する可能性があり、そして私たちはより厳格な製品ラベルと発売後のテスト及びその他の要求の影響を受ける可能性がある。
| 28 |
米国では,連邦医療保険現代化法案またはMMAに基づき,連邦医療保険D部は個人保険会社が提供する処方薬計画を承認·補助することにより,高齢者や障害者に外来処方薬保険を提供する。MMAはまたMedicare D部分処方薬計画使用処方を許可し、そこで彼らは任意の治療カテゴリがカバーする薬物数を制限することができる。 第D部分はその処方チップを使用して薬品メーカーのリベートおよび他の価格優遇を交渉することを計画している。同様にMMAでは、連邦医療保険B部分は、薬品の平均販売価格に基づいて高齢者および障害者に医師が管理する薬物を提供する保険であり、この価格は規制要求に基づいて計算され、メーカーは四半期ごとに連邦医療保険に報告する。連邦医療保険計画を管理する機関連邦医療保険·医療補助サービスセンター(CMS)、br}は、連邦医療保険B部分およびD部分における薬品コストを低減するために、立法、法規または他の措置を時々考慮する。例えば、ACAによると、薬品メーカーは受益者 がMedicare Part Dが保証不足にある時、ブランド薬品の処方に50%の割引を提供することを要求され、この切り欠きは“ドーナツ切り欠き”とも呼ばれる。MMAにおいてCMSがMedicare市場シェアを利用してより大きなD部分返金を交渉することを許可するbr}不介入条項を廃止することが提案されている。 さらにコストを下げることは、候補薬物に提供する保険範囲と価格を低下させる可能性があり、私たちの業務 を深刻に損なう可能性がある。個人支払者は,自己の精算料率を設定する際には通常連邦医療保険の保証政策や支払い制限に従っており,連邦医療保険計画によるいかなる精算減少も個人支払者の支払いの類似減少を招く可能性がある。
“2010年患者保護·平価医療法案”(ACA)は、医療保険のカバー面を拡大し、医療支出の増加を減少または制限することを目的としている。また、“平価医療法案”は、ブランド処方薬製品を生産または輸入した会社に高額な年会費を徴収する。それはまた、薬品メーカーが州医療補助計画に支払わなければならない税金還付金額を増加させ、管理された医療補助使用に対する医療補助還付の支払いを要求し、ブランド製品の固体経口剤形(例えば徐放製剤)の追加税金還付を増加させた。この法律には、詐欺やコンプライアンスや透明性に影響を与える多くの条項も含まれており、医療従事者とともに私たちの業務実践を修正し、コンプライアンスを確保するために多くのコストを発生させる必要があるかもしれません。
米国や他の地方のbr政策立案者や支払者の中で,医療システムの変革を推進することに大きな興味があり,その既定目標は医療コストの抑制,質の向上,および/または参入拡大である。アメリカでは、製薬業界はこれらの努力の重点であり、重大な立法計画の重大な影響を受けてきた。
例えば,米国では,ACAは政府や民間保険会社が医療に資金を提供する方式 を大きく変え,製薬業に大きな影響を与えている。ACAの多くの条項は生物製薬業界に影響を与え、 生物製薬製品がMedicare Part BとMedicaid計画に基づいて連邦補償を獲得するため、あるいはアメリカ政府機関に直接販売するために、メーカーは公共衛生サービス法(PHS)に基づいて薬品定価のbr計画に参加する資格のある実体に割引を提供しなければならない。公布以来、司法と国会はACAのいくつかの側面に疑問と改正を提起してきた。ACAの実施には、ACAのさらなる改正の可能性、およびACAの法的挑戦またはACAの廃止への努力を含む不確実性が依然として存在する。
また,ACAが公布されて以来,米国では製薬業に影響を与える他の立法改正が提案され採択された。例えば、“2022年インフレ率低減法案”には、CMSが毎年限られた数の高コストであることを許可する条項、単一源の薬物brが“最高公平価格”を交渉すること、および製薬会社がインフレよりも価格上昇が速い場合に連邦医療保険にリベートを支払うことを要求する条項が含まれている。また,各州は法律を通過または検討しており,製薬会社に値上げ前に通知し,値上げに理由を提供することを求めている。将来的にはより多くの医療改革措置がとられることが予想され,いずれも連邦や州政府が医療製品やサービスに支払う金額を制限する可能性があり,さらにいくつかの開発プロジェクトの予想価値 を著しく低下させ,収益性を低下させる可能性がある。
処方薬や生物製品コストの上昇を受けて、米国政府も薬品定価のやり方の審査を強化している。このような審査は最近のいくつかの国会調査を招き、連邦と州立法を提出し、公布し、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、br政府計画製品の精算方法を改革することを目的とした。連邦レベルでは、現在退任しているトランプ政権は多くの処方薬のコスト抑制措置を提案している。同様に、バイデン新政府も処方薬の価格を下げることを最優先課題の一つとしている。バイデン政府はまだ具体的な計画を提出していないが、これらの計画は近いうちに発表されると予想される。州レベルでは、立法機関はますます多くの立法と実施を通じて、価格或いは患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示と透明性措置を含む薬品と生物製品の定価を制御するための法規を制定し、実施しており、場合によっては、他の国からの輸入とbrの大量調達を奨励することを目的としている
その他の変更を提案する例としては,承認後の要求の拡大,孤児薬品法の変更,薬品の販売制限や販売促進活動に限定されないがあげられる.私たちは、追加の立法変更が公布されるかどうか、あるいは政府法規、ガイドライン、解釈が変更されるかどうか、あるいはそのような変更が私たちの候補薬物や製品(ある場合)の発売承認、販売、定価、または精算にどのような影響を与えるかを確認することができません。私たちは、これらのbrと将来取られる可能性のある他の医療改革措置が、より厳しいカバー基準をもたらす可能性があり、私たちが受け取った任意の承認された薬物の価格に追加的なダウン圧力をもたらす可能性があると予想している。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト制御措置や他のbr医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの薬品の商業化を阻止するかもしれない。
| 29 |
さらに、FDAは、我々の業務および製品に大きな影響を与える可能性がある方法でFDA法規およびガイドラインを修正または再解釈する可能性がある。任意の新しい法規またはガイドライン、または既存の法規またはガイドラインの修正または再解釈は、現在または将来の任意の候補製品に追加コストを適用するか、またはFDAの審査時間を延長する可能性がある。法規、法規、政策、あるいは解釈が発表、実施、または採用時の変化 が将来私たちの業務にどのように影響するかを決定することはできません。 このような変化は必要かもしれません
| ● | 承認を得る前に追加の臨床試験を行う; | |
| ● | 製造方法 ; | |
| ● | 1つ以上の製品のリコール、交換、または生産停止; | |
| ● | その他 記録保存. |
このような 変更には時間がかかり、大きなコストをもたらす可能性があり、あるいは私たちの候補製品の潜在的なビジネス価値 を低下させる可能性があります。さらに、他の製品の規制許可や承認を遅延させたり、取得できなかったりすることは、当社の業務、財務状況、および運営結果を損なうことになります。
私たちbrはまた医療法律、法規、法執行の制約を受ける可能性があり、私たちがこれらの法律を守らなければ、私たちの業務、運営、財務状況に悪影響を及ぼす可能性がある。
詐欺と乱用と患者の権利に関連するいくつかの連邦と州医療保健法律法規は現在も将来も私たちの業務に適用されている。私たちは連邦政府と私たちまたは私たちのパートナーが業務を展開する州の規制を受けています。br}は私たちの運営能力に影響を与える可能性のある法律と法規に含まれています
| ● | 他の事項に加えて、任意の個人または実体が、知られている場合および意図的な場合に任意の報酬(任意のリベート、賄賂またはリベートを含む)を提供、請求、受領または提供することを禁止し、直接または間接的に、現金または実物の形態で個人の推薦または購入、レンタルまたは注文を誘導し、任意の商品、施設またはサービスを提供、または注文することを禁止し、連邦医療保険および医療補助計画などの連邦医療保健計画に従ってすべてまたは一部の費用を支払うことができる連邦“リベート条例”である | |
| ● | 連邦民事および刑事虚偽申告法および民事金銭罰法は、例えば、連邦医療保険および医療補助計画、br虚偽または詐欺的な支払いクレーム、または虚偽陳述によって連邦政府に金銭を支払う義務を回避、減少または隠蔽することを含む連邦政府の提出または提出を含む民事通報者または準訴訟を含む個人または実体に対して刑事および民事処罰を実施する連邦民事虚偽申告法を含む | |
| ● | 1996年に“連邦健康保険携行性と責任法案”(HIPAA)は、支払人(例えば、公共または個人)が知らず、故意に詐欺の任意の医療福祉計画を実行または実行しようとする計画を知り、または実行しようとすることを禁止し、または虚偽または詐欺的な言い訳によって、任意の医療福祉計画が所有または管理または制御された任意の金銭または財産を得ることを禁止する新しい連邦刑事法規を制定し、支払人(例えば、公共または個人)が知らず、故意に医療福祉計画を流用または盗み取ることを禁止する。医療犯罪に対する刑事調査を故意に阻害し、医療事項に関連する医療福祉、プロジェクトまたはサービスの交付または支払いの重大な事実を故意に偽造、隠蔽または隠蔽し、または任意の重大な虚偽の陳述を行うことを知っている | |
| ● | HIPAAは、“経済·臨床健康情報技術法案”及びその実施条例により改正された“HIPAA”は、個人が健康情報を識別できるプライバシー、安全及び伝送を保護する上で、医療保健提供者、健康計画及び医療情報交換所を含む保証実体及びそのそれぞれのビジネスパートナーに対して、プライバシー保護、安全、個人識別可能な健康情報の伝送を義務化している | |
| ● | “平価医療法案”に規定されている連邦医師陽光要求は、薬品、設備、生物製品および医療用品のメーカーが、医師および教育病院に提供される価値の支払いおよび他の移転に関する情報、ならびに医師およびその直系家族が所有する所有権および投資権益を毎年医療保険および医療補助サービスセンターに報告することを要求する | |
| ● | 州法は、任意の第三者支払人(商業保険会社を含む)によって精算される物品またはサービスに適用される可能性がある反リベートおよび虚偽クレーム法律のような上記の各連邦法律と同等であり、州法律は、製薬会社が製薬業界の自発的コンプライアンスガイドラインおよび連邦政府によって公布された適用コンプライアンスガイドラインを遵守することを要求するか、または医療保健提供者および他の潜在的な転換源に提供される可能性のある支払いを他の方法で制限することを要求する。Br州法律は、医薬品製造業者に、医療提供者への支払いまたは他の方法での価値またはマーケティング支出に関する情報を報告することを要求し、場合によっては健康情報のプライバシーおよび安全を管理する州法を要求し、その中の多くの法律は、互いに大きく異なり、同じ効果を生じず、コンプライアンス作業を複雑化させる可能性がある。 |
| 30 |
これらの法律の広さと、法定例外と利用可能な安全港の狭さのために、私たちのいくつかの商業活動は、1つ以上のそのような法律の挑戦を受けるかもしれない。しかも、最近の医療改革法案はこのような法律を強化した。例えば、“平価医療法案”などは、連邦“反リベート法規”やある医療詐欺刑事法規を改正する意図的な要求をしている。個人や実体はこれ以上法規や法規違反の具体的な意図を理解する必要がない。また,“平価医療法案”では,政府は連邦民事虚偽クレーム法案の規定に基づき,連邦反リベート法規違反による物品やサービスのクレームが虚偽または詐欺的クレームを構成することを主張することができると規定している。
このような法律を達成して持続的に遵守することは費用が高いことが証明されるかもしれない。また、私たちのこれらの法律違反に対するいかなる行為も、私たちのbrが防御に成功しても、巨額の法的費用を発生させ、私たちの経営陣の注意を私たちの業務のbr運営から移行させる可能性があります。私たちの業務が上記の任意の法律または私たちに適用される任意の他の政府の法律または法規に違反していることが発見された場合、私たちは、行政、民事および刑事罰、損害賠償、罰金、返還、連邦および州医療計画から除外され、個人監禁または削減または再編を含む罰を受ける可能性があり、これらは、私たちの業務運営能力および私たちの財務業績に悪影響を及ぼす可能性があります。
私たちの業務は危険材料の使用に関連しており、私たちと私たちの第三者サプライヤーと製造業者は環境の法律と法規を守らなければなりません。これらの法律と法規はコストが高く、私たちの業務方式を制限しなければなりません。
私たちの第三者サプライヤーと製造業者の製造活動は、私たちの候補製品の構成要素と他の危険化合物を含む、私たちが持っている危険材料の制御された貯蔵、使用、および処置に関する。私たちと私たちの製造業者およびbrサプライヤーは、これらの危険材料の使用、製造、貯蔵、処理および処理に関する法律法規によって制限されています。場合によっては、これらの危険材料および使用中に発生した様々な廃棄物は、私たちのサプライヤーまたは製造業者のbr施設に貯蔵され、使用と処分を待っています。私たちと私たちのサプライヤーと製造業者は汚染リスクを完全に除去することができません。これは私たちの商業化努力、研究開発努力、業務運営中断を招き、私たちのサービスプロバイダや他の人に被害を与え、環境破壊をもたらし、高価な清掃作業を招き、これらの材料と指定廃棄物の使用、貯蔵、処理、処理を管理する適用法律と法規に基づいて責任を負う可能性があります。我々の第三者サプライヤーと製造業者がこれらの材料を処理して処理するための安全なbr手続きは通常これらの法律法規に規定された基準に適合していると信じているが、私たちは確かにそうであることを保証することはできず、これらの材料の意外な汚染や傷害リスクを除去することもできない。この場合、私たちはそれによって生じるいかなる損害にも責任を負わなければならないかもしれないが、このような責任は私たちの資源範囲を超える可能性がある。私たちは現在生物や危険廃棄物保険を受けていない。
私たちのbr従業員、独立請負業者、主要な調査者、コンサルタント、サプライヤー、CRO、私たちが協力する可能性のある任意のパートナー は、規制基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります。
私たちの従業員、独立請負業者、主要な調査者、コンサルタント、サプライヤー、CRO、私たちが協力する可能性のある任意のパートナー は、詐欺または他の不正活動に従事する可能性があるリスクに直面しています。これらの人員の不正行為は、意図的、無謀または不注意な行為、または以下の法律または法規に違反する不正な活動を含む可能性がある:FDAまたは外国の規制機関に真、完全かつ正確な情報を報告することを要求する法律、製造基準、連邦、州およびbr}外国医療詐欺および法律およびデータプライバシーの乱用、または財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む。特に、医療業界の販売、マーケティング、その他の業務配置は、詐欺、リベート、自己取引、その他の乱用を防止するための広範な法的制約を受けている。これらの法律は、研究、製造、流通、定価、割引、マーケティングおよび販売手数料、販売手数料、顧客インセンティブ計画、および他の商業計画を含む広範な商業活動を制限または禁止する可能性がある。これらの法律の制約を受けた活動はまた、臨床試験過程で得られた情報の不適切な使用、または薬品の不法流用に関連し、これは規制制裁やbrがこのような法律や法規を遵守できないことによる他の行動や訴訟を招き、私たちの名声を深刻に損なう可能性がある。また、連邦調達法は政府契約に関連する不当な行為を実質的に処罰し、一部の請負業者に商業道徳と行為準則を維持することを要求する。もし私たちにこのような訴訟を提起し、私たちが私たちの権利を弁護または維持することに成功しなかった場合、これらの訴訟は、民事、刑事および行政処罰、損害賠償、罰金、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、契約損害、名声損害、利益および将来の収益の減少、および業務削減brを含む私たちの業務に大きな影響を与える可能性があり、これらはいずれも私たちの業務運営能力と私たちの経営業績に悪影響を及ぼす可能性がある。
| 31 |
実際に または適用される雇用法律や法規を遵守していないと告発された場合、運営変革が必要となる可能性があり、私たちの競争地位を破壊したり、私たちの業務に他の重大な悪影響を与えたりする可能性がある。
私たちの業務は様々な雇用法律法規に制約されており、将来的にはこのような要求に制約される可能性があります。 私たちは適用された雇用法律法規を実質的に遵守していると考えていますが、需要が変化すると、このような法律法規の遵守を維持するために、私たちの運営や利用資源の改正を要求される可能性があります。また、私たちは将来、いわゆる雇用差別、従業員分類と関連控除、賃金工数紛争、労働基準またはbr}医療と福祉問題を含む、個人訴訟、集団訴訟、政府法執行訴訟など、様々な雇用関連クレームに直面する可能性がある。このようなクレームは、その有効性にかかわらず、我々の業務、財務状況、キャッシュフロー、または他の経営結果に重大な悪影響を及ぼす可能性がある。
私たちの将来の成長は海外市場に進出する能力にある程度依存しており、そこでは追加の規制負担や他のリスクや不確実性の影響を受ける。
私たちの将来の収益性は候補品を海外市場で商業化する能力にある程度依存し、第三者との協力に依存するつもりです。VAR 200またはIC 100または他の候補製品を海外市場で商業化すれば、私たちは追加のリスクと不確実性に直面するだろう
| ● | 私たちのbr顧客は海外市場で私たちの候補製品のために市場参入と適切な精算を得ることができます | |
| ● | 私たちは第三者に依存しているので、ビジネス活動を直接統制することはできません | |
| ● | 複雑で変化の多い外国の監督管理、税務、会計、法律要求の負担を遵守する | |
| ● | 外国の異なる医療実践と風習は市場受容度に影響を与える | |
| ● | 輸入または輸出許可要件; | |
| ● | 売掛金入金時間が長い ; | |
| ● | 出荷の納期がもっと長い; | |
| ● | 言語障害 技術訓練; | |
| ● | 海外の一部の国の知的財産権の保護を減少させる | |
| ● | 外国通貨の為替レートの変動 | |
| ● | 契約紛争が発生した場合、外国の法律によって管轄される契約条項の解釈。 |
私たちの候補製品の海外販売は、政府規制、政治的、経済的不安定、貿易制限、関税変化の悪影響を受ける可能性もあり、いずれも私たちの運営結果に悪影響を及ぼす可能性があります。
業務と特殊な目的で買収会社が合併するため、規制義務が私たちに与える影響は他の上場会社とは異なる可能性がある。
私たちのbrは、特別な目的買収会社Larkspurとの業務合併を完了することで上場企業になります。 業務合併とそれによって考慮された取引により、私たちの規制義務は、他の上場企業とは異なる影響を与え続ける可能性があります。例えば、米国証券取引委員会や他の規制機関は、追加的な指導意見を発表したり、我々のようにSPAC業務との合併を完了した企業のさらなる規制審査を行う可能性がある。このようなすでに発展して発展し続ける可能性のある規制環境を管理することは、私たちの業務運営に対する管理層の関心を分散させる可能性があり、必要に応じて追加資本を調達する能力に悪影響を与えたり、私たちの普通株価格に悪影響を与えたりする可能性がある。
私たちbrは自然災害と人為的災害、流行病、悪意とテロ行為のリスクに直面しており、これらのリスクは私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性がある。
自然と人為的災害,流行病および悪意やテロによるリスクは,我々の行動結果に実質的な悪影響を及ぼす可能性がある。これらのリスクを識別·緩和する措置を講じているが,このようなリスクは予測できず,完全に防止することもできない。さらに、このようなイベントは、全体的なマクロ経済変動、特に広範囲の地理的地域の経済活動の減少または停止をもたらす可能性があり、これらの地理的地域内のビジネスマーケティングまたは運営または全体的な経済環境に悪影響を与え、さらには、私たちの業務、運営、および財務状況に悪影響を及ぼす可能性がある。
特に、すでに世界保健機関によって世界大流行と発表された新冠肺炎疫病はアメリカと全世界の金融市場と経済状況に重大なマイナス影響を与えた。したがって,我々の運営は, を受け,さらに負の影響を受ける可能性がある.したがって、私たちの業務、財務状況、運営結果は影響を受けており、さらなる重大な悪影響を受ける可能性がある。
| 32 |
グローバル経済とサプライチェーンの中断は、我々の業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
2020年と2021年の世界経済への干渉はグローバルサプライチェーンを阻害し、納期の延長を招き、重要なコンポーネントコストと運賃を増加させた。私たちは、業務を展開する第三者と密接に協力することで、納期内にこれらの中断の影響を最小限に抑え、コストを増加させる措置を取らなければならないかもしれない。グローバル経済への影響を最小限に抑えるための行動をとっているか、あるいは行動しなければならないにもかかわらず、グローバル·サプライチェーンで予見できない未来の事件が、私たちの業務、財務状況、運営結果に大きな悪影響を与えないことは保証されない。
また,インフレは臨床試験コスト,候補製品の研究開発コスト,業務展開の管理やその他のコストを増加させ,我々に悪影響を与える。私たちは労働力価格と他の事業を展開する費用が上昇する状況に直面するかもしれない。インフレの環境では、コスト増加は私たちの予想を超える可能性があり、現金や他の流動資産を使用する速度は予想よりも速くなるかもしれない。このような状況が発生した場合、私たちは私たちの運営に資金を提供するために追加資本を調達する必要があるかもしれないが、これらの資金は十分な金額や合理的な条項を得ることができない可能性があり、もしあれば、予想よりも早くなるかもしれない。
経済的不確実性を含む不利な世界環境は、私たちの財務業績に悪影響を及ぼす可能性がある。
世界的な状況、金融市場の混乱、税制改革が米国に与えるいかなる負の財務影響や既存の貿易協定や税務慣行の変更も、私たちの業務に悪影響を及ぼす可能性がある。
さらに、世界のマクロ経済環境は、新冠肺炎または他の流行病や流行病、世界経済市場の不安定、米国の増加した貿易関税と他国との貿易紛争、グローバル信用市場の不安定、サプライチェーンの弱さ、英国のEU離脱による地政学的環境の不安定、ロシアのウクライナ侵入とその他の政治的緊張、外国政府債務への懸念などの負の影響を受ける可能性がある。これらの課題はすでに現地経済と世界金融市場で不確実かつ不安定をもたらし続けている可能性がある。
我々の第三者依存に関するリスク
我々 は過去に依存しており,引き続き第三者CROと他の第三者に依存して我々の臨床 試験や製品開発の他の側面を実施·監督することが予想される。もしこれらの第三者が私たちの要求を満たしたり、要求に従って試験を行ったりしなければ、私たちは私たちの契約義務を履行できないかもしれないし、監督部門の私たちの製品に対する承認を得ることができないし、私たちの候補製品を商業化することもできないかもしれない。
我々 は過去に依存しており,引き続き第三者CROに依存して我々の臨床試験や製品開発の他の側面 を行って監督する予定である。著者らはまた異なる医療機関、臨床研究者と契約実験室に依存して、著者らの臨床規程とすべての適用された法規要求に基づいて著者らの試験を行い、FDAの法規とGCPを含み、これは患者の権利と健康を保護するための国際標準であり、臨床試験発起人、管理者と監督者の役割、及び薬品と生物製品の処理、貯蔵、安全と記録保存を管理する国家法規を定義した。これらのCROと他の第三者はこれらの試験を行い、その後臨床試験からデータを収集と分析する上で重要な役割を果たしている。私たちはこれらの方面に深刻に依存して、私たちの臨床試験と前臨床研究を実行し、そして彼らの活動のいくつかの方面だけを制御する。我々および我々のCROおよび他の第三者請負者は、臨床開発における製品に対してFDAおよび同様の外国規制機関が実行する法規およびガイドラインであるGCP、GLP、およびGACP要件を遵守しなければならない。規制機関は,試験スポンサー,主要調査員,試験地点を定期的に検査することで,これらのGCP,GLP,GACP要求を実行する。私たちまたはこれらの第三者のいずれかが適用されるGCP、GLP およびGACP要件を遵守できない場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDAまたは他の規制機関 は、私たちまたはパートナーのマーケティング申請を承認する前に追加の臨床試験を行うことを要求することができる。特定の規制機関が検査を行った後、この規制機関は、私たちの任意の臨床または前臨床試験が適用されるGCPおよびGLP要求に適合していることを確認することを保証することはできません。また,われわれの臨床試験は通常cGMP規定により生産された製品を用いて行われなければならない。私たちはこれらの法規と政策を守らないで、私たちは臨床試験を繰り返す必要があるかもしれません。これは規制の承認過程を遅延させます。
私たちのCROは私たちの従業員ではなく、私たちは彼らが私たちの臨床試験に十分な時間と資源を投入するかどうかを制御できない。私たちのCROはまた、私たちの競争相手を含む他の商業実体と関係があるかもしれません。彼らはまだこれらの実体のための臨床試験または他の薬物開発活動を行っているかもしれません。これは私たちの競争地位を損なうかもしれません。私たちは、CROが私たちの知的財産権を不正に開示したり、私たちの知的財産権を流用したりするリスクに直面しており、これは、私たちのビジネス秘密保護を低下させ、私たちの潜在的な競争相手が私たちのノウハウにアクセスし、利用することを可能にするかもしれません。もし私たちのCROがその契約の義務や義務を成功裏に履行できなかった場合、brは予想された期限内に達成できなかった場合、あるいは彼らが得た臨床データの品質や正確性が私たちの臨床方案や法規の要求または任意の他の原因を遵守できなかった場合、私たちの臨床試験は延長、延期、またはbrによって終了する可能性があり、私たちは規制部門の私たちが開発した任意の候補製品の承認を得ることができず、それを商業化することに成功しない可能性がある。したがって、私たちが開発した任意の候補製品の財務業績や商業見通しが損なわれる可能性があり、私たちのコストが増加する可能性がある。私たちが収入を作る能力は延期されるかもしれない。
もし私たちのいかなるCRO或いは臨床試験サイトがいかなる原因で私たちの臨床試験に参加することを中止したら、私たちは他のCRO或いは臨床試験サイトと手配を達成できないかもしれない、あるいは商業的に合理的な条項でそうする。また,臨床試験サイトとの関係が終了すると,われわれが行っている臨床試験に登録されている患者の後続情報が失われる可能性があり,これらの患者の看護を別の適格な臨床試験サイトに移行することができない限りである。また、著者らの臨床試験の首席研究員は時々私たちの科学顧問或いは顧問を担当することができ、そしてこのようなサービスに関連する現金或いは持分補償を得ることができる。これらの関係と任意の関連する賠償が知覚的または実際の利益の衝突をもたらす場合、FDAは、適用される臨床試験地点で生成されたデータの完全性を疑問視する可能性がある。
| 33 |
私たちのbrは完全に第三者請負業者が私たちの候補製品の供給、製造、流通の臨床薬物供給に完全に依存して、brのある独占的なサプライヤーとメーカーを含み、もし私たちの任意の候補製品が監督管理の承認を得たら、私たちは第三者に頼って商業供給、製造と流通を行うつもりで、もし私たちの任意の候補製品が監督管理の承認を得たら、私たちは第三者の供給、製造と流通の任意の未来の候補製品の臨床前、臨床と商業供給に依存すると予想される。
我々のbrは現在はなく,臨床前,臨床あるいは商業数量の薬物物質や製品を供給,製造または流通するインフラや能力を得るつもりもない。私たちが候補製品を開発する能力は私たちが候補製品を開発する能力に依存し、私たちが商業的に私たちの製品を供給する能力は、私たちが第三者から私たちの候補製品に使用する原材料と原料薬、その他のbr物質と材料を成功的に獲得できるかどうかにある程度依存し、法規の要求に基づいて第三者から完成品brを製造し、臨床前と臨床試験と商業化を行う。もし私たちがこれらの第三者と供給関係を発展させ、維持することができなければ、私たちは私たちの候補製品を開発したり商業化したりすることができないかもしれない。
私たち は、その供給材料またはその 生産の完成品の唯一の供給源として、いくつかの第三者に依存し続けている。私たちの既存のどんなサプライヤーや製造業者でもいいです
| ● | 施設または設備の予期しない損傷または損傷または他の理由により、タイムリーまたは要求された量で製品を提供することができなかった | |
| ● | 生産能力を速やかに向上させ、より多くの数量とより高い生産量で薬品と成分を生産することができなかったか、あるいは私たちの商業需要を十分に満たすことができなかった | |
| ● | 独占サプライヤーとメーカーの関連問題に依存して、私たちの生産需要を満たすことができません | |
| ● | 規制要件を満たしていない製品を提供してくれます | |
| ● | 業務中断や財務無力で借金を返済できない | |
| ● | 承認源としての規制の地位を失う; | |
| ● | 現在の供給プロトコルが適時に満了し、条項が受け入れ可能または完全に満了した場合、 はこのようなプロトコルを継続することができないか、または継続することができない | |
| ● | 必要な医薬物質や製品の生産を停止したり製造したりする。 |
上記のいずれかの場合、私たちがサプライヤーまたは製造業者を代替していない場合、プロセスを識別、同定し、代替サプライヤーまたは製造業者に転送するために、多くの管理時間および費用がかかるであろう。技術を他のサイトに移転するには、追加のプロセス、技術、および検証研究が必要となる可能性があり、これらのプロセス、技術、および検証研究はコストが高く、かなりの時間を要する可能性があり、成功しない可能性があり、多くの場合、FDAの審査および承認が必要となる。新しいサプライヤーやメーカーの需要を探して同定する任意のものは、私たちの候補製品の生産を著しく遅延させ、私たちのマーケティング候補製品の能力に悪影響を与え、私たちの業務に悪影響を及ぼす可能性があります。私たちはタイムリーに、受け入れ可能な条項を押したり、交換を受けることができないかもしれない。また、私たちと私たちのメーカーは現在大量の薬品と他の材料の在庫を持っていません。Br薬物または他の材料の供給または私たちの候補製品生産の任意の中断は、私たちの業務、財務状況、経営業績、および将来性に重大な悪影響を及ぼす可能性があります。
私たちの契約サプライヤーとメーカーが私たちの需要を満たすために十分な生産能力と能力を維持する能力があるかどうかを直接制御することはできません。品質管理、品質保証と合格者を含む。我々は最終的にcGMPやGACPなどの法規要件の遵守を確保する責任があるが,我々は我々の契約サプライヤーやメーカー に依存してcGMPやGACPを日常的に遵守して原材料,原料薬,完成品を生産している。我々の契約サプライヤー及び製造業者は、原料薬及び他の物質及び材料又は完成品を製造するための商業販売のための施設を検査し、FDA及び他の関連規制機関の承認を得なければならない。我々の契約サプライヤーおよび製造業者は、FDAがその施設検査計画および審査によって提出された技術情報によって実行されるcGMPおよびGACP要件を遵守しなければならない。 任意の製品または製品候補またはコンポーネントのセキュリティが適用法律または他の を遵守できない理由で損害を受けた場合、影響を受けた製品または候補製品を商業化したり、規制部門の承認を得ることができない可能性があり、それによるダメージに責任を負う必要があるかもしれない。これらの要因のいずれも、候補製品の臨床前研究、臨床試験または規制提出または承認の遅延または終了をもたらす可能性があり、より高いコストをもたらすか、または承認された製品をタイムリーかつ効率的に商業化することができないか、または全く実現できない可能性がある。
| 34 |
また、これらの契約メーカーは、他の会社と協力して、このような会社のために材料または製品を供給し、製造することも、私たちのサプライヤーおよび製造業者をそのような材料および製品を生産する監督管理リスクに直面させる。そのため、 はこれらの材料と製品を生産する監督管理要求を満たすことができず、契約サプライヤーやメーカー施設の監督管理審査に影響を与える可能性もある。FDAや同様の外国の規制機関が私たちの候補製品を供給または製造するためにbrなどの施設を承認しない場合、またはそれが将来承認を撤回した場合、代替供給または製造施設を探す必要があるかもしれません。これは、私たちが規制機関の承認を得たり、私たちの候補製品を販売したりする能力に悪影響を及ぼすでしょう。
契約製造業者およびサプライヤーへの私たちの依存は、彼らまたはその施設にアクセスする権利のある第三者が、私たちのビジネス秘密または他の固有の情報を訪問して流用する可能性をさらに暴露します。
もし私たちが協力を確立し、維持することができなければ、私たちは私たちの開発と商業化計画を変更しなければならないかもしれない。
私たちの候補製品の開発と潜在的な商業化は費用を支払うために多くの追加現金が必要になるだろう。我々の候補製品をさらに開発するために,製薬やバイオテクノロジー会社と協力してこれらの候補製品を開発し,商業化する可能性がある。私たちは適切なパートナーを探すことで激しい競争に直面している。私たちが協力について最終的な合意に到達するかどうかは、パートナーの資源と経験の評価{br)、提案された協力の条項と条件、および提案されたパートナーの一連の要素の評価に依存する。 これらの要素は、臨床試験の設計または結果を含む可能性がある;FDAまたは他の規制機関が承認する可能性;テーマ候補製品の潜在的市場;そのような候補製品の製造と患者への配送のコストと複雑さ ;競争製品の潜在力;私たちの知的財産権の所有権に関連する任意の不確実性;業界や市場の状況もありますパートナーはまた、同様の候補製品または技術のために、協働可能な代替製品または技術 を考慮することができ、そのような連携が、我々の候補製品よりも魅力的であるかどうかを考慮することができる。将来のライセンス契約により、私たちは制限される可能性もあり、潜在的なパートナーといくつかの条項について合意することはできません。 の協力は非常に複雑で、交渉も記録も時間がかかります。また,大手製薬会社間で最近大量の商業合併が発生し,将来の潜在的パートナー数の減少を招いている。
私たちが未来に行う可能性のある協力は以下のリスクを含むかもしれない
| ● | 協力者(Br)は、それらがこれらの協調作業およびリソースに適用される可能性を決定する上で大きな裁量権を有する可能性がある | |
| ● | 協力者 は予想通りに義務を履行していない可能性がある | |
| ● | 協力者の戦略的重点または利用可能な資金または外部要素(例えば買収)の変化 は資源 を移転するか、または相互競争の優先順位を生成する可能性がある | |
| ● | 協力者 は発見と臨床前開発を延期する可能性があり、私たちが選択した目標の製品開発に不足した資金を提供し、 候補製品の発見と臨床前開発を停止または放棄し、候補製品の新発見と臨床前開発を繰り返し或いは行う |
| 35 |
| ● | 協力者 が独立して、または第三者開発と直接または間接的に私たちの製品または候補製品と競合する製品 を開発することができ、協力者が競争製品が私たちのよりも成功する可能性があると考えるならば、 | |
| ● | 私たちと協力して発見された候補製品 は、私たちの協力者によって彼ら自身の候補製品 と競争するとみなされるかもしれません。これは、協力者が資源を投入して私たちの候補製品を開発することを停止する可能性があります | |
| ● | 特許権、契約解釈、または第一選択開発プロセスにおける分岐を含む協力者との分岐 は、候補製品の発見、臨床前開発または商業化の遅延または終了をもたらす可能性があり、候補製品に対して追加の責任を負うことになる可能性があり、または訴訟または仲裁を引き起こす可能性があり、いずれも時間がかかりコストがかかる可能性がある | |
| ● | 協力者 は、私たちの知的財産権または許可された知的財産権を正確に維持または擁護できないかもしれないし、または私たちの固有の情報を使用して、訴訟を招き、それによって、私たちの知的財産権または独自の情報を危険にさらしたり、無効にしたり、または潜在的な訴訟に直面させたりする可能性がある | |
| ● | 協力者は第三者の知的財産権を侵害する可能性があり、これは私たちを訴訟と潜在的な責任に直面させる可能性がある | |
| ● | 協力者の便宜のために、協力 を終了する可能性があり、終了すれば、適用可能な候補製品をさらに開発するか、または商業化するために追加資金を調達する必要があるかもしれない。 |
連携 は通常,それぞれに詳細な義務を課す.もし私たちが私たちの義務に違反したら、私たちはbrを含めて協力を終了する可能性があり、私たちがパートナーの候補製品に多くの時間とお金を投入する権利は失われるだろう。
私たち はタイムリーで、受け入れ可能な条項によって、あるいは全く協力を協議できないかもしれません。これができなければ、候補製品の開発を減らし、私たちの開発計画や1つ以上の他の開発計画を減らしたり、私たちの潜在的な商業化を延期したり、私たちの支出を増加させたり、自費で開発または商業化活動を行う必要があるかもしれません。もし私たちが私たちの支出を増やして私たち自身の開発や商業化活動に資金を提供することを選択したら、追加の資本を得るためにbrが必要かもしれませんが、これらの資本は受け入れ可能な条項で私たちに提供できないかもしれません。もし私たちが十分な資金がなければ、私たちは私たちの候補製品をさらに開発したり、それを市場に出して製品収入を生成することができないかもしれない。
私たちの成長、従業員、運営に関するリスクを管理する
私たちは将来、私たちの組織の規模と複雑さをさらに増加させる必要があり、私たちは成長戦略を実行し、どんな成長を管理するかについて困難に直面する可能性がある。
私たちの既存の管理、人員、システム、および施設は、私たちの業務計画と最近の将来の成長を支援するのに十分ではありません。私たちの化学と製造チーム、臨床チーム、管理、運営、財務、および他の資源をさらに拡大して、私たちの計画の研究、開発、商業化活動を支援する必要があります。
私たちの運営、成長、様々なプロジェクトを効率的に管理するためには、
| ● | 私たちの業務、財務、管理、および規制コンプライアンス制御、および報告システムとプログラムを改善していきます | |
| ● | 十分な数の優秀な従業員を引きつけて維持します | |
| ● | マーケティング、販売、流通能力を発展させる |
| 36 |
| ● | 候補製品の商業化活動を効率的かつ経済的に管理しています | |
| ● | 開発と商業化パートナーとの関係を構築し、維持し、 | |
| ● | 私たちの臨床前と臨床試験を効果的に管理しています | |
| ● | 我々の第三者供給と製造運営を経済的かつ効率的に管理するとともに、現在の候補製品の生産能力をビジネスレベルに向上させる | |
| ● | 我々の開発作業を効率的に管理するとともに,パートナーや他の第三者に対する契約義務を履行する. |
また,歴史的には,臨床前や臨床試験に関する課題を含めて,アルバイト外部コンサルタントを用いて複数のタスクを遂行していきたいと考えてきた。私たちの成長戦略はまた、これらの任務と将来の他の任務を実施するために、コンサルタントへの私たちの使用 を拡大する必要があるかもしれない。私たちのいくつかの業務機能はコンサルタントに依存しており、これらのコンサルタントに対して効率的なbr管理を行い、彼らが契約義務を成功的に履行し、予想される期限内に任務を達成することを保証する必要がある。私たちが必要に応じて経済的に合理的な条項で私たちの既存のコンサルタントを管理したり、他の適任な外部コンサルタントを見つけたりすることができる保証はありません。新入社員の採用やコンサルタントの利用拡大で私たちの組織を効率的に管理し、拡大することができなければ、私たちが計画している研究開発や商業化活動を効果的に実行するために必要な任務を実行することができない可能性があり、私たちの研究開発やbrの商業化目標を達成できないかもしれません。
もし私たちが管理職や他のキーパーソンを引き付けることができない場合、私たちは私たちの候補製品の開発や商業化を成功させたり、他の方法で私たちの業務計画を実施したりすることができないかもしれません。
競争の激しい製薬業界における競争能力は私たちが高い素質の管理、科学、医療、販売とマーケティング人員及びその他の人員を誘致し、維持できるかどうかにかかっている。私たちはスティーブン·C·グローバー、ピーター·ウルフ、パブロ·A·グズマン、医学博士、カレン·A·カシュミールなど、私たちの経営陣に高く依存している。これらの個人のサービスを失うことは、私たちの製品パイプラインの成功開発を阻害、遅延、または阻止する可能性があり、私たちが計画した臨床試験の完成、私たちの候補製品の商業化 は内または新しい資産を得ることができるかもしれないし、私たちが業務計画を成功させる能力にマイナス影響を与えるかもしれない。もし私たちがこれらの人員のいずれかのサービスを失った場合、私たちは適切な代替人員をタイムリーに見つけることができないか、あるいは適切な代替人員を見つけることができないかもしれないので、私たちの業務は損害を受ける可能性があります。私たちはこれらの個人の生命や私たちの他の従業員の生命のために“キーパーソン”保険証書を維持しません。わが社の価値のある従業員を引き留めるために、br給料と現金奨励のほか、時間とともに付与された株式オプションを提供します。時間の経過とともに、従業員に付与される株式オプションの価値は、私たちがコントロールできない株価変動の大きな影響を受け、他社のオファー を相殺するのに不十分な場合があります。
私たちは未来に合格した管理職と他の重要な人員を引き付けることができないかもしれません。バイオテクノロジー、製薬と他の企業との間の合格人材の競争は非常に激しく、特に私たちの本社があるフロリダ州ウェストン地域では、経験者を私たちの会社に誘致することは難しいかもしれません。そして従業員を募集し、維持するために大量の財務資源が必要かもしれません。私たちと合格人材を競争する多くの他の製薬会社は私たちよりも多くの財務と他の資源、異なるリスク状況とより長い業界の歴史を持っている。それらはまたより多様な機会とより良い職業昇進の機会を提供することができる。業務目標を実現するために必要な人員 を引き付けることができなければ、我々は制限に遭遇する可能性があり、業務戦略を実施し、業務目標を実現する能力を損なうことになる。
また,科学と臨床コンサルタントを持ち,開発や臨床戦略の策定を支援している。これらのコンサルタント は私たちの従業員ではなく、他のエンティティと約束、相談、またはコンサルティング契約を締結しているかもしれません。これは、彼らの私たちに対する利用可能性を制限するかもしれません。また、私たちのコンサルタントは他社と合意し、これらの会社が私たちと競争する可能性のある製品や技術の開発に協力するかもしれません。
| 37 |
競争の激しい就職市場は私たちが発展し、高技能労働力を誘致と維持するために努力すると同時に、挑戦と潜在リスクをもたらした。
私たち従業員の競争は非常に激しく、高スキルの技術と製品専門家を含めて、これは労働市場の緊張を反映しています。これはリスクをもたらす可能性があります。私たちは経験のある候補者を競争しているので、特に競争がより魅力的な財務雇用条項を提供できれば。この危険は私たちの現在の従業員集団に延長されている。そのほか、著者らはすでに持続的な新冠肺炎疫病の影響を受け、更に影響を受ける可能性があり、これは才能のある従業員の転職を招く可能性があり、熟練した専門人員を誘致と維持する仕事をもっと挑戦的にする可能性がある。私たちの業務の発展に伴い、私たちはまた、私たちの従業員を誘致し、発展させるために多くの時間と費用を投入することができ、これはまた、彼らを募集する可能性のある他の会社に対する価値を増加させるだろう。人員交代は大きな交換コストと作業効率の損失を招く可能性がある。さらに、米国の移民政策は、条件に適合する外国市民がH-1 Bクラスの就労ビザを取得または維持することを困難にする可能性がある。これらのH-1 Bビザ制限は、成長戦略を実行するために必要な熟練した専門家を、私たちをより難しく、および/またはより高価に招聘することができ、私たちの業務に悪影響を及ぼす可能性がある。
私たち は現在マーケティング能力が限られており、販売組織がありません。もし私たちが自分または第三者を通じて販売とマーケティング能力を確立できなければ、私たちは私たちの候補製品を商業化することに成功したり、br製品収入を生成することができないだろう。
私たち は現在マーケティング能力が限られており、販売組織がありません。もし私たちの候補製品が承認されたら、アメリカ、カナダ、EU、私たちが進出を求めている他の司法管轄区域で商業化を実現するためには、私たちのマーケティング、販売、流通、管理、その他の非技術的能力を確立しなければなりません。あるいは第三者とこれらのサービスを実行することを手配しなければなりません。私たちはこれに成功できないかもしれません。我々の管理チームは医薬製品のマーケティング、販売と流通の面で経験があり、br前に他の会社で働いたことがあるが、ある会社として、私たちは医薬製品のマーケティング、販売と流通の面で経験がなく、販売組織の構築と管理は重大なリスクに関連しており、私たちはbrを採用、維持し、合格者を激励する能力を含み、十分な販売手がかりを生成し、販売とマーケティング人員に十分な訓練を提供し、そしてbr}は各地に分散している販売とマーケティングチームの能力を効果的に管理する。もし私たちの内部販売、マーケティング、流通能力の発展にどんな失敗や遅延が生じた場合、これらの製品の商業化に悪影響を及ぼすだろう。私たちは、自分たちの販売チームと流通システムを拡張したり、自分たちの販売チームや流通システムの代わりに、直売チームや構築された流通システムを持つ他の第三者と協力することを選択することができます。もし私たちが受け入れ可能な条項やそのような計画を根本的に達成できなければ、私たちは私たちの候補製品を商業化することに成功できないかもしれない。もし私たちの候補製品を単独でまたは1つ以上の第三者と協力して商業化することに成功しなければ、私たちの業務、財務状況、経営業績、見通しは影響を受けるだろう。
私たちのbrは、他の候補製品または承認された製品の許可、買収、開発、マーケティングに成功できず、私たちのビジネスを発展させる能力を弱めることになります。
私たちは他の製品や候補製品を許可、買収、開発、マーケティングする予定で、私たちは商業段階の製品を許可したり、買収したり、他の戦略取引に従事したりするかもしれません。私たちの内部研究開発能力が限られているため、私たちは製薬会社、学術科学者、他の研究者に依存して、可能な製品や技術を販売してくれるかもしれません。この戦略の成功は、将来性のある候補薬品および製品を識別および選択する能力、既存の所有者と許可または買収協定を交渉する能力、およびこれらの手配に資金を提供する能力にある程度依存する。
許可証の提案、交渉、および実施、または候補製品または承認された製品の取得の流れは、長くて複雑である。他の会社には、大量の財務、マーケティング、販売、その他の資源を持つ企業が含まれており、候補製品や承認された製品の許可または買収を競争する可能性があります。私たちの資源は限られており、第三者製品、業務、技術の買収や許可を識別して実行することができず、現在のインフラに統合することができません。また、未完了の潜在的な買収が可能かもしれない機会に資源を投入することができないかもしれません。あるいは、このような努力の予想される利点を実現できないかもしれません。私たちは私たちの が受け入れられると思う条項や他の候補製品の権利を全く得られないかもしれない。
| 38 |
さらに、我々が得た任意の候補製品は、商業販売の前に、臨床前または臨床試験およびFDAおよび適用される外国の規制機関の承認を含む追加の開発作業が必要となる可能性がある。すべての候補製品は薬品開発によく見られる失敗リスクが出現しやすく、候補製品は十分な安全かつ有効であることが証明されない可能性があり、監督管理機関の許可を得られない可能性がある。しかも、私たちが買収したいかなる承認された製品も利益のある方法で生産または販売されるか、または市場の承認を得ることは保証されない。
私たちが考慮する可能性のある他の潜在的取引には、剥離、戦略パートナー関係、合弁企業、再編、資産剥離、業務合併と投資を含む様々な異なる業務手配が含まれている。このような取引は、非日常的な費用または他の費用を発生させる必要がある可能性があり、短期的および長期的な支出を増加させる可能性があり、重大な統合課題をもたらしたり、私たちの管理や業務を中断したりする可能性があり、これは私たちの運営および財務業績に悪影響を及ぼす可能性があります。例えば、これらの取引は、多くの潜在的な運営および財務リスクに関するものである
| ● | 未知の債務にさらされるリスクは | |
| ● | 私たちの業務を中断し、買収した製品、候補製品、または技術を開発するために、私たちの経営陣の時間と注意を移します | |
| ● | 大量の債務や持分証券の希釈発行が発生し、買収費用を支払う | |
| ● | 膨大な買収と統合コスト | |
| ● | 資産または減価費用の減記 ; | |
| ● | 販売費用が増加した | |
| ● | 買収された企業の運営と人員を私たちの運営および人員と合併する難しさとコスト | |
| ● | 経営陣と所有権の変化により、任意の被買収企業の主要なサプライヤー、パートナーまたは顧客との関係が減少している ; と | |
| ● | 私たちの肝心な従業員や買収された企業の従業員を引き留めることはできません。 |
したがって、私たちが上述した性質のいかなる取引を行うか、または成功することは保証されず、私たちが完成したいかなる取引も、私たちの業務、財務状況、経営業績、および将来性を損なう可能性がある。
私たちの候補製品に使用される原料薬と他の物質と材料の製造と供給は複雑かつ技術的に挑戦的な仕事であり、br}の製造、テスト、品質保証と流通サプライチェーンの多くの環節は故障する可能性があり、br}製品の製造と流通後に潜在的な欠陥が存在する可能性がある。
原料薬、その他の物質と材料及び薬品完成品の製造と供給は技術的に挑戦的である。私たちの直接制御範囲を超えた変化は私たちの候補製品の品質、数量、価格と成功裏の納品に影響を与える可能性があり、そして私たちの候補製品の開発と商業化を阻害、遅延、制限、あるいは阻止する可能性がある。ミスと処理が不適切であることは珍しくなく、成功した生産と供給に影響を与える可能性がある。いくつかのリスクは
| ● | 当社の製造業者は、cGMPまたはGACP要件を遵守していないか、または生産または輸送準備中に製品を不適切に処理しています | |
| ● | 私たちの契約サプライヤーと製造業者は、高生産量とロット品質を効果的かつ経済的に向上させ、維持することができません | |
| ● | FDAが承認した生物検査を開発して未来の製品を発表することはできません |
| 39 |
| ● | 最適な薬物送達物質および技術、生産および貯蔵方法、ならびに包装および輸送プロセスを決定することは困難である | |
| ● | 輸送と輸出入リスク、特に私たちのサプライチェーンのグローバル性を考慮して | |
| ● | 遅延分析結果または品質管理と未来の製品発表の分析技術の失敗を行うことに依存する | |
| ● | 自然災害、流行病、労使紛争、財務困難、原材料供給の不足、施設と設備の問題、または他のbr形式が私たちの契約メーカーとサプライヤーの業務運営に対する妨害;および | |
| ● | 潜在的なbr製品が発表されると明らかな欠陥になる可能性があり、製品のリコールと廃棄を招く可能性がある。 |
これらの要因のいずれも、私たちの臨床試験、規制提出、必要な承認または候補製品の商業化に関連する遅延またはそれ以上のコストをもたらす可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性を損なう可能性があります。
私たちのbrの経営業績は大きく変動する可能性があり、これは私たちの将来の経営業績を予測しにくくし、私たちの経営業績が予想を下回ってしまう可能性があります。
これまで、私たちの業務は主に私たちの候補製品の研究と開発に限られ、私たちの候補製品に対して臨床前研究と臨床試験を行ってきた。私たちのどんな候補製品も規制部門の承認を受けていない。したがって、私たちの将来の成功や生存能力に対するあなたのどんな予測も、私たちがより長い運営歴史や市場で承認された製品を持っているように正確ではないかもしれません。 また、私たちの経営業績は様々な他の要素によって変動する可能性があり、その中の多くの要素は私たちがコントロールできないもので、以下の要素を含む予測が難しいかもしれません
| ● | 私たちの候補製品の開始、登録、臨床試験の時間を延期します | |
| ● | 我々の候補製品または競合候補製品の臨床試験のタイミングおよび成功または失敗、または私たちの競争相手またはパートナー間の統合を含む業界競争構造における任意の他の変化; | |
| ● | 臨床開発における候補製品の監督審査と承認に関するいかなる遅延もない | |
| ● | 我々の候補製品に関する研究や開発活動の時間、コスト、投資レベルは、時々変化する可能性がある | |
| ● | 我々の候補製品を製造するコストは、FDAのガイドラインや要求、生産数量によって異なる可能性がある | |
| ● | 私たちは候補製品を開発するために追加資金を得ることができます | |
| ● | 私たちは、他の候補製品および技術を取得または開発するための支出 ; | |
| ● | もし私たちの候補製品が承認されれば、それらの需要レベルは大きく異なるかもしれない | |
| ● | 私たちの候補製品の潜在的な副作用は、商業化を延期または阻止し、または承認された薬物の市場からの撤退を招く可能性がある | |
| ● | 承認された場合、患者または医療提供者は、候補製品のカバー範囲または十分な補償能力を得ることができる | |
| ● | 私たちは第三者製造業者が私たちの候補製品を供給したり製造したりすることに依存しています |
| 40 |
| ● | 効果的な販売、マーケティング、流通インフラをタイムリーに構築することができます | |
| ● | 市場は私たちの候補製品(承認されれば)を受け入れ、これらの候補製品の需要を予測する能力 | |
| ● | 私たちはアメリカ以外で承認され、私たちの候補製品を商業化する能力 | |
| ● | 私たちは協力、許可、または他の手配の能力を確立し、維持する | |
| ● | 知的財産権を保護する能力と第三者の能力 | |
| ● | 潜在的な訴訟または他の紛争に関連する費用と結果; | |
| ● | 私たちは未来の成長を十分に支援することができます | |
| ● | 私たちは私たちの業務を効率的に管理するために、重要な人員を引き付けて維持する能力がある | |
| ● | 危険物質に関わる潜在的な責任 | |
| ● | 私たちは十分な保険証書を維持することができます | |
| ● | 未来 私たちの会計政策における会計声明や変更。 |
私たちの経営業績と流動性需要は市場変動や経済低迷の負の影響を受ける可能性があります。
私たちの経営業績と流動性はアメリカや世界の他の地域の経済状況の負の影響を普遍的に受けるかもしれません。非必須医療製品やプログラムの市場は,特に不利な経済条件の影響を受けやすい可能性がある。一部の患者は私たちのいくつかの候補製品は自由に支配可能であると思うかもしれないが、もしこのような製品が全額精算を得ることができなければ、これらの製品に対する需要は著者らの目標患者群の自由支配可能な支出レベルとリンクするかもしれない。国内·国際経済状況と懸念に基づいて、国内·国際株式·債務市場は高度な変動や動揺を経験し続けている可能性がある。これらの経済状況や懸念が持続的または悪化し、市場が変動し続けると、私たちの経営業績と流動性は、私たちのいくつかの製品に対する需要が弱まって、必要に応じて資金を調達することが難しくなり、私たちの株価が下落する可能性があるなど、多くの面でこれらの要素の悪影響を受ける可能性がある。また、私たちは主にアメリカで私たちの製品を販売する予定ですが、将来的には幅広いグローバル業務を持つパートナーがいるかもしれません。これは間接的にリスクに直面させます。
もし私たちの内部コンピュータシステムが故障したら、私たちの業務と運営は影響を受けるだろう。
セキュリティ対策が実施されているにもかかわらず、私たちのコンピュータシステムおよび私たちの現在および未来の任意のパートナー、請負者、およびコンサルタントのコンピュータシステムは、コンピュータウイルス、許可されていないアクセス、自然災害、テロ、戦争および電気通信、および電気故障の破壊を受けやすい。我々はこれまでこのような重大なシステム故障,事故やセキュリティホールに遭遇していないが,このような事件が発生して我々の運営が中断されると,我々の製造活動,開発計画,業務運営に大きな中断を招く可能性がある.例えば、完成した或いは未来の臨床試験の生産記録或いは臨床試験データの損失は私たちの監督管理の承認作業を遅延させる可能性があり、私たちのデータの回復或いは複製のコスト を著しく増加させる。任意の中断またはセキュリティホールが、私たちのデータやアプリケーションの損失または破損、または機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの製品および候補製品のさらなる商業化および開発が遅延する可能性があります。
| 41 |
私たち はますます情報技術に依存しており、私たちのシステムとインフラはネットワークセキュリティ とデータ漏洩リスクを含む一定のリスクに直面している。
我々の情報技術システムに重大な中断や情報セキュリティが破壊され,我々の業務に悪影響を与える可能性がある.通常の業務プロセスでは,大量の機密情報を収集,格納,転送するため,安全な方法でこのような機密情報の機密性と完全性を確保しなければならない.我々の情報技術(Br)システムおよび我々と契約を締結した第三者サプライヤーのシステムの規模および複雑さは、当社の従業員、パートナーまたはサプライヤーの不注意または故意の行為、悪意のある第三者の攻撃、または私たちまたは第三者が維持するシステムインフラの意図的または意外な物理的損傷を含むため、サービス中断およびセキュリティ破壊の影響を受けやすい可能性がある。これらの機密、独自、または商業秘密情報を秘密にすることは、私たちの競争業務の地位に非常に重要だ。我々は、このような情報を保護し、情報技術に投資するための措置をとっているが、我々の努力は、システム内のサービス中断またはセキュリティホールを防止すること、または私たちのトラフィック運営に悪影響を及ぼす可能性があること、またはキーまたは敏感な情報の損失、伝播、または誤用をもたらす機密情報の不正使用または意図しないエラー使用または漏洩を防止することを保証することはできない。盗難、ハッカー攻撃、詐欺、brの詐欺、または他の形態の詐欺、または任意の他の理由によって、他の人が競合製品を生産すること、私たちのノウハウまたは情報を使用すること、または私たちの業務または財務状態に悪影響を及ぼす可能性がある、私たちのセキュリティ対策または意外な損失、開示意図のない伝播、許可されていない伝播、商業秘密、固有情報、または他の機密情報の流用または乱用。さらに、このような中断、セキュリティホール、機密情報の損失または漏洩は、私たちに財務、法律、業務、および名声被害をもたらす可能性があり、私たちの業務、財務状態、運営結果、またはキャッシュフローに重大な悪影響を及ぼす可能性があります。
私たちは主に遠隔従業員なので、私たちはより高い業務連続性とネットワークリスクに直面する可能性があり、これは私たちの業務と運営を深刻に損なう可能性があります。
Br新冠肺炎の流行はすでに私たちが業務やり方を修正し、主に遠隔に位置する従業員に移動し、私たちの従業員は家庭または他のネットワークを介して私たちのサーバに遠隔アクセスして彼らの仕事の職責を履行する。私たちの動作の多くは遠隔実行可能であり、現在有効に動作しているが、このような状況が継続されるか、または遠隔作業中に同じ効率を維持する保証はない。私たちのチームが分散しているので、多くの従業員は(例えば、学校の閉鎖または家族の病気のために子供の面倒を見る必要がある)追加の個人的な需要がある可能性があり、従業員は自分が病気になって仕事ができない可能性がある。条件の改善や制限の撤廃に伴い,作業再開過程にも同様の不確実性が存在する。また、データのセキュリティとプライバシーを保護するための追加のセキュリティ対策を講じていますが、遠隔従業員は私たちのユーザーインフラや第三者に緩和が困難な追加的な圧力を与えています。これらのリスクは、ホームインターネット利用可能性 が動作の連続性および効率に影響を与えること、およびインスタント·メッセージおよびオンライン会議プラットフォームなどの第三者通信ツールへの追加的な依存を含む。
私たちの知的財産権に関するリスク
私たちの知的財産権を十分に保護できなければ、私たちの業務、財務状況、経営業績に悪影響を及ぼす可能性があります。
私たちのビジネスは私たちの知的財産権とノウハウに依存していますが、知的財産権とノウハウの保護は私たちの業務の成功に重要です。私たちは商標、著作権、商業秘密法律、許可協定、知的財産権譲渡協定、秘密手続きによって私たちの知的財産権を保護します。さらに、私たちは、特許を申請できない可能性のある知的財産権を、ビジネス秘密、技術ノウハウ、機密情報などの独自の情報によって保護したり、公開開示を必要としない方法で最もよく保護されていると考えている。私たちは通常、私たちを代表して知的財産権を開発する従業員とコンサルタントに秘密および発明譲渡協定の締結を要求し、私たちの情報を共有する第三者と秘密協定を締結することによって、私たちの知的財産権、技術、機密情報を保護しようとしています。これらのプロトコルは、私たちの機密情報、知的財産権、または技術の不正使用または開示を効果的に防止することができず、私たちの機密情報または技術を無許可に使用または開示すること、または私たちの知的財産権を侵害する場合に十分な救済措置を提供することができない可能性がある。例えば、私たちは、これらの合意が締結されても、これらの合意が意図的に違反されても、または他の方法では、開示、第三者による権利侵害、または私たちの固有情報の盗用を阻止することができず、その期間が制限される可能性があり、許可されていない場合、または固有情報を使用する場合に十分な救済措置を提供できない可能性がある必要な合意に到達できない可能性がある。さらに、私たちの独自の情報は知られているかもしれないし、 は私たちの競争相手または他の第三者によって独立して開発されるかもしれない。私たちの従業員、コンサルタント、請負業者、および他の第三者が私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利について論争が生じる可能性がある。私たちの知的財産権および他の固有の権利の範囲を実行および決定するためには、高価で時間のかかる訴訟が必要となる可能性があり、取得または維持できない場合、私たちの固有情報の保護は、私たちの競争ビジネスの地位に悪影響を及ぼす可能性があります。
| 42 |
私たちは私たちの独占権を保護しようと努力しているが、他の当事者は、私たちの技術またはシステムを意図的に、または意図的に開示、取得、または使用することができ、これは、許可されていない当事者が、私たちのプラットフォームまたは他のソフトウェア、技術および機能の態様、または私たちが固有と考えている情報を取得して使用することを可能にするかもしれない。さらに、許可されていない当事者は、様々な方法で、私たちのウェブサイトまたはモバイルアプリケーションから公共データまたは他のコンテンツを盗むこと、ネットワークセキュリティ攻撃、およびこれらのデータを保護する法律または他の方法 を含む、様々な方法によって、私たちの知的財産権、機密情報、および商業秘密を取得しようと試みるか、または成功する可能性がある。私たちの知的財産権、ノウハウ、または機密情報の不正な使用および開示を監視することは困難で高価である可能性があり、私たちが取ったステップが、私たちの知的財産権または独自の権利の流用または侵害を防止することを保証することはできません。
私たちはビジネスで使用されているサイトにドメイン名を登録しましたWww.zyversa.com他の変種もあります本入札明細書に含まれるウェブサイトの住所は含まれていませんか、または引用によって当社のウェブサイトの情報を本募集説明書に入れます。
競争相手 は、私たちと類似したサービス名を採用し続け、ブランド識別を確立する能力を損なう可能性があり、 ユーザの困惑を招く可能性がある。さらに、我々の商標と類似した他の商標の所有者は、商号または商標侵害クレームを提起する可能性がある。さらに、将来的には、私たちの知的財産権を強制的に執行し、他人の独自の権利の有効性および範囲を決定するために、米国特許商標局または米国および海外の他の政府機関および行政機関に訴訟または訴訟を提起する必要があるかもしれない。私たちが始めた第三者が私たちの知的財産権を侵害する訴訟は、費用が高く時間がかかる可能性があり、私たちの知的財産権を無効にしたり、強制的に実行できない可能性があります。そうでなければ、私たちに否定的な結果をもたらすかもしれません。私たちがこのような侵害行為について他のbr側を起訴しても、このような訴訟は私たちの業務に不利な結果をもたらす可能性がある。さらに、私たちは、私たちの市場シェア、財務状況、および運営結果にマイナスの影響を与える可能性がある特許をタイムリーにまたは成功的に申請したり、私たちの商標を登録したり、他の方法で私たちの知的財産権を保護することができないかもしれません。私たちの固有の権利を保護、維持、または実行するための私たちの努力は、将来尊重されないかもしれないし、無効にされたり、回避されたり、挑戦される可能性があり、巨額のコストと資源移転を招く可能性があり、これは私たちの業務、財務状況、および経営業績に悪影響を及ぼす可能性がある。
私たち は、私たちが業務で使用しているドメイン名を継続して使用できない可能性があり、第三者が侵害、類似、または他の方法で私たちのブランド、商標またはサービスタグの価値を低下させるドメイン名 を取得して使用することを阻止できないかもしれません。
私たち は、私たちのビジネスで使用されるか、または私たちのビジネスに関連するドメイン名を登録しています。もし私たちがドメイン名を使用する能力を失った場合、商標主張、適用登録の更新ができなかった場合、私たちは新しいドメイン名を使用して私たちの製品を販売することを余儀なくされる可能性があり、これは私たちに大きな損害を与えたり、関連ドメイン名の権利を購入するために巨額の費用を発生させる可能性があります。様々な理由で,我々は などのドメイン名が他の人に保持されているため,米国以外で第一選択ドメイン名を得ることができない可能性がある.また,我々の競争相手や他社は,我々のドメイン名に類似したドメイン名を用いることで我々のブランド認知度を利用しようと試みることができる.私たちは、第三者が侵害、類似、または他の方法で私たちのブランドまたは商標またはサービスタグの価値を低下させるドメイン名を取得して使用することを阻止できないかもしれない。ドメイン名における私たちの権利を保護、維持、実行するためには訴訟が必要となる可能性があり、これは巨額のコストと資源移転を招く可能性があり、これは私たちの業務、財務状況、および運営業績に悪影響を及ぼす可能性があります。
| 43 |
最近の特許改革立法は、私たちの特許出願をめぐる起訴と実行または私たちの将来の特許を保護する不確実性とコストを増加させるかもしれない。
私たちが特許を得る能力は、これまでいくつかの法律原則が解決されていないため、米国特許で許可されている特許請求の範囲の広さまたは解釈に一貫したbr政策がなく、関連する法律、科学的、および事実的問題の複雑さのために、特許請求項を支援および解釈するために必要な特許および特許出願の具体的な内容は非常に不確実である。米国や他の国の特許法や特許法解釈の変化は,我々の知的財産権の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。
例えば、2011年9月16日、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名された。“ライシー·スミス法案” は、米国特許法の多くの重大な改正を含む。その中には特許出願起訴方式に影響を与える条項 が含まれており,特許訴訟に影響を与える可能性もある。米国特許商標局(“USPTO”) は、Leahy-Smith法案の全面的な実施、Leahy-Smith法案に関連する多くの特許法の実質的な改正、特に最初の提出条項の改正を管理するための新たな未検査法規とプログラムを制定し、2013年3月に発効した 。ライシー·スミス法案はまた、第三者が発行された特許に挑戦し、特許出願の起訴に介入しやすくするためのいくつかの手続きを導入している。最後に、“ライシー·スミス法案”には新しい法定条項が含まれており、米国特許商標局がその実施のために新しい法規を発表することを要求し、裁判所は新しい法規の条項を解釈するのに数年かかるかもしれない。Leahy-Smith法案が私たちの業務運営と私たちの知的財産権の保護と実行にどのような影響を与えるかを判断するのは時期尚早だ。しかし、Leahy-Smith法案とその実施は、私たちの特許出願をめぐる起訴と、私たちの将来の特許の実行または保護の不確実性とコストを増加させるかもしれない。さらに、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下しているが、場合によっては利用可能な特許保護の範囲を縮小するか、場合によっては特許所有者の権利を弱めるかである。このような事件の組み合わせは,我々の将来の特許取得能力の不確実性の増加に加えて,特許取得後の価値に対する不確実性をもたらしている.米国議会、連邦裁判所、および米国特許商標局の行動によれば、特許を管理する法律および法規は、予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を取得したり、私たちが所有または許可した特許を強制的に実行する能力 または将来入手可能な特許を弱める可能性がある。私たちのノウハウをカバーしている特許を取得、実行、保護できないことは、私たちのビジネスの見通しおよび財務状況に大きな悪影響を及ぼすでしょう。
同様に、 他の国または管轄区域の特許法律法規の変化またはそれらを実行する政府機関の変化、または 関連政府機関が特許法律または法規を実行する方法の変化は、私たちが未来に入手可能な特許を実行する能力を低下させる可能性がある。また,米国の法律のようにbrの所有権を保護していない国もある。したがって、アメリカと海外では、私たちの知的財産権を保護し保護する上で重大な問題に直面する可能性がある。例えば、ある国/地域である発明をカバーする特許が発行され、他の国/地域で同じ発明をカバーする特許がその後発行されていない場合、または1つの国/地域で発行される特許において権利要件の有効性、実行可能性または範囲、または書面記述または有効化された任意の司法解釈が、他の国/地域で発行される対応する特許によって与えられる解釈と異なる場合、これらの国/地域で私たちの知的財産権を保護する能力が制限される可能性がある。米国や他の国/地域特許法や特許法解釈の変化 は,我々の知的財産権の価値を大幅に低下させたり,我々の特許の保護範囲 を縮小したりする可能性がある。
| 44 |
私たち は世界的に私たちの知的財産権を保護できないかもしれない。
世界のすべての国/地域で私たちの候補製品申請、起訴、特許保護の費用は目を引くほど高いだろう。特定の国、特に発展途上国では、特許可能性に対する要求が異なる可能性がある。また、海外のいくつかの国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。したがって、私たちは第三者がアメリカ以外のすべての国/地域で私たちの発明を実施することを阻止できないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、私たちが特許保護を持っている地域に侵害製品を輸出することもできるが、侵害活動に対する法執行力は十分ではない。これらの製品は私たちの製品と競争するかもしれませんが、私たちの特許や他の知的財産権はそれらの競争を効果的にまたは阻止するのに十分ではないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に深刻な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許や他の知的財産権保護、特に薬品に関する保護の強制執行を支持しておらず、これは、私たちの特許の侵害を阻止したり、私たちの専有権を侵害する方法で競争製品を販売することを困難にする可能性がある。外国の管轄区域で私たちの特許権を強制的に執行する訴訟手続きは巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移す可能性があり、brは私たちの特許が無効または狭い解釈されるリスクに直面する可能性があり、私たちの特許出願は発表できないリスクに直面し、brの第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝利しないかもしれないし、判決された損害賠償や他の救済措置(ある場合)は商業的な意味がないかもしれない。また,ヨーロッパのある国やある発展途上国には強制許可法があり,これらの法律により特許権者は第三者に許可を強制的に付与される可能性がある。これらの国/地域では、もし私たちの特許が侵害された場合、あるいは私たちの特許を第三者にライセンスすることを余儀なくされた場合、私たちの救済措置が制限される可能性があり、これらの特許の価値を大幅に縮小させる可能性がある。これは私たちの潜在的な収入機会を制限するかもしれない。したがって、私たちの知的財産権を世界各地で強制的に実行する努力は、私たちが所有または許可している知的財産権から顕著なビジネス的優位性を得るのに十分ではないかもしれません。最後に、私たちが知的財産権を保護して実行する能力は、外国の知的財産法の意外な変化の悪影響を受ける可能性がある。
私たちの特許保護の獲得と維持は、政府特許機関が提出した様々なプログラム、書類提出、費用支払い、および他の要求 を遵守することに依存し、これらの要件に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
発行された特許の定期保守及び年金費用は、特許有効期間内にいくつかの段階に分けて米国特許商標局及び外国特許代理機関に支払われなければならない。米国特許商標局および各種外国政府特許機関は、特許出願過程において、いくつかのプログラム、文書、費用支払い、およびその他の同様の規定を遵守することを要求する。多くの場合、不注意は、滞納金を支払うことによって、または規則を適用する他の方法によって修復することができるが、場合によっては、規則を遵守しないことは、特許または特許出願が放棄または失効され、関連する司法管轄区域の特許権の一部または全部を喪失させる可能性がある。特許または特許出願が放棄または失効される可能性のある不正事件には、規定された期限内に公式行動に対応できなかったこと、費用が支払われていないこと、および適切に合法化されず、正式な文書が提出されなかったことが含まれる。もし私たちまたは私たちの許可者が私たちの候補製品をカバーする特許や特許出願を維持できなかった場合、私たちの競争相手は市場に参入する可能性があり、これは私たちの業務に悪影響を及ぼすだろう。
もし私たちが知的財産権許可協定に規定された義務を履行できなければ、私たちの業務に非常に重要な許可権を失う可能性があります。
私たちのbrは、様々な職務調査、マイルストーン、特許権使用料、保険、その他の義務を私たちに課すいくつかの許可協定の一方です。もし我々がこれらの義務を遵守できなかった場合,対応する許可側は許可を終了する権利がある可能性があり,この場合, は影響を受けた候補製品を開発やマーケティングできない可能性がある.このような権利を失うことは、私たちの業務、財務状況、経営業績、および将来性に重大な悪影響を及ぼす可能性がある。これらの許可手配の詳細については、ご参照くださいビジネス -戦略同盟と手配.”
| 45 |
もし私たちが第三者の知的財産権侵害で起訴されたら、これは高価で時間がかかり、この訴訟の不利な結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。
私たちのビジネス成功は、第三者の固有の権利を侵害することなく、当社の候補製品を開発、製造、マーケティング、販売し、当社の独自技術を使用する能力に依存します。私たちは、そのような候補製品をマーケティングして販売し、そのような技術を使用して既存または将来の特許を侵害しないことを保証することはできない。我々の候補製品に関連する分野には,第三者が所有する米国や外国から発行される特許や係属中の特許出願が多く存在する.バイオテクノロジーや製薬業界の拡張やより多くの特許の発行に伴い,他の人は我々の候補製品,技術または交付方法や使用が彼らの特許権を侵害するリスクが増加すると断言する可能性がある。さらに、私たちを含む業界参加者は、どの特許が様々な薬剤、生物学的製品、薬物送達システム、またはそれらの使用方法をカバーしているか、およびこれらの特許のうちどれが有効かつ強制的に実行可能である可能性があるかを常に明確にしているわけではない。したがって,我々の分野で発行される大量の特許や提出された特許出願数が多いため,第三者が我々の候補製品,技術または方法を含む特許権を持っていると主張するリスクがある可能性がある.
さらに、第三者の特許は、私たちの候補製品やノウハウによって侵害されたり、侵害されたりする可能性がある。米国のいくつかの特許出願は、特許発行前に秘密にされている可能性があるので、米国および多くの外国司法管轄区域の特許出願は、通常、提出後18ヶ月後に発行され、科学文献中の出版物は、通常、実際の発見よりも遅れているため、他の人が、私たち自身および認可内に発行された特許または私たちが処理している出願に含まれている技術について特許出願を提出していないとは判断できない。私たちの競争相手は特許出願を提出したかもしれませんし、将来的に提出されるかもしれません。私たちの候補製品または私たちと同様の技術をカバーしています。このような任意の特許出願は、私たち自身および認可内の特許出願または特許よりも優先される可能性があり、これは、そのような技術をカバーする発行された特許を取得する権利をさらに要求することができる。他方が私たちが所有または許可してくれた発明と同様の米国特許出願を提出した場合、私たちまたはライセンス技術の場合、許可者は、発明の優先度を決定するために、米国で干渉プログラムに参加しなければならない可能性がある。
私たちbrは、特許または他の知的財産権を有する第三者の将来の訴訟の脅威に直面するか、または受ける可能性があり、これらの第三者の知的財産権は、“ハッジ-ワックスマン法”第4項に基づいて提起された訴訟を含む、我々の候補製品または独自技術がこれらの第三者の知的財産権を侵害していると主張する。これらの訴訟は、このような薬物の既存の特許権が存在すると主張する可能性があり、このような訴訟はコストが高く、私たちの運営結果に悪影響を及ぼす可能性があり、私たちがこのような特許を侵害していない場合や、私たちに対する特許が最終的に無効と認定されていなくても、管理者および技術者の注意をそらす可能性がある。br}裁判所は、私たちが第三者の特許を侵害していると判断し、特許カバーの活動の停止を命令するかもしれない。また,裁判所は相手の特許侵害のために相手に損害賠償金を支払うよう命令する可能性がある.
特許侵害請求のため、または潜在的なクレームを回避するために、第三者に許可を求めることを選択または要求される可能性があります。これらの許可は、商業的に許容可能な条項に従って提供されないか、または全く適用されない可能性があります。私たちがライセンスを取得することができても、ライセンス は私たちに許可料および/または印税を支払うことを要求することができ、私たちに付与された権利は非排他的である可能性があり、これは私たちの競争相手が同じ知的財産権を獲得することをもたらすかもしれない、またはそのような権利は限定的であり、私たちの現在と未来の活動 を制限する可能性がある。最終的に、実際または脅威の特許侵害クレームにより、私たちまたは許可者が許容可能な条項で許可を得ることができない場合、私たちまたは許可者は、製品の商業化を阻止されるか、または私たちの業務のいくつかの態様を停止させることを余儀なくされる可能性がある。
私たちに提起される可能性のある侵害クレームに加えて、私たちは、米国特許商標局が発表または承認した妨害、派生、再審査、または他の許可後訴訟、および現在または他の製品知的財産権に関する外国の類似訴訟を含む他の特許訴訟および他の訴訟の当事者になる可能性がある。
バイオテクノロジーと製薬産業では、一般的に特許と他の知的財産権に関する多くの訴訟がある。今まで、誰も私たちに侵害訴訟を提起したことがない。もし第三者が私たちが知的財産権を侵害していると主張すれば、私たちは多くの問題に直面するかもしれない
| ● | 権利侵害と他の知的財産権クレームは、事件の状況にかかわらず、訴訟を提起するのは高価で時間がかかる可能性があり、そして私たちの管理層の核心業務に対する注意力を移転する可能性がある | |
| ● | 大量の侵害損害賠償は、もし裁判所が紛争製品または技術侵害または第三者の権利侵害と判断した場合、私たちは を支払う必要があるかもしれない。もし裁判所が侵害が故意であると認定した場合、私たちは3倍の損害賠償金と特許権者の弁護士費を支払うように命じられるかもしれない |
| 46 |
| ● | 裁判所は、第三者がその知的財産権を私たちに許可しない限り、製品や使用可能な技術を販売することを禁止しています | |
| ● | 第三者から許可を得た場合、私たちの製品または技術に相当な印税または前払い費用を支払うか、または知的財産権交差許可を付与する必要があるかもしれない;および | |
| ● | 私たちの製品やプロセスを再設計して、権利を侵害しないようにすることは不可能かもしれませんし、大量のお金の支出とbrの時間を必要とするかもしれません。 |
私たちのいくつかの競争相手は、彼らがより多くの資源を持っているので、私たちよりも複雑な特許訴訟の費用を効率的に負担するかもしれない。さらに、いかなる訴訟の開始および継続によって生じるいかなる不確実性も、追加資金を調達する能力を損なう可能性があり、または他の方法で私たちの業務、財務状況、経営業績、および見通しに悪影響を及ぼす可能性がある。
私たちはある第三者の許可者とパートナーに依存しているので、私たちの許可者またはパートナーのうちの1つが第三者の知的財産権侵害で起訴されれば、私たちの業務、財務状況、経営業績、見通しは私たちが直接起訴されるように影響を受けるかもしれない。訴訟のリスクに加えて、私たちは、いくつかの第三者許可者およびパートナーが私たちのノウハウによる侵害クレームを賠償することに同意し、私たちは、告発された侵害行為が私たちの独自技術によって引き起こされるかどうかにかかわらず、これらの第三者に対して提起された特許訴訟の費用の一部を支払うことを要求することができるか、または可能性がある。場合によっては、これらのコスト分担協定は、私たちの技術だけに基づいて負担するよりも大きな侵害損害賠償責任を負うことを要求する可能性もあります。
上記のいずれの状況が発生しても、我々の業務、財務状況、または経営業績に悪影響を及ぼす可能性があります。
私たちは、私たちの特許または他の知的財産権または私たちの許可側の特許を保護または強制する訴訟に巻き込まれる可能性があり、これは高価で時間がかかる可能性がある。
競争相手は私たちの特許や私たちの許可側の特許を含めて私たちの知的財産権を侵害する可能性がある。したがって、私たちは第三者の権利侵害または不正な使用を阻止するためにbr侵害クレームを提出する必要があるかもしれない。これは高くて時間がかかるかもしれないが、特に私たちのような規模の会社には。さらに、侵害訴訟では、裁判所は、私たちの特許が無効または強制的に実行できないと判断することができ、または私たちの特許主張が私たちのbr技術を含まないか、または侵害者に禁止を付与するために必要な要素を満たしていないことを理由に、他方の論争技術の使用を阻止することを拒否することができる。任意の訴訟または他の訴訟手続きに対する不利な裁決は、私たちの1つまたは複数の特許が無効、偏狭な解釈または修正されるリスクに直面する可能性があり、これらの特許は私たちの候補製品を含まない。さらに、このような不利な裁決は、私たちの特許出願を発行できない、または発行される範囲が限られており、私たちの候補製品をカバーしたり、他社が類似製品を販売することを阻止するのに十分でないリスクに直面する可能性があります。
我々の特許出願または我々の許可者または潜在的パートナーの特許出願については、発明の優先権または特許可能性を決定するために、米国特許商標局で干渉、br}派生または他の訴訟を行う必要がある可能性がある。私たちが提起した訴訟やUSPTO訴訟は失敗するかもしれないし、第三者によって私たちに引用される可能性があります。我々が勝訴しても、国内または海外訴訟や米国特許商標局または外国特許庁の訴訟は、巨額のコストを招き、私たちの経営陣の注意を分散させる可能性がある。私たちは、私たちの独占権の盗用を単独で、またはライセンシーまたは潜在的なパートナーと一緒に防止することができないかもしれません。特に法律では、このような権利を米国のように全面的に保護しない可能性があります。
さらに、 知的財産権訴訟または他の訴訟手続は、大量の発見を必要とするため、このような訴訟または他の訴訟手続では、我々のいくつかの機密情報が開示によって漏洩する可能性がある。 さらに、そのような訴訟または訴訟手続きの過程で、聴聞結果、br}動議または他の一時的手続きまたは事態の発展を公開発表するか、または関連文書に公開アクセスする可能性がある。もし投資家がこれらの結果がマイナスだと思うなら、私たちの普通株式または株式証明書の市場価格は深刻な損害を受ける可能性がある。
| 47 |
私たちの第三者への依存は、私たちのビジネス秘密を共有することを要求し、これは、私たちのビジネス秘密が盗用または漏洩する可能性を増加させ、従業員と第三者と締結された秘密保護協定は、ビジネス秘密の漏洩を十分に防止できず、他の固有情報を保護することができない可能性がある。
当社のビジネス秘密または機密ノウハウおよび非特許ノウハウは、当社のビジネスに非常に重要であると考えています。私たちは、特に特許保護の価値が限られていると思う場合、商業秘密または機密技術によって私たちの技術を保護することができる。
このような情報を競争相手から開示または盗み取らないようにするために、私たちの政策は、私たちの従業員、コンサルタント、協力者、請負業者、およびコンサルタントが、独自の情報の研究または開示を開始する前に、秘密協定および材料譲渡協定、br}プロトコル、または他の同様の合意を締結することを要求することである。これらのプロトコルは、一般に、我々の商業秘密を含む第三者が私たちの機密情報を使用または開示する権利を制限する。しかしながら、現職または元従業員、コンサルタント、協力者、請負業者、およびコンサルタントは、競争相手に意図的にまたは意図的に機密情報を漏洩する可能性があり、秘密協定は、機密情報を不正に漏洩させた場合に十分な救済措置を提供できない可能性がある。商業秘密および他の機密情報を共有する必要は、そのような商業秘密 が私たちの競争相手に知られ、無意識に他の人の技術に組み込まれているか、またはこれらの合意に違反して開示または使用されるリスクを増加させる。私たちの独自の地位が当社のノウハウやビジネス秘密にある程度基づいていることを考慮すると、競争相手は、私たちのビジネス秘密または他の不正な使用または開示が私たちの競争地位を損なうことを発見し、私たちの業務および運営結果に悪影響を及ぼす可能性があります。第三者が商業秘密または機密ノウハウを不正に取得し、使用することを強制することは、高価で、時間がかかり、予測不可能である。秘密保持協定の実行可能性は管轄区域によって異なる。
さらに、これらの合意は、通常、私たちの合意がいくつかの限られた発行権を含む可能性があるにもかかわらず、私たちの従業員、コンサルタント、協力者、請負業者、およびコンサルタントが、私たちのビジネス秘密に関連する可能性のあるデータを発行する能力を制限します。私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、私たちの競争相手は、私たちと第三者との合意に違反し、私たちの任意の第三者協力者が独立して情報を開発したり、発表したりすることで、私たちのビジネス秘密を発見するかもしれない。競争相手は私たちの商業機密が私たちの競争地位を悪化させ、私たちの業務に悪影響を及ぼすことを発見した。
私たちのbrは、私たちの従業員、コンサルタント、または独立請負業者が間違って使用しているか、または彼らの前の雇用主または彼らの以前または現在の顧客のいわゆる商業機密を開示してくれた疑いの影響を受けるかもしれない。
Brはバイオテクノロジーと製薬業界でよく見られるため、私たちのある従業員は以前、私たちの競争相手や潜在的な競争相手を含む他のバイオテクノロジーや製薬会社に雇われていた。さらに、私たちはコンサルタントを招聘して、私たちの製品および候補製品の開発を助けてくれます。その中の多くの人は以前に雇われていたか、または以前に雇われていたか、または他のバイオテクノロジーまたは製薬会社にコンサルティングサービスを提供しています。私たちは、これらの従業員とコンサルタント、または私たちが無意識にまたは他の方法で彼らの前の雇用主または彼らの前または現在の顧客の商業秘密または他の固有の情報を使用または漏洩したと非難されるかもしれない。私たちはまだこのようなクレームが告発されていることを知りませんが、このようなクレームが発生した場合、どのようなクレームにも対抗するために訴訟を提起する必要があるかもしれません。たとえ私たちがこのようなクレームに対抗することに成功しても、このような訴訟は長引く可能性があり、コストが高く、私たちの管理チームの注意を分散させ、投資家や他の第三者は私たちをよく見ておらず、不利な結果を招く可能性があります。
もし私たちの特許期間が私たちの製品が承認される前または直後に満期になったら、あるいは模倣薬や生物類似薬物製造業者が私たちの特許に挑戦することに成功した場合、私たちの業務は実質的な損害を受ける可能性があります。
特許 の有効期限は限られている.米国では、すべての維持費が直ちに支払われる場合、特許の自然失効時間は、通常、米国で最初の非臨時出願日から20(20)年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品、その製造、または用途をカバーする特許を取得しても、特許の有効期限が切れると、模倣薬または生物類似薬を含む競争薬からの競争に直面する可能性がある。
| 48 |
私たちの候補製品のFDA上場承認の時間、期限、条件によると、私たちの1つ以上の米国特許 は、1984年の“薬品価格競争と特許期限回復法”(“ハッジ-ワックスマン法”と略称する)とEUの類似立法に従って限られた特許期間延長を受ける資格がある可能性がある。ハッジ·ワックスマン法は、製品開発およびFDA規制審査中に失われた有効な特許期間を補償するために、承認された製品をカバーする特許の特許期間を最大 から5年間延長することを可能にする。特許期間の延長は,製品承認日から14年 を超えることはできず,承認された薬物に適用される特許は1つしか延長できない。しかし,適用の締め切り内に出願を提出できなかった場合,関連特許の満期前に出願を提出できなかった場合や が適用要求を満たしていなかった場合には,延期が得られない可能性がある.しかも、延期の長さは私たちが要求したものより短いかもしれない。もし私たちが特許の延期を得ることができない場合、あるいはこのような延期の期限が私たちが要求したものよりも短い場合、私たちはその製品に対して特許権を実行する期限が短縮され、競争相手は私たちが予想していたよりも早く承認され、競争製品を市場に出すことができるかもしれない。また、任意の特許期間延長期間内に排除される権利の範囲は限られている可能性があり、競争相手の製品やbr製品の使用を含まない可能性もある。したがって、私たちは適用製品からの収入が減少する可能性があり、大幅に減少するかもしれない。
新薬候補薬物の開発、テスト、および規制審査に要する時間を考慮すると、このような候補薬物を保護する特許は、これらの候補薬物の商業化前または直後に満了する可能性がある。したがって、私たちの特許および特許出願は、他の人が私たちと似ているか、または同じ製品を商業化することを排除するのに十分な権利を提供することができないかもしれない。上記のいずれの も、私たちの競争地位、業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
模倣薬または生物類似薬の製造業者brは、法廷または特許庁において、私たちの特許の範囲、有効性、または実行可能性に挑戦する可能性があり、私たちはこれらの知的財産権の実行または保護に成功しない可能性があり、したがって、関連製品を独占的に開発または販売することができない可能性があり、これは、製品の任意の潜在的販売に重大な悪影響を及ぼす。私たちが発行した特許または私たちが申請している特許が満期になった後、私たちは潜在的な競争相手に対してこのような特許権利を主張することができなくなり、私たちの業務および運営結果は不利な影響を受ける可能性がある。
もし私たちの商標と商号が十分に保護されなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は不利な影響を受ける可能性があります。
我々の 未登録商標または商号は、汎用商標として疑問視、侵害、回避または宣言される可能性があり、または他の商標の権利を侵害していると判断される可能性がある。私たちはこれらの商標や商品名に対する私たちの権利を保護できないかもしれません。私たちは関心のある市場における潜在的な協力者や顧客の中で知名度を確立する必要があります。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または商標の所有者は、我々の未登録商標または商号の変異体を含む商号または商標侵害クレームを提起することができる。長期的には、私たちの商標や取引名の登録に成功し、私たちの商標や商品名に基づいて名称承認を確立できなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。商標、商業秘密、ドメイン名、著作権または他の知的財産権に関連する専有権を実行または保護する努力は無効である可能性があり、巨額のコストおよび資源移転をもたらす可能性があり、私たちの財務状況または運営結果に悪影響を及ぼす可能性があります。
私たちの固有の情報は失われるかもしれないし、私たちはセキュリティホールに遭遇するかもしれない。
私たちの正常な業務過程で、私たちは知的財産権、臨床試験データ、独自の業務情報、個人データ、および臨床試験被験者と従業員の個人識別情報を含む敏感なデータを収集し、保存し、私たちのデータセンターとネットワークに保存する。このような情報の安全な処理、維持、そして伝達は私たちの行動に必須的だ。我々はセキュリティ対策を講じているにもかかわらず,我々の情報技術やインフラはハッカーの攻撃を受けやすいか,従業員のミス,汚職,その他の中断により破られやすい可能性がある.私たちの知る限り、私たちはこれまでこのような重大なセキュリティホールを経験したことがありませんが、brのどのような脆弱性は、私たちのネットワークを危険にさらす可能性があり、そこに格納されている情報がアクセスされ、公開され、紛失され、盗まれる可能性があります。br}どのようなアクセス、漏洩、または他の情報損失は、法的クレームや訴訟を招く可能性があり、個人情報のプライバシーを保護する法律に基づいて責任を負い、重大な規制処罰を負い、私たちの運営を乱し、私たちと私たちの臨床試験を行う能力に自信を失い、私たちの名声に悪影響を与え、候補製品の臨床開発を延期する可能性があります。
| 49 |
上場企業関連リスク
私たちのbr管理チームが上場会社を管理する経験は限られており、上場会社への移行をうまく管理できないかもしれません。
私たちの管理チームの大多数のメンバーは上場会社の管理、上場会社の投資家との相互作用、上場会社に関連するますます複雑な法律を守る上での経験は限られている。私たちの管理チームは連邦証券法に規定されている重大な監督と報告義務、および証券アナリストと投資家の持続的な審査を受けているため、上場企業への移行を成功または効果的に管理できない可能性がある。これらの新しいbr義務と構成要素は、私たちの上級管理層の高度な関心を必要とし、彼らの注意を私たちの業務の日常管理から に移すことが可能であり、これは私たちの業務、運営結果、財務状況 を損なう可能性がある。
上場企業として、私たちが著しく増加した費用と行政負担が生じており、これは私たちの業務、財務状況、経営業績に悪影響を及ぼす可能性があります。
上場企業として、私たちはより多くの法律、会計、行政、その他のコストと費用に直面しています。これは私たちが民間会社として発生していないbrであり、私たちがもはや“新興成長型会社”ではない後、これらの費用はもっと増加するかもしれません。サバンズ-オキシリー法は、404節の要求、および後に米国証券取引委員会によって実施される規則および条例、2010年のドッド·フランクウォール街改革および消費者保護法とその公布と間もなく公布される規則および条例、米国上場企業会計基準委員会と証券取引所およびナスダックの上場基準を含み、上場企業に追加の報告およびその他の義務を負担することを要求する。
上場企業の要求を守ることはコストを増加させ、ある活動をより時間をかける。その多くの要求 は,これまで実行されていなかったアクティビティの実行を要求する.例えば、新たな取締役会委員会を設立し、新たな保険証書を締結し、新たな内部制御及び開示制御プログラムを採用した。また, 米国証券取引委員会報告要求に関する費用も発生する。また、これらの要求を遵守する上で何らかの問題が発見された場合(例えば、経営陣や私たちの独立公認会計士事務所が財務報告の内部統制に大きな弱点があることを発見した場合)、これらの問題を是正するための追加コストが生じる可能性があり、これらの問題の存在は、私たちの名声や投資家の見方に悪影響を与える可能性があり、取締役や上級管理職責任保険を得るコストが高くなる可能性がある。私たちの上場会社の身分に関するリスクは、私たちが合格した人を引き付け、維持することを難しくして、私たちの取締役会に参加したり、幹部を務めたりする可能性があります。また、上場企業としては、株主急進主義の影響を受ける可能性があり、これは巨額のコストを招き、経営陣の注意を分散させ、現在予想されていない方法で業務を運営する方法に影響を与える可能性がある。本募集説明書および上場企業が要求する届出文書に情報を開示するため、我々の業務および財務状況はより可視化され、競争相手および他の第三者の訴訟を含む脅威または実際の訴訟を引き起こす可能性がある。もしこのようなクレームが成功すれば、私たちの業務および運営結果は実質的な悪影響を受ける可能性があり、たとえクレームが訴訟を引き起こさないか、または私たちに有利な解決策を得ることができなくても、これらのクレームおよびこれらのクレームを解決するのに要する時間およびリソースは、私たちの管理層のリソース を分散させ、私たちの業務および運営結果に悪影響を及ぼす可能性がある。これらの規則および法規で規定されている追加報告および他の義務は、法律および財務コンプライアンスコストおよび関連法律、会計、行政活動のコストを増加させる。これらの増加したコストは、業務の拡大と戦略目標の達成に本来使用できる大量の資金を移転することを要求する。株主や第三者の提唱努力は、ガバナンスや報告要件のより多くの変化を促す可能性もあり、コストをさらに増加させる可能性がある。
| 50 |
上場企業としてのbr要求は私たちの資源を緊張させ、管理層の注意力を分散させ、私たちの合格取締役会のメンバーを吸引し、維持する能力に影響を与える可能性がある。
私たちのbrは、改正された1934年の“証券取引法”(以下、“取引法”と略称する)、“サバンズ-オキシリー法案”及びその下で公布された任意の規則及びナスダックの報告要求を遵守しなければならない。これらの規則と法規の要求は私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動を更に困難にし、時間或いはコストを高め、そして私たちのシステムと資源に対する需要を増加させた。“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、私たちに効率的な開示統制と手続き、および財務報告書の内部統制を維持することを要求する。この基準を達成するために、必要に応じて我々の情報開示制御および手順および財務報告の内部統制を維持し、改善するためには、大量の資源および管理監視が必要となるため、管理職の注意が他の業務事項から移行する可能性がある。このような規制はまた私たちが合格した独立した取締役会のメンバーを引き付けて維持することをもっと難しくするだろう。また,これらの規制 は,我々が取締役や上級管理者責任保険を獲得することをより困難で高価にしている.私たちは、低い保証範囲を受け入れるか、またはより高い費用を発生させることを要求される可能性があります。上場企業の報告要求を遵守するコスト増加 や、これらの要求を満たすことができない可能性があり、私たちの運営、業務、財務状況 や運営結果に重大な悪影響を及ぼす可能性があります。
上場企業としての義務を履行するためには、適切な上場企業の経験を持つ合格会計·財務者を招聘する必要がある。
新たに設立された上場企業として、効果的な情報開示と財務制御を改善し、維持し、当社のコーポレートガバナンスのやり方を変更する必要があります。私たちは適切な上場企業の経験と技術会計知識を持つ会計と財務人員をもっと募集する必要があるかもしれませんし、これらの人員を募集し、維持することは難しいかもしれません。たとえ我々が適切な人員を採用することができても,我々の既存の運営費用や運営は,彼らを雇用する直接コストや研究開発事業からの管理資源の移転に関する間接的な結果の影響を受ける。
私たちのbrは新興成長型会社であり、いかなる決定も新興成長型会社に適用されるいくつかの減少した報告と開示要求を遵守することは、私たちの普通株の投資家に対する吸引力を低下させる可能性がある。
“雇用法案”の定義によると、私たちは新興成長型会社です。新興成長型企業であり続ける限り、他の上場企業に適用されるが“新興成長型企業”には適用されない様々な報告要件の免除を利用することを選択することができる
| ● | 独立公認会計士事務所にはサバンズ-オキシリー法第404節に基づく財務報告書の内部統制は要求されません | |
| ● | 私たちの定期報告書と10-K表年次報告書の役員報酬に関する開示義務を削減し、 | |
| ● | 役員報酬と株主承認前に承認されなかったいかなる黄金パラシュート支払いについても拘束力のない諮問投票の要求を免除する。 |
したがって、株主は彼らが重要だと思ういくつかの情報を得ることができないかもしれない。次のような状況が発生すると、私たちの新興成長型企業としての地位は直ちに終了します
| ● | 年収少なくとも10億7千万ドルの財政年度の最終日 | |
| ● | 私たちは“大型加速申請者”になる資格があり、非付属会社は少なくとも7.0億ドルの株式証券を持っている | |
| ● | 3年間で10億ドル以上の転換不可能な債務証券を発行しました | |
| ● | Larkspur初公募五周年後に終わった財政年度の最終日。 |
| 51 |
雇用法案によると、新興成長型企業は、これらの基準 が民間企業に適用されるまで、新たな会計基準の採用や改正を延期することもできる。私たちはこの延長された過渡期を利用することを選択するかもしれませんので、私たちの財務諸表は似たような状況の上場企業と比較できないかもしれません。
新興成長型企業が提供する任意の免除に依存することを選択すれば、投資家が私たちの普通株吸引力の低下を発見するかどうかを予測することはできません。もし一部の投資家がこれらの免除に依存して私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株はそんなに活発ではない取引市場があるかもしれません。私たちの普通株の市場価格はもっと変動し、低下するかもしれません。
もし私たちが財務報告に対して有効な開示制御と内部制御システムを維持できなければ、私たちが適時かつ正確な財務諸表を作成したり、適用法規を遵守する能力が損なわれる可能性があり、これは投資家の信頼に悪影響を与え、私たちの普通株の市場価格に影響を与える可能性がある。
上場企業として、私たちは効果的な開示統制と手続きの維持、財務報告の内部統制を含むサバンズ-オキシリー法案の要求を遵守することを要求される。我々は、米国証券取引委員会に提出された報告で開示すべき情報が、米国証券取引委員会規則および表が指定された期間内に記録、処理、集約および報告されることを確実にし、取引所法案に基づいて報告書に開示された情報が蓄積され、我々の主要幹部および財務官を含むことを確実にするために、私たちの開示制御および他の手続きを策定し、改善していく。
私たち は財政報告書の内部統制を改善し続けなければならない。私たちは、私たちの財務報告の内部統制の有効性を正式に評価することを要求されます 一旦、私たちが新興成長型会社でなくなると、私たちの独立公認会計士事務所が発行した財務報告の内部統制に関する認証報告を含むことが要求されます。規定された時間内にこれらの要求の適合性を達成するために、私たちは、高価で挑戦的な財務報告に対する私たちの内部 制御を記録して評価するためのプロセスに参加する。この点では、外部コンサルタントを招聘し、財務報告の内部統制に対する十分性を評価して記録するために、外部コンサルタントを招聘し、詳細な作業計画を採用することが可能であり、テストによって制御がファイルのように機能しているかどうかを検証し、持続報告 および財務報告内部制御改善プロセスを実施する必要がある。私たちは規定された時間内に結論を出すことができないかもしれない、すなわち、私たちは財務報告書の内部統制に有効であり、“サバンズ-オキシリー法案”404条の要求に適合している。さらに、私たちのテストまたは私たちの独立公認会計士事務所のその後のテストは、財務報告の内部統制における私たちの他の欠陥を明らかにするかもしれません。これらの欠陥は実質的な弱点と考えられています。
1つまたは複数の重大な弱点を決定することを含む、有効な開示制御および手順および財務報告の内部制御を実施および維持することができなかった場合、投資家が私たちの財務諸表および報告の正確性および完全性に自信を失う可能性があり、これは私たちの普通株式の市場価格に悪影響を及ぼす可能性がある。また、私たちは、私たちの普通株が上場している証券取引所、アメリカ証券取引委員会、他の規制機関の制裁や調査を受ける可能性があります。
この点で、2022年度の監査期間中、財務報告の内部統制には、重大かつ複雑な非通常取引の会計を効率的に制御する設計および実施がなされていないため、大きな弱点があることが分かった危険な要素-私たちは財務報告書の内部統制に重大な欠陥があることを発見した。もし私たちが重大な弱点を補い、他の方法で有効な財務報告内部制御制度 を維持できなければ、私たちの財務報告の信頼性、投資家の私たちに対する自信、そして私たちの普通株の価値は不利な影響を受ける可能性がある.”
私たちbrは証券訴訟の影響を受けるかもしれませんが、これは高価で、経営陣の注意をそらすかもしれません。
我々普通株の1株当たり価格は不安定である可能性があり,過去に市場価格変動を経験した会社の株価は集団訴訟を含めて証券訴訟を受けたことがある。このような訴訟は、大量の費用および経営陣の注意および資源を移転させる可能性があり、これは、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。訴訟のどんな不利な判決もまた私たちに重大な責任を負わせるかもしれない。
| 52 |
私たちは従来の公募株以外の方式で上場企業になったため、私たちの株主は追加のリスクと不確実性に直面する可能性がある。
従来の引受初公募株ではなく業務合併を整備することで上場企業となったため、独立した第三者引受業者が我々の普通株の株を売却していないため、我々の株主は、通常独立引受業者が公開証券発行で実行する独立審査·調査タイプから利益を得ることができない。職務調査審査は通常、会社、任意のコンサルタント及びそのそれぞれの付属会社の背景を独立して調査し、発売文書を審査し、業務計画と任意の潜在的な財務仮定を独立的に分析することを含む。
私たちはOld ZyVersaに対して業務合併に関連した職務審査と調査を行ったにもかかわらず、独立した職務審査と調査の不足は、私たちの職務審査と調査が潜在投資家に重要な事実を発見しなかったかもしれないので、私たちの証券投資に投資するリスクを増加させた。
また、私たちは伝統的な引受を通じて初めて公募株(IPO)を上場企業にするのではないので、証券や業界アナリストは私たちの記事を提供したり、あまり提供したりしないかもしれません。もし私たちが伝統的な公募株の方式で上場企業になれば、投資銀行も私たちを代表して二次発行を受けることに同意することができないかもしれません。彼らは私たちをよく知らないかもしれません。アナリストやメディアの報道がもっと限られているからです。もし私たちの普通株が市場で研究報告や支持を得ることができなければ、私たちが普通株のために流動性市場を開発する能力に悪影響を及ぼすかもしれません。
私たちの証券保有に関するリスク
私たちの普通株の活発な取引市場は永遠に発展したり持続しないかもしれない。
私たちの普通株はナスダックに上場していますが、私たちの株式市場はある程度の取引が活発です。もし取引が活発なbr市場が発展していない場合、あるいは発展しているが維持されていない場合、あなたは公衆流通株が限られているので、私たちのどんな普通株も売ることが難しいかもしれません。私たちは私たちの普通株の取引価格を予測できない。今後の1つまたは複数の時期に、私たちの運営結果と私たちの製品ラインの進展は、公開市場アナリストや投資家の予想に合わない可能性があり、これらおよび他の要因により、私たちの普通株価格は下落する可能性がある。したがって、私たちはあなたが必要な時に、またはあなたが購入した株式以上の価格で、またはあなたが持っている普通株を販売しない能力があることを保証することはできません。
私たちの普通株の市場価格は変動する可能性があり、これは投資家に大きな損失をもたらすかもしれない。
私たちの普通株の取引価格はずっと高度に変動し続ける可能性があり、様々な要素の広範な変動 を受ける可能性があり、その中のいくつかの要素は私たちがコントロールできない。
私たちの普通株の市場価格は様々な要素によって変動するかもしれません
| ● | 私たちの候補製品を開発し承認しました | |
| ● | 私たちの候補製品の発表と商業化の時間(承認されれば)、およびこのような発表と商業化は、証券アナリストや投資家の期待をどの程度満たしているか | |
| ● | 四半期と年度業績の変動を含む経営業績の実際または予想変動 | |
| ● | 運営費用 は予想を超えている; | |
| ● | 私たちの製品開発と研究計画は失敗または中断しています |
| 53 |
| ● | 学術と研究実験室及び機関研究の構造或いは資金面の変化は、彼らが私たちの機器や消耗品を購入する能力の変化を含む | |
| ● | 既存または新しい競争企業または技術の成功; | |
| ● | 我々の競争相手の新しい研究計画や製品に関する公告 ; | |
| ● | 特許出願、発行された特許または他の固有の権利に関連する発展状況または紛争; | |
| ● | キーパーソンの採用や退職 | |
| ● | 私たち、私たちの産業、または両方に関する訴訟と政府調査 | |
| ● | アメリカや他の国/地域の規制や法律の発展; | |
| ● | 一般生命科学技術部門、あるいは特にプロテオミクス部門あるいはゲノム学部門の変動性と市場状況の変化; | |
| ● | 投資家は私たちや私たちの業界について考えています | |
| ● | 私たちの研究開発計画や製品に関する費用レベルは | |
| ● | 私たちの財務業績または発展スケジュールの推定の実際または予想変化、私たちの財務業績または私たちに似ていると考えられる会社の財務業績の変化、または証券アナリストが私たちの普通株式または私たちに似ていると考えられる会社の推定または提案の変化(あれば); | |
| ● | 私たちの財務業績は証券アナリストや投資家の予想に合っているかどうか | |
| ● | 追加的な融資努力を発表または期待しています | |
| ● | 当社または当社内部の人々またはその他の株主は、当社の普通株を売却します | |
| ● | 市場の膠着状態またはロックプロトコルの満了 | |
| ● | 一般的な経済、産業、市場状況; | |
| ● | 新冠肺炎の大流行、自然災害或いは重大な災難性事件。 |
これらの市場と業界要素は、私たちの経営業績にかかわらず、私たちの普通株の市場価格を大幅に下げるかもしれない。
最近,株式市場全体,特に生命科学技術会社の市場は,重大な価格や出来高変動を経験しており,これらの変動は,その株式がこれらの価格や出来高変動を経験している会社の経営業績の変化に関係なくあるいは比例しないことが多く,特に現在の新冠肺炎が大流行している場合である。私たちの実際の経営業績にかかわらず、広い市場と業界要素は私たちの普通株の市場価格に深刻な影響を与える可能性がある。これらの変動 は私たちの普通株と権利証の取引市場でもっと明らかになるかもしれない。ある会社の証券市場価格にこのような変動が生じた後、同社に対して証券集団訴訟が提起されることが多い。
私たちの普通株価格の潜在的な変動性のため、私たちは将来証券訴訟の目標になる可能性があります。br証券訴訟は巨額のコストを招き、経営陣の関心と資源を私たちの業務から移行させる可能性があります。
| 54 |
私たちのbrは、融資、買収、投資、私たちの株式インセンティブ計画、または他の側面に関連する追加株式の発行は、他のすべての株主の権益を希釈する。
私たちが融資、買収、投資、株式インセンティブ計画、または他の方面で発行した追加株式は、私たちの株主を希釈します。私たちは将来的に追加の株式を発行し、これは他のすべての株主の持分希釈につながると予想されています。私たちは私たちの株式インセンティブ計画に基づいて従業員、取締役、コンサルタントに株式奨励を与える予定です。私たちはまた未来に株式融資を通じて資金を調達するかもしれない。我々の業務戦略の一部として、補完会社、br製品または技術を買収または投資し、そのような買収または投資のいずれかを支払うために株式証券を発行することができる。このような追加のbr株の発行は株主の所有権権益を著しく希釈する可能性があり、私たちの普通株の1株当たりの価値も低下する。
また,最近完成したベストエフォート発行により,このような発行価格とB系列株の転換価格と管権証の行使価格が適用底価格にリセットされたため,余分な償却が生じた.また,最近完成した2023年7月に発売されたため(以下のように定義される),このなどの発売価格と一部のベストエフォート承認証の行使価格が割引価格にリセットされたため,余分な割引 が生じた.PIPE株式承認証を行使する際に発行可能な普通株式数もPIPE株式転換後に発行可能普通株の100%に等しく調整されている。ベストエフォート 発売中に証券を発行することや、B株とPIPE引受権証(場合によっては)を行使または転換した後に普通株を増発する可能性があり、株主が重大な希釈を受ける可能性がある。
また,我々普通株の市場価格が管権証や権利証の行権価格リセット後の底値よりも高ければ,このような証券の所有者はそのような証券を行使し,普通株の対象となるbr株を売却し,そこから利益を得ることができる.もし私たちの普通株の市場価格が持分証の行使価格より低い場合、所有者はその株式承認証を行使する可能性が低い。したがって、このような調整の後、このような証券の保有者は、証券を私たちの普通株の株として行使し、その株を売却することが可能であり、それによって、私たちの普通株の市場価格に追加の負の圧力および他の希釈効果をもたらす可能性がある。
また, 今回の発行で登録された株式数は,我々が受け入れられる価格で追加株を発行する能力に悪影響を与える可能性があり ,発行金額は我々の業務戦略を実行させるのに十分である.私たちは後続発行で株式または株式リンク証券を発行することで追加資本を調達する予定だ。ベストエフォート発売、2023年7月発売、任意の将来発売の完了、またはBシリーズ株の行使または転換、パイプ株式承認証、ベストエフォート株式承認証、誘導権証(場合によっては)を追加的に発行する可能性があり、私たちに有利な条項や既存株主に実質的な希釈作用がない条項で追加資本を調達する能力に悪影響を及ぼす可能性があります。もし私たちに有利な条項で株式や株式に関連した証券を発行して追加資本を調達できなければ、私たちは私たちの業務戦略を実行するのに十分な流動性がないかもしれない。また、ベストエフォート発売、2023年7月発売または任意の未来発売を完了するか、またはB株、パイプ株式承認証、ベストエフォート株式承認証および誘導権証(場合によっては)を行使または転換した後に普通株を追加発行する可能性があり、ベストエフォート発売、2023年7月発売または任意の未来発売で販売される追加株式、またはBシリーズ株式の行使または転換、管路株式承認証および最適努力株式証(場合に応じて決定)の際に発行される追加株式が、当社普通株の市場価格に悪影響を及ぼす可能性がある。私たちの普通株の発行された株式と発行された株式の大きな一部を代表して、将来の任意の発行で販売される普通株の価格は、私たちの普通株の現在の市場価格よりも低い可能性がありますか、または適用された場合にBシリーズ株、管路承認権証、およびベストエフォート株主証を行使または転換して発行された普通株は、私たちの普通株の既存保有者を著しく希釈することができます。
私たちがナスダックの持続的な上場基準を遵守できる保証はありません。
もしナスダックがナスダックの上場基準に達しなかったため、私たちの普通株をその取引所で退市させた場合、私たちと私たちの株主は重大な不利な結果に直面する可能性があります
| ● | 私たちの証券の市場オファーは限られています | |
| ● | 証券の流動性を低下させました | |
| ● | 私たちの普通株が“細価格株”であることを確認することは、私たちの普通株の取引マネージャーにより厳しい規則を遵守することを要求し、二級取引市場における私たちの証券の取引活動レベルを低下させる可能性がある | |
| ● | 限られた新しい記事とアナリストの記事;および | |
| ● | A 将来的に追加証券を発行したり、追加融資を受ける能力が低下します。 |
| 55 |
私たちがナスダックの継続的な上場要求を守れなかったことは、私たちの普通株が銘柄を取られる可能性があります。
私たちの普通株は現在ナスダック世界市場で看板取引されている。私たちはナスダックの持続的な上場要求を満たさなければなりません。brは私たちの普通株のナスダック世界市場での上場を維持することができます。
2023年06月9日、当社はナスダックから手紙を受け取り、当社の普通株の30営業日連続の終値によると、当社は現在“ナスダック上場規則”第5550(A)(2)条に規定されているナスダック全世界市場への上場を継続して1株最低購入価格1.00ドルの要求を維持しなければならないと指摘している。
この通知は私たちの普通株のナスダック世界市場での継続上場状態に直ちに影響を与えないため、私たちの上場 は完全に有効である。
ナスダック上場規則第5810(C)(3)(A)条によると、我々は180暦の適合期間を獲得し、通知の日からまたは2023年12月6日まで、 の最低成約見積要求を再遵守する。2023年12月6日までのいつでも、私たちの普通株の終値が10営業日連続で1株1.00ドル以上になった場合、ナスダックは最低入札価格要求に達したことを書面で通知し、これは解決されるだろう。2023年12月6日までのコンプライアンス期間内にコンプライアンス を再獲得できなかった場合、ナスダックはさらに180暦の期間を与えてコンプライアンスを再獲得する可能性があり、条件は、我々(I)が公開持株時価の持続的な上場要求およびナスダック世界市場の他のすべての初期上場基準を満たすことであるが、最低終値要求は除外し、(Ii)はナスダックにbr不足の問題を解決しようとしていることを通知する。
私たち は引き続き私たちの普通株の終値を監視し、割り当てられたコンプライアンス期間内にすべての適用されたナスダック要求 を再遵守することを求めます。もし私たちが割り当てられたコンプライアンス期間内にナスダックが承認される可能性のあるいかなる延期も含めてコンプライアンスを再獲得できなかった場合、ナスダックは私たちの普通株式が退市されるという通知を出すだろう。そして、私たちはこの判決をナスダック公聴会グループに控訴する権利があるだろう。私たちはコンプライアンスを回復し、上場を維持するために努力するつもりですが、180日のコンプライアンス期間内に最低入札価格要求を再遵守する保証はありません。180日目の第2のコンプライアンス期間を確保して、コンプライアンスを回復したり、ナスダックに適合した他の上場要件を維持したりすることは保証されません。
また、当社は2023年9月1日にナスダックの手紙を受け取り、当社が過去30営業日以内に、当社 がナスダック上場規則第5450(B)(1)(C)条で締結した株式の最低時価5,000,000ドルを公開保有していないことをナスダック世界市場に上場し続ける要求を遵守できなかったことを通知した。
ナスダック上場規則第5810(C)(3)(D)条によると、当社は180暦、あるいは2024年2月28日まで、 がMVPHSを遵守する最低要求を回復する。コンプライアンスを再獲得するためには,会社普通株の最低MVPHSは または5,000,000ドルを満たさなければならず,180カレンダー日合期間内に少なくとも10営業日連続している.
もし会社が2024年2月28日までにMVPHSの最低要求を再遵守できなかった場合、ナスダックは会社に書面通知を出し、証券がキャンセルされることを通知する。あるいは、当社は当社の証券をナスダック資本市場に譲渡することを申請することも考えられます。
社は現在から2024年2月28日までその普通株のMVPHSを監視する予定であり,その普通株の取引レベルが規定を満たしていなければ,会社が利用可能な各種選択 を考慮する.
もし私たちが未来にすべての適用されたナスダックの全世界市場要求を満たすことができなければ、ナスダックは私たちの普通株を退市することを決定し、退市は私たちの普通株の取引量を大幅に減少させる可能性がある;ナスダックに関連する市場効率の喪失と連邦政府の州証券法に対する優先購入権を失ったため、私たちの普通株の市場流動性は悪影響を受け、私たちは受け入れ可能な条項で融資を得る能力に不利な影響を与える(もしあれば)、投資家、brサプライヤー、顧客、従業員の潜在的な自信を失い、業務発展の機会を減少させる可能性がある。また、私たち普通株の市場価格はさらに下落する可能性があり、株主は投資の一部または全部を損失する可能性がある。
私たちの普通株が引き続き全国証券取引所に上場しない限り、いわゆる を受けることになります“細価株” 制約販売実践要求のルール を強制的に実施する.
もし私たちの普通株のナスダックや他の国の証券取引所での上場を維持できなければ、もし私たちの普通株の時価が1株当たり5ドル以下であれば、私たちの普通株はいわゆる“細価格株”規則によって制約される可能性がある。米国証券取引委員会は規定により、細価格株を1株当たり5ドル以下の任意の市価を含む株と定義しているが、国家証券取引所で取引されている株式例外を含む例外がある。“アメリカ証券取引委員会条例”は自営業者が低価格株を販売する行為に対して制限的な販売行為 要求を提出し、販売対象はアメリカ証券取引委員会の関連規則で定義された確立された顧客と“認可投資家” ではない。これらの追加的な要求は、ブローカーが細価格株に分類された証券を取引することを阻止する可能性があり、これは、このような証券の市場価格および流動性を深刻に制限し、購入者が二次市場でそのような証券を販売する能力を深刻に制限する可能性がある。これは,我々の普通株の国家証券取引所への上場を維持できなければ,株主が二次市場で普通株を売却する能力が不利な影響を受ける可能性があることを意味する.
細価格株に関連する取引が米国証券取引委員会規則の制約を受けない場合、ブローカーは取引前に各投資家に細価格株市場に関する開示明細書を提出しなければならない。ブローカー-トレーダーはまた、ブローカーおよびその登録代表に支払われる手数料、細価格株式の現在のオファーを開示しなければならず、ブローカー-トレーダーが唯一の市営業者である場合、ブローカー-トレーダーは、この事実およびブローカー-トレーダーの市場に対する仮定制御を開示しなければならない。最後に,毎月の請求書 を送信し,顧客口座に保有する細価格株の最新価格情報と,細価格株の有限市場に関する情報を開示しなければならない.
私たちのbrは、私たちの財務状況および普通株株価に大きな負の影響を与える可能性のある費用を減記またはログアウト、再構成、および減額する必要があるかもしれません。これは、あなたの一部またはすべての投資損失を招く可能性があります。
私たちのbrは、後で資産を減記またはログアウトすること、トラフィックを再構成すること、または減価または他の費用を発生させることを余儀なくされる可能性があり、それによって損失を報告することができます。予期せぬリスクが生じる可能性があり,既知のリスクは以前には予想されていなかった方法で出現する可能性がある。これらのbr費用は非現金プロジェクトである可能性があり、私たちの流動性に直接的な影響を与えないかもしれないが、私たちはこのような性質の費用の事実が私たちまたは私たちの証券に対する市場の否定的な見方をもたらす可能性があると報告する。しかも、このような性質の疑いは私たちがレバーに違反したり、私たちが受ける可能性のある他の契約を招くかもしれない。したがって、私たちの株主はこのような減記や減記によってbr株価値の縮小を受ける可能性がある。
| 56 |
形式の財務情報を準備する際に使用される仮定は不正確であることが証明される可能性があり、他の要因は私たちの将来の財務状況や運営結果 に影響を与える可能性があります。私たちの財務状況や経営業績のいかなる潜在的な低下も、私たちの株価に大きな変化をもたらす可能性があります。
我々は、2023年1月27日に、我々が2023年12月16日に提出した現在の8-K/A表(“原始8-K/A”)に対する修正案(“修正案”)を提出した。この修正案は、純粋に、当社のS-4表における業務組合に関する登録声明に含まれる原始8-K/A表に含まれる監査されていない形式の簡明な総合財務情報を完全に置換するためのものである。審査されていない予備試験の簡明総合財務資料は以前管理層が業務合併完成時に得られた資料による推定を反映し、そして追加資料の獲得及び分析に伴い変動した。私たちは分析が完了した後、Old ZyVersaが可変利益エンティティであることを決定したので、業務合併がZyVersa治療会社(“Old ZyVersa”)の長期合併を反映するため、未監査備考簡明合併財務情報 を更新した。審査されていない備考簡明総合財務資料及びその関連付記は、当社が買収したOld ZyVersaの資産純資産に対する公正価値調整を反映しており、この純資産は主に行われている研究開発無形資産から構成されており、このなどの無形資産は無期限である。改訂された未審査備考簡明総合財務資料は本募集説明書に含まれている。監査されていない備考は財務情報の変化を簡明に合併するため、私たちは潜在的な訴訟或いは他の紛争に直面する可能性があり、その中には私たちの株主に関連する訴訟、連邦と州証券法を引用するクレーム、契約クレーム或いはこのような変更による他のクレームが含まれている可能性がある。本募集説明書の発表日まで、私たちはこのようなクレーム、訴訟、紛争があることを知りません。しかし、私たちはこのようなクレーム、訴訟、あるいは 紛争が未来に起こらないという保証はない。このようなクレーム、訴訟、あるいは紛争は、勝訴の有無にかかわらず、私たちの業務、運営結果、財務状況に重大な悪影響を及ぼす可能性がある。
私たちは 業務の不確実性の影響を受けて、これは私たちの普通株の市場価格に影響を及ぼすかもしれない。
我々の業務や運営の不確実性 は,それぞれのサプライヤー,ユーザ,流通業者,ライセンス側,ライセンサー側との関係に影響を与える可能性がある.どのような影響も私たちと私たちの普通株の市場価格に悪影響を及ぼすかもしれない。これらの 不確実性は、私たちと付き合っている当事者が彼らとの既存の業務関係の変更を求め、私たちに関する決定を延期または延期する可能性があります。終了または修正を含む既存の業務関係の変化は、私たちのすべての収入、収益とキャッシュフロー、および私たちの普通株の市場価格に負の影響を与えるかもしれません。
さらに、トランザクションは、時間およびリソースを投入する必要がある可能性があり、そうでなければ、これらの時間およびリソースは、他の可能性のある有利な機会に使用することができる。 さらに、業務統合は、業務統合に関連する係属中および将来の株主訴訟の結果を含む潜在的な責任を生じる可能性がある。これらの事項のいずれも、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
| 57 |
サード·パーティ は、我々との既存の契約または関係を終了または変更することができる。
流通業者、付属会社、大家、ライセンシー、および私たちが現在関係している他のビジネスパートナーおよび第三者と締結されている契約は、終了、範囲の縮小、または他の方法で彼らと私たちとの関係に大きな悪影響を及ぼす可能性があります。このような権利を追求することは、将来の潜在的収入の損失を被ったり、そのような合意に違反して責任を招き、私たちの業務に重要な権利を失ったりする可能性がある。このような中断は、私たちが予想される業務収益を達成する能力を制限することができる。このような中断の悪影響はまた、私たちの業務と運営、または私たちの普通株の市場価格 に影響を及ぼす可能性がある。
私たち LarkspurとOld ZyVersaの業務の統合を完了することに関連する巨額の取引費用とコスト。
当社では,業務合併及び業務合併完了プロトコル及び関連取引プロトコルが予想する取引に関する重大な非日常的支出 を発生させている。業務統合には一定のレベルの費用が発生すると想定されていますが、私たちの制御範囲を超えた多くの要因があり、合併業務のこのような費用総額やスケジュールに影響を与え続けている可能性があります。業務統合後、業務を展開する過程で追加の意外なコストが発生し続ける可能性がある。
もし私たちがどんな証券訴訟や株主維権活動の影響を受けていれば、私たちの業務と運営はマイナスの影響を受ける可能性があります。これは私たちに巨額の費用を発生させ、私たちの業務と成長戦略の実行を阻害し、私たちの株価に影響を与える可能性があります。
かつて、ある会社の証券市場価格の変動 に伴い、同社は証券集団訴訟を起こすことが多かった。株主急進主義は様々な形をとることができ、様々な状況で出現することも可能であり、最近増えてきている。私たち普通株株価の変動やその他の原因は、将来的に証券訴訟や株主次元権の目標となる可能性があります 潜在的な代理権競争を含む証券訴訟や株主急進主義は、巨額のコストを招き、経営陣や取締役会の関心や資源を我々の業務から移行させる可能性がある。また、このような証券 訴訟や株主急進主義は、私たちの未来に明らかな不確実性を与え、私たちとサービスプロバイダとの関係に悪影響を与え、合格者の誘致と維持をより困難にする可能性がある。私たちはまた、任意の証券訴訟や権利株主事項に関連する大量の法的費用や他の費用の支払いを要求される可能性がある。また、私たちの株価は大きな変動の影響を受けたり、任意の証券訴訟や株主次元権の事件、リスク、不確実性の悪影響を受ける可能性があります。
PIPEによる引受プロトコル、および将来のこのような 権利の行使は、私たちの普通株の市場価格に悪影響を及ぼす可能性があることを含む、いくつかの所有者に登録権を付与する。
業務合併が完了した後、改訂及び再予約された登録権プロトコルは、Larkspur以前の登録権プロトコルの代わりに、吾等及びいくつかの他の契約者によって締結される。改訂及び再予約された登録権協定に基づいて、改訂及び再予約の登録権協定の制約を受けた登録可能証券所有者及びその譲渡許可者及び譲渡者は、その普通株式株式に関する常習登録権 を有することになる(請求権、棚上げ権及び積載権を含むが、協力及び削減条項の規定の制限を受けなければならない)。PIPE投資の完了について締結した登録権協定に基づき、吾等 は業務合併後に米国証券取引委員会に登録声明を提出し、PIPE投資について、PIPE証券の基礎となる普通株を増発する。また,この等登録権協定により,我々は商業的に合理的な最善を尽くして(I)その登録声明をその後即時に発効 および(Ii)が登録すべき証券 の未弁済がなくなるまでその登録宣言の効力を維持することに同意した.また,PIPE引受プロトコルは,これらの所有者は何らかの“搭載”登録権利を持ち,その証券を我々が提出した他の登録声明に含めることを規定している.B系列株の所有者に登録権を付与することにも同意し,これによりこれらの保有者はB系列株に関連する普通株株の習慣登録権(請求権,棚上げ権,搭載権を含み,協力や削減条項の制限を受ける)を獲得する.
| 58 |
証券や業界アナリストが私たちに関する研究を発表しない場合、私たち、私たちの業務または私たちの市場に関する不正確または不利な研究を発表するか、または彼らが私たちの普通株に不利な提案をした場合、私たちの普通株の取引価格または取引量 が低下する可能性がある。
私たちの普通株の取引市場は、証券や業界アナリストが発表する可能性のある、私たちの業務、私たちの市場、または私たちの競争相手に関する研究と報告の影響をある程度受けるだろう。1つ以上の証券アナリストが不利な格付けで研究を開始したり、私たちの普通株格付けを引き下げたりして、私たちの競争相手に関するより有利な推薦を提供したり、私たちの業務の不正確または不利に関する研究報告を発表したりすれば、私たちの普通株価格は下落する可能性がある。もし私たちを報道し始めた証券アナリストが少ない場合、あるいは1人以上のアナリストが私たちの報告を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちは金融市場で可視性を失う可能性があり、私たちの証券に対する需要が減少し、ひいては私たちの普通株の価格と取引量を低下させる可能性がある。
私たちの総流通株の大部分は即時転売が制限されていますが、近い将来市場に売却される可能性があります。これは私たちの業務が良好であっても、私たちの普通株の市場価格を大幅に下落させる可能性があります。
私たちの普通株の市場価格は、私たちの普通株の株を市場で大量に売ることや、これらの売却が起こりうると思う感覚によって低下する可能性があります。2023年10月23日までに、我々は43,515,401株普通株 を発行した。当該等の株式の制約を受けた販売禁止期間が満了した後のいつでも、ある株主は、改正及び再予約された“登録権協定”に基づいて、証券法による当該株式の登録に関する要約及び売却に関するいくつかの権利を有し、その株式を登録するための登録声明の提出及び売却を要求することを含む。
吾らは、改正及び再予約された登録権協定及び配管株式前所有者及びB系列株式保有者と締結した登録権協定に基づいて負う義務に基づいて、本登録声明は最大24,647,598株普通株の登録を求める。この等証券は、本公告日までに発行された普通株式の約57%を占めている。本登録明細書に登録されている株をすべて売却株主が売却する場合、このような売却は私たち普通株の市場価格に大きなマイナス圧力を与える可能性があります。また、Bシリーズ株の転換価格は普通株式底価格1株7.00ドルの調整を受け、管状株式承認証の発行権価格 は普通株式底価格2.00ドルの調整を受け、2023年7月に発売された一部として、1,377,996件のベストエフォート株式承認証再定価 を受け、行権価格は行権価格1.00ドルから0.165ドルに引き下げられた。我々普通株の市場価格がパイプ承認株式発行権価格リセット後の底価格よりも高ければ、このような証券の所有者 はこのような証券を行使して普通株の対象株を売却し、そこから利益を得ることができる。もし私たちの普通株の市場価格が持分証の行使価格より低い場合、所有者は彼らの株式承認証を行使する可能性があまりありません。したがって、このような調整後、その証券の所有者は、証券を私たちの普通株に変換して売却する可能性が高く、それによって、私たちの普通株の市場価格に追加のマイナス圧力 および他の希釈効果をもたらす可能性があります。
本レジストリに基づいて保険者株を登録した後、私たちの普通株は500万株以上が短期的に市場で販売されるだろう。保証人株式のコストベースは、Larkspur IPOと業務合併により発行された普通株式よりも低いため、保険者株式保有者は、このような証券を私たち普通株の他の保有者よりも低い価格で売却したい可能性がある。保証人株と今回の発行によって登録された他の証券の可用性は、私たちの普通株の市場価格にマイナス影響を与える可能性があります。
また、私たちは最近、私たちの株式補償計画の下で将来のために保留株を発行するための登録声明書を提出しました。この登録声明が発効した後、適用される帰属制限及び上記市場硬直合意及びロック協定の満了又は免除に適合する場合、当該等の計画に基づいて付与された未償還株式オプション、制限株式単位奨励及び株式承認証又は帰属他の持分奨励を行使することにより発行された株式は、公開市場で即時に転売することができる。
制限が終了したり、登録権に基づいて私たちの普通株 を売却することは、将来的に私たちが適切だと思う価格で株式証券 を売ることをより困難にするかもしれない。これらの売却はまた、私たちの普通株の取引価格を下落させる可能性があり、私たちの普通株の株を適切な時間と価格で売却することが困難になります。
私たち は予測可能な未来に現金配当金を支払うつもりはない。
私たちは現在、私たちの未来の収益(あれば)を保留し、私たちの業務のさらなる発展と拡張に資金を提供するつもりで、予測可能な未来に現金配当金を支払うつもりはありません。未来に配当金を派遣するかどうかは私たちの取締役会が自分で決定し、そして私たちの財務状況、経営結果、資本要求、未来の合意に含まれる制限 及び融資ツール、業務の将来性と私たちの取締役会が関連すると考えている他の要素に依存する。
私たちのbr}株主は将来希釈されるかもしれない。
買収、資本市場取引、またはその他の株式発行は、取締役、高級管理者、従業員に株式奨励、私たちのbr承認株式証を行使する可能性があることなどを含むが、これらに限定されないため、現在の株主が保有する私たちの普通株の株式割合は将来的に希釈される可能性がある。
また,今回の発行で登録された株式数 は,我々が受け入れられる価格で追加株を発行する能力に悪影響を与える可能性があり,発行金額は我々の業務戦略を実行させるのに十分である.登録声明によれば、当社の普通株式の大量の株式は、保険者株式、パイプ株式承認証に関連する普通株式株式brを含む公開市場で販売され、利用可能であれば任意の時間または第144条で発生することができる。これらの売却、あるいは市場で大量の普通株を持っていると思っている人が株を売却しようとしていると、私たちの普通株の市場価格を下げる可能性があります。改正及び再予約された登録権協定及びB系列株式所有者と締結された登録権協定に規定されている義務により、本登録声明に最大24,647,598株の普通株を登録することに同意し、本登録日までに発行された普通株式の約57%を占める。本登録声明が発効した後、発効しなくなるまで、当該等の証券を登録する登録声明は、当該等の株式の転売を許可する。公開市場での大量の普通株の転売、期待、または転売の可能性があることは、普通株の市場価格に悪影響を及ぼす可能性があり、我々の株主は、彼らが適切だと思う時間および価格で保有株式を売却することを困難にする。保税人株式のコスト基準はLarkspurの初公募や業務合併関連発行株式よりも低いため、保権者株式保有者は他の投資家より低い価格でその株式などを売却することが決定できる。また,目論見書に基づいて登録された株式数が多く,本募集説明書がその一部であるため,売却証券保有者 は,募集説明書やルール144に従って,対象とする証券をかなり長い期間発売し続けることが予想され,正確な継続時間 は予測できない.したがって、本段落に記載された登録権プロトコル宣言に従って発行される不利な市場および価格圧力は、より長い期間継続する可能性がある。
| 59 |
当時発行されていなかった持株証の少なくとも50%の持株権証所有者の承認を経て、著者らは持分証の条項を修正することができ、修正方式は株式証の公開所有者に不利になる可能性がある。したがって,株式承認証の行使価格を向上させ,権利証の行使期限を短縮し,引受権証を行使する際に購入可能な普通株数を減らすことができ,これらはすべて株式承認1部あたりの 承認に影響を与えない.
我々の引受権証は,株式承認証代理である大陸株譲渡信託会社と我々との間の引受証プロトコルに基づいて登録形式で発行されている.株式承認協定は、株式証明書の条項はいかなる所有者の同意なしに修正することができ、brのいかなる曖昧なところを是正し、或いはいかなる欠陥のある条項を訂正することができるが、当時少なくとも50%が発行されていない持分証所有者の承認を得なければ、公共株式証明書登録所有者の利益に不利な影響を与える変更を行うことができる。したがって、当時発行されていなかった公共株式証明書の少なくとも50%の所有者がbrのような改正を承認した場合、私たちは所有者に不利な方法で公共持分証の条項を修正することができる。当時少なくとも50%が発行されていなかった公共株式証明書の同意を得た場合に公共株式証条項を修正する能力は無限であるが、このような改訂の例は、他の事項に加えて、株式証の行使価格を向上させ、株式証明書を現金に変換し、行使期間を短縮し、または株式証明書を行使する際に購入可能な普通株数を減少させることである可能性がある。
私たちは株式証明書の所有者に不利な時間に満期になっていない引受権証を償還することができ、それによってこの等持分証を一文の価値もないものにすることができる。
私たちは発行された株式承認証の行使可能後及び満期前の任意の時間に、1株承認株式証0.01ドルの価格で発行された引受証を償還することができ、前提は私たちの普通株式或いは普通株式(場合によって決まる)は、私たちが株式分割、株式資本化、再編、資本再編などの調整された日前の30取引日以内の任意の20取引日以内の最終販売価格が 1株当たり18.00ドル(株式分割、株式資本化、再編、資本再編などの調整された後)である。私たちは株式引受証を償還しません。証券法の下で引受権証を行使する際に普通株を発行することができる有効な登録声明が発効しなければ、普通株式に関する現行の株式募集説明書は全30日の償還期間内に獲得することができますが、株式証明書が無現金ベースで行使でき、かつ当該などの無現金行使が免除されて証券法に基づいて登録されている場合、当社は株式証明書を償還しません。株式証明書を私たちが償還することができる場合、引受権証を行使する際に発行された株が適用される州青空法律によって登録または資格免除を受けることができない場合、あるいはすべての適用された州証券法に基づいて対象証券を登録したり、売却資格に適合させることができない場合、私たちは償還権を行使できない可能性があります。償還未償還持分証は、その所有者に(I)引受権証を行使させ、それに不利な可能性がある場合に権利証を行使する価格を支払う可能性があり、(Ii)所有者が株式承認証を保有することを希望する場合、当時の市価brに従って株式証明書を売却するか、または(Iii)名義償還価格を受け、償還されていない株式証を償還することを要求する場合、名義償還価格は当該等株式証の時価を大幅に下回る可能性が高い。
私たちの株式承認証は私たちの普通株の市場価格に悪影響を及ぼすかもしれない。
株式承認証 は5,825,358株の普通株を購入し、Larkspur IPO発売単位の一部とするとともに、Larkspur IPO終了時には、私募で合計320,272単位を発行した(1株当たり普通株と1株11.50ドルで1株の普通株を購入できる償還回収株式証の4分の3を含む)。権利証所有者はLarkspur普通株の株式を購入する権利があり、これらの普通株は業務合併が完了した後に私たちの普通株に変換する権利があります。 私たちはまた株式承認証を発行して、最大4,965,125株のPIPE Investment普通株を購入して、ベストエフォート要約1株2.00ドル後に を行使することができます。その中には4,878,875株の普通株が含まれています。また、ベストエフォート引受権証を発行し、1株当たり1株1.00ドルの使用価格で11,015,500株のベストエフォート発行の普通株を購入し、そのうちの1,377,996株のベストエフォート引受証の行権価格は0.165ドルに再定価され、2023年7月に発売された一部として、行権価格は行権価格から1ドルに低下した。このような株式承認証は、行使時に、発行済みと発行済み普通株の数を増加させ、普通株の価値を低下させる。
Brは管理権証、私募株式証、株式公開承認証、誘導権証或いは力を尽くして権利証が行使可能な時にも現金の中にあることを保証できない;それらは期限が切れた時に価値がない可能性があるため、私たちは株式承認証の行使から現金収益を得ることができないかもしれない。
本公告日まで、私たちは5,825,358株の私たちの普通株を購入できる公共株式権証を持っていて、1株当たり11.50ドルの行使価格で行使することができ、(Ii)私募株式権証は、240,204株の私たちの普通株を購入することができて、1株当たり11.50ドルの行使価格で行使することができる;(Iii)パイプライン株式権証は、最大4,878,875株の私たちの普通株 を購入することができて、1株2.00ドルの行使価格で行使でき、2027年12月12日に満期になる。そして(Iv)力を尽くして権利証 に11,015,500株を購入して、私たちの普通株は1株1.00ドルの行使価格で行使することができ、その中で1,377,996株は力を尽くして再定価され、行権価格は行権価格の1ドルから0.165ドルに下がり、会社の7月のベストエフォート として発売された(“2023年7月発売”)の一部として当社は合計3,256,060株の普通株および9,471,213株の普通株を購入するための予融資権証、およびbr}が最大12,727,273株の普通株を購入する普通権証を売却し、公開発売価格は1株当たり0.165ドルと付随する一般権証、あるいは事前資金証および付随する普通権証0.1649ドルである。2023年7月に発行されて以来、すべての9,471,213株の普通株を購入する事前計画株式証はすでに行使され、最大12,121,213株の普通株を購入した引受権証 は0.1357ドルまで再定価された。管式株式承認証、私募株式承認証、株式公開承認証、力を尽くして権利証と誘導権証の行使、及び著者らがその行使から得られる可能性のあるいかなる収益は、著者らの普通株の価格及び当該等承認株式証の行使価格と行使時の著者らの普通株価格との間の利益に高度に依存する。例えば、もし私たちの普通株式価格が1株当たり11.50ドルを超えたら、私たちの私募株式証明書と公開株式証明書の所有者は彼らの株式引受証を行使する可能性が高い。もし私たちの普通株の価格が1株当たり11.50ドル以下であれば、これらの所有者は彼らの株式承認証を行使する可能性があまりありません。2023年10月23日まで、私たちの普通株の終値は1株当たり0.12ドルです。私たちのすべての引受権証が満期までに現金に含まれる保証はありません。私たちの公共株式証明書と私募株式証明書はある条件下(株式承認証合意で述べたように)は私たちが株式承認証1部当たり0.01ドルの価格で償還することができます。br私たちのパイプは株式証を償還することができなくて、現金のない基礎の上で行使することができます。したがって、私たちは株式承認証の行使からいかなる現金収益も得られないかもしれない。
| 60 |
PIPE株式承認証、最善権証と誘導権証を行使した後、著者らの普通株を発行することは著者らの普通株の現有所有者を大幅に希釈する。
ベストエフォート発売の結果,管路承認株式証の行使価格は2.00ドルにリセットされ,管路株式証を行使して普通株を発行可能な金額は4,965,125株に増加した。私たちはまた最善を尽くして発売中に引受権証を発行して、1ドルの行権価格で最大11,015,500株の私たちの普通株を購入して、その中の1,377,996株のベストエフォートの権証再定価は 行権価格が1ドルから0.165ドルに下がって、2023年7月に発売された一部として。2023年10月23日まで、私たちの普通株の終値は0.12ドルです。もし私たちの普通株がPIPE株式承認証の使用価格より高い場合、株式承認証と引受権証の所有者が普通株を行使し、発行する場合、私たちの既存の普通株保有者は深刻に希釈される。
普通株式を行使可能な株式認定証brが行使されれば,将来公開市場で転売する資格のある株式数を増加させ,我々株主の希釈につながる。
行使可能な私募株式権証があり,合計約240,204株の我々の普通株は,Larkspurの初公募株(IPO)に関連して発行され,加重平均行権価格は1株11.50ドルであった。公共株式権証があれば行使でき、計約5,825,358株の普通株であり、加重平均行権価格は1株11.50ドルである。我々は全部で4,926,125株の普通株がPIPE 引受権証(逆希釈事件によって調整される可能性がある)を行使でき、加重平均行権価格は1株2.00ドルである。2023年7月に発行された一部として、合計11,015,500株の普通株を行使できる権益証があり、行権価格は1,00ドルであり、その中の1,377,996株は力を尽くして再定価は であり、行権価格は行権価格の1ドルから0.165ドルに下がった。私たちのPIPE株価転換価格リセット後、 PIPE承認株式証の発行価格は私たちの普通株価格にリセットされますが、2.00ドル以下の価格 ではありません。PIPE株式承認証の行使により、発行可能普通株の数は、PIPE株式転換後に発行可能普通株の100%に等しく調整される。
いずれの当該等承認株式証を行使する範囲内では、当社普通株を増発し、当社普通株を保有するbr持株者の権益が償却され、公開市場で転売する資格のある普通株数を増加させることになる。公開市場で当該等普通株を大量に販売したり、当該等株式権証を行使することができたりすることは、当社の普通株の市価に悪影響を及ぼす可能性がある。
私たちが最善を尽くして提供した純収益の大部分を使用して、ほとんどのPIPE株を償還しましたが、これは私たちの業務や株主に悪影響を及ぼす可能性があります。
ベストエフォートの発売を終えて得られた純収益の大部分 は、ほとんどのPIPE 株を償還するために使用されます。Aシリーズ指定証明書により、発行価格の120%でパイプ株式を償還しました。そこで,発売して得られた純収益を発行価格の120%でPIPE株を償還するために最善を尽くしたことにより,保有者がこのようなPIPE株を購入するよりも約20%高い利益となった。吾らが当該等の発売で受け取った純額 (吾等が対応する発売に関する費用を差し引いた)は、すべてのPIPE株式を償還するのに必要な金額 を超えてのみ、運営資金や他の一般会社用途として利用される。我々が2022年12月12日に完了した我々の業務合併に関するPIPE株を売却して得られた総収益は約863.5万ドルであり,投資家に支払う償還価格は約1040万ドルである.今回発行された余剰収益を運営資金や他の一般会社用途に利用する予定であるが,PIPE株の償還は,他の用途や我々の業務戦略を実行するために利用可能な現金に影響を与える.私たちは後続発行で株式または株式にリンクした証券を発行することで追加資本を調達する予定だ。もし私たちに有利な条項で株式や株式リンク証券を発行することで追加資本 を調達できなければ、私たちは私たちの業務、私たちの普通株の価値、そして私たちの株主に悪影響を及ぼす可能性がある十分な流動性がないかもしれません。詳細については、 タイトルを参照してください“経営陣の財務状況と経営結果の検討と分析−流動性と資本資源−業務後組合せ資金需要“他のリスク要因と”リスク要因.”
私たちの憲章は、限られた例外を除いて、衡平裁判所は、特定の株主訴訟を処理する唯一のおよび独占法廷であり、これは、私たちまたは私たちの役員、高級管理者、従業員、または株主との紛争について、私たちの株主が選定司法裁判所の能力を獲得することを制限する可能性がある。
私たちの2回目の改正と再改訂された会社登録証明書(“憲章”)は、法律で許容される最大範囲で、私たちの名義で提起された派生訴訟、取締役、高級管理者、および従業員に対する受託責任違反訴訟、および他の同様の訴訟は、br衡平裁判所で提起することができ、その裁判所に管轄権がない場合、デラウェア州の別の連邦または州裁判所で訴訟を提起することができる。brは、私たちの株の任意の株式を購入または他の方法で買収した個人または実体を知っているとみなされ、私たちの憲章のフォーラム条項に同意するべきである。また、私たちの憲章および改正と再記述の定款は、アメリカ連邦br地域裁判所は、“証券法”と“取引法”に基づいて訴因を提出する任意の苦情を解決するための独占的なフォーラムでなければならないと規定する。排他的裁判所条項は、証券法による株主のクレーム能力を制限しないが、司法裁判所で株主が有利と思うクレームを提出する能力を制限する可能性があり、株主の何らかの訴訟費用を増加させる可能性があり、これは、証券法による私たち、取締役、上級管理職へのクレームを阻害する可能性がある。
| 61 |
2020年3月デラウェア州最高裁判所はSalzburgら。V.Sciabacucchi証券法による連邦裁判所へのクレームの排他的法廷条項 はデラウェア州法により表面的に有効であると考えられている。この決定が控訴されるかどうか、あるいはこの事件の最終結果が何なのかは不明だ。私たちはこの条項を実行するつもりだが、私たちは他の管轄区域の裁判所がこの決定に同意したり実行したりするかどうか分からない。
このような裁判所条項の選択は、株主が司法裁判所において、私たちまたは私たちの任意の役員、役員、他の従業員または株主との紛争に有利であると考えるクレームを提出する能力を制限する可能性があり、これは、このようなクレームに対する訴訟の提起を阻止する可能性がある。br}または、選択憲章に含まれる裁判所条項がbr訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の司法管轄区でこのような訴訟を解決することに関連する追加コストが生じる可能性があり、これは、私たちの業務、brの経営業績、および財務状況を損なう可能性がある。
また, はこの選択された裁判所条項が強制的に実行可能であるかどうかを決定しない.証券法第22条は,連邦裁判所及び州裁判所は,証券法又はその下の規則及び条例を実行するために生じた任意の義務又は責任に対して提起されたすべての訴訟に対して同時管轄権を有すると規定されている。このような不確実性を考慮して、クレームを出した投資家は、コスト増加と訴訟結果の不確実性を含むいくつかの追加リスクに直面する可能性がある。
逆買収 我々の組織文書中の条項は制御権の変更を延期または阻止する可能性がある.
私たちの定款と細則のいくつかのbr条項は逆買収の効力を持つ可能性があり、株主がその最適な利益に符合すると考えるかもしれない合併、買収、カプセル買収、買収企図或いはその他の制御権変更取引を遅延、遅延、遅延或いは阻止する可能性があり、私たちの株主の保有株式の時価より高い価格を招く可能性のある試みを含む。
これらの は、他の事項を除いて以下のように規定される
| ● | 私たちの取締役会は1つ以上の優先順位を発行する能力を持っています | |
| ● | 分類ブロックです | |
| ● | 株主指名取締役と株主が私たちの年次会議で審議する事項を事前に通知します | |
| ● | 特別株主総会を開催するためのいくつかの制限 | |
| ● | 株主特別会議を開催できる人員を制限する | |
| ● | 株主が書面で行動する能力を制限する; | |
| ● | 私たちの取締役会は私たちの規定を制定、変更、または廃止する明確な権力を持っている。 |
これらの逆買収条項は,買収をより困難や挫折にしたり,第三者買収を阻止したりする可能性があり,たとえ第三者の要約が我々の多くの株主に有益であると考えられている可能性がある.また、これらの規定は、株主が経営陣の任命を担当する取締役会メンバーを変更することを困難にし、それによって、我々の株主が現在の管理職を交代または罷免しようとしていることを挫折または阻止する可能性がある。したがって、私たちの株主が株式割増を得る能力は制限されるかもしれない。これらの規定はまた、代理権競争を阻止し、あなたと他の株主があなたが選択した取締役を選挙することを難しくし、あなたが希望する他の会社の行動を取ることを引き起こす可能性があります参照してください“私たちの証券説明 .”
| 62 |
私たちの役員と上級管理者からのクレームは、私たちの成功に対する第三者クレームを満たすために、私たちの利用可能な資金を減少させ、私たちの利用可能な資金を減少させる可能性があります。
私たちの組織文書は、デラウェア州の法律で許容されている最大限に私たちの役員と上級管理者を賠償することを規定しています。
また、デラウェア州会社法第145条が許可された場合、当社の付則と、取締役及び上級管理職と締結された賠償協定は、以下のとおりである
| ● | 私たちはデラウェア州の法律で許可されている最大範囲で、これらの身分で私たちにサービスしてくれたり、私たちの要求に応じて他の商業企業にサービスしている役員と上級管理者に対して賠償を行います。デラウェア州の法律では、もしその人が善意に基づいて行動し、その人が登録者の最大の利益に適合または反対しないと合理的に考え、いかなる刑事訴訟についても、その人の行為が不法であると信じる合理的な理由がなければ、会社はその人を賠償することができる |
| ● | 法律の適用が許可されている場合、私たちは従業員と代理人を適宜賠償することができます | |
| ● | 私たちbrは、私たちの役員や上級管理者に訴訟弁護に関連する費用を立て替えることを要求されますが、最終的にその人が賠償を受ける資格がないと判断された場合、その役員または上級管理者は前払金の返済を約束しなければなりません | |
| ● | 私たちの規約によると、私たちは誰かが私たちまたは他の賠償者に提起した訴訟について賠償義務を負いません。私たちの取締役会が許可した訴訟やクレーム権利の強制執行のための訴訟でなければ、 | |
| ● | 別例で与えられた権利は排他的ではなく,我々は我々の役員,上級職員,従業員,代理人と賠償協定を締結し,そのような者に賠償するために保険を購入する権利がある | |
| ● | 私たちbrは私たちの定款をさかのぼって修正して、取締役、高級管理者、従業員、br代理人に対する賠償義務を減らすことはできません。 |
| 63 |
収益を使用する
売却証券保有者が本募集説明書に基づいて提供するすべての証券は、売却証券保有者が代行して販売します。当社は株式募集説明書に登録された証券から何の収益も得ません。
もし任意の株式承認証が行使された場合、私たちは株権証が現金なしで行使されない限り、収益を獲得する。株式承認証が行使されることは保証されず、どのような行使からもいかなる収益も得られる保証はない。管式株式承認証、私募株式証、公開株式証と誘導権証の行使、及び著者らがこれらの株式承認証を行使することによって得られる任意の収益は、私たちの普通株の価格及びこの等株式証の行使価格と行権時の私たちの普通株の市場価格との間の利差に大きく依存する。私募株式証と公開株式証の現在の行権価格は1株普通株11.50ドルであり、パイプ承認株式証の現在の行権価格は1株普通株当たり2.00ドルである。2023年10月23日まで、私たちの普通株の現在の市場価格は0.12ドルです。もし私たちの普通株の市場価格が管理権証、私募株式証、公開株式証或いは誘導権証の行権価格でリセットした後、 が底価格より高い場合、当該等の証券の所有者はこの等株式証を行使し、br}利益で普通株関連株式を売却することができる。もし私たちの普通株の市場価格が持分証の行使価格より低い場合、所有者は彼らの株式引受証を行使することはあまりできません。すべての管理権証、私募株式証、公開株式権証或いは 誘導権証はすべて満期前に到着することを保証できない。著者らの公開株式証と私募株式証明書はあるbr条件の下で、株式承認証合意に記載されているように、著者らは公開株式証1部当たり0.01ドルの価格で償還することができる。我々のパイプは株式証brを償還することができず、現金あるいは非現金方式で行使することができる。したがって、私たちはこのような株式承認証を行使することからいかなる現金収益も得られないかもしれない。
本登録声明に基づいて任意の株式承認証を行使して得られた純収益 を一般会社用途に適用する予定である。私たちは株式承認証を行使して得られた収益の面で広範な裁量権を持つだろう。株式承認証の所有者が現金と交換するために、任意またはすべての当該等持分証を行使することを選択することは保証されない。いずれかの株式承認証が“キャッシュレスベース”で行使された場合、私たちが株式承認証を行使することから得られる現金金額は減少する。
売却証券保有者は、証券所有者がブローカー、会計、税務または法律サービスによって生成された任意の引受割引、手数料および費用、または証券所有者を売却する際に発生する任意の他の費用を支払う。私たちはすべての登録と届出費用、ナスダック上市費、および私たちの弁護士と独立公認会計士事務所の費用と支出を含む、コスト募集説明書に含まれる証券登録で発生したコスト、費用 と支出を負担します。
| 64 |
普通株と配当情報の市場価格
市場の普通株の価格
我々の普通株は現在、ナスダック世界市場ナスダック株式市場有限責任会社(“ナスダック”)に上場しており、コードは“ZVSA”である。 業務合併が完了する前に、ラックスパーの単位、普通株、公募権証はそれぞれ“LSPRU”、“LSPR”、“LSPRW”のコードでナスダック資本市場に上場している。ラクスパーの職場と公募株式証はナスダック資本市場に上場しなくなりました。
2023年10月23日、私たちの普通株の終値は1株当たり0.12ドルです。
2023年10月23日現在,我々普通株の記録保持者は約500人である。これらの数字には,利益を得る 所有者が指定された人の名前で我々の証券を持っていることは含まれていない.
配当政策
私たちは私たちの配当金についてどんな現金配当金も発表したり支払ったりしたことがありません。現在私たちは予測可能な未来にいかなる現金配当金を支払うつもりもありません。私たちは将来の収益を維持したいです。もしあれば、私たちの業務の発展と成長に資金を提供します。将来、私たちの普通株に配当金を支払うかどうかは私たちの取締役会が適宜決定し、私たちの財務状況、経営業績、現在と予想される現金需要、拡張計画、および取締役会が関連する他の要素に依存するだろう。
| 65 |
商売人
明確な説明や文意が別に指摘されているほか,本募集説明書で言及している“会社”,“登録者”,“私たち”,“私たち”および“我々”はいずれもZyVersa(および旧ZyVersaの業務を指し,業務合併発効後にZyVersaとなる業務 )を指す.
概要
われわれbrは臨床段階の生物製薬会社であり,ノウハウを用いて慢性腎臓疾患や炎症性疾患を有する患者のための薬剤を開発しており,これらの患者の医療ニーズは満たされていない。私たちの使命は,健康結果を最適化し,患者の生活の質を向上させる薬剤の開発である。
私たちのbrは2つの世界的に許可された特許薬物開発プラットフォームを持っており、すべてのプラットフォームはマイアミ大学ミラー医学院(以下、マイアミ大学)の研究科学者によって発見された。これらの開発プラットフォーム には:
| ● | コレステロール流出調節剤TMVAR 200(2−ヒドロキシプロピル−β−シクロデキストリン又は“2 HPβCD”)は、臨床開発における腎臓疾患治療の注射用薬剤である。VAR 200は2015年12月15日にL研究有限責任会社から許可を得た。L研究会社はマイアミ大学の研究科学者によって設立され,VAR 200が腎臓疾患に用いられていることが発見された。 | |
| ● | IC 100は,炎症性疾患の治療のための臨床前開発における単抗炎症症体ASC阻害剤である。IC 100は2019年4月18日にInflamaCore,LLCから許可を得た。InflamaCore,LLCはマイアミ大学の研究科学者によって作成され,IC 100を発明した。 |
私たちのすべての候補製品はそれぞれの治療分野で多様な適応を治療する潜在力があると信じています。私たちの戦略は適応拡張に集中して、ビジネスの潜在力を最大限に発揮することだ。
私たちの腎臓管は最初はまれな慢性糸球体疾患に集中していた。VAR 200に対する主な特徴は焦点性分節性糸球体硬化(FSGS)である。2020年1月21日,我々はVAR 200の新薬研究申請(“IND”)を提出し,米国食品医薬品局(“FDA”)は活性成分(2 HPβCD)のリスク/利益プロファイルに基づいてFSGS患者 で2 a期試験を行うことを許可した。FSGS患者に対する2 a期試験を開始する前に,2024年第1四半期にオープンラベル概念検証試験をサポートする予定であり,そこで糖尿病腎症患者8名のデータを得る予定である。これは,患者が治療を行う際に薬物効果 を評価することができ,我々の2 a段階レジメンの開発に知見を提供する。VAR 200は,FSGS,Alport症候群,糖尿病腎症を代表する動物モデルの薬理学的概念検証データを有しており,いずれも我々の適応拡張戦略に基づいて開発可能である。
われわれの炎症体ASC阻害剤計画IC 100は臨床前開発段階にある。私たちの重点は、1 C 100が2024年第2四半期に現在計画されているbr}INDを提出し、第1段階試験を開始することです。IC 100は、急性呼吸窮迫症候群(ARDS)および多発性硬化症(MS)を表す動物モデルの薬理学的概念検証データを有する。次の臨床前開発では、免疫グロブリンA(“IgA”)腎症、パーキンソン病、ハンチントン病、うっ血性心不全、早期アルツハイマー病など、6種類までの適応の追加動物研究を行う予定です。私たちの臨床前計画のデータに基づいてIC 100の1つ以上の主要な適応を選択する予定です。
慢性腎臓病(CKD)について
慢性腎臓疾患(“CKD”)は日々深刻な公衆衛生問題であり、全世界で7500万人が影響を受け、アメリカでは約3700万人が影響を受けている。国家腎臓基金会は、アメリカの約8000万人の成人が腎臓疾患のリスクに直面していると推定した。商業的に疾患を改善しない薬物療法のため,かなりの割合の腎臓患者が末期腎症(“ESRD”)に進展し,生存には透析や移植が必要である。疾病コントロール·予防センターのデータによると,2018年,米国では約131,600人がESRD治療を開始し,現在米国では786,000人近くがESRDを患っている(この786,000人のうち約71% が透析を受け,29%が腎臓移植を受けている)。また,慢性腎臓疾患に関する経済的負担は巨大である可能性があるが,国家腎臓基金会のデータによると,2018年の連邦医療保険のサービス別支出は1300億ドルであるからである。CKDによる高発症率と重い金銭負担が有効な疾患修飾薬br療法への需要を創出していると考えられる。
| 66 |
慢性腎臓病は予後不良と関係があり、国家生命統計報告によると、2017年、慢性腎臓病はアメリカの9番目の死因である。この重大な健康問題を解決するために、2019年7月10日、ホワイトハウスと衛生·公衆サービス部は、米国の腎臓疾患予防と看護を推進するために、アメリカの腎臓健康(AKH)計画を開始し、このイニシアティブは、(1)より良い診断、治療および予防的看護によって腎不全患者の数を減少させること、(2)家庭透析看護を最大限に提供すること、および(3)移植可能な腎臓プールを拡大することの3つの目標を有する。VAR 200は,腎臓損傷や機能障害を引き起こす余分な腎細胞内コレステロールの除去を調節することにより,AAKH計画の第1の目標,すなわち腎不全を発症する患者数の減少に寄与する可能性があると信じている。
われわれの主な腎臓適応はFSGSであり,進行性腎臓疾患であり,承認されていない薬物療法である。約40%-60%のFSGS患者は10−20年以内に末期腎症に進展し,透析と最終的な腎臓移植を必要として生存する。FSGSは孤児疾患であり,米国では約40,000人が影響を受けている。その特徴は腎濾過システム或いは“糸球体足細胞”が損傷し、局部(即ち、ある糸球体のみに影響を与える)と分節性(即ち、一部の糸球体のみに影響を与える)瘢痕形成を招くことである。FSGS患者の生検組織と代表的なFSGS動物モデルでは,糸球体へのコレステロールや脂質の蓄積がみられ,構造障害や腎機能障害に関与している。糸球体損傷によりタンパク質が尿中に漏洩することを蛋白尿と呼ぶ。尿中タンパク質レベルの増加に伴い,腎症症候群と呼ばれる一連の特殊な症状が出現する。蛋白尿は腎臓疾患の進展と密接に関連しており、腎症症候群は通常不良な予後を示唆している。FSGS患者の約70%は確定診断時にネフローゼ症候群が出現した。糸球体から余分なコレステロールを除去することを調節することにより、VAR 200は腎臓構造と機能を保存する潜在力を有し、FSGSの進展を引き起こす蛋白尿を減少させると信じられている。
炎症性疾患について
慢性炎症性疾患はすでに現在世界で最も重要な死亡原因の一つとして公認されており、全世界の50%以上の死亡 は虚血性心臓病、脳卒中、癌、糖尿病、慢性腎臓疾患、非アルコール性脂肪性肝疾患(NAFLD)及び自己免疫と神経変性疾患などの炎症に関連する疾患に起因する。炎症性小体の過剰および持続活性化はこれらのタイプの慢性疾患の病理生理学と関係がある。
炎症体は,(I)いくつかのタイプの受容体分子の1つ,(Ii)caspase募集ドメイン(“asc”)を含むアポトーシス関連スポット蛋白,および(Iii)炎症促進caspase−1(“caspase−1”)の3種類のタンパク質からなる。これらは、NLRP 1、NLRP 2、NLRP 3、NLRC 4、AIM 2、およびPYRINのようなそれらに関連するセンサ分子に基づいて命名される。多くの炎症性疾患はよく多種のタイプの炎症体の活性化と関係がある。例えば,多発性硬化症はAIM 2,NLRP 1,NLRP 3,NLRC 4の活性化に関与している。炎症性小体のASC成分 は上に述べた6種類の最もよく見られるタイプの炎症性小体の成分であるため、有望な薬物標的である。これは特定のセンサー蛋白に対してより有利であり,後者は炎症体の一成分であり,いくつかの潜在的なライバルの焦点であると考えられる。ASCは炎症反応を開始するために必要な炎症性小体の形成や活性化に重要な役割を果たすほか,ASCスポットの細胞外放出に関与する炎症の恒久化にも機能する。ASCに対して,IC 100は多くの炎症性疾患の炎症を制御するのに有効な潜在力があると信じられている。
私たちのbrパイプ
われわれのチャネルの目標は,高度に満たされていない医療ニーズを有する腎臓や炎症適応に対して,我々の行動機序で解決できると信じている。我々は,VAR 200やIC 100のための多様な適応,および潜在的な腎臓や抗炎症候補製品の許可を開発することにより,我々の製品組み合わせをさらに強化し拡大する予定である。
| 67 |
我々の現在のチャネルは以下のものを含む:
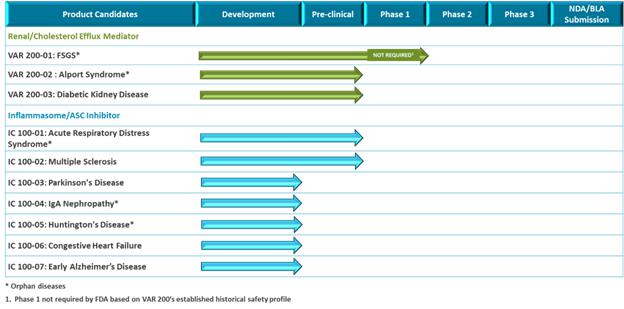
| 1. | 開発段階:適切な薬物送達パラメータを満たすことを確保するために薬物製剤を開発する段階。 | |
| 2. | 臨床前段階:体外(実験室)と体内(動物)の研究を行い、証拠を収集して人類で臨床試験を行う段階を証明する。 | |
| 3. | FDAは、VAR 200‘Sによって確立された履歴セキュリティプロファイルに基づいて、VAR 200は第1段階試験を行う必要がないことに同意する。 |
VAR 200では,我々の主要な腎臓徴候はFSGS(VAR 200−01)である。IC 100の場合、2024年第2四半期にINDを提出する予定である前に、1つまたは複数の引合指示を選択する。これは既存と未来の臨床前研究のデータに基づくだろう。
慢性炎症により無数の異なる疾患や状況が引き起こされ,IC 100は多くの炎症性疾患を治療する潜在力があると信じられている。以下にIC 100‘S電流管路の市場 の概要を示す。


| 1. | Quintanillaら。前列のギネットです。2021年12月 | |
| 2. | 国立多発性硬化症学会 | |
| 3. | IGA腎症市場。DelveInsight報告書によると2021年10月 |
| 4. | 国立がん研究所 | |
| 5. | パーキンソン病財団 | |
| 6. | ハンティントン疾病市場です。DelveInsight報告書によると2021年10月 | |
| 7. | 疾病管理·予防センター |
| 68 |
業務 戦略
私たちは、有力と認められているバイオ製薬会社を求め、満足されていない医療ニーズの高い患者に革新を提供しています。バイオ製薬製品を開発することで健康を回復し、患者の生活を変えることに取り組んでいます。私たちの戦略は:
| ● | VAR 200の開発を進める著者らは2024年第1四半期に8名の糖尿病腎症患者に対する概念検証研究を支持することにより、VAR 200の開発を推進し、その後2 a期の臨床試験を開始する予定である。この概念検証試験は,患者が試験を行いながら薬物効果を評価することができる。キー が学んだ知識は2 a段階実験の設計に用いる. | |
| ● | 私たちのIC 100臨床前計画を推進します我々は、2024年第2四半期にINDを提出するためにIC 100の臨床前計画を推進する予定である。現在、マウスおよび非ヒト霊長類動物(NHP)の非GLP毒性データは、300 mg/kgまでの用量に副作用がないこと、および急性呼吸窮迫症候群および多発性硬化症を代表する動物モデルにおけるIC 100の薬理学的概念検証データを示している。われわれはマウスとNHP上でGLP毒理学研究を行い,6つもの他の適応(例えばIgA腎症,パーキンソン病,早期アルツハイマー病,ハンチントン病とうっ血性心不全)で追加的な動物研究を行う予定である。これにより,1つ以上の鉛適応を最適に選択してbrを臨床に持ち込むことになる。 | |
| ● | 我々の適応拡張戦略を活用し,それぞれの治療分野で複数の適応を開発することで,個々の製品プラットフォームのビジネス潜在力を最大限に発揮する現在のチャネルには3つの可能なコレステロール流出調節剤の適応がありますTMVAR 200、VAR 200(FSGS、Alport症候群および糖尿病腎症を含む)、およびIC 100炎症体ASC阻害物質プラットフォームの8つの潜在的適応(ARDS、多発性硬化症、IgA腎症、パーキンソン病、ハンチントン病、うっ血性心不全および早期アルツハイマー病を含む)。我々は,両製品プラットフォームの臨床前と臨床計画から得られた知識を利用して,適応拡大の他の機会を決定する予定である。 | |
| ● | 私たちの候補製品を開発して商業化する権利を維持する我々は,米国で我々の候補製品を開発·商業化する権利を残すとともに,他の製薬会社との戦略連盟や協力 を求めて,開発を加速し,リスクを分担し,我々の資源を補完し,米国以外の潜在力を最大限に発揮することを求めている。 | |
| ● | 我々の候補製品の組合せを拡張する私たちは私たちの開発と商業化の専門知識を利用することで、より多くの臨床的かつ商業的な潜在力を持つ候補薬を決定し、許可するために、私たちの製品の組み合わせ を拡大する予定です。我々のビジネス戦略は、VAR 200およびIC 100プラットフォームの拡張を示すことに加えて、腎臓および炎症性疾患治療に関連する技術の開発および商業化の権利を決定し、つかむことを含む。 | |
| ● | 私たちの知的財産権の組み合わせを強化して拡大するために を続けるVAR 200の知的財産権は、米国および他の国/地域の発行および出願されている特許からなる。私たちは糸球体疾患と糖尿病腎症を含む二つの特許シリーズを持っている。同様に,FSGSとAlport症候群のために孤児薬の指定を求める予定であり,この2つの管轄区で承認されれば,米国で7年間の排他性を提供し,EUでは10年間の排他性を提供することになる。IC 100の知的財産権は、米国および他の国/地域の発行および出願されている特許の組み合わせからなる。私たちには5つの特許家族があり、物質の組成、バイオマーカー、使用方法をカバーしている。また,IC 100が開発したいかなるまれな疾患適応にも孤児排他性 を求める予定である。この2つの製品プラットフォームについて、追加の技術的ノウハウとビジネス秘密は、私たちの独自の地位を強化している。私たちは、特許または他の適用可能な知的財産権保護の出願、新しいまたは強化された特許技術、および開発中の新しい処方、投与レジメン、および投与経路をカバーする適切な場合に、私たちの候補製品のための最も広範な知的財産権保護を積極的に求める予定である。 |
前述に反映された 日付およびイベントは推定のみであり、含まれるイベントが提供された予想されるタイムライン内で完了するか、または完了が全く保証されない保証はない。さらに、私たちが私たちの任意の候補製品の開発に成功すること、または私たちが将来開発する可能性のある任意の他の製品または候補製品、または私たちが将来開発する可能性のある任意の候補製品がFDAによって承認される任意の適応が保証されない。
| 69 |
私たちの候補製品
コレステロール流出調節剤TM,Var 200(2−ヒドロキシプロピル−β−シクロデキストリン,2 HPβCD)
コレステロール流出調節剤VAR 200は、慢性糸球体疾患の治療のための臨床開発における注射可能な薬剤であり、最初はFSGSに集中している。われわれの適応拡張戦略により,Alport症候群や糖尿病腎臓疾患の適応が求められる可能性がある。
VAR 200を開発する目的は、腎臓構造と機能を保護し、仲介により糸球体を損なう余分なコレステロールを除去することにより、糸球体疾患の進展をもたらす蛋白尿を減少させることである。FSGS患者に対する2 a期試験を開始する前に,2024年第1四半期にオープンラベルの概念検証試験をサポートする予定であり,そこで糖尿病腎症患者8名のデータを得る予定である。これは,患者が治療を行う際に薬物効果 を評価することができ,我々の2 a段階レジメンの開発に知見を提供する。VAR 200は,FSGS,Alport症候群,糖尿病腎症を代表する動物モデルの薬理学的概念検証データを有しており,いずれも我々の適応拡張戦略に基づいて開発可能である。
糸球体疾患(FSGS、Alport症候群、糖尿病腎症を含む)におけるコレステロールと脂肪蓄積の作用
慢性糸球体疾患では,コレステロールが糸球体足細胞に蓄積し,一部の原因は細胞外輸送障害,あるいはコレステロールトランスポーターABCA 1とAbcg 1発現の減少による“流出”である。糸球体脂質蓄積が確認されました体外培養足細胞研究、人体生検データと各種腎臓疾患の動物モデルはFSGS、Alport症候群と糖尿病腎臓疾患を含む。以下の図に示すように、脂質蓄積は足細胞構造の歪みを招き、足細胞の足突起が損傷し、足細胞の離脱と喪失、腎臓濾過を損害し、蛋白尿と疾病の進展を招く。脂質バランスと足細胞完全性の回復は,進行中の腎損傷の腎不全への進展を遅延させ,透析や最終移植の需要を遅らせる可能性があると仮定した。


| 70 |
Var 200行動機構
S有効成分である2 HβCDは7つの糖分子からなる三次元環であり,コアは疎水性,外層は親水である。VAR 200は、糸球体膜上の親水性成分と相互作用することにより、コレステロール流出を受動的と能動的の2つの方法で調節する。
受動コレステロール流出
受動的なコレステロール流出は2 HPβCD二量体を形成することにより発生し,これらの二量体は細胞膜表面に結合し,コレステロールを包接物としてその疎水性コアに結合する。細胞膜表面から2 HPβCD/コレステロール包接物 を放出し、コレステロールを溶液に導入し、その後コレステロール受容体、例えば高密度リポ蛋白質に転移する。

積極的コレステロール流出
活発なコレステロール流出は,遊離コレステロールを調節して酸化ステロールに代謝することにより発生する。酸化ステロールは肝臓X受容体(LXR)転写因子を活性化し、細胞コレステロール流出経路の誘導を招き、コレステロール流出トランスポーターABCA 1とAbcg 1を上昇させ、遊離コレステロールを細胞外のコレステロール受容体、例えば高密度リポ蛋白(HDL)に輸送することを含む。
臨床前サポートCholestol Efflux MediatorTMVAR 200
VAR 200は既定の収益/リスクプロファイルを持っていると信じています体内にあるまた,FSGS,Alport症候群,糖尿病腎臓疾患を代表する動物モデルからのデータは,VAR 200が足細胞中のコレステロール除去を促進し,腎臓のろ過系を障害から保護し,尿や“蛋白尿”への蛋白 の流出を減少させることを示唆していると信じている。これらのタイプの結果は腎臓疾患の進展を遅延或いは防止するキーポイントと考えられている。
Var 200とFSGS
2種類のFSGSマウスモデルでvar 200を評価したが,1つは実験的活性化T核因子(NFAT)FSGSモデルであり,もう1つはアドリアマイシン(ADR)誘導FSGSモデルであり,腎症形式はNFATモデルよりも軽く,進行が遅いことが特徴である。
活性化T核因子(NFAT)モデル
ある研究では、6週齢のNFATc 1にVAR 200を皮下投与し、投与量は4,000 mg/kgであり、NFATを介した足細胞損傷における足細胞コレステロール恒常性変化の作用およびVAR 200の治療効果を検証したNUCマウスはドキシサイクリン誘導24時間前に1日おきに4日間連続した。単一遺伝子組換え(“ST”)マウスを対照とした。
| 71 |
未処理のダブルトランスジェニックマウス(下図ではDTで示す)と比較して,var 200(下図では“Cd”で示す)はFSGSマウスの腎皮質中のコレステロールを有意に低下させた。これは蛋白尿(アルブミン/クレアチン比率)の有意な低下に関与しており,以下のようになる。

アドリアマイシン(ADR)誘導動物モデル
2つ目のFSGSモデルでは,生後5週間のBALB/cマウスにアドリアマイシン11 mg/kgを投与した。その後、24時間後、VAR 200は40 mg/kgの用量で皮下浸透圧ポンプで10週間投与した。未誘導マウスを対照とした。
Var 200(下図では“CD”で示す)は,未治療ADR誘導マウスと比較して間膜拡張が有意に減少し,これは通常脂肪沈着に関与しており,以下のようになる。これは,VAR 200で処理したADR誘導マウスの蛋白尿 (アルブミン/クレアチン)と血中尿素窒素(BUN)の有意な減少に関与しており,以下に示す。

| 72 |

VAR 200とAlport症候群
別の研究では,VAR 200がアルポート症候群において保護作用を有するかどうかを評価するために,周囲大の雌Col4 A 3ノックアウト(Col4 A 3/)マウスにVAR 200を投与し,4,000 mg/kg,週3回,4週間持続した。野生型Col4 A 3(“Col43+/+”) マウスを対照とした。
Var 200(下図では“Cd”で示す)は,未治療のAlport症候群マウスと比較してAlport症候群マウス腎臓中性脂肪,コレステロールエステル,コレステロール結晶の蓄積を有意に減少させ,以下のようになった。

| 73 |

未治療のAlport症候群マウスと比較して,VAR 200で治療されたAlport症候群マウスの細胞内脂肪レベルの低下は腎臓障害br(間膜拡張減少,線維化,足突起消失)の有意な減少に関与し,腎機能が維持され,未治療Alport症候群マウスと比較して蛋白尿(アルブミン/クレアチニン),血中尿素窒素,血清クレアチニンが低下したことを以下に示す。

| 74 |



Var 200と糖尿病腎症
VAR 200が細胞内コレステロールを隔離し、足細胞を糖尿病腎症中のコレステロール依存性障害から保護できるかどうかを決定するための別の研究brでは、4週齢のTBBR ob/obホモ接合マウス(糖尿病進行性腎臓疾患モデル)に対して5ヶ月間の週3回VAR 200の皮下注射を行い、投与量は4,000 mg/kgであり、5ケ月間であった。混合子マウスを対照とした。
Var 200(下図の“CD”で示す)は、未治療糖尿病マウスと比較して、腎皮質中の総コレステロールを有意に低下させた。治療後2カ月からの未治療糖尿病マウスと比較して,腎臓障害(間膜拡張)と蛋白尿(アルブミン/クレアチニン) の有意な減少に関連しており,3カ月から研究終了まで統計学的に有意に低下しており,以下に示す。

| 75 |

以上にまとめた3種類の異なる腎臓疾患動物モデルの結果から,VAR 200はネフローゼ症候群患者の蛋白尿の部分的あるいは完全な緩解を誘導·維持し,腎臓疾患の進展率を低下させる可能性が考えられる。
炎症体ASC阻害剤IC 100
IC 100は、複数の炎症性疾患を治療するための臨床前開発におけるモノクロナル抗炎症症体ASC阻害剤であり、IC 100の開発目的は、先天性炎症反応の起動と持続を遮断することにより、疾患の進展を阻止し、生活の質を向上させ、複数の炎症性疾患において病原性の慢性異常炎症を媒介することである。
IC 100については の手がかり指示は決定されていない.我々のポイントは,IC 100が2024年第2四半期にIND申請 を計画的に提出することを推進し,その後第1段階試験を開始することである。IC 100はARDSおよびMSを代表する動物モデルの薬理学的概念検証データを有しており、マウスおよびNHPにおけるGLP毒理学的研究を行い、次の臨床前開発においてIgA腎症、パーキンソン病、早期アルツハイマー病、ハンチントン病、うっ血性心不全などの6種類もの追加適応について追加的な動物研究を行う予定である。われわれの臨床前計画のデータに基づいてIC 100に1つ以上の鉛適応を選択した。
炎症性疾患における炎症性小体の役割
炎症性疾患の病理生理学は炎症性小体の過活性化と持続活性化に関与している。炎症体は病原体や内部危険シグナルに対して免疫反応を開始する多蛋白複合体である。それらは、3つの基本タンパク質から構成される:(I)いくつかのタイプのセンサ分子(例えば、NLRP 1、NLRP 2、NLRP 3、NLRC 4、AIM 2およびPYRIN)のうちの1つ、(Ii)リンカータンパク質、ASCおよび(Iii)caspase原 1。各センサ分子は、異なる病原体または内部危険シグナルに反応する。
次の図に示すように,有害病原体や細胞損傷が存在する場合には,細胞内のセンサー分子(例えばNLRP 3)がトリガされ,アダプタASCの募集を刺激し,ASCは 前caspase−1を募集して炎症体を形成する。炎症性小体は組織中心であり、追加のASCを募集し、Pron様のbr構造で重合し、巨大な糸状信号プラットフォームを形成し、ASC SPECKと呼ばれる。ASC SPOKSは前caspase−1募集に足場を提供し, は前caspase−1から活性caspase−1への変換をトリガし,さらにサイトカインPro−IL−1?をその活性形式に変換し,炎症反応を開始する。活性化caspase-1はまたGasdermin Dの溶解を駆動し、それによって下垂を誘発し、1種のプログラム性細胞死形式で、活発なサイトカインとASCスポットを放出して細胞外空間に入り、そして持続的に 前IL-1üを活性化し、隣接細胞と組織の炎症反応を増強と維持する。炎症性小体が先天性免疫反応を誘発することは病原体を防ぐために不可欠であるが、炎症性小体の持続的な過活性化は多くの炎症条件と疾病の基礎となる慢性炎症を招く可能性がある。多くの炎症性疾患は多くのタイプの炎症体の活性化に関与している。例えば,多発性硬化症はAIM 2,NLRP 1,NLRP 3,NLRC 4の活性化に関与している。
| 76 |


IC 100行動機構
IC 100は、アダプタータンパク質ASC中の重要なアミノ酸と結合することを意図しており、ASCは、ASCの炎症体複合体およびASCスポットの再進入の形成を制御することを担当する
| ● | ASCが炎症体複合体に再集積することを抑制し、炎症体の形成を抑制することにより、炎症性物質の下落の起動を遮断する | |
| ● | ASC細胞内や細胞外斑の形成を破壊することにより,破壊的な炎症は持続的に阻止される。 |
| 77 |


炎症小体の一方の場合の活性化は別の状況に影響する可能性がある
最近“翻訳研究”に発表された論文は、1種の独特な炎症条件によって誘発される炎症体活動とシグナル蛋白が影響し、潜在的に別の炎症条件と相互作用することを示している。著者は、外傷性脳損傷(TBI)とアルツハイマー病(AD)が、様々なタイプの炎症体(NLRP 3、NLRP 1、およびAIM 2)の活性化によって関連していることを多くの証拠を提供している。いずれの場合も、炎症体の活性化は細胞死を招き、活性サイトカインおよびASCスポットを隣接細胞に放出し、一方の状況を悪化させる可能性がある。例えば,中等度の脳外傷歴のある人のADのリスクは前者の2.3倍である。同様に、脳損傷患者の炎症体活性化はIL-18及び病理性ASC SPECKとアミロイドβ蛋白とリン酸化tauの相互作用を通じてADの病理を悪化させる可能性があり、これらはすべてADの特徴である。著者はASCが近隣細胞の炎症の増強と維持における独特な作用、及びそれがアミロイドβ蛋白とリン酸化tauの病理と相互作用するため、ASCは脳外傷とADを治療する有望な治療標的であることを報告した。その後の研究では,IC 100を用いてASCを抑制することにより,炎症体活性を阻害することにより,脳損傷後のADマウスの上昇した炎症反応を減少させることができるかどうかを評価した。データにより、100は損傷後1週間のADマウス損傷皮質における炎症体を介したサイトカインIL-1βの減少を招くことが分かった。これはIC 100を用いた臨床前研究と一致しており,これらの研究は侵襲的脳損傷や年齢に関連する脳炎症(アルツハイマー病などの疾患に関連する)モデルで炎症活動が減少し,組織学的および/または機能結果が改善することを示しており,次節で重点的に紹介する。
臨床前サポートIC 100
マウスや非ヒト霊長類で行われた非GLP毒理学的研究では,IC 100は良好な安全性を示している。両種とも,投与量300 mg/kg以下の患者では薬物関連副作用は発生しなかった。同様に,エピジェネティックスクリーニングは多くの生物製品よりも低い免疫原性の潜在力を示した。我々がMSを代表する動物モデルで行った臨床前研究によると,炎症は免疫抑制なしに軽減される。br}は,上記の外傷性脳損傷や年齢関連炎症(早期認知障害)の研究に加えて,ARDSとMSを代表する動物モデルの薬理学的概念検証データと,脊髄損傷を代表する動物モデルの機械的概念検証データ を有する。
IC 100とMS
IC 100が多発性硬化症の進展を予防できるかどうかを決定する研究では,免疫髄鞘少突起グリア細胞糖タンパク質35−55(MOG 35−55)により,C 57 BL/6マウスに活発な実験的自己免疫性脳脊髄炎(EAE)が誘導された。IC 100は臨床症状が出現する8日前に10、30或いは45 mg/kgの用量で腹腔注射し、その後4日ごとに治療し、計32日であった。車両を制御点とする.
IC 100は、脊髄を透過し、脊髄活性化ミクログリア、CD 8+細胞、および髄細胞の数を減少させることができる。MS臨床採点により、これは発病遅延と機能の著しい改善と関係があり、以下に示す。
| 78 |


IC 100とARDS
IC 100がARDS組織病理学的結果を改善できるかどうかを決定する別の研究では、研究者は、外傷性脳損傷マウスの細胞外小胞(EV)を送達し、その後、EV送達後1時間にIC 100の機能プロトタイプを5 mg/kgの速度で静脈内投与し、24時間後に動物を処刑することにより、幼稚マウスの急性肺損傷とその後のARDSを誘導した。データ を単純,偽(生理食塩水),未処理あるいはエノールヘパリン3 mg/kg実験群と比較した。
IC 100は肺組織炎症小体とサイトカインの活性化を抑制でき、Caspase-1、Asc、IL-1β、AIM 2、HMGB 1の発現は未治療の陽性対照動物より明らかに低いことを示した。これは組織学的結果の改善と急性肺損傷採点の低下と関係があり、 は肺損傷の重症度の低下を示している。
| 79 |

| 80 |
IC 100概念データの機械的証明
脊髄損傷
脊髄損傷におけるASC中和の作用を決定するために,中等度頚脊髄損傷(“SCI”)のFischerラット損傷後20分に50マイクログラムの抗ASCツール抗体IVとipを投与した。対照群と比較して,抗ASC中和抗体 はcaspase−1の活性化とサイトカインレベルを低下させ,組織病理学的結果を改善し,脊髄損傷体積を減少させ,機能結果(例えば運動スキル)を改善した。
種々の炎症性疾患動物モデルにおける好ましい結果に基づき,IC 100は炎症性疾患に関連する持続的破壊的炎症を媒介し,予後を改善する可能性が信じられている。
外傷性脳損傷
2種類の異なる動物モデルにおいて、ASCと創傷性脳損傷における作用、即ち透過性弾道様脳損傷モデルと液体衝撃傷モデルを評価した。
貫通弾道様脳損傷モデルでは,貫通弾道様脳損傷を受けたSDラットに,損傷後4時間にIC 100の機能プロトタイプを5 mg/kgの速度で静脈内投与した。賦形剤対照群と比較して、IC 100は炎症性小体の活性化を低下させ、caspase-1活性の低下、ミクログリア細胞と浸潤性白血球の弛緩を示した。
流体衝撃損傷モデルでは,流体衝撃損傷を受けたSDラットに,損傷後15マイクログラムで抗ASCツール抗体を静脈内投与した。免疫グロブリンG(“Ig G”)を対照とした。ASCの中和はNLRP 1炎体シグナル伝達を妨害し,caspase−1はIg Gより有意に低下した。これは挫傷体積の著明な減少と関係がある。
年齢関連炎症(早期認知障害)
高齢マウス(すなわち18カ月齢)の炎症反応に対するIC-100の影響を決定するために、高齢マウス(すなわち18カ月齢)の高齢マウスにIC-100を10 mg/kgの用量で注射した。生理食塩水対照群を受けた高齢マウスと未治療の若年マウス(すなわち3カ月齢のマウス)を対照とした。IC 100は、炎症体タンパク質レベル(すなわち、NLRP 1、Asc、Capase−1)およびIL−1βの減少に関連するAscスポットを減少させ、IC 100が高齢マウス皮質における炎症体活性化を減少させることを示している。
バイオマーカーとしてASC
バイオマーカー は疾病の進展を予測、診断とモニタリングする貴重なツールである。それらはまた、特定の治療に反応する可能性のある患者を狙って、時間の経過とともにこれらの治療の持続的な治療効果を監視するために使用することができる。
マイアミ大学の研究者は,炎症性疾患の潜在的バイオマーカーとして血清炎症小体蛋白を評価し,ASC を潜在候補として決定した。健常者と比較して種々の炎症性疾患患者の血清ASCレベルが上昇している。また,多発性硬化症患者では,ASCはcaspase−1とバイオマーカーとして比較してcaspase−1に対する感受性は類似しているが,caspase−1より特異性が有意に高い。

ASC レベルは、例えば、疾患の結果および疾患の重症度と関連することが証明されている
| ● | 脳損傷患者では,損傷後5日前のASC蛋白レベルは創傷後5カ月の予後を予測することができる。 | |
| ● | MS患者を軽度または中等度疾患に分類した患者では,中等度患者の血清ASCレベルは軽度患者より高かった。 |
| 81 |
市場とビジネスチャンス
私たちの主要な候補製品は、(I) 我々の主要な腎臓候補製品VAR 200を含む重大な医療需要が満たされていない疾患を治療する潜在力があると信じており、病巣セグメント性糸球体硬化症(FSGS)、Alport症候群(孤児適応)および糖尿病腎症などの多種の腎臓適応の治療に使用されている可能性があり、(Ii)我々の主要な抗炎症候補製品IC 100は、多発性硬化症と急性呼吸窮迫症候群を含むが、これらに限定されない多種類の炎症性疾患の治療に使用されている。VAR 200は、FSGSまたはAlport症候群に対するFDAの孤児薬物指定を受けていない。
コレステロール流出調節剤TMVar 200個のビジネスチャンス
FSGS 市場
FSGSに対する疾患特定薬物療法の総目標市場は決定されておらず,承認されていない本疾患に対する薬物療法 (次節を参照し,現在の治療制限を検討する)。NephCure Kidney Internationalのデータによると,FSGSは孤児症状であり,米国では約40,000人が影響を受け,毎年5,400例を超える新診断例が推定されている。FSGSは45歳以上の成人に最もよく見られ、アメリカ黒人における発病率はコーカサスアメリカ人の4倍である。
現在のFSGS治療法と限界
現在,FSGSに対する疾患に対する商業的治療法はなく,既知の治療法もない。現在の治療法は十分な栄養を維持し、血圧と血中脂質をコントロールし、尿蛋白損失を最大限に減少させ、浮腫合併症を防止し、腎臓機能を安定させることに重点を置いている。最も一般的な薬物治療は、浮腫を治療する利尿剤、蛋白尿を減少させるアンギオテンシン変換酵素阻害剤およびアンギオテンシン変換酵素阻害剤、他の降圧薬および脂質低下薬を含む。ステロイドやカルモジュリン阻害剤は蛋白尿の部分的緩解を誘導するためにも用いられる。
著者らは、疾病の進展を遅延させ、末期腎臓疾患を予防し、患者の生活の質を高め、医療経済負担を軽減できる有効なFSGS特効治療に対して、まだ大量の満足されていない需要があると考えている。
アルポト症候群(AS)
孤児として腎臓疾患は進行性遺伝性疾患であり,通常聴力損失や眼異常に関与している。これはIV型コラーゲンファミリーのメンバーをコードする遺伝子突然変異によって引き起こされ、最終的に腎臓基底膜或いは“糸球体”、内耳或いは“蝸牛”、“br}と目の脂肪蓄積と瘢痕形成を招く。強直性脊椎炎の1つの重要な早期特徴は尿中の血液、或いは“血尿”であり、腎臓機能は進行性に低下し、最終的に腎機能不全を招く。両耳に影響する聴力損失は児童末期或いは思春期早期に発生し、通常は腎不全発作前である。患者にも水晶体奇形(水晶体前円錐)や網膜色異常がある可能性があるが,これらの異常は視力喪失をきたすことは少ない。AS患者の予後は比較的に悪い。
市場として
FDAが承認していないAS疾患に対するbr薬物療法(次節で検討する現在の治療制限を参照)のため,ASに対する疾患特定薬物療法の総目標市場は確立されていない。ASは のすべての地理と人種集団を代表する.普通の人群の全体発病率はまだ不明であるが、アメリカのデータにより、3%の児童と0.2%の成人は末期腎臓疾患を患っていることを示した。米国の希少疾患組織のデータによると,米国ASの遺伝子頻度は1:5,000から1:10,000人と推定されており,約30,000から60,000人が影響を受けていることが示唆されている。
現在の治療法と制限として
Brは現在のところASに対する疾患に対する商業的治療法はない。現在の治療法は尿中タンパク質の損失を最大限に減少させ,浮腫合併症を防止し,腎機能の安定に寄与している。明らかな蛋白尿を有するAS患者には、アンギオテンシン変換酵素(“ACE”)阻害剤やアンギオテンシン受容体遮断薬(“ARB”)治療が推奨されている。疾患の進展を遅延させ、末期腎臓疾患や聴力損失を防止し、患者の生活の質を向上させる有効なAS特異的治療には、まだ満足されていない需要が多いと考えられる。
| 82 |
糖尿病腎症
20世紀50年代以来、腎臓疾患或いは“腎症”はずっと糖尿病のよく見られる合併症と考えられてきた。現在、糖尿病腎症はアメリカと他の西洋社会の慢性腎臓疾患の主要な原因である。糖尿病患者の発病率と死亡率についても、それは最も重要な長期合併症の一つである。糖尿病はアメリカのすべての末期腎症(“ESRD”)病例の30%~40%を占める。蛋白尿は発病率と死亡率の予測指標である。蛋白尿患者の相対死亡率は40倍高い。微量アルブミン尿(尿中少量アルブミン) は独立に心血管疾患の発病率を予測でき、蛋白、アルブミンが尿中に入る(或いは“微量アルブミン尿と大量アルブミン尿”)は糖尿病患者のいかなる原因による死亡率を増加させる。
糖尿病腎症市場
糖尿病腎症の疾患特異的薬物療法の総目標市場は確立されておらず,この疾患に対する薬物療法は承認されていないためである(次節を参照して,現在の治療制限を検討する)。糖尿病を有する20年以上の患者のうち、50%以上の患者が糖尿病腎症を有している。疾病管理·予防センターによると、アメリカには1200万人もの人がいると推定されている。
糖尿病腎症治療の現状と限局性
高血糖或いは“高血糖”はすでに糖尿病腎症進展の主要な決定要素であることが証明されたため、良好な血糖コントロールはこの状況を管理するキーポイントである。他の腎臓疾患と同様に,腎臓に対する薬物療法は現在のところない。アンジオテンシン変換酵素阻害剤とARBを用いて血圧を制御することが看護の基準である。新しい治療ガイドラインは2型糖尿病、糖尿病腎症患者に対してナトリウム-グルコース共輸送体2(“SGLT 2”)阻害剤を使用することを提案し、現在の任意の血糖コントロールレベルで、1.73 m 2当たりの糸球体濾過率(“”)は30 ml/分と推定されている。SGLT 2阻害剤は、この集団の腎臓および心血管結果を改善することが確認されている。
著者らは、疾患の進展を遅延させ、末期腎臓疾患を予防し、患者の生活の質を高めることができる有効な糖尿病腎症の特効治療に対して、満足されていない巨大な需要が存在すると考えている。
IC 100のビジネスチャンス
抗炎症生物製品市場
“フォーチュンビジネス洞察”のデータによると、2019年の全世界の抗炎症生物製品市場の価値は648.4億ドルで、2027年には1498億ドルに達すると予想されている。
多発性硬化症(MS)
MS は脳と脊髄の潜在的障害性疾患であり、その発生原因は免疫系が神経繊維を覆う保護性髄鞘を攻撃し、脳と身体の他の部分との間の通信問題を招く。最終的に、この病気は永久的な神経損傷や悪化を招くだろう。
多発性硬化症のバイタルサインや症状は大きく異なり,神経障害の程度や特定の神経が影響を受けることに依存する。よく見られる症状は:1つ以上の肢体麻痺或いは虚弱、ある頚部運動を伴う電気ショック感、振戦、協調性の欠如、或いは歩行不安定を含む。深刻な多発性硬化症を有する人は自立歩行能力を失う可能性があり、他の人たちは新しい症状が出現することなく、長時間の緩和を経験する可能性がある。視覚問題は多発性硬化症患者にもよく見られ、部分的あるいは完全な視力喪失を含み、通常は1回の目、複視時間の延長、あるいは視力曖昧である。他の症状は話す曖昧、疲労、めまい、痛み或いは身体部分の痛みを含む可能性がある。約30%の患者が20年から25年以内に深刻な障害を発症する。
| 83 |
MS 市場
Cowan and Companyの2020年の報告によると,2019年,米国で多発性硬化症を治療する疾患修正薬は144億ドルの売上を達成した。国家多発性硬化症協会のデータによると、現在の推計によると、多発性硬化症は米国で100万人、世界で280万人に影響している。米国国立多発性硬化症協会のデータによると、多発性硬化症患者の約85%が再発緩和型多発性硬化症を有し、一定期間の新しい症状または再発を経験しており、これらの症状または再発は数日または数週間以内に進行し、通常部分的または完全に改善される。これらの再発後は疾患緩和のサイレント期であり,数カ月あるいは数年持続可能である。約60%から70%の再発緩解型多発性硬化症患者は、最終的に安定した症状の進行を示し、緩解期があるかないか、二次性進行型多発性硬化症と呼ばれる。一部の多発性硬化症患者のバイタルサインや症状は徐々に発作し、安定して進行し、何の再発もない。これは一次−進行性多発性硬化症と呼ばれる。
現在の多発性硬化症の治療法と限界は
現在多発性硬化症を治療する方法は、潜在的な免疫障害を解決するための免疫調節療法(“IMT”)と、症状を緩和または改善する療法とを含む。IMTの目標は再発の頻度の減少と疾患の進展の緩和である。市場には多くの疾患改良剤があるにもかかわらず、多くは再発性多発性硬化症のためにのみ承認されている。FDAは原発進行性多発性硬化症の治療にIMTのみを承認している。進行性多発性硬化症の治療に有効な薬剤には大きな需要があると考えられ、IC 100はこの満たされていない需要を満たす可能性があると信じている。
急性呼吸疾患症候群(ARDS)
ARDSは生命を脅かす呼吸不全であり、その特徴は肺部に広範な炎症、非心源性肺水腫、酸素療法が無効な低酸素血症、胸部X線写真の瀰漫性異常、肺コンプライアンスの低下である。患者 はICU入院期間と入院時間を延長する必要があり,大量の医療資源を消費する。予後が悪く、合併症が多く、死亡率が高い;生存者は回復後数年以内に深刻な機能障害がある。ARDSを引き起こす最もよく見られる原因は新冠肺炎、肺炎、胃内容物吸入と膿毒症である。
ARDS 市場
ARDSの総目標薬物治療市場は確立されていないが,薬物治療は現在治療に用いられていないため(次節を参照して現在の治療制限を検討してください)。米国ではARDSは年間約90,600人の患者 に影響しており,Quintanillaら(2021年の出版物)によると死亡率は45%と高い。全世界範囲内で、ARDSは集中治療室入院人数の10%を占め、毎年300万人以上のARDS患者がいる。ARDSの発症率には性差はないが,加齢に伴いARDSの発症率は増加する。
現在のARDS治療法と限界
BrはARDSを治療する薬剤は現在のところない。現在ARDSの治療重点は基礎条件、支持性看護、無侵襲或いは小換気量を使用した機械換気及び保守的な液体管理である。IC 200はARDSに広く存在する炎症病原体を治療する可能性があると信じている。
他の 候補開発者
我々は,腎臓や炎症性疾患に関連する他の技術を識別·獲得する商業的権利を求め続けている。
| 84 |
戦略同盟と手配
LとF Research LLCライセンスプロトコル
吾ら とL研究有限会社(“L研究”)は改訂後2015年12月15日に発効した許可協定(“L研究許可協定”)を締結し、これにより、L研究はVAR 200の特許及び知的財産権及び独自技術に基づいて吾などの独占的、印税を有し、全世界再許可可能な許可を付与し、FSGSを含むヒト腎臓疾患及びその症状の治療、抑制或いは予防に用いられる。L&F研究会社はマイアミ大学ミラー医学院のVAR 200発明家と研究者brによって設立され、彼らはマイアミ大学から知的財産権を獲得した。Lライセンス契約によると、吾らは(I)署名時にL研究に前払い許可料 200,000ドルを支払うことに同意し、(Ii)ある開発マイルストーンを実現したときにL研究に追加金 を支払うことに同意し、総額は最高2,150万ドルであり、(Iii)ある純販売マイルストーンを実現した場合、それによって生じる 製品の純売上高についてL研究に特許権使用料を支払うことに同意し、ある年度の純販売敷居に応じて5%から10%まで様々である。また、L及びF許可協定に署名した後、吾らはL許可協定に基づいて、L研究に4(4)部の株式承認証(“L F株式承認証”)を発行し、L許可協定及びL F株式承認証に掲載されているいくつかの条項及び条件に従って、合計878,947株式会社の普通株を行使することができる。
2022年12月23日、我々はL研究 有限責任会社(“L研究”)と“ライセンス放棄協定下のある権利第2修正案”(“第2修正案”)を締結し、これまでに開示された2022年3月2日のZyVersa治療会社、フロリダ州の会社(“Old ZyVersa”)とL研究との間のライセンス契約下のある権利の放棄(“放棄合意”)、br}改訂(“放棄合意”)を改訂した。第2の修正案は、さらに、Lがライセンス契約の終了を放棄し、ライセンスプロトコルに従って任意の他の救済措置を行使する期限を2023年3月31日まで延長し、L&Fライセンス契約に基づいてL&F研究に支払われるべき合計1,500,000ドルのマイルストーン支払い(“マイルストーン支払い”)に関連する。brは2023年2月28日に、吾らはL&F研究と改訂された改訂および再記述プロトコル(“br}改訂および改訂放棄合意を再確認する”を締結した。再記述声明は、マイルストーン支払いについて、L研究会社は、(A)2023年3月31日まで、L&F許可協定を終了し、合意に従って任意の他の救済措置の権利を行使する権利を放棄し、1,000,000ドルのマイルストーン支払い(“A免除”)、および(B)2024年1月31日、このマイルストーン 支払いに関する500,000ドル(“免除B”)を規定する。免除Aは、(I)先に開示された引受票(日付は2020年12月13日、L研究会社が借り手とし、Old ZyVersaを貸手とする(“手形”)に基づいて当社が開示した引受金総額351,579ドルに依存し、(Ii)当社は2023年3月31日または以前にL研究会社に648,421ドルの現金支払いを支払う。免除Bは、当社がL研究 に500,000ドルの現金を支払い、(X)2024年1月31日までに完了し、(Y)当社が新規株式を発行して少なくとも30,000,000ドルの純収益を受け取った日から10営業日から計算することに依存します。LとF 許可プロトコルの他のすべての条項は依然として有効である.
Lライセンスプロトコルは,Lライセンスプロトコルの下ですべての特許権使用料支払い義務が最後に満了した時点で終了し,60日前にLライセンスプロトコルの終了を通知する権利がある.
他方が合意に深刻に違反し、通知後60日以内に違約行為を是正していない場合、いずれも L&Fライセンスを終了することができる。もし私たちが合意に基づいてお金を支払うことができなければ、L&F研究会社は10日前に合意終了を通知することができます。また,我々 が直接または第三者の協力を与えることにより, ライセンス側特許権(プロトコルで定義されているような)の有効性や実行可能性に疑問を提起したり,br}のいずれかの許可側特許権に対して任意の延長または補足保護証明書の付与に反対する場合,L研究は書面通知後ただちにLライセンス契約を終了する権利がある.
スループットマイルストーン完了日(各用語はプロトコルで定義されている)前にスループットマイルストーンを完了できなかった場合、 LおよびF Researchは、90日以内に(A)すべてのプロトコル終了を書面で通知するか、または(B)プロトコルの排他性条項を終了し、ライセンスを非排他性に変換することを選択することができる。しかし、L研究が プロトコルを終了するか、または独占経営権を終了する前に、もし私たちが不可抗力イベントまたは の重大な変化(これらの用語はプロトコルで定義されている)によって指定された時間内に特定のスループットマイルストーンを達成できなかった場合、双方は誠実に協議して、関連するスループットマイルストーンの改訂日を合意する。もし私たちが不可抗力事件或いは重大な変更が予定されていた生産能力マイルストーンの完成日に達しなかった遅い日付或いは私たちが不可抗力事件或いは重大な変更が発生した後15日 を通知する前に合意できなければ、L&F Researchはその停止権を行使することができる。
InflamaCORE, 有限責任会社ライセンス契約
我々 は、InflamaCORE、LLC(“InflamaCORE”)と2019年4月18日に発効するライセンス契約(“InflamaCOREライセンス契約”)を締結し、この合意に基づいて、InflamCOREは、IC 100の開発および商業化のために、すべての疾患および疾患の治療および診断用途のための独自の、グローバルで再許可可能な特許、知的財産権、技術および技術ライセンスを付与してくれた。InflamaCOREはマイアミミラー医学院IC 100の発明者と研究者によって作成され、彼らはマイアミ大学とスイス細胞系開発会社Selexis SAから知的財産権の許可を得た。InflamaCOREライセンス契約によれば、我々は(I)署名時にInflamaCOREに346,321.08ドルの前払い許可料を支払うことに同意し、(Ii)ある開発マイルストーンを達成したときにInflamaCOREに追加金を支払うことに同意し、総額は最大2250万ドルであり、(Iii)ある純販売マイルストーンを達成したときにInflamaCOREに印税を支払うことに同意し、純売上高レベルによって5%から10%まで様々である。(Iv)ある純売上のマイルストーン(純売上高の3%から6%まで)を達成した後、マイアミ大学にある最終製品の純売上の特許権使用料を支払うことに同意し、(V)Selexis細胞系技術を含むすべての第三者技術の再許可を取得し、そのSelexis許可をInflamaCOREに支払う義務に同意する。Selexisライセンスにより,Selexisに50,000スイスフランの前払い許可料を支払った。Selexisに(InflamaCOREの償還により) (I)年間10,000スイスフランの維持費,(Ii)ある開発マイルストーンを実現する際に支払う金,最高総額約110万スイスフラン,および(Iii)純売上高に応じて低い桁に相当する特許権使用料を支払う義務がある.また,InflamaCOREライセンス契約に署名しInflamaCOREライセンス契約に基づき,吾ら(I)はマイアミ大学 に200,000株の普通株式を発行し,(Ii)InflamaCOREに4つの承認株式証(“InflamaCORE株式承認証”)を発行し,InflamaCOREライセンスプロトコルおよびInflamaCORE承認持分証に記載されているいくつかの条項や条件により,合計1,000,000株の普通株を行使することができる.
| 85 |
InflamaCOREライセンスプロトコルは、InflamaCOREライセンスプロトコルの下ですべての印税支払い義務が最終的に満了した時点で終了し、InflamaCOREライセンスプロトコルの終了を60日前に通知する権利があります。他方が本プロトコルに深刻に違反し、 通知後60日以内に修正されていない場合、本ライセンスは、いずれか一方によって終了することができる。私たちが合意に従って支払うことができなかった場合、InflamaCOREは10日前に合意終了を通知することができます。また、合意は、一方の当事者が他方の当事者が破産したり、債務を相殺しない場合に終了することができる。
InflamaCOREライセンスプロトコルの終了後,我々に付与されたライセンスは自動的に終了し,InflamaCOREに復帰する.
製造業
私たちは現在、VAR 200、IC 100、および開発が求められている任意の他の候補製品を作成、製造、テスト、記憶、包装、または流通するためのいかなる施設も所有または運営していません。現在、このような活動を行う能力はありません。 私たちは現在、VAR 200、IC 100、および開発を求める可能性のある他の候補製品を製造、記憶およびテストする第三者に依存しています。我々は、第三者サプライヤーおよび製造機関に依存して、必要なすべての原材料および薬品 を提供し、VAR 200、IC 100、および開発を求める可能性のある任意の他の候補製品の臨床試験数を作成、製造、試験、貯蔵、包装、配布する。私たちは引き続き第三者サプライヤーと製造組織ネットワークを発展させることを計画していますが、将来的には、技術的需要や戦略的あるいは財務的利益があれば、私たち自身の製造と供給能力に投資することを考えるかもしれません。
私たちは内部スタッフがいて、豊富な技術、製造、分析、品質経験を持つコンサルタントを利用して、私たちの契約製造とテスト活動を監督しています。製造は広範な法規の制約を受け、これらの法規はプログラムとファイル要求を規定し、記録保存、製造過程と制御、人員、品質管理と品質保証を含むがこれらに限定されない。私たちのシステム、手続き、そして請負業者はこのような規定を遵守し、定期的な監視と正式な監査によって評価されなければならない。
研究と開発
我々の は2020年の研究開発活動に約650万ドル,2021年12月31日までの1年間に210万ドル,2022年1月1日から2022年12月12日までの直前まで540万ドル,2022年12月13日から2022年12月31日までの後続期間 に40万ドルかかった.
販売 とマーケティング
私たち は現在マーケティング、販売、または流通能力がありません。商業販売のために許可された任意の製品を商業化するためには、私たちは、自分の販売、マーケティング、流通インフラを開発するか、またはそのような商業インフラおよび関連するマーケティングおよび販売経験を持つ第三者と協力しなければならない。私たちは、任意の予想される製品が発表される前に、時間の経過とともに私たちのビジネスインフラを構築し、戦略パートナーとの許可、共同販売、共同推進協定 によって私たちの製品を商業化することができることを願っています。VAR 200、IC 100、および開発を求める可能性のある任意の他の候補製品の潜在的マーケティングを支援するための商業インフラが構築された場合、そのような商業インフラは、販売管理、内部販売支援、内部マーケティンググループ、および流通支援によって支援される的確な販売チームを含むことが予想される。適切な商業インフラストラクチャを確立するためには、VAR 200、IC 100、および開発を求める可能性のある他の任意の候補製品を承認する前に、大量の財務および管理リソースを投入する必要がある。
競争
製薬とバイオテクノロジー業界は競争が激しい。これらの競争相手には、多くの公共および民間会社、大学、br政府機関、および他の積極的に製品研究開発に従事する研究組織が含まれており、これらの製品は、私たちが類似の適応を開発または解決することを求めている製品候補製品と類似している可能性がある。多くの競争相手は私たちより多くの財力、技術と人的資源を持っていて、彼らの製品を開発、製造、マーケティングすることができるかもしれません。我々の製品や療法のような製品の開発を求める会社数は時間とともに増加する可能性も予想される。製薬と生物技術業界の競争要素 は製品の効果、安全性、使いやすさ、価格、証明されたコスト効果、 マーケティングの有効性、サービス、名声と技術情報の獲得を含む。上記の1つまたは複数の考慮事項の点で、我々は、競合他社の製品と競合できない可能性がある任意の製品 を開発し、商業化することを求めている。
| 86 |
例えば,炎症,線維化,血管収縮に対するFSGS臨床薬は他にもいくつか開発されている。我々の競争相手には、第2段階及び第3段階の化合物を含む異なる開発段階にある製品がある。しかし,VAR 200は現在開発されている糸球体中の脂質蓄積を解決する唯一の薬剤である可能性が考えられる。現在、腎臓疾患の治療アルゴリズムは多種の薬物療法を含み、腎臓疾患を招く各種の経路を解決する。VAR 200は,他の病原性経路を解決するために,他の治療法と組み合わせて使用される可能性が考えられる。
また,炎症小体経路に対する薬剤を開発している会社もあり,中には多適応の臨床試験を行っている会社もある。これらの競争相手の中には,痛風,シュニッツラー症候群,新冠肺炎呼吸器症状,症候性膝骨性関節炎,家族性風邪自己炎症症候群,角膜上皮欠陥,乾/湿性黄斑変性,糖尿病網膜疾患,黒色腫などの適応を含む異なる開発段階にある製品が知られている。また、一部の一期臨床試験が行われており、健康被験者以外に、CAPS、軽度新冠肺炎、収縮性心不全、固形腫瘍などの適応がある。IC 100は,炎症の開始や持続を防ぐために,多様なタイプの炎症体 を潜在的に抑制する炎症体ASC成分に対する唯一のモノクローナル抗体である可能性が考えられる。
知的財産権
私たち は、特許、法規排他性、ノウハウの組み合わせによって私たちの製品と技術を保護することを求めています。私たちの目標は、私たちの製品、配合、プロセス、方法、および他の独自技術の特許保護を取得、維持、実施し、私たちの商業機密を保護し、米国および他の国/地域での他の当事者の固有の権利を侵害することなく運営することである。私たちの政策は、適切な場合に、契約配置と特許(適用される場合)を組み合わせて、現在の成分および方法、ならびに将来開発されている任意の成分および方法、独自情報およびノウハウのために、米国および海外で最も広範な知的財産権保護を得ることを積極的に求めることである。しかし,特許保護であっても競争相手が我々の特許 を回避しようとすることを完全に防止できるとは限らない.もっと知りたいことがあれば、タイトルを参照してください“危険要素-私たちの知的財産権と関連した危険
Lライセンス協定によれば、我々は、FGSを含むヒト腎臓疾患の治療のための2-ヒドロキシプロピル-β-シクロデキストリン (“2 HPβCD”)に関連する発明の世界的に独占的かつ再許可可能な許可を有しており、いくつかの使用方法特許 に記載されているように、特許協力条約(“特許協力条約”)の規定に基づいて米国と一部の外国(カナダ、中国、ヨーロッパ、日本、メキシコ)に提出された2つの国際特許出願の係属中の出願である。現在、3つの米国特許と7つの外国許可または許可された出願がある。これらの特許および 保留出願から発行される任意の特許の有効期限は少なくとも2033年と予想され,いかなる特許期間の調整や延長もない。
InflamaCOREライセンスプロトコルによれば、我々は、IC 100を含むが、これに限定されないヒト化IgG 4抗体、アポトーシス関連スポット様タンパク質(ASC)のパイリンドメインに対する特定のアミノ酸配列を含むが、IC 100に限定されない、炎症小体およびその構成要素を介した炎症反応および炎症に関連する発明の識別、診断および治療に関連する発明の独占的かつ許容可能な世界的許可を有する。IC 100の特許組み合わせは、物質組成、バイオマーカーおよび使用方法特許、および米国および選択された国/地域(オーストラリア、ブラジル、カナダ、チリ、中国、コロンビア、ヨーロッパ、インド、インドネシア、イスラエル、日本、マレーシア、メキシコ、フィリピン、シンガポール、南アフリカ、韓国、タイ、ベトナム)における関連国申告文書を含む5つの特許シリーズを含む。現在,発行された米国特許は5件,国外で承認または許可された出願は3件,承認待ち出願は56件である。これらの特許および保留出願から発行される任意の特許の有効期間は少なくとも2028年と予想され、 はいかなる特許期間の調整または延長もない。
| 87 |
今回の では,ZyVersaは特許や特許出願以外の接続L&FやInflamaCOREライセンスプロトコルを持たない.
たとえ 我々が発行した特許を許可しても,第三者から疑問視されれば,これらの特許の有効性が維持される保証はない. 私たちは私たちのどんな知的財産権も私たちを競争から守るためにどんな保護を提供するか保証できない。
2023年2月24日、我々は、腎臓疾患および障害を治療するための2つの商標出願を、(1)コレステロール流出調節剤および(2)脂質流出調節剤 に提出した。開発中の製品または技術の任意の名称または識別のための他の商標保護出願 はまだ提出されていない。私たちは適用された場合、アメリカ国内と海外で商標保護を求める予定だ。私たちはこれらの登録商標を私たちの薬品研究開発に使用するつもりで、特許技術と私たちの候補製品を含む。
規制事項
アメリカでは、FDAは連邦食品、薬物と化粧品法案(FDCA)、公衆衛生サービス法(PHSA)と他の連邦法律と法規に基づいて薬品、生物製品と医療機器を監督する。これらのFDAによって規制されている製品も州と地方法規および外国に適用される法律または法規によって制限されている。FDAと州、地方、地方司法管轄区と外国の類似規制機関はFDAによって監督されている製品の研究、開発、テスト、製造、品質管理、ラベル、包装、貯蔵、流通、記録保存、承認、br}承認後の監視、広告、販売促進、マーケティング、サンプリングと輸出入に対して実質的な要求を提出した。
政府の法規
私たちが将来開発または買収を求める可能性のあるVAR 200、IC 100および任意の他の候補製品に関連する任意の製品開発活動は、FDAと他の連邦、州とbr地方法規および他の国/地域の同様の規制機関を含む複数の政府機関の広範な規制を受けるであろう。それらは製薬 製品と設備の設計、研究、臨床 と非臨床開発、テスト、製造、貯蔵、流通、輸入、輸出、ラベル、広告、マーケティングを規範化する。通常、新薬を販売する前に、その品質、安全性、有効性を証明するデータを大量に取得し、各規制機関の特定のフォーマットに組織し、監督機関に提出して審査を行い、監督管理機関の許可を得なければならない。これらのデータは通常、2つの異なる開発段階で生成される:臨床前と臨床。VAR 200、IC 100、および私たちは将来、開発または買収の任意の他の候補製品を求めることができ、米国で合法的に発売されることができるように、FDAが新薬申請(“NDA”)、生物許可申請(“BLA”)または他の適用可能な承認手続きを介して承認されなければならない。
臨床開発段階は通常三つの重複可能な連続段階に分けられる:第一段階、第二段階と第三段階の臨床試験 である。第一段階では、通常、少量の健康ボランティアは単回漸増用量に曝露され、その後、候補製品の複数回の増加用量 に曝露される。これらの研究の主な目的は薬物の新陳代謝、薬理作用、副作用耐性と安全性を評価することである。第2段階試験は、一般に、予期される利益をもたらすために必要な用量を決定するために、疾患の影響を受ける患者の研究を含む。また,安全性とさらなる薬物動態と薬効学的情報を収集した。場合によっては、FDAは、正式な第1段階および第2段階試験を必要とするか、または要求しない可能性がある。FDAが原料薬の安全性と有効性が良いと考えている場合,通常はこのような場合である。第3段階の研究では,薬物や治療は大集団に提供され,その有効性を確認し,副作用をモニタリングし,通常の治療法と比較し,br薬や治療が安全に使用されるように情報を収集する。既定の規制経路の下で、原料薬はFDAで知られている原料薬と同じまたは類似した薬品は、通常、この機関よりも全く新しい化合物がより簡素化された開発計画に入る。
承認後のbr研究は、4期臨床試験と呼ばれることがあり、初歩的な発売承認後に行うことができる。これらの研究は、予想される治療条件下での患者の治療からより多くの経験を得るために使用されたり、薬物の他の適応 を得るために使用することができる。場合によっては、FDAは第4段階研究を強制的に実行するかもしれない。
| 88 |
アメリカの医薬品や生物製品の発展は
アメリカでは、規制の承認を得て、その後適切な連邦、州、地方、外国の法律法規を遵守する過程には多くの時間と財力が必要だ。製品開発過程,承認過程または承認後の任意の時間に適用される米国の要求を遵守できず,申請者が行政または司法制裁を受ける可能性がある.これらの制裁には、FDAによる承認保留申請の拒否、承認撤回、臨床封印、警告状、製品のリコールまたは市場からの撤回、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、払い戻し、またはbr}民事または刑事罰が含まれる可能性がある。
アメリカで新薬或いは生物製品に対する人体臨床研究を開始する前に、臨床前実験室と動物試験は通常FDAの“良好な実験室規範”に基づいて行われる。スポンサーは,臨床前試験の結果を生産情報,分析データ,任意の利用可能な臨床データや文献,提案された臨床案 とともに研究新薬(IND)申請の一部としてFDAに提出しなければならない。他の国も類似した書類の提出を要求しています。 INDで提供しなければならないデータ量は研究の段階に依存します。第一段階研究は通常比較的大きい第三段階研究はより少ないデータを必要とする。臨床試験を開始する前に,臨床計画をFDAに提出しなければならない。FDAが臨床計画や提案研究の安全性に懸念がある場合、彼らはいつでもこの研究を一時停止または終了することができる。研究は良好な臨床実践に従って行わなければならず、そして定期的に研究進展といかなる不良経験を報告しなければならない。研究も独立機関審査委員会の審査を受け,これらの委員会は特定の研究者の場所の研究 を監督し,人間の研究対象を保護することを担当している。独立機関審査委員会も起動後に研究を一時停止または終了することができる。 したがって、INDの提出はFDAが臨床試験の開始を承認することを保証することができない、あるいは一旦開始すると、試験の一時停止や終了を招く可能性があるという問題は生じない。
アメリカの医薬品と生物製品の審査と承認
第3段階試験が完了した後,試験データを分析し,安全性と有効性を確認する。そして、完全な開発データをセキュリティプロトコルまたはBLAの形態でFDAに提出するとともに、製品の提案ラベルおよび製品品質を確保するための製造および試験プロセスおよび施設の情報を提出する。NDAおよびBLA申請は、医薬品brスポンサーが米国での販売およびマーケティングを許可する新しい薬品をFDAに正式に提案するツールである。NDAあるいはBLA は安全性,純度,効力と有効性の証明を含まなければならず,広範な臨床前と臨床試験が必要である。INDの動物研究やヒト臨床試験期間中に収集されたデータはNDAやBLAの一部となる。
NDAまたはBLAに対するFDAの審査および評価には数年かかるかもしれない。FDAは新製品の生産施設に対して審査前検査を行うことができ、それらがcGMP要求に符合するかどうかを確定し、そして 臨床と臨床前試験のデータを監査する可能性がある。
FDAは、製剤の安全な使用を保証するために、リスク評価および緩和戦略(“REMS”)を要求することを含む承認時に条件を追加することができる。FDAがREMSが必要であると結論した場合、申請のスポンサーは、投与ガイド、医師のコミュニケーション計画、または制限された配布方法、患者登録、および他のリスク最小化ツールのような安全な使用を保証する要素を含む可能性がある提案されたREMSを提出しなければならない。
INDと薬物·生物製品の臨床試験
薬物または生物製品のヒト臨床試験を開始する前に、臨床前研究の結果および製品化学、製造および制御に関する情報および提案のような他の情報が含まれたINDをFDAに提出しなければならない。INDはFDAがヒトに研究薬や生物製品を投与することを許可する要求である。FDAが30日以内に臨床試験の進行を懸念したり、問題を提起しない限り、FDAが30日以内に自動的に発効する。この場合,INDスポンサーは臨床試験開始前にFDAの未解決の問題を解決しなければならない。薬物開発期間中に行われた後続臨床試験ごとに既存のINDに単独で提出しなければならない。
| 89 |
臨床試験を行う地点ごとの独立機関審査委員会(“IRB”)は,その地点で試験を開始する前に試験の研究計画を審査·承認しなければならないことを提案した。各被験者のインフォームドコンセントを得なければならない。
ヒトbr薬と生物製品の臨床試験は通常順に行われており,これらの段階が重なる可能性がある
| ● | フェーズ I:ヒトにおける薬物/生物学的に最初に健康なヒト対象または標的疾患または状態を有する患者 を研究して、ヒト内での薬物の新陳代謝および薬理作用、副作用を決定し、可能であれば、有効性に関する早期証拠を得る。第一段階臨床試験期間中に、薬物/生物の薬物動態学と薬理作用に関する十分な情報を得ることができ、良好かつ科学的に有効な第二段階臨床試験の設計制御を可能にする。 | |
| ● | フェーズ 第2段階:臨床試験を行うのは、特定の適応或いは標的群における限られた数の患者に対する薬物/生物製剤の有効性を評価し、可能な副作用と安全リスクを確定し、特定の標的疾患に対する薬物/生物製剤の治療効果を決定し、用量耐性と最適投与量を決定するためである。スポンサーは、より規模が大きく、コストの高い第3段階臨床試験を開始する前に、情報を得るために複数の第2段階臨床試験 を行うことができる。 | |
| ● | 第3段階:第二段階の臨床試験が薬物/生物製剤の用量範囲が有効かつ許容可能な安全性を有することを証明し、第三段階の臨床試験の設計に十分な情報を提供する時、第三段階の臨床試験は複数の臨床地点で拡大したbr患者集団で開始することができる。それらは用量、有効性と安全性を更に評価することを目的とし、 は薬物/生物を研究する全体的な利益-リスク関係を確立し、そして製品ラベル とFDA承認に十分な基礎を提供する。FDAは多くの場合,複数の臨床試験地点で拡大した患者群におけるこの薬剤の効果を証明するために,2つの十分かつ制御された良好なIII期臨床試験を必要とする。 |
すべての臨床試験はFDAの規定に従って行わなければならず、良好な臨床実践(“GCP”)の要求を含み、試験参加者の権利、安全と福祉を保護し、臨床試験発起人、管理者と監督者の役割を定義し、そして臨床試験データの完全性を確保することを目的としている。FDA、IRB、データ安全監視委員会またはスポンサーを含む監督機関は、参加者が受け入れられない健康リスクに曝露されていることを発見すること、または臨床試験がFDAの要求に従って行われていないことを発見することを含む、様々な理由で臨床試験を一時停止または終了することができる。
新薬や生物研究開発期間中,スポンサーは特定の時間にFDAと会う機会がある。これらの要件は、INDを提出する前、第2段階臨床試験の終了時、およびNDAまたはBLAの提出前にある可能性がある。他の時間に会議 を行うことが要求される可能性がある.これらの会議は,スポンサーにこれまで収集してきたデータに関する情報を共有させ,FDAにアドバイスを提供させ,スポンサーとFDAに次の段階の開発について合意させる機会を提供することができる。スポンサーは通常、第二段階臨床試験終了会議を利用して彼らの第二段階臨床試験結果を討論し、新薬/生物の承認を支持すると考えられる重要な第三段階登録試験計画を提出した。
同じ剤形中の2種類の異なる薬物を組み合わせた研究薬物製品は、各成分が薬物製品が主張する効果に貢献することを要求する付加規則 に適合しなければならない。これは通常,薬物の各成分について試験するために,より大規模な研究が必要である。
臨床試験情報開示
FDAが規制する製品(薬品、生物製品および設備を含む)の臨床試験のスポンサーであるbrは、いくつかの臨床試験情報を登録し、開示しなければならない。登録の一部として,製品,患者群,調査段階,研究場所や研究者,臨床試験の他に関する情報が公開される。スポンサーには,完成後にその臨床試験の結果を検討する義務がある。臨床試験結果の開示は,検討中の新製品や新適応が承認されるまで延期することができる。競合他社はこれらの公開情報を用いて 開発計画の進展に関する情報を取得する可能性がある.
| 90 |
新薬申請(NDA)と生物製品ライセンス申請(BLA)承認プロセス
私たちの薬品あるいは生物製品はそれぞれNDAとBLA承認プロセスを通じてFDAの許可を得て、アメリカで合法的に発売することができます。これらのFDAが要求する薬品或いは生物製品のアメリカでの発売の流れは通常br以下に関連しています
| ● | 非臨床実験室テストを完成し、NDAであれば、良好な実験室実践或いは他の適用法規による動物研究と調合研究を完成する | |
| ● | IND申請 ; | |
| ● | GCPによるヒト臨床試験に基づいて、その予期される用途に使用されるべき医薬または生物製品の安全性および有効性を決定する | |
| ● | すべての重要な臨床試験が完了した後、NDAまたはBLA(場合によっては適用)をFDAに提出する | |
| ● | FDAの生産施設の承認前検査と臨床試験場所の監査; | |
| ● | FDA は,秘密保持プロトコルまたはBLAを承認する(適用される場合). |
米国市場での薬物または生物製品の販売の承認を得るためには、FDAにマーケティング申請を提出しなければならず、FDAに満足できるデータを提供して、提案されたbr適応における薬物の安全性および有効性を決定する必要がある。秘密プロトコルやBLAを準備して提出するコストはかなり高い.セキュリティプロトコルまたはBLAを提出するたびに使用料br(2019年度は250万ドルを超える)を支払う必要があります。免除または免除が適用されない限り。承認されたBLAのメーカーやスポンサー は年次建造費も支払う必要がある。この出願は、陰性または不明確な結果および陽性結果、ならびに製品の化学、製造、制御および提案されたラベルに関する詳細な情報、ならびに他の情報を含む、関連する非臨床研究、br}または前臨床研究および臨床試験から得られるすべての関連データを含む。データは、製品使用の安全性と有効性を試験することを目的とし、研究者が開始したGCP要求に適合した研究を含む多くの代替源からの臨床試験から来ることができる。
会社 はまた、薬物や生物製品の特性に関する他の情報を開発し、最終的にNDAやBLAスポンサーが現在の良好な製造規範(CGMP)に従って製品を生産するプロセスを要求することを決定しなければならない。br}生産プロセスは一貫して高品質の候補製品ロットを生産することができなければならず、メーカーは完成品の薬品や生物製品をテストする方法を制定しなければならない。また,適切な包装を選択·試験しなければならず,候補製品がその賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
薬物または生物製品開発、非臨床研究および臨床試験の結果、および薬品または生物製品の製造プロセス、テスト、提案のラベルおよび他の関連情報の説明は、当該製品の発売承認を申請するセキュリティプロトコルまたはBLAの一部としてFDA に提出される。
FDAは、それらが届出を受ける前に十分に完全であり、実質的な審査を行うことができることを確実にするために、提出されたすべてのNDAまたはBLAを審査する。FDAは、NDAまたはBLAの申請を受け入れるのではなく、より多くの情報の提供を要求するかもしれない。この場合,秘密プロトコルやBLAおよび付加情報 を新たに提出しなければならない.再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。FDA は、申請が届出を受けるかどうかを決定するために、NDAまたはBLAを受信した日から60日の予備審査を行い、この機関の敷居に基づいて十分に完全であることを決定し、実質的な審査を行うことができる。
NDAまたはBLA提出が届出のために受け入れられると、FDAは、提案された製品がその予期される用途に対して安全かつ有効であるかどうかを決定し、製品の特性、強度、品質、および純度を保証するために、NDAまたはBLAの深い検討を開始するであろう。FDAはNDAとBLAの具体的な業績目標を審査することに同意し、申請提出後12ヶ月以内に標準NDAまたはBLAを審査し、申請提出後8ヶ月以内に生物製品を審査することを求めた。FDAは、いくつかの遅延された情報を考慮するために、または提出中に提供された情報を明確にすることを目的とした情報を考慮するために、審査プロセスをさらに3ヶ月延長することができる。
| 91 |
FDAがNDAまたはBLAを評価した後,承認状または完全な返信が発行される.承認書は、医薬または生物製品の商業販売を許可し、特定の適応の具体的な処方情報を提供する。完全返信 手紙は,申請が承認の準備ができていないことを示している.完全な返信は、追加の臨床データおよび/または追加の重要な臨床試験(S)、および/または臨床試験、臨床前研究または生産に関連する他の重要、高価および時間の要件を必要とする可能性がある。このような補足情報を提出しても,FDAはNDAやBLAが承認基準を満たしていないことを最終的に決定する可能性がある.FDAはまた,安全性や有効性の問題を提起した新薬や生物製品や薬物や生物製品の申請を諮問委員会に提出し,通常臨床医や他の専門家からなるグループで審査,評価を行い,申請が承認されるべきかどうか,どのような条件下で承認されるべきかについて提案することも可能である。FDAは諮問委員会の提案に制限されていないが、これらの提案を慎重に考慮し、決定を下す時には通常これらの提案に従う。
FDAは、セキュリティプロトコルまたはBLAを承認する前に、通常、その製品を生産する施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していると判断しなければ、製品が要求された仕様内で一貫して生産されることを保証するのに十分であることを決定しない限り、この製品を承認しないであろう。FDAはNDAやBLAや製造施設を評価した後,承認状または完全な返信状を発行する。FDAが申請、製造プロセス、または製造施設が受け入れられないと判断した場合、その完全な返信は、通常、不足点を列挙し、FDAが出願を再検討するために追加の大規模臨床試験または情報を含む可能性がある追加の試験または情報を提供することを一般的に要求する。これは申請に対する追加的な検討を大幅に延期するかもしれない。
FDAが臨床サイトがGCP規定に従って臨床試験を行っていないことが発見された場合,FDAは臨床サイトが生成したデータ をNDAやBLAが提供する初歩的な奏効率分析から除外することを決定する可能性がある。さらに、任意の要求された追加情報が提出されているにもかかわらず、FDAは最終的に、その申請が規制された 承認基準を満たしていないと判定する可能性がある。
NDAまたはBLAが再提出されたときに、これらの欠陥がFDAによって満足的に解決された場合、FDAは承認書を発行する。FDAは、含まれる情報タイプに基づいて、2ヶ月または6ヶ月以内にこのような再提出を審査することを約束しました。 承認書は、製品の商業マーケティングおよび流通を許可し、特定の適応に対する具体的な処方情報を提供します。承認の条件として、FDAは、追加の臨床試験を含む製品の安全性または有効性を監視するために、製品が承認された後に大量の承認後の試験および監視を行うことを要求する可能性があり、ラベルbr}制限を含む他の条件を適用することができ、これは、製品の潜在的な市場および収益性に大きな影響を与える可能性がある。これらのいわゆる第4段階または承認後の臨床試験は、薬物の承認を継続するための条件である可能性がある。IV期臨床試験の結果,候補製品の有効性が確認でき,重要な安全性情報を提供することができた。また,FDAは現在明確な法定権力を有しており,スポンサーに上場後の試験を行い,その機関が決定したセキュリティ問題を具体的に解決することを求めることができる。承認されると、最初の マーケティング後に規制基準の遵守が維持されていない場合、または問題またはセキュリティ問題が発見された場合、製品承認 を撤回する可能性がある。
FDAはまた、REMSが薬物またはバイオ製品の利益がそのリスクよりも大きいことを保証することを要求する権利がある。スポンサーはまた、NDA提出の一部としてREMSを自発的に提出することができる。NDAまたはBLAレビューの一部として,REMSが必要かどうかを決定する.REMSの要素には、“親愛なる医師状”、薬品使用ガイドライン、より詳細な的確な教育計画、および場合によっては安全な使用を確保する要素(“ETASU”)が含まれる可能性があり、これは最も制限の厳しいREMSである。ETASUは、処方または調剤のための特殊なトレーニングまたは認証、場合によっては調剤、特殊な監視、および患者登録簿の使用を含むことができるが、これらに限定されない。これらの要素は秘密保持プロトコルやBLA承認の一部として交渉されており,場合によっては承認日が遅れる可能性がある.実施されると、REMSは定期的な評価および 修正を受ける。
変更 を実施するためには、適応、ラベル、デバイスコンポーネントまたは製造プロセスまたは施設の変更 を含む承認申請において確立されたいくつかの条件を変更する必要があり、変更 を実施するために、FDAと新しいNDAまたはBLA、またはNDAまたはBLA補充物を提出する必要がある可能性がある。新しい適応のNDAまたはBLAサプリメントは、通常、元の出願と同様の臨床データを必要とし、FDAは、NDAまたはBLAサプリメントを審査する際に、NDAまたはBLAを審査するのと同じ手順および行動を使用する。
| 92 |
候補製品が監督部門の承認を得ても、承認は特定の疾病状態、患者集団と投与量に限定される可能性があり、あるいは警告、予防或いは禁忌症の形式で、或いは煩雑なリスク管理計画、流通制限或いは発売後の試験要求の形式で、使用に対する重大な制限を含む可能性がある。また,規制部門の承認を得た後であっても,従来未知の製品問題がその製品を制限し,市場から完全に撤退する可能性があることが分かった。我々の製品に対する規制機関の承認を遅延または獲得できなかったか,あるいはbrの承認を得たが用途は明らかに限られており,我々の業務を損なうことになる.さらに、brの新しい立法によって生じる要求、またはFDAの政策が変更される可能性があり、規制部門が私たちが開発している製品を承認することを延期または阻止することができる新しい政府要求が確立される可能性がある。また,将来の米国や外国政府の行動にどのような不利な政府法規が生じる可能性があるかは予測できない。
“ハッジ·ワックスマン法案”
改正された1984年の“薬品価格競争と特許期限回復法”(通称“ハッジ·ワックスマン法案”)によると、臨床開発·FDA規制審査中に失われた製品の米国特許期間の一部を回復することができる。Hatch-Waxman修正案はまた、FDAによって承認された医薬製品に承認された製品に関連する特許をリストし、治療同等性評価(一般にオレンジマニュアルと呼ばれる)を有し、リストされた特許の製品の出願を承認する競合他社を承認することを求めて、そのような特許に関連する認証を行うためのプログラムを提供する。さらに、“ハッジ·ワックスマン修正案” は、非特許排他性と呼ばれるFDAに対していくつかの競合他社出願を受け入れまたは承認するための法的保護を規定している。
特許期限回復
特許期限回復は、新製品またはその用途をカバーする特許のために最大5年間の特許寿命を返すことによって、薬物開発および規制審査中に損失した時間を補償することができる。この期間は、通常、INDの発効日(特許発行後)と秘密協定提出日との間の時間の半分であり、イニシエータが職務調査を行うことを前提として、機密協定提出日と出願が承認されたとの間の時間br}を加える。しかしながら、特許期限回復は、特許の残り期間を製品承認日から合計14年間延長することはできず、承認されたbr薬物に適用される特許のみを延長することができ、特許が満了する前に延長を出願しなければならない。米国特許商標局はFDAと協議した後,任意の特許期間の延長または回復の出願を審査·承認する。
オレンジ色の図書リスト
秘密協定を介して薬物承認を求める過程で、出願人は、その特許請求が出願人の製品をカバーする各特許をFDAにリストすることを要求される。薬物が承認されると、NDA保有者が薬物出願または他の態様に記載された各特許は、FDAのオレンジブックで公表される。オレンジマニュアルに記載されている薬物は、逆に、新薬申請の簡略化(“ANDA”)の許可を支持するために、潜在的な模倣薬競争相手によって参照されることができる。ANDAは市販薬と同じ強度と剤形を含む有効成分(S)の販売を許可し,生物学的同等性試験brにより治療上市販薬と同じ薬物製品を証明している。ANDA申請者は、生物学的同等性テストの要求を除いて、臨床前研究や臨床試験の結果を必要とせず、その薬物製品の安全性や有効性を証明する。ANDAによって承認された薬物は通常、発売薬の“模倣薬”と呼ばれ、通常は薬剤師が元の発売薬のための処方で代替することができる。オレンジブックに記載されている薬物の模倣薬またはオレンジブックに記載されている薬物に関する505(B)(2)NDAを承認するためにANDA出願を出願した場合、(I)出願の対象となる医薬製品の特許情報がFDAに提出されていないこと、(Ii) このような特許が満了していること、(Iii)このような特許が満了した日、(Iii)このような特許が満了していることをFDAに証明しなければならない。または(Iv)この特許は、出願出願された医薬品の製造、使用または販売によって侵害されることはない。最後の認証を第(Br)段IV認証と呼ぶ.第四項の認証の通知は、認証対象となる特許の所有者及びANDA又は505(B)(2)出願に示される承認された秘密協定の所有者に提供されなければならない。出願人はまた、“第8節”宣言を提出することを選択してもよく、その提案されたラベルが、記載された使用方法特許を証明するのではなく、特許使用方法に関連するいかなる言語も含まない(または刻まれている)ことを証明することができる。NDA所有者および特許所有者が第4項の認証通知を受けてから45日以内にオレンジ書に記載されている特許のうちの1つに特許挑戦を行う場合、FDAは、第4項の認証通知を受けてから30ヶ月後、すなわち特許が満了したとき、すなわち出願人に関連する侵害事件が出願人に有利な裁決を下すまで、または裁判所が命令する可能性のあるより短いまたはより長い期間まで、その出願を承認することができない。この禁止は、一般に30ヶ月の猶予と呼ばれる。 ANDAまたは505(B)(2)出願も、オレンジマニュアルに記載されたブランド参照薬の任意の適用非特許排他性が満了するまで承認されないであろう。したがって、ANDAまたは505(B)(2)NDAの承認は、出願人が行った特許認証および医薬品スポンサーを参照して特許訴訟を開始する決定に応じて、長い間延期される可能性がある。
| 93 |
市場排他性
市場 FDCA下の排他的条項はまた、いくつかの薬物申請の提出または承認を延期する可能性がある。ハッジ-ワックスマン法“(Hatch-Waxman Act) は、いくつかの承認された医薬製品のための規制排他期間を設定し、その間、FDAは、ブランド参照薬のANDAまたは505(B)(2)の申請を承認することができない(または場合によってはbr)申請を受け入れることができない。例えば、FDCAは、新しい化学物質(“NCE”)NDAの承認を得た最初の出願人に、米国内の非特許マーケティング排他性brを5年間提供している。FDAが以前に同じ活性部分を含む他の新薬を承認していない場合、薬剤はNCEであり、活性部分は医薬物質の作用を担当する分子またはイオンである。排他期間内に、FDAは、薬剤の別のバージョンのために別の会社によって提出されたANDAまたは505(B)(2) NDAの審査を受け入れない可能性があるが、出願人は、承認に必要なすべてのデータに対する法定参照権を有していないか、または所有していない。しかしながら、出願が第4段落の認証を含む場合、4年後に出願を提出することができる。 “ハッジ·ワックスマン法案”はまた、FDAが出願人が行ったり賛助したりする1つまたは複数の新しいbr}臨床研究(バイオアベイラビリティまたは生物学的同等性研究を除く)が承認申請に重要であると考えている場合、特定の承認条件に対するNDA(505(B)(2)NDAを含む)または以前に承認された製品の新しい処方のような発売製品の変更を規定し、“ハッジ·ワックスマン法”はまた、3年間の市場排他性を規定している。現在の薬物の用量または強度。この3年間の排他的期間は、FDA承認ANDAおよび505(B)(2)NDAを防止し、新しい臨床データを必要とする革新的な薬剤を含むように適用されるが、FDAによる元の有効成分を含むANDAの承認は禁止されていない。しかし,完全なセキュリティプロトコルを提出する申請者は,安全性と有効性を証明するために必要なすべての非臨床研究と,良好な臨床試験の参照権を十分かつ制御しなければならない。
生物相似 排他性
“2009年生物製品価格競争と革新法案”(BPCIA)は“公衆衛生サービス法”(PHSA)第351(K)条に基づいて生物類似製品に簡略化された承認ルートを開いた。生物類似製品または“Biosimily”とは,既存のFDAが許可している参考製品と高度に類似しており,臨床的に意味のない差のある生物製品である。生物学的類似性 は、免除がない限り、分析研究、動物研究、および少なくとも1つの臨床研究によって証明されなければならない。生物学的類似製品が生物学的に類似しており、参照製品と同じ臨床結果を生成することが予想されるリスクを含むBPCIAの追加の要件を満たし、複数回投与された製品の場合、生物学的製剤および参照生物製剤は、安全リスクを増加させることなく、または参照生物学的製剤の独占的使用と比較して治療効果が低下するリスクを増加させることなく、以前に許可された製品と交換することができると見なすことができる。交換可能な製品は、処方医の参加を必要とすることなく、参考製品を代替することができる。
BPCIAによると,参考製品が許可された日から4(4)年以内に,生物類似物に関する第351(K)条の出願を提出してはならない。また、参照生物は、参照製品が初めて許可された日から12(12)年の排他性が付与され、この12(12)年の排他的期間内に、FDAがPHSA第351(A)条に従って提出された競合製品の完全なBLAを承認した場合、競合スポンサー自身の臨床前データと十分かつ制御された臨床試験のデータとを含み、 他社の製品の安全性、純度、効力を証明するために、他の会社はその参照製品の競争バージョンを販売することができる。簡略化された承認経路に従って提出された第1の生物学的製品が参照製品と交換可能であると決定されたbr}は、(I)最初の交換可能な生物類似体の最初の商業マーケティング後1年;(Ii)特許挑戦がない場合、第1の交換可能な生物類似体が承認された後18(18) ヶ月、(Iii)参照生物類似体特許に関する訴訟の解決後18(18)ヶ月、第1の交換可能な生物類似体出願人の訴訟に有利である、より短い場合に排他性を得ることができる。または(Iv)42(42)ヶ月以内に特許訴訟が行われている場合、最初の交換可能な生物類似体の出願が承認された後42(Br)(42)ヶ月以内に。
| 94 |
開発と審査計画を加速する
高速 パス指定
もし製品が深刻な或いは生命に危害を及ぼす疾患或いは疾病の治療を目的とし、そしてbr}臨床前或いは臨床データがこの疾病が満たされていない医療需要を満たす可能性があることを示した場合、迅速な追跡認証を得ることができる。薬物製品を研究するスポンサーは、候補薬物のINDを提出すると同時にまたは後に、特定の適応の候補薬を迅速チャネル薬として指定するようにFDAに要求することができる。FDAは、スポンサー要請を受けてから60日以内に、候補薬剤が迅速チャネル指定 を得る資格があるかどうかを決定しなければならない。Fast Track製品については,スポンサーがFDAとより多くのインタラクションを行う可能性があり,FDAは申請完了前にFast Track製品セキュリティプロトコル部分の審査を開始する可能性がある.FDAがスポンサーから提出された臨床データを初歩的に評価した後、迅速な追跡製品 が有効である可能性があると判断すれば、スクロール審査 を行うことができる。スポンサーはまた、残りの情報を提出するスケジュールを提供しなければならず、FDAはこのスケジュールを承認しなければならず、スポンサーは適用された使用料を支払わなければならない。セキュリティプロトコルを提出する際には,FDAは優先審査指定を付与するかどうかを決定する. また,FDAがその指定が臨床試験中に出現したデータの支持を得られなくなったと考えると,高速チャネル指定を撤回する可能性がある.
画期的なbr治療指定
FDAはまた、特定の突破療法の承認を加速する可能性があり、これは、1つまたは複数の他の薬剤と単独でまたは1つまたは複数の他の薬剤と組み合わせて重篤または生命に危険な疾患または状態を治療することを意図した薬剤であり、初歩的な臨床証拠は、1つまたは複数の臨床的に重要な終点において、例えば、臨床開発早期に観察される顕著な治療効果のような既存の治療法よりも有意な改善を示す可能性があることを示す。画期的な治療法のスポンサーは、薬物のINDを提出したとき、またはその後の任意の時間に、FDAに画期的な療法として指定することを要求することができる。FDAが薬物を画期的な治療法として指定した場合、申請の開発と審査を加速させるために適切な行動を取らなければならない。これは、 (I)薬物開発の全過程においてスポンサーおよび審査チームとの会議を行うことと、(Ii)薬物の開発についてスポンサーにタイムリーなアドバイスを提供し、スポンサーと相互コミュニケーションを行うことで、承認に必要な非臨床および臨床データを収集する開発計画が可能な限り有効であることを保証することと、(Iii)高度管理者および経験豊富な審査者を適宜協働させる学際的審査と、を含むことができる。(Iv)開発計画の効率的な審査を促進し、審査グループとスポンサーとの間の科学的連絡人として機能するために、FDA審査グループに学際的なプロジェクト担当者を割り当てるステップと、(V)臨床試験の設計が科学的に適切な場合に可能な限り効率的に、例えば、潜在的に低い治療効果にさらされる患者数を最大限に減少させることによって、臨床試験の設計が可能な限り効率的であることを確実にするための措置をとる。
の承認を加速した
深刻または生命に危険な疾患を治療し、通常、既存の治療よりも意義のある治療優位性を患者に提供することを目的とした製品では、加速brの承認を得ることができるかもしれない。加速承認条件に符合する製品は以下の条件によって承認を得ることができる: は臨床利益の代替終点を合理的に予測することができ、或いは の不可逆的な発病率或いは死亡率の前に測定できる臨床終点は、不可逆的な発病率或いは死亡率或いは他の臨床利益の影響を合理的に予測することができ、同時に病状の深刻性、希少性或いは流行率及び代替治療を利用可能或いは不足することを考慮する。加速承認経路は病気経過が比較的に長く、製品の期待される臨床利益を測定するために時間を延長する必要がある環境に最もよく用いられ、代替物或いは中間臨床終点への影響が非常に速い。承認経路を加速することは、この製品の臨床的利益を検証し、説明するために、スポンサーが追加的な承認後の検証的研究を行うことに依存する。これらの検証試験 は、職務調査の場合に完了しなければならず、場合によっては、FDAは、承認前に試験 を設計、起動、および/または完全に組み込むことを要求する可能性がある。必要な承認後研究が行われていない場合や,発売後の研究期間中に臨床的利益が確認されなければ,FDAがこの製品の市場からの撤回を加速することを可能にする。加速規制によって承認された候補製品のすべての販売促進材料はFDAの事前審査を経なければならない。
| 95 |
孤児薬
孤児医薬品法によれば、FDAは、米国では200,000人未満の疾患または疾患に影響を与えることを指すか、または米国では200,000人を超える疾患または疾患に影響を与えることを指すが、そのような疾患または疾患に対する製品の開発および製造コストが米国での製品の販売から回収されることを合理的に予想することができないまれな疾患または疾患の治療のための薬剤の称号を与えることができる。
秘密保護協定を提出する前に、孤立した薬物指定を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、薬物の識別情報およびその潜在的な孤児用途を開示するであろう。孤児薬物指定は、規制審査および承認過程においていかなる利点も伝達されず、規制審査および承認過程の持続時間を短縮することもない。
FDAによって最初に承認された、このような指定されたまれな疾患を有する特定の活性部分を治療するためのNDA出願人 は、この適応のために、米国で7年間の独占営業期間を取得する権利がある。7年間の独占期間内に、FDAは、限定された場合を除いて、例えば、より効果的、より安全、または患者ケアに重大な貢献をすることによって、孤立した薬物独占製品に対する臨床的優位性を示すか、または医薬品供給問題の場合に、同じ疾患のために同じ薬剤を販売するための任意の他の出願を承認しない可能性がある。孤立薬物排他性は、FDAが同じ疾患または状態に対する異なる薬剤、または異なる疾患または状態に対する同じ薬剤を承認することを妨げるものではない。孤児薬を指定する他の利点は、いくつかの研究に対する税金免除と、NDA使用料の免除を含む。
小児科情報
小児科研究公平法によれば、またはPREA、NDAまたはNDAのサプリメントは、すべての関連する小児科亜集団において主張される適応の安全性および有効性を評価し、各小児科亜集団に対して安全かつ有効な用量および投与を支持するためのデータを含まなければならない。FDAは、提出データの全部または一部を免除または延期することができる。 法規が別の要求がある限り、PREAは、いくつかの例外を除いて、孤児として指定された適応として承認されたいかなる薬物にも適用されない。
児童最優秀医薬品法(BPCA)は、いくつかの条件が満たされる場合、NDA保有者は、薬物の任意の独占特許権(特許または非特許)を6ヶ月延長することができると規定している。排他的条件は、FDAが小児科集団における新薬の使用に関連する情報がその集団の健康に利益をもたらす可能性があることを決定することを含み、FDAは小児科研究に書面で要求されたbrを提出し、申請者は法定時間の枠組み内で要求された研究を報告することに同意する。BPCAによる出願は優先出願とみなされ、指定によって与えられたすべての利点を有する。
発売後のFDA法規
新製品が承認された後、製薬会社と承認された製品はFDAと他の連邦と州監督管理機関の持続的な監督管理を受け、その中には監視と記録保存活動を含み、適用された監督管理機関に製品の不良体験を報告し、監督管理機関に最新の安全と治療効果情報を提供し、製品のサンプリングと流通要求、および販売促進と広告要求を遵守し、その中には、他を除いて、直接消費者向けの広告基準が含まれている。薬品承認ラベルに記述されていない患者集団における薬物の普及のための制限br、業界賛助に対する科学と教育活動の制限、及びインターネットに関連する普及活動に対する要求。医師はラベル外用途のために合法的な薬品を処方する可能性があるが、メーカーはこのようなラベル外用途を販売または普及させてはならない。製品またはラベルの修正またはbrまたは生産場所の変更は、通常、FDAおよび他の規制機関の承認を得る必要があり、これは、受信されない可能性があり、または長い審査過程をもたらす可能性がある。
| 96 |
FDA、州、そして外国の規制機関は広範囲な法執行権力を持っている。適用される規制要件を遵守できないことは、FDA、州、または外国の監督管理機関が法執行行動をとる可能性がある
| ● | 見出しのない手紙や警告状 | |
| ● | 罰金、返納、原状回復、民事処罰 | |
| ● | 禁止 (例えば、生産の全部または一部の一時停止)または法令に同意する; | |
| ● | 製品のリコール、行政拘留、差し押さえ | |
| ● | お客様 通知または修理、交換または返金; | |
| ● | 経営制限または一部生産停止またはすべての生産停止; | |
| ● | 将来の製品承認または外国規制機関による新製品の承認、新用途の承認、または既存製品の修正の請求を延期または拒否する | |
| ● | FDAの製品上場承認または外国規制承認の撤回または一時停止により、製品販売が禁止された | |
| ● | 臨床試験を堅持する | |
| ● | FDAは、輸出製品が他国で販売されている証明書を外国政府に発行することを拒否した | |
| ● | 刑事起訴する。 |
これらの制裁のいずれも、予想以上のコストまたは予想よりも低い売上をもたらし、私たちの名声、業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。政府機関のこのような行動はまた私たちがこのような行動に対応するために多くの資源を使う必要があるかもしれない。どんな機関や司法法執行行動も私たちの業務に実質的な悪影響を及ぼす可能性がある。
処方薬の広告は連邦、州、そして外国の規制によって制限されている。米国では、FDAは消費者向けの広告を含む処方薬の販売促進を規制している。処方薬宣伝材料は初回使用時にFDAに提出されなければならない。処方薬製品および薬品サンプルのどの流通も、FDCAの一部である米国の処方薬マーケティング法案(“PDMA”)を遵守しなければならない。製品が承認されると、その生産はFDAの全面的で持続的な規制によって制限されるだろう。FDAの規定は,製品は特定の承認施設で生産されなければならず,cGMPに適合し,NDAまたはBLA所有者はその製品をリストし,その製造機関をFDAに登録しなければならない。これらの法規はまた、生産と品質保証活動に対して一定の組織、プログラム、文書要求を提出した。 薬品メーカーと他の承認薬品の生産と流通に参与する実体はFDAとある州機関の定期的な抜き打ち検査を受けて、cGMPと他の法律を遵守することを保証する。
NDA または契約メーカー、実験室または包装業者を使用するBLA所有者は、合格した 会社を選択し、監視する責任がある。これらの会社はFDAの検査を随時受けており、違反行為は、法執行行動がそのような施設の運営またはそれによって製造、加工またはテストされた製品の流通能力を中断する可能性があることを発見した。新たに発見または開発されたセキュリティまたは有効性データは、新たな警告および禁忌症を追加することを含む製品承認のラベルを変更する必要がある可能性があり、他のリスク管理措置を実施する必要がある可能性もある。
| 97 |
医療と精算条例
開発されたVAR 200、IC 100、および任意の他の候補製品がFDAの承認を得ることを求めれば、政府の保証範囲と精算政策は製品の商業化に成功する能力に直接かつ間接的に影響を与え、このような保証と精算政策は将来の医療改革措置の影響を受ける。政府衛生行政部門、個人健康保険会社、その他の組織は通常、彼らがどのような薬物のためにお金を支払うかを決定し、医療保健の精算レベルを確立する。特に、米国では、個人健康保険会社および他の第三者支払者は、通常、政府(MedicareまたはMedicaid計画)によってこのような治療に精算を提供するレベルで製品の精算を提供する。その病状のために治療を処方する患者と規定されたサービスを実行する提供者は、通常、第三者支払者に依存して、関連する医療費のすべてまたは一部を精算する。多くの患者は私たちの製品を使用することができません。保険を提供しなければ、brは私たちの製品の大きなコストを支払うのに十分です。したがって、私たちの製品の販売は国内と海外の状況に大きく依存し、具体的にはMedicareとMedicaid、個人健康保険会社、その他の第三者支払人のような政府衛生行政部門の精算状況に依存する。私たちの製品の市場は、第三者支払者の処方を得ることができるかどうか、あるいは第三者支払者が保証と精算の製品や治療リストを提供するかどうかに大きく依存します。また,第三者決済者は医療コストを抑えるための複雑な方法を開発している。治療製品の保証範囲と精算金額は支払人によって異なります。第三者支払者が医療製品またはサービスに保険を提供することを決定することは、十分な販売率が承認されることを意味するものではない。1つの第三者支払者は、ある特定の医療製品又はサービスを保証することを決定し、他の支払者も当該医療製品又はサービスに保険を提供することを保証することはできず、 又は適切な販売率で保険を提供する。そのため、保証範囲の確定過程はそれぞれの支払人に使用或いは製品の科学と臨床支持を提供することが要求されるが、十分な保証と精算を保証することはできない。
米国および私たちが開発を求めているVAR 200、IC 100、および任意の他の候補製品の他の潜在的に重要な市場では、政府当局および他の第三者支払者は、医療コストを制御するためのますます複雑な方法を開発している。例えば、第三者支払者は、医療製品の価格、特に新しいおよび革新的な製品および療法の価格を制限または調整しようと試みており、これは、より低い平均販売価格をもたらす。また、米国の管理型医療保健に対する日々の重視は製品の定価、精算と使用に追加的な圧力をもたらす。これらの圧力は管理型医療集団の規則とやり方、司法裁決及びMedicare、MedicaidとHealthcare改革に関連する政府の法律法規、薬品精算政策と一般定価から来る可能性がある。
米国および一部の外国司法管轄区域は、製品の販売収益性に影響を与える可能性のある方法で医療システムを変更することを目的として、いくつかの追加の立法および規制提案を公布または考慮している。米国や他の地方の政策立案者や支払者の中には,医療コストの抑制,質の向上および/または医療サービスの拡大という既定の目標を達成するために,医療システムの変革を推進することに大きな興味がある。米国では,製薬業はこれらの努力の重点であり,2010年3月に公布された“患者保護法案”や“平価医療法案”を含む重大な立法措置の大きな影響を受けてきた。将来、アメリカの医療制度改革に関する提案がもっとあるかもしれませんが、その中のいくつかの提案は、私たちの製品のために受け取ることができる価格、あるいは私たちの製品の精算金額をさらに制限するかもしれません。総務署の連邦供給スケジュールの許可されたユーザに薬品を提供する場合、他の法律と要求が適用される。このようなすべての活動はまた連邦と州消費者保護法と不正競争法によって制限される可能性がある。
さらに、医薬品がMedicare、Medicaid、または他の連邦または州医療保健計画によって精算される場合、私たちと私たちの業務活動は、販売、マーケティングおよび科学/教育援助計画を含むが、これらに限定されず、改正された“虚偽請求法”、改正連邦反バックル法、他の医療詐欺および乱用法律、および同様の州法律を遵守しなければならない。また、外来処方薬製品がMedicareまたはMedicaidによって精算される場合、定価と返却計画は改正された1990年総合予算調節法および2003年Medicare処方薬改善と現代化法案のMedicaid返却要求に符合しなければならない。
その他 法規事項とコンプライアンス要件
製品承認後の製造、販売、販売促進およびその他の活動もFDA監督機関によって監督され、米国の医療保険と医療補助サービスセンター(CMS)、衛生·公衆サービス部の他の部門、薬品監督管理局、消費財安全委員会、連邦貿易委員会、職業安全·健康管理局、環境保護局、州と地方政府を含む。販売、マーケティング、科学/教育プロジェクトはまた、連邦と州の詐欺と乱用法律を守らなければならない。定価と返却点(Br)計画は米国の1990年総合予算調節法の医療補助帰点要求に適合しなければならない。製品を総務庁連邦供給スケジュールのライセンスユーザに提供する場合には,他の法律や要求 が適用される.どんな制御物質の処理も米国の制御対象物質法案と制御物質輸入と輸出法案に適合しなければならない。製品は米国の“毒物予防包装法”に適用される児童保護包装要求に適合しなければならない。 製造、販売、販売促進、その他の活動は連邦と州消費者保護および不公平な完成法の制約を受ける可能性もある。
| 98 |
薬品流通は他の要求と法規の制約を受け、広範な記録保存、許可、保存と安全要求を含み、不正な薬品の販売を防止することを目的としている。
ACAの範囲内の“連邦医師支払い陽光法案”およびその実施条例の要件は、Medicare、Medicaidまたは児童健康保険計画(br}計画(いくつかの例外を除く)の下で支払うことができる薬品、器具、生物および医療用品のいくつかの製造業者は、br医師および教育病院に支払うか、またはbrの医師および教育病院に支払うか、または医師および教育病院の要求またはその指定された実体または個人の支払いまたは分配を表す特定の支払いまたは他の価値移転に関する情報を報告し、医師およびその直系親族が所有する特定の所有権および投資利益を毎年報告する。
また、私たちは連邦政府と私たちが業務を展開している州のデータプライバシーと安全法規の制約を受ける可能性があります。 “健康情報技術促進経済と臨床健康法”(“HITECH”)及びその実施条例が改正された“1996年健康保険携帯性と責任法案”(“HIPAA”)は個人が健康情報を識別できるプライバシー、安全と伝送に対していくつかの要求を提出した。他の事項に加えて、HITECHは、サービスを提供するために保護された健康情報を受信または取得する独立した請負者またはエージェントを表す“ビジネスパートナー”に、HIPAAのプライバシーおよびセキュリティ基準を直接適用する。HITECHはまた4つの新しい民事罰金レベルを作成し、HIPAAを改訂し、民事と刑事罰 を商業パートナーと可能な他の人に直接適用し、州総検察長に新しい権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償または禁止を要求して連邦HIPAA法律を実行し、連邦民事訴訟に関連する弁護士費と費用を求めることができる。また,州法は場合によっては健康情報のプライバシーやセキュリティを管理しており, の多くの法律は互いに大きく異なり,同様の効果が生じず,コンプライアンス作業を複雑化させる可能性がある.例えば、カリフォルニア州は最近“カリフォルニア消費者プライバシー法”(California Consumer Privacy Act、略称CCPA)を公布し、2020年1月1日に施行された。br}CCPAは他の事項に加え、保険会社のための新たなデータプライバシー義務を制定し、その情報を開示しない権利を選択することを含むカリフォルニア住民に新たなプライバシー権を提供した。CCPAはまた、あるデータ漏洩に対する法定損害賠償の個人訴権 を作成し、それにより、データ漏洩に関連するリスクを潜在的に増加させる。
腐敗法律
米国の“反海外腐敗法”および同様の外国腐敗防止法は、一般に、外国政府関係者に不正に影響を与えるために、会社およびその中間者が業務を取得または保留し、または不公平な優位性を得るために不当な金を支払うこと、または任意の価値のあるものを提供することを禁止している。近年、世界的に反腐敗法の法執行が大幅に増加している。私たちが予想している非米国業務と、発展途上国を含む米国以外の国への拡張が予想されており、このような違反のリスクが増加する可能性があります。これらの法律に違反することは、深刻な刑事または民事制裁をもたらす可能性があり、私たちの業務を混乱させ、私たちの名声、業務および運営結果、または財務状況に悪影響を及ぼす可能性があります。
国際薬品規制条例
VAR 200、IC 100、および開発を求める任意の他の候補製品を米国以外の任意の管轄区域で販売することができる前に、私たちはこの管轄区で必要なマーケティング許可を得なければならない。多くのこのような司法管轄区域は、FDAが上場許可を承認する前に要求されたデータと同様の広範な安全性と有効性データを必要とする。私たちはアメリカ以外で私たちが求めているマーケティング許可を得ることに成功できないかもしれない。もし私たちが1つの管轄区(米国を含む)でマーケティング許可を得ることに成功した場合、その許可は私たちが他の管轄区でマーケティング許可を得ることを保証することはできません。薬品を販売するために必要な許可は司法管轄区によって異なります。もし私たちがアメリカ以外のどの司法管轄区でもbrマーケティングの許可を得たら、私たちはこの司法管轄区域の持続的な規制を受けることになり、これは私たちがアメリカで持続的に規制される持続的な規制と一致する。
| 99 |
国際データプライバシーとセキュリティ法
GDPRのようないくつかの非米国法は、場合によっては健康情報のプライバシーおよびセキュリティを管理し、その中のいくつかはHIPAAよりも厳しく、その多くは互いに大きく異なり、同じ効果を生じず、 コンプライアンス作業を複雑化させる可能性がある。これらの法律を遵守しない場合は、重大な民事及び/又は刑事罰及び私的訴訟に処せられる可能性がある。例えば,欧州では,GDPRが2018年5月に発効し,欧州経済圏内の個人データの処理に厳しい要求が出されている。GDPRはまた,欧州経済区に位置する臨床試験地点から米国や他の管轄区への個人データの移転の審査を強化しており,欧州委員会はこれらの管轄区には“br”に十分な“データ保護法がないと考えている。また,ヨーロッパの最近の法律発展は,ヨーロッパ経済圏から米国に何らかの情報を送信する複雑性とコンプライアンス不確実性をもたらしている。例えば、2020年6月16日、EUまたはCJEU裁判所は、EU-米国プライバシー盾の枠組みまたはプライバシー盾の無効を宣言した。したがって,Privacy Shieldは,個人データをEEAから米国に転送する有効な機構ではなくなった.また,標準契約条項も欧州裁判所や立法機関によって無効と発表されるかどうかは不明であり,CJEUが米国政府の法律や実践を監視していることへの懸念から,可能であるようである。GDPRを遵守しなければならない会社は、より厳しいデータ保護要件を含むより多くのコンプライアンス義務とリスクに直面しており、GDPRを遵守しなければならない場合、2,000万ユーロまたはコンプライアンス会社の世界年収4%までの罰金(金額の大きい者を基準)に処せられる可能性がある。また、イギリスがEUや欧州経済圏を離脱した後、会社はGDPRとイギリスの法律に組み込まれたGDPRを遵守しなければならず、後者はそれぞれ1,750万GBまたは世界売上高4%の罰金を科すことができる。データ保護法のいくつかの側面におけるイギリスとEUの関係はまだ不明であり、例えば、各司法管轄区域間でどのように合法的にデータを転送するかは、私たちをさらにコンプライアンスのリスクに直面させるだろう。カナダでは、PIPEDAおよび同様の省レベルの法律では、会社は、健康関連情報を含む個人情報を処理し、組織が保有する個人情報の正確性にアクセスして疑問視する権利を含む個人にそのような情報に関するいくつかの権利を提供する義務があると規定されている。PIPEDA違反は巨額の罰金や処罰を招く可能性がある.
属性
2019年1月18日、当社は北商業園道2200 North Commerce Parkway,Suite 208,Weston 33326に位置し、約3,502平方尺オフィスビル 締結賃貸契約(“レンタル”)を締結した。レンタル期間は60ヶ月で、2019年1月から2024年1月までです。私たちの既存の施設は私たちの現在の需要を満たすのに十分だが、私たちの予想される従業員拡張を満たすために追加のオフィススペース が必要かもしれないと信じている。
従業員
2022年12月31日現在、私たちは7人のフルタイム従業員 を持っています。私たちのすべての従業員は行政、財務、研究開発、臨床、監督と業務発展機能に従事しています。私たちは私たちが従業員と仲がいいと信じている。また、著者らはコンサルタント、臨床研究組織と第三者を利用して、著者らの臨床前研究、臨床研究、製造と監督機能を実行し続ける。
法的訴訟
私たち は現在、いかなる重大な法的手続きによって制限されているかに参加したり認識していない。しかし、私たちは時々私たちの正常な業務過程で現れる様々な法律手続きの側になるかもしれません。これは私たちの業務、財務状況、または運営結果に重大な悪影響を及ぼす可能性があります。 結果にかかわらず、弁護と和解コスト、管理資源の移転、その他の要因により、訴訟は私たちの業務に影響を与える可能性がある。
企業情報
我々 は“Larkspur Health Acquisition Corp.”の名前登録で成立する.2021年3月17日、デラウェア州法律に基づいて、1つ以上の他の企業に関連する合併、資本株式交換、資産買収、株式購入、再編または同様の企業合併が行われる。2022年12月12日、私たちはbr“ZyVersa治療会社”と改称した。企業合併と関係がある。
私たちの主な実行事務室は北商業公園路2200 North Commerce Parkway、Suit 208、Weston、フロリダ州33326にあります。私たちの電話番号は(754) 231-1688で、私たちのサイトはHttp://www.zyversa.com.
| 100 |
経営陣の財務状況と経営結果の検討と分析
この節で言及されているすべての“私たち”、“私たち”または“私たち”は、業務合併前のフロリダ州ZyVersa治療会社とデラウェア州ZyVersa治療会社およびその合併子会社との業務合併発効前の合併業務を意味する
以下の議論と分析は、経営陣が我々のbrの総合運営結果と財務状況を評価·理解することに関する情報を提供する。あなたは、本募集説明書の他の部分に含まれる“選択されたbrの歴史的財務情報”と、私たちの合併財務諸表とその付記を読みながら、本議論と分析を読まなければなりません。 は四捨五入のため、いくつかの金額が足りない可能性があります。本議論および分析は、“リスク要因”および“前向き陳述に関する警告陳述”に記載されたリスクおよび不確実性を含むが、これらに限定されない多くのリスクおよび不確定要因に関連する前向き陳述を含む。私たちはこのような展望的な陳述のいずれかを更新する義務がない。実際の 結果は,いずれの前向き陳述に含まれる結果と大きく異なる可能性がある.
業務 の概要
著者らは臨床段階の専門生物製薬会社であり、先進的なノウハウを利用して腎臓或いは炎症性疾患患者のために製品を開発し、これらの患者は高度に満足していない医療需要を持っている。
著者らの主要な腎臓候補薬物はVAR 200(2-ヒドロキシプロピル-β-シクロデキストリン或いは“2 HβCD”)と呼ばれ、1種のコレステロール外排出調節剤であり、多種の腎臓適応を治療する潜在力がある。著者らの主要な抗炎症薬物候補薬物、著者らはIC 100と呼ばれ、1種のヒト化単抗炎症症体ASC阻害剤であり、多種の炎症性疾患を治療する潜在力を有する。
新冠肺炎疫病の影響
2019年12月、新型コロナウイルス或いは新冠肺炎が発生した。2020年3月、世界保健機関は新冠肺炎の大流行を発表した。現在の新冠肺炎疫病は全世界範囲内で公衆衛生と経済に巨大な挑戦を構成し、そして著者らの従業員、患者、コミュニティと業務運営、及びアメリカ経済と金融市場に影響を与えている。新冠肺炎疫病はどの程度直接或いは間接的に著者らの業務、運営結果と財務状況 に影響するかは高度の不確定と正確に予測できない未来の発展に依存し、出現する可能性のある新冠肺炎に関する新しい情報、それを抑制或いは軽減するための措置、及び現地、地区、国家と国際市場への経済影響を含む。これまで、大流行はすでにIC 100の臨床前計画のいくつかの遅延を招き、著者らはVAR 200 2 a段階の臨床試験の開始を延期せざるを得なかった。著者らは引き続き新冠肺炎疫病の著者らの業務、財務状況、流動性、資産と運営に対する全体的な影響を監視し、著者らの人員、計画、予想スケジュール、費用、第三者契約製造、br}契約研究機関と臨床試験を含む。
私たちの契約メーカーのプロセスは何の重大な中断にも遭遇していないが、疫病と対応措置は将来的に私たちの第三者契約メーカーの臨床前テストと臨床試験の候補製品の生産数量 の能力に影響を与える可能性がある。また,われわれは契約研究機関や他のbr第三者に依存して臨床試験を協力しており,大流行中にタイムリーかつ満足できる方法で動作する保証はない。同様に、著者らは臨床研究者が大流行期間中に適時かつ満足できる方法で仕事を展開できることを保証できない。私たちと私たちの契約研究機関はまた、大流行期間と一般的に試験完全性のリスクを最小限に抑えるために、計画された臨床試験の操作を何らかの調整する必要があるかもしれない。
我々は、ウイルスの従業員に対するリスクを最小限に抑えることを目的とした臨時予防措置を講じており、私たちのすべての従業員が遠隔勤務し、世界各地での従業員のすべての不要な旅行を一時停止し、従業員が業界活動や対面作業関連会議に参加することを奨励しないことは、私たちの業務に負の影響を与える可能性がある。
| 101 |
私たちは私たちの業務と運営に及ぼす新冠肺炎疫病の潜在的な影響を評価し続けている。新冠肺炎の大流行で構成される様々なリスクに関するより多くの情報は、“を参照されたい”リスク要因“この目論見書には。
業務合併
2022年12月12日(“締め切り”)に、フロリダ州のZyVersa治療会社(“Old ZyVersa”)、その中で指定されたOld ZyVersa株主の代表(“証券所有者代表”)、デラウェア州のLarkspur Health Acquisition Corp.(“Larkspur”)とデラウェア州の子会社、Larkspurの完全子会社Larkspur Merge Sub,Inc.“が完成した。業務合併プロトコルの条項(および業務統合プロトコルの他のすべての条件を満たしているか、または放棄する場合)、業務合併および行われる取引(“業務合併”)が完了した日(“終了日”)、(I)Larkspurは“ZyVersa Treateutics,Inc.”、デラウェア州の会社(“同社”)および(Ii)合併子会社がOld ZyVersaと合併してOld ZyVersa(“合併”)、Old ZyVersaが合併中に存在する会社に改称され、当該合併が発効した後、Old ZyVersaは当社の完全子会社となりました。
業務合併が完了する前に、同社は幽霊会社だった。業務統合後,Old ZyVersaの業務は会社の業務 である.会社は2021年3月17日にデラウェア州に登録設立され、その子会社Old ZyVersaは2014年3月11日に登録設立された。Larkspur合併子会社は2022年7月13日にデラウェア州に登録設立された。
Old ZyVersaは成約日に可変権益実体であることが確定したため、業務合併はアメリカ公認会計原則に従ってOld ZyVersaの長期合併入金とした。このような会計方法の下で、財務報告については、Old ZyVersaは“買収された”会社とみなされ、LarkspurはOld ZyVersaの主な受益者であることが決定されたので、Larkspurは会計購入者とみなされる。
| 102 |
財務 運営概要
私たち はこれまで何の収入も生じておらず、深刻な運営損失を出しています。我々の2023年1月1日から2023年6月30日までの純損失は82,057,043ドルであり、2022年1月1日から2022年6月30日(前継期)までの純損失は5,752,707ドルであった。2023年6月30日現在、私たちの累計赤字は約8700万ドル、現金は約20万ドルです。私たちは予測可能な未来に、私たちは引き続き巨額の費用と運営損失を発生させると予想している。私たちは私たちが行っている活動に関連する費用が増加すると予想している
| ● | VAR 200およびIC 100の開発進展; | |
| ● | を準備して規制書類を提出する; | |
| ● | 私たちの臨床試験候補製品の生産を始めました | |
| ● | 追加的な研究開発、財務、一般、行政員を招聘する | |
| ● | 私たちの知的財産権を保護し保護します | |
| ● | 上場企業の要求に合致する。 |
私たちは私たちの持続的な運営を支援するために追加的な資金が必要になるだろう。政府の資金調達や第三者との協力が含まれている可能性がある公共または私募株式または債務融資または他のソースを通じて私たちの運営に資金を提供することを求めます。私たちは受け入れ可能な条項で十分な追加融資を得ることができないかもしれないし、全く得られないかもしれない。私たちが必要な時に資金を集めることができなかったことは、私たちの財務状況と私たちの業務戦略を実施する能力にマイナス影響を与えます。私たちは利益を達成するために相当な収入を作らなければならないし、私たちは決してそうしないかもしれない。
経営成果の構成要素
収入.収入
Brが成立して以来,我々は何の収入も生じておらず,近い将来も製品販売から何の収入も生じないと予想される.候補製品の開発に成功し、規制部門の承認を得た場合、または第三者と協力または許可協定を締結した場合、将来的に製品販売 または協調またはライセンス契約支払いの組み合わせから収入を得ることができるかもしれません。
運営費用
研究と開発費
研究と開発費用には、主に、私たちの候補製品の発見と開発に生じるコストが含まれている
| ● | 契約研究組織(“CRO”)と研究場所と締結された第三者協定に基づいて発生する費用に基づいて、我々の臨床試験と一部の臨床前活動を行う費用を行うか、または行う | |
| ● | 原材料コストや臨床試験や他の開発試験のための材料の製造コスト | |
| ● | 研究開発活動に従事する従業員の給料、株式給与、福祉を含む費用 | |
| ● | 設備コスト、減価償却、その他の分担費用; | |
| ● | 契約規制サービスのために支払われる費用brと、米国食品医薬品局を含む規制機関に支払う費用 は、私たちの候補製品を審査·承認するために支払われます。 |
| 103 |
私たち は発生した費用で研究開発費を支払います。外部開発活動のコストは,サプライヤから提供された情報を用いて特定のタスクを達成する進捗を評価することで確認される.これらの活動の支払いは、発生したコストパターンとは異なる個別合意の条項に基づいており、私たちの財務諸表に前払い費用または計算すべき費用として反映される可能性がある。
研究と開発活動は私たちの業務モデルの核心だ。予測可能な未来には,我々の候補製品の臨床開発を継続するにつれて,我々の研究開発費は増加し続けると予想される。製品が臨床開発の後期段階に入るにつれて、それらの開発コストは通常臨床開発の早期段階より高くなり、これは主に後期臨床試験の規模と持続時間が増加しているためである。歴史的には,我々の研究開発コストは主にVAR 200やIC 100の開発に関係している.VAR 200およびIC 100を推進し、任意の他の潜在的な候補製品を決定するにつれて、私たちは、これらの製品に直接外部研究開発コストを割り当て続けます。私たちは、当社の現在の現金および現金等価物、ならびに任意の将来の持分または債務融資または他の資本源から、他社との潜在的な協力や他の戦略取引を含む研究開発費に資金を提供する予定です。
私たちの候補製品が開発に成功するかどうかは大きな不確実性を持っている。現在,余剰開発を達成するために必要な努力の性質,時間,コストを合理的に見積もることや知ることはできず,我々の候補製品がいつ現金純流入が生じ始める可能性があるかを知ることもできない。この不確実性は、臨床試験の持続時間やコストに関連する多くのリスクおよび不確定要因によるものであり、これらのリスクおよび不確定要因は、プロジェクトのライフサイクル全体で大きく異なる
| ● | 臨床試験に組み込まれた臨床地点の数 | |
| ● | 適切な患者を募集するのに要する時間の長さ | |
| ● | 臨床試験に参加した患者集団の大きさ | |
| ● | 患者が受けた用量数; | |
| ● | 患者のフォローアップの持続時間; | |
| ● | 候補製品の開発状況; | |
| ● | 候補製品の有効性と安全性。 |
私たちの支出は、規制承認の条項と時間、および任意の特許主張または他の知的財産権を提出、起訴、弁護、実行する費用を含む他の不確実性の影響を受ける。私たちの候補製品は規制部門の承認を得ることができないかもしれない。私たちの臨床試験は思わぬ結果を得るかもしれない。私たちは私たちの候補製品の臨床試験を停止、延期、あるいは修正することを選択するかもしれない。候補製品の開発のために、これらの変数のいずれかの結果が変化することは、候補製品の開発に関連するコストおよび時間の大きな変化を意味する可能性がある。例えば、FDAまたは他の規制機関が、現在の の予想を超える臨床試験を行うことを要求する場合、または任意の臨床試験の登録において重大な遅延に遭遇した場合、臨床開発を達成するために多くの追加の財政資源および時間を要する可能性がある。製品の商業化には数年かかります さらに数百万ドルの開発コストが必要かもしれません
一般料金 と管理費用
一般費用と行政費用は主に行政、行政、財務機能における従業員の給料、株式給与と関連コストを含む。一般および行政費用には、法律、会計、監査、税務、コンサルティングサービス、保険、人的資源、情報技術、オフィス、出張費用などの専門費用も含まれる。
私たちの一般と管理者 は、私たちの候補製品の持続的な研究開発と潜在的な商業化を支援するために、将来的に私たちの一般的かつ管理費用が増加することを予想している。また、会計、監査、法律、規制、税務コンプライアンスサービスコスト、役員と役員保険、投資家と広報コストなど、上場企業に関連する費用が増加すると予想されています。
その他 (収入)支出
利子 支出は無担保転換可能元票に関する債務利息と債務割引の増加を含み、この手形の年利率は6%である。
派生負債の公正価値変動 は私たちの派生負債が定期的に市価で計算されていることを表す。当社は発行時に公正な価値で計量された派生負債を記録し、いくつかの転換可能な手形の償還特徴および承認オプション に関連している。
PPPローン免除収益 は、私たちのPPPローン負債の収入を確認することを取り消します。
| 104 |
運営結果
2023年6月30日までの3カ月と2022年6月30日までの3カ月の比較
次の表は、2023年6月30日までの3ヶ月間の後続業務と2022年6月30日までの3ヶ月間の業務実績をまとめています。
| 後継者 | 前身 | |||||||||||||||
| の3つについて | の3つについて | |||||||||||||||
| 月 は終わりました | 月 は終わりました | 有利 (不利な) | ||||||||||||||
| (単位:千) | 2023年6月30日 | 2022年6月30日 | $ 変更 | % 変更 | ||||||||||||
| 運営費用: | ||||||||||||||||
| 研究開発 | $ | 1,221 | $ | 719 | $ | (501 | ) | (69.7 | )% | |||||||
| 一般と行政 | 3,929 | 1,164 | (2,765 | ) | (237.5 | )% | ||||||||||
| 進行中の研究開発減価 | 69,280 | - | (69,280 | ) | (100.0 | )% | ||||||||||
| 営業権の減価 | 11,895 | - | (11,895 | ) | (100.0 | )% | ||||||||||
| 運営費総額 | 86,325 | 1,883 | (84,441 | ) | (4338.6 | )% | ||||||||||
| 運営損失 | (86,325 | ) | (1,883 | ) | (84,441 | ) | (4483.4 | )% | ||||||||
| その他の収入(費用), 純額 | - | (121 | ) | 121 | 100.0 | % | ||||||||||
| 税前純損失 | (86,325 | ) | (2,004 | ) | (84,320 | ) | 4207.2 | % | ||||||||
| 収入br税収割引 | 7,812 | - | 7,812 | 100.0 | % | |||||||||||
| 純損失 | $ | (78,513 | ) | $ | (2,004 | ) | $ | (76,508 | ) | (3817.4 | )% | |||||
研究と開発費
2023年6月30日までの3カ月間の研究·開発費は120万ドルで、2022年6月30日までの3カ月より50万ドル増加し、69.7%増となった。この増加は主にIC 100の製造コストが50万ドル増加したためである。
一般料金 と管理費用
2023年6月30日までの3カ月間の一般·行政費は390万ドルで、2022年6月30日までの3カ月より280万ドルまたは237.5%増加した。この増加は主にデラウェア州有限責任会社(スポンサー)Larkspur Health LLCの一部のメンバーに120万ドルの普通株を授与し、brロック期間の延長と引き換えに、50万ドルの上場会社に関する専門費用、投資家と広報マーケティングコストが50万ドル増加し、役員と幹部保険が40万ドル増加し、ボーナス課税費用が20万ドル増加したためである。
進行中の研究開発と営業権減価
2022年6月30日までの3ヶ月間、行っている研究開発減値と商誉減値はそれぞれ6930万ドルと1190万ドルであり、減値はなかった。減値は株式価値の低下と会社の2023年6月30日の時価 によるものである。
その他 収入(費用)
2023年6月30日までの3カ月間の純収入(支出)総額は0ドルで、2022年6月30日までの3カ月より10万ドル増加し、100.3%増となった。この変化は転換可能債務の株式への転換により利息支出が約10万ドル減少したことによるものである。
| 105 |
2023年6月30日までの6カ月と2022年6月30日までの6カ月を比較
下表は,2023年6月30日までの6カ月間の後継者と,2022年6月30日までの3カ月間の前身の経営実績をまとめたものである。
| 後継者 | 前身 | |||||||||||||||
| の6つについて | の6つについて | |||||||||||||||
| 月 は終わりました | 月 は終わりました | 有利 (不利な) | ||||||||||||||
| (単位:千) | 2023年6月30日 | 2022年6月30日 | $ 変更 | % 変更 | ||||||||||||
| 運営費用: | ||||||||||||||||
| 研究開発 | $ | 2,277 | $ | 1,786 | $ | (490 | ) | (27.4 | )% | |||||||
| 通常 と管理 | 7,465 | 3,465 | (4,000 | ) | (115.4 | )% | ||||||||||
| 進行中の研究開発減価 | 69,280 | - | (69,280 | ) | (100.0 | )% | ||||||||||
| 営業権減価 | 11,895 | - | (11,895 | ) | (100.0 | )% | ||||||||||
| 運営費総額 | 90,917 | 5,252 | (85,665 | ) | (1631.2 | )% | ||||||||||
| 運営損失 | (90,917 | ) | (5,252 | ) | (85,665 | ) | (1631.2 | )% | ||||||||
| その他 収入(費用)、純額 | 1 | (501 | ) | 502 | 100.2 | % | ||||||||||
| 税前純損失 | (90,916 | ) | (5,753 | ) | (85,163 | ) | 1480.4 | % | ||||||||
| 収入br税収割引 | 8,859 | - | 8,859 | 100.0 | % | |||||||||||
| 純損失 | $ | (82,057 | ) | $ | (5,753 | ) | $ | (76,304 | ) | (1326.04 | )% | |||||
研究と開発費
2023年6月30日までの6ヶ月間の研究·開発費は230万ドルで、2022年6月30日までの6ヶ月より50万ドルか27.4%増加した。増加の主な原因はIC 100の製造コストが50万ドル増加したことである。
一般料金 と管理費用
2023年6月30日までの6カ月間の一般·行政費は750万ドルで、2022年6月30日までの6カ月より400万ドルまたは115.4%増加した。この増加は主に保証人のあるメンバーに付与された普通株が120万ドル増加し、その販売禁止期間を延長することと引き換えに、上場企業の“br”に関する専門費用が110万ドル増加し、投資家と広報マーケティングコストが70万ドル増加し、PIPE株式に関する有効性が失効したために40万ドルを支払ったためである。
進行中の研究開発と営業権減価
2022年6月30日までの6ヶ月間、行っている研究開発減値と商誉減値はそれぞれ6930万ドルと1190万ドルであり、減値はなかった。減値は株式価値の低下と会社の2023年6月30日の時価 によるものである。
その他 (収入)支出
2023年6月30日までの6カ月間の純収入(支出)総額は1,000ドルで、2022年6月30日までの6カ月より500万ドル増加し、100.2%増となった。この変化は、転換可能な債務の株式への転換による利息支出の約30万ドルの減少と、派生負債の公正価値の変化による損失が20万ドル減少したためである。
| 106 |
キャッシュフロー
次の表は、2023年6月30日までの6ヶ月間の後続業務と2022年6月30日までの6ヶ月間の業務と融資活動のキャッシュフローをまとめています
| 6月30日までの6ヶ月間、 | 増す | |||||||||||
| (単位:千) | 2023 | 2022 | (減少) | |||||||||
| 提供された現金純額 | ||||||||||||
| 操作 活動 | $ | (4,997 | ) | $ | (689 | ) | $ | (4,308 | ) | |||
| 活動に資金を提供する | (677 | ) | 689 | (1,366 | ) | |||||||
| 現金純増加 (減少) | $ | (5,674 | ) | $ | - | $ | (5,674 | ) | ||||
経営活動のキャッシュフロー
2023年6月30日と2022年6月30日までの6ヶ月間、経営活動で使用された現金純額はそれぞれ500万ドルと70万ドルだった。2023年6月30日までの6ヶ月と2022年6月30日までの6ヶ月間、経営活動で使用された現金純額は主に純損失約8,210万ドル及び580万ドルで相殺され、それぞれ非現金支出純額7,480万ドル及び290万ドル、それぞれ運営資産及び負債レベルによる現金約230万ドル及び210万ドルが相殺された。
純融資活動から提供された現金
融資活動が提供する現金純額は、2023年6月30日と2022年6月30日までの6カ月間で、それぞれ70万ドルと70万ドルだった。2023年6月30日までの6ヶ月間、融資活動が提供する現金には、主にAシリーズ優先株の償還に支払われた1,050万ドルの現金と、普通株発行に関する120万ドルの登録·発行コスト が含まれる。これは普通株式の公開によって得られた1100万ドルの収益によって相殺される。
2022年6月30日までの6ヶ月間、融資活動が提供する現金は、主に優先株の発行と投資家の預金を受ける収益である。
流動性 と資本資源
次の表は、2023年6月30日と2022年12月31日の流動資産、流動負債、運営資本不足総額をまとめています
| (単位:千) | 2023年6月30日 | 2022年12月31日 | ||||||
| 現在の資産 | $ | 1,116 | $ | 6,363 | ||||
| 流動負債 | $ | 10,485 | $ | 8,188 | ||||
| 運営資金が不足している | $ | (9,369 | ) | $ | (1,825 | ) | ||
2014年の設立から2023年6月30日まで、私たちは何の収入も生じず、運営により重大な運営損失と負のキャッシュフローが発生した。私たちの現在の運営計画によると、2023年6月30日までの20万ドルの現金は、私たちの運営費用と資本支出需要を月ごとに支払うのに十分であると予想されています。しかし、FDA承認を受ける前に、候補製品への私たちの支出を予測することは難しい。また、変化する環境は、私たちの現在の予想よりも現金がかかる速度を大幅に速くする可能性があり、私たちがコントロールできない状況のため、私たちは現在の予想よりも多くの現金を必要とするかもしれない。
注目を行っている
Brが成立して以来,資金調達や研究開発活動を含む組織活動に従事してきた。私たち はまだ収入が発生しておらず、利益運営が実現されておらず、運営から正のキャッシュフローが生じたこともありません。 は利益運営が実現しても継続できる保証はありません。いずれの臨床前段階の製薬会社にも関連するリスクに直面しており,これらの会社は研究開発に多くの資金を投入している。私たちの研究開発プロジェクトが成功することは保証されず、開発された製品が必要な監督管理の承認を得ることは保証されず、いかなる承認された製品も商業的に実行可能である保証はない。また,我々は技術が急速に変化する環境で運営し,従業員やコンサルタントのサービスに大きく依存している.しかも、私たちの未来の運営は私たちが追加資本を調達する努力が成功するかどうかにかかっている。これらの不確実性は,財務諸表発表日後12カ月以内に経営を継続する能力があるかどうかを大きく疑わせている。添付された財務諸表は持続的な経営に基づいて作成される。財務諸表には、当社が経営を継続できない可能性があり、資産の回収可能性および分類または負債の金額および分類に生じる可能性のある将来の影響を反映するための調整は含まれておらず、企業は通常の業務中に資産の経営、現金化、および清算負債を継続することを計画している。2023年6月30日までの6ヶ月間の純損失は8210万ドルで、2022年6月30日までの6ヶ月間、私たちの純損失は580万ドルで、2023年6月30日までの累計赤字は8700万ドルでした。私たちは現在開発されている候補製品から相当な収入を得ることができるまで追加の損失が予想される。私たちの主な資金源はいつも債務と株式証券を発行することだ。私たちは現在の現金が運営資金と資本需要を月ごとに支払うのに十分だと思う。私たちは私たちの運営に資金を提供して、私たちの候補製品の開発を完成させ、商業開発を行うために追加の資金が必要です。そのような資金調達は、必要に応じて、または許容可能な条件下で提供されることが保証されない。
契約義務
以下 は我々の2023年6月30日までの契約義務をまとめており,これらの義務は我々の将来の流動性に影響を与える。私たちの現在の運営計画によると、現在の現金残高と将来の融資から以下のように定められた義務を履行する予定です。
現金 2023年6月30日現在、私たちの流動負債に必要な現金には、約1,050万ドルの売掛金、課税費用、 と私たちの経営賃貸負債が含まれています。
| 107 |
経営成果
2022年12月31日までの年度と2021年12月31日までの年度比較
次の表は、2022年12月13日から2022年12月31日までの後続業務、2022年1月1日から2022年12月12日まで、および2021年12月31日までの前年の運営結果をまとめています
| 後継者 | 前身 | |||||||||||
| 期間について | 期間について | 本年度の | ||||||||||
| 12月 13から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 12月 12, | 十二月三十一日 | ||||||||||
| (単位:千) | 2022 | 2022 | 2021 | |||||||||
| 運営費用 : | ||||||||||||
| 研究開発 | $ | 400 | $ | 5,408 | $ | 2,124 | ||||||
| 通常 と管理 | 420 | 7,605 | 5,580 | |||||||||
| 総運営費 | 820 | 13,013 | 7,704 | |||||||||
| 運営損失合計 | (820 | ) | (13,013 | ) | (7,704 | ) | ||||||
| その他 収入(費用)、純額 | - | 1,035 | 380 | |||||||||
| 所得税前純損失 | (820 | ) | (14,048 | ) | (8,084 | ) | ||||||
| 収入br税収割引 | 745 | - | - | |||||||||
| 純損失 | $ | (75 | ) | $ | (14,048 | ) | $ | (8,084 | ) | |||
| 108 |
研究開発費
2022年12月13日から2022年12月31日までの後継者の研究開発費と、2022年1月1日から2022年12月12日までの期間および2021年12月31日までの前年の研究開発費をまとめた
| 後継者 | 前身 | |||||||||||
| 期間について | 期間について | 本年度の | ||||||||||
| 12月 13から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 12月 12, | 十二月三十一日 | ||||||||||
| (単位:千) | 2022 | 2022 | 2021 | |||||||||
| 研究開発 | ||||||||||||
| 人件費 | $ | 31 | $ | 1,045 | $ | 1,306 | ||||||
| 臨床br手術 | ||||||||||||
| VAR 200 | - | (100 | ) | 259 | ||||||||
| 臨床前操作 | ||||||||||||
| IC 100 | - | 60 | 161 | |||||||||
| 薬品の生産と調合 | ||||||||||||
| VAR 200 | 1 | 27 | 25 | |||||||||
| IC 100 | 322 | 3,934 | 144 | |||||||||
| その他 コスト | ||||||||||||
| VAR 200 | 36 | 314 | 215 | |||||||||
| IC 100 | 10 | 128 | 14 | |||||||||
| 研究開発総額 | $ | 400 | $ | 5,408 | $ | 2,124 | ||||||
2022年12月13日から2022年12月31日までの後続期間の研究開発費は40万ドル、2022年1月1日から2022年12月12日までの前期間の研究開発費は540万ドル。2022年12月31日現在の連結年度の研究開発費は580万ドルで、2021年12月31日現在の前年の210万ドルより370万ドルまたは173.4%増加している。研究開発費の増加は、量産分析サービスと製造材料供給の支出が全体的に増加しているためである。
2022年12月13日から2022年12月31日までの後続期間の人件費は31,000ドルであり、2022年1月1日から2022年12月12日までの前期間の人件費は100万ドルである。2022年12月31日までの連結年度の人事支出は110万ドルで、2021年12月31日までの前年の130万ドルから20万ドルか17.6%減少した。人件費減少の主な原因は、前年にすぐに帰属した相談者のオプションを付与した株式報酬が減少したことである。
| 109 |
2022年12月13日から2022年12月31日までの後続期間の臨床手術費用は0ドル,2022年1月1日から2022年12月12日までの前期間の臨床手術費用は(10万ドル)であった。2022年12月31日までの合併年度の臨床手術は(10万ドル) であり,2021年12月31日現在の前年の30万ドルより40万ドルまたは138.6%減少した臨床業務減少の主な原因は1つのサプライヤーが新冠肺炎疫病のために完成しなかった仕事に対して信用を獲得したことである。
2022年12月13日から2022年12月31日までの後続期間の臨床前 操作は0ドル,2022年1月1日から2022年12月12日までの前期間の臨床前 操作は60,000ドルであった。2022年12月31日までの合併年度の臨床前手術は6万ドルであり,2021年12月31日現在の前年の16.1万ドルより10.6万ドルまたは62.7%減少したBrが減少したのは,2022年12月31日までの年間薬品支出がわずかであったためである。
2022年12月13日から2022年12月31日までの後続期間の薬物製造·配合費用は40万ドル,2022年1月1日から2022年12月12日までの前期間の費用は400万ドルであった。2022年12月31日までの合併年度の薬品製造·配合は430万ドルで,2021年12月31日現在の前年の20万ドルより410万ドルまたは2436.1%増加したこの増加は、予想されるバッチ製造のために260万ドルの材料を購入し、バッチ製造と分析サービスのために150万ドルを購入したためだ。
2022年12月13日から2022年12月31日までの後続期間の他の研究開発コストは46,000ドルであり、2022年1月1日から2022年12月31日までの前期間の他の研究開発コストは442,000ドルである。2022年12月31日までの合併年度の他の研究開発コストは48.8万ドルで、2021年12月31日現在の前年の22.9万ドルより25.9万ドルまたは113.1%増加した成長はコンサルティングサービスによって推進された。
一般料金と管理費用
次の表は、2022年12月13日から2022年12月31日までの後継者および2022年1月1日から2022年12月12日までの期間および2021年12月31日までの前年の一般と行政費用をまとめたものである
| 後継者 | 前身 | |||||||||||
| その期間内に | その期間内に | この1年の | ||||||||||
| 十二月十三日から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 十二月十二日 | 十二月三十一日 | ||||||||||
| (単位:千) | 2022 | 2022 | 2021 | |||||||||
| 一般的な行政部門は | ||||||||||||
| 人員費 | $ | 138 | $ | 4,150 | $ | 4,474 | ||||||
| 取引コスト | 63 | 2,088 | - | |||||||||
| 弁護士費と弁護士費 | 100 | 887 | 639 | |||||||||
| 家賃費用 | 8 | 149 | 148 | |||||||||
| 他にも | 111 | 331 | 319 | |||||||||
| 一般と行政の合計 | $ | 420 | $ | 7,605 | $ | 5,580 | ||||||
2022年12月13日から2022年12月31日までの後続期間の一般·行政費は40万ドルであるのに対し、2022年1月1日から2022年12月12日までの前期間の一般·行政費は760万ドルである。2022年12月31日までの合併年度の一般·行政費は800万ドルで、2021年12月31日現在の前年の560万ドルより240万ドルか43.8%増加した。
2022年12月13日から2022年12月31日までの後続期間の人件費は10万ドル、2022年1月1日から2022年12月12日までの前期間の人件費は420万ドルである。2022年12月31日までの連結年度の人事支出は430万ドルで、2021年12月31日までの前年の450万ドルより20万ドルか4.1%減少した。人件費減少の主な原因は、2022年に付与されたオプションが減少したため、株式報酬が減少したことだ。
2022年12月13日から2022年12月31日までの後続期間の取引コストは100万ドルであるのに対し、2022年1月1日から2022年12月12日までの前期間の取引コストは210万ドルである。2022年12月31日までの連結年度の取引コストは220万ドルであるが、2021年12月31日までの前年の取引コストはゼロである。取引コストの増加は業務合併の準備と直接関連している。
2022年12月13日から2022年12月31日までの後続期間の法律·専門費 は10万ドル、2022年1月1日から2022年12月12日までの前期間の法律·専門費は90万ドルである。2022年12月31日までの合併年度の法律·専門費は100万ドルで、2021年12月31日までの前年の60万ドルより40万ドルまたは54.4%増加しています。br法や専門費用の増加は、取引に直接関係のない業務合併費用によるものです。
| 110 |
2022年12月13日から2022年12月31日までの後続期間のレンタル料は8,000ドル であり、2022年1月1日から2022年12月12日までの前期間のレンタル料は149,000ドルである。2022年12月31日までの連結年度の賃貸料支出は15.7万ドルで、2021年12月31日までの前年の14.8万ドルより9000ドルか6.1%増加した。この増加は公共地域料金の増加 によって推進される。
2022年12月13日から2022年12月31日までの後続期間の他の一般·行政費は10万ドル、2022年1月1日から2022年12月12日までの前期間の他の一般·行政費は30万ドルである。2022年12月31日までの合併年度の他の一般·行政費は40万ドルで、2021年12月31日現在の前年の30万ドルより10万ドルか38.5%増加した。その他の費用の増加は,主に役員や役人保険が5万ドル増加し,投資家や広報費用が約5万ドル増加したためである。
その他 (収入)支出
次の表は、2022年12月13日から2022年12月31日までの後継者のその他(収入)支出、および2022年1月1日から2022年12月12日までの期間および2021年12月31日までの年度の後継者のその他(収入)支出をまとめています
| 後継者 | 前身 | |||||||||||
| その期間内に | その期間内に | この1年の | ||||||||||
| 十二月十三日から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 十二月十二日 | 十二月三十一日 | ||||||||||
| (単位:千) | 2022 | 2022 | 2021 | |||||||||
| その他の費用 | ||||||||||||
| 利子支出 | $ | - | $ | 428 | $ | 821 | ||||||
| 派生負債の公正価値変動 | - | 607 | (228 | ) | ||||||||
| PPPローンの猶予権を得る | - | - | (213 | ) | ||||||||
| その他の費用の合計 | $ | - | $ | 1,035 | $ | 380 | ||||||
2022年12月13日から2022年12月31日までの後続期間の総他費用純額は0ドルであるのに対し、2022年1月1日から2022年12月12日までの前期間の純額は100万ドルである。2022年12月31日までの連結年度のその他の支出純額は100万ドルで、2021年12月31日までの前年の40万ドルから60万ドルまたは172.4%増加した。この変動は転換可能債務転換により利息支出が約40万ドル減少したことによるものであるが、派生債務公正価値変化が増加した損失40万ドルと2021年の購買力平価ローン免除収益(約20万ドル)によって相殺された。
キャッシュフロー
次の表は、2022年12月13日から2022年12月31日までの期間、2022年1月1日から2022年12月12日までの期間、および2021年12月31日までの前年の運営と融資活動のキャッシュフローをまとめたものである
| 後継者 | 前身 | |||||||||||
| 期間について | 期間について | 本年度の | ||||||||||
| 12月 13から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 12月 12, | 十二月三十一日 | ||||||||||
| (単位:千) | 2022 | 2022 | 2021 | |||||||||
| 純額 現金は | ||||||||||||
| 操作 活動 | $ | (3,394 | ) | $ | (1,495 | ) | $ | (5,076 | ) | |||
| 活動に資金を提供する | - | 1,865 | 5,230 | |||||||||
経営活動のキャッシュフロー
2022年12月13日から2022年12月31日までの後続期間の経営活動で使用される現金純額は340万ドル、2022年1月1日から2022年12月12日までの前期間は150万ドル。2022年12月31日までの合併年度の経営活動で使用される現金純額は490万ドルで、2021年12月31日までの前年の510万ドルより20万ドルまたは3.7%減少した。2022年12月31日までの連結年度と2021年12月31日現在の年度では,経営活動に用いられる現金純額は,主にそれぞれ約1,410万ドルと810万ドルの純損失により,それぞれ360万ドルと400万ドルの非現金純支出で相殺され,それぞれ運営資産と負債レベルによる現金約560万ドルと() の現金約100万ドルである。
| 111 |
純融資活動から提供された現金
2022年12月13日から2022年12月31日まで、融資活動が提供する純現金は0ドル、2022年1月1日から2022年12月12日まで、融資活動が提供する現金純額は190万ドル。2022年12月31日までの合併年度、融資活動が提供する現金純額は190万ドルで、2021年12月31日までの前年の520万ドルより330万ドルまたは64.3%減少した。2022年12月31日までの年度内に、融資活動が提供する現金は優先株発行の収益となる。2021年12月31日までの年間で、転換可能債券の発行から520万ドルを獲得しました。
流動性 と資本資源
次の表は、2022年12月31日と2021年12月31日の流動資産、負債、運営資本ギャップ総額をまとめています
| 後継者 | 前身 | |||||||
| 十二月三十一日 | 十二月三十一日 | |||||||
| (単位:千) | 2022 | 2021 | ||||||
| 現在の資産 | $ | 6,363 | $ | 812 | ||||
| 流動負債 | $ | 8,188 | $ | 13,626 | ||||
| 運営資金不足 | $ | (1,825 | ) | $ | (12,814 | ) | ||
2014年の設立から2022年12月31日まで、私たちは何の収入も生じず、深刻な運営損失と運営キャッシュフローが負に発生した。私たちの現在の運営計画によると、2022年12月31日までに、私たちの現金は590万ドルで、月ごとに計算された運営費用と資本支出要求を支払うだけだと予想されています。しかし、FDAの承認を得る前に、候補製品への支出を予測することは難しいです。また,変化する環境 は,我々が現在予想しているよりも現金がかかる速度をはるかに速くする可能性があり,また,我々が制御できない場合には,現在の予想よりも多くの現金 が必要となる可能性がある.
注目を行っている
Brが成立して以来,資金調達や研究開発活動を含む組織活動に従事してきた。私たち はまだ収入が発生しておらず、利益運営が実現されておらず、運営から正のキャッシュフローが生じたこともありません。 は利益運営が実現しても継続できる保証はありません。いずれの臨床前段階の製薬会社にも関連するリスクに直面しており,これらの会社は研究開発に多くの資金を投入している。私たちの研究開発プロジェクトが成功することは保証されず、開発された製品が必要な監督管理の承認を得ることは保証されず、いかなる承認された製品も商業的に実行可能である保証はない。また,我々は技術が急速に変化する環境で運営し,従業員やコンサルタントのサービスに大きく依存している.しかも、私たちの未来の運営は会社が追加資本を調達する努力が成功するかどうかにかかっている。これらの不確実性は、財務諸表の発表日以降も継続して経営を続ける企業として12カ月間継続できるかどうかを大きく疑わせている。添付財務諸表 は持続経営に基づいて作成されている。財務諸表は、会社が経営を継続できない可能性があるため、資産の回収可能性および分類または負債の金額および分類に及ぼす可能性のある将来的な影響を反映するための調整を含まず、通常の業務中に資産、資産および清算負債を継続することを計画している。2022年12月31日の会計年度までに1,410万ドルの赤字を計上し、2021年12月31日までの会計年度の純損失は810万ドル、2022年12月31日現在の累計赤字は490万ドルである。私たちは現在開発されている候補製品から相当な収入を得ることができるまで、より多くの損失を受けることが予想される。私たちの主な資金源であるbrは債務と株式証券を発行してきた。私たちは現在の現金が月ごとに運営と資本需要に資金を提供するのに十分だと思う。私たちは私たちの運営に資金を提供し、brの開発を完了し、私たちの候補製品を商業開発するための追加資金が必要です。そのような資金調達は、必要に応じて、または受け入れ可能な条項で提供される保証がない。
| 112 |
契約義務
以下 は我々の2023年6月30日までの契約義務をまとめており,これらの義務は我々の将来の流動性に影響を与える。私たちの現在の運営計画によると、現在の現金残高と将来の融資から以下のように定められた義務を履行する予定です。
2023年6月30日現在、私たちの現在の負債の現金需要には、約1,050万ドルの売掛金、売掛金、brが含まれています。
企業合併後の資本需要
私たちは将来的により多くの資金を集め、私たちの運営とVAR 200とIC 100の持続的な開発に資金を提供するつもりだ。
私たちは後続発行で株式または株式にリンクした証券を発行することで追加資本を調達する予定だ。もし私たちに有利な条項で株式や株式リンク証券を発行することで追加資本を調達できなければ、私たちは私たちの業務戦略を実行するのに十分な流動性がないかもしれない。私たちは普通株で行使できる各種の未完済株式証明書を持っています。その中の多くは、この等株式証所有者が私たちに支払った現金と交換するために行使しなければなりません。もし私たちの普通株の市場価格が持分証の取引価格より低い場合、所有者は株式承認証を行使する可能性が低い。したがって,我々の普通株の現在の市場価格と当該等株式証の行使価格から,短期的には我々を行使する大部分の株式承認証から大きな収益は得られないことが予想される.
私たちの政策は、私たちの現在の需要を超えた任意の現金を、元本残高を維持し、流動性を提供するための投資に投資し、適度な投資リターンを生成することである。したがって、私たちの現金等価物は主に通貨市場基金に投資され、現在の金利環境を考慮して、これらの基金は現在最低リターンしか提供していない。
私たちは、少なくとも今後数年以内に、私たちが候補製品を開発し、市場承認を求め、承認された後、最終的に私たちの製品を商業化することに伴い、大量の追加運営損失を招き続けると予想しています。もし私たちの候補製品が市場の承認を得たら、私たちは大量の販売、マーケティング、アウトソーシング製造費用を発生させるだろう。また、私たちが計画している製品の商業化努力を支援する人員を含め、運営、財務、情報システム、人員を増やすための追加費用が発生すると予想されています。私たちの上場企業として適用されるコーポレート·ガバナンス、内部統制、類似の要求を守る上で巨額のコストが生じることも予想されます。
私たちの将来の現金と資本需要の使用は、多くの前向きな要素に依存するだろう
| ● | 私たちの候補製品の臨床試験の開始、進捗、時間、コスト、結果 | |
| ● | 私たちは候補品ごとに臨床開発計画を立てました | |
| ● | 私たちが開発または許可される可能性のある候補製品の数量と特徴 | |
| ● | 私たちは実行される任意の協力協定の条項を選択することができる | |
| ● | FDAまたは他の同様の外国規制機関によって制定された規制要件の結果、時間、およびコストを満たす | |
| ● | 私たちの特許主張と他の知的財産権の費用を提出、起訴、弁護、実行します | |
| ● | 知的財産権紛争を弁護する費用は、第三者が私たちに提起した特許侵害訴訟を含む | |
| ● | ビジネス規模の製造活動を実施するコストと時間; | |
| ● | 私たちが自分で製品を商業化することを選択した地域では、規制の承認を得る可能性のある任意の候補製品のための販売、マーケティング、および流通能力を確立またはアウトソーシングするコスト がある。 |
| 113 |
我々の業務を長期的に持続的に増加させるために,我々は大量の資源を投入して研究開発,候補製品の臨床試験,その他の運営と潜在的な製品買収と許可を行う予定である。我々はすでに評価しており、我々の内部開発チャネルを強化するために、より多くの製品や候補製品を買収または許可して開発する計画の一部として、一連の戦略的取引を評価し続けることが予想される。私たちが求める可能性のある戦略的取引機会は、私たちの流動性と資本資源に重大な影響を与える可能性があり、追加の債務を発生させたり、株式資本を求めたり、あるいはその両方を要求することができるかもしれない。さらに、私たちは、承認されたまたは開発されている製品を新しいまたは既存の治療分野で開発、買収または許可するか、または既存の業務を拡張していく可能性があります。したがって、私たちは、私たちの業務を拡大するため、または一般会社の目的のために、他の製品、候補製品または会社を許可または買収するために、日和見主義的に追加資本を得る方法を求め続けることが予想される。 戦略取引は、1つまたは複数の公的または個人債務または持分融資によって追加資本を調達する必要があるかもしれない。または は、協力または協力手配として構築することができる。私たちは現在、買収、許可、または同様の戦略業務取引の手配、合意、または了解に達していません。また、古い製薬会社とのビジネス協力と戦略関係を評価し続け、より直接的なマーケティング、販売、市場参入、流通インフラを提供する。
もし私たちが株式証券を発行することで追加資金を調達すれば、私たちの株主は希釈されるだろう。債務融資が可能であれば、固定支払義務の増加を招き、追加債務を招く、資本支出を行う、または配当を宣言するなど、特定の行動をとる能力を制限または制限する契約を含むいくつかの合意に関連する可能性がある。私たちが調達した任意の債務融資または追加のbr持分には、清算および他の特典など、私たちまたは私たちの既存の株主に不利な条項が含まれている可能性があります。もし私たちが第三者との協力および許可を通じて追加資金を調達する場合、私たちの技術、将来の収入流、または候補製品に対する貴重なbr権利を放棄する必要があるかもしれません。または私たちに不利になる可能性のある条項でライセンスを付与する必要があります。
ポスト会計選挙法案
ZyVersaは“新興成長型会社”で、2012年のJumpStart Our Business Startups ActやJOBS Actの定義に基づいている。JOBS法案は、新興成長型会社の地位を有する企業が、延長された過渡期を利用して新たなまたは改正された会計基準を遵守することを許可し、民間会社に適用されるまで、これらの会計基準の採用を延期する。ZyVersaは、(1)新興成長型企業または(2)明確かつbr}が“雇用法案”に規定されている延長移行期間から脱退することを撤回できないまで、上場企業と民間企業に対して異なる発効日を有する新たなまたは改正された会計基準を遵守できるように、この延長された移行期間を利用することを望んでいる。したがって、上場企業の発効日まで、当社の財務諸表は、新たな会計基準や改訂された会計基準に適合する企業と比較できない可能性があります。
また,会社はJOBS法案が提供する他の免除や低減の報告要求に依存しようとしている。
表外手配
当社と、財務状況、財務状況、収入または支出、経営業績、流動資金、資本支出または資本資源が現在または将来に重大な影響を及ぼす可能性がある任意の他のエンティティとの間には、株主にとって重要な表外手配はありません。
重要な会計政策と試算
財務諸表と関連開示の作成はアメリカ公認会計基準に適合しなければならない。これらの会計原則は、財務諸表日までに報告された資産および負債額、ならびに列報中の報告書の収入および費用に影響を及ぼす可能性がある推定および判断を要求する。私たちが依存している推定と判断は、私たちがこれらの推定と判断を行う際に得られた情報に基づいていると信じている。もしこのような推定と実際の結果の間に大きな違いがあれば、私たちの財政結果は影響を受けるだろう。以下では、我々のより重要な見積もりと判断を反映した会計政策と、我々が報告した財務業績を全面的に理解·評価するのに役立つと考えられる最も重要な会計政策を紹介する。
以下は私たちのすべての会計政策や推定された総合的なリストではありません。我々の会計政策は、本募集説明書の末尾の財務諸表に付記されている3-重要会計政策の概要により包括的に記述されている。
予算の使用
米国公認会計原則に基づいて財務諸表を作成することは管理層に推定、判断と仮定を要求し、これらの推定、判断と仮定は財務諸表中に報告された金額と財務諸表関連付記に開示された金額に影響を与える。当社の見積もりと判断は歴史的経験とその当時の状況で合理的と考えられる様々な他の仮定に基づいています。当社貸借対照表に報告されている資産および負債額および列報の各期間の支出金額は、株式証券、負債、株式に基づく報酬および買収に基づく無形資産の公正価値計算、および繰延税br}資産のための推定値控除のために使用されるが、これらに限定されない推定および仮定の影響を受ける。会社のいくつかは、会社独自の状況や一般経済状況を含む外部条件の影響を受ける可能性がある。実際の結果はこれらの推定値とは異なる可能性があり,これは合理的である.
| 114 |
業務合併
買収企業合併会計方法を適用する際に、買収に割り当てられた識別可能な資産と負債の金額は、買収日に基づく推定公正価値であり、残りの部分は営業権として記録される。無形資産は最初に公正価値で評価 を行い,このタイプの無形資産に適した公認推定方法を採用した。企業合併で取得した研究·開発(IPR&D) は規制部門の承認を得る前に無期限無形資産として資本化され,規制承認を得た場合, は定期無形資産に計上され,その予想寿命内に償却され,そうでなければ 無形資産を解約する。
長期資産と商業権
社はASC 360-10-35の規定に従って長期資産を会計処理する財産、工場と設備、減価brまたは長期資産の処分それは.本会計基準は、事件や状況変化が発生して帳簿金額が回収できない可能性があることを示す限り、長期資産の減価審査を行うことを要求している。保有·使用する資産の回収可能性は、資産の帳簿価値と資産予想による将来の未割引現金流量とを比較することで測定される。 資産の帳簿価値がその推定された将来のキャッシュフローを超えていれば、資産帳簿価値が資産公正価値を超える金額で減価費用を確認する。
Br社は、ASC 350会計基準に基づいて営業権および無形資産を会計処理する無形資産-営業権とその他それは.商業権(Br)は、取得された資産および負担された負債の推定公正価値を超えるエンティティの購入価格を表す。 ASC 350は、営業権および他の無限寿命を有する無形資産が毎年減値テストを行うことを要求するか、または資産の公正価値がその帳簿価値よりも低く低下したことを示す場合に一時的減値テストを行うことを要求する
数量化評価が必要かどうかを判断する際に、当社は、報告単位の公正価値がその帳簿価値よりも低い可能性があるかどうかを決定するために、関連イベントまたは状況を評価する。定性的評価を行った後、あるエンティティが、報告単位の公正価値がその帳簿価値を下回る可能性が高いと結論した場合、エンティティは、ASC 350に記載された量子化減値テストを実行するであろう。しかしながら、定性的評価を適用した後、そのエンティティは、公正価値が帳簿価値よりも少なくない可能性が高いと結論した場合、量子化減値テストを行う必要はない。同社はその歴史データと経験、業界予測、ミクロとマクロ経済状況予測および予想に基づいてこれらの仮説を立てている
転換可能なチケット
当社は、このような契約またはこれらの契約の埋め込み部分が派生金融商品の資格に適合するかどうかを決定するために、その変換可能なツールを評価し、財務会計基準委員会(“FASB”)会計基準に従って編集(“ASC”)の815題の“派生ツールおよびヘッジファンド”(“ASC 815”)に個別に入金しなければならない。派生金融商品の会計処理は、当社が合意開始日の公正価値とその後の各貸借対照表日の公正価値記録とに基づいて、任意の食い違いのある埋め込み特徴を記録することを要求する。公正価値のいずれの変動も営業外,非現金収入または支出として期間ごとの収益 を計上する.当社は貸借対照表ごとにその派生ツールの分類を再評価します。期間内に発生したイベントによって分類が変更されると,契約は再分類された イベントが発生した日から再分類される.分岐の埋め込み機能は、その初期公正価値に従って記録され、これは、ホストツールのための追加の債務割引を作成する。
2021年1月1日に会計基準更新(ASU)2020-06年を採用する前に、埋め込まれた変換オプションが区別する必要がない場合、会社はその後、会社関連株の約束日までの公正価値とツールの有効な転換価格(内在価値)を比較することによって、有益な変換機能が存在するかどうかを評価する。預かり手形は剰余コストで計量し、帳簿価値は実際の利息法で契約満期の日本金金額を引き出し、相応の利息支出を計上する。2021年1月1日にASU 2020−06を採用した後,会社は有益な変換機能が存在するかどうかを評価する必要はなくなった。
金融商品の公正価値
当社はASC 820“公正価値計量と開示”(“ASC 820”)に基づいて金融資産と負債の公正価値を計量し、 は公正価値を定義し、公正価値計量枠組みを構築し、公正価値計量の開示を拡大する。
ASC 820は、公正価値 を、計量日市場参加者間の秩序ある取引において、資産または負債が元金または最も有利なbr市場で負債を移動させるために課金される交換価格(退出価格)として定義する。ASC 820はまた、公正価値レベルを確立し、実体が公正価値を計量する際に観察可能な投入を最大限に使用し、観察できない投入 を最大限に減少させることを要求する。ASC 820は、公正価値を計量するために使用されることができる3つのレベルの投入を説明する
第1レベル--アクティブ市場における同じ資産または負債のオファー ;
第2レベル-アクティブ市場または観察可能な投入における類似資産および負債の見積もり;
レベル3-観察できない入力(例えば、仮想キャッシュフローモデリング入力に基づく)。
これらのツールの短期的な性質のため、会社の金融商品、例えば現金、売掛金、投資家預金の帳簿価値は公正価値に近い。
第3レベル投入を評価するための推定技術と仮定の他の詳細については,付記8−派生負債 を参照されたい。
| 115 |
所得税
財務諸表または納税申告書に計上されているまたは計上されていない項目の将来の税務結果について、当社は繰延された納税資産および負債を確認します。繰延税項資産および負債は、資産および負債の課税基準と、それぞれ現行税率で計算された財務報告金額(“一時的差異”)との差額(“一時的差異”)に基づいて決定される。繰延税金資産は、経営陣が資産が現金化できない可能性が高いと考えている範囲に減額されている。税率変動が繰延税金資産と負債に及ぼす影響 は,公布日を含む期間の経営報告書で確認された
当社は確認敷居と計量プログラムを用いて財務諸表を確認し,納税申告書に採取されたまたは予想されている納税状況を計測した。
研究と開発費
研究開発コスト は発生した費用ごとに計上され,我々の候補製品開発に関するすべての直接·間接コストを含む。これらの費用 には、第三者に支払われる研究開発および製造サービス、人員コスト、および製造設備の減価償却 が含まれる。報告期間終了時に,第三者サービスプロバイダに支払う金額と,研究や開発目標の達成に関する見積り進捗を比較する.より多くの情報を取得するにつれて、このような推定は変化する可能性がある。 は、サービスプロバイダに支払う時間と、提供されるサービスが達成されると推定される進展とに基づいて、これらのコストに関連する前払いまたは計算されるべき費用の純額を記録する可能性がある。
株に基づく報酬
当社は,権益付与ツールの公正価値に基づいてサービス獲得コスト を計測する.奨励の公正価値 は付与日に計量される.次いで、報酬と交換するためにサービスを提供する必要がある期間(通常は許可期間)に、公正価値金額が確認される。
株式オプションと引受権証の公正価値
同社はBlack-Scholesオプション定価モデルを用いて、付与された株式オプションと引受権証の公正価値を計算した。オプション没収は発生時に に計上される.後続普通株は市場法を採用し、普通株のナスダック世界市場での取引価格を用いて推定する。2022年の間、前身普通株の公正価値は、業務合併協定が値の推定日ごとに買収側と公平に検討した状況と、この協定が最終的に2022年7月20日に締結され、前身の推定値は8,500万ドルであり、市場法を用いて決定された。2021年、経営陣は第三者評価専門家の協力を得て、収益法を用いて前身普通株の公正価値を決定した。オプション使用の期待 用語は,付与されたオプション未償還予定時間帯である. 株式証明書使用の期待期間は契約期間である.当社は“簡略化”方法を用いて“通常”オプション付与の期待期限を試算している。当社は2022年12月13日まで普通株の公開取引履歴がなく、そのbr履歴変動率計算を支持している。したがって,当社が使用している期待変動率数字は,評価ツールの期待寿命に相当する期間における6つの比較可能エンティティの履歴変動率を振り返った に基づいている.無リスク金利は米国債ゼロ金利債券の暗黙的収益率に基づいて決定され、残り期限は推定ツールの予想期限と一致する。
最近通過した会計公告
2019年12月、FASB は、所得税会計処理に関する様々な側面を簡略化するために、ASU 2019-12“所得税(740テーマ):所得税会計処理の簡略化”を発表した。ASU 2019−12は、主題740の一般原則のいくつかの例外を削除し、一貫性アプリケーションを改善するために既存のガイドを明確にして修正した。ASU 2019-12年度は、2021年12月15日以降にbrから始まる会計年度で有効です。この基準は2022年1月1日に採用され、会社の財務諸表に実質的な影響を与えていない。
2021年5月、FASBはASU 2021-04、1株当たり収益(主題260)、債務修正および補償(主題470-50)、補償-株式補償(主題718)、およびエンティティ自身の株式のデリバティブおよびヘッジ契約(主題815-40):発行者 は独立株式分類書面コールオプションのいくつかの修正または交換に対して会計処理を行った。この新しい基準は、明確化を提供し、独立株式分類 の修正または交換に対する発行者の書面コールオプション(例えば、権利証)の会計処理の多様性を減少させ、これらのオプションは、修正または交換後も株式分類を維持する。本基準は、2021年12月15日以降の移行期を含む2021年12月15日以降の年次で有効である。会社は、新基準の発効日以降に発生した修正または交換に新基準 を適用しなければならない。本指針は2022年1月1日に採用され、会社の財務諸表に実質的な影響を与えていない。
2020年8月、財務会計基準委員会は、債務転換および他のオプション(主題470-20)および派生ツールおよびヘッジ-エンティティ自己持分契約(主題815-40):実体自己持分における変換可能なツールおよび契約の会計処理 を発表し、負債および持分の特徴を有するいくつかの金融商品の会計処理を明確にする。今回の更新における改訂 は、現金変換モードと受益変換特徴パターンを削除することにより、転換可能債務ツールと転換可能優先株の会計モード数 を減少させる。制約会計モデルは,ホスト契約から個別に識別される組込み変換機能を 個減少させる.分離モード制約を継続する変換可能ツールは、(1)宿主契約と不明確かつ密接に関連する埋め込み変換特徴を有する変換可能ツールであり、派生ツールの定義に適合し、派生ツール会計範囲の例外に適合しない変換可能債務ツール、および(2) 発行された相当なプレミアム転換可能債務ツールであり、そのプレミアム記録は実資本である。さらに、このASUは、変換可能なツールと1株当たりの収益指針の開示要求を改善した。ASUはまた、実質的な会計結論ではなく、遠隔またはイベントによって駆動される形式ベースの会計結論を低減するために、派生製品 範囲例外ガイドを修正する。この更新中の改訂 は,2023年12月15日以降の財政年度およびその財政年度内の過渡期 に適用される。早期採用は許可されるが、2020年12月15日以降の年度を早めることはできない。当社はあらかじめASU 2020−06を採用しており,2021年1月1日から発効しており,新たな変換可能チケットを発行する際に有益な変換機能を確認する必要があるかどうかを評価する必要はない。
2016年2月、米国財務会計基準委員会は、2016−02年度会計基準更新(“ASU”)“レンタル(テーマ842)”を発表した。ASU 2016-02はテナントに経営性賃貸による資産と負債の確認を要求した。テナントは、財務状況表において、リース金を支払う負債(リース負債)と、リース期間内に標的資産を使用する権利を代表する使用権資産とを確認しなければならない。借地期間が12ヶ月以下の賃貸契約については、テナントは、対象資産種別に応じて会計政策選択を行うことが許可され、賃貸資産及び賃貸負債を確認しない。移行期間中、テナントとレンタル者 は、改正された遡及方法を採用した最初の期間開始時にレンタルを確認·計量しなければならない。この改正は、2021年12月15日以降の財政年度と2022年12月15日以降の財政年度内の移行期間内にプライベート会社や新興成長型会社に有効である。FASBは2018年7月にASU第2018-10号“テーマ842レンタルの改訂”とASU第2018-11号“レンタル(テーマ842)の的確な改善”を発表し、2018年12月にASU第2018-20号“レンタル(テーマ842)-レンタル者範囲の狭い改善”を発表した。ASU 2018−10およびASU 2018−20は、ASU 2016−02発表の指導に影響を与える狭義のいくつかの修正を提供する。ASU 2018-11は、ASU 2016-02のすべてのエンティティ を用いて追加(およびオプション)の移行方法を選択することを許可し、この方法によれば、エンティティは、最初に採用日に新しいレンタル基準を適用し、採用期間中に留保収益期間中の初期残高の累積影響調整を確認する。当社は2022年12月31日にASU 2016-02を採用し、2022年1月1日から発効したが、このASUを採用することにより、当社がレンタルを経営している使用権資産と賃貸負債が入金され、金額は約182,732ドルと199,642ドルであり、繰延費用のキャンセル確認は約16,910ドルであった。
市場リスクの定量的·定性的開示について
は適用されない.
| 116 |
管理する
執行役員と役員
次の表には、2023年10月23日現在の私たちの役員と役員に関するいくつかの情報を示しています
| 名前.名前 | 年ごろ | ポスト | ||
| スティーブン·C·グローバー | 64 | 最高経営責任者総裁兼会長 | ||
| Karen A.カシミア | 71 | 首席ビジネス官 | ||
| ピーター·ウルフ | 56 | 首席財務官兼秘書 | ||
| パブロ·A·グズマン医学博士 | 74 | 首席医療官·医事部上級副総裁 | ||
| ロバート·G·フィニツィオ | 52 | 役員.取締役 | ||
| Min Chul Park,博士 | 42 | 役員.取締役 | ||
| ジェームズ·サピルスタイン | 62 | 役員.取締役 | ||
| グレゴリー·フリーターガー | 61 | 役員.取締役 |
執行官
スティーブン·C·グローバーそれは.グローバーさんは、我々の共同創業者の一人で、2022年12月以来、当社のCEOや会長を務めています。グロフさんは2014年3月から2022年12月までOld ZyVersaの最高経営責任者兼社長を務め、2014年3月から2021年9月まで取締役会のメンバーを務め、2021年9月から2022年12月まで会長を務めた。グロフさんは以前Coherus Biosciencesの共同創業者であり、そこで彼は商業戦略、パートナー関係、製品開発努力、そして会社資本に集中した。Coherusに加入する前に、Insmed治療タンパク質会社の社長(2007年から2010年)、およびInsmed Inc.の首席商務官(2007年から2010年)であった。Insmedでは、グロフさんは、生物学的に似たビジネス部門の作成を担当し、マーク社にビジネスを剥離します。首席商務官としてInsmedの戦略審査の流れをリードし,InsmedとTransaveの統合を招いた.Insmedに入社する前に、グローバー·さんは、Andrx Corporation(br}であり、Andrx Corporation(Br)で、Andrx Corporation(2005年-2006年)で上級副社長兼社長を務めていました。Andrxでは、グローバーさんは、Andrx実験室(代謝性疾患や男性健康製品の開発とマーケティング)とAndrx Treeutics(新しい制御放出製品と契約製造の開発に専念)の戦略と運営を担当します。以前、ホフマン·ラローシュ(1984年~1995年)、安進(1995年~1998年)、IMS Health(1998年~2001年)で複数の販売、マーケティング、運営職を務めていた。グローバー·さんはイリノイ州立大学でマーケティングの学士号を取得した。グローバーさんは、富の100強、スタートアップ企業、および起業環境で多方面の経験を持ち、彼はPDS Biotech、クルト財団(マイアミ大学)とAsclepius Lifesciencesの取締役会にも勤めています。治療学分野でのグローバーさんの豊富な経験、ZyVersaに対する深い知識、および他の生命科学会社の取締役会のメンバーとしての彼の継続的な経験に基づいて、グローバーさんは私たちの取締役会のメンバーに選ばれました。GLOVERさんは、企業統合プロトコルに従ってZyVersa によって取締役会メンバーに任命されました。
Karen A.カシミアそれは.カシュミールさんは2022年12月から私たちの首席商務官を務めてきた。カシミアさんは2019年1月から2022年12月までOld ZyVersaで同様の職務を担当し、2014年8月から2019年1月まで副総裁代理を務め、開発とマーケティングを担当した。カシュミルさんはバイオ製薬や医療機器会社の業務計画と実行において25年以上の経験を持っており,これらの会社の規模はスタートアップ会社からフォーチュン100社までである。彼女はMako Surgical Corporation(新興のロボット整形外科会社)でマーケティングコミュニケーション機能を担当し、そこで彼女は1個当たり100万ドルを超えるロボットアームシステム及び一部の膝関節と全股関節置換のための関連インプラント の知名度を確立し、販売を推進することを担当した。カシュミルさんはAuxilium PharmPharmticals新製品マーケティング上級副総裁も務め、Auxilium PharmPharmticalsは男性の健康と孤児の適応に集中する新興製薬会社である。職責は新製品マーケティング業務部門の創設、戦略機会評価、パイプ優先順位、臨床開発の商業監督、及び新しい製品商業化戦略の企画を含む。カシュミルさんはAuxiliumの戦略的パートナーシップ審査プログラムを指導し、複数の指標を持つキー資産xiaflexの欧州権利をファイザー社に授与することになった。Auxiliumに加入する前に,カシュミールさんはアンドレアス実験室で役員高級マーケティング部 を務め,新たに設立された業務部を担当し,男性健康パイプライン製品の商業化に専念した。以前、彼女はNoven、Serono、Abbottで戦略的マーケティングの職を務めていた。
| 117 |
ピーター·ウルフウルフ·さんは2022年12月以来、我々の最高財務責任者兼秘書を務めてきた。ウルフさんは、2015年10月から2019年10月まで、財務副社長を務めた2019年10月から2022年12月まで、Old ZyVersa財務·行政部門の上級副社長を務めました。Wolfeさんは、金融サービス、金融、製薬/ヘルスケア分野で様々な財務職に就いています。最近、Wolfeさんは、様々な医療エンティティにおいて、多くのそのような最初の企業が成功するように、財務的枠組みを開発するために、しばしば複雑なビジネスモデルと付き合っているスタートアップ企業組織を培養しました。ウォルフさんは、医療業界の最後の24年間にずっと医療業界で過ごしていました。そのうちの4分の1は、Kos PharmPharmticalsで過ごしており、Kos PharmPharmticalsは、発売されている完全に統合されたプロの製薬会社です。ウォルフさんはマイアミ大学のビジネスマネジメントの学士号とピッツバーグ大学のMBAの学位を持っています。
パブロ·A·グズマン医学博士グズマン博士は2023年1月から私たちの首席医療官と医療事務上級副総裁を務めています。それまで、彼は2015年1月から私たちの顧問だった。グズマン博士は2017年以来、治療ソリューション国際会社の科学諮問委員会に勤めており、免疫調節に専念している会社である。彼は1971年にゼシシティ聖ペテロ大学で生物学学士号を取得し、1975年にプエルトリコ大学医学院で医学学位を取得し、1980年にボルチモアジョン·ホプキンス病院で介入心臓病学奨学金を獲得した。彼は内科(1978)と心血管疾患(1981)の取締役会認証を持っている。彼は1980年にジョンホプキンス大学のスタッフに加入し、彼の職責は患者の世話、教育、そして犬実験室の臨床と基礎科学研究を含む。彼は同業者評議の定期刊行物に30編以上の文章と多くの要約を発表し、その中のいくつかはアメリカ心臓協会とアメリカ心臓病学会を含む国家会議で発表した。ホプキンス大学の期間中、彼はアメリカ心臓協会臨床心臓病学委員会の会員、北米ペーシングと電気生理学学会の会員、アメリカ心臓病学会の会員になり、そしてボルチモア市病院(現在フランシス·スコットキー病院)心臓挿管実験室の取締役補佐、永久ペースメーカー実験室の連合取締役と心臓導管実験室の連合取締役を務めた。グズマン博士は南フロリダ州で医学/介入心臓病学執行35年 に従事し、1987年、グズマン博士はボカラトンコミュニティ病院(現在ボカラトン地区病院)心臓挿管実験室の取締役研究員に設計され、そして心臓血管造影と干与学会の会員になった。そして、北嶺医学センター心カテーテル実験室の役員補佐となった。彼は大ラウデールカドゥッセ学会の昔の総裁で、北嶺医学センター心血管と肺疾患科主任を務めたことがある。グズマン博士はローデールブルク心臓病協会の管理パートナーであり、ブロヴォド県医学会のメンバーであり、聖十字健康会社の取締役会のメンバーであり、2015年からずっと三一健康会社のメンバーである。彼はCampbell神経科学社と国際治療ソリューション会社の科学顧問委員会のメンバーです。
非従業員取締役
ロバート·G·フィニツィオそれは.さん·フィニツィオは2022年12月以来、取締役会のメンバーを務めてきた。Finizioさんは、Old ZyVersaで2018年9月から2022年12月まで同じ役割を果たしました。フィニツィオさんは現在、医薬品開発会社PleoPharmaの執行役員であり、同社はFDAによって承認された安全で効果的な薬物使用障害を治療する方法を探すことに集中しています。Finizioさんは、TreateuticsMD Inc.の共同創業者であり、2008年から2021年11月までの間に同社のCEOおよび取締役を務めた革新的な女性向け健康製薬会社です。Finizioさんは、内視鏡の専門家会社(ESI)で20年以上の医療経験を持ち、腹腔鏡装置のアウトソーシングと術中の技術的支援の分野で先頭に立った彼のキャリアを開始しました。ESIの在任中、Finizioさんは地域管理職に昇進し、最終的には製薬自動化分野のリーダーOmNicell Technologiesに参加するために離れました。マクロ同盟時にフィニーツィオは取締役の販売員を務め,最終的に2001年に会社を退社し,人と共同でCareFusionを設立した。CareFusionは病院患者の薬品使用、血液と看護点標本検証安全システムの先駆者である。Finizioさんは、2008年にTreateuticsMDを共同で創設し、女性医療、製薬技術、臨床ソフトウェア、および患者のセキュリティの背景に合わせて開発しました。フェニーツィオさんは、生物フロリダとボカラトン警察財団の2つの非営利団体です。Finizioさんは、医療事業に従事する前に、医学予科および心理学専攻の文学学士号をマイアミ大学を卒業し、日本で英語を大阪で教授した。フィニーツィオさんは、以前の医療産業の発展に関する豊富な経験から、当社の取締役会のメンバーに選出されました。Finizioさん(br}は、業務統合プロトコルに従ってZyVersaによって取締役会のメンバーに任命されました。
分 Chul朴智星博士それは.Park博士は2022年12月から私たちの取締役会のメンバーを務めてきた。朴槿恵氏は2021年5月から2022年12月までOld ZyVersaで同様の職務を担当した。Park博士は英傑大学薬学院のアシスタント教授です。Park博士は韓国ソウルバイオ製薬会社CureBioTreateuticsの最高経営責任者と取締役最高経営責任者を務め、2020年10月から2022年4月まで、癌、脱毛、傷のケアを治療するポリペプチド薬を開発した。Park博士はまた、2017年8月から2022年3月までの間にクリビオ首席技術官総裁と取締役執行副総裁を務めている。Park博士は2019年3月から2022年2月まで韓国大学薬剤科でADJUST教授を務めた。Park博士は製薬業界で10年間の仕事経験を持ち、薬物標的発見、分析開発と候補薬物最適化領域で仕事をしたことがある。彼は分子と細胞生物学の基礎と応用について専門的な知識を持っている。彼が以前クレビオ治療会社で務めていた職務中、Park博士は3つの製薬会社との共同開発協定、許可協定を含む融資と業務開発取引を指導した。また,化粧品ポリペプチドを開発し,抗体,循環腫瘍細胞による診断法,癌幹細胞解析システムを共同開発した。また,Park博士はTME治療会社の共同創業者であり,現在はその科学顧問委員会のメンバーである。
| 118 |
2017年まで、Park博士は韓国ソウル新バイオテクノロジー会社の最高経営責任者と取締役を務めてきたが、そこで彼は契約実験と生体材料業務の拡大を助け、新経済学とクレビオとBumYoung Bio,Ltd.をCureBio.に合併する努力を指導した。Park博士は化粧品ポリペプチドと皮膚疾患ポリペプチド候補薬を開発し,許可を得た。Park博士のキャリアはソウル国立大学医学生物融合研究センターの高級研究アシスタントbrから始まり、そこで彼は1種のエクソン分離装置の外部許可取引を開発し、指導し、彼は2つの抗腫瘍発癌ポリペプチドの外部許可取引を担当した。Park博士はソウル国立大学薬剤科で薬物生物科学博士号を取得した。Park博士は製薬業界と薬物開発技術を深く理解したため、私たちの取締役会メンバーに選ばれた。Park博士は企業合併協定によりZyVersa が我々の取締役会メンバーに任命された。
ジェームズ·サピルスタインそれは.ジェームズ·サピルスタインは2023年1月以来私たちの取締役会のメンバーを務めてきた。サピルスタインさんは現在、第一弾生物製薬(ナスダック:FWBI)の会長、CEO兼社長である。サピルスタインさんのキャリアは、ViRead(テノホビル)を発売するためにギリッド·サイエンス社に入社した後、2002年に開始された。2002年、Serono研究所代謝および内分泌学執行副社長の職を受けた。その後、2006年、当時の民間会社Tobira Treeuticsの創設最高経営責任者となった。Tobira治療会社は2016年にAllergan に買収された。2012年、SapirsteinさんはAliqua,Inc.のCEOとなった。その後、2014年3月から2018年10月までの間にContravir PharmPharmticalsのCEOを務めた。これらはすべて上場企業です。さん·サピルスタインは、彼がCEOを務める様々な活動の中で、ベンチャー投資と公共資本市場を通じて3億ドル以上の資金を調達した。 彼は2015年と2016年の安永年間企業家賞の決勝に進出した。First Wave Bio Pharmaの取締役会メンバーを務めたほか、Sapirsteinさんは現在も、ノキア生物科学会社(Enochian Biosciences)とブルーバイオワクチン会社(Blue Water Vaccines)の取締役を務めている。2017年2月から2019年2月にかけて、ニュージャージー州バイオ製薬業界協会BioNJ取締役会長を務めた。また、彼はBIO(バイオテクノロジー革新組織)の取締役会メンバーであり、BIOは医療保健分野の公共政策とネットワークを推進するリード的なバイオテクノロジー貿易組織であり、彼は新興会社のbr部門管理委員会のメンバーである。Sapirsteinさんが取締役会のメンバーに選ばれたのは、バイオテクノロジーや製薬業界の幹部や、これらの業界の複数の上場企業で役員を務めた経験があるからだ。
グレゴリーフレターガーそれは.グレゴリー·フレターグは2023年1月以来、私たちの取締役会のメンバーを務めてきた。Freitagさんは現在、PDSバイオテクノロジー会社(ナスダックコード:PDSB)の取締役メンバーであり、会社は臨床段階免疫療法会社であり、その独自のVeramuneとInfectimune T細胞活性化プラットフォームに基づいて、癌や感染症免疫療法パイプラインを開発し続けています。彼はまだ末梢神経修復に取り組んでいるリード再生医薬会社Axogen,Inc.(ナスダックコード:AXGN)の取締役会メンバーである。Freitagさんは、2020年6月から2021年3月までの間にAxogenの特別法律顧問を務め、2011年9月から2020年6月までの間に総法律顧問を務め、2011年9月から2014年5月まで、2015年8月から2016年3月までの間に財務大臣を務め、2014年5月から2018年10月までの間に上級副社長業務開発大臣を務めています。Freitagさんは、LecTec CorporationのCEO、CEO、取締役会メンバーであり、LecTec Corporationは、2011年9月にAxogen Inc.と統合され、2011年6月から2011年9月までの知的財産権ライセンスおよびホールディングスです。FreiMc,LLCの担当者であったFreitagさんは、2009年5月から現在まで、戦略的ガイダンスやビジネス開発コンサルティングサービスを提供する医療·生命科学コンサルティング会社およびコンサルティング会社を作成しています。FreiMc,LLCの作成前に、Freitagさんはファイザー·ヘルス·ソリューション会社の業務開発担当者であり、2006年1月から2009年5月までの間、ファイザー社の前子社であった。Freitagさんは、2005年7月から2006年1月までの間、Guidant Corporationの事業開発部門で働いている。Freitagさんは、Guidant社に加入する前に2000年3月から2005年初めまでバイオテクノロジー·ツール·スタートアップ企業HTS BioSystemsのCEOを務めていました。Freitagさんは、1995年12月から2000年3月まで、公共医療診断会社Quantechの最高経営責任者、財務責任者、および法律顧問を務めました。この前、Freitagさんはミネソタ州ミネアポリスで会社法の仕事をしていました。Freitagさんは、シカゴ大学の法学博士号、ミネソタ州Macalesterアカデミーの経済学、ビジネス、法律、社会専門の学士号を所有しています。Freitagさんが取締役会のメンバーおよび会社監査委員長に選ばれたのは、上場企業の特別な知識として、それに関連する報告、コンプライアンス、金融市場、財務および法律の専門知識を含む高度な管理者としてのリーダーシップと経験、および生命科学分野での30年以上の経験を担当してきた上場企業の特別な知識を持っているからです。
| 119 |
取締役会委員会
私たちの取締役会の常務委員会は監査委員会、報酬委員会、指名と会社管理委員会で構成されています。私たちの委員会は時々他の委員会を設立するかもしれない。当社の最高経営責任者や他の役員は、定期的に非執行役員に仕事および監査、報酬、指名および会社管理委員会を報告し、私たちの活動の効果的かつ効率的な監督を確保し、適切なリスク管理と持続的な管理制御評価に協力している。私たちの取締役会のリーダーシップは、会社の活動に適切なリスク監視を提供していると信じています。
監査委員会
監査委員会は議長を務めるグレゴリー·フレターグ、ロバート·G·フィニツィオ、ジェームズ·サピルスタインで構成されている。我々の取締役会は、取締役上場規則 と取引所法案規則10 A-3の独立性要求に基づいて、監査委員会の各メンバーが独立したナスダックになる資格があることを決定した。少なくとも1人の監査委員会のメンバーは、S-K条例第407(D)(5)項で定義された“監査委員会財務専門家”となる資格がある。監査委員会の目的は、米国証券取引委員会が要求する監査委員会報告書を準備することであり、この報告書は、米国証券取引委員会規則および条例の要求に基づいて会社が提出する任意の依頼書または募集説明書に含まれ、(1)財務諸表の品質と完全性、(2)法律および規制要件の遵守、(3)会社独立の公認会計士事務所の資格および独立性、(4)社内監査機能の履行状況(ある場合)、および(4)社内監査機能の履行状況を準備することである。(五)当社の独立公認会計士事務所の経営状況。私たちの取締役会は監査委員会の書面規定を採択しました。この定款は私たちの会社のサイトにあります(Www.zyversa.com).
報酬委員会
報酬委員会はロバート·G·フィニツィオが議長を務め,朴敏哲(Min Chul Park)博士とジェームズ·サピルスタインで構成されている。私たちの取締役会は、私たちの会社のウェブサイトにある報酬委員会の書面規定を採択しました(Www.zyversa.com)。 報酬委員会の目的は、(1) 会社の報酬計画およびその役員および役員の報酬を策定すること、(2)会社の奨励性および株式ベースの報酬計画を監督すること、および(3)会社が米国証券取引委員会の規則および規定に従って提出しなければならない任意の委託書または募集説明書に含まれなければならない報酬委員会報告の準備を支援することである
指名と会社管理委員会
指名と会社統治委員会はグレゴリー·フレターグ、ミン哲·パーカー博士、ジェームズ·サピルスタインからなり、議長を務めた。私たちの取締役会はすでに指名と会社管理委員会のための書面規定を採択して、私たちのbr会社のサイトにすることができます(Www.zyversa.com)である。指名と会社管理委員会の目的は、(1)取締役会の承認基準に基づいて取締役会が推薦した指名人選を取締役会に決定、審査すること、(2)取締役会を選抜または推薦して次の年度株主総会の取締役指名人選を選択すること、(3)監督取締役会と管理層の年間評価、および(4)取締役会に各委員会の取締役指名人選を推薦することを直接履行することを支援することである。
| 120 |
ビジネス行動基準
会社は、当社のウェブサイトで調べることができる当社のすべての取締役、上級管理者、および従業員に適用される新しいビジネス行動基準を採択しました。 会社の商業行動基準は、S-K条例第406(B)項で定義された“道徳基準”である。 社のインターネットサイトアドレスは非アクティブテキスト参照としてのみ提供されていることに注意してください。当社は、その会社のウェブサイト上で、その道徳規則条項の改正または免除について、任意の法律 規定の開示を行う。
報酬委員会と内部関係者の参加
2022年度の間、または任意の他の時間に、私たちの報酬委員会は、私たちの役員または従業員であることはありません。私たちの役員は、取締役または任意のエンティティの報酬委員会(または同等の機能を有する他の委員会)のメンバーを務めていません。そのうちの1人は、取締役会の役員または報酬委員会のメンバーを務めたことがあります。
取締役会独立性
ナスダック規則は一般に独立役員が上場会社の取締役会で多数を占めなければならないことを要求しています。各推薦役員の要求および提供されたその背景,仕事および従属関係(家族関係を含む)に関する資料に基づき,5(5)名の取締役のうち4名を代表するRob G.Finizio,Min Chul Park,Ph.D.,James SapirsteinおよびGregory Freitagを“独立”取締役とすることを決定し,この語は米国証券取引委員会が適用する規則や規則およびナスダックの上場要求および規則によって定義されている.
責任と賠償の制限事項
“第二次改正及び再署名された会社登録証明書”(以下、“憲章”と略す)に含まれる条項は、当社取締役がその受託責任に違反して負う金銭損害賠償責任を制限しているが、DGCLが免除できない責任は除外する。 デラウェア州法律規定によると、会社役員はその受託責任に違反した個人責任に対して個人責任を負わないが、次のいずれかの責任を除く
| ● | 会社や株主への忠誠義務に違反します |
| ● | 善意でない行為やしないこと、または故意の不正行為に関連しているか、または違法であることを知っている |
| ● | 会社条例第174条に規定する償還、又は株の不正な支払又は株式の不法な買い戻し、又は |
| ● | 取締役は不正な個人利益を得る任意の取引 を得る. |
この責任制限 は、連邦証券法による責任には適用されず、禁止救済や撤回のような公平な救済措置の可用性にも影響を与えない。
定款及び第二次改正及び再改正の付例(“附例”)はまた、法律で許容される最大限に当社の役員及び役員を賠償し、他の上級者及び従業員及び他の代理人を賠償することができることを規定している。“付例”に規定されている賠償には,少なくとも賠償を受ける側の不注意や重大な過失が含まれていると考えられる。別例(Br)はまた、附則が賠償を許可するか否かにかかわらず、任意の高級管理者、取締役、従業員、または他の代理人を代表して、そのポストでの行為によって引き起こされる任意の責任を保険にかけることを可能にする。
私たちの定款書類に規定されている賠償のほかに、私たちの役員や役員と単独の賠償協定を締結しました。これらの合意は、他の事項に加えて、この人が取締役または役員サービスとして、または私たちの要求に応じて引き起こした任意の訴訟または訴訟で発生した費用、判決、罰金、および和解金額を賠償することを規定している。これらの条項や合意は,適格者を取締役や役員に引き付けることや維持するために必要であると考えられる。
| 121 |
役員報酬
2022年12月31日までの年間給与表をまとめる
以下の報酬集計表には、2022年と2021年に当社および子会社に様々な身分でサービスを提供するために支払われ、指定された役員(br}上級管理者(“NEO”)または取得された報酬情報が表示されます。
| 名称と主要ポスト | 年.年 | 給料(元) | オプション賞(1)($) | 総補償(ドル) | ||||||||||||
| スティーヴン·C·グローバー | 2022 | 450,500 | 1,027,948 | 1,478,448 | ||||||||||||
| 共同創業者、CEO、総裁兼会長 | 2021 | 450,500 | 1,803,896 | 2,254,396 | ||||||||||||
| ニコラス·A·ラベラ(2) | 2022 | 325,000 | 385,394 | 710,394 | ||||||||||||
| 首席科学官兼研究開発部上級副総裁 | 2021 | 325,000 | 425,902 | 750,903 | ||||||||||||
| カレン·A·カシュミール | 2022 | 300,000 | 282,622 | 582,622 | ||||||||||||
| 首席商務官 | 2021 | 300,000 | 312,328 | 612,328 | ||||||||||||
| ピーター·ウルフ | 2022 | 275,000 | 282,622 | 557,622 | ||||||||||||
| 首席財務官兼秘書 | 2021 | 275,000 | 312,328 | 587,328 | ||||||||||||
| パブロ·グズマン医学博士(3) | 2022 | - | - | - | ||||||||||||
| 首席医療官と医事部上級副社長 | 2021 | - | - | - | ||||||||||||
| (1) | 報告されたbr金額は,FASB ASCテーマ718に基づいて計算された2022年12月31日と2021年12月31日までの年度内に,我々の2014年持分インセンティブ計画により取締役に付与された株式オプションの付与日公正価値合計を代表する。付与日の公正価値を計算する際に使用する仮定については,我々の財務諸表付記11を参照されたい. |
| (2) | 我々の元首席科学官、研究開発部門高級副総裁は2023年8月18日に退職した。 |
| (3) | グズマン博士は2023年1月26日から我々の首席医療官と医事事務上級副総裁を務めている。 |
役員報酬スケジュール
雇用契約を実行する
スティーブン·C·グローバー
2019年1月1日、吾らはStephen C.Gloverと雇用協定(“GLOVER雇用合意”)を締結した。 GLOVER雇用協定の条項によると、彼は最高経営責任者を務め、毎年45万ドルの基本給を受け取り、この基本給金額は取締役会や給与委員会によって定期的に調整される可能性がある。また、グローバーさんは、目標金額がグローバーさんの基本給の50%(50%)に相当する年間ボーナスを得る資格がある。 その年間ボーナスの実際の金額は、当社の目標の達成度と、グローバーさんの個人目標に基づいて、それぞれの場合において、我々とグローバーさんが年間ボーナスに関連するカレンダー年度について決定したものである。会社の目標の達成度と1年間のグローバーさんの個人的な業績目標は、合理的な情動に基づいて決定しなければなりません。また、グローバー雇用契約の条項によれば、グローバーさんは、当社の既存の持分インセンティブ計画または将来採用される可能性のある任意の他の持分インセンティブ計画に基づいて時々配当金を獲得する資格があり、報酬条項および条件(ある場合)は、当社の取締役会または報酬委員会によって適宜決定されます。グローバーさんは、私たちが採用している任意の役員福祉プログラムや計画に参加する資格があります。
“グローバー雇用契約”によれば、吾らはあらかじめ60日前に書面でグローバーさんに通知した後、いつでもグローバーさんに対する雇用を打ち切ることができる(その言葉は“グローバー雇用契約”に定義されている)。グローバーさんは、90日以内に我々に書面で通知を出した後、正当な理由(グローバーさんの雇用契約で定義されている)でその雇用関係を終了することができ、その通知を出した後、我々は、グローブスさんが正当な理由と考えている状況を解決するための30日の時間があるが、グローバーの雇用契約に規定されているいくつかの条件を遵守しなければならない。
労働さんの雇用が支配権変更後の期間(グローバー雇用契約で定義されているような)以外のいかなる理由又は正当な理由で終了した場合でも、グローバーさんは(I)保険債務(グローバー雇用契約で定義されているように)、(I)グローバーさんの基本給に相当する15か月の解散料(グローバーさんが解雇された後60日以内に次の正常賃金の日に一度に支払うこと)及び(Ii)当選した場合、会社はグロフさんに15ヶ月のコブラの健康福祉を精算する。
それにもかかわらず、グローバーさんが支配権変更後12ヶ月以内に理由なく雇用を中止または正当な理由のある辞任を受けた場合(グローバー雇用契約で定義されるように)、グローバーさんは(I)課税債務を取得し、(Ii)グローブスさんの基本給36カ月分の散逸料 (グローバーさんが解雇されてから60日以内の次の正常賃金日から2ヶ月以内に支払われる)、(Iii)グロフさんへの延滞金または賠償金(Iv)が当選すれば、当社は、グローバーさんの24カ月間のあるコブラの健康福祉を返済し、(V)グローバーのさんが発生した例年の目標年次配当金の支払い終了に相当し、(Vi)グローバーさんの未償還オプションを付与して発行された普通株式に代えて、(A)ナスダックで報告された普通株式終値に相当する超過積の現金を受け取ることになる。終了日または終了日に最も近い最低入札および最高入札の平均値(Br)の終了日または最近終了日から計算され、その時点で行使可能であったか否かにかかわらず、グローバーさんの保有する1株当たりの使用価格に任意の適用可能な現金付加価値額を加え、(B)その等購入持分ごとに含まれる普通株式の数を乗じたものであり、(Vii)その等の終了により生じた任意およびすべての法的費用金額の支払いに相当する。
| 122 |
“雇用契約”によると、グローバーさんの雇用を書面で通知した後、いつでもカルロス·さんの雇用を終了することができます。クロスさんは九十(九十)日前に通知会社に書面で通知した後、正当な理由なく自発的に雇用を打ち切ることができます。しかしながら、我々は権利を留保し、さんの辞任通知をグローバーに書面で通知した後、さんの辞任通知を受けて、速やかにそれを発効させ、ギャロフさんの辞任を速やかに発効させる通知を出し、あるいはグローバーさんの事業の最終日前に適切なその他の日に発効させると考えた。もしグローバーさんの雇用関係が何らかの理由であっても正当な理由なく終了した場合、(I)彼が雇われた最終日に得られた基本給を取得する権利があり、(Ii)彼は計上されているが使用されていない休暇、 (Iii)その雇われた最終日またはそれまでに雇用契約に従って精算可能な費用、ならびに(Iv)我々の任意の持分補償計画に基づいて当社の任意の持分補償計画に基づいて既得金額または福祉を得る権利がある。
“グローバー雇用契約”によれば、我々はグローバーさんの雇用をいつでも終了する旨の通知を書面で書くことができます。 グローバーさんは、正当な理由がない場合に自発的に雇用関係を終了することを2週間前に書面で通知することができます。
吾らは2022年7月20日にStephen C.Gloverと新たなエグゼクティブ採用契約(“新Gloverプロトコル”) を締結し、これにより業務統合が完了した後も発効することに同意した。これにより、吾らは業務合併完了後もGLOVERさんを我々の総裁として保持することに同意したが、新たなGLOVERプロトコルの条項や条件に制限される必要がある。新しいグローバー協定はグローバー雇用協定を代替した。新グローバー契約によると、グローバーさんの雇用条件には、他の事項を除いて、独自の情報および制限的な契約契約に同意し、署名することが含まれる。
新グローバー協定の条項によると、グローバーさんは引き続きCEOを務め、当社の標準的な給与慣行に基づいて年間550,000ドルの基本給を受け取る予定です。グローバーさんの基本給と今後の報酬の増加は、取締役会によって定期的に検討され承認されます。また、グローバーさんは、業績に基づく年間の現金ボーナスを得る資格があり、目標金額がグローバーさんの基本給の55%(55%)に相当し、取締役会は、グローバーさんが実績のある目標を達成する状況に応じて見直し、調整することになる。グローバーさんが年間ボーナスを獲得するか否かは、また、厚生労働省がボーナスを支払う際に引き続き我々に雇われているか否かにかかっており、そうでなければ、年間ボーナスは没収される。また、新グローバー契約の条項によれば、グローバーさんは、自らの普通株式について何らかの配当金を得る資格を有することができ、ただし、当該配当金計画の帰属その他の条件並びに当該報酬を付与する必要があるときは、当該グロフさんと契約を締結し、これを制限するものとする。グローバーさんは、似たような状況にある従業員と同じbrに基づいて、時々彼が雇われている間に有効になる計画で、私たちの福祉計画に参加する資格がある。
新グローバー協定(Br)によれば、我々は、グローバーさんに書面で通知した後、いつでもグローバーさんの雇用を終了することができる(新グローバー契約で定義されている)。我々がそれまでに彼の雇用関係を終了しようとしていたグローバーさんに通知がなければ、さんは新グローバー協定に規定されている条件を満たす場合には正当な理由(新グローバー協定で定義される用語)に基づいて60日以内に書面で通知を出すことができ、われわれはその条件に十分な理由があると考えたグローバーさんを30日以内に解決することができる。もしグローバーさんが正当な理由で辞任し、その解雇 が退職(新グローバー合意の定義のように)を構成している場合、グローバーさんが新グローバー協定の義務を履行した場合、グローバーさんは退職給付を受ける資格がある(新グローバー協定で定義されるとおり)その条項および条件は、我々が理由なしにその雇用関係を終了する権利を有する条項および条件と同じである。
われわれがいかなる時にも理由なく登用を中止する場合、又はグロフさんが正当な理由で辞任し、かつそのような終了が離職を構成した場合、グローバーさんは計算すべき債務(新グローバー協定に定義される条項)を取得する権利があり、かつ、グローバーさんが新グローバー協定に規定する義務を履行する場合には、グローバーさんが次のような給付を受ける権利がある。(I)グラバーさんがその時点で24か月間の基本給に相当する額有効日(br}新グローバープロトコルで定義されている用語)が発行された後の定期賃金請求日は、均等分割払いで支払われる。(2)グローバーさんが解雇されてから60日以内に一度に支給される額は、グローバーさんが解雇される前年に稼いだ未払いボーナスに相当する。(3)最低額が次の2つの額に等しい:(A)グローバーさんが終了するまでの業績年度に支払われるボーナスと、(B)グローバーさんがこのような終了をした業績年度に獲得すべきボーナスとを、いずれも、グローバーさんが解雇された日までの割合で計算し、グローバーさんが解雇されてから60日以内に一度に支払うことと、(IV) グローバーさん離職日までの間、グローバーさんの持分奨励が付与されていない日は100%既得株式オプションとなり、(A)グロフさん離職後18ヶ月、 または(B)適用奨励契約で規定されているこのような既得オプションの元の満期日まで行使が継続されます。そして(Iv)当選した場合は、我々は、18ヶ月に及ぶ特定のCOBRAの健康福祉のために、新たな“グローバー合意”の条項や適用上の法令に基づいて、グローバーさんに精算することになります。
それにもかかわらず、吾等(又は何れかの既存又は買収会社)が、支配権変更発効日(定義“グローバー雇用契約”と定義)の発効日前90日前及び発効日後24ヶ月以内に、理由なくグロフさんの雇用を終了し、又はグローバーさんが正当な理由で辞任した場合、グローバーさんは計算すべき債務を獲得する権利を有し、かつ、グローバーさんが新たなグローバー合意に義務を履行することを義務づけられた場合には、グローバーさんは、理由もなく彼の雇用を打ち切る条件と同じ条件で福祉を受ける資格がある。ただし、カルロス·さんがその終了年度に、グローバーさんの基本給の55%(55%)に相当する賞金を得た場合、および、制御権の変更が、会社の所有権の変更、会社の実際の支配権の変更、または会社の資産のかなりの部分の所有権の変更である場合、そのような終了に対応する(または残りの対処)解散費の累計金額は、制御権の変更後30日後または30日以内に一度に支払わなければなりません。
新グローバー契約によれば、グローバーさんの雇用をいつでも終了することができる旨の書面通知をいたします。もしグローバーさんの雇用関係がいつでも理由で終了すれば、グローバーさんは解散費やその他の解散費や福利厚生を得ることはできませんが、我々の標準賃金政策によれば、我々はグローバーさんに計算すべき債務を支払うことになります。グローバーさんは、30日以上前に私たちの会社を辞めることを通知する書面で通知しました。もしグローバーさんが何らかの理由で(正当な理由で辞任した場合を除く)私たちの仕事を辞めた場合、グローバーさんは解散費用またはその他の解散費または福利厚生を受けることはありませんが、我々は支払うべき債務を提供します。
グローバーさんは、いくつかの散逸料福祉の条件の一つを得る権利があります。彼は、私たちが受け入れることができる60のフォーマットのために、有効な免除 を交付する義務があります(新しいグローバー協定で定義されています)これは…。終了後の翌日またはプレスリリースに規定されているより早い日。
| 123 |
ピーター·ウルフ
私たちは、2022年7月20日に、Peter Wolfeと業務統合完了後に発効するPeter Wolfeとの間で合意(“Wolfe採用合意”)を締結し、これにより、私らは、業務統合が完了した後、Wolfe採用合意の条項と条件に基づいて、Wolfeさんを我々の最高財務責任者として留任させることに同意しました。Wolfeさんの雇用契約によれば、Wolfeさんの雇用条件には、他の事項を除いて、独自の情報および限定的な契約協定に同意し、署名することが含まれています。
ウルフ雇用契約の条項によると、ウォルフさんは当社の標準賃金慣行によると、毎年395,000ドルの基本給を記録している最高財務責任者として働くことになります。ウォルフさんの基本給と今後の給与の伸びは、取締役会によって定期的に審査·承認されます。また、ウォルフさんは業績効果に基づく年間現金ボーナスを得る資格があり、目標金額はウルフさんの基本給の40%(40%)に相当し、取締役会はウルフさんが一定の業績目標を達成する状況に応じて検討·調整することになる。ウルフさんが年間ボーナスを獲得するか否かは、ウォルフさんがボーナスを支給する際に我々に雇用され続けるか否かにも応じて異なり、そうでなければ年間ボーナス は没収される。さらに、ウルフ雇用協定の条項によれば、Wolfeさんは、我々の普通株式について何らかの配当を得る資格がある可能性があり、報酬を付与される当社の持分計画の帰属およびその他の条項および条件ならびに我々が提供する権利とWolfeさんとの合意の制限を受けることができます。ウォルフさんは、似たような立場にある従業員と同じ立場にある私たちの福祉計画に参加する資格があり、彼の在任中に時々発効する資格がある。
Wolfeは雇用契約に基づき、吾らはWolfeさんに書面で通知した後、随時Wolfeさんの雇用を終了することができる(この用語ではWolfeは雇用契約で定義される) 。もし我々が以前にWolfeさんに彼の雇用関係を終了しようとしていることを通知していなかった場合、Wolfeさんは雇用契約に規定されている条件に基づいて(Wolfe雇用契約で定義される)十分な理由(Wolfe雇用契約で定義されている)に基づいて彼を私たちの雇用関係で辞任することができる30日以内に私たちに書面で通知することができる。Wolfeさんが正当な理由で辞任し、その解雇が雇用合意で定義されるように離職する場合(Wolfeさんが雇用合意の下での義務を履行する場合には、Wolfeさんはその雇用関係を理由なく終了する資格がある(br}と同じ条項と条件でServerance福祉を受ける資格がある(この条項はWolfe雇用合意で定義される)。
Wolfeさんの雇用をいつでも理由なく終了する場合、またはWolfeさんが正当な理由で辞任し、そのような終了がサービスから切り離された場合、Wolfeさんは課税の債務を獲得する権利があり(この条項はWolfeさんの雇用契約で定義される)、そしてWolfeさんがWolfeさんがその雇用契約の下で義務を履行する場合には、Wolfeさんは次のような福利厚生を得る権利を有するものとする:(I)Wolfeさん当時12ヶ月の基本給の額に相当する。発効日(“ウルフ雇用協定”で定義されているように)が発表された後、定期的に手配されている給与支給日には均等分割払いで支払われる。(Ii)Wolfeさんが解雇される1年前に稼いだ未払いのボーナス額に相当し、Wolfeさんが解雇されてから60日以内に一括払いになります;および(Iv)が当選した場合、我々はWolfeさんに雇用契約および法律法規の適用条件および条件に基づいて、12ヶ月間にわたって特定のCOBRA健康福祉を返済することになります。
上記の規定にもかかわらず、われわれ(または任意の既存または買収した会社)が理由なくWolfeさんの雇用を中止するか、またはWolfeさんが支配権の変更(定義:Wolfe雇用協定)の発効日前90日以内および発効日後24ヶ月以内に正当な理由で辞任する場合、Wolfeさんは計算すべき債務を獲得する権利を有し、Wolfeさんは雇用協定の義務を履行することに制限される。ウルフさんは福祉を受ける資格があり、条件は我々が理由なくその雇用関係を終了する権利があることと次の条件と同じであるが、コントロール権の変更が会社の所有権の変更、会社の実際の支配権の変更または会社の資産の大部分の所有権の変更であれば、制御権変更後30日以内または制御権変更後30日以内に終了契約の解散料の累計額 :(I)ウルフさんは、ウォルフさんの基本給の40%(40%)に相当する賞金をその終了契約後60日以内に獲得し、ウルフ契約終了後60日以内に一度に支払う必要があります。(Ii)吾等がWolfeさんに発した持分報酬のうちのいずれかが、制御権変更が終了した時点でも完了していない場合 は、当該制御権変更中に生存エンティティが負うまたは継続する場合(その条項によれば)、当該持分報酬の非帰属部分は、Wolfeさんの終了時に100%帰属する。
ウルフ雇用契約によれば、我々はウルフさんに書面で通知することができ、随時ウルフさんの雇用を終了することができる。ウルフさんの雇用関係がいかなる理由でいつでも終了すれば、ウルフさんは解散費やその他の解散費補償または福利厚生を得ることはできないが、我々の標準賃金政策によれば、ウォルフさんに債務を計上することになる。ウォルフさんは30日以上前に私たちに当社の仕事を辞めるよう通知書を書きました。ウォルフさんが何らかの理由で(辞任を除く十分な理由がある)私たちの仕事を辞めた場合、ウォルフさんは離職金やその他の解散費や福利厚生を受けることはありませんが、我々は債務を支払うことになります。
ウォルフさんはいくつかの離職福祉の条件の1つを得る権利があり、(ウルフ雇用協定に定義されているように)有効な免責条項を署名および交付する義務があり、そのフォーマットは我々が受け入れることができる60ですこれは…。終了後の翌日またはプレスリリースに規定されているより早い日。
| 124 |
カレン カシミア
2022年7月20日、吾らはカレンカシミアと幹部採用協定(“カシミア採用協定”) を締結し、この協定は業務合併完了後に発効し、これにより吾らは業務合併完了後、カシミア採用協定の条項と条件に基づいて、引き続きカシュミールさんが私たちの首席商務官に留任することに同意した。カシミア雇用協定によると、他の事項に加えて、カシュミールさんの雇用条件には、彼女の合意と独自の情報の署名と制限的な契約協定が含まれている。
カシミア雇用協定の条項によると、キャシュミールさんは首席商務官を務め、私たちの標準給与慣行に基づいて32万ドルの基本年収を得る。カシュミールさんの基本給と将来の賃金増加は取締役会によって定期的に審査され、承認されるだろう。また、カシュミルさんは業績に基づく年間現金ボーナスを得る資格があり、目標金額はカシュミルさんの基本給の30%(30%)に相当し、取締役会はカシュミルさんが何らかの業績目標を達成した状況に応じて審査·調整する。カシュミールさんが年末賞を受け取るかどうかもまた、カシュミールさんが年末賞を授与する時に引き続き私たちに雇われているかどうかにかかっており、そうでなければ年末賞は没収される。また、カシミア雇用協定の条項によると、奨励を与えられた当社の株式計画の帰属およびその他の条項と条件に基づいて、ケシュミールさんは私たちの普通株のいくつかの持分奨励を獲得する資格がある可能性があり、私たちはカシミアさんと締結した協定を提供します。カシュミールさんも似たような状況にある従業員と同じように私たちの福祉計画に参加する資格があり、彼女が雇われている間に時々施行される。
“カシミア雇用協定”によると、私たちはカシュミルさんに書面で通知した後、カシュミールさんの採用をいつでも理由なく終了することができる(この用語は“カシミア雇用協定”に定義されている)。もし私たちがカシミールさんに私たちが彼女の雇用関係を終わらせるつもりだったことを知らせなかったら、カシュミールさんは30日以内に書面で通知することができます。カシュミルさんが正当な理由だと思っている条件を解決するために30日の時間がありますが、カシミア雇用協定に規定されているいくつかの条件を守らなければなりません。カシュミルさんが良い理由で退職し、その解雇が離職(“カシミア雇用協定”で定義されているように)であれば、カシュミールさんが“カシミア雇用協定”の下での義務を履行した場合、カシュミールさんは私たちと理由なく雇用関係を終了する権利のある条項と条件で退職福祉を受ける資格がある。
もし私たちがいつでもカシミールさんの雇用を理由なく中止したり、カシミールさんが正当な理由で退職し、このような構成の退職を中止した場合、カシミールさんは計算すべき債務を得る権利があります(この用語は“カシミール雇用協定”に定義されています)、カシミールさんが“カシミール雇用協定”に規定された義務を履行するという前提の下で、カシミールさんは以下の福祉を受ける権利があります:(I)カシミールさんの当時の12ヶ月の基本給に相当する金額。支給発効日(カシミア雇用協定で定義されている)の後、定期的に手配されている賃金支給日には均等分割払いで支払われる。(Ii)カシミアさんの退職後60日以内に、前年(br}カシミアさんが解雇されたときに稼いだ未払いボーナスに相当する金額を一度に支払うこと、および(Iv)当選した場合、カシミア雇用協定の条項や条件、適用される法律や法規に基づいて、12カ月に及ぶあるコブラの健康福祉をカシミアさんに返済する。
上記の規定にもかかわらず、私たち(または任意の既存または買収した会社)が支配権変更発効日(“カシミア雇用協定”の定義参照)の発効前90日以内と発効後24ヶ月以内に、カシミールさんの雇用関係を理由なく中止したり、キャシュミルさんが正当な理由で辞任したりすれば、キャシュミルさんは計算すべき債務を獲得する権利があり、ケシュミルさんが“カシミール雇用協定”に規定されている義務を守るという制約を受けることになる。カシュミールさんは、私たちと理由なく雇用関係を中止し、以下と同じbr条件で離職金を受け取る資格がありますが、コントロール権の変更が会社の所有権の変更、会社の実際の支配権の変更、あるいは会社の大部分の資産所有権の変更であれば、契約終了時に支払うべき解散費(または余剰金)の累積金額は、支配権変更後30日以内に一度に支払わなければならない:(I)キャシュミルさんは、契約終了当時にキャシュミール基本給の30%(30%)に相当するボーナスを獲得し、キャシュミルさんが解雇されてから60日以内に一度に支払う。および(Ii)もし吾らがカシミアさんに発行した任意の持分奨励 が制御権変更終了時にまだ返済されておらず、制御権変更中に残っているエンティティ(その条項による)が接収または継続する場合、このような持分報酬の非帰属部分は、カシミア女史の終了時に 帰属となる。
カシミア雇用協定によると、私たちはカシミールさんにいつでもキャシュミルさんに雇用を中止するように書面で通知することができる。カシュミールさんの雇用関係がいつでもどんな理由でも中止された場合、カシュミールさんは離職金や他の解散費補償や福祉を受けることはできませんが、私たちの標準賃金政策によると、私たちはカシミールさんに債務を支払うことになります。brのカシュミールさんは30日以上の事前書面で私たちの辞任を通知することができて、いつでも私たちの仕事を辞めることができます。もしカシュミールさんがどんな理由でも(正当な理由で辞任した)私たちの仕事を辞めた場合、カシュミルさんは離職金や他の解散費補償や福祉を受けないだろうが、私たちは負債を支払い、提供するつもりだ。
カシミールさんがある解散費福祉を得る権利がある条件の一つは、彼女が“カシミア雇用協定”に定義されているような効果的な免責声明に署名して渡す義務があるということで、私たちが受け入れられる60の形をしているこれは…終了後の翌日またはプレスリリースに規定されているより早い日。
| 125 |
ニコラス·ラベラJr
2018年12月28日、私たちは小さなNicholas A.LaBella,Jr.と雇用協定を締結した。LaBella雇用協定の条項によると,首席科学官や研究開発部門の上級副総裁 を務め,毎年基本給は325,000ドルであり,この基本給金額は取締役会や給与委員会によって定期的に調整される。
また、雇用契約によると、ラベラさんは、ラベラさんの初任給の35%に相当する目標金額に相当する年間ボーナスを得る資格を持っています。各年度のボーナスの実際の金額は、当社とグローバーさんが関連する企業の年間ボーナスの年次ボーナスの達成度に基づきます。 また、その雇用契約の条項に基づいて、ラベラさんは、将来的に当社の既存の持分インセンティブ計画または将来的に採用可能な任意の他の持分インセンティブ計画に基づいて時々持分インセンティブ を取得する資格を有しており、そのようなインセンティブの条項および条件(があれば)は、当社の取締役会または報酬委員会によって適宜決定されます。
LaBellaの雇用契約が定義されているように、支配権の変更の期間ではなく、有効日の後のいつでも、LaBellaさんの雇用を理由なく終了する場合、LaBellaさんの雇用契約が定義されたように)、LaBellaさんが雇用終了後60(60)日以内に実行し、会社に対する全面的なクレームを撤回せずに、Labellaさんが獲得する権利がある:(I)比例して計算された年間ボーナスから、適用される連邦および州の源泉徴収税を差し引くことを含む、その基本給を6ヶ月間受け取り続ける権利がある。会社の正常な賃金支給方法で給料を支払う。 (2)(A)COBRAが規定する毎月の医療と歯科保険料と(B)6の積に相当する金は,br}60で支払われるこれは…。(I)雇用関係の終了翌日に、(Iii)LaBellaさんによって帰属される雇用関係の終了直後6ヶ月以内に帰属する任意の購入株式および配当金の株式の数;および(Iv)既存株式の行使は、雇用関係終了後3ヶ月以内に行われるが、その雇用期間中に付与される株式については規定される。
もし、制御権の変更が開始されてから12ヶ月の間(ラベラ雇用契約で定義されているように)、我々はラベラの雇用契約によって定義されたように、ラベラさんの雇用を理由なく終了した場合、または(ラベラの雇用合意のように定義されているように)彼が正当な理由を持って辞任した場合、その雇用終了後60日以内に当社に対して受け入れられる形でのクレーム、および上記の散逸料および福祉の制限を取り消すことができません。LaBellaさんが終了した時点で保有している、任意の株式のオプションおよび配当金によって拘束されている100%帰属していない株式は、加速的かつ完全に帰属しており、彼は、雇用終了後6ヶ月以内に既存の株式を行使する権利を有するが、LaBellaさんの雇用期間中に付与されたオプションを遵守する必要がある。
2022年7月20日、私たちは小さなNicholas A.LaBella,Jr.と新しい役員採用協定を締結した。(ニューラベラ合意) 事業統合の完了後に発効し、それによると、私たちは、新しいラベラベラ協定の条項と条件に基づいて、業務統合の完了後に、引き続き私たちの首席科学官および研究開発のディレクターのための上級副社長として留任することに同意しました。新しいラベラ契約は、ラベラ雇用協定の代わりになりました。 新しいラベラ契約によると、ラベラさんの雇用条件は、彼が同意し、独自の情報および制限的な契約協定に署名することを含みます。
新しいラベラ協定の条項によると、ラベラさんは、引き続き首席科学官および研究開発部門の上級副社長を務め、私たちの標準賃金の慣例に基づいて、毎年40万ドルの基本給を取得します。 ラベラさんの基本給と今後の報酬の増加は、取締役会によって定期的に検討され、承認されるであろう。また、ラベラさんは、年間業績効果の現金ボーナスを得る資格があり、その目標金額は、ラベラさんの初任給の35%に相当する。取締役会は、ラベラさんがいくつかの業績目標を達成する状況を検討し、調整する必要があります。LaBellaさんが年間ボーナスを獲得するかどうかは、LaBellaさんがボーナスの支払い時に引き続き私たちに雇われるかどうかにもかかっている。そうでなければ、年間ボーナスは没収される。また、新しいラベラ協定の条項によれば、ラベラさんは、私たちの普通株式について特定の持分報酬を得る資格があるかもしれませんが、我々が帰属および報酬のために付与されるべき株式計画の他の条項および条件だけでなく、我々は、ラベラさんとの契約を提供し、制限を受けることになります。LaBellaさんはまた、似たようなポストの従業員と同じ基礎で私たちの福祉計画に参加する資格があり、彼の在任中に が発効した。
ニューラベラ協定によれば、吾らはラベラ·さんの書面による通知の後、いつでも新しいラベラ·さんの採用を中止することができます(この言葉はニューラベラ·プロトコルで定義されています)。もし私たちがLaBellaさんに私たちが彼の雇用関係を終わらせようとしていなかった場合、LaBellaさんは、新しいLaBella合意で定義された十分な理由を持っていることができる(この用語は、新しいLaBellaプロトコルで規定されているいくつかの条件に制限されているが、LaBellaさんが良い理由であると考えられる条件を解決するために30日以内に書面で通知してくれた)。LaBellaさんが新しいLaBella合意の下で義務を履行した場合、LaBellaさんが新しいLaBella合意の下で義務を履行した場合、LaBellaさんは新しいLaBellaプロトコルで定義された退職福祉を得る資格がある(新LaBella合意で定義された用語)、LaBellaさんがLaBella合意の下で義務を履行した場合、条項と条件は、私たちが理由なくその雇用関係を終了する権利がある条項と条件と同じである。
我々がいかなる時にも理由なくラベラさんの雇用を中止する場合、または、ラベラ·さんが正当な理由で辞任したが、そのような構成を終了した場合、ラベラ·さんは、新しいラベラ·さん協定に規定されているように、債務を取得する権利があり、および、新しいラベラ·さんが、新しいラベラ契約の下で義務を履行する場合には、以下の給付を受ける権利がある。(I)当時のラベラ·さんの12ヶ月間の初任給に相当する金額。発効日(新しいラベラ協定で定義されている用語)が発行された後、私たちが定期的に手配した賃金明細書の日付は均等分割払いで支払います。(Ii)LaBellaさんが解雇された後60日以内に、LaBellaさんが解雇される前の年に稼いだ未払いのボーナスに相当する金額を一度に60日以内に一度に支払う;(br}および(Iv)もし当選したら、私たちは12ヶ月に及ぶあるコブラの健康福祉をLaBellaさんに返済する予定で、どの場合も新しいLaBella合意の条項と条件、適用される法律や規制が遵守される。
| 126 |
上記の規定にもかかわらず、我々(または任意の既存または買収の会社)が理由なくラベラさんの雇用を終了する場合、またはラベラさんの制御権変更の発効日(ラベラの雇用契約の定義参照)の90日前および発効日後24ヶ月以内に正当な理由で辞任する場合には、ラベラさんは、計算すべき債務を得る権利があり、新しいラベラさんに新しいラベラ契約の下での彼の義務を遵守する場合には、ラベラさんは、われわれと理由なくその雇用関係を終了し、次の各項と同様の条件で離職福祉を得る資格があるが、支配権の変更が会社の所有権の変更、会社の実際の支配権の変更または会社の大部分の資産の所有権の変更である場合、コントロール権変更後30日以内またはコントロール権変更後30日以内に一度に終了契約の散逸料を支払うべき累積金額 :(I)ラベラさんは、その契約終了後60日以内に、ラベラさんの基本給の35%(35%)に相当するボーナスを獲得し、ラベラさんの契約終了後60日以内に一度に支払います。(Ii)もし、もし吾らがLaBellaさんに対して発した持分報酬が、制御権変更が終了した時点でも完了していない場合、一方、支配権変更に存在するエンティティ(その条項による) が接収または継続する場合、当該持分報酬の非帰属部分は、LaBellaさん終了時に100%帰属することになる。
新しいラベラ合意、吾等は書面でラベラさんの採用を通知した後、いつでも任意の理由でラベラさんの採用を終了することができます。ラベラさんのような任意の理由で採用を終了します。ラベラさんは解散費またはその他の解散費または福祉を受けることはありませんが、私たちの標準的な給与政策によれば、私たちはラベラさんに計算されたbr}債務を支払うことになります。LaBellaさんは、私たちの会社での彼の仕事をいつでも辞めることができる事前に30日以上の書面で私たちに通知することができる。LaBellaさんがどんな理由でも(良い理由で辞任を除く)私たちの仕事を辞めたら、LaBellaさんは離職金や他の解散費や福祉を得ることはできないが、私たちは負債を支払い を提供するだろう。
ラベラさんは、いくつかの散逸料福祉の条件の一つを得る権利があり、彼は、効果的な解除(新しいラベラ協定で定義されているように)を受け入れることができる形で署名および を提出する義務があることですこれは…終了後の 日目またはプレスリリースに規定されている早い日。
ニコラス·A·ラベラは2023年8月18日に退職した。
パブロ·A·グズマン医学博士
2023年1月26日、私たちはパブロ·グズマン博士と、業務統合が完了した後に発効する幹部採用協定(“グズマン採用協定”)を締結し、これにより、吾らはグズマン博士との間の未完了の相談契約を終了し、グズマン博士が私たちの首席医療官や医療事務部の上級副総裁として保持することに同意したが、グズマン採用協定の条項と条件を遵守しなければならない。グズマン雇用協定によると、他の事項を除いて、グズマン博士の雇用条件には、彼が独自の情報と制限条約に同意して署名することが含まれている。
グズマン雇用協定の条項によると、グズマン博士は首席医療官と医療事務部の上級副総裁を務め、私たちの標準賃金慣行に基づいて年間350,000ドルの基本給を得る。グズマン博士の基本給と将来の給与増加は取締役会によって定期的に審査·承認される。また、グズマン博士は業績に基づく年間現金ボーナスを得る資格があり、目標金額はグズマン博士の基本給の30%(30%)に相当し、取締役会はグズマン博士が何らかの業績目標を達成した場合に応じて審査·調整する。グズマン博士が年間ボーナスを獲得するかどうかは、グズマン博士がボーナスを支払う際に私たちに雇われ続けているかどうかにもかかっており、そうでなければ年間ボーナスは没収される。さらに、グズマン雇用協定の条項によると、グズマン博士は、私たちの普通株のいくつかの株式報酬を得る資格がある可能性があり、条件は、報酬を付与する私たちの持分計画の帰属と他の条項と条件、そして私たちはグズマン博士と締結された合意を提供してくれるだろう。グズマン博士も、似たような状況にある従業員と同じように、彼が雇われている間に時々発効する私たちの福祉計画に参加する資格がある。
| 127 |
グズマン雇用協定によると、グズマン博士に書面で通知した後、グズマン博士の雇用をいつでも理由なく終了することができる(この用語はグズマン雇用協定に定義されている)。もし私たちがグズマン博士に私たちが彼の雇用関係を終わらせるつもりだったことを知らせなかったら、グズマン博士は30日以内に私たちに書面で通知した後、正当な理由(グズマン雇用協定で定義されている)で彼の仕事を辞め、グズマン博士が正当な理由と考えている条件を30日以内に治癒することができるが、グズマン雇用協定に規定されているいくつかの条件を守らなければならない。グズマン博士が良好な理由で退職し,その解雇が離職(グズマン雇用合意の定義のような)を構成していれば,グズマン博士がグズマン雇用協定での義務を履行した場合,グズマン博士は,私たちが理由なくその雇用関係を終了する同一条項と条件で退職福祉を得る資格がある(グズマン雇用協定で定義されている)。
グズマン博士の雇用をいつでも無断で中止したり、グズマン博士が正当な理由で退職し、その構成を退職した場合、グズマン博士は課税債務(グズマン雇用協定で定義されているように)を得る権利があり、グズマン博士がグズマン雇用協定の下での義務を履行した場合、グズマン博士は次のような福祉を受ける権利がある。発効日(グズマン雇用協定で定義されている)が発行された後、定期的に手配された賃金請求日は均等分割払いで支払われる。(Ii)グズマン博士の退職後60日以内にグズマン博士が退職する1年前に稼いだ未払いボーナスに相当する金額を一度に支払います。br}と(Iv)が当選すれば、12ヶ月に及ぶあるコブラ医療福祉をグズマン博士に返済し、いずれの場合もグズマン雇用協定の条項と条件、適用される法律と法規を遵守しなければなりません。
上記の規定にもかかわらず、私たち(または既存または買収した会社)がグズマン博士の雇用を理由なく中止したり、グズマン博士が支配権変更発効日(“グズマン雇用協定”で定義されているように)の発効日前90日以内と発効日後24ヶ月以内に十分な理由で辞任した場合、グズマン博士は計算すべき債務を獲得し、グズマン博士が“グズマン雇用協定”の下での義務を履行する権利がある。グズマン博士は退職給付を受ける資格があり、私たちが理由なく解雇する権利がある場合に福祉を受ける権利がある条件と同じだが、支配権変更が会社の所有権の変更、会社の実際の支配権の変更、あるいは会社の大部分の資産所有権の変更であれば、契約終了後の支払(または余剰対応)解散費の累計金額 は、制御権変更後30日以内に一度に支払うべきである:(I)グズマン博士が契約を終了した当時は、グズマン博士の基本給の30%(30%)に相当するボーナスを獲得し、グズマン博士が契約を終了してから60日以内に一度に支払う。(Ii)もし吾らがグズマン博士に発行した任意の持分奨励が支配権変更終了時にも弁済されておらず、その支配権変更中の生存エンティティが(その条項に基づいて)接収または継続している場合、これらの持分報酬の未帰属部分は、グズマン博士の終了時に100%帰属する。
“グズマン雇用協定”によると、グズマン博士に書面で通知された後、グズマン博士の雇用をいつでも中止することができる。グズマン博士の雇用が何らかの理由でいつでも終了すれば、グズマン博士は離職金や他の解散費補償や福祉を受けないだろうが、私たちの標準賃金政策によると、グズマン博士に計算すべきbr義務を支払う。グズマン博士は30日以上前に私たちに辞任書面を送って、いつでも私たちの仕事を辞めることができます。グズマン博士が何らかの理由で(正当な理由で辞任した場合を除く)私たちの仕事を辞めた場合、グズマン博士は退職給付や他の解散費補償や福祉を受けることはありませんが、私たちは債務を支払い、提供します。
グズマン博士が何らかの解散費福祉を得る権利がある条件の一つは、私たちが受け入れられる形で有効な解除契約(グズマン雇用協定で定義されているように)に署名して渡す義務があることだTh 終了後の翌日またはプレスリリースに規定されているより早い日。
2023年1月26日、我々の取締役会の報酬委員会は、グズマン博士に100,000株の普通株式の行使可能なオプションを付与することを許可し、行権価格は2.11ドルであった。
年間現金ボーナス
彼らの雇用契約や招聘書(場合によって決まる)によると、各NEOは、会社や個人が取締役会が適宜決定した業績目標を実現することに基づく現金奨励ボーナスを得る資格がある。2021年、近地天体は年次現金奨励ボーナス計画に参加していないが、2022年1月1日に発効した年間現金奨励ボーナス計画に参加する資格がある可能性がある。2022年度には、私たちの各近地天体は、その年間基本給の割合を反映した目標ボーナス額を得る資格がある。取締役会はまた、具体的な状況に応じて私たちの近地天体に追加の適宜ボーナスを支給する権利がある。2022年12月31日までの財政年度中に、近地天体に付与された任意の自由支配可能なボーナスは上記のタイトルに記載されている“−“役員採用協定”
従業員福祉計画
各指定役員の雇用協定(上記のように)に規定されている任意の個人福祉を除いて、適用法律に基づいて、指名されたbr}幹部は、通常、会社の他の従業員と同じ基礎の上で私たちの役員や従業員の健康および他の従業員福祉計画に参加する資格がある。
私たちのbr従業員福祉計画には、私たちの医療、歯科、視力、団体人寿と事故死と肢解保険計画が含まれており、各ケースにおいて、その基礎は私たちの他のすべての従業員と同じです。
| 128 |
ご褒美 手配
2014持分インセンティブ計画
私たちは、2018年10月9日、2019年2月2日、2021年2月2日に改訂された2014年株式インセンティブ計画(“2014計画”)に基づいて奨励を発行する権利があります。2014年計画によると、2021年12月31日から、私たちの普通株1,000,000株の発行を許可します。2014年計画によると発行可能な普通株式数は、2014計画期間内に2019年から始まる例年1月の第1取引日に自動的に増加し、増加した金額は、前年12月の最終取引日に発行された普通株式総数の5%(5%)に相当するが、いずれの場合も、このような年間増加は10万株を超えてはならない。 2014計画は、私たちとその付属会社の従業員、取締役、コンサルタントに奨励的株式オプション、非法定株式オプション、普通株購入権、株式付加権、制限株式および制限株式単位を発行することを規定しています。 2014計画は株式オプションの発行価格が付与された日の私たちの普通株の公正価値 を下回らないことを要求します。2021年12月31日現在、2014年計画によると、将来発行可能な株は1,068,154株。
2014年計画修正案
2022年12月12日、当社は業務合併を完了するため、2014年計画の改訂 (“2014計画改訂”)を承認した。2014年計画改正案では、業務合併を完了した後、2014年計画で保留と発行可能な普通株の株式はさらに増加してはならず、2014年計画では新たな奨励を付与しないことが規定されている。2014年計画改正案の上記要約は、2014年計画改正案全文から本募集説明書の添付ファイルとして限定され、引用的に本明細書に組み込まれる
2022年総合持分インセンティブ計画
以下は“2022年総合株式インセンティブ計画”(以下、“2022年計画”と略す)の主要条項の説明であり、“2022年計画”全文をまとめたものである。
管理します。 全体的に、2022計画は取締役会報酬委員会によって管理されるだろう。報酬委員会は、どの人が普通株、株式付加価値権(またはSARS)、制限株式単位、制限または非制限普通株、業績株、業績単位、インセンティブボーナス、その他の株式奨励、および他の現金奨励を購入できるかを決定する。報酬委員会はまた、2022年計画の管理および未解決賠償金の改正または修正のための規則および条例 を制定することができる。報酬委員会は、適用される法律および“2022年計画”に基づいて、最高経営責任者および他の役員に、従業員(本人を除く)にオプションおよび他の報酬を付与することができる。2022年計画発効日である2032年(または満期日)後10年後には、2022年計画に基づいていかなるオプション、株式購入権または奨励を行ってはならないが、2022年計画はその後もbr}を継続し、以前に付与されたオプション、SARSまたは他の奨励はまだ完了していない。
| 129 |
資格。 2022年計画によると、オプション、SARSまたは他の報酬を取得する資格を有する者は、報酬委員会が当社の成功に貢献できると考えている当社およびその子会社の従業員、上級管理者、取締役、コンサルタント、コンサルタントおよび他の個人サービスプロバイダ、または報酬委員会が会社または任意の子会社の将来の従業員、役員、役員、コンサルタント、コンサルタントまたは他の個人サービスプロバイダであると考えている任意の者である。2022年10月31日現在、会社とその子会社には4人の役員と2人の非従業員取締役が含まれている7人の従業員がいる。2022計画下のbr報酬は報酬委員会の裁量であるため、上記の各カテゴリに何人が報酬を受けるかを決定することはできません。
2022年計画に拘束された株 2022年計画の調整条項と以下に述べる自動増資規定によると、2022年計画により発行可能な普通株の最大総数は1,453,108株である。
2022年計画によると発行可能な普通株式数は1月1日に自動的に増加するST毎年の は,2023年1月1日から始まり,その後毎年1月1日から満期日まで,金額は我々が12月31日に発行した普通株式総数の4%に相当するST取締役会がその前に行動しない限り、当該年度の株式準備が増加しないこと、またはその年度の株式準備が増加する普通株式数がそれ以外の場合に増加する普通株式数よりも少なくなることを規定する。
“2022年計画”によると、“2022年計画”に基づいて最大2,500,000株の普通株の奨励的株式オプション、またはISOを付与することができ、改正された“1986年国税法”422節の要求 を満たすことができる。前項の規定により発行可能な普通株式増発株式は国際標準化組織の制約を受けてはならない。
2022年計画に従って付与された任意のオプションまたはSARが、完全に行使されていない場合または任意の報酬が没収されていない場合に終了する場合、または普通株株 がオプションまたは他の報酬の源泉徴収を支払うために源泉徴収された場合、またはオプションの行使用価格または報酬を支払うための購入価格 であれば、没収された差し止めまたは支払われた普通株式数は、2022計画下の将来の付与のために使用されることができる。現金決済による奨励は、2022年計画により発行可能なbr株数には計上されない。
いずれのカレンダー年度においても、非従業員取締役は、会計価値が250,000ドルを超える報酬(非従業員取締役がこの年度に獲得したいかなる現金報酬も含むが、2022年計画によるものではない)を得ることはできないが、新たな非従業員取締役であれば、非従業員取締役任期の最初の年には、この金額は500,000ドルに増加する。
2022年計画に基づいて発行される株式数および前述の株式制限は、株式分割、株式配当、類似取引、または我々の普通株の任意の他の変化に影響を与える常習調整を受ける。
オプション条項 と条件2022年計画により付与されたオプションは,規則422節の要求を満たしていないISOや“不正注文株式オプション” である可能性がある.報酬委員会は、2022年計画に基づいて付与されたオプションの行権価格を決定する。株式オプションの発行価格は、付与日に我々普通株の1株当たり公正時価(10%株主に付与されたISOであれば、公正時価の110%を下回ってはならない)を下回ってはならない。
普通株が付与日に証券取引所に上場するか、またはナスダック株式市場自動見積システムでオファーされる場合、市場価値は、通常、付与日(または付与日 日に取引が発生しない)前の最終取引日の終値である。このような価格がなければ、公平な市場価値は賠償委員会が合理的な適用に基づいて合理的な推定方法 を誠実に決定する。
| 130 |
付与された日から10年を超えてはならない(ISOが10%の株主を付与すれば5年)。2022年計画に基づいて付与されたオプションは、報酬委員会が付与されたときに規定された1つまたは複数の時間内に行使される。任意の従業員が毎年初めて行使可能なISO金額は100,000ドルを超えてはならない。
報酬委員会は、オプション所有者がオプションが他の方法で行使される前にそのオプションを行使することを適宜許可することができ、 この場合、私たちが受信者に発行する普通株は、 行使前にそのオプションの帰属要求に適用されることを継続する。
通常、オプション価格は現金で支払うことができ、保険小切手、銀行為替手形あるいは為替手形で支払うこともできる。賠償委員会は、(A)公正な時価が購入価格に等しい普通株を交付することによって、 (B)賠償委員会によって許可された条項を有する全額請求権を有する利息元票、または(C)入札協定に規定されているまたは賠償委員会が他の方法で決定するような、他の支払い方法 を許可することができる。報酬委員会 は、無現金行権計画を確立することを許可され、行権価格(または源泉徴収義務) の履行を許可され、方法は、行権時に発行可能な株式から、公正な時価が行権価格に等しい株を差し引くことである。
遺言や相続と分配法を除いて、いかなる選択権も譲渡してはならず、受給者が生きている間は、選択権は受給者が行使するしかない。しかしながら、補償委員会は、オプション、特別行政区、または他の奨励の所有者が、オプション、権利または他の奨励を直系親族、遺産計画のための家庭信託、または慈善団体にプレゼントを譲渡することを可能にすることができる。報酬委員会は、株式オプション所有者が私たちとのサービスを終了した後にどの程度オプションを行使できるかを決定するだろう。
株 付加価値権利。補償委員会は2022年計画に基づいてSARSを承認するかもしれない。賠償委員会はSARSの他の条項に適用されることを決定するだろう。香港特別行政区の1株当たりの行使価格は、付与日の我々普通株の公平時価の100% を下回らず、補償委員会によって決定される。“2022年計画”により付与された任意の特区の最長期限は、授与日から10年である。一般的に、各特区は、運動時に参加者に以下の金額に等しい金額を与える
| ● | 行使日に我々普通株の公正時価が行権価格を超えるものに を乗じる | |
| ● | 香港特別行政区が扱っている普通株式数。 |
支払brは、私たちの普通株の株であってもよいし、現金であってもよいし、一部は普通株であってもよく、部分は現金であり、これらは報酬委員会によって決定される。
制限株と制限された株式単位報酬委員会は、2022年計画に従って制限普通株および/または制限株式 単位を付与することができる。限定的な株式奨励には参加者に譲渡された株が含まれているが、制限されたbrは、指定された条件を満たさなければ、これらの制限は没収につながる可能性がある。制限株式単位は、報酬委員会によって指定された特定の条件が達成された後、または未来の日に、私たちの普通株、現金または株式、および現金の組み合わせを受け入れる権利を付与する。制限株式または制限株に毎回適用される単位に適用される制限および条件は、業績に基づく条件を含むことができる。制限株式に関連する配当または分配は、株主に配当金を支払うとき、または制限株式が帰属したときに株式所有者に支払うことができ、補償委員会によって決定される。任意の配当または割り当てが制限された株式が帰属する前に株式で支払われる場合、それらは同じ制限を受ける。 制限株式単位は、株主に現金配当金を支払うときに配当値金額を支払うか、または単位帰属時に配当金等値金額を支払うことができる。報酬委員会が別途決定しない限り、制限された株の保有者は株に投票する権利があるだろう。
| 131 |
業績株と業績単位給与委員会は2022年計画に基づいて成績表株および/または業績単位を付与することができる。業績株と業績単位は株式或いはドル建ての奨励であり、特定のbr業績期間中に報酬委員会が制定した業績基準に基づいて稼いでいる。報酬委員会は、各業績株および業績単位報酬に適用される制限および条件を決定します。
ボーナス ボーナス報酬委員会は2022年計画に基づいて奨励ボーナスを不定期に支給することができる。報酬 ボーナスの条項は奨励協定に規定されるだろう。各報酬プロトコルには、業績目標と、これらの目標の実現状況に応じて支払われる金額を含む報酬委員会が決定した条項と条件がある。奨励ボーナスは現金および/または普通株式形式 で支払われる。
他の は株と現金の奨励に基づいている報酬委員会は、“2022年計画”に従って、帰属要件のない普通株式を付与または販売すること、および報酬委員会が適用可能な条件を満たす場合に、1つまたは複数の現金支払いの権利を得ることを含む他のタイプの株式または現金報酬を付与することができる。
ある会社の取引の影響 補償委員会は、(1)行使の加速または延長、任意の裁決に帰属する、または任意の裁決から収益を達成する期限、(2)裁決の業績または他の条件の取り消しまたは修正、または(3)補償委員会によって決定された同値現金価値現金決済裁決を含む、裁決を付与する際に、制御権変更(“2022年計画”によって定義されるように)の任意の裁決への影響を規定することができる。賠償委員会は、コントロール権の変動に応じて、適宜、(A)任意またはすべての未補償オプションおよびSARSを直ちに全部または部分的に行使可能にすること、(B)任意の他の賠償の全部または一部を没収できないようにすること、(C)代替オプションと交換するために任意のオプションまたは特別行政区をキャンセルすること、のうちの1つまたは複数をとることができる。(D)任意の相続人の株式の同様の報酬と交換するために、制限株式、制限株式単位、履行株式または業績単位への報酬をキャンセルする;(E)現金および/または他の代替対価格と交換するために任意の制限株を償還する。(F)支配権変更が発生した日にそのような報酬または権利を行使する際に参加者が獲得すべき金額(ある場合)の現金および/または財産に相当すると交換するために、任意の現金および/または他の代替対価格の報酬をキャンセルまたは終了することができるが、任意のオプションまたは特別行政区の制御権対価格に関する変更 がその行使価格を超えない場合、オプションまたは特別行政区は、いかなる対価格も支払うことなくキャンセルすることができる。 または(G)は、賠償委員会が必要または が適切であると考えられる他の未払い賠償金を修正、調整または修正する。
修正し, は終了する取締役会は、規則または他の適用される法律または法規の要件または任意の他の法律目的を満たすために2022年計画を随時改訂することができるが、株主の同意を得ず、取締役会は、(A)2022年計画下の普通株式数を増加させることができない、(B)オプション、SARSおよび/または他の奨励を得る資格を有する個人集団を変更するか、または(C)2022年計画の期間を延長することができない。
その他 情報
2022計画下のオプションおよび の他の報酬の付与は自由に支配可能であるので、米国証券取引委員会依頼書規則に記載された“新しい計画福祉”テーブルは提供されていないので、私たちは現在、任意の特定の個人または集団に任意の特定の個人または集団にオプションまたは報酬を付与する具体的な数またはタイプを決定することができない。
アメリカ連邦所得税の結果
以下は、2022年計画下のOPTIONとその他の贈与の米国連邦所得税結果の概要です。2022年計画に基づいて付与された他の権利および報酬の購入者および受給者は、オプションまたはbr}特別行政区またはオプションまたは特別行政区の行使によって、または任意の報酬を付与して支払った後に受信した任意の株を処分する前に、その個人税務顧問に相談することを提案する。さらに、以下の要約は、現行法、現行法、司法裁決、行政裁決、法規および提案法規の分析に基づいており、これらは、州、地方、外国または他のbr税法に関連しない変化が生じる可能性がある。
| 132 |
オプションの処理
“基準”は奨励的株式オプションと非法定株式オプションを区別して扱う。しかし,この2種類のオプションについては,2022年計画下のオプションを付与した場合には,オプション譲渡者に何の収入も確認することはなく,当社も減税 を享受する権利はない.
一般に、非法定株式オプション(奨励的株式オプションとして使用しようとしているが、行使時にその資格に適合していないオプションを含む)を行使した場合、オプション譲渡者は、行使日株の公平時価がオプション価格を超えていることについて一般所得税を確認する。当社は減税を受ける権利があり、減税金額は被購入者が購入者の納税年度終了を含む会計年度で確認した一般収入に等しい。私たちは適用された源泉徴収要求を満たすことが要求されて、税金減免を受ける権利がある。一般に,オプション受給者が非法定株式オプションを行使する際に,オプション価格の一部または全部を支払うことで我々の普通株の株式を入札すれば,入札は何の収益や損失も確認しない.ただし,入札した株式が奨励的株式オプションを行使する際に得られる であり,入札が付与日から2年以内または奨励的株式オプション行使の日から1年以内に行われる場合,入札 は奨励的株式オプションを行使する際に得られる株式の喪失資格に対する処置となる.
奨励的株式オプションについては,オプション保有者は行使時に課税収入は存在しない.しかし,“代替的最低税額”が行権年度に適用されるかどうかを決定する際には,株式の行権日の公平市価 が行権価格を超える場合が考えられる.行権時に買収した株式が付与された日から少なくとも2年、行権の日から1年以上保有されている場合、その等の株式を売却することによるいかなる損益も、資本資産として保有していれば、長期資本収益または損失(株式販売価格と行権価格との差額で測る)となる。現在の連邦所得税法によると、長期資本利益の税率は一般所得の最高税率を下回る。2年と1年の保有期間の要求(“資格取り消し処分”)に該当しない場合、オプション譲受人は、処分年度に一般収入を確認し、その額は、(I)株式の行使日の公正時価から執行価格を減算するか、または(Ii)処置現金化金額から行使価格の小さい者を差し引くことに等しい。 収益の残りの部分は長期資本収益とみなされ、具体的にはその株が1年以上保有しているかどうかに依存する。オプション受給者 が失格処分をすれば、当社はオプション受給者が確認した一般収入に相当する減税を受ける権利がある。
一般に,オプション受給者が奨励的株式オプションを行使する際に,オプション価格の一部または全部を支払うように普通株式株式を入札すると,入札時には何の収益や損失も確認されない.しかしながら、入札株式が別の奨励的株式オプション 行使時に買収され、入札が付与された日から2年以内または別のオプション行使日 の後1年以内に行われる場合、入札は、別のオプションを行使して得られた株式の喪失資格の処分となる。
先に述べたように,奨励的株式オプションを行使することは,オプション受給者に代替的最低税額を納付させることができる.任意の特定オプション所有者に代替的最低税額を適用することは、行使年度内にオプション保有者に関する特定の事実と状況に依存する。しかしながら、一般規則として、普通株のオプション行使の日の公正時価がオプション取引価格を超えた金額は、代替税を徴収可能な代替最低課税所得額を決定する“調整”項目を構成する。したがって,このプロジェクトは最低税に代わる課税基礎を計算するために入るため,代替最低税はどの所与の年度にも適用される可能性がある。
株式付加価値権の処理
一般的に、特区の受給者は特区を授与する際に何の収入も確認することはなく、当社も控除する権利がありません。 特区を行使する際には、所持者は普通収入を確認し、当社は一般的に相応の控除を受ける権利があります。br}は当時の私たちの普通株の公正時価が使用価格を超えた部分に相当します。
| 133 |
株式奨励の処理
通常、 が“規則”第83(B)条に基づいて現在課税すべき選択(又は第83(B)条)に基づいていない場合、制限的な株式奨励又は業績株奨励が付与された場合、受給者又は当社に対して連邦収入 税収の結果は生じない。制限期間の満了および制限された株式に適用される任意の他の制限が満たされた後、受取人は一般収入を確認し、当社は一般的に当時の普通株式公平市価に相当する相応の控除 を得る権利がある。制限株式奨励が付与された日から30日以内に83(B)条の選択がなされた場合、受給者は制限株を受け取ったときに一般的な収入を確認することになり、当社 は一般に相応の控除を受ける権利があり、当時の株式の公平な時価(適用制限を考慮せずに決定された) から受給者が株式に支払う任意の金額を差し引く権利がある。第83条(B)条の選択がなされた場合、株式制限が失効した場合(及び当該等の株式を売却する前に)、受給者は追加の収益を確認しないが、株式がその後没収された場合、受給者は株式を受け取ったときに第83(B)条に基づいて確認された収入 を控除することができない。
非限定株式賞(業績単位賞を含む)の 受賞者は一般収入を確認し,わが社は通常相応の控除を受ける権利があり,賞授与時に奨励対象となる普通株の公平時価 に相当する.
限定株式単位の受信者は,単位帰属や決済時に一般的な収入を確認するのが一般的である.収益の金額は私たちが当時発行した普通株の公正時価に等しく、わが社はそれに応じた控除を受ける権利があります。制限株式単位の受信者は、その裁決について83(B)条の選択 を行うことは許されない。
奨励的ボーナスと他の株や現金奨励の処理
通常、奨励ボーナスや株式や現金に基づく他の奨励金の取得者は、奨励付与時に何の収入も確認されないとともに、当社はその際に減額を受ける権利もない。このような奨励金を支払う際、受賞者は通常のbr収入を確認し、わが社は通常、支払いされた現金金額および/または私たちが当時発行した普通株の公平な市場価値に相当する相応の減額を得る権利がある。
会社控除額の潜在的制限
“規則”(Br)162(M)節は、一般に、公共ホールディングスが、1つの課税年度にその最高経営責任者および何らかの他の“被保険従業員”に100万ドルを超える補償の減税を支払うことを許可しない。我々の取締役会及び報酬委員会 は、2022年計画に従って支給される贈与に対する第162(M)条の潜在的な影響を考慮するつもりであるが、第162(M)条の減額額を超える役員オプション及び他の奨励金の贈与を承認する権利を保持する。
税金を前納する
“2022年計画”によると、私たちは適切な時に普通株を購入する各購入者と、普通株の奨励を受けたすべての譲受人に法律で源泉徴収しなければならない任意の連邦、州または地方税を支払う権利がある。
| 134 |
未償還のbr 2022年度末の持分奨励
次の表は、2022年12月31日現在、任命された役員1人当たりの普通株式標的発行済み株式オプションの株式数をまとめています
| オプション大賞(1) | ||||||||||||||||
| 名前.名前 | 付与日 | 行使可能な未行使オプションの基礎証券(#) | オプションを行使していない基礎証券は行使できない(#) | オプション取引権価格(ドル) | オプション期日 | |||||||||||
| スティーヴン·C·グローバー | ||||||||||||||||
| 共同創業者兼最高経営責任者 | 4/11/2014 | 138,980 | (2) | - | 5.03 | 04/11/2024 | ||||||||||
| 議長と一緒に | 10/28/2016 | 168,761 | (6) | - | 5.03 | 10/28/2026 | ||||||||||
| 4/2/2019 | 264,838 | (9) | - | 11.58 | 04/02/2029 | |||||||||||
| 2/8/2021 | 42,046 | (10) | 84,092 | (10) | 16.36 | 02/08/2031 | ||||||||||
| 2/3/2022 | - | 79,417 | (12) | 16.36 | 02/03/2032 | |||||||||||
| ニコラス·A·ラベラ | ||||||||||||||||
| 首席科学官と | 4/11/2014 | 19,854 | (2) | - | 5.03 | 04/11/2024 | ||||||||||
| 総裁副主任 | 6/9/2015 | 39,709 | (4) | - | 5.03 | 06/09/2025 | ||||||||||
| 研究と開発 | 10/30/2017 | 59,563 | (7) | - | 5.03 | 10/30/2027 | ||||||||||
| 4/2/2019 | 39,708 | (9) | - | 11.58 | 04/02/2029 | |||||||||||
| 2/8/2021 | 9,927 | (10) | 19,854 | (10) | 16.36 | 02/08/2031 | ||||||||||
| 1/28/2022 | - | 29,781 | (11) | 16.36 | 01/28/2032 | |||||||||||
| カレン·A·カシュミール | ||||||||||||||||
| 首席商務官 | 9/10/2014 | 9,927 | (3) | - | 5.03 | 09/10/2024 | ||||||||||
| 10/30/2017 | 19,854 | (7) | - | 5.03 | 10/30/2027 | |||||||||||
| 4/2/2019 | 29,781 | (9) | - | 11.58 | 04/02/2029 | |||||||||||
| 2/8/2021 | 7,280 | (10) | 14,560 | (10) | 16.36 | 02/08/2031 | ||||||||||
| 1/28/2022 | - | 21,840 | (11) | 16.36 | 01/28/2032 | |||||||||||
| ピーター·ウルフ | ||||||||||||||||
| 首席財務官 | 10/21/2015 | 9,927 | (5) | - | 5.03 | 10/20/2025 | ||||||||||
| 局長と | 10/30/2017 | 9,927 | (8) | - | 5.03 | 10/30/2027 | ||||||||||
| 04/02/2019 | 39,708 | (9) | - | 11.58 | 04/02/2029 | |||||||||||
| 02/08/2021 | 7,280 | (10) | 14,560 | (10) | 16.36 | 02/08/2031 | ||||||||||
| 01/28/2022 | - | 21,840 | (11) | 16.36 | 01/28/2032 | |||||||||||
| (1) | 本表で述べたすべての 未償還株式オプション奨励(“ZyVersaオプション”) はZyVersa 2014株式計画(“2014計画”)により付与され,ZyVersa普通株に対して を行使することができる.いくつかのオプションは、“-制御権の終了または変更後の潜在的支払い”に記載されているように、特定のイベントが発生したときに加速する可能性がある。業務合併を発効させるために,オプション関連株式数と行使価格は調整されている . |
| (2) | 2014年4月11日、私たちは10年間の株式オプションを付与し、合計158,834株の普通株を購入した。これらの株は3年以内に年等額で分割払いされ、発行権価格は1株5.03ドルであった。それは私たちのbr普通株の授与日の市場価格を代表します。 |
| (3) | 2014年9月10日、私たちは10年間の株式オプションを付与し、合計9927株の普通株を購入した。これらの普通株は3年以内に年等額分割払いで、1株当たり5.03ドルであった。それは私たちの普通株の授与日の市場価格 を代表する。 |
| (4) | 2015年6月9日、3年以内に年等額分割払いで発行された39,709株の普通株を購入する10年期株式オプションを付与し、1株当たり5.03ドルであった。私たちの普通株の付与日の市場価格 を代表します。 |
| (5) | 2015年10月21日、私たちは9927株の普通株を購入する10年期株式オプションを付与し、普通株は3年以内に年等額分割し、1株当たり5.03ドルとした。私たちの普通株の付与日の市場価格 を代表します。 |
| (6) | 2016年10月26日、私たちは168,761株の普通株を購入する10年期株式オプションを付与し、普通株は直ちに帰属し、行権価格は1株当たり5.03ドルであり、付与日の私たちの普通株の市場価格を代表している。 |
| (7) | 2017年10月30日、私たちは10年間の株式オプションを付与し、合計79,417株の普通株を購入し、そのうちの3分の1は直ちに帰属し、残りは2年以内に年間等額分割払いに帰属し、行権価格は1株5.03ドルだった。私たち普通株の付与日の市場価格を代表します。 |
| (8) | 2017年10月30日、私たちは10年間の株式オプションを付与し、合計9927株の普通株を購入し、そのうちの25%は直ちに帰属し、残りは3年以内に年などの分割払いに帰属し、行権価格は1株当たり5.03ドルだった。その中で は私たちの普通株の付与日の市場価格を表します。 |
| (9) | 2019年4月2日、私たちは10年間の株式オプションを付与し、合計374,035株の普通株を購入しました。これらの普通株は3年以内に年等分割払いで、発行権価格は1株11.58ドルです。それは私たちの普通株の授与日の市場価格を代表する。 |
| (10) | 2021年2月8日、我々は10年期の株式オプションを付与し、合計199,599株の普通株を購入し、これらの株は3年以内に年等額で分割払いし、発行権価格は1株16.36ドルであった。それは私たちのbr普通株の授与日の市場価格を代表します。 |
| (11) | 2022年1月28日、会社は10年期株式オプションを付与し、合計73,461株の普通株を購入し、年分3年分の分割払いで、行権価格は1株当たり16.36ドルとなった。それは私たちの普通株の授与日の市場価格を代表する。 |
| (12) | 2022年2月3日、会社は10年期株式オプションを付与し、合計79,417株の普通株を購入し、年分3年分の分割払いで、行権価格は1株当たり16.36ドルとなった。それは私たちの普通株の授与日の市場価格を代表する。 |
| 135 |
役員報酬
次の表には、2022年以内に当社の取締役会非従業員メンバーを務める各従業員が稼いだ報酬または支払いに関する報酬情報を示します。2022年には、以下に別の説明がある以外に、取締役会の他の非従業員メンバーに任意の費用を支払い、任意の株式奨励または他の報酬を支払っていません。私たちは取締役会の会議に出席したことによる合理的な出張費用を取締役会のメンバーに精算した。
稼いだ費用や 現金で支払う ($) | 在庫品 賞.賞(1) ($) | 選択権 賞.賞(1) ($) | 合計する ($) | |||||||||||||
| デヴィッド·S·ブリオネス(2) | - | - | - | - | ||||||||||||
| Raj Mehra博士、J.D.(2) | - | - | - | - | ||||||||||||
| グレゴリー·スカーレット(2) | - | - | - | - | ||||||||||||
| クリストファー·ターウィティ博士(2) | - | - | - | - | ||||||||||||
| Daniel·オコナー(3) | - | - | - | - | ||||||||||||
| ロバート·フィニツィオ(4) | 37,000 | - | 128,465 | 165,465 | ||||||||||||
| 民哲公園(4) | 30,000 | - | 128,465 | 158,465 | ||||||||||||
| (1) | 報告された金額代表は,FASB ASCテーマ718に基づいて計算された2022年12月31日までの年度であり,我々の2014年株式インセンティブ計画に基づいて取締役に付与された株式オプションの付与日公正価値合計である。与えられた日付の公正価値を計算する際に使用する仮定については、我々の財務諸表付記11を参照されたい。 |
| (2) | 業務合併完了後、個人 は2022年12月12日に会社取締役会を辞任した。 |
| (3) | Daniel オコナーは設立以来ラクスパーの取締役会社であり、業務合併完了後も会社の取締役会社である。 |
| (4) | 業務合併完了後、個人 は2022年12月12日に会社取締役会メンバー に任命された。 |
当社の非従業員取締役に付与された購入権は3年以内に授与され、その中の33 1/3%のオプションは授出日1周年の時に帰属及び行使可能であり、33 1/3%は購入権授与日の2年周年日及び33 1/3%が帰属した時に行使し、そして購入権授与日の3年周年日に行使し、ただし非従業員取締役brは適用帰属日前に引き続き当社の取締役会に残っていなければならない。
取締役会は非従業員取締役報酬を設定し、 は高品質な非従業員取締役を吸引し、維持するために必要な競争力のある報酬を提供し、私たちの普通株を保有することを奨励し、さらに彼らの利益を私たちの株主の利益と一致させることを目的としている。2022年には、会社の非従業員取締役1人当たり30,000ドルの年会費を得る資格があります。財務委員会のメンバーの一人はこの職務を担当して7,000ドルを追加的に獲得した。2014年の計画によると、会社は非従業員取締役に株式オプションも付与した。
Finizioさんは、年間40,000ドルの現金事前招聘料(本年度比で計算)と、委員長および監査委員会のメンバーとして15,000ドルおよび8,000ドルの追加現金を獲得します。当社が以前に開示した2022年総合持分インセンティブ計画(“2022年計画”)によると、さんFinizioはまた、初期および年度オプションを取得する予定です。
朴博士は毎年40,000ドルの現金予約料(本年度の割合で計算)を取得し、報酬委員会のメンバーのサービスとして7,500ドルの現金前払い金を追加的に獲得する。
O‘Connorさんは、毎年40,000ドルの現金予約料(本年度の比率で計算)を取得し、監査委員会のメンバーとして8,000ドルの追加予約を取得します。オコナーさんは、2022年計画に基づき、初期および年度オプションの付与も取得する。
サピルスタインさんは、会社のガバナンス委員会のメンバーとノミネートされた報酬委員会の追加現金として7,500ドル、4,000ドルの現金で年間40,000ドルの現金を受け取る予定です。 サピルスタインさんはまた、2022年計画に基づいて初期および年間オプションを付与されます。
フレイタガーさんは、年間40,000ドルの現金で事前招聘料(本年度比)と、監査委員会の会長およびコーポレート·ガバナンス委員会のメンバーとして18,500ドルの追加現金事前招聘料を取得します。Freitagさんは、2022年計画に基づき、初期および年間オプションの報酬も取得します。
ルパラ博士は毎年40,000ドルの現金事前招聘費(今年度の割合で計算)を獲得し、取締役会の指名と会社管理委員会の議長を務めることで8,000ドルの現金前払い金を追加する。Rupalla博士はまた、2022年計画に基づいて初期 と年間オプション贈与を獲得する。
| 136 |
利益を得る証券所有権
次の表は2023年10月23日までの会社普通株の実益所有権を示しており、具体的には以下の通りである
| ● | 既知の保有会社が普通株式の5%以上を発行している実益所有者の1人あたり; | |
| ● | 会社の幹部や役員は | |
| ● | すべてのbr社の現職幹部と役員を一つの団体としています。 |
利益所有権は、一般に、誰かが証券に対して単独または共有の投票権または投資権を有する場合、その人が証券に対して利益所有権 を有することを規定する米国証券取引委員会の規則に基づいて決定される。これらの規則によれば、利益所有権は、個人または実体が2023年10月23日から60日以内に引受権証または株式オプションを行使すること、または制限株式単位を付与することによって取得する権利を有する証券を含む。現在行使可能な権利証またはオプション、または2023年10月23日から60日以内に行使可能な引受権証またはオプション制約を受けた株式、または2023年10月23日から60日以内に帰属する制限された株式単位に拘束された株式は、その人の所有権パーセンテージを計算する際に、発行済み株式および実益保有の引受権証、オプションまたは制限株式単位brとみなされるが、他の人の所有権パーセンテージを計算する際に未償還株式とはみなされない。
脚注に明記されている を除いて,当社に提供する資料により,適用されるコミュニティ財産法の規定の下で,次表に示すbr}個人および実体がその実益を持つすべての株式に対して独占投票権および投資権を持つ.別の説明がない限り、次の表に記載されている各受益者の営業住所は、c/o ZyVersa Treateutics, Inc.,2200 N.Commerce Parkway,Suite 208,Weston,フロリダ州33326である。
| 137 |
私たちの普通株の実益所有権は2023年10月23日に発行と発行された43,515,401株普通株に基づいています。
| 実益所有者の氏名又は名称及び住所 | 番目 実益所有株式 | 株式パーセント 実益は を持つ | ||||||
| 役員および行政員 | ||||||||
| スティーヴン·C·グローバー(1) | 1,421,596 | 3.21 | % | |||||
| パク·ミン哲博士。(2) | 33,090 | * | ||||||
| ロブ·G·フィニツィオ(3) | 46,326 | * | ||||||
| ピーター·ウルフ(4) | 155,808 | * | ||||||
| カレン·カシュミール(5) | 81,402 | * | ||||||
| パブロ·グズマン医学博士(6) | 107,934 | * | ||||||
| ジェームズ·サピルスタイン | - | - | ||||||
| グレゴリー·フレターガー | - | - | ||||||
| 全役員と上級管理職が1組(8名) | 1,846,156 | 4.13 | % | |||||
| 他の5%の実益所有者 | ||||||||
| Ion Ventures LLC(7) | 3,066,812 | 6.76 | % | |||||
| Walleye Opportunities Master基金(8) | 4,831,891 | 9.99 | % | |||||
| L 1 Capital Global Opportunities Master Fund(9) | 2,849,738 | 6.42 | % | |||||
| * | 受益所有権が1%未満であることを示す. |
| (1) | スティーブン·C·グローバーとその関連会社が保有する普通株636,584株を含み、(1)スティーブン·C·グローバー登録普通株457,659株、(2)MedicaRx Inc.登録保有43,847株普通株、(3)Asclepius生命科学基金有限責任会社登録保有85,442株普通株、および(4)Asclepius Master Fund,Ltd.登録保有49,636株普通株を含む。この金額には、普通株式101,869株に対してそれぞれ683,143株および101,869株の普通株式に対して行使可能なオプションおよび引受権証が2023年9月11日以降60日以内に含まれます。 グローバーさんはMedicaRx Inc.の取締役管理役員、Asclepius Master Fund,Ltd.の管理役員、ならびにAsclepius生命科学基金有限責任会社の管理員です。 |
| (2) | 2023年9月11日からまたは2023年9月11日から60日以内に33,090株普通株に対して行使できるオプションを示す。 |
| (3) | 2023年9月11日からまたは2023年9月11日から60日以内に46,326株普通株に対して行使可能なオプションを示す。 |
| (4) | 代表: (I)44,585株普通株;及び (Ii)は2023年9月11日当日或いはその後60日以内にそれぞれ81,402株及び 29,821株普通株行使のオプション及び株式承認証を発行することができる。 |
| (5) | 代表は、2023年9月11日以降60日以内に81,402株の普通株に対して行使可能なオプションを表す。 |
| (6) | 代表: (I)26,021株普通株;及び(Ii)2023年9月11日当日或いはその後60日以内にそれぞれ72,898株及び9,015株普通株行使のオプション及び株式承認証を発行することができる。 |
| (7) | (I)1,245,906株普通株および(Ii)株式承認証を含み、2023年5月3日に提出された付表13 Gによって開示されるように、1,820,906株普通株を購入する。この等申告書類によると、開示された報告者が保有する引受権証は行使することができるが、当該等株式権証に記載されている9.99%の実益所有権制限阻止条項の規定の制限を受ける必要があるが、この等申告書類以来、当社が発行した株式の増加(Br)を考慮して、保有するすべての株式承認証はここで開示される。これらの証券はIonic Ventures LLC登録によって保有されている。Bendan O‘NeilとKeith CoulstonはいずれもIonic Ventures LLCのマネージャーであり、Ionic Ventures LLC実益が持つ株に対して共通の投票権と投資家統制権を持っている。Ionic Ventures,LLCのビジネスアドレスはカリフォルニア州サンフランシスコフェルモア街3053号スイートルーム、郵便番号:94123です。 |
| (8) | (I)905,228株の普通株および(Ii)3,926,663株の普通株を購入する引受権証を代表するが、この等株式証に記載されている9.99%の実益所有権制限により現在行使できない10,015,456株の株式の引受証は含まれていない。これらの証券はWalleye Opportunities Master Fund登録が保有している.Walleye Opportunities Master Fund Ltdメンバーの首席投資官William EnglandはWalleye Opportunities Master Fund Ltdが持つ証券に対して唯一の投票権と処分権を持っている。Walleye Opportunities Master Fundの業務アドレスはケイマン諸島ジョージシティエルキン通り190番地である。 |
| (9) | 合計2,849,738株の実益を代表する普通株は、(I)2,107,194株の普通株を含み、本合意に基づいて転売を登録し、各種私募方式で保証人や一部の他の投資家に発行し、Larkspurの成立とLarkspur初公募株の完成に関連し、Larkspur IPOの完成に関する発行の承認証を含み、(Ii)397,544株普通株は、2023年4月の株式発行時に発行された株式権利証 を行使することができる。(Iii)345,000株普通株は,本プロトコル項で転売 を登録し,管路株式転換後60日以内に発行可能であり,管路株式1株当たりの金額は管路株式の購入価格を2.00ドル(底値)で割った転換価格に等しい。これらの証券はL 1 Capital Global Opportunities Master Fund登録が保有している。DavidさんおよびJoel Arberは、L 1 Capital Global Opportunities Master Fund Ltd取締役である。したがって、L 1 Capital Global Opportunities Master Fund Ltd、Feldmanさん、Arberさんは、上記の証券を所有しているとみなされる(定義は1934年証券取引法第13 d-3条参照)。フェルドマンさんとアルバーさんがこれらの証券を所有していることが実益とみなされる範囲で、フェルドマンさんとアルベルさんが、これらの証券をすべての目的で所有することを拒否した。 L 1 Capital Global Opportunities Master Fundの営業アドレスは、ケイマン諸島大ケイマン諸島KY 1-10085、大ケイマン諸島シュデン路1砲兵法廷1号郵政ポスト161 A号 |
| 138 |
証券売却所持者
この 募集説明書は、以下の通りである
| ● | 最大5,858,714株の普通株を転売する | |
| ● | Bシリーズ株ベースの普通株として最大723,234株を転売した | |
| ● | 当社はすでに発行された株式承認証を行使する時、最大18,065,650株の普通株 を発行及び転売し、その中に私募株式証、公開持分証、パイプ承認持分証及び誘導権証を含む。 |
売却証券保有者は、本募集説明書および任意の添付の目論見書付録に従って、以下の普通株の任意または全部の株式を随時要約および売却することができる。“と言うと証券保有者の売却“本募集明細書において、私たちは、次の表に記載されたbr人、本募集説明書に含まれる引受権証の行使時に発行のために予約された普通株式保有者、br}質権者、譲受人、相続人、譲受人、および後に公開販売以外の他の方法で売却証券保有者の普通株式における任意の権益を保有する他の人を指す。
次の表は私たちが記録して販売証券所持者の承認を受けた情報に基づいて作成されています。以下の表は,本募集説明書までの日,売却証券保有者の氏名,および売却証券保有者が本募集説明書に従って提供可能な普通株式総数を示している。この表には、発行された公共株式承認証を行使する際に最大5,825,358株の普通株式を発行·転売することは含まれていない。
| 普通株株 | ||||||||||||||||
| 売却証券所持者名 | 番号
有益な 前に持っていたのは 提供するまで(1) | 登録番号 販売用 ここまで | 番号
有益な その後持っている 奉納する(2) | パーセント
有益な その後持っている 奉納する(2) | ||||||||||||
| Benchmark Company LLC(3) | 64,286 | 64,286 | 0 | 0 | % | |||||||||||
| AGP/アライアンスグローバルパートナー(4) | 1,025,481 | 1,025,481 | 0 | 0 | % | |||||||||||
| KLYコンサルティング(KLY Consulting LLC)(5) | 104,038 | 10,594 | 19,338 | * | % | |||||||||||
| ニコ·P·プロン(6) | 699,343 | 73,142 | 609,481 | 1.40 | % | |||||||||||
| Alpha Capital Anstalt(7) | 2,799,631 | 806,181 | 1,993,450 | 4.48 | % | |||||||||||
| 3 I、LP(8) | 3,066,812 | 575,000 | 2,234,906 | 4.99 | % | |||||||||||
| Alto Opportunity Master Fund,SPC分離の主ポートフォリオB(8) | 3,066,812 | 575,000 | 2,234,906 | 4.99 | % | |||||||||||
| ハドソンベイマスター基金有限公司(9) | 1,820,906 | 575,000 | 1,245,906 | 2.78 | % | |||||||||||
| S.H.N.金融投資(10) | 1,672,614 | 925,070 | 747,544 | 1.70 | % | |||||||||||
| Wleye Opportunitiesマスター基金(11) | 14,847,347 | 7,696,213 | 4,831,891 | 9.99 | % | |||||||||||
| L 1 Capital Global Opportunities Master Fund,Ltd.(12) | 2,849,738 | 2,452,194 | 397,544 | * | % | |||||||||||
| Dominion Capital LLC(8) | 3,066,812 | 575,000 | 2,234,906 | 4.99 | % | |||||||||||
| Ion Ventures LLC(8) | 3,066,812 | 575,000 | 2,234,906 | 4.99 | % | |||||||||||
| ウォバーグWF X LP(13) | 688,362 | 115,000 | 573,362 | 1.30 | % | |||||||||||
| エヴラト投資会社(14) | 1,733,406 | 287,500 | 1,445,906 | 3.27 | % | |||||||||||
| スティーブン·C·グローバー(15歳) | 1,421,596 | 18,813 | 1,319,727 | 2.97 | % | |||||||||||
| Daniel·オコナー(16歳) | 238,156 | 238,156 | 0 | 0 | % | |||||||||||
| ロバート·ニチェストロ(17歳) | 53,750 | 53,750 | 0 | 0 | % | |||||||||||
| デイビッド·ブリオネス(18歳) | 51,781 | 51,781 | 0 | 0 | % | |||||||||||
| ミッチェル·ヒフ(18歳) | 150,513 | 150,513 | 0 | 0 | % | |||||||||||
| Lakespor Holdings LLC(18) | 150,515 | 150,515 | 0 | 0 | % | |||||||||||
| ジェフリー·バーンスタイン(18歳) | 340,161 | 340,161 | 0 | 0 | % | |||||||||||
| M 2 B融資(18) | 346,181 | 346,181 | 0 | 0 | % | |||||||||||
| “アポロ”(18) | 346,181 | 346,181 | 0 | 0 | % | |||||||||||
| フランシス·クヌテル2世(18) | 77,681 | 77,681 | 0 | 0 | % | |||||||||||
| ニコラス·コバルチェビッチ(18歳) | 75,258 | 75,258 | 0 | 0 | % | |||||||||||
| トーマス·ポレティ(18歳) | 37,628 | 37,628 | 0 | 0 | % | |||||||||||
| Range Ventures,LLC(18社) | 69,068 | 69,068 | 0 | 0 | % | |||||||||||
| Raj Mehra(18歳) | 8,631 | 8,631 | 0 | 0 | % | |||||||||||
| グレゴリー·スカリギー(18歳) | 8,631 | 8,631 | 0 | 0 | % | |||||||||||
| クリストファー·ターウィティ(18歳) | 8,631 | 8,631 | 0 | 0 | % | |||||||||||
| DCコンサルティング(19) | 500,000 | 500,000 | 0 | 0 | % | |||||||||||
| MDM(19) | 10,000 | 10,000 | 0 | 0 | % | |||||||||||
| * | 実益所有権が1%以下であることを示す。 |
| 139 |
| (1) | 利益所有権番号Bシリーズ株が現在の転換価格 で普通株に変換されたと仮定すると、このような証券を管理する文書に含まれる7.00ドルの底値に相当し、本表 についてのみ、個人所有者転換可能証券の基礎となるいかなる利益所有権阻害要因も含まれていない。 |
| (2) | 我々普通株の実益所有権は、2023年10月23日までに発行された43,515,401株普通株に基づいており、発売後の実益所有数と発売後実益所有率は、個人 所有者の転換可能証券に基づく任意の実益所有権障害の適用を反映している。 |
| (3) | 合計64,286株の普通株式を代表します, は本プロトコル項で転売を登録し,B系列株転換後60日以内に発行することができる |
| (4) | 1,025,481株の普通株式の合計を表す 本プロトコルに従って転売を登録し、実益所有は、(I)450,270株の普通株式と、(Ii)575,211株がBシリーズ株式変換後60日以内に発行可能な普通株とを含む |
| (5) | 代表104,038株実益所有の普通株と(I)74,056株普通株は,旧ZyVersa承認株式証を行使する際に発行可能である,(Ii)10,594株普通株は,本プロトコルにより転売登録され,B系列株式転換後60日以内に発行可能である;および(Iii)19,388株普通株 は,KLY Consulting,Inc.が保有するオプション行使後60日以内に発行可能である.Kenneth J.YamashitaはKLY Consulting,LLCの最高経営責任者であり,KLY Consulting,Inc.が持つ証券に対して投票権と投資自由裁量権を持つ。この関係により、山下さんはKLYコンサルティング会社に記録されている証券に対して実益所有権を持っていると見られる可能性がある。山下さんのオフィスアドレスはフロリダ州パームシティ西南湖巷5005番地、郵便番号:34990 |
| (6) | 表した集合699,343株実益所有の普通株であって、(1)企業合併で発行された599,554株普通株と、(2)オプション行使後60日以内に発行可能な9,927株普通株と、(3)16,720株普通株と、旧ZyVersa承認株式証を行使してから60日以内に発行可能なbrと、を含む。(Iv)73,142株の普通株式は、本契約に基づいて転売登録され、来宝資本市場会社が保有するBシリーズ株に換算して60日以内に発行することができる。ニコP.ronkは、宝資本市場会社の総裁兼最高経営責任者であり、来宝資本市場会社が保有する証券に対して投票権および投資自由裁量権を有する証券である。この関係から、プーロンさんは、宝資本市場会社に登録保有証券を保有している実益と見なすことができる。さんの営業先は、ヤマトRoad,951である。フロリダ州ボカラトン二零零号室、郵便番号三三四三一です。 |
| (7) | 2,799,631株の実益を代表する普通株式と以下を含む:(I)996,725株普通株;(Ii)346,181株普通株は、本合意に基づいて転売を登録し、各種の私募方式で保証人とある他の投資家に発行し、Larkspurの成立とLarkspur IPOの完成に関連して、Larkspur IPO完了に関する権利証を含む;(Iii)996,725株普通株は、2023年4月の株式発行時に発行可能な株式権証 を行使して発行し、Alpha Capital Anstalt実益が所有する; と(Iv)460,000株の普通株は,本プロトコルにより転売を登録することにより,管路株転換後60日以内に発行可能であり,管路株1株あたりの金額は管路株の購入価格を2.00ドルで割った転換価格(下限価格 価格)に等しい |
| (8) | 3,066,812株を代表する実益を有する普通株式と(I)1,245,906株の普通株と、(Ii)1,245,906株の普通株と、(Ii)1,245,906株が2023年4月の株式発行時に発行可能な引受権証と、(Iii)575,000株の普通株とを含み、本合意により転売を登録することにより、管路株式転換後60日以内に発行することができ、管路株式1株当たりの金額は配管株式の購入価格を転換価格 2.00ドル(底価格)で割ることに等しい |
| (9) | 1,820,906株の実益を代表する普通株式と(I)1,245,906株普通株は、2023年4月の株式発行時に発行可能な引受権証と、(Ii)575,000株普通株とを含み、本プロトコルにより転売を登録し、管路株式転換後60日以内に発行することができ、金額は管路株式1株当たりの取得価格を管路株式の株式交換価格で割った2.00ドル(底値)である。 上記株式株式証はHudson Bay Master Fund Ltd.の子会社HB Strategy LLCが保有している。 |
| (10) | 1,672,614株の実益を代表する普通株式を含む(I)本プロトコルにより転売登録された752,570株普通株は、Larkspurの成立、Larkspur初公開入札の完了に合わせて、Larkspur IPO完了に関連して発行された引受権証を含む各種非公開配給方式で保証人及びいくつかの他の投資家に発行される。(Ii)373,772株普通株のうち、373,772株は2023年4月の株式発売から、(Iii)373,772株普通株は、2023年4月の株式発売株式承認権証を行使して発行することができる。和 (Iv)172,500株の普通株は,本プロトコルにより転売を登録することにより,管路株転換後60日以内に発行可能であり,管路株1株あたりの金額は管路株の買い取り価格を2.00ドルで割った転換価格(下限価格 価格)に等しい |
| 140 |
| (11) | 14,847,347株の実益を代表する普通株式と(1)905,228株普通株と(2)1,245,906株行使2023年4月株発行で発行可能な普通株は,2023年7月株発行の一部として行使価格は0.165ドル,(3)500,000株普通株 2023年7月株式発行で発行された株式承認証行使後に発行可能な普通株を含む(Iv)7,121,213株の普通株は、誘因 に基づいて株式証を承認して転売登録;及び(V)575,000株の普通株は、株式承認証に基づいて転売を登録し、管路株式転換後60日以内に発行することができ、管路株式1株当たりの金額は管路株式の購入価格を株式交換価格で割った2.00ドル(底値)に等しい |
| (12) | 2,849,738株の実益を代表する普通株(I) 2,107,194株普通株は、本プロトコルに基づいて転売を登録し、Larkspur IPOの成立とLarkspur IPOの完成に合わせてLarkspur IPOの完成に合わせて発行された引受権証;(Ii)397,544株普通株を含むLarkspur IPOの成立とLarkspur IPOの完成に合わせて、Larkspur IPOの完成に合わせて発行される株式証明書 ;および(Iii)本プロトコルにより転売を登録した345,000株の普通株は,管路株式転換後 60日以内に発行可能であり,管路株式1株あたりの金額は,管路株式の購入価格を管路株式の購入価格 で割った交換価格2.00ドル(底値)に等しい。これらの証券はL 1 Capital Global Opportunities Master Fund登録が保有している。DavidさんおよびJoel Arberは、L 1 Capital Global Opportunities Master Fund Ltd取締役である。したがって、L 1 Capital Global Opportunities Master Fund Ltd、Feldmanさん、Arberさんは、上記の証券を所有しているとみなされる(定義は1934年証券取引法第13 d-3条参照)。フェルドマンさんやArberさんは,その等の株式を実益所有しているとみなされているが,フェルドマンさんやArberさんは,他のすべての目的のためにその等の証券を所有することを拒否している.L 1 Capitalグローバルチャンスマスター基金の業務住所はケイマン諸島大ケイマン諸島KY 1-1001号大ケイマンKY 1-1001号郵便ポスト10085号施登路1号砲兵法廷161 A |
| (13) | 実益を代表する普通株総数688,362株は、(1)249,181株の普通株のうち、249,181株が2023年4月の株式発行で発行され、(2)249,181株が2023年4月の株式発行で発行された承認証、(3)37,500株が2023年7月に発行された普通株、(4)37,500株が2023年7月に発行された株式証で発行された普通株 を含む。及び(V)115,000株の普通株は、本プロトコルにより転売を登録することにより、管路株式転換後60日以内に 管路株式の1株当たり購入価格を管路株式の転換価格$2.00(底価格)で割ることができる。上記株式承認証は華宝富力X株式会社実益が所有及び保有する。 |
| (14) | 1,733,406株実益を代表する普通株は、(1)622,953株普通株であり、2023年4月に発行される普通株、(2)249,181株が2023年4月に発行された引受権証を行使する際に発行される普通株、(3)100,000株が2023年7月に発行される普通株、(4)100,000株行使2023年7月に発行された引受権証時に発行される普通株 を含む。和(V)287,500株の普通株は,本プロトコルにより転売を登録することにより,管路株式転換後60日以内に発行可能であり,1株当たり金額は管路株式であり,管路株式の購入価格を換算価格で割った2.00ドル(底値)に相当する。 |
| (15) | (1)業務合併で発行された627,834株の普通株 を含む実益所有普通株1,421,596株を代表する普通株であって、(1)Stephen C. グロフ登録保有448,909株普通株、(2)MedicaRx Inc.登録保有43,847株普通株、(3)Asclepius生命科学基金有限責任会社が登録保有した85,442株普通株、および(4)Asclepius Master Fund,Ltd.登録保有49,636株普通株を含む。この数字 は、(I)683,143株の普通株または60日以内に行使可能なオプションおよび引受権証と、(Ii)10,063株の普通株とをさらに含み、本プロトコルに従って転売を登録し、パイプ株転換後60日以内にbrパイプライン株の1株当たり金額をパイプ株の購入価格で割った2.00ドル( 底価)、(Iii)91,806株普通株、旧ZyVersa株式株式証の基礎;及び(Iv)が2023年4月に発行した8,750株の普通株は、本プロトコルにより転売を登録する。グローバーさんは、MedicaRx Inc.の取締役管理役員、Asclepius Master Fund、Ltd.の取締役管理メンバー、およびAsclepius生命科学基金LPの管理メンバーである。 |
| (16) | (I)2023年4月に発行された8,750株の普通株を含む、本プロトコルに従って転売、実益所有を代表する238,156株の普通株を代表する。(Ii)Larkspurの成立、Larkspur IPOの完了に関する保証人およびある他の投資家への各種私募において、Larkspur IPOの完了に関するbr発行の引受権証を含む219,343株の普通株式を特定の投資家に発行する。(Iii)管路株式転換後60日以内に10,063株普通株 を発行し,管路株式1株当たりの金額 は管路株式の購入価格を2.00ドルで割った換算価格( 底価格)に等しい。 |
| (17) | 合計53,570株の普通株を代表し、本契約に基づいて転売を登録した。実益所有であり、(I)28,750株がパイプ転換後60日以内に発行可能な普通株 パイプ株の1株当たり金額は、パイプの買い取り価格 株で割ることに等しい価格は2.00ドルですおよび(Ii)25,000株 を我々A系列優先株ベースの普通株とする. |
| (18) | この等所有者は普通株の株式を実益しており,本プロトコルの下で転売を登録し,様々な私募方式で保証人やある他の投資家に発行しており,Larkspurの成立に関係している.Larkspur初公募株式の完成は、Larkspur IPの完成に関する引受権証 を含む |
| (19) | この等所有者実益は,当社の利益のためのコンサルティングやコンサルタントサービスに関する株式 を所有している. |
| 141 |
ある関係は関係者と取引しています
役員や上級管理職との報酬を除いて“役員報酬 “と”管理する以下のbrは、2020年12月12日以来の各取引および現在行われている各取引の説明である
| ● | 私たちは参加者になっています | |
| ● | 12万ドル以上の金額になります | |
| ● | 当社の任意の役員、役員、または5%を超える株式を保有する実益所有者、またはbrの任意の直系親族、またはそのような個人(テナントまたは従業員を除く)と1戸に住んでいる人は、かつてまたは直接的または間接的な大きな利益を持つことになる。 |
郵政業務合併関連者取引
個人配給
2023年6月5日、私たちは、このようなメンバーが所有する自社のすべての証券のロック期間 を延長するために、保険者の一部のメンバーに合計3,044,152株の普通株を発行した。
婚約する 手紙(S)
2023年1月19日、AG.P/Alliance Global Partners(“AG.P.)と招聘状を締結し、AG.P.に現金費用を支払うことに同意し、発売中に証券を販売する購入者1人当たりの総購入価格の6.0%に相当し、AG.P.にこのような発売に関するいくつかの費用を返済し、総額は最高100,000ドルに達する。AGPはまた,以下に述べるように,我々IPOの引受業者brとパイプの配給エージェントを務めている前業務合併関連先取引: ラクスプ.”
プロトコルにお問い合わせください
2015年1月22日,我々は我々の首席医療官パブロ·グズマン博士と医療事務上級副総裁と改訂された諮問協定を締結し,我々の首席医療官代理としてサービスを提供してくれた。相談によると、2020年12月12日以来、私たちはグズマン博士に207,984ドル相当の現金をグズマン博士に支払い、(Ii)グズマン博士に1株11.33ドルから16.36ドルの取引価格で29,120株の私たちの普通株を購入するオプションを授与した。グズマン博士との相談合意は2023年1月26日に終了し、当社に雇用された時点で発効した。
パイプ取引と関連プロトコル
パイプ 購読プロトコル
業務合併については、吾らはPIPE投資家(当社のいくつかの連属会社を含む)と改訂されたPIPE引受契約を締結し、これにより、吾らは私募方式でPIPE投資家に合計8,636株Aシリーズ転換優先株 ,1株当たり額面0.0001ドル(“PIPE株式”)を売却し、総購入価格は8,635,000ドルであった。通常株 に変換することができ、変換価格は最初に1株10.00ドル(1株2.00ドル以上の下限価格に下方調整可能であり、これは、本登録声明に基づいてこのような証券登録の発効日後90日および150日後に計算された我々の普通株の公開取引価格)に基づいて、Aシリーズ指定証明書の条項に基づいてパイプライン株を変換する際に発行することができるが、何らかの調整が必要である。及び(Ii)普通株引受権証(1部当たり“PIPE株式承認証”)は、PIPE株式転換後に発行された普通株及び発行可能な普通株に最大相当し、数は発行済み普通株の100%に相当し、行使価格は最初は1株11.50ドルであるが、若干の調整が必要である。PIPE株式承認証の株式価格はいくつかの調整の影響を受け、(I)株式配当金及び分割、(br}(Ii)後続株式供給、(Iii)比例配分、(Iv)基本取引、(V)いくつかの自発的調整及び (Vi)PIPE株式承認証の条項に基づいて当時の有効価格で他の証券を発行する)による調整を含む。Aシリーズ指定証明書には、発行者がその時点で発行されたパイプ株の発行価格の120%でこのような株を償還する権利が含まれている。さらに、PIPE加入プロトコルは、慣例的な陳述および保証、 およびいくつかの譲渡制限を含む。管路株式の売却及び管路承認株式証を完了する条件には、通常の完了取引条件及び業務合併契約を完了するために行われる取引が含まれる。PIPE引受プロトコルにより証券を発行する は基本的に業務合併の完了と同時に完了する.
パイプ保証プロトコル
PIPE引受契約については、吾らは他のPIPE投資家と株式承認証合意を締結し、これにより、吾らは普通株引受権証(1部は“PIPE株式承認証”)を発行し、最大数はPIPE株式転換後に普通株株式 から100%の普通株を発行することができ、行価格は1株11.50ドルに初歩的に等しく、若干の調整を行うことができる。PIP権証の条項によると、PIP権証の発行価格は、(I)株式配当及び分割、(Ii)後続株式供給、(Iii)比例配分、(Iv)基本取引、(br}(V)若干の自発的調整及び(Vi)当時の有効行使価格で他の証券を発行する)による調整を含むいくつかの調整の影響を受ける。
| 142 |
パイプ 登録権プロトコル
業務合併の完了について、吾らはPIPE投資家と登録権協定 (“PIPE登録権協定”)を締結し、これにより、吾らは、1933年証券法 下で改正された表S−1を基準として、PIPE株式の転換又は行使により発行可能なすべての普通株株式の販売 及びPIPE引受プロトコル及びPIP権証により発行されるPIP権証を含むPIPE株式の転換又は行使により発行可能なすべての普通株株式の再販売 及びPIPE引受プロトコル及びPIP権証に基づいて発行されるPIP権証を含むことに同意した。私たちはまた、このような初期登録声明(およびPIPE登録権利協定に従って提出される必要がある他の登録声明)が、提出後、実行可能な範囲内でできるだけ早く米国証券取引委員会によって発効されるように最善を尽くす必要があるが、いずれの場合も、提出後20暦のbrに遅れてはならない(米国証券取引委員会が“全面的な審査”を行う場合は、45暦に遅れてはならない)。さらに、パイプ登録権協定の条項 によれば、ある要求および習慣条件に適合する場合、行使可能ないくつかの 請求権を含み、パイプ投資家はまたいくつかの“便式”登録権利を有するべきであるが、いくつかの要求および習慣条件の制約を受けなければならない。私たちはこのような登録声明の提出に関連する費用 を負担するつもりだ。
株主 サポートプロトコル
業務合併協定については、Larkspur、Old ZyVersa、および主要ZyVersa株主は、主要ZyVersa株主(その所有権権益共同代表発行されたZyVersa普通株式およびZyVersa Aシリーズ優先株(変換後の基準投票)がOld ZyVersaを代表して業務合併を承認するのに十分である)を規定し、業務合併協定および予定された取引の承認および採択を支持し、書面同意を署名·交付した。株主支援プロトコルは,(A)企業合併終了,(B) 企業合併プロトコルがその条項に従って終了し,(C)LarkspurおよびOld ZyVersaが企業合併プロトコルの任意の重大な改訂を採択し,および(D)Larkspur,Old ZyVersaおよびZyVersa株主が株主支援プロトコルを終了する書面プロトコル(“終了時間”)のうち最も早い者を基準に終了する.ZyVersaの主要株主は, が満期になるまで,何らかの譲渡制限(変換を含まない)を遵守することにも同意している.
ロック プロトコル
株主支援プロトコルについては,Key ZyVersa株主とロックプロトコルを締結し,これを“ロックプロトコル”と呼ぶ.禁売期間プロトコルにより,ZyVersaに発行される業務合併に関する既発行および未償還証券総額の約75%は以下に述べる制限を受け,取引終了 から適用禁売期間が終了するまでである.
我々とZyVersaの主要株主は同意しており、当社取締役会監査委員会の事前書面による同意を得ていない場合には、いくつかの例外的な場合を除いて、適用される販売禁止期間内にはありません
| ● | 直接または間接販売、要約売却、契約締結または同意売却、質権、質権、購入または他の方法で譲渡、処分または同意譲渡または処分のいずれかのオプション、権利または権利証を付与する あるいは格下げオプション等の値を設定又は増加させ、又は平倉又は取引所法案及びそれに基づいて公布された米国証券取引委員会規則及び条例に示されるコールオプション等の値を減少させる。買収合併が発効した直後に保有する任意の合併実体の普通株式、または業務合併により発行または発行可能な任意の株式(パイプライン投資の一部として買収または交換のために発行された会社普通株を含む)。パイプライン投資の一部として発行された証券を転換したり行使したり)オプションを行使する際に発行可能な会社普通株は、買収合併後に保有する会社普通株を購入し、 発効時間 または買収合併発効直後に、会社が保有する普通株に変換または行使可能または交換することができる任意の証券(“禁売株”); | |
| ● | このような取引が現金または他の方法でそのような証券決済を送達することにかかわらず、任意の販売禁止株の任意の経済的結果を譲渡するすべてのまたは部分的な譲渡の任意のスワップまたは他の手配を締結する | |
| ● | は上記の条項に規定された任意の取引を達成する意向を有する任意の取引を公開する. |
| 143 |
販売禁止協定によると、吾ら及びZyVersaの主要株主は、締め切りから(X)締め切り(X)及び(Y)当社が清算、合併、株式交換、再編又は当社のすべての 株主がその株式を現金、証券又は他の財産に両替する権利がある日(早い者を基準とする)までの期間内に、上記譲渡制限に同意する。
を改訂して登録権協定に再署名した
業務合併については、Larkspur とLarkspur証券を持つある個人と実体との間で2021年12月10日に締結された特定の登録権協定(“IPO登録権協定”)が改正され、再記載され、当社、保険者、取引終了前にLarkspur証券を保有するある個人および実体(保険者、“Larkspur所有者”)および取引終了前にOld ZyVersa証券を保有するある個人および実体(“ZyVersa所有者”、およびLarkspur所有者。登録権保持者“)は,2022年12月12日の改訂と再署名のための登録権協定を締結した。改訂及び再予約された登録権利協定に基づいて、当社は、(I)登録権利保持者が業務合併完了後6ヶ月間、ある登録権利の取得を要求することを許可されることに同意し、(Ii)当社は、その商業的に合理的な努力を尽くして、登録転売が が保有または登録権利保持者に発行可能ないくつかの証券の登録声明(“転売登録声明”)を米国証券取引委員会に提出し、費用は当社が自己負担する。及び(Iii)当社は、その商業上合理的な努力を尽くし、転売登録声明を提出した後、合理的で実行可能な場合には、できるだけ早く当該声明の発効を宣言する。場合によっては、登録権保持者は、習慣上の便乗式登録権を得る権利がある最大2回のパケット販売発行を要求することができる。改訂および再予約された登録権協定は、当社が改訂および再予約された権利協定項の下のいかなる責任も履行できなかったことについて、いかなる現金罰金を支払うかについて規定していない。
Bシリーズ調達協定
業務合併については,私たちにサービスを提供してくれたある買手に合計5,062株のB系列転換可能優先株(“Bシリーズ購入プロトコル”)を私募で発行することに同意し,1株当たり額面0.0001ドル(“Bシリーズ株”)であり,総購入価格は5,062,000ドルである.私たちの普通株に変換できる株は、転換価格は最初は1株10.00ドル(brを受けて1株7.00ドル以上に下方調整された底価格であり、これは私たちの普通株の株式公開取引価格 株の公開取引価格に基づいて、本登録声明の発効日後150日に計算されます)、Bシリーズ指定証明書の条項によってBシリーズ株に変換する際に発行することができ、 は何らかの調整が必要である。Bシリーズ指定証明書には、発行者がその時点で発行されたBシリーズ株式発行価格の120%の でこのような株を償還する権利が含まれる。さらに、Bシリーズ購入プロトコルは、慣例的な陳述および保証、およびいくつかの譲渡制限を含む。Bシリーズの株式売却を完了する条件には、慣用的な成約条件と、業務合併協定で予定されている取引を完了することが含まれる。証券の発行 は基本的に業務統合の終了と同時に完了する.
系列 B登録権プロトコル
Bシリーズ購入プロトコルについては,吾ら及び他の買い手は登録権プロトコル(“Bシリーズ登録権プロトコル”)を締結し,これにより,吾らは1933年証券法(改正)によりS−1フォームフォーマット(又は その他適用登録声明)形式で米国証券取引委員会に本予備登録声明を提出し,Bシリーズ購入プロトコルにより発行されたBシリーズ株式の転換又は行使時に発行可能なすべての普通株の全株式の転売をカバーしている。私たち はまた、この初期登録声明(および登録権合意に基づいて提出される追加の登録声明(br})を、提出後、実行可能な範囲内で可能な限り早く米国証券取引委員会によって発効させるために最善を尽くすことを要求されている。さらに、 は、B系列登録権協定の条項に基づいて、いくつかの要求および習慣条件に適合する場合には、行使可能ないくつかの要求に関する権利を含み、購入者は、いくつかの要求および習慣条件によって制限されるいくつかの“搭載”登録権利 を有するべきである。私たちはこのような登録宣言の提出に関連する費用を負担するつもりだ。
| 144 |
過橋融資
Old ZyVersaは、2022年3月から2022年12月まで、Old ZyVersaの普通株(“過橋融資”)を購入するためにAシリーズ変換可能優先株と引受権証(“過橋株式証”)の私募発行を行った。 Aシリーズ変換可能優先株の株式は、業務合併完了直前にOld ZyVersa普通株に自動的に変換される。業務合併完了後、この等Old ZyVersa普通株株式(交換比率)は1,271,904株当社普通株(うち327,765株はブリッジ融資に関連しており、残りの株式は2021年の本票融資をブリッジ融資に変換する転換から得られた。また,業務統合が完了した後,発行されたブリッジ株式証が想定され,(合併取引所比率に応じて)株式承認証に変換され,我々の普通株の株式を購入する.株式交換承認証は1,271,904株自社普通株(その中の327,765株株式承認証は橋融資からのものであり、残りの株式承認証は2021年の承諾票(Br)手形融資をブリッジ融資に変換することから由来する)、初期行使価格は1株6.90ドル(業務合併を発効させるように調整された)に相当するが、いくつかの調整が必要である。当社のある関連会社は投資家としてブリッジ融資に参加しています。
関連する 側取引政策
我々のbr取締役会は書面による関係者取引政策を採択し,関係者取引の審査と承認のために以下の政策と手順を提案した。
“関連者取引”とは、会社またはその任意の子会社 がかつて、現在、または参加者になる取引、手配、または関係を意味し、120,000ドルを超える金額を含み、任意の関連者がその中で所有し、所有するか、所有するか、または直接的または間接的に重大な利益を有するであろう。
“関係者”とは:
| ● | 適用期間内、または適用期間中の任意の時間に、当社の上級職員または取締役のうちの1つであった任意のbr人; |
| ● | 会社が知っている5%を超える (5%)議決権を持つ株の実益所有者 |
| ● | 上記のいずれかの直系親族とは、子供、継子、両親、継父母、配偶者、兄弟姉妹、姑、義父、息子の嫁、取締役の義弟または兄嫁、議決権のある株式を5%(5%)以上保有する高級社員または実益所有者、およびその取締役家庭を共有する誰(テナントまたは従業員を除く)。5%(5%)を超える議決権株を有する上級管理職または実益所有者 ;そして |
| ● | 任意の商号、会社、または他のエンティティであり、上記のいずれかは、パートナーまたは担当者であるか、または同様の職にあるか、または10%(10%)以上の実益所有権権益を有する。 |
会社が制定した政策および手順は、そのbr関連会社が発生する可能性のある任意の取引所と生じる潜在的利益衝突を最大限に低減し、時々存在する任意の実際的または潜在的利益衝突を開示するために適切な手続きを提供することを目的としている。具体的には、その定款によると、監査委員会は関連側の取引を審査する責任がある。
本節で述べたすべての 取引は,本ポリシーを採用する前に行われる.上記で開示されたいくつかの内容 は、我々の関連側プロトコルのいくつかの条項の要約であり、そのすべての内容は、そのようなプロトコルのすべての条項 を参照して限定される。これらの記述は適用プロトコルの要約のみであるため,必ずしも有用である可能性のあるすべての情報が含まれているとは限らない.いくつかのプロトコル(またはプロトコル形態)のコピーは、本募集説明書の一部として登録説明書の添付ファイルとして提出されており、米国証券取引委員会ウェブサイト上で電子的に取得することができるWwwv.sec.gov.
役員と役員の報酬配置
“を参照役員報酬“雇用、終了雇用および制御権スケジュールの変更、株式奨励、および何らかの他の福祉を含む、会社役員および役員の報酬スケジュールに関する情報を取得する。
役員brと将校賠償
当社の第二次改訂及び再予約の会社登録証明書(“定款”)及び第二次改訂及び再予約の附例(“附例”) は当社の役員及び高級社員に最大限の保障を提供しています。私たちは私たちのすべての役員と幹部と賠償協定を締結した。より多くの情報については、含まれる賠償検討 を参照してください“管理。”
| 145 |
開業前の旧ZyVersa合併関連側取引
2021年の本チケット融資
Old ZyVersaは2021年2月から3月までの間に、元金総額523万ドルの転換可能な元票(“2021年手形”)を発行した。Old ZyVersaの5%を超える株主Inon株式会社は元金総額250万ドルの2021年債を購入し、Old ZyVersa最高経営責任者のスティーブン·グローバーは元金総額30万ドルの2021年債を購入した。 2021年債の利息年利率は6%で、日複利で2021年12月31日に満期となる。ZyVersaが2021年2月15日以降に債務融資(“合格債務融資”)を開始すれば、2021年手形は自動的に と合格債務融資で発行された同じ形式、同じ条項と条件の元票に変換され、元本 金額は2021年手形項の当時の未返済元金と未払い利息(“手形義務”)に等しい。brは、会社が2021年2月15日以降に最低50万ドルの株式融資(“合格株式融資”)を完了したとき、2021年手形は、この等合資格株式融資の任意の投資家が受信した同じ価格及び同じ条項及び1つの合資格株式融資(“後続の証券”)で販売される株式証券に自動的に変換される。 は、この等変換後に発行される後続一輪証券の数は、(I)当該等制限持分融資終了時に返済されていない手形責任の金額を当該等の後続証券が当該合資格株式融資で販売される最低1証券価格(“交換価格”)で割った商数に等しい。適格株式融資前の任意の時間に制御権が変更された場合、その制御権変更終了時に手形債務を返済していない金額に相当する金額は、制御権変更終了時に自動的に変換され、価格は1株3.25ドルとなる。2022年7月8日、Aシリーズ優先株融資(合格株式融資を招き、累計毛収入は500,000ドルを超える)、2021年手形は5,230,000ドル元金と428,888ドルの利息からなり、 は自動的に1,802,193株Aシリーズ優先株に変換され、実際の転換価格はAシリーズ優先株1株3.14ドルである。また、Aシリーズ株式承認証購入2,035,571株普通株は、Aシリーズ優先株自動転換時に2021年までに手形所持者に発行されたbr}Aシリーズ優先株が業務合併終了時に発生する。 これらの証券は最終的に橋梁融資で発行された証券に変換され、同じ条項で変換される。
在庫 とINCON,Ltd.の調達プロトコル.
2018年11月15日の融資取引では、Old ZyVersaはINCON,Ltdに4,347,826株のOld ZyVersa普通株 を発行し、総代償は1,000万ドル(“2018 INCON投資”)となった。2018年のINCON投資について、INCONはOld ZyVersaに参加する取締役会を代表して任命し、INCONはOld ZyVersaの最高経営責任者Stephen GloverにINCON取締役会のメンバーに参加することを要求する可能性がある。
登録 権利プロトコル
2016年11月、Old ZyVersaの普通株(“2016 Old ZyVersa融資”)について、 Old ZyVersaと2016年の融資に参加した各投資家が登録権協定(“2016登録権協定”)を締結した。二零一六年登録権協定によると、二零一六年融資に参加した各投資家に搭載登録権が付与され、これにより、Old ZyVersaがOld ZyVersaが販売する株式株式を証券法に基づいて登録することを提案し、登録形式が投資家の普通株式の登録を許可する場合、二零一六年融資に参加した各投資家は、保有するOld ZyVersa普通株式をこの登録声明に含める権利がある。2016登録権利プロトコルは、ビジネス統合が終了すると自動的に終了します。
2016年のOld ZyVersaのリリースでは、オーld ZyVersaのスティーブン·グローバー最高経営責任者(CEO)とグローバー·さんが関わったエンティティが合計55万ドルの普通株式を購入し、Old ZyVersaの5%株主であるショーン·テトコムと関連するエンティティが20万ドルの普通株式を購入した。
2014年旧ZyVersa株主契約
二零一四年四月十一日、Old ZyVersaと3人の5%株主Shawn Titcomb、Nico PronkおよびNathan Cali、およびOld ZyVersa 行政総裁Stephen Gloverが株主合意(“2014 Old ZyVersa株主合意”)を締結することにより、株主合意は、(I)Old ZyVersaの取締役数がいつでも3人の取締役、および(Ii)Shawn Titcomb、NronicoおよびStephen Gloverが当選し、Old ZyVersa取締役を継続することを確保することに同意した。
| 146 |
“2014旧ZyVersa株主合意”には、東洋株が所有する証券に対するいくつかの譲渡制限 も含まれているが、いくつかの慣行例外は除外されている。2014年Old ZyVersaの株主契約によると、任意の他の株式が第三者がその証券を売却する誠実な要約を受け取った場合、株主はそれぞれ優先的な購入権を持っている。 2016年10月28日、ノーベル国際投資会社のOld ZyVersa普通株式の5%を超える株主と、Pronkさんに関連するエンティティ が共同合意に署名し、他の当事者と同じ条項に従って2014 Old ZyVersa株主合意の契約者に決定した。2014年の旧ZyVersa株主プロトコルは、業務統合終了時に自動的に を終了します。
開業前のLarkspur合併関連側取引
2021年4月4日、LarkspurとBrio Financial Group(“Brio Financial”) は合意(“Brioプロトコル”)を締結し、これに基づいてBrio FinancialはLarkspurにいくつかの財務及び会計サービスを提供し、Larkspurの毎月及び四半期会計決済プロセスの制定及び記録、財務諸表の作成、Larkspur会計システム及びその内部債務及び権益分類帳の維持、四半期及び年度報告のMD&A部分の作成、及びその財務報告の内部制御を評価することを含むが、これらに限定されない。Brioプロトコルによると、Larkspurは、Brio Financialに固定価格15,000ドルの初期サービスと固定された毎月1,750ドルの日常的なサービスを支払うことに同意し、2021年6月から開始する。Larkspur はまた、Brio Financialの旅費と他の自己負担費用を精算することに同意した。“Brio協定”の有効期限は2021年4月4日から発効し、有効期限は2022年12月31日まで。LarkspurまたはBrio Financialは、書面で他方に通知してから10日以内に、任意の理由でBrioプロトコルを随時終了することができます。David·S·ブリオネスは、Larkspurの最高財務官、財務担当、秘書兼取締役であり、Brio Financialの管理メンバーであり、Brio Financialの100%の株式を持っている。ブリオ協定の価値は約48,250ドル,David·S·ブリオネスのブリオ合意における権益の価値は約48,250ドルである。
業務合併完了では,LarkspurはA.G.P. とA.G.P.にBシリーズ株4,026株を発行することを含めてBシリーズ購入契約を締結し,A.G.P.が我々を代表して展開している活動を考慮すると, は潜在目標業務の決定と適切な業務合併に対する職務調査を含み,購入総価格は約4,026,000ドルであり,(I)配管に関する配給代理費6.0%,金額約506,000ドル,(Ii)当社初公募に関する繰延引受販売割引4.5%,金額は3,495,000ドルに相当し,および(Iii)申告不可能な 支出は,金額は25,000ドルに相当する.
Larkspur初公募が終了する前に、Larkspur Health LLCの投資家は、今回発行された費用の一部に合計75万ドルの融資をLarkspurに提供することに同意した。これらのローンは無利子、無担保であり、2021年12月31日までまたはLarkspur初公募終了時(早い日を基準とする)の満期(br}は、関連発売費用(引受手数料を除く)の推定1,176,000ドルの発売に用いられる。
Larkspurの最初の業務合併後、その管理チームに引き続き合併後会社に残っているメンバーは、合併後の会社から相談費、管理費またはその他の費用を獲得し、入札要約や依頼書募集材料(場合によっては)で株主に任意およびすべての金額を十分に開示する可能性がある。このような報酬の金額 は,このような入札要約材料を配布する際や,我々の最初の業務統合を考慮するために開催された株主総会 では,合併後の業務の取締役 が役員と取締役の報酬を決定するためであることが分かる.
Larkspur は、我々の上級管理者や取締役と慣例協定を締結し、その改訂と再改訂された会社登録証明書に規定されている賠償に加えて、契約賠償を提供します。Larkspurの定款はまた、デラウェア州法律 がこのような賠償を許可するかどうかにかかわらず、いかなる幹部、取締役、あるいは従業員を代表してその行為によるいかなる責任の保険加入を許可することを許可する。Larkspurは取締役と上級管理者責任保険を購入し、その高級管理者と取締役が場合によっては弁護、和解、または判決の費用を支払うために保険を提供し、その賠償のために高級管理者と取締役の義務に保険を提供する。
| 147 |
2021年5月7日、保証人は書面合意に基づいてLarkspurに合計320,272個の私募単位を購入し、購入価格は1株10.00ドルの私募であり、IPO終了と引受業者がその超過配給選択権を行使すると同時に行った。各私募部門はA類普通株と4分の3の償還可能な私募株式証からなる。1部の私募株式証は所有者に1株11.50ドルの価格でA類普通株 を購入する権利を持たせ、価格は調整される可能性がある。普通株式及び私募株式権証の対象株式(引受権証を行使する際に発行可能な普通株式を含む)は、ある限られた例外の場合を除いて、初期業務合併完了後30日まで譲渡、譲渡又は売却を行うことができない。
Larkspurは2021年5月7日に保証人の投資家に無担保本券(“本票”)を発行し、2021年10月7日に改訂及び再発行することにより、Larkspurは元金総額750,000ドルに達することができる。 本券は無利子手形であり、(I)2021年12月31日及び(Ii)Larkspurが初公開発売時(比較的早い者を基準)に支払いを完了する。
初期業務統合が完了する前または初期業務合併に関連するサービスについては、発起人および相談料を含む任意の形態の補償は、保険者、上級管理者および取締役、またはそれらのそれぞれの関連会社に支払われない。しかしながら、これらの個人は、潜在的なターゲットビジネスの決定および適切なビジネスの組み合わせの職務調査など、Larkspur代表活動に関連する任意の自己負担費用の精算 を得るであろう。Larkspurの監査委員会は、Larkspurがスポンサー、上級管理者、役員またはその付属会社に支払ったすべての金額を四半期ごとに審査し、どのような費用と費用金額が精算されるかを決定する。このような者がLarkspurを代表して活動することにより発生する自己負担費用に上限や上限はない。
また,計画された初期業務合併に関する取引コストを支払うために,保証人や保証人の付属会社やLarkspurのある上級管理者や取締役は,必要に応じてLarkspur資金 (“運営資金ローン”)を貸すことができる(ただし義務はない).この運転資金ローンは約束手形で証明されるだろう。手形は業務合併完了時に返済でき、利息は含まれていません。これらの単位は個人配給単位と同じになるだろう。企業合併が終了していない場合、会社は信託口座以外の収益の一部を用いて運営資金ローンを返済することができるが、信託口座における収益は運営資金ローンの償還には利用されない。2022年9月30日現在、運営資金ローンでは未返済額はない。Larkspurは、第三者がこのような資金を貸してくれると信じていないため、スポンサー、その付属会社、またはその管理チーム以外の他の者から融資を求めず、信託口座の資金を使用するためのいかなる権利も免除すると信じていないからである。
賠償協定
Br社は各役員と指定された役員と賠償協定を締結している。これらの協定は、デラウェア州の法律で許可されている範囲内で、これらの個人が会社にサービスすることによって生じる可能性のある責任を最大限に賠償し、賠償を受ける可能性があるため、彼らに対する訴訟によって発生した費用を前借りすることを要求している。同社は将来の役員や役員と賠償協定も締結しようとしている。 については、賠償協定のより詳細な説明については、“を参照されたい”役員報酬.”
関係者取引の政策と手順
我々の取締役会は、役員、取締役、取締役に選出された被著名人、任意のカテゴリの普通株の実益所有者、上記のいずれかの直系親族、および上記のいずれかが雇用され、パートナーまたは主事者であるか、または同様の職にあるか、または5%以上の実益所有権を有する任意の会社、会社、または他のエンティティ(総称して“関連者”と呼ぶ)の政策を採択した。当社の取締役会が審査委員会を介して行動するか、または場合によっては審査委員会主席の事前の同意を得ていない場合は、当社と取引することはできません。関連金額が100,000ドルを超え、関連者が直接的または間接的な利益を有する場合、最初に監査委員会に提出するか、または場合によっては監査委員会議長に提出して審査、審議および承認を行わなければならない場合がある。そのような提案を承認または拒否する場合、監査委員会または監査委員会議長は、取引条項が、同じまたは同様の場合に非関連第三者が一般的に得ることができる条項、私たちへの利益の程度、比較可能な製品またはサービスの他のソース ,および関連する当事者の取引における利益の程度を下回っていないかどうかを含むが、これらに限定されない取引の重大な事実を考慮すべきである。
取締役 独立
私たちの取締役会はその構成、委員会の構成、そして各取締役の独立性を審査しました。各取締役が要求し提供するその背景,雇用,従属関係に関する情報に基づいて,我々の取締役会は,董事7(7)名董事中の6(6)名を代表するロブ·G·フィニツィオ,朴敏哲,Daniel·J·オコナー,ジェームズ·サピルスタイン,グレゴリー·フレータグとカトリーヌ·ルパラ博士に取締役責任履行の独立判断を妨害する関係は存在しないことを決定した。この等 名取締役はすべて“独立”取締役であり、この言葉はアメリカ証券取引委員会の適用規則及び規則及びナスダックの上場 要求及び規則によって定義されている。
| 148 |
私たちの証券説明
以下は、ZyVersa治療会社(“私たち”、“私たち”、“私たち”または“会社”)の証券の説明であり、これらの証券は、私たちが第2回改正および再署名した会社登録証明書(“憲章”)および私たちの第2回改正および再改訂された定款(“定款”)のいくつかの条項、Aシリーズ指定証明書、Bシリーズ指定証明書、および適用される株式証明書に記載されている。各文書は、以前に米国証券取引委員会(“米国証券取引委員会”)に提出され、本明細書の構成要素である本登録声明の証拠物を参照によって組み込まれている。本要約は完全な ではなく、全文には憲章全文、定款、Aシリーズ指定証明書、Bシリーズ指定証明書、適用される授権書フォーマット、および“デラウェア州会社法”(以下、“DGCL”)の適用条項が含まれています。 私たちの憲章、定款、Aシリーズ指定証明書、Bシリーズ指定証明書、適用される授権書フォーマット、DGCLの適用部分をよく読むことを奨励します。
授権 資本化
当社の法定配当金総額は、以下の通りです
| ● | 1.1億株普通株、1株当たり額面0.0001ドル(“普通株”)、および | |
| ● | 1,000,000株優先株、1株当たり額面0.0001ドル(“優先株”)。 |
2023年10月23日現在、私たちの発行と発行済み株は43,515株、401株普通株、50株Aシリーズ優先株と5,062株Bシリーズ優先株を含む。私たちの普通株はナスダック世界市場に上場し、コードは “ZVSA”です
普通株 株
投票権 権利
普通株式保有者は、株主が一般的に議決権を有するすべての事項において、その登録されている普通株式を1株保有するごとに、1票を投じる権利がある。
配当権
任意の発行された優先株に適用可能な優先株割引に適合する場合、普通株式保有者は、我々の取締役会が時々発表する可能性のある配当権を有する普通株から、合法的な利用可能資金から比例して配当金を得る権利がある。
清算時の権利
会社に任意の自発的または非自発的清算、解散または終了が発生した場合、普通株式保有者は、会社の債務および他の負債を返済した後に残ったすべての資産を比例的に共有する権利があるが、 平価通行証優先株または普通株に優先する任意の種類または系列株の優先分配権は、あれば発行済み株である。
その他 権利
普通株の 保有者は優先引受権や転換権や他の引受権を持たない.普通株に適用される償還や債務超過はありません。普通株式保有者の権利、優先権、および特権は、会社が将来発行する可能性のある任意の優先株の所有者の権利、優先権、および特権に支配されるだろう。
| 149 |
優先株
私たち は50株のAシリーズ優先株と5,062株Bシリーズ優先株が発行され流通しています。 憲章は、優先株は時々1つまたは複数のシリーズで発行できると規定しています。取締役会は、一連の優先株株の投票権、指定、権力および特典、相対、参加、選択、または他の特殊な権利およびそれらの任意の資格、制限、制限に適用されることを決定することを許可されている。取締役会は、株主の承認なしに投票権及び他の権利を有する優先株を発行することができ、これらの権利は、普通株式保有者の投票権及び他の権利に悪影響を及ぼす可能性があり、逆買収効果を生じる可能性がある。取締役会が株主の承認を得ずに優先株を発行する能力は、br社の支配権の変更や既存経営陣の更迭を遅延、延期または阻止する可能性がある。
系列 A転換可能優先株
業務合併については、吾らはPIPE投資家(当社のある関連会社を含む)と改訂されたPIPE引受契約を締結し、これにより、吾らは私募方式でPIPE投資家に合計8,636株Aシリーズ転換可能優先株を売却し、1株当たり額面0.0001ドル、総購入価格は8,635,000ドルであった。普通株に変換することができ、変換価格は最初に1株10.00ドル(1株2.00ドル以上の下限価格に下方調整可能であり、これは、我々の普通株の公開取引価格に基づいて、このような証券の登録に関する登録声明発効日後90日および150日に基づいて算出される)、Aシリーズ指定証明書の条項に基づいてパイプライン株を変換する際に発行することができるが、何らかの調整が必要である。そして (Ii)PIPE株式承認証は最も多くの数量の普通株を購入し、初歩的に発行された普通株の100%に相当し、そしてAシリーズ指定証明書と株式承認証の条項によってPIPE株式転換時に発行することができ、 行使価格は最初に1株11.50ドルに相当し、ある調整を行うことができる。PIP権証の条項によると、PIPE株式証の取引価格はいくつかの調整の影響を受け、(I)株式配当及び分割、(Ii)後続株式供給、(Iii)比例配分、(Iv)基本取引、(V)いくつかの自発的調整及び(Vi)当時有効な行使価格で他の証券を発行することを含む。A系列指定証明書には,発行者がその時点で発行されたパイプ株発行価格の120%でこのような株 を償還する権利がある.さらに、PIPE加入プロトコルは、慣例的な陳述および保証、およびいくつかの譲渡制限 を含む。管路株式の売却及び管路株式承認証を完成する条件には、慣用的な成約条件及び業務合併協議を完了するために行われる取引が含まれる。PIPE引受契約に基づいて証券 を発行することは基本的に業務合併と同時に完了します。 2023年9月11日まで、(I)は50株のPIPE株式流通株、および(Ii)4,878,875株のPIPE株式権証は、すべて1株2.00ドルで行使することができます。
Bシリーズ転換可能優先株
業務合併が完了する直前に,吾らは引受 プロトコル(総称して“B系列引受プロトコル”と呼ぶ)により,当社の複数のサービス供給者に合計5,062株自社B系列転換可能優先株(“B系列株”)を発行し,購入価格は1株1,000ドル とし,当該等のサービス供給者に支払う若干の費用の現金支払いの代わりに総額5,062,000ドルとした.各Bシリーズ株はいくつかの普通株 に変換することができ、購入価格を転換価格で割ることに等しい。Bシリーズ指定証明書の条項によると、転換価格は1株7.00ドルに等しく、何らかの調整が行われる可能性がある。B系列指定証明書には、発行者がその時点で発行されたBシリーズ株発行価格の120%でこのような株を償還する権利があることが含まれている。さらに、Bシリーズ調達プロトコルには、慣例的な陳述および保証、およびいくつかの譲渡制限が含まれている。Bシリーズ株式の売却を完了する条件には、通常の成約条件と、業務合併合意が予想される取引を完了することが含まれる。証券の発行は基本的に業務合併の完了と同時に完了する。
| 150 |
未償還引受権証
公共株式証明書
各完全株式証明書は登録所有者にLarkspur初の公募終了後1年後まで業務合併が完了してから30日後までの任意の時間に、1株11.50ドルの価格で普通株を購入する権利があるが、次項で述べた調整は除外する。株式承認証協議によると、株式証明証所有者は整数株普通株に対してのみ株式承認証を行使することができる。
この は,権利証保持者が与えられた時間内に権証全体しか行使できないことを意味する.単位を分割した後,断片的な株式承認証を発行することはなく,株式承認証全体を売買するだけである.この等株式証は業務合併完了後5年、アメリカ東部時間午後5:00或いは償還或いは清算時にもっと早く満期になる。
我々は,株式承認証の行使に応じていかなる普通株にも交付する義務がなく,このような株式承認証の行使について決済する義務もなく,証券法に基づいて株式証に関する普通株式の登録声明が発効しない限り,募集説明書は最新であり,以下に述べる登録義務 を履行しているか,あるいは有効な登録免除があることを前提としている.株式承認証は行使されず、株式証の行使時に普通株式を発行する義務はありません。株式証の行使時に発行可能な普通株式が株式承認証登録所有者の居住国の証券法に基づいて登録され、資格に適合しているか、免除されているとみなされなければなりません。前2文の条件が持分証明書の条件を満たしていない場合、当該株式承認証の所有者は当該株式承認証を行使する権利がなく、当該株式承認証は価値がなく、期限時に一文の価値がない可能性がある。いかなる場合においても、私たちは現金純額でいかなる株式承認証を決済することを要求されない。登録宣言が行使された株式証明書に対して無効である場合、当該株式承認証を含む単位の購入者は、当該単位の普通株式のみに当該単位の全購入価格を支払う。
私たちはすでに同意しました。私たちは私たちの商業上の合理的な努力を尽くして、できるだけ早くアメリカ証券取引委員会に登録声明を提出して、証券法に基づいて引受証を行使する時に発行可能な普通株式を登録して、私たちは私たちの商業上合理的な努力を尽くして、私たちの最初のbr業務合併が終了してから60営業日以内に発効させ、この登録声明と当該普通株に関連する現在の株式募集説明書の有効性を維持します。我々の普通株式brが、国家証券取引所に上場されていない公共株式証明書を行使する際に、証券法第18(B)(1)条に規定する“担保証券”の定義に適合すれば、証券法第3(A)(9)条の規定に基づいて、その株式承認証を行使する公共株式証保有者に“キャッシュレスベース”で行使することを要求することができる。私たちは、証券法に基づいて引受権証を行使する際に発行可能な普通株式のbrの提出や維持登録声明として登録することは要求されませんが、私たちは私たちの商業的に合理的な努力を尽くして、適用された青空法律に基づいて登録したり、売却資格 に適合して免除 を得ることができません。株式承認証の行使時に普通株式を発行できる登録声明は60年前に発効していないこれは…。初期業務合併終了翌日には、権利証所持者は、証券法第3(A)(9)条またはその他の免除により“キャッシュレスベース”方式で株式承認証を行使することができるが、適用される青空法律に基づいて株式を登録したり、有効な登録声明及び有効な登録声明を維持できない期間があるまで、適用される青空法律に基づいて株式を登録したり、免除条件を満たしたりすることができる。この場合、各持株者は、使用価格を支払うために普通株式の引受証を提出し、承認株式証の数は、(A)株式証明書の普通株式数に(X)承認株式証に関連する普通株式数を乗じて(X)承認株式証の行使価格を乗じた“公平市価”(以下、定義)に(Y)公平市価と(B)1部当たりの株式証の0.361を乗じたものに等しい。本項でいう“公正市価”とは、権証代理人が行権通知を受けた日の前10取引日以内の普通株式成約量加重平均価格をいう。
償還権証
株式承認証が行使できるようになると、まだ償還されていない引受権証を償還することができる(本稿の私募株式証に関する記述を除く)
| ● | 一部ではありません |
| ● | 株式承認証1部当たり0.01ドルの価格 |
| ● | 各名権証所持者に少なくとも30日間の早期償還書面通知を発行し、 |
| ● | もし、 であり、普通株式の終値が1株当たり18.00ドル以上である場合にのみ(行使された場合に発行可能な株式数調整または タイトルで説明する引受権証の行使価格調整後)未償還のbrは権利証明書を償還できる−株式公開承認証−逆希釈調整“ は,我々が株式承認証所有者に償還通知を出した日前30(30)取引日内の任意の20(20)取引日内の任意の20(20)取引日である. |
| 151 |
我々は、証券法の下で引受権証を行使する際に発行可能な普通株式brに関する登録声明が発効しない限り、上記株式承認証を償還することはなく、当該普通株式br株式に関する最新の目論見書を全30日間の償還期間内に閲覧することができる。もし株式証明書を私たちが償還することができれば、私たちはすべての適用された州証券法に基づいて対象証券を登録したり、売却資格に適合させることができなくても、償還権を行使することができます。
もし私たちが上述したように権利証の償還を要求した場合、私たちの経営陣は、brの権利を行使したいすべての所有者に“キャッシュレスに基づいて”そうすることを要求する権利があるだろう。すべての所有者が“キャッシュレス”に基づいてその株式承認証を行使することを要求するか否かを決定する際には、他の要因を除いて、我々の経営陣は、私たちの現金状況、発行されていない引受証の数、および私たちの引受証を行使した後に発行された最大数の普通株の株主への希釈影響を考慮する。この場合、各持株者は、(A)株式承認証関連普通株式数に(X)普通株式数を乗じて(Y)承認株式証行使価格を(Y)公平市場価値で割った普通株“公平市価”の差額に等しい普通株株式の引受権証を渡すことにより使用価格を支払う。
私たちはすでに上記の最後の償還基準を確立して、償還を防止するために、償還時に株式証券取引に対する著しい割増が存在しない限り、償還を防止した。上記の条件を満たし、株式承認証の償還通知が発行された場合、各持分証所有者は、所定の償還日前にその株式承認証を行使する権利がある。このような行使はいずれも“現金なし”に基づいて行われず、行使権証所有者に、行使された株式承認証毎に行使 価格の支払いが要求される。しかしながら、普通株式の価格は、18.00ドルの償還トリガ価格 を下回る可能性がある(行使時に発行可能な株式数や権利証の行使価格の調整に応じて、タイトルのような調整が行われる“−未償還償還可能権利証−公有権証−逆希釈調整“ および償還通知が発行された後の11.50ドル(全株)株式証発行権価格。
権利を行使する際には普通株式の断片的な株式は発行されない。もし行使時に,所有者が1株の株式の端数 権益を獲得する権利があれば,我々は 所有者に発行される普通株式数の最も近い整数に丸められる.償還時に、株式承認証合意に基づいて、株式承認証は普通株式以外の証券(例えば、私たちが最初の業務合併に存在する会社ではない場合)を行使することができれば、そのような証券について株式承認証を行使することができる。株式証が普通株式以外の証券で行使可能である場合、当社(又は存続会社)は、証券法に基づいて商業的に合理的な努力を行い、引受権証を行使する際に発行可能な証券を登録する。
償還手順
株式証所有者が当該持分証を行使する権利がないという要求を受けることを選択した場合、当該株式証所有者は書面で吾等に通知することができるが、当該等の権利を行使した後、当該人(当該人のbr連属会社とともに)が、持分証代理人が実際に知っていることから、実益を9.8%(又は所有者 が指定した他の金額)を超える発行及び発行された普通株式を所有することが条件となる。
株式承認証 収益
当社が要約買収またはその他の方法で仮定したLarkspur承認株式証を償還、終了またはログアウトする場合、(X)Larkspur創設株主および(Y)当社経営陣のいくつかのメンバーは、当該等の償還に関連するいかなるLarkspur承認株式証を行使することにより、当社が実際に受け取った任意の現金収益の5%(5%)を得る権利がある。
逆希釈調整
普通株式の流通株数が普通株の資本化または配当に対応することによって増加する場合、または普通株の分割または他の類似イベントによって増加する場合、資本化または株式配当、分割または類似イベントの発効日に、株式承認証1部当たり発行可能な普通株数は、普通株式流通株のこのような増加割合で増加する。すべてまたはほぼすべての普通株式保有者に“歴史的公正市価”(以下の定義を参照)より低い価格で普通株を購入する権利があり、 を以下の積に相当する普通株式配当とする:(I)配株中で実際に販売される普通株式数(または株式で販売される普通株または行使可能な普通株に変換可能な任意の他の持分証券の下で発行可能な)および(Ii)1(X)このような配当金で支払われる普通株式1株当たり価格および(Y)歴史的に公正な時価の商数を差し引く。この目的のために、(I)配当が普通株または普通株で行使可能な証券である場合、普通株の対処価格を決定する際には、当該権利が受信した任意の対価格を考慮する。ならびに行使または変換時に支払われるべき任意の追加金額、ならびに(Ii)“歴史的公正市価”とは、普通株が取引所または市場正常取引が適用される第1の取引日前の10取引日前に報告された普通株式成約量加重平均価格を意味するが、その権利を得る権利がない。
| 152 |
さらに、株式証明書の未満期および未満期期間のいずれかの時間において、普通株式(または株式承認証が他の証券に変換可能な他の証券)の株式(または株式承認証が他の証券に変換可能な他の証券)の株式によって、現金、証券または他の資産ですべてまたはほぼすべての普通株式所有者に配当金を支払うか、または分配する場合、(A)上述したように、(B)任意の現金配当金または現金分配は含まれない。1株当たりに基づいて他のすべての現金配当金および現金分配と組み合わせた場合、普通株式に支払われる現金配当金および現金分配は、配当または分配が発表された日までの365日の間、br}0.50ドルを超えないように調整されているが、使用価格または各承認株式を行使する際に発行可能な普通株式数を調整する現金配当金または現金分配を含まない他の調整を適切に反映するように調整されているが、1株当たり0.50ドル以下の現金配当または現金分配総額にのみ関連している。(C)普通株式保有者が提案された初期業務統合に関連する償還権利を満たす。(D) 普通株式保有者の償還権利を満たし、これは、株主投票が私たちの憲章に関連するbr(A)私たちの義務の実質または時間を修正し、私たちの普通株式所有者が、私たちの最初の業務合併で彼らのbr株を償還する権利があるようにするか、または最初の公募株終了後12ヶ月以内に私たちの最初の業務合併を完了しなかった場合、100%の公開株式を償還する(この日が既存の組織文書に従って延長されない限り)または(B)私たちの普通株式保有者の権利に関連する任意の他の条項。又は(E)吾等が予備業務組合を完成させていない場合には、自社の公開株式を償還する場合には、株式証行権価格から現金金額を減算し、及び/又は当該事件について普通株当たりに支払われる任意の証券又は他の資産の公平な市価を減算し、当該事件の発効日のすぐに発効する。
普通株式の流通株数が普通株式合併、合併、株式逆分割または再分類、または他の同様のイベントによって減少した場合、合併、合併、株式逆分割、または同様のイベントの発効日に、承認株式証1部あたりに発行可能な普通株式数は、普通株式流通株のこのような減少に応じて比例して減少する。
上述したように、株式承認証を行使するたびに購入可能な普通株式数が調整されるたびに、株式承認証の取引価格は、この調整直前の引受権行使価格に1つのスコア(X)を乗じる方法であり、br分子は、その調整前の 行使引受証の直前に購入可能な普通株式数であり、(Y)の分母は、その調整直後に購入可能な普通株式数である。
一般株式流通株の任意の再分類または再分類または再編成(上述したまたはそのような普通株額面のみに影響を与えるbr}を除く)、または私たちは または他の会社との任意の合併または合併(合併または合併を除く。ここで、私たちは持続会社であり、私たちの普通株式流通株の再分類または再編をもたらすことはない)。又は吾等の全部又は実質的に吾等の解散に関連する資産又は他の財産を他の会社又は実体に売却又は譲渡する場合、株式証所有者は、その後、株式証明書に指定された条項及び条件に基づいて、それに代表される権利を行使する際にこれまでに購入及び受け取ることができる普通株又は他の証券又は財産(現金を含む)の種類及び金額の代わりに、直ちに普通株を購入及び受信する権利を有する。合併又は合併、又は当該等の売却又は譲渡のいずれかの後に解散した場合、権利証所有者は、当該等の事件が発生する直前にその株式承認証を行使した場合、当該等株式証所有者は、当該等引受持分証を受け取ることができる。しかしながら、当該等所有者が当該等合併又は合併後の受取証券、現金又は他の資産の種類又は金額について選択権を行使する権利がある場合、株式承認証毎に行使可能な証券、現金又は他の資産の種類及び金額は、当該等所有者が当該等合併又は合併において徴収した種類及び1株当たり金額の加重平均値とみなされ、当該等所有者(入札を除く)に入札、交換又は償還要約を提出し、当該等の要約を受け入れた。会社が本定款に規定する会社株主が保有する償還権に関する交換又は償還要約、又は会社が普通株株式を償還した結果(提案された初期業務が合併して会社株主に提出された場合)、この場合、入札又は交換要約が完了した後、その発起人は、当該発起人が所属する任意の団体のメンバーとともに(規則13 d-5(B)(1)の範囲内)、そして、当該ディーラーの任意の共同会社または共同会社(“取引法”規則12 b-2に基づく意味)、および任意のそのような共同会社または共同会社がその一部の任意のこのようなグループの任意のメンバーであり、実益は (“取引法”規則13 d-3の意味による)の50%を超える発行および発行された普通株式を有し、株式証所有者は最高額の現金を得る権利があることを認識する。当該株式証明書所有者が当該等の買収要約又は交換要約が満了する前に引受権証を行使し、当該契約を受け付け、当該所有者が保有するすべての普通株式が当該買収要約又は交換要約に基づいて購入された場合、当該所有者 は実際に株主として所有する証券又は他の財産を有する権利があり、調整(当該買収要約又は交換要約が完了したとき及びその後) を経て、株式証明書合意に規定されている調整とできるだけ等しくする必要がある。このような取引における普通株保有者の売掛金の70%未満が普通株の形態で全国証券取引所に上場されるべきである場合、または確立された場外取引市場でオファーされた継承エンティティが支払うべきである場合、またはそのような事件の発生直後にそのような上場取引またはオファーが行われ、権利証の登録所有者がそのような取引の公開開示後30日以内に引受権証を正しく行使する場合、権証実行権価格は,権証プロトコルにおけるブラック-スコアーズ価値(権証プロトコルにおける定義)に基づいて,権証プロトコルにおける規定に従って引き下げられる.このような権利価格引き下げの目的は,権証の行権期間内に権証保持者が権証のすべての潜在価値を獲得できなかった特別な取引が発生した場合に,権証所持者に付加価値を提供することである.
| 153 |
株式承認証は,株式承認証代理である大陸株式譲渡信託会社と我々との間の引受証プロトコルに基づいて登録形式で発行される.株式証承認協定の規定によると、株式証を承認する条項はいかなる所有者の同意なしに修正することができ、(I)任意の曖昧なところを是正するか、或いは任意の誤りを是正することができ、株式証明書協定の規定を本募集説明書に記載されている株式証明書条項及び株式承認証合意の説明に符合させることを含む。(Ii)株式承認協定に基づいて普通株式発行現金配当金に関連する条文 を改訂するか、又は株式証明書協議当事者が必要又は適切であると考え、株式証登録所有者の権利に悪影響を与えない事項又は問題を考慮し、brを加入又は変更するか、株式証明書合意項の下の事項又は問題に関する任意の条文を変更するが、当時発行された少なくとも50%の公開株式証所有者の承認を経て、登録所有者の利益に悪影響を与える任意の変更を行うことができる。株式承認証プロトコルの写しは初公開株式登録声明の証拠物として提出されたものであり、その中には株式承認証に適用される条項と条件の完全な説明が盛り込まれている。
権利証所有者は、株式引受証を行使して普通株式を取得する前に、普通株式保有者の権利又は特権及びいかなる投票権も有していない。株式権証の行使後に普通株を発行した後、株主一人一人が株主がすべての事項について保有する登録株式ごとに投票する権利がある。
単位を分割した後,いかなる断片的な株式承認証も発行することはなく,株式承認証全体を売買するだけである.株式承認証の行使時には、保有者は1株の株式の断片的な権益を獲得する権利があり、吾らは株式引受証を行使する際に普通株式数を最も近い整数に丸めている。
私たちは、適用された法律に適合する場合、権証合意によって引き起こされる、または任意の方法で権証合意に関連する任意の私たちに対する訴訟、訴訟またはクレームが、ニューヨーク州裁判所またはニューヨーク州南部アメリカ地域裁判所で提起され、強制的に実行されることに同意し、私たちは、このような訴訟、訴訟、またはクレームの任意の独占裁判所であるこの司法管轄区域に撤回することはできません。本条項は証券法下のクレームに適用されるが、“取引法”下のクレームにも適用されず、アメリカ合衆国連邦地方裁判所が唯一かつ排他的裁判所であるいかなるクレームにも適用されない。
私募株式証
以下に述べる を除いて,私募株式証の条項および条項は,Larkspurが初めて公募したbrの部分単位で販売される引受権証と同様である.私募株式承認証(私募株式承認証を行使する際に発行可能な普通株式を含む)は、我々の初期業務合併完了後30日以内に譲渡、譲渡又は売却(我々の高級職員及び取締役及び私募株式証の初期購入者に関連する他の個人又は実体の限られた例外を除く)は、それらが保証人又はその譲渡者によって所有されることが許可されている限り、吾等は償還することができない。保証人又はその譲渡を許可された人は、現金なしで私募株式証を行使する権利がある。もし私募株式証明書が保証人またはその譲渡許可者以外の所有者が保有している場合、私募株式承認証は私たちがすべての償還状況で償還することができ、所有者がLarkspur初公募株の販売先に含まれる引受権証と同じ基準で行使することができる。私募株式証明書条項のいかなる改訂或いは株式証承認協定中の私募株式証に関するいかなる条項も、当時発行されていなかった私募株式証数の少なくとも50%のbr所有者が投票する必要がある。
もし私募株式証所有者が無現金に基づいて引受権証を行使することを選択した場合、彼らは使用価格を支払い、使用価格を支払い、使用価格 他/彼女或いはその株式証明書の引受権証の数量は(X)株式承認証関連普通株数に等しい積に“保険者公平市価”(定義は下記を参照) を引受権証の行使価格で割って(Y)保証人公平市価で得られた商数に等しい。これらの目的については,“保険者公平市価” は株式証行使通知が株式証代理人に送付される日前に,第3取引日までの10取引日以内の普通株の平均終値を指す.Larkspurはこれらの株式承認証が現金なしで行使できることに同意しているが,それらが保証人とその許可譲り受け人が所有している限り,Larkspurが初めて株式を公開した場合,業務合併後に私たちと連絡を結ぶかどうかを知らないからである。もし彼らがまだ私たちと連絡を取り合っているなら、彼らが公開市場で私たちの証券を売る能力は大きく制限されるだろう。我々は,我々の証券の売却を制限する政策を策定したが,特定の時間帯では除外した.内部の人が私たちの証券を売却することが許可されている間も、内部の人が重要な非公開情報を把握していれば、彼や彼女は私たちの証券を取引することができない。したがって,公衆株主が引受証を行使し,引受権証を行使して得られた普通株を公開市場で自由に売却して行使権証を回収できるコストとは異なり,内部者はこのような証券を売ることができない可能性が大きく制限される可能性があるため,所有者がキャッシュレスで引受権証を行使することを許可することは適切であると考えられる.
運営資金の不足を補うために、Larkspur計画の初期業務合併に関する取引コストを支払うために、発起人または発起人の関連会社またはLarkspurのいくつかの高度管理者および取締役は、必要に応じて資金を貸してくれることができる(ただし義務はない)。貸手の選択により、最高1,500,000ドルに達するこのようなローンは会社の引受権証に変換でき、株式承認証1部あたりの価格は1ドルである。このような株式承認証は私募株式証明書と同じになるだろう。
| 154 |
パイプ 授権書
PIPE引受契約に合わせるために、吾らは最初の指定証明書及びPIP権証の条項に基づいて、普通株引受権証(1部は“PIPE株式承認証”)を発行し、PIPE変換後に発行可能な普通株に最大100%相当の普通株株式 を購入し、行使価格は最初に1株11.50ドルであり、若干の調整を行うことができる。私たちのベストエフォート発売後、PIPE権証の発行価格は2.00ドルにリセットされ、PIPE権証を行使して発行可能な普通株金額は4,965,125株に増加しました。 PIPE権証の発行期間は5年です。PIPE株式承認証の行使用価格は、(I)株式配当及び分割、(Ii)後続株式供給、(Iii)比例配分、(Iv)基本取引、(V)いくつかの自発的調整及び(Vi)行使価格より低い行使価格で他の証券を発行することによる調整 を含むいくつかの調整 を受け、それぞれの場合、PIPE株式証の条項によって発効する。
Br管承認株式証には両替機能は含まれていません。管路持分証は現金なしで行使することができる:(I)管路持分証に関する普通株に関する有効な登録声明がない場合、及び(Ii)管承認持分証の発行期間が満了したとき。PIP権証所有者は、引受権証を行使して普通株式株式を取得する前に、普通株式保有者の権利又は特権及びいかなる投票権も有していない。株式承認証の行使時に普通株を発行した後、各株主は、株主の議決すべき事項が保有するすべての普通株について1票の投票権を有する権利がある。
最善を尽くすことが必要だ
我々が2023年1月27日に米国証券取引委員会に提出したS-1表登録声明(書類第333-269442号)(“ベストエフォート発売”)によると、承認証を発行し、1株当たり1.00ドル(または1株当たり合併公開発行価格および付随株式証の100%)で11,015,500株の普通株(“ベストエフォート株式承認証”)を購入した。その中の1,377,996件の権利証の再定価は、2023年7月に発行された一部として、行権価格 は行権価格の1ドルから0.165ドルに引き下げられた。以下はベストエフォート引受権証のある条項と条項の要約であり、これらの条項と条項は完全ではなく、株式承認証の条項に制約され、その全内容も株式証の条項制約を受け、その形式は本募集説明書の一部として登録説明書の一部として提出される。私たちは株式証明書の承認表の条項と条項を慎重に検討して、株式証明書の条項と条件の完全な記述を得ることを奨励します。
存続期間と行権価格
1部の株式証の発行権価格は1株当たり1.00ドル(あるいは1株当たりの公開発行価格と株式証の合併価格の100%に相当する)。br承認株式証は直ちに行使でき、発行日から5年以内に行使することができる。株式配当、株式分割、再編などの事件が発生して私たちの普通株式と行権価格に影響を与える場合、行権価格と行権時に発行可能な普通株式数は適切に調整される。株式承認証はそれぞれ普通株式または事前資金権証と分けて発行され、その後すぐに単独で譲渡することができる。株式承認証は認証形式 のみで発行される。
可運動性
所有者ごとの選択により,株式証はすべてまたは部分的に行使可能となり,正式に署名された行権通知 を吾等に提出し,行権時に購入した普通株式数について全数金を支払う(以下で議論するキャッシュレス行権は除く).所有者(及びその連合会社)は当該等所有者承認株式証の任意の部分からbrを行使してはならず、行使後すぐに4.99%を超える発行済み普通株式を所有しているが、もし所有者がbrで吾等に少なくとも61日間の事前通知を出した場合、所有者はこの等承認株式証を行使した後に発行された普通株の保有量を増加させることができ、行使後に自社のすでに発行された普通株式数の9.99%まで増加することができ、このパーセンテージ所有権は株式証明書条項に基づいて決定される。終止日,権利証 はキャッシュレス行使で自動的に行使される.
キャッシュレス運動
もし, が所有者が株式承認証を行使する際に,株式承認証関連普通株の登録発行または転売の登録声明 がそのような株式の発行に有効でないか適用されない場合, 所有者は,株式承認証を行使する際に承認株式証に記載されている式に基づいて決定された普通株式純額を選択することができ,本来承認持分を行使する際に吾などに支払うことが予想されていた現金を支払うのではない.
| 155 |
ファンダメンタルズ取引
Br承認株式証に記載されている任意の基本取引(一般に他のエンティティとの任意の合併または合併を含む)、我々のすべてまたはほぼすべての資産の売却、要約買収または交換要約、または我々の普通株の再分類の場合、任意の がその後に承認株式証を行使するとき、所有者は、そのような基本取引が発生する直前にそのような権利を行使して発行可能な普通株の1株当たりの権利を有し、後継者または買収会社または自社普通株の株式数を代替対価として受け取る。存続している会社である場合、および所有者がその事件の直前に引受権証を行使することができる普通株式数の取引において、またはその取引のために受信されるべき任意の追加の対価である。上記の規定にもかかわらず、基本取引が発生した場合、株式証所有者は、現金と交換するために、吾らまたは後続実体が基本取引完了後30日以内に或いは同時に株式証未行使部分のBlack-Scholes 価値を償還することを要求する権利がある。
しかしながら、我々の制御範囲内でない基本取引が発生した場合、我々の取締役会によって承認されていない基本取引を含む場合、権利証明者は、現金形態で私たちの普通株式所有者に提供および支払いされるにもかかわらず、基本取引に関連する同じタイプまたは形態(かつ同じ割合)の対価格を私たちまたは後続エンティティから得る権利があるであろう。株式または現金と株式の任意の組み合わせ、または我々普通株の保有者が、基本取引に関連する他の形態の対価格を得ることを選択することができるかどうか。
譲渡可能性
適用法律に適合する場合には,権証所持者は,権利証を適切な譲渡文書とともに本行に戻す際に,自ら譲渡権証を選択することができる.
細切れ株
株式承認証の行使時には、普通株式の断片的な株式は発行されない。逆に、私たちの選択によると、発行された普通株式数を次の完全な株式に上方丸め込むか、またはその最後のbr部分について現金調整を支払い、金額はその部分に行使価格を乗じたものに等しい。
取引市場
現在株式証はまだ成熟した取引市場がなく、私たちは活発な取引市場が出現しないと予想している。私たちはいかなる証券取引所や他の取引市場での市権証を申請するつもりはありません。もし取引市場がなければ、権利証の流動性は非常に限られるだろう。
株主としての権利
株式証明書に規定があるか、または所有者が当社の普通株式に対する所有権を持っていない限り、この承認持分所有者は、当該所有者が当該等の株式所有者が株式証を承認するまで、任意の投票権を含む当社の普通株式所有者の権利または特権を有していない。株式承認証は、株式証所有者が私たちの普通株の分配或いは配当に参与する権利があることを規定する。
免除と改訂
当方と所持者の書面の同意を得て,本授権書を修正または修正したり,本授権書の規定を放棄したりすることができる.
| 156 |
引受持分証
2023年9月、有限時間インセンティブ要約により、当社の普通株式は0.1357ドルの値下げで既存の7,121,213部の株式承認証を行使した。そこで,同社は7,121,213株の普通株 を発行し,7,121,213株の新たな誘導権証を発行し,使用価格は0.1357ドルで約966,000ドルの毛収入を得た。新しい誘導権証は発行日から6ヶ月以内に行使でき、その日から5年間行使することができる。
期限と行権価格 価格
各インセンティブ権証 の発行権価格は、その適用される値引き行権価格に等しい。誘導権証は発行日から6ヶ月のbr周年日から行使され、その日から5年間行使することができる。株式配当,株式分割,再編,あるいは我々の普通株と行権価格に影響を与える類似イベントが発生した場合,行権時に発行可能な普通株の行権価格と株式数 が適切に調整される.
可運動性
インセンティブ株式証 は、所有者毎に全部または一部の行使を選択することができ、正式に署名された行使承認証を吾等に提出し、当該株式証明書を行使する際に購入した普通株式数の全額支払いに添付する方法である(以下で議論するキャッシュレス行使は除く)。所有者(およびその共同経営会社)は,その所有者の誘導権証の任意の部分 を行使してはならず,所有者が権利証を行使した直後に9.99%を超える発行済み普通株を所有していることが条件であるが,所持者が吾等に少なくとも61日間の事前通知を出した後,所持者はそのパーセンテージの所有権を増加させることができる.
キャッシュレス運動
もし所有者 がその誘導権証を行使する際に、1933年の証券法(改正)(“証券法”)に基づいて誘導権証株式を発行する登録声明が当時有効でなかったか、または当該等の株式の発行に適用されなかった場合、 所有者は、誘導権証を行使する際に誘導権証に記載された式に基づいて決定された普通株式株式純額を選択し、当該等株式証の行使を期待する際に吾等に現金を支払うことを選択することができる。
ファンダメンタルズ取引
誘導権証に記載されているように、一般に、他のエンティティとの任意の統合、我々の全てまたは実質的にすべての資産の売却、要約買収または交換要約、または我々の普通株の再分類を含む任意の基礎取引が発生した場合、その後、誘引証を行使する際に、保持者は、その基礎取引が発生する直前にその権利証を行使した後に発行可能な普通株の1株当たりの普通株の数を代替対価として取得する権利を有するであろう。既存の会社、および所有者がその事件の直前に誘導性引受権証を行使することができる普通株株数の取引である場合、またはその取引のために受信されるべき任意の追加的な対価 である。上述したにもかかわらず、基礎取引の場合、誘引権証所持者は、基礎取引完了後30日以内に、または誘引権証の中で行使されていない部分のBlack−Scholes 価値(各誘引権証を定義する)の現金病因証を同時に償還する権利を吾らまたは後続エンティティに要求する権利がある。
しかし、我々の取締役会によって承認されていない基本取引を含む我々の制御範囲内でない基本取引が発生した場合、誘導権証の保持者は、我々または後続エンティティから、この基本取引が完了した日から同じタイプまたは形式(および同じ割合)の対価を取得する権利のみを有し、その基本取引に関連するように、私たち普通株式保有者に提供され、私たち普通株式保有者に支払われる部分のブラックスコールス価値を行使しない。株式も現金と株の任意の組み合わせでも、私たち普通株の保有者は、基本取引に関連する他の形態の対価格を受け入れることを選択することができるかどうか。
譲渡可能性
適用法律に適合する場合には,誘因両立持分証を適切な譲渡文書とともに吾等に返送する際に,所有者は譲渡誘因承認持分証を選択することができる。
細切れ株
インセンティブ権行使時に普通株の断片的な株式 を発行しない.逆に、私たちの選択によると、発行された普通株式数 は次の完全なシェアに四捨五入されるか、または最終シェアについて現金を支払って を調整し、金額はそのシェアに行使価格を乗じたものに等しい。
取引市場
現在のところ成熟した誘導権証取引市場はなく、活発な取引市場は出現しないと予想される。私たちはいかなる証券取引所や他の取引市場での上場誘導権証を申請するつもりはありません。もし取引市場がなければ、誘導権証の流動性は非常に限られるだろう。
| 157 |
株主としての権利
誘導権証の中に他に規定 或いは所有者による当社の普通株株式の所有権がない限り、この誘導権証所有者 は、当該所有者が当該等のbr所有者の誘導権を行使するまで、任意の投票権を含む当社の普通株保有者の権利又は特権を有していない。誘導権証は誘導権証の保有者が私たちの普通株の分配或いは配当に参与する権利があることを規定する。
免除と改訂
当方と所有者の書面による同意を経て,誘因引受権証,あるいは放棄誘因引受権証の規定を修正または修正することができる。
株式承認証を交換する
フロリダ州のZyVersa治療会社(“Old ZyVersa”)は,2022年3月から2022年12月まで,Aシリーズ変換可能優先株と引受権証(“橋梁株式承認証”)を発売し,br}Old ZyVersaの普通株(“橋融資”)を購入する私募を行った。当社のある関連会社は投資家としてブリッジ融資に参加しています。Aシリーズ転換可能優先株株は業務合併が完了する直前に旧ZyVersa普通株に自動的に変換されます。この等旧ZyVersa普通株株式は業務合併完了後に交換(取引所 比率で)1,271,904株式自社普通株(うち327,765株はブリッジ融資に関連し、残りは2021年本票融資をブリッジ融資後のbr株式に変換する)。また、業務合併完了後、発行されたブリッジ株式証が仮定され、(合併取引br比率により)株式証に変換され、自社普通株株式を購入する。2022年12月12日、ほぼ業務と合併が完了すると同時に、当社は置換株式証(“置換株式証”)を発行し、ブリッジ株式証 と交換し、以下のように述べる。
1,271,904株の普通株に対して株式承認証(その中の327,765株承認株式証はBridge{br)融資から、残りの株式承認証は2021年の本票融資からBridge融資に転換) からの交換が可能であり、初期行使価格は1株6.90ドル(業務合併を発効させるように調整された)に相当し、いくつかの 調整を経なければならない。株式承認証に代わる使用期間は5年である。株式交換株式証の使用価格 は株式配当、再分類と分割による調整を含むいくつかの調整の影響を受ける。交換株式証の交換には両替機能は含まれていません。代替株式証明書は現金なしで行使することができる。代替株式証所有者は、引受権証を行使して普通株式株式を取得する前に、普通株式所有者の権利又は特権及びいかなる投票権を有していない。株式承認証の代わりに普通株式を発行した後、各株主はその株主が投票しなければならないすべての事項について、登録されている普通株式1株当たり1票を投じる権利がある。
変換可能債券権利証
Old ZyVersaは2018年11月30日、以下のように変換可能債券輪権証(“変換可能債券輪権証”)を発行した。未発行の転換債券輪認株式証は、当社が業務合併を完了した後に負担します。
転換債券輪認株式証は131,450株の普通株を行使することができ、初期行権価格は1株11.58ドルに相当し、ある調整の影響を受ける。転換可能な債券輪認株式証の使用期間は5年である。転換可能債券輪の発行権価格は、株式配当、再分類、分割による調整を含む一定の調整を受ける。転換可能な債券輪認株式証には何の償還機能も含まれていない。転換可能な債券輪認株式証 はキャッシュレスベースで行使できる。転換可能債権証所有者は、引受権証を行使して普通株式株式を受け取る前に、普通株式所有者の権利又は特権及びいかなる投票権も有していない。転換可能債券輪認株式証の行使後に普通株を発行した後、各保有者はその株主がすべての事項について登録保有している普通株式1株について一票を投じる権利がある。
仲買人株式証
2018年11月30日、Old ZyVersaは議事録株式証(以下、議事録株式証と略す)を発行した。まだ発行されていない議事録株式証は業務合併完了後に当社が負担します。
紀律承認株式証は112,159株の普通株に対して行使でき、初期行権価格は1株11.58ドルに相当し、ある調整の影響を受ける。議事録の使用期間は5年である.株式配当、再分類と分割による調整を含む紀律承認株式証の行権価格はある調整の影響を受ける。マネージャー株式承認証には何の償還機能も含まれていない。議事録は現金なしで行使することができる。紀律承認株式証所有者は、引受権証を行使し、普通株式株式を受け取る前に、普通株式所有者の権利又は特権及びいかなる投票権を有していない。株式権証の行使後に普通株式を発行した後、所有者一人一人がその株主投票で議決されるすべての件について、登録された普通株式について一票を投じる権利がある。
| 158 |
戦略的株式証明書
2019年4月16日、Old ZyVersaは戦略株式承認証(“戦略株式承認証”)を発表し、詳細は以下の通り。未償還のbr戦略株式証は当社が業務合併完了後に負担します。
戦略株式承認証は303,427株の普通株に対して行使でき、初期行権価格は1株10.23ドルに相当し、ある調整の影響を受ける。戦略株式証の使用期間は5年である.戦略株式承認証の使用価格はいくつかの調整の影響を受け、配当金、再分類及び分割による調整を含む。戦略株式承認証brは何の償還機能も含まれていない。戦略株式承認証は現金なしで行使することができる。戦略株式承認証保有者は、引受権証を行使して普通株式株式を取得する前に、普通株式所有者の権利又は特権及びいかなる投票権を有していない。戦略株式証の行使後に普通株を発行した後、株主ごとにその株主がすべての事項を持っている1株当たりの普通株株式 について投票する権利がある。
反買収:憲章と定款の効力
憲章と定款には、一方が当社に対する支配権を獲得することを遅延、延期、または阻止する可能性がある条項が含まれています。以下に概説するこれらの規定は,強制買収行為や不十分な買収入札を阻止することを希望している.これらの規定はまた、その会社の支配権を得ることを求める人たちがまず取締役会は、会社はこのような買収の条項が改善され、会社の株主に有利になる可能性があると考えている。しかし、それらはまた、いくつかの株主が賛成するかもしれない合併を阻止する権限を取締役会に与える。
取締役会の構成と穴埋め
憲章は、理由があり、かつ取締役選挙で投票する権利がある当社が当時発行した議決権のある株の少なくとも多数の保有者の賛成票を得なければならない場合にのみ、取締役を罷免することができる。死亡、辞任、失格、退職、免職又はその他の理由による取締役会の空き、及び取締役数の増加により生じた新たに設立された取締役職は、完全に当時在任している取締役が賛成票を投じなければならない。または唯一の残りの取締役(1つまたは複数の発行された優先株系列の単独投票によって選択された任意の取締役(Br)を除く)であり、株主によって補填されてはならない。前項の規定により任命された取締役は、当該取締役がクラスの任期満了又は早期死去、辞任、退職、資格取り消し又は免職まで任期を有する。
株主特別会議
憲章は:(A)株主総会議長は株主特別会議を招集することができる取締役会、(B)取締役会、または(C)当社の最高経営責任者または社長 であるが、この特別会議は、取締役会または会議を招集する他の者によって延期、再配置、またはキャンセルすることができる。この定款は,年次又は特別株主総会で行われる可能性のある事務を会議に適切に提出する事項に制限する。
書面で同意した行動
憲章は,株主が要求又は許可するいかなる行動も株主年次会議又は特別会議で取らなければならず,書面で会議の代わりに同意してはならないと規定している。
事前に要求を通知する
“定款”は,株主指名候補者が取締役に就任するか,又は株主会議に提出する新業務に関する事前通知手続を規定している。これらのプログラムは,株主提案通知 は,行動する会議の前に適切な形で速やかに会社の会社秘書に提出しなければならないことを規定している.一般的に、通知は、通知が90日以上であるか、または前年年次総会の1周年日を超えない120日前に会社の主な実行オフィスに到着するか、または、10日遅れでなければならないこれは…。 この特別会議日の翌日を初めて公開します(2.4節参照)。“定款”は,すべての株主通知の形式及び内容に対する要求を規定している。これらの要求は,株主 が年次会議や特別会議で株主に質問することを阻止する可能性がある.
| 159 |
定款と付例修正案
取締役会はこの規定を採択、改正、または廃止することを明確に許可した。会社の株主には定款を通過、修正、または廃止する権利がある。しかし、法律または本憲章に規定されている当社の任意のカテゴリまたは系列株の所有者(1つまたは複数の優先株系列についての任意の指定証明書を含む)または当社規約に規定されている任意の投票権を含む以外に、当社株主は、定款の改正、改正または廃止によって、少なくとも66%(66%)の当社の当時議決権を有する株式の流通株の所有者が賛成票を投じる必要がある。1つのクラスとして一緒に に投票する.
デラウェア州の反買収法規
DGCLと我々の規約の条項 は,要約買収,依頼書競争やその他の方式で当社を買収することをより困難にする可能性があり,現在の上級管理者や取締役を罷免したりする.これらの条項は,強制買収行為や不十分な買収要約を阻止し,会社の支配権獲得を求める者がまずbr取締役会と交渉することを奨励することを目的とした以下のように概説される。これらの条項のメリットは、いくつかの買収や買収提案を阻止するデメリットよりも大きいと考えられ、これらの提案を交渉することは条項を改善し、株主価値最大化を実現する能力を強化する可能性があるからである。しかし、これらの条項は、普通株の現行市場価格よりも割増をもたらす可能性がある試みを含む、株主がその最適な利益に適合していると考えられる私たちの合併または買収を遅延、阻止、または阻止する可能性がある。
さらに、私たちの憲章は反買収の効力を持つ可能性のある他の条項を規定している
| ● | 役員選挙に関する累積投票はない; | |
| ● | Br取締役会は、取締役会の拡大、または場合によっては取締役の辞任、死亡、または罷免によって生じる空席を埋めるために取締役を選出する権利がある | |
| ● | 取締役は理由がある場合にのみ取締役会から免職することができる | |
| ● | 取締役会は3種類の取締役に分類されるので、1人は2つ以上の年次会議で代理競争に成功することで、私たちの取締役会に対する制御権を得ることができる | |
| ● | 株主が書面の同意の下で行動することを禁止し、株主に年次会議または特別会議での行動を強要する | |
| ● | 株主が特別会議を開催することを禁止し、我々の取締役会メンバーのみが株主会議を開催することを要求することは、我々の株主が提案や行動を強制的に考慮する能力を遅らせる可能性がある。罷免役員も含まれている;そして | |
| ● | 私たちのbrは許可されていますが、発行されていない普通株式と優先株は将来の発行に使用でき、株主の承認を必要とせず、 様々な会社の目的に使うことができます将来的に追加資本の調達、買収、そして従業員福祉計画のための製品が含まれる。当社取締役会は、株主のさらなる承認を必要とせずに、1つまたは複数の優先株系列およびその系列優先株に関する投票権、優先株、特権を指定する権利がある。許可されているが発行されていない および未保持の普通株式および優先株の存在は、制御権を獲得する試みをより困難にしたり、阻害したりする可能性がある。私たち は代理競争を通じて買収、合併、または他の方法を要約する。 |
| 160 |
フォーラム 選択条項
私たちのbr憲章はフォーラム選択条項を含む。私たちの憲章は、限られた例外を除いて、デラウェア州衡平裁判所とデラウェア州内の連邦裁判所は次のいずれかの排他的フォーラムになると規定している
| ● | 会社を代表して提起された訴訟または訴訟; |
| ● | 取締役、当社幹部又は株主が当社又は当社株主の受託責任又はその他の不当行為に違反すると主張する訴訟; |
| ● | 当社又は当社の任意の高級職員、株主、従業員又は代理人に対して、当社の定款又は附例の任意の規定又は当社がデラウェア州衡平裁判所に管轄権を行使することを許可した訴訟; | |
| ● | 当社の定款又は定款の有効性を解釈、適用、強制又は決定する行動 ;又は | |
| ● | 会社または内部事務原則によって管轄されている会社の任意の現職または前任取締役、役員、brまたは株主がクレームを主張する他のbr行動。 |
この 選択された裁判所条項は、“取引法”または連邦裁判所が排他的管轄権を有する任意の他のクレームを実行するために提起された義務または責任の訴訟には適用されない。また、我々の定款によれば、会社が書面で代替裁判所を選択しない限り、米国連邦地域裁判所は、br法によって許容される最大範囲で、証券法に基づいて提起された任意の訴因を解決する独占裁判所となるであろう。会社 は、証券法第22節の規定にかかわらず、連邦裁判所と州裁判所は、“証券法”またはその下で公布された規則および条例で規定されている任意の義務または責任を実行するために提起されたすべての訴訟を同時に管轄することができる“証券法”に基づいて訴因を提出する任意のクレームに本条項を適用することを意図している。
上級職員と役員の責任と賠償制限
憲章には,会社の現職および元役員の金銭損害に対する責任をデラウェア州法律で許容される最大限に制限する条項が含まれている。デラウェア州の法律では、会社役員は取締役の受託責任に違反する行為に対して個人賠償責任を負わないと規定されているが、以下の責任は除く
| ● | 私たちや株主への忠誠義務に違反する行為は | |
| ● | 好意的でない行為やしない,あるいは故意の不正行為に触れたり,違法であることを知っている | |
| ● | 配当金を不正に支払うか、株式を不正に買い戻すか償還するか | |
| ● | 取締役は不当な個人利益の取引をむさぼる。 |
米国連邦証券法に違反する行為については、これらの規定は実行不可能と判断される可能性がある。
エージェントに接続する
普通株譲渡エージェントと登録機関および株式公開承認証と私募株式証の引受権証代理は大陸株式譲渡信託会社である.我々は、大陸証券譲渡信託会社が譲渡代理人および引受権証代理人、その代理人およびその株主、取締役、高級職員および従業員のすべての責任として賠償することに同意し、その身分で行われた活動または漏れた行為によって生じる可能性のある判決、費用および合理的な弁護士費を含むが、損害者または実体のいかなる深刻な不注意、故意の不正行為または信用喪失行為によって生じる責任は除外する。
| 161 |
われわれの証券転売に対する証券の制限
証券法第144条(“第144条”)によれば、実益が私たちの普通株式又は私たちの引受権証を少なくとも6ヶ月間所有する者は、その証券を売却する権利がある。ただし、(I)当該人は、前の3ヶ月の間、又はいかなる時間においても私たちの付属会社とみなされない。また(Ii)我々は、売却前の少なくとも3ヶ月間の取引所法案の定期報告要件を遵守し、売却前12ヶ月(または当社が報告書の提出を要求されたより短い期間)内に取引所法案第13条または15(D)条に基づいてすべての規定された報告書を提出しなければならない。
実益は、私たちの普通株式または株式承認証を少なくとも6ヶ月間所有しているが、販売時または前の3ヶ月以内の任意の時間に、私たちの関連会社である人は追加的に制限されるであろう。これらの制限によれば、この人は、任意の3ヶ月以内に以下の大きな者を超えない数の証券のみを販売する権利がある
| ● | 当時発行された普通株式総数の1% ;または | |
| ● | 販売に関する表 144通知を提出する前の4つのカレンダー週間内に、私たちの普通株の週平均取引量。 |
ルール144によれば、弊社の販売 は、販売条項や通知要求の方式、および当社の現在の 公開情報に関する可用性にも制限されています。
シェル会社またはフロントシェル社の使用制限ルール144
ルール 144は、空殻会社(業務合併に関連する空殻会社を除く)や発行者によって最初に発行された証券の転売には適用されず、これらの会社はいつでも空殻会社であった。しかしながら、以下の条件が満たされる場合、ルール144は、この禁止の重要な例外をさらに含む
| ● | 幽霊会社だった証券発行人は空殻会社ではなくなった | |
| ● | 証券発行者は、取引法第13又は15(D)節の報告要件を遵守しなければならない | |
| ● | 証券の発行者は、適用されるすべての“取引法”報告および材料を以前の12ヶ月以内(または発行者がそのような報告および材料を提出することを要求された)に提出しているが、テーブル8−Kの現在の報告は除外されている | |
| ● | 自発歩行者が米国証券取引委員会に現在のForm 10タイプ情報を提出して以来,少なくとも1年が経過し,非シェル会社の実体としての状態 を反映している. |
そのため、保険者は、当社が予備業務合併を完了して1年後、規則第144条に基づいてその創設者株式及び私募株式権証を売却することができ、br登録を必要としない。
最近業務合併が完了した後、当社は空殻会社ではなく、上記例外ケースに規定されている条件を満たせば、第144条は上記制限証券の転売に用いることができる。
ロックプロトコル
企業合併協定に関連する合意に基づいて締結されたいくつかの販売禁止制限に基づいて、いくつかの例外的な場合を除いて、保険者、当社のいくつかの主要株主及び当社の行政者及び取締役は、契約制限に基づいて保有する任意の普通株株式(PIPE投資又はBシリーズ投資で発行される当社普通株株式を含まない)(“禁売株”)を売却又は譲渡する。このような制約は,業務統合終了後 から始まり,業務統合終了180日後に終了する.
| 162 |
流通計画
売却証券保有者は、譲渡者、質権者、譲受人、贈与者又は他の利益相続人、売却普通株、B株関連普通株、及び流通権証、私募株式証及び公開株式証を公開した後の普通株を総称して証券と呼び、又は本募集説明書の日付後に売却証券保有者から受け取った贈与、質権、パートナーシップ分配又は他の譲渡された証券としての権益を、時々売却、譲渡、譲渡することができる。証券取引を行う任意の証券取引所、市場または取引施設において、または個人取引において、そのいくつかの証券または証券権益を分配または処分する。これらの処置は、固定価格、販売時の現行市場価格、現行市場価格に関連する価格、販売時に決定された異なる価格、または協議価格で行うことができる。売却証券保有者が本募集説明書 に従って提供するすべての証券は、売却証券保有者が代行して売却する。我々は,本プロトコルによって登録された証券を売却して得られた 収益を受け取ることはない.
もし任意の株式承認証が行使された場合、私たちは株権証が現金なしで行使されない限り、収益を獲得する。株式承認証が行使されることは保証されず、どのような行使からもいかなる収益も得られる保証はない。管式株式承認証、私募株式証、公開株式証と誘導権証の行使、及び著者らがこれらの株式承認証を行使することによって得られる任意の収益は、私たちの普通株の価格及びこの等株式証の行使価格と行権時の私たちの普通株の市場価格との間の利差に大きく依存する
パイプ株式承認証、私募株式承認証と公開株式証の現在の使用価格は1株普通株11.50ドル であり、2023年10月23日までの著者らの普通株の現在の市場価格は0.12ドルである。また、パイプ承認株式証の発行価格は、ベストエフォート製品における当社株の売却価格にリセットされますが、2.00ドル以下の価格ではありません。PIPE株式承認証を行使した後に発行可能な普通株の株式数 は、PIPE株式に変換した後、発行可能な普通株式に等しい100% に調整される(基本的にすべての株式はベストエフォート発売によって償還されている)。我々普通株の市場価格がパイプ承認株式発行権価格リセット後の底価格よりも高ければ、当該等証券の所有者 はそのような証券を変換または行使し、普通株の対象株式を売却して利益を得ることができる。もし私たちの普通株の市場価格が所有者承認株式証の行権価格より低い場合、所有者はその株式証明書を行使する可能性が低い。すべてのパイプの株式承認証、私募株式証あるいは公開株式証が満期までに資金中にあることを保証することはできない。私たちの公開株式証と私募株式証明書はある条件の下で、株式承認証合意に記載されているように、私たちは公開株式証1部当たり0.01ドルの価格で償還することができる。私たちのパイプは株式証を償還することができなくて、現金や非現金方式で実行することができます。 したがって、私たちはこのような株式承認証を行使することからどんな現金収益も得られないかもしれない。
証券を売却する所有者は、証券またはその権益を処分する際に、以下のいずれか1つまたは複数の方法を使用することができる
| ● | 一般ブローカー取引と自営業業者がバイヤーを誘致する取引 | |
| ● | コミットメントまたは最善を尽くした上で1つまたは複数の引受製品を提供すること | |
| ● | 取引業者は、代理として証券を販売しようとするが、第brブロックの一部を依頼者として頭寸および転売して取引を促進することができる | |
| ● | ブローカーは元金として購入し、ブローカーはその口座を転売する | |
| ● | 取引所を適用する規則による取引所割当; | |
| ● | 個人的に協議した取引 | |
| ● | そのメンバー、パートナー、または株主に割り当てまたは移転すること | |
| ● | 本募集説明書に属する登録書の日後に完了した空売り取引は、米国証券取引委員会によって発効が宣言された | |
| ● | オプションまたは他のヘッジ取引の成約または決済は、オプション取引所または他の方法によって行われる | |
| ● | 国家証券取引所または見積サービスまたは場外市場での取引を含む市場取引; | |
| ● | 本募集説明書及び任意の適用される目論見書付録に基づいて、当該等の取引計画に記載されているパラメータに基づいて、その証券を定期的に売却する目論見書及びその任意の適用される目論見書付録に規定することにより、その証券を定期的に売却する場合には、売却証券保有者が“取引法”第10 b 5−1条に基づいて締結した取引計画; | |
| ● | 直接 は、特定の入札、オークションまたは他のプロセス、または私的交渉による取引を含む1つまたは複数の購入者に送信される | |
| ● | 証券法第415条の規定によれば、全国証券取引所で直接行われる販売または取引所以外の市商による販売または販売代理による他の類似販売を含む協議価格、販売時の現行価格またはこのような現行市場価格に関する価格で、証券法第415条で定義された“市場”での販売; | |
| ● | 個のエージェントによって; |
| ● | 証券所有者の売却と合意した仲買業者によって、指定された数のこのような証券を1株または株式承認証の約束価格で販売すること | |
| ● | 変換可能または交換可能な証券を発行する可能性のある第三者と取引することによって、 またはそのリターンの全部または一部が私たちの普通株からの価値、および | |
| ● | このような販売方法のいずれか、または適用法によって許可される任意の他の方法の組み合わせ。 |
| 163 |
売却証券保有者は、その所有する証券の一部または全部の保証権益を時々質権または付与することができ、売却証券保有者がその担保債務を履行できない場合、質権者または担保当事者は、本募集説明書または本募集説明書の修正案または補足条項に基づいて、時々このような証券を提供して売却することができる。br}は、売却証券保有者リストを修正し、質権者、譲受人または他の利益相続人を本募集説明書の下の売却証券保持者として含む。売却証券保有者はまた、他の場合に証券を譲渡することができ、この場合、譲渡者、質権者又は他の利益相続人は、本募集説明書における売却受益者となる。
証券又は証券権益を売却する過程において、証券を売却する証券保有者は、ブローカー又は他の金融機関とヘッジ取引を行うことができ、ブローカー又は他の金融機関は、その保有頭寸をヘッジする過程で空売り証券取引を行うことができる。証券所有者を売却して空売りして証券を受け渡しして、平倉の空頭寸で、あるいは証券をブローカーに貸したり質を委託したりすることができ、仲買自営業者は証券を売却する可能性がある。売却証券保有者は、ブローカーまたは他の金融機関とオプション取引または他の取引を行うこともでき、または1つまたは複数の派生証券を作成し、ブローカーまたは他の金融機関に証券を渡すことを要求することができ、ブローカーまたは他の金融機関は、本募集説明書に従ってこれらの証券を転売することができる(そのような取引を反映するために補充または改訂される)。
売却証券保有者がその提供された証券を売却して得た総収益は、そのような証券の購入価格から割引または手数料を減算することになる(ある場合)。証券保有者は、権利を保持して、その代理人と共に直接または代理人を介して証券を購入することの全部または一部の提案を時々拒否する。私たち は、本登録声明に登録された証券売却によって得られたいかなる収益も、証券保有者が本登録声明に登録した証券を売却して得られたいかなる収益も受けない。
売却証券保有者が本募集説明書が提供するすべてまたは任意の証券を売却することは保証されない。売却証券保有者 は将来、証券法第144条の規則に従って公開市場取引において証券を転売することができ、これらの証券が当該規則の基準を満たし、その規則の要求に適合すること、又は証券法の登録要求に適合する他の利用可能な免除 を前提とする。
証券を売却する所有者および証券または証券の権益の売却に関与する任意の引受業者、ブローカーまたは代理人は、証券法第2(11)条でいう“引受業者”であってもよい。証券法によると、彼らが証券を転売する際に得られる任意の割引、手数料、割引または利益は、引受割引および手数料である可能性がある。もし任意の売却証券の所有者が証券法第2(11)条にいう“引受業者”である場合、売却証券保有者は、証券法の目論見書交付要求を遵守する。私たちと販売証券所有者と締結された協定によると、引受業者及びその制御者、取引業者及び代理は、証券法下の責任を含む特定の民事責任を賠償して負担する権利がある可能性がある。
特定の要約に必要な範囲、販売すべき証券、それぞれの購入価格および公開発行価格、任意の代理、取引業者または引受業者の名称、および任意の適用可能な割引、手数料、特典または他の補償については、添付の入札説明書付録または適切な場合には、登録声明の発効後の修正案に説明され、 は、本入札説明書を含む。
証券株式の発売を促進するために、ある発売に参加する人は、安定、維持、または他の方法で証券価格に影響を与える取引に参加することができる。これは、発売に参加した人が彼らに販売した証券よりも多くの証券を販売することに関連する超過配給または空売りを含むことができる。この場合、これらの人たちは、ある場合、その超過配給選択権を公開市場で購入または行使することによって、そのような超過配給または空手形を往復補充するであろう。さらに、これらの人は、公開市場で証券を競合または購入することによって、または懲罰的入札を実施することによって、証券価格を安定または維持することができ、これにより、彼らが販売した証券が安定した取引によって買い戻すことができれば、発売に参加することを許可する取引業者の売却許可権を回収することができる。これらの取引の効果は、我々の証券の市場価格を公開市場に普遍的に存在する可能性の高いレベルに安定または維持することである可能性がある。これらの取引はいつでも中断される可能性がある.
| 164 |
証券を売却する証券保有者は、機関投資家又は他の人に直接証券購入の申し出を求めることができ、機関投資家又は他の人に直接このような証券を売却することができる。この場合、引受業者や代理人は関連されないだろう。このような販売のいずれかの条項は、任意の入札またはオークションプロセスの条項(使用する場合)を含み、適用される入札説明書の付録に説明される。
1つまたは複数の引受業者は私たちの証券で市をすることができますが、このような引受業者はこのようにする義務はありません。また通知することなく、いつでも市行為を停止することができます。私たちは私たちの証券の取引市場の流動性を何も保証することができない。
私たちの普通株はナスダックに上場して、コードは“ZVSA”です。
販売証券保有者は、引受業者、ブローカーまたは代理人が特定の購入者の要約を求めることを許可し、募集説明書付録に規定されている公開発行価格に従って証券を購入し、約束に基づいて将来の指定日の支払いおよび交付の遅延交付契約 を提供することができる。契約は、募集説明書付録に記載されている条件のみによって制限され、募集説明書付録は、これらの契約を求めるために吾らまたは売却証券保持者が支払う任意の手数料を列挙する。br}引受業者、ブローカーおよび代理は、通常の業務中に吾などまたは証券保有者と取引することができ、または私たちまたは証券所有者のためのサービスを提供することができる。
“PIPE登録権協定”および“B系列登録権協定”によれば、我々は、証券法項の下で責任を含み、販売証券所有者が本協定の下で登録された証券を売却する際に生じる可能性のある責任を賠償し、販売証券所有者が支払うことを要求される可能性のある金を支払うことに同意する。さらに、私たちおよび販売証券所有者は、証券法に基づいて生じる責任を含む、任意の引受業者、ブローカー、または代理人が証券販売に関連するいくつかの責任を賠償することに同意することができる。
私たちは、このようなすべての証券が、本登録声明または証券法第144条に従って売却または償還されなくなるまで、本登録声明の有効性を維持することに同意した。私たちは今回の発行に関連するすべての費用を支払うことに同意しましたが、引受費、割引、販売手数料、株式譲渡税、いくつかの法律費用は除外します。証券売却所有者は、今回の発行に関連する任意の引受料、割引、売却手数料、株式譲渡税、いくつかの法的費用を比例的に支払う。証券法の目論見書交付要求を満たすために、売却証券保有者に本募集説明書の写しを提供する。
| 165 |
Brを販売する証券所持者は、証券を転売する際に本募集説明書を使用することができる。本募集説明書および任意の付随する入札説明書は、売却証券保有者、証券条項、および私たちと売却証券保有者との間の任意の実質的な関係を決定する。 証券法によれば、売却証券所有者は、彼らが転売した証券に関連する引受業者(Br)とみなされる可能性があり、販売利益は、証券法に規定されている引受割引および手数料とみなされる可能性がある。募集説明書の付録に別途規定されていない限り、売却証券保有者は、ここに登録されたbr証券転売の全純収益を得る。
実体売却証券の所有者としては,本募集説明書が属する登録声明に従って証券実物をそのメンバ,パートナーまたは株主 に割り当てて目論見書を提出することを選択することができる.当該等の会員、パートナー又は株主が自社の共同経営会社でない場合、当該等の会員、パートナー又は株主は、登録声明により流通により自由に売買可能な証券を取得する。
もし が本募集説明書による任意の発売時に、発売に参加するFINRAメンバにFINRAルール5121(“ルール5121”)で定義された“利益衝突” が存在すれば、この発売は ルール5121に関する規定に従って行われる。
私たちの知る限り、証券保有者の売却と任意の自営業者または代理人との間には、現在、証券保有者の証券売却に関する計画、手配、または了解はない。販売証券保有者が、大口取引、特別発行、交換流通、二次流通または仲買業者による証券の購入について、引受業者またはブローカーと任意の重大な手配を達成したことを通知した後、我々は、証券法第424(B)条の規定に基づいて、本募集説明書の補足文書を提出し、当該引受業者または仲買取引業者及びこのような発行に関連するいくつかの重要な情報を開示する。
Brでは,ある州の証券法(適用される場合)を遵守するために,証券は で登録または許可されたブローカーまたは取引業者によってこれらの管轄区でしか販売されない.さらに、ある州では、証券は、適用された州で登録されているか、または売却資格を取得しているか、または登録または資格要件の免除を取得し、遵守されていない限り、販売されてはならない。
証券所有者および証券販売または流通に参加する任意の他の者は、証券法および取引法の適用条項、ならびに第br}M条を含むがこれらに限定されない関連規則および条例を遵守しなければならない。これらの条項は、証券保有者または任意の他の人員の何らかの活動を制限し、任意の証券の購入および販売の時間を制限する可能性があり、これらの制限は、証券株の販売可能性に影響を及ぼす可能性がある。
私たちは、本募集説明書に基づいて発行·販売された証券登録に関するすべての費用と支出を支払う必要があり、費用は約65,000ドルと予想されています。
法務
ニューヨーク州ニューヨーク州Thompson Hine LLPは、本募集説明書によって提供されたZyVersa治療会社の証券の有効性及び本募集説明書に関連するいくつかの他の法律事項に基づいて保持されている。
| 166 |
専門家
ZyVersa Treateutics,Inc.2022年12月31日(前身)および2021年12月31日(前身)の財務諸表、および2022年12月13日から2022年12月31日(前身)までの財務諸表と2021年12月31日現在の財務諸表は、独立公認会計士事務所安永会計士事務所が監査されている。その報告に掲載されているように(財務諸表に付記されているbr 2に記載されている当社の持続的な経営能力に重大な疑いがある場合を記述した解釈が掲載されており)、同社が会計及び監査の専門家としての認可に基づいて登録されている。
| 167 |
ここで詳細な情報を見つけることができます
私たちは、年度、四半期、現在の報告、依頼書、その他の情報を米国証券取引委員会に提出します。我々はまた、証券法に基づいて本募集説明書に提供された証券に基づいて、証拠物を含むS-1表の登録声明 を提出した。本募集説明書 は、登録説明書の一部であるが、登録説明書や証拠物に含まれるすべての情報は含まれていない。 我々の米国証券取引委員会届出ファイルは、米国証券取引委員会が維持しているサイトを介してインターネット上で取得することができ、サイトは:www.sec.govである。公衆は、私たちのウェブサイトhttp://www.zyversa.comの“財務および届出” の下でこれらの記録ファイルを閲覧または閲覧することもできます。しかしながら、私たちのウェブサイトに含まれているか、または他の方法でアクセスされる情報は、本募集説明書の一部とみなされてはならない。
| 168 |
財務諸表索引
| 独立公認会計士事務所報告(PCAOB ID:42) | F-2 | |
| 2022年12月31日(後継者)及び2021年12月31日(前身)までの貸借対照表 | F-3 | |
| 2022年12月13日から2022年12月31日まで(後任)、2022年1月1日から2022年12月12日(前身)と2021年12月31日終了年度(前身)の業務説明 | F-4 | |
| 2022年12月13日から2022年12月31日まで相続期株主権益変動表 | F-5 | |
| 2021年12月31日から2022年12月12日までの前期間の株主損失額変動レポート | F-6 | |
| 2022年12月13日~2022年12月31日(後任)、2022年1月1日から2022年12月12日(前身)及び2021年12月31日終了年度(前身)のキャッシュフロー表 | F-7 | |
| 連結財務諸表付記 | F-8 |
| 2023年6月30日(監査なし)及び2022年12月31日(その後)までの連結貸借対照表 | F-33 | |
| 監査されていないbrは、2023年6月30日(後続)と2022年6月30日(前任)までの3ヶ月と6ヶ月の簡明総合経営報告書と全面赤字 | F-34 | |
| 2023年6月30日(後継者)と2022年6月30日(前身)までの3ヶ月と6ヶ月監査されていない簡明総合株主権益変動表 | F-35 | |
| 監査を受けていない2023年6月30日(後続)と2022年6月30日(前身)までの6ヶ月現金フロー表簡明合併報告書 | F-36 | |
| 未監査簡明合併財務諸表付記 | F-37 |
| F-1 |
独立公認会計士事務所報告{br
ZyVersa治療会社の株主と取締役会に。
財務諸表に対する意見
ZyVersa治療会社(当社)の2022年12月31日まで(後継者) と2021年(前身)の合併貸借対照表,2022年12月13日から2022年12月31日(後継者)までの関連総合経営報告書,株主権益とキャッシュフローの変化,2022年1月1日から2022年12月12日(前身)と2021年12月31日までの年度に関する総合経営報告書,株主不足とキャッシュフローの変化および関連付記を監査した (総称して“連結財務諸表”と呼ぶ)。総合財務諸表は,すべての重要な面で,2022年12月31日,2022年12月31日,2021年12月31日までの財務状況,および2022年12月13日から2022年12月31日(後継者),2022年1月1日から2022年12月12日(前身)および2021年12月31日までの年度の経営成果とキャッシュフローを公平に反映しており,米国公認会計原則に適合していると考えられる。
企業を継続的に経営する能力として
添付されている総合財務諸表 は、当社が経営を継続すると仮定して作成されています。財務諸表付記2で述べたように,当社は経常的な運営赤字を受けており,運営資金が不足しているが,当社が経営を継続する能力があるかどうかには大きな疑問がある。付記2では、これらの事項に対する経営陣のイベントや条件の評価、経営陣の計画も紹介されています。合併財務諸表には、このような不確実性の結果生じる可能性のある調整は含まれていません。
意見を求める根拠
これらの財務諸表は会社経営陣が担当しています。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはアメリカ上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、アメリカ連邦証券br法律およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければならない。
私たち はPCAOBの基準に従って監査を行います。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。会社 はその財務報告の内部統制を監査する必要はなく、私たちを招いて監査を行うこともありません。私たちの監査の一部として、財務報告の内部統制を知る必要がありますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々のbr監査には、財務諸表の重大な誤報のリスクを評価するための実行プログラムが含まれており、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行する。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。私たちの監査には、経営陣が使用する会計原則の評価と重大な推定、財務諸表の全体的なレポートの評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/ 安永法律事務所
私たち は2019年以来当社の監査役を務めています。
フロリダ州オーランド
2023年3月31日
| F-2 |
ZYVERSA 治療会社
合併貸借対照表
| 後継者 | 前身 | |||||||
| 十二月三十一日 | 十二月三十一日 | |||||||
| 2022 | 2021 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金 | $ | 5,902,199 | $ | 328,581 | ||||
| 前払い費用と他の流動資産 | 225,347 | 106,929 | ||||||
| 仕入先保証金 | 235,000 | 376,272 | ||||||
| 流動資産総額 | 6,362,546 | 811,782 | ||||||
| 装置、ネットワーク | 17,333 | 27,733 | ||||||
| 現在行われている研究と開発 | 100,086,329 | - | ||||||
| 商誉 | 11,895,033 | - | ||||||
| 保証金 | 46,659 | 46,659 | ||||||
| 経営的リース使用権資産 | 98,371 | - | ||||||
| 仕入先保証金 | - | 240,000 | ||||||
| 総資産 | $ | 118,506,271 | $ | 1,126,174 | ||||
| 負債、仮持分、株主権益(不足) | ||||||||
| 流動負債: | ||||||||
| 売掛金 | $ | 6,025,645 | $ | 2,000,100 | ||||
| 費用とその他の流動負債を計算しなければならない | 2,053,559 | 1,914,101 | ||||||
| リース負債を経営する | 108,756 | - | ||||||
| 派生負債 | - | 560,600 | ||||||
| 支払変換可能手形(2022年12月31日と2021年12月31日まで、それぞれ0ドルと39,942ドルの債務割引を差し引く) | - | 5,976,508 | ||||||
| 変換可能支払手形関連先 | - | 3,175,000 | ||||||
| 流動負債総額 | 8,187,960 | 13,626,309 | ||||||
| 繰延税金負債 | 10,323,983 | - | ||||||
| 総負債 | 18,511,943 | 13,626,309 | ||||||
| 引受金及び又は有事項(付記10) | - | - | ||||||
| 後継者は普通株を償還することができ、償還可能で、2022年12月31日までに65,783株を発行した | 331,331 | - | ||||||
| 前身は普通株を償還することができ、償還する必要がある可能性があり、2021年12月31日までに発行された331,331株 | - | 331,331 | ||||||
| 株主権益(不足): | ||||||||
| 優先株、額面0.0001ドル、ライセンス株式1,000,000株: | ||||||||
| 2022年12月31日現在、Aシリーズ後継者優先株、指定株式8,635株、発行済み株式8,635株 | 1 | - | ||||||
| 後継者Bシリーズ優先株は,5,062株を指定し,2022年12月31日現在5,062株を発行·発行している | 1 | |||||||
| 後続普通株、額面0.0001ドル、認可株式1.1億株;2022年12月31日までに発行と発行済み株9,016,139株 | 902 | - | ||||||
| 前身普通株、額面0.00001ドル、認可株式75,000,000株;2021年12月31日までに24,167,257株を発行·発行済み | - | 242 | ||||||
| 実収資本を追加する | 104,583,271 | 40,065,109 | ||||||
| 赤字を累計する | (4,921,178 | ) | (52,896,817 | ) | ||||
| 株主権益総額(不足) | 99,662,997 | (12,831,466 | ) | |||||
| 総負債、仮持分、株主権益(不足) | $ | 118,506,271 | $ | 1,126,174 | ||||
付記はこれらの連結財務諸表の構成要素である。
| F-3 |
ZYVERSA 治療会社
統合の作業報告書
| 後継者 | 前身 | |||||||||||
| 期間について | 期間について | 本年度の | ||||||||||
| 12月 13から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 12月 12, | 十二月三十一日 | ||||||||||
| 2022 | 2022 | 2021 | ||||||||||
| 運営費用 : | ||||||||||||
| 研究開発 | $ | 399,894 | $ | 5,407,859 | $ | 2,124,277 | ||||||
| 通常 と管理 | 420,174 | 7,605,205 | 5,580,099 | |||||||||
| 運営費総額 | 820,068 | 13,013,064 | 7,704,376 | |||||||||
| 運営損失 | (820,068 | ) | (13,013,064 | ) | (7,704,376 | ) | ||||||
| その他 (収入)支出: | ||||||||||||
| 利息 費用 | - | 427,542 | 821,366 | |||||||||
| 派生負債公正価値変動 | - | 607,001 | (228,100 | ) | ||||||||
| PPPローン免除を受ける | - | - | (213,481 | ) | ||||||||
| 税前純損失 | (820,068 | ) | (14,047,607 | ) | (8,084,161 | ) | ||||||
| 収入br税収割引 | 745,050 | - | - | |||||||||
| 純損失 | (75,018 | ) | (14,047,607 | ) | (8,084,161 | ) | ||||||
| 優先株株主配当として | - | (10,015,837 | ) | - | ||||||||
| 普通株主は純損失を占めるべきだ | $ | (75,018 | ) | $ | (24,063,444 | ) | $ | (8,084,161 | ) | |||
| 1株当たり純損失 | ||||||||||||
| -基本的かつ希釈 | $ | (0.01 | ) | $ | (0.99 | ) | $ | (0.33 | ) | |||
| 重み 発行済み普通株式平均数 | ||||||||||||
| -基本的かつ希釈 | 9,016,139 | 24,194,270 | 24,167,257 | |||||||||
付記はこれらの連結財務諸表の構成要素である。
| F-4 |
ZYVERSA 治療会社
合併株主権益変動表
| 2022年12月13日から2022年12月31日まで | ||||||||||||||||||||||||||||||||||||
| Aシリーズ | Bシリーズ | その他の内容 | 合計する | |||||||||||||||||||||||||||||||||
| 優先株 | 優先株 | 普通株 | 支払い済み | 積算 | 株主の | |||||||||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 権益 | ||||||||||||||||||||||||||||
| 後継者 | ||||||||||||||||||||||||||||||||||||
| 残高-2022年12月13日 | 0 | 8,635 | $ | 1 | 5,062 | $ | 1 | 9,016,139 | $ | 902 | $ | 104,526,938 | $ | (4,846,160 | ) | $ | 99,681,682 | |||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | 56,333 | - | 56,333 | ||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | (75,018 | ) | (75,018 | ) | ||||||||||||||||||||||||
| 残高-2022年12月31日 | - | 8,635 | $ | 1 | 5,062 | $ | 1 | 9,016,139 | $ | 902 | $ | 104,583,271 | $ | (4,921,178 | ) | $ | 99,662,997 | |||||||||||||||||||
付記はこれらの連結財務諸表の構成要素である。
| F-5 |
ZYVERSA 治療会社
合併 株主欠陥性変更報告書
| 2020年12月31日から2022年12月12日まで | ||||||||||||||||||||||||||||
| その他の内容 | 合計する | |||||||||||||||||||||||||||
| 優先株 | 普通株 | 支払い済み | 積算 | 株主の | ||||||||||||||||||||||||
| 前身 | 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 遺憾に思う | |||||||||||||||||||||
| 残高-2020年12月31日 | - | - | $ | - | - | 24,167,257 | $ | 242 | $ | 35,923,373 | $ | (44,812,656 | ) | $ | (8,889,041 | ) | ||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | 4,141,736 | - | 4,141,736 | |||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | (8,084,161 | ) | (8,084,161 | ) | |||||||||||||||||
| 残高-2021年12月31日 | - | - | - | - | 24,167,257 | 242 | 40,065,109 | (52,896,817 | ) | (12,831,466 | ) | |||||||||||||||||
| 私募で優先株を発行する[1] | - | 625,639 | 6 | - | - | - | 1,865,378 | - | 1,865,384 | |||||||||||||||||||
| 支払可能手形を優先株に変換する[2] | - | 1,802,193 | 18 | - | - | - | 5,658,870 | - | 5,658,888 | |||||||||||||||||||
| 優先株を普通株に転換する | - | (2,427,832 | ) | (24 | ) | - | 6,406,210 | 64 | (40 | ) | - | - | ||||||||||||||||
| 支払可能手形を普通株式に変換する[3] | - | - | - | - | 2,940,537 | 29 | 5,838,180 | - | 5,838,209 | |||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | 3,524,801 | - | 3,524,801 | |||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | (14,047,607 | ) | (14,047,607 | ) | |||||||||||||||||
| - | ||||||||||||||||||||||||||||
| 残高-2022年12月12日 | 1 | - | $ | 0 | 1 | 33,514,004 | $ | 335 | $ | 56,952,298 | $ | (66,944,424 | ) | $ | (9,991,791 | ) | ||||||||||||
付記はこれらの財務諸表の構成要素である。
| [1] | 1,964,524ドルの総収益から99,140ドルの発行コストを引いた |
| [2] | 元金5,230,000ドルと利息428,888ドルが含まれています |
| [3] | 元金3,961,000ドル、課税利息709,608ドル、派生負債1,167,601ドルを含む |
| F-6 |
ZYVERSA 治療会社
合併 現金フロー表
| 後継者 | 前身 | |||||||||||
| その期間内に | その期間内に | この1年の | ||||||||||
| 十二月十三日から | 一月一日から | 一段落した | ||||||||||
| 十二月三十一日 | 十二月十二日 | 十二月三十一日 | ||||||||||
| 2022 | 2022 | 2021 | ||||||||||
| 経営活動のキャッシュフロー: | ||||||||||||
| 純損失 | $ | (75,018 | ) | $ | (14,047,607 | ) | $ | (8,084,161 | ) | |||
| 純損失と経営活動で使用される現金純額の調整: | ||||||||||||
| 株に基づく報酬オプション | 56,333 | 3,524,801 | 4,141,736 | |||||||||
| 債務割引償却 | - | 39,492 | 317,833 | |||||||||
| PPPローンの猶予権を得る | - | - | (213,481 | ) | ||||||||
| 派生負債の公正価値変動 | - | 607,001 | (228,100 | ) | ||||||||
| 固定資産償却 | 532 | 9,868 | 10,400 | |||||||||
| 非現金レンタル料 | 4,443 | 79,918 | - | |||||||||
| 繰延税金負債 | (745,050 | ) | - | - | ||||||||
| 経営性資産と負債変動状況: | ||||||||||||
| 前払い費用と他の流動資産 | 36,606 | 73,675 | (318,761 | ) | ||||||||
| 保証金 | - | - | 11,665 | |||||||||
| 仕入先保証金 | 125,645 | 255,627 | 10,000 | |||||||||
| 売掛金 | (2,076,863 | ) | 6,617,064 | (311,862 | ) | |||||||
| リース負債を経営する | (4,786 | ) | (86,100 | ) | - | |||||||
| 費用とその他の流動負債を計算しなければならない | (715,730 | ) | 1,431,620 | (411,358 | ) | |||||||
| 経営活動に使われている現金純額 | (3,393,888 | ) | (1,494,641 | ) | (5,076,089 | ) | ||||||
| 資金調達活動のキャッシュフロー: | ||||||||||||
| 優先株で得た金を私募で発行する | - | 1,964,524 | - | |||||||||
| 優先株発行に関する発行コスト | - | (99,140 | ) | - | ||||||||
| 転換支払手形を発行して得た金 | - | - | 5,230,000 | |||||||||
| 融資活動が提供する現金純額 | - | 1,865,384 | 5,230,000 | |||||||||
| 現金と制限現金の純増加 | (3,393,888 | ) | 370,743 | 153,911 | ||||||||
| 現金--期初 | 9,296,087 | 328,581 | 174,670 | |||||||||
| 現金--期末 | $ | 5,902,199 | $ | 699,324 | $ | 328,581 | ||||||
| キャッシュフロー情報の補足開示: | ||||||||||||
| 非現金投資と融資活動: | ||||||||||||
| PPPローンの猶予権を得る | $ | - | $ | - | $ | 231,481 | ||||||
| 変換可能手形と課税利息を優先株 に変換する | $ | - | $ | 5,658,888 | $ | - | ||||||
| 変換可能手形と課税利息を普通株 に変換する | $ | - | $ | 5,838,209 | $ | - | ||||||
| ASC 842を採用したROU資産とリース負債の確認 | $ | - | $ | 182,732 | $ | - | ||||||
| 発売延期料金の売掛金 | $ | 240,691 | $ | 667,224 | $ | 25,000 | ||||||
付記はこのような簡明な財務諸表の構成要素である。
| F-7 |
ZYVERSA 治療会社
財務諸表付記
注 1-企業組織、運営性質およびリスクと不確実性
業務組織、業務性質と列報根拠
組織 と運営
Larkspur(“Larkspur”)は空白小切手特殊用途買収会社で、2021年3月17日にデラウェア州に登録設立された。2022年12月12日、LarkspurはZyVersa Treateutics,Inc.(前身)との業務合併を完了し(詳細は注4-業務合併)、ZyVersa Treateutics,Inc.(前身)は2014年3月11日にVariant PharmPharmticals,Inc.としてフロリダ州に登録設立された。業務合併完了日には、Larkspur(“新親会社”)はZyVersa Treateutics,Inc.,前身は新親会社との子会社合併後にZyVersa Treateutics Operating,Inc.(“運営中のbr}”)と改称した。これにより、デラウェア州に登録設立され、新親会社の完全子会社(総称して“相続人”と呼ぶ)となる。 すべてが“会社”または“ZyVersa”と言及する場合は、2022年12月13日から2022年12月31日までの相続人を指し、2021年1月1日から2022年12月12日までの前身を指す。
ZyVersa は臨床段階の生物製薬会社であり、ノウハウを利用して慢性腎臓疾患或いは炎症性疾患患者のために薬物を開発し、これらの患者は高度に満足されていない医療需要を持っている。私たちの使命は,健康結果を最適化し,患者の生活の質を向上させる薬剤の開発である。
リスク と不確実性
2020年初め、コロナウイルス病を引き起こす1種の新しいコロナウイルス株--SARS-CoV-2(新冠肺炎)が全世界で突然発生した。最初は、同社の業務は多くの面で大きなマイナス影響を受けていた。これらの影響には,潜在的な患者参加者が危険を冒して施設に入って試験を行うことを望まないため,br}VAR 200 2 a期試験の開始遅延が含まれている。また、個人融資市場が不安定で、会社は業務融資に必要な流動資金を失っている。そのため、経営陣は経済状況改善まで継続するために大量のコスト削減措置を実施した。新冠肺炎Sの未来が会社の運営と財務状況に与える全面的な影響はまだ確定していない。持続的な新冠肺炎疫病は同社の運営業績、財務状況と流動性に重大な不利な影響を与える可能性があり、同社がその臨床開発計画を推進する時間と能力を含む。財務諸表には、このような不確実性に起因する可能性のあるいかなる調整も含まれていない。
2023年3月10日、シリコンバレー銀行(SVB)はカリフォルニア州金融保護·革新部によって閉鎖され、連邦預金保険会社(FDIC)は係に任命された。同様に,2023年3月12日,Signature銀行とSilvergate Capital Corp.はそれぞれ破産管理プログラムに巻き込まれた.財務省、FRB、連邦預金保険会社の声明によると、SVBのすべての預金者は閉鎖されてわずか1つの仕事後に、未保険預金口座の資金を含むすべての資金を引き出すことができる。各口座所有権カテゴリについて、各保険銀行の預金者当たりの標準預金保険金額は最大250,000ドルである。私たちは上記の銀行には何の預金もありませんが、他の金融機関との現金残高はFDIC保険限度額を超えています。預金機関が預金を返却できなかった場合、現金または現金等価物を得ることに影響を与え、当社の経営流動性や財務業績に悪影響を及ぼす可能性があります。
注[br}2-継続経営と経営陣の計画
設立以来、会社は毎年赤字を出しており、2022年12月31日現在、会社の純運営資金が不足している。財務諸表発表日の手元現金によると、当社は、財務諸表発表日から12ヶ月以内に、会社の現在の利用可能現金ではその運営をサポートするには不十分であると予想しています。したがって、会社 は、株式または債務融資によって追加資金を調達することを要求され、追加資本 を得ることに成功することは保証されない。これらの条件は、会社がこれらの財務諸表の発表日から少なくとも1年以内に経営を継続する能力があるかどうかを大きく疑わせる。
社はまだ利益を実現しておらず、運営からの現金流出が引き続き発生する見通しだ。その研究と開発および一般的かつ管理費が増加し続けることが予想されるため,最終的には利益を達成するために相当な製品収入を生成するためにbrが必要となる。
| F-8 |
Br社のキャッシュフロー需要には,研究開発に資金を提供するために必要な金額,運営資本,資本支出が含まれる運営業務の計画コストが含まれている。会社の将来の資本需要およびその利用可能な資金の十分性は、企業がその製品およびサービスを商業化することに成功する能力、競争する技術および市場発展、および当社の製品およびサービスを強化または補完するために、他の会社と協力または買収する必要があるかどうかを含む多くの要素に依存する。私たちは未来にもっと多くの資本を集めて、運営に資金を提供するつもりだ。Br社がより多くの資金を得ることができない場合には、その研究開発計画を削減し、コストを低減して現金を節約するための追加の措置をとる必要があるかもしれない。
添付されている財務諸表はアメリカ公認会計原則(“アメリカ公認会計原則”)に基づいて作成され、このような会計原則は当社を持続経営企業として持続的に経営し、正常な業務過程で資産と負債を清算することを考えている。財務諸表には、会社が経営を継続できない場合に必要ないかなる調整も含まれていない。
付記 3-重要会計政策の概要
列報根拠と合併原則
添付されている連結財務諸表は、当社とその合併子会社の会計記録から来ています。 業務合併のため、会計目的で、Larkspur Health Acquisition Corp.は買収側、ZyVersa Treateutics,Inc.は被買収側と会計の前身である。したがって、財務諸表列報には、前身の2022年12月13日までの財務諸表と、2022年12月13日以降の後継者を含む財務諸表とが含まれており、合併ZyVersa Treateutics Operating,Inc.を含む。すべての重大な会社間残高は、連結財務諸表に打ち消されている。総合財務諸表は、米国公認会計原則(“米国公認会計原則”)及び米国証券取引委員会(“米国証券取引委員会”)の会計規則及び規定に基づいて作成される。
見積もりを使った
米国公認会計原則に基づいて財務諸表を作成することは、管理層 に推定、判断と仮定を要求し、これらの推定、判断及び仮定は、財務諸表中に報告された金額及び財務諸表関連付記に開示された金額に影響を与える。当社の見積もりと判断は、歴史的経験と、その当時の状況で合理的と考えられる様々な他の 仮説に基づいています。当社貸借対照表に記載されている貸借対照額および列報の各期間の支出金額は、株式証券、派生負債、株式に基づく報酬および買収された無形資産の公正価値計算、および繰延税金資産の推定値控除に使用されるが、これらの推定および仮定は、株式証券、派生負債、株式に基づく報酬および買収に基づく無形資産の公正価値計算、および繰延税金資産の推定値控除に使用されるが、これらに限定されない。会社のいくつかの見積もり は、会社独自の状況や一般経済状況を含む外部条件の影響を受ける可能性があります。実際の結果はこれらの推定値とは異なる可能性があり,これは合理的である.
現金 と現金等価物
会社は財務諸表において、すべての元の満期日が三ヶ月以下の高流動性投資を現金等価物と見なしている。2022年12月31日と2021年12月31日まで、会社は現金等価物を持っていない。
Br社の現金預金は、連邦預金保険会社(“FDIC”)の保険限度額を超える可能性があります。 会社はこのような口座で損失に遭遇しておらず、その金融機関の信用を定期的に評価しています。付記1-リスクと不確実性を参照してください。
| F-9 |
業務合併
業務合併会計の買収方法を適用する際に、買収に割り当てられた識別可能な資産及び負債の金額は、買収日の推定公正価値に基づいており、 の残りの部分は営業権として記録される。無形資産は最初に公正価値によって評価され、このタイプの無形資産に適した公認評価方法 を採用した。企業合併で取得した進行中の研究·開発(IPR&D)は,規制部門の承認を得る前に,無期限無形資産として資本化し,規制部門の承認を得る前に,定期無形資産に計上し,その予想寿命内に償却したり,使用を停止したりする場合には,その無形資産を解約する。
長期資産と商業権
当社 はASC 360-10-35の規定により長期資産を会計処理しています財産·工場·設備·減価または長期資産の処分それは.本会計基準は、事件や状況変化が発生して帳簿金額が回収できない可能性があることを示す限り、長期資産の減価審査を行うことを要求している。保有·使用する資産の回収可能性は、資産の帳簿価値と資産予想による将来の未割引現金流量とを比較することで測定される。 資産の帳簿価値がその推定された将来のキャッシュフローを超えていれば、資産帳簿価値が資産公正価値を超える金額で減価費用を確認する。当社は毎年10月1日から年次減値テストを行う予定です。
当社 はASC 350会計基準に基づいて営業権と無形資産を会計処理する無形資産-営業権とその他それは.営業権とは、1つの実体の購入価格が買収された資産と負担された負債の推定公正価値を超えた部分である。ASC 350は、無限寿命を有する営業権および他の無形資産が毎年減値試験を行うことを必要とするか、またはイベントまたは状況が資産の公正価値がその帳簿価値よりも低くなったことを示す場合に一時的に減値試験を行うことを必要とする
数量化評価が必要か否かを判定する際には、報告単位の公正価値がその帳簿価値よりも低い可能性が高いか否かを決定するために、関連イベントや状況を評価する。定性的評価を行った後、 のあるエンティティが、報告単位の公正価値がその帳票価値よりも少ない可能性が高いと結論した場合、そのエンティティ は、ASC 350に記載されている量子化減値テストを実行する。しかし,定性的評価を適用した後,エンティティ は公平価値が帳票価値より小さい可能性が低い可能性が低いと結論すれば, による量子化減値テストは必要ない.同社はその歴史データと経験、業界予測、ミクロとマクロ全体の経済状況予測及び予想に基づいてこれらの仮説を立てた
設備、 純額
設備 はコスト換算減価償却累計額を差し引いた純額を列報し,稼働日から直線 法を採用し,耐用年数(すなわち5年)内に減価償却すべき資産のコストを運営に計上するのに十分な比率で記録した。2022年と2021年12月31日現在、設備には、2019年9月1日に使用された52,000ドルの医療機器が含まれており、2022年と2021年12月31日現在のそれぞれ34,667ドルおよび24,267ドルの累積減価償却を引いている。2022年12月13日から2022年12月31日までの間、後継者 確認償却費用は532ドルです。 は2022年12月12日と2021年12月31日までの間、前任者の減価償却確認費用は$です各期間9,869ドル、業務報告書に含まれる一般費用と行政費用。
融資コスト
債務 発行コストは主に債務融資に関する直接的·増加的な専門費用から構成され,支払手形額面から直接差し引かれ,実際の利子法を用いて対象支払手形の契約期間内に を償却することが報告されている。
転換可能本券 本票
当社は、財務会計基準委員会(“FASB”)会計基準に従って (“ASC”)815題“派生ツールおよびヘッジ”(“ASC 815”)が個別に入金された派生金融商品の資格に適合するかどうかを決定するために、その変換可能なツールを評価する。派生金融商品の会計処理は、当社が合意開始日の公正価値と、その後の各貸借対照表日の公正価値とに基づいて、任意の分岐の埋め込み特徴 を記録することを要求する。公正価値の任意の変動は、期間ごとの収益のうち、非営業、非現金収入または費用として入金される。当社は貸借対照表ごとにその派生ツールの分類を再評価します。期間内の イベントによって分類が変更されると,契約は再分類されたイベントが発生した日から再分類される.分岐されたbr}埋め込み機能は、その初期公正価値記録に従って記録され、これは、ホストツールのための追加の債務割引を作成する。
2021年1月1日に会計基準更新(ASU)2020-06年1月1日までに、埋め込まれた変換オプションがbr分岐を必要としない場合、会社は、会社が約束日までの対象株式の公正価値とツールの有効転換価格(内在価値)を比較することで有益な変換機能が存在するかどうかを評価する。 ホストツールは余剰コストで計量し、帳簿価値は所定の契約満期日本金brを有効利息法を用いて使用し、それに応じて利息費用を計上する。2021年1月1日にASU 2020−06を採用した後、会社は有益な変換機能が存在するかどうかを評価する必要がなくなった。
金融商品の公正価値
会社はASC 820“公正価値計量と開示”(“ASC 820”)に基づいて金融資産と負債の公正価値を計量し、この基準は公正価値を定義し、公正価値計量枠組みを構築し、公正価値計量の開示を拡大した。
| F-10 |
ASC 820は、公正価値を、計量日 市場参加者間で秩序的に取引される資産または負債の元本または最も有利な市場において負債を移動させるために課金または支払いされる交換価格(退出価格)として定義する。ASC 820はまた、公正価値レベルを確立し、これは、公正価値を計量する際に観察可能な投入を最大限に使用し、観察不可能な投入を最大限に減少させることを要求する。ASC 820は、公正価値を計量するために使用されることができる3つのレベルの投入を説明する
第1レベル--活発な市場における同じ資産または負債の見積もり;
第2レベル--アクティブ市場における資産および負債のような見積もりまたは観察可能な投入;
レベル3 では観察できない入力(例えば、仮想キャッシュフローモデリング入力に基づく)。
当該等の金融商品の短期的性質により、当該等の金融商品の帳簿価値、例えば現金、売掛金及び投資家預金は、公正価値に近い。
第3レベル投入を評価する際に使用される推定技術や仮定の詳細については、付記8−派生負債を参照されたい。
所得税 税
財務諸表または納税申告書に計上されているまたは計上されていない項目の将来の税務結果について、会社は繰延税金資産および負債を確認する。繰延税項資産および負債は、資産および負債の課税基準とそれぞれの財務報告金額(“一時的差異”)との差額(“一時的差異”)に基づいて決定され、この差額は一時的な差額が予想される年度の現行税率 で計算される。繰延税金資産は、経営陣が資産が顕在化しない可能性が よりも大きい範囲で減値する可能性があると結論した。税率変動が繰延税金資産や負債に及ぼす影響は、公布日を含む期間の経営報告書で確認される
会社は確認敷居と計量プロセスを用いて財務諸表を確認し、納税申告書の中ですでに採用されているか、あるいは予想されている納税頭寸を計量する。
賃貸借証書
ASC 842の採用に関するより詳細な情報は、付記3-重要会計政策の概要-最近採択された会計公告を参照されたい。
研究と開発
研究開発費は発生時に運営費を計上する。
株に基づく報酬
社は,権益付与ツールの公正価値に基づいて獲得したサービスコストを計測する.報酬の公正な価値は付与された日に計量される。次いで、報酬と交換するためにサービスを提供する必要がある期間(通常は許可期間)に、公正価値金額が確認される。
株式オプションと引受権証の公正価値
社はBlack-Scholesオプション定価モデルを用いて、付与された株式オプションと引受権証の公正価値を計算した。オプション没収 は発生時に計上される.後続普通株は市場法を採用し、普通株のナスダック世界市場における取引価格 を用いて推定する。2022年の間、前身普通株の公正価値は、推定日ごとに買収側との業務合併協定が公平に議論されている状況 に基づいて市場法を用いて決定され、この協定は最終的に2022年7月20日に締結され、前置推定値は8,500万ドルである。2021年、経営陣は第三者評価専門家の協力のもと、br収益法を用いて前身普通株の公正価値を決定した。オプション使用の予想用語は、付与されたオプション未償還予定期間である。 株式証明書で使用される予想用語は、契約期間である。当社は“簡略化”方法を用いて“通常”オプション付与の期待期限を試算している。当社は2022年12月13日まで普通株の公開取引履歴がなく、その歴史変動率計算を支持している。そこで,当社では,評価ツールの期待寿命に相当する期間における6つの比較可能エンティティの履歴変動率の回顧に基づいた期待変動率 数字を採用した。無リスク金利は、米国債ゼロ金利債券の暗黙的収益率に基づいて決定され、その残り期限は、推定ツールの予想期限と一致する。
| F-11 |
普通株1株当たり純損失
基本 1株当たりの普通株純損失の計算方法は,純損失を期間中に発行された既存普通株で割った加重平均である。1株当たりの純収入の計算方法は、純収入を期間ごとに発行された普通株と希釈性普通株で割った加重平均である。
次の表は、希釈後の1株当たり純損失計算から除外された発行された潜在的希薄化証券 を示している
別表逆希釈証券は希釈後の1株当たり純損失を計上しない
| 後継者 | 前身 | |||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 前任持分証[1] | - | 8,560,561 | 2,154,351 | |||||||||
| 後任権証[1][5] | 8,628,695 | - | - | |||||||||
| 前置タスクオプション | - | 10,039,348 | 8,755,179 | |||||||||
| 後継者選択肢 | 1,993,235 | - | - | |||||||||
| 前身Aシリーズ転換可能優先株 | - | 6,406,210 | - | |||||||||
| 後継者シリーズA転換優先株 | 863,500 | (3) | - | - | ||||||||
| 後継者Bシリーズ転換優先株 | 506,264 | (4) | - | - | ||||||||
| 前身転換支払手形[2] | - | - | 3,400,187 | |||||||||
| 潜在希釈株式総数 | 11,991,694 | 25,006,119 | 14,309,717 | |||||||||
| [1] | InflamaCORE,LLCライセンスプロトコルの一部として、600,000株の前身または119,125株の普通株を購入する引受権証は、あるマイルストーンを満たした後に が発行されるので、現在報告されている金額には含まれていません。 |
| [2] | 社の変換可能な支払手形には変換オプションが含まれており,ある条件を満たす取引が完了した後に普通株式 を自動発行することができる.変換価格は、条件を満たす取引に関連する暗黙的な普通株価格の関数である。上の表の潜在的な希釈証券を開示するために、条件を満たす取引が発生し、隠れ普通株価格が2021年12月31日現在の1株当たり3.25ドルの普通株式公正価値に等しい場合に発行可能な普通株数を使用した |
| [3] | 後続A系列変換可能優先株変換価格をその下限価格にリセットすると, は余分な3,454,000株を含まない. |
| [4] | 後続のB系列変換可能な優先株変換価格がその下限価格にリセットされた場合、 は追加の216,970株を含まない。 |
| [5] | 後続のAシリーズ株式承認行の権益が底値にリセットされた場合、 は追加の3,454,000株を含まない。 |
細分化市場報告
当社は報告可能な運営部門と運営部門としてその業務を経営·管理している。すべての資産と業務はアメリカにあります。会社の最高経営責任者は最高経営決定者で、彼はまとめた上で財務情報を審査して、資源を割り当て、財務業績を評価します。
最近は会計公告が採用されている
2019年12月、FASBは、所得税会計の簡略化を目的としたASU 2019−12“所得税(主題740):所得税会計の簡略化”を発表した。ASU 2019−12は、主題740の一般原則のいくつかの例外を削除し、一貫性アプリケーションを改善するために、既存のガイドを明確にして修正した。ASU 2019-12は、2021年12月15日以降のbr}会計年度に有効です。この基準は2022年1月1日に採択され、会社の財務諸表に実質的な影響を与えていない。
2021年5月、FASBは、ASU 2021-04、1株当たり収益(主題260)、債務修正および補償(サブテーマ470-50)、 補償-株式補償(主題718)、およびエンティティ自身の株式のデリバティブおよびヘッジ-契約(サブテーマ 815-40):発行者による独立持分分類書面コールオプションのいくつかの修正または交換の会計処理を発表した。この新しい基準は、独立 持分分類書面コールオプション(例えば、株式承認証)の修正または交換に対する発行者の会計処理の多様性を明確にし、減少させ、これらのオプションは、修正または交換後も持分分類を維持する。本基準 は、これらの年度内の移行期間を含む2021年12月15日以降の会計年度に適用される。会社は、新標準の発効日以降に発生した修正または交換に、前向きに新基準を適用しなければならない。本指針は2022年1月1日に採用され、会社の財務諸表に実質的な影響を与えていない。
| F-12 |
2020年8月、財務会計基準委員会は、債務転換および他のオプション(主題470-20)および派生ツールおよびヘッジ-エンティティ自己持分契約(主題815-40):実体自己持分における変換可能なツールおよび契約の会計処理 を発表し、負債および持分の特徴を有するいくつかの金融商品の会計処理を明確にする。今回の更新中の改訂は現金変換モデルと受益変換機能モデルを削除し、転換可能債務ツールと転換可能優先株の会計モデル数を減少させた。制限会計モデルは、ホスト契約から個別に識別される組み込み変換 機能をより少なくする。分離モード制約を継続する変換可能ツールは、(1)宿主契約と明確かつ密接に関連し、派生ツール定義 に適合し、派生ツール会計例外範囲に適合しない埋め込み変換特徴を有する変換可能債務ツールと、(2)発行され、実質資本として記録されたかなりの割増可能債務ツール と、を含む。さらに、このASUは、変換可能なツールおよび1株当たりの収益指針の開示要求を改善した。ASUはまた、実質的な会計結論ではなく、遠隔またはイベントによって駆動される実質的な会計結論を低減するために、派生ツール範囲例外ガイドを修正する。この更新中の改訂は,2023年12月15日以降のbrから始まる財政年度およびこれらの財政年度内の過渡期に適用される。早期採用は許可されるが、2020年12月15日以降のbr年度より早くはならない。会社はあらかじめASU 2020-06を採用しており,2021年1月1日から発効しており,新たな変換可能チケットを発行する際に有益な変換機能を確認する必要があるかどうかを評価する必要はない.
2016年2月、米国財務会計基準委員会は、2016−02年度会計基準更新(“ASU”)“レンタル(テーマ842)”を発表した。ASU 2016-02はテナントに経営性賃貸による資産と負債の確認を要求した。テナントは、財務状況表において、リース金を支払う負債(リース負債)と、リース期間内に標的資産を使用する権利を代表する使用権資産とを確認しなければならない。リース期間が12ヶ月以下のリースについては、テナントは、対象資産種別に応じて会計政策選択を行うことが許可され、リース資産及びリース負債を確認しない。移行段階では,テナントとレンタル者は,改良されたバックトラック法で提案された最初の期間開始時のテナントを確認·計測しなければならない。この改正は、2021年12月15日以降の会計年度 および2022年12月15日以降の会計年度内の移行期間内に非上場企業と新興成長型企業に対して発効する。FASBは2018年7月にASU 第2018-10号“テーマ842レンタルの編纂改善”とASU第2018-11号“レンタル(テーマ842)的確な改善”を発表し、2018年12月にASU第2018-20号“レンタル(テーマ842)-レンタル人の範囲の狭い改善”を発表した。ASU 2018−10およびASU 2018−20は、ASU 2016−02に発表されたガイドラインの狭義の側面に影響を与えるいくつかの修正案を提供する。ASU 2018-11は、ASU 2016-02を採用するすべてのエンティティが別の(およびオプション)移行方法を選択することを許可し、この方法によれば、エンティティは、最初に採用日に新しいレンタル基準を適用し、採用期間中に利益を残す期間初期残高の累積影響調整 を確認する。当社は2022年12月31日にASU 2016-02を採用し、2022年1月1日から発効し、このASUを採用すると、当社が経営するリースの使用権資産と賃貸負債が入金され、金額は約182,732ドルと199,642ドル、繰延レンタル料のキャンセル確認は約16,910ドルである。
再分類する
ある 前年度残高は本年度に該当する列報方式で再分類されている.これらの再分類は 以前に報告された運営実績や1株当たりの損失に影響を与えない。
注: 4-業務合併
業務合併、営業権、進行中の研究開発
運営会社は2022年7月20日、運営会社株主代表として、Larkspur、Larkspur Merge Sub Inc.(Larkspurの全資付属会社)およびStephen Gloverと業務合併協定(“業務合併合意”)を締結した。Larkspurは空白小切手特殊目的買収会社(“SPAC”) が2021年12月23日に初公募株(IPO)を完了して上場企業となり、設立目的は個人会社との業務統合を実現するためであり、同社はナスダックでの株式公開取引により得られた資金を得ることで利益を得ることができる。
| F-13 |
2022年12月12日、Larkspurの株主は2022年12月8日に株主特別会議を開催し、企業合併協定を採択する提案を審議し、承認し、その後業務合併を完了した。業務合併に関するさらなる 詳細は、(I)最初に2022年8月12日に米国証券取引委員会に提出され、2022年11月14日に米国証券取引委員会によって発効が発表されたS-4表(アーカイブ番号333-266838)で改訂および補充された委託書/募集説明書;および(Ii)現在2022年7月22日に米国証券取引委員会に提出された8-K表報告書に記載されている。
ビジネスグループは、以下の取引を含む:
| ● | 運営会社はMerge Subに合併するため,運営会社はまだ存在するエンティティであり,デラウェア州に登録して設立される. | |
| ● | 経営会社の普通株株主は、33,845,335株の前身普通株(33,514,004株永久株式および331,331株仮株式を含む)と交換して、6,719,730株を普通株と交換する5.037の既定の為替レートで行う。これらの前身普通株は解約され、新親会社は運営会社の1株しか持っていない。そのため、運営会社は新親会社の完全子会社となった。 | |
| ● | 10,039,348個の未償還の前置オプションを1,993,235個の未償還の後継オプションに置き換えた.前置オプション保持者に発行される後続オプション数 は,5.037の交換レートを実施して決定した.該当オプションの ごとの行権価格も交換割合に応じて調整されている. | |
| ● | 8,560,561件の未満期先行権証を1,699,633件の未満期後継権証に交換した。先行権証所持者に発行される後継権証数 は,5.037の交換レートを実施して決定される.1部当たりの株式承認証の行権価格も交換比率に応じて調整された。 |
社は業務合併を運営会社の長期買収入金としており,運営中の 社は業務合併日に可変権益実体であることが決定しているためである.新親会社は主な受益者であり,その所有権 は運営会社に運営会社の活動を指導する権限を与え,運営会社の損失および/または運営会社の利益 を受ける義務があるからである。
Br業務合併は買収会計方法を採用して入金し、初期買収価格分配は買収対価格の公正価値と経営会社が買収日に買収した有形と無形資産及び負担した負債の公正価値の初歩的な評価に基づいている。買収日がカレンダー年末に近づいているため,調達価格配分が完了しておらず,許可されている12カ月間の精算期間内に詳細化する.
買収対価格の買収期日公正価値の初歩的な推定は市場法を用いて推定し、後継者普通株の公正価値に対して、1級投入(観察投入可能)を採用し、継継権証とオプションの公正価値に対して、3級投入(観察できない投入) を採用する。業務合併協議によると、買収側は運営会社の既存株式承認証及びオプションに代わる責任がある。そのため、購入対価格(合併前サービスの公正価値)と合併後サービス補償の間に株式承認証とオプションを代替する公正価値を割り当てる必要がある。合併後のサービスに起因することができる代替権証およびオプションの公正価値は、それぞれ584,260ドルおよび1,731,237ドルである。
| F-14 |
購入対価格の買収日の公正価値の初歩的な推定は以下の通りである
購入対価公正価値別表
| 相続人普通株 | $ | 67,197,300 | ||
| 後任権証 | 12,190,015 | |||
| 後継者選択肢 | 11,864,556 | |||
| 購入対価の公正価値総額 | $ | 91,251,871 |
買収資産の初歩的な買収日の公正価値は経営陣によって推定されるが、最終的には改善され、特に行われている研究·開発については、収益法を用いた推定が含まれる。買収価格は、買収した純資産の推定公正価値を確認できる部分を超えて営業権に計上されている。
買収した識別可能な純資産推定公正価値別表 を商業権と記す
| 流動資産、現金699 324ドルを含む | $ | 1,093,223 | ||
| 現在行われている研究と開発 | 100,086,329 | |||
| 商誉 | 11,895,033 | |||
| 他の非流動資産 | 64,523 | |||
| 買収した総資産 | 113,139,108 | |||
| 流動負債 | 10,818,204 | |||
| 繰延税金負債 | 11,069,033 | |||
| 負担負債総額 | 21,887,237 | |||
| 取得した純資産 | $ | 91,251,871 |
帳簿目的のために記録されている研究·開発は,研究·開発作業が完了または放棄されるまで無期限の無形資産とみなされている。買収は株式売却の形で行われるため、行われている研究開発や営業権には何の税収もなく、税収目的で控除されることもないと予想される。
2022年12月12日までの前身期間では,前身は約210万ドルの取引コストが発生し,このうち は営業報告書の一般と行政費用に計上されている。
LarkspurのSPACとしての活動の非日常的な性質から,Larkspurと運営会社の業務前統合結果 を統合した形式財務データは意味がなく,公表されていない。
後継者は業務統合に成功するとともに,A系列優先株 を8,635,000ドルの純収益で売却した.より多くの情報については、付記11-株主永久および一時持分-後続Aシリーズ優先株融資 を参照されたい。
| F-15 |
付記 5-受取手形
二零二年十二月十三日、当社はLと本券契約(“L元票合意”)を締結し、これにより、当社はL本金額351,579ドルの受取手形(“L本票”)を受け入れることに同意した。L手形の利息は年利1.17厘で、年に1回配当され、満期日は(A)当社が違約事件が発生した後にL手形項目のすべての未返済金の支払いを要求した日と(B)2025年12月15日であり、両者のうち早い者を基準としている。L社は、L社手形のすべての未払い利息および未払い利息を即時前払いすることを要求され、(A)ZyVersaは、許可契約の条項に従ってL社に支払う第2の500,000ドルの記念碑的支払いの100% (付記10-承諾およびまたは事項を参照)、(B)L&Fは、承認オプションの条項に従ってZyVersaに普通株を売却して得られた100%(付記11-株主永久および一時持分を参照)、(C)L法律事務所は、ZyVersa普通株が1株1.00ドルを超える総収益 と、(D)プロトコルで定義されたある清算イベントによって受信された収益 とをZyVersa以外のいずれか一方に売却する。2021年12月13日から2025年12月13日まで、L手形元金 が返済されていない限り、当社は毎年Lに6,000ドル相当の管理費を支払います。二零二二年十二月三十一日、当社はL及びFが支払った支払金を受け取っていないため、L及びFに支払うべき許可協定に関する記念碑的支払い を相殺するために、L及びFに支払うべき許可協定に関する記念碑的支払い を相殺するために、当該金が計上された支出及びその他の流動負債に計上されている。売掛金L&F手形を相殺責任に計上する際には,当社がL研究の記念碑的債務と当社が受け取るべきL&F手形を相殺するための双方の法的権利を与えるビジネス実質,双方の意図,およびZyVersaとL研究との全体契約合意を考慮した。当社はこのような金額が貸借対照表内で相殺可能であることを決定した,その理由は,i)当社が不足している当社の金額を割り引くことができること,ii)当社にはL研究会社のL手形金額で自社のマイルストーン負債を相殺する法定のbr権利があること,iii)当社 はL受取手形をマイルストーン負債に相殺しようとしていること,iv)相殺権利は法に基づいて強制的に実行できること,である。L&Fチケットのその他の詳細については, 付記13-後続イベントを参照されたい.
付記 6--計算すべき費用とその他の流動負債
2022年12月31日と2021年12月31日まで、計算すべき費用およびその他の流動負債は、
計算すべき費用とその他の流動負債明細書
| ここ数年で | ||||||||
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| L&Fマイルストーン支払い責任 | $ | 1,500,000 | $ | 1,500,000 | ||||
| L&F注 | (351,579 | ) | (351,579 | ) | ||||
| LとF、ネット | 1,148,421 | 1,148,421 | ||||||
| 給与課税項目 | 584,226 | - | ||||||
| その他の課税費用 | 214,229 | - | ||||||
| 連邦所得税を課税する | 106,683 | - | ||||||
| 応算利息 | - | 748,767 | ||||||
| 賃料を繰延する | - | 16,913 | ||||||
| 費用とその他の流動負債総額を計算しなければならない | $ | 2,053,559 | $ | 1,914,101 | ||||
付記 7-変換可能支払手形
無担保 は本チケットを変換できます
2019年10月から2020年7月までの間に、当社は投資家およびブローカーに24カ月期無担保転換可能な元票(“手形”)を発行し、元金総額は3,961,000ドルとなった。このうち,25,000ドルのチケットは関連先(会社管理チームのメンバー )に発行されている.債券の利息は年利6厘に相当し、満期日は(I)初期成約後24ヶ月 ヶ月である;(Ii)無責任事件が発生した時、当日又はその後;又は(Iii)自社制御権の任意の変更が発生した場合(br}の早い者)。会社が合格発行を終了した場合、以下のように定義する。(I)初公募株、総収益が少なくとも2000万ドル、または普通株が適格取引所に上場する実体となり、(Ii)上場企業と逆合併し、(Iii)会社株式証券の法規A発行、総収益少なくとも2000万ドル、または(Iv)会社株式証券の発行、総収益が2000万ドル以上である。債券項の下で満期になった元金及び応算利息は、投資家が当該等合資格発売中に受け取った同じ 条項及び条件に応じて自動的に転換しなければならない。自動転換価格は、(A) 1株当たり3.25ドルまたは(B)1株当たり価格の80%に等しくなければならず、(I)初公開(IPO)またはREG A発行であれば、 合格発行証券の最低1株価格、(Ii)逆合併であれば、会社株主に対応する普通株1株当たり価格、または(Iii)私募であれば、株式の1株当たり価格(“償還機能転換価格”)を転換する。当社は手形の埋め込み特徴を分析し、手形には(I)固定価格で1株3.25ドルの合資格発売時の自動転換、(br}には有益な転換機能が含まれていない、(Ii)違約時の償還機能、分割不要、(Iii)償還機能によって価格を転換する合資格発行時の償還 機能、総公正価値は373,000ドルであり、この機能は債務宿主から分岐し、貸方から負債と借方から債務への割引を記録したものであることを決定した。および(Iv)は制御権変更時に承認権をトリガし,公平値は64,342ドルであり,債務負担者によって分割され,派生負債の貸方および借方と債務の割引に記入される.債務割引は実際の金利法で手形の期限内に償却され、負債は報告日ごとに市価で計算される。詳細については、付記8-派生負債を参照されたい。
| F-16 |
2021年2月から3月までの間に、会社は新たな無担保転換可能元票(“2021年手形”)を発行し、元金総額は5,230,000ドルであり、そのうち3,150,000ドルは会社関連側(会社経営陣メンバー、創業者1人、重要株主を含む)に発行された。2021年に発行された債券の年利率は6%で、日割りで複利し、満期日は2021年12月31日となる。もし当社が2021年2月15日以降に債務融資(“条件付き債務融資”)を開始すれば、2021年手形は自動的に本票に変換され、その形式と条項は条件付き債務融資で発行された手形と同じであり、元本金額は2021年手形項の当時の未償還元金と未払い利息(“手形義務”)に等しい。当社が2021年2月15日以降に最低500,000ドルの株式融資(“合資格株式融資”)を完了した後、2021年に債券は自動的に合資格株式融資(“次の証券”)で販売される株式証券に変換され、その価格と条項はどの投資家がこの等合資格持分融資で受け取ったものと同じである。この等転換時に発行される後続ラウンド証券の数 は、以下に得られる商数に等しくなければならない:(I)当該等適格株式融資完了時の未償還手形債務の金額を、その後の各証券が適格株式融資で販売される最低価格 (“転換価格”)で割ることに等しい。適格持分融資前のいつでも制御権変更が発生した場合、その制御権変更終了時に手形債務を返済していない金額に相当する金額は、制御権変更終了時に同時に自動的に変換され、価格は1株当たり3.25ドルとなる。当社は2021年債券の埋め込み特徴を分析し、2021年債券には(I)資格に適合する債務融資時に自動転換して分割する必要がないこと、(Ii)資格に適合する株式融資時に 1株3.25ドルの固定価格を自動的に転換して分割する必要がないこと、(Iii)制御権変更時に1株3.25ドルの固定価格で自動転換して分割する必要がないこと、および(Iv)違約時の償還 機能を分割する必要がないことを確定した。
2022年1月に、当社及びその交換可能手形所持者は、手形及び2021年手形の満期日を2022年12月31日に延長することに同意した。これらの拡張は、これらの用語が本質的に異なるものではないので、修正に限定される。したがって,拡張説明 は元の説明と2021年の説明の継続とみなされる.
Br社は総収益の8%に相当する現金費用を支払う必要があり、金額は配給エージェントが最初に決定した範囲 であり、債券融資の任意の投資家を会社にもたらす必要がある。手形融資に関しては、前身は合計228,236ドルの配給エージェントおよび法的費用が発生し、これらの費用は債務割引として記録され、実際の利子法に従って手形期限内に償却される。
2022年12月13日から2022年12月31日までの間、相続人は手形に関する債務割引0ドルを記録しました。 次の自動転換を参照してください。
前身は、2022年12月12日と2021年12月31日までの間に、前身がそれぞれ手形に関する営業報告書に債務割引償却を利息支出 709,608ドルと317,833ドルとした。
| F-17 |
自動 変換
2022年7月8日、追加の前身Aシリーズ優先株融資(これにより合格株式融資{br)、累計毛収入は500,000ドルを超えた)、2021年手形は5,230,000ドル元金と428,888ドルの利息から構成され、自動的に前身Aシリーズ優先株1,802,193株に変換され、有効転換価格は1株前身Aシリーズ優先株3.14ドルに転換された。より多くの詳細は付記11--株主永久と仮株式--前身Aシリーズ優先株融資である。元の条項に従って転換された2021年債券と2021年債券には株式決済償還機能が含まれていないため、自動転換は転換会計によって計算され、その中で2021年債券の元本と課税利息の帳簿価値がキャンセルされ、これらの総額 は普通株(額面)と追加の実収資本に割り当てられる。
2022年12月12日、当社は、上場企業との逆合併の法的定義に適合する業務合併(付記4-業務合併を参照)を完了した(会計目的であるにもかかわらず、順方向合併である)。したがって,この業務組合せは合格発売の定義に適合しているため,3,961,000ドルの手形元金,709,608ドルの関連課税利息 および1,167,601ドルの派生負債は自動的に2,940,537株の前身普通株に変換され,続いて583,831株が普通株に続く.自動株式交換は、手形元条項に含まれる株式決済償還機能 による株式交換価格は1.58835ドル(業務合併交換比率5.037センチで定められた前身普通株1株当たり公正価値1.98542ドルの80%)である。株式決済償還特徴による変換可能手形の自動変換 は清算に計上されるが、この自動変換 は、償還特徴(派生負債)が業務合併の日(詳細は付記8-派生負債)において手形元金、課税利息、および派生負債の帳簿価値終了確認の前に市場に計上され(付記8-派生負債参照)、これらの総額は普通株(額面)および追加実収資本に割り当てられるため、清算損失の確認を招くことはない。
付記 8--派生負債
2021年1月1日現在、当社は3級派生負債を持っており、発行時の公正価値によって計量され、債券の償還機能と承認オプションと関係がある。詳細については、付記7-変換可能な支払手形を参照されたい。償還機能は,割引キャッシュフローとBlack−Scholes推定技術を組み合わせて推定した。
2022年12月12日、業務合併完了時(付記4-業務合併参照)、手形は自動的に を2,940,537株の前身普通株に変換し、転換価格は1.58835ドル(業務合併時に当社の株主に支払うべき普通株式1株当たり1.98542ドルの公正価値の80%)、公正価値対価格は5,838,209ドルであった。自動 変換の損益表の影響は,派生負債の公正価値変動186,401ドルを確認し,補償収益や損失がないことである.
以下の表は、公正価値によって恒常的に計量される第3級派生負債の公正価値変動について概説する
第三級派生負債公正価値変動表
| 2021年1月1日現在の期初残高 | $ | 788,700 | ||
| 派生負債の公正価値変動 | (228,100 | ) | ||
| 2021年12月31日までの期末残高 | $ | 560,600 | ||
| 派生負債の公正価値変動 | 607,001 | |||
| 債券転換後株に再分類する | (1,167,601 | ) | ||
| 2022年12月12日期末残高 | $ | - |
| F-18 |
2022年12月31日現在、デリバティブ負債はない。派生負債推定値については,2021年12月31日現在,割引キャッシュフローで使用されている重大未観察投入25%の割引率,合格発売が発生する可能性 85%,制御権変更が発生する可能性0%である。2021年12月31日までの推定値について、ブラック·スコアーズは以下のように仮定する
派生負債公正価値仮定明細書
| 2021年12月31日 | ||||
| 普通株式発行日の公正価値 | $ | 3.25 | ||
| 無リスク金利 | 0.06% - 0.19 | % | ||
| 所期期間(年) | 0.00 - 0.50 | |||
| 予想変動率 | 75 | % | ||
| 配当を期待する | 0.00 | % | ||
付記 9--所得税
この会社はアメリカ連邦と州所得税を支払う必要があります。
所得税準備金には、以下の(福祉)準備金が含まれます
所得税引当表
| 後継者 | 前身 | |||||||||||
| その期間内に | その期間内に | |||||||||||
| 十二月十三日から | 1月1日 から | この1年の は終了しました | ||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 繰延税の割引: | ||||||||||||
| 連邦制 | $ | (151,625 | ) | $ | (2,191,344 | ) | $ | (1,480,472 | ) | |||
| 状態.状態 | (34,844 | ) | (482,283 | ) | (763,612 | ) | ||||||
| 繰延税の割引 | (186,469 | ) | (2,673,627 | ) | (2,244,084 | ) | ||||||
| 評価免除額を変更する | (558,581 | ) | 2,673,627 | 2,244,084 | ||||||||
| 所得税支給 | $ | (745,050 | ) | $ | - | $ | - | |||||
所得税準備金と連邦法定税率との違いは以下のとおりである
所得税計上明細書は連邦法定税率とは異なる
| 後継者 | 前身 | |||||||||||
| その期間内に | その期間内に | |||||||||||
12月 13 通り抜ける | 1月 1 通り抜ける | 本年度の 一段落した | ||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 連邦法定金利 | 21.0 | % | 21.0 | % | 21.0 | % | ||||||
| 連邦福祉を差し引いた州税率 | 3.6 | % | 3.6 | % | 3.7 | % | ||||||
| 永久品 | (1.9 | %) | (5.4 | %) | (0.9 | %) | ||||||
| 差し引くことのできない基礎差 | 0.0 | % | 0.0 | % | 0.1 | % | ||||||
| 国の金利変化の影響 | 0.0 | % | (0.1 | %) | 3.9 | % | ||||||
| 前期調整数とその他 | 0.0 | % | (0.1 | %) | 0.0 | % | ||||||
| 評価免除額を変更する | 68.1 | % | (19.0 | %) | (27.8 | %) | ||||||
| 有効所得税率 | 90.8 | % | (0.0 | %) | 0.0 | % | ||||||
| F-19 |
繰延税金資産と負債は、
繰延税金貸借対照表
| 後継者 | 前身 | |||||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||||
| 純営業損失が繰り越す | $ | 6,671,907 | $ | 6,639,882 | $ | 4,930,055 | ||||||
| 株に基づく報酬費用 | 2,936,945 | 4,084,595 | 3,220,799 | |||||||||
| 資本化研究開発コスト | 2,421,390 | 2,362,939 | 2,199,126 | |||||||||
| 資本化起動コスト | 1,121,802 | 565,530 | 620,016 | |||||||||
| 資本化許可コスト | 687,926 | 689,820 | 735,485 | |||||||||
| 派生負債 | - | - | 6,388 | |||||||||
| 大文字特許 | 288,123 | 273,682 | 235,065 | |||||||||
| 株式承認証 | 133,203 | 238,768 | 239,307 | |||||||||
| 賃金総額を計算すべきである | 71,830 | - | - | |||||||||
| 寄付金が繰り越す | 2,833 | 2,833 | 2,840 | |||||||||
| 賃貸負債 | 26,794 | - | - | |||||||||
| 賃料を繰延する | - | - | 4,176 | |||||||||
| 繰延税金資産 | 14,362,753 | 14,858,049 | 12,193,257 | |||||||||
| 推定免税額 | - | (14,853,648 | ) | (12,180,021 | ) | |||||||
| 繰延税金資産 | 14,362,753 | 4,401 | 13,236 | |||||||||
| 債務を繰延する | - | - | (6,388 | ) | ||||||||
| 使用権資産 | (24,236 | ) | - | - | ||||||||
| 現在行われている研究と開発 | (24,658,231 | ) | - | - | ||||||||
| 固定資産 | (4,270 | ) | (4,401 | ) | (6,848 | ) | ||||||
| 繰延税金負債 | (24,686,737 | ) | (4,401 | ) | (13,236 | ) | ||||||
| 税金資産を繰延し,純額 | $ | (10,323,984 | ) | $ | - | $ | - | |||||
2022年12月31日には、後継者が繰り越した連邦純営業損失は約27,515,427ドル、州純営業損失は約20,567,703ドルであり、2022年12月12日と2021年12月31日には、後継者の連邦純営業損失は約27,385,445ドルと20,446,200ドルに転換し、州純営業損失の繰越は約20,458,902ドルと14,644,000ドルであり、未来の連邦と州課税収入を相殺することができる。このようなNOL繰り越しは期限が切れない。しかし、所有権変更のため、それらが将来の課税所得額を相殺するために使用されることは、国税法第382条および同様の州法規によって制限される可能性がある。
会社は繰延税金資産の現金化の可能性を評価し、繰延税金負債の予定沖販売、将来の課税所得額の予想、税務計画戦略を含むすべての利用可能なプラスと負の証拠を考慮した。“繰延税金資産の全部または一部が現金化されない可能性が高い”場合は、会計評価値を準備する。brは2022年12月12日と2021年12月31日までに審査を行った後、管理層は前述の繰延税金資産の将来の顕在化に不確定性があると考えているため、このなどの日に全額評価準備を設定している。そのため、前任者は2022年1月1日から2022年12月12日までの期間と2021年12月31日終了年度の税務準備金に関する推定免税額をそれぞれ2 673 627ドルと2 244 084ドル増加させた。
2022年12月12日の業務合併と新たな繰延税金負債の出現により(A)買収会計の一部として、前身 はその14,853,648ドルの推定準備を公表した。その後、新親会社は所得税優遇として558,581ドルの推定免税額を支給し、業務合併と分離した。
| F-20 |
経営陣は評価し、2022年12月31日と2021年12月31日現在、会社財務報告書に確認すべき重大な不確定税務状況はないと結論した。当社はその未確認の税務割引は報告日から12ヶ月以内に大きな変化はないと予想しています。
2022年12月31日および2021年12月31日までの年度内に、税務審査を開始したり、税務審査を行っていることはなく、このなどの年度内に税務に関する利息や罰金は何も生じていない。当社の2019年12月31日までの年度開始の申告表はまだ審査が必要です。
付記 10--支払いの引受とまたは事項
訴訟、クレーム、評価
正常な業務過程において、会社は正常な業務過程で発生した法律手続き、クレームと評価に関連する可能性がある。 損失が発生する可能性があり、損失金額が合理的に推定可能であると評価された場合、会社は、そのようなクレームによって発生したまたはあるような負債を記録する。
ライセンス プロトコル
L 研究有限責任会社
2015年12月15日、当社はL法律事務所とライセンス契約を締結し、合意に記載されている条項及び条件に基づいて、LはZyVersaのいくつかの技術の独占許可を付与した。ライセンス契約の期限は,発効日から とし,合意条項に従って早期に終了しない限り,被許可者のすべての使用料支払い義務の最後の満了まで継続する.
ライセンス契約には、前払い現金200,000ドル(2015年に支払い、研究開発費として確認された)、マイルストーン現金支払い総額2,150万ドル(会社はマイルストーンを達成する可能性がある場合にマイルストーン現金支払いに関する支出を確認する;2020年に確認された1,500,000ドルの支出(うち500,000ドルは最初にbrに期限が切れ、2021年に支払うべきである)は、米国食品医薬品局(FDA)が新薬申請および2 a期臨床試験の開始に関連している。2,500,000ドルの次のマイルストーンは、FDAとの第2段階会議が積極的に終了したときに稼いだ(br})、製品が市場に進出したとき、印税は製品販売の5%~10%から様々である(販売が発生した場合、会社は印税費用 ;今までまだ確認されていない)及び前置承認株式証は、合計878,947株の前置承認株式証を購入することができ、行使価格は1株1.00ドルであり、付与日公正価値は766,384ドルであり、指定されたマイルストーンを実現した日から5年以内に行使することができる(前置認株式証で351,579株の前置普通株を購入する権利証は2015年発行時に行使することができるため、当社は2015年以内にその授与日公正価値306,411ドルを研究開発費と確認し、追加実収資本と対応する。関連する履行条件を達成する可能性がある場合、当社は残りの株式承認証に関する費用を確認し、FDAの定義によると、FDAが化合物や製品の研究新薬申請を受けた後、2020年1月に175,789株の前任普通株を購入する前任引受権証を行使することができ、当時会社が確認した費用は授権日公正価値153,324ドルに等しい;2022年12月31日現在、351,578株の前任普通株を購入した前任引受権証 は行使されておらず、マイルストーンが実現されていないため)。上記の未支出または支払いの対価格については、当社は関連項目が実現可能で価値が評価可能な場合に関連支出を確認します。
2020年1月9日、(I)第1段階臨床試験の成功に関連する1,000,000ドルのマイルストーン現金支払いの支払時間(2 a段階臨床試験開始時に500,000ドル(“1/2段階マイルストーン”)を部分的に延長し、1/2段階マイルストーン開始1周年(“1周年マイルストーン”)に500,000ドルを支払う改正が規定されている。および(Ii)Lが第1段階/第2段階マイルストーンを完了したときにその株式承認証を行使する条件では、351,579ドルの行権価格は、Lに支払われた第2段階マイルストーンに関連する現金支払いには計上されない。L及びLが株式承認証を行使する際に締結した本票プロトコル及び付注11-株主持分引受オプションのさらなる詳細については、付記4-応収手形 を参照して、当社とLがL手形協定について締結した引受オプション契約を検討する。
| F-21 |
2022年3月7日、当社はL社と放棄協定に調印し、L社が2022年8月31日までに150万ドルの記念碑的支払いを支払わなかったため、許可協定または他の救済措置を終了する権利を放棄した。許可協定の他のすべての条項はまだ有効だ。
2022年8月26日、当社はL法律事務所と放棄協定に署名し、L法律事務所が2023年1月3日までに150万ドルのマイルストーン支払いを支払わなかったため、許可協定または他の何らかの救済措置を終了する権利を放棄した。許可協定の他のすべての条項はまだ有効だ。
2022年12月23日、当社はL法律事務所と放棄協定に署名し、L法律事務所が2023年3月31日までに150万ドルのマイルストーン支払いを支払わなかったため、許可協定または他の救済措置を終了する権利を放棄した。許可協定の他のすべての条項はまだ有効だ。
L&Fライセンスプロトコルの詳細については, 付記13-後続アクティビティを参照されたい.
InflamaCORE
InflamaCOREは2019年4月18日にInflamaCORE,LLC(“InflamaCORE”)とライセンス契約を締結し,これにより,InflamaCOREはその前身にInflamaCORE計画技術の独占許可を付与することに同意した。ライセンス契約の期限は,発効日から とし,合意条項に従って早期に終了しない限り,被許可者のすべての使用料支払い義務の最後の満了まで継続する.本ライセンス契約と同時に、InflamaCOREはマイアミ大学と協定を締結し、InflamaCORE科学者が開発したすべての知的財産権と技術をInflamaCORE傘下に統合し、これらの科学者はすべてマイアミ大学の従業員である。本協定の有効期間は、発効日から発効し、(A)特許権の範囲内のすべての発行された特許及び出願された特許出願が失効したか、又は放棄され、使用料が満了していない日、又は(B)20(20)年まで、合意条項に従って早期に終了しない限り有効である。この2つの協定に署名した了解は、ZyVersaがライセンス契約に基づいて知的財産権と技術をさらに開発することだ。
ライセンスの対価格として、前任者は、マイアミ大学への特許返済費用を支払うために、346,321ドルの前金をInflamaCOREに支払うことに同意した。InflamaCOREはまた,6つの記念碑的な支払いを得る権利があり,合計22,500,000ドル(最初の200,000ドルの記念碑的支払いは,治療許可製品の最初の適応の研究新薬申請の提出によるものである)。ZyVersaは、プロトコルで定義されている(A)最後の満了特許または(B)法規排他的満了の最新 の満了時に満了する5%~10%の販売特許使用料をInflamaCOREに支払う必要がある。ZyVersa はマイアミ大学に3%から6%の販売印税を支払う必要があります。最後に、InflamaCOREは合計1,000,000株前普通株の5年前置権証を獲得し、その中で、前置株式証は400,000株前普通株を購入し、発行日の公正価値は815,822ドルであり、研究開発費用と記入し、 は協議実行時に1株2.30ドルの行使価格で発行し、残りの前置株式権証は60万株前普通株を購入し、あるマイルストーンを満たした後、発行時の前置普通株公正価値に相当する1株価格で発行する。当社が初公開株式(“IPO”)を完了しない限り、前身普通株または他の株式証券の初公開株式と定義するすべての引受権証 を発行する。もし会社が満期日直前の3年以内に初公募株を完成させれば、満期日は会社初公募株発効日の3周年まで自動的に延長される。同社はこの業務合併が初公募株の定義に適合していないと認定した。協定によると、マイアミ大学はまた200,000株の前身 普通株を受け取り、付与日公正価値は460,000ドルであり、研究開発費と表記されている。 2022年12月31日現在、後継者はいかなる特許使用料も支払われていないし、現金支払いと発行相続者承認株式証に関する業績マイルストーンは実現されておらず、会社は何の支払いも生じておらず、ライセンス契約に関する残りの継承者権証 も発行されていない。
| F-22 |
運営 借約
前任者は2019年1月18日、フロリダ州ウェストンにある約3,500平方フィートのオフィススペースの賃貸契約を締結し、レンタル期間は5年となった。賃貸契約によると、初年度の年間基本賃貸料(前任者が負担すべき税額や運営コストを除く)は約89,000ドルで、その後毎年約3%上昇し、総基本賃貸料は約497,000ドルである。
後継者は2022年12月13日から2022年12月31日までの賃貸料支出が7,795ドルであることを確認し,後継者は2022年12月12日と2021年12月31日までの賃貸料支出がそれぞれ148,881ドル,148,125ドルであることを確認した。
新リース会計基準の採用および使用権資産と経営リース負債の確認に関する情報は、付記3-重要会計政策概要−最近採択された会計公告 を参照されたい。
会社の使用権資産と負債の概要は以下の通りです
貸借対照明細書
| 財務指定、前任者、後継者[固定名簿] | 後継者 | 前身 | ||||||
| 2022年12月31日 | 2022年12月12日 | |||||||
| 賃貸負債に含まれる金額を計量するために支払う現金: | ||||||||
| 経営活動に使われているキャッシュフロー | $ | 4,786 | $ | 86,100 | ||||
| レンタル義務と引き換えに使用する資産 | ||||||||
| 運営 借約 | $ | - | $ | - | ||||
| 重み 平均残余レンタル期間 | ||||||||
| 運営 借約 | 1.08年 | 1.08年 | ||||||
| 重み 平均割引率 | ||||||||
| 運営 借約 | 6.5 | % | 6.5 | % | ||||
これらの運営リース契約によると、将来の最低支払いは以下の通りです
レンタル項目の下で将来最低支払明細書
| 金額 | ||||
| 将来の最低返済額 | $ | 112,916 | ||
| 差し引く:推定利息を表す金額 | (4,160 | ) | ||
| 合計する | $ | 108,756 | ||
付記[br]11-株主の永久及び仮持分
ライセンス資本
前身は75,000,000株の前身普通株、1株当たり額面0.00001ドル、および5,000,000株前身優先株の発行を許可され、1株当たり額面0.00001ドル。前任普通株の保有者は1株1票を保有する権利がある。
相続人は、相続人普通株110,000,000株、1株当たり額面0.0001ドル、および1,000,000株相続人優先株の発行を許可され、1株当たり額面0.0001ドル。相続人普通株の保有者は1株当たり1票を投じる権利がある。
| F-23 |
持分インセンティブ計画
前身 2014持分インセンティブ計画
前身は、2018年10月9日、2019年2月2日、2021年2月2日に改訂される予定の2014年株式インセンティブ計画(“2014計画”)に基づいて奨励金を発行することを許可された。2014年計画によると、2021年12月31日から、自社10,000,000株の前身普通株 の発行を許可する。2014年計画で発行可能な普通株式数は、2014計画期間内に2019年からの例年1月の第1取引日に自動的に増加し、増加した金額は前年12月の最終取引日に発行された普通株式総数の5%(5%)に相当するが、いずれの場合も、このような年間増加は10万株の普通株を超えてはならない。2014年には、当社及びその関連会社の従業員、取締役及びコンサルタントに奨励的株式オプション、非法定株式オプション、普通株購入権、株式付加権、制限株式及び制限株式単位を発行する予定である。2014年には株式オプションの発行権価格が付与日会社普通株の公正価値を下回らないようにする計画だ。2022年12月31日現在、2014年計画によると、将来発行可能な前身株は45,652株。
2022年12月12日、企業合併の完了に伴い、前身は2014年計画改正案(“2014計画改正案”)を承認した。“2014年計画修正案”は、業務合併を完了した後、2014年計画の下で保留と発行可能な普通株式の株式をさらに増加させてはならず、2014年計画の下で新たな奨励を付与してはならないと規定している。
後継者 2022総合持分インセンティブ計画
後継者は“2022年総合持分インセンティブ計画”(“2022年計画”)に基づいて奨励を授与する権利がある。2022年計画によると、2022年12月12日から、後継者1,089,831株の後継者普通株の発行を許可する。2022年計画で発行可能な普通株式数は、2022年計画期間内の各例年1月1日の最初の取引日(2023年例年から)に自動的に増加し、増加した金額は前の例年12月の最終取引日の発行済み普通株式総数の4%(4%)に相当する。2022年計画では、当社及びその関連会社の従業員、取締役及びコンサルタントに奨励的株式オプション、非法定株式オプション、普通株購入権、株式付加価値権、制限株式及び制限株式単位を発行することを規定する。2022年計画では、株式オプションの発行権価格が付与日会社普通株の公正価値を下回らないことが要求される。2022年12月31日現在、2022年計画によると、将来発行可能な後続株は1,089,831株。
普通株式を償還できる
2020年12月13日(“発効日”)、L手形協定(詳細は5-受取手形 )について、前身はLと合意し、Lに引受オプションを提供し、当社が1株1.00ドルの価格で最大331,331株の前身普通株(“承認オプション”)を購入できるようにした。 承認オプション権は(A)L手形が全額返済された日に満了する。または(B)発効日5(5)周年。L社が権力を行使する場合、当社はL社手形協定に基づいて、L社に引受株式を支払う代わりに、L社が当時当社に借りていた未収金を減少させることに同意した。引受オプション は331ドルの総代価でL基金に販売し、追加実収資本に記入する。
2022年12月12日、当社は業務合併(付記4-業務合併参照)を終了し、この合併により、331,331株が承認オプション制約を受けた前身普通株を1株5.04ドルで65,783株を普通株に交換した。見下げオプションは普通株の対象株を償還可能にする実際の効果がある。したがって、それらは後継者と前任貸借対照表の両方で一時的な株式に分類される。
| F-24 |
L債券およびコールオプションの詳細については、 付記13-後続イベントを参照されたい。
前身 Aシリーズ優先株
前身 Aシリーズ優先株融資s
2022年3月31日、前身は1株3.14ドルで投資家に133,541株Aシリーズ優先株を売却し、純収益は392,301ドルで、そのうち10万ドルは関連側から来た。
保有者の選択により、前身Aシリーズ優先株はいつでも1対1で前身普通株の株式 に変換することができるが、標準的な逆希釈調整が必要である。また、当社が有効株式交換価格を下回る方式で任意の非免除発行を行うと、前身Aシリーズ優先株交換価格は加重 平均価格で引き下げられます。前身A系列優先株の1株当たりは当時有効な転換価格で前身A系列優先株の普通株に自動的に転換しなければならないとともに、(I)公開取引終了又は(Ii)前身A系列優先株が当時発行されていた大部分の株式の保有者が書面で同意又は同意した日。公開 取引は、(A)公開発行の決定承諾を引受すること、または(B)ナスダックに上場する特殊目的買収会社(“SPAC”)との取引が完了し、この取引では、当社がSPACの完全子会社となる。
前身A系列優先株株主は前身普通株株主とともに換算後の基準で投票し, 配当は前置普通株株主に支払う際にのみ換算後の基準で支払うべきである.いずれかの清算、前身会社の解散または清算が発生した場合、または清算事件とみなされる場合、前身Aシリーズ優先株株主は、前の普通株株主が任意の金を支払う権利がある前に、前身会社が割り当て可能な資産から を取得して支払いを受けることができ、元の購入価格の倍であり、前身会社A系列優先株が1株当たり発表および未払いの配当金 株を追加し、またはそれ以上の場合、前身会社Aシリーズ優先株保有者が変換後に受け取った金額である。任意の収益の残高は前任普通株株主に比例して割り当てられなければならない。清算イベントとみなされることは、(A)前身またはその子会社が支配権変更をもたらす参加者(“合併 事件”)である合併または合併、または(B)前身のすべてまたはほぼすべての資産を売却、レンタル、譲渡、独占許可、または他の方法で処分することを含む(“処分事件”)。
前身A系列優先株は強制償還できないため、負債に分類すべきではない。 前身は清算事件が前身制御範囲内であるとみなされることが決定されているため、前身A系列優先株は永久持分に分類されるべきである。具体的には,州法により,合併事件や処分事件は取締役会の承認を得る必要があるが,前任優先株主は取締役会の投票 を制御できない.埋め込まれた変換オプションは優先株宿主と明確に密接に関連していることが確認されているため,埋め込まれた変換オプションは2つに分類される必要はない.しかし、その後の証券発行で転換価格を再設定すると、前任者は価格再設定の会計処理を評価する必要がある。前身は2021年1月1日にASU 2020-06を採用しているため、有益な変換 機能を実現するために埋め込み変換オプションを評価する必要はない。
2022年7月8日、前身は1株3.14ドルで投資家に94,393株の前身Aシリーズ優先株を売却し、296,400ドルの毛収入を生み出した。21,200ドルの配給代理費は、追加実収資本の減少として記録されている。
2022年9月16日、前身は1株3.14ドルで投資家に222,929株の前身Aシリーズ優先株を追加売却し、700,000ドルの毛収入を生み出した。配給代理費16,000ドルは追加実収資本の減少として記録されている。
2022年12月6日、前身は1株3.14ドルで投資家に174,776株の前身Aシリーズ優先株を売却し、548,805ドルの毛収入を生み出した。2,000ドルの配給代理費は、追加実収資本の減少として記録されている。
| F-25 |
前身系列A優先株名を改正する
2022年5月10日、前身は必要な承認を得て、(A)前身会社登録証明書中の前身Aシリーズ優先株名を修正し、前身Aシリーズ優先株の有効転換価格 を前身普通株1株3.14ドルから前身普通株1株2.78ドルに引き下げ、(B)100%の引受権証カバー面を増加させ、 のように、転換時に発行された前身普通株1株当たり、保有者も前身普通株を購入するために前身株式権証を取得する。これらの前置承認株式証は、1株当たり3.20ドルの初期行権価格で行使することができ(発行価格が現在の行権価格より低いとみなされる場合、公開取引完了時に減持することができる)、5年後に満了する(“前置Aシリーズ株式承認証”)、または公開取引定義に適合しないより早い制御権変更時 である。前身決定(A)前身A系列権証 は,発行時に株式に分類される資格があり,その後の再計測を必要とせず,(B)前身A系列権証や発行性質が前身を変えないという結論,すなわち埋め込まれた変換オプションは優先株宿主と明確に に関連しているため,埋め込まれた変換オプションは分離される必要はない.前身会社は前身A系列優先株転換価格を下げ,転換時に100%の権証カバー率を増加させることに加えて, は前身A系列優先株条項を代表して代償会計の大きな変化を適用する必要があると認定した。したがって,1株当たり損失を計算する際には,改訂された前身A系列優先株および新前身A系列株式承認証の331,200ドル増量公正価値(A系列優先株の帳簿価値と比較)を配当として記録して1株当たり損失 を計算する必要がある。
第二次改正前身系列A優先株名
2022年8月31日、前身会社登録証明書における前身Aシリーズ優先株名の第2回改正をフロリダ州国務省に提出し、前身Aシリーズ優先株の転換価格を前身普通株と前身Aシリーズ株式承認証から1株1.19ドルに低下させた。また、前身は転換時に発行可能な前身Aシリーズ権証の発行権価格を1株3.20ドルから1株1.37ドルに引き下げた。
前身は前身Aシリーズ優先株転換価格の引き下げを決定し、転換時に発行可能な前身Aシリーズ株式承認証(総称して“第二改訂証券”と呼ぶ)に関する改訂条項 、 は代償会計を適用する必要がある重大な変化を代表する。そのため、1株当たりの損失を計算するためには、改訂された前身Aシリーズ優先株及び改訂された前身Aシリーズ株式承認証の9,684,637ドル増量公正価値(Aシリーズ優先株の帳簿価値及び前身Aシリーズ株式承認証の第2回改訂前の公正価値と比較)を配当として記録し、1株当たり損失を計算する必要がある。
前身Aシリーズ優先株の撲滅
当社は、Aシリーズ優先株転換価格を下げ、Aシリーズ株式承認証の発行やAシリーズ優先株の変更(総称して“改訂証券”と呼ぶ)を加えたり、発行したりすることは、代償会計を適用する必要がある重大な変化であると考えている。したがって,1株当たりの損失を計算するためには,改訂された証券の331,200ドルの増分価値(従来のA系列優先株の価値と比較して)を配当 と記録する必要がある。
| F-26 |
前身系列A優先株を自動 変換する
2022年12月12日、業務合併と関係があり、すべての発行された2,427,832株の前身Aシリーズ優先株 は自動的に6,406,210株前普通株と5年期前A承認株式証に変換して、6,406,210株前普通株を購入し、その後1,271,904株で普通株と に続いて1,271,904株を購入して普通株の5年権証に続いて交換し、行使価格は1株6.90ドルである。優先株の元条項によって転換された権益を優先株に分類し、優先株の帳簿価値の確認を終了し、損益を確認することなく、その金額を普通株(額面)と追加の実収資本に割り当てる。
後継者 優先株
後継者Aシリーズ優先株融資
業務合併では、相続人 は1株11.50ドルの行使価格であるバイヤーに8,635株Aシリーズ優先株と5年期承認株式証を売却し、863,500株後続普通株(“管路株式承認証”)を購入し、純収益は8,635,000ドル(“パイプ”融資)である。
所有者の選択により、後続Aシリーズ優先株は随時いくつかの後続普通株に変換することができ、額面をその時に発効した転換価格で割ることに等しい(最初は10.00ドル)。また、後続Aシリーズ優先株発行後5年以内に、変換価格は、(A)2.00ドル、および(B)変換価格を下回る任意の後続証券発行の最低価格のうちの1つに自動的に調整される。
A系列優先株登録が発効した後も、 変換価格は、(A)2.00ドルと、(B)開始日毎(開始日を含む)から開始され、含まれる連続する10個の1日当たり出来高加重平均価格の85%の大きいものを基準として、それぞれ90日と150日(“開始日”)にリセットされる。出願日まで、後続系列A優先株は登録されておらず、転換価格リセットは行われていない。
| F-27 |
後任A系列優先株株主には投票権がなく、後任の普通株株主に配当金を支払う場合にのみ、配当金は換算後の基礎で支払われます。相続人が清算、解散、または清算を発生した場合、各Aシリーズ優先株式相続人は、合法的に分配可能な会社の資産、その保有株式の宣言価値、および任意の計算すべきおよび支払われていない配当金からbr}支払いを得る権利がある。いかなる収益の残高も換算した上で後続のA系列優先株株主に分配しなければならないPari 通行証後継者の普通株主がいます。
後継者A系列優先株は所有者選択時にbrを償還できないため,永久持分に分類される.しかし、所有者がbrを選択して変換する権利がある場合、会社はいつでも額面の120%で後続のAシリーズ優先株を償還する権利がある。後継者 は,埋め込みの変換オプションが優先株ホストと明らかに密接に関連していることを決定するため,埋め込まれた 変換オプションを2つに分割する必要はない.しかしながら、その後の証券発行により変換価格がリセットされた場合、当社では、価格リセットを評価する会計処理が必要となる。後継者は2021年1月1日にASU 2020−06を採用しているため、有益な変換機能を実現するために埋め込み変換オプションを評価する必要はない。
後継者 はBシリーズ債券を優先的に発行する
業務合併では、相続人は、5,062,000ドルの会社債務と引き換えに、1株1,000ドルで当社にサービスを提供するあるサプライヤーに5,062株Bシリーズ優先株を発行した。
後続Bシリーズ優先株は、所有者の選択に応じて、任意の時間にいくつかの後続普通株 に変換することができ、額面をその時点で発効した転換価格で割ることに等しい(最初は10.00ドル)。また、後続Bシリーズ優先株発行後の5年間、転換価格は自動的に(A)7.00ドルと(B)任意の後続証券発行の最低価格に調整され、価格は転換価格を下回る。
後続のB系列優先株登録が発効してから150日以内に、変換価格も(A)7.00ドルにリセットされ、(B)連続する5つの取引量加重平均価格の最低者は、開始日(開始日を含む)から開始される。出願日まで、後続B系列優先株は登録されておらず、転換価格リセットは行われていない。
後継者B系列優先株株主には投票権がなく、後継者普通株株主に配当金を支払う場合にのみ、配当金は換算後の基礎で支払われる。相続人に清算、解散、または清算が発生した場合、各相続人B系列優先株株主は、会社が合法的に分配可能な資産、その保有株式の所定の価値、および任意の計算すべきおよび支払われていない配当金から支払う権利がある。 任意の収益の残高は、換算後の基礎で相続人B系列優先株株主に分配されなければならない平価通行証 と後継者普通株株主。
後継者B系列優先株は を償還できないため,永久持分に分類される.後継者が埋め込みを決定する変換オプションは優先株宿主と明確に密接に関連しているため,埋め込まれた変換オプションは2つに分割される必要はない.しかし,その後の証券発行で変換価格 がリセットされた場合,後継者はリセット価格を評価する会計処理が必要となる.後継者は2021年1月1日にASU 2020−06を採用しているため、有利な変換機能を得るために埋め込み変換 オプションを評価する必要はない。
| F-28 |
株に基づく報酬
2022年12月13日から2022年12月31日までの間に、後継者が記録した株式報酬支出は56,333ドル(うち、7,808ドルは研究開発に含まれ、48,525ドルは一般および行政費用に含まれる)であり、従業員やコンサルタントに支給されるオプションbrに関連している。2022年12月12日までの間、前任者が記録した株式ベースの報酬支出は3,524,802ドル(うち、673,160ドルは研究開発に含まれ、2,851,642ドルは一般および行政費用に含まれる)であり、従業員およびコンサルタントに支給されるオプションに関連している。2022年12月31日現在,2,957,047ドルの未確認株式報酬 費用があり,会社は1.6年間の加重平均期間内に確認する予定である。
2021年12月31日までの年間で、会社は4,245,463ドルの株式給与支出(うち944,525ドルは研究開発に含まれ、3,300,938ドルは一般および行政費用に含まれる)を記録し、従業員やコンサルタントに支給されたオプションに関連している。
株 オプション
当社は2022年12月12日に業務合併(付記4-業務合併参照)を完了し、10,039,348件の未償還 前置オプションを1,993,235件の未返済の後継オプションに交換した。前身 オプション所有者に発行される後継オプション数は,発行可能な前置普通株式数を5.037の交換比率で割ることで決定される.前置オプションごとの実行権価格にも交換比率が乗じられている。
ブラック·スコアーズオプション定価モデルを付与された前身株式オプションに適用する際、同社は以下の仮定を用いた
付与された株式オプションスケジュール
| 後継者 | 前身 | |||||||||
| その期間内に | その期間内に | この1年の | ||||||||
| 十二月十三日から | 一月一日から | 一段落した | ||||||||
| 2022年12月31日 | 2022年12月12日 | 2021年12月31日 | ||||||||
| 日普通株の公正価値を付与する | 適用されない | $2.27 - $3.00 | $ | 3.25 | ||||||
| 無リスク金利 | 適用されない | 1.68% - 3.01 | % | 0.66% - 1.26 | % | |||||
| 所期期間(年) | 適用されない | 3.53 - 6.00 | 5.00 - 6.00 | |||||||
| 予想変動率 | 適用されない | 111% - 119 | % | 118% - 125 | % | |||||
| 配当を期待する | 適用されない | 0.00 | % | 0.00 | % | |||||
前身普通株の公正価値は,2022年12月12日までの間に,業務合併協定が推定日ごとに買収側と公平に検討した状況と,最終的に2022年7月20日に締結され,会社推定値は8500万ドルであり,市場法を用いて決定された。2022年12月12日までの期間内に付与されるオプションの契約期間は7年から10年であり、必要なサービス期間はゼロ~3年である
前任普通株の公正価値は、2021年12月31日までの年度内に、経営陣が第三者評価専門家の協力を得て収益法を用いて決定される。2021年12月31日までの年度内に付与されるオプションの契約期間は10年であり,必要なサービス期間はゼロから3年である。
| F-29 |
後任者の2022年12月13日から2022年12月31日までの期間および前任者の2022年12月12日までの期間のオプション活動の概要は以下のとおりである
株式オプション活動スケジュール
| 後継者 | 量 オプション | 重みをつける 平均値 トレーニングをする 値段 | 重みをつける 平均値 残り 命 年単位で | 骨材 固有の 価値がある | ||||||||||||
| 未返済、2022年12月13日 | 1,993,235 | $ | 10.81 | |||||||||||||
| 授与する | - | - | ||||||||||||||
| 鍛えられた | - | - | ||||||||||||||
| 没収される | - | - | ||||||||||||||
| 未返済、2022年12月31日 | 1,993,235 | $ | 10.81 | 5.8 | $ | - | ||||||||||
| 行使可能、2022年12月31日 | 1,639,566 | $ | 9.63 | 5.3 | $ | - | ||||||||||
| 前身 | 量 オプション | 重みをつける 平均値 トレーニングをする 値段 | 重みをつける 平均値 残り 命 年単位で | 骨材 固有の 価値がある | ||||||||||||
| 未返済、2022年1月1日 | 8,755,179 | $ | 2.00 | |||||||||||||
| 授与する | 1,284,169 | 3.17 | ||||||||||||||
| 鍛えられた | - | - | ||||||||||||||
| 没収される | - | - | ||||||||||||||
| 未完成、2022年12月12日 | 10,039,348 | $ | 2.15 | 5.9 | $ | 3,271,992 | ||||||||||
| 行使可能、2022年12月12日 | 8,258,023 | $ | 1.91 | 5.3 | $ | 3,271,992 | ||||||||||
次の表に2022年12月31日までの株式オプションに関する情報を示す
株式オプションに関する情報付表
| 後継者 | ||||||||||||||
| 未完成オプション | 行使可能なオプション | |||||||||||||
| 卓越した | 加重平均 | 練習可能である | ||||||||||||
| トレーニングをする | 量 | 余生 | 量 | |||||||||||
| 値段 | オプション | 年単位で | オプション | |||||||||||
| $ | 5.03 | 662,887 | 3.1 | 662,887 | ||||||||||
| $ | 11.33 | 12,186 | 9.5 | 12,186 | ||||||||||
| $ | 11.58 | 728,430 | 6.3 | 723,576 | ||||||||||
| $ | 16.36 | 589,732 | 8.3 | 240,917 | ||||||||||
| 1,993,235 | 5.3 | 1,639,566 | ||||||||||||
| F-30 |
株式株式承認証
以下は、2022年12月13日から2022年12月31日までの後継者の権証活動および2022年12月12日現在の前任者権証活動の概要である
保証活動の概要
| 重みをつける | ||||||||||||||||
| 重みをつける | 平均値 | |||||||||||||||
| 平均値 | 残り | 骨材 | ||||||||||||||
| 量 | トレーニングをする | 命 | 固有の | |||||||||||||
| 後継者 | 株式承認証 | 値段 | 年単位で | 価値がある | ||||||||||||
| 未返済、2022年12月13日 | 8,628,706 | $ | 10.75 | |||||||||||||
| 発表されました | - | - | ||||||||||||||
| 未返済、2022年12月31日 | 8,628,706 | $ | 10.75 | 4.8 | $ | - | ||||||||||
| 行使可能、2022年12月31日 | 8,558,904 | $ | 10.79 | 4.8 | $ | - | ||||||||||
| 重みをつける | ||||||||||||||||
| 重みをつける | 平均値 | |||||||||||||||
| 平均値 | 残り | 骨材 | ||||||||||||||
| 量 | トレーニングをする | 命 | 固有の | |||||||||||||
| 前身 | 株式承認証 | 値段 | 年単位で | 価値がある | ||||||||||||
| 未返済、2022年1月1日 | 2,154,352 | $ | 1.98 | |||||||||||||
| 発表されました | 6,406,210 | 1.37 | ||||||||||||||
| 鍛えられた | - | - | ||||||||||||||
| 未完成、2022年12月12日 | 8,560,562 | $ | 1.52 | 1.8 | $ | 59,681 | ||||||||||
| 行使可能、2022年12月12日 | 8,560,562 | $ | 1.55 | 3.9 | $ | 34,203 | ||||||||||
次の表に2022年12月31日までの後継者の引受権証に関する情報を示す
株式承認証関連資料付表
| 後継者 | ||||||||||||||
| 未弁済持分証 | 行使可能な引受権証 | |||||||||||||
| トレーニングをする | 卓越した | 加重平均 | 行使可能な数 | |||||||||||
| 値段 | 量 | 余生 | 株式承認証 | |||||||||||
| $ | 5.03 | 104,704 | 2.0 | 34,901 | ||||||||||
| $ | 6.90 | 1,271,904 | 4.9 | 1,271,904 | ||||||||||
| $ | 11.50 | 6,929,073 | 4.9 | 6,929,073 | ||||||||||
| $ | 11.58 | 323,026 | 1.0 | 323,026 | ||||||||||
| 8,628,706 | 4.8 | 8,558,904 | ||||||||||||
2022年12月31日までの後続株式承認証には、以下の内容が含まれる
| (a) | 株式承認証を行使して6,065,573株の後続普通株を購入することができ、最初にLarkspurからLarkspurの業務前に初めて公開発行と私募の参加者に合併して発行する(“Larkspur承認株式証”)。その条項によると、Larkspur引受権証(I)の行使価格は1株当たり後続普通株11.50ドルであり、(Ii)業務合併の終了により、その満期日は2027年12月12日まで延長される。及び(Iii)自社が株式承認証所有者に償還通知日前の第三取引日に終了した任意の20取引日以内に、後続普通株の収市価が1株当たり18.00ドル以上である場合には、当社はLarkspur承認株式証1株当たり0.01ドルの価格で、少なくとも30日前に償還書面通知を出した場合には、当該普通株を償還することができる |
| F-31 |
| (b) | 株式承認証を行使して863,500株の後続普通株を購入することができ、LarkspurのPIPE融資参加者から を発行し、この融資は業務合併と同時に終了し、そしてこれを条件とする(付記11-株主永久と臨時持分-後続Aシリーズ優先株融資参照)。その条項によると、パイプ承認株式証 (I)の行使価格は1株当たり後続普通株11.50ドルである;(Ii)満期日は2027年12月12日である。 | |
| (c) | 株式承認証 はすでに発行された前置株式証 の代わりに1,699,633株後続普通株(“代替株式証”)を購入し、2022年12月12日に会社が業務合併を完了した時に8,560,561株前普通株 を購入する(付記4-業務合併参照)。後続株式承認証に基づいて発行可能な株式数は、前置株式証1部当たりに発行可能な株式を5.037の交換比率で割って によって決定される。後続権証の行権価格 の計算方法は,前置承認株式証ごとの行権価格に5.037の交換比率を乗じたものである | |
| 株式交換承認証は:(A)1,271,904株後続普通株を購入する実行可能な使用可能な権利証を含み、行使価格は1株6.90ドルであり、満期日は2027年12月12日であり、前身Aシリーズ優先株所有者の代わりに前身A系列優先株を前身Aシリーズ優先株と前身Aシリーズ株式承認証に自動変換した後に発行した権証(注11-株主 永久と仮持分-前身Aシリーズ優先株の自動変換参照)。(B)前身のbrが戦略パートナーに発行した権利証の代わりに104,704株の後続普通株の権利証を購入し、行使価格は1株当たり5.03ドルであり、その中で34,901株を購入した権利証は2025年1月6日頃まで行使でき、残りの部分はあるマイルストーンを実現した時にbrを付与し、これらのマイルストーンを実現した後5年以内に満期になる。および(C)行使可能な株式引受証は、323,026株の後続普通株を購入することができ、行使価格は1株当たり11.58ドルであり、締め切りは2024年4月17日であり、前任者が許可協定を締結したときに特定の変換可能な手形の購入者、特定のブローカーおよび戦略パートナーに発行された引受権証(付記10-コミットメント および-ライセンス契約-InflamaCOREを参照)である。 |
付記 12-関連先取引
2022年12月13日から2022年12月31日までの間,後継者は関連先取引を何もしていない.
前任者は、2022年12月12日と2021年12月31日までの間に、それぞれ会社の一部所有者である投資銀行家に0ドルと50,000ドルの議事費を支払った。
2022年12月12日と2021年12月12日までの間に、会社はそれぞれ会社管理チームメンバー、創業者、主要株主から0ドルと3,150,000ドルを獲得し、2021年債の購入に使用した。2021年手形のさらなる検討については,付記7−変換可能支払手形 を参照されたい。
付記 13-後続イベント
財務諸表が発表された日から、会社は後続事件を評価した。評価によると、当社は確認されたまたは確認されていない後続事項を財務諸表に調整または開示する必要はありませんが、以下の場合は除外します。
ライセンス プロトコル
当社は2023年2月28日にL法律事務所と改訂·再記述協定に署名し、(A)2023年3月31日まで(B)このようなマイルストーン支払いのうち1,000,000ドル(“免除A”)および(B)2024年1月31日に500,000ドルのマイルストーン支払い(“放棄(Br)B”)についてLが1,500,000ドルのマイルストーン支払いを支払うことができなかったため、Lが許可契約または任意の他の救済措置を終了する権利を放棄した。免除Aは、(I)当社の猶予元金総額351,579ドル、および(Ii)当社は2023年3月31日までにL法律事務所に648,421ドルの現金を支払うとしている。免除Bは状況に応じて当社は2024年1月31日またはそれまでにL法律事務所に500,000ドルの現金を支払い、(Y)当社が新規株式を発行して得られた純額を少なくとも30,000,000ドル受け取った日から10営業日とします。ライセンス契約の他のすべての 条項は依然として有効である.
2023年3月29日、当社はL基金に648,421ドルの現金を支払い、A免除の条件を満たすとともに、受取手形と見下げオプションをキャンセルする効果もある。
株 オプション付与
当社は2023年1月27日,ナスダック上場規則第5635(C)(4)条に基づき,新たに任命された首席医療官および医療部上級副総裁に10年間の株式購入権を付与し,後継普通株100,000株を購入し,2022年計画で当社に雇用される誘因とした。これらの株式オプションは3年以内に年に1回付与され、行権価格は1株2.11ドルである。
2023年3月10日、会社は2022年計画に基づいて会社員に後続普通株13,000株を購入する10年期株式オプションを付与した。株式オプションは3年以内に毎年 が付与され、行権価格は1株2.26ドルである。13,000株のうち、5,000株は当社の役員の息子に発行されました。
有効性が無効になる
当社は2023年2月20日頃、米国証券取引委員会がPIPE証券購入協定(“PIPE証券購入協定”)に規定されている 期限内申告にPIPE登録すべき証券の登録声明 を発効させることができなかった(“発効失敗”)。SPAは、PIPE投資家が、有効性失敗日に各投資家購入価格1.5%に相当する登録遅延支払いを受信し、有効性失敗が続いた後、30 日毎に遅延支払いを得る権利を有するようにする。登録遅延支払いをタイムリーに支払うことができなかったことは、毎月2.0%の金利で金利を計算することになります。提出日までに、会社は2ヶ月の登録遅延支払い(合計約260,000ドル)を支払わなければなりません。有効性障害を解決することができます。
| F-32 |
ZYVERSA 治療会社
簡素化された合併貸借対照表
| 後継者 | ||||||||
| 六月三十日 | 十二月三十一日 | |||||||
| 2023 | 2022 | |||||||
| (未監査) | ||||||||
| 資産 | ||||||||
| 現在の 資産: | ||||||||
| 現金 | $ | 228,693 | $ | 5,902,199 | ||||
| 前払い料金と他の流動資産 | 886,911 | 225,347 | ||||||
| 仕入先保証金 | - | 235,000 | ||||||
| 流動資産合計 | 1,115,604 | 6,362,546 | ||||||
| 設備、 純額 | 12,133 | 17,333 | ||||||
| 進行中の研究開発作業 | 30,806,158 | 100,086,329 | ||||||
| 商誉 | - | 11,895,033 | ||||||
| 保証金br | - | 46,659 | ||||||
| 運営 レンタル使用権資産 | 53,898 | 98,371 | ||||||
| 総資産 | $ | 31,987,793 | $ | 118,506,271 | ||||
| 負債、一時持分、株主権益 | ||||||||
| 流動負債 : | ||||||||
| 売掛金 | $ | 8,144,033 | $ | 6,025,645 | ||||
| 費用とその他の流動負債を計算しなければならない | 2,281,026 | 2,053,559 | ||||||
| 運営 賃貸負債 | 59,625 | 108,756 | ||||||
| 流動負債合計 | 10,484,684 | 8,187,960 | ||||||
| 繰延納税義務 | 1,441,467 | 10,323,983 | ||||||
| 総負債 | 11,926,151 | 18,511,943 | ||||||
| 引受 とあるいは事項があります(注8) | - | - | ||||||
| 後継者 2023年6月30日と2022年12月31日までに発行された償還可能普通株はそれぞれ0株と65,783株であるが,償還が可能である | - | 331,331 | ||||||
| 株主権益: | ||||||||
| 後継者 優先株、額面0.0001ドル、ライセンス株式1,000,000株: | ||||||||
| シリーズ A優先株は,8,635株を指定発行し,2023年6月30日と2022年12月31日までにそれぞれ200株と8,635株 を発行·発行する | - | 1 | ||||||
| Bシリーズ優先株は,5,062株を指定し,2023年6月30日と2022年12月31日までに5,062株を発行·発行した | 1 | 1 | ||||||
| 相続人 普通株、額面0.0001ドル、許可発行1.1億株;それぞれ2023年6月30日と2022年12月31日に23,669,074株と9,016,139株を発行した;2023年6月30日と2022年12月31日までにそれぞれ23,666,915株と9,016,139株を発行した | 2,367 | 902 | ||||||
| 追加実収資本 | 107,044,663 | 104,583,271 | ||||||
| 累積赤字 | (86,978,221 | ) | (4,921,178 | ) | ||||
| 国庫株は,コストで計算すると,2023年6月30日と2022年12月31日はそれぞれ2,159株と0株である | (7,168 | ) | - | |||||
| 株主権益合計 | 20,061,642 | 99,662,997 | ||||||
| 負債、仮持分、株主権益の合計 | $ | 31,987,793 | $ | 118,506,271 | ||||
付記はこのような簡明な総合財務諸表の構成要素である。
| F-33 |
ZYVERSA 治療会社
簡素化された合併業務報告書
(未監査)
| 後継者 | 前身 | 後継者 | 前身 | |||||||||||||
| の3つについて | の3つについて | の6つについて | の6つについて | |||||||||||||
| 月 は終わりました | 月 は終わりました | 月 は終わりました | 月 は終わりました | |||||||||||||
| 2023年6月30日 | 2022年6月30日 | 2023年6月30日 | 2022年6月30日 | |||||||||||||
| 運営費用 : | ||||||||||||||||
| 研究開発 | $ | 1,220,576 | $ | 719,395 | $ | 2,276,519 | $ | 1,786,357 | ||||||||
| 通常 と管理 | 3,929,225 | 1,164,013 | 7,465,362 | 3,465,382 | ||||||||||||
| 進行中の研究開発減価 | 69,280,171 | - | 69,280,171 | - | ||||||||||||
| 営業権減価 | 11,895,033 | - | 11,895,033 | - | ||||||||||||
| 運営費総額 | 86,325,005 | 1,883,408 | 90,917,085 | 5,251,739 | ||||||||||||
| 運営損失 | (86,325,005 | ) | (1,883,408 | ) | (90,917,085 | ) | (5,251,739 | ) | ||||||||
| その他 (収入)支出: | ||||||||||||||||
| 利子(収入)支出 | 314 | 140,404 | (765 | ) | 308,468 | |||||||||||
| 派生負債公正価値変動 | - | (19,600 | ) | - | 192,500 | |||||||||||
| 税前純損失 | (86,325,319 | ) | (2,004,212 | ) | (90,916,320 | ) | (5,752,707 | ) | ||||||||
| 収入br税収割引 | 7,812,226 | - | 8,859,277 | - | ||||||||||||
| 純損失 | (78,513,093 | ) | (2,004,212 | ) | (82,057,043 | ) | (5,752,707 | ) | ||||||||
| 優先株株主配当として | (7,915,836 | ) | (331,200 | ) | (7,915,836 | ) | (331,200 | ) | ||||||||
| 普通株主は純損失を占めるべきだ | $ | (86,428,929 | ) | $ | (2,335,412 | ) | $ | (89,972,879 | ) | $ | (6,083,907 | ) | ||||
| 1株当たり純損失 | ||||||||||||||||
| -基本的かつ希釈 | $ | (4.84 | ) | $ | (0.10 | ) | $ | (6.66 | ) | $ | (0.25 | ) | ||||
| 重み 発行済み普通株式平均数 | ||||||||||||||||
| -基本的かつ希釈 | 17,855,762 | 24,167,257 | 13,517,314 | 24,167,257 | ||||||||||||
付記はこのような簡明な総合財務諸表の構成要素である。
| F-34 |
ZYVERSA 治療会社
簡明 合併株主権益変動表(赤字)
| 2023年6月30日までの3ヶ月と6ヶ月 | ||||||||||||||||||||||||||||||||||||||||||||
シリーズ A 優先株 | シリーズ B 優先株 | ごく普通である 在庫品 | 財務局 在庫品 | その他の内容 支払い済み | 積算 | 合計する 株主の | ||||||||||||||||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 権益 | ||||||||||||||||||||||||||||||||||
| 後継者 | ||||||||||||||||||||||||||||||||||||||||||||
| 残高 -2023年1月1日 | 8,635 | $ | 1 | 5,062 | $ | 1 | 9,016,139 | $ | 902 | - | $ | - | $ | 104,583,271 | $ | (4,921,178 | ) | $ | 99,662,997 | |||||||||||||||||||||||||
| 以前償還可能な普通株を再分類する | - | - | - | - | 65,783 | 7 | - | - | 331,324 | - | 331,331 | |||||||||||||||||||||||||||||||||
| 仕入先合意により普通株式 を発行する | - | - | - | - | 130,000 | 13 | - | - | 395,187 | - | 395,200 | |||||||||||||||||||||||||||||||||
| 登録 優先株発行に関するコスト | - | - | - | - | - | - | - | - | (34,674 | ) | - | (34,674 | ) | |||||||||||||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | - | 287,461 | - | 287,461 | |||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | - | (3,543,950 | ) | (3,543,950 | ) | |||||||||||||||||||||||||||||||
| 残高 -2023年3月31日 | 8,635 | 1 | 5,062 | 1 | 9,211,922 | 922 | - | - | 105,562,569 | (8,465,128 | ) | 97,098,365 | ||||||||||||||||||||||||||||||||
| 普通株式の登録発行 [1] | - | - | - | - | 11,015,500 | 1,101 | - | - | 9,829,917 | - | 9,831,019 | |||||||||||||||||||||||||||||||||
| A系列優先株を償還する | (8,400 | ) | (1 | ) | - | - | - | - | - | - | (10,080,000 | ) | - | (10,080,001 | ) | |||||||||||||||||||||||||||||
| Aシリーズ優先株を普通株に転換する | (35 | ) | - | - | - | 17,500 | 2 | - | - | (2 | ) | - | - | |||||||||||||||||||||||||||||||
| 禁売期間を延長する対価として発行された株 | - | - | - | - | 3,044,152 | 304 | - | - | 1,156,474 | - | 1,156,778 | |||||||||||||||||||||||||||||||||
| 仕入先合意により普通株式 を発行する | - | - | - | - | 380,000 | 38 | - | - | 209,962 | - | 210,000 | |||||||||||||||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | - | 365,742 | - | 365,742 | |||||||||||||||||||||||||||||||||
| 物置は原価で株を購入する | - | - | - | - | - | - | (2,159 | ) | (7,168 | ) | - | - | (7,168 | ) | ||||||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | - | (78,513,093 | ) | (78,513,093 | ) | |||||||||||||||||||||||||||||||
| 残高 -2023年6月30日 | 200 | $ | - | 5,062 | $ | 1 | 23,669,074 | $ | 2,367 | (2,159 | ) | $ | (7,168 | ) | $ | 107,044,662 | $ | (86,978,221 | ) | $ | 20,061,642 | |||||||||||||||||||||||
| 2022年6月30日までの3ヶ月と6ヶ月 | ||||||||||||||||||||||||||||
シリーズ A 優先株 | ごく普通である 在庫品 | その他の内容 支払い済み | 積算 | 合計する 株主の | ||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 遺憾に思う | ||||||||||||||||||||||
| 前身 | ||||||||||||||||||||||||||||
| 残高 -2022年1月1日 | - | $ | - | 24,167,257 | $ | 242 | $ | 40,065,109 | $ | (52,896,817 | ) | $ | (12,831,466 | ) | ||||||||||||||
| 私募発行優先株 [2] | 133,541 | 1 | - | - | 393,300 | - | 393,301 | |||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | 1,941,746 | - | 1,941,746 | |||||||||||||||||||||
| 純損失 | - | - | - | - | - | (3,748,495 | ) | (3,748,495 | ) | |||||||||||||||||||
| 残高 -2022年3月31日 | 133,541 | 1 | 24,167,257 | 242 | 42,400,155 | (56,645,312 | ) | (14,244,914 | ) | |||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | 695,940 | - | 695,940 | |||||||||||||||||||||
| 純損失 | - | - | - | - | - | (2,004,212 | ) | (2,004,212 | ) | |||||||||||||||||||
| 残高 -2022年6月30日 | 133,541 | $ | 1 | 24,167,257 | $ | 242 | $ | 43,096,095 | $ | (58,649,524 | ) | $ | (15,553,186 | ) | ||||||||||||||
| [1] | 総収益11,015,500ドルから発行コストを引いた1,011,064ドル |
| [2] | 419,320ドルの総収益から26,019ドルの発行コストを引いた |
付記はこのような簡明な総合財務諸表の構成要素である。
| F-35 |
ZYVERSA 治療会社
簡明 統合キャッシュフロー表
(未監査)
| 後継者 | 前身 | |||||||
| の6つについて | の6つについて | |||||||
| 月 は終わりました | 月 は終わりました | |||||||
| 2023年6月30日 | 2022年6月30日 | |||||||
| 経営活動からのキャッシュフロー: | ||||||||
| 純損失 | $ | (82,057,043 | ) | $ | (5,752,707 | ) | ||
| を調整し、純損失と経営活動で使用されている現金純額を照合する: | ||||||||
| 進行中の研究開発減価 | 69,280,171 | - | ||||||
| 営業権減価 | 11,895,033 | - | ||||||
| 株に基づく報酬 | 653,203 | 2,637,686 | ||||||
| 仕入先合意により普通株式 を発行する | 605,200 | - | ||||||
| 禁売期間を延長する対価として発行された株 | 1,156,778 | - | ||||||
| 債務割引償却 | - | 36,469 | ||||||
| 派生負債公正価値変動 | - | 192,500 | ||||||
| 固定資産減価償却 | 5,200 | 5,200 | ||||||
| 非現金レンタル料 | 44,473 | 41,486 | ||||||
| 繰延税金割引 | (8,882,516 | ) | - | |||||
| 経営資産と負債の変化 : | ||||||||
| 前払い料金と他の流動資産 | (661,565 | ) | (934,853 | ) | ||||
| 保証金br | 46,659 | - | ||||||
| 仕入先保証金 | 235,000 | 120,000 | ||||||
| 売掛金 | 2,118,388 | 2,204,406 | ||||||
| 運営 賃貸負債 | (49,131 | ) | (44,627 | ) | ||||
| 費用とその他の流動負債を計算しなければならない | 613,077 | 804,973 | ||||||
| 純額 経営活動で使用した現金 | (4,997,072 | ) | (689,467 | ) | ||||
| 資金調達活動によるキャッシュフロー: | ||||||||
| 普通株式を公開発行して得られる収益 | 11,015,500 | - | ||||||
| 普通株式発行に関する登録·発行コスト | (1,213,657 | ) | - | |||||
| A系列優先株を償還する | (10,465,610 | ) | - | |||||
| 私募優先株発行で得られた金 | - | 419,320 | ||||||
| 在庫株を買う | (7,168 | ) | - | |||||
| 投資家預金収益 | - | 296,400 | ||||||
| 登録 と優先株発行に関する発行コスト | (5,500 | ) | (26,019 | ) | ||||
| 純融資活動で提供される現金(使用 | (676,435 | ) | 689,701 | |||||
| 現金純増加 (減少) | (5,673,506 | ) | 234 | |||||
| 現金 -期初 | 5,902,199 | 328,581 | ||||||
| 現金 -期末 | $ | 228,693 | $ | 328,815 | ||||
| 現金brおよび制限現金には以下が含まれる: | ||||||||
| 現金 | $ | 228,693 | $ | 31,465 | ||||
| 制限された 現金 | - | 297,350 | ||||||
| $ | 228,693 | $ | 328,815 | |||||
| 補足 キャッシュフロー情報開示: | ||||||||
| 以前償還可能な普通株を再分類する | $ | 331,331 | $ | - | ||||
| ASC 842を用いたROU資産とリース負債の確認 | $ | - | $ | 182,732 | ||||
| 延期発行原価買掛金 | $ | 44,892 | $ | - | ||||
付記はこのような簡明な総合財務諸表の構成要素である。
| F-36 |
ZYVERSA 治療会社
簡明合併財務諸表付記
付記 1--業務組織、業務性質、列報根拠
組織 と運営
Larkspur(“Larkspur”)は空白小切手特殊用途買収会社で、2021年3月17日にデラウェア州に登録設立された。2022年12月12日、Larkspurは、2014年3月11日にVariant PharmPharmticals,Inc.としてフロリダ州に登録成立したZyVersa Treateutics,Inc.(前身)との業務統合(以下の定義)を完了した。業務合併合意(“業務合併合意”)の条項(および業務合併合意の他のすべての条件を満たすか放棄した場合)に基づいて、業務合併とそれによる予想される取引(“業務合併”)の期日(“締め切り”)を完了し、Larkspur(“新親会社”) はZyVersa Treateutics,Inc.と改称され、前身は新親会社の子会社と合併してZyVersa Treating,Inc.(“運営会社”)と改称され、運営会社は既存の実体であり、デラウェア州に登録設立され、新親会社の完全子会社(“後継者”と総称される)となる。br}が言及している“会社”または“ZyVersa”とは、2023年6月30日までの3ヶ月と6ヶ月の後継者を意味する。 および2022年6月30日までの3ヶ月と6ヶ月の前任者。
ZyVersa は臨床段階の生物製薬会社であり、ノウハウを利用して慢性腎臓或いは炎症性疾患患者のために一流の薬物を開発し、これらの患者は高度に満足されていない医療需要を持っている。同社の使命は,健康結果の最適化と患者の生活の質を向上させる薬剤の開発である。
列報根拠と合併原則
添付されていない審査簡明総合財務諸表はアメリカ中期財務資料公認会計基準(“アメリカ公認会計原則”)に基づいて作成された。したがって、それらは、アメリカ合衆国で公認されている年次財務諸表によって要求されるすべての情報および開示を含まない。経営陣は、この報告書には、当社の2023年6月30日現在および2023年6月30日現在、2023年および2022年6月30日までの6ヶ月間の審査簡明総合財務諸表を審査していないために必要なすべての調整(正常経常項目のみを含む) が含まれていると考えている。2023年6月30日までの6カ月間の経営業績は必ずしも通年の経営業績を代表するとは限らない。これらの監査されていない簡明総合財務諸表と、会社が2023年3月31日に米国証券取引委員会(“米国証券取引委員会”)に提出した2022年12月31日までの10-K表年次報告書に含まれる総合財務諸表とその付記を併せて読むことを提案する。
添付されている審査されていない簡明総合財務諸表 は、当社及びその合併付属会社の会計記録に由来している。業務合併の結果,会計目的でLarkspurは買収側であり,その前身であるZyVersa治療会社は買収側と会計前身である。したがって、財務諸表列報は、2022年12月13日までの前身の財務諸表と後継者が、運営会社の合併を含む2022年12月13日以降の財務諸表を含む。すべての重大な会社間残高は監査されていない簡明な連結財務諸表に出荷されています。監査されていない簡明合併財務諸表はアメリカ公認会計原則及びアメリカ証券取引委員会の会計基準及び 規定に基づいて作成されたものである。
注[br}2-継続経営と経営陣の計画
添付されている簡明総合財務諸表は持続経営を基礎として作成され、正常業務過程中の資産現金化と負債返済を考慮する。簡明総合財務諸表には、資産金額の回収や分類や負債分類に関するいかなる調整も含まれていないが、当社が経営を継続できない場合には、当該等の調整には が必要となる可能性がある。
| F-37 |
ZYVERSA 治療会社
簡明合併財務諸表付記
2023年6月30日現在、会社の現金は約20万ドル、運営資金の赤字は約940万ドル。2023年6月30日までの6カ月間で、会社の純損失は約8,210万ドル、運営に使用された現金は約500万ドルだった。同社の累計赤字は2023年6月30日現在で約8700万ドル。
社はまだ利益を実現しておらず、運営からの現金流出が引き続き発生する見通しだ。その研究と開発および一般的かつ管理費が増加し続けることが予想されるため,最終的には利益を達成するために相当な製品収入を生成するためにbrが必要となる。
したがって、会社は株式や債務融資を通じて追加資金を調達することを要求されるだろう。経営陣は、当社が資本資源を獲得し、追加的な融資機会を評価し続けることができると信じているが、当社が追加資本の獲得に成功する保証はない、または当社が商業的に許容可能な条件で資金を得ることができる(あれば)。また,当社が調達可能な資金額は,当社が運営資金赤字を解消し,その発展計画を達成したり,利益運営を実現したりすることができる保証はない.上記のbr条件は、会社がこれらの財務諸表が発表された日から少なくとも1年以内に経営を継続する能力があるかどうかを大きく疑う。
付記 3-重要会計政策の概要
会社が2022年12月31日までの2022年年報で2022年12月31日財務諸表をForm 10−K形式で発表して以来、会社の重大な会計政策に大きな変化は生じていない。
見積もりを使った
米国公認会計原則に基づいて財務諸表を作成することは、財務諸表中に報告された金額と財務諸表関連付記に開示された金額に影響を与えるために、管理層に推定、判断と仮定を行うことを要求する。当社の見積もりと判断は、歴史的経験とそれが の場合に合理的と考えられる様々な他の仮定に基づいています。当社貸借対照表に記載されている資産および負債額および列報の各期間の支出金額は、株式証券、派生負債、株式に基づく報酬および買収の無形資産の公正価値計算、および繰延税金資産の推定値を決定する準備に使用されるが、これらの推定および仮定は、株式証券、派生負債、株式に基づく報酬および買収に基づく無形資産の公正価値計算に使用されるが、繰延税金資産の推定値を決定するために準備されている。会社のいくつかは、会社独自の状況や一般経済状況を含む外部条件の影響を受ける可能性がある。実際の結果はこれらの推定値とは異なる可能性があり,これは合理的である.
普通株1株当たり純損失
基本 1株当たりの普通株純損失の計算方法は,純損失を期間中に発行された既存普通株で割った加重平均である。1株当たりの純収入の計算方法は、純収入を期間ごとに発行された普通株と希釈性普通株で割った加重平均である。
| F-38 |
ZYVERSA 治療会社
簡明合併財務諸表付記
次の表は、希釈後の1株当たり純損失計算から除外された発行された潜在的希薄化証券 を示している
逆償却証券付表は1株当たりの純損失を計上しない
| 後継者 | 前身 | |||||||
| 2023年6月30日 | 2022年6月30日 | |||||||
| 前身 ライセンス[1] | - | 2,305,184 | ||||||
| 後任者株式証明書[1] | 23,742,163 | - | ||||||
| 前置タスク オプション | - | 10,039,348 | ||||||
| 後継者 オプション | 3,559,342 | - | ||||||
| 後継者 A系列転換可能優先株 | 100,000 | - | ||||||
| 後継者 B系列転換可能優先株 | 723,234 | - | ||||||
| 前身 Aシリーズ転換可能優先株 | - | 150,832 | ||||||
| 前身 変換可能支払手形[2] | - | 4,992,076 | ||||||
| 潜在希釈株式総数 | 28,124,739 | 17,487,440 | ||||||
| [1] | InflamaCORE,LLCライセンスプロトコルの一部として、600,000株の前身普通株または119,125株を購入した後継普通株の引受権証は、いくつかのマイルストーンを満たした後に発行されるので、現在報告されている金額には含まれていません。詳細は、注8-コミットメントおよび-ライセンスプロトコルを参照してください。 |
| [2] | 社の変換可能な支払手形には変換オプションが含まれており,ある条件を満たす取引が完了した後に普通株式 を自動発行することができる.変換価格は、条件を満たす取引に関連する暗黙的な普通株価格の関数である。上表の潜在的な希釈性証券を開示するために、条件を満たす取引が発生した時に普通株を発行できる数量を使用し、隠れ普通株価格は2022年6月30日までの普通株の公正価値1株当たり2.27ドルに等しい |
支部報告
Br社はその業務を報告可能な運営部門として運営·管理している。すべての資産と業務はアメリカにあります。会社の最高経営責任者は最高経営決定者で、彼はまとめた上で財務情報を審査して、資源を割り当て、財務業績を評価します。
注[br}4-業務合併、営業権と進行中の研究と開発
2022年12月12日、LarkspurはZyVersa Treateutics,Inc.との業務統合を完了した(注1-業務組織、 運営性質および陳述基礎参照)。当社は業務合併を経営会社の長期買収として入金しており、経営会社が業務合併日に可変権益実体であることが確定しているからです。新親会社は、その所有権が運営会社の活動を指導する権限を与え、運営会社の損失及び/又は運営会社の利益を受ける義務を負うため、主な受益者として決定された。
LarkspurのSPACとしての活動の非日常的な性質から,Larkspurと運営会社の業務前統合結果 を統合した形式財務データは意味がなく,公表されていない。
| F-39 |
ZYVERSA 治療会社
簡明合併財務諸表付記
購買 価格配分
業務合併は買収会計方法を採用して入金し、初期買収価格分配は買収対価格に対する会社の公正価値の初歩的な評価、及び経営会社が買収日に買収した有形と無形資産及び負担した負債の公正価値に基づいている。年末、買収日がカレンダー年末に近づいているため、調達価格配分 は完了していません。
2023年6月30日現在、買収対価格の買収日公允価値の初歩的な推定と買収価格分配の初歩的な推定は確認されており、試算期間の調整を必要とせず、現在は最終推定とされている。購入対価格要素の購入日公正価値は市場法を用いて推定され、後継者普通株の公正価値に対しては、1級投入(観察可能投入)を採用し、公正価値が後任権証とオプションに帰属する公正価値に対しては、3級投入(観察不能投入)を採用する。業務合併協議によると、買収側は運営会社の既存株式承認証及びオプションに代わる責任がある。そのため、購入対価格(合併前サービスの公正価値)と合併後サービス補償との間に代替権証とオプションの公正価値を割り当てる必要がある。合併後のサービスによる代替権証およびオプションの公正価値は、それぞれ584,260ドルおよび1,731,237ドルである。
購入対価格の買収日の公正価値の最終推定は以下の通りである
購入対価公正価値別表
| 相続人 普通株式 | $ | 67,197,300 | ||
| 後任者株式証明書 | 12,190,015 | |||
| 後継者 オプション | 11,864,556 | |||
| 購入対価の公正価値総額 | $ | 91,251,871 |
買収資産と仮想負債の最終買収日公正価値(下記表参照)は、研究開発(“IPR&D”)を専門とする第三者評価専門家の協力の下で管理層が決定している。 IPR&D資産の推定公正価値は、市場参加者による資産の残存使用寿命内に第3レベル投入を使用することによるキャッシュフローの期待に基づいて、資産公正価値の推定を提供する“収益法”を用いて決定される。評価に使用されるいくつかのより重要な仮定は、各資産の毎年の推定純キャッシュフロー、将来のキャッシュフロー固有リスクを測定するために必要な適切な割引率、各資産のライフサイクル、潜在的な規制と商業成功リスク、純売上高の特許権使用料、およびその他のbr要素を含む。これらの要因に関連する固有の不確実性が存在し,管理層はこれらの要因を適用して公正価値を推定する際の判断を得ている.買収価格が買収された識別可能な純資産の推定公正価値の部分を超えて商誉と記されており、経営層は、集合した労働力や他の単独確認資格に適合していない無形資産によるものと考えている。
買収した識別可能な純資産推定公正価値別表 を商業権と記す
| 流動資産、現金699、324ドルを含む | $ | 1,093,223 | ||
| 進行中の研究開発作業 | 100,086,329 | |||
| 商誉 | 11,895,033 | |||
| その他 非流動資産 | 64,523 | |||
| 買収した総資産は | 113,139,108 | |||
| 流動負債 | 10,818,204 | |||
| 繰延納税義務 | 11,069,033 | |||
| 負担した負債合計 | 21,887,237 | |||
| 純資産買収 | $ | 91,251,871 |
研究·開発作業が完了または放棄される前に、帳簿目的のために記録された知的財産権と開発は無期限無形資産とされている。今回の買収は株式販売の形で行われているため、知的財産権研究開発と営業権には何の課税基礎もなく、納税時に控除することもできない。
| F-40 |
ZYVERSA 治療会社
簡明合併財務諸表付記
減損する
経営陣はその知的財産権研究開発資産に関する不利な発展は見られなかったが、経営陣は確かに、会社の時価が大幅に低下し続けているため、当社の単一報告単位の公正価値がその帳簿価値よりも低い可能性が高いことを確定した。そのため,2023年6月30日から中期減値テストを行う必要がある
当社の公正価値は収益法を採用して決定することである.収益法は将来のキャッシュフローの現在値に基づいており,これらのキャッシュフローは財務予測に基づいており,資産ごとの年間純現金流量の推定,将来のキャッシュフロー固有リスクを測定するために必要な適切な割引率,資産ごとのライフサイクル,潜在的な規制と商業成功リスク,純売上高の特許権使用料,その他の要因を含む重大な仮定と判断が必要である。これにより発生した見積公正価値は当社の時価と照合した
入金には、会社の時価より約100%高い2023年6月30日に推定された暗黙的な制御権プレミアムが含まれる。
当社の割引現金流量計算で示した当社の営業権および知的財産権研究開発公正価値の総和は、当社の時価が示す当社の総合公正価値と比較し、当社の計算の合理性を評価します。当社は投資家が価格をコントロールするために支払う時価を超える合理的な価格制御にはいくつかの要素が含まれていると判断した
| ● | 市場 はプレミアムを制御する;同業者より買収取引が可能な最新の公開市場情報 を識別する。同業者買収取引の選択は判断と不確実性の影響を受けることができる。 |
| ● | 公衆流通株が少ないことと取引活動が時価に与える影響は限られている:当社のかなりの一部の普通株は集中した数の投資家が所有している。当社の普通株の公開流通株、すなわち公衆投資家が自由に取引する普通株の割合を当社の総流通株で割ると、当社の上場同業者の流通株の割合より明らかに低い。当社の第三者市場データの評価によると、公衆流通株が少なく、取引量が限られているため、当社の株価に影響を与える固有の割引があり、当社の時価に影響を与えていると考えられる。 |
当社の分析結果として、当社は1190万ドルの営業権を完全に減値し、その他の無期限無形資産、すなわち知的財産権と発展のために6930万ドルの減価費用 を提案した。
| F-41 |
ZYVERSA 治療会社
簡明合併財務諸表付記
付記 5--計算すべき費用とその他の流動負債
2023年6月30日と2022年12月31日まで、計算すべき費用およびその他の流動負債は、
計算すべき費用とその他の流動負債明細書
| 六月三十日 | 十二月三十一日 | |||||||
| 2023 | 2022 | |||||||
| L&F 記念碑的支払い責任 | $ | 500,000 | $ | 1,500,000 | ||||
| Lと女(Br)手記[1] | - | (351,579 | ) | |||||
| LとF, 網 | 500,000 | 1,148,421 | ||||||
| 給料総額 課税額 | 528,049 | 584,226 | ||||||
| その他の は費用を計算します | 104,369 | 214,229 | ||||||
| 連邦所得税対応 | 129,922 | 106,683 | ||||||
| ボーナス 応募 | 998,778 | - | ||||||
| 登録 遅延責任[2] | 19,908 | - | ||||||
| 計算すべき費用とその他の流動負債総額 | $ | 2,281,026 | $ | 2,053,559 | ||||
| [1] | L照会の許しの詳細は 付記8--“約束とあるいは事項”を参照されたい。 |
| [2] | 登録遅延責任の詳細は 付記9--“株主永久と仮持分”を参照されたい。 |
付記 6--派生負債
2022年1月1日現在、当社は発行時の公正価値によって計量された3級派生債務を持っており、ある転換可能な手形の償還特徴と引受オプションと関係がある。償還機能は割引キャッシュフローとブラック·スコアーズ推定技術を組み合わせて推定した。2023年6月30日または2022年12月31日現在、デリバティブ負債はない。
前身は、2022年6月30日までの3カ月と6カ月で、負債公正価値変動(損失)収益(19,600ドル)と192,500ドルをそれぞれ記録した。
付記 7--所得税
2023年6月30日および2022年6月30日までの6ヶ月間の税額支出は、課税司法管轄区の年間の推定実効税率に基づいて計算される。当社の税率は、必要に応じて経営陣の四半期審査と 改訂を受けます。2023年,2023年,2022年6月30日までの6カ月間,会社の実際の税率はそれぞれ9.7% と0.0% であった。四半期金利の増加は主にその推定手当の変化によるものである。2022年6月30日現在、過去と予想損失のため、会社は全額推定準備金を計上している。当社は2022年12月31日現在、2022年12月12日に業務と合併して設立された重大な繰延納税負債を記録しており、その繰延納税純資産の将来の課税所得額を実現する源である。当社は2023年6月30日までの6ヶ月間、繰延税金負債に関する資産減価を記録し、繰延税金負債を減少させた。したがって,2023年6月30日までの6カ月間の実質税率は9.7% であり,主に繰延税項純負債の調整によるものである。
付記 8--支払引受及び又は事項
訴訟、クレーム、評価
通常の業務過程で、会社は法律訴訟、クレーム、評価に参加する可能性がある。損失が発生する可能性があり、損失金額が合理的に推定可能であると評価された場合、会社は、そのようなクレームによって発生したまたはあるような負債を記録する。
| F-42 |
ZYVERSA 治療会社
簡明合併財務諸表付記
ライセンス プロトコル
L 研究有限責任会社
Br社とL研究有限責任会社(“L研究”)は 改訂された許可協定(“L許可協定”)を締結し、2015年12月15日に発効し、これにより、Lは吾らに彼等しい全世界範囲内で特許権使用料を有する独占的再許可許可を付与し、VAR 200の開発及び商業化のための知的財産権及び独自技術に特定し、ヒト腎臓疾患及びその症状の治療、抑制或いは予防に用いられ、局所性節性糸球体硬化を含む。当社は2023年2月28日にL法律事務所と改訂及び再記述協定を締結し、(A)2023年3月31日に当該等のマイルストーン支払いにおける1,000,000ドル(“免除A”)及び(B)2024年1月31日の500,000ドルに関するマイルストーン支払い(“免除B”)まで、L法律事務所がL法律事務所許可協定又は任意の他の救済措置を終了する権利を放棄する。免除Aは、(I)ある交換可能な手形について当社が作成した元金総額351,579ドルの猶予と、(Ii)当社が2023年3月31日またはそれまでにL法律事務所に支払った現金648,421ドルに依存する。免除Bは、当社が(X)2024年1月31日および(Y)当社が新規株式を発行して得た純額が少なくとも30,000,000ドルの日から10営業日または前にLファンドに現金500,000ドルを支払うことに依存します。L&Fライセンスの他のすべての条項はまだ有効です。
2023年3月29日、当社はある手形の元金総額351,579ドルを免除し、L基金に648,421ドルの現金を支払い、A免除の条件を満たした。Lの承認オプションはA免除の条件を満たした後に満期になり、br}は65,783株普通株と331,331ドルの仮持分を永久持分に再分類した。
運営 借約
前任者は2019年1月18日、フロリダ州ウェストンにある約3,500平方フィートのオフィススペースの賃貸契約を締結し、レンタル期間は5年となった。賃貸契約によると、初年度の年間基本賃貸料(前任者が負担すべき税額や運営コストを除く)は約89,000ドルで、その後毎年約3%上昇し、総基本賃貸料は約497,000ドルである。
後継者は2023年6月30日までの3カ月および6カ月の経営リースについて38,783ドルおよび77,198ドルの使用権資産の償却を確認したが、前身は2022年6月30日までの3カ月および6カ月の経営賃貸確認賃貸費用38,141ドルおよび76,294ドルについてそれぞれ確認した。
会社の使用権資産と負債の概要は以下の通りです
貸借対照明細書
| 財務名、前身、後継者[固定名簿] | 後継者 | 前身 | ||||||
| の6つについて | の6つについて | |||||||
| 月 は終わりました | 月 は終わりました | |||||||
| 2023年6月30日 | 2022年6月30日 | |||||||
| 賃貸負債に含まれる金額を計量するために支払う現金: | ||||||||
| 経営活動に使われているキャッシュフロー | $ | 49,130 | $ | 44,627 | ||||
| レンタル義務と引き換えに使用する資産 | ||||||||
| 運営 借約 | $ | - | $ | - | ||||
| 加重平均 残りのレンタル期間 | ||||||||
| 運営 借約 | 0.59歳 | 1.59歳 | ||||||
| 加重平均割引率 | ||||||||
| 運営 借約 | 6.5% | 6.5% | ||||||
| F-43 |
ZYVERSA 治療会社
簡明合併財務諸表付記
これらの運営リース契約によると、将来の最低支払いは以下の通りです
レンタル項目の下で将来最低支払明細書
| 金額 | ||||
| 2023年7月1日から2023年12月31日まで | $ | 60,938 | ||
| 減算: は利息を推定する金額を表す | (1,313 | ) | ||
| 合計する | $ | 59,625 | ||
付記 9--株主の永久及び仮持分
普通株 株
当社は2023年6月5日に、当該等投資家が保有する1,977,749株の普通株と引き換えに、120万ドルの3,044,152株の普通株を私募方式で複数の投資家(当社の保有者の一部を含む)に発行し、2023年7月31日に延長した。発行された普通株の公正価値は、2023年6月30日までの3ヶ月の営業報告書に一般と行政費用に記録されている。
当社は2023年6月30日までの6ヶ月間、マーケティングサービスと引き換えに合計510,000株の普通株式と現金を発行した2つのサプライヤーとマーケティング協定を締結した。普通株の500,200ドルの公正価値は前払い費用と決定され、会社は契約条項の費用を確認している。
株式(Br)製品
2023年4月28日、当社は11,015,500株普通株と引受権証の発行を完了し、総収益1,100万ドルで11,015,500株普通株(“登録発行”)を購入した。1株の普通株は1部の5年期承認株式証と一緒に販売され、株式承認証は発行時に1株1.00ドルの取引価格で1株の普通株を購入することができる。当社は株式分類に属するべきであると確定した。主に当社自身の株とリンクし、持分分類の要求に符合するからである。したがって,普通株も権利証も持分ごとに分類されるため, は収益や発行コストをそれぞれの証券に割り当てる必要はない.総発行コストは100万ドルで、その中には40万ドルの配給費用が含まれている。
A系列優先株を償還する
2023年4月28日頃には、登録発行された現金収益1,050万ドルが8,400株Aシリーズ優先株の償還に用いられる。優先株清算損失の会計処理方式は優先株に対して配当金を支払う処理方式と類似している。清算損失は、(A)A系列優先株保有者に譲渡された1,050万ドルの現金の公正価値(これは、会社がプレミアムと有効性失敗払いを支払う義務も解決した)と(B)Aシリーズ優先株の380万ドルの帳簿純額との差額で計算される。そのため、償還により会社の1株当たり普通株損失を計算した場合に670万ドルを確認したものを配当金とした。会社には累積損失があり、配当に関連する借方と貸方はいずれも追加の実収資本であるため、貸借対照表効果は存在しない。
| F-44 |
ZYVERSA 治療会社
簡明合併財務諸表付記
次のラウンドをトリガして
登録発行の結果として、(A)元のPIPE融資参加者に発行されたAシリーズ株式承認証は、1株11.50ドルの行権価格で863,500株の普通株を購入した行権価格を1株当たり2.00ドルの元値にリセットするとともに、4965,125株の普通株を行使することができる(これにより 140万ドルを配当とすることが確認された)。(B)残りの235株Aシリーズ優先株の元の変換価格 は、1株当たり2.00ドルの最低変換価格にリセットされ(これにより37,000ドルの配当が確認される); および(C)業務合併に関連して発行された5,062株Bシリーズ優先株の10.00ドルの元の変換価格 は、1株当たり7.00ドルの底値に再設定される(これにより、10万ドルの配当が確認される)。
変換A系列優先株
次の条項をトリガした後、Aシリーズ35株の優先株の保有者は1株2.00ドルの新転換価格で17,500株の普通株 に転換した。
仮持分
2023年3月29日に仮株式が永久持分に移行する検討については、“引受金と或いは有事項”が付記されている。
株に基づく報酬
2023年6月30日までの3ヶ月間、後継者が記録した株式報酬支出は365,742ドル(うち109,066ドルは研究開発に含まれ、256,676ドルは一般および行政費用に含まれる)であり、従業員やコンサルタントに支給されるオプションに関連している。2022年6月30日までの3ヶ月間、前身に記録された株式報酬支出は695,940ドル(うち243,918ドルは研究開発に含まれ、452,022ドルは一般および行政費用に含まれている)であり、従業員やコンサルタントに支給されるオプションbrに関連している。
2023年6月30日までの6ヶ月間、後継者が記録した株式報酬支出は653,203ドル(うち、158,521ドルは研究開発に含まれ、494,682ドルは一般および行政費用に含まれる)であり、従業員およびコンサルタントに支給されたオプションに関連している。2022年6月30日までの6ヶ月間、前身に記録された株式報酬支出は2,637,686ドル(うち、551,756ドルは研究開発に含まれ、2,085,930ドルは一般および行政費用に含まれる)であり、従業員およびコンサルタントに支給されたオプションbrに関連している。2023年6月30日現在、1,787,428ドルの未確認株式ベースの報酬支出があり、 社は1.8年間の加重平均期間内に確認される予定である。
株 オプション
当社は2023年1月27日に、新たに任命された首席医療官および医療部高級副総裁に10年間の株式購入権を付与し、100,000株の後継普通株を購入し、付与日は合計184,426ドルであり、ナスダック上場規則第5635(C)(4)条に基づいて2022年総合持分激励計画(“2022年計画”)の下で当社に入社する激励brとした。これらの株式オプションは3年以内に年に1回付与され、行権価格は1株2.11ドルである。
2023年3月10日、会社は2022年計画に基づいて会社員に後続普通株13,000株を購入する10年期株式オプションを付与した。これらの株式オプションの付与日総価値は23,770ドルであり,3年以内に年に1回付与され,行権価格は1株2.26ドルである.13,000株のうち、5,000株は当社の役員の息子に発行されました。
| F-45 |
ZYVERSA 治療会社
簡明合併財務諸表付記
2023年5月24日、会社は2022年計画に基づいて会社員と取締役に1,453,107株の後続普通株を購入する10年間の株式オプションを付与した。株式オプションの付与日総価値は555,004ドルであり,そのうち499,660ドルは3年以内に毎年帰属し,55,344ドルは3年以内に直ちに帰属し,行権価格は1株当たり0.44ドルであった。
2023年6月30日と2022年6月30日までの6ヶ月間に付与された株式オプションの付与日公正価値は、ブラック·スコアーズ法を用いて決定され、以下の仮定を用いた
付与された株式オプションスケジュール
| 後継者 | 前身 | 後継者 | 前身 | |||||||||||||
| 3人にとっては | 3人にとっては | 6人に | 6人に | |||||||||||||
| 現在までの月 | 現在までの月 | 現在までの月 | 現在までの月 | |||||||||||||
| 2023年6月30日 | 2022年6月30日 | 2023年6月30日 | 2022年6月30日 | |||||||||||||
| 付与された日普通株の公正価値 | $ | 0.44 | $ | 2.27 - $3.00 | $ | 0.44 - $2.23 | $ | 2.27 - $3.00 | ||||||||
| 無リスク金利 | 3.76 | % | 2.79% - 3.01 | % | 3.53% - 4.27 | % | 1.68% - 3.01 | % | ||||||||
| 所期期間(年) | 6.00 | 5.00 | 6.00 | 3.53 - 6.00 | ||||||||||||
| 予想変動率 | 122 | % | 112% - 114 | % | 120% - 123 | % | 111% - 119 | % | ||||||||
| 配当を期待する | 0.00 | % | 0.00 | % | 0.00 | % | 0.00 | % | ||||||||
2023年6月30日までの6ヶ月間のオプション活動の概要は以下の通り
株式オプション活動スケジュール
| 重みをつける | |||||||||||||||
| 重みをつける | 平均値 | ||||||||||||||
| 平均値 | 残り | 骨材 | |||||||||||||
| 番目 | トレーニングをする | 命 | 固有の | ||||||||||||
| オプション | 値段 | 年内に | 価値がある | ||||||||||||
| 未完成、 2023年1月1日 | 1,993,235 | $ | 10.81 | ||||||||||||
| 授与する | 1,566,107 | 0.56 | |||||||||||||
| 鍛えられた | - | - | |||||||||||||
| 没収される | - | - | |||||||||||||
| 未返済、2023年6月30日 | 3,559,342 | $ | 6.30 | 6.9 | $ | - | |||||||||
| 行使可能、2023年6月30日 | 1,938,385 | $ | 9.43 | 5.4 | $ | - | |||||||||
| F-46 |
ZYVERSA 治療会社
簡明合併財務諸表付記
次の表に2023年6月30日までの株式オプションに関する情報を示す
株式オプションに関する情報付表
| オプション 未完了 | 行使可能オプション | ||||||||||||
| 重みをつける | |||||||||||||
| 卓越した | 平均値 | 練習可能である | |||||||||||
| トレーニングをする | 番目 | 残存寿命 | 番目 | ||||||||||
| 値段 | オプション | 年内に | オプション | ||||||||||
| $ | 0.44 | 1,453,107 | 10 | 150,000 | |||||||||
| $ | 2.11 | 100,000 | - | - | |||||||||
| $ | 2.26 | 13,000 | - | - | |||||||||
| $ | 5.03 | 662,887 | 2.6 | 662,887 | |||||||||
| $ | 11.33 | 12,186 | 9.0 | 12,186 | |||||||||
| $ | 11.58 | 728,430 | 5.8 | 728,430 | |||||||||
| $ | 16.36 | 589,732 | 7.9 | 384,882 | |||||||||
| 3,559,342 | 5.4 | 1,938,385 | |||||||||||
株式株式承認証
2023年4月28日、発売登録について、当社は11,015,500株の普通株を購入し、付与日価値は3,974,831ドルである5年間の引受権証を発行した。 引受権証の行使価格は1株1.00ドルで、直ちに行使することができる。
2023年6月30日と2022年6月30日までの6ヶ月以内に付与された引受権証の付与日公正価値は、ブラック·スコイルズ法を用いて決定され、以下の仮定を用いた
承認株式証公正価値別表{br)を付与した
| 後継者 | 前身 | 後継者 | 前身 | |||||||||||
| の3つについて | の3つについて | の6つについて | の6つについて | |||||||||||
| 月 は終わりました | 月 は終わりました | 月 は終わりました | 月 は終わりました | |||||||||||
| 2023年6月30日 | 2022年6月30日 | 2023年6月30日 | 2022年6月30日 | |||||||||||
| 付与された日普通株の公正価値 | $1.00 | 適用されない | $1.00 | 適用されない | ||||||||||
| リスク 無利子 | 3.51% | 適用されない | 3.51% | 適用されない | ||||||||||
| 予想期限(年) | 5年間 | 適用されない | 5年間 | 適用されない | ||||||||||
| 期待変動 | 適用されない | 適用されない | 適用されない | 適用されない | ||||||||||
| 期待変動 | 123% | 適用されない | 123% | 適用されない | ||||||||||
| 期待配当 | 適用されない | 適用されない | 適用されない | 適用されない | ||||||||||
| F-47 |
ZYVERSA 治療会社
簡明合併財務諸表付記
2023年6月30日までの6ヶ月間の権証活動の概要は以下の通り
保証活動の概要
| 重みをつける | |||||||||||||||
| 重みをつける | 平均値 | ||||||||||||||
| 平均値 | 残り | 骨材 | |||||||||||||
| 量 | トレーニングをする | 命 | 固有の | ||||||||||||
| 株式承認証 | 値段 | 年内に | 価値がある | ||||||||||||
| 未返済、2023年1月1日 | 8,628,706 | $ | 10.75 | ||||||||||||
| 発表されました | 11,015,500 | 1.00 | |||||||||||||
| 没収される | (3,669 | ) | 11.58 | ||||||||||||
| 再定価 -旧版[1] | (863,500 | ) | 11.50 | ||||||||||||
| 再定価 -新しい[1] | 4,965,125 | 2.00 | |||||||||||||
| 未返済、2023年6月30日 | 23,742,163 | $ | 4.02 | 4.6 | $ | - | |||||||||
| 行使可能、2023年6月30日 | 23,672,360 | $ | 4.37 | 4.6 | $ | - | |||||||||
| [1] | 株式承認証代表は863,500株の普通株を購入したPIPE株式証の行使価格を1株当たり2.00ドルの底価格にリセットする。br}株式承認証は旧株式承認証の退出と新株式承認証が入った場合に提出され、展示を容易にする。 |
次の表に2023年6月30日までの引受権証に関する情報を示す
株式承認証関連資料付表
| 未償還株式証明書 | 引受権証 を行使できる | |||||||||||||
| 卓越した | 加重平均 | 練習可能である | ||||||||||||
| トレーニングをする | 量 | 残存寿命 | 量 | |||||||||||
| 値段 | 株式承認証 | 年内に | 株式承認証 | |||||||||||
| $ | 1.00 | 11,015,500 | 4.8 | 11,015,500 | ||||||||||
| $ | 2.00 | 4,965,125 | 4.5 | 4,965,125 | ||||||||||
| $ | 5.03 | 104,704 | 1.5 | 34,901 | ||||||||||
| $ | 6.90 | 1,271,904 | 4.5 | 1,271,904 | ||||||||||
| $ | 11.50 | 6,065,573 | 4.5 | 6,065,573 | ||||||||||
| $ | 11.58 | 319,357 | 0.5 | 319,357 | ||||||||||
| 23,742,163 | 4.6 | 23,672,360 | ||||||||||||
有効性 失敗
業務合併では,当社は2022年7月20日の引受契約(総称して“PIPE引受合意”と呼ぶ)に基づき,8,635株A系列転換可能優先株 (“PIPE株式”)および普通株引受権証(1株当たり“PIPE承認株証”)を発行し,1株1,000ドルの買い取り価格および株式証863,500株普通株,総価格8,635,000ドル(“PIPE投資”)を購入した。当社は2023年2月20日頃、米国証券取引委員会にPIPE証券購入協定(“PIPE証券購入協定”)に規定された時間内に 私募株式投資(“PIPE”)の登録すべき証券をカバーする登録声明を発効させることができなかった(“発効失敗”)と発表した。SPAは、PIPE投資家が、有効性失敗日に各投資家購入価格1.5% に相当する登録遅延支払い(“登録遅延支払い”)を受信し、有効性 失敗が続いた後、30日毎に登録遅延支払いを得る権利を有するようにする。登録遅延支払いが間に合わなかったことは、毎月 2.0% の金利で利息を計算することになります。2023年4月28日、登録発行によって得られた資金は、ほとんどのPIPE株の償還に使用される。 “を参照Aシリーズ優先株を償還する“上の図。本文書の提出日までに,当社は有効性障害を修復する前に合計約5,000ドルの登録遅延支払い を支払う予定である.
| F-48 |
ZYVERSA 治療会社
簡明合併財務諸表付記
注 10-後続イベント
2023年7月公開
当社は2023年7月26日に3,256,060株の普通株、予備金権証(“予備金権証”)の公開発売を完了し、9,471,213株の普通株および普通権証(“普通権証”)を購入し、1株0.165ドルの総合公開発行価格で12,727,273株の普通株を購入し、総収益は2,100,000ドル(“2023年7月発売”)とした。事前資金権証は直ちに行使可能であり,随時行使可能であり,すべての予備資本権証がすべて行使されるまで,行使価格は1株当たり0.0001ドルである。普通権利証は直ちに行使でき、使用期間は5年、行使価格は1株当たり0.165ドルである。
株式承認証
2023年7月26日、2023年7月の発行について、当社は3人の投資家のために1,377,996株の普通株を購入する若干の 引受権証の発行価格と満期日をそれぞれ1株1ドルから0.165ドルに改訂し、2028年4月28日から2028年7月26日まで とする。
2023年8月2日、8月8日、9月8日、2023年7月に発行された1人の投資家は事前融資権証を行使し、1株0.0001ドルの使用価格で9,471,213株の普通株を購入し、総収益は947ドルであった。
A系列転換可能優先株を償還する
2023年8月3日、当社は1人の投資家と償還契約と株式発行を締結し、その結果、当社は150株のAシリーズ転換優先株及び引受権証を償還し、1株2.00ドルの使用価格で86,250株の普通株を購入し、現金で230,000ドルを支払うことができる。
誘因 割引
2023年9月14日、有限時間インセンティブ要約により、当社の普通株式は0.1357ドルの割引価格で7,121,213件の既存株式承認証を行使した。そのため、同社は7,121,213株の普通株を発行し、加えて7,121,213株の新たな誘導権証を発行し、使用価格は0.1357ドルであり、約966,000ドルの毛収入を得た。新しい誘導権証 は発行6ケ月の周年日から行使することができ、そしてその日から5年間行使することができる。
| F-49 |
5,858,714株普通株式
723,234株普通株Bシリーズ優先株
4,878,875株普通株関連管状株式承認証
5,825,358株普通株式関連公共株式承認証
240,204株普通株式関連私募株式証明書
誘導権証の基礎となる7,121,213株
ZYVERSA 治療会社

普通株 株
目論見書
2023年10月20日