

がん免疫抵抗性に対処する次世代免疫療法の開発 KA(ナスダック)2023年10月別紙99.2

免責事項とその他の情報将来の見通しに関する注意事項このプレゼンテーションには、1995年の民間証券訴訟改革法の意味における「将来の見通しに関する記述」が含まれています。「信じる」、「期待する」、「見積もる」、「プロジェクト」、「意図」、「可能性」、「継続」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「かもしれない」、「できる」などの言葉の使用は、将来の見通しに関する記述を識別することを目的としています。将来の見通しに関する記述は、歴史的事実でも将来の業績を保証するものでもありません。代わりに、キネタの事業の将来、将来の計画と戦略、臨床結果、その他の将来の状況に関するキネタの現在の信念、期待、仮定に基づいています。新しいリスクや不確実性が時折発生する可能性があり、すべてのリスクと不確実性を予測することは不可能です。そのような将来の見通しに関する記述の正確性について、(明示または黙示を問わず)いかなる表明または保証も行われません。このような将来の見通しに関する記述には、キネタの将来の事業を支援するための資本の妥当性(以前に開示された私募の第2トランシェを完了する能力を含む)、臨床試験を首尾よく開始して完了する能力、キネタの製品候補の開発時間とコストの予測の難しさ、キネタの研究計画など、多くの重大なリスクと不確実性が伴いますが、これらに限定されません。、現在および将来の製品候補を開発し、商品化します。KVA12123を含みますが、これらに限定されません。Kinetaが計画している前臨床試験と臨床試験の時期と予想される結果、およびKinetaの前臨床試験と臨床試験の結果が、将来の研究または臨床試験に関連する将来の結果を予測できないリスク、Kinetaの臨床試験からのデータが入手できるタイミング、治験中の新薬申請または新薬申請のタイミングなどを含みますが、これらに限定されません。Kinetaまたはその進行中または計画中の臨床試験の中止または遅延のリスク協力者、Kinetaの製品候補の臨床的有用性、潜在的な利益と市場での受け入れ、Kinetaの商品化、マーケティング、製造能力と戦略、Kinetaの競合他社とその業界に関する開発と予測、政府の法律と規制の影響、Kinetaが計画している規制当局とのやり取りのタイミングと結果、Kinetaの知的財産権の保護能力、将来の収益、費用、資本要件、必要性に関するKinetaの見積もり追加資金調達、2023年4月と2023年10月に完了した登録直接募集による収益の使用目的、および2023年3月31日に証券取引委員会(「SEC」)に提出されたKinetaの最新の年次報告書の「リスク要因」、および2023年5月11日と2023年8月11日にSECに提出されたフォーム10-Qの四半期報告書の「リスク要因」というキャプションに記載されているリスクも Kinetaがその後SECに提出する書類における潜在的なリスク、不確実性、その他の重要な要因についての議論として。将来の見通しに関する記述は、それが作成された日付の時点でのみ述べられています。法律で義務付けられている場合を除き、Kinetaは、新しい情報、将来の出来事、その他の結果として、将来の見通しに関する記述を公に更新または改訂する義務を負いません。

KVA12123:進行した固形腫瘍におけるKVA12123単独またはペムブロリズマブとの併用を評価するTME第1/2相臨床試験におけるVISTA遮断mAb、初期の単剤療法データ:最初の3つのコホート、用量制限毒性なし、90%以上のVISTA受容体占有率枯渇したT細胞に対処するための前臨床抗CD27アゴニストmAbをクリア、第2四半期へのキャッシュランウェイ 2025* 1,030万株の発行済み株式(KA:ナスダック)4Q23:初期単剤療法の有効性データ 2Q24:追加の単剤療法の安全性と有効性データ 2Q24:初期併用療法データ Innate免疫に焦点を当てたパイプライン、期待されるKVA12123 Catalystsの財務状況 Kinetaは、がん免疫抵抗性に対処する次世代免疫療法を開発しています。潜在的なマイルストーン支払い額約13億ドルと純販売パートナーシップのロイヤルティ*には、23年第2四半期現在の780万ドルの現金、23年10月23日の登録による直接決済済みの300万ドル、23年7月23日に受け取った500万ドルのメルクマイルストーン支払い、および24年4月24日に完了する予定の2250万ドルのPIPE融資が含まれます
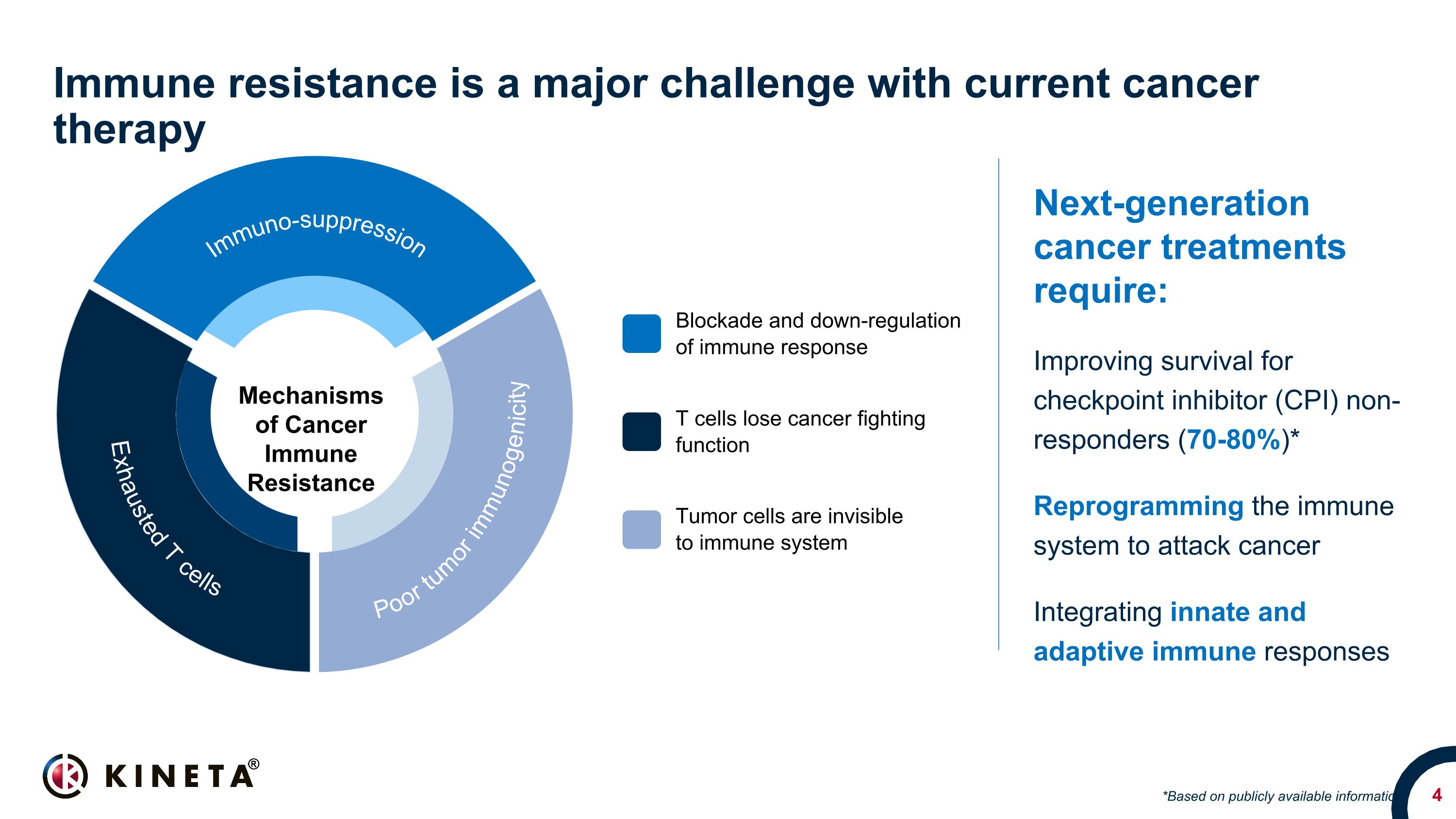
免疫抵抗性は、現在のがん治療における主要な課題です。次世代のがん治療には、チェックポイント阻害薬(CPI)が反応しない人の生存率の向上(70〜80%)*がんを攻撃するための免疫系の再プログラミング自然免疫応答と適応免疫応答の統合*公開されている情報に基づく免疫応答の遮断とダウンレギュレーション T細胞はがんとの闘い機能を失います。がん免疫抵抗性のメカニズム腫瘍細胞は免疫系に見えません。疲れたT細胞は免疫系に見えません。免疫力の低いT細胞。免疫力の低下原性免疫抑制
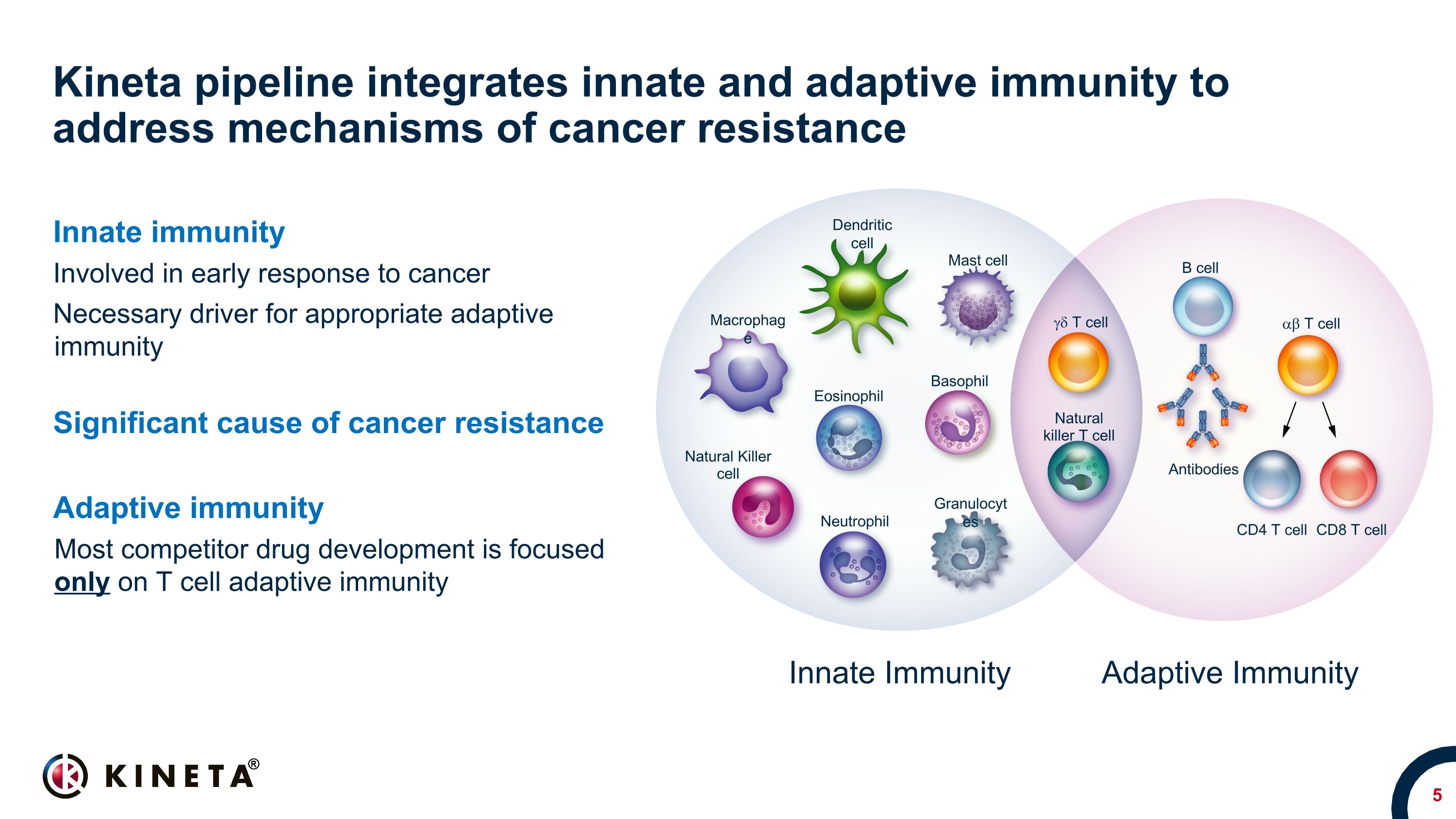
キネタパイプラインは、自然免疫と獲得免疫を統合して、がん抵抗性のメカニズムに対処します。自然免疫には、がんの早期反応に関与します。適切な適応免疫に必要なドライバーがん耐性の重要な原因適応免疫適応免疫適応免疫ほとんどの競合医薬品は、T細胞適応免疫のみに焦点を当てています。自然免疫適応免疫樹状細胞マクロファージマスト細胞好酸球、好酸球、好塩基球、好中球、ナチュラルキラー細胞、顆粒球 B細胞抗体 CD4 T細胞 CD8 T細胞 AB T細胞
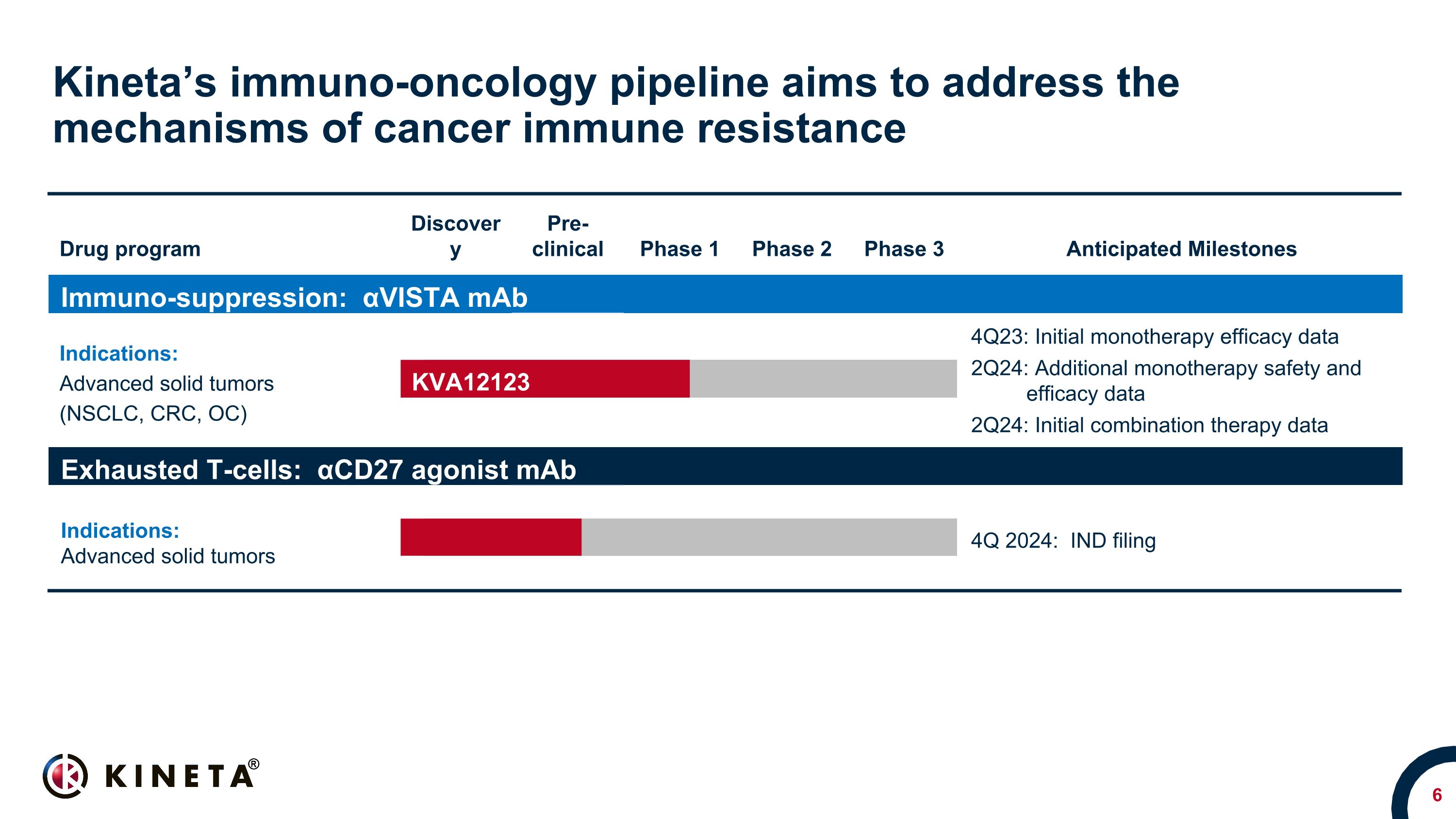
Kinetaの免疫腫瘍学パイプラインは、がん免疫抵抗性のメカニズムに取り組むことを目的としています。薬物プログラムの発見前臨床第1相第2相第3相予想マイルストーン免疫抑制:αVista mAb適応症:進行性固形腫瘍(NSCLC、CRC、OC)進行性固形腫瘍(NSCLC、CRC、OC)、進行性固形腫瘍 NSCLC、CRC、OC、RCC、SCCHN* 4Q23:初期の単剤療法有効性データ 2Q24:単剤療法の安全性と有効性に関するその他のデータ 2Q24: 初期併用療法データ枯渇T細胞:αCD27アゴニストモノクローナル抗体適応症:進行性固形腫瘍進行性固形腫瘍 2024年第4四半期:IND申告 KVA12123

kva12123分化の可能性のあるVISTAブロッキング免疫療法
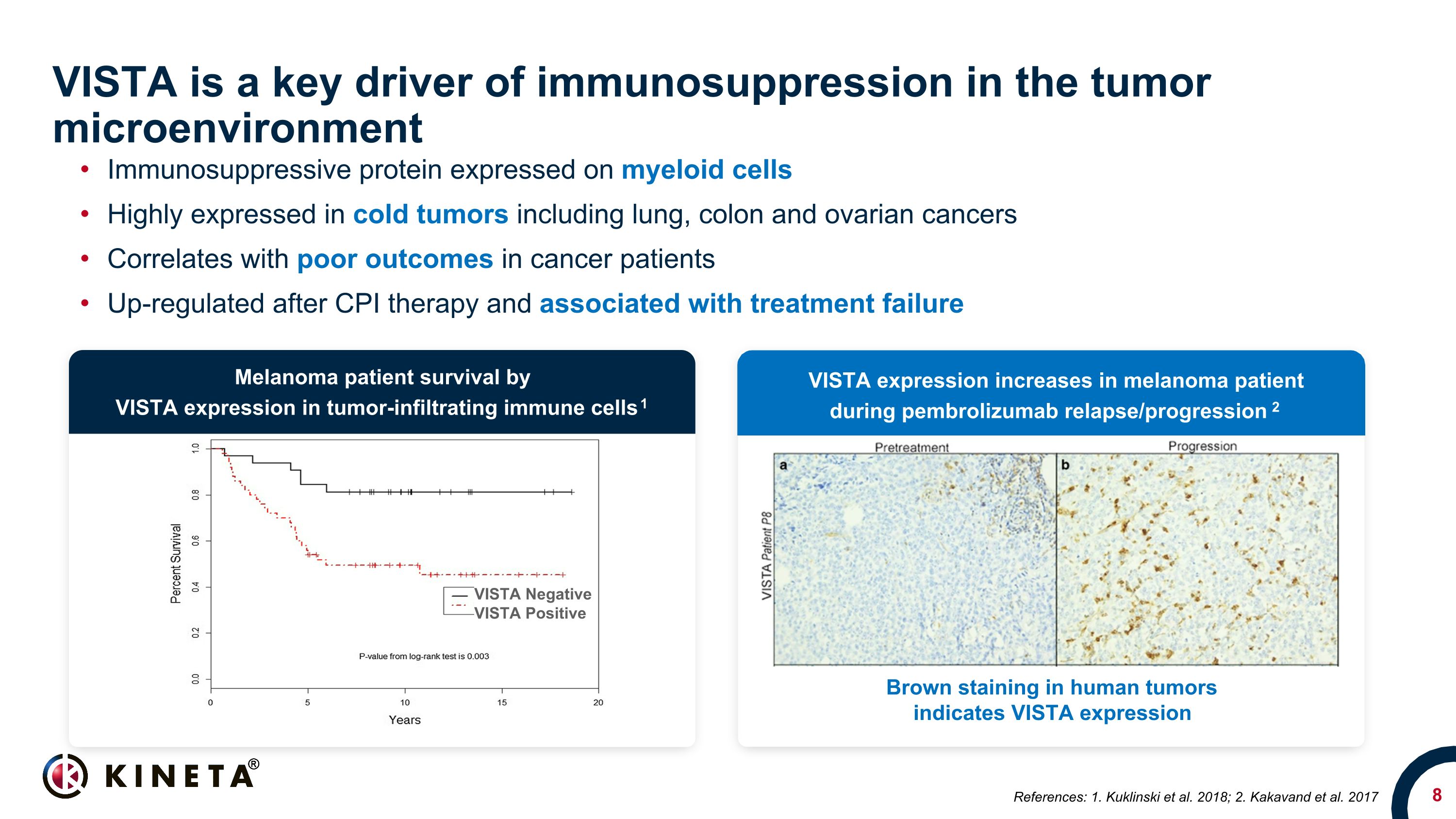
VISTAは、腫瘍微小環境における免疫抑制の主要な推進力です。骨髄性細胞で発現する免疫抑制タンパク質は、肺がん、結腸がん、卵巣がんなどの冷え性腫瘍で高く発現し、がん患者の予後不良と相関し、CPI療法後にアップレギュレートされ、治療失敗と関連しています。ヒトの腫瘍でVISTA陰性褐色染色は、腫瘍浸潤性免疫細胞でのVISTA発現により、VISTA発現黒色腫患者の生存率を示します。ペムブロリズマブ再発時の黒色腫患者の増加/進行状況 2 参考文献:1.ククリンスキーら2018; 2.カカバンドら2017年
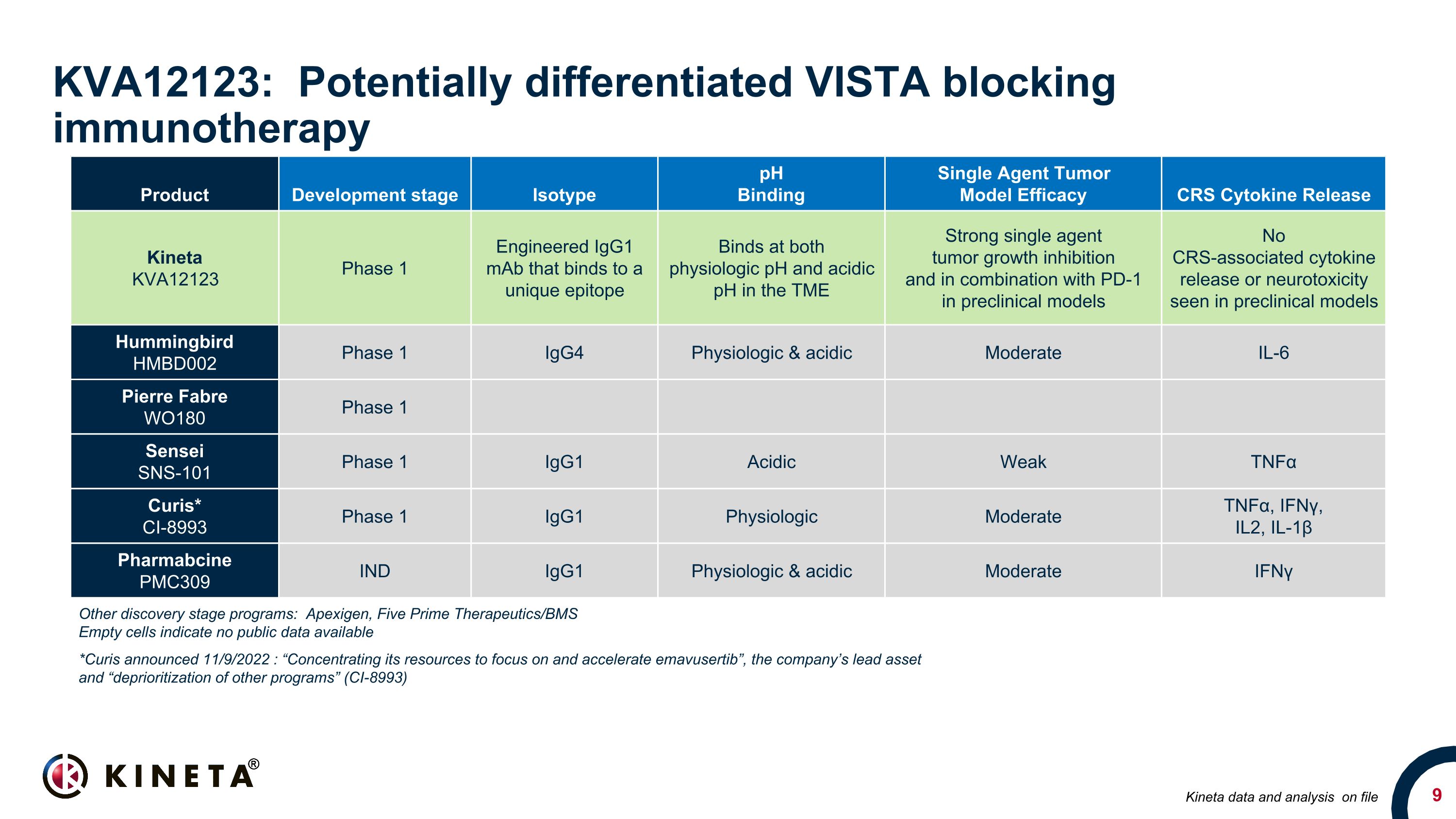
KVA12123:分化する可能性のあるVISTAブロッキング免疫療法製品開発段階アイソタイプpH結合単剤腫瘍モデル有効性 CRSサイトカイン放出キネタ KVA12123 フェーズ1に設計されたIgG1 mAbは、TMEの生理学的pHと酸性pHの両方でユニークなエピトープに結合します。強力な単剤による腫瘍増殖阻害と、前臨床モデルではPD-1との併用で、CRSはありません前臨床モデルに見られる関連サイトカイン放出または神経毒性ハミングバードHMBD002フェーズ1 IgG4 生理学および酸性中等度 IL-6 ピエール・ファーブル WO180 フェーズ1先生SNS-101 フェーズ 1 IgG1 酸性弱TNFαキュリス* CI-8993 フェーズ 1 IgG1 生理学中等度TNFα、IFNγ,IL2、IL-1βファーマバイシン PMC309 IND IgG1 生理学および酸性中等度IFNγその他の発見段階プログラム:アペキシゲン、ファイブプライム治療薬/BMS 空細胞は公開データがないことを示します*Curis 2022年11月9日に発表しました:同社の主要資産である「emavusertibに注力し、加速するためのリソースの集中」と「他のプログラムの優先順位低下」(CI-8993)Kinetaのデータとファイル上の分析
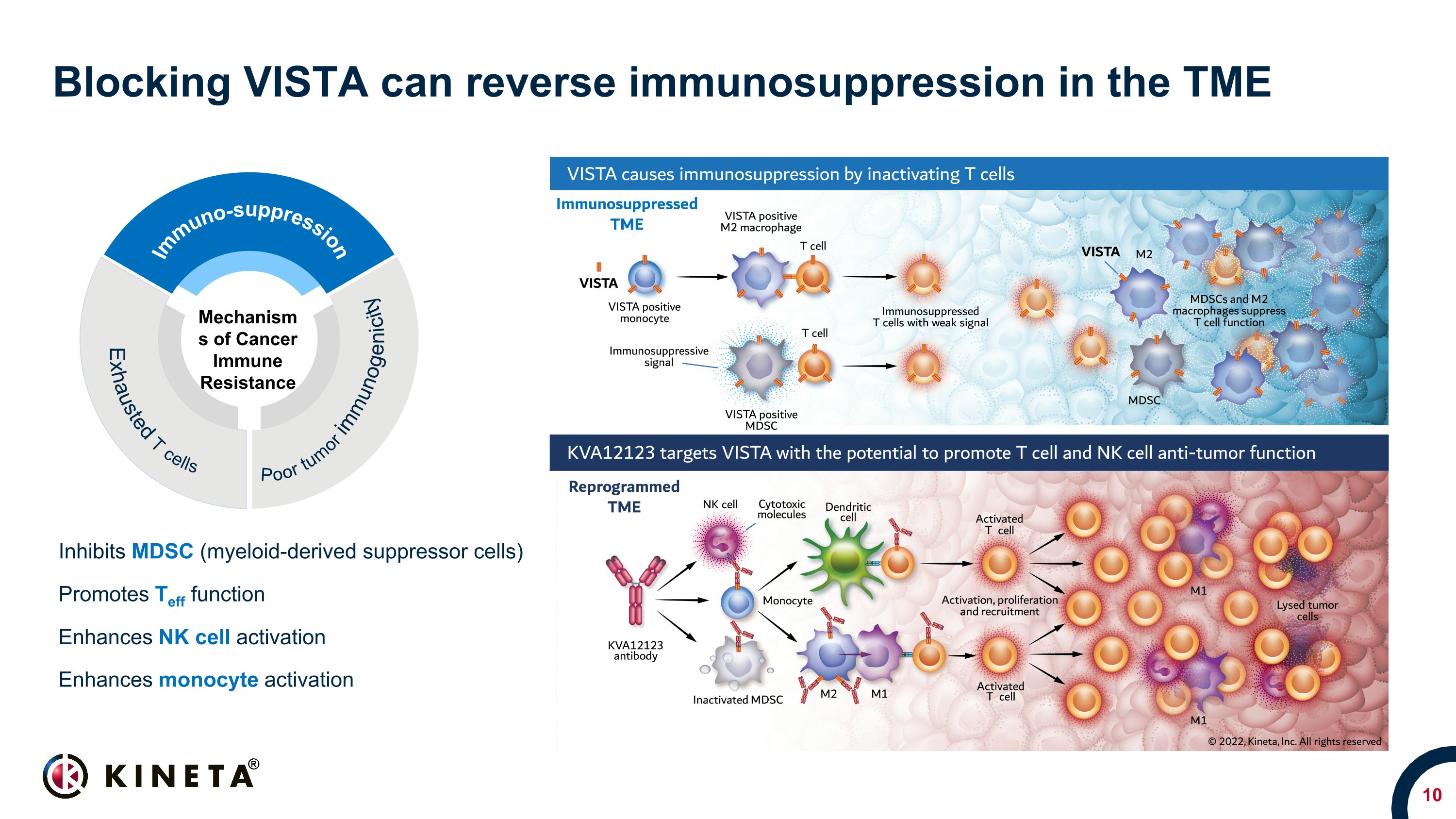
VISTAをブロックすると、TMEの免疫抑制が逆転し、MDSC(骨髄由来抑制細胞)がTeff機能を促進し、NK細胞の活性化を促進します。単球の活性化メカニズムを高めます。免疫抵抗性の単球活性化メカニズムを高めます。免疫抵抗性のT細胞を使い果たします。腫瘍の免疫原性が低い免疫抑制
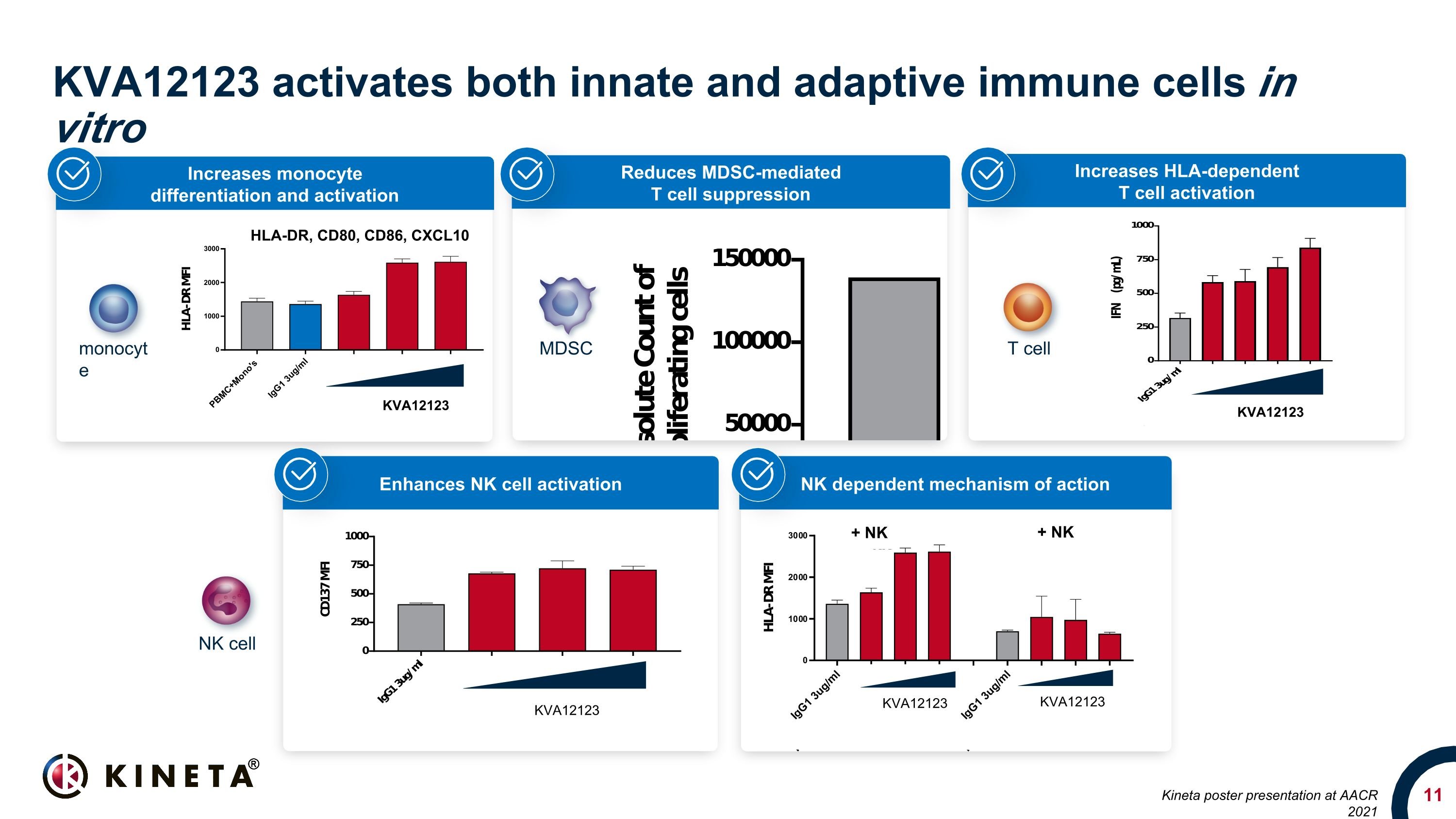
HLA依存性T細胞の活性化を高めます。MDSCを介したT細胞抑制を低下させます。KVA12123は体外で自然免疫細胞と適応免疫細胞の両方を活性化します。HLA-DR、CD80、CD86、CXCL10 KVA12123 KVA12123 KVA12123 NK依存性作用機序はNK細胞の活性化 MDSC T細胞、NK細胞、単球、KVA、KVA、KVA、単球、KVA、KVA 12123 KVA12123 + NK + NK + NK KinetaのAACR 2021でのポスタープレゼンテーション
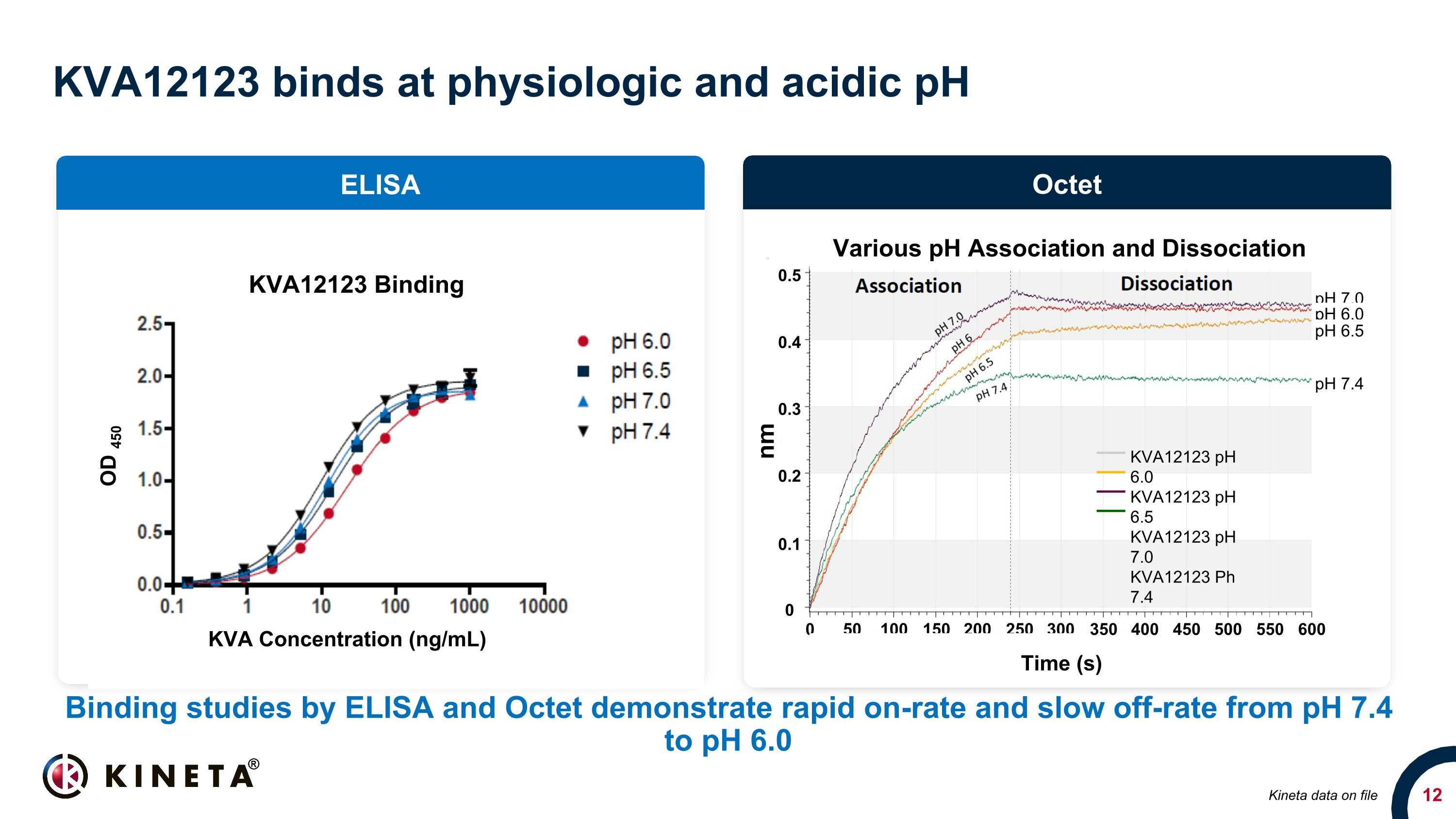
KVA12123は生理学的および酸性のpHに結合します。ELISAとOctetによる結合研究では、pH 7.4からpH 6.0 ELISAオクテットキネタデータファイル0.5 0.4 0.1 0.3 0.2 0 nm 0 50 100 150 200 250 300 時間 (s) 350 400 450 500 550 600 KVA12123 pH 6.0 KVA12123 pH 6.5 KVA12123 pH 6.5 KVA12123 pH 6.5 KVA12123 pH 7.0 KVA1223 pH 7.0 KVA1232 PVA12123 Ph7.4 さまざまなpH結合および解離pH 7.0 pH 6.0 pH 6.5 pH 7.4 KVA12123 結合KVA濃度(ng/mL)OD 450
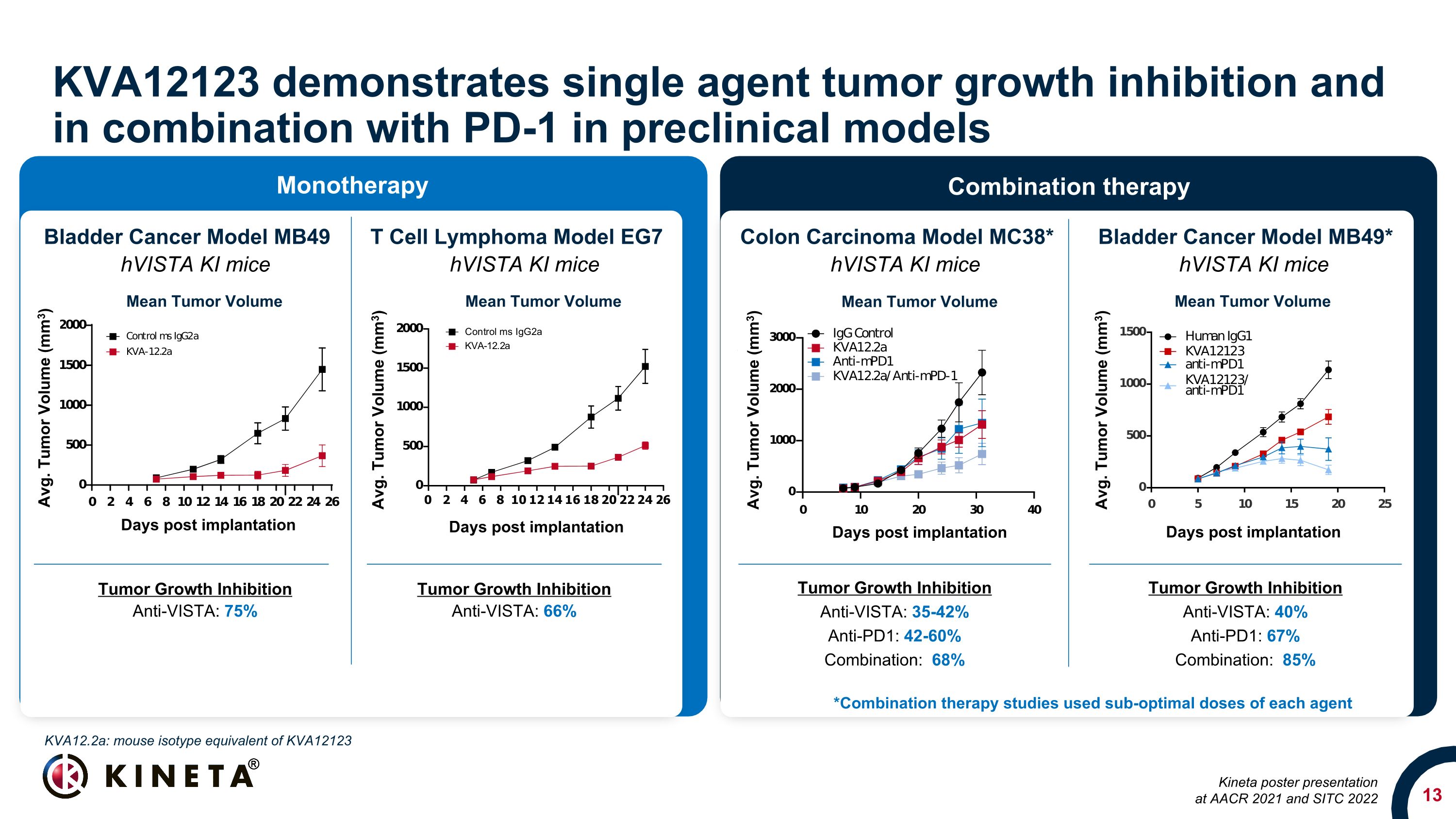
KVA12123は、前臨床モデルで単剤の腫瘍増殖阻害とPD-1との併用を示しています。腫瘍増殖阻害抗Vista:35-42% 抗PD1:42-60% 組み合わせ:68% 結腸がんモデル MC38* 膀胱がんモデル MB49 T細胞リンパ腫モデル EG7 HVista KIマウス HVista KI マウス HVista KI マウス HVista KI マウス HVista KI マウス HVista KI マウス HVista KI マウス腫瘍増殖阻害抗VISTA: 40% 抗PD1:67% 組み合わせ:85% 腫瘍増殖抑制抗Vista: 75% 腫瘍増殖阻害抗Vista: 66% *併用療法の研究では、各薬剤の最適ではない用量が使用されましたKVA12.2a:AACR 2021およびSITC 2022単剤療法併用療法でのKVA12123キネタのポスター発表におけるKVA12123キネタと同等のマウスアイソタイプ同等物、移植後の平均腫瘍体積日数。腫瘍体積(mm3)平均腫瘍体積移植後の平均日数腫瘍の体積(mm3)移植後平均日数腫瘍の体積(mm3)移植後平均日数腫瘍体積(mm3)平均腫瘍体積平均腫瘍体積
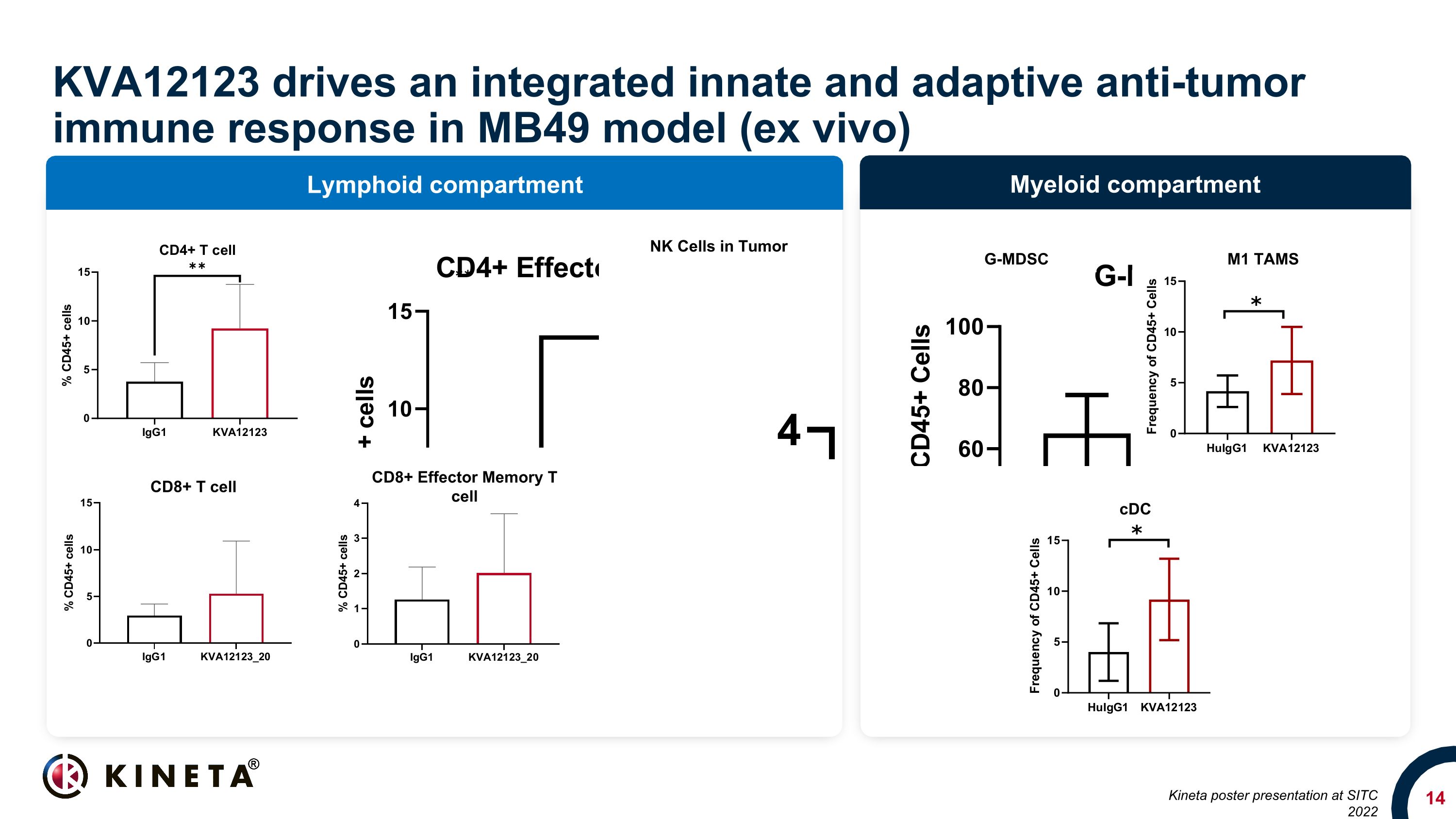
骨髄コンパートメントリンパコンパートメントKVA12123は、MB49モデル(ex vivo)で統合された自然免疫応答と適応抗腫瘍免疫応答を促進します(ex vivo)。腫瘍内のNK細胞 CD8+ T細胞、CD8+、エフェクター、メモリー、T細胞、G-MDSC M1、TAMS、CDC、キネタ、SITC 2022でのポスタープレゼンテーション。

KVA12123は、NHP毒性学研究で忍容性が高いことが確認されています。Kinetaは、最大100 mg/kgのKVA123用量(対象ヒトへの曝露量の100倍以上)で、NHPで複数の単回投与および反復投与毒性学研究を完了しました(明らかな臨床徴候や体重減少なし)治療関連の有害事象なし CRSサイトカインレベル(IL6またはTNFα)の変化はありません。許容される死亡率なし、キネタのデータがファイルにあります
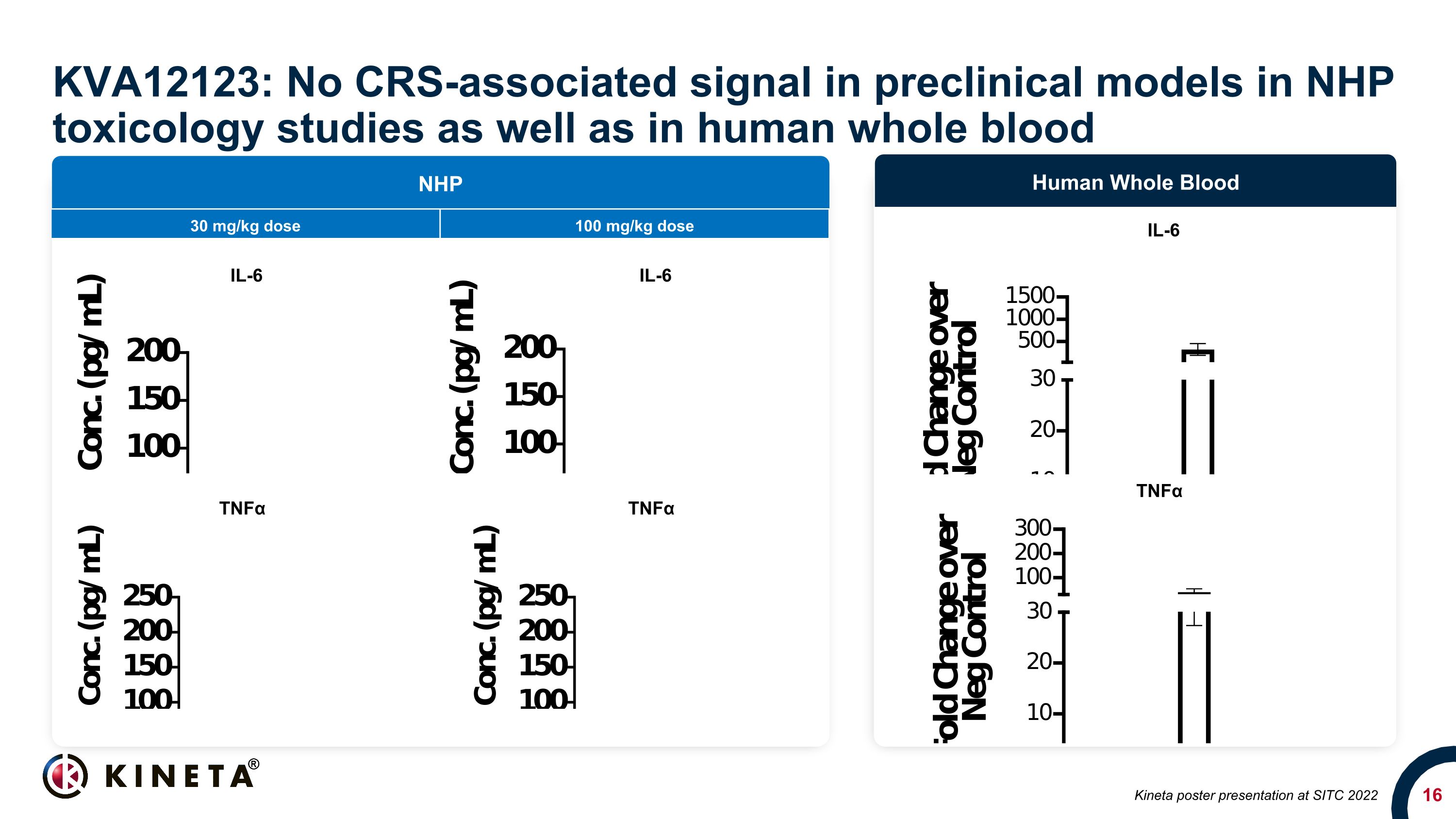
KVA12123: NHP毒物学研究およびヒト全血の前臨床モデルではCRS関連のシグナルはありません(NHP)、ヒト全血、TNFα、TNFα、IL-6 30 mg/kg用量、100 mg/kg用量、TNFα IL-6 Kineta SITC 2022でのポスタープレゼンテーション
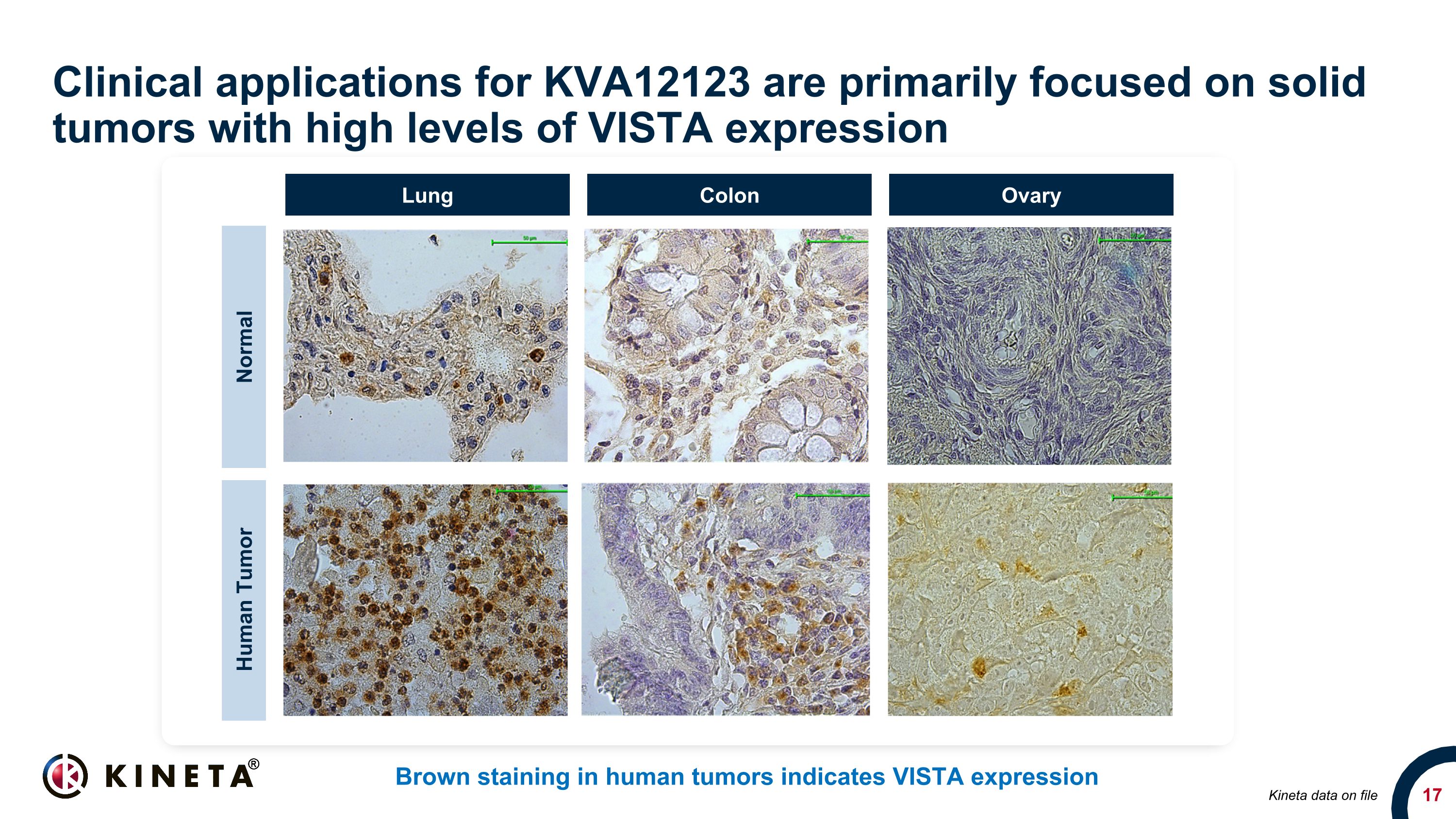
KVA12123の臨床応用は、主にVISTA発現レベルが高い固形腫瘍に焦点を当てています。ヒト腫瘍の褐色染色はVISTA発現を示し、正常ヒト腫瘍の肺結腸卵巣キネタデータは20倍20倍です。
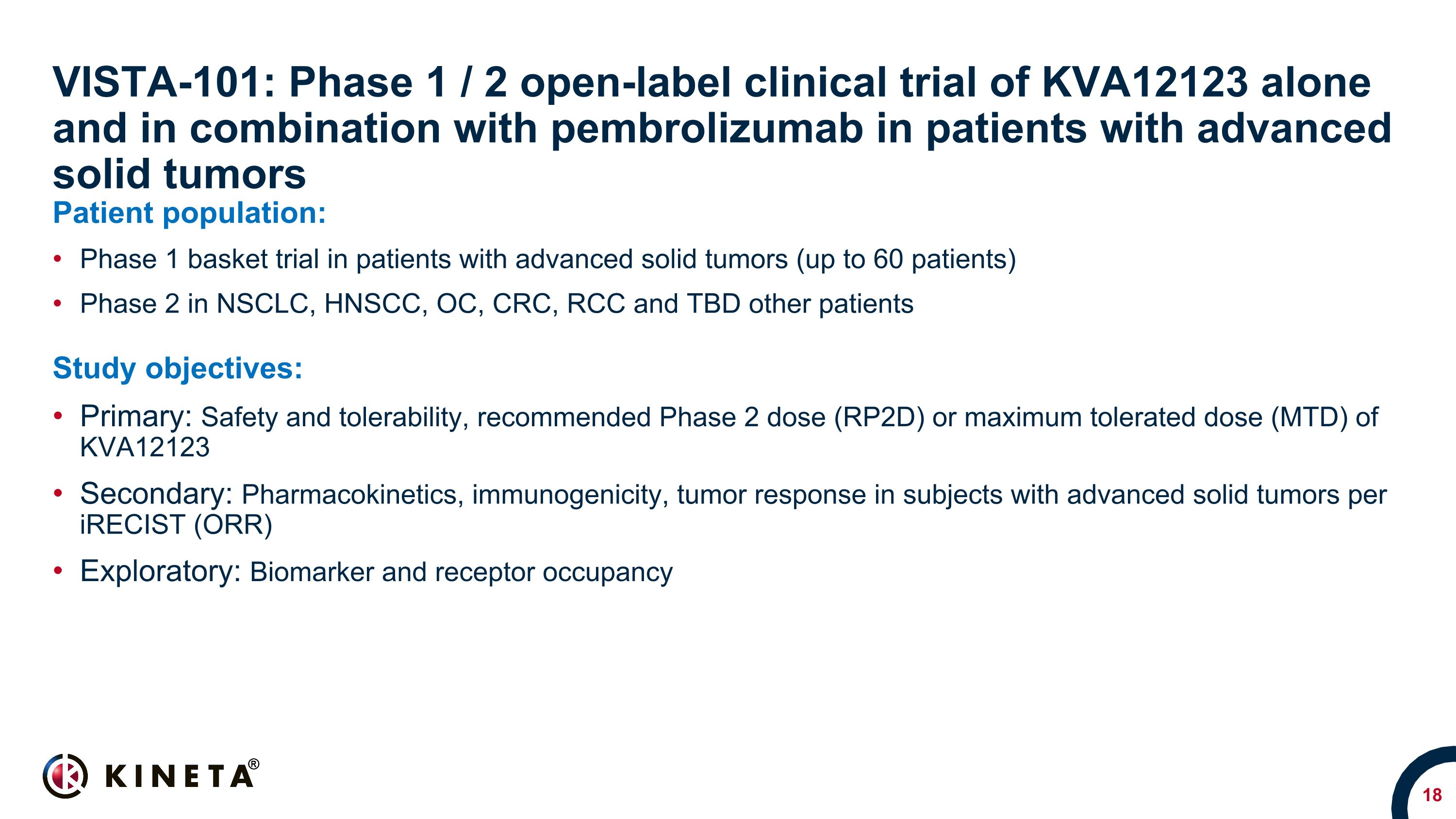
VISTA-101:進行性固形腫瘍患者を対象としたKVA12123単独およびペムブロリズマブとの併用に関する第1/2相非盲検臨床試験患者集団:進行性固形腫瘍患者(最大60人の患者)を対象とした第1相バスケット試験(NSCLC、HNSCC、OC、CRC、RCC、TBDその他の患者を対象とした第2相臨床試験)研究目的:プライマリー:安全性と耐容性、推奨第2相用量(RPP)2D)またはKVA12123の最大耐量(MTD)二次:iRECist(ORR)による進行性固形腫瘍の被験者における薬物動態、免疫原性、腫瘍反応:バイオマーカーと受容体の占有率
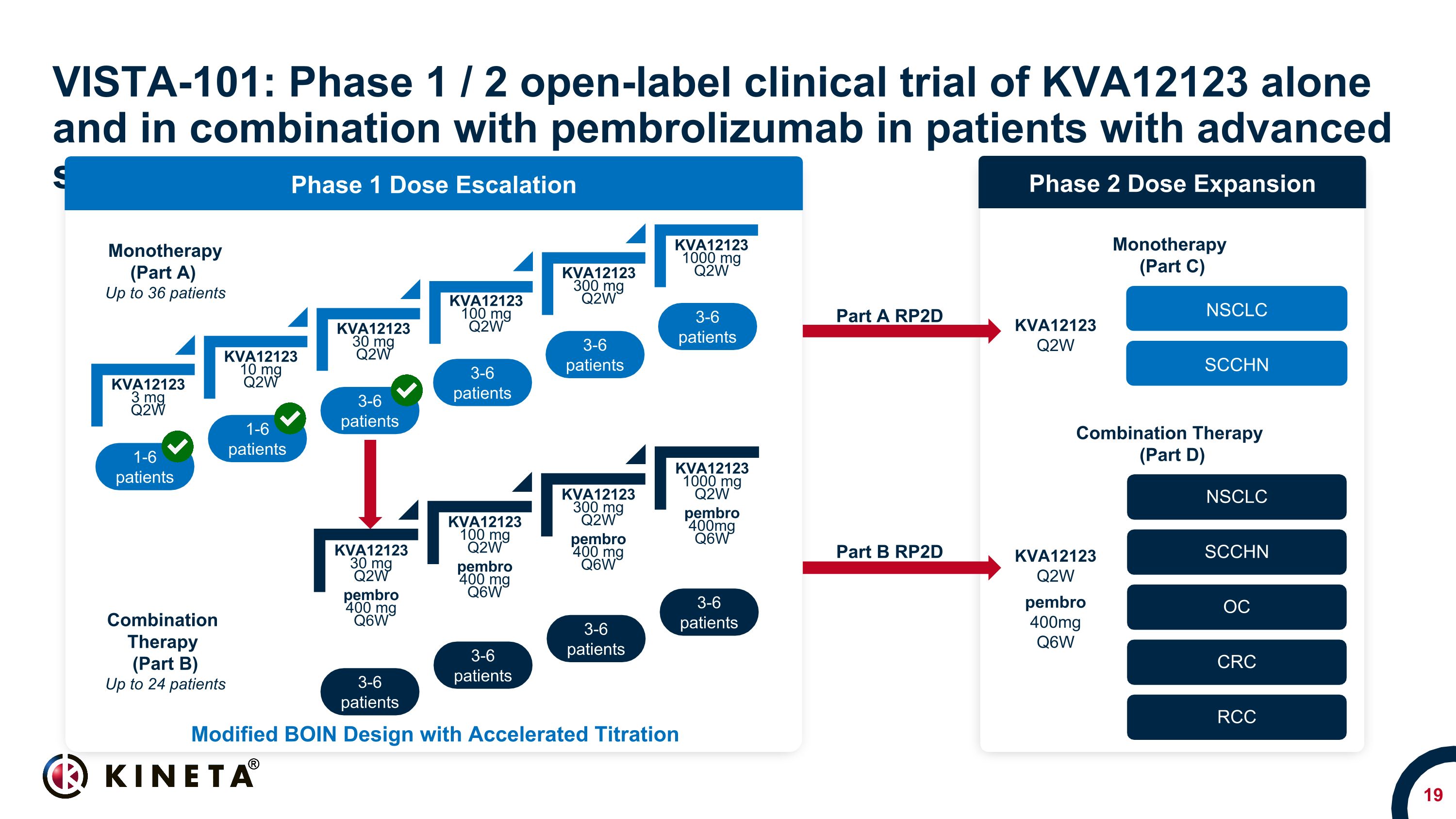
KVA12123 3 mg Q2W KVA12123 10 mg Q2W KVA12123 30 mg Q2W KVA12123 30 mg Q2W KVA12123 300 mg Q2W KVA12123 1000 mg Q2W VISTA-101: 進行性固形腫瘍患者 1-6 人を対象とした KVA12123 単独およびペムブロリズマブとの併用に関する第1/2相非盲検臨床試験 6人の患者 3-6人の患者 3-6人の患者 3-6人の患者 3-6人の患者:第1相用量の漸増3-6人の患者 3-6人の患者:第2相用量の拡大 NSCLC SCCHN OC CRC NSCLC SCCHN単剤療法(パートA)最大36人の患者の併用療法(パートB)最大24人の患者単剤療法(パートC) コンビネーションセラピー (パートD) パートA RP2D パートB RP2D KVA12123 Q2W ペンブロ 400mg Q6W KVA12123 Q2W 加速滴定による改良型BOIN設計 KVA12123 30 mg Q2W KVA12123 100 mg Q2W ペンブロ 400 mg Q6W KVA12123 300 mg Q6W 2W ペンブロ 400 mg Q6W KVA12123 1000 mg Q2W ペンブロ 400mg Q6W
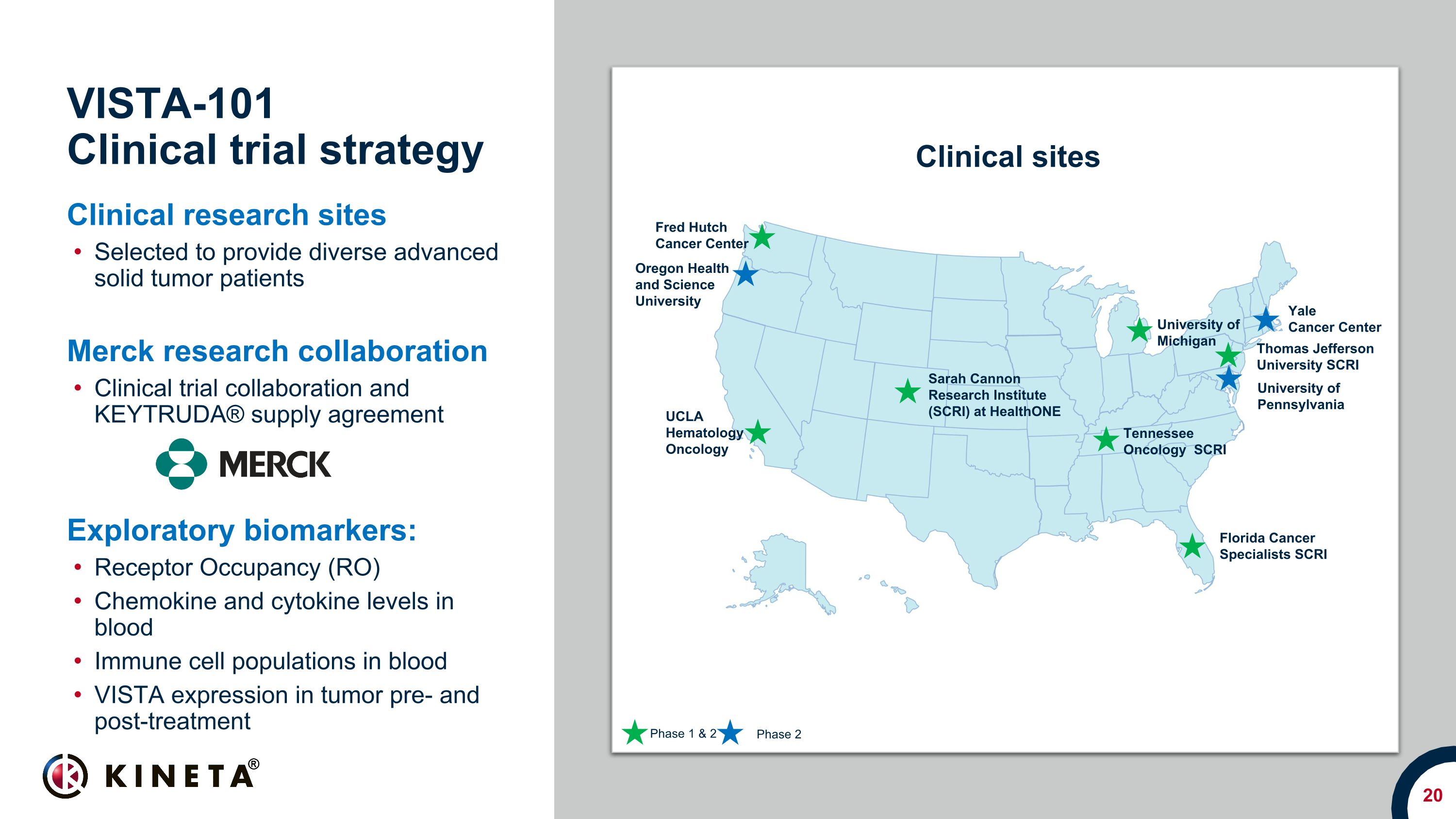
Vista-101臨床試験戦略、臨床研究拠点多様な進行固形腫瘍患者を提供するために選ばれました。メルクの共同研究、臨床試験の協力とKEYTRUDA® 供給契約探索的バイオマーカー:血液中の受容体占有率(RO)、血液中の免疫細胞集団におけるケモカインとサイトカインレベル:治療前と治療後の腫瘍におけるVISTAの発現、オレゴン健康科学大学、ミシガン大学、UCLA血液学、腫瘍学イェールがんセンター、テネシーオンコロジー(SCRI)、臨床施設、ペンシルバニア大学トーマス・ジェファーソン大学SCRI、フロリダがん専門医、SCRI、サラ・キャノン研究所(SCRI)、HealthOne第1相および第2相2

VISTA-101: 最初の3つの単剤療法コホートで確立された安全性プロファイル、薬物動態、受容体占有率単剤療法の用量漸増コホートでは11人の進行性固形腫瘍患者(3、10、または30 mg)患者は化学療法、放射線、免疫療法を含む複数の治療ラインで厳重に前治療されていました。最初の3つの単剤療法コホートすべての用量で耐容性が高く、用量制限はありません結毒性(DLT)が観察されました。CRSまたは炎症誘発性サイトカイン誘導(IL6とTNFα)の証拠は観察されていません任意の用量レベルの薬物動態学および受容体占有率(RO)KVA12123の投与は、30 mgの用量で90%を超えるVISTA ROを達成しました。薬物動態分析では、評価されたすべての用量で薬物曝露が用量比例を超えて増加することが示されました。これは、低用量での標的媒介薬物動態と一致しています
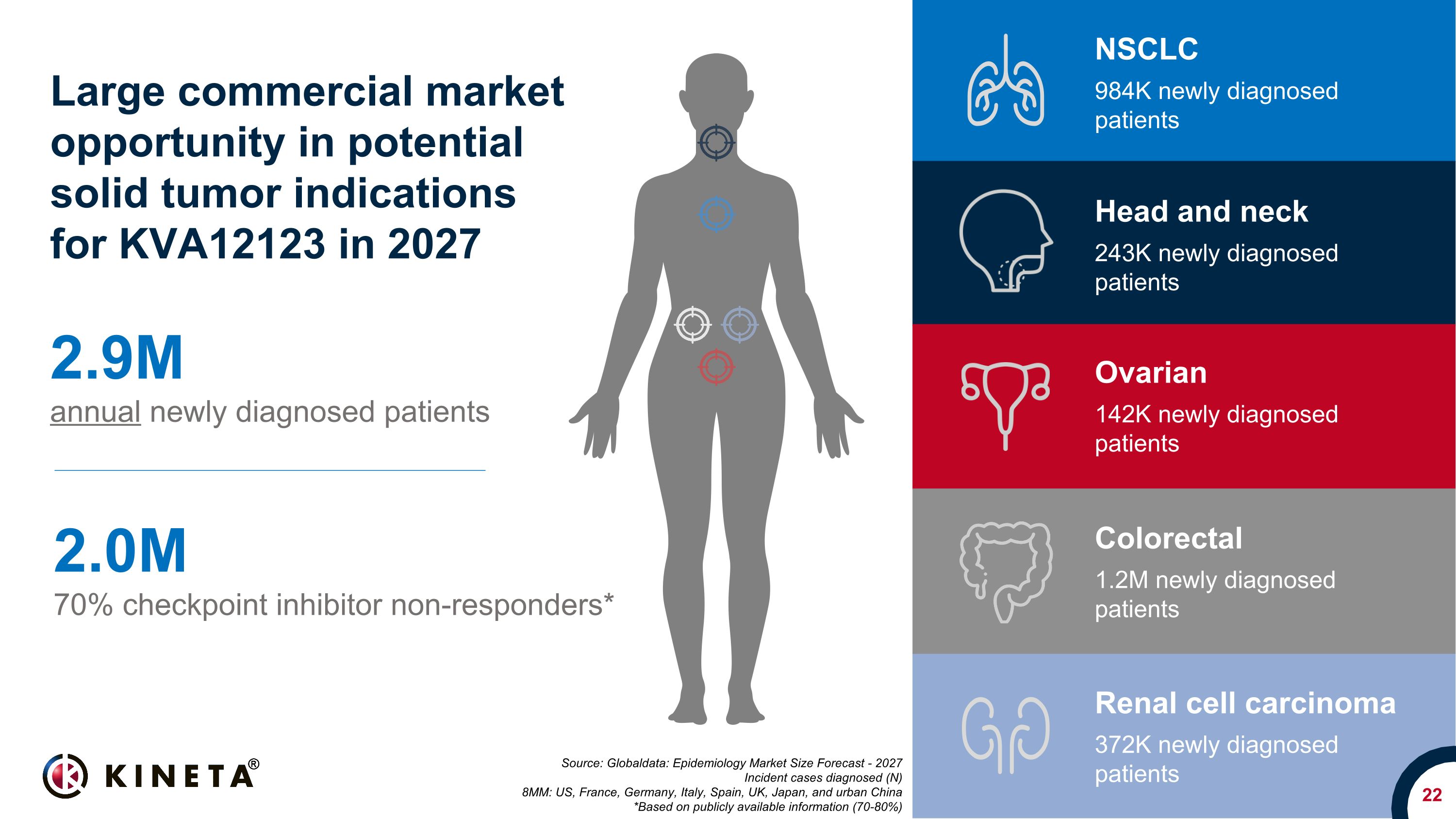
22 出典:グローバルデータ:疫学市場規模予測-2027年の診断されたインシデントケース(N)800万:米国、フランス、ドイツ、イタリア、スペイン、英国、日本、中国都市部 *公開されている情報(70-80%)に基づく年間290万人の新規診断患者 2.0M 70% チェックポイント阻害剤非反応者* 2027年のNSCLにおけるKVA12123の潜在的な固形腫瘍適応症における大規模な商業市場機会 c. 984,000人、新たに診断された患者、結腸直腸で新たに診断された120万人の患者、卵巣の14万2千人、頭頸部、新たに診断された患者243,000人、腎細胞がん、372K新たに診断された患者
抗CD27アゴニストmAb免疫療法
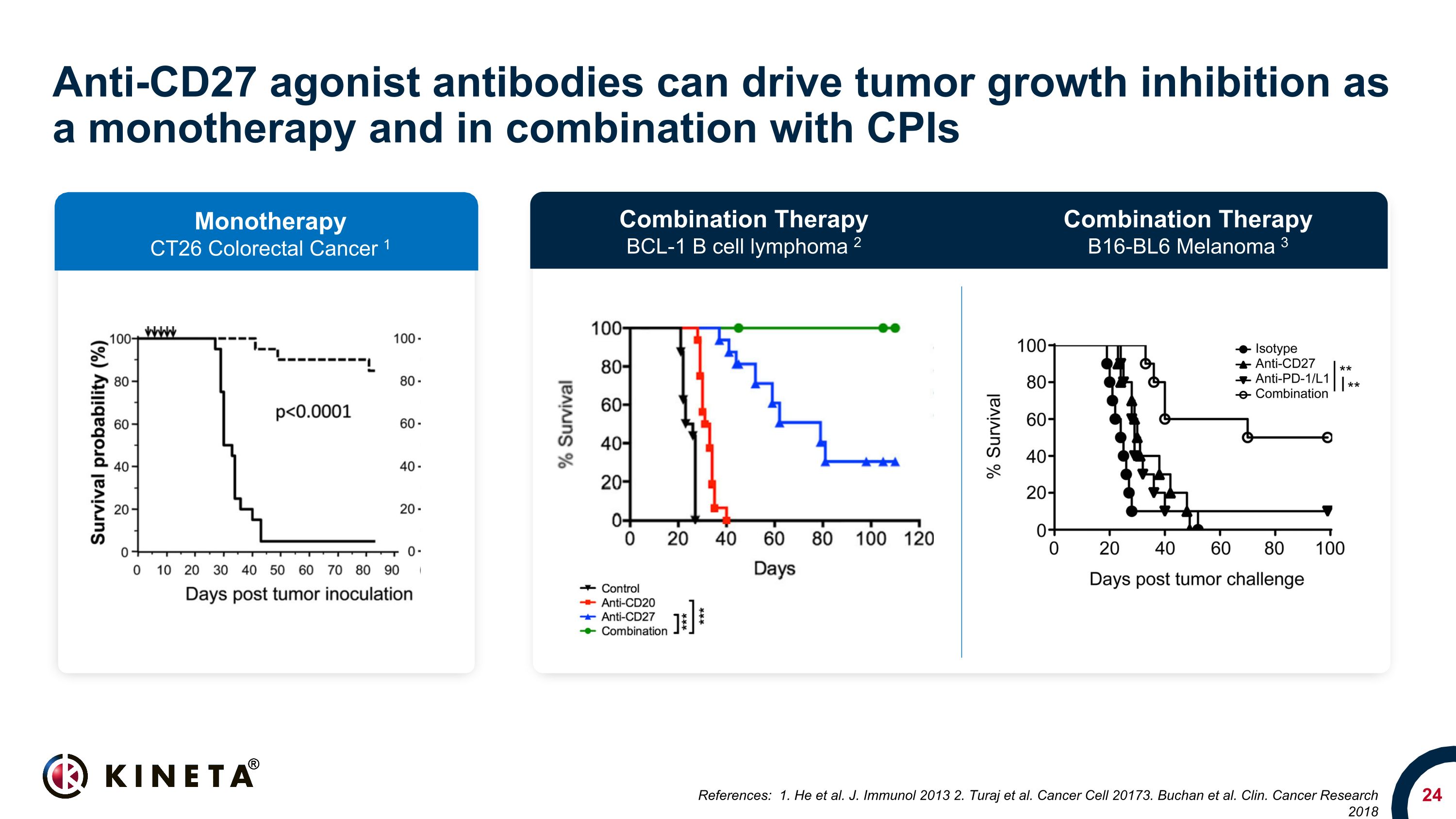
抗CD27アゴニスト抗体は、単剤療法として、またCPIとの併用で腫瘍増殖抑制を促進できます。参考文献:1.彼ら。ジェイ・イムノール 2013 2.Turajら。がん細胞20173。ブッチャン他クリン。がん研究 2018 単剤療法 CT26 大腸がん 1 併用療法 BCL-1 B細胞リンパ腫 2 併用療法 B16-BL6 メラノーマ 3
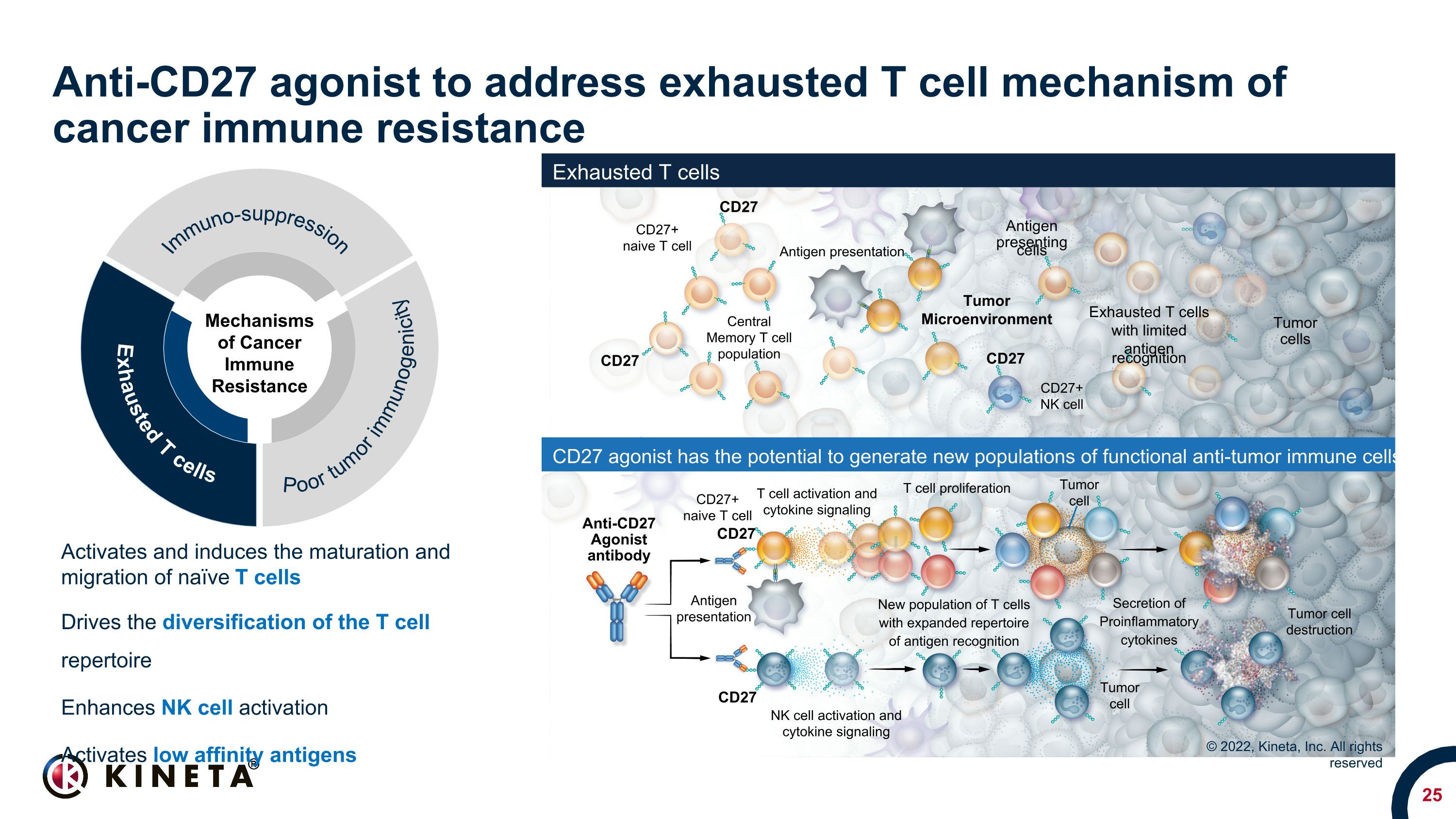
がん免疫抵抗性の枯渇したT細胞メカニズムに対処するための抗CD27アゴニスト枯渇したT細胞 CD27アゴニストは、機能的な抗腫瘍免疫細胞CD27 CD27+ナイーブT細胞 CD27+ NK細胞腫瘍細胞抗原認識が制限されている抗CD27アゴニスト抗体 CD27 T細胞の増殖抗原認識のレパートリーが拡張されたT細胞の新しい集団を生成する可能性があります。腫瘍細胞破壊 CD27 抗原提示細胞 CD27 中央記憶T細胞集団抗原提示抗原提示 CD27+ナイーブT細胞CD27 NK細胞活性化とサイトカインシグナル伝達炎症誘発性サイトカインの分泌腫瘍細胞T細胞の活性化とサイトカインシグナル伝達腫瘍の微小環境は、ナイーブT細胞の活性化と成熟と遊走を活性化し、T細胞レパートリーの多様化を促進します。NK細胞の活性化を促進します。NK細胞の活性化を促進します。低親和性抗原を活性化します © 2022、Kineta, Inc. 抵抗性免疫抑制、腫瘍の免疫原性が低い、枯渇したT細胞
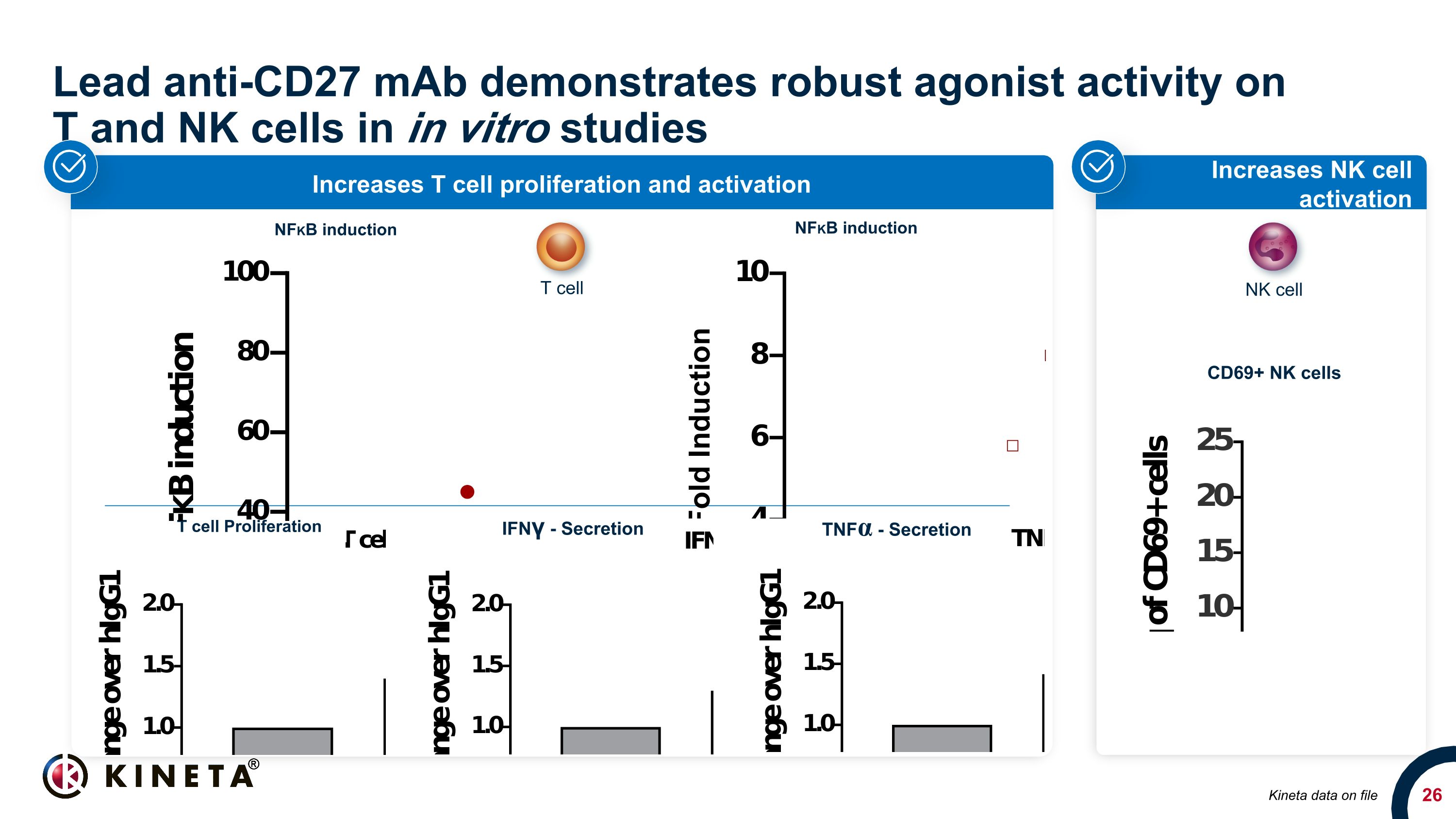
鉛抗CD27 mAbは、インビトロ研究でT細胞とNK細胞に対して強力なアゴニスト活性を示します。NK細胞の活性化を増加させます。T細胞の増殖と活性化を高めます。IFN□-分泌 TNFα-ファイル CD69+ NK細胞上の分泌キネタ、T細胞、NK細胞、NFKBの誘導、NFKBの誘導。

抗CD27リードアゴニストmAbは、前臨床モデルで単剤の腫瘍増殖抑制(TGI)を示します。大腸がんモデルMC38 HUCD27 KIマウス腫瘍増殖抑制リード抗CD27 mAb:61% mMRK131a:単剤療法による移植後日数(mm3)(mm3)
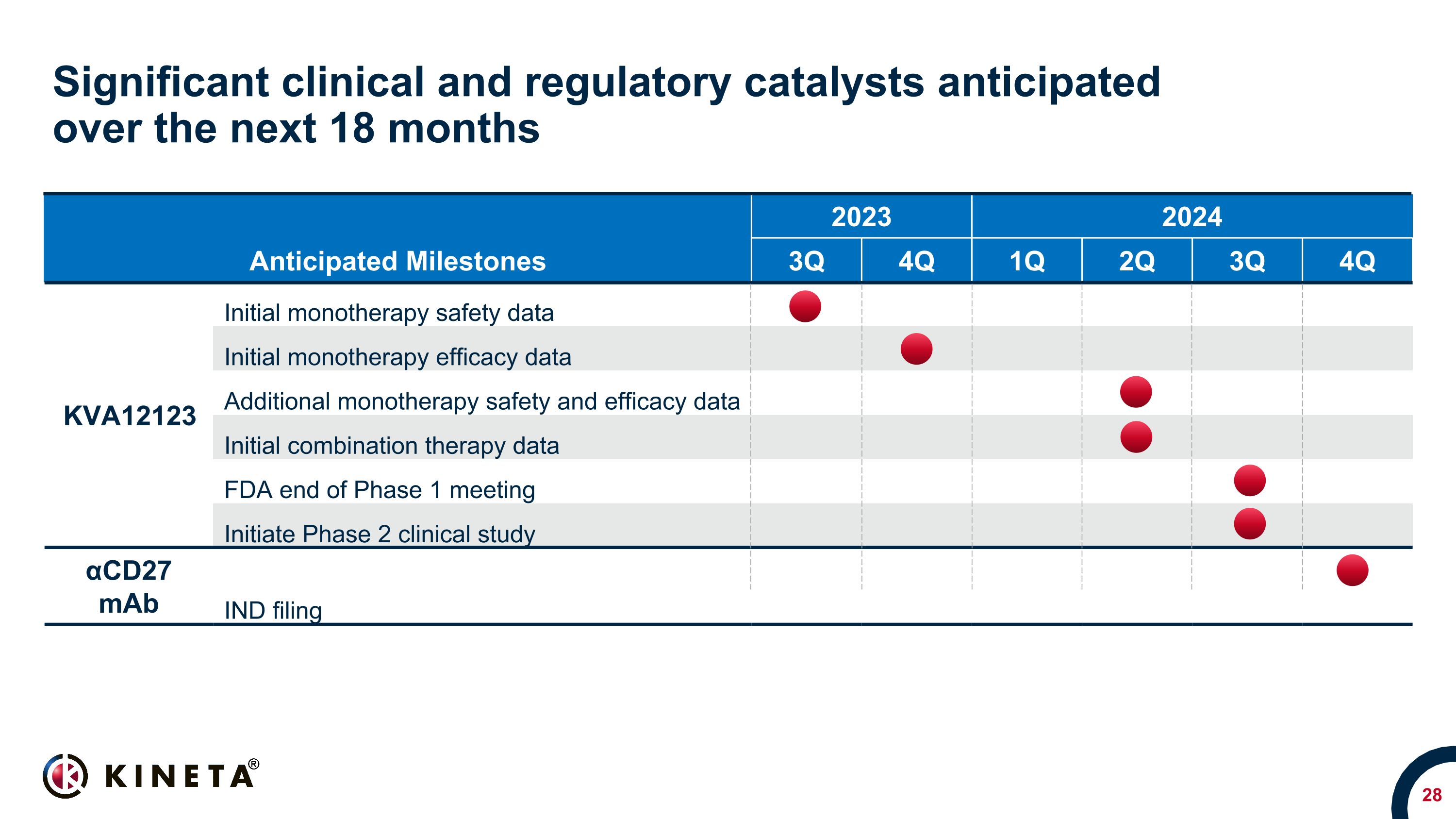
今後18か月間に予想される重要な臨床的および規制上の触媒 2023 2024 2024 3Q 4Q 1Q 2Q 3Q 4Q 4Q 4Q 4Q 4Q 4Q 4Q 4Q 4Q KVA12123 初期単剤療法の有効性データ-追加の単剤療法の安全性と有効性データ-初期の併用療法データ、FDA、第1相会議の終了、第2相臨床試験の開始、αCD27 mAb IND申請

プログラム、神経筋疾患-ALS 腫瘍学、嚢胞性線維症、パートナー、主な取引条件 2023年7月に500万ドルのマイルストーン支払いを受け取りました。マイルストーンの純売上高に対するロイヤルティ最大9600万ドルのマイルストーン純売上高に対するロイヤルティ商業のみのマイルストーンでのロイヤルティ純売上高に対するロイヤルティサブライセンス支払いにおける収益シェア、約13億ドルの潜在的なマイルストーン支払いとロイヤリティ純販売ライセンス契約に関する手数料

ショーン・イアドナート博士、最高経営責任者、ビニー・ヘイレ博士、臨床研究担当副社長、ティエリー・ギヨードゥ博士、最高科学責任者、最高科学責任者、ジャック・ブーシー博士、投資家向け広報・事業開発担当上級執行役員、経験豊富なリーダーシップチーム、クレイグ・フィリップス社長、キース・ベイカー、最高財務責任者、ポーリーン・ケニー、ジェネラル・カウンセル

KVA12123:進行した固形腫瘍におけるKVA12123単独またはペムブロリズマブとの併用を評価するTME第1/2相臨床試験におけるVISTA遮断mAb、初期の単剤療法データ:最初の3つのコホート、用量制限毒性なし、90%以上のVISTA受容体占有率枯渇したT細胞に対処するための前臨床抗CD27アゴニストmAbをクリア、第2四半期へのキャッシュランウェイ 2025* 1,030万株の発行済み株式(KA:ナスダック)4Q23:初期単剤療法の有効性データ 2Q24:追加の単剤療法の安全性と有効性データ 2Q24:初期併用療法データ Innate免疫に焦点を当てたパイプライン、期待されるKVA12123 Catalystsの財務状況 Kinetaは、がん免疫抵抗性に対処する次世代免疫療法を開発しています。潜在的なマイルストーン支払い額約13億ドルと純販売パートナーシップのロイヤルティ*には、23年第2四半期現在の780万ドルの現金、23年10月23日の登録による直接決済済みの300万ドル、23年7月23日に受け取った500万ドルのメルクマイルストーン支払い、および24年4月24日に完了する予定の2250万ドルのPIPE融資が含まれます

がん患者のための次世代免疫療法の開発www.kinetabio.com