nvax-20230630偽2023Q2000100069412/31PY00010006942023-01-012023-06-300001000694DEI: 元アドレスメンバー2023-01-012023-06-3000010006942023-07-31エクセルリ:シェア0001000694米国会計基準:プロダクトメンバー2023-04-012023-06-30ISO 4217: 米ドル0001000694米国会計基準:プロダクトメンバー2022-04-012022-06-300001000694米国会計基準:プロダクトメンバー2023-01-012023-06-300001000694米国会計基準:プロダクトメンバー2022-01-012022-06-300001000694米国会計基準:補助金メンバー2023-04-012023-06-300001000694米国会計基準:補助金メンバー2022-04-012022-06-300001000694米国会計基準:補助金メンバー2023-01-012023-06-300001000694米国会計基準:補助金メンバー2022-01-012022-06-300001000694NVAX: ロイヤリティとその他のメンバー2023-04-012023-06-300001000694NVAX: ロイヤリティとその他のメンバー2022-04-012022-06-300001000694NVAX: ロイヤリティとその他のメンバー2023-01-012023-06-300001000694NVAX: ロイヤリティとその他のメンバー2022-01-012022-06-3000010006942023-04-012023-06-3000010006942022-04-012022-06-3000010006942022-01-012022-06-30ISO 4217: 米ドルエクセルリ:シェア00010006942023-06-3000010006942022-12-310001000694米国会計基準:普通株式会員2023-03-310001000694米国会計基準:追加払込資本構成員2023-03-310001000694米国会計基準:利益剰余金メンバー2023-03-310001000694米国会計基準:米国財務省株式普通会員2023-03-310001000694米国会計基準:その他の包括利益の累計メンバー2023-03-3100010006942023-03-310001000694米国会計基準:追加払込資本構成員2023-04-012023-06-300001000694米国会計基準:普通株式会員2023-04-012023-06-300001000694米国会計基準:米国財務省株式普通会員2023-04-012023-06-300001000694米国会計基準:その他の包括利益の累計メンバー2023-04-012023-06-300001000694米国会計基準:利益剰余金メンバー2023-04-012023-06-300001000694米国会計基準:普通株式会員2023-06-300001000694米国会計基準:追加払込資本構成員2023-06-300001000694米国会計基準:利益剰余金メンバー2023-06-300001000694米国会計基準:米国財務省株式普通会員2023-06-300001000694米国会計基準:その他の包括利益の累計メンバー2023-06-300001000694米国会計基準:普通株式会員2022-03-310001000694米国会計基準:追加払込資本構成員2022-03-310001000694米国会計基準:利益剰余金メンバー2022-03-310001000694米国会計基準:米国財務省株式普通会員2022-03-310001000694米国会計基準:その他の包括利益の累計メンバー2022-03-3100010006942022-03-310001000694米国会計基準:追加払込資本構成員2022-04-012022-06-300001000694米国会計基準:普通株式会員2022-04-012022-06-300001000694米国会計基準:米国財務省株式普通会員2022-04-012022-06-300001000694米国会計基準:その他の包括利益の累計メンバー2022-04-012022-06-300001000694米国会計基準:利益剰余金メンバー2022-04-012022-06-300001000694米国会計基準:普通株式会員2022-06-300001000694米国会計基準:追加払込資本構成員2022-06-300001000694米国会計基準:利益剰余金メンバー2022-06-300001000694米国会計基準:米国財務省株式普通会員2022-06-300001000694米国会計基準:その他の包括利益の累計メンバー2022-06-3000010006942022-06-300001000694米国会計基準:普通株式会員2022-12-310001000694米国会計基準:追加払込資本構成員2022-12-310001000694米国会計基準:利益剰余金メンバー2022-12-310001000694米国会計基準:米国財務省株式普通会員2022-12-310001000694米国会計基準:その他の包括利益の累計メンバー2022-12-310001000694米国会計基準:追加払込資本構成員2023-01-012023-06-300001000694米国会計基準:普通株式会員2023-01-012023-06-300001000694米国会計基準:米国財務省株式普通会員2023-01-012023-06-300001000694米国会計基準:その他の包括利益の累計メンバー2023-01-012023-06-300001000694米国会計基準:利益剰余金メンバー2023-01-012023-06-300001000694米国会計基準:普通株式会員2021-12-310001000694米国会計基準:追加払込資本構成員2021-12-310001000694米国会計基準:利益剰余金メンバー2021-12-310001000694米国会計基準:米国財務省株式普通会員2021-12-310001000694米国会計基準:その他の包括利益の累計メンバー2021-12-3100010006942021-12-310001000694米国会計基準:追加払込資本構成員2022-01-012022-06-300001000694米国会計基準:普通株式会員2022-01-012022-06-300001000694米国会計基準:米国財務省株式普通会員2022-01-012022-06-300001000694米国会計基準:その他の包括利益の累計メンバー2022-01-012022-06-300001000694米国会計基準:利益剰余金メンバー2022-01-012022-06-30NVAX: セグメント0001000694米国会計基準:後任イベントメンバーNVAX: カナダ事前購入契約メンバー2023-07-012023-07-310001000694NVAX: カナダ事前購入契約メンバー2023-01-012023-06-30nvax: メンバー0001000694NVAX:予防接種と予防接種に関する合同委員会JCVIメンバー2023-06-300001000694米国会計基準:政府契約メンバーNVAX: 米国政府協定加盟国2023-06-300001000694NVAX: GAVI事前購入契約 Covaxファシリティメンバー2023-06-3000010006942023-05-012023-05-31エクセルリ:ピュア0001000694NVAX: GAVI事前購入契約 IIPLメンバー2023-06-30NVAX: 投与量0001000694NVAX: GAVI事前購入契約 Covaxファシリティメンバー2022-11-180001000694NVAX: GAVI事前購入契約 IIPLメンバー2021-12-310001000694NVAX: GAVI事前購入契約 IIPLメンバー2022-12-310001000694SRT: 北米メンバー米国会計基準:プロダクトメンバー2023-04-012023-06-300001000694SRT: 北米メンバー米国会計基準:プロダクトメンバー2022-04-012022-06-300001000694SRT: 北米メンバー米国会計基準:プロダクトメンバー2023-01-012023-06-300001000694SRT: 北米メンバー米国会計基準:プロダクトメンバー2022-01-012022-06-300001000694SRT: ヨーロッパメンバー米国会計基準:プロダクトメンバー2023-04-012023-06-300001000694SRT: ヨーロッパメンバー米国会計基準:プロダクトメンバー2022-04-012022-06-300001000694SRT: ヨーロッパメンバー米国会計基準:プロダクトメンバー2023-01-012023-06-300001000694SRT: ヨーロッパメンバー米国会計基準:プロダクトメンバー2022-01-012022-06-300001000694NVAX: 世界のその他のメンバー米国会計基準:プロダクトメンバー2023-04-012023-06-300001000694NVAX: 世界のその他のメンバー米国会計基準:プロダクトメンバー2022-04-012022-06-300001000694NVAX: 世界のその他のメンバー米国会計基準:プロダクトメンバー2023-01-012023-06-300001000694NVAX: 世界のその他のメンバー米国会計基準:プロダクトメンバー2022-01-012022-06-300001000694NVAX: カナダ事前購入契約メンバー2023-06-30NVAX: 分割払い0001000694NVAX: 米国政府パートナーシップメンバー2023-06-300001000694NVAX: 米国政府パートナーシップメンバー2023-01-012023-06-300001000694NVAX: 売上ベースのロイヤリティメンバー2023-04-012023-06-300001000694NVAX: 売上ベースのロイヤリティメンバー2023-01-012023-06-300001000694NVAX: 売上ベースのロイヤリティメンバー国:日本2022-04-012022-06-300001000694NVAX: 売上ベースのロイヤリティメンバー国:日本2022-01-012022-06-300001000694NVAX: 売上ベースのロイヤリティメンバー2022-04-012022-06-300001000694NVAX: 売上ベースのロイヤリティメンバー2022-01-012022-06-300001000694NVAX: 武田アレンジメントメンバー2021-09-300001000694NVAX: 決済契約メンバー2022-09-300001000694米国会計基準:未払負債メンバーNVAX: 決済契約メンバー2023-06-300001000694NVAX: 決済契約メンバー2023-06-300001000694NVAX: 決済契約メンバー2023-01-012023-06-300001000694US-GAAP: マネー・マーケット・ファンド・メンバー米国会計基準:フェアバリューインプットレベル1メンバー2023-06-300001000694US-GAAP: マネー・マーケット・ファンド・メンバー米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2023-06-300001000694US-GAAP: マネー・マーケット・ファンド・メンバー米国会計基準:フェアバリューインプットレベル1メンバー2022-12-310001000694US-GAAP: マネー・マーケット・ファンド・メンバー米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバーUS-GAAP: マネー・マーケット・ファンド・メンバー2022-12-310001000694NVAX: 政府支援証券メンバー米国会計基準:フェアバリューインプットレベル1メンバー2023-06-300001000694NVAX: 政府支援証券メンバー米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバーNVAX: 政府支援証券メンバー2023-06-300001000694NVAX: 政府支援証券メンバー米国会計基準:フェアバリューインプットレベル1メンバー2022-12-310001000694NVAX: 政府支援証券メンバー米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバーNVAX: 政府支援証券メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:企業債務証券メンバー2023-06-300001000694米国会計基準:企業債務証券メンバー米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:企業債務証券メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル1メンバー米国会計基準:企業債務証券メンバー2022-12-310001000694米国会計基準:企業債務証券メンバー米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:企業債務証券メンバー2022-12-310001000694米国会計基準:米国政府機関債務証券メンバー米国会計基準:フェアバリューインプットレベル1メンバー2023-06-300001000694米国会計基準:米国政府機関債務証券メンバー米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:米国政府機関債務証券メンバー2023-06-300001000694米国会計基準:米国政府機関債務証券メンバー米国会計基準:フェアバリューインプットレベル1メンバー2022-12-310001000694米国会計基準:米国政府機関債務証券メンバー米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバー米国会計基準:米国政府機関債務証券メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル1メンバー2023-06-300001000694米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル1メンバー2022-12-310001000694米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバー2022-12-310001000694米国会計基準:無担保債務メンバーNVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け2023-06-300001000694米国会計基準:フェアバリューインプットレベル1メンバーNVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け2023-06-300001000694NVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバーNVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け2023-06-300001000694米国会計基準:フェアバリューインプットレベル1メンバーNVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け2022-12-310001000694NVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバーNVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け2022-12-310001000694NVAX: 2023年締切の転換社証のスリーポイント75枚、メンバー米国会計基準:無担保債務メンバー2023-06-300001000694NVAX: 2023年期限のコンバーチブルノート7ポイント5ポイント会員向け米国会計基準:フェアバリューインプットレベル1メンバー2023-06-300001000694NVAX: 2023年期限のコンバーチブルノート7ポイント5ポイント会員向け米国会計基準:公正価値インプットレベル2メンバー2023-06-300001000694米国会計基準:フェアバリューインプットレベル3メンバーNVAX: 2023年期限のコンバーチブルノート7ポイント5ポイント会員向け2023-06-300001000694NVAX: 2023年期限のコンバーチブルノート7ポイント5ポイント会員向け米国会計基準:フェアバリューインプットレベル1メンバー2022-12-310001000694NVAX: 2023年期限のコンバーチブルノート7ポイント5ポイント会員向け米国会計基準:公正価値インプットレベル2メンバー2022-12-310001000694米国会計基準:フェアバリューインプットレベル3メンバーNVAX: 2023年期限のコンバーチブルノート7ポイント5ポイント会員向け2022-12-3100010006942022-01-012022-12-31NVAX: レポートユニット0001000694NVAX: 決済メンバー2023-04-012023-06-300001000694NVAX: 2023年締切の転換社証のスリーポイント75枚、メンバー米国会計基準:無担保債務メンバー2022-12-310001000694米国会計基準:無担保債務メンバーNVAX: 2027年までに5ポイントのゼロ・コンバーチブル・ノートを期限とする会員向け2022-12-310001000694NVAX: 2023年締切の転換社証のスリーポイント75枚、メンバー米国会計基準:無担保債務メンバー2023-02-012023-02-280001000694米国会計基準:普通株式会員NVAX:2021年6月販売契約メンバー2021-06-300001000694米国会計基準:普通株式会員NVAX:2021年6月販売契約メンバー2023-01-012023-06-300001000694米国会計基準:普通株式会員NVAX:2021年6月販売契約メンバー2023-04-012023-06-300001000694米国会計基準:普通株式会員NVAX:2021年6月販売契約メンバー2023-06-300001000694米国会計基準:普通株式会員NVAX:2021年6月販売契約メンバー2022-01-012022-06-300001000694NVAX: 二千二十三株誘因プランのメンバー2023-01-310001000694NVAX: 二千二十三株誘因プランのメンバー2023-06-300001000694NVAX: 2千15株インセンティブプランのメンバー2023-06-300001000694NVAX: 2千15株インセンティブプランのメンバー2015-06-012015-06-300001000694NVAX: 2千15株インセンティブプランのメンバー2015-06-300001000694NVAX: 2千15株インセンティブプランのメンバーSRT: 最低メンバー数2015-06-012015-06-300001000694NVAX: 2千15株インセンティブプランのメンバーSRT: 最大メンバー数2015-06-012015-06-300001000694米国会計基準:売上原価メンバー2023-04-012023-06-300001000694米国会計基準:売上原価メンバー2022-04-012022-06-300001000694米国会計基準:売上原価メンバー2023-01-012023-06-300001000694米国会計基準:売上原価メンバー2022-01-012022-06-300001000694米国会計基準:研究開発費メンバー2023-04-012023-06-300001000694米国会計基準:研究開発費メンバー2022-04-012022-06-300001000694米国会計基準:研究開発費メンバー2023-01-012023-06-300001000694米国会計基準:研究開発費メンバー2022-01-012022-06-300001000694米国会計基準:一般管理費の売上メンバー2023-04-012023-06-300001000694米国会計基準:一般管理費の売上メンバー2022-04-012022-06-300001000694米国会計基準:一般管理費の売上メンバー2023-01-012023-06-300001000694米国会計基準:一般管理費の売上メンバー2022-01-012022-06-300001000694NVAX: 二千二十三株誘因プランのメンバー2022-12-310001000694NVAX: 2千15株インセンティブプランのメンバー2022-12-310001000694NVAX: 二千五株インセンティブプランのメンバー2022-12-310001000694NVAX: 二千二十三株誘因プランのメンバー2023-01-012023-06-300001000694NVAX: 2千15株インセンティブプランのメンバー2023-01-012023-06-300001000694NVAX: 二千五株インセンティブプランのメンバー2023-01-012023-06-300001000694NVAX: 二千五株インセンティブプランのメンバー2023-06-300001000694米国会計基準:従業員ストックオプションメンバー2023-04-012023-06-300001000694米国会計基準:従業員ストックオプションメンバー2022-04-012022-06-300001000694米国会計基準:従業員ストックオプションメンバー2023-01-012023-06-300001000694米国会計基準:従業員ストックオプションメンバー2022-01-012022-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最低メンバー数2023-04-012023-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最大メンバー数2023-04-012023-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最低メンバー数2022-04-012022-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最大メンバー数2022-04-012022-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最低メンバー数2023-01-012023-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最大メンバー数2023-01-012023-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最低メンバー数2022-01-012022-06-300001000694米国会計基準:従業員ストックオプションメンバーSRT: 最大メンバー数2022-01-012022-06-300001000694米国会計基準:RSU 加盟国の制限付株式単位NVAX: 二千二十三株誘因プランのメンバー2022-12-310001000694NVAX: 2千15株インセンティブプランのメンバー米国会計基準:RSU 加盟国の制限付株式単位2022-12-310001000694米国会計基準:RSU 加盟国の制限付株式単位NVAX: 二千二十三株誘因プランのメンバー2023-01-012023-06-300001000694NVAX: 2千15株インセンティブプランのメンバー米国会計基準:RSU 加盟国の制限付株式単位2023-01-012023-06-300001000694米国会計基準:RSU 加盟国の制限付株式単位NVAX: 二千二十三株誘因プランのメンバー2023-06-300001000694NVAX: 2千15株インセンティブプランのメンバー米国会計基準:RSU 加盟国の制限付株式単位2023-06-300001000694米国会計基準:従業員株式会員2013-06-300001000694米国会計基準:従業員株式会員2023-06-300001000694米国会計基準:従業員株式会員2023-01-012023-06-3000010006942022-01-0100010006942022-12-122022-12-12NVAX: 被告00010006942022-12-012022-12-3100010006942022-12-282022-12-28NVAX: 訴訟00010006942023-04-042023-04-0400010006942023-04-040001000694米国会計基準:未払負債メンバー2023-01-012023-06-30 米国証券取引委員会
ワシントンD.C. 20549
フォーム10-Q
☒ 1934年の証券取引法のセクション13または15 (d) に基づく四半期報告書
四半期終了時 2023年6月30日
または
☐ 1934年の証券取引法第13条または第15条 (d) に基づく移行報告書
からへの移行期間中。
コミッションファイル番号000-26770
ノババックス株式会社
(憲章に明記されている登録者の正確な名前)
| | | | | | | | | | | |
| デラウェア州 | 22-2816046 |
(州またはその他の管轄区域)
法人または組織) | (IRS) 雇用主
識別番号) |
| |
700 クインス・オーチャード・ロード、 | ゲイサーズバーグ、 | MD | 20878 |
| (主要執行機関の住所) | (郵便番号) |
(240) 268-2000
(登録者の電話番号、市外局番を含む)
21 ファーストフィールドロード, ゲイサーズバーグ, MD20878
(前回の報告以降に変更された場合は、以前の名前、元の住所、および以前の会計年度)
同法第12条 (b) に従って登録された証券:
| | | | | | | | |
| 各クラスのタイトル | 取引
シンボル (複数可) | 登録された各取引所の名前 |
| 普通株式、額面価格1株あたり0.01ドル | NVAX | ナスダック・グローバル・セレクト・マーケット |
登録者が、(1)1934年の証券取引法の第13条または第15条(d)で提出が義務付けられているすべての報告書を過去12か月間(または登録者がそのような報告を提出する必要があったよりも短い期間)に提出したか、(2)過去90日間にそのような提出要件の対象であったかどうかをチェックマークで示してください。 はいxいいえ o
登録者が過去 12 か月間(または、登録者がそのようなファイルの提出を求められたほど短い期間)に、規則 S-T の規則 405(本章の §232.405)に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。 はいx いいえ o
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、および「新興成長企業」の定義を参照してください。
| | | | | | | | | | | |
| 大型加速フィルター | x | アクセラレーテッド・ファイラー | o |
| | | |
| 非加速ファイラー | o | 小規模な報告会社 | o |
| | | |
| 新興成長企業 | o | | |
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。 o
登録者がシェル会社(取引法規則12b-2で定義されている)かどうかをチェックマークで示してください。はい☐いいえ x
登録者の普通株式の発行済株式数、額面0.01ドルは 94,404,1852023年7月31日時点のものです。
ノババックス株式会社
目次
| | | | | | | | |
| ページ番号 |
第I部。財務情報 | 1 |
アイテム 1. | 連結財務諸表 | 1 |
| 2023年6月30日および2022年6月30日に終了した3か月および6か月間の未監査連結包括利益(損失)計算書および未監査連結包括利益(損失)計算書 | 2 |
| 2023年6月30日(未監査)および2022年12月31日現在の連結貸借対照表 | 3 |
| 2023年6月30日および2022年6月30日に終了した3か月および6か月間の未監査の連結株主資本(赤字)変動計算書 | 4 |
| 2023年6月30日および2022年6月30日に終了した6か月間の未監査の連結キャッシュフロー計算書 | 5 |
| 連結財務諸表の注記 (未監査) | 6 |
アイテム 2. | 経営陣による財政状態と経営成績に関する議論と分析 | 23 |
アイテム 3. | 市場リスクに関する定量的・質的開示 | 38 |
アイテム 4. | 統制と手続き | 39 |
第二部その他の情報 | 39 |
アイテム 1. | 法的手続き | 40 |
アイテム 1A. | リスク要因 | 42 |
| | |
アイテム 5 | その他の情報 | 45 |
アイテム 6. | 展示品 | 45 |
署名 | 47 |
第I部。財務情報
アイテム 1.財務諸表
ノババックス株式会社
連結営業明細書
(千単位、1株あたりの情報を除く)
(未監査)
| | | | | | | | | | | | | | | | | | | | | | | |
| 終了した3か月間
6月30日 | | 終了した6か月間
6月30日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| 収益: | | | | | | | |
| 製品販売 | $ | 285,163 | | | $ | 55,455 | | | $ | 277,706 | | | $ | 641,083 | |
| 助成金 | 137,079 | | | 107,774 | | | 224,458 | | | 207,075 | |
| ロイヤルティとその他 | 2,184 | | | 22,696 | | | 3,213 | | | 41,738 | |
| 総収入 | 424,426 | | | 185,925 | | | 505,377 | | | 889,896 | |
| | | | | | | |
| 経費: | | | | | | | |
| 売上原価 | 55,777 | | | 271,077 | | | 89,863 | | | 286,281 | |
| 研究開発 | 219,475 | | | 289,648 | | | 466,576 | | | 673,131 | |
| 販売、一般、管理 | 93,717 | | | 108,160 | | | 206,249 | | | 204,152 | |
| 経費合計 | 368,969 | | | 668,885 | | | 762,688 | | | 1,163,564 | |
| 事業からの収益(損失) | 55,457 | | | (482,960) | | | (257,311) | | | (273,668) | |
| その他の収入 (費用): | | | | | | | |
| | | | | | | |
| 支払利息 | (3,124) | | | (6,234) | | | (7,440) | | | (11,110) | |
| その他の収入 (費用) | 5,532 | | | (19,873) | | | 29,894 | | | (18,219) | |
| 所得税費用控除前の収入(損失)(利益) | 57,865 | | | (509,067) | | | (234,857) | | | (302,997) | |
| 所得税費用(給付) | (143) | | | 1,418 | | | 1,040 | | | 4,080 | |
| 当期純利益 (損失) | $ | 58,008 | | | $ | (510,485) | | | $ | (235,897) | | | $ | (307,077) | |
| | | | | | | |
| 1株当たりの純利益(損失): | | | | | | | |
| ベーシック | $ | 0.65 | | | $ | (6.53) | | | $ | (2.69) | | | $ | (3.97) | |
| 希釈 | $ | 0.58 | | | $ | (6.53) | | | $ | (2.69) | | | $ | (3.97) | |
| 加重平均発行済普通株式数 | | | | | | | |
| ベーシック | 89,362 | | | 78,143 | | | 87,769 | | | 77,305 | |
| 希釈 | 104,065 | | | 78,143 | | | 87,769 | | | 77,305 | |
連結包括利益(損失)計算書
(千単位)
(未監査)
| | | | | | | | | | | | | | | | | | | | | | | |
| 終了した3か月間
6月30日 | | 終了した6か月間
6月30日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| 当期純利益 (損失) | $ | 58,008 | | | $ | (510,485) | | | $ | (235,897) | | | $ | (307,077) | |
| その他の包括利益 (損失): | | | | | | | |
| 外貨換算調整 | (5,011) | | | (9,558) | | | (1,800) | | | (9,517) | |
| その他の包括利益 (損失) | (5,011) | | | (9,558) | | | (1,800) | | | (9,517) | |
| 包括利益 (損失) | $ | 52,997 | | | $ | (520,043) | | | $ | (237,697) | | | $ | (316,594) | |
添付の注記は、これらの財務諸表の不可欠な部分です。
ノババックス株式会社
連結貸借対照表
(千単位。株式と1株あたりの情報を除く)
| | | | | | | | | | | |
| 6月30日
2023 | | 12月31日
2022 |
| (未監査) | | |
| 資産 | | | |
| 流動資産: | | | |
| 現金および現金同等物 | $ | 505,912 | | | $ | 1,336,883 | |
| | | |
| 制限付き現金 | 10,361 | | | 10,303 | |
| 売掛金 | 394,890 | | | 82,375 | |
| インベントリ | 23,488 | | | 36,683 | |
| 前払費用およびその他の流動資産 | 192,903 | | | 237,147 | |
| 流動資産合計 | 1,127,554 | | | 1,703,391 | |
| 資産および設備、純額 | 299,955 | | | 294,247 | |
| 使用権資産、純額 | 95,739 | | | 106,241 | |
| | | |
| グッドウィル | 128,366 | | | 126,331 | |
| その他の非流動資産 | 33,434 | | | 28,469 | |
| 総資産 | $ | 1,685,048 | | | $ | 2,258,679 | |
| 負債と株主の赤字 | | | |
| 流動負債: | | | |
| 買掛金 | $ | 87,246 | | | $ | 216,517 | |
| 未払費用 | 458,397 | | | 591,158 | |
| 繰延収益 | 300,473 | | | 370,137 | |
| ファイナンスリース負債の現在の部分 | 953 | | | 27,196 | |
| 転換社債型支払手形 | — | | | 324,881 | |
| その他の流動負債 | 749,186 | | | 930,055 | |
| 流動負債合計 | 1,596,255 | | | 2,459,944 | |
| 繰延収益 | 606,937 | | | 179,414 | |
| 転換社債型支払手形 | 167,248 | | | 166,466 | |
| 非流動ファイナンス・リース負債 | 30,744 | | | 31,238 | |
| その他の非流動負債 | 38,383 | | | 55,695 | |
| 負債総額 | 2,439,567 | | | 2,892,757 | |
| | | |
| コミットメントと不測の事態(注15) | | | |
| | | |
優先株式、$0.01額面価格、 2,000,0002023年6月30日および2022年12月31日に承認された株式。 いいえ2023年6月30日および2022年12月31日に発行され発行済み株式。 | — | | | — | |
| | | |
| 株主赤字: | | | |
普通株式、$0.01額面価格、 600,000,0002023年6月30日および2022年12月31日に承認された株式。 95,183,750発行済株式および 94,308,3792023年6月30日に発行済み株式と 86,806,554発行済株式および 86,039,9232022年12月31日時点で発行されている株式 | 952 | | | 868 | |
| 追加払込資本 | 3,855,916 | | | 3,737,979 | |
| 累積赤字 | (4,511,786) | | | (4,275,889) | |
自己株式、原価基準、 875,3712023年6月30日の株式と 766,6312022年12月31日時点の株式 | (91,424) | | | (90,659) | |
| その他の包括損失の累計 | (8,177) | | | (6,377) | |
| 株主総赤字 | (754,519) | | | (634,078) | |
| 負債総額と株主赤字 | $ | 1,685,048 | | | $ | 2,258,679 | |
添付の注記は、これらの財務諸表の不可欠な部分です。
ノババックス株式会社
連結株主資本変動計算書(赤字)
スリーアンドシックスは、2023年と2022年6月30日に終了しました
(千単位、株式情報を除く)
(未監査)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通株式 | | [追加]
支払い済み
資本 | | 累積
赤字 | | 財務省
株式 | | 累積その他
包括的
損失 | | 株主総数
資本 (赤字) |
| 株式 | | 金額 | | | | | |
| 2023年3月31日現在の残高 | 87,139,831 | | | $ | 871 | | | $ | 3,767,733 | | | $ | (4,569,794) | | | $ | (91,226) | | | $ | (3,166) | | | $ | (895,582) | |
| 株式報酬制度 | — | | | — | | | 20,292 | | | — | | | — | | | — | | | 20,292 | |
| インセンティブプログラムに基づいて発行された株式 | 95,965 | | | 1 | | | (1) | | | — | | | (198) | | | — | | | (198) | |
普通株式の発行、発行費用を差し引いた金額$861 | 7,947,954 | | | 80 | | | 67,892 | | | — | | | — | | | — | | | 67,972 | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | (5,011) | | | (5,011) | |
| 当期純利益 | — | | | — | | | — | | | 58,008 | | | — | | | — | | | 58,008 | |
| 2023年6月30日の残高 | 95,183,750 | | | $ | 952 | | | $ | 3,855,916 | | | $ | (4,511,786) | | | $ | (91,424) | | | $ | (8,177) | | | $ | (754,519) | |
| | | | | | | | | | | | | |
| 2022年3月31日現在の残高 | 78,722,337 | | | $ | 787 | | | $ | 3,566,292 | | | $ | (3,414,542) | | | $ | (85,901) | | | $ | (1,312) | | | $ | 65,324 | |
| 株式報酬制度 | — | | | — | | | 38,048 | | | — | | | — | | | — | | | 38,048 | |
| インセンティブプログラムに基づいて発行された株式 | 53,897 | | | 1 | | | 274 | | | — | | | (554) | | | — | | | (279) | |
| | | | | | | | | | | | | |
| | | | | | | | | | | | | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | (9,558) | | | (9,558) | |
| 純損失 | — | | | — | | | — | | | (510,485) | | | — | | | — | | | (510,485) | |
| 2022年6月30日時点の残高 | 78,776,234 | | | $ | 788 | | | $ | 3,604,614 | | | $ | (3,925,027) | | | $ | (86,455) | | | $ | (10,870) | | | $ | (416,950) | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 普通株式 | | [追加]
支払い済み
資本 | | 累積
赤字 | | 財務省
株式 | | 累積その他
包括的
損失 | | 株主総数
資本 (赤字) |
| 株式 | | 金額 | | | | | |
| 2022年12月31日現在の残高 | 86,806,554 | | | $ | 868 | | | $ | 3,737,979 | | | $ | (4,275,889) | | | $ | (90,659) | | | $ | (6,377) | | | $ | (634,078) | |
| 株式報酬制度 | — | | | — | | | 48,939 | | | — | | | — | | | — | | | 48,939 | |
| インセンティブプログラムに基づいて発行された株式 | 429,242 | | | 4 | | | 1,106 | | | — | | | (765) | | | — | | | 345 | |
普通株式の発行(発行費用を差し引いたもの)861 | 7,947,954 | | | 80 | | | 67,892 | | | — | | | — | | | — | | | 67,972 | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | (1,800) | | | (1,800) | |
| 純損失 | — | | | — | | | — | | | (235,897) | | | — | | | — | | | (235,897) | |
| 2023年6月30日の残高 | 95,183,750 | | | $ | 952 | | | $ | 3,855,916 | | | $ | (4,511,786) | | | $ | (91,424) | | | $ | (8,177) | | | $ | (754,519) | |
| | | | | | | | | | | | | |
| 2021年12月31日時点の残高 | 76,433,151 | | | $ | 764 | | | $ | 3,351,967 | | | $ | (3,617,950) | | | $ | (85,101) | | | $ | (1,353) | | | $ | (351,673) | |
| 株式報酬制度 | — | | | — | | | 70,981 | | | — | | | — | | | — | | | 70,981 | |
| インセンティブプログラムに基づいて発行された株式 | 145,685 | | | 2 | | | 2,303 | | | — | | | (1,354) | | | — | | | 951 | |
普通株式の発行(発行費用を差し引いたもの)2,311 | 2,197,398 | | | 22 | | | 179,363 | | | — | | | — | | | — | | | 179,385 | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | (9,517) | | | (9,517) | |
| 純損失 | — | | | — | | | — | | | (307,077) | | | — | | | — | | | (307,077) | |
| 2022年6月30日時点の残高 | 78,776,234 | | | $ | 788 | | | $ | 3,604,614 | | | $ | (3,925,027) | | | $ | (86,455) | | | $ | (10,870) | | | $ | (416,950) | |
添付の注記は、これらの財務諸表の不可欠な部分です。
ノババックス株式会社
連結キャッシュフロー計算書
(千単位)
(未監査)
| | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 |
| 営業活動: | | | |
| 純損失 | $ | (235,897) | | | $ | (307,077) | |
| 純損失と営業活動に使用された純現金との調整: | | | |
| 減価償却と償却 | 19,110 | | | 13,485 | |
| | | |
| 非現金株式報酬 | 48,939 | | | 70,981 | |
| 余剰在庫および陳腐在庫引当金 | 31,546 | | | 155,662 | |
| 長期資産の減損 | 10,081 | | | — | |
| 受け取ったクレジットを差し引いた使用権支出資産 | — | | | (3,291) | |
| その他の商品、純額 | (89) | | | (642) | |
| 営業資産および負債の変動: | | | |
| インベントリ | (19,361) | | | (403,725) | |
| 売掛金、前払費用、その他の資産 | (266,482) | | | 112,845 | |
| 買掛金、未払費用、その他の負債 | (443,238) | | | 179,158 | |
| 繰延収益 | 357,860 | | | (76,809) | |
| 営業活動に使用された純現金 | (497,531) | | | (259,413) | |
| | | |
| 投資活動: | | | |
| 資本支出 | (26,774) | | | (41,402) | |
| 社内使用ソフトウェア | (4,563) | | | — | |
| 投資活動に使用された純現金 | (31,337) | | | (41,402) | |
| | | |
| 資金調達活動: | | | |
| 普通株式の売却による純収入 | 61,986 | | | 179,385 | |
| 株式報奨の行使による純収入 | 345 | | | 1,050 | |
| ファイナンスリース支払い | (26,784) | | | (15,911) | |
| 2023年転換社債の返済 | (325,000) | | | — | |
| 2027年転換社債の発行に関連する費用の支払い | (3,591) | | | — | |
| 財務活動によって提供された(使用された)純現金 | (293,044) | | | 164,524 | |
| 現金、現金同等物、制限付現金に対する為替レートの影響 | (8,992) | | | (4,453) | |
| 現金、現金同等物、および制限付現金の純減少 | (830,904) | | | (140,744) | |
| 現金、現金同等物、および期首制限付現金 | 1,348,845 | | | 1,528,259 | |
| 現金、現金同等物、および期末制限付現金 | $ | 517,941 | | | $ | 1,387,515 | |
| | | |
| 非現金活動の補足開示: | | | |
| | | |
| | | |
| 普通株式の売却が期末に決済されていません | $ | 5,986 | | | $ | — | |
| 新しいリース契約による使用権資産 | $ | — | | | $ | 69,366 | |
| 買掛金と未払費用に含まれる資本支出 | $ | 6,591 | | | $ | 17,890 | |
| | | |
| キャッシュフロー情報の補足開示: | | | |
| 現金利息の支払い、資本化された金額を差し引いたもの | $ | 11,294 | | | $ | 8,604 | |
| 所得税として支払われた現金 | $ | 128 | | | $ | 17,778 | |
添付の注記は、これらの財務諸表の不可欠な部分です。
ノババックス株式会社
連結財務諸表の注記
2023年6月30日
(未監査)
注意事項1 — 組織とビジネス
Novavax, Inc.(「Novavax」、およびその完全子会社である「当社」)は、重篤な感染症を予防する革新的なワクチンの発見、開発、および商品化を通じて、世界の健康増進を促進するバイオテクノロジー企業です。同社のワクチンとワクチン候補は、疾患の病因に重要なコンフォメーション的に正しい組換えタンパク質の遺伝子操作されたナノ構造であり、分化した免疫応答を誘発する可能性があり、自然に発生する免疫や他のワクチンアプローチよりも効果的である可能性があります。Novavaxには現在、COVIDを予防するためのワクチン(「Novavax COVIDワクチン、アジュバンテッド」)の商用プログラムが1つあり、許可されているさまざまな地域で「Nuvaxovid™」というブランド名で販売しています。NovavaxのプロトタイプCOVIDワクチンは、COVIDのプロトタイプ株から派生したもので、本書や以前の財務諸表では「NVX-CoV2373」とさまざまに呼ばれています。私たちのパートナーであるセラム・インスティテュート・オブ・インディア・プライベート・リミテッド(「SIIPL」)は、NVX-CoV2373を「Covovax™」として販売しています。Novavaxは現在、「XBB COVIDワクチン」と呼ばれる最新のワクチンを開発しています。
2022年以降、当社は世界中の複数の規制当局から、成人と青年の両方の集団を対象としたNVX-CoV2373について、および相同性と異種の両方のブースター適応症について、承認、暫定承認、暫定承認、条件付き販売承認、および緊急使用許可(「EUA」)を受けました。Novavaxは現在、2023年秋以降の単回投与ブースターとして、XBB COVIDワクチンについて、世界中の複数の規制当局から同様の承認を求めています。同社は、共同製剤、充填、仕上げ(ヨーロッパ以外)についてはSIIPLおよびその子会社であるSerum Life Sciences Limited(「SLS」)との供給契約と、ヨーロッパでの仕上げについてはPCI Pharma Services(「PCI」)とのサービス契約のみに依存しています。同社は、許可があれば、2023年の秋のワクチン接種キャンペーン中およびその後、これらの取り決めに基づいてXBB COVIDワクチンを供給する予定です(注4を参照)。
Novavaxは、インフルエンザワクチン候補、COVID-インフルエンザ併用(「CIC」)ワクチン候補、その他のワクチン候補など、他のワクチン候補の開発を進めています。Novavax COVIDワクチン、アジュバントおよびその他のワクチン候補には、免疫反応を高め、より高いレベルの機能性抗体を刺激して細胞性免疫応答を誘導する同社独自のMatrix-M™ アジュバントが組み込まれています。
注意事項2 — 重要な会計方針の要約
プレゼンテーションの基礎
添付の未監査の連結財務諸表は、中間財務情報およびForm 10-Qおよび規則S-Xの第10条の指示について、米国で一般に認められている会計原則(「米国会計基準」)に従って作成されています。連結財務諸表は未監査ですが、当該期間の財政状態、経営成績、包括損失、株主資本(赤字)の変動、およびキャッシュフローを公平に提示するために必要であると当社が考えるすべての調整(通常の定期調整を含む)が含まれています。当社は、これらの未監査の連結財務諸表の開示は、提示された情報を誤解を招かないようにするのに十分だと考えていますが、米国会計基準に従って作成された連結財務諸表に通常含まれる特定の情報および脚注情報は、米国証券取引委員会(「SEC」)の規則および規制で許可されているとおり、要約または省略されています。
未監査の連結財務諸表には、Novavax, Inc. とその完全子会社の会計が含まれています。すべての会社間アカウントと取引は統合により廃止されました。その他の包括損失の累積には、ドルの外貨換算損失が含まれていました8.2百万と $6.42023年6月30日と2022年12月31日にそれぞれ百万です。取引通貨を機能通貨に換算したことによる外貨取引の損益の合計は、$でした0.2百万の損失と1ドル16.1百万の利益、そして1ドル22.2百万と $21.02023年6月30日と2022年に終了した3か月と6か月間でそれぞれ100万ドルの損失が発生し、これらはその他の収入(費用)に反映されます。
添付の未監査の連結財務諸表は、2022年12月31日に終了した年度の当社の年次報告書(Form 10-K)に含まれる財務諸表およびその注記と併せて読む必要があります。この期間または中間期間の業績は、必ずしも将来の中間期間または年間全体の業績を示すものではありません。会社は営業しています 一事業セグメント。
流動性と継続性
添付の未監査の連結財務諸表は、当社が財務諸表が発行された日から1年以内も継続することを前提に作成されています。さらに、2023年6月30日の時点で、同社には$がありました517.9数百万ドルの現金および現金同等物および制限付現金。2023年6月、当社と公共事業・政府サービス大臣(「カナダ政府」)が代表を務めるカナダ右翼女王陛下の利害の後継者として、公共事業・政府サービス大臣が代表を務めるカナダ右派国王陛下との間の事前購入契約(「APA」)の改正に従い、当社は$を受け取りました174.82023年7月にカナダ政府から100万ドル、2回目の分割払い174.8100万ドルは、2023年後半に同社がワクチンを接種することを条件として支払われます(注3を参照)。2023年6月30日までの6か月間に、会社は$の純損失を被りました235.9百万ドルで、営業活動に使用された純キャッシュフローはドルでした497.5百万。
当社は、会計基準体系化205-40、Going Concernに従い、これらの未監査の連結財務諸表が発行された日から1年以内に、継続企業として存続できるかどうかについて大きな疑問を呈する状況や事象があるかどうかを評価しました。当社の現在の1年間のキャッシュフロー予測では、将来を見据えて、事業資金を調達するのに十分な資本があると予測していますが、この予測は、今後12か月間の収益、米国政府からの資金調達、仲裁手続の対象となる係争事項など、重大な不確実性の影響を受けます。同社の収益予測は、2023年秋のCOVIDワクチンシーズンに向けて、COVID-19のワクチン候補の最新の1価製剤の開発、製造、流通、販売を成功させる能力にかかっています。これは本質的に不確実であり、規制当局の承認、用量の適時提供能力、商業的採用、市場での受け入れなど、多くのリスクを伴います。さらに、規制上のマイルストーンを満たさなかったり、政府の諮問委員会から支持的な勧告を適時に入手できなかったり、会社の事前購入契約に基づく製品の量や納期の義務を果たせなかったりすると、会社は前払い金やその他の支払いの一部を返金しなければならなくなったり、将来の支払い額が減額されたりする可能性があります。たとえば、会社が2023年後半にXBB COVIDワクチンの投与量をカナダ政府に届けなかった場合、2回目の分割払い(ドル)174.8100万円は解約され、会社への支払いはできません。また、(a)英国でのSARS-CoV-2ワクチン追加キャンペーンの一環としての一般成人人口または(b)SARS-CoV-2ワクチン接種の一般青少年集団に対するNVX-CoV2373の使用について、当社がグレートブリテンおよび北アイルランド政府のワクチン接種と予防接種に関する合同委員会(「JCVI」)からの支持的勧告を適時に達成しない場合英国でのCoV-2ワクチンの追加接種キャンペーン、または一次シリーズのSARS-CoV-2ワクチン接種(その勧告のみに関連する場合を除く)以下を含む1つ以上の人口グループに 一百万英国のメンバーの場合、会社は最大$を返済する必要があります112.5100万は、元の英国供給契約に基づいて当局から以前に受け取った前払いに関連します。2023年2月、USG契約(注記3で定義)の修正17の締結に関連して、米国政府は当社に対し、この賞を現在の履行期間を超えて延長することはできないと指示しました。会社の経営陣が以前に予想していたように、USG契約が修正されない場合、会社は残りの金額のすべてを受け取ることができない可能性があります250.62023年6月30日の時点で数百万ドルの資金調達が行われています。2023年1月24日、ワクチンアライアンス(「Gavi」)のGavi(「Gavi」)は、当社とGavi(以下「Gavi APA」)との事前購入契約(「Gavi APA」)に対する重大な違反の疑いについて、国際仲裁裁判所に仲裁請求を提出しました。仲裁審問は2024年7月に予定されており、その後に書面による決定が下されます。その仲裁の結果は本質的に不確実であり、会社はドルの残りの前払いの全部または一部を返金するよう求められる可能性があります696.42023年6月30日時点で百万です(注3と注15を参照)。
経営陣は、これらの不確実性の重大さを考えると、当社がこれらの財務諸表が発行された日から1年間継続企業として存続できるかどうかについては、かなりの疑問があると考えています。
2023年5月、同社はNVX-CoV2373プログラムへのより焦点を絞った投資、パイプライン支出の削減、製造ネットワークの継続的な合理化、会社のグローバル人材の削減、施設とインフラの統合を含むグローバルなリストラおよびコスト削減計画(「リストラクチャリング計画」)を発表しました。人員削減計画には、およそ 25会社の全世界の労働力の削減率。およそ 20Novavaxのフルタイムの従業員と、残りは請負業者とコンサルタントで構成される従業員の割合が減少しました。同社はCICを開発後期段階に向けて進めることを決定しました。そのため、人材要件への影響を評価しています。当社は、リストラクチャリング計画によるコスト削減の年間効果の全額が2024年に、年間の影響の約半分が2023年に実現すると予想しています。これは、措置の実施時期、および当社が事業を行う管轄区域に適用される法律、規制、およびその他の要因によるものです。2023年6月30日までの3か月間に、会社は$の請求を記録しました4.61回限りの従業員の退職金と福利厚生に関連する数百万ドルと10.1100万は施設とインフラの統合に関係しています(注16を参照)。
会社が会社の運営資金を調達できるかどうかは、自社製品および製品候補のワクチン販売に関連する収益、特に2023年の秋のCOVIDワクチン接種キャンペーンに左右されます。これは本質的に不確実であり、規制当局の承認、用量の適時提供能力、商業的採用、市場での承認、特定の問題(かどうか、いつ、方法)の解決など、多くのリスクを伴います。Gaviとの論争は解決済み、およびリストラ計画に関連するコスト削減を含む経営陣の計画。経営陣の計画には、エクイティファイナンスとデットファイナンス、コラボレーション、戦略的提携、マーケティング、流通、またはライセンス契約を組み合わせて追加資本を調達することも含まれる場合があります。新しい資金調達は、商業的に受け入れられる条件では提供されない場合もあれば、まったく提供されない場合もあります。また、コラボレーション、戦略的提携、マーケティング、流通、またはライセンス契約では、会社が製品または技術に対する権利の一部または全部を放棄する必要がある場合があり、場合によっては、そのような権利の潜在的価値の合計を下回ることもあります。さらに、NVX-CoV2373や、インフルエンザワクチン候補、CICワクチン候補、COVID-19変異株を含む一価製剤など、同社の他のワクチン候補が規制上および商業的に成功するかどうかは不明です。会社が追加の資本を獲得できない場合、会社は資本資源を評価し、事業の一部または全部の延期、範囲の縮小、廃止、または組織のさらなる縮小を求められることがあります。これらのいずれかが事業、財政状態、経営成績、および継続企業としての事業能力に重大な悪影響を及ぼす可能性があります。
見積もりの使用
米国会計基準に従って連結財務諸表を作成する場合、経営陣は、連結財務諸表の日付における報告された資産および負債の金額、偶発資産および負債の開示、および報告期間中に報告された収益および費用の金額に影響を及ぼす見積もりと仮定を行う必要があります。実際の結果は、これらの見積もりとは大きく異なる場合があります。
収益認識の制約
同社は、認識された累積収益に大きな逆転が起こらない可能性が高くなるまで、顧客との取り決めの取引価格を制限しています。具体的には、顧客の取り決めに、顧客が以前に履行した履行義務の割引、返品、または返金を要求できる条項が含まれている場合、またはその他の方法で取引価格を引き下げる効果がある場合には、認識された累積収益に大きな逆転が起こらない可能性が高くなるまで、認識された取引価格への影響の見積もりに基づいて収益が制限されます。
リストラ
会社はリストラ費用が発生した場合、そのような費用を認識します。会社のリストラ費用は、従業員の退職金や、人員の削減、施設、インフラの統合、その他の費用に関連するその他の退職給付で構成されています。退職給付金は、会社が従業員に通知した日に支出されます。ただし、従業員が将来のサービスを提供する必要がある場合を除きます。その場合、給付金は将来の勤務期間にわたって比例して支払われます。継続的な利益は、リストラ活動が可能で、その利益が推定できる場合に費用計上されます。
退職した従業員の退職金および福利厚生費用、および会社のリストラクチャリング計画に関連する資産の減損に関する追加情報については、注記16を参照してください。
最近の会計上の宣言
採用されました
2016年6月、財務会計基準審議会は、2018年、2019年、2020年、2022年に改正を加えた会計基準更新(「ASU」)第2016-13号、金融商品-信用損失(トピック326):金融商品の信用損失の測定(「ASU 2016-13」)を発行しました。ASUは、過去の経験、現在の状況、および妥当な支持可能な予測に基づいて、報告日に保有されている金融商品の予想信用損失をすべて測定することを企業に要求する「現在の予想信用損失」モデルを定めています。ASU 2016-13は、歳入取引から生じる売掛金を含め、公正価値で測定されない金融商品に適用されます。同社は2023年1月1日に修正された遡及的アプローチを使用してASU 2020-06を採用しましたが、会社の連結財務諸表に重大な影響はありませんでした。
注意事項3 — 収益
会社の売掛金にはドルが含まれています334.4百万と $53.8100万は請求された金額に関連します
顧客と $60.5百万と $28.6百万円は、それぞれ2023年6月30日と2022年12月31日の時点でまだ顧客に請求されていない金額です。 2023年6月30日および2022年6月30日に終了した6か月間の、会社の売掛金、貸倒引当金、および繰延収益残高の変動は次のとおりです(千単位)。
| | | | | | | | | | | | | | | | | | | | | | | |
| 残高、期初 | | 追加 | | 控除 | | 残高、期末 |
| 売掛金: | | | | | | | |
| 2023年6月30日に終了した6か月間 | $ | 96,210 | | | $ | 793,039 | | | $ | (486,684) | | | $ | 402,565 | |
| 2022年6月30日に終了した6か月間 | 454,993 | | | 808,713 | | | (1,069,173) | | | 194,533 | |
疑わしい口座の手当(1): | | | | | | | |
| 2023年6月30日に終了した6か月間 | $ | (13,835) | | | $ | — | | | $ | 6,160 | | | $ | (7,675) | |
| 2022年6月30日に終了した6か月間 | — | | | — | | | — | | | — | |
繰延収入:(2) | | | | | | | |
| 2023年6月30日に終了した6か月間 | $ | 549,551 | | | $ | 414,816 | | | $ | (56,957) | | | $ | 907,410 | |
| 2022年6月30日に終了した6か月間 | 1,595,472 | | | 49,107 | | | (128,432) | | | 1,516,147 | |
(1) ありました いいえ2023年6月30日または2022年6月30日に終了した3か月と6か月の間に記録された不良債権費用。$がありました6.2以前に認められた貸倒引当金の徴収により、2023年6月30日までの3か月間に100万円の不良債権引当金が取り消されました。貸倒引当金を見積もるために、会社は過去の損失経験、経済状況、売掛金の経年劣化、および顧客固有のリスクに基づいて、顧客に関連する信用リスクを評価します。
(2) 繰延収益からの控除は、通常、顧客との契約における履行義務が履行された後の収益の計上に関するものです。
2023年6月30日の時点で、売上ベースのロイヤリティ、Gavi APA、および修正および改訂された英国供給契約に関連する線量の削減に関連する金額を除いた履行債務に割り当てられた取引価格の合計額は、約$でした。2そのうち10億ドル907.4百万は繰延収益に含まれていました。規制上のマイルストーンを満たさなかったり、政府の諮問委員会から支持的な勧告を適時に入手できなかったり、会社の事前購入契約に基づく製品の量や納期に関する義務を果たせなかったりすると、会社は前払い金やその他の支払いの一部を返金しなければならなかったり、将来の支払いが減額されたりする可能性があり、その結果、履行義務の不履行による収益実現能力に悪影響を及ぼす可能性があります。助成金契約に関連する履行義務を履行するタイミングは、臨床試験を含む会社の研究開発活動の結果や用量の提供によって異なります。APAに関連する履行義務を履行するタイミングは、製品の製造時期、追加適応症の販売承認の受領、顧客の需要に基づく用量の提供、および顧客が会社の特定のAPAに基づいてプロトタイプのNVX-CoV2373ワクチンの代わりに変異型ワクチンを要求できるかどうかによって異なります。
Gavi APAの条件と、GaviとSIIPLの間の個別の購入契約に基づき、 1.1COVAXファシリティに参加している国には、10億回分のNVX-CoV2373が提供されることになっていました。会社は製造と流通を予定していました 350COVAXファシリティに参加している国に、NVX-CoV2373を100万回接種します。Gaviとの個別の購入契約に基づき、SIIPLは残りを製造して納品することが期待されていました 1.1COVAXファシリティに参加している低中所得国にNVX-CoV2373を10億回投与しています。同社は、エピデミック対策イノベーション連合(「CEPI」)との資金提供契約に基づいて直接資金提供を受けた施設で製造された抗原とアジュバントを含む用量を、供給契約に基づいてSIIPLとSLSが初期用量を提供する予定でした。同社は、段階的な価格体系を利用して、Gaviが一定の制限付きで低、中、高所得国に配分する大量の用量を供給することを期待していました。Gaviは、そのような用量を低・中所得国に優先的に低価格で提供することができました。さらに、SIIPLがCOVAX施設に期待した用量のワクチンを実質的に届けることができなかった場合に、CEPIが資金提供する製造施設から入手可能な範囲で、NVX-CoV2373を追加投与することができます。契約に基づき、会社はドルの前払い金を受け取りました350.02021年にGaviから100万ドルを受け取り、さらに1ドルの支払いを行います3502022年の100万ドルは、当社がWHOからNVX-CoV2373の緊急使用ライセンスを取得したことに関連しています(「前払い額」)。
2022年11月18日、当社は、Gaviが購入を怠ったことを理由に、Gavi APAを終了するよう書面でGaviに通知しました 350Gavi APAの要求に応じて、当社からNVX-CoV2373を100万回投与しました。2022年11月18日現在、当社はGavi APAでの注文を約 2百万回投与。オンです
2022年12月2日、Gaviは、Gaviが契約を拒否したため、Gavi APAに重大な違反があったというGaviの主張に基づいて、Gavi APAの終了を目的とした書面による通知を発行しました。Gaviはまた、Gavi APAの終了を理由に、COVAXファシリティに参加している購入者が行った拘束力のある注文の購入価格から差し引かれた金額を差し引いた前払い金額の払い戻しを受ける権利があると主張しています。2022年12月31日以降、Gaviの前払いの残りの金額は、$696.42023年6月30日現在、100万ドルは、残りの前払金額の返還に関するGaviとの紛争が解決されるまで、当社の連結貸借対照表ではその他の流動負債に分類されています。2023年1月24日、Gaviは上記の請求に基づいて国際仲裁裁判所に仲裁請求を提出しました。同社は2023年3月2日に回答と反訴を提出しました。2023年4月5日、Gaviは会社の反訴に対する回答を提出しました。仲裁審問は2024年7月に予定されており、その後に書面による決定が下されます。仲裁は本質的に不確実であり、当社はGaviから受け取った残りの前払い金額を留保する権利があると考えていますが、Gaviから残りの前払金額の全部または一部を返金するよう求められる可能性があります。
製品販売
会社の顧客の地理的位置別の製品売上は次のとおりです(千単位)。
| | | | | | | | | | | | | | | | | | | | |
| 3 か月が終了
6月30日 | 6 か月間終了
6月30日 |
| 2023 | | 2022 | 2023 | | 2022 |
北アメリカ | $ | — | | | $ | — | | $ | — | | | $ | 64,762 | |
| ヨーロッパ | 1,518 | | | — | | 58,785 | | | 413,745 | |
その他の地域 | 283,645 | | | 55,455 | | 218,921 | | | 162,576 | |
| 製品の総売上収入 | $ | 285,163 | | | $ | 55,455 | | $ | 277,706 | | | $ | 641,083 | |
2023年5月、同社はオーストラリア政府との契約に基づいて交換の対象となった2022年に納入された特定の用量のクレジットを延長しました。このクレジットは、オーストラリア政府に単一ロットを売却した結果です。事前に計画された6か月の安定性試験で、定義された仕様を下回ったことが判明したため、そのロットは市場から除外されました。このクレジットは、顧客への今後の用量の販売時に適用され、2023年6月30日までの6か月間に、同社は$の減額を記録しました64.7製品の売上高は100万で、それに応じて繰延収益も増加します。
2023年4月、同社はカナダ政府とのAPAを改正し、NVX-CoV2373(「カナダAPA」)の用量の購入について、当初2022年に納入される予定だった特定の用量を$の支払いで没収しました。100.42023年の第2四半期に100万が受領されました。2023年6月30日、当社はカナダのAPAに追加の改正(「2023年6月改正」)を締結しました。2023年6月の改正に従い、両当事者は、(i)以前に納入予定されていたNVX-CoV2373の一定用量を没収すること、(ii)納入予定のNVX-CoV2373の投与量を減らすこと、(iii)残りの投与量のNVX-CoV2373の納入スケジュールを改訂すること、(iv)生物製剤製造センター(「BMC」)社を利用して、2024年と2025年の用量の抗原を大量生産しました。NVX-CoV2373の投与量の没収に関連して、カナダ政府は合計金額を支払うことに同意しました349.6会社に100万ドル 二2023年の分割払いは同額です。その合計金額は、没収されたワクチンの投与量に関してカナダ政府が支払うべき残額と等しくなります。最初の分割払いは2023年6月の修正条項の施行時に支払われ、2回目の分割払いは2023年後半に会社がワクチンの投与量を納入することを条件として支払われます。$の最初の分割払い174.82023年7月にカナダ政府から100万が受領されました。会社が2023年後半にカナダ政府にCOVID-19ワクチンの投与量を届けなかった場合、$の2回目の分割払い174.8100万円は解約され、会社への支払いはできません。カナダ政府は、会社が2024年12月31日以前にNVX-CoV2373の生産にBMCを使用するための規制当局の承認を得られなかった場合、改正されたカナダのAPAを終了することがあります。2023年6月の修正により、元のカナダのAPAの契約総額が維持されました。2023年6月の改正に従い、当社とカナダ政府は、以前に合意したカナダ国内での取り組みを拡大し、カナダに健康、経済、および将来のパンデミックに備えるための給付を提供するためのさらなるパートナーとなるよう努めます。その価値は、設備投資、活動やサービスの実施、技術または知的財産ライセンスの提供を含むがこれらに限定されないさまざまな活動を通じて提供されます。さらに、両当事者は、会社がそのような利益をもたらす能力を説明する覚書(「覚書」)を締結するよう努めます 15合計値が以下の1年の期間 1002023年6月の修正条項に基づいて支払われ、最終的に会社が受領する予定の残りの金額の%。会社は$を保有することに同意しました20カナダ人の利益のために数百万ドルをエスクローに預けています
政府です。覚書に基づいて履行されなかった場合にカナダ政府が利用できる唯一の手段は、この金額です。
助成金
同社の米国政府との契約は、プロジェクト契約(「プロジェクト契約」)と、以前はオペレーション・ワープ・スピードと呼ばれていたパートナーシップに関連して、メディカルCBRN防衛コンソーシアムに代わって活動するコンソーシアム管理会社であるアドバンスト・テクノロジー・インターナショナルとの基本契約(基本契約とプロジェクト契約を合わせて「USG契約」と呼びます)で構成されています。2023年2月、プロジェクト契約の修正17の締結に関連して、米国政府は、この賞を現在の実施期間である2023年12月31日を超えて延長することはできないと当社に指示しました。また、修正17には、$の支払いを要求する条項が含まれていました60.0現在、製造作業に関連する何百万もの対価は、特定のマイルストーンを達成することを条件としています。これには、最大で 1.5NVX-CoV2373の100万回投与、および商業的準備、EUAの拡大、および複数のバイアル剤の開発に関連する開発と規制のマイルストーン。2023年6月30日の時点で、同社は合計取引価格を$制約しました48.0100万ドルは、会社が完全に管理できないマイルストーンに関連する対価です。この制約は、修正17に含まれる他の契約変更に加えて、約$になりました292023年6月30日までの6か月間の契約で以前に計上された収益を累計で100万円削減しました。
ロイヤルティとその他
2023年6月30日までの3か月と6か月の間に、同社は いいえtは、マイルストーンの支払いや売上に基づくロイヤリティに関連する収益を認識します。2022年6月30日までの3か月と6か月の間に、会社は$を認識しました20.0NVX-CoV2373を日本で初めて販売したときの100万マイルストーンの支払いと1.7百万と $9.2売上ベースのロイヤリティに関連する収益がそれぞれ百万.
ノート 4 — コラボレーション、ライセンス、および供給契約
SIPL
同社は以前、NVX-CoV2373、独自のCOVID-19変異抗原候補、4価インフルエンザワクチン候補、およびCICワクチン候補の開発、共同製剤、充填と仕上げ、登録、および商品化について、SIIPLに独占的および非独占的なライセンスを付与していました。SIIPLは当社のMatrix-M™ アジュバントの購入に同意し、当社はSIIPLに対し、NVX-CoV2373の製造にのみ使用することを目的として、SIIPLの認可地域でNVX-CoV2373の抗原原物質成分を製造する非独占的なライセンスを付与しました。当社とSIIPLは、SIIPLによるライセンス地域でのNVX-CoV2373の販売による収益を、合意された費用を差し引いて均等に分配しました。同社はまた、SIIPLおよびSLSと供給契約を結んでいます。この契約に基づき、SIIPLとSLSは、NVX-CoV2373、独自のCOVID-19変異抗原候補、4価インフルエンザワクチン候補、および特定の地域での商品化と販売のためのCICワクチン候補を当社に提供します。また、SLSとの開発製造契約も締結しており、SLSは完成ワクチンを製造・供給します。当社が提供する抗原原物質とMatrix-M™ アジュバントを使用して当社に提供する製品。2020年3月、当社はSIIPLに対し、オックスフォード大学ジェンナー研究所が開発したマラリア候補であるR21(「R21/Malaria」)の開発、製造、および商品化のために、当社が提供するMatrix-M™ アジュバントの使用に関する非独占的なライセンスを付与しました。この契約に基づき、SIIPLはR21/Malariaを製造するための当社のMatrix-M™ アジュバントを購入し、SIIPLは一定期間一桁台から2桁台前半までのロイヤルティを支払います。 15各国での製品の最初の商業販売から数年後。
武田薬品工業株式会社
同社は武田薬品工業株式会社(「武田」)とコラボレーションおよびライセンス契約を結んでおり、その下で当社は武田薬品にNVX-CoV2373を日本で開発、製造、および商品化する独占ライセンスを付与しました。本契約に基づき、武田薬品はNVX-CoV2373の用量を製造するためにMatrix-M™ アジュバントを会社から購入し、当社は特定の開発および商業上のマイルストーンの達成に基づいて武田薬品から支払いを受ける権利があります。また、NVX-CoV2373の売却による純利益の一部を受け取る権利があります。2021年9月、武田薬品は日本政府の厚生労働省(「厚生労働省」)と、以下の買収に関する契約を締結しました。 150NVX-CoV2373を100万回接種しました。2023年2月、厚生労働省は武田薬品との契約に基づいて残りの投与を中止しました。その結果、現在のコラボレーションおよびライセンス契約の条件に基づいて、当社が武田薬品から将来支払いを受けるかどうかは不明です。
ビル&メリンダ・ゲイツ医学研究所
2023年5月、私たちはビル&メリンダ・ゲイツ医学研究所と、前臨床ワクチン研究に使用するためのMatrix-M™ アジュバントを提供する3年間の契約を締結しました。
その他の供給契約
2022年9月30日、当社、富士フイルムディオシンスバイオテクノロジーズUKリミテッド(「FDBK」)、富士フイルムディオシンスバイオテクノロジーズテキサス合同会社(「FDBU」、およびFDBKおよびFDBTとともに「富士フイルム」)は、秘密和解契約を締結し、リリース(「富士フイルム和解」)を締結しました。2021年8月20日付けの商業供給契約(「CSA」)および2020年6月30日付けのマスターサービス契約に基づくFDBTでの製造活動の終了に関連して富士フイルムに支払うべき金額に関する契約(」)および会社と富士フイルムによる、または会社と富士フイルム間の関連する作業明細書(「MSA」)。MSAとCSAは、関連する作業指示書に基づいて、NVX-CoV2373に関連する富士フイルムの製造および供給活動に適用される一般条件を定めました。
富士フイルムの和解契約に従い、会社は最高$の支払い責任を負います185.0CSAに基づくFDBTでの製造活動のキャンセルに関連して富士フイルムに100万ドル(「和解金」)、そのうちiドル47.8CSAに基づく初回予約料となる100万ユーロが、2022年9月30日に決済金から差し引かれ、(ii) 残りの残高は 四四半期ごとの均等分割払い34.3それぞれ100万件で、2023年3月31日に始まりました。2023年6月30日の時点で、ドルの残りの支払いは68.6百万は未払費用に反映されました。富士フイルム和解契約に基づき、富士フイルムは、富士フイルムCSAに基づくFDBTでの製造活動の終了によって生じた空いている製造能力に関連する損失を軽減するために、商業的に合理的な努力を払う必要があります。 二四半期ごとの分割払いは、富士フイルムが2023年7月1日から2023年12月31日の間に達成した代替収益によって軽減されます。
2023年5月、当社はSKバイオサイエンス株式会社(「SKバイオサイエンス」)に、SKバイオサイエンスが当社に供給するすべての原薬および製剤製造活動を中止し、中止するよう通知を出しました。会社は$を認識しました20.4解約の結果として支払期限が到来した受取または支払義務に関連する何百万もの研究開発費。
当社は引き続き製造ニーズを評価し、NVX-CoV2373の供給に対する契約上の義務と予想される需要に合わせて、グローバルな製造拠点を修正するつもりであり、その際に多額の費用が発生する可能性があることを認識しています。
ノート 5 – 1株当たりの利益(損失)
1株あたりの基本および希薄化後の純利益(損失)は、次のように計算されました(1株あたりのデータを除き、千単位)。
| | | | | | | | | | | | | | | | | | | | | | | |
| 3 か月が終了
6月30日 | | 6 か月間終了
6月30日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| 分子: | | | | | | | |
| 純利益 (損失)、基本 | $ | 58,008 | | | $ | (510,485) | | | $ | (235,897) | | | $ | (307,077) | |
| 転換社債の利息 | 2,582 | | | — | | | — | | | — | |
| 純利益 (損失)、希薄化 | 60,590 | | | (510,485) | | | (235,897) | | | (307,077) | |
| 分母: | | | | | | | |
| 加重平均発行済普通株式数、基本 | 89,362 | | | 78,143 | | | 87,769 | | | 77,305 | |
| 希薄化証券の影響 | 14,703 | | | — | | | — | | | — | |
| 希薄化後の加重平均発行済普通株式数 | 104,065 | | | 78,143 | | | 87,769 | | | 77,305 | |
| 1株当たりの純利益(損失): | | | | | | | |
| ベーシック | $ | 0.65 | | | $ | (6.53) | | | $ | (2.69) | | | $ | (3.97) | |
| 希釈 | $ | 0.58 | | | $ | (6.53) | | | $ | (2.69) | | | $ | (3.97) | |
| | | | | | | |
| 希薄化後の1株当たり純利益(損失)の計算から除外された希薄化防止有価証券 | 6,791 | | | 8,073 | | | 23,447 | | | 8,073 | |
注意事項6 — 現金、現金同等物、および制限付現金
次の表は、連結貸借対照表に報告されている現金、現金同等物、および制限付現金を調整したもので、連結キャッシュフロー計算書に記載されている金額の合計 (千単位) になります。
| | | | | | | | | | | |
| 2023年6月30日 | | 2022年12月31日 |
| 現金および現金同等物 | $ | 505,912 | | | $ | 1,336,883 | |
| 制限付現金、現行 | 10,361 | | | 10,303 | |
制限付現金、非流動現金(1) | 1,668 | | | 1,659 | |
| 現金、現金同等物、および制限付現金 | $ | 517,941 | | | $ | 1,348,845 | |
(1)連結貸借対照表では、2023年6月30日および2022年12月31日の時点で、その他の非流動資産に分類されます。
ノート 7 — 公正価値測定
次の表は、会社の金融資産と負債の公正価値階層 (千単位) を表しています。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年6月30日の公正価値 | | 2022年12月31日時点の公正価値 |
| 資産 | レベル 1 | | レベル 2 | | レベル 3 | | レベル 1 | | レベル 2 | | レベル 3 |
マネー・マーケット・ファンド(1) | $ | 81,268 | | | $ | — | | | $ | — | | | $ | 398,834 | | | $ | — | | | $ | — | |
政府支援証券(1) | — | | | 180,000 | | | — | | | — | | | 296,000 | | | — | |
| | | | | | | | | | | |
企業債務証券(1) | — | | | 28,515 | | | — | | | — | | | — | | | — | |
エージェンシー証券(1) | — | | | 9,971 | | | — | | | — | | | 104,536 | | | — | |
| 現金同等物の合計 | $ | 81,268 | | | $ | 218,486 | | | $ | — | | | $ | 398,834 | | | $ | 400,536 | | | $ | — | |
| 負債 | | | | | | | | | | | |
5.002027年満期転換社債の割合 | $ | — | | $ | 130,957 | | | $ | — | | $ | — | | $ | 172,789 | | $ | — |
3.752023年満期転換社債の割合 | — | | | — | | | — | | | — | | | 322,111 | | | — | |
| 支払可能な転換社債総額 | $ | — | | | $ | 130,957 | | | $ | — | | | $ | — | | | $ | 494,900 | | | $ | — | |
(1)連結貸借対照表では、2023年6月30日と2022年12月31日の時点で、すべての投資は現金および現金同等物に分類されています。
レベル2に分類される債券投資は、一般的に相場されている金利や利回り曲線、クレジットスプレッド、ブローカーやディーラーが提供する入札、または同様の特性を持つ有価証券の相場価格など、検証可能な観察可能な市場データを使用する第三者の価格ベンダーの評価モデルによってカストディアン銀行で評価されます。会社の転換社債の価格は、会社の普通株価、インプライド・ボラティリティ、金利、クレジット・スプレッドなど、観察可能なインプットに基づいて見積もられています。
2023年6月30日と2022年6月30日に終了した6か月間、会社はレベル間の移動はありませんでした。
買掛金および未払費用の当社の連結貸借対照表の金額は、短期的な性質から公正価値に近いものです。
ノート 8 — インベントリ
在庫は次のとおりでした(千単位)。
| | | | | | | | | | | |
| 2023年6月30日 | | 2022年12月31日 |
| 原材料 | $ | 10,892 | | | $ | 13,912 | |
| 半完成品 | 12,596 | | | 21,410 | |
| 完成品 | — | | | 1,361 | |
| 在庫合計 | $ | 23,488 | | | $ | 36,683 | |
超過、陳腐化、満了、またはその他の理由による在庫減価償却、および会社の購入約束による損失は、そのような約束の回収によって相殺され、当社の連結営業報告書に売上原価の一部として記録されます。2023年6月30日までの3か月と6か月間、在庫の減価償却額は$でした19.1百万と $31.5それぞれ100万ドル、そして確定購入約束による損失は$でした0.7百万と $8.5それぞれ、百万。さらに、2023年6月30日までの3か月と6か月の間に、同社は確定購入約束による回収額を記録しました17.9百万と $18.8それぞれ100万ドルですが、これは主に、以前に認識されていた企業の購入コミットメントの交渉による削減に関するものです。2022年6月30日までの3か月と6か月の間に、在庫の減価償却と企業購入契約による損失は$でした155.7百万と $99.6それぞれ百万。
ノート 9 — グッドウィル
当社は 一報告単位。2023年6月30日および2022年12月31日の時点でマイナス資本です。 の
2023年6月30日までの6か月間ののれんの帳簿価額の変動は次のとおりです(千単位)。
| | | | | |
| 金額 |
| 2022年12月31日現在の残高 | $ | 126,331 | |
| 通貨換算調整 | 2,035 | |
| 2023年6月30日の残高 | $ | 128,366 | |
ノート 10 — リース
同社には、NVX-CoV2373を製造するための受託製造機関(「CMO」)および受託製造開発組織との供給契約に関連するリースのほか、研究開発および製造施設、本社とオフィス、および特定の機器のリースを組み込んでいます。2023年6月30日までの6か月間、当社はNVX-CoV2373の供給と需要予測に関する契約上の義務に沿った製造ニーズを継続的に評価した結果、グローバルな製造拠点を調整し続けました。
2023年6月30日までの3か月と6か月の間に、同社は$の短期リース特典を認識しました9.2百万と $8.5主に$の利益の結果として、それぞれ100万ドルが組み込みリースに関連していました9.52023年6月30日までの3か月間に実行された和解に関連する100万ドル。2022年6月30日までの3か月と6か月の間に、当社は$の短期リース費用を認識しました5.8百万と $83.9埋め込みリースに関連して、それぞれ100万ドル、費用が発生しました9.4百万と $19.8研究開発活動のために取得した資産で、リースの開始時または変更時に将来の代替用途がなかったものを表す使用権(「ROU」)資産の償却(「ROU」)用で、それぞれ100万です。2023年6月30日までの3か月と6か月の間に、組み込みリースに関連して償却されたROU資産はありませんでした。
2023年6月30日までの3か月と6か月の間に、会社は$を認識しました0.5百万と $0.9そのファイナンスリース負債にかかる支払利息はそれぞれ数百万です。2022年6月30日までの3か月と6か月の間に、会社は$を認識しました2.3百万と $3.4そのファイナンスリース負債にかかる支払利息はそれぞれ数百万です。
2023年6月30日までの3か月と6か月の間に、会社は$の減損費用を記録しました5.9リストラ計画の影響を受ける研究開発、製造、オフィススペースに使用されるROU施設のリースに関連する数百万ドル(注16を参照)。
ノート 11 — 長期債務
支払われる転換社債の総額は以下の通りです(千単位):
| | | | | | | | | | | |
| 2023年6月30日 | | 2022年12月31日 |
| 現在の部分: | | | |
3.752023年満期転換社債の割合 | $ | — | | | $ | 325,000 | |
| 未償却債務発行費用 | — | | | (119) | |
| 現在支払われる転換社債の総額 | $ | — | | | $ | 324,881 | |
| 非流動部分: | | | |
5.002027年満期転換社債の割合 | $ | 175,250 | | | $ | 175,250 | |
| | | |
| 未償却の債務発行費用と割引 | (8,002) | | | (8,784) | |
| 支払われる非流動転換社債の総数 | $ | 167,248 | | | $ | 166,466 | |
2023年2月、会社は未払いの元本を返済しました325.0その上に100万台 3.75% 2023年に発行予定の転換社債と、満期日の未払利息を含む。返済資金は、の発行によって賄われました 5.002027年満期転換社債の%、および2022年12月の同時発行普通株式、および手持ち現金。2027年の転換社債の実効金利は 6.2%.
転換社債の支払いに関連して発生した支払利息は、次のとおりです(千単位)。
| | | | | | | | | | | | | | | | | | | | | | | |
| 3 か月が終了
6月30日 | | 6 か月間終了
6月30日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| クーポンの利息 | $ | 2,191 | | | $ | 3,047 | | | $ | 5,397 | | | $ | 6,094 | |
| 債務発行費用の償却 | 391 | | | 356 | | | 900 | | | 712 | |
| 支払われる転換社債の支払利息総額 | $ | 2,582 | | | $ | 3,403 | | | $ | 6,297 | | | $ | 6,806 | |
ノート 12 — 株主資本 (赤字)
2021年6月、当社はアットマーケット発行販売契約(「2021年6月の販売契約」)を締結しました。これにより、最大$の発行と販売が可能になります。500その普通株式の総収入は百万です。2023年6月30日までの3か月と6か月の間に、会社は売却しました 7.92021年6月の売買契約に基づくその普通株式の100万株で、純収入は約$です68百万、そのうち$62022年6月30日の時点で、百万ドルが前払費用およびその他の流動資産に含まれ、2023年7月に現金で受領されました。2023年6月30日の時点で、2021年6月の売買契約に基づいて利用可能な残高はおよそ$でした249百万。
2022年6月30日までの6か月間に、会社は売却しました 2.2普通株式100万株で、純収益は約$です1792021年6月の販売契約に基づき、100万ドル。
ノート 13 — 株式ベースの報酬
エクイティプラン
2023年1月、当社は2023年導入計画(「2023年導入計画」)を策定しました。この計画では、会社に就職する個人への誘因として、以前は従業員ではなかった個人、または正真正銘の非雇用期間を経た個人に株式ベースの報奨を与えることを規定しています。会社は予約しました 1.02023年の誘因計画に基づく補助金として100万株の普通株式。2023年6月30日の時点で、 0.32023年の誘導計画に基づいて発行可能な株式は100万株です。
修正された2015年株式インセンティブプラン(「2015年プラン」)は、2015年6月の当社の年次株主総会で承認されました。2015年計画では、当社および現在または将来の子会社の役員、取締役、従業員、コンサルタント、顧問に株式報奨を与えることができます。2015年計画では、最大の発行が承認されています 14.82015年プランに基づいて付与された株式報奨に基づく100万株の普通株式。2015年プランに基づいて発行が承認されたそのような株式はすべて留保されています。2015年のプランは2025年3月4日に期限切れになります。2023年6月30日の時点で、 0.92015年計画で発行可能な株式は100万株です。
修正および改訂された2005年株式インセンティブ制度(「2005年制度」)は2015年2月に失効したため、その制度に基づいて新たな報奨を行うことはできません。ただし、報奨は引き続きその条件に従って未払いのままです。
2023年の導入計画と2015年計画の許可と2005年の計画では、ストックオプション(インセンティブストックオプションを含む)、制限付株式、株式評価権(「SAR」)、および制限付株式ユニット(「RSU」)の付与が認められました。さらに、2023年導入計画と2015年計画では、無制限の株式、株式、業績報奨が付与される場合があります。ストックオプションとSARの上限は通常 十年そして、それ以上の行使価格で付与されることもあれば、付与されたこともあります 100付与時点での当社普通株式の公正市場価値の%。株式ベースの報奨の付与は、通常、次のような期間にわたって権利確定の対象となります 一に 四年間.
同社は、連結損益計算書に株式ベースの報酬費用を次のように記録しました(
(千):
| | | | | | | | | | | | | | | | | | | | | | | |
| 3 か月が終了
6月30日 | | 6 か月間終了
6月30日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| 売上原価 | $ | 998 | | | $ | — | | | $ | 1,516 | | | $ | — | |
| 研究開発 | 9,946 | | | 19,695 | | | 23,804 | | | 36,582 | |
| 販売、一般、管理 | 9,348 | | | 18,353 | | | 23,619 | | | 34,399 | |
| 株式報酬費用の総額 | $ | 20,292 | | | $ | 38,048 | | | $ | 48,939 | | | $ | 70,981 | |
2023年6月30日および2022年12月31日の時点で、資産計上され在庫に含められた株式ベースの報酬の合計は$でした1.7百万。
2023年6月30日の時点で、およそ$がありました122未確定ストックオプション、SAR、RSU、および修正後の当社の従業員株式購入制度(「ESPP」)に関連する未認識報酬費用の総額は百万です。この未計上非現金報酬費用は、加重平均の概算期間にわたって計上されると予想されます 一年。この見積もりには、将来の期間に行われる可能性のある他の株式ベースの報奨の影響は含まれていません。
総本質価値は、2023年6月30日にすべてのストックオプションとSAR保有者がストックオプションとSARを行使した場合に保有者が受け取っていたはずの本質的価値(期間の最終取引日の会社の終値と行使価格との差に、インザマネーのストックオプションとSARの数を掛けたもの)の合計を表します。この金額は、会社の普通株式の終値の変動に基づいて変更される場合があります。2023年6月30日と2022年6月30日までの6か月間のストックオプションとSAR行使とRSUの権利確定の総本質的価値は約$でした2百万と $8それぞれ百万。
ストックオプションと株式評価権
以下は、2023年6月30日までの6か月間の2023年誘因計画、2015年計画、および2005年計画に基づくストックオプションとSAR活動の概要です。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2023年のインダクションプラン | | 2015年計画 | | 2005年の計画 |
| 株式
[オプション] | | 加重平均
エクササイズ
価格 | | 株式
[オプション] | | 加重平均
エクササイズ
価格 | | 株式
[オプション] | | 加重平均
エクササイズ
価格 |
| 2022年12月31日時点で未処理です | — | | | $ | — | | | 4,053,290 | | | $ | 46.07 | | | 63,725 | | | $ | 112.94 | |
| 付与されました | 358,600 | | | 10.96 | | | 860,872 | | | 7.29 | | | — | | | — | |
| 運動した | — | | | — | | | (5,031) | | | 6.81 | | | — | | | — | |
| キャンセルされました | — | | | — | | | (63,839) | | | 51.41 | | | (5,250) | | | 36.60 | |
| 2023年6月30日に素晴らしいです | 358,600 | | | $ | 10.96 | | | 4,845,292 | | | $ | 39.15 | | | 58,475 | | | $ | 119.80 | |
| 2023年6月30日に行使可能な株式 | — | | | $ | — | | | 3,295,810 | | | $ | 40.62 | | | 58,475 | | | $ | 119.80 | |
2023年誘致計画と2015年計画に基づいて付与されたストックオプションの公正価値は、
Black-Scholesのオプション価格モデルを使用して付与します。ただし、次の前提条件があります。
| | | | | | | | | | | | | | | | | | | | | | | |
| 3 か月が終了
6月30日 | | 6 か月間終了
6月30日 |
| 2023 | | 2022 | | 2023 | | 2022 |
| 付与されたストックオプションの加重平均ブラック・ショールズ公正価値 | $6.79 | | $43.21 | | $7.24 | | $62.52 |
| リスクフリー金利 | 3.5%-3.9% | | 2.7%-3.2% | | 3.5%-4.0% | | 1.4%-3.2% |
| 配当利回り | —% | | —% | | —% | | —% |
| ボラティリティ | 120.4%-131.3% | | 120.5%-136.7% | | 120.4%-140.3% | | 120.5%-136.7% |
| 期待期間 (年単位) | 3.9-6.4 | | 4.0-6.2 | | 3.9-6.4 | | 4.0-6.2 |
2023年6月30日の時点で、2023年誘致計画、2015年計画、および2005年計画に基づいて未払いのストックオプションとSARの本質的価値と加重平均残存契約期間の合計は約$でした1.7百万と 7.3それぞれ、何年も。2023年6月30日の時点で、2023年誘致計画、2015年計画、および2005年計画に基づいて行使可能なストックオプションとSARの本質的価値と加重平均残存契約期間の合計は約$でした1.1百万と 6.3それぞれ年。
制限付株式ユニット
以下は、2023年6月30日までの6か月間のRSUの活動の概要です。
| | | | | | | | | | | | | | | | | | | | | | | |
| 2023年のインダクションプラン | | 2015年計画 |
| の数
株式 | | 一株当たり
加重-
平均
公正価値 | | の数
株式 | | 一株当たり
加重-
平均
公正価値 |
| 2022年12月31日時点で未確定で未払い | — | | | $ | — | | | 2,034,574 | | | $ | 61.67 | |
| 付与されました | 308,390 | | | $ | 10.96 | | | 2,767,475 | | | 7.23 | |
| 既得 | — | | | $ | — | | | (307,653) | | | 82.94 | |
| 没収 | — | | | $ | — | | | (637,727) | | | 29.46 | |
| 2023年6月30日の時点で優れており、権利が確定していません | 308,390 | | | $ | 10.96 | | | 3,856,669 | | | $ | 26.23 | |
従業員株式購入制度
ESPPは、2013年6月の同社の年次株主総会で承認されました。ESPPは現在、集計を承認しています 1.2100万株の普通株式を購入し、株式の総額は増え続けます 5採択記念日の各記念日の%(最大) 1.65百万株。ESPPでは、従業員は各購入日に最大で給与控除によって会社の普通株式を購入することができます 15報酬の%、 85購入時の株式の市場価格またはオプション期間の開始日(または、それより遅い場合は、オプション期間中に従業員が最初に参加資格を得た日付)の市場価格のいずれか低い方の割合。2023年6月30日の時点で、 0.6ESPPに基づいて発行可能な株式は100万株です。
ノート 14 — 所得税
会社は、入手可能な肯定的証拠と否定的証拠を評価して、既存の繰延税金資産の使用を可能にするのに十分な将来の課税所得が生み出されるかどうかを推定します。評価された重要な客観的証拠は、2023年6月30日までの3年間に発生した累積損失と、当社が過去に税引前損失を計上してきたということでした。そのような客観的な証拠は、将来の成長の予測など、他の主観的な証拠を検討する能力を制限します。この評価に基づいて、2023年6月30日現在、当社は、純営業損失(「NOL」)が課税所得の削減に使用されている場合を除き、繰延税金資産に対する評価引当金を全額維持し続けています。当社の残りの米国連邦NOLは、2017年の減税および雇用法(「TCJA」)に基づく制限の対象となります。この法律では、許容されるNOL控除は連邦課税所得の80%に制限されています。
2022年1月1日より、TCJAの規定が発効し、TCJAの扱いに大きな変更が加えられました
IRCの第174条に基づく研究および実験支出(「第174条経費」)。これまで、企業は発生年度に第174条の費用を控除するか、5年間にわたって費用を資産計上して償却するかを選択してきました。ただし、新しいTCJA条項ではこのオプションが廃止され、米国で行われた研究に関連する第174条の費用は、5年間にわたって資産計上および償却することが義務付けられています。米国外での研究に関連する費用については、第174条の費用は資産計上され、Aに償却されます 15 年間ピリオド。
2023年6月30日と2022年6月30日に終了した3か月間に、当社は連邦、州、および外国の所得税の優遇措置を認めました0.1100万ドルと$の所得税費用1.4それぞれ、百万。2023年6月30日と2022年6月30日に終了した6か月の間に、会社は2ドルの所得税費用を認識しました1.0百万と $1.9それぞれ、百万。同社は、外国の源泉徴収税費用を$のロイヤリティに計上しました2.22022年6月30日までの6か月間で100万ドルでした。会社がやりました いいえtは、2022年6月30日までの3か月間、および2023年6月30日までの3か月と6か月のロイヤリティに対する外国の源泉徴収税費用を認識します。
ノート 15 – コミットメントと不測の事態
法務事項
2021年11月12日、Sothinathan Sinnathuraiは米国メリーランド州地方裁判所(以下「メリーランド州裁判所」)に、当社および一部の上級管理職メンバーに対して証券集団訴訟を提起しました。「Sothinathan Sinnathurai対Novavax, Inc.他」、「8:21-CV-02910-TDC」(「シンナトゥライ訴訟」)というキャプションが付けられました。)。2022年1月26日、メリーランド州裁判所は、デビッド・チュオン、ナッゲハリ・バルムクンド・ナンドクマール、ジェフリー・ガバートをシンナトゥライ訴訟の共同主任原告として指名する命令を出しました。共同主任原告は、2022年3月11日に、NVX-CoV2373を商業規模で製造し、NVX-CoV2373の規制当局の承認を確保する当社の能力について、被告が虚偽で誤解を招くような陳述をしたと主張して、統合修正訴状を提出しました。修正された訴状では、対象となるクラスを、2021年2月24日から2021年10月19日の間に会社の証券を購入した株主と定義しています。2022年4月25日、被告は統合修正訴状を却下する申立てを提出しました。2022年12月12日、メリーランド州裁判所は、被告の却下の申立ての一部を認め、一部を却下する判決を下しました。メリーランド州の裁判所は、これに対するすべての請求を却下しました 二個々の被告人と、統合修正訴状で異議を申し立てられた特定の公式声明に基づく請求。メリーランド州裁判所は、残りの請求と被告について棄却する申立てを却下し、当社と他の残りの被告に範囲内で回答するよう指示しました 十四日間。2022年12月27日、当社は回答と肯定的抗弁を提出しました。
シンナチュライ訴訟が提起された後、 八派生訴訟が提起されました:(i)ロバート・E・マイヤー対スタンレー・C・エルク他、第8:21-CV-02996-TDC(「マイヤー・アクション」)、(ii)シュイ・シン・ヨン対スタンレー・C・エルク他、第8:21-CV-03248-TDC(「ヤング・アクション」)、(iii)ウィリアム・カーストら対スタンレー・C・エルクら、いいえ。C-15-CV-21-000618(「カースト・アクション」)、(iv)エイミー・スナイダー対スタンレー・C・エルク他、No. 8:22-CV-01415-TDC(「スナイダー・アクション」)、(v)チャールズ・R・ブラックバーン他対スタンレー・C・エルク他、第 1:22-CV-01414 17-TDC(「ブラックバーン・アクション」)、(vi)ディエゴ・J・メサ対スタンレー・C・エルク他、2022-0770-NAC号(「メサ・アクション」)、(vii)ショーン・アコスタ対スタンレー・C・エルク他、2022-1133-NAC(「アコスタ・アクション」)、および(viii)J.J. レッド・ニードルマン対スタンレー・C・エルク他、いいえ。C-15-CV-23-001550(「ニードルマンアクション」)。マイヤー、ヤン、スナイダー、ブラックバーンの訴訟はメリーランド州の裁判所に提起されました。カースト訴訟はメリーランド州モンゴメリー郡巡回裁判所に提起され、その後まもなく、被告によってメリーランド州裁判所に移されました。ニードルマン訴訟は、メリーランド州モンゴメリー郡の巡回裁判所にも提起されました。メサとアコスタの訴訟は、デラウェア州チャンスリー裁判所(「デラウェア州裁判所」)に提起されました。デリバティブ訴訟では、会社の取締役会のメンバーと一部の上級管理職が被告として指名されます。会社は名目上の被告とみなされます。原告は、シンナトゥライ訴訟と実質的に同じ疑惑の事実と状況から生じる派生的請求を主張します。デリバティブに関する苦情を総称すると、受託者責任違反、インサイダー売却、不当利益、連邦証券法違反、統制の乱用、無駄、管理ミスの請求が主張されます。原告は、宣言的救済および差し止めによる救済、ならびに金銭的損害賠償および弁護士費用の裁定を求めます。
2022年2月7日、メリーランド州裁判所は、Meyer訴訟とYung訴訟を統合する命令(「最初の統合デリバティブ訴訟」)を出しました。第1次統合デリバティブ訴訟の原告は、2022年4月25日に連結デリバティブに関する苦情を申し立てました。2022年5月10日、メリーランド州裁判所は、シンナトゥライ訴訟における解雇または回答の提出のいずれか早い方まで、すべての手続きと期限を延期するという当事者の要求を認める命令を出しました。2022年6月10日、スナイダー訴訟とブラックバーン訴訟が提起されました。2022年10月5日、メリーランド州裁判所は、第1次統合デリバティブ訴訟およびスナイダー訴訟およびブラックバーン訴訟の原告による、3つの訴訟すべてを統合し、共同主任原告および共同主任弁護士および連絡弁護士を任命するよう求める要求を認める命令を出しました(「第2次統合デリバティブ訴訟」)。第二次統合デリバティブ訴訟の共同主任原告は、2022年11月21日に統合修正訴状を提出しました。2023年2月10日、被告は第2次連結デリバティブ訴訟を却下する申立てを提出しました。原告は、2023年4月11日に却下の申立てに異議を申し立てました。被告は、2023年5月11日に却下の申立てをさらに裏付ける回答概要を提出しました。
2022年7月21日、メリーランド州裁判所は、Kirst訴訟を州裁判所に差し戻す覚書、意見、命令を出しました。2022年12月6日、Kirst訴訟の当事者は、原告が2022年12月22日に修正訴状を提出することを想定したスケジュールを提出し、(i)当事者がKirst訴訟の規定の執行猶予を提出するか、(ii)被告が2023年1月23日までに訴訟を延期する申立てを提出するかのいずれかを提出します。原告は2022年12月30日に修正訴状を提出しました。2023年1月23日、被告はKirst訴訟の延期を求める申立てを提出しました。2023年2月22日、Kirst訴訟の当事者は、第2次統合デリバティブ訴訟における被告の却下の申立てが解決されるまで、Kirst訴訟を保留する条項の承認を裁判所に申請しました。2023年3月22日、裁判所は、第2次統合デリバティブ訴訟における却下の申立てが解決されるまで、Kirst訴訟を延期する命令を出しました。
2022年8月30日、メサ訴訟が提起されました。2022年10月3日、デラウェア州裁判所は、シンナトゥライ訴訟の棄却またはシンナトゥライ訴訟における運用上の苦情に対する回答の提出のいずれか早い方まで、メサ訴訟のすべての手続きと期限を延期するという当事者の要求を認める命令を出しました。2023年1月9日、シンナトゥライ訴訟の却下の申立てに関する判決を受けて、デラウェア州裁判所は、被告による出頭停止の申立てに関連して、ブリーフィングスケジュールの設定を求めるメサ訴訟当事者の要求を認める命令を出しました。2023年2月28日、裁判所は被告の申立てを認め、第2次統合デリバティブ訴訟で控訴できない最終的な判決が下されるまで、Mesa訴訟を延期しました。
2022年12月7日、アコスタ訴訟が提起されました。2023年2月6日、被告はアコスタ訴訟の訴状と召喚状の送達を受け入れました。2023年3月9日、裁判所は、第二次統合デリバティブ訴訟において上訴できない最終的な判決が下されるまで、アコスタ訴訟を延期するという両当事者の要求を認める命令を出しました。2023年6月28日、当社は保険会社の代表者とともに、シンナトゥライ・アクションの原告と原告と調停面し、和解案について話し合いました。両当事者は、友好的な解決が可能かどうかについて引き続き話し合っています。
2023年4月17日、ニードルマン訴訟が提起されました。2023年7月12日、両当事者は、第2次統合デリバティブ訴訟における棄却の申立てに関するメリーランド州裁判所の判決が出るまで、ニードルマン訴訟を延期する条項と命令を提出しました。この請求、および上記の請求の経済的影響は推定できません。
2021年2月26日、トーマス・ゴルビンスキーという会社の株主が、デラウェア州裁判所に当社の取締役会メンバーおよび上級管理職メンバーに対してデリバティブ訴訟を提起しました。「トーマス・ゴルビンスキー対リチャード・H・ダグラス他、第2021-0172-JRS」というキャプションが付けられました。会社は名目上の被告とみなされます。ゴルビンスキーは、2020年4月と2020年6月に行われた株式報奨が「スプリングロード」、つまりそのような取締役会メンバーまたは上級管理職が会社に関する未公開の重要な情報を所有していたとされる時期に行われたものであるという理由で異議を申し立てました。訴状には、受託者責任の違反、無駄、不当利得の請求がありました。原告は、会社に対する損害賠償裁定、両方の裁定を取り消す命令または棄権を求める命令、および訴訟に関連して発生した弁護士費用の裁定を求めました。2021年5月10日、被告は訴状を完全に却下するよう動きました。2021年6月17日、当社の株主は2020年4月の賞の批准と2020年6月の賞の批准に賛成票を投じました。批准提案の詳細は、2021年5月3日に提出された当社の最終委任勧誘状に記載されています。投票の結果は、2021年6月24日に提出されたフォーム8-Kに関する当社の最新報告書で開示されました。その後、原告は、2021年6月17日の投票結果に基づき、2020年4月と2020年6月の裁定から生じた訴訟や請求をもはや追求するつもりはないと規定しました。2021年8月23日、原告は弁護士費用および経費の裁定を求める申立てを提出し、被告はこれに異議を申し立てました。2022年10月18日、デラウェア州裁判所は原告の手数料申請を完全に却下しました。以前のデラウェア州裁判所の命令により、原告の手数料申請が却下された時点で、訴訟は偏見をもって自動的に却下されました。2022年11月14日、ゴルビンスキーはデラウェア州最高裁判所に控訴通知を提出しました。原告/控訴人は、2022年12月30日に最初の控訴概要を提出しました。会社は2023年1月30日にレスポンシブブリーフを提出し、控訴人は2023年2月14日に回答概要を提出しました。2023年6月8日、最高裁判所は、チャンスリー裁判所による原告の手数料申請の却下を支持しました。この訴訟は2023年6月26日にクローズされました。
2022年3月29日、Par Sterile Products, LLC(「Par」)は、NVX-CoV2373の充填仕上げ製造サービスを提供するために同社が2020年9月にParと締結した製造およびサービス契約(「Par MSA」)の特定の条項に会社が違反したとして、当社に対する仲裁請求を米国仲裁協会に提出しました。2023年4月4日、両当事者は和解契約と請求の解除を締結し、それに基づいてNovavaxは$を支払うことに同意しました27.0額面金額は100万ドルで、2023年3月31日時点で全額発生しています。Novavaxは支払いをドルと特徴づけました15.0解約手数料 (百万円) と12.0百万決済の支払い。Parとその親会社であるEndo International plcは、第11章の破産手続きの当事者であるため、和解契約と請求の放棄、およびそれに基づく支払いには、破産裁判所の承認が必要であり、その後承認を受けました。会社は和解契約と請求の放棄に必要な支払いを行いましたが、2023年8月1日にParとNovavaxが共同で申し立てた後、仲裁は偏見をもって却下されました。
2022年11月18日、当社は、Gaviが購入を怠ったことを理由にGavi APAを終了するよう書面でGaviに通知しました 350Gavi APAの要求に応じて、当社からNVX-CoV2373を100万回投与しました。2022年11月18日現在、当社はGavi APAでの注文を約 2百万回投与。2022年12月2日、Gaviは、Gaviが契約を拒否したため、Gavi APAに重大な違反があったというGaviの主張に基づいて、Gavi APAの終了を目的とした書面による通知を発行しました。Gaviはまた、Gavi APAの終了を理由に、COVAXファシリティに参加している購入者が行った拘束力のある注文の購入価格から差し引かれた金額を差し引いた前払い金額の払い戻しを受ける権利があると主張しています。2022年12月31日以降、Gaviの前払いの残りの金額は、$696.42023年6月30日現在、100万ドルは、残りの前払金額の返還に関するGaviとの紛争が解決されるまで、当社の連結貸借対照表ではその他の流動負債に分類されています。2023年1月24日、Gaviは上記の請求に基づいて国際仲裁裁判所に仲裁請求を提出しました。同社は2023年3月2日に回答と反訴を提出しました。2023年4月5日、Gaviは会社の反訴に対する回答を提出しました。仲裁審問は2024年7月に予定されており、その後に書面による決定が下されます。仲裁は本質的に不確実であり、当社はGaviから受け取った残りの前払い金額を留保する権利があると考えていますが、Gaviから残りの前払金額の全部または一部を返金するよう求められる可能性があります。
同社はまた、通常の業務過程で生じるさまざまな法的手続きにも関与しています。これらの他の法的手続きの結果を予測することは本質的に困難ですが、当社は、これらの他の法的手続きの解決が財政状態、経営成績、またはキャッシュフローに重大な悪影響を及ぼすとは考えていません。
ノート 16 – リストラ
2023年6月30日までの3か月と6か月の間に、リストラ計画の結果として当社が記録したリストラ費用には、(千単位)が含まれます。
| | | | | |
| 金額 |
| 退職金と従業員給付費用 | $ | 4,643 | |
| |
| |
| 資産の減損 | 10,081 | |
| |
| |
リストラ費用の総額 (1) | $ | 14,724 | |
(1) $のリストラ費用0.5百万、ドル2.7百万と $11.52023年6月30日までの3か月と6か月間の連結営業報告書では、それぞれ売上原価、研究開発費、販売費、一般管理費に100万円が含まれています。これらの費用は、リストラ計画に基づいて予想されるリストラ費用のほぼすべてを反映しています。
退職金と従業員給付費用
リストラ計画に基づく人員削減の影響を受ける従業員は、退職金と特定の解雇給付を受ける権利があります。同社は、3023年6月30日までの3か月間に退職の通知を受け、将来の勤務要件がなかった従業員を対象に、退職金および退職給付費用の全額を記録しました。会社は合計$を支払いました3.62023年6月30日までの3か月間の退職金および従業員福利厚生費用、および残りの負債は$です1.02023年6月30日現在、当社の連結貸借対照表の未払費用には百万ドルが含まれています。
資産の減損
リストラ計画に関連して、同社はメリーランド州ゲーサーズバーグにある特定の賃貸実験室やオフィススペースを含む、長期にわたる資産の減損を評価しました。当社は、該当する長期資産の減損評価を実施しましたが、これは判断次第であり、実際の結果は予想と異なる場合があり、その結果、記録された金額が将来調整される可能性があります。2023年6月30日までの3か月と6か月の間に、会社は$の減損費用を記録しました10.1長期資産の減損に関連する100万ドル(ドルを含む)5.9施設リースのROU資産に関連する数百万。
アイテム 2.経営陣による財政状態と経営成績に関する議論と分析
フォーム10-Qのこの四半期報告書(「四半期報告書」)の以下の説明やその他の場所にある、Novavax, Inc.(以下「Novavax」とその完全子会社「当社」)の期待、信念、計画、目的、仮定、または将来の出来事や業績に関する記述は、歴史的事実ではなく、将来の見通しに関する記述です。このような将来の見通しに関する記述には、当社の能力、目標、将来の収益と経費水準に関する期待、および資金調達活動に関する記述、2023年6月30日までの期間の未監査の財務諸表の日付から1年間継続する能力を含む当社の事業計画と見通し、より焦点を絞った投資を含む当社のグローバルなリストラおよびコスト削減計画(「リストラクチャリング計画」)が含まれますが、これらに限定されません当社のNVX-CoV2373プログラム、パイプライン支出の削減、製造ネットワークの継続的な合理化、グローバルな労働力の削減、および施設とインフラの統合、人員削減の規模と時期、開発後期段階に向けてCOVID-19-インフルエンザ併用(「CIC」)ワクチン候補を進めるという決定が労働力要件に与える影響、人員削減による費用と現金支出の金額と時期、および予想される時期と影響当社のグローバルなリストラとコスト削減計画によるコスト削減の。潜在的な市場規模と製品候補の需要、製品候補の有効性、安全性、および使用目的、臨床段階の製品候補と、「XBB COVIDワクチン」と呼ばれる最新の一価オミクロンXBB.1.5 COVID-19ワクチンを含む組換えワクチンとアジュバント技術の開発、臨床試験の実施、時期、および潜在的な臨床試験の結果、計画と潜在的なタイミング米国食品医薬品局(「FDA」)への提出を含む、規制当局への提出書類のNovavax COVID-19ワクチン、アジュバンテッドの完全承認のための生物製剤ライセンス申請。当社および当社のパートナーによるNVX-CoV2373の製造能力、時期、生産、流通、および納入に対する当社の期待、NVX-CoV2373の継続的な開発と商品化またはライセンス供与に関する当社の期待、インフルエンザワクチン候補であるCOVID-19-インフルエンザ併用の継続的な開発(「CIC」)ワクチン候補、高用量のCOVID-19ワクチン候補、およびCOVID-19変異株を含む一価製剤、これには、第2b/3相Hummingbird™ 試験の結果が予想される時期と、2023年秋のワクチン接種シーズンに向けた当社の取り組み、NVX-CoV2373ラベルをブースターとして世界的に、さまざまな年齢層や地域に拡大するための取り組み、規制措置の予想時期、内容、結果、USG協定に基づく米国政府のパートナーシップ(以前はオペレーションワープスピードと呼ばれていました)からの資金提供が含まれます下記); 当社の事前購入契約(「APA」)および供給契約に基づく資金調達、および修正、終了、またはそのような契約に関連する法的紛争、当社が利用できる現金資源と使用方法、一般的な資金調達の有無、提携活動と事業開発イニシアチブに関する計画、および本書で言及されているその他の事項。一般的に、将来の見通しに関する記述は、「信じる」、「かもしれない」、「できる」、「する」、「できる」、「できる」、「できる」、「見積もり」、「続ける」、「継続する」、「継続する」、「継続する」、「検討する」、「予測する」、「意図する」、「探す」、「計画」、「計画」、「計画」、「期待」、「すべき」などの言葉やフレーズを使って特定できます。「する」、「目指す」、「仮定する」、またはこれらの用語の否定的言葉、またはその他の同等の用語ですが、将来の見通しに関する記述のすべてにこれらの言葉が含まれているわけではありません。
将来の見通しに関する記述は、歴史的事実でも将来の業績を保証するものでもありません。代わりに、それらは私たちのビジネスの将来についての私たちの現在の信念と期待、将来の計画と戦略、予測、予想される出来事と傾向、経済、およびその他の将来の状況にのみ基づいています。将来の見通しに関する記述には、推定、仮定、リスク、および不確実性が含まれており、実際の結果や結果が、将来の見通しに関する記述で表明または暗示されているものと大きく異なる可能性があります。したがって、そのような将来の見通しに関する記述にあまり依存しないでください。このようなリスクと不確実性には、2023年秋のCOVIDワクチンシーズンに向けてCOVID-19に対するXBB COVIDワクチンの開発、製造、流通、または販売を成功させる当社の能力が含まれますが、これらに限定されません。これは本質的に不確実であり、規制当局の承認、用量の適時提供能力、商業的採用、市場での受け入れなど、多くのリスクを伴います。NVX-CoV2373またはそれを含むCOVID-19変異株の商業的採用を獲得する際の課題です。策定。単独で、またはパートナーと一緒に満足できる課題、さまざまな安全性、FDA、世界保健機関(「WHO」)、英国(「英国」)医薬品・ヘルスケア製品規制庁(「MHRA」)、欧州医薬品庁(「EMA」)、韓国の食品医薬品安全部、または日本などの該当する規制当局を満たすために必要な、有効性および製品特性評価要件(プロセス認定、アッセイ検証、安定性試験に関連するものを含む)の厚生労働省、臨床試験の実施における課題または遅延、または規制の取得2023年秋のワクチン接種シーズンに間に合う一価XBB COVIDワクチンを含む当社の製品候補の承認、または将来のCOVID変異株の変更、製造、流通、輸出の遅延または課題(2023年秋のワクチン接種シーズンにそのようなワクチン候補を適時に届けるためのXBB COVIDワクチンの販売についてインドの医薬品ライセンス機関から承認を得る必要性を含む)。当社は、CO-IPLとSLSに独占的に依存しています。調合と充填、およびNVX-CoV2373を仕上げるためのPCIとその影響これらのサプライヤーの顧客からの注文の配送業務の遅延または中断、希少な原材料や消耗品の入手の難しさ、人的資本や製造能力を含むリソースの制約、複数の法域で同時に複数の法域で計画された規制経路を追求するNovavaxの能力に対する制約、規制当局への提出書類のばらつきや潜在的な規制措置、複数の商社、政府、その他の団体との契約に基づく契約上の要件を満たす際の課題;グローバルなリストラクチャリングを実施する際の課題とコスト
削減計画、およびフォーム10-Qのこの四半期報告書のパートII、項目1A「リスク要因」、2023年3月31日に終了した四半期のフォーム10-Qの四半期報告書のパートII、項目1A「リスク要因」、および終了した年度のフォーム10-Kの年次報告書のパートI、項目1A「リスク要因」に記載されているその他のリスクと不確実性 2022年12月31日。これは、SECに提出される他の文書で詳述、変更、または更新される可能性があります。www.sec.govおよびwww.novavax.comで入手できます。これらの申告書は作成され次第読むことをお勧めします。
将来の結果、出来事、活動レベル、業績、または業績を保証することはできません。この四半期報告書の将来の見通しに関する記述の一部または全部が、不正確であるか、実際の結果と大きく異なることが判明する可能性があります。さらに、将来の見通しに関する記述は、それが作成された日付の時点でのみ述べられており、法律で義務付けられている場合を除き、当社は、新しい情報、将来の出来事、またはその他の結果として、将来の見通しに関する記述を更新または改訂する義務を負わないものとします。新しい要因が時々出現し、どの要因が発生するかを予測することはできません。さらに、各要因が当社の事業に与える影響や、何らかの要因または要因の組み合わせにより、実際の結果が将来の見通しに関する記述に含まれるものと大きく異なる可能性があるかを評価することはできません。
この四半期報告書の情報には、米国で一般に認められている会計原則(「GAAP」)に従って作成されていない財務指標(「調整後売上原価」と呼びます)が含まれています。私たちの事業とその業績を理解しやすくするために、この非GAAP財務指標を提示しています。調整後の売上原価には、以前はNVX-CoV2373の規制当局による承認前に研究開発に費やされていた標準的な製造費の見積もりが含まれており、そうでなければ在庫に資産計上されていたはずです。提示されている非GAAP財務指標は、GAAPで要求される財務指標に代わるものではなく、またそのように見なされるべきでもありません。GAAPで規定されている標準化された意味はなく、他の企業の同様の指標の計算と比較できない場合があります。
[概要]
私たちは、重篤な感染症を予防する革新的なワクチンの発見、開発、商品化を通じて、世界の健康増進を促進するバイオテクノロジー企業です。当社独自の組換え技術プラットフォームは、遺伝子工学の力とスピードを活用して、緊急のグローバルヘルスのニーズに対応するように設計された免疫原性の高いナノ粒子ワクチンを効率的に製造しています。
私たちのワクチン候補は、天然の病原体に見られるものを模倣した、構造的に正しい組換えタンパク質のナノ構造です。この技術により、免疫系は標的タンパク質を認識し、防御抗体を開発することができます。私たちのワクチン技術は、自然発生する免疫や他のワクチンのアプローチよりも効果的な分化免疫応答の誘導につながる可能性があると私たちは信じています。当社のワクチン候補には、免疫応答を高め、高レベルの機能性抗体を刺激し、細胞性免疫応答を誘発する当社独自のサポニンベースのMatrix-M™ アジュバントも組み込まれています。
私たちは、成人の両方を対象に、世界中の複数の規制当局から完全な販売承認(「MA」)、承認、暫定承認、暫定承認、条件付き販売承認(「CMA」)、および緊急使用許可(「EUA」)を受けたCOVID-19ワクチン、NVX-CoV2373(「Nuvaxovid™」、「Covovax™」、「Novavax COVID-19 ワクチン、アジュバンテッド」)を開発しました。と、主要シリーズとして、および同種と異種のブースター適応の両方について、および思春期の集団が対象です。さらに、規制当局や公衆衛生当局と協力して、2023年秋のシーズンに向けたFDA、WHO、EMAの勧告に沿ったXBB COVIDワクチンを商業規模で開発および製造してきました。規制当局からの承認を待つ間、2023年秋のワクチン接種キャンペーン用のXBB COVIDワクチンを届ける予定です。また、スタンドアロンのインフルエンザワクチン候補、高用量のCOVID-19ワクチン候補、およびCICワクチン候補も開発しています。COVID-19と季節性インフルエンザに加えて、私たちの他の重点分野には、最近いくつかの国で認可を受けたR21/Matrix-M™ アジュバントマラリアワクチンなど、マラリアの予防に関する共同研究のためのMatrix-M™ アジュバントの提供や、ビル&メリンダ・ゲイツ医学研究所と提携したMatrix-M™ アジュバントを用いたその他の前臨床ワクチン研究などがあります。
私たちは、2023年の秋にXBB COVIDワクチンを接種するという最優先事項に合わせて、投資と活動を調整するように組織を集中させるつもりです。機会を最大化し、COVID-19市場の重大なリスクと不確実性を軽減するために、私たちは支出の削減、キャッシュランウェイの拡大、効率的な運営のためのコスト再編措置を進め、長期的な成長を実現するために会社が最適な立場に立つことを目指しています。これらのコスト再編戦略については、この四半期報告書の連結財務諸表の注記2で詳しく説明しています。
技術の概要
当社独自のMatrix-M™ アジュバントと組み合わされた組換えナノ粒子ワクチン技術は、呼吸器やその他の広範囲を標的とするワクチン候補の開発と商品化に適していると考えています。
風土病や新興感染症。
組換えナノ粒子ワクチン技術
目的の病原体が特定されると、抗原をコードする遺伝子配列が選択され、ワクチン構築物が開発されます。遺伝子配列は、タンパク質の安定性を高めたり、分解に対する耐性を付与したりするように最適化されている可能性があります。この遺伝子構築物は、バキュロウイルスのSpodoptera frugiperda(「SF/bV」)昆虫細胞発現システムに挿入され、最適化されたタンパク質の効率的かつ大規模な発現を可能にします。SF/bVシステムは、適切に折りたたまれて改変されたタンパク質ベースの抗原を生成します。これは、機能的で防御的な免疫にとって重要な場合があります。タンパク質抗原は、ポリソルベートベースのナノ粒子コアを中心に、本来の状態に似た構成で精製され、組織化されます。その結果、Matrix-M™ アジュバントをすぐに配合できる免疫原性の高いナノ粒子が得られます。
マトリックス-M™ アジュバント
当社独自のMatrix-M™ アジュバントは、当社のプラットフォームにおける重要な差別化要因です。このアジュバントは、注射部位への抗原提示細胞(「APC」)の侵入を刺激し、局所リンパ節での抗原提示を促進することにより、強力で耐容性が高く持続的な効果をもたらしました。これにより、APC、T細胞とB細胞の集団、形質細胞が活性化され、免疫増強反応である高親和性抗体の産生が促進されます。この強力な作用機序により、低用量の抗原で望ましい免疫応答が得られるため、ワクチンの供給と製造能力の向上に貢献します。これらの免疫力を高め、用量を節約する機能は、アジュバントの非常にユニークな特徴の一因となっています。
私たちは、Matrix-M™ アジュバントを他のメーカーが製造したワクチン抗原と併用する商業的機会を引き続き評価しています。Matrix-M™ アジュバントは、オックスフォード大学ジェンナー研究所が作成したマラリアワクチン候補であるR21/Matrix-M™ アジュバントなど、パートナー主導のいくつかのマラリアワクチン候補と組み合わせて評価されています。R21/Matrix-M™ アジュバントワクチンは、セラム・インスティテュート・オブ・インディア株式会社(「SIIPL」)に商業化のライセンス供与を受けています。さらに、2023年5月、ビル&メリンダ・ゲイツ医学研究所と、前臨床ワクチン研究に使用するためのMatrix-M™ アジュバントを提供する3年間の契約を締結しました。また、当社のアジュバント技術は、馬インフルエンザやストラングルに対する動物用ワクチンの主要成分として、またクロゴケグサの抗毒剤の製造における重要な要素として、商業パートナーによっても使用されています。
COVID-19ワクチンの規制とライセンス
私たちは、COVID-19ワクチンの規制当局の認可を拡大し続け、2023年秋に予定されているXBB COVIDワクチンのEUA申請に引き続き注力しています。私たちは、FDA、WHO、EMA、MHRAなどの主要な規制機関を含め、世界40か国以上でNVX-CoV2373の認可を受けています。現在までに、一部の地域で、18歳以上の成人集団、12〜17歳の青年集団、および7〜11歳の小児集団を対象に、完全なMA、承認、暫定承認、暫定承認、CMA、およびEUAを受けています。NVX-CoV2373の規制認可には、特定の国における一次シリーズと相同ブースター適応症と異種ブースター適応症の両方が含まれています。当社のワクチンが規制当局の認可を受けている地域では、NVX-CoV2373は(i)ヌバクソビッド™(SARS-CoV-2 rS組換え、アジュバント)、(ii)Covovax™(SIIPLによる製造および商品化)、または(iii)ノババックスCOVID-19ワクチン、アジュバンテッドのブランド名で販売されています。
以下に、フォーム10-Qへの提出日までのNVX-CoV2373の2023年第2四半期とその後の規制の進捗状況を示します。
2023年7月、私たちは12歳以上の個人を対象としたノババックスCOVID-19ワクチンの完全承認のための生物製剤ライセンス申請の段階的提出を開始しました。
2023年7月、欧州連合の欧州委員会は、12歳以上の個人を対象としたプライマリシリーズとして、18歳以上の成人を対象としたブースターとして、Nuvaxovid™ の最初の完全MAを認可しました。この決定は、2023年5月に欧州医薬品庁のヒト用医薬品委員会が正修士号を求めたという肯定的な意見に続くものです。
2023年5月、シンガポール保健科学局は、12歳から17歳の青少年を対象とした非mRNAオプションとしてのNuvaxovid™ の暫定承認の延長を許可しました。
さらに、2023年5月、台湾の食品医薬品局は、12歳から17歳の青少年のブースターとしてNuvaxovid™ のEUAを認可しました。
私たちは、成人と青少年の異種ブースト療法、年少の小児における一次ワクチン接種と再ワクチン接種のラベルを引き続き拡大し、幅広い市場アクセスを可能にする支持的な政策提言を実現するよう取り組んでいます。私たちは、COVID-19ワクチンへの世界的なアクセスを促進するために、政府、規制当局、非政府組織と緊密に協力し続けています。
臨床パイプライン
私たちの臨床パイプラインは、当社のCOVID-19ワクチンであるNVX-CoV2373を主力製品とする感染症のワクチン候補で構成されています。NVX-CoV2373は、世界中の成人と青少年の両方を対象とした認可を受けています。私たちは、2つの重要な第3相臨床試験を通じてNVX-CoV2373を進めました。これらの試験では、試験の実施中に、良好な安全性を維持しながら、元のCOVID-19株と一般的に流行しているCOVID-19変異株の両方に対して高い有効性が示されました。現在、2023年秋のシーズンに向けたFDA、WHO、EMAの勧告に沿ったXBB COVIDワクチンを開発中です。2023年6月、米国ワクチンおよび関連生物製品諮問委員会の会議で、XBB COVIDワクチンがオミクロンXBB.1.5、XBB1.16、およびXBB.2.3サブバリアントに対して機能性免疫応答を誘発することを示す非臨床データを共有しました。これは、フォワードドリフト変異に適用できる可能性のある幅広い反応を示しています。私たちは、EUAやその他の規制当局向けのXBB COVIDワクチンを裏付けるために、COVID-19フェーズ3の菌株変化中間研究報告書とその他の非臨床データおよび製造データの概要を最終決定しています。これは、FDAが提出物に対して規制措置を講じ、米国疾病予防管理センターが2023年9月の後半にワクチン接種の推奨を行うことを伝える、米国保健福祉サービス局がすべてのCOVID-19メーカーに宛てた期待に沿ったものです。EUAおよびその他の規制当局の承認を待つ間、2023年の秋にXBB COVIDワクチンを商品化して、市場におけるタンパク質ベースの選択肢へのアクセスと入手可能性を提供する予定です。新型コロナウイルス以外にも、当社の臨床パイプラインには、季節性インフルエンザやCICワクチンのほか、マラリアの予防に関する共同研究に使用されているMatrix-M™ アジュバントも含まれています。
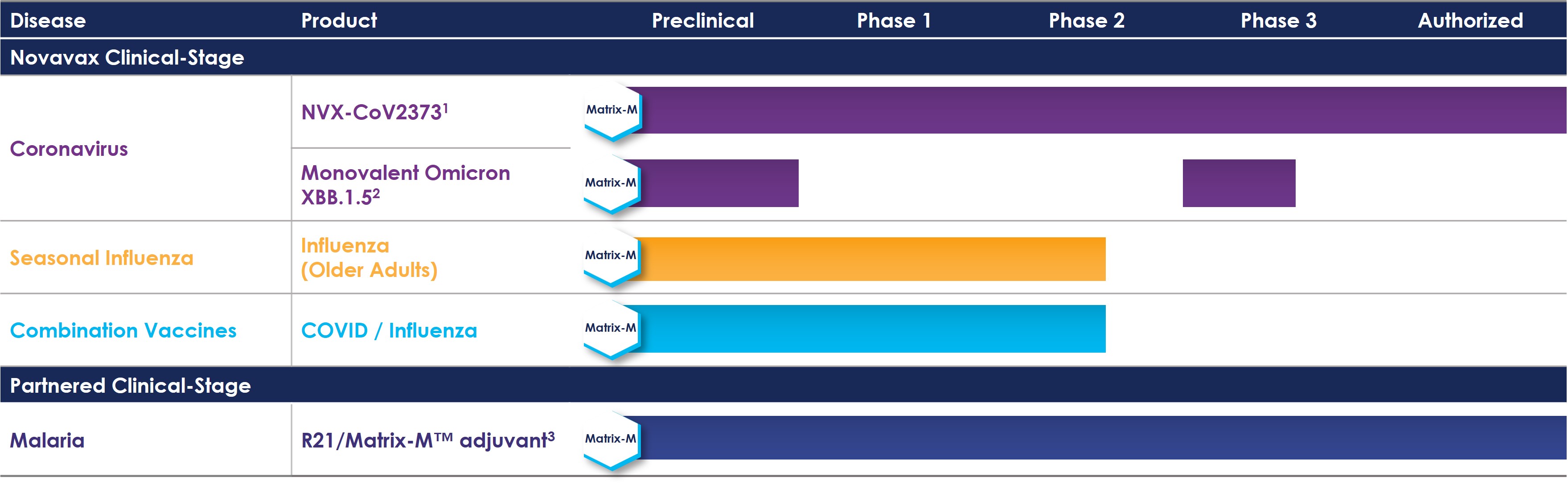
下のパイプラインチャートは、私たちが短期的に注力している中核的な臨床開発プログラムをまとめたものです。
(1) 一部の地域では、ノババックスCOVID-19ワクチン、アジュバンテッド、コボバックス™、ヌバクソビッド™ の商品名で認可されています。
(2)進行中の第3相菌株変更試験。
(3) R21/Matrix-M™ アジュバント・マラリアワクチンはSIIPLによって商品化されています。
コロナウイルスワクチンの臨床開発
私たちは、来たる2023年秋に予定されているXBB COVIDワクチンのFDA、WHO、およびEMAへの承認申請を支援するために、継続的かつ計画的なブースター研究を通じてワクチンの有効性を評価し続けています。これらの研究を活用して、世界中の一次適応症、再ワクチン接種、小児適応症に対するCOVID-19ワクチンの追加の規制当局認可を求めることを期待しています。
第3相ひずみ変化試験
2023年8月、私たちは3つの共同原発性を達成した第3相菌株交換試験のトップライン結果を発表しました
当社のプロトタイプワクチン(NVX-CoV2373)と比較して、二価プロトタイプのオミクロンBA.5バリアントとオミクロンBA.5ワクチンの免疫学的優位性を示すエンドポイントです。この研究では、以前にmRNAワクチンを3回以上接種した成人750人を対象に、プロトタイプワクチン(NVX-CoV2373)を一価オミクロンBA.5ワクチンおよび二価ワクチン(プロトタイプおよびオミクロンBA.5)と比較しました。この研究デザインは、XBB COVIDワクチンに関するFDAへの間近に迫っている株変更EUAの要請に対応するために、規制当局と協議して作成されました。
データはまた、一価のオミクロンBA.5ワクチンが二価ワクチン(プロトタイプとオミクロンBA.5)よりも高い中和力価と血清反応率で優れていることを示しており、2023年の秋のワクチンシーズンにおけるXBB COVIDワクチンの使用を裏付けています。これらの結果は、当社のタンパク質ベースのワクチンが新しい変異株にうまく適応できることを示しています。
フェーズ2b/3ハミングバード™ トライアル
2023年8月、私たちは6歳から11歳の小児を対象に主要評価項目を達成した第2b/3相Hummingbird™ 試験のトップライン結果を発表し、免疫学的有効性が確認されました。この進行中の試験では、NVX-CoV2373を2回接種し、続いて一次ワクチン接種シリーズの6か月後にブースターを投与することの安全性、有効性(免疫原性)、および有効性を評価しています。この試験には、それぞれ1,200人の子供からなる年齢制限緩和コホートが3つ含まれています。2歳から5歳までの次のグループは完全に登録され、2023年の第4四半期にトップラインの結果が出ると予想されています。
COVID-インフルエンザの組み合わせとスタンドアロンのインフルエンザプログラム
2023年5月、CIC、スタンドアロンインフルエンザ、および高用量のCOVID-19ワクチン候補を対象とした第2相試験の暫定トップラインデータを発表しました。3つのワクチン候補すべてに当社のMatrix-M™ アジュバントが含まれており、予備的に強力な免疫反応を示し、安全性プロファイルが安心でき、認可されたインフルエンザワクチンの比較群に匹敵する反応原性を示しました。私たちは、選ばれた候補者を開発の後期段階に進めるための選択肢をさらに模索するつもりです。
R21/Matrix-M™ アジュバント・マラリアワクチン
私たちのパートナー主導のマラリア候補は、将来の発展のための大きな機会を提供します。当社のパートナーであるオックスフォード大学ジェンナー研究所が開発し、SIIPLが製造したR21/Matrix-M™ アジュバントマラリアワクチンの第3相臨床試験が進行中です。このワクチンは当社のMatrix-M™ アジュバントを配合しています。2023年4月、R21/Matrix-M™ アジュバントマラリアワクチンは、ガーナとナイジェリアを含む複数の認可を受け、2023年7月にブルキナファソでも認可を受けました。私たちはSIIPLとR21/Matrix-M™ アジュバントマラリアワクチンの製造に関する契約を結んでいます。SIIPLはMatrix-M™ アジュバントを購入し、ワクチンの売上に基づいてロイヤルティを支払います。
ビジネスハイライト
2023年第2四半期と最近のハイライト
第2四半期中、私たちは2023年に向けた3つの主要な優先事項について引き続き進展を遂げました。
優先事項 #1: 来たる2023年秋のワクチン接種シーズンに向けて、最新のCOVIDワクチンを届けましょう
第2四半期も、2023年秋のシーズンに向けて最新のXBB COVIDワクチンを提供する準備を続けました。米国を含む当社の主要なターゲット市場のほとんどでは、承認されれば、ノババックスワクチンは、利用可能な唯一の非mRNAタンパク質ベースのXBB COVIDワクチンになります。
•FDA、EMA、WHOの勧告に従い、秋に向けて最新のXBB COVIDワクチンを届ける準備を続けてください
◦米国で申請を開始し、今後数週間以内に欧州連合(「EU」)とカナダでの提出を予定しています
◦世界市場に供給するために、商業規模で製造を続けています
◦米国、EU、その他の特定の市場にコマーシャルチームをフル配置し、市場アクセスをサポートする契約を締結しています
•12歳以上の個人では一次シリーズとして、18歳以上の成人を対象としたブースターとして、Nuvaxovid™ のEUで最初の完全販売承認を受けました
•Novavax COVID-19ワクチンの完全承認のための米国生物製剤ライセンス申請(BLA)のローリング提出を開始しました。アジュバントは12歳から18歳の成人と青少年を対象としています
優先事項 #2: 支出率を下げ、キャッシュフローを管理し、規模と構造を発展させましょう
私たちは財政状態の強化に向けて大きな進歩を遂げました。私たちは、長期的な価値創造のための強固な財務基盤を構築することを目標に、支出の削減、一時的負債の処理、キャッシュフローの改善という約束を引き続き果たしました。
•流動負債を第2四半期に3億2,300万ドル、2023年上半期に8億6,400万ドル削減しました
•研究開発と販売、一般管理費を合わせた費用を、2022年の同時期の3億9,800万ドルから2023年第2四半期には3億1,300万ドルに削減しました
•リストラクチャリング計画は順調に進んでおり、研究開発と販売、一般管理費を合わせた年間の費用を合わせた費用を2022年と比較して2023年には約20%から25%、2024年には2022年と比較して約40%から50%削減するという目標を改めて表明しました。
•2023年6月に修正カナダAPAを締結し、Nuvaxovid™ の最新の配送スケジュールの概要を説明し、2023年の支払いで最大3億5000万ドルの交渉を行いました
優先事項 #3: 当社のテクノロジープラットフォーム、能力、資産ポートフォリオを活用して、Nuvaxovid以外の付加価値を高めましょうティム 一人で
私たちは、長期的な成長を実現し、世界の健康を守ることを目的として、パイプラインとテクノロジープラットフォームを引き続き活用しました。
•CICの第2相安全性と免疫原性の結果を継続的に受領して分析した結果、2023年と2024年に戦略的なステージゲート投資を行い、開発後期段階に備えて共同製剤したCICワクチン候補を進めることを決定しました
•Matrix-Mとのパートナーシップを進め続けましたTMアジュバント技術
◦オックスフォード大学およびSIIPLと提携して、ガーナ、ナイジェリア、ブルキナファソでR21/Matrix-Mの認可を取得しましたTMMatrix-Mを活用したマラリアワクチンTMアジュバント技術
•ビル&メリンダ・ゲイツ医学研究所との提携を発表し、Matrix-Mを提供しましたTM前臨床ワクチン研究で使用するためのアジュバント
普通株式の売却
2021年6月に、市場発行販売契約(「2021年6月の売買契約」)を締結しました。これにより、総収入が最大5億ドルの普通株式を発行して売却することができます。2023年6月30日までの3か月と6か月の間に、2021年6月の売買契約に基づいて790万株の普通株式を売却した結果、純収入は約6,800万ドルになりました。そのうち600万ドルは、2023年6月30日の時点で前払費用およびその他の流動資産に含まれ、2023年7月に現金で受領されました。2023年6月30日の時点で、2021年6月の売買契約に基づいて利用可能な残高は約2億4,900万ドルでした。
2022年6月30日までの6か月間に、2021年6月の売買契約に基づき、220万株の普通株式を売却し、純利益は約1億7,900万ドルになりました。
重要な会計方針と見積もりの使用
当社の財政状態と経営成績に関する議論と分析は、米国で一般に認められている会計原則に従って作成された連結財務諸表(未監査)と付随する注記に基づいています。
連結財務諸表の作成には、報告された資産、負債、資本の金額に影響する見積もり、仮定、判断を行い、その日付における偶発資産と負債の開示を行う必要があります
報告期間中の財務諸表および報告された収益および費用の金額。当社の重要な会計方針と見積もりは、SECに提出された2022年12月31日に終了した会計年度のフォーム10-Kの年次報告書の項目7に含まれています。
まだ採択されていない最近の会計上の宣言
当社の連結財務諸表注記(キャプションの下)に含まれている「注記2―重要な会計方針の要約」を参照してください最近の会計上の宣言”).
業務結果
以下は、過去の財政状態と当社の経営成績についての説明です。この四半期報告書に記載されている未監査の連結財務諸表および注記と併せて読む必要があります。
2023年6月30日と2022年6月30日に終了した3か月間
収益
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した3か月間 |
| 2023 | | 2022 | | 変更 |
| 収益 (千単位): | | | | | |
| 製品販売 | $ | 285,163 | | | $ | 55,455 | | | $ | 229,708 | |
| 助成金 | 137,079 | | | 107,774 | | | 29,305 | |
| ロイヤルティとその他 | 2,184 | | | 22,696 | | | (20,512) | |
| 総収入 | $ | 424,426 | | | $ | 185,925 | | | $ | 238,501 | |
2023年6月30日までの3か月間の収益は、2022年の同時期の1億8,590万ドルと比較して4億2,440万ドルで、2億3,850万ドル増加しました。2023年6月30日および2022年6月30日までの3か月間の収益は、主にNVX-CoV2373の製品販売およびアドバンスト・テクノロジー・インターナショナルとの米国政府契約(「USG契約」)に基づいて行われたサービスからの収益で構成されていました。アドバンスト・テクノロジー・インターナショナルは、以前はオペレーション・ワープ・スピードと呼ばれていたパートナーシップに関連して、メディカルCBRN防衛コンソーシアムに代わって行動するコンソーシアム管理会社です。収益の増加は主に、2023年6月30日までの3か月間のNVX-CoV2373の用量販売量が2022年の同時期と比較して増加したことによるものです。
製品販売
2023年6月30日までの3か月間の製品売上高は、2022年6月30日までの3か月間の5,550万ドルに対し、2億8,520万ドルでした。当社の製品販売は、APA契約に基づくNVX-CoV2373の販売に関連していました。製品販売の地理的分布は次のとおりです。
| | | | | | | | | | | | | | | | | |
| 3月31日に終了した3か月間 |
| 2023 | | 2022 | | 変更 |
北アメリカ | $ | — | | | $ | — | | | $ | — | |
| ヨーロッパ | 1,518 | | | — | | | 1,518 | |
その他の地域 | 283,645 | | | 55,455 | | | 228,190 | |
| 製品の総売上収入 | $ | 285,163 | | | $ | 55,455 | | | $ | 229,708 | |
助成金
2023年6月30日までの3か月間の助成金収入は、2022年の同時期の1億780万ドルと比較して1億3710万ドルで、2,930万ドル増加しました。2023年と2022年の助成金収入は、USG協定に基づいて実施されたサービスの収益で構成されていました。この増加は主に、2023年6月30日までの3か月間にUSG協定に基づく支援活動が増加したことによるものです。
経費
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した3か月間 |
| 2023 | | 2022 | | 変更 |
| 経費 (千単位): | | | | | |
| 売上原価 | $ | 55,777 | | | 271,077 | | | $ | (215,300) | |
| 研究開発 | 219,475 | | | 289,648 | | | (70,173) | |
| 販売、一般、管理 | 93,717 | | | 108,160 | | | (14,443) | |
| 経費合計 | $ | 368,969 | | | $ | 668,885 | | | $ | (299,916) | |
売上原価
2023年6月30日までの3か月間の売上原価は5,580万ドルでした。これには、特定の企業購買契約の超過、陳腐化、または期限切れの在庫と損失に関連する1,980万ドルの費用と、以前に認識された企業購買コミットメントに対する特定の削減を交渉したことに関連する1,790万ドルのクレジットが含まれます。2022年6月30日までの3か月間の売上原価は2億7,110万ドルでした。これには、超過在在庫、陳腐化在庫、または期限切れ在庫に関連する2億5,530万ドルの費用と、企業購入契約の損失が含まれます。規制当局の承認を受ける前は、製造コストを研究開発費として計上していました。規制当局の承認を受けた後、製品に関連する経済的利益を受ける権利が現在あると判断した場合、そのサプライチェーンの生産コストを資産計上します。製造したワクチン製品と成分の数量を追跡しましたが、承認前の製造コストは追跡していませんでした。そのため、承認前に作成された発売前在庫の製造コストは合理的に決定できません。ただし、ワクチン製品およびコンポーネントの在庫を作成するための将来の製造コストに関する予想に基づくと、2023年6月30日の時点で、承認前に費用処理された販売可能な商業在庫は約2,590万ドルあったと推定しています。2023年までに、削減された在庫の大部分を利用する予定です。2023年6月30日までの3か月間に販売された在庫を、過剰在庫や古くなった在庫に関連する費用を含め、予想される標準原価で評価した場合、その期間の調整後売上原価は約7,170万ドルで、認識された売上原価と比較して1,590万ドル調整されたことになります。2022年6月30日までの3か月間に販売された在庫が予想標準原価で評価された場合、その期間の調整後売上原価は約2億7,950万ドル、調整後840万ドルになります。製品売上に占める売上原価の割合は、お客様の価格構成または標準原価の変更の結果として、将来変動する可能性があります。
研究開発費用
研究開発費は、2022年6月30日までの3か月間の2億8,960万ドルに対し、2023年6月30日までの3か月間の研究開発費は2億1,950万ドルで、7,020万ドル減少しました。この減少は主に、下の表(千単位)に要約されているように、NVX-CoV2373やXBB COVIDワクチン、およびCICを含むコロナウイルスワクチンの開発活動に関連する総支出の減少によるものです。
| | | | | | | | | | | |
| 6月30日に終了した3か月間 |
| 2023 | | 2022 |
| コロナウイルスワクチン | $ | 139,646 | | | $ | 201,015 | |
インフルエンザワクチン | — | | | 2,274 | |
| その他のワクチン開発プログラム | 285 | | | 224 | |
| 外部からの直接研究開発費の総額 | 139,931 | | | 203,513 | |
| 従業員経費 | 46,132 | | | 43,177 | |
| 株式ベースの報酬費用 | 9,946 | | | 19,695 | |
| 施設経費 | 14,158 | | | 10,863 | |
| その他の費用 | 9,308 | | | 12,400 | |
| 研究開発費の合計 | $ | 219,475 | | | $ | 289,648 | |
2023年6月30日と2022年6月30日に終了した3か月間のコロナウイルスワクチンの研究開発費は、主に受託製造組織(「CMO」)および受託製造開発機関(「CDMO」)との製造供給契約に基づく製造およびサポートコストの削減、臨床研究費の削減、および社内製造の商業化の結果として、2億100万ドルから1億3,960万ドルに減少しました。
能力は、CMOやCDMOとの製造供給契約に組み込まれていると当社が判断したリースの製造コストに関連して、それぞれ2,050万ドルと8,720万ドルの利益によって相殺されます。
販売費、一般管理費
2023年6月30日までの3か月間の販売、一般、および管理費は、2022年の同時期の1億820万ドルから9,370万ドルで、1,440万ドル減少しました。販売費、一般管理費の減少は、主に営業支出を削減するための特定のコスト抑制措置によるもので、1150万ドルのリストラ費用によって一部相殺されています。
2023年6月30日までの3か月間に発表されたリストラ計画の結果として、2023年の残りの期間は、研究開発費と販売、一般管理費を合わせた年間の支出が削減されると予想しています。
その他の収入 (費用)
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した3か月間 |
| 2023 | | 2022 | | 変更 |
| その他の収入 (費用): | | | | | |
| 支払利息 | $ | (3,124) | | | $ | (6,234) | | | $ | 3,110 | |
| その他の収入 (費用) | 5,532 | | | (19,873) | | | 25,405 | |
| その他の収益(費用)の合計、純額 | $ | 2,408 | | | $ | (26,107) | | | $ | 28,515 | |
2023年6月30日までの3か月間のその他の収入の純額は240万ドルでしたが、2022年の同時期のその他の費用の合計は2,610万ドルでした。その他の収益の増加は、Novavax CZとの会社間ローンを含む外貨建て残高に対する為替レートによる好影響によるものです。
所得税費用
2023年6月30日と2022年6月30日に終了した3か月間に、連邦、州、および外国の所得税に関連する所得税費用について、それぞれ10万ドルの所得税控除と140万ドルの所得税費用を認識しました。
純利益 (損失)
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した3か月間 |
| 2023 | | 2022 | | 変更 |
| 純利益(損失)(千単位、1株あたりの情報を除く): | | | | | |
| 当期純利益 (損失) | $ | 58,008 | | | $ | (510,485) | | | $ | 568,493 | |
| 1株当たり純利益(損失)、基本利益 | $ | 0.65 | | | $ | (6.53) | | | $ | 7.18 | |
| 1株当たりの純利益(損失)、希薄化後 | $ | 0.58 | | | $ | (6.53) | | | $ | 7.11 | |
| 加重平均発行済株式、基本 | 89,362 | | | 78,143 | | | 11,219 | |
| 加重平均発行済株式、希薄化後 | 104,065 | | | 78,143 | | | 25,922 | |
2023年6月30日までの3か月間の純利益は5,800万ドル、つまり基本1株あたり0.65ドルでしたが、2022年の同時期の純損失は5億1,050万ドル、つまり基本1株あたり6.53ドルでした。2023年6月30日までの3か月間の収益の増加は、主に、2023年6月30日までの3か月間にNVX-CoV2373の商業販売が増加したことと、リストラクチャリング計画の実施による企業買収、研究開発、販売、一般管理費の超過在庫、時代遅れ、または期限切れの在庫と損失の減少によるものです。
2023年6月30日までの3か月間の加重平均発行済株式数の増加は、主に普通株式の売却によるものでした。
2023年および2022年6月30日に終了した6か月間
収益
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 | | 変更 |
| 収益 (千単位): | | | | | |
| 製品販売 | $ | 277,706 | | | $ | 641,083 | | | $ | (363,377) | |
| 助成金 | 224,458 | | | 207,075 | | | 17,383 | |
| ロイヤルティとその他 | 3,213 | | | 41,738 | | | (38,525) | |
| 総収入 | $ | 505,377 | | | $ | 889,896 | | | $ | (384,519) | |
2023年6月30日までの6か月間の収益は、2022年の同時期の8億8,990万ドルと比較して5億540万ドルで、3億8,450万ドル減少しました。2023年6月30日までの6か月間の収益は、主にNVX-CoV2373の製品販売と当社のUSG契約に基づいて実施されたサービスからの収益で構成されていました。収益の減少は主に、2023年6月30日までの6か月間のNVX-CoV2373の用量の販売量が2022年の同時期と比較して減少したことによるものです。
製品販売
2023年6月30日までの6か月間の製品売上高は、2022年6月30日までの6か月間の6億4,110万ドルに対し、2億7,770万ドルでした。当社の製品販売は、APA契約に基づくNVX-CoV2373の販売に関連していました。製品販売の地理的分布は次のとおりです。
| | | | | | | | | | | | | | | | | |
| 6月31日に終了した6か月間 |
| 2023 | | 2022 | | 変更 |
北アメリカ | $ | — | | | $ | 64,762 | | | $ | (64,762) | |
| ヨーロッパ | 58,785 | | | 413,745 | | | (354,960) | |
その他の地域 | 218,921 | | | 162,576 | | | 56,345 | |
| 製品の総売上収入 | $ | 277,706 | | | $ | 641,083 | | | $ | (363,377) | |
助成金
2023年6月30日までの6か月間の助成金収入は、2022年の同時期の2億710万ドルと比較して2億2450万ドルで、1,740万ドル増加しました。2023年と2022年の助成金収入は、USG協定に基づいて実施されたサービスの収益で構成されていました。この増加は主に、2023年6月30日までの6か月間にUSG協定に基づく臨床および開発活動が増加したことによるものです。
経費
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 | | 変更 |
| 経費 (千単位): | | | | | |
| 売上原価 | $ | 89,863 | | | $ | 286,281 | | | $ | (196,418) | |
| 研究開発 | 466,576 | | | 673,131 | | | (206,555) | |
| 販売、一般、管理 | 206,249 | | | 204,152 | | | 2,097 | |
| 経費合計 | $ | 762,688 | | | $ | 1,163,564 | | | $ | (400,876) | |
売上原価
2023年6月30日までの6か月間の売上原価は8,990万ドルでした。これには、特定の企業購入契約の超過、陳腐化、または期限切れの在庫と損失に関連する4,000万ドルの費用と、以前に認識されていた特定の企業購入コミットメントの交渉による削減に関連する1,880万ドルのクレジットが含まれます。2022年6月30日までの6か月間の売上原価は2億8,630万ドルでした。これには、超過在在庫、陳腐化在庫、または期限切れ在庫に関連する2億5,530万ドルの費用と、企業購入契約の損失が含まれます。承認を受ける前に、製造コストを研究開発費として計上していました。承認を受けた後、製品に関連する経済的利益を受ける権利が現在あると判断した場合、特定のサプライチェーンの生産コストを資産計上します。製造したワクチン製品と成分の数量を追跡しましたが、承認前の製造コストは追跡していませんでした。そのため、承認前に作成された発売前在庫の製造コストは合理的に決定できません。ただし、ワクチン製品およびコンポーネントの在庫を作成するための将来の製造コストに関する予想に基づくと、2023年6月30日の時点で、承認前に支出された商業在庫は約2,590万ドルあったと推定しています。2023年までに、削減された在庫の大部分を利用する予定です。2023年6月30日までの6か月間に販売された在庫を、余剰在庫や古くなった在庫に関連する費用を含め、予想される標準原価で評価した場合、その期間の調整後売上原価は約1億2,080万ドルで、認識された売上原価と比較して3,090万ドル調整されたことになります。2022年6月30日までの3か月間に販売された在庫が予想標準原価で評価された場合、その期間の調整後売上原価は約4億3,950万ドル、調整後1億5,320万ドルになります。製品売上に占める売上原価の割合は、顧客構成または標準原価の変更の結果として、将来変動する可能性があります。
研究開発費用
研究開発費は、2022年の同時期の6億7,310万ドルから、2023年6月30日までの6か月間の4億6,660万ドルに減少し、2億660万ドル減少しました。この減少は主に、下の表(千単位)に要約されているように、NVX-CoV2373やXBB COVIDワクチン、およびCICを含むコロナウイルスワクチンの開発活動に関連する総支出の減少によるものです。
| | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 |
| コロナウイルスワクチン | $ | 279,869 | | | $ | 489,948 | |
インフルエンザワクチン | 1,476 | | | 3,570 | |
| その他のワクチン開発プログラム | 557 | | | 1,027 | |
| 外部からの直接研究開発費の総額 | 281,902 | | | 494,545 | |
| 従業員経費 | 99,545 | | | 86,919 | |
| 株式ベースの報酬費用 | 23,804 | | | 36,582 | |
| 施設経費 | 33,561 | | | 24,072 | |
| その他の費用 | 27,764 | | | 31,013 | |
| 研究開発費の合計 | $ | 466,576 | | | $ | 673,131 | |
2023年6月30日と2022年6月30日までの6か月間のコロナウイルスワクチンの研究開発費は、主にCMOおよびCDMOとの製造供給契約に基づく製造およびサポートコストの削減、臨床研究コストの削減、および社内製造能力の商業化の結果ですが、以前に加速したことに関連してそれぞれ3,220万ドルと6,740万ドルのメリットによって相殺されました。に組み込まれていると私たちが判断したリースの製造原価CMOやCDMOとの製造供給契約。
販売費、一般管理費
販売費、一般管理費は、2022年の同時期の2億420万ドルから、2023年6月30日までの6か月間で2億620万ドルに増加し、210万ドル増加しました。販売費、一般管理費の増加は、主にリストラ費用によるものですが、NVX-CoV2373プログラムをサポートする専門家費用やマーケティング費用の削減など、営業支出を削減するためのコスト抑制措置によって一部相殺されています。
その他の収入 (費用)
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 | | 変更 |
| その他の収入(費用)(千単位): | | | | | |
| | | | | |
| 支払利息 | $ | (7,440) | | | $ | (11,110) | | | $ | 3,670 | |
| その他の収入 (費用) | 29,894 | | | (18,219) | | | 48,113 | |
| その他の収益(費用)の合計、純額 | $ | 22,454 | | | $ | (29,329) | | | $ | 51,783 | |
2023年6月30日までの6か月間のその他の収益の合計は、その他の費用の合計が2,250万ドルで、2022年の同時期の純額は2,930万ドルでした。2023年6月30日までの6か月間に、Novavax CZとの会社間ローンを含む外貨建て残高に対する為替レートによる好影響と、金利の上昇による投資収益の増加により、その他の収益が増加しました。2022年6月30日までの6か月間、その他の費用は主に、Novavax CZとの会社間ローンに対する為替レートの差異による不利な影響に関連していました。
所得税費用
2023年6月30日と2022年に終了した6か月間に、連邦および州の所得税に関連する所得税費用と、ロイヤルティに対する外国の源泉徴収税に関連する所得税費用が、それぞれ計上されました。
純損失
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 | | 変更 |
| 純損失(千単位、1株あたりの情報を除く): | | | | | |
| 純損失 | $ | (235,897) | | | $ | (307,077) | | | $ | 71,180 | |
| 1株当たり純損失(基本および希薄化後) | $ | (2.69) | | | $ | (3.97) | | | $ | 1.28 | |
| | | | | |
| 加重平均発行済株式、基本発行済株式および希薄化後発行済株式 | 87,769 | | | 77,305 | | | 10,464 | |
| | | | | |
2023年6月30日までの6か月間の純損失は2億3,590万ドル、つまり1株あたり2.69ドルでしたが、2022年の同時期の3億710万ドル、つまり1株あたり3.97ドルでした。2023年6月30日までの6か月間の純損失の減少は、主にNVX-CoV2373に関連する研究開発費と売上原価の減少によるもので、製品販売収益の減少によって一部相殺されました。
2023年6月30日までの6か月間の加重平均発行済株式数の増加は、主に2023年と2022年の当社の普通株式の売却によるものです。
流動性問題と資本資源
当社の将来の資本要件は、製品販売による収益や、戦略的パートナーとのライセンス契約に基づくロイヤリティ、助成金契約に基づく資金調達と返済、さまざまな受託研究機関、CMO、CDMO契約に基づく重要なコミットメントを含むNVX-CoV2373および変異候補の開発と商業支援に関連する当社の予測活動、前臨床研究と臨床試験の進捗状況、時間とおよびこれらに限定されません。入手にかかる費用規制当局の承認、特許請求およびその他の知的財産権の申請、訴訟、弁護、執行にかかる費用、およびその他の製造、販売、流通の費用。インフルエンザワクチン候補や潜在的な混合ワクチン候補など、さまざまな開発段階にある他のワクチンや製品候補の開発を続ける予定です。
私たちは、Gavi、ワクチンアライアンス(「Gavi」)、欧州委員会(「EC」)、および世界のさまざまな国と、APAと呼ばれることもある供給契約を締結しています。また、助成契約やライセンス契約も結んでいます。2023年6月30日現在、履行義務に割り当てられた取引価格の総額は、ライセンス契約、Gaviとの事前購入契約(以下「Gavi APA」)に基づく売上ベースのロイヤルティに関連する金額、および修正および改訂された英国供給契約(以下に定義)に関連する線量の削減を除いては、約20億ドルで、そのうち9,090ドルです。740万は連結残高の繰延収益に含まれています
シート。規制上のマイルストーンを満たさなかったり、政府の諮問委員会から支持的な勧告をタイムリーに入手できなかったり、APAに基づく製品の量や納期の義務を果たせなかったりすると、前払い金やその他の支払いの一部を返金しなければならなかったり、将来の支払い額が減ったりする可能性があり、履行義務の未履行による収益実現能力に悪影響を及ぼす可能性があります。助成金契約に関連する履行義務を履行するタイミングは、臨床試験を含む当社の研究開発活動の結果や用量の提供によって異なります。供給契約に関連する履行義務を履行するタイミングは、製品の製造時期、追加適応症の販売承認の受領、顧客の需要に基づく用量の提供、および特定のAPAに基づくプロトタイプのNVX-CoV2373ワクチンの代わりに顧客が変異ワクチンを要求できるかどうかによって異なります。供給契約には通常、当社のグローバルな供給コミットメントを支援するために、製造および流通ネットワークの構築と運営に関連する投資の資金調達を支援するための前払いを含む条件が含まれており、NVX-CoV2373の納入時の請求に適用されます。このような前払い金は、通常、開発、規制、および商業上の特定のマイルストーンを達成した時点で返金不可になります。
富士フイルム和解契約に基づき、当社は、富士フイルムCSAに基づくFDBTでの製造活動のキャンセルに関連して、富士フイルムに最大1億8,500万ドルの和解金を支払う責任を負います。このうち、(i)CSAに基づく初期予約手数料となる4,780万ドルは、2022年9月30日の和解金として入金され、(ii)残りの残高は4四半期に分けて支払われますそれぞれ3,430万ドルの分割払い。2023年6月30日までの3か月と6か月間に1回目と2回目の分割払いを支払い、残りの6,860万ドルは未払費用に反映されます(この四半期報告書の連結財務諸表の注記4を参照してください)。
2023年4月、和解契約および請求の免除に基づき、Par Sterile Products, LLC(「Par」)に2,700万ドルを支払いました(この四半期報告書の連結財務諸表の注記15を参照)。
さらに、私たちは引き続き製造ニーズを評価し、NVX-CoV2373の供給に関する契約上の義務と予想される需要に合わせて、グローバルな製造拠点を変更しています。その際、多額のコストが発生する可能性があることを認識しています。現在、私たちは共製剤と充填をSIIPLとSLS、NVX-CoV2373の仕上げをPCIのみに頼っています。これらのサプライヤーの業務の遅延や中断により、顧客の注文の配達が妨げられたり遅れたりする可能性があります。
NVX-CoV2373の用量の購入について、オーストラリア連邦とAPA(以下「オーストラリアAPA」)を締結しています。2023年4月、私たちはオーストラリアのAPAを改正し、投与回数を減らし、それに見合った用量単価を引き上げました。これにより、オーストラリアのAPAの契約総額は、2024年まで投与される用量で維持されます。2023年5月、2022年にオーストラリアに納入された特定の用量のうち、オーストラリアAPAに基づく代替品の対象となった用量のクレジットを延長しました。このクレジットは、オーストラリア政府に単一ロットを売却した結果です。事前に計画された6か月の安定性試験で、定義された仕様を下回ったことが判明したため、そのロットは市場から除外されました。このクレジットは、オーストラリアへの今後の用量の販売に適用されます。2023年7月、私たちはオーストラリアのAPAを改正して、代替用量を規定し、2025年まで納品スケジュールを延長しました。
NVX-CoV2373(以下「カナダAPA」)の用量の購入について、公共事業・政府サービス大臣(以下「カナダ政府」)が代表を務めるカナダ右翼女王陛下の権益の後継者として、カナダ右翼国王陛下とのAPAを設けています。2023年4月、私たちはカナダのAPAを改正し、当初2022年に納入される予定だった特定の用量を2023年の第2四半期に受け取った1億40万ドルの支払いで没収しました。2023年6月、私たちはカナダのAPAに追加の改正(「2023年6月改正」)を締結しました。2023年6月の改正に従い、両当事者は、(i)以前に納入予定されていたNVX-CoV2373の一定用量を没収すること、(ii)納入予定のNVX-CoV2373の投与量を減らすこと、(iii)残りの投与量のNVX-CoV2373の納入スケジュールを改訂すること、(iv)生物製剤製造センター(「BMC」)社を利用して、2024年と2025年の用量の抗原を大量生産しました。NVX-CoV2373の用量の没収に関連して、カナダ政府は2023年に合計3億4,960万ドルを2回に分けて会社に支払うことに合意しました。この合計金額は、没収されたワクチンの投与量に関してカナダ政府が支払うべき残りの残高に相当します。最初の分割払いは2023年6月の修正条項の施行時に支払われ、2回目の分割払いは2023年後半にワクチン接種が行われた時点で支払われます。最初の分割払いは2023年7月にカナダ政府から1億7,480万ドルを受け取りました。会社が2023年後半までにカナダ政府にCOVID-19ワクチンの投与量を届けなかった場合、1億7,480万ドルの2回目の分割払いは終了し、会社への支払いはできなくなります。カナダ政府は、2024年12月31日以前にNVX-CoV2373の生産にBMCを使用するための規制当局の承認を得られなかった場合、修正されたカナダのAPAを終了することがあります。2023年6月の修正により、元のカナダのAPAの契約総額が維持されました。
2023年6月の改正に従い、私たちとカナダ政府は、以前に合意したカナダ国内での取り組みを拡大し、カナダに健康、経済、および将来のパンデミックに備えるための給付を提供するために提携するよう努めます。その価値は、設備投資、活動やサービスの実施、技術または知的財産ライセンスの提供を含むがこれらに限定されないさまざまな活動を通じて提供されます。さらに、両当事者は覚書(「覚書」)を締結するよう努めます。覚書(「覚書」)は、当社が15年間にわたってそのような利益を提供できることを説明するものです。その総額は、2023年6月の修正に基づいて支払われ、最終的に当社が受領する金額の100%以上です。私たちは、カナダ政府の利益のために2,000万ドルのエスクローを保有することに合意しました。この金額は、覚書に基づいて履行されなかった場合にカナダ政府が利用できる唯一の手段です。
2022年7月、当社は英国および北アイルランド連合王国政府(以下「当局」)を代表して、ビジネス、エネルギー、産業戦略担当国務長官(英国保健安全保障局に任命)と、修正および改訂されたSARS-CoV-2ワクチン供給契約(2022年9月26日に改正、「修正および改訂された英国供給協定」)を締結しました。2020年10月22日付けの両当事者間のSARS-CoV-2ワクチン供給協定(「元の英国供給契約」)の全文を記載しています」)。当初の英国供給契約に基づき、当局はNVX-CoV2373を6,000万回分購入することに合意し、当社に前払いをしました。修正および改訂された英国供給契約の条件に基づき、当局はNVX-CoV2373を最低100万回分、さらに最大1,500万回(「条件付き投与量」)を購入することに合意しました。条件付き投与の回数は、ワクチン接種と予防接種に関する合同委員会(「JCVI」)からの支持的な勧告が適時に達成されたことを条件とし、それに基づいて削減される場合があります。)これは、(a)SARSの一環としての一般成人集団へのワクチンの使用に関して、英国保健大臣によって承認されています-英国でのCoV-2ワクチン追加接種キャンペーン、または (b) 英国でのSARS-CoV-2ワクチン追加接種キャンペーンの一環としての、または一次シリーズのSARS-CoV-2ワクチン接種の青少年全般。ただし、その勧告が英国の人口100万人未満の1人以上の集団グループのみを対象とする場合は除きます。当局が条件付き用量を購入しない場合、またはそのような条件付き投与回数がNVX-CoV2373の1,500万回分未満に減らされた場合、元の英国供給契約に基づいて当局から以前に受け取った前払いに関連して最大2億2,500万ドルを返済する必要があります。修正および改訂された英国供給契約に基づき、当局は2024年までに1回以上のトランシェで最大4,400万回分を追加購入することもできます。
2022年11月30日現在、JCVIはまだNVX-CoV2373に関する支持的な勧告を行っていなかったため、改正・改訂された英国供給協定の条件に基づき、(i) 条件付き投与回数を1500万回から750万回に減らすことになりました。条件付き投与回数の削減は、条件付き投与回数の条件付きで、以下に基づいてさらに削減される可能性があります、2023年11月30日までに、上記の段落に記載されているとおり、英国保健省長官によって承認されたJCVIからの支持勧告を適時に達成しました。および (ii) 当初の英国供給契約に基づいて当局から以前に受け取った前払い金に関連する1億1,250万ドルの返済義務。2023年4月、私たちは2022年11月30日のトリガーイベントに関連する1億1,250万ドルを返済しました。2023年11月30日までにJCVIからの支持勧告を適時に達成できない場合、条件付き投与回数を750万回からゼロに減らし、2024年にはさらに1億1,250万ドルの返済を求められる可能性があります。
Gavi APAの条件に基づき、WHOによるNVX-CoV2373の緊急使用ライセンスの取得に関連して、2021年にGaviから3億5,000万ドルの前払い金を受け取り、2022年に3億5,000万ドルの追加支払いを受けました(「前払金額」)。2022年11月18日、GaviがGaviAPAの要求に従って3億5000万回分のNVX-CoV2373を当社から購入できなかったことを理由に、GaviAPAを終了するようGaviに書面で通知しました。2022年11月18日の時点で、Gavi APAでは約200万回分の注文しか受けていませんでした。2022年12月2日、Gaviは、Gaviが契約を拒否したため、Gavi APAに重大な違反があったというGaviの主張に基づいて、Gavi APAの終了を目的とした書面による通知を発行しました。Gaviはまた、Gavi APAの終了を理由に、COVAXファシリティに参加している購入者が行った拘束力のある注文の購入価格から差し引かれた金額を差し引いた前払い金額の払い戻しを受ける権利があると主張しています。2022年12月31日以降、残りのGavi前払い金額は、2023年6月30日時点で6億9,640万ドルで、残りの前払い額の返還に関するGaviとの紛争が解決するまで保留中ですが、当社の連結貸借対照表では、その他の流動負債に分類されています。2023年1月24日、Gaviは上記の請求に基づいて国際仲裁裁判所に仲裁請求を提出しました。2023年3月2日に回答と反訴を提出しました。2023年4月5日、Gaviは反訴に対する回答を提出しました。仲裁審問は2024年7月に予定されており、その後に書面による決定が下されます。仲裁は本質的に不確実であり、当社はGaviから受け取った残りの前払い金額を留保する権利があると考えていますが、Gaviから残りの前払金額の全部または一部を返金するよう求められる可能性があります。
2023年2月、USG協定の修正17の締結に関連して、米国政府は、この賞を現在の実施期間を超えて延長することはできないと私たちに指示しました。USG協定が以前に予想していたように修正されない場合、6月30日の残りの2億5,060万ドルの資金のすべてを受け取ることができない可能性があります。
2023年は、USG協定に従って以前に予想していました。修正17には、製造作業に関連する6,000万ドルの対価の支払いを、最大150万回分のNVX-CoV2373の配送、および商業的準備に関する開発および規制上のマイルストーン、EUAの拡大、複数のバイアルプレゼンテーションの開発など、特定のマイルストーンを満たすことを条件とすることを要求する条項が含まれていました。2023年6月30日の時点で、2023年の秋のワクチン接種キャンペーンで承認できるこれらの偶発的なマイルストーンのうち、4,800万ドルを制限しました。
私たちの資金調達契約には現在、エピデミック対策イノベーション連合(「CEPI」)からの1つ以上の免除可能な無利子タームローン(「CEPI免除ローン資金」)という形での資金提供が含まれています。CEPI免除融資資金に基づいて受領した支払いは、CEPIが資金提供したCMOネットワークによって製造されたNVX-CoV2373が1人以上の第三者に販売された場合にのみ返済可能で(これには、以前は当社のGavi APAに基づく販売が含まれていましたが、これらに限定されません)、そのような販売がそのようなワクチンの製造費用に充てられ、CEPIが資金を提供する製造コストは含まれません。ローン返済の時期と金額は、現在不明です。
2023年6月30日の時点で、当社の現金および現金同等物および制限付現金は5億1,790万ドルでしたが、2022年12月31日時点では13億ドルでした。
2023年6月30日までの6か月間の事業資金は、主に現金および現金同等物と製品販売による収益、およびNVX-CoV2373ワクチン開発活動を支援するUSG契約に基づく収益で賄いました。2023年5月、私たちは計画的な支出を削減するためにグローバルフットプリントを再構築する計画を発表しました。将来の事業は、主に製品販売からの収益、USG契約に基づく収益、現金および現金同等物、およびその他の潜在的な資金源によって賄われると予想しています。
次の表は、2023年6月30日および2022年6月30日までの6か月間のキャッシュフロー(千単位)をまとめたものです。
| | | | | | | | | | | | | | | | | |
| 6月30日に終了した6か月間 |
| 2023 | | 2022 | | 変更 |
| 提供した純現金(使用量): | | | | | |
| 営業活動 | $ | (497,531) | | | $ | (259,413) | | | $ | (238,118) | |
| 投資活動 | (31,337) | | | (41,402) | | | 10,065 | |
| 資金調達活動 | (293,044) | | | 164,524 | | | (457,568) | |
| 現金、現金同等物、制限付現金の為替レートへの影響 | (8,992) | | | (4,453) | | | (4,539) | |
| 現金、現金同等物、および制限付現金の純増額(減少) | (830,904) | | | (140,744) | | | (690,160) | |
| 現金、現金同等物、および期首制限付現金 | 1,348,845 | | | 1,528,259 | | | (179,414) | |
| 現金、現金同等物、および期末制限付現金 | $ | 517,941 | | | $ | 1,387,515 | | | $ | (869,574) | |
2023年6月30日までの6か月間の営業活動に使用された純現金は、2022年の同時期の2億5,940万ドルに対し、4億9,750万ドルでした。営業活動に使用される現金の増加は、主にAPAに基づいて受け取る前払いの減少によるもので、ベンダーへの支払いのタイミングによって一部相殺されています。
投資活動に使用された純現金は、2022年の同時期の4,140万ドルに対し、2023年6月30日までの6か月間で3,130万ドルでした。投資活動に使われる現金の減少は、主に設備投資の減少と借地権の改善によるものです。
2023年6月30日までの6か月間の財務活動に使用された純現金は2億9,300万ドルでしたが、2022年の同時期の財務活動によって提供された純現金は1億6,450万ドルでした。財務活動に使用される現金の増加は主に、2023年に3.75%の転換社債が3億2,500万ドル返済されたことと、2022年の2021年6月の売買契約に基づく当社の普通株式の売却による約1億7,900万ドルの純収入によるものです。
ゴーイング・コンサー
この四半期報告書のパートI、項目1「連結財務諸表」にある添付の未監査の連結財務諸表は、財務諸表が発行された日から1年以内も継続する企業であることを前提に作成されています。2023年6月30日の時点で、現金および現金同等物および制限付現金は5億1,790万ドルありました。2023年6月30日までの6か月間に、2億3,590万ドルの純損失を被り、営業活動に使用された純キャッシュフローは4億9,750万ドルでした。
現在の1年間のキャッシュフロー予測では、事業資金を調達するのに十分な資本があると予測していますが、この予測は、今後12か月間の収益、米国政府からの資金調達、仲裁手続きの対象となる係争事項など、重大な不確実性の影響を受けます。当社の収益予測は、2023年秋のCOVIDワクチンシーズンに向けて、COVID-19のワクチン候補となる最新の1価製剤の開発、製造、流通、またはマーケティングを成功させる能力にかかっています。これは本質的に不確実であり、規制当局の承認、用量の適時提供能力、商業的採用、市場での受け入れなど、多くのリスクを伴います。さらに、規制上のマイルストーンを満たさなかったり、政府の諮問委員会から支持的な勧告を適時に入手できなかったり、会社の事前購入契約に基づく製品の量や納期の義務を果たせなかったりすると、会社は前払い金やその他の支払いの一部を返金しなければならなくなったり、将来の支払い額が減額されたりする可能性があります。2023年2月、USG協定の修正17の締結に関連して、米国政府は、賞を現在の履行期間を超えて延長することはできないと私たちに指示しました。その結果、2023年6月30日現在、以前に予想していた残りの2億5,060万ドルの資金のすべてを受け取ることができなくなる可能性があります。2023年1月24日、Gaviは、Gavi APAに対する当社による重大な違反の疑いについて、国際仲裁裁判所に仲裁請求を提出しました。その仲裁の結果は本質的に不確実であり、2023年6月30日の時点で、残りの6億9,640万ドルの前払金の全部または一部を返金するよう求められる可能性があります。Gaviとの仲裁に関する追加情報については、この四半期報告書のパートI、項目1「連結財務諸表」の未監査連結財務諸表の注記3と注記15を参照してください。経営陣は、これらの不確実性の大きさを考えると、これらの財務諸表が発表された日から1年間継続して事業を継続できるかどうかについて、大きな疑問があると考えています。
会計基準体系化205-40に従い、ゴーイング・コンサー、これらの未監査の連結財務諸表が発行された日から1年以内に継続企業として存続できるかどうかについて、全体的に見て大きな疑問を呈する状況や出来事があるかどうかを評価しました。2023年5月、私たちはリストラ計画を発表しました。これには、NVX-CoV2373プログラムへのより集中的な投資、パイプライン支出の削減、製造ネットワークの継続的な合理化、グローバルな労働力の削減、施設とインフラの統合が含まれます。人員削減計画には、当社の全世界の労働力を約25%削減することが含まれていました。これは、Novavaxのフルタイムの従業員を約20%削減し、残りは請負業者とコンサルタントで構成されていました。私たちはCICを開発後期段階に向けて進めることを決定しました。そのため、人材要件と将来のニーズを満たす能力への影響を評価しています。2023年6月30日までの3か月間に、1,470万ドルのリストラ費用を1回発生しました。リストラクチャリングの詳細については、パートIの未監査連結財務諸表の注記16を参照してください。対策を実施するタイミング、および当社が事業を行う管轄区域の適用される法律、規制、およびその他の要因により、コスト削減による年間影響の全体は2024年に、年間影響の約半分は2023年に実現すると予想しています。
私たちの事業に資金を提供できるかどうかは、当社の製品および製品候補のワクチン販売に関連する収益に依存します。そのような製品候補がマーケティング承認を受けて商品化に成功するかどうか、特に2023年の秋のワクチン接種キャンペーンは、本質的に不確実であり、規制当局の承認、適時の投与能力、商業的採用、市場での受け入れなど、特定の問題の解決、Gとの紛争の有無、時期、方法などの特定の問題の解決 aviは解決しました。そして経営陣は計画。これには、当社のグローバルなリストラとコスト削減計画に関連するコスト削減の完了が含まれます。私たちの計画には、エクイティファイナンスとデットファイナンス、コラボレーション、戦略的提携、マーケティング、流通、またはライセンス契約を組み合わせて追加資本を調達することが含まれる場合があります。新しい資金調達は、商業的に受け入れられる条件では利用できない場合もあれば、まったく利用できない場合もあります。また、コラボレーション、戦略的提携、マーケティング、流通、またはライセンス契約では、製品または技術に対する当社の権利の一部または全部を放棄することが求められる場合があり、場合によっては、そのような権利の潜在的価値の合計を下回ることもあります。さらに、NVX-CoV2373や、インフルエンザワクチン候補、CICワクチン候補、またはCOVID-19変異株を含む一価製剤を含む当社の他のワクチン候補の規制上および商業上の成功は依然として不明です。追加の資本を獲得できない場合、当社は資本資源を評価し、事業の一部または全部の延期、範囲の縮小、廃止、または組織のさらなる縮小を求められる場合があります。これらのいずれかが当社の事業、財政状態、経営成績、および継続企業としての事業能力に重大な悪影響を及ぼす可能性があります。
アイテム 3.市場リスクに関する定量的および定性的な開示
私たちは、外貨為替レートや金利変動の変動など、経営成績、キャッシュフロー、資産と負債の公正価値に影響を与える可能性のある特定のリスクにさらされています。
外貨為替リスク
当社の本社は米国にありますが、海外子会社の事業を含む当社の業績は、主に米ドルに対するユーロ、英ポンド、スウェーデンクローナ、チェココルナなどの外貨為替レートの変動の影響を受けます。この為替リスクは、当社の現金および現金同等物、キャッシュフロー、および経営成績に重大な影響を与える可能性があります。特に、当社および当社の取引相手の為替リスクに影響を与える条項を含むAPAに基づいて生み出される収益の場合には。これまでのところ、外貨ヘッジ契約は締結していませんが
将来はそうするかもしれません。
また、グローバル事業の結果を、期首から変動した為替レートで米ドルに換算することから生じる外貨為替リスクにも直面しています。当社のグローバル活動の財務結果は米ドルで報告されますが、当社の海外子会社の機能通貨は通常、それぞれの現地通貨です。私たちが事業を行っている国の外貨為替レートの変動は、多くの場合、予測が難しい形で当社の業績に影響を与えます。当社の海外子会社の外国為替レートが(主に米ドルに対して)10%低下すると、2023年6月30日現在、株主資本(赤字)が約2,000万ドル減少することになります。
市場リスクと金利リスク
私たちの投資活動の主な目的は資本の保全であり、第二の目的は収入の最大化です。
金利リスクに対する当社のエクスポージャーは、主に投資ポートフォリオに限定されており、歴史的には売却可能に分類されてきました。市場金利の変動が当社の投資ポートフォリオの実現可能な価値に大きな影響を与えるとは考えていません。金利の変動は、有価証券が満期を迎え、その収益が新しい有価証券に再投資されたときに得られる投資収益に影響を与える可能性があり、したがって当社のキャッシュフローと経営成績に影響を与える可能性があります。
利息と配当収入は、稼いだときに記録され、投資収益に含まれます。有価証券のプレミアムや割引(ある場合)は、満期までに償却または加算され、投資収益に含まれます。当社の有価証券売却による実現損益の計算には、特定の識別方法が使用されます。
当社の転換優先無担保債券は金利が固定されており、追加の重要な負債はありません。そのため、借入活動の結果として重大な金利リスクにさらされるとは考えていません。
アイテム 4.統制と手続き
開示管理と手続きの評価
当社の経営陣は、最高経営責任者および最高財務責任者の支援を得て、2023年6月30日現在の開示管理および手続き(改正された1934年の証券取引法に基づく規則13a-15(e)および15d-15(e)に定義)の有効性をレビューおよび評価しました。経営陣は、どんなにうまく設計され運用されていても、どのような統制や手順も、その目的を達成するための合理的な保証しか提供できないことを認識しています。経営陣は、可能な統制と手順の費用対効果の関係を評価する際に必然的にその判断を適用します。当社の開示管理と手続きは、そのような管理目標の達成を合理的に保証するように設計されています。2023年6月30日現在の当社の開示管理と手続きの評価に基づいて、当社の最高経営責任者および最高財務責任者は、現時点で当社の開示管理および手続きは妥当な保証レベルで有効であると結論付けました。
財務報告に関する内部統制の変更
最高経営責任者や最高財務責任者を含む当社の経営陣は、2023年6月30日に終了した四半期に発生した財務報告に対する内部統制の変更を評価し、次のような結論に達しました。 財務報告に関する内部統制に、財務報告に関する内部統制に重大な影響を及ぼした、または重大な影響を及ぼす可能性がかなり高い変更はありません。
第二部その他の情報
アイテム 1.法的手続き
株主訴訟
2021年11月12日、Sothinathan Sinnathuraiは米国メリーランド州地方裁判所(以下「メリーランド州裁判所」)に、当社および一部の上級管理職メンバーに対して証券集団訴訟を提起しました。「Sothinathan Sinnathurai対Novavax, Inc.他」、「8:21-CV-02910-TDC」(「シンナトゥライ訴訟」)というキャプションが付けられました。)。2022年1月26日、メリーランド州裁判所は、デビッド・チュオン、ナッゲハリ・バルムクンド・ナンドクマール、ジェフリー・ガバートをシンナトゥライ訴訟の共同主任原告として指名する命令を出しました。共同主任原告は、2022年3月11日に、NVX-CoV2373を商業規模で製造し、NVX-CoV2373の規制当局の承認を確保する当社の能力について、被告が虚偽で誤解を招くような陳述をしたと主張して、統合修正訴状を提出しました。修正された訴状では、対象となるクラスを、2021年2月24日から2021年10月19日の間に会社の証券を購入した株主と定義しています。2022年4月25日、被告は統合修正訴状を却下する申立てを提出しました。2022年12月12日、メリーランド州裁判所は、被告の却下の申立ての一部を認め、一部を却下する判決を下しました。メリーランド州の裁判所は、2人の被告人に対するすべての請求、および統合修正訴状で異議を申し立てられた特定の公式声明に基づく請求を却下しました。メリーランド州の裁判所は、残りの請求と被告に関する却下の申立てを却下し、会社と他の被告に14日以内に回答するよう指示しました。2022年12月27日、同社は回答と肯定的な抗弁書を提出しました。
シンナトゥライ訴訟が提起された後、8つの派生訴訟が提起されました:(i)ロバート・E・マイヤー対スタンレー・C・エルク他、第8:21-CV-02996-TDC(「マイヤー・アクション」)、(ii)シュイ・シンヨン対スタンレー・C・エルク他、第8:21-CV-038-24TDC(「ヤング・アクション」)、(iii) ウィリアム・カーストら対スタンレー・C・エルクら、いいえ。C-15-CV-21-000618(「カースト・アクション」)、(iv)エイミー・スナイダー対スタンレー・C・エルク他、No. 8:22-CV-01415-TDC(「スナイダー・アクション」)、(v)チャールズ・R・ブラックバーン他対スタンレー・C・エルク他、第 1:22-CV-01414 17-TDC(「ブラックバーン・アクション」)、(vi)ディエゴ・J・メサ対スタンレー・C・エルク他、2022-0770-NAC号(「メサ・アクション」)、(vii)ショーン・アコスタ対スタンレー・C・エルク他、2022-1133-NAC(「アコスタ・アクション」)、および(viii)J.レッド・ニードルマン対スタンレー・C・エルク他、いいえ。C-15-CV-23-001550(「ニードルマンアクション」)。マイヤー、ヤン、スナイダー、ブラックバーンの訴訟はメリーランド州の裁判所に提起されました。カースト訴訟はメリーランド州モンゴメリー郡巡回裁判所に提起され、その後まもなく、被告によってメリーランド州裁判所に移されました。ニードルマン訴訟は、メリーランド州モンゴメリー郡の巡回裁判所にも提起されました。メサとアコスタの訴訟は、デラウェア州チャンスリー裁判所(「デラウェア州裁判所」)に提起されました。デリバティブ訴訟では、会社の取締役会のメンバーと一部の上級管理職が被告として指名されます。会社は名目上の被告とみなされます。原告は、シンナトゥライ訴訟と実質的に同じ疑惑の事実と状況から生じる派生的請求を主張します。デリバティブに関する苦情を総称すると、受託者責任違反、インサイダー売却、不当利益、連邦証券法違反、統制の乱用、無駄、管理ミスの請求が主張されます。原告は、宣言的救済および差し止めによる救済、ならびに金銭的損害賠償および弁護士費用の裁定を求めます。
2022年2月7日、メリーランド州裁判所は、Meyer訴訟とYung訴訟を統合する命令(「最初の統合デリバティブ訴訟」)を出しました。第1次統合デリバティブ訴訟の原告は、2022年4月25日に連結デリバティブに関する苦情を申し立てました。2022年5月10日、メリーランド州裁判所は、シンナトゥライ訴訟における解雇または回答の提出のいずれか早い方まで、すべての手続きと期限を延期するという当事者の要求を認める命令を出しました。2022年6月10日、スナイダー訴訟とブラックバーン訴訟が提起されました。2022年10月5日、メリーランド州裁判所は、第1次統合デリバティブ訴訟およびスナイダー訴訟およびブラックバーン訴訟の原告による、3つの訴訟すべてを統合し、共同主任原告および共同主任弁護士および連絡弁護士を任命するよう求める要求を認める命令を出しました(「第2次統合デリバティブ訴訟」)。第二次統合デリバティブ訴訟の共同主任原告は、2022年11月21日に統合修正訴状を提出しました。2023年2月10日、被告は第2次連結デリバティブ訴訟を却下する申立てを提出しました。原告は、2023年4月11日に却下の申立てに異議を申し立てました。被告は、2023年5月11日に却下の申立てをさらに裏付ける回答概要を提出しました。
2022年7月21日、メリーランド州裁判所は、州裁判所にカースト訴訟を差し戻す覚書と命令を出しました。2022年12月6日、カースト訴訟の当事者は、原告が2022年12月22日に修正訴状を提出し、(i) 両当事者がキルスト訴訟の規定の執行猶予を申し立てるか、(ii) 被告が2023年1月23日までに訴訟を延期する申立てを提出するかのどちらかの方法で規定されたスケジュールを提出しました。原告は2022年12月30日に修正訴状を提出しました。2023年1月23日、被告はカースト訴訟を延期する申立てを提出しました。2023年2月22日、カースト訴訟の当事者は、第2次連結デリバティブ訴訟における被告の却下申立ての解決を待つ間、カースト訴訟を存続させる条項の承認を裁判所に申請しました。2023年3月22日、裁判所は、第2次連結デリバティブ訴訟における却下申立ての解決を待つ間、Kirst訴訟を留保する命令を出しました。
2022年8月30日、メサ訴訟が提起されました。2022年10月3日、デラウェア州裁判所は、シンナトゥライ訴訟の棄却またはシンナトゥライ訴訟における運用上の苦情に対する回答の提出のいずれか早い方まで、メサ訴訟のすべての手続きと期限を延期するという当事者の要求を認める命令を出しました。2023年1月9日、シンナトゥライ訴訟の却下の申立てに関する判決を受けて、デラウェア州裁判所は、被告による出頭停止の申立てに関連して、ブリーフィングスケジュールの設定を求めるメサ訴訟当事者の要求を認める命令を出しました。2023年2月28日、裁判所は被告の申立てを認め、第2次統合デリバティブ訴訟で控訴できない最終的な判決が下されるまで、Mesa訴訟を延期しました。
2022年12月7日、アコスタ訴訟が提起されました。2023年2月6日、被告はアコスタ訴訟の訴状と召喚状の送達を受け入れました。2023年3月9日、裁判所は、第二次統合デリバティブ訴訟において上訴できない最終的な判決が下されるまで、アコスタ訴訟を延期するという両当事者の要求を認める命令を出しました。2023年6月28日、当社は保険会社の代表者とともに、シンナトゥライ・アクションの原告と原告と調停面し、和解案について話し合いました。両当事者は、友好的な解決が可能かどうかについて引き続き話し合っています。
2023年4月17日、ニードルマン訴訟が提起されました。2023年7月12日、両当事者は、第2次統合デリバティブ訴訟における棄却の申立てに関するメリーランド州裁判所の判決が出るまで、ニードルマン訴訟を延期する条項と命令を提出しました。この請求、および上記の請求の経済的影響は推定できません。
2021年2月26日、トーマス・ゴルビンスキーという会社の株主が、デラウェア州裁判所に当社の取締役会メンバーおよび上級管理職メンバーに対してデリバティブ訴訟を提起しました。「トーマス・ゴルビンスキー対リチャード・H・ダグラス他、第2021-0172-JRS」というキャプションが付けられました。会社は名目上の被告とみなされます。ゴルビンスキーは、2020年4月と2020年6月に行われた株式報奨が「スプリングロード」、つまりそのような取締役会メンバーまたは上級管理職が会社に関する未公開の重要な情報を所有していたとされる時期に行われたものであるという理由で異議を申し立てました。訴状には、受託者責任の違反、無駄、不当利得の請求がありました。原告は、会社に対する損害賠償裁定、両方の裁定を取り消す命令または棄権を求める命令、および訴訟に関連して発生した弁護士費用の裁定を求めました。2021年5月10日、被告は訴状を完全に却下するよう動きました。2021年6月17日、当社の株主は2020年4月の賞の批准と2020年6月の賞の批准に賛成票を投じました。批准提案の詳細は、2021年5月3日に提出された当社の最終委任勧誘状に記載されています。投票の結果は、2021年6月24日に提出されたフォーム8-Kに関する当社の最新報告書で開示されました。その後、原告は、2021年6月17日の投票結果に基づき、2020年4月と2020年6月の裁定から生じた訴訟や請求をもはや追求するつもりはないと規定しました。2021年8月23日、原告は弁護士費用および経費の裁定を求める申立てを提出し、被告はこれに異議を申し立てました。2022年10月18日、デラウェア州裁判所は原告の手数料申請を完全に却下しました。以前のデラウェア州裁判所の命令により、原告の手数料申請が却下された時点で、訴訟は偏見をもって自動的に却下されました。2022年11月14日、ゴルビンスキーはデラウェア州最高裁判所に控訴通知を提出しました。原告/控訴人は、2022年12月30日に最初の控訴概要を提出しました。会社は2023年1月30日にレスポンシブブリーフを提出し、控訴人は2023年2月14日に回答概要を提出しました。2023年6月8日、最高裁判所は、チャンスリー裁判所による原告の手数料申請の却下を支持しました。この訴訟は2023年6月26日にクローズされました。
2022年3月29日、Par Sterile Products, LLC(「Par」)は、NVX-CoV2373の充填仕上げ製造サービスを提供するために同社が2020年9月にParと締結した製造およびサービス契約(「Par MSA」)の特定の条項に会社が違反したとして、当社に対する仲裁請求を米国仲裁協会に提出しました。2023年4月4日、両当事者は和解契約と請求の免除を締結し、これに基づいてNovavaxはParに2,700万ドルを支払うことに合意しました。この金額は、2023年3月31日の時点で全額未払いです。Novavaxは、この支払いを1,500万ドルの解約手数料と1,200万ドルの決済支払いと特徴づけました。Parとその親会社であるEndo International plcは、第11章の破産手続きの当事者であるため、和解契約と請求の放棄、およびそれに基づく支払いには、破産裁判所の承認が必要であり、その後承認を受けました。会社は和解契約と請求の放棄に必要な支払いを行いましたが、2023年8月1日にParとNovavaxが共同で申し立てた後、仲裁は偏見をもって却下されました。
2022年11月18日、当社は、GaviがGavi APAの要求に従って3億5000万回分のNVX-CoV2373を当社から購入しなかったことを理由に、GaviAPAを終了するようGaviに書面で通知しました。2022年11月18日の時点で、当社はGavi APAに基づいて約200万回分の注文しか受けていませんでした。2022年12月2日、Gaviは、Gaviが契約を拒否したため、Gavi APAに重大な違反があったというGaviの主張に基づいて、Gavi APAの終了を目的とした書面による通知を発行しました。Gaviはまた、Gavi APAの終了を理由に、COVAXファシリティに参加している購入者が行った拘束力のある注文の購入価格から差し引かれた金額を差し引いた前払い金額の払い戻しを受ける権利があると主張しています。2022年12月31日以降、残りのGavi前払い金額は、2023年6月30日時点で6億9,640万ドルで、残りの前払い額の返還に関するGaviとの紛争が解決するまで保留中ですが、当社の連結貸借対照表では、その他の流動負債に分類されています。2023年1月24日、Gaviは上記の請求に基づいて国際仲裁裁判所に仲裁請求を提出しました。同社は2023年3月2日に回答と反訴を提出しました。2023年4月5日、Gaviは会社の反訴に対する回答を提出しました。仲裁審問は2024年7月に予定されており、その後に書面による決定が下されます。仲裁は本質的に不確実であり、当社はGaviから受け取った残りの前払い金額を留保する権利があると考えていますが、Gaviから残りの前払金額の全部または一部を返金するよう求められる可能性があります。
また、通常の業務過程で発生するさまざまな法的手続きにも関与しています。これらの他の法的手続きの結果を予測することは本質的に困難ですが、これらの他の法的手続きの解決が当社の財政状態、経営成績、またはキャッシュフローに重大な悪影響を及ぼすとは考えていません。
アイテム 1A.リスク要因
私たちの事業に関連するリスクと不確実性に関する情報は、パートIの項目1Aに記載されています。2023年2月28日にSECに提出された2022年12月31日に終了した会計年度のフォーム10-Kの年次報告書と、パートIIの項目1Aの「リスク要因」。2023年5月9日にSECに提出された2023年3月31日に終了した会計四半期のフォーム10-Qの四半期報告書の「リスク要因」。2022年12月31日に終了した会計年度のフォーム10-Kの年次報告書および2023年3月31日に終了した会計四半期のフォーム10-Qの四半期報告書に以前に開示されたリスク要因から、以下に記載されている以外に重要な変更はありません。
従業員問題、成長管理、情報技術に関連するリスク
現在のキャッシュポジションとキャッシュフローの予測、および2023年の収益、米国政府からの資金調達、およびGaviとの係争中の仲裁に関する重大な不確実性を考えると、この四半期報告書に含まれる財務諸表が発行された日から1年間継続企業として存続できるかどうかについては、かなりの疑問があります。
当社の経営陣は、財務諸表が発行された日から1年以内に継続する企業としての当社の能力に重大な疑問を投げかけるような状況や出来事があるかどうかを総合的に評価する必要があります。2023年6月30日の時点で、現金および現金同等物および制限付現金は5億1,790万ドルありました。2023年6月30日までの6か月間に、2億3,590万ドルの純損失を被り、営業活動に使用された純キャッシュフローは4億9,750万ドルでした。
現在の1年間のキャッシュフロー予測では、事業資金を調達するのに十分な資本があると将来的に予測していますが、この予測には、以下を含む大きな不確実性が伴います。
• 収益: 同社の収益予測は、2023年秋のCOVIDワクチンシーズンに向けて、COVID-19のワクチン候補の最新の1価製剤の開発、製造、流通、販売を成功させる能力にかかっています。これは本質的に不確実であり、規制当局の承認、用量の適時提供能力、商業的採用、市場での受け入れなど、多くのリスクを伴います。さらに、規制上のマイルストーンを満たさなかったり、政府の諮問委員会から支持的な勧告を適時に入手できなかったり、会社の事前購入契約に基づく製品の量や納期の義務を果たせなかったりすると、会社は前払い金やその他の支払いの一部を返金しなければならなくなったり、将来の支払い額が減額されたりする可能性があります。
• 米国政府からの資金: 当社のUSG契約は、その条件により2023年12月に失効します。米国政府は、承認された18億ドルの金額が全額確定するまでUSG協定を延長すると予想していました。2023年2月、USG協定の修正17の締結に関連して、米国政府は、この賞を現在の実施期間を超えて延長することはできないと私たちに指示しました。以前に予想していたようにUSG協定が修正されない場合、残りの2億5,060万ドルの資金のすべてを受け取ることができない可能性があります 2023年6月30日現在私たちは以前、USG協定に従って予想していました。
• 係争中の仲裁:2023年1月24日、Gaviは、Gavi APAに対する当社による重大な違反の疑いについて、国際仲裁裁判所に仲裁請求を提出しました。その仲裁の結果は本質的に不確実であり、残りの6億9,640万ドルの前払いの全部または一部の払い戻しを求められる可能性があります。Gaviとの仲裁に関する追加情報については、フォーム10-Qのこの四半期報告書のパートI、項目1「財務情報」の連結財務諸表の注記3と注記15を参照してください。
経営陣は、これらの不確実性の重大さを考えると、これらの財務諸表が発行された日から1年間継続企業として存続できるかどうかについて、かなりの疑問があると考えています。
当社の事業運営に資金を提供できるかどうかは、当社の製品および製品候補のワクチン販売に関連する収益、そのような製品候補が販売承認を受けて商品化に成功するかどうか、Gaviとの紛争が解決されるかどうか、いつ、どのように解決されるかなどの特定の問題の解決、および当社のグローバルフットプリントの再構築に関連するコスト削減を含む経営陣の計画に依存します。経営陣の計画には、エクイティファイナンスとデットファイナンス、コラボレーション、戦略的提携、マーケティング、流通、またはライセンス契約を組み合わせて追加資本を調達することも含まれる場合があります。2023年5月、私たちはグローバルなリストラとコスト削減計画を発表しました。この計画には、COVID-19ワクチンプログラムへのより焦点を絞った投資、パイプライン支出の削減、製造ネットワークの継続的な合理化、グローバルな労働力の削減、施設とインフラの統合が含まれます。新しい資金調達は、商業的に受け入れられる条件では利用できない場合もあれば、まったく利用できない場合もあります。また、コラボレーション、戦略的提携、マーケティング、流通、またはライセンス契約では、製品または技術に対する当社の権利の一部または全部を放棄することが求められる場合があり、場合によっては、そのような権利の潜在的価値の合計を下回ることもあります。さらに、当社のCOVID-19ワクチンと、インフルエンザワクチン候補、CICワクチン候補、またはCOVID-19変異株を含む一価製剤を含む他のワクチン候補の規制上および商業上の成功は依然として不明です。追加の資本を獲得できない場合、当社は資本資源を評価し、事業の一部または全部の延期、範囲の縮小、廃止、または組織の縮小を求められる場合があります。これらのいずれかが当社の事業、財政状態、経営成績、および継続企業としての事業能力に重大な悪影響を及ぼす可能性があります。
規制やコンプライアンスに関連するリスク
XBB COVIDワクチン、または将来の株の変化に対するCOVIDワクチンの製造、臨床試験、規制当局の承認、および輸出を効果的に進めることができなければ、これらのワクチンの商業的流通の遅れや課題に直面する可能性があります。
米国食品医薬品局(FDA)を含む世界中の規制当局は、2023年秋のCOVIDワクチンシーズンとその後のワクチン接種に向けて、COVIDワクチンを一価のXBB.1.5株に更新することを製造業者に推奨しています。私たちは、2023年秋のCOVIDワクチンシーズンに向けて市販することを目標に、XBB COVIDワクチンの製造、臨床試験、規制当局による承認、および販売を続けています。XBB COVIDワクチンの認可申請書をいくつかの規制当局に提出する予定です。規制当局は引き続きSARS-CoV-2の進化を監視および評価し、製造業者が少なくとも年に1回、COVIDワクチンの組成に対応する更新を行うことを推奨することを期待しています。
XBB COVIDワクチンの開発など、COVIDワクチンの新株を製造するためのこの進化するアプローチに内在しているため、輸出に関する課題を含む規制当局の承認、製造、流通の課題に直面する可能性があります。その際、関連するXBB COVIDワクチンの正確な特性評価プロファイル(純度、効力、安定性などを含む)をサポートする、初期のCOVIDワクチンの製造および商品化の取り組みで採用されていた製造および分析試験方法を使用できるように、規制当局による調整と承認を求めることを期待しています。差し迫った2023年秋のCOVIDワクチンキャンペーン、および今後のその後のキャンペーンでは、製品開発の課題を克服できず、規制当局との調整が取れなかった場合、XBB COVIDワクチンまたは将来のCOVIDワクチンのライセンスを、またはタイムリーに取得する能力に悪影響を与える可能性があります。
XBB COVIDワクチンを含む将来のCOVIDワクチン開発に関して、商業規模でバッチ間の一貫性を実証するのに十分なバッチ分析データを生成できない場合、または当社の漸進的な研究開発プログラムから得られたデータが、ワクチンが適切なレベルのSARS-CoV-2の変異株から個人を保護するためのワクチンの継続的な有効性を裏付けていない場合、規制当局の承認を得られない可能性があります。そのような変異体に対する化力価、または、製品が許容できないほどの安全性を示し、利益とリスクのバランスが悪くなる場合。さらに、公式に指定された研究所による必要なバッチリリース試験で、そのようなワクチンの品質が許容範囲内であることが示されない場合、新しいワクチンロットの配布が承認されない可能性があります。
米国では、XBB COVIDワクチンで使用する予定だった単回投与バイアルの提示をタイムリーに検証することができませんでした。その結果、このワクチンについてFDAからEUAを取得した場合、2023年秋のワクチン接種シーズンには5回分のバイアルでのみ製品を提供すると予想しています。これは、市場の受け入れや製品の返品率に悪影響を及ぼしたり、より高い価格譲歩を必要としたりする可能性があります。米国
完成品はインドのSIIPLによって製造されるため、XBB COVIDワクチンを製品申請の規制審査が保留になっているそれぞれの市場に輸出するには、インドの医薬品管理機関(「DCGI」)からの適時の承認が必要です。このDCGI承認を適時に受けられない場合、XBB COVIDワクチンを適時に商業的に配布できない可能性があります。2023年秋のシーズンです。
COVIDワクチンを十分な量、十分な収量で効果的に製造できない場合、またはCOVIDワクチンの製造施設の規制当局の承認を得ることができない場合、製品開発、臨床試験、規制当局の承認、および商業流通に遅れや悪影響が生じる可能性があります。
私たちは、商品化に向けて、COVIDワクチン(プロトタイプCOVIDワクチンとXBB COVIDワクチンの両方)の製造、流通、臨床試験を続けています。COVIDワクチンやその他のワクチン候補の臨床試験と商品化を完了するには、COVIDワクチンやその他のワクチン候補を十分な収量で商業規模で効果的に製造するための施設の利用または開発が必要です。商業販売に必要な量のワクチン候補を製造した経験は限られています。私たちはCOVIDワクチンの世界的な製造能力を増強しましたが、製造能力を確立し維持するための私たちの努力は、タイミング、スケールアップ、再現性、収量、純度、コスト、効能、または品質に関する期待に応えられない可能性があります。私たちは、ワクチン製造活動のかなりの部分を第三者の組織に大きく依存しています。当社には、COVIDワクチンの世界的な商業化をサポートするための十分な社内製造インフラがなく、COVIDワクチンの成分および商業用充填仕上げ製造に関する第三者契約を締結しています。2023年秋の製造キャンペーンに向けて、当社のCOVIDワクチンの抗原成分はインドのSIIPLで製造され、当社のCOVIDワクチンのMatrix-M™ アジュバント成分は現在ヨーロッパのNovavax ABとAGC Biologicsで製造されています。抗原成分またはアジュバントの製造における課題、または製造後の段階での問題は、当社のCOVIDワクチンの製造を妨げる可能性があります。さらに、現在、私たちは現在、共同製剤、充填、仕上げ(ヨーロッパ以外)をSIIPLとSLS(ヨーロッパ以外)、およびヨーロッパでのCOVIDワクチンの仕上げをPCIのみに依存しています。これらのサプライヤーの業務に遅れや中断があると、顧客の注文の配達が妨げられたり、遅れたりする可能性があります。
さらに、十分な在庫供給を確保し、事業を管理するために、予想される製造要件と顧客の需要を予測して在庫ニーズを予測し、その予測に基づいてサードパーティのメーカーに注文します。COVIDワクチンの需要を正確に予測する当社の能力は、商業戦略の管理における課題、一般的な市況や規制事項の予期せぬ変化、変異型固有のCOVIDワクチンに対する市場の需要など、多くの要因によって悪影響を受ける可能性があります。第三者製造要件を過小評価すると、顧客供給契約に基づく義務を適時に履行できなくなる可能性があります。逆に、第三者製造要件を過大評価すると、在庫レベルが顧客の需要を上回り、その結果、在庫の一部が陳腐化または期限切れになったり、在庫の減価償却や償却が行われたり、以前に予測されていた第三者メーカーの製品バッチをキャンセルしなければならなくなり、材料キャンセル料が発生する可能性があります。たとえば、2022年9月、当社は富士フイルムと機密和解契約および公開契約を締結しました。この契約に基づき、当社は製造活動の終了に関連して富士フイルムに最大1億8,500万ドルの責任を負います。2022年12月、私たちは2022年のバッチのキャンセルに関連して、AGC Biologicsに支払うべき約9,500万ドルの手数料に合意しました。COVIDワクチンの需要とサードパーティメーカーからの必要なサービスを正確に予測できない場合、当社の業績に重大な悪影響が及ぶ可能性があります。
私たちのCOVIDワクチンの製造には複雑なプロセスが必要で、経験は限られています。私たちとサードパーティのメーカーが、COVIDワクチンを臨床量または商業用量で、十分な収量で、必要な仕様で製造できない場合、臨床試験と商品化は遅れ、追加のサードパーティを特定して供給契約を結ぶ必要があります。また、サードパーティの製造業者は、臨床材料や商用製品を製造する前に、FDAまたは同等の外国の規制機関の承認を受ける必要があります。これにより、遅延が発生したり、当社の生産スケジュールが変更されたりする可能性があります。当社のCOVIDワクチンは、これらの第三者の施設へのアクセスをめぐって他の製品と競合しており、第三者が他の製品を優先した場合、製造が遅れる可能性があります。許容できる条件で、またはタイムリーに、必要な追加の第三者製造契約を締結できない場合があります。さらに、技術移転契約を締結し、第三者の製造業者とノウハウを共有する必要があります。これには時間がかかり、遅延を招く可能性があります。
契約上の制約と、商業規模で大量ワクチンを製造するための専門知識、必要な規制当局の承認、および設備を備えた第三者メーカーの数が限られているため、製造業者の交換には費用と時間がかかり、ワクチンの製造が中断される可能性があり、顧客供給契約に基づく義務を適時に履行する能力に悪影響を与える可能性があります。当社および当社の第三者メーカーも、以下に関連する生産上の課題に直面する可能性があります。
•コスト、スケールアップ、利回り。
•原材料や消耗品の不足。
•出荷の遅延やその他のサプライチェーンの混乱
•品質管理と保証。
•汚染、ロットの一貫性、効力、純度。
•有能な人材の不足やその他の能力の制約。
•製品が販売される可能性のある国有化やその他の地域制限を含む、厳格に施行され、進化し続ける連邦、州、および外国の規制の順守。これには、自社および第三者の製造拠点に課せられる国有化やその他の地域制限が含まれます。
•と資本資金。
遅延や中断は、当社の事業、財政状態、経営成績、キャッシュフローに重大な悪影響を及ぼす可能性があります。
アイテム 5.その他の情報
2023年6月30日までの3か月間、会社の取締役または「役員」(改正された1934年の証券取引法の規則16a-1(f)で定義されているとおり)はいませんでした 採用されたまたは 終了しましたa「規則10b5-1取引協定」または「非規則10b5-1取引協定」。各用語は規則S-Kの項目408(a)で定義されています。
アイテム 6.展示品
| | | | | | | | |
| 3.1 | | 2回目の修正および改訂後の会社設立証明書(2015年8月10日に提出された2015年6月30日までの四半期の当社の四半期報告書(フォーム10-Qの当社の四半期報告書(ファイル番号000-26770)の別紙3.1を参照して組み込まれています) |
| | |
| 3.2 | | 第2次修正および改訂された会社の設立証明書の修正証明書(2019年5月9日に提出されたフォーム8-Kの会社の最新報告書(ファイル番号000-26770)の別紙3.1を参照して組み込まれています) |
| | |
| 3.3 | | 会社の改正および改訂された付則(2023年4月4日に提出されたフォーム8-Kの最新報告書(ファイル番号000-26770)の別紙3.1を参照して組み込まれています) |
| | |
| 3.4 | | 当社のシリーズA転換優先株式の指定証明書(2020年6月19日に提出されたフォーム8-Kの当社の最新報告書(ファイル番号000-26770)の別紙3.1を参照して組み込まれています) |
| | |
| 10.1*± | | 2023年5月25日付けの当社とアドバンスト・テクノロジー・インターナショナルとの間の未確定プロジェクト契約第1号への第18号の修正 |
| | |
| 10.2*± | | 2022年1月26日付けで、公共事業・政府サービス大臣が代表を務めるカナダ右翼女王陛下の権益の後継者として、当社とカナダ右翼国王陛下との間で交わされる事前購入契約の第1号が改正されます。 |
| | |
| 10.3*± | | 2022年10月18日付けで、当社と公共事業・政府サービス大臣が代表を務めるカナダ右翼女王陛下の利害の後継者であるカナダ右翼国王陛下との間の事前購入契約の第2号改正です。 |
| | |
| 10.4*± | | 2023年4月25日付けで、当社と公共事業・政府サービス大臣が代理を務めるカナダ右翼女王陛下の利害関係の後任として、公共事業・政府サービス大臣が代表を務めるカナダ右翼国王陛下との間の事前購入契約の第3号改正です。 |
| | |
| 10.5*± | | 2023年6月30日付けで、公共事業・政府サービス大臣が代表を務めるカナダ右翼女王陛下の利権代理として、当社と公共事業・政府サービス大臣が代理を務めるカナダ右翼国王陛下との間で締結された第4号の事前購入契約 |
| | |
| 10.6*± | | 2022年4月6日付けの、当社と保健省が代表を務めるオーストラリア連邦との間の事前購入契約の修正第2号 |
| | |
| 10.7*± | | 2023年4月5日付けの、当社と保健省が代表を務めるオーストラリア連邦との間の事前購入契約の修正第3号 |
| | |
| 10.8*± | | 2023年7月5日付けの、当社と保健省が代表を務めるオーストラリア連邦との間の事前購入契約の修正第4号 |
| | |
| | | | | | | | |
10.9*† | | 会社の修正および改訂された2015年の株式インセンティブプランに基づいて付与された非法定ストックオプション報奨契約(非従業員取締役)の形式 |
| | |
10.10*† | | 会社の修正および改訂された2015年ストックインセンティブプランに基づいて付与されるグローバルな非法定ストックオプション報奨契約の形式 |
| | |
10.11*† | | 会社の修正および改訂された2015年株式インセンティブプランに基づいて付与された制限付株式ユニット報奨契約(非従業員取締役)の形式 |
| | |
10.12*† | | 会社の修正および改訂された2015年株式インセンティブプランに基づいて付与されるグローバル制限付株式ユニット報奨契約の形式 |
| | |
| 31.1* | | 証券取引法規則13a-14 (a) または15d-14 (e) に基づく最高経営責任者の認定 |
| | |
| 31.2* | | 証券取引法規則13a-14 (a) または15d-14 (e) に基づく最高財務責任者の認定 |
| | |
| 32.1* | | 2002年のサーベンス・オクスリー法第906条に基づいて採択された、米国法第18条第1350条に基づく最高経営責任者の認定 |
| | |
| 32.2* | | 2002年のサーベンス・オクスリー法第906条に基づいて採択された米国法第18条第1350条に基づく最高財務責任者の認定 |
| | |
| 101 | | インライン拡張可能なビジネス報告言語(インラインXBRL)でフォーマットされた、2023年6月30日に終了した四半期のフォーム10-Qの次の財務情報:(i)2023年6月30日および2022年6月30日に終了した3か月および6か月間の連結包括利益(損失)計算書、(iii) 2023年6月30日および2022年12月31日現在の連結貸借対照表、(iv) 連結株主変動計算書'2023年6月30日および2022年6月30日までの3か月および6か月間の資本(赤字)、(v)2023年6月30日および2022年に終了した6か月間の連結キャッシュフロー計算書、および(vi)連結財務諸表の注記。 |
| | |
| 104 | | 表紙インタラクティブデータファイル(インラインXBRLとしてフォーマットされ、別紙101に含まれています)。 |
| | |
___________________________________
*ここに提出または提供されています。
± この展示の一部は、規則S-Kの項目601 (b) (10) (iv) に従って省略されています。
† 管理契約、報酬計画、または取り決め
署名
1934年の証券取引法第13条または第15条 (d) 条の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、それにより正式に権限を与えられました。
| | | | | | | | |
| ノババックス株式会社 |
| | |
| 日付:2023年8月8日 | 作成者: | /s/ ジョン・C・ジェイコブス |
| | ジョン・C・ジェイコブス
社長兼最高経営責任者
(最高執行役員) |
| | |
| 日付:2023年8月8日 | 作成者: | /s/ ジェームズ・P・ケリー |
| | ジェームズ・P・ケリー
執行副社長、最高財務責任者兼会計
(最高財務会計責任者) |