アメリカです
アメリカ証券取引委員会
ワシントンD.C.,郵便番号:20549
表
(マーク1)
本四半期末まで
あるいは…。
移行期になります 至れり尽くせり .
依頼文書番号
(登録者の正確な氏名はその定款に記載)
|
|
||
(登録設立又は組織の国又はその他の管轄区域) |
|
|
(国際税務局雇用主身分証明書番号) |
|
||
(主にオフィスアドレスを実行) |
|
(郵便番号) |
(
(登録者の電話番号、市外局番を含む)
適用されない
(前氏名、前住所、および前会計年度は、前回報告以来変化した場合)
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
取引記号 |
登録された各取引所の名称 |
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
☑ |
|
ファイルマネージャを加速する |
|
☐ |
|
非加速ファイルサーバ |
|
☐ |
|
規模の小さい報告会社 |
|
|
|
|
|
|
新興成長型会社 |
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)はい、そうです ☐ 違います。
2023年7月31日までに登録者は
Ultragenyx製薬会社
2023年6月30日までの四半期10-Q表
索引.索引
|
|
|
|
|
|
ページ |
|
|
|
|
|
||
前向き陳述に関する警告説明 |
|
1 |
||||
|
|
|
|
|
||
第I部- |
|
財務情報 |
|
|
||
|
|
|
|
|
|
|
|
|
第1項。 |
|
財務諸表 |
|
|
|
|
|
|
|
|
|
|
|
|
|
簡明総合貸借対照表 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
簡明総合業務報告書 |
|
4 |
|
|
|
|
|
|
|
|
|
|
|
簡明総合総合損失表 |
|
5 |
|
|
|
|
|
|
|
|
|
|
|
株主権益簡明合併報告書 |
|
6 |
|
|
|
|
|
|
|
|
|
|
|
キャッシュフロー表簡明連結報告書 |
|
8 |
|
|
|
|
|
|
|
|
|
|
|
簡明合併財務諸表付記 |
|
9 |
|
|
|
|
|
|
|
|
|
第二項です。 |
|
経営陣の財務状況と経営成果の検討と分析 |
|
22 |
|
|
|
|
|
|
|
|
|
第三項です。 |
|
市場リスクの定量的·定性的開示について |
|
34 |
|
|
|
|
|
|
|
|
|
第四項です。 |
|
制御とプログラム |
|
35 |
|
|
|
|
|
||
第II部- |
|
その他の情報 |
|
|
||
|
|
|
|
|
|
|
|
|
第1項。 |
|
法律訴訟 |
|
36 |
|
|
|
|
|
|
|
|
|
第1 A項。 |
|
リスク要因 |
|
36 |
|
|
|
|
|
|
|
|
|
第二項です。 |
|
未登録株式証券販売と収益の使用 |
|
72 |
|
|
|
|
|
|
|
|
|
第三項です。 |
|
高級証券違約 |
|
72 |
|
|
|
|
|
|
|
|
|
第四項です。 |
|
炭鉱安全情報開示 |
|
72 |
|
|
|
|
|
|
|
|
|
五番目です。 |
|
その他の情報 |
|
72 |
|
|
|
|
|
|
|
|
|
第六項です。 |
|
陳列品 |
|
73 |
|
|
|
|
|
|
|
|
|
サイン |
|
|
|
74 |
C前向き陳述に関する説明
本Form 10-Q四半期報告または四半期報告書には、リスクおよび不確定要因に関する前向きな陳述が含まれている。我々は1995年の個人証券訴訟改革法と他の連邦証券法における安全港条項に基づいてこのような前向きな声明を行った。本四半期報告では歴史的事実に関する陳述を除いて、他のすべての陳述は前向き陳述である。場合によっては、“予想”、“信じる”、“考慮”、“継続”、“可能”、“推定”、“予想”、“予測”、“予定”、“可能”、“計画”、“潜在”、“予測”、“プロジェクト”、“求める”、“すべき”、“目標”、“将”、“将”などによって、“またはこれらの語の否定、または他の類似した用語。これらの前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
本四半期報告中の任意の展望性陳述は私たちの未来の事件或いは私たちの未来の財務表現に対する現在の見方を反映し、既知と未知のリスク、不確定性とその他の要素に関連し、これらの要素は私たちの実際の結果、業績或いは業績を招く可能性があり、これらの展望性陳述と明示的或いは暗示する任意の未来の結果、業績或いは成果とは大きく異なるかもしれない。他に加えて、実際の結果が現在の予想と大きく異なる要因には、第2の部分項目1 Aで議論される要因が含まれる可能性がある。危険要素とこの四半期報告書の他の部分。このような不確実性を考慮して、あなたはこのような前向きな陳述に過度に依存してはいけない。法的要求がない限り、私たちは未来に新しい情報があっても、これらの前向きな陳述を任意の理由で更新または修正する義務がない。
1
本四半期報告はまた、これらの市場の推定規模および特定の疾患の発病率および流行率に関するデータを含む、私たちの業界、私たちの業務、およびいくつかの疾患の市場の推定、予測、および他の情報を含む。見積り,予測,予測,市場研究や類似方法に基づく情報自体は不確定要素の影響を受け,実際のイベントや状況はその情報に反映されるイベントや状況とは大きく異なる可能性がある.他に明確な説明がない限り、私たちは、報告、研究調査、研究、および市場研究会社および他の第三者によって準備された類似データ、業界、医療および一般出版物、政府データ、および同様のソースから、そのような業界、企業、市場、および他のデータを取得する。
2
第1部金融L情報
第1項融資するALレポート
Ultragenyx製薬会社
CONDENSED合併貸借対照表
(未監査)
(単位は千で、シェアは含まれていない)
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
2023 |
|
|
2022 |
|
||
資産 |
|
||||||
流動資産: |
|
|
|
|
|
||
現金と現金等価物 |
$ |
|
|
$ |
|
||
売却可能債務証券 |
|
|
|
|
|
||
売掛金純額 |
|
|
|
|
|
||
在庫品 |
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
||
財産·工場·設備·純価値 |
|
|
|
|
|
||
株式投資 |
|
|
|
|
|
||
売却可能債務証券 |
|
|
|
|
|
||
使用権資産 |
|
|
|
|
|
||
無形資産、純額 |
|
|
|
|
|
||
商誉 |
|
|
|
|
|
||
その他の資産 |
|
|
|
|
|
||
総資産 |
$ |
|
|
$ |
|
||
負債と株主権益 |
|
||||||
流動負債: |
|
|
|
|
|
||
売掛金 |
$ |
|
|
$ |
|
||
負債を計算すべきである |
|
|
|
|
|
||
契約責任 |
|
|
|
|
|
||
賃貸負債 |
|
|
|
|
|
||
将来の特許使用料の負債を販売する |
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
||
賃貸負債 |
|
|
|
|
|
||
繰延税金負債 |
|
|
|
|
|
||
将来の特許使用料の負債を販売する |
|
|
|
|
|
||
その他負債 |
|
|
|
|
|
||
総負債 |
|
|
|
|
|
||
株主権益: |
|
|
|
|
|
||
優先株- |
|
|
|
|
|
||
普通株- |
|
|
|
|
|
||
国庫株は、原価で計算する |
|
( |
) |
|
|
|
|
賠償義務を延期する |
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
||
その他の総合損失を累計する |
|
( |
) |
|
|
( |
) |
赤字を累計する |
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
||
総負債と株主権益 |
$ |
|
|
$ |
|
||
添付の説明を参照してください。
3
Ultragenyx製薬会社
CONDENSED統合業務レポート
(未監査)
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
6月30日までの3ヶ月間 |
|
|
6月30日までの6ヶ月間 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
収入: |
|
|
|
|
|
|
|
|
|
|
|
||||
協力と許可 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
製品販売 |
|
|
|
|
|
|
|
|
|
|
|
||||
特許権使用料収入 |
|
|
|
|
|
|
|
|
|
|
|
||||
総収入 |
|
|
|
|
|
|
|
|
|
|
|
||||
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
||||
販売コスト |
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発 |
|
|
|
|
|
|
|
|
|
|
|
||||
販売、一般、行政 |
|
|
|
|
|
|
|
|
|
|
|
||||
総運営費 |
|
|
|
|
|
|
|
|
|
|
|
||||
運営損失 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
利子収入 |
|
|
|
|
|
|
|
|
|
|
|
||||
株式投資は価値変動を公平に許容する |
|
|
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
将来の特許使用料負債を販売する非現金支払利息 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
その他の費用 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税前損失 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税支給 |
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
純損失 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり基本と希釈して純損失 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり純損失の加重平均株式を計算し |
|
|
|
|
|
|
|
|
|
|
|
||||
添付の説明を参照してください。
4
Ultragenyx製薬会社
CONDENSED総合総合損失報告書
(未監査)
(単位:千)
|
6月30日までの3ヶ月間 |
|
|
6月30日までの6ヶ月間 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
純損失 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
その他の全面収益(損失): |
|
|
|
|
|
|
|
|
|
|
|
||||
外貨換算調整 |
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
||
証券売却可能な未実現収益 |
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
||
その他の全面収益(損失): |
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
||
全面損失総額 |
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
添付の説明を参照してください。
5
Ultragenyx製薬会社
株主権益報告書を簡明に合併する
(未監査)
(単位は千で、シェアは含まれていない)
|
|
普通株 |
|
|
その他の内容 |
|
|
積算 |
|
|
積算 |
|
|
財務局 |
|
|
繰延補償 |
|
|
合計する |
|
|||||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
収入(損) |
|
|
赤字.赤字 |
|
|
在庫品 |
|
|
義務 |
|
|
権益 |
|
||||||||
2023年3月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
$ |
|
|||||
以下の事項に関する普通株式を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株に基づく報酬 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
前項普通株の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
繰延補償 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
— |
|
|
その他総合収益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
2023年6月30日までの残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
$ |
|
|||||
|
|
普通株 |
|
|
その他の内容 |
|
|
積算 |
|
|
積算 |
|
|
財務局 |
|
|
繰延補償 |
|
|
合計する |
|
|||||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
収入(損) |
|
|
赤字.赤字 |
|
|
在庫品 |
|
|
義務 |
|
|
権益 |
|
||||||||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||||
以下の事項に関する普通株式を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
株に基づく報酬 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
前項普通株の発行 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
繰延補償 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
— |
|
|
その他総合損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
2023年6月30日までの残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
|
$ |
|
|||||
|
|
普通株 |
|
|
その他の内容 |
|
|
積算 |
|
|
積算 |
|
|
財務局 |
|
|
繰延補償 |
|
|
合計する |
|
|||||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
収入(損) |
|
|
赤字.赤字 |
|
|
在庫品 |
|
|
義務 |
|
|
権益 |
|
||||||||
2022年3月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
前項普通株の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|||
その他総合損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
2022年6月30日までの残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||||
6
|
|
普通株 |
|
|
その他の内容 |
|
|
積算 |
|
|
積算 |
|
|
財務局 |
|
|
繰延補償 |
|
|
合計する |
|
|||||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
収入(損) |
|
|
赤字.赤字 |
|
|
在庫品 |
|
|
義務 |
|
|
権益 |
|
||||||||
2021年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||
前項普通株の発行 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
その他総合損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
2022年6月30日までの残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||||
添付の説明を参照してください。
7
Ultragenyx製薬会社
Cキャッシュフロー表統合レポート
(未監査)
(単位:千)
|
6月30日までの6ヶ月間 |
|
|||||
|
2023 |
|
|
2022 |
|
||
経営活動: |
|
|
|
|
|
||
純損失 |
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
||
取引可能債務証券(割引)割増償却純額 |
|
( |
) |
|
|
|
|
減価償却および償却 |
|
|
|
|
|
||
株式投資は価値変動を公平に許容する |
|
|
|
|
|
||
非現金使用料収入 |
|
( |
) |
|
|
( |
) |
将来の特許使用料負債を販売する非現金支払利息 |
|
|
|
|
|
||
他にも |
|
|
|
|
|
||
経営性資産と負債変動状況: |
|
|
|
|
|
||
売掛金 |
|
( |
) |
|
|
( |
) |
在庫品 |
|
( |
) |
|
|
( |
) |
前払い費用と他の資産 |
|
|
|
|
( |
) |
|
売掛金、売掛金、その他の負債 |
|
( |
) |
|
|
|
|
契約責任 |
|
( |
) |
|
|
( |
) |
経営活動のための現金純額 |
|
( |
) |
|
|
( |
) |
投資活動: |
|
|
|
|
|
||
家屋·工場·設備を購入する |
|
( |
) |
|
|
( |
) |
有価証券を購入する |
|
( |
) |
|
|
( |
) |
有価証券を売却して得た金 |
|
|
|
|
|
||
有価証券満期日収益 |
|
|
|
|
|
||
無形資産の支払い |
|
( |
) |
|
|
( |
) |
他にも |
|
( |
) |
|
|
( |
) |
投資活動が提供する現金純額 |
|
|
|
|
|
||
融資活動: |
|
|
|
|
|
||
市場で発行された普通株に関する収益,純額を発行する |
|
|
|
|
|
||
株式計画奨励項の下で普通株を発行する収益は,税収を差し引く |
|
|
|
|
|
||
他にも |
|
( |
) |
|
|
( |
) |
融資活動が提供する現金純額 |
|
|
|
|
|
||
為替レート変動が現金に与える影響 |
|
|
|
|
( |
) |
|
現金、現金等価物、および限定的な現金純減少 |
|
( |
) |
|
|
( |
) |
期初現金、現金等価物、および限定現金 |
|
|
|
|
|
||
期末現金、現金等価物、および制限現金 |
$ |
|
|
$ |
|
||
|
|
|
|
|
|
||
非現金情報の追加開示: |
|
|
|
|
|
||
使用権資産の取得による既得賃貸負債 |
$ |
|
|
$ |
|
||
期末在庫の株式報酬を計上する |
$ |
|
|
$ |
|
||
売掛金、売掛金、その他の負債に含まれるPP&Eコスト |
$ |
|
|
$ |
|
||
将来の特許権使用料の負債を売却する非現金利息支出であり、これらの特許使用料は今年度中に期末財産、工場、設備に資本化される |
$ |
|
|
$ |
|
||
添付の説明を参照してください。
8
Ultragenyx製薬会社
NOTESから簡明な連結財務諸表まで
1.組織構造
Ultragenyx製薬会社、または会社は、デラウェア州に登録して設立されたバイオ製薬会社です。
同社は深刻な希と極端な遺伝病の治療に用いられる新製品の識別、買収、開発と商業化に集中している。その会社の運営方法は
Crysvita(ブロスモノクロナル抗体)はアメリカ、アメリカ、EU或いはEUとその他の地区で承認され、一歳以上の成人と児童患者のX-連鎖低リン血症の治療に用いられる。Crysvitaはまたアメリカと他のある地域で承認され、腫瘍誘導骨軟化症(TIO)の治療に用いられる線維芽細胞増殖因子23(FGF 23)に関連する低リン血症であり、これらの腫瘍はリン酸尿間葉系腫瘍に関連し、2歳以上の成人と児童患者で治療的切除或いは定位を行うことができない。
Mepsevii(ウェスト龍酵素α)は、小児および成人ムコ多糖症VII、またはMPS VII、Sly症候群とも呼ばれる第1の薬剤として、米国、EU、およびいくつかの他の地域で承認されている。
Dojolvi(トリヘプチルアルコール)は、長鎖脂肪酸酸化障害(LC-FAOD)の影響を深刻に受ける児童および成人患者の治療のために、米国および他のいくつかの地域で承認されている。
Evkeeza(Evinacumab)はアメリカとヨーロッパ経済区でホモ接合子家族性高コレステロール血症の治療に許可されている。同社はEvkeeza(Evinacumab)を米国以外の地域で商業化する独占的な権利を持っている。
同社には、承認された製品のほかに、以下のような臨床開発計画がある
同社は経営赤字を受けており、この年度赤字は今後数年続くと予想される。会社(The Company)’Sの最終成功はその研究開発と商業化活動の結果にかかっている。2023年6月30日まで同社は,主に株式証券の売却,商業製品収入,将来の特許使用料の販売および戦略協力手配に依存して運営に資金を提供してきた。同社は、株式発行、借入金、またはパートナー会社と戦略同盟を構築することで、その業務計画を全面的に実施するために、追加の資本を調達する必要があると予想している。しかし、このような融資が十分なレベルでなければ、会社はその運営計画を再評価する必要があるだろう。
2.主な会計政策の概要
陳述の基礎
添付の審査されていない簡明総合財務諸表は当社及びその全額付属会社の勘定を含み、そしてすでにアメリカ公認会計原則或いは公認会計原則に基づいて作成した
9
中期財務情報は、S-Xルール10-Q表とルール10-01の説明に従って行う。したがって、それらは、会計基準によって要求される完全な財務諸表に必要なすべての情報および脚注を含まない。審査されていない中期簡明総合財務諸表は、年次財務諸表と同じ基準で作成されている。経営陣は、添付されていない簡明な総合財務諸表は、公正新聞に必要とされるすべての調整(正常な経常的調整のみを含む)を反映していると考えている。これらの財務諸表を読む際には、会社が2023年2月17日に米国証券取引委員会または米国証券取引委員会に提出したForm 10−K年次報告書または年次報告書に含まれる前期監査された財務諸表およびその説明に関連しなければならない。
2023年6月30日までの3ヶ月と6ヶ月の運営結果2023年12月31日までの1年間の予想結果を示すとは限らない。2022年12月31日現在の簡明総合貸借対照表は、当該日経監査の財務諸表から導出されているが、GAAPが要求する完全財務諸表のすべての情報は含まれていない。
予算の使用
添付されている簡明総合財務諸表は公認会計基準に基づいて作成されている。公認会計原則に基づいて簡明総合財務諸表を作成する時、管理層は簡明総合財務諸表及び付記中の資産及び負債の届出金額、或いは負債の開示及び届出の支出金額に影響するため、推定と仮定を行わなければならない。経営陣は、臨床試験に計上されるべき費用、資産および負債の公正価値、所得税、株式ベースの報酬、収入確認、および将来の特許使用料販売負債に関する推定を含むその推定値を継続的に評価する。経営陣は過去の経験や管理職が当時の状況で合理的だと考えている他の様々な特定の市場や関連仮定に基づいて推定している。実際の結果はこれらの推定とは異なる可能性がある。
現金、現金等価物、および限定現金
限定的な現金には、主に会社施設賃貸義務担保として使用される通貨市場口座が含まれる
|
六月三十日 |
|
|||||
|
2023 |
|
|
2022 |
|
||
現金と現金等価物 |
$ |
|
|
$ |
|
||
前払い料金と |
|
|
|
|
|
||
他の資産に含まれる現金 |
|
|
|
|
|
||
現金総額、現金等価物、制限された現金 |
$ |
|
|
$ |
|
||
信用損失
同社は主に顧客とパートナーの売掛金とその売却可能な債務証券を通じて信用損失に直面している。売掛金やその他のツールについては、当社は前向き予想損失モデルを採用しており、これは通常、損失確認準備を早期に確認することにつながる。未実現損失のある売却可能債務証券については、これらの損失は、証券償却コストの減少ではなく、準備金として確認されている。
当社の売掛金予想損失準備方法は、歴史収集経験、現在と将来の経済市場状況、実体の現在の帳簿状況と財務状況の審査に基づいて作成されています。特定の免税額を確立し、違約確率の高い顧客に対する適切な免税額を記録する。残高は回収できないと判断された場合は解約します。当社の債務証券に対する予想損失準備方法は、未実現損失の程度、発行者の規模、期限、地理的位置と業界、発行者の信用格付けおよびこれらの格付けの任意の変化を審査し、現在と将来の経済市場状況および発行者の現在の状況と財務状況を審査することによって制定された。いくつありますか
10
収入確認
協力とライセンス収入
会社は、会計基準編纂またはASC、808、協調プロトコルの範囲内のいくつかの許可および協調プロトコルを有し、このプロトコルは、協調スケジュールの提示および開示に指示を提供する。一般に,協調スケジューリングによる取引分類は,手配された契約条項の性質および参加者の業務的性質に基づいて決定される.会社が手配中の代理店とみなされた場合、会社はこのような販売が発生している間に純売上に関する移転定価後の協力収入シェアを記録する。パートナーが製品を顧客に転送する前に製品を制御する場合、会社はエージェントとみなされ、製品の使用を指導し、製品から実質的にすべての残りの利益を得ることができる。簡明総合経営レポートでは、研究開発サービスおよび商業化コストに関する資金は、一般的に、パートナーへのこのようなサービスの提供は、会社が行っている主要またはコア業務の一部とはみなされないので、研究開発費および販売、一般および管理費用の減少にそれぞれ分類される。
提携収入を記録するために、会社は、製品販売収入、収入に関する準備金、および開発および販売活動によるコストを含む、その提携パートナーからのいくつかの情報を使用する。記載された財務諸表に係る期間については、前期収入と支出推定数に実質的な変化はなかった。
当社はまた、知的財産権許可と交換するために、当社のいくつかの許可または協力協定に基づいて印税収入を記録します。会社がこれらの許可または協力協定に対して将来の履行義務がない場合、特許権使用料収入は基礎販売が発生したときに記録される。
同社は、Royalty Pharmaの付属会社RPI Finance TrustまたはRPI、およびオンタリオ州市政従業員退職制度(OMERS)の投資ツールOCM LS 23 Holdings LPに、Crysvitaのある地域の純売上から特定の特許権使用料支払いの権利を得る権利を売却していることは、“将来の特許権使用料販売の付記8負債”にさらに記載されている。当社は適用手配の有効期限内に、Crysvitaの適用地域での純販売で得られた特許権使用料収入を予想基準で総合経営報告書における特許権使用料収入と表記しています。
同社の協力およびライセンス契約の条項には、ライセンスおよび研究開発活動が含まれている可能性がある複数の履行義務が含まれている場合があります。同社は、異なる履行義務を決定するために、ASC 606に基づいて、顧客との契約収入またはASC 606を評価する。当社はASC 606と同様に、顧客と関係のある異なる履行義務を会計処理する。収入を確認する前に、同社は制限された可変対価格を含めて取引価格を推定する。可変対価金額は取引価格に計上され、確認された累積収入金額が大きく逆転しない可能性があり、可変対価格に関する不確実性がその後解決される可能性がある。総対価格には、払戻不可能な前払い許可料、研究開発活動の支払い、ある第三者コストの精算、特定のマイルストーン実現状況に基づく支払い、および協力製品の売上に基づく印税支払いが含まれる可能性がある。
複数の異なる履行義務が存在すれば,当社はその相対的に独立した販売価格に応じて取引価格をそれぞれ異なる履行義務に割り当てる.独立販売価格は、一般に、顧客から徴収された価格または予想されるコストを使用して利益率に基づいて決定される。当社は業績義務達成に必要な努力を見積もり、投入措置を用いて業績義務の完全履行の進捗状況を測定することで収入を確認しています。
製品販売
同社は限定された数量の流通業者を通じてその承認された製品を販売している。ASC 606によれば、製品販売収入は、交付時および所有権および損失リスクがこれらの流通業者に移転されたときに確認される。同社はまた、ある製品の販売収入が“指定患者”に基づいていることを確認しており、製品が商業的に承認される前に、ある国で許可されている。収入を確認する前に、同社は制限された任意の可変対価格を含む取引価格を推定する。可変対価金額は取引価格に計上され、確認された累積収入金額が大きく逆転しない可能性があり、可変対価格に関する不確実性がその後解決される可能性がある。製品売上高は,推定された政府の強制リベートと記憶容量による使用課金,推定された製品返品その他控除された純額を差し引くものである。
条文経営陣の見積もりによると、関連収入が入金されている間に差戻しやその他の調整を計上した。これらの準備金は、関連販売によって稼いだまたは請求された金額の見積もりに基づいて、定期的な審査と必要に応じて調整される。会社の政府規定の返金、返金、推定製品の見積もり
11
返品しますその他の控除は,キー顧客契約条項と条件の決定,および異なる種別の支払者の売上高推定に依存する。実際の結果が異なれば、会社はこれらの見積もりを調整する必要がある可能性があり、これは調整期間中の収益に実質的な影響を与える可能性がある。
給与繰延計画
当社は無保留繰延給与計画を維持し、この計画によると、ある従業員と取締役会メンバーはある持分奨励及びその他の報酬の支払いを遅延させることができる。繰延された金額は様々な共同基金に投資された。この計画は国税法第409 a節の規定を満たしている。この計画が保有するすべての互恵基金は取引型証券に分類され,総合貸借対照表の他の非流動資産に公正価値で入金され,公正価値変動はその発生期間中に収益として確認される。この計画の対応する負債は、簡明総合貸借対照表中の他の非流動負債に含まれる。この計画に基づいて延期されたいくつかの株式奨励は会社の株を発行することで解決される必要がある。これらの奨励は在庫株と株主権益における繰延補償義務として記録されている。
3.金融商品
金融資産と負債は公正な価値で入金される。いくつかの金融商品は、現金及び現金等価物、売掛金、売掛金及び売掛金を含み、満期日が相対的に短いため、その帳簿額面は公正価値に近い。貸借対照表では,公正価値で恒常的に記録されている資産と負債は,その公正価値を計測するための投入に関する判断レベルに基づいて分類される.公正価値は、計量日に市場参加者間の秩序ある取引において資産または負債の元本または最も有利な市場の負債を移動させるために、受信される交換価格または支払いされる退出価格として定義される。“公正価値計量に関する権威指針”は公正価値計量の開示のために三級公正価値等級を確立し、具体的には以下の通りである
レベル1−投入は、計量日と同じ資産または負債のアクティブな市場で調整されていないオファーである
レベル2−投入とは、アクティブ市場における同様の資産または負債の観察可能、調整されていないオファー、非アクティブ市場上で同じまたは同様の資産または負債の調整されていないオファー、または資産または負債に関する観察可能な市場データによって観察または確認可能な他の投入を意味する
レベル3−計量資産または負債の公正な価値に大きな意味を有する観察不可能な投入であり、これらの資産または負債は非常に少ないか、または市場データサポートが全くない。
同社は、オファーされた市場価格を使用することによって、Solid Biosciences Inc.またはSolidの株式投資における公正価値を決定し、これは第1級公正価値測定基準である。
次の表は同社の金融資産の公正価値を示しており、これらの公正価値は三級公正価値レベル(千単位)に基づいて日常的な基礎によって再計量された
|
2023年6月30日 |
|
|||||||||||||
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
貨幣市場基金 |
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
預金証書と定期預金 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
社債 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
商業手形 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
資産支援証券 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
米国債と機関証券 |
|
|
|
|
|
|
|
— |
|
|
|
|
|||
信頼できる普通株への投資 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
他にも |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
*ダダール |
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
12
|
2022年12月31日 |
|
|||||||||||||
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
貨幣市場基金 |
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
預金証書と定期預金 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
社債 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
商業手形 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
資産支援証券 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
米国債と機関証券 |
|
|
|
|
|
|
|
— |
|
|
|
|
|||
政府支援実体債務証券 |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
信頼できる普通株への投資 |
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
他にも |
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
*ダダール |
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
|||
4.貸借対照表の構成要素
現金等価物と有価証券
販売可能な証券として分類された現金等価物および取引可能な債務証券の公正価値は、以下のものを含む(千で計算)
|
2023年6月30日 |
|
||||||||||||||
|
|
|
|
|
未実現総額 |
|
|
|
|
|||||||
|
|
償却する |
|
|
収益.収益 |
|
|
損 |
|
|
推定数 |
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
預金証書と定期預金 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
社債 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
商業手形 |
|
|
|
|
|
— |
|
|
|
|
|
|
|
|||
資産支援証券 |
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
米国債と機関証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
合計する |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
|
2022年12月31日 |
|
||||||||||||||
|
|
|
|
|
未実現総額 |
|
|
|
|
|||||||
|
|
償却する |
|
|
収益.収益 |
|
|
損 |
|
|
推定数 |
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
預金証書と定期預金 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
社債 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
商業手形 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
資産支援証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
米国債と機関証券 |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
政府支援実体債務証券 |
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
||
合計する |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
2023年6月30日証券を売却可能な残りの契約期限が期日より少ない何年もです。本報告に記載されている間、証券を売却することができる重大な達成された収益または損失はない。損失を達成していない投資には当社は当該等の投資を売却するつもりはありませんが、当社もその償却コスト基準を回収する前に当該等の投資を売却することを要求される可能性はありません。
13
在庫品
在庫は以下のものからなる(千単位):
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
製品の中で |
|
$ |
|
|
$ |
|
||
完成品 |
|
|
|
|
|
|
||
総在庫 |
|
$ |
|
|
$ |
|
||
負債を計算すべきである
計算すべき負債には、以下の内容が含まれる(千計)
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
研究、臨床研究、製造費用 |
|
$ |
|
|
$ |
|
||
給与明細及び関連費用 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
負債総額を計算すべきである |
|
$ |
|
|
$ |
|
||
5.収入
以下の表では,連携と許可収入および製品売上高ごとに外部顧客の総収入を細分化した(千単位):
|
3か月まで |
|
|
6か月まで |
|
||||||||||
|
六月三十日 |
|
|
六月三十日 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
協力と許可収入: |
|
|
|
|
|
|
|
|
|
|
|
||||
利益のCrysvita協力収入- |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
第一三共 |
|
|
|
|
|
|
|
|
|
|
|
||||
協力と許可総収入 |
|
|
|
|
|
|
|
|
|
|
|
||||
製品販売: |
|
|
|
|
|
|
|
|
|
|
|
||||
クリスヴィータ |
|
|
|
|
|
|
|
|
|
|
|
||||
メイプセヴィ |
|
|
|
|
|
|
|
|
|
|
|
||||
ドホルヴィ |
|
|
|
|
|
|
|
|
|
|
|
||||
エフキザ |
|
|
|
|
|
|
|
|
|
|
|
||||
製品総売上高 |
|
|
|
|
|
|
|
|
|
|
|
||||
Crysvita特許使用料収入 |
|
|
|
|
|
|
|
|
|
|
|
||||
総収入 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
次の表は総収入を地理的位置別に細分化した(千単位):
|
3か月まで |
|
|
6か月まで |
|
||||||||||
|
六月三十日 |
|
|
六月三十日 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
北米.北米 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
ラテンアメリカ.ラテンアメリカ |
|
|
|
|
|
|
|
|
|
|
|
||||
ヨーロッパ.ヨーロッパ |
|
|
|
|
|
|
|
|
|
|
|
||||
日本です |
|
|
|
|
|
|
|
|
|
|
|
||||
総収入 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
14
以下の表に契約負債の変化(千計)を示す
|
6月30日までの6ヶ月間 |
|
|||||
|
2023 |
|
|
2022 |
|
||
期初契約負債残高 |
$ |
|
|
$ |
|
||
足し算 |
|
|
|
|
|
||
控除額 |
|
( |
) |
|
|
( |
) |
期末契約負債残高純額 |
$ |
|
|
$ |
|
||
契約負債活動のその他の詳細については、付記7を参照されたい。
会社の最大の売掛金残高はパートナーから来て、
6.GeneTxの買収
2019年8月、同社はGeneTx BioTreateutics LLC(GeneTxと略す)とAngelman症候群を治療するASOであるGeneTxのGTX-102の開発に協力して計画協定と単位所有者オプション協定を締結した。職場所有者が株式購入契約の条項に基づいて
当社は2022年7月にGeneTxを買収する仮選択権を行使し、単位購入契約または購入協定を締結し、この合意に基づいて、当社はGeneTxのすべての未償還単位を購入する。購入契約の条項によると、会社はオプション行権価格#ドルを支払った
この取引は資産購入とみなされており,買収された総資産の公正価値のほとんどが単一の識別可能な研究開発無形資産に集中しているためである.ある開発と監督管理のマイルストーンに達する前に、買収が行われている研究開発無形資産はまだ技術実行可能性に達しておらず、未来には代替用途がない。したがって、会社が記録した買収価格は#ドルとなる
7.ライセンスと検討プロトコル
京華麒麟株式会社
2013年8月、当社はKyowa麒麟株式会社またはKKC(前身はKyowa Hakko麒麟株式会社またはKHK)と協力·許可協定を締結した。改訂された協力·許可協定条項によると、会社とKKCは、米国、カナダまたは利益共有地域、ならびにEU、イギリス、スイスまたはヨーロッパ地域でCrysvitaを協力して開発および商業化し、会社はメキシコおよび中南米またはラテンアメリカの孤児疾患分野でこのような製品を開発および商業化する権利がある。
発展活動
15
孤児疾患分野では,KKCが行っている研究を除いて,適用移行日まで,同社は利益共有地域とヨーロッパ地域発展活動の先頭に立ってきた。当社はKKCと利益共有地域とヨーロッパ地域を折半して移行日を適用する前に発展計画に基づく開発活動の費用を共有しています。2023年4月、すなわち利益共有領土の移行日には、KKCが先頭となり、開発活動の費用を担当する。しかし、当社は移行日を適用する前に開始した研究の費用をKKCと平均的に分担していきます。
協調および許可プロトコルはASC 808の範囲に属し、ASC 808は、協調スケジュールの提示および開示に指示を提供する。
利益共有地域販売の連携と印税収入
同社とKKCは2023年4月まで利益共有分野で商業責任と利益を分担している。提携協定によると、KKCは利益共有地域の商業用途のためにCrysvitaを製造し、供給し、会社に#を受け取る
当社は2022年9月、KKCが2023年4月までに当社のビジネス活動への参加範囲を増加させることを明らかにし、2024年4月までKKCの米国でのビジネス現場活動を支援し続ける権利があることを明らかにした協力協定改正案に署名したが、改正案で規定されている制限や条件の制限を受けている。そのため、同社は2024年4月までコスト分担手配により商業分野やマーケティング業務を支援し続けるが、改正案で規定されている制限や条件の制限を受けている。2024年4月以降、会社が米国でCrysvitaを普及させる権利は医学遺伝学者に限られ、会社は利益共有地域でCrysvitaを普及させる費用を独自に負担する。
KKCは顧客と販売取引を行う依頼者であるため,会社は販売発生期間中に提携収入から譲渡定価後の比例シェアを差し引いた割合を確認する.当社は,KKCの2023年4月までの利益共有分野での販売シェアは特許権使用料に類似しているため,そのシェアを特許権使用料に類似した連携収入として記録していると結論した。2023年4月から、当社は特許権使用料収入を基礎販売に計上し始めました。
2022年7月にOMERSに売却されました
ヨーロッパ地域で販売されている特許使用料収入
KKCはヨーロッパ領土のCrysvitaに対して商業的責任がある。2019年12月、当社は、欧州地域での販売に応じて特許権使用料を徴収する権利をRoyalty Pharmaに売却し、2020年1月1日から発効し、具体的には“付記8.将来の特許権使用料販売の責任”を説明した。会社が特許権使用料を売却する前に,会社はガンダムを受け取った
他の地域で販売されている製品収入
その会社はCrysvitaをラテンアメリカとトルコで商業化する責任がある。同社はこれらの地域の依頼者とされており,同社は製品を顧客に譲渡する前に制御しているためである。そのため、製品が納入され、製品のリスクと所有権をディーラーに移転すると、会社はCrysvitaを販売する毛数に応じて収入を記録する。KKCは一定の最低期限後、トルコの商業化努力を会社が負担する権利がある。
提携協定によると、KKCはCrysvitaを製造して供給し、同社はラテンアメリカ地域での販売のためにCrysvitaを購入し、会社に徴収している
Crysvitaの総収入は以下の通り(千単位):
16
|
6月30日までの3ヶ月間 |
|
|
6月30日までの6ヶ月間 |
|
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
|
||||
利益共有分野の収入: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
協力収入 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
||||
特許権使用料収入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
非現金使用料収入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
利益共有区の総収入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
製品販売 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
ヨーロッパ地域の非現金特許使用料収入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
Crysvita総収入 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
||||
費用を分担して支払う
協力協定によると、KKCと同社は一定の開発と商業化コストを分担する。そのため、会社はこれらの費用の補償を受け、業務費用は以下のように減少した(千計)
|
6月30日までの3ヶ月間 |
|
|
6月30日までの6ヶ月間 |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
研究開発 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
販売、一般、行政 |
|
|
|
|
|
|
|
|
|
|
|
||||
合計する |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
協同して応待する
会社はKKCからの売掛金#ドルを持っている
第一三共
2020年3月、当社は第一三共株式会社又は第一三共とライセンス及び技術アクセス協定又はライセンス契約に調印した。ライセンス契約によれば、当社は、そのPinnacle PCLTM生産者細胞系プラットフォームまたはPinnacle PCLプラットフォームおよびAAVベースの遺伝子治療製品のためのHEK 293瞬時遺伝子組換え製造技術プラットフォームに関する非独占的知的財産権許可を第1の3社に付与する。
ライセンス契約の条項によると、Daiichi Sankyoは#ドルを前払いしました
2020年6月、当社は第一三とその後のライセンス契約または再ライセンス契約に調印し、いくつかの技術を譲渡し、代償は#ドルを前払いした
当社は,ASC 606項下のライセンスプロトコルおよび再ライセンスプロトコルを評価し,このようなプロトコルでの履行責任は,(I)そのPinnaclePCLプラットフォームおよびHEK 293が製造技術プラットフォームの知的財産権を瞬時に導入すること,および予備技術援助および技術譲渡サービス,および(Ii)初期技術譲渡完了後3年の技術譲渡満了までの任意のノウハウおよび改善の譲渡であることを決定した。
当社は相対的な独立販売価格で取引総価格をこの二つの履行義務に割り当てています。知的財産権と技術移転サービスに割り当てられた収入は2022年第1四半期に完了した初歩的な期間内に確認され、投入措置を用いて個人の履行義務を完全に履行する上での進展を測定した。2023年3月に終了した残りの技術移転期間中に、第1の3者が全期間にわたって一貫して収益を獲得し、消費することが予想されるため、専門知識および技術移転完了後の改善された収入が直線的に確認される。ライセンスプロトコルと再ライセンスプロトコルは,技術移転期限終了後に終了する.2023年6月30日現在この手配により確認された総収入はい$です
17
会社は認識しています
Mereo
2020年12月、同社はMereoとsetrusumabの開発に協力する許可·協力協定を締結した。合意条項によると、同社は将来的にsetrusumabの児童と成人骨形成不全(OI)患者における世界的な開発をリードする。同社は、欧州経済地域、イギリス、スイス、またはMereoが商業権を保持しているMereo地域を含まず、米国、トルコ、世界の他の地域でsetrusumabを開発·商業化する独占ライセンスを取得した。すべての側はそれぞれの領土での上場後の約束と商業供給を担当するだろう。
2021年1月に取引が完了した時点で、会社は#ドルを支払った
Mereoは可変利益実体であるにもかかわらず、その会社は主な受益者ではなく、Mereoの経済表現に最も大きな影響を与える活動を指導する権限がないからである。いくつかの開発マイルストーンを実現する前に,Mereoに支払われるすべての対価格は,Mereoが行っている研究や開発活動に関する将来の潜在的利益の権利を表しており,これらの活動は技術的可能性に達しておらず,将来の代替用途もない.
再生
2022年1月、同社はRegeneron製薬会社と協力し、HoFHを治療するEvkeezaを米国以外の地域で商業化することを発表した。Evkeezaは米国で承認され、Regeneronによって販売され、EUやイギリスでは一流療法として食事や他の低密度リポ蛋白低下コレステロール療法とともに12歳以上のHoFH成人や青少年の治療に用いられている。協定の条項によると、同社は米国以外の国でHoFH製品を開発、商業化、流通する権利を獲得した。同社は$までの支払いを義務付けている
協調プロトコルはASC 808の範囲に属し、ASC 808は、協調スケジュールの提示および開示に指示を提供する。当社は将来的に顧客との販売取引の主体となるため、当社は関連販売が発生し、関連収入確認基準が達成されたときに製品販売と販売コストを確認します。協力協定によると、Regeneronは製品を提供し、会社から最低賃金を徴収します
2022年1月の取引完了時に、会社はRegeneronに#ドルを支払いました
提携協定により,会社はRegeneronに#ドルの開発費用を返済した
その他の手配
同社はまた、これまでのいくつかの時期にいくつかの協力および/または許可手配を達成した。上述した開示者を除いて、2023年6月30日までの6ヶ月以内に、年報総合財務諸表“付記8許可及び研究協議”に開示された手配と比較して、このような手配に大きな変動はない。
これらの手配された財務条項によると、会社は開発、規制、ビジネスマイルストーンを実現する際にお金を支払うことを要求される可能性があり、これは重大かもしれない。未来のマイルストーン支払いがあれば
18
イベントが発生した場合または発生した場合は、業務簡明統合レポートに反映される。また、これらの手配に関連する製品が商業化されていれば、会社は将来の販売で印税を支払う必要があるかもしれない。しかしながら、これらの額の支払いは、将来発生する様々なイベントに依存し、これらのイベントは高い不確実性を有する。
年次報告書で述べたように,SolidやArcturus治療ホールディングスやArcturus社との協力では,会社は以前各エンティティに何らかの持分を持っていた。2022年12月31日現在、会社はArcturus普通株を保有していない
|
普通株 |
|
|
2021年12月31日まで |
$ |
|
|
価値変動を公平に承諾する |
|
( |
) |
株を売却する |
|
( |
) |
2022年12月31日 |
|
|
|
価値変動を公平に承諾する |
|
( |
) |
2023年6月30日 |
$ |
|
|
8.将来の特許使用料を販売する責任
2019年12月、当社はRPIと特許権使用料購入協定を締結しました。プロトコルにより,RPIは#ドルを支払った
これらの取引所で得られた金は、将来の販売特許権使用料の負債として簡明総合貸借対照表に記録されている。手配開始時に、当社は$を録画しました
同社は歴史的結果、内部予測、外部源の予測に合わせて、予想される特許権使用料を定期的に評価して支払う。この等支払いが当社の初歩的な推定より大きいか少ないか、またはその等支払いの時間がその最初の推定と大きく異なる限り、当社は負債の償却および実金利を前向きに調整する。同社の有効年利率は約
KKCが適用地域で特許使用料を支払う金額や時間に大きな影響を与える可能性が多く、その大部分は会社の制御範囲内ではない。これらの要素は、KKC販売とCrysvitaの普及成功、看護基準の変化、マクロ経済とインフレ圧力、競争製品の発売、異なる地域での補償定価、製造またはその他の遅延、知的財産権の問題、政府衛生当局がCrysvitaの使用に制限を加える不良事件を含むが、これらに限定されない
19
特許使用料はドルまたはドルで支払われるため、Crysvitaの大部分のベース販売はドル以外の通貨で行われ、Crysvita販売の特許使用料支払いの減少をもたらす可能性がある他のイベントまたは場合、これらすべては、特許権使用料収入および合意の有効期間内の非現金支払利息の減少をもたらす。逆に、Crysvitaの関連地域での売上高が予想を超えると、当社が手配期間内に記録した特許使用料収入と非現金利息支出が大きくなる。
次の表は負債口座内の活動(千単位)を示している
|
将来の特許使用料の負債を販売する |
|
|||||||
|
RPI |
|
OMERS |
|
合計する |
|
|||
2021年12月31日 |
$ |
|
$ |
|
$ |
|
|||
先物売却の純収益 |
|
|
|
|
|
|
|||
特許権使用料収入 |
|
( |
) |
|
|
|
( |
) |
|
非現金利子支出 |
|
|
|
|
|
|
|||
2022年12月31日 |
|
|
|
|
|
|
|||
特許権使用料収入 |
|
( |
) |
|
|
|
( |
) |
|
非現金利子支出 |
|
|
|
|
|
|
|||
2023年6月30日 |
$ |
|
$ |
|
$ |
|
|||
9.株ベースの報酬
2023年6月30日までいくつありますか
以下の表に記載されている期間の株式ベースの報酬費用(千単位)を示す
|
3か月まで |
|
|
6か月まで |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
販売コスト |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
研究開発 |
|
|
|
|
|
|
|
|
|
|
|
||||
販売、一般、行政 |
|
|
|
|
|
|
|
|
|
|
|
||||
株式に基づく報酬総支出 |
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
10.1株当たり純損失
1株当たり基本純損失の算出方法は,純損失を発行済み普通株の加重平均株式数と普通株での決済を要求する繰延補償債務の加重平均在庫株で割る。1株当たり純損失の算出方法は,純損失を普通株の加重平均株式数で割る,普通株決済の繰延補償義務が必要な加重平均在庫株および期内に発行される潜在希釈性証券である。
以下の加重平均発行された普通株式等価物は、これらの等価物を計上することは逆償却作用を有するので、本報告に記載されている間の希釈1株当たり純損失の計算には含まれない
|
3か月まで |
|
|
6か月まで |
|
||||||||||
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
普通株のオプションを購入し、 |
|
|
|
|
|
|
|
|
|
|
|
||||
従業員株購入計画 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
20
11.株式取引
2021年5月、当社はJefferies LLCまたはJefferiesと公開市場販売協定を締結し、この合意により、当社は当社の普通株株式を発売および販売することができ、総発売で得られた金額は最高$に達する
12.関連するパーティ取引
2022年7月、会社は非営利財団と協定を締結し、会社の取締役会のメンバー2人、会社のCEOを含み、財団の取締役会のメンバーも務めている
13.その他の全面的な損失の累計
累積その他の総合損失総額には、以下の項目が含まれています(千計)
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
外貨換算調整 |
|
$ |
( |
) |
|
$ |
( |
) |
証券売却可能な未実現損失 |
|
|
( |
) |
|
|
( |
) |
累計その他総合損失合計 |
|
$ |
( |
) |
|
$ |
( |
) |
21
ITEM 2経営陣の財務状況と経営成果の検討と分析
以下、当社の財務状況及び経営業績に関する検討及び分析は、項目1に添付されていない監査総合財務諸表及び関連付記とともに読み、当社の2022年12月31日までの年次報告(Form 10-K)又は“年報”に掲載されている監査総合財務諸表及び関連付記と併せて読まなければならない。
概要
Ultragenyx製薬会社、私たちまたは当社は、深刻なまれかつ極端な遺伝疾患を識別、買収、開発、商業化する新製品の識別、買収、開発、商業化に専念するバイオ製薬会社です。我々の目標は,満たされていない医療ニーズが高く,治療の生物学的に明らかであり,通常承認されていない潜在疾患の治療法を治療する疾患である。われわれの戦略は,時間と費用対効果の高い薬物開発をもとに,最も緊急な患者に安全で効率的な治療を提供する目標を実現するとともに,複数の計画を実施できるようにしている。
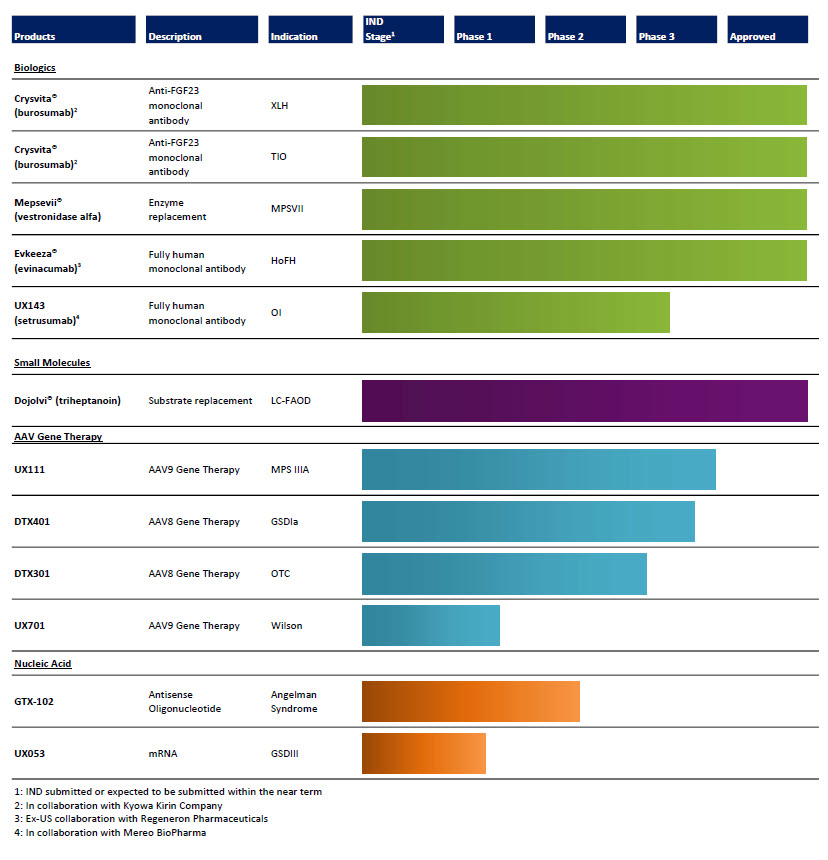
承認された治療法及び臨床候補製品
私たちが現在承認している療法と臨床段階パイプラインは、生物製剤、小分子、遺伝子療法、候補核酸製品の4つの製品カテゴリを含む。我々が承認したいくつかの療法と臨床段階パイプライン製品の最新更新の説明については,以下の“最近の計画更新”と題する部分を参照されたい。
私たちの生物学的製品には、承認された療法Crysvita(ブロスモノクロマブ)、Mepsevii(ヴェストロニダ酵素α)、Evkeeza(Evinacumab)および臨床開発におけるUX 143:
Crysvitaは米国や他のある地域でも承認されており,腫瘍誘導骨軟化症(TIO)におけるFGF 23に関連する低リン血症の治療に用いられており,この腫瘍はリン酸尿間葉系腫瘍に関連しており,2歳以上の成人や小児患者で治療的切除や定位を行うことはできない。先進国では約2,000~4,000人のTio患者がいる。TIOは深刻な低リン血症、骨軟化、骨折、疲労、骨格と筋肉痛及び筋肉無力を招くことができる。
我々は,Kyowa Kirin Co.,Ltd.,KKC(前身はKyowa Hakko Kirin Co.,Ltd.,またはKHK),KKCの完全子会社Kyowa麒麟と協力して,Crysvitaを世界的に開発し,商業化している。
22
私たちの小分子製品には承認された治療薬Dojolvi(トリヘプタン):
私たちの臨床段階遺伝子治療パイプラインはUX 111、DTX 401、DTX 301、UX 701を含む
我々の臨床段階核酸導管は、Angelman症候群を治療するためのGTX−102と、GSDIIIを治療するためのUX 053とを含む:
23
次の表に承認された製品と臨床候補製品ラインをまとめます

最近の計画更新
Crysvita X連鎖低リン血症と腫瘍による骨軟化症の治療に用いられる
2023年4月、Crysvitaの北米での商業化責任は私たちからKKCに移行した。双方の協力協定の2022年9月改正案によると、2024年4月までKKCの米国での商業化努力をコスト分担手配で支援していくが、改正案に規定されている制限と条件を遵守しなければならない。
24
UX 143(Setrusumab)による骨形成不全治療
2023年6月、私たちはパートナーのMereoと共に2/3段階用量選択第2段階の積極的なデータを発表しました軌道.軌道SetrusumabはOI患者の骨生成を迅速に誘導することが示唆された。カットオフ時に評価を受けたすべての患者において,setrusumabは血清P 1 NPレベルの統計学的有意な上昇を示し,P 1 NPは骨形成の感受性マーカーであり,3カ月後に骨密度(BMD)は有意に改善した。
切断されたデータまで、登録された24人の患者のすべての治療期間中の血清P 1 NPレベルが利用可能である軌道.軌道Setrusumabの治療は2用量群の血清P 1 NPを有意に増加させ,1~2週間でピークに達し,予想通り2カ月の用量時点後に再びピークに達したことが証明された。第二段階軌道.軌道両行列において血清P 1 NPとBMDの反応は有意であり,その多くは20 mg/kgに影響が認められた。
中国で観察される骨密度の大幅な増加軌道.軌道前3カ月の患者数は血清P 1 NPレベルの急速な上昇と一致しており,Mereo以前に成人OI患者で行った小惑星研究が1年かけて得られた結果と類似している。腰椎骨密度データは24人中17人が利用可能である軌道.軌道患者は3カ月の時点であった。Setrusumabによる治療3カ月後,腰椎骨密度は20 mg/kg(n=10)でベースラインより9.4%増加したことは,Zスコアがベースライン時の−2.12(n=11)から+0.65有意に増加したことを意味している。40 mg/kg用量群(n=7)の骨密度は9.8%増加した。プラセボを服用した患者は3カ月の時点(n=2)で骨密度や腰椎Zスコアに有意な変化はなかった。
データ切断時までの研究では,治療に関する重篤な有害事象は認められなかった。報告された不良事件は小惑星研究で観察されたものと基本的に一致し、輸液関連事件、頭痛と副鼻腔炎を含む。Setrusumabに関するアレルギー反応は報告されていない。投与量群と年齢群の間に安全に関する差は認められなかった。
2023年7月私たちは2つの末期臨床試験で最初の患者が薬物治療を受けたと発表しました軌道.軌道そして宇宙小児および青壮年OI患者におけるsetrusumabの使用を評価する。Pivotalのステップ3の部分軌道.軌道ある研究では、setrusumabとプラセボが5歳から5歳までの患者の年化臨床骨折発生率に与える影響を評価している軌道.軌道12カ国の40カ所以上で約195人の患者を募集する予定だ。第3段階宇宙この研究は能動対照研究であり、setrusumabとビスフォスフォネート(IV-BP)静脈注射治療が2歳から10歳までの患者の年間総骨折発生率に与える影響を評価した
第2段階からの他のデータを共有する予定です軌道.軌道10月中旬に予定されているアナリストの日に勉強する。
GTX-102 Angelman症候群の治療
2023年5月、我々は、Angelman症候群を有する小児科患者においてFDAがAngelman症候群を有する小児科患者におけるGTX-102の1/2期研究の合意修正案を検討し、同意することを発表し、米国の用量範囲と研究の前の米国のキューで使用された用量範囲とを調整することができるようにした。この1/2段階、開放ラベル、用量増加の研究は、遺伝的に全芽細胞腫と診断されたAngelman症候群児童患者におけるGTX-102の安全性と耐性を評価しているUBE 3 A遺伝子が欠けていますこの研究はGTX−102の用量範囲と治療案の検証を求めており,第3段階計画で使用される予定である。
2023年8月3日現在,19名の患者がGTX−102に接触して12カ月を超え,最長2年近くであった。この研究の用量アップグレード段階は今年の早い時期に完成し、拡大キュー中の投与量は進行中である。本文書が提出された日まで、長期治療と用量維持後、用量増加キュー中の患者は引き続き鼓舞的な用量と時間依存の臨床活動を示した。自己が前回2023年1月に更新されて以来、他の治療に関連する深刻な不良事件や下肢無力不良事件は発生しなかった。
全世界範囲内で、各サイトは患者を拡大キューに入れており、用量増加キューと同じ安全性、薬物動態学と治療効果措置を評価する。過去2カ月間,米国を含むより多くのサイトが活性化されるにつれて登録者数が加速し,現在20人以上の患者が世界各地の場所に登録されている。これまで,拡大キュー中の患者では下肢無力の安全事象は認められなかった。
2023年10月中旬のアナリスト日に臨時計画更新を提供する予定です。2024年上半期には,少なくとも6カ月の治療を受けた少なくとも20名の患者の用量拡大コホートデータを共有することが予想され,この疾患の自然病歴との有意な比較を提供することが予想される。
DTX 401はIa型グリコーゲン沈着症またはGSDIAの治療に使用される
2023年5月、DTX 401の第3段階研究の最後の患者を発表した。第三段階の研究は48週間の主要な治療効果分析期があり、約50名の8歳と以上の患者を募集し、ランダムに1:1にDTX 401(1.0 x 10 ̄13 GC/kg用量)或いはプラセボを服用した。主な終点は経口トウモロコシ澱粉のブドウ糖代替を減少させ、同時に血糖コントロールを維持することである。私たちは2024年上半期にこの第3段階研究の結果を共有する予定だ。
25
DTX 301はオルニチントランスアミナーゼまたはOTC欠損症の治療に使用される
64週間のDTX 301第3段階研究では、患者にランダムなグループ分けと用量分配を行っている。研究中の患者はランダムにDTX 301(1.7 x 10 ̄13 GC/kg用量)或いはプラセボに分けられる。12歳以上の患者約50名を募集する予定である。共通の主要な終点は患者が応答に達したパーセンテージであり、ベースライン疾患管理を停止または減少させることによって測定され、24時間の血中アンモニアレベルである。
UX 701治療肝豆状核変性
Pivotal第1段階の患者に薬を募集していますキプロス2+UX 701による肝豆状核変性の治療の研究。2023年7月、私たちは、データセキュリティ監視委員会が第1のキューのセキュリティデータを検討し、それを第2の用量レベル(1.0 x 10 ̄13 GC/kg用量)に向上させることを提案することを発表した。Cohort 2の投与量はすでに開始されており,段階1は現在計画通り今年末頃に登録を完了している。この段階では、UX 701の安全性および有効性は、52週間以内に最大3つの用量レベルの評価が行われ、第2段階で1つの用量を選択してさらに評価される。2024年上半期には、安全性に関する中期データおよび潜在的な臨床活動の初歩的な兆候が予想される。
企業動態
2023年7月には、ハワード·ホーンを首席財務官に任命し、総裁を執行副総裁に任命し、企業戦略を担当し、2023年10月16日から発効することを発表した。このポストでは、ハワードは財務、会計、会社戦略と投資家関係を指導する機能を担当する。彼はEmil D.Kakkis博士に仕事を報告し、実行指導チームに勤務する予定だ。
財務運営の概要
私たちは生物製薬会社で、運営の歴史が限られている。これまで、私たちは臨床研究を行い、これらの業務に販売、一般、行政支援を提供することを含む、私たちの製品と候補製品を決定、獲得、開発するために、ほとんどの努力と財政資源を投入してきた。今まで、私たちの運営資金は主に私たちの株式証券の売却、私たちの商業製品の収入、ある未来の特許使用料の売却、戦略協力手配から来ています。
設立以来、私たちは毎年純損失を出している。2023年6月30日までの3ヶ月と6ヶ月の純損失はそれぞれ1.598億ドルと3.238億ドルで、2022年6月30日までの3ヶ月と6ヶ月の純損失はそれぞれ1.582億ドルと3.105億ドルだった。私たちのほとんどの純損失は私たちの研究開発計画に関するコストと私たちの運営に関する販売、一般、行政コストによるものです。
2023年6月30日までの3ヶ月と6ヶ月の総収入はそれぞれ1.083億ドルと2.088億ドルですが、2022年6月30日までの3ヶ月と6ヶ月の総収入はそれぞれ8930万ドルと1億693億ドルです。収入の増加は私たちが承認した製品に対する需要の増加によるところが大きい。
2023年6月30日現在、私たちは6.184億ドルの利用可能な現金、現金等価物、および売却可能な債務証券を持っている。
肝心な会計見積もり
我々の経営陣の財務状況と経営結果の討論と分析は私たちの簡明な総合財務諸表に基づいており、これらの簡明な総合財務諸表はアメリカ公認会計原則(GAAP)に基づいて作成された。これらの簡明な総合財務諸表を作成する際には、財務諸表の日付の報告済み資産および負債額、または有資産および負債の開示、および報告期間内に発生した報告済み費用に影響を与える推定および仮定を行う必要がある。我々の見積もりは,我々の歴史的経験と,当時の状況では合理的な様々な他の要因に基づいており,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。2023年6月30日までの6ヶ月間、私たちのキー会計政策に大きな変化はなく、私たちの年報で“経営陣の財務状況と経営結果の議論と分析--キー会計政策と重大な判断と見積もり”で開示された内容と比較した。
26
経営成果
2023年6月30日までの3ヶ月と6ヶ月と2022年6月30日現在の3ヶ月と6ヶ月の比較:
収入(千ドル単位)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
協力と許可収入: |
|
|
|
|
|
|
|
|
|
|
|
||||
利益共有におけるCrysvita連携収益 |
$ |
19,799 |
|
|
$ |
51,609 |
|
|
$ |
(31,810 |
) |
|
|
-62 |
% |
第一三共 |
|
— |
|
|
|
1,479 |
|
|
|
(1,479 |
) |
|
|
-100 |
% |
協力と許可総収入 |
|
19,799 |
|
|
|
53,088 |
|
|
|
(33,289 |
) |
|
|
-63 |
% |
製品販売: |
|
|
|
|
|
|
|
|
|
|
|
||||
クリスヴィータ |
|
16,884 |
|
|
|
12,402 |
|
|
|
4,482 |
|
|
|
36 |
% |
メイプセヴィ |
|
8,439 |
|
|
|
4,933 |
|
|
|
3,506 |
|
|
|
71 |
% |
ドホルヴィ |
|
16,491 |
|
|
|
13,497 |
|
|
|
2,994 |
|
|
|
22 |
% |
エフキザ |
|
365 |
|
|
|
— |
|
|
|
365 |
|
|
|
100 |
% |
製品総売上高 |
|
42,179 |
|
|
|
30,832 |
|
|
|
11,347 |
|
|
|
37 |
% |
Crysvita特許使用料収入 |
|
46,331 |
|
|
|
5,423 |
|
|
|
40,908 |
|
|
|
754 |
% |
総収入 |
$ |
108,309 |
|
|
$ |
89,343 |
|
|
$ |
18,966 |
|
|
|
21 |
% |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
協力と許可収入: |
|
|
|
|
|
|
|
|
|
|
|
||||
利益共有におけるCrysvita連携収益 |
$ |
69,705 |
|
|
$ |
96,773 |
|
|
$ |
(27,068 |
) |
|
|
-28 |
% |
第一三共 |
|
1,479 |
|
|
|
4,728 |
|
|
|
(3,249 |
) |
|
|
-69 |
% |
協力と許可総収入 |
|
71,184 |
|
|
|
101,501 |
|
|
|
(30,317 |
) |
|
|
-30 |
% |
製品販売: |
|
|
|
|
|
|
|
|
|
|
100 |
% |
|||
クリスヴィータ |
|
38,118 |
|
|
|
21,796 |
|
|
|
16,322 |
|
|
|
75 |
% |
メイプセヴィ |
|
16,919 |
|
|
|
9,794 |
|
|
|
7,125 |
|
|
|
73 |
% |
ドホルヴィ |
|
30,794 |
|
|
|
25,926 |
|
|
|
4,868 |
|
|
|
19 |
% |
エフキザ |
|
577 |
|
|
|
— |
|
|
|
577 |
|
|
|
100 |
% |
製品総売上高 |
|
86,408 |
|
|
|
57,516 |
|
|
|
28,892 |
|
|
|
50 |
% |
Crysvita特許使用料収入 |
|
51,213 |
|
|
|
10,261 |
|
|
|
40,952 |
|
|
|
399 |
% |
総収入 |
$ |
208,805 |
|
|
$ |
169,278 |
|
|
$ |
39,527 |
|
|
|
23 |
% |
利益共有分野でのCrysvita協力収入シェアは低下しました3180万ドルと2710万ドルf3ヶ月と6ヶ月で終わるかもしれません2023年6月30日,それぞれ2022年同期と比較した。減少の要因は,Crysvitaの商業化責任が2023年4月にKKCに移管されたことである。移行後、利益共有分野のCrysvita販売から収入シェアを獲得し続け、現在は特許使用料収入として記録されている。
3ヶ月と6ヶ月まで、私たちがDaiichi Sankyo手配から得た収入はそれぞれ150万ドルと320万ドル減少しました2023年6月30日それぞれ2022年同期と比較した。減少の要因は,技術移転と2023年3月までの技術移転期限が完了したことである。
2022年同期と比べ、2023年6月30日までの3ヶ月と6ヶ月間、私たちの製品の売上高はそれぞれ1130万ドルと2890万ドル増加した。増加の主な原因は、治療を受ける患者の数が増加し続け、他の承認された製品に対する需要が増加し続けているため、Crysvitaに対するラテンアメリカの需要が増加していること、私たちが命名した患者計画の収入の増加、特にラテンアメリカでの注文の時間スケジュールである。
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月間、私たちのCrysvita特許使用料収入はそれぞれ4090万ドルと4100万ドル増加した。この成長は主に2023年4月の利益共有分野のビジネス責任がKKCに移管されたことによるものである。移行後,利益共有分野におけるCrysvita販売収入シェアを特許使用料収入として確認し,移行前に協調収入として記録した。
販売コスト(千ドル)
27
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
販売コスト |
$ |
9,914 |
|
|
$ |
8,270 |
|
|
$ |
1,644 |
|
|
|
20 |
% |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
販売コスト |
$ |
22,171 |
|
|
$ |
14,370 |
|
|
$ |
7,801 |
|
|
|
54 |
% |
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月の販売コストはそれぞれ160万ドルと780万ドル増加した。販売コストの増加は、我々が承認した製品の需要増加によるものであるが、ラテンアメリカで販売されているCrysvita譲渡価格は、2022年12月31日までの35%から2023年の30%に低下し、この影響を部分的に相殺している。
研究開発費(千ドル)
研究開発費には、我々の計画および候補計画の研究·開発のために生じる内部および外部コスト、および業務開発取引によって取得または許可されたいくつかの技術に関する費用が含まれている。これらの費用には,主に契約研究機関による臨床研究,契約製造機関による薬物物質や薬品の製造,材料や用品,協力やその他の手配からの費用,マイルストーン,免許,その他の費用,賃金,福祉,株式報酬を含む人員費用,各種支援やインフラ費用からなる間接費用分配が含まれている。
商業プロジェクトには、疾病監視プロジェクトの費用と、プロジェクトが商業承認を受けた後のいくつかの監督管理と医療事務支援活動が含まれる。臨床プロジェクトは臨床プロジェクト候補に関連する研究行為と製造コストを含む。転化性研究は臨床前研究のコストとIND提出前の臨床前プロジェクトに関連するコストを含む。前期許可とマイルストーン費用には、戦略的許可協定に関連する任意の重大な費用が含まれています。インフラコストには、実験室、IT、および設備減価償却コストに関連する直接的なコストと、人的資源、IT、および他の分配可能なコストのための間接費用分配が含まれる。
次の表は主なプロジェクトタイプと業務活動によって私たちの研究開発費を細分化しました
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
商業番組 |
$ |
14,903 |
|
|
$ |
16,279 |
|
|
$ |
(1,376 |
) |
|
|
-8 |
% |
臨床計画: |
|
|
|
|
|
|
|
|
|
|
|
||||
中国は様々な遺伝子治療計画を発表しました |
|
40,742 |
|
|
|
35,743 |
|
|
|
4,999 |
|
|
|
14 |
% |
現代生物と核酸科学 |
|
22,024 |
|
|
|
21,852 |
|
|
|
172 |
|
|
|
1 |
% |
翻訳研究 |
|
18,405 |
|
|
|
21,315 |
|
|
|
(2,910 |
) |
|
|
-14 |
% |
ライセンス料とマイルストーン費用を前払いする |
|
9,000 |
|
|
|
— |
|
|
|
9,000 |
|
|
* |
|
|
インフラ施設 |
|
18,420 |
|
|
|
17,683 |
|
|
|
737 |
|
|
|
4 |
% |
株に基づく報酬 |
|
19,138 |
|
|
|
20,430 |
|
|
|
(1,292 |
) |
|
|
-6 |
% |
他の研究と開発 |
|
22,317 |
|
|
|
21,227 |
|
|
|
1,090 |
|
|
|
5 |
% |
研究開発費総額 |
$ |
164,949 |
|
|
$ |
154,529 |
|
|
$ |
10,420 |
|
|
|
7 |
% |
*意味がない |
|
|
|
|
|
|
|
|
|
|
|
||||
28
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
商業番組 |
$ |
30,750 |
|
|
$ |
29,343 |
|
|
$ |
1,407 |
|
|
|
5 |
% |
臨床計画: |
|
|
|
|
|
|
|
|
|
|
|
||||
中国は様々な遺伝子治療計画を発表しました |
|
79,229 |
|
|
|
76,023 |
|
|
|
3,206 |
|
|
|
4 |
% |
現代生物と核酸科学 |
|
52,878 |
|
|
|
42,326 |
|
|
|
10,552 |
|
|
|
25 |
% |
翻訳研究 |
|
38,829 |
|
|
|
41,642 |
|
|
|
(2,813 |
) |
|
|
-7 |
% |
許可証とマイルストーン費用を前払いします |
|
9,000 |
|
|
|
— |
|
|
|
9,000 |
|
|
* |
|
|
インフラ施設 |
|
37,958 |
|
|
|
34,067 |
|
|
|
3,891 |
|
|
|
11 |
% |
株に基づく報酬 |
|
37,258 |
|
|
|
37,337 |
|
|
|
(79 |
) |
|
|
0 |
% |
他の研究と開発 |
|
44,745 |
|
|
|
36,946 |
|
|
|
7,799 |
|
|
|
21 |
% |
研究開発費総額 |
$ |
330,647 |
|
|
$ |
297,684 |
|
|
$ |
32,963 |
|
|
|
11 |
% |
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月の総研究開発支出はそれぞれ1040万ドルと3300万ドル増加した。研究と開発費の変化は主に
臨床開発による我々の候補製品の推進に伴い,将来的には年間研究·開発費が減少することが予想される。発生費用の時間と金額は、私たちの候補製品の現在または未来の臨床研究の結果、ならびに関連する法規の要求、製造コスト、および私たちの臨床前計画の推進に関連する任意のコストに大きく依存するであろう。
29
販売、一般、管理費(千ドル)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
販売、一般、行政 |
$ |
81,403 |
|
|
$ |
68,137 |
|
|
$ |
13,266 |
|
|
|
19 |
% |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
販売、一般、行政 |
$ |
158,049 |
|
|
$ |
135,449 |
|
|
$ |
22,600 |
|
|
|
17 |
% |
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月の販売、一般と行政費用はそれぞれ1330万ドルと2260万ドル増加した。販売、一般、行政費用の増加は、主に私たちのビジネス活動を支援する従業員数の増加、商業化コストと専門サービスコスト、使い捨て法律対応費用による人員コストの増加です。
私たちは、承認された製品と複数の臨床段階の候補製品を支持し続けるにつれて、将来の販売、一般、管理費用が減少すると予想し、Crysvitaが利益共有分野のパートナーにビジネス責任を移譲するため、ビジネス活動は減少すると予想される。
利子収入(千ドル)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
利子収入 |
$ |
5,964 |
|
|
$ |
899 |
|
|
$ |
5,065 |
|
|
* |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|||
利子収入 |
$ |
12,254 |
|
|
$ |
1,393 |
|
|
$ |
10,861 |
|
|
* |
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月の利息収入がそれぞれ510万ドルと1090万ドル増加したのは、主に金利上昇によるものだ。
株式投資公正価値変動(千ドル)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
|
||||
株式投資は価値変動を公平に許容する |
$ |
261 |
|
|
$ |
(10,184 |
) |
|
$ |
10,445 |
|
|
|
-103 |
% |
|
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
|
||||
株式投資は価値変動を公平に許容する |
$ |
(73 |
) |
|
$ |
(19,513 |
) |
|
$ |
19,440 |
|
|
|
-100 |
% |
|
2022年6月30日までの3ヶ月と6ヶ月のうち、2022年6月30日までの3ヶ月と6ヶ月の間にArcturus治療ホールディングスまたはArcturus普通株への投資が560万ドルと1060万ドルの未達成損失を出したことと、2022年6月30日までの3ヶ月と6ヶ月で固体普通株への投資が460万ドルと890万ドルの未達成損失が発生したため、株式投資の公正価値は1020万ドルと1950万ドル減少した。2022年12月31日まで、Arcturusでのすべての余剰株式投資を売却しました。
将来の特許使用料負債を販売する非現金支払利息(千ドル単位)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
年間負債の非現金支払利息 |
$ |
(15,375 |
) |
|
$ |
(6,052 |
) |
|
$ |
(9,323 |
) |
|
|
154 |
% |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
将来の特許使用料負債を販売する非現金支払利息 |
$ |
(31,011 |
) |
|
$ |
(12,636 |
) |
|
$ |
(18,375 |
) |
|
|
145 |
% |
30
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月、将来の特許権使用料販売負債の非現金利息支出はそれぞれ930万ドルと1840万ドル増加した。これは,2022年7月に北米Crysvita特許使用料部分をオンタリオ州市政従業員退職制度(OMERS)の投資ツールOCM LS 23 Holdings LPに売却し,利息支出が増加したためである。特許使用料の支払いが私たちの最初の見積もりよりも高いか低いか、またはその支払いの時間が私たちの最初の推定と大きく異なる場合、実際の金利を前向きに調整します。
その他の費用(千ドル)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
その他の費用 |
$ |
(1,989 |
) |
|
$ |
(930 |
) |
|
$ |
(1,059 |
) |
|
|
114 |
% |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
その他の費用 |
$ |
(1,681 |
) |
|
$ |
(641 |
) |
|
$ |
(1,040 |
) |
|
|
162 |
% |
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月の他の支出はそれぞれ110万ドルと100万ドル増加した。このような変化は主に為替レートの変動によるものだ。
所得税準備金(千ドル)
|
6月30日までの3ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
所得税支給 |
$ |
(732 |
) |
|
$ |
(302 |
) |
|
$ |
(430 |
) |
|
|
142 |
% |
|
6月30日までの6ヶ月間 |
|
|
ドル |
|
|
% |
|
|||||||
|
2023 |
|
|
2022 |
|
|
変わる |
|
|
変わる |
|
||||
所得税支給 |
$ |
(1,227 |
) |
|
$ |
(860 |
) |
|
$ |
(367 |
) |
|
|
43 |
% |
2022年同期と比較して、2023年6月30日までの3ヶ月と6ヶ月の所得税引当名目金額が増加した。
流動性と資本資源
今まで、私たちの運営資金は主に私たちの株式証券の売却、私たちの商業製品の収入、ある未来の特許使用料の売却、戦略協力手配から来ています。
2023年6月30日現在、私たちは6.184億ドルの利用可能な現金、現金等価物、および売却可能な債務証券を持っている。私たちは私たちの既存の資本資源が少なくとも今後12ヶ月間の私たちの予想される運営需要を満たすのに十分だと信じている。私たちの現金、現金等価物、および取引可能な債務証券は、様々な預金口座、利子計算口座、社債証券、商業手形、米国政府証券、資産支援証券、および通貨市場基金に格納されている。現在の需要を超える現金による投資は流動性と資本保護のためであり、集中度と信用リスクの潜在的影響を最小限に抑えることを求めている。
2021年5月、私たちはJefferies LLCまたはJefferiesと公開市場販売協定を締結し、この協定によると、私たちは時々Jefferiesを介して市場またはATMで私たちの普通株の株式を発行して販売することができ、総発行収益は3億5千万ドルに達する。2023年6月30日までの3カ月と6カ月で、この予定に基づいて564,302株が売却され、純収益は約2850万ドルだった。2022年6月30日までの3ヶ月と6ヶ月以内に、この予定に基づいて株式は何も売却されていない。2023年6月30日現在、この手配により売却された株式の純収益は約1.075億ドル。
次の表は、示す期間のキャッシュフロー(千単位)をまとめた
|
6月30日までの6ヶ月間 |
|
|||||
|
2023 |
|
|
2022 |
|
||
経営活動用の現金 |
$ |
(273,028 |
) |
|
$ |
(194,778 |
) |
投資活動が提供する現金 |
|
210,722 |
|
|
|
41,806 |
|
融資活動で提供された現金 |
|
32,298 |
|
|
|
7,449 |
|
為替レート変動が現金に与える影響 |
|
75 |
|
|
|
(1,346 |
) |
現金、現金等価物、および限定的な現金純減少 |
$ |
(29,933 |
) |
|
$ |
(146,869 |
) |
31
経営活動用の現金
私たちの現金の主な用途は研究開発と商業支出を含む運営費用に資金を提供することです。私たちの巨額の研究開発支出により、私たちは設立以来大きな運営赤字を生み出してきた。運営費に資金を提供するための現金は、これらの費用を支払う時間の影響を受けており、これは私たちの未済売掛金や売掛金の変化に反映されている。
2023年6月30日までの6ヶ月間、経営活動で使用された現金は2.73億ドルで、主に純損失3.238億ドル、償却購入のための販売可能債務証券の割引を反映し、2220万ドルはRPI Finance TrustまたはRPI(Royalty Pharmaの付属会社)とOMERSへの将来の特許権使用料の売却に関する非現金特許権使用料収入のため、6660万ドルの株式ベースの給与の非現金費用によって相殺され、1060万ドルは減価償却と償却に使用され、10万ドルは固体株式投資の公正価値の変化に使用され、将来の特許使用料の売却に関連する負債によって生成された非現金利息のために、3100万ドルがRPIおよびOMERSに使用される。経営活動で使用される現金が1 760万ドル減少した理由は、売掛金が増加したためであり、主に収入増加と注文時間スケジュールであり、主にDojolvi在庫の増加、150万ドルの減少、契約負債の150万ドルの減少、純額はDaiichi Sankyoのライセンス契約で確認された収入に関連しており、支払請求、売掛金、その他の負債は2 220万ドル減少し、主に支払いと領収書受信のスケジュール、製造業の課税項目および一般会社の課税項目の減少、および2022年の年間ボーナスの支払いによるものである。前払い費用と主に前払い製造減少に関する他の資産純減少により,増加した1,160万ドルを部分的に相殺した。
2022年6月30日までの6ヶ月間、経営活動で使用された現金は1.948億ドルで、主にRPIへの将来の特許使用料の売却に関する純損失3.105億ドルと非現金特許権使用料収入1030万ドルを反映しており、株式ベースの報酬6530万ドル、販売可能債務証券プレミアム償却340万ドル、減価償却と償却860万ドル、ArcturusとSolid持分投資の公正価値変化1950万ドルによって相殺された。将来の特許使用料のRPIへの売却に関連する負債によって生成された非現金利息のために1,260万ドル。経営活動で使用されている現金が890万ドル減少したのは,主に注文スケジュールに関する売掛金の増加,主にDojolviとMepseviiの在庫増加,470万ドルの減少であり,主に前払い製造増加,前払い費用や他の資産増加,680万ドル減少であり,一部はパートナーの売掛金の減少に相殺され,契約負債純額は460万ドル減少し,Daiichi Sankyoとのライセンス契約から確認された収入に関係しているが,売掛金増加により4130万ドル増加した。その他の負債は,主に製造業と2022年年度ボーナス課税項目の増加と,支払タイミングによる売掛金の増加であるが,2021年年度ボーナスの支払部分によって相殺される。
投資活動が提供する現金
2023年6月30日までの6ヶ月間、投資活動が提供する現金は2.107億ドルで、主に売却可能債務証券の売却収益1460万ドルと売却可能債務証券の満期日4.072億ドルに関連しているが、購入物件、工場、設備3900万ドルによって相殺され、主に私たちの遺伝子治療製造工場の購入、1.653億ドルの販売可能債務証券の購入、無形資産として記録された250万ドルのマイルストーン支払いに使用されており、この支払いはDojolviに関連するいくつかの商業マイルストーンを実現したことによるものである。
2022年6月30日までの6ヶ月間、投資活動が提供する現金は4,180万ドルで、主に売却可能債務証券の売却収益4,300万ドルと売却可能債務証券の満期日2.973億ドルに関連しているが、不動産、工場、設備6,310万ドルの購入に相殺され、主に私たちの遺伝子治療製造工場の購入、売却可能債務証券2.053億ドルの購入、Regeneronに3,000万ドルの無形資産の支払いに用いられている。
融資活動で提供された現金
2023年6月30日までの6ヶ月間、融資活動が提供した現金は3230万ドルで、主に私たちのATMが発行した純収益約2850万ドルと、株式計画に基づいて普通株の発行を奨励する純収益380万ドルを含む。
2022年6月30日までの6ヶ月間、融資活動が提供した現金は740万ドルで、主に株式計画に基づいて普通株を発行する770万ドルの純収益を奨励することが含まれている。
資金需要
非日常的なプロジェクトは含まれておらず、私たちが候補製品を開発し続け、規制部門の承認を求め、承認された製品を商業化し続けるにつれて、予測可能な未来に年間損失が発生し続けると予想される。私たちの運営を支援するために追加の資金が必要になります私たちが行っている臨床研究を完成させるためには
32
私たちの製品を商業化するために、私たちのパイプライン成長を促進するために早期研究能力に投資し続け、将来のマイルストーン支払いを含む、当社の業務または製品の補充または拡大に引き続き投資し、私たちのGMP遺伝子治療製造施設の拡張を含む私たちの一般的なインフラをさらに発展させ、このような資金は許容可能な条項で得られないか、または全く得られないかもしれません。
もし私たちが受け入れられる金額や条項で追加資本を調達できない場合、私たちは私たちの1つ以上の臨床研究、研究と開発計画、将来の商業化努力、または私たちが自分で開発し、マーケティングすることをより望んでいた候補製品を開発し、マーケティングする権利を与え、延期、制限、縮小、または終了することを要求されるかもしれない。
私たちの未来の支出需要は多くの要素に依存するだろう
33
私たちは既存の資本残高、商業製品の収入、ならびに公共またはプライベート株式発行、債務融資、協力、戦略連盟、許可手配、その他のマーケティングと流通手配の組み合わせによって、将来の現金需要を満たすことを望んでいる。“リスク要因-私たちの財務状況と資本要求に関連するリスク”を参照してください
契約義務と約束
通常業務過程で発生する材料契約義務は主に経営と融資リース、製造とサービス契約義務及び建築建築と内装協定を含む。
2023年6月30日現在、レンタルキャンセル不可により、将来の最低レンタル支払いは約5170万ドルで、そのうち1470万ドルが1年以内に満期になります。
製造とサービス契約義務は主に私たちのために承認された製品製造在庫に関するものだ。2023年6月30日までに、私たちは約2860万ドルの債務があり、そのうちの2140万ドルが1年以内に満期になった。
ビルの建設と改善協定は当社の賃貸物件の建設と内装に関係している。2023年6月30日現在、私たちの債務は約990万ドルで、そのうち140万ドルは1年以内に満期になる見通しだ。
私たちは一般的に手元の現金と経営活動が提供する現金でこのような約束を履行することを望んでいる。私たちのいくつかの許可、特許使用料、開発と協力協定、その他の研究開発活動の条項は、製品開発に基づいて潜在的な将来のマイルストーン支払いに成功することを要求します。このような借金の金額と時間は未知か不確実だ。
ITEM 3。市場リスクの定量的·定性的開示について
金利リスク
私たちの金利変化に対する市場リスクの開放は主に私たちの現金等価物と債務証券を販売して稼ぐことができる利息と関係があります。私たちの投資活動の主な目標は私たちの資本を保存し、運営に資金を提供することだ。第二の目標は、重大なリスクを負うことなく投資収益を最大限に増加させることである。私たちの投資政策は低リスク、投資レベルの債務ツールに投資することを規定している。2023年6月30日現在、私たちは合計6.184億ドルの現金、現金等価物、取引可能な債務証券を持っていますが、2022年12月31日現在、私たちは銀行預金、通貨市場基金、アメリカ政府国債と機関証券、投資レベルの社債を含む8.967億ドルを持っています。これらの証券は契約違反、信用格付けの変化、時価変化を含む可能性があります。私たちのポートフォリオにおける証券は売却可能に分類され、金利リスクの影響を受け、市場金利が上昇すれば、これらの証券の価値は縮むだろう。金利が上記のどの時期に100ベーシスポイント変化しても、2023年6月30日または2022年12月31日までの現金等価物や取引可能債務証券の公平な市場価値に実質的な影響を与えないと仮定する。これまで、私たちのどの投資にも元本損失はなく、2023年6月30日まで、私たちはいかなる投資信用損失準備金も記録していません。
外貨リスク
私たちはドル以外の通貨での取引が達成されたため、為替リスクに直面している。外貨での支払いが予想される時間が不確定なため、長期外貨契約は何も使用しません。すべての外国取引は支払い時に適用される現金で決済されます。マクロ経済環境(銀行システムや金融機関に影響を与える金融状況を含む)、インフレや世界的な政治不安定による不安定な市場状況は、為替レートの大きな変化を招く可能性があり、特にドルに対する外貨の疲弊は、ドルで表される収入や運営収入に悪影響を及ぼす可能性がある。為替レートの不利な変動は、外国サプライヤーへの支払いやライセンス契約に関連した支払いに実質的な影響を与える可能性がある。2023年6月30日までの3ヶ月と6ヶ月以内に、私たちの大部分の収入、支出、資本支出はドルで価格を計算します。為替レートが上記のいずれの期間に10%の変動が発生しても我々の簡明な総合財務諸表に実質的な影響を与えないと仮定する。
34
ITEM 4.制御とプログラム
情報開示制御とプログラムの評価
経営陣は、最高経営責任者及び最高財務官の監督の下、1934年の証券取引法又は取引法下の第13 a-15(B)及び15 d-15(B)規則に基づいて、本四半期報告に記載された期間終了時までの“開示制御及び手続”の有効性を評価した。この評価では、我々のCEOおよび最高財務官は、2023年6月30日まで、開示されなければならない情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されなければならない合理的な保証を提供することを目的とした開示制御および手続きが有効であると結論した。本検討において、開示制御および手続とは、提出または提出された報告書において開示すべき情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、集約および報告されることを保証するための制御および手順を意味する。これらの開示制御およびプログラムは、提出または提出された報告書において開示すべき情報が蓄積され、管理層(我々のCEOおよび最高財務責任者を含む)に伝達されることを保証するための制御および手順に限定されないが、開示要求に関する決定をタイムリーに行うために、これらに限定されない。開示制御やプログラムを設計·評価する際には、任意の制御およびプログラムは、設計および動作がどんなに良好であっても、予想される制御目標を達成するために合理的な保証を提供することしかできず、我々の管理層は、可能な制御とプログラムの費用対効果関係を評価する際にその判断を適用しなければならないことを認識している。
財務報告の内部統制の変化
2023年6月30日までの四半期内に、財務報告の内部統制(“取引法”第13 a-15(F)および15 d-15(F)規則の定義による)には何の変化もなく、これは私たちの財務報告の内部統制に大きな影響を与えたり、合理的な可能性がそれに大きな影響を与えたりする。
35
P第二条-その他の情報
I項目1。法律訴訟
私たちは現在どんな実質的な法的手続きの当事者でもない。しかし、通常の業務過程では、第三者または政府規制機関からの様々なクレームに直面する可能性があり、私たちは時々クレームを出したり、私たちの権利を維持するために法的行動を取ったりする可能性があります。私たちの役員、高級管理者、株主、知的財産権、雇用事項、および私たちの製品の安全性または有効性に関するクレームを含むかもしれません。これらのクレームのいずれも、私たちをコストの高い訴訟に直面させる可能性があります。私たちは通常、多くの異なるタイプの債務をカバーするのに十分な保険があると考えていますが、私たちの保険会社は保証を拒否するかもしれません。有効なクレームを支払うための十分な資本金がないかもしれません。あるいは私たちの保険限度額は、いかなる損害賠償や和解を完全に満たすのに十分ではないかもしれません。このような状況が発生した場合、どのような報酬の支払いも、私たちの総合的な業務、キャッシュフロー、および財務状況に重大な悪影響を及ぼす可能性がある。しかも、このようなクレームは、成功するかどうかにかかわらず、私たちの名声と業務を損なう可能性がある。
第1 A項。リスク要因
私たちの普通株に投資することは高い危険と関連がある。私たちの普通株式への投資を決定する前に、以下の重大なリスクと、当社の財務諸表とその付記を含む本四半期報告書の他のすべての情報をよく考慮しなければなりません。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今知らないか、あるいは私たちが現在あまり重要ではないと思う追加のリスクと不確実性もまた私たちの業務運営を損なう可能性があります。次のいずれかのリスクが実際に発生すれば、我々の経営業績、財務状況、流動性は実質的な悪影響を受ける可能性がある。したがって、私たちの普通株の取引価格は下がるかもしれません。あなたは投資の一部または全部を失うかもしれません。わが社の業務、財務状況および経営結果は、現在知られているか未知であっても、以下に説明する要因を含むが、これらに限定されないが、いずれか1つまたは複数の要因は、過去または予想される未来、財務状況および経営結果とは大きく異なる可能性がある多くの要因の影響を受ける可能性がある。これらの要因のいずれも、すべてまたは一部は、我々の業務、見通し、財務状況、経営業績、および株価に重大かつ不利な影響を与える可能性がある。
以下の要素及びその他の要素が私たちの財務状況と経営業績に影響する要素のため、過去の財務業績は未来の業績の信頼できる指標と見なすべきではなく、投資家は歴史傾向を利用して未来の業績或いは傾向を予測すべきではない。
以下の当社の業務に関連するリスク要因の説明は、先に年報第I部第1 A項に開示された自社業務に関連するリスク要因の任意の重大な変化の説明を含み、その説明の代わりに説明する。
リスク要因の概要
36
37
私たちの財務状況と資本要求に関連するリスク
私たちは運営赤字の歴史があり、予測可能な未来に損失を被っていくと予想される。
私たちは運営赤字の歴史があるバイオ製薬会社で、予想される未来には運営赤字が続くと予想されています。バイオ製薬製品開発は投機性の強い仕事であり、大きなリスクに関連している。私たちは臨床研究、製造プロセスの開発、臨床研究のための候補製品の生産、およびこれらの業務のための販売、一般、行政支援を含む、ほとんどの財務資源を投入して、私たちの製品と候補製品を決定、獲得し、開発した。私たちの未来の純損失額は、非再現性事件、私たちの商業化努力の成功度、そして私たちの未来の支出の比率に部分的に依存するだろう。私たちの費用は大幅に増加すると予想されています
我々が発生した純損失は四半期ごとに毎年大きく変動する可能性があるため,我々の運営結果を経時的に比較することは将来の業績の良い指示ではない可能性がある。
38
製品販売から収入を作る上での私たちの経験は限られています。
私たちが製品販売から相当な収入を得る能力は、私たち単独または戦略協力パートナーと私たちの製品を商業化することに成功し、私たちの候補製品の開発を完了し、商業化に必要な規制とマーケティング承認を得る能力に依存します。私たちが製品販売(指定された患者の販売を含む)から相当な将来の収入を得ることができるかどうかは、多くの分野での成功に大きくかかっているが、これらに限定されない
もし私たちが解決できる稀な疾患患者の数が私たちが推定したほど多くなければ、規制部門が承認した適応は私たちが予想していたより狭い、あるいは競争、医師の選択、治療ガイドライン、あるいは任意の他の理由で合理的に治療を受ける人たちを縮小した場合、規制部門の承認を得ても、私たちの製品販売から大量の収入を得ることができないかもしれない。
私たちは私たちの活動に資金を提供するためにもっと多くの資金を集める必要があると予想する。この追加融資は、もし本当にあれば、受け入れ可能な条項で提供されないかもしれない。必要な時に必要な資金を得ることができなければ、私たちの製品開発努力や他の活動を延期、制限、中止させることができないかもしれません。
2023年6月30日現在、私たちの利用可能な現金、現金等価物、および売却可能な債務証券は6.184億ドルです。私たちは、私たちの製品を商業化し、すべての候補製品を開発し、規制部門の承認を得て商業化するために追加の資金が必要になると予想している。また、私たちの現在知られていない多くの要素のため、私たちの運営計画は変化する可能性があり、私たちは計画よりも早く追加資金を求める必要があるかもしれない。私たちの未来の支出需要は多くの要素に依存するだろうが、これらに限定されない
39
どんな追加的な資金調達努力も、私たちの経営陣の日常活動への関心を移す可能性があり、これは私たちの候補製品の開発や私たちの製品を商業化する能力に悪影響を及ぼすかもしれない。また、将来の融資が受け入れられる十分な額や条件で得られる保証はなく、特に全体的な経済減速と潜在的な衰退環境を含む現在のマクロ経済状況を考慮する。任意の融資条項は、私たちの株主の持株または権利に悪影響を及ぼす可能性があり、私たちが追加証券(株式または債務を問わず)、またはそのような証券を発行する可能性は、私たちの株式の市場価格の下落を招く可能性がある。追加的な株式または転換可能な証券の売却は私たちのすべての株主を希釈するだろう。もし私たちが債務を発生させると、固定支払い義務の増加を招く可能性があり、私たちは私たちが追加債務を発生させる能力の制限、私たちが知的財産権を獲得、販売する能力の制限、そして私たちの業務を展開する能力に悪影響を及ぼす可能性のある他の運営制限のようないくつかの限定的な条約に同意する必要があるかもしれない。私たちは過去に、Royalty PharmaおよびOMERSとの私たちとの取引のような特許権使用料の支払い、またはパートナー関係、戦略同盟、許可または他の手配、例えば私たちが第1の3との取引をし、資金を求めることによって、私たちのいくつかの技術または製品候補、将来の収入フロー、研究計画および他の候補製品に対する権利を放棄すること、または他の方法で私たちに不利な条項に同意することを求め、将来的に可能性があり、いずれも私たちの業務、運営結果、および将来の見通しに実質的な悪影響を及ぼす可能性がある。私たちが現在または未来の運営計画が十分な資金を持っていると思っていても、市場状況が有利であれば、あるいは特定の戦略的考慮があれば、追加の資本を求めることができるかもしれない。
また、市場状況のため、既存の現金、現金等価物、および投資の一部を得ることができない可能性がある。例えば、2023年3月10日、連邦預金保険会社(FDIC)はシリコンバレー銀行を引き継ぎ、SVBの係に任命された。また、我々ポートフォリオの一部は、金融機関の通貨市場基金と投資級社債証券からなる。2022年12月31日現在、SVBでの現金、現金等価物、有価証券の総額は1%未満であるにもかかわらず、他の銀行や金融機関が銀行システムや金融市場の財務状況に影響を与えて破産手続きや将来の倒産に入った場合(あるいは彼らがそうすることを心配している人がいる場合)、既存の現金、現金等価物、投資を得る能力が脅かされる可能性があり、私たちの投資の価値は深刻な損害を受ける可能性がある。
もし私たちが既存の現金、現金等価物および投資を得ることができない場合、および/またはタイムリーに資金を得ることができない場合、または資金を得ることができない場合、私たちは、私たちの1つまたは複数の研究開発計画や製品および任意の承認された候補製品の商業化を大幅に削減、延期、または停止することを要求されるかもしれないし、必要に応じて私たちの業務を拡大したり、他の方法で私たちのビジネスチャンスを利用することができなくなり、これは私たちの業務、財務状況、および運営結果に大きな影響を与える可能性がある。
我々の候補製品の発見と開発に関するリスク
臨床薬物開発は長い、複雑かつ高価な過程に関連し、結果は不確定であり、実質的な遅延が出現する可能性があり、早期研究の結果は未来の研究結果を予測できないかもしれない。
規制部門の許可を得て私たちの候補製品を販売する前に、私たちは広範な臨床研究を行い、候補製品の人体上の安全性と有効性を証明しなければならない。臨床テストは高価で、複雑で、時間がかかり、しかも結果は確定しない。もしあれば、どんな臨床研究も計画通りに行われるか、あるいは予定通りに完成することは保証できません。われわれは臨床現場調査員や臨床スタッフを募集して研究を行う際にも困難に直面しており,このような困難に直面し続けている可能性がある。さらに、1つまたは複数の臨床研究はテストのどの段階でも失敗する可能性があり、私たちの将来の臨床研究は成功しないかもしれない。早期臨床研究において有望な結果を示す候補製品は依然として重大な挫折を受ける可能性があり、あるいはその後の臨床研究で失敗する可能性がある。これまで臨床研究で生じてきた安全性や有効性の結果は,今後の臨床研究で類似した結果を示すことは確保されていない。また,我々はすでに報告し,われわれの臨床試験の予備的または中期的なデータを報告し続ける予定である。著者らの臨床試験の初歩的或いは中期データは患者登録の継続及び/或いはそれ以上の患者データの出現に伴い実質的に変化する可能性がある。これらのデータは、臨床的利益の初歩的な証拠を示す可能性があるが、患者の持続的な評価およびより多くの患者データの獲得に伴い、任意の治療効果が患者に対して持続的ではなく、および/または時間の経過とともに減少または完全に停止するリスクが存在する。したがって、最終データを得る前に、予備データまたは中間データを慎重に考慮すべきである。研究者が後援した研究や同情使用研究の結果は,会社が後援した研究で確認されないか,あるいは我々のプロジェクトの将来性に負の影響を与える可能性がある.また、私たちが治療を求める稀な疾患の性質を考慮して、私たちはよく新しい定義の終点を設計して、私たちの研究でテストを行い、これは研究結果を解釈する時の主観を招く可能性があり、そして監督機関が私たちの終点の有効性あるいは臨床データの解読に同意しないことを招き、それによって承認を延期または拒否する可能性がある。私たちが研究している患者の病状を考えると
40
その稀な疾患の性質のため、私たちはまたオープンラベルに基づいていくつかの研究を行うことを要求または選択される可能性がある。過去にもあり,将来的には研究期間中の複数の時点で一時的な臨床データを審査することを選択する可能性もあり,研究結果に偏りをもたらし,承認拒否につながる可能性がある。
生物製薬業界では、薬物と生物製品の臨床研究による失敗率は非常に高く、非臨床研究と初歩的な臨床研究を通過したにもかかわらず、臨床研究後期段階の候補製品は期待した安全性と有効性を示すことができないかもしれない。早期の研究で人を奮い立たせる結果を得たが、治療効果或いは不良安全性が乏しいため、生物製薬業界のいくつかの会社は高級臨床研究において重大な挫折を受けた。
成功または臨床開発の即時完了を妨げる可能性がある場合には、これらに限定されるものではない
41
非臨床と臨床開発に成功できない場合は、私たちの追加コスト、あるいは私たちの創造能力に負の影響を与える可能性がある。さらに、もし私たちが私たちの候補製品を製造または配合変更した場合、私たちの修正された候補製品を早期バージョンに関連付けるために、追加の毒理学、比較可能性、または他の研究を行う必要があるかもしれない。臨床研究遅延はまた、私たちの製品が商業的に排他的な任意の期限を短縮する可能性があり、私たちの競争相手が私たちの前に製品を市場に出すことを可能にする可能性があり、これは私たちの排他的な孤児を獲得し、私たちの候補製品を商業化することに成功する能力に負の影響を与え、私たちの業務と運営結果を損なう可能性がある。
もし私たちが発表し、予想された時間枠内で私たちの期待した開発目標を達成しなければ、私たちの製品の商業化は遅れる可能性があり、私たちの経営陣の信頼性は不利な影響を受ける可能性があり、したがって、私たちの株価は下落する可能性がある。
計画の目的で,様々な科学,臨床,法規,その他の製品開発目標の達成時期を見積もり,マイルストーンと呼ぶことがある。これらのマイルストーンは、科学研究および臨床試験の開始または完了、患者投与の時間、臨床試験データの時間、タイプまたは解像度、規制文書の提出または受け入れ、およびそのような規制文書の可能な承認を含むことができる。私たちはその中のいくつかのマイルストーンの予想時間を定期的に発表する。このようなすべてのマイルストーンは様々な仮定に基づいているが、これらのマイルストーンの実際の時間は私たちの推定とは大きく異なるかもしれない。もし私たちがこれらの公開発表のマイルストーンに達していなければ、私たちの製品の商業化は遅れる可能性があり、私たちの経営陣の信用は不利な影響を受ける可能性があるので、私たちの株価は下落する可能性があります。
我々の候補製品が研究している疾患を有する患者数が限られていることや,他の予見不可能なイベントを含む様々な要因により,我々の臨床研究に参加する患者を識別·募集することは困難であることが分かるかもしれない。患者募集の困難は我々の候補製品の臨床研究を延期または阻止する可能性がある。
患者を確定し、それを著者らの候補製品の臨床研究に参与させることは著者らの成功に非常に重要である。著者らの臨床研究の時間はある程度著者らが患者を募集して著者らの候補製品のテストに参加する速度に依存し、もし著者らが登録時に困難に直面すれば、著者らは臨床研究の遅延に遭遇する可能性がある。
私たちは現在の候補製品のすべての状況を評価することを計画しているが、珍しい遺伝病だ。そのため,臨床研究に利用できる患者池は限られている。例えば、全世界で約6000人の患者がGSDIaを患っていると推定され、DTX 401は研究中であり、もし彼らがAAVウイルスベクターに対して免疫力を持っていれば、これらの患者はすべて治療できないかもしれない。
これらの疾患のまれさに加えて、我々の臨床研究の資格基準は、患者に測定可能な特定の特徴を有すること、または彼らの疾患が十分に深刻であるか、またはそれらを研究に組み込むことができないことを保証するために、利用可能な研究参加者のプールをさらに制限するであろう。患者を探し、診断する過程は高価で時間がかかり、特に私たちが研究している稀な疾患は通常過小評価されているからである。著者らはまた、潜在患者の人口統計基準、研究された製品候補の感知リスクとメリット、潜在患者の臨床研究場所の隣接と可用性、および医師の患者紹介方法のため、十分な数の適切な患者を識別、募集し、募集することができない可能性がある。競合療法や臨床研究の有用性や有効性も登録に悪影響を及ぼす可能性がある。患者が何らかの理由で(薬物に関連する副作用のような)私たちの研究に参加したくない場合、私たちは患者を募集し、研究を行い、規制機関の許可を得た潜在的な製品のスケジュールと成功が延期または損害される可能性があり、私たちの候補製品の商業的な見通しが損なわれる可能性があり、これらの候補製品の中から製品販売を創出する能力は延期または阻止される可能性がある。私たちの臨床研究の完成を遅延することは私たちのコストを増加させ、私たちの候補製品の開発と承認過程を緩和し、そして私たちの製品販売と収入を創造する能力を危険にさらす。
42
FDAと外国機関のような規制承認過程は長く、時間がかかり、本質的に予測できない。たとえ私たちが臨床前と臨床研究で積極的な結果を得ても、もし私たちが最終的に監督部門の候補製品に対する承認を得ることができなければ、私たちの業務も深刻な損害を受けるだろう。
私たちの将来の成功は、私たちの製品を商業化し、開発し、監督部門の承認を得て、1つ以上の候補製品を商業化することに成功する能力にかかっている。FDAや同様の外国規制機関の規制承認を得るまで、私たちは私たちの候補製品をマーケティングしたり普及させたりすることは許されません。私たちが開発した3つの製品は規制部門の承認のみを得ており、私たちの既存の候補製品や将来開発を求める可能性のあるどの製品も規制部門の承認を得られないかもしれません。そのほか、監督管理機関の臨床試験要求及びこれらの監督管理機関が候補製品の安全性と有効性を決定するための標準は候補製品のタイプ、複雑性、意外性及び期待用途と市場によって大きく異なるため、著者らの遺伝子治療候補製品などの新製品候補製品の監督管理審査過程は他の候補製品よりも高価で、更に長い時間がかかる可能性があり、それによって製品審査がもっと少ない可能性がある。これまで、米国やヨーロッパで遺伝子治療製品が規制部門の承認を得たことは少ない。遺伝子治療製品開発に対する監督枠組みと監督はすでに変化し、未来に変化し続ける可能性がある。FDA内部では、生物製品の評価と研究センター(CBER)が遺伝子治療製品の監督管理を担当している。CBER内部では,遺伝子治療と関連製品の審査が細胞,組織と遺伝子治療オフィスに統合され,FDAは細胞,組織と遺伝子治療諮問委員会を設立し,その審査についてCBERにアドバイスを提供している。CBERは米国国立衛生研究院(NIH)と密接に協力している。FDAとNIHは遺伝子治療案の開発と提出に関するガイドラインを発表している。例えば,2020年1月,FDAは最終指導意見を発表し,遺伝子療法の開発,審査,承認の枠組みを述べた。最後の指導意見は,まれな疾患を含む特定疾患別の治療のための遺伝子療法の開発,遺伝子療法に関する製造や長期後続問題などに触れた。同時に、FDAは新しいガイドライン草案を発表し、FDAが孤児薬物の排他性を評価するために2種類の遺伝子治療製品を確定するための同じ或いは異なる方法を記述した;FDAは2021年9月に最終的にガイドライン草案を決定した。ヨーロッパ薬品管理局(EMA)内で、特殊な規則は遺伝子治療と関連製品に適用され、高級治療薬物製品(ATMP)と考えられているからである。ATMP法規により,高度治療委員会(CAT)はヒト用薬品委員会(CHMP)とともにATMPの評価を担当している。CHMPとCATはATMPに関するガイドラインの提供も担当しています。これらのガイドラインは、ATMPの特徴を決定するために必要な臨床前研究を含む、EMAが考慮するATMPの開発および評価に関連する要因について追加的な指導を提供する。MAAに提出すべき製造と制御情報;および患者を監視し、ATMPの長期治療効果と潜在的副作用を評価するために必要な承認後の措置。このようなガイドラインには法的拘束力がないにもかかわらず,これらのガイドラインを遵守することは候補製品の承認を得て保持するために必要であることが多い。強制的リスク管理計画またはRMPに加えて、ATMPのマーケティング許可保持者は、含まれ得る細胞または組織と接触する可能性のあるすべての物質を含むすべての個々の製品およびその開始および原材料を保証するために、調達、製造、包装、貯蔵、輸送、および使用する関連医療機関に調達、製造、包装、貯蔵、輸送および送達することができるシステムを確立し、維持しなければならない。
アメリカと他の管轄区域の監督管理許可を得るために、私たちは安全性、有効性、化学、製造と制御、臨床研究(良好な臨床実践を含む)、商業販売、定価と私たちの候補製品の流通に関する多くのと異なる要求を遵守しなければならない。たとえ私たちが一つの管轄区域で承認を得ることに成功したとしても、私たちは私たちが他のどんな管轄区でも承認されることを確実にすることはできない。さらに、候補製品の臨床開発過程において、承認政策、法規、規制機関の研究設計および/または終点に対する立場、または承認を得るために必要な臨床データのタイプおよび数が変化する可能性があり、これは、承認の遅延または承認申請の不承認の決定をもたらす可能性がある。承認過程で規制機関とのコミュニケーションも予測できない;承認過程の早期に良好なコミュニケーションを行うことは承認を確保することはできないが、早期に行われた不利なコミュニケーションは承認を拒否する保証はない。私たちの候補製品の申請は規制部門の承認を得られないかもしれないし、多くの理由で規制部門の承認を遅らせる可能性がありますが、以下の理由に限定されません
43
さらに、私たちが評価している疾患状態は、通常、承認および/または検証されていない結果測定のための明確な規制経路を有していない。この場合、規制当局と密接に協力して承認経路を定義し、結果測定基準を開発計画の一部としなければならない可能性がある。また,我々が対象としている多くの疾患状態は本質的に高度な異質性であり,潜在的療法の治療的利益を決定する能力に影響する可能性がある。
この長く不確実な承認過程、および臨床および非臨床研究の予測不可能性は、規制部門の任意の候補製品の上場承認を得ることができない、あるいは規制部門の承認を遅らせることができない可能性がある。
私たちの候補製品については、承認されれば、迅速なチャネル、突破療法、優先審査または再生医学高度療法(RMAT)、FDAの指定、またはEMAの優先薬物計画(Prime)へのアクセスは、より速い開発または規制審査または承認過程をもたらすことができず、私たちの候補製品が発売承認される可能性も増加しないかもしれない。
“プロジェクト1.企業-政府規制”または私たちの年間報告書に記載されているように、臨床試験結果がサポートされている場合、私たちの候補製品のために、迅速なチャネル、画期的な治療指定、RMAT指定、最適プランアクセス、または優先審査指定を求めることができます。快速チャネル製品、突破療法、RMAT、Prime或いは優先審査製品に指定されている製品は関連する監督管理機関が自ら決定する。したがって,我々の候補製品の1つが高速チャネル製品,ブレークスルー,RMAT,Primeまたは優先審査製品として指定された基準に適合していると考えても,この機関は同意しない可能性があり,このような指定を行わないことにした。従来の規制手続きに従って承認を考慮した薬物と比較して、候補製品のこのような指定を受けても、より速い開発過程、審査または承認を招くことはなく、最終的に規制当局の承認を得ることも保証されない。また,迅速チャネル製品や画期的な療法については,FDAは今後,これらの製品が高速チャネル製品,RMATまたは画期的療法の資格条件を満たしていないこと,あるいは製品を優先的に審査することに対して,FDAの審査や承認の時間を短縮しないことを決定する可能性がある。また,EMAのPrime指定については,Prime資格は製品承認の基準を変更することはなく,このような指定や資格が迅速な審査や承認につながることも保証されない.
FDA稀な小児科疾患優先審査証明書計画またはPRV証明書計画は、優先審査証明書またはPRVを特定の標準に適合する稀な小児科製品応用のスポンサーに付与する。この計画によれば、まれな小児科疾患製品の承認(適用される法規によって決定される)を取得した会社は、異なる製品の後続のマーケティング申請の優先審査を得るためにPRVを償還する資格がある可能性がある。PRVは同社が第三者に販売することもできる。我々は、2018年にPRVクーポン計画に従ってMepseviiおよびCrysvitaの承認に関するPRVを受け取り、その後、この2つのPRVをPRV 1台あたりの平均金額1.053億ドルで第三者に販売した。現在のPRVクーポン券は、FDAが2024年9月30日までにFDAが候補製品のまれな小児科疾患の指定を受けた場合にのみ、PRV製品申請を付与することができるように日没する予定であり、FDAは2026年9月30日以降にPRVの付与を停止する。現在のPRVクーポン計画の延長は国会の承認が待たれており、この計画が延長されるかどうかは定かではない。もし私たちの合格候補製品が現在の承認締め切り後にFDA承認を得た場合、私たちは私たちの候補製品のために追加のPRVを得る資格がないので、私たちはこれらのPRVを私たちの別の計画の優先審査や販売に使用することができなくなり、このような販売はかなりの収益をもたらす可能性があります。
44
私たちの候補製品は、不良な副作用を引き起こす可能性があり、またはその規制承認を遅延または阻止し、承認ラベルの商業イメージを制限するか、または上場承認後の重大な負の結果をもたらす可能性がある(ある場合)特性を有する可能性がある。
私たちの候補製品によって引き起こされる副作用は、私たちまたは規制機関の臨床研究の中断、延期または停止、またはさらなる開発をもたらす可能性があり、より厳しいラベル、FDA、または他の同様の外国機関の規制承認遅延または拒否、またはリスク評価および緩和戦略(REMS)計画をもたらす可能性があり、患者、制限配布、医療提供者のコミュニケーション計画、および/または安全使用を確保するための他の要素に配布するために、そのような副作用のリスクを概説する薬物ガイドラインが含まれている可能性がある。私たちの候補製品は開発中で、安全状況はまだ確立されていない。さらに、第1段階および/または第2段階臨床試験の目標の1つは、研究参加者に安全に提供できる最高用量の治療を決定することであるため、いくつかの研究では、投与レジメンの変更により、重篤な副作用を含む副作用が発生しており、将来の研究で発生する可能性がある。我々の研究者または研究者が後援した試験結果は、これらまたは他の副作用の重症度および流行度を明らかにする可能性があり、これは受け入れられない。この場合、私たちの研究は一時停止または終了される可能性があり、FDAまたは同様の外国規制機関は、任意のまたはすべての目標適応のさらなる開発を停止するように命令するか、または私たちの候補製品の承認を拒否または撤回することができる。
さらに、私たちは以前または将来、私たちの候補製品に対して規制承認を行ったにもかかわらず、もし私たちまたは他の人が後にこのような製品による不良副作用を発見すれば、多くの潜在的な重大な負の結果を招く可能性があるが、これらに限定されない
これらの事件のいずれも、承認されれば、特定の候補製品に対する市場受容度を達成または維持することを阻止することができる。
遺伝子治療候補製品に関連する臨床試験中の深刻な不良事件は著者らの候補製品に対する公衆の安全性に対する見方を損なう可能性があり、政府の監督管理を増加させ、そして候補製品の監督管理の許可或いは業務を展開する能力に不利な影響を与える。
遺伝子治療はまだ新しい技術である。公衆の認知は遺伝子療法が安全でないという説の影響を受ける可能性があり,遺伝子療法は公衆や医学界の受け入れを得られない可能性がある。例えば、AAV 8ベクター(我々の遺伝子治療候補製品で使用されている用量よりもはるかに高い用量にもかかわらず)および他のベクターを使用するいくつかの遺伝子治療試験は、白血病および死亡例を含むいくつかのよく知られている有害事象をもたらす。癌や死亡のリスクは依然として遺伝子治療の問題であり,我々の計画や将来のどの臨床研究においてもこのようなことは起こらないことを保証することはできない。また,遺伝物質や遺伝物質を携帯するための製品の他の成分の持続的生物活性により,遺伝子治療製品に接触した後に不良事象を遅延させる潜在的リスクがある。我々の臨床試験または他の遺伝子治療製品、特にAAV遺伝子治療製品の臨床試験において発生する深刻な有害事象、例えば、私たちの候補製品と同じカプシド血清型の候補遺伝子、または競争相手の製品を使用する際に発生する深刻な有害事象に基づいて、最終的に関連候補製品に起因することができなくても、それによって生じる宣伝は、政府の規制を増加させる可能性があり、私たちの候補遺伝子治療製品に対する国民の見方が不利であり、私たちの候補遺伝子治療製品をテストまたは承認する上で規制遅延が生じる可能性があり、承認された候補遺伝子治療製品に対するラベル要求がより厳しく、任意の候補遺伝子治療製品に対する需要が減少する可能性がある。
45
遺伝子治療および候補mRNA、DNAおよびsiRNA製品は、新規、複雑、高価で製造が困難である。私たちは製造問題に直面し、これらのプログラムの開発と商業化の遅延、あるいは他の方法で私たちの業務を損なう可能性があります。
我々の遺伝子治療、メッセンジャーリボ核酸、DNAおよびsiRNA候補製品を生産するための製造プロセスは斬新で複雑であり、まだ商業的に検証されていない。いくつかの要素は生産中断を招く可能性があり、設備故障、内部情報技術システム故障、監督管理検査、施設汚染、原材料不足或いは汚染、自然災害、地政学的不安定、公共事業サービス中断、人為的エラー或いはサプライヤー運営中断を含む。また、cGMP遺伝子治療、mRNA、DNAとsiRNA製造は新興業界であることから、少数のCMOは著者らの候補遺伝子治療製品を製造するために必要な経験を持っており、これらのCMOとの関係を見つけたり維持したり、専門家を招いて内部製造を行うことは困難である可能性があるため、私たちの生産能力は制限される可能性がある。
私たちの遺伝子治療、mRNA、DNA、およびsiRNA製品候補は、ほとんどの小分子薬物に必要な処理工程よりも複雑な工程を必要とする。さらに、小分子とは異なり、遺伝子治療、メッセンジャーリボ核酸、DNAおよびsiRNAのような生物候補製品の物理的および化学的性質は、通常完全には表現できない。したがって、候補完成品の分析は、候補製品がバッチ間で一致することを保証するのに十分ではないか、または予期される方法で実行されるであろう。したがって、我々は、プロセスが繰り返し実行可能であることを保証し、プロセスに従って候補製品を厳密かつ一致的に生産するために、複数のステップを用いて製造プロセスを制御する。製造過程の問題は、正常過程との微小な偏差であっても、製品欠陥或いは製造失敗を招く可能性があり、それによって大量故障、法規要求に符合しない、製品リコール、製品責任クレーム或いは在庫不足を招く。私たちは問題に直面する可能性があり、十分な数量と品質の臨床レベルの材料を得ることができず、FDA、EMA或いは他の適用される標準或いは規範を満たし、一致と受け入れ可能な生産生産量とコストを持っている。
さらに、FDA、EMA、および他の外国規制機関は、任意のロットの承認された製品のサンプルをいつでも提出し、適用試験結果を示すプロトコルを要求することができるかもしれない。場合によっては、FDA、EMA、または他の外国規制機関は、機関が発行を許可するまで大量の製品を配布しないように要求するかもしれません。製造過程中の微小な偏差は、品質属性や安定性に影響を与える偏差を含み、製品に許容できない変化を招き、大量故障や製品リコールを招く可能性がある。大量失敗や製品リコールは製品の発表や臨床試験を延期する可能性があり、これは高い代価を払わせるかもしれません。そうでなければ、私たちの業務、財務状況、運営結果、将来性を損なうことになります。
私たちの候補製品が規制部門の承認を得ても、私たちの製品は監督部門の審査を受けている。
私たちの製品と未来に承認された任意の候補製品は、生産、ラベル、包装、貯蔵、流通、広告、販売促進、サンプリング、記録保存、発売後の研究、および安全性、有効性およびその他の発売後情報を提出することを含む持続的な法規要件を遵守しなければならない。
製造業者およびメーカーの工場は、品質管理および製造手順が良好な製造規範またはGMP法規に適合することを確保することを含む、広範なFDAおよび同様の外国規制機関の要求を遵守しなければならない。したがって、私たちと私たちの契約製造業者は、GMPの遵守状況と、任意のNDA、BLA、MAA、または他の同様の申請が別の管轄区域で承認された約束の遵守状況を評価するために、持続的な審査および検査を受けなければならない。規制機関は、我々の製品、候補製品、または関連品質システムの準備に関連する製造施設が、進行中の活動に適用される法規に適合しているかどうかを随時審査または検査することができる。KKCやRegeneronのような私たちの協力者、または私たちの任意の第三者メーカーが規制適合性を維持できなかった場合、FDAまたは他の適用可能な規制機関は、臨床研究または商業販売の一時的または永久的な一時的な停止、製品のリコールまたは差し押さえ、または施設の一時的または永久的な閉鎖、または製品の承認の撤回を含む規制制裁を実施することができる。承認された製造業者の供給が規制コンプライアンスを維持できなかったために中断された場合、別のメーカーは、NDAまたはBLA補充またはMAA変更または同等の外国規制申請によって資格を得る必要があり、製品供給遅延を招く可能性がある。商業生産が新しい製造業者、材料、試験方法または基準に依存する場合、規制機関はまた追加の研究を要求する可能性がある。製造業者、材料、試験方法、または基準の交換は、巨額のコストを伴う可能性があり、私たちに必要な臨床およびビジネススケジュールの遅延をもたらす可能性があります。したがって、私たちは私たちと協力しなければならない他の人たちは製造、生産、品質管理を含むすべてのコンプライアンス分野で時間、お金、エネルギーをかけ続ける必要がある。
46
私たちの候補製品のために得られた任意の規制承認は、その製品が発売される可能性のある承認指示用途の制限または他の承認条件によって制限される可能性があり、または第4段階の臨床研究、および候補製品の安全性および有効性を監視するモニタリングを含む可能性の高い上場後テスト要件を含む可能性がある。我々も市販後の臨床研究を要求され、一般的あるいは特定の患者亜群における我々の製品の安全性と有効性を検証することができる。最初の上場承認が承認の加速または条件付きマーケティング許可経路によって得られた場合、私たちは私たちの製品の臨床効果を確認するために、成功した発売後の臨床研究を行うことを要求されるだろう。成功しなかった上場後の研究やこのような研究が完成できなかったことは、上場承認の撤回につながる可能性がある。私たちはFDAと似たような外国の規制機関に特定の不良事件と製造問題を報告することを要求されるだろう。承認されたNDA、BLA、MAA、または他の同様の出願の保持者は、新しいまたは追加の出願を提出し、承認された製品、製品ラベル、または製造プロセスのいくつかの変更の承認を得なければならない。
もし私たちが適用された規制要件を遵守できなかった場合、あるいは製品に安全や効果の問題がある場合、規制機関や法執行機関は他の措置をとる可能性がある
政府は違法の疑いのあるいかなる調査にも対応するために多くの時間と資源を必要とする可能性があり、否定的な宣伝が生じる可能性がある。現行の法規の要求を守らないいかなる行為も、私たちの製品の商業化と創造能力に重大な悪影響を及ぼす可能性がある。規制制裁を実施したり、規制承認を撤回したりすれば、わが社の価値と私たちの経営業績は悪影響を受けるだろう。
私たちに対する製品責任訴訟は、私たちが重大な責任を負うことになり、私たちが承認した製品や候補製品の商業化を制限する可能性があります。
我々は,人体臨床試験で承認された製品や候補製品を試験することに関する固有製品責任リスクと,現在および将来の製品の商業化に関するリスクに直面している。もし私たちが自分自身を弁護することに成功できなければ、私たちの任意の承認された製品や候補製品がダメージを与えたと主張すれば、私たちは重大な責任を招くかもしれない。私たちの製品責任保険は現在あるいは計画されている臨床計画によって十分であることは保証できません。この保険は合計1,500万ドルの保険を提供します。私たちは責任による損失から私たちを守るために、合理的な費用あるいは十分な金額で保険範囲を維持することができないかもしれません。あるいは損失は私たちが加入した保険金額を超える可能性があります。私たちに提出された製品責任クレームや一連のクレームは私たちの株価を下落させる可能性があり、私たちの保険範囲を超えていると判断すれば、私たちの運営と業務結果に悪影響を及ぼす可能性があります。また、是非曲直や最終結果にかかわらず、製品責任クレームは、私たちの商業的名声の損傷、臨床研究参加者の脱退、関連訴訟によるコスト、管理層の私たちの主要業務に対する注意力の分散、監督管理機関の調査、患者や他のクレーム者が巨額のお金の奨励を得ること、私たちの候補製品を商業化することができず、商業販売への使用が許可された場合、私たちの候補製品に対する需要は減少する可能性がある。
有効なバイオマーカーを識別、探し、開発できない場合、あるいは私たちの協力者が候補製品の開発と商業化に診断を伴うことに成功しなかったり、その過程で大きな遅延があったりすれば、私たちの候補製品のすべての商業的潜在力を実現できないかもしれない。
私たちは、私たちのいくつかの候補製品のために適切な患者を決定し、治療反応を監視するためのセットの診断テストを開発している。場合によっては、いくつかの候補製品を商業化するために、セット診断として診断テストを開発し、規制承認を得る必要があるかもしれない。私たちは現在、バイオマーカーを使用して、私たちのいくつかの候補製品のために適切な患者を識別し続ける予定である。私たちは未来に予測性バイオマーカーを開発する必要があるかもしれない。現在または未来の潜在的バイオマーカーが実際に予測可能であることが証明され、確実に測定されるか、またはFDAまたは他の規制機関によって有効性の測定基準として受け入れられることは保証されない。また、著者らの成功はセット診断技術の開発と商業化にある程度依存する可能性がある。FDAは開発を要求すると予想しています
47
そして監督部門は私たちの遺伝子治療製品の候補製品を承認する条件としてセット診断テストを許可した。これまで,業界全体でこれらのタイプの開発や商業化に伴う診断の成功は限られていた。セット診断の開発と製造は複雑であり、必要な専門知識と能力を持つメーカーは限られている。セット診断プログラムの開発に成功しても、候補製品と一緒に使用するために、コスト、ロット、スケジュールで診断プログラムを生産することができない可能性があります。成功するために、私たちはいくつかの科学、技術、そして後方勤務の挑戦を解決しなければならない。我々は現在,第三者と連携して診断プログラムを開発しているが,診断プログラムの開発や商業化にはほとんど経験がなく,最終的には市場で承認された任意の候補製品とペアリングするために適切な診断プログラムの開発や商業化に成功しない可能性がある.我々は第三者に依存して我々の生物分析分析,セット診断とキー試薬の生産を自動化,定性化と検証した。
セット診断は医療機器としてFDAや米国以外の同様の規制機関の規制を受けており,商業化前に規制部門の承認や承認が必要である。米国では、診断に伴う診断は、FDAの510(K)上場前通知または発売前承認またはPMAプロセスによって承認または承認される。開発中の市場承認政策の変更、追加法規または法規の変更、または各提出された510(K)販売前通知、PMAまたは米国以外の司法管轄区の同等の申請タイプの規制審査の変更は、申請の承認、承認または拒否の遅延を招く可能性がある。我々の開発と商業化診断における限られた経験から,一部または全部を第三者に依存したセット診断設計と商業化を行う予定である。著者らと著者らの協力者は、選択性/特異性、分析検証、再現性或いは臨床検証に関連する問題を含む、セット診断の承認或いは許可を開発と獲得する上で困難に直面する可能性がある。私たちまたは私たちの協力者は、規制機関のセット診断の承認を開発または獲得する上で、いかなる遅延や失敗も、私たちの候補製品の承認を延期または阻止する可能性があります。
私たちの第三者への依存に関するリスクは
私たちは第三者に依存して私たちの非臨床と臨床研究を行い、他の任務を実行してくれます。もしこれらの第三者がその契約責任を成功的に履行できず、予想された期限までに規制要求を達成したり、遵守したりすることができなければ、私たちは品質不良と名声被害のリスクに直面する可能性があり、私たちは規制部門の候補製品の承認を得られないか、商業化できない可能性があり、私たちの業務は深刻な損害を受ける可能性がある。
我々はCRO,協力パートナー,独立した調査者を含む第三者に依存し続け,我々が行っている非臨床·臨床プロジェクトのデータを分析,収集,監視,管理することを計画してきた。私たちは第三者に依存して私たちの非臨床と臨床研究を実行し、完成したコストと努力の見積もりに依存して、私たちは彼らの活動のいくつかの側面だけを制御します。我々と我々のCROおよび他のサプライヤーおよびパートナーは、GMP、GCP、GLPを遵守しなければならない。これらは、FDA、欧州経済圏加盟国の主管当局、および同様の外国規制機関が、私たちが開発しているすべての製品に対して実行されている法規およびガイドラインである。規制機関は、研究スポンサー、主要調査者、研究場所、その他の請負業者を定期的に検査することで、これらの規定を実行する。私たちまたは私たちの任意のCROまたは他のサプライヤーおよびパートナーが、臨床研究を行う場所を含めて、適用された法規を遵守できなかった場合、私たちの非臨床および臨床研究で生成されたデータは信頼できないと考えられる可能性があり、FDA、EMAまたは同様の外国の規制機関は、承認を拒否する可能性があり、および/または、私たちのマーケティング申請を承認する前に追加の非臨床および臨床研究を行うことを要求する可能性があり、これは承認プロセスを延期するであろう。特定の規制機関の検査後、この規制機関は、私たちの任意の臨床研究がGCP規定に適合しているか、あるいは非臨床研究がGLP規定に適合していることを確認することは保証できない。また,われわれの臨床研究はGMP法規下で生産された製品を用いて行わなければならない。もし規制機関が私たちがGLP、GMP、またはGCP法規を遵守できないと判断した場合、彼らは私たちの候補製品の承認を拒否する可能性があり、および/または臨床研究または非臨床研究を繰り返すことを要求する可能性があり、これは規制承認過程を延期するだろう。
私たちのCROと他のサプライヤーやパートナーは私たちの従業員ではなく、私たちが行っている非臨床·臨床プロジェクトに十分な時間と資源を投入しているかどうかを制御することができません。私たちがこのような第三者との合意に基づいて、限られた救済措置を得ることができます。もし私たちのサプライヤーとパートナーがその契約の義務または義務を成功裏に履行できなかった場合、または予想された最終期限内に完了できなかった場合、もし彼らが交換する必要がある場合、または彼らが得たデータの品質や正確性が私たちの方案、法規の要求、または他の理由に従わなかった場合、私たちの臨床研究は延長、遅延、または終了される可能性があり、私たちは規制部門の私たちの候補製品の承認または商業化に成功することができないかもしれない。CROおよび他のサプライヤーおよびパートナーは、作業範囲の変化または他の理由により、予想よりも高いコストを生じる可能性がある。したがって、私たちの候補製品のビジネス見通しは損なわれ、私たちのコストは増加するかもしれないし、私たちの収入を作る能力は延期されるかもしれない。
48
もし私たちがこれらの第三者との任意の関係が終わったら、私たちは他のサプライヤーと手配したり、商業的に合理的な条項でそうすることができないかもしれない。より多くのサプライヤーを交換または増加させることは、追加コストに関連し、管理時間と重点を必要とする。しかも、新しい供給者たちが仕事を始める時、自然な過渡期もある。したがって,遅延が生じる可能性があり,期待される臨床開発スケジュールを満たす能力に実質的な影響を与える可能性がある。私たちはサプライヤーやパートナーとの関係を管理するために努力しているが、将来的に類似した挑戦や遅延に遭遇しない保証はなく、これらの遅延や挑戦が私たちの業務、財務状況、および業務の将来性に実質的な悪影響を与えないことを保証することはできない。
私たちはまた、患者の診断と患者の識別を支援し、私たちの財務および法律部門を支援し、私たちの業務に他の資源を提供することを含む第三者に依存しています。これらの第三者を使用することは、品質不良、予想締め切りを逃し、適用法律を遵守しないリスクに直面する可能性があり、これらはすべて私たちの名声を損なわせ、私たちの業務にマイナスの影響を与える可能性があります。
私たちはKKCがすべての主要市場にCrysvitaの臨床と商業供給を提供し、いくつかの主要市場でCrysvitaを開発と商業化することに依存しているが、KKCはこれらの市場に十分なCrysvitaを提供できなかったり、Crysvitaを商業化したりすることができず、私たちの業務と運営業績に重大な悪影響を与える可能性がある。
KKCと私たちが合意した合意によると、KKCはCrysvitaをヨーロッパで、いくつかの特定の時間に米国、カナダ、トルコで商業化する唯一の権利を持っているが、いくつかの権利を保持しなければならない。KKCとのパートナーシップは成功しないかもしれませんが、以下のような重要な要素を含むが、以下のような重要な要素を含むが、このようなパートナーシップの期待的な利点を実現できない可能性がある
私たちは第三者に依存して私たちの製品と候補製品を製造し、私たちは大量の製造リスクに直面しています。そのいずれも私たちのコストを大幅に増加させ、私たちの製品と候補製品の供給を制限する可能性があります。
私たちは現在、私たちの製品と大多数の臨床あるいは商業規模の候補製品を生産するための資源と能力が不足しているため、私たちは第三者に依存して私たちの製品と候補製品を生産します。私たちは契約メーカーを監督していますが、契約製造パートナーの製造過程を制御することはできず、契約製造パートナーの法規要件に大きく依存しています。会いましょう“-私たちの候補製品が規制機関の承認を得ても、私たちの製品は依然として規制機関の審査を受けている以上のリスク要因。さらに私たちはメーカーに依存しています
49
第三者サプライヤーから私たちの製品と候補製品を生産するために必要な材料を調達します。私たちの薬物、プラセボまたは活性対照を生産するための原材料サプライヤーの数は限られており、私たちの製品と臨床研究のための候補製品を生産するのに必要な材料生産の中断を防止または軽減するために代替サプライヤーを探す必要があるかもしれないが、承認されれば、最終的には商業販売に使用される。私たちは製造業者がこのような原材料を買収する過程や時間についても何の統制もない。もし製品や原材料部品が私たちの品質管理標準やサプライヤーの品質管理基準を満たしていなければ、私たちも製品の供給が中断する状況に遭遇する可能性があります。
さらに、私たちの製品および候補製品を生産するメーカーは、ビジネスレベルで私たちの製品および候補製品を生産した経験がない可能性があり、利益のある商業化を支援するために必要なコスト、品質、数量、場所、時間で私たちの製品および候補製品を生産することができない可能性がある。私たちは、私たちのすべての候補製品の商業ロットの製造能力を確保しておらず、商業的に合理的な条項での商業化活動を支援するために、拘束力のある合意をメーカーと交渉できないかもしれない。我々の第三者製品メーカーが許容可能な製造プロセスを開発しても、コンプライアンス及びタイムリーな方法で必要な数量の当社製品及び候補製品を提供しても、これら第三者が製造した製品及び候補製品の供給コストが高くなり、収益性を制限することができる。例えば、KKCは私たちの商業ロットCrysvitaの唯一の供給者だ。Crysvitaのラテンアメリカでの商業販売が私たちに提供する供給価格と、米国およびカナダでの商業販売の移転価格は、2022年12月31日までの純売上高の35%であり、その後30%であり、これは珍しい疾患に集中している会社の典型的な販売コストよりも高い。
私たちの製品と候補製品の製造過程は複雑で厳格に規制されており、以下のリスクを含むが、以下のリスクを含むいくつかのリスクの影響を受けている。
私たちの製品と候補製品の製造運営に影響を与える不利な発展は、出荷遅延、在庫不足、ロット故障、撤回またはリコール、または私たちの製品と候補製品供給の他の中断を招く可能性があります。それらの開発段階、小ロット需要および量産運転の頻度が低いため、私たちの製品と候補製品のために携帯する安全在庫数は限られている。我々は、将来的には、規格に適合していない製品や候補製品の在庫抹消を要求され、他の費用や費用を発生させ、高価な救済努力を行ったり、より高価な製造代替案を求めたりすることも可能である。
50
私たちの製品の薬物物質と薬品そして私たちの候補製品の大部分は現在単一源のサプライヤーから得られています。これらの供給者を失ったり、彼らは私たちに必要な薬物や薬品を供給することができなくて、私たちの業務に実質的な悪影響を与えるかもしれません。
私たちの製品と候補製品の大部分の薬物と薬品は単一源から得られた。もし単一ソースサプライヤーが私たちとの合意に違反したり、当方が約束を破ったために合意を終了したり、他の理由でその供給義務を履行できなくなったりした場合、合格した代替サプライヤーが見つかるまで、製品または候補製品を製造して流通することができなくなり、製品を商業化したり、候補製品の開発を延期したりすることが深刻に弱まる可能性がある。例えば,CrysvitaとEvkeezaの薬物物質と薬物製品はそれぞれKKCが許可と協力プロトコルおよびRegeneronにより供給プロトコルによって製造されている。Mepseviiのための医薬物質および医薬製品は、現在、商業供給およびサービスプロトコル、付随する調達注文、および他のプロトコルに従ってRentschlerによって生産されている。Dojolviのための医薬物質は、IOI Oleoから供給プロトコルに従って製造され、Dojolviのための医薬製品は、ホストサービスプロトコルに従ってHaupt Pharma AGから調製される。単一由来の供給者たちはまた私たちの遺伝子治療計画に使用されている。2023年第1四半期、Haupt PharmaはDojolvi医薬製品を生産するドイツWolfrathhausenの工場を2023年末に閉鎖することを発表した。したがって、私たちは代替サプライヤーの資格を探して決定し、そのサプライヤーに活動を移すことを要求されている。Dojolvi薬物製品または私たちの他の任意の薬物物質および医薬製品のために代替源を識別および同定することは保証されず、これらの源との関係を確立することは、私たちの製品の商業化や私たちの候補製品の開発の重大な費用や遅延を引き起こさない。しかも、私たちは商業的に合理的な条項や代替供給業者と供給計画を達成できないかもしれない。どんな新しい協定の条項もまた私たちが現在のサプライヤーとの条項よりも安くて高いかもしれない。私たちの製品の商業化を延期したり、私たちの候補製品の開発を延期したり、他の第三者と新しい合意を締結しなければなりません。条項は既存のサプライヤーよりも悪く、私たちの業務に重大な悪影響を及ぼす可能性があります。
ディーラーや専門薬局の行動は、私たちが製品を販売したり、マーケティングしたりする利益のある能力に影響を及ぼすかもしれない。このような流通業者および専門薬局の購入または流通モードの変動は、私たちの収入、財務状況、または運営結果に悪影響を及ぼす可能性がある。
私たちの相当部分の製品販売は商業流通業者と専門薬局に依存しており、これらの販売は少数の流通業者と専門薬局に集中している。どちらの財政的失敗も私たちの収入、財務状況、または経営結果に悪影響を及ぼす可能性がある。私たちの収入、財務状況、あるいは経営結果もこのような流通業者と専門薬局の購入或いは流通モードの変動の影響を受ける可能性があります。これらの変動は、季節的、価格設定、卸売在庫目標、または他の要因による可能性がある。
51
私たちの製品や候補製品の商業化に関連するリスク
もし私たちの製品と候補製品の市場機会が私たちが思っているより小さいなら、私たちの収入は不利な影響を受けるかもしれません。私たちの業務は影響を受けるかもしれません。私たちの製品と候補製品の目標患者数は少ないが、潜在的な患者数はもっと少ないかもしれないため、私たちは患者の識別に成功し、著しい市場シェアを獲得し、利益と成長を実現することができなければならない。
私たちはまれで極端な遺伝性疾患の治療の研究と製品開発に集中している。我々の目標疾患を有する患者数が少ないことから,これらのまれで極端な遺伝性疾患を有する患者の識別に成功し続けており,我々の成長と収益性に重要である。私たちの現在のいくつかの製品や臨床計画はまたより深刻な病気を患っている患者に最も適しているかもしれない。例えば,成人はXLH患者の大多数を占めているが,通常はあまり深刻ではない疾患を有しており,子供人口ではなく成人人口におけるCrysvitaの浸透率を低下させる可能性がある。私たちが対象とする疾患の全体的な稀さを考慮すると、より深刻な形態、または私たちの製品および候補製品解決に最も適している可能性がある他の患者亜群の流行の程度を予測することは困難であり、これは、アドレス指定可能な患者集団をさらに一部に制限する可能性がある。これらの疾患に罹患している人の数の予測と、私たちの製品および候補製品の治療から利益を得る可能性があるこれらの疾患患者のサブセットは、私たちの信念と推定に基づいている。これらの推定は,科学文献,診療所調査,患者基礎あるいは市場研究を含む様々な源から来ており,不正確であることが証明されている可能性がある。また、新しい研究はこれらの疾病の推定発病率或いは流行率を変える可能性がある。患者数は予想より少ないかもしれない。我々が治療を求めている疾患を識別する患者の努力はまだ早期段階であり,治療が得られる可能性のある患者数を正確に予測することはできない。さらに、私たちの各製品および候補製品の潜在的にアドレス指定可能な患者集団は限られているかもしれないし、または私たちの製品および候補製品の治療を受け入れられない可能性があり、新しい患者はますます識別または接触が困難になっている可能性がある。また、私たちの製品や候補製品がかなりの市場シェアを獲得していても、潜在的なターゲット層が非常に少ないため、利益を上げたり、利益を維持したりすることはなく、私たちの業務を維持するのに十分な収入増加を生じることはありません。
私たちは激しい競争と迅速な技術変革に直面しており、私たちの競争相手は私たちと似た、より先進的、あるいはより効果的な治療法を開発するかもしれません。これは私たちの財務状況と候補製品を商業化することに成功した能力に悪影響を及ぼすかもしれません。
生物技術と製薬業界の競争は激しく、迅速で重大な技術変革の影響を受けている。私たちは現在、様々な既存の治療法が私たちの製品や候補製品と競争する可能性があることを認識している。私たちの年報の“プロジェクト1.ビジネス競争”を参照してください。
私たちはアメリカと国際に競争相手がいて、大型多国籍製薬会社、専門製薬会社、バイオテクノロジー会社、スタートアップ会社、学術研究機関、政府機関、公共と個人研究機関を含みます。私たちの多くの競争相手は、より多くの研究開発者と経験豊富なマーケティングと製造組織のような、より多くの財務、技術、および他の資源を持っている。バイオテクノロジーと製薬産業のより多くの合併と買収は、私たちの競争相手により多くの資源を集中させるかもしれない。したがって、これらの会社が規制承認を受ける速度は私たちよりも速いかもしれませんし、彼らの製品を販売し、マーケティングする上でも効果的かもしれません。規模が小さいか早い段階にある会社も重要な競争相手になる可能性があり、特に大手老舗会社との協力で手配されている。技術の商業適用性の進歩やこれらの業界に投資する資本の増加により、競争はさらに激化する可能性がある。私たちの競争相手は独占に基づいて開発、買収に成功するかもしれないし、私たちが開発する可能性のある任意の候補製品よりも効果的またはコストの低い製品、あるいは私たちよりも早く特許保護、規制承認、製品商業化、市場浸透を実現することができるかもしれない。また、私たちの競争相手が開発した技術は私たちの潜在的な製品と候補製品を経済的あるいは時代遅れにする可能性があり、私たちは競争相手に対して私たちの製品と候補製品をマーケティングすることに成功できないかもしれません。
52
私たちは統合された商業組織を設立することを含めて、私たちの組織の拡張を効果的に管理できないかもしれない。既存の商業インフラを拡大したり、第三者と合意したりすることができなければ、必要に応じて私たちの製品や候補製品をマーケティングして販売することができなければ、収入を増やすことができないかもしれません。
私たちは、私たちの開発と商業化計画と戦略を支援するために、より多くの管理、運営、マーケティング、財務、法律、その他の資源が必要だと予想しています。我々の製品および我々の開発計画が生成する可能性のある任意の他の製品または第三者から取得または許可された任意の他の製品の商業化に成功するために、私たちは北米、ヨーロッパ、ラテンアメリカ、アジア太平洋地域で私たちの商業インフラを建設し、拡大している。このインフラは技術専門のオフィスチームと現場チームからなり,我々の開発計画による他製品の潜在承認日が近づくにつれて,このインフラは拡大するであろう。私たちの経営陣は私たちの日常活動から過度な注意を移し、これらの成長活動を管理するために多くの時間を投入する必要があるかもしれない。私たちは私たちの業務拡張を効果的に管理できないかもしれません。これは私たちのインフラが弱く、運営ミス、ビジネス機会の喪失、従業員の流失、余剰従業員の生産性の低下を招く可能性があります。私たちの予想成長は大量の資本支出を必要とし、より多くの候補製品を開発するなど、他のプロジェクトから財務資源を移転する可能性がある。私たちの経営陣が私たちの成長を効果的に管理できなければ、私たちの費用は予想以上に増加する可能性があり、私たちの収入を創出および/または増加させる能力は低下する可能性があり、私たちは私たちの業務戦略を実施できないかもしれない。私たちの将来の財務業績と私たちが候補製品を商業化し、効果的に競争する能力は、私たちが未来のどんな成長を効果的に管理する能力にある程度依存するだろう。
会社として、私たちは最近私たちの製品を販売してマーケティングした経験が限られていて、私たちの一部の従業員だけが他の会社に雇われた時に他の類似製品を普及させた経験があります。私たちの商業化製品の数量と範囲の増加に伴い、販売プロセスや戦略に追加の複雑さが遭遇する可能性があり、特定の製品の販売やマーケティングのために十分な資源を割り当てることが困難になる可能性がある。また、私たちがより多くの製品を発売したり、私たちの製品に対する需要が変化したりするにつれて、私たちの必要な現場部隊の規模の初歩的な推定は、私たちの候補製品を効果的に商業化するために必要な現場部隊の規模よりも大きくまたは下回る可能性がある。したがって、私たちは、私たちの製品や候補製品の商業化を十分に支援するために、より大きなチームを雇用する必要があるかもしれません。そうでなければ、ビジネスマンの採用を最適化しようと努力する過程で追加のコストが発生する可能性があります。いくつかの地理市場については、現地でのマーケティングと流通能力を利用するために他の実体と協力するかもしれませんが、もしあれば、割引条項でこのような合意に到達できないかもしれません。もし私たちの未来のパートナーが十分な資源を投入して私たちの未来の製品を商業化しなければ(もしあれば)、私たちは必要なマーケティング能力を自ら開発することができなければ、私たちは私たちの業務を維持するために十分な製品販売を生成することができないだろう。私たちは現在広く資金の豊富なマーケティングや販売業務を持っている会社と競争しているかもしれない。重要なビジネス機能を果たすための巨大な内部チームや第三者の支援がなければ、これらのより成熟した会社との競争に成功できない可能性がある。
私たちはアメリカとカナダでCrysvitaを推進する独占的な権利をKKCに戻した。
KKCとの協力·許可協定の条項、または協力協定によれば、指定された期間内に米国とカナダまたは利益共有地域でCrysvitaを普及させる権利があり、KCは2023年4月の移行日まで製品の普及にますます参加することになる。移行日には,Crysvitaの利益共有地域における商業化責任がKKCに移行し,KKCは地域における製品の商業化責任を担っている。2022年9月には、改正案に規定された制限や条件を満たした場合、2024年4月までKKCの米国におけるビジネス分野での活動を支援する権利があることを認可する協力協定修正案に署名した。したがって、KKCは、2024年4月まで、修正案に規定されている制限や条件に制限されるまで、コスト分担手配によりビジネス分野やマーケティング努力を支援していきます。2024年4月以降、米国でCrysvitaを普及させる権利は医学遺伝学者に限られ、利益共有分野でCrysvitaを普及させることに関連する費用を独自に負担する。移行日は2023年4月に発生しているが、移行に関する継続的な責任があり、経営陣の注意をそらす可能性がある。このような移行活動で、私たちはまた思わぬ困難に直面したり、予期しない費用を発生させるかもしれない。また、2024年4月以降、北米での野戦部隊や香港の商業インフラの他の側面を支援するのに十分な商業活動があることは保証できません。私たちはこの不確実性のために、私たちの野戦チームのメンバーを維持することができないかもしれません。KKCとの協力は職責のシームレスな移行、商業的成功を招くことはないかもしれない
53
その他にも、移行日後のCrysvitaの利益共有分野における地位は、KKCの努力と資源配分に依存する。
いかなる現在または未来の製品の商業成功は医師、患者、第三者支払人、および医学界の他の人の市場に対する受け入れの程度に依存する。
FDAと同様の外国の監督管理機関の必要な承認を得ても、私たちの現在と未来の製品の商業成功は医学界、患者、支払人が私たちの現在と未来の製品を受け入れているかどうかにある程度依存し、医療に有用で、費用効果が高く、安全である。私たちが市場に発売したどの製品も医者、患者、支払人、医学界の他の人の市場受け入れを得ることができないかもしれない。市場が私たちの現在と未来のどの製品に対する受け入れ度は多くの要素に依存するだろう
1種の潜在的な製品が非臨床と臨床研究において良好な治療効果と安全性を示しても、市場のこの製品に対する受容度はそれが発売されてから完全に知ることができる。医学界や支払人に候補製品のメリットを知ってもらうために努力しており,これには大量の資源が必要であり,決して成功しない可能性がある。もし私たちが現在と未来の製品が医者、患者、支払人、医学界の他の人の十分な受け入れを得ることができなければ、私たちは利益を達成または維持するのに十分な収入を生むことができないだろう。
新たに承認された製品の保険カバー範囲と精算状況はまだ確定していない。新製品や既存製品のために十分な保険や精算を得ることができない場合、これらの製品をマーケティングする能力を制限し、収入を創出する能力を低下させる可能性があります。
私たちの目標患者数は少ないので、私たちの製品と候補製品が承認されれば、その定価、カバー範囲、精算は私たちの商業インフラをサポートするのに十分でなければならない。私たちの一人当たりの価格は私たちの開発と製造コストを回収し、利益を達成するのに十分でなければならない。遺伝子治療製品が規制部門の承認を得た場合,例えば我々が開発している製品は,1回の投与コストが膨大になると予想される。したがって,承認されれば,政府や個人支払者が提供する保険および補償の利用可能性および十分性は,大多数の患者に我々のような高価な治療を支払うことに重要である。私たちの製品と候補製品の販売は、承認されれば、国内外の医療保健、管理性医療、薬局福祉、類似医療管理組織がそのコストを支払う程度、あるいは政府当局、個人健康保険会社、その他の支払人が精算する程度に大きく依存する。保険や精算を提供しない場合は、限られたレベルに限られている場合や、タイムリーに提供できない場合には、承認されれば、当社の製品や候補製品を商業化することに成功できない可能性があります。例えば、一部のラテンアメリカ諸国やトルコ地域で悪化している経済条件や政治的不安定は、製品精算の承認を得る上で大きな遅延を招き続け、これらの地域での製品商業化スケジュールに影響を与えている。保険を提供しても、承認された精算金額は、企業全体の価格を維持するのに十分な価格を確立したり維持したりするのに十分ではないかもしれません。また、私たちが製品を販売して実際に料率を交渉する準備ができるまで、私たちは販売率を知らない。
54
新たに承認された製品の保険カバーと精算に関する不確実性が大きい。アメリカでは、医療保険と医療補助サービスセンター(CMS)はアメリカの衛生と公衆サービス部の一つの機関であり、それがどの程度新薬が連邦医療保険の下でカバーと精算されるかどうかを決定する。個人支払者はCMSが確立した保険精算政策に大きく従う傾向がある。CMSあるいは個人支払人が私たちの製品、特に私たちの遺伝子治療製品の候補製品の精算についてどのような決定を下すかを予測することは困難である。遺伝子治療製品の既定のやり方と前例が限られているからである。
アメリカ以外では、国際運営は通常広範な政府価格制御と他の市場監督管理を受けており、私たちはヨーロッパ、カナダ、その他の国のコスト制御措置に対する日々の重視は私たちの製品と候補製品の定価と使用に圧力を与えると信じている。多くの国では、国家衛生システムの一部として、医療製品の価格は異なる価格制御メカニズムの制約を受けている。他の国は会社が自ら医薬製品を価格設定することを許可しているが、会社の利益を監督し、コントロールしている。追加の外国価格規制や定価規制の他の変化は、私たちの候補製品に受け取ることができる費用を制限するかもしれません。そのため、米国以外の市場では、米国に比べてわが製品の精算が減少する可能性があり、商業的に合理的な収入や利益を生み出すには不十分である可能性がある。どの国でも交渉プロセスが完了する時期は非常に不確定であり、米国以外のいくつかの国では、交渉プロセスが数ヶ月を超えると予想される。交渉によって価格を達成することができても、時間の経過とともに、各国はトレーサビリティのある“回収”値下げを含めて価格や他の譲歩を要求したり、要求したりすることが多い。さらに、EU加盟国は定期的に薬品に対して、大量割引、コスト上限、回収、および予想される治療期間の期間内に無料製品を提供するなど、新しいまたは追加のコスト制御措置を実施する。例えば、フランスでは、私たちは現在の規制、Dojolviを承認する際の価格の推定、および他の要因に基づいてDojolviの回収埋蔵量を推定する。しかし、定価が承認されたレベルが予想を下回った場合、または規制枠組みがさらに変化した場合、私たちは引戻し準備金よりも高い金額を返済し、以前に記録された収入を逆転させる必要があるかもしれない。
また、米国や海外の政府や第三者支払者が医療コストの制限や低減に力を入れていることは、これらの組織が新製品の保証範囲や精算レベルを制限する可能性があるため、私たちの製品や候補製品に十分な支払いを提供できない可能性がある。私たちは、管理型医療の傾向、ヘルスケア組織の日々の影響力、追加的な立法変化(2022年のインフレ削減法案の影響を含む)、民選当局者の声明により、どの製品や候補製品の販売も価格設定圧力に直面すると予想している。例えば、米国の薬品価格を他国のコストとリンクさせる提案が検討されており、米国のいくつかの州は、その製品の価格が合理的であることを証明するために、製薬会社にそのコストを開示することを立法している。薬品の価格設定はまだ現大統領政府と議会の重点になると予想される。医療費は全体的に下振れ圧力,特に処方薬,外科手術,その他の治療における下振れ圧力が非常に大きくなっている。そのため、新製品の参入にはますます高い壁が設けられている。
私たちの知的財産権に関するリスクは
もし私たちの製品、候補製品、あるいは未来の候補製品の有効な特許権を獲得して維持できなければ、私たちは私たちの市場で効果的に競争することができないかもしれません。
私たちは特許、商業秘密保護、および秘密協定の組み合わせによって、私たちの技術、私たちの製品、および私たちの候補製品に関連する知的財産権を保護します。私たちの成功は、私たちと私たちの許可者がアメリカと他の国/地域で私たちの独自技術、私たちの製品、および私たちの候補製品について特許および他の知的財産権保護を獲得し、維持する能力に大きく依存している。
私たちは、私たちの新技術、製品、および候補製品に関連する特許出願をアメリカと海外に提出することで、私たちの独自の地位を保護しようとしています。これらの技術、製品、および候補製品は私たちの業務に非常に重要です。この過程は高価で時間がかかり、私たちはすべての必要または望ましい特許出願を合理的なコストまたはタイムリーに提出して起訴することができないかもしれない。我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.
55
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、その法律原則はまだ解決されていない。私たちが所有しているまたは許可されている特許出願は、発行された特許を生成できない可能性があり、その権利要件は、米国または他の国/地域における私たちの製品または候補製品をカバーする。私たちの特許および特許出願に関連するすべての潜在的に関連する既存技術が発見されたことは保証されず、これは、特許を無効にするか、または係属中の特許出願から特許が発行されることを阻止する可能性がある。第三者は、発行された特許の任意の有効性、実行可能性、または範囲に疑問を提起することができ、これは、そのような特許の範囲が縮小され、強制的に実行できない、または無効になる可能性がある。また、私たちが所有または許可している特許や特許出願が挑戦されていなくても、それらは私たちの知的財産権を十分に保護し、私たちの製品や候補製品に排他性を提供したり、私たちの声明をめぐる他の人の設計を阻止したりすることができないかもしれない。このような結果のいずれも、私たちが第三者からの競争を阻止する能力を弱める可能性がある。
私たちは独立して、または私たちの許可者と共に複数の特許出願を提出しました。私たちの製品または候補製品の様々な側面をカバーしています。私たちは、どのような特許が発行されるか(あれば)、任意のそのような特許の広さ、または発行された任意の特許が無効であることが発見されるか、実行不可能であるか、または第三者によって脅かされるかどうかを保証することはできない。これらの特許に対するいかなる成功反対も、私たちの製品の独占的な地位を損なうことや、承認された候補製品の商業化に成功するために必要な権利を奪う可能性がある。また、規制承認に遅延が生じた場合、特許保護の下で候補製品を販売する期間が短縮される可能性があります。
私たちの現在の特許または応用は、使用方法およびいくつかの物質成分を含み、すべての地域で私たちの製品および候補製品に完全な特許保護を提供することはできない。例えば、ラテンアメリカでは、私たちはこのような製品を商業化する権利があるが、Crysvita物質組成をカバーする特許は発行されていない。したがって、競合他社は、ラテンアメリカでの潜在的な商業化は、私たちに付与された任意の知的財産権または規制排他性に依存する、同じ抗体または同様の抗体、およびFGF 23のための他の方法を開発することができる。もし私たちが私たちの製品や候補製品の有効な特許権を獲得して保持できなければ、効果的な競争ができないかもしれません。私たちの業務と運営結果は損なわれます。
私たちは私たちの製品と業務を効果的に保護するための十分な特許条項を持っていないかもしれない。
特許の寿命は限られている。アメリカでは、特許の自然消滅は一般的にその有効出願日の20年後だ。様々な延期がある可能性があるにもかかわらず、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許を取得しても、製品の特許有効期限が満了すると、模倣薬や生物類似薬からの競争に直面する可能性がある。
米国“ハッジ·ワックスマン法案”および欧州補充保護証明書の特許期間延長によると、我々の製品や候補製品の特許専有期間を延長することができない可能性があり、このような特許期間を延長する保証はなく、取得された場合、どのくらい延長されるかは保証されない。また,適用の最終期限内に出願を提出できなかった場合,関連特許の満了前に出願を提出できなかった場合,または適用の要求を満たしていなかった場合には,延期が得られない可能性がある.しかも、延期の長さは私たちが要求したものより短いかもしれない。もし私たちが私たちの製品を保護するために十分な特許条項や規制排他性がなければ、私たちの業務と運営結果は不利な影響を受けるかもしれない。
特許政策や規則の変化は、私たちの特許出願をめぐる起訴や、私たちが発表した特許の実行または保護の不確実性とコストを増加させる可能性があります。
米国や他の国の特許法や特許法解釈の変化は,我々の特許の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。外国の法律は、米国の法律のように私たちの権利を保護しないかもしれない。科学文献に発表された発見は、実際の発見よりも遅れがちであり、米国および他の司法管轄区の特許出願は、通常、出願後18ヶ月後に公表されるか、または場合によっては全く公表されない。したがって、私たちまたは私たちの許可者が、私たちの所有および許可中の特許または係属中の特許または係属中の発明の保護を要求した最初の人であるか、または私たちまたは私たちの許可者が、そのような発明のために特許を保護した最初の人であることを確認することはできない。
2011年、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名され、米国特許出願の起訴と米国特許への挑戦手続きが大きく改革された。法律の進化の性質や裁判所システムの審査や解釈に関する長いスケジュールのため、これらの変化の影響はまだ不明である。しかし、Leahy-Smith法案とその実施は、私たちの特許出願をめぐる起訴と、私たちが発行した特許の実行または保護の不確実性とコストを増加させる可能性があり、これらはすべて私たちの業務と財務状況に大きな悪影響を及ぼす可能性がある。
56
もし私たちが私たちの製品、候補製品、または未来の候補製品に対して有効な独占権を維持できなければ、私たちは私たちの市場で効果的に競争することができないかもしれない。
特許提供の保護に加えて、我々は、特許を出願できない独自技術、特許を実施することが困難な方法、および我々の製品の任意の他の要素、または特許がカバーされていない独自技術、情報または技術に関する製品候補発見および開発プロセスを保護するために、商業秘密保護および秘密協定に依存する。しかし、商業秘密は保護するのが難しいかもしれない。当社の従業員、コンサルタント、科学コンサルタント、請負業者、および他の第三者と締結されたセキュリティ協定は、当社のノウハウおよびプロセスを保護するのに十分ではない可能性があり、これらの合意は、私たちのノウハウおよびプロセスを保護するのに十分ではない可能性があり、そのようなビジネス秘密が、私たちの競争相手に知られているか、または意図せずに他社技術に組み込まれる可能性があるリスクを増加させる可能性がある。
我々の場所の実体セキュリティおよび我々情報技術システムの実体と電子セキュリティは,我々のデータやビジネス秘密の完全性やセキュリティを保護しない可能性がある.このような個人、組織、そしてシステム、合意、またはセキュリティ措置は違反される可能性があり、私たちはどんな違反にも対応するための十分な救済措置を持っていないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。
私たちが従業員やコンサルタントと締結した譲渡協定は、彼らの発明を私たちに譲渡し、私たちが従業員、コンサルタント、コンサルタント、および私たちのノウハウ、情報、または技術にアクセスできる第三者と締結した秘密協定は適切に実行されていない可能性があり、私たちのビジネス秘密や他の機密固有情報が漏洩しないこと、または私たちの競争相手が他の方法で私たちのビジネス秘密や独立開発と実質的に同じ情報および技術を獲得しないことを保証することはできません。私たちのビジネス秘密を流用したり不正に開示したりすることは、私たちの競争地位を損なう可能性があり、私たちの業務に実質的な悪影響を及ぼす可能性があります。また,我々のビジネス秘密を守るための手順が不十分であると考えられれば,第三者による商業秘密の流用に対抗する十分な追跡権がない可能性がある.
知的財産権侵害のクレームは私たちの開発と商業化努力を阻害したり延期したりする可能性がある。
私たちのビジネス成功は私たちが他人の特許と独自の権利を侵害することを避けることにある程度かかっている。バイオテクノロジーおよび製薬業界では、特許侵害訴訟、介入、当事者間の審査、許可後審査、反対および再審手続きを含む特許および他の知的財産権に関する訴訟および他の手続きが多く、米国特許商標局(USPTO)および対応する外国特許庁に提出されている。我々が候補製品を開発する分野には,他の当事者が所有する米国や外国から発行される特許や係属中の特許出願が多く存在する.バイオテクノロジーや製薬業界の拡張や特許の発行に伴い、我々の製品や候補製品がこれらの他の側の特許権を侵害している疑いを受けるリスクが増加する可能性がある。
他の当事者たちは私たちが彼らの独自技術を無許可で使用したと断言するかもしれない。我々の製品または候補製品の使用または製造に関連する特許または特許出願が存在する可能性があり、これらの特許または特許出願は、材料、配合、製造方法または治療方法を必要とする。私たちは私たちの製品と私たちのいくつかの候補製品だけを自由に操作分析したので、他のすべての特許が私たちのすべての候補製品を商業化する能力を損なうかどうかはわかりません。私たちはまた、私たちのいかなる分析も完全で完全であることを保証することはできず、私たちがアメリカと海外が私たちの製品や候補製品の商業化に関連しているか、または必要なすべての特許と保留出願を決定したことを確実にすることはできない。特許出願は、発行するのに数年の時間を要する可能性があるので、現在処理されている特許出願が存在する可能性があり、これらの出願は、今後、我々の製品または候補製品に関連する発行された特許をもたらす可能性がある。
私たちは、第三者が所有するいくつかの米国および外国特許が、裁判所が、私たちの1つまたは複数の候補遺伝子治療製品、その製造または送達のために使用される可能性のある方法、または1つまたは複数の私たちの候補遺伝子治療製品を含むいくつかの処方に対して有効かつ関連していると解釈する可能性があることを知っている。第三者が所有するいくつかの米国および外国特許は、核酸を含む脂質粒子または特定のmRNA修飾に関連しており、裁判所はそれを有効と解釈し、UX 053に関連する可能性があることも知られている。これらの第三者のうちの1つまたは複数は、強制執行または他の方法で彼らの特許権を主張するために、私たちと訴訟を行うことを選択する可能性があるというリスクがある。このような主張に法的根拠がないと考えても、管轄権のある裁判所は、これらの特許のうちの1つまたは複数が有効で、強制的に実行可能であり、侵害されていると判断することができ、この場合、どのような特許の所有者も、適用される特許によって許可されているか、またはこれらの特許が満了するまで、候補製品を商業化する能力を阻止することができるかもしれない。しかし、そのような許可は商業的に合理的な条項や全く存在しないかもしれない。
57
我々にクレームをつけた当事者は、禁止または他の公平な救済を受ける可能性があり、これは、私たちの製品を商業化し続けることを効果的に阻止したり、私たちの1つまたは複数の候補製品を開発して商業化することを阻止することができるかもしれない。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、当社の業務における従業員資源を大量に移転することになる。もし私たちに対する侵害クレームが成功した場合、私たちは故意に侵害された3倍の損害賠償金と弁護士費、特許権使用料の支払い、私たちの侵害製品の再設計、または第三者から1つ以上の許可を得ることを含む大量の損害賠償を支払わなければならないかもしれないし、多くの時間とお金の支出が必要かもしれない。
私たちは買収と許可を通じて私たちの候補製品に必要な権利を獲得したり維持することができないかもしれない。
私たちの手続きは第三者が持っている独占権を使用する必要があるかもしれないので、私たちの業務の成長は、私たちがこれらの独占権を取得、許可、または使用する能力にある程度依存するかもしれない。例えば、私たちの候補製品は、効率的かつ効率的に動作するために特定の配合物を必要とする場合があり、これらの配合物の権利は他の人によって保持されている可能性がある。私たちは、私たちの候補製品にとって必要と考えられる任意の成分、使用方法、プロセス、または他の第三者知的財産権を第三者から得ることができないかもしれません。第三者知的財産権の許可·買収は競争分野であり、一部のより成熟した企業も魅力的と考えられる第三者知的財産権許可または買収戦略を求めている。これらの老舗会社は私たちより競争優位があるかもしれません。それらの規模、現金資源及びもっと強い臨床開発と商業化能力のためです。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資が適切な見返りを得るための条項の許可や第三者知的財産権を得ることができないかもしれない。
我々は米国や外国の学術機関と協力し,これらの機関との書面合意に基づいて,われわれの臨床前研究や開発を加速することがある。一般に、これらの機関は、協力によって得られた任意の技術的権利の許可を交渉するためのオプションを提供してくれる。このようなオプションにかかわらず、私たちは指定された時間範囲内でまたは私たちが許容できる条項の下でライセンスを交渉することができないかもしれない。もし私たちがそれができなければ、その機関は知的財産権を他の側に提供するかもしれないし、私たちの計画を実行し続けることを阻止するかもしれない。
もし私たちが必要な第三者知的財産権を成功させたり、私たちの既存の知的財産権を維持することができなければ、私たちはそれに応じたプログラムの開発を放棄しなければならないかもしれない。
私たちは生物模倣薬からの競争に直面するかもしれませんが、これは私たちの生物製品と候補製品の将来のビジネス見通しに実質的な悪影響を及ぼすかもしれません。
私たちが規制部門の承認を得ることに成功しても、私たちの競争相手よりも早く候補製品を商業化しても、私たちは私たちの生物製品(Crysvita、Mepsevii、Evkeeza)と私たちの生物製品候補物の面で生物模倣薬からの競争に直面する可能性がある。米国では、2009年の“生物製品価格競争と革新法案”、あるいはBPCI法案と呼ばれ、“平価医療法案”に組み込まれ、FDAが承認した生物製品と“高度に似ている”あるいは“交換可能”が証明された生物製品に短い承認ルートを開いた。BPCI法案は、参照製品が許可されてから12年後まで、FDAがブランド生物製品を参照する生物類似または交換可能な製品を承認することを禁止するが、基準製品が初めて許可された4年後に生物学的類似または交換可能な製品の申請をFDAに提出することを可能にする。BPCI法案は、他の会社が革新製品と高度に似た製品を開発し、自分のデータを生成し、承認を求めることを阻止しない。この法律は複雑であり、FDAはまだ説明して施行している。したがって、その最終的な影響、実施、そして意味には不確実性がある。Bpci法案の改正,あるいはFDAのbpci法案の解釈や実施の変更は,我々のバイオ製品や候補製品の将来のビジネス見通しに重大な悪影響を及ぼす可能性がある。
ヨーロッパでは、欧州委員会は過去数年間に発表された生物類似承認に関する一般的かつ特定の製品カテゴリに関するガイドラインに基づいて、いくつかの生物模倣薬のマーケティング許可を承認した。ヨーロッパでは、競争相手は革新的な生物製品の承認を支持するデータを参考にすることができるが、革新製品が承認されてから10年以内に市場に参入することができる。この10年前の8年前に、マーケティング許可者が承認され、1つまたは複数の新しい治療適応が承認され、既存の療法と比較して有意な臨床的利益をもたらす場合、この10年間の市場排出期間は11年に延長される。また、会社は他の国で生体模倣薬を開発し、私たちの製品と競争するかもしれない。
もし競争相手が私たちの製品を参照する生物模倣薬のマーケティング許可を得ることができれば、私たちの製品はこのような生物模倣薬の競争を受ける可能性があり、それに伴い競争圧力と結果がある。
58
競争相手は模造版のDojolviや私たちの小分子候補製品で市場に参入する可能性があり、影響を受けた製品の売上が大幅に低下する可能性がある。
ハッジ·ワックスマン法案によると、製薬メーカーは、短い新薬申請、またはANDAを提出し、承認された革新者製品の模造薬を求めることができる。ハッジ·ワックスマン法によれば、製造業者は、以前に承認された薬物の安全性および有効性の発見に言及した第505条(B)(2)条に基づいてNDAを提出することもできる。505(B)(2)セキュリティプロトコル製品は、元のイノベーター製品の新しいバージョンまたは改善されたバージョンであってもよい。革新的な小分子薬物は、特定の規制排除期間(例えば、新しい化学物質が5年であり、新しい臨床研究が必要な承認された薬物の変更が3年、孤児薬が7年)に適合する可能性があり、これは、FDAが承認できない(または場合によっては、FDAが提出および審査する)ANDAまたは505(B)(2)NDAは、革新薬物に対するFDAの安全性および有効性の発見に依存する。排他的な利点を規制することに加えて、イノベーターNDA保有者は、その薬剤の有効成分、製品調製、または承認用途を主張する特許を有している可能性があり、これらの特許は、製品と共に“オレンジブック”に記載されている。Orange Bookに記載されている特許がある場合は,特許が満了する前にその製品の販売を求める非特許出願人は,ANDAまたは505(B)(2)にいわゆる“第4段落認証”を含まなければならず,列挙された1つ以上の特許の有効性または実行可能性に疑問を提起し,または侵害がないと主張しなければならない。認証通知はイノベーターにも発行されなければならず,イノベーティブが通知を受けてから45日以内に訴訟を提起し,その特許の強制執行を要求した場合,ANDAの承認は30ヶ月間停止されるか,または裁判所によって延長または短縮される.
したがって、競合他社は、我々の小分子製品Dojolviの模倣バージョンまたはDojolviの505(B)(2)NDAを参照してANDAを申請することができる。オレンジブックにDojolviに記載されている特許の場合、これらのANDAおよび505(B)(2)NDAは、各リストされた特許に関する証明を含むことを要求され、ANDA出願人がその特許に挑戦することを意図しているかどうかを示す。私たちはどのような模倣薬の競争相手がこのような特許をどのように処理するか、私たちはこのような特許について訴訟を提起するか、あるいはそのような訴訟の結果をどのように処理するかを予測することができない。
私たちが開発または許可した製品と技術については、私たちは独自の特許保護を取得したり維持することができないかもしれない。また,オレンジブックに並ぶ任意の特許が第4段落認証とその後の訴訟で挑戦に成功すれば,影響を受けた製品はより直接的に後発薬競争に直面する可能性があり,その売上は大幅に低下する可能性がある。売上高が低下すれば、影響を受けた製品に関連する無形資産の一部または全部を解約しなければならないかもしれません。私たちの運営業績とキャッシュフローは重大な悪影響を受ける可能性があります。
私たちのいくつかの製品と候補製品の特許保護と特許起訴は第三者に依存している。
私たちは通常、私たちの製品または候補製品に関連する特許を完全に起訴する権利を求めて獲得しているが、時々私たちの製品または候補製品に関連する特許は私たちの許可者によって制御される可能性がある。私たちとKKCとRegeneronの許可協定はこの場合であり、彼らは主にCrysvitaとEvkeezaのいくつかの特許と特許出願の起訴をカバーする責任がある。
さらに、ペンシルバニア大学が所有する我々のDTX 301、DTX 401および/またはUX 701候補製品に関連する様々な特許および特許出願を許可した。その中のいくつかの特許と特許出願はRegenxbioまたはReGenXによって許可または再許可され、再許可されている。私たちはこのような特許出願の起訴やこのような特許の維持を統制する権利がない。また,ReGenXとの合意によると,我々はライセンス特許を強制的に実行する優先権を持っておらず,我々の強制実行権はいくつかの制限を受けており,ライセンス特許を用いて他の競合製品の商業化を排除する能力に悪影響を与える可能性がある.また,ReGenXとペンシルバニア大学は,このような特許を強制的に実行するかどうかを決定し,どのような方法でこのような特許を強制するかを決定する点で,我々の利益とは異なる可能性がある.
Arcturusが所有しているUX 053で使用されているカチオン性脂質に関するライセンス内特許および特許出願も有している。私たちはこのような特許出願の起訴やこのような特許の維持を統制する権利がない。さらに、Arcturusとの合意によると、私たちはこれらの特許を強制的に実行する優先権を持っておらず、私たちの強制執行権はいくつかの制限を受けており、これは、他の競合製品の商業化の能力を排除するためにこれらの許可特許を使用することに悪影響を及ぼす可能性がある。また,このような特許を強制的に実行するかどうかを決定する上で,Arcturusは我々の利益とは異なる可能性がある.
KKC、Regeneron、ペンシルバニア大学、ReGenX、Arcturus、または私たちの将来の任意の許可パートナーが、私たちの任意の製品または候補製品の特許を適切に起訴、維持し、特許保護を行うことができない場合、私たちがこれらの製品または候補製品を開発し、商業化する能力は悪影響を受ける可能性があり、私たちは競争相手が競合製品を製造、使用、販売することを阻止できないかもしれない。さらに、私たちが今、第三者から許可された特許および特許出願の特許起訴を制御する権利があっても、私たちは、特許起訴を制御する前の私たちの許可者およびその弁護士の行動または不作為の悪影響または損害を受ける可能性がある。
59
もし私たちが合意における私たちの義務を履行できなかった場合、私たちはこれらの合意に従って第三者から知的財産権や他の権利を許可したり、許可者との業務関係が妨害されたりすると、私たちは私たちの業務に非常に重要な許可権を失うかもしれません。
私たちは、私たちの業務に非常に重要な知的財産権ライセンス協定の多くの締約国であり、将来的により多くのライセンス契約を締結したいと思っています。私たちの既存のライセンス契約は、様々な職務調査、マイルストーン支払い、印税、その他の義務を負うことを要求しており、将来のライセンス契約もそうなると予想されています。もし私たちがこれらの合意の義務を履行できなかった場合、あるいは私たちが破産に直面した場合、私たちは許可側に何らかのお金を支払うことを要求される可能性があり、私たちは許可の排他性を失う可能性があり、あるいは許可側が許可を終了する権利がある可能性があり、この場合、私たちは許可がカバーする製品を開発または販売することができないだろう。さらに、このようなライセンスに関連したマイルストーンと他の支払いは、私たちが開発した候補製品の利益を減少させるだろう。
場合によっては、私たちは許可技術によって作られた特許の起訴を統制する。もし私たちがこのような起訴に関連したいかなる義務にも違反したら、私たちは私たちの許可パートナーに重大な責任を負うかもしれない。知的財産権許可は複雑な法律、商業、そして科学的な問題に関する私たちの業務に重要だ。ライセンス契約によると、知的財産権に関する紛争が発生する可能性がありますが、これらに限定されません
私たちが許可している知的財産権と他の権利に関する紛争が、許容可能な条項で現在の許可スケジュールを維持する能力を阻害したり弱体化したりすれば、影響を受けた候補製品の開発に成功し、商業化することができないかもしれない。
私たちは、私たちの特許が人かもしれない特許を保護または強制する訴訟に巻き込まれるか、または私たちの特許または他の知的財産権の発明権または所有権に挑戦するクレームに巻き込まれる可能性があり、これは高価で時間がかかり、不利な結果をもたらす可能性がある。
競争相手は私たちの特許や私たちの許可側の特許を侵害するかもしれない。もし私たちまたは私たちの許可パートナーのうちの1つが第三者に対して法的訴訟を提起して、私たちの製品または候補製品をカバーする特許を強制的に執行する場合、被告は私たちの製品または候補製品をカバーする特許を無効および/または強制的に執行できないと反訴することができる。米国の特許訴訟では、被告が無効および/または実行不可能と主張する反訴はありふれている。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.法的に無効と実行不可能と断言された後の結果は予測できない。
“Leahy-Smith Act”によれば、我々の特許または特許出願または我々の許可者の発明に関連する発明の優先度を決定するために、第三者によって提起されるか、またはUSPTOによって宣言または提起された干渉プログラムまたは派生プログラムが必要である可能性がある。不利な結果は、私たちが関連技術の使用を停止することを要求するか、または勝利者から許可を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条件で私たちにライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。さらに、我々の特許の有効性は、新しいライセンス後のプログラムのうちの1つを介して米国特許商標局で疑問を提起することができる(すべての人の間の審査または支出後審査)は、“ライシー·スミス法案”によって取得されるようになりました。私たちは“ライシー·スミス法案”による訴訟、介入訴訟、または支出後の訴訟の弁護に失敗する可能性があり、成功しても巨額のコストを招き、我々の経営陣や他の従業員の注意を分散させる可能性がある。
私たちは将来、元従業員、協力者、または他の第三者が発明者または共同発明者として私たちの特許に権利を持っているというクレームを受けるかもしれない。また、私たちの候補製品の開発に参加したコンサルタントや他の人の義務紛争によって所有権紛争が生じる可能性があります。訴訟は、これらと他の挑戦在庫または所有権のクレームに対抗するために必要かもしれない。もし私たちがこのような訴訟やクレームに対して抗弁することに成功できなければ、金銭損害賠償を支払う以外に、貴重な知的財産権、例えば貴重な知的財産権の独占所有権や使用権を失う可能性がある。
60
私たちがこのような訴訟やクレームを弁護することに成功しても、このような訴訟は巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性がある。知的財産権訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報は訴訟中の開示によって漏洩される可能性がある。公聴会、動議、または他の一時的手続きの結果、またはそのような訴訟またはクレームに関連する事態の発展も公表される可能性がある。もし証券アナリストや投資家がこれらの結果がマイナスだと思っていれば、私たちの普通株の価格に実質的な悪影響を及ぼす可能性がある。
私たちは、私たちの従業員、コンサルタント、または独立請負業者が第三者の機密情報を誤って使用または開示したか、または私たちの従業員がその前の雇用主によって言われた商業機密を誤って使用または開示したという疑惑の影響を受けるかもしれない。
私たちが雇用している一部の人は以前、私たちの競争相手や潜在的な競争相手を含む大学や他のバイオテクノロジーや製薬会社に雇われていた。私たちは、従業員、コンサルタント、独立請負業者を検討し、私たちのために働いているときに他人のノウハウやノウハウを使用する努力が成功しない可能性があり、将来的には、従業員、コンサルタント、または独立請負業者が第三者の機密情報を誤って使用したり、漏洩したりするというクレームを受ける可能性があります。もし私たちがこのようなクレームを弁護することができなければ、金銭損害賠償の支払いに加えて、貴重な知的財産権や人員を失う可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
米国特許法の変化は特許の全体的な価値を低下させ、製品を保護する能力を弱める可能性がある。
他のバイオテクノロジーや製薬会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存している。バイオテクノロジーおよび製薬業界で特許を取得して実施することは、技術的な複雑さと、法律的な複雑さとも関連する。したがって、そのような特許を取得して実施することは高価で時間がかかり、本質的に不確実である。また、米国は最近、広範囲な特許改革立法を公布し、実施している。米国最高裁判所の最近の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。また,最近では米国や他の国の特許法をより多く改正することが提案されており,採択されれば,我々のノウハウのために特許保護を受ける能力,あるいは我々のノウハウを実行する能力に影響を与える可能性がある。米国議会、米国裁判所、米国特許商標局、および他の国の関連立法機関の将来の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それによって、私たちが新しい特許を獲得したり、私たちの既存の特許と将来獲得可能な特許を実行する能力を弱める可能性がある。
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
世界のすべての国/地域で私たちの製品や候補製品の申請、起訴、特許保護の費用は目を引くほど高くなり、私たちのアメリカ以外のいくつかの国での知的財産権は米国の知的財産権が広くない可能性がある。また、一部の外国の国の法律は知的財産権の保護の程度は米国の連邦や州法に及ばない。また、KCやRegeneronなどの許可パートナーは、私たちが商業権利を獲得する可能性のある司法管轄区で特許を起訴することはできず、これらの国で後で特許保護を受ける可能性が排除されるかもしれない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して彼ら自身の製品を開発することができ、私たちの特許保護を持っている地域に侵害製品を輸出することもできますが、法執行力はアメリカほど強くありません。これらの製品は私たちの製品と競争する可能性があり、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止することができないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許、商業秘密、および他の知的財産権保護、特にバイオテクノロジー製品に関する保護の実行に賛成しておらず、これは、私たちの特許の侵害を阻止したり、私たちの専有権を侵害する方法で競争製品をマーケティングすることを困難にするかもしれない。外国の管轄区域で私たちの特許権の訴訟を強制的に執行することは、成功するかどうかにかかわらず、巨額のコストを招き、業務の他の方面への私たちの努力と注意を移動させる可能性があり、私たちの特許が無効または偏狭に解釈されるリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。
61
私たちの業務運営に関するリスク
自分の製造施設を運営する会社として、私たちは経験がなく、思わぬコストや挑戦に出会うかもしれません。
2023年第2四半期、マサチューセッツ州ベッドフォードにある遺伝子治療製造工場の建設を完了しました。しかし、会社として、私たちは自分の製造施設を運営した経験がなく、特に私たちが製造業務を開始したときに工場がいつでも十分に利用される保証はありません。私たちはその施設を運営するための巨額の費用と費用を負担し続けるつもりだ。私たちがこの施設での私たちの製造プロセスの最適化と運営を求めるにつれて、私たちは技術と科学的な挑戦と、経験豊富な合格者を採用·採用する潜在的な困難に直面する可能性があります。製造活動中に、私たちはまた予期しない技術、法規、安全、品質、あるいは操作の問題に直面する可能性がある。私たちが私たちのビジネスの足跡を複数の地域に拡張するにつれて、私たちは複数の製造施設を設立するかもしれません。これは規制の遅延やコスト高を招く可能性があります。たとえ私たちが成功しても、私たちはそのような追加生産能力が必要だという保証はなく、私たちの投資が回収されることを保証することはできない。また、私たちの製造能力はコスト超過、意外な遅延、設備故障、生産能力不足、労働力不足、自然災害、電力故障、計画失敗、実際或いは脅威の公共衛生突発事件及び多くの他の要素の影響を受ける可能性があり、これらの要素は私たちの製造戦略の期待的な利益を実現することを阻害するかもしれない。
私たちの未来の成功は私たちが創始者総裁とCEOを引き留めることができるかどうか、そして他の合格人材を誘致、維持、激励できるかどうかにある程度かかっている。
私たちはEmil D.Kakkis医学博士に依存しています。私たちの創始者社長とCEOは、彼らのサービスを失うことが私たちの目標の実現に悪影響を及ぼすかもしれません。Kakkis博士は、彼が“勝手”な従業員だから、いつでも私たちの仕事を離れることができる。私たちの業務のために他の合格した従業員、コンサルタント、コンサルタントを募集し、維持し、科学と技術者を含むことも、私たちの成功の鍵となるだろう。私たちの産業は現在熟練した人材が不足しており、この状況は続くかもしれない。そのため、技能人材に対する競争は非常に激しく、離職率が高い可能性がある。そのほか、臨床前或いは臨床研究で成功できなかったことは、合格者の採用と維持を更に挑戦的になる可能性がある。ここ数年間、私たちはまたいくつかの行政指導部の変動を経験した。指導部交代自体が管理が難しく、不確実性や混乱を招き、他のキーパーソンや従業員が離職する可能性が高まる可能性がある。合格者を募集して引き留めることができない、あるいはKakkis博士や私たちが指導チームを実行する他のメンバーや他の重要な従業員のサービスを失ったり、私たちの研究、開発、商業化目標の進展を阻害する可能性があります。
もし私たちが私たちの製品の孤児薬物の独占経営権を獲得したり維持できなければ、私たちの競争相手は同じ病気を治療する製品を販売するかもしれません。私たちの収入は減少します。
我々のビジネス戦略は,FDAとEU孤児薬物指定資格に適合した薬物の開発に焦点を当てている。米国では,孤児薬物指定は,臨床研究費に贈与資金を提供する機会,税収割引,ユーザ費用減免など,一方が財政的インセンティブを得る権利がある。さらに、1つの製品が孤児指定の適応を有するFDAの最初の承認を得た場合、この製品は、孤児薬物に対する排他性を得る権利があり、これは、FDAが7年以内に他の出願を承認することができず、限られた場合、例えば孤児に対する排他的製品に対する臨床的優位性を示すか、または製造業者が十分な製品数を保証できない限り、同じ適応下で同じ薬剤を販売することを意味する。EUでは,孤児薬物指定は,費用の低減や費用の免除,薬物や生物製品の承認後10年の市場排他性など,一方が財政的インセンティブを得る権利がある。孤児薬物指定基準に適合しなくなり、製品の利益が十分に高く、市場排他性を維持するのが合理的であることを証明するのに不十分であれば、この期間は6年に短縮される。
我々の製品の特許保護範囲や範囲は場合によっては限られている可能性があるため,孤児薬物名を得ることができる製品にとっては,孤児薬物を指定することが特に重要である。条件に適合した薬物については,“孤児薬物法”下の専営期に依存して競争地位を維持する予定である。もし私たちの薬物製品と広範な特許保護されていない生物製品が孤児薬物独占経営権を獲得していなければ、私たちの競争相手は私たちが孤児薬物独占経営権を獲得するよりも早く同じ薬物を販売して同じ病気を治療することができ、私たちの収入は減少するだろう。
62
米国には脂肪酸酸化障害を治療するDojolviの孤児薬物名があり、ヨーロッパにはLC−FAODの様々なサブタイプを治療する孤児薬物名があり、米国およびヨーロッパにはCrysvita、Mepsevii、DTX 301、DTX 401およびUX 701の孤児薬物名があるにもかかわらず、医薬品開発に関連する不確実性のため、市場で承認された最初の特定の孤児薬ではないかもしれない。また、異なる活性部分を有する異なる薬剤が同じ条件のために承認されることができるか、または同じ薬剤が異なる適応のために承認されることができるので、異なる活性部分を有する異なる薬物の排他性が得られても、このような承認された新しい化学物質の排他性を阻止するような他の排他性がない限り、このような排他性は、製品の孤立薬物排他性を獲得しても、そのような排他性から製品を効果的に保護することができない可能性がある。孤児薬物が承認された後であっても、FDAまたはEMAが、後の薬剤がより安全で、より効果的であると結論した場合、FDAまたはEMAは、その後、同じ疾患に対して同じ活性部分を有する同じ薬剤を承認することができる。孤児薬物を指定することは薬物の開発時間や監督審査時間を短縮することもなく、監督審査或いは承認過程において薬物にいかなる利点をもたらすこともない。
もし私たちの無形資産が減少すれば、私たちの経営業績は不利な影響を受けるだろう。
我々は2017年11月にDimension Treateutics,Inc.またはDimensionを買収したため,DTX 301やDTX 401に関連して行われている研究開発やIPR&Dの無形資産を統合貸借対照表に記録した.私たちはまたRegeneronからEvkeezaのために私たちのライセンスに関連した無形資産を記録した。私たちは第4四半期に毎年無形資産の減値をテストし、イベントや状況の変化が資産がより減値する可能性があることを示すならば、無形資産の減値をより頻繁にテストする。関連する研究開発作業が放棄され、関連資産がログアウトされれば、私たちの簡明な総合経営報告書に非現金減価損失を記録します。私たちは2023年6月30日まで無形資産に関連した減値を記録していない。
他の候補製品を決定、許可、発見、開発、または商業化するための努力は成功しないかもしれない。
私たちの業務の成功は、他の候補製品を識別、許可、発見、開発または商業化する能力、および私たちの既存の候補製品の持続的な臨床試験、潜在的な承認、商業化にかかっている。新製品候補製品を識別·開発する研究プロジェクト、例えばArcturusと協力するプロジェクトは、大量の技術、財政、人的資源を必要とする。私たちは最終的に成功しないことが証明された潜在的な計画や製品候補に私たちの努力と資源を集中させるかもしれない。私たちの研究計画や許可は、臨床開発と商業化のための候補製品をもっと作ることができないかもしれません
上記のいずれかの事件が発生した場合、1つまたは複数の計画のための開発作業を放棄することを余儀なくされる可能性があり、または、他の候補製品を識別、許可、発見、開発、または商業化することができない可能性があり、これは、私たちの業務に重大な悪影響を与え、運営を停止させる可能性があります。
私たちは、より利益的または成功可能性の高い製品、候補製品、または適応を利用することなく、特定の製品、候補製品、または適応を追求するために限られた資源を費やす可能性がある。
63
私たちの財務と管理資源が限られているので、私たちは販売、マーケティング、研究計画をいくつかの製品、候補製品、あるいは特定の適応に集中します。したがって、私たちは他の製品や候補製品または他の後により大きな商業潜在力を持つことが証明された兆候を追求する機会を放棄または延期するかもしれない。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。私たちの現在と未来の研究開発計画と候補製品への支出はいかなる商業的に実行可能な製品も発生しないかもしれない。特定の製品や候補製品の商業的潜在力や目標市場を正確に評価していなければ、独占開発と商業化の権利を保持することが有利な場合には、協力、許可、または他の特許権使用料手配によって貴重な権利を放棄するか、またはある治療分野の候補製品に内部資源を割り当て、その分野で協力計画を達成することが有利になるかもしれない。
医療およびFDAの法律、法規、政策の変化は、私たちの業務や運営結果に実質的な悪影響を及ぼす可能性がある。
我々の年間報告書の“プロジェクト1.企業-政府規制”と“新承認製品の保険カバー範囲と精算状況が不確定”と題するリスク要因で述べられているように、医療コストを制御するための複数の立法措置が継続され、薬品や生物製品の監督管理が改正される。我々は,将来的には,承認された生物製品への排他的保護を削減し,生物類似および交換可能な生物製品により容易に承認される方法を提供することを含む,より多くの州や連邦医療改革措置や法規をとることを予想している。これらの措置および法規のいずれも、連邦政府および州政府が医療製品およびサービスのために支払う金額を制限する可能性があり、私たちの候補製品に対する需要の減少または追加の価格設定圧力を招き、私たちの製品開発、テスト、マーケティング承認、販売後活動に影響を与える。
法律法規を遵守しないことは私たちの業務と名声を損なうかもしれない。
私たちの業務は様々な連邦、州、地方と外国政府機関によって規制されており、雇用と労働法、職場の安全、プライバシーと安保法律法規、税収法律法規の監督と実行を担当する機関を含む。いくつかの管轄区域では、これらの規制要求はアメリカよりも厳しいかもしれないが、他の場合、これらの要求はアメリカではもっと厳しいかもしれない。
特に、私たちの業務は、当社の顧客によって、連邦反リベート法規、連邦虚偽請求法案および医師日光法律法規を含むが、これらに限定されない様々な連邦および州詐欺および乱用法律を遵守し、GDPRおよびカリフォルニア消費者プライバシー法、またはCCPAを含む患者および非患者プライバシー法規、または我々の年間報告書“項目1.企業-政府規制”で説明されているように、カリフォルニアプライバシー法またはCPRAの改正を含む。これらの法律の範囲が広く、法定例外状況と選択可能な避難港が限られていることから、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。例えば、私たちが患者の正確な診断を支援する支援遺伝子検出計画の一つは、適用される政府当局が様々な詐欺や法律のコンプライアンスを継続的に検討するテーマであり、この計画や私たちの他の操作や計画がこのような法律に違反することが発見されないことを保証することはできない。
GDPRは、個人データを処理する能力に対して、特に健康データなどの特殊なカテゴリの個人データに関する厳しい義務および制限を規定している(例えば、法的根拠に依存して個人に情報を提供し、個人データが漏洩した場合に関連国のデータ保護当局に通知し、適切なセキュリティ措置を実施する)。EU加盟国はまた自国の立法を通じて特殊なカテゴリの個人データに追加的な要求を加えることができる。また、GDPRは欧州経済圏以外の国(米国を含む)への個人データの移転に具体的な制限を加えており、これらの国は欧州委員会によって十分な保護レベルを提供しているとはみなされていない。このような譲渡(例えば、標準契約条項および譲渡リスク評価に依存する)を行うためには、適切な保障措置が必要である。“経済·臨床健康情報技術法”(HITECH)により改正された1996年連邦“健康保険携帯性と責任法案”(HIPAA)には,いくつかのコンプライアンス要求があり,保護された健康情報のプライバシーや安全に関する要求が実施されている。多くの場合、このような要求は、カバーされたエンティティのビジネスパートナーにも適用される。場合によっては,臨床試験を行うことを含め,我々の業務運営や契約協定に基づいて,HIPAAの要求を遵守しなければならない。さらに、新たに公布され、最近公布された法律(例えば、CCPAおよびCPRA)を含む米国の他の連邦、州、地方プライバシー法律法規を遵守する必要があるかもしれませんが、これらの法律は、現在または将来、私たちおよび/または私たちのサービスプロバイダに適用される可能性があり、これらの法律は、私たちが業務で収集して使用するいくつかの情報(個人情報、特にHIPAAに拘束されていない個人情報を含む)に対して透明な措置をとり、その権利を尊重し、そのプライバシーおよび安全を保護することを要求しています。
64
もし私たちの業務が上記の任意の法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは民事と刑事罰、損害賠償、罰金、連邦医療保険や医療補助などの政府医療計画から除外され、監禁、利益の返還、そして私たちの業務を削減または再編することを含む罰を受ける可能性があります。いかなる政府制裁、罰金または処罰が適用された場合、または可能な民事または刑事訴訟で私たちが勝つことができない場合、私たちの業務、経営業績、財務状況、および私たちの名声は損なわれる可能性がある。また、どの行動への対応も、経営陣の注意力や資源の著しい移転、専門費の増加を招く可能性がある。
私たちの研究と開発活動は、私たちの品質管理実験室での過程と分析開発活動、および私たちと私たちの第三者メーカーとサプライヤーの活動を含み、私たちの遺伝子治療製造施設の建設と拡張に関する活動を含み、危険材料の制御貯蔵、使用、処置に関連し、私たちの候補製品の成分、例えばウイルスや他の危険化合物を含み、これは私たちがこのような活動を管理する法律と法規の制約を受けることができる。場合によっては、これらの危険材料とそれらを使用して発生した様々な廃棄物は、私たちまたは私たちの製造業者の施設に貯蔵され、使用と処分を待っている。私たちは汚染リスクを除去することができません。これは、私たちの商業化努力、研究開発努力、業務運営の中断、あるいは環境破壊を招き、コストの高い清掃作業を招き、これらの材料の管理と指定廃棄物の使用、貯蔵、処理、処理の適用法律と法規に基づいて責任を負う可能性があります。私たちと私たちの第三者製造業者がこれらの材料を処理して処分する際に使用するセキュリティ手続きがこれらの法律法規に規定された基準に符合することは保証されず、これらの材料の意外な汚染や傷害リスクを除去する保証もない。この場合、私たちはそれによって生じるいかなる損害にも責任を負わなければならないかもしれない-このような責任は、私たちの資源を超える可能性があります--州、連邦、または他の適用機関は、特定の材料の使用を制限し、および/または私たちの業務運営を中断するかもしれません。また,環境法律法規は複雑で変化が頻繁であり,より厳しくなる傾向にある。私たちはこのような変化の影響を予測することもできないし、私たちの未来のコンプライアンス状況を決定することもできない。
さらに、私たちと私たちの従業員が公衆とのコミュニケーションの手段としてソーシャルメディアツールを使用するようになるにつれて、私たちまたは私たちの従業員がソーシャルメディアを使用して私たちの製品や業務をコミュニケーションすることは、会社の政策やガイドラインを通じてこのようなソーシャルメディアコミュニケーションを監視しようとしているにもかかわらず、適用される法律に違反していることが発見される可能性があります。さらに、私たちの従業員は、意図的に、または意図的に、私たちの会社の政策または他の法律または契約要件に適合しない方法でソーシャルメディアを使用する可能性があり、これは、責任、商業機密または他の知的財産権の損失を招き、名声を損なうこと、または私たちの従業員、臨床試験患者、顧客、および他の人の個人情報開示をもたらす可能性がある。
私たちの業務の国際拡張は、アメリカ以外での業務展開に関するビジネス、規制、政治、運営、金融、経済リスクに直面しています。
私たちの業務戦略には国際拡張が含まれている。我々は現在、臨床研究や規制活動を行っており、米国以外の製品も商業化している。国際的な業務展開には多くのリスクが含まれているが、これらに限定されない
65
これらの要素のいずれも、私たちの将来の国際拡張と運営を深刻に損なう可能性があり、それによって私たちの運営結果を損なうかもしれない。
一般に、当社の企業リソース計画またはERPシステムの拡張に関連するリスクは、当社の業務および運営結果、または財務報告の内部統制の有効性に悪影響を及ぼす可能性があります。
私たちは私たちの遺伝子治療製造施設に関連するいくつかの既存の業務、運営と財務プロセスをアップグレードするために当社の全会社ERPシステムを拡張しています。現在私たちは2023年に完成する予定です。企業資源計画の拡張は複雑で時間のかかる工事である。ERP拡張過程で時間遅延やコスト超過に遭遇した場合、あるいはERPシステムや関連するプロセス変更が予想されるメリットを生じていない場合、私たちの運営結果は不利な影響を受ける可能性がある。このプロジェクトは、資本と人的資源の投資、私たちのビジネスプロセスの再設計、および多くの従業員の注意を必要とし、継続する可能性があり、そうでなければ、彼らは私たちの業務の他の側面に集中するだろう。拡張された企業資源計画システムの設計および実施におけるいかなる欠陥も、私たちが発生したコストよりもはるかに高いコストをもたらす可能性があり、解決策の開発と発売、サービスの提供、契約義務の履行、適時に米国証券取引委員会に報告を提出し、私たちの業務を運営し、または他の方法で私たちの環境を制御する能力に悪影響を及ぼす可能性がある。このような結果のいずれも私たちの運営結果と財政状況に悪影響を及ぼす可能性がある。
コンピュータシステムの故障やセキュリティホールが発生した場合、私たちの業務と運営は重大な悪影響を受ける可能性があります。
ネットワーク釣り攻撃や機密や独自情報の盗用や漏洩や企業ITシステムの破壊を含むネットワークセキュリティ事件は,ますます頻繁かつ複雑になっている.当社の技術システムおよび当社の戦略パートナー、CRO、契約製造業者、サプライヤー、販売業者、または当社がビジネスを運営する他の第三者のシステムで処理および格納された情報およびデータは、失われ、破損し、サービスを拒否し、不正アクセスまたは流用しやすい可能性があります。マルウェア、ハッカー攻撃、商業電子メール漏洩、恐喝ソフトウェア攻撃、ネットワーク釣り、またはサードパーティによる他のネットワーク攻撃は、データセキュリティホールを引き起こす可能性があります。私たちおよび私たちが業務を運営するいくつかの第三者は、第三者の不正アクセスと金融情報の流用を含むネットワークセキュリティ事件を経験した。また,我々の大多数の人員や我々と業務往来のある多くの第三者の人員が新冠肺炎流行後に柔軟な作業手配を行ったため,不正アクセスやサイバー攻撃のリスクが増加した。従業員、請負業者、および私たちのシステムにアクセスする権利のある他の人の不適切な行為または不注意は、不正な人または公衆に敏感なデータを暴露する可能性がある。システム障害またはセキュリティホールは、当社の運営または第三者サプライヤーまたはパートナーの運営を中断し、知的財産権および他の独自または機密情報の紛失または盗難、または私たちの薬物開発計画および商業運営に重大な破壊をもたらす可能性があります。例えば、進行中または計画中の臨床試験における臨床試験データの損失は、我々の規制承認作業を遅延させる可能性があり、データを回復または複製するコストを著しく増加させる。任意の中断またはセキュリティホールが、私たちのデータまたはアプリケーションの損失または破損、商業秘密損失または機密または固有情報(保護された健康情報、従業員または元従業員の個人情報を含む)の不適切な開示、私たちの臨床データへのアクセスまたは製造過程の中断をもたらした場合、私たちは責任を招く可能性があり、私たちの候補薬物のさらなる開発は延期される可能性がある。さらに、私たちはこのようなサイバーセキュリティ事件を調査して緩和するために巨額のコストを発生させるかもしれない。不正アクセス、個人情報の使用、または開示をもたらすセキュリティホールはまた、プライバシーおよびセキュリティ法律法規または他の義務に基づいて、個人、政府当局、信用報告機関、または他の当事者に通知することが要求される(例えば、適用される)。このようなセキュリティホールは私たちの名声を損なう可能性があり、人々の情報セキュリティ対策に対する信頼を侵食し、規制審査を招き、処罰、罰金、賠償要求、訴訟、潜在的な民事或いは刑事責任を招く可能性がある。
66
私たちまたは私たちが依存している第三者は、地震や他の自然災害の悪影響を受ける可能性があり、私たちの業務の連続性や災害復旧計画は、深刻な災害から私たちを十分に保護できないかもしれません。
私たちの会社本部と私たちの研究室は旧金山湾区にあり、CrysvitaのパートナーであるKKCは日本に位置しており、この2つの国は過去に深刻な地震と他の自然災害を経験した。私たちは地震保険に加入しません。地震やその他の自然災害は、私たちまたはパートナーの運営を深刻に混乱させ、私たちの業務、運営結果、財務状況、および見通しに実質的な悪影響を及ぼす可能性があります。旧金山湾区の野火による停電も経験しており,将来的には継続する可能性がある。自然災害、停電、または他の事件が発生した場合、本社の全部または大部分を使用することができなくなり、重要なインフラ(例えば、第三者契約製造業者の製造施設)を破損したり、他の方法で運営を中断したりすることは、困難かもしれませんし、場合によっては、長い間私たちの業務を継続することはできません。我々が現在策定している災害復旧·業務連続計画は限られており、深刻な災害や同様の事件が発生した場合には十分ではない可能性がある。私たちの災害復旧と業務連続計画の性質が限られているため、大量の費用が発生する可能性があり、特に地震保険が不足している場合には、私たちの業務に実質的な悪影響を及ぼす可能性があります。
私たちは会社や製品を買収したり、戦略取引を行ったりする可能性があり、これは私たちの経営陣の関心を分散させ、様々なコストや支出を発生させ、あるいはこのような投資の価値変動を招き、私たちの経営業績に影響を与える可能性があります。
私たちは、私たちの業務を補完したり拡大したり、成長機会を提供することができると思う業務や製品に買収または投資することができるかもしれません。例えば、2017年11月にDimensionを買収し、2022年7月にGeneTxを買収しました。潜在的な買収や投資を追求することは、経営陣の注意をそらす可能性があり、それらを識別、調査、追求する際に、それらが完成しているかどうかにかかわらず、様々なコストや支出が生じる可能性がある。私たちは望ましい買収や投資を決定できないかもしれないし、そのような取引の期待収益を成功または達成できないかもしれない。買収された会社の人員、運営、製品の吸収に困難がある可能性があり、経営陣の注意が他の業務に移ってしまう可能性があり、買収された会社のキーパーソンを失う可能性があります。買収された会社の業務を当社の業務とうまく統合できなければ、予期しない負債が生じる可能性があり、買収による収入増加、相乗効果、その他の期待利益を実現することができず、私たちの業務、運営結果、財務状況は重大な悪影響を受ける可能性がある。
私たちの他の会社や業務への投資価値も大きく変動し、四半期ごとや毎年の経営業績に影響を与える可能性があります。私たちは2020年10月に7,825,797株のSolid普通株を購入した。私たちはSolidに対する投資を公正な価値で入金します。公正な価値が確定しやすいからです。そのため、株式投資株価の上昇や下落はすでに私たちの投資の公正価値を変化させ、報告期間内に私たちの経営業績が大幅に変動することになる。Solidへの投資の公正価値はSolidの株価に依存するが,Solidの株価は最近大きく変動しているため,我々の投資の価値と我々の経営業績への影響も同様に異なる四半期と年度の間に大きく変動する可能性があるため,期間と期間の比較は投資の将来価値と我々の将来の経営業績をうまく示すことができない可能性がある.
私たちの普通株式所有権に関連するリスク
私たちの普通株の市場価格は非常に不安定かもしれない。
私たちの普通株の市場価格はずっと不安定で、私たちの業務変化とは関係のない原因を含めて変動し続ける可能性が高い。私たちの株価は様々な要因によって大きく変動する可能性がありますが、以下の要因に限定されません
67
また、バイオテクノロジーと生物製薬会社は特に極端な価格と数量変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績と関係がないか比例しない。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格にマイナス影響を与える可能性がある。
将来的に私たちの株主の所有率をさらに希釈し、私たちの株式インセンティブ計画に基づいて、私たちの株主の所有率をさらに希釈し、株価を下落させる可能性があることを含む、私たちの普通株を売却して発行する権利、または普通株を購入する権利。
私たちは未来に私たちが計画している業務を継続するために追加的な資金が必要になるだろう。ある程度、私たちは株式証券を発行することで追加資本を調達し、私たちの株主は深刻な希釈を経験するかもしれない。私たちは1回または複数回の取引で、私たちが時々決定した価格および方法で普通株、転換可能証券、または他の株式証券を販売することができる。もし私たちが1つ以上の取引で普通株、転換可能証券、または他の株式証券を販売すれば、投資家はその後の売却によって深刻に希釈されるかもしれない。これらの売却はまた、私たちの既存株主の実質的な希釈をもたらす可能性があり、新しい投資家は私たちの既存株主よりも優れた権利を得る可能性がある。
2023年6月、株主が私たちの2023年インセンティブ計画または2023年計画を承認した後、2014年のインセンティブ計画の代わりにこの計画を採択しました。私たちの2023年計画によると、私たちの経営陣は、私たちの従業員、役員、コンサルタントに株式オプションとその他の持分ベースの奨励を与える権利があります。2023年6月30日現在、2023年計画によると、将来付与可能な株は4,601,218株。
68
2023年6月に改訂·再記述された2014年従業員株式購入計画またはA&R ESPPによると、条件を満たす従業員は現在の市場価格を下回る価格で普通株を買収することができる。2023年6月30日現在、A&R ESPPにより発行可能な株は6,694,377株である。
我々の取締役会は、2023年6月に改正された雇用インセンティブ計画、またはインセンティブ計画を採択しており、この計画によると、付与可能な株は最大850,000株である。2023年6月30日現在,インセンティブ計画により発行可能な株は515,719株である。もし私たちの取締役会が2023年計画、A&R ESPP、またはインセンティブ計画によって将来付与可能な株式数を増加させることを選択すれば、私たちの株主は追加的な希釈を経験する可能性があり、これは私たちの株価を下落させる可能性がある。
我々の会社登録証明書や定款の条項、およびデラウェア州法律の条項を改訂して再記述することは、第三者が私たちを買収したり、買収コストを増加させたりすることを難しくするかもしれません。そうしても、私たちの株主に利益を与えたり、現在の経営陣を罷免したりします。
当社の会社登録証明書の改訂と再記載、改正と再記述の定款、およびデラウェア州法律に含まれる条項は、私たちの統制権の変更や私たちの経営陣の変更を遅延または阻止する可能性があります。当社の会社登録証明書の改訂と再記載には、以下の条項が含まれます
これらの条項は単独または共同で敵意の買収、統制権の変更、または管理層の変動を延期、阻止または阻止する可能性がある。
また、私たちはデラウェア州で登録されているので、私たちはデラウェア州会社法第203条の規定によって管轄されています。この条項は、私たちが発行した議決権株の15%以上の株主が私たちと合併または合併する能力を持つことを制限しています。また、いかなる株主も、当社の改正及び再記載された会社登録証明書には含まれていないので、いかなる取締役選挙においても投票権を累積してはならない。
私たちが改正して再記載した会社登録証明書または改正および再記述された定款またはデラウェア州法律の遅延または抑止権変更を有するいかなる条項も、私たちの株主が彼らが保有する普通株から割増の機会を得ることを制限する可能性があり、一部の投資家が私たちの普通株に支払う価格に影響を与える可能性もある。
69
私たちの会社登録証明書の改正と再記述は、デラウェア州衡平裁判所は、私たちと私たちの株主とのほとんどの紛争の唯一かつ独占的なフォーラムであり、これは、私たちまたは私たちの役員、上級管理職、または従業員との紛争を処理するために、私たちの株主が有利な司法フォーラムを得ることを制限する可能性があります。
私たちが改正および再説明した会社登録証明書は、デラウェア州衡平裁判所は、(1)私たちを代表して提起された任意の派生訴訟または法的手続き、(2)私たちの任意の取締役、高級管理者または他の従業員が私たちなどまたは私たちの株主に対して受託責任を有すると主張する任意の訴訟、(3)デラウェア州一般会社法または私たちの改正および再記載された会社登録証明書または別例に従って私たちにクレームを提起した任意の訴訟、または(4)私たちに対して内部事務原則によって管轄されていると主張する任意の訴訟の唯一および独占法廷である。裁判所条項の選択は、私たちまたは私たちの役員、役員、または他の従業員とのトラブルに有利だと考える株主のクレームを司法裁判所で提出する能力を制限する可能性があり、これは、私たちと私たちの役員、役員、および他の従業員に対するこのような訴訟を阻止する可能性があります。あるいは、裁判所が、私たちが修正および再記載した会社登録証明書に含まれる裁判所条項の選択が訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の司法管轄区域で、このような訴訟の解決に関連する追加費用を発生させる可能性があり、これは、私たちの業務、経営業績、および財務状況を損なう可能性があります。
一般リスク因子
もし私たちが財務報告に対して効果的な内部統制を維持できなければ、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの株式の市場価格は低下する可能性がある。
“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、財務報告および開示制御および手続きに対して効果的な内部統制を維持することを要求する。特に、“サバンズ-オキシリー法”第404(A)節の要求によると、経営陣が財務報告の内部統制の有効性を報告できるように、財務報告の内部統制のシステムおよびプロセス評価およびテストを行わなければならない。サバンズ-オキシリー法404(B)条はまた、私たちの独立監査人にこの管理評価を証明して報告することを要求する。正確な財務諸表をタイムリーに作成できるように十分な内部統制措置があることを確保して、高価で時間のかかる仕事であり、常に評価する必要がある。もし私たちが第404条の要求を遵守できない場合、あるいは私たちまたは私たちの独立公認会計士事務所が財務報告の内部統制に対する私たちの有効性を証明できない場合、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの株式の市場価格は下落する可能性があり、私たちはナスダック、米国証券取引委員会、または他の規制機関の制裁または調査を受ける可能性があり、これには追加の財務および管理資源が必要になるだろう。
70
私たちは私たちの業務に関連した追加税金を発生させるかもしれない。
私たちは国際的な税金構造を持っていて、アメリカと各外国の管轄区域で所得税を払わなければなりません。私たちの有効税率は、私たちの経営構造の変化、異なる国/地域での収益の組み合わせの変化、子会社間の損益分配、私たちの会社間移転定価協定と移転定価に関する規則、アメリカの研究開発税収相殺の可用性、アメリカと他の国の未来の税収法律法規の変化を含む多くの要素の影響を受けています。我々の納税義務を決定する際には、経営陣の不確定な納税状況の判断を含む重大な判断が必要である。アメリカ国税局、他の国内税務機関、あるいは外国の税務機関は、私たちの業務に適用される税法の解釈に同意しないかもしれません。私たちが報告した有効税率と税引後キャッシュフローは、私たちの財務諸表の課税金額を超える納税評価の大きな悪影響を受ける可能性があります。これは私たちの将来の有効税率を大幅に引き上げ、純収入を減少させ、将来の経営業績に悪影響を及ぼす可能性がある。
私たちの純営業損失の繰越と他の税務属性を使用する能力は限られているかもしれません。
私たちの歴史上、私たちは大きな損失を受けた。我々が課税損失を引き続き発生させた場合、未使用の課税損失は、当該等の未使用の赤字が満期になるまで、一定の制限の下で繰り越して将来の課税収入(あれば)を相殺する。改正後の1986年の国税法(IRC)第382条と383条によると、ある会社が“所有権変更”を経験すれば、通常、その持分が3年以内に50%を超える変化が発生したと定義され(価値で計算する)、会社は変更前の純営業損失の繰越やNOL繰り越しやその他の変更前の税収属性(例えば税収控除を検討する)を用いて変更後の収入を相殺する能力は限られている可能性がある。私たちは以前に発生した所有権変更が私たちのNOL繰越と他の変更前の税収属性に対する制限を確定するために分析を行い、連邦と州NOL繰り越し金額の恒久的な720万ドルの減少を招き、連邦研究税収の繰越免除永久的に20万ドルを減少させた。これらの減少と、将来の所有権変更による可能性のある他の状況のため、私たちは変更前のNOL繰り越しと他の税務属性を使用して、アメリカ連邦課税収入と納税義務を相殺する能力は限られており、より大きな制限を受ける可能性があり、これは私たちの未来の連邦納税義務を加速または恒久的に増加させるかもしれない。さらに、ある時期には、州所得税NOL繰り越しおよび他の州税属性繰り越し(例えば、州研究税控除)の使用が一時停止されるか、または他の方法で制限される可能性があり、これは、私たちの将来の州税負担を加速または永久的に増加させる可能性がある。
訴訟は私たちの費用を大幅に増加させ、私たちの業務を損なうかもしれない。
私たちは、将来的に訴訟の当事者になる可能性があり、訴訟は、通常の業務過程において、私たちの役員、上級管理者、株主、知的財産権および雇用事項および政策に関する訴訟、クレームおよび法的手続きを含むが、これは、賠償義務に基づいて上級管理者および取締役の法的費用を返済する潜在的費用を含む法的費用および他の関連コストを発生させることになる。このようなクレームや訴訟に対する弁護の費用は高くなるかもしれないし、私たちがどんな弁護でも成功するという保証はない。さらに、このようなクレームや訴訟を解決するのに要する時間は予測できない可能性があり、これらの行動は、経営陣の私たちの業務の日常運営に対する関心を分散させる可能性があり、これは、私たちの業務、運営結果、およびキャッシュフローに悪影響を及ぼす可能性がある。訴訟は固有の不確実性の影響を受け、時々発生するこのような事件の不利な結果は、私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性がある。
もし私たちが株主急進主義や敵意買収の対象になれば、私たちの業務や運営はマイナスの影響を受ける可能性があり、これは私たちに巨額の費用を発生させ、私たちの業務戦略の実行を阻害し、株価に影響を与える可能性があります。
株主急進主義は様々な形で出現し、様々な状況で出現し、ますます盛んになっている。株価下落はまた要請されていない方法の前で私たちの脆弱性を増加させるかもしれない。もし私たちが何らかの形の株主急進主義の対象になれば、例えば代理権競争や敵意買収など、私たちの経営陣や取締役会の関心は私たちの戦略を実行することから移ってしまうかもしれません。このような株主急進主義は、私たちの未来の戦略に明らかな不確実性をもたらし、私たちとビジネスパートナーとの関係に悪影響を与え、合格者の誘致と維持をより困難にする可能性がある。また、維権株主事項に関連した巨額の法的費用やその他の費用を含む大量のコストが発生する可能性がある。私たちの株価は大きな変動を受けたり、任意の株主行動の事件、リスク、不確実性の悪影響を受ける可能性があります。
71
ESG実践および開示をより厳密に検討することは、追加のコストをもたらし、私たちのサービスおよび名声に悪影響を及ぼす可能性がある。
すべての業界の企業は、その環境、社会、およびガバナンス(ESG)の実践および開示に関連するますます厳しい審査に直面しており、機関および個人投資家は、ESGスクリーニング基準を使用して投資決定を行うようになっている。これらの事項の開示またはESG実践および報告の変化に対する利害関係者の期待を満たすことができなかったことは、私たちの名声を損なう可能性があり、従業員の留任および資本獲得に影響を与える可能性がある。さらに、私たちは、私たちが発表した期間内に私たちの目標、指標、目的を追求したり、達成できなかったり、様々な報告基準を満たしていなかったり、全くなかったりすることができなかったと考えられています。これは、政府の法執行行動や個人訴訟に直面する可能性があります。
環境および多様性イニシアティブおよびESG報告基準を遵守する能力を含む任意の目標または目的を達成する能力は、多くのリスクに直面しており、その多くのリスクは制御できない。このようなリスクの例は、持続可能性および道徳的サプライチェーン基準に適合する技術および製品の利用可能性およびコスト、ESG基準または開示に影響を与える変化する規制要件、多様な人材を労働市場で募集、育成および維持する能力、およびESG指標を識別、測定、報告するために、変化する基準に適合する報告プロセスおよび制御の能力を開発することを含む。ESGベストプラクティス、報告基準、および開示要件の発展に伴い、ESG監視および報告に加えて、ESG目標の維持または達成に関連するコスト増加が生じる可能性がある。
ITEM 2未登録株式証券販売と収益の使用
ない。
ITEM 3高級証券違約
ない。
ITEM 4炭鉱安全情報開示
適用されません。
ITEM 5その他の情報
開ける
72
ITEM 6陳列品
|
|
|
|
引用で編入する |
|
|
||||
展示品番号 |
|
展示品説明 |
|
表 |
|
日取り |
|
番号をつける |
|
本ファイルで提供またはアーカイブされると |
3.1 |
|
改訂および再予約された会社登録証明書 |
|
8-K |
|
2/5/2014 |
|
3.1 |
|
|
3.2 |
|
付例を改訂および再制定する |
|
8-K |
|
2/5/2014 |
|
3.2 |
|
|
4.1 |
|
普通株の書式 |
|
S-1 |
|
11/8/2013 |
|
4.2 |
|
|
4.2 |
|
義歯の形式 |
|
S-3 ASR |
|
2/12/2021 |
|
4.2 |
|
|
10.1* |
|
Ultragenyx製薬会社とKyowa麒麟株式会社との間で2023年5月16日に施行された協力·許可協定改正案第13号。 |
|
|
|
|
|
|
|
X |
10.2# |
|
Ultragenyx製薬会社とHoward Horn間の招待状は,2023年6月22日であった。 |
|
8-K |
|
7/12/2023 |
|
10.1 |
|
|
10.3# |
|
2023年5月1日、Ultragenyx製薬会社とCamille Bedrosian医学博士との間の招待状の修正案第2号。 |
|
10-Q |
|
5/4/2023 |
|
10.3 |
|
|
10.4# |
|
2023年インセンティブ計画 |
|
S-8 |
|
6/8/2023 |
|
4.4 |
|
|
10.5# |
|
従業員の株購入計画を改訂·再策定する |
|
S-8 |
|
6/8/2023 |
|
4.5 |
|
|
10.6# |
|
“雇用誘因計画第一修正案” |
|
S-8 |
|
6/8/2023 |
|
4.7 |
|
|
31.1 |
|
取引法規則13 a-14(A)または規則15 d-14(A)に要求される最高経営責任者および財務責任者の証明 |
|
|
|
|
|
|
|
X |
32.1** |
|
取引法第13 a-14条又は第15 d-14(B)条及び米国法第18編第1350条に規定する最高経営責任者及び最高経営責任者の証明 |
|
|
|
|
|
|
|
X
|
101.INS |
|
XBRLインスタンスドキュメント、インラインXBRL形式 |
|
|
|
|
|
|
|
X |
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
|
|
|
|
X |
101.カール |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
|
|
|
|
|
X |
101.def |
|
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
|
|
|
|
|
X |
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
|
|
|
|
X |
101.Pre |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
|
|
|
|
|
X |
104 |
|
表紙相互作用データファイルは、添付ファイル101に含まれるイントラネットXBRLのフォーマットである。 |
|
|
|
|
|
|
|
|
#は、管理契約または補償計画を示します。
*S-K法規第601(B)(10)(Iv)項によれば、特定の識別された情報は、スター番号でそのような情報をマークすることによって、実質的でもなく、登録者が個人または機密とみなすタイプでもあるので、いくつかの識別された情報が欠落している。
**本四半期の報告書に添付されている添付ファイル32.1に添付されている認証は、米国証券取引委員会に提供されたものであり、米国証券取引委員会に提出されたものとみなされず、文書に含まれる任意の一般的な登録言語にかかわらず、参照によって登録者が証券法または取引法に従って提出された任意の文書に組み込まれてはならない。
73
登録する解決策
1934年の証券取引法の要求によると、登録者はすでに正式に本報告を正式に許可した署名者がそれを代表して署名することを促した。
|
|
Ultragenyx製薬INC. |
|
|
|
|
|
日付:2023年8月3日 |
|
差出人: |
/S/エミール·D·カキス |
|
|
|
Emil D.Kakkis医学博士博士 |
|
|
|
社長と取締役CEO |
|
|
|
|
日付:2023年8月3日 |
差出人: |
/S/セオドア·A·恵曽加 |
|
|
|
|
セオドア·A·恵曽加 |
|
|
|
上級副社長と首席会計官 (首席会計主任) |
74