
cs
米国
証券取引委員会
ワシントンDC 20549
フォーム
(マークワン)
1934年の証券取引法のセクション13または15 (d) に基づく四半期報告書 |
四半期終了時
または
1934年の証券取引法第13条または第15条 (d) に基づく移行報告書 |
からへの移行期間中
コミッションファイル番号:

(憲章に明記されている登録者の正確な名前)
|
||
(州またはその他の管轄区域) 法人または組織) |
|
(IRS) 雇用主 |
|
|
|
(主要執行機関の住所) |
|
(郵便番号) |
(
(登録者の電話番号、市外局番を含む)
同法第12条 (b) に従って登録された証券:
各クラスのタイトル |
|
取引 シンボル (複数可) |
|
登録された各取引所の名前 |
|
|
登録者が、(1)1934年の証券取引法の第13条または第15条(d)で提出が義務付けられているすべての報告書を過去12か月間(または登録者がそのような報告を提出する必要があったよりも短い期間)に提出したかどうか、および(2)過去90日間にそのような提出要件の対象であったかどうかをチェックマークで示してください。
登録者が過去 12 か月間(または、登録者がそのようなファイルの提出を求められたほど短い期間)に、規則 S-T の規則 405(本章の §232.405)に従って提出する必要のあるすべてのインタラクティブデータファイルを電子的に提出したかどうかをチェックマークで示してください。
登録者が大規模な加速申告者、加速申告者、非加速申告者、小規模な報告会社、または新興成長企業のいずれであるかをチェックマークで示してください。取引法規則12b-2の「大規模加速申告者」、「加速申告者」、「小規模報告会社」、および「新興成長企業」の定義を参照してください。
大型加速フィルター |
|
☐ |
|
アクセラレーテッド・ファイラー |
|
☐ |
|
|
|
|
|||
|
☒ |
|
小規模な報告会社 |
|
||
|
|
|
|
|
|
|
新興成長企業 |
|
|
|
|
|
|
新興成長企業の場合は、登録者が取引法第13条 (a) に従って規定された新規または改訂された財務会計基準を遵守するために延長された移行期間を使用しないことを選択したかどうかをチェックマークで示してください。☐
登録者がシェル会社(取引法の規則12b-2で定義されている)であるかどうかをチェックマークで示してください。はい
2023年8月2日現在、登録者は 持っていました
アークトゥルス・セラピューティクス・ホールディングス株式会社とその子会社
目次
|
|
ページ |
第一部。 |
財務情報 |
1 |
アイテム 1. |
財務諸表 (未監査) |
1 |
|
2023年6月30日および2022年12月31日現在の要約連結貸借対照表 |
1 |
|
2023年6月30日および2022年6月30日に終了した3か月および6か月間の要約連結営業報告書および包括損失 |
2 |
|
2023年6月30日および2022年6月30日に終了した3か月および6か月間の要約連結株主資本の変動計算書 |
3 |
|
2023年6月30日および2022年6月30日に終了した6か月間の要約連結キャッシュフロー計算書 |
4 |
|
要約連結財務諸表の注記 |
5 |
アイテム 2. |
経営陣による財政状態と経営成績に関する議論と分析 |
16 |
アイテム 3. |
市場リスクに関する定量的・質的開示 |
25 |
アイテム 4. |
統制と手続き |
25 |
第二部 |
その他の情報 |
26 |
アイテム 1. |
法的手続き |
26 |
アイテム 1A. |
リスク要因 |
26 |
アイテム 2. |
持分証券の未登録売却および収益の使用 |
26 |
アイテム 3. |
シニア証券のデフォルト |
26 |
アイテム 4. |
鉱山の安全に関する開示 |
26 |
アイテム 5. |
その他の情報 |
26 |
アイテム 6. |
展示品 |
27 |
署名 |
30 |
|
i
将来の見通しに関する記述に関する特記事項
このフォーム10-Qの四半期報告書、または「経営陣による財政状態および経営成績に関する議論と分析」というタイトルのセクションを含むこの四半期報告書、およびここに参照して組み込まれている文書には、連邦証券法、改正された1933年の証券法のセクション27A、および改正された1934年の証券取引法のセクション21Eの意味における、明示的または黙示的な「将来の見通しに関する記述」が含まれる場合があります(「取引法」)、そして民間証券のセーフハーバー条項に従って作成されました1995年の訴訟改革法。当社の実際の業績は、さまざまな要因の結果として、これらの将来の見通しに関する記述で予想されるものと大きく異なる可能性があります。その中には、この四半期報告書のパートIIの項目1A「リスク要因」に記載されているものが含まれます。法律で義務付けられている場合を除き、当社は、新しい情報、将来の出来事、またはその他の結果として、これらの将来の見通しに関する記述を更新する義務を負いません。これらの記述は、将来のさまざまな出来事に関する現在の期待または信念を表しており、「可能性」、「意志」、「期待」、「予測」、「意図」、「計画」、「信じる」、「見積もり」などの言葉を含む場合がありますが、すべての将来の見通しに関する記述に必ずしもこれらの識別語が含まれているわけではありません。この四半期報告書の将来の見通しに関する記述には、以下に関する記述が含まれますが、これらに限定されません。
ii
これらおよびその他の将来の見通しに関する記述は現在の予測に過ぎず、当社または当社の業界の実際の結果、活動レベル、業績、または成果が、将来の見通しに関する記述で予想されるものと大きく異なる原因となる既知および未知のリスク、不確実性、およびその他の要因の影響を受けます。さらに、科学研究、前臨床試験、臨床試験の過去の結果は、将来の研究や試験が同じ結論を示唆することを保証するものではなく、また、本書で言及されている歴史的結果が、追加の研究、前臨床試験や臨床試験の結果などによって同じように解釈されることも保証されません。この四半期報告書に含まれる将来の見通しに関する記述は、リスクと不確実性の影響を受けます。これには、米国証券取引委員会または米国委員会へのその他の提出書類に記載されている内容も含まれます。読者は、特に明記されていない限り、これらの将来の見通しに関する記述に過度に依存しないように注意してください。現在、将来の見通しに関する記述に反映されている期待は妥当だと考えていますが、将来の結果、活動レベル、業績、または成果を保証することはできません。
iii
パートI—財務情報
アイテム 1.財務諸表。
アークトゥルス・セラピューティクス・ホールディングス株式会社とその子会社
要約連結貸借対照表
|
|
6月30日 |
|
|
12月31日 |
|
||
(千単位、額面情報を除く) |
|
(未監査) |
|
|
|
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金および現金同等物 |
|
$ |
|
|
$ |
|
||
制限付き現金 |
|
|
|
|
|
— |
|
|
売掛金 |
|
|
|
|
|
|
||
前払費用およびその他の流動資産 |
|
|
|
|
|
|
||
流動資産合計 |
|
|
|
|
|
|
||
資産および設備、純額 |
|
|
|
|
|
|
||
オペレーティングリースの使用権資産、純額 |
|
|
|
|
|
|
||
非流動制限付現金 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主資本 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
買掛金 |
|
$ |
|
|
$ |
|
||
未払負債 |
|
|
|
|
|
|
||
長期債務の現在の部分 |
|
|
— |
|
|
|
|
|
繰延収益 |
|
|
|
|
|
|
||
流動負債合計 |
|
|
|
|
|
|
||
繰延収益、当期分を差し引いたもの |
|
|
|
|
|
|
||
オペレーティング・リースの負債、当期分を差し引いたもの |
|
|
|
|
|
|
||
その他の非流動負債 |
|
|
|
|
|
|
||
負債総額 |
|
|
|
|
|
|
||
株主資本 |
|
|
|
|
|
|
||
普通株式、$ |
|
|
|
|
|
|
||
追加払込資本 |
|
|
|
|
|
|
||
累積赤字 |
|
|
( |
) |
|
|
( |
) |
株主資本の総額 |
|
|
|
|
|
|
||
負債総額と株主資本 |
|
$ |
|
|
$ |
|
||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
1
アークトゥルス・セラピューティクス・ホールディングス株式会社とその子会社
要約連結損益計算書および包括損失
(未監査)
|
|
3 か月が終了 |
|
|
6 か月間終了 |
|
||||||||||
|
|
6月30日 |
|
|
6月30日 |
|
||||||||||
(千単位、一株当たりのデータを除く) |
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
収益: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
コラボレーション収益 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
助成金収入 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
総収入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
営業経費: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発、純額 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
一般管理と管理 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
営業費用の合計 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
事業による損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
持分法投資による損失 |
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
外貨による利益(損失) |
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|||
債務消滅による利益 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
金融収入(費用)、純額 |
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
||
税引前純損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税引当金 |
|
|
|
|
|
- |
|
|
|
|
|
|
|
|||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり純損失(基本および希薄化後) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
加重平均発行済株式数、基本株式、希薄化後株式 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
総合損失: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
包括的損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
2
アークトゥルス・セラピューティクス・ホールディングス株式会社とその子会社
要約された統合状態株主資本の計算です
(未監査)
|
|
|
|
|
|
|
|
[追加] |
|
|
|
|
|
合計 |
|
|||||
|
|
普通株式 |
|
|
支払い済み |
|
|
累積 |
|
|
株主の |
|
||||||||
(千単位) |
|
株式 |
|
|
金額 |
|
|
資本 |
|
|
赤字 |
|
|
エクイティ |
|
|||||
残高 — 2021年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの報酬費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
ストックオプションの行使による普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
残高 — 2022年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの報酬費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
ストックオプションの行使による普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
残高 — 2022年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
[追加] |
|
|
|
|
|
合計 |
|
|||||
|
|
普通株式 |
|
|
支払い済み |
|
|
累積 |
|
|
株主の |
|
||||||||
(千単位) |
|
株式 |
|
|
金額 |
|
|
資本 |
|
|
赤字 |
|
|
エクイティ |
|
|||||
残高 — 2022年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
株式ベースの報酬費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
ストックオプションの行使による普通株式の発行 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
残高 — 2023年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの報酬費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
ストックオプションの行使による普通株式の発行 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
残高 — 2023年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
3
アークトゥルス・セラピューティクス・ホールディングス株式会社とその子会社
要約連結ステートメント何万ものキャッシュフロー
(未監査)
|
|
6月30日に終了した6か月間 |
|
|||||
(千単位) |
|
2023 |
|
|
2022 |
|
||
営業活動 |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失を営業活動に使用された純現金と調整するための調整: |
|
|
|
|
|
|
||
減価償却と償却 |
|
|
|
|
|
|
||
株式ベースの報酬費用 |
|
|
|
|
|
|
||
持分法投資による損失 |
|
|
— |
|
|
|
|
|
外貨換算損失 (利益) |
|
|
|
|
|
( |
) |
|
債務消滅による利益 |
|
|
( |
) |
|
|
— |
|
その他の非現金支出 |
|
|
|
|
|
|
||
資産と負債の変動: |
|
|
|
|
|
|
||
売掛金 |
|
|
( |
) |
|
|
|
|
前払費用およびその他の資産 |
|
|
|
|
|
( |
) |
|
使用権資産 |
|
|
|
|
|
|
||
買掛金 |
|
|
|
|
|
( |
) |
|
未払負債 |
|
|
( |
) |
|
|
|
|
繰延収益 |
|
|
|
|
|
( |
) |
|
リース負債 |
|
|
( |
) |
|
|
— |
|
営業活動によって提供された(使用された)純現金 |
|
|
|
|
|
( |
) |
|
投資活動 |
|
|
|
|
|
|
||
資産および設備の取得 |
|
|
( |
) |
|
|
( |
) |
投資活動に使用された純現金 |
|
|
( |
) |
|
|
( |
) |
資金調達活動 |
|
|
|
|
|
|
||
ストックオプションの行使による収入 |
|
|
|
|
|
|
||
債務の支払い |
|
|
( |
) |
|
|
— |
|
財務活動によって提供された純現金(使用量) |
|
|
( |
) |
|
|
|
|
現金、現金同等物および制限付現金の純減少 |
|
|
( |
) |
|
|
( |
) |
期首における現金、現金同等物および制限付現金 |
|
|
|
|
|
|
||
期末の現金、現金同等物および制限付現金 |
|
$ |
|
|
$ |
|
||
|
|
6月30日に終了した6か月間 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
キャッシュフロー情報の補足開示 |
|
|
|
|
|
|
||
利息として支払われた現金 |
|
$ |
|
|
$ |
|
||
非現金投資活動 |
|
|
|
|
|
|
||
オペレーティングリースにより取得した使用権資産 |
|
$ |
— |
|
|
$ |
|
|
買掛金および未払費用での資産および設備の購入 |
|
$ |
|
|
$ |
|
||
添付の注記は、これらの要約連結財務諸表の不可欠な部分です。
4
アークトゥルス・セラピューティクス・ホールディングス株式会社とその子会社
要約された統合へのメモ財務諸表
(未監査)
注意 1.事業の説明、プレゼンテーションの基礎、重要な会計方針の要約
事業内容の説明
アークトゥルス・セラピューティクス.(以下「当社」または「Arcturus」)は、感染症ワクチンの開発と肝臓や呼吸器系の希少疾患における機会に焦点を当てた、世界的な後期臨床メッセンジャーRNA医薬品企業です。同社は、オルニチントランスカルバミラーゼ(「OTC」)欠損症の治験薬(「IND」)申請とLUNAR-COV19候補の臨床試験申請(「CTA」)が該当する保健当局によって承認されたことを発表した2020年に臨床段階の企業になりました。
プレゼンテーションの基礎
添付の要約連結財務諸表には、Arcturusとその子会社の勘定が含まれており、未監査です。すべての会社間の口座と取引は、統合によって削除されました。これらの要約連結財務諸表は、中間財務情報に関する米国の一般に認められた会計原則(「GAAP」)に従って作成されています。したがって、GAAPが財務諸表全体に必要なすべての情報や脚注が含まれているわけではありません。経営陣の見解では、添付の要約連結財務諸表には、提示された中間期間の結果を公平に提示するために必要と考えられる、通常の定期的な調整からなるすべての調整が反映されています。
中間財務結果は、必ずしも通年の業績予測を示すものではありません。これらの要約連結財務諸表は、2022年12月31日に終了した年度のForm 10-Kの当社の年次報告書に含まれる監査済み連結財務諸表および脚注と併せて読む必要があります。
これらの要約連結財務諸表はGAAPに従って作成されているため、経営陣は債務証券、持分法投資、株式ベースの報酬費用、負債の発生額、所得税、収益と繰延収益、リース、および財務諸表の日付および報告された資産と負債の開示に影響を与えるその他の事項の評価に関する見積もりと仮定を行う必要があります期間中の収入と支出の金額報告期間。これらの見積もりは、現在の出来事や会社が将来行う可能性のある行動に関する経営陣の知識に基づいていますが、実際の結果は、最終的にはこれらの見積もりや仮定と異なる場合があります。
ジョイントベンチャー、持分法投資、変動持分法人
会社が大きな影響力を行使しているが支配権を持たない投資は、持分法で会計処理されます。持分法投資活動は
流動性
同社は創業以来、大きな営業損失を被っています。2023年6月30日と2022年12月31日の時点で、同社の累積赤字は$でした
創業以来の会社の活動は、主に研究開発活動、一般管理活動、資金調達で構成されてきました。会社の活動には、会社が持続可能な収益と事業利益を達成する前に追加の資金を確保できないなど、重大なリスクと不確実性が伴います。会社の設立から2023年6月30日まで、当社は主に資本金の売却による収入、協力契約による収入、および長期債務からの収益で事業資金を調達してきました。
2023年6月30日の時点で、当社の現金および現金同等物(制限付現金および非流動制限付現金を含む)の残高は$でした
経営陣は、これらの要約連結財務諸表が発行された日から少なくとも今後12か月間は、事業資金を調達するのに十分な運転資金が手元にあると考えています。会社が追加の資金の確保に成功する保証も、将来の運転資金ニーズに関する会社の予測が正確であることも、追加の資金が将来事業を継続するのに十分であるという保証もありません。
5
セグメント情報
資源配分に関する意思決定や業績評価を行う際、最高執行意思決定者は、事業セグメントを、個別の財務情報を評価できる企業の構成要素として特定します。会社とその最高経営意思決定者は、会社の運営を把握し、事業を管理します。
収益認識
契約の開始時に、当社は締結された取り決めを分析して、そのような取り決めに、活動に積極的に参加し、その活動の商業的成功に応じて重大なリスクと報酬にさらされている当事者による共同運営活動が含まれるかどうかを評価します。したがって、ASCトピック808、協調的取り決め(ASC 808)の範囲内です。ASC 808の範囲内で複数の要素を含むコラボレーションの取り決めについては、会社はまず、コラボレーションのどの要素がベンダーと顧客の関係を反映しているか、したがってASC 606の範囲内にあるかを判断します。
当社は、(i) 契約の特定、(ii) 契約の履行義務の特定、(iii) 取引価格の決定、(iv) 契約の履行義務への取引価格の割り当て、(v) Ccurompanyが履行義務を履行する場合、または履行義務を履行する場合の収益の認識という5つのステップを実行して、トピック606の範囲内の取り決めの収益認識を決定します。
会社の収益契約の条件には、ライセンス料、前払い、マイルストーン支払い、研究開発活動の払い戻し、オプション行使料、コンサルティングおよび関連する技術移転手数料、および商品化された製品の販売に対するロイヤルティが含まれます。前払いを含む取り決めは、受領時または期日になると繰延収益として記録され、会社がこれらの取り決めに基づく義務を履行するまで、収益認識を将来の期間に延期する必要がある場合があります。イベントベースのマイルストーン支払いは変動対価であり、会社はマイルストーン支払いを受けるか受け取らないかのどちらかになるため、会社はこの変動対価を見積もるのに最も可能性の高い金額の方法を使用しています。つまり、潜在的なマイルストーン支払いは二元イベントになります。最も可能性の高い金額の方法では、会社がマイルストーンの支払いを受ける可能性を判断する必要があります。これらのマイルストーンの達成に関する不確実性が高いことを踏まえ、当社はそのマイルストーンに完全に制約があると判断し、これらの支払いに関連する不確実性が解消されるまで収益を認識しません。会社は、売上に基づくロイヤリティ支払いによる収益を、売り上げが発生したとき、または売上が発生したときに認識します。不確実な事象が解決され、その他の状況に変化が生じた場合、会社は各報告期間に取引価格を再評価します。
履行義務とは、特定の商品やサービスを共同パートナーに譲渡することを契約で約束することであり、トピック606の会計単位です。契約の取引価格は、独立した相対的な販売価格に基づいてそれぞれの履行義務に配分され、履行義務が履行されたとき、または履行義務が履行されたときに収益として認識されます。
時間の経過とともに認識される履行義務については、会社はインプットメソッドを使用して進捗状況を測定します。使用される入力方法は、履行義務の履行に費やされた労力または発生した費用に基づいています。会社は、履行義務を果たすための推定総労力または費用と比較して、活動の完了にかかる推定時間や特定の期間に発生した費用を含め、費やされた労力量を見積もります。このアプローチでは、会社が見積もりをして判断する必要があります。コラボレーションの過程で見積もりや判断が変わった場合は、その変化が確認された期間に、累積的な収益のキャッチアップが認識されます。
会社の取り決めに関する具体的な詳細については、「注記2、収益」を参照してください。
リース
契約がリースであるかどうかは、開始時に会社が判断します。リース使用権資産はリース期間中に原資産を使用する会社の権利を表し、リース負債はリースから生じるリース支払いを行う会社の義務を表します。初期期間が12か月を超えるオペレーティングリースの場合、当社は開始日のリース期間中のリース支払いの現在価値に基づいて、オペレーティングリースの使用権資産とオペレーティングリース負債を認識します。オペレーティングリースの使用権資産は、リース負債にリース料を加えたもので構成され、リースインセンティブは含まれません。リース条件には、会社が更新オプションが行使されると合理的に確信している場合、または終了オプションが行使されないことが合理的に確実な場合に、リースを更新または終了するオプションが含まれます。会社のオペレーティングリースの場合、将来のリース支払いの現在価値を決定するために使用される金利が容易に決定できない場合、会社は借入増額金利をリースの割引率と見積もります。会社の増額借入金利は、同様の条件と支払いで、同様の経済環境における担保ベースの金利を概算すると推定されています。リース料支払いのためのリース費用は、リース期間中に定額で計上されます。同社は、リースの要素と非リースの要素を分けないという現実的な手段を選択しました。
「」を参照 「注9、コミットメントと不測の事態」会社のリースに関する具体的な詳細について。
6
研究開発費、純額
研究開発費はすべて、発生時に費用計上されます。研究開発費は主に、給与、従業員の福利厚生、前臨床試験や臨床試験に関連する費用(臨床研究機関やその他の専門サービスに支払われる金額を含む)、進行中の研究開発費、ライセンス契約費用で構成され、助成金や発売前の在庫を差し引いたものです。研究開発サービスの実施前に行われた支払いは、サービスが提供されるまで資産計上されます。
会社は、第三者の請負業者、研究所、参加している臨床試験施設などによって行われた作業に対する支払いを含む、推定研究開発費用の見越額を記録します。これらの請負業者の中には、実際に行われたサービスに基づいて毎月請求するものもあれば、特定の契約上のマイルストーンの達成に基づいて定期的に請求するものもあります。後者の場合、会社は商品やサービスの使用または提供に応じて費用を計上します。
第三者が実施する臨床試験活動は、臨床研究機関(「CRO」)および臨床試験施設との間で締結された契約に従って、個々の臨床試験期間中に完了した作業の割合と患者登録率に基づいて計上され、費用計上されます。見積もりは、契約、ベンダー契約、発注書を確認し、試験やサービスの進行状況や完了段階、およびそのようなサービスに対して支払われる合意済みの料金について、社内の臨床担当者や外部のサービスプロバイダーと話し合って決定されます。
発売前の在庫
治験薬候補について最初の規制当局の承認を得る前に、会社は在庫の生産に関連する費用を、発生した期間における要約連結損益計算書の研究開発費用と包括損失として計上します。治験薬候補の規制当局による承認とその後の商品化が可能であると会社が判断し、治験薬候補の販売による将来の経済的利益も実現すると見込んでいる場合、製造コストを在庫として資産計上します。
制限付き現金
制限付現金残高は、要約連結キャッシュフロー計算書の現金、現金同等物、および営業、投資、財務活動の制限付現金調整に含めています。
次の表は、要約連結貸借対照表で報告された現金および現金同等物および制限付現金を、要約連結キャッシュフロー計算書に示されている金額の合計と調整したものです。
(千単位) |
|
2023年6月30日 |
|
|
2022年6月30日 |
|
||
現金および現金同等物 |
|
$ |
|
|
$ |
|
||
制限付き現金 |
|
|
|
|
|
- |
|
|
非流動制限付現金 |
|
|
|
|
|
|
||
現金、現金同等物および制限付資産の合計 |
|
$ |
|
|
$ |
|
||
1株当たり純損失
1株当たりの基本純損失は、純損失を、普通株式同等物を考慮せずに、その期間に発行された普通株式の加重平均数で割って計算されます。希薄化後の1株当たり純損失は、純損失を、自己株式法を用いて決定された期間の発行済普通株式および希薄化後の普通株式同等物の加重平均数で割ることによって計算されます。
最近発行された会計基準はまだ採用されていません
時々、FASBまたは他の基準設定機関によって新しい会計宣言が発行され、指定された発効日に会社によって採択されます。特に明記されていない限り、当社は、最近発行された基準がまだ有効になっていなくても、要約された連結財務諸表や開示に重大な影響を与えることはないと考えています。
7
ノート 2.収入
同社は、製薬会社やバイオテクノロジー企業とライセンス契約や共同研究開発契約を締結しているほか、コンサルティング、関連する技術移転、製品収益に関する契約を締結しています。これらの取り決めに基づき、会社はライセンス料、コンサルティング料、製品料金、技術移転手数料、前払い、特定の研究開発マイルストーンまたは技術移転マイルストーンが達成された場合のマイルストーン支払い、承認された製品販売に対するロイヤリティ、および研究開発活動の払い戻しを受ける権利があります。これらのサービスを実施するための会社の費用は、研究開発費に含まれています。会社のマイルストーン支払いは通常、特定の前臨床的、臨床的、および商業的成功基準の達成によって定義されます。前臨床のマイルストーンには、疾患動物モデルにおける生体内概念実証、リード候補の特定、INDを可能にする毒性学研究の完了などが含まれます。臨床マイルストーンには、たとえば、第1相、第2相、第3相臨床試験への最初の患者の登録または完了が含まれ、商業的なマイルストーンは、多くの場合、純売上高または総販売額に基づいて段階的に決定されます。核酸医薬ベースの治療法やワクチンの開発に必要な前臨床および臨床活動に関連するリスクがあるため、会社はこれらのマイルストーンの達成を保証することはできません。
次の表は、期間中の変更を示しています 2023年6月30日までの6か月間の契約資産と負債の残高を、会社の年次報告書で開示されたものと比較したものです。
(千単位) |
|
2022年12月31日 |
|
|
追加 |
|
|
控除 |
|
|
2023年6月30日 |
|
||||
契約資産: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
売掛金 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
契約負債: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
繰延収益 |
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
次の表は、指定された期間の会社の収益をまとめたものです。
|
|
3 か月間 |
|
|
6 か月間 |
|
||||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
コラボレーション収益: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
CSL Seqirus |
|
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
||
ビンビオケア |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
ヤンセン |
|
|
|
|
|
|
|
|
|
|
|
|
||||
イスラエル保健省 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
その他のコラボレーション収入 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
コラボレーション総収益 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
助成金収入: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
バルダ |
|
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
||
助成金の総収入は |
|
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
||
次の段落は、会社の最も重要な協力と助成金の取り決めの性質と目的に関する情報を提供します。
8
CSL Seqirus
2022年11月1日、当社はCSL Limited(以下「CSL Seqirus」)の一部であるSeqirus, Inc. と、ワクチンの研究、開発、製造、および商品化に関する世界的な独占権に関するコラボレーションおよびライセンス契約(修正後、「CSLコラボレーション契約」)を締結しました。CSLコラボレーション契約の条件に基づき、当社はCSL SeqirusにそのSTARRの独占的なグローバルライセンスを提供します®自己増幅型mRNAテクノロジー、LUNAR®脂質を介した送達、mRNA、原薬、製剤製造プロセス。CSL Seqirusは、共同でワクチンの開発と商品化を主導します。このコラボレーションでは、SARS-CoV-2(COVID-19)、インフルエンザ、パンデミック対策、その他3つの呼吸器感染症に対するワクチンの開発を進める予定です。
会社はドルを受け取りました
2023年3月、Arcturusは次世代ワクチン候補の推薦に関連するマイルストーンを含む開発マイルストーンを達成しました。その結果、$が調達されました
会計基準体系化(「ASC」)のトピック606に従ってCSLコラボレーション契約を評価した結果、同社はCSL Seqirusは顧客であると結論付けました。会社はCSLコラボレーション契約の中で約束されたすべての商品/サービスを特定し、特定の約束された商品/サービスを組み合わせる場合、会社は5つの明確な履行義務があると結論付けました。履行義務の内容は、ワクチンライセンスの提供、COVIDおよび非COVIDワクチンの研究開発サービス、およびCOVIDワクチンの規制活動です。各履行義務について、当社は、1)ライセンスの場合、再作成のための公正価値+マージン法、2)研究開発サービスおよび規制活動の場合は費用とマージン、推定フルタイム相当(「FTE」)費用の費用とマージン、実験用品、請負業者を含む直接費用、および研究開発サービスおよび規制活動のためのその他の自己負担費用に基づいてスタンドアロン販売価格を見積もりました。
2023年6月30日現在取引価格は、受け取った前払いの対価と2023年3月に達成されたマイルストーンで構成されています。ありました
会社は、独立した販売価格に比例して、取引価格を履行義務に割り当てました。ワクチンのライセンスは譲渡された時点で承認され、ライセンスに割り当てられた追加の対価は、履行義務が履行された時点で対価が取り消されない可能性が高くなる時点で認識されます。研究開発および規制活動の履行義務は、インプットメソッドを使用して提供されたサービスの割合、つまり実際に発生した費用を履行義務を果たすために予算化された総費用で割って、一定期間にわたって計上されます。売上に基づくロイヤリティに関する対価は、金額が取り消されない可能性がある場合に計上されます。ただし、報告された売上が確実に測定可能であり、会社が約束した商品やサービスが残っていない場合、それらには制約があり、したがって取引価格からも除外されているためです。2023年6月30日に終了した四半期に計上された収益は、提供されたライセンス、達成されたマイルストーン、および実施されたサービスに関するものです。
2023年6月30日および2022年12月31日現在の繰延収益の合計は $
9
ビンビオケア
2021年に、当社はVingroup合資会社のメンバーであるVinbiocare Biotechnology株式会社(「Vinbiocare」)と特定の契約(総称して「Vinbiocare ライセンスおよび供給契約」)を締結しました。これにより、当社はVinbiocareに技術的専門知識とサポートサービスを提供して、ベトナムでのmRNA医薬品製造施設の建設を支援することになります。会社は合計$の前払いを受け取りました
2022年10月、ライセンスおよび供給契約の終了に伴い、当社はVinbiocareと研究支援契約を締結しました。この契約では、Vinbiocareは、当社とVinbiocareとの取り決め(「研究支援契約」)に従って、引き続きベトナムで実施されるARCT-154の臨床試験の規制上および財政上のスポンサーとしての役割を果たすことが規定されています。これらの研究の継続的な活動を支援するために、研究支援契約ではさらに、会社が特定のサービスを実施し、これらの研究の目的の達成を支援するためにVinbiocareに報酬を支払うことを規定しています。2023年2月、同社は約$の追加財政支援を提供することに合意しました
同社は、次のような結論を出しました
ヤンセン
2017年10月、当社はヤンセンと研究協力およびライセンス契約(「2017年契約」)を締結し、RNA治療薬によるHBVの治療薬候補の開発に協力しました。2017年の契約では、発見、開発、資金調達義務、および関連する知的財産の所有権が当社とヤンセンの間で割り当てられました。会社は$の前払い金を受け取りました
2022年10月31日、Arcturusはヤンセン・ファーマシューティカルズ社から2017年の契約の終了の通知を受け取りました。終了は2022年12月30日に発効しました。この解約の結果、会社はいかなる罰則も発生しませんでした。2023年6月30日の時点で、ヤンセンに付与されたライセンスは終了し、同社は残りの先行投資対価と2021年10月に達成された開発のマイルストーンを確認しました。
当社は
バルダ・グラント
2022年8月、当社は、米国保健社会福祉省(HHS)内の準備と対応担当次官補(ASPR)の一部門である生物医学先端研究開発局(「BARDA」)と、最大$の報奨による費用償還契約を締結しました。
同社は、BARDAとの契約はASC 808またはASC 606の範囲に含まれないと判断しました。国際会計基準第20号(「IAS 20」)、「政府助成金の会計処理」および「政府援助の開示」を適用すると、会社は助成金に関連する研究費の直接的な自己負担費用、諸経費の配分、および付随する給付の払い戻しから助成金収入を認識しています。これらの償還に関連する費用は、研究開発費の一部として会社の要約連結営業報告書および包括損失に反映されます。
当社は$を認めました
10
注意 3.公正価値測定
会社は、資産と負債の公正価値を、測定日に市場参加者間の秩序ある取引において、資産の売却時に受け取る価格または負債の移転のために支払われる価格を使用して設定します。同社は、公正価値の測定に使用されたインプットに基づいて公正価値ヒエラルキーを確立しました。
公正価値階層の3つのレベルは次のとおりです。
レベル1:同じ資産または負債の活発な市場における相場価格。
レベル2:活発な市場における相場価格以外の、直接的または間接的に観察可能なインプット。
レベル3:市場データがほとんどまたはまったく存在しないため、市場参加者が使用するであろうものを反映した、会社が策定した見積もりと仮定を使用して決定される、観察不可能なインプット。
現金、制限付現金、売掛金、買掛金、未払負債、およびシンガポールローン(以下に定義)の帳簿価額は、満期が比較的短いため、それぞれの公正価値の概算です。2023年第1四半期に長期債務を返済する前は、金利が変動し、現在の市場金利を反映していたため、会社の債務枠で引き出された金額に対する長期債務の帳簿価額は公正価値に近いものでした。
2023年6月30日および2022年12月31日現在、定期的に公正価値で測定されるすべての資産は、公正価値階層のレベル1に分類された現金同等物とマネーマーケットファンドで構成されていました。これらの金融商品の公正価値は、相場価格に基づいて測定されました。
注意 4.貸借対照表の詳細
資産および設備、純残高は次のとおりです。
(千単位) |
|
2023年6月30日 |
|
|
2022年12月31日 |
|
||
研究機器 |
|
$ |
|
|
$ |
|
||
コンピューターとソフトウェア |
|
|
|
|
|
|
||
オフィス機器と家具 |
|
|
|
|
|
|
||
借地権の改善 |
|
|
|
|
|
|
||
建設中 |
|
|
— |
|
|
|
|
|
合計 |
|
|
|
|
|
|
||
減価償却累計額と償却額の減価償却額が少ない |
|
|
( |
) |
|
|
( |
) |
資産および設備、純額 |
|
$ |
|
|
$ |
|
||
減価償却費は $
未払負債は以下のとおりです。
(千単位) |
|
2023年6月30日 |
|
|
2022年12月31日 |
|
||
未払報酬 |
|
$ |
|
|
$ |
|
||
未払所得税 |
|
|
— |
|
|
|
|
|
オペレーティング・リース負債の現在の部分 |
|
|
|
|
|
|
||
臨床的発生数 |
|
|
|
|
|
|
||
ヴィンバイオケアの契約上の責任 |
|
|
|
|
|
|
||
その他の未払研究開発費 |
|
|
|
|
|
|
||
合計 |
|
$ |
|
|
$ |
|
||
注意 5.借金
ウェルズ・ファーゴ信用契約
11
2023年4月21日、当社の完全子会社であるArcturus Therapeutics, Inc. は、全米協会のウェルズ・ファーゴ銀行(「ウェルズ・ファーゴ」)と信用契約を締結しました。これにより、ウェルズ・ファーゴは1ドルを稼ぐことになります。
契約に基づく借入には、次の金利で利息がかかります
契約期間は
製造サポート契約
2020年11月7日、当社の完全子会社であるArcturus Therapeutics, Inc. は、シンガポール共和国経済開発委員会(以下「EDB」)と製造支援契約(「サポート契約」)を締結しました。サポート契約に従い、EDBはシンガポールドルのタームローン(「シンガポールローン」)を行うことに合意しました。
2023年6月30日までの3か月間、同社は記録しました
ウエスタンアライアンス銀行との契約の終了
2023年3月14日、アリゾナ州の法人であるウエスタンアライアンスバンク(「ウエスタンアライアンス」)との2018年10月12日付けのローンおよび担保契約(修正および補足により、「ウエスタンアライアンス契約」)は、ウエスタンアライアンスが約$のペイオフ額を受領した時点で終了(以下「解約」)されました
2023年6月30日までの3か月間、同社は記録しました
12
注意 6.株主資本
1株当たり純損失
2023年6月30日までの3か月と6か月間の希薄化後の1株当たり純損失の計算に含まれていなかった希薄化の可能性のある有価証券の合計は
注意 7.株式ベースの報酬費用
2022年6月、当社の2022年年次株主総会(「2022年次総会」)で、当社の株主は、当社の2019年オムニバス株式インセンティブプラン(修正後、「2019年プラン」)の改正を承認しました。これにより、とりわけ、2019年プランに基づいて適格者への報奨を行う際に使用が承認された株式の総数が増加しました。
2021年10月、当社は2021年のインセンティブ・エクイティ・インセンティブ・プランを採用しました。このプランでは、最大以下の賞が対象となります。
ストックオプション
会社の要約連結損益計算書に含まれる株式ベースの報酬費用と、終了した3か月と6か月の包括損失 2023年6月30日、2022年6月30日は次のとおりでした。
|
|
3 か月間 |
|
|
|
6 か月間 |
|
||||||||||||
(千単位) |
|
2023 |
|
|
|
2022 |
|
|
|
2023 |
|
|
|
2022 |
|
||||
研究開発 |
|
$ |
|
|
|
$ |
|
|
|
$ |
|
|
|
$ |
|
||||
一般管理と管理 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
合計 |
|
$ |
|
|
|
$ |
|
|
|
$ |
|
|
|
$ |
|
||||
ノート 8.所得税
同社は、米国およびさまざまな州で課税の対象となっています。会社は、予測される年間実効税率を使用して四半期所得税引当金を計算し、四半期中に発生する個別の項目を調整します。実効税率と連邦法定税率の主な違いは、連邦および州の所得税費用が会社の繰延税金資産の評価引当金によって相殺されることです。
2023年6月30日に終了した3か月と6か月の間、会社は$を記録しました
ノート 9.コミットメントと不測の事態
嚢胞性線維症財団契約
2019年8月1日、当社は2017年5月16日付けで2018年7月13日に修正された嚢胞性線維症財団(「CFF」)との開発プログラムレター契約を修正しました。修正条項に従い、(i) CFFはLUNAR-CFを前払いするために授与される金額を$に引き上げました
13
リース
2017年10月、同社は以前使用していた本社に隣接するオフィススペースについて、キャンセル不可のオペレーティングリース契約を締結しました。リースの開始は2018年3月に始まり、リースの期間は約
2020年2月、同社は現在の本社近くのオフィススペースを対象に、キャンセル不可の2回目のオペレーティングリース契約を締結しました。リースの延長は
2021年9月、当社は現在の本社近くのオフィス、研究開発、エンジニアリング、ラボスペースに関する解約不可の3番目のリース契約を締結し、リース期間は2022年の第2四半期に開始されました。最初のリース期間が延長されます
要約連結貸借対照表のオペレーティングリースの使用権資産と負債は、残りのリース期間における残りのリース支払いの現在価値を表します。同社はリース料をリース以外のコンポーネントに割り当てていません。したがって、共用エリアの保守および管理サービスの支払いは、オペレーティングリースの使用権資産および負債には含まれません。リースの暗黙の金利は簡単には判断できないため、会社は増分借入金利を使用してリース支払いの現在価値を計算します。
現在 2023年6月30日、オペレーティングリース負債の残りの支払い額は次のとおりです。
(千単位) |
|
残りのリース料 |
|
|
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
その後 |
|
|
|
|
残りのリース支払い総額 |
|
|
|
|
控える:帰属 |
|
|
( |
) |
オペレーティングリース負債総額 |
|
$ |
|
|
加重平均残存リース期間 |
|
|
||
加重平均割引率 |
|
|
% |
|
オペレーティングリースの費用は、固定料金で構成されていますASEの支払いはオペレーティングリースの負債に含まれ、リース期間全体にわたって定額で記録されます。オペレーティングリースの費用は $
14
注意 10.関連当事者間の取引
持分法投資
2018年6月、同社はADAIR技術に関連する無形資産の売却を完了しました。ADAIRの資産購入契約に従い、同社は
2022年12月13日、VallonはGRI Bio, Inc.(「GRI Bio」)と契約を締結しました。この契約に基づき、GRI BioはVallonの完全子会社と全株式取引で合併することになっていました。取引は2023年4月に完了し、会社の幹部はVallonの取締役会を辞任しました。合併の完了後、合併後の会社は現在「GRI Bio, Inc.」という名前で運営されており、GRI Bioのパイプラインの開発とナスダックでのティッカーシンボル「GRI」での取引に焦点を当てます。合併の完了後、同社は
15
アイテム 2.経営陣の議論と分析財政状態と経営成績。
以下は、2023年6月30日までの3か月および6か月間のアークトゥルス・セラピューティクス・ホールディングス社の財政状態と経営成績についての説明です。本書に特に明記されていない限り、「会社」、「アークトゥルス」、「私たち」、「私たち」とは、アークトゥルス・セラピューティクス・ホールディングス株式会社とその連結子会社を意味します。以下の考察と分析を、本書の他の場所に含まれる中間要約連結財務諸表および関連注記とともにお読みください。経営陣による財務状況と経営成績に関する議論と分析に関する追加情報については、2023年3月29日に米国証券取引委員会(以下「委員会」)に提出された2022年12月31日に終了した年度のフォーム10-Kの年次報告書(「2022年次報告書」)を参照してください。本書で特に定義されていない限り、本書で使用される大文字の単語や表現は、2022年の年次報告書に記載されているものと同じ意味を持つものとします。
このレポートには将来の見通しに関する記述が含まれていますが、これらは当社が合理的と考える仮定に基づいていますが、実際の出来事や状況が、そのような将来の見通しに関する記述によって現在予測され、明示または暗示されているものと大きく異なる可能性があります。
このレポートと、このレポートで参照し、このレポートの別紙として提出した文書をよく読んでください。また、実際の将来の結果は予想と大きく異なる可能性があることを理解した上で。また、この報告の日付以降に委員会に提出または提出する報告書に記載されている要因とリスクを確認する必要があります。
[概要]
私たちは、感染症ワクチンの開発と肝臓や呼吸器系の希少疾患における機会に焦点を当てた、後期臨床メッセンジャーRNA医薬品の世界的な会社です。メッセンジャーRNA(「mRNA」)プラットフォーム、当社独自の脂質ナノ粒子(「LNP」)デリバリーシステムであるLUNARに加えて®は、複数の核酸医薬品を可能にする可能性を秘めており、当社独自の自己増幅型mRNA技術(自己転写複製RNA、またはSTARR、技術)は、従来のmRNAと比較して、より低い用量レベルでより長持ちするRNAと持続的なタンパク質発現を提供する可能性があります。
私たちは独自のLUNARプラットフォームと核酸技術を活用して、満たされていない重大な医療ニーズがある感染症や希少な遺伝性疾患に対するmRNAベースのワクチンと治療薬のパイプラインを開発し、発展させています。私たちは、発見の取り組みを拡大できる新しい革新的な配信ソリューションを追加することで、このプラットフォームを拡大し続けています。当社独自のLUNAR技術は、RNA医薬品開発の主要なハードル、つまり疾患に関連する標的組織へのRNA治療薬の効果的かつ安全な送達に対処することを目的としています。複数の組織をターゲットにする当社のプラットフォームの多様性、さまざまな核酸治療薬との互換性、およびスケーラブルな製造プロセスの開発に関する専門知識により、次世代の核酸医薬品を提供できると考えています。
16
ビジネスアップデート
ワクチンプログラムの最新情報
2022年11月、私たちはCSL Limitedの一部であり、世界有数のインフルエンザワクチンプロバイダーの1つであるSeqirus, Inc.(「CSL Seqirus」)と、COVID-19、インフルエンザ、その他3つの非独占的な呼吸器感染症に対する自己増幅型mRNAワクチンの研究、開発、製造、および商品化の世界的な独占権に関するコラボレーションおよびライセンス契約(「CSLコラボレーション契約」)を締結しました。パンデミック病原体に対する権利。CSLコラボレーション契約は2022年12月8日に発効しました。このコラボレーションは、CSL Seqirusが確立したグローバルなワクチンの商業および製造インフラストラクチャと、Arcturusの製造に関する専門知識と革新的なSTARRを組み合わせたものです。®自己増幅型mRNAワクチンとLUNAR®配信プラットフォーム技術。CSL Seqirusとの共同研究の枠組みのもと、季節性インフルエンザワクチン(LUNAR-FLU mRNAワクチン候補)の有効性と安全性を前臨床試験で評価しています。感染症分野の日本のリーダーである明治ホールディングス株式会社(「明治」)の子会社である明治製菓製薬株式会社と2022年12月に締結した第三者研究契約に基づき、ARCT-154のブースターショットの安全性と免疫原性を評価し、非ARCT-154の非評価を目的として、明治はARCT-154の第3相臨床試験を日本で開始しました。ブースターとしてのARCT-154は劣っています。この試験は合計780人の成人参加者を対象としており、半分はARCT-154グループ、もう半分は比較グループ(Comirnaty)でした®、ファイザー-バイオエヌテック)、2023年2月に828人が参加して登録を完了しました。
2023年4月11日、明治はCSL Seqirusと、COVID-19に対する自己増幅型mRNAワクチン候補であるARCT-154の日本での販売と販売に関する契約を締結したと発表しました。
2023年4月28日、明治は、日本の成人のCOVID-19を予防するための一次予防接種のARCT-154を製造および販売するための新薬申請(NDA)を日本医薬品医療機器総合機構(PMDA)に提出したと発表しました。
2023年4月、CSL SeqirusからARCT-154の製造と供給のための2360万ドルの前払いを受け取りました。前払いは、使用した原薬、予約料、および関連する製造要件を含む、ARCT-154の特定の製造工程に対してです。
2023年6月30日、明治は、日本の成人の新型コロナウイルスを予防するために、ARCT-154の追加投与をPMDAに追加申請したことを発表しました。
2023年7月13日、「自己増幅型SARS-CoV-2 RNAワクチンとmRNAワクチンの追加投与量:ARCT-154とComirnatyの第3相比較」というタイトルの記事がMedRxiv.orgの https://www.medrxiv.org/content/10.1101/2023.07.13.23292597v1 に投稿されました。この記事は、明治が日本で実施したARCT-154の第3相臨床試験の中間結果に基づいており、COVID-19に対するブースターとしてのARCT-154の安全性と免疫原性を、Comirnatyと比較して評価しています。記事はプレプリントであり、ピアレビューによる認定は受けていません。
2023年8月7日、私たちは第1/2相臨床試験のデータで、検証済みの微量中和化(MNT)アッセイを用いて測定したARCT-154ブースターワクチン投与後の免疫反応の1年間の持続性が示されたことを発表しました。フェーズ1/2の研究データは、米国とシンガポールの12人の参加者からのものです。中和抗体の幾何平均倍率上昇(GMFR)は、ARCT-154ブースターを受けた参加者について、D614G変異を持つ祖先株、ベータ(B.1.351)、デルタ(B.1.617.2)、オミクロン(BA.1)を含むSARS-CoV-2変異体のパネル全体で1年間ベースラインの10倍以上高いままでした。参加者
17
研究以外のCOVID-19ワクチンを接種した人、またはSARS-CoV-2のPCR結果が陽性だった人は、イベント後の分析から除外されました。他の探索的アッセイでも同様の傾向が示されました。
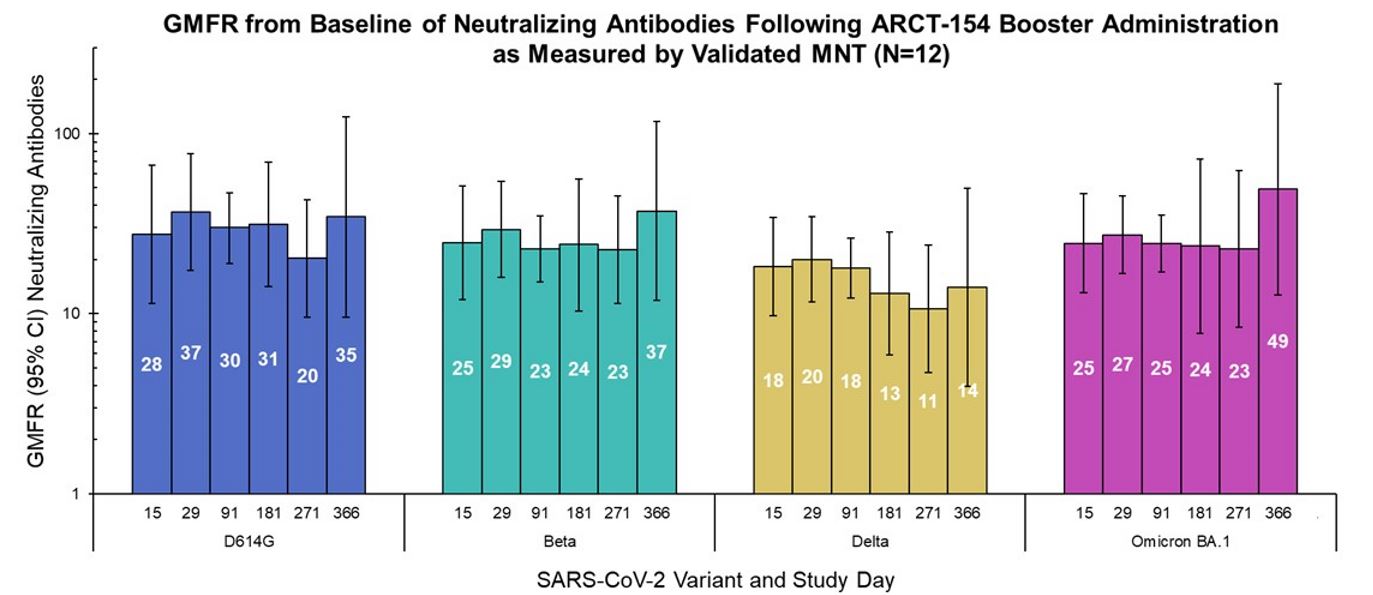
ARCT-154ブースターワクチン接種後の、SARS-CoV-2変異体に対する中和抗体の幾何平均倍数上昇(GMFR)(ブースター前レベルとの比較)は、検証済みの疑似ウイルスマイクロ中和アッセイ(N=12)で測定されました。エラーバーは95%のCIを表します。GMFR値は白で表示されています。フォローアップ期間中にCOVID-19ワクチンを接種した参加者、または検査室でSARS-CoV-2感染が確認された参加者は、イベント後のサンプリング時間に免疫原性分析から除外されました。
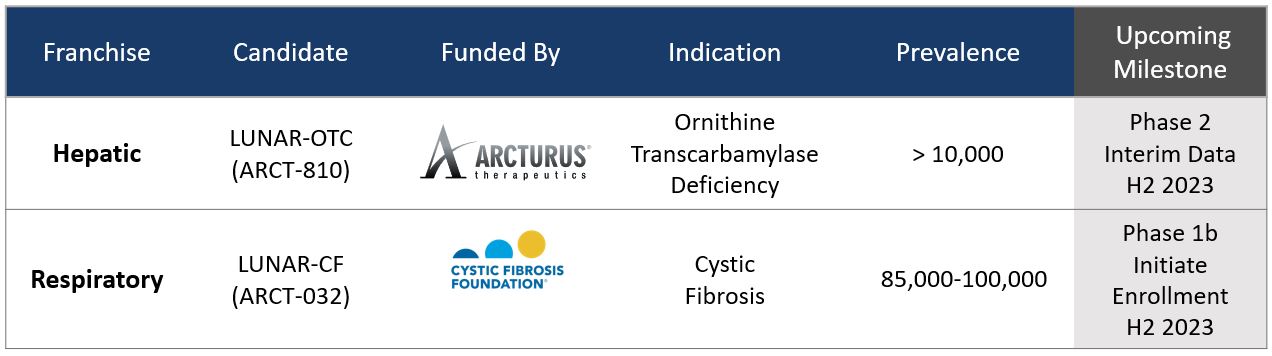
アークトゥルスが所有するmRNA治療薬開発候補に関する重要な最新情報
次の表は、アークトゥルスが所有するmRNA治療薬候補の現在のパイプラインを表しています。
18
コラボレーション協定の最新情報
ウルトラジェニクス
2015年10月26日、私たちはUltragenyxと研究協力およびライセンス契約を締結しました。この契約はその後、2017年、2018年、および2019年の第2四半期に修正されました(修正されたとおり、「Ultragenyx契約」)。2021年12月1日、Ultragenyxは、グリコーゲン蓄積症III型の治療のために共同開発中のメッセンジャーRNA療法であるUX053の第1/2相試験で最初の患者に投与したことを発表しました。これにより、共同研究契約に基づく最初のマイルストーンが達成されました。Ultragenyxは、UX053の第1/2相試験の単回昇順投与(SAD)段階での投与を完了しましたが、安全上の問題は見られませんでした。Ultragenyxは、他の後期段階やより大きな適応症の臨床プログラムに集中できるように、現時点では複数の昇順投与コホートに患者を登録しないことを明らかにしました。Ultragenyxは、SADコホートのデータが分析されており、2023年の第2四半期に予定されていると発表しました。2023年6月18日、リザーブドターゲットの独占期間が終了しました。この有効期限が切れる前に、Ultragenyxは予約されたターゲットのいくつかについてオプションを行使し、それによってそれらを契約に基づく開発ターゲットに変換しました。
CureVac
2018年1月1日、私たちはCureVacと開発およびオプション契約を締結しました。この契約は2018年5月3日に修正され、2018年9月28日に修正され、2019年7月24日に修正されました(修正および改訂されたとおり、「開発およびオプション契約」)。開発およびオプション契約の条件に基づき、CureVacとArcturusは共同の前臨床開発プログラムを実施することに合意し、私たちはCureVacに当社の特定の技術(「Arcturus LMD技術」)とCureVac技術を組み込んだ特定の製品を開発および商品化するライセンスを付与しました。CureVacは、有効期限が切れる前に期間を延長するオプションを行使しませんでした。また、開発およびオプション契約は2023年7月24日に失効しました。
研究とプラットフォーム活動の最新情報
私たちは、ゲノム編集の評価や新しいターゲティングアプローチなど、探索的なプラットフォーム開発活動を続けています。私たちのLUNARでは®とスター®プラットフォームは、私たちのポートフォリオに追加する製品の特定と開発に役立つ可能性があります。
供給と製造に関する最新情報
私たちは、Aldevron、Catalent、Recipharm、Polymun、Arcalisなどのパートナーとともに、グローバルな製造拠点を築いてきました。このような協力により、米国、EU、アジアに拠点を置く一次調達および二次調達受託開発製造組織(CDMO)と、重要な原材料、原薬、およびパッケージ化された完成品を生産する統合グローバルサプライチェーンネットワークを確立しました。COVIDワクチンの市場が複数回投与のバイアル形式から低用量の単回投与バイアル形式に移行する中、私たちは引き続き協力者であるCSL Seqirusとともに、製造プロセスと能力、技術移転を評価および進め、COVIDワクチンの備蓄と商品化に備えています。
業務結果
当社の財政状態と経営成績に関する以下の議論と分析は、本レポートの他の部分に記載されている要約連結財務諸表および関連注記、および2022年12月31日に終了した年度の監査済み財務諸表および関連注記と併せて読む必要があります。当社の過去の経営成績およびそれに続く経営成績の前年比比較は、必ずしも将来の業績を示すものではありません。
19
収益
当社は、製薬およびバイオテクノロジーのパートナーや政府機関と、前払い、研究開発契約のライセンス料、研究開発資金、マイルストーン支払い、オプション行使および独占権、将来の販売に対するロイヤリティ、コンサルティング料、技術移転の支払いを含む契約を締結します。次の表は、指定された期間の当社の総収益をまとめたものです。
|
|
6月30日に終了した3か月間 |
|
|
2022年から2023年 |
|
||||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
||||
収益 |
|
$ |
10,519 |
|
|
$ |
27,093 |
|
|
$ |
(16,574 |
) |
|
|
-61.2 |
% |
2022年6月30日までの3か月間と比較して、2023年6月30日までの3か月間の収益は1,660万ドル減少しました。この減少は主に、Vinbiocareとの契約の終了に関連した1,270万ドルの収益の減少と、イスラエル保健省との契約に関連した1,250万ドルの収益の減少によるものです。この減少は主に、2022年後半に締結されたCSL Seqirusとのコラボレーション契約とBARDAとの助成金契約に関連する860万ドルの収益の増加によって相殺されました。
|
|
6月30日に終了した6か月間 |
|
|
2022年から2023年 |
|||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|||
収益 |
|
$ |
90,804 |
|
|
$ |
32,337 |
|
|
$ |
58,467 |
|
|
* |
* 100% より大きい
2022年6月30日までの6か月間と比較して、2023年6月30日までの6か月間の収益は5,850万ドル増加しました。この増加は、主に2022年後半に締結されたCSL Seqirusとのコラボレーション契約とBARDAとの助成金契約に関連して、8,760万ドルの収益増加によるものです。この増加は主に、以下の収益の減少によって相殺されました。(i) Vinbiocareとの契約の終了に関連する1,560万ドル、(ii) イスラエル保健省との契約に関連する1,250万ドル、(iii) ヤンセンとの契約の終了に関連する100万ドルの収益の減少によって相殺されました。
当社の営業費用は、研究開発費と一般管理費で構成されています。
|
|
6月30日に終了した3か月間 |
|
|
2022年から2023年 |
|
|
6月30日に終了した6か月間 |
|
|
2022年から2023年 |
|
||||||||||||||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
||||||||
営業経費: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
研究開発、純額 |
|
$ |
52,668 |
|
|
$ |
38,189 |
|
|
$ |
14,479 |
|
|
|
37.9 |
% |
|
$ |
104,436 |
|
|
$ |
83,082 |
|
|
$ |
21,354 |
|
|
|
25.7 |
% |
一般管理と管理 |
|
|
13,225 |
|
|
|
10,993 |
|
|
|
2,232 |
|
|
|
20.3 |
% |
|
|
26,987 |
|
|
|
21,723 |
|
|
|
5,264 |
|
|
|
24.2 |
% |
合計 |
|
$ |
65,893 |
|
|
$ |
49,182 |
|
|
$ |
16,711 |
|
|
|
34.0 |
% |
|
$ |
131,423 |
|
|
$ |
104,805 |
|
|
$ |
26,618 |
|
|
|
25.4 |
% |
研究開発費、純額
次の表は、当社の研究開発費の合計をカテゴリー別に示しています。
|
|
6月30日に終了した3か月間 |
|
|
2022年から2023年 |
|
|
6月30日に終了した6か月間 |
|
|
2022年から2023年 |
|
||||||||||||||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
||||||||
外部パイプライン開発費: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
ルナ・コビッド、ネット |
|
$ |
19,688 |
|
|
$ |
16,939 |
|
|
$ |
2,749 |
|
|
|
16.2 |
% |
|
$ |
42,516 |
|
|
$ |
44,755 |
|
|
$ |
(2,239 |
) |
|
|
-5.0 |
% |
ルナ-OTC、ネット |
|
|
2,200 |
|
|
|
2,764 |
|
|
|
(564 |
) |
|
|
-20.4 |
% |
|
|
5,519 |
|
|
|
4,408 |
|
|
|
1,111 |
|
|
|
25.2 |
% |
初期段階のプログラム |
|
|
7,563 |
|
|
|
2,323 |
|
|
|
5,240 |
|
|
* |
|
|
|
12,432 |
|
|
|
4,230 |
|
|
|
8,202 |
|
|
* |
|
||
ディスカバリー・テクノロジーズ |
|
|
6,853 |
|
|
|
3,242 |
|
|
|
3,611 |
|
|
* |
|
|
|
11,604 |
|
|
|
4,607 |
|
|
|
6,997 |
|
|
* |
|
||
外部プラットフォーム開発費用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
人件費関連費用 |
|
|
13,458 |
|
|
|
10,533 |
|
|
|
2,925 |
|
|
|
27.8 |
% |
|
|
26,728 |
|
|
|
20,850 |
|
|
|
5,878 |
|
|
|
28.2 |
% |
施設や設備費 |
|
|
2,906 |
|
|
|
2,388 |
|
|
|
518 |
|
|
|
21.7 |
% |
|
|
5,637 |
|
|
|
4,232 |
|
|
|
1,405 |
|
|
|
33.2 |
% |
研究開発費の合計、純額 |
|
$ |
52,668 |
|
|
$ |
38,189 |
|
|
$ |
14,479 |
|
|
|
37.9 |
% |
|
$ |
104,436 |
|
|
$ |
83,082 |
|
|
$ |
21,354 |
|
|
|
25.7 |
% |
* 100% より大きい
当社の研究開発費は、主に外部の製造コスト、受託研究機関、臨床および規制コンサルタント、人件費および施設関連コンサルタントによる生体内調査および臨床試験、人件費および施設関連費用で構成されています
20
研究開発活動の実施に関連する費用と実験用品。2023年6月30日までの3か月間の研究開発費は、昨年の同時期の3,820万ドルから5,270万ドルでした。これは主に、臨床研究および製造コストが1,140万ドル増加し、人件費が290万ドル増加したことを反映しています。2023年6月30日までの6か月間の研究開発費は、前年同期の8,310万ドルに対し、1億440万ドルでした。これは主に、製造コストが1,110万ドルの増加、人件費590万ドルの増加、コンサルティング費用の180万ドルの増加、施設費用の130万ドルの増加、および認識された対比研究開発費の減少を反映しています。。この増加は主に、120万ドルの臨床関連費用の減少によって相殺されました。パイプラインが進むにつれて、研究開発努力と関連コストは増加し、今後数年間は引き続き相当額になると予想しています。
初期段階のプログラムとは、前臨床段階または第1相臨床段階にあるプログラムのことで、LUNAR-CFやLUNAR-FLUプログラムなど、提携している場合もあれば、提携していない場合もあります。ディスカバリーテクノロジーは、製品パイプラインを拡大するための私たちの取り組みを表しており、主に提携前の調査と新能力評価に関係しています。一部のプログラムでは、活動は協力関係やその他の関係の一部であり、費用の一部は会社に授与された資金で相殺される場合があります。費用は主に、外部の製造コスト、実験用品、機器、コンサルティング、専門家費用で構成されています。初期段階のプログラムとディスカバリー・テクノロジーの費用は、どちらも今後数年間で着実に増加すると予想されます。
人件関連の費用は、主に従業員の給与と福利厚生、株式ベースの報酬、コンサルタントで構成されており、外部のパイプライン、プラットフォーム、臨床試験の取り組みのニーズを満たすために人員を増やし続けるため、近い将来も増加し続けると予想されます。さらに、従業員を維持するために市場金利の上昇に合わせて給与を引き上げるため、人件費は増え続けるでしょう。
施設や設備費は、事業を拡大するにつれて増え続けています。2023年6月30日までの6か月間には、2022年4月に所有した新しい施設に関連する家賃および関連費用の増加が含まれています。施設や設備費は、3つの施設に関連する家賃費の増加により、短期的には増加すると予想されます。
一般管理費
一般管理費は、主に、当社の役員、管理、法務、会計機能の給与および関連給付、法務および会計サービスの専門サービス料、およびその他の一般管理費で構成されます。
2023年6月30日までの3か月と6か月の一般管理費は、それぞれ1,320万ドルと2,700万ドルでしたが、昨年の同時期には1,100万ドルと2,170万ドルでした。増加は主に、人員と給与の増加による人件費の増加、旅費とコンサルティング費の増加、および新しい施設に関連する家賃費の増加によるものです。
財務(費用)収入、純額
|
|
6月30日に終了した3か月間 |
|
|
2022年から2023年 |
|
6月30日に終了した6か月間 |
|
|
2022年から2023年 |
|
|||||||||||||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
|||||||
利息収入 |
|
$ |
3,252 |
|
|
$ |
168 |
|
|
$ |
3,084 |
|
|
* |
|
$ |
6,472 |
|
|
$ |
322 |
|
|
$ |
6,150 |
|
|
* |
|
|
支払利息 |
|
|
— |
|
|
|
(728 |
) |
|
|
728 |
|
|
* |
|
|
(743 |
) |
|
|
(1,446 |
) |
|
|
703 |
|
|
|
-48.6 |
% |
合計 |
|
$ |
3,252 |
|
|
$ |
(560 |
) |
|
$ |
3,812 |
|
|
* |
|
$ |
5,729 |
|
|
$ |
(1,124 |
) |
|
$ |
6,853 |
|
|
* |
|
|
* 100% より大きい
利息収入は現金および現金同等物で生み出されます。2023年6月30日までの3か月および6か月間の利息収入が昨年の同時期と比較して増加したのは、主に金利の上昇と、CSL Seqirus契約に基づいて受領した金額の結果としての現金残高の増加によるものです。2023年の第1四半期にウエスタンアライアンス協定が消滅し、シンガポールの融資が免除されたため、2023年の第2四半期には支払利息が発生しなかったため、支払利息が減少しました。
21
その他の収入と支出
|
|
6月30日に終了した3か月間 |
|
|
2022年から2023年 |
|
|
6月30日に終了した6か月間 |
|
|
2022年から2023年 |
|
||||||||||||||||||||
(千単位) |
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
|
2023 |
|
|
2022 |
|
|
$ 変更 |
|
|
% 変化 |
|
||||||||
持分法投資による損失 |
|
$ |
— |
|
|
$ |
(131 |
) |
|
$ |
131 |
|
|
|
-100.0 |
% |
|
$ |
— |
|
|
$ |
(516 |
) |
|
$ |
516 |
|
|
|
-100.0 |
% |
外貨による利益(損失) |
|
|
149 |
|
|
|
1,217 |
|
|
|
(1,068 |
) |
|
|
-87.8 |
% |
|
|
(179 |
) |
|
|
1,376 |
|
|
|
(1,555 |
) |
|
* |
|
|
債務消滅による利益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
0.0 |
% |
|
|
33,953 |
|
|
|
— |
|
|
|
33,953 |
|
|
|
100.0 |
% |
合計 |
|
$ |
149 |
|
|
$ |
1,086 |
|
|
$ |
(937 |
) |
|
|
-86.3 |
% |
|
$ |
(179 |
) |
|
$ |
860 |
|
|
$ |
(1,039 |
) |
|
* |
|
|
* 100% より大きい
その他の収益および費用項目は、主に持分法投資と外貨取引による損益に関するものです。さらに、2023年の第1四半期にシンガポールの融資が免除された結果、2023年6月30日までの6か月間に、シンガポールの融資に関連する債務消滅による3,400万ドルの利益を記録しました。
GRI Bio, Inc.(旧Vallon Pharmaceuticals, Inc.)への投資に関連して、2022年6月30日までの3か月と6か月でそれぞれ10万ドルと50万ドルの損失があったのに対し、2023年6月30日までの3か月と6か月には利益も損失も記録されませんでした。
2023年6月30日までの3か月と6か月と2022年6月30日までの3か月と6か月間の外貨からの利益(損失)の変動は、主に2023年の第1四半期にシンガポールのローンが免除されたことに起因しています。外貨からの利益(損失)として記録される残りの金額は、外貨で行われた取引に関するものです。
貸借対照表外の取り決め
2023年6月30日まで、当社は、貸借対照表外の取り決めの円滑化やその他の契約上限定された目的のために設立された、非連結事業体または財務協力(ストラクチャード・ファイナンスや特別目的事業体と呼ばれることが多い事業体など)を締結しておらず、関係もありませんでした。
流動性と資本資源
会社の設立から2023年6月30日に終了した四半期まで、当社は主に資本金、長期負債の売却による収入、および協力契約や政府契約によって得た収益で事業資金を調達してきました。2022年の第4四半期に、CSL Seqirusから2億ドルの前払い金を受け取りました。さらに、2023年6月30日までの3か月間に、CSL Seqirusから9,000万ドルのマイルストーン支払いと、ARCT-154の製造と供給のための2,360万ドルを受け取りました。今後、主にCSLコラボレーション契約に関連する将来のマイルストーンを達成することで、CSL Seqirusから支払いを受けることを期待しています。2023年6月30日の時点で、無制限の現金および現金同等物が3億2,350万ドルありました。
CSL Seqirus, Inc. コラボレーションとライセンス契約
私たちは、自己増幅型mRNAワクチンの研究、開発、製造、商品化の世界的な独占権について、世界有数のインフルエンザワクチンプロバイダーであるCSL Limitedの一部であるCSL SeqirusとCSLコラボレーション契約を締結しました。
CSL Seqirusは、SARS-CoV-2(COVID-19)、インフルエンザ、その他3つの呼吸器感染症に対するワクチンに関する当社の技術に対する独占的な世界的権利を取得しましたが、パンデミック病原体に対する非独占的な権利も取得しました。2022年の第4四半期に2億ドルの前払い金を受け取りました。すべての製品がライセンス対象分野に登録されていれば、合計13億ドルを超える開発マイルストーンを受け取る資格があります。また、さまざまな分野でのワクチンの「純売上」に基づいて、最大30億ドルの商業的マイルストーンを受け取る権利もあります。
さらに、COVID-19ワクチンの売上による純利益の40%、インフルエンザと他の3つの特定の感染症病原体に対するワクチンの年間純売上高の最大2桁のロイヤリティ、およびパンデミックに備えて開発される可能性のあるワクチンの収益に対するロイヤルティを受け取る権利があります。
CSL協力協定は、CSL Seqirusと私たちがどのように協力してワクチン候補の研究開発を行うかを定めています。COVID-19分野では、米国とヨーロッパにおけるARCT-154の特定の規制当局への申請、および次世代のCOVIDワクチン候補の研究開発活動を主導します。CSL Seqirusは、COVID-19、インフルエンザ、その他の分野の他のすべての研究開発を主導し、責任を負います。
22
ウェルズ・ファーゴ信用契約
2023年4月21日、当社の完全子会社であるArcturus Therapeutics, Inc. は、全米協会のウェルズ・ファーゴ銀行(「ウェルズ・ファーゴ」)と信用契約を締結しました。これにより、ウェルズ・ファーゴは、5,000万ドルのリボルビング・クレジットライン(「ウェルズ・ファーゴ・ローン」)と、各ウェルズ・ファーゴのローンを回転クレジットノート(「リボルビング・クレジット・ノート」)で証明します(「注意」)。
契約に基づく借入には、デイリー・シンプルSOFRまたはタームSOFR(これらの用語はウェルズ・ファーゴ紙幣で定義されています)のいずれかを1.00%上回る利息がかかります。「SOFR」は、ニューヨーク連邦準備銀行が管理する担保付きオーバーナイト融資金利に等しい年利です。債務不履行事由(信用契約で定義されているとおり)が発生した場合、ウェルズ・ファーゴの融資はすべて、債務不履行事由の発生直前に適用された金利を2.00%上回る金利で利息を負うものとします。
契約期間は2年間です。1年間の更新のオプションはウェルズ・ファーゴの承認を条件とし、会社はそのような更新のたびにウェルズ・ファーゴのローン金額の0.25%に相当する返金不可のコミットメント手数料をウェルズ・ファーゴに提供します。契約を解除しても違約金はありません。ウェルズ・ファーゴ紙幣の満期日より前に施設を終了しても違約金はありません。担保として、当社は、担保契約に基づき、ウェルズ・ファーゴの関連会社であるウェルズ・ファーゴ証券合同会社との間で5,500万ドルの現金を当社の証券口座に預けることに合意しました。
生物医学先端研究開発局からの助成金
2022年8月31日、当社独自の自己サンプリングに基づく低用量のパンデミックインフルエンザ候補の開発を支援するために、米国保健社会福祉省(HHS)内の準備と対応担当次官補(ASPR)の一部門である生物医学先端研究開発局(「BARDA」)と費用償還契約(「BARDA契約」)を締結しました。メッセンジャーRNAベースのワクチンプラットフォーム。BARDA契約は、当社の非臨床および前臨床開発、初期段階の臨床開発からフェーズ1まで、および関連する医薬品の製造、規制、品質保証活動を3年間にわたって支援することです。これにより、BARDAは許容される費用を最大6,320万ドルまで払い戻すことができます。
ビンバイオケア契約
2021年に、私たちはVingroup Joint Stock CompanyのメンバーであるVinbiocareと技術ライセンスおよび技術サポート契約(総称して「Vinbiocareライセンス&サプライ契約」)を締結しました。これにより、Vinbiocareに技術的な専門知識とサポートサービスを提供して、ベトナムでのmRNA医薬品製造施設の建設を支援することになります。Vinbiocareのライセンスおよび供給契約の一環として、合計4,000万ドルの前払い金を受け取りました。2022年10月、私たちはVinbiocareのライセンスおよび供給契約の終了に関連して、VinbiocareとVinbiocareサポート契約を締結しました。これにより、Vinbiocareの臨床上の義務は継続され、ライセンスおよび供給契約から受け取った当初の4,000万ドルの前払い金の一部を将来の期間にわたって支払うことを留保しました。
Vinbiocareサポート契約では、2025年の第1四半期までに特定の事象が発生した場合を含め、一定の制限付き支払いをVinbiocareに支払うことが義務付けられています。Vinbiocareは、ARCT-154(または次世代COVIDワクチン)の純売上高(ある場合)に対してArcturusが受け取った金額の1桁の割合を上限額まで受け取る資格もあります。
一般的な財源
現在の現金残高の一部は、2023会計年度中に、(i)LUNAR-OTC候補であるARCT-810の継続的な第2相試験、(ii)臨床試験におけるLUNAR-CFプログラムへの進出、(iii)CSLコラボレーション契約およびBARDA契約に基づく顧客支払いの前に発生した費用、および(iv)当社のプラットフォームおよびその他の一般管理に関連する継続的な調査活動に充てられる予定です。アクティビティ。
私たちの将来の資本要件は予測が難しく、私たちの手に負えない多くの要因に左右されます。十分な財源を維持できない場合、当社の事業、財政状態、経営成績は重大かつ悪影響を受けます。許容できる条件で、あるいはまったく必要な資金を調達できるという保証はありません。さらに、エクイティまたはデットファイナンスは、既存の株主の持ち株に希薄化効果をもたらす可能性があります。
長期的には引き続き追加の損失が発生すると予想され、CSLコラボレーション契約内のマイルストーンを履行するか、追加の負債またはエクイティファイナンスを調達するか、開発資金を調達するために追加のパートナーシップを締結する必要があります。私たちが収益を上げられるかどうかは、CSLコラボレーション契約内のマイルストーンを実行し、成功するmRNA薬とワクチンの候補を特定して開発できるかどうかにかかっています。計画したマイルストーンを達成できなかったり、予測を超える費用が発生したりした場合は、裁量支出を削減し、プログラムの一部または全部の開発を中止する必要があります。その結果、開発プログラムの一部が遅れ、そのすべてが意図した事業目標を達成する能力に重大な悪影響を及ぼします。
23
資金要件
当面は引き続き損失が発生すると予想しています。また、製品候補の開発を続け、規制当局の承認を求め、製品の商品化を開始するにつれて、損失は増加すると予想しています。その結果、長期計画をサポートするために、事業資金を調達するために追加の資本が必要になります。当社の現在のキャッシュポジションは、とりわけ、予期しない多額の費用がなく、パートナーからの資金が予想される水準で継続していることを前提として、少なくとも今後12か月間は予想される現金要件を満たすのに十分であると考えています。私たちは、エクイティやデットファイナンス、パートナーとの共同またはその他の資金調達の取り決め、またはその他の資金源を通じて、追加の資本を求めるつもりです。外部から追加の資金調達を求めると、私たちに受け入れられる条件でそのような資金を調達できないか、まったく調達できない可能性があります。必要なときに、または許容できる条件で追加の資本を調達できない場合、製品候補の拡大縮小または中止、人員の削減、資産の清算、破産の申請、再編、他の事業体との合併、または事業の停止を求められることがあります。
私たちの将来の資金調達要件は予測が難しく、次のような多くの要因に左右されます。
重要な会計方針と見積もり
私たちは、GAAPに従って要約連結財務諸表を作成します。そのため、入手可能な情報に基づいて、合理的と思われる特定の見積もり、判断、仮定を行います。これらの判断には、本質的に不確実であり、報告された経営成績や財務状況に大きな影響を与える可能性のある事項の影響についての見積もりが含まれます。当社の重要な会計方針については、2022年12月31日に終了した年度の連結財務諸表の注記2で詳しく説明しています。
2022年の年次報告書に含まれる項目7「経営陣による財政状態と経営成績に関する議論と分析」に記載されている情報によると、当社の重要な会計方針と見積もりに重大な変更はありません。
24
アイテム 3.定量的・質的e 市場リスクに関する開示
私たちが主に市場リスクにさらされるのは、利息収入の感応性です。これは、米国の一般的な金利水準の変動の影響を受けます。当社の現金および現金同等物の性質上、当社はいかなる重大な市場リスクにさらされることもないと考えています。外貨やその他のデリバティブ金融商品はありません。
アイテム 4.コントロールと手順。
開示管理と手続きの評価
取引法の規則13a-15(b)および規則15d-15(b)で義務付けられているように、当社の最高経営責任者、最高財務責任者、最高会計責任者を含む当社の経営陣は、フォーム10-Qのこの四半期報告書の対象期間の終了時点で、当社の開示管理および手続きの設計と運用の有効性について評価を実施しました。その評価に基づいて、経営陣は、2023年6月30日現在、会社の開示管理と手続きは妥当な保証レベルで有効であると結論付けました。このフォーム10-Qに含まれる2023年6月30日までの四半期期間の要約連結財務諸表は、すべての重要な点において、当社の財政状態、経営成績、包括損失、株主資本計算書、および契約期間中のキャッシュフローを公正に示していると考えています。米国で一般に認められている会計原則との適合性。
財務報告に関する内部統制の変更
取引法の規則13a-15(d)および規則15d-15(d)で義務付けられているように、当社の経営陣(最高経営責任者、最高財務責任者、最高会計責任者を含む)は、財務報告に対する内部統制を評価して、フォーム10-Qのこの四半期報告書の対象期間中に、財務に対する当社の内部統制に重大な影響を及ぼした、または重大な影響を与える可能性がかなり高い他の変更が発生していないかを判断しました報告です。その評価に基づいて、当社の最高経営責任者、最高財務責任者、および最高会計責任者は、このForm 10-Qの四半期報告書の対象期間中に、財務報告に対する当社の内部統制に重大な影響を及ぼす、または重大な影響を与える可能性がかなり高い変更はないと結論付けました。
25
パートII—その他R 情報
アイテム 1.リーガル議事録。
時々、私たちはさまざまな法的手続きに関与し、通常の業務過程で生じる請求の対象となることがあります。これには、政府の調査、知的財産、商業関係に関連するものが含まれます。そのような法的手続きや請求の対象となる内容は、非常に複雑で、かなりの不確実性が伴います。そのような手続きや請求の結果は、本案にかかわらず、本質的に不確実であり、今後も不確実です。したがって、損失の可能性や推定損害額を評価することは困難であり、かなりの判断が必要です。
アイテム 1A.リスクk ファクター。
当社の事業は、2022年12月31日に終了した会計年度のForm 10-Kの年次報告書の項目1Aに記載されているものを含め、さまざまなリスクにさらされています。これらを確認することを強くお勧めします。2023年3月29日に委員会に提出した2022年12月31日に終了した年度のフォーム10-Kの年次報告書と、2023年5月9日に委員会に提出された2023年3月31日に委員会に提出されたフォーム10-Qの四半期報告書に記載されているリスク要因から重大な変更はありません。
アイテム 2.エクイの未登録売上tyの有価証券と収益の使用。
[なし]。
アイテム 3.デフォルトはn シニア証券。
[なし]。
アイテム 4.マインセーフ情報開示を試してください。
該当しません。
アイテム 5.その他 情報。
[なし]。
26
アイテム 6.展示品。
展示物索引
展示品番号 |
|
説明 |
|
|
|
3.1 |
|
法人設立証明書。2019年3月18日に提出されたフォームS-4の登録届出書(ファイル番号333-230353)の一部を構成する委任勧誘状/目論見書の附属書Bを参照して組み込まれています。 |
|
|
|
3.2 |
|
2020年11月25日付けの修正証明書。2020年11月25日に提出されたフォーム8-Kの別紙3.1(ファイル番号001-38942)を参照して組み込まれました。 |
|
|
|
3.3 |
|
アークトゥルス・セラピューティクス細則は、2020年5月8日にSECに提出されたフォームS-3の会社の登録届出書(ファイル番号333-238139)の別紙3.2を参照して設立されました。 |
|
|
|
4.1 |
|
登録者の有価証券の説明。2022年2月28日に提出された2021年12月31日に終了した年度のフォーム10-Kの当社の年次報告書(ファイル番号001-38942)の別紙4.1を参照して組み込まれています。 |
|
|
|
10.1 |
|
補償契約の形式。2020年3月16日に提出された2019年12月31日に終了した年度のフォーム10-Kの当社の年次報告書(ファイル番号001-38942)の別紙10.1を参照して組み込まれました。 |
|
|
|
10.2 |
|
2019年のオムニバス株式インセンティブプランを修正および改訂しました。2020年8月5日に提出されたフォームS-8の登録届出書(ファイル番号333-240397)の別紙4.3を参照して組み込まれています。 |
|
|
|
10.3** |
|
2018年9月28日付けの、CureVac AGとArcturus Therapeutics Inc.との間の開発およびオプション契約の修正を修正および改訂しました。2018年10月1日に提出されたフォーム6-Kの外国民間発行者に関する当社の報告書(ファイル番号001-35932)の別紙99.2を参照して設立されました。 |
|
|
|
10.4** |
|
アークトゥルス・セラピューティクス社とシンセティック・ジェノミクス社との間の研究および独占ライセンス契約は、2017年10月24日に発効します。2018年5月14日に提出されたフォーム20-Fの別紙4.8(ファイル番号001-35932)を参照して組み込まれました。 |
|
|
|
10.5** |
|
アークトゥルス・セラピューティクス社とウルトラジェニクス・ファーマシューティカル社との間で、2015年10月26日に締結された研究協力およびライセンス契約は、2017年10月17日および2018年4月20日に修正されました。2018年5月14日に提出されたフォーム20-Fの別紙4.10(ファイル番号001-35932)を参照して組み込まれました。 |
|
|
|
10.6** |
|
アークトゥルス・セラピューティクス社とウルトラジェニクス・ファーマシューティカル社との間の研究協力およびライセンス契約の第3改正は、2019年6月18日に発効します。2019年6月20日に提出されたフォーム8-Kの別紙10.2(ファイル番号001-38942)を参照して組み込まれました。 |
|
|
|
10.7** |
|
2017年5月16日付けのアークトゥルス・セラピューティクス社と嚢胞性線維症財団との間の書簡合意書。2018年5月14日に提出されたフォーム20-Fの別紙4.11(ファイル番号001-35932)を参照して組み込まれました。 |
|
|
|
10.8** |
|
2019年8月1日付けのアークトゥルス・セラピューティクス社と嚢胞性線維症財団との間の書簡契約の修正第2号。2019年8月14日に提出されたフォーム10-Qの別紙10.16を参照して組み込まれました。 |
|
|
|
10.9** |
|
2018年1月1日付けのアークトゥルス・セラピューティクス社とCureVac AGとの間の開発およびオプション契約。2018年5月3日に修正されました。2018年5月14日に提出されたフォーム20-Fの別紙4.12(ファイル番号001-35932)を参照して組み込まれました。 |
|
|
|
10.10** |
|
2019年7月26日付けのアークトゥルス・セラピューティクス社とCureVac AGとの間の開発およびオプション契約の第3修正。2019年8月14日に提出されたフォーム10-Qの別紙10.20(ファイル番号001-38942)を参照して組み込まれました。 |
|
|
|
10.11** |
|
2012年11月28日付けのマリーナ・バイオテック社の後継者であるアークトゥルス・セラピューティクス社とプロティバ・バイオセラピューティクス社との間のライセンス契約。2018年7月10日に提出されたフォーム20-F/Aの別紙4.14を参照して組み込まれました(ファイル番号001-35932)。 |
|
|
|
10.12** |
|
2013年8月9日付けのアークトゥルス・セラピューティクス社とマリーナ・バイオテック社との間の特許譲渡およびライセンス契約2018年5月14日に提出されたフォーム20-Fの別紙4.15(ファイル番号001-35932)を参照して組み込まれました。 |
|
|
|
10.13 |
|
2019年3月18日に提出された2018年12月31日に提出された年度のフォーム10-Kの年次報告書の別紙10.13を参照して設立されたArcturus Therapeutics Ltd. とアークトゥルス・セラピューティクス・ホールディングス社との間の2019年2月11日付けの株式交換契約(ファイル番号001-35932)。 |
27
|
|
|
10.14 |
|
2017年10月4日付けのアークトゥルス・セラピューティクス社とARE-SD地域第44号LLCとの間のリース契約。2018年5月14日に提出されたフォーム20-Fの別紙4.6(ファイル番号001-35932)を参照して組み込まれました。 |
|
|
|
10.15 |
|
2020年2月1日付けのアークトゥルス・セラピューティクス・ホールディングスとARE-SD Region No. 44、LLCとの間のリース契約の第1修正。2020年3月16日に提出された2019年12月31日に終了した年度のフォーム10-Kの当社の年次報告書(ファイル番号001-38942)の別紙10.23を参照して組み込まれました。 |
|
|
|
10.16** |
|
2020年3月4日付けのアークトゥルス・セラピューティクス・ホールディングスとシンガポール経済開発委員会との間の承認書です。2020年3月16日に提出された2019年12月31日に終了した年度のフォーム10-Kの当社の年次報告書(ファイル番号001-38942)の別紙10.24を参照して組み込まれました。 |
|
|
|
10.17 |
|
2020年の従業員株式購入計画。2020年8月5日に提出されたフォームS-8(ファイル番号333-240392)の別紙4.3を参照して組み込まれています。 |
|
|
|
10.18 |
|
2020年11月13日付けのアークトゥルス・セラピューティクス社とARE-SD地域第44号LLCとの間のリースの第2改正です。2020年3月1日に提出された2020年12月31日に終了した年度のフォーム10-Kの当社の年次報告書(ファイル番号001-38942)の別紙10.29を参照して組み込まれました。 |
|
|
|
10.19 |
|
2021年2月25日付けのアークトゥルス・セラピューティクス社とARE-SD地域第44号LLCとの間のリースの第3改正です。2020年3月1日に提出された2020年12月31日に終了した年度のフォーム10-Kの当社の年次報告書(ファイル番号001-38942)の別紙10.30を参照して組み込まれました。 |
|
|
|
10.20 |
|
アークトゥルス・セラピューティクス役員向け退職金ポリシー。2021年4月26日に提出されたフォーム8-Kの最新報告書(ファイル番号001-38942)の別紙10.1を参照して組み込まれています。 |
|
|
|
10.21 |
|
2021年9月29日付けのアークトゥルス・セラピューティクス社とTPSC IX, LLCとの間のリース。2021年11月9日に提出されたフォーム10-Qの別紙10.35を参照して組み込まれました(ファイル番号001-38942)。 |
|
|
|
10.22 |
|
アークトゥルス・セラピューティクス 2021 インダクション・エクイティ・インセンティブ・プラン。2021年10月20日に提出されたフォームS-8の登録届出書(ファイル番号333-260391)の別紙4.1を参照して組み込まれています。 |
|
|
|
10.23 |
|
修正されたとおり、2019年のオムニバス株式インセンティブプランを修正および改訂しました。2022年6月30日に提出されたフォームS-8の登録届出書の別紙4.3を参照して組み込まれています。 |
|
|
|
10.24** |
|
2022年8月31日付けの、Arcturus Therapeutics Holdings Inc. と米国保健社会福祉省の生物医学先端研究開発局との間の費用償還契約。2022年11月9日に提出されたフォーム10-Qの四半期報告書(ファイル番号001-38942)の別紙10.36を参照して組み込まれています。 |
|
|
|
10.25** |
|
2022年10月31日付けのアークトゥルス・セラピューティクス社とヴィンビオケア・リサーチ・アンド・マニュファクチャリング合資会社との間の研究支援契約。2022年11月4日に提出されたフォーム8-Kの最新報告書(ファイル番号001-38942)の別紙10.1を参照して組み込まれています。 |
|
|
|
10.26** |
|
2022年11月1日付けのアークトゥルス・セラピューティクス・ホールディングスとCSLリミテッドとの間のコラボレーションおよびライセンス契約。2022年11月9日に提出されたフォーム10-Qの四半期報告書(ファイル番号001-38942)の別紙10.38を参照して組み込まれています。 |
|
|
|
10.27** |
|
2023年3月23日付けのアークトゥルス・セラピューティクス社とシンガポールの経済開発局との間の製造サポート契約終了の手紙。2023年3月29日に提出されたフォーム10-Kの年次報告書(ファイル番号001-38942)の別紙10.41を参照して組み込まれています。 |
|
|
|
10.28** |
|
2023年4月21日付けの、アークトゥルス・セラピューティクス社と全米協会のウェルズ・ファーゴ銀行との間の信用契約。2023年5月9日に提出されたフォーム10-Qの四半期報告書(ファイル番号001-38942)の別紙10.28を参照して組み込まれています。 |
|
|
|
10.29** |
|
2023年4月21日付けの、アークトゥルス・セラピューティクス社と全米協会のウェルズ・ファーゴ銀行との間のセキュリティ契約。2023年5月9日に提出されたフォーム10-Qの四半期報告書(ファイル番号001-38942)の別紙10.29を参照して組み込まれています。 |
|
|
|
10.30** |
|
アークトゥルス・セラピューティクス社と全米協会のウェルズ・ファーゴ銀行との間の2023年4月21日付けのリボルビング・ライン・オブ・クレジットノート。2023年5月9日に提出されたフォーム10-Qの四半期報告書(ファイル番号001-38942)の別紙10.30を参照して組み込まれています。 |
|
|
|
31.1* |
|
改正された1934年の証券取引法に基づく規則13a-14(a)または15d-14(a)に基づく首席執行役員の認定。 |
|
|
|
28
31.2* |
|
改正された1934年の証券取引法に基づく規則13a-14(a)または15d-14(a)に基づく最高財務責任者による証明書。 |
|
|
|
32.1* |
|
2002年のサーベンス・オクスリー法第906条に基づいて採択された、米国法第18条第1350条に基づく最高経営責任者の認定 |
|
|
|
32.2* |
|
2002年のサーベンス・オクスリー法第906条に基づいて採択された、米国法第18条第1350条に基づく最高財務責任者の認定 |
|
|
|
101* |
|
2023年3月31日に終了した会計四半期のフォーム10-Qの登録者の四半期報告書の次の財務諸表と脚注は、インライン拡張可能なビジネス報告言語(インラインXBRL)でフォーマットされています。 |
|
|
101.INSインラインXBRLインスタンスドキュメント-XBRLタグがインラインXBRLドキュメントに埋め込まれているため、インスタンスドキュメントはインタラクティブデータファイルには表示されません |
|
|
101.SCH インライン XBRL タクソノミー拡張スキーマ |
|
|
101.CAL インライン XBRL タクソノミー拡張計算リンクベース |
|
|
101.DEF インライン XBRL タクソノミー拡張定義リンクベース |
|
|
101.LAB インライン XBRL タクソノミー拡張ラベルリンクベース |
|
|
101.PREインラインXBRLタクソノミー拡張プレゼンテーションリンクベース |
104 |
|
表紙インタラクティブデータファイル (インライン XBRL ドキュメントに埋め込まれています) |
|
|
|
* ここに提出。
** この展示品の特定の機密部分は、(i) 重要ではなく、(ii) 公に開示すると競争上有害となるため、公開された文書から削除されています。
経営陣の報酬計画、契約、または手配。
29
信号チュール
1934年の証券取引法の要件に従い、登録者は署名者に代わってこの報告書に正式に署名させ、正式に権限を与えられました。
|
アークトゥルス・セラピューティクス・ホールディングス株式会社 |
|
|
|
|
日付:2023年8月7日 |
作成者: |
/s/ アンディ・サッシン |
|
|
アンディ・サッシーヌ |
|
|
最高財務責任者 |
30