アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
本四半期末まで
あるいは…。
移行期になります 至れり尽くせり .
依頼書類番号:
(登録者の正確な氏名はその定款に記載)
|
||
(明またはその他の司法管轄権 会社や組織) |
|
(税務署の雇用主 識別番号) |
|
|
|
|
|
|
|
||
(主にオフィスアドレスを実行) |
|
(郵便番号) |
(
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
取引コード |
登録された各取引所の名称 |
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社か新興成長型会社かを再選択マークで示した。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“非加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバ |
☐ |
ファイルマネージャを加速する |
☐ |
☒ |
規模の小さい報告会社 |
||
|
|
新興成長型会社 |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、違います
2023年8月1日までに
Aldeyra治療会社は
Form 10-Q四半期レポート
2023年6月30日までの四半期
索引.索引
|
ページ |
|
第1部-財務情報 |
||
第1項。 |
簡単な連結財務諸表: |
3 |
|
2023年6月30日現在(監査なし)及び2022年12月31日現在の連結貸借対照表 |
3 |
|
2023年6月30日と2022年6月30日までの3ヶ月と6ヶ月の総合業務報告書(監査なし) |
4 |
|
2023年6月30日および2022年6月30日まで3カ月および6カ月総合全面損失表(監査なし) |
5 |
|
2023年6月30日と2022年6月30日までの3ヶ月と6ヶ月の株主権益総合レポート(監査なし) |
6 |
|
2023年6月30日と2022年6月30日までの6ヶ月間総合現金フロー表(監査なし) |
8 |
|
簡明合併財務諸表付記 |
9 |
第二項です。 |
経営陣の財務状況と経営成果の検討と分析 |
19 |
第三項です。 |
市場リスクの定量的·定性的開示について |
26 |
第四項です。 |
制御とプログラム |
26 |
第2部-その他の資料 |
|
|
第1項。 |
法律訴訟 |
27 |
第1 A項。 |
リスク要因 |
27 |
第二項です。 |
未登録株式証券販売と収益の使用 |
73 |
第三項です。 |
高級証券違約 |
73 |
第四項です。 |
炭鉱安全情報開示 |
73 |
五番目です。 |
その他の情報 |
73 |
第六項です。 |
陳列品 |
74 |
サイン |
75 |
|
2
最初の部分は資金調達ですAL情報
プロジェクト1.圧縮統合FI財務諸表。
ALDEYRA治療会社
合併残高シーツ
|
|
六月三十日 |
|
|
|
|
||
|
|
2023 |
|
|
十二月三十一日 |
|
||
|
|
(未監査) |
|
|
2022 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
有価証券 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
使用権資産 |
|
|
|
|
|
|
||
固定資産、純額 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
費用を計算する |
|
|
|
|
|
|
||
長期債務の当期部分 |
|
|
|
|
|
|
||
リース負債を経営する |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
長期債務,当期分を差し引く |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
*(注14) |
|
|
|
|
|
|
||
株主権益: |
|
|
|
|
|
|
||
優先株、$ |
|
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
その他の総合損失を累計する |
|
|
|
|
|
( |
) |
|
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
3
ALDEYRA治療会社
アーバン社合併報告書取引(監査なし)
|
|
6月30日までの3ヶ月間 |
|
6月30日までの6ヶ月間 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
2023 |
|
|
2022 |
|
||||
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発 |
|
$ |
|
|
$ |
|
$ |
|
|
$ |
|
||||
一般と行政 |
|
|
|
|
|
|
|
|
|
|
|
||||
運営損失 |
|
|
( |
) |
|
|
( |
) |
|
( |
) |
|
|
( |
) |
その他の収入(支出): |
|
|
|
|
|
|
|
|
|
|
|
||||
利子収入 |
|
|
|
|
|
|
|
|
|
|
|
||||
利子支出 |
|
|
( |
) |
|
|
( |
) |
|
( |
) |
|
|
( |
) |
その他の収入を合計して純額 |
|
|
|
|
|
( |
) |
|
|
|
|
( |
) |
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
$ |
( |
) |
|
$ |
( |
) |
1株当たり純損失--基本損失と赤字 |
|
$ |
( |
) |
|
$ |
( |
) |
$ |
( |
) |
|
$ |
( |
) |
加重平均発行済み普通株式-基本普通株式と希釈普通株 |
|
|
|
|
|
|
|
|
|
|
|
||||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
4
ALDEYRA治療会社
COMPREHENの統合レポート重大な損失(監査なし)
|
|
6月30日までの3ヶ月間 |
|
|
6月30日までの6ヶ月間 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
その他総合(赤字)収入: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
取引可能証券の未実現収益(赤字),税引き後純額 |
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
||
その他総合収入合計 |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
$ |
( |
) |
||
総合損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
5
ALDEYRA治療会社
合併株主権益報告書(監査なし)
|
|
株主権益 |
|
|||||||||||||||||||||
|
|
普通株 |
|
|
|
|
|
積算 |
|
|
|
|
|
|
|
|||||||||
|
|
株 |
|
|
金額 |
|
|
その他の内容 |
|
|
他にも |
|
|
積算 |
|
|
合計する |
|
||||||
バランス、2022年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
普通株発行·行使 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
普通株を発行し、従業員 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
既得普通株を発行する |
|
|
|
|
|
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
その他総合収益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
( |
) |
||||
バランス、2023年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
バランス、2021年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
( |
) |
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
Helioに対する制限を解除する |
|
|
|
|
|
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
普通株を発行し、従業員 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
既得普通株を発行する |
|
|
|
|
|
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
その他総合損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
バランス、2022年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
6
ALDEYRA治療会社
合併株主権益報告書(監査なし)
|
|
株主権益 |
|
|||||||||||||||||||||
|
|
普通株 |
|
|
|
|
|
積算 |
|
|
|
|
|
|
|
|||||||||
|
|
株 |
|
|
金額 |
|
|
その他の内容 |
|
|
全面的に |
|
|
積算 |
|
|
合計する |
|
||||||
バランス、2023年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
普通株発行·行使 |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||||
その他総合収益 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
バランス、2023年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
バランス、2022年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
その他総合損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
— |
|
|
|
( |
) |
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
バランス、2022年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
|
||||
7
ALDEYRA治療会社
連結現金報告書流量(監査なし)
|
|
6月30日までの6ヶ月間 |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
経営活動のキャッシュフロー: |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
|
||
非現金利子支出 |
|
|
|
|
|
|
||
有価証券の割増純償却 |
|
|
( |
) |
|
|
( |
) |
減価償却および償却費用 |
|
|
|
|
|
|
||
営業資産と負債の変動: |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
( |
) |
|
売掛金 |
|
|
|
|
|
( |
) |
|
費用とその他の負債を計算すべきである |
|
|
( |
) |
|
|
|
|
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
||
固定資産買収 |
|
|
|
|
|
( |
) |
|
有価証券を購入する |
|
|
|
|
|
( |
) |
|
有価証券の満期日 |
|
|
|
|
|
|
||
投資活動提供の現金純額 |
|
|
|
|
|
( |
) |
|
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
||
株式オプションを行使して得られる収益 |
|
|
|
|
|
|
||
従業員の株購入計画の収益 |
|
|
|
|
|
|
||
融資活動が提供する現金純額 |
|
|
|
|
|
|
||
現金および現金等価物の純増加(減額) |
|
|
|
|
|
( |
) |
|
期初現金及び現金等価物 |
|
|
|
|
|
|
||
期末現金と現金等価物 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
キャッシュフロー情報の補足開示: |
|
|
|
|
|
|
||
期日内支払利息現金 |
|
$ |
|
|
$ |
|
||
付記はこのような監査されていない簡明な総合財務諸表の構成要素だ。
8
ALDEYRA治療会社
濃縮合併財務に関する注記Lレポート(監査なし)
Aldeyra治療会社とその完全子会社(“会社”あるいは“Aldeyra”)はデラウェア州の会社であり、臨床段階のバイオテクノロジー会社であり、免疫調節疾患の治療を目的とした革新的な治療法の発見に取り組んでいる。
これまでの同社の主な活動には、研究·開発活動や関連する一般業務計画が含まれており、資金調達も含まれている。
添付されている中期簡明総合財務諸表及び関連開示は監査されておらず、すでにアメリカ中期財務情報公認会計原則及び10-Q表指示とS-X規則に基づいて作成された。したがって、GAAPによって要求される完全な財務諸表に必要なすべての情報および脚注は含まれておらず、会社が監査された総合財務諸表および会社が2022年12月31日までのForm 10−K年次報告(2022年3月9日に米国証券取引委員会に提出されたForm 10−K)の関連注釈と共に読まなければならない。
2023年6月30日までの財務情報と、2023年6月30日と2022年6月30日までの3ヶ月と6ヶ月の財務情報は監査されていません。経営陣は、すべての調整が含まれており、これらの調整は、公正列報に記載されている日付と期間の財務状況、業務成果、キャッシュフローに必要な正常な経常的な調整のみを含むと考えている。2022年12月31日現在の貸借対照表データは、監査された連結財務諸表から来ている。任意の中期における会社の経営結果は、必ずしも他の中期または会計年度全体の予想結果を代表するとは限らない。
現在の運営計画によると、会社は2023年6月30日までの現金と現金等価物が、会社が2024年第4四半期までに予定している運営費用を支払うのに十分であると信じている。企業の流動資金や資本資源の評価には、これらの変化に対する財務的影響の推定が含まれている。同社は現在の運営計画に基づいて運営資本需要を予測しており、その中には不正確であることが証明される可能性のあるいくつかの仮定が含まれており、会社は会社が予想していたよりも早く利用可能なすべての資本資源を使用する可能性がある。会社は将来、会社のすべての計画の研究開発活動および規制活動を実行するために、1つまたは複数の株式または債務融資、協力、または他の源から追加資金を得る必要があるだろう;製造、販売、マーケティングおよび流通を含む、企業が上場許可を得る可能性のある任意の候補製品のための持続的な商業化活動を開始または継続するか、または食品医薬品局(FDA)に要求される任意の重大な追加開発要件を実行する。受け入れ可能な条項によると、会社は追加的な資金を得ることができないかもしれないし、全く得られないかもしれない。同社が追加資金を得ることができない場合、計画支出額の大幅な削減が要求され、運営停止が要求される可能性がある。
業務削減は、会社がその製品を開発し、市場に出す努力に大きな遅延を招くことになり、その業務計画や会社の将来の運営を実現するために重要である。
予算の使用
9
重要会計政策の概要
2023年6月30日までの6ヶ月間、2022年に決定された会計政策と比較して、大きな会計政策の変化はない表格10-K
最近の会計公告
2016年6月、財務会計基準委員会(FASB)は、会計基準更新(ASU)2016-13号、金融商品-信用損失(主題326):金融商品信用損失の計量(ASU 2016-13)を発表した。ASU 2016-13は、現在発生すると予想されているクレジット損失のエンティティの推定値を表す信用損失報告を準備するために、予想損失モデルを使用することを要求する。現在施行されている会計基準は発生した損失モデルに基づいている。未実現損失のある売却可能債務証券については、この基準は現在、投資の償却コストを削減するのではなく、記録準備金を要求している。ASU 2016−13年度の改正案は、2022年12月15日以降に開始された中期·年度財政期間に対して有効である。当社は2023年1月1日からこの基準を採用しており、当社の財務諸表に実質的な影響はありません。
2019年1月28日(締め切り)、会社はHelio Vision,Inc.(Helio)を買収した。買収の結果,同社は最初に合計を発行した
2021年1月に、買収協定条項に基づき、当社は発行します
会社は確定し、FASB ASCテーマ480項の下のマイルストーン株は負債会計処理を行う必要がない負債と持分を区別する(ASC 480)。マイルストーン株から2023年6月30日まで、マイルストーン株はFASB ASCテーマ815派生ツールとヘッジファンド(ASC 815)下のデリバティブとして、範囲例外に該当することも決定したそれは.したがって、マイルストーン株によってFASB ASCテーマ450、または有(ASC 450)を評価し、マイルストーンが実現すれば、会社はマイルストーン株に関する負債を記録し、マイルストーン株を発行する義務が可能となる。その際,当社はHelio創業者に発行されたマイルストーン株のコストを補償費用とし,将来他の用途がなければHelio非創業者に発行されたマイルストーン株を進行中の研究·開発(IPR&D)費用と記す。2020年12月31日、1月の株発行が可能とされた
10
2023年6月30日と2022年6月30日までの3ヶ月と6ヶ月以内に、会社の純損失状況のため、希釈後の発行済み加重平均普通株は基本加重平均普通株に等しい。
このような証券は、逆希釈の影響を有するので、以下の希釈可能な発行証券は、希釈加重平均発行株式の計算範囲から除外されている
|
|
6月30日までの3ヶ月と6ヶ月は |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
普通株購入オプション |
|
|
|
|
|
|
||
非既得限定株式単位 |
|
|
|
|
|
|
||
普通株等価物合計 |
|
|
|
|
|
|
||
はい2023年6月30日、現金および現金等価物は:
|
|
携帯する |
|
|
識別できない |
|
|
識別できない |
|
|
推定数 |
|
|
現金と現金 |
|
|
現在のところ |
|
||||||
現金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|||
貨幣市場基金 |
|
|
|
|
|
— |
|
|
|
— |
|
|
$ |
|
|
|
|
|
|
— |
|
|||
現金と現金等価物の合計 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|||
いくつありますか
2022年12月31日現在、現金、現金等価物、有価証券は以下の通り
|
|
携帯する |
|
|
識別できない |
|
|
識別できない |
|
|
推定数 |
|
|
現金と現金 |
|
|
現在のところ |
|
||||||
現金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
|
$ |
— |
|
|||
貨幣市場基金 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
— |
|
|||
現金と現金等価物の合計 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
|
$ |
|
|
|
— |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
アメリカ政府機関証券 |
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
— |
|
|
|
|
|||
販売可能である(1) |
|
|
|
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
— |
|
|
|
|
|||
現金、現金等価物、流動有価証券総額 |
|
|
|
|
|
|
|
|
|
|
|
|
|
$ |
|
|
$ |
|
||||||
2022年12月31日現在、売却可能なすべての証券の契約満期日は1年未満である。
公正価値は、計量日市場参加者間の秩序ある取引において、資産または負債が元金または最も有利な市場で負債を移転するために徴収または支払いされる交換価格として定義される。公正価値を計測するための推定技術の実行方式は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に削減することである。ASC 820、公正価値計量3つのレベルの投入によって公正価値等級が確立され、その中で最初の2段階は観察可能とされ、最後のレベルは観察不可能とされ、公正価値を計量するために使用することができ、この3段階の投入は以下の通りである
レベル1アクティブな市場オファーでは、市場日に同じ制限されない資産または負債を得ることができる。
11
レベル2−レベル1以外の直接的または間接的に観察可能な投入、例えば、同様の資産または負債のオファー、アクティブでない市場のオファー、またはすべての重要な投入が、資産または負債の全期間にわたって観察可能な市場データによって確認されることができる他の投入を観察することができる。
レベル3−市場活動支援が少ないか、または資産または負債の公正価値に大きな影響を与える観察不可能な投入が少ないか、または全くない。
いくつありますか
総合貸借対照表に現金と現金等価物を計上した通貨市場ファンドは活発な市場で市場見積で価格を計算している。これらは公正価値に従って入金され、公正価値階層構造下の第一級投入とみなされる。
逆買い戻し協定とアメリカ政府機関証券は市場価値記録を公正に許可し、市場価値を公正に許可することは、活発な市場中の類似ツールの最新の観察可能な投入または非活発または直接または間接的に観察可能な市場における同じまたは類似のツールのオファーによって決定される。それらは公正な価値階層構造の下での二番目のレベルの投入とみなされる。
現金等価物を含む金融商品 契約研究機関に対する臨床試験前払金と売掛金は簡明総合財務諸表に記載されており,金額は当該などのツールの短期満期日に基づいてその公正価値に近づいている。当社のHercules信用手配(注9参照)の項の定期融資の額面は、当社が現在利用している市場金利と比較しています。
前払い費用と他の流動資産2023年6月30日と2022年12月31日は:
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
研究開発費を延期する |
|
$ |
|
|
|
|
||
保険料を前払いする |
|
|
|
|
|
|
||
その他当期売掛金 |
|
|
|
|
|
|
||
雑前払い費用やその他の流動資産 |
|
|
|
|
|
|
||
前払い費用とその他の流動資産総額 |
|
$ |
|
|
$ |
|
||
計算すべき費用は2023年6月30日と2022年12月31日は:
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
補償すべきである |
|
$ |
|
|
$ |
|
||
研究と開発費用を計算すべきである |
|
|
|
|
|
|
||
その他の費用を計算しなければならない |
|
|
|
|
|
|
||
費用総額を計算する |
|
$ |
|
|
$ |
|
||
同社の現在および長期債務には、Hercules Capital,Inc.(Hercules)との信用スケジュールに基づいて、会社が返済義務のある金額が含まれている。2019年3月、当社はHerculesおよび数間銀行および他の金融機関または実体(本プロトコルは時々貸手と呼ぶ)と融資および保証プロトコル(融資および保証プロトコルまたはHercules Credit Finance)を締結し、$を超えない定期融資を提供する
12
降下する当社は2019年9月に全額支払い、2020年及び2021年に満了して使用されておらず、当社はこの等期数の融資条件を満たしていません。2021年4月20日、会社は“融資と担保協定第1改正案”(第1改正案)を締結した。第1修正案は、その他の事項を除いて、#ドルから第4弾の融資を増加させた
当社は2022年12月22日に“融資·担保協定第2改正案(第2改正案)”を締結し、2022年12月31日(第2改正案発効日)から発効する。その他の事項を除いて、“第2改正案”(I)は、“融資·担保協定”に規定されている借入金が利息のみを支払う期限を2023年5月1日から2024年5月1日に延長する
力神信用手配について、当社では承諾料#ドルが発生しました
第1改正案と第2改正案の発効日から2023年6月30日まで総額は$
長期債務には以下の内容が含まれる
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
2023 |
|
|
2022 |
|
||
定期融資に応じる |
|
$ |
|
|
$ |
|
||
期末料金です |
|
|
|
|
|
|
||
未償却債務発行コスト |
|
|
( |
) |
|
|
( |
) |
マイナス:現在の部分 |
|
|
( |
) |
|
|
( |
) |
長期債務総額 |
|
$ |
|
|
$ |
|
||
13
12月31日までの各年度の将来元本支払いは、期末費用を含めて以下の通りです
2023 |
|
$ |
|
|
2024 |
|
|
|
|
合計する |
|
$ |
|
融資と担保協定には、会社のある違約事件、陳述、担保、非金融契約も含まれている。2023年6月30日まで当社はすべての重要な点で大力神信用手配のすべてのチノを守っています。また、融資及び担保契約条項を満たした場合、当社は貸手に合計#ドルの株式を購入する権利を付与する
2021年3月に当社は公開市場販売協定を締結したSMJefferies LLCと販売エージェント(2021年Jefferies販売プロトコル)として。“2021年ジェフリー販売協定”によると、会社は時々ジェフリーを通じて普通株を提供·販売することができ、販売総収益は最高で$に達する
会計基準アセンブリ(ASC)740、所得税(ASC 740)に従って繰延税の純現金化可能性が評価されるとき、会社は、繰延税金資産の一部または全部が現金化できない可能性が高いかどうかを考慮する。既存証拠の重要性によると,主に設立以来発生した純損失,近い将来予想される純損失,既存の仮差異の逆転,各種連邦や州属性の満期であり,同社は繰延純税項の一部または全部は実現不可能であると考えている。したがって,a
改正後の1986年の国内税法第382条(第382条)によると、会社が“所有権変更”を行う際には、変更前の純営業損失(NOL)と何らかの他の税務資産(税務属性)を利用して将来の課税収入を相殺する能力が制限される。一般的にある株主の総持分が増加すれば
同社は2023年6月30日から米国(連邦とマサチューセッツ州)で納税している。当社は2022年12月31日まで、2021年、2020年、2019年12月31日までの納税年度を開放審査しています。しかも、どんな赤字年度も開放されており、損失が今後数年間に繰り越すことができる限り。
米国会計基準第740-10条によれば、当社は、納税申告書において採取された又は発生すると予想される不確定税務状況の確認敷居及び財務諸表確認計量プログラムを規定している。
14
税務状況がこの敷居に達した場合、確認すべき利益は、最終的に税務機関と和解したときに実現可能性の最も高い税収利益と評価される。そのため、所得税準備では、会社は未確認の税収割引や罰金に関する課税利息を確認したが、経営陣は現在、何の不確定な税収状況も知らない。そのため、当社は不確定な税務状況による利息や罰金を含む負債を記録していません。
“インフレ低減法案”(IRA)は2022年8月16日に公布された。金利協定の審査により、当社はその税務支出に何の影響も受けないと予想しています。特に、同社は今後数年以内にその予想損失に応じて最低税(CAMT)を支払う会社を代替しない見通しだ。2023年から、納税年度までの任意の3連続の納税年度の平均年調整財務諸表収入が10億ドルを超える会社について、アイルランド共和軍は15%のCAMTを導入した。
その会社は所有している
2023年5月、会社取締役会は会社の2013年の株式激励計画に代わる2023年の株式計画を承認した。2023年6月30日、会社株主は会社2023年株主総会で2023年株式計画を承認した。2023年の株式計画によると、当社は2023年6月30日以降に2013年の株式計画に基づいてさらなる奨励を提供することはありません。以前に2013年の株式計画に基づいて付与された奨励はまだ完了していません。2023年株式計画は2023年6月30日から発効し、有効期間は10年で、合計
2020年と2022年には、会社は改正された管理現金インセンティブ計画に基づいて現金奨励を付与する。現金奨励は、付与された日から4回に分けて年分割し、継続サービスを基礎とし、従業員に(I)の早い者に現金支払いを受ける権利を持たせる
2022年、会社は改訂された管理現金インセンティブ計画に基づいて業績CSBUを付与する。米国食品医薬品局が会社から提出された再融資守秘協定(業績基準)を受けた条件では、奨励は授与日から4年間に分けて分割払いし、継続サービスをもとに、従業員に(I)付与日から4年または(Ii)統制権を変更させる権利があり、会社の普通株の支払日終値の1株当たり終値の早い者に相当し、現金支払いを受ける。2023年6月30日までに$
当社は必要なサービス期間中の株式報酬支出を確認します。会社は株式ベースの奨励を株式ツールとして入金しているが、現金奨励とCSBUを除いて負債として入金されている
|
|
6月30日までの3ヶ月間 |
|
|
6月30日までの6ヶ月間 |
|
||||||||||
|
|
2023 |
|
|
2022 |
|
|
2023 |
|
|
2022 |
|
||||
研究開発費 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
一般と行政費用 |
|
|
|
|
|
|
|
$ |
|
|
$ |
|
||||
株式に基づく報酬総支出 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
15
株式オプション
#年インセンティブ計画における株式オプションに関する活動を表にまとめた2023年6月30日までの6ヶ月:
|
|
量 |
|
|
重みをつける |
|
|
重みをつける |
|
|
骨材 |
|
||||
2022年12月31日に返済されていません |
|
|
|
|
$ |
|
|
|
|
$ |
|
|||||
授与する |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
$ |
|
|
|
|
|
|
|
|||
2023年6月30日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023年6月30日に行使できます |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
2023年6月30日現在、発行済み株式オプションの未償却株補償は$
限定株単位
次の表は制限株式単位(RSU)に関する活動をまとめたものである2023年6月30日までの6ヶ月:
|
|
番号をつける |
|
|
加重平均付与日公正価値 |
|
||
2022年12月31日に返済されていません |
|
|
|
|
|
|
||
授与する |
|
|
|
|
|
|
||
既得 |
|
|
( |
) |
|
|
|
|
2023年6月30日現在の未返済債務 |
|
|
|
|
|
|
||
承認されたRSUの加重平均バッチ日の公正価値は$
従業員株購入計画
2023年6月30日までに会社は
|
6月30日までの6ヶ月間 |
|
|||||
|
2023 |
|
|
2022 |
|
||
加重平均付与日1株当たり公正価値 |
$ |
|
|
$ |
|
||
株式に基づく報酬総支出 |
$ |
|
|
$ |
|
||
16
同社は現在、業務を展開するためのオフィスを借りている。当社は適宜賃貸借継続選択権を行使することができますが、賃貸条項の継続延長は当社の使用権資産や賃貸負債には含まれていません。当該等の資産や負債は合理的に行使されないためです。当社は定期的に継続選択を評価し、行使可能な期間を合理的に確定した場合、継続期間をレンタル期間に計上します。2022年12月、会社はレンタル延長約2023年12月31日までの選択権を行使した。当社のレンタルは暗黙的な金利を提供していないため、当社はレンタル開始日に得られる情報に基づいて漸増借入金金利を用いてレンタル支払いの現在値を決定しています。
2023年6月30日現在、会社は償却されていない使用権資産を保持しており、対応する経営賃貸負債は約$
2023年の残り賃貸支払い総額 |
|
$ |
|
|
減算:割引の影響 |
|
|
( |
) |
賃貸負債現在価値 |
|
$ |
|
|
|
|
|
|
|
流動経営賃貸負債 |
|
$ |
|
|
合計する |
|
$ |
|
|
2023年6月30日現在、同社のすべてのキャンセル不可能な経営リース項目の今後の最低支払総額は、
|
|
合計する |
|
|
2023 |
|
|
2024 |
|
|
2025 |
|
|
2026 |
|
|||||
経営リース義務 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|||||
保証と補償
デラウェア州の法律で許可されている場合、高級職員又は役員が高級職員又は取締役として会社の要求に応じてサービスを提供する場合、ある事件又は事件が発生した場合、会社は高級職員及び取締役に賠償を行うことができる。賠償期間はその役員または役員の生涯である。2023年6月30日まで当社は、当該等の賠償責任により何の損害も受けていません
許可内合意
MEEIプロトコル
同社は,マサチューセッツ州眼耳病院(MEEI)と最初に2016年7月にMEEIとHelio Vision,Inc.が締結した改訂された独占許可協定(MEEI協定)に基づいてADX−2191を開発している。当社は2019年にHelio Visionを買収する際にMEEI協定を締結しました。
MEEI協定に基づいて、同社は、特定の特許および特許出願および他の知的財産権許可(MEEI特許権)の下でADX-2191を開発および商業化するために、MEEIの独占的グローバルライセンスを取得した。同社は、ビジネス上の合理的な努力を使用してADX-2191を開発し、特定の日までに特定の努力および達成基準を達成することに同意している。
MEEIプロトコルによって付与された権利の代償として,Helio VisionはMEEIにいくつかの優先株を発行し,Helio Visionは入金不可能かつ払い戻し不可能なライセンス維持費#ドルをMEEIに支払うことに同意した
17
ロー合計7桁、およびMEEIに支払われる使用料は、純売上高のパーセンテージとして、米国でMEEI特許権を組み入れまたは使用する製品については、税率が低い1桁であり、米国以外でMEEI特許権を導入または使用する製品については、割合が低い1桁である。MEEIプロトコルによれば、当社は、任意の第三者と任意の再許可手配を締結することによって徴収されたいくつかの許可収入のパーセンテージをMEEIに支払う責任があり、再許可の日付に応じて下位から2桁までのパーセンテージで減少する。当社がHelio Visionを買収した後、当社はMEEI協定に基づいて不足している任意の将来金を支払う義務があります。1種類あります
MEEIプロトコルは、MEEIプロトコルによって許可された最後の満期特許の満期日まで有効である。当社はMEEIに速やかに書面で通知した後、MEEIプロトコルを終了することができます。特定の治療期間内に、MEEIがMEEI協定を終了し、許可製品に関連するすべての業務運営を停止する権利があり、MEEI協定下の満期金額を支払うことができず、何らかの職務調査義務を履行できなかった場合、私たちは保険を維持する義務を履行することができず、私たちの役人の一人は、許可製品の製造、使用、販売、または輸入に関する重罪を犯し、私たちはMEEI協定のいかなる条項にも深刻に違反し、またはその破産または破産の場合には。
MEEIプロトコルが早期に終了した場合、当社はMEEIプロトコルに従って許可および開発したすべての権利をMEEIに回復する可能性があります。当社はMEEI協定の下で起こりうるいくつかのクレームについてMEEIに賠償することに同意しました。
法律訴訟
2023年7月31日、ある株主が米マサチューセッツ州地方裁判所に可能な集団訴訟を提起した。会社と特定の現職および元幹部に対して、タイトルは以下の通りであるJuliana PaiceはAldeyra治療会社らの事件を訴えた。(テーブル23-cv-11737)。訴訟は、被告が1934年の証券取引法第10(B)と20(A)条および米国証券取引委員会規則10 b-5に違反したと告発した。原告によると、被告は虚偽または誤解性の陳述をしたか、またはADX-2191による原発性硝子体網膜リンパ腫の治療に関する新薬申請(NDA)と将来性に関するいくつかの情報を開示できなかった。その他の事項に加えて、この訴訟は、本人および2022年3月17日から2023年6月20日までの間に、同社の証券のすべての個人および実体および弁護士費および費用を購入または購入することを要求する。当社は原告の訴訟主張に異議を唱え、積極的に抗弁するつもりです。現在、会社はこの事件による可能性のある結果を合理的に予測したり、潜在的な損失を推定したりすることはできない。
また、当社は通常業務過程で訴訟や請求の影響を受けることがありますが、上記のほか、当社は現在いかなる重大な法的訴訟の側でもなく、当社は彼らの未解決または脅威に対する法的訴訟を一切知りませんが、当社はこのような訴訟や訴訟が当社の業務、経営業績、キャッシュフローまたは財務状況に重大な悪影響を及ぼす可能性があると信じています。
18
プロジェクト2.経営陣の議論と分析財務状況と経営実績。
前向き陳述に関する注意事項
本報告の各種陳述は,1995年の個人証券訴訟改革法で指摘された“前向き陳述”である。展望的な陳述は重大な危険と不確実性と関連がある。歴史的事実に関する陳述を除いて、本報告に含まれる私たちの戦略、将来の業務、将来の財務状況、将来の収入、予想コスト、見通し、計画、および管理目標に関するすべての陳述は前向きな陳述である。これらの陳述はリスクと不確実性の影響を受け、私たちの経営陣が現在把握している情報に基づいている。例えば、“予想”、“信じ”、“推定”、“予想”、“予定”、“可能”、“計画”、“考慮”、“予測”、“計画”、“目標”、“可能”、“潜在”、“継続”、“進行中”、“設計”、“可能”、“可能”、“目標”、“会”、“会”などに限定されない。“すべき”、“可能”またはこれらの用語の否定または同様の表現または言葉は、前向きな陳述である。これらの陳述は、私たちの現在の未来の事件に対する見方を反映しており、仮説に基づいており、リスクと不確実性の影響を受けている。このような不確実性を考慮して、あなたはこのような前向きな陳述に過度に依存してはいけない。私たちの前向き陳述に反映された事件と状況は発生しない可能性があり、実際の結果は私たちの前向き陳述で予測されたものと大きく異なる可能性がある。実際の結果が異なることをもたらす可能性のある有意な要因は、これらに限定されない
19
私たちまたは私たちを代表する誰のためのすべての書面と口頭前向き声明は、本節で掲載または言及された警告声明によって明確に制限されている。私たちは投資家たちに私たちがしたことや私たちを代表する展望的な陳述にあまり依存しないように想起させる。私たちはいかなる義務も負いません。特にいかなる義務も拒否し、新しい情報、未来のイベント、または他の理由でも、いかなる前向きな陳述も公開的に更新または修正します。しかし、私たちが米国証券取引委員会(米国証券取引委員会)に提出された任意の年度、四半期、または現在の報告書で関連テーマについて行われた任意のさらなる開示を参考にすることをお勧めします。
“経営陣の財務状況と経営結果の議論と分析”および“リスク要因”、および本四半期報告Form 10-Qに含まれる監査されていない簡明な総合財務諸表を読むことをお勧めします。また、私たちが2023年3月9日に米国証券取引委員会に提出した2022年12月31日までの10-K表年次報告(2022年年次報告)を読むことを奨励します。その中には、私たちの業務に関連するリスクと不確実性のより包括的な議論が含まれています。上記のリスクと我々2022年年報におけるリスクのほかに、他の未知または予測不可能な要素も私たちの業績に影響する可能性がある。したがって、本報告書の情報は、これらのリスク要因を追加、修正、置換、または更新する可能性がある10−Qテーブル、8−Kテーブル、および10−Kテーブルを含む、米国証券取引委員会に時々提出される他の報告および文書と共に読まれるべきである。私たちが予想していた実際の結果や事態の発展が達成される保証はないし、実質的に実現されても、私たちの結果が私たちに予想された結果や私たちに与える影響を保証することはできない。したがって、このような前向きな陳述と推定で述べられた結果が必ず達成されることは保証されない。
概要
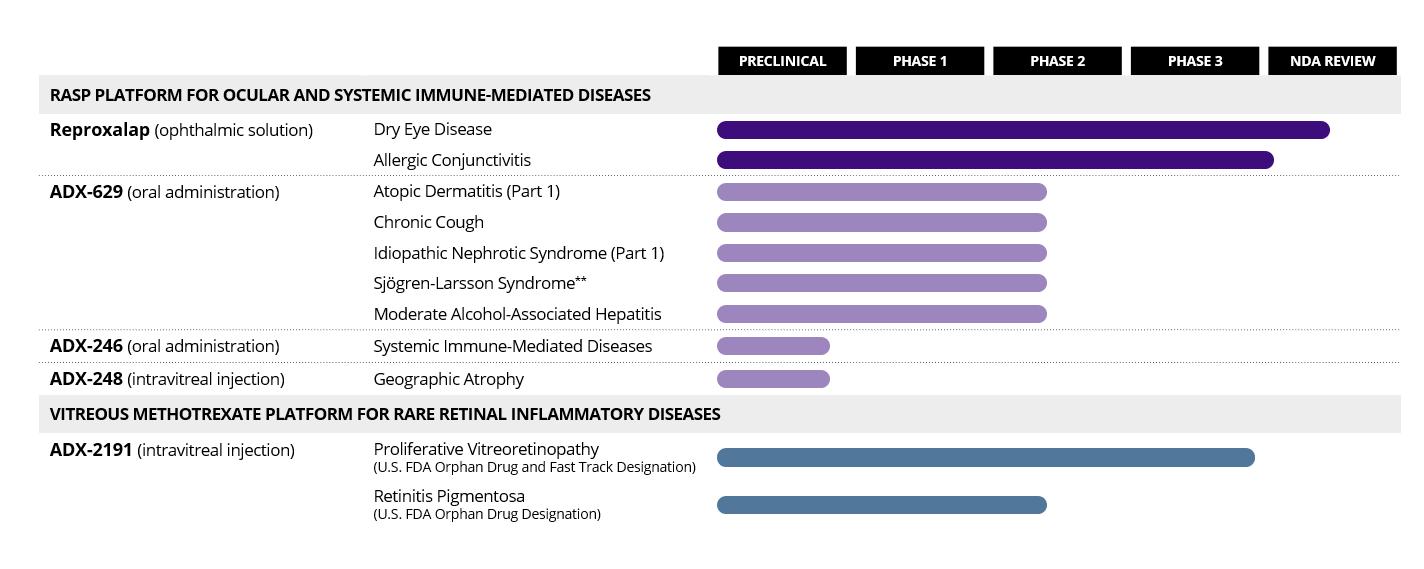
Aldeyra治療会社は,その完全子会社(WE,USまたは当社)を含め,免疫介在性疾患の治療のための革新的な療法の発見に取り組むバイオテクノロジー会社である。我々は,炎症を特徴とする疾患を進行させるrasp(反応アルデヒド種)と呼ばれる炎症促進メディエーターを目指した新しい薬物プラットフォームを開発している。我々のRASP調節剤製品ラインは、アトピー性皮膚炎、特発性ネフローゼ症候群、中等度アルコール関連肝炎、慢性咳、およびSjögren−Larsson症候群の臨床開発のための新規経口RASP調節剤であるADX−629を含む。我々の臨床前RASPプラットフォームは、ADX−246、ADX−248、および全身炎症性疾患および地理的萎縮を治療するために開発されている他の候補薬剤を含む。RASPプラットフォームの有効性はreproxalapの支持を得ており、reproxalapは著者らがアメリカ食品と薬物管理局(FDA)の新薬申請(NDA)審査下の一流の候補製品であり、ドライアイ病の治療に用いられる。いくつかの2期と3期の臨床試験において、Reproxalapは広範で、迅速に効果的な活性と一致した安全性を示した。ADX−2191を含む他の候補製品が開発されており,増殖性硝子体網膜症と網膜色素変性の治療に用いられており,炎症と視力喪失が特徴である。ADX−2191は,これら2つの網膜疾患を治療する孤児薬の指定を受けており,現在開発中である。我々の開発の流れを以下に示す.

20
2023年の臨床と規制のマイルストーンは
規制審査のスケジュールは柔軟であり、規制機関の仕事量や他の潜在的な審査問題に応じて変更される可能性がある。現在行われている臨床試験のスケジュールは,臨床研究施設や人員整備の有用性,患者募集能力にある程度依存している。
私たちが私たちの候補製品ラインを拡大する戦略を実行し続けるにつれて、私たちは新しい治療潜在力を持つ新しい免疫調節方法を許可または獲得することができるかもしれない。2019年1月、私たちはHelio Vision,Inc.(Helio)を買収し、ADX-2191の権利を獲得した。
私たちのすべての開発計画とスケジュールは募集速度、監督審査、臨床前と臨床結果、資金とその他の臨床試験の開始、完成或いは報告を遅らせる可能性がある要素によって調整される可能性がある。
私たちは製品がアメリカや他の場所で販売されることを許可されていない。規制部門の承認を得るまで、私たちは私たちが開発したどんな候補製品からも何の収入も得ないだろう。もし私たちの製品が販売を許可されたら、私たちは直接または協力を通じてそれを商業化するつもりだ。私たちは将来商業収入を得るかもしれないが、これまで、私たちは主に普通株の売却、転換可能な優先株、転換可能な本票、株式承認証、債務ツール下の借金を通じて、私たちの運営に資金を提供してきた。私たちは債務または持分の形で、またはパートナー関係を通じて追加資本を調達し、私たちの候補製品の追加開発に資金を提供する必要があり、私たちは補充業務または製品に許可、買収、または投資するかもしれない。さらに、資本資源に応じて、本明細書に記載された臨床開発計画を増加、減少、または他の方法で修正することができる。
2021年3月に公開市場販売協定を締結しましたSMJefferies LLCと販売エージェント(2021年Jefferies販売プロトコル)として。“2021年ジェフリー販売協定”によると、私たちは時々ジェフリーを通じて普通株を提供·販売することができ、販売総収益は最高1.00億ドルに達する。2021年のジェフリー販売契約に基づいて任意の株式を売却する義務はありません。2021年のジェフリー販売契約によるオファーや要約を随時一時停止することができます。2023年6月30日現在、2021年のジェフリー販売契約に基づいていかなる販売も行われていない。
2019年1月28日、私たちはHelioを買収した。買収の結果、私たちは証券保有者とHelioのコンサルタントの一人に合計1,407,006株の普通株を発行した。買収協定の条件によると、私たちはHelioの前証券所有者に以下の追加金を支払う義務がある:(A)FDAが増殖性硝子体網膜症の予防および/または治療のためのNDAまたは10年前に実質的に類似したラベルを承認した後、Helioの前証券所有者に1,000万ドルの普通株式を支払うこれは…。閉鎖日周年記念日;および(B)FDAが12日前の適応(増殖性硝子体網膜症または実質的に類似したラベルを除く)の使用を許可した250万ドルの普通株式これは…。完成日周年には、いずれの場合も、吾等は5,248,885株を超える買収に関連する普通株を発行する義務はない。さらに、私たちが何らかの統制権変更や資産剥離が発生した場合、Helioのいくつかの前転換可能な手形所有者は、合計100万ドル以下の税収総額を得る権利があるだろう。
2019年3月には、6000万ドルまでの定期融資を提供する大力神信用手配を締結し、2023年6月30日現在、1500万ドルが使用されている。2021年4月、大力神信用手配を改訂し、他の事項を除いて、2023年5月までに引き出し可能な金額を1,000万ドルから2,000万ドルに増加させるが、その中に掲載されているいくつかの条件を満たす必要がある。2022年12月、Hercules信用スケジュールは、(I)借金が利息のみを支払う期限を2023年5月1日から2024年5月1日に延長することと、(Ii)満期日を2023年10月1日から2024年10月1日に延長することと、(Iii)その中に記載されているいくつかの条件を満たす場合に、2000万ドルの引き出しの獲得可能性を2023年5月から2024年5月に延長することとを含む、さらに改訂された。力神信用メカニズムは常習的な肯定と否定契約及び違約事件を含む。他にも、平権条約には、私たちが合法的な存在と政府の承認を維持することを要求し、いくつかの財務報告書を提出することが含まれている
21
保険カバー面を維持しています否定的な契約は、私たちの業務または知的財産権の任意の部分の譲渡を制限すること、追加の債務を招くこと、合併または買収を行うこと、配当金を支払うこと、または他の分配を行うこと、投資を行うこと、および私たちの資産に他の留置権を設立することを含むが、すべての場合は慣例的な例外によって制限される。改訂されたHercules信用手配は本10-Q表四半期報告に掲載された簡明総合財務諸表付記9内に掲載されている。 2023年6月30日現在、Hercules信用手配による未返済額は1,500万ドルであり、2024年5月1日までに、貸手投資委員会の承認により、追加の2,000万ドルを選択することができるかもしれません。
研究開発費
私たちのすべての研究と開発費用は実際に発生した方式で支出されている。業績前に支払われた研究·開発コストは発生前に前払い費用として資本に計上される。研究開発費は主に
これまで,我々のほとんどの研究や開発費用は,reproxalap,ADX−2191,ADX−629,新しいプラットフォーム分子の発見に関与してきた。予測可能な未来には,臨床前と臨床開発によるADX−629や他の化合物の推進に伴い,われわれの研究·開発費用が増加することが予想される。必要な臨床試験を行って監督管理の承認を得る過程は高価で時間がかかる。私たちは私たちの候補製品を開発し続ける時に発生するコストを確定的に見積もることができない。臨床開発スケジュール、成功の確率と開発コストは期待と大きく異なる可能性がある。私たちは私たちの候補製品が市場承認を得ることに絶対に成功しないかもしれない。しかし以下の理由に限定されないため,臨床試験のコストは項目のライフサイクル全体で大きく異なる可能性がある
研究と開発には資産買収に関する費用が含まれている。資産買収取引で購入された資産は、買収された資産が代替の将来的な用途とみなされない限り、研究·開発支出として行われている。買収の進行中の研究開発支払いは、前金、取引費、その後のマイルストーン支払いを含む即時計上費用を計上している。資産買収後に発生した開発コストは発生時に費用を計上する。
22
私たちはreproxalapや私たちの他の任意の候補製品が少なくとも2023年下半期まで発売されないと予想しています。
一般と行政費用
2023年6月30日と2022年6月30日までの6ヶ月間、私たちの一般的および行政的費用には、フルタイム従業員の福祉および株式ベースの報酬、reproxalapおよびADX-2191のビジネス前コストを含む従業員関連の費用が主に含まれています。その他の一般及び行政費用には、保険料、相談費及び監査、税務、投資家関係及び法律サービスの専門費用が含まれ、特許に関する費用が含まれる。経営活動の拡大に伴い,上場企業に関する追加コストの発生を継続し,取引所上場や米国証券取引委員会の要求を遵守したまま,一般的かつ行政的費用が今後増加することを予想している。これらの増加には、より高いコンサルティングコスト、私たちの候補製品の商業化費用、弁護士費、会課金、保険料、および投資家関係に関連する費用が含まれるかもしれない。
その他の収入(費用)
その他の収入(支出)総額には、主に私たちが利息口座から稼いだ利息収入と私たちの未返済債務による利息支出が含まれています。
総合損失
全面的な損失は、一定期間内に非所有者由来の取引および他のイベントおよび/または状況によって発生する権益変化として定義される。2023年6月30日までの6カ月間の総合損失は、2460万ドルの純損失と10万ドルの有価証券が収益を実現していないことに相当する。2022年6月30日までの6カ月間、総合損失は3460万ドルの純損失と30万ドルの有価証券の未実現損失に相当する。
肝心な会計見積もり
財務諸表を作成する際には、財務諸表日に報告された資産及び負債の報告金額及び又は有資産及び負債の開示、並びに報告期間内に報告された費用に影響を与える推定及び仮定を行う必要がある。私たちはこのような推定と判断を持続的に基づいて評価する。我々は歴史的経験や当時の状況では合理的な様々な他の要因を推定していると考えられるが,これらの要因の結果は資産や負債の帳簿価値を判断する基礎となっており,そのような資産や負債の帳簿価値は他の源から容易に見られるものではない。異なる仮定または条件では、実際の結果は、これらの推定値と大きく異なる可能性がある。私たちの重要な会計政策は、本四半期10-Q表に監査されていない簡明な総合財務諸表の付記と、2022年年報で監査された財務諸表の付記により全面的に記載されていますが、これらのすべての重要な会計政策が重要な会計政策と考えられる推定と仮定を要求しているわけではありません。
2023年6月30日までの6ヶ月間、我々のキー会計推定は、2022年年次報告における経営陣の財務状況や運営結果の検討·分析に記載されている状況と比較して大きな変化はない。重要なのは、私たちのこれからの経営業績の討論は、私たちの2022年年次報告書で開示された重要な会計政策と組み合わせて読むべきだ。
経営成果
私たちは予測可能な未来に、私たちの運営結果はいくつかの要素によって変動し、著者らの研究開発仕事の進展、臨床試験の時間と結果及び監督管理要求を含むと予想している。私たちの限られた運営の歴史は未来の運営を予測することを困難にしたり不可能にした。設立以来、私たちは大きな損失を受けた。
2023年6月30日までの3ヶ月と2022年6月30日までの3ヶ月
研究と開発費用。2023年6月30日までの3カ月間の研究開発費は700万ドルだったが、2022年6月30日までの3カ月は1460万ドルだった。760万ドルの減少は主に外部臨床開発コストと薬品製造支出の減少によるものであるが、人員コストと外部臨床前開発コストの増加によって相殺される。
一般と行政費用です2023年6月30日までの3カ月間、一般·行政費は340万ドルだったが、2022年6月30日までの3カ月は310万ドルだった。30万ドル増加の主な原因は法的費用と人件費の増加だが、相談費用の減少は増加した費用を相殺している。
23
その他の収入(費用)2023年6月30日と2022年6月30日までの3カ月間の純収入(支出)総額はそれぞれ140万ドルと10万ドルだった。純その他の収入が150万ドル増加したのは、2023年6月30日までの3カ月の利息収入が2022年6月30日までの3カ月を上回ったためだ。
2023年6月30日までの6カ月と2022年6月30日までの6カ月
研究と開発費用。2023年6月30日までの6カ月間の研究開発費は1820万ドルだったが、2022年6月30日までの6カ月は2680万ドルだった。860万ドルの減少は主に外部臨床開発コストの減少であるが,人員コスト,薬品製造支出と外部臨床前開発コストの増加によって相殺される。
一般と行政費用です2023年6月30日までの6カ月間の一般·行政費は890万ドルだったが、2022年6月30日までの6カ月は740万ドルだった。150万ドル増加の主な原因は法的費用と人件費の増加であるが,相談費用の減少は増加した費用を相殺している。
その他の収入(費用)2023年6月30日と2022年6月30日までの6カ月間の純収入(支出)総額はそれぞれ250万ドルと40万ドルだった。純その他の収入が290万ドル増加したのは、2023年6月30日までの6カ月の利息収入が2022年6月30日までの6カ月を上回ったためだ。
流動性と資本資源
私たちの運営資金は主に株式証券の売却と転換可能な持分証券及び信用手配下の借金から来ています。設立以来,経営活動により運営損失と負キャッシュフローが生じ,ほとんどの努力を研究·開発に投入してきた。2023年6月30日現在、我々の株主権益総額は約1兆299億ドル、現金と現金等価物は1兆517億ドル。2023年6月30日までの6カ月間、約2,460万ドルの純損失を出した。私たちは予測可能な未来に運営損失が生じると予想している。
2021年3月、私たちは2021年のジェフリー販売協定を締結した。“2021年ジェフリー販売協定”によると、私たちは時々ジェフリーを通じて普通株を提供·販売することができ、販売総収益は最高1.00億ドルに達する。2021年のジェフリー販売契約に基づいて任意の株式を売却する義務はありません。2021年のジェフリー販売契約によるオファーや要約を随時一時停止することができます。2023年6月30日現在、2021年のジェフリー販売契約に基づいていかなる販売も行われていない。
2019年3月に、吾らは力持ち信用手配(融資及び保証協定)を締結し、この合意により、吾らは元金総額6,000万ドルに達する定期融資を提供することができた。融資·安全協定は、(I)2019年9月30日(2019年分)、2020年3月31日(2020年分)、2021年3月31日(2021年部分)までに何らかの資金条件が発生した場合、(I)2019年4月15日に満期となる未使用の初期定期融資前払い、1件あたり最大1500万ドルの追加定期融資前払いを選択することができる。(Iii)2021年12月31日までに、我々の選択に応じて、貸手投資委員会が承認した場合には、最高1,000万ドルの最終追加定期融資前払い(第4回融資)を提供する。私たちは2019年9月に2019年の部分を全数抽出しましたが、2020年部分と2021年部分はこの部分の融資条件を満たすまで満期になって使用していません。2021年4月20日、大力神と融資·担保協定第1改正案(第1改正案)を締結した。第1修正案は、他の事項を除いて、(I)第4回融資を1,000万ドルから2,000万ドルに増加させ、第4回融資を抽出する最終期限を2022年7月1日に延長し、(Ii)融資·担保協定下での借入の可変年利率を(A)最優遇金利プラス3.10%または(B)8.60%のうちの大きいものに引き下げ、(Iii)融資と担保協定に基づいて利息を支払うだけの期限を2021年5月1日から2022年7月1日に延長する。および(Iv)ある条件が2021年4月に満たされた後、利息のみを受け取る期限および第4回融資の最終期限をさらに2023年5月1日に延長する。2022年12月22日、Herculesと融資·保証協定第2改正案(第2改正案)を締結し、2022年12月31日(第2改正案発効日)から発効する。“第2改正案”は、その他の事項を除いて、(1)“融資·担保協定”に規定されている借入金が利息のみを支払う期限を2023年5月1日から2024年5月1日に延長する;(2)満期日を2023年10月1日から2024年10月1日(満期日)に延長する;(3)2000万ドルの第4回融資約束額を2023年5月1日から2024年5月1日に延長する。および(Iv)前払い費用(以下のように定義する)を第2改正案発効日から12カ月間の前払い額の0.75%,その後0%に改訂した。4回目の融資を引き出す能力があるかどうかは、貸手投資委員会の承認にかかっている。また、292,500ドルの補充期末費用(補充期末費用)は、(A)修正された満期日または(B)ローン返済および保証契約下の立て替え総額のうち、早い日に満了しなければならない。既存の1,042,500ドルの期末費用(期末費用)は、(A)2023年10月1日または(B)ローン返済及び担保契約下の立て替え総額のうち比較的早い日に満了しなければならない。定期ローンの未返済元金残高総額は月分割払いで、受取利息期限が満了した時点で返済を開始し、満期日まで継続しています。
24
融資と保証協定には、慣習的な肯定と否定条約および違約事件が記載されている。他にも、平権条約には、合法的な存在の維持と政府の承認、特定の財務報告書の提出、保険範囲の維持を要求する条約が含まれている。否定的な契約は、私たちの業務または知的財産権の任意の部分の譲渡を制限すること、追加の債務を招くこと、合併または買収を行うこと、配当金を支払うこと、または他の分配を行うこと、投資を行うこと、および私たちの資産に他の留置権を設立することを含むが、すべての場合は慣例的な例外によって制限される。2023年6月30日まで、Hercules信用手配下の未返済金額は1,500万ドルであり、融資と保証協定によると、私たちの選択により、2024年5月1日までに他の2,000万ドルが使用できるかもしれないが、貸手投資委員会の承認を得なければならない。
私たちの現在の運営計画によると、私たちの現金と現金等価物は、2023年6月30日まで、reproxalapの初歩的な商業化と発売計画(承認されれば)、眼および全身性免疫介在性疾患領域の候補製品の持続的な早期および後期開発を含む、現在予想されている2024年第4四半期の運営費用を支払うのに十分であると信じている。私たちの運営資本需要の予測は、いくつかの不正確であることが証明される可能性のある仮定を含む、私たちの現在の運営計画に基づいており、私たちは予想よりも早くすべての利用可能な資本資源を使用するかもしれない。候補製品の研究,開発,商業化に関する多くのリスクと不確実性のため,我々の運営資金需要の正確な金額を見積もることはできない。私たちは将来、私たちのすべての計画された研究開発活動および規制活動を実行するために、1つまたは複数の株式または債務融資、協力、または他のソースから追加資金を得る必要があり、私たちの候補製品のための製造、販売、マーケティング、および流通、またはFDA要求を実行する任意の重大な追加開発要件を含む商業化を開始または継続するだろう。現在,薬物開発過程に固有のリスクにより,reproxalapや我々の他の候補製品の開発を継続する際に生じるコストを確定的に見積もることはできない。我々のこれまでの臨床試験結果,およびFDAや他の第三者からのフィードバックにより,遅い日に開始される後続試験のコストがはるかに高くなる。したがって、私たちは引き続き私たちの臨床開発と潜在的な商業化活動を継続するために多くの追加資本が必要だ。私たちが未来に必要な支出の額と時間は、多くの要素に依存するだろうが、これらに限定されない
私たちは債務、株式、または代替融資計画を通じて私たちの運営に資金を提供するために、追加の資本を必要または望んでいるかもしれない。私たちはまた他の会社との協力やパートナーシップを通じて資金を求めることができる。債券を発行するには、私たちが特定の資産に追加的な留置権を付与する必要があるかもしれないが、これは私たちの柔軟性を制限するかもしれない。もし私たちが株式証券を発行することで追加資本を調達すれば、これらの融資の条項と価格は新しい投資家が私たちの既存の株主が獲得した条項よりも有利かもしれない。このような資金調達はまた私たちの既存の株主の所有権を大幅に希釈することができる。私たちは経済不確定、インフレ、資本市場が混乱している時期にあり、これは金融サービス業の不利な事態の発展、ロシアとウクライナの持続的な軍事衝突による地政学的不安定、および新冠肺炎疫病の著しい影響を受けている。さらに、資本市場の混乱はどの融資も挑戦的になる可能性があり、商業的に合理的な条項やこのような融資を得ることができない保証はない。もし私たちが得られなければ
25
追加的な融資がなければ、私たちは私たちの将来の活動の範囲を縮小することを要求されるかもしれません。これは私たちの業務、財務状況、経営業績を損なうかもしれません。未来に必要ないかなる追加融資も受け入れ可能な条件で提供されることは保証されず、もし本当にあれば。
上場企業として、取締役報酬金のコストおよび支出に限定されないが、取締役と上級管理職保険の増加、投資家関係費用、2002年のサバンズ-オキシリー法案および米国証券取引委員会とナスダックが実施した規則に関連する費用を含むコストを発生させ続け、私たちの普通株はナスダックに上場し、様々な他のコストを提供する。2002年のサバンズ-オキシリー法案は、効果的な情報開示制御、手続き、内部統制を維持することを要求した。
キャッシュフロー
次の表は、2023年6月30日と2022年6月30日までの6ヶ月間のキャッシュフローをまとめています
|
|
6か月来た |
|
|||||
|
|
2023 |
|
|
2022 |
|
||
経営活動のための現金純額 |
|
$ |
(22,801,654 |
) |
|
$ |
(32,831,792 |
) |
投資活動提供の現金純額 |
|
|
30,000,000 |
|
|
|
(75,970,506 |
) |
融資活動が提供する現金純額 |
|
|
57,851 |
|
|
|
23,324 |
|
現金および現金等価物の純増加(減額) |
|
$ |
7,256,197 |
|
|
$ |
(108,778,974 |
) |
経営活動それは.2023年6月30日までの6カ月間の経営活動用の純現金は2280万ドルだったが、2022年同期の経営活動用の純現金は3280万ドルだった。現金の主な用途は私たちの業務に資金を提供することだ。2022年同期と比較して、2023年6月30日までの6ヶ月間の経営活動で使用された現金が減少したのは、主に我々の純損失が減少したためであり、主に研究開発活動からの純損失であり、2022年同期と比較した計算すべき費用の変化(研究開発活動の支払金額と時間による)、前金の変化(支払いと入金の時間による)、株式報酬の増加も含まれている。
投資活動それは.2023年6月30日までの6カ月間、投資活動が提供した純現金は3,000万ドル、2022年6月30日までの6カ月間、投資活動用の現金純額は7,600万ドルだった。投資活動が提供する現金純額は主に2023年6月30日までの6カ月間の有価証券満期日と関係がある。投資活動のための現金純額は,主に有価証券の購入に関連しており,2023年6月30日まで6カ月間である。
融資活動それは.2023年6月30日までの6カ月間の融資活動で提供された純現金は579000ドルだったが、2022年6月30日までの6カ月は23.3万ドルだった。融資活動が提供する現金純額には、2023年6月30日と2022年6月30日までの6ヶ月間、主に従業員の株式購入計画下の株式購入が含まれる。
プロジェクト3.数量と品質市場リスクの開示について。
取引規制則12 b−2で定義されている“小さな報告会社”に適用される開示義務を遵守することが許可されているため、本プロジェクトに要求される情報を提供する必要はない。
項目4.制御プログラムがあります
開示制御とプログラムの有効性に関する結論
我々の開示委員会および経営陣(我々の最高経営責任者および臨時最高財務官を含む)の監督·参加の下で、本報告で述べた期間終了までの我々の開示制御および手順(1934年証券取引法(取引法)規則13 a-15(E)および15 d-15(E)で定義されたような)の設計および動作の有効性を評価した。我々の経営陣の評価(我々のCEOや仮財務官の参加を含む)によると、本報告期末までに、我々の最高経営責任者および仮財務官は、我々の開示統制および手続きが合理的な保証レベルで有効であると結論している。
財務報告の内部統制の変化
2023年6月30日までの3ヶ月間、財務報告の内部統制(“外国為替法案”第13 a-15(F)および15 d-15(F)条参照)に大きな影響を与えなかったり、財務報告の内部統制に大きな影響を与えたりする可能性がある。
26
部分II--その他の資料
第1項法律訴訟。
2023年7月31日、株主が米マサチューセッツ州地方裁判所に可能な集団訴訟を提起し、私たちおよび特定の現職および元官僚を対象にしたJuliana PaiceはAldeyra治療会社らの事件を訴えた。(テーブル23-cv-11737)。訴訟は、被告が1934年の証券取引法第10(B)と20(A)条および米国証券取引委員会規則10 b-5に違反したと告発した。原告によると、被告は虚偽または誤解性の陳述をしたか、またはADX-2191による原発性硝子体網膜リンパ腫の治療に関するNDAと将来性に関するいくつかの情報を開示できなかった。その他の事項を除いて、訴訟は、彼女自身と、2022年3月17日から2023年6月20日までの間に、私たちの証券を購入または他の方法で購入することを要求します。私たちは原告の主張に異議を唱え、積極的に訴訟を弁護しようとしている。現在、私たちはこの問題がもたらす可能性のある結果を合理的に予測したり、潜在的な損失を推定することができない。
また、吾らは通常業務過程で訴訟や請求の影響を受けることがあるが、上記に加えて、吾等は現在いかなる重大な法律訴訟の一方でもなく、吾等は吾等の未解決又は脅威に対する法的訴訟を一切知り得ておらず、吾等は当該等の訴訟や訴訟が吾等の業務、経営業績、キャッシュフロー又は財務状況に重大な悪影響を及ぼす可能性があると信じている。
プロジェクト1 A.リスク要因です
私たちの業務は多くの危険に直面している。以下に説明するリスク、および当10-Qフォーム四半期報告書に記載されている他の情報をよく考慮しなければなりません。これらのリスクは、私たちの業務、財務状況、および将来の業績に大きな影響を与える可能性があります。以下に説明するリスクはわが社が直面している唯一のリスクではない。私たちは今知らないか、あるいは私たちは現在どうでもいいリスクと不確実性が私たちの業務、将来性、財務状況、経営業績に重大な悪影響を及ぼす可能性があると考えています。
私たちの業務に関するリスクの概要
以下は,我々の普通株投資に投機的あるいはリスクを持たせる要因の概要である.この結論は私たちが直面しているすべての危険を解決していない。本リスク要因要約でまとめられたリスクおよび我々が直面している他のリスクに関する他の議論は、以下で見つけることができ、当社の普通株について投資決定を行う前に、本四半期報告書の10-Q表と、証券取引委員会に提出された他の文書の他の情報とをよく考慮しなければならない。
27
Reproxalapと我々の候補製品の潜在的開発と商業化に関するリスク
承認されれば、私たちの業務はreproxalapの成功した商業化に大きく依存する。もし私たちがreproxalapの上場承認を得ることに成功しなかった場合、あるいはこの過程で重大な遅延に遭遇した場合、あるいはマーケティング承認を得た後、これらの候補製品の商業化に成功できなかった場合、私たちの業務は実質的に損害を受けるだろう。
私たちは、私たちの将来の業務の成功を確保するために、規制部門の承認とreproxalapの成功商業化に大きく依存している。私たちは上場承認を成功させることができず、および/またはreproxalapを商業化することができない、これは大きなリスクだ。製薬業で大量に開発されている薬物のうち,一部の薬物のみがFDAに秘密保持協定を提出し,より少ない薬物が商業的に承認されている。
潜在的なNDAが承認される前と後に、私たちはreproxalapの商業化のためにかなりの時間と財力を投入するだろう。私たちはreproxalapがいつ発売されるかどうかを正確に予測できない。私たちが製品収入を作る能力は私たちがreproxalapの市場承認を得て商業化することにかかっているだろう。Reproxalapと私たちの他の候補製品の将来の規制と商業成功は、以下のリスクを含むいくつかのリスクの影響を受ける可能性があります
28
さらに、私たちが発売reproxalapまたは私たちの任意の他の候補製品の規制承認を得たとしても、そのような承認は、私たちが販売する指定された用途によって制限される可能性があります。したがって、私たちが必要な資金を得て私たちの候補製品を商業化したり、私たちの開発計画に資金を提供し続けても、私たちはreproxalapの商業化に成功するか、あるいは私たちの他の候補製品が開発または商業化に成功することを保証することはできない。もし私たちが規制部門の承認を得ることができない場合、あるいは承認された場合、私たちまたは私たちの未来のどのパートナーもreproxalapと私たちの他の候補製品を商業化することに成功できなければ、私たちは私たちの業務を継続するのに十分な収入を生むことができないかもしれない。
収入を生み出すために、私たちはFDAの承認とreproxalapの成功的な商業化に依存するだろう。もし私たちがFDAの承認を得ることに成功しなかったり、FDAの承認が延期されたり制限されたりすれば、私たちの収益能力は大幅に延期されるだろう。
私たちが収入を作る能力はreproxalapの成功的な開発、規制承認、商業化に依存するだろう。著者らは2022年12月にドライアイバイタルサインと症状を治療する非特許薬品申請を提出した。FDAは2023年2月にreproxalap NDAの申請を受け,PDUFA日を2023年11月23日とした。しかし,FDAはNDAの届出を受けることを決定し,PDUFA日付を設定することは,それが承認されて何の決定もなされていないことを示しておらず,これらの日までに承認されることも保証されていない.FDAは承認過程において大きな裁量権を有しており,臨床試験データの解釈やデータの十分性に同意しない可能性がある。臨床試験結果はよく異なる解釈の影響を受けやすく、監督管理機関はデータを分析する適切な方法に相違がある可能性があり、これは監督管理の承認を延期、制限或いは阻止する可能性がある。FDAはまた、追加の研究または臨床試験を行うことを要求することができ、申請を再検討する前に、これらの研究または臨床試験の結果を提出することができ、これは、私たちが計画または利用可能な資源よりも多くの資源を必要とし、私たちの申請に対するいかなる承認も大幅に延期する可能性がある。例えば、2023年6月に、原発性硝子体網膜リンパ腫の治療に使用されているADX−2191に関するNDAに関するFDAから完全な返信を受けた。完全な返信状は,文献に基づく“不拡散条約”の届出では“十分かつ良好な統制の調査に乏しい”,“有効性の実質的な証拠に欠ける”ことを指摘している。FDAの完全な返信を考慮して、著者らはADX-2191に関連する商業化前活動を一時停止し、原発性硝子体網膜リンパ腫の治療に用いた。Reproxalapまたは私たちの他の候補製品に対するマーケティング承認が延期され、制限され、または拒否された場合、私たちの候補製品をマーケティングする能力および製品販売を創造する能力は不利な影響を受けるだろう。このような遅延は、競争相手の製品が私たちの製品の前に承認され、特許保護、市場独占性、または両方を確保し、私たちの製品が数年以内に承認されないようにするためかもしれない。追加的な研究や臨床試験が私たちの申請を承認するのに十分ではない可能性もある。FDAが受け入れた提出されたNDAがタイムリーまたは根本的に承認されないという保証はない。
もし私たちが他の候補製品を開発して商業化できなければ、私たちは私たちの業務を発展させることができないかもしれない。
我々の成長戦略の一部として,免疫介在性疾患に関連する他の療法の開発と商業化を評価する予定である。著者らは化合物バンクの内部機会を評価し、また、高度に満たされていない医療需要と治療選択の限られた免疫介在性疾患患者を治療するために、他の候補製品および商業製品を継続的に許可または買収することを選択する可能性がある。これらの他の候補製品は、商業販売の前に、臨床前研究、臨床試験およびFDAおよび/または適用される外国の規制機関の承認を含む追加的で時間のかかる開発作業が必要となる。許可されていない候補製品は、私たちが追求する可能性のあるような兆候で他の人によって開発されたかもしれない。すべての候補製品は薬品開発固有の失敗リスクに直面しやすく、候補製品は十分な安全及び/又は有効性が証明されない可能性があり、監督管理機関の許可を得られない可能性がある。さらに、承認されたこのような製品は、経済的に生産または生産され、価格が適切で、商業化に成功したり、市場で広く受け入れられたり、他の商業代替製品よりも効果的であることを保証することはできません。
29
私たちの臨床試験のいかなる終了または一時停止、または開始または完了の遅延は、私たちのコスト増加を招き、私たちの収入を創出する能力を延期または制限し、私たちのビジネスの将来性に悪影響を及ぼす可能性がある。
私たちが行っているあるいは計画中の候補製品の臨床試験の開始または完成遅延は、私たちの製品開発コストとスケジュールに著しく影響する可能性があります。私たちは未来の裁判が時間通りに始まるか、あるいは予定通りに終わるかどうか分からない。臨床試験の開始と完成は様々な原因で延期される可能性があり、以下に関連する遅延を含む
もし私たちが私たちの候補製品をテストしたり承認したりすれば、あるいは計画よりも多く、より大きく、あるいは長い臨床試験を行う必要があれば、製品開発コストが増加するだろう。さらに、規制要件や政策は変化する可能性があり、私たちまたは私たちのパートナーは、これらの変化を反映するために臨床試験案を修正する必要があるかもしれない。修正案は,われわれの臨床試験案をIRBsに再提出して再検査することが要求される可能性があり,臨床試験のコスト,時間,あるいは成功に影響する可能性がある。もし私たちが遅延完了に遭遇した場合、または私たち、FDAまたは他の規制機関、IRB、他の審査エンティティ、または私たちの任意の臨床試験サイトが私たちの任意の臨床試験を一時停止または終了すれば、候補製品の商業的見通しが損なわれる可能性があり、私たちが製品収入を創出する能力は延期されるだろう。さらに、臨床試験の終了または一時停止、または臨床試験の開始または完了遅延をもたらす多くの要因も、最終的に候補製品の規制承認を拒否する可能性がある。さらに、1つ以上の臨床試験が延期されれば、私たちの競争相手は私たちよりも早く製品を市場に出すかもしれません。私たちの候補製品の商業実行可能性は著しく低下するかもしれません。
30
Reproxalapと私たちの他の候補製品は広く規制されており、これらの規制を遵守するのは高価で時間がかかり、このような規制は予期せぬ遅延を招き、あるいは私たちの候補製品を商業化するために必要な承認を受けることを阻止する可能性がある。
著者らの候補製品の臨床開発、製造、ラベル、貯蔵、記録保存、広告、販売促進、輸入、輸出、マーケティングと流通はすべてアメリカFDAと国外市場の類似機関の広範な監督管理を受けている。アメリカでは、FDAの規制承認を受けるまで、私たちの候補製品の販売は許可されていません。監督管理の承認を得る過程は高価で時間がかかり、しかも関連する製品のタイプ、複雑性と意外性及び目標適応と患者群によって大きく異なる可能性がある。審査政策或いは法規は変化する可能性があり、FDAは薬品の審査過程中にかなりの自由裁量権を持ち、多種の原因で延期、制限或いは承認候補製品を拒否する権利がある。候補製品の臨床開発に時間と費用を投入したにもかかわらず、監督管理部門の承認及びその後の商業成功は不確定であり、保証することもできない。
Reproxalapと私たちの他の候補製品、およびテスト、製造、安全性、有効性、記録保存、ラベル、貯蔵、承認、広告、販売促進、販売、流通を含む開発と商業化に関連する活動は、米国FDAと他の規制機関および他の管轄区域の類似機関によって広く規制されている。
私たちが行っている研究と開発活動、そして私たちの候補製品計画のための臨床開発と商業化は、様々な理由で延期、修正、停止される可能性があります
31
FDAまたは同様の外国規制機関は、様々な理由で承認候補製品を延期、制限、または拒否することができるが、これらに限定されない
外国市場については,承認手続きは国によって異なり,上記のリスクに加えて,追加の製品テスト,行政審査期限,価格主管部門との合意に及ぶ可能性がある。また、ある上場薬品の安全性に対する疑問を引き起こす事件はFDAと類似の外国の監督管理機関が安全性、有効性或いはその他の監督管理に基づいて新薬を審査することを考慮する時に更に慎重であり、そして監督管理の許可を得る重大な遅延を招く可能性がある。適用可能な規制承認を得るか得られないかのいずれの遅延も、私たちまたは私たちの任意の未来の開発パートナーが私たちの候補製品を商業化することを阻止するだろう。また,連邦資金や保険カバー範囲を減少させる可能性があること,およびそのような改革が我々の業務および現在または将来の候補製品の規制承認を得る能力に悪影響を及ぼすかどうかを含む,将来的にとりうる医療改革の取り組みを予測することはできない。変化する法的要求は私たちの業務に引き続き影響を及ぼすだろう。
同社は薬品の商業化に経験がないため、私たちに関する情報は限られており、私たちの候補製品や業務の将来性を評価するために使うことができます。
私たちは、企業が新たかつ急速に発展する分野でよく遭遇する多くの商業前および商業リスクおよび不確実性、特にバイオ製薬分野で成功的に克服する能力があることを証明していない。例えば私たちの業務計画を実行するには成功する必要があります
32
これらの目標を達成できなければ、候補製品を開発し、資金を調達し、業務を拡大したり、運営を継続することができないかもしれない。また,候補製品の臨床試験で成功しても,知覚されたマーケティング挑戦や我々のポートフォリオにおけるビジネス吸引力の相対的な違いを考慮して,さらなる開発や商業化を保留することを選択する可能性がある。
臨床前研究と早期臨床試験の結果は常に未来の結果を予測するわけではない。私たちまたは私たちの任意の未来開発パートナーが臨床試験に入った任意の候補製品は、今後の臨床試験で有利な結果が得られない可能性があり、もしあれば、規制部門の承認を得ない可能性もある。
薬物開発には内在的なリスクがある。私たちまたは私たちの任意の未来の開発パートナーは、私たちの候補製品が安全かつ有効で、良好な利益-リスクプロファイルを有することを十分かつ制御された臨床試験によって証明することを要求され、その目標適応に使用することができ、その後、規制機関にその商業販売の承認を求めることができる。薬物開発は長い、高価で不確実なプロセスであり、開発のどの段階でも遅延または失敗が生じる可能性があり、私たちの任意の臨床試験の開始後を含む。1つの適応の臨床試験において、任意の負の結果または負の結果と考えられることは、別の適応を開発および潜在的に商業的に治療するreproxalapまたは我々の他の候補製品の能力に悪影響を及ぼす可能性がある。さらに、候補製品の開発に伴い、試験設計は常に異なる可能性があり、適応試験の場合のように、異なる段階または同じ段階または同じ試験で変化および変更する必要があるかもしれない;車両または制御装置は異なる試験で修正される可能性があり、商業規模で製造可能な製品候補サンプルを試験する必要があるため、製品配合または製造過程が異なる可能性がある。臨床試験の他の段階に合格したにもかかわらず、後期臨床試験における候補製品は、臨床試験の他の段階に合格したにもかかわらず、摩耗行列、早期臨床試験、または異なる適応に集中した臨床試験における成功は、後の臨床試験が成功することを意味するものではない。また,FDAなどの規制機関との検討は,試験設計や計画の変更を招く可能性がある。会社は高度臨床試験で大きな挫折を経験することが多く,コホートや早期臨床試験が有望な結果を示した後も同様である。たとえば,静かな実験の結果は静かなすり合わせ行列の結果を反映していない.また,開発中の薬物の一部のみがNDAをFDAに提出し,より少ない薬物が商業化承認された。
我々は疾患を治療する新製品候補製品を開発しているが,臨床薬物開発経験はほとんどなく,場合によっては適応試験や新たな終点や方法を設計しているため,承認された規制経路がよく定義されていないため,我々の臨床試験は期待される結果や追加試験を必要とするリスクが大きい。
我々の臨床重点は免疫介在性疾患を治療する新製品の開発である。われわれは増殖性硝子体網膜症における適応試験,すなわちGARD試験を行い,将来的には他の適応がある可能性がある。適応性試験では,実験の最初の部分がキーや決定的に設計されているわけではない.逆に,適応性試験の最初の部分は,試験の後続部分を指導するためのデータを提供する予定であり,異なる終点を含むが異なる終点を含む設計を変更する必要があるかもしれない.また,適応性試験の初期部分の後には,他の事項に加えて,継続試験の後続部分を決定し,これらの初期部分の成功や失敗に基づいて試験を終了するか,試験·開発計画の次のステップを決定する前に,試験結果や規制経路を規制機関と検討することが可能である。したがって,われわれの晩期臨床プロジェクトが成功する可能性は必ずしも予測可能ではない。
新型療法の歴史臨床試験経験が不足しているため、著者らは臨床試験の設計と著者らの候補製品の監督管理許可を獲得する上でも挑戦に直面する可能性がある。そのため、規制機関が候補製品の承認を受けるかどうかを決定することは困難であり、規制承認の獲得に関連する時間やコストを予測することも困難である。FDAとその他の監督機関の臨床試験要求及び監督機関が候補製品の安全性と有効性を確定するための標準は、潜在製品のタイプ、複雑性、意外性及び期待用途と市場によって大きく異なる。我々のような新製品候補製品の規制承認プロセスは、他のより有名またはより広く研究されている候補製品カテゴリと比較して、より多くの時間および試験データを必要とする可能性がある。また、規制機関が競争相手を審査することで、私たちの候補製品タイプをよりよく知ることも可能です
33
候補製品に対して、このような機関は私たちの候補製品に予期しない新しい条件を加えるかもしれない。適用規制機関が受け入れられる方案、方法と終点を使用して臨床試験を設計することができない場合、及び私たちの候補製品のために監督管理の許可を得ることができない場合は、すべて私たちの業務、将来性、財務状況と運営結果に不利な影響を与える。
私たちの知る限り、いくつかの候補製品は新しい化学物質であるため、開発時間とコストを予測することは困難であり、これらの候補製品の臨床開発を成功させ、商業化に必要な規制承認を得る能力を得ることができる。
私たちの知る限り、私たちのいくつかの候補製品は新しい化学物質であり、新しい技術に関連する意外な問題が発生する可能性があり、これらの問題は私たちの開発作業を延期、一時停止、または終了させる可能性がある。そのため,短期的かつ長期的な安全性や有効性の見通しが完全に理解されておらず,予測も困難である。監督管理機関の候補新製品の承認は、良好な特徴を持つ或いはより広く研究されている薬品候補製品を承認するコストよりも高く、所要時間が長い可能性がある。FDAおよびこの分野の専門家と議論した後、私たちは、いくつかの適応の下で私たちの1つまたは複数の製品を開発することが費用対効果に適合しないことを決定するか、またはその分野での開発を停止するか、または戦略的パートナーを探すことを決定するかもしれない。
私たちは規制機関の様々な指定を得ることができないかもしれませんが、これらの指定は、私たちの1つ以上の候補製品の審査過程を加速させるかもしれません。たとえ私たちが1つ以上のそのような指定を受けたとしても、最終的に審査過程を加速させることを保証したり、市場の承認を得たり、市場排他性を提供したりするのを助けることはできません。
私たちはFDAおよび他の規制機関にいくつかの指定を申請することができ、これは、規制審査を加速させる可能性、特定の財務的インセンティブ、および一定期間の承認後の排他的な可能性を含む様々な組み合わせを提供するだろう。これらの指定には,孤児薬指定,画期的治療指定,加速承認,迅速チャネル状態,および我々候補製品の優先審査が含まれているが,これらに限定されない。私たちは現在と未来の候補製品のための1つ以上のそのような称号を求めるかもしれない。ADX−2191は2018年4月にFDA指定の増殖性硝子体網膜症予防孤児薬を獲得し,2020年6月にADX−2191は欧州委員会により網膜剥離治療孤児薬として指定された。2019年9月、ADX-2191は増殖性硝子体網膜症の予防のためにFDAの快速チャネルの称号を獲得した。私たちは私たちの他の候補物がこのような称号を得る資格があるということを保証できない。私たちのどの候補製品もこのような認証を受ける資格があることも保証されないし、FDAが遅れてその付与された認証を撤回しないだろう。さらに、このような認証を取得した候補製品がこのような認証から利益を得ることは保証されず、FDAがそのような認証を取得した後にそのような認証を撤回しない保証はない。孤児薬物排他性のような一定期間の市場排他性の指定を受けた場合、この排他性は、異なる薬物が同じ条件のために承認されることができるので、競合から製品を効果的に保護することができない可能性がある。また,孤児薬物状態については,孤児薬物が承認された後であっても,FDAが後者の薬物の方が臨床的に良いと結論すれば,より安全,より有効であることが証明され,患者ケアに大きな貢献が証明されれば,FDAはその後同じ状況に対して同じ薬物を承認することができる。
試験の完全性を保護するために、適応臨床試験の初期部分の臨床データは開示されない可能性がある。
適応臨床試験は、一般に、試験の初期部分が、その後、試験の重要な部分である可能性のあるサンプル量および終点を決定するために使用される。したがって、適応試験の最初の部分の結果は、キーまたは決定的に設計されているわけではなく、場合によっては、試験後続部分に参加する調査者または患者に積極的または消極的な偏見が生じないように、詳細な試験データが開示されない可能性がある。
増殖性硝子体網膜症の適応試験を行っている。上記の理由により、裁判の後続部分が完了するか、または適合裁判全体が完了するまで、警備裁判の最初の部分の詳細な結果が開示される。さらに、適応試験の初期部分は、バイオマーカーまたは代替マーカーを生成、分析、および解釈するために多くの時間を必要とする可能性があることを評価するために部分的に実行されてもよい。したがって,バイオマーカーや代替マーカーの評価に要する時間により,適応試験初期部分の臨床結果の開示が遅れる可能性もある。
孤児またはまれな疾患に対する候補製品が商業化されている間(私たちの製品が規制機関の承認を得た場合)、患者を私たちの臨床試験に参加したり、患者を識別したりすることは困難であることが分かるかもしれない。
我々の業務戦略の一部として,孤児や他のまれな疾患(増殖性硝子体網膜症および網膜色素変性を含む)の治療のための候補製品の開発と商業化を継続して評価してきた。もし私たちが十分な数の合格患者がFDA或いは他の非アメリカ監督機関が要求した臨床試験に参加することを望むことができなければ、著者らは臨床試験を開始或いは継続できないかもしれない。また、他の人が似たような病気を治療する製品を開発すれば、希少な患者集団の登録人数を競争するかもしれない
34
これは,われわれの現在および計画中の臨床試験の患者登録比率やタイムリーな完成に悪影響を及ぼす可能性がある。著者らの候補製品の臨床試験中のいかなる負の結果あるいは負の結果と考えられても、私たちは同じ候補製品の他の臨床試験で患者を募集または維持することを困難または不可能にする可能性がある。患者登録不足は他の要素の作用である可能性があり、患者群の大きさと性質、方案の性質、患者と臨床場所の接近程度、疾病症状の出現時間と程度、関連疾病の有効な治療方法の可用性及び臨床試験の資格標準を含む。私たちは私たちの現在または未来の任意の臨床試験に参加するのに十分な数の合格患者を識別し、募集することができず、重大な遅延を招くか、あるいは1つ以上の臨床試験あるいは開発計画を放棄する必要があるかもしれない。新冠肺炎の大流行はすでに著者らが臨床試験中に患者を募集と維持する能力に影響を与える可能性がある。例えば,われわれのADX−2191のGARD試験と12カ月間のreproxalap安全試験の患者登録者数が負の影響を受けたのは,試験地点の臨床試験者が限られていることと,一部の患者が手術を延期することを選択したためである。これらや他の要因により,将来の患者登録の遅延はコスト増加を招く可能性があり,あるいはわれわれの臨床試験の時間や結果に影響を与える可能性があり,これらの試験の完了を阻止し,候補製品開発を進める能力に悪影響を及ぼす可能性がある。例えば,増殖性硝子体網膜症などのまれな疾患では,利用可能な患者が不足している,あるいは十分な数の患者を募集あるいは保持することが困難であり,我々の臨床試験を困難あるいはコストが高すぎる可能性があり,適用候補製品の規制承認を継続的に開発し,求めることができない可能性がある。さらに、私たちの製品が規制機関の承認を受けた場合、私たちは十分な数の患者を識別して相当な収入を得ることができないかもしれない。
私たちまたは私たちの任意の未来の開発パートナーが臨床試験を推進する任意の候補製品は、受け入れられない有害事象をもたらす可能性があり、またはその規制承認または商業化を延期または阻止し、またはその商業的潜在力を制限する可能性がある他の特性を有する。
私たちまたは他の人が私たちの任意の候補製品を臨床試験に推進することによって引き起こされる許容できない有害事象は、私たちまたは規制機関の臨床試験の中断、延期、または強制臨床保留を招く可能性があり、FDAまたは他の規制機関が任意またはすべての目標適応および市場の規制承認を拒否する可能性がある。これは逆に、影響を受けた候補製品の開発や商業化を阻止し、その販売から収入を得ることを阻止する可能性がある。
我々は,承認を求める適応を治療するための候補製品の開発を継続しており,我々のどの候補製品を受け入れた被験者において観察された有害事象の全程度は知られていない。もし私たちの候補製品が臨床試験で受け入れられない有害事象を招く場合、以前に行われた試験よりも大きくまたは長い可能性があり、規制部門の承認を得ることができないか、あるいはその候補製品を商業化することができないかもしれない。
私たちがreproxalapや任意の他の候補製品の上場承認を得ても、規制要求を遵守していなければ、あるいは私たちの候補製品が承認された時に予期しない問題に遭遇した場合、処罰を受けるかもしれないという制限や市場から撤退する可能性がある。
米国の監督管理部門の許可を得ても、FDAは製品の指示用途やマーケティングに重大な制限を加えたり、高価で時間がかかる可能性のある承認後の研究或いは臨床試験、発売後のモニタリング或いは他の潜在的な追加の臨床試験に持続的な要求を提出する可能性がある。Reproxalapまたは任意の他の候補製品が承認された後(ある場合)、これらの候補製品は、ラベル、パッケージ、貯蔵、流通、セキュリティ監視、広告、販売促進、記録保存、およびセキュリティおよび他の発売後の情報報告に対するFDAの持続的な要件にも準拠する。また、薬品メーカー及びその施設はFDAと他の監督機関の持続的な審査と定期検査を受けて、品質管理、品質保証と相応の記録とファイルの保存に関する要求を含むcGMP要求に適合することを確実にしなければならない。もし私たちまたは監督機関がある製品に以前に未知の問題があることを発見した場合、例えば予期しない深刻性、深刻性または頻度の不良事件、またはその製品の製造施設に問題がある場合、監督管理機関は、リコールを要求するか、市場から製品を撤回するか、または生産を一時停止することを含む、製品、製造施設、または私たちに制限を加えることができる。
私たちまたはreproxalapの製造施設または規制の承認を受ける可能性のある他の候補製品(ある場合)が適用される規制要件を遵守できない場合、規制機関は:
35
上記のいずれの事件や処罰の発生も、候補製品を商業化し、収入を創出する能力を抑制することができる。
FDAは、NDAの一部としてリスク評価および緩和戦略(REMS)計画を要求する権利があり、または承認された後、承認された薬物の配布または使用に、特定の医師または専門的に訓練された医療センターの処方を制限し、治療を特定の安全使用基準に適合する患者に制限し、治療を受けることを要求する患者の登録を制限するなど、さらなる要求または制限を加える可能性がある。
さらに、reproxalapまたは私たちの他の任意の候補製品が承認された場合、私たちの製品ラベル、広告、および販売促進は、規制要件および持続的な規制によって検討されるだろう。FDAは処方薬に関する販売促進声明を厳格に規制する。特に、製品は、当該製品が承認されたラベルに反映されるように、FDA承認されていない用途に使用されてはならない。もし私たちが候補製品のマーケティング承認を得たら、医師は承認されたラベルと一致しない方法で患者に処方するかもしれない。もし私たちがこのようなラベル外の使用を普及させることを発見されたら、私たちは重大な責任を負うかもしれない。FDAや他の機関はラベル外用途の普及を禁止する法律や法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な制裁を受ける可能性がある。連邦政府は不正販売促進の疑いのある会社に巨額の民事と刑事罰金を科し、いくつかの会社がラベル外販売促進に従事することを禁止している。政府はまた、同意法令や会社誠実協定に署名しており、これらの合意によると、具体的な販売促進行為が変更または制限される。
規制部門のreproxalapや他の候補製品の承認を得ても、商業化に成功できない可能性があり、私たちがその販売から得た収入(あれば)は限られているかもしれない。
我々の候補製品が規制部門の承認を得ても,医師,患者,医療支払者,医療界の市場に受け入れられない可能性がある。第三者支払人(政府支払人を含む)の私たちの候補製品に対する保証と精算も通常、商業成功に必要です。さらに、私たちは支払人との有利な契約を得ることができないかもしれないし、私たちの製品の価格を予想レベルにしたり、商業化を成功させることができるレベルにすることができないかもしれない。私たちの製品の価格は多くの要素の影響を受けます。その中の多くの要素は私たちがコントロールできるものではありません。似たような製品の価格設定を含みます。私たちの候補製品に対する市場の受け入れ度は多くの要素に依存するだろうが、これらに限定されない
36
また,ADX−2191(メトトレキサート)の活性成分は模倣薬であるため,後発薬メーカーは,ある孤児薬物指定の商業排他性満了後に,競争力のあるメトトレキサート硝子体内製剤を開発·販売することができる可能性がある。模倣薬競争はADX-2191の商業的潜在力に実質的な悪影響を及ぼすだろう。さらに、承認された場合、ADX−2191の商業化に成功するかどうかは、薬剤品質および安全法(DQSA)および米国連邦食品、薬物および化粧品法(FDCA)に違反する可能性のある他の関連条項の複合コピーを含む、複方薬局によって製造された商業がFDAによって承認されることができる製品の複合コピーを保証するために、多くの他の要因に依存するが、これらに限定されない。
しかも、私たちは未来にどのような医療改革が行われるかもしれないと予測できない。連邦と州の立法と規制はさらに発展する可能性があり、米国が行っている措置は薬品価格の圧力を増加させると予想される。このような改革は、現在または将来規制によって承認される可能性のある候補製品の価格設定および予想収入に悪影響を及ぼす可能性があり、私たちの全体的な財務状況や候補薬を開発する能力に影響を及ぼす可能性がある。
任意の候補製品が承認されたが、医師、病院、医療支払者、または患者の十分な程度の受け入れが得られなかった場合、候補製品から十分な収入を得ることができず、利益を達成または維持することができない可能性がある。私たちの教育医療界と第三者支払者のreproxalapや私たちの他の候補製品のメリットに関する努力は大量の資源を必要とするかもしれないし、決して成功しないかもしれない。また、候補製品を商業化することに成功した能力は、私たちが製品を製造する能力、私たちの製品を競争製品と区別する能力、私たちの製品の知的財産権を保護する能力に依存する。多くの承認された製品を持つ競争相手が交渉できる可能性がある これは私たちが交渉できる価格と精算よりずっと有利だ。
また,我々の競争相手のどの製品も承認されているが,何らかの理由で市場に受け入れられなければ,reproxalapのような製品は満たされていない医療ニーズを十分に満たしていないと考えられるかもしれない。もし私たちが医者、病院、第三者支払人と患者に私たちの製品がもっと良い代替品であることを証明できなければ、私たちは私たちの予想されたレベルで市場が私たちの製品を受け入れることができないかもしれないので、私たちの業務は実質的な損害を受けるかもしれません。
もしreproxalapと私たちの他の候補製品の市場機会が私たちが思っているより小さいなら、私たちが患者を識別して著しい市場シェアを得ることができなければ、私たちの収入は不利な影響を受ける可能性があり、私たちの業務は影響を受けるかもしれない。
我々は免疫介在性疾患の治療に関する研究と製品開発に焦点を当てている。我々が候補薬物のために推定した潜在市場と市場機会は、第三者が発表したデータ、私たち自身の市場洞察と内部市場情報、内部で発生したデータと仮定を含む様々な投入に基づいている。私たちはいかなる第三者情報も独立して確認していないし、その正確性や完全性を保証することもできない。これらの疾患に罹患している人の数および候補製品治療から利益を得る可能性があるこれらの疾患患者のサブセットの予測は、推定に基づいている。これらの推定は,科学文献,診療所調査や市場研究を含む様々な源から来ており,不正確であることが証明されている可能性がある。また、新しい研究はこれらの疾病の推定発病率或いは流行率を変える可能性がある。患者の数は予想よりも少ないか、または識別しにくいかもしれない。さらに、市場状況や規制の挑戦のため、私たちの候補製品は商業的に成功できないかもしれない。
これらの要素のいずれも、製品販売から収入を得る能力および利益を達成し、維持する能力に悪影響を及ぼす可能性があり、したがって、私たちの業務は影響を受ける可能性がある。さらに、これらの不正確またはエラーは、資本および他の重要な業務リソースを誤って構成することを招き、これは私たちの業務を損なう可能性があります。
37
私たちの候補製品については、いくつかの細分化市場では、精算が限られているか、使えないかもしれません。これは、私たちの候補製品を利益的に販売することを困難にするかもしれません。
私たちの候補製品に対する市場の受け入れと販売は、私たちの候補製品が十分な保険カバー範囲と第三者支払者の精算を持っているかどうかに大きく依存し、既存と将来の医療改革措置の影響を受ける可能性がある。政府当局と第三者支払者、例えば個人健康保険会社や健康維持組織は、どのような薬剤を支払うかを決定し、精算レベルを確立する。清算水準は私たちの候補製品の現在の予想価格より大幅に低いかもしれない。米国または私たちが業務を展開する可能性のある他の管轄区域全体の経済的負の傾向により、これらの組織はその返済義務を履行できないか、支払いを遅延させる可能性がある。第三者支払者が候補製品を使用するかどうかを決定することを含む、第三者支払者の精算は、多くの要因に依存する可能性がある
政府または他の第三者支払人から候補製品の保証範囲および精算承認を得ることは、適用可能な候補製品を使用するために、支払人に支援を提供する科学的、臨床的、および費用便益データを必要とするかもしれない。私たちは保証と補償の承認を得るのに十分なデータを提供できないかもしれない。私たちは私たちのどんな候補製品も保険や十分な精算を受けることができることを確実にすることができない。しかも、私たちは精算金額が私たちの候補製品に対する需要や価格を下げないということを確認できない。精算が得られない場合や限られたレベルの精算のみが提供されなければ、承認されても、私たちのいくつかの候補製品を商業化することができないかもしれません。近年,立法と規制行動により,連邦政府は医療保険精算の方法や金額を変更するなど,米国の医療保健制度を重大な改革を行っている。多くの米議会議員が“患者保護·平価医療法案”(PPACA)の廃止と代替を試みていたが、本報告が提出された日まで成功しなかった。PACAの最終的な形式や時間を廃止または置換することは予測できず,このような廃止や置換が我々の業務に与える影響も予測できない.PACAの廃止や代替が我々に与える影響にかかわらず,政府は医療改革の推進と医療コストの低減に強い興味を示している。これらの改革は今後10年で医療保険や医療補助の支出を大幅に減少させる可能性がある。これらの支払いシステムの改革または他の変更は、支払資格条件の修正、バンドル支払い、または新しいプロバイダに登録制限を加えることを含み、連邦医療保険、個人保険会社、および他の第三者支払者が私たちの現在および将来の候補製品(ある場合)の精算の利用可能性、方法、およびレートを変更する可能性があり、規制部門の承認を得ることができる。その中のいくつかの変化と提案された変化は、このような製品候補製品の販売率を低下させる可能性があり、承認されれば、これは私たちの業務戦略、運営、財務業績に悪影響を及ぼすだろう。
立法提案や米国の医療管理傾向により,第三者決済者は新薬のカバー範囲や精算レベルを制限することで医療コストを抑制しようとするようになってきている。支払者は、FDAが承認して発売された製品以外の医学的適応の承認された候補製品に保険を提供することを拒否することもできる。したがって,第三者支払者が患者に新たに承認された薬物を多少補償するかどうかには大きな不確実性があり,逆に薬品価格を低下させる可能性がある。私たちは、管理的医療の傾向、ヘルスケア組織のますます増加している影響力、支払者と契約を締結して、競争製品の精算を減らすための大きな会社、追加の立法提案、および国、地域、あるいは地方医療予算制限により、私たちの候補製品の販売に関連した価格設定圧力に直面することが予想される。
私たちは大量の製造リスクに直面しています。どのリスクも私たちのコストを大幅に増加させ、私たちの製品の供給を制限する可能性があります。
私たちの製品の製造過程は複雑で、監督管理が厳しく、いくつかのリスクの影響を受けています
38
私たちの候補薬の臨床試験を行うためには、それらを大量に生産する必要がある。拡張活動中に品質の問題が発生する可能性がある。限られた数の契約製造組織(CMO)への依存、薬品生産の複雑さ、生産プロセスの拡大の困難は、私たちの候補薬物の臨床試験、監督提出、必要な承認或いは商業化の遅延を招き、私たちにより高いコストを発生させ、私たちの候補薬物の商業化に成功することを阻止するかもしれない。さらに、我々のCMOが必要な商業品質および数量の材料を商業的に合理的な価格でタイムリーに提供できず、実質的に同じコストでタイムリーに生産できる1つ以上の代替CMOを確保できない場合、候補薬剤の試験および臨床試験は延期または不可能になる可能性があり、任意の最終製品の規制承認または商業投与が遅延または入手できない可能性があり、これは私たちの業務を深刻に損なう可能性がある。さらに、CMOが規制と品質要求を遵守できなかったことは、私たちの生産や私たちのマーケティング申請の審査を遅延させる可能性があります。
私たちの製品の製造運営に影響を与える不利な事態の発展は、新冠肺炎の疫病或いはこれに対する対応措置を含めて、出荷遅延、在庫不足、ロット故障、製品撤回、リコール、承認或いはその他の製品供給中断を招く可能性がある。在庫を解約して計算し、規格に合わない製品に他の費用や支出を発生させ、高価な救済努力を行ったり、より高価な製造代替案を求めたりしなければならない可能性もある。
製品品質の問題は私たちの業務に実質的な悪影響を与える可能性があり、私たちは規制行動の影響を受け、顧客が私たちあるいは私たちの製品に対して自信を失ってしまう可能性があります。
私たちの成功は私たちの製品の品質にかかっている。品質管理、保証と管理は顧客の要求を満たし、欠陥を防止し、私たちの候補製品とサービスを改善し、候補製品の安全性と有効性を確保する上で重要な役割を果たしている。私たちの未来の成功は私たちの品質管理計画を維持し、持続的に改善する能力にかかっている。品質または安全問題は、不利な検査報告、警告状、製品のリコールまたは差し押さえ、金銭制裁、生産および流通製品の停止禁止、民事または刑事制裁、コストの高い訴訟、政府の承認および許可証の拒否、既存の承認および許可証の運営を制限または撤回する可能性がある。品質や安全問題を効果的かつタイムリーに解決できないことは、負の宣伝を招く可能性もあり、顧客は私たちまたは未来の製品に対して自信を失い、これは候補製品の成功的な発売と販売損失を招く可能性があり、これは私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性がある。
39
もし私たちの競争相手が私たちの候補製品の目標適応のために開発した治療法が私たちよりも早く承認され、マーケティングに成功したり、私たちの候補製品よりも安全または効果的であることが証明されれば、私たちのビジネス機会は減少または消失するだろう。
私たちはバイオテクノロジー市場競争の激しい細分化市場で事業を展開している。私たちは商業製薬とバイオテクノロジー企業、学術機関、政府機関、私営と公共研究機関を含む多くの異なる源からの競争に直面している。我々の候補製品開発が成功し承認されれば,既存療法(後発薬や非処方薬を含む)やわれわれのライバルが発売する可能性のある新しい療法と競争するであろう。増殖性硝子体網膜症や網膜色素変性のほかに,様々な承認された薬剤や候補薬が開発されており,テストしようとしている適応に用いられている。現在アメリカでドライアイの治療法には非処方薬の人工涙、Restasisがあります®シドラ®、CEQUA®Eysuvis®ティルヴァア®MieboTMVevyeとTMそれは.FDAは2022年2月にRESTASISの最初の模倣バージョンを承認しました®私たちの多くの競争相手は私たちよりずっと多くの財務、候補製品開発、製造、マーケティング資源を持っています。大手製薬と生物技術会社は薬物の臨床テストと監督管理の承認を得る上で豊富な経験を持っている。しかも、大学と民間と公共研究機関は私たちと直接競争するかもしれない。これらの組織と管理者、科学者、商業、臨床開発者の募集で競争する可能性もある。また、臨床試験場所の確立、臨床試験の被験者の登録、および新製品候補の決定および許可を含む、これらの第三者からの競争に直面する。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。
製薬と生命科学業界は迅速に新しい発展が現れ、他の疾病を治療する製薬技術と方法の発展を含む。競争相手の発展は私たちの候補製品を時代遅れにしたり競争力を欠いたりするかもしれない。他の当事者は、私たちと類似しているか、または異なる治療法および組成物を発見し、特許を出願するかもしれない。薬物開発分野の競争は非常に激しい。新しい治療法の市場進出と先進技術の出現に伴い、私たちは激しい競争と日々の競争に直面することを予想している。
私たちの将来の成功は、reproxalapまたは私たちの他の候補製品の設計、開発、商業化の面で競争優位性を展示し、維持する能力にかかっている。炎症性疾患はコルチコステロイドを含む一般的な免疫抑制療法で治療可能であり,その中のいくつかは後発薬である。我々の炎症性疾患分野における潜在的競争相手は,我々の候補品よりも安全または有効である可能性のある新たな免疫調節療法を開発している可能性がある。
もし私たちが販売、流通、マーケティング能力を確立し、維持することができなければ、あるいは第三者と合意して、私たちの候補製品をマーケティング、販売、流通することができなければ、私たちは何の収入も生まれないかもしれません。
私たちは最近販売やマーケティングインフラを設立し始めましたが、会社として、バイオ製薬製品の販売、マーケティング、流通には経験がありません。Reproxalapや私たちの他の任意の候補製品が最終的に規制部門の承認を得た場合、私たちは候補製品を効果的にマーケティングして流通させることができないかもしれません。私たちは内部販売、流通、およびマーケティング能力を発展させ、維持するために大量の財務および管理資源を投入しなければならず、いくつかはreproxalapまたは私たちの任意の他の候補製品が承認されることを確認する前に約束されるだろう。
私たちは現在、マーケティング承認を得た候補製品の米国での商業化を支援するために、独自の販売·マーケティング組織を構築する可能性があると予想している。Reproxalapの発売承認を得る前に、私たちは私たちの商業インフラを建設し始めた。私たち自身の販売とマーケティング能力を確立することは危険に関するものだ。例えば、販売チームの採用と訓練は高価で時間がかかり、どんな製品の発表も延期される可能性がある。Reproxalapまたは私たちが商業インフラを確立するための任意の候補製品の商業発表が何らかの理由で遅延または発生していない場合、私たちが予想している時間枠内でマーケティング承認を得ていない場合、私たちはこれらの商業化費用を早期または不必要に発生させるだろう。これらの努力は費用が高いかもしれません。もし私たちが私たちの販売とマーケティング担当者を維持したり、再配置できなければ、私たちの投資は損失します。
もし私たちが自分の販売とマーケティング能力を確立し、第三者とこれらのサービスを提供する手配を達成できなければ、私たちの製品の販売収入と私たちの収益性(あれば)は、私たちが開発したどの製品も私たちがマーケティングして販売しているものよりも低くなるかもしれません。さらに、私たちは私たちの候補薬をマーケティングして販売するために、第三者との合意に成功できないかもしれないし、私たちが受け入れられる条項でそうすることができないかもしれない。これらの第三者のいずれかは、私たちの製品を効率的に販売し、マーケティングするために必要な資源と注意を投入することができないかもしれない。もし私たちが販売とマーケティング能力を確立することに成功できなければ、私たち自身も第三者と協力しても、私たちの候補薬物を商業化することに成功しないだろう。
40
FDAまたは同様の外国規制機関が上場承認された候補製品の模造薬バージョンを承認した場合、またはこれらの機関が私たちの候補製品模造薬を承認する前に私たちの候補製品に適切なデータ期間や市場排他性を与えなかった場合、私たちの候補製品の販売は悪影響を受ける可能性がある。
NDAが承認されると、そのカバーされた薬剤は、FDA出版物“治療同等性評価を有する承認された医薬製品”における“参照リスト薬物”となる。メーカーは,米国に簡略化された新薬申請(ANDA)を提出することにより,発売薬の後発薬バージョンを参考にした発売承認を求めることができる。ANDAを支援するためには,後発薬メーカーは安全性と有効性を証明するための臨床試験を行う必要がない。対照的に、出願人は通常、参照発売薬と同じ有効成分(S)、剤形、強度、投与経路および使用条件またはラベルを有するので、その薬物が参考発売薬と同じ薬学的に証明しなければならず、模倣薬は参考発売薬物と生物学的同等性を有し、これは体内での吸収速度と程度が同じであることを意味する。後発薬の発売コストは発売された薬物を参考にするよりはるかに低い可能性があり、模造薬を生産する会社は通常より低い価格で薬品を提供することができる。そのため,後発薬が発売された後,任意のブランド製品や参考リスト薬物の売上のかなりの部分が模倣薬の手に流出することが多い。
FDAは、参照リスト薬剤の任意の適用可能な非特許専有期間が満了するまで、模倣薬のANDAを承認しない可能性がある。FDCAは新しい化学実体を含む新薬に5年間の非特許専門期を提供した。排他期間内に、FDAは、出願人が合法的な参照承認に必要なすべてのデータの権利を所有していないことを前提として、候補製品の別のバージョンのために提出されたANDAまたは505(B)(2)NDAを別の会社が審査することを受け入れてはならない。しかしながら、出願が特許無効、実行可能、または侵害可能な証明を含む場合、4年後に提出することができる。FDCAはまた、出願人がバイオアベイラビリティ研究以外の新しい臨床研究(例えば、既存の薬剤の新しい適応、用量または強度をサポートする研究)を行ったり賛助したりすることを前提として、505(B)(1)NDA、505(B)(2)NDAまたは承認されたNDAの補充のための3年間の市場排他性を提供し、FDAは申請を承認するために重要であると考えられる。この3年間の専門権は、新しい臨床研究に関連する条件のみをカバーしており、FDAが競合他社の製品を他の使用条件の候補製品に承認することを禁止しておらず、その中には元の活性物質が含まれている。5年および3年の排他性は、完全な505(B)(1)秘密協定の提出または承認を延期または承認しない。メーカーは市場の排他期間が終わった後にこれらの模造薬の発売を求めるかもしれません。私たちの薬物でも特許保護があります。
EUおよびイギリスでは、革新的な医薬製品は、完全なマーケティング許可申請に基づいて許可されている(それに対して、マーケティング許可申請は、以前に承認された別の医薬製品のマーケティング許可ファイル内のデータに依存する)。革新的医薬製品の発売許可申請は、マーケティング許可を求める医薬製品に対する薬物試験、臨床前試験、および臨床試験の結果を含まなければならない(適用される場合、免除または延期が得られない限り--以下に述べる)。EUでは,これらの出願は,第2001/83/EC号指示(分散手順または相互承認手続に関する)または第726/2004号条例(集中手続に関する)に基づいて提出されなければならない。イギリスでは、新しい薬品規制法の枠組みの下で様々な手続きが利用可能であり、場合によっては欧州当局によって公認評価される可能性が含まれているか、または英国規制機関(MHRA)に直接申請されている。
上場許可された出願人が、自分の薬品、臨床前試験、および臨床試験データを含み、既存の医薬製品に属さない“グローバルマーケティング許可”を申請する完全なファイルを提出した場合、出願人は、マーケティング許可を得た後に8年間の規制データ保護を有する権利がある(この期限は、EU/欧州経済地域(EEA)の最初のマーケティング許可から計算される)。この間、模倣薬または生体模倣薬の承認を申請する人は、許可されたまたは参照された医薬製品のために提出された上場許可ファイルに含まれるデータに依存して、その申請をサポートすることができない。8年間の監督管理データ保護期間が満了した後、参考薬品は他の2年間のマーケティング保護期間から利益を得る。この2年間の市場保護期間中、参照薬品ファイルに依存する模倣薬または生物類似薬はEU市場に入ることができないが、その間、模倣薬または生物類似薬の上場許可申請はEU加盟国の主管監督機関に提出することができる。2年間の上場保護期間をさらに1年延長することができ、最初の発売許可の最初の8年以内に、マーケティング許可保持者が1つまたは複数の新しい治療適応の許可を得たが、許可前の科学的評価では、これらの適応は既存の治療法と比較して有意な臨床的利益をもたらすことができると考えられる。しかしながら、1つの化合物が新しい活性物質であると考えられていても、イノベーターは、他の知的財産権または規制排他性が適用されていないことを前提として、規制データ保護期間およびマーケティング保護期間を得ることができ、別の無関係な会社もマーケティング許可を申請することができ、同じ治療適応のために別の競争相手の薬品をマーケティングすることができ、その会社がその申請をサポートする完全な独立した科学的データパケットに基づいて、単独のマーケティング許可申請に従って自分のマーケティング許可を得ることを前提とする。規制データ保護期間とマーケティング保護期間はイギリスに適用される(イギリス初許可の日から計算)。
41
EUでは、第1901/2006号条例によれば、イギリスでは、2012年のヒト医薬品条例(改正)によれば、MAAが(I)新しい活性物質、または(Ii)新しい適応、薬理形態または投与経路(製品が補充保護証明書または補充証明書を取得する資格を有する特許の保護を受けている場合)に関連している場合、上場許可出願は、EMAと合意された小児科調査計画に基づく小児科データを含まなければならない。場合によっては、出願人は、これらの要件を遵守することを免除または延期することができる(例えば、このような状況が成人人口にのみ発生する場合、免除を受けることができる)。必要があれば、小児科研究は既存と新しい適応、薬理形式と投与経路の小児科人口のすべてのサブグループをカバーしなければならない。模倣薬または生物学的に類似した応用に関連するものを含む、限られた適用をさらに排除する。小児科研究を完成することは一定の奨励を受けるかもしれない。例えば、MAASが合意された小児科調査計画に従って行われたすべての研究の結果を含む場合、特許または補足保護証明書の保持者は、補充保護証明書を6ヶ月間延長する権利がある可能性がある。
ヨーロッパ経済区で孤児の称号を得るために、製品はいくつかの挑戦的な基準を満たさなければならない。条例(EC)141/2000第3条によれば、以下の基準を満たす医薬品は、(1)生命または慢性衰弱に危険な疾患の診断、予防または治療を目的としている、(2)申請時、そのような疾患のEUでの流行率は、10,000人当たり5人を超えてはならない、または孤児身分によるメリットがない場合、EUでの販売は、その開発に必要な投資が合理的であることを証明するために十分な見返りをもたらす可能性が低い。および(3)このような疾患を満足できる診断、予防または治療する方法がEU市場で販売されていないこと、またはそのような方法が存在する場合、製品は、(EC)847/2000法規に定義されているこのような疾患の影響を受けている人に大きな利益をもたらすであろう。
EUで孤児指定を獲得した製品は10年の孤児市場排他性を得ることができ,合意した小児科研究計画に基づいて小児科研究を行えば,さらに2年間延長することができる。申請はまず孤児指定基準を満たし、孤児指定を申請しなければならず、それから上場許可を申請することができる。そして,申請者は上場許可を申請する際に孤児指定を成功させなければならず,10年間の孤児市場排他性を得る資格がある。この10年間、EU加盟国と欧州委員会の主管当局は、同じ孤児の治療適応の他の類似医薬製品の申請を受けたり、マーケティングの許可を与えたりしてはならない。場合によっては、EUの孤児市場独占性によって提供される保護は、異なる治療適応のために許可されているか、または異なる治療適応のために許可されている競合製品によって回避される可能性がある。一部のEU加盟国の医療専門家が孤児治療適応のために“ラベル外”の製品を出す可能性があるというリスクがあるかもしれない。
孤児市場排他性原則にも三つの例外がある。以下の場合、同一孤児の治療適応の類似医薬製品に対して発売許可を与えることができる
マーケティング許可申請が合意された小児科調査計画に従って行われたすべての小児科研究の結果を含む場合、孤児製品はまた、EUで追加2年間の孤児市場独占経営権を得ることができる。5年目の終了時に、製品が指定された孤児の基準をもはや満たしていないと判定された場合、例えば、製品が十分に利益があり、市場排他性を維持するのが合理的であることを証明するのに十分でない場合、10年間の市場排他性は6年に減少することができる。
イギリスの規制法の枠組みは、似たような保護期間、すなわち規制データ保護、マーケティング保護、市場排他性を規定している。
注目すべきは、EUは現在、データ独占性、マーケティング保護、孤児適応の市場独占性と小児科普及など、医薬製品に提供する監督管理保護を審査している。EUが現在提供している保護は今後数年で減少すると予想される。
私たちの候補製品は候補製品の模造バージョンからの競争に直面する可能性があり、これは私たちの将来の収入、収益力、およびキャッシュフローに実質的な悪影響を与え、これらの候補製品の投資から利益を得る能力を大きく制限するかもしれない。私たちの将来の収入、収益力、キャッシュフローも実質的で不利な影響を受ける可能性があり、もし私たちの候補製品が承認された後に適切な非特許特定期間を得られなければ、私たちがこれらの候補製品から投資収益を得る能力は大きく制限されるかもしれない。
42
FDAが新製品を審査·承認する能力は、予算と資金レベル、重要な人員を雇用し、維持する能力、法律、法規、政策の変化を含む様々な要素によって阻害される可能性がある。
FDAが新製品を審査·承認する能力は、予算や資金レベル、キーパーソンを雇用·保留する能力、法律、法規、政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また,他の研究開発活動を援助する政府機関への政府の援助は政治過程の影響を受けており,この過程は本質的に不安定で予測不可能である。
FDAと他の政府機関がその機能を正確に管理する能力は、政府資金レベルとキーリーダー任命を埋める能力、及び各種の要素に大きく依存する。キーポストの補填或いは交換を延期することはFDAと他の機関がその機能を履行する能力に深刻な影響を与える可能性があり、医療保健と製薬業界に大きな影響を与える可能性がある。
2016年12月、第21回ST世紀治療法案の署名は法律となり、医療革新を促進し、FDAが薬物と設備開発と審査に関連するポストを直接募集する権利があることを許可した。従来、FDAは、民間企業が提供する報酬と比較して、競争力のある重要な指導者候補(科学者を含む)の報酬を提供できないことが多かった。21世紀ST世紀治療法案はこの機構の採用プロセスを簡略化し、現有の給与構造中に提供する狭い範囲を拡大することによって、FDAが指導人材を競争できるようにすることを目的としている。
FDAや他の政府機関の中断も、必要な政府機関の新薬審査および/または承認に要する時間を遅らせる可能性があり、これは私たちの経営業績や業務に悪影響を及ぼす。
外国の管轄区域で規制の承認を得られなければ、海外で当社の製品を販売·商業化することができず、製品販売から収入を得る能力を制限することが可能になる。
私たちは私たちの候補製品を国際的にマーケティングして商業化するつもりだ。アメリカ以外の管轄地域で私たちの候補薬物をマーケティングし、販売するためには、単独の上場許可を得て、多くの異なる規制要求を守らなければならない。承認手続きは国によって異なり、追加的なテストが含まれるかもしれない。承認を得るのに要する時間は、FDA承認を得る時間とは大きく異なる可能性がある。米国以外の規制承認手続きには、通常、FDA承認の取得に関するすべてのリスクが含まれる。また、アメリカ以外の多くの国では、まず製品の精算許可を得てから、規制機関がその製品の同国での販売を許可しなければならない。外国の監督管理の承認を適時に得られなかったか、或いは外国の監督管理要求を守らないことは私たちに重大な遅延、困難とコストをもたらす可能性があり、そして私たちの候補薬物のある国/地区での発売を延期或いは阻止する可能性がある。FDAの承認は、他国又は管轄区域の規制機関の承認を確保するものではなく、米国以外の1つの規制機関の承認も、他の国又は司法管区の規制機関又はFDAの承認を確保することができない。私たちはマーケティング承認を申請できないかもしれませんし、どの司法管轄区域でも私たちの製品を商業化するために必要な承認を得ることができないかもしれません。これは私たちの収益能力を大きく損なうことになります。
イギリスのEU離脱は、特にイギリスとEUで政治的と経済的不確実性をもたらし続けている。イギリスは今EUから“第3国”とみなされており、新しいイギリス立法が施行された。これはイギリスで行われたバッチテストと合格者認証のようないくつかの規制活動を意味し、EUではこれ以上認められない。しかし、イギリスとEUは、イギリス議会、欧州理事会、欧州議会の承認を得て、医薬品供給への干渉を制限し、特にイギリスとEUとの間の無関税および無割当貿易(原産地規則要件を満たすことを前提とする)を許可することによって、cGMP検査および証明書の相互承認を許可することによって、いくつかの問題を簡略化した貿易·協力協定(TCA)を達成した。過渡期終了前に存在した薬品規制枠組みはイギリス国内立法においても有効に保持されており,“保留EU法”と呼ばれている。EU立法の核心的な内容を残すことで、イギリスは薬品監督の面で大きな相違が生じることを防止した(いくつかの分野で食い違いがあったにもかかわらず)。しかし、イギリス立法のいくつかの修正は、北アイルランド議定書(NIP)を実施することを含む直ちに必要であり、この議定書によると、EU製薬業法律枠組みAQUISは北アイルランドに引き続き適用され(北アイルランド立法議会の定期的な同意を必要とする)、EUの法律に適合する製品のみが北アイルランド市場に入ることができる--追加の規制の複雑さを増加させる。会社は現在、イギリスの規制法の枠組みを単独で遵守する必要があるため、イギリス(すなわちイングランド、ウェールズ、スコットランド、EU法律が北アイルランドに適用され続けるため)で医薬製品を商業化することができる。英国政府は現在,NIPの基本的な側面を再交渉しようとしているため,近い将来,企業にとって予測不可能な分野である。TCAは未来に現在の監督管理枠組みから逸脱することを許可し、現在まだいかなる逸脱が発生する可能性があるかどうかは不明であり、これは薬品の開発、製造、マーケティング許可、商業販売と流通に影響を与える可能性がある。また、マーケティング許可を得ることはまだEUとイギリスの市場に有効に参入するのに十分ではないことを指摘しなければならない;会社は依然として製品の精算価格について合意する必要があり、いくつかの司法管轄区、例えばイギリスとドイツでは、衛生技術がコスト効果に対して更なる積極的な提案を提出する必要があり、製品を実際に処方し、それぞれの国家衛生システムから精算することができる(以下参照)。もし私たちが法規を守る要求がなければ
43
国際市場で相応のマーケティング承認が得られれば、私たちの目標市場は減少し、候補薬物市場の潜在力を十分に発揮する能力が損なわれ、私たちの業務も悪影響を受けるだろう。もしあれば、私たちは外国の規制部門の承認をタイムリーに得られないかもしれない。もし私たちの任意の候補薬が他の国家規制機関の承認を得られなければ、その候補薬のビジネスの将来性を大幅に低下させる可能性があり、私たちのビジネスの将来性は低下する可能性がある。
私たちの財務状況と資本要求に関連するリスク
設立以来、重大な運営損失が発生しており、今後数年以内に重大な損失が予想される。私たちは永遠に利益を上げないかもしれないし、もし実現すれば、私たちは持続的に利益を上げることができるだろう。
2004年の設立以来、著者らはすでに深刻な運営損失が発生し、著者らは引き続きreproxalapと著者らの他の候補製品の臨床試験、開発計画と商業活動を行うことに伴い、今後数年は重大な損失が予想される。2023年6月30日と2022年6月30日までの6カ月間の純損失はそれぞれ約2460万ドルと3460万ドルだった。2023年6月30日現在、我々の株主権益総額は1兆299億ドル、累計赤字は3.813億ドル。損失の主な原因は,われわれの臨床試験,研究,開発計画によるコスト,および一般と行政費用である。将来的には、研究開発、臨床テスト、コンプライアンス活動、ビジネス前活動を継続する予定であり、reproxalapまたは私たちの任意の他の候補製品が承認され、販売およびマーケティング活動を含む商業化努力が行われれば、予想される一般的および管理費用に加えて、今後数年間でさらなる大きな損失をもたらす可能性がある。私たちの純損失は四半期ごとと毎年大きく変動するかもしれません。
Reproxalapを商業化し、ADX-2191、ADX-629、ADX-246、ADX-248および他の候補製品の開発を継続する準備ができていること、および私たちの臨床、製造、商業化活動を支援する管理者を含む従業員数の増加、インフラの拡大、法律、コンプライアンス、会計、上場企業に関連する投資家や広報費用の増加、その他の要因により、私たちの支出は前の時期より大幅に増加すると予想される。マサチューセッツ州眼耳病院(MEEI)と合意した許可協定によると、私たちはADX-2191のために特定の特許権と大部分の技術を許可し、私たちに印税と他の財務義務を適用し、私たちは第三者と追加の許可と資金手配を締結することができ、これは私たちに記念碑的な支払い、特許権使用料、保険、その他の義務を加えるかもしれない。
私たちの費用も増えますもし私たちが
44
医薬品開発に関連する多くのリスクや不確実性のため、費用を増加させる時間や金額、あるいはいつ、または利益を達成できるかどうかを正確に予測することはできない。以下の場合、私たちの支出は私たちが予想していたより高くなるだろう
私たちが利益を達成して利益を維持する能力は私たちが収入を作る能力にかかっている。私たちは現在販売から何の収入も得ていないし、私たちはreproxalapや私たちの他の候補製品を商業化することができないかもしれない。私たちは現在私たちの候補製品をマーケティングするために必要な承認を持っていないし、私たちは永遠にそれらを受け取っていないかもしれない。私たちは、私たちの1つ以上の候補製品のマーケティング承認を得て商業化しない限り、利益を達成するのに十分な収入が発生しないと予想される。私たちは2023年末までにreproxalapや私たちの他の候補製品を商業化しないと予想しています。利益を得るためには一連の挑戦的な活動で成功する必要があります
私たちはこのような活動で決して成功しないかもしれないし、利益を達成するのに十分な収入が生まれないかもしれない。我々の候補製品の開発や商業化に関連する多くのリスクや不確実性により、将来の損失の程度やいつ利益が達成されるかを予測することはできない(あれば)。たとえ私たちが確実に利益を達成したとしても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。もし私たちが実現して利益を維持できなければ、会社の価値を下げ、資金を調達し、業務を拡大し、研究開発の努力を維持し、製品の供給を多様化し、さらには運営を継続する能力を弱める可能性がある。
私たちは大量の追加資金が必要であり、必要な場合に受け入れ可能な条件で必要な資金を得ることができない場合、あるいは必要な資金を全く得ることができない場合、私たちの製品開発、他の運営、または商業化努力を延期、制限、減少、または終了させることができるかもしれない。
バイオ製薬製品の開発と商業化は資本集約型である。我々は,我々が行っている活動や計画中の活動に多くの資金を投入する予定であり,特に市場承認やreproxalapの商業化に備えた場合には,我々の候補製品のための複数の進行·計画中の臨床試験を含め,臨床前と臨床開発により我々の候補製品の開発を継続する予定である。私たちが行っている活動に関連する費用が増加すると予想され、特にreproxalapを商業化する際に、承認されれば、私たちの候補製品の研究と開発を継続し、成功すれば、私たちの候補製品のマーケティング承認を求める。
私たちは、商業インフラの建設を開始することを含め、reproxalapに関する商業化費用を生成し始めており、reproxalapの発売承認を得る前に追加の商業化費用が発生すると予想されている。もし私たちがreproxalapや私たちが開発した任意の他の候補製品の発売承認を得たら、製品販売、マーケティング、流通、製造に関連する多くの追加商業化費用が発生すると予想されます。もし私たちが私たちの候補製品のためにより多くの適応を求めることを選択したり、他の方法で私たちが今期待しているよりも早く拡張すれば、私たちはまたもっと早く追加資金を集める必要があるかもしれない。また、上場企業の運営に関連した追加コストが引き続き発生すると予想される。したがって、私たちは私たちの持続的な業務と関連した多くの追加資金を得る必要があるだろう。もし私たちが必要な時に魅力的な条件で資金を集めることができなければ、もし本当にあれば、私たちのいくつかの臨床開発計画、研究開発計画、あるいは将来の商業化努力を延期、減少、または廃止することを余儀なくされるだろう。しかも、私たちが商業的に合理的な条件でこのような融資を受けることができる保証はない。私たちの候補製品の開発過程は非常に不確定で、私たちの候補製品の開発、規制承認、商業化に成功した実際の金額を確定的に見積もることはできません。私たちの運営計画は以下のような理由で変わるかもしれません
45
多くの要素は現在私たちにとって未知であり、私たちは公共またはプライベート株、債務融資、または他の出所を通じて、予想よりも早く追加資金を求める必要があるかもしれない。私たちの開発と商業化計画を実施するために必要な任意の支出の額と時間は、多くの要素に依存する
その中のいくつかの要素は私たちがコントロールできないことだ。私たちの既存の資本資源は私たちがreproxalapの商業化と私たちの臨床試験を完成させ、私たちの候補製品の商業導入を通じて開発を維持するために資金を提供するのに十分ではない。私たちは近い未来に、私たちが多くの追加資金を集める必要があると予想する。
私たちは何の製品も販売していません。予測可能な未来には、私たちはいかなる製品も販売しないことも、どの製品の販売からも収入を得ることはないと予想しています。私たちは債務融資を含めて協力協定と公共または個人融資を通じて追加的な資金を求めるかもしれない。世界経済の状況と市場の不安定さはビジネス環境を不安定にし、コストをより高くしている。不確定な経済状況、不確定なマクロ経済環境の大きな方向、そして私たちの普通株の価格は、私たちがコントロールできず、任意の必要な債務や株式融資をより困難にし、コストが高く、希釈度をより高くするかもしれない。例えば、資本と信用市場は、ロシアとウクライナの間の持続的な衝突、より広範なヨーロッパまたは世界的な衝突の可能性、およびそれによって実施される世界的な制裁の悪影響を受ける可能性がある。世界金融危機のような深刻または長期的な経済低迷は、追加資本を調達する能力に影響を与える可能性がある。受け入れ可能な条項の下で、私たちは追加的な資金を得ることができないかもしれないし、全くないかもしれない。さらに、どんな融資条項も、私たちの株主の持株や権利に悪影響を及ぼすか、または過度に希釈される可能性がある。また、私たちが株を増発したり、この株を発行したりする可能性は、私たちの株の市場価格の下落を招く可能性があります。
もし私たちがタイムリーに資金を得ることができない場合、私たちは、私たちが確立した販売およびマーケティング能力を大幅に削減、延期、減少または停止すること、または私たちの候補製品を商業化するために必要な活動、または私たちの1つまたは複数の臨床前研究、臨床試験、または他の研究または開発計画を減少、延期、または停止することを要求されるかもしれない。私たちはまた、私たちの業務を拡大したり、他の方法で私たちのビジネスチャンスを利用することができないかもしれないし、私たちの組織を再構成する必要があるかもしれないし、私たちの候補製品や他の技術に対する権利を放棄すること、または他の方法で私たちに不利な条項に同意することを要求されるかもしれない。これらの状況のいずれも、私たちの業務、財務状況、および経営結果に大きな影響を与える可能性がある。
私たちの四半期の経営業績は大きく変動するかもしれません。
私たちの経営業績は四半期変動の影響を受けると予想されています。私たちの純損失と他の経営業績は様々な要素の影響を受けます
46
もし私たちの四半期の経営業績が投資家や証券アナリストの予想を下回れば、私たちの普通株の価格は大幅に低下する可能性がある。また、私たちの経営業績のどの四半期の変動も、私たちの株価を大幅に変動させる可能性があります。私たちの財務業績を四半期比較することは必ずしも意味があるわけではなく、私たちの将来の業績としての指標に依存すべきではないと考えられます。
追加資本の調達は株主に希釈を与え、私たちの運営を制限するか、あるいはその技術または候補製品の権利を放棄することを要求するかもしれない。
これまで、相当な製品収入を生み出すことができれば、株式発行、債務融資、協力、戦略連合、許可手配、マーケティング、流通手配を通じて、私たちの現金需要に資金を提供する予定です。私たちが株式または転換可能な債務証券を売却することによって追加資本を調達する場合、あなたの所有権資本は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての権利に悪影響を及ぼす可能性がある。債務融資および優先持分融資が実行可能であれば、関連する可能性のある合意は、追加債務を招く、資本支出を行う、または配当を宣言するなど、具体的な行動をとる能力を制限または制限する契約を含む。
もし私たちが協力、戦略連合、許可手配、またはマーケティングと流通手配を通じてより多くの資金を調達すれば、私たちは私たちの技術、将来の収入源、研究計画、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になる可能性のある条項で許可を与えなければならないかもしれない。もし私たちが必要な時に株式や債務融資を通じてより多くの資金を調達することができない場合、私たちはその製品開発または将来の商業化努力を延期、制限、減少または終了することを要求されるか、あるいは私たちが自分で開発し、マーケティングすることをより望んでいた製品または候補製品の権利を与えることができるかもしれない。
私たちはあなたと他の株主が同意しないかもしれない方法で私たちの現金、現金等価物、および有価証券を構成するかもしれません。
私たちの経営陣は現金、現金等価物、有価証券の運用に幅広い裁量権を持っています。私たちの現金、現金等価物、および有価証券の使用を決定する要素の数量と可変性のため、管理層の現金、現金等価物および有価証券の最終使用は現在の予想用途と大きく異なる可能性がある。私たちの経営陣は最終的にあなたの投資価値を増加させる方法で私たちの現金、現金等価物、有価証券を使用しないかもしれません。私たちは、私たちが計画した複数の候補製品の臨床試験に資金を提供すること、reproxalapのNDA承認プロセスに資金を提供し続けること、FDAがreproxalapの承認を要求する可能性のある任意の他の臨床試験または他の活動を含む、reproxalapのNDA承認プロセスに資金を提供すること、承認された場合、reproxalapの初期商業化および発売に資金を提供すること、免疫媒介性疾患に関連する他の分子を開発すること、私たちの候補製品に対する規制機関の承認を求めること、私たちの債務を返済すること、および他の一般企業用途に運営資金および資本を提供することを含む、私たちの現金、現金等価物、および有価証券を使用する予定だ。もし私たちの経営陣がこのような資金を有効に運用できなかったら、私たちの業務を損なうかもしれない。私たちは現金、現金等価物、および有価証券を短期、投資レベル、有利子証券に投資することができる。このような投資は私たちの株主に良い見返りを与えないかもしれない。私たちが株主価値を高める方法で私たちの現金、現金等価物、および有価証券に投資したり、運用しなければ、予想される財務結果を達成できないかもしれません。これは私たちの株価を下落させる可能性があります。
私たちが債務融資を保証する条項は、私たちが特定の運営契約を満たし、私たちの運営と財政的柔軟性に制限を加えることを要求する。もし私たちが債務融資を通じて追加資本を調達すれば、どんな新しい債務の条項も私たちが業務を運営する能力をさらに制限するかもしれない。
2019年3月、私たちはHercules Capitalと信用手配を締結し、その後、2021年4月と2022年12月に私たちの知的財産権以外のすべての資産の留置権を保証する改正を行った。ローン契約には
47
習慣の肯定と否定の契約や違約事件。他にも、平権条約には、合法的な存在の維持と政府の承認、特定の財務報告書の提出、保険範囲の維持を要求する条約が含まれている。否定的な契約は、私たちの業務または知的財産権の任意の部分の譲渡を制限すること、追加の債務を招くこと、合併または買収を行うこと、配当金を支払うこと、または他の分配を行うこと、投資を行うこと、および私たちの資産に他の留置権を設立することを含むが、すべての場合は慣例的な例外によって制限される。もし私たちが追加的な債務融資を調達すれば、このような追加債務の条項は私たちの運営と財政的柔軟性をさらに制限するかもしれない。これらの制限には、他にも、借入金の制限と、私たちの資産使用に対する具体的な制限と、私たちの留置権の作成、配当金の支払い、配当金の償還、または投資を行う能力の禁止が含まれています。もし私たちが力神信用手配または任意の未来の債務手配の条項の下で約束を違えれば、貸金人は私たちのすべての返済義務を加速させ、私たちの質的資産を制御することができ、これは私たちが合意の中で私たちにあまり有利ではない条項を再交渉することを要求するか、または直ちに運営を停止することを要求するかもしれない。さらに、もし私たちが清算された場合、貸手の返済権は私たちの普通株式保有者の権利よりも優先されるだろう。貸手は、彼らが融資プロトコル定義の実質的な悪影響と考えられる任意の事件が発生したときに違約を宣言することができる。融資者の違約事件に対するいかなる声明も、私たちの業務と将来性を深刻に損なう可能性があり、私たちの普通株の価格下落を招く可能性がある。もし私たちが追加的な債務融資を調達すれば、このような追加債務の条項は私たちの運営と財政的柔軟性をさらに制限するかもしれない。
私たちの普通株の取引に関連しているため、純営業損失の繰越と税収控除を使って将来の課税収入を相殺する能力が制限される可能性があります。
一般的に、改正後の1986年の国内税法第382条によると、会社が“所有権変更”を行う際には、変更前の純営業損失(NOL)と何らかの他の税務資産(税務属性)を利用して将来の課税所得額を相殺する能力が制限される。一般に,テスト期間(一般に3年)では,ある株主の総株式保有量がこれらの株主の最低持株率より50ポイント以上増加すると,所有権変更が発生する.テスト期間内に私たちの普通株の取引に関連し、投資家の購入や販売など、私たちの制御範囲内にない取引であっても、所有権変更を招く可能性がある。私たちがNOLまたはすべてのNOLまたは信用を使用する能力が制限され、私たちの運営結果やキャッシュフローに実質的な悪影響を及ぼす可能性があります。2021年12月31日までに,設立以来4回の所有権変更が発生したと考えられる.経営陣は、その第382条に規定されている全体的な制限(確認された“内在的収益”の追加制限を含む)で十分であるため、その所有権変更前の税項属性を現在の減値する必要はないと考えている。私たちの株式歴史の回顧によると、2021年12月31日から2023年6月30日まで所有権に変化はないと考えられます。私たちの最近または将来の融資活動による変更を含め、将来の任意の所有権変更は、私たちの既存の税金属性に追加的な制限をもたらす可能性があります。しかし,年次制限により,2018年以降に発生する連邦NOLには無期限の繰越期間があり,期限が切れない。NOL繰り越しに関する連邦や州税法の将来の変化は,このようなNOLの制限や制限を要求する可能性もある。もしNOL繰越が私たちに使用できないか、あるいは十分に利用されなければ、もしいくつかのアメリカ連邦と州税収控除がなければ、私たちの未来の課税所得額は連邦と州所得税を免除することができなくなり、そうでなければ、一般企業用途に利用できる資金は減少する。
政府は価格規制を実施するかもしれないが、これは私たちの将来の収益性に悪影響を及ぼすかもしれない。
私たちはアメリカと他の司法管轄区で私たちの候補製品を販売することを承認することを求めるつもりだ。もし私たちがアメリカで承認されれば、私たちは最近公布された“インフレ低減法案”(IRA)の制約を受けるであろう。この法案は他にも、衛生と公衆サービス部(HHS)がMedicare&Medicaid Services(CMS)がMedicare B部分とD部分によって精算されたいくつかの薬物と生物製品の販売価格について交渉することを許可する。いくつかの外国、特にEUでは、処方薬の価格設定は政府によって統制されている。これらの国では、候補製品の上場承認を受けた後、政府当局との定価交渉にかなりの時間がかかる可能性がある。一部の国で精算や定価の承認を得るためには、私たちあるいは私たちの協力者は臨床試験を行い、私たちの薬物の費用効果を他の利用可能な治療法と比較する必要があるかもしれない。また、一部のヨーロッパ諸国では、当局が衛生技術評価を行い、製品のコスト効果を評価しており、効果的な市場進出に大きな影響を与える可能性がある。もし私たちの未来の製品が精算を得られない場合、あるいは範囲や金額が制限されている場合、あるいは定価が満足できないレベルに設定されている場合、利益を達成したり維持したりすることができないかもしれません。
業務中断は私たちの将来の収入と財務状況を深刻に損害し、私たちのコストと支出を増加させるかもしれない。
我々の業務は、地震、電力不足、電気通信障害、水不足、洪水、ハリケーン、台風、火災、極端な気象条件、公衆衛生流行病(新冠肺炎の大流行を含む)、地域またはより大規模な衝突または地政学的行動、ロシアとウクライナとの間の衝突のエスカレート、貿易政策、制裁、条約および関税、その他の自然災害や人為的災害またはその他を含む、業務中断の影響を受ける可能性がある
48
業務が中断されて、私たちはこれに対して主に自己保険です。これらの業務中断の発生は、私たちの運営と財務状況を深刻に損害し、私たちのコストと費用を増加させる可能性がある。私たちは第三者製造業者に依存してreproxalapと私たちの他の候補製品を生産する。これらのサプライヤーの運営がこれらの業務中断の影響を受ける場合、私たちがreproxalapまたは私たちの他の候補製品の臨床的および商業的供給を獲得する能力は妨害される可能性がある。
私たちは経済不確定と資本市場が混乱している時期にあり、ロシアとウクライナ間の持続的な軍事衝突及び新冠肺炎の流行により、地政学的不安定はこれに重大な影響を与えた。ウクライナ紛争や他の地政学的緊張情勢や新冠肺炎疫病が全世界経済と資本市場に与えるマイナス影響は私たちの業務、財務状況と運営結果に重大な悪影響を与える可能性がある。
地政学的緊張がエスカレートし、ロシアとウクライナ間の軍事衝突の後、米国と世界市場は動揺と混乱を経験している。2022年2月、ロシア軍はウクライナへの全面的な軍事侵入を開始した。進行中の軍事衝突の持続時間と影響は非常に予測できないにもかかわらず、ウクライナの衝突は大口商品価格、信用と資本市場の大幅な変動、およびサプライチェーンの中断を含む市場混乱を招いた。
さらに、ロシアの様々な行動は、いくつかのロシア金融機関をSWIFT支払いシステムから除去することに同意し、ロシア石油、液化天然ガス、石炭の輸入を制限することを含む、米国、EUおよび他の国および他の公共および個人行為者および会社がロシアおよびいくつかの他の地理的地域に対して制裁およびその他の罰を科すことをもたらす。また、より多くの可能な制裁と処罰措置を取ることを提案し、(または)脅している。ロシアの軍事行動とそれに伴う制裁は、世界経済や金融市場にさらに悪影響を及ぼす可能性があり、資本市場の不安定化と流動性の不足を招き、より多くの資金を得ることを難しくする可能性がある。
新冠肺炎及びその変異体の全世界範囲内での伝播は巨大な波動性、不確定性と経済混乱をもたらした。私たちの業務はすでに新冠肺炎の疫病の悪影響を受け続けるだろう。例えば、私たちは新冠肺炎の疫病による運営中断を経験し、臨床試験の遅延や中断を含む業務中断による損害を救済するための追加のコストが発生する可能性がある。新冠肺炎の大流行が私たちの業務、運営、財務業績に与える影響の程度は、流行病の持続時間と範囲、私たちがすでに取っている政府、企業、個人の対応行動、大流行が経済活動と対応措置に与える影響、私たちの計画中または計画中の臨床試験への影響、および私たちのオフィスまたは臨床試験施設の閉鎖を含む、私たちが正確に予測できないかもしれない多くの変化の要素に依存する。
上記のいずれの要素も、私たちの業務、見通し、財務状況、経営業績に影響を与える可能性があります。軍事行動,制裁および新冠肺炎の流行およびそれによる市場混乱の程度や持続時間は予測できないが,巨大である可能性がある。このような中断のいずれも、本年度報告書に記載されている他のリスクの影響を拡大する可能性がある。
金融機関、金融サービス業会社又は金融サービス業全体の不利な事態の発展に影響を与え、例えば流動資金、違約又は不良表現に係る実際の事件又は懸念は、我々の運営及び流動資金に悪影響を及ぼす可能性がある
流動性が限られている、契約違反、業績が悪い、または金融機関または金融サービス業の他の会社または金融サービス業全体の他の不利な発展に影響を与える実際の事件、またはそのような任意の事件に関する懸念または噂は、過去に発生し、将来的に市場全体の流動性問題を引き起こす可能性がある。例えば、2023年3月10日、シリコンバレー銀行(SVB)はカリフォルニア州金融保護·革新部によって閉鎖され、後者は連邦預金保険会社(FDIC)を担当者に任命した。米国財務省、連邦準備委員会(FRB)と連邦預金保険会社(FDIC)は共同声明を発表し、SVBのすべての預金者は閉鎖日後の1つの仕事後にのみすべての資金を引き出すことができるが、より広範な金融サービス業の不確定性と流動性の懸念は依然として存在すると述べた。インフレと金利の急速な上昇は、以前に発行された金利が現在の市場金利よりも低い国債の取引価値を低下させる。米国財務省、FDIC、FRBは、このようなツールを売却する潜在的損失リスクを低減するために、金融機関が保有するこのような政府証券保証の金融機関に250億ドルまでの融資を提供する計画を発表した。しかしながら、広範な顧客引き出し需要または金融機関の即時流動性の他の需要は、このような計画の能力を超える可能性がある。米国財務省、FDIC、FRBが将来他の銀行または金融機関が適時または全く閉鎖されていない場合に、未保険資金を得る方法を提供することは保証されない。
私たちと直接手配された金融機関が流動性制限に直面したり
49
失敗する。さらに、米国または国際金融システムに対する投資家の懸念は、より高い金利またはコスト、より厳しい財務および運営契約、または信用および流動性源を得るための体系的な制限を含む、あまり有利ではない商業融資条項を招く可能性があり、それによって、私たちは融資を受けにくく、さらには融資を受けることができない。利用可能な資金の任意の実質的な低下や、現金および現金等価物を得る能力は、私たちが運営費用を支払う能力に悪影響を及ぼす可能性があり、契約義務違反をもたらしたり、連邦または州賃金および労働時間法に違反したりする可能性があり、いずれも私たちの運営および流動性に大きな悪影響を及ぼす可能性がある。
もし私たちが現金と現金等価物を持っている金融機関が倒産すれば、私たちの現金と現金等価物は悪影響を受けるかもしれない
私たちは定期的に第三者金融機関でFDIC保険限度額を超える現金残高を維持しています。預金機関がこれらの預金を返却できなかった場合、又は預金機関が金融又は信用市場において他の不利な条件の影響を受けた場合、我々が投資した現金又は現金同等物を得ることにさらに影響を与え、我々の運営流動性及び財務業績に悪影響を及ぼす可能性がある。
もし私たちが買収、再編、あるいは業務合併を行えば、私たちは様々なリスクを招き、これらのリスクは私たちの業務運営や私たちの株主に悪影響を及ぼすかもしれません。
私たちは時々策定しており、今後も業務発展を推進するための戦略的な業務措置を検討していきます。これらの計画は、事業、技術または製品の買収、または他の会社との事業合併を含むことができる。例えば、2019年1月、私たちはHelio Vision,Inc.を買収し、ADX-2191の権利を獲得し、ADX-2191は眼内注射のための硝子体互換性メトトレキサート製剤であり、増殖性硝子体網膜症を予防するためのものである。私たちが行ったり最近完成したどんな買収にもビジネスリスクが伴うかもしれません
このような要素は私たちの業務、経営結果、または財政状況を損なうかもしれない。
上記のような企業や資産を買収する際によく遭遇するリスクのほかに、取引完了の挑戦やコストに関するリスクに遭遇する可能性がある。複数の買収を同時に管理することにより、上記のリスクが悪化する可能性がある。
私たちの第三者への依存に関するリスクは
私たちの多くの活動は、臨床開発、商業準備、およびreproxalapと私たちの他の候補製品の供給を含むアウトソーシング手配に依存し続けます。
2023年6月30日まで、私たちは15人のフルタイム従業員しかいないので、私たちの活動の大部分は、臨床研究、データ収集と分析、製造、商業準備、財務報告と会計、人的資源、および必要ないくつかの機能を含むアウトソーシング手配に依存し続けると予想されています
50
上場企業のリスト。私たちは第三者に対する統制が限られているかもしれないし、私たちはいかなる第三者がその義務を効果的かつタイムリーに履行することを保証することはできない。
さらに、新しい冠肺炎の流行、ロシアとウクライナに関する政治的不確実性のような挑戦と不確定な経済環境、信用緊縮市場、公衆衛生流行病の間、私たちの第三者請負業者、サプライヤー、またはパートナーの業績は中断または遅延する可能性がある。もしこのような第三者が私たちに対する彼らの約束を履行できなければ、私たちの業務と経営結果は不利な影響を受けるだろう。
私たちは第三者に頼って臨床試験を行う。もしいかなる第三者が締め切り前に完成したり、規定に従って試験を行うことができなければ、私たちの臨床開発計画は延期されたり成功しなかったりする可能性があり、私たちは監督部門の私たちの候補製品の承認や成功を得られず、商業化することができず、甚だしきに至っては実現できないかもしれない。
私たちは自分で前臨床試験や臨床試験のすべての側面を行うことができない。我々は第三者に依存して我々の候補製品の臨床試験を行っているため,これらの試験の起動と完了時間はこれらの第三者によって制御されており,我々の見積もりとは大きく異なる可能性がある。具体的には,われわれはCROを用いて臨床試験を行い,医療機関,臨床研究者,コンサルタントに依存してわれわれの臨床案や法規の要求に基づいて試験を行っている。我々のCRO,調査者,その他の第三者はこれらの実験の進行とその後のデータ収集と分析において重要な役割を果たしている。
CRO、研究者、あるいは私たちの臨床試験管理と実施に依存する他の第三者がこのような試験に十分な時間と資源を投入したり、契約の要求に従って試験を行うことは保証されない。これらの第三者のいずれかが予想される最終期限内に完了できなかった場合、私たちの臨床計画を遵守できなかった場合、または他の基準を満たさない方法で実行された場合、私たちの臨床試験は延長され、延期され、または終了される可能性がある。我々の任意の臨床試験サイトが何らかの理由で終了すれば,これらの被験者を別の合格した臨床試験サイトに移すことができない限り,行われている臨床試験に登録されている被験者の後続情報が失われる可能性がある。さらに、私たちの臨床試験の首席研究者は時々私たちの科学顧問や顧問を担当し、このようなサービスのために現金または株式補償を得ることができるかもしれない。新冠肺炎の疫病或いは全世界の商業と経済環境のいかなる悪化もこれらのリスクを激化或いは激化させる効果をもたらす可能性がある。
我々の候補製品のいくつかは,我々以外の組織や機関が共催する臨床試験で研究されるか,あるいは研究者による臨床試験で研究される可能性があり,このような試験の進行はほとんどコントロールされていないことを意味する。
我々の戦略の一部,すなわち我々の候補製品が関与する可能性のある広範な適応を追求することは,研究者による臨床試験に関与すると予想されている。研究者による臨床試験によるリスクは,本“リスク因子”の節でわれわれの内部臨床試験に関する他の部分で述べたリスクと類似している。研究者が開始した試験は臨床データを提供し、私たちの未来の発展戦略に情報を提供するかもしれないが、私たちは通常試験の進行と設計制御が少ない。著者らは研究者が始めた試験の発起人ではないため、著者らは患者のフォローアップと治療後の持続的なデータ収集を含む試験の方案、管理或いは進行を制御しない。そのため,調査者による試験進行方式に関するリスクに直面している。特に、私たちは訴訟で指名されるかもしれないが、これは法律の弁護に関連する費用の増加につながるだろう。その他のリスクには、調査者や管理者とのコミュニケーションの困難や遅延、プログラムの遅延、その他の時間の問題、データを解釈する上での困難や分岐がある。第三者研究者は,我々自身が設計した臨床試験と比較して,より実現困難な臨床終点を有する臨床試験を設計したり,他の方法で臨床試験結果が陰性となるリスクを増加させたりする可能性がある。研究者が開始した臨床試験の負の結果は、私たちの将来性と私たちの製品候補製品の見方に実質的な悪影響を及ぼすかもしれない。したがって、私たちは研究者に実験の進行と時間およびFDAとのコミュニケーションが制御されていないことを賛助し、私たちはより多くのリスクと不確定性に直面させ、その中の多くのリスクと不確定性は私たちがコントロールできず、これらのリスクと不確定性が発生すれば、私たちの候補製品の商業見通しに不利な影響を与える可能性がある。
私たちは第三者に完全に依存して、私たちの臨床試験と臨床前研究に薬物物質を提供し、薬物製品を製造する。私たちは他の第三者に依存して候補製品の商業供給を生産するつもりですが、私たちの第三者への依存は私たちの業務に悪影響を及ぼす可能性があります。
私たちの候補製品は薬品と薬品の第三者供給者に完全に依存している。もし第三者サプライヤーが適用された規格や他の法規の要求に基づいて十分な数の材料を適時に供給しなければ、私たちの供給は深刻に中断される可能性があり、これは臨床開発と商業化に悪影響を与える。しかも、もし私たちのどの契約メーカーも成功的に製造できなければ
51
私たちの規格に適合する材料が法規の要求を満たしていれば、私たちの候補製品に対する法規制の承認を確保および/または維持することができません。
私たちはまた、私たちの契約メーカーに依存して第三者サプライヤーから必要な材料を購入し、予想される臨床試験のために私たちの候補製品を生産します。私たちは契約製造業者が原材料を調達する過程や時間について何の統制権もない。しかも、私たちは現在このような原材料の商業生産について合意していない。現在行われている臨床試験中の候補製品或いはその原材料供給の任意の重大な遅延は、新冠肺炎疫病或いはロシアとウクライナの間の衝突を含めて、この臨床試験、候補製品テストの完成及びこの候補製品の潜在的な監督管理許可を大きく延期する可能性がある。
承認されれば、我々が提案した候補製品を商業的に生産する資源や能力はなく、第三者メーカーに依存し続ける可能性が高い。私たちの第三者による臨床試験材料の生産と供給および任意の承認された候補製品への依存は、私たちの候補製品を適時に開発し、商業化する能力に悪影響を及ぼす可能性がある。
私たちは開発、商業、または他の戦略的パートナーシップの構築と維持に成功できないかもしれませんが、これは私たちが候補製品を開発し、商業化する能力に悪影響を及ぼすかもしれません。
私たちは過去に選択したが、将来的には主要なバイオテクノロジーや製薬会社との協力を含む発展または他の戦略的パートナーシップを構築することを選択する可能性もある。私たちは適切なパートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑だ。さらに、私たちの任意の候補製品または計画のための他の開発パートナー関係または他の代替手配を確立する努力は成功しない可能性があり、私たちの研究および開発チャネルが不足している可能性があるので、私たちの候補製品または計画は、協力努力の初期開発段階にあると考えられる可能性があり、および/または第三者は、私たちの候補製品または計画が必要な商業または技術的潜在力を持っていると思わない可能性がある。私たちが開発や商業パートナー関係の構築に成功したとしても、私たちが合意した条項は、例えば、候補製品の開発や承認が延期されたり、承認された候補製品の販売が予想を下回った場合、このようなパートナーシップを維持できないかもしれません。我々の候補製品に関する開発パートナー合意のいかなる遅延も、候補製品の開発と商業化を遅らせる可能性があり、承認されれば、競争力も低下する。
また、候補製品に関連したパートナー関係を維持できなければ、
私たちは私たちの現在または未来の戦略連合の利点を認識していないかもしれない。
私たちは過去と将来に戦略連合を結成し、合弁企業や協力関係を構築したり、reproxalapや私たちの他の候補製品の開発を継続したり、商業化することを含む、第三者とライセンス契約を締結したり、私たちの既存の業務を補完または拡大したりする可能性があります。戦略連合は、私たちが非日常的な費用や他の費用を発生させ、私たちの短期的かつ長期的な支出を増加させ、既存の株主を希釈した証券を発行したり、私たちの管理と業務を混乱させる必要があるかもしれない。また、適切な戦略的パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑である。さらに、第三者が開発失敗のリスクが大きすぎる、あるいは私たちの候補製品のビジネス機会が限られていると考える可能性があるので、私たちはreproxalapや私たちの他の候補製品のための戦略的パートナーシップや他の代替計画を構築する努力は成功しないかもしれない。戦略的取引または許可証の後に、このような取引の合理的な収入または特定の純収入を証明することを達成することは確認できません。
我々の内部コンピュータシステム、または私たちの開発パートナー、第三者臨床研究組織、または他の請負業者またはコンサルタントのシステムは、故障したり、セキュリティホールに遭遇したりする可能性があり、これは、私たちの製品開発計画を深刻に中断させる可能性があります。
セキュリティ対策が実施されているにもかかわらず、私たちの内部コンピュータシステムと、私たちの現在と未来のCROおよび他の請負業者、コンサルタント、および協力者のコンピュータシステムは、コンピュータウイルス、不正アクセス、自然を受けやすい
52
ロシアとウクライナの間の紛争のエスカレート、電気通信と電力故障を含む災害、テロ、戦争、または他の軍事衝突。我々の知る限り,これまでこのような重大なシステム故障,事故,セキュリティホールを経験したことはないが,このような事件が発生して我々の運営が中断されると,我々の開発計画や業務運営に大きな中断を招く可能性がある.例えば、完成した或いは未来の臨床試験の臨床試験データの紛失は著者らの監督管理の承認作業を遅延させ、著者らのデータの回復或いは複製のコストを著しく増加させる可能性がある。同様に,我々は第三者に依存して候補製品を製造し臨床試験を行い,彼らのコンピュータシステムに関連する類似イベントも我々の業務に大きな悪影響を与える可能性がある.任意の中断またはセキュリティホールが、私たちのデータやアプリケーションを紛失したり、破損したり、機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの候補製品のさらなる開発および商業化は延期される可能性があります。
私たちは電子メールと私たちの運営に関連する他のメッセージサービスに依存している。私たちは、パスワードの盗用、支払い情報または他の個人情報の盗用、またはトロイの木馬プログラムを介して、または私たちのネットワーク、コンピュータ、スマートフォン、タブレット、または他のデバイスを介してウイルスを導入するために、詐欺詐欺および釣り電子メールを使用する当事者の目標となる可能性があります。様々な制御や非電子検査により、このような悪意のある電子メール活動の有効性を低減しようと努力しているにもかかわらず、詐欺やネット釣りは私たちの業務を損なう可能性があり、コストを増加させる可能性がある。もし私たちのすべての従業員が自発的に遠隔作業を選択すれば、新冠肺炎の流行中に、これらのリスクは悪化するかもしれない。また、ロシアとウクライナに関する政治的不確実性により、緊張のエスカレートはサイバー攻撃の可能性を増加させる可能性があり、これは私たちの行動に直接または間接的に影響を与える可能性がある。このような事件や状況は、私たちの業務、財務状況、および経営業績に重大な悪影響を及ぼす可能性があります。
私たちの知的財産権に関するリスクは
私たちの成功は私たちと私たちの許可者たちが私たちの知的財産権と独自技術を保護する能力にかかっている。
私たちのビジネス成功は、私たちの候補製品、ノウハウ、私たちの候補製品またはノウハウを使用して特許保護および商業秘密保護を取得および維持する能力、および他人の固有の権利を侵害することなく運営する私たちの能力にある程度依存する。我々の特許出願または我々許可側の特許出願が追加の特許発行をもたらすことが保証されないか、または発行された特許は、同様の技術を有する競争相手に対して十分な保護を提供することになり、発行された特許が第三者によって侵害され、設計され、失効されないことも保証されない。発行された特許が後になっても実行不可能であると考えられるか、または第3の方向の各特許庁または裁判所が提起した訴訟において修正または撤回される可能性がある。未来の私たちの所有権に対する保護の程度は不確実だ。限られた保護だけを提供するかもしれないし、私たちの権利を十分に保護できないかもしれないし、私たちがどんな競争優位性を獲得したり維持したりすることを可能にするかもしれない。これらの候補製品に関連する知的財産権を適切に保護できなかったことは、私たちの財務状況や運営結果に重大な悪影響を及ぼす可能性がある。
活性医薬成分に関する物質組成特許は、このような特許提供の保護は任意の使用方法とは無関係であるため、医薬品の知的財産権保護の最強形態とされている。私たちはすでに米国や他の国でreproxalapや他の候補製品のための物質組成特許を発行しているが、私たちの特許出願で初期候補製品をカバーしている物質組成の権利要件が米国特許商標局(USPTO)および米国裁判所または外国特許庁および裁判所によって出願可能特許とみなされることは保証できず、挑戦されれば、私たちが発行した物質組成特許における権利要求が無効または強制的に実行されないことを確認することもできない。使用方法特許保護製品は特定の方法で使用される。このようなタイプの特許は、製品が特許方法の範囲を超えていることを示すために、競合他社が我々の製品と同じ製品を製造および販売することを阻止しない。また,競争相手が我々の目標適応に対して彼らの製品を積極的に普及させなくても,医師はラベルの外にこれらの製品を処方する可能性がある。ラベル外の処方は使用方法特許の侵害を侵害または助長する可能性があるにもかかわらず,このようなやり方は一般的であり,このような侵害行為の予防や起訴は困難である。さらに、私たちが特許を申請することを構想または試みていない治療組成物および方法が存在する可能性があり、他の当事者は、私たちと類似または異なる方法および組成物の特許を発見して出願することができるかもしれない。
特許出願プロセスは多くのリスクと不確実性の影響を受けており、私たちまたは私たちの任意の未来の開発パートナーが特許を取得して保護することによって私たちの候補製品を保護することに成功する保証はありません。これらのリスクと不確実性には
53
しかも、私たちは私たちの商業秘密とノウハウの保護に依存している。我々は、第三者とのセキュリティ協定の締結、および従業員、コンサルタント、およびコンサルタントとのセキュリティ情報および発明協定の締結を含む、当社の商業秘密および非特許ノウハウを保護する措置を取っているが、第三者は、この情報を取得することができ、または独立して情報または同様の情報を取得することができる。このような事件が発生した場合、または私たちが他の方法で私たちの商業秘密またはノウハウの保護を失った場合、私たちの商業秘密またはノウハウの価値は大幅に縮小する可能性がある。
第三者は私たちが彼らの専有権を侵害し、損害賠償責任を招いたり、私たちの開発と商業化努力を阻害したり延期したりする可能性があると主張している。
バイオテクノロジー産業の特徴は特許と他の知的財産権に関する訴訟がよく発生することだ。特許出願は特許出願が発行される前に秘密であるため、第三者特許がreproxalapまたは我々の他の候補製品の商業化によって侵害される可能性があることを知らないかもしれない。さらに、特許検索は、特許間の用語の違い、データベースの不完全さ、および特許請求の意味を評価することが困難であるため、我々の技術に関連する可能性のある第三者特許権を識別することは困難である。第三者が主張するいかなる特許侵害請求も非常に時間がかかり、可能性がある
第三者が私たちの特許侵害を主張していないが、他の人は独自の権利を持っている可能性があり、reproxalapや私たちの他の候補製品の発売を阻止するかもしれない。私たちの特許関連法律訴訟に対して損害賠償を要求し、私たちの候補製品またはプロセスに関連する商業活動を禁止しようと努力しても、潜在的な損害賠償責任を負うことができ、reproxalapまたは私たちの他の候補製品の生産または販売を継続する許可証を取得することを要求する可能性がある。私たちがこのような訴訟に勝つかどうかは予測できませんし、これらの特許に必要ないかなる許可が商業的に受け入れられる条項で提供されるかどうかも予測できません。さらに、必要であれば、権利侵害を避けるために、私たちの候補製品やプロセスを再設計できるかどうかを決定することはできません。したがって、司法または行政訴訟における不利な裁決、または必要なライセンスを取得できなかった場合、reproxalapまたは私たちの他の候補製品の開発および商業化を阻止することができ、これは、私たちの業務、財務状況、および経営業績を損なう可能性があります。
融資と保証協定によると、私たちに対するどのようなクレームも違約事件とみなされる可能性がある。融資が継続的に違約した場合、他の救済措置を除いて、Herculesは、すべての未返済金額の即時満期と支払いを宣言し、さらなる信用を延長するすべての約束を終了することを選択することができる。もし私たちが約束違反が発生した時に債務を返済できないか、または債務を返済できない場合、Herculesは破産および/または他の破産手続きを開始して起訴するか、または融資によってHerculesに付与された担保を提訴することを選択することができる。
54
もし法廷で疑問視されたら、私たちが発行した特許は無効または実行不可能と認定されるかもしれない。
もし私たちまたは私たちの任意の未来の開発パートナーが第三者に対して法的訴訟を提起して、私たちの候補製品または私たちの未来の候補製品をカバーする特許を強制的に執行する場合、被告は私たちの特許の無効および/または強制執行ができないと反訴することができる。米国の特許訴訟では,被告が無効および/または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許訴訟に関連する者が米国特許商標局に関連情報を隠蔽したり,起訴期間中に誤った声明をしたりしたためであろう.第三者も米国特許商標局に類似したクレームを出すことができ、訴訟範囲外であっても同様である。法的に無効と実行不可能と断言された後の結果は予測できない。有効性に関しては、例えば、無効な以前の技術がないことは確認できませんが、私たちと特許審査員は起訴中にこれを知りません。被告が無効および/または強制執行できない法的主張に勝った場合、私たちは候補製品の少なくとも一部またはすべての特許保護を失うだろう。このような特許保護の喪失は私たちの業務に実質的な悪影響を及ぼすだろう。
私たちは、既存または将来の合意に従って権利または技術を許可する私たちが負ういかなる義務も履行できないかもしれません。これは、私たちの業務に重要な権利または技術の損失を招く可能性があります。
私たちはADX-2191(ライセンス内計画)を含む技術ライセンスの側であり、私たちは将来的により多くのライセンスを締結するかもしれない。このようなライセンスは、未来に私たちに商業的、または支払い、特許権使用料、保険、賠償、および他の義務が適用される可能性がある。もし私たちがこれらの義務を守らなければ、許可側は許可を終了する権利があるかもしれません。この場合、私たちは協力協定の下で貴重な権利を失う可能性があり、候補製品を開発する能力が損なわれる可能性があります。さらに、このような許可プロトコルが何らかの理由で終了した場合、代替許可者の数は限られている可能性があり、代替許可者に移行するのに時間がかかる可能性がある。
我々は、ライセンス内プログラムを開発し、それを商業化する権利が第三者ライセンスの条項および条件にある程度制限され、この条項および条件に基づいて、独占的権利および他の知的財産権を取得した。各ライセンス契約に含まれるその開発および商業化に関するいくつかのマイルストーンに到達できなかった場合、知的財産権に関連する開発および商業化ライセンス計画の権利は全部または部分的に終了する可能性がある。私たちはまた任意の許可協定を開発して商業化する権利を失うかもしれない もし私たちが必要なマイルストーンや印税を支払うことができなかったら。私たちのライセンス契約が早期に終了すれば、本プロトコルに従って許可および開発されたすべての権利が終了する可能性があり、これは私たちの業務および運営結果に悪影響を及ぼす可能性があります。
私たちは競争相手から従業員を誤って雇用したか、または私たちまたは私たちの従業員、コンサルタント、または代理人が彼らの前の雇用主のいわゆる機密情報または商業秘密を誤って使用または開示したという非難を受けるかもしれない。
バイオテクノロジーや製薬業界でよく見られるように、私たちは私たちの候補製品の開発を支援するためにコンサルタントを招いた。その中の多くのコンサルタントおよび私たちの従業員は、以前に雇用されていたか、または以前に、私たちの競争相手または潜在的なライバルを含む他のバイオテクノロジーまたは製薬会社に提供されていたか、または現在、これらの会社にコンサルティングサービスを提供している。私たちは、私たちの会社または従業員、コンサルタントまたは代理人が、その前の雇用主またはその前の顧客または現在の顧客の商業秘密または他の固有の情報を無意識にまたは他の方法で使用または漏洩した疑いの影響を受けるかもしれない。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。私たちがこれらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの管理チームの注意を分散させる可能性がある。
もし私たちが特許期間を延長し、私たちの候補製品のためのデータ独占権を得ることでHatch-Waxman修正案の保護を得なければ、私たちの業務は実質的な損害を受ける可能性がある。
FDAがreproxalapまたは他の候補製品の発売を承認した時間、期限、および詳細によれば、私たちの1つ以上の米国特許は、1984年の“薬品価格競争および特許期限回復法”(Hatch-Waxman修正案と略称する)に従って限られた特許期間を回復する資格がある可能性がある。ハッジ·ワックスマン改正案は、製品開発およびFDA規制審査中に失われた特許期間の補償として、特許回復期間を最長5年とすることを許可している。しかし,適用の最終期限内に出願を提出できなかったこと,関連特許の満了前に出願を提出できなかったことや適用の要求を満たしていなかったことなどにより延期が得られなかった可能性がある.しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長や回復を得ることができない場合、あるいはどのような延長の期限が私たちが要求したよりも短い場合、私たちの競争相手は私たちの特許が満期になった後に競争製品の承認を得ることができ、私たちの収入は減少する可能性があり、実質的である可能性がある。
55
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません。
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません。我々の登録または未登録商標または商号は、挑戦、侵害、回避、または汎用商標として宣言されるか、または他の商標が侵害されたと認定される可能性がある。私たちはこれらの商標や商品名に対する私たちの権利を保護できないかもしれません。私たちは私たちが関心のある市場の潜在的なパートナーや顧客の中で知名度を確立するために必要です。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または商標の所有者は、我々の登録または未登録商標または商号の変異体を含む商号または商標侵害クレームを提出することができる。長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。商標、商業秘密、ドメイン名、著作権、または他の知的財産権に関連する専有権を実行または保護する努力は無効である可能性があり、大量のコストおよび資源移転を招き、私たちの財務状況または運営結果に悪影響を及ぼす可能性があります。
米国特許法の変化は特許の全体的な価値を低下させ、私たちの候補製品を保護する能力を弱める可能性がある。
他のバイオテクノロジー会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存する。生物製薬産業で特許を取得して実施することは複雑な技術と法的問題に関連している。したがって、バイオテクノロジー特許の取得と実施は高価で時間がかかり、本質的に不確実である。しかも、議会は特許改革法案を採択するかもしれない。近年、最高裁はいくつかの特許事件に対して裁決を下し、利用可能な特許保護範囲を縮小するか、特許所有者の権利を弱体化させている。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、連邦裁判所、および米国特許商標局の決定によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を獲得したり、既存の特許および将来獲得可能な特許を強制的に執行する能力を弱めることができる。
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
私たちはすでに米国と他の国でreproxalapと私たちのいくつかの他の候補製品をカバーする物質構成特許を発行しているが、世界のすべての国/地域でreproxalapと私たちの他の候補製品の特許出願、起訴、弁護を行うことは目を引くほど高価であり、アメリカ以外のいくつかの国/地域での知的財産権は米国の知的財産権が広くなく、持続時間も米国の知的財産権よりも明らかに短いかもしれない。また、いくつかの外国の法律は知的財産権の保護の程度はアメリカの連邦や州法律に及ばない。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を持っているが法執行力がアメリカに及ばない地域に輸出することもできる。これらの製品は私たちの候補製品と競争するかもしれませんが、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許や他の知的財産権保護、特に薬品に関連する特許保護の強制執行に賛成しておらず、これにより、私たちの特許の侵害を阻止したり、私たちの専有権を侵害する方法で競争製品を販売することを困難にする可能性があります。外国の管轄区域で私たちの特許権を強制的に執行する訴訟手続きは、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移す可能性があり、私たちの特許が無効または偏狭に解釈されるリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。
56
従業員の事務と管理成長に関するリスク
私たちは私たちの高度な管理チームと特定の重要なコンサルタントのサービスに強く依存している。
限られた人員の会社として、私たちは私たちの高級管理チームの開発、監督、商業、財務の専門知識に強く依存しています。チームのメンバーは、トッド·C·ブレイディ医学博士、総裁CEO兼最高経営責任者スティーブン·G·マチャタ博士、最高開発責任者スティーブン·G·マチャタ博士、臨時財務官ブルース·グリーンバーグ、その他の一部の従業員です。また、著者らは知的財産権、薬物動態学、化学、毒理学、薬物開発と商業化コンサルタントを含むいくつかの重要なコンサルタントのサービスに依存している。指導部の移行自体が管理が困難であり、永久首席財務官に移行する時間が不十分であれば、わが社内の混乱を招く可能性がある。また、適格な候補者が常任首席財務官に就くことができなければ、業務目標や戦略計画を実現する能力が悪影響を受ける可能性がある。これらの人員の流出や私たちの管理チームの将来のメンバーのサービスは、私たちの候補製品のさらなる開発と商業化を延期または阻止する可能性があり、適切な代替者を見つけることができなければ、私たちの業務を損なう可能性があります。
もし私たちが高度な管理者と肝心なビジネス員を引き付けることができなければ、私たちは私たちの候補製品の開発に成功したり、商業化することができないかもしれません。
私たちの臨床開発と商業化努力に成功するために、私たちの管理、運営、財務、その他の資源を拡大し、効果的に管理する必要があるだろう。私たちの成功はまた私たちが引き続き素質の高い管理と科学者を誘致、維持し、激励する能力にかかっているが、生物技術と製薬会社、大学と研究機関の間の合格人材に対する激しい競争のため、私たちは未来にこれをすることができないかもしれない。必要な人員を引き付けることができなければ、私たちが業務戦略を実施する能力は大きな障害に直面する可能性がある。
私たちは常任首席財務官を決定することを含めて私たちの管理チームを拡大したい。私たちの将来の業績は、新たに採用された幹部を私たちの管理チームに組み入れることに成功するかどうか、および上級管理職の間で効果的な仕事関係を築くことができるかどうかにある程度かかっています。私たちはこれらの個人を統合し、彼らと他の経営陣のメンバーとの間に有効な作業関係を構築することができず、私たちの候補製品の開発と商業化効率の低下を招き、将来の規制審査、私たちの候補製品の販売、私たちの運営結果に悪影響を及ぼす可能性がある。
私たちの候補製品を商業化するためには、私たちの組織の規模を大幅に拡大する必要がある。私たちは私たちの成長を管理し、私たちの業務の成功を拡大する困難に直面するかもしれない。
2023年6月30日現在、私たちは15人のフルタイム従業員しかいない。したがって、私たちは引き続き発展し、reproxalapと私たちの他の候補製品の潜在的な商業化を追求し、上場企業として機能するために、私たちの組織を拡大する必要があるだろう。私たちがreproxalapと他の候補製品を潜在的な商業化に推進することを求め、進行中の製品開発計画の数量を増加させ、臨床前研究と臨床試験を通じて私たちの未来の候補製品を推進することに伴い、私たちは私たちの財務、開発、監督、製造、マーケティングと販売能力を拡大し、あるいは第三者と契約を締結し、これらの能力を提供する必要がある。私たちの業務の拡大に伴い、様々な戦略パートナー、サプライヤー、他の第三者とのより多くの関係を管理する必要があると予想されます。今後の成長は経営陣のメンバーにより多くの責任を負わせ、より多くの内部能力を維持することを要求するだろう。私たちの将来の財務業績と私たちが候補製品を商業化し、効果的に競争する能力は、私たちが未来の成長を効果的に管理する能力にある程度依存するだろう。そのため、私たちは私たちの開発仕事と臨床試験を有効に管理し、より多くの管理、臨床と監督、財務、行政、販売とマーケティング人員を募集、訓練と統合することができなければならない。私たちはこれらの任務を達成できないかもしれません。もし私たちがこれらの任務を達成できなければ、私たちは会社の成功を阻害するかもしれません。
他の法律または規制事項に関連するリスク
私たちの業務は政治、経済、法律、社会リスクの影響を受けており、これは私たちの業務に悪影響を及ぼす可能性がある。
アメリカとアメリカ以外の市場では、私たちは重大な規制、経済、法的障害を克服しなければならない。私たちは、重なったり衝突したりする可能性のある複数の法律を含む、様々な国や地方の法律を遵守する負担を負うことができる。私たちはまた新しい文化、商業慣習、そして法律制度に適応する困難に直面するかもしれない。どんな販売と運営も政治的、経済的、社会的不確実性の影響を受けるだろう
57
米国社会、政治、規制、経済条件の変化、または対外貿易、製造業、発展と投資を管理する法律と政策の変化、およびこれらの変化による米国のいかなる負の感情も、私たちの業務に悪影響を及ぼす可能性がある。景気後退、新冠肺炎の疫病、利上げとインフレ、サプライチェーンの遅延と中断、アメリカ大統領政府の政策重点、貿易戦争、失業或いは政府の長期的な停滞に対する懸念は変動性を悪化させ、経済と市場への期待を低下させる可能性がある。また、地政学的問題への懸念は、市場の長期的な変動や不安定を招く可能性もある。例えば、ロシアとウクライナの間の紛争は、世界の市場と産業の混乱、不安定、変動を招く可能性がある。米国政府や他の司法管轄区域の政府はロシアとロシアの利益に対して厳しい経済制裁と輸出規制を実施し、ロシアをユニバーサル銀行間金融電信支払い協会(SWIFT)システムから除名し、追加の制裁と制御を実施すると脅している。このような措置の影響と、このような措置に対するロシアの潜在的な反応は未知だ。
これらの要素と他の要素に関連するどんな変化も、私たちがアメリカ国外で行っている任意のビジネス運営に悪影響を及ぼす可能性があります.
セキュリティホール ネットワーク攻撃、データ損失、および私たちの情報技術システムまたは私たちの第三者協力者、サービスプロバイダ、請負業者またはコンサルタントに影響を与える情報技術システムの他の中断は、私たちの業務に関連する敏感な情報のプライバシー、セキュリティ、完全性または機密性を脅かす可能性があり、または私たちが重要な情報にアクセスすることを阻止し、規制調査または行動、訴訟、および巨額の罰金および処罰を含むが、これは私たちの業務、財務状況および名声に悪影響を及ぼす可能性がある。
私たちの通常のビジネスプロセスでは、私たちは、法律によって保護された健康情報、患者および従業員に関する個人情報(特定のデータプライバシー法に従って個人情報または個人識別情報とも呼ばれる)、知的財産権、ならびに私たち独自の業務および財務情報(総称して敏感情報と呼ぶ)を含む、現在または将来の第三者パートナー、サービスプロバイダ、請負業者およびコンサルタントと収集し、敏感なデータを格納および送信することができる。我々は、現場システム、ホスト·データセンターシステム、およびクラウド·ベースのデータセンタシステムの組み合わせを利用して、敏感な情報を含むデータを管理および維持する。私たちは、アクセスできない、不適切な開示、および不適切なまたは許可されていないアクセス、およびそのようなイベントを識別および監査する能力に関連するリスクを含む、私たちの保護および私たちの第三者パートナー、サービスプロバイダ、請負業者、およびコンサルタントのこれらの敏感な情報の保護に関連する多くのリスクに直面している。
敏感な情報のセキュリティ処理、保存、維持、転送は、私たちの運営および業務戦略に重要であり、私たちはこのような情報を保護するために多くの資源を投入しています。私たちは、不正なアクセスや開示から敏感な情報を保護する措置を取っているにもかかわらず、私たちの情報技術およびインフラ、ならびに私たちの第三者協力者、サービスプロバイダ、請負業者およびコンサルタントの情報技術およびインフラは、サービス中断、システム障害、自然災害、テロ、戦争、電気通信および電気故障、ならびに悪意のある第三者のネットワーク攻撃(有害なマルウェアの配備、恐喝ソフトウェア、サービス拒否攻撃、社会工学および他の手段を含む)やウイルスまたは他の方法の破壊、または従業員または第三者のミス、不正行為のために、サービス信頼性に影響を与え、情報の機密性、完全性および可用性を脅かす可能性があります。他の活動もあります新冠肺炎が大流行している間、私たちの誰かの従業員が遠隔操作すれば、これらのリスクは増加するかもしれない。
このような攻撃、侵入、またはシステム障害があることはわかりませんが、私たちのデータ保護努力と情報技術への私たちの投資、または私たちの第三者パートナー、サービスプロバイダ、請負業者、コンサルタントの投資が、関連システムまたは他のネットワーク事件における重大な障害、データ漏洩、および侵入を防止する保証はありません。このような事件が発生し、私たちの運営が中断された場合、私たちのネットワークは脅かされる可能性があり、これらのネットワーク上に格納された敏感な情報は、許可されていない当事者のアクセス、公開開示、紛失、または盗まれる可能性がある。このような不正アクセス、開示、または他の情報損失、またはそのいずれかが発生したと考えられる感覚は、法的クレームまたは訴訟を引き起こす可能性がある
58
個人データのプライバシーを保護する連邦、州、および国際法律は、2020年に“カリフォルニアプライバシー権法案”(CPRA)によって改正された“カリフォルニア消費者プライバシー法案”に基づいて提起された個人訴訟または集団訴訟、および重大な法律または財務リスクをもたらす可能性のある監督管理処罰を含むが、これらに限定されない。また,個人データが漏洩した場合に影響を受けた個人や州規制機関に通知することが州法律の制約を受ける可能性があり,これは“健康保険携帯性·責任法”(HIPAA)で保護されている健康情報よりも広い情報種別である。不正アクセス、紛失、または敏感な情報の伝播はまた、私たちの研究および開発活動を行う能力を乱す可能性があり、会社の財務情報を収集、処理、準備すること、私たちのウェブサイトを介して私たちの候補製品や他の患者や医師教育や外展の仕事に関する情報を提供すること、私たちの業務の行政的側面を管理すること、または私たちの名声が損なわれることを防止することは、いずれも私たちの業務に悪影響を及ぼす可能性がある。
私たちは厳格で変化しているアメリカと外国の法律、法規、規則、契約義務、政策、その他のデータプライバシーとセキュリティに関する義務に支配されています。私たちが実際にまたはそのような義務を履行できなかったことは、規制調査または行動、訴訟、巨額の罰金および処罰、私たちの業務運営中断、名声損害、収入または利益損失、顧客または販売損失、および他の不利な業務結果をもたらす可能性があると考えられている。
我々の通常の業務プロセスでは、我々は、個人データ(特定のデータプライバシー法に従って個人情報または個人識別情報とも呼ばれる)個人データ(特定のデータプライバシー法に従って個人情報または個人識別情報とも呼ばれる)および独自および機密の商業データ、商業秘密、知的財産権、敏感第三者データおよび患者情報を含む他の敏感な情報を処理、生成、使用、送信、開示、アクセス、保護、保護、処置、送信および共有する。私たちのデータ処理活動は、様々な連邦、州と外国の法律、法規、ガイドライン、業界基準、外部と内部のプライバシーとセキュリティ政策、契約、私たちを管理し、私たちを代表して個人データを処理する他の義務など、多くのデータプライバシーとセキュリティ義務を負担するかもしれません。私たちは適用可能な範囲で適用されるデータプライバシーとセキュリティ義務を遵守するために努力している。しかし、これらの義務の解釈および適用は、異なる管轄区域間で一致しない可能性があり、他の規則および/または私たちの接近と衝突する可能性がある。私たちが適用されるプライバシーおよびデータセキュリティの法律法規、私たちのプライバシー政策、または第三者へのプライバシー関連義務、または不正アクセス、個人データまたは他の敏感な情報の公開または移転を招くいかなるセキュリティ妥協も、政府の法執行行動および罰金または命令を招く可能性があり、私たちのやり方、個人訴訟(集団訴訟を含む)、または消費者権益提唱団体または他の人の私たちに対する公開声明を変更することを要求することができ、私たちへの信頼喪失を招く可能性があり、重大な法律または財務リスクおよび名声被害を招き、私たちの業務に悪影響を及ぼす可能性があります。
米国では、データ漏洩通知法、個人データプライバシー法、消費者保護法(例えば、連邦貿易委員会法案第5条)を含む多くのデータプライバシーおよびセキュリティ法律が連邦、州、地方政府によって公布されている。例えば、“健康情報技術促進経済と臨床健康法案”(HITECH)によって改正されたHIPAAは、個人が健康情報を識別できるプライバシー、安全と伝送に対して具体的な要求を提出した。さらに、CPRAによって改正されたカリフォルニア消費者プライバシー法を含む様々な州データプライバシーおよびセキュリティ法律法規によって制限される可能性があり、カバーされた“企業”が、その個人データの収集、販売、および共有に関する具体的な開示をカリフォルニアの消費者に提供することを要求し、そのような消費者に特定の個人情報販売からの離脱を選択する権利を与えることができる。CPRAは、違反行為に対する民事処罰と、セキュリティホール訴訟の可能性および関連リスクを増加させる可能性のあるいくつかのセキュリティホールに対する個人訴権を規定する。さらに、CPRAは、実施と法執行を監督するための新しい国家機関を作成し、これはさらなる不確実性を招く可能性があり、規定を遵守するために追加のコストと支出を招くことを要求している。CPRAの多くの条項は2023年1月1日に施行される。他の州でも,2023年1月1日に施行されるバージニア州消費者データ保護法(VCDPA),2023年7月1日に施行されるコロラド州プライバシー法案(CPA)やコネチカット州データプライバシー法案(CCTPA),2023年12月31日に発効するユタ州消費者プライバシー法案(UCPA)のような総合的な州プライバシー法が制定されている。CPRA、VCDPA、CPA、CCTPA、UCPA、および他の同様の法律は、適用範囲内で、私たちのコンプライアンスコストおよび潜在的責任を増加させる可能性があり、特にデータ漏洩の場合、個人データを処理する方法、私たちの財務状況、および私たちの運営結果を含む、私たちの業務に実質的な悪影響を及ぼす可能性があります。これらの法律はまた、いくつかの新しい連邦と州プライバシー立法提案を促進し、通過すれば、私たちの潜在的な責任を増加させ、私たちのコンプライアンスコストを増加させ、私たちの業務に悪影響を及ぼすかもしれない。
欧州の最近の事態は,ヨーロッパからの個人データの処理にコンプライアンス不確実性が生じている。例えば,EUの一般データ保護条例(EU GDPR),イギリスのGDPR(UK GDPR),スイス連邦データ保護法はヨーロッパデータ保護法の地理的範囲を非ヨーロッパ実体に拡大し,個人データの処理に厳しい要求をしている。例えば、EU GDPRおよび/またはイギリスGDPRによると、政府規制機関は、データ処理に対して一時的または最終的な禁止を実施する可能性があり、最も深刻な違反に対して、前会計年度の世界年商4%または2000万ユーロまでの罰金を科す可能性がある。これは私たちを2つの平行した法規に直面させ、すべての法規はある人に似た罰金と他の可能性のない法執行行動を許可することができるかもしれない
59
違反行為。さらに、法的権限は、その利益を代表する個人または消費者保護組織が、個人個人データの処理に関する訴訟を提起することができる。
私たちの正常な業務過程で、私たちは個人データをヨーロッパや他の司法管轄区域からアメリカや他の国に移すかもしれない。EU GDPRとイギリスGDPRはそれぞれ欧州経済圏以外の国やイギリス(米国を含む)への個人データの移転を禁止しており、これらの国と地域はそれぞれ欧州委員会またはイギリスデータ保護規制機関によって不十分とされている。スイスはまた似たような制限措置を取った。個人データをヨーロッパ経済圏、イギリス、スイスから米国に移すことができる法的メカニズムがあるが、これらのメカニズムは法的挑戦を受けており、これらの措置が個人データを合法的に米国に移転できることを満たしたり、依存したりできる保証はない。例えば、EUの最近の法律発展はこのような譲渡の複雑さと不確実性をもたらし、異なるEU加盟国からのデータ保護当局はEU GDPRを異なる解釈をするかもしれない。さらに、実施およびコンプライアンスに関するガイドラインは、しばしば更新または他の方法で修正され、これは、EUが個人データを処理する複雑さを増加させる。このような譲渡メカニズムはまた様々な法的挑戦を受けている。特に、2020年7月16日、EU裁判所は、データ保護専門家がFacebookアイルランド株式会社、Maximillian Schrems(案件C-311/18)(Schrems II)を訴えた事件で、EU-米国個人データがEUから米国に移行するプライバシー盾計画の無効を宣言し、個人データをEU以外に移行するコンプライアンス機構として標準契約条項を使用する不確実性と複雑性を増加させた。
もし私たちが合法的な方法で個人データをヨーロッパ経済区、イギリス、スイスからアメリカに移していない場合、あるいは合法的な移転の要求が煩雑すぎる場合、私たちは私たちの業務の中断や降格を含む深刻な不利な結果に直面する可能性があり、高い費用で業務の一部または全部のデータ処理活動を他の司法管轄区に移す必要があり、より多くの規制行動、巨額の罰金と処罰に直面し、データを移転できず、パートナー、サプライヤー、他の第三者と協力することができ、これはヨーロッパや他の場所で臨床試験活動を行う能力を制限するかもしれない。私たちの業務を処理したり移転したりするために必要な個人データを禁止する禁止もあります。
EU、イギリス、スイスを除いて、ますます多くの他のグローバル司法管轄区域は、データ保護要件を実施したり、データのローカルな保存と処理を要求したり、同様の要求を検討したりしており、これは、私たちの業務のコストと複雑さを増加させる可能性がある。その中のいくつかの法律は,ブラジルの一般データ保護法や日本の個人情報保護法のように,EU GDPRやイギリスGDPRが規定している義務と類似した義務を課している。ロシア、インド、中国のような他の国は、データローカライズ要求を含むより厳しい義務を課すかもしれない。もし私たちがこれらの変化する法的要求を満たすことができない場合、あるいはプライバシー、データ保護または情報セキュリティに関連する任意の法律、法規、または他の義務に違反または違反したと考えられた場合、私たちの名声は損なわれる可能性があり、調査、クレーム、その他の救済措置を受ける可能性があり、これは私たちを巨額の罰金、処罰、その他の損害賠償に直面させる可能性があり、これらはすべて私たちの業務を損なうことになる。
現在と将来の法律は、規制やマーケティングの承認を得て、私たちの候補製品を商業化する難しさやコストを増加させ、入手可能な価格に影響を与える可能性があります。
米国や一部の外国司法管轄地域では、医療システムに関する立法や規制変更、提案された変更は、候補製品の上場承認を阻止または延期し、承認後の活動を制限または規制し、マーケティング承認を得た候補製品を収益的に販売する能力に影響を与える可能性がある。製薬産業はこのような努力の重点であり、立法計画の大きな影響を受けてきた。現行法、および将来取られる可能性のある他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受けた任意のFDA承認製品の価格に追加の下振れ圧力をもたらす可能性がある。
将来採用される可能性のある医療改革措置は、連邦医療保険および他の医療資金の減少、より厳しいカバー基準、新しい支払い方法、および任意の承認された製品のために得られる価格および/または医師が市場に進出する可能性のある任意の承認された製品を管理することによって得られる精算レベルの追加的な下振れ圧力をもたらす可能性がある。精算レベルの低下は私たちが受け取った価格や私たちの製品の処方や管理頻度に悪影響を及ぼす可能性があります。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。
60
これまで、アメリカ議会は最近数回の調査を行い、州と連邦立法と法規を提出し、公布し、薬品定価の透明性を高め、定価とメーカー患者支持計画との関係を審査し、連邦医療保険下の薬品のコストを下げ、政府の薬品に対する計画精算方法を改革することを目的とした。例えば、2021年総合支出法案には、いくつかの医薬品価格報告および透明性措置が含まれており、例えば、いくつかの連邦医療保険計画開発ツールが、連邦医療保険D部分の処方薬福祉情報をリアルタイムで表示することを要求し、団体および医療保険発行者に、薬局福祉および薬品コストに関する情報を衛生公衆サービス部長官、労働部および財政部に報告することを要求する。また、国会もバイデン政権も、処方薬コスト問題を解決するために新たな立法および/または行政措置を求め続けたいと表明している。例えば、2021年7月9日、バイデン総裁は、処方薬問題を解決するいくつかの取り組みを含む米国経済競争を促進する行政命令を発表した。他の条項では、行政命令は、バイデン政府は“医療保険の薬品価格交渉の許可、インフレ上限の設定、その他の関連改革による処方薬価格の低下を含む積極的な立法改革を支持する”と規定している。行政命令への対応として、2021年9月9日、HHSは高薬価に対応する総合計画を発表し、その中で国会と同機関が取ることができる潜在的な立法政策と行政ツールを決定し、薬品価格をより負担と公平にし、処方薬業界全体の競争を改善し、促進し、科学革新を促進する。国会はまた、処方薬業界の価格設定のやり方について調査を続けている。
これらの取り組みは最近ピークに達し,2022年8月に“アイルランド共和法”が公布されたほか,衛生·公衆サービス部は,少なくとも7年(生物製品は11年)の高支出単一由来薬物の承認にのみ適用されるにもかかわらず,CMSが連邦医療保険B部分とD部分で精算されたいくつかの薬物や生物製品の販売価格に基づいて交渉することを許可する。交渉価格は2026年に初めて発効し、法定最高価格を上限とすることは、卸売業者や直接購入者の平均価格に対して大きな割引があることを意味する。2023年10月から、この法律はまた、インフレ率よりも高い速度で連邦医療保険B部分とD部分の薬物価格を向上させた薬品メーカーを処罰する。また,この法律は2025年から新たに設立されたメーカー割引計画により受益者の最大自己コストを著しく低減し,連邦医療保険D部分下の“ドーナツ穴”を解消している。アイルランド共和軍はまた、ACA市場で医療保険を購入した個人に2025年まで強化された補助金を提供する。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。IRAを守らないメーカーは民事罰金を含めて様々な処罰を受ける可能性がある。このような規定は法的挑戦を受ける可能性があるにもかかわらず、2023年から段階的に施行されるだろう。したがって,アイルランド共和軍がどのように実施されるかは不明であるが,我々の業務や製薬業全体に大きな影響を与える可能性がある。
州レベルでは、各州は立法と実施を通じて薬品と生物製品の定価を制御するための法規を実施する面でますます積極的になっている。これらの措置には、価格または患者の精算制限、割引、特定の製品参入およびマーケティングコスト開示に関する制限、および透明性措置に関する立法および条例が含まれており、場合によっては、他の国からの輸入および一括調達を奨励するための立法行動も含まれる。また、地域衛生保健当局や個別病院は、どの薬品やサプライヤーが彼らの処方薬や他の医療計画に含まれるかを決定するために入札プログラムを使用することが増えている。承認されれば、これらの措置は私たちの製品に対する最終的な需要を減らしたり、私たちの製品の価格設定に圧力をかけるかもしれません。
また、承認後の要求を拡大し、薬品の販売や販売促進活動を制限するための立法と監督管理提案を提出した。私たちは、より多くの立法変化が公布されるかどうか、あるいはFDAの法規、ガイドライン、解釈が変わるかどうか、あるいはこれらの変化が私たちの候補薬物の潜在的な承認と上場承認にどのような影響を与える可能性があるかどうかを決定することはできない。アメリカ議会のFDA承認過程に対するより厳格な審査は上場承認を著しく延期或いは阻止する可能性があり、そして私たちはより厳しい製品ラベルと上場後のテストとその他の要求の制約を受けることができる。
政府、保険会社、医療組織を管理し、他の医療サービス支払者が医療コストのコントロールあるいは低減に努力し続けることは、以下の点に悪影響を及ぼす可能性がある
61
私たちの業務および実際と潜在的な顧客、プロバイダ、第三者支払者との関係は、適用されるリベート、詐欺、乱用、および他の医療法律法規の制約を受けることになり、これは、私たちを刑事制裁、民事処罰、政府計画から除外され、契約損害、名声損害などの処罰に直面させ、私たちの将来の利益と収益を減少させる可能性がある。
第三者支払者、医師、他の潜在的な顧客との合意は、市場で承認された任意の候補薬物の業務または財務的配置と関係を制限する可能性がある幅広い適用された詐欺や乱用、および他の医療法律および法規の制約を受けることになります。
アメリカ連邦と州医療に関する法律には
62
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する現行または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの運営がこのような法律または任意の他の私たちに適用される可能性のある政府法規に違反していることが発見された場合、私たちは重大な民事、刑事、そして行政処罰、損害、罰金、監禁、連邦医療保険と医療補助のような政府資金援助の医療計画から除外されることが発見された場合、返還、契約損害、名声損害、利益と将来の収入減少、および私たちの業務の削減または再編。もし私たちがそれと業務を行うことが予想される任意の医師や他の医療提供者や実体が適用されない法律に適合していないことが発見された場合、彼らは政府の援助された医療計画から除外されることを含む刑事、民事または行政制裁を受ける可能性もある。有効なコンプライアンス計画は,これらの法律違反による調査·起訴のリスクを低減することができるにもかかわらず,これらのリスクを完全に解消することはできない。どんな告発や違反の疑いも、このような行為が成功して弁護されても、巨額の法的費用を招き、経営陣の業務運営への注意をそらす可能性がある。
EUでは、不適切な行為を誘導または奨励するために利益または利益を提供することは、処方、推薦、裏書き、購入、供給、注文または医薬製品の使用を誘導または奨励するために一般的に禁止されている。不当な行為を誘導または奨励するために利益または利益を提供し、EU加盟国の国家収賄法およびイギリスの“2010年反収賄法”によって管轄されている。このような法律に違反することは巨額の罰金と監禁につながるかもしれない。EU指令2001/83/ECは人が薬品を使用することに関するEUの指令であり、医療保健専門家に薬品を普及させる場合、このような個人にいかなるプレゼント、金銭優遇または実物福祉を提供、提供または承諾してはならず、これらの贈り物が安価で医療或いは薬局の実践と関連しない限り、規定している。この規定は2012年の“人間医薬品条例”に移されたため、依然としてイギリスに適用されている。
いくつかの連合会員国で医者に支払われた費用は公開されなければならない。さらに、医療専門家との合意は、通常、医療専門家の雇用主、その主管専門組織および/または個々のEU加盟国の規制機関に事前に通知し、その承認を得なければならない。これらの要件は、EU加盟国およびイギリスに適用される国家法律、業界規範、または専門行動基準に列挙されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
もし私たちが製品をマーケティングする方法が医療詐欺や乱用法律に違反している場合、あるいは政府価格報告法に違反した場合、民事または刑事罰を受ける可能性があります。
FDAによる薬品マーケティングの制限以外に、近年、製薬業界のあるマーケティング行為を制限するために、他のいくつかのタイプの州と連邦医療詐欺と乱用法律が適用されている。このような法律には虚偽請求規制と反リベート規制が含まれている。これらの法律の範囲が広く、避風港の範囲が狭いことから、私たちのいくつかの商業活動はそのうちの1つ以上の法律によって挑戦されるかもしれない。
連邦虚偽申告法は、誰もが故意に連邦政府に提出するか、虚偽クレームを提出することを引き起こすか、または虚偽クレームを得るために故意にまたは虚偽陳述を引き起こすことを禁止する。連邦医療計画反リベート法規は、購入、レンタル、注文または購入、レンタルまたは手配として、Medicare、Medicaid、または他の連邦によって援助された医療計画に従って精算可能な任意の医療項目またはサービスの報酬を誘導または発注するために、故意に提供、支払い、請求または報酬を受けることを禁止する。この法律は一方の薬品製造業者と処方者、購入者、および
63
もう一方は方程式マネージャーです。いくつかの法定免除と規制避風港はいくつかのよく見られる活動を起訴から保護しているが、免除と避風港の範囲は狭く、処方、購入或いは推薦の報酬を誘導するためのやり方が免除や避風港の資格を満たしていなければ、審査される可能性がある。私たちの接近はすべての場合、安全港が反リベート責任から保護されるすべての基準を満たしていないかもしれない。
過去数年間、いくつかの製薬と他の医療保健会社は、無料旅行、無料商品、虚偽の相談費と補助金、その他の金銭的利益を処方者に提供した疑いがあり、定価サービスに平均卸売価格を上昇させ、その後、連邦はこれらの卸売価格を利用して販売率を設定する予定であり、ラベル外販売促進に従事し、非引受、ラベル外用途にクレームを提出したこと、Medicaid返却計画に過大な最適価格情報を提出し、Medicaid返却の責任を減少させるために、様々な疑いのある販売促進やマーケティング活動で起訴された。多くの州にも連邦反リベート法や虚偽申告法のような法規や法規があり,連邦医療補助や他の州計画に基づいて精算するプロジェクトやサービス,あるいはいくつかの州では支払者にかかわらず適用される。これらの連邦と州法律によると、制裁には民事罰金、政府計画に基づいてメーカーの製品を精算から除外し、刑事罰金、監禁を含む可能性がある。
米国食品医薬品局、米国証券取引委員会、その他の政府機関の資金不足は、重要な指導部や他の人員の採用と維持の能力を阻害し、新製品やサービスの適時な開発や商業化を阻止するか、あるいはこれらの機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを阻止する可能性があり、これは私たちの業務に負の影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、キーパーソンの雇用と保留、ユーザー費用の支払いを受ける能力、法律、法規、政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また、政府が米国証券取引委員会や我々の業務に依存する可能性のある他の政府機関に提供する資金は、研究開発活動に資金を提供する機関を含め、政治プロセスの影響を受けており、政治プロセス自体が不安定で予測不可能である。
FDAや他の機関の中断は、新冠肺炎疫病によるまたは対応の中断を含み、必要な政府機関の新薬の審査および/または承認に要する時間を遅らせる可能性もあり、これは私たちの業務に悪影響を及ぼす。例えば、ここ数年間、米国政府は何度か閉鎖されており、食品·医薬品局や米国証券取引委員会のようないくつかの規制機関は、重要なFDA、米国証券取引委員会、および他の政府従業員を休暇させ、重要な活動を停止しなければならない。政府が長期的に停止すれば、FDAが私たちが提出した規制文書を適時に審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。また、当社の上場企業としての運営では、将来的に政府の閉鎖が公開市場に参入し、必要な資本を得る能力に影響を与える可能性があり、適切な資本化と運営を継続することができます。
もし私たちに製品責任訴訟を提起すれば、私たちは重大な責任を招く可能性があり、reproxalapや私たちの他の候補製品の商業化を制限することが要求されるかもしれない。
私たちの候補製品の臨床テストのため、私たちは固有の製品責任リスクに直面しています。私たちの候補製品を商業化すれば、私たちはもっと大きなリスクに直面します。例えば、reproxalapまたは私たちの他の候補製品が、製品テスト、製造、マーケティング、または販売中にダメージを与えたと言われている場合、または不適切が発見された場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、候補製品固有の危険、不注意、厳格な責任、保証違反の告発を警告できなかった場合があります。州消費者保護法によると、クレームも主張することができる。
もし私たちが製品責任クレームで自分自身を弁護することに成功できなければ、私たちは重大な責任を招いたり、私たちの候補製品の商業化を制限することを要求されるかもしれません。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。事件がどうであっても最終的な結果がどうであろうと、賠償責任は次のようになるかもしれない
64
私たちは製品責任保険を維持して、保険金額は500万ドルです。私たちはもし私たちがどんな候補製品を商業化すれば、私たちの保険範囲を増加させる必要があると予想する。潜在的な製品責任クレームを防止するために、許容可能なコストで十分な製品責任保険を得ることができず、これはreproxalapまたは私たちの他の候補製品の商業化を阻止または阻害する可能性がある。私たちはこのような保険を維持しますが、私たちに対するいかなるクレームも、裁判所の判決や和解の金額が私たちの保険範囲内にない、あるいは私たちの保険範囲を超えてしまう可能性があります。私たちの保険証書も様々な排除があります。私たちは製品責任クレームの影響を受けるかもしれませんが、私たちは保険範囲を持っていません。私たちは私たちの保険範囲の制限を超えたり、私たちの保険カバー範囲内でない裁判所の裁決または和解合意で達成された任意の金額を支払う必要があるかもしれません。私たちはこれらの金額を支払うために十分な資本を持っていないか、または得ることができません。
私たちと私たちの開発パートナー、第三者製造業者、サプライヤーは生物材料を使用し、危険な材料を使用する可能性があり、これらの材料の不適切な処理、貯蔵、または処置に関連するいかなるクレームも非常に時間的または費用がかかる可能性がある。
私たちと私たちの開発パートナー、第三者製造業者、およびサプライヤーは、人間の健康および安全または環境に危険をもたらす可能性のある化学品、生物学的製剤および化合物を含む危険な材料を使用する可能性がある。私たちの業務や私たちの開発パートナー、第三者メーカー、サプライヤーの業務にも危険廃棄物製品が発生します。連邦、州、地方の法律法規はこれらの材料と廃棄物の使用、発生、製造、貯蔵、処理、処理を管理する。適用される環境法律や法規を遵守することは費用がかかる可能性があり、現在または未来の環境法律と法規は私たちの製品開発努力を損なう可能性がある。しかも、私たちはこのような材料や廃棄物が意外なダメージや汚染をもたらすリスクを完全に除去することはできない。私たちは特定の生物或いは危険廃棄物保険を受けていません。私たちの財産、意外と一般責任保険は生物或いは危険廃棄物の暴露或いは汚染による損害と罰金は明確に含まれていません。したがって、汚染や傷害が発生した場合、損害賠償責任を請求されたり、私たちの資源を超えた罰金が科されたりする可能性があり、私たちの臨床試験や規制承認は一時停止される可能性があります。
もし私たちのいかなる承認された製品が不良医療事件を引き起こしたり、私たちの未来の開発パートナーとも規制機関に報告することを要求されるならば、そうしないいかなる行為も私たちの業務に実質的な損害を与える制裁を招くだろう。
もし私たちと私たちの任意の未来開発パートナーが私たちの製品を商業化することに成功すれば、FDAと外国規制機関は、これらの製品がこれらの不良事件を引き起こしたり、促進したりする可能性があれば、私たちと私たちの任意の未来開発パートナーにいくつかの不良医療事件に関する情報を報告することを要求する。私たちの報告義務の時間は私たちが不良事件とイベントの性質を認識した日によって触発されるだろう。私たちと私たちの未来の開発パートナーは、規定された期限内に私たちが知った有害事象を報告したり、その原因を十分に調査することができないかもしれない。私たちと私たちの未来の開発パートナーとも、私たちが報告可能な有害事象を認識していることを認識していないかもしれません。特にそれが有害事象として報告されていない場合、またはそれが意外である場合、または私たちの製品を使用する際にタイムリーに除去された有害事象である場合。もし私たちと私たちの未来の任意の開発パートナーが私たちの報告義務を履行できなかった場合、FDAまたは外国規制機関は、警告状を出すこと、ラベルの変更を要求すること、刑事起訴を開始すること、民事罰金を適用すること、私たちの製品を差し押さえること、または将来の製品の承認を延期または承認することを含む法執行行動をとることができる。
私たちは反腐敗法、そして輸出規制法、税関法、規制法、その他私たちの業務を管理する法律を守らなければならない。もし私たちがこれらの法律を遵守しなければ、私たちは民事または刑事処罰、または他の救済措置と法的費用を受ける可能性があり、そのいずれも私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性がある。
私たちの業務は、“反海外腐敗法”(FCPA)、“反賄賂法”、その他、私たちが業務を展開し、将来業務を展開する可能性のある国/地域に適用される反腐敗法律を含む反腐敗法律によって拘束されています。“海外腐敗防止法”、“反賄賂法”およびその他の法律は、一般に、業務を獲得または保留し、またはいくつかの他の業務的利点を得るために、私たち、私たちの職員、および仲介機関が、政府関係者または他の人に賄賂、贈賄、または他の禁止された金を支払うことを禁止している。私たちは将来、“海外腐敗防止法”や“収賄法”に違反する可能性のある司法管轄区域で業務を展開する可能性があり、私たちは第三者との協力や関係に参加する可能性があり、これらの第三者の行為は私たちに“反海外腐敗法”の下での責任を負わせるかもしれない
65
法案、あるいは地方反腐敗法。また、将来の規制要求の性質、範囲、影響を予測することはできず、私たちの国際業務はこれらの要求によって制約される可能性があり、現行の法律が管理または解釈される可能性がある方式を予測することもできない。
私たちはまた、アメリカ、イギリス政府、EU当局が管理する法規、適用される輸出規制法規、国と人員に対する経済制裁、税関要求、通貨両替法規を含む、私たちの国際業務を管理する他の法律と法規を管理しています。私たちは総称して貿易制御法と呼ばれています。
私たちが適用されるすべての反腐敗法律、“海外腐敗防止法”、“収賄法”、または貿易統制法を含む他の法律要件を遵守することを完全に効果的に確保することは保証されない。もし私たちが“海外腐敗防止法”、“反賄賂法”および他の腐敗防止法または貿易統制法を遵守しなければ、私たちは刑事および民事処罰、法的費用、返還、および他の制裁および救済措置を受ける可能性があり、これは私たちの業務、財務状況、運営結果、または流動性に悪影響を及ぼす可能性がある。米国証券取引委員会は、発行者が海外腐敗防止法の会計規定に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性もある。同様に、米国、イギリス、または他の当局が“反海外腐敗法”、“収賄法”、または他の腐敗防止法または貿易統制法に違反する可能性があるいかなる調査も、私たちの名声、私たちの業務、運営結果、または財務状況に悪影響を及ぼす可能性がある。
私たちの従業員、独立請負業者、サプライヤー、主要な調査者、契約研究組織(CRO)とコンサルタントは監督基準を守らない、監督管理要求とインサイダー取引を含む不当な行為或いはその他の不当な活動に従事する可能性がある。
私たちは、従業員、独立請負業者、サプライヤー、主要な調査者、CRO、コンサルタントが詐欺行為または他の不正活動に従事する可能性があるリスクに直面しています。これらの当事者の不適切な行為には
特に、医療業界の販売、マーケティング、商業配置は、詐欺、不正行為、リベート、自己取引、その他の乱用行為を防止するための広範な法律法規によって制約されている。これらの法律法規は、広範な定価、割引、マーケティングと販売促進、販売手数料、顧客激励計画、その他の業務手配を管理している。行動指針を採択し、すべての従業員に適した他の内部統制措置を実施しているが、従業員や他の第三者の不正行為を常に識別して阻止できるわけではなく、このような活動を発見し、防止するための予防措置は有効ではないかもしれない。さらに、私たちは誰かが詐欺や他の不適切な行為を告発する可能性があるという危険に直面している。もし私たちにこのような訴訟を提起した場合、私たちは自分の権利を弁護または維持することに成功しませんでした。これらの訴訟は、民事、刑事および行政処罰および損害を適用することを含む、私たちの業務に大きな影響を与えたり、損害をもたらす可能性があります。連邦医療保険、医療補助、および他の連邦医療保健計画から除外される可能性があります;利益および将来の収入の減少。
また、当社の運営過程では、取締役、役員、従業員、コンサルタント、その他の第三者が、私たちの業務、私たちの運営結果、または私たちが考えている潜在的な取引に関する重要な非公開情報にアクセスすることができます。私たちは重要な非公開情報を取得したり、普通株の取引を阻止したりすることができないかもしれない。もしそのような人がインサイダー取引で調査や起訴されれば、私たちの名声や株価にマイナスの影響を与えるかもしれない。このような言い方は、合理的かどうかにかかわらず、大量の時間とお金の支出を招き、私たちの管理チームの注意を私たちの業務の成功に重要な他の任務からそらす可能性がある。
私たちは訴訟の危険に直面している。
私たちは時々、規制手続き、行政訴訟、政府調査、契約紛争を含む様々な訴訟事項やクレームに巻き込まれるかもしれない。私たちは約束違反、誹謗、誹謗、詐欺、または不注意を含む潜在的なクレームまたは責任に直面するかもしれない。私たちはまた、年齢差別、セクハラ、性差別、移民違反、または他の地方、州、連邦労働法違反のクレームを含む雇用関連訴訟に直面する可能性がある。訴訟や保険引受決定の不確実性により、このような訴訟や訴訟の結果は確実に予測できず、そのうちの1つまたは複数の不利な解決に実質的な悪影響が生じる可能性がある
66
私たちの業務、財務状況、経営結果、キャッシュフロー、証券取引価格への影響。また、提訴や弁護訴訟に関連する法的費用やコストは、私たちの業務、財務状況、運営結果、当社証券の取引価格に大きな悪影響を及ぼす可能性があります。
私たちはいて、未来に証券集団訴訟の影響を受けるかもしれない。
従来、証券集団訴訟は、ある会社の証券市場価格が下落した後に提起されることが多かった。証券集団訴訟のリスクは我々に特に関連しており,バイオテクノロジーや製薬会社が近年大幅な株価変動を経験しているためである。2023年7月31日、集団訴訟は、特定の連邦証券法に違反していることを告発するために、私たちと私たちの一部の現職および元官僚に対して提起された。被告は原告の主張に異議を唱え、このことを積極的に弁護しようとしている。私たちに訴訟を起こすと、この事件や他の訴訟は、私たちに巨額のコストを発生させ、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務を損なう可能性があります。
私たちの保険証書は高くて、いくつかの商業リスクから私たちだけを保護して、これは私たちを重大な未保険債務に直面させます。
私たちは私たちの業務が直面する可能性のあるすべての種類のリスクに保険をかけない。私たちが現在維持しているいくつかの保険書は一般責任、製品と臨床試験責任、労働者補償及び役員と高級管理者保険を含む。しかし、私たちは私たちが既存の保険を維持し、十分な保険を提供できるかどうか分からない。いかなる重大な、未加入の責任も、私たちが多額の金額を支払う必要があるかもしれないが、これは私たちの運営資金と運営結果に悪影響を及ぼすだろう。
アメリカ連邦所得税改革は私たちに悪影響を及ぼすかもしれない。
どの政府当局も私たちの税務負担に影響を及ぼす可能性のある新しい立法や条例を制定することができる。私たちの財務業績に悪影響を及ぼす可能性があるので、このような税務関連の事態の時期や程度を予測することはできません。しかも、私たちは私たちの最適な判断を使用して、このような納税義務を定量化して維持しようと努力している。しかし、税務機関の挑戦、私たちは税金優遇(例えば繰越または税金控除)の能力を利用したり、他の税金関連の仮定から外れたりすることは、私たちの業務、経営結果、または財務状況に実質的な悪影響を及ぼす可能性がある。
私たちの普通株に関するリスクは
もし私たちの普通株に活発な取引市場がなければ、投資家は彼らが株式を購入したかそれ以上の価格で彼らの株を転売することができないかもしれない。
私たちの普通株が活発な取引市場を持っていない場合、投資家は彼らが支払いたい価格で、あるいは彼らが販売したい時間に彼らの普通株を売ることができないかもしれない。また、不活発な市場は、株を売却することで資金を調達する能力を弱める可能性があり、株を対価格として他社や技術を買収する能力を弱める可能性があり、逆に私たちの業務を損なう可能性がある。
私たち普通株の取引価格はずっと不安定で、変動し続ける可能性が高く、私たち普通株を購入した人は大きな損失を受ける可能性があります。
予測可能な未来に、私たちの株価はずっと変動し続ける可能性がある。一般的な株式市場、特にバイオテクノロジー会社の市場は極端な変動を経験しており、この変動は往々にしてある会社の経営業績とは無関係である。このような変動のため、投資家は彼らが支払った価格で普通株を売ることができないかもしれない。私たちの普通株の市場価格は多くの要素の影響を受けるかもしれません
67
景気後退、新冠肺炎の疫病、利上げとインフレ、金融サービス業に影響を与える不利な事態の発展、サプライチェーンの遅延と中断、アメリカ大統領政府の政策重点、貿易戦争、失業或いは政府の長期的な停止に対する懸念は変動性を激化させ、経済と市場への期待を低下させる可能性がある。また、地政学的問題への懸念は、市場の長期的な変動や不安定を招く可能性もある。例えば、ロシアとウクライナの間の紛争は、世界の市場と産業の混乱、不安定、変動を招く可能性がある。米国政府や他の管轄区域の政府はロシアとロシアの利益に対して厳しい経済制裁と輸出規制を実施し、ロシアをSWIFTシステムから除去し、より多くの制裁と制御を実施すると脅している。このような措置の影響と、このような措置に対するロシアの潜在的な反応は未知だ。
また、過去には、バイオテクノロジーや製薬会社の株式市場価格が変動した後、これらの会社の株主がこれらの会社に対して集団訴訟を起こしていた。私たちにこのような訴訟を提起すれば、巨額のコストが発生し、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちはナスダック資本市場の持続的な上場要求を満たすことができず、私たちの普通株が銘柄を取られる可能性があります。
もし私たちがナスダック資本市場(ナスダック)の持続的な上場要求、例えば会社管理要求や最低終値要求を満たすことができなければ、ナスダックは私たちの普通株を撤退させる措置を取るかもしれない。このような退市は、私たちの普通株の価格にマイナス影響を与える可能性があり、私たちの普通株の売却または購入を希望する時に私たちの普通株を売却または購入する能力を弱める可能性があります。退市事件が発生した場合、ナスダックの上場要求の遵守を回復する行動をとる予定ですが、私たちが取ったどのような行動も、私たちの普通株の再上場を許可し、市場価格を安定させたり、私たちの普通株の流動性を高めたり、私たちの普通株がナスダックの最低購入要求を割ってしまうことを防止したり、将来ナスダックの上場要求に合わないことを防止したりすることを保証することはできません。
私たちの既存株主の一部は私たちが発行した普通株のかなりの割合を持っているので、あなたが会社の事務に影響を与える能力は制限されます。
2023年6月30日現在、私たちの役員、役員、5%を超える株主は、私たちが発行した普通株の約21%を持っています。したがって、これらの人たちは一緒に行動して、私たちの管理やビジネスを制御することができ、私たちの株主に提出された承認の基本的なすべての事項は、取締役の選挙や罷免、および任意の重大な取引の承認を含むことができるかもしれない。このような所有権集中は、制御権の変更を遅延、遅延、または阻止する可能性があり、我々の合併、合併、買収または他の業務合併に関連することを阻害するか、または潜在的な買収者が買収要約を提出することを阻止するか、または他の方法で我々の業務に対する制御権を獲得しようと試みる可能性があり、たとえそのような取引が他の株主に利益をもたらすであろう。
もし私たちの株が細かい株規則に制約されたら、私たちの株を取引することはもっと難しくなるだろう。
アメリカ証券取引委員会はすでに規則を発表し、低価格株取引に関連する自営業行為を規範化した。細価格株は通常5ドル以下の株式証券であり、特定の国の証券取引所に登録されている証券は含まれていない
68
または、取引所またはシステムが、そのような証券取引に関する現在の価格および出来高情報を提供することを前提として、いくつかの自動見積システム上でのオファーを許可する。もし私たちがナスダック資本市場での上場を保留しなければ、もし私たちの普通株価格が5ドル以下であれば、私たちの普通株は細価格株とみなされます。細価株規則は、取引業者がこれらの規則に拘束されない細価格株取引を行う前に、特定の情報を含む標準化リスク開示文書を提出することを要求する。また、“細価格株規則”は、取引業者は、任意の細価格株の取引を行う前に、特に書面で当該細価格株が買い手の適切な投資項目であることを決定し、(I)買い手がリスク開示声明の書面確認を受けたこと、(Ii)細価格株の取引に関する書面合意、及び(Iii)署名及び明記された日付の書面妥当性声明の写しを受けなければならないと規定している。これらの開示要求は、二級市場での私たちの普通株の取引活動を減少させる可能性があるため、株主は彼らの株を売却することが困難かもしれない。
私たちは私たちの普通株に配当金を支払うつもりはありません。したがって、あなたが投資リターンを達成する能力は私たちの普通株価格の上昇にかかっています。
私たちは私たちの普通株に現金配当金を支払うことを発表したり、今は予測可能な未来にそうするつもりはない。私たちは現在、将来の収益を維持し、私たちの業務の発展、運営、拡張のために、予測可能な未来に、私たちはいかなる現金配当金も発表したり支払うことはないと予想しています。また、大力神信用手配は現在禁止されており、将来の任意の債務融資計画には、私たちの普通株が発表または支払い可能な配当を禁止または制限する条項が含まれている可能性がある。したがって、株主のどんな見返りもその株の増価に限定されるだろう。したがって、私たちの普通株株への投資の成功は私たちの普通株価値の未来の任意の付加価値にかかっているだろう。私たちの普通株の株が値上がりする保証はなく、私たちの株主が株を購入する価格が変わらない保証さえありません。
近い将来、私たちの普通株の大量の株が公開市場で販売される可能性があり、これは私たちの株価を押し下げるかもしれない。
公開市場で私たちの普通株を大量に売ることは私たちの普通株の現行市場価格を下げるかもしれません。基本的には,既存と行使可能な株式オプションおよび既存RSU決済時に発行可能な普通株のように,発行された普通株をすべて売却する資格がある.既存の株主が私たちの普通株の株を大量に売却したり、公開市場で既存の株主が普通株を売却する可能性があると考えたりすれば、私たちの普通株の市場価格は大幅に低下する可能性がある。既存の株主売却もまた、適切な時間と価格で追加的な株式証券を売却することを困難にする可能性があります。
私たちは小さな報告会社であり、より小さい報告会社に適用される報告要求が私たちの普通株の投資家に対する吸引力を低下させるかどうかを決定することはできません。
1934年の証券取引法第12 b-2条によると、我々は比較的規模の小さい報告会社である。私たちが比較的小規模な報告会社であり続ける限り、当社の定期報告書や依頼書における役員報酬に関する開示義務を削減することを含め、他の非小報告会社に適用される上場企業の様々な報告要件の免除を利用することができる。私たちは投資家が私たちが小さい報告会社の免除に依存する可能性があるために、私たちの普通株の吸引力が低下していることを発見する可能性があるかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株はそれほど活発ではない取引市場が出現する可能性があり、私たちの株価はもっと変動するかもしれない。
上場企業として、大幅なコスト増と経営陣への要求を招いている。
上場企業として、特に私たちが“小さな報告会社”でなければ、大量の法律、会計、その他の費用が発生しますが、これは私たちが個人会社としては起きていないことです。私たちは、改正された1934年証券取引法または取引法の報告要件を遵守しなければなりません。その中で、私たちは、私たちの業務および財務状況に関する年間、四半期、および現在の報告書をアメリカ証券取引委員会またはアメリカ証券取引委員会に提出することを要求します。また、サバンズ-オキシリー法案および米国証券取引委員会とナスダックが後にサバンズ-オクスリ法案の条項を実施するために採択された規則は、有効な情報開示と財務制御の確立と維持を要求し、コーポレートガバナンスのやり方を変更することを含む上場企業に重大な要求を提出した。また、2010年には“ドッド·フランクウォール街改革·消費者保護法案”、あるいは“ドッド·フランク法案”が公布された。テレス·フランク法案には重要な会社管理と役員報酬に関する条項があり、米国証券取引委員会はこれらの分野で“報酬発言権”や代理アクセスのような追加的な規則を取ることを要求している。株主急進主義、現在の政治環境、および現在の高度な政府介入と規制改革は、大量の新しい法規と開示義務を招く可能性があり、これは追加のコンプライアンスコストを招き、現在予見できない方法で業務を運営する方法に影響を与える可能性がある。
69
上場企業に適用されるルールや法規は、引き続き私たちの法律や財務コンプライアンスコストを大幅に増加させ、いくつかの活動をより時間的で高価にすることを予想しています。上場企業の規則が私たちの経営陣と従業員の注意を他の業務から移したら、私たちの業務、財務状況、経営結果は不利な影響を受ける可能性があります。上場企業の費用に関するコスト増加は私たちの純損失を増加させます。例えば、上場企業の規則は、取締役や高級管理者責任保険をより難しく、より高価にすることを難しくしており、そのコストは近年上昇し続けているため、同じまたは類似した保証範囲を維持するために大量のコストが発生する可能性がある。私たちは、私たちがこれらの要求に応答することによって生じるかもしれない追加コストの額や時間を予測または推定することができず、これらの追加コストの影響は、私たちの取締役会、取締役会委員会、または役員に参加する資格のある人を引き付け、維持することをより難しくするかもしれない。
もし私たちが未来に財務報告書に対して適切かつ有効な内部統制を維持することができなければ、私たちが正確かつ適時に財務諸表を作成する能力は損害を受ける可能性があり、これは私たちの経営業績、投資家の私たちに対する見方を損害し、それによって私たちの普通株の価値を損なう可能性がある。
サバンズ·オキシリー法404条によると、私たちの経営陣は財務報告書の内部統制に対する私たちの有効性を報告しなければならない。管理管理層は、財務報告の内部統制に達成しなければならない標準的なルールを評価するには複雑であり、大量の文書、テスト、可能な救済措置が必要である。取引法における報告会社としての要求を遵守し続けるためには、情報技術を含む我々のシステムのアップグレードと維持を継続すること、追加的な財務および管理制御、報告システムおよび手続きを実施および維持すること、およびより多くの会計および財務者を雇用することを要求される。また,我々の報告義務と効率的な内部制御を確保するためにソフトウェアやシステムベンダを含む第三者に依存し,これらの第三者が規模を拡大して我々の成長に対応できないことや,これらの増加した報告や内部制御プログラムを実施することを含む十分なサービスを提供できない場合には,システムのアップグレードや切替えにより大きなコストが発生する可能性があり,我々の業務は大きな影響を受ける可能性がある.
しかし、より小さい報告会社及び非加速申告会社として、私たちの独立公認会計士事務所は、“加速申告会社”または“大型加速申告会社”とみなされない限り、第404条に基づいて財務報告の内部統制の有効性を証明することを要求されないであろう
効果的な内部統制を確立し、維持できなければ、私たちの業務、財務状況、運営結果、またはキャッシュフローに大きな悪影響を及ぼす可能性があります。
私たちの発展に伴い、私たちはより多くの人員を雇用し、外部の一時的な資源を利用し、効果的な内部統制を維持するために政策と手続きを実施、記録、修正することが可能だ。しかし,我々は内部制御の欠陥や弱点を発見したり,それまでに発見された内部制御欠陥を修正することができない可能性がある.もし私たちの内部統制に重大な弱点や欠陥が存在し、発見または修復されていない場合、私たちの財務諸表は重大なエラー陳述を含む可能性があり、未来にこれらのエラー陳述が発見された場合、私たちは未来の報告義務を履行できず、私たちの普通株価格の下落を招く可能性がある。さらに、私たちは米国証券取引委員会や他の規制機関の制裁や調査を受ける可能性があり、追加の財務と管理資源が必要になるだろう。
証券や業界アナリストが我々の業務に不利な研究報告や報告を発表し続けなければ、私たちの株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は、証券または業界アナリストが発表した、私たちの業務、私たちの市場、または私たちの競争相手に関する研究と報告に部分的に依存するだろう。私たちの一人以上のアナリストを追跡して私たちの株式格付けを下げたり、私たちの業務に不利な研究や報告を発表したりすれば、私たちの株価は下落するかもしれません。これらのアナリストのうちの1人以上が私たちの追跡を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの株への興味が減少する可能性があり、これは私たちの株価や取引量を低下させる可能性がある。
70
私たちの定款書類やデラウェア州法律によると、反買収条項は私たちの買収をより困難にする可能性があり、これは私たちの株主に有利になる可能性があり、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止するかもしれません。
当社の会社登録証明書の改訂及び再記載の定款の条項は、私たちの買収や私たちの経営陣の変動を延期または阻止する可能性があります。これらの規定には
また、私たちはデラウェア州で登録されているので、私たちはデラウェア州会社法第203条の規定によって管轄されています。この条項は、私たちが発行した議決権株の15%以上の株主が私たちと合併または合併する能力を持つことを制限しています。これらの条項は,潜在的な買収者に我々の取締役会との交渉を要求することで,株主により大きな価値を得る機会を提供していると信じているが,我々の取締役会が拒否した要約が一部の株主から有益であると考えられていても,これらの条項は適用される.また、これらの規定は、株主が責任を持って私たちの経営陣に命じられた取締役会のメンバーを交代させることを難しくし、株主が現在の経営陣を交代または罷免しようとしていることを挫折または阻止する可能性がある。
71
当社の会社登録証明書および改訂·再記述の定款規定を再記述すると、デラウェア州衡平裁判所とアメリカ連邦地域裁判所は、私たちの株主とのほとんどの紛争の独占法廷となり、これは、私たちまたは私たちの役員、役員、または従業員との紛争において有利な司法フォーラムを得る株主の能力を制限する可能性があります。
我々が再記述した会社登録証明書は、デラウェア州衡平裁判所は、私たちを代表して提起された任意の派生訴訟または訴訟、受託責任違反を主張する任意の訴訟、デラウェア州会社法、当社の会社登録証明書、または私たちの定款に基づいて私たちにクレームを提起する任意の訴訟、または私たちの内部事務原則によって管轄されているクレームを提起する任意の訴訟の独占法廷である。この規定は、取引法に規定された義務または責任を執行するためのクレームにも適用されず、連邦裁判所が排他的管轄権を有する他のクレームにも適用されない。私たちが改正して再記述した付例は、米国連邦地域裁判所が証券法に基づいて提出された任意の訴因を解決するための独占的なフォーラムになるとさらに規定している。これらの裁判所条項の選択は、株主が司法裁判所において、私たちまたは私たちの役員、上級管理者、または他の従業員と紛争することに有利であると考えるクレームを提出する能力を制限し、このような訴訟を阻止する可能性がある。また,他社の会社登録証明書や定款で類似した場所条項を選択する実行可能性が法的手続きで疑問視されており,裁判所はこれらのタイプの条項が適用されないか実行不可能であると考える可能性がある。デラウェア州裁判所は、このような選択された裁判所条項が事実上有効であることを決定しているが、株主は、専属裁判所条項が指定された場所以外の場所でのクレームを求めることができ、これらの規定がこれらの他の法域の裁判所によって実行されることを保証することはできない。もし裁判所が私たちが改正して再記載した会社登録証明書に含まれる排他的フォーラム条項が訴訟で適用されないか、または実行できないことを発見した場合、私たちは他の管轄区域でこのような訴訟を解決することに関連する追加費用が発生する可能性があり、これは私たちの業務を損なう可能性がある。
私たちの業務は維権株主の行動によって否定的な影響を受けるかもしれない。
ここ数年間、バイオテクノロジー産業の多くの会社に対して代理権競争が開始された。私たちの株価の変動により、私たちは特に維権株主の影響を受けやすいかもしれない。依頼書競争や他のタイプの株主急進主義に直面すれば、競争や紛争にうまく対応できない可能性があり、私たちの業務を乱すことになります。私たちが成功しても、私たちの業務は、私たちまたは私たちのパートナーに関する代理権競争や株主紛争の悪影響を受ける可能性があります
このような行動は私たちの株価の一定期間の変動を招くかもしれない。
72
項目2.未登録持分販売Y証券と収益の使用。
ない。
第3項.違約高級証券です。
ない。
4つ目:地雷の安全TYが披露する。
適用されません。
項目5.その他情報です。
ない。
73
プロジェクト6.実行ヒビスです。
展示品 番号をつける |
|
説明する |
|
|
|
3.1 |
|
再申告された登録者登録証明書(登録者として2014年5月7日に提出された8−Kフォームの現在の報告書の添付ファイル3.1が提出され、参照によって本明細書に組み込まれる)。 |
|
|
|
3.2 |
|
登録者規約(登録者として2020年5月1日に提出された8−K表の現在の報告書の添付ファイル3.1が改正および再改訂され、引用によって本明細書に組み込まれる)。 |
|
|
|
10.1 |
|
Aldeyra Treateutics,Inc.2023年株式インセンティブ計画,オプションプロトコルのフォーマット,およびその下のRSUプロトコルのフォーマット. |
|
|
|
31.1 |
|
2002年のサバンズ·オクスリ法案第302条の要求に基づき、首席執行幹事証明書が発行された。 |
|
|
|
31.2 |
|
2002年のサバンズ·オキシリー法第302条の要求に基づき、首席財務·会計幹事証明書が発行された。 |
|
|
|
32.1 |
|
2002年のサバンズ·オクスリ法案第906条の要求に基づき、最高経営責任者と臨時最高経営責任者を証明する。 |
|
|
|
101.INS |
|
連結されたXBRLインスタンス文書-インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルには表示されない
|
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
101.カール |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
101.def |
|
インラインXBRL分類拡張Linkbase文書を定義する |
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
101.Pre |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
104 |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
航空会社の給与スケジュール。
本10-Qフォーム四半期報告書に添付されている添付ファイル32.1認証は、米国証券取引委員会に提出されたものとはみなされず、引用によってAldeyra Treeuticsに組み込まれてはならず、Inc.は、この文書に含まれる任意の一般的な登録言語にかかわらず、1933年証券法(改訂本)または1934年証券取引法(改訂本)に従って提出された任意の文書に基づいて作成されてはならない。
74
標札すきま
1934年の証券取引法の要求によると、登録者はすでに正式に本報告を正式に許可した署名者がそれを代表して署名することを促した。
|
|
Aldeyra治療会社は |
|
|
|
2023年8月3日 |
|
/S/トッド·C·ブレイディ医学博士 |
|
|
トッド·C·ブレイディ医学博士博士です |
|
|
最高経営責任者 |
|
|
(首席行政主任) |
|
|
|
|
|
Aldeyra治療会社は |
|
|
|
2023年8月3日 |
|
/S/ブルース·グリーンバーグ |
|
|
ブルース·グリーンバーグ |
|
|
財務総監上級副社長、臨時首席財務官 |
|
|
(首席財務官および首席会計 (税関職員) |
75