
Chimerixコーポレートプレゼンテーション(2023年8月3日)

2 将来の見通しに関する記述このプレゼンテーションには、1995年の民間証券訴訟改革法の意味における将来の見通しに関する記述が含まれています。これらの記述はリスクと不確実性の影響を受けやすく、実際の結果が予測と大きく異なる可能性があります。将来の見通しに関する記述には、とりわけ、第3相ACTION試験の成功確率、ONC201のNDAの申請と承認の可能性、およびその後の商業的機会、ONC206の用量漸増中に観察された単剤療法によるX線部分反応の影響、臨床所見と前臨床所見を再現する能力、および将来のデータ読み上げの資金とタイミングに関する予測に関する記述が含まれます。実際の結果が将来の見通しに関する記述に示されているものと大きく異なる原因となる可能性のある要因とリスクの中には、ONC201のフェーズ3アクション試験の時期、完了、および結果に関連するリスク、以前の前臨床試験または臨床試験で得られた肯定的な結果を将来の研究で繰り返すことに関連するリスク、ONC206の臨床開発に関連するリスク、および当社が証券取引委員会に提出した書類に記載されている追加リスクがあります。これらの将来の見通しに関する記述は、本リリースの日付における当社の判断を表しています。ただし、当社は、これらの将来の見通しに関する記述を更新する意図や義務を一切負いません。

3つの投資のハイライト • 有効な治療法の選択肢がない末期疾患 • 神経腫瘍学コミュニティにおけるプログラムに対する高い認知度 • 少なくとも2037年までの米国特許独占権 • 最初の適応症だけで約7億5000万ドルの世界的な収益が見込まれる• 困難な治療状況における単剤の活性を分離することを目的とした第2相試験 • OSやその他の形態の臨床的利益に関連する持続的な反応 • 多数の独立した自然病歴研究が潜在的な生存優位性を支える • 遺伝的に選択された患者の人口を制限している異質性 • リーダーシップチームが大規模な研究と規制当局の承認に成功しました • 強固な貸借対照表は、アクションスタディと潜在的なONC206触媒に充てられています • 希釈不要のTEMBEXAのマイルストーンとロイヤルティを継続できる機会があるため、柔軟性が高まります • 価値を捉える道筋の確立における客観性の実績、ONC201の第3相アクションスタディの商業的可能性に対する障壁が低い。企業能力と財務上の柔軟性
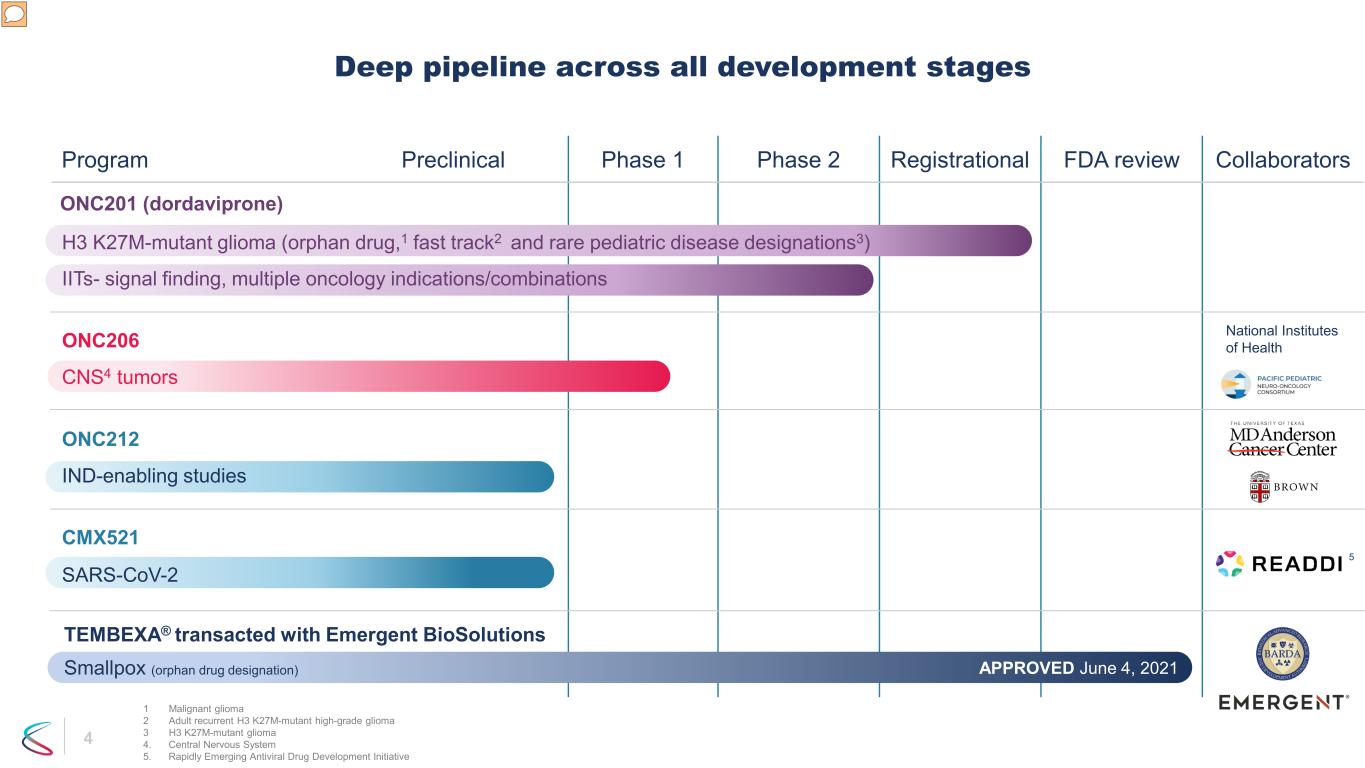
4 プログラム前臨床フェーズ 1 フェーズ 2 登録 FDA 審査協力者 ONC201 (ドルダビプロン) H3 K27M変異グリオーマ (希少疾病用医薬品1、ファストトラック2、希少小児疾患指定3) IIT-シグナル探索、複数の腫瘍学の適応/組み合わせ CMX521 SARS-CoV-2 CNS4 腫瘍 ONC206 IND-D エマージェント・バイオソリューションズ天然痘(希少疾病用医薬品指定)と取引されたONC212 TEMBEXA®(希少疾病用医薬品指定)、2021年6月4日承認済み、5件の国立衛生研究所、1件の悪性グリオーマ、2件の成人再発H3 K27M変異型高悪性度グリオーマ3 H3 K27M変異型グリオーマ 4.中枢神経系 5.急速に発展している抗ウイルス薬開発イニシアチブ

ONC201(ドルダビプロン)第2相有効性分析
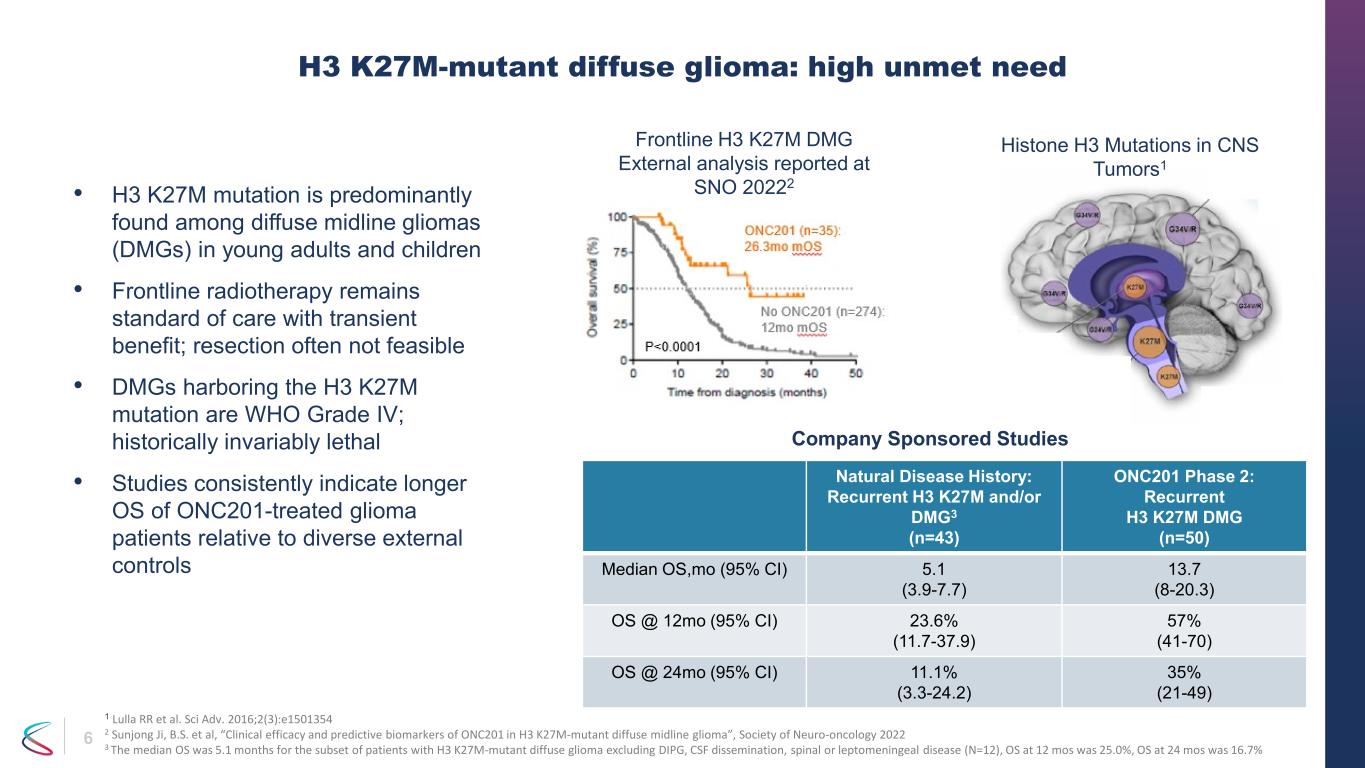
6 • H3 K27M変異は、主に若年成人と小児のびまん性正中線グリオーマ(DMG)に見られます。• 最前線の放射線療法は依然として一過性の有益性を伴う標準治療です。切除できないことが多い• H3 K27M変異を宿すDMGはWHOグレードIVで、歴史的に致死率が高いことが研究で一貫して示されています。多様な外部コントロールに関連する患者 H3 K27M変異型びまん性グリオーマ:満たされていないニーズが高い自然疾患の病歴:再発性H3 K27Mおよび/またはDMG3(n=43)ONC201フェーズ 2:再発性H3 K27M DMG(n = 50)OSの中央値、mo(95%CI)5.1(3.9-7.7)13.7(8-20.3)OS @ 12mo(95%CI)23.6%(11.7-37.9)57%(41-70)OS @ 24mo(95%CI)11.1%(3.3-24.2)35%(21-49)中枢神経系腫瘍におけるヒストンH3変異1社主催研究 1 Lulla RRら。Sci Adv. 2016; 2 (3): e1501354 2 Sunjong Ji, B.S. ら、「H3 K27M変異型びまん性正中線グリオーマにおけるONC201の臨床的有効性と予測バイオマーカー」、神経腫瘍学会 2022 3 DIPGを除くH3 K27M変異型びまん性グリオーマの患者のOS期間中央値は5.1か月でした。、CSF拡散、脊髄または軟髄膜疾患(N = 12)、12か月でのOSは25.0%、24か月のOSは16.7%でした。最前線のH3 K27M DMG外部分析はSNO 2022で報告されました。

7 • ONC201単剤療法は、再発性H3 K27M変異DMGに対して持続的で臨床的に有意な有効性を示しました-RANO HGGおよび/またはLGGデュアルリーダーBICRによる総奏効率(ORR)は 30%(95%CI:18-45%)-デュアルリーダーBICRによるRANO-HGG基準 • ORR 20%(95%CI:10 — 34%)•奏効期間の中央値(DOR)11.2か月(95%CI:3.8 —達していない)•応答までの中央値8.3か月(1.9〜15.9の範囲)•疾病コントロール率40%(95%CI:26〜55%)• 6か月のPFS(95%CI:21〜49%); 12か月目のPFS 30%(95%CI:17〜44%)-以下によって評価されたRANO-LGGの基準デュアルリーダーBICR • ORR 26%(95%CI:15〜40%)-全生存期間 •12か月:57%(95%CI:41-70%)•24か月:35%(95%CI:21〜49%)•パフォーマンスステータスの改善とコルチコステロイド使用の減少 •スポンサーがONC201に関連しないと見なしたすべてのSAEは、再発H3 K27におけるONC201の第2相有効性 DMG

8 目的 • 再発H3 K27M変異型びまん性正中線グリオーマにおけるONC201の単剤療法の有効性を評価すること • 年齢が2歳以上で、ONC006、ONC013、ONC014、ONC016、またはONC018の研究でONC201を受けた • H3 K27M変異が知られており、脳の正中線構造が関与しているびまん性グリオーマ • RANO-高悪性度グリオーマ(HGG)基準による造影増強脳MRIの進行性かつ測定可能な疾患 • 少なくとも放射線による事前治療 • ONC201の初回投与前の洗浄:-放射線:90日-テモゾロミド:23日/抗体(例:ベバシズマブ)):42日/その他の抗がん療法:28日間 •ベースラインパフォーマンスステータス ≧60 •ベースラインスキャンの少なくとも3日前にコルチコステロイドが安定しているか減少している • 除外:DIPG、原発性脊髄腫瘍、非定型および非星状細胞性ヒスト、軟髄膜拡散、CSF拡散、FDAに準拠した第2相有効性分析の基準で分離します ONC201シングルエージェントアクティビティ
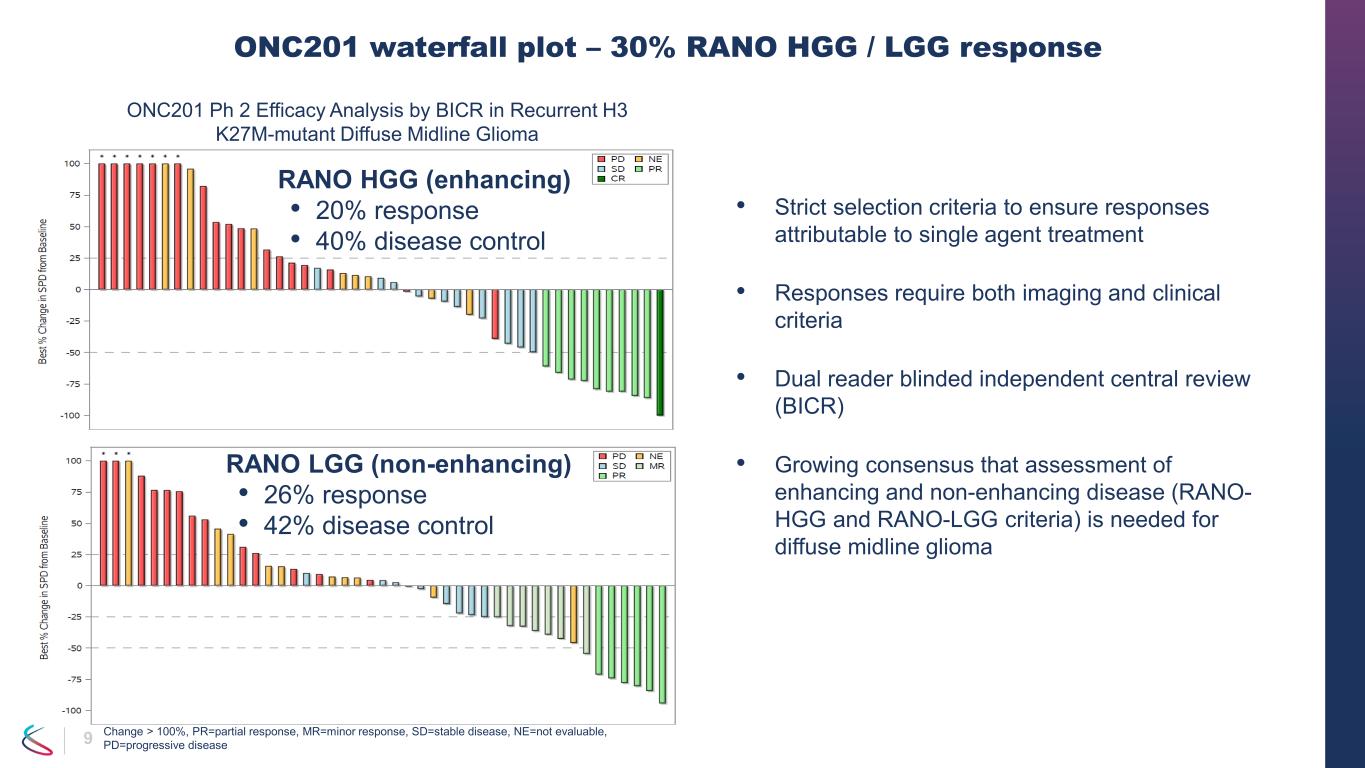
9 • 単剤治療に起因する奏効を確保するための厳格な選択基準 • 奏効には画像検査と臨床基準の両方が必要 • 二重読者盲検独立中央レビュー(BICR)• びまん性正中線グリオーマには増悪性疾患と非増強性疾患(RANO-HGGおよびRANO-LGG基準)の評価が必要であるというコンセンサスが高まっています。ONC201ウォーターフォールプロット — 30% RANO HGG/LGG反応 RANO HGG(強化)• 20% の奏効率 • 40% の疾患コントロールRANO LGG(非増強)• 26% の奏効率 • 42% の疾患コントロールONC201 Ph 2再発性Hに対するBICRによる有効性分析3 K27M変異型びまん性正中線グリオーマの変化 > 100%、PR=部分奏効、MR=軽微な反応、SD=病勢が安定、NE=評価できない、PD=進行性疾患
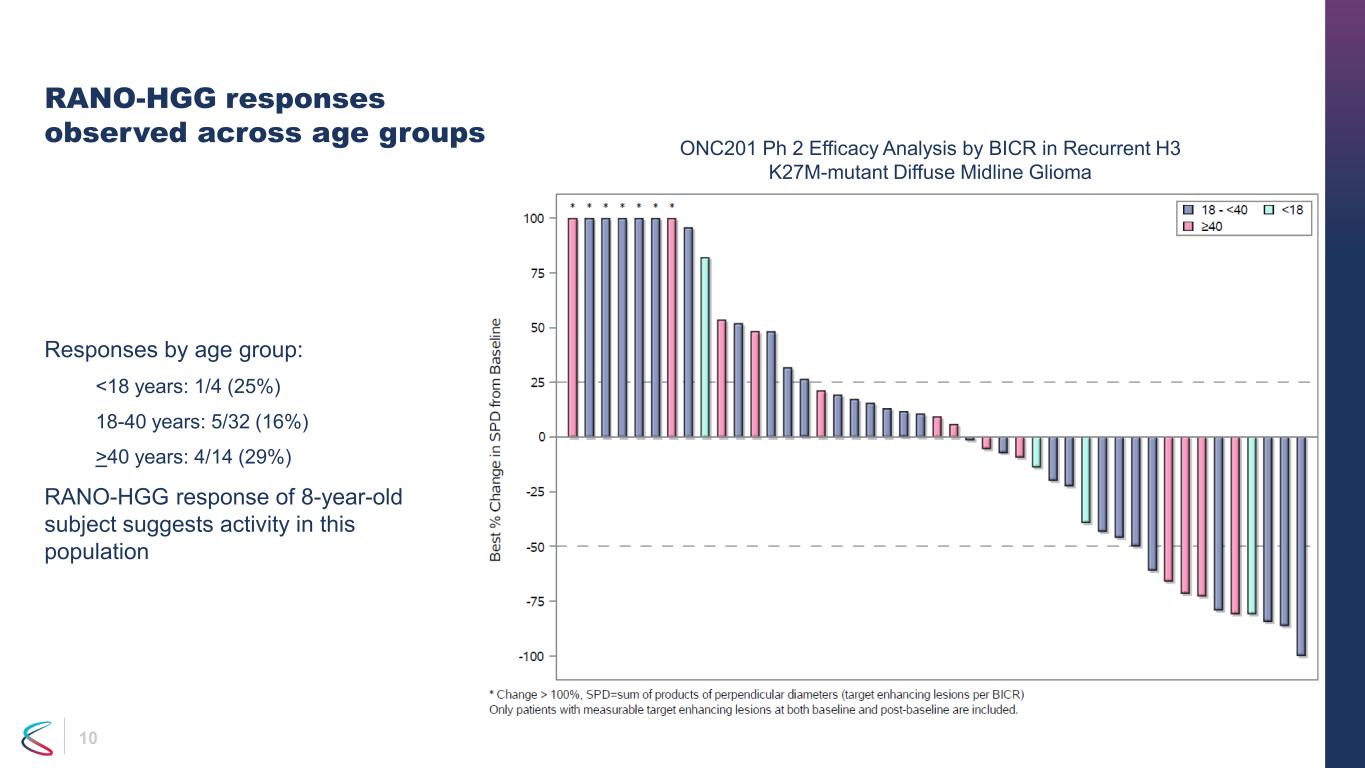
年齢層全体で10件のRANO-HGG反応が観察されました。年齢層別の回答:40歳:4/14(29%)8歳の被験者のRANO-HGG反応は、この集団における活性を示唆しています。ONC201 Ph 2の再発H3 K27M変異型びまん性正中線グリオーマにおけるBICRによる有効性分析は、この集団における活性を示唆しています。
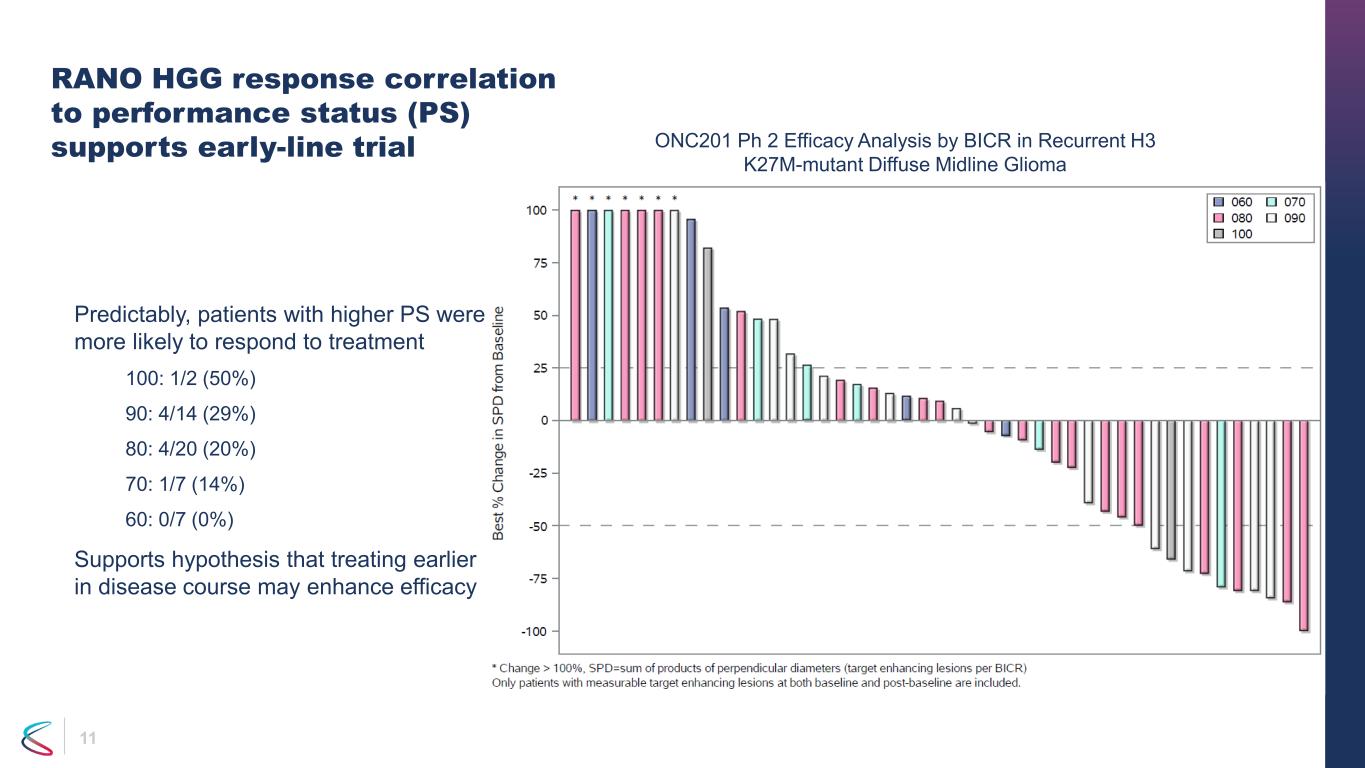
11 RANO HGGの反応とパフォーマンスステータス(PS)の相関関係が初期の試験を裏付けています。予想通り、PSが高い患者は治療に反応する可能性が高くなりました。100:1/2(50%)90:4/14(29%)80:4/20(20%)70:1/7(14%)60:0/7(0%)は、疾患経過の早い段階で治療することで有効性が向上する可能性があるという仮説を支持しています。ONC201 Ph2有効性分析再発性H3 K27M変異型びまん性正中線グリオーマのBICRによる
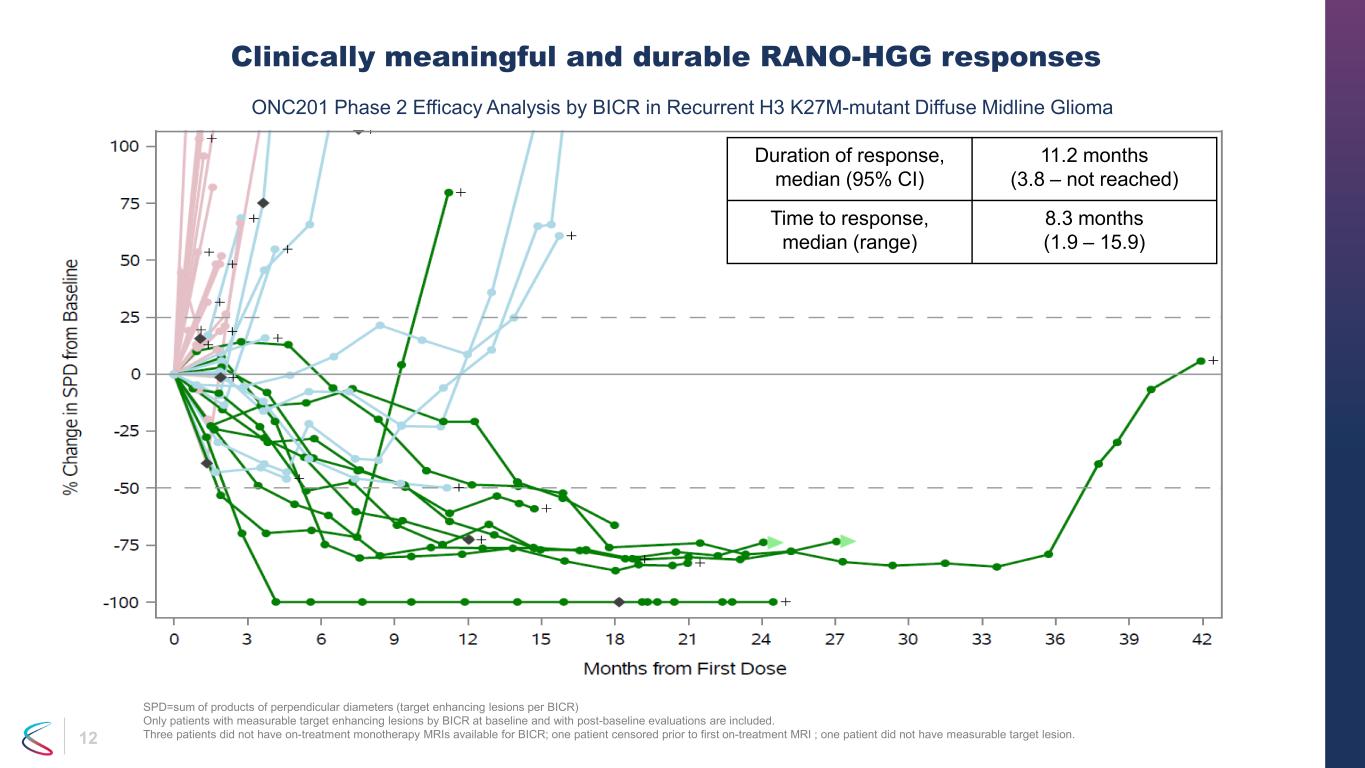
12 臨床的に有意で持続的なRANO-HGG反応SPD=垂直直径の積(BICRあたりの標的増強病変)の合計です。ベースライン時にBICRで測定可能な標的増強病変があり、ベースライン後の評価を受けた患者のみが含まれます。3人の患者はBICRで利用できる治療中の単剤療法MRIを受けていませんでした。1人の患者は最初に治療を受けるMRIの前に検閲を受け、1人の患者には測定可能な標的病変がありませんでした。奏効期間、中央値(95%CI)11.2か月(3.8 —達していない)、奏効までの時間の中央値(範囲)8.3か月(1.9〜15.9)再発H3 K27M変異型びまん性中線グリオーマにおけるBICRによるONC201第2相有効性分析
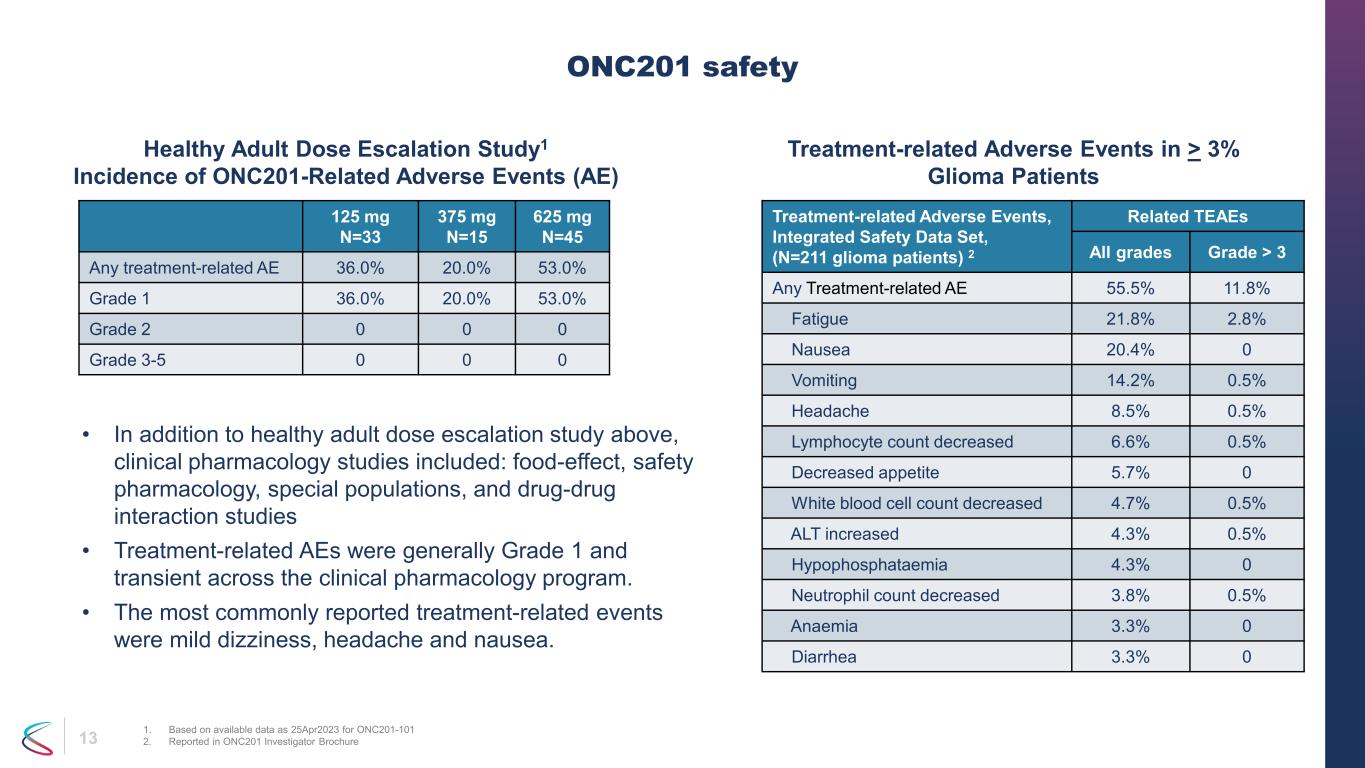
13件の治療関連の有害事象、統合安全性データセット、(N=211人の神経膠腫患者)2件の関連TEAE 全グレード > 3 任意の治療関連AE 55.5% 11.8% 疲労 21.8% 2.8% 吐き気 20.4% 0 嘔吐 14.2% 0.5% 頭痛 8.5% リンパ球数減少 6.6% 0.5% リンパ球数減少 6.6% 0.5% 食欲減少 5.7% 0 白血球数 4.7% 0.5% ALT増加 4.3% 0.5% 低リン酸血症 4.3% 0 好中球数は 3.8% 0.5% 減少貧血 3.3% 0 下痢 3.3% 0 ONC201安全性 1.ONC201-101 2の2023年4月25日現在に入手可能なデータに基づいています。ONC201の研究者向けパンフレットで報告されています。健康成人用量漸増研究1、3%を超える神経膠腫患者におけるONC201関連の有害事象(AE)治療関連の有害事象の発生率 • 上記の健康な成人の用量漸増研究に加えて、臨床薬理学の研究には、食品効果、安全性薬理学、特殊集団、薬物間相互作用研究などが含まれていました。• 治療関連のAEは一般的にグレード1で、臨床薬理学プログラム全体で一過性でした。最も一般的に報告された治療関連イベントは、軽度のめまい、頭痛、吐き気でした。125 mg N=33 375 mg N=15 625 mg N=45 あらゆる治療関連AE 36.0% 20.0% 53.0% グレード 1 36.0% 20.0% 53.0% グレード 2 0 0 0 グレード 3-5 0 0
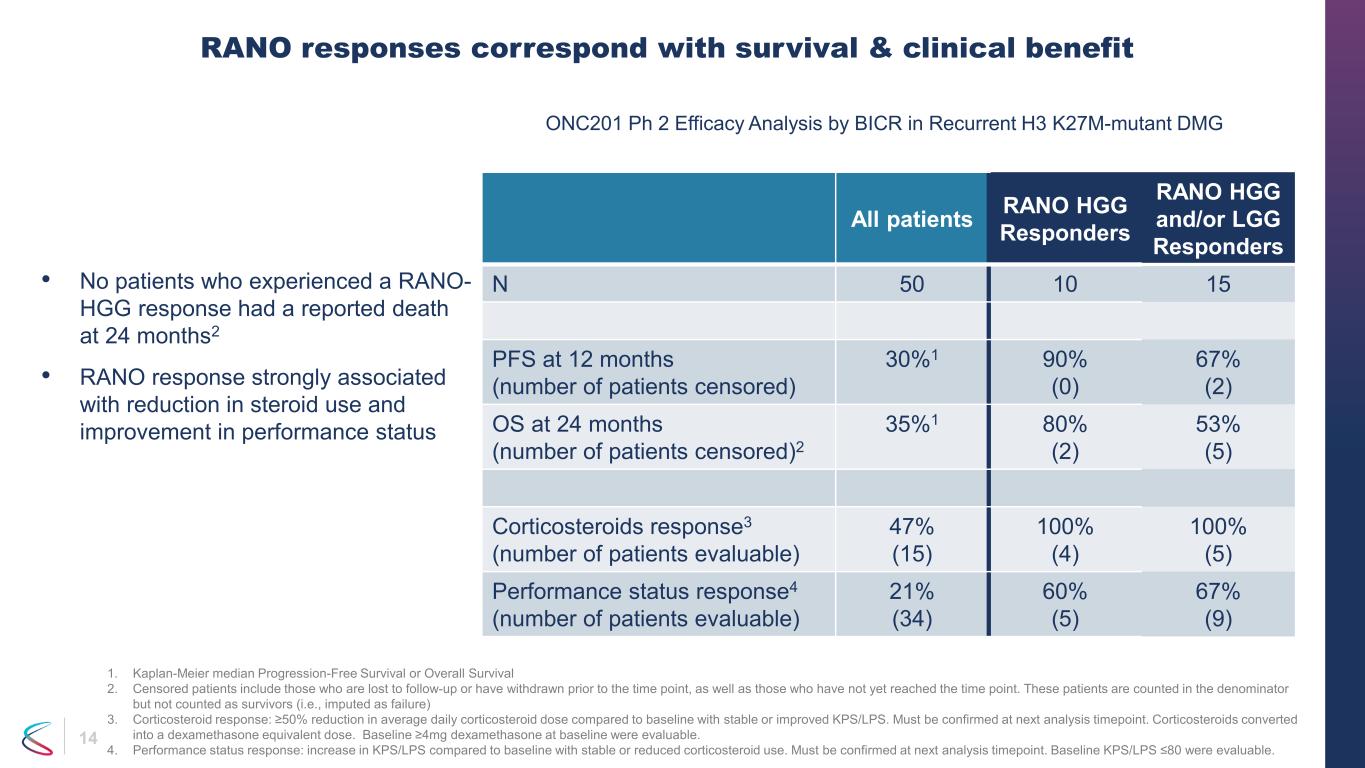
14 すべての患者 RANO HGG レスポンダー RANO HGGおよび/またはLGG Responders N 50 10 15 PFS(検閲された患者数)(検閲された患者数)(検閲された患者数)30% 1 90%(0)67%(2)24ヵ月でのOS(検閲された患者数)2 35% 1 80%(2)53%(5)コルチコステロイド反応3(評価可能な患者数)47%(15)100%(4) 100% (5) パフォーマンスステータス応答4 (評価可能な患者数) 21% (34) 60% (5) 67% (9) RANOの回答は、生存率と臨床的有益性1と一致します。カプラン・マイヤー無増悪生存期間の中央値または全生存期間は2です。検閲対象の患者には、フォローアップができなかったり、その時点より前に離脱した患者や、まだその時点に達していない患者が含まれます。これらの患者は、分母では数えられますが、生存者としてはカウントされません(つまり、障害として帰属)3。コルチコステロイド反応:ベースラインと比較して、1日の平均コルチコステロイド投与量が50%以上減少し、KPS/LPSが安定または改善しました。次の分析時に確認する必要があります。コルチコステロイドはデキサメタゾンと同等の用量に変換されました。ベースライン時のデキサメタゾン4mg以上が評価可能でした。4.パフォーマンスステータスへの対応:コルチコステロイドの使用が安定または減少した場合、ベースラインと比較してKPS/LPSが増加します。次の分析時に確認する必要があります。ベースラインのKPS/LPS ≤80は評価可能でした。再発性H3 K27M変異型DMGにおけるBICRによるONC201 Ph2の有効性分析 • RANO-HGG反応を経験した患者で24か月で死亡が報告された人はいません2 • RANO反応は、ステロイド使用の減少とパフォーマンスステータスの改善と強く関連しています
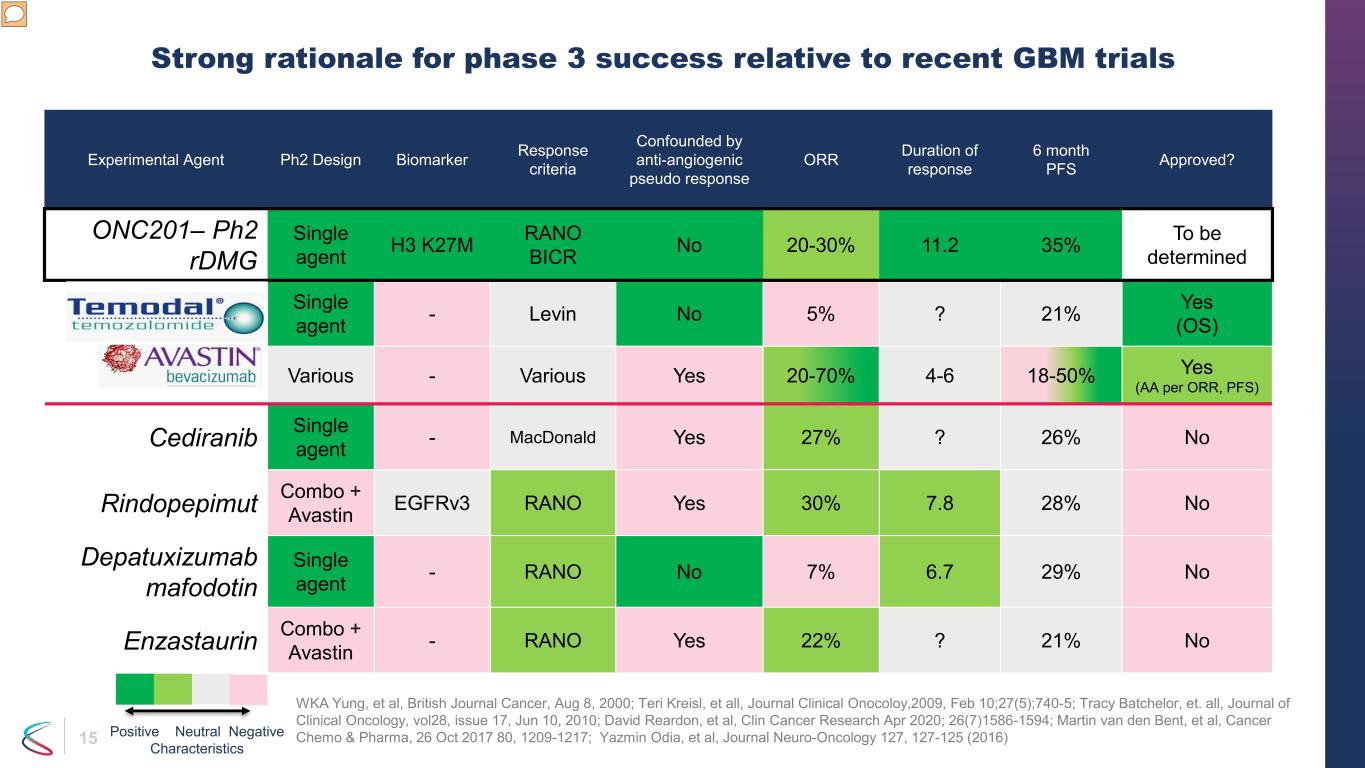
15. 実験薬、Ph2設計、バイオマーカーの反応基準、抗血管新生疑似反応と混同されます。ORR 奏効期間:6ヶ月、PFSは承認されましたか?ONC201—Ph2 RdMg単剤H3 K27Mラノ BICR番号 20-30% 11.2 35% 未定テモゾロミド単剤-レビン番号 5%?21% はい(OS)ベバシズマブ各種-いろいろはい 20-70% 4-6 18-50% はい(ORRごとのAA、PFS)セディラニブ単剤-マクドナルドはい 27%?26% リンドペピムットコンボ+アバスチンeGFRv3 RANOはい 30% 7.8 28% デパツキシズマブなしマフォドチン単剤-RANOいいえ 7% 6.7 29% エンザスタウリンコンボ+アバスチン-ラノはい 22%?21% 最近のGBM試験と比較して、フェーズ3の成功の確固たる根拠はありません。WKA Yungら、ブリティッシュ・ジャーナル・キャンサー、2000年8月8日、テリ・クライスル他、Journal Clinical Onocoloy,2009、2月10日、27(5); 740-5; トレイシー・バチェラー他、臨床腫瘍学ジャーナル、第28巻、17号、6月10日、2010; デビッド・リアドンら、クリン・キャンサー・リサーチ 2020年4月26(7)1586-1594; マーティン・ヴァン・デン・ベント他、キャンサー・ケモ&ファーマ、2017年10月26日 80、1209-1217; ヤズミン・オディア他、ジャーナルニューロオンコロジー127、127-125(2016)

ONC201フェーズ3アクションスタディのまとめ
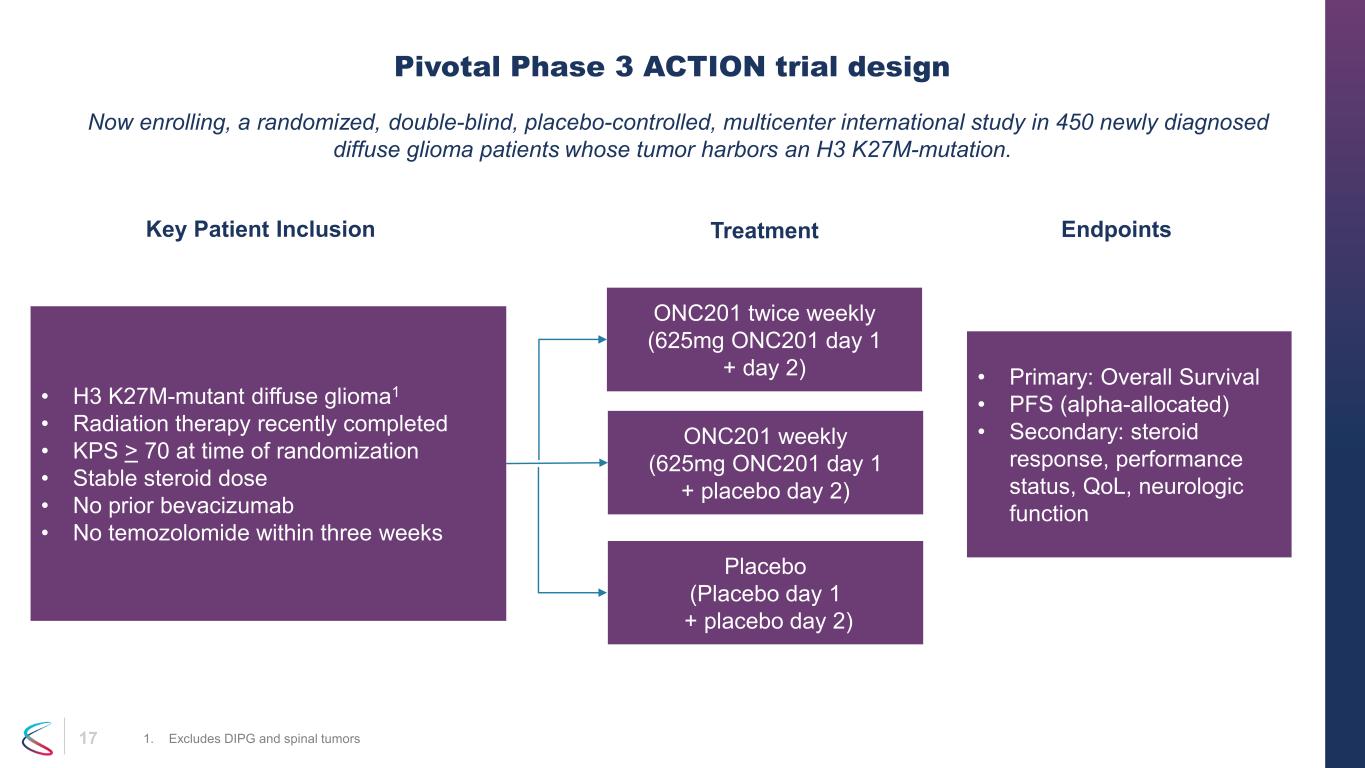
17 現在、腫瘍にH3 K27M変異が認められたびまん性グリオーマと新たに診断された450人を対象とした、無作為化二重盲検プラセボ対照多施設国際研究を登録しています。ピボタルフェーズ 3 アクショントライアル、デザイン 1.DIPGと脊髄腫瘍を除く • H3 K27M変異型びまん性グリオーマ1 • 最近完了した放射線療法 • KPS > ランダム化時に70 • ステロイド用量が安定しています• ベバシズマブの投与なし • 3週間以内にテモゾロミドを投与しませんでした • ONC201 週間に2回(625mg ONC201 1日目+ 2日目)ONC201週に(625mg ONC201 1日目+ プラセボ1日)2)プラセボ(プラセボ 1日目+ プラセボ2日目)• 原発性:全生存期間 • PFS(アルファ配分)• 二次:ステロイド反応、パフォーマンスステータス、QoL、神経機能、主要な患者インクルージョンエンドポイント/治療
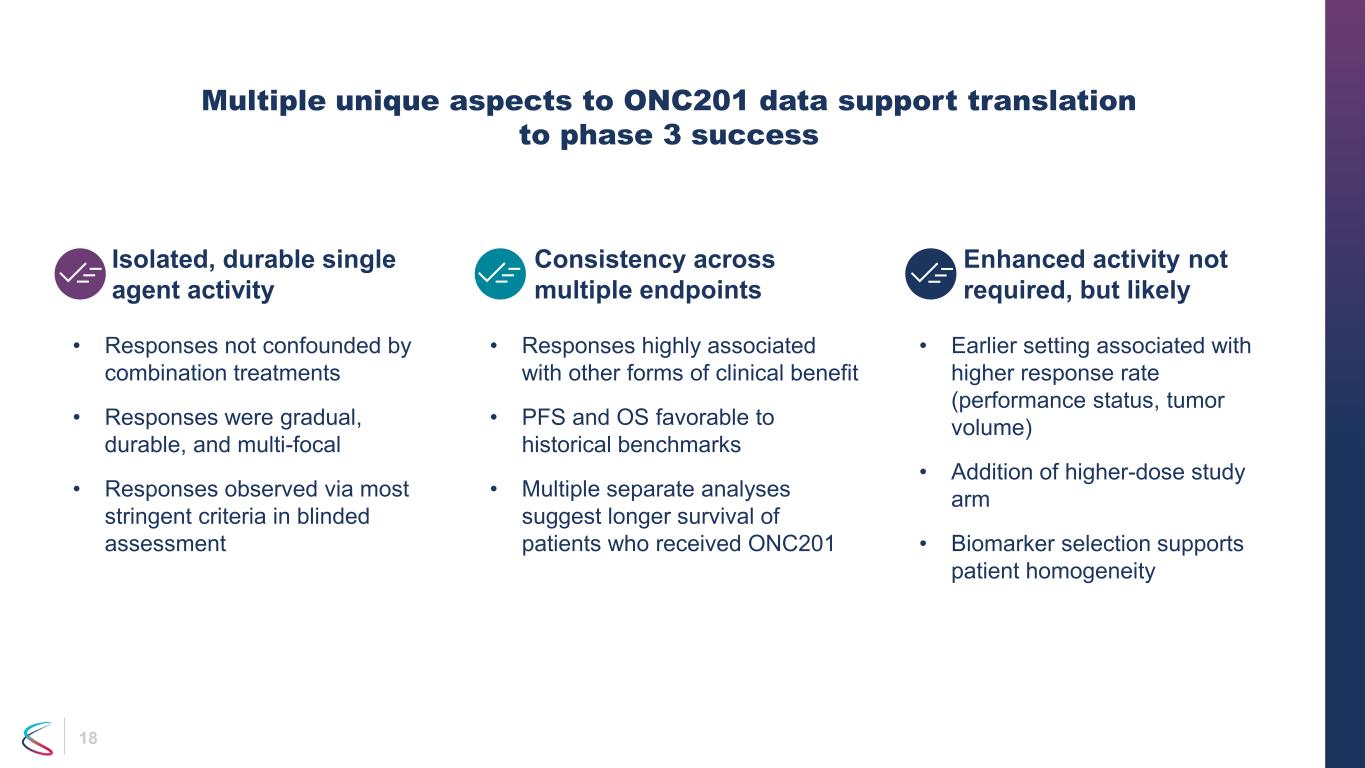
18 ONC201データには、第3相の成功につながる複数のユニークな側面があります。分離された持続性のある単剤活性。複数のエンドポイントでの活性の向上は必要ありませんが、可能性は高いです。• 反応は併用療法によって混乱することはありませんでした。• 奏効は徐々で、持続し、多巣性でした。• 盲検評価で最も厳しい基準で奏効が観察されました • 初期設定により奏効率が上がりました(パフォーマンスステータス、腫瘍量)•高用量研究群の追加 •バイオマーカーの選択患者の均質性をサポートします • 反応他の形態の臨床的有益性と高い関連性があります • PFSとOSは過去のベンチマークよりも有利です • 複数の個別の分析により、ONC201を受けた患者の生存期間が長いことが示唆されています

19 デザインは、成功への複数の道筋を提示しています。2025年初頭に予定されている暫定データと2026年の第2OS暫定データ • 約246件のイベント • HR=0.64最終OSでの成功 • 約327件のイベント • RANO HGGによるHR=0.73 PFSでの成功 (2) • 約286件のイベント • HR=0.68での成功 1.全生存期間(OS)2.無増悪生存(PFS)。PFSは、規制に関する議論に役立つデータを提供するかもしれません。3.各ONC201アームと対照のハザード比は、各時点で独立して比較されます。原動力の仮定は、OSの場合は0.65の予想時間、PFSの最初のOSの場合は0.60の予想時間(1)暫定•約164イベント •人事での成功(3)=0.52
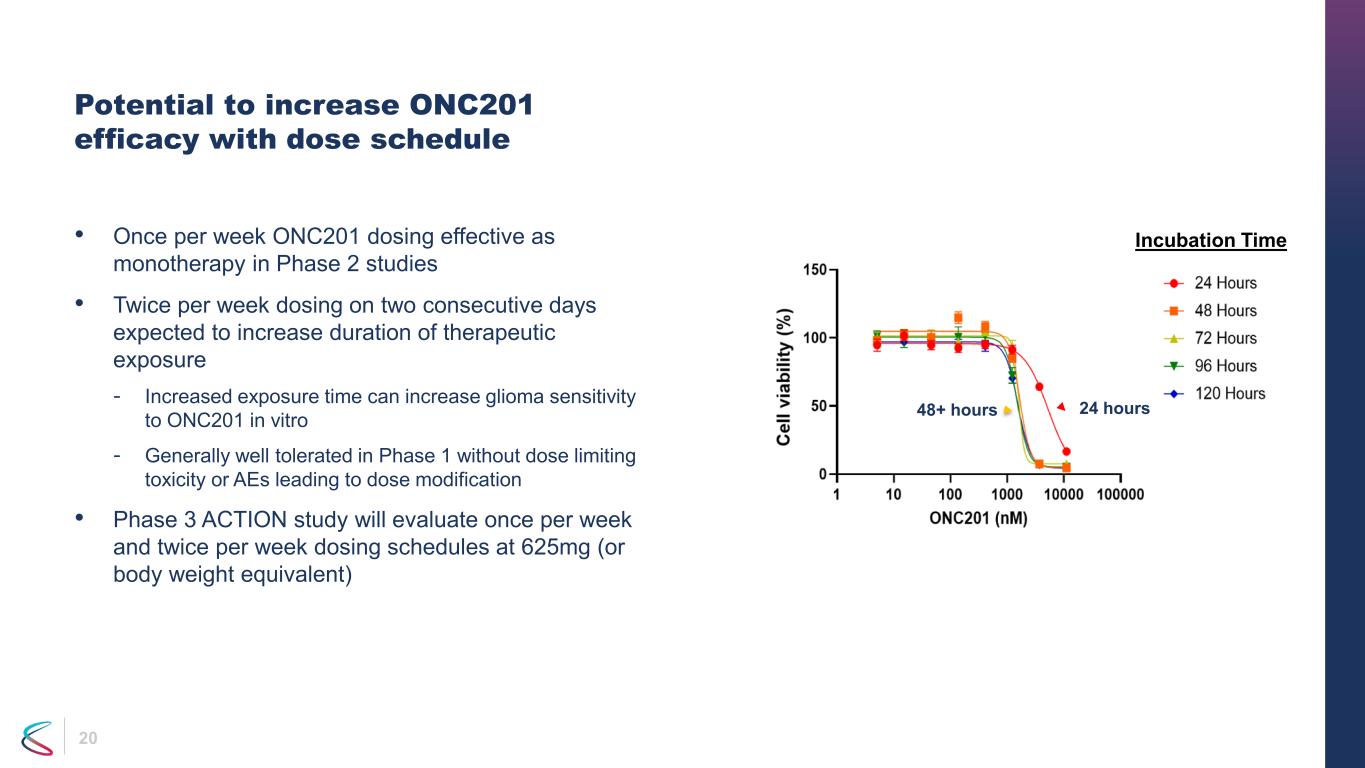
20 投与スケジュールによりONC201の有効性を高める可能性 •第2相試験では週1回のONC201投与が単剤療法として有効 •週2回の連続投与により治療的曝露期間の延長が見込まれます。-曝露時間が長くなると、体外でのONC201に対する神経膠腫の感受性が高まります。-フェーズ1では、用量制限毒性や用量変更につながるAEがなく、一般的に耐容性が良好です。第3相ACTION試験では、週に1回評価し、週に2回、625mg(または体重相当量)の投与スケジュール、24時間48時間以上のインキュベーション時間

ONC201市場機会評価

22 (1) オストロムQT、他神経腫瘍。2022; 24(補足5):v1-v95;(2)患者数とパーセンテージは、(2012-2023)の文献レビューから導き出された推定値(サンプルサイズあたりの加重平均)です:(Aihara K, et al.ニューロオンコール。2014; 16 (1): 140-6; Feng J、他ハムパトール。2015; 46 (11): 1626-32; ソロモンDA、他脳病変。2016; 26 (5): 569-80; Ryall S、他アクタ・ニューロパトール・コミューン。2016; 4 (1) :93; アボリアン多発性硬化症、他AJNR Am J ニューロラジオール。2017; 38 (4): 795-800; Wang L、他ハムパトール。2018; 78:89-96; Castel D、他アクタ・ニューロパトール・コミューン。2018; 6 (1): 117; Karremann M, et al.神経腫瘍。2018; 20 (1): 123-131; アボリアン多発性硬化症、他AJNR Am J ニューロラジオール。2019; 40 (11): 1804-1810; Dorfer C、他アクタ・ニューロキル(ウィーン)。2021; 163(7):2025-2035; シーバーズP、他神経腫瘍。2021; 23(1):34-43; マッカイA、他がん細胞。2017; 32 (4): 520-537 e5; フアン・T、他オンコターゲット。2018; 9 (98): 37112-37124; シュレックKC、他J ニューロンコール。2019; 143 (1): 87-93; 千葉健一他世界脳神経外科。2020; 134:e530-e539; ムカサ・A、他神経腫瘍。2014; 16(補足3):iii9-ii10; キャッスルD、他アクタニューロパトール。2015; 130 (6): 815-27; Khuong-Quang DA、他アクタ・ニューロパトール。2012; 124 (3): 439-47; ルー・A、他神経腫瘍。2020; 22(8):1190-1202; ジャニャコーヴォ M、他チャイルズ神経系。2020; 36 (4): 697-704; ウー・ジー他ナット・ジェネット。2014; 46 (5): 444-450; ウー・ジー他ナット・ジェネット。2012; 44 (3): 251-3; テイラーKR、他Nat Genet。2014; 46 (5): 457-461; サラツィスAM、他アクタ・ニューロパトール。2014; 127(6):881-95; エルカー・C、他神経腫瘍。2022; 24(1):141-152; ブツコヴィッチP、他アクタ・ニューロパトール。2014; 128 (4): 573-81; Daoud EV、他J Neuropathol Exp Neurool. 2018; 77 (4): 302-311; Chai RC, et al.アクタ・ニューロパトール・コミューン。2020; 8 (1) :40; Yi S, et al.脳神経外科。2019; 84 (5): 1072-1081; ジェッシ・M、他アクタ・ニューロパトール。2015; 130 (3): 435-7; Alvi MA、他モッド・パトール。2019; 32 (9): 1236-1243; クロッティ・イー他J ニューロロンコール。2020; 148(3):607-617; ドノA、他J・クリン・ニューロサイエンス。2020; 82(Pt A):1-8; アキンデューロOO、他J Neurosurg Spine。2021; 35 (6): 834-843; 中田S、他脳腫瘍の病原性。2017; 34 (3): 113-119; 野村M、他アクタニューロパトール。2017; 134(6):941-956; エシュバッハーKL、他私はJ・サージ・パトールです。2021; 45 (8): 1082-1090; ダミーコ RS、他J ニューロノコール。2018; 140 (1): 63-73; コルシュノフ A, 他アクタ・ニューロパトール。2015; 129 (5): 669-78; アイバイドゥーラA、他神経腫瘍。2017; 19 (10): 1327-1337.) • 4,000以上の正中線グリオーマの約40%がH3 K27M変異を保有すると予想されています2 • 17,000以上の非正中線グリオーマの約2%がH3 K27M変異を保有すると予想されています2 • 毎年、約2,000人の患者がH3 K27M変異性グリオーマに罹患していると推定されています米国では、世界の上位7市場の約5,000人の患者視床220人(52%)松果体40人(20%)小脳240人(22%)脳幹(肺を除く)270人(50%)非正中線〜350人(約2%)心室250人(71%)ポン 290人(75%)脊髄370人の患者(49%)米国では毎年約21,000件の神経膠腫が報告されており、脳のすべての部位に影響を及ぼしています1 腫瘍の位置別の米国のH3 K27M+患者の推定数(陽性率)2

23 • H3 K27M変異性グリオーマの治療法は承認されていません。ONC201は、この突然変異を対象とした世界有数のプログラムです。• 潜在的な市場機会は約7億5,000万ドル • 上位7市場で約5,000人の患者 • 超希少疾病適応薬の価格 • 小児/若年成人に最も多くみられるH3 K27M突然変異(メディケアへの曝露が少ない)•採用障壁が低い-効果的な代替療法がない-自発的な認知度が高い神経腫瘍医-既存の診断法で日常的に特定される突然変異-長期的には、他の神経膠腫と併発する可能性がある治療法 • 2037年までの鉛適応症の特許保護-米国特許期間延長(最長5年)の可能性(最長5年)H3 K27M変異グリオーマ:ピーク収益への急速な増加が見込まれています

24の規制上の指定 1.希少小児疾患バウチャープログラムの継続を条件として、バウチャーからの収益は、Oncoceuticsのレガシー株主である米国オーファンドラッグ指定(ODD)(神経膠芽腫の治療と悪性神経膠腫の治療)(EU-ODD)と50/50に分割されます(グリオーマの治療および悪性神経膠腫の治療)(EU-ODD)(成人再発性H3 K27M変異型高悪性度グリオーマ)のファストトラック指定(FTD)H3 K27M変異グリオーマの治療のための希少小児疾患の指定-まれな小児用バウチャーを受け取る可能性があります1
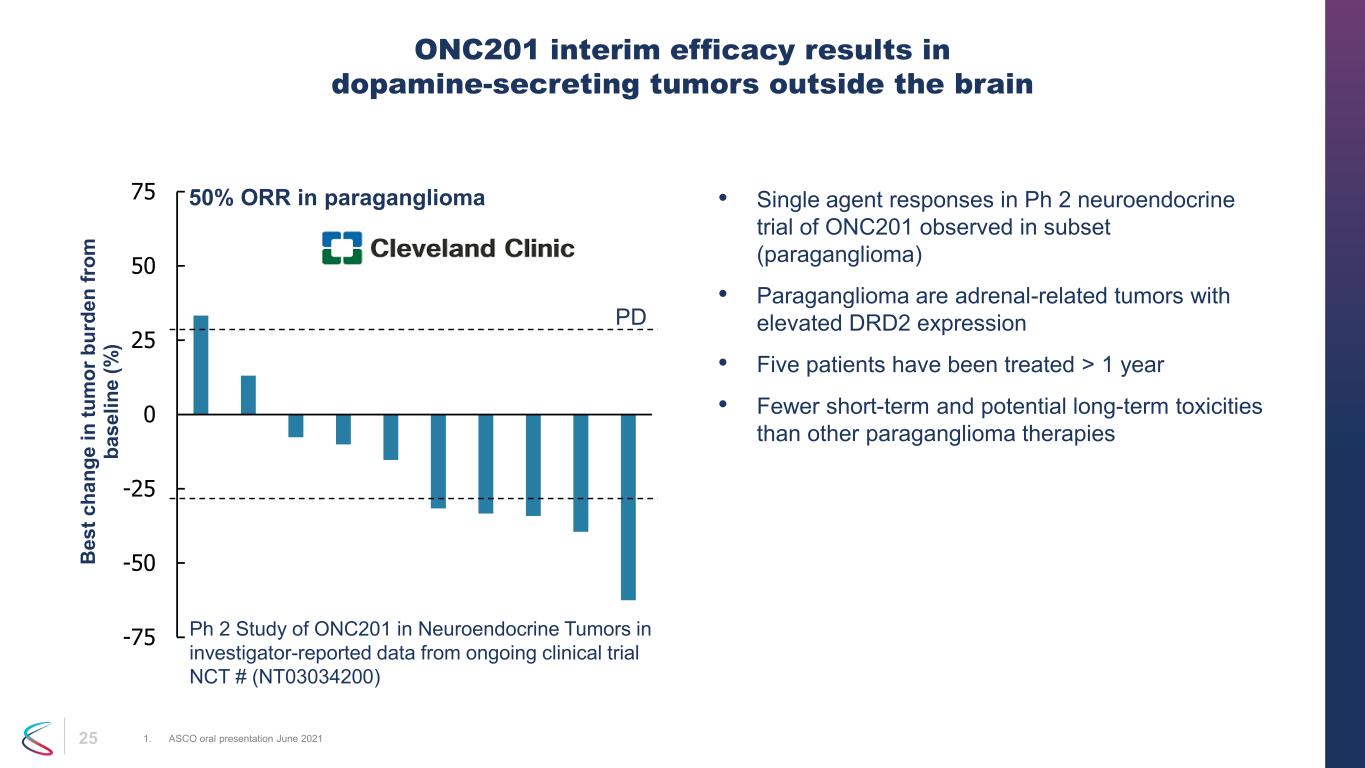
25 • サブセット(傍神経節腫)で観察されたONC201のPh2神経内分泌試験における単剤反応 • 傍神経節腫は、DRD2の発現が高い副腎関連腫瘍です。•5人の患者が1年以上治療を受けています • 他の傍神経節腫療法よりも短期的および潜在的な長期毒性が少ないONC201の暫定的な有効性により、脳外にドーパミン分泌腫瘍が発生します 1。ASCO口頭発表会 2021年6月 -75 -50 -25 50 75 B es t c ha ng e in tu m or b ur de n fr om ba se lin e (%) 傍神経節腫の 50% ORR PD Ph2 研究における神経内分泌腫瘍におけるONC201の研究者が報告した進行中の臨床試験 NCT# (NT03034200)

ONC201の作用メカニズム
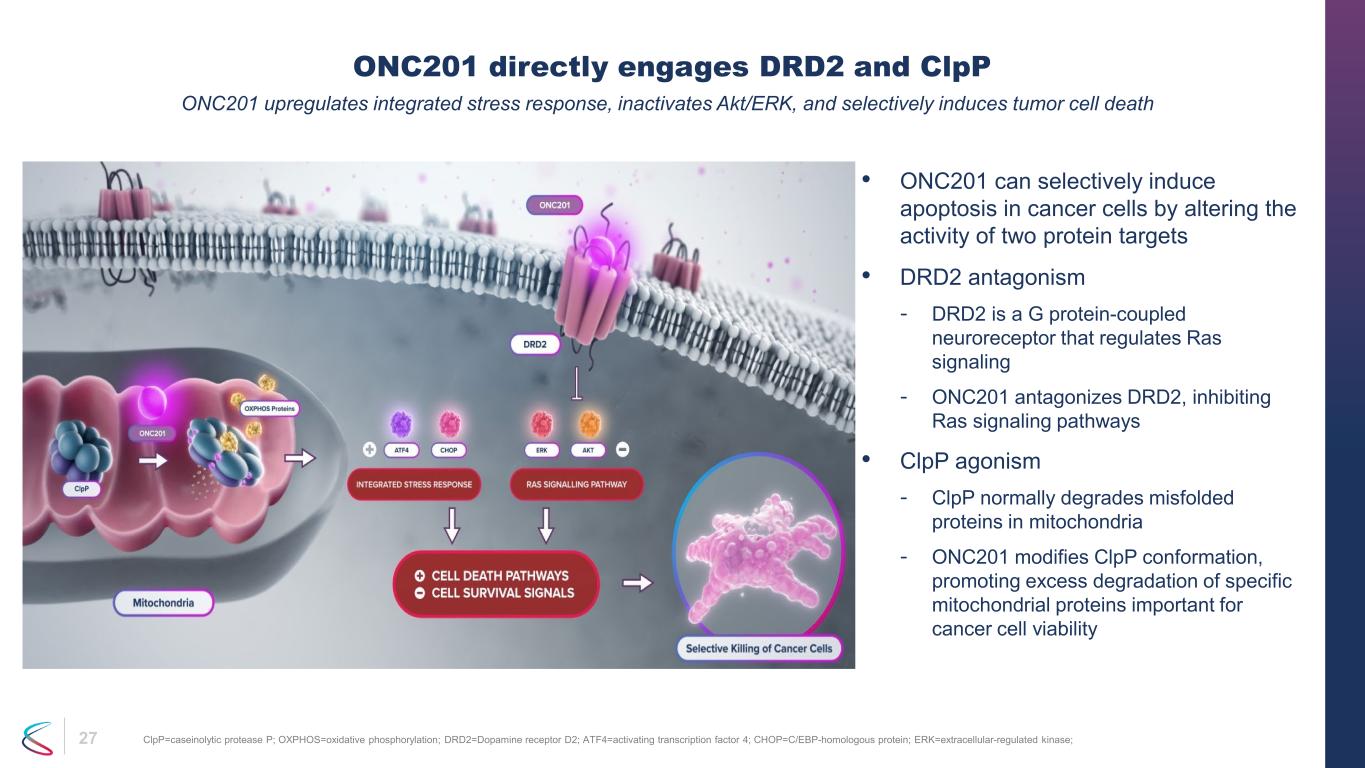
27 • ONC201は、2つのタンパク質標的の活性を変化させることにより、選択的にがん細胞にアポトーシスを誘導できます。• DRD2はRasシグナル伝達を調節するGタンパク質共役神経受容体です。ONC201はDRD2に拮抗してRasシグナル伝達経路を阻害します。• CLPPは通常、miTで誤って折りたたまれたタンパク質を分解します ONC201はClPP立体構造を変化させ、がん細胞の生存に重要な特定のミトコンドリアタンパク質の過剰分解を促進します。ONC201はDRD2に直接関与し、ClPP ONC201は統合ストレス反応をアップレギュレートして不活性化しますakt/ERK、そして選択的に腫瘍細胞死を誘導します。CLPP=カゼイン分解性プロテアーゼP; oxphos=酸化リン酸化; DRD2=ドーパミン受容体D2; ATF4=活性化転写因子4; CHOP=C/EBP-相同タンパク質; ERK=細胞外調節キナーゼ;
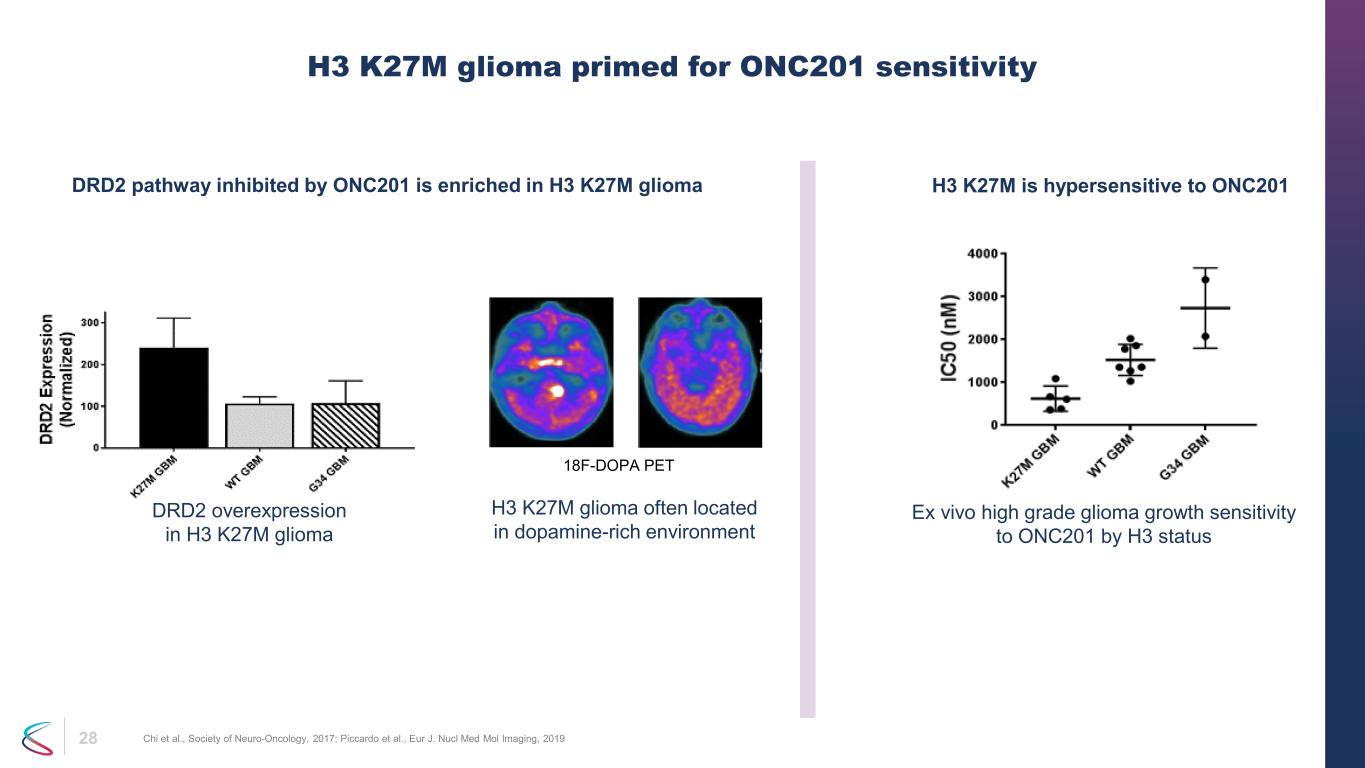
28 H3 K27M グリオーマ ONC201 感受性のプライミング済み Chiら、神経腫瘍学会、2017年; ピッカルドら、Eur J. Nucl Med Mol Imaging、2019 ONC201 によって阻害された H3 ステータス DRD2 経路による ONC201 に対する高悪性度グリオーマの増殖感受性は、H3 K27M グリオーマ H3 K27M に富んでいます。グリオーマはドーパミンが豊富な環境によく見られます。18F-DOPA PET DRD2のH3 K27Mグリオーマ H3 K27Mでの過剰発現は、ONC201に対して過敏です。
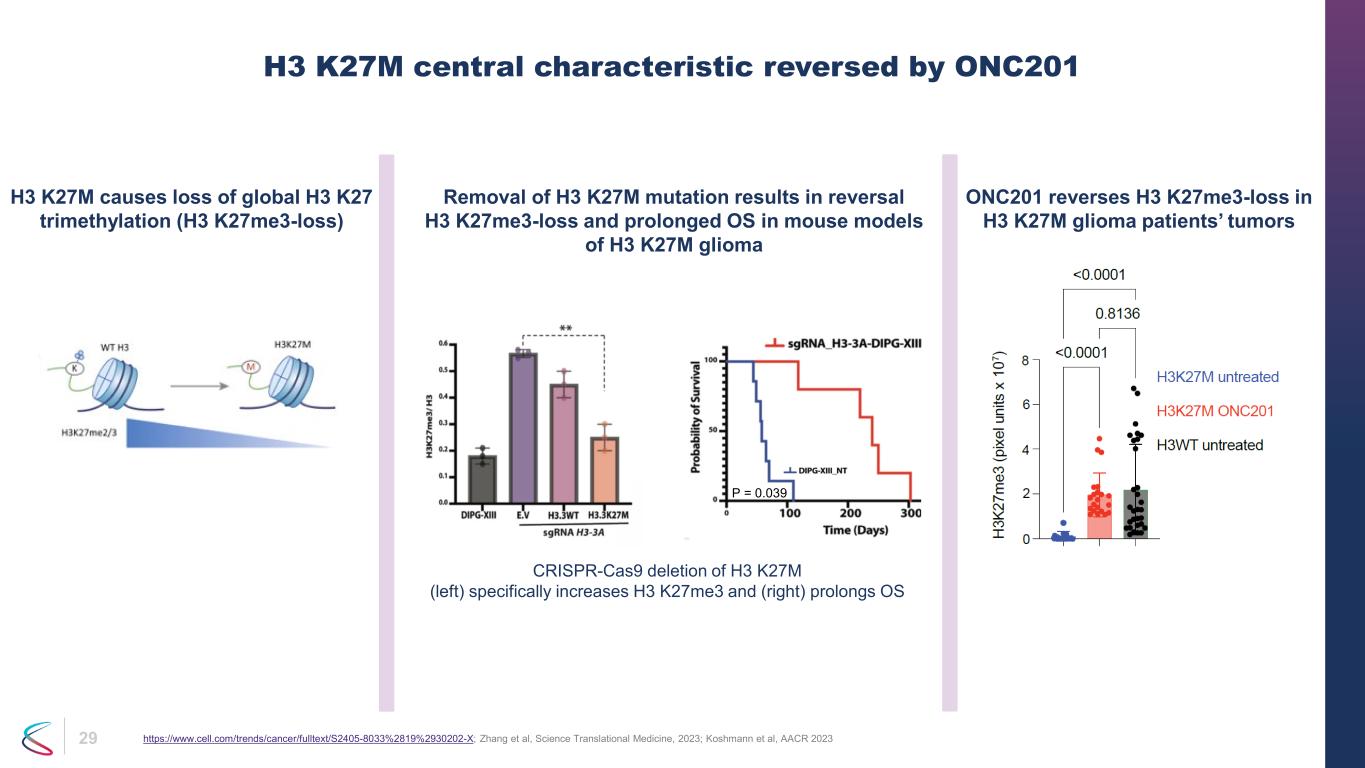
29 H3 K27Mの中心的特徴はONC201によって逆転します https://www.cell.com/trends/cancer/fulltext/S2405-8033%2819%2930202-X; 張ら、サイエンス・トランスレーショナル・メディシン、2023年; コシュマンら、AACR 2023 H3 K27MはグローバルなH3 K27トリメチル化(H3 K27me3-損失)の喪失を引き起こします。H3 K27M変異を除去すると、H3 K27me3-消失が逆転し、OSが長期化します。H3 K27Mグリオーマ ONC201は、H3 K27Mグリオーマ患者の腫瘍におけるH3 K27ME3の喪失を逆転させます。CRISPR-Cas9によるH3 K27Mの欠失(左)の欠失(左)はH3 K27me3を増加させ、(右)はOSを延長します P = 0.039

ONC206
31 ONC206:経口脳浸透剤DRD2アンタゴニスト+ CLPPアゴニスト1。PDB 6センチメートル4 2.PDB 6DL7 DRD21 clPP2 ONC206• 新しい適応症に拡大するように設計された第2世代のイミプリドン • 細胞培養、異種移植、トランスジェニック中枢神経系(CNS)などの腫瘍モデルでの有効性 • CNSがんを対象に進行中の経口用量漸増試験 • 再発した非H3 K27Mの患者を対象に、早期用量漸増コホートで単剤療法の反応が報告されました GBM-H3K27Mグリオーマのみの中枢神経系腫瘍におけるドルダビプロン反応-用量レベル2(100mg)、週1回の投与
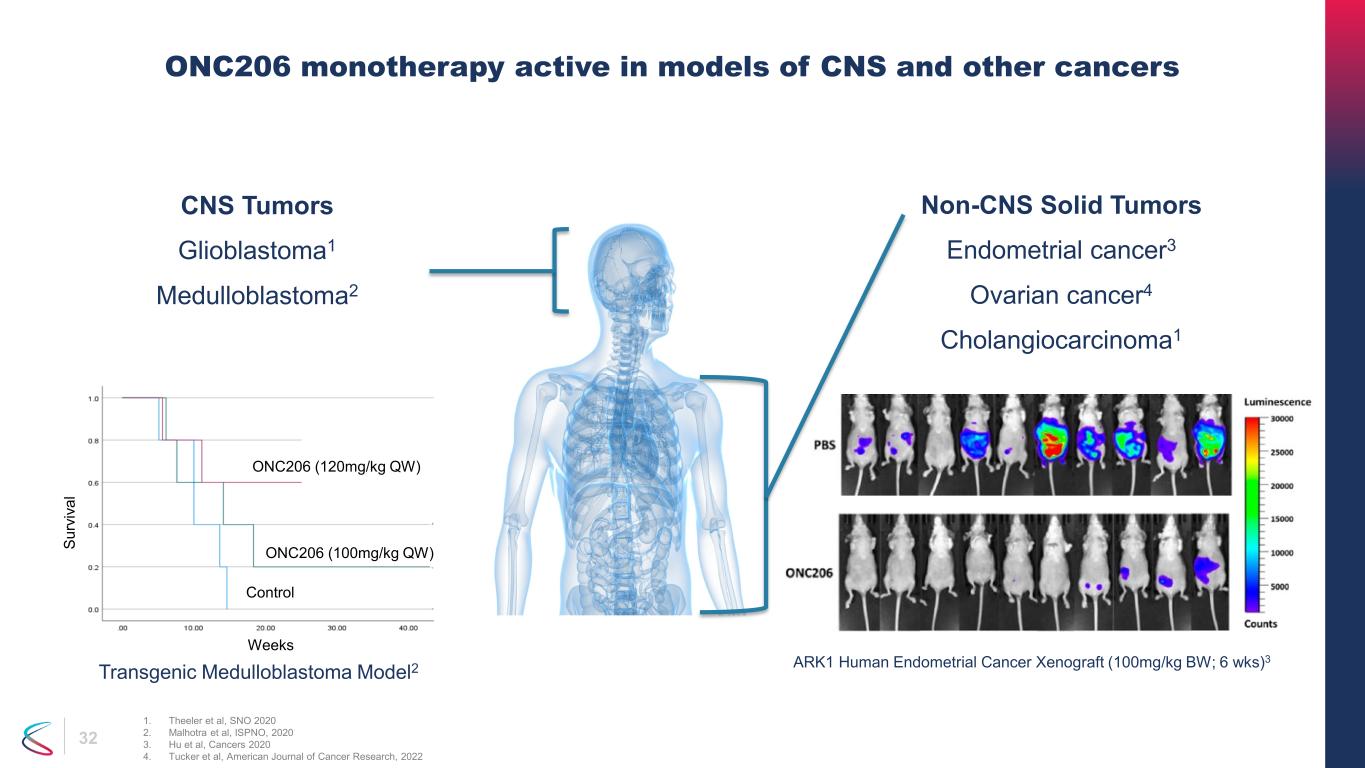
32の中枢神経系腫瘍神経膠芽腫1 髄芽腫2、ONC206 CNSおよびその他のがんのモデルに有効な単剤療法 1.シーラーら、SNO 2020 2.マルホトラら、ISPNO、2020 3.胡ら、がん 2020 4.タッカーら、アメリカがん研究ジャーナル、2022週
33 ONC206の用量漸増:小児と成人のCNS腫瘍 •成人と小児の中枢神経系腫瘍を対象に並行して登録されている単剤療法の用量漸増試験 • H3 K27M変異のない初期のコホート(100mg QW)の研究者により奏効が報告されました-再発した側頭葉膠芽腫の18歳の患者-PET画像によるMRIの退行と代謝の低下、継続中 15か月にわたる治療 •週に1回の用量増加は、週に3日連続で増加すると予想されます。国立衛生研究所
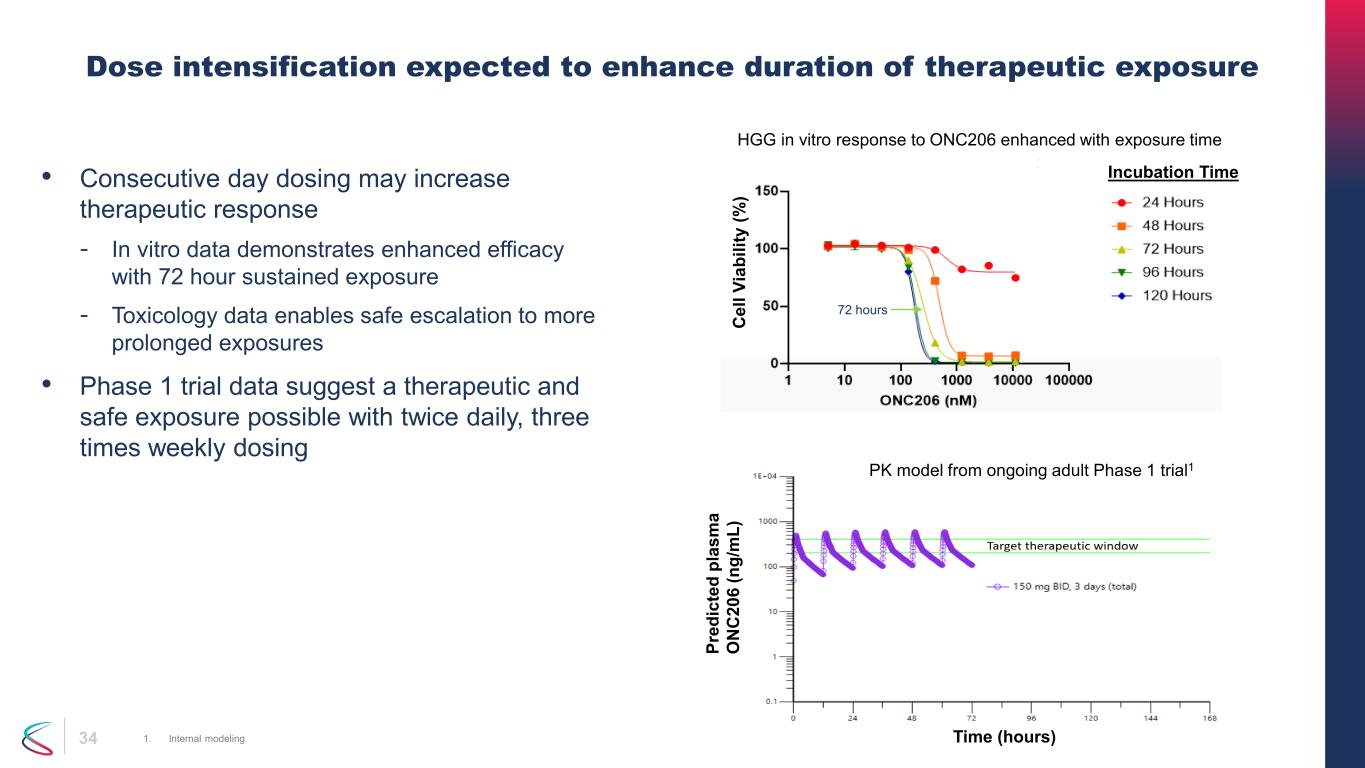
34 • 連続した投与は治療効果を高める可能性があります-体外データは72時間の持続暴露で有効性が高いことを示しています-毒性学データにより、より長期間の曝露まで安全にエスカレーションできます。•第1相試験のデータでは、1日2回、週3回の投与で治療的で安全な曝露が可能であることを示唆しています。用量を強化することで、治療的曝露期間を延ばすことが期待されます 1.内部モデリング 72時間、インキュベーション時間 C el l V、バイリストによる赤外線 (%)、d pl as m a O N C 20 6 (n g/ m L) 時間 (時間) ONC206に対するHGGの体外反応は、曝露時間によって増強されます。進行中の成人第1相試験のPKモデル1
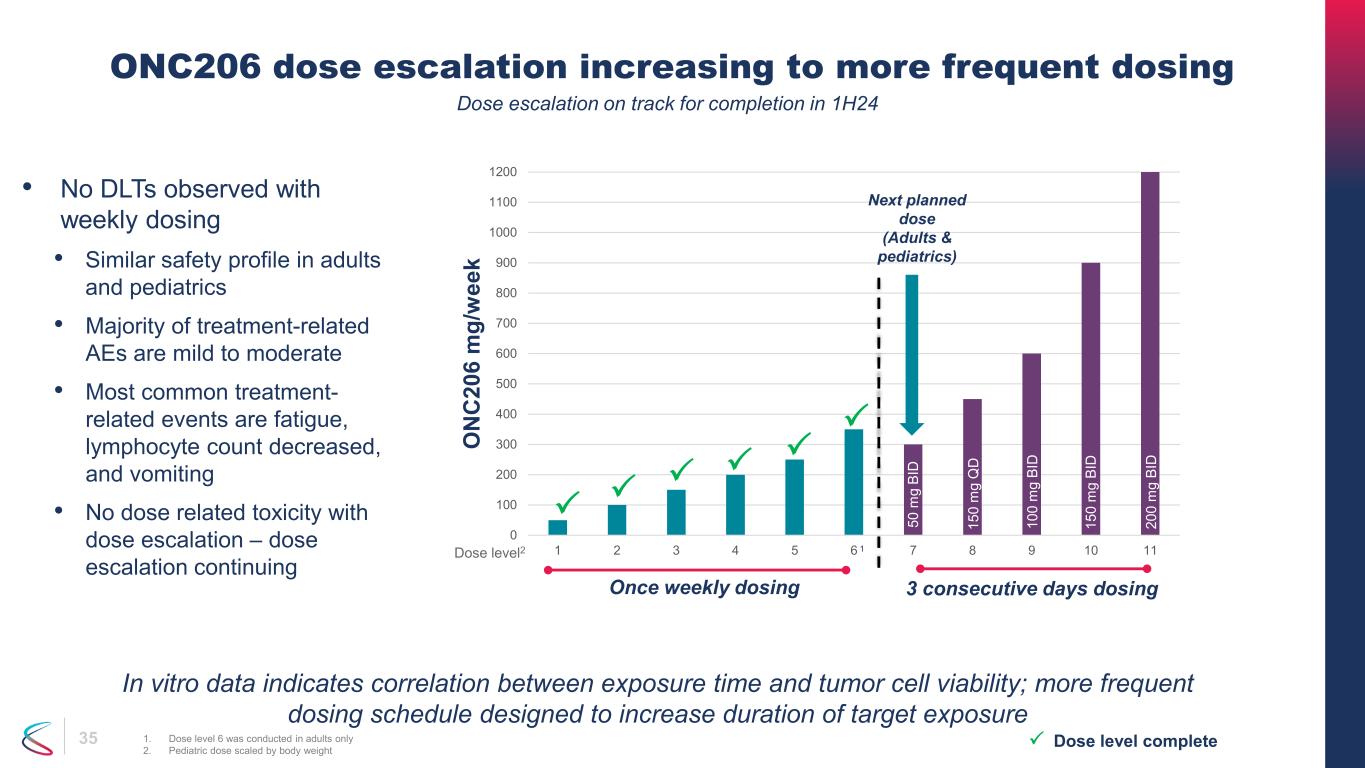
35 ONC206の用量漸増は、より頻繁な投与に増加しています1。レベル6の用量は成人2でのみ実施されました。体重に応じた小児用量 • 毎週の投与でDLTは認められなかった • 成人と小児科で同様の安全性プロファイル • 治療関連のAEの大半は軽度から中等度です • 最も一般的な治療関連事象は、疲労、リンパ球数の減少、嘔吐です • 用量の漸増による用量関連毒性なし — 用量漸増継続用量レベル完了 0 100 200 400 500 600 700 900 1000 1100 1200 1 2 3 4 5 6 7 8 9 10 11 O N C 20 6 m g/ w ee k 次の計画用量 (成人および小児科) 用量レベル2 50 m g BI D 15 0 m g Q D 10 0 m g BI D 15 0m g BI D 20 0 m g BI D 週1回、3日間連続投与、1回の投与量漸増は、24年上半の完了に向けて順調に進んでいます。体外データは、曝露時間と腫瘍細胞の生存率との相関関係を示しています。より頻繁な投与スケジュールは、目標曝露期間を延ばすように設計されています。

36 • GBMは急速に進行する疾患で、生存率が低く、過去25年間に承認された薬剤はほとんどありません。-テモゾロミド(TMZ)は1999年に承認されました-ベバシズマブは2009年に承認されました。• 既存の治療法では持続的な効果はほとんどありません-診断から3年生存します。• ChimerixはONC2062のグローバルな営業権を保有しています。• 世界市場機会は20億ドルを超えています。-TMZの収益は、それ以前の2009年に約14億ドルでピークに達しました。ジェネリック医薬品化 o インフレ調整後のピーク:> 25億ドル-新しいGBM療法:現代の抗がん剤承認の平均価格で 50% の普及率が20億ドルを超えています上位7つの市場で年間約3万件のGBMの新規案件が発生しています。>20億ドルを超える市場機会 1 wjso.biomedcentral.com/articles/10.1186/10.1186/1477-7819-10-220 2 2021年の合併契約により、オンコシューティクスのレガシー株主にロイヤルティとマイルストーンが支払われます。201件中1件中

ONC212とCMX521の前臨床開発
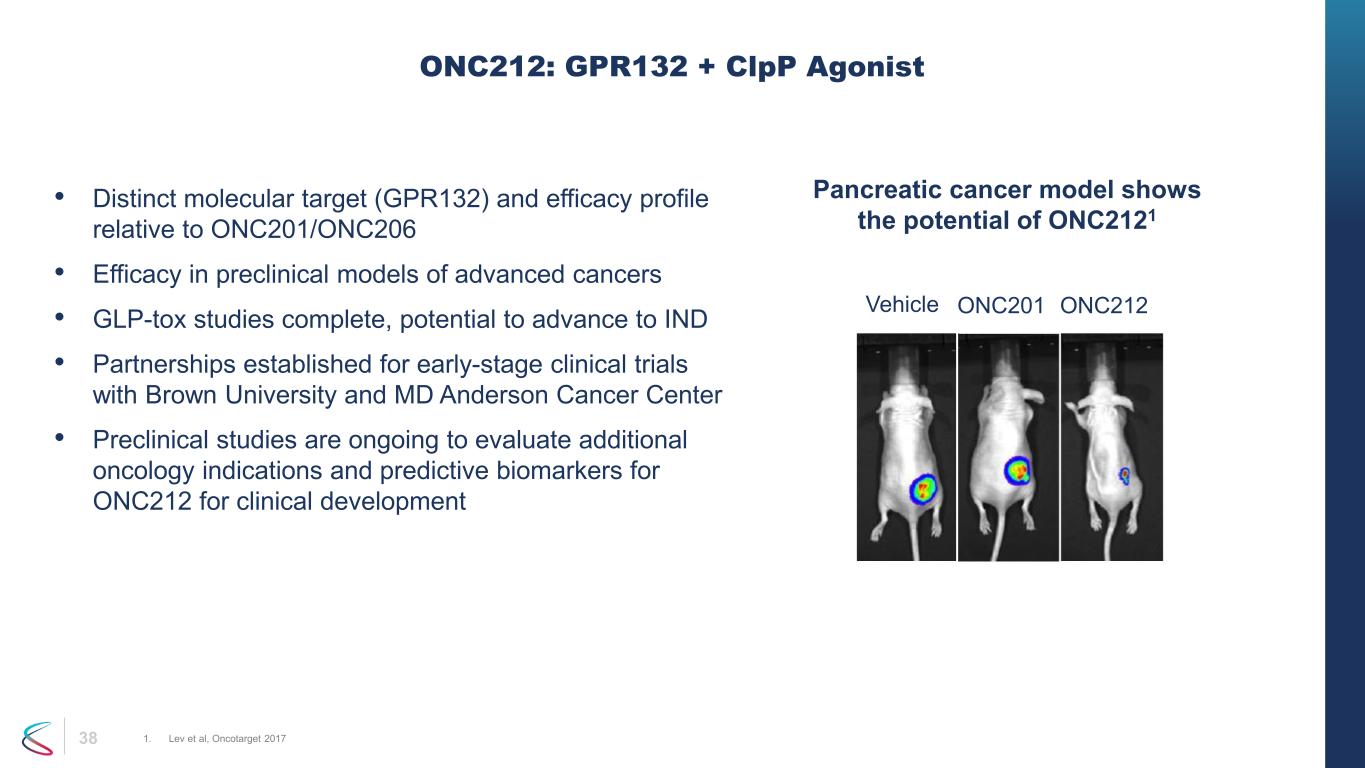
38 • ONC201/ONC206と比較した明確な分子標的(GPR132)と有効性プロファイル • 進行がんの前臨床モデルにおける有効性 • GLP-TOX試験が完了し、INDに進出する可能性がある • ブラウン大学とMDアンダーソンがんセンターとの早期臨床試験のためのパートナーシップが確立されました • ONC212のその他の腫瘍学的適応症と予測バイオマーカーを評価するための前臨床研究が進行中です臨床開発 ONC212:GPR132+ CLPP アゴニスト 1.レブら、オンコターゲット 2017 膵臓がんモデルは ONC2121 車両 ONC201 ONC212 の可能性を示しています
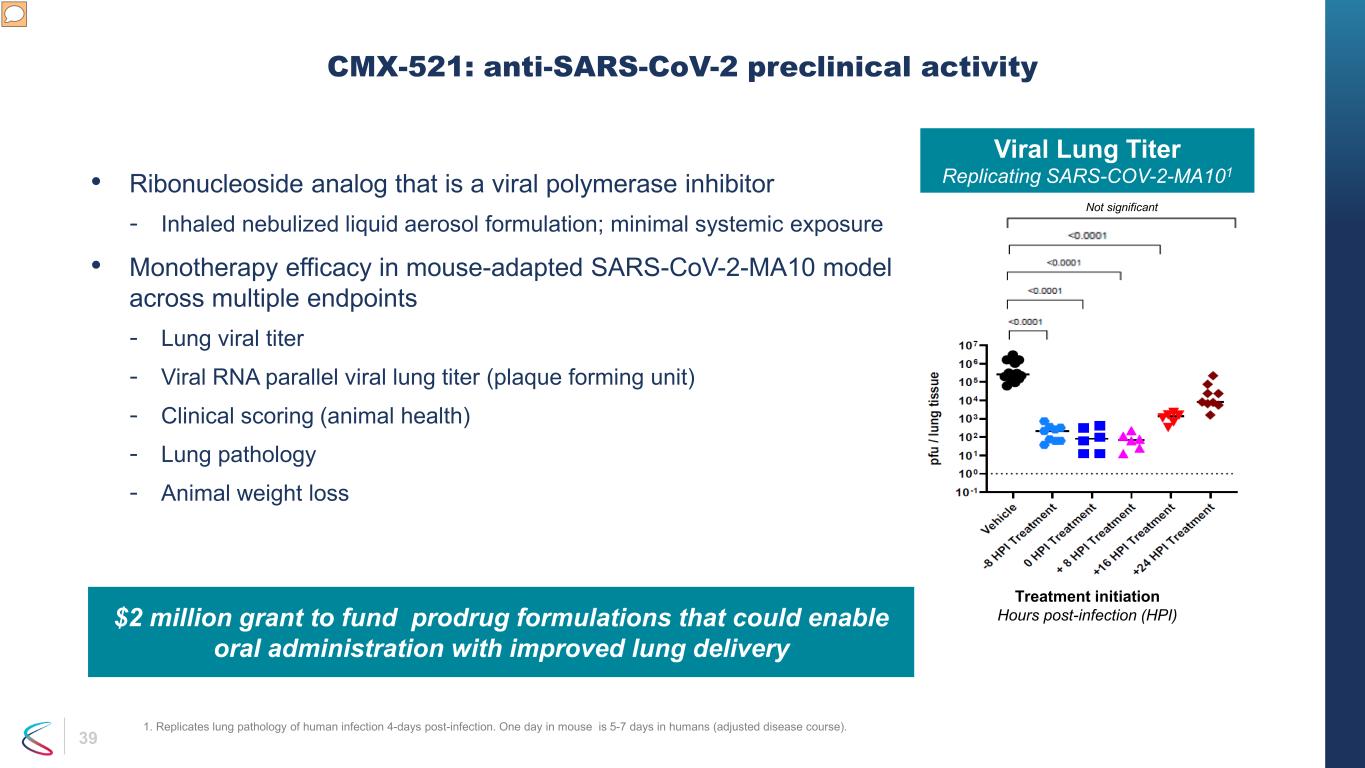
39 • ウイルスポリメラーゼ阻害剤であるリボヌクレオシド類似体-吸入噴霧液体エアロゾル製剤、最小限の全身曝露 • 複数のエンドポイントにわたるマウス適応型SARS-CoV-2-MA10モデルにおける単剤療法の有効性-肺ウイルス力価-ウイルスRNAパラレルウイルス肺力価(プラーク形成単位)-臨床スコア(動物の健康)-肺病理-動物の体重損失 CMX-521:抗SARS-CoV-2前臨床活性 SARS-COV-2-MA101を再現するウイルス性肺力価は有意ではありません。感染後治療開始時間(HPI)、プロドラッグに資金を提供するための200万ドルの助成金経口投与が可能で肺への送達が改善される製剤 1.感染の4日後に、ヒトの感染の肺病変を再現します。マウスの1日は、ヒトの場合は5〜7日です(病勢の調整後)。

コーポレートアップデート

41 Emergent BioSolutionsは、公衆衛生を保護するために政府機関と協力している経験豊富なバイオディフェンス企業です。規約の概要:• 2022年第3四半期の決算時に2億3800万ドルを前払い受領しました。• BARDAの調達マイルストーンの可能性として最大1億2400万ドル • 治療コースが170万コースを超える場合、将来の米国総利益に対して 20% のロイヤリティ • 国際売上総利益全体の 15% のロイヤリティ • 開発マイルストーンをさらに最大1,250万ドル追加します TEMBEXA® の取引期間の概要

4.2の財政力は、主要な触媒を通じて開発を支援します。承認までの複数の可能性を秘めた全額出資のPh3プログラム — アクションスタディ試験は2022年11月に開始され、NIHとPNOCでの早期用量漸増研究における暫定OSデータは2025年初頭に予定され、全OSデータは2026年ONC206と予想されています。研究者らは、H3 K27M以外の再発性神経膠芽腫患者に奏効したと報告しました 2023年6月30日現在、運営資金を調達するための資本は2億3,300万です。負債なし初期段階のパイプラインは、外部資本を活用した前臨床プログラムですクリニックまたはパートナー(ONC212、CMX521)に進む可能性強固な事業開発、検索、評価プロセス ONC201のフェーズ3アクション研究が成功する可能性が高い ONC201の商業的可能性に対する障壁が低い、企業の能力と財務上の柔軟性

Chimerixの企業プレゼンテーション