
ルール424(B)(4)に従って提出する
登録番号333-269876
目論見書
1500,000株
普通株 株

Azitra, Inc.
Azitra,Inc.が普通株を初めて公開するという確約である。今回の発行まで、私たちの普通株はまだ公開されていない。私たちの株の初公募価格は5ドルです。
私たちの普通株はニューヨーク証券取引所アメリカ取引所に上場することが許可されており、コードは“AZTR”です
連邦証券法によると、私たちは“新興成長型会社”であり、いくつかの低下した上場企業の報告要求を遵守することを選択した。
私たちの普通株に投資することは高い危険と関連がある。“”というタイトルの部分を参照リスク要因“br”は11ページから始まる。米国証券取引委員会、米国証券取引委員会、およびどの国の証券委員会もこれらの証券を承認または承認しておらず、本入札説明書が事実または完全であるかどうかも決定されていない。どんな反対の陳述も刑事犯罪だ。
| 1株当たり | 合計する | |||||||
| 初公開価格 | $ | 5.00 | $ | 7,500,000 | ||||
| 保証割引と手数料 (1) | $ | 0.375 | $ | 562,500 | ||||
| 費用を差し引く前に私たちにくれた収益 | $ | 4.625 | $ | 6,937,500 |
| (1) | 引受割引および手数料には、引受業者に支払う初公募株価格の1.0% に相当する非責任費用手当は含まれていない。訪問することをお勧めします“引受販売“ 105ページから、引受業者賠償に関する他の情報を知る。 |
私たちは、最大225,000株の追加普通株 を購入するために、超過販売(あれば)にのみ使用するために、引受業者に45日間の選択権を付与した。
引受業者は2023年6月21日頃に買い手に株式を納入する予定だ。
ThinkEquity
本募集説明書の日付は2023年6月15日です

カタログ表
| ページ | |
| 業界と市場データ | II |
| 募集説明書 概要 | 1 |
| リスク要因をまとめる | 9 |
| 財務データまとめ | 10 |
| リスク要因 | 11 |
| 前向き陳述に関する警告的説明 | 38 |
| 商標、サービスマーク、商号 | 38 |
| 収益を使用する | 39 |
| 配当政策 | 40 |
| 大文字である | 41 |
| 薄めにする | 42 |
| 経営陣の財務状況と経営結果の検討と分析 | 44 |
| 商売人 | 51 |
| 管理する | 86 |
| 主要株主 | 94 |
| 証券説明 | 95 |
| 将来売却する資格のある株 | 99 |
| 米国連邦所得税の非米国保有者への重大な影響 | 101 |
| 引受販売 | 105 |
| 法律事務 | 113 |
| 専門家 | 113 |
| そこでもっと多くの情報を見つけることができます | 113 |
| 財務諸表索引 | 114 |
あなたはこの目論見書に含まれている情報だけに依存しなければなりません。私たちは、本入札明細書に含まれている情報とは異なる、または本入札明細書に含まれる情報とは異なる情報を提供することを許可していません。私たちは、他の人があなたに提供する可能性のある他の任意の情報に対して何の責任も負いません。もし誰かがあなたに違う情報や不一致の情報を提供したら、あなたはそれに依存してはいけない。私たちはこれらの証券を要約や販売を許可しない司法管轄区域で販売しません。本募集説明書に表示されている情報は、本募集説明書の表紙に表示されている日付のみが正確であると仮定しなければなりません。この日以来、私たちの業務、財務状況、br}運営結果と見通しが変化した可能性があります。
アメリカ以外のいかなる司法管轄区域もいかなる行動も取らず、私たちの普通株式或いは財産の公開発行を許可し、あるいはこの司法管轄で本募集説明書を区別することを許可する。米国以外の管轄区で本募集説明書を持っている人は、自分に知らせ、当該管轄区に適用される今回の発行と分配明細書に関するいかなる制限も守らなければならない。
本願明細書で使用されるように、文脈が表明または他の要求がない限り、“当社”、“当社”、“当社”とは、デラウェア州のAzitra,Inc.を意味する。
| i |
業界と市場データ
本募集説明書、特に“業務”部分は、独立した業界、政府および非政府組織の出版物または他の公開情報に基づく観察、統計データ、推定および予測、ならびに私たちの内部ソースに基づく他の情報を含む。本明細書で言及されたサード·パーティ·メッセージ·ソースは信頼できると信じているが、予測に関連する推定は、リスクおよび不確実性の影響を受け、タイトルに含まれる様々な要因によって変化する可能性がある“との多くの仮定を含むリスク要因また,本入札明細書中の他の である.これらの要素や他の要素は、結果が独立した当事者や私たちが推定で表現した結果と大きく異なる可能性がある。
本募集説明書の本文中のいくつかの情報は、独立業界の政府および非政府組織出版物に含まれている
| ● | Stacy とBelkaid研究アポロ·ステイシーとアスミンはベルケドは皮膚の健康な微生物衛士です科学、2019年1月18日;第363(6424):227-228. DOI:10.1126/cience.aat 4326。PMID:30655428 | |
| ● | ああbr}研究、周偉、Spoto M、Hardy R、Guan C、Fleming E、Larson PJ、Brown JS、oh J.宿主特有の進化と伝播動力学 は人体皮膚表皮ブドウ球菌の機能多様性を形作った。独房です。2020年2月6日;180(3):454-470.e 18。DOI:10.1016/j.cell。2020.01.006.epub 2020 1月30日。PMID:32004459;PMCID | |
| ● | 研究では,Satoh TK,Mellett M,Meier-Schiesser B,Fenini G,Otsuka A,Beer HD,Rordorf T,Maudl JT,Hafner J,Navarini AA,Contassot E,France LEである.IL-36γは表皮増殖因子受容体/チロシナーゼ阻害とざ瘡皮膚桿菌の共生を抑制することによって皮膚毒性を引き起こすことができる。J Clin Invest. 2020年3月2日;130(3):1417-1430。DOI:10.1172/JCI 128678。PMID:31805013;PMC 7269569 | |
| ● | Barbati研究,子供におけるNetherton症候群の管理と将来の見通し,Federica Barbati,Mattia Giovannini Teresa Orange,Lorenzo Lodi,Simona Barni,Elio Novembre,Ermanno Baldo,Mario Cristofolini,Stefano Stagi,Silvia Ricci,Francesca Mori,Cesare Filippeschi,Chiara AzzariとGiusepe Indol,2021年5月小児科先端 | |
| ● | 研究、Netherton症候群:症例報告と文献回顧、Joannie D.Sun、医学博士とKenneth G.Linden、博士、医学博士、国際皮膚病雑誌2006 | |
| ● | 孤児網、Netherton症候群、離島:Netherton症候群 |
| II |
募集説明書 概要
この 要約は,本募集説明書の他の箇所に出現するいくつかの情報を重点的に紹介している.私たちの普通株に投資することは高度な危険と関連がある。これは要約に過ぎず、私たちの普通株式に投資する前に考慮すべきすべての情報 を含まないので、そのすべての内容は一致し、本入札明細書の他の場所のより詳細な情報と共に を読まなければならない。あなたが私たちの普通株に投資することを決定する前に、11ページ目からの“リスク要因”および本募集説明書に含まれる財務諸表および関連説明書を含む株式募集説明書全体をよく読みなさい。
2023年5月17日我々は7.1対1の比率で長期株式分割を行った.本入札明細書のすべての株式および株価情報は、長期株式分割が有効になるように調整されている。
私たちの会社
我々brは早期臨床生物製薬会社であり,工学brタンパク質と局所活性生物治療製品を用いて正確な皮膚病の革新療法の開発に専念している。我々はすでに1,500個の独特な細菌菌株からなり、独特の治療特徴に基づいてbrをスクリーニングすることができる微生物ライブラリーを含むbr特許プラットフォームを構築した。このプラットフォームは人工知能と機械学習技術によって増強され、br分析、予測と助け、著者らの菌株バンク中の類薬物分子のスクリーニングを助ける。このプラットフォームは,許可された遺伝子工学技術を利用して,従来遺伝が困難であった菌株を形質転換することができる。私たちの最初のポイントは遺伝子工学菌株の開発です表皮ブドウ球菌や表皮ブドウ球菌皮膚疾患治療プロジェクトの最適な治療候補種であると考えられる。この特定の種は皮膚において良好な特性 を記述していることが多く示されている。本募集説明書の発表日までに,我々は我々の微生物ライブラリーにおいて60種類以上の異なる細菌を決定しており,これらの細菌は顕著な治療効果を有する生生物や工学タンパク質に改造できると信じている。
我々brは皮膚科治療用遺伝子工学細菌の先駆者である。我々の目標は,我々のプラットフォームや内部微生物ライブラリー細菌株を用いて新たな療法を創出することであり,これらの療法は工学的生物であるか,工学的タンパク質やポリペプチドであり,皮膚疾患の治療に用いられる。私たちの最初のポイントは現在の候補製品を開発することです
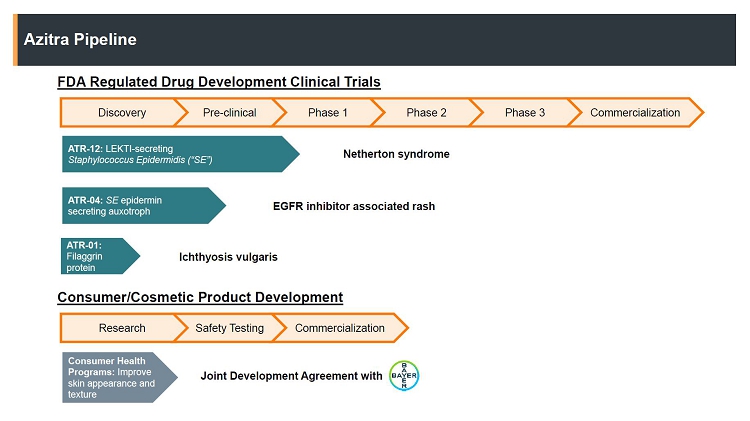
| ● | ATR-12,br 1遺伝子組換え株表皮ブドウ球菌孤児疾患Netherton症候群の治療に対して、これは1種の慢性、時々致命的な皮膚疾患であり、100,000人に1人が影響を受けると推定されるが、他の皮膚病と類似しているため誤診され、その発病率は過小評価される可能性がある。我々は2019年にATR-12に対する米国食品·薬物管理局(FDA)の小児科まれな疾患称号 を獲得した。2022年12月にNettherton症候群患者における1 b期臨床試験の研究新薬申請、またはINDを提出し、1月27日にbrに提出した。2023我々はFDAから通知を受け,提案された1 b期臨床試験については を継続する可能性がある。私たちは2023年上半期に私たちの1 b期の臨床試験を開始し、2024年上半期に初歩的な結果を報告する予定だ。 |
| ● | ATR-04,br株遺伝子組換え株表皮ブドウ球菌上皮増殖因子受容体阻害剤またはEGFRi標的治療を受けた癌患者に出現する丘疹の治療のための。2023年末までにINDを提出し,EGFRi標的治療を受けたある癌患者で1 b期の臨床試験を行う予定である。FDAの我々INDに対する承認を得られれば,2024年上半期にわれわれの1 b期臨床試験を開始する予定であり,初歩的な結果は早ければ2024年末に発表される予定である。 |
| ● | ATR-01は,慢性,乾燥(異常乾燥),鱗片状皮膚疾患であり,250人における発症率と罹患率は1と推定される尋常型魚鱗病の治療に用いられる工学的組換えヒトフィラメント蛋白である。このことは,米国の患者総数が130万であることを示している。 2023年にLead最適化とIND支援研究を完了し,2024年末のIND申請の提出を支援する予定である。 |
| 1 |
| ● | 私たちとバイエル社の消費財部門バイエル消費者看護株式会社あるいは国際生命科学会社バイエルは2種類の異なる細菌微生物菌株を研究·開発している。我々は2019年12月にバイエルと共同開発協定(JDA)を締結した。JDAの条項によると、私たちは私たちの細菌菌株及びその天然産物バンク中の重要な臨床前特性をテストする責任がある。数百個の菌株のスクリーニングを経て、著者らとベイヤは2つの特定の菌株 を選択し、更なる研究を行った。バイエルはこれらの品種に特許権を付与する独占的な選択権を持っています。バイエルは2020年12月、私たちBシリーズの800万ドルの優先株を購入しました。 |
私たちはまた、カーネギーメロン大学とフレッド·ハッチンソンがんセンターやフレッド·ハッジのチームとパートナー関係を築き、この2つのセンターはアメリカで最も重要な学術センターである。我々はカーネギーメロン大学とのチームとの協力も全ゲノムシークエンシングの力を活用した。このパートナーシップは、新しい類似薬のポリペプチドやタンパク質を探すために、私たち固有の細菌株バンクを発掘している。このチームが開発した人工知能/機械学習技術は,微生物の遺伝子配列から微生物が産生する分子を予測する。次に、このシステムは、将来の予測を改善するために、直列質量分析および/または核磁気共鳴画像によって実際に作られた製品と予測結果を比較する。これらの予測は、同様の薬剤の構造を選択するために、公開されて利用可能な2 Dタンパク質データベースおよび3 Dタンパク質データベースと比較することができる。
我々brはFred Hutchの世界的な独占的許可を持ち,皮膚病のための工学的微生物療法や微生物由来ポリペプチドやタンパク質の発見,開発,商業化を含むSyngenicDNAマイクロループ粒子またはSyMPL技術を遺伝子工学のすべての分野で使用することを許可している。我々は,これまで実現したことのない遺伝子変換 を行うために,我々が許可した特許権を用いてプラスミドを構築している。これまで,われわれのチームはSyMPL技術なしにわれわれの主要な治療案候補を設計することに成功してきた。しかし,SyMPLはbr微生物種の拡張宇宙を遺伝子変換する能力を開始すると信じており,我々の将来のいくつかまたはすべての候補製品はSyMPL技術を採用することが予想される。Fred Hutchとの協力は微生物工学の専門家Christopher Johnston博士が指導し,彼もSyMPL技術の革新者である。
バイエルパートナー
2019年12月、私たちはバイエルと共同開発協定(JDA)を締結し、この合意に基づいて、私たちの独自微生物ライブラリーから選択されたいくつかの菌株を共同開発することに同意した。私たちとバイエルはアイデンティティと試験管の中でそして離体する局所配合に用いた微生物菌株の特徴は,br潜在的な非処方化粧品として開発する予定である。バイエルは共同開発協定に署名した際に一括払いを支払い、開発コストの返済に同意した。2021年10月、バイエルはオプション合意を拡大し、追加鑑定作業の第2の費用を支払った。我々は,JDAに基づいて最大6品目の独占印税許可の選択権を取得し,任意の関連特許権の独占印税許可を含むバイエルに付与した.バイエルは私たちがJDA開発活動の結果をバイエルに渡した後、6ヶ月間の独占許可権を得る権利がある。brは数百種類の菌株をスクリーニングした後、私たちとベイヤは2種類の特定の菌株を選択して体外と体外鑑定を行った。
2020年9月、バイエルのベンチャーグループLeaps by Bayerは私たちBシリーズの優先株800万ドルを購入した。
私たちの 戦略
私たちの3つの主要な候補製品とバイエルとの協力に加えて、幅広い候補製品の組み合わせを開発し、私たちの正確な皮膚病プラットフォームを拡張する応用に専念することを目標としています。我々は,正確な皮膚疾患生物製剤の開発を推進する上で独自の地位を確立したと信じている。
我々は,我々の特許微生物バンクから選ばれた約1,500種類のユニークな細菌菌株から選択された遺伝子工学brタンパク質を開発することにより,精密皮膚病のために広範な候補製品の組合せを創出する予定である。我々の戦略は以下のとおりである
| ● | 持続可能な正確な皮膚病会社を作ります私たちの目標は、持続可能な候補製品パイプラインを持つ有力な正確な皮膚病会社を作ることです。そのため,我々は現在の生物治療候補製品ラインの迅速な推進に注力するとともに,他の候補製品を積極的に開発している。私たちの現在の各候補製品 は独自製品であり、特許を出願している。私たちが開発した多くの(すべてでなければ)遺伝子工学製品候補品は特許保護を受ける資格があると予想される。 |
| ● | 我々の主要候補製品ATR-12とATR-04の臨床試験を推進した。2022年のNetherton症候群患者において、著者らはFDAとのIND前通信を獲得し、目的は著者らが提案したATR-12制御経路を検討し、FDA からATR-12 INDの提出と受け入れを招く臨床前計画指導を獲得することである。2022年12月に、Netherton症候群患者においてATR-12の最初のヒト試験を行うことを要求するIND申請を提出した。著者らINDはNetherton症候群患者に対してATR-12の1 b期臨床研究を行うことを提案した。2023年1月27日にFDAから通知を受け,提案された1 b期臨床試験については引き続き検討が行われる可能性が予想され,2023年上半期に1 b期臨床試験が開始される予定であり,初歩的な結果 は2024年上半期に予定されている。EGFRi治療を受けたある癌患者で1 b期試験 を行う予定であり,我々のATR−04は治療を受けたある癌患者で行い,ATR−04のINDを2023年末に提出する予定である。 |
| ● | 戦略的パートナー関係を選択的に探索することによって、私たちの正確な皮膚科プロジェクトの潜在力を最大限に発揮し、私たちのプラットフォームを広げる。私たちは私たちのすべての核心技術と候補製品に対する重要な権利を維持するつもりだ。しかし,我々は引き続き 戦略パートナーが技術や候補製品開発の協力機会を加速させ,協同組合を得る方法を提供することを評価し続ける.あるいは専門知識を提供し,異なるタイプの皮膚病の治療に拡張できるようにした。私たちはまた技術や候補製品を選択的に許可することで、私たちのプラットフォームのカバー範囲を拡大することができます。さらに、私たち自身が追求していない適応と業界 に、私たちのいくつかのノウハウをライセンスすることを考慮します。私たちの遺伝子工学技術と技術は化粧品、洗浄燃料の生成とバイオレメディエーションを含む医薬分野以外に適用性があると信じている。 |
| 2 |
| ● | 私たちの学術パートナー関係を利用して私たちは現在、フレッド·ハッチンソンがんセンター、エール大学、ジャクソンゲノム医学実験室、カーネギーメロン大学の研究者とパートナーシップを結んでいる。我々は,これらのパートナーシップを利用して,それらを拡大したり,他の学術パートナー関係を形成したりして,我々の工学プラットフォームを支援し,我々の研究開発チャネルを拡大することを可能にしたい. |
| ● | 私たちの他の潜在的候補製品を拡張します私たちの3つの主要な候補製品に加えて、幅広い候補製品の組み合わせを開発し、私たちの正確な皮膚病プラットフォームの応用を拡大することに集中することを目標としています。私たちは正確な皮膚病治療製品を発見し、開発する独自のプラットフォームを持っている。著者らのプラットフォームは約1,500個の独特な細菌菌株からなる微生物ライブラリーを中心に構築され、独特な治療特性をスクリーニングし、微生物遺伝子技術を利用して皮膚微生物が産生するタンパク質、ポリペプチドと分子を分析、予測、設計した。我々が処理しにくい微生物種を遺伝子工学する能力は,SyMPL技術の独占的許可を得て唯一無二に利用されている。 |
我々の 知的財産権
本出願明細書の発行日までに、我々は、発行された2つの米国特許、4つの係属中の米国特許出願、係属中のPCT出願、および38件の他の外国国段階の出願を所有または独占的に許可し、その中には、我々の業務発展に非常に重要な欧州地域段階出願が3つ含まれている。
私たちのリーダーチームは
私たちの最高経営責任者Francisco D.Salvaと私たちの共同創業者Travis Whitillが指導し、彼ら はバイオテクノロジー会社の管理と医療投資において35年以上の経験を持っている。サルワは以前Acerta Pharmaの共同創業者で、同社は2016年からの段階的買収でアスリコンに約63億ドルで販売していた。Pharmacclicsの黒字化にも力を入れ、その後2015年に約210億ドルでAbbvieに売却した。これまで、サルヴァさんは10年近く生命科学ベンチャーキャピタルの分野で働いてきました。ホイットフィルさんはエール大学で副研究科学者と助教授を務め、小児科と急診医学科でアルバイトをしていた。彼は多くの寄付金援助プロジェクトを指導し、12件近くの特許を持ち、50冊以上の出版物を共著した。
私たちの競争優位は
Azitra は皮膚科臨床試験で治療に用いられている遺伝子工学細菌の先駆者である。我々は、約1,500個のユニークな細菌株からなる微生物ライブラリーを含む独自のプラットフォームを構築し、これらの菌株は、治療特性 および候補主薬がスクリーニングされた。また,従来処理が困難であった細菌微生物を遺伝的に形質転換させる可能性のある新しい技術を独占的に許可した。バイオテクノロジーにおける組換えタンパク質工学の歴史は伝統的に20種以下に制限されている。我々が許可を得た技術により,数千種類の微生物に対して遺伝子工学brを行い,これまで製造されたことのないタンパク質やポリペプチドを作製することが可能となった。我々の管理チームは治療薬の発見,開発,製造,商業化に豊富な経験を持っている。我々のリーダーチームのメンバーはPharmacclics,Acerta Pharma,Botanix PharmPharmticals,Realm Treeuticsなどの会社で開発された専門知識を持っている.
| 3 |
私たちの市場機会
私たちは私たちのすべての潜在的な市場に捕まえなければならない多くの市場機会があると信じている。皮膚科市場自体は過去10年間でかなりの増加を示し,今後も増加が予想される。Vision Researchによると,皮膚科薬物市場は2021年に170億ドルを超え,2030年には8.8%の複合年間成長率で増加すると予測されている。私たちが私たちのプラットフォームから発売した最初の候補製品 はNettherton症候群の孤児適応に集中している。BarbatiとSunの研究に基づいて、私たちは2030年中期まで、この候補製品は2.5億ドルの世界販売機会を代表すると信じています。私たちが狙っている病気は良い特徴を持っていて、通常は単遺伝子変異です。また,ゲノム配列決定時代 は遺伝子検出においてこれまでにない進歩を迎えている。現在,100種類以上のまれな皮膚病の分子病理生理学が定義されている。
私たちの会社情報は
私たちは2014年1月2日にデラウェア州法律登録により設立されました. 私たちの主な実行事務室はコネチカット州ブランフォード商業園大通り21号にあります。郵便番号:06405、電話番号は(203)646-6446です。私たちのサイトの住所はwww.azitrainc.comです。 本募集説明書に含まれているか、または本募集説明書でアクセス可能な情報は本募集説明書に含まれていません。本募集説明書に含まれているか、または本サイトを介してアクセス可能ないかなる情報も本募集説明書の一部と見なしてはいけませんし、 が私たちの普通株を購入するかどうかを決定する際に考慮すべきではありません。
私たちは私たちの会社名を含めてアメリカと外国の登録商標を持っている。本入札明細書に記載されている他のすべての商標または商品名 は、そのそれぞれの所有者の財産である。便宜上、本明細書の商標および商品名の両方は、記号および使用されないが、そのような参照は、それぞれの所有者が、適用法に従ってその権利を最大限に主張するいかなる兆候もないと解釈されるべきではない。
| 4 |
私たちは証券の私募を転換することができます
Br日まで、私たちは一連の非公開配給を通じて私たちの転換可能な優先株と転換可能な本チケットを販売して、私たちの業務を資本化しました。これらはすべて今回の発行が完了した後に私たちの普通株に変換します
| ● | 2017年3月の配給205,385株Aシリーズは優先株に転換でき、価格は1株16.25ドルで、今回の発行を完了すると1,458,234株の普通株 に転換される | |
| ● | 2019年2月に1株37.50ドルで380,657株を私たちA-1シリーズに転換可能な優先株を販売し、 今回の発行が完了した後、2,958,120株に転換します | |
| ● | 2020年9月に1株43.45ドルで392,000株のBシリーズを優先株に転換でき、完成後は3,277,083株の普通株に転換する | |
| ● | 2021年1月に、それによって生成されたすべての計算および未払い利息と共に、2023年1月に23,432株Bシリーズ転換可能な優先株に変換された100万ドルの無担保転換可能なチケットを配給する | |
| ● | 当社は2022年9月に435万ドルの無担保転換可能な本チケットを配給し、元金は本チケットの項目のすべての計算と未払い利息と一緒に販売されている。今回の発行が終了する直前に、完全に希釈した上で、 1株当たりの転換価格は(I)3000万ドルに等しく、私たちが発行した普通株式数と発行済み普通株数で割った低い者は、 が私たちの普通株式または(Ii)に変換できるかどうか今回の発行では1株当たり価格の50%です。 |
| 5 |
他に説明がある以外に、本募集説明書の当社が発行した普通株に関するすべての資料は、上記の転換可能優先株および変換可能手形が今回の発売完了後に合計約9,542,519株式当社普通株に自動的に変換されると仮定している。
私たちの大文字を変更する
2023年5月17日、私たちは(I)私たちの法定普通株を1,950,000株から100,000,000株に増加させ、(Ii)私たちの株式額面を0.10ドルから0.0001ドルに変更し、(Iii)私たちの会社名 を“Azitra Inc.”から“Azitra,Inc.”に変更するために、当社の登録証明書を修正し、再記載した。および(Iv)我々が発行した普通株に対して7.1対1の長期株式分割,または株式分割を行う.本募集説明書 が発効した後、私たちはわが社の登録証明書をさらに修正して再記載し、10,000,000株の“空白小切手”優先株の発行を許可する予定です。株式 分割と,上記の直前に議論したすべての発行された変換可能優先株と変換可能手形 を実施した後,10,586,510株の普通株が今回の発売 終了直前に発行および発行される.
本募集説明書には別途説明があるほか、本募集説明書内のすべての株式及び株価資料は株式分割を実施するために調整されている。なお、本募集説明書の他の箇所に含まれる財務諸表 および本募集説明書には別の説明があるほか、本募集説明書における当社が発行した普通株に関するすべての情報は、上記変換可能優先株と変換可能手形が今回の発売完了後に自動的に変換されると仮定している。
新興成長型会社としての影響
JumpStart Our Business Startups Act(JumpStart Our Business Startups Act)やJOBS法案は2012年4月に公布され、米国での資本形成を奨励し、“新興成長型会社”の資格を満たす新上場企業の監督管理負担を軽減することを目的としている。 私たちはJOBS法案が指す新興成長型会社である。新興成長型企業として、私たちは様々な公開報告書の要求に制限されないように、いくつかの免除を利用するかもしれない
| ● | 2002年のサバンズ-オキシリー法404節の規定によると、財務報告の内部統制は、私たちの独立公認会計士事務所によって証明されなければならない | |
| ● | 本募集説明書および当社の定期報告および委託書に役員報酬に関するいくつかの要件を開示すること | |
| ● | 役員報酬や金パラシュート報酬に拘束力のない相談投票を行うことを要求します | |
| ● | 民間企業が新たな財務会計基準または改正財務会計基準の遵守を要求されるまで、新たなまたは改正された財務会計基準の遵守を延期することができる。 |
私たちは上で議論された“雇用法案”の免除を利用して、私たちが新興成長型会社ではなくなるまで利用することができる。私たちは(1)財政年度の最終日まで、私たちの年収が10.7億ドルに達するか、またはそれを超える新興成長型会社を維持します。(2)“大型加速申告会社”の資格に適合し、非関連会社が少なくとも7億ドルの株式証券を持っています。(3)私たちは任意の3年間で10億ドルを超える転換不可能債券 を発行しました。または(4)私たちの初公募5周年後に終了した財政年度の最終日。
私たち は“雇用法案”の下の部分(すべてではない)福祉を利用することを選択することができる。私たちは で議論された他のすべての免除を利用することを選択した。したがって、本稿およびその後に米国証券取引委員会に提出される文書に含まれる情報は、あなたが株式を持っている他の上場企業から受け取った情報とは異なる可能性があります。
新興成長型会社としての私たちの地位に関するいくつかのリスクについては、本募集説明書を参照してください“リスクbr要因−今回の発行と我々の普通株保有に関するリスク−雇用法案によると,我々は“新興成長型会社”であり,新興成長型会社に適用される開示要求を低下させることが,我々の普通株の投資家に対する吸引力を低下させるかどうかは確定できない.”
小さな報告会社としての影響
また, 我々はS−K法規第10(F)(1)条で定義されている“小さな報告会社”である。より小さい報告会社は、監査された財務諸表のみを2年間提供することを含むいくつかの減少した開示義務を利用する可能性がある。当社は、本年度の最終日まで、(1)前期第2四半期末まで、非関連会社が保有する私たちの普通株の時価が2.5億ドル以上となるまで、より小さな報告会社となる。または(2)完成した財政年度内に、私たちの年収brは1億ドル以上であり、会計年度第2四半期の終了までに、非付属会社が保有する私たちの普通株の時価は7億ドル以上である。
| 6 |
製品
| 発行人 | Azitra, Inc. | |
| 普通株式を提供する | 1500,000株です。 | |
| 今回の発行後は普通株式 を発行します | 12,086,510株普通株式(または12,311,510株は、引受業者が追加株式を購入する場合の選択権が全て行使されている)。 | |
| 超過配給オプション | 我々はすでに引受業者に本募集説明書の発表日から45日間以内に、初回公開価格から引受割引を引いて最大225,000株の普通株を購入する選択権を付与して、超過配給(あれば)を補う。 | |
| 収益を使用する | 今回の発行から普通株を売却して約650万ドルの純収益を得,引受業者 がその超過配給選択権を全面的に行使すれば約750万ドルを獲得すると予想される.今回発行された純収益を,我々の既存の現金や現金等価物とともに臨床試験や製品開発,研究開発,臨床製造および運営資金や他の一般企業用途に利用する予定である。 タイトルを参照してください“収益の使用“この製品加工の期待用途に関するより多くの 完全な説明は、本募集説明書を参照してください。 | |
| 取引市場と取引記号 | 私たちの普通株はニューヨーク証券取引所アメリカ取引所への上場が許可されており、コードは“AZTR”です | |
| リスク要因 | 私たちの普通株に投資することは高い危険と関連がある。“”というタイトルの部分を参照リスク要因 “11ページ目および本入札明細書の他の情報から始めて、私たちの普通株式に投資することを決定する前によく考慮すべき要因を検討します。 | |
| ロックする | いくつかの例外を除いて、私たちのすべての取締役、高級管理者、および0.5%以上の普通株を持つ株主は、売却、要約売却、売却同意、売却契約の締結、担保、質権、任意の購入選択権を付与することに同意しました。六(6)ヶ月または12(12)ヶ月の間、直接または間接的に空売りするか、または当社の株式の任意の株式または行使可能または交換可能な株式に変換または交換可能な任意の証券を処理またはヘッジする。本募集説明書の発行日後、代表者の事前書面による同意は得られません。適用禁止期間 が満期になった後、私たちの普通株のすべての発行済み株式と発行済み株は将来的に販売する資格がありますが、適用される数量、販売方式、 保有期間、規則144の他の制限を受けます。本募集説明書の“br”と題する部分を参照してください引受販売“より多くの情報を得るために。 |
| 7 |
今回の発行後の我々の普通株の流通株数は、2023年6月2日現在の10,586,510株流通株(上記株式分割と我々の転換可能優先株と転換可能本票の転換発効後)に基づいており、含まれていない
| ● | 1,290,319株我々の普通株brは、2016年の株式インセンティブ計画に基づいて付与され、未償還オプションを行使する際に発行することができ、加重平均行権価格は1株1.33ドルである。 または2016年計画; | |
| ● | 約275,210株私たちの普通株は発行された株式承認証を行使する時に発行することができ、加重平均行権価格は1株当たり4.23ドルである | |
| ● | 引受業者の超過配給選択権に応じて、最大225,000株を発行することができる | |
| ● | 引受権証を行使すると60,000株 を発行することができ,引受業者の今回の発行に関する補償の一部 (超過配給選択権があれば最高69,000株 を発行することができる行使価格は1株6.25ドル。そして | |
| ● | 157,989株私たちの普通株brは私たちの2016年計画下の未来奨励のために予約され、2,000,000株私たちの普通株brは私たちの2023年の株式インセンティブ計画下の未来の奨励のために予約されています。2023年計画です |
私たちが他の説明または文脈に別の要求がない限り、本出願明細書のすべての情報は、以下のように仮定される
| ● | 今回の発行終了時に、私たちのすべての転換可能な優先株のすべての流通株と私たちのすべての転換可能株を自動的に変換します | |
| ● | 上記未弁済株式証又はオプションを行使していないこと; | |
| ● | 引受業者の超過配給選択権を行使しない. |
| 8 |
リスクファクターの概要
私たちの業務は、私たちの業務目標を達成することを阻止したり、私たちの業務、運営結果、キャッシュフロー、見通しに悪影響を与える可能性があるリスクを含む多くのリスクに直面しており、私たちの普通株に投資する前にこれらのリスクを考慮する必要があります。これらのリスクは 節でさらに検討されるリスク要因本募集説明書の要約に従った後. いくつかのリスク には:
| ● | 私たちbrは初期臨床生物製薬会社で、運営の歴史が限られている | |
| ● | 私たちbrは重大な運営損失の歴史があり、予測可能な未来には引き続き運営損失が予想される | |
| ● | 私たちは、私たちの業務計画を実行し、運営に資金を提供するために追加の資金が必要になると予想していますが、これらの追加の資金は合理的な条項では得られないかもしれません | |
| ● | 私たちの微生物ライブラリーと遺伝子工学プラットフォームの臨床的および商業的用途は不確定であり、永遠に実現されないかもしれない | |
| ● | 私たちの候補製品は早期開発段階にあるため、広範な臨床前と臨床テストが必要である | |
| ● | 持続的な新冠肺炎疫病は著者らの臨床試験、サプライチェーンと業務発展活動を含む著者らの業務に不利な影響を与える可能性がある | |
| ● | 私たちは私たちの組織の規模を拡大する必要があり、私たちはこのような成長を管理する時に困難に直面するかもしれない | |
| ● | 私たちは現在販売やマーケティング組織を持っていません | |
| ● | 私たちの予測可能な未来では、私たちの候補製品は商業販売のために第三者が生産することに完全に依存します | |
| ● | 私たちのビジネスモデルには、私たちの独自微生物ライブラリーまたは私たちの候補製品の菌株を他の製薬会社にアウトソーシングすることが含まれていますが、製薬業界の技術的許可は長い過程であり、私たちがコントロールできないいくつかのリスクと要因の影響を受けています | |
| ● | 私たちの業務は重要な人員の流出の影響を受けるかもしれない | |
| ● | もし私たちに製品責任訴訟を提起すれば、私たちは重大な責任を負い、私たちの候補製品の商業化を制限することを要求されるかもしれません | |
| ● | 情報技術システムに障害やセキュリティホールが発生した場合、私たちの業務運営は影響を受ける可能性があります | |
| ● | 私たちは他のバイオテクノロジーや製薬会社の医療皮膚病の適応に対する激しい競争に直面しています | |
| ● | 私たちの成功は、FDAと外国司法管轄区域規制機関が私たちの候補製品の発売許可を得ることができるかどうかにかかっています。私たちはこれらの管轄区で私たちの候補製品を販売しようとしていることは保証されません | |
| ● | 私たちのbr臨床試験は、私たちの候補製品または任意の未来の候補製品の安全性と有効性を証明する実質的な証拠がないかもしれない | |
| ● | 私たちの候補製品の臨床前研究の結果は未来の臨床前研究或いは臨床試験の結果を予測できないかもしれない | |
| ● | もし私たちの候補製品が規制部門の承認を得ても、私たちはその製品を商業化することに成功できないかもしれません。私たちがその販売から得た収入(あれば)は限られているかもしれません | |
| ● | 現在と未来の立法は、候補製品の発売承認を得て、それを商業化する難しさとコスト を増加させ、私たちが獲得する可能性のある価格に影響を与えるかもしれない | |
| ● | 私たちの知的財産権を保護することは難しく、コストが高く、私たちはこれらの権利の保護を確保できない | |
| ● | 私たちの候補製品は他人の知的財産権を侵害する可能性があり、これは私たちのコストを増加させ、私たちの開発と商業化努力を遅延または阻害する可能性がある | |
| ● | 活発で流動的で秩序のある株式取引市場は発展できないかもしれない | |
| ● | 将来の増資はあなたの所有権を希釈し、私たちの運営に他の悪影響を及ぼすかもしれません | |
| ● | 私たちの株の市場価格は変動と変動の影響を受けるかもしれない | |
| ● | 効果的な財務報告内部統制制度を維持できなければ、私たちの財務業績を正確に報告したり、不正を防止することができないかもしれません | |
| ● | 私たちは“デラウェア州一般会社法”(DGCL)第204条に基づいていくつかの会社の行為を承認したが、承認や関連会社の行為の有効性に疑問を提起しないと主張しない保証はない | |
| ● | 私たちの定款とデラウェア州法律は株主が有利だと思う買収を阻止するかもしれない。 |
| 9 |
財務データをまとめる
以下の表は私たちの財務データをまとめたものです。あなたはこの要約財務データとタイトルを読むべきです“経営陣の財務状況と経営結果の検討と分析また、当社の財務諸表および関連説明書は、本募集説明書の他の部分に含まれています。2022年及び2021年12月31日までの財政年度及び2021年12月31日現在の財政年度の財務情報は、本募集明細書の他の部分に含まれる監査された財務諸表からのものである。2023年3月31日まで、2023年3月31日まで、2022年3月31日までの3ヶ月間の財務情報は、本募集説明書の他の部分に含まれる未監査財務諸表から来ています。未監査財務諸表は、監査された財務諸表と同じ基礎で作成されています。我々の経営陣は、 未監査の財務諸表は、当該等期間の財務状況と経営業績に必要なすべての調整 を公平に報告することを反映していると考えている。私たちの歴史的結果は必ずしも未来に現れる可能性のある結果を代表するとは限らない。
3ヶ月 終了 3月 31 | 年限 終わり 十二月三十一日 | |||||||||||||||
| (単位は千で、シェアは含まれていない) | 2023 | 2022 | 2022 | 2021 | ||||||||||||
| (未監査) | (未監査) | |||||||||||||||
| 収入.収入 | $ | 113 | $ | 120 | $ | 284 | $ | 110 | ||||||||
| 純損失 | $ | (2,457 | ) | $ | (2,326 | ) | $ | (10,680 | ) | $ | (8,940 | ) | ||||
| 1株当たりの純損失は,ほぼ と割り勘である | $ | (3.00 | ) | (2.86 | ) | $ | (12.74 | ) | $ | (11.20 | ) | |||||
| 純損失-備考と調整後の備考(1)(2) | $ | (5,006 | ) | $ | (2,310 | ) | $ | (14,014 | ) | $ | (8,940 | ) | ||||
| 1株当たりの損失,基本損失とbrを希釈して損失を予想する(1) | $ | (0.48 | ) | (0.22 | ) | $ | (1.32 | ) | $ | (0.85 | ) | |||||
| 1株当たり基本と希釈後の1株当たり損失-調整後の予備試験金額 (2) | $ | (0.39 | ) | $ | (0.19 | ) | $ | (1.08 | ) | $ | (0.69 | ) | ||||
| 2023年3月31日 | ||||||||||||
| (単位:千) | 実際 | PRO 表(1) | Pro
形式は 調整後の(2) | |||||||||
| (未監査) | (未監査) | (未監査) | ||||||||||
| 貸借対照表データ: | ||||||||||||
| 現金と現金等価物 | $ | 1,833 | $ | 1,833 | $ | 8,346 | ||||||
| 運営資本 | $ | 361 | $ | 361 | $ | 6,874 | ||||||
| 総資産 | $ | 5,655 | $ | 5,655 | $ | 12,168 | ||||||
| 転換支払手形(4) | $ | 6,400 | $ | - | $ | - | ||||||
| 転換可能優先株 | $ | (34,819 | ) | $ | - | $ | - | |||||
| 普通株合計 | $ | - | $ | 1 | $ | 1 | ||||||
| 追加実収資本 | $ | 1,093 | $ | 46,024 | $ | 51,368 | ||||||
| 株主権益合計 | $ | (38,679 | ) | $ | 3,550 | $ | 8,894 | |||||
| (1) | 1株当たり予想損失には,我々の転換可能元票の280万ドルの損失が含まれており,予想欄は(I)株式分割を反映しており,(Ii)今回の発売終了時に,我々が発行したすべての転換可能優先株を自動的に7,693,436株の普通株に変換してbr}普通株に再分類し,(Iii)今回の発売終了時に,我々の未償還転換可能元票 手形項のすべての元金と未払い利息を約1,838,775株普通株と追加実収資本に自動変換した。 |
| (2) | 調整後の備考表欄は備考表欄に含まれるすべての調整を反映しており, 本募集説明書が提供する1,500,000株普通株の取引を1株5.00ドルの初回公募価格で売却して発効させた.引受割引と手数料と私たちが支払うべき予想発売コストを差し引いた。 |
| (3) | 私たちはその公正価値に従ってこのツールを会計処理することを選択したので、変換可能な手形の公正価値を表す |
| 10 |
リスク要因
私たちの普通株に対するどんな投資にも高い危険がある。あなたが私たちの普通株に投資することを決定する前に、以下に説明するリスクをよく考慮しなければなりません。これらのリスクは、私たちの業務のいくつかの重大なリスクと、本募集明細書の他の場所に含まれる情報を表していると思います。ここで強調されているリスクは、私たちが直面する可能性のある唯一のリスクではないことに注意してください。例えば、私たちが現在未知で、私たちが現在重要ではないと考えている、または起こりうると考えている他のリスクも、私たちの運営に影響を及ぼす可能性があります。以下のいずれかの事件や実際に私たちが現在未知の他のリスクが発生した場合、私たちの業務、財務状況、および経営業績は重大な悪影響を受ける可能性があります。この場合、私たちの普通株の取引価格はbr}下落する可能性があり、あなたは投資の全部または一部を損失するかもしれません。
私たちの業務に関するリスク
私たちは初期段階の臨床生物製薬会社で、運営の歴史は限られています.
著者らは早期臨床生物製薬会社であり、2014年1月2日に設立され、運営歴史は限られている。限られた贈与やサービス収入を除いて、私たち はまだ事業を創設していません。これまで、私たちの業務は、治療効果を提供するために、私たちの独自微生物ライブラリーの開発、同定、特徴づけ、遺伝子工学、およびいくつかの細菌種のテスト、および私たちの最初の候補製品の開発を含む。私たちの限られた運営履歴 は、潜在的な投資家が私たちの技術や未来の運営を評価することを困難にする。初期段階にある臨床生物製薬会社として、私たちは新しい業務に関連する組織、融資、支出、合併症、遅延に固有のすべてのリスクを負担しなければならない。したがって、私たちの将来性を考慮して、会社が開発の初期段階、特に私たちのような臨床早期バイオ製薬会社がよく遭遇するコスト、不確実性、遅延、困難を考慮すべきです。潜在投資家は運営履歴が限られている会社が直面するリスクと不確実性を慎重に考慮しなければならない。特に潜在的な投資家は考えられないかもしれません
| ● | 私たちの業務計画を実施または実行することに成功するか、または私たちの業務計画が健全である | |
| ● | 臨床前と臨床試験の完成に成功し、そして監督部門の著者らの候補製品に対するマーケティング許可を得た | |
| ● | 我々の正確な皮膚病候補製品brと市場上の現在の製品との良好な差別化を示すことに成功した | |
| ● | 私たちの臨床薬物製品の契約生産に成功し、商業薬物供給を確立した | |
| ● | 私たちの候補製品が市場排他性または十分な知的財産権保護を受けることを確実にする | |
| ● | 経験豊富な管理とコンサルティングチームを引き付けて保持しています | |
| ● | 私たちの候補製品の臨床開発、規制承認、商業化を含む、資本市場で十分な資金を集めて、私たちの業務計画を実施します。 |
投資家 は、発展中に会社が競争環境で遭遇した不確実性に基づいて、私たちへの投資を評価すべきである。 は私たちの努力が成功する保証もなく、最終的に利益を実現できる保証もありません。もし私たちが上記のいずれかを成功させることができなければ、私たちの業務は成功しないかもしれません。あなたの投資は不利な影響を受けるでしょう。あなたはすべての投資を失う準備ができていなければならない。
私たちは重大な運営損失の歴史があり、予測可能な未来に運営損失を継続すると予想されています.
2022年と2021年12月31日までの会計年度では、それぞれ1070万ドルと890万ドルの純損失を計上し、2023年3月31日と2022年3月31日までの3ヶ月間でそれぞれ250万ドルと230万ドルの純損失を計上した。2023年3月31日現在、私たちの累計赤字は3980万ドルです。今回の発売完了後、規制部門の承認を得て、私たちの少なくとも1つの候補製品の商業化に成功しない限り、巨額の費用 が発生し続ける予定です。また、規制部門の承認を得ることができると仮定して、規制部門の最初の候補薬の承認を得るためには、少なくとも発売終了から4~6年が必要だと考えています。たとえ私たちの候補製品を商業化することができても、私たちが相当な収入を生み出したり、利益を達成する保証はありません。
| 11 |
私たちが候補製品を商業化する過程で、私たちは多くの研究、規制、開発費用があると予想されています。そのため、予測可能な未来には、大きな損失を受けることが予想され、これらの損失も増加します。私たちはいつ、または利益を達成できるか、または利益を維持することができるかどうか分からない。もし私たちが未来に利益を達成すれば、私たちは後続期間に収益を維持できないかもしれない。実現して利益を維持できなかったことは、運営を維持する能力を弱める可能性があり、私たちの業務や資金調達能力に悪影響を及ぼす可能性がある。もし私たちが合理的な時間内に正のキャッシュフローを生成できなければ、私たちは私たちの業務計画をさらに実行したり、運営を継続することができないかもしれません。この場合、あなたはすべての投資を損失する可能性があります。
我々の独立公認会計士事務所の2022年12月31日までの年度と2023年3月31日までの3カ月の報告 は,我々の累積赤字,経常的運営キャッシュフローと負キャッシュフローにより,継続的に経営する企業として継続的に経営する能力があるかどうかが深刻に疑われていることを指摘している。
私たちは、私たちの業務計画を実行し、運営に資金を提供するために追加の資金が必要になると予想していますが、これらの追加資金は合理的な条項や根本的に得られないかもしれません。
2023年3月31日現在、私たちの総資産は570万ドル、運営資本は36.1万ドルです。今回発行された純収益は,募集説明書日までの手元の現金に加えて,ATR−12で提案された1 b段階臨床試験の用量とATR−04で提案された1 b段階臨床試験の初期 登録を含む少なくとも今後12カ月以内に提案されたbr運営計画を支払うのに十分であると信じている。しかし、本募集説明書が発表された日まで、今後12ヶ月以内に追加の資本が必要であり、追加的な資本がすぐに必要ではないという保証はありません。また, 我々は,ATR-12とATR-04が上場承認を得ることができると仮定すると,このような承認を得るためには追加の資金が必要となると考えられる. 私たちは、私たちの株式や債務証券の売却、私たちの技術と業界パートナーとの合弁企業に許可料を支払うなど、様々な融資源を通じてより多くの資金を求めるつもりです。また、現在の業務計画の代替案を考慮して、少ない資本で創収業務と有意義なビジネス成功を実現できるようにします。しかし、これらの資金が商業的に合理的な条項で利用できる保証はありません(あれば)。このような融資を満足できる条項で得ることができなければ、私たちの業務計画をさらに実行できない可能性もあり、運営を継続できない可能性があり、この場合、すべての投資を損失する可能性があります。
私たちの微生物ライブラリーと遺伝子工学プラットフォームの臨床と商業用途は不確定であり、永遠に実現されないかもしれない
著者らは、約1,500個の独特な細菌菌株から構成され、独特の治療特徴をスクリーニングすることができる微生物ライブラリーを含む独自のプラットフォームを構築した。このプラットフォームは人工知能,機械学習,遺伝工学技術によって拡張された。これまで私たちの重点は遺伝子工学株の開発でした表皮ブドウ球菌は皮膚疾患治療プロジェクトの最適な治療候補種であると考えられる。しかし遺伝子工学は表皮ブドウ球菌斬新で実証されていない治療パターンです本募集説明書の発表日までに、私たちは私たちの特許菌株をテストして評価しました表皮ブドウ球菌臨床前研究が行われており,安全性,耐性あるいは有効性を評価するための臨床試験は行われていない。私たちは現在2023年上半期に私たちのATR-12の1 b段階臨床試験を開始し、2024年上半期に私たちのATR-04候補製品の1 b段階臨床試験を開始する予定である。しかし,早期臨床試験の成功は大規模臨床試験の成功を確保することはできず,最終結果を予測することもできない。われわれが提案した1 b期臨床試験終了後も,最初の候補品は一部の患者でのみ試験を行った。私たちがより大きな臨床試験に拡張するにつれて、これらの臨床試験の結果は必ずしも私たちの候補製品或いは私たちの製品の安全性と耐性或いはbrの有効性を表明するとは限らないかもしれない。これまで、安全性、有効性、純度、および有効性を支持するのに十分な臨床的証拠をFDAに提供することができれば、FDAが私たちの特許製品の任意の適応を承認するのに十分な声明を提供することができれば、私たちの独自微生物ライブラリーおよび遺伝子工学プラットフォームはまだ確認されていないであろう。
| 12 |
我々の候補製品は早期開発段階にあるため,広範な臨床前と臨床 テストが必要である。前臨床研究または早期臨床試験の成功は未来の臨床試験の結果を代表しない可能性があり、私たちはあなたに行われている、計画中、あるいは未来の臨床試験が必要な監督管理の承認を得るのに十分な結果 を生成することを保証することはできない
われわれの候補製品は早期開発段階にあるため,広範な臨床前と臨床試験が必要である。ATR-12およびATR-04は私たちの唯一の候補製品であり、私たちはすでに有意義な臨床前研究を行っている。今回の発売後,我々は2023年上半期にATR−12の1 b段階臨床試験を開始し,ATR−04 1 b段階臨床試験のIND申請を2023年末までに提出する予定である。前臨床試験と早期臨床試験の成功は、今後の臨床試験が同じ結果をもたらすことを保証することができない、あるいは他の方法で十分なデータを提供して候補製品の有効性と安全性を証明することができる。臨床前研究と1 b期の臨床試験は主に安全性のテスト、薬物動態学と薬効学の研究に用いられ、そして異なる用量とスケジュールの候補製品の副作用を理解する。1 b期臨床試験はまた、ある疾患の新しい治療法に対する反応がどうかをテストした。臨床前研究と早期臨床試験の成功は後の治療効果試験が成功することを確保できず、最終結果を予測することもできない。我々の候補製品は,臨床前研究で積極的な結果が得られたにもかかわらず,あるいは早期の臨床試験に成功しても,臨床 開発において期待される安全性と有効性を示すことができない可能性がある。
また,臨床試験の設計はその結果が製品の承認を支持しているかどうかを決定することができるが,臨床試験設計における欠陥は臨床試験の進展が良好になるまで明らかにならない可能性がある。組織として、著者らは臨床試験の設計における経験が限られており、臨床試験を設計と実行して監督部門の承認を支持することができないかもしれない。製薬と生物技術業界の多くの会社はすべて重大な挫折に遭遇し、臨床前テストと早期臨床試験は人を奮い立たせる結果を得た後、依然として後期臨床試験で成功できなかった。臨床前と臨床活動から得られたデータは異なる解釈を受ける可能性があり、これは監督部門の承認を延期、制限或いは阻止する可能性がある。
さらに、私たちは、規制の承認のために、またはいつ、私たちの任意の候補製品に生物製品ライセンス申請またはBLAを提出する可能性があるかどうか、またはそのようなBLAがFDAによって審査を受けるかどうか、または任意のBLAが審査後に承認されるかどうかを確実に予測することはできない。われわれの臨床試験が計画通りに完了しても,彼らの結果がわれわれが提案したbr適応を支持しているかどうかは確認できない。前臨床試験や早期臨床試験の成功は今後の臨床試験も成功することは確保できず,今後の臨床試験の結果が従来の臨床試験や前臨床試験の結果をコピーすることは確保できない。br}臨床試験過程では,我々の候補製品がその提案の用途に対して安全かつ有効であることが証明できない可能性がある。この失敗 は,ある候補製品を放棄し,他の候補製品の開発を遅延させる可能性がある.我々の臨床試験のいかなる遅延または終了も遅延し、FDAへの任意のBLASの提出を阻止し、最終的に候補製品を商業化し、製品収入を創出する能力に影響を与える可能性がある。
持続的な新冠肺炎疫病は著者らの臨床試験、サプライチェーンと業務発展活動を含む著者らの業務に不利な影響を与える可能性がある
持続的な新冠肺炎の大流行に対して、各国政府はすでに重大な措置を取り、企業の閉鎖、隔離、旅行制限とその他の社会距離指令を含み、ウイルスの伝播を制御することを目的としている。疾病と対策 はここ数ヶ月である程度軽減されているが、この大流行の影響は引き続き社会の多くの方面 に広く影響し、引き続き世界経済及び世界各地の企業と資本市場に重大な破壊をもたらす可能性がある。持続的な新冠肺炎疫病のため、多くの製薬会社の臨床試験は遅延と一時停止が出現し、その中には:
| ● | 患者の臨床試験の登録と維持に遅延或いは困難が出現した | |
| ● | 持続的な新冠肺炎疫病が政府と商業運航組織に与える影響により、その臨床試験に必要な用品、サンプル或いは製品の遅延或いは適時な輸送と交付が困難である |
| 13 |
| ● | 任意の必要な契約を達成することが困難であること、IRB審査を適時に成功させること、または臨床現場調査員と臨床現場スタッフを募集することを含む、臨床現場起動遅延または困難 | |
| ● | サプライチェーンの中断は、著者らの臨床前研究と臨床試験に必要な原材料、製造設備、活性薬物成分と完成品の不足を招く | |
| ● | 持続的に発生する新冠肺炎への応答の一部として,地方法規における変更 は臨床試験を行う方式を変更する必要がある可能性があり,意外なbrコストを招き,あるいは臨床試験を完全に停止させる可能性がある。 |
これらの や我々の運営やグローバル経済における他の中断は,我々の業務,運営実績,財務状況 に負の影響を与える可能性がある.
私たちは私たちの組織の規模を拡大する必要があり、私たちはこのような成長を管理する時に困難に直面するかもしれません.
私たちの発展や商業化計画や戦略の発展に伴い、従業員やコンサルタント/請負業者の規模を拡大する必要があります。将来の成長は、確定、採用、メンテナンス、 の激励、より多くの従業員の統合を含む管理層メンバーにより多くの責任を負わせるだろう。また、私たちの経営陣は、私たちの日常活動から不比例な注意を移し、これらの成長活動を管理するために多くの時間を投入しなければならないかもしれない。私たちの将来の財務業績 と、私たちの候補製品と他の候補製品を商業化する能力と、私たちの効果的な競争能力 は、私たちが未来の成長を効果的に管理する能力にある程度依存するだろう。
もし私たちが高い素質の人材の誘致と維持に成功できなければ、私たちは私たちの業務 戦略を成功的に実施することができないかもしれない。また、上級管理職のサービスを失うことは、私たちの業務の将来性に悪影響を及ぼすだろうそれは.私たちの管理チームは薬物開発と商業化の多くの異なる点で専門的な知識を持っている。しかし、競争の激しい製薬業界における競争能力は、高い素質の管理、科学と医療者を誘致し、維持する能力に大きく依存している。私たちが私たちの候補製品をさらに開発する時、私たちはもっと多くの人員を募集する必要があるだろう。私たちの市場は熟練人材に対する競争は非常に激しいが、経験豊富な科学者に対する競争は私たちが受け入れ可能な条件で高い素質のbr人員を採用と維持する能力を制限するかもしれない。私たちは価値のある従業員を引き留めるために努力しているにもかかわらず、私たちの管理チーム、科学チーム、医療チームのメンバーは短時間で私たちとの雇用関係を終了するかもしれない。私たちの役員や他の重要な従業員のサービスを失ったり、目標幹部を採用することができなくなったりして、私たちの業務、運営業績、財務状況を潜在的に損なう可能性があります。特に, CEOを失ったサービスは我々の業務に大きな悪影響を与えると考えられる.
私たちと適格な人材を競争する他の生物製薬会社は、私たちよりも多くの財務と他の資源、異なるリスク の概況、そしてより長い業界の歴史を持っています。それらはまた、より多様な機会およびより良い職業昇進機会 を提供することができる。このような特徴の中のいくつかは私たちが提供したより高い素質の応募者を引き付けるかもしれない。もし私たちが引き続き高い素質の人材を誘致し、維持することができなければ、私たちが候補製品を開発と商業化する速度と成功は制限される。
私たち は現在販売とマーケティング組織がありません。もし私たちが満足できる販売とマーケティング能力を確立できない場合、あるいは第三者の販売とマーケティング関係を得ることができなければ、私たちの任意の候補製品を商業化することに成功できないかもしれません.
現在、私たちは販売やマーケティングをしていません。私たちの1つ以上の薬物製品に必要な規制の承認を初歩的に受けた後、私たちはアメリカで私たちの開発計画を商業化する能力を確立することを計画しており、私たちの開発計画は皮膚病の治療のための活性生物治療製品と組換えタンパク質に重点を置いており、そこでは、適応を目指す患者集団と医学専門家が十分に集中しており、的確な販売チームを通じて私たちの製品を効果的に普及させることができると信じている。商業化が私たちにとって資本効率が低いかもしれない他の市場では、私たちの候補製品のビジネス潜在力を最大限に発揮するために、第三者との戦略的協力を選択的に求めることができるかもしれない。場合によっては、私たちの微生物ライブラリーや特許権の許可を求めたり、共同開発計画を達成したりする可能性があります。販売·マーケティング担当者の募集、販売·マーケティングインフラの構築、または第三者との適切な協力手配に成功しなければ、私たちの候補製品の商業化に成功することは困難であり、私たちの業務、運営実績、財務状況に悪影響を及ぼすだろう。
| 14 |
私たちが第三者マーケティングと流通手配を締結しても、これらの第三者の販売、マーケティング、流通活動の制御は限られている可能性があり、コントロール権さえないかもしれない。私たちの将来の収入はこれらの第三者の努力の成功に大きく依存するかもしれません。販売とマーケティングインフラの構築において、私たちは資金の豊富な老舗製薬会社とバイオテクノロジー会社と競争して、販売とマーケティング担当者を募集、採用、訓練、維持しなければなりません。内部販売組織の確立を阻害する可能性があり、または第三者との連携計画を達成することを阻害する可能性がある要因は、
| ● | 私たちは十分な数の効果的な販売とマーケティング担当者を募集して維持することができない | |
| ● | 販売員は十分な数の医者に接触したり、私たちの候補製品を出すように説得することができません | |
| ● | 販売員は補充可能な製品が不足しており、これは私たちがより広い製品ラインを持つ会社と比較して競争劣勢になる可能性がある | |
| ● | 内部販売およびマーケティング組織の作成に関連する予測不可能なコストおよび費用。 |
予測可能な将来、私たちのbrは、商業販売のために第三者が私たちの候補製品を生産することに完全に依存し、もしこれらの第三者がFDAまたは同様の外国規制機関の生産許可を得られなかった場合、十分な数の候補製品を提供できなかったか、または許容可能な品質レベルまたは価格で商業化できなかった場合、私たちの候補製品の商業化は停止、延期、または利益低下する可能性がある.
私たちは現在の候補製品を商業生産するための製造施設を所有または運営していません。著者らは現在第三者契約メーカーに依存して、著者らの臨床前研究と臨床試験に必要なすべての原材料、製造設備と活性薬物成分 を提供している。私たちはコネチカット州グロートン工場で臨床試験brのために完成品を生産することができますが、私たちは第三者に依存して商業販売のための完成品を生産します。私たちはこのような第三者のいずれかと長期的な合意を締結しなかった。私たちは現在、商業用品の契約関係もありません。 私たちは、未来の生産のために第三者契約メーカーと1つ以上のバックアップメーカーと合意するつもりです。 私たちは、私たちが開発した任意の製品の未来の開発と商業のための製造能力を構築する可能性を分析しています。このような製品は、FDAおよび我々が承認を求めている他の管轄区域規制機関の要求に適合した施設およびプロセスで生産される必要がある。また,いずれかの候補製品が商業化されることが承認された場合,契約メーカーに依存して臨床前研究,臨床試験,商業生産を行う義務がある。
私たちまたは任意の契約製造業者が、私たちの原材料、製造設備、活性医薬成分および完成品を生産するための施設は、FDAまたは同様の外国規制機関の承認を受けなければならない。このような承認は検査 を受け,検査は我々がFDAや他の関連規制機関にBLAを提出した後に行う.これまで、私たちが自分の製造施設を設立すれば、私たちは候補製品の製造過程を制御することはなく、私たちの契約製造パートナーは、私たちの原材料、製造設備、活性医薬成分、完成品を生産するために、現在の良好な製造実践、すなわちcGMPに完全に依存します。これらのcGMP法規は、私たちの候補製品に関連する製造、テスト、品質管理、貯蔵、流通、記録保存のあらゆる面をカバーしています。もし私たちの契約メーカーが私たちの規格 やFDAや他の機関の厳格な規制要求に合った材料を生産することに成功しなければ、私たちはその製造工場で生産された製品 を確保または維持することができなくなります。FDAや同様の外国規制機関がこれらの施設を承認して私たちの候補製品を生産しない場合、または将来的にそのような承認を撤回すれば、代替製造施設を探す必要があるかもしれません。これは、私たちの臨床試験を著しく延期し、規制機関の承認を得たり、規制機関の承認を得たり、私たちの候補製品をマーケティングする能力に影響を与えるかもしれません。同様に、私たちの任意の契約製造業者が私たちとの業務関係を終了することを選択すれば、私たちは否定的な影響を受けるかもしれません。
| 15 |
我々の契約メーカーは、cGMPや類似の法規要件に適合しているかどうかを知るために、FDAおよび対応する州と外国機関の持続的な定期抜き打ち検査を受ける。私たちは私たちの契約製造業者がこのような規制と基準を遵守する状況を統制できない。もし私たちの任意の契約製造業者が適用された法規を遵守できなかった場合、罰金、禁止、民事処罰、私たちのいかなる製品の上場を許可できなかったか、br候補製品、遅延、一時停止または承認撤回、製品、運営制限、刑事起訴を含む制裁を実施する可能性があり、これらのいずれも私たちの業務に重大な悪影響を及ぼす可能性がある。しかも、私たちの契約製造業者が十分な品質管理、品質保証、合格者の能力を維持することはコントロールできないだろう。もし私たちの契約製造業者がこれらの基準のいずれかを遵守または維持できなかった場合、私たちの開発、製造、規制機関の承認、または私たちの任意の候補製品を販売する能力に悪影響を及ぼす可能性がある。
もし、 がいかなる理由でも、これらの第三者が私たちの義務を履行することができないか、または履行したくない場合、私たちは代替製造業者や調合業者を見つけることができず、彼らと有利な合意を達成することができない可能性があり、どのような第三者が将来の要求を満たす製造能力を持っているかどうかを決定することはできない。もしこれらの製造業者または任意の完成品薬品代替メーカーがそれぞれの生産プロセスにおいて、私たちが必要な原材料、製造設備、活性薬物成分または完成品の任意の重大なbr困難に遭遇した場合、あるいは任意の原因で私たちとの業務往来を停止する場合、私たちの臨床試験は重大な遅延が生じる可能性があり、私たちの任意の候補製品の供給は重大な中断が発生する可能性があり、あるいは私たちの候補製品brを提供できない可能性がある。
どんな製造問題や代行メーカーを失っても、私たちの運営に中断をもたらし、開発と臨床試験の遅延と販売損失を招く可能性がある。また,我々の製品を生産するために必要な原材料 候補製品を第三者に提供することに依存する.このようなサプライヤーへの依存は、重要な材料が得られない可能性があり、生産コスト、交付スケジュール、信頼性、品質の制御の減少を含むいくつかのリスクに関連する可能性がある。サプライヤー問題は私たちの契約メーカーの一つの運営に対するいかなる意外な中断も私たちの任意の候補製品の出荷を遅延させる可能性があり、私たちの販売商品のコストを増加させ、臨床試験の遅延または販売損失を招く可能性がある。
私たちのビジネスモデルには、私たちの独自微生物ライブラリーまたは私たちの候補製品の菌株を他のbr生物製薬会社に付与することが含まれていますが、バイオ製薬業界の技術許可は長い過程であり、私たちが制御できないいくつかのリスクと要因の影響を受けており、私たちが私たちの技術許可を超えたり、新しい許可関係を構築するのに要する時間を予測することができません。
私たちのビジネスモデルは、私たちの独自微生物ライブラリーまたは私たちの候補製品br中の菌株を潜在的に外部にアウトソーシングするか、または他の生物製薬会社に開発することを含む。このような計画は、通常、私たちの潜在的なパートナーまたは許可者による予備実行可能性テストおよび評価から始まります。実行可能性テストが成功したと仮定して、私たちが成功したテストを商業許可または共同開発プロトコルに変換する能力は、多くのリスクと要素に依存し、その中の多くのリスクと要素は私たちの制御範囲内ではない
| ● | 製薬業界のメンバーは一般的に新技術を採用し、採用する速度 | |
| ● | 我々の潜在的なライセンシーによるマーケティング皮膚病製品の経済効果の内部評価 この製品は、予想される利点や を考慮することなく、私たちの潜在的なパートナーまたは被許可者が開発または商業販売している他の製品と競合する可能性がある。私たちの技術や製品の利点は | |
| ● | 私たちの潜在的なパートナー/許可側の内部予算と製品開発問題は、彼らが資本と人的資源を私たちの技術または製品の開発と商業化に投入する能力、および | |
| ● | 私たちの潜在的なパートナー/許可側は、前払い費用と継続印税の要求を受け入れてくれるかどうか。 |
| 16 |
さらに、多くの場合、私たちの潜在的なパートナーまたは許可された側は、様々な薬物および薬物送達レジメンの一部を評価し、任意の決定を下す前に、または新薬製品の開発を約束する前に、早期実行可能性テストを我々と共に行う可能性があると考えられる。したがって,我々のプラットフォームが早期フィージビリティスタディに成功しても,我々の潜在的パートナー/ライセンシー は,我々の技術性能に関係なく我々とライセンス契約を締結しないことを決定する可能性がある.したがって,我々 は我々が提案する許可モデルがどの程度成功するかを予測することができない.
もし私たちに製品責任訴訟を提起すれば、私たちは大量の責任を負うことができて、私たちの候補製品の商業化を制限することを要求されるかもしれません.
私たちの候補製品の臨床テストのため、私たちは潜在的な製品責任リスクに直面し、任意の候補製品を商業化すれば、私たちはもっと大きなこのような責任リスクに直面します。例えば、私たちが開発した任意の製品(私たちの任意の候補製品を含む)または私たちが候補製品で使用した任意の材料が傷害の疑いがある場合、または製品テスト、製造、マーケティング、または販売中に不適切なことが発見された場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、製品固有の危険について警告、不注意、厳格な責任と保証違反の告発を含む可能性がある。アメリカでは、州消費者保護法によって、私たちにクレームをつけることもできる。もし私たちが製品責任クレームを弁護することに成功できなければ、私たちは巨額の責任を負うか、あるいは私たちの候補製品の商業化を制限することを要求されるかもしれない。これらのクレームを正当化することに成功しても、私たちは大量の財務と管理資源を使用する必要があります。事件がどうであっても、最終的な結果にかかわらず、責任クレームは:
| ● | 私たちの候補製品や私たちが開発する可能性のある未来の製品への需要を減らしました | |
| ● | 私たちの名声を損なう | |
| ● | 私たちの候補製品に対する規制部門の承認を得られなかった | |
| ● | 臨床試験から撤退した参加者は | |
| ● | 当方関連訴訟弁護に関する費用 ; | |
| ● | 私たちの経営陣の時間と資源を移す | |
| ● | 試験参加者または患者に巨額の金銭的報酬を支給する | |
| ● | 製品 リコール、撤回またはラベル付け、マーケティングまたは販売促進制限; | |
| ● | 私たちの候補品の一部や全てを商業化することはできません | |
| ● | 私たちの株の価値は下落した。 |
本募集説明書の発表日までに、私たちが加入した製品責任保険は私たちの現在の臨床テストと開発レベルを満たすのに十分である。しかし、私たちが初期製品の商業販売を開始する時、私たちは追加の製品責任保険が必要になります。 私たちは受け入れ可能なコストで十分な製品責任保険を獲得して保持することができません。潜在的な製品責任クレームを防止することができません。私たちが開発した製品はその商業化を阻止または阻害する可能性があります。私たちはこのような保険金額を獲得し、維持するために努力しますが、私たちに対するいかなるクレームも、裁判所の判決や和解の金額が私たちの保険範囲内にない、あるいは私たちの保険範囲を超えてしまう可能性があります。私たちの保険リストも様々な排除があり、私たちは保険範囲のない製品責任クレームの影響を受ける可能性があります。私たちは、私たちの保険範囲の制限を超えたり、私たちの保険範囲内にない任意の裁判所によって裁決されたり、和解合意で協議された任意の金額を支払う必要があるかもしれません。私たちは、これらの金額を支払うために十分な資本を得ることができないか、または得ることができません。
情報技術システムに障害やセキュリティホールがあれば、私たちの業務運営は影響を受ける可能性があります.
我々は内部情報技術やネットワークシステムで十分なセキュリティ対策を実施していると考えられるが,我々の情報技術システムはセキュリティホール,コンピュータウイルス,自然災害,テロ,通信障害の影響を受ける可能性がある.独自の情報および商業機密が失われる可能性に加えて、どんなシステム障害やセキュリティホールも、私たちの運営を中断させる可能性があります。もしいかなる中断またはセキュリティホールが私たちの機密情報を不適切に開示することを招いた場合、私たちの競争地位は不利な影響を受ける可能性があり、私たちはこれらの中断またはセキュリティホールによる損害を修復するための責任または追加コストを生じる可能性がある。
| 17 |
我々は他のバイオテクノロジーや製薬会社の医療皮膚病適応に対する激しい競争に直面しており,有効に競争できなければ,我々の経営業績は影響を受ける。
皮膚病治療市場の競争は激しく、重大な技術発展のリードを受けている。私たちがbrが規制部門の候補薬物の承認を得ることに成功すれば、私たちの業界から発売される他の承認療法やbr薬物の激しい競争に直面すると予想される。他のブランド、後発薬、または非処方薬の効果が悪くても、コストや利便性に基づいて、私たちの製品よりも早く医師や患者に採用される可能性がある。
製品規制に関するリスク
私たちの成功は私たちがFDAと外国管轄区域規制機関が私たちの候補製品の発売許可を得ることができるかどうかに完全にかかっており、私たちはこれらの管轄区域で私たちの候補製品をマーケティングしようとしていることは保証されない。
私たちの候補製品を処方薬製品としてアメリカで販売することは許可されていません。FDAのBLAの承認を得るまで、あるいは私たちがこれらの国/地域の必要な承認を得るまで、私たちはいかなる外国でも私たちの候補製品を販売することは許されません。米国では,FDAは通常,各生物の臨床試験を完了してその安全性と有効性を決定し,その品質を確保するために広範な薬物開発を行い,その後BLAを承認することが求められている。大量に開発されている生物製品のうち,一部 のみがFDAにBLAを提出しており,最終的に商業化が許可されているものはさらに少なくなる。本募集説明書の発表日までに、我々はBLAをFDAに提出しておらず、他の規制機関にもどのような候補製品の類似申請も提出していない。
私たちのbrの成功は私たちが上述の規制の承認を得るかどうかにかかっていますが、このような規制の承認の発行は不確定であり、多くのリスクの影響を受けています
| ● | このようなbr当局は、私たちの臨床試験または任意の協力者の臨床試験の数、設計、規模、実施または実施に同意しないかもしれない | |
| ● | このような 当局は私たちの臨床前研究や臨床 試験データの解釈に同意しないかもしれないし、研究結果を私たちの現在または未来の候補製品の前兆として使用するかもしれない; | |
| ● | 毒理学研究結果は著者らの候補製品の研究新薬申請、br或いはIND或いはBLAの提出を支持しない可能性がある | |
| ● | FDAまたは同様の外国の規制機関または機関審査委員会は、私たちの臨床試験の設計または実施に同意しないかもしれない | |
| ● | 私たちの候補製品の安全性と の有効性に許容できる証拠を提供できないかもしれません | |
| ● | 著者らの臨床試験の結果は満足できない可能性があり、あるいはFDA、ヨーロッパ薬品管理局或いはEMA或いは他の監督機関が私たちの任意の候補製品の上場承認に要求する統計レベル或いは臨床意義に符合しない可能性がある | |
| ● | 特定の臨床試験における私たちの候補製品の用量は最適なbrレベルではないかもしれない | |
| ● | われわれの臨床試験中の患者 は副作用が出現する可能性があり、原因は私たちの候補製品に関係している可能性もあり、関連していない可能性がある | |
| ● | 臨床試験から収集されたデータは、BLAまたは他の提出をサポートするのに十分ではないか、または米国または他の場所の規制承認を得るのに十分ではない可能性がある | |
| ● | FDAは、承認の条件として、リスク評価および緩和策、またはREMSを必要とする可能性がある | |
| ● | FDAまたは同様の外国の規制機関は、私たちと臨床および商業用品契約を締結する第三者メーカーの製造プロセスまたは施設を承認できないかもしれない;および | |
| ● | FDAあるいは同様の外国規制機関の承認政策や法規 は重大な変化が発生する可能性があり、私たちの臨床データは私たちの候補製品 を承認するのに十分ではない。 |
| 18 |
規制部門の承認を得る過程は非常に高価であり、通常は数年かかり(最終的に承認されれば)、関連する候補製品のタイプ、複雑さ、新規性、規制部門の承認を求める司法管轄区域、規制機関の重大な裁量権などによって大きく異なる可能性がある。開発期間中の規制承認政策の変化、付加法規や法規の変更や提出された製品申請の監督審査の変更 は、申請承認や拒否の遅延を招く可能性がある。1つの管轄区域で規制承認を得ることは、必ずしも候補製品が私たちが承認を求める可能性のあるすべての管轄区域で規制承認を得ることを意味するわけではないが、1つの管轄区で承認されなかったことは、異なる管轄区で承認を求める能力に悪影響を及ぼす可能性がある。上記のような理由や他の理由で、私たちの候補製品が規制部門の承認を得られなければ、私たちの候補製品を商業化することができなくなり、私たちの収益能力は深刻な影響を受けるだろう。
さらに、FDA、EMA、または他の規制機関によって承認される可能性のある候補製品の適応は、私たちの要求よりも少ないか、またはそれを超える可能性があり、いくつかの年齢層の使用制限、警告、予防措置または禁忌症に重大な制限を加えるか、または高価な発売後の臨床試験またはリスク緩和要件の表現によって承認される可能性がある。FDA、EMA、または他の規制機関も、私たちの候補製品の商業化に成功することが必要または望ましいと考えているラベル宣言を受け入れないかもしれません。
2022年12月、アメリカ議会は新しい法律、即ち“2022年化粧品現代化監督管理法案”を公布し、MOCRAと略称した。MOCRAは化粧品メーカーまたは輸入業者に要求する:その手元にその製品と成分の安全性証明を確保し、 増加の登録、記録保存と報告要求を満たす;そのラベルに香料とアレルゲン情報を含み、FDAが公布する良好な製造規範要求を満たす準備をする。このような追加的な要求は予算 とスケジュールに影響を及ぼすかもしれない。
私たちの臨床試験は、私たちの候補製品または任意の未来の候補製品の安全性と有効性を証明する実質的な証拠を証明できないかもしれません。これは、規制承認と商業化の範囲を阻止、延期、または制限します.
私たちのビジネスモデルは私たちの候補製品の成功的な開発、規制承認、商業化に完全に依存しており、これは決して起こらないかもしれない。私たちの候補製品は初期開発段階にあり、本募集説明書が発表された日まで、私たちのどの候補製品も進展していません はATR-04の消費者保健品としての性能表現、動物テストと限られた人体テスト を超えています。2022年12月,我々は我々のATR−12に1 b期臨床試験のINDを提出し,これは薬物会社が米国でヒト臨床試験を開始することを承認した手段であり,2023年1月27日にFDAからbrの通知を受け,提案された臨床試験については継続する可能性がある。ATR-12を除いて、私たちの他の任意の候補製品に対して、私たちはFDAが有効なINDを持っていませんし、類似した外国の規制機関にも申請していません。本募集説明書の日付までには、ATR-04のINDを2023年末までに提出する予定ですが、この時間枠内でINDを提出できる保証はありません。私たちはFDAや同様の外国の規制機関から承認を得ることに成功して、私たちの任意の候補製品の臨床試験を始めることができないかもしれない。もし私たちが現在の計画のこのような承認を得ていなければ、私たちは任意の候補製品のための臨床計画を開始する時間が長くなると予想され、この延長は私たちの費用を増加させ、私たちが受け取る可能性のある収入を延期し、追加資本の需要を増加させる。また、人間の臨床試験を開始する承認を得ることは保証されないし、もし私たちが本当に承認されれば、私たちのbrの臨床試験は成功するか、またはFDAや同様の外国の規制機関の任意の適応の承認を支援するために臨床開発を継続する。多くの候補製品は臨床開発段階に達していないことに注目し,brは確実に臨床開発を開始した製品であっても臨床開発に成功し,規制部門の承認を得る機会しかないことに注意した。臨床前と臨床試験の早期段階の成功は今後の臨床試験も成功することは確保されておらず,臨床試験の中期結果が最終結果を予測できるとは限らない。私たちの1つ以上の臨床試験はテストのどの段階でも失敗する可能性がある。臨床試験過程中あるいは臨床試験過程のため、私たちは多くの予見できない事件に遭遇する可能性があり、brは私たちが監督部門の許可を得たり、私たちの候補製品を商業化することを延期したり阻止したりする可能性がある。したがって、私たちの現在の業務は、私たちの候補製品の成功した開発、規制承認、商業化に完全に依存しており、これは決して起こらないかもしれない。
私たちの候補製品の臨床前研究結果 は未来の前臨床研究或いは臨床試験の結果を予測できないかもしれない。
私たちの任意の候補製品を発売と販売するために必要な監督管理許可を得るためには、著者らは広範な臨床前研究と臨床試験を通じて、私たちの候補製品が人体内で安全、純粋かつ有効であることを証明しなければならない。INDは広範な臨床前研究(臨床前実験室テスト、動物実験と良好な実験室規範に符合する調合研究を含む)を経て初めてFDA を提出し、発効することができ、これはアメリカで人体臨床試験を行う前提条件である。臨床前研究の成功は後の臨床前研究或いは臨床試験も成功することを確保できない。生物技術と製薬業界のいくつかの会社は臨床試験で重大な挫折を経験し、早期の臨床前研究においても積極的な結果を得た。これらの挫折は,臨床試験施行期間中の臨床前発見や臨床試験で行われた安全性や有効性観察(以前に報告されていない有害事象を含む)などの原因によるものである。臨床試験の設計はその結果が製品の承認を支持するかどうかを決定することができ,brは臨床試験の進展が良好になるまで臨床試験設計における欠陥が明らかにならない可能性がある。また、著者らまたは私たちの研究者は、被験者が臨床試験方案を遵守するかどうかの重要な面を制御できない可能性がある。また、臨床前と臨床データは異なる解釈と分析の影響を受けやすい。早期の研究には潜在的な有望な結果があるにもかかわらず、私たちは似たような挫折に直面しないと確信できない。また、著者らの臨床前動物研究結果は後続の人体臨床試験の結果を予測できない可能性がある。臨床試験中の候補製品はすでに臨床前研究を通じて進展したにもかかわらず、必要な薬理特性或いは安全性と有効性特性を示すことができないかもしれない。
| 19 |
もし私たちが候補製品の臨床前研究或いは臨床試験で積極的な結果を得られなかった場合、私たちの最先端の候補製品の開発スケジュールと監督管理許可及び商業化の将来性はそれに応じて負の影響を受け、私たちの業務とbrの財務見通しは負の影響を受ける。
私たちの任意の候補製品に対して任意の適応に対する必要な研究を行う任意の 終了または一時停止、または開始または完了の任意の遅延は、私たちのコスト増加、遅延、または私たちの創造能力を制限し、私たちのビジネスの将来性に悪影響を及ぼす可能性があります.
臨床研究の開始と完成は様々な原因で延期される可能性があり、以下の方面に関連する遅延を含む
| ● | FDAあるいは類似の外国の監督管理機関は継続を許可できず、臨床研究を保留した | |
| ● | 臨床試験被験者は私たちの試験に参加することを期待した速度で登録または継続することができなかった | |
| ● | 我々の任意の候補製品を生産する工場は、cGMP要求または他の適用要件に違反したため、FDAまたは他の政府または規制機関によって一時的または永久的な閉鎖を命じられ、あるいは製造過程における候補製品の交差汚染 ; | |
| ● | 私たちの製造プロセスの任意の変更が必要または希望される場合があります | |
| ● | 被験者は,我々が開発している製品の適応のために代替療法候補を選択したり,競争的臨床研究に参加したりした | |
| ● | 重度または予期せぬ薬物副作用が出現した被験者は | |
| ● | 類似技術と製品の臨床試験報告 は安全性および/または有効性の問題 を引き起こした | |
| ● | 第三者の臨床研究者は臨床試験を行うために必要な免許或いは許可を取り消され、予想されたスケジュールに従って臨床試験を行うか、臨床試験規程、cGMPの要求に符合する方法を採用していない。またはデータ収集および分析をタイムリーかつ正確に行われていない他の第三者; | |
| ● | FDA、類似の外国の監督管理機関あるいはIRBsが臨床研究地点を検査し、brが規定に違反した行為を発見し、1つ以上の場所を一時停止または終了させ、あるいは研究全体の臨床一時停止を実施するための是正措置を要求した。 または私たちのマーケティングアプリケーションをサポートするためにデータの一部または全部を使用することを禁止します | |
| ● | 第三者請負業者は、規制要件違反によりFDAまたは他の政府または規制機関によって禁止または一時停止または他の方法で処罰され、この場合、代替請負業者を探す必要があるかもしれない。このような請負業者が提供するデータの一部または任意のデータを使用して、私たちのマーケティングアプリケーションをサポートすることはできないかもしれません | |
| ● | 1つ以上の研究所は、研究場所の研究を承認、一時停止、または終了することを拒否し、より多くの対象を募集することを禁止するか、または試験の承認を撤回することを禁止する。潜在的契約研究機関、あるいはCROと臨床試験地点は受け入れられる条項と合意し、条項は広範な交渉を行うことができ、異なるCROと試験地点の条項は比較的に大きな差がある可能性がある | |
| ● | 臨床サイトは試験案から外れたり、試験を終了したりした | |
| ● | 新しい臨床試験地点を増やす; | |
| ● | CROはどんな理由でも臨床試験を行うことができません | |
| ● | 政府 または規制遅延または試験の一時停止または終了を必要とする“臨床保留” 。 |
| 20 |
製品 がテストや承認に遅延があれば、あるいは計画よりも多くの臨床研究を実行する必要があれば、どの候補製品の開発コストも増加します。また,規制要求や政策が変化する可能性があり,これらの変化を反映するためにbr研究案を修正する必要があるかもしれない。修正案は、本研究のコスト、時間、または成功に影響を与える可能性があるFDA、同様の外国規制機関、およびIRBsに我々の研究案を再提出することを再検討することを要求するかもしれない。もし私たちがbr}遅延完了に遭遇した場合、または私たち、FDAまたは他の規制機関、IRBまたは他の審査エンティティ、または私たちの任意の臨床研究サイトが任意の候補製品に対する私たちの任意の臨床研究を一時停止または終了すれば、その商業的見通しが実質的なbrによって損なわれる可能性があり、私たちが製品収入を創出する能力は延期されるだろう。臨床試験を完成するいかなる遅延も私たちのコストを増加し、brは私たちの開発と承認の流れを遅くし、そして私たちの製品販売と収入を創造する能力を危険にさらす。このようなbrイベントは、私たちの業務、財務状況、および将来性を深刻に損なう可能性がある。さらに、臨床研究の終了または一時停止、または臨床研究の開始または完了遅延をもたらす多くの要因は、最終的には、私たちの候補製品が規制部門によって承認を拒否される可能性もある。さらに、1つまたは複数の臨床研究が延期された場合、私たちの競争相手は私たちよりも先に競争製品を市場に投入するかもしれませんが、私たちの任意の影響を受けた候補製品の商業的実行可能性は著しく低下する可能性があります。
たとえ私たちの候補製品が規制部門の承認を得たら、私たちはその製品を商業化することに成功できないかもしれません。私たちがその販売から得た収入は限られている可能性があります。
もしbrが発売されることが承認されれば、私たちの候補製品の商業成功は、医療 コミュニティ(医師、患者、医療支払者を含む)の各製品に対する受け入れの程度に依存する。私たちの任意の候補製品に対する市場の受け入れ度は、多くの要素に依存します
| ● | 臨床的安全性と有効性を示した | |
| ● | Brに対して便利で、投与負担があり、管理しやすい; | |
| ● | どのような悪影響の流行率や深刻さ | |
| ● | 医師が私たちの候補製品に処方する意思と,目標患者群が新たな療法を試みる意欲である | |
| ● | 私たちの候補製品は競争製品と比較した効果 ; | |
| ● | 私たちの候補製品が承認される可能性のある適応について、将来出現する可能性のある任意の新製品を発売します | |
| ● | 新しいbrプログラムや療法は、私たちの候補製品が実用的な任意の適応を示す可能性のある発生率を減少させることができる | |
| ● | 価格設定と費用効果; | |
| ● | 適用可能な治療およびワクチンガイドラインには、私たちの候補製品が含まれているか、または省略されている | |
| ● | 私たち自身または任意の未来のパートナーの販売およびマーケティング戦略の有効性 | |
| ● | 規制当局が承認したラベルに含まれている制限または警告; | |
| ● | 私たちは政府の医療計画(MedicareとMedicaidを含む)から十分な第三者保険や精算を得ることができます個人健康保険会社および他の第三者支払人、または治療薬の価格設定および使用を管理する政府機関から必要な価格設定の承認を受ける。そして | |
| ● | 患者は,第三者保険や精算や政府定価承認なしに費用を自己負担する意思 である。 |
もし私たちのすべての候補製品が承認されたが、医師、医療支払者、患者の十分な程度の受け入れが得られなければ、私たちは十分な収入を生み出すことができず、利益を達成したり維持することができないかもしれない。医療界と第三者支払者に私たちの候補製品のメリットを知ってもらうために努力しており,これには大量の資源が必要であり,決して成功しないかもしれない。
| 21 |
また、規制部門の承認を得ても、どの承認の時間や範囲も、候補製品を商業化に成功させる能力を禁止または低減する可能性があります。 例えば、承認過程が長すぎると、予想される市場機会を逃し、他の 会社に競争製品を開発したり、市場主導的な地位を確立したりする能力がある可能性がある。私たちが最終的に得たどんな規制承認も限られているかもしれないし、制限されたり、承認された後に約束された制限を受けて、私たちの候補製品が商業的に実行できないようにすることができる。例えば、規制機関は、私たちの任意の候補製品の適応が私たちの要求された範囲以下またはそれを超えることを承認するかもしれないし、任意の候補製品に請求しようとしている価格を承認しないかもしれないし、高価な発売後の臨床試験に依存する表現を承認するかもしれないし、または私たちの任意の候補製品を承認する可能性のあるラベルは、この適応の商業化に必要または必要なラベル宣言を含まないかもしれない。さらに、FDAまたは同様の外国規制機関は、承認に条件を追加することができ、または薬物の安全な使用を確保するために、リスク管理計画またはリスク評価および緩和戦略(REMS)を要求することができる。また、製品が規制基準を満たしていない場合、または製品の初発売後に問題が発生した場合、製品承認を撤回する可能性がある。上記のいずれの場合も、私たちの候補製品の商業成功に実質的な損害を与える可能性があります。
もし私たちの候補製品が市場で承認された場合であっても、私たちは持続的な義務と持続的な規制によって検討され、これは多くの追加費用を招く可能性がある。また、私たちの候補製品はラベルや他のbrによって制限されて市場から撤退する可能性があり、規制要求や私たちの候補製品が予期せぬ問題に遭遇した場合、処罰される可能性があります
もし我々の任意の候補製品が監督部門の承認を得た場合であっても、FDAまたは外国同等機関は、その指示用途またはマーケティングまたは承認条件に重大な制限を加えることができ、またはbrが高価で時間がかかる可能性のある承認後研究(4期臨床試験を含む)および発売後モニタリングを適用して安全性およびbr}治療効果を監視するために持続的な要求を加える可能性がある。私たちの候補製品はまた、製造、ラベル、包装、保存、流通、安全監視、広告、販売促進、記録と報告不良事件及びその他の発売後の情報に関する持続的な法規要求 を遵守する。これらの要件は、FDAへの登録と、私たちが承認後に行った任意の臨床試験について、現在の良好な臨床実践法規またはCCPを継続することを含む。また、薬品メーカー及びその施設 はFDAと他の監督機関の持続的な審査と定期検査を受けて、現在のcGMP、品質管理、品質保証と相応の記録とファイル維持に関する要求に符合することを確実にしなければならない。
FDAは、REMSをBLAの一部として使用することを要求するか、または承認後に行う権利があり、これは、承認された薬剤の配布または使用に、例えば、br専門訓練を受けた特定の医師または医療センターに処方を制限し、治療をいくつかの安全な使用基準を満たす患者に制限するか、または患者のテスト、監視、および/または登録への登録を要求する可能性がある。
我々の候補製品に関する販売やマーケティング活動については,広告や販売促進材料は,米国の他の適用可能な連邦,州や地方法律および他の国/地域の類似した法律要求に従うほか,FDAのbr規則に適合しなければならない。米国では,医師に製品サンプルを配布することは,米国処方薬 営業法の要求に適合しなければならない。変更された性質によると、申請保持者はFDAの承認を得なければ製品や製造を変更することができません。私たちはまた、米国の反リベート法規、米国の虚偽請求法案、および同様の州法律を含む様々な詐欺や乱用の法律の制約を直接または間接的に受けることができます。これらの法律は他に加えて、私たちが提案している販売、マーケティング、科学/教育支援計画にも影響を与えます。もし私たちがアメリカ医療補助薬品リベート計画、アメリカ退役軍人事務部の連邦供給スケジュールあるいは他の政府薬品計画に参加すれば、私たちは報告と支払い義務に関する複雑な法律とbr法規の制約を受ける。これらのすべての活動はまた、米国連邦と州消費者保護および不正競争法によって制約される可能性がある。他の国の多くのこのような分野にも似たような要求がある。
さらに、私たちの候補製品が特定の用途のために承認された場合、私たちの製品ラベル、広告、および販売促進は、規制要件および持続的な規制審査を受けるだろう。FDAは処方薬に関する販売促進声明を厳格に規制している。特に、製品は、製品承認ラベルに反映されるように、FDA承認されていない用途に使用されてはならない。もし私たちの候補製品が市場の承認を得たら、医者は依然として合法的にbrを承認されたラベルと一致しない方法で彼らの患者に私たちの製品を処方することができる。もし私たちがこのようなbrタグの外使用を普及させることが発見されたら、私たちは重大な責任と政府の罰金に直面するかもしれない。FDAや他の機関はラベル外使用の普及を禁止する法律や法規を積極的に実行しており,ラベル外使用を不当に普及させていることが発覚した会社は重大な制裁を受ける可能性がある。連邦政府は不正販売促進の疑いのある会社に巨額の民事と刑事罰金を科し、いくつかの会社がラベル外販売促進に従事することを禁止している。FDAはまた、永久禁止の同意法令を締結することを会社に要求しており、これらの法令により、特定の販売促進行為が変更または減少される。
| 22 |
もし私たちまたは規制機関が候補製品に以前に知られていない問題、例えば予想されていない深刻さや頻度の不良事件、製品を生産する施設に問題があることを発見した場合、あるいは私たちまたは私たちのメーカーが適用されるbr規制要求を遵守できなかった場合、私たちは以下の行政または司法制裁を受ける可能性がある
| ● | 製品の販売または製造を制限し、市場から製品をリコールするか、または自発的または強制的に製品をリコールすること | |
| ● | 警告状や無見出しの手紙を出す | |
| ● | 臨床的に堅持する; | |
| ● | 民事または刑事罰または罰金を禁令または適用する | |
| ● | 規制承認の一時停止または撤回; | |
| ● | 進行中の臨床試験を一時停止します | |
| ● | 私たちが提出した保留申請または承認された申請を承認することを拒否するか、または製品許可の承認を一時停止または撤回すること | |
| ● | コストの高い新しい製造要件を含む、brを一時停止するか、または運営に制限を加えること | |
| ● | 製品 は製品の輸入または輸出の許可を差し押さえ、差し押さえ、または拒否する。 |
上記のいずれかの事件や処罰が発生すると、候補製品を商業化し、収入を創出する能力を抑制する可能性があります。 承認前も承認後も、不利な規制行動は、製品責任クレームを招き、私たちの製品責任リスクを増加させる可能性があります。
私たち もアメリカ或いは国外の未来の立法或いは行政 行動によって生じる可能性のある政府規制の可能性、性質或いは程度を予測することができず、このような規制を遵守することはコストが高く、大量の財務 と管理資源を消費する可能性がある。もし、私たちまたは任意の未来のマーケティング協力者または契約製造業者が、既存の要求の変化や新しい要求や政策の採用に適応できない場合、または法規遵守性を維持できない場合、私たちの製品の普及、マーケティング、または販売を遅延または阻止する可能性があり、これは私たちの業務および運営結果に悪影響を及ぼすだろう
1つの管轄区域で私たちの候補製品に対する規制承認を獲得し、維持することは、私たちの候補製品の規制承認を他の管轄区域で成功的に得ることを意味するわけではない
1つの管轄区域で私たちの候補製品に対する規制承認を獲得し、維持することは、他の任意の管轄区で規制承認を得ることができるか、または維持できる保証はありませんが、1つの管轄区域で規制承認を得ることができないか、または遅延することは、他の管轄区の監督管理承認の流れに悪影響を及ぼす可能性があります。例えば、FDAが候補製品の発売を承認しても、外国司法管轄区の比較可能な規制機関は、この候補製品のこれらの国/地域での製造、マーケティング、普及を承認しなければならない。審査手続きは司法管轄区域によって異なり、1つの司法管轄区で行われた臨床研究は他の管轄区の監督機関に受け入れられない可能性があるため、米国とは異なる要求と行政審査期限に関連する可能性がある。米国以外の多くの管轄区では、候補製品は先に精算許可を得てから、その管轄区で販売を許可することができる。場合によっては、私たちが製品に受け取る価格も承認される必要がある。
外国の監督管理の許可を得て、外国の監督管理要求を遵守することは私たちに重大な遅延、困難とコストをもたらす可能性があり、そして私たちの候補製品がある国/地域で発売されることを延期または阻止する可能性がある。もし私たちが国際市場の規制要求を遵守できず、および/または相応のマーケティング承認を得られなければ、私たちの目標市場は を減少させ、候補製品の市場潜在力を十分に発揮する能力は損なわれるだろう。
| 23 |
たとえ 候補製品に孤児薬物指定を申請することができても、私たちは孤児薬物マーケティングの排他性を得ることができない可能性があります。
いくつかの場合,我々の候補品はFDAの孤立薬物地位を獲得する資格がある可能性があると考えられている。FDAが私たちの任意の候補製品の将来の任意の孤児薬物指定申請を承認することは保証されず、これは私たちがbr孤児薬物指定の追加的な排他性および他の利点を得る資格がないだろう。
孤児医薬品法によれば、FDAは、米国では200,000人未満の疾患または疾患に影響を及ぼす疾患または疾患を指すのが一般的であるため、米国でそのような疾患または疾患を治療する薬剤を開発および提供するコストは、製品の販売からbrを回収するために、まれな疾患または疾患を治療するための薬剤の称号を与えることができる。BLAを提出する前に,指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、治療薬の識別およびその潜在的な孤児の使用を開示するであろう。孤立製品命名は が規制承認過程でいかなる優位性を伝達したり、持続時間を短縮したりすることはない。可能な独占期間の他に、孤児指定は、臨床試験費用、臨床研究費用の税収免除、およびFDA申請ユーザー費用を免除するために、会社に4年以内に毎年400,000ドルの贈与資金を得る資格を持たせる。
孤児の称号を有する製品がその後、孤児の称号を有する疾患または状態に対するFDAの最初の承認を得た場合、この製品は、孤児医薬品の排他性を得る権利があり、これは、FDAが、限定された場合、例えば、(I)薬剤の孤児の称号が取り消され、(Ii)その発売許可が撤回された場合、(Iii)孤児排他的所有者が別の出願人のbr製品を承認することに同意しない限り、同じ薬物が同じ適応下で販売される任意の他の出願を許可しないことを意味する。(Iv)孤児排他性保持者は、十分な数の薬剤を得ることを保証することができない、または(V)競争相手の製品は、孤児に対して排他的な製品に対する臨床的利点を示す。孤児製品に指定された薬物が指定範囲よりも広い適応の上場承認を得た場合,孤児薬物独占経営権を得る資格がない可能性がある。このような申請を求めることを選択すれば,我々のいずれの候補も条件を満たす可能性があると考えられる適応において孤児薬指定が得られる保証はない。
現在の と将来の立法は、候補製品の上場承認を得て商業化の難しさとコスト を増加させ、入手可能な価格に影響を与える可能性があります。
アメリカと一部の外国司法管轄区では、医療保健システムに関する立法と法規の変更及び提案された変更 は私たちの候補製品の発売承認を阻止或いは延期し、承認後の活動 を制限或いは規範化し、そして私たちの候補製品の販売収益能力に影響を与える可能性がある。承認後の要求を拡大し、医薬品の販売や販売促進活動を制限するための立法·規制提案がなされている。追加的な立法変更が公布されるかどうか、FDAの法規、ガイドライン、解釈が変更されるかどうか、またはそのような変更が私たちの候補製品の上場承認にどのような影響を与える可能性があるかどうかはわかりません。そのほか、米国議会のFDA審査過程に対するより厳格な審査は上場承認を著しく延期或いは阻止し、更に厳格な製品ラベルと上場後のテスト及びその他の要求の制約を受ける可能性がある。
アメリカでは、“連邦医療保険現代化法案”(Medicare Modinization Act、MMAと略称する)は連邦医療保険カバーと薬品支払い方式を変えた。立法は高齢者が薬品を購入する医療保険のカバー範囲を拡大し、薬品の平均販売価格に基づく新しい精算方法を導入した。また,この立法はMedicare Part D処方薬の使用処方を許可しており,これらの処方では, は任意の治療カテゴリがカバーする薬物数を制限することができる。この立法と連邦薬品カバー範囲の拡大により、私たちはより多くの圧力がコストをコントロールして低減することが予想される。これらのコスト低減の取り組み およびこの立法の他の条項は、候補製品に提供されるカバー範囲および価格を低下させる可能性があり、私たちの業務を深刻に損なう可能性があります。MMAはMedicare受益者の薬品福祉にのみ適用されるが、個人支払者は、自分の精算料率を設定する際に、通常Medicare保証政策および支払い制限に従うが、MMAによる任意の精算減少は、個人支払者の支払い減少に類似した状況をもたらす可能性がある。
| 24 |
“患者保護·平価医療法案”は2010年の“医療·教育負担能力調整法案”(または総称してACA)によって改正され、医療保険の許容性を拡大し、医療支出の増加を減少または制限し、詐欺や乱用に対する救済措置を強化し、医療保健·医療保険業界のために新たな透明性要求を増加させ、医療業界に新たな税費を徴収し、追加の医療政策改革を実施することを目的とした全面的な法律である。報告目的でACAは“メーカー平均価格”の定義を修正し,各州への医療補助薬品還付額を増加させる可能性がある。また,法律 はブランド処方薬製品を生産または輸入した会社に高額な年会費を徴収する。
また、ACAが公布されて以来、米国は他の立法改正を提案し、採択した。2011年、米国のbr国会は連邦赤字削減のための条項を含む“2011年予算制御法”または“予算制御法”を公布した。予算統制法案は2013年から医療保険提供者への支払いを2%減少させ、その後の法案の立法改正により、国会の追加行動なしに2027年まで有効になる。しかし,CARE法案や後続立法により,新冠肺炎が大流行したため,これらの削減は2020年5月1日から2022年3月31日まで停止される。2013年1月、2012年に“米国納税者救済法”が署名され、複数の医療サービス提供者に支払う医療保険費用を削減し、政府がサービス提供者に多額の金を取り戻す訴訟時効期間を3年から5年に延長した。これらの新しい法律は、連邦医療保険や他の医療資金のさらなる減少を招く可能性があり、承認されれば、私たちの薬品の顧客および私たちの財務運営に実質的な悪影響を及ぼす可能性がある。政府支出がさらに削減されれば、予想される予算不足は、FDAなどの関連機関が現在のレベルで動作し続ける能力にも影響を与える可能性があり、これは、関連機関が研究開発、製造、マーケティング活動を適時に審査·承認する能力に影響を与える可能性があり、これは、私たちが任意の候補製品を開発、マーケティング、販売する能力を遅らせる可能性がある。また、Medicare、Medicaid、または他の実施可能な公共援助または補助医療計画に影響を与える重大な支出削減、または私たちに徴収される任意の重大な税金または費用に影響を与える可能性がある。より広範な赤字削減努力の一部であるbrや“予算制御法案”の立法代替は、我々が予想する製品収入に悪影響を及ぼす可能性がある。
また、最近、政府はメーカーがその商業製品の価格設定方式の審査を強化した。米議会は最近数回の調査を行い、薬品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、医療保険下の薬品コストを下げ、政府が計画している薬品精算方法を改革するための連邦と州立法を提出し、公布した。2020年9月24日、FDA は最終規則を発表し、各州がカナダからの薬物輸入計画の制定と提出に指導を提供した。また、2020年11月20日、アメリカ衛生·公衆サービス部(HHS)は1つの法規を決定し、薬品メーカーがD部分のスポンサー値下げを計画している安全港保護 を直接或いは薬局福祉マネージャーを通じて、法律が値下げを要求しない限り、廃止した。この規則はまた、販売所での値下げを反映するための新しい安全港を創出し、brはまた薬局福祉マネージャーとメーカーとの間のいくつかの固定費用手配のための安全港を創出する。2022年8月16日、br国会は“2022年インフレ削減法案”を公布し、その中には、連邦政府の価格交渉に対する要求、返却要求、およびMedicare Part D保険加入者への自己支出上限を含む複数の処方薬コストに関する条項が含まれている。州レベルでは、立法機関は、価格や患者の精算制限、割引、ある製品への参入制限、マーケティングコスト開示と透明性措置を含む立法および実施が増えており、場合によっては、他の国からの輸入とbrの大量購入を奨励することを目的としている。
| 25 |
2020年11月20日、衛生と公衆サービス部監察長弁公室は連邦反リベート法規の更なる改正を決定した。“最終規則”によると、衛生·公衆サービス部監察長事務室は“反リベート法規”に基づいて臨床医師、提供者と他の人との間のいくつかの調整看護と価値に基づく手配のために安全港保護を追加したが、法律がbrを値下げすることを要求しない限り、製薬業者は直接または薬局福祉マネージャーを通じてD部分下の計画スポンサーに対して値下げする安全港保護を取り消した。この規則はまた、販売時点での値下げを反映するための新しい安全港を創出し、薬局福祉マネージャーと製造業者との間のいくつかの固定費用手配のための安全港を創出する。この規則(例外がある)は2021年1月19日に施行される。私たちはこのような規則が私たちの業務にどのような影響を与えるか(あれば)を評価し続けるつもりだ。CMSは2019年7月9日に、医薬品または生物製品の毎月の供給または通常の治療コースの卸売価格が35ドル以上である場合、医薬品または生物製品の毎月の供給または通常の治療コースの卸売価格が35ドル以上である場合、処方薬および生物製品の直接消費者向けの広告を要求する最終規則を発表した。このような要求に違反した処方薬と生物製品は公共リストに登録されるだろう。採用された医療改革措置brが承認されれば、私たちの製品に対する最終的な需要を下げたり、私たちの製品の価格設定に圧力をかけたりする可能性がある。アメリカの各州もますます積極的に立法と法規の実施を通じて薬品の定価を制御し、価格或いは患者の精算制限、割引、ある製品の参入とマーケティングコストの開示の制限及び透明性措置を含み、場合によっては、他の国からの輸入と大量調達を奨励することを目的としている。また,地域医療当局や個別病院では,どの薬品 およびどのサプライヤーがその処方薬や他の医療計画に含まれるかを決定するために入札プログラムが使用されるようになってきている。私たちは未来にもっと多くの州と連邦医療改革措置を取ると予想している。
EUで医療サービスを提供することは、医療サービスの確立と運営、薬品の定価と精算を含み、brはほぼ完全に国家の法律と政策の問題であり、EUの法律や政策ではない。各国政府と衛生サービス提供者は衛生保健及び製品定価と精算を提供する上で異なる優先事項と方法がある。しかし、全体的に言えば、大多数のEU加盟国の医療予算制限は関連医療サービス提供者が薬品の定価と精算を制限した。加えて、製品の開発と販売を希望するEUと国家の監督管理負担が増加しており、これは私たちの候補製品の上場承認を阻止または延期し、承認後の活動を制限したり、規制したりして、上場承認を得た製品を商業化する能力に影響を与える可能性がある。米国とEUでは,承認後の要求を拡大し,薬品の販売や販売促進活動を制限するための立法と規制の提案がなされている。私たちは追加の法的変更が公布されるかどうか、あるいは法規、ガイドライン、解釈が変更されるかどうか、あるいはこのような変更が私たちの候補製品の上場承認にどのような影響を与える可能性があるかわかりません。
第三者保険や精算、医療コスト制御計画、治療ガイドラインは、私たちの将来の収入を制限する可能性がある。
私たちの候補製品のマーケティングに成功できるかどうかは、政府衛生行政部門、個人健康保険会社、その他の組織が私たちの候補製品と関連治療に提供する精算レベルに依存しています。私たちの任意の候補製品は、国家医療保険計画下の精算計画を通じて販売される国/地域を介して、薬品メーカーと販売業者に初期価格と任意の後続価格が上昇した時に政府の承認を得ることを要求しています。ある国では、米国を含め、政府援助や個人医療計画は価格に大きな間接的な圧力をかける可能性がある。十分な価格やカバー範囲が承認されず、精算や精算範囲が限られていなければ、利益を上げるために候補製品を販売することができないかもしれません。ますます多くの第三者支払者は、私たちの製品開発に影響を与える可能性がある方法で医療コストを制御しようとしています
| ● | 保健品の価格に異議を唱えることができなかったのは | |
| ● | 価格の低い司法管轄区域からbr再輸入計画を導入する | |
| ● | 新治療製品のカバー範囲と精算金額を制限する | |
| ● | Brを拒否するか、または規制機関の承認を制限するが、第三者支払者によって試験的または調査的製品とみなされる保証範囲;および | |
| ● | 承認された製品が規制部門のbr市場の承認を得ていない方法に使用されている場合、保険の提供を拒否する。 |
| 26 |
顧客や支払者との関係は、リベート、詐欺、乱用、および他の医療法律法規に適用され、これらの法律法規に違反すれば、私たちは刑事制裁、民事処罰、政府医療計画から除外され、契約損害、名声損害、利益および将来の収入減少に直面する可能性がある。
医療提供者、医師、他の人は、私たちが市場で承認された任意の製品を推薦し、処方する際に主な役割を果たす。私たちの将来の第三者支払者や顧客との合意は、主にアメリカでは、マーケティング、販売、流通がマーケティングの承認を得た製品の業務または財務スケジュールと関係を制限することができる広範な詐欺や乱用や他の医療法律法規に直面する可能性があります。Brに適用される医療法律法規の制限には,以下のようなものがある
| ● | 連邦反リベート法規は、br(I)を誰かに紹介したり、誘惑したりするために、故意に提供、支払い、誘致、または任意の形の報酬を受け取ることを禁止している。(Ii)Medicare、Medicaid、または他の政府計画に従って精算可能な物品またはサービスを提供または手配するか、または(Br)(Iii)Medicareに従って精算可能な任意の物品またはサービスを購入、レンタルまたは注文または推薦、購入、レンタルまたは注文することができる。医療補助や他の政府計画。 個人や実体は実際に法規や具体的な意図を知ることなく法規 に違反すれば違反を実施することができる。さらに、政府は、連邦“反リベート条例”違反によって発生した物品またはサービスのクレームが虚偽または詐欺的クレームを構成することを含む“虚偽請求法”に基づくことを主張することができる | |
| ● | 連邦虚偽請求法案は、故意に連邦政府に提出または提出を招いた個人または実体に民事処罰を適用し、民事通報者または準訴訟を規定する。虚偽または詐欺的な支払い要求、または連邦政府への支払い義務の回避、減少または隠蔽のための虚偽陳述 | |
| ● | HIPAA は,詐欺の任意の医療福祉計画を実行する計画や医療保健事項に関する虚偽陳述を行う行為に対して刑事や民事責任を追及する。連邦“反リベート法規”と同様に、個人または実体は、法規または法規違反の具体的な意図を実際に知る必要がなく、違反を実施することができる | |
| ● | 連邦虚偽陳述法は、重大な事実を知り、故意に偽造、隠蔽し、または医療福祉、プロジェクトまたはサービスの交付または支払いに関連する任意の重大な虚偽陳述を禁止する | |
| ● | ACAが作成した“医師支払い陽光法案”とその実施条例によると、この法案は、薬品、機器、生物製品、医療用品の指定メーカーbrが連邦医療保険に基づいて支払いを受けることを要求している。医療補助や児童健康保険計画は,特定の例外を除いて,毎年CMSに の支払いや医師への他の“価値移転”に関する情報を報告している。このようなすべての報告情報 は、公開的に取得することができる | |
| ● | 同様の州および非米国の法律、例えば、いくつかの州の反リベートおよび虚偽クレームの法律は、商業保険会社のbrを含む任意の第三者支払人精算の項目またはサービスに適用される可能性がある。州の法律は、製薬会社がbr業界の自発的コンプライアンスガイドラインおよび連邦政府が公布した適用コンプライアンスガイドラインを遵守すること、または医療提供者および他の潜在的な紹介源に支払う可能性のあるお金を他の方法で制限することを要求する。州法は、医薬品製造業者に、医師および他の医療提供者への支払いまたは他の方法での価値またはマーケティング支出に関する情報を報告することを要求する。そして、いくつかの場合には、健康情報のプライバシーおよびセキュリティを管理する州法があり、その多くの法律は、多くの点で大きな差があり、同じ効果を生じることなく、コンプライアンス作業を複雑化させる可能性がある | |
| ● | CMS規制とHHS監察長事務室または米国司法省によって実行される。 |
これらの法律の広さおよび法定例外および利用可能な避風港の狭さのために、私たちの将来のいくつかの商業活動は、1つまたは複数のそのような法律の挑戦を受けるかもしれない。
| 27 |
我々が第三者の業務手配と適用される医療法律法規に適合することを確保する努力 は大量のコストに及ぶ。政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの業務がこれらの法律または任意の他の私たちに適用される可能性のある任意の政府法規に違反していることが発見された場合、私たちはMedicare およびMedicaidのような重大な民事、刑事と行政処罰、損害賠償、罰金、Medicare およびMedicaidのような米国政府が援助する医療計画から除外される可能性があり、私たちの業務を削減または再構成することができる。もし私たちがそれと業務を展開することを望む任意の医師または他の提供者または実体が適用されない法律に適合していないことが発見された場合、彼らは政府が援助する医療計画から除外することを含む刑事、民事または行政の制裁を受ける可能性がある。
私たちの知的財産権に関するリスク
私たちの知的財産権を保護することは難しくて高価で、私たちはこのような権利の保護を保障できない
私たちのビジネス成功は、必要に応じて第三者 に対して私たちの特許権の起訴と擁護に挑戦する能力があるかどうかにある程度依存し、第三者の競争相手に対してこれらの特許権を実施することに成功します。製薬会社の特許地位は非常に不確定である可能性があり、複雑な法律、科学、事実の問題に関連しており、その中で重要な法律原則はまだ解決されていない。 特許法または特許法解釈の変化は、私たちの知的財産権の価値を低下させる可能性がある。したがって、私たちまたは私たちの特許権ライセンシーが提出した任意の特許出願において許容または強制的に実行可能なクレームの広さを予測することはできない。私たちが保有または許可している私たちの微生物プラットフォームおよび関連技術に関連する特許および特許出願は、第三者の挑戦、無効または回避を受ける可能性があり、類似した製品または技術を有する競争相手から私たちを保護することができないかもしれない。
法的手段は限られたbr保護しか提供できず、私たちの権利を十分に保護できない可能性があり、私たちの競争優位性を獲得したり、維持したりすることができるように、私たちが持っているか許可されている特許権によって提供される将来の保護の程度は不確定である。私たちは、第三者が持っているいかなる特許出願も、私たちが提出したり、許可権を持っている特許出願よりも優先されないことを確認することはできませんし、米国や外国特許庁の妨害、反対または無効訴訟に巻き込まれないと判断することもできません。
さらに、 私たちが任意の候補製品をカバーする特許を強制的に執行するために第三者に対して法的訴訟を提起した場合、被告 は、その特許の無効および/または強制執行が不可能であることを反訴することができる。米国の特許訴訟では,被告が無効および/または実行不可能と主張する反訴はありふれている。有効性を疑問視する理由には、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件を満たしていないといわれるいずれかが含まれている。実行不可能な断言の理由には,特許起訴に関連する者が起訴中に米国特許商標局またはUSPTOに関連情報を隠蔽したり,誤った陳述をしたりした疑いがある.第三者も米国や海外の行政機関に類似したクレームを出すことができ、訴訟範囲外でも同様である。このようなメカニズムには、再審、贈与後審査、外国司法管轄区の同等の手続き、例えば反対手続きが含まれている。このような訴訟は、私たちが持っているか許可された特許を撤回または修正し、私たちの候補製品や競争製品をカバーしないようにすることをもたらす可能性がある。無効と実行不可能と法的に断言された結果 は予測不可能である.例えば、有効性については、無効な以前の技術がないことは確認できませんが、私たち、私たちの特許権のいかなるライセンシーまたは特許審査員も起訴中にそれを知りません。 被告が勝訴した場合、無効および/または強制執行できない法的主張が成立すれば、私たちは私たちの任意の候補製品の少なくとも一部、さらにはすべての 特許保護を失うことになります。このような特許保護の喪失は私たちの業務に実質的な悪影響を及ぼすだろう。
我々 は,特に特許保護が適切でないと考えられる場合や が入手可能であると考えられるノウハウとビジネス秘密に依存して技術を保護する.しかし、独自技術と商業秘密を保護することは難しい。従業員、学術協力者、コンサルタント、および他の請負業者にセキュリティ協定を締結することを要求していますが、私たちのビジネス秘密または他の固有のbrまたは許可情報を十分に保護できない可能性があります。通常、研究協力者や科学コンサルタントはデータや情報を発表する権利があり、私たちはこれらのデータや情報を発表する権利があるかもしれない。第三者が我々のいかなる商業秘密を不正に取得して使用するかを強制する宣言は高価で時間のかかるbrであり,結果は予測できない.しかも、裁判所は特許よりも商業秘密を保護することを望んでいないことがある。また,我々の競争相手は同等の知識,方法,ノウハウを自主的に開発することができる.
| 28 |
もし私たちが候補製品や私たちの技術のために特許保護または商業秘密保護を獲得または維持することができない場合、第三者 は私たちの固有の情報を使用するかもしれません。これは私たちの市場での競争能力を弱化させ、私たちがbr}収入を創出し、利益を達成する能力に悪影響を及ぼす可能性があります。
私たちの候補製品は他人の知的財産権を侵害する可能性があり、これは私たちのコストを増加させ、私たちの開発と商業化努力を遅延したり阻害したりする可能性があります。
私たちの成功は他人を侵害することを避けるためのノウハウにある程度かかっている。製薬業の特徴は特許と他の知的財産権に関する訴訟が頻繁であることだ。特許検索は、特許間の用語の違い、データベースの不完全さ、および特許請求の範囲の意味の評価が困難であるため、我々のノウハウに関連する可能性のある第三者特許権を識別することは困難である。さらに、特許出願 は、出願が発表されるまで秘密にされているため、私たちの任意の候補製品または任意の将来の候補製品の商業化が第三者特許を侵害する可能性があることを知らないかもしれない。私たちは、私たちの任意の候補製品を研究、開発、または商業化するために許可を得る必要があるかもしれないと主張するいくつかの発行された特許および特許出願があるかもしれないが、私たちは、これらの特許および特許出願が商業的に合理的な条項で許可を得ることができるかどうか、または全く知らない。第三者による特許侵害請求は非常に時間がかかり、可能性がある
| ● | その結果、訴訟費用が高かった | |
| ● | 私たちの技術者と管理者の時間と注意力を移します | |
| ● | 主張する特許が満期になるまで、または最終的に裁判所によって無効と判断されるか、または裁判所に侵害されないまで、製品を商業化することを防止する | |
| ● | この技術の使用を停止または修正すること、および/または非侵害技術の開発を停止または修正することが要求される | |
| ● | 私たちは印税や許可協定を締結することを要求します。 |
第三者 は、私たちの任意の候補製品の発売を阻止することができる独自の権利を持っている可能性がある。私たちが損害賠償を要求し、私たちの任意の候補製品または私たちのプロセスに関連する商業活動を禁止しようとしている特許関連法律訴訟は、私たちに潜在的な損害賠償責任を負わせる可能性があり、私たちの任意の候補製品または任意の未来の候補製品を製造または販売し続けるために許可証を得ることを要求する。私たちは私たちがこのような訴訟で勝つかどうかを予測することもできないし、これらの特許に必要ないかなるライセンスが商業的に受け入れられる条項で提供されるかどうかも予測できない。さらに、必要であれば、私たちが権利侵害を回避するために、私たちの候補製品または任意の未来の候補製品またはプロセスを再設計できるかどうかを決定することはできません。したがって、司法または行政訴訟における不利な裁決、または必要な許可証を取得できなかったことは、私たちの任意の候補製品または将来の候補製品を開発および商業化することを阻止する可能性があり、これは、私たちの業務、財務状況、および経営業績を損なう可能性がある。
私たちは、主要なバイオ製薬会社を含め、私たちが推奨する候補製品と競争する分野で仕事を行っている他の会社があると予想されています。これらの分野は、私たちの活動に関連すると考えられる特許出願の提出につながっている可能性があります。 もし私たちが法廷でこれらまたは任意の発表された米国特許の有効性に挑戦するならば、私たちは、発表されたすべての米国特許に適用される法定有効性推定 を克服する必要があります。これは、勝訴のために、特許請求の無効性について明確で納得できる証拠を提示しなければならないことを意味する。USPTOの特許裁判および控訴委員会の行政裁判において、これらまたは発行された任意の米国特許の有効性を疑問視するならば、証拠が優勢であるため、br権利要件が特許不可であることを証明しなければならない。陪審員および/または裁判所が侵害、有効性、または実行可能性の問題で私たちに有利な判決を下すことを保証することはできない。たとえ私たちが成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
| 29 |
私たちは競争相手から従業員を誤って雇用した、または私たちまたは私たちの従業員がbrを誤って使用した、または彼らの前の雇用主のいわゆる機密情報または商業秘密を漏洩したという告発を受けるかもしれない。
Brは私たちの業界でよく見られるので、私たちの競争相手や潜在的な競争相手を含めて、以前他の生物製薬会社で働いていた人を採用します。現在、私たちに対するクレームは解決されていませんが、私たちは将来、私たちの従業員または潜在的な従業員がその前の雇用主に対して持続的な義務(例えば、競業禁止義務または非募集義務)を負っているか、または私たちの従業員または私たちがその前の雇用主の商業秘密または他の固有情報を使用または漏洩することを意図していないか、または漏洩する可能性があります。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。これらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
今回の発行と私たちの普通株保有に関するリスク
私たちの株は活発で、流動的で秩序のある取引市場を形成しない可能性があり、これは私たちの株主が今回の発行後に株を売る能力を抑制する可能性があります.
本目論見書 は我々普通株の初公開である.今回の発行まで、私たちの株は公開市場 を持っていません。今回の発行完了後、私たちの普通株はニューヨーク証券取引所アメリカ証券取引所で取引を開始し、コードは “AZTR”です。しかし、我々株の活発、流動、あるいは秩序ある取引市場は、今回の発行完了後に発展しないか、あるいは発展しても持続できない可能性がある。活発な市場の不足はあなたが株を売却したい時間やあなたが合理的だと思う価格で株を売る能力を弱めるかもしれません。活発な市場の不足はまたあなたの株の公正な市場価値を下げるかもしれない。不活発な市場は、株を売却することで資金を調達する能力を弱める可能性もあり、株を対価格で他社を買収する能力を弱める可能性もある。
私たちのbrがニューヨーク証券取引所アメリカ人の持続的な上場要求を満たしていないことは私たちの普通株の退市を招く可能性があります。
もし、brが発売された後、私たちはニュー交所アメリカ人の継続上場の要求を満たしていません。例えば、会社の管理要求や最低終値要求のように、ニュー交所アメリカ人は私たちの普通株を撤退させる措置を取るかもしれません。このような退市は私たちの普通株の価格にマイナス影響を与える可能性があり、私たちの普通株を売却したり購入したりする能力を弱める可能性があります。そうしたい場合。退市が発生した場合、上場要求を遵守するための私たちのいかなる行動も、私たちの普通株の再上場を許可し、市場価格を安定させたり、私たちの普通株の流動性を高めたりすることを保証することはできません。brは、私たちの普通株がニューヨーク証券取引所アメリカ人の最低入札要求を割ってしまうことを防止したり、未来にニューヨーク証券取引所アメリカ人の上場要求に合わないことを防止します。
将来の増資は、あなたの所有権を希釈し、および/または私たちの運営に他の悪影響を及ぼす可能性があります.
もし私たちが株式証券を発行することで追加資本を調達すれば、私たちの既存株主の所有権パーセンテージは減少し、これらの 株主は大幅な希釈を経験する可能性がある。もし私たちが債務証券を発行することでより多くの資金を調達すれば、これらの債務証券は私たちの普通株よりも優先する権利を持ち、発行された債務証券の条項は私たちの資産の留置権を含む私たちの業務に重大な制限を加えるかもしれない。もし私たちが協力と許可手配を通じてより多くの資金を調達すれば、私たちは私たちの知的財産権や候補製品のいくつかの権利を放棄するか、または私たちに不利な条項で許可を付与することを要求されるかもしれない。
私たちの株の市場価格は変動と変動の影響を受けるかもしれない。投資の全部または一部を失うかもしれません.
株式の初公募株価格はすでに我々と引受業者代表との交渉によって決定されており、取引市場の価格を代表していない可能性がある。今回の上場後、私たちの株価は下落する可能性があります。 株式市場、特に初期段階にある上場企業は、極端な価格や出来高変動を経験しており、 は通常、このような会社の経営業績に関係なく、あるいは比例していません。これらの広範な市場要素は私たちの普通株の市場価格を深刻に損害する可能性があり、私たちの実際あるいは予想される経営業績および財務状況や将来性にかかわらず、これは投資家が私たちの普通株の急速な変化の価値を評価することを困難にするかもしれない。過去には、会社証券市場価格の変動に伴い、証券集団訴訟がしばしば提起されてきた。私たちの集団訴訟は重大な責任を招く可能性があり、結果にかかわらず、巨額のコストと私たちの経営陣の資源と注意の移転を招く可能性があります。ニューヨーク証券取引所アメリカ取引所での株価は様々な要因によって変動する可能性があります。その中のいくつかの要素は制御できませんが、これらに限定されません
| ● | 私たちと私たちの競争相手の経営結果と財務状況の実際または予想変化 ; | |
| ● | 私たちの候補製品に対する市場の受容度は |
| 30 |
| ● | もし私たちの株がアナリストの追跡範囲内にあれば、証券アナリストの収益予想または推薦が変化する | |
| ● | 他の人は技術革新や競争力のある新製品を開発し | |
| ● | 私たちが発表した技術革新または新製品公告 | |
| ● | 候補製品の臨床試験や臨床試験の結果を発表します | |
| ● | 私たちは公開発表のマイルストーンを実現できませんでした | |
| ● | 私たちは、新しいまたは強化された製品の支出とこれらの製品によって生成される販売との間の遅延 ; | |
| ● | 私たちが提起したり、私たちに対して提起された訴訟に参加することを含む知的財産権の発展について ; | |
| ● | 事態の発展と規制当局の新製品または改良製品の承認または拒否に関する決定 | |
| ● | 新製品、技術、またはビジネスを開発、取得するための私たちの金額を変更します | |
| ● | 候補製品を普及させるための支出を変更します | |
| ● | 私たちのbrは、私たちの主要株主が未来に私たちの株または他の証券を売却することを提案したり、販売することを提案します | |
| ● | キーパーソン変動 ; | |
| ● | 私たちや競争相手の研究開発プロジェクトの成功や失敗 | |
| ● | 私たちの株の取引量 | |
| ● | 一般に 経済や市場状況,その他の要因には,我々の経営業績とは無関係な要因が含まれている. |
これらの要因と任意の対応する価格変動は私たちの株式の市場価格に重大な悪影響を与え、私たちの投資家に重大な損失をもたらす可能性がある。過去には、市場変動後、上場企業の株主が証券集団訴訟を起こすことが多かった。もし私たちが証券訴訟に巻き込まれれば、私たちに巨額のコストをもたらし、私たちの経営陣の資源と注意を私たちの業務から移すかもしれない。
“雇用法案”によると、私たちは“新興成長型会社”であり、新興成長型会社に適用される情報開示要求の低下が、私たちの普通株の投資家に対する吸引力を低下させるかどうかを決定することはできません.
私たちbrは、JOBS法案で定義されている“新興成長型企業”であり、“新興成長型企業”ではない他の上場企業に適した様々な報告要求のいくつかの免除を利用することができるが、これらに限定されない
| ● | “サバンズ-オキシリー法”第404節の監査役認証要件の遵守は要求されていない | |
| ● | 私たちの定期報告書と代理声明では、役員報酬に関する開示義務が減少した | |
| ● | 役員報酬について拘束力のない諮問投票を行うことと、株主が金パラシュート支払いを承認することを要求するbrを免除すること | |
| ● | 新しい会計基準または改正された会計基準を遵守するために使用できる移行期間が延長された。 |
| 31 |
私たちは、上記で議論された免除を含む“雇用法案”によって提供されるすべての福祉を利用することを選択した。私たちは投資家が私たちがこのような免除に依存する可能性があるために私たちの普通株の吸引力が低下していることを発見するかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株はそれほど活発ではない取引市場が出現する可能性があり、私たちの株価はもっと変動するかもしれない。
私たちは5年間で“新興成長型会社”になるでしょう。もし私たちの収入が10.7億ドルを超えたら、もし私たちが3年以内に10億ドルを超える転換不可能債券を発行すれば、あるいは私たちの非付属会社が持っている普通株の時価が今後1年の6月30日に7億ドルを超えたら、私たちはこの地位をより早く失うだろう。
“雇用法案”によると、私たちの“新興成長型会社”としての身分は、必要なときに資金を集めることをより困難にする可能性があります.
我々は“新興成長型会社”として様々な報告要求の免除を受けているため,投資家への吸引力が低下する可能性があるため,必要なときにより多くの資本を集めることは困難である可能性がある。もし投資家が私たちの報告が業界の他の会社より透明ではないと思ったら、彼らは私たちの業務を業界内の他の会社と比較できないかもしれません。もし私たちが必要な時に追加資本を調達できなければ、私たちの財務状況と運営結果は実質的なbrと不利な影響を受ける可能性があります。
私たちは過去に普通株に配当金を支払っていませんでしたが、今のところこのような配当金を支払う計画もありません.
私たちは私たちのすべての収益を再投資して、運営コストを補い、他の面で競争力を維持することを計画しています。 予測可能な未来に、私たちは私たちの普通株についていかなる現金配当金も支払うつもりはありません。私たちはいつでも十分な黒字現金を生産して、配当金として私たちの普通株式の保有者に分配することを保証できません。したがって、あなたは私たちが提供した普通株式から現金配当金を得ることを期待してはいけない。
| 32 |
もし株式研究アナリストが私たちの業務に関する研究や報告を発表しなければ、あるいは彼らが不利なコメントをしたり、私たちの株式格付けを下げたりすれば、私たちの株価は下落するかもしれません.
私たちの株の取引市場は株式研究アナリストが発表した私たちと私たちの業務に関する研究と報告に部分的に依存しています。もしあれば。私たちはこのアナリストたちに統制権がなく、彼らは私たちに関する研究報告書を書くことを約束しなかった。もし私たちまたは私たちの業務に関する研究報告が発表されていない場合、または1つ以上の株式研究アナリストが私たちの株式格付けを引き下げた場合、またはこれらのアナリストが他の不利なコメントを発表したり、私たちまたは私たちの業務に関する報告書の発表を停止した場合、私たちの株価は下落する可能性がある。
私たちの普通株の市場が発展してきたと仮定すると、将来的に資格のある株は私たちの普通株の市場に悪影響を及ぼす可能性がある.
今回の発売まで、私たちが発行したすべての普通株は、私たちの転換可能な優先株と転換本チケットを転換する際に発行可能な普通株を含めて、ロックプロトコルの制約を受けており、この合意により、所有者は今回の発売終了後180日以内に私たちの任意の証券を直接または間接的に売却、譲渡、譲渡、または要約しないことに同意しましたが、私たちの上級管理者と取締役が今回の発売終了後1年以内に売却しないことに同意した場合は除外します。ロックプロトコルによると、吾らは転換可能な優先株および転換可能な本券所持者に引受および付帯登録権を付与しており、これにより、今回の発売終了後180日から、転売のために最大9,542,519株の普通株の登録を要求することができる。また、今回の発行終了後90日目から、私たちの株主は、証券法公布の第144条に基づいて公開市場で普通株式の全部または一部を一般取引で販売する資格がある可能性がありますが、第144条とロック契約のいくつかの制限を受けています。一般に、ルール144によれば、非関連株主は6ヶ月後に株式 を自由に売却することができるが、現在の公開情報要求を遵守しなければならない(1年後にその要求が消失する)。
規則144または任意の転売目論見書(投資家が今回の発行に関連する証券brを売却することを含む)に従って私たちの普通株を大幅に売却することは、私たちの普通株の市場価格に大きな悪影響を及ぼす可能性がある。
あなたが購入した普通株の1株当たりの帳簿価値はすぐに希釈されるだろう
我々の普通株の1株当たりの要約価格は私たちの普通株の1株当たりの帳簿価値よりも大幅に高いため、今回の発行で購入した普通株の有形帳簿純値は大幅に希釈されます。1株当たり5.00ドルの初期公開発行価格に基づいて、今回の発行で普通株を購入した場合、普通株の2023年3月31日の有形帳簿純価値における1株4.28ドルの大幅な希釈を直ちに経験することになります。
| 33 |
私たちはより高い証券集団訴訟のリスクに直面しているかもしれない
歴史的に見ると、証券集団訴訟は通常、ある会社の証券市場価格が下落した後に提起される。このリスクは私たちに特に関連している。バイオテクノロジーや製薬会社は近年著しい株価変動を経験しているからだ。もし私たちが起訴されれば、巨額のコストを招き、経営陣の注意と資源を移す可能性があり、これは私たちの業務を損なう可能性がある私たちは取締役と高級職員保険を維持して、これらの保険は合理的に私たちを潜在的なクレームから守るのに十分だと思います。しかし、私たちは保険項目の下のいくつかの免責額を満たす責任があります。いずれにしても、保険範囲が私たちをクレームから守るのに十分であることを保証することはできません。また、保険コストが増加する可能性があり、保険の獲得性が減少する可能性がある。したがって,現在の保険レベル を合理的なコストで維持できないか,あるいは全く維持できない可能性がある。
我々の は,今回発行された収益をどのように使用するかについて広範な裁量権を持ち,これらの収益を有効に使用できない可能性があり,これは我々のbr}の運営結果に影響を与え,我々の株価を下落させる可能性がある.
私たちはあなたが同意しない方法とあなたの投資に見返りを与えないかもしれない方法で投資したり、これらの収益を使用したりするかもしれません。私たちの経営陣は、今回発行された純収益を運用するためのかなりの裁量権を持っています。本募集説明書を含めて“収益の使用”。しかし,我々の業務や業界の発展に伴い,我々の需要が変化する可能性があるため,今回の発行から得られた収益は,我々の現在のbr期待とは大きく異なる方法で使用される可能性がある.私たちは、私たちの株主に著しい見返りや何の見返りも与えない目的に純収益を使うことができます。また、使用前に、今回発行された純収益に収入や価値を失わないように投資する可能性があります。私たちの経営陣がこれらの資金を有効に使用できなければ、財務損失を招き、私たちの業務を損ねる可能性があり、 は私たちの普通株価格を下落させ、候補製品の開発を延期します。あなたはあなたの投資決定の一部として純収益が適切に使用されているかどうかを評価する機会がありませんので、あなたは私たちの経営陣の判断に依存します。
我々 はDGCL第204条に基づいてある会社行為を承認したが,承認または関連会社行為の有効性を疑問視するためにクレーム を提出しない保証はない。
今回の発行準備の一部として、私たちの取締役会と株主は、2023年2月にDGCL第204条に基づいて、デラウェア州の会社が欠陥のある会社の行動を承認することを許可し、その効力は会社の行為が最初に取られた日に遡ることを許可している。第204条の承認または承認は、純粋に、任意の不確実性を除去し、特定の安全発表、取締役会任命、および他社行為の有効性を確保するための、特定の許可失敗の救済事項である。承認を発効させるために、私たちの取締役会は、私たちの取締役会と株主がその後、(I)会社規約の採択、(Ii)取締役会の規模と構成を決定し、変更すること、(Iii)いくつかの株式、株式オプション、株式承認証、転換可能な手形を発行することを決定した。そして(Iv)配当金に基づいて株式を発行する。 承認は、不確実性の解消とその有効性を確保する効果もあり、これらの行動の有効性は、これまでの不確実性と、その後、そのような行動を許可した取締役や株主の権力の不確実性について疑問視されている その後、204節により、承認された行為を総称して“会社法”と呼ぶ。“会社法”が施行された日から,第204条の規定により,承認された日から,推定及び有効株を保有するすべての所有者に承認の書面通知を直ちに発行する(第204節でこのような用語が使用されているため)。
DGCL第205条によれば、承認によって承認された任意の会社法が許可に失敗したために無効または撤回可能な請求に関する任意のクレーム(定義第204条参照)、またはデラウェア州衡平裁判所は、第204条によって承認された任意の会社法の無効またはある条件下でのみ有効であることを適宜宣言しなければならず、承認後120日以内に の有効時間を提出しなければならず、この場合は2023年6月である。取締役会と私たちの約%の未償還および議決権証券の保有者 (有効と推定の)は会社法の承認と発効に同意します。承認に同意しないいかなる株主も、DGCL第205節で承認されたいかなるダメージに挑戦するのに十分なダメージを示す可能性は低いと考えられる。承認への挑戦リスクが低く,挑戦者 が法律や公平の基礎を構築して承認や会社行動を無効または制限することは困難であると考えられるが,裁判所は承認や会社行為への挑戦を維持する可能性があり,そうすれば,わが社の管理やガバナンスに悪影響を及ぼす可能性がある。
| 34 |
私たちの定款とデラウェア州法律は株主が有利だと思う買収を阻止するかもしれない
今回の発行が完了した後、私たちは、改正および再記載された会社登録証明書および改正および再記載された会社定款を採用する予定です。当社の改正および再記載された会社登録証明書および改正および再記載された会社登録証明書の条項およびデラウェア州法の適用条項は、株主がその株式からプレミアムな取引を得る可能性があること、または当社株主がその最適な利益に適合すると考える取引を含む、実際または潜在的な支配権変更または管理層変更に関連する取引を遅延または阻止する可能性があります。当社の会社登録証明書の改訂と再記載の定款の規定:
| ● | 株主総会を開催できる人を制限する | |
| ● | 我々の株主が我々の年次株主総会に事項を提出することを制限したり,適切な手続きに従わない場合は, が我々の年次株主総会で取締役を指名することを禁止する | |
| ● | 株主が書面で行動することを規定していないかどうか | |
| ● | 累積投票権が規定されていないかどうか;および | |
| ● | Brを提供するすべての取締役会の空きは、定足数が不足していても、当時在任していた多くの取締役が賛成票を投じて埋めることができる。 |
また、一旦上場企業になると、DGCL第203条は、特定の条件を満たさない限り、議決権を有する株式を発行した15%以上の人と任意の業務統合を行う能力を有する実益を制限することができる。これらの規定は、私たちの管理チームを強化し、現在の価格より高い割増であなたの株を潜在的な買収者に売却する機会を奪う可能性があります。このような割増価格をコントロールできない可能性がある場合は、私たちの普通株の価格を下げる可能性があります。
一般リスク因子
会計基準の変化及び経営陣の複雑な会計事項に関する主観的仮定、見積もりと判断は私たちの財務状況と経営結果の報告に重大な影響を与える可能性がある。
会計 米国で一般的に受け入れられている会計原則および関連する会計声明、実施ガイド、解釈は、長期資産減価会計や株式ベースの報酬など、我々の業務に関連する広範な事項に適用され、これらは複雑であり、私たちの経営陣の主観的な仮定、推定、判断に関連している。これらのルールまたはその解釈の変化、または我々の経営陣の基本的な仮定、推定または判断の変化は、私たちの報告または予想財務業績を著しく変化させ、または大幅に変動させる可能性がある。
サバンズ·オキシリー法第404条に基づいて財務報告を効果的に内部統制できなければ、我々の業務、財務状況、経営結果に重大な悪影響を及ぼす可能性がある。
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。財務報告の内部制御はアメリカ公認会計原則(GAAP)に基づいて財務報告の信頼性と財務諸表の作成に対して合理的な保証を提供することを目的とした過程である。アメリカ上場会社会計監督委員会(PCAOB)が制定した標準 によると、財務報告の内部制御に欠陥があり、即ち制御の設計或いは操作は管理層或いは人員がその指定機能を履行する正常な過程中に適時に誤り陳述を防止或いは発見することを許可しない。PCAOBは重大な弱点を財務報告内部制御の欠陥或いは欠陥の組み合わせと定義しているため、合理的な可能性があり、年度或いは中期財務諸表の重大な誤報は適時な予防或いは発見と是正を得ることはできない。
| 35 |
“サバンズ-オキシリー法案”第404条によると、私たちは、米国証券取引委員会に提出された第2の10-Kフォーム年次報告書と、その後、経営陣の財務報告の内部統制に対する有効性を含む財務報告書の内部統制の有効性に関する報告書を毎年提出することが求められる。私たちの監査人は、私たちが新興成長型会社やより小さい報告会社ではなく、加速届出や大型加速申告会社である場合にも、私たちの財務報告内部統制の有効性を証明する必要がある。もし私たちが財務報告の内部統制に有効であると断言できない場合、あるいは将来必要な場合、私たちの独立公認会計士事務所が私たちの財務報告の内部統制の有効性に保留の意見を発表できなければ、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの普通株の市場価格は悪影響を受ける可能性があり、私たちは私たちの普通株式上場取引所、アメリカ証券取引委員会、あるいは他の監督機関の訴訟や調査対象になるかもしれない。これは追加的な財務および管理リソースを必要とする可能性があり、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性がある。
我々の管理チームの限られた上場企業の経験は、米国証券法の報告要求を遵守する能力に悪影響を及ぼす可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。
私たちのbr官僚の上場企業は経験が限られていて、これは私たちが法律と規制要求を守る能力、例えば サバンズ-オクスリー法案が規定している要求を弱めるかもしれません。このような責任には、連邦証券法を遵守し、必要な情報をタイムリーに開示することが含まれている。 このような欠陥、弱点、またはコンプライアンスは、1934年の証券取引法や“取引法”の報告要求を遵守する能力に重大な悪影響を及ぼす可能性があり、“取引法”は私たちの上場企業の地位を維持するために必要である。もし私たちがこれらの義務を履行できなかったら、私たちは引き続きアメリカの上場企業としての能力が危険にさらされています。この場合、あなたはわが社へのすべての投資を失うかもしれません。
私たちは財務報告の内部統制における私たちの重大な弱点を発見しました。私たちは将来的に他の重大な弱点を発見する可能性があります。これらの弱点は、私たちが報告義務を履行できない場合、あるいは私たちの財務諸表に重大な誤報を招く可能性があります。もし私たちがいかなる重大な弱点を正すことができなかった場合、あるいは財務報告の効果的なコントロールを確立し、維持できなかった場合、 私たちは財務業績を正確に適時に報告する能力が悪影響を受ける可能性があります。
効果的な財務報告内部統制は、信頼できる財務報告を提供するために必要であり、それに加えて、詐欺を防止するための十分な開示制御および手続きが必要である。必要な新しいまたは改善された制御措置を実施できなかったか、または実施中に困難に遭遇した場合、私たちは私たちの報告義務を履行できない可能性がある。さらに、“サバンズ-オキシリー法案”第404条に基づいて行われた任意のテスト、または必要に応じて私たちの独立公認会計士事務所による後続テストは、実質的な弱点と考えられる財務報告における内部統制の欠陥を明らかにすることができ、または、私たちの財務諸表の前向きまたはトレーサビリティ変更、またはさらなる注目または改善が必要な他の分野を決定する必要があるかもしれない。brの悪い内部統制は、投資家が私たちの報告書の財務情報に自信を失う可能性があり、これが私たちの普通株の取引価格に負の影響を与える可能性がある。もう1つのリスクは,我々も我々の独立公認会計士事務所も(将来適用される場合)所定の時間範囲で結論を出すことができないこと,すなわち財務報告の内部統制が第404条の要求に従って有効であることである。したがって、投資家は私たちの財務と他の公開報告書に自信を失うかもしれません。これは私たちの業務と私たちの普通株の取引価格を損なうことになります。
| 36 |
2022年12月31日と2021年12月31日までの年次財務諸表を作成する間、私たちと私たちの独立公認会計士事務所は、会計機能の十分な分離が不足し、2021年に発行されたいくつかの権証が適切な会計処理に欠けていることに関連しているため、これらの権証は、私たちが以前発行したが返済されていない債務ツールに関連している。私たちは財務報告の内部統制を改善するための措置 を実施し、この大きな弱点を補っている。私たちの会計インフラ内に十分な人員を増やして、会計機能の適切な分離を促進し、私たちの内部で作成された財務諸表を適切に審査できるようにするつもりです。
私たちのbrは、財務報告の内部統制において将来の重大な弱点を発見したり、サバンズ-オキシリー法案の要求を含む上場企業の要求を満たすことができないかもしれません。私たちは、私たちの財務結果を正確に報告したり、法律や証券取引所法規要求の時間範囲でこれらの結果を報告することができないかもしれません。私たちは、私たちの既存の材料欠陥が修復されるか、あるいは他の材料欠陥が存在しないか、あるいは他の材料欠陥が発見されないか、私たちの名声、財務状況、および運営結果に悪影響を及ぼす可能性がある場合 を保証することはできない。
我々brは,米国証券取引委員会に報告する上場企業となることによりコストが大幅に増加し,我々の経営陣はコンプライアンス義務を履行するために多くの時間を投入することを要求される.
上場後に米国証券取引委員会に報告する上場企業として、重大な法律、会計、その他の費用が発生しますが、これは私たちが民間会社としては発生していないことです。我々は、取引法の報告要求、サバンズ-オキシリー法案、“ドッド·フランクウォール街改革と保護法”の報告と管理条項、その後、米国証券取引委員会によって実施される規則を遵守し、これらの規則は上場企業に重要な要求を提出し、有効な開示と維持を要求し、財務制御と会社管理のやり方を変更する。これらの法律には重要な会社管理と報告条項 があり、これは私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動を更に困難にし、時間或いはコストを更に高くし、また私たちの人員、システム、資源に不必要な圧力を与える可能性がある。私たちの管理職と他の人たちはこのような規定を実行するために多くの時間を投入する必要があるだろう。また、これらの規制は、取締役や上級職員責任保険を獲得することをより困難かつ高価にすることが予想され、同じまたは同様の保証範囲を得るために、低減された保険限度額および保証範囲を受け入れることが要求される可能性があります。したがって、私たちは私たちの取締役会委員会に参加したり、役員になったりすることが、brの合格者を引き付けて維持することはもっと難しいかもしれません。
我々brは現在,経済不確定と資本市場の混乱の時期にあり,ロシアとウクライナの間で続く軍事衝突により,この時期は地政学的不安定の大きな影響を受けている。
地政学的緊張のエスカレートやロシアとウクライナ間の軍事衝突の開始に伴い、米国と世界市場は動揺と混乱を経験している。2022年2月、ロシアはウクライナに対して全面的な軍事侵入を発動した。持続的な軍事衝突の持続時間と影響の高さは予測できないが、ウクライナ衝突は大口商品価格、信用と資本市場の大幅な変動を含む市場混乱を招く可能性がある。また、ロシアの以前のクリミア併合と、最近ウクライナドネツクとルガンスク地域の2つの分離主義共和国を認め、その後のウクライナへの軍事介入により、米国、EUおよび他の国がロシア、ベラルーシ、ウクライナクリミア地域、いわゆるドネツク人民共和国およびいわゆるルガンスク人民共和国に対して制裁およびその他の処罰を実施することになり、いくつかのロシア金融機関を環球銀行間金融電気通信協会(SWIFT)支払いシステムから除去することに同意した。また、より多くの可能な制裁と処罰措置を取ることを提案し、(または)脅している。ロシアの軍事行動とそれに伴う制裁は、世界経済や金融市場に悪影響を及ぼす可能性があり、資本市場の不安定化と流動性の不足を招き、追加的な資金を得ることを難しくする可能性がある。上記のいずれの要素も、私たちの業務、見通し、財務状況、経営業績に影響を与える可能性があります。軍事行動、制裁、それによる市場混乱の程度や持続時間は予測できないが、巨大な可能性がある。このような中断は、本明細書に記載された他のリスクの影響 を大きくすることも可能である。
| 37 |
前向き陳述に関する警告的説明
本募集説明書は、タイトルを含む“募集説明書の概要,” “リスク要因は” “ の収益を使って、” “経営陣の財務状況と経営成果の検討と分析“ と”業務.業務“前向きな陳述が含まれている。“信じる”、“可能”、“そうなる”、“可能”、“推定”、“継続”、“予想”、“意図”、“可能”、“会議”、“プロジェクト”、“計画”、“予想”、および未来のイベントまたは結果の不確実性を表す同様の表現は、前向き表現を識別することを目的としている。これらの前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
| ● | 私たちの将来の財務と経営業績は | |
| ● | 私たちの業務の期待成長、市場浸透と傾向に対するbrの意図、期待、そして信念 | |
| ● | 私たちのビジネス計画のタイミングと成功 | |
| ● | 候補製品の開発と臨床試験に成功しました | |
| ● | 私たちは私たちの候補製品のためにFDAの承認を得ることができます | |
| ● | 私たちは私たちの候補製品の開発、製造、販売に関するすべてのアメリカと外国の法規を遵守することができます | |
| ● | 私たちは第三者に依存して候補品を生産します | |
| ● | 今回発行された純収益は十分であるかどうか | |
| ● | 市場状況が私たちの株価と経営業績に与える影響 | |
| ● | 私たちは知的財産権を維持し、保護し、向上させる能力; | |
| ● | 私たちの市場競争の激化の影響と私たちの効果的な競争能力 | |
| ● | 私たちのbrは今回の発行で得られた資金を使用する予定です | |
| ● | 知的財産権侵害や他のクレームの発起と弁護に関する費用 | |
| ● | 合格した従業員とキーパーソンを引きつけて維持する | |
| ● | 相互補完会社や技術への将来の買収や投資; | |
| ● | 私たち は変化する法律基準と法規、特に上場会社に関する要求を遵守する能力があります。 |
これらの前向き陳述は、“を含む多くのリスク、不確定要素、仮説の影響を受ける”リスク要因 “そして本募集説明書の他の場所で。また,我々の運営環境は競争が激しく目まぐるしく変化し, の新たなリスクが時々発生している。私たちはすべてのリスクを予測することができず、すべての要素が私たちの業務に与える影響を評価することもできないし、任意の要素や要素の組み合わせは、実際の結果が私たちが行う可能性のある任意の前向きな陳述に含まれる結果と大きく異なる程度をもたらす可能性がある。これらのリスク、不確実性、および仮定を考慮して、本明細書で議論される展望的イベントおよびbr}状況は発生しない可能性があり、実際の結果は、私たちの展望的陳述において予期されるまたは示唆とは大きく異なる可能性がある。
あなたは未来の事件の予測として展望的な陳述に依存してはいけない。私たちは展望性陳述に反映された予想が合理的であると考えているが、私たちは展望性陳述に記述された未来の結果、活動レベル、業績或いは事件 と状況が実現或いは発生することを保証することができない。しかも、私たちまたは他の人たちは展望的陳述の正確性と完全性に責任を負わない。法律の要求を除いて、私たちは、これらの陳述が実際の結果に適合するか、または私たちの予想される変化に適合するように、本募集説明書の発行日後に、任意の理由で任意の 前向き陳述を公開更新する義務がない。
あなたは本募集説明書を読んで、私たちが募集説明書で引用してアメリカ証券取引委員会に提出した登録説明書の一部としての文書 を読んで、私たちの未来の実績、活動レベル、業績、およびbr}事件と状況は私たちの予想と大きく異なるかもしれません。
商標、サービスマーク、商号
私たちは、米国および/またはいくつかの外国司法管轄区において、当社の業務に関連する複数の登録商標および一般法商標、サービスマークおよび/または商品名を所有または使用する権利があります。
便宜上、本入札明細書に記載されている商標、サービスマーク、ロゴ、および商品名にはおよび記号がないが、このような参照は、適用される法律に基づいて、私たちの権利または適用許可者がこれらの商標、サービスマーク、および商品名に対する権利を最大限に主張しないことをいかなる方法でも示すものではない。本募集説明書には、他社の他の商標、サービスマーク、商号が含まれており、これらはそれぞれの所有者の財産である。本入札明細書に登場するすべての商標、サービスマーク、および商品名は、それぞれの所有者の財産であることが知られている。私たちは、他の会社との関係を暗示するために、他の会社の商標、サービスマーク、著作権、または商号を使用したり、展示したりするつもりはありません。
| 38 |
収益を使用する
今回の発行で1,500,000株の私たちの普通株を発行·販売し、1株5.00ドルの初期発行価格で計算すると、純収益は約650万ドル(引受業者が追加株を購入する選択権を全面的に行使すれば750万ドル)、推定された引受割引と手数料、私たちが支払うべき推定発売費用 を差し引くと推定される。
我々 は,今回発行した純収益と我々の既存の現金と現金等価物を使用する予定であり,以下のようになる
| ● | ATR-12 Netherton症候群計画のための250万ドルを含む臨床試験および製品開発を支援するために約300万ドルが使用され、提案された1 b期臨床試験の用量に資金を提供することが予想される。ATR-04 EGFR阻害剤関連皮疹計画に20万ドルを提供し、提案された1 b期臨床試験の初期登録を通じて資金を提供する予定である | |
| ● | 研究および開発に約200万ドル、ATR-12バイオマーカー開発に約100万ドル、ATR-04バイオマーカー開発に50万ドル、新製品開発に50万ドルが使用されている | |
| ● | 約50万ドルを臨床製造に使用しました | |
| ● | 残高は、許可内および協力活動、br}実験室施設改善、一般と行政費用、および運営資本を含む他の一般会社用途に使用される。 |
我々の現在の計画と業務状況によると、我々のbr}今回の純収益の期待用途は、現在の意図を代表しています。 本募集説明書の日付まで、今回の発行完了後に受け取る純収益のすべての特定用途 を完全に肯定的に予測することはできません。上記の用途の実際の金額に使用します。私たちは時々買収によって候補製品を補充することで、私たちの現在の業務を拡張する機会があると信じている。現在、特定の買収やライセンス内のプロトコルや計画はありませんが、純収益の一部をこれらの目的に使用する可能性があります。
私たちが実際に支出した金額と時間は、私たちの臨床試験と私たちの最初の候補製品の他のbr開発と商業化努力の進展、私たちの運営に使用された現金の数を含む多くの要素に依存するだろう。しかし, 上記の目的に用いる純利益額を確定的に見積もることはできない.私たちは純収益を他の目的に使用することが必要であるか、または賢明であることを発見するかもしれないが、私たちは純収益の応用において広範な裁量権を持つだろう。上記の用途を完了する前に、今回発行した純収益を短期·中期有利子債務、投資レベル手形、預金証書または政府の直接または保証債務に投資する予定です。
| 39 |
配当政策
私たちは普通株についていかなる現金配当金も発表したり支払ったりしたことがありません。私たちは予測可能な未来に私たちの普通株に対していかなる現金配当金も支払わないと予想しています。投資家は現金配当金を獲得して私たちの普通株を購入することを期待してはいけません。将来私たちの普通株(あれば)の配当支払いは私たちの取締役会が適宜決定し、私たちの収益、資本要求と財務状況、その他の関連事実に依存します。私たちは現在、将来のすべての収益(あれば)を残し、私たちの業務の発展と成長に資金を提供するつもりです。
| 40 |
大文字である
次の表は2023年3月31日までの現金と資本総額を示しています
| ● | 実際の状況で計算する | |
| ● | 形式に基づいて(I)長期株式分割、または株式分割を実施し、2023年5月17日に7.1対1の比率で を行い、(2)今回の発行終了時に,発行されたすべての転換可能優先株を合計7,693,436株普通株に自動変換し,および(3)すべての変換可能本票を合計1,838,775株普通株に自動変換し,今回の発行終了時には、そして | |
| ● | 調整後の予備試験に加え、1株5.00ドルの初公募株価格で今回の発行で1,500,000株の普通株を売却したことを反映している。 引受割引と手数料および私たちが支払う予定の発売費用を差し引いた |
本募集明細書の他のすべての株式及び株価情報は、株式分割を反映するように調整されている。
あなたはこの表の情報を私たちの財務諸表と関連する注釈と一緒に読んでください“経営陣の財務状況と経営結果の検討と分析“本募集説明書の他のところに出てきます。
| 2023年3月31日まで | ||||||||||||
| (単位は千で、シェアは含まれていない) | 実際 | 形式的には | 調整後の備考 | |||||||||
| 現金と現金等価物 | $ | 1,833 | $ | 1,833 | $ | 8,346 | ||||||
| 転換支払手形 | $ | 6,400 | ||||||||||
| Aシリーズ転換可能優先株;額面0.0001ドル、許可205,385株、発行済みと発行済み株、実際;発行済み株式と発行済み株、形式と調整後の形式 | $ | 3,273 | — | — | ||||||||
| A-1シリーズ転換可能優先株;額面0.0001ドル,380,657株認可された、発行された株と発行済み株、実際;発行済み株式と発行済み株、形式と調整後の形式がない | $ | 14,101 | — | — | ||||||||
| Bシリーズ転換可能優先株;額面0.0001ドル、発行許可851,108株、発行済みと発行済み株414,735株、実際;発行済み株式と発行済み株、形式と調整後の形式はない | $ | 17,446 | — | — | ||||||||
| 普通株、額面0.0001ドル、認可株式1,950,000株、発行済み株式147,041株、実際;10,586,510株発行済株式と既発行株式、予想数;12,086,510株発行済株式と発行済み株式、調整後の予想数 | $ | - | $ | 1 | $ | 1 | ||||||
| 追加実収資本 | $ | 1,093 | $ | 46,024 | $ | 51,368 | ||||||
| 赤字を累計する | $ | (39,772 | ) | $ | (42,475 | ) | $ | (42,475 | ) | |||
| 株主権益合計 | $ | (38,679 | ) | $ | 3,550 | $ | 8,894 | |||||
| 総時価 | $ | 2,541 | $ | 3,550 | $ | 8,894 | ||||||
| 41 |
薄めにする
今回の発行で私たちの普通株に投資した場合、あなたの権益は今回の発行で普通株購入者が支払う1株当たりの普通株金額と、今回の発行が完了して調整された1株当たりの有形帳簿純価値の予想値との差額に希釈されます。
2023年3月31日まで、私たちの予想有形帳簿純価値は約340万ドル、あるいは普通株1株当たり0.32ドルです。私たちの予想1株当たりの有形帳簿純資産とは、私たちの総有形資産から私たちの総負債を引いて、2023年3月31日までの発行済み普通株式総数で割って、2023年5月17日に7.1対1の割合で実施した前向き株式分割または株式分割、および(Ii)2023年3月31日現在の私たちの優先株と転換可能手形のすべての流通株が普通株に自動変換された 株である。
今回1,500,000株の私たちの普通株を発売した後、1株5.00ドルの初回公募株価格で計算して、引受割引と手数料、支払うべき発売費用を差し引いた後、2023年3月31日まで、私たちの予想有形帳簿純価値は約870万ドル、あるいは1株当たり0.72ドルです。これは、我々の既存株主の調整後の有形帳簿純価値 が直ちに1株0.40ドル増加する見込みであり、今回発行株を購入した投資家は直ちに1株4.28ドルを希釈することを意味する。
次の表はこの希釈を説明している:
| 1株あたりの初公開価格 | $ | 5.00 | ||||||
| 今回の発売発効前に、2023年3月31日までの1株当たり有形帳簿純価値を予定しております | $ | 0.32 | ||||||
| 新投資家が今回発行した株を購入したため、1株当たりの有形帳簿純価値が増加すると予想される | $ | 0.40 | ||||||
| 今回の発売発効後に調整された1株当たりの有形帳簿純価値の予定です | $ | 0.72 | ||||||
| 今回の発行株を購入した新投資家の1株当たりの償却 | $ | 4.28 |
| 42 |
以下の表は、上述した予想調整に基づいて、既存株主((I)株式分割と(Ii)の実施時に今回発行されたすべての優先株と未償還変換可能手形を自動的に普通株に変換した後) と新規投資家との間の、我々から購入した普通株数、我々に支払われた総対価格および1株5.00ドルの初期公開発行価格(引受割引と手数料および推定発行費用を差し引く前)との差をまとめたものである
| 株を購入する | 合計 考慮事項 | 平均値 | ||||||||||||||||||
| 価格 毎に | ||||||||||||||||||||
| 番号をつける | パーセント | 金額 | パーセント | 共有 | ||||||||||||||||
| 既存の 株主 | 10,586,510 | 88 | % | $ | 40,182,933 | 84 | % | $ | 3.80 | |||||||||||
| 新しい公共投資家 | 1,500,000 | 12 | % | $ | 7,500,000 | 16 | % | $ | 5.00 | |||||||||||
| 合計する | 12,086,510 | 100.0 | % | $ | 47,682,933 | 100.0 | % | |||||||||||||
なお、上記の表および計算は、いずれも、当社が2023年3月31日までの発行済み普通株数をもとに、(I)株式分割を実施していること、および(Ii)自社優先株および転換可能本票のすべての発行済み株式を今回の発行終了時に自動的に普通株に変換することを実施しているが、含まれていない
| ● | 1,290,319株我々の普通株brは、2016年の株式インセンティブ計画に基づいて付与され、未償還オプションを行使する際に発行することができ、加重平均行権価格は1株1.33ドルである。 または2016年計画; | |
| ● | 約275,210株私たちの普通株は発行された株式承認証を行使する時に発行することができ、加重平均行権価格は1株当たり4.23ドルである | |
| ● | 引受業者の超過配給選択権に応じて、最大225,000株を発行することができる | |
| ● | 引受権証を行使すると60,000株 を発行することができ,引受業者の今回の発行に関する補償の一部 (超過配給選択権があれば最高69,000株 を発行することができる1株当たり6.25ドルそして | |
| ● | 157,989株私たちの普通株brは私たちの2016年計画下の未来奨励のために予約され、2,000,000株私たちの普通株brは私たちの2023年の株式インセンティブ計画下の未来の奨励のために予約されています。2023年計画です |
| 43 |
経営陣の財務状況の検討と分析
と運営結果
あなたは、以下の議論および本募集説明書の他の場所に含まれる財務諸表および関連する説明を読まなければなりません。 本議論は、私たちの現在の業務および運営に対する予想、推定、および予測に基づく前向きな陳述を含む。 私たちが“リスク要因”および本募集説明書の他の部分で議論している要素を含む多くの要素のため、私たちの実際の結果は、このような前向き陳述における現在の予想および表現の結果とは大きく異なる可能性がある。 は、“前向き陳述に関する警告説明”というタイトルの節を参照してください
概要
WE は2014年1月に設立され、生物製薬会社であり、工学蛋白と活性生物治療製品を用いて精確な皮膚病のための革新的な治療法の開発に専念している。著者らは、約1,500個のユニークな細菌菌株からなり、独特の治療特徴をスクリーニングすることができる微生物ライブラリーを含む独自のプラットフォームを構築した。このプラットフォームは人工知能と機械学習技術によって増強され、この技術は著者らの菌株バンク中の類似薬物の分子の分析、予測とスクリーニングを助けることができる。このプラットフォームはまた許可を得た遺伝子工学技術を利用して、この技術は以前遺伝しにくい菌株を転化することができる。私たちは初期段階の臨床生物製薬会社で、まだ商業運営を開始していません。
Br日まで、私たちは主に一連の私募私たちの転換可能な優先株と転換可能な本チケットを通じて私たちの業務資本化を実現します。これらはすべて今回の発行完了後に私たちの普通株に変換します
| ● | 2017年3月の配給205,385株Aシリーズは優先株に転換でき、価格は1株16.25ドルで、今回の発行を完了すると1,458,234株の普通株 に転換される | |
| ● | 2019年2月に1株37.50ドルで380,657株を私たちA-1シリーズに転換可能な優先株を販売し、 今回の発行が完了した後、2,958,120株に転換します | |
| ● | 2020年9月には1株43.45ドルで392,000株のBシリーズを優先株に転換でき、配給完了後は3,277,083株に転換されます | |
| ● | 2021年1月に、それによって生成されたすべての計算および未払い利息と共に、2023年1月に23,432株Bシリーズ転換可能な優先株に変換された100万ドルの無担保転換可能なチケットを配給する | |
| ● | 当社は2022年9月に435万ドルの無担保転換可能な本チケットを配給し、元金は本チケットの項目のすべての計算と未払い利息と一緒に販売されている。完全に希釈した上で、(I)3000万ドルを私たちが発行した普通株と発行済み普通株数の低い者に相当する1株当たりの転換価格で私たちの普通株に変換できるかどうか。今回の募集終了直前あるいは (Ii)今回の募集1株当たり価格の50%である。 |
別途説明がある以外に、本募集説明書では、当社が発行した普通株に関するすべての情報(I)は、2023年5月17日に7.1対1の割合で長期分割を行い、(Ii)上記転換可能優先株と転換可能本票の株式は、今回の発売完了後に合計約9,542,519我々の普通株に自動的に変換されると仮定している。別の説明がない限り、本明細書の他のすべての株式 および株価情報は、前向き株式分割を反映するように調整されている。
| 44 |
運営結果
著者らは早期臨床生物製薬会社であり、2014年1月に設立され、運営歴史は限られている。我々とバイエルのJDAによる有限サービス収入を除いて,我々 はまだ創設業務を開始していない.JDAの条項によると、私たちは私たちの微生物菌株とその天然産物バンク中の重要な臨床前特性をテストし、バイエルは私たちの開発コストを精算する。これまで,我々の業務は,我々の独自微生物brライブラリーの開発,我々の微生物ライブラリーからの同定,特徴づけ,テストであり,顕著な治療効果を提供できると考えられる特定の細菌種の工学設計と,我々の初期候補製品の開発であった。
2023年3月31日までの3ヶ月と2022年3月31日までの3ヶ月
| 3月31日までの3ヶ月間 | ||||||||||||||||
| 2023 | 2022 | $Change | 変更率 | |||||||||||||
| サービス収入関係者 | $ | 113,300 | $ | 120,000 | $ | (6,700 | ) | (6 | )% | |||||||
| 総収入 | 113,300 | 120,000 | (6,700 | ) | (6 | )% | ||||||||||
| 運営費用: | ||||||||||||||||
| 一般と行政 | 843,011 | 861,308 | (18,297 | ) | (2 | )% | ||||||||||
| 研究開発 | 830,181 | 1,555,368 | (725,187 | ) | (47 | )% | ||||||||||
| 総運営費 | 1,673,192 | 2,416,676 | (743,484 | ) | (31 | )% | ||||||||||
| 運営損失 | (1,559,892 | ) | (2,296,676 | ) | 736,784 | (32 | )% | |||||||||
| その他の収入(支出): | ||||||||||||||||
| 利子収入 | 285 | 520 | (235 | ) | (45 | )% | ||||||||||
| 利子支出 | (89,832 | ) | (17,637 | ) | (72,195 | ) | 409 | % | ||||||||
| その他の収入 | 1,146 | - | 1,146 | 適用されない | ||||||||||||
| 転換可能手形は価値変動を公正に許容する | (800,000 | ) | - | (800,000 | ) | 適用されない | ||||||||||
| その他の費用 | (8,886 | ) | (12,224 | ) | 3,338 | (27 | )% | |||||||||
| その他収入合計 | (897,287 | ) | (29,341 | ) | (867,946 | ) | 2958 | % | ||||||||
| 所得税前純損失 | (2,457,179 | ) | (2,326,017 | ) | (131,162 | ) | 6 | % | ||||||||
| 所得税の割引 | - | - | ||||||||||||||
| 純損失 | $ | (2,457,179 | ) | $ | (2,326,017 | ) | $ | (131,162 | ) | 6 | % | |||||
| 優先配当金 | (712,080 | ) | (692,246 | ) | (19,834 | ) | 3 | % | ||||||||
| 普通株主は純損失を占めなければならない | $ | (3,169,259 | ) | $ | (3,018,263 | ) | $ | (150,996 | ) | 5 | % | |||||
サービス 収入関係者
私たちのbrは2023年度前の3ヶ月間にバイエルJDAによって113,300ドルのサービス収入が発生したのに対し,2022年度同期のJDAのサービス収入は120,000ドルであった。サービス収入が6 700ドル減少したのは、2023年に精算可能な開発コストが減少したためだ。
通常 と管理
2023年度前3ヶ月の一般および行政コストは、前期より18,297ドルまたは2%減少し、843,011ドルに減少した。brの減少の主な原因は、離職停止による賃金および関連コストの158,000ドルの減少、前の首席運営官に支払われる福祉は46,000ドル減少し、法的費用は46,000ドル減少したが、会計および公共関係費用は167,000ドル増加し、その他の管理費用は18,703ドル増加したことである。
研究と開発
研究·開発費には,すべての研究者の給料と福祉,契約研究機関に支払う費用,研究コンサルタントに支払う費用,実験室用品を購入する費用が含まれている。これらの支出は政府支出が支払う収入によって相殺されます。私たちは様々な連邦機関や非営利研究機関と契約を結ぶことで、私たちが行っている一般研究のための支出収入 を作ります。これらの贈与手配も収入確認の基準を満たしておらず,これらの贈与契約によって稼いだ金額 は負の研究や開発費用として記録されている。
2023年度までの3ヶ月間、研究開発費は前年より725,187ドル減少し、減少幅は47%で830,181ドルに低下した。 減少の主な原因は、Netherton計画を推進しようと努力したため、研究開発に関連するコストが448,613ドル減少したのに対し、リストラにより賃金および関連コストが281,000ドル純減少したからである。 2023年度と2022年度の前3ヶ月の研究開発費は、それぞれ私たちが受け取った政府と非営利の贈与収入の0ドルと4,426ドルによって相殺された。
私たちの研究開発費は将来大幅に増加すると予想されています主に我々が計画した臨床試験活動と候補製品の持続開発に用いられている。
その他 収入(費用)
我々のその他の収入(支出)には、払戻可能な研究開発信用、株式証明書の推定値、債務発行コストの償却 転換可能手形の公正価値変化及び2021年1月に100万ドルの無担保本券を発行する利息支出 が含まれる。2021年度同期と比較して、2023年度前3カ月の他の収入(支出)は867,946ドル増加し、2,958%増加した。この増加は主に変換可能手形の公正価値の変化により800,000ドル増加し、利息支出は72,195ドル増加したが、他の収入と支出は4,249ドル減少した。
2022年12月31日までの年度と2021年12月31日現在の年度との比較
| 十二月三十一日までの年度 | ||||||||||||||||
| 2022 | 2021 | $Change | 変更率 | |||||||||||||
| サービス収入関係者 | $ | 284,000 | $ | 110,000 | $ | 174,000 | 158 | % | ||||||||
| 総収入 | 284,000 | 110,000 | 174,000 | 158 | % | |||||||||||
| 運営費用: | ||||||||||||||||
| 一般と行政 | 3,639,666 | 3,951,352 | (311,686 | ) | (8 | )% | ||||||||||
| 研究開発 | 6,097,938 | 5,380,102 | 717,836 | 13 | % | |||||||||||
| 総運営費 | 9,737,604 | 9,331,454 | 406,150 | 5 | % | |||||||||||
| 運営損失 | (9,453,604 | ) | (9,221,454 | ) | (232,150 | ) | 3 | % | ||||||||
| その他の収入(支出): | ||||||||||||||||
| 利子収入 | 4,818 | 8,759 | (3,941 | ) | (45 | )% | ||||||||||
| 利子支出 | (251,891 | ) | (66,968 | ) | (184,923 | ) | 276 | % | ||||||||
| その他の収入 | 65,849 | 112,141 | (46,292 | ) | (41 | )% | ||||||||||
| 従業員留任ポイント | 229,813 | - | 229,813 | 100 | % | |||||||||||
| 給与保障計画ローンの猶予 | - | 232,506 | (232,506 | ) | (100 | )% | ||||||||||
| 転換可能手形は価値変動を公正に許容する | (1,250,000 | ) | - | (1,250,000 | ) | 100 | % | |||||||||
| その他の費用 | (25,351 | ) | (4,659 | ) | (20,692 | ) | 444 | % | ||||||||
| その他収入合計 | (1,226,762 | ) | 281,779 | (1,508,541 | ) | 734 | % | |||||||||
| 所得税前純損失 | (10,680,366 | ) | (8,939,675 | ) | (1,740,691 | ) | 19 | % | ||||||||
| 所得税の割引 | - | - | ||||||||||||||
| 純損失 | $ | (10,680,366 | ) | $ | (8,939,675 | ) | (1,740,691 | ) | 19 | % | ||||||
サービス 収入関係者
私たちのbrは2022年度にバイエルJDAによって28.4万ドルのサービス収入を生成しましたが、2021年度にはJDAのサービス収入は110,000ドルでした。サービス収入が174,000ドル増加したのは,2022年に精算可能な開発コストが増加したためである.
通常 と管理
前年同期と比較して、2022年度の一般·行政コストは311,686ドル減少し、減少幅は8%で、3,639,666ドルに低下した。減少の主な原因は、賃金総額および関連コストが961,000ドル減少したことであり、これは、元最高経営責任者とCEOへの退職福祉の支払い停止と、私たちの新任最高経営者の採用費用が減少したが、会計と法律費用の増加607,000ドルおよびその他の管理費の純増加43,000ドルによって相殺されたためである。
| 45 |
研究と開発
研究·開発費には,すべての研究者の給料と福祉,契約研究機関に支払う費用,研究コンサルタントに支払う費用,実験室用品を購入する費用が含まれている。これらの支出は政府支出が支払う収入によって相殺されます。私たちは様々な連邦機関や非営利研究機関と契約を結ぶことで、私たちが行っている一般研究のための支出収入 を作ります。これらの贈与手配も収入確認の基準を満たしておらず,これらの贈与契約によって稼いだ金額 は負の研究や開発費用として記録されている。
研究開発費は前期比717,836ドル増加し,13%増の6,097,938ドルであった。この増加は主にNetherton計画の推進に努力したことによる研究開発関連コストが808,000ドル増加したが、リストラにより賃金や関連コストが85,738ドル純減少したためである。2022年度および2021年度の研究開発支出は、それぞれ、私たちが受け取った政府および非営利贈与収入の4,426ドルおよび202,509ドルによって相殺されます。
私たちの研究開発費は将来大幅に増加すると予想されています主に我々が計画した臨床試験活動と候補製品の持続開発に用いられている。
その他 収入(費用)
我々のその他の収入(支出)には、払戻可能な研究開発信用、従業員留任信用、賃金保護ローンの免除、株式証明書の推定値、債務発行コストの償却、転換可能な手形の公正価値変化 及び2021年1月に100万ドルの無担保本票を配給する利息支出が含まれる。2022年度には、他のbr収入(支出)は2021年度より1,508,541ドル増加し、734%に増加した。増加の主な原因は、転換可能な手形の公正価値変動による1,250,000ドルの増加、従業員の保留信用の増加229,813ドル、利息支出は184,923ドル増加したが、他の収入と支出は156,195ドル減少したことである。
流動性 と財務状況
概要
2023年3月31日現在、私たちの総資産は570万ドル、運営資本は36.1万ドルです。2023年3月31日現在、私たちの流動資金には180万ドルの現金と現金等価物が含まれており、2022年9月に無担保転換可能なチケットを配給することで435万ドルの収益を得た。本募集説明書の日付までに、我々が予想する運営資金需要には、臨床試験および製品開発、研究開発、臨床製造をさらに行うための資金、および一般および行政費用を含む他の一般会社用途のための資金が含まれる。“”というタイトルの部分を参照収益の を使用する.”
資金需要
今回発行された純収益は,我々の募集説明書日までの手元現金とともに,ATR−12提案1 b段階臨床試験の用量 およびATR−04提案1 b段階臨床試験の初期登録を含む少なくとも今回の発行後12カ月以内の提案運営計画を支払うのに十分であると信じている。しかし、本募集説明書の日付 まで、私たちは今後12ヶ月後に追加の資本が必要になると考え、私たちがもっと早く に追加的な資本を必要としないという保証はありません。また,ATR-12とATR-04が上場承認されたと仮定すると,このような承認を得るために追加の資金が必要となると考えられる.私たちは、私たちの株式や債務証券の売却、私たちの技術の許可料、業界パートナーとの合弁企業など、様々な融資源を通じてより多くの資金を求めるつもりです。また, は,現在の業務計画の代替案を考慮し,少ない資本で創収業務と有意義なビジネス成功を実現できるようにする.しかし、このような資金が商業的に合理的な条項(あれば)で利用できるという保証はない。このような融資を満足できる条項で獲得できなければ、私たちの業務計画を継続できない可能性もあり、運営を継続できない可能性があります。
| 46 |
株式または転換可能な債務証券を売却することによって追加資本を調達する程度では、あなたの所有権資本は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての権利に悪影響を及ぼす可能性がある。債務融資および優先持分融資(利用可能な場合)に関連する可能性のあるプロトコルは、追加債務を招く、買収または資本支出を招く、または配当を発表するなど、私たちの特定の行動をとる能力を制限または制限する契約を含む。 もし私たちが第三者との協力、戦略連合またはマーケティング、流通または許可手配によって追加資金を調達する場合、私たちは私たちの技術、将来の収入源、研究計画または候補製品に対する貴重な権利、または私たちに不利になる可能性のある条項でライセンスを付与しなければならないかもしれない。もし私たちが必要な時に株式や債務融資や他の手配を通じてより多くの資金を調達できない場合、私たちは私たちの研究、製品開発、あるいは将来の商業化努力を延期、制限、減少または終了する必要があるかもしれません。あるいは私たちは自分で開発とマーケティングをより望んでいた候補製品の権利を与えています。
我々の独立公認会計士事務所は,2023年3月31日までの3カ月間の報告 は,我々の累積赤字,経常的運営キャッシュフロー,負キャッシュフローにより,我々の持続経営能力が大きく疑われていることを指摘している。我々の財務諸表は、付記1において、継続的な経営企業としての私たちの能力に関する重大な疑いの開示を含み、我々の独立監査人の報告は、当該重大な疑いに関する説明的段落を含む。
契約義務
材料 が正常業務過程で発生する契約義務は主に経営リースを含む。今後5年以内の初期または残り期間が1年を超える取消不能経営リース下の将来の最低支払いについては、監査された財務諸表付記15を参照されたい。
キャッシュフロー
次の表に示した時期のキャッシュフローの概要を示す
3ヶ月まで ヶ月 3月 31、 | ||||||||
| 2023 | 2022 | |||||||
| 経営活動用の現金 | $ | (1,209,347 | ) | $ | (2,358,478 | ) | ||
| 投資活動用の現金 | $ | (82,834 | ) | $ | (93,392 | ) | ||
| 融資活動で提供された現金 | $ | (367,080 | ) | $ | 1,510 | |||
| 現金および現金等価物の純減少 | $ | (1,659,261 | ) | $ | (2,450,360 | ) | ||
イベントを操作する2023年度の最初の3ヶ月間、運営活動は120万ドルの現金を使用し、主に250万ドルの純損失によって130万ドルの非現金プロジェクトを相殺した。2022年度の比較可能期間中、運営活動は240万ドルの現金を使用したが、主に私たちの純損失230万ドルと非現金プロジェクト10万ドルのためだ。
個の活動に投資します2023年度の最初の3ヶ月間、投資活動は主に6.9万ドルの商標と特許コスト、0.14億ドルの家具·設備調達コストによって推進された8.3万ドルの現金を使用した。2022年度の比較可能期間中、投資活動は、主に6.3万ドルの商標と特許コスト、0.30億ドルの家具·設備調達コストによって推進された0.93万ドルの現金を使用した。
活動に資金を提供する2023年度の前3カ月で、融資活動は36.7万ドルの現金を使用し、これは36.7万ドルの繰延発行コストによって推進された。2022年度の比較可能期間には、融資活動は、主に株式オプション行使の収益によって推進される0.002万ドルの現金を提供する。
2022年12月31日までの年度と2021年12月31日現在の年度との比較
年限 終わり 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 経営活動用の現金 | $ | (8,349,469 | ) | $ | (8,067,359 | ) | ||
| 投資活動用の現金 | $ | (336,761 | ) | $ | (652,275 | ) | ||
| 融資活動が提供する現金 | $ | 4,134,624 | $ | 992,862 | ||||
| 現金および現金等価物の純減少 | $ | (4,551,606 | ) | $ | (7,726,772 | ) | ||
イベントを操作する2022年12月31日までの年間で、経営活動は830万ドルの現金を使用しており、主に1070万ドルの純損失は240万ドルの非現金プロジェクトで相殺されている。2021年12月31日までの1年間、経営活動は810万ドルの現金を使用し、主に890万ドルの純損失は80万ドルの非現金プロジェクトで相殺された。
個の活動に投資します投資活動は2022年12月31日までの1年間に33.6万ドルの現金を使用し,主に30.8万ドルの商標と特許コストおよび0.028万ドルの家具·設備調達費用によって推進された。2021年12月31日までの1年間,投資活動には65.2万ドルの現金が使用され,主に20.6万ドルの商標と特許コストおよび44.6万ドルの家具·設備調達費用によって推進された。
活動に資金を提供する2022年12月31日までの年間で、融資活動が410万ドルの現金を提供したのは、主に440万ドルの転換可能な本票を発行したため、30万ドルの繰延発行コストで相殺された。2021年12月31日までの年間で,融資活動が0.93万ドルの現金を提供したのは,主に100万ドルの転換可能な元票 が発行されたためである。
| 47 |
キー会計政策
経営陣は私たちの財務状況と経営結果の討論と分析は私たちの財務諸表に基づいており、これらの報告書はアメリカ公認会計基準に基づいて作成されている。これらのbr財務諸表を作成するには、財務諸表に報告されている資産、負債および費用金額、または資産および負債の開示に影響を与える推定および判断を行う必要があります。私たちは、前払い/計算研究開発費用、株式ベースの給与、および転換可能な本チケットの公正価値に関する推定と判断を含む、私たちの推定と判断を継続的に評価する。私たちの推定は、歴史的経験、既知の傾向、および事件、およびこの場合に合理的と考えられる様々な他の要因に基づいており、これらの要因の結果は、資産および負債の帳簿価値を判断する基礎を構成しており、これらの資産および負債は、他のソースからは明らかではないように見える。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。
我々の主な会計政策は、本募集説明書の他の箇所の審査財務諸表付記2により詳細に記載されているが、以下の会計政策は、財務諸表作成に使用される判断と推定に最も重要であると考えられる。
財務報告内部統制
財務報告の内部統制は財務報告の信頼性とアメリカ公認会計基準に基づいて財務諸表を作成するために合理的な保証を提供するための過程である。上場企業会計監督委員会(PCAOB)が確立した基準によると、制御の設計或いは操作 が管理層或いは人員がその指定機能を履行する正常な過程中に適時に誤った陳述 を防止或いは発見することを許可しない時、財務報告の内部制御に欠陥がある。PCAOBは、重大な欠陥を財務報告内部制御の欠陥または欠陥の組み合わせとして定義し、年度または中期財務諸表の重大なミス報告が適時に防止または発見および是正されない可能性がある。
2022年12月31日と2021年12月31日までの年次財務諸表を作成している間、私たちと独立公認会計士事務所は、会計機能が十分に分離されていないことと、私たちが以前に発行したが返済されていない債務ツールに関連する2021年に発行されたいくつかの権証が適切な会計処理に欠けているため、大きな弱点を発見した。私たちは財務報告の内部統制を改善するための措置を実施しており、この大きな弱点を補っている。私たちの会計インフラ内に十分な人員を増やして、会計機能の適切な分離を促進し、私たちの内部で作成された財務諸表を適切に審査できるようにするつもりです。
収入 確認
本登録表の他の部分に記載されているように、会計基準 編纂またはASC,606に従って、顧客と契約した収入は、その顧客が約束されたbr}商品またはサービスに対する制御権を獲得したとき、エンティティは収入を確認し、その金額は、そのエンティティがそのような商品またはサービスと交換されることを期待している対価格を反映する。
ASC 606の範囲内の手配が確認すべき適切な収入金額を決定するために、(I)顧客との契約を決定するステップ(S)、(Ii)契約で約束された貨物またはサービスを決定し、約束された貨物またはサービスが履行義務であるかどうかを決定するステップ、(Iii)取引価格を計測するステップ、(Iv)取引価格を履行義務に割り当てるステップ、および(V)(または)各履行義務を満たすときに収入を確認するステップの5つのステップを実行する。私たちは、エンティティが顧客に譲渡された商品またはサービスと交換するために獲得する権利のある対価格を受け取る可能性がある場合にのみ、5段階モデルを契約に適用する。
オプション商品またはサービスが提供される場合、オプションが顧客物質の権利を付与するかどうかを決定するためのオプションを評価します。この は,オプションを含む定価がクライアントが 契約を締結していない場合に受信しない金額であるかどうかを決定する.もし私たちが結論を出したら、オプションは実質的な権利を伝達し、それは単独の履行義務として入金されるだろう。契約中の 履行義務を決定する際に、私たちはそれらの異なる約束を確定した。顧客が単独でまたは既製の資源と共に貨物またはサービスから利益を得ることができ、貨物またはサービスが契約内の他の承諾とは別に識別できる場合、コミットメントされた貨物またはサービスは異なる とみなされる。約束が明確でない場合は、合併後の承諾グループが区別できるまで、契約中の他のコミットメントと統合する。
| 48 |
我々 は,譲渡契約で約束された貨物やサービスが期待して受信した対価格金額から取引価格 を推定する.対価は固定対価格と変動対価を含むことができます。各可変対価格を含む手配の開始時に、潜在的な支払いの金額と支払いを受ける可能性を評価します。 大きな収入逆転が発生しない可能性が高い場合、可変対価格は取引価格に含まれます。 許可化合物に基づく販売ベースの印税を含む契約については、関連販売が発生した日に収入を確認します。 最後に、約束商品及びサービスの独立販売価格に対するコミットメント対価格と、コミットメント商品及びサービス譲渡に対する支払時間を分析することにより、契約に重要な融資部分が含まれているか否かを決定する。報告日ごとに,取引価格と履行義務の実現可能性および取引価格に関する制限を再評価する。必要であれば、取引価格を調整し、これまで制限されていた金額の進捗記録に基づいて累積進捗を記録します。
収入 は,義務制御権を履行してクライアントに移行したときに確認する.統合履行義務 がコミットメントのライセンスおよび関連サービスまたは他のコミットメントを含む場合、管理層は、収入確認の適切な時間 を決定するために判断する必要がある。そのためには、収入がある時点で確認されるか、またはある時間に確認されるかを決定するために、契約内の1つまたは複数の主な約束を決定しなければならない。もし時間が経つにつれて、私たちは適切な進展測定基準を決定しなければならない。ライセンスが義務履行における主要な約束であると考えられる場合、時点または長期収入確認に最適な結論を得るために、機能的または象徴的なbr知的財産権にかかわらず、ライセンスの性質を決定しなければならない。機能 または象徴的知的財産権を決定するためには、クライアントがその現在の状態でライセンスを利用して利益を得ることができるかどうか、またはライセンスの効用が私たちが行っている活動に依存するか、または私たちの影響を受けているか、または私たちに関連しているかどうかを評価する必要がある。
各報告日に、私たちは一定期間内に移転された履行義務の進捗を計算するつもりだ。計算 は通常,これまでに発生したコストの見積り総コストに対する入力計測を用いて 履行義務の移行を完了する.
研究と開発費
研究と開発費用には主に我々の候補製品開発に関するコストが含まれている。私たちは実際に発生した費用で研究開発費を支払います。
私たちのbrは完成した仕事の割合の見積もりに基づいて、私たちのサプライヤーが実行した臨床前研究と臨床試験活動に費用を計算した。私たちは、契約、サプライヤー契約、および調達注文を審査し、私たちの内部臨床者および外部サービスプロバイダと試験またはサービスの進捗または完了段階と、そのようなサービスに支払われる合意費用を議論することによって推定数を決定します。しかし,臨床試験の実際のコストや時間は高度に不確実であり,リスクの影響を受け,われわれの臨床開発計画を含む多くの要因によって変化する可能性がある。
我々は,その時点で既知の事実と状況に基づいて財務諸表において各貸借対照表の日付までの前払い/計上費用を推定する.サービス実行の実時間や努力度が推定値と異なる場合には,対応する項目を調整する.将来の研究開発活動で使用される臨床試験費用、プロセス開発または臨床用品の製造および流通費用を含む払戻不可能な商品およびサービス前払いであって、支払いが延期され、関連商品またはサービスが消費またはサービス提供されている間に費用として確認されることを含む、払戻不可能な商品およびサービスの前払い。
| 49 |
株式ベースの報酬
我々は、付与日の株式に基づく報酬の推定公正価値に基づいて、株式ベースの報酬のすべての報酬支出を測定する。 我々は、Black-Scholesオプション定価モデルを用いて株式ベースの報酬を推定する。必要なサービス期間内の補償費用 を直線的に確認し,これは通常報酬の授権期間である.私たちは市場または業績条件に基づいて奨励を授与していません。その帰属は市場または業績条件に依存します。
ブラック·スコアーズオプション定価モデルは、期待株価変動率と日標付与の普通株式公正価値を含む主観的仮定を用いることが要求される。ブラック·スコアーズオプション定価モデルを適用して、私たちが付与した報酬の推定公正価値を決定する際に使用されるいくつかの特定の仮定に関する情報は、本募集説明書の他の部分に含まれる監査された財務諸表の付記10を参照してください。
普通株の公正価値を見積もる
ブラック·スコアーズオプション定価モデルを用いて公正価値計算を行う場合,株式奨励の基礎となる普通株の公正価値を推定する必要がある。我々の普通株は現在公開取引されていないため、私たちの株式オプション関連普通株の公正価値は授与日ごとに取締役会の承認を得ており、経営陣も意見を提供している。
我々の普通株の第三者推定値は,米国公認会計士協会,監査,会計実務援助シリーズ:補償として発表されたプライベート持株会社株式証券推定値 と一致する方法,方法,仮定を用いて行った。また、私たちの取締役会は、私たちの普通株式の推定公正価値を推定するために、様々な客観的かつ主観的な要素を考慮した
| ● | 公正取引で外部投資家に売却される私たちの優先株の価格と、私たちの優先株に対する私たちの優先株の権利、優先順位、特権は、私たちの優先株の清算優先を含む | |
| ● | 未償還証券と期待証券の推定価値 | |
| ● | 予想される資本構造は、現在発行されている証券の価値に直接影響を与えるだろう | |
| ● | 私たちの経営業績と財務状況は | |
| ● | 私たちの研究と開発の状況は | |
| ● | 私たちの管理チームと取締役会の構成と変動 | |
| ● | 個人会社として、私たちの普通株は流動性が不足している | |
| ● | 私たちの発展段階と業務戦略、そして私たちの業務と業界に関連する重大なリスク | |
| ● | 生命科学やバイオテクノロジー業界の外部市場状況に影響を与えます | |
| ● | アメリカと世界の経済状況は | |
| ● | 現在の市場条件の下で、私たちの普通株式保有者のために流動性イベントの可能性、例えば、最初の公募株またはIPO、またはわが社のbrを売却する可能性;および | |
| ● | 会社の時価と変動性を比較することができる。 |
私たちの普通株の推定公正価値を決定する際に、私たちの取締役会は、上記で議論した主観的要素と、独立第三者が作成した私たちの普通株の最新の推定値を考慮した。我々の取締役会では,2017年10月から2021年12月までに付与された奨励金の普通株推定公正価値を決定する際に,独立推定専門家br}を用いた.これらの第三者推定値によると、我々の取締役会は2017年10月までの普通株式推定値を1株3.39ドル、2019年4月現在の1株当たり推定値を6.58ドル、2020年9月までの普通株式推定値を1株当たり12.09ドル、2021年12月現在の普通株式推定値を1株11.05ドルとすることを承認した。
権利証の公正価値を評価する
我々はブラック·スコイルズ法を用いて報告期間ごとに未償還株式証を推定し,公正価値の変化をbr経営報告書で確認した。株式証負債の推定公正価値は第3級投入を用いて確定された。ブラック·スコイルズモデルに固有の仮定は、期待株価変動、期待寿命、無リスク金利、配当収益率と関係がある。私たちは、市場参加者の仮定に基づいて私たちの普通株の変動率を推定し、私たちの株式オプションを評価するための変動率に一致しています。無リスク金利は、付与日の米財務省のゼロ金利収益率曲線に基づいており、満期日は株式承認証の期待残存期限と似ています。私たちの未弁済株式証の期待寿命はその残りの契約期間と等しいと仮定しています。配当率は歴史金利に基づいており、会社は歴史金利をゼロに維持すると予想している。
最近の会計声明
当社の財務諸表に適用される最新の会計声明の説明については、本募集説明書の他の部分の 当社が監査財務諸表に付記されている2を参照してください。
| 50 |
商売人
概要
我々brは早期臨床生物製薬会社であり,工学brタンパク質と局所活性生物治療製品を用いて正確な皮膚病の革新療法の開発に専念している。我々はすでに1,500個の独特な細菌菌株からなり、独特の治療特徴に基づいてbrをスクリーニングすることができる微生物ライブラリーを含むbr特許プラットフォームを構築した。このプラットフォームは人工知能と機械学習技術によって増強され、br分析、予測と助け、著者らの菌株バンク中の類薬物分子のスクリーニングを助ける。このプラットフォームは,許可された遺伝子工学技術を利用して,従来遺伝が困難であった菌株を形質転換することができる。私たちの最初のポイントは遺伝子工学菌株の開発です表皮ブドウ球菌や表皮ブドウ球菌皮膚疾患治療プロジェクトの最適な治療候補種であると考えられる。この特定の種は皮膚において良好な特性 を記述していることが多く示されている。本募集説明書の発表日までに,我々は我々の微生物ライブラリーにおいて60種類以上の異なる細菌を決定しており,これらの細菌は顕著な治療効果を有する生生物や工学タンパク質に改造できると信じている。
私たちは遺伝子工学細菌が皮膚病治療に使用された先駆者だ。我々の目標は,我々のプラットフォームや内部微生物ライブラリー細菌株を用いて新たな療法を創出することであり,これらの療法は工学的生物であるか,工学的タンパク質やポリペプチドであり,皮膚疾患の治療に用いられる。私たちの最初のポイントは現在の候補製品を開発することです
| ● | ATR-12,br 1遺伝子組換え株表皮ブドウ球菌孤児疾患Netherton症候群の治療に対して、これは1種の慢性、時々致命的な皮膚疾患であり、200,000人に1人が影響を受けると推定されるが、他の皮膚病と類似しているため誤診され、その発病率は過小評価される可能性がある。我々は2019年にFDAのATR−12小児科まれな疾患称号 を獲得した。2022年12月に1 b期臨床試験の研究新薬申請(IND)を提出し,2023年1月27日に米国食品·薬物管理局から通知を受け,提案された1 b期臨床試験については,米国食品·薬物管理局から通知を受け,提案された1 b期臨床試験については継続する可能性がある。私たちは2023年上半期に私たちの1 b期の臨床試験を開始し、2024年上半期に初歩的な結果を報告する予定だ。 | |
| ● | ATR-04,br株遺伝子組換え株表皮ブドウ球菌上皮増殖因子受容体阻害剤またはEGFRi標的治療を受けた癌患者に出現する丘疹の治療のための。2023年末までにINDを提出し,EGFRi標的治療を受けたある癌患者で1 b期の臨床試験を行う予定である。FDAによるわれわれINDの承認により,2024年初めにわれわれの1 b期臨床試験が開始されることが予想され,初歩的な結果は2024年末に予定されている。 | |
| ● | ATR-01、 は通常型魚鱗病を治療するための工学組換えヒトマイクロフィラメント蛋白であり、これは慢性、乾燥性、鱗片状皮膚病であり、発病率と罹患率は1/250と推定され、これはアメリカの患者総数が130万であることを示している。私たちは2023年に鉛最適化とINDの研究を完成し、2024年末にIND申請を提出することを支持する予定である。 | |
| ● | 私たちとバイエル消費者ケア株式会社は2種類の異なる微生物菌株を研究·開発しており、バイエル消費者ケア株式会社は国際生命科学会社バイエル株式会社の消費財部門である。我々は2019年12月にバイエルと共同開発協定(JDA) を締結した。JDAの条項によると,我々は我々の微生物菌株とその製品ライブラリにおける重要な臨床前特性の試験を担当しており,これらの特性を潜在的な非処方薬化粧品として開発する予定である。数百の菌株をスクリーニングした後、著者らとベイヤは2つの特定の菌株を選択し、更なる研究を行った。バイエルはこれらの菌株に特許権を付与する独占的な選択権を持っている。2020年12月、バイエルは800万ドルのBシリーズ優先株を購入した。 |
私たちはまた、カーネギーメロン大学とフレッド·ハッチンソンがんセンターやフレッド·ハッジのチームとパートナー関係を築き、この2つのセンターはアメリカで最も重要な学術センターである。我々はカーネギーメロン大学のチームと協力して全ゲノム配列決定の力を利用した。このパートナーシップは,brのような新しい薬物ポリペプチドやタンパク質を探すために,我々固有の細菌菌株バンクを発掘している。このチームが開発した人工知能/機械学習技術は,微生物の遺伝子配列からそれらが作製した分子を予測する。次に、このシステムは、将来の予測を改善するために、直列質量分析および/または核磁気共鳴画像によって実際に作られた製品と比較する。これらの予測は、同様の薬剤の構造を選択するために、公開されて利用可能な2 Dタンパク質データベースおよび3 Dタンパク質データベースと比較することができる。
| 51 |
我々brはFred Hutchの世界的な独占的許可を持っており,皮膚病のための工学微生物療法や微生物由来ポリペプチドやタンパク質 の発見,開発,商業化を含む特許を取得したSyMPL技術の遺伝子工学のすべての分野への応用を許可している。我々は,これまで実現したことのない遺伝子形質転換を行うために,我々が許可した特許権を用いてプラスミドを構築している。Fred Hutchとの協力は微生物工学の専門家Christopher Johnston博士が率いるものであり,SyMPL技術の革新者でもある。
私たちの3つの主要な候補製品とバイエルとの協力に加えて、幅広い候補製品の組み合わせを開発し、私たちの正確な皮膚病プラットフォームを拡張する応用に専念することを目標としています。我々は,正確な皮膚疾患生物製剤の開発を推進する上で独自の地位を確立したと信じている。

私たちのビジネス戦略
我々は,我々の特許微生物バンクから選ばれた約1,500種類のユニークな細菌菌株から選択された遺伝子工学brタンパク質を開発することにより,精密皮膚病のために広範な候補製品の組合せを創出する予定である。我々の戦略は以下のとおりである
| ● | 持続可能な正確な皮膚病会社を作ります私たちの目標は、持続可能な候補製品パイプラインを持つ有力な正確な皮膚病会社を作ることです。そのため,我々は現在の生物治療候補生体管路の迅速な推進に専念するとともに,より多くの候補製品を積極的に開発している。私たちの現在のすべての候補製品は独自製品であり、特許を申請する必要がある。我々が開発した多くの(すべてでなければ)遺伝子工学製品候補品は特許 保護を受ける資格があると予想される。 | |
| ● | 我々の主要候補製品ATR-12とATR-04の臨床試験を推進した。我々は現在,Netherton症候群患者におけるATR−12に対する−1 b段階試験と,治療を受けたいくつかの癌患者において我々のATR−04に対するEfR−04 1 b段階試験を含む今後12カ月以内に2つの臨床試験を開始する予定である。我々は ATR-12のINDの提出に成功しており,2023年末にATR-04のINDを提出する予定である. | |
| ● | 戦略的協力パートナーシップを選択的に探索することによって、私たちの正確な皮膚病プロジェクトの潜在力を最大限に発揮し、私たちのプラットフォームを広げる。私たちは私たちのすべてのコア技術と候補製品に対する重要な権利を維持するつもりだ。しかし,我々は 戦略パートナーが技術や候補製品開発の協力機会を加速させることを支援してくれることを評価し続け, は協同組合の経路を提供したり,専門知識を提供したりして,異なるタイプの皮膚病の治療 に拡張できるようにする。私たちはまた技術または候補製品を選択的に許可することで、私たちのプラットフォームのカバー範囲を拡大することができる。さらに、私たちは私たち自身が追求していない適応と産業に私たちの特定のノウハウを付与することを考慮するつもりだ。私たちの遺伝子工学技術と技術は化粧品を含む医薬分野だけでなく、クリーン燃料の発生とバイオレメディエーションにも適用できると信じている。 | |
| ● | 私たちの学術パートナー関係を利用して私たちは現在、フレッド·ハッチンソンがんセンター、エール大学、ジャクソンゲノム医学実験室、カーネギーメロン大学の研究者とパートナーシップを結んでいる。2020年1月、イェール大学と臨床試験協定を締結し、EGFR阻害剤治療を受けて丘疹皮疹を起こした約10名の患者の微生物群を評価した。これらの患者の皮膚微生物環境を知ることを目的とした観察試験である。サンプル保存への挑戦 により患者登録の開始が延期され,2023年末に再開する予定である。試用費用は100,000ドル以下になると予想され、費用は私たちが支払います。ジャクソン実験室のジュリア·ウー博士と持続的な科学顧問委員会契約を締結し,マウス実験の協賛研究を通じてジャクソン実験室と歴史的協力を行った。私たちはこれらのパートナー関係を利用して、それらを拡大したり、他の学術パートナー関係 を形成したりして、私たちのプロジェクトプラットフォームを支援し、私たちの研究開発ルートを拡大することが可能であることを期待しています。 | |
| ● | 管理チームそれは.私たちは最高経営責任者のフランシスコ·D·サルワと共同創業者のトラビス·ホイットフィルが指導し、バイオテクノロジー会社の管理と医療投資で35年以上の経験を持っています。サルワは以前、Acerta Pharmaの共同創業者で、同社は2016年から段階的に買収し、約63億ドルでアスリコンに販売した。Pharmacclicsの黒字化にも力を入れており、同社はその後2015年に約210億ドルでAbbvieに売却した。これまで、サルヴァさんは10年近く生命科学ベンチャーキャピタルの分野で働いていました。ホイットフィルさんはエール大学で副研究科学者と助教授の兼任を務め、小児科と急診医学部に勤めている。彼は多くの寄付金援助プロジェクトを指導し、12件近くの特許を持ち、50冊以上の出版物を共著した。私たちの取締役会はバイオテクノロジー業界の有名な幹部、科学者、投資家で構成されています. |
私たちの微生物ライブラリーと微生物薬物送達プラットフォームは
共生微生物は人体表面や粘膜に存在し,ヒトの健康を損なうことはない。それらは宿主の免疫系に作用し、保護性反応を誘導し、感染病原体の浸潤と浸潤を防止し、それによって人類の多くの器官系の健康を維持する上で重要な役割を果たし、特に皮膚にある。皮膚には様々な微生物群落が分布しており,1平方センチメートルには10億個もの微生物を収容できる。これらの異なる細菌、真菌、ダニとウイルス群落は疾病の保護を提供し、皮膚に動態的で独特な生態位を形成することができる。皮膚微生物群を構成しています
| 52 |
遺伝子によって駆動されるヒト疾患の多くは、系統的または部分的に特定のタンパク質の機能障害に関連しており、これらのタンパク質は変異によって欠失または機能不活性である。約1982年以来、生物製薬業界は細菌微生物中の組換え蛋白に対して遺伝子工学を行っており、ヒトの正常な機能を模倣または支持するタンパク質とポリペプチドの療法を提供することを目的としている。何十年もの間ほとんどの遺伝子工学は初期に限られてきました大腸菌.大腸菌そして少数の他の細菌br種は、その多くが発病し、感染を招くことができる。対照的に私たちは重点を置いて表皮ブドウ球菌皮膚に自然に存在する共生微生物として有益な役割を果たしているからである。我々の目標は,我々のプラットフォームと60種類以上の細菌の内部微生物バンクを用いて皮膚角質層を介して共生皮膚細菌を目標皮膚に直接輸送することである。皮膚のこれらのより深いレベルで、工学微生物は欠失または不活性なタンパク質を産生することができ、それによって潜在的な疾患原因を解決することができる。
S.と私たちの独自微生物ライブラリー
表皮ブドウ球菌皮膚には良好な特性が多く記述されているため、強力な治療候補種である表皮ブドウ球菌 グラム陽性細菌であり,ヒト皮膚や粘膜菌群に一般的に存在する。最初の皮膚植民地者の一人として 表皮ブドウ球菌皮膚免疫と微生物群落の動態バランスの維持に重要な役割を果たしている表皮ブドウ球菌 宿主と有益な皮膚共生関係があることが知られている。この種は病原株brに対して抑制作用を示した黄色ブドウ球菌や黄色ブドウ球菌そしてストレスもざ瘡プロピオン酸菌あるいは、あるいはにきびシュードモナス. 表皮ブドウ球菌 角質形成細胞の抗菌ペプチド産生を誘導し,免疫細胞シグナルによりCD 4+とCD 8+T細胞の非炎症性T細胞蓄積を産生する。T細胞反応は損傷後の皮膚の再上皮化を誘導し、修復と傷口の閉鎖を加速する。これらの理由から私たちは表皮ブドウ球菌治療用タンパク質を局所的に送達するベクターとしていくつかの利点を提供する。
彼らの2019年の研究では、世界有数の皮膚微生物グループの専門家StacyとBelkaidが説明しています表皮ブドウ球菌“皮膚微生物区系の”ポスター子供“として、微生物が皮膚生理と健康に果たす異なる機能を示している”表皮ブドウ球菌巨大な菌株の多様性があり、治療目的に用いることができる。2020年のONG研究において,ジュリア·ウーの実験室は,1,482株独特の表皮ブドウ球菌5つの個体にしか現れませんこれらの菌株は著しい遺伝多様性を有するだけでなく、比較的に大きな表現型多様性を持っている。この巨大な菌株間の違いは表皮ブドウ球菌利用できます。そこで,我々は健康ボランティアのサンプルを収集し,我々自身の菌株brライブラリを開発·同定した表皮ブドウ球菌900以上のユニークなものが含まれています表皮ブドウ球菌治療用途の潜在力を持つ菌株。この微生物ライブラリーを用いて抗菌ペプチド分泌を含む選定された特性をスクリーニングしました黄色ブドウ球菌殺傷力、抗生物質感受性、その他の治療に関連する特徴。図書館中の他の種も収集し,その中には約60種類の異なる皮膚共生種が含まれており,治療目的でのスクリーニングも可能である。
図1.Azitra微生物ライブラリーの代表的な種
| 表皮ブドウ球菌 | ヘリコバクター·ピロリ | 肺炎連鎖球菌 | コレラ菌 | |||
| 大腸菌 | ケイ氏菌催産症 | 陰溝腸桿菌 | 小腸大腸炎エルソン菌 | |||
| 黄色ブドウ球菌 | 肺炎クレブシエラ | サルモネラ菌オスロ | フレンディクエン酸菌 | |||
| 枯草芽胞菌 | Kluyveromyes乳酸菌 | 放射線耐性ブドウ球菌 | ガス腸菌を産生する | |||
| コリネバクテリウム | Kocuria好根菌 | 糞腸球菌 | 陰溝腸桿菌 | |||
| 酒造酵母 | ライト氏微球菌 | モラゼラカタラ菌 | 奇異変形菌 | |||
| カンジダ?カンジダ | ケタモラ菌 | 乳連鎖球菌群 | センフェンベルグサルモネラ菌 | |||
| Finegoldia Magna | モルガン·モルガン菌 | 連鎖球菌/口腔 | 粘質セラチア菌 | |||
| 膣ガードナー菌 | 巻葉の毛かび | 肺炎連鎖球菌 | 宋内氏志賀菌 | |||
| インフルエンザ菌 | 溶血性ブドウ球菌 | 化膿性連鎖球菌 | 淋病ナイザー菌 | |||
| 副インフルエンザ菌 | 溶血性ブドウ球菌 | 竹ストレプトマイセス | 糞腸球菌 | |||
| 副インフルエンザ菌 | ヒトブドウ球菌 | マリアン耐性熱気菌 | ネズミチフス菌 | |||
| アルカリ地 | 鹿トンブドウ球菌 | 好熱好熱菌 | バウマンアシネトバクター | |||
| 好熱バチルス | 緑膿菌 |
| 53 |
私たちの微生物ライブラリーの予測分析は
生物製薬業界は数千種類の細菌の鑑定と分離に成功した。しかし,比較的少ないいくつかのこのような種のみが,20個未満とされており,治療可能性のあるタンパク質やポリペプチドを生産するように改造されている。私たちはカーネギーメロン大学の研究開発グループChia Biosciences,Inc.とパートナーシップを構築した。我々は中国生物科学社との協力により,彼ら独自のゲノムやポリペプチド人工知能と機械学習システムNRPMiner,brを用いて,我々固有のbrライブラリーから産生されるタンパク質,ポリペプチド,小分子の天然産物予測を開発·確認することができる。これらの予測は直列質量分析または核磁気共鳴によって確認された。そして,予測を改善するために機械学習アルゴリズムに情報をフィードバックする.既存の2 Dおよび3 Dタンパク質データベースと比較して、我々の製品が既存のタンパク質およびポリペプチド薬物との構造相同性を調べることもできる。私たちはカーネギーメロン大学のチームと協力して、私たちの微生物brバンクの治療発見を加速させるために、拡張可能で修正可能な方法を提供してくれたと信じている。
微生物が生産した薬の送達は
遺伝子工学蛋白を皮下標的に輸送する過程は,天然バリアや角質層防御によって阻害される。これは皮膚の最も外の層であり、バリアの役割を果たし、不要な物質が体に入ることを防ぐ。この課題に対応するために,通常透過できない角質層を迂回するようにタンパク質の輸送を促進する特許プロセスを開発した。この戦略は特定の微生物が皮膚のより深層に浸透する能力を利用する。そこで,遺伝子組換え微生物はマイクロプラントとして機能し,必要な場所で治療用タンパク質や分子を生産する。
皮膚疾患を治療するタンパク質輸送能力は工学技術に基づいています表皮ブドウ球菌他の微生物とタンパク質を分泌し、薬物を皮膚に輸送する。どの量のタンパク質も我々の細菌によって工学·コードされ,brを産生し,皮膚に輸送され,様々な皮膚疾患を治療することができると信じられている。私たちはまた、タンパク質の送達を促進するために、そのプラットフォームに重要な独自機能を追加した。このシステムの重要な特徴の1つは,通常透過できない皮膚バリアを迂回していることであり,局所タンパク質輸送の問題である。皮膚バリアは角質層からなり、脱核した角質形成細胞で閉鎖され、多くの構造、物理と生化学特性から形成される。他の経皮投与課題は,酵素消化に対するタンパク質の感受性と,疎水性表面と角質層を構成する連続角質細胞層による溶解や拡散障害である。私たちは自然を利用して表皮ブドウ球菌角質層以下の層。臨床前研究では表皮ブドウ球菌角質層の下に生息するいくつかの層は,より深い表皮にタンパク質を輸送する。
我々の組換えタンパク質構築能力を拡張するために,従来処理が困難であった細菌種でタンパク質を生産できるように,我々の遺伝子工学DNA配列を偽装する独自の技術の許可を得た。フレッド·ハッチンソンがんセンターやフレッド·ハッジのこの技術は、遺伝子改変によって可能な細菌種の範囲を拡大した。これは、制限修正システムであるサイレントSyMPLツールセットに基づきます。SyMPL技術プラットフォームは細菌の防御システムに人工DNAを見られないようにした。理論的には、この方法はどんな種類の細菌にも適用できる。私たちの現在の候補製品 はSyMPL技術プラットフォームを採用していませんが、将来の候補製品の一部または全部がこの技術プラットフォームを採用すると予想されます。
実際,自然に産生されるすべての細菌菌株には制約修飾系と呼ばれる防御機構がある。4つのタイプの制限修飾システムは、組換えタンパク質をコードする外来DNAの挿入を認識および防御する。Sの機能遺伝子工学それは.表皮膚炎(そして)黄色ブドウ球菌)これらの細菌種のほとんどの菌株にI型およびIV型制限系 が存在するため、以前に制限されていた。これらの制限システムは、標準クローン増幅システム(例えば、)から識別される(E.Coli)外来DNAの微生物への結合を阻害している表皮ブドウ球菌その遺伝的頑固性により、かつて1種の“転化できない”菌株と考えられていた。しかし私たちは克服することができましたS. 表皮‘防御する。
| 54 |
現在の遺伝子工学の流れは,侵入者 が自身のDNAの一部であると細菌をだますために特定の修飾を加えて人工DNAを偽装している。この方法は、一般に、正しい偽装を各特定の識別トピックに一致させようと試みるために、かなりの時間およびリソースを必要とする。対照的に、Fred HutchのSyMPL技術プラットフォームは、制限を克服して防御システムを修正するために、システム化された“工学的隠蔽”の方法である。これらの制限修飾防御システムは外来DNAから微生物を保護し,大多数の遺伝子工学方法を阻害する。SyMPL技術プラットフォームはマイクロループDNAプラスミドを構築する能力に基づいており、これらのDNAプラスミドは任意の標的認識モチーフが不足し、微生物の防御システムの識別に供する。この技術は、標的細菌ゲノム配列中のゲノムおよびメチル基を使用して、酵素修飾を制限する標的モチーフを識別する。遺伝子ツールのヌクレオチド配列から除去しますシリコン片それは.生成された系列は制約 修正,SyMPLツールを構築するために用いられる.これらの遺伝子は繁殖し遺伝子変換に使われています工程によるステルス法は、遺伝的に処理が困難な細菌株で形質転換できるだけでなく、形質転換効率を著しく向上させることができることが証明されている。原則的な実験により、遺伝子組換えコロニーの生産量が10,000倍以上向上したことが証明された。
Fred Hutchは2022年1月、すべての使用分野におけるSyMPL技術プラットフォームのグローバル独占特許権許可および非独占グローバル独自特許権使用料許可を付与しました。フレッド·ハッジライセンス契約によって取得された知的財産権に関するより多くの情報は、タイトルを参照してください“営業許可証と知的財産権.”
私たちの候補製品
ATR-12によるNetherton症候群の治療
ATR-12は、新しい株を含む当社の特許および特許出願中の候補薬である表皮ブドウ球菌この遺伝子は遺伝子修飾を経て全長タンパク質を発現·分泌する活性断片であり,リンパ上皮型Kazal関連阻害物,あるいはLektiと呼ばれる。それはまた栄養欠損型に設計されており、これは製剤中のD-アラニン栄養が生存と繁殖するために必要であることを意味する。これは潜在的な体系的な感染を防ぐ追加的な安全レベルを提供する。ATR-12はNetherton症候群の根本的な原因を解決するための局部応用であり、方法はNettherton症候群患者に観察された皮膚セリンプロテアーゼ活性の失調に対抗するために、ヒト組換えLektiの活性断片或いはrhLEKTI-D 6を置換し、不足したLektiを置換することである。br}セリンプロテアーゼ活性が制御されないと深刻な皮膚バリア欠陥を招き、そして角質形成細胞と免疫細胞の炎症促進とアレルギー促進媒体を招く。本募集説明書が発表された日まで,Netherton症候群の治癒または有効な治療法は知られていない。ATR−12はこの皮膚疾患を治療するのに有効な第一の治療法になる可能性があると信じている。
Netherton 症候群の概要
Netherton症候群は稀な常染色体劣性遺伝病であり、200,000人に1人が罹患していると推定されているが、誤診のため、その罹患率は過小評価されている可能性がある。これは1種の慢性皮膚疾患であり、深刻な炎症、掻痒、鱗屑、赤腫と脱水を特徴とする。出生時にNetherton症候群を有する乳児は発育不良の苦痛を受ける可能性があり,約10分の1のNetherton症候群児が生後1年目に死亡することが報告されている。生き残った人たちは一生皮膚病の挑戦に直面して、赤色、鱗片状皮膚、髪の欠陥及び正常レベルより持続的に高い感染とアレルギーリスクを含む。
Netherton症候群は遺伝子変異によるものですSpink 5遺伝子、それをコードするリンパ上皮型Kazal関連阻害物、またはlekti。Lektiの機能は、Kalikrein 5、7および14、またはKLK 5、KLK 7およびKLK 14のような表皮中の酵素を阻害することであり、皮膚細胞の脱皮と呼ばれる過程での脱落を促進する。Lektiの欠損や活動が減少すると、過度の脱皮は皮膚の敏感、開放を招き、赤色と鱗片が出現する。これに伴うのは、角質層の離脱であり、深刻なバリア機能障害、脱水、および化学品のような環境要因に曝露される可能性がある。健常ボランティアと比較して、Netherton症候群患者の皮膚組織病理学および免疫蛍光染色は、角化過剰、表皮増厚、好塩基性角化ヒアルロン粒子の減少など、皮膚にLEKIや皮膚異常がないことを示している。

図2:Nettherton症候群の病理生理学とLETKI欠損症
Netherton症候群の重症度は軽微な皮膚紅斑から生命に危害を及ぼすまで様々である。疾患の重症度は皮膚上のLEKTI機能喪失の程度と直接関連している。Netherton症候群は出生直後に出現し,乳児出生1年目が最も深刻であった。ほとんどの場合,1年目以上の生存は一般的であるが,この疾患の影響は生涯の挑戦である。
| 55 |
本募集説明書が発表された日まで、Netherton症候群はまだ既知の治癒方法がなく、治療選択も限られている。Netherton症候群の重篤な皮膚症状を治療する皮膚科介入措置は,保湿クリーム,コルチコステロイド外用,カルモジュリン阻害剤を含み,これらはすべて持続的な救済措置を提供できないため限られている。新生児期疾患の重症度を考慮すると,これらの患者によく発生する感染の治療に加え,液体/電解質や食事支援が必要である。Netherton症候群に関連する免疫不全に対する免疫グロブリン治療は限られた成功を示したが、現在、lekti調節失調による皮膚バリア欠陥を持続的に修復することはできない。
我々の解決策であるATR-12はNetherton症候群の治療に使用されています
ATR-12は外用軟膏であり、表皮ブドウ球菌菌株SE 351は,すでに遺伝子改変を経て 染色体由来のlektiを発現している。SE 351菌株はまたD-アラニンに対して栄養欠損性を有するように設計されており、これは配合中に提供された外因性D-アラニン栄養なしでは生存できないことを意味する。ATR-12は、欠乏/機能不全のlektiを活性を有する組換えヒト全長タンパク質断片rhLEKTI-D 6に置き換えることによって、Netherton症候群の根本的な原因を解決することを意図している。治療には,ATR−12を影響を受けた地域に適用することが含まれる。SE 351産生rhLEKTI−D 6はNetherton症候群患者に観察された皮膚セリンプロテアーゼ活性失調に対して皮膚バリア機能を回復し,炎症を減少させる。この方法の重要な利点の1つは,時間の経過とともにrhLEKTI−D 6を角質層や表皮の下層に輸送する可能性があり,Nettherton症候群患者の調節失調の主要部位であると考えられる。
表皮ブドウ球菌SE 351は、我々の特許菌株バンクから選択された組換えヒトLEKTI-D 6を皮膚に搬送する菌株である。brは毒性が低く、生物膜を形成しない宿主菌株であることが特徴である。ATR−12の安全性をさらに向上させるために,D−アラニンの微生物を栄養欠損性に改造した。工学栄養欠損症の肝心な優勢は成長を制御し、潜在的な感染を阻止できることである。全長ヒトLETKIは15ドメインのタンパク質(145 KDa)であり,大きすぎて細菌に確実に発現·分泌できない。全長タンパク質断片はNetherton症候群患者に観察された失調した皮膚セリンプロテアーゼ活性に対抗するのに十分であることが示されており、私たちはD 6を選択した表皮ブドウ球菌.
2020年5月にFDAからATR-12のまれな小児科疾患の称号を獲得した。したがって、FDAからATR-12の発売前承認 を得ることができれば、承認後に優先審査証明書を受け取る資格があり、この証明書を使用して6ヶ月の加速期間内にFDA によるこれまたは他の候補薬剤の新薬申請の審査を得ることができる。これらのクーポン券は通常譲渡可能で、販売価格は1億ドルを超えている。
| 56 |
ATR−12の臨床前データ
本募集説明書の発表日までに,われわれはすでに何度か行った体内にあるそして離体するNetherton症候群患者の疾患修正療法の潜在的治療効果としてATR−12の実験を共同で支持した。製剤ATR−12医薬製品に使用されている遺伝子工学表皮ブドウ球菌菌株をSE 351と呼ぶ。2021年には体外培養外源がSE 351を用いて無菌で人類表皮を再建する能力を評価することを研究した。SE 351は再建されたヒト表皮への定植に成功し、しかも、ありませんでした表皮ブドウ球菌D−アラニンの存在なしに定植が発生し,皮膚にSE 351を成長させるためにはD−アラニンを供給しなければならないことが確認された。これらのデータは,SE 351がヒト皮膚に定植可能であり,D−アラニンを補充することで定植を制御できることを示している。
また, 体外培養KLK 5を添加した健常ボランティアのテープ剥離皮膚を用いてNetherton症候群をシミュレーションした研究では,希釈SE 351培養上清はトリプシン様活性(KLK 5活性)を用量依存的に抑制することが示唆された。0.5%を含むSE 351培養上清を添加すると、Nettherton症候群代謝物中の膵臓酵素様活性は正常な健康レベルに回復した。

図 3:離体するヒトベルト抽出液補助病級KLK 5活性によるNetherton症候群モデルの構築
また他にも離体するブタ皮膚モデルは、3用量レベルの単回局所用量のATR-12が活性rhLEKTI-D 6の分泌をもたらすことができることを示した。最後には前 生体健康なヒト皮膚モデルによると、単回局所用量のATR-12の最大予想用量は10である9CFU/gは十分に活性なrhLEKTI-D 6を角質層下層に送り込み、有効に蛋白加水分解酵素KLK 5(“KLK 5”)を抑制し、Nettherton症候群患者の典型的なレベルに達することができる。
具体的には、体外健康ヒト皮膚モデルからのデータは、単一局所用量のATR-12の最大予想用量は10であることを示している9コロニー形成単位(CFU/g)は十分な活性のrhLEKTI-D 6を角質層の下層に送り込み、KLK 5を有効に抑制し、Netherton症候群患者の典型的なレベルに達することができる。プラセボとATR−12で処理した体外ヒト皮膚のテープ試料から抽出した層間Lekti活性 量。皮膚塗布(t=0時間,白条)または30°Cで8時間(t=8時間,黒条)インキュベートした直後に採取した。総Lekti活性 レベルは、プラセボ(灰条)またはATR−12(黒条)試料の第1~30層にpmol量を添加することにより得られた。データは3つの独立サンプル(N=3)の平均±a標準偏差(SD)である.Iにおける統計解析は二元分散分析を用い,**はp を表す

図br}4:プラセボおよびATR−12処理皮膚試料の0および8時間インキュベート後のLETKI活性
さらに、単回治療用量のATR-12が24時間のインキュベーションで産生されたLEKTI活性は、8時間インキュベートの~2倍であった。これは、ATR-12が時間の経過とともに機能的組換えヒトLEKTI-D 6を持続的に産生することを示している。

| 57 |
図5:24時間インキュベートした後のプラセボおよびATR-12処理皮膚試料中のLETKI活性
Azitraによる体外化学量論的研究では,KLK 5はlekti−D 6蛋白に2モル当量の抑制br(IC 50測定)が必要である。歴史研究により、Netherton症候群患者のKLK 5含有量は正常皮膚の~6倍である。これは、各特定の領域60 pmoLのKLK 5に相当する。以上の研究から,SE 351は350 pmoLのlekti−D 6を8時間で放出し,700 pmoLのlekti−D 6を24時間で放出することが示唆された。これは予定されている活動に必要な金額より5倍から11倍高い。

図 6:離体するKLK 5を抑制するLEKTI−D 6の化学量論比
2022年には、我々が提案したATR-12規制経路を検討し、ATR-12のIND申請の提出および受け入れをもたらす臨床前計画指導をFDAから取得することを目的としたFDAとのIND前通信を取得した。2022年12月、我々はNettherton症候群患者においてATR-12の最初のヒト試験を行うことを要求するIND申請を提出した。著者らのINDはNetherton症候群患者に対して1 b期多中心、ランダム、二重盲検、単用量レベル、プラセボ対照のATR-12臨床研究を行うことを提案した。 の主要な終点は安全性であり、副次的な終点は治療効果と薬物動態学信号を含む。探索的終点には免疫と炎症機序バイオマーカーがある。2023年1月27日にFDAから通知を受け,提案された1 b期臨床試験についてはbrを継続する可能性があり,2023年上半期に1 b期臨床試験が開始される予定であり,2024年上半期に初歩的な結果が予想される。
| 58 |
EGFRi関連皮疹の治療のためのATR−04
ATR-04は、新しい株を含む当社の特許および特許出願中の候補薬である表皮ブドウ球菌SE 484、遺伝子改変により栄養欠損型D-アラニンに改変された。ATR-04は、上皮増殖因子受容体阻害剤(EGFRi)標的治療を受けた癌患者が経験した丘疹/丘疹を解決することを目的とした局所使用である。
EGFRi−関連 皮疹の概要
標的癌療法は各種の腫瘍タイプと診断された患者に著しい治療進展をもたらしたが、それらも独特な皮膚ウイルス性と関係があり、これらの毒性は治療努力を阻害し、そして患者に深刻な身体と心理不快感をもたらす可能性がある。これらの毒性を予防と処理することは患者に治療にもっとよく耐えさせ、治療時間を延長させる可能性があり、それによって薬物から最大の臨床利益を得る可能性がある。その中の1種類の標的癌治療はEGFR阻害剤を含む。EGFRは細胞表面の蛋白質であり、細胞の成長と分裂に役立つ。それもある悪性腫瘍の重要な要素であり、その活性は腫瘍の成長、浸潤と転移を促進する。EGFRi製剤への全身曝露は標的腫瘍部位のEGFRを抑制するとともに,全身のEGFRも抑制する。皮膚において、EGFRは増殖、粘着、遷移、生存と分化を含む多種の角質形成細胞の機能を調節する。そのため、皮膚中のEGFRを抑制することは不良皮膚反応を引き起こし、患者はこれらの有効な治療法を堅持することが困難である。
皮膚ウイルス性はEGFRi標的治療中に最もよく見られる副作用の一つである。丘疹はEGFRi治療の中で最も早くて最もよく見られる皮膚科不良事件であり、通常50%-80%の患者に発生し、具体的には薬物、治療中の癌と治療方案に依存する。丘疹皮疹の出現は1種の用量依存の皮膚薬物反応であり、通常最初の1~2週間以内に出現し、治療後3~4週間にピークに達する。皮疹の強度は2週間後から軽減する可能性があるが,EGFRi治療の全過程で持続可能である。皮疹の臨床特徴は細く柔らかい紅斑丘疹であり、数日後に膿疱疹に変化し、その後顔面、頭皮、胸部と上背部にかさぶたを形成する。皮疹は通常重篤な乾燥症を伴い,重篤な皮膚細菌感染が出現することもあり,主に黄色ブドウ球菌それは.皮疹の多くは軽度から中等度と考えられているが,重篤なものもある。多くの場合、皮疹は深刻な生活の質の問題を引き起こし、甚だしきに至ってはEGFRiの治療中断或いは停止を招く可能性がある.
現在EGFRi治療を受けている患者の皮疹治療基準は皮疹の重症度によって異なる。通常,皮膚保湿剤,局所ステロイド,ドキシサイクリンはEGFRi治療から予防的に使用され,治療期間全体で持続的に使用されている。皮疹が進行し続けると,ステロイドおよび/または抗生物質の経口投与が必要となる。しかし,これらの補助療法に関連する全身副作用が知られており,医師や患者は使用制限を試みていると考えられる。また,抗生物質の経口投与は腸管微生物群の破壊を招き,EGFRiを含めて標的治療の有効性を低下させることが示唆されている。これらの患者に持続的に皮疹が出現する高発症率と、これらの治療に対する抗生物質の潜在的な影響に関する懸念から、丘疹−丘疹を解決するために、追加の安全かつ有効な補助治療に対する医療需要が存在することは明らかであると考えられる。
佐藤とリヒテンベルグに基づく研究,サイトカインIL−36ガンマまたはIL−36γと黄色ブドウ球菌IL-36γはEGFR治療を受けた患者の皮膚で上昇した。2020年、Satohは遺伝子発現プロファイルを用いてIL-36γがEGFRi/Meki皮膚毒性の候補駆動因子であることを決定した。EGFR阻害によって誘導されますざ瘡皮膚桿菌それは協同的に皮膚中のIL-36γとその後のIL-8と核因子-κBを誘導し、それによって皮膚好中球の増加を招く。IL-36γはEGFRi皮疹を治療する重要な標的である可能性がある。2013年、LichtenbergerはEGFRiを使用した患者(n=107)の細菌感染率が高いこと(70%)に注目し、EGFRアブレーションによる黄色ブドウ球菌-マウス感染を誘導する。この研究によるとほとんどの患者はS 金色(54%)著者らは,機序的にはEGFRi療法が宿主防御を損なうことを指摘している:抗菌ペプチドの発現障害,特に対黄色ブドウ球菌密接な連接の表現レベルが低下するそのほか、研究により、EGFRアブレーションは皮膚バリア欠陥、及び皮膚免疫反応とサイトカイン発現損傷を招くことを発見した。
| 59 |
EGFRi関連性皮疹の治療のための我々の解決策−ATR−04
ATR-04は、EGFRi関連皮疹の治療に使用するための我々の製剤候補医薬製品である。新しい栄養欠損株を含んでいます表皮ブドウ球菌我々の微生物菌種バンクから選択された菌株は、必要なIL−36γ還元特性と阻害に基づいている黄色ブドウ球菌生物膜もあります現在の鉛菌株はSE 484と呼ばれている。次に,SE 484を遺伝子工学を行い,栄養欠乏型D−アラニンとし,我々の候補薬物製品ATR−04を創出した。
我々の微生物ライブラリーからSE 484を選択することは、IL-36γの抑制および対などの重要な特性に基づいているS 金色それは.つまり,これらの作用機序はEGFRi治療を受けた患者の皮疹の重症度を有意に低下させることが予想される。
ATR-04は現在EGFRi関連皮疹の治療の限界を解決する可能性があると信じている
| ● | 抗生物質の使用を減らした。臨床医や主要オピニオンリーダーに対するわれわれの調査から,事業者はEGFRi治療を受けた患者に全身抗生物質 を処方したくなかった。これらの患者は通常抗生物質を12ケ月以上服用することができ、抗生物質に関連する不良事件を受けることができる。ATR-04はこれらの患者の抗生物質に対する需要を減少させ、EGFRiおよび抗生物質の使用によって少ない有害事象をもたらすと信じている。 | |
| ● | EGFRiコンプライアンスを改善した.EGFRi治療を受けた患者の20%が有害事象(主に皮疹)により治療を中止した。EGFRi治療を受けた患者の中止率を低下させ,コンプライアンスを向上させることができると信じている。 | |
| ● | より高い生活の質ですEGFRi治療を受けた多くの患者は,有害事象や丘疹により生活の質が悪いと報告している。現在の治療案ではこれらの有害事象を十分に減少させることはできない。EGFRi治療を受けた患者では,ATR−04治療は皮疹の重症度を低下させ,生活の質を向上させると信じている。 |
ATR-04の臨床前データ
我々は、安全性(例えば、抗生物質耐性の欠如)および生物活性(例えば、IL-36γ阻害および活性と黄色ブドウ球菌)を、SE 484を我々の主要候補株として指定した。この菌株をD-アラニンの栄養欠損型菌株として設計した後、著者らはこの候補菌株をATR-04薬物製品製剤中の活性微生物として指名した。
| 60 |
EGFRiは皮膚の発赤、掻痒、刺激を特徴とする疾患であり、ある癌治療によって引き起こされる。遺伝子発現プロファイル(Satoh Et Al 2020)により、健常ドナーからの皮膚と比較して、EGFRi患者からの皮膚生検試料ではサイトカインIL−36γ(IL−36γ)とIL−8レベルが上昇することが示されている。これらは炎症性サイトカインであり,brは免疫系のシグナル分子であり,免疫反応の強度を増加させ,組織損傷を引き起こす可能性がある。サイトカインレベルの上昇以外に、EGFRi治療を受けた患者の皮膚バリア機能は損傷した。黄色ブドウ球菌病原菌株の感染はEGFRi誘導皮膚病を悪化させた。
著者らの仕事の重点は1種の表皮ブドウ球菌菌株を同定することであり、それは1種の皮膚共生菌であり、IL-36γレベルを低下させ、それによってEGFRiに関連する皮疹を減少させることができる。ヒト皮膚に生息する多くの細菌種がそこに生息している可能性が推測されるが,brはヒト免疫系の存在に対する反応を減少させる方法が進化しているため,生存しているヒト皮膚共生細菌を認識し,特にIL−36γの活性を低下させることができるかもしれない。
このような表皮ブドウ球菌菌株を同定するために、培養ヒト皮膚細胞が産生するIL−36γおよびIL−8のレベルを検出するインビトロ検出方法を開発した。我々が用いた細胞系はHaCaTと呼ばれ,ヒト角質形成細胞に由来し,表皮の細胞型である。表皮増殖因子受容体関連疾患の炎症所見をシミュレートするために,HaCaT 細胞は免疫刺激剤Poly ICによって刺激され,高レベルのIL−36γとIL−8を分泌する。本試験は異なる表皮ブドウ球菌株がIL-36γとIL-8レベルを低下させる能力を同定と評価するために用いた。
著者らは安全性(例えば、抗生物質耐性の欠如)と生物活性(IL-36γ阻害と黄色ブドウ球菌に対する活性)に基づいて100株以上の菌株をスクリーニングし、SE 484を私たちの第一選択候補菌株とした。この菌株をD-アラニンに対して栄養欠損性を有するように改造した後、 はD-アラニンを提供する場合にのみ成長でき、著者らはこの候補微生物をATR-04薬物製品 配合中の活性微生物として指名した。
図7にIL 36 Gインビトロ試験の結果を示し,菌株SE 484がHaCaT細胞中のIL−36γレベルを低下または阻害する能力を評価した。黒条はHaCaT細胞にPoly ICを加えてIL−36γレベルを誘導する効果を示し,正常レベルの約2倍であった。SE 484培養上清(CS)存在下でIL−36 gレベルは基礎レベルまで低下し,Poly ICの化学阻害剤(Poly IC+Inhで表される)に類似した。A群は各種処理48時間後の結果を示し,B群は72時間後の結果を示した。

図7.SE 484のCSはPoly ICのIL−36 G誘導を低下させた。黒条はPoly ICがHaCaT細胞を刺激した場合のIL−36 gのレベルである。SE 484の培地はPoly IC刺激を阻止し、IL-36 g(赤い矢印)を放出することができる。対照(青色矢印)としてPoly ICの阻害剤 を用いた。A群ではSE 484曝露48時間後のIL−36 Gの抑制,B群では72時間 曝露を示した。データは2つの独立した実験を表している.CS=培養上清
| 61 |

図8.SE 484のCSはPoly ICのIL−8誘導を低下させた。SE 484からの培地はPoly IC刺激を阻止し、IL-8(赤い矢印)を放出することができる。対照としてPoly ICの阻害剤(青色矢印)を用いた。データは2つの独立した 実験を表す.CS=培養上清
図8にSE 484培養上清によるPoly IC誘導IL−8の抑制作用を示す。IL−36 Gと同様に,Poly IC をHaCaT細胞に加えるとIL−8も分泌され,バックグラウンドより数倍高くなる(“未処理HaCaTやSE 484で処理されたHaCaT”)。しかし,SE 484の存在下で低レベルのIL−8が検出され,SE 484がEGFRiに関与する皮疹を抑制する炎症促進経路の有効性がさらに証明された。
われわれの結果は,健常ボランティアから分離した表皮ブドウ球菌SE 484菌株の培地がHaCaT細胞産生IL−36 gとIL−8レベル(それぞれ図7と図8)を低下させ,EGFRi関連皮疹の治療に寄与することを示した。その抗IL-36 Gの特性以外に、SE 484は異なるMRSA菌株のタイプ及びメチシリンに敏感な黄色ブドウ球菌に対して広範な活性を有する。SE 484はIL-36 G/IL-8レベルの能力およびその抗黄色ブドウ球菌の活性および改造されたD-アラニン栄養欠乏症を低下させ、株SE 484をATR-04薬物 製品製剤中の活性微生物として指名し、治療の基礎を形成し、EGFRi皮疹の重症度を低下させることができる。
SE 484が助けになることも示しています体外培養メチシリン耐性を抑制する既知の毒性菌株USA 300とメチシリンに敏感なMSSA。ATR−04は原因黄色ブドウ球菌 細菌の増殖と感染を誘発する能力を低下させ,この感染はEGFRi皮疹患者にみられたことを示している。

図9.Epiderminを発現するSE 484は、インビトロ寒天プレート上でモピロシンと同様の活性で黄色ブドウ球菌を死滅させる。

| 62 |
我々はATR-04レシピ中のSE 484を予備研究することを提案した.これは1 b期多中心、ランダム、二重盲検、単用量、プラセボ対照試験であり、EGFRiモノクロナル抗体治療を開始している結腸直腸癌或いは頭頚部癌患者に適していると予想される。主要な終点は安全であり,副次的な終点は治療効果と生活の質,あるいはQOLを含めて2023年末までにINDを提出することを計画している。FDAが我々のINDを承認すれば,2024年上半期にわれわれの1 b期臨床試験を開始する予定であり,初歩的な結果は2024年末に予定されている。
ATR-01尋常性魚鱗症の治療
ATR−01は我々が従来型魚鱗症の治療に用いた候補薬である。このプロジェクトは現在,ヒトミクログロブリンの特許と特許を出願している新規工学断片を研究している。ATR-01は通常型魚鱗症の治療を目的とした局部応用として開発されており、これは慢性鱗状皮膚病であり、発病率と罹患率は1/250と推定され、アメリカの患者総数は130万人に達する。従来型魚鱗病は、ミクログロブリンをコードする遺伝子機能欠損変異によるものである。タンパク質工学の合成生物学的ツールを用いて、ミクログロブリンに細胞透過ペプチドを付加することで、ミクログロブリンをより深く皮膚に輸送するのに役立つ。これは皮膚バリアの不透過性を克服するためであり,そうでなければ局所タンパク質の伝達を制限するためである。
尋常型魚鱗病の概要
尋常型魚鱗症、或いはIVは1種の慢性、乾燥性、鱗片状皮膚病であり、発病率と罹患率は1/250と推定され、これによりアメリカの患者総数は130万人に達する。IVの臨床的特徴は通常2カ月程度で出現し,全身乾燥や腹部,胸部や四肢伸筋表面に突出した微細,白から灰色までの鱗片を含む。brはまれであるが,一部のIV患者でも汗量の減少や熱耐性が出現する。長い間、IVの発病機序はずっと表皮角質透明質顆粒の減少或いは数量の減少と考えられ、甚だしきに至っては全く存在しなかった。また,IV患者ではアトピー性皮膚炎,喘息,アレルギーのリスクが増加している。
常在型魚鱗病は常染色体半優性遺伝病であり、マイクロフィラメント蛋白をコードする遺伝子機能欠損突然変異によるものである。ミクログロブリンは必須の構造タンパク質であり,フィブリノーゲンに由来し,角質層で単独のミクログロブリン単位に分解される。これらのbrは,角質形成細胞細胞骨格中のケラチンと他の中間フィラメント蛋白と結合することにより皮膚バリアを増強する。多くの研究で機能喪失変異が発見されている外掛IV患者の中で、これらの突然変異はケラチンフィラメントの乱れ、皮膚バリア欠陥と角質層微小骨折と関連し、それによって経皮アレルゲン増感の増強を招く。また,糸状蛋白とその分解産物は皮膚に顕著な付加機能を有し,皮膚(吸湿性アミノ酸や“天然保湿因子”による)を潤し,抗菌分子の産生に影響を与える(特に対象)S 金色)および有益な脂質分布および皮膚のpHを維持する。
IVの治療には有効な治療法はほとんどない。現在IVの治療選択は、主に局所水分蒸発阻害剤br(例えば、塩化ナトリウム、尿素、乳酸、サリチル酸)、および少量の保湿剤(例えば、グリセロール、プロピレングリコール)を含む。局所レチノイン酸を使用してヒト皮膚細胞の産生を遅らせることもできる。しかし,レチノイン酸の長期使用は理想的ではない。特に懸念されるのは,すべてのレチノイン酸の奇形作用であり,生育潜在力のある女性への使用を制限している。レチノイン酸治療を長期的に用いた慢性毒性は骨異常を引き起こす可能性がある。また,子供がレチノイン酸を長期的に使用することは彼らの成長を抑制する可能性がある。注目すべきは、多くのIV患者は自己意識と社交気まずいため、生活の質を著しく低下させ、家庭生活、教育/職業生活、甚だしきに至ってはレジャー/スポーツ活動に負の影響を与えたことである。
我々の日常型魚鱗症治療の解決策−ATR−01
IVはミクログロブリンをコードする遺伝子機能喪失変異によるものであり、ケラチンフィラメント組織の乱れ、皮膚バリア欠陥と角質層微小骨折、及び細菌とウイルス皮膚感染による経皮アレルゲン増感を引き起こすことが知られている。我々はIVの新しい治療法としてATR−01を開発しており,この疾患の病理生理学に直接対応している。ATR−01は、ヒトFlgタンパク質のFlG 5−6機能単位と、1つの付着細胞透過ペプチドとからなる。標的br}は,局所塗布と細胞透過ペプチドによる皮膚浸透によりhFlgを補充する安定放出である。
| 63 |
ATR−01の臨床前データ
ヒトFlg単位(ドメイン9−10)は,ヒト皮膚外植体(整形手術由来)で評価されている離体するそれは.外植体の皮膚バリアは繰り返し剥離テープで破壊され,経皮水分損失やTEWL値は正常皮膚より有意に増加した。以下の例に示すように,細胞透過ペプチドを含むヒトミクログロブリン単位を1日5日間局所投与すると,TEWLを迅速に改善し,用量依存性(図示せず)を示し,皮膚バリアの改善が示唆された。そのため、組換えhFLG単位と細胞透過ペプチドを外用することは損傷したヒト皮膚バリアの修復を改善/加速することができる。

図 10:剥離したテープ上の局所マイクロフィラメント接着応用離体するヒトマイクロフィラメント凝集蛋白を用いたヒト皮膚。
最後に,マイクロフィラメント蛋白の外用がミクログロブリン欠損マウスモデルの皮膚バリア欠陥を改善することを証明した。組換えマウスマイクロフィラメントタンパク質、またはmFlgを、シート状尾またはFTマウスの尾部に適用する(1つは千切り研磨遺伝子)、1日1回、2週間持続(50μg総タンパク質/尾部または15.2μg総タンパク質/cm2)である。MFlgの1日投与は、賦形剤(“ベースライン”群)と比較して、FTマウスの治療時の経皮水分損失(FT+Flg群)を有意に改善した。X軸上の第3のグループは正常で対照的な野生型グループ(WT)であり、ありません千切り研磨ジーンがダウンした 組換えmFlgと細胞貫通ペプチドの併用による損傷マウス皮膚の治療は損傷マウス皮膚バリアを改善できる(以下図A参照)。また,マウス尾部切片の表皮の組織学的解析では,mFlgで処理したところ,角質層厚が改善する傾向が認められた(以下図B参照)。この図において,Y軸は角質層が厚くなっていることを示しており,角質層は正常厚さを超えると破砕やスケールが開始されている。MFlgで処理したところ,6試料中4試料の厚さが改善した。

他の潜在的候補製品
私たちの三つの主要な候補製品を除いて、広範な候補製品の組み合わせを開発し、私たちの正確な皮膚病プラットフォームの応用を拡大することに集中することを目標としています。私たちは正確な皮膚病治療製品を発見し、開発する独自のプラットフォームを持っている。著者らのプラットフォームは約1,500個の独特な細菌菌株からなる微生物ライブラリーを中心に構築され、独特な治療特性をスクリーニングし、微生物遺伝子技術を利用して皮膚微生物が産生するタンパク質、ポリペプチドと分子を分析、予測、設計した。SyMPL技術の独占的な許可により,扱いにくい微生物種の遺伝子工学を行う能力がユニークに利用されている。
バイエル共同開発プロトコル
2019年12月、私たちはバイエルと共同開発協定(JDA)を締結し、この合意に基づいて、私たちの独自微生物ライブラリーから選択されたいくつかの菌株を共同開発することに同意した。我々とバイエルは、局所製剤の微生物菌株の同定およびインビトロおよびインビトロ同定において協力することに同意した。バイエルはJDA署名時に150,000ドルを一度に支払い、私たちの開発費を返済することに同意しました。2021年10月、バイエルはオプション協定を拡大し、追加の表現作業のために375,000ドルを支払いました。我々は,JDA項の開発活動の最大6品目の独占印税許可の選択権を取得し,任意の関連特許権の独占印税許可を含むバイエルに付与した.数百菌株のスクリーニングを経て、著者らとバイエルは2つの特定の菌株を選択して体外と体外鑑定を行い、潜在的な非処方薬化粧品を開発する予定である。私たちは2023年第3四半期に特徴づけ作業を完了し、バイエルにデータを配信する予定で、その時、バイエルは12ヶ月の間に菌株と関連特許に対する許可選択権を行使する。特性研究を完了し、データ をベイヤに渡した後、JDAは終了するが、バイエルは菌株と関連特許を許可する権利がある。本募集説明書の日付までは、私たちはバイエルと商業許可協定について交渉していません。バイエルが独占印税許可を得るbr選択権を行使するまではそうしません。
2020年9月、バイエルのベンチャーグループLeaps by Bayerは私たちBシリーズの優先株800万ドルを購入した。
販売 とマーケティング
私たちがいる開発段階を考慮して、私たちはまだ商業組織や流通能力を確立していない。我々は米国に重点を置いたbr能力を構築し,我々の開発計画を商業化する予定であり,皮膚病治療のための生生物治療製品と組換えタンパク質(Br)に重点を置いており,米国では患者集団と我々の目標適応に対する医学専門家が十分に集中しており,的確な販売チームを通じて我々の製品を効果的に普及させることができ,商業販売が許可されればと信じている。商業化が私たちにとって資本効率が低いかもしれない他の市場では、私たちの候補製品のビジネス潜在力を最大限に発揮するために、第三者との戦略的協力 を選択的に求めることができるかもしれない。
| 64 |
製造業
我々 は現在の候補製品を生産するための製造施設を所有または運営していない。私たちは現在第三者契約メーカーに必要なすべての原材料、製造設備と活性薬物成分、及び私たちのbr臨床前研究と臨床試験を提供することに依存している。私たちはコネチカット州グロートン工場で臨床試験brのために完成品を生産することができますが、私たちは第三者に依存して商業販売のための完成品を生産します。我々はこれらの第三者のいずれとも長期的な プロトコルを持っていない.我々も現在,3期臨床試験や商業用品の製造に関するいかなる契約関係もない。我々は、将来の生産のために、第三者契約製造業者および1つまたは複数のバックアップ製造業者と合意を締結する予定である。我々は,将来の開発と我々が開発した任意の製品のビジネス 量のための製造能力の実現可能性を分析している。このような製品は、FDAおよび我々が承認を求めている他の管轄区域規制機関の要求に適合した施設およびプロセスで生産される必要がある。
競争
生物製薬業界の特徴は技術進歩が迅速で、競争が激しく、特許薬物に対する重視度が比較的に高いことである。私たちは私たちの知識、経験と科学資源が私たちに競争優位を提供すると信じているが、私たちは他の生物製薬会社、学術機関と政府機関 および公共と個人研究機関を含む多くの異なる源からの潜在的な競争に直面している。我々が開発·商業化に成功したどの候補薬剤も,既存療法や将来出現する可能性のある新しい療法と競争するであろう。
Netherton症候群
Netherton症候群については,これまでFDAによって承認されておらず,特にNetherton症候群に対するものであった。標準ケアには,温和/柔軟な非洗剤液体洗剤油を用いて皮膚を洗浄することがあり,好ましくは酸性(5)がある。Netherton症候群患者の皮膚に最もよく見られるのは乾燥,鱗屑,脱皮であるため,保湿剤や保湿クリームもよく使用されている。サリチル酸、尿素或いはα-ヒドロキシ酸などの角質溶解薬物は通常刺激性があり、Netherton症候群患者はその耐性が良くない。Netherton症候群患者の皮膚は細菌に感染しやすい。限られた感染は局部抗生物質で治療し、治療時間は短く、最長2週間に達する。経口抗生物質は病原体の治療にも使えます黄色ブドウ球菌そして連鎖球菌より極端な感染を引き起こす菌株です漂白剤は抗菌作用があるため、週に2~3回洗うことも推奨されている。外用コルチコステロイドは通常非感染性Netherton症候群の皮膚損傷に関連する炎症や過増殖の治療に用いられるが,その副作用のため制限しなければならない。これらの有害事象はアミノ酸尿症、クッシング症候群、皮膚萎縮、副腎機能不全、成長遅延、高血圧と虚弱を含む。局所ステロイドの過剰投与は角質層の喪失を招き,皮膚バリアの欠陥を悪化させる。全身性レチノイン酸はNetherton症候群に対して異なる程度の治療効果を示したが、骨毒性と奇形作用もあった。局部のカルシニューリン阻害剤はすでに紅斑(赤腫)の減少に応用されているが、患者 はすでに迅速な反応を示し、そして治療時間の延長に従って治療効果を低下させた。これらの免疫調節剤はまた、感染、腫脹、灼熱感、痛みのリスクを増加させることを含む深刻な悪影響のリスクが存在する。光線療法(狭帯域UVB(NB−UVB)や補骨脂−UVA(PUVA))もNetherton症候群患者への応用が研究されているが,紅斑や皮膚癌のリスクが増加する可能性があるため制限されている。
Sixera Pharmaは2021年12月にヨーロッパでSXR−1096の臨床試験を開始し,SXR−1096は局所的に使用されている小分子KLK阻害剤 であり,Netherton症候群の治療に用いられることが知られている。Krystore Biotech,MatriSys,Quoin,BridgeBioは,臨床前段階のNetherton症候群プロジェクトを開発していると報告している。
| 65 |
もし私たちの競争相手がATR-12または私たちが開発する可能性のある他の任意の薬物よりも安全で、より効果的で、副作用が少ない、より便利またはより安い薬物を開発および商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。私たちの競争相手は私たちよりも早くFDAや他の規制機関のその薬物の承認を得ることができ、 これは私たちの競争相手が市場に入る前に強力な市場地位を確立することができるかもしれない。私たちと比較して、私たちは競争或いは未来に競争する可能性のある多くの会社は研究開発、製造、臨床前試験、臨床試験を行い、監督管理の許可とマーケティング 薬品の方面でより多くの財務資源と専門知識を持っている。製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。規模が小さいか早い段階にある会社も重要な競争相手になる可能性があり、特に大企業や成熟会社との協力で手配する。これらの競争相手はまた合格した科学と管理人員を募集と維持し、臨床 試験のために臨床試験サイトと被験者登録を確立し、著者らの計画と相補的或いは必要とする技術を獲得する上で私たちと競争を展開する。
EGFRi 関連皮疹
FDAではこれまでEGFRi関連皮疹の治療に特化した薬剤は承認されていない。抗EGFR治療を持続的に受けている患者の多く(90%に達すると推定される)は皮膚病の副作用が出現し、特に丘疹、掻痒、乾燥(乾燥)と爪皺(爪感染)が出現する。丘疹或いはざ瘡様皮疹はEGFRIが皮膚に最もよく見られる不良事件である。この皮疹は多くの患者のEGFRi治療コンプライアンスに負の影響を与えた。重症者は投与量を調整したり、治療を停止することができる。根拠に基づく対照試験は依然として非常に稀であるため、EGFRiの皮膚毒性の治療は主に医師の経験と専門家共通認識会議の提案に依存する。したがって,EGFRi皮疹の臨床治療には地域差があり,一致していない。ヨーロッパでは局所コルチコステロイドによるざ瘡様皮疹の治療は避けられているが,米国ではよく使用されている。また,局所治療は通常個別患者に対してカスタマイズされた であり,状況によって変化する可能性がある。すべての患者に一般的に適用できる局所治療計画はない。
EGFRi関連皮疹に対する候補研究薬の開発が以下の第二段階計画であることが分かった。Lutris Pharmaは米国とイスラエルでB−Raf阻害剤LUT 014の外用薬を開発している。大同薬業は韓国でDWP 708を開発している。
知的財産権
概要
私たちは、内部開発でも第三者からも許可を得るなど、様々な方法で当社の独自技術、発明、発明改善、および他の当社のビジネス発展に重要なビジネス的意義を有する知的財産権を保護することを積極的に求めています。私たちはまた、私たちの独自技術プラットフォームに関連する商業秘密と技術ノウハウに頼ることができ、持続的な技術革新と未来の許可機会によって遺伝子治療分野における私たちの地位を発展、強化、維持することができ、これは私たちの業務発展に重要であるかもしれない。データ独占性,市場独占性,特許期間の延長により追加的な規制保護 を提供することも可能である。
本出願明細書の発行日までに、我々は、発行された2つの米国特許、4つの係属中の米国特許出願、係属中のPCT出願、および38件の他の外国国段階の出願を所有または独占的に許可し、その中には、我々の業務発展に非常に重要な欧州地域段階出願が3つ含まれている。
私たちのbr政策は、独自技術、発明、および発明の改善、および私たちの業務発展に重要なビジネス的意義を有する可能性のある他の知的財産権を保護するために特許出願を提出することである。私たちはまた、追加の特許保護、または独自技術または商業秘密権に依存して、私たちの生きている生物治療製品を生産および開発するために使用される可能性のある他の技術を保護するつもりです。以下に述べるように,我々は独占ライセンスプロトコルの一方であり,これらのプロトコルは我々の生体生物治療製品および我々の製品の製造·開発に特定の技術を使用する権利を付与している“
| 66 |
私たちのbr特許の組み合わせ
我々の特許の組み合わせは、異常な皮膚状態を治療するための治療細菌、およびこれらの組換え細菌を製造および使用する方法を含む細菌治療用医薬組成物を広くカバーしている。我々の最も広範な出願では、治療効果を有する組換えポリペプチドを発現する細菌株を用いた異常な皮膚状態の治療のための医薬組成物を保護する米国特許brを取得した。この特許は2035年5月に満期になるだろう。特に、本特許は、ビフィズス菌、短桿菌、プロピオン酸菌、ラクトコッカス、連鎖球菌、ブドウ球菌、ラクトバチルス、腸球菌、小球菌、カンジダまたはブドウ球菌のうちの1つまたは複数を含む医薬組成物に関し、前記細菌株は、異常な皮膚状態を治療するための治療用ポリペプチドを製造するように改変されている。私たちはこの特許が組換え細菌を使用した皮膚病と疾病の治療に広範な保護を提供すると信じている。2035年5月までに満期になります。
我々の最先端プロジェクトに対する特許出願の概要は以下のとおりである.
ATR-12
我々の候補ATR-12製品は、発行された2つの米国特許、4つの係属中の米国特許出願、および26件の係属中の外国出願を有している。これらの特許および特許出願は、4つの一連の特許要件を表し、カバーされている表皮ブドウ球菌 組換え治療用ポリペプチドの発現−栄養欠損型表皮ブドウ球菌再構成された人と表皮ブドウ球菌 治療性lekti蛋白を発現する菌株。米国特許の1つは、2035年に満了する異常皮膚疾患の治療のための治療用ポリペプチドを含む組換え細菌に関する。2つ目のアメリカ特許は栄養欠乏症をカバーしています表皮ブドウ球菌 この規定は2039年に期限が切れるだろう。未解決の特許出願からより多くの特許が付与された場合、これらの特許は2035年から2039年の間に満了する。
ATR-04
我々のATR-12候補製品は、発行された米国特許、2つの係属中の米国特許出願、および17の係属外国出願のうちの1つによって制限されている。これらの特許および特許出願は、栄養欠損細菌およびその疾患治療用途に対する2つの請求項を表す。私たちはATR-04をカバーする発行されたアメリカ特許を持っている。より多くの特許が付与された場合、それらはまた2039年に満了するだろう。全体的に、この2つの家族は、発行された1つの米国特許、2つの係属中の米国出願、および17件の係属外国出願を含む。
特許期限と期限延長
個別特許には異なる期限があり、具体的な期限は、特許出願の提出日又は特許発行日及び特許を取得した国·地域の特許の法的期限に依存する。通常、米国で提出された出願のために発行される実用新案特許の有効期限は、非臨時特許出願の最初の有効出願日から20年である。さらに、場合によっては、米国特許の有効期限を延長して、米国特許商標局またはUSPTOの一部を再取得し、特許の発行を遅延させ、FDA規制審査期間によって実際に失われた期間 の一部を延長することができる。しかし,FDAのコンポーネントでは,回復期間は5年を超えることはできず,回復期間はFDA承認日から14年以上延長することはできない。さらに、承認された薬物に適用される1つの特許のみが延期される資格があり、承認された薬物、その使用方法、または製造方法に関する権利要件のみが延長されることができる。外国特許の有効期限は適用される現地法の規定によって異なるが,通常は最初の発効日から20年である。米国特許商標局および各外国司法管轄区の要求によると、特許のすべての税金、年金または維持費は、特許がこの期間内に有効に維持されるようにタイムリーに支払われなければならない。
特許提供の実際の保護は、国/地域の異なる製品によって異なる可能性があり、特許のタイプ、そのカバー範囲、規制に関連する延期の利用可能性、特定の国/地域の法律br}救済措置の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する可能性がある。
| 67 |
私たちの特許と特許出願は他の人たちの手続きや法的挑戦を受けるかもしれない。私たちは業務を展開するために必要な知的財産権を獲得、維持、保護することができない可能性があり、私たちは侵害されたり、他の方法で他人の知的財産権を侵害したりするクレームを受ける可能性があり、これは私たちの業務に実質的な損害を与える可能性がある。詳細については、タイトル “を参照してくださいリスク要因-私たちの知的財産権に関するリスク.”
取引秘密とコツ
私たちのbrはまた、ビジネス秘密、技術ノウハウ、持続的な技術革新、および機密情報に依存して、私たちのbrの独自の地位を発展させ、維持し、私たちの業務における特許保護から保護されているか、または活性生物治療製品を生産する独自のプロセスを含む特許保護に適していないと思う側面を保護することも可能である。私たちは、従業員、コンサルタント、科学コンサルタント、請負業者、および独自の情報にアクセスできる他の人と秘密保護協定および発明譲渡協定を締結することによって、私たちのノウハウおよびプロセスを保護することを求めており、これらの合意に基づいて、彼らが雇用中またはサービス期間内に作った発明を私たちに譲渡する義務があります。このような合意は違反されるかもしれないし、私たちは十分な違反の救済措置を持っていないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。私たちの請負業者、商業パートナー、協力者、従業員、およびコンサルタントが、私たちのために働いているときに他人が所有する知的財産権を使用する程度については、関連するまたはそれによって生じるノウハウおよび発明の権利について議論される可能性がある。詳細については、“br}タイトルを参照してください”リスク要因-私たちの知的財産権に関するリスク.”
我々はまた,我々の場所の物理的セキュリティおよび我々の情報技術システムの物理的および電子的セキュリティを維持することで,我々のデータとビジネス秘密の完全性と機密性を保護しようとしている.
フレッド·ハッチソンがんセンターと独占許可協定を締結しました
2022年1月、私たちはフレッド·ハッチンソンがんセンターやフレッド·ハッジと独占ライセンス契約を締結した。Fred Hutchとの合意によると、Fred Hutchによって開発および所有されているSyMPL技術に関連するいくつかの特許に基づいて、このような特許がカバーされている製品を開発、製造、流通、流通、使用、研究、改善、輸入、販売および販売、および他の方法で商業化することができる。このような独占的許可 は、Fred Hutchおよび米国政府によって保持されているいくつかの権利によって制限される。フレッド·ハッジが付与した特許権は、異種DNAをより容易に導入するために制限修飾システムをバイパスする方法を対象とした2つのシリーズの特許出願を含む。これらの特許出願およびこれらの出願から発行された任意の特許は、疾患治療のためのより多くの改良微生物を生産することを可能にするであろう。私たちの現在の候補製品はSyMPL技術 プラットフォームを使用していませんが、将来の候補製品の一部または全部がこの技術を採用すると予想されています。発行されれば、この二つの家族はそれぞれ2037年と2040年に満期になるだろう。
Fred Hutch許可プロトコルにより我々の許可が与えられたことを考慮して,我々はFred Hutchに象徴的な前払い を支払った.また、いくつかの開発とビジネスマイルストーンの支払いをFred Hutchに支払い、ライセンス製品の純売上高に応じて1桁の印税を支払う必要があります。フレッド·ハッジ協定はまた、フレッド·ハッジの起訴とライセンス特許の維持費用の返済を要求した。
フレッド·ハッジ許可協定によると、私たちは商業的に合理的な努力をして、積極的で勤勉な計画を通じて、許可製品を市場に出して、許可された特許権を利用しなければならない。フレッド·ハッジライセンス契約の有効期限は、(I)ライセンス特許の満了または(Ii)ライセンス製品の初販売日から10年以内に続きます(遅い者を基準に)。フレッド·ハッジライセンス契約は、フレッド·ハッジライセンス契約をいつでも終了することができるFred Hutchに事前に書面で通知することができます。もし私たちが合意に深刻に違反し、指定された治癒期間内にこのような違反を是正できなかった場合、または私たちが破産したり借金をしなかった場合、フレッド·ハッジはフレッド·ハッジ許可協定を終了する権利がある。フレッド·ハッジライセンス契約によって取得された知的財産権に関するより多くの情報は、タイトルを参照してください“営業許可証と知的財産権.”
私たちはまた、アメリカと7カ国/地域にわが社名と設計の登録商標を持っています。
| 68 |
政府法規
製薬会社は外国、連邦、州と現地機関の広範な監督管理を受けており、例えばアメリカFDA、及び全世界の大多数の国と地区の各種の類似機関である。薬品の研究、開発、テスト、製造、流通、包装、ラベル、貯蔵、記録保存、マーケティングと販売はすべてアメリカとその他の国で政府の監督管理を受けている。また, は米国ではFDAが作成した規制を遵守し,我々の候補製品 が安全かつ有効であることを示し,cGMP規定により生産されていることを示すデータの提出を要求しなければならない。もし私たちが適用された要求を守らなければ、私たちは罰金を科されるかもしれません。政府は私たちのマーケティング申請の承認を拒否するか、あるいは私たちの候補製品を製造したり、マーケティングしたりすることを許可して、私たちは刑事起訴を受けるかもしれません。私たち、私たちのメーカーと臨床研究組織も他の外国、連邦、州と現地の法律によって監督される可能性があり、アメリカの“職業安全と健康法”、“資源保護と回収法”、“クリーン空気法”、“輸出入と税関法規、その他のbr}国の法律法規を含むが、これらに限定されない。米国政府は国内や国際的な不正マーケティング行為に対する法執行活動を強化している。そのため、製薬会社は“反海外腐敗法”や連邦医療詐欺、“虚偽請求法”を含む乱用法を遵守することを確保しなければならない。
これらの規制要件は、私たちの運営に影響を与え、国/地域によって異なるため、一方の国/地域が適用される規制承認を得ることを確保することは、他の国/地域の承認を意味するものではない。承認プロセスはコストが高く,人手が密集しており, は通常長年継続しており,高いスキルと専門資源が必要である.
FDAの上場承認プロセス
アメリカでは、私たちの候補製品は連邦食品、薬物、化粧品法案(FDCA)、公衆衛生サービス法案(PHSA)、FDAによって公布された法規に基づいて生物製品としてFDAによって規制されている。製品開発プロセス(臨床前テスト、臨床テスト、承認プロセスまたは承認後のプロセスを含む)の間の任意の時間に適用要求 を遵守できないことは、申請者が臨床試験、監督審査と承認および/または行政或いは司法制裁を行う上で遅延を受ける可能性がある。これらの制裁は、申請者が臨床試験を継続することを許可することを拒否すること、係属中の出願の承認、取り消しまたは免許の取り消し、承認の撤回、警告状、不良宣伝、顧客通知、製品のリコール、製品の差し押さえ、輸出または輸入の承認の拒否、生産または流通の完全または部分的な一時停止、同意法令、禁止、罰金、およびFDAまたは米国司法省または他の政府エンティティによって提起された民事または刑事調査および処罰を含むことができるが、これらに限定されない。
新しい生物がアメリカで発売される前に通常必要なステップは
| ● | FDAの現在の良好な実験室操作規範に基づいて臨床前実験室テストと動物研究を完成した | |
| ● | 臨床試験が開始される前に発効しなければならないINDをFDAに提出し、毎年更新するか、または大きな変化が生じたときに ; | |
| ● | 試験開始前に治療場所ごとの独立機関審査委員会または倫理委員会が許可した | |
| ● | 十分かつ良好に制御された人体臨床試験を実行し、提案された生物製品の安全性、純度と効力の候補生物製品提案の使用適応を決定した | |
| ● | 安全性と有効性を支援するデータ,および製品臨床開発と提案ラベルの製造と成分に関する詳細な情報を提出した |
| 69 |
| ● | すべての重要な臨床試験が完了した後、BLAをFDAに提出する準備ができた | |
| ● | 満足できるbrが適用されれば、FDA諮問委員会の審査を完了する | |
| ● | FDAはBLAを受信してから60日以内に再審申請を提出することを決定した | |
| ● | 満足できるbrは、cGMP標準に適合することを評価するために、生産推奨製品の1つまたは複数の製造施設に対するFDAの承認前検査を完了し、施設、方法、および生物学的製品の持続的な安全性、純度および効力を維持するのに十分な制御を確保し、良好な臨床実践またはGCPに適合するかどうかを評価するために選択された臨床研究場所を提供する | |
| ● | 満足できるbrは、CGP要求に適合し、BLAを支持する臨床データの完全性を保証するために、非臨床および臨床試験場所に対するFDAの任意の監査を完了する | |
| ● | 使用料を支払い、FDAが適応の提案されたBLAの使用を承認することを確実にする | |
| ● | FDA は、この製品が米国で使用される特定の適応のビジネスマーケティングを可能にするためにBLAを審査および承認する; と | |
| ● | REMSおよびFDA要求を含む任意の承認後要求を遵守して検討する。 |
臨床前研究と探索性新薬応用
臨床前試験は製品の化学成分、調合と安定性に対して実験室評価を行い、及び動物に対して動物研究を行い、その潜在的な治療効果と毒性を評価することを含む。臨床前試験と試験に用いる化合物調合は必ず連邦法規と要求に符合しなければならない。臨床前試験の結果は,生産情報と分析データとともにIND申請の一部としてFDAに提出された。IND申請を提出した後であっても、いくつかの臨床前試験が継続される可能性がある。INDは、それ以前にFDAが提案された臨床試験の製品またはヒト研究ボランティアが不合理な健康リスクに直面することを懸念することを含む、FDAが提案された臨床試験の製品または問題を提起しない限り、FDAが受領後30日後に自動的に発効する可能性がある。この場合,INDスポンサーやFDAは臨床試験開始前にFDAの未解決の問題を解決しなければならない。
したがって,INDの提出はFDAが臨床試験の開始を許可しないか,あるいは臨床試験を発起人が最初にINDに指定された条項で開始することを許可する可能性がある。FDAが最初の30日間の間、またはINDプロセスのいつでも懸念または問題を提起した場合、それは、臨床的保留の一部または全部を実施することを選択することができる。FDAが発表したこの命令は,すべての懸案問題が十分に解決されるまで,提案されている臨床試験や進行中の臨床試験の一段階の開始遅延を遅らせることになり,FDAは調査を継続する可能性を同社に通知している。これは計画を適時に完成する臨床試験において重大な遅延或いは困難を招く可能性がある。
臨床試験
臨床 試験は良好な臨床実践或いはGCP要求に基づいて、合格した首席研究者の監督の下で、研究製品を健康ボランティア或いは治療を受ける疾患患者に候補を与えることに関連する。臨床 研究は、研究目標、どのタイプの患者が研究、テストとプログラムに参加できるかを詳細に説明するスケジュール、薬物、投与量と研究時間、および安全性を監視するためのパラメータと評価すべき治療効果基準の方案の下で行われる。INDプロセスの一部として、各臨床研究のレジメンおよび任意の後続レジメン修正はFDAに提出されなければならない。
| 70 |
米国国外で臨床試験を行うスポンサーはFDAの認可を得ることができるが,INDによる臨床試験を希望している。米国国外での臨床試験がINDによって行われない場合、臨床試験の進行がGCPの精神に符合し、国際臨床研究道徳行為ガイドライン“ヘルシンキ宣言”および/または臨床試験を行う1つまたは複数の国の法律法規に符合すれば、スポンサーは臨床試験のデータをFDAに提出してBLAを支持することができ、臨床試験の参加者がより大きな保護を提供するために を提供することができる。
IRBはまた、臨床試験を行う各機関の各臨床試験を集中的または個別に検討しなければならない。IRBは、臨床試験設計、患者インフォームドコンセント、倫理的要因、ヒト対象の安全、機関の可能な責任、および適切な場合にヒト対象のプライバシーを保護することを考慮する。IRBはFDAの規定に従って動作しなければならない。FDA、IRBまたは臨床試験スポンサーまたは首席研究者は、臨床試験がFDAの要求に従って行われていないこと、または対象または患者が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で任意の時間に臨床試験を一時停止または中止することができる。臨床テストはまた広範なGCP規則とインフォームドコンセントの要求を満たさなければならない。そのほか、いくつかの臨床研究は臨床研究スポンサーが組織した独立した合格専門家グループが監督し、データ安全監視委員会或いは委員会と呼ばれる。研究中のあるデータへのアクセスにより,そのグループは指定されたチェックポイントで実験が可能かどうかを提案する.臨床研究スポンサー はまた、絶えず変化する業務目標及び/又は競争環境に基づいて臨床試験を一時停止或いは中止することができる。
臨床試験は通常3つの連続段階に分けて行われるが、これらの段階は重複或いは合併する可能性がある。臨床試験段階の結果を詳細に説明する年次進捗はFDAに提出しなければならない。
| ● | ステップ 1臨床試験は通常健康ボランティアの小団体で行われ、各種の投与方案と薬物動態学の安全性と耐性を評価する。孤児、重篤な疾患、または生命に危険な疾患に対するいくつかの製品、特に製品の毒性が大きすぎて健康な人体の使用に適していない場合、初期臨床試験は特定のbr疾患を有する個人で行われる可能性があり、試験製品の使用を指示する。これらの患者に対する試験は通常1 b期試験と呼ばれる。それらの が特定の用量を決定する設計を含む場合、一般に1 b/2 a期臨床試験と呼ばれる。しかしながら、重要な3期臨床試験に入るために、最終的な選択された用量を詳細化するために、追加の2期(2 b期と呼ばれることがある)の臨床試験が一般的に必要である。 | |
| ● | ステップ 2臨床試験は通常限られた患者集団で行われ、可能な副作用と安全リスクを確定し、特定の標的適応に対する候補製品の治療効果を評価し、そして薬物耐性と最適投与量を決定する。スポンサーは、より規模が大きく、コストの高い3期臨床試験を開始する前に情報を得るために、複数の2期臨床試験を行う可能性がある。 | |
| ● | ステップ 3第2段階臨床試験が候補製品の用量範囲 が潜在的に有効であり、許容可能な安全性を有することが証明された場合、臨床試験を継続する。第三段階の臨床試験を行うことは、より多くの患者の中で更に投与量を評価し、大量の臨床治療効果の証拠を提供し、そして複数の地理的に分散した臨床試験地点で拡大したbrと多様な患者群に対して更なる安全性テストを行うことである。コントロールが良好で、統計的に穏健な3期試験を設計することができ、規制機関が承認するかどうかを決定するためのデータ、 および承認された場合、どのように薬物を適切に標識するかを提供することができる:この3期研究は“キー”と呼ばれる |
FDAが臨床研究がFDAの要求に従って行われていないと考えている場合、あるいは参加者が受け入れられない健康リスクに直面している場合、FDAはいつでも臨床研究の一時的または永久的な停止または他の制裁の適用を命令することができる。場合によっては、FDAは候補製品のBLAを承認する可能性があるが、BLA承認後に薬剤の安全性および有効性をさらに評価するために、スポンサーに追加の臨床試験を行うことが要求される。このような承認後試験は通常4期臨床試験と呼ばれる。これらの研究は、予想される治療適応患者の治療からより多くの経験データを得るために使用され、加速承認br法規によって承認された薬物または生物製品の場合に臨床的利益を証明するために使用される。FDAが製品を承認し、ある会社が承認を必要としない臨床試験を行っている場合、会社 は、任意の4期の臨床試験のすべてまたは一部の要件を満たすために、これらの臨床試験のデータを使用することができるか、または製品ラベルの変更を要求することができるかもしれない。4期臨床試験を行う職務調査ができなかったことは,製品の承認撤回につながる可能性がある。
| 71 |
CGMP要求 に該当する
候補製品が臨床テスト段階を通過する時、生産プロセスは更に定義、詳細化、制御と検証する。 FDAに要求される制御と検証レベルは臨床研究の進展に従って向上する。FDAは通常、製造プロセスおよび施設がcGMP要件に完全に適合していると判断しない限り、BLA申請を許可せず、 は、製品が要求された仕様内で一貫して生産されることを保証することができる。PHSAは,属性が正確に定義できない生物製品などの製品の生産制御の重要性を強調している。
私たちbrと私たちは私たちの候補製品とそのそれぞれのコンポーネント(原料薬を含む)を生産する第三者メーカーは薬品の製造、包装とラベルはcGMPの要求に符合しなければならない。CGMP要求に適合するために、製造業者は、人員、施設、設備、生産およびプロセス、ラベルおよび包装、品質管理、記録保存および他の要求に関連する要求を満たすために、時間、お金、およびエネルギーを継続しなければならない。
製造業者や製品の製造と流通に関連する他の企業もFDAと特定の州規制機関に登録しなければならない。米国と非米国の製造企業が初めて製造過程に参加する際には,登録してFDAに付加情報を提供しなければならない。登録されていない工場で製造または輸入されたどの製品も、米国でも非米国でも、FDCAの下で間違ったブランドがあるとみなされている。機関はcGMPや他の法律の遵守を確保するために、政府当局の定期的な抜き打ち検査を受ける可能性がある。検査は“リスクに基づくスケジュール” に従わなければならず,これはいくつかの機関がより頻繁に検査される可能性がある.メーカーはまた、その工場に関する電子または実物記録の提供を要求しなければならないかもしれない。FDAの検査の延期、拒否、制限、または拒否は、製品が偽とみなされる可能性がある。
BLA 提出と審査
すべての適用された法規要件に従ってすべての要求のテストが完了したと仮定すると、候補製品に関する詳細な情報がBLAの形態でFDAに提出され、1つまたは複数の適応に対する製品の販売の承認を要求し、放棄しない限り 使用料が支払われる。BLAには,関連する非臨床·臨床研究から得られたすべての関連データが含まれており,陰性や不明な結果および陽性結果,化学,製造,対照,推奨に関するbrタグなどの詳細な情報が含まれている。上場承認を支持するために、提出したデータは品質と数量において候補製品の安全性と有効性を確定し、FDAを満足させなければならない。FDAはまた,BLAを承認する前にメーカーや実験室に対して事前承認 検査を行っている。
BLAからの申請が受け入れられた場合、FDAはBLAの深い審査を開始する。“処方薬使用料法案”(PDUFA)によれば、FDAの目標は、提出後10ヶ月以内に予備審査を完了し、申請が満たされていない医療需要に関連しない限り、または深刻なまたは生命に危険な適応に関連しない限り、BLA提出後6ヶ月以内に を目標とする可能性がある。しかし,PDUFA目標日は法定要求ではなく,FDAの応答は通常最初のPDUFA目標日より数カ月遅れている。さらに、FDAがBLAにおいて提供された情報に関する補足情報または明確化を他の方法で提供することを要求またはBLAイニシエータが要求する場合、PDUFA項下の審査プロセスおよび目標応答日を延長することができる。したがって,BLA審査 過程は非常に長い可能性がある.BLAの審査中に、FDAは、申請を承認すべきかどうかを決定するために、審査、評価、および提案のために諮問委員会に申請を提出することができる。FDAは諮問委員会の提案によって制限されていないが、それは一般的にそのような提案に従っている。臨床研究からのデータは常に決定的ではなく、FDAおよび/またはその任命された任意の諮問委員会は、申請者とは異なる方法でデータを解釈する可能性がある。
BLAを評価し、医薬品および/またはその原料薬の製造施設を製造および試験することを検査した後、brは、医薬製品の商業販売を承認し、特定の適応の処方情報を提供するか、または完全なbr返信を発行し、申請が承認の準備ができていないことを示し、BLAの承認を確保するために満たされなければならない条件を説明する。完全な返信が追加のデータを必要とし、出願人がその後データを提出した場合、FDAは、BLAがその承認基準を満たしていないと最終的に判定する可能性がある。FDAはまた、リスクを低減するために、リスク評価および緩和戦略またはREMS計画によってBLAを承認することができ、その中には、制限された配布方法、患者登録および他のリスク最小化ツールなどの薬物ガイドライン、医師のコミュニケーション計画、または安全な使用を確保する要素が含まれている可能性がある。FDAはまた、提案されたラベルを変更し、適切な制御および規範を作成し、または発売後のテストを行うことを条件として承認することができる。このような発売後のテストは第4段階の臨床試験とモニタリング を含む可能性があり、承認後の製品の安全性と有効性を更に評価とモニタリングする。重篤または生命を脅かす適応の製品の規制承認は、この薬物の全体的な生存利益を決定するために、臨床研究の参加者を長期的に追跡する必要があるかもしれない。
| 72 |
FDAが私たちの候補製品の一つを承認した場合、私たちは承認されたいくつかの規制要件を遵守することを要求されます。 私たちは、いくつかの副作用や生産問題をFDAに報告し、最新の安全性と有効性情報を提供し、私たちの任意の候補製品に関する広告および販売促進ラベルの要求を遵守することを要求されます。また、品質管理および製造プロセスは、承認後もcGMPに適合し続けなければならず、FDAはcGMPに適合するかどうかを定期的に検査し、幅広い手続き性を規定しています。実質的かつ記録保存要求。もし私たちが承認された製品のいくつかの変更、例えばいくつかの製造変更を求める場合、変更を実施するためにFDA審査と承認が必要になる可能性があります。
Br先生はFDAで承認されていない適応に製品を用いることができるが,未承認の適応には使用できない。FDAが新しい適応を承認することを確保することは,原始適応を承認する流れ に類似しており,他の事項に加えて,新適応における安全性と有効性を証明するために十分かつ制御された研究データを提出する必要がある。このような研究を行っても,FDAはいかなる変化もタイムリーに承認しないか,あるいは全く承認しない可能性がある。
FDAはまた、製品の流通または使用を制限する可能性のある承認製品または場所条件または承認の効果を監視するために、上場後試験または第4段階試験、およびリスク最小化行動計画および監視を要求する可能性がある。
迅速な追跡、画期的な治療、優先的な指定の検討
FDAは、特定の製品を指定して迅速な審査を行う権利があり、これらの製品が深刻または生命に危険な疾患または状況を治療すること、または緊急時に満たされていない医療需要を満たすことを目的としている場合。これらの計画は,迅速チャネル指定,画期的治療指定,優先審査指定である。
具体的には、1つの製品が重篤なまたは生命を脅かす疾患または状態を治療するためのものであり、そのような疾患または状態の満たされていない医療要件を満たす可能性がある場合、FDAは、製品が単独で使用されるか、または1つまたは複数の他の製品と組み合わせて使用されるかにかかわらず、迅速なチャネル審査を行うように製品を指定することができる。Fast Track製品については,スポンサーがFDAとより多くのインタラクションを行う可能性があり,FDAは申請完了前にFast Track製品申請の部分を審査する可能性がある。FDAがスポンサーから提出された臨床データを初歩的に評価した後、高速チャネル製品が有効である可能性があると判断した場合、スクロール審査を行うことができる。スポンサーは残りの情報を提出するスケジュールを提供しなければならず、スポンサーは適用されるユーザ料金を支払わなければならない。しかしながら、FDAが高速チャネル申請の期間目標を検討することは、申請の最後の 部分が提出されてから開始される。また,FDAが迅速チャネル指定が臨床試験中に出現したデータの支持を得なくなったと考えた場合,FDAはその指定を撤回する可能性がある。
次に,2012年,国会は“食品·薬物管理局安全·革新法案”を公布し,FDASIAと略称した。この法律は、“画期的な治療法”に指定された製品の審査を加速させるための新たな規制案を確立した。1つの製品が、深刻または生命に危険な疾患または状態の治療のために単独でまたは1つまたは複数の他の製品と組み合わせて使用されることが意図されており、初歩的な臨床証拠が、製品が1つまたは複数の臨床的重要終点で既存のbr療法よりも著しく改善された効果を示す可能性があることを示す場合、例えば、臨床開発早期に顕著な治療効果が観察される場合、製品は、開発および承認に関する提案をタイムリーに提供することを含む、画期的な療法に対していくつかの行動をとる可能性がある。より多くの高級者に審査の流れに参加させる;審査チームに学際的なプロジェクト担当者を割り当てる;及び他のステップを取って効率的な方式で臨床試験を設計する。
| 73 |
第三に、FDAは、重篤な疾患を治療し、承認された場合、安全性または有効性の面で重大な改善を提供する優先的に検討された製品を指定することができる。FDAは具体的な状況から,他の利用可能な療法と比較して推奨製品が有意に改善しているかどうかを決定している。著明な改善は,ある疾患の治療においてbrの有効性が向上し,制限治療の産物反応が除去または大幅に減少したこと,記録されたbr}患者のコンプライアンスの向上が重篤な結果の改善を招く可能性があること,新たなbr}亜群の安全性と有効性を示す証拠である可能性が示唆された。優先的に指定された目的は、全体的な関心とリソースをこのような申請の評価に誘導し、FDAがマーケティング申請に行動する目標を10ヶ月から6ヶ月に短縮することである。
第四に、米国政府が実際的または潜在的な緊急事態が発生することを指定した場合、衛生·公衆サービス部長官は、許可されていない薬品および生物製品を販売することができる。緊急事態を指定した後、FDAはFDCAによって確立された基準に基づいて、特定の製品の使用に緊急使用許可を発行することができる。EUAは製品に固有であり,特定の 条件と制限を受ける.EUAベースとなる緊急事態が終了すると,EUAは終了する.
小児科の珍しい病気指定と優先審査証明書
改訂後のFDCAにより、FDAは“稀な小児科疾患”の定義に符合する薬物と生物製品の開発を奨励した。“深刻なまたは生命を脅かす疾患として定義され、その深刻な生命を脅かす表現は、米国では200,000人未満、または米国では200,000人以上に影響を与え、そのような疾患または疾患を治療するための医薬または生物製剤を米国で開発および製造するコストは、米国でそのような薬剤または生物製剤を開発および製造するコストから得られることは、主に18歳までの個人に影響を及ぼす。稀な小児科疾患候補製品のbrスポンサーは、稀な小児科疾患医薬製品の承認日後に後続のヒト薬物または生物用途の優先審査を得るために使用される資格がある可能性があり、優先審査クーポン、またはPRVと呼ばれる。スポンサーは、その秘密協定またはBLAを提出する前に、まれな小児科疾患の指定をFDAに申請することができる。まれな小児科疾患指定は、スポンサーがそのNDAまたはBLAが承認された後にPRVを受信することを保証しない。さらに、稀な小児科疾患指定要求を提出しないスポンサーを選択し、元の証明書を要求する場合、そのマーケティング申請が承認された後もPRVを受信することができる。市場普及申請は,すべての資格条件 を満たす.PRVを受信した場合、それは何度も販売または譲渡される可能性がある。国会はPRV計画を2024年9月30日まで延長し、2026年までPRVを承認する可能性がある。
承認後条例
規制機関によって承認された製品の発売または既存製品の新しい適応を得ると、スポンサーは、FDAが承認条件 として課す可能性のある任意の承認後要求を含む承認後の規制要件を遵守するように要求される。スポンサーは、いくつかの不良反応や生産問題をFDAに報告し、最新の安全性および有効性情報を提供し、広告や販売促進ラベル要求に関する要求を遵守することを要求される。メーカーおよびそのいくつかの下請け業者は、FDAとある州機関にその機関を登録し、医薬品メーカーにいくつかの手続きと文書要求を適用するcGMP法規を含む持続的な法規要件に適合しているかどうかを理解するために、FDAといくつかの州機関の定期的な抜き打ち検査を受けなければならない。そのため、スポンサーとその第三者メーカーは、cGMP法規や他の法規要求を遵守するために、生産と品質管理に時間、お金、精力を投入し続けなければならない。
Br製品も正式なロット発表が必要となる可能性があり、これは、製造業者が 製品の各ロットについていくつかのテストを行い、その後、流通を発表する必要があることを意味する。製品が正式に発表される必要がある場合、製造業者は、各バッチのサンプルをFDAに提出し、バッチの生産履歴要約および製造業者がバッチに対して行ったすべての試験結果を示す発表プロトコルを提示しなければならない。さらに、FDAは、いくつかのbr製品のバッチに対していくつかの検証性テストを行い、その後、バッチを発行して流通する可能性がある。最後に、FDAは薬品の安全性、純度、効力と有効性に関する実験室研究を行う。
| 74 |
承認後,規制要求や基準を遵守していない場合,あるいは製品発売後に問題が生じた場合,FDAは承認を撤回する可能性がある。予想されていない重症度または頻度の有害事象、または生産プロセス、または法規要件を遵守できないことを含む製品に以前に未知の問題が存在することが後に発見された場合、新しいセキュリティ情報を追加するために承認されたラベルの改訂につながる可能性がある;新規の安全リスクを評価するために発売後研究または臨床試験を実施するか、またはREMS計画に従って流通または他の制限を実施する。他の事項を除いて、他の潜在的な結果は以下のことを含む
| ● | 製品の販売または製造、製品の完全な市場撤退、または製品のリコールを制限する | |
| ● | 罰金、許可後の臨床試験の警告状または一時停止; | |
| ● | FDAは、承認されるべきBLASまたは承認されたBLASの追加の承認を拒否するか、または製品ライセンスの承認を一時停止または撤回する | |
| ● | 製品 は、製品の輸出入を許可することを拒否するか、差し押さえたり、差し押さえたりすることを拒否する | |
| ● | 禁止されたり、民事または刑事処罰が適用される。 |
FDAは市場に投入された製品のマーケティング、ラベル、広告、販売促進を厳格に管理している。薬品と生物製品 は承認された適応に対してのみ承認されたラベルの規定に基づいて普及している。FDAや他機関 は非ラベル用途の普及を禁止する法律や法規を積極的に実行しており,不正な方法で非ラベル用途を普及させていることが発見された会社は重大な責任を負う可能性がある。
孤児薬名
孤児医薬品法によれば、FDAは、米国で200,000人未満に影響を与える稀な疾患または疾患、または他の限られた場合に治療することを目的とした薬物孤児の称号を付与することができる。孤児薬物指定(ODD)は,特定製品を市場に出すODDを持つ会社に7年間の市場排他性を規定し,特許保護とは独立している。また、孤児薬を開発した会社は、合格した臨床試験に税金控除を与えることを含む何らかのインセンティブ措置を受ける資格がある。また,孤児薬指定製品を獲得したBLA は,希な疾患や障害の治療以外の他の適応を含む薬物指定を申請しない限り,処方薬使用料の制限を受けない。
排他性を得るために、孤児薬物指定を有する製品がその後、そのような指定された疾患または状況を有するFDAの最初の承認brを得た場合、この製品は、孤児薬物排他性を得る権利があり、これは、FDAが、限定された場合、例えば 別の薬剤が孤児排他性を有する薬物よりも優れた臨床的利点を示さない限り、7年以内に他の出願が同じ適応内で同じ活性部分を販売することを許可しないことを意味する。また,医師は非ラベル用途のための製品 を処方し,我々の排他性を破壊する可能性がある。競争相手が我々より先に同じ適応の同じ活性部分の承認を得た場合,孤立薬独占は我々の製品が臨床的に優位であることが証明できない限り,7年以内に我々の候補製品が承認されることを阻止する可能性がある。
スポンサーは、以前に承認されていない製品のために孤児薬物指定を申請することができ、または発売された製品のために新しい孤児薬物指定を申請することができる。また、スポンサーがそのbr製品が第1の承認された製品よりも臨床的に優れている可能性があるという合理的な仮定を提出することができる場合、その製品が承認された孤児薬と同じ製品を申請し、同じ珍しい疾患または疾患の後続製品に対する孤児薬物指定を得ることができる。複数のスポンサーは、同じ稀な疾患または疾患のために同一の製品の孤児薬物指定を得ることができるが、孤児薬物指定を求める各スポンサーは、完全な孤児薬物指定申請を提出しなければならず、その薬剤の孤児適応の承認を得た最初のスポンサーのみが市場排他性を得ることができ、brは、競合他社が開発中の製品が臨床的に承認された製品よりも優れていることを証明することができない限り、または承認されたbr製品の供給不足を効果的に阻止する。FDAが別のメーカーの孤児排他期を終了することを可能にするために、FDAは、このメーカーが後者の薬物がより安全で、より有効であることを証明することによって、またはbrが他の面で患者ケアに大きな貢献を果たしていることを確認し、このメーカーの臨床的優位性を証明しなければならない。
| 75 |
専門期間はFDAが上場申請を承認した日から,この製品が指定されている 適応のみに適用される。FDAは、異なる用途のための同じ製品の第2の出願、またはその後、同じ適応に対する異なる薬剤のためのbr出願を承認する可能性がある。孤児薬物を指定することは薬物の開発時間や監督審査時間を短縮することもなく、監督審査或いは承認過程において薬物にいかなる利点をもたらすこともない。
私たちのbrは、アメリカ、EU、および他の特定の製品に関心のある地域で、私たちのいくつかの候補製品のために孤児薬物指定および独占経営権を申請することを計画しているかもしれない。私たちは私たちがどの司法管轄区のどの製品でも孤児薬物の称号を得ることを保証することはできない。たとえ私たちが製品の孤児薬物の称号を得ることができても、その製品がbrの承認を得ることができることを保証することはできません。私たちは承認された後に孤児薬物の独占経営権を得ることができるかどうか、あるいは付与された任意の独占特許権を維持することができるかどうか。
生物模倣薬と排他性
2010年3月23日に法律となった“患者保護·平価医療法案”(ACA)には、“2009年価格競争·革新法案”(BPCIA)という副題が含まれている。BPCIAは、FDAが生物模倣薬と交換可能な生物模倣薬を承認することを許可する管理方案を確立した。FDAはすでにいくつかの指導文書草案を発表し,生体模倣薬の審査·承認方法について概説した。生物製品のより大きく,しばしばより複雑な構造に関する複雑さや,このような製品を製造するプロセス は,実施に重大な障害となり,FDAはこれらの障害を策定している。
バイオ製品検査法によれば、製造業者は、以前に承認された生物製品または参照製品と生体類似性または互換性を有する生物製品の許可申請を提出することができる。FDAに生物類似製品を承認させるためには,参考製品と提案された生物類似製品が安全性,純度と効力の面で臨床的に有意な差がないことを発見しなければならない。FDAが生物学的類似製品を参照製品と交換することができるようにするために、この機関は、生物学的類似製品が参照製品と同じ臨床結果を生成することが期待できることを発見しなければならず、(複数回投与された製品のための)生物学的製剤および参照生物製剤は、以前の投与後に安全リスクを増加させることなく、または参照生物学的製剤の単独使用と比較して治療効果を低下させることなく切り替えることができる。
BPCIAによると,生物類似製品の申請は参考製品が承認された日から4年後にFDAに提出されなければならない。FDAは、参考製品が承認された日から12年後に生物類似製品を承認する可能性がある。1つの製品が独占販売の資格がある参考製品と考えられていても、FDAが製品の完全なBLAを承認した場合、スポンサー自身の臨床前データと、十分な臨床試験および良好に制御された臨床試験からのデータとを含み、その製品の安全性、純度、および有効性を証明するために、別の会社は、その製品の競争バージョンを販売することができる。BPCIAはまた、交換可能な製品として承認された生物模倣薬のためのいくつかの排他的期限を設けている。
アメリカ以外の法規
アメリカ国外で任意の製品を販売するために、会社はまた他の国/地区と司法管轄区域の品質、安全性と有効性に関する多く、しかもそれぞれ異なる監督管理要求を遵守しなければならず、その中には臨床試験、マーケティング許可、商業販売と薬品流通を含む。製品がFDAの承認を得ているか否かにかかわらず、同社は非アメリカの監督管理機関のような必要な承認を得て、その後、これらの国或いは司法管轄区で臨床試験或いは製品マーケティングを開始することができる。承認の流れは最終的に国と司法管轄区によって異なり、追加の製品テストと追加の行政審査期間に関連する可能性がある。他の国や管轄地域で承認を得るのに要する時間は、FDAの承認を得るのに要する時間とは異なり、さらに長くなる可能性がある。1つの国/地域または司法管轄区域で規制承認を得ることは、他の国/地域で規制承認を得ることを保証することはできないが、1つの国/地域または司法管轄区域で規制承認を得ることができなかったり、遅延したりすることは、他の国/地域の監督管理プロセスに悪影響を及ぼす可能性がある。
| 76 |
EUの法規と販売許可
ヨーロッパ薬品管理局(EMAと略称する)はEU或いはEUの科学機関であり、薬品と生物製品などの新しいと許可された医薬製品の評価とモニタリングを調整することを担当している。それはEUのマーケティング許可申請に対して科学的な評価を行い、技術指導を制定し、スポンサーに科学的な提案を提供することを担当する。
EUの医薬製品の審査プロセスはアメリカのプロセスと大体同じで、通常は以下の項目を円満に完成することも含まれている
| ● | 臨床前のbr実験室テスト、動物研究と調合研究はすべて適用したEUの良好な実験室規範に従って行った | |
| ● | 各臨床試験の臨床試験申請またはCTAをEU加盟国の関連監督機関または国家当局に提出し、この申請は人体臨床試験が開始される前に承認されなければならない | |
| ● | 各提案に対する製品の適応の安全性と有効性を決定するために、十分かつ良好に制御された臨床試験の業績を決定する | |
| ● | 安全性と有効性を支援するデータと,臨床開発における製品の製造や成分に関する詳細な情報,提案されたラベルを含む上場認可申請やMAAを関係国当局に提出する | |
| ● | 関係国当局は、cGMPの遵守状況を評価するための第三者の検査を含む生産製品の1つまたは複数の製造施設の検査を完了することが好ましい | |
| ● | MAAを支持するデータが生成された非臨床および臨床試験地点を監査することが可能である | |
| ● | 製品に対してどんな商業マーケティング、販売、または出荷を行う前に、 を審査してMAA関連国当局の承認を得てください。 |
臨床前研究
臨床前試験は製品の化学成分、調合と安定性の実験室評価、及び動物の潜在的な治療効果と毒性に対する評価研究を含む。臨床前試験と試験に用いる化合物調合は必ずEUの関連法規と要求に符合しなければならない。前臨床試験の結果は,関連する生産情報と分析データとともに,承認を求めて臨床試験開始時にCTAの一部として提出し,マーケティング許可を求める際にMAAとともに提出する。
臨床試験承認br
EUにおける臨床試験(CGCPを含む)の要求brは現在の臨床試験指令2001/20/ECと GCP指令2005/28/ECで実行されている。改正後の2001/20/EC号指令と2005/28/EC号指令に基づいて、EUはすでに加盟国の国家立法を通じて臨床試験審査制度を実施した。この制度によれば,試験を計画している国家主管部門の承認を得なければならず,複数の加盟国で臨床試験を行うためには,複数の加盟国で承認されなければならない。そのためには,薬品アーカイブやIMPDを調査する指令2001/20/ECと指令2005/28/ECおよび他の適用マニュアル文書に規定されているさらなる支援情報を調査するCTAを提出しなければならない。また,主管倫理委員会がその国の臨床試験申請に積極的な意見を発表した後にのみ,臨床試験を開始することができる。
| 77 |
2022年1月31日、“臨床試験条例”(EU)第536/2014号は現行の“臨床試験指令2001/20/EC”に代わった。臨床試験規則がEU全体で一致することを確保するために,すべてのEU加盟国に直接適用される条例として“臨床試験条例”(EU)第536/2014号が採択された。しかし、“臨床試験指令2001/20/EC”は、“臨床試験条例”が施行された日から3年以内に、(I)申請前に提出された臨床試験申請、および(Ii)発起人が旧システムを選択すれば、申請後1年以内に提出される臨床試験申請に適用される。
第(Br)(EU)2014号法規はEUの臨床試験の承認プロセスを簡略化することを目的としている。この条例の主な特徴は次の通りです
| ● | 臨床試験情報システムと呼ばれる単一入口点によって申請プログラムを簡略化する | |
| ● | 出願のために作成され提出された文書のセットおよび簡略化された報告プログラムは、発起人が実質的に同じ情報を異なる国家当局に別々に提出する必要がないようにする | |
| ● | 臨床試験申請の統一手順を評価し、2つに分けた | |
| ● | 臨床試験の申請評価の締め切りを厳格に規定する | |
| ● | 道徳委員会は、加盟国に関する国家法律に基づいているが、(EU)第536/2014号条例で規定されている全体的な期限内に評価手続きに参加する。 |
マーケティング ライセンス
EU加盟国での製品販売の許可は、集中プロセス、相互承認プロセス、分散プログラム、または国家プログラムのうちの4つに従って行われる。
集中式 プロセス
集中手続きにより、申請者は単一の 申請によってすべてのEU加盟国で有効なマーケティング許可を得ることができる。生物技術方法によって開発された製品を含むいくつかの医薬製品は、集中的な上場許可手続きを経なければならず、EMAの意見に基づいて、EU委員会の承認を得た場合、自動的にすべてのEU加盟国で有効である。スポンサーは,他のカテゴリの 製品の集中プログラムでMAAを提出することを選択することができる.
集中手順は、遺伝子工学のようなバイオテクノロジープロセスからの薬剤、遺伝子療法または組織工学薬などの高度な治療薬、孤児薬、およびHIV、エイズ、癌、糖尿病、神経変性疾患、自己免疫および他の免疫機能障害、ならびにウイルス疾患の治療のための新しい活性物質を含む医薬製品のようないくつかのタイプの製品に対して強制的である。
もし他の医薬製品が新しい活性物質を含み、申請者 が関連医薬製品が重大な治療、科学或いは技術革新を構成していることを証明し、あるいは承認された承認がEUの公共利益に符合する場合、選択的に 集中認可プログラムを採用することができる。
| 78 |
プログラムを管理する
集中プログラムにより、EMAのヒト医薬製品委員会、あるいはCHMPを科学委員会として、EMAを代表して人類が使用する医薬製品の安全性、有効性と品質について意見を提出した。CHMPは各加盟国の国家薬品主管部門が指名した専門家で構成されており,そのうちの1人は協調作業を評価する調査委員に任命され,できれば別の委員会のメンバーが共同調査委員を務めることになる。承認後、調査委員(S)は製品の全ライフサイクルを監視し続けた。CHMPは210個の有効日数があり,マーケティング許可を付与すべきかどうかについて意見 を採択することができる.追加情報を要求する場合、プロセスは、通常、プログラムスケジュール内のクロック停止をトリガするより長い時間を必要とする。この過程は複雑で、会員国の規制当局や一部の専門家と広範な協議が必要だ。公衆衛生の観点から、特に治療革新の観点から、重大な意義を有する薬物について発売許可申請を提出する場合、出願人は、第14条(9)(EC)第726/2004号条例に基づいて、評価手続の加速を請求することができる。CHMPがこのような要求を受けると,210日のタイムリミットは150日に減少するが,CHMPが加速評価に適していないと考えると,集中プログラムの標準時限 に回復することができる.プログラム が完了すると,EPARと略すヨーロッパ公共評価報告書が生成される.意見が否定的であれば,その結論を出す理由に関する情報を提供する.CHMP意見が採択された後,MAAに関する決定はEU加盟国に諮問した後に欧州委員会が通過しなければならず,合計60日以上かかる可能性がある。薬品が許可を得て市場に投入された後,その品質,安全性,有効性に関するすべての面について 審査を行わなければならないことは,上場認可を維持する条件である。
条件付き 承認
特定の場合、EU立法(第14条(7)条(欧州共同体)第726/2004号及び(欧州共同体)第507/2006号)は、出願人が包括的な上場許可を申請するために必要な包括的な臨床データを取得する前に、条件付きマーケティング許可を得ることを可能にする。(1)その製品のリスク−利益バランスが陽性である場合,(2)申請者が必要な包括的な臨床試験データを提供できる可能性が高い,(3)満たされていない医療需要を満たしている場合,および(4)関連医薬製品が直ちに公衆健康に有益である可能性が高い場合,このような条件付き承認brを与えることができ,(1)その製品のリスク−利益バランスが陽性であること,(2)申請者が必要な包括的臨床試験データを提供できる可能性が高いこと,(3)直ちに発売される公衆健康へのメリットが依然として追加データを必要とするという事実に固有のリスクを超えている。条件付きマーケティング許可は、進行中または新しい研究の完了に関連する義務、および薬物警戒データの収集に関する義務を含むマーケティング許可所有者が履行しなければならない特定の義務を含むことができる。条件付きマーケティング 許可有効期間は1年であり、リスク-収益バランスが正のままであり、条件および/または特定の義務を追加または修正する必要があるかどうかを評価した後、年に1回継続することができる。上記の集中プログラムのスケジュールは、条件付きマーケティング許可申請の審査にもCHMPに適用される。
マーケティングの特別な場合のライセンス
第(Br)条第(8)項(EC)第726/2004号条例によれば、特殊な場合、出願人は、(立法で予想される特定の理由による)総合データ(改正された2001/83/EC指令添付ファイルIの要件に適合する)を提供できない製品が上場許可を得る資格がある可能性があることを証明することができる。このような承認は毎年 を審査してリスクと収益のバランスを再評価する.特別な場合、マーケティング許可の一部として適用される任意の特定のプログラム/義務を履行することは、一般に、完全なアーカイブ/承認の完了をもたらすことなく、製品の安全かつ有効な使用に関する情報を提供することを意図している。
| 79 |
小児科研究
EUがマーケティング許可を得る前に、出願人は、(1)特定の製品の免除、(2)カテゴリ免除、または(3)PIPに含まれる1つまたは複数の措置を延期しない限り、EMA承認に適合するすべての小児科集団をカバーする小児科調査計画(PIP)に含まれるすべての措置を証明しなければならない。すべての販売許可手続のそれぞれの要求は(EC)第1901/2006号条例,いわゆる小児科条例に規定されている。会社が許可された薬物に新たな適応,薬物形式あるいは投与経路を添加することを希望する場合,この要求はbrにも適用される。EMAの小児科委員会、またはPDCOは、ある薬物の延期を承認する可能性があり、会社が成人に対する有効性および安全性を証明するのに十分な情報があるまで、小児薬の開発を延期することを可能にする。小児における薬物の開発が不要または不適切である場合、PDCOは、高齢者人口のみに影響を与える疾患のような免除を承認することもできる。
マーケティング許可申請を提出する前に、または既存のマーケティング許可を修正する前に、EMAは、会社 が各関連するPIPに列挙された合意された研究および措置を確実に遵守していると判断する。
ライセンスと更新期間
営業許可は原則として5年間の有効期間であり、マーケティング許可は5年後にEMAまたは国家当局によってリスク-収益バランスを再評価した上で更新することができます。そのため、マーケティング授権書所有者は、マーケティング授権書の失効の少なくとも9ヶ月前に、マーケティング許可書発行以来導入されたすべての変化を含む、品質、安全性、および有効性に関する文書の統合バージョンをEMAまたは主管当局に提供しなければならない。一旦更新されると、上場許可は無期限有効であり、欧州委員会または国家当局が薬物警戒に関連する正当な理由に基づいて5年間の継続を決定しない限り、許可後3年以内に薬品がEU市場(集中手続きである場合)または許可加盟国のbr市場に実際に投入されなければ、もはや有効ではない、いわゆる“日没条項”である
孤児薬品名と排他性
欧州委員会は、スポンサーに、(1)生命または慢性衰弱を脅かす疾患、または(2)生命を脅かす、深刻な衰弱または深刻な慢性疾患の診断、予防または治療のための製品に孤児医薬品の称号を付与することができ、インセンティブ措置がなければ、EUでの販売は、必要な投資が合理的であることを証明するのに十分な見返りを与えることができない。スポンサーは、EUが承認していない他の満足できる診断、予防または治療方法を証明しなければならない、またはそのような方法が存在すれば、提案された孤児薬は患者に大きな利益をもたらすであろう。
孤児の薬物指定は、費用減免、監督管理協力、集中的なEUマーケティング許可を申請することを含む多くの利点を提供します(“-政府法規と製品承認-米国国外の規制-集中的な認可手続き”を参照)、およびマーケティング許可を取得してから10年の市場排他性を参照してください。この市場独占期間内に、EMA、欧州委員会または加盟国は、許可された孤児薬と類似した1つまたは複数の活性物質を含む薬剤と、同じ治療適応のための医薬品とを申請または付与することができない。5年目の終了時に孤児薬物指定基準に適合しないことが決定された場合、治療適応を許可する市場専門期間は、製品が市場固有性を維持するのに十分ではないことを証明するのに十分な利益を有することを証明することを含む6年に短縮されることができる。さらに、市場独占期間が終了する前に、競合他社の類似薬は、許可された孤児薬よりも安全で、より効果的であることが証明された場合、または承認された孤児薬の上場許可保持者が十分な数の製品を供給できない場合を含む許可を得ることができる。
孤児薬物として指定された医薬製品のMAAが、合意されたPIPに従って行われたすべての研究の結果を含み、その後、付与された上場許可に対応する声明が含まれている場合、10年間の市場専門期間は12年に延長される。
| 80 |
規制データ保護
連合立法はまた規制データと市場排他性制度を規定する。マーケティング許可を得た後、完全な独立したデータパケットに基づいて承認された新しい化学品brエンティティは、8年間のデータ独占権および追加の2年間の市場独占権から利益を得るであろう。データ排他性は、EUの監督管理機関が革新者のデータを参考にして汎用または生物類似(略称)応用を評価できないようにする。追加の2年間の市場独占期間内に、模倣薬或いは生物類似薬の発売許可を提出することができ、革新者のデータを参考することができるが、市場独占経営権が満期になるまで、模倣薬或いは生物類似薬を販売することはできない。この10年前の8年間に、マーケティング許可保持者またはMAHが1つまたは複数の新しい治療適応の許可を得た場合、10年全体の期間は最大11年 に延長され、許可前の科学的評価では、これらの適応は、既存の療法と比較して有意な臨床的利益をもたらすことができると考えられる。1つの化合物が新しい化学物質であると考えられても、革新者はデータ独占期間を得ることができるが、別の会社は、同社が薬物試験、臨床前試験、および臨床試験の完全な独立したデータパケットを有するMAAに基づいてbr}マーケティング許可を得ることを前提として、この薬剤の別のバージョンを販売することができる。しかし、孤児薬品に指定された製品は発売許可を得た後、10年間の孤児市場独占権を有している(また“プロジェクト4.B--政府法規と製品承認--EUの法規とマーケティング--孤児薬品の指定と専門権”を参照)。EUのマーケティング許可プロセスの時間と持続時間によると、製品は最大5年間の補足保護証明書、またはbr}SPCを取得する資格がある可能性がある。このSPCはこの薬物の基本特許下の権利を延長する。
マーケティング許可を得た後の規制要求
もし私たちがEUで医薬製品の許可を得たら、私たちは医薬製品の製造、マーケティング、販売促進、販売に適した一連の要求を遵守することが要求されるだろう
薬物警戒
例えば,我々 はEUの厳格な薬物警戒や安全報告規則を遵守しなければならず,これらの規則により,認可後の研究や追加的なモニタリング義務を実施することができる。
他のbr要件は、例えば、良好な製造規範基準に従って製品および原料薬を製造することに関連している。br}EU規制機関は、私たちが適用される要求に適合しているかどうかを検証するために検査を行う可能性があり、私たちは引き続き時間、お金、労力をかけてコンプライアンスを維持しなければならない。安全モニタリングや薬物警戒に関するEUの要求や,小児科群のための製品開発に関する要求を守らないことは,EUの重大な経済処罰 を招く可能性もある。同様に、個人データ保護に関するEUの要求を守らないことはまた重大な処罰と制裁につながる可能性がある。もし私たちが現地で適用される要求を守らなければ、個別のEU加盟国も様々な制裁と処罰を施行することができる。
製造業
単独の製造業者ライセンスを持たなければならないライセンス薬品の生産は、EMAのcGMP要件および他の国の主管部門の同様の要件を遵守しなければならず、これらの要件は、その安全性およびアイデンティティを確保するために、医薬品の生産、加工および包装中に使用される方法、施設、および制御措置を規定する。EMAは強制登録施設とこれらの施設を検査することでそのcGMP要求を実行する.EMAはこれらの検査に対して協調的な役割を果たす可能性があり,これらの検査を実行する責任はメーカーが属する加盟国の主管当局が担当する。これらの要求を遵守しないことは、供給を中断し、遅延、意外なコスト、収入損失を招く可能性があり、申請者を潜在的な法律または規制行動に直面させる可能性があり、警告状、生産の一時停止、製品の差し押さえ、禁止行動、または可能な民事と刑事罰を含むが、これらに限定されない。
| 81 |
マーケティング と販促
EUは許可薬品のマーケティングと普及を厳格に監督し、業界賛助の継続医学教育と薬品処方者及び/又は一般公衆向けの広告を含む。適用された法規は、マーケティング許可所有者が提供するその製品に関する情報 が真実でバランスがとれていることを保証し、EMAまたはライセンス加盟国の国家当局が許可した安全性および効果宣言を正確に反映することを目的としている。これらの要求を守らないことは,負の宣伝,警告状,改正広告,潜在的な民事や刑事罰を招く可能性がある.
他のアメリカの医療保険法やコンプライアンスの要求は
アメリカで流通されている製品については、連邦政府と私たちが業務を行っている州の追加医療法規と法執行も受けます。適用される連邦と州医療法律法規には以下が含まれている
| ● | 連邦医療保険逆控除法規は、他の事項に加えて、個人の推薦または購入、注文または推薦の任意の商品またはサービスを誘導または奨励するために、直接または間接的に現金または実物の形態で報酬を請求、提供、受信、または提供することを禁止し、これらの商品またはサービスは、Medicare、Medicaidまたは他の政府計画に従って支払うことができる。個人または実体は、連邦反リベート法規またはこの法規違反の具体的な意図を実際に知る必要がなく、違反を実施することができ、また、“虚偽申告法”によれば、連邦反リベート法規違反による物品またはサービスは虚偽または詐欺的クレームを構成する可能性がある | |
| ● | “患者回診道徳法”(一般的には“スタック法”と呼ばれる)およびその対応する法規は、医師がMedicareまたはMedicaid計画によって精算された指定された健康サービス(外来薬を含む) を医師またはその直系親族が財務関係または所有権利益を有するエンティティに転送することを禁止するが、規制された例外の制限を受け、これらのエンティティがMedicareまたはMedicaidに支払い項目または転介受益者に提供するサービスのクレームを提出することを禁止する | |
| ● | 連邦虚偽請求法案は、連邦政府に金銭を支払う義務を回避、減少または隠蔽するために、連邦政府に虚偽または詐欺的または虚偽陳述を提起することを意図的または原因とした個人またはエンティティに、民事告発者または準訴訟を含む刑事および民事処罰を適用する | |
| ● | 1996年の“保険携帯·責任法案”は,詐欺の任意の医療福祉計画を実施する計画の刑事と民事責任を規定し,強制契約条項を含めて個人が健康情報を識別できるプライバシー,安全,転送を保護する義務を規定している。この法規はまた、医療福祉、プロジェクトまたはサービスの交付または支払いに関連する重大な事実を故意に偽造、隠蔽、または隠蔽すること、または任意の重大な虚偽陳述を行うことを禁止する | |
| ● | 連邦虚偽陳述法は、重大な事実を故意に偽造、隠蔽、または隠蔽すること、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の重大な虚偽陳述を禁止する | |
| ● | ACAが作成した“医師支払い陽光法案”およびその実施条例によると、特定の薬品、設備、生物製品および医療用品メーカー がMedicare、Medicaidまたは児童健康保険計画の下で支払いを受けることができることを要求するbr}は、特定の例外を除いて、毎年Medicare&Medicaidサービスセンター(CMS)に医師への支払いまたは他の“価値移転”に関する情報を報告する。このような報告書のすべての情報は公開されている | |
| ● | 州反リベートおよび虚偽クレーム法律のような同様の州法律は、非政府第三者支払者(個人保険会社を含む)によって精算される医療項目またはサービスの販売またはマーケティング手配およびクレームに関連することに適用される可能性があり、いくつかの州法律は、製薬会社に製薬業界の自発的コンプライアンスガイドラインおよび連邦政府によって発行された関連するコンプライアンスガイドラインを遵守することを要求する。 |
| 82 |
これらの法律の広さおよび法定例外および利用可能な避風港の狭さのために、私たちの将来のいくつかの商業活動は、1つまたは複数のそのような法律の挑戦を受けるかもしれない。私たちが第三者の業務計画と適用される法律と法規に適合することを確保するために努力して、これは多くのコストに関連するだろう。政府br当局は、私たちの業務実践は、現在または未来に適用される詐欺および乱用、または他の医療保健法律および法規に関連する法律、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの運営がこれらのbrの法律または任意の他の私たちに適用される可能性のある政府法規に違反していることが発見された場合、私たちは重大な民事、刑事、行政の処罰、損害賠償、罰金、政府が援助する医療計画(例えばMedicareおよびMedicaid)から除外され、私たちの運営を削減または再編する可能性がある。もし私たちがそれと業務を展開する任意の医師または他の提供者または実体がbrが適用法に適合していないことが発見された場合、彼らは政府が援助する医療計画から除外することを含む刑事、民事または行政制裁を受ける可能性がある。
精算する
私たちの候補製品のアメリカでの売上は、政府医療計画、商業保険、管理医療機関のような第三者支払者が候補製品コストを支払う程度にある程度依存するかもしれない。これらの第三者支払者は医療製品やサービスの料金にますます多くの挑戦を提起している。また,医療コストの抑制は連邦と州政府の優先順位となっており,薬品価格はこの努力の重点となってきた。アメリカ政府、州立法機関と外国政府はコスト制御計画の実施に大きな興味を示し、価格制御、精算制限と非特許製品の代替要求を含む。価格制御とコスト制御措置を採用し、既存の制御と措置を採用した司法管轄区でより厳しい政策を採用することで、私たちの純収入と業績をさらに制限する可能性がある。もし、これらの第三者支払者が、私たちの候補製品が他の利用可能な療法と比較して費用対効果があると思わない場合、彼らは承認後に私たちの候補製品をその計画の下の福祉としてカバーしないかもしれない、または、もし彼らがそう思う場合、支払いレベルは、利益に基づいて私たちの候補製品を販売するのに十分ではないかもしれない。
販売が許可される可能性のある任意の製品の保証範囲および精算を確保するためには、製品の医療必要性および費用効果を証明し、FDA、EMAまたは他の同様の規制承認を得るために必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。私たちの候補製品は医療の必要性や費用効果があるとみなされないかもしれません。支払人が薬品に保険を提供することを決定することは、適切な販売率を承認することを意味するわけではありません。 第三者精算は、製品開発投資の適切なリターンを達成するために、価格を十分に高いレベルに維持するのに十分ではないかもしれません。
定価 と精算案は国/地域によって異なる。一部の国では、精算価格を合意した後にのみ、薬品を販売することができると規定されている。いくつかの国は追加的な研究を完成し、特定の候補製品のコスト効果を現在利用可能な治療法と比較することを要求するかもしれない。このような研究を行うコストが高い可能性があり,我々の商業化作業が遅延している.EUはその加盟国に多種の選択を提供し、その国家医療保険制度が精算薬品を提供する範囲を制限し、人が使用する医療製品の価格を制御する。EU加盟国 は薬品の具体的な価格を承認することができ、あるいは薬品を市場に投入する会社の収益力に対して直接または間接的な制御制度をとることができる。他の会員国は会社が自ら薬品価格を決定することを許可するが、会社の利益を監督してコントロールする。全体的には,医療コスト,特に処方薬の下り圧力が非常に大きくなっている。そのため、新製品の参入にはますます高い壁が設けられている。また、ある国/地域では、低価格市場からの国境を越えた輸入製品が競争圧力をもたらし、一国国内の定価水準を低下させる可能性がある。薬品に対して価格制御や精算制限を実施する国/地域が、私たちのどの製品に対しても優遇的な精算と定価手配を許可することは保証されません。
| 83 |
政府や第三者支払者が十分な保険や精算を提供できない場合、規制部門の承認を得て商業販売のための任意の製品の適正性が影響を受ける可能性がある。また,米国の管理式医療への重視度も向上しており,薬品定価の圧力が増加していくことが予想される。保証政策、第三者精算料率と薬品定価規則はいつでも変更される可能性があります。 規制部門の承認を得た1つ以上の製品が有利な保証範囲と精算状態を獲得しても、将来的にはあまり有利ではない保証政策や精算料率が実施される可能性がある。
医療改革
アメリカでは、医療コストを抑えるための多くの重要な立法措置が続いているだろう。ACAは2010年3月に米国で公布され、その中に含まれる条項は、例えば、Medicaid薬品返却計画によって拘束された薬品の返却点を増加させること、Medicaid返却点をMedicaid管理の看護計画に拡大すること、いくつかのMedicare Part D受益者への強制割引、および連邦医療計画の販売に占める製薬会社のシェアに基づいて計算される年会費を含む医薬品の収益性を低下させる可能性がある。
また、“ACA”が公布されて以来、他の立法改正も提案され、採択された。これらの変化には、2013年4月1日から提供者に支払われる医療保険総金額が前期当たり2%削減され、その後の法規改正により、これらの削減は国会が追加的に行動しない限り2027年まで続くことが含まれているが、CARE法案とその後のbr立法によると、新冠肺炎の流行により、これらの削減は2020年5月1日から2022年3月31日まで停止される。2013年1月、“2012年米国納税者救済法”が法律に署名し、いくつかの医療サービス提供者への医療保険支払いを減らし、政府が提供者に多額の支払いを取り戻す訴訟時効期間を3年から5年に延長した。これらの新しい法律は,医療保険や他の医療資金のさらなる減少を招く可能性があり,承認されれば,我々の薬品の顧客および我々の財務運営に実質的な悪影響を及ぼす可能性がある。
また、最近、政府はメーカーがその商業製品の価格設定方式の審査を強化した。米議会は最近数回の調査を行い、薬品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、医療保険下の薬品コストを下げ、政府が計画している薬品精算方法を改革するための連邦と州立法を提出し、公布した。FDAは2020年9月24日に最終規則を発表し、2020年11月30日から発効し、各州がカナダからの薬品輸入計画の制定と提出に指導を提供した。また、2020年11月20日、アメリカ衛生·公衆サービス部(HHS)は、薬品メーカーのD部分下の計画スポンサーに対する値下げ安全港保護を直接或いは薬局福祉マネージャーを通じて削除する法規を決定した。この規則はまた、販売時点での値下げを反映するための新しい安全港を創出し、薬局福祉マネージャーとメーカーとの間のいくつかの固定費用手配のための安全港を創出した。州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入の制限、およびマーケティングコスト開示および透明性措置を含む医薬品および生物製品の価格を制御するための法規をますます立法し、実施しており、場合によっては、他の国からの輸入およびbrの大量購入を奨励することを目的としている。
その多くの措置および他の提案された措置は、発効するために追加の立法許可を必要とする可能性があるが、国会 は、医薬品コストを制御するために新たな立法措置を求め続けることを示している。
CMSは、薬物または生物製品の毎月の供給または通常の治療コースの費用が35ドル以上である場合、処方薬および生物学的br製品の直接消費者向け広告を要求する最終ルールを2019年7月9日に施行する最終規則を発表した。このような要求に違反した処方薬と生物製品は公開リストに登録されるだろう。
| 84 |
任意のbr医療改革措置が承認されれば、私たちの製品に対する最終的な需要を減少させたり、私たちの製品の価格設定に圧力を与えたりする可能性がある。アメリカ各州も、価格や患者の精算制限、割引、ある製品への制限、br参入およびマーケティングコスト開示および透明性措置を含む薬品の価格設定を制御するための法規を立法および実施するようになっており、場合によっては、他の国/地域からの輸入および大量購入を奨励することを目的としている。また、地域医療当局や個別病院では、どの薬品やサプライヤーがその処方薬や他の医療計画に組み込まれるかを決定するために入札プログラムが使用されるようになってきています。将来的にはより多くの州や連邦医療改革措置が取られると予想されています。
私たちbrは、将来的により多くの州と連邦医療改革措置、および外国政府の法律改革を取ることが予想され、いずれも政府が医療製品およびサービスのために支払う金額を制限する可能性があり、これは私たちの候補製品に対する需要の減少または追加の価格設定圧力を招く可能性がある。
従業員
本募集説明書の日までに、私たちの役員、管理および財務サービスの提供、一般行政責任を含む10人の従業員とフルタイムのコンサルタントがいます。私たちは、私たちの従業員と満足できる仕事関係を維持していると信じています。私たちは何の重大な労使紛争や、私たちの運営のために従業員を募集する上で何の困難にも遭遇していません。私たちの従業員には労働組合代表はいません。
人的資本資源
私たちの人的資本資源目標は、私たちの既存のbrと新入社員、コンサルタント、コンサルタントを識別、採用、維持、激励、統合することを含む。私たちの株式と現金インセンティブ計画の主な目的は、株と現金に基づく報酬奨励を付与することで、これらの人々を激励してできる限りのことをし、私たちの目標を実現することで、株主価値と会社の成功を増加させることです。
法的訴訟
私たち はどんな重大な法的手続きの一方でもない。通常の業務過程で、私たちは時々法的訴訟に巻き込まれたり、クレーム事件の影響を受けたりする可能性がある。結果にかかわらず、このような訴訟またはクレームは、弁護および和解コスト、リソース移動、および他の要因のために私たちに悪影響を与える可能性があり、有利な結果 が得られる保証はない。
施設
私たちの行政事務室はコネチカット州06405号ブランフォード商業園大通り21号約12,030平方フィートのレンタルオフィスと実験室空間内にあります。レンタル契約は2027年に満期になります。私たちが5年間延長することを選択するかどうかにかかっています。賃貸契約によると、私たちは現在毎月14,035ドルを支払い、2024年には14,385ドルに増加し、私たちが比例して分担するいくつかの物件の運営費用を加えます。
コネチカット州グロートン市シェネコセット路93号にある約1,093平方フィートの追加の実験室空間もレンタルしました。brレンタルは2023年4月に満期になりますが、私たちはレンタルをさらに2回延長して1年を選択することができます。賃貸契約によると、私たちは毎月七、235ドルを支払います。そして、私たちが比例して分担するいくつかの物件の運営費用を払います。賃貸契約は2023年4月に満期になり、私たちは現在レンタル延長について交渉しています。
私たちはまた約1,868平方フィートのオフィスと実験室空間を借りました。カナダケベック州ラバルのカルティエ通り500号にあります。レンタル契約によると、私たちは毎月6,583ドルを支払います。レンタル契約は2023年4月に満期になりましたが、現在レンタル延長を協議しています。
私たちの施設は私たちの現在の需要を満たすのに十分であり、必要に応じて商業的に合理的な条項でより多くの空間を得ることができると信じている。
| 85 |
管理する
役員·役員·役員が有名人になる
次の表列明(I)当社の現行政総裁及び取締役、(Ii)今回の発売終了時の首席運営官及び(Iii)は、今回の発売終了時に取締役に就任する取締役指名人選の氏名、年齢及び役職を列明する
| 名前.名前 | 年ごろ | ポスト | ||
| フランシスコ·D·サルバ | 53 | 取締役最高経営責任者総裁 | ||
| ノーマン·スタスキー | 53 | 最高財務官 | ||
| トラヴィス·ホイットフィル | 33 | 首席運営官兼取締役 | ||
| アンドリュー·マクラーリ医学博士 | 38 | 独立 取締役 | ||
| バーバラライアン | 63 | 独立取締役が有名人になる(1) | ||
| ジョン·シュロール | 57 | 独立取締役が有名人になる(1) |
(1)取締役の指名者は今回の発行終了後に私たちの取締役会に移行する予定です。
私たちの役員、役員、役員の指名人選に関する情報
フランシスコ·D·サルバ2021年4月以降、私たちの総裁兼最高経営責任者、取締役会のメンバーを務めてきました。Salvaさんは、バイオテクノロジーおよび製薬業界のトップレベルで15年以上の経験を持っています。サルヴァさんは、炎症と線維化に焦点を当てたバイオ製薬会社Complexa,Inc.のCEO兼CEO(br}を2018年5月から2020年8月まで務めます。2011年2月から2016年11月までの間に、サルヴァさんは、がんおよび自己免疫に専念するバイオ製薬会社Acerta Pharma B.V.、 Inc.の共同創業者で運営副社長を務めています。サルヴァさんは、Vincerx Pharma,Inc.(ナスダック株式コード:VNC)の取締役社長であります。 は、営業職に就く前に、サルヴァさんは、医療、バイオテクノロジー、製薬会社に専念するために、ベンチャー投資銀行や投資銀行の分野で複数の上級職に就いていました。サルヴァさんはブラウン大学の学士号と理学修士号を持っています。ロンドン政治経済学院の経済学と哲学です。我々は、Salvaさんがバイオテクノロジーや製薬業界の高度な管理者、ベンチャー投資家、投資銀行家の経験から、私たちの取締役会に在籍する資格があると信じています。
ノーマン·スタスキー2022年10月以来、私たちの最高財務責任者を務めてきた。スタスキー·さんは、2021年5月15日以降も、生命科学分野で財務、会計、報告サービスを提供する全国的なコンサルティング会社であるタンフォス社の上級取締役を務めている。Staskeyさんは、2014年9月~2021年5月に安永(前身:安永)に雇われ、最近では安永財務会計·コンサルティング·サービス業の取締役管理職を務めている。
トラヴィス·ホイットフィルAzitraの共同創業者で、設立以来私たちの取締役会に勤めてきました。ホイットフィルさんは、2014年1月~2019年9月に役員を務めた首席科学官を含むAzitraで様々な職務を担当し、2019年9月以降は上級技術会社の首席運営官を務め、本発行完了後に首席運営官を務める。ホイットフィルさんは、2015年10月からバイオテクノロジーに専念するベンチャーキャピタルBios Equity Partners,LPのパートナーを務め、2014年9月からBios Researchのシニアアナリストを務めています。2016年7月から2022年3月までエール大学で副研究科学者を務め、小児科と急診医学部に勤務した。ホイットフィルさんは、2018年3月からIN 8 Bio,Inc.(ナスダックコード:INAB) の取締役を務めており、2017年9月から2019年7月まで410医療会社取締役会メンバーを務め、2021年9月にSIRPant免疫療法会社取締役会メンバーを務めています。ホイットフィルさんは、多くの特許を取得し、50冊以上の出版物を共著した資金援助プロジェクトの多くをリードしています。ホイットフィルさんは、ダラス·エキスプレス大学で学士号、エール大学で公衆衛生修士号、ロンドン大学で修士号を取得しています。私たちは、ホイットフィルさんは、バイオ技術や医療産業との深い背景の下で、当社の取締役会のメンバーになる資格があると信じています。
アンドリュー·マクラーリ医学博士2019年3月から私たちの取締役会のメンバーを務めてきました。McClary博士はKDT Ventures LPの創始一般パートナーであり,KDT Venturesはバイオテクノロジーに専念するベンチャー企業であり,2017年に設立された。KDTでは,McClary博士は物理科学と工学(計算と生化学を含む)を利用して交差する会社に投資している。AzitraへのKDTの投資をリードするほか、McClary博士はPathAI、Dyno Treateutics、Solugen、Terray Treateutics、STRM Treeutics、Elegen、Checkerpotへの投資をリードしている。KDT以前、McClary博士はスタンフォード大学で教職員を務め、Include Health(前身はGrand Runds)の早期従業員であり、そこではデータ科学と分析チームの内科担当であった。McClary博士はデュラン大学で医学博士号を取得し,同大学で学術職を務め,HHMI/NIH研究員であり,ブラウン大学で生化学と分子生物学理学学士号を取得した。McClary博士は内科科学者の医療と科学の専門家として、リスク投資業界での仕事経験に加え、私たちの取締役会に就く資格があると信じている。
| 86 |
バーバラライアン今回の募集終了後に当社の取締役会メンバーとなります。ライアンさんは2012年にBarbara Ryan Advisorsを設立した。これは資本市場と広報会社で、これまで彼女はウォール街で30年以上の売り手研究アナリストを務め、アメリカの製薬業界をカバーしてきた。Ryanさんは多くの生命科学会社の株式と債務融資、M&A、評価、アメリカ証券取引委員会報告、財務分析と企業戦略の面で豊富な経験を持っている。RyanさんはShireのAbbvieに対する敵意の買収企図の弁護、ShireのBaxaltaの買収、AllerganのValeantの弁護、PerrigoのMylanの弁護を含む業界最大のM&A取引に参加した。Ryanさんは2014年1月から2017年12月までRadius Healthの幹部チームのメンバーと開示委員会のメンバーを務めた。これまで,Ryanさんはドイツ銀行/アレックス·ブラウンで取締役の執行役員と同社薬物研究チームの責任者を19年間務め,1982年にベルストンで製薬業界の研究人生を開始した。Ryanさんは現在ミンク治療会社(ナスダックコード:iNKT)取締役会のbr取締役であり、監査委員会の議長を務め、同委員会の監査委員会主席はインボ生物科学会社(ナスダックコード:INVO)、英偉達会社(LON:INDV)である。赤門コミュニティ(旧ギルダニューヨーククラブ)は非営利団体ですRyan さんは女性のバイオ製薬業界の発展を推進する非営利組織であるFAMOMARY Pharma Fembersの創始者であり、同時に“製薬幹部”誌編集顧問委員会のメンバー、GLG研究所教員、グランプリ実行顧問委員会のメンバーでもある。Ryanさんが取締役会のメンバーになる資格があるのは、会社の財務、M&A、会社の管理、その他の運営、財務、会計事務の経験と、他の上場や民間会社の前任者や現職の幹部および/または取締役として得られた知識があるからだと思います。
ジョン·シュロール今回の募集終了後に当社の取締役会メンバーとなります。シュロールは2022年3月以来Alumis,Inc.の首席財務官,Alumis,Inc.は個人持株のバイオテクノロジー会社であり,精密免疫療法を開発してきた。シュロールさんは、物理腫瘍のためにプログラム可能な細胞療法を開発するプライベート持株型バイオテクノロジー会社であるアーセナル生物科学会社の最高財務責任者を務め、2021年2月から2022年2月までの間に実行されます。シュロールはバイオテクノロジー会社Translate Bio,Inc.の首席財務長であり、同社は遺伝子療法とワクチンを開発し、セノフィは2021年9月に32億ドルで同社を買収し、期間は2018年5月から2020年12月までである。これまで、シュロールさんは、2014年1月から2018年5月までの間に、国際資産管理会社アン連のグローバル投資家向けヘルスケア部門の主管を務めていました。シュロールはウィスコンシン大学マディソン校で学士と工商管理修士号を取得した。我々は、シュロールさんがバイオテクノロジー産業のリーダーとしての役割を果たしている深い背景と、生命科学分野における最近30年間の投資経験によって、彼が私たちの取締役会のメンバーになる資格があると信じています。
家族関係
私たちのどの幹部、役員、取締役も有名人には家族関係はありません。
法律の手続きに関与しています
私たちの知る限り、過去10年間、私たちの幹部、役員、または取締役は、S-K法規401(F)項に記載された任意の法的訴訟に参加していないことを指名された。
取締役会 構成
私たちのbr取締役会は時々決議案によって許可された役員数を決定することができる。本発売が完了すると、我々の取締役会は5名のメンバーからなり、そのうち3名がニューヨーク証券取引所アメリカ人上場規則の独立した資格を満たすことになります。 SalvaさんとWhitillさんは当社の執行者であるため独立とみなされません。しかし、我々の取締役会は、McClary博士、Ryanさん、およびSchroerさんとの間には何の関係もありません は、米国証券取引委員会規則および法規だけでなく、ニューヨーク証券取引所米国上場要件の適用に関する規則によって定義される“独立”である取締役執行責任の行使を妨害することを決定しました。この決定を下した時、我々の取締役会はMcClary博士、Ryanさん、Schroerさんの各個人が現在と以前に当社との関係を考慮していただけでなく、私たちの取締役会は彼らの独立性を決定することに関連する他のすべての事実と状況を考慮して、私たちの株式の実益所有権を含めています。
| 87 |
リスク監督における取締役会の役割
私たちの取締役会の主な機能の一つは私たちのリスク管理の流れを知ることだ。私たちの取締役会はリスク管理委員会を常設するのではなく、取締役会全体と私たちの取締役会の各常設委員会を通じてこの監督機能を直接管理しようとしており、これらの委員会はそれぞれの規制分野の固有のリスクを処理します。特に、我々の取締役会は戦略リスクの監視と評価を担当し、私たちの監査委員会は、私たちの主要な財務リスクの開放を考慮して検討し、これらの開口を監視·制御するための私たちの経営陣のステップを担当し、リスク評価と管理の流れを管理するためのガイドラインと政策を含む。監査委員会はまた法律と法規の要求事項の遵守状況を監視するだろう。
取締役会 委員会
我々のbr取締役会は監査委員会、報酬委員会、指名と会社管理委員会を設立し、各委員会は委員会の規約に基づいて運営されている。私たちの取締役会は私たちの業務の管理を促進するために他の委員会を設置するかもしれない。各委員会の構成と機能は以下のように説明される。
監査委員会
今回の発行が終わったら、私たちの監査委員会はMcClary博士、Ryanさん、Schroerさんによって構成され、Schroerさんは会長になるだろう。我々の取締役会 は、各メンバーが“サバンズ-オキシリー法案”、“取引所法案”のルール10 A-3、およびニューヨーク証券取引所米国証券取引所に適用される上場基準の独立性要件に適合することを決定した。米国証券取引委員会とニューヨーク証券取引所米国監査委員会の要求によると、我々監査委員会の各メンバーは基本財務諸表を読んで理解することができる。この決定を下した時、取締役会は各監査委員会のメンバーの経験範囲、および彼らの以前および/または現在の仕事の性質を審査した。
当社の取締役会は、シュロールさんが米国証券取引委員会で規定されている監査委員会の財務専門家の資格を満たし、かつ がニューヨーク証券取引所米国上場規則の財務的複雑性要件を満たしていると認定しました。私たちの独立公認会計士事務所と経営陣は定期的に私たちの監査委員会と私的に会います。
他の事項を除いて、この委員会の機能は以下のことを含む
| ● | 条件を満たす会計士事務所を独立公認会計士事務所として選び、私たちの財務諸表を監査します |
| ● | 独立公認会計士事務所と監査の範囲と結果を検討し、経営陣や独立公認会計士事務所と一緒に中期および年末経営実績を審査します | |
| ● | 私たちの独立監査師を招いて監査サービスおよび任意の許可された非監査サービスを実行することを審査し、許可します | |
| ● | 問題のある会計や監査事項に対する懸念を従業員に匿名で提出させるためのプログラムを作成する | |
| ● | リスク評価とリスク管理に関する私たちの政策を検討します |
| ● | 個の関連先取引を審査する;および | |
| ● | 監査委員会と監査委員会規約の業績を毎年審査して評価する。 |
私たちの監査委員会の構成と運営は、サバンズ-オクスリ法案のすべての適用されたbr要求と、すべての適用されたアメリカ証券取引委員会とニューヨーク証券取引所アメリカ規則と法規に適合すると信じています。私たちは将来の要求を私たちの範囲に適用してこのような要求を遵守するつもりだ。
| 88 |
報酬委員会
今回の発行が終了すると、私たちの給与委員会はライアンさんとさんさんで構成され、ライアンさんが議長を務めることになります。各会員は非従業員取締役であり、具体的な定義は“取引法”公布の第16 b-3条の規則を参照されたい。我々の取締役会は、各メンバーが、報酬委員会のメンバーの特定の基準 を含む、ニューヨーク証券取引所米国証券取引所に適用される上場基準によって定義される“独立” であることを決定した。他にも、この委員会の機能には以下のようなものがある
| ● | 私たちの全体的な報酬戦略と政策は、審査、修正、承認(または適切と考えられた場合、取締役会全員に提案されます) | |
| ● | 審査、修正、承認(または適切であると考えられた場合、取締役会全員に提案する)私たち役員の報酬および他の雇用条項; | |
| ● | 私たちが提案した株式インセンティブ計画、報酬計画および同様の計画、ならびに既存の計画および計画を修正、修正、または終了する(または適切と思われる場合、取締役会全員に提案される)審査および承認 | |
| ● | 私たちの株式インセンティブ計画を管理しています | |
| ● | 株式給与に関する政策を策定すること | |
| ● | 給与委員会と給与委員会規約の業績を毎年検討して評価する。 |
私たちの報酬委員会の構成と運営は、サバンズ-オキシリー法案のすべての適用要件に適合し、すべての適用されるアメリカ証券取引委員会とニューヨーク証券取引所のアメリカ規則と法規に適合すると信じている。私たちは未来の要求事項が私たちに適用される範囲内でこのような要求を遵守するつもりだ。
Brとコーポレートガバナンス委員会を指名する
今回の発行終了後、私たちの指名と会社統治委員会はMcClary博士とRyanさんで構成され、McClary博士が議長を務める。私たちの指名と会社管理委員会の構成 はニューヨーク証券取引所アメリカ上場基準 とアメリカ証券取引委員会規則の独立性に対する要求に符合している。他の事項を除いて、私たちの指名と会社管理委員会は次のようになるだろう
| ● | 取締役会と各委員会の指名人選を確定、評価し、取締役会に推薦する | |
| ● | 当社の取締役会と個人取締役の業績を評価します | |
| ● | Brを審議し、取締役会とその委員会の構成について取締役会に提案する | |
| ● | Br社のガバナンス実践の発展を審査する; |
| ● | 私たちの会社の管理実践と報告書の十分性を評価します | |
| ● | を開発し、コーポレートガバナンス基準と事項について私たちの取締役会に提案します。 |
我々の各委員会は書面規約に基づいて運営されており、ニューヨーク証券取引所米国証券取引所に適用される上場要求と規則を満たしている。
| 89 |
ビジネス行為と道徳的基準
私たちは、私たちすべての従業員、役員、取締役に適用される“ビジネス行為と道徳基準”または“行動基準”を採用する予定です。採択されると、行動基準は私たちのウェブサイトwww.azitrainc.comで提供されるだろう。我々の取締役会の監査委員会は“行動基準”を監督する責任があり、従業員、幹部、取締役が“行動基準”に対するいかなる免除も承認しなければならない。さらに、私たちは、行動基準の任意の条項のいかなる改正または免除にも関連して、証券取引所の法律または上場基準要件を適用するすべての開示を私たちのウェブサイトで発表する予定です。
役員報酬
役人の報酬
次の表には、2022年12月31日と2021年12月31日までの年間、最高報酬の役員と他の2人の役員が得た報酬を示しています。この表をレビューする際には、注意してください
| ● | フランシスコ·D·サルバは2021年4月に総裁兼最高経営責任者に任命された | |
| ● | ジェニー·ベトニスは2022年4月まで2021年と2022年に私たちの首席運営官を務めた | |
| ● | ノーマン·スタスキーは2022年10月に私たちの首席財務官に任命された。 |
| 年.年 | 給料 (ドル) | ボーナス ($) | オプション 報酬$(1) | すべて その他の報酬(2) | 合計する | ||||||||||||||||||
| フランシスコ·D·サルバは | 2022 | $ | 403,846 | $ | — | $ | — | $ | 202 | $ | 404,048 | ||||||||||||
| 社長とCEO | 2021 | $ | 281,615 | $ | — | $ | 724,880 | $ | 19,125 | $ | 1,025,620 | ||||||||||||
| ノーマン·スタスキーは | 2022 | $ | — | $ | — | $ | — | $ | 63,200 | $ | 63,200 | ||||||||||||
| 首席財務官 | 2021 | $ | — | $ | — | $ | — | $ | — | $ | — | ||||||||||||
| ジェニー·ベトニス | 2022 | $ | 87,610 | $ | — | $ | — | $ | 169,523 | $ | 257,133 | ||||||||||||
| 首席運営官 | 2021 | $ | 303,714 | $ | — | $ | — | $ | 185 | $ | 303,899 | ||||||||||||
| (1) | ASC 718によると、上記オプション奨励列におけるドル金額は、2022年12月31日と2021年12月31日までの年度のオプション価値を反映している報酬--株式報酬(“ASC 718”)したがって, は必ずしも個人が獲得した実利益を反映しているとは限らない.これらの金額を計算する際に使用される仮定は、我々が監査した財務諸表の付記11に含まれている。 | |
| (2) | 他のすべての補償には、通勤者福祉、休暇支出、移転補償、401 K試合支払い、生命保険料が含まれている。バートニスへの退職給付金と、スタスキー氏の首席財務官のために支払われた相談費もあった。 |
| 90 |
Narrative 主管者の給与表に開示
私たちが現在任命しているすべての役員は好きなような従業員で、以下は彼らの現在の給与スケジュール条項の要約 です。
フランシスコ·D·サルバ
我々 は2021年4月22日にSalvaさんと役員採用協定を締結しており、この合意によるとSalvaさんは当社の総裁兼CEOを務めることになります。合意に基づき、我々は年初来の基本給42万ドルをサルヴァさんに支払うことに同意しました。Salvaさんは、取締役会で設定された業績パラメータに基づいて、その基本給の35%までのボーナスを取得する資格があります。Salvaさんの役員雇用契約は、彼が医療保険やその他の福祉に参加する権利を持っていることを私たちが負担し、他の役員に提供することを可能にします。Salvaのさんが理由なく解雇または正当な理由で辞任した場合、役員採用契約で定義されているような条項 のように、Salvaのさんは12ヶ月以内に基本給や医療保険を受け取り続け、発生した年次ボーナスを比例して取得終了する権利がありますが、適用する業績目標を満たす必要があります。Salvaさんの役員雇用契約は、任意の当事者がいつでも任意の理由で終了することができ、特定の通知要件を遵守する必要がある“任意の”契約です。この協定は知的財産権の譲渡、秘密と賠償に関する慣行条項を含む。
役員採用契約を行うにあたり、Salvaさんは2016年計画に基づき1株あたり1.56ドルで最大465,760株の普通株式を購入する選択権を授与しました。オプションが付与され行使可能である は以下のとおりである.80%のオプションまたは372,608株の普通株を購入するオプションは時間的に帰属しなければならず、93,152株(25%)を購入したオプション は、付与1周年後に帰属し、279,456株(75%)を購入したオプション は、1周年後の36ヶ月以内に月額で帰属する。20%のオプション、または13,120株の普通株のオプションを購入し、患者用量に基づいてATR-12または代替生物治療製品の最初のヒト臨床試験を付与し、我々の取締役会が合理的に適宜決定する。オプションは付与された日の10年記念日に満期になる。
ノーマン·スタスキー
2002年10月12日にタンフォスコンサルタントとの間で締結されたコンサルティング契約に基づき、スタスキーさんは私たちの最高財務責任者として機能します。コンサルティング·プロトコルによると、ダボス·コンサルタント会社は、Staskeyさんが首席財務官として提供するサービスを含む、いくつかの戦略的および財務的コンサルティング·サポートサービスを提供しており、サービスレベルやサービスプロバイダの経歴に応じて、1時間135ドル~575ドルの料金を徴収しています。諮問協定は、いずれか一方が30日間の書面通知後に を終了することができ、知的財産権譲渡、秘密保護、賠償に関する慣例条項を含むことができる。
ジェニー·ベトニス
2019年9月1日付の役員採用協定によると、Bertonisさんは2019年9月から2022年4月まで私たちの首席運営官を務めています。Bertonisさんは2022年と2021年の基本給は303,714ドルであり、取締役会が設定した業績パラメータに基づいて基本給の25%までのボーナスを得る資格がある。Bertonisさんの幹部雇用協定 は彼女に医療保険や他の福祉に参加する権利を持たせ、費用は私たちが支払い、他の幹部に提供する。Bertonisさんの雇用は2022年4月に終了し、彼女の合意の解散費条項によると、彼女は退職日から6ヶ月連続で基本給と健康福祉を受け取った。2022年の間、私たちは全部で156,877ドルの解散費と12,579ドルの休暇支出をバートニスに支払った。
| 91 |
非従業員役員報酬
私たちは取締役を担当しているので、私たちの役員に取締役費用や他の補償を支払っていません。私たちのすべての取締役は取締役会会議に参加する自己負担費用を精算することができます。私たちは現金と持分報酬の支払い、あるいは両方を含めて、私たちのbr非執行役員に支払いを始めるつもりですが、今のところ、私たちはこのようなbr計画や政策を取っていません。私たちは時々未来のいくつかの外部取締役会のメンバーを招いて、私たちがサービスを提供することを代表して、私たちはその人たちが提供するサービスを補償するかもしれません。
株激励計画
我々は,Azitra,Inc.2016株式インセンティブ計画を通過し,我々の普通株の株式を購入するために非制限株式オプションと奨励的株式オプションを付与し,制限および非制限株式付与および 制限株式単位を付与することを規定した.2016年の計画によると、私たちは現在157,989株の普通株を予約している。2016年計画の目的は、条件に合った参加者に当社の所有権を得る機会を提供することです。2016年の計画によると、わが社のすべての高級管理者、役員、従業員、コンサルタントが参加する資格があります。2016年計画では、付与日を下回る我々の普通株公平市場価値の行使価格でオプションを付与してはならないと規定されている。本募集説明書の日付までに、私たちは2016年計画で付与された未償還オプションを持っており、平均執行権価格で1株1.33ドルで1,290,319株の普通株を購入します。
2023年3月、我々の取締役会と株主は、Azitra,Inc.2023年株式インセンティブ計画、すなわち2023年計画を承認し、非限定株式オプションおよび奨励株式オプションを付与して我々の普通株の株式を購入し、br}制限および非制限株式付与および制限株式単位を付与することを規定した。2023計画によると、私たちは現在2,000,000株の普通株 を予約しています。2023計画の目的は、条件を満たした参加者に、当社の所有権を取得する機会を提供することです。2023年計画によると、わが社のすべての役員、役員、従業員、コンサルタントが参加する資格があります。“2023年計画”では、付与された日に、私たちの普通株式公平時価を下回る行権価格でオプションを付与してはならないと規定されている。本募集説明書の発表日まで、私たちは2023計画の下でいかなる賞も授与していません。
関連する 側取引
以下に述べるbrを除いて、当社は2020年1月1日以降、いかなる取引にも関与しておらず、取引に係る金額 が12万ドルを超えるか、または当社の2022年3月31日、2023年および2022年3月31日までの総資産平均値の1%を超える。この取引において、私たちの取締役、役員、または私たちの知る限り、投票権を有する証券の実益所有者の5%以上を有する直系親族は、持分やその他の補償を含む補償手配ではなく、直接または間接的な利益を有することになる。終了、制御権変更、その他の手配、これらの手配 はあります“役員報酬“私たちは、取締役、高級管理者、私たちの普通株の5%以上を持つ実益所有者、上記の任意の直系親族または前述の任意の と同時に高級管理者または取締役または彼らが財務利益を持つ実体とのいかなる取引も、業界br基準に適合する条項でしか行われず、当社の取締役会の多くの利害関係のない取締役の承認を得る政策をとった。
| 92 |
当社は2022年9月に5人の既存株主に元金総額435万ドルの無担保転換可能票を発行し,元金総額400万ドルの手形を含む3つの共同制御の基金をそれぞれBios Fund III, LP,Bios Fund III QP,LPおよびBios Fund III NT,LPとした。Bios実体実益を有する今回の発行直前に我々が発行した普通株の合計は4,883,658株、または約43.0%である。Bios Entitiesの当社への投資について、私たちはBios Entitiesのある取締役会に委任権を授与し、これにより、彼らは私たちの取締役会にBios代表 を任命し、この人は2016年4月から本募集説明書の日付まで私たちの取締役会に勤めています。また、私たちの共同創業者で取締役会のトラビス·ホイットフィルはBios Equity Partners、LPのパートナーであり、Bios Equity Partnersは上記のBiosエンティティの一般的なパートナーである
2019年12月、私たちはバイエルと共同開発協定(JDA)を締結し、この合意に基づいて、私たちの独自微生物ライブラリーから選択されたいくつかの菌株を共同開発することに同意した。バイエルはJDA実行時に一度に低い六桁の支払いをしてくれました。共同開発プロトコルにより,バイエルは我々の開発コストの精算を担当し,2023年にバイエルは6桁の開発コストを支払ってくれた.我々は,JDAによる開発活動を行っている品種6個までに独占印税許可 を得ることができるバイエルに選択権を付与しており,任意の関連特許権の独占印税許可を含む.
2020年9月、バイエルのベンチャーグループLeaps by Bayerは私たちBシリーズの優先株800万ドルを購入した。この投資について、吾らはバイエルのいくつかの取締役会の委任権を授与し、これにより、バイエル委員会の1人のバイエル代表が当社の取締役会に参加し、この人は2020年9月から本募集説明書の日付前日まで当社の取締役会に在任している。
賠償協定
今回の発行が終わる前に、DGCLに含まれる具体的な賠償条項よりも広い可能性がある賠償協定は、私たちのすべての役員や幹部と締結される予定です。これらの賠償br協定は、私たちの役員と役員がその身分やサービスによって生じる可能性のある責任を賠償することを要求します。これらの賠償協定はまた、このような行動、訴訟、または訴訟によって生じたすべての費用を調査または弁護するために、取締役および役員を前借りすることを要求するだろう。これらの合意は,合格者を誘致·維持するために取締役や役員を務めることが必要であると考えられる。
役員責任制限と役員及び上級職員の賠償
デラウェア州一般会社法では、会社はその会社登録証明書に条項を加えて、取締役が取締役としての受託責任に違反するために負う金銭的責任を免除することができるが、この条項は取締役の以下の責任を免除または制限してはならない:(I)取締役の会社またはその株主に対する忠誠義務に違反する;(Ii)善意のない行為または非作為、あるいは故意の不当な行為または違法を知っていることに関連する;(Iii)配当金或いは不法株式の購入或いは償還を不法に支払うことができる。又は(Iv)取締役がそこから不正な個人的利益を得るいかなる取引であっても。 我々は、デラウェア州の法律で許可されている取締役が取締役としての受託責任に最大で違反し、我々又は我々の株主に対して金銭損害賠償責任を負わないことを規定し、再記載する。上記の規定に加えて、当社は、法律で許可されている最大限に取締役及び上級管理者に対して賠償を行うことができる会社登録証明書の改正及び再記載を行う。
今回の発行完了後に採用される改訂·再記述された会社登録証明書の上記条項は、取締役に対するデリバティブ訴訟の可能性を低下させる可能性があり、株主や経営陣 がその受託責任に違反して取締役を訴訟することを阻止または阻止する可能性があり、このような訴訟が成功した場合であっても、私たちと私たちの株主 との利益を得ることができるかもしれない。しかし,上記の規定は,合格したbr人員を吸引·保持するために取締役を務める必要があると考えられる。
上記の条項またはその他の規定に基づいて、我々の役員、高級管理者、および制御者は、1933年の証券法の下で発生した責任の賠償を許可される可能性があることを考慮して、米国証券取引委員会は、このような賠償は、証券法で表現された公共政策に違反すると考えているため、強制的に実行することはできないと言われている。
| 93 |
主要株主
以下の表は、本募集説明書の発表日までの私たちの普通株の実益所有権のいくつかの情報を示しており、具体的には以下の通りである
| ● | 私たちが知っている普通株発行および流通株の5%(5%)を超える実益所有者の一人一人 | |
| ● | 今回の発行完了後に役員、役員、取締役の著名人を務める各 ; と | |
| ● | すべての 上記取締役,役員,取締役指名者は1組である. |
各人の実益所有権は、発行前に発行され、発行された10,586,510株の普通株から計算されたbr}であり、本募集説明書の日付までの1,043,991株の発行および発行された普通株、および本募集説明書の日付 までの変換可能な優先株および発行された転換可能な本票が発行可能な約9,542,519株を含む。米国証券取引委員会は、“利益所有権”を、通常の意味での所有権以外の他の意味として定義する。例えば、ある人は、株式の実益所有権を所有するだけでなく、株式を投票、販売、または他の方法で処理する権限(単独または共有)を有する。利益所有権はまた、本募集説明書の発行日から60日以内にオプションまたは株式承認証の行使または手形、債券または他の債務の転換によって取得される権利を有する個人の株式数を含む。二人以上の者は、同一株式の実益所有者とすることができる。別の説明がない限り, 各通報者のアドレスはC/o Azitra,Inc.,Business Park Drive,21,Branford,Connecticut 06405である.
| 取締役CEOまたは役員指名人選名 | 株式数 | 発売前に持っていた割合(1) | 見積もり後に持っている割合(2) | |||||||||
| フランシスコ·D·サルバ(1) | 186,304 | 1.7 | % | 1.5 | % | |||||||
| ノーマン·スタスキー | — | — | — | |||||||||
| トラビス·ホイットフィル(2) | 412,652 | 3.8 | % | 3.4 | % | |||||||
| アンドリュー·マクラーリ(3) | 291,049 | 2.7 | % | 2.4 | % | |||||||
| バーバラ·ライアン | — | — | — | |||||||||
| ジョン·シュロール | — | — | — | |||||||||
| 役員·役員·役員著名人、団体(6人)として | 890,005 | 8.2 | % | 7.47 | % | |||||||
| 5%株主の名前または名前および住所 | 株式数 | 発売前に持っていた割合 | 見積もり後に持っている割合 | |||||||||
| 基本入出力システム資本エンティティ(4) | 4,883,657 | 43.0 | % | 40.4 | % | |||||||
| バイエル保健有限責任会社(5) | 1,307,401 | 11.0 | % | 10.8 | % | |||||||
| コネチカット州革新会社は(6) | 689,054 | 6.1 | % | 5.7 | % | |||||||
| (1) | 現在行使可能なオプションを行使する際に発行可能な186,304株の普通株式を含む。 |
| (2) | 現在行使可能なオプションを行使する際に発行可能な93,152株 を含む. |
| (3) | 現在行使可能な引受権証brを行使する際に発行可能な21,804株を含む。 |
| (4) | (I)今回の発行終了後に我々の転換可能優先株変換時にBios Fund I,LPに発行された799,467株普通株 (Ii)今回の発行終了後に我々の転換可能優先株変換時にBios Azitra Co-Invest I,LPに発行された397,600株普通株 および株式承認証行使時に発行可能な39,760株普通株,(Iii)284,987株Bios Fund IIに発行可能な普通株 ,を含む.Lpは今回の発行終了後に我々の転換可能優先株を変換する場合と,22,727株が株式承認証行使時に発行可能な普通株,(Iv)123,718株がBios Fund IIIに発行可能な普通株,LP が今回の発行終了後に我々の転換可能優先株を変換する際に発行する77,953株普通株,(V)今回の発行終了後に我々の転換可能優先株変換 時にBios Fund I QP,LP発行467,613株普通株に変換可能である.(Vi)今回の発行終了後に我々の転換可能優先株を変換する際にBios Fundに発行可能な普通株931,094株 II QP,LPおよび引受権証を行使する際に発行可能な普通株式74,238株,(Vii)Bios Fund III QP,LPの発行可能普通株808,058株 優先株変換後に発行可能な普通株509,141株,(8)Bios Fund IIに発行可能な普通株124,641株今回の発行終了後に我々の転換可能優先株と9,940株を切り替えて普通株を発行することができ,(Ix) は我々の転換可能優先株転換時にBios Fund III NT,LPに130,498株普通株を発行し,今回の発行終了後に転換可能本票を変換した場合に82,223株普通株 を発行する.Bios Equity,LPは以下のエンティティの一般的なパートナーである:Bios Fund I,LPおよびBios Fund I QP,LP。Bios Equity Partners II,LP はBios Fund II,LP,QP,LP,Bios Fund II,LPとBios Fund II NT,LPの通常パートナーである.Les Kreisさんによって管理および制御されるエンティティCavu Management,LPおよびAaron Fletcherによって管理および制御されるエンティティBios Capital Management,LPはBios Equity I,LPおよびBios Equity II,LPの一般的なパートナーである。Cavu Advisors LLCは、Kreisさんによって管理と制御されているエンティティであり、Cavu Management LPの一般的なパートナーです。Bios Advisors GP,LLCは、Bios Capital Management,LPの一般的なパートナーであるFletcherさんによって管理および制御されたエンティティです。Bios Fund I、Bios Fund I QP、Bios Fund II、Bios Fund II QP、Bios Fund II NTおよびBios Fund III NT(“Bios Equity Entity”)が所有する株式の合計は、株式所有権情報 を報告するために使用される。クライスラーさんとフレッチャーさんは、Bios Equityエンティティの株式の投票権と投資制御権を共有しています。 会社の役員トラビス·ホイットフィルは、Bios Equity Partners,LPのパートナーです。しかし、本脚注4に記載されている株式には投票権や投資権はありません。Bios Equityエンティティのいかなる も今回の発行で普通株を購入するのは役に立ちません。Bios Equity Entitiesの住所はテキサス州フォートワース400号スイートルーム1751 River Run、郵便番号:76107です。 |
| (5) | 1,307,401株の普通株式を含み、今回の発行終了後に私たちの転換可能な優先株 に変換することができます。バイエル医療有限責任会社の住所は マサチューセッツ州ケンブリッジ市メインストリート610番地、郵便番号:02139。 |
| (6) | (I)605,907株発行可能普通株 が今回の発売終了後に私たちの転換可能優先株を転換し、(Ii)41,315株発行可能普通株 が株式権証行使に発行できる時及び(Iii)41,832株は今回の発売終了後に転換可能本票 を含む。コネチカット州革新会社の住所はニューヘヴィンジェームズ街470号8号室で、郵便番号:06513です。 |
| 94 |
証券説明
一般情報
以下に,これらの条項が今回の発行終了時に発効する予定であるため,我々の株式の最重要条項について概説する.今回の発行に関連する改正·再記述された会社登録証明書および改正·再記載の法律により、このような文書に含まれる予定の条項について概説する予定です。それはただの要約なので、あなたに重要かもしれないすべての情報は含まれていません。本“証券説明書”に記載されている事項の完全な説明については、当社の改正及び再記載された会社登録証明書、並びに改正及び再記載された会社定款及び投資家権利協定を参照しなければならない。これらは、本入札明細書の登録説明書、並びにデラウェア州法律の適用条項に証拠物として含まれるか、又は含まれるものである。
今回の発行が完了した後、私たちの法定株式は直ちに100,000,000株の普通株、1株当たり額面0.0001ドル、および10,000,000株の非指定優先株、1株当たり額面0,0001ドルを含む。
2023年5月17日に7.1:1の割合で長期株式分割を実施した後,本募集説明書日までに我々のすべての転換可能優先株と転換可能本票を発行したすべての株式が自動変換されると仮定し(この変換は今回の発行完了時に直ちに行われる),本募集説明書日までに,我々の発行済み普通株は10,586,510株であり,我々の優先株は を発行していない.
本募集説明書の発表日までに、私たちは11人の登録株主がいます。
普通株 株
普通株式保有者は普通株を保有するごとに1票の投票権を享受することができる。普通株式保有者は、取締役会が適宜決定した時間と額で、取締役会が発表する可能性のある任意の配当金 を取得して、配当金の支払いに使用可能な合法的な資金から を得る権利がある。当社でいかなる清算、解散または清算が発生した場合、普通株式保有者は、普通株式保有者が保有する普通株式数に比例して、その株主に分配可能な会社資産を受け取る権利がある。普通株保有者には優先引受権、転換権、引受権、または累積投票権がない。
優先株
本募集説明書の発表日までに、全部で1,437,150株の転換可能優先株が発行され、その中でAシリーズ転換可能優先株205,385株、A-1シリーズ転換可能優先株380,657株、Bシリーズ転換可能優先株はすでに発行され、414,638株発行された。今回の発行完了後、私たち が優先株に転換できるすべての流通株は直ちに私たちの普通株の合計7,693,436株に変換されます。
今回の発行完了後,改訂·重記された会社登録証明書を採用する予定であり,これにより に10,000,000株の優先株発行を許可する。当社取締役会は、時々1つまたは複数の優先株系列にbr}未発行の優先株株を提供することを許可し、各株主について、シリーズを構成する株式数およびシリーズの指定、シリーズ株式の権限(投票権を含む)、br}があれば、シリーズ株式の優先および相対、参加、選択、特別または他の権利(例えば、あり)、および シリーズの株式の資格、制限または制限(例えば、ある)を決定する。私たちの優先株発行は、私たちの普通株式保有者の投票権や、その等持者が清算時に配当金や支払いを得る可能性に悪影響を及ぼす可能性があります。また、優先株の発行は、制御権変更や他社の行動を延期、延期または防止する効果がある可能性がある。
| 95 |
株式承認証
今回の発行が完了した後、私たちの普通株の株式を購入するために、以下の株式証明書を所有します
| ● | 2018年4月に無担保転換可能な本チケットを配給したため発行された引受権証は、最大47,890株を購入し、1株当たり0.48ドルに相当する。これらの株式承認証は2028年4月に満期になる。 | |
| ● | 我々が2019年2月にA-1シリーズ転換可能な優先株に関連して発行した引受権証は、合計215,854株の私たちの普通株 を購入し、1株当たりの行使価格は5.28ドルに相当する。これらの株式承認証は2029年2月に満期になる。 | |
| ● | 今回の発行終了時にThinkEquityとその指定者に株式承認証を発行し、今回発行で売却された普通株式の4%に相当する普通株を購入する。本株式証明書は1株6.25ドル(今回発売された普通株価格の125%に相当)で行使でき、本募集説明書の発表日から満5年となる。 |
株激励計画
我々は,Azitra,Inc.2016株式インセンティブ計画を通過し,我々の普通株の株式を購入するために非制限株式オプションと奨励的株式オプションを付与し,制限および非制限株式付与および 制限株式単位を付与することを規定した.2016年の計画によると、私たちは現在157,989株の普通株を予約している。2016年計画の目的は、条件に合った参加者に当社の所有権を得る機会を提供することです。2016年の計画によると、わが社のすべての高級管理者、役員、従業員、コンサルタントが参加する資格があります。2016年計画では、付与日を下回る我々の普通株公平市場価値の行使価格でオプションを付与してはならないと規定されている。本募集説明書の日付までに、私たちは2016年計画で付与された未償還オプションを持っており、平均執行権価格で1株1.33ドルで1,290,319株の普通株を購入します。
2023年3月、我々の取締役会と株主は、Azitra,Inc.2023年株式インセンティブ計画、すなわち2023年計画を承認し、非限定株式オプションおよび奨励株式オプションを付与して我々の普通株の株式を購入し、br}制限および非制限株式付与および制限株式単位を付与することを規定した。2023計画によると、私たちは現在2,000,000株の普通株 を予約しています。2023計画の目的は、条件を満たした参加者に、当社の所有権を取得する機会を提供することです。2023年計画によると、わが社のすべての役員、役員、従業員、コンサルタントが参加する資格があります。“2023年計画”では、付与された日に、私たちの普通株式公平時価を下回る行権価格でオプションを付与してはならないと規定されている。本募集説明書の発表日まで、私たちは2023計画の下でいかなる賞も授与していません。
配当をする
私たちは予測可能な未来に私たちの普通株に現金配当金を支払わないと予想している。
登録 権利
今回の発行が完了した後、私たちの普通株式のいくつかの所有者またはその譲渡を許可された人は以下の登録権利 を享受する権利があります。以下に述べる登録権の行使により,我々普通株の株式を登録し,所有者が適用された登録宣言が発効したときに証券法の制限を受けずにこれらの株式 を売却できるようにする.引受割引及び手数料を除いて、本行は、登録株式の登録費用 を以下の登録方式で支払う。以下に述べる登録権は、今回の発行が完了してから3年以内の早い者で失効するか、またはすべての投資家(その関連会社と共に)が規則144に従って3ヶ月以内にそのすべての株式を売却することができる場合に失効する。
転換可能株登録権それは.私たちの転換可能な優先株融資について、私たちは修正された投資家権利協定を締結し、この合意に基づいて、転換可能な優先株の購入者にいくつかの需要と付随する呼吸権を付与した。今回の発売完了後、上記各方面は、私たちが発行した転換可能優先株と無担保転換手形を転換する際に発行された7,693,437株の私たちの普通株と、2018年に私たちの無担保転換可能株券と2019年にA-1シリーズ転換可能優先株を配給するために発行された株式権利証で発行可能な1,838,775株の普通株を含む約9,542,519株の普通株 を保有しています。
| 96 |
投資家権利協定によれば、吾らは、投資家権利協定の下で登録権を有する権利を有する少なくとも50%の株式の所有者が、今回の発売完了後180日を超える任意の時間に書面で要求し、公開転売のために実際の可能な範囲内で可能な範囲内で株式の全部または一部をできるだけ早く登録する。S-1表の登録声明に基づいて2回の需要登録を行う必要があります。このような登録要求の総発行価格は引受割引と手数料を差し引いた総価格であり、2000万ドル以上であることを前提としています。当社がS-3表中の登録声明 を使用する資格があるかどうかによると、吾らはS-3表に基づいて回数制限のない要求登録を行う必要があり、このような登録申請 は引受割引及び手数料を差し引いた総発行価格であり、1,000,000ドル以上であることが条件である。私たちはまた、投資家権利協定に基づいて、搭載式登録権と需要登録権を付与した。投資家が証券法第144条に基づいて登録権協定により拘束された株式を売却する場合、これらの請求権及び搭載式登録権は、第144条に規定する販売量制限を受けずに終了する。
引受業者 登録権。今回の発行については、引受業者またはその指定者の代表者に株式承認証を発行し、最大60,000株(または69,000株、超過配給選択権がすべて行使された場合)の普通株式(今回発行された普通株式総数の4%を占める)を購入することに同意した。 代表株式証は、FINRA規則5110.05に適合する登録権(一度需要登録権と無限の搭載権を含む)を提供する。FINRA規則5110(G)(8)(C)によれば、登録要求は、代表授権証が初めて行使された日から本登録声明が発効した日から5周年の日までの任意の時間に提出することができる。一度に登録権を要求する以外に、FINRA規則第5110(G)(8)(D)条によれば、代表の権利証 は、代表の持分証が初めて行使された日から2年を超えない期間内に、制限されない付帯権利を有するべきである。
デラウェア州の法律と私たちの憲章文書のある条項の効力を逆買収する
以下は,デラウェア州法および我々が改正·再記述した会社登録証明書のいくつかの条項の概要,および今回の発行完了後に採用される改正·重述の定款である。この要約は完全であると主張しているわけではなく、デラウェア州の会社法および私たちが改訂して再説明した会社登録証明書および改訂および再記載された会社規約に基づいて完全な修正が行われている。
デラウェア州の法律
私たちは反買収法デラウェア州会社法第203条の制約を受けている. 一般的に、第203条は、デラウェア州会社が株主が利益株主になった日から3年以内に任意の利益関連株主と任意の業務合併を行うことを禁止する(以下のように定義される)
| ● | その日までに、会社取締役会は、株主が利益株主になる企業合併や取引を承認した | |
| ● | により株主が利害関係のある株主となる取引が完了すると, 利害関係のある株主は取引開始時に少なくとも会社が発行した議決権のある株の85%を持つ.発行された議決権付き株(ただし関連株主が所有する議決権付き株を含まない)の数を決定するために、 には取締役や上級管理者が所有する株は含まれておらず、従業員が計画に参加している従業員株も含まれていない。計画的に保有する株式が入札または交換要約の形で入札されるか否かを決定する権利はない。あるいは… | |
| ● | その日又は後には、企業合併は、会社取締役会の承認を受け、書面ではなく、株主年次会議又は特別会議の承認を受けなければならない。少なくとも662/3%の投票権を有する非関連株主が所有する株式を発行した賛成票を採択する。 |
| 97 |
節では、“企業合併”を以下を含むように定義する
| ● | 会社と利益関連株主に関する任意の合併または合併 |
| ● | 利害関係者に関連する会社資産の10%以上の任意の 売却、譲渡、質権またはその他の処置 | |
| ● | いくつかの例外を除いて、会社が利害関係のある株主に会社株を発行または譲渡する取引を招くことはない | |
| ● | 限られた例外を除いて、会社に関連する任意の取引の効果は、利害関係のある株主の実益が所有する任意のカテゴリまたは系列会社の株の割合シェアを増加させることである | |
| ● | 利益関連株主は、会社によって提供された、または会社によって提供された任意の融資、下敷き、保証、質権、または他の財務的利益の利益を受ける。 |
全体的に、第203条は、利害関係のある株主を任意の実体又は個人と定義し、彼らの実益は、会社が議決権付き株式の15%以上を所有しているか、又はその人が利害関係のある株主であるか否かを決定する直前の3年間の間の任意の期間において、実益所有会社が議決権付き株式の15%以上を発行し、これらの任意の実体又は個人と関連して又は制御又は制御している任意の実体又は個人である。
私たちのbr憲章文書
私たちのbr憲章文書に含まれる条項は、他の人が私たちの株に買収要約を提出することを阻止する可能性があり、 は敵意の買収を阻止したり、私たちの支配権や管理層の変動を遅らせる効果があるかもしれません。これらの規定は、私たちの取締役会構成とその政策が持続的に安定している可能性を高め、私たちのいくつかのタイプの取引を実際にまたは脅して買収することを阻止することを目的としている。これらの条項は,能動的買収提案に対する我々の脆弱性を低下させ,エージェント権争いで使用可能な何らかの戦略を阻止することを目的としている.しかしながら、このような条項は、我々の株主が保有する株式のために市場価格よりも高い割増をもたらす可能性のある提案を含む、株主が有利と考えるかもしれない制御権変更または能動的買収提案を阻止、延期、または阻止する効果を有する可能性がある。以下の段落は、その中のいくつかの条項をまとめている。
許可したが発行されていない普通株と優先株の影響 許可が存在するが発行されていない普通株と優先株の影響の1つは、合併、要約買収、代理権競争、あるいは他の方法でわが社への支配権を獲得しようとすることを阻止し、管理層の連続性を保護しようとすることを阻止することである可能性がある. 取締役会がその受託責任を適切に行使する際に買収提案が我々の最適な利益に適合していないと判断した場合、取締役会は、株主の承認を必要とすることなく、1つまたは複数の取引でそのような株式を発行することができ、これらの取引は、買収取引を阻止または困難にすることができ、または、提案された買収者または反逆株主集団の投票権または他の権利を希釈することによって、買収取引を完了するコスト(Br)を得ることができ、多くの投票権を機関または他の既存の取締役会の地位を支持することを承諾することができる手に置き、買収を複雑化または排除または他の方法で行うことができる。
投票を累計する私たちが改訂·再記述した会社登録証明書は、取締役選挙で累積投票を行うことを規定していません。これは、株式の多数以下を保有する株主が一部の取締役を選挙することを許可します。
空きです。 私たちが改正して再記載した規定は、すべての空席を在任中の大多数の役員が賛成票を投じて埋めることができ、たとえ定足数より少なくても埋めることができる。
株主特別会議及び株主が書面で同意した株主行動株主特別会議は私たちの取締役会 または取締役会議長が招集するしかありません。すべての株主行動は書面での同意ではなく、正式に開催された株主会議で行われなければならない。
事前に 通知条項を通知する.我々の改正·再記述の定款は、我々の年次株主総会で業務を展開することを求め、又は我々の年次株主総会で取締役候補者を指名する株主に事前通知手続を提供する。我々が改訂したbrと再記述された定款はまた、株主通知の形式と内容に対して何らかの要求を提出する。適切な手続きに従わなければ,これらの条項 は,我々の株主が我々の年次株主総会に事項を提出したり,我々の年次株主総会で取締役を指名したりすることを阻止する可能性がある.これらの規定は,潜在的な買収者がエージェントを募集して購入者自身の取締役リストを選挙することを阻止または阻止したり,他の方法でわが社への制御権を獲得しようとしたりする可能性も予想される.
フォーラムオプション 私たちが改正して再説明した会社登録証明書および改正および再記載された定款は、デラウェア州衡平裁判所は、私たちが提起した任意の派生訴訟または訴訟を代表する独占裁判所である;受託責任違反を主張するいかなる訴訟も、デラウェア州会社法、私たちが改訂した会社登録証明書または私たちの定款に基づいて私たちにクレームを提起した任意の訴訟、または内部事務原則によって管轄されている私たちのクレームに対する任意の訴訟と規定される。
エージェントとレジストリを接続する
今回の発行終了後,我々の普通株式の譲渡エージェントと登録機構はStock Transfer,LLCとなる.移籍代理と登録員の住所はニューヨークウッドミルラファット広場18号、郵便番号:11598です。
全国証券取引所に上場する
私たちはニューヨーク証券取引所アメリカ取引所に私たちの普通株を上場することを申請しました。コードは“AZTR”です
| 98 |
未来に売る資格のある株
今回の発行まで、私たちの普通株は公開市場を持っていません. 今回の発行後,将来的には,発行された株式承認証やオプションの行使により発行された株を含む大量の普通株 を公開市場で販売したり,このような売却の可能性が発生したりすることは,我々の普通株の現行市場価格に悪影響を与えたり,株式資本を調達する能力を弱めたりする可能性がある.
今回の発行完了後,すべての発行された転換可能優先株と転換可能本票が今回の発行完了に関する普通株に自動的に変換されると仮定すると,計12,086,510株の普通株が流通する.我々が今回の発行で売却したすべての1,500,000株の普通株に,引受業者が超過配給選択権を行使して売却した任意の株に加えて,公開市場で自由に取引することができ,制限されず,証券法で規定されているさらなる にも登録されず,これらの株が証券法第144条の規則で定義されている“関連会社”が保有していない限りである.
残りの10,586,510株式普通株は、証券法第144条に定義されている“制限証券”と呼ばれるであろう. これらの制限された証券は、証券法に基づいて登録されている場合、又は証券法第144条又は701条の規則により免除登録を受ける資格がある場合にのみ、公開販売する資格がある。
以下に述べるロック契約及び証券法第144及び701条の規定を遵守することを前提として、これらの制限された証券は、本募集説明書の発行日から90日後に公開市場での販売を開始する。
ルール 144
全体的に、現在有効な第144条規則によれば、上場企業報告に少なくとも90日間の制約を受けると、売却前90日以内のいつでも、証券法によれば、誰も私たちの付属会社の一つとはみなされず、実益は、当社以外の任意の以前の所有者の保有期間を含む少なくとも6ヶ月間、売却方法、出来高制限、または規則144の通知br条項を遵守することなく、そのような株を売却する権利がある。ルール144を遵守する公開情報要求. 当該者が売却予定株式を少なくとも1年間所有している場合は,我々関連会社以外のいずれかの以前の所有者の保有期間を含む場合は,その者は,第144条のいかなる要求も遵守せずに当該株式等を売却する権利がある。
一般的に、現在有効な第144条の規則によれば、当社の関連会社または我々の関連会社を代表して株式を売却する者は、以下のロック契約の満了後、本募集説明書の日付から90日後のいずれか3ヶ月以内に、以下の大きな者を超えない数の株式を売却する権利がある
| ● | 当時発行された普通株式数の1% ;または | |
| ● | 普通株式の週平均取引量は、売却通知を表144で提出する前の4つのカレンダー週内に行われる。 |
私たちの連合会社または私たちの連合会社を代表して株式を売却する人は、規則144に従って行われる販売も、いくつかの販売条項および通知要求によって制限され、私たちの現在の公開情報に関する利用可能性に制限されています。
| 99 |
ルール 701
ルール 701は、一般に、書面補償計画または契約に従って私たちの普通株の株主を購入することを許可し、 は直前90日以内に私たちの関連会社の1つの株主とみなされず、ルール 144に従ってこれらの株を売却することができるが、ルール 144の公開情報、保有期間、数量制限、または通知条項を遵守する必要はない. ルール701はまた、ルール144の保有期間要求 を遵守せずに、ルール144に従ってそのルール701株を売却することを許可する. しかしながら、ルール701によれば、すべてのルール701の株式の所有者は、本入札説明書の日付の90日後にこれらの株を売却することができるまで待たなければならない。
ロックプロトコル
いくつかの例外を除いて、私たちの各役員および上級管理者は同意しており、本募集説明書の発行日から12(12)ヶ月以内に、代表の事前書面の同意を得ずに、直接または間接的に要約、質権、売却、付与、貸し出し、または他の方法で任意の交換または他の手配を譲渡または処分することなく、私たちの株式の任意の株式を全部または部分的に譲渡するか、または私たちの普通株の任意の証券に行使または交換することができる任意の経済的結果に変換することができる。いくつかの例外を除いて、私たちは、オプションおよび引受権証を含む0.5%以上の発行された普通株(または普通株に変換可能な証券)を持つ他のすべての株主と同意し、いくつかの例外を除いて、直接的または間接的に提供、質権、販売、契約売却、付与、貸し出し、または他の方法で譲渡または処理するか、または他人に全部または部分的に譲渡する任意の交換または他の手配を締結する。代表事前書面の同意なしに、本募集説明書の日付から6(6)ヶ月以内に、当社の株式を保有する任意の株式、または行使可能または行使可能または当社の普通株に交換可能な任意の証券の任意の経済的結果。
持分計画
私たちは証券法に基づいて表S-8の形式で登録声明を提出し、2016年計画と2023年計画の下で発行または発行されるすべての普通株を登録する予定です。本登録声明に含まれる株式は、ロックプロトコルの満了または解除後に、公開市場で販売する資格があり、当該等の 株式の帰属によって制限される。
| 100 |
材料:米国連邦所得税の非米国保有者への影響
以下の議論は,今回発行された普通株の購入,所有権,処分が非米国保有者(以下のように定義される)にもたらす重大な米国連邦所得税結果の要約であるが,すべての潜在税収影響の完全な分析 ではない.相続税や贈与税法など、他の米国連邦税法の影響は議論されておらず、どのような適用される州、現地、または非米国税法も議論されていない。本議論は、1986年に改正された“米国国税法”または“国税法”、それに基づいて公布された“財務省条例”、司法裁決および米国国税局または米国国税局が公表した裁決と行政声明に基づいており、いずれの場合も本協定の発効日から発効する。このような機関たちは変化するかもしれないし、違う解釈の影響を受けるかもしれない。このような変更または異なる解釈のいずれかは、非米国人所有者に悪影響を及ぼす可能性のある方法に適用される可能性がある。私たちは以下の議論の事項についてアメリカ国税局に何の裁決も求めないだろう。国税局や裁判所が我々普通株の購入、所有権、処分の税収結果について以下の議論とは逆の立場を取らないことは保証されない。
本議論は、我々の普通株式を規則第1221条に示す“資本資産”として保有する非米国保有者(通常は投資のために保有する財産)に限定される。本議論は,非米国所有者の特定の状況に関連するすべての米国連邦所得税の結果には触れず,連邦医療保険納付税が純投資収入に与える影響 と代替最低税を含む。さらに、特別なルールによって制約された非米国人所有者の関連結果は含まれていないが、これらに限定されない
| ● | アメリカにいる華僑や元市民や長期住民 |
| ● | ヘッジファンド、クロスボーダー、または他のリスク低減戦略の一部として、または転換取引または他の総合投資の一部として、私たちの普通株を保有する者 ; |
| ● | 銀行や保険会社や他の金融機関 |
| ● | 取引業者、取引業者、証券取引業者 |
| ● | “支配された外国企業”“受動的な外国投資会社”と、収益を蓄積することで米国連邦所得税から逃れる会社 |
| ● | 共同企業(Br)または米国連邦所得税目的のために、共同企業の他の実体または手配(およびその投資家)とみなされる |
| ● | 免税組織や政府組織 |
| ● | 基準に基づく推定販売条項は、私たちの普通株を売却する者とみなされる |
| ● | 任意の従業員株式オプションの行使または他の方法で補償として私たちの普通株を保有または受け入れた者 ; |
| ● | 税務条件に適合した退職計画 |
| ● | “基準”第897条(L)(2)で定義された“適格海外年金基金”、及びその全ての 権益が適格海外年金基金が保有する実体。 |
米国連邦所得税の目的で,組合企業の実体が我々の普通株を持っているとみなされる場合,br組合企業におけるパートナーの納税待遇は,パートナーの状態,組合企業の活動,パートナー(Br)レベルでの何らかの決定に依存する.そのため、私たちの普通株を持っている組合員とこのような組合員は、アメリカ連邦所得税が発生した結果についてその税務顧問に相談しなければならない。
| 101 |
この 議論は参考にするだけで、税務提案ではありません。投資家は、米国連邦所得税法のその特定の場合の適用状況、および米国連邦相続法または贈与税法または任意の州、地方または非米国課税管区の法律または任意の適用された所得税条約に基づいて、私たちの普通株を購入し、処分することによって生成された任意の税収結果について、彼らの税務顧問に相談しなければならない。
非アメリカホルダーの定義
本議論について言えば、“非米国所有者”とは、私たちの普通株のいかなる実益所有者でも、“アメリカ人”でもなく、米国連邦所得税で共同企業とみなされている実体でもない。アメリカ人とは、アメリカ連邦所得税について、次のいずれかとみなされるか、またはみなされる人を意味する
| ● | アメリカ市民や住民の個人です |
| ● | 米国、その州、またはコロンビア特区の法律に基づいて作成または組織された会社 |
| ● | その収入は、その出所にかかわらず、アメリカ連邦所得税の遺産を納めなければならない |
| ● | A 信頼(1)米国裁判所の主な監督と1人以上の“アメリカ人”の制御を受ける(“規則”第7701(A)(30)条の意味に適合)。あるいは(2)米国連邦所得税については,米国人とみなされる有効な選挙 を持つ. |
分配する
“配当政策”の節で述べたように、私たちは予測可能な将来に私たちの普通株の保有者に配当を発表したり、支払わないと予想される。しかし、普通株で現金や財産の分配を行う場合、このような分配 は米国連邦所得税用途の配当金を構成し、米国連邦所得税の原則に基づいて決定され、私たちの現在または累積の収益と利益から支払われる。米国連邦所得税については,配当とみなされない金額は資本返還を構成し,まず米国保有者ではない普通株調整後の課税基礎に適用されるが,ゼロを下回ることはできない。超過した任意の部分は資本利益とみなされ、以下の“-売却または他の課税処分”の項の説明に従って処理される
有効な関連収入に関する以下の議論によれば、非米国所有者に支払われる配当金は、米国連邦源泉徴収税(または所得税条約によって規定されるより低い税率が適用され、非米国所有者が有効なIRS表W−8 BENまたはW−8 BEN−E(または他の適用文書)を提供して、 の低い条約税率の資格を証明するために、配当金総額の30%で納付されるであろう)。非米国保有者が必要な書類をタイムリーに提供していないが、低減された条約料率を享受する資格がある場合、米国国税局に適切な払い戻し申請をタイムリーに提出することにより、任意の差し止め超過額の返金を得ることができる。非米国所有者brは彼らの税務顧問に相談し、彼らがどのような適用された所得税条約によって享受されている福祉を理解しなければならない。
非米国保有者に支払われる配当金が、非米国保有者が米国内で貿易または業務を行う行為と有効に関連している場合(適用される所得税条約の要求があれば、非米国保有者は米国内に永久機関を設置している)、非米国保有者は上述した米国連邦源泉徴収税を免除する。免除を申請するためには,非米国保有者は適用された源泉徴収代理人に有効な米国国税局W-8 ECI表を提供し,配当金が非米国保有者が米国内で行っている貿易または業務と有効に関連していることを証明しなければならない。
このような有効な関連配当金は、通常の税率で純収入に応じて米国連邦所得税を納付する。会社である非米国保有者は、このような有効な関連配当金に対して、ある項目に対して調整された支店利得税を、30%の税率(または適用される所得税条約で規定される低い税率)で納付することもできる。非米国所有者は、異なる規則を規定する可能性のある適用税条約について彼らの税務顧問に相談しなければならない。
| 102 |
販売 またはその他の課税処分
米国以外の所有者が私たちの普通株を売却または他の課税方法で処理するときに得られる収益は、米国連邦所得税を支払う必要はないだろう
| ● | 収益は、非米国保有者が米国内で貿易や業務を行うことに関連している(適用される所得税条約の要件があれば、米国以外の所有者は、この機関に起因する常設機関を米国に持っている) |
| ● | Br非米国所有者とは、資産処分の納税年度内に米国に183日以上居住し、何らかの他の要求に適合する非住民外国人を意味する |
| ● | 私たちの普通株はアメリカ不動産権益あるいはUSMPIを構成しています。私たちはアメリカ不動産持ち株会社あるいはUSMPHCで、アメリカ連邦所得税目的に使われています。 |
上記の第1の要点で説明された収益 は、一般に、通常の税率で純所得額で米国連邦所得税を納付する。 は、会社の非米国保有者として、このような有効な関連収益に対して30%の税率(または適用される所得税条約で規定される低い税率)で、ある項目に対して調整された支店利得税を納付することも可能である。
上記の第2の要点で説明した非米国所有者は、普通株を売却または他の課税で処理する際に達成された収益を30%(または所得税条約に規定された低い税率)で米国連邦所得税に納付し、 は、米国所有者ではない米国由来資本損失によって相殺されることができる(たとえ個人が米国住民のbrとみなされなくても)。アメリカでない所有者がこのような損失に関するアメリカ連邦所得税申告書をタイムリーに提出しさえすれば。
上の三番目の要点について、私たちは今のところそうでもなく、USMPHCにもならないと思います。しかし,我々がUSUPHCであるかどうかを決定することは,我々のUSRPIの公平な市場価値と我々の他の業務資産に対する我々のUSRPIの公平な市場価値に依存するため,我々が現在USRPHCでないか,将来USURPHCにならないことは保証されない.たとえ私たちがUSRPHCになっても、私たちの普通株が適用された財務省法規の定義に従って定期的に取引され、非米国所有者が実際にかつ建設的にこの普通株を所有している場合、非米国保有者が普通株を売却または他の課税方法で処分することによって生じる収益は米国連邦所得税を納付しないだろう。販売または他の課税処分日または非米国所有者が保有するまでの5年間の短い期間で、私たちの普通株の5%以下を占めている。
非米国 保有者は、適用可能な所得税条約についてその税務顧問に相談しなければならず、これらの条約は異なる規則を規定する可能性がある。
| 103 |
情報br報告とバックアップ控除
私たちの普通株式の配当金支払いは、適用される源泉徴収義務者が所有者が米国人であることを知らないまたは理由がないことを前提とし、所有者が米国人ではないことを証明し、例えば、有効なIRS表W−8 BEN、W−8 BEN−EまたはW−8 ECIを提供することによって、または他の方法で免除を決定することを前提としている。しかし,このような分配が配当金を構成しているかどうかにかかわらず,米国国税局に情報申告書を提出する必要があり,このような分配が配当金を構成しているかどうか,または実際に何らかの税金が源泉徴収されているかどうかにかかわらず,米国の所有者ではない普通株に支払われるどのような分配についても,情報申告書を提出する必要がある.さらに、米国内またはいくつかの米国関連仲介人による売却または他の課税によって私たちの普通株の収益を処分し、適用された控除代理人が上記の証明を受けているが、その所持者が米国人であることを知っている理由が実際に知られていないか、または所持者が他の方法で免除を確立している場合、通常は予備控除や情報報告の制約を受けない。非米国ブローカーの非米国事務所による我々の普通株の収益 の処分は、通常、予備抑留または情報br報告の制約を受けない。
適用条約や合意の規定により,米国国税局に提出された情報申告書の写し は,非米国所有者が居住または設立した国/地域の税務機関にも提供することができる。
バックアップバックルは付加税ではありません。バックアップ源泉徴収規則によって源泉徴収された任意の金額は、適時にアメリカ国税局に必要な情報を提供すれば、米国所有者ではないアメリカ連邦所得税義務の返金または免除とすることができる。
外国口座に支払う追加の源泉徴収税
“規則”第1471~1474節(一般に“外国口座税収コンプライアンス法”またはFATCAと呼ばれる)によれば、非米国金融機関およびいくつかの他の非米国エンティティに支払われるいくつかのタイプのお金に源泉徴収税を徴収することができる。具体的には、(1)外国金融機関が一定の職務調査および報告義務を負わない限り、“外国金融機関”または“非金融外国実体”に支払われる普通株の配当金または毛収入に30%の源泉徴収税を徴収することができる。(2)非金融外国エンティティは、“主要米国所有者” (“規則”の定義参照)、または各主要米国所有者に関する識別情報を提供するか、または(3)外国金融機関または非金融外国エンティティが、本規則の制約を受けない他の方法で免除を受ける資格があることを証明する。受取人が外国金融機関であり、上記(1)の職務調査·報告要求を遵守する場合には、米国財務省と協定を締結しなければならず、他の事項に加えて、財務省に、何らかの“特定の米国人”または“米国が所有する外国実体”(それぞれ規則で定義されている)が保有する口座を決定することを約束し、そのような口座に関する何らかの情報を毎年報告することを要求する。そして、規定されていない外国金融機関およびいくつかの他の口座所有者に支払われたいくつかのお金に対して30%を控除する。br}は、米国とFATCAを管理する政府間協定を有する司法管轄区域にある外国金融機関とは異なる規則によって制限される可能性がある。
適用される財務省条例と行政指導によると,FATCAでの控除は一般に我々の普通株の配当金支払いに適用される。FATCA下の事前提出は、2019年1月1日以降に株式の毛収入の支払いを売却または他の方法で処分することにも適用されるが、提案された財務省条例は、毛収入支払いに対するFATCAの事前提出を完全に廃止する。納税者は、最終的な財務省条例が発表されるまで、通常、これらの提案された財務省条例に依存することができる。
潜在的な投資家は彼らの税務顧問に問い合わせ、彼らが私たちのbr}普通株に投資する時にFATCAでの事前提出が適用可能かどうかを知るべきだ。
| 104 |
引受販売
ThinkEquity LLCは今回発行された引受業者代表である。私たちはその代表と2023年6月15日の引受協定を締結した。引受契約の条項と条件に基づいて、吾らは以下の各引受業者にbrを販売することに同意し、各引受業者はそれぞれ公開発行価格で本募集説明書の表紙に記載されている引受割引 を引いて次の表の名称の横に記載されている普通株の株式数を購入することに同意した
| 引受業者 | 量 株 | |||
| ThinkEquity LLC | 1,500,000 | |||
| 合計する | 1,500,000 | |||
引受業者は私たちが提供したすべての株を購入することを約束し、もし何かの株を購入した場合、以下の超過配給オプションに含まれる株は含まれていません。 引受契約で約束された事項が発生した場合、引受業者の義務は終了することができる。そのほか、引受契約に基づいて、引受業者の責任は保証協定に含まれている慣用条件、陳述及び保証規定の制限を受けなければならず、例えば引受業者は高級職員証明書 及び法律意見を受け取る必要がある。
引受業者は,株式発行時,発行時,受け入れ時に事前に株を売却し,彼らの弁護士を介して法律 事項やその他の条件を承認しなければならない.引受業者は、一般向けのオファーを撤回、キャンセル、または修正する権利 を保持し、注文の全部または一部を拒否する。
引受業者は、募集説明書の表紙の公開発行価格に従って、私たちが発行した株を社会に公開する予定です。株式公開後、引受業者は発行価格と他の販売条項を何度に分けて変更することができます。
超過配給オプション
我々 はすでに引受業者に超過配給選択権を付与した.このオプションは、本株式募集説明書の発行日から最大45日以内に行使可能であり、代表が最大225,000株の追加普通株(今回発売販売株式の15%を占める)を購入して、超過配給(あれば)を補うことを許可する。代表がそのオプションの全部または一部を行使する場合、本募集説明書の表紙に表示されている1株当たりの初公募株価格で、引受割引を減算し、そのオプションに含まれる株式を購入する。この選択権を全面的に行使すれば、公衆への総発行価格は860万ドルとなり、私たちに提供される控除前の総純収益は800万ドルになる。
割引
引受業者は、本募集説明書の表紙に掲載されている初公開入札価格で一般向けに普通株を発売することを初歩的に提案し、この価格から1株当たり0.30ドル以下の割引で取引業者に普通株を発売することを提案した。もし我々が発行したすべての普通株 が初回公開発行価格で販売されていなければ、引受業者は本募集説明書を補充することで発行価格と他の売却条項を変更することができる。
次の表に私たちの初公募株価格、引受割引、費用控除前の収益を示します。情報 は,引受業者がその超過配給選択権を行使または完全に行使しないと仮定する.
| 1株当たり | 合計を含まない 超過配給 選択権 | 合計は 超過配給 選択権 |
|||||||||
| 初公募株価格 | $ | 5.00 | $ | 7,500,000 | $ | 8,625,000 | |||||
| 引受割引(7.5%) | $ | 0.375 | $ | 562,500 | $ | 646,875 |
|||||
| 費用を差し引く前の収益は私たちに払います | $ | 4.625 | $ | 6,937,500 | $ | 7,978,125 |
|||||
我々 は,今回の発行で受け取った総報酬の1.0%に相当する非現実的費用手当 を引受業者に支払うことに同意した(引受業者の超過配給選択権の行使により得られた収益は含まれていない).
| 105 |
私たち は、このような自己負担可能費用がFINRAルール5110(F)(2)(C)によって実際に発生しないことを前提として、自己負担可能費用を支払うための35,000ドルの費用保証金を代表に支払っています。
さらに、(I)引受業者法律顧問の費用および支出を代表者に返済することに同意し、(Ii)Ipreoを使用した問い合わせ、入札説明書追跡およびコンプライアンスソフトウェアの使用に関連する費用および支出29,500ドル、(Iii)最高15,000ドル、私たちの高級管理者および役員の背景調査のための最高15,000ドル、(Iv)合理的に指定された外国司法管轄区域を代表する証券法に基づいて、このような株の登録、資格または免除に関するすべての費用、支出、および支出を免除することに同意する。(Iv)合理的に指定された州(例えば、適用される)および他の管轄地域を代表する“青空”証券法に基づいて登録、資格または免除に関連するすべての費用、支出および支出、(V)データサービスおよび通信費用のための10,000ドル、(Vi) 3,000ドル、製本の公開発行材料および記念品および墓石に関するコスト、 (Vii)実際に説明するための“ロードショー”費用、最大10,000ドル。および(Viii)最大30,000ドルは,市と取引を行い, と決済会社が今回の発行に支払う決済費用に用いられる.
私たちは、私たちが支払うべき発行総費用は約1,035,000ドルであると推定し、その中で、募集説明書の日付までに約610,000ドルが支払われており、まだ約425,00ドルが支払われています。その中には、引受割引総額および非実販売費用は含まれていません。
代表的 許可
私たちは、最大60,000株(または69,000株、超過配給選択権がすべて行使された場合)の普通株式(今回発売された普通株式総数の4%を占める)、または株式承認証を代表またはその指定者に発行することに同意した。代表的な株式引受証は1株当たり行使可能となり、価格は今回発売された普通株1株公開発売価格の125%に相当する。代表的な引受権証は、今回の証券発売開始日から4年半の間、随時、時々、全部または一部行使することができる。
代表株式証と代表株式承認証に関する普通株式はFINRA補償 とされているため,FINRA規則5110(G)(1)により禁売期間は180日となる.この規則によれば、代表または許可された譲渡者(Br)は、売却、譲渡、譲渡、質権または質権代表権証または代表株式承認証関連証券(Br)代表に従事してはならず、いかなる対沖、空売り、派生、見下げまたは上昇取引に従事してはならず、この取引は、代表株式承認証または普通株関連株式が登録声明が発効した日から180日以内に有効に経済的処置を行うことになる。また、代表の引受権証(Br)は、登録声明が発効した日から180日以内に販売、譲渡、譲渡、質権または質権を提供してはならないが、発売に参加する任意の引受業者および選定された取引業者およびその誠実な高級管理者またはパートナーに販売または質権を除外する。資本再編、合併、株式分割、または他の構造的な 取引が発生した場合、あるいは私たちが将来融資を行う場合、代表権証の数量と価格、代表権証に関連する普通株の数量と価格が調整される。代表持分証は、FINRA規則5110.05に従って登録権(一度の要求登録権および無限積載権を含む)を規定する。FINRA規則5110(G)(8)(C)によれば、登録要求は、代表権証が初めて行使された日から本登録声明が発効した日から5周年 までの任意の時間に提出することができる。FINRA規則第5110(G)(8)(D)条によると、一度に登録権を要求する以外に、代表持分証は制限されない付帯権利を享受すべきであり、代表持分証が初めて行使された日から2年 を超えない。代表株式承認証はまた、FINRA規則5110に基づいて常習的な逆希釈条項(株式配当、分割と資本再編のための)を規定し、また、必要であれば、代表株式権証の株式数は、FINRA規則と法規に適合するように減少すべきである。
自由支配可能なbrアカウント
引受業者は、ここで発売された証券を自由裁量権を持ついかなる口座にも売却することを確認するつもりはない。
| 106 |
ロックプロトコル
いくつかの例外を除いて、私たちの各役員および上級管理者は、本募集説明書の発行日から12(12)ヶ月以内に、直接または間接的に提供、質権、販売、契約販売、付与、貸し出し、または他の方法で譲渡または処分することなく、または任意の交換または他の手配を締結して、私たちの株式の任意の株式を全部または部分的に譲渡するか、または普通株として行使または交換可能な任意の証券に変換することができる任意の経済的結果に同意した。 は事前書面で同意されていません。いくつかの例外を除いて、私たちは、オプションおよび引受権証を含む0.5%以上の発行された普通株(または普通株に変換可能な証券)を持つ他のすべての株主と同意し、いくつかの例外を除いて、直接的または間接的に提供、質権、販売、契約売却、付与、貸し出し、または他の方法で譲渡または処理するか、または他人に全部または部分的に譲渡する任意の交換または他の手配を締結する。本募集説明書の日付から6(6)ヶ月以内に、br代表の事前書面の同意なしに、当社の株式を保有する任意の株式または行使可能または行使可能または当社の普通株に交換可能な任意の証券の任意の経済的結果。
我々 は,(I)上記の制限期間の満了と(Ii)その最初にこれを行う資格のある日(早い者を基準とする)の30日間に,通常汎用棚登録宣言をS-3表で提出することに同意する.また、吾らは、今回の発売後12(12)ヶ月以内に、ThinkEquity事前 書面の同意なしに、吾等はいかなる“市価”、持続株権、株式線又は変動金利取引においても、売却、売却、締結契約を提出し、任意の売却又は他の方法で自社株株式を処分するか、又は自社株式株式に変換又は交換可能な証券の選択権を付与することに同意した。
適用されるロック期間が終了した後、私たち普通株のすべての発行済み株式と発行済み株は将来 で販売する資格がありますが、適用数量、販売方法、保有期間、第144条その他の制限を受けています。
優先購入権
引受契約は、発売終了から十五(15)ヶ月の間、吾らは代表 が取り消すことのできない優先購入権を付与し、当該十五(15)ヶ月の間、吾等又は吾等又は吾等の任意の相続人又はその任意の付属会社は、当該十五(15)ヶ月の間、代表が適宜決定し、吾等又は吾等の任意の相続人又はその任意の付属会社の独占投資銀行、独占帳簿管理人、独占引受業者及び/又は独占販売代理を担当し、将来の各公開及び私募株式及び債券発行を処理し、すべての持分に関連する融資を含むこととする。この代表は、任意の他のブローカーがこのような発売に参加する権利があるかどうか、およびそのような参加のための経済条項を決定する権利がある。
賠償する
法的に許容される範囲内で、証券法下の責任を含み、引受業者およびその関連会社、株主、取締役、上級管理者、従業員、および制御者のいくつかの責任を賠償し、引受業者がこれらの責任のために支払うことを要求される可能性のある金brを支払うことに同意する。
電子株式要約、売却、分配
今回発行された1つまたは複数の引受業者または販売チームメンバー(ある場合)の保守に参加するウェブサイト上で電子フォーマットの入札説明書を提供することができ、今回発行された1つまたは複数の引受業者は、入札説明書 を電子的に配信することができる。代表は、オンラインブローカー口座保持者に売却するために、引受業者および販売グループのメンバーに一定数の株式を割り当てることに同意することができる。インターネット流通は、他の割当と同じベースでインターネット流通を行う引受業者と販売グループのメンバーによって割り当てられる。電子フォーマットの募集説明書以外に、引受業者ウェブサイト上の情報は本募集説明書或いは登録説明書の一部でもなく、本募集説明書或いは登録説明書の一部でもなく、著者ら或いはいかなる引受業者が引受業者として承認或いは裏書きしていない場合、投資家は に依存すべきではない。
| 107 |
安定化
今回の発行に対して、引受業者は安定取引、超過配給取引、銀団戻し取引、懲罰的入札と購入に従事し、空売りによって設立された頭寸を補うことができる。
安定取引は、安定入札が所定の最高入札を超えない限り、有価証券の購入を許可し、発行中に証券市場価格の下落を防止または遅延させることを目的としている。
超過配給取引は、引受業者が引受業者が購入義務のある証券の数を超える証券を販売することに関連する。これはシンデガ空頭寸を作り、空頭寸であっても、裸空頭寸であってもよい。保証されたbrの空頭寸では、引受業者が超過配給した証券の数は、超過配給オプションで購入できる証券の数を超えない。裸頭頭寸では、関連する証券の数は、超過配給オプションの証券数よりも多い。引受業者は、超過配給選択権を行使することによって、および/または公開市場で証券を購入することによって、任意の空頭を平定することができる。
シンジケートの補充取引は、流通が完了した後に公開市場で証券を購入し、 シンジケートの空手形を補充することに関連している。平倉の証券源を決定する際には、引受業者は、公開市場で購入可能な証券の価格と、超過配給選択権を行使して証券を購入する価格とを比較することを考慮する。引受業者が売却した証券が超過配給選択権を行使するためにカバーできる範囲を超えているため,裸頭寸を持っていれば,公開市場で証券を購入することで平倉するしかない.引受業者が定価後の公開市場の証券価格が下振れ圧力に直面する可能性が懸念され、今回発行された投資家に悪影響を与える可能性があれば、さらに裸頭を構築する可能性がある。
罰金 入札は、シンジケート メンバーが最初に売却した証券を代表して安定またはシンジケート補充取引によって購入してシンジケートの空手形を補充することを許可した場合、そのシンジケートメンバーから売却特許権を回収する。
これらの安定した取引、銀団カバー取引、および懲罰的入札は、我々の証券の市場価格を向上または維持し、または我々の証券の市場価格の下落を防止または遅延させる効果がある可能性がある。したがって、我々の証券の公開市場での価格は、これらの取引がない場合の価格よりも高くなる可能性がある。私たちも引受業者も、上記の取引が私たちの証券価格に与える可能性のある影響について何も述べたり予測したりしません。これらの 取引はニューヨーク証券取引所米国取引所,場外取引市場または他の市場で行うことができ,開始すればいつでも を終了することができる.
受動的な市
今回の発行に関連して、引受業者と販売グループメンバーは、“取引法”に規定されている規則第103条に基づいて、証券の発売または販売を開始する前から流通が完了するまでの間、ニューヨーク証券取引所米国取引所または場外取引市場の我々の普通株式brで受動的に市取引を行うことができる。受動市場 ディーラーは、その証券の最高独立オファーを超えない価格でそのオファーを提示しなければならない。しかしながら、すべての独立した入札が受動的に市販された入札よりも低い場合には、所定の購入制限を超えた場合には、入札を下げなければならない。
その他 関係
いくつかの引受業者およびその関連会社は将来、通常の業務中に様々な相談、投資、商業銀行、および他のサービスを提供してくれるかもしれないので、彼らは通常の費用および手数料を受け取るかもしれない。しかし、私たちはまだ、 は現在、どの販売業者ともさらなるサービスについて何の手配も達成していません。
| 108 |
アメリカ以外の制限を提供する
米国以外にも、我々または引受業者は、本募集説明書が提供する証券が、行動を必要とする任意の司法管区で公開発行されることを可能にする行動を取っていない。本募集説明書によって提供される証券は、直接または間接的に発売または販売されてはならない。本募集説明書または任意のそのような証券の発売および販売に関連する任意の他の発売材料または広告は、当該司法管轄区域の適用規則に適合する場合を除き、任意の司法管轄区域で配布または発行されてはならない。本募集説明書を持っている人は自分に知らせ、今回の発行と株式分配説明書に関するいかなる制限を遵守することを提案します。 本募集説明書は のいかなる司法管轄区で本募集説明書が提供する任意の証券の売却または購入を招待する要約ではなく、どの司法管区でもこのような要約または要約は不正である。
オーストラリア
この目論見書は、“オーストラリア会社法”第6 D章に規定する開示文書ではなく、オーストラリア証券·投資委員会に提出されておらず、“オーストラリア会社法”第6 D章に規定する開示文書に要求される情報も含まれていると主張していない。したがって、(I)“オーストラリア会社法”第6 D章の規定により、“オーストラリア会社法”第708条に規定する1つ以上の免除により、本募集明細書下の証券要約は、“オーストラリア会社法”第6 D章に基づいて開示されない場合に合法的に証券を提供する者にのみ提供され、(Ii)本募集説明書は、オーストラリアにおいて前文第(I)項に記載された者のみに提供され、(Iii)被申出者に通知を送信しなければならず、実質的に要約を受けた者が上記(I)項に記載の者であることを通知しなければならない。また、“オーストラリア会社法”が許可されていない限り、募集説明書下の要人に証券を譲渡してから12ヶ月以内に、オーストラリア国内で要人に売却されたいかなる証券も売却または要約しないことに同意した。
中国
本文書中の情報は、Republic of China(このセグメントは香港特別行政区、マカオ特別行政区、台湾を含まない)を販売または引受方式で公開発売する証券を構成していない。証券は中国国内で直接または間接的に法人または自然人に発売または販売してはならない。“適格国内機関投資家”に直接発行または販売しない限り
ヨーロッパ経済圏-ベルギー、ドイツ、ルクセンブルク、オランダ
本文書の情報は,欧州経済圏加盟国(各加盟国は“関連加盟国”)が実施した指令2003/71/EC(“目論見指示”)下の免除要求に基づいて証券要約を作成したものである。
関連加盟国は、当該関連加盟国で実施されている“目論見指示”に基づいて規定されている次のbr免除のうちの1つを除いて、まだ公衆に証券要約を発行することができない
| ● | 許可されているか、または規制されているかは、金融市場で経営されることができる法人エンティティ、または許可されていない場合、または規制されていない場合、その会社の目的は、証券に投資する法人エンティティのみである |
| ● | 以下の2つ以上を有する任意の法人エンティティについて:(I)前年度中に少なくとも250人の従業員がいた;(2)総貸借対照表が43,000,000ユーロを超える(前年度未合併または連結財務諸表に示すように)、および(3)年間売上高純額が5,000万ユーロを超える(前年度未合併または連結財務諸表に示す); |
| ● | 100人未満の自然人または法人(“目論見書指令”第2(1)(E)条でいう適格投資家を除く)に株を売却するが、事前に会社または任意の引受業者の同意を得なければならない;または |
| ● | 募集定款指令第3(2)条の範囲内の任意の他の場合、もし このような証券要約が 会社が目論見指令第3条に基づいて目論見書を発表することを招くことはない。 |
| 109 |
フランス
“フランス通貨·金融法”(Code Monétaire et Financer)第L.411-1条と第 211-1条および以下の条項の意味によると、本文書はフランスで金融証券(Offre Au Public De Titires Finance Ers) を公開していない。フランスS金融家監督管理総局(“金融監督機関”)の規定による。これらの証券 はまだ発売または販売されておらず、直接または間接的にフランスの公衆に発売または販売されることもない。
本文書や証券に関連する任意の他の発売材料はまだであり、フランスでAMF承認 に提出されることもないので、直接または間接的にフランスの公衆に配布したり、配布を手配したりしてはならない。
このような要約、販売および分配は、フランスでのみ(I)適格投資家(適格投資家S) に“フランス通貨·金融法典”第L.411-2-2条およびD.411-1~D.411-3、D.744-1、D.754-1およびD.764-1、ならびに任意の実施条例および/または(Ii)限られた数の非適格投資家(投資者)の自己行動に基づいて行われなければならない。第L.411-2-II-2およびD.411-4、D.744-1、D.754-1およびD.764-1、ならびに任意の実施条例の定義および規定に従って、“フランス通貨·金融法”第L.411-2-II-2およびD.411-4、D.744-1、D.754-1およびD.764-1に基づく。
“資産管理基金通則”第211-3条の規定によると、フランスの投資家は、“フランス通貨·金融法典”第L.411-1、L.411-2、L.412-1およびL.621-8からL.621-8-8-3条の規定に従わない限り、投資家は(直接または間接的に)証券を公衆に流通することができないと言われている。
アイルランド
アイルランドの法律または法規によると、この文書の情報は入札説明書を構成しておらず、アイルランドの規制機関 に記録または承認されていない。これらの情報はアイルランドの公開発行証券を背景に用意されていないので、 “アイルランドの株式募集説明書2005年(指令2003/71/EC)条例”(“目論見書条例”)である。 これらの証券は発売または販売されておらず、アイルランドで公開発売されている方法で直接または間接的に提供、販売、または交付されることもない。(I)募集定款第2(L)条で定義された合資格投資家及び(Ii)が100名未満の非合資格投資家の自然人又は法人を除く。
イスラエル
本募集説明書が提供する証券は、イスラエル証券管理局(ISA)の承認または不承認を受けず、イスラエルで登録販売されていない。株式募集説明書が発表されていない場合は、直接または間接的にイスラエルの公衆に株式を発売または売却してはならない。ISAは今回の株式募集説明書 の発行或いは発行について許可証、承認或いは許可証を発行しておらず、本文に含まれる詳細について検証、その信頼性或いは完全性を確認し、或いは発行された証券の品質について意見を発表していない。イスラエル国内で直接或いは間接的に本募集説明書を転売して提供する証券はすべて譲渡制限を受け、しかもイスラエル証券の法律法規に符合する場合にしか行われない。
| 110 |
イタリア
イタリア証券法によると、イタリア共和国での証券発行はイタリア証券取引委員会(Comissione)の許可を得ていないため、イタリア国内で証券関連の発売材料を流通してはならず、1998年2月24日第58号法令(“第58号法令”)第1.1(T)条の規定に適合しない限り、イタリア国内でこのような証券を公開してはならない
| ● | イタリアの適格投資家(“適格投資家”)は、第58号法令第100条で定義されているように、改正された1999年5月14日の“全国委員会条例”11971号第34条の3(“条例第1197 l号”)を参照し、 |
| ● | 公募規則の制約を受けないその他の場合は,第58号法令第100条及び第1197 l号条例により規定される。 |
上記段落によれば、イタリア証券に関連する任意の要約、証券の売却または交付、または任意の要約文書の配布(適格投資家が発行者に要約の配給を求めることを含まない)は、以下のとおりでなければならない
| ● | 投資会社、銀行又は金融仲介機関は、改正された1993年9月1日法律第385号、2007年10月29日第58号法令、全国委員会16190号条例、及び任意の他の適用法に基づいて、イタリアでのこのような活動を許可された |
| ● | 関連するすべてのイタリア証券、税金、そして外国為替規制、そして任意の他の適用法を遵守する。 |
その後イタリアで行われた任意の証券流通は、これらの規則に例外がない限り、第58号法令及び改正11971号条例で規定されている公開要約及び目論見要求規則を遵守しなければならない。このような規則を遵守しないことは、このような証券の売却が無効と宣言され、証券を譲渡するエンティティが投資家が受けたいかなる損害に対しても責任を負うことになる可能性がある。
日本です
日本金融商品取引法(1948年第25号法律)第4条1項(以下“FIEL”という。)により、適格機関投資家への私募証券の登録要件(定義及びFIEL第2条第3項及びその下に公布された条例)に適用され、当該等証券はなく、改正された“日本金融商品及び取引法”(FIEL)第4条第1項に基づいて登録されることもない。したがって、これらの証券は、直接または間接的に日本国内または適格機関投資家以外の任意の日本住民のために提供または販売してはならない。証券を購入する適格機関投資家は、それを日本国内の非適格機関投資家の誰にも転売してはならず、このような人が証券を購入するには、関連協定に署名することを条件としなければならない。
ポルトガル
この文書は、ポルトガル証券法第109条の規定に従って、ポルトガルで金融証券(oferta p≡blica de valors mobiliários) を公開発行しているわけではない。これらの証券はまだ発売または販売されておらず、直接または間接的にポルトガルの公衆に発売されたり販売されたりしない。本文書 や他の証券に関する発売材料はまだ提出されておらず、ポルトガル証券市場委員会(Comiss o do Mercado de Valore Mobiliários)がポルトガルで承認されていないため、ポルトガル証券法により が公開発売資格を満たしていないとみなされない限り、ポルトガル国民に直接または間接的に配布してはならない。ポルトガルでは、このような証券の発売、販売、流通は“適格投資家”(ポルトガル証券法の定義に基づく)に限られている。このような投資家のみがこのbr文書を受信することができ、それまたはその中に含まれる情報を他の誰にも配布してはならない。
スウェーデン
本文書 は、スウェーデン金融監督局(FinansinSpektionen)に登録または承認されていないこともありません。 したがって、スウェーデン金融商品取引法(1991:980)(Sw)に基づいて目論見書が不要とされている場合を除いて、本文書はスウェーデンで提供することもできず、スウェーデンで証券を販売することもできません。遅れ(1991:980)(ハンデル医学Fansiella機器)。スウェーデンでは、どの証券発行も“適格投資家”に限られている(“金融商品取引法”で定義されている)。そのような投資家だけが本ファイルを受け取ることができ、彼らは本ファイルまたはその中に含まれる情報を他の誰にも配布することができない。
| 111 |
スイス
これらの証券はスイスで公開発売されない可能性があり、スイス証券取引所(“Six”)やスイスの他の任意の証券取引所や規制された取引機関に上場することもない。本文書は,ART発行目論見書による開示基準 を作成する際には考慮していない.652 aかArt1156“スイス債権法”または上場目論見書の開示基準 。27歳からです。6つの上場規則またはスイスの任意の他の証券取引所または規制された取引機関の上場規則。本文書または証券に関連する任意の他の発売材料は、スイスで公開または公開されてはならない。
本文書または証券に関連する任意の他の発売材料は、スイスの規制機関に提出されていないか、またはその承認を得るであろう。特に、本文書はスイス金融市場監督局(FINMA)に届出することもなく、証券の発売を規制することもない。
この ファイルは宛先個人情報のみであり,スイスでは広く伝播されていない.
アラブ首長国連邦
本文書または証券は、アラブ首長国連邦中央銀行またはアラブ首長国連邦のいかなる他の政府機関もいかなる方法でも承認、承認または伝達されておらず、当社もアラブ首長国連邦中央銀行またはアラブ首長国連邦の任意の他の政府機関の許可を得ておらず、アラブ首長国連邦国内で証券を販売することができるかもしれない。本稿のプロファイルは構成されておらず,要約や招待の目的にも利用できない.当社は、申請の受信及び/又は当該株式の配布又は償還等を含むアラブ首長国連邦国内で証券関連サービスを提供してはならない。
ドバイ国際金融センターでは、どの証券引受の申し出や招待も無効または許可されていない。
連合王国
本文書中の情報または要約に関連する任意の他の文書は、イギリス金融サービス管理局の承認に提出されておらず、証券に関する目論見書も発表または配布しようとしていない(“br}改正された”2000年金融サービスと市場法“第85条の意味に適合)。本文書は、イギリスの“適格投資家”(FSMA第86(7)条に示される適格投資家)に秘密裏に発行され、 は、FSMA第86(1)条の規定に従って入札説明書を発行する必要がない限り、本文書、任意の添付書簡、または任意の他の文書を介してイギリスで証券を発売または販売してはならない。本文のドキュメントは、すべてまたは部分的に配布、配布、または複製されてはならず、受信者は、その内容をイギリスの他の誰にも開示してはならない。
証券発行または販売に関連する任意の投資活動への招待または誘因(FSMA第21条の意味)は、伝達または伝達されるのみであり、FSMA第21条(1)が当社に適用されない場合にのみ、イギリスで伝達または伝達を招く。イギリスでは, 本稿では,(I)投資に関する専門経験のある者にのみ配布され, は“2000年金融サービス及び市場法令2005(金融普及)令”(“金融普及条例”)第19条(5)条(投資専門家),(Ii)第49(2)(A)から(D)条に属する者(高純価値会社, 非法人団体など)に属する。または(Iii)他の方法で合法的に誰に伝えるか(“関係者”と総称する). 本文書に関連する投資は関係者にのみ利用可能であり,任意の招待,要約,購入プロトコルは関係者のみと を行う.いかなる非関係者も、この文書やそのどんな内容にも行動したり依存してはいけない。
カナダ
証券は、カナダでのみ購入または購入元金とみなされる購入者に販売され、これらの購入者は、国文書45-106募集説明書免除または証券法(オンタリオ省)73.3(1)項で定義され、国家文書31-103の登録要求、免除、および持続登録義務のようなbr}顧客を許可する。証券の任意の転売 は、証券法が適用される株式募集説明書の要求 の免除またはその制約を受けない取引に適合しなければならない。本入札明細書(その任意の修正案を含む)が不実陳述を含む場合、カナダのある省または地域の証券法は、買い手が買い手のいる省または地域の証券法に規定されている期限内に撤回または損害賠償を行使することを前提として、買い手に撤回または損害賠償を提供することができる。買い手は、これらの権利の詳細を理解するために、または法律顧問に相談するために、買い手の所在省または地域証券法規の任意の適用条項を参照しなければならない。NI33-105“引受衝突”(NI 33-105)第3 A.3節の規定によると、引受業者は、引受業者が今回の発行に関する利益衝突に関する開示要求を遵守する必要がない。
| 112 |
法務
Greenberg、Traurig、LLP、カリフォルニア州オーウェン、ここで提供される普通株の有効性を伝える. VEnable LLP,ニューヨーク, ニューヨークは,今回の発行に関する何らかの法律事務の法律顧問を引受業者として担当している.
専門家
本募集明細書に含まれる2022年及び2021年12月31日まで及び2021年12月31日までの財政年度の財務諸表は、独立公認会計士事務所Grassi&Co.,CPAS,P.C.の報告に基づいて含まれており、この報告は、Grassi&Co.,CPAS,P.C.の認可 に基づいて監査及び会計専門家として提供されている。
ここで詳細な情報を見つけることができます
我々 は、証券法に基づいて、本募集説明書が提供する普通株式に関する登録説明書 をS-1表で米国証券取引委員会に提出した。本入札説明書は、登録説明書の一部であり、登録説明書に規定されているすべての情報を含まず、いくつかの情報は、米国証券取引委員会規則および規則によって許可された場合に登録説明書の証拠物に含まれる。私たちと私たちの普通株に関するより多くの情報については、登録声明の一部として提出された展示品を含む登録声明を参考にすることをお勧めします。本入札明細書に含まれる任意の契約または任意の他の文書の内容に関する陳述は、必ずしも完全ではない。契約又は書類が登録声明の証拠物として提出された場合は、提出された契約又は書類の写しを参照してください。すべての声明は本募集説明書であり、証拠物として記録された契約或いは書類と関係があり、各方面ですべて届出証拠物の要求に符合する。登録声明を読んでコピーして、私たちがアメリカ証券取引委員会に記録した関連展示品とその他の資料、住所はワシントンD.C.アメリカ証券取引委員会公共資料室、住所はワシントンD.C.20549号NE.1580号、住所はワシントンD.C.F街100号です。コピー料を支払った後、米国証券取引委員会にbrを書くことで、これらの書類のコピーを請求することもできます。公共資料室の運営詳細については、1-800-米国証券取引委員会-0330に電話して米国証券取引委員会に問い合わせてください。米国証券取引委員会はまた、発行者に関する報告書、依頼書、その他の情報を含む相互接続サイトを維持しており、これらの発行者は、私たちと同様に、米国証券取引委員会に電子的に記録されている。このサイトのサイトはwww.sec.govです。
今回の発行完了後,改正された1934年の証券取引法の情報と報告要求を遵守し,同法により,定期報告,依頼書,その他の情報の提出が求められる。これらの定期報告書、依頼書、その他の情報は、上記の米国証券取引委員会のサイトで提供されます。私たちはまた、ウェブサイトwww.azitrainc.comを保持しています。我々のサイトおよびそれを介してアクセス可能な情報 に含まれるか、またはアクセス可能な情報 我々のサイトは、参照によって本募集説明書に入るものとはみなされず、本募集説明書の一部ともみなされない。あなたは私たちの普通株を購入するかどうかを決定するために、このような情報に依存してはいけません。
本入札明細書に含まれている情報を除いて、私たちは、誰もあなたに任意の情報を提供することを許可していません。または本募集明細書で議論されている取引について、あなたに任意の陳述をすることができません。本明細書で議論されていないこれらの事項に関する任意の情報または陳述が提供された場合、あなたはその情報に依存してはならない。本募集説明書は、どこでも、又は適用法律に基づいて、証券の提供又は売却を許可していない者に証券の売却又は購入を招待する要約ではない。
| 113 |
AZITRA, Inc.
財務諸表インデックス
| 独立公認会計士事務所Grassi&Co.,CPAS,P.C.,ニューヨーク州ジェリコ,PCAOB ID 606 2022年12月31日と2021年12月31日までの年次報告 | F-1 | |
| 2022年12月31日現在と2021年12月31日現在の貸借対照表 | F-2 | |
| 2022年と2021年12月31日までの年度の業務報告書 | F-3 | |
| 2022年12月31日と2021年12月31日までの年度株主権益(赤字)変動報告書 | F-4 | |
| 2022年と2021年12月31日までの年間現金フロー表 | F-5 | |
| 財務諸表付記 | F-6-F-32 |
| 2023年3月31日現在(監査なし)及び2022年12月31日現在の貸借対照表 | F-33 | |
| 2023年3月31日と2022年3月31日までの3ヶ月間の運営報告書(未監査) | F-34 | |
| 2023年3月31日と2022年3月31日までの3ヶ月間の株主権益報告書(監査なし) | F-35 | |
| 2023年3月31日と2022年3月31日までの3ヶ月間現金フロー表 (未監査) | F-36 | |
| 未監査財務諸表に付記 | F-37-F-51 |
| 114 |
独立公認会計士事務所報告{br
Azitra,Inc.取締役会と株主へ。
Branford CT
財務諸表に対する意見
Azitra,Inc.(“当社”)2022年と2021年12月31日までの貸借対照表,およびこの日までの関連経営報告書,株主権益と現金流量,および関連付記(総称して財務諸表と呼ぶ)を監査した。この等財務諸表は,当社の2022年および2021年12月31日の財務状況と,この日までの経営業績およびキャッシュフローを各重大な面で公平に反映しており,米国公認の会計原則に適合していると考えられる。
会社の継続経営企業としての継続経営能力に大きな疑いがある
添付の財務諸表が作成されたと仮定すると,Azitra,Inc.は継続して経営を継続する企業となる。財務諸表付記1で述べたように、同社の重大な経営損失は、持続経営企業としての持続経営能力に大きな疑いを抱かせる。付記1では、経営陣のイベントや状況の評価、および経営陣のこれらの事項に対する計画も紹介されています。財務諸表 には、このような不確実性の結果によるいかなる調整も含まれていません。
意見を求める根拠
これらの財務諸表は会社経営陣が担当しています。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはアメリカ上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、アメリカ連邦証券br法律およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければならない。
私たちはPCAOBの基準とアメリカ合衆国で一般的に受け入れられている監査基準に基づいて監査を行う。これらの基準は、財務諸表に重大な誤報がないかどうかの合理的な保証を得るために、エラーによるものであっても詐欺によるものであっても、監査を計画し、実行することを要求する。当社は必要とせず、財務報告書の内部統制を監査する必要もありません。私たちの監査の一部として、私たちは財務報告の内部統制を理解することが求められていますが、会社の財務報告の内部統制の有効性について意見を述べるためではありません。 したがって、私たちはこのような意見を表現しません。
我々のbr監査には、財務諸表の重大な誤報のリスクを評価するための実行プログラムが含まれており、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行する。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。私たちの監査には、経営陣が使用する会計原則の評価と重大な推定、財務諸表の全体的なレポートの評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/S/ グラシ会計士事務所、P.C.
私たち は2022年以来当社の監査役を務めています。
ニューヨークジェリコ
2023年2月20日、付記9、10、11、14、19を除いて、日付は2023年6月13日。
| F-1 |
Azitra, Inc.
貸借対照表 表
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金と現金等価物 | $ | 3,492,656 | $ | 8,044,262 | ||||
| 売掛金 | 182,820 | 160,867 | ||||||
| 課税額相殺 | 69,666 | 173,311 | ||||||
| 課税所得税 | 13,722 | - | ||||||
| 繰延発売コスト | 216,886 | - | ||||||
| 前払い費用 | 160,133 | 110,289 | ||||||
| 流動資産総額 | 4,135,883 | 8,488,729 | ||||||
| 財産と設備、純額 | 846,958 | 946,681 | ||||||
| その他の資産 | ||||||||
| その他の資産 | 47,507 | 48,201 | ||||||
| 経営的リース使用権資産 | 1,116,697 | - | ||||||
| 無形資産、純額 | 219,567 | 97,693 | ||||||
| 繰延特許コスト | 800,831 | 620,029 | ||||||
| その他資産総額 | 2,184,602 | 765,923 | ||||||
| 総資産 | $ | 7,167,443 | $ | 10,201,333 | ||||
| 負債、転換可能優先株、株主損失 | ||||||||
| 流動負債: | ||||||||
| 売掛金 | $ | 784,687 | $ | 717,800 | ||||
| 当期経営賃貸負債 | 287,384 | - | ||||||
| 所得税に対処する | - | 1,302 | ||||||
| 費用を計算する | 993,961 | 475,485 | ||||||
| 契約責任 | 156,000 | 15,000 | ||||||
| 流動負債総額 | 2,222,032 | 1,209,587 | ||||||
| 長期経営賃貸負債 | 840,896 | - | ||||||
| 株式証法的責任 | 70,283 | 71,104 | ||||||
| 転換支払手形、純額 | 6,600,000 | 992,019 | ||||||
| 総負債 | 9,733,211 | 2,272,710 | ||||||
| 転換可能優先株: | ||||||||
| Aシリーズ転換可能優先株;額面0.0001ドル;2022年と2021年12月31日に発行を許可した205,385株;2022年と2021年12月31日に発行された205,385株;2022年と2021年12月31日までの清算価値3337,506ドル | 3,272,944 | 3,272,944 | ||||||
| A-1シリーズ転換可能優先株;額面0.0001ドル;2022年と2021年12月31日に発行された380,657株;2022年と2021年12月31日に発行·発行された380,657株;2022年と2021年12月31日までの清算価値14,274,638ドル | 14,100,533 | 14,100,533 | ||||||
| Bシリーズ転換可能優先株;額面0.0001ドル;それぞれ2022年と2021年12月31日に851,108株と392,000株の発行を許可した;2022年と2021年12月31日に発行·発行された391,303株;2022年と2021年12月31日までの清算価値17,000,159ドル | 16,321,065 | 16,321,065 | ||||||
| 株主赤字: | ||||||||
| 普通株;額面0.0001ドル;それぞれ2022年と2021年12月31日に1億株の発行を許可した;それぞれ2022年と2021年12月31日に1,043,991株と1,043,103株を発行し、brはそれぞれ12月31日と2021年に流通株を発行した | 104 | 104 | ||||||
| 追加実収資本 | 1,054,138 | 868,163 | ||||||
| 赤字を累計する | (37,314,552 | ) | (26,634,186 | ) | ||||
| 株主総損失額 | (36,260,310 | ) | (25,765,919 | ) | ||||
| 総負債、転換可能優先株、株主赤字 | $ | 7,167,443 | $ | 10,201,333 | ||||
付記をご参照ください
| F-2 |
Azitra, Inc.
運営レポート
| 十二月三十一日までの年度 | ||||||||
| 2022 | 2021 | |||||||
| サービス収入関係者 | $ | 284,000 | $ | 110,000 | ||||
| 総収入 | 284,000 | 110,000 | ||||||
| 運営費用: | ||||||||
| 一般と行政 | 3,639,666 | 3,951,352 | ||||||
| 研究開発 | 6,097,938 | 5,380,102 | ||||||
| 総運営費 | 9,737,604 | 9,331,454 | ||||||
| 運営損失 | (9,453,604 | ) | (9,221,454 | ) | ||||
| その他の収入(支出): | ||||||||
| 利子収入 | 4,818 | 8,759 | ||||||
| 利子支出 | (251,891 | ) | (66,968 | ) | ||||
| その他の収入 | 65,849 | 112,141 | ||||||
| 従業員留任ポイント | 229,813 | - | ||||||
| 給与保障計画ローンの猶予 | - | 232,506 | ||||||
| 転換可能手形は価値変動を公正に許容する | (1,250,000 | ) | - | |||||
| その他の費用 | (25,351 | ) | (4,659 | ) | ||||
| その他収入合計 | (1,226,762 | ) | 281,779 | |||||
| 所得税前純損失 | (10,680,366 | ) | (8,939,675 | ) | ||||
| 所得税の割引 | - | - | ||||||
| 純損失 | $ | (10,680,366 | ) | $ | (8,939,675 | ) | ||
| 優先配当金 | (2,768,984 | ) | (2,768,984 | ) | ||||
| 普通株主は純損失を占めなければならない | $ | (13,449,350 | ) | $ | (11,708,659 | ) | ||
| 1株当たり基本と希釈して純損失 | $ | (12.74 | ) | $ | (11.20 | ) | ||
| 加重平均発行済み普通株式、基本普通株式、希釈普通株 | 1,055,457 | 1,045,766 | ||||||
付記をご参照ください
| F-3 |
Azitra, Inc.
転換可能優先株と株主損失報告書
2022年12月31日と2021年12月31日までの年度
| シリーズ Aオープンカー | シリーズA-1オープンカー | Bシリーズオープンカー | その他の内容 | 合計する | ||||||||||||||||||||||||||||||||||||||||
| 優先株 | 優先株 | 優先株 | 普通株 株 | 支払い済み | 積算 | 株主の | ||||||||||||||||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 赤字.赤字 | ||||||||||||||||||||||||||||||||||
| 残高、 2020年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,025,353 | $ | 103 | $ | 553,534 | $ | (17,694,511 | ) | $ | (17,140,774 | ) | ||||||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | - | 306,055 | - | 306,055 | |||||||||||||||||||||||||||||||||
| 株式オプションの行使 | - | - | - | - | - | - | 17,750 | 1 | 8,574 | - | 8,475 | |||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | - | (8,939,675 | ) | (8,939,675 | ) | |||||||||||||||||||||||||||||||
| 残高、 2021年12月31日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 391,303 | 16,321,065 | 1,043,103 | 104 | 868,163 | (26,634,186 | ) | (25,765,919 | ) | |||||||||||||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | - | 184,465 | - | 184,465 | |||||||||||||||||||||||||||||||||
| 株式オプションの行使 | - | - | - | - | - | - | 888 | - | 1,510 | - | 1,510 | |||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | - | (10,680,366 | ) | (10,680,366 | ) | |||||||||||||||||||||||||||||||
| 残高、 2022年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,043,991 | $ | 104 | $ | 1,054,138 | $ | (37,314,552 | ) | $ | (36,260,310 | ) | ||||||||||||||||||||||||
付記をご参照ください
| F-4 |
Azitra, Inc.
現金フロー表
| 締切り年数 | ||||||||
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 経営活動のキャッシュフロー: | ||||||||
| 純損失 | $ | (10,680,366 | ) | $ | (8,939,675 | ) | ||
| 純損失と経営活動に使用する純現金と現金等価物の調整: | ||||||||
| 減価償却および償却 | 125,885 | 84,772 | ||||||
| 債務割引償却 | 7,981 | 7,632 | ||||||
| 使用権資産の償却 | 280,092 | - | ||||||
| 転換可能手形の利子 | 164,611 | 59,181 | ||||||
| 株に基づく報酬 | 184,465 | 306,055 | ||||||
| 株式証負債の公正価値変動を認める | (821 | ) | (989 | ) | ||||
| 転換可能手形は価値変動を公正に許容する | 1,250,000 | - | ||||||
| 給与保障計画ローンの猶予 | - | (230,685 | ) | |||||
| 財産と設備処分損失 | 7,923 | - | ||||||
| 経営性資産と負債変動状況: | ||||||||
| 売掛金 | (21,953 | ) | (37,573 | ) | ||||
| 前払い費用 | (49,844 | ) | 163,952 | |||||
| その他の資産 | 694 | (919 | ) | |||||
| 課税額相殺 | 103,645 | 231,745 | ||||||
| 課税所得税 | (15,024 | ) | - | |||||
| 売掛金と売掛金 | 420,752 | 282,976 | ||||||
| リース負債を経営する | (268,509 | ) | - | |||||
| 所得税に対処する | - | (8,831 | ) | |||||
| 契約責任 | 141,000 | 15,000 | ||||||
| 経営活動に使用されている現金と現金等価物純額 | (8,349,469 | ) | (8,067,359 | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 財産と設備を購入する | (33,101 | ) | (446,136 | ) | ||||
| 財産と設備を売却して得た収益 | 4,250 | - | ||||||
| 繰延特許コストの資本化 | (180,802 | ) | (196,267 | ) | ||||
| 許可証の資本化 | (65,510 | ) | - | |||||
| 特許と商標費用の資本化 | (61,598 | ) | (9,872 | ) | ||||
| 投資活動に使用する現金と現金等価物純額 | (336,761 | ) | (652,275 | ) | ||||
| 資金調達活動のキャッシュフロー: | ||||||||
| 転換可能手形の収益は、発行コストを差し引く | 4,350,000 | 984,387 | ||||||
| 繰延発売費を支払う | (216,886 | ) | - | |||||
| 株式オプションを行使して得られる収益 | 1,510 | 8,475 | ||||||
| 活動融資のための現金と現金等価物純額 | 4,134,624 | 992,862 | ||||||
| 現金と現金等価物の純減少 | (4,551,606 | ) | (7,726,772 | ) | ||||
| 年明けの現金と現金等価物 | 8,044,262 | 15,771,034 | ||||||
| 年末現金と現金等価物 | $ | 3,492,656 | $ | 8,044,262 | ||||
付記をご参照ください
| F-5 |
Azitra, Inc.
財務諸表付記
2022年12月31日と2021年12月31日
1. 業務の組織と性質
Azitra, Inc.は2014年1月2日に設立された.皮膚微生物のスクリーニングや遺伝子工学に集中している合成生物会社です我々の使命は,皮膚病治療の新しいパラダイムを作成するために,新たな療法brを発見·開発することである。同社の発見プラットフォームは有益な効果を有する自然産生細菌br細胞をスクリーニングした。そしてこれらの微生物に対してゲノム配列測定を行い、それに対して工学設計を行い、細胞療法、組換え治療性タンパク質、ポリペプチドと小分子を製造し、皮膚病の精確な治療に応用した。
Br社はカナダモントリオールにある研究活動のための場所を設置している。この地点とそこで行われた操作は2021年と2022年の間に一致している。2021年にはコネチカット州グロートンに製造·実験室スペースも開設された。
注意事項に行きます
財務諸表は持続的な経営基盤に基づいて作成されており、会社が予見可能な未来に経営を継続し、正常な業務過程で資産や清算負債を現金化することを考えていると仮定している。しかし、経営陣は、企業の持続的な経営企業としての能力に対する不確実性をもたらしている状況や事件を確認している。2022年12月31日までの年間累計赤字は3,730万ドル、運営損失は950万ドル、運営資金は860万ドル。これらの要因やその他の要因は,会社の持続経営企業としての持続的な経営能力を大きく疑っている。
経営陣は、運営および運営資金需要を満たすために、株式および債務融資による資金調達を継続する計画であるが、会社 は、その製品開発を完了するために大量の追加資金を必要とし、今後数年で発生すると予想される追加損失に資金を提供する。同社は早期臨床段階であるため,まだbr製品収入がない。2022年、同社は転換可能な手形を発行し、純現金収益は440万ドルだった(付記7参照)。 会社が必要な時に追加融資を成功させ、その運営ニーズを満たすことが保証されません。
これらの条件と事件は、会社が2024年2月20日(財務諸表発表の日後1年)まで経営を続ける能力に不確実性をもたらしている。財務諸表には、会社が経営を継続できない場合に必要な調整は含まれていません。
| F-6 |
Azitra, Inc.
財務諸表付記
2. 重要な会計政策の概要
会計基礎
当社の財務諸表はアメリカ公認会計原則に従って作成されています。
見積もりを使った
米国公認の会計原則に従って財務諸表を作成するには、貸借対照表の日付報告の資産および負債額に影響を与える推定および仮定が必要である。 管理層は、財務諸表を作成する際に使用される推定および仮定は適切であると考えているが、実際の結果はこれらの推定とは異なる可能性がある。
現金 と現金等価物
貸借対照表およびキャッシュフロー表については、当社はすべての手元現金、普通預金およびすべての原始満期日が3ヶ月以下の高流動性投資を現金等価物と見なしている。
売掛金
会社の売掛金はコストから不良債権を引いて提出しようとしています。当社は定期的に売掛金を評価し、過去の核販売、催促、現在の状況に基づいて不良債権を準備している。2022年12月31日または2021年12月31日の不良債権は言及しない。売掛金は回収できないと思われた場合は返金します。以前に査定された売掛金は受け取った時に記録されています。
繰延発売コスト
会社は繰延発売コストを資本化し、主に会社の初公募株に関する直接、逓増法律、専門、会計、その他の第三者費用を含む。繰延発売コストは、発売完了後に初の公募で得られた金 を相殺する。計画中のIPOが成功しない場合、これらの繰延コストおよび生成される追加料金は運営費用に計上される。
財産 と設備
財産と設備はコストで入金される。減価償却は直線法を用いて計算され、耐用年数は3~10年と推定される。維持·メンテナンス支出は関連資産の経済使用寿命を延長することはなく, は発生時に運営費用を計上する。処分財産と設備の損益は処分期間中の経営報告書 に反映される。
| F-7 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
資産を使用する権利
2016年2月、財務会計基準委員会(“FASB”)は、ASU第2016-02号リース(“テーマ842”)を発表した。ASU 2016-02は、テナントに貸借対照表に12カ月を超える使用権資産と賃貸負債を記載することを要求した。付記2--最近採択された会計公告を参照。
ASU 2016−02年度の影響を計算する際には,当社は移行方法を選択したため,可比期間を繰り返さない。会社 は,非レンタルコンポーネントをそれに関連するレンタルコンポーネントの一部として計算することを選択した.賃貸会計は、賃貸期間、賃貸支払い、割引率に関する推定を含む重大な判断に関連する。指導意見によると、会社はすべてのレンタル期間が12ヶ月を超える賃貸のROU資産と賃貸負債を確認した。
会社は建物の運営賃貸契約を持っています。現在,2022年1月1日現在,同社には3件の運営リースがあり,そのROU資産とリース負債総額は1,418,502ドルである。賃貸契約の基礎、条項及び条件は個別合意によって決定される。当社はある賃貸契約を延長することを選択できます。期間は36~52ヶ月です。すべての延期オプションはROU資産とレンタル負債の計算に含まれている。賃貸借契約には、会社に追加的な財務義務が生じる可能性のある残存価値保証、制限、またはチェーノは含まれていません。転貸、レンタル、または関連先取引は存在しません。
2022年12月31日現在、会社の経営的使用権資産純資産額は1,116,697ドルであり、流動と長期経営賃貸負債はそれぞれ287,384ドルと840,896ドルである。
無形資産
無形資産は商標と特許を含む。特許及び商標出願の提出及び起訴に直接関連するすべてのコストは資本化されている。特許は正式に承認された後、それぞれの残存使用寿命内に償却される。商標は無限の生命期 を持つ.
Br社はASCテーマ350に従って他の無期限無形資産を計算し、商業権その他無形資産 (ASC 350).ASC 350は、無限年限を有する無形資産が少なくとも毎年減値テスト を行わなければならないことを要求するか、またはイベントまたは状況変化が発生する限り、帳簿価値が回収できない可能性があることを示す。寿命の限られた無形資産はその使用年数内に償却され続けるだろう。2022年または2021年に無形資産に関する減価損失 が記録されていない。
| F-8 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
延期された特許コスト
繰延特許コストとは、承認すべき特許出願の提出に関する法律及び出願費用を意味する。これらの繰延コストは、特許が正式に承認された後の予想使用寿命内に償却を開始する。特許 が承認されていない場合、その特許に関連するコストは、その特許が拒否された年に支出されるであろう。2022年12月31日および2021年12月31日までに,繰延特許コストに関する減価損失はなかった。
長期資産減価
ASCテーマ360-10によると長期資産減価または処分の会計処理米国会計基準(ASC 360-10)によると、当社の 政策は、イベントや環境変化がある資産の帳簿金額が回収できない可能性があることを示すたびに、当社はその長期資産の減値状況を審査する。今回の審査では、会社はこれらのbr資産の償却期も再評価した。資産の使用と最終処分による未割引予想の将来のキャッシュフローの和がその帳簿金額より少ない場合、当社は減価損失を確認した。1つの資産が減値とみなされる場合、確認すべき減値は、当該資産の帳簿価値が当該資産の公正価値を超える金額で計量され、当該金額は、当該資産によって生成される将来の運営現金流量正味値の現在値に基づいて決定される。
転換可能な債務と権証会計
株式承認証
権利証の具体的な条項の評価及びASC 480に適用される権威的指導に基づいて、会社は権証を株式分類又は負債分類ツールとして会計処理を行う負債と持分を区別する(“ASC 480”)およびASC 815、派生ツールおよびヘッジ(“ASC 815”)。評価は、株式証明書がASC 480が指す独立財務ツールであるかどうか、ASC 480が指す負債定義に適合するかどうか、および株式承認証がASC 815中の株式分類に関するすべての要求に適合するかどうかを考慮し、権利証が自社自身の普通株にリンクされているかどうか、および他の株式分類条件を含む。この評価は専門的な判断を用いて,権証発行時および権証が決済されていない四半期終了日ごとに行う必要がある.
| F-9 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
転換可能債務と権証会計(継続)
株式承認証(Br)(続)
すべての持分分類基準に符合する発行済み権証に対して、権証は発行時に追加 実収資本の構成部分として記録しなければならない。すべての持分分類基準を満たしていない発行済み権利証については、権利証 は、発行当日及びその後の各貸借対照表日にその初期公正価値で入金されなければならない。株式証券推定公正価値の変動は,他の損益項下の経営報告書では非現金損益であることが確認された。
転換可能債務
社が転換機能を持つ債務を発行する際には,まず転換機能が株式決済債務として入金される要求に適合しているかどうかを評価する.これらの要求に適合しない場合、変換機能を に分割し、派生負債として処理すべきかどうかが評価され、以下に示すように、a)1つまたは複数の標的、通常は私たちの普通株の価格、b)1つまたは複数の名目金額または支払い条項、または両方を兼ねて、通常は変換後の株式数である、c)初期純投資がなく、通常 は借入金金額を含まない、d)純決済準備金は、転換可能債務の場合、通常、変換後に受信した株式を随時現金として販売することができることを意味する。デリバティブ定義に適合する組み込み株式フックコンポーネントが、発行者の自己持分に関するある契約の範囲例外に適合すれば、宿主ツールから分離する必要はない。契約の範囲例外は,a)自分の株をインデックスとする場合,b)その財務諸表において株主権益に分類する場合に適用される.
変換可能優先株
転換可能優先株株主は清算事件が発生したときに清算権を持つが、場合によっては は完全に当社の制御範囲内ではなく、当時発行されていなかった転換可能な優先株を償還する必要があるため、当社は転換可能な優先株を貸借対照表の中間株式に分類する。現在、清算とされる事件が発生する可能性が低いため、転換可能な優先株の帳簿価値はその償還価値に計上されない。清算事件とみなされることが発生する可能性がある場合にのみ、転換可能優先株の帳簿価値を後続調整する。
| F-10 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
収入.収入
社は以下の5つの手順でASCでの顧客との契約収入を確認する606,顧客との契約収入 (“ASC606”)とは、
| ● | 第 ステップ1:顧客との契約を確定する | |
| ● | ステップ2:契約中の履行義務を決定する | |
| ● | 第 ステップ3:出来高を確定する | |
| ● | 第 ステップ4:契約の履行義務に取引価格を割り当てる | |
| ● | ステップ5:契約履行義務を履行する際に収入を確認する |
同社はある研究パートナーと締結した共同開発協定を通じてサービス収入を得ている。契約作業の完了に伴い,会社は入力法を用いてプロトコル研究や開発に関する収入を確認した。
Br社は贈与収入も発生しており,これは各連邦機関や非営利研究機関と締結した契約から受け取ったものであり,会社がさらなる製品開発のための一般的な研究に用いられているため,会社への貢献とみなされている。契約の期限は一般的に1年以上で、どちらでもキャンセルすることができます。当社の結論は、当社 はこの手配の唯一の積極的な参加者であるため、贈与手配はFASB ASCテーマ808項の下の協力手配とみなされる基準を満たしていない。贈与手配も、米国政府が顧客の定義に適合していないため、主題606下の収入確認基準を満たしていない。
条件に適合した費用が発生し、かつ支払権が実現または実現され、本政策が主題606と一致することが確認された場合、これらの付与契約によって稼いだ金額 は、主題606に定義された交換がなくても、主題606に定義された交換がなくても、これらの付与契約によって稼いだ金額 が負の研究開発費として記録され、顧客への譲渡承諾を反映した商品またはサービスの金額が確認されることを保証する。当社は、受信した金額を、生成されたコストおよび現金化可能な金額 として確認することが、主題606における経時的にサービス制御権を転送する概念と類似していることを決定した。
| F-11 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
収入 (続)
前払い補助金の受領書 は,贈与中の条件に沿って使用されていない場合は,出資機関に返却すべきであり,これらの贈与は,br}契約作業を実行する前に許可されたコストや研究パートナーから得られたサービス収入手配に関する資金に関し,付随する貸借対照表では契約負債に分類される。
研究と開発
当社は会計基準編纂(ASC)小見出し730-10に従って研究開発費を計算した研究と開発 それは.そのため,内部研究や開発コストは発生時に費用を計上する.研究開発コストには人力、材料、用品に関するコストが含まれる。2022年と2021年までの年間研究開発コストはそれぞれ5,920,538ドルと5,380,102ドルである。
2022年12月31日と2021年12月31日まで、同社はそれぞれ32,459ドルと71,396ドルの州税収控除を持ち、研究開発税収控除をコネチカット州に返還するための未決返金に用いられている。2022年12月31日と2021年12月31日まで、同社はそれぞれ28,925ドルと89,855ドルをカナダ科学研究と実験発展ポイントに関する未定払い戻しに使用している。同社は2022年12月31日と2021年12月31日現在、カナダ商品·サービス税(GST)とケベック販売税(QST)の払い戻しに関連する8,282ドルと12,060ドルをそれぞれ記録している。返金収入は経営報告書に記載されている他の収入に記入される。
株に基づく報酬
Br社はASC 718に基づいて株式報酬を計算し、報酬--株式報酬(ASC 718)。ASC 718は、従業員の株式オプションと、株式参加計画に基づいて株式を購入する権利とを要求し、公正価値で入金しなければならない。ASC 718は、株式ベースの支払い取引に関連する補償コストを財務諸表において運営費用として確認することを要求する。 は、この方法によれば、付与または修正された報酬の補償コストは、付与日の推定公正価値に従って計量され、報酬の帰属期間の補償費用と交換するために従業員がサービスを提供することに計上される。業績条件が帰属に影響を与える奨励 に対して、会社は業績条件に達する可能性があると確定した時に補償費用を確認する。
| F-12 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
株に基づく報酬 (継続)
同社はブラック·スコアーズオプション定価モデルを使用してその株式オプションの公正価値を決定した。ブラック·スコアモデルには、対象となる普通株の価値、株式オプションの期待寿命、期待変動率、および予想無リスク金利が含まれる様々な仮説が含まれる。これらの仮定は会社の最適な見積りを反映しているが,一般に会社に支配されていない市場状況に基づく固有の不確実性 に関する.したがって、他の仮定を用いれば、株ベースの報酬コストは大きな影響を受ける可能性がある。また、会社が将来の贈与に異なる仮定を使用すれば、株式ベースの報酬コストは将来的に大きな影響を受ける可能性がある。
会社は会計基準更新(ASU)2018-07号更新のASC 718の規定に従って、非従業員に発行された株式ツールに対して会計計算を行う非従業員株式支払会計の改善これは、非従業員に対する株式ベースの支払い取引を含むASC 718の範囲を拡大する。
Black-Scholesオプション定価モデルを用いて発行されたオプションを推定する際には,以下の仮定を用いる
期待変動 それは.会社株の予想変動率は会社の外部推定値に基づいて推定されています。
所期の 期限それは.オプションの予期される期限は、各付与された帰属期限および契約 期間に基づくか、または階層的な帰属を有する報酬の各ホーム部分について推定される簡略化された方法を使用する。
基礎 普通株価値当社株の基本普通株価値は第三者評価専門家が推定しています。
無リスク金利 それは.同社の無リスク金利は米国国庫券の隠れた収益をもとにしており、その条項は標授権書の期待期限に等しい。
配当金 収益率それは.ブラック·スコアーズ推定モデルは単一の期待配当収益率を入力とすることを要求する。当社は過去に普通株について配当金を支払っていませんでしたが、近いうちに普通株に配当金を支払うこともありません。したがって,会社が使用する配当金 収益率はゼロとなる.
| F-13 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
所得税 税
Br社はASC 740に規定されている所得税責任会計方法を採用している所得税会計それは.この方法により、繰延税項資産及び負債は、資産及び負債の帳簿額面と課税基準との間の一時的な差異及び経営損失繰越純額の間の一時的な差による予想将来の税項結果を確認し、いずれも現行の 現行税率で計算される(付記13参照)。
経営陣は、所得税の不確定性に関するASC指導の効果を評価し、会社は2022年12月31日と2021年12月31日の財務諸表に不確定所得税頭寸への大きな開放がないと結論した。2022年12月31日現在、当社の所得税申告書 は税務機関の審査を受けていません。当社は現在、いかなる税務管轄区の監査も受けていません。
公正価値計測
会社は公正な価値に応じて一定の負債を日常的に負担する。公正価値評価技術の入力の優先順位は、3つのレベルからなる公正価値階層構造を使用して決定される:
| ● | レベル1-アクティブな市場で取引される同じツールに基づく観察可能な価格またはオファーが投入される。 | |
| ● | レベル2-アクティブ市場における同様のツールのオファー、非アクティブ市場における同じまたは同様のツールのオファー、およびモデルベースの推定技術の投入は、 市場において観察可能であるか、または資産または負債のほぼ全期間の観察可能な市場データによって確認されることができる。 | |
| ● | レベル 3-投入は通常観察できず、一般に、資産または負債の価格設定の際に市場参加者が使用する仮定の推定を反映している。したがって、公正価値は、オプション価格モデル、割引キャッシュフローモデル、および同様の技術を含むモデルベースの技術を使用して決定される。 |
公正価値を確定する際に、当社は評価技術を採用し、観察可能な投入を最大限に利用し、観察できない投入を最大限に減少させ、公正価値を評価する際に取引相手の信用リスクを考慮する。
| F-14 |
Azitra, Inc.
財務諸表付記
2. 重要会計政策の概要(継続)
最近は会計公告が採用されている
2016年2月、財務会計基準委員会(“FASB”)は、2016−02年度の最新会計基準(“ASU”)リース契約(テーマ842)を発表した。本ASUは、テナントがその貸借対照表において、多くの経営リース項目における使用権資産と賃貸負債を確認することを要求する。ASUは2021年12月15日以降に開始された年度と過渡期に有効である。当社は2022年1月1日にASU 2016-02を採用した。付記15--レンタルを経営しています。
2019年12月、FASBはASU第2019-12号を発表した所得税(話題740):所得税会計の簡略化それは.この基準 は以前に規定された各種の例外状況を取り消し、追加の所得税申告要求を規定し、所得税の会計計算を簡略化した。ASUは2022年1月1日から会社に対して発効する。当社は2022年1月1日からこの基準を採用しており、財務諸表に実質的な影響を与えていない。
FASBは2020年8月にASU第2020-06号を発表しました債務--転換可能な債務およびその他の選択(主題470-20)および派生ツールおよびヘッジ--エンティティ自己資本の契約(主題815-40)変換可能なツールおよびエンティティの自己資本の契約を含む、負債および権益の特徴を有するいくつかの金融商品の会計処理が簡略化される。この基準は2024年1月1日に会社に対して施行され、早期採用が許可される(ただし、2020年12月15日から開始されるbr年度より早くない)。当社は2021年1月1日からこの基準を採用しており、この基準は財務諸表に大きな影響を与えていない。
経営陣は、最近発表されたが発効していない他の会計基準が添付された財務諸表に実質的な影響を与えるとは考えていない。新たな会計公告の発表に伴い、会社はこの場合に適用される会計公告を採用する。
金融商品
会社の金融商品には主に売掛金、長期債務が含まれている。売掛金,売掛金については,当該等の手形の短期満期日により,帳簿金額は公正価値に近い。当社の長期債務の見積もり公正価値は帳簿価値に近い。
| F-15 |
Azitra, Inc.
財務諸表付記
3. 従業員留任ポイント
“CARE法案”は、条件に適合した雇用主の従業員1人当たり最大5,000ドルの雇用税を支払うことができる払戻可能な税金控除(“CARE Employee Return Credits”)を提供します。税収控除は、1四半期以内に従業員に支払われる合格賃金の50%に相当し、2020年12月31日現在、従業員1人当たりの合格賃金の上限は10,000ドルである。米国政府は追加の救済条項“br”を採択し、これらの信用限度額の適格賃金上限を延長し、2021年9月30日にわずかに拡大した。これらの追加規定によると、税金控除は現在、1四半期に従業員に支払われる合格賃金の70%に相当し、従業員1人当たりの合格賃金上限は四半期ごとに10,000ドルに引き上げられている。2022年4月、会社 は、“CARE法案”に規定されている税収免除条件に適合することを決定し、229,813ドルの売掛金を記録し、経営報告書上でその金額を他の 収入として確認した。会社は2022年9月にこのお金の全額支払いを受けた。
4.“br}財産とデバイス
2022年12月31日と2021年12月31日まで、財産と設備は以下の通り
| 2022 | 2021 | |||||||
| 実験室装置 | $ | 1,034,579 | $ | 1,016,737 | ||||
| コンピュータ装置 | 30,825 | 30,825 | ||||||
| 家具と固定装置 | 24,316 | 24,316 | ||||||
| 賃借権改善 | 28,855 | 28,855 | ||||||
| 建築設備 | 14,932 | 14,932 | ||||||
| 1,133,507 | 1,115,665 | |||||||
| 減算:減価償却累計 | (286,549 | ) | (168,984 | ) | ||||
| 純資産と設備 | $ | 846,958 | $ | 946,681 | ||||
2022年12月31日現在と2021年12月31日現在の年間減価償却費用はそれぞれ120,651ドルと81,866ドル。
| F-16 |
Azitra, Inc.
財務諸表付記
5. 無形資産
無形資産 は、12月31日まで:
2022:
推定数 使用寿命 | 総金額 | 累計償却する | 純額 | |||||||||||
| 商標 | 不定である | $ | 53,999 | $ | - | $ | 53,999 | |||||||
| 特許 | 17年 | 108,198 | 8,140 | 100,058 | ||||||||||
| 許可協定 | 17年 | 65,510 | - | 65,510 | ||||||||||
| 無形資産 | $ | 227,707 | $ | 8,140 | $ | 219,567 | ||||||||
2021:
推定数 使用寿命 | 総金額 | 累計償却する | 純額 | |||||||||||
| 商標 | 不定である | $ | 50,955 | $ | - | $ | 50,955 | |||||||
| 特許 | 17年 | 49,644 | 2,906 | 46,738 | ||||||||||
| 無形資産 | $ | 100,599 | $ | 2,906 | $ | 97,693 | ||||||||
2022年と2021年には、無形資産に関する償却費用はそれぞれ5,234ドル、2,906ドルとなる。
12月31日までの年間償却費用は以下のように予想される
| 2023 | $ | 2,920 | ||
| 2024 | 2,920 | |||
| 2025 | 2,920 | |||
| 2026 | 2,920 | |||
| 2027 | 2,920 | |||
| その後… | 85,456 | |||
| 合計する | $ | 100,058 |
| F-17 |
Azitra, Inc.
財務諸表付記
6. は料金を計算する
当計 2022年12月31日現在と2021年12月31日までの料金には、
| 2022 | 2021 | |||||||
| 従業員給与明細とボーナス | $ | 371,010 | $ | 138,671 | ||||
| 休暇をとる | 27,082 | 43,473 | ||||||
| 研究と開発プロジェクト | 316,389 | 149,711 | ||||||
| 利子 | 223,792 | 59,181 | ||||||
| 専門費 | 24,502 | 58,892 | ||||||
| 他にも | 31,186 | 25,557 | ||||||
| $ | 993,961 | $ | 475,485 | |||||
会社は、受け取ったサービスの評価と、契約に基づいて手配された条項に基づいて支出する作業に基づいて、第三者が展開する開発活動に関する費用を算出する。その中のいくつかの契約によって支払われる費用は研究と非臨床試験マイルストーンに依存する。場合によっては、会社のサプライヤーに支払われるお金は、提供されたサービスレベルを超え、前払い費用をもたらす可能性がある。サービス料を計算する際には,会社はサービスを提供する時間帯 と時間帯ごとにかかる作業量を見積もる.実際にサービスを実行する時間または努力の程度が推定値と異なる場合、会社はそれに応じて計算または前払い費用を調整する。当社は設立以来コストと実コストとの間に大きな差は見られませんでした。
| F-18 |
Azitra, Inc.
財務諸表付記
7.変換可能な債務
当社は2022年9月に最大4,500,000ドルの変換可能チケット を発行する変換可能チケット購入プロトコル(このプロトコル)を締結した。同日、会社は3人の投資家と転換可能な元票(2022年転換可能手形)を締結し、総額は4,350,000ドルだった。2022年に転換可能な手形は2023年1月13日に満期または違約事件が発生し(定義)、年利8%で利息を計算するが、元金を転換または全額返済するまで期限が切れず、対応することはない。2022年転換手形項で未償還の元本と利息は、a)合格融資終了時に自動的に証券に変換され、会社に少なくとも2000万ドルの有毛収入をもたらし、1株当たり30%の割引価格で合格融資関連証券を発行する、b)支配権変更事件終了時に会社またはBシリーズ優先株の株式に変換する。およびc)上場企業活動終了時に、投資家に発行された株式は、当時発行された元本と当算利息金額を1株当たり公開発行価格の2倍(2倍)で割ったものに等しい。2022年に交換可能株式証拠の下の未償還元本および利息は、満期日に新カテゴリーに転換する会社優先株(C系列優先株)を保有者が選択することができ、未償還元本金額と利息を上限価格で割ることに相当し、上限価格は1株価格が推定値上限3,000万ドルを会社資本で割ると定義される(定義は合意参照)。
同社はASC 815項下の2022年転換可能手形を担当している。815-15-25によれば、金融商品の開始時に を選択して、ASC 825項目の公正価値オプションに従ってツールを会計処理することができる。同社は2022年の転換債券のためにこのような選択をした。公正価値オプションを使用して、本チケットは発行日に初期公正価値で入金すべきであり、その後、各貸借対照表は一日ごとに初期公正価値で入金すべきである。当社は現在の市場価値の換算価格に基づいて変化を評価します。確認時には,手形推定公正価値の変動は 経営報告書上で他の収入(費用)における非現金収益または損失であることが確認された.当社は2022年12月31日までの年度の2022年転換可能手形の公正価値変動が1,250,000ドルであることを確認した。
2021年1月5日から、当社は手形購入契約を締結し、最大2,000,000ドルを発行して本チケットを変換することができます。同日、会社は投資家と転換可能なチケット(2021年変換可能手形)を締結し、金額は1,000,000ドルだった。2021年に発行された転換可能手形の利息年利率は6%で、2023年1月5日に満期となり、全額支払われる。2021年に変換可能な手形 は、手形プロトコルで定義された合格持分融資に従って、すべての元本および計算すべき利息を変換価格48.00ドルで割った株式数に自動的に変換され、この数字は、手形プロトコルの定義に従って調整することができる。いくつかの非限定的な融資、制御権の変更、または2021年の変換可能チケットの満期日についても、2021年の変換可能チケットは、チケットプロトコルの定義に従ってオプション的に変換することができる。当社の2021年の転換手形に関する発行コストは15,613ドルであり、債務割引として記録されており、2021年の転換可能手形の期限内に償却されています。発行コストは2022年12月31日に全額償却された。
| F-19 |
Azitra, Inc.
財務諸表付記
7. 転換可能債務(継続)
Br社は、ASC 480-負債と株式およびASC 815-派生商品および沖項下の会計考慮事項を区別するために、2021年の変換可能手形に関連する手形購入プロトコルの条項および条件を評価した。 社は、転換可能な手形がASC 480による負債の会計処理のいずれの基準にも適合していないと認定した。会社 はまた、ASC 815のガイドラインに基づいて組み込み機能を評価し、組み込み機能がいかなる分岐基準 にも適合しないことを決定した。
12月31日現在、変換可能なbr対応チケットには、以下が含まれています
| 2022 | 2021 | |||||||
| 2021年の変換可能チケット | $ | 1,000,000 | $ | 1,000,000 | ||||
| 2022年変換可能手形 | 5,600,000 | - | ||||||
| 6,600,000 | 1,000,000 | |||||||
| 起債コスト | - | (7,981 | ) | |||||
| $ | 6,600,000 | $ | 992,019 | |||||
2022年および2021年12月31日までの年間で、それぞれ7,981ドルおよび7,632ドルが債務発行コストに関する償却がある。2022年12月31日と2021年12月31日までの換算手形の累計利息はそれぞれ223,792ドルと59,181ドルであった。
8.給与保障計画ローン
2020年4月10日、会社は給与保障計画(PPPローン)に基づいて230,685ドルのローンを獲得した。ローンは1%の金利で利息を計算し、満期日を2年とする予定で、会社と融資者の双方の同意を経て5年に延長することができる。
2021年のPPP柔軟性法案と総合支出法案によって改正されたCARE法案の要求によると、収益は会社の合格賃金コスト(従業員1人当たりの年収上限100,000ドル)、またはbr}と賃貸料、担保融資利息公共事業、保証運営支出、保証財産損失、保証仕入先コストと労働者保護支出に関する他の条件に適合するコストにしか使用できず、いずれの場合も支払い後24週間以内に支払われる。(I)収益が条件に適合する賃金コストまたは他の条件に適合するコストを支払うために使用される場合、(Ii)フルタイム従業員数および給与が支払い後24週間以内に一定のままである場合、または2020年12月31日までに回復する場合、PPP ローンは完全に免除することができる。
会社は2021年1月25日にPPPローンの全額免除の通知を受け、金額を経営報告書上の他の収入に記録した。
| F-20 |
Azitra, Inc.
財務諸表付記
9. 株主資本
普通株 株
それぞれ2022年及び2021年12月31日に、当社の改訂及び再記載された会社登録証明書に基づいて、当社は100,000,000株額面0.0001ドルの普通株の発行を許可した。長期分割のより多くの 情報については、付記19、後続イベントを参照されたい。
2022年12月31日と2021年12月31日までに、会社は普通株1,043,991株と1,043,103株をそれぞれ発行·発行した。
普通株株主は自社株主が議決したすべての事項を提出して一票を投じる権利があり、普通株式保有者は当社の取締役株主を選挙する権利がある。
会社は現在、将来発行のための8,504,678株の普通株を予約し、発行された優先株を転換し、2022年12月31日の未償還引受権と引受権証を行使するために使用されている。
優先株
それぞれ2022年と2021年12月31日に、会社の改訂と再記載された会社登録証明書に基づいて、会社は1,437,150株と978,042株の額面0.0001ドルの優先株を承認した。
Aシリーズ、A-1シリーズ、およびBシリーズ優先株は、以下の権利、優先オプション、および特権を有する:
転換する
優先株は、保有者の選択により、予め定義された式に従って普通株に変換することができる。優先株の保有者はいつでも優先株を普通株に変換することができる。転換については、Aシリーズ優先株の初期転換価格は1株2.2887ドル(オリジナル発行価格)、A-1シリーズ優先株の初期転換価格は1株5.2817ドル(オリジナル発行価格)、Bシリーズ優先株の初期転換価格は1株6.1190ドル(元発行価格)であり、会社登録証明書の説明に基づいて調整することができる。優先株は、(A)総収益が100,000,000ドルを超える初公募株または(B)投票または必要な優先株株主の書面同意により指定された日時やイベントが発生したときに自動的に普通株に変換され、発行されたすべてのA系列、A系列1およびB系列優先株は、そのとき有効な転換率で自動的に普通株に変換される。
| F-21 |
Azitra, Inc.
財務諸表付記
9. 株主資本(続)
優先株(続株)
投票権 権利
Aシリーズ、A-1シリーズ、Bシリーズの優先株の所有者は、会社の任意の株主総会で行動または審議するための任意の事項投票(または会議の代わりに株主の書面による同意)のために会社株主に提出する権利があれば、優先株流通株保有者1人当たり普通株式全体の株式数に等しい投票数を投じる権利があり、当該普通株式保有者が保有する優先株株式は、その事項について投票する権利のある株主の記録日 を確定した日から普通株に変換することができる。AシリーズとA-1シリーズ優先株の保有者は1人当たり会社の取締役メンバーを選挙する権利がある。Bシリーズ株の保有者は、2人の取締役会メンバーを選挙する権利がある。各優先株は、当該等の取締役を罷免することができ、会社登録証明書に記載されている特定の場合には、当該取締役の辞任、死亡、又は罷免による空きを埋めることができる。
配当をする
Aシリーズ優先株の保有者は、Aシリーズオリジナル発行価格の年利8%で1株2.2887ドルのAシリーズ優先株発行済み株の配当を得る権利がある(Aシリーズ優先株に関連する任意の配当、株式分割、合併または他の類似資本再編が発生した場合には、適切な調整が必要である)。配当金 はAシリーズ優先株発行日から累計し、累積配当金であり、会社取締役会が発表又は会社清算時に支払う。2022年12月31日現在、Aシリーズ優先株の累計配当金は1,541,575ドル。
A-1シリーズ株の保有者は、A-1シリーズオリジナル発行価格1株当たり5.2817ドルの年利で配当金を得る権利がある(A-1シリーズ優先株に任意の配当、株式分割、合併、または他の類似した資本再編が発生した場合、適切な調整が必要である)。配当金は累積的であり、取締役会が会社の清算を発表した時に支払わなければならない。2022年12月31日までのA-1系列優先株の累計配当金は4,332,153ドルであった。
Bシリーズ株の保有者は、Bシリーズオリジナル発行価格1株6.1190ドルの年利率で配当を得る権利がある(任意の配当金、株式分割、合併、またはBシリーズ優先株に関連する他の類似資本再編が発生した場合、適切な調整が必要である)。配当金は累積され、取締役会が会社の清算を発表したときに支払われる。2022年12月31日までのBシリーズ優先株の累計配当金は3,135,585ドル。
| F-22 |
Azitra, Inc.
財務諸表付記
9. 株主資本(続)
優先株(続株)
清算する
会社に清算、解散、または清算が発生した場合、優先株保有者は、普通株式保有者の前および普通株式保有者よりも優先して、Aシリーズ、Aシリーズ1またはBシリーズ優先株の元の発行価格に相当する金額を獲得する権利があり、発表および/または計算すべきであるが支払われていない配当金を有する。このような清算事件が発生した場合、優先株保有者に支払う必要があるすべての優先金額を支払った後、会社がその株主に割り当てることができる余剰資産は、各優先株および普通株式所有者が保有する株式数に応じて優先株および普通株式所有者に比例して割り当てられなければならず、そのため、このようなすべての証券を、その清算事件の直前の会社登録証明書条項に従って 普通株に変換したとみなす。
10. 株式認証
会社は2018年に株式承認証を発行し、47,889株の普通株及び転換可能な債務融資を購入し、転換可能な債務融資 は償還条項を有し、所有者は取締役会或いは独立評価士が決定した株式公平市価に相当する購入価格で全部或いは任意の部分承認株式証(又はそれが転換した株式)を償還することを要求する権利があることを規定した。この償還条項の結果として、株式承認証は、ASC 480に基づく財務諸表において負債と持分とを区別するように分類される。これらの株式承認証の行使価格は1株当たり0.48ドルであり,期限は10年である。権利証は各報告期間に市価で計算される.2022年12月31日と2021年12月31日の公正価値は、それぞれ70,283ドル、71,104ドル である。2022年12月31日、当社はBlack-Scholesオプション定価モデルを用いて株式証明書の公正価値を推定し、基礎普通株価値は1.70ドル、予想期間は5年、予想変動率は86.0%、 無リスク金利は3.01%、配当率は0%であると仮定した。2021年12月31日、当社はBlack-Scholesオプション定価モデルを用いて株式証明書の公正価値を推定し、関連する普通株価値は1.70ドル、予想期間は6年、予想変動率は86.0%、無リスク金利は1.35%、配当率は0%であると仮定した。
同社も2016年と2019年に株式承認証を発行したが、この等株式証はASC 480が負債に分類する基準を満たしておらず、株式分類基準に符合している。
| F-23 |
Azitra, Inc.
財務諸表付記
10. 引受権証(続)
次の表は、2022年12月31日の未満期株式証明書に関する情報をまとめたものである
| 未弁済持分証 | 行使可能な引受権証 | |||||||||||||||||||||||||
授与された年 |
行権価格 | 2022年12月31日までの引受権証数 | 加重平均残存契約寿命 | 加重平均行権値 |
2022年12月31日までの引受権証数 | 加重平均残存契約寿命 | 加重平均行権値 | |||||||||||||||||||
| 2016 | $ | 0.01 | 11,467 | 3.7年 | $ | 0.01 | 11,467 | 3.7年 | $ | 0.01 | ||||||||||||||||
| 2018 | $ | 0.48 | 47,889 | 5.3年 | $ | 0.48 | 47,889 | 5.3年 | $ | 0.48 | ||||||||||||||||
| 2019 | $ | 5.28 | 215,854 | 3.1年 | $ | 5.28 | 215,854 | 3.1年 | $ | 5.28 | ||||||||||||||||
| 275,210 | $ | 4.23 | 275,210 | $ | 4.23 | |||||||||||||||||||||
11. 株式オプション
2016年、会社はAzitra,Inc.2016株式インセンティブ計画(以下、計画と略す)を策定し、会社員、上級管理者、取締役、コンサルタント、コンサルタントに株式オプションと制限株を付与することを規定した。この計画によると、2022年12月31日と2021年12月31日までに1,490,595株が配給できる。オプションは異なる時間範囲で付与される。
当社は2022年及び2021年12月31日までの年度内に、それぞれ0及び495,580件の購入株式を付与して普通株株式を買収する。これらのオプションは2年から4年の間の異なる時間範囲で付与され、期限は10年、執行価格は1.70ドルである。当社が発行サービス型株式オプションに関する株式報酬支出は、2022年および2021年12月31日までにそれぞれ184,465ドルおよび306,055ドルであることが確認された。2022年12月31日現在、427,784ドルの未償却補償費用 が残りの授権期間内に償却される。2022年12月31日現在、未返済の業績オプション数は93,152件、公正価値は109,551ドルである。当社は2022年12月31日までの年間で、業績オプションの補償費用 を確認していません。当社はSAB 107の規定に基づいて通常オプション条件に適合するオプションを決定し、簡略化方法を用いて期待オプション寿命を推定する。
2021年期間に付与されたオプションの推定公正価値を決定するために、当社はBlack-Scholesオプション定価モデルを使用して、 仮定:基礎普通株式価値は1.70ドル、予想期間は7年、予想変動率は86.0%、無リスク金利は0.66%-1.26%、配当率は0%である。
| F-24 |
Azitra, Inc.
財務諸表付記
11. 株式オプション(継続)
次の表は、2022年12月31日現在の未完了と行使可能なオプションの情報をまとめています
| 未完成オプション | 行使可能なオプション | |||||||||||||||||||||||
行権価格 | 2022年12月31日のオプション数 | 加重平均残存契約寿命 | 加重平均行権値 |
2022年12月31日のオプション数 | 加重平均残存契約寿命 | 加重平均行権値 | ||||||||||||||||||
| $ | 0.48 | 246,136 | 3.0年 | $ | 0.48 | 246,136 | 3.0年 | $ | 0.48 | |||||||||||||||
| $ | 0.93 | 231,680 | 3.0年 | $ | 0.93 | 231,680 | 3.0年 | $ | 0.93 | |||||||||||||||
| $ | 1.70 | 812,502 | 8.3年 | $ | 1.70 | 411,707 | 8.0年 | $ | 1.70 | |||||||||||||||
| 1,290,318 | 889,523 | |||||||||||||||||||||||
2022年12月31日と2021年12月31日までの年間株式オプション活動総額の概要は以下の通り
株 | 重みをつける 平均値 トレーニングをする 値段 | |||||||
| 2020年12月31日現在返済していません | 959,827 | $ | 1.11 | |||||
| 授与する | 495,580 | 1.70 | ||||||
| 鍛えられた | (17,750 | ) | 0.48 | |||||
| 没収される | (55,749 | ) | 1.03 | |||||
| 2021年12月31日現在の未返済債務 | 1,381,908 | $ | 1.34 | |||||
| 鍛えられた | (888 | ) | 1.70 | |||||
| 没収される | (90,702 | ) | 5.91.41 | |||||
| 2022年12月31日に返済されていません | 1,290,318 | $ | 1.33 | |||||
2022年12月31日現在、同計画によると、将来付与可能な株式数は157,989株。
| F-25 |
Azitra, Inc.
財務諸表付記
12. 公正価値計測
次の表は公正価値レベル中の公正価値とレベルをまとめ、その中で公正価値計量は経常的な基礎によって計量された資産と負債に属し、以下の日付までである
| 2022年12月31日 | ||||||||||||||||
| 説明する | レベル1 | レベル2 | レベル3 | 合計する | ||||||||||||
| 負債: | ||||||||||||||||
| 普通株式引受証 | $ | - | $ | - | $ | 70,283 | $ | 70,283 | ||||||||
| 2022年変換可能手形 | - | - | 5,600,000 | 5,600,000 | ||||||||||||
| 合計する | $ | - | $ | - | $ | 5,670,283 | $ | 5,670,283 | ||||||||
| 2021年12月31日 | ||||||||||||||||
| 説明する | レベル1 | レベル2 | レベル3 | 合計する | ||||||||||||
| 負債: | ||||||||||||||||
| 普通株式引受証 | $ | - | $ | - | $ | 71,104 | $ | 71,104 | ||||||||
次の表に2022年12月31日と2021年12月31日までの年度内に定期的に計測した3級文書の変動状況を示す
| 2021年1月1日の残高 | $ | 72,093 | ||
| 株式許可証は価値変動を公正に許可する | (989 | ) | ||
| 2021年12月31日の残高 | 71,104 | |||
| 株式許可証は価値変動を公正に許可する | (821 | ) | ||
| 2022年転換手形を発行 | 4,350,000 | |||
| 2022年転換可能手形公正価値変動 | 1,250,000 | |||
| $ | 5,670,283 |
会社の普通株式公正価値の変動 は毎年普通株式証券負債推定値の変化の主要な駆動要素 である。普通株式公正価値の増加に伴い、手形所持者の価値も通常増加する。
各種投入の変動 は、企業価値、流動性に達する時間、変動性と割引率を含み、各報告期間2022年にチケットの推定値変化を転換できる主要な駆動要素である。企業価値の公正価値,流動性が予想される時間,変動性,割引率の増加に伴い,2022年には転換可能な手形保持者の価値が一般的に増加する。
| F-26 |
Azitra, Inc.
財務諸表付記
13. 所得税
繰延所得税は、財務報告用途の資産と負債の帳簿価値と所得税報告用途の資産と負債の帳簿価値との仮差額に基づいて算出される。2022年と2021年12月31日までの繰延所得税資産/(負債)は以下の通り
| 2022 | 2021 | |||||||
| 繰延税金資産: | ||||||||
| 純営業損失が繰り越す | $ | 7,870,665 | $ | 6,994,967 | ||||
| 税金控除 | 1,729,421 | 1,216,246 | ||||||
| 減価償却および償却 | 1,189,975 | |||||||
| 費用を計算する | 81,876 | 48,288 | ||||||
| 他にも | 28,057 | 25,240 | ||||||
| 繰延税金資産総額 | 10,899,994 | 8,284,741 | ||||||
| 繰延税金負債: | ||||||||
| 減価償却および償却 | - | (234,616 | ) | |||||
| 繰延税金負債総額 | - | (234,616 | ) | |||||
| 推定免税額 | (10,899,994 | ) | (8,050,125 | ) | ||||
| 繰延税金(負債)純資産 | $ | - | $ | - | ||||
2022年12月31日と2021年12月31日までの納税年度では、会社が繰り越した連邦純営業損失はそれぞれ約29,192,000ドルと25,954,000ドルであり、うち1,285,000ドルは2036~2037納税年度に満期となり、約27,907,000ドルは未満期の納税年度で満期となる。2022年12月31日と2021年12月31日までの納税年度では,当社が繰り越した国の純営業損失はそれぞれ約29,374,000ドルと25,947,000ドルであり,この2つの納税年度は2036~2042納税年度で満期となる。
Br社は,2022年12月31日と2021年12月31日までの納税年度にそれぞれ約1,235,000ドルと859,000ドルの連邦研究税収相殺 を有しており,この2つの納税年度は2039~2042納税年度に満期となる。2022年12月31日と2021年12月31日までの2つの納税年度では、会社はそれぞれ約350,000ドルと249,000ドルの州研究税控除を持ち、そのうち60,000ドルは2036納税年度に満期になり、100,000ドルは2037納税年度に満期になり、残りの部分は無期限に繰り越すことができる。同社は2022年12月31日と2021年12月31日までの納税年度にそれぞれ約21.8万ドルと13.8万ドルのカナダ研究税収免除を有しており、この2つの納税年度は2039年から2042年までの納税年度が満期となる。
| F-27 |
Azitra, Inc.
財務諸表付記
13. 所得税(継続)
アメリカ国税法第382節では、所有権の50%を超える会社がその純営業損失繰越を用いて納税義務を減らす能力を年間制限しています。 将来的に当社の所有権変更が第382条に規定されている50%制限敷居を超えると、当社が繰り越した純営業損失は特定年度の使用量において著しく制限される可能性がある。また、当社が2018年までに発生した純営業損失の全部または一部は繰越 満期で使用されていない可能性があります。
繰延税金資産の現金化は、一時差額控除可能な間に将来の課税所得額を生成する会社の能力に依存します。会社の最近の利益の歴史と予想される米国の将来収益によると、経営陣は、予見可能な未来には、その連邦と州繰延税金資産が完全に現金化できない可能性があると考えている。この評価の結果として,経営陣は連邦と州繰延税の純資産を全額推定控除する必要があると考えている。
社は、不確定な税務状況を処理するためにASC 740-10の規定を適用する。ASC 740−10は、納税申告書に財務諸表に記録されるべきかどうか、または申告されるべきと予想される税金割引の決定問題を解決する。米国会計基準第740-10条によれば、会社は、税務機関が税務機関の技術的価値に基づいて審査した後、その税務頭寸を維持しない可能性がある場合にのみ、不確定税務頭寸からの税収割引を確認することができる。当社は、そのbrに重大な不確定税務状況がないことを確認し、米国会計基準740−10に基づいて確認および計量する必要があることを確認した。
同社はアメリカ連邦所得税、コネチカット州所得税、カナダ支店税を支払う必要がある。当社は米国国税局、州又は外国税務機関の所得税に関する監査を受けていません。当社の納税年度は、純営業損失が繰越使用され、適用される訴訟時効が満了するまで、すべての連邦と州税務事項の審査 を継続して受けます。
適用された場合、会社は、未確認の税収割引に関する利息及び罰金を確認し、所得税費用の構成要素とする。
| F-28 |
Azitra, Inc.
財務諸表付記
14. 1株当たり純損失
基本 と希釈後の1株当たり純損失は以下のように計算される
1株当たりの基本純損失と薄くした後の純損失の分子は以下の通り
| 12月31日までの年度 | ||||||||
| 2022 | 2021 | |||||||
| 純損失 | $ | 10,680,366 | $ | 8,939,675 | ||||
| 優先配当金 | 2,768,984 | 2,768,984 | ||||||
| 普通株主は純損失を占めなければならない | $ | 13,449,350 | $ | 11,708,659 | ||||
分母は以下のとおりである
| 12月31日までの年度 | ||||||||
| 2022 | 2021 | |||||||
| 加重平均発行済み普通株式、基本普通株式、希釈普通株 | 1,043,990 | 1,034,299 | ||||||
| $0.01株式承認証 | 11,467 | 11,467 | ||||||
| 合計する | 1,055,457 | 1,045,766 | ||||||
1株当たり純損失(基本損失と赤字)は以下の通り
| 12月31日までの年度 | ||||||||
| 2022 | 2021 | |||||||
| 1株当たり基本と希釈して純損失 | $ | (12.74 | ) | $ | (11.20 | ) | ||
| F-29 |
Azitra, Inc.
財務諸表付記
14. 1株当たり純損失(継続)
以下の潜在普通株等価物は、期末ごとの未償還金額列に基づいて示されており、示す期間の希釈後の1株当たり純損失計算 は計上されておらず、これらの等価物を計上すると逆償却効果が生じるからである
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 普通株式購入オプション | 1,290,318 | 1,381,908 | ||||||
| 未弁済持分証 | 263,743 | 263,743 | ||||||
| 1,554,061 | 1,645,651 | |||||||
15. 支払いの引受およびまたは事項
法律.法律
その会社は通常の業務過程で法的手続きやクレームの制約を受けている。まれに不利な決定や和解が生じるが、当社はその件などの最終処分がその財務状況、経営業績、流動資金に重大な悪影響を与えるべきではないと信じている。
ライセンス プロトコル
当社は2022年1月26日から、関係のない第三者と独占ライセンス契約(同協定)を締結した。この協定によると、会社は特定の特許の独占許可および特定の独自技術の非独占許可を取得する。合意の有効期間は、最後の許可特許の満了後または最初の許可の治療的または非治療的製品の最初の商業販売後10年までである。当社はいつでも第三者に少なくとも30日間の書面通知を提供することで、本合意を終了することができます。その協定はまた協定に規定された重大な義務違反や破産時に終了する。プロトコル終了後,いずれも終了前に発生した義務を解除してはならない.
2022年12月31日までの年度内に、会社は本ライセンス契約に基づいて支払われた金額を資本化し、金額は65,510ドルである。これらの 資本化コストは,許可された特許発行後の有効期限内に償却される.
運営 借約
同社はコネチカット州ブランフォード、コネチカット州グロートン、ケベック州ラバルでオフィスと実験室スペースを借りている。当社のレンタル契約は2027年5月31日までの異なる日に満了します。ほとんどの賃貸契約は固定期限と固定金額です。当社は、いかなる指数または料率に基づいて賃貸料条項、アップグレード条項、資本改善資金、または支払いが増加した賃貸契約にも参加しません。
| F-30 |
Azitra, Inc.
財務諸表付記
15. 支払いを受けることと、または事項がある(継続)
運営 借約(継続)
2020年の間、会社はコネチカット州ブランフォードに位置する主要な事務と実験室空間について新しい賃貸契約を締結した。Branford借約は借約の初年度に毎月13,033ドルを支払う必要があり、次の数年間で毎年約2%増加する。Branford賃貸借契約はまた、同社に公共地域維持費用を比例的に支払うことを要求した。
2021年5月、会社はコネチカット州グロートンのオフィスと実験室と新しい賃貸契約を締結した。グロートンのレンタルは毎月4,234ドルを支払う必要があり、追加スペースをレンタルした後、この数字は2021年9月に6,824ドルに増加する。Grotonのレンタル期間は最初は1年 であり,最大3年間継続可能である.
今後のbrの次の5年間で、毎年初期または残り期間が1年を超える経営リースをキャンセルできない最低支払いは以下の通りである
| 2023 | $ | 329,937 | ||
| 2024 | 335,988 | |||
| 2025 | 277,209 | |||
| 2026 | 204,159 | |||
| 2027 | 76,324 | |||
| 将来割引されていない賃貸支払い総額 | 1,223,617 | |||
| 差し引く:利息 | (95,337 | ) | ||
| 賃貸負債現在価値 | $ | 1,128,280 |
2022年12月31日までの年間,すべての経営リースのレンタル料は338,864ドルである。すべての運営リースの加重平均レンタル期間は3.8年であった。すべての経営リースの加重平均割引率は4.25%であった。
16. 退職計画
2019年1月1日から、会社はほとんどの従業員をカバーする401(K)計画を開始した。参加資格があるためには、従業員は2ヶ月連続のサービスを完了し、サービスの最初の年に少なくとも250時間または1,000時間働かなければなりません。従業員は計画資格要求を満たした後に税引前延期を行うことができる。2020年1月1日から、この計画は安全港計画に移行し、高給従業員は一致納付 を得る資格がなく、非高給従業員は前3%の支払いとその後の2%の支払いで100%の一致と50%のマッチングを得る。2022年12月31日と2021年12月31日までの年間の雇用主マッチングの納付総額はそれぞれ23,466ドルと31,548ドルであった。
| F-31 |
Azitra, Inc.
財務諸表付記
17.信用リスク集中
会社を信用リスクに直面させる可能性のある金融商品には主に現金と売掛金が含まれている。
2022年12月31日と2021年12月31日までの年間で、すべての許可収入はそれぞれ1人の授与者と3人の授与者から来ており、すべてのサービス収入 は1人の顧客から来ている。
貸借対照表で決定された現金残高は金融機関の口座に格納されており、連邦預金保険会社(FDIC)が保証し、最高250,000ドルに達する。時々、銀行に預けられた現金がFDICの限度額を超える可能性がある。
2020年3月初め、新冠肺炎は全世界範囲で爆発し、全世界経済に重大な変化を招いた。当社はこれまで何の業務運用中断も経験していませんが、潜在的な経済低下や、当社に与える可能性のある直接的または間接的なマイナス影響を含むこれらの変化は特定できませんが、当社の業務、キャッシュフロー、流動資金に予想される大きな影響を与える可能性があります。
18. 関連先
Br社は1つの実体からサービス収入を獲得し、この実体も会社Bシリーズ優先株融資の投資家である(br注9参照)。2022年および2021年12月31日までの関連側総収入はそれぞれ284,000ドルおよび110,000ドルであったのに対し,2022年および2021年12月31日には関連側の売掛金はそれぞれ175,000ドルおよび125,000ドルであった。2022年12月31日と2021年12月31日までの関係者の契約負債はそれぞれ156,000ドルと15,000ドルであった。
2022年9月、当社は総額4,350,000ドルの転換可能な本票を締結し、そのうち4,000,000ドルは当社のAシリーズ、A-1、Bシリーズの優先株融資の投資家でもあるエンティティに帰属します。(注7参照)
19. 後続イベント
会社は2022年12月31日から2023年6月13日までの間に発生した事件を評価し、2023年6月13日は財務諸表発表の日 である。
当社は2023年1月に、計算に応じてまだ支払われていない利息120,058ドルを含む2021年の交換可能手形(付記7参照)を選択し、換算価格48.00ドルでそのBシリーズ優先株23,335株に変換し、付記 購入合意に基づいて概説した条項である。
2023年2月、2022年転換可能手形を改訂し、満期日を2023年3月31日に延長し、条件付融資または制御権変更事件時の転換価格 を3,000万ドルに変更し、条件付融資または制御権変更イベント終了直前に完全希釈ベースで発行·発行した会社普通株数 で割った。
2023年3月、会社取締役会と株主は、2023年株式インセンティブ計画(“2023年計画”); を承認したが、提案された長期株式分割および普通株式認可株式増加の発効日までに、付与すべきでないbr}は、本募集説明書 からなる登録説明書が発効した日から発効する予定である。“2023年計画”は、委員会が、従業員、取締役および非従業員に最大2,000,000株の普通株を奨励および非法定株式オプション、制限株式奨励、制限株式単位および他の株式ベースの奨励形態で付与することを可能にする。2023年3月20日現在、2023年計画に基づいて授与される賞はない。
2023年5月17日、取締役会は、目論見書に含まれる登録説明書の効力に基づいて、7.1対1の割合で分割を行う前向き株式分割を承認した。取締役会はまた、会社普通株の法定株式を100,000,000株に増加させるとともに、普通株額面を0.0001ドルに変更することを許可した。株式分割後の新たな価値を反映するために、株式分割の影響、普通株額面の変化、および優先株転換比率の調整を反映するために、普通株、購入普通株の選択権、株式データ、および合併財務諸表および関連付記に含まれる関連情報が適用された場合に遡及調整を行った。
| F-32 |
Azitra, Inc.
貸借対照表 表
監査を受けていない
| 3月31日 | 十二月三十一日 | |||||||
| 2023 | 2022 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金と現金等価物 | $ | 1,833,395 | $ | 3,492,656 | ||||
| 売掛金 | 97,389 | 182,820 | ||||||
| 課税額相殺 | 72,356 | 69,666 | ||||||
| 課税所得税 | 13,722 | 13,722 | ||||||
| 繰延発売コスト | 583,966 | 216,886 | ||||||
| 前払い費用 | 43,636 | 160,133 | ||||||
| 流動資産総額 | 2,644,464 | 4,135,883 | ||||||
| 財産と設備、純額 | 830,798 | 846,958 | ||||||
| その他の資産 | ||||||||
| その他の資産 | 47,535 | 47,507 | ||||||
| 経営的リース使用権資産 | 1,045,454 | 1,116,697 | ||||||
| 無形資産、純額 | 223,208 | 219,567 | ||||||
| 繰延特許コスト | 864,035 | 800,831 | ||||||
| その他資産総額 | 2,180,232 | 2,184,602 | ||||||
| 総資産 | $ | 5,655,494 | $ | 7,167,443 | ||||
| 負債、転換可能優先株、株主損失 | ||||||||
| 流動負債: | ||||||||
| 売掛金 | $ | 982,870 | $ | 784,687 | ||||
| 当期経営賃貸負債 | 292,036 | 287,384 | ||||||
| 費用を計算する | 965,461 | 993,961 | ||||||
| 契約責任 | 42,700 | 156,000 | ||||||
| 流動負債総額 | 2,283,067 | 2,222,032 | ||||||
| 長期経営賃貸負債 | 767,159 | 840,896 | ||||||
| 株式証法的責任 | 64,662 | 70,283 | ||||||
| 転換支払手形、純額 | 6,400,000 | 6,600,000 | ||||||
| 総負債 | 9,514,888 | 9,733,211 | ||||||
| 転換可能優先株: | ||||||||
| Aシリーズ転換可能優先株;額面0.0001ドル;2023年3月31日と2022年12月31日に発行された205,385株;2023年3月31日と2022年12月31日に発行·発行された205,385株;2023年3月31日と2022年12月31日の清算価値3337,506ドル | 3,272,944 | 3,272,944 | ||||||
| A-1シリーズ転換可能優先株;額面0.0001ドル;2023年3月31日と2022年12月31日に発行された380,657株;2023年3月31日と2022年12月31日に発行·発行された380,657株;2023年3月31日と2022年12月31日までの清算価値14,274,638ドル | 14,100,533 | 14,100,533 | ||||||
| Bシリーズ転換可能優先株;額面0.0001ドル;2023年3月31日と2022年12月31日に発行を許可した851,108株;それぞれ2023年3月31日と2022年12月31日に発行·発行された414,735株と391,303株;br}現在の2023年3月31日と2022年12月31日までの清算価値はそれぞれ18,018,162ドルと17,000,159ドルである | 17,445,824 | 16,321,065 | ||||||
| 株主赤字: | ||||||||
| 普通株;額面0.0001ドル;2023年3月31日と2022年12月31日に発行許可された1億株;2023年3月31日と2022年12月31日に発行·発行された1,043,991株 | 104 | 104 | ||||||
| 追加実収資本 | 1,092,932 | 1,052,138 | ||||||
| 赤字を累計する | (39,771,731 | ) | (37,314,552 | ) | ||||
| 株主総損失額 | (38,678,695 | ) | (36,260,310 | ) | ||||
| 総負債、転換可能優先株、株主赤字 | $ | 5,655,494 | $ | 7,167,443 | ||||
付記はこのような簡明な財務諸表の構成要素である。
| F-33 |
Azitra, Inc.
運営レポート
監査を受けていない
| 3月31日までの3ヶ月間 | ||||||||
| 2023 | 2022 | |||||||
| サービス収入関係者 | $ | 113,300 | $ | 120,000 | ||||
| 総収入 | 113,300 | 120,000 | ||||||
| 運営費用: | ||||||||
| 一般と行政 | 843,011 | 861,308 | ||||||
| 研究開発 | 830,181 | 1,555,368 | ||||||
| 総運営費 | 1,673,192 | 2,416,676 | ||||||
| 運営損失 | (1,559,892 | ) | (2,296,676 | ) | ||||
| その他の収入(支出): | ||||||||
| 利子収入 | 285 | 520 | ||||||
| 利子支出 | (89,832 | ) | (17,637 | ) | ||||
| その他の収入 | 1,146 | - | ||||||
| 転換可能手形は価値変動を公正に許容する | (800,000 | ) | - | |||||
| その他の費用 | (8,886 | ) | (12,224 | ) | ||||
| その他収入合計 | (897,287 | ) | (29,341 | ) | ||||
| 所得税前純損失 | (2,457,179 | ) | (2,326,017 | ) | ||||
| 所得税の割引 | - | - | ||||||
| 純損失 | $ | (2,457,179 | ) | $ | (2,326,017 | ) | ||
| 優先配当金 | (712,080 | ) | (692,246 | ) | ||||
| 普通株主は純損失を占めなければならない | $ | (3,169,259 | ) | $ | (3,018,263 | ) | ||
| 1株当たり基本と希釈して純損失 | $ | (3.00 | ) | $ | (2.86 | ) | ||
| 加重平均は普通株式を発行しています | ||||||||
| 基本的希釈の | 1,055,457 | 1,055,223 | ||||||
付記はこのような簡明な財務諸表の構成要素である。
| F-34 |
Azitra, Inc.
転換可能優先株と株主損失報告書
2023年3月31日と2022年3月31日までの3ヶ月間
監査を受けていない
シリーズ A 変換可能優先株 | シリーズA-1オープンカー 優先株 | シリーズ B オープンカー 優先株 | 普通株 | 追加の 個の実収 | 累計 | 株主合計 | ||||||||||||||||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 株 | 金額 | 株 | 金額 | 資本 | 赤字.赤字 | 赤字.赤字 | ||||||||||||||||||||||||||||||||||
| バランス、2021年12月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 391,303 | $ | 16,321,065 | 1,043,103 | $ | 104 | $ | 868,163 | $ | (26,634,186 | ) | $ | (25,765,919 | ) | ||||||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | - | 56,983 | - | 56,983 | |||||||||||||||||||||||||||||||||
| 株式オプションの行使 | - | - | - | - | - | - | 888 | - | 1,510 | - | 1,510 | |||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | - | (2,326,017 | ) | (2,326,017 | ) | |||||||||||||||||||||||||||||||
| バランス、2022年3月31日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 391,303 | 16,321,065 | 1,043,991 | 104 | 926,656 | (28,960,203 | ) | (28,033,443 | ) | |||||||||||||||||||||||||||||||
| バランス、2022年12月31日 | 205,385 | 3,272,944 | 380,657 | 14,100,533 | 391,303 | 16,321,065 | 1,043,991 | 104 | 1,054,138 | (37,314,552 | ) | (36,260,310 | ) | |||||||||||||||||||||||||||||||
| Bシリーズ転換優先株を発行する | - | - | - | - | 23,432 | 1,124,759 | - | - | - | - | 1,124,759 | |||||||||||||||||||||||||||||||||
| 株に基づく報酬 | - | - | - | - | - | - | - | - | 38,794 | - | 38,794 | |||||||||||||||||||||||||||||||||
| 純損失 | - | - | - | - | - | - | - | - | - | (2,457,179 | ) | (2,457,179 | ) | |||||||||||||||||||||||||||||||
| バランス、2023年3月31日 | 205,385 | $ | 3,272,944 | 380,657 | $ | 14,100,533 | 414,735 | $ | 17,445,824 | 1,043,991 | $ | 104 | $ | 1,092,932 | $ | (39,771,731 | ) | $ | (38,678,695 | ) | ||||||||||||||||||||||||
付記はこのような簡明な財務諸表の構成要素である。
| F-35 |
Azitra, Inc.
現金フロー表
監査を受けていない
| 3月31日までの3ヶ月間 | ||||||||
| 2023 | 2022 | |||||||
| 経営活動のキャッシュフロー: | ||||||||
| 純損失 | $ | (2,457,179 | ) | $ | (2,326,017 | ) | ||
| 純損失を調節するように調整する | ||||||||
| 経営活動に使用する現金を浄化するには、以下の操作を実行してください | ||||||||
| 減価償却および償却 | 32,149 | 30,539 | ||||||
| 債務割引償却 | - | 1,968 | ||||||
| 使用権資産の償却 | 71,243 | 66,679 | ||||||
| 転換可能手形の利子 | 89,832 | 15,669 | ||||||
| 株に基づく報酬 | 38,794 | 56,983 | ||||||
| 株式証負債の公正価値変動を認める | (5,621 | ) | (356 | ) | ||||
| 転換可能手形は価値変動を公正に許容する | 800,000 | - | ||||||
| 財産と設備処分損失 | - | 7,923 | ||||||
| 経営性資産と負債変動状況: | ||||||||
| 売掛金 | 85,431 | (5,200 | ) | |||||
| 前払い費用 | 116,497 | 35,509 | ||||||
| その他の資産 | (28 | ) | (167 | ) | ||||
| 課税額相殺 | (2,690 | ) | (231 | ) | ||||
| 売掛金と売掛金 | 204,610 | (224,992 | ) | |||||
| リース負債を経営する | (69,085 | ) | (61,785 | ) | ||||
| 契約責任 | (113,300 | ) | 45,000 | |||||
| 経営活動に使用した現金純額 | (1,209,347 | ) | (2,358,478 | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 財産と設備を購入する | (14,392 | ) | (29,731 | ) | ||||
| 財産と設備を売却して得た収益 | - | 4,250 | ||||||
| 繰延特許コストの資本化 | (63,204 | ) | (67,326 | ) | ||||
| 許可証の資本化 | (3,858 | ) | - | |||||
| 特許と商標費用の資本化 | (1,380 | ) | (585 | ) | ||||
| 投資活動に使用した現金純額 | (82,834 | ) | (93,392 | ) | ||||
| 資金調達活動のキャッシュフロー: | ||||||||
| 繰延発売費を支払う | (367,080 | ) | - | |||||
| 株式オプションを行使して得られる収益 | - | 1,510 | ||||||
| 融資活動が提供する現金純額 | (367,080 | ) | 1,510 | |||||
| 現金と現金等価物の純変化 | (1,659,261 | ) | (2,450,360 | ) | ||||
| 年明けの現金と現金等価物 | 3,492,656 | 8,044,262 | ||||||
| 年末現金と現金等価物 | $ | 1,833,395 | $ | 5,593,902 | ||||
| キャッシュフロー情報の追加開示: | ||||||||
| 非現金取引: | ||||||||
| 賃貸負債と引き換えに使用権資産を取得する | $ | - | $ | 1,418,502 | ||||
| 手形をBシリーズに転換可能な優先株に変換する | 1,124,759 | - | ||||||
付記はこのような簡明な財務諸表の構成要素である。
| F-36 |
1. 業務の組織と性質
Azitra, Inc.は2014年1月2日に設立された.皮膚微生物のスクリーニングや遺伝子工学に集中している合成生物会社です我々の使命は,皮膚病治療の新しいパラダイムを作成するために,新たな療法brを発見·開発することである。同社の発見プラットフォームは有益な効果を有する自然産生細菌br細胞をスクリーニングした。そしてこれらの微生物に対してゲノム配列測定を行い、それに対して工学設計を行い、細胞療法、組換え治療性タンパク質、ポリペプチドと小分子を製造し、皮膚病の精確な治療に応用した。
Br社はカナダモントリオールにある研究活動のための場所を設置している。この場所は、そこで行われた操作と2022年と2023年の間に一致している。同社は2021年にコネチカット州グロートンに製造·実験室を開設した。
注意事項に行きます
簡明財務諸表を審査していないのは持続経営基準に従って作成され、当社は予見可能な未来に経営を継続すると仮定し、正常な業務過程で資産の現金化及び清算負債を考慮する。しかし、経営陣は、会社の持続的な経営能力 に不確実性がある場合やイベントを決定している。2023年3月31日までの3カ月間、会社は累計3980万ドルの赤字、運営損失は160万ドル、運営資金は120万ドルだった。これらの要因やその他の要因は,会社の持続経営企業としての持続的な経営能力を大きく疑っている。
経営陣は、運営および運営資金需要を満たすために、株式および債務融資による資金調達を継続する計画であるが、会社 は、その製品開発を完了するために大量の追加資金を必要とし、今後数年で発生すると予想される追加損失に資金を提供する。同社はまだ臨床前段階であるため,まだbr製品収入はない。会社が必要な時に追加融資を成功させ、その 運営ニーズを満たすことは保証されない。
これらの条件とイベントは、当社が財務諸表が発行された日から12ヶ月以内に経営を継続できる能力に不確実性がある。財務諸表には必要な調整は一切含まれておらず、会社が経営を継続できなければ。
2. 重要な会計政策の概要
会計基礎
会社の財務諸表は米国公認会計原則(“米国公認会計原則”)に基づいて作成されている。
監査されていない中期財務情報
監査されていない中期財務諸表及び関連付記はアメリカ中期財務情報公認会計基準 に基づいてアメリカ証券取引委員会(“アメリカ証券取引委員会”)の規則制度の下で作成されている。米国公認会計原則に従って作成された年次財務諸表に通常含まれるいくつかの情報 と開示内容はすでにこのような規則と規定に基づいて簡素化または省略されている。審査されていない中期財務諸表は審査された財務諸表と一致する基準で作成され、管理層はこのような中期財務諸表はすべての調整を反映していると考えており、正常な経常的な調整、公平な報告書の中間業績に必要な調整及び中期貸借対照表の日付までの財務状況を含む。中間財務諸表付記に開示されている3ヶ月間に関連する財務データ及びその他の情報は監査されていない。監査されていない中期業績は必ずしも財政年度全体の業績を代表するとは限らない。これらの審査されていない中期財務諸表は、当社の2022年12月31日までの年度の財務諸表とその付記とともに読まなければなりません。この等の付記は当社の登録説明書に掲載されています。
| F-37 |
見積もりを使った
米国公認の会計原則に従って財務諸表を作成するには、貸借対照表の日付報告の資産および負債額に影響を与える推定および仮定が必要である。 管理層は、財務諸表を作成する際に使用される推定および仮定は適切であると考えているが、実際の結果はこれらの推定とは異なる可能性がある。
現金 と現金等価物
貸借対照表およびキャッシュフロー表については、当社はすべての手元現金、普通預金およびすべての原始満期日が3ヶ月以下の高流動性投資を現金等価物と見なしている。
財産 と設備
財産と設備はコストで入金される。減価償却は直線法を用いて計算され、耐用年数は3~10年と推定される。メンテナンス·メンテナンス支出は、関連資産の経済使用寿命を延長することなく、発生時に運営費用を計上する。処分財産や設備の収益または損失 は、処分期間中の業務報告書に反映される。
売掛金
会社の売掛金はコストから不良債権を引いて提出しようとしています。当社は定期的に売掛金を評価し、過去の核販売、催促、現在の状況に基づいて不良債権を準備している。2023年3月31日と2022年12月31日の不良債権は計上しない。売掛金は回収できないと考えられた場合に査定を行う。以前に査定された売掛金は受け取った時に記録されています。
延期された 製品コスト
Br社は繰延発売コストを資本化し、これらのコストは主に会社の初公募株に関する直接、逓増法律、専門、会計、その他の第三者費用を含む。繰延発売コストは、発売完了後に初の公募で得られた金 を相殺する。計画されたIPOが成功しないことが証明された場合、これらの繰延コストおよび生成される追加費用 は運営費用に計上される。
資産を使用する権利
2016年2月、財務会計基準委員会(“FASB”)は、ASU第2016-02号リース(“テーマ842”)を発表した。ASU 2016-02は、テナントに貸借対照表に12カ月を超える使用権資産と賃貸負債を記載することを要求した。付記2--最近採択された会計公告を参照。
ASU 2016−02年度の影響を計算する際には,当社は移行方法を選択したため,可比期間を繰り返さない。会社 は,非レンタルコンポーネントをそれに関連するレンタルコンポーネントの一部として計算することを選択した.賃貸会計は、賃貸期間、賃貸支払い、割引率に関する推定を含む重大な判断に関連する。指導意見によると、会社はすべてのレンタル期間が12ヶ月を超える賃貸のROU資産と賃貸負債を確認した。
会社は建物の運営賃貸契約を持っています。現在,2022年1月1日現在,同社には3件の運営リースがあり,そのROU資産とリース負債総額は1,418,502ドルである。賃貸契約の基礎、条項及び条件は個別合意によって決定される。当社はある賃貸契約を延長することを選択できます。期間は36~52ヶ月です。すべての延期オプションはROU資産とレンタル負債の計算に含まれている。賃貸借契約には、会社に追加的な財務義務が生じる可能性のある残存価値保証、制限、またはチェーノは含まれていません。転貸、レンタル、または関連先取引は存在しません。
2023年3月31日現在、会社の経営権資産純資産は1,045,454ドル、流動と長期経営賃貸負債はそれぞれ292,036ドル、767,159ドルである。
| F-38 |
無形資産
無形資産は商標と特許を含む。特許及び商標出願の提出及び起訴に直接関連するすべてのコストは資本化されている。特許は正式に承認された後、それぞれの残存使用寿命内に償却される。商標は無限の生命期 を持つ.
Br社はASCテーマ350に従って他の無期限無形資産を計算し、商業権その他無形資産 (ASC 350).ASC 350は、無限年限を有する無形資産が少なくとも毎年減値テスト を行わなければならないことを要求するか、またはイベントまたは状況変化が発生する限り、帳簿価値が回収できない可能性があることを示す。寿命の限られた無形資産はその使用年数内に償却され続けるだろう。2023年3月31日または2022年3月31日までの3カ月間、無形資産に関する減価損失は記録されていない。
延期された特許コスト
繰延特許コストとは、承認すべき特許出願の提出に関する法律及び出願費用を意味する。これらの繰延コストは、特許が正式に承認された後の予想使用寿命内に償却を開始する。特許 が承認されていない場合、その特許に関連するコストは、その特許が拒否された年に支出されるであろう。2023年3月31日または2022年3月31日までの3ヶ月間、繰延特許コストに関する減価損失は記録されていない。
長期資産減価
ASCテーマ360-10によると長期資産減価または処分の会計処理米国会計基準(ASC 360-10)によると、当社の 政策は、イベントや環境変化がある資産の帳簿金額が回収できない可能性があることを示すたびに、当社はその長期資産の減値状況を審査する。今回の審査では、会社はこれらのbr資産の償却期も再評価した。資産の使用と最終処分による未割引予想の将来のキャッシュフローの和がその帳簿金額より少ない場合、当社は減価損失を確認した。1つの資産が減値とみなされる場合、確認すべき減値は、当該資産の帳簿価値が当該資産の公正価値を超える金額で計量され、当該金額は、当該資産によって生成される将来の運営現金流量正味値の現在値に基づいて決定される。
転換可能な債務と権証会計
株式承認証
権利証の具体的な条項の評価及びASC 480に適用される権威的指導に基づいて、会社は権証を株式分類又は負債分類ツールとして会計処理を行う負債と持分を区別する(“ASC 480”)およびASC 815、派生ツールおよびヘッジ(“ASC 815”)。評価は、株式証明書がASC 480が指す独立財務ツールであるかどうか、ASC 480が指す負債定義に適合するかどうか、および株式承認証がASC 815中の株式分類に関するすべての要求に適合するかどうかを考慮し、権利証が自社自身の普通株にリンクされているかどうか、および他の株式分類条件を含む。この評価は専門的な判断を用いて,権証発行時および権証が決済されていない四半期終了日ごとに行う必要がある.
すべての持分分類基準に符合する発行済み権証に対して、権証は発行時に追加 実収資本の構成部分として記録しなければならない。すべての持分分類基準を満たしていない発行済み権利証については、権利証 は、発行当日及びその後の各貸借対照表日にその初期公正価値で入金されなければならない。株式証券推定公正価値の変動は,他の損益項下の経営報告書では非現金損益であることが確認された。
転換可能債務
転換機能を有する債務を会社が発行する場合、まず、債務がASC 480-に従って負債と株式-入金を区別すべきかどうかを評価する。債務がASC 480負債の基準を満たしていない場合、チケットの 変換機能は、ASC 815派生ツールおよび対沖による分流を必要とする。もし会社が埋め込まれた変換機能をASC 815に従って分類する必要があると判断した場合、会社はまた公正価値オプションを選択できるかどうかを考慮する。 公正価値オプションを選択した場合、会社は初期公正価値に従ってチケットを記録し、収益に公正価値の後続の変化 を記録する。付記7に示すように、当社は2022年に交換可能な手形のために公正価値オプションを選択し、その初期公正価値に基づいてこのような手形を計上し、その後公正価値に変動があれば収益を記入する。
| F-39 |
変換可能優先株
転換可能優先株株主は清算事件が発生したときに清算権を持つが、場合によっては は完全に当社の制御範囲内ではなく、当時発行されていなかった転換可能な優先株を償還する必要があるため、当社は転換可能な優先株を貸借対照表の中間株式に分類する。現在、清算とされる事件が発生する可能性が低いため、転換可能な優先株の帳簿価値はその償還価値に計上されない。清算事件とみなされることが発生する可能性がある場合にのみ、転換可能優先株の帳簿価値を後続調整する。
収入
会社は従う5人ASCにより顧客との契約収入を確認する手順606,顧客との契約収入 (“ASC606”)とは、
| ● | 第 ステップ1:顧客との契約を確定する | |
| ● | 第 ステップ2:契約中の履行義務を確定する | |
| ● | 第 ステップ3:出来高を確定する | |
| ● | 第 ステップ4:契約の履行義務に取引価格を割り当てる | |
| ● | 第 ステップ5:契約履行義務を履行する際に収入を確認する |
同社はある研究パートナーと締結した共同開発協定を通じてサービス収入を得ている。契約作業の完了に伴い,会社は入力法を用いてプロトコル研究や開発に関する収入を確認した。
Br社は贈与収入も発生しており,これは各連邦機関や非営利研究機関と締結した契約から受け取ったものであり,会社がさらなる製品開発のための一般的な研究に用いられているため,会社への貢献とみなされている。契約の期限は一般的に1年以上で、どちらでもキャンセルすることができます。当社の結論は、当社 はこの手配の唯一の積極的な参加者であるため、贈与手配はFASB ASCテーマ808項の下の協力手配とみなされる基準を満たしていない。贈与手配も、米国政府が顧客の定義に適合していないため、主題606下の収入確認基準を満たしていない。
条件に適合した費用が発生した場合、これらの付与契約によって得られた金額 は、負の研究開発費と記載されており、 は支払権を実現または実現し、当社が本政策が主題606と一致すると考えられる収入を稼ぐことができ、 が顧客に譲渡承諾した商品やサービスを反映した金額を確認することができ、その金額は、主題606で定義された交換がなくても、会社 がこれらの商品やサービスの対価格を交換する権利があることを反映している。さらに、当社は、受信された金額を生成されたコストおよび換金可能な金額として確認することが、主題606における経時的にサービス制御権を転送する概念と類似していることを決定した。
前払い補助金の受領書 が贈与における許容コストに関する条件に従って使用されていない場合や,契約を実行する前に研究パートナーからサービス収入手配に関する資金を受け取っている場合は,出資機関に返却すべきであり,付随する貸借対照表では契約負債に分類される。
| F-40 |
研究と開発
当社は会計基準編纂(ASC)小見出し730-10に従って研究開発費を計算した研究と開発 それは.そのため,内部研究や開発コストは発生時に費用を計上する.研究開発コストには人力、材料、用品に関するコストが含まれる。研究と開発費は$2023年3月31日と2022年3月31日までの3ヶ月間はそれぞれ830,181ドルと1,555,366ドルだった。
2023年3月31日と12月31日に2022年3月31日と2022年12月31日に、会社は32,459ドルの州税控除を持っており、コネチカット州への研究開発税収相殺に関する未定払い戻しのために使用されている。brは2023年3月31日と2022年12月31日に、会社はそれぞれ29,009ドルと28,925ドルのカナダ科学研究と実験発展(SRED)相殺に関する未定払い戻しを持っている。会社は2023年3月31日と2022年12月31日までにそれぞれ10,888ドルと8,282ドルを記録し、カナダ商品·サービス税(GST)とケベック販売税(QST)の払い戻しに関連している。返金収入は経営報告書に記載されている他の収入に記載されています。
株に基づく報酬
Br社はASC 718に基づいて株式報酬を計算し、報酬--株式報酬(ASC 718)。ASC 718は、従業員の株式オプションと、株式参加計画に基づいて株式を購入する権利とを要求し、公正価値で入金しなければならない。ASC 718は、株式ベースの支払い取引に関連する補償コストを財務諸表において運営費用として確認することを要求する。 は、この方法によれば、付与または修正された報酬の補償コストは、付与日の推定公正価値に従って計量され、報酬の帰属期間の補償費用と交換するために従業員がサービスを提供することに計上される。業績条件が帰属に影響を与える奨励 に対して、会社は業績条件に達する可能性があると確定した時に補償費用を確認する。
同社はブラック·スコアーズオプション定価モデルを使用してその株式オプションの公正価値を決定した。ブラック·スコアモデルには、対象となる普通株の価値、株式オプションの期待寿命、期待変動率、および予想無リスク金利が含まれる様々な仮説が含まれる。これらの仮定は会社の最適な見積りを反映しているが,一般に会社に支配されていない市場状況に基づく固有の不確実性 に関する.したがって、他の仮定を用いれば、株ベースの報酬コストは大きな影響を受ける可能性がある。また、会社が将来の贈与に異なる仮定を使用すれば、株式ベースの報酬コストは将来的に大きな影響を受ける可能性がある。
会社は会計基準更新(ASU)2018-07号更新のASC 718の規定に従って、非従業員に発行された株式ツールに対して会計計算を行う非従業員株式支払会計の改善これは、非従業員に対する株式ベースの支払い取引を含むASC 718の範囲を拡大する。
Black-Scholesオプション定価モデルを用いて発行されたオプションを推定する際には,以下の仮定を用いる
期待変動 それは.会社株の予想変動率は会社の外部推定値に基づいて推定されています。
所期の 期限それは.オプションの予期される期限は、各付与された帰属期限および契約 期間に基づくか、または階層的な帰属を有する報酬の各ホーム部分について推定される簡略化された方法を使用する。
基礎 普通株価値当社株の基本普通株価値は第三者評価専門家が推定しています。
無リスク金利 それは.同社の無リスク金利は米国国庫券の隠れた収益をもとにしており、その条項は標授権書の期待期限に等しい。
配当金 収益率それは.ブラック·スコアーズ推定モデルは単一の期待配当収益率を入力とすることを要求する。当社は過去に普通株について配当金を支払っていませんでしたが、近いうちに普通株に配当金を支払うこともありません。したがって、同社が使用している配当収益率はゼロとなる
| F-41 |
所得税 税
Br社はASC 740に規定されている所得税責任会計方法を採用している所得税会計それは.この方法によると、繰延税項資産及び負債の資産及び負債の帳簿額面及び課税基準間の一時的な差異及び経営損失繰越額の予想将来税務結果確認は、いずれも現行の税率で計算される。
経営陣は、所得税の不確定性に関するASC指導の影響を評価し、会社は2023年3月31日と12月31日の財務諸表で不確定所得税頭寸に大きなリスクがないと結論した2022年。 2022年12月31日現在、当社の所得税申告書は税務機関の審査を受けていません。
公正価値計測
会社は公正な価値に応じて一定の負債を日常的に負担する。公正価値評価技術の入力の優先順位は、3つのレベルからなる公正価値階層構造を使用して決定される:
| ● | レベル1-アクティブな市場で取引される同じツールに基づく観察可能な価格またはオファーが投入される。 | |
| ● | レベル2-アクティブ市場における同様のツールのオファー、非アクティブ市場における同じまたは同様のツールのオファー、およびモデルベースの推定技術の投入は、 市場において観察可能であるか、または資産または負債のほぼ全期間の観察可能な市場データによって確認されることができる。 | |
| ● | レベル 3-投入は通常観察できず、一般に、資産または負債の価格設定の際に市場参加者が使用する仮定の推定を反映している。したがって、公正価値は、オプション価格モデル、割引キャッシュフローモデル、および同様の技術を含むモデルベースの技術を使用して決定される |
公正価値を確定する際に、当社は評価技術を採用し、観察可能な投入を最大限に利用し、観察できない投入を最大限に減少させ、公正価値を評価する際に取引相手の信用リスクを考慮する。
最近の会計声明
2016年2月、財務会計基準委員会(“FASB”)は、2016−02年度の最新会計基準(“ASU”)リース契約(テーマ842)を発表した。本ASUは、テナントがその貸借対照表において、多くの経営リース項目における使用権資産と賃貸負債を確認することを要求する。ASUは2021年12月15日以降に開始された年度と過渡期に有効である。当社は2022年1月1日にASU 2016-02を採用した。付記13--レンタルを経営しています。
2019年12月、FASBはASU第2019-12号を発表した所得税(話題740):所得税会計の簡略化それは.この基準 は以前に規定された各種の例外状況を取り消し、追加の所得税申告要求を規定し、所得税の会計計算を簡略化した。ASUは2022年1月1日から会社に対して発効する。当社は2022年1月1日からこの基準を採用しており、財務諸表に実質的な影響を与えていない。
FASBは2020年8月にASU第2020-06号を発表しました債務--転換可能な債務およびその他の選択(主題470-20)および派生ツールおよびヘッジ--エンティティ自己資本の契約(主題815-40)変換可能なツールおよびエンティティの自己資本の契約を含む、負債および権益の特徴を有するいくつかの金融商品の会計処理が簡略化される。この基準は2024年1月1日に会社に対して施行され、早期採用が許可される(ただし、2020年12月15日から開始されるbr年度より早くない)。当社は2021年1月1日からこの基準を採用しており、この基準は財務諸表に大きな影響を与えていない。
経営陣は、最近発表されたが発効していない他の会計基準が添付された財務諸表に実質的な影響を与えるとは考えていない。新たな会計公告の発表に伴い、会社はこの場合に適用される会計公告を採用する。
| F-42 |
金融商品
会社の金融商品には主に売掛金、長期債務が含まれている。売掛金,売掛金については,当該等の手形の短期満期日により,帳簿金額は公正価値に近い。当社の長期債務の見積もり公正価値は帳簿価値に近い。
3. 従業員留任ポイント
“CARE法案”は、条件に適合した雇用主の従業員1人当たり最大5,000ドルの雇用税を支払うことができる払戻可能な税金控除(“CARE Employee Return Credits”)を提供します。税収控除は、1四半期以内に従業員に支払われる合格賃金の50%に相当し、2020年12月31日現在、従業員1人当たりの合格賃金の上限は10,000ドルである。米国政府は追加の救済条項“br”を採択し、これらの信用限度額の適格賃金上限を延長し、2021年9月30日にわずかに拡大した。これらの追加規定によると、税金控除は現在、1四半期に従業員に支払われる合格賃金の70%に相当し、従業員1人当たりの合格賃金上限は四半期ごとに10,000ドルに引き上げられている。2022年4月、会社 は、“CARE法案”に規定されている税収免除条件に適合することを決定し、229,813ドルの売掛金を記録し、経営報告書上でその金額を他の 収入として確認した。会社は2022年9月にこのお金の全額支払いを受けた。
4.“br}財産とデバイス
財産·設備には、2023年3月31日と12月31日まで、以下の内容が含まれている2022:
| 2023年3月31日 | 2022年12月31日 | |||||||
| 実験室装置 | $ | 1,049,152 | $ | 1,034,579 | ||||
| コンピュータ装置 | 30,825 | 30,825 | ||||||
| 家具と固定装置 | 24,316 | 24,316 | ||||||
| 賃借権改善 | 28,855 | 28,855 | ||||||
| 建築設備 | 14,932 | 14,932 | ||||||
| 1,148,080 | 1,133,507 | |||||||
| 減算:減価償却累計 | (317,282 | ) | (286,549 | ) | ||||
| 純資産と設備 | $ | 830,798 | $ | 846,958 | ||||
2023年3月31日と2022年3月31日までの3ヶ月間の減価償却費用はそれぞれ30,552ドルと29,809ドルである。
5. 無形資産
無形資産 は以下の資産からなる:
2023年3月31日:
推定数 有用な寿命 | 総金額 | 累計償却する | 純額 | |||||||||||
| 商標 | 不定である | $ | 54,776 | $ | - | $ | 54,776 | |||||||
| 特許 | 17年 | 108,801 | 9,737 | 99,064 | ||||||||||
| 許可協定 | 17年 | 69,368 | - | 69,368 | ||||||||||
| 無形資産 | $ | 232,945 | $ | 9,737 | $ | 223,208 | ||||||||
2022年12月31日 :
推定数 有用な寿命 | 総金額 | 累計償却する | 純額 | |||||||||||
| 商標 | 不定である | $ | 53,999 | $ | - | $ | 53,999 | |||||||
| 特許 | 17年 | 108,198 | 8,140 | 100,058 | ||||||||||
| 許可協定 | 17年 | 65,510 | - | 65,510 | ||||||||||
| 無形資産 | $ | 227,707 | $ | 8,140 | $ | 219,567 | ||||||||
2023年3月31日までの3ヶ月以内に2022年、無形資産に関連する償却費用はそれぞれ1,597ドル、730ドル。
| F-43 |
6. は料金を計算する
計算すべき費用 には以下の費用が含まれている:
| 2023年3月31日 | 2022年12月31日 | |||||||
| 従業員給与明細とボーナス | $ | 425,528 | $ | 371,010 | ||||
| 休暇をとる | 43,353 | 27,082 | ||||||
| 研究と開発プロジェクト | 292,529 | 316,389 | ||||||
| 利子 | 188,865 | 223,792 | ||||||
| 専門費 | 13,082 | 24,502 | ||||||
| 他にも | 2,104 | 31,186 | ||||||
| $ | 965,461 | $ | 993,961 | |||||
会社は、受け取ったサービスの評価と、契約に基づいて手配された条項に基づいて支出する作業に基づいて、第三者が展開する開発活動に関する費用を算出する。その中のいくつかの契約によって支払われる費用は研究と非臨床試験マイルストーンに依存する。場合によっては、会社のサプライヤーに支払われるお金は、提供されたサービスレベルを超え、前払い費用をもたらす可能性がある。サービス料を計算する際には,会社はサービスを提供する時間帯 と時間帯ごとにかかる作業量を見積もる.実際にサービスを実行する時間または努力の程度が推定値と異なる場合、会社はそれに応じて計算または前払い費用を調整する。当社は設立以来コストと実コストとの間に大きな差は見られませんでした。
7. 転換可能債務
当社は2022年9月に最大4,500,000ドルの変換可能チケット を発行する変換可能チケット購入プロトコル(このプロトコル)を締結した。同日、会社は3人の投資家と転換可能な元票(2022年転換可能手形)を締結し、総額は4,350,000ドルだった。2022年に転換可能な手形は2023年1月13日に満期または違約事件が発生し(定義)、年利8%で利息を計算するが、元金を転換または全額返済するまで期限が切れず、対応することはない。2022年転換手形項で未償還の元本と利息は、a)合格融資終了時に自動的に証券に変換され、会社に少なくとも2000万ドルの有毛収入をもたらし、1株当たり30%の割引価格で合格融資関連証券を発行する、b)支配権変更事件終了時に会社またはBシリーズ優先株の株式に変換する。およびc)上場企業活動終了時に、投資家に発行された株式は、当時発行された元本と当算利息金額を1株当たり公開発行価格の2倍(2倍)で割ったものに等しい。2022年に交換可能株式証拠の下の未償還元本および利息は、満期日に新カテゴリーに転換する会社優先株(C系列優先株)を保有者が選択することができ、未償還元本金額と利息を上限価格で割ることに相当し、上限価格は1株価格が推定値上限3,000万ドルを会社資本で割ると定義される(定義は合意参照)。
2023年2月、2022年転換可能手形を改訂し、満期日を2023年3月31日に延長し、条件付融資または制御権変更事件時の転換価格 を3,000万ドルに変更し、条件付融資または制御権変更イベント終了直前に完全希釈ベースで発行·発行した会社普通株数 で割った。
同社はASC 815項下の2022年転換可能手形を担当している。815-15-25によれば、金融商品の開始時に を選択して、ASC 825項目の公正価値オプションに従ってツールを会計処理することができる。同社は2022年の転換債券のためにこのような選択をした。公正価値オプションを使用して、本チケットは発行日に初期公正価値で入金すべきであり、その後、各貸借対照表は一日ごとに初期公正価値で入金すべきである。当社は現在の市場価値の換算価格に基づいて変化を評価します。確認時には,手形推定公正価値の変動は 経営報告書上で他の収入(費用)における非現金収益または損失であることが確認された.
| F-44 |
2021年1月5日から、当社は手形購入契約を締結し、最大2,000,000ドルを発行して本チケットを変換することができます。同日、会社は投資家と転換可能なチケット(2021年変換可能手形)を締結し、金額は1,000,000ドルだった。2021年に発行された転換可能手形の利息年利率は6%で、2023年1月5日に満期となり、全額支払われる。2021年に変換可能な手形 は、手形プロトコルで定義された合格持分融資に従って、すべての元本および計算すべき利息を変換価格48.00ドルで割った株式数に自動的に変換され、この数字は、手形プロトコルの定義に従って調整することができる。いくつかの非限定的な融資、制御権の変更、または2021年の変換可能チケットの満期日についても、2021年の変換可能チケットは、チケットプロトコルの定義に従ってオプション的に変換することができる。当社の発行コストは#ドルです15,613は、2021年の変換可能チケットに関連して、債務割引として記録されており、2021年の変換可能チケットの期限内に償却される。
2023年1月、当社は、手形購入協定で概説された条項に基づいて、2021年の転換可能手形(計算すべきがまだ支払われていない利息124,759ドル、換算価格48.00ドルを含む)を23,432株Bシリーズ優先株に変換することを選択した。
Br社は、ASC 480-負債と株式およびASC 815-派生商品および沖項下の会計考慮事項を区別するために、2021年の変換可能手形に関連する手形購入プロトコルの条項および条件を評価した。 社は、転換可能な手形がASC 480による負債の会計処理のいずれの基準にも適合していないと認定した。会社 はまた、ASC 815のガイドラインに基づいて組み込み機能を評価し、組み込み機能がいかなる分岐基準 にも適合しないことを決定した。
変換可能 対応チケットは以下のものを含む:
| 2023年3月31日 | 2022年12月31日 | |||||||
| 2021年の変換可能チケット | $ | - | $ | 1,000,000 | ||||
| 2022年変換可能手形 | 6,400,000 | 5,600,000 | ||||||
| $ | 6,400,000 | $ | 6,600,000 | |||||
2023年3月31日と2022年3月31日までの3ヶ月間に、それぞれ0ドルと1,968ドルの債券発行コストに関する償却があった。2023年3月31日と2022年12月31日まで、転換可能な手形の利息はそれぞれ188,865ドルと223,792ドルだった。
8. 株主資本
普通株 株
2023年3月31日及び2022年12月31日に、当社の改訂及び再記載された会社登録証明書に基づいて、当社は額面0.0001ドルの100,000,000株の普通株の発行を許可した。長期株式分割に関するより多くの情報は、付記17、後続イベントを参照されたい。
会社は2023年3月31日と2022年12月31日までに普通株1,043,991株を発行·発行した。
普通株株主は自社株主が議決したすべての事項を提出して一票を投じる権利があり、普通株式保有者は当社の取締役株主を選挙する権利がある。
会社は現在、発行された優先株を転換する可能性があり、2023年3月31日に発行された引受権と引受証を行使する可能性のある未来発行のために、8,671,045株の普通株を予約している。
| F-45 |
優先株
2023年3月31日及び2022年12月31日に、当社の改訂及び再記載された会社登録証明書に基づいて、当社はすでに1,437,150株額面0.0001ドルの優先株を承認した。
2023年1月、会社は23,432株と2021年の転換手形変換に関するBシリーズ優先株を発行し、転換価格は1株48.00ドルであった(付記7参照)。
Aシリーズ、A-1シリーズ、およびBシリーズ優先株は、以下の権利、優先オプション、および特権を有する:
変換
優先株は、保有者の選択により、予め定義された式に従って普通株に変換することができる。優先株の保有者はいつでも優先株を普通株に変換することができる。転換については、Aシリーズ優先株の初期転換価格は1株2.2887ドル(オリジナル発行価格)、A-1シリーズ優先株の初期転換価格は1株5.2817ドル(オリジナル発行価格)、Bシリーズ優先株の初期転換価格は1株6.1190ドル(元発行価格)であり、会社登録証明書の説明に基づいて調整することができる。優先株は、(A)総収益が100,000,000ドルを超える初公募株または(B)投票または必要な優先株株主の書面同意により指定された日時やイベントが発生したときに自動的に普通株に変換され、発行されたすべてのA系列、A系列1およびB系列優先株は、そのとき有効な転換率で自動的に普通株に変換される。
投票権 権利
Aシリーズ、A-1シリーズ、Bシリーズの優先株の所有者は、会社の任意の株主総会で行動または審議するための任意の事項投票(または会議の代わりに株主の書面による同意)のために会社株主に提出する権利があれば、優先株流通株保有者1人当たり普通株式全体の株式数に等しい投票数を投じる権利があり、当該普通株式保有者が保有する優先株株式は、その事項について投票する権利のある株主の記録日 を確定した日から普通株に変換することができる。AシリーズとA-1シリーズ優先株の保有者は1人当たり会社の取締役メンバーを選挙する権利がある。Bシリーズ株の保有者は、2人の取締役会メンバーを選挙する権利がある。各優先株は、当該等の取締役を罷免することができ、会社登録証明書に記載されている特定の場合には、当該取締役の辞任、死亡、又は罷免による空きを埋めることができる。
配当をする
Aシリーズ優先株の保有者は、Aシリーズオリジナル発行価格の年利8%で1株2.2887ドルのAシリーズ優先株発行済み株の配当を得る権利がある(Aシリーズ優先株に関連する任意の配当、株式分割、合併または他の類似資本再編が発生した場合には、適切な調整が必要である)。配当金 はAシリーズ優先株発行日から累計し、累積配当金であり、会社取締役会が発表又は会社清算時に支払う。Aシリーズ優先株の累計配当は2023年3月31日現在1,608,325ドル。
A-1シリーズ株の保有者は、A-1シリーズオリジナル発行価格1株当たり5.2817ドルの年利で配当金を得る権利がある(A-1シリーズ優先株に任意の配当、株式分割、合併、または他の類似資本再編が発生した場合には、適切な調整が必要である)。配当金は累積され、取締役会が会社の清算を発表したときに支払われる。2023年3月31日までのA-1系列優先株の累計配当金は4,617,646ドルだった。
Bシリーズ株の保有者は、Bシリーズオリジナル発行価格1株6.1190ドルの年利率で配当を得る権利がある(任意の配当金、株式分割、合併、またはBシリーズ優先株に関連する他の類似資本再編が発生した場合、適切な調整が必要である)。配当金は累積され、取締役会が会社の清算を発表したときに支払われる。B系列優先株の累計配当金は2023年3月31日現在で3,608,757ドル。
| F-46 |
清算
会社に清算、解散、または清算が発生した場合、優先株保有者は、普通株式保有者の前および普通株式保有者よりも優先して、Aシリーズ、Aシリーズ1またはBシリーズ優先株の元の発行価格に相当する金額を獲得する権利があり、発表および/または計算すべきであるが支払われていない配当金を有する。このような清算事件が発生した場合、優先株保有者に支払う必要があるすべての優先金額を支払った後、会社がその株主に割り当てることができる余剰資産は、各優先株および普通株式所有者が保有する株式数に応じて優先株および普通株式所有者に比例して割り当てられなければならず、そのため、このようなすべての証券を、その清算事件の直前の会社登録証明書条項に従って 普通株に変換したとみなす。
9. 株式認証
会社は2018年に株式承認証を発行し、47,889株の普通株及び転換可能な債務融資を購入し、転換可能な債務融資 は償還条項を有し、所有者は取締役会或いは独立評価士が決定した株式公平市価に相当する購入価格で全部或いは任意の部分承認株式証(又はそれが転換した株式)を償還することを要求する権利があることを規定した。この償還条項の結果として、株式承認証は、ASC 480に基づく財務諸表において負債と持分とを区別するように分類される。これらの株式承認証の行使価格は1株当たり0.48ドルであり,期限は10年である。権利証は各報告期間に市価で計算される.2023年3月31日と2022年12月31日の公正価値は、それぞれ64,662ドル、70,283ドルである。2023年3月31日、当社はブラック-スコアーズオプション定価モデルを用いて株式権証の公正価値を推定し、その仮定は以下の通りである:関連する普通株価値は78.38ドルである;予想年間は5.04年である;予想変動率は95.0%であり、無リスク金利は3.01%であり、配当率は0%である2022年12月31日、当社はブラック-スコアーズオプション定価モデルを採用し、以下の仮定で株式権証の公正価値を推定した:基本普通株式価値1.70ドル;予想年間5年;予想変動率86.0%;無リスク金利3.01%、配当率0%であった。
同社も2016年と2019年に株式承認証を発行したが、この等株式証はASC 480が負債に分類する基準を満たしておらず、株式分類基準に符合している。
次の表は、2023年3月31日に満期未承認株式証に関する情報をまとめたものである
| 未弁済持分証 | 行使可能な引受権証 | |||||||||||||||||||||||
授与年 |
演習 価格 | 2023年3月31日までの引受権証数 | 加重平均残存契約寿命 | 加重平均行権値 |
2023年3月31日の引受権証数 | 加重平均残存契約寿命 | 加重平均行権値 | |||||||||||||||||
| 2016 | $ | 0.01 | 11,467 | 3年半 | $ | 0.01 | 11,467 | 3年半 | $ | 0.01 | ||||||||||||||
| 2018 | $ | 0.48 | 47,889 | 5.0年 | $ | 0.48 | 47,889 | 5.0年 | $ | 0.48 | ||||||||||||||
| 2019 | $ | 5.28 | 215,854 | 2.9年 | $ | 5.28 | 215,854 | 2.9年 | $ | 5.28 | ||||||||||||||
| 275,210 | $ | 4.23 | 275,210 | $ | 4.23 | |||||||||||||||||||
10. 株式オプション
2023年3月、会社取締役会と株主は、2023年株式インセンティブ計画(“2023年計画”); を承認したが、提案された長期株式分割および普通株式認可株式増加の発効日までに、付与すべきでないbr}は、本募集説明書 からなる登録説明書が発効した日から発効する予定である。2023年計画では、委員会は、従業員、取締役、非従業員に最大200万株の普通株を奨励的かつ非法定株式オプション、制限株式奨励、制限株式単位、その他の株式ベースの奨励の形で付与することを許可する。2023年3月31日現在、2023年計画に基づいて発行された奨励はない。
| F-47 |
2016年、会社はAzitra,Inc.2016株式インセンティブ計画(以下、計画と略す)を策定し、会社員、上級管理者、取締役、コンサルタント、コンサルタントに株式オプションと制限株を付与することを規定した。2022年12月31日現在、同計画によると、付与可能な株式数は1,490,595株。オプションは異なる時間範囲で付与される。
当社は2023年3月31日および2022年3月31日までの3ヶ月間、普通株式を買収するための購入持分を付与していない。会社は、2023年、2023年、2022年3月31日までの3ヶ月間、サービス型株式オプションの発行に関する株式報酬支出38,974ドル、56,983ドルをそれぞれ確認した。2023年3月31日現在、388,990ドルの未償却補償費用 が残りの帰属期間内に償却されます。2023年3月31日と2022年3月31日までに、13,120件の業績オプションが返済されておらず、公正価値は109,551ドルである。会社は、2023年3月31日と2022年3月31日までの3ヶ月間、業績オプションを確認するための補償費用を一切持っていない。SAB 107の規定によると、当社は通常オプション条件を満たすオプションを決定し、簡略化方法を用いて期待オプション寿命を推定する。
10. 株式オプション(継続)
次の表は、2023年3月31日現在の未完了と行使可能なオプションの情報をまとめています
| 未完成オプション | 行使可能なオプション | |||||||||||||||||||||
演習 価格 | 2023年3月31日のオプション数 | 加重平均残存契約寿命 | 加重平均行権値 |
2023年3月31日のオプション数 | 加重平均残存契約寿命 | 加重平均行権値 | ||||||||||||||||
| $ | 0.48 | 246,136 | 2.8年 | $ | 0.48 | 246,136 | 2.8年 | $ | 0.48 | |||||||||||||
| $ | 0.93 | 231,680 | 2.8年 | $ | 0.93 | 231,680 | 2.8年 | $ | 0.93 | |||||||||||||
| $ | 1.70 | 812,502 | 8.0年 | $ | 1.70 | 411,707 | 7.8年 | $ | 1.70 | |||||||||||||
| 1,290,318 | 889,523 | |||||||||||||||||||||
2023年3月31日までの3ヶ月間、いかなる株式オプションも付与、行使、没収されていない。
この計画によると、2023年3月31日までに157,989株が将来付与できる。
11. 公正価値計測
次の表は公正価値レベル中の公正価値とレベルをまとめ、その中で公正価値計量は経常的な基礎によって計量された資産と負債に属し、以下の日付までである
2023年3月31日 説明する | レベル 1 | レベル 2 | 第 レベル3 | 合計する | ||||||||||||
| 負債: | ||||||||||||||||
| 普通株式証明書 | $ | - | $ | - | $ | 64,662 | $ | 64,662 | ||||||||
| 2022年変換可能手形 | - | - | 6,400,000 | 6,400,000 | ||||||||||||
| 合計する | $ | - | $ | - | $ | 6,464,662 | $ | 6,464,662 | ||||||||
2022年12月31日 説明する | レベル 1 | レベル 2 | 第 レベル3 | 合計する | ||||||||||||
| 負債: | ||||||||||||||||
| 普通株承認株式証 | $ | - | $ | - | $ | 70,283 | $ | 70,283 | ||||||||
| 2022年変換可能手形 | - | - | 5,600,000 | 5,600,000 | ||||||||||||
| 合計する | $ | - | $ | - | $ | 5,670,283 | $ | 5,670,283 | ||||||||
| F-48 |
次の表に2023年3月31日までの恒常的な方法で計測された3級機器の変化を示す
| 2022年12月31日の残高 | $ | 5,670,283 | ||
| 株式許可証は価値変動を公正に許可する | (5,621 | ) | ||
| 2022年転換可能手形公正価値変動 | 800,000 | |||
| 2023年3月31日の残高 | $ | 6,464,662 |
会社の普通株式公正価値の変動 は毎年普通株式証券負債推定値の変化の主要な駆動要素 である。普通株式公正価値の増加に伴い、手形所持者の価値も通常増加する。
各種投入の変動 は、企業価値、流動性に達する時間、変動性と割引率を含み、各報告期間2022年にチケットの推定値変化を転換できる主要な駆動要素である。企業価値の公正価値,流動性が予想される時間,変動性,割引率の増加に伴い,2022年には転換可能な手形保持者の価値が一般的に増加する。
12. 1株当たり純損失
基本 と希釈後の1株当たり純損失は以下のように計算される
1株当たりの基本純損失と薄くした後の純損失の分子は以下の通り
| 3月31日までの3ヶ月間 | ||||||||
| 2023 | 2022 | |||||||
| 純損失 | $ | 2,457,179 | $ | 2,326,017 | ||||
| 優先配当金 | 712,080 | 692,246 | ||||||
| 普通株主は純損失を占めなければならない | $ | 3,169,259 | $ | 3,018,263 | ||||
分母は以下のとおりである
| 3月31日までの3ヶ月間 | ||||||||
| 2023 | 2022 | |||||||
| 加重平均発行済み普通株式、基本普通株式、希釈普通株 | 1,043,990 | 1,043,756 | ||||||
| $0.01株式承認証 | 11,467 | 11,467 | ||||||
| 合計する | 1,055,457 | 1,055,223 | ||||||
1株当たり純損失(基本損失と赤字)は以下の通り
3月31日までの3ヶ月間 | ||||||||
| 2023 | 2022 | |||||||
| 1株当たり基本と希釈して純損失 | $ | (3.00 | ) | $ | (2.86 | ) | ||
以下の潜在普通株等価物は、期末ごとの未償還金額列に基づいて示されており、示す期間の希釈後の1株当たり純損失計算 は計上されておらず、これらの等価物を計上すると逆償却効果が生じるからである
| 3月31日 | ||||||||
| 2023 | 2022 | |||||||
| 普通株式購入オプション | 1,290,318 | 1,378,359 | ||||||
| 未弁済持分証 | 263,743 | 263,743 | ||||||
| 1,554,061 | 1,642,102 | |||||||
| F-49 |
13. 約束と事項
法律.法律
その会社は通常の業務過程で法的手続きやクレームの制約を受けている。まれに不利な決定や和解が生じるが、当社はその件などの最終処分がその財務状況、経営業績、流動資金に重大な悪影響を与えるべきではないと信じている。
ライセンス プロトコル
当社は2022年1月26日から、関係のない第三者と独占ライセンス契約(同協定)を締結した。この協定によると、会社は特定の特許の独占許可および特定の独自技術の非独占許可を取得する。合意の有効期間は、最後の許可特許の満了後または最初の許可の治療的または非治療的製品の最初の商業販売後10年までである。当社はいつでも第三者に少なくとも30日間の書面通知を提供することで、本合意を終了することができます。その協定はまた協定に規定された重大な義務違反や破産時に終了する。プロトコル終了後,いずれも終了前に発生した義務を解除してはならない.
2023年3月31日までの3ヶ月間、会社は本ライセンス契約に基づいて支払われた金を3,858ドルに資本化した。これらの 資本化コストは,許可された特許発行後の有効期限内に償却される.
運営 借約
同社はコネチカット州ブランフォード、コネチカット州グロートン、ケベック州ラバルでオフィスと実験室スペースを借りている。当社のレンタル契約は2027年5月31日までの異なる日に満了します。ほとんどの賃貸契約は固定期限と固定金額です。当社は、いかなる指数または料率に基づいて賃貸料条項、アップグレード条項、資本改善資金、または支払いが増加した賃貸契約にも参加しません。
2020年の間、会社はコネチカット州ブランフォードに位置する主要な事務と実験室空間について新しい賃貸契約を締結した。Branford借約は借約の初年度に毎月13,033ドルを支払う必要があり、次の数年間で毎年約2%増加する。Branford賃貸借契約はまた、同社に公共地域維持費用を比例的に支払うことを要求した。
2021年5月、会社はコネチカット州グロートンのオフィスと実験室と新しい賃貸契約を締結した。グロートンのレンタルは毎月4,234ドルを支払う必要があり、追加スペースをレンタルした後、この数字は2021年9月に6,824ドルに増加する。Grotonのレンタル期間は最初は1年 であり,最大3年間継続可能である.
今後のbrの次の5年間で、毎年初期または残り期間が1年を超える経営リースをキャンセルできない最低支払いは以下の通りである
| 2023 | $ | 331,801 | ||
| 2024 | 337,984 | |||
| 2025 | 257,540 | |||
| 2026 | 184,541 | |||
| 2027 | 30,983 | |||
| 将来割引されていない賃貸支払い総額 | 1,142,849 | |||
| 差し引く:利息 | (83,654 | ) | ||
| 賃貸負債現在価値 | $ | 1,059,195 |
2023年3月31日までの3ヶ月間、すべての運営レンタルのレンタル料金は27,156ドルです。すべての運営リースの加重平均レンタル期間は3.6年であった。すべての経営リースの加重平均割引率は4.25%であった。
| F-50 |
14. 退職計画
2019年1月1日から、会社はほとんどの従業員をカバーする401(K)計画を開始した。参加資格があるためには、従業員は2ヶ月連続のサービスを完了し、サービスの最初の年に少なくとも250時間または1,000時間働かなければなりません。従業員は計画資格要求を満たした後に税引前延期を行うことができる。2020年1月1日から、この計画は安全港計画brに移行し、高給従業員は、上位3%の支払いとその後の2%の支払いで100%の一致 を得る資格がない。2023年3月31日と2022年3月31日までの3ヶ月間、雇用主の対支出総額はそれぞれ2191ドルと8743ドルだった。
15. 信用リスク集中
会社を信用リスクに直面させる可能性のある金融商品には主に現金と売掛金が含まれている。
すべてのサービス収入は、2023年3月31日と2022年3月31日までの3ヶ月間、1つのお客様からのものです。2022年3月31日までの3ヶ月間、すべての贈与収入は1人の授権者から来た。
貸借対照表で決定された現金残高は金融機関の口座に格納されており、連邦預金保険会社(FDIC)が保証し、最高250,000ドルに達する。時々、銀行に預けられた現金がFDICの限度額を超える可能性がある。
2020年3月初め、新冠肺炎は全世界範囲で爆発し、全世界経済に重大な変化を招いた。当社はこれまで何の業務運用中断も経験していませんが、潜在的な経済低下や、当社に与える可能性のある直接的または間接的なマイナス影響を含むこれらの変化は特定できませんが、当社の業務、キャッシュフロー、流動資金に予想される大きな影響を与える可能性があります。
16. 関連先
2023年と2022年3月31日までの3カ月間の関連側の総収入はそれぞれ113,300ドルと120,000ドルであったが,2023年3月31日と2022年12月31日には,関連側の売掛金 はそれぞれ0ドルと175,000ドルであった。2023年3月31日と2022年12月31日までの関係者の契約負債はそれぞれ42,700ドルと156,000ドルであった。
当社は2022年9月に総額4,350,000ドルの転換可能な本票を締結し、そのうち4,000,000ドルは同時に当社Aシリーズ、A-1およびBシリーズの優先株融資投資家でもある実体に帰属している。(注7参照)
17. 後続イベント
会社は貸借対照表の日の後から2023年6月13日までの事件を評価し、2023年6月13日はこれらの簡明財務諸表が発表可能な日である。
2023年4月から6月までの間に、2022年に交換可能な手形がさらに改訂され、満期日を2023年6月30日に延長し、500,000ドルの追加手形の販売が許可され、元金総額は4,850,000ドルである
2023年5月17日、取締役会は目論見書の発効後に7.1対1の割合で前向き株式分割を行うことを許可し、本募集説明書はその構成部分である。取締役会はまた、会社普通株の法定株式を100,000,000株に増加させるとともに、普通株額面を0.0001ドルに変更することを許可した。合併財務諸表および関連脚注に含まれる普通株、普通株購入のオプション、株式データ、1株当たりデータおよび関連情報に対するすべての 引用は、株式分割の影響、普通株額面の変化、および優先株転換比率の調整(例えば、適用)を反映するように遡及調整されている。そこで、総合貸借対照表中の普通株と追加実収資本との間で、株式分割後の新たな価値を反映するように調整した。
| F-51 |
1500,000株の普通株式

Azitra, Inc.
目論見書
ThinkEquity
2023年6月15日
2023年7月10日(今回の発行日後25日目を含む)までに、これらの証券を取引するすべての取引業者は、今回の発行に参加するか否かにかかわらず、目論見書の提出を要求される可能性がある。これは,トレーダーが引受業者と売れ残りの配給や引受時に目論見書を渡す義務 の補完である.