| *具体的には、1~2回の系統的治療(免疫腫瘍学(IO)および血管内皮増殖因子チロシンキナーゼ阻害剤(VEGF-TKI)に基づく治療(組み合わせまたは順序)を含む)の後に進行するccRCC患者 |
カタログ表
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク·オネル)
| | 1934年証券取引法第13又は15(D)節に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
| | 1934年証券取引法第13又は15(D)節に提出された移行報告書 |
移行期になります 至れり尽くせり
委員会ファイル番号:
アラビフ社
(登録者の正確な氏名はその定款に記載)
| | | |
| (明またはその他の司法管轄権 会社や組織) | (税務署の雇用主 識別番号) |
オーク川ビル
(主にオフィスアドレスを実行)
(
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| クラスごとのタイトル | 取引コード | 登録された各取引所の名称 | ||
| | | |
登録者が証券法405条の規則で定義されている有名な経験豊富な発行者であるかどうかをチェックマークで示す。*は,**
登録者が当該法案の第13又は15(D)節に基づいて報告を提出する必要がない場合は,複選マークで示してください。同意を示す
再選択マークは、登録者が、(1)過去12ヶ月以内(または登録者がそのような報告書の提出を要求された短い期間内)、(1)1934年“証券取引法”第13または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にこのような提出要求を遵守してきたかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小報告会社”、“新興成長型会社”の定義を参照してください
| 大規模データベース加速ファイルマネージャ | ☐ | 加速ファイルマネージャ | ☐ | |||
| | ☒ | 規模の小さい新聞報道会社 | | |||
| 新興成長型会社 | |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する。*☐
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法規則第12 b-2条で定義されている)
登録者の非関連会社が保有する投票権と無投票権普通株の総時価は,登録者が最近完成した第2財期の最終営業日,すなわち2022年6月30日の普通株のナスダック全世界精選市場における終値に基づいて,$となる
2023年3月10日現在,登録者が発行する普通株式数は
参照により編入された文書:なし
カタログ表
| ページ |
||||
| 第1部 |
||||
| 第1項。 |
業務.業務 |
3 |
||
| プロジェクト1 A |
リスク要因 |
25 |
||
| 項目1 B。 |
未解決従業員意見 |
57 |
||
| 第二項です。 |
属性 |
57 |
||
| 第三項です。 |
法律訴訟 |
57 |
||
| 第四項です。 |
炭鉱安全情報開示 |
57 |
||
| 第II部 |
||||
| 第5項。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
58 |
||
| 第6項。 |
[保留されている] |
58 |
||
| 第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
59 |
||
| プロジェクト7 A。 |
市場リスクの定量的·定性的開示について |
66 |
||
| 第8項。 |
財務諸表と補足データ |
67 |
||
| 第9項。 |
会計と財務情報開示の変更と相違 |
67 |
||
| プロジェクト9 Aです。 |
制御とプログラム |
67 |
||
| プロジェクト9 B。 |
その他の情報 |
67 |
||
| プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 67 | ||
| 第III部 |
||||
| 第10項。 |
役員·幹部と会社の管理 |
68 |
||
| 第十一項。 |
役員報酬 |
74 |
||
| 第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
87 |
||
| 十三項。 |
特定の関係や関連取引、取締役の独立性 |
89 |
||
| 14項です。 |
チーフ会計士:費用とサービス |
90 |
||
| 第IV部 |
||||
| 第十五項。 |
表示、財務諸表明細書 |
92 |
||
| 第十六項。 |
表格10-Kの概要 |
92 |
||
第1部
一般情報
別の説明がない限り、本10−Kフォーム年次報告書で言及されている“Aravive”、“私たち”または“会社”は、Aravive,Inc.およびそれらの完全子会社Aravive Biologics,Inc.を意味する。
Aravive“および我々の他の登録および一般法商標、商標およびサービスマークは、Aravive,Inc.の財産である。本年度報告で使用される10-K表で使用される他の商標、商標およびサービスマークは、それらのそれぞれの所有者の財産である。便宜上、本年度報告の10−Kフォーム中の商標および商号は、シンボルおよび記号を有しない可能性があるが、そのような参照は、それぞれの所有者がその権利を主張しないいかなる指示として解釈されるべきではない。
私たちは、私たちの投資家関係サイトhttp://ir.aravive.com/Investors/Financial-Informationを介して、私たちの投資家に重要なビジネスおよび金融情報を公表するかもしれません。したがって、我々は、米国証券取引委員会(“米国証券取引委員会”)に提出された文書、インターネット放送、プレスリリース、および電話会議の後を除いて、投資家およびAraviveに興味を持つ他の人が、私たちがウェブサイト上で提供する情報を見ることを奨励する。当サイトに含まれている、または当サイトを介してアクセス可能な情報は、本Form 10-K年次報告に引用的に組み込まれることはありません。私たちのサイト上の情報は、本Form 10-K年次報告の一部とみなされてはなりません。
前向きに陳述する
このForm 10-K年度報告書には、リスクと不確実性に関する“前向きな陳述”が含まれている。私たちの実際の結果は展望的陳述で議論された結果と大きく違うかもしれない。本報告に含まれる非純粋な歴史的陳述は前向き陳述であり、1933年の“証券法”(以下、“証券法”と呼ぶ)第27 A条と1934年の“証券取引法”(以下、“取引法”)第21 E条の意味に適合する。前向きな陳述は、一般に、例えば、“予想”、“信じる”、“できる”、“継続”、“可能”、“推定”、“予想”、“予定”、“可能”、“計画”、“プロジェクト”、“求める”、“すべき”、“戦略”、“目標”、“意志”、““将”および同様の表現または変形は、前向き陳述を識別することを目的とする。これらの陳述は、私たちの経営陣の信念と仮定に基づいており、経営陣が現在把握している情報に基づいている。このような前向き表現はリスク、不確定要素、および他の重要な要素の影響を受け、これらの要素は実際の結果とあるイベントの時間がこのような前向き表現の明示的または暗示的な未来の結果と大きく異なる可能性がある。このような差異をもたらすか、または促進する可能性のある要因は、以下の決定された要因と、以下の第1の部分1 Aの次項で“リスク要因”と題する節で説明する要因とを含むが、これらに限定されない。しかも、このような展望的陳述は本報告の日までしか説明されていない。法律には別に規定がある以外に、このような陳述が発表された日以降の事件や状況を反映するために、いかなる前向きな陳述も更新する義務はありません。
このForm 10-K年度報告書には、私たちの業務や業界に関する市場データも含まれています。これらの市場データは複数の仮定に基づく予測を含む。これらの仮説が正しくないことが証明されれば,実際の結果はこれらの仮定に基づく予測とは異なる可能性がある.したがって、私たちの市場はこのようなデータ予測の速度で増加しないかもしれないし、全くそうではないかもしれない。もしこれらの市場がこれらの予想された速度で成長できなければ、私たちの業務、運営結果、財務状況、私たちの普通株の市場価格に損害を与えるかもしれない。
リスク要因をまとめる
以下に同社に関する主なリスクの概要を示す。各リスクについてのより詳細な説明は以下の1 A項を参照されたい。リスク要因です
リスクRうれしそうにO私たちはF財務状況P場所:A発送するC大文字?大文字要求する
| • |
我々の経営の歴史は限られており,設立以来ずっと重大な損失を被っている.私たちはただ一つの候補製品、batiraxcept、商業販売がありません。 | ||
| • | 私たちは予測可能な未来に引き続き重大な損失を受け、永遠に利益を達成したり維持したりしないかもしれないと予想している。 | ||
| • | 私たちが私たちの業務を効率的に運営するために十分な流動性を維持できるかどうかには不確実性があり、私たちが経営を続けている企業として経営を続ける能力が疑われています。 | ||
| • | 私たちは私たちの運営を支援するための追加の資金が必要になるだろうが、これらの資金は私たちに提供できないかもしれないし、受け入れ可能な条件で提供できないかもしれない。 | ||
| • | 証券発行による追加資金の調達は既存の株主に希釈される可能性があり、貸借や許可手配による資金調達は、私たちの業務を制限したり、所有権の放棄を要求したりする可能性があります。 | ||
| • | 私たちの経営業績は大幅に変動する可能性があり、私たちの経営は予測を困難にします。 | ||
私たちの業務に関わるリスク
| • |
総経済条件、地政学的条件、国内外の貿易政策、通貨政策、その他の我々がコントロールできない要素の変化は、私たちの業務や経営業績に悪影響を及ぼす可能性がある。 |
||
| • | 業務中断は私たちの将来の収入と財務状況を深刻に損害し、コストと費用を増加させる可能性がある。 | ||
| • | 私たちは政府資金への依存に要求を加え、私たちが何らかの行動をとる能力を制限し、潜在的な経済的処罰を受けることができるかもしれない。 | ||
| • | もし私たちが依存しているライセンスに基づく合意が終了された場合、あるいは製品の商業化に必要な他の権利が得られない場合、私たちは実質的な悪影響を受けるだろう。 | ||
| • | もし私たちが知的財産権許可に対する私たちの義務を履行できなかったら、私たちは重要な許可権を失うかもしれない。 | ||
| • | 私たちは第三者との協力に依存して私たちのいくつかの候補製品を開発して商業化する。 | ||
| • | 私たちは私たちの情報技術システムに広く依存しており、破壊され中断されやすい。 | ||
| • | プライバシー規制に関連する特定のデータ保護、データセキュリティ、プライバシーのリスクに直面する可能性があります。 | ||
| • | 情報セキュリティを維持できないいかなる行為も、私たちを訴訟、政府の法執行行動、コストの高い対応に直面させ、私たちの運営を混乱させ、私たちの名声を損なう可能性がある | ||
| • | 我々は現在1つの候補製品,batiraxceptのみであり,臨床開発を行っている。 | ||
| • | 私たちは私たちが臨床開発の異なる段階でバテラックセットを成功させる能力に依存している。 | ||
| • | われわれが臨床試験を行った経験は限られている。 | ||
| • | Batiraxceptの実際または期待される治療効果、または安全性または耐性が他の競合療法と同等またはそれより優れていない場合、batiraxceptの開発を中止する可能性がある。 | ||
| • | 著者らの臨床試験で使用した看護薬物標準を獲得するいかなる問題も試験遅延或いは中断を招く可能性がある。 | ||
| • | Batiraxceptが必要である場合、または付随診断から商業的利益を得ることができ、もし私たちがこのような随伴診断テストに対する規制部門の承認または承認を得ることができない場合、私たちはbatiraxceptのすべての商業的潜在力を達成できないかもしれない。 | ||
| • | もしbatiraxceptに不良な副作用がある場合、それはその開発を阻止または延期するかもしれない。 | ||
| • | われわれの実験が奏効率の増加や許容可能な有害事象のプロファイルを示さなければ,開発は中止される可能性がある。 | ||
| • | 私たちは第三者に依存して私たちの薬物物質を生産する。 | ||
| • | 私たちは商業化のために十分な数の候補製品を生産できないかもしれない。 | ||
| • | 私たちの第三者契約製造業者の変化は私たちのスケジュールと費用に悪影響を及ぼすかもしれない。 | ||
| • | 私たちはサプライヤー、製造業者、そして様々なサービスとして第三者に依存しているが、私たちはこれらのサービスを制御することができない。 | ||
| • | もし第三者の表現が満足できなければ、私たちの業務を損なうかもしれない。 | ||
| • | 私たちは重要な人員を引き留めることができないかもしれないし、合格した人員を引き付け、維持し、激励することもできないかもしれない。 | ||
臨床開発,規制承認,商業化に関するリスク
| • |
もし私たちの候補製品の臨床前研究または臨床試験の結果が不利であれば、候補製品のさらなる開発または商業化は終了または延期される可能性がある。 | |
| • | 臨床試験は非常に高価で、時間がかかり、設計と実施が困難であり、しかも不確定な結果に関連している。 | |
| • | 臨床試験で被験者を登録·保持することは高価で時間のかかるプロセスであり,我々が制御できない様々な要因によりより困難になったり不可能になったりする可能性がある。 | |
| • | もし私たちが計画通りに規制部門の承認を得ることができなければ、私たちは予想以上の追加臨床試験を行う必要があるかもしれません。これは必要な上場承認を得る費用を増加させ、必要な市場承認を受けることを延期する可能性があります。 | |
| • | 私たちの候補製品の迅速な指定は、より速い開発、規制審査、または承認過程をもたらすことができないかもしれません。 | |
| • | 私たちは私たちの候補薬の孤児薬物指定や排他性を獲得したり維持できないかもしれない。 | |
| • | 私たちは他のバイオテクノロジーと製薬会社からの激しい競争に直面している。 | |
| • | Batiraxceptは、悪影響をもたらす可能性があり、または私たちの規制の承認を遅延または阻止するか、または承認された任意のラベルまたは市場受容度を制限する可能性のある他の属性を有する可能性があります。 | |
| • | 当社の従業員、独立請負業者、主な調査者、コンサルタント、商業協力者、サービスプロバイダ、および他のサプライヤーの不適切な活動は、私たちの運営結果に悪影響を及ぼす可能性があります。 | |
| • | もし私たちが必要な規制承認を得たり遅延したりできなければ、私たちは商業化できないし、batiraxceptを商業化することができず、私たちは決して承認または商業化batiraxceptを得ることができないかもしれない。 | |
| • | 私たちが規制部門の承認を得ても、私たちは未来の発展と規制面の困難に直面する可能性がある。 | |
| • | 私たちの候補製品は医者、患者、第三者支払人、あるいは他の人に受け入れられないかもしれません。 | |
| • | 医療規制法を遵守しないいかなる行為も私たちの業務に否定的な影響を及ぼす可能性がある。 | |
| • | 私たちは製品責任リスクの影響を受けて、これは訴訟を招き、私たちに重大な責任を招くことを要求するかもしれません。 | |
| • | 私たちは販売、マーケティング、そして流通を確立する必要があるだろう。 | |
| • | 承認されてbatiraxceptをアメリカ以外の場所で商業化することは私たちを様々なリスクに直面させるだろう。 | |
| • | 最近制定された立法と未来の立法は私たちの上場承認の難しさとコストを増加させるかもしれない。 |
私たちの知的財産権に関するリスクは
| • |
私たちはbatiraxceptに対する特許保護を獲得して維持することができないかもしれないし、あるいは私たちが獲得した任意の特許保護の範囲が不足している可能性がある。 | |
| • | 私たちは私たちが依存している特許を保護したり強制したりする訴訟に巻き込まれるかもしれない。 | |
| • | 米国特許法の変化は特許の価値を低下させ、候補製品を保護する能力を弱める可能性がある。 | |
| • | もし第三者が私たちが彼らの知的財産権を侵害したと主張すれば、私たちは巨額の費用を招くか、またはbatiraxceptのさらなる開発や商業化を阻止されるかもしれない。 | |
| • | 私たちは世界各地で私たちの知的財産権を保護できないかもしれないが、これは私たちの業務を損なうかもしれない。 | |
| • | 私たちは競争相手に私たちのビジネス秘密を発見され、流用されたり開示される可能性がある。 | |
| • | 政府の様々な要求を守らなければ、私たちの特許保護は減少またはキャンセルされるかもしれない。 | |
| • | 知的財産権は必ずしも私たちの競争優位に対するすべての潜在的な脅威を解決できるとは限らない。 | |
| • | 私たちは私たちの従業員がその前の雇用主によって言われた商業機密を間違って使用したり開示したりしたと告発されるかもしれない。 |
私たちの普通株式所有権に関連するリスク
| • | 私たちはナスダック世界の精選市場の持続的な上場要求を満たすことができず、私たちの普通株が銘柄を取られる可能性があります。 | ||
| • |
私たちの株価は大きく変動し、未来も変動するかもしれない。 |
||
| • | 私たちの役員、役員、彼らの支配下の実体と主要株主は、彼らが株式を持っているので、株主の承認を提出するすべての事項に大きな影響を与えることができます。 | ||
| • | 上場企業として、私たちの運営コストは高い。 | ||
| • | 取引法の定義によると、私たちは現在“小さな報告会社”であり、より小さい報告会社を利用して得られるいくつかの大規模な開示を選択しており、これは私たちの株の投資家への魅力を低下させる可能性がある。 | ||
| • | 私たちの普通株の活発な取引市場は維持できないかもしれない。 | ||
| • | 証券や業界アナリストが我々の業務に関する研究を発表しない場合、あるいは不正確または不利な研究を発表しなければ、私たちの株価や取引量は低下する可能性がある。 | ||
| • | わが社の定款書類やデラウェア州の法律の条項は、私たちの買収をより困難にし、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止するかもしれません。 | ||
| • | 私たちが改正して再記載した会社登録証明書は、デラウェア州衡平裁判所は私たちと私たちの株主との間のいくつかの紛争の独占法廷です。 | ||
| • | 場合によっては、私たちと行政員の雇用計画は私たちに解散費の支払いを要求するかもしれない。 | ||
| • | 私たちは予測可能な未来に私たちの普通株にどんな現金配当金も支払わないと予想している。 | ||
プロジェクト1.業務
概要
Aravive,Inc.(“Aravive”または“会社”)は2008年12月10日にデラウェア州に登録設立された。我々の完全子会社Aravive Biologics,Inc.(以下“Aravive Biologics”)は2007年に設立された。我々は臨床段階の腫瘍学会社であり,癌や線維化を含む生命を脅かす疾患の進展を阻止するための変革的治療法を開発している。
Batiraxcept(前身はAVB-500)は1種の超親和性の誘導蛋白であり、Gas 6-Axlシグナル経路に対して。血清Gas 6を捕獲し、batiraxceptはAxl経路のシグナルを飢餓させ、疾病の進展を促進する生物プログラミングを潜在的に停止した。AXL受容体シグナル経路は転移、癌細胞の生存促進、薬剤耐性と免疫抑制を通じて多種のタイプの悪性腫瘍において重要な役割を果たしている。
我々の現在の開発計画は、薬理活性用量を選択することによってbatiraxcept薬の開発を加速させ、batiraxceptに最大の反応機会を有する癌患者を識別することを可能にする血清ベースの独自バイオマーカーの利用可能性のおかげである。
われわれが完成した健常ボランティアがBatiraxceptを服用した第1段階臨床試験では,BatiraxceptにおけるGas 6の機序が証明されている。重要なことは,ヒト試験や癌患者1 b期臨床試験において,batiraxceptが臨床前と第1回臨床試験において良好な安全性を有していることである。
2018年8月,米国食品医薬品局(FDA)はbatiraxcept,白金耐性再発性卵巣癌(Proc)の研究を急速発展計画に指定した。
2018年12月,batiraxceptとPROC患者の標準看護治療を組み合わせた1 b期臨床試験を開始し,2020年7月に結果を報告した。
2020年4月に、著者らは薬明生物(香港)有限会社(“無錫”)と許可と協力協定を締結し、その目標はCCN 2に対する新型高親和性二重特異性抗体を識別と開発することであり、結合組織成長因子(“CTGF”)とも呼ばれ、癌と繊維化と関係があり、そして1つの類似した標的発見スクリーニングから癌におけるAx 1/Gas 6経路の重要性を確定した。しかし2022年8月末には,我々はCTGFプロジェクトへの無錫との作業を一時的に停止し,進行中の臨床プロジェクトにすべての資源を集中させるように努力した。
2020年11月に、吾らは3 D Medicines Inc.と協力及び許可協定(“3 D Medicines協定”)を締結し、これにより、吾らは3 D Medicinesに独占許可を付与し、中国、台湾、香港及びマカオ(“領土”)でバテラシェットを唯一の薬物物質として含む製品を開発及び商業化し、人類腫瘍疾患を診断、治療或いは予防する。
2020年第4四半期にbatiraxceptによる腎透明細胞癌(CcRCC)の1 b/2期試験の1 b期部分の治療を開始し,2021年3月に1名目の患者に投与した。
2021年第1四半期に、私たちはprocにおけるbatiraxceptの登録第3段階試験を開始し、2021年4月に試験中の第1人の患者に投与した。この世界的、無作為、二重盲検、プラセボ対照試験は、15 mg/kgのbatiraxceptとパクリタキセル(PAC)の併用とPAC単独の治療効果と安全性を評価することを目的としている。
2021年5月,Batiraxceptの開発計画を第一線の膵管腺癌(PDAC)に拡張することを発表し,2021年末に試験を開始することを目標とした。私たちは2021年8月に最初の患者に薬を処方した。
2021年6月、我々はccRCC 1 b/2期臨床試験のbatiraxcept 1 b期部分の初歩的な安全性、薬物動態学(PK)、および薬効学(PD)の結果を発表した。
2021年10月、EMAは、孤児医薬品委員会の提案に基づいて、procのbatiraxceptを治療するための孤児薬物名を承認した。
2021年11月、batiraxceptとCabozantinibの併用治療ccRCCの1 b期試験を評価する予備データを公表した。
2022年1月、私たちは、Cabozantinibと組み合わせてbatiraxceptにccRCCの1 b/2期研究の第2段階を治療した第1の患者に用量を投与したことを発表した。
2022年3月,ccRCCにおけるbatiraxcept 1 b期試験の更新データと新たなバイオマーカーデータを発表した。
2022年5月、私たちはキーオピニオンリーダーシンポジウムで最新のデータと情報を提供しました。
2022年10月、私たちは3 D Medicinesから600万ドルの開発マイルストーン支払いを受け取りました。この支払いは、彼らのいる地域で開始された世界3期PROC臨床試験に基づいています。
2022年11月、FDAは、免疫腫瘍学(IO)および血管内皮増殖因子チロシンキナーゼ阻害物質(VEGF-TKI)に基づく治療(組み合わせまたは順序)を含む1~2つの以前のシステム治療シリーズを含む、末期または転移性ccRCC患者の治療のための迅速開発計画としてbatiraxceptの研究を指定した。
2023年1月、我々は世界第3段階PROC臨床試験への完全登録を発表した。
2023年2月、我々は2023年2月16日から18日までサンフランシスコで開催された2023年アメリカ臨床腫瘍学会(ASCO)泌尿生殖系(GU)癌シンポジウムで更新された1 b/2期ccRCCデータを提出した。
2023年2月、我々はFDAがPDACを治療する孤児薬としてbatiraxceptを承認することを発表した。
アラビフ管
| *具体的には、1~2回の系統的治療(免疫腫瘍学(IO)および血管内皮増殖因子チロシンキナーゼ阻害剤(VEGF-TKI)に基づく治療(組み合わせまたは順序)を含む)の後に進行するccRCC患者 |
最初の腫瘍学的適応である卵巣癌 現在の市場機会と
高レベル白金耐性再発性卵巣癌(“proc”)をわれわれの第1の適応として選択する決定は、procにおいてbatiraxceptを使用して産生された臨床前データ、すなわち高レベル漿液性卵巣癌と腫瘍高度Axl陽性の事実、およびprocの治療に有効な治療に対する高度な医学的需要に基づいている。2018年8月、FDAは、Procの高速チャネル指定のためのbatiraxceptを承認しました。
卵巣癌は米国女性がん死亡の中で5位にランクインし、女性生殖系癌の中で死亡者数が最も多い癌です。米国癌協会のデータによると、2023年に米国では約1979例の新たに診断された卵巣癌症例が、米国では約13270例の卵巣癌が死亡すると予想されています。女性の生きている間に卵巣癌のリスクは約1/78である。彼女が一生卵巣癌で死ぬ確率は約1/108です。しかし、疾患症状の非特異性のため、現在約70%の卵巣癌患者が末期疾患と診断されており、予後が悪いです。局所性疾患と診断された女性の5年生存率が90%を超えることを考慮すると,卵巣癌の早期発見能力を向上させることが重要である。
Decision Resources Group,LLC(DRG)は,その2021年1月に発表された“卵巣癌,疾患概況と予測報告”で,主要市場(米国,フランス,ドイツ,イタリア,スペイン,イギリス,日本)の卵巣癌市場総額は12.5%の年成長率で増加し,2019年の30億ドル近くから2029年の100億ドル近くに増加すると推定している。
PROC患者(その疾患が最後の白金系治療後6ヶ月以内に進行した患者)に対する第2および第3の線治療は、この場合、逐次単剤救命化学療法が多剤化学療法よりも優れていることが証明されているので、非白金単剤治療を含む(DRG−2019年12月卵巣癌疾患プロファイルおよび予測)。この集団で広く使用されている単剤療法は、ゲムシタビン、ペグ化リポソームアドリア、トポテカンおよびPACプラスまたは無ベバシズマブまたはアバスチンを含む。標準治療(PACまたはDoxil/ペグ化アドリアマイシンリポソーム(PLD))を受けて白金系薬剤耐性の再発卵巣癌を治療した患者の中位無進展生存率(PFS)は3-4カ月、中位総生存期間(OS)は9-12カ月(PFS)であったA.Davisら。/婦人科腫瘍学133(2014)624–631化学療法にベバシズマブを添加したところ、中位PFSは6.7カ月であった(プレジェンド·ローランなど、臨床医学誌32:1302-1308)ですが、オペレーティングシステムのメリットはありません(ストークラーさんら。J·クライン·オコールです2014年5月1日;32(13):1309-16)。米国では、三線白金耐性/難治性卵巣癌のもう1つの治療レジメンは、悪性BRCA変異(生殖器および/または体細胞)を有する進行卵巣癌患者の治療のための単一療法と考えられているポリADPリボポリメラーゼ阻害剤(“PARPI”)であり、これらの患者は2つ以上の化学療法を受けている。非BRCA変異/HR熟練卵巣癌患者では,第4線と後続線設定に標準的な看護はなかった。これらの患者の多くは白金に耐性があり,通常単一療法で化学療法を行っている。
Batiraxceptの1 aと1 b期臨床試験データ
84名の被験者のうち,1 a期臨床試験における健常ボランティア31名と1 b期臨床試験中のproc患者53名(10 mg/kg群40例,15 mg/kg群6例,20 mg/kg群7例)を含め,バッチラシップの安全性を検討した。
2018年12月、正常な健康ボランティア試験において、血清Gas 6レベルを2週間以内に阻害するのに十分な10 mg/kgの用量を決定した後、1 b期臨床試験で患者を治療し、10 mg/kg(2週間に1回投与)を標準ケア療法(特にPACまたはPLD)と組み合わせてproc患者の治療を開始した。1 b期臨床試験の設計部分は、健康ボランティア1期試験に基づいて予測された用量レジメンを確認し、後期試験で検討すべき用量を決定するためである。1 b期臨床試験の主な目標は、PACまたはPLDと組み合わせて使用される安全性および耐性を評価することであり、第2の目標は、PKおよびPD(血清Gas 6および可溶性Axl(“Saxl”)レベル)、治療効果、および潜在的な免疫原性を評価することである。探索的目標は、血清および/または腫瘍組織におけるこれらのバイオマーカーの発現に基づいて定義された集団におけるバイオマーカー(Gas 6,Ax 1)の治療効果の終点を含む。
セキュリティデータ:Batiraxceptの全体的な耐性は良好であり、用量制限毒性或いは予期しない安全信号はなかった。Batiraxceptに関連した重大な有害事象は報告されていない。1 b期proc試験では,2種類の有害事象がbatiraxceptに関与していると考えられており,これは独立した医学的モニタリングによって決定されている:輸液反応と疲労。試験期間中に潜在的な輸液反応を管理するための事前投与レジメンが設計·実施された。
薬物動態:*10 mg/kg行列からの31名のproc患者の以前のデータ分析では、最低有効濃度(MEC)>13.8 mg/Lに達した患者が、より大きな応答可能性およびより長いPFSを示すため、1日目15日目にバルテラクセプを服用した血液谷レベル(C 1 D 15)は、臨床活動と統計的に有意な相関を示した。すべての入選患者の実際のデータ更新を使用したモデリングは、15 mg/kg用量と比較して20 mg/kg用量でPFSの改善を予測することができないので、15 mg/kg用量がbatiraxceptの推奨2期用量またはRP 2 Dとして選択されることを示している。
臨床活動:1 b期臨床試験は安全試験であり、治療効果を証明する動力はないが、RECIST v 1.1のすべての列中のbatiraxceptに対する最適な反応に基づいて、研究者が評価した最適反応は有望な臨床活動を支持している。2019年9月、バルセロナで開催されたヨーロッパ医学腫瘍学会大会での最新の口頭報告では、1 b期臨床試験の最初の12名の患者のデータを示し、データの分析に基づいてより高用量の薬物を検討することを決定し、1 b期試験を15 mg/kgと20 mg/kgの用量レベルに拡大した。
1 b段階研究データの概要は以下のとおりである
| • |
Batiraxcept(10、15と20 mg/kg)のすべての用量の耐性は良好であり、PAC或いはPLDの連合応用の安全性とPAC或いはPLDの単独使用の安全性と一致した。輸液反応に注意すると,バルテラシプ注入に関与している可能性が高く,必要であれば,あらかじめ投与レジメンや輸液時間を調整することでこれらの反応を管理することができる。 |
| • |
緩解率に基づいて,BatiraxceptプラスPACはbatiraxceptプラスPLDよりもよく表現されているようである:すべてのキューにおいて,batiraxceptプラスPACのデータはOORが35%(8/23,2つのCRSを含む)を示し,batiraxcept+PLDのOORは11%(3/28)であった. |
| • |
効果は証明できないが,薬物曝露レベルは臨床反応と関連しており,batiraxcept谷値とPFSとの間に統計的に有意な関係があるため,10 mg/kg以上のbatiraxceptの使用を支持している。また,batiraxcept併用PACは,谷値がMEC 13.8 mg/Lより高い患者ではMECより低い患者よりも良好な臨床反応を示している。 |
| • |
すでに発表された文献と比較して、BatiraxceptはPACと併用して、複数の治療コースを受けたか、あるいは最後の白金含有レジメンを受けてから3ヶ月以内に進展した患者を治療することが期待できる(Bruchimら、“ヨーロッパ産婦人科と生殖生物学雑誌”166(2013)94–98やKobayashi-Katoらは 癌化学療法と薬理学(2019)84:33−39 37)。 |
| • |
Batiraxceptプラス化学療法は,以前ベバシズマブに曝露されていなかった患者の方が良好であったようである。 |
| o |
これまでベバシズマブ治療を受けていなかった患者の亜群分析では,バルテラクセプ併用化学療法はPACとの併用時のOORは60%(6/10),PLDとの併用時のOORは19%(3/16)であった。参考までに,ベバシズマブの第三者オレリア試験(NCT 00976911)の対照群では,55名の患者のうちPAC単独のORRは30.2%,64名の患者ではPLDのみのORRは7.8%であった。 |
| o |
Aurela試験において、10或いは15 mg/kgの連合PACを受け、しかも低谷レベルがMEC 13.8 mg/Lより高い患者の臨床活動度(有効率67%、PFS 7.7月、OS 19.3ケ月)は報告された単用PAC(ベバシズマブ)より高い患者:ORRは30.2%(CR報告なし)、MPFSは3.9ケ月、MOSは13.2ケ月(MOSは13.2月)であったPovedaらは,“臨床腫瘍学雑誌”,第33巻,第32号(11月10日),2015:pp 3836−3838)である。 |
| • |
血清Sax 1/Gas 6比レベルはbatiraxceptに対する反応と関係があり、batiraxcept化学療法の組み合わせに反応するproc患者を確定する可能性がある。 |
| o |
1 b期列全体では,Sax 1/Gas 6比率の高い患者OORは33%(11/33)であったのに対し,Sax 1/Gas 6比率が低かった患者ORRは0%(0/15)であった。 |
| o |
このバイオマーカーを調べ,反応の可能性のある患者集団に豊富に使用できるかどうかを検証する。 |
13.8 mg/Lより高い最初の谷値10 mg/kgおよび15 mg/kg患者の臨床活動データ
| PAC(N=10) |
|
| PFS中央値(月) |
7.5 |
| あるいは… |
5 (50% [完全回答2件(20%)]) |
| 回答者の中位回答期(“DOR”)(月) |
7.4 |
| オペレーティングシステム中央値(月) |
19.0 |
| • |
Batiraxcept単独治療は腫瘍反応を維持する能力を示した。1 b期臨床試験では,3名の患者は化学療法中止後3−6カ月以内に反応を維持しながらバルテラクセプ治療を継続した。15 mg/kg群は1例の腫瘍が完全に緩和し(CR)、10 mg/kg群は2例の腫瘍が完全に緩和し(PR)、引き続きバテラシプ治療を受けた。下半身.下半身 |
| • |
2人の患者は、化学療法中止後にbatiraxceptのみで治療効果(CRおよびPR)を少なくとも6カ月維持し、次の用量のbatiraxcept(1人の患者がCOVIDで入院し、もう1人の患者が休暇を取りたい)を期待できず、彼らの腫瘍は次の受診時に進展を示した。これらのデータは、これらの患者が経験した反応がbatiraxceptによる可能性が高いことを示している。 |
ステップ3:行っている登録試験設計
2020年11月19日,batiraxcept in procの登録第3段階試験設計に関するFDAから指導意見を受けたことを発表した。FDAが受信したフィードバックは、この実験が成功すれば、procの治療のためのbatiraxceptの完全な承認をサポートする可能性があるということである。現在、さらなる臨床前或いは臨床薬理学研究を必要としない。この世界的な無作為、二重盲検、プラセボ対照試験はアメリカ、カナダ、中国とヨーロッパの約155地点で行われており、15 mg/kg用量のバルテラクセプとPACの併用による高レベル漿液性卵巣癌患者の治療効果と耐性を評価することを目的としている。肝心な3期試験は2021年4月にスタートし、2023年1月初めに360人以上の患者の完全登録を実現した。試験の主要な終点はPFSであり、副次的な終点はOS、RECIST 1.1によるOOR、安全性と耐性、DOR、生活の質、臨床受益率及びPKとPD概況を含む。探索性バイオマーカーは血清Gas 6、血清Saxlとbatiraxcept薬物レベルを含む。
Procにおけるパクリタキセルと組み合わせたBatiraxceptの登録指導の第3段階スキームはまだ行われている。2023年に試験の裏線データを報告し,具体的にはデータ解析に必要なPFSイベント発生回数に依存する予定である。化学、製造、および制御(“CMC”)作業はまだ進行中であり、2023年末までに生物製品ライセンス申請(“BLA”)の提出を目指す。この世界的、無作為、二重盲検、プラセボ対照の第三段階試験は、15 mg/kg用量のバルテラクセプとパクリタキセルとプラセボ併用パクリタキセルの治療効果と耐性を評価している。
第3段階batiraxcept-OC-004設計
第二腫瘍学的徴候−ccRCC
中国農村信用社と現在の市場チャンス
私たちの第2の適応としてccRCCを選択する決定は、私たちがbatiraxceptを使用して生成した強力な臨床前データと、第三者研究と私たち自身の研究に基づいている(蘭金ら、“アメリカ国立科学院刊”2014年9月16日第111巻第37号13373–13378)は、侵襲性腫瘍行動に関連している。
腎臓癌はアメリカの癌関連死亡の主要な原因であり、男性と女性に最もよく見られる10種類の癌の一つでもある。遠隔臓器への転移は肺、骨、肝臓と脳を含み、腎臓癌患者の死亡の主要な原因であり、12%の転移性腎癌患者のみが5年以上生存できるためである。米国癌協会のデータによると,2023年に米国では約81,800例の新たな腎癌症例が予想され,14,890人がこの疾患で死亡すると予想されている。
CcRCCは腎臓癌の一種である。透明細胞という名前は、顕微鏡で癌細胞の外観を観察することを意味する。腎臓中の細胞数が急速に増加し,塊状(団塊)を形成すると,腎細胞癌が発生する。CcRCCの正確な原因は不明であるが、喫煙、ある薬物の過剰使用および遺伝感受性条件、例えばvon Hippel Lindau症候群は、VHLの遺伝子変異に関連し、CcRCC腫瘍開始の90%を制御する腫瘍抑制遺伝子であり、このタイプの癌の発展を招く可能性がある。
治療は通常手術から始まり,可能な限り多くの癌を切除し,その後放射線治療,化学療法,生物治療あるいは標的治療を行う可能性がある。大多数の腎臓癌は化学療法と放射線耐性に対して、治療方案に対する大量の満足されていない需要を招く。Decision Resources Group,LLCの2019年12月の腎癌の将来性と予測に関する報告で述べたように,FDA承認以来(それぞれ2015年と2016年),nivolumabとCabozantinibは二線療法として強く採用されている。しかし,DRGは,主な市場でnivolumabの二線患者シェアが2018年の29%−35%から2028年の22%−27%に低下し始め,一部の原因はipilimumabと組み合わせて使用される一線ラベルが拡張し,その後PD−1/PD−L 1阻害剤の他の組み合わせレジメンが一線設定に入ることであると予想している。対照的に,単一療法としてのカポザンチニブの二線患者シェアは,一線環境での使用量がそれに応じて低下し,第一線の免疫チェックポイント阻害剤を組み合わせて第一選択治療としての地位を固めたため,予測期間内に着実に増加することが予想される。DRGは2023年までにCabozantinibがnivalumabを超えてすべての主要市場の二線販売と患者シェアのリーダーになると推定し,2028年には主要市場で31%~43%の患者シェアを得ることが予想される。同様に、DRGはAxitinibの二線患者シェアが予測期間内に低下することを予想し、これはCabozantinibの吸収と第一線の設定におけるPembrolizumabとaxitinibの著しい吸収に対応する;2024年から2028年まで、その主要な市場患者シェアは6-16%で安定する。腎細胞癌のこれらの仮定は,最大の需要が二次治療およびCabozantanibとの結合である可能性を示唆している
1 b/2期臨床試験
2019年2月,われわれはわれわれの第2の腫瘍学適応ccRCCにおけるbatiraxceptの開発計画を発表した。2020年1月13日、著者らはすでにFDAから著者らの研究新薬申請(IND)を許可され、batiraxceptの研究に用いられ、第一線の治療に進展する或いは第一線の治療に耐えられない末期或いは転移性ccRCC患者の治療に用いられることを発表した。
中国農村合作医療の発展を加速するための1 b/2段階試験
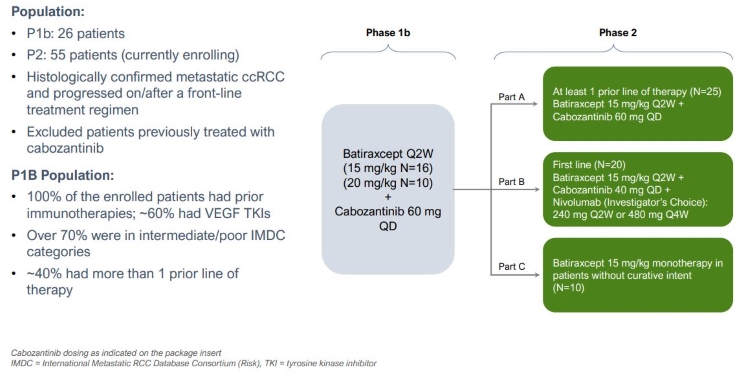
1 b段階試験は、以前の治療(2 L+)のccRCC患者のために、1日60 mgのCabozantinibを加えて、batiraxcept 15 mg/kgおよび20 mg/kgの用量を評価している。カポザンチニブ治療の事前使用は許可されていない。主な目標は安全性であり、第2および探索的目標は、推奨される第2段階用量(“RP 2 D”)、ORRおよびDORを決定することを含む。著者らのbatiraxcept in procの1 b期臨床試験において、血清Sax 1/Gas 6のベースラインレベルは臨床活動と関連していることから、ccRCC試験の目標の一つはベースラインSax 1/Gas 6をbatiraxceptプラスCabozantinibを用いて治療したccRCC患者の治療効果と相関することである。われわれは両群患者に薬物を投与し,1群は15 mg/kg,もう1群は20 mg/kgであった。1 b期データの回顧では、15 mg/kgのbatiraxceptはCabozantinib治療を受けたこれらの患者の血清Gas 6レベルを低下させる適切な用量であり、20 mg/kgのbatiraxceptは15 mg/kgのbatiraxceptよりも多くの臨床活性を提供せず、これは1 b期procデータを用いたモデリングと一致した。
2022年1月、第1の患者がccRCC試験の第2段階で用量を服用したことを発表した。BatiraxceptのccRCCの1 b/2期臨床試験の第二段階は開放ラベル研究であり、55名の患者が三つの部分の研究に参加する予定である。A部では約25名の患者を募集する予定であり,2 L+ccRCC患者に15 mg/kgのパチラシップとカルポザンチニブを併用した場合を検討する。B部分は約20名の患者を募集し、Batiraxcept 15 mg/kgと標準治療標準nivolumabとCabozantinibの併用による第一線のccRCC患者の治療効果を評価する予定である。C部では,治療意向治療条件を満たしていない慢性腎癌患者約10名におけるバルテラクセップ15 mg/kg単一療法の役割を評価する予定である。実験の第2段階では各部分の主端点はOORであり,キーの副次端点はDOR,PFS,OSである.CcRCC臨床試験の第二段階では,血清中のバイオマーカー(Sax 1とGas 6)に対するbatiraxceptの影響も探索する。
2022年8月8日現在,26名の以前治療(2 L+)の慢性腎細胞癌患者は1 b/2期試験の1 b期部分でbatiraxceptの治療を受け,投与量はそれぞれ15 mg/kg(n=16)と20 mg/kg(n=10)であり,カルボザンチニブ60 mg/dを加えた。いずれの用量でも用量制限性毒性は認められなかった。意思治療(“ITT”)群の最適総有効率(OOR,確認)は42%であった。現在行われている1 b/2期ccRCC試験の目標の1つは、ベースライン血清Sax 1/Gas 6(バイオマーカー)とbatiraxceptプラスCabozantinib治療を受けたccRCC患者の放射線反応との関連性を評価することである。バイオマーカー高集団での最適ORRは55%であった。9カ月無進展生存率(PFS)はITT群で65%,バイオマーカー高群で72%であった。Sax 1/Gas 6比率を潜在的加速承認の基礎として使用することを含む登録経路についてFDAと議論した。
2022年11月29日、FDAは、IOベースおよびVEGF-TKIベースの治療(組み合わせまたは順序)を含む1~2つの以前のシステム治療ライン後に進行する末期または転移性ccRCC患者の治療のためのbatiraxceptへの迅速追跡指定を許可したと発表した。
快速チャンネルは研究薬物の開発と審査を加速する過程を促進し、深刻な疾病を治療し、満たされていない医療需要を満たすことを目的としている。迅速チャネル指定を得た薬物は、臨床試験の設計、バイオマーカーの使用、および承認を支援するために必要なデータ範囲を含む、この薬物の開発計画を検討するために、FDAとより頻繁なコミュニケーションおよび会議を行う資格がある可能性がある。関連基準を満たしていれば,迅速チャネル指定を有する薬物も新薬申請の加速と優先審査を行う資格がある。
高速チャネルの指定は,9月に1 b/2段階ccRCC研究(AVB 500−RCC−003;NCT 04300140)の段階1 b部分からこの機構に提出された新しいデータに基づく。2022年9月26日現在,以前治療した慢性腎細胞癌患者26名(二線以上)は,1 b/2期試験の1 b期部分でbatiraxceptの治療を受け,それぞれ15 mg/kg(n=16)と20 mg/kg(n=10)であり,1日60 mgを加えた。いずれの用量でも用量制限性毒性は認められなかった。この研究の臨床データは,バルテラクセプは転移性腎細胞癌患者のCabozantinibの臨床活性を高める潜在力があり,これらの患者はIOとVEGF−TKIによる治療後に進展し(26名中14名),この群のOORが57%,中位PFSが11.4カ月であったためである。
CCRCCで予想されるBatiraxcept 2/3期試験設計
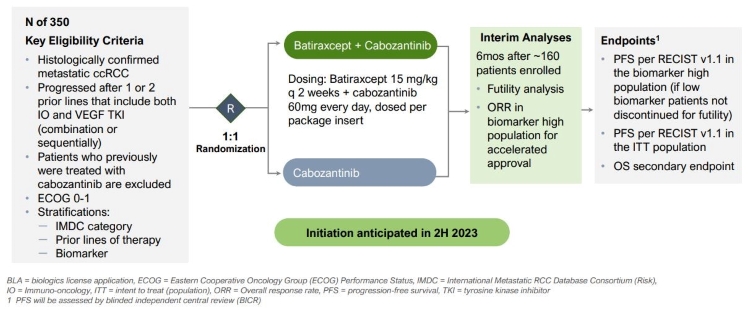
2022年第1四半期に提供されたデータに基づいて、FDAは総合的な2/3期研究を行い、中間分析を行い、バイオマーカーの低人口とOOR中の無効性を考察し、PFS終点の全面的な承認を得ることを提案した。このような研究設計は1つの研究において承認と確認性承認を加速する機会を提供し、ITTとバイオマーカーの高い人の中で最終的なPFS分析を行うことを許可することによって、潜在的に成功の機会を増加させた。9月の最新データと迅速チャネル指定を考慮して、著者らはまたIOと血管内皮増殖因子-TKIに基づく治療(組み合わせ或いは順序)に基づいて進展した末期或いは転移性腎細胞癌患者を分析する予定である。完全なプログラムと統計計画はFDAに提出される準備ができている。
私たちは2023年にccRCC試験1 b段階の追加データとccRCC試験2段階の予備データを報告する予定です。2023年下半期に登録された2/3段階試験を開始する予定です。
第三腫瘍学的適応−PDAC
1 L膵癌の1 b期設計
膵臓は長さ約6インチの腺体であり,薄い梨のような形をしており,腹部に横になり,胃,腸,他の器官に近い。膵臓は体内に2つの主要な機能がある:1)消化(分解)を助ける食物の汁を製造する;2)ホルモン、例えばインシュリンと高血糖素を製造し、血糖値のコントロールを助ける。この2つのホルモンはいずれも食べ物から得られたエネルギーを利用して貯蔵するのに役立つ。消化液は外分泌膵細胞から作製され,ホルモンは内分泌膵細胞から作製される。約95%の膵臓癌は外分泌細胞から始まり、最もよく見られる膵外分泌腫瘍は腺癌と呼ばれる
膵臓癌はアメリカで3番目に死亡率の高い癌であり、すべての癌の中で死亡率が最も高く、5年生存率は11%である(モニタリング、疫学、最終結果(SEER)サイト)です。癌は通常確定診断時に転移しているため,根治的治療に適している患者は少ない。化学療法のメリットは限られており、緻密な発育不良間質が分娩と迅速な発展の薬剤耐性を阻害しているためである。免疫治療の作用も限られており,膵癌は高度な免疫抑制の微小環境を有するためである。(拍手)ネバラ·プラグマンC、イダルゴM、カリド-ラグナーI。最先端の治療法から進行膵癌までの新しい治療法。ナト牧師クライン·オンコール。2020年2月;17(2):108-123。電話:10.1038/s 41571-0190281-6米国癌協会は2023年までに64,050人が膵癌と診断され,50,550人が膵癌で死亡すると推定している。AACRの予測によると,2025年には膵癌が世界3位の癌死亡原因となり,2040年には米国第2位の癌死亡原因となる(トップページ--定期刊行物の主な分類--定期刊行物の詳細紹介--定期刊行物の題録とダイジェスト--ダイジェスト内容2040年までに米国の癌発症率と死亡者数が予想される。JAMAネットワークが開きます。2021年4月;4(4):E 214708。DOI:10.1001/jamanetworkopens.2021.4708).
Decision Resources Group,LLCはその2019年12月に発表された膵癌疾患の概況と予測報告の中で、第一線の転移人口は膵臓癌の中で最大の薬物治療可能な人群であることを示した。そのため、第一線転移群の治療売上高は最も高く(2018年は9.01億ドル、6200万は膵臓外分泌腫瘍群からの以外、残りはすべて膵臓外分泌腫瘍群から来た)、膵臓癌治療市場全体の53%を占めた。これらの売上高は2028年までに1億ドルを超えるギャップ(2028年は7.64億ドル)が予想されており、主に多くの一線転移性膵癌の処方薬が通用していることや、いくつかの期待される末期パイプライン薬の失敗が期待されているためである。しかし、明らかにより多くの治療法が必要であり、かなりの割合の早期研究が2つ以上の研究薬を用いて行われているため、組み合わせ方に発展する傾向がある。米国とEUの5つの主要地域のアドレス可能人口(すなわちゲムシタビン+NAB−パクリタキセルを第一線の治療として受ける資格がある人口)は約3.8万人と推定されている。
2021年8月9日,我々はAVB−551 b/2期の1 b期部分の第1の患者を一次療法とし,ゲムシタビンとNaB−パクリタキセル(アブラシャ)を併用して,条件を満たしてゲムシタビンとNaB−パクリタキセルの併用治療を受けた末期または転移性膵癌患者を治療したと発表した。臨床試験の1 b段階では21名の患者の安全性,耐性,PK,PD,臨床活動を評価しており,これらの患者は15 mg/kgのバルテラセプをゲムシタビンとNAB−パクリタキセルと併用している。
2022年9月20日までに,18例のPDAC患者は15 mg/kg(1~15日目)+NAB−パクリタキセル(125 mg/m 2,1,8,15日目)とゲムシタビン(1000 mg/m 2,1,8,15日目)治療を受け,PK資料があった。Batiraxceptを用いた他の1 b期癌研究と同様に,batiraxceptへの曝露と臨床活動との間には関係があることから,PDAC研究ではbatiraxceptレベルがbatiraxceptを超えたMEC 9名中5名が反応し,MEC群より低かった9名中1名が反応した。同様に,以上のMEC群のMPFSは5.6カ月(95%CI 2.1,評価不可)であったのに対し,MEC以下の群のMPFSは2.7カ月(95%CI 1.1,5.4)であった。2022年5月、私たちはバルテラクセップとゲシタビンとナイバテインの併用耐性は一般に良好で、意外な安全シグナルがないことを報告したことがある。著者らの他の臨床試験と一致し、著者らは臨床活動とbatiraxcept薬物レベルとの関係に注目したが、PDACのような高度繊維化腫瘍は白金耐性卵巣癌と透明細胞腎癌患者より高いbatiraxcept濃度を必要とし、適切なbatiraxcept薬物レベルを達成することができるかもしれない。膵癌のこの特徴から,三胞胎レジメンから利益を得る患者の割合を増加させることができるかどうか,より高用量のbatiraxceptをテストしている。
2023年2月、FDAは、batiraxceptによるPDAC治療の孤児薬物称号ODDを付与した。
調査員が賛助した実験
2019年5月、私たちはM.D.アンダーソン癌センターと機関後援の臨床試験プロトコルを締結し、M.D.アンダーソン癌センターが行っている1/2期試験において、私たちのbatiraxceptとAstraZeneca PharmPharmticals LPの医薬製品Durvalumabを使用して供給し、白金耐性の再発性上皮性卵巣癌患者を治療する。この研究のデータはアリゾナ州で開催された2022年婦人科腫瘍学会(SGO)会議で発表された:AVB S 6 500連合Durvalumab(MEDI 4736)による白金耐性再発性上皮性卵巣癌(EOC)のIb期研究が完成した。
2020年3月,EMD Seronoの医薬製品Avelumabと併用し,末期尿路上皮癌(COAXIN試験)の治療に用いた1/2期試験で供給されたBatiraxceptを1/2期試験で服用したことを発表した。この研究のデータは,シカゴで開催された2022年ASCO会議で発表された:転移性尿路上皮癌(MUC)患者におけるAvelumabと新規Axl阻害剤AVB−S 6−500のIb研究,Abhishek Tripari,Melissa Clingerman,Riza Celine Fabreo,Adanma Ayanambakam,Brian Cross,Kelly Lynn Stratton,Michishek son,Sumanta K.PalとNeeraj Agarwal,臨床腫瘍学誌2022:16_Suppl,4579−4579。
戦略的協力
2020年4月、私たちは無錫と許可と協力協定を調印し、その目標はCCN 2に対する新しい高親和性二重特異性抗体を識別と開発することであり、CTGFとも呼ばれ、癌と繊維化に関連し、そして1つの類似した標的発見スクリーンから癌におけるAx 1/Gas 6経路の重要性を確定した。目標は2023年に臨床的に最も良い結合組織増殖と腫瘍成長に対する治療法を産生することである,その後、私たちはCTGFプロジェクトにおける無錫との仕事を一時的に停止し、私たちのすべての資源をbatiraxceptに関する臨床プロジェクトに集中させるために努力した。
2020年11月6日、我々は3 D Medicines協定に署名し、この協定に基づいて、ヒト腫瘍疾患を診断、治療または予防する唯一の医薬物質であるパチラクセットを含む製品を領土内で開発および商業化することを可能にする独占ライセンスを3 D Medicinesに付与した。
Gas 6軸経路
以下の図に示すように、Axl受容体シグナルは転移促進、癌細胞の生存、薬剤耐性と免疫抑制を通じて多種のタイプの悪性腫瘍において重要な役割を果たしている
図6:Gas 6とAx 1は多くの癌で過剰発現し、腫瘍の成長に関連している
転移、薬剤耐性、生存不良
臨床前研究において、著者らはまたAxlが放射線治療と免疫治療を結合した腫瘍に高発現し、免疫治療と放射線治療に耐性のある腫瘍の中で遺伝子不活化Axlを通じて抗腫瘍免疫反応を回復できることを発見した。
スタンフォード大学Giaccia博士の実験室で行われた臨床前研究では,Giaccia博士はAXL欠損による免疫反応がPD−L 1発現とTreg(制御性T細胞)浸透により獲得性免疫抵抗を引き起こすことを証明した。これにより,腫瘍は従来薬剤耐性を有していた場合にチェックポイント免疫治療に敏感になる。そのため、Gas 6-Axl経路阻害剤は放射線化学療法と免疫治療と結合し、1種の有望な治療方案であり、抗腫瘍免疫反応を回復する可能性がある。
Aravive−S 6(AVB−S 6)
AVB-S 6は一連の新型、高親和性、可溶性Fc融合タンパク質からなり、その中にBbatiraxceptを含み、Gas 6を遮断し、その受容体Axlとの結合を妨害することによって、Gas 6-Axlシグナル経路の活性化を阻止することを目的としている。AVB-S 6蛋白とヒトGas 6の親和性は天然Axl受容体の50-200倍であり、Gas 6を有効に分離し、Axlシグナル伝達をキャンセルした。この“誘導受容体”法は,小分子受容体チロシンキナーゼ阻害剤や抗体よりもAxlの抑制に適していると信じられており,次の図に示すように
[図7]Gas 6/Axl信号パスを抑制する方法
臨床前結果
著者らのAVB-S 6蛋白はGas 6に結合する親和性が内因性Ax 1蛋白より高いことが証明され、Gas 6/Axlシグナル伝達を抑制した。最初の臨床前薬理学的研究は各種工程AVB−S 6蛋白を用いて行われた。臨床前計画により、高いGas 6結合親和性はAVB-S 6の転移抑制と疾病進展を抑制する能力と重要かつ関連していることが表明された体内にあるそれは.AVB−S 6蛋白は転移性卵巣癌,乳癌,腎癌,膵癌のマウスモデルで有意な効果を示した。
バイオマーカー
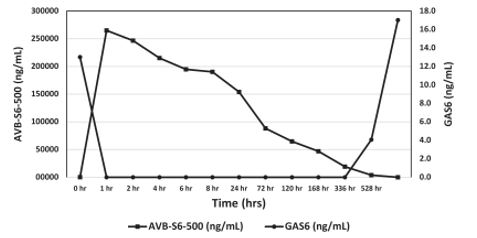
腫瘍におけるGas 6の発現はすでにいくつかの癌の不良予後要素であることが報告されており、尿路上皮癌、卵巣癌、肺腺癌、胃癌、神経膠芽腫、口腔扁平上皮癌、肝癌と腎臓癌を含む。我々が行った研究では,AVB−S 6蛋白は内因性AX 1蛋白よりも高い親和性でGas 6に結合し,AX 1受容体上のGas 6シグナル伝達を阻止した。AVB-S 6治療計画の臨床前治療効果データにより、血清Gas 6の低下と抗転移作用の間に関係があることを表明した。我々は,ヒトが我々の開発候補薬を服用した前後の血液中のGas 6レベルを測定するための試験方法を開発した。薬理活性用量のAVB−S 6が存在する場合,血清Gas 6は検出されなかった。したがって、患者の血液中のGas 6レベルはPDバイオマーカーであり、AVB-S 6の用量選択に役立ち、AVB-S 6の治療反応を予測するバイオマーカーとして機能する可能性がある。また,われわれのPhase 1 b Proc臨床試験では,治療に反応する患者ごとに化学療法の併用にかかわらず,Sax 1/Gas 6>0.773であるため,Sax 1/Gas 6比率との関係が決定された。他の臨床試験ではこれらのバイオマーカーを探索し続ける。
次の図に初めてヒト試験でBbatiraxcept試験に関与したヒト血液中のBbatiraxceptタンパク質レベルとGas 6レベルとの関係を示す。
製造業
著者らの臨床試験材料の製造は3つの主要な段階、即ち大口蛋白質(薬物)の生産、調合/充填操作及び完成品のラベル/包装操作を含む。高収率,高純度でこのタンパク質を作製した。臨床原料薬は薬品と同様に業界標準製造技術を用いて生産されている。
2017年9月以来、私たちは第三者契約メーカーの無錫に依存しており、私たちの契約メーカーが開発した細胞線とプロセスを用いて臨床原料薬とバルテラクセットの薬品を生産しており、同社は非独占的に許可している。われわれはすでに十分なbatiraxceptを生産しており,計画された3期proc試験,われわれが行っている他の臨床試験,予想されるproc BLA提出支援により患者への提出が可能である。臨床原料薬と薬品は、2016年7月に私たちの契約メーカーと締結した5年間の主製造サービス契約の条項に基づいて製造され、この協定は連続して1(1)年間を自動的に更新し、いずれか一方が当時の期限満了前に少なくとも90日前に他方に書面通知を出さない限り、更新したくないことを示している。我々の契約メーカーが180日前に書面通知を出し、この時点ですべての作業説明書が完了したことを規定しており、合意条項に違反した場合は60日以内に是正されなかった場合は、60日前に書面通知を出さなければなりません。
私たちはテキサス州にある独立した第三者と契約を結び、注射できるタンパク質のラベル、包装、流通を担当した。
著者らの人員は豊富な技術、製造、分析、品質とプロジェクト管理経験を持ち、製造プロセスの開発を実行と管理することができ、そしてFDAが公布した現行の“良好な製造規範”(“cGMPs”)とその他の法規に基づいて薬品の製造、テスト、品質放出、貯蔵と流通を監督することを要求する。CGMP条例には、人員、建物および施設、設備、構成要素および薬品容器および閉鎖的な制御、生産およびプロセス制御、包装およびラベル制御、保有および分配、実験室制御、記録および報告、ならびに製品の返品または回収に関する要件が含まれる。私たちの工場と私たちの第三者メーカーはFDAと地方当局の定期検査を受けるかもしれません。これらの検査は、私たちの生物候補薬をテストして生産するための手続きと操作を含んでいますが、私たちが適用される法規に適合しているかどうかを評価します。法律及び法規の要求を遵守しない場合、製造業者は、警告状、製品の差し押さえ又はリコール、禁止及び同意法令を含む可能性のある法律又は規制行動に直面し、これらの法令は、生産作業に重大な制限又は一時停止をもたらし、民事及び刑事罰を招く可能性がある。これらの行動はその生物候補薬の供給に実質的な影響を及ぼす可能性がある。契約メーカーと同様に、生産生産量、品質管理と品質保証、合格者不足の困難に直面する可能性がある。
研究と開発
私たちはすでに研究と開発に多くの投資を続けていくつもりだ。2022年12月31日と2021年12月31日までの年間の研究開発費総額はそれぞれ約6690万ドルと3750万ドル。
正常な業務過程において、著者らは第三者、例えばCRO、医療機関、臨床研究者と契約実験室と協定を締結し、臨床試験及び研究と臨床前テスト方面の仕事を行う。これらの第三者は、プロジェクト管理と監視サービス、規制コンサルティングと調査サービスを提供する。
競争
バイオテクノロジーと製薬業界の特徴は,新技術と独自製品の開発競争が激しいことである。私たちはバイオテクノロジーと製薬会社、学術機関、政府機関、公共と個人研究機関を含む多くの異なる源からの競争に直面している。私たちが商業化する可能性のあるどの製品も、既存の製品や療法、将来出現する可能性のある新製品や療法と競争しなければならない。
現在,FDAやEMAが承認したGas 6に対する療法はない。この作用機序は,腫瘍の成長や転移を抑制する新しい方法を代表し,腫瘍免疫逃避や他の抗癌剤に対する耐性の問題を解決していると考えられる。Exelixis社はカポザンチニブを販売しており、これはチロシンキナーゼ阻害剤であり、現在唯一発売されている化合物であり、他のいくつかの酵素を抑制するほか、Axlを抑制することができる。我々の知る限り,多くの会社はBerGenBio ASA,Astellas Pharma Inc.,Mirati Treateutics,Inc.,Les Labatores Servier,SAS,Eli Lilly and Company,Bristol−Myers Squibb Company,Tear o PharmPharmticals,Inc.,Ignyta,Inc.およびAxl阻害剤,PARP 1/2阻害剤および関連シグナル経路を開発しているいくつかの会社を含む様々な適応のAxl阻害剤の開発に注力している。
私たちの競争には、卵巣癌、腎臓癌、膵臓癌を含む、私たちが狙っている同じ治療分野の治療法を開発している会社も含まれているかもしれません。私たちの多くの潜在的な競争相手は、単独でも、あるいはその戦略パートナーと共に、研究開発、製造、臨床前テスト、臨床試験を行い、監督管理許可とマーケティング承認を得た製品の面で、私たちよりも多くの財務資源と専門知識を持っているかもしれない。これらの競争相手はまた合格した科学と管理人員を募集と維持し、臨床試験のために臨床試験場所と患者登録を確立し、著者らの計画と相補的或いは必要な技術を獲得する上で著者らと競争している。
もし私たちの競争相手が私たちが開発する可能性のあるどの製品よりも安全で、より効果的で、副作用が少なく、より便利で、より安い製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。私たちの競争相手も私たちよりも早くFDAや他の規制機関のその製品の承認を得ることができ、これは私たちの競争相手が私たちの製品が市場に入る前に強力な市場地位を確立することをもたらすかもしれない。また、多くの場合、私たちの競争能力は、後発薬の使用を奨励することを求める保険会社または他の第三者支払者の影響を受ける可能性がある。
許可協定
2012年、Aravive Biologicsはラン·スタンフォード初級大学(“スタンフォード大学”)と独占的許可協定を締結し、標的受容体チロシンキナーゼAxlの治療のための生物学的阻害剤に関連する知的財産権および有形財産を取得した。ライセンス契約は、ある声明のマイルストーンを修正し、Aravive Biologicsに付与された特許権を拡大するために、2012年、2015年、2017年に改訂された。ライセンスの期限は期限が切れた最後の特許の長さである。ライセンス契約は、以下の特許関連権利に基づいて特許材料を製造、使用または販売するAravive Biologics社にグローバル独占権利を付与する
| • |
米国特許出願:シリアル番号PCT/US 2012/069841、2012年12月14日に提出、シリアル番号13/714,875、2012年12月14日に提出、シリアル番号PCT/US 2013/074786、2013年12月12日に提出;シーケンス番号14/650,854、2015年6月9日に提出;シーケンス番号PCT/US 2015/066498,2015年12月17日に提出;シーケンス番号15/535,995,2017年6月14日に提出;どの特許がPrivate Araviveおよびすべての米国特許と外国特許およびその出願に基づく特許出願と共通しているか;それらが出願中に十分に記載されており、前述の任意の再検査または再発行がある限り、すべての部分、継続期間、および部分継続中のクレームを有する。 |
| • |
米国特許出願:シリアル番号PCT/US 2011/022125は、2011年1月21日に提出され、シリアル番号13/554,954は、2012年7月20日に提出され、シリアル番号13/595,936は、2012年8月27日に提出され、シリアル番号13/950,111は、2013年7月24日に提出され、シリアル番号14/712,731は、2015年5月14日に提出され、どの特許がスタンフォード大学独自であり、すべての米国特許および外国特許およびその出願に基づく特許出願であるか。それらが出願中に十分に記載されており、前述の任意の再検査または再発行がある限り、すべての部分、継続期間、および部分継続中のクレームを有する。 |
Aravive Biologicsは,ライセンス契約で付与された権利の対価格として,スタンフォード大学に毎年のライセンス料とマイルストーン支払いと,上記特許関連権利に基づいてカバーされる製品の純売上の特許権使用料を支払う義務がある。より具体的には、Aravive Biologicsは、(I)年間許可料、(Ii)臨床および規制マイルストーンを実現した後の合計1,000,000ドルの記念碑的支払い、および(Iii)許可製品の純売上に相当するパーセンテージ(より低い1桁)の特許権使用料を支払う義務があり、支払われた年間許可料がその許可年度に満了する任意の特許権使用料を相殺(記入)することを前提としている。スタンフォード大学独自の特許に基づく任意の権利の再許可が第三者に付与された場合、Aravive Biologicsは、再許可の下で製品を販売する際にスタンフォード大学に支払う必要があるAravive Biologicsに相当する印税のパーセンテージをスタンフォード大学に支払う義務がある。また,この場合,Aravive Biologicsはスタンフォード大学に一定割合の再許可収入を支払う必要がある.Aravive Biologicsが、任意のマイルストーンまたは他の必要な支払いを支払うことができなかったこと、または許可された製品を市場に出すために努力することを含むその規定の義務に違反した場合、スタンフォード大学は、30日以内に許可協定を終了するための書面通知を発行することができる。終了した場合、Aravive Biologicsは終了前のすべての課税金を支払う義務がある。ライセンス契約はまた、ライセンス契約の項目の下の権利またはライセンス協定の違反によって生成された、またはそれに関連する任意の責任の賠償に同意することを許可者が同意することを含む業界および学術界同様の合意に一般的な他の習慣条項および条項を含み、ライセンシーは、許可された知的財産権をその内部、非商業目的のために使用する権利を保持し、様々な保証の制限/免責声明を保持する。
テキサス州がん予防·研究機関(CPRIT)からの贈与
Aravive Biologicsは2016年、AVB-S 6の開発のためにCPRITから2000万ドルの贈与を受けた。CPRIT贈与は、Aravive BiologicsがCPRITから1ドルを得るごとに0.5ドル一致しなければならないことを要求する一致資金要件を含むCPRITの通常の資金条件に従う。そのため,Aravive Biologicsは1000万ドルのセット資金の調達を要求され,2016年以来1140万ドルを調達している。すべてのCPRIT報酬の慣例によれば、贈与報酬要求Aravive Biologicsは、CPRIT基金を使用して開発された商業製品販売の階層的特許権使用料をCPRITに支払うことを要求し、この使用料は、CPRIT収入の中央値パーセントに相当し、CPRITが贈与報酬収益400%に相当する総額を得るまでに相当する。400%の贈与報酬を支払った後,Aravive Biologicsが政府の排他性を保つ限り,Aravive BiologicsはCPRITに1%未満の特許権使用料を支払うことが義務付けられている。CPRIT贈与契約は2019年11月30日に終了しました。終了日後、CPRITの承認を受けず、未使用の補助金収益を保持してはならないが、我々の特許権使用料およびその他の義務は、場合によっては支払われた補助金収益を償還する義務、ある記録や文書を保存する義務、予期しない有害事象をCPRITに通知する義務、および私たちのCPRITプロジェクトの任意の側面に関連する任意の新しいまたは拡大された臨床前試験、臨床試験、商業化、または生産が合意終了後もテキサス州で行われる義務を確保するための合理的な努力をとる。私たちはすでに2000万ドルのすべての贈与奨励収益を受け取り、合意終了日までにすべての贈与奨励収益を支出した。
3 D Medicines Inc.プロトコル
2020年11月6日、我々は3 D Medicines協定に署名し、この協定に基づいて、ヒト腫瘍性疾患の診断、治療または予防のために、パチラクセットを唯一の医薬物質として含む製品を領土内で開発および商業化することを可能にする。
2021年8月、3 D Medicinesは3 D Medicinesから提出されたIND中国国家医療製品管理局薬物評価センター(CDE)の許可を得て、著者らの国際batiraxcept 3期PROC臨床試験に参与することができる。
3 D Medicines協定の条項によると、私たちは3 D Medicinesから2,700万ドルの現金支払い(マイルストーン支払いを含む)を取得し、3 D Medicinesから臨床開発、監督、および商業マイルストーン支払いの合計2.07億ドル(マイルストーン支払い1,500万ドルを含む)を得る資格がある。そのようなマイルストーンが本当に達成されるという保証はない。私たちとスタンフォードとの間の既存の許可プロトコルによると、私たちは3 D Medicinesプロトコルに従って3 D Medicinesから受け取ったいくつかの金額に基づいてスタンフォード大学にいくつかのお金を支払う義務がある。
私たちはまた、batiraxceptを含む製品を領土内で販売する階層印税を獲得する権利があり、低い2桁から10代程度まで様々である。(I)領土内の当該司法管轄区域内の特定特許権が最後に満了した日、又は(Ii)領土内で当該司法管轄区域内の製品が初めて商業販売されてから10(10)年となるまで、領土内の各司法管轄区域について印税を支払わなければならない。さらに、いくつかの特定の条件では、本プロトコルに従って支払われるべき特許権使用料は、模倣薬競争によって減少し、任意のこのような減少した上限は、適用される特許権使用料の支払い中に支払われるべき金額の特定のパーセンテージである。
| • |
3 D Medicines協定の条項と条件によると、3 D Medicinesは領土内の特許製品の開発と商業化を完全に担当する。 |
| • |
私たちまたは3 D Medicinesが3 D Medicinesプロトコルに実質的に違反し、そのような違反を是正できない場合、非違約者は、3 D Medicinesプロトコルを完全に終了することができる。他方が破産、解散、またはそのほとんどの財産のための係を指定した場合、いずれか一方も書面通知の下で3 D Medicinesプロトコルを終了することができる。3 D Medicines、その連合会社、またはその分割許可者が、任意の許可化合物または製品をカバーする任意の特許の有効性または実行可能性に疑問を提起する場合、または特定の期間内に許可製品の領土内でのすべての開発および商業化を実質的に停止する場合、3 D Medicinesプロトコルを終了することができるが、いくつかの例外は除外する。便宜上、3 D Medicinesは、一定の通知を提供することを前提として、3 D Medicinesプロトコルを終了することもできる。 |
この協定は、臨床供給協定と製造技術移転協定を含む3 D Medicinesと補助手配を達成することを想定している。
知的財産権
私たちは、特許権を求め、維持し、守ることを含む、私たちの業務に重要なビジネス的意義を持つノウハウ、発明、改善の保護と強化に努めています。私たちはまた、癌治療と繊維化の治療候補薬を識別し、開発するために、Gas 6-Axl経路領域における私たちの特許地位を発展、強化、維持するために、私たちの技術とノウハウに関連する商業秘密に依存している。また,データ独占性,市場独占性,特許期間延長(可能であれば)による規制保護に依存している。私たちはまた、私たちの会社名に商標保護を使用し、製品および/またはサービスが発売された時にそうすることを期待しています。
私たちのビジネス成功は、私たちの業務に関連する重要な商業技術、発明およびノウハウの特許および他の独自保護を取得して維持する能力があるかどうか、私たちの特許を擁護し実行する能力があるかどうか、私たちのビジネス秘密を秘密にし、第三者が効果的に強制的に実行可能な特許および独自の権利を侵害することなく運営されるだろう。私たちが第三者が私たちの候補治療薬を製造、使用、販売、販売、または輸入することを阻止する能力は、これらの活動をカバーする有効かつ実行可能な特許または商業秘密に基づいて権利を有する私たちの程度に依存するかもしれない。ライセンスおよび会社のすべての知的財産権について、私たちは、私たちの任意の未解決特許出願または将来提出される任意の特許出願が特許を得ることを保証することはできません。私たちはまた、私たちの任意の既存特許または将来私たちに付与される可能性のある任意の特許が、私たちの商業製品を保護し、これらの製品を製造する方法において商業的用途を有することを保証することはできません。
Gas 6−Axl計画に関する我々の特許は、新規Gas 6結合融合タンパク質に関連する物質の組み合わせ、腫瘍浸潤および/または転移の感受性または可能性を決定するための薬剤および診断方法、ならびに様々な腫瘍疾患および抗ウイルスおよび抗線維症疾患の治療のための我々の新規融合タンパク質の主張を含む9つの包括的な特許の組み合わせを含む。スタンフォード大学とのライセンス契約は、スタンフォード大学が独自に所有するか、スタンフォード大学と私たちが共同で所有するか(以下、ポートフォリオII、III、V)の知的財産権(IP)の独占的権利を提供してくれます。私たちはまた、私たちが独占的に所有している知的財産権(以下、ポートフォリオIVとVI-X)を持っている。
2023年2月1日現在、我々は、スタンフォード大学と達成されたライセンス合意のテーマである50件の特許が発行された独占的な権利(ポートフォリオIの36の有効なEP国/地域を含む)、香港記録の特許2件、および出願中の1つの特許を有している。これらの特許/特許出願の満期日は2031年である。我々はまた、スタンフォード大学と共同で所有する58件の発行された特許(ポートフォリオIIIの36の有効なEP国/地域およびポートフォリオVの7つの有効なEP国/地域を含む)およびスタンフォード大学とのライセンス契約を遵守する必要がある係属中の2つの特許を有している。これらの特許/特許出願の満期日は2033−2035年から様々である。私たちは発行された2つの特許と30個の私たちが独占的に所有している未定の申請を持っている。これらの特許の満期日は2035年から2042年まで様々である。我々の関連ポートフォリオに関するその他の詳細は以下のとおりである
| • |
ポートフォリオI-“AXLシグナルの抗転移治療における抑制作用”14件の特許出願*−US 8618254、US 9074192、US 9266947、AU 201207381、CA 2786149、CN−ZL 201180014940、EP 2525824(*18 EP国で検証)、EP 3241840(*18 EP国で検証)、IN 6649/CHENP/2012、JP 5965322、KR 127996-6、RU 2556822、ZA 2012/04866、ZA 2013/07676-2が記録されている-HK-122355、H12455-6567-6467 |
| • |
ポートフォリオ2−“疾患治療におけるAx 1/Gas 6シグナル抑制”1特許を取得−米国9,879,061 |
| • |
組み合わせIII-“修飾Axlポリペプチドおよび抗転移治療におけるAxLシグナル阻害の応用”10特許が付与されている**−US 9822347、US 1136563、AU 2013359179、AU 2019210662、CA 2894539、EP 2931265(**18 EP国で検証)、EP 3326622(**18 EP国で検証)、JP 2015-547567、JP 2018-154641、HK 1256071-1は、出願-US 17/465,203 |
| • |
ポートフォリオIV−“Gas 6阻害剤の抗ウイルス活性”1米国特許第US 10137173−−1出願待ち−CA 2909609 |
| • |
ポートフォリオV−“Gas 6阻害剤の抗線維化活性”4件に特許が付与されている*−US 10,876,176,AU 2015364437,EP 3233902(*7 EP国で検証),HK 1244825−−1はCA 2971406を出願中である |
| • |
ポートフォリオVI-“AXL誘引受容体を用いた転移性癌の治療方法”1特許出願−RU 2020116224−−10件の保留出願−US 20200289613,AU 2018359863,CA 3080732,CN 2018800840462,EP 18872866.1,HK 62020020701.2,HK 62020020973.3,JP 2020−523776,K R 10−2020−7016082,MX/a/2020/007130 |
| • |
ポートフォリオ7:“AXL餌受容体を用いた免疫グロブリンA腎症の治療方法”PCT/US 2020/022860−放棄−ビジネス決定 |
| • |
項目群VIII--“AXL誘導受容体を用いた腎透明細胞癌の治療方法”--9項目の係属中の出願であるUS 17/790282、AU 2021206613、CA 3166634、CN 2021800193394、EP 2 1738664.8、JP 20022-541228、KR 10-2022-7027149、MX/a/2022/008289、RU 2022119783 |
| • |
ポートフォリオ9-“AXL餌受容体を使用した癌診断方法”9申請待ち-US 18/016765,AU-待ちシーケンス番号,CA 3185356,CN-待ちシーケンス番号,EP 2 1948702.2,JP 2-23-502928,KR-待ちシーケンス番号,MX/a/2023/000810,RU 2023100902 |
| • |
ポートフォリオX-“局所進行性または転移性膵癌を治療するための一線療法としてAXL餌受容体を使用する方法”1申請待ち−PCT/US 2022/043234 |
未来に、私たちは特定の構成事項の申請についてもっと広い統制を提起し続ける予定だ。また、私たちは新しい候補特許、製造、臨床調合、用量と適応に関連する新しい特許を申請し、他の革新的な知的財産権の買収を評価する。
個別特許の期限は特許を取得した国の法的期限に依存する。私たちが出願を提出したほとんどの国では,特許期間は非仮出願を提出した日から20年である。米国では、特許期間の延長は、特許期限調整によって延長することができ、これは、特許権者が米国特許商標局(USPTO)の特許付与時の行政遅延による損失を補償することができ、または、1つの特許が以前に提出された特許によって最終的に放棄された場合、特許期間を短縮することができる。
FDAによって承認された薬物をカバーする特許期限も特許期間を延長する資格がある可能性があり、これにより、FDA規制審査中に失われた特許期限の補償として、米国特許の特許期限の回復が可能となる。ハッジ-ワックスマン法は特許期間を特許満了後最大5年間延長することを許可している。特許期間の延長の長さは,薬物が規制審査を受ける時間の長さと関係がある。1つの特許の残り期間を延長することは、製品承認日から合計14年間を超えることができず、承認された薬物に適用される特許を延長することしかできない。また、1つの特許は1回しか展示期間がないので、1つの特許が複数の製品に適用される場合は、1つの製品展示期間に基づくしかない。欧州や他の外国司法管区にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。可能な場合には,臨床試験の時間の長さやBLA提出に係る他の要因を考慮し,その治療候補薬剤とその使用方法をカバーするための特許出願を特許期間を延長する。
場合によっては、私たちは商業秘密に依存して私たちの技術を保護するかもしれない。しかし、商業秘密は保護するのが難しいかもしれない。私たちは、従業員、コンサルタント、科学コンサルタント、請負業者と秘密保持協定を締結することで、私たちのノウハウやプロセスを保護することを求めています。また、私たちは私たちのビルの実体安全と、私たちの情報科学技術システムの実体と電子安全を維持して、私たちの資料と商業秘密の完全性とセキュリティを維持することに力を入れています。私たちはこのような手続きに自信がありますが、合意や安全措置は違反される可能性があり、私たちはどんな違反にも対応する十分な救済措置がないかもしれません。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。私たちのコンサルタント、請負業者、または協力者が、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利について論争が生じる可能性がある。
政府の監督管理
アメリカとその他の国の連邦、州と地方政府当局は生物と医薬製品の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、販売促進、広告、流通、承認後のモニタリングと報告、マーケティング及び輸出入などの方面に対して広範な監督管理を行った。私たちの候補製品はFDAの承認を得て、アメリカで合法的に発売され、適切な外国監督管理機関の許可を得て、外国で合法的に発売することができます。規制マーケティングの承認を得る過程とその後、適切な連邦、州、地方、外国の法律法規を遵守する過程には、多くの時間と財力が必要だ。
アメリカの薬品審査手続き
アメリカでは、FDAは“連邦食品、薬物と化粧品法”、“公衆衛生サービス法”(以下は“公衆衛生サービス法”と略称する)と実施条例に基づいて薬品と生物製品を監督管理する。製品はまた他の連邦、州、そして地方法律法規によって制限されている。製品開発過程,承認過程又は承認後のいずれかの場合,出願人が適用される米国の要求を遵守できない場合には,行政又は司法制裁を受ける可能性がある。FDAの制裁には、承認保留申請の拒否、承認撤回、臨床一時停止、警告状、製品のリコールまたは市場からの撤回、製品の差し押さえ、生産または流通禁止の完全または部分的な一時停止、罰金、政府契約の拒否、原状回復、返還、返還、または民事または刑事罰が含まれる可能性がある。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない。FDAが医薬品または生物製品が米国で発売される前に必要とされるプログラムは、一般に以下のような態様を含む
| • |
良好な実験室実践又はGLP及び実験動物の人道使用の適用要件又は他の適用法規に基づいて非臨床実験室試験及び動物研究を完成させる |
| • |
FDAに研究用新薬を提出し、この新薬は人体臨床試験が始まる前に発効しなければならない |
| • |
FDAが一般的に良好な臨床実践またはGCPと呼ばれる法規および人体研究対象およびその健康情報を保護する任意の追加の要求に基づいて、十分かつ制御された人体臨床試験を行い、提案製品の期待用途に対する安全性および有効性を決定する |
| • |
非臨床試験および臨床試験の結果に基づいて、BLAの対象となる製品の持続的な安全性、純度、効力を確保するために、適用要件に適合したBLAをFDAに提出する |
| • |
施設、方法、および製品の特性、強度、品質、および純度を維持するのに十分な制御を保証するために、cGMPのコンプライアンスを評価するために、バイオ製品を製造するためのFDAの1つまたは複数の製造施設の検査を満足的に完了させる |
| • |
FDAは、BLAをサポートするデータを生成する非臨床試験および臨床研究サイトを監査することができる |
| • |
FDAによるBLAの審査および承認、またはライセンス。 |
人体で任意の生物開発候補をテストする前に、候補者は臨床前試験段階に入る。臨床前試験は、非臨床研究とも呼ばれ、製品の化学、毒性と調合に対する実験室評価、及び候補薬物の潜在的安全性と活性を評価する動物研究を含む。臨床前試験の進行はGLPを含む連邦法規と要求に適合しなければならない。臨床試験スポンサーは臨床前試験の結果を生産情報、分析データ、任意の利用可能な臨床データ或いは文献、提案された臨床方案と共にFDAに提出し、INDの一部としなければならない。IND提出後も,いくつかの臨床前試験が継続される可能性がある。INDはFDAが提案された臨床試験に対して懸念または問題を提起し、30日以内に臨床試験を一時停止しない限り、FDA受信後30日以内に自動的に発効する。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。FDAはまた、臨床試験の前または期間のいつでも、安全考慮または要件を満たしていない理由で、候補生物製品の臨床一時停止を実施することができる。FDAが臨床一時停止を強制した場合、FDAの許可がない場合には、試験は再開することができず、その後、FDAが許可した条項に基づいてしか行われない。したがって,INDの提出によりFDAが臨床試験の開始を許可するか,あるいは開始すると,このような試験を一時停止または終了するという問題はないとは判断できない。
臨床試験は,合格した調査者の監督の下で健康なボランティアや患者に候補生物製品を服用することに関連し,これらの調査者は通常,試験スポンサーに雇用されたりコントロールされていない医師である。臨床試験は,いくつかの有害事象発生時に臨床試験が停止されることを確保する停止ルールを含む,臨床試験の目標,投与手順,被験者選択と排除基準,および被験者の安全性を監視するためのパラメータを詳細に説明するプロトコルで行われる。各スキームおよびスキームの任意の修正は、INDの一部としてFDAに提出されなければならない。臨床試験はGCP要求を構成するFDAの規定に従って行わなければならず,すべての研究対象にインフォームドコンセントを要求することを含む。さらに、各臨床試験は、臨床試験を行う各機関に位置するか、またはサービスする独立した機関審査委員会またはIRBによって審査および承認されなければならない。IRBは試験参加者の福祉や権利の保障を担当し,臨床試験に参加する個人のリスクが最低に低下するかどうか,期待利益と比較して合理的かどうかなどの項目を考慮している。IRBはまた、各臨床試験対象またはその法律代表によって署名されなければならないインフォームドコンセントの形態および内容を承認し、完成まで臨床試験を監視しなければならない。人体臨床試験は通常3つの連続段階に分けて行われる;これらの段階は重複または組み合わせることができる
| • |
ステップ1それは.この生物製品は最初に健康なヒトボランティアに導入され,安全性試験が行われた。深刻または生命に危害を及ぼす疾患を治療するいくつかの製品、特に製品自体の毒性が大きすぎて道徳的に健康なボランティアに服用できない場合、最初の人体テストは通常目標疾患患者で行われる。 |
| • |
第二段階それは.生物製品は限られた患者集団で評価を行い、可能な副作用と安全リスクを確定し、特定の目標疾患に対するこの製品の治療効果を初歩的に評価し、用量耐性、最適用量と用量計画を確定する。 |
| • |
第3段階それは.臨床試験は地理的に分散した臨床試験地点で患者群を拡大し、投与量、臨床治療効果、効力と安全性を更に評価するためである。これらの臨床試験は製品の全体的なリスクと収益比を確定し、製品ラベルに十分な基礎を提供することを目的としている。 |
承認後の臨床試験は,4期臨床試験と呼ばれることがあり,最初の上場承認後に行われる可能性がある。これらの臨床試験は,治療適応が予想される患者の治療から追加的な経験を得るためのものであり,特に長期安全とフォローアップのためである。
臨床開発のすべての段階において、監督管理機関はすべての臨床活動、臨床データと臨床試験調査人員に対して広範なモニタリングと監査を行うことを要求している。臨床試験結果を詳細に説明する年次進展報告はFDAに提出しなければならない。深刻かつ予期しない有害事象については、他の研究からの任意の発見、実験室動物試験または体外試験により、ヒト被験者に重大なリスクがあることを示す任意の発見、または任意の臨床上の深刻な疑わしい副作用の発生率は、方案または研究者マニュアルに記載されているよりも増加し、迅速にFDAと調査者に書面IND安全報告を提出しなければならない。スポンサーは15日以内にINDセキュリティ報告書を提出し,スポンサーがその情報有資格報告を確定した後でなければならない。スポンサーはまた、スポンサーが初めて情報を受け取ってから7日以内に、任意の意外、致命的、あるいは生命に危害を及ぼす疑いのある副作用をFDAに通知しなければならない。第1段階、第2段階、および第3段階の臨床試験は、もしあれば、任意の指定された時間で成功しない可能性がある。FDAまたはスポンサーまたはそのデータ安全監視委員会は、研究対象が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で臨床試験を一時停止または終了することができる。同様に、臨床試験がIRBの要求に従って行われない場合、または生物製品が対象に予期せぬ深刻な傷害を受けることに関連している場合、IRBは、その機関の臨床試験の承認を一時停止または終了することができる。
臨床試験と同時に、会社は通常追加の研究を完成しなければならず、生物製品の物理的特徴に関する追加情報を開発し、cGMP要求に基づいて商業大量生産製品のプロセスを最終的に決定しなければならない。PHSAは,生物製品を用いた外来製剤導入のリスク低減を支援するために,属性が正確に定義できない製品の製造制御の重要性を強調した。生産過程は一貫して高品質の候補製品ロットを生産することができなければならず、他の標準以外に、スポンサーは最終生物製品の特性、強度、品質、効力と純度をテストする方法を制定しなければならない。また,適切な包装を選択·試験し,候補生物製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
アメリカの審査と承認の流れ
生物製品の臨床試験が完了した後,生物製品の商業販売の前に,FDAによるBLAの承認を得なければならない。BLAには,製品開発,実験室と動物研究,人体試験の結果,製品製造と成分の情報,アドバイスのラベル,その他の関連情報が含まれていなければならない。FDAはデータの提出を延期することを承認するか、またはすべてまたは部分的な免除を与えるかもしれない。テストや承認過程には多大な時間と労力が必要であり,FDAがBLAの届出を受ける保証はなく,届出してもどの承認もタイムリーに承認される保証はない.
改正された“処方薬使用料法案”(PDUFA)によると、BLAごとに相当な使用料が添付されなければならない。FDAは毎年PDUFAユーザ料金を調整する。PDUFAは承認された生物製品に年間計画費も徴収している。場合によっては、小企業が初めて出願した出願料を免除することを含む、費用を免除または減免することができる。孤児薬として指定された製品については,非孤児薬の適応も含まれていない限り,BLASで使用料を評価することはない。
FDAは特定の基準に適合する新薬と生物製品の審査過程を加速または促進するための迅速なチャネル計画を持っている。具体的には,新たな生物製品が重篤あるいは生命に危険な疾患の治療を目指し,このような疾患が満たされていない医療需要を解決する潜在力を示した場合,迅速なチャネル指定を受ける資格がある。高速チャネル指定は,製品と研究中の特定の適応の組合せに適している.高速チャネル生物製品の場合、FDAは、スポンサーがBLAの完全な部分のスケジュールを提供し、FDAが提出を受けることを前提として、BLAの完全な部分をスクロール審査することを考慮することができる。この場合、スポンサーは、“合意”の第1部を提出する際に、任意の必要な使用料を支払わなければならない。Fast Trackが指定した候補薬も優先審査する資格がある可能性があり,この条件により,FDAは届出を受けてから6カ月以内ではなく10カ月以内にBLAを審査した。
出願提出後60日以内に、FDAは、機関が提出を受け入れる前に実質的に完了したかどうかを決定するために、提出されたBLAを審査する。FDAは、それが不完全であるか、または提出時に適切に審査できないと考えられる任意のBLAの提出を拒否することができ、より多くの情報の提供を要求することができる。この場合,BLAおよび付加情報を再提出しなければならない.再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。提出された書類が届出を受けると,FDAはBLAの深い審査と実質的な審査を開始する。FDAは、提案された製品が安全であるかどうか、有効であるかどうか、および/またはその予期される用途に有効であるかどうか、許容可能な純度プロファイルを有するかどうか、および製品がcGMPに従って製造されているかどうかを決定して、製品の特性、安全性、強度、品質、効力および純度を確保および保存するためにBLAを審査する。FDAは、新規な生物製品または安全性または有効性の問題を提起する生物製品の申請を諮問委員会に提出することができ、一般に、申請を承認すべきかどうか、およびどのような条件下で承認すべきかを審査、評価および提案するための臨床医および他の専門家を含むグループである。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。バイオ製品の承認過程において、FDAはまた、バイオ製品の安全な使用を確保するために、リスク評価および緩和戦略、またはREMSを策定する必要があるかどうかを決定する。FDAがREMSが必要であると結論した場合,BLAのスポンサーは提案したREMSを提出しなければならない。必要であれば、FDAはREMSのないBLAを承認しないだろう。
BLAを承認する前に、FDAはこの製品を生産する施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、この製品を承認しないであろう。さらに、BLAを承認する前に、FDAは通常、IND試験要求およびGCP要求に従って臨床試験が行われることを確実にするために、1つまたは複数の臨床場所を検査する。CGMPとGCPに適合することを確保するためには,申請者は訓練,記録保存,生産,品質管理に多大な時間,お金,労力をかけなければならない。
関連データおよび情報が提出されたにもかかわらず、FDAは、BLAがその承認の規制基準を満たしていないことを最終的に決定し、承認を拒否する可能性がある。臨床試験から得られたデータはつねに決定的ではなく,FDAのデータ解釈は我々の同じデータに対する解釈とは異なる可能性がある。FDAが現在の形態のBLAを承認しないと決定した場合、FDAは、FDAによって決定されたBLA内のすべての特定の欠陥を記述する完全な返信を発行するであろう。決定された欠陥は微小である可能性があり、例えば、ラベル変更が必要であるか、または重大であり、例えば、追加の臨床試験が必要である。さらに、完全な返信状は、出願人がとり得る、申請を承認条件に置くための提案行動を含むことができる。完全な返信が発行された場合、出願人は、BLAを再提出し、手紙で決定されたすべての不足点を解決するか、または出願を撤回することができる。
1つの製品が規制部門の承認を得た場合、この承認は、特定の疾患および用量に明らかに限定される可能性があり、または使用の適応が制限される可能性があり、これは、製品の商業的価値を制限する可能性がある。
さらに、FDAは、いくつかの禁忌症、警告、または予防措置を製品ラベルに含めることを要求する可能性がある。FDAは、リスク管理計画の形態で製品流通、処方または調剤に制限および条件を適用することができ、または他の方法で任意の承認範囲を制限することができる。そのほか、FDAは発売後の臨床試験を要求する可能性があり、時々第四段階の臨床試験と呼ばれ、生物製品の安全性と有効性を更に評価することを目的とし、そして商業化された承認製品の安全性を監視するためにテストと監督計画を要求する。
さらに、“小児科研究公平法”によれば、BLAまたは補足BLAは、すべての関連する小児科亜群において主張される適応の安全性および有効性を評価し、各安全で有効な小児科亜群に対する製品の用量および投与をサポートするためのデータを含まなければならない。FDAはデータの提出を延期することを許可するか、またはすべてまたは部分的な免除を与えることができる。
承認後に要求する
FDAによって承認されたどの製品も、記録保存要件、製品副作用報告、FDAへの最新の安全および治療効果情報の提供、製品サンプルおよび流通要件、およびFDAの宣伝および広告要件を遵守することを含むFDAの持続的な規制を受けなければならない。その中には、他に加えて、直接消費者向け広告基準、製品承認用途に記載されていない製品用途、または患者集団における製品の普及制限、いわゆる“非ラベル”使用、業界支援の科学的および教育活動の制限、およびインターネットに関連する販売促進活動の要求が含まれている。医師は合法的に得られた製品をラベル外の薬物使用に使用する可能性があるが、医師が彼らの専門的な医療判断が適切であると思っていれば、メーカーはこのようなラベル外の薬物使用をマーケティングしたり、普及させたりしない可能性がある。
また、品質管理及び製造プロセスは、製品の長期安定性を確保するために、承認された後も適用される製造要件に適合し続けなければならない。CGMP条例では,他の事項のほかに,品質管理と品質保証およびそれに応じた記録やファイルの保守が要求され,cGMPから外れた状況を調査·是正する義務がある.承認製品の製造·流通に参加するメーカーおよび他のエンティティは、FDAおよびある州機関にその工場を登録し、cGMPおよび他の法律を遵守することを確実にするために、FDAおよび特定の州機関の定期的な抜き打ち検査を受けなければならない。そのため、メーカーはcGMPコンプライアンスを維持するために、生産と品質管理に時間、お金、労力をかけ続けなければならない。承認後に製品が発見された問題は、製品のリコールまたは市場からの撤回を含む製品、製造業者、または承認されたBLA所有者の制限をもたらす可能性がある。また,製造プロセスの変更は厳しく規制されており,変更の重要性に応じてFDAの承認を得て実施する必要がある可能性がある。新たな適応や声明を増やすなど、製品の他のタイプの変化を承認するには、FDAのさらなる審査と承認も必要である。
FDAはまた、上場後テスト、いわゆる第4段階テストを要求し、許可された製品の効果を監視するために監視を行う可能性がある。製品が以前に未知の問題を発見し、あるいは適用されたFDA要求を遵守できなかったことは、負の結果をもたらす可能性があり、負の宣伝、司法或いは行政法執行、FDAの警告状、強制要求の是正広告或いは医師とのコミュニケーション、民事或いは刑事罰などを含む。新たに発見または開発された安全性または有効性データは、新たな警告や禁忌症を増加させることを含む製品承認のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要がある可能性もある。また、新しい立法によって生成された要求を含む新たな政府要求が確立される可能性があり、またはFDAの政策が変更される可能性があり、規制部門が私たちが開発している候補製品を承認することを延期または阻止する可能性がある。
他のアメリカの医療保険法やコンプライアンスの要求は
米国では、FDAに加えて、私たちの活動は、医療保険や医療補助サービスセンター(CMS)、監察長事務室、米国司法省(DoJ)、司法省内の個別連邦検事室、州や地方政府など、様々な連邦、州、地方当局によって規制されている可能性があるが、これらに限定されない。例えば、販売、マーケティング、および科学/教育支援プロジェクトは、HITECHによって改正された“社会保障法”、“虚偽申告法”、“医師支払い透明性法”、“HIPAAプライバシーおよびセキュリティ条項”の詐欺および乱用防止条項、および改正された同様の州法を遵守しなければならない。
他の事項に加えて、連邦反リベート法規は、任意の個人またはエンティティが、購入、レンタル、注文または購入の手配、レンタルまたは購入の手配、レンタル、またはMedicare、Medicaidまたは他の連邦医療保険計画に従って精算可能な任意の物品またはサービスの見返りとして、任意の個人またはエンティティが、故意に、または故意に現金または実物で直接または間接的に、公開または隠蔽的に提供、支払い、請求、または任意の報酬を受けることを禁止する。報酬という単語は価値のあるものを含むと広く解釈されている。逆リベート法規は、医薬品製造業者と処方者、購入者、および処方マネージャーとの間の配置に適用されると解釈される。いくつかの法的例外と規制避難所がいくつかの一般的な活動を保護することは起訴されない。例外や安全港の範囲は狭く,処方,購入または推奨の報酬を誘導するために告発される可能性があるやり方に関連しており,例外や安全港の資格を満たさなければ審査される可能性がある。私たちの接近はすべての場合、法定例外や安全港保護を規制するすべての基準を満たしていないかもしれない。しかし、特定の適用された法定例外または安全港を規制するすべての要求を満たすことができず、逆リベート法規に基づいて、このような行為自体が不法であることを意味するわけではない。逆に、そのすべての事実と状況の累積審査に基づいて、この手配の合法性を逐案的に評価する。この法律に違反した行為は、監禁、刑事罰金、行政民事罰金、連邦医療計画から除外された罰を受けるだろう。
また,反リベート法規下の意図基準は“平価医療法案”(“ACA”)によってより厳しい基準に改正され,個人や実体が法規や法規違反の具体的な意図を実際に知る必要がなく違反を実施することができる。また、2010年に医療·教育和解法案により改正された患者保護やACA、または総称してACAと呼ばれ、政府は、連邦民事虚偽請求法案(FCA)の目的に基づいて、連邦反リベート法規違反によるプロジェクトやサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言することができる。
民事罰金法規は、任意の個人またはエンティティに処罰を加え、その個人またはエンティティは、連邦健康計画へのクレームを出したか、または結果として判断され、そのクレームがクレームに従って提供されていないプロジェクトまたはサービス、または虚偽または詐欺的であることを知っているか、または知るべきである。
支払人に直接クレームを提出することはありませんが、連邦民事FCAによると、医薬品製造業者は、民事通報者または準訴訟による個人またはエンティティ(製造業者を含む)の民事処罰を含む個人またはエンティティ(製造業者を含む)への民事処罰を要求される可能性があり、その理由は、連邦計画(連邦医療保険および医療補助を含む)に故意に提出すること、または連邦医療保険および医療補助を含む連邦計画(連邦医療保険および医療補助を含む)に虚偽または詐欺的な物品またはサービスクレームを提出すること、クレーム提供されていない物品またはサービスのクレーム、または医療上不必要な物品またはサービスのクレームを故意に連邦計画(連邦医療保険および医療補助を含む)に提出することを含む、虚偽または詐欺的な物品またはサービスクレームを提出すること、または連邦政府への支払い義務を回避、減少、または隠蔽することを含む。FCA違反に対する処罰には,政府が実際に受けた被害の3倍を含み,個々の虚偽クレームに対する強制民事処罰に加え,連邦医療保健計画への参加から除外される可能性があり,連邦FCAは民事法規であるにもかかわらず,FCA違反を招く行為には様々な連邦刑法が関与している可能性がある。政府は、製造業者が顧客に不正確な請求書や符号化情報を提供したり、ラベル外で製品を宣伝したりすることによって、虚偽または詐欺的なクレームの提出を“招く”と考える可能性がある。FCAについては,連邦反リベート法規違反による物品やサービスを含むクレームは虚偽または詐欺的クレームである。当社の将来のマーケティング及び報告卸売業者又はわが製品の推定小売価格に関する活動(承認された場合)、医療補助フィードバック情報を計算するための価格報告及びその他のわが製品に影響を与える連邦、州及び第三者精算に関する情報、並びに私たちの製品及び任意の将来の候補製品の販売及びマーケティングは、この法律の審査を受けるべきである。これらの法律により,製薬や他のヘルスケア会社は顧客に製品を無料で提供する疑いがあり,顧客が製品の連邦計画に課金することを期待して起訴されている。これらの会社が未承認の用途に販売し、虚偽のクレームを提出することになったため、他の会社も起訴された。
HIPAAは、計画を故意かつ故意に実行または実行しようとすることを禁止し、虚偽または詐欺的な言い訳、陳述または承諾の方法で任意の医療福祉計画(個人第三者支払者を含む)が所有または制御または保管している任意の金銭または財産を詐欺または取得し、悪巧み、計画または装置、重大な事実、または任意の重大な虚偽、架空または詐欺的陳述によって、医療福祉、プロジェクトまたはサービスの提供または支払いに関連する情報を故意に偽造、隠蔽または隠蔽する新しい連邦刑法を制定する。連邦反リベート法規と類似しており、個人や実体は法規や法規違反の具体的な意図を実際に知る必要がなく、違反を実施することができる。
私たちは連邦政府と私たちが業務を展開している州のデータプライバシーと安全規制の制約を受けるかもしれない。HIPAAはHITECH法案とそのそれぞれの実施条例改正後、個人が識別できる健康情報のプライバシー、安全と伝送に要求を提出した。他の事項に加えて、HITECHは、HIPAAのプライバシーおよびセキュリティ基準を商業パートナーに直接適用し、商業パートナーは、カバーエンティティを表すサービス提供に関連する保護された健康情報を作成、受信または取得する医療提供者、健康計画、および医療情報交換所を含むエンティティをカバーする独立した請負者またはエージェントとして定義される。HITECHはまた、実体と商業パートナーをカバーする可能性のある民事と刑事処罰を増加させ、州総検察長に新たな権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償または禁制令を要求して連邦HIPAA法を実行し、連邦民事訴訟の提起に関連する弁護士費と費用を求めることができる。また、ある州の法律は特定の場合に健康情報のプライバシーやセキュリティを管理しており、その中のいくつかの法律はより厳しく、多くの法律は互いに大きく異なり、コンプライアンス作業を複雑化させている。このような法律を守らなければ、重大な民事と刑事罰を受けるかもしれない。
さらに、ACA下の連邦医師支払い陽光法案およびその実施条例の要求に基づいて、連邦医療保険、医療補助または児童健康保険計画によって支払うことができるいくつかの薬品、器具、生物および医療用品の製造業者(いくつかの例外を除いて)は、医師および教育病院、または医師および教育病院への要求またはその指定された実体または個人を代表して行われる特定の支払いまたは他の価値移転に関する情報を毎年連邦医療保険および医療補助センター(CMS)に報告し、医師およびその直系親族が持っているいくつかの所有権および投資利益を毎年報告する。必要な情報をタイムリーかつ正確かつ完全に提出できなかったことは民事罰金を招く可能性がある。いくつかの州はまた、医薬品製造業者のマーケティング行為に制限を加え、および/または医療提供者およびエンティティに提供されるプレゼント、補償、および他の報酬を追跡および報告することを要求するコンプライアンス計画を強制的に実施する。
製品を商業的に流通させるためには、州の薬品および生物製品の製造業者および卸売業者に登録を要求する州の法律を遵守しなければならない。これらのメーカーまたはディーラーが州に営業場所がなくても、いくつかの州で製品を州のメーカーおよびディーラーに輸送することを含む。一部の州はまた、メーカーと流通業者が流通チェーン中で製品の系統を確立することを要求しており、いくつかの州はメーカーと他の州に流通チェーン中の製品の流れを追跡し追跡できる新しい技術を採用することを要求している。いくつかの州はすでに立法を公布し、製薬と生物技術会社にマーケティングコンプライアンス計画を確立し、州政府に定期報告を提出し、販売、マーケティング、定価、臨床試験およびその他の活動を定期的に公開し、および/またはその販売代表を登録し、薬局および他の医療保健実体が製薬および生物技術会社にいくつかの医師処方データを販売およびマーケティングのために提供することを禁止し、いくつかの他の販売およびマーケティング行為を禁止する。私たちのすべての活動は連邦と州消費者保護と不正競争法によって制限されるかもしれない。
もし私たちの操作が上記の任意の連邦および州医療法律または任意の他の適用可能な政府法規に違反していることが発見された場合、私たちは、MedicareとMedicaid、禁止、個人通報者が政府の名義で提起した個人訴訟、または政府契約、契約損害、名声損害、行政負担、利益減少と将来の収入減少、および業務再編を含む、重大な民事、刑事および/または行政処罰、損害賠償、罰金、返還、監禁、MedicareおよびMedicaid、禁止、個人通報者の政府名義での個人訴訟の締結を含むが、処罰を受ける可能性がある。いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります。もし私たちがそれと業務を展開することを期待している任意の医師または他の医療提供者または実体が適用されない法律に適合していないことが発見された場合、彼らは政府の援助された医療計画から除外されることを含む刑事、民事または行政制裁を受ける可能性がある。ビジネス手配が適用される医療保険法に適合することを確保することや,政府当局が行う可能性のある調査に対応することは,時間や資源がかかる可能性があり,会社の業務への関心を分散させる可能性がある。
保証範囲·定価·精算
私たちが規制部門の承認を得た任意の候補製品のカバー範囲と精算状態には、重大な不確実性がある。米国や他の国·地域の市場では、規制機関の承認を得て商業販売を行う任意の製品の販売は、第三者支払者が保険を提供する程度にある程度依存し、そのような製品のための十分な補償レベルを確立する。米国では,第三者支払者には連邦や州医療計画,個人管理のヘルスケア提供者,医療保険会社,その他の組織が含まれている。第三者支払者が製品に保険を提供するかどうかを決定するプロセスは、製品価格を決定するプロセス、または第三者支払者が製品のために支払うべき支払率を決定するプロセスから分離することができる。第三者支払者は、承認リスト上の特定の製品に保証範囲を制限することができ、処方表とも呼ばれ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。第三者決済者は、価格に挑戦し、医療の必要性を審査し、医療製品、療法、サービスの費用対効果を審査するとともに、それらの安全性と有効性を疑問視するようになっている。私たちは、私たちの候補製品の医療の必要性と費用効果、およびFDAの承認を得るのに必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。私たちの候補製品は医学的に必要で費用効果があると思われないかもしれない。支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。また、支払者が1つの商品に保険を提供することを決定し、他の支払者もその商品に保険を提供することを保証することはできない。十分な第三者精算が得られない可能性があり、製品開発投資の適切なリターンを実現するために十分な価格レベルを維持することができる。
他の国もまた違う価格設定と精算プログラムを持っている。いくつかの法域はプラスリストとネガティブリスト制度を実行し、補償価格を合意した後にのみ、製品を販売することができる。精算または定価の承認を得るために、その中のいくつかの国は臨床試験の完成を要求する可能性があり、特定の候補製品のコスト効果を現在利用可能な治療法と比較する。他の国は会社が自分の薬品価格を固定することを許可しているが、会社の利益を監視する。医療コストの下振れ圧力は非常に大きくなっている。そのため、新製品の参入にはますます高い壁が設けられている。また、一部の国では、低価格商品市場からの国境を越えた輸入が一国国内の定価に商業圧力をかけている。
政府や第三者支払者が十分な保険や補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の候補製品の適正性が影響を受ける可能性がある。また,米国では管理型医療への重視度が向上しており,医療定価の圧力が増加し続けることが予想される。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
アメリカの医療改革
米国や一部の外国司法管轄地域では、医療システムに関する複数の立法·規制改革および提案された改革が継続して存在する可能性があり、医療の獲得性を拡大し、医療の質を向上させ、医療のコストをコントロールまたは低減することを目的としている。
ACAのいくつかの条項はまだ完全に施行されておらず、いくつかの条項は司法と国会の挑戦を受けている。これらの課題やACAの廃止と代替の他の努力が我々の将来のビジネスにどのように影響するかは不明である。
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。また、米国議会は最近数回の調査を行い、薬品定価の透明性の向上、価格設定とメーカー患者計画との関係の審査、政府計画の薬品精算方法の改革を目的とした法案を提出した。
私たちは未来にどのような医療改革措置が取られるのか予測できない。連邦、州、外国の立法と規制はさらに発展する可能性があり、私たちが行っている措置は薬品価格の圧力を増加させると予想される。これらの改革は、候補製品の予想収入に悪影響を及ぼす可能性があり、私たちの全体的な財務状況や候補製品を開発する能力に影響を与える可能性がある。
現在と将来の米国の立法医療改革は、私たちが受け取った任意の承認された製品の価格を追加の下ぶれ圧力に直面させる可能性があり、カバーすれば、私たちの業務を深刻に損なう可能性があると予想しています。医療保険や他の政府が計画している精算のどの減少も、個人支払者の支払いのような減少を招く可能性がある。
外国監督管理
アメリカ国外で任意の製品をマーケティングするために、私たちは他の国と司法管轄区域の品質、安全性と有効性に関する多くの異なる監督管理要求、及び私たちの製品の臨床試験、マーケティング許可、商業販売と流通などの方面の監督管理要求を遵守する必要がある。我々の製品がFDAの承認を得ているか否かにかかわらず,外国の監督管理機関のような必要な承認を得て,外国や司法管轄区でその製品の臨床試験やマーケティングを開始する必要がある。米国に関する上記の多くの問題は欧州連合にも同様に適用されるにもかかわらず、承認手続きは国および司法管轄区域によって異なり、追加の製品テストおよび追加の行政審査期限が関連する可能性がある。他の国や管轄地域で承認を得るのに要する時間は、FDAの承認を得るのに要する時間とは異なり、さらに長くなる可能性がある。1つの国または管轄区域で規制承認を得ることは、他の国または管轄区域で規制承認を得ることを保証することはできないが、1つの国または管轄区域で規制承認を得ることができなかったか、または遅延して監督管理許可を得ることは、他の国または司法管轄区の規制手続きに悪影響を及ぼす可能性がある。
ヨーロッパデータ収集
欧州経済圏(EEA)の個人健康データの収集と使用は,2018年5月25日に施行された2016/679号一般データ保護条例(GDPR)によって管轄されている。GDPRは、EU内のデータ主体に商品やサービスを提供したり、EU内のデータ主体の行動を監視したりすることに関連している欧州経済地域に設立された任意の会社と、欧州経済区以外に設立された個人データを処理する会社に適用される。GDPRは,個人データ制御者のデータ保護義務(データ当事者の同意に関する厳しい要求,個人データの使用に関するより多くの開示,“ハイリスク”処理に対するプライバシー影響評価の要求,個人データの保留制限,強制的データ漏洩通知,“プライバシー設計”要求を含む)を強化し,データ処理者であるサービス提供者に直接義務を規定している.GDPRはまた、個人データを欧州経済圏以外の国に移すことに対して厳しいルールを実施しており、これらの国は米国のような十分な保護レベルを確保していない。GDPRの要求や欧州経済圏加盟国に関する国家データ保護法を遵守しなければ、2000万ユーロにのぼる罰金や前期の会社の世界年収の4%を招く可能性があり、金額が高い者を基準とする。また,GDPRはデータ主体にGDPR侵害による物質や非物質被害の権利を付与する。データ保護義務の変化の広さと深さを考慮して、GDPRの遵守を維持するには大量の時間、資源、および費用が必要となり、新たなデータ保護規則の遵守を保証するための追加のメカニズムを確立する必要があるかもしれない。これは激務であり、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性がある。
人力資本
私たちは私たちの成功は私たちが重要な人員を引きつけ、発展させ、維持する能力にかかっていると思う。著者らの管理と科学チームは薬物発見、研究、製造、臨床開発と監督事務の面で豊富な経験を持っており、私たちはこれらの経験と業界知識から利益を得ると信じている。私たちの研究チームは癌生物学の専門知識を持つ医学博士、医学修士、博士レベルの科学者を含む。2022年12月31日までに、私たちは23人のフルタイム従業員がいて、そのうち15人は私たちの研究チームの一部で、8人は私たちの執事チームの一部です。管理チームでは、80%が女性や少数派だ。私たちは従業員たちと集団交渉合意に到達しなかったし、何の中断も経験しなかった。私たちは私たちが従業員と仲がいいと思う。経営陣はより多くの人材の増加を求めているにもかかわらず、経営陣は業務を成功させるのに十分な人的資本を持っていると信じている。
競争力のある報酬と福祉
私たちの給与計画は、従業員の報酬を私たちの業績と一致させ、従業員の優れた業績を誘致、維持、激励するための適切なインセンティブを提供することを目的としています。私たちの給与計画の構造は短期的で長期的な業績のインセンティブ収入のバランスを取っている。具体的には
| • |
私たちは従業員に競争力のある給料を提供し、従業員の職位、技能レベル、経験、知識、地理的位置と一致している。 |
| • |
私たちは全国公認の外部給与と福祉コンサルティング会社を招いて、私たちの役員報酬と福祉計画の有効性を独立して評価し、業界内の同業者と比較した。 |
| • |
私たちは換金可能な報酬を株式業績にリンクさせることで、役員の長期持分報酬を株主の利益にリンクさせる。 |
| • |
年間昇給と奨励報酬は業績をもとに、採用時に従業員に伝え、私たちの人材管理プロセスを通じて記録され、私たちの年間審査プログラムの一部として、内部異動および/または昇進となります。 |
| • |
すべての従業員は医療保険、有給と無給休暇、401 K退職計画及び雇用主マッチング支払い(最高2%マッチング)及び生命保険と障害/意外保険を取得する資格がある。また、柔軟な休暇、遠隔医療、有給育児休暇など、従業員が彼らのニーズに合った選択肢を選択することを可能にする様々な自発的な福祉を提供しています。 |
健康と安全
従業員の健康と安全は私たちの最優先順位であり、これは私たちの経営理念と一致する。そのため、新型新冠肺炎の流行が全世界に蔓延することに伴い、私たちはすでに新冠肺炎の疫病が私たちの従業員と業務の安全に与える影響に対応し、軽減するための計画を実施した
| • |
在宅勤務の柔軟性を高める |
| • |
出勤政策を調整し、病気の人が家にいることを奨励する |
| • |
全ての場所で清掃協定を追加し |
| • |
健康と安全協定とプログラムを含む、新冠肺炎の大流行の影響に関する定期的なコミュニケーションを開始する |
核心的価値観と文化
強力で健康な文化を育成し、維持することは重要な戦略的重点だ。私たちの核心的価値観は、私たちが誰であるか、そして私たちの従業員が他の人、私たちの顧客、パートナー、株主と相互作用する方法を反映している。我々の核心的価値観には,相互尊重,他者のニーズを考慮して解決策を提供し,彼らのニーズに応えるために努力し,新たな方法を試み,長期的な観点から決定し,相互に耳を傾け,チームワークを行うことでチームの役割を発揮し,共通の目標に向かって進むことがある.私たちは協力して成果を上げ、私たちの患者と株主のために成功することに集中した。
企業情報
著者らは2008年12月にデラウェア州法律に基づいて設立され、名称はVersartis,Inc.であり、2014年3月に初公募株を完成した。Aravive Biologicsは2007年4月にデラウェア州法律によって設立され、最初はHypoximed,Inc.の名称で登録され、2009年7月にRuga Corporationと改称され、2016年10月にAravive Biologics,Inc.と改称された。2018年10月12日、当時Versartis,Inc.とAravive Biologicsという私たちは合併と再編(以下、合併と略す)を完了し、Aravive Biologicsは我々の完全子会社として存在し続けた。合併の完了に伴い、2018年10月15日に私たちの名称をVersartis,Inc.から“Aravive,Inc.”に変更した。2018年10月16日、普通株式を6対1の割合で逆分割(すなわち、逆分割)した。
利用可能な情報
私たちのサイトはwww.aravive.comです。Form 10-Kの年間報告、Form 10-Qの四半期報告、Form 8-Kの現在の報告、依頼書、その他の資料をアメリカ証券取引委員会に提出します。我々は、取引法の情報要求を遵守し、米国証券取引委員会に報告書、依頼書、その他の情報を提出または提供しなければならない。同社が米国証券取引委員会に提出したこのような報告書やその他の情報は、http://ir.aravive.com/Investors/Financial-Informationである当社のサイトで無料で取得することができます。当サイトに含まれている、または当サイトを介してアクセス可能な情報は、本Form 10-K年次報告に引用的に組み込まれることはありません。私たちのサイト上の情報は、本Form 10-K年次報告の一部とみなされてはなりません。
米国証券取引委員会はまた、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の情報を含むウェブサイトを維持しており、URLはwww.sec.govである。
プロジェクト1 Aリスク要因です
私たちの普通株に投資することは高い危険と関連がある。以下のリスクと、タイトルを含む本Form 10-K年次報告の他のすべての情報をよく考慮しなければなりません“前向きな陳述についての警告説明は”第2部プロジェクト7です“管理する’財務状況と経営成果に関する検討と分析”そして我々の合併財務諸表と付記は、本年度報告の他の場所にあるForm 10-Kを含む。以下に説明する危険は私たちが直面している唯一の危険ではない。次のどんな危険も私たちの業務に実質的な悪影響を及ぼす可能性がある。次のいずれかのリスクが実際に発生すれば、我々の経営業績、財務状況、流動性は重大な悪影響を受ける可能性がある。したがって、私たちの普通株の取引価格は下がるかもしれません。あなたは投資の一部または全部を失うかもしれません。私たちの業務、財務状況、経営結果もリスクと不確実性の被害を受ける可能性があり、これらのリスクと不確実性は現在私たちは知らない、あるいは私たちは現在実質的ではないと考えている
私たちの財政状況と資本要求と関連した危険
私たちの経営の歴史は限られており、設立以来ずっと大きな損失を受けており、予測可能な未来には、引き続き大量かつ増加していく損失を被ることが予想される。私たちはただ一つの候補製品batiraxceptしかありません。商業販売がなく、私たちの限られた運営履歴に加えて、私たちの業務を評価し、私たちの将来の生存能力を評価することが困難になります
私たちは臨床段階の生物製薬会社で、運営の歴史は限られている。私たちはどんな製品収入も発生したこともなく、どの製品も販売を許可されたことがない。
これまで、私たちの業務は主に私たちの唯一の候補製品batiraxceptの開発に集中してきた。私たちはまだ市場承認を得ることに成功しておらず、ビジネス規模のbatiraxcept製品の生産に成功していない、あるいはbatiraxceptの商業化に成功するために必要な販売やマーケティング活動を行っている。したがって、私たちがより長い運営履歴や成功開発と商業化候補製品の歴史を持っていれば、私たちの将来の成功や生存能力の予測はそれほど正確ではないかもしれない。
私たちのどの候補製品の販売が規制部門の承認を得ても、もし本当に収入が生まれることができれば、私たちはいつ収入を生み出すことができるのか分からない。私たちが収入を作る能力は私たちの能力を含む多くの要素にかかっています
| • |
私たちの製品に受け入れ可能な価格を設定し、第三者支払者から保険と十分な補償を受けます |
| • |
販売、マーケティング、製造、流通システムを構築し |
| • |
上場企業の臨床、製造、計画としての将来の臨床開発と商業化努力と運営を支援する人員を含む、運営、財務、管理情報システムおよび人員を増加させる |
| • |
大口材料の製造能力を発展させ、受け入れ可能なコストレベルで商業ロットの候補製品を生産する |
| • |
私たちの製品を医療界や第三者支払者や消費者に広く市場受容度を得ることができます |
| • |
経験豊富な管理とコンサルティングチームを引き付けて維持します |
| • |
他の人と協力して私たちの製品の商業販売を行っています |
| • |
私たちの知的財産権の組み合わせを維持し、拡大し、保護する。 |
開発や製造に関連する多くのリスクや不確実性のため、収入が生じるかどうかは予測できない。もし私たちが上記のすべての要素を成功的に実行できなければ、私たちの業務は成功しないかもしれません。私たちは決して収入を生じないかもしれません。あなたの投資は不利な影響を受けるでしょう。
設立以来、私たちはすでに重大な損失が発生しており、予測可能な未来には引き続き重大な損失を受け、永遠に実現したり、利益を維持したりすることはないかもしれない。
私たちが設立して以来、私たちは毎年重大な運営損失が発生しており、予測可能な未来には大量かつ増加する損失が予想される。2022年12月31日までの累計赤字は約6.161億ドル。
これまで、私たちは主に私たちの株式証券、債務融資、CPRIT贈与収益、市場で私たちの普通株を発行し、私たちの普通株を公開し、許可協定から受け取った前金とマイルストーン支払いによって、私たちの業務に資金を提供してきました。我々は基本的にすべての努力を臨床研究を含めて研究と開発に投入しているが,候補製品の開発はなされていない。私たちの費用は以下のように増加すると予想される
| • |
私たちの唯一の候補製品batiraxceptや未来の候補製品の研究開発を続けています |
| • |
将来、より多くのバルチラシープ臨床研究を行い、特により多くの患者の後期試験に関連する |
| • |
他の候補製品の発見や許可を求める; |
| • |
Batiraxceptと将来臨床研究に成功した任意の候補製品の承認を求める |
| • |
営業、マーケティング、および流通インフラを確立し、規制部門の承認を得た場合に、商業規模のbatiraxcept生産を達成するためのプロセスを改善することを含む、batiraxceptまたは他の将来の候補製品を商業化するための製造能力を拡大すること |
| • |
運営、財務、情報管理システムを強化し、Batiraxceptや任意の将来の候補製品の開発を支援する者を含む多くの人員を雇用し、候補製品が承認された場合には、我々の商業化努力を支援する。 |
将来的に利益を上げるためには、batiraxceptや他の巨大な市場潜在力を持つ製品を開発し、最終的に商業化しなければならない。これは、batiraxceptおよび任意の未来の候補製品を推進し、これらの候補製品の臨床研究を完了し、これらの候補製品の規制承認を得ること、および規制承認を得ることができる製品を製造、マーケティング、販売することを含む一連の活動で成功することを要求するであろう。私たちはこれらの活動で成功しないかもしれないし、将来的に利益を得るのに十分な収入を生むことはできないかもしれない。私たちが利益を出しても、私たちは四半期や年間の収益性を維持したり向上させることができないかもしれない。持続的な利益を達成できなければ、会社の価値を下げ、資金を調達し、業務を拡大し、候補製品を多様化し、候補製品をマーケティングする(承認されれば)、あるいは運営を継続する能力を弱める可能性がある。
我々の候補製品の臨床開発の進展に伴い,我々の研究·開発費は大幅に増加することが予想される。私たちの業務は多くのリスクと不確実性に関連しているため、開発費用を増加させる時間や金額を正確に予測することができず、FDAや同様の非米国規制機関が現在予想されている基礎研究や臨床試験を要求すれば、私たちの費用は予想を超えるレベルに増加する可能性がある。私たちの候補製品batiraxceptが商業販売のために承認されても、batiraxceptの商業発売と関連する商業規模製造要求に関連する巨額のコストが生じることが予想される。そのため、予測可能な未来には、重大かつ増加していく運営損失と負のキャッシュフローを受け続けることが予想される。バイオ製薬製品の開発や商業化に関連する多くのリスクや不確実性のため、将来の支出の時間や金額、あるいはいつ、または利益を達成または維持できるかどうかを正確に予測することはできない。このような損失はすでに私たちの財務状況と運営資本に悪影響を与え続けるだろう。
私たちが私たちの業務を効率的に運営するために十分な流動性を維持できるかどうかには不確実性があり、私たちが経営を続けている企業として経営を続ける能力が疑われています。
我々が2022年12月31日まで及び2022年12月31日までの総合監査財務諸表は、今後12ヶ月間経営を継続するという仮定に基づいて作成されています。私たちの経営陣の結論は、私たちの運営が経常的に赤字になっていることと、運営から大きな収入や正のキャッシュフローが生じていないという事実は、財務諸表発表後の今後12ヶ月以内に継続して経営を続ける企業としての能力に大きな疑いを抱かせているということです。私たちの監査人はまた、2022年12月31日現在と2022年12月31日までの年次財務諸表報告書に、このような不確実性に関する説明的な段落を含んでいます。私たちが継続的に経営している企業としての経営継続能力は、追加株式や債務融資を獲得し、運営効率をさらに向上させ、支出を削減し、最終的に収入を創出する能力にかかっています。成立以来,純損失と運営キャッシュフローが負となる状況が発生している。2022年12月31日現在、私たちの累計赤字は6.161億ドル、運営資金は3590万ドルです。将来的には、batiraxceptの開発や関連行政活動に関する費用が引き続き赤字になることが予想されます。2022年12月31日現在、私たちの現金と現金等価物の残高は約5370万ドルで、現金と高流動性アメリカ通貨市場基金への投資が含まれている。私たちの現在の現金と現金等価物は、2023年第4四半期まで、現在計画されている運営に資金を提供するのに十分であると信じていますが、今後12ヶ月の運営と資本需要を満たすために追加の資本を求め、私たちの臨床開発計画を開発の後期段階に進め、私たちの臨床候補製品を商業化する必要があります。経営陣は過去に資金調達に成功したが、私たちが成功する保証はなく、将来会社が受け入れられる条項で必要な融資を受ける保証もない。したがって,当社は,このような計画が本年度報告に含まれる10−K表の財務諸表を米国証券取引委員会に提出してから1年以内に効率的に実施することができ,我々の業務を効率的に運営するために十分な流動性を維持する能力があるかどうか,持続的な経営企業としての能力を大きく疑っていると結論できない。
私たちは私たちの運営を支援するための追加の資金が必要になるだろうが、これらの資金は受け入れ可能な条項で私たちに提供できないかもしれないし、全く得られないかもしれない。これは、私たちの研究開発計画と他の運営または商業化努力を延期、減少、または一時停止させるだろう。
Batiraxceptと任意の将来の候補製品の開発と潜在的な商業化を完了し、それらが承認されれば、大量の資金が必要となる。また,BLA提出や潜在的な商業化に備えて,今年の製造コストは大幅に増加することが予想される。2022年12月31日現在、私たちは約5370万ドルの現金と現金等価物を持っている。私たちは、私たちの既存の業務計画によると、私たちの既存の現金と現金等価物は、私たちが現在計画している2023年第4四半期の運営に資金を提供するのに十分であると信じている;しかし、私たちの既存の現金と現金等価物は、私たちがbatiraxceptの臨床開発と商業化を達成するのに十分ではないだろう。私たちの未来の資金調達需要は多くの要素に依存し、その中のいくつかの要素は私たちがコントロールできない
| • |
私たちの将来の臨床研究の進捗とコスト |
| • |
著者らの臨床試験中の患者数と病状進行の時間の長さ |
| • |
FDAと他の規制機関が承認した時間と関連するコストを求める |
| • |
もし私たちがより大規模なbatiraxceptを生産することを選択すれば、そのようなコストを準備する |
| • |
Batiraxceptまたは任意の将来の候補製品が承認された場合、製品販売、マーケティング、製造、および流通を含む商業化活動のコスト; |
| • |
私たちまたは未来のパートナーが発売した任意の製品の市場受容度と受容率 |
| • |
任意の特許請求書および他の知的財産権の費用の提起、起訴、弁護、および実行; |
| • |
私たちは追加的な協力、許可、商業化、または他の計画の能力、およびそのような計画の条項と時間を達成する |
| • |
競争的な技術や他の不利な市場発展が現れました |
| • |
合格した人材を引きつけ、採用し、維持するコスト。 |
私たちは私たちの開発のために約束したいかなる物質、外部資金源、または他の支援も持っていない。我々は,Piper Sandler&Co.(“Piper Sandler”)やCantor Fitzgerald&Co.(“Cantor Fitzgerald”)と販売エージェントとして市場融資メカニズムを締結しているが,このような融資メカニズムの継続に必要なすべての条件を満たす保証はなく,このような融資メカニズムに基づいて証券販売から十分な収益を得ることができる保証はない.私たちが十分な製品収入を生成して私たちの現金需要を満たすことができる前に、私たちは公開または私募株式発行、債務融資、協力、戦略連合、許可手配、その他のマーケティングと流通手配を通じて、未来の現金需要に資金を提供する予定です。もし私たちが株式証券を発行することでより多くの資金を調達すれば、私たちの株主は深刻な希釈を経験するかもしれない。いかなる債務融資も、実行可能であれば、限定的な契約に関連する可能性があり、私たちの業務を展開する能力に影響を与え、インフレの負の影響を受ける可能性がある。私たちが必要な時、私たちは追加的な融資を受けることができないかもしれないし、優遇された条項で融資を受けることができないかもしれない。また、我々の非関連流通株が7,500万ドル未満であることによるいくつかの米国証券取引委員会の制限と、我々の棚上げ登録声明の使用に対する制限を含むナスダック株式市場グローバルファンドの資金調達に関するいくつかの制限は、追加資金の調達をより困難にする可能性がある。もし私たちが必要な時に十分な資金を得ることができなければ、私たちは私たちの1つ以上の臨床研究や研究開発計画、または私たちの商業化努力を延期、縮小、または一時停止しなければならないかもしれない。
証券発行による追加資金の調達は既存の株主に希釈される可能性があり、貸借や許可手配による資金調達は、私たちの業務を制限したり、所有権の放棄を要求したりする可能性があります。
私たちは将来的に私たちが計画している業務を継続してbatiraxceptを商業化するために多くの追加資金が必要になると予想する。これまで、相当な製品収入を生み出すことができれば、株式発行、債務融資、戦略連合、および任意の協力に関する許可および開発協定によって、私たちの現金需要を満たす予定です。私たちは現在約束された外部資金源を持っていない。私たちが株式証券を発行することで追加資本を調達する場合、既存株主の所有権は深刻に希釈される可能性があり、これらの証券の条項は清算または普通株主の権利に悪影響を及ぼす他の特典を含む可能性がある。また、未弁済株式証やオプションを行使することも赤字になる。債務融資および優先株融資は、追加債務を招く、資本支出を行う、配当金を発表する、留置権を作成する、株式を償還する、または投資を行うなど、私たちが特定の行動をとる能力を制限または制限する契約を含むことができる。
もし私たちが第三者との協力、戦略連合またはマーケティング、流通または許可手配を通じてより多くの資金を調達するならば、私たちは私たちの技術、将来の収入源、研究計画、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になる可能性のある条項でライセンスを付与しなければならないかもしれない。もし私たちが必要な時に株式や債務融資を通じてより多くの資金を調達することができない場合、あるいは第三者と受け入れ可能な条項で協力し、戦略連合またはマーケティング、流通または許可手配を行うことによって、私たちは私たちの製品開発または将来の商業化努力を延期、制限、減少または終了することを要求されるか、または私たちが本来開発およびマーケティングする候補製品を開発し、マーケティングする権利を付与されるかもしれない。
私たちの経営業績は大幅に変動する可能性があり、これは私たちの将来の経営業績を予測しにくくし、私たちの経営業績が予想を下回ったり、私たちの指導を招いたりする可能性があります。
私たちの四半期と年間経営業績は将来的に大きく変動する可能性があり、将来の経営業績を予測することは困難です。私たちは時々他の会社と協力協定を締結するかもしれませんが、開発資金と重要な前金とマイルストーン支払いおよび/または特許権使用料を含めて、これは私たちの収入の重要な源になるかもしれません。したがって、私たちの収入は、開発資金と、任意の潜在的な未来の協力および許可協定によって実現される開発および臨床マイルストーン、および私たちの製品の販売(承認されれば)に依存する可能性があります。これらの前金とマイルストーン支払いは時期によって大きく異なる可能性があり、このような違いは、私たちの経営業績が異なる時期の間に大きな変動をもたらす可能性があります。また、私たちの製造と臨床試験費用は大きく予想され、私たちが臨床試験に従事したり、私たちの候補製品batiraxceptを生産したりするかどうか、そして私たちのプロセス開発のタイミングによって、四半期ごとに大きく変動する可能性があります。また、取締役会が決定した報酬の公正な価値に基づいて、日に従業員に支給される株式報酬の報酬コストを測定し、そのコストを従業員に必要なサービス期間内の費用として確認します。これらの報酬を評価するための変数が時間とともに変化するにつれて、潜在的な株価や株価変動は、費用の大きさが大きく変化する可能性があることを認めなければならない。また、私たちの経営業績は様々な他の要素によって変動する可能性があり、その中の多くの要素は私たちがコントロールできないもので、以下の要素を含む予測が困難かもしれません
| • |
Batiraxceptおよび任意の将来の候補製品に関連する研究および開発活動の時間、コスト、および投資レベルは時々変化する |
| • |
患者の臨床試験に参加する能力と募集時間を募集します |
| • |
Batiraxceptおよび任意の将来の候補製品を生産する時間およびコストは、FDAのガイドラインおよび要求、生産数量、および私たちが製造業者と達成した合意条項によって異なる可能性がある |
| • |
他の候補製品や技術を取得または開発するための支出を獲得または生成することができます |
| • |
バテラシップおよび任意の将来の候補製品または競合候補製品の臨床研究の時間および結果; |
| • |
業界競争構造の変化は、私たちの競争相手またはパートナー間の統合を含む |
| • |
Batiraxceptまたは私たちの将来の任意の候補製品の規制審査または承認における任意の遅延; |
| • |
Batiraxceptおよび任意の未来の候補製品の需要レベルは、それらが承認されれば、大きく変動する可能性があり、予測が困難である |
| • |
私たちの候補製品のリスク/収益プロファイル、コストおよび精算政策(承認されれば)、および私たちの候補製品と競争する既存および潜在的な未来の薬剤について; |
| • |
Batiraxceptまたは私たちの未来の任意の候補製品と競合する既存および潜在的な未来の薬剤からの競争; |
| • |
独立しても第三者と協力しても、Batiraxceptまたは任意の未来の製品候補製品を米国内外で商業化することができます |
| • |
私たちは協力、許可、または他の手配の能力を確立し、維持する |
| • |
私たちは未来の成長能力を十分に支持しています |
| • |
潜在的な予測不可能な業務中断は、私たちのコストや支出を増加させる |
| • |
未来の会計宣言や私たちの会計政策の変化; |
| • |
絶えず変化して不安定な世界経済環境。 |
これらの要因の累積影響は我々の四半期や年度経営業績に大きな変動と予測不可能を招く可能性がある。したがって、異なる時期に私たちの経営業績を比較することは意味がないかもしれない。投資家たちは私たちの過去の業績を私たちの未来表現の指標として依存してはいけない。このような変化性および予測不可能性はまた、業界や金融アナリスト、または投資家の任意の時期に対する期待を満たすことができない可能性がある。もし私たちの収入や経営業績がアナリストや投資家の予想よりも低い場合、または私たちが市場に提供するいかなる予測よりも低い場合、または私たちが市場に提供する予測がアナリストや投資家の予想よりも低い場合、私たちの普通株の価格は大幅に下落する可能性がある。私たちが提供する可能性のある以前に公開された収入および/または収益案内に到達したとしても、そのような株価下落は起こる可能性がある。
私たちの業務に関わるリスク
総経済条件、地政学的条件、国内外の貿易政策、通貨政策、その他の我々がコントロールできない要素の変化は、私たちの業務や経営業績に悪影響を及ぼす可能性がある。
私たちの業務と業績は世界、地域、アメリカの経済的、地政学的条件に依存する。近年、世界全体の経済状況は最近の世界経済の不確定性と金融市場状況を含む重大な不安定を経験している。ロシアのウクライナへの侵入と軍事攻撃は米国と欧州の指導者の厳しい制裁を引き起こし、2022年2月にロシアがウクライナに侵入して以来、世界各地の金融市場は動揺を経験している。これによる米国の貿易政策の変化は、ロシア、その盟友、中国を含む他の影響を受けた国の報復行動を引き起こし、“貿易戦”を招く可能性がある。また、米国を含む他の国がこの紛争にさらに巻き込まれれば、私たちは私たちのビジネスや財務状況に大きな悪影響を及ぼす可能性がある。
著者らの臨床プロジェクトの推進に伴い、著者らは著者らの臨床研究機関(CRO)と臨床サイトと密接な関係を維持し、そして絶えず新冠肺炎が著者らの計画中の試験、現在のスケジュールとコストに対する影響、及び侵入とウクライナの軍事攻撃への影響を評価した。不確定な金融市場、サプライチェーンの中断、流動性制限、変化する優先事項、不安定な資産価値が私たちの将来の業務に影響を与える可能性がある。新冠肺炎の発生と政府が疫病に対応するために取った措置も企業と商業に直接と間接的な重大な影響を与え、労働力不足が発生したため、サプライチェーンの中断;施設と生産の一時停止;医療サービスと用品などのある商品とサービスに対する需要が急増し、旅行などの他の商品とサービスに対する需要が低下した。大流行の将来の進展とそれが私たちの業務や業務に与える影響は不確実だ。患者がウイルスの影響を受けたり、疫病発生やウクライナの軍事情勢により、すでに臨床試験を計画している他の国に拡大したりすると、進行と計画されている臨床試験で患者を募集または維持することが困難になる可能性がある。どのような中断や遅延も、私たちの業務、財務状況、運営結果、成長の見通しに悪影響を与え、どのような増加した臨床計画費用も、私たちの業務、財務状況、運営結果、および成長の見通しに悪影響を及ぼす可能性がある。私たちと私たちの第三者契約メーカー、契約研究組織、臨床サイトは、私たちの研究開発活動に重要なプロジェクトを調達する際にも中断に直面する可能性があり、例えば、私たちの臨床試験または臨床前研究で使用されている医療と実験室用品を含み、すべての場合、これらの用品は海外から来ているか、あるいは疫病に対応するために持続的な努力によって不足している。また、インフレ上昇は私たちの業務に実質的な悪影響はありませんが、それは多くの企業の運営コストを高め、将来的には私たちの候補薬物やサービスプロバイダの需要や定価製造、為替レート、従業員の賃金に影響を与える可能性があります。最近、特にアメリカとイギリスでは、インフレ率は長年見られないレベルまで上昇しており、インフレの激化は私たちの運営コスト(労働コストを含む)の増加、流動性の減少、信用を獲得したり、他の方法で資金を調達する能力が制限されています。また、FRBは金利を引き上げ、インフレへの懸念に応えるために再び金利を上げる可能性があり、政府支出の減少や金融市場の変動に加え、経済の不確実性をさらに増加させ、これらのリスクを悪化させる可能性がある。
流動性の減少または限られた実際の事件、違約、業績不振、または金融機関または金融サービス業の他の会社または金融サービス業全体に影響を与える他の不利な事態の発展、またはこれらのような事件に対する懸念またはデマは、過去に発生し、将来的に市場全体の流動性問題を引き起こす可能性がある。例えば、2023年3月10日、シリコンバレー銀行はカリフォルニア金融保護·革新部によって閉鎖され、後者は連邦預金保険会社を担当者に指定した。私たちはシリコンバレー銀行に現金や現金等価物の残高は何もないにもかかわらず、より広範な金融サービス業の不確実性と流動性の懸念は依然として存在し、シリコンバレー銀行の倒産及びバイオテクノロジー業界及びその参加者(例えば、私たちのサプライヤー、サプライヤー、投資家)への潜在的な短期的かつ長期的な影響は、私たちの運営や株価に悪影響を及ぼす可能性もある。
私たちはこのような中断と上昇しているインフレが私たちの運営に及ぼす影響を積極的に監視している。
このような状況は私たちが未来の商業活動を正確に予測して計画することを困難にする。
上記の要素は、米国および国外の他のいくつかの経済および地政学的要因を含み、最終的には、私たちの業務、財務状況、運営結果、またはキャッシュフローに重大な悪影響を及ぼす可能性がある
| • |
影響を受けた国の臨床サイトで患者を募集することはできません |
| • |
中国で生産されたBatiraxceptの供給を受けたり遅延したりすることはできない |
| • |
米国と国外の経済、通貨と財政政策の重大な変化は、通貨変動、インフレ圧力と重大な所得税変化の影響を含む |
| • |
私たちの細分化された市場の世界的あるいは地域的な経済減速は |
| • |
企業やその重要な顧客に影響を与える政府政策や法規の変化 |
| • |
各国の産業政策は、多国籍企業ではなく、国内産業に偏重しているか、あるいは外国企業を完全に制限している |
| • |
中国などの国が米国の貿易政策や関税の変化に対応するために制定した新たなまたはより厳しい貿易政策と関税 |
| • |
支出を延期し、信用の引き締め、金融市場の変動などの要素に対応する |
| • |
規制のコンプライアンスと訴訟費用の実質的な急速な上昇 |
| • |
知的財産権の保護は難しい |
| • |
支払い周期が長い |
| • |
売掛金引上げ過程における信用リスクおよび他の課題; |
| • |
上記のすべての項目がアウトソーシングと調達手配に与える影響。 |
さらに、疫病の発生は、感染または罹患した管理職メンバーまたは他の従業員が欠勤したこと、または管理職メンバーおよび他の従業員が病気のために私たちのオフィスや実験室施設内の他の人に影響を与えたり、隔離によって仕事を選択しないことが原因で、私たちの運営を混乱させる可能性がある。流行病はまた、私たちの取締役会メンバーに影響を与え、取締役会または取締役会委員会会議の欠席を招き、私たちの事務を管理する会議を開催するために必要な取締役会全体またはその委員会の定足数をより困難にする可能性がある。
業務.業務 中断する 私たちの未来の収入と財政状況を深刻に損害し、費用と費用を増加させるかもしれない。
私たちの製造業者を含む当社の業務および第三者サプライヤーおよびパートナーは、地震、電力不足、電気通信故障、水不足、洪水、ハリケーン、または他の極端な天気条件、医療流行病、労使紛争、戦争、または他の業務中断の影響を受ける可能性があります。いかなる中断も、私たちが適時に任意の臨床計画を行うこと、あるいは私たちの臨床計画または商業化中に候補製品を提供する能力を深刻に損なう可能性がある。例えば、現在の新冠肺炎の大流行は時々著者らの臨床試験活動を中断させる。しかも、サプライチェーン中断は私たちの研究活動に影響を与え続ける可能性がある。さらに、ウクライナの侵入や米国、NATO、その他の国がすでに講じているか、または将来的にとりうる報復措置は、地域紛争を引き起こす可能性があり、そうでなければ、地域および世界経済に持続的な影響を与える可能性があり、いずれも私たちのサプライチェーンを乱し、私たちの候補製品が行われており、将来の臨床試験を行っている能力に悪影響を及ぼす可能性がある。これは、私たちの臨床試験および/または臨床結果分析の予想時間および完了時間に悪影響を及ぼす可能性がある。また、中国に対して著者らの臨床試験材料の輸出に影響を与える制裁を実施すれば、現在と未来の臨床試験を完成する能力は不利な影響を受ける可能性がある。
政府資金への依存は、私たちが何らかの行動をとる能力を制限し、潜在的な経済的処罰に直面させる可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちの資金の大部分はCPRITが提供するAravive Biologics寄付によって提供された。CPRIT贈与(以下に述べる)には、政府の実質的な権利および救済措置を反映する条項が含まれており、多くの権利および救済措置は、政府が場合によっては全額または一部の贈与報酬の返済を要求する権利がある場合を含む商業契約では通常見つからず、場合によっては利息とともに、任意の潜在的なテキサス州以外の移転を含む様々な事項に関連するいくつかの契約に違反した場合がある。CPRITとの契約は2019年11月30日に終了しましたが、私たちの特許権使用料やその他の義務は、場合によっては支払われた贈与収益を返済する義務、ある記録や書類を保存する義務、CPRITのある予期しない有害事象を通知する義務、および私たちのCPRITプロジェクトの任意の側面に関連する任意の新しいまたは拡大された臨床試験、臨床試験、商業化、または製造の義務を確保するために合理的な努力を取って、合意終了後も存在します。私たちは2000万ドルのすべての贈与収益を受け取り、合意終了日までにすべての贈与報酬収益を使い切りました。
CPRITから与えられた報酬は、特定の製品を販売している私たちの収入の一部をCPRITに支払うこと、または私たちの許可者または再許可者から受け取った収入の一部を、このような支払い総額が贈与報酬収益の400%に等しくなるまで、収入の下位から中央値の割合で計算し、その後、政府の排他性を維持している限り、1%未満の比率で支払いますが、場合によっては、特定の金額のお金をCPRITに一度に支払い、このような支払い義務を終了する権利があります。
我々のCPRITプロジェクトの任意の態様に関連する任意の新しいまたは拡大された臨床前試験、臨床試験、商業化または製造がテキサス州で行われる要求を満たすためには、テキサス州で臨床前試験、臨床研究および試験、政府規制、処方および製造、販売およびマーケティング、ならびに会計および融資の専門知識を有するより多くの合格者およびサプライヤーを雇用する必要がある。私たちは多くの生物製薬会社、大学、他の研究機関と競争して合格した個人、サプライヤー、臨床試験場所、メーカー。このような人員に対する競争は非常に激しく,このような人員の探索が成功する保証はなく,特にCPRITによる領土制限を考慮すると考えられる.
もし私たちが現在または将来私たちに適用されるかもしれないどんな要求も守れなければ、私たちは潜在的な責任を負い、CPRIT Grantを含む可能性があり、これは私たちの巨額の費用を招くかもしれない。
私たちは もし私たちがライセンスに依存して私たちの業務に重要な様々な技術を使用すれば、ライセンスベースのプロトコルが終了した場合、あるいは私たちの予想される製品を商業化するために必要な他の権利を得ることができない場合、これは私たちの製品や技術の販売を停止させ、直ちに私たちの業務、運営業績、財務状況に大きな悪影響を与えます。
私たちの将来性はスタンフォード大学での免許(“スタンフォード免許”)に大きくかかっていますスタンフォード大学のライセンスは、AVB-S 6シリーズタンパク質から選択された最新の開発候補をカバーするいくつかの既存の特許および関連知的財産権を世界的に独占的に取得する権利を付与する。もし私たちがスタンフォード許可の条項に違反した場合、その中で規定された最低使用料を支払うことができなかったか、またはいくつかの開発マイルストーンに達しなかったこと、およびスタンフォードの許可を遵守できなかった実質的な条項を含むが、許可を終了する権利があるが、許可者は許可を終了する権利があるが、これらに限定されない。もし私たちが受け入れ可能な条項でライセンスを維持したり、他の第三者から必要または適切に新しいライセンスを取得したりする必要があることが発見された場合、私たちは私たちの製品や技術を販売することができなくなり、これは現在の業務を停止する必要があるかもしれません。これは、直ちに私たちの業務、運営実績、財務状況に大きな悪影響を与えます。
もし私たちが知的財産権許可における私たちの義務を履行できなかったら、私たちは私たちの業務に重要な許可権を失うかもしれない
スタンフォード大学の許可のほか、第三者と知的財産権許可協定を締結しており、将来的により多くのライセンス契約を締結したいと考えています。私たちの既存の許可協定は、私たちの将来の許可協定は、私たちに様々な勤勉さ、マイルストーン支払い、特許権使用料、保険、その他の義務を負担することを要求すると予想される。もし私たちがこれらの義務を守らなければ、私たちの許可者はこれらの合意を終了する権利があるかもしれません。この場合、私たちはこれらの合意がカバーするいかなる製品も開発して販売することができないかもしれません。このような事件の発生は私たちの業務と財政状況に実質的な損害を与えるかもしれない。
他の場所で説明されている私たちの知的財産権に関するリスクは、私たちが許可した知的財産権にも適用され、私たちまたは私たちのライセンシーがこれらの権利を獲得、維持、擁護、実行できなかった場合、私たちの業務に実質的な悪影響を及ぼす可能性がある。場合によっては、私たちは、私たちが許可した特許の起訴、保守、または強制執行を制御することができず、そのような特許の起訴、保守、および弁護過程に投入する十分な能力がない可能性があり、私たちの許可者は、許可された特許を取得、維持、弁護、および強制執行するために必要または適切なステップを取ることができないかもしれない。私たちはスタンフォード大学の利益のための広範な特許主張(妨害または再審行動を含む)を準備し、提出し、起訴する責任があり、すべての許可された特許を維持する責任がある。
私たちは第三者との協力でいくつかの製品やアメリカ以外の候補製品を開発して商業化したいと思っています。このような製品と候補製品に対する私たちの見通しは、このような協力の成功に部分的に依存するだろう。
私たちはアメリカで自分のbatiraxceptを商業化していますが、協力手配を通じて、アメリカ以外でbatiraxceptを商業化することを求めています。例えば、我々は、領土でのbatiraxceptの開発および商業化の独占的な再許可を3 D Medicinesに付与する3 D Medicinesプロトコルを締結した。
私たちが達成したどんな協力計画によると、研究開発費、許可費、マイルストーン支払い、特許権使用料から収入を得ることができないかもしれません。私たちがこれらの手配から収入を創出する能力は、私たちの協力者がこれらの手配の中で彼らに割り当てられた機能を成功的に履行する能力に依存し、転任地域で監督管理の承認を得ることを含め、米国市場製品の規制承認を得ても、承認を得ることができない可能性がある。さらに、約束された条項が満了する前または後に、私たちの協力者は、資金義務を含む研究または開発プロジェクトを放棄し、適用される合意を終了する権利がある可能性がある。したがって、私たちが許可した製品または候補製品の将来成功した制御権の一部または全部を第三者に放棄することが予想される。
私たちの製品と候補製品の協力、例えば私たちと3 D Medicinesとの許可手配は、多くのリスクをもたらす可能性があります
| • |
協力者は彼らがこれらの協力の努力と資源に適用することを決定する上で大きな自由裁量を持っている |
| • |
協力者は、予期されているか、または適用されていない法規の要求に従ってその義務を履行していないかもしれない |
| • |
協力者は、我々の製品および候補製品を開発および商業化してはならない、または臨床試験結果、協力者の戦略的重点または利用可能な資金の変化または外部要素(例えば、買収)に基づいて、開発または商業化計画を継続しないか、または商業化計画を選択することができる |
| • |
協力者は臨床試験を延期し、臨床試験計画に不足した資金を提供し、臨床試験を停止或いは候補製品を放棄し、ユーザーの異なる用量を使用して、新しい臨床試験を繰り返し或いは行うことができ、或いは臨床試験候補製品の新しい調合を要求することができる |
| • |
私たちと協力して発見された候補製品は、私たちの協力者によって彼ら自身の候補製品や製品と競争されるかもしれません。これは、協力者が資源を投入して私たちの候補製品を商業化することを停止する可能性があります |
| • |
1つまたは複数の製品のマーケティングおよび流通権利を有する協力者は、これらの製品または製品をマーケティングおよび流通するために十分なリソースを投入していない可能性がある |
| • |
特許権、契約解釈、または第一選択開発過程における分岐を含む協力者との相違は、製品および候補製品の研究、開発または商業化の遅延または終了をもたらす可能性があり、製品および候補製品に対して追加的な責任を負うことになる可能性があり、または訴訟または仲裁を引き起こす可能性があり、いずれも時間的で高価である |
| • |
協力者は、私たちの知的財産権を正確に維持したり、守ったりすることができないかもしれないし、何らかの方法で私たちの固有の情報を使用して、それによって訴訟を引き起こし、それによって、私たちの知的財産権または固有の情報を無効にしたり、私たちを潜在的な訴訟に直面させたりすることができる |
| • |
協力者は第三者の知的財産権を侵害する可能性があり、これは私たちを訴訟と潜在的な責任に直面させるかもしれない |
| • |
協力は終了する可能性があり、終了すれば、適用地域で適用される候補製品をさらに開発または商業化するために追加の資金が必要になる可能性がある。 |
協力協定は、最も効果的な方法で、または製品または候補製品の開発または商業化を全くもたらさない可能性がある。
また,いずれの第三者協力者(3 D Medicinesを含む)による臨床試験のいずれの負の結果も,これらの試験を行わないにもかかわらず,我々の商業化努力に負の影響を与えるであろう。
我々は我々の情報技術システムに広く依存しており,これらのシステムは破壊や中断を受けやすい.
私たちは顧客とサプライヤーの情報を維持することを含む、私たちの情報技術システムとインフラに依存して取引を処理し、結果をまとめ、私たちの業務を管理します。さらに、クラウド·プロバイダを含むサード·パーティを利用して、データを格納し、送信し、処理する。我々の情報技術システムや我々のサプライヤーや他のパートナーのシステムは,そのシステムが我々の制御を受けず,中断の影響を受けやすく,会社の敏感な情報を取得するために意図的に侵入していくリスクが高まっている.同様に、従業員および他の権利があるか、または私たちのシステムにアクセスすることが許可されていない人によって発生するデータセキュリティイベントおよび違反は、不正な人または公衆に曝露される可能性のある敏感なデータのリスクをも構成する。当社の情報技術システムまたは当社のサプライヤー、プロバイダ、および他のパートナーに関連するシステムのネットワーク攻撃または他の重大な中断は、キーシステムの中断、腐敗またはデータの損失、およびデータ、資金、または知的財産権を盗まれる可能性があります。*当社のシステムの障害やセキュリティホールを防ぐことができない場合があります。臨床前或いは臨床試験データの損失は監督管理の承認仕事の遅延を招き、データの回復或いは複製のコストを増加させる可能性がある。いくつかの場合、私たち、私たちのサプライヤー、および私たちの他のパートナーは、事件またはその規模と影響を知らないかもしれないので、私たちはまだもっと多くの既知または未知の脅威の影響を受ける可能性がある。私たちはまた私たちのサプライヤーやパートナーをネットワークセキュリティ攻撃に暴露するリスクに直面している。上記のいずれかまたはすべては、私たちの経営結果と私たちのビジネス名声に悪影響を及ぼす可能性があります。
私たちの顧客、従業員、サプライヤーに関連する情報セキュリティを維持できない行為は、ネットワークセキュリティ攻撃によっても他の理由でも、私たちを訴訟、政府の法執行行動、コストの高い対応に直面させ、私たちの運営を混乱させ、私たちの名声を損なう可能性があります。
私たちの製品やサービスの販売やマーケティングに関連する過程で、私たちは時々機密情報を伝達することができる。私たちはまた、私たちの臨床試験および試験に参加した患者、従業員およびサプライヤー、ならびに私たちの業務に関する個人的または機密情報をアクセス、収集、または維持することができます。サイバー攻撃は急速に発展しており、ますます複雑になっている。コンピュータハッカーや他の人は、私たちの安全対策を破壊したり、現在または将来私たちと業務往来のある当事者の安全対策を破壊し、私たちの臨床試験、サプライヤー、従業員、サプライヤー、または私たちの業務情報から患者の個人情報を取得する可能性があります。物理的または電子的侵入、コンピュータウイルスおよびハッカー、従業員または他の人の攻撃を含む任意のタイプのセキュリティホールは、データ損失、訴訟、政府の法執行行動、規制処罰、およびコストの高い対応のリスクに直面し、私たちの運営を深刻に混乱させる可能性がある。これによって生じる負の宣伝は、私たちの名声を深刻に損なう可能性があり、これは私たちの市場シェアを失い、私たちの運営結果に悪影響を及ぼす可能性がある。
プライバシー規制に関連する特定のデータ保護、データセキュリティ、プライバシーのリスクに直面する可能性があります。
米国では,健康情報のプライバシーを保護する複数の法律やデータ漏洩通知法の制約を受けており,これらの法律に違反した者は罰,刑事,民事罰を受ける可能性がある。米国以外では、多くの司法管轄区域の法律、法規、基準は個人情報の収集、使用、その他の処理に広く適用されている。例えば、欧州連合では、個人資料の収集·使用は“一般データ保護条例”(以下、“一般データ保護条例”)の規定によって管轄されている。GDPRと欧州連合の国家立法、条例、そして基準。加盟国は、個人資料の処理において、(I)責任と透明性の要求、および資料当事者の有効な同意を得る要求を向上させること、(Ii)任意の新製品やサービスを開発する際に資料を保護する義務を考慮し、処理する個人資料の数を制限すること、(Iii)資料当事者の資料保護権利を遵守する義務、および(Iv)政府当局および個人に何らかの個人資料違反を報告する義務を含むが、これらに限定されない厳格な義務を課している。異なるEU加盟国および他の欧州諸国からのデータ保護当局は、GDPRおよび各国のデータ保護法を異なる方法で実行し、欧州個人データを処理する複雑さを増加させる追加の国家法規およびガイドラインを導入する可能性がある。GDPRや国家データ保護法を遵守しない要求は、巨額の罰金やその他の行政処罰(GDPRライセンスは、世界の年収4%または2000万ユーロまでの罰金、金額の大きい者を基準とする)、個人データが処理された個人の民事責任クレームを招く可能性がある。また、コンプライアンスに関連する費用は私たちの運営利益率を低下させる可能性がある。
GDPRはまた、個人データをEUからEU以外の国への移行を禁止し、欧州委員会が個人データに対して十分な保護を提供していると考えている国への移行、または承認されたデータ転送機構(例えば、標準契約条項)によって完了しない限り、個人データをEU以外の国に転送することを禁止する。データ保護機関の指導と会社のデータ転送能力を制限する法執行行動は、データ転送に関連するリスクを増加させるか、またはEU個人データを米国に送信することをより困難または不可能にする可能性がある。
私たちは現在1つの候補製品、batiraxceptだけで、臨床開発を行っており、batiraxceptの成功に依存している 規制部門の承認を求める前に追加的な臨床試験が行われる。Batiraxceptが臨床試験に成功し、規制部門の承認を得なかった場合、あるいは商業化に成功しなかった場合、私たちの業務は 傷害を受ける。
我々は現在,いくつかの癌の潜在的治療法として臨床候補製品,batiraxceptを開発している。Batiraxceptは現在臨床試験を行っており,これまで候補製品の商業化販売が承認されていない。私たちは市場価値のある候補製品を永遠に開発できないかもしれない。われわれの主な注目点は,白金耐性の再発性卵巣癌,ccRCC,膵癌の治療のためのbatiraxceptの開発である。私たちのbatiraxceptがprocの第3段階試験に成功した場合、私たちは2023年末にBLAをFDAに提出する予定です。FDAは、データの説明に同意しないことや、私たちの単一の重要な試験が臨床効果の原因を証明するのに不十分だと考えることを含む、BLAの提出を拒否するか、承認ではなく、完全な返事を発行することを拒否するかもしれません。FDAは別の第3段階試験を要求するかもしれません。
私たちは今後数年間私たちの努力と支出の大部分がbatiraxceptに使用されると予想している。そのため、私たちの業務は現在、batiraxceptの成功した開発、規制承認、商業化に大きく依存しており、規制承認を得ても、規制承認や商業化に成功できない可能性がある。候補製品の研究、テスト、製造、ラベル、承認、販売、マーケティング、流通は、FDAと米国および他の国の他の規制機関の広範な規制を受け続けており、これらの国と地域はそれぞれ異なる規制規定を持っている。私たちは、これらの国の規制機関の必要な承認を得ない限り、FDAまたはいかなる外国のBLAの承認を得ない限り、米国でいかなる製品も販売することは許されない。私たちはFDAや他の規制機関にBLAなどの申請を提出したことがありません。もし私たちが行っている第3段階PROC試験が成功すれば、2023年末に提出される予定です。BLAの承認を得ることは、広く、長く、高価で、内面的に不確実なプロセスであり、FDAは多くの理由で製品の承認を延期、制限、または拒否する可能性がある。
私たちの成功は私たちが薬物開発の各段階で私たちの臨床候補製品batiraxceptを推進できるかどうかに大きく依存しており、この製品は開発の初期段階にある。もし私たちがbatiraxceptを成功的に推進したり開発できなかったら、私たちの業務は実質的な損害を受けるだろう。
著者らの臨床候補製品Batiraxceptは臨床開発の初期段階にあり、その商業実行可能性は依然として未来の臨床前研究、臨床試験、製造技術、監督管理許可の成功結果、及び候補薬物開発の通常固有のリスクに依存する。Batiraxceptの開発を進めることができなければ,我々の業務に実質的な悪影響を与える可能性がある.私たちの業務の長期的な成功は、最終的には、臨床試験を通じてbatiraxceptの開発を推進し、厳格な規格と法規に基づいて適切な調合と一貫した生産を行い、FDAまたは他の国の同様の規制機関の販売許可を得て、最終的に戦略パートナーまたは許可された人と直接または商業化することに成功する。私たちは、私たちが行っているまたは未来の研究、臨床前研究、または臨床試験の結果がbatiraxceptの継続開発が合理的であることを支持または証明するか、または最終的にFDAまたは他の国の同様の規制機関の承認を得て、batiraxceptの開発を推進することを投資家に保証することはできない。
Batiraxceptは厳格な安全、治療効果、製造規制基準を満たさなければならず、私たちはその開発を推進または完成することができ、それはFDAまたは他の国の同様の規制機関によって販売を許可することができる。これらの標準を達成するために、著者らは高価で長い研究と臨床試験を行い、受け入れ可能かつ費用対効果の高い製造技術を開発し、監督部門のbatiraxceptに対する許可を得なければならない。このような努力にもかかわらず、batiraxceptはできないかもしれない
| • |
治療を受けていない患者と比較して、または同じ患者集団を治療するための既存の薬剤または開発されている他の候補製品を超えることを証明することは、臨床的意義のある治療または他の医療的利益を有する |
| • |
将来の前臨床研究や臨床試験で安全かつ有効であることが証明されている |
| • |
期待される治療や医療効果があります |
| • |
悪い副作用や予期しない副作用を容認することができます |
| • |
適用される規制基準に適合している |
| • |
適切な配合および製造を商業的に適切な数量または規模で許容可能なコストで行うことができる;または |
| • |
私たちや私たちの許可者や協力者たちによって商業化に成功した。 |
われわれが前臨床研究や早期臨床試験で良好な結果を示しても,後期臨床試験の結果がバテラックセットの継続開発を支援するのに十分であることは保証できない。製薬やバイオ製薬業界の多くの会社は,大多数の会社でなければ,発展のすべての段階で,後期臨床試験を含めて重大な遅延,挫折,失敗を経験しており,前臨床試験や早期臨床試験がエキサイティングな結果を得た後も同様である。したがって,我々batiraxceptが完成した臨床前研究と早期臨床試験の結果は,将来の後期試験で得られる可能性のある結果を予測できない可能性があり,特にわれわれの臨床試験の結果はこれまで一部の患者から来ており,より多くの患者に複製されない可能性がある。また、我々の任意の臨床候補製品に関連する臨床前研究および臨床試験から収集されたデータから満足できる安全性、耐性および有効性を示しても、これらの結果は、米国FDAまたは他の管轄地域の他の同様の規制機関の規制承認を得るのに十分ではない可能性があり、これは、製品のマーケティングおよび販売に必要である。
臨床試験はリスクが大きく、時間が長く、費用が高い。私たちは臨床前テストと臨床試験に多くの費用を費やし、大量の時間と資源を投入したが、これらのテストと試験が候補製品が有効で耐性が良いことを証明するか、あるいはその承認と商業販売を支持するかどうかを決定することはできない。例えば、臨床試験には十分な臨床試験材料と十分な患者登録が必要であり、試験を支持する。患者登録の遅延はコスト増加や開発期間の延長を招く可能性がある。たとえ私たちまたは許可者や協力者がbatiraxceptの臨床試験を成功させたとしても、私たちまたは彼らは必要な規制文書をタイムリーに提出できない可能性があり、batiraxceptの上場承認を得ることができないかもしれない。私たちはあなたにBatiraxceptが薬物開発過程でさらなる進展に成功するか、あるいは最終的に承認されて商業的に実行可能な製品につながるということを保証することはできません。
われわれが臨床試験を行った経験は限られている。
私たちは初期臨床段階にある会社であり、私たちの成功は私たちが監督部門のbatiraxceptの承認を得て商業化する能力にかかっているが、私たちはいかなる候補製品の承認や商業化に成功するために必要な機能を履行する能力があるかどうかを証明していない。候補製品の商業化には様々な機能を実行する必要があるかもしれません
| • |
臨床前開発を続け、被験者を臨床試験に参加させることに成功した |
| • |
監督管理の手続きに参加します |
| • |
製品を調製し製造します |
| • |
販売とマーケティング活動を展開する。 |
被験者の指導と募集における臨床試験の経験は限られている。われわれの一部の管理者や従業員は臨床試験を行う上で豊富な経験を持っているが,これまで臨床試験を行った経験は限られている。一部は経験不足のため,計画中の臨床試験が時間どおりに完了する保証はない(あれば),あるいはわれわれの試験設計の変更を要求しない。大規模試験には大量の追加的な財務と管理資源、モニタリングと監督、及び第三者臨床研究者、顧問或いは契約研究組織(CRO)への依存が必要である。第三者の臨床研究者、CROとメーカーに依存して、それらもすべて政府の監督と監督を受けて、私たちはコントロールできない遅延に直面する可能性もある。
もし私たちの臨床候補製品batiraxceptの実際または期待される治療効果、または安全性または耐性が、他の販売許可または臨床開発が許可された競争薬と同等かそれよりも優れていれば、私たちはbatiraxceptの開発を随時中止する可能性があり、私たちの業務の将来性と潜在的な利益能力は損害を受ける可能性がある。
癌や線維症患者の治療のための候補製品をマーケティングまたは開発している会社もあり、これらの会社は販売が承認されているか、臨床開発では私たちの会社よりも進んでいるため、承認および商業化される時間はbatiraxceptよりも短い可能性があることが知られている。
FDAが承認したGas 6/Ax 1経路に対する生物学的薬剤は現在のところない。しかしながら、batiraxceptが癌の治療のために承認された場合、それは、nivalumab、pembrolizumab、atezolizumab、およびこの経路に対する他の小分子化学製造薬または他のカテゴリーの薬剤を含む、様々なタイプの癌の治療のために許可された薬剤と間接的に競合し、これらの薬剤は、現在臨床的に求められている臨床適応に使用されている。
もし私たちがいつでもbatiraxceptが意味的または差別的な治療効果を提供できない可能性があると思う場合、知覚的にも真実であっても、その競争相手の製品または候補製品と同等またはそれ以上であるか、またはその安全性または耐性が潜在的なライバル化合物に劣る可能性があると考えられる場合、私たちはその開発を延期または終了する可能性がある。Batiraxceptの将来の開発は、現在販売が承認されているか、または開発されている潜在的競合化合物と比較して、任意の有意な治療的利益を示すか、または許容可能な安全性または耐性が、その開発継続の合理性を証明するのに十分であることを保証することはできない。
白金耐性の再発性卵巣癌患者の3期臨床試験,および慢性腎細胞癌または膵癌患者の1 b/2期臨床試験については,われわれの臨床候補製品Batiraxceptと承認された看護標準薬の併用を計画している。看護薬物標準を獲得する問題はすべて著者らの臨床試験の遅延或いは中断を招く可能性がある。
われわれが行っている各臨床試験については,承認された標準看護薬を併用して使用する。したがって、私たちの成功は標準的な看護薬の継続使用と能力にかかっているだろう。われわれが他の適応のために行った任意の他の臨床試験においても,われわれの臨床候補品は第三者の持つ薬剤と併用されることが予想される。臨床試験で使用されている任意の標準看護薬が試験継続期間中に得られなければ、適時性と商業化コストが影響を受ける可能性がある。さらに、これらの薬剤のいずれかが安全または治療効果の問題があると判定された場合、我々の臨床試験および商業化努力は悪影響を受けるであろう。
もし私たちの候補製品batiraxceptが必要またはセット診断から商業的利益を得ることができなければ、もし私たちがこのようなセット診断テストの監督許可や承認を成功的に検証、開発、獲得できなかった場合、あるいはそのような点で重大な遅延があった場合、私たちは私たちの候補製品のすべての商業的潜在力を達成できないかもしれない。
いくつかの適応のbatiraxceptまたは他の候補製品の臨床開発のために、著者らは協力者と協力して、疾患カテゴリにおいて私たちの候補薬物から選択性および意義のある利益を得る可能性のある患者サブグループを識別するために、in vitroキット診断テストを開発または獲得する可能性がある。我々の臨床試験や我々の候補製品の商業化に関連する過程では,この随伴診断を用いることができる。成功するためには、私たちまたは私たちの協力者はいくつかの科学、技術、監督と後方勤務方面の挑戦を解決しなければならない。FDAや同様の外国の規制機関は,体外随伴診断を医療機器として規制しており,この規制の枠組みの下では,我々が開発可能な任意の診断方法の安全性と有効性を証明するための臨床試験が要求される可能性があり,商業化前に単独の規制承認や承認を得る必要があると予想される。私たちは、このような任意のセットの診断テストの規制許可または承認を成功的に検証、開発し、得ることができないかもしれないし、そうするときに遅延に遭遇する可能性があり、これは、私たちの候補製品に実質的な損害を与えたり、その商業的潜在力を制限したりする可能性がある。
我々の臨床候補製品batiraxceptの単独使用または他の承認された医薬品との併用時に副作用が生じる可能性があり、これは、その開発または規制承認を延期または排除するか、または承認された後に使用を制限する可能性がある。
薬物開発過程全体において、私たちはバテラクセプの活性、安全性と耐性を絶えず証明して、監督部門の承認を得て、更に私たちの臨床開発を推進し、あるいは最終的にそれを市場に投入しなければならない。我々の臨床候補製品が十分な生物活性および明確な臨床的利益を示していても、任意の許容できない副作用または有害事象は、単独または他の薬剤と共に使用される場合、これらの潜在的な利点を超える可能性がある。我々は、batiraxceptの臨床前研究または臨床試験において、不良または深刻な不良事象または薬物と薬物との相互作用を観察する可能性があり、これは、その開発遅延または終了を招き、規制部門の承認を阻止し、または最終的に承認された市場受容度を制限する可能性がある。
私たちの臨床候補製品batiraxceptでは、私たちは第三者に依存してその薬物物質を生産する。当社の第三者製造業者または当社のサプライヤーが遭遇したどんな問題も、第三者製造業者またはそのサプライヤーが問題を解決するまで、または代替製造および供給源を見つけるまで、batiraxceptを私たちに供給する遅延または中断をもたらす可能性があります。
私たちの臨床候補製品batiraxceptについて、私たちは現在、中国にある第三者メーカーが私たちの臨床研究のためにbatiraxceptを生産することに依存しており、このメーカーは私たちの第三者サプライヤーから材料を購入し、必要な試薬と容器のようなbatiraxceptを生産するために必要な材料を輸送している。もしウイルスが私たちのメーカーの工場のある地域に伝播すれば、私たちの臨床製品の製造と出荷が遅延する可能性があり、これは臨床試験の遅延を招く可能性があります。第三者メーカーの製造が長期的な中断に遭遇した場合、追加の第三者製造契約を求めさせられ、私たちの開発コストを増加させ、私たちのスケジュールや任意の商業化コストに悪影響を与える可能性があります。もし私たちが開発過程のいつでも、あるいは製品候補が承認された後にメーカーを交換すれば、旧メーカーによって製造された製品と新メーカーによって製造された製品との比較性を証明することが要求されるだろう。もし私たちがそれができなければ、私たちは新しいメーカーが生産した製品に対して追加の臨床試験を行う必要があるかもしれない。
もし私たちの製造業者が十分な数のBatiraxceptを生産できなければ、私たちの開発活動は影響を受けるだろう。さらに、我々の臨床候補製品batiraxceptの生産工場は、cGMPに適合することを確実にするために、FDAまたは他の同様の規制機関の持続的な定期検査を受けている。メーカーがこのようなcGMP法規或いは他の法規要求に従わず、記録できなかった行為は、臨床原料薬と臨床試験完成品の供給に重大な遅延を招く可能性があり、それによって臨床試験の終了或いは保留を招く可能性があり、或いはbatiraxceptの発売申請の提出或いは承認を遅延或いは阻止する可能性がある。私たちはまた次のような点で問題に直面するかもしれない
| • |
一致かつ許容可能な生産生産量とコストで、FDAまたは他の比較可能な規制機関標準または規範に適合する十分または臨床レベルの材料を得る |
| • |
私たちの契約製造業者は、私たちの臨床候補製品batiraxceptの後期臨床試験または商業化を支援するために許容可能な処方を開発することができなかった |
| • |
私たちの契約製造業者は、私たちの臨床候補製品batiraxceptの規模や生産能力を増加させることができず、またはその形態を再設定することは、私たちの供給不足を招き、あるいはbatiraxceptの生産コストの増加につながる可能性がある。私たちの契約製造業者が適切な商業規模でパチラシープを生産することができるか、または私たちが受け入れられる代替製造業者を見つけることができることを保証することはできません |
| • |
私たちの契約メーカーは、私たちの製品ではなく、他の顧客の製品や自分の製品を優先的に生産します |
| • |
私たちの契約製造業者または私たちのサプライヤーは、適切な包装、輸送または百テラキシブまたはその試薬を貯蔵することができなかった、または契約製造事業を終了することを含む約束に従って義務を履行することができなかった |
| • |
私たちの契約製造業者の工場は規制制裁または自然災害または流行病によって閉鎖された |
| • |
合格者、原材料、または重要な請負業者が不足している |
| • |
私たちの契約メーカーはFDAの許可を得て商業規模生産を行うことができませんでした |
| • |
アメリカ食品薬品監督管理局あるいは他の類似規制機関のcGMP法規とその他の要求を持続的に遵守する。 |
もし私たちがこれらの問題や遅延に遭遇した場合、あるいは中国工場での製造コストが経済的に実行できない場合、あるいは他の第三者メーカーが見つからなければ、私たちは将来の需要を満たすために、私たちの臨床候補製品Batiraxceptを生産できないかもしれない。
また、中国に位置する第三者メーカーに依存しているため、私たちの業務は、中国でのビジネスに関するリスクの影響を受けています
| • |
不利な政治的·経済的条件、特に米国と中国との貿易関係に悪影響を及ぼす可能性のある条件 |
| • |
関税、輸出入許可、規制要件の向上などの貿易保護措置 |
| • |
税法の変化がもたらす潜在的な否定的な結果 |
| • |
中国の法律制度に関する困難には、中国の契約義務執行のコスト増加と不確定性が含まれる |
| • |
歴史的に知的財産権保護レベルは低い |
| • |
通貨レートの変化と変動 |
| • |
規制は事故や不利な変化を要求する |
| • |
米国で製造されたより成熟した医薬品および医療機器に対する患者または医師の選好; |
| • |
対外関係と運営を管理することに困難がある。 |
既存の製品と製造プロセスに対する私たちの経験が限られているため、これらのリスクは悪化する可能性がある。もし私たちの製品に対する需要が現実になれば、私たちはもっと多くの資源を投入して材料を購入し、従業員を雇用し、訓練し、私たちの製造技術を改善しなければならないかもしれません。私たちは私たちの臨床候補製品batiraxceptを生産することができないかもしれないが、そのコスト或いは数量はその臨床候補製品に商業可能性を持たせるのに十分である。これらの要素のいずれも私たちの製品を生産する能力に影響を与える可能性があり、毛金利と収益力を低下させることができる。
第三者メーカーと供給商会に依存してリスクをもたらし、もし私たちが自分でbatiraxceptを作ったら、私たちはこれらのリスクの影響を受けません
| • |
第三者に依存して規制コンプライアンスと品質保証を行う |
| • |
第三者は、私たちがコントロールできない要素またはこれらの第三者のいずれかの破産または他の財務的困難、労働騒乱、自然災害、またはそれらの業務能力に悪影響を及ぼす他の要因によって製造協定に違反する可能性がある |
| • |
私たちが製造契約に違反したり、彼ら自身のビジネス優先順位に基づいているので、第三者がコストが高い場合、または不便な場合には、プロトコルを終了または更新しない可能性があります。 |
私たちの契約製造業者またはそのサプライヤーが臨床試験に必要な臨床候補製品batiraxceptの商業数量を適時に提供できず、承認された後に商業的に合理的な価格で商業販売を行うことができない場合、私たちは実質的に同じコスト、実質的に同じ数量と品質、およびタイムリーに生産できる代替メーカーまたはサプライヤーを見つけることができず、私たちの製品に対する需要を満たすことができず、私たちの臨床前試験または臨床試験を延期または終了しなければならない場合、潜在的な収入を損失するだろう。Batiraxceptのための代替供給源を確立し、任意のそのような新しいソースがFDAまたは任意の適用可能な外国規制機関の承認を得るのに長い時間がかかるかもしれない。さらに、上記のいずれの要因も、臨床試験の開始または完了、提出または規制に必要なbatiraxcept承認の遅延または一時停止を招き、より高いコストを生じさせ、batiraxceptの商業化に成功することを阻止する可能性がある。
私たちは商業化のために十分な量のバッチラックセットを生産できないかもしれない。
著者らの臨床候補製品batiraxceptに対するFDAの承認を得るためには、このような臨床候補製品を大量に生産する必要がある。私たちの第三者製造業者は、batiraxceptの製造能力をタイムリーまたは経済的にまたは根本的に増加させることを望まないか、または根本的に成功できないかもしれない。FDAが承認すれば、私たちはbatiraxceptの生産量を増加させる必要があるだろう。大規模な製造には追加的な検証研究が必要かもしれず、FDAは審査して承認しなければならない。Batiraxceptの生産能力の向上に成功できなければ、batiraxceptの臨床試験および監督部門の承認や商業発売が遅れる可能性があり、あるいは供給不足が生じる可能性がある。Batiraxceptは正確で高品質な製造が必要だ。製造ミスの発生率を含む高品質の製造を実現し、維持できなかったことは、患者の負傷または死亡、テストまたは交付遅延または失敗、コスト超過または他の我々の業務、財務状況および運営結果を損なう可能性のある問題を招く可能性がある。
もし私たちの第三者契約製造業者、私たちの臨床前研究、または臨床試験を変更する必要があれば、私たちの臨床候補製品batiraxceptの商業化は延期され、悪影響を受けたり、終了したりする可能性があり、またはそのような変更は、私たちの業務に実質的な損害を与える可能性がある著しい高いコストをもたらす可能性があります。
アメリカと他の多くの国の様々な規制制限と、私たちの業界で時々発生する製造に対する潜在的な生産能力制限のため、batiraxcept製造中の各種材料はある契約メーカーから単独で調達した。CGMPによれば、交換メーカーは、製造プロセスおよびプログラムのより多くの再検証を必要とする可能性があり、異なるメーカーによって製造された材料間の比較可能性を証明するために、さらなる臨床前研究または臨床試験が必要である可能性がある。私たちの現在または未来の契約製造業者を変えることは難しいかもしれませんが、もし私たちが不可能でなければ、もし私たちが本当にそのような変化をしたら、非常に高い代価を払うかもしれません。これは私たちが長い間batiraxceptを生産できず、batiraxceptの開発を延期することにつながるかもしれません。また、第三者契約メーカーが変化した場合に私たちの開発スケジュールを維持するために、著しく高い生産コストが生じる可能性があります。
第三者サプライヤー(私たちは第三者サプライヤーに依存して臨床前研究または臨床試験を行う)が実行されないか、または厳格な法規を遵守できない場合、これらの研究または試験は延期、終了または失敗する可能性があり、または私たちは大量の追加費用を発生する可能性があり、これは私たちの業務に実質的な損害を与える可能性がある。
著者らは著者らの臨床前研究と臨床試験の資源が限られていることを設計、実施と管理に力を入れている。著者らは従来からCRO、コンサルタントと主要な研究者を含む第三者に依存し続け、著者らの設計、管理、実施、監視と分析を助けるつもりである。著者らはこれらのサプライヤーと個人代表に依存して、臨床前研究、著者らの臨床試験に参加する地点と被験者の募集、臨床地点と良好な関係を維持し、これらの地点が試験方案と適用法規に従って著者らの試験を行うことを確保することを含む臨床開発プロセスの多くの方面に依存している。もしこれらの第三者が私たちが彼らと合意した条項の義務を満足に履行できなかった場合、私たちは不適切な遅延や追加支出なしに代替手配を達成できないかもしれないので、私たちの臨床候補製品batiraxceptの臨床前研究および臨床試験は延期されるか、または成功しないことが証明されるかもしれない。
さらに、FDA、EMA、または他の国の類似規制機関は、私たちの臨床試験に参加するいくつかの臨床サイトまたは私たちの第三者サプライヤーサイトを検査して、私たちの臨床試験が良好な臨床実践またはGCPまたは同様の法規に従って行われるかどうかを決定するかもしれない。もし私たちまたは監督機関が私たちの第三者サプライヤーが適用された法規に基づいて私たちの臨床試験を行っていないと判断した場合、私たちは試験結果からいくつかのデータを排除したり、このような臨床試験を延期、繰り返し、または中止させられたりする可能性がある。
私たちは第三者に依存して、私たちの臨床試験を監督して、これらの第三者の表現が満足できなければ、私たちの業務を損なうかもしれません。
われわれはCROと臨床試験地点に依存してわれわれの臨床試験の適切かつタイムリーな進行を確保しており,彼らの実際の表現への影響は限られていると予想される。
私たちはまたCROに依存して、私たちの臨床プロジェクトのデータ、そして未来の非臨床研究の実行を監視し、管理する。私たちは私たちのCRO活動のいくつかの側面だけを統制することを望んでいる。しかし、私たちは私たちのすべての研究が適用された合意、法律、法規、そして科学的基準に従って行われ、私たちのCROへの依存が私たちの規制責任を免除しないことを確実にする責任を負うつもりだ。
私たちと私たちのCROは、FDAが実行した法規とガイドラインである良好な実験室操作規範とGCPの遵守を要求され、欧州薬品管理局加盟国の主管当局と同様の外国監督機関が国際人間用薬品技術要求調整理事会の形で要求された、私たちの臨床前および臨床開発における任意の候補製品のためのガイドラインでもある。監督当局は定期的に試験スポンサー、主要な調査者、臨床試験地点を検査することでGCPを実行する。もし私たちまたは私たちのCROがGCPに従わなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれませんが、FDAまたは同様の外国の規制機関は、私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。したがって,我々のCROがこれらの規定を遵守できなかったり,十分な数の被験者を募集できなかった場合には,臨床試験の繰り返しが要求される可能性があり,規制承認過程を延期し,コストを増加させることになる。
私たちのCROは私たちの従業員ではなく、私たちは彼らが私たちの未来の臨床と非臨床プロジェクトに十分な時間と資源を投入するかどうかを制御できない。これらのCROはまた、私たちの競争相手を含む他の商業実体と関係がある可能性があり、彼らはまた、これらの実体のための臨床試験または私たちの競争地位を損なう可能性のある他の薬物開発活動を行っているかもしれない。私たちはCROが私たちの知的財産権を不正に開示または流用する可能性があるというリスクに直面しており、これは私たちのビジネス秘密保護を低下させ、私たちの潜在的な競争相手が私たちのノウハウを訪問して利用することを可能にするかもしれない。もし私たちのCROがその契約の職責や義務を成功裏に履行できず、予想された最終期限内に達成できなかった場合、あるいは彼らが得た臨床データの品質または正確性が私たちの臨床方案や法規の要求または任意の他の原因を遵守できなかった場合、私たちの臨床試験は延長、延期または終了される可能性があり、私たちは監督部門の私たちが開発した任意の候補製品の承認を得ることができず、商業化に成功できない可能性がある。したがって、私たちの財務業績とそれが開発した任意の候補製品のビジネス見通しが損なわれ、そのコストが増加する可能性があり、私たちが収入を創出する能力が延期される可能性がある。
もし私たちがこのようなCROとの関係が終わったら、私たちは他のCROと合意できないかもしれないし、商業的に合理的な条項でそうすることができないかもしれない。追加のCROを交換または増加させることは、多くのコストに関連し、管理時間と重点を必要とする。しかも、新しいCROが仕事を始める時、自然な過渡期がある。したがって,遅延が生じ,期待される臨床開発スケジュールを満たす能力に実質的な影響を与える可能性がある。私たちはCROとの関係を慎重に管理しようとしているが、それが未来に挑戦や遅延に遭遇しないこと、またはこれらの遅延や挑戦が私たちの業務、財務状況、および見通しに悪影響を与えないことを保証することはできない。
私たちの未来の成功は私たちが行政人員を維持できるかどうか、そして合格した人員を吸引、維持、激励できるかどうかにかかっている。
私たちは私たちの幹部たちと私たちの管理と科学チームの他の主要な会員たちに非常に依存している。私たちの幹部の採用は勝手で、私たちの幹部はいつでも彼らの採用を終わらせることができる。私たちの高度管理者を失ったサービスは、私たちの研究、開発、商業化目標の達成を阻害する可能性がある。私たちはどんな幹部や従業員にも“キーパーソン”保険を提供しない。
合格した科学、臨床、製造及び販売とマーケティング人員を募集と維持することも著者らの成功のキーポイントである。多くの製薬とバイオテクノロジー会社の間の類似者に対する競争を受けて、私たちは受け入れ可能な条件でこれらの人員を吸引し、維持することができないかもしれない。私たちはまた、大学や研究機関から科学や臨床人を募集する競争に直面している。近年,我々の業界の管理者や科学者の流出率が上昇している。また、私たちは、科学や臨床コンサルタントを含むコンサルタントやコンサルタントに依存し、私たちの研究開発と商業化戦略の策定を支援しています。私たちのコンサルタントやコンサルタントは第三者に雇われ、他のエンティティとの相談やコンサルティング契約に基づいて約束する可能性があり、これは彼らが私たちの戦略目標を推進することを制限するかもしれない。これらのコンサルタントまたはコンサルタントのいずれかがこれ以上会社に十分な時間を投入できなければ、私たちの業務は損なわれる可能性がある。
私たちと適格な人材やコンサルタントを競争している多くの他の製薬会社は、私たちよりも多くの財務や他の資源、異なるリスク状況、およびより長い業界歴史を持っています。それらはまた職業発展にもっと多様な機会とより良い機会を提供するかもしれない。これらの特徴のいくつかは、それが提供するものではなく、素質の高い候補者やコンサルタントにもっと魅力的かもしれない。もし私たちが引き続き高い素質の人員と顧問を引き付けることができなければ、私たちの臨床候補製品batiraxceptを選択し、開発する速度と成功率は制限され、私たちの業務も制限されるだろう。
臨床開発,規制承認,商業化に関するリスク
Batiraxceptの臨床前研究または臨床試験結果が不利であれば、私たちはそれのさらなる開発または商業化から延期または排除される可能性があり、これは私たちの業務に実質的な損害を与える可能性がある。
Batiraxceptの開発を更に推進し、最終的にBatiraxceptを販売する市場の許可を得るために、著者らは広範な臨床前研究と臨床試験を行い、著者らの安全性と有効性を証明し、FDA或いは他の国の類似規制機関(状況に応じて)を満足させなければならない。臨床前研究と臨床試験は高価で複雑であり、完成するには何年もかかるかもしれず、しかも高度に不確定な結果を持っている。遅延、挫折または失敗は、安全性、耐性、毒性、証明の欠如を懸念する生物活性、または販売またはより高度な開発段階にある類似製品と比較して、より高い治療効果、悪い研究または試験設計の欠如、および試験を行うための材料の配合または製造プロセスに関連する問題である可能性があり、任意の時間および臨床前または臨床試験の任意の段階で発生する可能性がある。これまでの前臨床研究や早期臨床試験の結果は、特に我々が完成した臨床試験の被験者数が少ないため、後期臨床試験で観察される可能性のある結果を予測することはできない。多くの場合、臨床開発における候補製品は、臨床前研究または早期臨床試験において良好なこれらの特徴を示すにもかかわらず、必要な耐性、安全性、有効性の特徴を示すことができない可能性がある。
また、前臨床研究と臨床試験過程において、私たちは多くの予見できない事件に遭遇する可能性があり、これらの事件は、我々の臨床候補製品Batiraxceptの開発、市場承認または商業化を推進する能力を遅延または阻害する可能性があるが、これらに限定されない
| • |
FDAまたは異なる国の同様の規制機関と1つまたは複数の試験の範囲または設計についてコミュニケーションするか、候補製品の開発を臨床的に保留するか、または問題または問題が満足できる解決されるまで、追加の研究を行って彼らの質問に答えることを含む開発の次の段階を延期する |
| • |
規制機関または機関審査委員会(“IRBs”)は、予想される試験地点で臨床試験を開始または実施することを許可していないか、または予想された試験地点で受け入れられる臨床試験契約または臨床試験方案との合意を遅延または達成できなかった |
| • |
私たちの臨床試験の登録は延期されたり、進行速度が予想より遅くなったりします。参加者や参加者を募集して予想以上の速度で臨床試験を終了することは難しいからです |
| • |
私たちの第三者請負業者、私たちは彼らの臨床前研究、臨床試験、私たちの臨床試験材料の製造に依存して、監督要求を適時に遵守したり、私たちに対する契約義務を履行することができませんでした |
| • |
参加者が受け入れられない健康または安全リスクに直面している場合、臨床試験を一時停止または最終的に終了しなければならない |
| • |
監督機関やIRBsは様々な理由で、規制要件を満たしていないことを含む、私たちの臨床前研究と臨床試験を一時停止、一時停止または中止することを要求している |
| • |
著者らの臨床前研究或いは臨床試験を行うために必要な材料の供給或いは品質不足、不適切或いは使用できない。 |
Batiraxceptに関する臨床前研究または臨床試験から収集されたデータが満足できる耐性、安全性、および有効性を示しても、これらの結果は、米国FDAまたは他の外国司法管轄地域の他の同様の規制機関の承認を得るためにBLAの提出をサポートするのに十分ではない可能性があり、これは、私たちがbatiraxceptをマーケティングおよび販売するために必要である。
臨床試験は非常に高価で、時間がかかり、設計と実施が困難であり、しかも不確定な結果に関連し、もしそれらがFDA或いは類似の監督管理機関を満足させる安全性と有効性を証明できなければ、著者らは著者らの臨床候補製品batiraxceptを商業化することができない。
Batiraxceptはまだ臨床開発段階にあり、著者らが任意の適応或いは任意の治療方案のためにBLAを監督部門の承認のために提出する準備ができる前に、広範な追加の臨床テストが必要となる。私たちは規制部門がbatiraxceptを承認するためにBLAを提出するか、またはそのような未来のBLAがFDAによって承認されるかどうかを確実に予測することはできない。人体臨床試験は非常に高価で、設計と実施が困難であり、一部の原因はそれらが厳格な監督管理要求を受けているからである。例えば,FDAは我々が提案したどの臨床試験の終点にも同意しない可能性があり,臨床試験の開始を遅らせる可能性がある。臨床試験過程も時間がかかる。また,試験のどの段階でも失敗する可能性があり,臨床試験の放棄や重複を招く問題に遭遇する可能性がある。臨床試験後期段階の候補製品は期待された安全性と有効性特徴を示すことができない可能性があり、すでに臨床前研究と初歩臨床試験を通過したにもかかわらず、著者らは候補臨床製品の第一段階の臨床試験結果及び臨床前結果に対して著者らの第二段階或いは第三段階試験の結果を予測できないかもしれない。治療効果或いは不良の安全性が不足しているため、生物製薬業界のいくつかの会社は高級臨床試験で重大な挫折を受けた。
そのほか、臨床前と臨床データはよく多種の解釈と分析の影響を受けやすい。多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると思っているが、依然としてその製品のマーケティング許可を得られなかった。前臨床試験および早期臨床試験の成功は、今後の臨床試験がより多くの被験者に及ぶことを確保することはできず、後期臨床試験の結果は、以前の臨床試験および前臨床試験の結果をコピーしない可能性がある。例えば、2022年には、batiraxcept in proc適応設計第3段階試験の統計分析計画を修正し、試験中の中期分析を省略した。潜在的成功研究所に必要なベバシズマブ小児患者数を募集することができると信じているが、私たちの信念は誤りである可能性があり、最終的にはBLA承認の陰性試験結果や不確定な試験結果を支持することができない可能性がある。
もし私たちが現在予想されているbatiraxceptを超える追加の臨床試験または他の試験を行うことを要求された場合、もし私たちがbatiraxceptの臨床試験または他の試験を成功させることができなければ、これらの試験または試験の結果が陽性でないか、またはわずかな陽性である場合、または安全問題がある場合、私たちは:
| • |
Batiraxceptの上場承認を得ることで遅延された |
| • |
予算外の追加資金が必要です |
| • |
市場の承認を得ていません |
| • |
承認された適応や患者集団は期待や期待ほど広くない |
| • |
重大な使用または配布制限または安全警告(ボックス警告を含む)を含むラベルによって承認される; |
| • |
追加の上場後のテスト要求を受ける |
| • |
発売承認を得た後にこの製品を市場から撤退させます。 |
もし私たちがテストやマーケティング承認を得る上で遅延に遭遇すれば、製品開発コストも増加するだろう。いずれの臨床試験が計画通りに開始されるかどうか,再構成が必要かどうか,予定通りに完成するかどうか,あるいは全く知られていない。重大な臨床試験遅延は、私たちが臨床候補製品batiraxceptが独占的に商業化する権利を持つ任意の期限を短縮する可能性もあり、私たちの競争相手が私たちの前に製品を市場に出すことを可能にし、私たちの商業化に成功するbatiraxceptの能力を弱める可能性があり、これらはすべて私たちの業務と運営結果を損なう可能性がある。
臨床試験で被験者を登録·保持することは高価で時間のかかるプロセスであり,我々が制御できない様々な要因によりより困難になったり不可能になったりする可能性がある。
我々が行っている登録臨床試験や将来の臨床試験を完成させるのに十分な数の参加者を登録する際に,遅延や登録できない場合があるかもしれない。十分な数の患者を募集できることは少なくても,いったん募集すると,十分な数の参加者を残して何の実験もできない可能性がある。Batiraxceptの後期臨床試験は大量の被験者を登録と保留する必要があるかもしれない。被験者の臨床試験における登録と保留は、被験者群の規模、試験方案の性質、試験薬に関連する既存の安全性と有効性データ、競争療法の数と性質、同一適応競争薬が行っている臨床試験、被験者と臨床場所の距離、および試験の資格基準を含む多くの要素に依存する。
さらに、batiraxceptの臨床試験で報告された任意の負の結果、著者らの協力者による臨床試験で報告された負の結果、または同様の候補製品の負の結果は、同じ候補臨床製品の他の臨床試験の参加者を募集および維持することを困難または維持することを困難にする可能性がある。計画中の被験者の登録または保留の遅延または失敗は、コスト増加、計画遅延、または両方をもたらす可能性があり、これは、臨床候補製品を開発する能力に有害な影響を与える可能性があり、またはさらなる開発を不可能にする可能性がある。また,CROと臨床試験サイトにより将来の臨床試験が正確かつタイムリーに行われることを確保する予定であり,われわれのサービスについて合意する予定であるが,適用された法規に基づいて実際の表現を強制する能力が制限される。これらの第三者に対して提起された法執行行動は、私たちの臨床開発計画に関連するさらなる遅延と費用をもたらす可能性がある。
我々は,承認経路を加速することで,FDAによるccRCCへのbatiraxceptの承認を求める予定である.もし私たちがそのような承認を得ることができなければ、私たちは予想以上の追加臨床試験を要求される可能性があり、これは必要な上場承認を得る費用を増加させ、必要な上場承認を遅らせる可能性がある。FDAの加速的承認を得ても,我々の検証的試験が臨床的利益を確認していない場合,あるいは厳格な上場後の要求を遵守していない場合,FDAや同様の外国規制機関は加速承認の撤回を求める可能性がある。
加速承認計画によれば、FDAは、代替終点または中間臨床終点に対して臨床的利益を合理的に予測することができる候補製品を決定する場合に、既存の治療法よりも意義のある治療利益を提供する、深刻または生命に危険な疾患の治療のための候補製品の承認を加速することができる。FDAは臨床利益は特定の疾病の背景下で臨床意義のある積極的な治療効果であり、例えば不可逆的な発病率或いは死亡率であると考えている。承認を加速するために、代替終点は1つの標識であり、例えば実験室測定、放射画像、バイタルサイン或いは他の臨床利益を予測できると考えられる指標であるが、それ自体は臨床利益の測定基準ではない。中間臨床終点は不可逆的発病率或いは死亡率への影響の前に測定できる臨床終点であり、それは不可逆的な発病率或いは死亡率或いは他の臨床利益に対する影響を合理的に予測する可能性がある。加速承認経路は既存療法に対する新薬の優位性は直接の治療優位ではないかもしれないが、患者と公衆衛生の観点から見ると臨床上重要な改善状況である。承認が得られた場合、承認を加速することは、一般に、製品の臨床的利益を検証および説明するために、勤勉な方法で追加の承認後の検証的研究を行うことにスポンサーが同意することに依存する。このような承認後の研究がこの製品の臨床的利益を証明できなければ、FDAは承認を撤回する可能性がある。
我々の任意の候補製品の加速承認を求める前に、FDAや同様の外国規制機関からのフィードバックを求める予定であり、そうでなければ、承認を求めて加速させる能力を評価する。フィードバックや他の要因を評価した後、BLAまたは同様の加速承認または任意の他の形態の加速開発または審査の申請を継続または提出することを決定することは保証されません。同様に、FDAなどの外国規制機関からのその後のフィードバックが保証されない後、私たちが最初にそうすることを決定しても、承認の加速または任意の他の形態の加速開発や審査を求めたり申請したりし続ける。さらに、私たちが私たちの候補製品のために加速承認または他の加速開発または審査の申請を提出することを決定した場合、そのような提出または申請が受け入れられるか、または任意の加速開発または審査がタイムリーに承認されるか、または全く保証されない保証はない。FDAまたは他の同様の外国規制機関も、私たちの申請を考慮したり、任意の種類の申請を承認する前にさらなる検討を要求することができる。我々の候補製品が加速承認または任意の他の形態の加速開発または審査を得ることができない場合、候補製品の商業化の時間がより長くなり(あれば)、候補製品の開発コストを増加させ、市場での競争地位を損なう可能性がある。
私たちの候補製品の迅速なチャネル指定は、より速い開発や規制審査や承認過程をもたらすことができない可能性があり、これらの指定は、私たちの候補製品が上場承認される可能性を増加させません。
私たちはbatiraxceptの高速チャネルの称号を得た。1つの薬剤または生物学的候補薬剤が、深刻または生命に危険な疾患または疾患の治療に使用され、そのような疾患が満たされていない医療要件を解決する可能性を示す場合、スポンサーは、迅速なチャネル指定を申請することができる。FDAの従来のプログラムによる承認を考慮した製品と比較して、候補製品の迅速なチャネル指定を受けることは、より速い開発プロセス、審査または承認を招くことなく、FDAの最終承認を確保することもできない可能性がある。さらに、FDAは、この製品が高速チャネル指定の条件を満たさなくなることを後に決定する可能性がある。
私たちは候補薬の孤立した薬物指定または独占経営権を獲得または維持することができないかもしれません。これは私たちの候補製品の潜在的な収益力を制限するかもしれません。
米国およびヨーロッパを含むいくつかの管轄区域の規制当局は、患者数が比較的少ないまれな疾患または疾患を治療または予防する薬剤を孤児薬として指定する可能性がある。1983年の“孤児薬物法案”(“孤児薬物法案”)によると、1つの製品がまれな疾患または疾患を治療するための薬剤である場合、FDAは、米国患者数が20万人未満であると定義された孤児薬物として指定することができる。2021年10月、私たちはEMAからFDA指定の卵巣癌治療のバルテラケセットの孤児薬物名を取得した。孤児薬物指定を有する製品がその後、その指定された適応を有する最初の発売許可を得た場合、製品は7年間の市場排他期を得る権利があり、これにより、FDAはその間に同じ薬物の同じ適応の別の発売申請を承認することができないが、いくつかの例外は除外される。連合の類似条項はヨーロッパで10年間の排他性を許可する。薬物が孤児薬物指定の基準に適合しなくなった場合、またはその薬物の利益が十分に高く、マーケティング排他性がもはや合理的でない場合、ヨーロッパの排他的期間は6年に短縮されることができる。場合によっては、ヨーロッパでは、孤児薬物の排他性を失う可能性があり、例えば、孤児薬物指定保持者は、まれな疾患または疾患を有する患者の需要を満たすために十分な数の薬剤を生産できない、または何らかの他の理由で使用することができる。
私たちは他のバイオテクノロジーや製薬会社からの激しい競争に直面しています。もし私たちが効果的に競争できなければ、私たちの経営業績は影響を受けます。
癌治療の発展競争は激しく、迅速かつ重大な技術進歩に支配されている。特に、私たちは、より規模が大きく、資金がより十分な製薬、専門製薬、バイオテクノロジー会社、学術機関、政府機関、公共および民間研究機関を含む様々な源からの競争に直面している。これらの競争相手は様々な癌を治療する治療薬の提供に集中しており、これらの製品はすでに発売され、標準治療方案として市場に受け入れられている。さらに、将来的には、いくつかの癌の治療に使用することができるより多くの薬物または他の治療方法があるかもしれない。
私たちの多くの既存または潜在的な競争相手は、私たちよりも多くの財力、技術、人的資源を持っており、癌治療製品の発見と開発、および米国と外国のこれらの製品に対する監督管理の承認を得る上でも明らかに多くの経験がある。私たちは現在、潜在的な未来の競争相手とより多くの経験を持っており、発売が承認された薬物を商業化している。製薬とバイオテクノロジー産業の合併と買収は、私たちの少数の競争相手により多くの資源を集中させる可能性がある。
技術の商業適用性の進歩やこれらの業界に投資する資本の増加により、競争はさらに激化する可能性がある。私たちの競争相手は独占的な基礎の上で開発、買収に成功するかもしれません。私たちが開発する可能性のある任意の候補製品よりも効果的または安い薬があるかもしれません。
現在行われている他の感染症の治療については、現在承認されているか、または将来承認される他の薬剤からの競争に直面する。したがって、私たちが競争に成功する能力は私たちの能力に大きく依存するだろう
| • |
市場の他の製品よりも優れた候補製品を開発し商業化することです |
| • |
著者らの臨床試験により、著者らの臨床候補製品batiraxceptは既存と未来の治療方法と異なることが証明された |
| • |
質の高い科学技術人材とビジネス人材を誘致する |
| • |
Batiraxceptの特許または他の固有の保護を取得する |
| • |
必要な規制の承認を得る |
| • |
第三者支払者から保険と適切な補償を受け、競争力のある価格設定を第三者支払者と交渉すること |
| • |
独自またはパートナーとの新製品候補製品の開発と商業化に成功した。 |
私たちの競争相手の製品供給は私たちが開発したすべての候補製品の需要と私たちが受け取ることができる価格を制限するかもしれません。既存またはその後に発売された治療法と競争できないことは、私たちの業務、財務状況、および将来性に悪影響を及ぼすだろう。
古い製薬会社は、新しい化合物の発見と開発を加速させるために投資したり、私たちの候補製品の競争力を低下させる可能性のある新しい化合物に許可を提供したりする可能性がある。また、承認された製品と競争するいかなる新製品も、価格競争を克服し、商業的に成功するために、効果、利便性、耐性、安全性の面で納得できる優位性を示さなければならない。したがって、私たちの競争相手は、私たちの前に特許保護を成功させ、FDAの薬品の承認、または商業化を発見、開発、獲得することに成功する可能性があり、これは私たちの業務および運営結果に悪影響を及ぼすだろう。
私たちの臨床候補品batiraxceptは 悪影響を及ぼす可能性があり、または、私たちの規制の承認を遅延または阻止するか、または承認された任意のラベルまたは市場受容度を制限する可能性のある他の属性を有する。
Batiraxceptによる不良事件は審査実体、臨床試験場所或いは監督機関の中断、臨床試験の延期或いは停止を招く可能性があり、そして監督部門の承認拒否を招く可能性がある。もし私たちのbatiraxcept臨床試験で報告された有害事象の頻度または重症度が受け入れられない場合、私たちはこのような臨床候補製品のために規制された承認を得る能力は負の影響を受ける可能性がある。さらに、任意の臨床候補製品と我々の候補製品との併用によって引き起こされる有害事象は、batiraxceptによって引き起こされなくても、同様の中断および遅延をもたらす可能性がある。
さらに、もし私たちのすべての製品が承認され、その後深刻または予期しない副作用を招く場合、多くの潜在的な重大な負の結果を引き起こす可能性があります
| • |
規制部門は、候補製品の承認を撤回したり、その流通または他のリスク管理措置に制限を加えたりすることができる |
| • |
規制当局は警告や禁忌症のようなラベル宣言の追加を要求するかもしれない |
| • |
より多くの臨床試験が必要かもしれません |
| • |
私たちは起訴され、患者が受けた傷害に責任を負うかもしれない |
| • |
私たちの候補製品の販売を中止することができます |
| • |
私たちの名声は損なわれるかもしれない。 |
これらの事件のいずれも、影響を受けた候補製品に対する市場の受け入れを達成または維持することを阻止することができ、商業化コストを大幅に増加させる可能性がある。
私たちの従業員、独立請負業者、主要な調査者、コンサルタント、商業協力者、サービスプロバイダ、および他のサプライヤーは、規制基準と要求を守らないことを含む不当な行為または他の不適切な活動に従事する可能性があり、これは私たちの運営結果に悪影響を及ぼす可能性があります。
私たちは、首席調査者、コンサルタント、商業協力者、サービスプロバイダ、および他のサプライヤーが詐欺または他の不正活動に従事する可能性があるリスクに直面しています。これらの当事者の不正行為は、そのような規制機関に真実、完全かつ正確な情報を報告することを要求する法律、製造基準、連邦および州医療詐欺および乱用、ならびに衛生規制法および他の同様の外国詐欺的不正行為法律、または財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む、故意、無謀および/または不注意な行為、またはFDAおよび他の同様の規制機関の法律に違反する不正な活動を含むことができる。これらの各方面の不当な行為はまた、臨床試験過程で得られた情報の不適切な使用或いは虚偽陳述に関連する可能性があり、これは規制制裁と著者らの名声に深刻な損害を与える可能性がある。第三者の不正行為を識別し、阻止することは常に可能ではなく、私たちがそのような活動を発見し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはそのような法律または法規に準拠していないことによる政府調査または他の行動または訴訟から保護することができない可能性がある。もし私たちにこのような訴訟を提起した場合、私たちは私たちの権利を弁護したり、維持することに成功しませんでした。これらの訴訟は、重大な民事、刑事および行政処罰、損害賠償、罰金、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、名声被害、利益および将来の収益の減少、および私たちの業務削減を含む、私たちの業務運営能力および運営結果に悪影響を及ぼす可能性があります。
もし私たちが必要な規制承認を得ることができない場合、あるいは規制承認を得る上で遅延が発生した場合、私たちの臨床候補製品batiraxceptを商業化することができない、あるいは商業化が延期され、私たちの収益能力が損なわれるだろう。
私たちの設計、テスト、製造、安全性、有効性、記録保存、ラベル、保存、承認、広告、販売促進、販売、流通を含むBatiraxceptおよび私たちの開発と商業化に関連する活動は、米国FDAと他の規制機関、および他の国や地域の類似機関によって全面的に規制されている。もし臨床候補製品が市場の承認を得られなければ、私たちはこの候補臨床製品を商業化できないだろう。私たちはまだどの管轄区の規制機関からもBatiraxceptの承認を受けていない。私たちは市場承認を得るために必要な申請の提出と支援に必要な経験が限られており、この過程でCROに依存することが予想される。監督部門の承認を得るためには、各監督機関に広範な臨床前と臨床データ及び支持情報を提出し、臨床候補製品の安全性と有効性を確定する必要がある。監督管理の承認を得るためには、製品の製造過程に関する情報を関連監督機関に提出し、関連監督機関が製造施設を検査する必要がある。Batiraxceptは効果がない可能性があり、適度に有効である可能性があるか、または不良または意外な副作用、毒性または他の特徴を有することが証明される可能性があり、上場承認を阻止するか、または商業用途を阻止または制限する可能性がある。
アメリカや他のところでは、マーケティング承認を得る過程は高価で、何年もかかるかもしれませんし、関連する候補製品のタイプ、複雑さ、新規性を含む様々な要素によって大きく異なるかもしれません。私たちはあなたに私たちの候補製品がどんな司法管轄区でもどんなマーケティング承認を受けることを保証できません。事実,FDAは白金耐性再発卵巣癌に対するbatiraxceptの研究を急速発展計画として指定しており,有利である可能性があるが,FDAのいかなる規制手順の時間や結果も保証されていない。高速道路を指定する条件を満たさなければ,高速道路の状態が破棄される可能性がある.開発中の市場承認政策の変化、追加法規または法規の変化、または各提出された製品申請に対する規制審査の変化は、承認の遅延または申請の拒否を招く可能性がある。FDAや他国の類似機関は承認過程において大きな裁量権を有しており,任意の申請を拒否することができ,我々のデータが承認を得るのに不十分であり,追加の臨床前や他の研究や臨床試験が必要であることを決定することもできる。そのほか、前臨床試験と臨床試験から得られたデータの異なる解釈は候補製品の上場承認を延期、制限或いは阻止する可能性がある。さらに、私たちが最終的に得たどのマーケティング承認も限られているかもしれないし、制限されたり、承認された後の約束は、承認された製品が商業的に実行できないようにすることができる。
米国でFDAの承認を得ても、私たちの臨床候補製品batiraxceptは他のいかなる司法管轄区域でも承認または商業化されない可能性があり、これは私たちがすべての製品を達成する能力を制限するだろう’It‘それは十分な市場潜在力を持っている。
特定の管轄区域でbatiraxceptを販売するためには、国ごとに安全性と有効性に関する多くのおよび異なる規制要件を確立し、遵守しなければならない。米国FDAの承認は、他国又は管轄区域の規制機関の承認を確保しておらず、他の国又は管轄区域の規制機関の承認はFDAの承認を確保していない。また、一国で行われた臨床試験は他の国の規制機関に受け入れられない可能性があり、一国の規制承認は他の国の規制承認を保証することはできない。承認の流れは国/地域によって異なり、追加の候補製品テストと検証、および追加の行政審査期限が含まれる可能性があります。外国の監督管理機関の承認を求めることは私たちに困難とコストをもたらす可能性があり、追加の臨床前研究或いは臨床試験が必要であり、これは高価で時間がかかるかもしれない。各国の規制要求には大きな違いがある可能性があり、これらの国でのbatiraxceptの導入を延期または阻止する可能性がある。私たちは国際市場も含めてどの司法管轄区域でも候補製品の販売を許可していませんし、国際市場で規制の承認を受けた経験もありません。もし私たちまたは私たちのパートナーが国際市場の規制要求を遵守できなかったり、必要な承認を得て維持できなかったり、あるいは国際市場の規制承認が延期された場合、私たちの目標市場は減少し、私たちが開発した任意の候補製品のすべての市場潜在力を達成する能力は達成できないだろう。
私たちが監督部門の承認を得ても、私たちは広範な持続的な規制要求に直面し、私たちの臨床候補製品batiraxceptは未来の開発と規制困難に直面する可能性がある。
私たちが上場承認を得た任意の候補製品、及びこの候補製品の製造プロセス、承認後の臨床データ、ラベル、包装、流通、不良事件報告、貯蔵、記録保存、輸出、輸入、広告と販売促進活動などは、FDAと他の監督管理機関の広範かつ持続的な要求と審査を受ける。これらの要求は安全性、有効性とその他の発売後の情報と報告の提出、機関登録と薬品発売要求、引き続き製造、品質管理、品質保証と相応の記録とファイル維持に関するcGMP要求、医師へのサンプル配布と記録保存に関する要求、及び著者らが承認後に行った任意の臨床試験の現行GCP要求を含む。候補製品の上場が承認されても、承認は、その候補製品が市場の指定用途に使用される可能性のある制限または承認条件によって制限される可能性がある。Batiraxceptが発売承認された場合、付属のラベルは私たちの製品の承認使用を制限する可能性があり、これは販売を制限する可能性があります。
FDAはまた、バルテラシップの安全性および/または有効性を監視するために、高価な上場後研究または臨床試験およびモニタリングを要求する可能性がある。FDAは薬品の承認後のマーケティングと販売促進を密接に監督し、薬品が承認された適応のみに対する販売を確保し、承認されたラベルの規定に基づいて販売する。FDAはメーカーの非ラベル薬物使用に関するコミュニケーションに厳しい制限を加えており,その承認された適応に対してbatiraxceptを販売しなければ,非ラベル薬物マーケティングにより法執行行動の影響を受ける可能性がある。処方薬の促進に関連する連邦食品、薬物、化粧品法案の違反は、FDAが法執行行動を取り、連邦と州医療保健詐欺と法律乱用、州消費者保護法に違反していることを告発する可能性がある。
さらに、以前未知の有害事象またはbatiraxcept、製造業者または製造プロセスに関連する他の問題、または規制要件を遵守できなかったことが後に発見され、様々な結果が生じる可能性がある
| • |
このような臨床候補製品の生産を制限し |
| • |
臨床候補製品のラベルまたはマーケティングの制限; |
| • |
製品の流通や使用の制限; |
| • |
発売後の研究や臨床試験が求められている |
| • |
警告状 |
| • |
臨床候補製品が市場から撤退した |
| • |
私たちが提出した保留申請または承認された申請を承認する補充申請を拒否する; |
| • |
このような候補臨床製品をリコールします |
| • |
罰金、利益または収入の返還、 |
| • |
上場承認の一時停止または撤回 |
| • |
候補臨床製品の輸入または輸出を許可することを拒否する |
| • |
臨床製品候補てんかん |
| • |
民事または刑事処罰を禁令または適用する。 |
FDAの政策は変わる可能性があり、政府はbatiraxceptに対する規制部門の承認を阻止、制限、または延期するための追加法規を公布するかもしれない。もし私たちが既存の要求の変化に緩やかに適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは私たちがコンプライアンスを維持できない場合、私たちは私たちが得る可能性のあるマーケティング承認を失う可能性がある。
私たちの臨床候補製品batiraxceptが市場承認を得ても、私たちは医者、患者、第三者支払人あるいは医学界の他の商業成功に必要な人の受け入れを得ることができないかもしれない。
もしbatiraxceptが市場の承認を得たら、私たちはまだ医者、患者、第三者支払人と医学界の他の人の十分な市場受容度を得ることができないかもしれない。もし私たちが十分な受容度に達していなければ、私たちは相当な収入を得られないかもしれないし、利益も得られないかもしれない。市場受容度は、商業販売のために許可された場合、多くの要因に依存するが、これらに限定されない
| • |
代替療法と比較した治療効果と潜在的優位性 |
| • |
販売とマーケティングの有効性 |
| • |
代替治療に関連する治療費 |
| • |
私たちは競争力のある価格でbatiraxceptを売ることができる |
| • |
代替療法と比較して投与の利便性と簡易性 |
| • |
対象患者群が新たな療法を試みる意欲と,医師がこれらの治療法を処方する意欲 |
| • |
医学界はbatiraxceptを代替または補完するために、私たちの製品候補オプションを顧客に提供することを望んでいるかどうか |
| • |
有力なマーケティングと流通支援 |
| • |
第三者保険と適切な補償を提供する |
| • |
どんな副作用の流行や重症度も |
| • |
私たちの製品が他の薬と一緒に使用されることを制限するいかなる制限もない。 |
私たちはすべてのbatiraxceptの販売が同じ行動メカニズムに基づいていると予想しているため、私たちの最初の候補製品が市場承認を得られなかったことは私たちの業務を損なうことになり、私たちはもともと計画されていたよりも早く追加融資を求めることを要求するかもしれない。
新ロット製品の保険カバー範囲と精算状況はまだ確定していない。私たちの候補製品は不利な価格設定法規、第三者保険、清算やり方、あるいは医療改革措置の影響を受ける可能性があり、これは私たちの業務を損なうことになります。新製品や既存製品のために十分な保険や精算を得ることができない場合、これらの製品をマーケティングする能力を制限し、収入を創出する能力を低下させる可能性があります。
新薬の発売審査、定価、カバーと精算を管理する規定は国によって異なる。米国では、最近公布された立法が承認要求を大幅に変更する可能性があり、これは追加のコストに関連し、承認の遅延を招く可能性がある。一部の国は薬品の販売価格が承認されてから発売されることを要求している。多くの国で、定価審査期間はマーケティングまたは製品許可を承認した後から始まる。一部の外国市場では、処方薬の定価は初歩的な承認を得た後も、政府の持続的なコントロールを受けている。したがって、特定の国/地域での製品のマーケティング承認を得ることができるかもしれませんが、その後、価格法規の制約を受けて、これらの法規は私たちの製品の商業発表を延期し、長い時間遅延し、その国/地域で製品を販売することによって生じる収入に悪影響を与える可能性があります。不利な価格設定制限は、私たちが開発可能な任意の候補製品が市場承認を得ても、1つ以上の候補製品への投資を回収する能力を阻害する可能性がある。
私たちの候補製品の商業化に成功できるかどうかは、政府衛生行政部門、個人健康保険会社、その他の組織がこれらの製品と治療に提供する保険範囲と十分な補償にある程度依存する。政府当局と第三者支払者、例えば個人健康保険会社や健康維持組織は、どのような薬剤を支払うかを決定し、精算レベルを確立する。政府や個人支払者が提供する保険範囲や精算範囲は,多くの患者が遺伝子治療製品などの治療費を支払うために重要である。私たちが決定するかもしれないこれらまたは他の候補製品の販売は、私たちの製品候補の費用がどの程度健康維持、管理医療、薬局福祉および同様の医療管理組織によって支払われるか、または政府衛生行政当局、個人健康保険会社、および他の第三者支払人によってどの程度精算されるかに大きく依存する。保険や十分な精算が得られない場合、あるいは限られたレベルに限られていれば、候補製品を商業化することに成功できないかもしれません。保険を提供しても、承認された精算金額が十分に高くない可能性があり、十分な投資リターンを実現するために十分な価格設定を確立したり維持したりするのに十分ではないかもしれません。
政府と個人支払者の獲得性と精算範囲は大多数の患者が高価な治療費用を負担できる鍵である。米国および国際的に、上場承認を得たbatiraxceptの販売は、batiraxceptのコストがどの程度健康維持、管理医療、薬局福祉および同様の医療管理組織によって支払われるか、または政府衛生行政当局、個人健康保険会社、および他の第三者支払人によってどの程度精算されるかに大きく依存する。もし精算が得られない場合、あるいは限られた基礎でしか精算できない場合、私たちはbatiraxceptを商業化することに成功できないかもしれない。保険を提供しても、承認された精算金額は、私たちの投資から十分な見返りを得ることができるように、十分な価格設定を確立したり維持したりするのに十分ではないかもしれません。
アメリカ以外では、国際業務は通常広範な政府価格規制と他の市場規制を受けており、私たちはヨーロッパ、カナダ、中国、その他の国のコスト制御措置が日々重視されており、Batiraxceptの価格設定の条項が現在予想されているほど優遇されていない可能性があると考えている。多くの国、特に欧州連合国では、国家衛生システムの一部として、医療製品の価格は異なる価格制御メカニズムの制約を受けている。これらの国では、製品の発売許可を受けた後、政府当局との定価交渉にかなりの時間がかかる可能性がある。一部の国で精算或いは定価の承認を得るためには、batiraxceptを他の既存療法のコスト効果と比較する臨床試験を行う必要があるかもしれない。一般的に、この制度での製品価格はアメリカよりずっと低い。他の国は会社が自ら価格を設定することを許可しているが、会社の利益を監視する。外国の追加価格規制や定価法規の他の変化は、臨床候補製品の料金金額を制限する可能性がある。そのため、米国以外の市場では、米国に比べて製品の精算が減少する可能性があり、商業的に合理的な収入や利益を生み出すには不十分である可能性がある。
また、アメリカと国際では、政府と第三者支払人が医療コストを制限或いは低減することは、これらの組織が新承認製品のカバー範囲と精算レベルを制限する可能性があり、そのため、十分な臨床製品候補支払いをカバー或いは提供できない可能性がある。管理型ヘルスケアの傾向,ヘルスケア組織のますますの影響力,追加的な立法変化により,batiraxcept販売に関する定価圧力に直面することが予想される。全体的に,医療コストの下振れ圧力は非常に大きくなり,特に処方薬,外科手術,その他の治療が行われている。そのため、新製品の市場進出にますます高い壁が設けられている。
州や連邦医療規制法を遵守しなければ、重大な処罰、損害賠償、罰金、返還、政府医療計画への参加から除外され、運営を削減される可能性があり、これらはいずれも私たちの業務を損なう可能性がある。
医療サービスを提供したり、第三者精算請求を提出したりしないにもかかわらず、医療詐欺や規制の乱用、連邦や州政府の法執行を受けており、私たちの業務に大きな影響を与える可能性があります。私たちの運営能力に影響を与える可能性のある法律は含まれているが、これらに限定されない
| • |
連邦反リベート法規は、他の事項に加えて、個人および実体がインフォームドコンセントおよび故意の場合、直接または間接的に現金または実物で報酬を請求し、受け入れ、提供または報酬を支払うことを禁止し、個人を紹介または購入、レンタル、注文または推薦する任意の商品、施設、物品またはサービスを提供または誘導し、これらの商品、施設、物品またはサービスは、連邦医療保険および医療補助などの連邦医療計画に従って全部または部分的に支払うことができる。個人または実体は、この規制について実際に理解したり、それに違反したりする具体的な意図を持つ必要はない |
| • |
民事FCAは、他の事項に加えて、個人または実体が虚偽または詐欺的な連邦医療保険、医療補助または他の第三者支払者の支払い請求を意図的に提出または提出することを禁止すること;政府の支払いまたは承認された虚偽または詐欺的クレームを得るために虚偽記録または報告書を作成または使用することを故意に使用または使用すること、または連邦政府への支払いの義務を回避、減少または隠蔽するために、虚偽記録または報告書の作成または使用をもたらすこと、または虚偽記録または報告書の作成、使用または使用をもたらすこと; |
| • |
刑事FCAは、このような虚偽、虚構または詐欺的だと主張することを知りながら政府に提出または主張した個人または実体に刑事罰金または監禁を科す |
| • |
連邦刑法を制定し、任意の医療福祉計画を詐欺する計画や医療保健事項に関する虚偽陳述を行うことを禁止するHIPAA |
| • |
連邦民事罰金法規は、他の事項に加えて、受益者に影響を与える可能性があることを知っているか、または知っているべきか、連邦または州政府が計画して精算することができる物品またはサービスを選択した受益者への提供または報酬の提供を禁止する |
| • |
ACA下の連邦医師の日光要求は、ある薬品、設備、生物製品および医療用品メーカーが毎年アメリカの衛生·公衆サービス部に医師、他の医療保健提供者および教育病院への支払いおよび他の方法での価値移転に関する情報、ならびに医師および他の医療保健提供者およびその直系親族が所有する所有権および投資権益を報告することを要求する |
| • |
州および外国の法律は、商業保険会社を含む任意の第三者支払者によって返済される可能性のあるプロジェクトまたはサービスに適用可能な反リベートおよび虚偽クレーム法律のような上述した各連邦法律に相当し、州法律は、製薬会社に、デバイス業界の自発的コンプライアンスガイドラインおよび連邦政府によって発行された関連するコンプライアンスガイドラインを遵守することを要求するか、または医療サービス提供者および他の潜在的な転換源に支払う可能性のあるお金を他の方法で制限すること、およびデバイスメーカーに医師および他の医療保健提供者またはマーケティング支出への支払いおよび他の価値移転に関する情報を報告することを要求する州法律に相当する。 |
また,ACAは連邦反リベート法規と何らかの医療詐欺を管理する刑事法規の意図要件を改正した。現在、個人又は実体が法規に違反する具体的な意図を実際に理解していない場合には、有罪判決を受けることができる。また,ACAは,政府は,FCAについては,連邦反リベート法規違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると主張することができる。もし政府当局が私たちが顧客に不適切な提案をしたり、虚偽の精算申請の提出を奨励していると判断した場合、私たちは政府当局の訴訟に直面する可能性があります。これらの法律に違反するいかなる行為も、私たちのこれらの法律に違反するいかなる行為も、私たちが防御に成功しても、私たちの名声、業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性がある。
私たちは医師や他の医療提供者と相談と科学顧問委員会の手配を達成した。その中のいくつかの計画の補償は株式オプションを提供することを含む。私たちは適用された法律を遵守するために私たちの手配を構築しようと努力してきたが、これらの法律の複雑かつ深遠な性質のため、規制機関はこれらの取引を再構成または終了しなければならない禁止された手配と見なすか、あるいは私たちはそれによって他の重大な処罰を受けるかもしれない。規制当局が私たちの製品の発注や使用に影響を与えるサプライヤーとの財務関係を適用法違反と解釈すれば、悪影響を受ける可能性がある。
これらの法律の範囲も執行も不確定であり,現在の医療改革環境下では,特に適用の前例や法規が乏しい場合には,急速な変化が生じる可能性がある。連邦と州法執行機関は最近、医療保険会社と医療保健提供者の間の相互作用の審査を強化し、医療保健業界の一連の調査、起訴、有罪判決と和解を招いた。
調査への対応に時間と資源がかかる可能性があり、経営陣の業務への関心を分散させる可能性がある。また,これらの調査の結果として,医療提供者や実体は,法令や会社の誠実な合意の一部である余分な煩雑なコンプライアンスや報告要求に同意しなければならない可能性がある。このような調査や和解は、私たちのコストを増加させるか、または他の方法で私たちの業務に悪影響を及ぼす可能性がある。
私たちに対する製品責任訴訟は、私たちが重大な責任を負うことを招き、私たちが開発する可能性のある任意の候補製品の商業化を制限する可能性があります。
我々は,ヒト臨床試験でbatiraxceptを試験することに関連する製品責任曝露の固有のリスクに直面しており,承認後に開発可能な任意の製品を商業化販売すれば,より大きなリスクに直面する。著者らの臨床試験におけるいかなる副作用もbatiraxceptに関与していると考えられ、これらの傷害のクレームを招く可能性があり、私たちは重大な責任を招く可能性がある。是非曲直や最終結果にかかわらず、賠償責任は
| • |
私たちが開発する可能性のある候補製品の需要が減少しています |
| • |
私たちの名声とメディアの深刻な否定的な関心を損なう |
| • |
臨床試験参加者の脱退 |
| • |
関連訴訟を正当化するための巨額の費用 |
| • |
被験者や患者に巨額の金銭的報酬を与え |
| • |
収入の損失 |
| • |
私たちが開発する可能性のあるどんな製品も商業化できない。 |
私たちは製品責任保険を維持しています。毎回のクレーム金額は最高1,000万ドル、総金額は10億ドルに達しますが、私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれません。私たちが臨床試験を続けるにつれて、どんな製品を商業化することに成功すれば、私たちの保険カバー範囲を増やす必要があると予想されます。保険範囲はますます高くなっています。私たちは可能などんな責任にも対応するために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。
もし私たちが単独であるいは第三者と協力して販売、マーケティング、流通能力を確立できなければ、私たちは私たちの臨床候補製品を商業化することに成功できないかもしれないBatiraxceptはもし承認されたら。
私たちはbatiraxceptの販売、マーケティング、または流通のインフラを持っていません。そのような組織を確立して維持するコストは、そうする費用対効果を超える可能性があります。承認される可能性のある任意の候補製品をマーケティングするためには、私たちの販売、流通、マーケティング、管理、および他の非技術的能力を確立するか、または第三者とこれらのサービスを実行するように手配しなければなりません。私たちが市場で承認された任意の候補製品を商業的に成功させるためには、販売とマーケティング組織が必要だ。承認されれば、米国で任意の他の候補製品をマーケティングするために、販売、流通、マーケティングに集中したインフラを構築したい。私たち自身の販売、マーケティングと流通能力を確立することは、私たちが合格者を募集し、維持し、適切に激励し、十分な販売手がかりを生成し、販売とマーケティング人員に十分な訓練を提供し、異なる地理的位置に分散した販売とマーケティングチームを効果的に管理する能力を含む大量の費用とリスクに関連する。私たちの内部販売、マーケティング、および流通能力の発展のいかなる失敗や遅延も、任意の候補製品の発表を延期する可能性があり、これは商業化に悪影響を及ぼすだろう。
Batiraxceptの商業化を阻害する可能性があります
| • |
十分な数の効果的な販売とマーケティング担当者を募集し、訓練し、維持することはできません |
| • |
販売員は私たちの製品を管理するために医師に接触したり、十分な数の医者を得ることができない |
| • |
独立した販売およびマーケティング組織の作成に関連する予測不可能なコストおよび費用。 |
私たちはいくつかの国際市場のbatiraxceptの販売とマーケティングについて協力するつもりで、承認されれば、このような協力スケジュールを確立または維持することができないかもしれません。そうすることができれば、私たちの協力者は効果的な販売を行うことができないかもしれません。私たちが第三者に依存してマーケティングや流通を行う程度では、私たちが得たどんな収入もこれらの第三者の努力にかかっており、このような努力が必ず成功する保証はない。
もし私たちがアメリカに自分の販売チームを作ったり、アメリカ以外でbatiraxceptの商業化交渉について協力関係を結ぶことができなければ、潜在的な商業化を延期したり、私たちの販売やマーケティング活動の範囲を縮小したりすることを余儀なくされる可能性があります。私たちは第三者と合意しなければならないかもしれないし、私たちが選択したより早い段階で合意しなければならないかもしれません。私たちは私たちの知的財産権の権利を放棄すること、または他の方法で私たちに不利な条項に同意することを要求されるかもしれません。いずれも私たちの業務、経営業績、および見通しに悪影響を及ぼす可能性があります。
私たちは多くの会社と競争しているかもしれません。これらの会社は現在広範で資金的なマーケティングと販売業務を持っています。マーケティングおよび販売機能を実行するための内部チームまたは第三者の支援がなければ、これらのより成熟した会社との競争に成功することができないかもしれない。
私たちの臨床候補製品batiraxceptをアメリカ以外の地域で商業化することが承認されれば、国際業務に関連する様々なリスクが私たちの業務を損なう可能性があります。
もし私たちの臨床候補製品が商業化されることが承認されたら、私たちは3 D Medicineとの合意など、米国以外のいくつかの司法管轄区域でこれらの製品を販売することを第三者と合意するつもりだ。私たちは、国際運営や国際業務関係の構築に関する追加的なリスクに直面すると予想しています
| • |
国外の薬品審査に対する異なる監督管理要求と薬品商業化規則 |
| • |
知的財産権の保護を減らすことです |
| • |
関税、貿易障壁、規制要求の意外な変化 |
| • |
インフレ、特に外国経済と市場の政治的不安定を含む経済的疲弊 |
| • |
外国に住んだり旅行したりする従業員は税収、雇用、移民、労働法を遵守する |
| • |
海外清算、定価、保険制度 |
| • |
外国の税金 |
| • |
外国為替変動は、営業費用の増加と収入の減少、他の国での業務展開に付随する他の義務を招く可能性がある |
| • |
労働騒乱がアメリカよりも一般的な国では労働力の不確実性 |
| • |
1977年に改正された米国の“海外腐敗防止法”、イギリスの“2010年反賄賂法”、その他の司法管轄区域に類似した反賄賂や反腐敗法を遵守しない可能性がある |
| • |
海外の原材料供給や製造能力に影響を与える事件による製品不足; |
| • |
地政学的行動(戦争やテロを含む)や地震、台風、洪水、火災などの自然災害による業務中断。 |
私たちは以前このような分野で経験がなかった。また、EUと多くのヨーロッパ諸国と中国は複雑な規制、税収、労働者、その他の法律要求を提出しており、私たちはこれらの要求を遵守する必要がある。
最近公布された立法と将来の立法は、臨床候補製品batiraxceptの上場承認と商業化の難しさとコストを増加させ、私たちが獲得する可能性のある価格に影響を与えるかもしれない。
米国や一部の外国司法管轄地域では、医療システムに関する立法や規制改革、提案された改革は、臨床候補製品の上場承認を阻止または延期し、承認後の活動を制限または規制し、マーケティング承認された候補製品を収益的に販売する能力に影響を与える可能性がある。規制、法規、または既存の規制の解釈の変化は、(I)私たちの製造スケジュールの変更、(Ii)製品ラベルの追加または修正、(Iii)私たちの製品のリコールまたは停止、または(Iv)追加の記録保存要件のような、私たちの将来の業務に影響を与える可能性があります。このような変化を強制的に実施すれば、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
米国や他の地域の政策立案者の中で,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上および/または参入拡大を既定の目標としている。米国では、製薬業はこれらの努力の重点であり、重大な立法計画の大きな影響を受けてきた。2010年3月,ACAが採択され,政府や民間保険会社が医療に融資する方式を大きく変更し,米国製薬業に大きな影響を与えた。その他の事項以外に、ACAは生物製品を低コストの生物模倣薬の潜在競争を受けさせ、医療補助薬物リベート計画に基づいてメーカーが医療補助薬物リベート計画の下で不足しているリベートを計算し、医療補助薬物リベート計画の下でメーカーが不足している最低医療補助リベートを増加し、リベート計画を医療補助管理の看護組織に登録した個人に拡大し、あるブランドの処方薬メーカーに対する年会費と税収を増加させ、そして新しい連邦医療保険D部分カバーギャップ割引計画を作成する新しい方法を解決した。その中で、メーカーは保証期間内に条件を満たす受益者にブランド薬品交渉価格を適用する販売時点割引を提供することに同意しなければならず、メーカーの外来薬品として連邦医療保険D部分の保証の条件に組み入れなければならない。
ACAのいくつかの条項はまだ完全に施行されておらず、いくつかの条項は司法と国会の挑戦を受けている。国会はACAの全部または一部を廃止または廃止し、代替する立法を考慮しており、これらの挑戦およびACAの廃止および代替の他の努力がACAおよび我々の業務にどのように影響するかは不明である。
外国、連邦と州の各レベルはすでに立法と監督管理提案を引き続き提出することが可能であり、医療保健の獲得性を拡大し、医療保健コストをコントロール或いは低減することを目的としている。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの製品の商業化を阻止するかもしれない。これらの改革は、私たちが開発に成功し、規制承認を得る可能性のある候補製品の予想収入に悪影響を及ぼす可能性があり、私たちの全体的な財務状況や候補製品を開発する能力に影響を及ぼす可能性がある。
私たちは、将来的により多くの州と連邦医療改革措置を取ることが予想され、いずれも連邦および州政府が医療製品に支払う金額を制限する可能性があり、これはbatiraxceptに対する需要の減少または追加の価格設定圧力をもたらす可能性がある。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。
私たちの知的財産権に関するリスクは
もし私たちが私たちの臨床候補製品batiraxceptのために特許保護を獲得して維持することができない場合、あるいは得られた特許保護範囲が十分に広くなければ、私たちは私たちの市場で効果的に競争することができないかもしれない。
私たちは特許、商業秘密保護、秘密保護協定の組み合わせによって、私たちの薬物開発計画と臨床候補製品に関連する知的財産権を保護する。私たちの成功は私たちがアメリカや他の国で特許保護を取得して維持する能力に大きくかかっている。私たちはアメリカと海外で私たちの開発計画や臨床製品候補に関連する特許出願を提出することで私たちの特許地位を保護することを求めています。特許起訴過程は高価で時間がかかり、私たちはすべての必要または望ましい特許出願を合理的なコストでまたはタイムリーに提出して起訴することができないかもしれない。
我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.私たちが所有しているまたは許可されている特許出願は、発行された特許を生成できない可能性があり、その権利要件は、米国または他の国/地域における私たちの候補製品をカバーする。私たちの特許を無効にする可能性があり、または特許が発見された後に私たちの保留特許出願が発表される可能性のある潜在的に関連する以前の技術を阻止することは保証されない。特許が確実に発行されたとしても、第三者はその有効性、実行可能性、または範囲に疑問を提起する可能性があり、これは、このような特許が縮小され、無効にされ、または強制的に実行されない可能性がある。これらの特許または私たちが所有または許可してくれた任意の他の特許に対する任意の成功的な挑戦は、私たちの候補製品または私たちが開発する可能性のあるセット診断プログラムを商業化することに成功するために必要な権利を奪う可能性がある。また、規制承認に遅延が生じた場合、特許保護の下で候補製品と診断セットを販売する期間が短縮される可能性があります。
もし私たちが持っているプラットフォーム技術および臨床候補製品に関連する特許出願が発表されなかった場合、それらの保護の広さや強度が脅かされている場合、またはbatiraxceptに意味のある排他性を提供できなければ、会社が私たちと協力して未来の候補製品を開発することを阻止し、私たちの将来の薬物商業化の能力を脅かすかもしれない。そのような結果は私たちの業務を損なう可能性がある。
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。しかも、外国の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。例えば,欧州特許法のヒト治療法に対する特許性制限は米国法よりも多い。科学文献中の発見発表は往々にして実際の発見より遅れており,米国や他の管轄区の特許出願は通常出願18カ月後に発表され,時にはまったく発表されないこともある.したがって、私たちは、私たちが所有または許可している特許または出願中の特許出願において最初に要求された発明であるか、またはそのような発明のための最初の特許保護であるかを正確に知ることができない。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの未解決および未来の特許出願は、私たちの技術または候補製品の全部または一部を保護するために、または他社が競争技術を商業化することを効果的に阻止するために、特許の発行を招くことができないかもしれない。米国や他の国の特許法や特許法解釈の変化は,我々の特許の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。
最近の特許改革立法は、私たちの特許出願をめぐる起訴と、私たちが発表した特許の実行または保護の不確実性とコストを増加させるかもしれません。2011年、“ライシー·スミス米国発明法”(略称“ライシー·スミス法案”)が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を及ぼす可能性もある。米国特許庁は最近,Leahy−Smith法案の管理を管理するための新たな法規や手続きを制定し,Leahy−Smith法案に関連する特許法の多くの実質的な改正,特に最初の提出条項の改正は2013年に発効した。したがって,Leahy-Smith法案が我々の業務運営にどのような影響を与えるかは不明である(もしあれば).しかし、Leahy-Smith法案とその実施は、私たちの特許出願をめぐる起訴と、私たちが発行した特許の実行または保護の不確実性とコストを増加させる可能性があり、これらはすべて私たちの業務と財務状況に悪影響を及ぼす可能性がある。
さらに、私たちは、第3の方向の米国特許商標局が提出した既存技術の発行前に提出されたり、派生、再審査に参加したりすることができる各方面間私たちの特許権または他人の特許権の介入手続きを審査、許可後に審査または挑戦します。他の国では、私たちの特許権や他人の特許権に挑戦する反対手続きを受けたり、巻き込まれたりする可能性があります。このような提出または手続きにおける不利な裁決は、私たちの特許権の範囲を縮小したり、無効にしたりして、第三者が私たちの技術または候補製品を商業化し、私たちと直接競争することを可能にし、または第三者特許権を侵害することなく候補製品を製造または商業化することができなくなる可能性がある。さらに、私たちの特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、会社が私たちと協力し、現在または将来の候補製品を許可、開発、または商業化することを阻止するかもしれない。
特許の発行は、その発明性、範囲、有効性または実行可能性に対して決定的ではなく、所有および許可された特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。このような挑戦は、特許主張の全部または部分的な縮小、無効または実行不能をもたらす可能性があり、これは、他人が同様の技術および製品を使用または商業化することを阻止する能力を制限するか、または我々の技術および候補製品の特許保護期間を制限する可能性がある。しかも、特許の寿命は限られている。アメリカと他の国では、特許の自然消滅時間は一般的に提出後20年だ。様々な延期があるかもしれない;しかし、特許の有効期限とその提供される保護は限られている。もし私たちが現在または未来の候補製品に特許保護がなければ、私たちはそのような候補製品からの模造バージョンの競争に直面するかもしれない。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちが持っている特許と許可された特許の組み合わせは、他の会社が私たちと似ているか同じ候補製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
私たちは私たちの特許、ライセンシーの特許、または私たちの他の知的財産権を保護または強制する訴訟に巻き込まれるかもしれません。これは高価で、時間がかかり、成功しないかもしれません。
競争相手および他の第三者は、私たちの特許、私たちのライセンシーの特許、私たちのライセンシーの特許、または私たちの他の知的財産権を侵害または他の方法で侵害する可能性がある。権利侵害や不正使用に対抗するために、私たちは高価で時間がかかるかもしれない法的請求を要求されるかもしれない。さらに、侵害訴訟では、裁判所は、私たちまたは私たちのライセンシーの特許が無効であるか、または強制的に実行できないと判断することができ、または、そのような特許が関連する技術をカバーしないことを理由に、他方の関連する技術の使用を阻止することを拒否することができる。任意の訴訟または弁護手続における不利な結果は、私たちの1つまたは複数の特許を無効または狭義に解釈されるリスクに直面させ、私たちの特許出願を発行できないリスクに直面させる可能性がある。第三者へのクレームは、私たちの特許が無効または強制的に実行できないと主張するような第三者からの反クレームを引き起こす可能性もある。米国の特許訴訟では,被告が無効または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明確性の欠如、使用不可能性、または法定テーマの欠如を含む、いくつかの法定要求のいずれかを満たすことができなかったと言われている可能性がある。主張を実行できない理由は,特許訴訟に関連する人が起訴期間中に米国特許商標局に重要な情報を隠蔽したり,重大な誤解を持つ声明をしたりしたからであろう.第三者は、例えば、資金調達後の手続きにおいて、米国特許商標局に同様の有効性クレームを提出することもできる各方面間審査、又は認可後審査、又は反対意見又は米国国外の類似訴訟は、訴訟と同時に行われ、訴訟の範囲内でもない。法的に無効と実行不可能と断言された後の結果は予測できない。私たちは無効な以前の技術がないことを確認することができず、私たちと特許審査員は起訴中にこれを認識しなかった。私たちが許可した特許および特許出願については、第三者の挑戦を防ぐために、限られた権利またはいかなる許可特許の弁護に参加する権利もないかもしれない。もし被告が無効または強制不可能な法的主張に勝った場合、私たちは少なくとも部分的、さらにはすべて、私たちの現在または未来の候補製品の任意の未来の特許保護を失うだろう。このような特許保護の喪失は私たちの業務を損なうかもしれない。
私たちは私たちの知的財産権の盗用を単独でまたは私たちのライセンシーや被許可者と一緒に防ぐことができないかもしれません。特に法律ではアメリカのようにこれらの権利を十分に保護していないかもしれません。訴訟で勝訴した側が商業的に合理的な条項でライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。私たちの知的財産権を強制的に執行する訴訟や他の手続きは失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性があります。
さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。聴聞、動議、または他の一時的手続き、または事態発展の結果を公開することもできる。もし証券アナリストや投資家がこれらの結果がマイナスだと思ったら、私たちの普通株の価格に悪影響を及ぼすかもしれない。
米国特許法の変化は特許の全体的な価値を低下させ、私たちの臨床候補製品batiraxceptを保護する能力を弱める可能性がある。
米国は最近、広範囲な特許改革立法を公布し、実施した。近年、米国最高裁判所はいくつかの特許事件に対して裁決を下し、場合によっては利用可能な特許保護範囲を縮小するか、場合によっては特許権者の権利を弱めるかを決定している。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、連邦裁判所、および米国特許商標局の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を獲得したり、私たちが許可または将来獲得可能な特許を実行する能力を弱める可能性がある。
もし第三者が私たちが彼らの知的財産権を侵害していると主張すれば、私たちは巨額の費用を発生させるか、あるいは私たちの臨床候補製品batiraxceptのさらなる開発または商業化を阻止されるかもしれません。これは私たちの業務に実質的な損害を与えるかもしれません。
私たちの成功はまた、第三者特許や他の独自の知的財産権を侵害することなく運営する能力にかかっているだろう。これは一般的に“運営の自由”を持つと呼ばれる。私たちはまだ深く自由な操作検索を行っていないが、これは時間がかかって費用がかかるだろう。バイオテクノロジーと製薬産業の特徴は特許と他の知的財産権に関する広範な訴訟だ。米国と国際では、知的財産権主張の弁護と起訴、介入訴訟および関連する法律と行政訴訟は複雑な法律と事実問題に関連している。そのため,このような訴訟手続きは冗長であり,費用が高く,時間がかかり,その結果はきわめて不確実である.私たちは、他人の固有の権利の実行可能性、範囲、有効性を決定するために、長期的で費用の高い訴訟に巻き込まれるか、または私たちが他人の知的財産権に関連する運営自由を持っているかどうかを決定するかもしれない。例えば、Axl融合タンパク質および癌治療におけるそれらの使用を主張する米国特許番号8,168,415および8,920,799が知られている。これらの特許のうちの1つまたは別の特許が将来的に我々のGas 6-Axl計画に対して成功的に主張された場合、私たちは、全くなければ、特許権者の許可なしに製品を販売することができない可能性があり、これは、全くなければ、商業的に合理的な条項では得られないかもしれない。
ほとんどの場合、米国の特許出願は、特許出願が提出されてから約18ヶ月後まで秘密にされている。科学または特許文献における発見の発表は、通常、潜在的発見の日よりもはるかに遅い。したがって、私たちと類似した候補製品の特許出願は、私たちが知らずに他の人によって提出されたかもしれない。第三者がbatiraxceptをカバーする特許出願も提出した場合、私たちは、発明の優先度を決定するために、干渉プログラム、または他の国/地域の同様のプログラムのような米国特許商標局の対抗プログラムに参加しなければならないかもしれない。もし私たちに権利侵害を請求すれば、私たちはこのようなクレームを弁護するために巨額の弁護士費と他の費用を支払うことを要求されるかもしれません。もし私たちが弁護に成功しなかった場合、私たちは候補製品の開発と商業化を阻止される可能性があり、禁止および/または損害賠償の制約を受ける可能性があります。
将来、米国特許商標局または外国特許庁は、batiraxceptをカバーする特許権を第三者に付与する可能性がある。これらの将来の特許の発表に伴い、適切な自由があり、それらをさらに開発または商業化するために、これらの権利の許可または再許可を得る必要があるかもしれない。私たちは許容可能な条項で必要な許可証を得ることができないかもしれない(もしあれば)。もし私たちがそのようなライセンスや再許可を得る必要があるが、それができなければ、私たちはbatiraxceptの開発遅延に遭遇したり、batiraxceptを開発、製造、商業化することができないかもしれない。私たちが発行された特許を侵害し、経営の自由がないと判断された場合、私たちは禁止令の制約を受け、および/または懲罰的損害賠償を含む重大な損害賠償の支払いを余儀なくされる可能性がある。私たちが許可内の知的財産権を持っている場合、私たちがこのような合意の条項や条件を守らなければ、私たちの業務を損なう可能性があります。
開発に成功した候補製品や承認された薬物の特許主張に第三者が疑問を提起することが一般的になってきている。もし私たちまたは私たちのライセンシーや協力者が任意の特許訴訟、妨害、または他の法的手続きに巻き込まれた場合、私たちは巨額の費用を発生する可能性があり、私たちの技術と管理者の努力と注意力は著しく分散するかもしれない。このような訴訟または訴訟の負の結果は、私たちの独自の地位を失ったり、重大な責任を負うリスクに直面したり、商業的に許容可能な条項で第三者から取得できない可能性があるライセンス(あれば)を求めることを要求する可能性があります。もし司法や行政訴訟で不利な判決が下された場合、またはもし私たちが必要な許可証を取得できなかった場合、私たちはbatiraxceptの開発、製造、販売を制限または阻止するかもしれない。
私たちは世界各地で私たちの知的財産権を保護できないかもしれないが、これは私たちの業務を損なうかもしれない。
Batiraxceptをカバーする特許は世界各地で申請され、起訴され、擁護されることは恐ろしいほど高価になるだろう。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を得ることができるが、特許執行力がアメリカに及ばない地域に輸出することもできる。これらの他の製品は、可能な特許が発行された可能性のある司法管轄区域でbatiraxceptと競争していないかもしれませんが、将来の任意の特許主張または他の知的財産権は、それらのような競争を効果的にまたは阻止するのに十分ではないかもしれません。
私たちの第三者への依存は、私たちのビジネス秘密を共有することを要求し、これは、競争相手がこれらの秘密や私たちのビジネス秘密が流用または開示されていることを発見する可能性を増加させる。
私たちは、当社のノウハウをある程度保護し、独自情報の研究または開示を開始する前に、適用されれば、当社のコンサルタント、従業員、第三者請負業者およびコンサルタントと材料譲渡協定、コンサルティング契約、または他の同様の合意を締結することを求めています。これらの協定は、一般に、私たちの商業秘密を含む、第三者が私たちの機密情報を使用または開示する権利を制限する。第三者と協力する際に契約条項が採用されているにもかかわらず、商業秘密および他の機密情報を共有する必要は、そのような商業秘密が私たちの競争相手に知られ、無意識に他の人の技術に組み込まれているか、またはこれらの合意に違反した場合に開示または使用されるリスクを増加させる。私たちの独自の地位が私たちのノウハウおよびビジネス秘密にある程度基づいていることを考慮すると、競争相手は、私たちのビジネス秘密または他の許可されていない使用または開示が私たちの競争地位を損なうことを発見し、私たちの業務および運営結果に悪影響を及ぼす可能性があります。
さらに、これらの合意は、一般に、私たちの合意がいくつかの限られた発行権を含む可能性があるにもかかわらず、私たちのコンサルタント、従業員、第三者請負業者、およびコンサルタントが、私たちのビジネス秘密に関連する可能性のあるデータを発行する能力を制限します。私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、私たちの競争相手は、私たちと第三者との合意、独立開発、または私たちの任意の第三者協力者が情報を発表することによって、私たちのビジネス秘密を発見するかもしれない。競争相手は私たちのビジネス秘密が私たちの競争地位を損なうことを発見し、私たちの業務に悪影響を及ぼすだろう。
私たちの特許保護を獲得し、維持することは、政府の特許機関が提出した様々な手続き、書類提出、費用支払い、およびその他の要求を遵守することに依存し、私たちの特許保護は減少またはキャンセルすることができる これらの要求を守らない。
発行された特許の定期維持費は、特許有効期間内にいくつかの段階で米国特許商標局および外国特許代理機関に支払われなければならない。米国特許商標局および各種外国政府特許機関は、特許出願過程において、いくつかのプログラム、文書費用支払い、および他の同様の条項を遵守することを要求する。多くの場合、適用規則に従って滞納金を支払うか、または他の方法で不注意を是正することによって失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効され、関連法ドメインの特許権の一部または全部の喪失をもたらす可能性がある。特許または特許出願の放棄または失効をもたらす可能性のある規定を遵守しないイベントは、規定された期限内に公式行動に応答できなかったこと、費用を支払わなかったこと、および適切に合法化されず、正式な文書を提出することができなかったことを含むが、これらに限定されない。もし私たちと私たちの許可者たちがbatiraxceptをカバーする特許と特許出願を維持できなかったら、私たちの競争地位は不利な影響を受けるだろう。
知的財産権は必ずしも私たちの競争優位に対するすべての潜在的な脅威を解決できるとは限らない
私たちの知的財産権が提供する未来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。以下の例は例示的である
| • |
他の会社は私たちの候補製品と似たような製品を生産することができるかもしれないが、これらの製品は私たちが許可した特許請求の範囲内ではない |
| • |
私たちのライセンシーまたは協力者は、発表された特許または係属中の特許出願によってカバーされた発明をした最初の人ではないかもしれない |
| • |
私たちのライセンシーまたは協力者は発明特許出願を最初に提出した人ではないかもしれない |
| • |
他の人は、私たちの知的財産権を侵害することなく、類似または代替技術を独立して開発したり、私たちまたは私たちの許可者の任意の技術をコピーしたりすることができる |
| • |
未解決の特許出願は、発行された特許を生成してはならない |
| • |
発行された特許は、私たちにいかなる競争優位性を提供してくれないかもしれないし、私たちの競争相手の法的挑戦のために無効または実行不可能と認定されるかもしれない |
| • |
私たちの競争相手は特許権のない国で研究や開発活動を行い、これらの活動から学んだ情報を利用して競争力のある製品を開発し、私たちの主要な商業市場で販売するかもしれません |
| • |
他の特許を申請できるノウハウを開発しないかもしれません |
| • |
他の人たちの特許は私たちの業務に悪影響を及ぼすかもしれない。 |
このような事件が発生した場合、私たちの業務、運営結果、そして将来性を深刻に損なう可能性がある。
私たちは私たちの従業員がその前の雇用主によって言われた商業機密を間違って使用したり開示したりしたと告発されるかもしれない。
私たちの多くの従業員は、私たちの高級管理者を含めて、他のバイオテクノロジーや製薬会社に雇われていた。このような従業員たちは一般的に彼らの以前の雇用主と所有権、秘密、そして競争禁止協定に署名する。私たちは、私たちの従業員が私たちのために働いているときに他人の固有情報やノウハウを使用しないことを保証するために努力しているが、私たちは、商業秘密または他の固有情報を含む、私たちまたはこれらの従業員が、そのような任意の元雇用主の知的財産権を使用または開示しているという疑惑を受ける可能性がある。私たちはこれらの問題に関連した脅威や未解決のクレームがあることを知らないが、将来的にはこのようなクレームに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
私たちの普通株式所有権に関連するリスク
私たちはナスダック世界の精選市場の持続的な上場要求を満たすことができず、私たちの普通株が銘柄を取られる可能性があります。
私たちの普通株は現在ナスダック世界ベスト市場(“ナスダック”)に上場している。もし私たちがナスダックの継続上場の要求、例えば会社の管理要求、最低入札価格要求、あるいは最低株主権益要求を満たすことができなければ、ナスダック株式市場有限責任会社は措置を取って、私たちの普通株を撤退させるかもしれません。どの退市も私たちの普通株の価格にマイナス影響を与える可能性があり、株主が普通株を売却または購入する際に普通株を売却または購入する能力を弱める可能性がある。
2022年8月9日、吾らはナスダック証券市場有限責任会社上場資産部から書面通知を受け、これまで30営業日連続(2022年6月27日から2022年8月8日)まで、我々の普通株はナスダック上場規則第5550(A)(2)条の要求に沿って、1株1.00ドルの最低終値(以下、“最低購入価格”と略す)を維持できなかったことを通知した。2022年11月、我々はナスダック株式市場有限責任会社上場資産部から、ナスダックの上場要求に再適合したとの書面通知を受けた。私たちは私たちがナスダックの発売要求を満たし続けることができるという保証はない。将来的に上場要求を達成できなかったり、ナスダックが私たちの普通株の買い取りを達成できなかったことは、私たちの新投資家を引き付ける能力に悪影響を与える可能性があり、私たちの普通株の発行された株式の流動性を低下させ、そのような株の取引価格を低下させ、そのような株を取引する固有の取引コストを増加させ、私たちの株主に全面的なマイナス影響を与えるかもしれない。さらに、私たちの普通株がナスダックから撤退することは、経営者が私たちの普通株式に市をすることを阻止するか、あるいは他の方法で私たちの普通株への興味を求めたり、生成したりして、特定の機関と個人が私たちの普通株に投資することを阻止するかもしれない。
我々の株価は過去に変動しており、最近も変動しており、将来も変動する可能性があるため、私たち普通株の投資家は大きな損失を受ける可能性がある
私たちの株価は過去に変動していましたが、最近も変動しており、将来も変動する可能性があります。2022年1月1日から2022年12月31日まで、我々普通株の最高と最低販売価格は1株5.8億ドルから2.84億ドルの間で変動した。一般的な株式市場、特にバイオテクノロジー会社の市場は極端な変動を経験しており、この変動は往々にしてある会社の経営業績とは無関係である。このような変動により、投資家は私たちの普通株に投資する時に損失を受けるかもしれない。私たちの普通株の市場価格は以下の要素を含む多くの要素の影響を受ける可能性がある
| • |
投資家のビジネス戦略に対する反応は |
| • |
競争力のある製品や技術の成功 |
| • |
Batiraxceptまたは将来の候補製品または私たちの競争相手の臨床研究結果 |
| • |
アメリカや他の国の法規や法律の発展、特に私たちの製品に適用される法律または法規の変化 |
| • |
私たちの新製品の紹介と公告、臨床試験の結果、私たちの商業化されたパートナーまたは競争相手、およびこれらの紹介または公告の時間 |
| • |
規制当局が私たちの製品、臨床研究、製造技術、または販売とマーケティング条項に対する行動 |
| • |
私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い |
| • |
私たちは他の製品や候補製品の努力が成功したかどうかを獲得したり許可したりします |
| • |
私たちの協力の発展については、私たちの製造供給源や商業化パートナーとの協力を含むが、これらに限定されない |
| • |
私たちの製造過程を費用対効果的に大規模化する能力の発展について |
| • |
私たちまたは私たちの競争相手は、重大な買収、戦略的パートナーシップ、合弁企業、または資本約束を発表します |
| • |
特許、訴訟事項、および製品のための特許保護を得る能力を含む、特許または他の固有の権利に関連する開発または紛争; |
| • |
私たちが追加資本を調達する能力や能力と資本調達の条件は |
| • |
キーパーソンの採用や退職 |
| • |
医療支払い制度の構造を変え |
| • |
製薬とバイオテクノロジー部門の市場状況 |
| • |
株式市場価格は全般的に下落している |
| • |
収益推定の実際または予想変化または株式市場アナリストの私たちの普通株、他の比較可能な会社または私たちの業界全体に対する提案の変化 |
| • |
当社の普通株式出来高 |
| • |
私たちや株主は普通株を売っています |
| • |
一般的な経済、業界、市場状況 |
| • |
他の事件または要因は、そのような事件によって引き起こされる事件または要因、またはそのような事件の見通し(戦争、テロおよび他の国際紛争を含む)、公衆衛生問題(発生している新しい冠肺炎の大流行などの衛生流行病または流行病を含む)、および自然災害(例えば、火災、ハリケーン、地震、竜巻または他の不利な天気および気候条件)を含み、米国または他の場所で発生するか否かにかかわらず、私たちの運営を混乱させ、サプライヤーの運営を妨害し、または政治的または経済的不安定をもたらす可能性がある; |
| • |
この“リスク要因”の節で説明した他のリスク。 |
これらの広範な市場と業界要素は、私たちの経営業績にかかわらず、私たちの普通株の市場価格を深刻に損なうかもしれない。我々普通株の株価は過去に変動しており、最近は変動しており、将来も変動する可能性があるため、私たち普通株の投資家は大きな損失を受ける可能性がある。過去、市場が一定期間の変動を経験した後、証券会社は集団訴訟を起こすことが多い。私たちにこのような訴訟を提起すれば、巨額のコストと経営陣の注意と資源の移転を招く可能性があり、これは私たちの業務、財務状況、運営結果、成長見通しに実質的な悪影響を及ぼす可能性がある
私たちの役員、取締役、および私たちの統制下のエンティティおよび主要株主は、株主に承認されたすべての事項を制御または顕著に影響する能力を維持し続けます
2023年3月10日現在、我々の現職幹部、役員、彼らがコントロールしている実体および主要株主は合計約60.2%の普通株を持っている。私たちの執行議長フレデリック·N·エセルマン博士は私たちの55.5%の普通株式を持っています。したがって、エセルマン博士は私たちの株主に提出されたすべての事項と、私たちの管理と問題を制御または顕著に影響することができます。例えば、エセルマン博士は、取締役の選挙と、私たちのすべてまたはほとんどの資産の任意の合併、合併、または売却の承認を制御または著しく影響するだろう。このような投票権の集中は他の株主が希望する可能性のある条項でわが社を買収することを延期または阻止する可能性があります。
上場企業として、私たちの運営コストは高く、私たちの経営陣は新しいコンプライアンスイニシアチブに大量の時間を投入します
上場企業として、私たちはすでに大量の法律、会計、その他の費用を発生させ続けており、これらの費用は私たちが民間会社として発生していない。私たちは、改正された1934年の証券取引法、米国証券取引委員会の他の規則と規定、およびナスダックの規則と規定の報告要件を遵守しなければならない。上場企業に適用される各種報告書やその他の要求を遵守するにはかなりの時間と経営陣の注意が必要である。例えば、“サバンズ-オキシリー法案”や米国証券取引委員会や国家証券取引所の規則は、効率的な開示と財務制御の確立と維持を要求するなど、上場企業に対して様々な要求をしている。私たちの経営陣と他の人たちはこのようなコンプライアンス計画を実施するために多くの時間を投入し続けるために努力している。このような規制は私たちの法律と財務コンプライアンスコストを増加させ続け、いくつかの活動をもっと時間的で高価にするだろう。これらの事件の影響は、私たちの取締役会、取締役会委員会、あるいは幹部に参加することをより難しくし、合格した人材を引き付け、維持することを難しくするかもしれない。
“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、財務報告および開示制御および手続きに対して効果的な内部統制を維持することを要求する。特に、我々は、“サバンズ·オキシリー法”第404条の要求に基づいて、経営陣が財務報告内部統制の有効性を報告できるように、我々の財務報告内部統制のシステムおよびプロセス評価およびテストを行わなければならない。また、私たちの独立公認会計士事務所に、財務報告の内部統制に対する私たちの有効性を証明させることを要求されます。私たちが再び申請者を加速させ、新興成長型会社ではなくなった日から、私たちの10-K表年次報告から始めます。私たちはサバンズ-オキシリー法404条を遵守して、私たちに大量の会計費用を発生させ、多くの管理努力をすることを要求するだろう。もし私たちが404条の要求を直ちに遵守できない場合、あるいは私たちまたは私たちの独立公認会計士事務所が財務報告の内部統制において重大な弱点と考えられる欠陥を発見した場合、私たちの株式の市場価格は下落する可能性があり、私たちはナスダック、SECまたは他の規制機関の制裁または調査を受ける可能性があり、これには追加の財務と管理資源が必要になるだろう。
私たちは、業務計画を成功させ、第404条の能力を遵守し、タイムリーで正確な総合財務諸表を作成できることを求めている。私たちは、私たちの業務を効率的に管理するために、既存の運営と財務システム、プログラム、制御措置を引き続き改善する必要があると予想しています。任意の遅延実施または新しいまたは強化されたシステム、プログラム、または制御への移行の中断は、私たちの運営に影響を与える可能性があり、財務報告の内部統制に有効であるという結論を得ることができないかもしれませんし、サバンズ-オキシリー法404条の要求に基づいて、私たちの監査人から内部統制に関する保留されていない報告を得ることができないかもしれません。これは逆に私たちの普通株の取引価格に悪影響を及ぼす可能性があり、資本市場に参入する能力に悪影響を及ぼす可能性がある。
私たちは今家族です“規模の小さい報告会社は”そして、ある規模の小さい報告会社が入手可能な情報開示を利用することを選択しており、これは、私たちの株の投資家への魅力を低下させる可能性がある。
取引法の定義によると、私たちは現在“小さな報告会社”であり、いくつかの小さな報告会社が使用できる大規模な開示を利用することを選択している。取引法第12 B-2条の規則で定義されている“より小さい報告会社”の資格に適合し続ける限り、SOXに規定されている監査役認証要件の免除、および当社役員報酬スケジュールの開示を削減することを含む、他の“より小さい報告会社”ではない上場企業に適用されるいくつかの開示要件の免除を得ることができる。
したがって、我々が株主に提供する情報は、他の上場企業が提供する情報とは異なることになる。このForm 10-K年次報告書には、私たちがより小さな報告会社でなければ必要とされるすべての役員報酬に関する情報も含まれていませんし、私たちがより小さい報告会社でなければ必要とされるすべての市場リスクに関する定量的で定性的な開示も含まれていません。私たちはもし私たちがこのような免除に依存すれば、投資家が私たちの普通株の吸引力の低下を発見するかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株はそれほど活発ではない取引市場が出現する可能性があり、私たちの株価はもっと変動するかもしれない。
私たちの普通株の活発な取引市場は維持できないかもしれないし、私たちは適用されるナスダック上場要求を満たすことができないかもしれない
私たちの普通株は現在ナスダックで取引されていますが、将来私たちの株がナスダックや他のどの取引所でも活発な取引市場を維持できる保証はありません。実は、私たちの普通株のかなりの部分の流通株は少数の人が保有しており、これは私たちが活発な取引市場を維持することをもっと難しくする。もし私たちの普通株が活発な市場を持っていなければ、私たちの株主は株式市場価格を下げることなく株を売却することが難しいかもしれません。あるいは根本的に不可能で、私たちの株価は下落するかもしれません。私たちは適用されるナスダック上場要求を守ることができないかもしれません。
証券や業界アナリストが我々の業務に関する研究を発表しない場合、あるいは不正確または不利な研究を発表しなければ、私たちの株価や取引量は低下する可能性がある
私たちの普通株の取引市場は、証券や業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存している。私どもの業務を担当するアナリストはわが社に関する研究報告の発表を随時中止することを自ら決定することができます。これらのアナリストのうちの1人以上がわが社への報道を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの普通株に対する需要が減少する可能性があり、これは私たちの株価や取引量を低下させる可能性がある。さらに、私たちの1人以上のアナリストを追跡して私たちの株式格付けを引き下げたり、私たちの業務に関する不正確または不利な研究報告を発表したりすれば、私たちの株価は下落するかもしれない。もし私たちの経営業績がアナリストの予測に達していなければ、私たちの株価は下落するかもしれない。
私たちの定款書類とデラウェア州法律の条項と私たちのいくつかの未償還株式証明書は私たちの買収をより困難にする可能性があり、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止するかもしれません
当社の定款およびわれわれの定款における条項は、株主がその株式から割増取引を得る可能性があることを含む、株主が有利と考える合併、買収、または他の支配権変更を阻止、延期または阻止する可能性がある。これらの条項はまた、投資家が将来私たちの普通株に支払いたいかもしれない価格を制限し、それによって私たちの普通株の市場価格を下げる可能性がある。また、これらの規定は、株主が取締役会のメンバーを交代させることをより困難にし、株主が現在の経営陣を交代または罷免しようとしていることを挫折または阻止する可能性がある。私たちの取締役会は責任を持ってチームのメンバーを管理するように命じているので、これらの規定は逆に私たちの株主が私たちの管理チームの既存のメンバーを交換するいかなる試みにも影響を与える可能性があります。これらの規定には
| • |
私たちの取締役会は3つのレベルに分かれていて、3年間の任期を交錯させて、私たちの管理層の交代や統制権の変更を延期または阻止する可能性があります |
| • |
私たちの取締役会は、取締役会の拡大や取締役の辞任、死亡、罷免による株主が取締役会の空きを埋めることができないことを埋めるために取締役を選挙する権利があります |
| • |
私たちの株主は書面で行動したり、特別株主総会を開催することに同意することはできません。したがって、私たちの株式の大部分を制御する1つまたは複数の株主は、取締役会、会長、CEO、または総裁が招集した年間株主総会または特別株主総会でしか特定の行動をとることができません |
| • |
わが社の登録証明書は、取締役選挙での累積投票を禁止しており、小株主が取締役候補を選挙する能力を制限している |
| • |
私たちの株主は、取締役会選挙に個人を指名するために、または株主総会で行動可能な事項を提出するための事前通知および追加開示を要求されており、潜在的な買収者が購入者自身の取締役リストを代理選挙することを阻止または阻止するか、または他の方法でわが社に対する支配権を獲得しようと試みる可能性がある |
| • |
私たちの取締役会は、株主の承認なしに非指定優先株を発行することができ、これにより、私たちの取締役会は、投票権または他の権利または特典を有する優先株を発行することが可能となり、これは、任意の買収試みの成功を阻害する可能性があります。 |
また、私たちはデラウェア州に登録して設立されたので、私たちはデラウェア州会社法第2203条の規定によって管轄されています。この条項は、規定された方法で合併または合併が承認されない限り、15%を超える議決権を発行した株を所有している人が取引日後3年以内に私たちと合併または合併しないことを禁止しています。
私たちのいくつかの未弁済株式証のいくつかの条項は第三者が私たちをもっと難しくまたは高価に買収することを可能にするかもしれない。ある株式承認証は私たちが“基本取引”を構成するいくつかの取引に従事することを禁止し、他の事項を除いて、生存実体は私たちの株式承認証の下での義務を負う。また、当該等株式証は、ある取引が“基本取引”を構成する場合、ある例外的な場合を除いて、当該等株式証所有者はその選択に応じて、当該等株式証を指定価格で買い戻すことを要求する権利があると規定されている。
私たちは会社登録証明書の規定を改正し、再記載します。デラウェア州衡平裁判所は私たちと私たちの株主との間のいくつかの紛争の独占法廷であり、これは私たちの株主を制限することができます’私たちまたは私たちの役員、上級管理職、または従業員との紛争について有利な司法フォーラムを得ることができます。
私たちが改正および再記載した会社登録証明書は、デラウェア州衡平裁判所は、会社を代表して提起された任意の派生訴訟または法的手続き、会社の任意の役員または他の従業員が会社または会社の株主に対する受託責任に違反すると主張する任意の訴訟、デラウェア州会社法の任意の規定によって発生したクレームを主張する任意の訴訟、または内部事務原則によって管轄されていると主張する任意のクレームの唯一および独占法廷でなければならない。本裁判所選択条項は、証券法又は“取引法”に規定された義務又は責任を執行するために提起された訴訟にも適用されず、連邦裁判所が排他的管轄権を有するいかなるクレームにも適用されない。
このフォーラム選択条項は、司法フォーラムにおいて、私たちまたは私たちの任意の取締役、上級管理者、他の従業員または株主との紛争に有利であると考えられる特定のクレームを株主が提出する能力を制限する可能性があり、これは、私たちの株主が連邦証券法およびその規則および法規の遵守を放棄したとみなされないにもかかわらず、このようなクレームに関連する訴訟を阻止する可能性がある。もし裁判所がこの裁判所選択条項が訴訟で適用されないか、または実行できないことを発見した場合、私たちは他の管轄区域でこのような訴訟を解決するために追加費用が発生する可能性があり、これは私たちの業務および財務状況に悪影響を及ぼす可能性がある。
場合によっては、私たちと行政員の雇用計画は私たちに解散費の支払いを要求するかもしれない。
私たちの一部の幹部は、私たちの統制権および解散費条項の変更を含む雇用または他の合意の当事者または計画の参加者であり、これらの条項は、私たちの支配権変更に関連する雇用が終了した場合に、解散費および他の福祉の現金総額を支払い、株式オプションの付与を加速することを規定している。オプションの加速付与は、私たちの既存株主の株式を希釈し、私たちの普通株の市場価格を損なう可能性がある。このような解散費を支払うことは私たちの財政状況と業績を損なうかもしれない。さらに、これらの潜在的な解散費は、第三者が私たちの業務との統合を求めていることを阻害または阻止する可能性がある。
私たちは予測可能な将来に私たちの普通株に現金配当金を支払わないと予想されているので、資本増価は私たちの株主になるだろう’唯一の利益源です
私たちは普通株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、私たちの未来のすべての収益を維持するつもりで、もしあれば、私たちの業務の成長と発展に資金を提供します。しかも、既存または未来の債務協定の条項は私たちが配当金を支払うことを阻止するかもしれない。したがって、私たちの普通株の資本付加価値は(あれば)私たちの株主が予測可能な未来に唯一の収益源になるだろう
項目1 B。未解決の従業員のコメント
ありません
項目2.財産
私たちはノースカロライナ州モリスビル、カリフォルニア州メンロパークとテキサス州ヒューストンに不動産と賃貸施設がありません。私たちの主な実行オフィスはテキサス州ヒューストンにあります。2023年10月31日に満期になった賃貸契約条項によると、私たちはそこにオフィススペースを占有しています。この協定は期限終了時に三ヶ月のキャンセル通知を出さない限り、六ヶ月間自動的に更新します。レンタル契約によると、私たちのレンタル料は毎月約1,800ドルです。
二零一七年三月、吾らはカリフォルニア州共同企業Bohannon Associatesと二零一七年三月十七日に運営施設賃貸協定(“総賃貸”)を締結し、カリフォルニア州モンロパマシュ路1020号に位置する約34,500平方尺のオフィス空間(“1020達信施設”)を借りた。1020沼施設の借約は2017年8月に開始され,レンタル期間は86カ月であり,継続オプションがあり,レンタル期間は5年であった。2021年12月31日までのレンタル期間中、私たちが将来借りている基本レンタル料は830万ドルです。
2021年8月1日に,吾らはGrail,Inc.やGrail(“テナント”)と締結し,2021年6月8日に締結した分譲契約(“転貸協定”)が発効したことにより,現在総レンタル約1020達信物件に基づいて現在賃貸可能な約34,500平方フィートの賃貸オフィス空間をすべて転貸者に転貸することに同意した。分譲は2021年8月1日に開始され、分譲期間は2024年10月31日までで、主レンタル契約がテナント違約により早期に終了しない限り。2021年12月31日現在、テナントは670万ドルの基本賃貸料を支払う義務があります。
2020年8月にPerieter Center 7 Pack,LLCと2020年8月14日にノースカロライナ州モリスビル1800 Perieter Park Suite 130約4,128平方フィートのオフィススペースをレンタルする運営施設レンタル契約を締結しました。2022年12月31日までのレンタル期間中、私たちが将来借りている基本レンタル料は50万ドルです
私たちは私たちの既存の施設が私たちの現在の必要性を満たすのに十分だと信じている。
第三項:法的訴訟
私たちは現在、実質的な法的手続きの影響を受けていない。私たちは時々その正常な業務活動の過程で発生する様々な法的手続きやクレームの影響を受けるかもしれない。結果にかかわらず、訴訟は弁護と和解費用、管理資源の移転などの要因で私たちに悪影響を及ぼす可能性がある。
四番目の鉱山は安全に開示されている
適用されない
第II部
第五項登録者普通株式市場、関連株主事項及び発行者が株式証券を購入する
登録者普通株市場
2018年10月16日から、我々の普通株はナスダックで取引され、取引コードはARAVである。これに先立ち、2014年3月21日から2018年10月16日まで、私たちの普通株はナスダックで取引され、取引コードは“VSAR”である。合併の完了に伴い、2018年10月15日に改訂され、再記載された会社登録証明書は、2018年10月16日に、私たちの普通株が6対1の割合で逆分割されるように修正された。
所持者
2023年3月10日現在、我々普通株の登録株主は36人であり、そのうちの1人は預託信託会社(DTC)の被著名人である。ブローカー、銀行、他の金融機関が受益者の株式として保有している私たちの普通株の全株式はDTCの参加者口座に入金されているため、譲渡会社が株主として保有していると考えられる。
配当政策
私たちは私たちの普通株に配当金を支払わなかった。私たちは現在私たちの業務を発展させて拡大するためにどんな収益も維持するつもりだ。したがって、私たちは予測可能な未来に私たちの普通株に現金配当金を支払わないと予想する。
未登録株式証券を売却する
2022年12月31日までの年度中には、未登録株式証券販売はなく、米国証券取引委員会に提出された文書では開示されていません。
発行人が株式証券を購入する
2022年12月31日までの第4四半期には、発行者が株式証券を購入しなかった。
[パフォーマンスチャート]
取引法第12 b-2条の定義によると、我々は小さな報告会社であり、本プロジェクトに要求される情報を提供する必要はない。
第6項[保留されている]
項目7.経営陣の財務状況と経営成果の検討と分析
以下の財務状況と経営結果の検討と分析、および当社の連結財務諸表と本年度報告書の他の場所に関する付記(Form 10-K)を読むべきです。本議論および本10−Kテーブルの他の部分は、我々の計画、目標、期待、および意図のようなリスクおよび不確実性に関する前向きな陳述を含む。私たちの実際の結果はこのような前向きな陳述で議論された結果と大きく違うかもしれない。このような差異をもたらすか、または促進する可能性のある要因は、本表の格10−Kにおける題に限定されるものではないが、“リスク要因です”
重要な説明
本経営陣の財務状況及び経営結果の検討及び分析には、2022年12月31日及び2021年12月31日までの年度の経営状況についての検討が含まれている。
本報告で言及した“私たち”,“私たち”,“私たちの”と類似した一人称表現とはAravive,Inc.(前身はVersartis,Inc.)である。二等兵Araviveを含むその子会社。“Versartis,Inc.”を引用するまたは“プライベートAravive”とは、2018年10月に合併が完了する前のこれらの会社を意味する。
概要
我々は臨床段階の腫瘍学会社であり,癌や線維化を含む生命を脅かす疾患の進展を阻止するための変革的治療法を開発している。
Batiraxcept(前身はAVB-500)は1種の超親和性の誘導蛋白であり、Gas 6-Axlシグナル経路に対して。血清Gas 6を捕獲し、batiraxceptはAxl経路のシグナルを飢餓させ、疾病の進展を促進する生物プログラミングを潜在的に停止した。AXL受容体シグナル経路は転移、癌細胞の生存促進、薬剤耐性と免疫抑制を通じて多種のタイプの悪性腫瘍において重要な役割を果たしている。
我々の現在の開発計画は、薬理活性用量を選択することによってbatiraxcept薬の開発を加速させ、batiraxceptに最大の反応機会を有する癌患者を識別することを可能にする血清ベースの独自バイオマーカーの利用可能性のおかげである。
われわれが完成した健常ボランティアがBatiraxceptを服用した第1段階臨床試験では,BatiraxceptにおけるGas 6の機序が証明されている。重要なことは,ヒト試験や癌患者1 b期臨床試験において,batiraxceptが臨床前と第1回臨床試験において良好な安全性を有していることである。
2018年8月,FDAはbatiraxceptによる白金耐性再発卵巣癌の治療研究を急速発展計画に指定した。
2018年12月,batiraxceptとPROC患者の標準看護治療を組み合わせた1 b期臨床試験を開始し,2020年7月に結果を報告した。
2020年4月、私たちは無錫と許可と協力協定を調印し、その目標はCCN 2に対する新しい高親和性二重特異性抗体を識別と開発することであり、CTGFとも呼ばれ、癌と繊維化に関連し、そして1つの類似した標的発見スクリーンから癌におけるAx 1/Gas 6経路の重要性を確定した。しかし、2022年8月末に、会社はCTGFプロジェクトにおける無錫との仕事を一時停止し、すべての資源を臨床プロジェクトに集中させるために努力した。
2020年11月、私たちは3 D Medicines協定に署名し、この協定に基づいて、私たちは人類腫瘍疾患の診断、治療または予防のための唯一の薬物物質としてパチラクセットを含む製品を領土内で開発および商業化することを許可した。
2020年第4四半期に、ccRCCにおけるbatiraxceptの第1段階1 b/2試験の1 b段階部分を開始し、2021年3月に試験中の第1人の患者に投与量を提供した。
2021年第1四半期に、私たちはprocにおけるbatiraxceptの登録第3段階試験を開始し、2021年4月に試験中の最初の患者に投与した。この世界的、無作為、二重盲検、プラセボ対照試験は、15 mg/kgのbatiraxceptとPACの併用とPAC単独使用の治療効果と安全性を評価することを目的としている。
2021年5月,Batiraxceptの開発計画を第一線の膵管腺癌(PDAC)に拡張することを発表し,2021年末に試験を開始することを目標とした。私たちは2021年8月に最初の患者に薬を処方した。
2021年6月、著者らはccRCC 1 b/2期臨床試験のbatiraxcept 1 b期部分の初歩的な安全性、薬物動態学と薬効学的結果を発表した。
2021年10月、EMAは、孤児医薬品委員会の提案に基づいて、procのbatiraxceptを治療するための孤児薬物名を承認した。
2021年11月、batiraxceptとCabozantinibの併用治療ccRCCの1 b期試験を評価する予備データを公表した。
2022年1月、私たちは、Cabozantinibと組み合わせてbatiraxceptにccRCCの1 b/2期研究の第2段階を治療した第1の患者に用量を投与したことを発表した。
2022年3月,ccRCCにおけるbatiraxcept 1 b期試験の更新データと新たなバイオマーカーデータを発表した。
2022年5月、私たちはキーオピニオンリーダーシンポジウムで最新のデータと情報を提供しました。
2022年10月、私たちは3 D Medicinesから600万ドルの開発マイルストーン支払いを受け取りました。この支払いは、領土で世界3期白金耐性卵巣癌(PROC)臨床試験を開始し、batiraxceptを開発するためのものです。
2022年11月、FDAは、免疫腫瘍学(IO)および血管内皮増殖因子チロシンキナーゼ阻害物質(VEGF-TKI)に基づく治療(組み合わせまたは順序)を含む1~2つの以前のシステム治療シリーズを含む、末期または転移性ccRCC患者の治療のための迅速開発計画としてbatiraxceptの研究を指定した。
同社は2023年1月、世界3期白金耐性卵巣癌(“PROC”)の臨床試験を完了することを発表した。
臨床医学の最新の進展
白金耐性卵巣癌(PROC)3期試験はまだ行われている
登録指向batiraxcept併用パクリタキセルは、procにおける第3段階スキームがまだ進行中であり、登録が完了した。2023年中までに試験の背線データを報告する予定である。CMCの作業はまだ段階的に行われており、2023年末までにBLAを提出することを目標としている。この世界的、無作為、二重盲検、プラセボ対照の第三段階試験は、15 mg/kg用量のバルテラクセプとパクリタキセルとプラセボ併用パクリタキセルの治療効果と耐性を評価している。この試験は360人以上の白金耐性の高レベル漿液性卵巣癌患者の登録を完了し、1~4つの以前の治療経路を受けている。
最新の透明細胞腎癌データ(CcRCC)は引き続き鼓舞される
2022年8月8日現在,先行治療(2 L+)の慢性腎細胞癌患者26名が1 b/2期試験の1 b期部分でbatiraxceptの治療を受け,投与量はそれぞれ15 mg/kg(n=16)と20 mg/kg(n=10)であり,Cabozantinibを1日60 mg加えた。いずれの用量でも用量制限性毒性は認められなかった。ITT群の最適全体応答率(OOR,確認)は42%であった。進行中の1 b/2期ccRCC試験の目標の1つは,batiraxceptプラスCabozantinib治療を受けたccRCC患者のベースライン血清可溶性Ax 1(Sax 1)/Gas 6(バイオマーカー)と放射線学的反応との関連性を評価することである。バイオマーカー高集団での最適ORRは55%であった。9カ月の無進展生存率(PFS)はITT群で65%,バイオマーカー高群で67.2%であった。我々は、Sax 1/Gas 6比率を加速承認の基礎として使用することを含む登録経路について米国FDAと議論した。
我々は,2023年にccRCC試験1 b段階部分からのより多くのデータとccRCC試験2段階部分からの予備データを報告する予定である
膵癌1 b期拡張性研究
2022年9月20日現在,18例の膵癌患者は15 mg/kg(1~15日目)+NAB−パクリタキセル(125 mg/m 2,1,8,15日目)とゲムシタビン(1000 mg/m 2,1,8,15日目)の治療を受け,薬物動態データがある。Batiraxceptを用いた他の1 b期癌研究と同様に,batiraxceptへの曝露と臨床活動との間には関係があることから,PDAC研究ではbatiraxceptレベルがbatiraxcept最低有効濃度(MEC)を超えた9名中5名が反応したが,低MEC群の9名中1名が反応した。同様に,高MEC群のMPFSは5.6カ月(95%CI 2.1,評価不可)であったのに対し,低MEC群のMPFSは2.7カ月(95%CI 1.1,5.4)であった。2022年5月、私たちはバルテラクセップとゲシタビンとナイバテインの併用耐性は一般に良好で、意外な安全シグナルがないことを報告したことがある。これらのデータに基づいて、より高い用量(20 mg/kgおよび潜在的25 mg/kg)で6~18名の患者に投与し、より高い用量が高MECに達する患者の割合を増加させ、ゲムシタビン+NAB−パクリタキセルを併用する臨床活性を増加させることを意図しているかもしれない。
最近の金融発展
202年1月、EShelman Ventures,LLCと投資協定(“投資協定”)を締結し、投資協定第4条と第5条の目的についてのみ、EShelman Venturesは最大4,545,455株の普通株の事前資本金権証を購入することに同意し、1株当たり0.0001ドル(“株式承認証”)、価格は1株2.2ドルであり、これは2021年12月31日のナスダックでの合併終値であり、総購入価格は1,000万ドルである。取引は2022年1月5日に完了した。投資協定の条項によると、私たちは事前承認株式証の基礎となる普通株式を登録する登録声明の提出を要求された。この登録声明は2022年1月5日に提出され、2022年1月18日に米国証券取引委員会によって発効された。EShelman Ventures,LLCに発行された予備資本金権証は,我々の株主が行使を承認した後に行使することができ,この承認は2022年4月1日に承認され,予備資本権証はすべて行使された。
2022年3月31日、私たちは医療保健に集中した機関投資家とEShelman Ventures,LLCと私たちの普通株の登録直接発行を完了し、これにより、私たちは3,185,216株の普通株、1,665,025株の事前融資権証(“3月事前融資権証”)と普通株承認株式証(“普通株式承認株式証”)を発行し、登録直接発行の中で最大4,850,241株普通株を購入し、ナスダック規則に従って市場定価を決定した。機関投資家の1株当たりの購入価格は2.005ドル、EShelman Ventures、LLCは2.325ドル。3月の事前資金調達権証とセット普通株承認株式証の購入価格は2.004ドル。引受割引、手数料、発売費用を差し引いたところ、今回発行された純収益は約930万ドル。機関投資家に発行された普通株式証は直ちに行使でき、行使可能日から満5年、行使価格は1株1.88ドルとなる。EShelman Ventures,LLCに発行された普通株式承認証は,我々の株主が以前発行した証券の行使を承認した後で行使可能であり,この承認は2022年4月1日に承認され,行使後5年で満期となり,行使価格は1株2.20ドルとなる。もし普通株式承認証が十分に行使されれば、私たちは追加の毛収入940万ドルを得ることができる。
2022年10月27日、私たちは、新しいバイオテクノロジー投資家、既存の投資家、私たちの経営陣、私たちの一部の取締役と私募発行を完了し、合計45,178,811株の私たちの普通株、または代替としての資本金権証(“10月資本権証”)、および3月の資本資本権証、“資本権証”)と権利証(“10月権利証”、および3月の一般資本権証)を発行·売却した。株式承認証)はナスダック規則に従って市価で最大45,178,811株の普通株或いは事前資金承認株式証(“私募”)を購入する。この取引に参加したすべての投資家に対して、1株当たりの買収価格と付随する引受権証は0.9199ドル(または1株当たり事前融資の引受証と付随する10月の株式承認証は0.9198ドル)であった。50%の10月の株式承認証の発行価格は1株0.7949ドルであり、以下の遅い日に満了する:(I)普通株式許可株式数が増加した日から15ヶ月、または(Ii)TOPLINE第3段階PROCデータが公表されてから1ヶ月。残りの50%の10月の株式承認証の発行価格は1株0.7949ドルで、普通株式許可株式数が増加した日から30ヶ月以内に満期になる。10月に資金を前払いして持分証を承認する以外、すべての10月の株式承認証はすべて行使でき、株式証所有者の現金と交換することができる。純収益は約4000万ドルで,我々の臨床開発計画を支援するために用いられる。私たちが締結した登録権協定の条項によると、発行された普通株式と、事前資本権証の基礎となる10月権証と10月予融資本権証の普通株式を登録する登録声明の提出が求められています。登録声明は2022年11月18日に提出され、2022年11月28日にSECによって発効されます。
財務概要
収入.収入
今まで、私たちはどんな候補製品の商業販売からも何の収入も得ていない。しかし、2022年12月31日と2021年12月31日までの年間で、3 D Medicines協定から約910万ドルと740万ドルが生成され、これは3 D Medicinesから受信した初期署名およびマイルストーン支払いの一部であり、受信時に確認され、PROC試験期間内に延期および確認された支払いの一部である。
将来的には、私たちが開発した製品が承認されて販売可能な製品販売、許可料、マイルストーン、研究開発、戦略協力または政府契約、または私たちの知的財産権許可に関連する印税支払いを含む様々なソースから収入を得ることができます。
研究開発費
私たちは発生した内部と外部研究と開発費用を確認した。私たちの外部開発費は主に
| • |
契約製造組織との合意に従って発生する費用を含む、臨床試験および他の材料を取得および製造するコスト; |
| • |
契約研究組織、研究場所、臨床試験を行うコンサルタントとの合意による費用 |
| • |
追加的な研究を含む開発活動に関連する他の費用; |
内部研究開発コストには、主に従業員の賃金と関連する付帯福祉コスト(例えば、労働者補償や健康保険料)、株式ベースの給与費用、出張コストが含まれる。
一般と行政費用
一般および行政費用には、主に人事関連費用、法律、相談、監査および税務サービスの専門費用、レンタル料およびその他の研究および開発に含まれない一般業務費用が含まれる。
その他の収入,純額
その他の収入(支出)、純額は主に我々1020達信施設賃貸の転貸収入、海外に本部を置く契約製造組織の第三者契約に関する外貨取引の損益及び株式証負債の公正価値変化を含む。
行動の結果
2022年と2021年12月31日終了年度比較
次の表は、私たちの示した期間の純損失(百分率を除いて千で)をまとめています
| 現在までの年度 |
||||||||||||||||
| 十二月三十一日 |
増加/ |
|||||||||||||||
| 2022 |
2021 |
(減少) |
||||||||||||||
| 収入: |
||||||||||||||||
| 協力収入 |
$ | 9,137 | $ | 7,442 | $ | 1,695 | 23 | % | ||||||||
| 運営費用: |
||||||||||||||||
| 研究開発 |
66,938 | 37,541 | 29,397 | 78 | % | |||||||||||
| 一般と行政 |
13,036 | 10,550 | 2,486 | 24 | % | |||||||||||
| 総運営費 |
79,974 | 48,091 | 31,883 | 66 | % | |||||||||||
| 運営損失 |
(70,837 | ) | (40,649 | ) | 30,188 | 74 | % | |||||||||
| その他の収入を合計して純額 |
(5,485 | ) | 1,498 | (6,983 | ) | -466 | % | |||||||||
| 純損失 |
$ | (76,322 | ) | $ | (39,151 | ) | $ | 37,171 | 95 | % | ||||||
協力収入
2022年12月31日と2021年12月31日までの年度の協力収入はそれぞれ約910万ドルと740万ドル。2021年同期と比較して、2022年収入の増加は主に第3段階PROC試験に関する支出の増加によるものであり、試験期間内の繰延収入の確認を推進している。
研究開発費
2022年、研究開発支出は2021年末の3750万ドルから6690万ドルに増加し、2940万ドルに増幅され、78%に増加した。この成長は主にprocにおけるbatiraxcept第3段階試験、ccRCCでのbatiraxcept 1 b/2段階試験、および膵臓癌におけるbatiraxceptの第1段階試験を含むわれわれの臨床計画の持続的な進展によるものである。2021年同期と比較して、procにおけるbatiraxcept第3段階試験の継続的推進は2022年の費用増加の最大の駆動因子である。2022年には、CMCの製造活動も大幅に増加し、2023年末に提出されたBLAに備えています。
一般と行政費用
一般と行政費用は約250万ドル増加し、あるいは24%増加し、2021年同期の約1,060万ドルから2022年の約1,300万ドルに増加した。この増加は,主に賃金支出の増加,株式による報酬支出の増加,解散費の増加,相談費の増加によるものである。
その他の収入を合計して純額
その他の収入(支出)総額は、純額が約700万ドル変動し、他の支出総額の純額を約550万ドル、2022年の純額を他の収入総額の約150万ドル、2021年の純額を約150万ドルとした。この変化は2022年に私たちの転貸者から受け取った年間転貸収入と関係があるが、2021年は一部の時間しかないが、2022年には株式証負債の公正価値が約900万ドル増加し、この変化を相殺した。
流動性と資本資源
私たちの設立から2022年12月31日まで、私たちは私たちの株式証券を私募し、私たちの株式証券の公開、債務融資、CPRIT贈与収益、私たちの市場メカニズムによる普通株の売却、許可協定から受け取った支払いを通じて、私たちの運営に資金を提供します。2022年12月31日現在,我々の累計赤字は約6.161億ドルであり,主に研究開発および一般·行政費用,3590万ドルの運営資本によるものである。2022年12月31日現在、私たちは約5370万ドルの現金と現金等価物を持っており、その大部分はいくつかの格付けの高い金融機関の通貨市場基金に投資されている。
2021年と2022年の間、私たちの主な資金源は、3 D Medicinesの記念碑的支払いと、私たちの普通株と他の証券の売却収益です。2020年11月、2021年6月、2021年8月に、私たちは3 D Medicinesと締結された3 D Medicines協定に基づいて、それぞれ3 D Medicinesから1200万ドル、600万ドル、300万ドルの前金とマイルストーン支払いを受け取った。2022年10月、私たちは3 D Medicinesから600万ドルの記念碑的支払いを受けた。2021年2月18日、私たちはEShelman Venturesから2,875,000株を購入し、私たちの普通株から約2,100万ドルを獲得した。2020年9月4日、Piper SandlerとCantor Fitzgeraldと株式分配協定(“株式割当協議”)を締結し、時々“市場で発売”を通じて私たちの普通株を売却する計画で、総発行価格は60,000,000ドルに達し、Piper SandlerとCantor Fitzgeraldが販売代理を務める。2021年12月31日までの年間で、1,432,627株の普通株を売却し、株式分配協議によると、純収益は980万ドルだった。2022年1月5日、EShelman Ventures,LLCから予備金権証を購入して約990万ドルの純収益を得て、最大4,545,455株を購入した。2022年3月には、EShelman Ventures,LLCと医療に専念する機関投資家から普通株3,185,216株を購入し、合計約930万ドルの純収益を得た。3月の1,665,025部の事前融資権証と3月の普通株式承認株式証は、登録された直接発売で最大4,850,241株の普通株を購入した。2022年10月、私たちは新しいバイオテクノロジー投資家、既存投資家、私たちの経営陣、および私たちの一部の取締役から約4,000万ドルの私募収益純額を獲得し、合計45,178,811株の私たちの普通株(または代替の10月の事前融資権証として)、10月の一般権証を発行し、ナスダック規則に基づいて市場定価による私募発行で合計45,178,811株の普通株を購入した。取引に参加したすべての投資家の1株当たりの購入価格および付随する10月の一般権証は0.9199ドル(または1株10月の事前資本権証および付随する10月の一般権証は0.9198ドル)である。2022年12月31日までの年度中に、株式分配協議により54,7.63億株の普通株を売却し、純収益は10万ドルとなった
私たちの現金と現金等価物は2022年12月31日まで約5370万ドルです。私たちの既存の現金と現金等価物は、私たちのPROC第3段階の業績を維持した後の運営を維持し、2023年第4四半期まで継続し、私たちの臨床開発計画を開発の後期段階に進め、パイプラインを拡大し、2023年第4四半期以降の運営に資金を提供するために追加の資金を得る必要があると信じています。私たちは、株式または債務融資、会社源との協力または他の手配、または他の融資源を通じてより多くの資金を求め、上記に資金を提供するつもりだ。このような要素は私たちが経営を続ける能力に大きな疑いを抱かせる。本年度報告Form 10−Kに記載されている総合財務諸表には、記録資産の回収可能性や負債分類に関する調整は含まれておらず、これらの調整は、経営を継続できない場合に必要である。経営陣は過去に資金調達に成功したにもかかわらず、私たちが成功する保証はなく、将来私たちが受け入れられる条項で必要な融資を得る保証もありません。必要な時に資金を集めることができなければ、私たちの財務状況や臨床試験の完成、私たちのビジネス戦略を実施する能力に悪影響を及ぼす可能性があります。私たちは多くの追加資本を集める必要があると予想しています。必要な資金は多くの要素に依存します
| • |
FDAが追加試験を要求する場合の需要を含む、我々の臨床研究の進捗、コスト、および臨床研究の結果 |
| • |
FDAと他の規制機関が承認した時間と関連するコストを求める |
| • |
大規模生産のコストを準備し |
| • |
任意の将来の候補製品が承認された場合、製品販売、マーケティング、製造、および流通を含む商業化活動のコスト |
| • |
私たちまたは未来のパートナーが発売した任意の製品の市場受容度と受容率 |
| • |
任意の特許請求書および他の知的財産権の費用の提起、起訴、弁護、および実行; |
| • |
私たちは、追加的な協力、許可、商業化、または他の計画の能力、およびそのような計画の条項と時間を達成する |
| • |
競争技術の出現や他の不利な市場発展。 |
もし私たちが必要な時にもっと多くの資金を集めることができない場合、あるいは資金調達の条項が私たちに不利な場合、私たちは私たちの開発計画および臨床試験の一部または全部を延期、減少、または終了することを要求されるかもしれない。私たちはまた販売を要求されるかもしれませんが、私たちは自分で開発し、商業化する技術や臨床製品の候補やプログラムを望んでいるかもしれません。
キャッシュフロー
以下の表に、以下の各期間の現金および現金等価物の主な出所と用途を示す
| 現在までの年度 |
||||||||
| 十二月三十一日 |
||||||||
| 2022 |
2021 |
|||||||
| (単位:千) |
||||||||
| 提供された現金純額(使用): |
||||||||
| 経営活動 |
$ | (65,079 | ) | $ | (32,177 | ) | ||
| 投資活動 |
(11 | ) | — | |||||
| 融資活動 |
59,369 | 31,061 | ||||||
| 現金と現金等価物の純減少 |
$ | (5,721 | ) | $ | (1,116 | ) | ||
経営活動用の現金
2022年12月31日と2021年12月31日までの年間で,運営活動で使用されている純現金はそれぞれ6510万ドルと3220万ドルであり,これは主に我々の候補製品batiraxceptの開発に関する資金を運営に使用しているためである。2021年12月31日までの年度と比較して,2022年に経営活動のための現金が増加したのは,主にわれわれの第3段階試験Batiraxcept in procの増加と,われわれの第2の腫瘍学適応ccRCCとわれわれの第3の腫瘍学適応膵癌の試験に関する持続コストによるものである。2022年にはCMCの製造活動も大幅に増加し、2023年末に提出したBLAの準備をしています。
投資活動用の現金
2022年と2021年12月31日までの年間で、投資活動のための現金純額はそれぞれ1.1万ドルと0ドルだった。
融資活動で提供された現金
2022年と2021年12月31日までの年間で、融資活動が提供する純現金はそれぞれ5940万ドル、3110万ドルだった。2022年12月31日までの年度に関する融資活動には,我々の証券の登録直接発行,収益930万ドル,予融資権証の発行,990万ドルの収益,市場発行収益10万ドル,および私募融資,純収益約4000万ドルが含まれている。2021年12月31日までの年度に関する融資活動には,登録直接発行,募集資金2,090万ドル,および市場での募集資金980万ドルがある。
肝心な会計見積もり
私たちの財務状況と経営結果の討論と分析は、アメリカ合衆国で一般的に受け入れられている会計原則またはGAAPに従って作成された財務諸表に基づいている。これらの財務諸表を作成するには、報告の資産、負債、費用、および関連開示の金額に影響を与えるために、管理層が推定および判断する必要がある。我々は、収入確認及び将来の研究開発費の推定、株式証負債及び株式ベースの報酬に関する推定を含むこのような推定を継続的に評価する。過去の経験,第三者から受け取った資料,および関連する場合には合理的と考えられる他の様々な仮定に基づいて行われていると考えられるが,これらの仮定の結果は資産や負債の帳簿価値を判断する基礎を構成しており,当該などの資産や負債の帳簿価値は他の出所から容易に見られるものではない.異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。歴史的に見ると、私たちの見積もりの修正は財務諸表の実質的な変化を招いていない。
協力収入
私たちは外部許可と協力協定を締結し、これらの協定に基づいて、私たちの候補製品のいくつかの権利を第三者に許可し、これまでこれらの権利はASC 606の範囲内にありました。これらの取り決めの条項は、一般に、払い戻し不可能な前払い許可料、開発、規制、および商業マイルストーン支払い、契約製造業者によって提供される製造供給サービスの支払い、および製品の純売上を許可する印税のうちの1つまたは複数を私たちに支払うことを含む。これらの支払いのいずれも許可、協力、その他の収入を招く可能性があるが、許可製品の純売上の印税収入は除外され、これらの収入は印税収入に分類される。
ASC 606に入金された我々の連携プロトコルの要素については、単独の承諾が単独の履行義務として入金されるべきか、合併の履行義務として入金されるべきかを決定し、契約で決定された個々の履行義務の独立販売価格を決定するために判断すべき仮定を作成しなければならない。我々は重要な仮定を用いて独立販売価格を決定し、その中には予測収入、開発スケジュール、人員コスト販売率、割引率、および技術と監督管理が成功する確率が含まれている可能性がある。我々の知的財産権許可が、外部許可や連携手配で決定された他の履行義務とは異なると判定された場合、許可が顧客に譲渡され、顧客が許可を使用して利益を得ることができる場合には、許可に割り当てられた払戻不可能な前払い費用の収入を確認する。他の約束とバンドルされたライセンスについては、合併履行義務が時間の経過とともに履行されるか、ある時点で履行されるかを決定するために、合併履行義務の性質を評価する判断を利用し、時間の経過とともに進行を測定する適切な方法を決定して、払い戻し不可能な前払い費用からの収入を確認する。3 D Medicines連携プロトコルについては、基本サービスを実行する際に、決定されたパフォーマンス義務に割り当てられた金額に関する収入を比例的に確認します。
これらの見積りと判断は,連携収入の確認に大きな影響を与えている。我々は,開発コスト見積りの変化が比例したパフォーマンスパーセンテージに影響する可能性が予測され,変化した期間に記録された連携収入の決定に大きな影響を与える可能性がある.
臨床試験は費用を計算しなければならない
われわれの臨床試験に計上すべき費用は,臨床研究者サイトの患者登録と関連コストの見積もりと,代表会社と臨床試験を行って管理する複数の研究機関とCROとの契約によるサービスと努力の見積もりに基づいている。
われわれの臨床前と臨床試験費用の見積もりは,われわれを代表して臨床前研究と臨床試験を行って管理する研究機関とCROとの契約に基づいて提供されたサービスである。サービス料を計算する際に、サービスを提供する時間帯と、各時間内の患者登録と活動のレベルを推定します。実際にサービスを提供する時間や努力の程度が見積りと異なる場合には,対応する項目を調整する.これらの手配に基づいて関連サービスを受信する前に第三者に支払われるお金は、サービスを提供する前に前払い料金と表記される。
上記の見積もりと判断は、私たちの研究開発費に大きな影響を与えます。患者登録人数や関連コストの見積もりが変化すれば、私たちの研究開発費に実質的な影響を与える可能性があります。
株に基づく報酬費用
株式ベースの報酬を計算するために、Black-Scholesオプション定価モデルを用いて、株式に基づく報酬報酬の公正価値を推定する。ブラック·スコアモデルを用いて、報酬期間内の予想株価変動および株式オプションの予想期間を含むが、これらに限定されないが、株の報酬報酬に基づく公正価値は、我々の株価および多くの仮定の影響を受けることが決定される。
もし要因が変化すれば、私たちは異なる仮定を採用して、株式ベースの給与支出は私たちが過去に記録したものと大きく異なるかもしれない。株式ベースの補償費用を決定する際に使用される仮定と、時間とともに分かる実要因との間に差があれば、将来付与される株式ベースの補償費用を決定する際に使用される入力要因を変更する可能性がある。これらの変化があれば,我々がこのような変化を行っている間の運営結果に大きな影響を与える可能性がある.実際の没収については、没収発生期間中の補償費用の調整を確認します。
株式証法的責任
当社は、推定日および報告日における権証の個別的な特徴に基づく仮定を用いて、これらの負債の公正価値を推定する。会社はブラック·スコアーズオプション定価モデルと対象株式の公正価値(適用すれば)を使用して、これらの負債の公正価値を決定する。推定モデルは,我々の株の推定変動率,権利証の残存契約期間,無リスク金利,各種その他の要因を含む推定日までの投入に基づいている。
もし要素が変化すれば、私たちは異なる仮定を採用して、株式証負債と他の収入/支出は私たちが過去に記録したものと大きく異なるかもしれない。株式証券負債を決定する際に使用する仮説と時間とともに分かる実要因との間に差があれば,推定モデルで用いた入力を変更する可能性がある.これらの変化があれば,我々がこのような変化を行っている間の運営結果に大きな影響を与える可能性がある.
情報を付加する
当社の総合財務状況、経営業績またはキャッシュフローに重大な影響を及ぼすことが影響または予想されている会計声明の詳細については、簡明総合財務諸表付記2を参照されたい。
最近の会計公告
本年度報告書10 K表の他の部分に添付されている連結財務諸表の“付記2--重要会計政策概要”には、当年度報告書10 K表の他の部分に添付されている、または現在評価されている最近発表された会計声明が詳細に記載されている。
プロジェクト7 A。市場リスクに関する定量的で定性的な開示
取引法第12 b-2条の定義によると、我々は小さな報告会社であり、本プロジェクトに要求される情報を提供する必要はない。
項目8.財務諸表および補足データ
以下は登録者の総合財務諸表、独立公認会計士事務所に関する付記及び報告であり、本報告F−1ページから列挙する。
| 独立公認会計士事務所報告(BDO USA,LLP;ノースカロライナ州ローリー;PCAOB ID#243) |
F-2 |
|
| 合併貸借対照表 |
F-4 |
|
| 連結業務報告書 |
F-5 |
|
| 株主権益合併報告書 |
F-6 |
|
| 統合現金フロー表 |
F-7 |
|
| 連結財務諸表付記 |
F-8 |
第9項会計及び財務開示面の変更と会計士との相違
ありません
プロジェクト9 Aです。制御とプログラムです
(A)開示制御及びプログラムの評価
2022年12月31日現在、CEOおよび最高財務官を含む我々の経営陣の監督·参加の下で、1934年に改正された証券取引法(The Exchange Act)下のルール13 a-15(E)において会社の制御および他のプログラムとして定義され、取引法に基づいて提出または提出された報告書において開示を要求する企業の情報がSECルールおよび表に指定された期間内に記録、処理、集計、報告されることを確保するために、当社の“開示制御および手続”の有効性が評価されている。これらの情報は収集され、開示すべき情報をタイムリーに決定するために、私たちの最高経営責任者やCEOを含む私たちの経営陣に伝えられます。この評価に基づき、我々の最高経営責任者および最高財務責任者は、2022年12月31日までに、我々の開示統制および手続きが合理的な保証レベルで有効であると結論した。
(B)財務報告の内部統制に関する経営陣の報告
我々の経営陣は、財務報告書の十分な内部統制の確立と維持を担当しており、この用語は、“取引法”規則第13 a-15(F)条に定義されている。我々の内部制御システムは公認された会計原則に基づいて、対外財務諸表の作成と公平な列報に合理的な保証を提供することを目的としている。すべての内部制御システムは,どんなに良く設計されていても,固有の限界があり,内部制御システムの目標が実現されることを合理的に保証するしかない.
最高経営責任者や最高財務責任者を含む経営陣の監督と参加の下、2013年の内部統制-総合的な枠組みでテレデビル委員会(COSO)協賛組織委員会が確立した基準に基づいて、財務報告の内部統制の有効性を評価した。私たちの評価によると、2022年12月31日まで、財務報告書の内部統制に有効であると結論した。
2022年12月31日現在、私たちは非加速届出者であり、私たちの独立公認会計士事務所は私たちの財務報告内部統制について認証報告を発行する必要はありません。
(C)財務報告の内部統制の変化
私たちの経営陣は、最高経営責任者やCEOを含め、2022年12月31日までの四半期内財務報告内部統制に発生したいかなる変化も評価しており、その間に財務報告内部統制に重大な影響を与えるか、または合理的に大きな影響を与える可能性のある変化は発生していないと結論した。
プロジェクト9 B。その他の情報
ありません
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
適用されない
第三部
プロジェクト10.取締役、上級管理者、および企業管理
会社の取締役会および上級管理者
次の表は、2023年3月10日までの年齢を含む、私たちの役員と役員に関する情報を示しています。私たちのどの役員や役員の間にも家族関係はありません。
| 名前.名前 |
年ごろ |
ポスト |
||
| フレデリック·N·エゼルマン製薬会社ですD。(1) |
74 |
取締役会執行議長 |
||
| ゲイル·マッキントソール博士(2) |
60 |
取締役最高経営責任者総裁 |
||
| ルディ·ハワードです(3) |
65 |
首席財務官 |
||
| ロバート·B·ゲラー医学博士(4) | 69 | 首席医療官 | ||
| レナード·スコット·ドフ博士です(5) |
50 |
首席運営官 |
||
| アマト·ジャシア博士 |
64 |
役員.取締役 |
||
| エリック·チャン |
41 |
役員.取締役 |
||
| ジョン·A·ホーネク医学博士です | 63 | 役員.取締役 | ||
| マイケル·W·ロジャース |
63 |
役員.取締役 |
||
| 何俊仁、医学博士、博士。 | 61 | 役員.取締役 | ||
| シグッド·C·カーク | 56 | 役員.取締役 |
| (1) |
エセルマン博士は2022年1月3日にわが社の執行議長に任命され、2020年4月8日から当社の執行議長に任命されるまで取締役会の非執行議長を務めてきました。 |
| (2) |
マッキントッシュ博士は総裁兼最高経営責任者兼取締役に任命され、2020年4月8日から発効した。McIntyre博士は2019年2月12日からCEOに任命されるまで私たちの首席科学者を務めている。 |
| (3) |
ハワード·チェンさんは2022年6月3日から当社の最高財務責任者を務めます。 |
| (4) |
ギャラー博士は2022年7月1日以来私たちの首席医療官を務めてきた。 |
| (5) |
ドルフ博士は2022年3月21日以来私たちの首席運営官を務めてきた。 |
フレデリック·N·エゼルマン製薬会社ですD取締役会長
EShelman博士は2022年1月3日にわが社の執行議長に任命され、2020年4月8日から取締役会非執行議長を務め、当社の執行議長に任命されるまで務めています。これまで、会社を私募株式に売却する前に、製薬製品開発会社(PPDI)の会長兼最高経営責任者を立ち上げ、務めてきた。PPD後,Furiex製薬会社(FURX)の創設会長と最大株主を務め,FURXは許可を得て迅速に新薬を開発する会社である。Furiexは2014年に森林実験室会社(後にActavisに買収)に売却された。彼のキャリアには、元グラクソ·スミスクライン社の上級副社長開発と取締役会メンバーの職、ビトラム実験室とバーリングマンハイム製薬会社の管理職も含まれている。エセルマン博士はAmplance Healthcare Acquisition Corp.(ナスダック市場コード:AMHC)とEyenovia Inc.(ナスダック市場コード:Eyen)の取締役会メンバーでもある。彼は現在いくつかの生物技術会社の会長であり、以前は薬品会社(MDCO)の会長であり、ボッシュ健康(BHC)G 1治療会社(ナスダック市場コード:GTHX)の取締役会メンバーであった。エシェルマン博士はノースカロライナ州医学基金会実行委員会に勤め、ノースカロライナ州大会に同州多キャンパス大学システム取締役会(監査委員会議長)及びノースカロライナ州バイオテクノロジーセンターのメンバーに任命された。また、ノースカロライナ大学シャーロット校(UNC-CH)薬学院来訪者委員会の議長も務めている。この学校はノースカロライナ大学エセルマン薬学院と命名され、学校や専攻への多くの貢献を表彰している。
彼はノースカロライナ大学のデビッド賞と傑出したサービス賞、ノースカロライナ大学とシンシナティ大学薬学学院の傑出した校友、生命科学リーダー賞(CED)とノースカロライナ州バイオテクノロジーの殿堂を含む多くの賞を受賞した。エセルマン博士はシンシナティ大学の薬学博士号を取得し,シンシナティ総合病院で駐院実習を完了し,ノースカロライナ大学の薬学学士号を取得した。彼はハーバードビジネススクールでOPM課程を修了した。エセルマン博士はノースカロライナ大学から名誉理学博士号も取得した。
生命科学、バイオテクノロジー、製薬業界での彼の経験と企業発展事務に対する彼の理解に基づいて、私たちはエセルマン博士が私たちの取締役会のメンバーになる資格があると信じている。
Gail Mclntyre博士CEO兼役員です
マッキンドール博士は2020年4月8日から2019年2月まで、彼女が私たちのCEOに任命され、私たちのCEOを務めるまで、私たちの取締役会のメンバー、総裁兼CEOを務めてきた。マッキンドール博士は2018年10月12日から2019年2月まで、我々の研究開発部門の上級副総裁を務め、2017年1月から2018年10月までアラヴィ生物会社の研究開発部門の上級副総裁を務め、2016年8月から2017年1月までアラヴィ生物会社のコンサルタントを務めた。多種の薬物を市場に投入した後、マッキンドール博士は薬物開発、戦略業務開発、許可とM&A活動において20年以上の経験を持っている。McIntyre博士はIntelliDev Consulting LLCで3年間担当を務め、いくつかのバイオテクノロジー会社にコンサルティングサービスを提供するとともに、2014年1月から2016年1月までの間にMeryx,Inc.の開発副総裁を務めた。これまでマッキンドール博士はFuriex製薬会社で研究部門の高級副総裁を務め、医薬製品開発有限責任会社(PPD)化合物協力業務の責任者を務めていた。FuriexとPPDでは、彼女は薬物開発計画のためにすべての臨床前と臨床活動を制定と管理し、新しい協力機会を探し、許可機会と新しい業務買収のための技術の職務調査を担当した。PPDでは、彼女はPreIND段階でのSyrx,Inc.の協力とAlogliptinの許可を指導し、第2段階で武田の許可を指導した。彼女はDapoxetineを現在のジョンソンとその後のMenarini集団に権限を与えることに重要な役割を果たした。彼女は2014年にAllerganを11億ドルで買収した取引で重要な役割を果たし、CSSとViberziのスケジュールについて交渉することに成功し、またすべての開発を推進した。マッキンドール博士は30件以上の監督意見書を執筆し、委員会の認証を受けた毒性学者である。彼女の経験は、腫瘍学(免疫腫瘍学を含む)、感染性疾患、中枢神経系、胃腸および代謝/内分泌、および小型薬物、治療用ワクチン、抗体、免疫結合体、およびポリペプチド模倣物を含む様々な治療領域を含む様々な治療領域を含む。マッキンドール博士はまたアメリカ臨床病理学会の臨床病理学(血液学と臨床化学)委員会の認証を得た。マッキントッシュ博士はメリマルク大学で生物学の学士号を取得した。彼女はノースカロライナ大学教会山校で生化学と生物物理学の修士号と博士号を取得しました。
マッキントッシュ博士の医療·製薬業界における臨床·指導経験により、彼女は取締役会に貴重な貢献をすることができると信じている。
ルディ·ハワード最高財務責任者
ハワードさんは2022年6月3日から当社の最高財務責任者を務めています。ハワードさんは2015年6月から2021年12月までの間にVTV治療会社の最高財務責任者を務め、ナスダック資本市場(ナスダック·コード:VTVT)に上場している臨床フェーズ製薬会社です。ハワードさんは、VTV治療会社に加入する前に、2010年1月から2015年5月までの間に、国際支出管理ソフトウェア会社SciQuest,Inc.の最高財務責任者を務めました。2008年11月から当社に追加して、医薬サービス会社のMDS Pharma Servicesでハワードさんは、上級副社長とチーフ財務官を担当します。2003年からMDS Pharma Servicesに加入し、ハワードさんはノースカロライナ州ウィルミントンで自身の財務コンサルティング会社Rudy C.Howard,CPA Consultingを経営しており、M&A取引、株式、債務発行、その他の一般的な管理に関する相談を含むサービスを提供しています。2001年から2003年にかけて、ハワードさんは国際人的資本管理ソフトウェア会社Peopleclick,Inc.の最高財務責任者を務めました。2000年からPeopleclickに加入して、ハワードさんはマーケティングとインターネット技術会社のマーケティングサービスグループのチーフ財務責任者を務めています。ハワードさんは1995年から2000年にかけて臨床研究機関PPD,Inc.の首席財務官を務めた。PPDに加入する前に、ハワードさんは普華永道のパートナーだった。ハワードさんはノースカロライナ州立大学で会計学の学士号を持ち、公認会計士です。
ロバート·B·ゲラー医学博士首席医療官
ギャラー博士は2022年7月1日以来私たちの首席医療官を務めてきた。ゲラー博士の学術人生は,シカゴ大学幹細胞移植プロジェクトの役員と,エマレー大学白血病サービスセンターの役員と移植プロジェクトに関係のない取締役から始まった。そして彼はコミュニティ実践に移行し、血液系悪性腫瘍と固形腫瘍患者のためのクリニカルパスの開発に集中し、コミュニティに基づく臨床研究計画を拡大した。臨床実践20年余り後、彼は生物製薬業界に移行し、Alexion治療会社、サギ治療会社とCoherus生物科学会社で医療事務と臨床開発職を務めた。具体的には,2019年から2022年6月まで,ゲラー博士はコヘル生物科学会社で高級副総裁(医療事務)を務め,そこで彼らの生物類似特許経営権と免疫腫瘍製品ラインの臨床開発と商業化に成功した。2015年から2019年にかけて、ゲラー博士はサギ治療会社の副社長を務め、そこで医療事務チームを開発·募集し、サギの製品を発売し、パイプラインの開発を図った。ギャラー博士は200編以上の出版物と要約を執筆し、多くの医学定期刊行物の査読者を務めたことがある。ギャラー博士はマサチューセッツ工科大学で物理学学士と修士号を取得し、ハーバード医学院で医学博士号を取得した。ギャラー博士はペンシルバニア大学病院で医学入院医師資格を修了し、ジョン·ホプキンス腫瘍センターで医学腫瘍学奨学金を受けた。ギャラー博士は米国内科医学委員会の内科と内科腫瘍学外交官である。
レナード·スコット·ドルフ博士最高経営責任者
ドルフ博士は2022年3月21日以来私たちの首席運営官を務めてきた。これまで、2017年11月から2022年3月まで、Dove博士はThermo Fisher Science社(ニューヨーク証券取引所コード:TMO)傘下のPPD、Inc.(PPDと略称する)で上級副総裁兼社長を務め、PPD早期開発サービス業務部門の戦略指導と監督を担当してきた。この職では、Dove博士はCROの早期運営の組織設計と実行管理を担当している。PPDは生物製薬と生物技術業界に臨床研究サービスを提供する全世界のリードサプライヤーである。PPDに加入する前,2015年8月から2017年11月まで,ドーフェン博士はエル建社(以下,エル建)臨床開発部門の取締役執行役員,契約制職はVIBRZI/Truberzi(イルサドーリン)のグローバル臨床開発担当であった。Allerganでは,eluxdorineの過敏性腸症候群治療薬としての発売承認,ラベルと発売後の要求について交渉するとともに,そのラベル拡張とライフサイクル管理臨床戦略の開発と運営実行を監督した。ドフ博士は以前,Furiex製薬会社のプロジェクト担当者としてeluxdorineの開発を監督し,Actavis plc(現在Allergan)にFuriexが買収されるまでセキュリティプロトコルの提出に成功して管理していた。ドフ博士はテキサス農工大学で生化学学士号と薬理学博士号を取得しました。
アーマト·ジャシア取締役博士
ジャシア博士は2018年10月12日の合併完了以来、取締役会のメンバーを務めてきた。合併完了日まで2010年8月から2018年10月までPrivate Aravive取締役会メンバーを務め、2017年1月から2018年10月までPrivate Aravive代理首席科学官を務め、2018年10月12日まで合併が完了した。ジャシア博士はまた、スタンフォード大学医学院放射腫瘍系放射と癌生物学教室放射腫瘍学教授、取締役研究と助教授を務め、2011年以来この職を務め、2019年1月以来ずっとオックスフォード大学放射腫瘍学研究所放射腫瘍学教授を務め、同時に取締役基礎科学アシスタントとスタンフォード癌研究所放射生物学プロジェクトの責任者でもある。癌生物学学際大学院生プロジェクトの取締役も務め、現在はスタンフォード大学医学部の“ジャック、ルー、サム·ウィルソン癌生物学教授”である。彼はペンシルバニア大学で博士号を取得した。
ジャシア博士が取締役会に貴重な貢献をできるのは、広範な科学と医学知識と経験を持っており、Araviveの技術を熟知しており、この技術の発端となる実験室の指導者であるからだと信じている。
張リック取締役
Mr.Zhangは2018年10月12日の合併完了以来、取締役会メンバーを務めてきた。合併完了日まで、2016年6月から2018年10月までの間にAravive Biologicsの取締役会メンバーを務めていた。Mr.Zhangは新時代技術管理有限会社の管理パートナーで、2016年に設立された会社で、バイオテクノロジーと応用物理会社の多戦略投資家である。Mr.Zhangは2013年から2016年まで新時代の科学技術管理有限会社を設立し、彼の家族理財室投資マネージャーを務めた。Mr.Zhangは2006年にモルガン大通香港駐在の中国投資銀行チームに入社した。次の7年間、Mr.Zhangは香港のマッコリ資本とバークレイズ資本で働き、大中国地区の医療保健と科学技術業界の顧客をカバーすることを担当した。Mr.Zhangはカナダのキングストン女王大学で商学学士号と経済学学士号を取得した。
Mr.Zhangが取締役会に貴重な貢献をすることができるのは,わが社や取締役や他のバイオテクノロジー会社の投資家や投資家としての豊富な経験のためであると信じている。
ジョン·A·ホーネク医学博士役員は
ホネーク博士は2021年5月12日以来取締役会のメンバーを務めてきた。ホネック博士はバイオテクノロジーと製薬業界で30年間の薬物開発と指導経験を持っている。2018年1月から2021年1月まで、ホネック博士はバイオテクノロジー会社Anokion SAの総裁兼最高経営責任者を務めた。Anokion SAに加入する前に、Hohneker博士は2015年8月から2018年1月までバイオテクノロジー会社Forma Treateutics Inc.で研究開発者総裁を務めた。2001年から2015年にかけて、ホネック博士はノワ製薬での職務がますます多くなり、最近の職務は高級副総裁と全世界発展、免疫学と皮膚科担当者である。ノワールに加入する前に、彼はグラクソ·スミスクラインとそのレガシー会社Burroughs Wellcomeでますます多くの責任職を務めてきた。
ホーネク博士は、以下の上場企業の取締役会メンバーである:Curis,Inc.,Evelo Biosciences,Inc.およびHumanigen,Inc.である。2017年1月から11月まで、バイオテクノロジー会社Dimension Treateutics Inc.の取締役会に勤め、Ultragenyx Pharmtics Inc.に買収されるまで務めた。ホーネック博士はゲティスバーグ学院から化学学士号を取得し、ロッグス医学院のニュージャージー医科大学と歯科大学から医学博士号を取得した。ノースカロライナ大学教会山校で内科実習と入院実習を修了し,腫瘍学研究員の学位を取得した。
彼の製薬とバイオテクノロジー業界での経験から、私たちはホネーク博士が私たちの取締役会のメンバーになる資格があると信じている。
マイケル·ロジャース役員
ロジャーズさんは2020年9月15日から取締役会のメンバーを務める。ロジャーズは2020年11月からApnimed,Inc.の首席財務官を務めてきた。Apnimed,Inc.に入社する前に、2017年11月から2019年10月15日までAerpio製薬会社(ナスダック株式コード:ARPO)の首席財務官を務めた。Aerpio製薬会社に入社する前に、2013年から2016年までAcorda治療会社(ナスダック:ACOR)の首席財務官を務め、BG医薬、InDevus製薬会社(Endo製薬会社に買収された)、高級健康会社とAuto免疫会社で幹部と指導職を務めた。ロジャーズさんは現在、ケレックス生物製薬会社、アイポイント製薬会社、コロナド生物科学会社の顧問として働いている木通治療会社(ナスダック世界市場コード:AKBA)の取締役会のメンバーです。彼のキャリアの初期、ロジャースはリーマン兄弟とPaineWebberの投資銀行家で、そこで彼は生命科学会社に集中していた。彼はバージニア大学ダットンビジネススクールで工商管理修士号を取得し、共同学院で学士号を取得した
我々は、ロジャーズさんが取締役会に貴重な貢献をすることができると信じているのは、彼がバイオテクノロジー企業の幹部や取締役として上場企業の経験を豊富に持っているからです。
何俊仁、医学博士、取締役
何博士は2021年5月12日から取締役会のメンバーを務めている。何博士は25年以上のバイオテクノロジーと製薬業界の経験を持ち、複数の運営職を務めたことがある。何博士は2018年から2020年までの間にボストン製薬会社の首席医療官を務めた。2014年9月から2017年まで、何博士は商業段階でバイオ製薬会社イピア社で様々な職務を担当し、2015年9月から2017年12月31日まで執行副総裁兼首席医療官、2014年9月から2015年9月まで首席発展官を務めた。何博士は2013年2月から2014年9月まで薬物製剤会社Metastagen Inc.の最高経営責任者を務め、2013年2月から2014年9月まで北京に本部を置く生物製薬会社百済神州有限公司の総裁を務め、2010年10月から2012年12月まで中国を担当し、2008年9月から2010年9月までジョンソン社腫瘍学開発副主任総裁を務め、これに先立ち、2008年9月から2010年9月までグラクソ·スミスクライン社薬物開発腫瘍学卓越センターの高級副総裁を務めた。何博士は現在サイリス治療有限会社の取締役会メンバー、Accent Treeutics,Inc.と太郎ウォーカー生物治療会社の科学顧問委員会のメンバーを務めている。オークランド製薬(米国)有限公司と香港に本社を置くD 3生物会社の高級科学·医療コンサルタントである。彼のキャリアの中で、何博士は直接19種類の抗癌薬物の初の人体投与量を担当し、そして臨床試験のすべての段階で60種類以上の血液学と腫瘍学化合物の開発を監督した。これまで、彼の仕事は11項目のNCEまたは生物製品の承認を促進した:Gleevec、Arranon、Tykerb、Promacta、Votrient、Synribo、Tafinlar、Mekinist、Sylvant、Rydap、Tazverik。
何博士は現在第一段階顧問有限会社の校長、ノースカロライナ大学イヒマン薬学院化学生物学及び薬物化学系兼任助教授及びジョンホプキンス大学兼任講師である。何博士はエール大学で医学博士と博士(薬理学)の学位を取得し、その後ボストン児童病院で小児科入院医師の学位を取得し、その後Dana-Farber癌研究所で小児科血液学/腫瘍学臨床研究員の学位を取得し、アメリカFDAと国家癌研究所を通じて臨床腫瘍学と監督科学を専攻した。彼はジョン·ホプキンス大学で生物学の学士号を取得した。
何博士の製薬やバイオ製薬業界での経験から、私たちは彼が私たちの取締役会のメンバーになる資格があると信じています。
シゲド·C·カーク監督
カークさんは2021年5月12日から取締役会のメンバーを務めている。カークさんは高級企業のビジネス開発担当者で、バイオ製薬、医療機器、ジェネリック医薬品のブランドで15年以上の製薬経験を持っています。2009年から2020年5月までAbbVie Inc.に買収され、カークはAllergan plcで複数のポストを務めた。(前身はアトビス)。カークさんは、2012年5月から2020年5月までの間に、エル建の企業ビジネス開発担当の実行副社長を務め、同社の12人の幹部リーダーチームのメンバーです。彼は発展とビジネスの機会を評価し、リーダーの職務調査と交渉と重要な法律と金融条項を処理するために不可欠なメンバーだ。カークさんは2003年から2009年にかけて、バル製薬の上級副社長、世界的な財務総監、首席会計官も務めた。カークは徳勤で彼のキャリアを始め、当時は監査マネージャーで、その後公認会計士資格を取得した。カークさんはペス大学の工商管理学士号を取得した.
コークさんは製薬やバイオ製薬業界での経験から、私たちの取締役会のメンバーになる資格があると信じています。
役員の任期と人数
取締役会は現在8(8)名の取締役で構成されており、3つのレベルに分かれている。各クラスの任期は3年であり,各クラスの任期は数年連続で満了する.第I類取締役(EShelman博士とKirkさん)は2024年株主総会に立候補し、クラスII役員(Giaccia博士、Hohneker博士、Rogersさん)は2025年株主総会に立候補し、クラスIII取締役(McIntyre博士、Ho博士、張さん)は2023年株主総会に立候補する。
取締役会の空きは余剰役員の過半数選挙でしか埋められません。取締役会が選出したクラスの空席を埋める役員は、役員数の増加による欠員を含め、取締役の後継者が正式に選出され資格を持つまで、そのクラスの残りの任期内に在任しなければならない。
取締役会と会社のガバナンスに関する情報
取締役会の独立性
私たちの普通株はナスダックに上場しています。ナスダック上場基準によると、独立取締役は上場会社の取締役会の多数のメンバーから構成されなければならず、監査委員会、報酬委員会及び指名と会社管理委員会のすべてのメンバーは独立しなければならない。監査委員会のメンバーはまた、取引法規則10 A-3に規定されている独立性基準を満たさなければならず、報酬委員会メンバーも取引法規則10 C-1に規定されている独立性基準を満たさなければならない。ナスダック上場基準によると、一人の取締役は、その人が取締役の職責を履行する際に独立判断を妨害する関係がないと判断した場合にのみ、“独立取締役”になる資格がある。
上場企業の監査委員会のメンバーは、監査委員会、取締役会又は任意の他の取締役会委員会のメンバーであることを除いて、(I)上場企業又はその任意の付属会社の任意の相談、相談又はその他の補償費を直接又は間接的に受け入れてはならない、又は(Ii)は当該上場会社又はその任意の付属会社の連結者となってはならない。
取締役会は取締役会メンバーの独立性を審査し、取締役が当社と実質的な関係にあるかどうかを考慮し、職責を履行する際に独立した判断能力を行使する可能性を損なう可能性がある。取締役会は、各取締役が要求し、提供する彼らの背景、仕事、関係(家族関係を含む)に関する情報に基づいて、EShelman博士(彼は執行主席であるため)とMcIntyre博士(彼女は現在わが社の総裁兼最高経営責任者であるため)を除いて、私たちの現取締役はすべて“独立”であり、この用語はナスダック規則に基づいて定義されている。したがって、ジャシア博士、ホネッカー博士、何博士、カークさん、ロジャースさん、張さんは、ナスダックのルールに従って定義されているので、“独立”とみなされます。
これらの決定を行う際に、取締役会は、各非従業員取締役の現在と以前のわが社との関係、および取締役会が彼らの独立性の決定に関連すると考えているすべての他の事実および状況を考慮し、各非従業員取締役の株式に対する実益所有権、および本修正案13条の“特定の関係および関連側取引、取締役独立性”に記載されている彼らに関連する取引を含む
取締役会の各委員会に関する情報
取締役会は委員会を特定の管理と行政機能を履行するように任命する権利がある。上述したように、取締役会は監査委員会、報酬委員会、および指名と会社管理委員会を設置した。取締役会は他の委員会を設置し、会社の経営管理に便宜を図ることができる。各委員会の構成と機能は以下のとおりである。会員たちは彼らが辞任したり取締役会が別の決定をするまで、この委員会に勤めている。
すべての委員会は2002年のサバンズ-オクスリ法案、ナスダック、米国証券取引委員会のすべての適用要求を遵守しており、規則と条例は以下の通りである。このような委員会の規定は私たちのウェブサイトwww.aravive.comで調べることができる。当社のサイトに掲載されているか、当社のサイトから取得できる資料は、本10-Kフォーム年報の一部ではありませんが、本10-Kフォーム年報に掲載されているサイトのアドレスは非公式テキスト参照のみです。
取締役会各委員会
以下の表は、現在の監査委員会、報酬委員会、指名および会社管理委員会のメンバーまたは議長の取締役を示しています。取締役会は時々設置することもできます仮特定の問題を解決する委員会。
| 名前.名前 |
監査?監査 |
補償する |
指名と会社 統治する |
関係者取引委員会 | ||||
| ゲイル·マッキントソール |
||||||||
| フレデリック·N·エゼルマン製薬会社ですD.* |
|
|||||||
| アマト·ジャシア博士 |
X |
X |
X** |
|||||
| マイケル·W·ロジャース |
X** |
X** |
X | |||||
| エリック·チャン |
X |
|||||||
| ジョン·A·ホーネク医学博士 | X | X | ||||||
| 何俊仁、医学博士、博士。 | X | |||||||
| シグッド·C·カーク | X | X** |
| * |
マッキントッシュ博士は2020年4月8日に取締役会に参加し、第3種メンバーとなった。彼女は取締役会のどの委員会のメンバーでもない。 |
| ** |
委員会議長 |
| *** |
エセルマン博士はどの委員会のメンバーでもなく、取締役会の執行議長を務めている。 |
以下は取締役会の各委員会についての説明だ。
監査委員会
ロジャース、カーク、張暁紅、ジャシア博士は現在監査委員会のメンバーを務めている。取締役会では、ナスダック株式市場の独立性の定義に基づき、ロジャースさん、カークさん、張暁紅さん、ジャシア博士がそれぞれ“独立”であることを決定した。取締役会では、ロジャースさん、カークさん、張さん、ジャシア博士がナスダックの株式市場ルールの指定した財務管理に関する専門知識を所有しており、ロジャースさん、カークさん、張さんはいずれも米国証券取引委員会やナスダック市場の規程といった規制下で財務の専門家であることを認めていた。
監査委員会の主な目的は、取締役会を代表して、当社の会計及び財務報告手続、財務報告の内部統制システム及び財務諸表の監査、我々の財務諸表及び報告の品質及び完全性、並びに監査報告の準備又は発表又は監査サービスを提供するために招聘された公認会計士事務所又は独立した外部監査士事務所の資格、独立性及び業績について取締役会の監督責任を履行することである。監査委員会の具体的な役割には、以下のことが含まれる
| • |
独立監査人の業績と資格を評価する |
| • |
独立監査人の採用を決定し、承認する |
| • |
既存の独立監査役を保留または終了するか、新たな独立監査役を任命して採用するかを決定する |
| • |
任意の提案された許容可能な非監査サービスを実行するために独立監査師を審査および承認すること |
| • |
法律の要求に基づいて、私たちの監査参加グループにおける独立監査員パートナーの交代状況を監視する |
| • |
私たちと任意の関係者との間の取引を審査、承認、または拒否します |
| • |
財務報告の内部統制の有効性について経営陣と独立監査人と協議する |
| • |
法律の適用要件に基づいて、会計、内部会計制御又は監査事項に関する苦情、及び従業員が問題のある会計又は監査事項について提出された秘密及び匿名苦情を受信、保留及び処理するための手続を確立する |
| • |
経営陣や独立監査人と会議を開き、私たちの年度監査財務諸表と四半期財務諸表を審査します。 |
監査委員会は取締役会が採択した書面規約に基づいて運営されており、この定款は私たちのウェブサイトで調べることができます。URLはWwwv.aravive.comそれは.その規約は監査委員会の職責の性質と範囲をより詳細に説明する。
報酬委員会
ジャシア博士、ホネック博士、およびロージャースさんは現在、取引法第10 C-1条およびナスダックの独立性の定義に基づいて各個人が独立していると判断した報酬委員会のメンバーであり、取引法第16 B-3条の規則に基づいて定義される“非従業員取締役”である。
給与委員会の主な目的は取締役会の職責を履行し、給与政策、計画と方案を監督し、幹部、取締役及びその他の高級管理者に支払う給与を適宜審査し、確定することである。賠償委員会の具体的な役割は以下のとおりである
| • |
独立取締役会メンバーが役員報酬に関する目標および目的を承認し、これらの目標および目的に基づいて業績を評価することを審査および承認または提案し、雇用、解散費、制御規定の変更およびその他の補償スケジュールを審査および承認すること |
| • |
役員の報酬を審査する |
| • |
株式インセンティブ計画の管理を監督し、贈与と奨励を承認する |
| • |
私たちの株式インセンティブ計画の採択、修正、終了を取締役会に提案します |
| • |
独立した報酬コンサルタント、法律顧問、または委員会の他の顧問を保持する前に、彼らの独立性を評価する |
| • |
法律またはナスダック上場要件の範囲内で、使用補償の開示に関する任意の10-K表の年次報告、登録声明、または委託書における使用補償の開示について検討し、管理層と議論する |
| • |
法律とナスダック上場要求の範囲内で、当社の年間委託書に含まれる役員報酬に関する委員会の報告書を準備し、検討します |
| • |
賠償委員会がこのような調査が適切であると判断した場合、賠償委員会の職責範囲内で賠償委員会に注意を促す任意の事項を調査する |
| • |
賠償委員会の業績とその定款の適切性を審査して評価する。 |
報酬委員会は取締役会が採択した書面規約に基づいて運営されており、この定款は私たちのウェブサイトで調べることができます。URLはWwwv.aravive.comそれは.憲章は賠償委員会の義務の性質と範囲をもっと詳しく説明する。
指名と会社管理委員会
ジャシア博士と何博士は現在指名と会社管理委員会のメンバーを務めており、取締役会は彼らのすべてがナスダックの独立性の定義に基づいて独立していることを確定した。指名とコーポレートガバナンス委員会の具体的な役割には、以下のことが含まれる
| • |
取締役会の選挙人選を確定、評価し、取締役会に推薦し、現取締役の改選について提案する |
| • |
株主が取締役会の指名人選について提出した提案と提案を審議し、そのような提案と提案に関する政策(株主と取締役会とのコミュニケーションを含む)を制定し、そのような株主の提案と提案について取締役会に任意の行動を推薦する |
| • |
取締役会の各委員会委員の人選を確定、評価し、取締役会に推薦する |
| • |
取締役会のパフォーマンスを評価し |
| • |
取締役会に会社の管理原則を制定、推薦し、審査し、そして定期的にこのなどの原則、著者らの商業行為準則とその他の管理原則を審査し、そしてこれについて取締役会に提案を提出する。 |
指名と会社管理委員会は取締役会が採択した書面定款に基づいて運営されており、この定款は私たちのウェブサイトで調べることができます。URLはWwwv.aravive.comそれは.その規約は指名と会社統治委員会の職責の性質と範囲をより詳細に描写する。
関係者取引委員会
ホーネク博士、カークさん、ロジャースさんは現在、関連側取引委員会のメンバーであり、関連側取引委員会の職責は、関連会社と我々の取締役との間のいかなる取引や一連の取引、または取締役の統制または取締役(“関連会社”)と共同で制御する任意のエンティティ間の任意の取引または一連の取引を検討することであり、それらの取引で我々が支払った金額が100万ドルを超える(“取引”)としています。関連側取引委員会は、取引にも関連会社も参加していない取締役のみで構成されている。
特設委員会
2022年7月、我々は特別委員会を設立し、融資取引の条項を交渉し、特別委員会が承認した任意の融資取引を全取締役会に提案する。
取締役会候補者を推薦する手続きを変更する。
ない。
ビジネス行為と道徳的基準
私たちは財務報告を担当する上級職員を含むすべての高級職員、役員、従業員に適用される行動規則を採択した。行為規則全文は本署のウェブサイトに掲載されていますWwwv.aravive.com*行動基準が実質的に修正された場合、または実行者または取締役に行動基準条項の任意の免除が付与された場合、修正または免除の性質は、直ちに当社のウェブサイトで開示されます。
項目11.役員報酬
役員報酬
取引法が公布されたS-K法規第10項によると、私たちは“小さな報告会社”であり、以下の報酬開示は、より小さい報告会社に適用される要件を遵守することを目的としている。規則は私たちの役員報酬計画の詳細を提供することを可能にしているが、報酬委員会は、株主がその役員報酬に関する決定を理解するのを助けるために必要な情報を提供することに取り組んでいる。したがって、本節では、補足説明を含め、私たちが指定した役員の2022年役員報酬計画について説明する。
以下は、2022年12月31日までの年度内の“被指名行政者”です
| • |
ゲイル·マッキントソールCEOです |
| • |
ルディ·ハワード最高財務責任者は |
| • |
レナード·スコット·ドフ最高経営責任者です |
| • |
Vinay Shah,我々の元財務責任者(Shahさんは私たちの最高財務責任者を辞任し、2022年6月2日から発効) |
役員報酬の監督
私たちが任命した役員の報酬は、他の任命された役員について私たちの報酬委員会と最高経営責任者が議論して決定し、承認されました。CEOは彼女自身の報酬に関する議論や決定に参加しません。
私たちの株主のために価値を創造するためには、競争力のある報酬案を提供することで、重要な幹部人材を誘致、激励、維持することが重要だと信じている。そこで私たちが役員報酬計画を設計する目的は
| • |
私たちのビジネス計画を実行するスキルと専門知識を備えた幹部を引きつけ、激励し、維持する |
| • |
長期的な株主価値の創出に一致する行動を公平に奨励する幹部は、時間が経つにつれて、 |
| • |
私たちの役員の利益を私たちの株主の利益と一致させる |
| • |
競争の激しい生命科学市場の中で、才能のある個人に競争力、合理的、公平な報酬プランを提供する。 |
報酬委員会は、報酬委員会によって採用され、報酬委員会に直接報告された独立した報酬コンサルタントのサービスを利用して、報酬委員会の関連市場や業界やり方の評価について報酬委員会に追加的な外部視点を提供する。2021年末、報酬委員会はKorn Ferryを招聘し、第三者報酬コンサルタントとして、報酬委員会が2022年の全体報酬レベルを決定することに協力する。Korn Ferryは適切な同業者群、役員報酬及び生命科学業界の報酬傾向などについて分析し、提案を提供した。同世代グループはKorn Ferryによって推薦され、2021年末に報酬委員会によって以下のパラメータに基づいて選択された:腫瘍学製品を開発している生物製薬会社、類似の開発段階(第1段階または第2段階臨床試験)を有する先行製品、および他の適切な財務および組織指標。
報酬総額表
次の表は、2022年12月31日と2021年12月31日までの会計年度について、役員が取得した報酬または取得報酬を指定しています。
| 非持分 |
||||||||||||||||||||||
| 激励する |
||||||||||||||||||||||
| 選択権 |
平面図 |
他のすべての |
||||||||||||||||||||
| 賞.賞 |
補償する |
補償する |
合計する |
|||||||||||||||||||
| 名称と主要ポスト |
年.年 |
給料(元) |
($) (1) |
($) (2) |
($) (3) |
($) |
||||||||||||||||
| ゲイル·マッキントソール(4) |
||||||||||||||||||||||
| 最高経営責任者 |
2022 |
510,000 |
776,645 |
267,750 |
26,244 |
1,580,639 |
||||||||||||||||
| 2021 |
500,000 | 824,291 | 187,500 | 12,202 | 1,523,993 | |||||||||||||||||
| ルディ·ハワード(5) |
||||||||||||||||||||||
| 首席財務官 |
2022 |
227,624 |
298,613 |
96,358 |
9,889 |
632,484 |
||||||||||||||||
| 2021 |
— | — | — | — | — | |||||||||||||||||
| レナード·スコット·ドフ(6) |
||||||||||||||||||||||
| 首席運営官 |
2022 |
300,781 |
321,580 |
126,702 |
6,947 |
756,010 |
||||||||||||||||
| 2021 |
— | — | — | — | — | |||||||||||||||||
| ウィネ·シャア(7) |
||||||||||||||||||||||
| 元首席財務官 |
2022 |
308,922 |
455,966 |
— |
217,226 |
982,114 |
||||||||||||||||
| 2021 |
370,800 | 299,742 | 111,240 | 14,464 | 796,246 | |||||||||||||||||
| (1) |
米国証券取引委員会規則によれば、この欄は、財務会計基準委員会会計基準がまとめた株式報酬取引に関する第718号主題(ASC 718)に基づいて計算されるそれぞれの会計年度内に付与または修正された株式およびオプション報酬の合計公正価値を反映する。この等金額を定める際に用いられる推定値の仮定は,本年度報告10−K表の他の部分の総合財務諸表付記2および付記9に記載されている。 |
| (2) |
非持分インセンティブ報酬計画欄に報告されている金額は、取締役会報酬委員会が決定した本年度の企業目標達成に応じて得られた報酬であり、2023年および2022年第1四半期に支払われる。 |
| (3) |
他のすべての補償は、主に私たちが支払った生命保険支払いと雇用主が私たち401(K)計画の支払いを一致させることを含む。 |
| (4) |
McIntyre博士は2019年2月12日に私たちの首席科学者となり、2020年4月8日まで私たちのCEOになりました。 |
| (5) |
ハワードさんは2022年6月3日に当社の最高財務責任者になります。 |
| (6) |
ドルフ博士は2022年3月21日に私たちの首席運営官となりました。 |
| (7) |
Mr.Shahは2022年6月2日から首席財務官を辞任。2022年の間、Mr.Shahの他の報酬には、相談費、コブラ精算、生命保険賠償が含まれている。 |
報酬送金表の説明
2022年、私たちが任命された役員に提供する役員報酬計画の3つの主要な構成要素は、基本給、年間業績ボーナス、長期持分報酬です。基本給は、仕事の職責を履行するために固定額の現金を提供することで財務的安定と保障を提供する。年間業績ボーナスと長期配当インセンティブ報酬は、特定の戦略目標の達成を奨励することを目的としており、これらの目標は、私たちの業務戦略を推進し、株主のための長期的な価値を創出すると信じています。
私たちの高素質の幹部チームを誘致、激励、維持する目標と一致し、私たちの役員報酬計画は業績に応じて報酬を支払うことを目的としている。私たちは報酬要素を利用して、私たちが任命された役員の利益を私たちの株主の利益と意味的に一致させ、長期的な価値を創造する。したがって、私たちのCEOや他の役員の報酬の大部分は“リスク”であり、業績に基づく報酬は、次の表に示すように、長期配当報酬と年間現金報酬の形で、測定可能な会社の指標に達したときにのみ稼ぐことができます。
| 年に1回 |
||||||||||||
| 目標現金 | ||||||||||||
| 名前.名前 |
据え置き |
“危険な状況にある” |
激励賞 |
持分激励 |
||||||||
| ゲイル·マッキントソール |
33 | % | 67 | % | 17 | % | 50 | % | ||||
| ルディ·ハワード |
46 | % | 54 | % | 19 | % | 35 | % | ||||
| レナード·スコット·ドフ |
45 | % | 55 | % | 18 | % | 37 | % | ||||
| ウィネ·シャア(1) |
39 | % | 61 | % | 15 | % | 46 | % | ||||
| (1) |
Mr.Shahは最高財務官を辞任し、2022年6月2日から発効した。 |
私たちは、賃金、年間目標現金奨励、株式贈与、短期と長期報酬の間、または現金と非現金報酬の間での報酬の分配に関する正式な政策は何もない。逆に、報酬委員会は、その判断に基づいて、任命された各役員の総報酬計画を決定し、取締役会が現在、短期、長期的な奨励的報酬の組み合わせを承認することを提案し、この組み合わせは、当社の役員報酬計画の目標および当社の目標を達成するのに適していると考えられる。
年間基本給
2022年1月、給与委員会は、私たちが任命した役員の基本給、輝かしい国際市場データ、各役員の職責範囲、各役員の以前の経験、内部報酬を審査しました。このような審査を経て、マッキンドール博士の年間基本給は50万ドルから51万ドルに引き上げられ、Mr.Shahの年間基本給は37.08万ドルから381,924ドルに引き上げられた。2022年2月、私たちは道夫博士と採用書を締結し、2022年3月25日から私たちの最高経営責任者を務め、年間基本給は385,000ドルです。2022年6月、Mr.Shahは私たちの首席財務官を辞め、ハワードさんと採用書を締結し、私たちの最高財務責任者を務め、年間基本給は395,000ドルです。マッキントスタン博士の年間基本給は2023年2月に56万ドルに引き上げられ、ハワードさん博士の年間基本給は412,775ドルに引き上げられ、ドーフェン博士の年間基本給は40.5万ドルに引き上げられました。給与委員会で承認された2022年の年間基本給は以下の通りです
| 2022年基礎 |
||||
| 名前.名前 |
給料(元) |
|||
| ゲイル·マッキントソール |
510,000 | |||
| ルディ·ハワード |
395,000 | |||
| レナード·スコット·ドフ |
385,000 | |||
| ウィネ·シャア(1) |
381,924 | |||
| (1) |
Mr.Shahは最高財務官を辞任し、2022年6月2日から発効した。 |
年間現金奨励(業績奨励)機会
基本給に加えて、任命された役員には、既定の年間企業業績目標を達成するために、任命された役員に適切なインセンティブを提供し、これらの目標を達成するために、役員個人の業績を奨励する資格があります。各実行幹事が取得する資格のある年間業績奨励は、基本賃金の割合として個人の目標に応じて奨励される。給与委員会が提案したある会社の業績目標の実現状況によると、役員の業績ボーナス(あれば)の金額は毎年異なる可能性があり、関連年度の開始前または直後に毎年指定された役員に伝えられている。
会社目標は通常、私たちの年間目標や各種業務達成に関連しており、これらの目標は私たちの全体的な戦略目標によって変化します。私たちの全体的な戦略目標および報酬委員会と取締役会がどのような目標が私たちの業績に与える影響がより大きいかという主観的な決定によると、各目標の割合の重点は時間とともに変化する可能性がある。
彼らの雇用協定や招聘書によると、指名された実行幹事ごとに2022年の目標奨励を受ける資格があり、報酬額は以下のように基給の一パーセントである。
| 目標激励賞 |
||||
| 名前.名前 |
パーセント |
|||
| ゲイル·マッキントソール |
50 | % | ||
| ルディ·ハワード |
40 | % | ||
| レナード·スコット·ドフ |
40 | % | ||
| ウィネ·シャア(1) |
40 | % | ||
| (1) |
Mr.Shahは最高財務官を辞任し、2022年6月2日から発効した。 |
2022年、会社の目標は主に臨床マイルストーンと融資マイルストーンを含む。精査の結果、給与委員会と取締役会は、105%の企業業績目標を達成したため、業績ベースのインセンティブ報酬は105%の目標機会に基づいて支払われたと結論した。
2022年実績に基づく賞
年末後、給与委員会は経営陣の審査と提案に基づいて会社の目標の達成度を承認するが、私たちの役員は自分の業績について提案しない。したがって、どんな報酬を与えるかどうかは報酬委員会によって適宜決定される。ボーナスとボーナスを支払う前に、ボーナスを獲得したり、付与したりしない。戦略目標の達成度を決定する際には、報酬委員会は、達成されている目標の実行可能性をめぐる場合のような、業績期間の開始時に考慮されていない重大な企業イベントや他の重大な成果も考慮する。
2023年2月、我々の報酬委員会と取締役会は、2022年の具体的な目標の実現度に基づいて、2022年の業績に関する以下の2022年業績インセンティブ奨励を承認した。
| 名前.名前 | 基本給 | 基本給の目標パーセント | 目標を達成する割合 | パフォーマンスに基づくインセンティブ支出 |
| ゲイル·マッキントソール | $510,000 | 50% | 105% | $267,750 |
| ルディ·ハワード | $395,000 | 40% | 105% | $96,358 |
| レナード·スコット·ドフ | $385,000 | 40% | 105% | $126,702 |
| ウィネ·シャア | $381,924 | 40% | 0% (1) | $0 (1) |
| (1) |
奨励金を付与して支払う前に、奨励金を受けたり付与したりしないだろう。従業員が2022年インセンティブ賞を授与し、支払う前に辞任するため、Aravive,Inc.は2022年以内に従業員雇用に関連するインセンティブ賞を受賞、付与、または支払いしない。 |
長期奨励的報酬
株式インセンティブは私たちの役員報酬計画の重要な構成要素であり、給与委員会は、インセンティブを私たちの普通株の切り上げと結びつけることで、役員を激励することで私たちの業務目標を実現すると考えている。2022年の間、私たちは株式オプションの形で株式奨励を付与し、奨励期間は4年とした。私たちの長期持分インセンティブ奨励は、私たちが指定した役員と他の従業員、非従業員取締役、コンサルタントの利益を私たちの株主の利益と一致させることを目的としています。奨励は持続的なサービスに基づいているため、私たちの持分激励はまた奨励の許可期間内に私たちが任命された幹部を保留することを奨励する。
私たちは、私たちが指定した役員の長期報酬を行うための主なインセンティブとして株式オプションを使用します。彼らは、株式オプションの行権価格に対して私たちの株価が上昇した場合にのみ、株式オプションから利益を得ることができるからです。私たちは通常、私たちの給与委員会が適切なものを決定するために、私たちの指定された役員の雇用開始に関する初期贈与を提供する。私たちはまた毎年終わった直後に年間補助金を提供する。
2022年1月、報酬委員会は、2021年の会社の目標を取締役会で審査するとともに、任命した役員に株式オプションを付与した。McIntyre博士は株式オプションを取得し、1株2.18ドルの取引価格で425,000株を購入した。Mr.Shahは株式オプションを付与され,1株2.18ドルの発行価格で175,000株を購入した。
2022年3月、Dove博士は私たちの首席運営官に任命された後、1株1.89ドルの発行価格で20万株を購入する株式オプションを獲得した。
2022年6月、ハワードさんは私たちの最高財務責任者に任命され、株価オプションを付与され、1株1.21ドルの行相場で29万株を購入した。2022年6月に首席財務官を辞任した後、Aravive,Inc.とMr.Shahが2022年6月2日に締結した分離協定条項により、Mr.Shah購入合計403,207株の未返済オプションの授与が加速し、すべてのこのような奨励は2022年6月2日にすべて授与された。
2023年1月、報酬委員会は承認され、2023年2月、取締役会は2022年の会社目標を審査するとともに、任命した役員に株式オプションを付与した。McIntyre博士は株式オプションを付与され、1株1.67ドルの取引価格で70万株を購入した。ハワードとドフはそれぞれ1株1.67ドルの行権価格で40万株を購入した株式オプションを獲得した。
その他の補償
従業員福祉計画
私たちが指定した役員は、私たちの医療、歯科、視力、団体生命保険、事故死と肢解保険計画を含む私たちの従業員福祉計画に参加する資格があり、いずれの場合も、他のすべての従業員と同じように参加することができます。私たちは、私たちが指定した幹部を含めて、私たちの合格従業員に利益をもたらすために401(K)計画を維持し、以下の節で“401(K)計画”と題する
401(K)計画
私たちの指定された管理職を含むすべての従業員は、401(K)計画に参加する資格があり、1986年に改正された“国内所得法”(以下“規則”と略す)第401(A)節に基づいて設立された退職貯蓄固定供出計画である。私たちの401(K)計画によると、従業員は、2022年法定の年間上限19,500ドル(50歳以上の従業員は6,500ドル以下の追加延期賃金を得ることができる)まで、税引前に条件を満たした報酬を計画に延期することを選択し、この減額額を401(K)計画に貢献することができる。一般に、401(K)計画の場合、資格に適合する補償は、従業員の賃金、賃金、専門サービス料、および私たちの雇用中に実際に提供される個人サービスによって徴収される他のお金を含み、これらが総収入に含まれ、規則によって要求されるいくつかの調整および除外された規定によって制限される限り、他のお金が含まれる。401(K)計画は現在、私たちの証券に投資する能力を提供していません。
私たちは指定された幹部が私たちが始めた合格または非合格の固定収益計画、非合格の固定拠出計画、または年金計画に参加しておらず、口座残高もない。
年金福祉
私たちはどんな年金福祉計画も維持しない。
非限定延期補償
私たちは不合格な繰延賃金計画を維持しない。
採用通知書、解散費、規制手配の変更
私たちは私たちが任命したすべての幹部と採用招待状を締結した。招聘状には、初期年度の基本給、目標ボーナス機会、株式補償、解散費福祉、および私たちの従業員の福祉計画と計画に参加する資格を含む雇用条項と条件が記載されている。基本給の増加のような未来の賃金を持続的に増加させる保証はない。招待状の有効期限は無期限で、どちらか一方で終了することができ、理由の有無にかかわらず、事前に通知する必要はない。私たちの任命されたすべての幹部は、私たちの標準的な固有情報と発明協定を実行することを要求された。これらの招聘状の具体的な条項は以下のように要約される。これらの要約は,証拠品としてアーカイブされた招待状の実際のテキストを参照することで全文を限定している.
ゲイル·マッキントソール
2020年4月8日から、彼女が最高経営責任者に任命された後、2017年に締結され、2019年と2020年に改訂されたアラヴィ生物会社と締結された招聘書の代わりに、マッキン太爾博士の招聘状(以下、マッキン太爾招聘書)について改正案(2020年改正案)を締結した。2020年改正案では、マッキン太博士が総裁と最高経営責任者を務めることが規定されている。改正案は、2020年には、他の事項を除いて、このようなサービスの年間基本給は415,000ドルと規定されている。2021年1月に50万ドル、2022年1月に51万ドル、2023年2月に56万ドルに増加。(Iii)McIntyre博士年度基本給の45%に相当する目標ボーナスは、2021年1月に50%に増加する。(Iv)最大12ヶ月の賃金更新とコブラ保険の補償は、会社の目標の実現状況に応じて、原因や永久障害以外の任意の理由(このような用語は採用状に定義されている)や統制権の変更(この用語は採用状で定義されている)とは無関係に、その年末目標ボーナスの比例部分を比例的に支払う。マッキントッシュ博士は4年以内に月ごとに8万株の普通株を購入する選択権も獲得した。
2022年1月24日、マッキンドール博士は1株2.18ドルの使用価格で42.5万株の私たちの普通株を購入する選択権を獲得し、4年以内に月に比例して付与した。2023年2月、マッキンドール博士はまた、1株1.67ドルの使用価格で700,000株の普通株を購入する選択権を獲得し、3年以内に帰属し、そのうちの50%は授与日1周年の時に帰属し、残りの50%は授与日1周年後の2年間に月に比例して帰属する。
ルディ·ハワード
ハワードさんと2022年6月2日に当社が締結した招聘状(“ハワード招聘状”)の規定によると、ハワードさんは、(I)年間基本給395,000ドル、2023年2月より412,775ドルへの増給、(Ii)年間情状酌量金、(I)会社の執行議長が策定し、取締役会で承認された客観的かつ主観的な基準に達するか否かに応じて、基本給の40%を目標とする年間適宜配当金(Iii)29万株の普通株式を購入するオプション;及び(Iv)時々発効する可能性のある福祉計画の条項及び条件に基づいて、その医療、歯科及び401(K)計画を含む会社後援のいくつかの福祉に参加する資格がある。株式購入の行使価格は、授出日の普通株式の公平な時価に等しく、授出後10年以内に、以下のように帰属する:購入株式の制限を受けた25%の株式は、授出日から12ヶ月後に帰属し、購入株式の制約を受けた残りの75%の株式は、授出日の1周年後の36ヶ月以内に月額で帰属するが、ハワードさんによって引き続き当社にサービスを提供しなければならない。ハワードさんに提供されるすべての補償には適用される源泉徴収税がかかります。ハワードさんは2023年2月にも、1株当たり1.67ドルで400,000株の普通株式を購入し、授出日の1周年から2年間の期間内に、授出日の翌月から2年間の期間内に、50%および残りの50%の割合で帰属する選択権を授与する。
他の理由や永続的障害によって終了するのではなく、他の理由によってハワードさんが終了し、統制権の変更(招聘状参照)に関係なく終了した場合、ハワードさんは、(I)最大12ヶ月の基本給の継続、(Ii)コブラ保険の精算、(Iii)12ヶ月間のハワードさんの株式オプションの付与加速、および(Iv)終了後最大12ヶ月の既存株式の行使を含む、いくつかの散逸料の給付を受ける資格がある。
支配権変更により解雇された場合、解散費福祉は、当社のある条件に適合する上級管理者や従業員に特定の解散費給付を提供する2019年の持分インセンティブ計画および会社支配権変更サービス計画で指定された福祉となります。また、支配権変更が終了した日から12ヶ月以内に、吾等が任意の原因又は永久障害以外の理由でその採用を終了した場合、すべての非帰属持分報酬は直ちに帰属するが、いくつかの制限を受けなければならない。また、2019年の持分インセンティブ計画によると、ハワードさんが特定の企業の取引(支配権変更を含む)によって自発的に終了した場合、ハワードさんは、その未償還株式オプションの付与を全面的に加速する資格があります。
スコット·ドフ
Dove博士と締結された2022年3月21日に施行された招聘状条項によると、Dove博士が私たちの首席運営官として提供するサービスの報酬には、(I)年間基本給385,000ドル、2023年2月に405,000ドルに増加する(Ii)年間基本給の40%(2022年勤務日数の割合)を目標とした年間インセンティブと留任ボーナスを得る資格があり、会社取締役会が決定した会社や個人目標の表現に依存する。(Iii)200,000株の私たちの普通株の選択権を購入します。授与された購入権行使価格は授出日の普通株の公平な市価に等しく、授出後10年で満了し、以下のように帰属する:購入株式規約の25%の株式は授出日から12ヶ月後に帰属し、購入株式規限の残りの75%の株式は授出1周年後の今後36ヶ月は月などの額で帰属するが、Dove博士は引き続き吾などにサービスを提供しなければならない。Dove博士に提供されたすべての補償は適用された源泉徴収税を払わなければならない。ドフィンの招聘状にはまた従業員秘密情報と発明分配協定が含まれている。ハワードさんは2023年2月にも、1株当たり1.67ドルで400,000株の普通株式を購入し、授出日の1周年から2年間の期間内に、授出日の翌月から2年間の期間内に、50%および残りの50%の割合で帰属する選択権を授与する。
支配権変更により解雇された場合、解散費福祉は、当社の特定の資格を有する上級管理者や従業員に特定の解散費給付を提供する2019年の持分インセンティブ計画および会社支配権変更サービス計画で指定された福祉となります。また、支配権変更が終了した日から12ヶ月以内に、吾等が任意の原因又は永久障害以外の理由でその採用を終了した場合、すべての非帰属持分報酬は直ちに帰属するが、いくつかの制限を受けなければならない。また、2019年の持分インセンティブ計画によると、ハワードさんが特定の企業の持分取引(支配権変更を含む)によって自発的に終了した場合、ハワードさんは、その未償還株式オプションの完全な帰属を加速する資格を有することになります。
ウィネ·シャア
2018年12月31日と2019年12月31日までの年次内に、Aravive Biologicsと2018年5月30日と2019年2月6日に改訂された2017年2月1日に発行された招聘状条項によると、Shahさんの雇用は任意であり、この条項によれば、彼は2019年の年間基本給335,000ドルを取得する権利があり、年間目標ボーナスは基本給の40%であり、特定の解雇が生じた場合、6ヶ月間の解散料を得る権利がある。
2020年3月26日に、我々はShahさんと採用書を締結したり、Aravive Biologics社との招聘状に取って代わって、Shahさんは我々の最高財務責任者を担当し、報酬は基本給360,000ドルを含み、2021年1月は370,800ドルに増加し、2022年1月にはさらに381,924ドルに増加し、目標ボーナスはShahさんの年間基本給の40%に相当することを規定している。また、Shahは、原因または永久障害以外の任意の理由で彼の雇用を終了し、制御権の変更に関係なく、制御権変更に関連する雇用を終了する資格がある場合には、以下の“-終了または制御権変更後の潜在的支払い”の節で説明される何らかの解散費および福祉を得る権利があると契約する
シャアさんは2022年6月2日から最高財務責任者を辞任。2022年6月2日には、Shahさんとコンサルティング契約(“コンサルティング契約”)を締結しており、このプロトコルにより、シャーさんは時々相談サービスを提供することに同意しています。諮問協定の有効期間は事前に終了しない限り4ヶ月です。シャーさんは30日前に書面で会社に通知した後、いつでも理由なく相談を終了することができます。他方が実質的に問合せプロトコルに違反していれば,どちらか一方がただちに問合せプロトコルを終了することができる.
補償として、当社は(I)4ヶ月間の相談期間内に44,557ドルの現金で月賦の支払い;および(Ii)相談期間内にShahさんの支払いを継続しているすべてのコブラの支払いに同意します。
Mr.Shahも当社と離職契約および退職協定(“離職協定”)を締結し、(I)発効日(定義離職契約参照)から9カ月以内に、毎月31,827ドルで、適用された源泉徴収金を差し引いて、Mr.Shahに合計286,443ドルを支払った。(Ii)(A)2022年6月2日(“別居日”)から12(12)ヶ月およびコンサルティング契約日から4ヶ月、または(B)Mr.Shahへの新しい仕事または実質自己雇用の開始;(Iii)より短い者を基準として、購入権を付与すべきすべての株式の付与を加速する。(Iv)Mr.Shahが任意の既存株式を行使する権利を有する期限を(A)株式購入満期日、(B)株式購入譲渡日10周年、(C)分割日から計36(36)ヶ月または(D)制御権が変更される(当社2019年の持分インセンティブ計画の定義参照)(制御権変更取引で負担されない限り)。分割協定には、双方に対する非けなす責任およびMr.Shah側の標準債権解除も含まれている。
終了または統制権変更の際に支払う可能性のある金額
統制権変更に関する解散費を除いて
マッキンドール招聘書は、私たちが原因または永久障害(採用状の定義)以外の任意の理由で、統制権変更に関係なく任意の雇用関係を終了した場合、彼ら(I)が私たちとの雇用を終了した日から60日以内に実行され、撤回されず、(Ii)彼または彼女が所有している私たちのすべての財産を返却した場合、(A)12ヶ月間McIntyre博士に給料を支払い続けて支払いを継続する権利がある(B)もし彼または彼女がCOBRA項の下で医療保険を継続することを選択した場合、私たちは、彼または彼女の毎月のCOBRA保険料の一部(私たちが在職従業員のために支払う同じレート)を支払い、彼または彼女が私たちとの雇用関係を終了した日から12ヶ月以内に(C)彼または彼女の株式オプションとRSUの12ヶ月の付与を加速し、(D)終了後9ヶ月に及ぶ、このオプションに制約された任意の既得株式を行使する。ハワードさんは、そのほかの理由で解雇されたり、永続的に損傷を受けたり、支配権の変更により解雇されたわけではありません(いずれもハワードの定義通り)解雇された場合には、(I)最大12ヶ月の基本給の継続、(Ii)コブラ保険の精算、(Ii)ハワードさんの株式オプションの付与加速、および(Iv)終了後最大12ヶ月の既存株式の行使、および(Iv)終了後最大12ヶ月間の報酬を得る資格があると規定している。
また、支配権変更により終了した場合、解散費福祉は、以下に述べるわが社のいくつかの条件に適合する上級管理者や従業員に特定の解散費給付を提供する2019年の持分インセンティブ計画と、当社支配権変更サービス計画で指定された福祉となります。また、支配権変更が終了した日から12ヶ月の間、吾等が任意の原因又は死亡又は障害以外の任意の理由でその雇用を終了し、又は正当な理由で辞任した場合、すべての非帰属持分報酬は直ちに帰属するが、何らかの制限を受けなければならない。さらに、2019年の持分インセンティブ計画によると、自発的に終了するのではなく、特定の会社の取引(支配権変更を含む)のために終了すれば、マッキントッシュ博士、ハワードさん、ドーフ博士は、株式オプションの未償還およびRSUの完全な加速帰属を取得する資格があります。
統制権離職福祉計画の変更
私たちは統制権を変更する解散費福祉計画(“解散費計画”)を採択した。解散費計画は、私たちが現在雇われている高級管理者を含め、私たちの従業員の一部に解散費と福祉を提供し、解散費計画の定義に基づいて、統制権変更終了後の1年以内に、ある資格に合った雇用を終了した場合、解散費と福祉を得る。以下の要約は,2014年3月10日に米国証券取引委員会に提出されたS-1表の証拠物として提出された解散計画の実際のテキストを参照して限定した
解散費計画によると、参加者が自発的に終了せずに理由(死亡や障害ではない)がない場合、または参加者が正当な理由で辞任した場合(各条項は解散費計画で定義されている)、解散費計画の参加者(I)が私たちとの雇用関係を終了した日から60日以内に執行されてクレームを撤回していない場合、(Ii)私たちのすべての財産を返却すると、毎月の基本給と毎月の年間ボーナス目標の合計に相当する現金解散料を得る権利があり、解散費乗数に乗じて、CEOは15人,他のC-Suite社員(我々が指定した実行者を含む)は12人であった.また,資格の終了後,参加者がCOBRA下の医療保険を継続することをタイムリーに選択した場合,終了日後に指定された数ヶ月以内に毎月のCOBRA保険料の一部を支払う。
(I)適用解散期間の最終日、すなわち行政総裁が15ヶ月、他の幹部は12ヶ月、(Ii)当該株式奨励の元の期限が満了するまで、資格終了解散費計画に適合した日に帰属及び行使可能な株式奨励(株式適用計画の条文を含む)は、未済及び行使可能に維持される。
もし私たちの指名された行政員が支配権変更後12ヶ月以内に資格に適合して雇用関係を終了したため、解散費計画下の解散費福祉を得る権利があれば、その招聘書条項によると、彼は解散費給付を受ける権利がないだろう。
また、解散費計画は、私たちと参加者との間の合意が別途明確に規定されていない限り、参加者が統制権変更によって得られた任意の支払いまたは福祉が“国税法”第280 G条に示される“パラシュート支払い”を構成し、そのような支払いまたは福祉が国税法第4999条に徴収される消費税の影響を受ける場合、そのような支払いまたは福祉は、(I)制御権変更支払いの最大部分に等しくなり、その部分は、支払いまたは福祉の任意の部分消費税納付、または(Ii)最大部分にはならないと規定されている。消費税(いずれも最高適用限界税率で計算される)を含むすべての適用税項目を計上した後、参加者は、金額にかかわらず、税引後に参加者への最大の経済的利益を得るであろう。たとえ全部または一部の支払いまたは福祉が消費税を支払う必要がある場合がある。リストラが必要であれば、リストラは解散費計画に定められた順序で行われる。
財政年度終了時未償還持分奨励
次の表は、2022年12月31日現在の事業年度と、任命された役員が事業年度終了時に持分報酬を返済していないことに関するいくつかの情報を示している。以下に示す報酬は、マッキンゼー博士、ハワードさん、ドーフェン博士、Mr.Shahにそれぞれ付与され、“終了または制御権変更後の潜在的な支払い”などの条件を満たした解雇後に加速的に付与される。Mr.Shahは2022年6月2日から我々の最高財務責任者を辞任して発効する。
未償還持分奨励金は2022年12月31日
| 選択権 |
|||||||||||||||
| 賞.賞(1) |
|||||||||||||||
| 量 |
量 |
||||||||||||||
| 証券 |
証券 |
||||||||||||||
| 潜在的な |
潜在的な |
||||||||||||||
| 体を鍛えていない |
体を鍛えていない |
選択権 |
選択権 |
||||||||||||
| オプション(#) |
オプション(#) |
トレーニングをする |
満期になる |
||||||||||||
| 名前.名前 |
授与日 |
練習可能である |
行使できない |
値段(ドル) |
日取り |
||||||||||
| ゲイル·マッキントソール |
6/15/2017 (3) |
29,641 | — | $ | 0.66 | 6/14/2027 |
|||||||||
| 12/14/2017 (3) |
14,820 | — | $ | 0.90 | 12/13/2027 |
||||||||||
| 3/20/2018 (3) |
14,820 | — | $ | 0.90 | 3/19/2028 |
||||||||||
| 2/28/2019 (2) |
50,791 | 2,209 | $ | 5.83 | 2/27/2029 |
||||||||||
| 1/22/2020 (2) |
35,425 | 13,158 | $ | 10.84 | 1/21/2030 |
||||||||||
| 4/8/2020 (2) |
53,333 | 26,667 | $ | 6.16 | 4/7/2030 |
||||||||||
| 1/25/2021 (2) |
79,062 | 85,938 | $ | 5.95 | 1/24/2031 |
||||||||||
| 1/24/2022 (2) |
97,395 | 327,605 | $ | 2.18 | 1/23/2032 |
||||||||||
| ルディ·ハワード |
6/3/2022 (4) |
— | 290,000 | $ | 1.21 | 6/2/2032 |
|||||||||
| レナード·スコット·ドフ |
3/21/2022 (4) |
— | 200,000 | $ | 1.89 | 3/20/2032 |
|||||||||
| ウィネ·シャア |
10/01/2014 (5) |
19,380 | $ | 0.24 | 9/30/2024 |
||||||||||
| 6/15/2017 (5) |
38,001 | $ | 0.66 | 6/1/2025 |
|||||||||||
| 12/14/2017 (5) |
19,000 | $ | 0.90 | 6/1/2025 |
|||||||||||
| 3/20/2018 (5) |
19,000 | $ | 0.90 | 6/1/2025 |
|||||||||||
| 2/28/2019 (5) |
38,000 | $ | 5.83 | 6/1/2025 |
|||||||||||
| 1/22/2020 (5) |
34,826 | $ | 10.84 | 6/1/2025 |
|||||||||||
| 1/25/2021 (5) |
60,000 | $ | 5.95 | 6/1/2025 |
|||||||||||
| 1/24/2022 (5) |
175,000 | $ | 2.18 | 6/1/2025 |
|||||||||||
| (1) |
別の説明に加えて、すべてのオプションの帰属は、ホーム日が適用される継続サービスを基準とする。 |
| (2) |
1/48これは…。付与された日から、購入持分制約を受けた株式の半分は月ごとに行使することができる。 |
| (3) |
この等買株権規程を受けた株式は合併完了時に全数帰属し、私が合併中に負担する。 |
| (4) | 株式オプション制約を受けた株式は、4年以内に以下のように帰属する:オプション関連株式の25%は、帰属開始日の1年周年に帰属し、その後、毎月1/48%の株式に帰属する。 |
| (5) | すべてのオプションは完全に付与された。2022年6月2日に帰属していないオプションは、2022年6月2日に分離日に直ちに帰属するように改訂され、当該オプションについては、当該オプションを行使する権利は、(A)オプション満了、(B)オプション付与日10周年、(C)分離日から36ヶ月、または(D)制御権変更(当社2019年持分インセンティブ計画の定義参照)が発生した場合(支配権変更取引で仮定されない限り)、早い者を基準とする。 |
2019年に株式奨励の処理を計画
2019年計画では、2019年計画で定義されているある会社の取引が発生した場合、以下の規定は、参加者との間の株式奨励協定または任意の他の書面合意が別途規定されていない限り、または取締役会が株式奨励を付与する際に別途明確に規定されていない限り、未償還株式報酬に適用されると規定されている
既存または買収した会社(またはその親会社)は、2019年計画下の発行済み株式報酬の代わりに、継続、または同様の株式奨励を採用することができ、私たちが保有する任意の買い戻しまたは買い戻し権利は、既存または買収した会社(またはその親会社)に譲渡することができる
完成していない株式報酬が、そのような仮定、継続、または置換ではない範囲内で、その継続サービスは、会社の取引発効時間前に終了していない参加者が所有する任意のそのような株式報酬の帰属および使用可能性(適用される場合)は、その会社の取引の有効性に応じて完全に加速され(会社の取引の有効性に依存して)、その会社の取引の発効時間または前に行使されない場合(適用される場合)、これらの株式報酬は終了し、吾等が保有する任意の買い戻しまたは買い戻し権利は、その会社の取引の有効性に応じて失効する;
未完了株式報酬がこのように仮定されていない、継続または置換されていない範囲内で、持続サービスは、会社の取引発効時間前に終了した参加者が保有する任意の株式報酬の帰属および実行可能性(適用される場合)は加速されず、そのような参加者が所有するすべての非帰属株式報酬が、会社取引の発効時間前に行使されなければ(適用される場合)は終了するが、たとえ会社が取引していても、我々が保有する任意の買い戻しまたは買い戻し権利は継続して行使することができる
株式奨励が会社取引発効時間前に行使されない場合、株式奨励は終了し、取締役会は、株式奨励所有者が株式奨励を行使することができず、取締役会が決定した支払いを得ることができ、その価値は、株式奨励を行使する際に参加者が獲得した財産価値がその所有者を超えた場合に株式奨励金が支払うべき任意の行使価格を行使することに相当する。また、会社取引の最終合意における任意の代行、差し止め、儲け、または同様の条項は、このような支払いに適用することができ、適用範囲および方法は、普通株式保有者に適用されるものと同じである。
株式報酬は、2019年計画で定義されているように、支配権変更時または後に帰属および実行可能性を追加的に加速させることができ、株式報酬の株式報酬プロトコルまたは吾などと参加者との間の任意の他の書面合意は規定されている可能性があるが、このような規定がない場合には、このような加速は発生しない。
2019年計画の場合、会社取引とは、一般に、(1)私たちのすべてまたはほぼすべての資産を売却すること、(2)発行された証券の50%以上を売却または処分すること、(3)合併または合併を完了すること、または(4)合併または合併を完了することであり、私たちは確かに取引で生き残っているが、取引直前に発行された普通株式は、取引によって他の財産に変換または交換される。
2014年に株式奨励の処理を計画
2014年計画では、2014年計画で定義されているある会社の取引が発生した場合、以下の規定は、参加者との間の株式奨励協定または他の書面合意が別途規定されていない限り、または取締役会が株式奨励を付与する際に別途明確に規定されていない限り、未償還株式奨励に適用されると規定されている
既存または買収された会社(またはその親会社)は、2014年計画下で発行された株式報酬の代わりに、引き続き、または同様の株式奨励を採用することができ、私たちが保有する任意の買い戻しまたは買い戻し権利は、既存または買収された会社(またはその親会社)に譲渡することができる;条件は、任意のそのような株式報酬がこのように仮定され、継続または代替される場合、参加者がその会社の取引日または後12ヶ月以内に非自発的終了が発生した場合、そのような仮定、継続、または代替株式の非帰属株式は、終了の日にすべて帰属する
未完了株式報酬が仮定されていない、継続または置換されていない範囲内で、その継続的なサービスが会社の取引発効時間前に終了していない参加者が保有する任意のそのような株式報酬の帰属および行使(適用可能である場合)は、その会社の取引発効時間前の日付まで完全に加速され、会社の取引発効時間または以前に行使されていない(適用される場合)そのような株報酬が終了する場合、これらの株報酬は終了し、吾等が保有する任意の買い戻しまたは買い戻し権利は無効になり、特にその会社の取引の有効性に依存する
未完了株式報酬がこのように仮定されていない、継続または置換されていない範囲内で、持続サービスは、会社の取引発効時間前に終了した参加者が保有する任意の株式報酬の帰属および実行可能性(適用される場合)は加速されず、そのような参加者が所有するすべての非帰属株式報酬が、会社取引の発効時間前に行使されなければ(適用される場合)は終了するが、たとえ会社が取引していても、我々が保有する任意の買い戻しまたは買い戻し権利は継続して行使することができる
株式奨励が会社取引発効時間前に行使されない場合、株式奨励は終了し、取締役会は、株式奨励所有者が株式奨励を行使することができず、取締役会が決定した支払いを得ることができ、その価値は、株式奨励を行使する際に参加者が獲得した財産価値がその所有者を超えた場合に株式奨励金が支払うべき任意の行使価格を行使することに相当する。
株式報酬は、2014年計画で定義されたように、支配権変更時または後に追加的に帰属および行使を加速させることができ、株式報酬の株式報酬プロトコルまたは吾などと参加者との間の任意の他の書面合意は規定される可能性があるが、このような規定がない場合には、そのような加速は発生しない。
2014年計画の場合、非自発的終了とは、一般に、会社の取引終了または統制権変更後12ヶ月以内に、(1)非理由(2014年計画で定義されたように)でサービスを終了すること、または(2)自発的な辞任:参加者の基本給が大幅に減少すること、参加者の権力、職責、職または責任が大幅に減少すること、参加者の主管の権力、職責、職または責任が大幅に減少すること(参加者に会社管理者または従業員に報告することを含む)、直接取締役会に報告することを含む)。参加者が権限を保持する予算における実質的な減少;参加者の主要な勤務先は、会社の取引完了または制御権変更の前に、主要な勤務地から50マイル以上離れた場所に移転するか、または2014年の計画に対する私たちの実質的な違反を構成する他のいかなる行為もしない。
Aravive Biologicsによると、Inc.2010年と2017年の株式インセンティブ計画に基づいて株式オプションを処理する
合併については,Aravive Biologics,Inc.2010年,2017年の持分インセンティブ計画を想定した。Aravive Biologics、Inc.2010年および2017年の株式インセンティブ計画は、計画に定義されたいくつかの会社の取引が発生した場合、取締役会は、株式奨励協定または私たちと参加者との間の任意の他の書面合意が別に規定されていない限り、株式報酬を返済していない場合、以下の1つまたは複数の行動をとることができる。あるいは、取締役会が株式奨励を付与する際に別途明確な規定がない限り、発行された株式報酬は、相続人会社が負担または継続することができ、または同値な株式報酬は、相続人会社によって置換されてもよく、以前の株式奨励に基づいて発行された普通株が保有している任意の買い戻しまたは買い戻し権利は、相続人会社に譲渡することができる。この計画はまた、特定の会社取引が発生した場合、取締役会は、株式報酬の全部または一部の帰属を加速させ、その株報酬が会社の取引前に完全に帰属して行使可能にすることを決定し、株式報酬保有の任意の買い戻しまたは買い戻し権利を無効にするように吾等に手配するか、または現金対価の代わりに株式報酬をキャンセルまたはキャンセルするように手配することができると規定している。会社の取引の前に負担、継続、代替、または行使されなかった任意の報酬は、取引終了時に終了する。Aravive Biologicsによると、Inc.2010年と2017年に株式計画が発表されたすべての合併完了時に返済されていないオプションは、合併完了時に付与されます。
役員報酬
取締役会は、当該等の報酬の額や形式が競争市場のやり方を反映していることを確保するために、非従業員取締役の報酬を随時検討している。2020年1月、取締役会は、当時の取締役報酬政策を評価した報酬委員会の報酬コンサルタントKorn Ferryが用意した競争的市場分析を評価した。この分析は著者らの役員報酬レベル、実践と設計特徴と報酬同業者グループの構成メンバーとの比較を考察し、給与委員会は役員報酬を設定する時に同じ同業者グループを参考にした。この分析と、私たちの財務業績、全体的な市場状況、株主利益の考慮に基づいて、取締役会は当時、私たちの非従業員役員報酬政策を当時の現金と株式報酬レベルに維持することを決定した。これらの給与水準は2020年9月まで維持されており、取締役会は報酬委員会の報酬顧問光輝国際が準備した競争的市場分析を評価し、この分析は私たちの当時の役員報酬政策を評価した。2020年9月には、委員会の年会費は変わらず、非執行年度現金給与は40,000ドルから65,000ドルに増加し、議長が獲得した総報酬上限は70,000ドルから95,000ドルに増加し、年間配当奨励と新たな役員報酬は、7,500株普通株の購入を付与するオプションから、付与日公平時価75,000ドルの普通株式のオプションを付与するために改訂された。2021年と2022年の費用は変わらない。
次の表は、2022年12月31日までの会計年度の、私たちの現職および前任非従業員役員の報酬に関するいくつかの情報を示しています
役員による2022年度の補償
| 稼いだ費用や |
選択権 |
制限株 |
||||||||||||||
| 名前.名前 |
現金払い(ドル) |
賞(元)(1) |
受賞額(ドル) |
合計(ドル) |
||||||||||||
| フレデリック·N·エゼルマン製薬会社ですD(2) |
$ | 95,000 | $ | 75,000 | — | $ | 170,000 | |||||||||
| アマト·ジャシア博士 |
$ | 87,500 | $ | 75,000 | — | $ | 162,500 | |||||||||
| マイケル·W·ロジャース(3) |
$ | 92,500 | $ | 75,000 | — | $ | 167,500 | |||||||||
| エリック·チャン |
$ | 72,500 | $ | 75,000 | — | $ | 147,500 | |||||||||
| ジョン·A.Hohneker医学博士(4) |
$ | 70,000 | $ | 75,000 | — | $ | 145,000 | |||||||||
| 何達輝、M.D.,Ph.D.(4) |
$ | 68,500 | $ | 75,000 | — | $ | 143,500 | |||||||||
| シグッド·C·カーク(4) |
$ | 72,500 | $ | 75,000 | — | $ | 147,500 | |||||||||
| (1) |
米国証券取引委員会規則によれば、この欄は、それぞれの会計年度内に付与されたオプション報酬の合計公正価値を反映しており、これらのオプション報酬は、財務会計基準委員会会計基準編集テーマ718に基づいて株式報酬取引(ASC 718)について計算され、それぞれの付与日までである。この等金額を定める際に用いられる推定値の仮定は,本年度報告10−K表の他の部分の総合財務諸表付記2および付記9に記載されている。 |
| (2) |
エセルマン博士は2020年4月8日に取締役会長に任命され、2022年1月3日まで取締役会執行議長に任命された。 |
| (3) | ロジャーズは2020年9月15日に取締役CEOに任命された。 |
| (4) |
ホーネク博士、何志平博士、カークさん博士は2021年5月12日に役員を任命された。 |
次の表は私たちの現職と前任非従業員取締役の財政年度末に返済されていないオプション報酬の総数を示しています。
| 株式数 |
||||
| 未完成のものに制限される |
||||
| 締め切りのオプション |
||||
| 名前.名前 |
2022年12月31日 |
|||
| フレデリック·エゼルマン製薬会社ですD(1) |
146,630 | |||
| アマト·ジャシア博士(2) |
312,626 | |||
| マイケル·ロジャース(3) |
149,886 | |||
| エリック·チャン |
155,592 | |||
| ジョン·A.Hohneker医学博士(4) |
140,555 | |||
| 何達輝、M.D.,Ph.D.(4) |
140,555 | |||
| シグッド·C·カーク(4) |
140,555 | |||
| (1) |
エセルマン博士は2020年4月8日に取締役会長に任命され、2022年1月3日まで取締役会執行議長に任命された。 |
| (2) |
上取締役のジャシア博士に対する賠償表の金額には,我々が合併中に負担したオプションが含まれており,これらのオプションはAravive Biologicsによって合併前に発表された. |
| (3) | ロジャーズは2020年9月15日に取締役CEOに任命された。 |
| (4) |
Hohneker博士、Ho博士、Kirkさんは2021年5月12日に取締役に任命された。 |
非従業員役員報酬政策
2022年12月31日までの年度内に、我々の非従業員取締役報酬政策に基づいて、各非従業員取締役に現金前払い金を支払い、取締役会と取締役の在任委員会に在任した報酬金とする。すべての委員会の議長はこのようなサービスのために追加的な採用金を受けるだろう。これらの招聘金は、各四半期の最終日に4回に分けて平均的に支払われ、このような支払い金額が取締役会に在任していないどの四半期にも比例して割り当てられることが条件となる。
2022年12月31日までの1年間、非従業員取締役の取締役会サービスと取締役所属各取締役会委員会に支払われるサービス採用費は以下の通り
| 会員年度 |
会長年度 |
|||||||
| サービスロケータ |
サービスロケータ |
|||||||
| サーフボード |
$ | 65,000 | $ | 30,000 | ||||
| 監査委員会 |
$ | 7,500 | $ | 15,000 | ||||
| 報酬委員会 |
$ | 5,000 | $ | 12,500 | ||||
| 指名と会社管理委員会 |
$ | 3,500 | $ | 10,000 | ||||
取締役会は、当該等の報酬の額や形式が競争市場のやり方を反映していることを確保するために、非従業員取締役の報酬を随時検討している。2020年9月、取締役会は報酬委員会の報酬顧問光輝国際が準備した競争的市場分析を評価し、この分析は私たちの当時の役員報酬政策を評価した。この分析は著者らの役員報酬レベル、実践と設計特徴を報酬同業者グループの構成メンバーと比較し、報酬同行グループは著者らが役員報酬を設定する際に参考にした同一行グループであることを考察した。この分析、および我々の財務業績、一般市場状況および株主利益の考慮に基づいて、取締役会は、上述した現金補償および以下に説明する持分補償を提供することを決定した。
各株主年次総会が開催される当日、各非従業員メンバーとして取締役会に勤務し続ける非従業員取締役は、授与日に75,000ドルの公正価値で普通株を買収する選択権を獲得し、毎月1/12を付与し、次の株主年会日に完全に帰属する(完全に帰属していなければ)。このようなオプションの発行価格は付与された日の私たちの普通株の公正な市場価値に等しいだろう。すべての新しい非従業員取締役はまた、付与日に公平価値75,000ドルの普通株式を獲得し、36ヶ月以内に月ごとに付与するための新しい非従業員取締役オプション奨励を付与される。いずれかの新規非従業員取締役が年次株主総会以外の時間に取締役会に加入すれば、新たな非従業員取締役が付与されるほか、これらの取締役は取締役普通株購入の選択権を得ることになる。普通株式権益株式数は(I)授出日公平値75,000ドルの普通株式数と(Ii)分子等しい取締役初当選或いは取締役会メンバーに任命された日と取締役前回年度株主総会日1周年の日との日数、及び(Y)分母は365に等しい。いずれの場合も、報酬の帰属は、各ホーム日における取締役の継続的なサービスを基準とする。この政策は、私たちが合格と経験のある個人を取締役に引き付けることができ、政策条項に基づいて私たちの取締役の利益を私たちの株主の利益と一致させることができるように、全面的な報酬案を提供することを目的としている。2022年9月23日、私たちはエセルマン博士、ジャシア博士、ロジャースさん、Mr.Zhang、何博士、ホネック博士、およびカークさんにそれぞれ97,063株の普通株式を購入するオプションを発行しました。
取締役は取締役会や委員会会議への出席など、取締役としての活動に直接関連した費用精算を継続している。取締役も彼らの賠償協定やわが社の登録証明書や別例の賠償条項による保護を得る権利があります。
第12項:特定の実益所有者と管理職の保証所有権及び関連株主事項。
特定の実益所有者と経営陣の保証所有権
次の表は、2023年3月10日現在の私たちの普通株の実益所有権のいくつかの情報を示しています。具体的には、(I)各取締役、(Ii)概要報酬表で指名された各役員、(Iii)当社の全体としてのすべての役員と取締役、および(Iv)私たちが知っているすべての普通株の5%以上を保有する実益所有者。
| 所有権(1)から利益を得る |
||||||||
| 実益所有者 |
株式数 |
全体のパーセントを占める |
||||||
| 5%以上の株主(役員と取締役を除く): |
||||||||
| EShelman Ventures LLC(2) |
42,684,225 | 55.43 | % | |||||
| Invus Public Equities,L.Pとその付属実体(3) |
6,132,553 | 9.99 | % | |||||
| BVFパートナーに関するエンティティ(4) |
3,908,320 | 6.4 | % | |||||
| ベーカー兄弟コンサルタント会社の付属実体(5) |
4,586,404 | 7.5 | % | |||||
| 指名された行政員や役員: |
||||||||
| フレデリック·N·エゼルマン製薬会社ですD(6) |
42,790,412 | 55.49 | % | |||||
| アマト·ジャシア博士(7) |
1,757,599 | 2.9 | % | |||||
| マイケル·W·ロジャース(8) |
107,361 | * | ||||||
| エリック·チャン(9) |
2,061,989 | 3.4 | % | |||||
| ルディ·ハワード(10) |
21,740 | * | ||||||
| ゲイル·マッキントソール(11) |
558,887 | * | ||||||
| ロバート·B·ゲラー(12) |
— | * | ||||||
| レナード·スコット·ドフ(13) |
54,166 | * | ||||||
| 何俊仁、M.D.,Ph.D.(14) |
204,673 | * | ||||||
| ジョン·A·ホーネク医学博士(15位) |
94,967 | * | ||||||
| シグッド·C·カーク(16) |
94,967 | * | ||||||
| ウィネ·シャア(17) |
594,049 | 1.0 | % | |||||
| すべての現職執行幹事と役員を全体として(11人)(18) |
47,746,761 | 60.2 | % | |||||
| * |
代表実益所有権は発行された普通株式の1%(1%)未満である。 |
| (1) |
本表は、役員、取締役、および主要株主が提供する情報と、米国証券取引委員会に提出された付表13 Dおよび13 Gに基づく。本表の脚注に別途説明があり,適用されるコミュニティ財産法規の制限を受けない限り,本表に示した各株主は実益として示された株式に対して独占投票権および投資権を持つと信じている.適用百分率は2023年3月10日の59,844,850株流通株をもとに、米国証券取引委員会が発表した規則に基づいて調整される。株式の実益所有権は、株式に対する投票権及び投資権を含む米国証券取引委員会規則に基づいて決定される。未償還オプション制限を受けた普通株は、2023年3月10日から60日以内に行使可能であれば、そのようなオプションを持っている人の所有権パーセンテージを計算する際に未償還普通株とみなされる。個人配給その他の融資で発行された引受権証が行使時に発行可能な普通株株式は、当該等株式証を保有する者の所有権パーセンテージを計算する際に発行済み株式とみなされる。別の説明がない限り、次の表に列挙された各受益者の住所は、c/o Aravive,Inc.,River Oaks Tower,3730 Kirby Drive,Suite 1200,Houston,Texas 77098である。 |
| (2) |
EShelman Ventures,LLCの情報は,2022年11月3日に米国証券取引委員会に提出された付表13 D/Aに基づく。(I)EShelman博士の完全所有実体EShelman Ventures,LLCが直接保有する25,517,889株の普通株式と、(Ii)860,216株が3月2日に株式証行使時に発行可能な普通株と、(Iii)16,306,120株が10月承認株式証行使時に発行可能な普通株とを含む。会社の住所はノースカロライナ州ウィルミントン市北三街319号、301号室、郵便番号:28401です。 |
| (3) |
情報はINVUS Public Equities,L.P(INVUS Public Equities),Invus Public Equities Advisors,LLC(INVUS PE Advisors),Artal International S.C.A(“Artal International”),Artal International Management S.A.(“Artal International Management”),Artal Group S.A.(“Artal Group”),Westend S.A.(“Westend”)が2023年2月13日に米国証券取引委員会の付表13 G/Aに提出された。The Invus Public Equitiesは直接4,572,515株の普通株を保有し、10月の株式承認証は7,609,522株の普通株を追加購入することができ、株式証9.99%の実益所有権の制限を受ける。そのため、2022年12月31日に、上記の列名のInvus Public Equities及びその連属実体実益は合計6,132,553株の普通株を持ち、(I)4,572,515株普通株式及び(Ii)1,560,038株はいくつかの10月承認株式証を行使した後に発行することができる。Invus PE AdvisorsはInvus Public Equitiesの一般パートナーとしてInvus Public Equitiesを制御するため,実益がInvus Public Equitiesが保有する普通株式を所有していると見なす可能性がある.Artal Internationalジュネーブ支社はInvus PE Advisorsの管理パートナーとしてInvus PE Advisorsを制御しているため,Invus PE Advisors Artal International ManagementはArtal Internationalの管理パートナーとしてArtal Internationalの普通株式を支配しているとみなされる可能性があるため,Artal Internationalの実益所有株式とみなされる可能性がある.アタル·グループは、アタル国際管理会社の唯一の株主として、アタル国際管理会社を支配しているため、アリババ国際管理会社が実益所有の普通株とみなされる可能性がある。Artal Groupの親会社としてWestendはArtal Groupを制御しているため,実益所有Artal Groupは実益所有の普通株とみなされる可能性がある.Westendの大株主としてStichtingはWestendを制御しているため,実益所有Westendは実益所有の普通株とみなされる可能性がある.ベジェ·さんはStichting取締役会の唯一のメンバーとしてStichtingを制御しているため、Stichtingは実益所有の普通株式とみなされる可能性があります。Invus Public EquitiesとInvus PE Advisorsのアドレスはレキシントン通り750号、30階、New York 10022である。Artal International、Artal International Management、Artal Groupのアドレスと同じであり、WestendのアドレスはValley Park,44,Rue de la Vallée,L-2661,ルクセンブルクである。StichtingのアドレスはClaude Debussylaan,46,1082 MDアムステルダム,オランダである。ヴィトゥクの住所は谷公園、44、Rue de la Vallée、L-2661、ルクセンブルクです。 |
| (4) |
情報は,2023年11月7日にBiotech Value Fund,L.P.(“BVF”),BVF I GP LLC(“BVF GP”),Biotech Value Fund,L.P.(“BVF 2”),BVF II GP LLC(“BVF 2 GP”),BVF Value Trading Fund OS LP(“Trading Fund OS”),BVF Partners OS Ltd.(“Partners OS”),BVF GP Holdings LLC(“BVF GPHH”),BVF PartnL.Pers(“Partners OS”),BVF Voldings LLC(“BVF PartnL.Pers”)に基づく.Mark N.Lampert(“Lampert”)(BVF,BVF GP,BVF 2,BVF 2 GP,Trading Fund OS,Partners OS,BVF GPH,Partners,BVF Inc.とLampertを総称して“BVF関連会社”と呼ぶ).2022年11月7日の営業時間終了時に、(I)BVF実益は3,908,320株の普通株を有し、1,324,744株が保有する複数の10月予備資本権証に関する普通株を含み、複数の10月予備資本権証を含まない1,961,882株の普通株を有し、(Ii)BVF 2実益は1,961,528株の普通株を有し、保有する2,495,477株の普通株を含まない;および(Iii)運営基金OS実益は191,368株の普通株を有し、保有する243,461株を含まない。BVF GPはBVFの通常パートナーとして,実益がBVF実益を持つ3,908,320株の普通株と見なすことができる。BVF 2 GPはBVF 2の通常パートナーとして,BVF 2実益が持つ1,961,528株普通株と見なすことができる.BVF 2パートナーOSは運営基金OSの一般パートナーとして,実益は運営基金OS実益が持つ191,368株普通株を持っていると見なすことができる.BVF GPHはBVF GPおよびBVF 2 GPそれぞれの唯一のメンバとして,BVFおよびBVF 2合実益が持つ5,869,848株の普通株を実益と見なすことができる.パートナーは、BVF、BVF 2、Trading Fund OSの投資マネージャ、およびPartners OSの唯一のメンバーとして、パートナー管理アカウントに保有する47,842株の普通株を含むBVF、BVF 2、Trading Fund OSの共通実益が所有する6,109,058株の普通株式を実益所有し、パートナー管理口座に保有する47,842株の普通株を含むあるパートナー管理口座(“パートナー管理口座”)によって所有されていると見なすことができる。BVF Inc.パートナーである一般パートナーは、実益所有パートナー実益所有の6,109,058株普通株と見なすことができる。取締役およびBVF Inc.の上級管理職として、Lampertさんは、実益所有BVF Inc.実益所有の6,109,058株式普通株式と見なすことができる。10月の事前資本証および10月の引受権証の実益所有権は9.99%に制限され、10月の引受権証の住所はBiotech Value Fund,L.P.,BVF I GP LLC,Biotech Value Fund II,L.P.,BVF II LLC,BVF Holdings LLC,BVF Partners P.,BVF Partners P.,BVF Partners Pこれは…。カリフォルニア州サンフランシスコ、郵便番号:九四四零四。バイオテクノロジー価値取引基金OS LPおよびBVF Partners OS Ltd.のアドレスは、POBox 309 Uland House、Grand Cayman、KY 1-1104である。 |
| (5) |
情報は、ベーカー兄弟コンサルタント株式会社(“コンサルタント”)、ベーカー兄弟コンサルタント(GP)有限責任会社(“コンサルタント”)、フェリックス·J·ベック、ジュリアン·C·ベック(“ベイカー兄弟報告者”と総称する)に基づいて、2023年2月14日に米国証券取引委員会の付表13 Gに提出された。667,L.P.およびBaker Brothers Life Science,L.P.(総称して“基金”と呼ぶ)は、それぞれ447,661株および4,138,743株の普通株を有する。これらの基金はまた10月の引受権証を保有し、合計4586,404株の普通株を購入することができるが、10月の普通株式承認株式証の実益所有権制限は4.99%であり、10月の事前計画権証の実益所有権制限は7.5%である。改訂されたコンサルタント、基金及びそのそれぞれの一般パートナー間の管理協定によれば、基金それぞれの一般パートナーは基金が保有する証券への投資及び投票権のすべての適宜決定権及び権力を放棄するため、コンサルタントは基金に対する投資及び投票権が完全かつ無限の適宜決定権及び権力を有する。コンサルタントGPはこのコンサルタントの唯一の普通のパートナーである。コンサルタントGP,Felix J.Baker,Julian C.BakerはコンサルタントGPの管理メンバーであり,このコンサルタントは基金が直接保有する発行者証券の実益所有者と見なすことができる.ベーカー兄弟報道者の業務住所はニューヨークワシントン通り860号、三階、New York 10014です。 |
| (6) |
106,187株が2023年3月10日から60日以内に行使可能な株式オプションに従って発行可能な普通株、860,216株が3月承認株式証行使時に発行可能な普通株、および16,306,120株が10月承認株式証行使時に発行可能な普通株を含む。 |
| (7) |
合計272,183株が2023年3月10日から60日以内に行使可能な株式オプションに従って発行可能な普通株と、271,768株が10月の株式承認証行使後に発行可能な普通株を含む。 |
| (8) |
2023年3月10日から60日以内に行使可能な株式オプションによって発行可能な普通株式総数107,361株を含む。 |
| (9) |
合計115,149株が2023年3月10日から60日以内に行使可能な株式オプションに従って発行可能な普通株と、543,537株が10月の株式承認証行使後に発行可能な普通株を含む。 |
| (10) |
2023年3月10日から60日以内に行使可能な株式オプションによって発行可能な普通株総数が0株と、10月の株式承認証行使時に発行可能な普通株10,870株を含む。 |
| (11) |
2023年3月10日から60日以内に行使可能な株式オプションによって発行可能な439,044株普通株と、10月の株式承認証行使後に発行可能な54,353株普通株を含む。 |
| (12) |
2023年3月10日から60日以内に行使可能な株式オプションを含めて発行可能な普通株式総数は0株である。 |
| (13) |
合計54,166株の普通株を含み、2023年3月10日から60日以内に行使可能な株式オプションにより発行可能である。 |
| (14) |
合計94,967株が2023年3月10日から60日以内に行使可能な株式オプションに従って発行可能な普通株と、54,353株が10月の株式承認証行使後に発行可能な普通株を含む。 |
| (15) |
2023年3月10日から60日以内に行使可能な株式オプションによって発行可能な普通株式総数94,967株を含む。 |
| (16) |
2023年3月10日から60日以内に行使可能な株式オプションによって発行可能な普通株式総数94,967株を含む。 |
| (17) |
合計403,207株の普通株を含み,2023年3月10日から60日以内に行使可能な株式オプションにより発行可能である. |
| (18) |
役員および現行政員が保有する28,266,553株,2023年3月10日から60日以内に行使可能な株式総数1,378,991株と,3月および10月の株式承認証行使後に発行可能な普通株18,101,217株を含む。 |
次の表は、2014年計画、2019年計画、2014年計画、2014年従業員株式購入計画を含む、2022年12月31日までに、我々の既存の株式補償計画に基づいて発行可能な普通株株式の情報を示している。私たちは株主の承認されていない株式激励計画を維持しない。
株式報酬計画情報
| 証券数量 |
||||||||||||
| 使えるようにする |
||||||||||||
| 未来の発行に使う |
||||||||||||
| 権益の下で |
||||||||||||
| 証券数量 |
報酬計画 |
|||||||||||
| 以下の期日に発送します |
加重平均 |
(証券は除く) |
||||||||||
| 演習をする |
行権価格 |
反映されています |
||||||||||
| 卓越した |
卓越した |
(A)欄) |
||||||||||
| 計画種別 |
代替案(A) |
代替案(B) |
(c) |
|||||||||
| 証券保有者が承認した持分補償計画(1) |
||||||||||||
| 2014持分インセンティブ計画 |
120,091 | $ | 5.26 | — | ||||||||
| 2014年度従業員株購入計画 |
— | — | 327,496 | |||||||||
| 2019年持分インセンティブ計画 |
3,621,973 | $ | 2.89 | 673,591 | ||||||||
| 合計する |
3,742,064 | $ | 2.97 | 1,001,087 | ||||||||
| (1) |
この表は,我々が合併で想定しているAravive Biologics,Inc.2010年持分インセンティブ計画およびAravive Biologics,Inc.2017持分インセンティブ計画下での持分奨励情報を提供しない。2022年12月31日現在、私たちの追加の828,368株普通株は、合併で負担される発行済みオプションの制約を受けている。 |
項13.特定の関係および関連取引、ならびに取締役の独立性
関係者との取引
関連者取引政策と手続き
2014年、私たちは書面による関係者取引政策を採択し、“関連者取引”を識別、審査、考慮、承認または承認する上での政策と手順を述べた。私たちの政策だけで言えば、“関連者取引”とは、100,000ドルを超える金額を含む私たちが任意の“関連者”と参加する取引、手配、または関係(または任意の一連の類似した取引、手配、または関係)を意味する。従業員、取締役、コンサルタント、または関係者として同様の身分で提供されているサービスを補償することに関する取引は、本保険書のカバー範囲内ではありません。関係者とは、当社の任意の直系親族、およびその人によって所有または制御されている任意のエンティティを含む、当社の任意の役員、取締役、または5%を超える株主を意味する。
この政策によれば、ある取引が関連者取引として決定された場合、管理層は、審議および承認または承認のために、提案された関連者取引に関する情報を監査委員会に提出しなければならない(または、監査委員会の承認が適切でない場合は、理事会の別の独立機関に提出しなければならない)。陳述には、重要な事実、関係者の直接的かつ間接的な利益、取引が私たちにもたらす利益、および代替取引があるかどうかの説明が含まれなければならない。関連者取引を事前に識別するために、私たちはその役員、取締役、いくつかの重要株主が提供する情報に依存します。関係者の取引を考慮する際には、審査委員会は、(I)吾等に対して構成されるリスク、コスト及び利益を含むが、限定されないが、(Ii)関係者が取締役、取締役の直系親族又は取締役に関連する実体の直系親族である場合、取締役独立性への影響、(Iii)取引の条項、(Iv)他のソースが類似したサービス又は製品を提供するか否か、及び(V)類似サービス又は製品の他の出所があるか否か、及び(V)無関係な第三者又は一般従業員に提供する条項を含む既存の関連事実及び状況を考慮する。取締役が提案された取引と利害関係があれば、取締役は審議と承認を回避しなければならない。この政策では,関係者の取引を承認,承認または拒否するか否かを決定する際には,監査委員会は既知の状況に応じて,監査委員会がその適宜決定権を誠実に行使して決定されたように,その取引が吾等及び吾等の株主の最適な利益に適合しているかどうかを考慮しなければならない。
さらに、我々の会社と取締役または取締役によって制御されているか、または取締役(関連会社)と共同で制御する任意のエンティティとの間の任意の取引または一連の取引を検討するための関連側取引委員会を設立し、これらの取引において100,000ドルを超える金額を支払うか受け取る(“取引”)。関連側取引委員会は、取引にも関連会社も参加していない取締役のみで構成されている。
ある関係者が取引して
以下は、2021年1月1日以降の取引の概要と、現在提案されているすべての取引についてです
| • |
12万ドル以上の金額になります |
| • |
それぞれの株式の5%以上を保有する任意の役員、役員または所有者、または上記の者の任意の直系親族は、かつて、または“行政職報酬”および“役員報酬”以外の直接的または間接的な重大な利益を有することになる。 |
2020年12月31日、Tabibiazar博士と諮問協定(“諮問協定”)を締結し、この協定に基づき、Tabibiazar博士は時々相談サービスを提供することに同意した。相談契約の期限は1年であり,早期終了しない限り,連続1年の期限(“期限”)を自動的に更新する.諮問協定は、いずれか一方が15(15)日の書面通知後にいつでも終了することができる。補償として、(1)Tabibiazar博士または我々が諮問協定を終了した1年後および(2)適用奨励協定に規定されたオプションの満了の最終日まで、各オプションの行使可能日を延長するために、Tabibiazar博士が当社の株式補償計画に基づいて発行するオプション付与条項を修正することに同意する。さらに、Tabibiazar博士は、(A)私たちの任意の証券を売却、売却、質権、または他の方法で譲渡または処分すること、または私たちの普通株または実行可能または私たちの普通株のために交換可能な証券に変換することができ、(B)私たちの普通株式所有権を移転する任意の経済的利益またはリスクを達成する任意の経済的利益またはリスクのスワップまたは他の派生取引を達成すること、または(C)2021年4月5日までに、彼が上記の任意のことをすることを意図していることを開示することに同意する。
2021年2月12日、私たちはEShelman Venturesと購入契約を締結し、1株7.29ドルで2,875,000株の会社普通株を発行·販売することに関連した。今回の発行は2021年2月18日に終了し,今回の発行から合計約2100万ドルの毛収入を得た。
202年1月、私たちはEShelman Venturesと投資協定を締結し、事前融資承認株式証を発行し、1株2.2ドルの価格で最大4,545,455株の会社の普通株を購入し、1株当たり額面0.0001ドルで、これは私たちの普通株が2021年12月31日のナスダックでの合併終値であり、総購入価格は1,000万ドルである。また、再販株式の登録と事前融資権証の基礎となる普通株の発行に同意し、登録声明は2022年1月18日に発効することを発表した
2022年3月、私たちは機関投資家と証券購入協定を締結した。今回の発行では、EShelman Venturesと証券購入協定を締結し、この合意に基づいて、EShelman Venturesに株式を発行し、ナスダック株式市場規則に適合する登録直接発行定価(I)860、216株の普通株、1株当たり額面0.0001ドル、および(Ii)5年承認株式証で、最大860,216株の追加普通株を購入する。普通株1株と付帯株式証の合計買い取り価格は1株2.325ドルであった。株式付株式証の発行権価格は2.20ドルで、これは私たちの普通株の2021年12月31日のナスダックでの合併終値です。EShelman Venturesと合意したこの証券購入合意の総収益は200万ドルです。
2022年10月24日、吾らは私募取引(“10月私募”)を行い、数機関と投資家(“投資家”)及びEShelman Ventures,LLC(“EShelman Ventures”)及びDr.Giaccia博士及びDr.McIntyreと証券購入協定(“10月購入協定”)を締結した。何博士、ハワードさん、張さん(“インサイダー取引家”および“インサイダー投資家”)によると、吾らはEShelman Ventures、Giaccia博士、McIntyre博士に書簡を送った。何博士および張さんは、16,306,120,271,768,54,353,54,353,10,870および543,537株式会社の普通株式および付随するAシリーズ承認株式証(“Aシリーズ承認株式証”)およびBシリーズ承認株式証(“Bシリーズ承認株式証”と共に、Aシリーズ承認株式証、“株式承認証”)と共に16,306,120,271,768,54,353,54,353,10,870および543,537株式を購入する。普通株1株とセット株式承認証の合計買い取り価格は0.9199ドルであった。権証の1株当たりの権益は0.7949ドル。内部投資家に売却された1株当たりの価格と付随する権証部分は、ナスダック世界ベスト市場2022年10月24日に報告された総合終値に基づいている。前回報告された普通株のナスダック全世界精選市場における終値は2022年10月24日であり、ナスダック全世界精選市場で報告された合併終値は2022年10月24日であり、これは同じ価格(0.7949ドル)である。
10月の私募については、吾らはインサイダー投資家と登録権協定(“登録権協定”)を締結し、この合意に基づき、吾らは転売株式の登録及び株式承認証の発行に関する普通株株式の登録に同意し、この登録声明は二零二二年十一月二十八日に発効を宣言した
2021年1月1日以来、上記取引、“行政者報酬”及び“役員報酬”の項に記載された報酬スケジュール、及び取締役及び行政人員と以下の標準フォーマットの補償協定を締結する以外に、他の取引はなく、提案中の取引関連金額が120,000ドルを超えることもないが、吾等又は吾等の任意の付属会社はかつて又は参加することができ、任意の取締役、取締役が著名人、行政職、当社の5%以上の株式を所有している者、又は任意の直系親族又はこれらの者と一緒に住んでいる者である。直接的または間接的な物質的利益がある(またはあるだろう)。
賠償協定
私たちが改訂して再記述した会社登録証明書には取締役責任を制限する条項が含まれており、私たちはデラウェア州の法律で許可されたすべての取締役を最大限賠償する定款規定を改正し、再記載します。当社の会社登録証明書の改訂及び再記載の定款は、取締役会が適切に決定した場合に、上級管理者及び従業員を適宜賠償する権限を取締役会にも付与します。また、私たちは合意に達しており、取締役や役員を保障するために協定を締結し続ける予定です。
取締役会の独立性
取締役会は取締役会メンバーの独立性を審査し、取締役が当社と実質的な関係にあるかどうかを考慮し、職責を履行する際に独立して判断する能力に影響を与える。各取締役要求と提供された彼らの背景、仕事、および従属関係(家族関係を含む)に関する情報に基づいて、取締役会は、マッキンドール博士を除いて、マッキントッシュ博士がわが社の最高経営責任者であるため、ナスダック規則に基づいてこの言葉の定義を定義し、すべての現取締役は“独立”であることを決定した。したがって、ジャシア博士、何博士、ホネック博士、カークさん、ロジャースさんおよびMr.Zhangはナスダックのルールに従って定義されているので、“独立”の用語として扱われています。本年度報告では“プロジェクト10.取締役、行政者と会社管理--取締役会の独立性”と題するテーブル10-K部分を参照されたい
プロジェクト14.チーフ会計士費用とサービス料
チーフ会計士費用とサービス
次の表に、2022年12月31日から2021年12月31日までの1年間に、BDO USA、LLP(以下、BDO)が提供する監査とその他のサービスによる費用総額を示す
| 財政年度が終わる |
||||||||
| 2022 |
2021 |
|||||||
| (単位:千) |
||||||||
| 料金を審査する(1) |
$ | 388 | $ | 254 | ||||
| 監査関連費用(2) |
— | — | ||||||
| 税金.税金(3) |
49 | 34 | ||||||
| 他のすべての費用(4) |
20 | — | ||||||
| 総費用 |
$ | 457 | $ | 288 | ||||
| (1) |
監査費用には、当社の総合年次財務諸表を監査し、中期総合財務諸表を審査し、米国証券取引委員会に提出された登録声明届出について同意書と慰問状を発行するために徴収される専門サービス費用と、会計士事務所が通常提供する法定及び規制届出又は採用に関するすべてのサービスが含まれています。 |
| (2) |
ない。 |
| (3) |
税金には、表示された会計期間中に税務コンプライアンス専門サービスのために発行された費用が含まれています。 |
| (4) |
私たちの382節の研究に関する費用。 |
上記のすべての費用は監査委員会によって事前に承認された。
承認前の政策と手順
監査委員会は、我々の独立公認会計士事務所が提供する監査及び非監査サービスを事前に承認する政策及び手続を採択した。この政策は一般的に規定カテゴリの監査サービス、監査関連サービス、税務サービスにおける規定サービスを事前に承認しているが、最高限度額は規定額を超えてはならない。事前承認は、監査委員会が独立監査師の採用範囲を承認する一部として、または独立監査師を招聘して各サービスを提供する前に個別、明確、逐案承認することもできる。サービスの事前承認は監査委員会の1人以上のメンバーに委託することができるが、この決定は監査委員会が次回予定した会議で全監査委員会に報告しなければならない。
監査委員会は、BDOが2022年と2021年に非監査サービスを提供することは、主会計士の独立性を維持することと互換性があると認定した。
第4部
項目15.物証、財務諸表付表
連結財務諸表:
F-1ページの連結財務諸表インデックスを参照してください。
財務諸表明細書:
これらは必要ではないか、または必要な資料が連結財務諸表または付記に含まれているので、すべての付表は省略されている。
展示品:
添付展示品索引に記載されている展示品は、“2022年年次報告書10-K表”の一部として提出されるか、引用により組み込まれている。
項目16.表格10-Kの概要
適用されません。
連結財務諸表索引
| 独立公認会計士事務所報告(BDO USA,LLP;ノースカロライナ州ローリー;PCAOB ID# | F-2 | |
| 合併貸借対照表 | F-4 | |
| 連結業務報告書 | F-5 | |
| 株主権益合併報告書 | F-6 | |
| 統合現金フロー表 | F-7 | |
| 連結財務諸表付記 | F-8 |
独立公認会計士事務所報告
株主と取締役会
アラビフ社
ヒューストン、テキサス州
連結財務諸表に対するいくつかの見方
Aravive,Inc.(“当社”)2022年12月31日現在と2021年12月31日までの連結貸借対照表,同年度までの関連総合経営報告書,株主権益と現金流量および関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は,すべての重要な点において,当社の2022年,2022年,2021年12月31日の財務状況,および同日までの経営結果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。
持続的経営の不確実性
添付されている総合財務諸表の作成仮説会社は引き続き経営を継続する企業となる。総合財務諸表付記2で述べたように、当社は経営により経常赤字を被っており、経営から正のキャッシュフローは生じていません。これらの要因は、同社の継続経営企業としての持続的な経営能力を大きく疑わせている。付記2は、これらの事項における経営陣の計画も説明しています。連結財務諸表には、このような不確実性の結果によって生じる可能性のあるいかなる調整も含まれていません。
意見の基礎
これらの連結財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の総合財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、連結財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項は、監査委員会が監査委員会に伝達または要求する当期総合財務諸表監査によって生じる事項を指すことである:(1)総合財務諸表に対して大きな意味を有する勘定または開示に関するものであり、(2)私たちが特に挑戦的で主観的または複雑な判断に関するものである。重要な監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項またはそれに関連する勘定または開示について個別の意見を提供することもない。
収入確認–協力と許可協定
当社は2020年11月6日に3 D Medicines協定(“同協定”)を締結し、これにより、当社は、いくつかの地域でヒト腫瘍性疾患を診断、治療または予防するために、3 D Medicines独占ライセンスを付与し、バテラシェットを唯一の薬物物質として含む製品を開発および商業化することを、当社の総合財務諸表付記2および付記5に記載した。当社は以下の規定により合意の評価を行っている会計基準コード606-お客様との契約の収入1)知的財産権許可と,2)臨床試験を含む研究開発サービスを決定し,会社が研究開発サービスに対して受け取る総対価格の見積もりと会社がサービスを提供するモデルに基づいて,研究開発サービスに関する収入を確認した。履行モードは、一般に、契約されたサービス部分に関連する総予想コストのパーセンテージとして、顧客の契約のサービス部分に関連する発生した費用の額として決定される。同社は2022年12月31日までの1年間に、研究開発サービスに関する630万ドルの収入を確認した。
協定に基づいて提供される研究開発サービスの予想総費用の推定値を、協定に基づいて重要な監査事項として決定した。総予想コストの見積もりには、製品候補の第3段階臨床試験の実行に関連するコストを含む、管理層が将来の開発コストを判断する必要がある。臨床開発過程に関連する内在的不確定性のため、監査管理層の総期待コストに対する推定は監査人の判断力を増加させる必要がある
この重要な監査問題を解決するために私たちが実行する主な手続きは以下の通りです
| ● | 管理層の第三段階臨床試験の総期待コストに対する推定を評価し、方法は試験に組み入れられた患者数に基づいて臨床試験の推定コストを支持する第三者証拠を審査し、及び候補製品の現在の臨床開発進展を理解する会社の臨床開発専門家と討論を行う。 |
| ● | 取締役会会議の議事録及び開発更新を審査し、製造パートナー及び臨床研究組織とのコミュニケーションを検討して、総予想コストを推定するための管理層の情報と一致することを確実にする。 |
権証会計
当社の総合財務諸表付記2、4及び8に記載されているように、2022年1月の投資協定に関連して、当社は事前融資権証を発行して、最大4,545,455株当社普通株を購入する。2022年3月、当社は1回の登録直接発行を完了し、これにより、当社は最高1,665,025株式会社普通株と承認証を購入し、最大4,850,241持株会社普通株を購入するための事前融資権証を発行した。2022年10月の1回の私募で、同社は15,870,199株の自社普通株を購入する予融資権証と45,178,811株を購入する普通株の普通権証を発行した。それぞれの株式証合意の条項によると、1月の予融資権証と10月の普通株式証は発行時に派生負債に分類される。3月の予融資権証と普通株承認株式証および10月の予融資権証は発行時に株主権益に分類される。
予融資権証と普通株式承認証の貸借対照表分類を決定することは重要な監査事項であると考えられる。各株式承認証の貸借対照表の分類を決定するには、株式認証証の複雑な条項と特徴およびこれらの特徴が会計分類に与える影響を評価する必要がある。監査これらの要素は、専門技能と専門知識を持つ専門家の参加を含む監査役の努力の性質と程度が必要であるため、特に挑戦性と複雑な監査師の判断に関連する。
この重要な監査問題を解決するために私たちが実行する主な手続きは以下の通りです
| ● | それぞれの事前資金及び普通株式承認証プロトコル及びその他の関連協定に含まれる条項と特徴を評価し、株式承認証貸借対照表の分類に対する影響を確定する。 |
| ● | 複雑な債務と持分ツール会計専門知識と経験を持つ専門家を利用して、関連する権威ある会計指針をすでに発行された事前資金権証及び普通株式承認証の条項と特徴に応用することに協力する。 |
臨床試験は費用を計算しなければならない
当社の総合財務諸表付記2と付記3で述べたように、当社は2022年12月31日現在、総合貸借対照表の計上すべき負債に含まれる臨床費用470万ドルを計上している。同社は,それを代表して臨床試験を行い管理する研究機関と臨床研究機関(“CRO”)と締結した契約に基づき,提供されたサービスに基づいて臨床試験費用を試算している。サービス料を計算する際には、当社はサービスを提供する時間帯と期間ごとの患者登録と活動支出レベルを推定します。
臨床試験すべき項目は重要な監査事項であり、大量の管理判断が必要で特定の任務を達成する進捗を推定する必要があるため、これは内部臨床者と第三者サービスプロバイダが提供するデータと情報に依存すると考えられる。これらの事項を処理するために必要な監査作業の性質と程度により、監査これらの要素は、特に監査人の判断に挑戦することに関連する。
この重要な監査問題を解決するために私たちが実行する主な手続きは以下の通りです
| ● | 経営陣は臨床計算すべき負債の流れを評価し、直接対応すべきいくつかの金額を会社のCROと確認した。 |
| ● | ある臨床試験研究が貸借対照表の日付前に完成した臨床活動の推定を評価する方法は、(I)元の契約条項変更リストと関連研究の予想スケジュールを検査すること、(Ii)詳細な実地調査活動の第三者情報を取得すること、および(Iii)貸借対照表の日付前後に受信した領収書に照らして計算すべき負債の完全性を評価し、計算すべき費用を推定する際の適切な考慮要素を決定することである。 |
| ● | 会社が推定したいくつかの臨床計算負債を評価して、公開情報と一致して、プレスリリースと投資家紹介、取締役会材料、および臨床人員とある管理層のメンバーに聞いて、行っている重大な臨床試験の状況を理解することを含む。 |
/s/
2018年以来、当社の監査役を務めてきました。
2023年3月15日
ARAVIVE,Inc.
合併貸借対照表
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
| 十二月三十一日 | 十二月三十一日 | |||||||
| 2022 | 2021 | |||||||
| 資産 | ||||||||
| 流動資産 | ||||||||
| 現金と現金等価物 | $ | $ | ||||||
| 前払い費用と他の流動資産 | ||||||||
| 流動資産総額 | ||||||||
| 制限現金 | ||||||||
| 財産と設備、純額 | ||||||||
| 経営的リース使用権資産 | ||||||||
| その他の資産 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 流動負債 | ||||||||
| 売掛金 | $ | $ | ||||||
| 負債を計算すべきである | ||||||||
| 賃貸債務を経営し,今期の部分 | ||||||||
| 繰延収入の当期分 | ||||||||
| 流動負債総額 | ||||||||
| 繰延収入,当期分を差し引く | ||||||||
| 経営性賃貸債務、当期分を差し引く | ||||||||
| 株式証法的責任 | ||||||||
| 総負債 | ||||||||
| 引受金及び又は有事項(付記7) | ||||||||
| 株主権益 | ||||||||
| 普通株、$額面は2022年12月31日と2021年12月31日に認可された株そしてそれぞれ2022年12月31日及び2021年12月31日に発行及び発行された株式 | ||||||||
| 追加実収資本 | ||||||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益総額 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
付記はこれらの連結財務諸表の構成要素である。
ARAVIVE,Inc.
連結業務報告書
(千単位で、1株当たりを除く)
| 現在までの年度 |
||||||||
| 十二月三十一日 |
||||||||
| 2022 |
2021 |
|||||||
| 収入.収入 |
||||||||
| 協力収入 |
$ | $ | ||||||
| 総収入 |
||||||||
| 運営費 |
||||||||
| 研究開発 |
||||||||
| 一般と行政 |
||||||||
| 総運営費 |
||||||||
| 運営損失 |
( |
) | ( |
) | ||||
| その他の収入(費用)、純額: |
||||||||
| 利子収入 |
||||||||
| 株式証負債の公正価値変動を認める |
( |
) | ||||||
| その他の収入、純額 |
||||||||
| その他の収入を合計して純額 |
( |
) | ||||||
| 純損失 |
$ | ( |
) | $ | ( |
) | ||
| 1株当たり純損失--基本損失と赤字 |
$ | ( |
) | $ | ( |
) | ||
| 加重平均普通株、基本と希釈後の1株当たり純損失の計算に用いられる |
||||||||
付記はこれらの連結財務諸表の構成要素である。
ARAVIVE,Inc.
合併株主権益報告書
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
| その他の内容 | 合計する | |||||||||||||||||||
| 普通株 | 支払い済み | 積算 | 株主の | |||||||||||||||||
| 株 | 金額 | 資本 | 赤字.赤字 | 権益 | ||||||||||||||||
| 2021年1月1日の残高 | $ | $ | $ | ( | ) | $ | ||||||||||||||
| オプション行使時に普通株式を発行する | ||||||||||||||||||||
| 従業員福祉計画に基づいて普通株を発行する | ||||||||||||||||||||
| 直接発行で普通株を発行し、発行コストを差し引いて#ドル | ||||||||||||||||||||
| 市場発行時に普通株を発行し、発行コストを差し引く$ | ||||||||||||||||||||
| 株に基づく報酬 | — | |||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||
| 2021年12月31日の残高 | ( | ) | ||||||||||||||||||
| 従業員福祉計画に基づいて普通株を発行する | ||||||||||||||||||||
| 登録直接発売で普通株式と普通株式承認証を発行し、発行コストを差し引いて#ドル | ||||||||||||||||||||
| 市場発行時に普通株を発行し、発行コストを差し引く$ | ||||||||||||||||||||
| 事前資本権証を行使する際に普通株式を発行する | ||||||||||||||||||||
| 私募融資で普通株式と普通株式承認証を発行し、発行コスト#ドルを差し引く | ||||||||||||||||||||
| 株に基づく報酬 | — | |||||||||||||||||||
| 純損失 | — | ( | ) | ( | ) | |||||||||||||||
| 2022年12月31日の残高 | $ | $ | $ | ( | ) | $ | ||||||||||||||
付記はこれらの連結財務諸表の構成要素である。
ARAVIVE,Inc.
統合現金フロー表
(単位:千)
| 現在までの年度 |
||||||||
| 十二月三十一日 |
||||||||
| 2022 |
2021 |
|||||||
| 経営活動のキャッシュフロー |
||||||||
| 純損失 |
$ | ( |
) | $ | ( |
) | ||
| 純損失と経営活動で使用した現金純額の調整 |
||||||||
| 減価償却および償却 |
||||||||
| 株に基づく報酬費用 |
||||||||
| 権証発行コスト |
— | |||||||
| 権証負債公正価値調整 |
— | |||||||
| 資産と負債の変動 |
||||||||
| 前払い費用と他の資産 |
( |
) | ( |
) | ||||
| 売掛金 |
||||||||
| 収入を繰り越す |
( |
) | ||||||
| 負債その他の負債を計上しなければならない |
( |
) | ||||||
| 経営活動のための現金純額 |
( |
) | ( |
) | ||||
| 投資活動によるキャッシュフロー |
||||||||
| 財産と設備を購入する |
( |
) | ||||||
| 投資活動のための現金純額 |
( |
) | ||||||
| 融資活動によるキャッシュフロー |
||||||||
| 従業員福祉計画に関する普通株を発行して得られる収益 |
||||||||
| オプション行使で普通株を発行して得られた収益 |
||||||||
| 普通株式と普通株式の株式承認証を直接発行する収益は,発行コストを差し引く |
||||||||
| 私募融資で普通株式と普通株式承認株式証を発行する収益は,発行コストを差し引く |
||||||||
| 普通株で得た金を市場で発行する |
||||||||
| 融資活動が提供する現金純額 |
||||||||
| 現金、現金等価物および限定的現金の純変化 |
( |
) | ( |
) | ||||
| 期初現金、現金等価物、および限定現金 |
||||||||
| 期末現金、現金等価物、および制限現金 |
$ | $ | ||||||
| 非現金項目を補充開示する |
||||||||
| 株式承認証負債は株式承認証を行使する際に追加実収資本に再分類される |
||||||||
付記はこれらの連結財務諸表の構成要素である。
ARAVIVE,Inc
連結財務諸表付記
1.会社の結成と業務
Aravive,Inc.(“Aravive”または“会社”)が設立された2008年12月10日デラウェア州にあります。会社の第2の完全子会社Aravive Biologics,Inc.(“Aravive Biologics”)が設立された2007.Araviveは臨床段階の腫瘍学研究会社であり、癌と繊維化を含む生命を脅かす疾病の進展を阻止するために、変革性治療方法を開発した。
Batiraxcept(前AVB-500)を標的とした超親和性の餌タンパク質ですGas 6-AXLシグナル·パス。血清を捕獲することでGAS 6、BatiraxceptはAxl経路にシグナルを失わせ、潜在的に疾病の進展を促進する生物プログラミングを阻止した。AXL受容体シグナル経路は転移、癌細胞の生存促進、薬剤耐性と免疫抑制を通じて多種のタイプの悪性腫瘍において重要な役割を果たしている。
はい2016年7月Aravive Biologicsが承認され、金額は$です
CPRITによって発行されたAravive Biologics賞は、特定の製品を販売するその収入の一部をCPRITに支払うこと、またはその許可者または再ライセンサーから得られた収入の一部を、そのような支払いの総額が等しくなるまで、収入の低い中央値の段階パーセントで支払うことを要求する
はい2020年4月当社は薬明生物(香港)有限会社と許可と協力協定を締結し、新しい高親和性二重特異性抗体の識別と開発を目指しているCCN 2、結合組織成長因子(CTGF)とも呼ばれ、癌や線維化に関連し、類似した標的発見スクリーンから発見され、このスクリーンは決定されたAXL/GAS 6癌の経路ですが2022年8月同社はCTGFプロジェクトにおける無錫との仕事を一時停止し、すべての資源を臨床プロジェクトに集中させるために努力している。
はい2020年11月同社は以下の会社と協力·許可協定を締結した3D医薬会社("3D薬品“(”合意“または”3D“医薬品協定”は,会社がこれに基づいて授与する3D医薬品は、中国大陸、台湾、香港、マカオ(“領土”)において、ヒト腫瘍性疾患を診断、治療または予防する唯一の薬剤としてパチラセプを含む製品の開発と商業化の独占ライセンス、前払い現金$
はい2021年8月その会社は1ドルを受け取った
はい2022年10月その会社は1ドルを受け取った
Aravive Biologicsとして2012アラン·スタンフォード初級大学(“スタンフォード大学”)の知的財産権および有形知的財産権によると、Aravive Biologicsは、毎年の許可料および記念碑的な支払い、および特許関連権利がカバーする製品の純売上に応じて支払われる使用料を支払う義務がある。より具体的には、Aravive Biologicsはスタンフォード大学に(I)年間許可料(Ii)の合計#ドルまでの記念碑的支払いを支払う義務がある
2.重要会計政策の概要
予算の列報と使用根拠
添付されている総合財務諸表は、米国公認会計原則(“公認会計原則”)に基づいて作成される。公認会計基準に基づいて添付の連結財務諸表を作成することは、報告期間中の資産および負債の報告金額、連結財務諸表の日付または有資産および負債の開示、ならびに報告期間中の収入および支出の報告金額に影響を与えるために、管理層に推定および仮定を要求する。実際の結果はこれらの推定とは異なる可能性がある。
添付財務諸表は年末までの総合財務諸表である2022年12月31日そして2021Aravive,Inc.およびその完全子会社Aravive Biologicsのアカウントも含まれています。すべての会社間口座と取引は合併でログアウトしました。ドルは会社の子会社と合併業務の機能通貨です。
持続的経営の不確実性
設立以来、同社は運営により純損失とマイナスキャッシュフローを見せている。はい2022年12月31日同社の累積赤字は#ドルだ
ナスダックコンプライアンス
開ける2022年8月9日当社はナスダックから書面通知を受け、当社の普通株対に基づいて30連続営業日期間2022年6月27日通り抜ける2022年8月8日“会社”ができた注釈最低入札値を満たす$1.00ナスダック上場規則によると、引き続きナスダック世界の精選市場に上場するために必要な1株当たりの収益5550(a)(2).
ナスダックの最低入札価格要求を再遵守するためには、会社普通株は最低終値を維持しなければならない$1.00少なくともあるのは10個コンプライアンス期間内の連続営業日。
開ける2022年11月10日当社はナスダック上場資格審査員(“当該等人員”)の通知を受け、当社は“ナスダック証券市場上場規則”の遵守を再開しました。スタッフが確定しました11営業日を続けて、2022年10月27日至れり尽くせり2022年11月10日同社の普通株の終値はずっと$1.00一株以上です。そのため、同社はコンプライアンスを回復し、この件は現在解決された。
細分化市場
同社は以下の地域で運営している市場を細分化する。用途を管理する1つは収益性と経営業績の尺度注釈その業務を内部報告に隔離する。すべての長期資産はアメリカ合衆国に残っている。
濃度:CREDITRISK
会社を集中的な信用リスクに直面させる可能性のある金融商品には、現金と現金等価物が含まれる。同社のすべての現金と現金等価物は、経営陣が高い信用品質を有すると考えられているいくつかの金融機関に保管されている。この種の預金5月.連邦保険の限度額を超えます。
リスクと不確実性
同社の将来の経営業績は多くのリスクと不確実な要素に関連している。会社の将来の経営業績に影響を与え、実際の結果が予想と大きく異なる要素が含まれている可能性がある注釈これらのリスクと不確定性は:臨床試験結果とマイルストーンに達する不確定性、会社の潜在候補薬物が監督管理許可を獲得した不確定性、市場の会社製品受容度に対する不確定性、代替製品と比較的に大きな会社の競争、特許技術の安全と保護、戦略関係及び肝心な個人と唯一の供給源サプライヤーへの依存を含む。
同社が開発した製品は、商業販売の前に、米国食品医薬品局(FDA)、医薬品·設備管理局(PMDA)または他の国際監督管理機関の承認を得る必要がある。あるかもしれない違います。製品が必要な許可を得ることを保証します。当社がクリアを拒否されたり、クリアが遅れたり、当社がクリアを維持できない場合は、当社に重大な悪影響を与える可能性があります。
同社は今後数年で巨額の運営損失が予想され、規制部門の承認を得た候補品を発売して商業化するために追加融資を受ける必要がある
その会社は第三に-第三者製造業者が彼らの第三に−締約国サプライヤーは、候補製品を生産し、臨床研究候補製品を製造するために必要な材料を提供する。その会社はまた第三に-研究および開発で使用されるキー材料およびサービスおよび製造プロセスの供給者は、これらの損失に関連するいくつかのリスクに直面している第三に-一方のサプライヤーまたは彼らは、十分な材料およびサービスを提供できません。その会社はやった注釈契約開発·製造組織(“CDMO”)の製造プロセスを制御し,それと契約を結び,これらの組織に依存する第三に締約国は関連条例(例えば現行の良好な製造規範或いはcGMP)に基づいてその候補治療薬物を生産しなければならず、その中には他の以外にも、品質管理、品質保証及び記録と文書の維持が含まれる。また会社は第三に−cGMP施設を構築するために必要な材料と、施設を実行するために必要な装置の当業者と。
現金とC灰.灰E指し値現金、指し値現金
会社が購入したすべての高流動性投資の初期期限は三つ数ヶ月以下の時間を現金等価物とする。はい2022年12月31日そして2021同社の現金と現金等価物は、通貨市場基金における預金を含む米国内の複数の機関に保管されており、これらの基金は引き出しや使用の制限を受けない。制限現金には、会社が使用権レンタルによって負担する義務を保証するための信用状が含まれている。
属性とE設備、ネット
財産や設備をコスト別に列記し、資産の推定耐用年数内に直線減価償却を使用するのが一般的であるそして何年もです。レンタル改善は、その使用年数またはレンタル期間が短い時間に直線的に償却する。メンテナンスとメンテナンスは発生時に費用を計上し、計上資本化を改善する。資産が廃棄またはその他の方法で処分された場合、コストおよび減価償却は、連結貸借対照表から除外され、それによって生じる収益または損失は、実現された期間の運営に反映される。
賃貸借証書
その会社はそのすべてのオフィスを借りて業務を展開している。開始時に、当社は契約がレンタルを代表するかどうかを決定し、開始時に、会社は各レンタルプロトコルを評価して、レンタルが経営的賃貸であるか融資賃貸であるかを決定する。
当社はリースを締結する際に、総合貸借対照表に運営賃貸使用権(“ROU”)資産および運営賃貸債務を記録している。ROU資産とは,会社がリース期間内に対象資産に対するROUであり,リース義務は会社のリースによる賃貸支払いに対する承諾を代表するものである。リース責任は開始日にレンタル期間内の余剰賃貸支払いの現在値に基づいて確認し、ROU資産はレンタル負債として計算し、未償却初期直接コスト、受信した未償却賃貸インセンティブ、累積繰延または前払い賃貸支払いと累積減価損失調整後に計算する。会社の賃貸借契約のとおり注釈隠れた金利を提供する場合、当社は、レンタル開始日利用可能な情報に基づく推定増額借入金金利を使用して、レンタル支払いの現在値を決定する。賃借期間5月.賃貸借契約の延長または終了の選択権が含まれていますが、当社がその選択権を行使すると合理的に判断した場合、当社はその推定賃貸期間の計算に継続選択権を計上します。経営リース費用はリース期間内に直線法で確認され、リース契約の任意の変化や条項への期待の影響を受ける。公共エリアコストや物流税のような賃貸コストを変動させ、発生時に費用を計上する。可変レンタルコストと短期レンタル支払い注釈賃貸負債に含まれるキャッシュフロー表は、統合キャッシュフロー表の経営活動に分類される。すべての賃貸契約について、当社はレンタルと非レンタル部分を合併しました。賃貸契約の初期期限は12月以下の時間は注釈総合貸借対照表に計上する。これらの費用は連結経営報告書の営業費用で確認します。
株式証法的責任
普通株式購入の引受権証2022年1月融資(資金調達)“2022年1月権証“)総合貸借対照表で派生負債とされている2022年3月31日捜査令状は注釈会社自身の普通株とリンクする2022年4月1日当該等株式証はすでに行使され、株式に変換された。*株式証の行使日に、株式承認証はその公平な価値によって追加実収資本に再分類される2022年4月1日期内見積公正価値の変動に伴い他の収入(費用)の構成要素として確認され,純額は我々の経営報告書で確認され,それに応じて純損失と経営活動で使用されている現金純額の入金に反映される。
普通株式購入の引受権証2022年10月融資(資金調達)“2022年10月権証“)総合貸借対照表で負債とされる2022年12月31日会社がやったから注釈行使された場合、発行された株式承認証を支払うのに十分な認可株式がある。この期間の見積公正価値変動は、我々の経営報告書において、他の収入(費用)純額の構成要素であることが確認され、それに応じて純損失と経営活動用現金純額との入金に反映される。
当社は推定株式証の個別特徴に基づく仮定を採用し、このような負債の公正価値を推定している。同社はブラック·スコアーズオプション定価モデルと標的株の公正価値を使用して、これらの負債の公正価値を決定した。推定モデルは、我々株の推定変動率、権利証の残存契約期間、無リスク金利を含む推定日までの投入に基づいている。備考をご参照ください4.
長期資産減価準備
事件や状況の変化があるたびに資産の帳簿金額を示す5月.注釈取り戻すことができます。回収可能性は,帳簿金額と資産予想による将来のキャッシュフロー純値との比較によって測定される。このような資産は減値とみなされ、確認すべき減値は、その資産の帳簿金額がその資産によって生成される公正価値(すなわち、将来割引現金流量または他の許容可能な公正価値を決定する方法を推定することによって決定される)の金額を超えることによって計量される。いくつありますか違います。この等長期資産はこの年度末までに減価される2022年12月31日。
金融商品の公正価値
これらのプロジェクトの短期的な性質のため、会社の現金と現金等価物、制限的現金、売掛金と売掛金の帳簿価値は公正価値に近い。
公正価値は、計量日市場参加者間の秩序ある取引において、資産または負債が元金または最も有利な市場で負債を移動させるために支払われる受信される資産交換価格または退出価格として定義される。公正価値を計量するための推定技術は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に減少させなければならない。
公正価値階層構造は三つ-開示公正価値計測の評価レベルは、以下の通りです
| レベル:1 - | 活発な市場における同じ資産または負債の未調整見積もり; |
| レベル:2 - | レベル内の見積もり以外の投入を含む1市場で観察できる未調整の見積もり注釈アクティブな、または関連する資産または負債の実質的に完全な期限の観察可能な市場データによって確認されることができる他の観察可能な投入;および |
| レベル:3 - | 観察できない入力はごくわずかなものや違います。関連資産や負債の市場活動。 |
評価レベル内で金融商品の分類は公正価値計量に重要な最低投入レベルに基づいている。
会社の金融商品はLevelで構成されている1現在の資産2022年12月31日そして2021レベルとレベル3現在の負債2022年12月31日水平1証券は流動性の高い通貨市場基金で構成されている。水平3負債は株式証明書負債から構成される。
臨床試験は費用を計算しなければならない
同社の臨床試験の計上すべき利益は,臨床研究者地点の患者登録と関連コストの見積もりと,代表会社と臨床試験を行って管理する複数の研究機関とCROとの契約によるサービスと費用の見積もりに基づいている。
同社は,それを代表して臨床前研究と臨床試験を行う研究機関とCROと締結した契約に基づき,提供されたサービスから臨床前と臨床試験費用を推定している。サービス料を計算する際には、当社はサービスを提供する時間帯と期間ごとの患者登録と活動支出レベルを推定します。実際にサービスを実行する時間や努力の程度が見積もりと異なる場合、当社は該当項目を調整します。支払い対象:第三にこれらの手配された当事者は,関連サービスを受信する前にサービスを提供するまで前払い料金として記録される.
研究とD発展する
研究·開発コストは発生時に運営費を計上する。研究と開発コストには注釈賃金および人件費、実験室用品、コンサルティング費用、外部研究開発費用、分配された管理費用に限られ、賃貸料、設備減価償却、光熱費など。研究開発のための技術を得るコスト注釈技術的な可能性を達成しました違います。代替用途は発生時に研究と開発コストを計上する。
収入.収入T軸.軸
当社は貸借対照法で所得税を計算します。この方法によれば、繰延税金資産と負債は、資産と負債の財務諸表と税ベースとの差額に基づいて、予想差額を使用することが課税所得額の年間の現行税率に影響を与えることで決定される。繰延税金資産を予想現金化金額に減少させるために、必要に応じて評価準備を設ける。
当社は、関連税務機関の評価または質疑を受けなければならないすべての課税年度の重大な不確定倉位を含む任意の所得税申告表内のすべての重大な倉庫位を評価します。不確定な税収状況を評価することは、この状況の持続可能性の初歩的な決定から始まり、最終的な和解後に達成可能な最大収益で測定される。各貸借対照表日までに、未解決の不確定税務状況は再評価されなければならず、会社は、(I)持続可能なアサートを支持する要因が変化したか否か、および(Ii)確認された税収割引額が依然として適切であるか否かを判断する。税金優遇の確認と測定には重大な判断が必要だ。新たな情報の出現に伴い、税収割引に関する確認や評価に関する判断が変化する可能性がある。
株を基礎とするC賠償する
従業員に付与された株式オプションについては、会社は、付与日の推定公正価値に基づいて、株式の奨励に基づく補償費用をすべて確認する。最終的に付与されると予想されるその部分賠償金の価値は必要なサービス期間に比例して費用として確認される。株式オプションの公正価値は、Black-Scholesオプション定価モデルを使用して決定される。オプション定価モデルを使用して、付与された日に株式奨励の公正価値を決定し、管理層にいくつかの複雑かつ主観的な変数に対していくつかの仮定をすることを要求する。
非従業員に付与された株式オプションに関する株式ベース報酬支出は、株式オプションの公正価値に基づいて確認され、株式オプションの公正価値は、ブラック·スコアーズオプション定価モデルによって獲得時に決定される。報酬は、一般的に、会社が非従業員からサービスを受けることが予想される期間内に付与される。
普通株1株当たり純損失
普通株1株当たりの基本純損失の計算方法は、普通株株主が純損失を当期発行普通株の加重平均で割るべきであり、潜在的な希釈証券は考慮しない。1株当たりの純損失の計算方法は、普通株株主が純損失を当期に発行された普通株と潜在的な希薄化証券の加重平均で割るべきである。1株当たり純損失を算出する際には、株式オプションと制限株式単位が潜在的に希薄化された証券とみなされる。その会社が報告したから2022年12月31日そして2021会社普通株等価物の効果は逆希薄であり、希釈後の1株当たり普通株純損失は同期の普通株1株当たり純損失とほぼ同じである。
協力手配
会社はASCテーマに基づいて共同運営活動を代表する連携プロトコルの要素を記録している808, 協力手配(ASC)808)である。そのため,双方を代表する積極的な参加者の活動と,双方が活動のビジネス成功に依存する重大なリスクとリターンに直面している協力合意の要素が連携手配として記録されている.会社はASCにおける指導意見を考慮している606-10-15, 取引先と契約した収入–範囲と範囲例外会社とそのパートナーとの間の取引及び会社とパートナーとの取引の適切な処理方法を決定する第三にパーティーです。一般に,協調スケジューリングによる取引分類は,スケジューリングの性質と契約条項および参加者の操作的性質によって決定される1つは以下の会社と提携契約を結ぶ3D薬は付注を参照5さらなる議論に供する。
収入確認
年に同社の唯一の収入源2022と…2021それはまだその世界的な協力と許可協定によって作られていない。同社の協力·許可協定には、(I)知的財産権許可や(Ii)研究·開発サービスを含む複数の要素が含まれることが多い。これらの手配によって受け取った価格は5月.前金、研究開発資金、コスト精算、マイルストーン支払い、製品販売支払い、特許権使用料が含まれています。その会社の顧客には3D薬です。
会社はASCに従う606, 取引先と契約した収入(ASC)606)の協力および許可協定を承認します。ASCの下で606,顧客が承諾した商品やサービスの制御権を取得した場合,収入が確認される.確認された収入金額は、販売奨励及び代表を含まない会社が獲得する権利があると予想される商品又はサービス交換の対価格を反映している第三にパーティーです。同社は個別合意の範囲内でこれらの履行義務の性質を分析し,異なる履行義務を評価する。
当社は以下の規定を適用する5人収入を確認するステップモード:(I)契約で約束された貨物またはサービスを確認するステップと、(Ii)契約において異なるかどうかを含む約束された貨物またはサービスが契約義務であるかどうかを決定するステップと、(Iii)可変対価格の制限を含む取引価格の測定と、(Iv)取引価格を契約義務に割り当てるステップと、(V)会社が各履行義務を履行する場合(または義務として履行する場合)収入を確認するステップ。
I)顧客との契約を決定する。*会社は、ASCの範囲内の契約を決定するために、その契約の条項および条件を考慮します606.契約が承認された場合、会社は顧客と契約を締結したと認定し、双方が譲渡する商品及びサービスに対する権利を特定することができ、商品及びサービスの支払条件を特定することができ、顧客に能力及び支払い意図があることを確定し、契約は商業的実質を有する。同社は、顧客の履歴支払い経験や(新規顧客に対する)顧客に関する信用や財務情報などの要因に基づいた判断を用いて顧客の支払い能力や意図を決定する。
二)契約中の履行義務を確定する。プロトコルにおける履行義務は,クライアントに転送される商品やサービスに基づいて決定され,これらの商品やサービスは異なることができ,クライアントは単独でまたはいつでも以下のアドレスから取得できる他のリソースとともにサービスから利益を得ることができる第三にサービスの譲渡は、契約中の他の約束とは異なり、契約中の他の承諾とは異なる。同社の履行義務には,一般に許可やサービス協定に関する知的財産権許可や研究開発サービス,製品販売プロトコルのための製品の製造·供給が含まれている。
三)成約価格を確定する。*会社は、商品およびサービスをお客様に転送する代わりに、会社が獲得する権利があると予想される価格に基づいて取引価格を決定します。取引価格を決定する際には、会社は適用範囲内で任意の可変対価格を考慮し、当社の判断によれば、将来の契約で累積収入の大きな逆転が可能になる注釈起こります。ASC項による特許使用料例外606知的財産権許可については、取引価格には、将来会社の顧客から受け取った使用料支払いは含まれていませんありません同社の創収契約には、その顧客に支払う対価格または重要な融資部分が含まれている。
四)契約の履行義務に取引価格を割り当てる。契約に単一の履行義務が含まれている場合は、取引価格全体をその履行義務に割り当てる。複数の履行義務を含む契約は,相対的に独立した販売価格に応じて取引価格を履行義務ごとに割り当てる必要がある.
V)私たちが義務を果たしたとき、または義務を履行したときに収入を確認します。収入は,承諾した貨物やサービスを顧客に譲渡することで関連履行義務を履行する際に確認する.商品又はサービスの制御権が顧客に移転した場合、会社は収入を確認し、金額は、企業がこれらの商品又はサービスの交換から得た対価格を反映している。
契約義務を履行する
以下に同社が収入を生み出す主な商品やサービスの一般的な記述を示す。
知的財産権許可証
同社は、知的財産権(ノウハウ、開発権、商業化権利を含む)を許可することで収入を得ている。このライセンスは、顧客に、内部で発見または協力している候補薬剤をさらに研究、開発および商業化する権利、またはbatiraxceptを使用して顧客候補薬剤をさらに研究、開発および商業化する権利を与える。会社が受け取った対価格は,機能性知的財産権許可に関する払戻不可能な前払い対価格であり,会社がこのような許可を顧客に譲渡する際に,他の商品やサービスとの合併を許可しない限り確認する1つは履行義務は、この場合、収入は、会社が合併履行義務を履行する推定モードに基づいて一定期間内に確認される。会社のライセンス契約は通常廃止することができる
研究と開発サービス
同社はその顧客に提供する研究と開発サービスから収入を得ており、主に臨床試験と監督管理許可申請過程における協力を含む。これらのサービスに関連する収入は、会社がこのようなサービスを受信する総対価格の推定および会社がサービスを実行するモードに基づいて確認される。履行モードは、一般に、契約されたサービス部分に関連する総予想コストのパーセンテージとして、顧客の契約のサービス部分に関連する発生した費用の額として決定される。
多重履行義務を持つ契約
同社と顧客との協力および許可協定には、複数の約束された商品またはサービスが含まれている。約束された貨物とサービスの特徴に基づいて、会社はそれらが単独であるか合併の履行義務であるかを分析する。取引価格は相対的に独立した販売価格で単独の履行義務に割り当てられる。独立販売価格の推定は調整された市場評価方法に基づいており、未来のキャッシュフローの推定現在値とコストプラス利益法を推定し、サービスカテゴリ、1時間当たりの市価推定及び発展段階を考慮している。
可変考慮事項
会社と顧客との契約には主に二つ可変価格のタイプ:(1)発展と規制マイルストーン支払い、具体的な発展と規制マイルストーンを実現する際に会社に支払うべき、および(2)1つは−ライセンス知的財産権に関連する時間ベース販売の支払いおよび販売ベースの印税。
開発と規制マイルストーンの実現に関する不確実性のため、関連するマイルストーン支払いは契約対価格以外に含まれておらず、それに応じた収入は注釈会社が終わったことを確認すると、このような記念碑的な収入逆転が可能になります注釈会社の評価制限の一部として、マイルストーンの実現が会社のコントロールを超えているかどうか、規制部門の承認にかかっているか、許可されている人の努力にかかっているかなど、多くの要因が考えられている。
ライセンス知的財産権と製品販売に基づく使用料1つは-時間支払いは、特許使用料例外に計上されます。当社は、ライセンス知的財産権の下で販売に基づく使用料収入を確認し、1つは−販売が発生したか、または義務が履行されたか、または部分的に履行された場合のより遅い時間の支払い。
各報告期間内に、不確定イベントが解決された場合、または状況が他に変化した場合、取引価格が再評価される。
最近の会計公告
新しい会計公告は、財務会計基準委員会またはFASBまたは他の基準策定機関によって時々発行され、指定された発効日から採択される。別の議論がない限り、最近発表された基準の影響は注釈しかし効果的なのは注釈採用後は会社の財務状況や運営結果に実質的な影響を与える見通しだ。
はい2016年6月FASBはASUを発表しました違います。 2016-13,金融商品の信用損失を計量し、余剰コストで帳簿に記入した金融資産を歴史経験、現在の状況と予測に基づいて受け取る予定の純額を記録することを要求する。その後FASBはASUを発表しました違います。 2018-19,主題の符号化改善326,経営性賃貸による売掛金がリース会計基準の範囲に属することを明らかにする。また,FASBはASUを発表している違います。 2019-04,ASU違います。 2019-05,ASU2019-10,ASU2019-11,ASU2020-02ASUと2020-03信用損失基準について追加的な指導を提供する。ASUSの採択は修正された遡及に基づいて行われた。会社は以下の時間にこのASUを採用する予定です2023年1月1日その会社はやった注釈この新基準の採用は、会社の総合財務諸表や関連開示に実質的な影響を与えることが予想される。
3.貸借対照表の構成要素
前払い費用とその他の流動資産(千)
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 臨床.臨床 | $ | $ | ||||||
| 賃借金を受け取る | ||||||||
| 合計する | $ | $ | ||||||
財産と設備,純額(千)
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 設備と家具 | $ | $ | ||||||
| 建物、レンタル権、建物の改善 | ||||||||
| 減算:減価償却累計と償却 | ( | ) | ( | ) | ||||
| 減価損失を累計する | ( | ) | ( | ) | ||||
| 財産と設備、純額 | $ | $ | ||||||
減価償却費用は約$
負債を計算すべきだ
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 給与明細及び関連 | $ | $ | ||||||
| 臨床.臨床 | ||||||||
| 転貸早期返済 | ||||||||
| 専門サービス | ||||||||
| 他にも | ||||||||
| 合計する | $ | $ | ||||||
4.公正価値計量
会社の持分責任2022年1月権証は、総合貸借対照表で派生負債とされている2022年3月31日観察できない投入を含めて,これらの投入は,計量日に市場活動がほとんどなく,レベルに分類される会社自身の仮説を反映している3入力します。そのため、会社の権利証負債は公正価値に従って各報告期間内に観察できない投入を使用して公正価値の経常的な計量を行う2022年4月1日当該等株式証はすでに行使され、株式に変換された。*株式証の行使日に、株式承認証はその公平な価値によって追加実収資本に再分類される2022年4月1日期内見積公正価値の変動は他の収入(費用)の構成要素として確認されていないため,我々の経営報告書では純額である.備考をご参照ください2.
権利証の公正価値はBlack-Scholesオプション定価モデルを用いて推定される。このようにした権利証注釈固定的な終了日があるため、予想条項は経営陣の推定に基づいて持分証の予想未返済期間を代表する。無リスク金利は米国の固定満期日国債曲線に基づいており、未返済時間に見合っている。期待配当金は当社が持っているように注釈予測可能な未来に、その会社はまたその普通株に何の配当も支払わないだろう。期待変動率は,類似時間帯における我々の履歴変動率から推定される.
報告期末および株式承認証行使日に公正価値を計算する際に使用する仮説は、当社の最適な推定を代表する。しかし、これには内在的な不確実性が含まれている。もし要素や仮定が変化すれば、推定された公正価値は大きく異なるかもしれない。
同社の金融商品には、主に現金と現金等価物、前払い費用、売掛金、負債が含まれている。以下の金融商品は、会社の総合アセットバランスシート上で現在の公正価値に近い金額で報告されています。以下の表は、会社が公正価値レベルで公正価値を段階的に定期的に計量する金融商品(千計)を示しています
| 公正価値に応じて計量する | ||||||||||||||||
| 2022年12月31日 | ||||||||||||||||
| 合計する | レベル1 | レベル2 | レベル3 | |||||||||||||
| 資産 | ||||||||||||||||
| 貨幣市場基金 | $ | | $ | | $ | — | $ | — | ||||||||
| 負債.負債 | ||||||||||||||||
| 株式証法的責任 | $ | | $ | — | $ | — | $ | | ||||||||
| 公正価値に応じて計量する | ||||||||||||||||
| 2021年12月31日 | ||||||||||||||||
| 合計する | レベル1 | レベル2 | レベル3 | |||||||||||||
| 資産 | ||||||||||||||||
| 貨幣市場基金 | $ | $ | $ | $ | ||||||||||||
株式証法的責任
会社の持分責任2022年10月総合貸借対照表では派生負債の権証とされている2022年12月31日観察できない投入を含めて,これらの投入は,計量日に市場活動がほとんどなく,レベルに分類される会社自身の仮説を反映している3入力します。したがって,当社の引受権証負債は公正価値に応じて報告期間ごとに観察できない投入を用いて恒常的な基礎計量を行う。備考をご参照ください2.
権利証の公正価値はBlack-Scholesオプション定価モデルを用いて推定される。株主の承認を得て私たちの法定普通株数の不確定性とタイミングを増加させるため、普通株の公正価値は市場性に乏しい割引によって調整された。このようにした権利証注釈固定的な終了日があるため、予想条項は経営陣の推定に基づいて持分証の予想未返済期間を代表する。無リスク金利は米国の固定満期日国債曲線に基づいており、未返済時間に見合っている。期待配当金は
報告期末の推定公平価値を計算する際に用いる仮定は,当社の最適な推定を代表する.しかし、これには内在的な不確実性が含まれている。もし要素や仮定が変化すれば、推定された公正価値は大きく異なるかもしれない。
はい2022年12月31日当社はその等の財務負債の公正価値を推定している2022年10月以下の重み付き平均仮定を使用した重み:
| 2022年10月株式承認証 | ||||
| 2022年12月31日 | ||||
| 予想期限(年単位) | ||||
| 予想変動率 | % | |||
| 無リスク金利 | % | |||
| 期待配当収益率 | % | |||
| 普通株主公正価値 | $ | |||
| 行権価格 | $ | |||
以下の表は、会社株式証負債の推定公正価値変化(単位:千)をまとめた
| 2022年1月株式承認証 | 2022年10月株式承認証 | |||||||
| 2022年1月1日の残高 | $ | $ | ||||||
| 株式承認証を発行する | ||||||||
| 価値変動を公平に承諾する | ( | ) | ||||||
| 2022年3月31日の残高 | ||||||||
| 株式承認証を発行する | ||||||||
| 価値変動を公平に承諾する | ( | ) | ||||||
| 行使時に追加実収資本に再分類する | ( | ) | ||||||
| 2022年12月31日の残高 | $ | $ | ||||||
当社は報告期末までに価値階層間の移転を確認しました。いくつありますか
5.協力と許可協定
開ける2020年11月6日当社は契約を締結した3D医薬品協定,会社はこの協定に基づいて付与された3D当社は中国,台湾,香港およびマカオ(以下“当地域”と呼ぶ)に独自の許可証を持ち,パチラセプを唯一の薬物物質とする製品を開発·商業化し,ヒト腫瘍疾患の診断,治療または予防を行っている。
協定条項によると、同社は#ドルを獲得した
同社はまた、batiraxceptを含む製品(あれば)を領土内で販売することで、下位2桁から10代までの等級別印税を得る権利がある。以下の場合において最も遅く発生するまで、領土内の各管轄区域について使用料を支払わなければならない:(1)領土内の当該司法管轄区域内の特定特許権が最後に満了した時間;又は(2)10個 (
“合意”の条項と条件によると3D薬品は領土内の特許製品の開発と商業化に完全に責任を負うだろう。
もしその会社や3D薬品は実質的に合意に違反し,かつ確かである注釈このような違約を治すのは違約した方ではない5月.本プロトコルを完全に終了する.どちらか一方5月.他方が破産、解散を申請し、またはその実質的にすべての財産のために係を指定した場合、書面通知の下で合意を終了することもできる。会社(The Company)5月.以下の場合は本プロトコルを終了する3Dいくつかの例外を除いて、製薬会社、その連属会社、またはその再取得許可者は、当社が任意の許可化合物または製品をカバーする任意の特許の有効性または実行可能性に疑問を提起するか、または特定の期間内に、許可製品の地域内のすべての開発および商業化を実質的に停止する3D薬品5月.また、便宜上、当社に何らかの通知を提供した場合には、本プロトコルを終了する。
この協定は会社が以下の会社と付属手配を結ぶことを期待している3D医薬品は、臨床供給協定と製造技術移転協定を含む。
会社はASCに基づいてこの手配を評価した606以下の主な履行義務を決定した1)知的財産権ライセンス、batiraxcept、証明書、および2)臨床試験を含む研究·開発サービス。会社は、これらの業績義務のそれぞれが異なると結論した3D医薬品は、貨物またはサービスから個別に利益を得ることができ、また、他のいつでも利用可能なリソースと共に利益を得ることができ、各履行義務は、契約中の他の約束とは別に決定することができる。
総取引価格は履行義務の相対独立販売価格によって履行義務の間に分配されると予想される。会社は現金割引方法と期待コストプラス保証金方法を用いて契約履行義務の独立販売価格を推定しています。その会社は$を割り当てた
自分から2022年12月31日, 違います。臨床または法規のマイルストーンは達成可能であると評価されているため、十分に制限されています。当社は各報告期間の終了時に将来のマイルストーンの実現可能性を再評価し続けています。
同社は収入の中で$と確認した
6.賃貸借証書
はい2017年3月同社は運営施設賃貸契約を締結し、レンタル時間は約
はい2020年8月同社はノースカロライナ州で賃貸契約を締結しました
同社の賃貸支出には短期と可変レンタル部分が含まれている
自分から2022年12月31日期間別のキャンセル不可経営リースでの最低賃貸支払いは以下のように予定されています(千計算)
| 十二月三十一日までの年度 |
||||
| 2023 |
||||
| 2024 |
||||
| 2025 |
||||
| 2026 |
||||
| 将来の最低賃貸支払い総額 |
||||
| 値引き:割引 |
( |
) | ||
| リース総負債 |
$ |
1020達信施設転貸
開ける2021年6月8日当社は1名のテナント(“テナント”)と分譲経営を締結している1020沼施設。所有者から得た最終的な合意と同意は2021年7月13日転貸期間は#年から発効します2021年8月1日続けていきます2024年10月31日主賃貸契約が分譲者の違約によって早期に終了しない限り。テナントも、当社が総借款に応じて分譲物件に占めるべき運営費に等しい額を追加賃貸料として当社に支払わなければなりません注釈当社の今年度までの長期資産減価を招く2022年12月31日今回の転貸に関する賃貸収入は、添付されている総合経営報告書に他の収入を計上する。同社はこの転貸に関する賃貸収入を約#ドルと記録している
将来の基本賃貸料分譲人は分譲期間内に会社に支払うべきです2022年12月31日具体的には以下のとおりである(千単位)
| 十二月三十一日までの年度 |
||||
| 2023 |
||||
| 2024 |
||||
| 合計する |
$ |
7.引受金とその他の事項
購入承諾
同社は,契約製造組織や契約研究組織との手配など,内部と協力計画を組み合わせた方式で研究·開発計画を行っている。同社は、マイルストーン義務を有するライセンス契約と、主に提供されるサービスの義務に基づくサービス契約を含む契約書をこれらの組織と契約している。
正常な業務過程において、同社はある臨床前と臨床研究に関連する各種の会社の購入承諾を行った。
事件があったり
通常の業務過程において、会社は、各種陳述及び保証を含む契約及び協定を締結し、一般賠償を規定する。同社のこれらの合意の下でのリスクは不明であり,以下のクレームに関連しているからである5月.将来的には会社に告発しますが注釈しかし作られました将来支出が発生する可能性があり、当該等の支出を合理的に見積もることができれば、当社はその等の事項について責任を負うべきである
賠償する
当社が改訂及び重述した会社登録証明書及び改訂及び重述された付例によると、当社は高級管理者及び取締役が当社の要求に応じて当該等の身分でサービスしている間、その高級職員及び取締役に対して賠償責任を負うが、何らかの制限を受けなければならない。あったことがある違います。これまで会社には役員と高級社員保険証書がありました5月.未来の請求のために支払われた任意の金額の一部を回収できるようにする。
訴訟を起こす
会社(The Company)5月.通常の業務過程による法的訴訟に時々巻き込まれる。ここにあります未決または脅威進行の法的手続き2022年12月31日.
8.普通株式と普通株式承認証
改訂及び再予約された会社登録証明書は当社に発行することを許可した
同社は将来の発行のために普通株式を以下のように予約している
| 十二月三十一日 |
||||||||
| 2022 |
2021 |
|||||||
| 株式計画に基づいて持分ベースの奨励を支給する |
||||||||
| 株式計画下のオプション行使時に発行する |
||||||||
| 株式承認証(前払い資金と2022年3月31日株式承認証) |
||||||||
| 合計する |
||||||||
市場販売促進計画では
はい2020年9月当社は表Sで棚登録説明書を提出します3米国証券取引委員会が米国証券取引委員会によって発効を宣言されたことに伴い、2020年11月20日(“表S-3”)である。前のページ:2020年9月4日同社はPiper Sandler&Co.とCantor Fitzgeraldと株式割当契約を締結し、会社の普通株の株式を売却し、額面は$
登録された直売製品
関係者取引
開ける2021年2月12日当社はEShelman Venturesと証券購入契約を締結し、発行及び販売について(“発売”)
はい2022年1月当社は関係者EShelman Ventures,LLC(“EShelman Ventures”)と投資協定(“投資協定”)を締結し,投資協定第IV条および第V条の目的のみである。投資協定によるとEShelman Venturesはガンダムの購入に同意しました
開ける2022年4月1日当社は株主特別総会を開催し,当社株主は提案を採決し,“ナスダック上場規則”を採択した5635(二)発行が最も多い
開ける2022年3月31日会社は医療に専念する機関投資家と関連側EShelman Ventures,LLC登録会社の普通株を直接発行する取引を完了し,その取引により会社が発行した
♪the the the
自分から2022年12月31日同社は登録された直接発売に関する未償還普通株式承認証を持っており、詳細は以下の通り
| 株式数 |
行権価格 |
期日まで |
|
| 3,990,025 |
$ |
|
|
| 860,216 |
$ |
|
|
私募株式融資
開ける2022年10月27日会社はすでに新しいバイオテクノロジー投資家、既存の投資家、会社の管理層とある会社の取締役と最終合意に達し、発行と販売の合計
自分から2022年12月31日同社は私募に関する未償還普通株式承認株式証を持っており、詳細は以下の通り
| 防衛を強化する |
株式数 |
行権価格 |
期日まで |
|
| 資金を前払いする |
|
$ |
|
期限が切れない |
| Aシリーズ |
|
$ |
|
2024年4月16日(1) |
| Bシリーズ |
|
$ |
|
2025年7月16日 |
| (1) | これらの株式承認証は,次の日に満了する:(I)15普通株式査定株式数が増加した日から数か月(発生は2023年1月17日)または(Ii)1つは背線段階公表後1ヶ月3白金耐性卵巣癌Procデータ。 |
9.株に基づく奨励
持分激励計画
会社取締役会(以下“取締役会”と略す)と株主が承認した2019持分インセンティブ計画("2019計画、発効日は2019年9月12日♪the the the2019計画はすべての以前の計画の継承と継続で、会社の2014エクイティ·インセンティブ計画とアラヴィ生物は2017持分インセンティブ計画と2010改訂された持分インセンティブ計画(元計画)。自分から2022年12月31日発行可能な普通株式総数2019計画は
会社の株式オプション計画下の活動は以下の通り
| 重みをつける |
||||||||||||||||
| 平均値 |
||||||||||||||||
| 重みをつける |
残り |
骨材 |
||||||||||||||
| 平均値 |
契約書 |
固有の |
||||||||||||||
| 量 |
トレーニングをする |
命 |
価値がある |
|||||||||||||
| 株 |
値段 |
(単位:年) |
(単位:千) |
|||||||||||||
| 残高、2022年1月1日 |
$ | |||||||||||||||
| 付与したオプション |
||||||||||||||||
| オプションはキャンセルされました |
( |
) | ||||||||||||||
| 行使のオプション |
||||||||||||||||
| 残高、2022年12月31日 |
$ | $ | ||||||||||||||
| 未返済は、2022年12月31日に授与される予定です |
$ | $ | ||||||||||||||
| 2022年12月31日から行使可能 |
$ | $ | ||||||||||||||
発行済みオプション、既得オプション、および行使可能オプションの内在的価値は、株式数に期待権価格と普通株式公正価値との差額を乗じることによって決定される。本年度までに行使される株式オプションの内在的価値2021年12月31日はい$です
従業員に株式オプションを付与する
次の年度まで2022年12月31日そして2021,会社は上級管理者,役員,従業員が普通株を購入する株式オプションを付与し,加重平均付与日の公正価値は$とする
自分から2022年12月31日,付与された株式オプションに関する未確認従業員株式報酬総額は$
従業員株式オプションの公正価値は、ブラック·スコアモデルを使用して以下の加重平均仮定の下で推定される
| 十二月三十一日 |
十二月三十一日 |
|||||||
| 2022 |
2021 |
|||||||
| 予想変動率 |
% | % | ||||||
| 無リスク金利 |
% | % | ||||||
| 配当率 |
% | % | ||||||
| 予想寿命(年) |
||||||||
株式オプションの公正価値を決定する
株式オプションを付与する各項目の公正価値は、以下に説明する方法および仮定を用いて当社が決定する。これらの入力のいずれも主観的であり,通常決定するには重大な判断が必要である.
予想変動率予想変動率は、私たちの株式オプションの推定予想期限に適合する、私たちの普通株の最近の歴史的変動率に基づいている
無リスク金利·無リスク金利仮定は、会社の株式オプションの予想期限と一致する米国債ツールに基づく。
配当を期待する·予想配当仮定は、会社の歴史および配当金支払いの予想に基づく。
所期期限--株式オプションの予想期間は、株式オプション予想未償還の加重平均期間を表す。“普通”とされるオプション付与について、当社は、米国証券取引委員会が提供する簡略化方法を用いて期待期限を見積もることを選択した。簡略化された方法は、期待期間をオプションの平均帰属時間および契約期間として計算する。
罰金率-没収は歴史的経験から推定されます。
普通株主公正価値-標的普通株式の公正価値は、ナスダックの見積もりに基づく。
株式に基づく補償費用から推定罰金を差し引いた後、業務報告書に反映される場合は以下のようになります(千計)
| 現在までの年度 |
||||||||
| 十二月三十一日 |
||||||||
| 2022 |
2021 |
|||||||
| 運営費 |
||||||||
| 研究開発 |
$ | $ | ||||||
| 一般と行政 |
||||||||
| 合計する |
$ | $ | ||||||
2014従業員株購入計画
取締役会が通過し、会社の株主が承認し、2014従業員株購入計画(ESPP)は2014年3月ESPPは以下の日に発効します2014年3月20日。
以下の条件を満たす普通株式の最大株式総数5月.各購入期間内にESPPによって発行されたのは
1人の従業員5月.注釈ESPPに従って株を購入する権利が付与され,当該従業員(I)が付与直後に株式を所有する権利を有する場合5%またはそれ以上の総投票権または会社普通株の総価値、または(Ii)ESPPに従って株を購入する権利を保有し、株式を購入する比率が超えるであろう$25,000返済されていない権利が維持されている毎年、私たちの株の価値。
管理人5月.承認継続時間は注釈超過27月和5月.指定1つはまたは各製品でより短い購入期間を提供する。すべての製品は1つはまたはそれ以上の購入日は、この日に発売に参加した従業員のために普通株を購入する。管理者はESPP下の製品条項を自ら決定するだろう。
ESPPは参加者が賃金減額で私たちの普通株の株を購入することを許可して、最高で15%彼らの収入。株式の買い取り価格は注釈少ないです85%私たち普通株の公正時価は1つ目は供物の日や購入の日。ESPP贈与の公正価値はこの年度まではどうでもいい2022年12月31日そして2021それぞれ,である.
10.所得税
年連邦所得税の規定(福祉)2022そして、2021以下の(千単位):
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 現在のところ | ||||||||
| 連邦制 | $ | $ | ||||||
| 状態.状態 | ||||||||
| — | — | |||||||
| 延期する | ||||||||
| 連邦制 | $ | $ | ||||||
| 状態.状態 | ||||||||
| 繰延税金総額 | ||||||||
| 所得税総支出 | $ | $ | ||||||
年間所得税支出2022そして、2021法定連邦税率を税前収益や損失に適用する予想金額とは異なり、以下のようにまとめられる
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 法定税率の連邦税収割引 | % | % | ||||||
| 評価免除額を変更する | % | ( | )% | |||||
| 第三百八十二条制限 | ( | )% | ||||||
| その他差し引かれない費用 | ( | )% | ||||||
| 株に基づく報酬 | ||||||||
| 他にも | ( | )% | % | |||||
| 合計する | ||||||||
繰延所得税は、純営業損失、税額控除及び財務報告のための資産·負債の帳簿金額と所得税用金額との仮差額の税収純影響を反映する。当社の繰延税項目純資産の重要な構成要素2022年12月31日そして2021具体的には以下のとおりである(千単位)
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 営業純損失繰り越し | $ | $ | ||||||
| 研究開発税収控除 | ||||||||
| 資本化研究と開発 | ||||||||
| 株式に基づく報酬やその他 | ||||||||
| 経営リース義務 | ||||||||
| 繰延税金資産総額 | ||||||||
| 減算:推定免税額 | ( | ) | ( | ) | ||||
| 繰延税金負債 | — | — | ||||||
| 経営的リース使用権資産 | ( | ) | ( | ) | ||||
| 繰延税項目純資産 | $ | $ | ||||||
同社の繰延税項目の会計は、その繰延税項目の純資産の現金化に関連するいくつかの要素を評価することに関連している。当社が主に考慮している要因は、経営損失の歴史、当社の繰延税金資産の性質、および当該等の一時的な差異や繰越控除可能な期間内に、将来課税収入の時間、可能性、額(あれば)である。現在その会社には注釈それを信じて注釈繰延税金資産は現金化される;そのため、全額推定準備が設立され、違います。繰延税金資産は添付の総合貸借対照表に記載されている。
推定手当は約#ドル減少した
はい2022年12月31日会社は純営業損失の繰り越しがあり、連邦所得税目的で約$となっている
同社には利益の歴史がなく、その将来の課税収入能力をめぐる不確実性があるため、繰延税純資産は推定手当によって完全に相殺されている。繰延税項資産は主に連邦税純営業損失と税収控除繰越から構成されている。純営業損失と税収繰越の利用5月.第節で定義したように“所有権変更”規則の制限を受ける382国税法(このような制限のいずれか,節382“)”を制限する.類似の規則5月.州税法に基づいて申請する。会社は以下の日付で所有権変更が発生したかどうかを決定するために分析を行った2022年12月31日この分析によると、経営陣は同社が確かに所有権変更を経験していると判断した2022年4月1日これは純営業損失と信用繰越の大幅な減少を招いた。
会社はFASB会計基準に基づいて編集した規定に従っている740-10(ASC)740-10), 所得税における不確実性会計それは.ASC740-10総合財務諸表において確認、計量、列報および開示された納税申告書上で取得されることが予想される不確定税務状況の総合モデルを規定する違います。不確定税務状況に関する負債を総合財務諸表に計上する。はい2022年12月31日そして2021、会社の未確認税収割引準備金は約$
訴訟の時効が決まったから注釈純営業損失と信用繰越が実際に使用される前に、法規は実際にすべての納税年度を開放する。しかし,上記の所有権変更と減価純営業損失と貸記繰越のため,純営業損失と貸記のみが繰り越しした2022年4月1日連邦と州の税金目的のために今後数年に繰り越します。
税収割引が確認されていない期初と期末金額の入金は以下の通り(千計)
| 金額 | ||||
| 2021年1月1日の残高 | $ | |||
| 前年度の納税状況に関する毛増/(減) | ||||
| 今年度のポストに関する増額 | ||||
| 訴訟時効失効に関する未確認税収割引の減少 | ||||
| 2021年12月31日の残高 | $ | |||
| 前年度の納税状況に関する毛増/(減) | ||||
| 今年度のポストに関する増額 | ||||
| 訴訟時効失効に関する未確認税収割引の減少 | ||||
| 2022年12月31日の残高 | $ | |||
すべての納税年度はまだ連邦と州税務当局の審査のために開放されている。
11.従業員福祉計画
支払い計画を確定する
当社は1項目賛助している401(K)適格な従業員が選択可能であることを規定する計画401(K)計画は、資格に適合する補償のいくつかの制限を受ける必要がある。会社(The Company)5月.従業員に合わせて支払う金額は会社が自分で決めます。雇用主は$として資金を供給する
12.普通株1株当たり純損失
以下の表は、会社の普通株株主が1株当たり基本純損失と償却純損失を占めるべき計算方法(単位は千、1株当たりデータを含まない)をまとめた
| 現在までの年度 | ||||||||
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 1株当たりの基本と償却純損失 | $ | ( | ) | $ | ( | ) | ||
| 基本と希釈後の1株当たり純損失の加重平均株数を計算するための | ||||||||
普通株株主が基本純損失を占めるべき計算方法は、普通株株主が純損失を当期発行普通株で割った加重平均であるべきである。加重平均-期内に発行された普通株式の加重平均、会社が発行した事前融資権証の加重平均を含む,それの行使は不可能だ注釈意外な状況の影響を受けて、ほとんど必要か不要か違います。これは一つの考えです。普通株株主が1株当たりの純損失を占めるべき計算方法は:普通株株主は純損失を当期に発行された普通株と希釈性普通株等価物の加重平均で割るべきであり、希釈性普通株に組み入れられていれば、在庫株方法と仮定割引法によって確定する。その会社が報告したから2022年12月31日そして2021その会社はできました希釈普通株等価物があるため、希釈後の1株当たり普通株純損失は同年度の普通株1株当たり純損失とほぼ同じである。
次に提出年度終了時に希薄化作用が生じる可能性のある発行済み証券は、発行済み希釈株式の計算には含まれていない
| 現在までの年度 | ||||||||
| 十二月三十一日 | ||||||||
| 2022 | 2021 | |||||||
| 普通株購入オプション | ||||||||
| 普通株式引受証 | ||||||||
13.後続事件
開ける2023年1月17日Aravive,Inc.社は会社の法定普通株の数、額面$を増加させるために、会社の改訂と再登録証明書の改訂証明書をデラウェア州州務卿に提出した
展示品索引
| 展示品 番号をつける |
説明する |
|
| 1.1 |
株式割当協議は,期日は2020年9月4日であり,Aravive,Inc.,Piper Sandler&Co.とCantor Fitzgerald&Co.(2020年9月4日に米国証券取引委員会に提出されたS-3表登録声明(文書番号333-248612)の第1.1号証拠物を引用して合併する). |
|
| 3.1 |
改訂·再登録された会社証明書(2014年3月26日に米国証券取引委員会に提出された8-K表(文書番号:001-36361)の同じ番号の展示品を参考にして会社に統合されます)。 |
|
| 3.2 |
Versartis,Inc.証明書の改訂·再登録証明書(2017年6月1日に米国証券取引委員会に提出された現在の報告Form 8−K(文書番号:001−36361)の証拠第3.1号を参照することにより)。 |
|
| 3.3 |
Versartis,Inc.証明書の改訂·再登録証明書(2017年9月12日に米国証券取引委員会に提出された現在の報告Form 8−K(文書番号:001−36361)の第3.1号証拠を参考に合併する)。 |
|
| 3.4 |
Versartis,Inc.証明書の改訂および再登録証明書(我々が2018年10月16日に米国証券取引委員会に提出した最新報告8−K表(文書番号001−36361)の証拠第3.1号を参照して本明細書に組み込む)。 |
|
| 3.5 |
Versartis,Inc.証明書の改訂·再登録証明書(2018年10月16日に米国証券取引委員会に提出された現在の報告Form 8−K(文書番号:001−36361)の第3.2号証拠を参考に合併する)。 |
|
| 3.6 |
証明書の修正と再登録証明書(2019年3月15日に米国証券取引委員会に提出したForm 10-K年次報告(文書番号:001-36361)の第3.6番目の証拠品を引用します)。 |
|
|
|
||
| 3.7 |
添付例を改訂及び再編成する。(2014年3月6日に米国証券取引委員会に提出されたS-1表登録説明書添付ファイル3.4(文書番号333-193997)を参照して改訂して本明細書に組み込む)。 |
|
| 3.8 | Versartis,Inc.証明書の改訂と再登録証明書の改訂証明書(ここに統合し、2023年1月18日に米国証券取引委員会に提出された8-K表現在報告(文書番号001-36361)の第3.1号証拠を参照)。 | |
|
|
||
| 4.1 |
株式証明書フォーマット。(2014年3月31日現在の四半期報告書10-Q表(文書番号001-36361)の同じ番号の展示品を引用し、2014年5月14日に米国証券取引委員会に提出された)。 |
|
| 4.2# |
初創証券の概要。 |
|
| 4.3* |
Aravive,Inc.2019年持分インセンティブ計画(2019年8月9日に米国証券取引委員会に提出された付表14 Aの最終委託書の付録Aを引用して組み込む). |
|
| 4.4 | Aravive,Inc.の事前出資普通株購入承認証表(現在報告されている8-K表の添付ファイル4.1を参照することによって本明細書に組み込まれる(文書番号001-36361は、2022年1月4日に米国証券取引委員会に提出される)。 | |
| 10.1* |
改訂されたVersartis 2009株計画。(2014年2月18日に米国証券取引委員会に提出されたS-1表登録声明(文書番号333-193997)の同じ番号証拠を参照して本明細書に組み込む)。 |
|
| 10.2* |
Versartis,Inc.2009年株式計画下の株式オプション付与と奨励的株式オプション合意通知表(これに合併し,2014年2月18日に米国証券取引委員会に提出したS-1表登録声明(文書番号333-193997)の同じ番号展示品を参照). |
|
| 10.3* |
2009年株式計画は、株式オプション通知表および非法定株式オプション協定を付与する。(2014年2月18日に米国証券取引委員会に提出されたS-1表登録声明(文書番号333-193997)の同じ番号証拠を参照して本明細書に組み込む)。 |
|
| 10.4* |
2014持分インセンティブ計画。(2014年3月6日に米国証券取引委員会に提出されたS-1表登録説明書の添付ファイル10.6を参照することにより、改訂された表(文書番号333-193997)が本明細書に組み込まれる)。 |
|
| 10.5* |
Versartis,Inc.2014年株式インセンティブ計画株式オプション付与公告と株式オプション協定(ここに合併し,2014年4月1日に米国証券取引委員会に提出したS-8表登録説明書99.5号ファイル(文書番号333-194949)を参考にする. |
|
| 10.6* |
Versartis,Inc.2014年株式インセンティブ計画制限株式単位付与通知と制限株式単位奨励プロトコル表(これに合わせて、2014年4月17日に米国証券取引委員会に提出された現在の8-Kレポート添付ファイル10.1(ファイル番号001-36361))を参照されたい。 |
|
| 展示品 番号をつける |
説明する |
|
| 10.7* |
Versartis,Inc.により策定された制御権変更審査計画(2014年3月10日に米国証券取引委員会に提出されたS−1表登録声明の10.7号添付ファイル(文書番号333−193997)を参考に合併する)。 |
|
| 10.8* |
2014年度従業員株購入計画。(2014年3月6日に米国証券取引委員会に提出されたS-1表登録説明書の添付ファイル10.9(文書番号333-193997)を参照して改訂して本明細書に組み込む)。 |
|
| 10.9* |
会社とその各役員と上級管理者との間の賠償協定フォーマット。(2014年3月6日に米国証券取引委員会に提出されたS-1表登録説明書の添付ファイル10.10(文書番号333-193997)を参照して改訂して本明細書に組み込む)。 |
|
| 10.10 |
Versartis,Inc.,Velo Merger Sub,Inc.およびAravive Biologics,Inc.が2018年6月3日に署名した合併および組織協定および計画(ここに組み込まれ、現在の8-Kレポートの添付ファイル2.1(2018年6月4日に米国証券取引委員会に提出された第001-36361号ファイルを参照)。 |
|
| 10.11† |
癌研究補助金契約は,2015年12月1日にテキサス州癌予防·研究所がルガ社と締結した(ここで合併し,我々S−4/A表登録声明の添付ファイル10.1(2018年8月24日に米国証券取引委員会に提出された第333−226594号文書を参照)。 |
|
| 10.12† |
独占ライセンス契約は、2012年1月25日、リラン·スタンフォード初級大学取締役会とルガー社(ここで合併し、S-4/A表登録声明の添付ファイル10.2を参照)である(2018年8月24日に米国証券取引委員会に提出された333-226594号文書)。 |
|
| 10.13† |
メリーランド·スタンフォード初級大学取締役会とルガー社の間で2012年7月26日に署名された独占許可協定改正案(ここでは、S-4表登録声明の添付ファイル10.3を参照してください。(2018年8月3日に米国証券取引委員会に提出された333-226594号文書)。 |
|
| 10.14† |
ラン·スタンフォード初級大学取締役会とルガー社の間で2017年9月25日に署名された独占許可協定の改正案第2号(ここでは、S-4表登録声明の添付ファイル10.4を参照してください。(2018年8月3日に米国証券取引委員会に提出された第333-226594号文書)。 |
|
| 10.15† |
ラン·スタンフォード初級大学取締役会とルガー社の間で2017年9月25日に署名された独占許可協定の改正案第3号(ここでは、S-4表登録声明の添付ファイル10.5を参照してください。(2018年8月3日に米国証券取引委員会に提出された333-226594号文書)。 |
|
| 10.16† |
薬明生物(香港)有限会社とAravive Biologics,Inc.(我々S-4/A表登録声明の添付ファイル10.6(2018年8月24日に米国証券取引委員会に提出された第333-226594号文書を参照することにより)は、2016年7月11日の主製造サービス協定である。 |
|
| 10.17† |
薬明生物(香港)有限会社とAravive Biologics,Inc.が2017年12月1日に締結した許可協定(本稿では,我々S−4表登録説明書の添付ファイル10.7(2018年8月3日に米国証券取引委員会に提出された第333−226594号文書)を引用した。 |
|
| 10.18* |
Ruga CorporationとVinay Shahの間で2016年10月17日に署名された賠償協定(ここでは、S-4表登録説明書の添付ファイル10.8を参照してください。(2018年8月3日に米国証券取引委員会に提出された333-226594号文書)。 |
|
| 10.19 |
転貸日は2018年8月21日であり,Versartis,Inc.とEva Automation,Inc.が締結されている(ここで合併し,我々が現在報告している8−K表の添付ファイル10.1(2018年9月20日に米国証券取引委員会に提出された第001−36361号ファイルを参照). |
|
| 10.20* |
Aravive,Inc.2017年株式インセンティブ計画(これに合わせて、2018年10月17日に米国証券取引委員会に提出されたS-8フォーム登録説明書(ファイル番号333-227865)の添付ファイル4.9を参照). |
|
| 10.21* |
改訂されたAravive,Inc.2010年株式インセンティブ計画(これに合わせて、2018年10月17日に米国証券取引委員会に提出されたS-8表登録説明書の添付ファイル4.10(ファイル番号333-227865))を参照します。 |
|
| 展示品 番号をつける |
説明する |
|
| 10.22* |
Aravive Biologics,Inc.とVinay Shahとの間の2018年5月31日の解散費協定とその2018年9月24日の修正案(ここに組み込まれ、現在報告されている表8-Kの添付ファイル10.3(2019年2月12日に米国証券取引委員会に提出された第001-36361号文書を参照). |
|
| 10.23* |
2019年1月3日に改訂されたAravive,Inc.の非従業員役員報酬政策(本稿は、2019年3月15日に米国証券取引委員会に提出された10-Kフォーム年次報告書(文書番号001-36361)の証拠品10.60号を引用して本明細書に組み込む)。 |
|
| 10.24* |
Aravive,Inc.2014年株式インセンティブ計画第1修正案(これに合わせて、現在報告されている8-K表の添付ファイル10.2を参照(2019年3月6日に米国証券取引委員会に提出された第001-36361号文書). |
|
| 10.25* |
Aravive,Inc.2019年株式インセンティブ計画(これに合わせて、2019年9月20日に米国証券取引委員会に提出されたS-8フォーム登録説明書(ファイル番号333-233866)添付ファイル99.1を参照). |
|
| 10.26* |
株式オプション付与通知と株式オプションプロトコル表およびAravive,Inc.2019年インセンティブ計画下での行使通知(これに合併し、2019年9月20日に米国証券取引委員会に提出されたS-8フォーム登録説明書第99.2号ファイル(第333-233866号ファイル)を参照). |
|
| 10.27* |
Vinay ShahとAravive,Inc.の間の招待状は,2020年3月26日(我々が2020年3月27日に提出したForm 10-K年度報告の添付ファイル10.48(ファイル番号001-36361)統合を参照することにより). |
|
| 10.28* |
Gail McIntyreとAravive,Inc.の間で2020年3月26日に発行された招待状(2020年3月27日に提出したForm 10-K年度報告添付ファイル10.49(ファイル番号001-36361)を参考に統合した). |
|
| 10.29* |
“2019年株式インセンティブ計画制限株式単位付与公告及び制限株式単位奨励契約書”フォーマット。(2020年3月27日に提出したForm 10-K年次報告書(ファイル番号001-36361)添付ファイル10.50を参照)。 |
|
| 10.30 |
投資協定は、日付が2020年4月6日であり、Aravive,Inc.,EShelman Ventures,LLCおよび投資協定第4条および第5条の目的のみで、Fredric N.EShelman,Pharm.D.(現在報告されている8-K表の添付ファイル10.1を参照することにより本明細書に組み込まれる(文書番号001-36361、2020年4月9日に米国証券取引委員会に提出)。 |
| 展示品 番号をつける |
説明する |
|
| 10.31* |
Aravive,Inc.とGail McIntyreの間の日付が2020年4月8日の招待状に対する修正案。(これに合わせて、現在報告されている8-K表の添付ファイル10.7(2020年4月9日に米国証券取引委員会に提出された第001-36361号文書)を参照) |
|
| 10.32†† |
Aravive,Inc.および3 D Medicines Inc.が2020年11月6日に署名した協力および許可協定(ここでは、現在報告されている8-Kフォームの添付ファイル10.1(ファイル番号001-36361、2020年11月10日に米国証券取引委員会に提出)を参照) |
|
| 10.33* |
Aravive,Inc.とRay Tabibiazarとの間のコンサルティング契約は、2020年12月31日である(ここで統合し、現在報告されている表8-Kの添付ファイル10.1(ファイル番号001-36361を参照して、2021年1月1日に米国証券取引委員会に提出) |
|
| 10.34* |
Reshma RangwalaとAravive,Inc.の間の招待状は,2020年9月8日(ここで合併し,我々の年次報告書10-K表の添付ファイル10.48(文書番号001-36361,2021年3月16日に米国証券取引委員会に提出)を参照) |
|
| 10.35 | Aravive,Inc.とGail McIntyreの間で2021年1月25日に発行された招待状に対する修正案(ここで合併し,我々が現在報告している表8-Kの添付ファイル10.1(文書番号001-36361,2021年1月27日に米国証券取引委員会に提出)を参照) | |
| 10.36 | Aravive,Inc.とEShelman Ventures,LLCとの間の証券購入契約は,2021年2月12日(ここで合併し,我々が現在報告している8−K表の添付ファイル10.1(2021年2月16日に米国証券取引委員会に提出された第001−36361号文書を参照)) | |
| 10.37 | 2021年6月8日にアラヴィ社と聖杯会社が締結し、アラヴィ社と聖杯会社の間で締結された(ここで合併し、現在報告されている8-K表の添付ファイル10.1(文書番号001-36361、2021年6月14日に米国証券取引委員会に提出)を参照) | |
| 10.38 | 投資協定は,期日は2022年1月3日であり,Aravive,Inc.,EShelman Ventures,LLCによって署名され,投資協定第4条と第5条の目的のみで,フレデリック·N·エゼルマン製薬会社(現在の8−Kレポートの添付ファイル10.1を参照することにより本明細書に組み込まれる(文書番号001−36361,2022年1月4日に米国証券取引委員会に提出) | |
| 10.39* | レナード·スコット·ドフとアラヴィ社の間の招待状は、2022年2月20日、2022年3月22日に施行された(合併は、現在報告されている8-K表の添付ファイル10.1(ファイル番号001-36361、2022年3月22日に米国証券取引委員会に提出)を参照) | |
| 10.40 | 証券購入契約表は、日付が2022年3月29日であり、Aravive,Inc.とその買い手との間で締結される(ここでは、現在報告されている8-K表の添付ファイル10.1(2022年3月31日に米国証券取引委員会に提出された第001-36361号文書を参照)。 | |
| 10.41 | 証券購入契約表は、日付が2022年3月29日であり、Aravive,Inc.とEShelman Ventures,LLC(ここで合併し、我々が現在報告している8−K表の添付ファイル10.1(2022年3月31日に米国証券取引委員会に提出された第001−36361号文書)を参照)。 | |
| 10.42 | Aravive,Inc.とルディ·C·ハワード(Rudy C.Howard)が2022年6月2日に発行した招待状(ここで合併し,我々が現在報告している添付ファイル8-K表10.1(文書番号001-36361,2022年6月3日に米国証券取引委員会に提出)を参照). | |
| 10.43 | コンサルティング契約は、Aravive,Inc.とVinay Shahによって締結され、日付は2022年6月2日である(ここで合併し、現在報告されている8-Kフォームの添付ファイル10.2(2022年6月3日に米国証券取引委員会に提出された第001-36361号ファイルを参照)。 | |
| 10.44 | Aravive,Inc.とVinay Shahの間で2022年6月2日に締結された分離協定および解除協定(ここでは、現在報告されている8-K表の添付ファイル10.3(2022年6月3日に米国証券取引委員会に提出された第001-36361号文書を参照)。 | |
| 10.45 | Aravive,Inc.とRobert B.Geller博士との間の招待状は、2022年6月13日(ここで合併し、現在報告されている添付ファイル8-K(文書番号001-36361、2022年7月5日に米国証券取引委員会に提出)を参照)。 | |
| 10.46 | Aravive,Inc.と当事者との間の付属書簡プロトコルフォーマット(ここに組み込まれ、現在の8−Kレポートの添付ファイル10.2(ファイル番号001−36361を参照して、2022年10月26日に米国証券取引委員会に提出される)。 | |
| 10.47 | Aravive,Inc.とそのBVF投資家側との間の付随的なレタープロトコルのフォーマット(ここに組み込まれ、現在報告されている8−Kフォームの添付ファイル10.3を参照する(2022年10月26日に米国証券取引委員会に提出された第001−36361号ファイル)。 | |
| 10.48 | Aravive,Inc.と当事者との間の登録権プロトコル表(本明細書に組み込まれ、現在の8−K表の添付ファイル10.4を参照する(2022年10月26日に米国証券取引委員会に提出された第001−36361号文書)。 | |
| 10.49 | 関連登録権プロトコル表は、Aravive,Inc.およびその当事者の間で提供される(ここに組み込まれ、現在報告されている8−K表の添付ファイル10.5(2022年10月26日に米国証券取引委員会に提出された第001−36361号文書を参照)。 | |
| 10.50 | Aravive,Inc.と買い手の間で2022年10月24日に発行された証券購入プロトコルテーブル(本明細書では、現在報告されている8−K/Aテーブルの添付ファイル10.1を参照することによって本明細書に組み込まれる(ファイル番号001−36361は、2022年10月28日に米国証券取引委員会に提出される)。 | |
| 10.51 | 修正案第3号は,Aravive,Inc.とGail McIntyre,Ph.D.が2023年2月1日に発行した要約状(我々の現在の報告におけるForm 8−Kに関する添付ファイル10.1を引用することにより本明細書に組み込まれる(文書番号001−36361,2023年2月6日に米国証券取引委員会に提出される)。 | |
| 10.52 | 第1号修正案は、Aravive,Inc.とルディ·ハワードが2023年2月1日に発行または間の要項(ここで統合し、現在報告されている表8-Kの添付ファイル10.2(文書番号001-36361、2023年2月6日に米国証券取引委員会に提出)を参照)。 | |
| 10.53 | 修正案第1号は,Aravive,Inc.とRobert Geller,M.D.の間およびAravive,Inc.によって2023年2月1日に発行された要約状(我々の現在の報告におけるForm 8−Kに関する添付ファイル10.3を参照することにより本明細書に組み込まれる(文書番号001−36361,2023年2月6日に米国証券取引委員会に提出される)。 | |
| 10.54 | 第1号修正案は,Aravive,Inc.とLeonard Scott Dove,Ph.の間で発行された2023年2月1日の要約状(我々の現在の報告におけるForm 8−Kに関する添付ファイル10.4を引用することにより本稿に組み込まれる(文書番号001−36361,2023年2月6日に米国証券取引委員会に提出される)。 | |
| 21.1# |
子会社リスト。 |
|
| 23.1# |
BDO USA,LLPは同意する. |
|
| 24.1# |
授権書(本文書の署名ページに含まれる). |
|
| 31.1# |
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
| 31.2# |
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
| 32.1# |
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条に規定されている最高経営責任者証明書。 |
|
| 32.2# |
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による首席財務官の認証。 |
|
| 101.INS |
XBRLインスタンスドキュメントを連結する |
|
| 101.書院 |
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
| 101.カール |
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
| 101.def |
インラインXBRL分類拡張Linkbase文書を定義する |
|
| 101.介護会 |
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
||
| 101.Pre |
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
| 104 | 表紙相互データファイル(内蔵XBRLに埋め込まれ、添付ファイル101に含まれる) | |
| # |
同封アーカイブ |
| † |
登録者たちはこの協定のいくつかの部分の秘密待遇を与えられた。漏れた部分は米国証券取引委員会に個別に提出された。 |
| †† |
S-K条例第601(B)(10)項によれば、登録者は本展示品の一部を見落としている。会社は、これらの展示品の編集されていないコピーをアメリカ証券取引委員会に提供することを要求しなければならない。 |
| * |
契約または補償計画を管理すること。 |
サイン
改正された1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、正式に許可された以下の署名者が代表して本報告書に署名することを正式に手配している
| アラビフ社 |
||||
| 日付:2023年3月15日 |
差出人: |
/s/ゲイル·マッキンタール |
||
| ゲイル·マッキントソール |
||||
| 最高経営責任者 (首席行政主任) |
||||
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
授権依頼書
私はすべての人が、次のように署名することを知っています:ゲイル·マッキンドールとウィネ·シャア、そして彼らのすべての人、彼ら一人一人、彼の真の合法的な事実代理人と代理人は、十分な代替と再代理の権力を持っていて、任意とすべての身分で、彼の名義、場所と代理で、本報告書の任意およびすべての修正に署名し、その中のすべての証拠品とそれに関連する他の文書、アメリカ証券取引委員会と共に、上記の事実代理人と代理人、そして彼ら一人一人に授与します。これに関連するすべての必要かつ必要なものおよび事項を決定し、実行する権利が完全にあり、その可能性または自ら行うことができるすべての意図および目的を尽くし、本明細書で上述したすべての事実弁護士および代理人、または彼らのいずれか、または彼らまたは彼らの代替者または代替者を承認し、確認することができ、本条例によって行われたすべてのことを合法的に行うことができるか、または結果として、すべてのことを行うことができる。
| サイン: |
タイトル: |
日付: |
|||
| ゲイル·マッキントタール: |
取締役CEO兼最高経営責任者 |
2023年3月15日 | |||
| ゲイル·マッキントソール |
(首席行政主任) | ||||
| ルディ·ハワード:彼は言いました |
首席財務官 |
2023年3月15日 | |||
| ルディ·ハワード |
(最高財務官& 首席会計官) |
||||
| フレデリック·N·エゼルマン製薬会社 |
役員.取締役 |
2023年3月15日 | |||
| フレデリック·N·エゼルマン製薬会社です |
(取締役会執行議長) |
||||
| アマト·ジャシア博士は米国の大学を卒業した |
役員.取締役 |
2023年3月15日 | |||
| アマト·ジャシア博士です |
|||||
| “ウォールストリートジャーナル”マイケル·W·ロジャース |
役員.取締役 |
2023年3月15日 | |||
| マイケル·W·ロジャース |
|||||
| /s/* |
役員.取締役 |
2023年3月15日 | |||
| エリック·チャン |
|||||
| /s/Sigurd C.Kirkおよび |
役員.取締役 |
2023年3月15日 | |||
| シグルド·C·カーク |
|||||
| アメリカの医学博士ジョン·A·ホーネックは言いました |
役員.取締役 | 2023年3月15日 | |||
| ジョン·A·ホーネク医学博士 |
|||||
| 何俊仁医学博士 |
役員.取締役 |
2023年3月15日 | |||
| 何俊仁、医学博士、博士。 |