
v
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15(D)条に基づいて提出された |
手数料書類番号
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引 記号 |
|
登録された各取引所の名称 |
|
|
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法第405条に規定する有名な経験豊富な発行者である場合は、再選択マークで表示してください。はい。☐
登録者がこの法第13又は15(D)条に従って報告書を提出する必要がないか否かを、再選択マークで示す。はいES ☐
登録者が(1)過去12ヶ月以内(または登録者がそのような報告を提出する必要があるより短い期間)に1934年の証券取引法第13条または15(D)条に提出されたすべての報告書を再選択マークで示すかどうか、および(2)このような提出要求を過去90日以内に遵守してきた
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバ |
|
☐ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|||
|
☒ |
|
規模の小さい報告会社 |
|
||
|
|
|
|
|
|
|
新興成長型会社 |
|
|
|
|
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表を複選マークで表す
申告に含まれる財務諸表は、以前に発表された財務諸表の誤り訂正を反映している
これらのエラーのより真ん中に何か再記述が必要かどうかをチェックマークで示しますインセンティブに基づく回復分析が必要です
第240.10 D-1(B)節によれば、登録者のいずれかのCER幹部は、関連回復中に受信した補償を受ける
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい違います
登録者普通株2022年6月30日のナスダック資本市場における終値計算によると、登録者非関連会社が保有する投票権及び無投票権普通株の総時価は
登録者2023年3月24日現在の発行済み普通株式数かつては…
引用で編入された書類
ない。
カタログ表
|
|
ページ |
第1部 |
|
|
第1項。 |
業務.業務 |
3 |
第1 A項。 |
リスク要因 |
35 |
項目1 B。 |
未解決従業員意見 |
76 |
第二項です。 |
属性 |
76 |
第三項です。 |
法律訴訟 |
77 |
第四項です。 |
炭鉱安全情報開示 |
77 |
|
|
|
第II部 |
|
|
五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
78 |
第六項です。 |
選定された財務データ |
78 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
79 |
第七A項。 |
市場リスクの定量的·定性的開示について |
88 |
第八項です。 |
財務諸表と補足データ |
F-1 |
第九項です。 |
会計と財務情報開示の変更と相違 |
86 |
第9条。 |
制御とプログラム |
86 |
プロジェクト9 B。 |
その他の情報 |
86 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
86 |
|
|
|
第三部 |
|
|
第10項。 |
役員·幹部と会社の管理 |
87 |
第十一項。 |
役員報酬 |
94 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
110 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
112 |
14項です。 |
最高料金とサービス |
114 |
|
|
|
第4部 |
|
|
第十五項。 |
展示·財務諸表明細書 |
116 |
第十六項。 |
表格10-Kの概要 |
118 |
1
第1部
前向き陳述に関する特別説明
この10-K表の年次報告又は(本“年次報告”)には、改正された1933年証券法(“証券法”)第27 A節及び改正された1934年証券取引法(“取引法”)第21 E節の安全港条項に基づいて作成された“前向き陳述”が含まれている。本年度報告では歴史的事実に関する陳述を除き,他のすべての陳述は前向き陳述である。私たちの前向きな陳述は、未来に対する私たちまたは私たちの管理チームの期待、希望、信念、意図、または戦略に関する陳述を含むが、これらに限定されない。さらに、未来のイベントまたは状況を言及する任意の予測、予測、または他の特徴は、任意の基本的な仮定を含む任意の陳述であり、前向きな陳述である。用語“予想”、“信じる”、“考慮”、“継続”、“可能”、“推定”、“予想”、“予定”、“可能”、“可能”、“計画”、“可能”、“潜在”、“予測”、“プロジェクト”、“すべき”、“会する”、“会する”、および同様の表現は、前向き陳述を識別することができる。しかし、このような言葉がないということは声明が展望性を持っていないということを意味するわけではない。
前向き陳述は、会社及びその経営陣の現在の予想に基づいて、環境及びその潜在的な影響の不確定性と変化の影響を固有に受け、この陳述発表の日にのみ発表される。未来の状況の発展が予想されるという保証はない。これらの前向き陳述は、多くのリスク、不確実性、または他の仮定に関連し、これらのリスク、不確実性、または他の仮定は、実際の結果または表現が、これらの前向き陳述の明示的または暗示的なものとは大きく異なる可能性がある。これらのリスクと不確実性は含まれているが、これらに限定されない
2
本年度報告に含まれる展望的陳述は、会社とその経営陣が将来の発展及び私たちに与える潜在的な影響の現在の期待と信念に基づいて、環境不確定性と変化の影響を固有に受けている。私たちの未来の状況に影響を及ぼすことが私たちが期待していることに影響を与える保証はない。これらの展望的陳述は、多くのリスク、不確実性(その中のいくつかは私たちが制御できない)または他の仮定に関連し、実際の結果または表現は、これらの前向き陳述の明示的または暗示とは大きく異なる可能性がある。これらのリスク·不確定要因は、第1部1 A項“本年度報告におけるリスク要因”に記載されている要因を含むが、これらに限定されない。これらのリスクまたは不確実性のうちの1つまたは複数が現実になった場合、または私たちの任意の仮定が正しくないことが証明された場合、実際の結果は、これらの前向き陳述で予測された結果とは重大な点で異なる可能性がある。その中のいくつかのリスクと不確定性は未来に全世界の経済と政治発展及び新冠肺炎の疫病によって増幅される可能性があり、もっと多くの私たちはどうでもいい或いは未知のリスクがあると思うかもしれない。このようなすべての危険を予測したり識別することは不可能だ。本年度報告書の展望的な陳述はただその陳述の日付だけを代表する。私たちは、適用される証券法が私たちにそうすることを要求しない限り、新しい情報、未来の事件、または他の理由でも、どんな前向きな陳述を更新または修正する義務も負いません。
プロジェクト1.ビジネス
概要
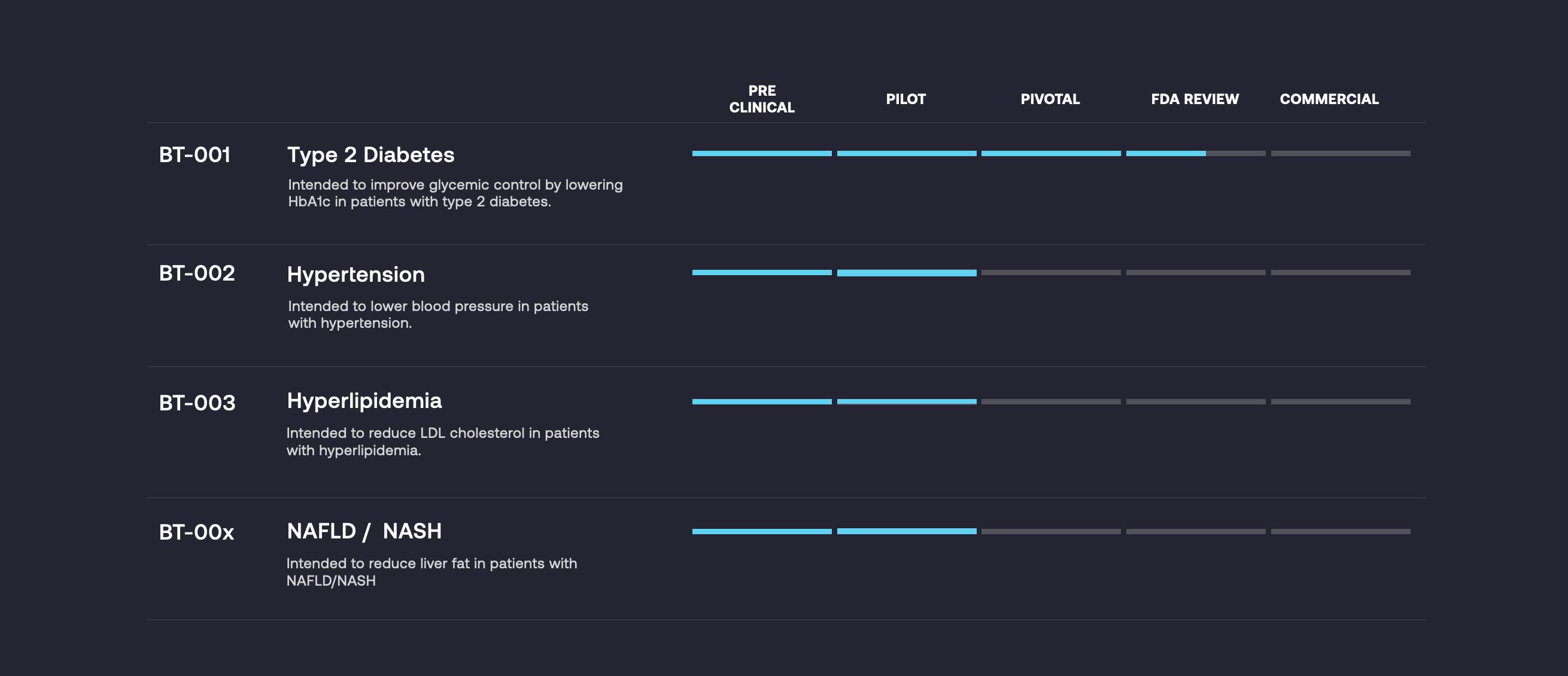
著者らは処方デジタル治療会社であり、臨床検証されたソフトウェアに基づく新しいCBTを開発し、心臓代謝性疾患(CMDX)の根本的な原因を解決する。私たちの使命は行動変化の力によって人間の健康を促進することだ。我々はFDA規制のソフトウェアに基づくPDT特許プラットフォームを開発し,心臓代謝性疾患の根本的な原因を解決することでこれらの疾患を治療している。われわれの最初の研究開発の重点は2型糖尿病(T 2 D),高血圧,高脂血症,非アルコール性脂肪性肝疾患(NAFLD),非アルコール性脂肪性肝炎(NASH)と慢性腎臓疾患(CKD)である。私たちは2015年に設立され、幹部が指導し、数十億ドルの業務を設立した記録を持ち、開発と商業化治療の面で豊富な業界経験を持っている。
私たちは心臓代謝性疾患を私たちの初期目標市場として選択したのは、それらは1)生活様式行為を共通の根本的な原因とし、私たちのプラットフォームを多種の関連疾病に迅速に拡張させる可能性があるため、2)最も普遍的かつ最も高価な慢性病の列にランクインし、これらの慢性病は基本的に可逆的かつ予防可能であり、変革性影響を与える機会を提供した、3)重大な満たされていない需要領域を代表しており、現在の薬物は主に治療症状であり、根本的な原因を解決するのではなく、時間の経過とともに、疾病の進展とより高価な医療干与を招くことが多いからである。
われわれが臨床検証したPDTは医師が処方し,従来の薬物のように支払者が精算することを目的としている。我々のPDTに埋め込まれた行動パターンは,我々が治療を求める疾患を引き起こす特定の行動に対する新しいCBT形式である。われわれの光線力学療法が提供するCBTは,脳の神経経路を変化させ,行動の持続的な変化を可能にすることを目的としている。
3
著者らの主要なPDT候補製品BT-001は2022年7月に一流の開放ラベル、ランダム、対照、平行グループの臨床試験を完成し、T 2 D患者の治療に応用し、そしてその主要と副次的な終点及び多くの探索性終点を満たすことに成功した。私たちは提出しました初めからやり直す2022年9月にFDAに分類要求を提出し、成人T 2 D患者の治療のためのBT-001のマーケティング許可を求め、2022年10月、FDAは私たちの初めからやり直す分類要求は実質的な検討のために受け入れられた。著者らの一部のデータは2022年10月の同業者評議定期刊行物“糖尿病看護”に発表された。典型的な初めからやり直す審査過程は我々が予想したように,2023年2月,FDAからより多くの情報の提供を要求され,我々が提出した材料を審査した後,FDAはより多くの情報を提供する必要があると決定したことを通知した.この手紙は,我々が提出した材料には多くの欠陥があり,重大な欠陥と副次的な欠陥に分類されるFDAの観点を概説している。私たちは、指摘されたいくつかの主要な欠陥を明らかにし、これらの問題を解決するための選択について指導を求めるためにFDAとの会議を要求する。その会議も2月に行われた。会期中、FDAは有益な背景、明確化、そして指導を提供し、私たちは今FDAのコメントに答えるために私たちの反応をまとめている。私たちはFDAの問題を解決できると信じており、私たちがこれまで提供してきた指導意見は変わらない、すなわちFDAは2023年に決定を下すことが予想される。もし私たちがこれらの不足を解決できない場合、私たちは許可を求めている使用適応を修正する必要があるかもしれないし、および/または別の臨床試験を行う必要があり、BT-001の許可および商業発売は著しく延期または許可が拒否される可能性があるかもしれない。
われわれのLivVita研究も積極的なトップライン結果を得ており,史上初の臨床研究であり,われわれがデジタル配信したCBTをNAFLDやNASHの潜在療法としての可能性を評価し,肝臓脂肪の低下と肝疾患バイオマーカーの改善を行った。現在,FDAはこれらの疾患の治療法を承認しておらず,これらの疾患は米国人の4分の1に影響し,毎年約1000億ドルの直接医療コストをもたらしている。満たされていない医療ニーズが多いため,2023年上半期にCBTのこれらの適応に基づく研究的治療プラットフォームのための画期的な設備指定をFDAに申請する予定である。我々は,この研究のデータとBT−001キー試験の探索的終点を用いて,T 2 D以外のCMDX適応におけるFDAの認可を支援するための追加的なキー試験の起動が可能な情報を提供する予定である。
私たちはPDT領域のいくつかの重要な側面が他の会社とは異なり、これらの側面は、以前に承認されたPDTよりも良い商業的業績と最高収入をもたらす可能性があると信じている:1)私たちは心臓代謝性疾患に集中しており、T 2 Dは私たちの主要な適応として、私たちは重大に満たされていない医療需要を有する非常に大きな患者集団を狙っている;2)私たちの研究PDTは、現在の糖尿病治療の臨床ガイドラインが治療の基礎であることを強調し、既存の治療例に適合した治療介入を提供することを目的としている。3)われわれが提案した療法は多大な健康経済効果をもたらす可能性があり,われわれPDTの使用は支払者の収益性を向上させる可能性がある,4)開発と商業化療法の面で豊富な業界経験を有するチームを有している。また,我々の内部で開発された新しいCBTは,デジタル治療分野でCBTの原則を取り入れた他の方法とは異なると信じている。
BT−001の臨床試験は,これまで光線力学療法に対する最大規模の無作為対照研究であり,体重指数25 mg/mの多様化した全国代表的な患者668名が組み込まれている2, 晩期と治療困難なT 2 Dは,平均ベースラインA 1 cは8.1%であった。試験参加者は長期(平均11年)、T 2 Dコントロールが良くなく、心血管リスクが高く、多種の合併症、多種の血糖降下薬物は1つの治療困難な患者群を代表した。研究が開始される前に,我々はいくつかの正式な会議インタラクションの中でFDAと実験設計の核心面を検討した.これらの本格的な会議インタラクションにおいて,適切な終点はBT−001群A 1 cの平均変化が対照群の平均変化に対して決定した臨床的意義のあるA 1 c変化であるとFDAと一致した。これらの議論の後、参加者は、BT−001の使用または使用しない標準ケア(“SOC”)をランダムに受け入れることが決定され、主要および副次的な治療効果の終点は、90日および180日におけるA 1 cの平均変化とベースラインとの差である。この研究のモチベーションは,Bt−001と対照群との間にA 1 cの0.4%以上の変化が90日で検出され,統計学的に有意な変化が認められたことである(p
4
われわれのBT−001臨床試験は主要と副次的終点ともに統計的に有意かつ臨床的に有意な変化を得た。主要な治療効果の終点は治療90日後の糖化ヘモグロビンの平均変化とベースラインの差異である。BT−001は主要終点に達し,対照群と比較してA 1 cは統計学的に有意に改善(−0.4%,n=610,p)した
LivVita研究は著者らが有力な肝臓臨床研究センターアリゾナ州肝臓健康センターと協力して行ったものであり、著者らの臨床研究はNAFLDとNASHの潜在療法としてデジタル配信されたCBTの可能性を評価した。この片腕介入コホート研究は22名の患者を募集し,CBTによる90日間の治療プラットフォームを獲得した。この臨床研究はその主要な終点に達し,統計的に有意な陽性信号を示し,意向治療群(n=19)では磁気共鳴イメージング−プロトン密度脂肪スコア(“MRI−PDFF”)の平均が相対的に16%減少した(p=0.01)。また、臨床研究により:(I)アラニントランスアミナーゼ(ALT)は平均-17 IU/L低下し(p=0.002)、(Ii)FAST採点は平均20%(p=0.10)、(Iii)深刻な有害事象或いは設備に関連する有害事象がなく、(Iv)患者の治療に対する高い参加度と満足度、純Promoter採点+75,94%の被験者は90日後もこのアプリを使用している。NAFLDとNASHは米国で8000万人を超える成人に影響を与え,年間1000億ドルを超える直接医療コストを招いている。FDAが承認したNAFLDやNASHに対する治療法は現在のところない。
BT−001によるT 2 D治療に関する長期有効性と医療利用変化を評価するために,実世界のエビデンス研究も開始した。このランダム,対照,多点の研究では,患者を募集して少なくとも12カ月の治療を行う予定である。糖化ヘモグロビンと医療資源利用の変化を評価し,通常の看護と比較した。十分な数の患者が180日間の漸増治療を完了すると、中期研究結果は2023年第4四半期に報告される予定である。この研究は,支払者や提供者に実世界環境における使用や結果に関する長期データを提供することを目的としている.
我々はすでに代表的な支払人グループが私たちの主要な候補製品を精算する可能性について初歩的な市場研究を行い、時間の経過とともに、FDAのマーケティング許可により、広範な精算範囲を構築できると信じている。これらの発見は,Xcenda,L.L.C(“Xcenda”)によって行われ,2022年10月に開催されるAMCP Nexus会議(“AMCP”)で提案された研究のような,より大規模な独立研究のさらなる支持を得ている。
我々が利害関係者に提示する価値主張の基本的な要素は,
5
現在の治療パラダイムの不足点
米国は大規模で悪化している持続不可能な医療危機に陥っている。半世紀以来,CMDXの流行と米国の医療支出は上昇傾向にあった。このような大きな危機は遺伝などの単一要素だけによるものではない。デジタル娯楽の到来、私たちの食事の変化、そして他の社会的決定要素が役割を果たしている。
アメリカの医療支出とCMDXの流行

処方薬によるCMDX治療は症状を緩和することができ,場合によっては疾患の進行をコントロールすることも可能である。しかし、薬物は通常根本的な原因を解決できず、根本的な原因は主に行為面である。科学界と医学界はすでに明確な共通認識を達成し、即ち不良飲食、運動不足とその他の生活様式要素はCMDXに関連する発病、併存と死亡を招いた。米国では,3種類のCMDX,T 2 D,高血圧,高脂血症だけで1000億ドルを超える処方薬支出を占めているが,これらは根本的な原因を解決していない。
米国では3700万人がT 2 Dを患っていると推定されている。また、アメリカでは9600万人が前糖尿病を患っており、その70%は生きている間にT 2 Dに発展すると予測されている。2017年、米国のT 2 D治療の年間直接医療コストは2370億ドルを超え、2012年以来610億ドル増加した。2030年までに、このような費用は4720億ドルに増加すると予想される。
薬物治療で進展したにもかかわらず、アメリカのT 2 D患者の約半分は血糖コントロール(すなわちA 1 c)を実現していない
6
食事モードと運動を含む行動、T 2 Dと他の心臓代謝疾患の発展と進展における作用はすでによく実証されている。これらの行為は、強力な社会規範と文化強化の観念によって創造され、強化されているため、変化を抵抗する要素を決定する。CBTを用いてこれらの行為に直接対応することは,質の高いCMDX看護を実現するための重要な手段である。患者にとって残念ながら,米国衛生システムは組織されておらず,必要な規模で包括的なCBTを提供している。臨床ガイドラインは医療保健提供者が行為の変化を促進することを提案してきたが、彼らはよく患者に有効な行為療法を提供或いは処方する能力がない。
そのため,CMDXの治療や関連医療支出の制御には,まだ満足されていない需要が多い。この問題を解決するためには,その根本的な原因に注目し,これまでCMDX行動矯正療法がほぼ完全に欠けていた問題を解決しなければならないと考えられる。
私たちの解決策は
著者らは医学、行為科学とデータ科学を結合し、臨床検証を経たソフトウェアに基づく治療プラットフォームを開発し、大規模な行為変化を目標とした。我々のプラットフォームは、CMDXの根本的な原因を解決するために、アプリケーションによってCBT患者の治療をデジタル的に提供することを目的として、複数のPDTを作成することを可能にする。FDAの認可を受けると,我々のPDTは医師が処方し,医療保険提供者が精算する。
CBTは不安障害や強迫症などの精神疾患を治療するために最初に開発された治療例である。従来のCBTは、行動反応を生じるコア信念を識別および変化させることによって、非生産的または悪影響を及ぼす場合(不良行為に適応する)の行動反応を是正することを目的としている。それ以来,CMDXを含む様々な慢性疾患への応用に成功し,全体的な耐性が良好に観察され,単独でも他の療法との併用でも持続的な治療効果を提供する可能性がある。現在の実践において,CBTは受容と承諾療法,弁証法的行動療法,正念に基づく認知療法を含む数十年来発展してきた一連の療法を代表している。
著者らは上述の危機に対する解決方案は著者らがT 2 Dと他のCMDX患者のために開発した新しい行為療法であり、専ら飲食モードと関連生活様式の行為を駆動する認知モードと心理構造を設計する。
CBTシステムは認知構造,行動習慣,情緒パターン,対応スキルを目指しており,これらは特定の文化的食行動の基礎である。著者らの新しいCBTの内容と交付機序は第一原則の内部から開発され、臨床医師-健康コーチ-患者の相互作用の経験を利用して、飲食と生活様式に関連するよく見られる適応不良思考と信念を精製する。それはデジタル交付の治療方法として設計されているため、大量の患者に広く伝播することができるが、人工知能(AI)駆動のフィードバックサイクルを用いて個別患者を個性化する。
我々のPDTはCBTを大規模に提供し,看護面のこの重要なギャップを埋めることができる。広く採用されるためには,有効なPDTは医療提供者が処方し,従来の処方薬のように支払者が精算する必要があると考えられる。これにより、デジタルセラピストは、患者−提供者関係において確立された信頼を利用して強化し、看護の推進を支援するために、提供者および患者に操作可能なデータを提供することができる。
著者らのPDTは患者がその一次保健提供者の指導の下で使用することを目的とし、そして現有の臨床ガイドライン中の1つの重要な空白を埋める可能性がある。我々の最初のPDT候補薬BT−001がFDAの許可を得た場合、根本的な原因となる行動によって成人T 2 D患者の血糖コントロールを改善することを意図しており、患者の医師は、時間の経過とともにこれらの慢性疾患を治療する処方薬の持続的な需要を最終的に減少または除去する可能性がある。我々の目標は,まずT 2 Dの商業化を実現することであり,我々の治療プラットフォームを迅速に有効に利用して,より多くのCMDXに対するPDTを作成することができ,CMDXが現在持続不可能で増加している人的·金銭的コストの低減を支援する上で重要な役割を果たすことが納得できる機会を見た。
私たちのプラットフォームは
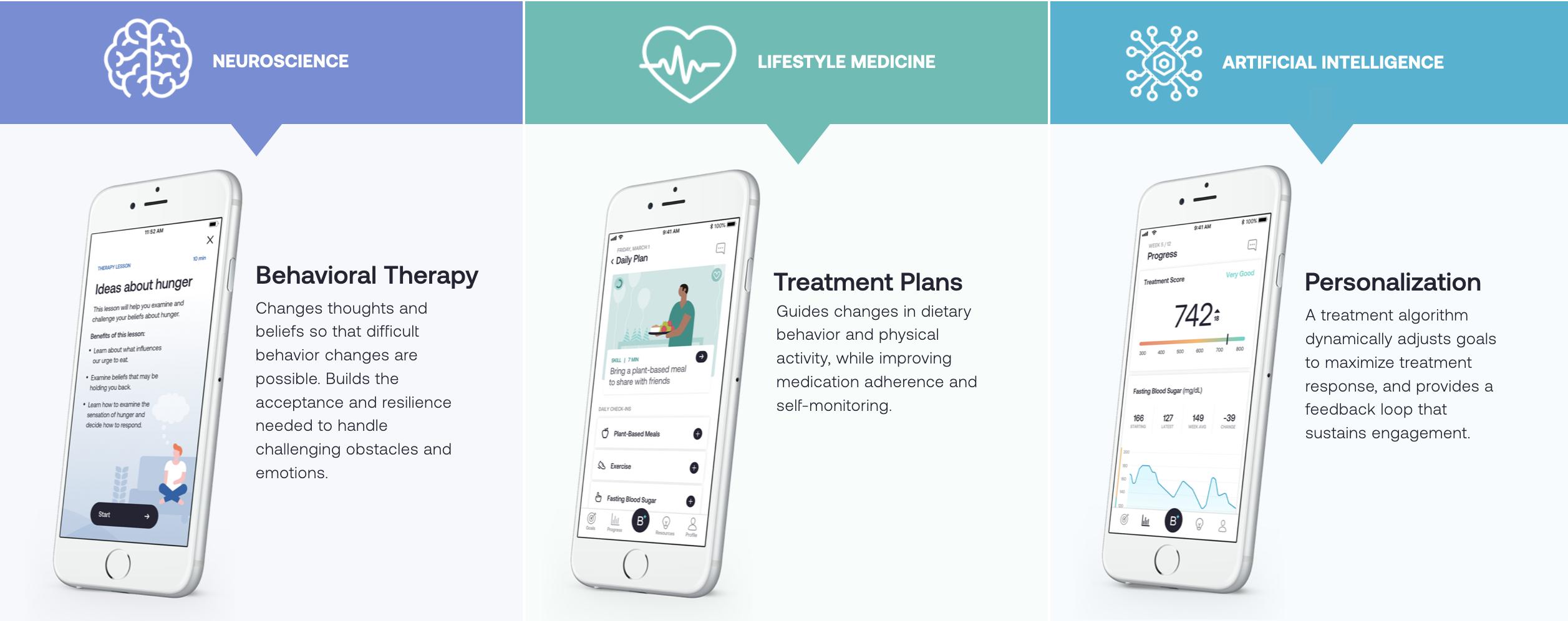
我々のプラットフォームがFDA認可と発売された製品の生産に成功すれば,より多くのPDTの発見と開発を支援することができ,これらのPDTはCBTを用いたCMDX治療の臨床開発を進めることができると信じている。このプラットフォームは3つの統合コンポーネントから構成される。
7
行為療法.このプラットフォームの行動治療コンポーネントは授業、技能育成モジュール、目標設定メカニズムを含む。これらのコンポーネントは患者にCBTの速度と順序を提供し、個人の治療結果を最大限に高めることを目的としている。これらは行動を推進する考え方,信念,期待であり,これらの行為はCMDXの根本的な原因であり,脳の神経経路を変化させ,持続的な行動変化を行う障害を減少または除去するのに役立つ。FDAが許可すれば,我々の研究的PDT BT−001は,26本の治療コースを含むT 2 Dの治療を目指しており,約週1節の速度で完成する予定である。1時間あたりの治療授業は5分から20分かかります。授業ごとに関連するのは技能育成モジュールであり,治療授業内容を日常生活で実用化できるようにした。BT−001には96個の技能培養モジュールがあり,患者は自己指導に基づいて参加している。
治療計画.毎日治療計画は患者が参加する主要なインターフェースである。それは飲食と運動の変化を日常と毎週の目標と一致させ、処方薬の服用を堅持することを奨励し、疾病の生物特徴を自己監視することができる。短い、毎日の自己報告の行為と生物特徴測定を著者らの治療アルゴリズムの入力とした。
個性化.我々は、人工知能、またはAIを使用して、私たちのアルゴリズムに予めプログラムされ、各患者の参加度と投入に応じて、目標を調整し、各患者のための治療計画を個性化する。遠隔モニタリングのアプリケーション参加データ、自己報告の測定、および患者特定の健康データは、私たちの独自治療アルゴリズムの主な入力とした。著者らはまたゲーム化と各種フィードバック機序を用いて進展を奨励し、持続的な使用を奨励し、そして可視化行為の変化が疾病状態の主要な測定基準に与える影響を観察した。
私たちのプラットフォームの起動、開発、検証
私たちは2015年に私たちのプラットフォームを開発し始めました。まず、臨床証拠に基づく有効かつ持続的な行動変化を支援するために重要と考えられる機能です。反復と可用性テストのサイクルを通じて、著者らはプラットフォームを最低準備状態にアップし、ソフトウェアを取締役会で認証された医師が指導した健康コーチとペアリングし、異なるCMDX患者群で研究を行った。これらの早期の実行可能性研究により、臨床潜在力は糖尿病と高血圧を治療する常用処方薬に相当することが示唆された。これらの早期研究からのデータは同業者の審査を経て医学定期刊行物に発表され(製品候補-BT-001-糖尿病;高血圧の問題、解決方案と市場機会を参照)、そして純ソフトウェア配置の更なる開発に参考を提供した。このプラットフォーム上に出現した最初の純ソフトウェア候補製品BT-001はコントロールされていないT 2 D患者において試験的な研究を行い、BT-001の使用は血糖コントロールにおいて臨床的に意義のある改善を産生したことを表明した。パイロット研究のデータは2020年の内分泌大会で発表された。その後,BT−001はこれまでに行われてきた最大規模のPDT無作為対照臨床試験で試験を行った(候補製品BT−001の問題,解決策と市場機会−BT−001−糖尿病−キー試験参照)。これらのデータを私たちの初めからやり直す食品医薬品局に分類請求をする。
8
包括的な持続可能な製品開発枠組みを構築するために,厳しい製品開発手順とプロセスを堅持し,商業的に拡張可能な品質管理システム(“QMS”)に記録した.これにより,柔軟なソフトウェア開発プロセスを採用し,最高レベルの製品革新を実現するとともに,一致した製品品質と患者の安全確保を助けることができると信じている。
私たちの品質管理システムの基本的な要素は、制御とリスク管理プログラムを設計することです
プラットフォームの優位性
CMDXは共通の根本的な原因を持っているが,我々のプラットフォームはこれらの問題を解決することを目指しているため,我々の主要PDT候補BT−001を比較的小さく変更すれば,他のCMDXを治療するための製品を開発できると信じている。これは製品開発時間と費用を大幅に減らすだろう。我々はさらに,どのPDT上での学習や改善もプラットフォーム全体で機能すると信じている.また,多くのCMDXが他のCMDXと併存しているため(例えば,糖尿病と診断された患者も通常心臓病と診断される),1つの研究により複数の疾患に関する有効性データを収集することができる。2022年10月、BT-001はFDAによって上場許可の実質的な審査を受けた。これはFDAを通じて提出された最初の候補品です初めからやり直す分類過程。以下の方法でBT-001マーケティング許可を取得すれば、510(K)プロセスで後続製品を申請し、商業化する予定です初めからやり直す分類過程。510(K)プロセスは、一般に、より短い上場前審査期間を必要とする。
これらの効率のため、私たちはアメリカのいくつかの最も流行している疾病を治療するための一連のPDTを開発する潜在力があると信じているが、時間とコストは伝統的な療法の一部しかない。
市場のチャンス
2016年,同社プラットフォームが解決可能なCMDXによる直接年度医療コストは約4900億ドルであった。全体的には,直接医療費の約30%が薬物に関連しているが,T 2 Dでは薬物に関する部分が約43%である。ミルケン研究所のデータによると、2016年に米国が指示通りに計算した直接医療総コストは以下のようになる
9
私たちのパイプは
多様な候補製品を迅速に開発し,FDAの認可を得て商業化する予定である。著者らの臨床開発と監督戦略は前向きに一連の関連した、高い価値の製品を提供し、もしFDAの許可を得たら、これらの製品は伝統的な分子治療会社とは異なる。従来療法とは異なり,従来療法は離散的かつ連続的なI,II,III期試験が必要であり,その後長い規制審査過程が必要であり,われわれのPDTSにはFDAに提出するために必要なデータを生成するための潜在的なキー試験が必要であると予想される。これらの潜在的な肝心な試験は伝統的な新薬試験の一部のコストと時間で行うことができ、私たちが考えているより短い規制審査過程の影響を受けると考えられる。
ソフトウェア代替薬:デジタル治療の独特の利点
デジタル療法は新しい治療法であり、ある疾患の根本的な原因を解決することを目的としている。多くの最もよく見られる慢性病は飲食、運動とその他の生活様式要素によるものである。これらの行動はデジタル行動療法の影響や変化を受ける可能性があり,これらの療法は従来の薬物開発で用いられてきた同じ臨床終点に対する活性を示している。従来の薬物は特定の症状を緩和する傾向があるが,疾患の根本的な原因に対する行動療法は疾患の進行を予防および/または逆転させる可能性がある。また、デジタル療法は、従来の薬物と比較して、いくつかのユニークな利点を提供する可能性がある
10
候補製品別の問題、解決策、市場機会
BT-001-糖尿病
T 2 Dは慢性健康状態であり、高血糖値を招く。身体がインスリンを正しく使用できない場合には,このようなことが起こる。インスリンは主に私たちが食べている食べ物からの血糖が細胞に入り、エネルギーを提供することを可能にする。T 2 D患者はまた、高血圧、高コレステロール、心臓病および/または慢性腎臓疾患などの1つまたは複数の他の疾患が出現する可能性が高い。
T 2 Dは最もよく見られる糖尿病タイプである。2019年に米国では3700万人の成人がT 2 Dを患っていると推定されている。2700万人の成人がT 2 Dの医療看護を受けているが、その中で約1300万人の患者の血糖のみがよくコントロールされている。また、約9600万人のアメリカの成人が糖尿病前期に罹患しており、そのうちの70%が生きている間にT 2 Dにかかると予想されている。
ADAとアメリカ臨床内分泌学者協会及びアメリカ国内分泌学学会はT 2 Dの管理ガイドラインに対してa)行為を変えて血糖、血圧とコレステロールを下げること、b)定期的に血糖、腎臓、心臓、血管、眼と神経機能をモニタリングすること、c)血糖降下薬物を長期的に使用することを提案した。普遍的に行為を変えることができず、及び現有の薬物がT 2 Dを解決できない根本的な原因は、このような疾病治療中の大規模、日々深刻かつ持続不可能な危機を招いた。
解く
医師の指導の下で、BT-001は1種のPDT研究であり、FDAが発売を許可すれば、T 2 D患者の血糖コントロールの改善を助けることを目的とする。BT−001ソフトウェアは、血糖コントロールの改善に関連する行動に対してA 1 cを低下させることを目的としたモバイルアプリケーションを介して患者に行動治療を提供する。医師は患者が行動治療の適切な候補であることを確保し、患者の治療効果をモニタリングし、必要に応じて同時投与を調整する。
市場のチャンス
米国食品薬品監督管理局のデータによると,糖尿病と診断された患者の年間医療費は非糖尿病患者の2.3倍である。ADAは,2017年にT 2 Dと診断された患者の平均医療費は16,750ドルと推定されており,そのうち約9,600ドルは糖尿病に直接起因している。そのほか、ADAは2017年に糖尿病を治療する年間薬物の総コストは約1020億ドルであり、2007年以来4倍に増加したと推定した。これには150億ドル近くのインスリン、160億ドルの他の血糖降下薬、710億ドルの他の処方薬が含まれており、これらの薬剤は糖尿病に関連するより高い疾患罹患率に起因することができる。
臨床発展
前期フィージビリティスタディ
2017年、著者らは118名のT 2 D患者に対して12週間の実行可能性研究を行った。介入は、約2週間毎に電話を介して患者に遠隔支援を提供する早期バージョンのBT−001を健康コーチとペアリングすることによって行われる。すべての研究参加者のベースラインA 1 c>6.5%(平均値=8.1%),多くは女性(81%)であり,米国38州に居住し,平均年齢は51歳であった。
12週間後の糖化ヘモグロビンの平均変化は−0.8%(p<.001 result is considered to be statistically significant and among those participants with baseline a1c>7.0%,平均変化率-1.1%(p<.001 result is considered to be statistically significant greater glycemic control was observed in those that used bt-001 more often the average engagement rate times per day and retention this broadly distributed sample.>
この研究のデータは同業者の評議を経て、2018年に“医学インターネット研究糖尿病雑誌”に発表された。
11
試験的研究の主な結果
2020年初め、著者らはBT-001の単腕、制御されない、非盲目的に関する初歩的な研究を完成し、2020年の内分泌会議でデータを公表し、“内分泌学会雑誌”で結果を発表した。われわれの片腕試験研究では,平均2.2種類の経口糖尿病薬を服用し,研究中にこれらの薬剤を継続した被験者にBT−001治療レジメンを増加させ,参加者84日後のA 1 cを平均1.0%減少させた。このパイロット研究はBT−001を経口薬と対面比較するためではないが,これらのデータは2010年8月に“糖尿病看護誌”に発表された履歴データと比較して有利であり,経口薬単独の未治療ベースラインのA 1 cは平均0.5%−1.25%低下していることが示唆されている。鍵となる発見は,純ソフトウェア製品を用いて測定した臨床結果が早期ソフトウェアプラスコーチ配置と同様に強いことである。早期の実行可能性研究では、結果は早期のBT-001ソフトウェアと健康コーチと行動専門家が提供する遠隔人工介入の組み合わせによるものである。対照的に、パイロットで発見された結果は、BT-001ソフトウェアの使用に直接起因することができる。
この予備研究は、糖尿病罹患率が上昇している人(例えば、フロリダ州、インディアナ州、ノースカロライナ州)を含む米国32州に住むT 2 Dを有する80人の成人に関するものであり、彼らは12週間にわたってBT-001を使用している。ベースラインレベルでは、これらの患者は平均的に多種の血糖降下薬を服用しているにもかかわらず、彼らの糖尿病コントロールは非常に悪い。参加者の3日間の平均空腹血糖値は152 mg/dL以上であり、対応するベースラインA 1 cは7%以上であった。参加者の平均年齢は55.7歳,体重指数は肥満範囲で2.2種類の血糖降下薬を服用しており,研究開始前10.4年にT 2 Dと診断された。
BT−001の使用は血糖コントロールの臨床的有意な改善をもたらした。空腹時血糖平均低下-22.9 mg/dL(P<.001 corresponds to approximately a reduction in a1c. an a1c of has been associated with decrease diabetes related mortality and microvascular complications the uk prospective study multi-site randomized intervention trial involving patients follow up. these results suggested use bt-001 may be meaningful improvements glycemic control widely distributed treatment population offers potential as standalone or when used alongside medications.>
T 2 Dを服用した成人では,CBT含量の関与度と血糖コントロールの改善との間に有意な用量反応(p=0.04)が認められた(この結果は統計学的有意と考えられた)。これは,ソフトウェアのみを用いたデジタル伝達の行動療法が疾患を大規模に治療する可能性があることを示しているため鼓舞的である。血糖値の低下は私たちが予想していたよりも著しく、早く発生した。BT−001は、患者が自律的な速度で行動変化を行うことを可能にし、これは、一部の人にとって、血糖低下を見るのにより長い時間がかかる可能性があることを意味する。この場合、血糖のコントロールは予想よりも速く、参加者の42%は152 mg/dL未満の空腹時血糖(A 1 cに対応する)を達成した
全国各地と長期糖尿病を有する参加者からの血糖は改善した。研究期間中に重篤な副作用は認められなかった。新たに診断された患者のみが行動療法から利益を得ると考えられているが,普遍的に受け入れられているHbA 1 c 0.4低下が有意であるという観点から,10年以上前に平均的に糖尿病と診断された患者からBT−001を用いて臨床活動がみられた。
BT-001の重要な実験
2021年2月、著者らはBT-001の肝心な非盲法研究において1人目の患者をスクリーニングし、2021年第4四半期に全面登録を完成し、計668名の患者を登録した。
12
BT−001キー試験への参加に興味がある患者には,年齢18歳から75歳の間,体重指数が25 kg/平方メートル以上であり,最近血糖降下薬の服用に変化がない患者が含まれている。潜在的参加者が食事インスリン、タバコまたは他の嗜癖物質を使用している場合、または化学療法またはステロイドなどの研究対策を妨害する薬剤を服用している場合は除外される。新冠肺炎や自発的自殺などの不安定または生命に危害を及ぼす疾患を有する参加者、および前6ケ月以内に心不全、腎不全または心絞痛歴を有する患者も除外された。募集の目的は、5つの異なる地理的領域に位置する全国代表的な成人サンプルを生成することである。
スクリーニング期間を通過した人は,1対1でSOCグループまたはSOC+BT-001グループにランダムに分類される.両群とも90日と180日で血液試験と生物測定を収集し、全研究期間にわたって有害事象を密接に追跡した。A 1 cレベルに加えて,コレステロール,炎症マーカーおよび心血管リスクの実験室測定,およびベースライン,90日目および180日目の血圧および体重を収集した。参加者はまた、抑うつ、生活の質、および患者満足度の変化を評価するために、90日目および180日目に標準化調査を完了することを要求された。
われわれのBT−001臨床試験は主要と副次的終点ともに統計的に有意かつ臨床的に有意な変化を得た。主要な治療効果の終点は治療90日後の糖化ヘモグロビンの平均変化とベースラインの差異である。BT−001は主要終点に達し,対照群と比較してA 1 cは統計学的に有意に改善(−0.4%,n=610,p)した

180日のA 1 c抽選後,SOC対照群患者の投与増加人数はBT−001患者の1.7倍であった。BT−001は持続的かつ数字的な改善を示し,有意治療群ではA 1 cレベルがベースラインレベル90日の0.3%から180日の0.4%に改善し,持続的な治療効果を示した。BT−001患者では半数の患者で糖化ヘモグロビンが有意に低下し(0.4%低下と定義された),この亜群では糖化ヘモグロビンは平均1.3%低下した。
13
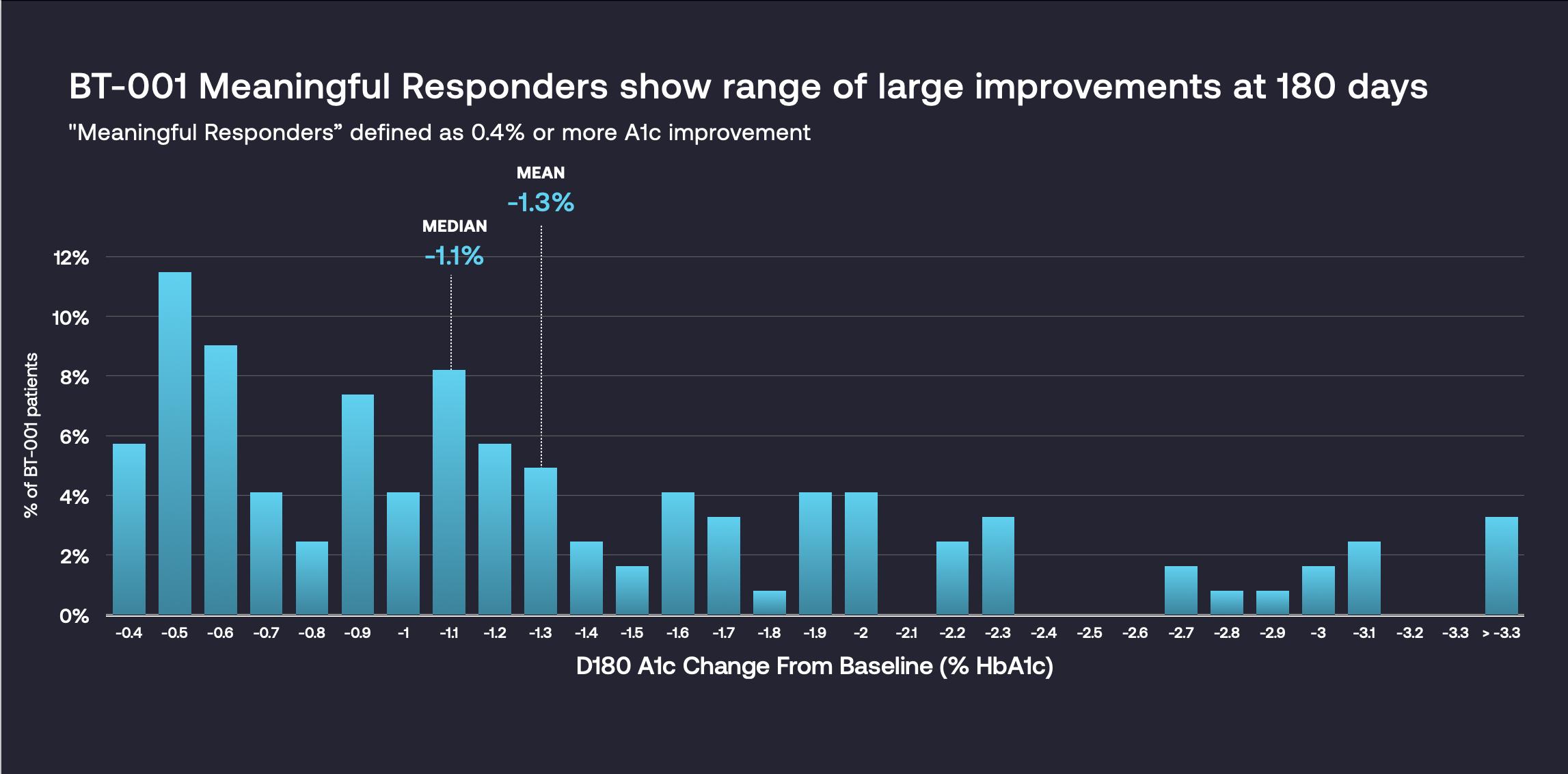
臨床試験はまた、A 1 cの低下以外に、(1)CBTにより多く参与することとA 1 cをより大きく減少させることとの間に明らかな用量-反応関係が存在し、CBTを行動機序として支持することを提供した;(2)患者の参加度、コンプライアンス、持続性、満足度の測定はすべて積極的であった;(3)BT-001は安心な安全データを招き、副作用は著しく減少した(P初めからやり直す2022年9月にFDAに分類要求を提出し、BT-001の発売許可を求め、成人T 2 D患者の治療に用いられる。我々は,この研究のデータを用いて,追加のキー実験を開始して我々のPDTパイプを拡大することが可能な情報を提供する予定である.
2022年10月FDAは私たちの初めからやり直す分類要求は実質的な検討のために受け入れられた。典型的な初めからやり直す審査過程は我々が予想したように,2023年2月にFDAからより多くの情報の提供を要求され,我々が提出した材料を審査した後,FDAはより多くの情報を提供する必要があると決定し,審査を一時停止することを通知した.この手紙は,我々が提出した材料には多くの欠陥があり,重大な欠陥と副次的な欠陥に分類されるFDAの観点を概説している。私たちは、指摘されたいくつかの主要な欠陥を明らかにし、これらの問題を解決するための選択について指導を求めるためにFDAとの会議を要求する。その会議も2月に行われた。会期中、FDAは有益な背景、明確化、そして指導を提供し、私たちは今FDAのコメントに答えるために私たちの反応をまとめている。私たちはFDAの懸念を解決できると信じており、私たちがこれまで提供してきた指導意見は変わらない、すなわちFDAは2023年に決定を下すことが予想される。もし私たちがこれらの不足を解決できない場合、私たちは許可を求めている使用適応を修正する必要があるかもしれないし、および/または別の臨床試験を行う必要があり、BT-001の許可および商業発売は著しく延期または許可が拒否される可能性があるかもしれない。
BT−001とマサチューセッツ工科大学,コロラド州予防センター臨床研究,コロラド大学とダレム退役軍人管理局医療センターの併用に関するT 2 D治療に関する長期有効性と医療利用変化を評価するために実世界のエビデンス研究を開始した。このランダム,対照,多点の研究では,患者を募集して少なくとも12カ月の治療を行う予定である。糖化ヘモグロビンと医療資源利用の変化を評価し,通常の看護と比較した。十分な数の患者が180日間の漸増治療を完了すると、中期研究結果は2023年第4四半期に報告される予定である。この研究は,支払者や提供者に実世界環境における使用や結果に関する長期データを提供することを目的としている.
14
高血圧.高血圧
高血圧は慢性的な健康状態であり、高血圧を引き起こす。血管を流れる血液の圧力を身体が適切に調節できない場合には,このようなことが発生する。慢性高血圧を有し、人体器官は持続的な圧力下にあり、さらに崩壊する可能性がある。長期にわたって高血圧を有する患者は、通常、心臓病、脳卒中、慢性腎臓疾患および/または認知症になる。
高血圧は最もよく見られる慢性病の一つである。2017年には1.08億人のアメリカ人成人が高血圧を患っていると推定されている。これらの降圧薬を服用している患者のうち,約35%の患者の血圧はコントロールされていない。
高血圧管理ガイドラインはa)行動を変えて血圧を下げること、b)血圧、腎臓と心臓機能を定期的にモニタリングすること、c)抗高血圧薬物を長期的に使用することを提案した。普遍的に行為を変えることができず、及び現在の薬物は高血圧の根本的な原因を解決できず、このような疾病治療中の大規模、日々深刻かつ持続不可能な危機を招いた。
解く
医師の指導の下で、高血圧患者の血圧改善を助けるPDTを含む、私たちのプラットフォームを拡張することができるかもしれない。このソフトウェアは、血圧制御の実現に関連する行動に対して、収縮期血圧および拡張期血圧を低下させることを目的としたモバイルアプリケーションを介して患者に行動治療を提供することを意図している。
市場のチャンス
高血圧患者の処方薬コストは非高血圧患者のほぼ3倍と推定されている。2016年に“アメリカ心臓協会誌”に発表された研究では、高血圧患者の年間処方薬コストは2400ドルであり、高血圧患者ではない年間処方薬コストはわずか815ドルであると結論した。米国の高血圧を有するすべての成人にとって、これは2016年の高血圧患者の年間増量薬物コストが420億ドルと推定されていることを意味する。
臨床発展
BT−001無作為対照試験から得られた血圧データを用いて潜在的キー試験の詳細な計画を整備する予定である。BT−001試験では,約3分の2の参加者が高血圧が共通病であることを報告し,すべての参加者の約18%がベースラインレベルで高血圧コントロールが不良であった。BT−001試験は各時点で血圧と糖化ヘモグロビンを測定することを含むため、約400人の参加者の90日と180日のランダム対照血圧データがあり、これらのデータは十分な試験データである可能性があり、潜在的な重要な高血圧試験を計画することができると信じている。
1つの重要な試験は、5つの異なる地域に分布する約500名の高血圧を有するアメリカの成人に対して全国の代表的なサンプルの安全性と有効性評価を行う予定である。18~75歳の成人は、彼らの安静血圧制御が好ましくない場合(すなわち、140/90 mmの水銀を超える)が含まれるであろう。これらの参加者たちは1対1の方法で対照群または介入群にランダムに割り当てられるだろう。対照群は標準看護治療を行った。介入グループは高血圧候補製品と一緒に標準看護を受ける。主な結果は90日間の安静収縮圧を測定した。副次的な結果測定は安静収縮圧となり,測定時間は180日であった。
高脂血症
高脂血症は慢性的な健康状態であり、血中コレステロール値の上昇を招く。体が血液中を循環する有害なタイプのコレステロールを除去できない場合、このようなことが発生する。低密度リポ蛋白質コレステロールは最もよく見られる有害コレステロールである。食事パターンには不健康な脂肪,コレステロール,精製炭水化物が多く含まれており,運動不足に加え,血液コレステロール上昇の最もよく見られる原因である。時間の経過とともに,有害コレステロールの存在が多すぎると人体動脈にコレステロールが蓄積し,血液流動を制限する。長期高脂血症の患者にとって、コレステロール蓄積による1種以上の他の疾患は非常によく見られる、例えば心臓病、脳卒中および/または末梢動脈疾患である。
15
高脂血症は最もよく見られる慢性病の一つである。2016年に米国では6500万人の成人が高脂血症を患っていると推定されている。2016年、2800万人の成人のコレステロール値のコントロールが悪いと推定されている。
高脂血症管理ガイドラインは,a)有害コレステロールを低下させ,健康なコレステロールレベルを向上させるための行動を変更すること,b)血中コレステロール,血糖および血圧を定期的にモニタリングすること,c)コレステロール低下薬を長期的に使用することを推奨している。普遍的に行為を変えることができず、及び現有の薬物は高脂血症の根本的な原因を解決できず、このような疾病の治療中の大規模、日々深刻かつ持続不可能な危機を招いた。
解く
私たちは、高脂血症患者のコレステロールレベルの改善を助けるために、医師の指導の下でPDTを含むプラットフォームを拡張することができるかもしれない。このソフトウェアは、コレステロールレベルの制御に関連する行動に対して、低密度リポ蛋白質を低下させることを目的としたモバイルアプリケーションを介して患者に行動治療を提供することを目的としている。
市場のチャンス
米国心臓協会のデータによると、2016年の高脂血症患者の年間増量薬物コストは120億ドルと推定されている。また,更新された臨床ガイドラインにより積極的な治療が提案されているため,2025年には他の1230万人がコレステロール低下薬治療を受けることになり,治療コストは年間133億ドル増加する。
臨床発展
BT−001無作為対照試験から得られた血液コレステロールデータを用いて潜在的キー試験の詳細な計画を整備したい。BT−001試験では,約45%の参加者が高脂血症を報告し,約3分の1の参加者がベースライン時の低密度リポ蛋白質コレステロール制御が不良であった。BT-001試験は各時点で空腹血コレステロールおよびA 1 cを測定することを含むので、私たちは約380人の参加者の90日と180日のランダム対照コレステロールデータを持っており、これらのデータは潜在的な重要な高脂血症試験を計画することができる十分な試験データである可能性があると信じている。
1つの重要な試験は、5つの異なる地域に分布する約500人の高脂血症を有するアメリカ人成人に対して、全国の代表的なサンプルの安全性と有効性評価を行う予定である。もし彼らの空腹低密度リポ蛋白質コレステロールコントロールが良くない(すなわち彼らのリスク調整目標より高い)場合、18-75歳の成人は含まれる。これらの参加者たちは1対1の方法で対照群または介入群にランダムに割り当てられるだろう。対照群は標準看護治療を行った。介入グループは高脂血症候補製品と共に標準看護を提供する。主な結果指標は空腹低密度リポ蛋白質コレステロールであり、90日時に測定する。副次的な結果指標は空腹低密度リポ蛋白質コレステロールであり、測定時間は180日であった.
NAFLDとNASH
NAFLDは肝臓脂肪蓄積をきたす疾患であり,NASHは肝臓炎症や障害を含む疾患の進展である。
非アルコール性脂肪肝はよく見られる慢性病であり、公衆健康に対する脅威はますます大きくなっている。現在、20%-30%のアメリカ成人と約70%のT 2 D患者がこの疾患を患っていると推定されている。NASHは約5%の米国成人に影響し,最近では肝臓移植の主な適応となっている。
これらの状況は深刻であるにもかかわらず,FDAが承認した治療法はない。NAFLDとNASHの管理ガイドラインは,ダイエット,食事の質の改善,体力活動の増加などの行動調整を提案している。これらの干与措置は肝臓脂肪変性と繊維化の進展を緩和し、逆転する方面で良好な効果があることが証明された。普遍的に行為を変えることができないとFDA承認の不足の薬物治療はこれらの疾病の治療中の大規模、日々深刻かつ持続不可能な危機を招く。
16
解く
われわれは,NAFLDやNASH患者の肝臓脂肪の改善を支援するために,医師の指導の下でPDTを含むプラットフォームを拡張する可能性がある。ソフトウェアは、肝臓脂肪レベルの制御に関連する行動に対して、肝臓脂肪含有量を低下させることを目的としたモバイルアプリケーションを介して患者に行動治療を提供することを目的としているはい。
市場のチャンス
2016年のNAFLDやNASHに関する直接医療コストは1030億ドルと見積もられている。
臨床発展
著者らはCBTの実行可能性の初歩的な研究を完成し、その肝臓脂肪の低下と肝臓疾患バイオマーカーの改善の潜在力を検証し、NAFLDとNASHの潜在的な治療方法とした。この研究は有力な肝臓臨床研究センターアリゾナ州肝臓健康センターと協力して行われた。この片腕介入コホート研究は22名の患者を募集し,CBTによる90日間の治療期を獲得した。この臨床研究はその主要な終点に達し,統計学的に有意な陽性信号を示し,意向治療群(n=19)ではMRI−PDFFの平均が相対的に16%減少した(p=0.01)。また、臨床研究により:(I)アラニントランスアミナーゼ(ALT)は平均-17 IU/L低下し(p=0.002)、(Ii)FAST採点は平均20%(p=0.10)、(Iii)深刻な有害事象或いは設備に関連する有害事象がなく、(Iv)患者の治療に対する高い参加度と満足度、純Promoter採点+75,94%の被験者は90日後もこのアプリを使用している。潜在キー試験の詳細な計画はNAFLDとNASHのパイロット研究から得られたMRI−PDFFデータを用いて整備する。満たされていない医療ニーズが多いため,2023年上半期にCBTのこれらの適応に基づく研究的治療プラットフォームのための画期的な設備指定をFDAに申請する予定である。
競争優位
目標市場で競争優位性を確立するために、CMDXにおけるPDTの潜在力の早期認識、根本的な原因への関心、および私たちのプラットフォームを利用して後続製品の発表に対する規制承認を加速する能力を構築している。私たちは、既存および/または潜在的な競争相手と比較して、以下のような利点を持っていると信じている
17
会社戦略
著者らはCMDXの治療方式を変更し、患者の健康を改善し、医療支出を減少させることを渇望している。我々のプラットフォーム技術、率先して市場に投入された優位性、知的財産権の組み合わせと先駆的な研究はこの目標の実現に役立つと信じている。私たちの現在のポイントは
18
19
競争
製薬、生物技術とデジタル健康業界の特徴は技術が迅速に進歩し、競争が激しく、独自製品を強調することである。私たちは私たちの技術、開発経験と科学知識が私たちに競争優位を提供すると信じているが、私たちは大型製薬と生物技術会社、デジタル健康会社、学術機関、政府機関とその他の研究、特許保護を求め、心臓代謝療法の研究、開発、製造と商業化のための協力手配の公共と個人研究組織を含む多くの異なる源からの潜在的な競争に直面している。私たちが開発と商業化に成功したどんな製品も未来に出現する可能性のある新しい療法と競争するだろう。
我々は製薬,バイオテクノロジー,その他の関連市場で競争を展開し,これらの市場はCMDXを治療する薬剤を開発している。他の多くの企業が商業化および/またはCMDXのこのような治療法を開発しており、例えば、ノボノード、礼来、メルク、セノフィ、アスリカン、ノワールなどの大型製薬およびバイオテクノロジー会社を含む。
以下に示す競争構造は不十分であるが,通常“糖尿病テクノロジー”と記述されている市場分野におけるライバルであり,T 2 Dに関する問題の解決に専念したデジタル健康分野であることを示している。主要な行動メカニズム(行動支援/介入や服薬コンプライアンスの改善や追跡)を患者が獲得したビジネスモデル(消費者向けアプリケーション;健康計画メンバーに提供される科学技術医療サービス,通常は自己保険雇用主の医療サービス;あるいはプロバイダが開発した規制された製品)と比較することで,競争パターンを最もよく理解できると考えられる。

いくつかの解決策は、行動支援、薬物依存性警告、または生体特徴データの遠隔監視および送信のような様々なメカニズムを含む要素に発展しているが、私たちの考えでは、各解決策は、疾患に影響を与える主要なメカニズムと、患者または消費者を取得するための明確に定義されたモデルとを有する。
20
私たちの知る限り、一旦規制された許可を得ると、BT-001は唯一の規制されたPDTとなり、T 2 Dを直接治療することができ、提供者が処方し、処方薬やFDAが許可した他の医療機器のように保険で精算することができる。この機会を利用するには,安全性,有効性,医療総コストへの影響に関する重要な証拠が必要である。早期に市場に進出した多くの会社(実際、アップルアプリストアは現在36万近くの健康アプリケーションを提供している)は、T 2 D治療の能力改善に関するマーケティング主張を宣伝し、雇用主または消費者向けの広告によって患者を獲得しているが、新しい解決策が工夫された臨床試験の臨床証拠の支持の下で、プロバイダが処方して保険でカバーできる場合、状況は大きく変化すると信じている。処方デジタル治療分野には多くの会社があるが,これらの会社は現在のところ心臓代謝性疾患に対する処方デジタル治療を商業化していない。
私たちと比較して、私たちが競争しているか、あるいは将来競争する可能性のある多くの会社は、研究開発、製造、臨床前テスト、臨床試験を行い、監督マーケティング許可とマーケティング承認製品を獲得する上で、より多くの財務資源と専門知識を持っている。製薬、バイオテクノロジー、デジタル健康業界の合併と買収は、私たちの少数の競争相手により多くの資源を集中させる可能性がある。規模が小さいかスタートアップ段階にある会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配する。これらの競争相手はまた、合格した科学と管理者を募集し、維持し、臨床試験場を構築し、私たちの臨床試験のために被験者を募集し、私たちの計画と相補的あるいは必要な技術を獲得する上で私たちと競争している。
もし私たちの競争相手が私たちまたは私たちの協力者が開発する可能性のあるどんな製品よりも安全で、より効果的で、より便利で、より安い製品を開発し、商業化すれば、私たちのビジネス機会が減少したり消えたりすることを見ることができるかもしれない。私たちの競争相手も私たちよりも早くFDAや外国の規制機関の製品の許可を得ることができ、これは私たちの競争相手が私たちまたは私たちの協力者が市場に入る前に強力な市場地位を確立することをもたらすかもしれない。私たちのすべての製品の成功に影響する重要な競争要素は、上場を許可されれば、それらの有効性、安全性、利便性、価格及び政府と商業支払者が精算できるかどうかである可能性が高い。
知的財産権
私たちの成功は私たちが核心技術と知的財産権を保護する能力にある程度かかっている。私たちの知的財産権を保護するために、私たちは特許、商標、著作権および商業秘密法、秘密手続き、および従業員開示および発明譲渡協定に依存します。私たちの知的財産権は私たちの業務に重要であり、アメリカと国際的に私たちのデジタル治療プラットフォームのための特許保護、新しい治療アルゴリズムとその使用、その他の私たちの業務に重要な発明を含む様々な方法でそれを保護するために努力しています。私たちのデジタル治療プラットフォームに対して、私たちは全体的に特許保護を申請し、私たちの製品の機械学習方面と肝心な機能をカバーし、各種の心臓代謝疾患の治療と患者及びその介護者の疾病管理を助けるための使用方法を提供する予定である。私たちが私たちの候補製品を開発し続けるにつれて、私たちは、他の使用方法およびその後の私たちの製品の反復および改善、および予測分析の使用のクレームを含む商業的成功を向上させる可能性がある特許保護を得る他の方法を決定するつもりである。
2022年12月31日現在、2つの特許ファミリーがあり、そのうちの1つは、2022年6月7日に米国特許(番号11,355,228)が付与されており、欧州およびカナダでは、我々のデジタル治療プラットフォームを含むシステムおよび心臓代謝障害を治療するための関連方法を対象とした合計10件の審査される米国および外国出願がある。これら2つの特許シリーズによって発行される任意の米国および外国特許の法定満期日は、特許期間の任意の調整および/または延長に応じて2038年から2039年の間に決定される。米国,ヨーロッパ,カナダ,そして第3の特許シリーズの国家段階出願が行われており,これらの特許は健康結果を予測し慢性薬物を管理する方法を対象としている。この特許シリーズで発行される任意の米国および外国特許の法定満期日は2039年となり、特許期間の任意の調整および/または延長の影響を受ける。さらに、我々のデジタル治療プラットフォームにおける栄養性CBTの様々な実施のための請求項を提示する係属中の国際PCT出願によって代表される第4の特許シリーズがある。本特許シリーズで発行される任意の米国および外国特許の法定失効日は2042年であり、特許期間の任意の調整および/または延長の影響を受ける。
21
政府の監督管理
保険と保険の範囲
米国や他の国の市場では,患者は通常第三者支払者によって治療に関連する費用の全部または一部を精算する。政府医療保健計画(例えば連邦医療保険や医療補助)や商業支払者の十分なカバーと精算は新製品の受容度に重要である。もし私たちの製品が発売されることを許可されたら、私たちはそれを商業化することに成功するかどうかは、政府衛生行政当局、個人健康保険会社、その他の組織がこれらの製品と関連治療に提供する保険範囲と十分な補償にある程度依存する。政府当局や他の第三者支払人、例えば個人健康保険会社や健康維持組織は、どのような治療費を支払うかを決定し、精算レベルを確立する。米国では,新療法の精算に関する主な決定は通常,米国衛生·公衆サービス部(HHS)の一機関である医療保険·医療補助サービスセンター(CMS)によって行われている。CMSは新しい治療を決定するかどうか及びどの程度連邦医療保険の下でカバーと精算するかを決定し、個人支払者はよくCMSに大きく従う。商業支払者は連邦医療保険のカバー範囲内にない製品をカバーすることができる。現在,PDTに対する連邦医療保険種別はないため,連邦医療保険の前に商業支払者と保険を構築する可能性がある。政府や個人支払者が提供する保険範囲と精算範囲は,多くの患者が治療費を負担できるようにするために重要である。私たちが開発する可能性のある製品の販売は、私たちの製品のコストがどの程度健康維持、管理医療、薬局福祉、および同様の医療管理組織によって支払われるか、あるいは政府衛生行政当局、個人健康保険会社、および他の第三者支払人によってどの程度精算されるかに大きく依存する。
新たに承認された製品の保険カバーや精算に関連する大きな不確実性があり、カバー範囲はFDAや同様の外国規制機関がこの装置を許可する目的よりも限られている可能性がある。
支払側は,精算を決定する際に,製品がそうであるかどうかを考慮する
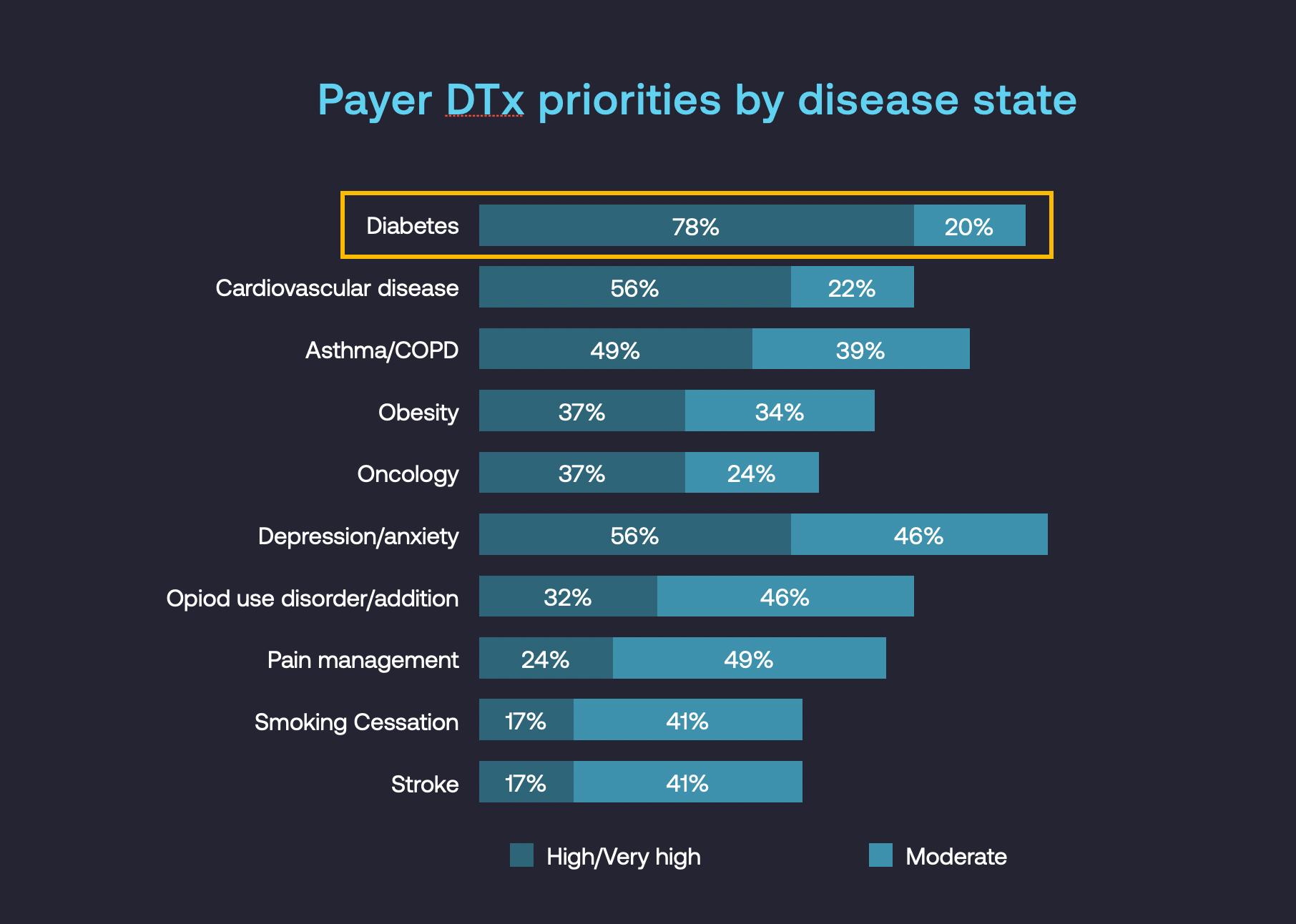
各支払者は、治療に保険を提供するか否か、どのような福祉下(薬局、医療、その他)、製造業者にどれだけの治療費用を支払うか、およびその薬局の処方のどのレベルで、またはどのような医療保険政策に基づいて支払うかを決定する。支払者の保険薬品,生物製品と医療機器や処方リスト上の位置は,通常,患者が治療に要する共同費用を獲得することを決定し,患者や医師のこのような治療に強い影響を与える可能性がある。病状に応じて処方治療を受けた患者やこのようなサービスを処方した提供者は,通常第三者支払者によってすべてまたは一部の関連医療費を精算する。我々が支払者と行った市場調査と,Xcendaが最近発表し,2022年10月にAMCPに提出した第三者研究に基づき,時間の経過とともに広いカバー範囲を得ることができると信じている。例えば,Xcendaが発表されAMCPで発表された研究では,支払者は糖尿病がPDT製品管理の最優先分野であると考えている.
22
患者は保険を提供しなければ、私たちの製品を使用することはあまりできません。私たちの製品の大きなコストを支払うのに十分な費用を精算するのに十分です。新たに認可された製品については、このような保険の取得や精算に重大な遅延が生じる可能性があり、保険範囲はFDAが許可した製品よりも目的が限られている可能性がある。
また、一部の外国では、処方設備の提案価格は合法的に発売されるために承認されなければならない。設備価格に対する各国の要求の差が大きい。例えば、欧州連合は、その国の健康保険制度が補償を提供する製品範囲を制限し、人が使用する医療製品の価格を制御するために、その加盟国に様々な選択を提供している。精算或いは定価の承認を得るために、その中のいくつかの国は臨床試験の完成を要求する可能性があり、特定の製品のコスト効果を現在利用可能な治療法と比較する。加盟国は製品の具体的な価格を承認することができ、医薬製品を市場に投入する会社の収益力に対して直接または間接的に制御する制度をとることもできる。製品に対して価格制御や精算制限を実施することが保証されない国は、私たちのいかなる製品に対しても有利な精算と定価手配を許可する。歴史的に見ると、EUで発売された製品はアメリカの価格構造に従わず、通常価格ははるかに低くなることが多い。
医療保健法律法規
私たちは、米国連邦反リベート法規とアメリカ連邦虚偽請求法案(“FCA”)を含むが、これらに限定されない他の医療法律法規の制約を受けており、これは、私たちの製品の販売、マーケティング、流通の業務または財務配置と関係を制限するかもしれません。特に、医療プロジェクトおよびサービスの普及、販売およびマーケティング、ならびに医療業界のいくつかの商業的配置(例えば、ヘルスケア提供者、医師、および第三者支払者)は、詐欺、リベート、自己取引、および他の乱用を防止するための広範な法律によって制限されている。これらの法律および法規は、広範な価格設定、割引、マーケティングおよび販売促進、構造および手数料、特定の顧客インセンティブ計画、および他のビジネススケジュールを制限または禁止する可能性があります。私たちはまた、連邦政府と私たちが業務を展開している州と外国の司法管轄区域の患者情報、プライバシー、安全に対する規制を受ける可能性があります。私たちの運営能力に影響を与える可能性のある連邦、州、外国の医療に関する法律と法規は含まれていますが、これらに限定されません
23
24
また、他の事項以外に、著者らは上述の各医療法律と法規を遵守する州と国外等価物が必要であり、その中のいくつかの法律と法規の範囲はもっと広く、異なる支払人に適用する可能性がある。アメリカの多くの州は連邦反リベート法規とFCAのような法律を採用しており、研究、流通、販売またはマーケティング手配、および非政府支払人(個人保険会社を含む)によって精算される医療項目またはサービスに関するクレームを含むが、私たちのビジネス実践に適用可能である。いくつかの州はまた、他のマーケティング制限を実施したり、医療機器メーカーにその州へのマーケティングまたは価格開示を要求したりする。2018年5月に施行された欧州連合一般データ保護条例を含む国と外国の法律は、健康情報のプライバシーやセキュリティを管理する場合もあり、その多くの法律は互いに大きく異なり、HIPAAに先を越されず、コンプライアンス作業を複雑化させることが多い。このような州の要求を守るために何が必要なのかは曖昧で、もし私たちが適用された州の法律要求を守らなければ、私たちは処罰されるかもしれない。最後に,健康情報のプライバシーや安全を管理する国や外国の法律もあり,その多くの法律は互いに大きく異なり,HIPAAに先を越されず,コンプライアンス作業を複雑にしていることが多い。
これらの法律の広汎性、および法定例外および利用可能な安全港の狭さのため、私たちのいくつかの商業活動は挑戦される可能性があり、1つ以上のこのような法律、法規、および指導に適合しないかもしれない。法執行部門は詐欺と法の乱用をますます重視しており、私たちのいくつかの接近はこのような法律の挑戦を受けるかもしれない。私たちの現在と将来の第三者との業務配置と、私たちの業務が全体的に適用される医療法律や法規に適合していることを確保するために努力しており、多くのコストがかかります。もし私たちの業務が、医師および他の医療提供者との手配を含めて、私たちに適用される任意のこのような法律または任意の他の政府法規に違反していることが発見された場合、私たちは、行政、民事および刑事罰、損害賠償、罰金、返還、契約損害、名誉損害、利益減少および将来の収益、私たちの業務の縮小または再編、連邦および州医療保健計画(例えばMedicareおよびMedicaid)から除外された参加、および監禁、および当社が誠実協定または他の合意に違反した場合、これらの法律違反に関する疑惑、および追加の報告義務および監督を解決するために罰を受ける可能性があります。いずれも私たちの業務運営能力と財務業績に悪影響を及ぼす可能性がある。
データプライバシーとセキュリティ法
多くの連邦と州の法律と法規は、保護された健康情報を含む個人識別情報の収集、使用、開示、保存、転送を管理する。このような法律と法規は、政府機関のそれらの解釈を含めて、しばしば変化する。さらに、将来的には、連邦および州レベルの業界要件またはガイドライン、契約義務、および/または立法は、米国国外での健康情報の使用または伝播を制限、禁止、または規範化する可能性がある。
米国連邦貿易委員会(“FTC”)と各州総検察長はますます連邦と州消費者保護法を適用し、ウェブサイトまたは他の方法による個人または個人識別情報の収集、使用、保存、開示を規範化し、ウェブサイトの内容の提示を規範化する。
プライバシー擁護者、監督管理機関、その他の人はデータプライバシーとセキュリティ問題に注目し続け、データプライバシーとセキュリティ法律を制定する司法管轄区の数は増加している。さらに,アイデンティティ認識,匿名または仮名健康情報を廃止する基準が十分であるかどうか,再アイデンティティのリスクが十分小さいかどうか,患者のプライバシーを十分に保護するための公共政策検討が行われている。米国では、2020年1月1日に施行され、何度も改正された“カリフォルニア消費者プライバシー法案”(CCPA)のような、プライバシー、データ保護、情報セキュリティに関する新たな法律、法規、業界基準が新たに提案され、改正されることが予想される。また、カリフォルニアの有権者は2020年11月3日に新しいカリフォルニアプライバシー法“カリフォルニアプライバシー権法案”(CPRA)を可決した。CPRAは、2023年1月1日に施行される(特定の条項は、2022年1月1日まで遡及効力を有する)個人情報の処理および記憶に追加的な義務を追加する。また、バージニア州の新たなプライバシー法である総合データ保護法(VCDPA)は2021年3月2日に法律に署名され、2023年1月1日に施行される予定だ。VCDPAは、CCPAおよびCPRAと同様の義務を個人情報の処理および記憶に多く加える。米国の他の州でも総合的なプライバシー立法の制定が考えられており,業界組織はこれらの分野で新たな基準を採用し提唱することが多い.CCPA、CPRA、およびVCDPAは、HIPAAが規制されている保護された健康情報(“PHI”)の活動に関連するいくつかの例外を含むが、CCPA、CPRA、VCDPA、または他のこのような将来の法律、法規、および基準が私たちの業務に及ぼす可能性のある影響を決定することはできない。
25
医療立法改革
米国や一部の外国司法管轄地域では、医療システムの立法や規制に多くの変化が生じており、製品販売の収益性に影響を与える可能性がある。特に、2010年にACAが公布され、その中で他の事項以外に、吸入、輸液、点滴、移植または注射に対する薬物計算メーカーのMedicaid薬品リベート計画の下でのリベートを解決する新しい方法が解決された;大多数のメーカーのMedicaid薬品リベート計画の下での最低医療補助リベートが増加した;Medicaid薬品リベート計画をMedicaid管理の看護組織に登録された個人処方を使用する個人処方に拡大した;メーカーにあるブランドの処方薬に新しい年会費と税を徴収することを要求した;新しいMedicare Part D引受切欠き割引計画を作成し、メーカーは保証不足期間中に条件を満たす受益者に50%(2018年両党予算法によって70%に増加し、2019年1月1日から発効)の販売時点割引を提供することに同意しなければならず、メーカーの外来薬物としてMedicare Part Dの条件を組み込む;そして連邦政府の比較有効性研究の計画を増加させるために激励を提供する。2025年1月1日から、2022年の“インフレ率低減法案”のいくつかの条項は、連邦医療保険Dの一部の受益者の年間自己払い最高限度額を7,050ドルから2,000ドルに引き下げ、カバーギャップを効果的に除去する。
公布以来、“反腐敗法”のある方面に対して多くの司法、行政、行政と立法方面の挑戦を提出した。2021年6月17日、米国最高裁はいくつかの州がACAに対して提出した最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。最高裁が裁決を下す前に,バイデン大統領はACA市場による医療保険の取得を目的とした2021年2月15日から2021年8月15日までの特別保険期間を開始する行政命令を発表した。行政命令はまた、特定の政府機関に、医療補助モデルプロジェクトおよび免除計画の再審査、および医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策を含む医療補助モデルプロジェクトおよび免除計画の再審査および見直し、医療補助またはACAによる医療保険のカバー範囲を制限する既存の政策およびルールを再検討するように指示する。バイデン政府の他の医療改革措置や他の挑戦,ACAの廃止または代替の努力(あれば)が我々の業務にどのように影響するかは不明である。
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した
アメリカでは、製品の価格設定に関する立法と法執行の関心がますます大きくなっている。具体的には,米国議会は最近数回の調査を行い,製品定価の透明性の向上,連邦医療保険下の治療コストの低減,価格決定とメーカー患者計画との関係の審査,政府計画の薬品精算方法の改革を目指して連邦と州立法を提案した。衛生·公衆サービス部はすでにその中のいくつかの措置についてフィードバック意見を求め始めており、同時に、その現有の権力に基づいて直ちに他の措置を実施している。このような立法と法執行関心が処方装置にどのような影響を与える可能性があるのかはまだ分からない。
26
将来的にとりうるこれらおよび他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受け取った任意の承認されたデバイスの価格に追加の下り圧力を与える可能性があり、候補製品の顧客に悪影響を及ぼす可能性があると予想しています。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。
アメリカ外国、連邦と州の各レベルはすでに医療保健の獲得性を拡大し、医療保健コストを制御或いは低減するための立法と監督管理提案を引き続き提出することが可能である。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの製品の商業化を阻止するかもしれない。これらの改革は、私たちが開発に成功し、規制承認を得る可能性のある候補製品の予想収入に悪影響を及ぼす可能性があり、私たちの全体的な財務状況や製品を開発する能力に影響を及ぼす可能性がある。もし私たちまたは私たちが接触する可能性のある任意の第三者が既存の要求の変化に緩やかに適応できない場合、または新しい要求や政策を採用することができない場合、または私たちまたはそのような第三者が規制適合性を維持できない場合、私たちが現在または私たちが開発する可能性のある任意の未来の候補製品は、得られた可能性のある任意の規制承認を失う可能性があり、私たちは利益を達成したり維持することができないかもしれない。
FDA法規
アメリカです
我々が開発している医療機器は,FDAによって“連邦食品,薬物,化粧品法案”(“FD&C法案”)とその実施条例および米国の他の連邦·州規制機関および他の国の類似機関によって他の法規や法規に基づいて広範かつ持続的に規制されている。その他の事項以外に、法律法規管理製品の設計と開発、臨床前と臨床試験、製造、包装、ラベル、貯蔵、記録保存と報告、承認、初めからやり直す分類または審査、マーケティング、流通、販売促進、輸出入と発売後の監督。適用された要件を遵守しないことは、警告状の発行、輸入拘留、民事罰金および/または司法制裁、例えば、製品差し押さえ、禁止、および刑事起訴のような、設備および/またはその製造業者に様々な行政制裁を受ける可能性がある。
FDAの上場前承認、承認、承認要求
アメリカで商業流通されるすべてのデジタル治療法を求めるには事前に初めからやり直す分類許可は、510(K)許可を得ない限り、免除されないか、またはFDAがその医療機器許可に基づいて承認された上場前承認申請(“PMA”)である。一般に、新しいデバイスが510(K)の許可の下で発売された述語を有する場合、FDAは、新しいデバイスが510(K)の許可の下で発売されることを可能にするか、または合法的に発売された述語デバイスがなく、一般的な制御のみまたは合理的な安全性および有効性保証を提供するために特別な制御を有する場合、FDAは、510(K)の許可下での新規デバイスの販売を可能にするであろう初めからやり直す分類許可;そうでなければ,PMAが必要である.医療機器は,I類,II類あるいはIII類の3つに分類され,個々の医療機器に関するリスクの程度と,合理的な安全性と有効性保証を提供するために必要な制御程度に依存する。クラスIの装置は、低リスク装置とみなされ、例えば、偽、ブランドエラー、登録および上場、修理、交換または払い戻し、記録および報告、および良好な製造実践を含む“食品および医薬品局法案”の一般的な制御によって制御される。FD&C法案510(K)条によれば、多くのI類機器は上場免除前通知に分類されるため、FDA 510(K)の許可を得ずに商業流通を行うことができる。クラスII設備は一般的な制御を受けながら、合理的な安全と有効性保証を提供するために特別な制御を受けている。特殊な制御は業績標準、上場後のモニタリング、患者登録と指導文書を含む。製造業者は、FDAに発売前通知を提出することを要求される可能性があり、いくつかのクラスIIデバイスの商業販売を可能にすることを要求する。FDAが最大のリスクを構成すると考えられるデバイス、例えば、生命を維持する、生命を維持する、または移植可能なデバイス、または以前に承認された510(K)デバイスと実質的に同等ではないと考えられるデバイスは、クラスIIIデバイスに分類される。FDAがPMAの提出後にデバイスを承認しない限り、クラスIIIデバイスは米国で販売することができない。しかし、一部のIII系デバイスFDAはまだPMAを要求していない。これらのデバイスの場合、製造業者は、これらのデバイスを商業的に販売するために、発売前通知を提出し、510(K)の許可を取得しなければならない。FDAはまた、それらが安全かつ効率的な方法で使用されることを保証するために、デバイスに販売、マーケティング、または他の制限を実施することができる。
27
510(K)クリーンパス
510(K)の許可が必要な場合、私たちは、提案された装置が、以前に承認され、合法的に発売された510(K)装置または1976年5月28日以前に商業販売に投入された装置と実質的に等しいことを証明する上場前通知をFDAに提出しなければならない。規定によると、510(K)計画が発売される前に、私たちが流通装置を販売しようとする前に少なくとも90日前にFDAに提出しなければならない。実際の問題として、通関には一般的にもっと長い時間がかかる。実質的な等価性を証明するために、製造業者は、提案されたデバイスが述語デバイスと同じ予期される用途を有し、同じ技術的特徴を有するか、または異なる技術的特徴を有することを証明しなければならず、510(K)の発売前通知における情報は、デバイスが同様に安全かつ有効であることを示し、異なるセキュリティおよび有効性の問題を引き起こさない。FDAは、実質的な同等性を決定するために、臨床データを含むさらなる情報を必要とするかもしれない。FDAが装置またはその予期される用途が以前に承認された装置または用途と実質的に等しくないと判断した場合、FDAは装置をクラスIIIに分類する。
510(K)には、従来、特殊、および略語の3つのタイプがある。特別な510(K)は、修正された装置のためのものであり、修正は新しい510(K)を必要とし、変更を評価するための方法はよく確立され、結果は、要約またはリスク分析のフォーマットで十分な検討を行うことができる。略称510(K)は、公認規格に適合するデバイスを意味する。特別および略語510(K)sは、レビューを簡略化することを意図しており、FDAは、特別510(K)sを受信した30日以内に特別510(K)sを処理することを意図している。
初めからやり直す分類する
合法的に販売されている述語装置がないと判断した場合初めからやり直すこの過程は新しい医療機器を分類するための経路を提供し、これらの新しい医療機器に対して、一般的な制御または一般的および特殊な制御は単独で期待される用途の安全性と有効性の合理的な保証を提供する。FDAが従来I類,II類またはIII類に分類されていなかった医療機器タイプは,それらの構成リスクレベルにかかわらず自動的にIII類に分類される。1997年の食品·医薬品局近代化法案(FDAMA)は、“自動III類指定の評価要求”と呼ばれる述語装置の不足により自動的にIII類に分類される低中リスクの医療機器のための市場進出の新しい道を確立した初めからやり直す分類プログラム。このプログラムは、その新しいデバイスがクラスIIIに自動的に分類される製造業者が、そのデバイスが低または中リスクがあることに応じて、PMA出願の提出および承認を必要とすることなく、その医療デバイスをクラスIまたはクラスIIに格下げすることを要求することを可能にする。製造業者がクラスIIに分類することを求める場合、製造業者は、医療機器の安全性および有効性を合理的に保証するために必要な特別な制御提案草案を含まなければならない。2012年にFDA安全·革新法案(FDASIA)が公布されるまで、医療機器は資格しか得られなかった初めからやり直す製造業者が最初に510(K)の発売前通知を提出し、FDAの決定を受信した場合、すなわち装置が実質的に同じではない場合、装置は分類されるであろう。FDASIAは簡略化しました初めからやり直す製造業者が分類パスを要求することを可能にすることで初めからやり直す510(K)の発売前通知を最初にFDAに提出するのではなく、直接分類し、実質的に同等ではない決定を受信する。FDASIAによると,FDAは受信した120日以内にデバイスを分類する必要がある初めからやり直す申請します。“2022年医療機器使用料改正案”(MDUFA V)によると、FDAは70%の初めからやり直す150日以内に申請します。しかし、検討の時間ははるかに長いかもしれない。
一度なると初めからやり直す審査要請が受け入れられた場合、FDAは実質的な検討を行うだろう。実質的な審査の間、FDAは、FDAが審査を完了するために必要な装置に関する追加情報の提供を要求する可能性がある初めからやり直すお願いします。FDAは、対話的に任意の未解決の欠陥(すなわち、相互作用審査)をリアルタイムで解決しようと試みることができる。FDAが要求者が必要とする追加情報が対話審査に適していないと判断した場合、および/または合理的な時間範囲で提供できない場合、FDAは追加情報要求を発行する初めからやり直すしばらく保留をお願いします。出願人は、FDAによって決定された各項目に対する完全な応答を提出するために180日の時間を有する。FDAが180日以内に補足情報要求のすべての欠陥に対する完全な回答を受け取っていない場合、初めからやり直す申請は撤回とみなされ、FDAの審査システムから削除されるだろう。もし…初めからやり直す要求が削除された場合、初めからやり直す要求者は、装置に対するFDAのマーケティング許可を求めるために、新しい出願を提出する必要がある。
28
FDAは拒否するかもしれません初めからやり直す他の理由に加えて、510(K)の合法的な販売に適した述語デバイスが決定された場合、またはデバイスが低~中リスクではないと判断された場合、または一般的な制御措置がリスクを制御するのに不十分であり、特別な制御措置を制定することができない場合、または出願人がその臨床試験に関連する欠陥を十分に解決しておらず、FDAが要求補足情報において欠陥を決定した場合、分類要求を引き起こす可能性がある。クラスIまたはクラスIIに分類されるデバイス初めからやり直す分類要求を販売し、将来の販売前通知510(K)によって提出される述語として使用することができる。
上場前の承認ルート
FDAがPMAを要求するIII系デバイスについては,PMAをFDAに提出しなければならない。PMAプロセスは510(K)上場前通知プロセスよりもはるかに要求が高い.PMAは、FDAがこの装置の安全性と有効性を満足的に証明する合理的な証拠を証明するために、技術、臨床前、臨床試験、製造およびラベルを含む広範なデータ支持を有しなければならない。
PMA提出後、FDAは、FDAが審査申請を提出するかどうかを決定するために、実質的な審査を可能にするために、申請が十分に完全であるかどうかを決定するために45日の時間がある。FDAは180日間の審査で提出されたPMAがあり,申請の審査には通常より長い時間がかかるにもかかわらず,数年もかかる可能性がある。この審査期間内に、FDAは、より多くの情報を提供することを要求することができ、または提供された情報を明確にすることを要求することができる。また,FDA以外の専門家コンサルタントグループを集めて申請を審査·評価し,装置の承認についてFDAに提案することも可能である。FDAは諮問グループ決定に制約されていないにもかかわらず,グループのアドバイスはFDAの全体的な意思決定過程に重要である。また,FDAは生産施設の承認前検査を行い,品質体系法規(QSR)に適合することを確保する可能性がある。この機関はまた、FDAの規定に適合することを確実にするために、1つまたは複数の臨床場所を検査することができる。
FDAは,申請者がテストと分析を完了した直後にPMAの離散部分(モジュール)をFDAに提出して審査することを可能にしている。FDAは1種のメカニズムを提供し、申請者が臨床前データと生産情報を提出して審査を行うことができ、同時に臨床データを収集、編集と分析することができる。したがって、モジュール化されたPMAは、異なる時間に提出された部分または“モジュール”のアセンブリであり、これらの部分または“モジュール”は一緒に完全な出願となる。さらに、モジュール化方法は、従来のPMA出願ではなく、FDAが審査中に発見した任意の欠陥を潜在的に解決することを可能にする。
PMA審査が完了した後、FDAは、(I)商業マーケティングを許可し、最初に要求されたものよりも限られた1つまたは複数の適応の特定の処方情報を提供するPMAを承認することができ、(Ii)FDAがPMAが承認可能であると考え、FDAがどのような追加の情報を必要とするか、または承認前に同意しなければならない承認後の承諾を示す承認可能な書簡を発行することができる。(Iii)承認に必要なステップを概説する承認不可能な手紙を発行するが、これらのステップは、通常、承認可能な手紙のステップよりも煩雑であり、追加の臨床試験を必要とする可能性があり、これらの試験は、しばしば高価で時間がかかり、承認が数ヶ月または数年遅れる可能性があり、または(Iv)出願を拒否する。FDAが承認可能または承認不可能な手紙を発行した場合、出願人は180日の時間で応答し、その後、FDAの審査クロックがリセットされる。
29
臨床試験
臨床試験はほとんどいつも発売前の承認を支持する必要があり、通常は必要です初めからやり直す分類許可は,510(K)の許可が必要となる場合がある.米国では,重大なリスク機器については,これらの試験は臨床試験を開始する前に研究装置免除(IDE)申請をFDAに提出する必要がある。IDEアプリケーションは、動物および実験室テスト結果のような適切なデータサポートを必要とし、人体上でデバイスをテストすることが安全であり、テストスキームが科学的に合理的であることを示している。特定の研究場所の特定の数の患者に対して、IDEは事前にFDAの承認を得なければならない。試験期間中、スポンサーは調査員の選択、試験モニタリング、報告、記録保存に関するFDAのIDEの要求を守らなければならない。調査者は患者のインフォームドコンセントを得,調査計画や研究案を厳格に遵守し,調査設備の配置を制御し,すべての報告や記録保存要求を遵守しなければならない。IDE申請がFDAや臨床試験現場の適切な機関審査委員会(“IRBs”)の承認を得るまで,重大なリスク機器の臨床試験は開始されない可能性がある。IRBは適切に構成されたグループであり、被験者に関連する医学研究を審査および監督することが正式に指定されており、ヒト研究被験者の権利、安全および福祉を保護するために、研究の修正、または不承認を承認、要求する権利がある。重大なリスクのないデバイスは、FDAがIDEを承認する必要はない;しかし、臨床試験は依然としてFDAのIDE法規の様々な要求に適合し、臨床試験場所のIRBによって承認されなければならない。FDAまたは臨床試験が行われている各地点のIRBは、対象のリスクが利点よりも大きいと考えられるか、またはFDAまたはIRBの要求を遵守できないと考えることを含む、様々な理由で臨床試験の承認を随時撤回することができる。試験が完了しても、臨床試験の結果は、装置の安全性および有効性を証明できない可能性があり、曖昧である可能性があり、または製品の承認または許可を得るのに不十分である可能性がある。
設備臨床試験のスポンサーはWww.Clinicaltrials.gov臨床試験情報の公共データベースです登録の一部として,設備,患者群,調査段階,研究場所や研究者,臨床試験の他に関する情報が公開される。
アメリカ食品医薬品局の持続的な規制
設備が許可された後でも初めからやり直す分類または承認され、市場に投入され、多くの規制要件が適用される。これらの措置には
デバイスで510(K)の許可または初めからやり直す分類補助金の場合、その安全性または有効性に深刻な影響を与える可能性のある修正、またはその予期される用途に重大な変更を構成する可能性のある任意の修正は、新しい許可を必要とするか、またはPMAが必要とされる可能性がある。FDAは各メーカーに最初にこの決定を行うことを要求しているが、FDAはどのような決定も審査することができ、メーカーの決定に同意しなくてもよい。FDAが新たな510(K)承認を求めない決定に同意しない場合、FDAは、製造業者に510(K)の承認または可能な上場前承認を求めることを遡及することができる。FDAはまた、510(K)の許可または発売前に承認されるまで、製造業者に販売および流通および/または修正された装置のリコールを要求することができる。しかも、このような場合、製造業者は巨額の規制罰金と処罰を受けるかもしれない。
30
適応、ラベル、または製造プロセスまたは施設の変更を含む承認されたPMAデバイスのいくつかの変更は、変更を実施するために、新しいPMAまたはPMAサプリメントをFDAと承認して提出する必要がある。PMAの補足は、通常、元のPMAに必要な同じタイプの情報の提出が要求されるが、補足は、一般に、元のPMAがカバーするデバイスの提案変更をサポートするために必要な情報に限定される。FDAはPMAサプリメントを審査する際に原始PMAを審査するのと同様のプログラムと行動を使用する。
FDAの規定は製造業者にFDAへの登録を要求し、彼らが販売している設備を列挙する。また,カリフォルニア衛生サービス部(“CDHS”)はメーカーに同州への登録を要求している。これらの登録の後、FDAとCDHSは、メーカーがQSRと適用される州法規に適合しているかどうかを定期的に検査する。これらの規定は私たちの製品を生産し、規定された方法で製造、テスト、制御活動に関連するファイルを保存することを要求します。私たちはまた安全作業条件、実験室、製造実践に関連する他の連邦、州、地方法律法規を守らなければならない。適用される規制要件を遵守しないことは、FDAまたは州当局が法執行行動をとる可能性があり、その中には、以下のいずれかの制裁が含まれている可能性がある
医療機器報告法律および法規は、製造業者が、その装置が死亡または深刻な傷害をもたらす可能性があり、またはそれを促進する可能性があること、および(障害が再び発生した場合)死亡または深刻な傷害を引き起こす可能性があるという情報を受信または認識した場合に、FDAに情報を提供することを要求する。さらに、FDAによって販売が禁止されているデバイスは、タグ外用途のために使用され、特定のデバイスの広告が規制されている。FDAおよび他の機関は、ラベル外用途の普及を禁止する法律および法規を積極的に実行しており、ラベル外用途を不当に普及させていないことが発見された企業は、巨額の罰金や刑事起訴、連邦医療保健計画がカバーする製品のFCA責任を含む重大な責任に直面する可能性がある。
最後に、新たに発見または開発された安全性または有効性データは、新たな警告や禁忌症の増加を含む上場製品のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要があるかもしれない。さらに、新しい立法によって生成された要求を含む新しい政府要求が確立される可能性があり、またはFDAの政策が変更される可能性があり、規制部門が私たちが開発している製品の承認または承認を延期または阻止する可能性がある。
公表された指導意見とFDAとの4回の相互作用によると、BT-001の制御経路は初めからやり直す分類要求提出。2022年10月FDAは私たちの初めからやり直すBT-001の分類要求を受けて実質的な審査を行った。BT−001のマーケティング許可を得た後、以下の候補製品は510(K)の許可を得る可能性が高いと予想される。
保証と精算を請け負う
薬物とデジタル疾病管理計画のカバー範囲は広いにもかかわらず、アメリカの商業保険会社、連邦医療保険と医療補助(総称して“支払者”と呼ぶ)はそのT 2 D患者群のために経済的で効率的な看護を実現する上で引き続き挑戦に直面している。T 2 Dは1患者あたり年間10,000ドル以上の直接医療費を増加させると推定されており,その中で処方薬は患者あたり年間4,500ドルを占めている。個々の患者のコストが高く,支払者は疾患管理に大量の資源を投入しているにもかかわらず,T 2 D患者の約半分は血糖コントロールを実現できない。
31
CMDXの根本的な原因であるPDTに対して、よく見られる併存問題を解決し、持続的な薬物需要を潜在的に減少或いは除去し、疾病の進展を阻止或いは逆転することによって、他の医療コストを大幅に低減し、支払者に重大な価値を提供する可能性があると信じている。2022年5月、私たちは15の支払先に対して初歩的な定価研究を行い、その中に国家計画、地域計画、PBMを含む。2022年12月、私たちはBT-001と支払者の間の価値物語の草稿をテストするための単盲研究を行った。参加者(n=10)は、現在または最近の支払者P&T処方または医療政策決定者である。審査の価値提案草案は疾病負担、満たされていない需要、治療方案及びBT-001の製品と臨床情報草案を含む。この研究のフィードバックは支払者に対する私たちの価値主張陳述を改善するために使用される。我々は,2023年3月から,認可前の衛生経済情報交流対話でこのプレゼンテーションを使用する予定である。2023年2月、我々は単独の二重盲検研究を行い、参加者(n=7)は、支払先との契約構造をどのように最適化するかを知るために、現在の支払先の意思決定者である。著者らはいくつかの変数をテストし、これらの変数に基づいてプロトコルを構築することができ、患者参加度、臨床結果と財務目標を含む。全体有料ユーザーはBT-001の目標製品の概要と肝心な実験結果に積極的に反応した。最後に、HEORモデルが完成し、最適化が行われている。2023年上半期により多くの定価と支払者研究を行う予定だ。結論的に、これらの研究およびモデリング作業の結果は、価格設定および契約構造に関する私たちの意思決定に参考を提供するだろう。
潜在的なビジネス投入後に支払人の精算範囲を最適化するために,実世界環境における使用と結果に関する長期データを用いてBT−001の価値を実証する証拠を生成している。これは私たちの6ヶ月間の無作為対照の重要な実験によって作られた証拠の補充だ。我々は,マサチューセッツ工科大学ブリグラム校,コロラド州予防センター臨床研究,コロラド大学,ダレム退役軍人管理局医療センターと協力してこのような実世界証拠研究を行っている。
また,多支払者クレームデータセットを用いて予想される患者群の総看護コストを評価することで,この証拠を補完したい。BT−001の総介護コストへの影響を見積もるために,BT−001使用に関するすべての証拠を用いてロバストな費用対効果と予算影響モデルを作成する予定である。信頼性の良い組織とともにこれらの結果を公表し,これらの証拠を利用して処方審査委員会に提出するために我々のAMCP価値アーカイブを開発したい。われわれは支払人と接触し,臨床的エビデンスの期待に関する知見を得て,カバーを考慮してきた。証拠が利用可能な場合には,支払者と授権前の医療経済情報交換対話を行い,2023年3月から補償範囲の検討を開始する予定である。
時間の経過とともに,BT−001の広範な支払者のカバーまたは十分な補償を得ることに成功したかどうかは予測できないが,以下の要因は支払者の積極的な保証と補償決定を支持する:(1)BT−001は商業支払者と連邦医療保険(約86%の糖尿病患者に保険を提供する)を解決し,年間約2000億ドルかかる巨大な問題(T 2 D),(2)BT−001は薬品使用や全体医療コストを減らすことで支払者に資金を節約する可能性があり,(3)BT−001は既存の臨床ガイドラインの空白を埋め,既存のプロバイダのワークフローと統合する可能性がある。
販売とマーケティング
BT-001の市販時の予想される用途は、医師の監視下で、コントロールされていないT 2 D患者の血糖コントロールを改善することである。これは米国のターゲット患者人口が約1300万人であり,毎年処方薬への支出が400億ドルであることを意味する。86%のT 2 D患者が一次保健提供者の定期看護を受け、彼らの病状を治療したと推定されている。
市場戦略を押し上げる
アメリカには約1300万人の未コントロールの成人T 2 D患者がいるが、的確な方法が望まれる。我々の方法を知らせるために,非制御T 2 D患者密度が最も高い提供者,衛生システム,支払者を決定した。分析により、50個の総合提供ネットワーク或いは衛生システムは約25の区域の主要な支払者と重なり、約4000万人の生命、あるいは区域支払者がカバーする総生命の45%をカバーしていることが分かった。これらの目標は、強力な初期送信をサポートし、重複が存在する地域に比較的柔軟なチームを配置するために使用される。
32
1つの患者クレーム分析は、BT-001が最大の潜在的なメリットを有する患者キューを決定し、私たちはこれらの患者を私たちが重点的に注目する医療提供者と一致させた。これらの供給者は、我々のクレーム分析において使用されている制御されていない特定の集団に加えて、T 2 Dを有する他の患者を治療し、これらの患者も処方の適切な候補である可能性があり、それにより、商業化された最初の数ヶ月にBT−001に導入される可能性のある患者の範囲を拡大する。この戦略は,支払者の手がかり,顧客マネージャー,医学連絡人からなる50名以下の現場代表に向けて起動時に実行したい.時間が経つにつれて、地域と国家計画のカバーと参入を獲得することで、地方向けのチームを拡大することができます。
BT−001が市販されていれば,現在商業発売に備えており,臨床利害関係者を含めた科学会議で存在している。我々は,我々の重要な試験と実際の研究による証拠を用いて臨床と健康結果データを発表し,BT−001の利点を示している。BT−001の早期発射段階に合わせて、今年後半の会議で提出するための要約が作成されている。証拠の発生に伴い、T 2 Dを治療する第一線のPDTとしての使用をさらに統合するために、BT-001を未来のコンセンサスガイドラインに組み込むことを提唱し始めたい。私たちは、これらの努力を指導するための医療事務組織を構築しており、その主な役割は、思想指導者を科学的発話に参加させること、重要なオピニオンリーダーからなる顧問委員会を構築し、講演者グループを作成し、BT-001を将来のT 2 Dコンセンサスガイドラインの一部とすることを支援することを含む。私たちの医療チームはまた証拠の生成と発表に重要で持続的な役割を果たし、これらの証拠はBT-001と未来のプラットフォーム製品が臨床結果、効果の持続性と総看護コストに影響を与えることを示している。
私たちはまた、主要なオピニオンリーダー顧問を招聘し、私たちが発売した教育番組やマーケティング材料に情報を提供してくれた。私たちは目標分析と数字と非個人普及に引き続き投資する予定だ。支払人の精算範囲の拡大に伴い,ターゲットを絞った消費者向け広告を実施し,BT−001のT 2 Dにおけるメリットに対する認識を高める予定である。
看護基準と結合する
T 2 Dは壊滅的な疾患であり、時間の経過とともに徐々に悪化し、通常、高血圧、高コレステロール、心不全、慢性腎臓疾患などの複雑な併存疾患を引き起こす。疾患進展を引き起こす不良行為に適応するツールが不足しているため、提供者は現在唯一利用可能な治療選択-薬物を利用している。患者の糖尿病の悪化に伴い、サプライヤーは通常多種の薬物を増加し、患者の血糖コントロールを実現しようとしている。65歳の時、T 2 D患者は平均5種類の薬物を服用して糖尿病とよく見られる合併症を治療したが、多くの人は血糖コントロールを実現できなかった。
ADAの臨床治療ガイドラインは,行為療法を疾患進展の第一線の治療として,単独で使用または薬物と併用することを推奨している。最近更新された2022年糖尿病医療看護標準はすべての糖尿病患者が糖尿病自己管理教育に参加することを提案し、そして必要な支持を得て、糖尿病自己看護の知識、意思決定と技能把握を促進し、そしてデジタルコーチとデジタル自己管理干与は糖尿病自己管理教育と支持を提供する有効な方法であることを指摘した。これらの共通認識ガイドラインと広く一致しているにもかかわらず、現在FDA監督管理の治療方法はまだこの満たされていない需要を解決しておらず、医療保健システムがこれらの需要を提供する実用的な方法もない。BT-001は、FDAによって規定された行動療法を彼らの患者に処方することができるユニークな機会を提供する。BT-001は彼らの病状の根本的な原因を引き起こす行為に特化して設計されているため、著者らが初めて発売したT 2 D PDT療法はこれらの患者の多くの人に希望を提供し、より良い血糖コントロールを実現し、薬物に対する需要を減少或いは除去し、インシュリン治療を完全に回避した.
最初の目標患者には18歳以上の患者が含まれ,新たな非インスリン治療を受けているにもかかわらず,A 1 c目標には達していない。これらの患者の治療は徐々にアップグレードしており、代替解決策を求める動力がある。著者らのクレームデータ分析は、この定義に符合するT 2 D患者密度が最も高く、彼らはBT-001から最大の利益を得ることを示した。研究の結果、著者らは50名未満の代表的な中規模の販売チームを用いて、大多数の制御されていないT 2 D患者を治療する的確な医師を集めることで、50万近くの患者に接触することができる。BT-001は、大規模な採用を実現するために、既存のプロバイダのワークフローに容易に適応することを目的としている。BT−001は処方をもとにT 2 D管理の同じ看護基準に従う。BT−001は薬物治療と組み合わせることを目的としており,患者の疾患を安定させ,A 1 Cの改善を推進する機会がある。プロバイダは依然としてBT-001の核心的なケア者であり、BT-001は治療を通じて患者と患者の関係を強化する方法を提供し、この治療は診察中に患者の肝心な行為の変化方案を助け、そして持続的な生活様式の変化を行う機会がある。
33
協力パートナーシップ
私たちは業務発展に取り組んでおり、BT-001と私たちのプラットフォームの価値を非希釈で最大化しています。私たちは製薬、医療技術、技術会社と協力する機会を模索しています。これらの会社はCMDXのために伝統的な薬物療法をマーケティングし、デジタル健康に戦略的興味を持っているか、あるいは私たちのプラットフォームの開発と商業化に成功した組織インフラを持っています。心臓代謝分野で運営する製薬会社と共同で新しい組合せ製品を開発する機会もある可能性がある。
私たちは私たちの製品をアメリカで商業化するつもりだ。製薬会社と協力する機会を求め、私たちの製品をアメリカ以外で商業化していきたいと思います。
従業員と人的資本
2022年12月31日までに、私たちは54人の従業員がいて、すべて常勤従業員で、そのうち研究開発者は40人、販売とマーケティング人員は3人、一般と行政人員は11人です。私たちは労働組合によって代表されている職員は一人もおらず、私たちは私たちと従業員との関係が良いと信じている。
私たちは私たちの未来の成功は私たちが高い技能職員たちを引きつけて維持し続ける能力にかかっていると信じている。私たちは従業員に競争力のある給料とボーナス、株式機会、持続的な学習と成長を支援する発展計画、医療保健、退職計画、有給休暇を含む彼らの生活のあらゆる福祉を促進する穏健な雇用プランを提供する。私たちは人材を向上させ、維持するための努力の一部として、持続的な発展にも投資している。
私たちの成功は私たちのグループの多様性と包容に対する私たちの約束に根付いている。私たちは様々なレベルの多様性を重視し、私たちの多様性と包括的なイニシアティブを従業員チーム全体に拡張し、マネージャーとの協力から多様なチームを構築する戦略の策定、様々な背景からのリーダーの昇進を促進することに集中し続けています。
法律訴訟
私たちは現在どんな実質的な法的手続きの当事者でもない。正常な業務過程で、私たちは法的手続き、クレーム、そして訴訟の影響を受けるかもしれない。
企業情報
著者らは2015年4月1日にデラウェア州有限責任会社として設立され、名称は栄養発展集団有限責任会社(“LLC”)である。LLCは2016年8月18日にFarewell LLCに変更され、2018年1月4日にBetter Treateutics LLCに変更された。LLCは2020年8月14日にその完全子会社Better Treateutics,Inc.,Inc.に合併し,これはデラウェア州の会社(“Legacy BTX”)であり,Legacy BTXは合併後に生き残った。2021年10月28日、Legacy BTXはMountain Crest Acquisition Corp.IIの完全子会社MCAD Merge Sub,Inc.(MCADと略す)(このような合併、業務合併)と合併し、MCADはBetter Treateutics,Inc.と改称された.
私たちは遠く離れた“完全に分散した”会社で、オフィスがない。私たちの会社の郵送先はサンフランシスコ市場街548番、49404番、CA 94104、電話番号は(415)887-2311です。私たちのサイトはhttp://www.bettertx.comです。当社のサイトに掲載されているか、当社のサイトから取得可能な資料は本年度報告に含まれていませんので、閣下はこれを本年度報告の一部と見なすべきではありません。私たちは本年度報告書に私たちのサイトアドレスを含めて、非アクティブなテキストとしてのみ参考にします。
利用可能な情報
Form 10−Kの年次報告,Form 10−Qの四半期報告,Form 8−Kの現在報告,依頼書,その他の情報をSECに提出した。私たちが証券取引委員会に提出した書類は、証券取引委員会のウェブサイトwww.sec.govで調べることができる。ウェブサイトもありますhttp://www.bettertx.comです当社は、当社のForm 10-K年次報告、Form 10-Q四半期報告、Form 8-K現在の報告、および任意の証拠品およびこれらの報告の修正を含む、当社のサイトの投資家関係部分でSECに提出または提出した文書を無料で提供します。このような材料をSECに電子的に提出したり、SECにこのような情報を提供したりした後、合理的に実行可能な場合には、このような情報をできるだけ早く提供する。私たちのウェブサイト上の他の情報は、本報告またはSECに提出または提供する任意の他の報告の一部ではありません。
34
第1 A項。リスク要因です
会社や我々の業務を評価する際には、本年度報告書や証券取引委員会に提出された他の書類に記載されている他の情報に加えて、以下のリスク要因を慎重に考慮しなければならない。私たちの普通株に投資することは高い危険と関連がある。もし実際に以下のいかなるリスクと不確定要素が発生すれば、私たちの業務、将来性、財務状況と経営結果は重大な不利な影響を受ける可能性がある。以下に説明する危険は詳細ではなく、私たちが直面している唯一の危険でもない。新しいリスク要素は時々出現する可能性があり、いかなる要素或いは要素の組み合わせが私たちの業務、将来性、財務状況と運営結果に与える影響を予測できない。
リスク要因の概要
35
私たちの業務に関わるリスク
著者らは臨床段階のデジタル治療会社であり、運営歴史は限られており、設立以来ずっと重大な財務損失を受けている。私たちは予測可能な未来に、私たちは引き続き重大な財政的損失を受けると予想している。
私たちは臨床段階のデジタル治療会社で、運営の歴史は限られている。私たちは2015年4月に設立され、今まで私たちの行動は限られていた。私たちは、収入を創出し、規制されたマーケティング許可を得る能力があること、ビジネス規模で任意の製品を製造すること、または第三者代表がそうすること、または成功した製品の商業化に必要な販売およびマーケティング活動を行うことを証明していません。
36
私たちは商業販売を許可していない製品は、これまで製品販売から何の収入も発生していません。BT-001がFDAの許可を得ていれば、2023年の商業化までは何の収入も生じないと予想されます。われわれの臨床前と臨床開発,商業化前活動と持続運営に関する多くの研究·開発,その他の費用が発生し続ける。したがって、私たちは利益を上げず、設立以来各時期に損失を出した。純損失と負のキャッシュフローはすでに我々の株主権益と運営資本に悪影響を与え続けている。2022年12月31日と2021年12月31日までの12ヶ月間の純損失はそれぞれ3980万ドルと4030万ドルだった。2022年12月31日現在、私たちの累計赤字は1兆115億ドルです。私たちは予測可能な未来に引き続き大きな損失を受けることが予想され、私たちが私たちの候補製品を研究·開発し、規制マーケティング許可を求めるにつれて、これらの損失は増加するだろう。
私たちは次の場合、私たちの費用が大幅に増加すると予想している
デジタル治療製品の開発には大量の前期資本支出と重大なリスクが必要であり、即ちいかなる潜在的な候補製品は十分な治療効果を示すことができず、監督管理マーケティングの許可を得て、市場参入と精算を確保し、商業上実行可能になるため、わが社のいかなる投資に対しても非常に高い投機性を持っている。さらに、FDAまたは他の規制機関が、現在予想されている基礎の上で臨床試験を行うことを要求する場合、または私たちの臨床試験または私たちの任意の候補製品の開発のための適切な手配を確立したり、任意の製品開発を完了する上で何かの遅延が生じた場合、私たちの費用は私たちの予想を超えるまで増加する可能性があります。
あなたは私たちの将来性を考慮して、会社が臨床開発でよく遭遇するコスト、不確実性、遅延と困難、特に私たちのような臨床段階のデジタル治療会社を考慮すべきです。私たちの将来の成功や生存能力に対するあなたのどんな予測も、私たちがより長い運営歴史や成功開発と商業化デジタル治療製品の歴史を持っているほど正確ではないかもしれません。私たちの業務目標を達成する時、私たちは予見できない費用、困難、複雑な状況、遅延、および他の既知または未知の要素に遭遇する可能性がある。
私たちが経営を続けている企業として継続する能力には大きな疑いがあります。
設立以来、私たちは大きな財政的損失を受けた。2022年12月31日と2021年12月31日までの12ヶ月間の純損失はそれぞれ3980万ドルと4030万ドルで、2022年12月31日までの累計赤字は1兆115億ドルだった。しかも、私たちは予測可能な未来に、私たちは引き続き重大な財政的損失を受けると予想している。2022年12月31日まで、私たちの既存の現金と現金等価物は1570万ドルで、2023年第1四半期まで私たちの運営に資金を提供する予定です。そのため、私たちが経営を続けている企業として継続する能力を大きく疑っています。本年度報告書の他の部分に含まれる我々の財務諸表には、このような不確実性の結果に起因する可能性のある調整は何も含まれていない。また、我々の独立公認会計士事務所の2022年12月31日までの年次報告には説明段落が含まれており、私たちが継続的に経営している企業として経営を継続する能力に深刻な疑いを示しています。
37
私たちは、株式や/または債務証券の売却など、様々な融資源を通じてより多くの資金を求める予定であり、他の非希薄融資選択を模索している。未来のどんな資金調達努力も成功するという保証はない。もし私たちが追加資金を得ることができない場合、あるいは私たちが受け入れられる条件で十分な追加資金を集めることができなければ、私たちは私たちの製品開発計画や商業化計画を大幅に延期、減少、または中止しなければならないかもしれない。私たちはまた、私たちの業務を制限または終了し、私たちの従業員を削減し、私たちの開発計画を停止し、私たちの資産の全部または一部を清算したり、他の戦略的選択を求めたりすることを要求される可能性があり、この場合、投資家は彼らの投資から何の見返りも得られず、彼らのすべての投資を失う可能性がある。
私たちは製品販売から収入を得たことがなく、永遠に利益を上げないかもしれない。
私たちが利益を達成して維持する能力は、私たちが収入を創出したり、他の業務発展計画を実行する能力にかかっています。私たちは、規制部門が開発または開発可能な候補製品の許可を得ることができなければ、大量の収入は発生しないと予想し、商業化に成功した。成功した商業化は多くの重要なマイルストーンを実現する必要があり、臨床試験において安全性と有効性を証明し、これらの候補製品のために監督管理許可を獲得し、私たちが監督管理許可を得る可能性のある製品を開発、販売し、任意の発売後の要求を満たし、個人保険或いは政府支払人から有利な製品補償を得ることを含む。これらの活動に関連する不確実性とリスクのため、私たちは収入の時間と金額、さらなる損失の程度、または私たちがいつ利益を達成することが可能かどうかを正確かつ正確に予測することができない。私たちはこのような活動で決して成功しないかもしれないし、たとえ私たちが成功しても、私たちは私たちが利益を達成するのに十分な収入を生むことができないかもしれない。たとえ私たちが確実に利益を達成したとしても、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。
私たちは実現して利益を維持することができず、私たちの普通株の市場価格を低くし、資金を調達し、業務を拡大し、製品を多様化したり、運営を継続する能力を弱める可能性があります。もし私たちが設立以来のように損失を受け続けると、投資家は彼らの投資から何の見返りも得られず、彼らのすべての投資を失うかもしれない。
私たちは大量の追加資金が必要になります。もし私たちが必要な時に資金を集めることができなければ、私たちは私たちの製品発見と開発計画や商業化努力の延期、減少、または中止を余儀なくされるかもしれません。
設立以来、私たちの業務は大量の現金を消費した。我々の候補製品の臨床や臨床前開発,BT−001の商業化前活動を継続するために多くの資金を費やしていく予定である。私たちは私たちが現在計画している臨床試験、そして私たちの製品候補製品の任意の未来の臨床試験と任意の未来の臨床試験を完成するために追加の資金を集める必要があります。私たちの開発努力の過程で、他の予期しない費用が生じるかもしれない。もし私たちが開発した候補製品のためにマーケティングの許可を得ることができれば、これらの候補製品を発売して商業化するために多くの追加資金が必要になるだろう。私たちが開発した候補製品の開発と商業化に成功するために必要な実際の金額を合理的に見積もることはできません。私たちは候補製品の開発と商業化を達成するために多くの追加資金が必要かもしれません。
私たちが今後追加支出が必要かどうかは、多くの要素によります
38
私たちは許容可能な条件で追加資金を提供するかどうか、あるいは根本的にできないかどうかを確認することができない。もし私たちが受け入れられる条件で十分な追加資本を調達できなければ、私たちは私たちの製品開発計画や商業化計画を大幅に延期、減少、または中止しなければならないかもしれない。
2023年第1四半期まで、私たちは私たちの運営費用と資本支出需要に資金を提供できると信じています。私たちの推定は間違っていることが証明されるかもしれないし、私たちは今予想されているよりも早く私たちが利用できる資本資源を使用することができる。さらに、変化する状況-そのいくつかは私たちの制御を超えているかもしれない--私たちの資本消費速度は私たちの現在の予想よりも大きく速く、私たちは計画よりも早く追加資金を求める必要があるかもしれない。
私たちのパイプライン開発には大量の資源が必要であるため、私たちが資金を得る能力に応じて、いくつかの候補製品を優先的に開発しなければならない。私たちはもっと利益があるかもしれないし、成功する可能性の高い候補製品や適応に限られた資源を使うことができないかもしれない。
私たちには現在候補品があります初めからやり直す分類要求は、FDAおよび異なる早期開発段階にある他のいくつかの候補製品を待っている。優先順位と資源配分の過程を維持し、より先進的な候補製品BT-001の商業化を積極的に推進する前に、より多くの潜在的候補製品の開発と最適なバランスを確保することを求めている。我々の候補製品の開発には大量の資源が必要であり,現在資金が限られているため,どの候補製品を追求し推進するか,各候補製品に割り当てる資源数を決定しなければならない.
我々は、特定の候補製品または治療分野に研究、開発、協力、管理および財政資源を割り当てる決定が、いかなる実行可能な商業製品の開発にもつながらない可能性があり、より良い機会から資源を移転する可能性がある。もし私たちが任意の候補製品の生存能力や市場潜在力について誤った判断をしたり、製薬業界の傾向、特に心臓代謝の乱れを誤読したりすれば、私たちの業務、財務状況、運営結果は実質的な悪影響を受ける可能性がある。したがって、私たちは、実行可能な商業製品または利益の市場機会を利用することができず、他の候補製品または他の疾患および疾患経路との機会の追求を放棄または延期することが要求される可能性があり、これらの疾患および疾患経路は、後に、私たちが追求することよりも大きな商業的潜在力を有することが証明される可能性があり、または私たちに有利な場合には、協力、許可、または他の特許権使用料によって、これらの候補製品に貴重な権利を放棄するように構成される。
追加資本の調達は私たちの株主に希釈し、私たちの運営を制限したり、私たちの技術や候補製品に対する権利を放棄することを要求するかもしれません。
私たちは私たちが計画した運営に関連した費用が増加すると予想している。私たちの候補製品から大量の収入を生み出すことができない限り、私たちは公開または私募株式発行、債務融資、協力、許可手配、または上記の任意の組み合わせによって、私たちの将来の現金需要に資金を提供する予定です。また、有利な市場条件や戦略的考慮により、現在または将来の運営計画のために十分な資金があると考えても、追加の資本を求めることができる。
私たちが普通株、転換可能証券、または他の株式証券を売却することによって追加資本を調達する場合、あなたの所有権権益は希釈される可能性があり、これらの証券の条項は清算または他の特典および逆希釈保護を含む可能性があり、これは普通株主としての権利に悪影響を及ぼす可能性がある。さらに、債務融資(実行可能であれば)は、固定支払義務をもたらす可能性があり、追加債務を招く、資本支出を招く、留置権を作成する、株式を償還する、または配当を宣言するなど、私たちの具体的な行動をとる能力を制限する制限的な契約を含むいくつかの合意に関連する可能性があり、これらは、私たちの業務を展開する能力に悪影響を及ぼす可能性がある。また、融資獲得には、私たちの経営陣の多くの時間と注意力が必要となる可能性があり、彼らの注意を日常活動から移すことが可能であり、経営陣が候補製品開発を監督する能力に悪影響を及ぼす可能性がある。
39
もし私たちが第三者との協力やマーケティング、流通、または許可手配を通じてより多くの資本を調達するならば、私たちは私たちの技術、将来の収入源、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になる可能性のある条項でライセンスを付与しなければならないかもしれない。もし私たちが必要な時にもっと多くの資金を集めることができなければ、私たちは私たちの製品発見と開発計画や商業化努力を延期、減少、または中止することを要求されるかもしれません。あるいは私たちは自分で開発し、マーケティングすることをより望んでいた候補製品の権利を与えます。
私たちの将来の赤字額は不確定であり、私たちの四半期と年間の経営業績は投資家や証券アナリストの予想よりも大幅に変動したり、下回ったりする可能性があり、どれも私たちの株価変動や下落を招く可能性がある。
私たちの四半期と年度経営業績は未来に各種の要素によって大幅に変動する可能性があり、その中の多くの要素は私たちがコントロールできないもので、以下の要素を含む予測が難しいかもしれない
これらの要因の累積影響は我々の四半期や年度経営業績に大きな変動と予測不可能を招く可能性がある。したがって、異なる時期に私たちの経営業績を比較することは意味がないかもしれない。このような変化性および予測不可能性はまた、業界や金融アナリスト、または投資家の任意の時期に対する期待を満たすことができない可能性がある。もし私たちの経営業績や収入がアナリストや投資家の予想よりも低い場合、または私たちが市場に提供するいかなる予測よりも低い場合、または私たちが市場に提供する予測がアナリストや投資家の予想よりも低い場合、私たちの普通株の価格は大幅に下落する可能性がある。私たちが提供する可能性のある以前の公開声明の指導を満たしていても、このような株価下落は起こる可能性がある。
私たちの業務は私たちの主要候補製品BT-001の成功に強く依存している。もし私たちが臨床開発に成功できなければ、BT-001の規制マーケティング許可や商業化を得ることができず、私たちの現実世界の証拠計画を成功させることができない、あるいはもし私たちがそうする過程で遅延に遭遇すれば、私たちの業務は実質的に損害を受けるだろう。
今まで、私たちは組織として候補製品のマーケティング許可を得ていなかった。私たちの将来の成功と候補製品から収入を創出する能力は、BT-001の規制マーケティング許可を取得し、それを商業化する能力に依存します。2022年7月にBT-001の重要な臨床試験を完了しました初めからやり直すFDAは2022年10月に分類請求を受けて実質的な審査を行った。BT-001が規制の問題や他の問題に遭遇した場合、私たちの他の候補製品や業務の開発計画は実質的な損害を受けるだろう。
40
候補品を開発し続ける財力がないかもしれません初めからやり直すFDAによるBT-001の分類を待っている要求は、任意の遅延または規制許可を阻止するか、またはBT-001を商業化する問題に遭遇している
もし医者が現在のやり方を変えたくなければ、BT-001を採用し、あるいは私たちの製品が市場受容度を達成し、維持できなければ、マーケティングを許可すれば、私たちの業務、財務状況と経営結果は実質的で不利な影響を受けるだろう。
私たちの現在の業務戦略は私たちの製品に強く依存しており、FDAの商業流通許可を得て、市場受容度を維持することが可能です。市場の私たちの製品に対する受け入れと採用は心臓代謝疾患を有する患者及び支払人、健康計画と政府実体に対する教育に依存し、彼らに著者らの製品の独特な機能、臨床影響、コスト節約とその他のメリットを理解させる。もし私たちが潜在的な患者を治療する医者に私たちの製品のメリットを示すことに成功できなければ、もし私たちが販売を許可された場合、あるいは私たちが保険会社の私たちの製品に対する支持を得ることができなければ、私たちの業務、財務状況、そして経営結果は実質的で不利な影響を受けるだろう。
私たちの収入増加の主な戦略は、彼らの患者が血糖コントロールを改善するのを助けるために、私たちのBT-001デジタル療法(マーケティング許可を得たら)を採用するように医者を推進することである。医師は様々な理由で私たちのデジタル治療製品を採用しないことを選んでいるかもしれません
41
私たちの主要な候補製品BT-001について、マーケティングの許可を得たら、私たちの販売、マーケティングと訓練努力を主に一次保健医師に集中するつもりです。しかしながら、内分泌学者などの他の学科からの医師、および看護師従業員や医師アシスタントのような他の医療専門家は、糖尿病管理の需要がある患者の初期接触点であることが多い。これらの学科の医師や他の医療専門家に対して我々のデジタル治療製品の臨床利点,患者利益と安全概況に関する教育を行うことは,製品採用率を増加させる1つの要因であると考えられる。しかし、他の一次保健医や他の医療専門家が何らかの理由で(上に挙げた理由を含む)私たちのデジタル治療の利点を鑑賞し、推奨しない場合、成長戦略を実行する能力が損なわれ、私たちの業務が悪影響を受ける可能性がある。
また、私たちの製品は患者や医療保健提供者に伝統的な方法よりも複雑あるいはもっと有効ではないと思われる可能性があり、人々は彼らの現在の健康養生法を変えたくないかもしれない。また,医療提供者がそのやり方を変える速度は遅いことが多く,感知された責任リスクや新製品の使用による新たなワークフローや第三者精算の不確実性が考えられる。したがって、医療提供者は、現在の方法を変えるように説得するのに十分な証拠があるまで、私たちの製品を推薦しないかもしれない。
さらに、患者が私たちのデジタル治療を使用する潜在的な悪影響を心配したり、十分な第三者保険や精算が得られない場合、患者は私たちのデジタル治療を採用しないことを選択できないかもしれない。もし私たちの製品がどんな理由でも市場の承認を得られなければ、私たちの業務、財務状況、経営業績は実質的な悪影響を受けるだろう。
競合製品は、マーケティングが許可されていれば、私たちの候補製品のビジネス機会を減少または除去することができる。もし私たちの競争相手が技術や候補製品を開発することが私たちよりも速い場合、あるいは彼らの技術や候補製品が私たちよりも効果的または安全であれば、私たちの候補製品を開発して商業化する能力は不利な影響を受ける可能性がある。
心臓代謝性疾患を治療する臨床と商業の将来性の競争は激しく、そして迅速と重大な技術変化の影響を受ける。我々の候補製品の適応については,主要製薬会社,専門製薬会社,バイオテクノロジー会社,可能な他の技術会社からの競争に直面している。現在,いくつかの大手製薬やバイオテクノロジー会社が薬物をマーケティング·販売しているか,あるいは我々が求めている適応を治療するための候補薬を開発している。
潜在的な競争相手はまた学術機構、政府機関とその他の公共と個人研究組織を含み、これらの組織は研究を展開し、特許保護を求め、研究、開発、製造と商業化のための協力手配を確立する。そのほか、科学技術会社はますますデジタル製品の管理と心臓代謝性疾患の治療の潜在力を探索し、マーケティングの許可を獲得すれば、これらの製品は私たちの候補製品と競争するかもしれない。
私たちの競争相手は私たちよりもっと多くの財務資源、成熟した市場地位、研究開発、製造、臨床前と臨床テスト方面の専門知識を持って、監督管理マーケティングの許可を得て、清算とマーケティング商業化製品を獲得するかもしれません。したがって、私たちの競争相手は私たちよりも治療の規制マーケティング許可を得ることに成功し、広範な市場で受け入れられるかもしれない。私たちの競争相手の製品は、私たちが商業化する可能性のある任意の候補製品よりも効果的で、あるいはより効率的にマーケティングと販売することができ、私たちが開発と商業化費用を回収する前に、私たちの治療法を時代遅れにしたり、競争力を欠いたりするかもしれない。BT-001を含む任意の候補製品がマーケティングを許可されていれば、開発されている一連の治療法と競合する可能性がある。
もし私たちが私たちのすべての候補製品のためにマーケティング許可を獲得すれば、私たちは私たちの製品の有効性、安全性と耐性、私たちの製品の管理の容易さ、これらの製品の規制マーケティング許可の時間と範囲、製造、マーケティングと販売能力の可用性とコスト、価格、精算範囲、特許地位を含む多くの異なる要素に基づく競争に直面するかもしれません。既存および将来の競合製品は、私たちが開発する可能性のある任意の製品よりも効率的で、より安全で、より安価で、またはより効率的なマーケティングおよび販売を含む、より良い治療代替案を提供するかもしれない。我々が候補製品を開発·商業化する費用を回収する前に、競争力のある製品は、私たちが開発したいかなる製品も時代遅れまたは競争力を持たないかもしれない。これらの競争相手はまた私たちの従業員を募集する可能性があり、これは私たちの専門レベルと業務計画を実行する能力にマイナスの影響を与える可能性がある。
42
さらに、私たちの競争相手は、私たちよりも早く特許保護またはFDA承認およびマーケティング許可を取得し、製品を商業化することができ、これは、私たちが将来求める可能性のある許可または許可、またはマーケティング許可または許可を監督する任意の候補製品の販売に影響を与える可能性がある。FDAが私たちの任意の候補製品の商業販売を承認すれば、マーケティング能力と製造効率の面でも競争を展開するだろう。製品間の競争は、製品の効果と安全性、規制許可または許可の時間と範囲、マーケティングと販売能力、製品価格、政府と個人第三者支払者の清算範囲、規制排他性、特許地位に基づくと予想される。もし私たちの候補製品が規制マーケティングの許可を得たが、市場で効果的に競争できなければ、私たちの収益性と財務状況は影響を受けるだろう。
さらに、製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。規模の小さいものや他の早期会社も重要な競争相手であることが証明される可能性があり,特にこれらの会社が大企業や老舗会社との協力手配により破壊的療法を開発している場合である。これらの第三者は合格した科学と管理者を募集と維持し、臨床試験場所を構築し、私たちの計画と相補的あるいは必要な技術を獲得する上で私たちと競争を展開している。
買収と投資は経営困難、希釈とその他の有害な結果を招く可能性があり、私たちの業務、経営結果と財務状況に不利な影響を与える可能性がある。
私たちは将来的に補完的な会社、製品、技術、または収入を増加させるために買収するかもしれない。このような取引は私たちの運営結果と財政状況に大きな影響を及ぼすかもしれない。私たちはまた一連の潜在的な戦略的取引を評価して討論することができる。適切な買収候補を決定することは困難であり、時間がかかり、高価である可能性があり、もしあれば、有利な条件で買収を達成できないかもしれない。買収された会社、業務または技術を統合する過程は、予見できない経営困難や支出をもたらす可能性がある。私たちが直面しているリスクの分野は
43
将来の買収はまた、大量の現金支出、株式証券の希釈発行、債務の発生、私たちの業務の制限、あるいは負債、償却費用、営業権のログアウトを招く可能性があり、これらのいずれも私たちの財務状況を損なう可能性がある。しかも、私たちが発表したどんな買収も患者たちに否定的だとみなされるかもしれない。
また、私たちの業界では買収業務、技術、資産の競争が激しくなる可能性があります。私たちが達成したい買収を確認できても、商業的に合理的な条項で買収を達成できないかもしれないし、目標が別の会社に買収される可能性がある。私たちは最終的に未完成の買収について交渉するかもしれない。
このような交渉は管理時間の移転と大量の自己負担費用をもたらす可能性がある。買収の評価と実行に成功できなければ、これらの買収のメリットを実現できない可能性があり、私たちの経営業績が損なわれる可能性があります。もし私たちがこれらのリスクのいずれにも成功的に対応できなければ、私たちの業務、財務状況、または経営業績が損なわれる可能性がある。
もし私たちが単独であるいはマーケティングパートナーとの協力を通じて私たちの販売、マーケティング、流通能力を発展させることができなければ、私たちがマーケティングを許可されたら、私たちの候補製品を商業化することに成功できないだろう。
私たちは現在商業化前の活動を始めていますが、私たちのマーケティング、販売、あるいは流通能力の建設はまだ完了していません。私たちはマーケティングが許可されていれば、私たちの候補製品を商業化する販売·マーケティング組織を設立するつもりです。これらの努力は、製品候補製品が承認される前に発生する可能性がある大量の追加資源を必要とするであろう。もし私たちの販売、マーケティング、および流通能力の発展にどんな失敗や遅延が生じた場合、もしマーケティングが許可されていれば、私たちの候補製品の商業化に悪影響を及ぼすだろう。
マーケティングを許可すれば、候補製品の商業化を阻害する可能性があります
私たちの既存と未来の候補製品については、私たち自身の販売チームと流通システムの代替案として、直接販売チームと流通システムを構築する第三者との協力を選択することができます。もし私たちがマーケティングを許可されたら、私たちの未来の製品収入は私たちが直接マーケティングしたり、私たちの候補製品を販売したりするかもしれません。さらに、私たちが得たどんな収入もこのような第三者の努力に全部または部分的にかかっているが、このような努力は成功しないかもしれないし、一般的には私たちの制御範囲内でもないだろう。もし私たちがいかなるライセンスマーケティングの製品を商業化することに成功できなければ、私たちの未来の製品収入は影響を受け、私たちは重大な追加損失を受けるかもしれない。
44
もし私たちの製品が広く受け入れられなければ、マーケティングを許可すれば、私たちの収入増加は私たちが予想していたより遅くなるかもしれません。私たちの業務は不利な影響を受けるかもしれません。
私たちは医者が患者のために処方した製品処方から収入を得たいです。もし私たちの製品の販売を許可すれば。したがって、マーケティングを許可すれば、私たちの製品の広範な受容度、処方、使用は私たちの未来の成長と成功に重要だ。もし市場が成長できなかったり、増加速度が私たちの現在の予想より遅くなったら、私たちのいかなるマーケティング製品に対する需要もマイナスの影響を受けるかもしれません。私たちの収入の増加は私たちの予想よりも遅くなるかもしれません。私たちの業務は不利な影響を受けるかもしれません。私たちが販売しているどの製品の需要も、FDAの許可を得たら、多くの要素の影響を受けます。その中の多くの要素は私たちがコントロールできません。いくつかの潜在的な要因は
質の高い患者支援を提供できなかった場合、あるいは著者らの製品を開発したHCPに支援を提供できなかった場合は、既存の患者と潜在的な患者との関係に悪影響を与え、更に私たちの業務、運営結果、財務状況に影響を与える可能性がある。
私たちの製品を実施して使用する時、私たちの患者は私たちの患者の支持に依存して問題を適時に解決するだろう。私たちは患者の需要の短期的な増加に適応するために十分に速い反応をすることができないかもしれない。患者のサポートに対する需要増加はコストを増加させ、私たちの手術結果や財務状況に悪影響を及ぼす可能性がある。質の高い患者支持を維持できなかった場合、あるいは市場が質の高い患者支持を維持していないと考えられているいかなる場合も、患者満足度や医師が私たちの製品を開発する意欲に悪影響を与え、更に私たちの業務、手術結果、財務状況に影響を与える可能性がある。
私たちは将来、第三者との協力、許可手配、合弁企業、または戦略連合を行う可能性があり、これらの協力または戦略連盟は、商業可能性のある製品の開発や、相当な将来の収入をもたらすことはないかもしれない。
私たちの正常な業務過程で、提案された製品を開発し、新しい市場を求めるために、協力、許可手配、合弁企業あるいは戦略連盟を行う可能性があります。
将来的には、提案、交渉、協力、許可内手配、合弁企業、戦略同盟、またはパートナーシップを実施することは、長く複雑な過程である可能性がある。他の会社は、より多くの財務、マーケティング、販売、技術、または他の業務資源を持っている会社を含み、これらの機会や手配を競争してくれるかもしれません。私たちは、費用対効果に適合した方法で、許容可能な条項で、またはそのような取引または手配を迅速に決定、保証、または完了することはできないかもしれないし、そのような取引またはスケジュールの予期される収益を達成することもできないかもしれない。
さらに、現在と未来の協力については、私たちは取引や手配に対して唯一の意思決定権を行使できない可能性があり、これは意思決定が行き詰まる潜在的なリスクをもたらす可能性があり、私たちの協力者は、私たちの商業的利益や目標と一致しない、または一致しなくなる可能性のある経済的または商業的利益または目標を持っている可能性がある。
45
業績マイルストーンを達成することに関する衝突、または協力中に形成される財務的義務または知的財産権の所有権または制御権に関連する用語のような任意の合意の下で重要な用語の解釈など、我々の協力者と衝突する可能性がある。もし私たちの現在または未来の協力者とどんな衝突があれば、彼らは自分の利益のために行動するかもしれないし、これは私たちの最良の利益に反するかもしれないし、彼らは私たちに対する彼らの義務に反するかもしれない。さらに、私たちの現在の協力者または任意の未来の協力者が私たちの協力者または私たちの未来の製品に投入する資源の数と時間の制御は限られている。私たちと私たちの協力者との間の紛争は訴訟や仲裁を招く可能性があり、これは私たちの費用を増加させ、私たちの経営陣の注意をそらすだろう。さらに、このような取引および手配は、契約の性質に属し、適用される合意の条項に従って終了または解散することができ、この場合、当社等は、そのような取引または手配に関連する製品権利を継続しないか、または追加価格でそのような権利を購入する必要がある可能性がある。
私たちのプラットフォームまたは私たちが依存しているクラウドおよびインターネットインフラは、中断、停止、欠陥、および他の性能および品質の問題が発生する可能性があります。
私たちの業務は私たちのプラットフォームに依存して、妨害されずに利用できるようにします。私たちはすでに未来に私たちのプラットフォームの中断、停止、欠陥、その他の性能と品質の問題を経験することができます。我々のプラットフォームが依存するクラウドやインターネットインフラにも中断,停止,欠陥,その他の性能や品質の問題が発生しており,将来的にもこのような状況が生じる可能性がある.これらの問題は、新しい機能、独自およびオープンソースコードソフトウェアにおける脆弱性および欠陥、人為的エラーまたは不適切な行為、容量制限、設計制限またはサービス拒否攻撃、またはセキュリティに関連する他のイベントを含む様々な要因によって引き起こされる可能性がある。
さらに、クラウド·サービスプロバイダとの契約関係および他のトラフィック関係が終了し、一時停止され、または私たちが依存するサービスまたは機能をキャンセルするような大きな変化を受けた場合、私たちは私たちのプラットフォームを提供することができず、患者を異なるクラウドサービスプロバイダに移行する際に重大な遅延に遭遇し、追加料金を生じる可能性がある。
私たちのプラットフォームまたは私たちが依存しているクラウドおよびインターネットインフラの任意の中断、停止、欠陥、および他の性能および品質の問題、または私たちとクラウドサービスプロバイダとの間の契約および他の業務関係の任意の実質的な変化は、サービス信用義務を含む費用が増加し、私たちのブランドおよび名声を損なう可能性があり、これらは、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
私たちの業務は電力遮断、データセキュリティホール、テロのような悲劇的な事件と人為的な問題の妨害を受けるかもしれない。
私たちのプラットフォームおよび私たちのプラットフォームが依存するクラウドベースのインフラは、地震、火災、洪水、津波または他の天気イベント、停電、電気通信障害、ソフトウェアまたはハードウェア障害、ネットワーク攻撃、戦争、テロ、持続的な新冠肺炎の大流行および類似の事件など、任意の悲劇的な事件の損傷または中断を受けやすく、これらの事件は、私たちのプラットフォームの長時間のアクセス中断をもたらす可能性がある。さらに、インターネットベースの悪意のある活動を含むテロ行為は、インターネットや経済全体に破壊をもたらす可能性がある。私たちの災害復旧計画があっても、私たちのプラットフォームへのアクセスは中断される可能性がある。もし私たちのシステムが自然災害や他の事件で故障したり、負の影響を受けたりすると、プラットフォームや製品を患者に渡す能力が損なわれたり、重要なデータが失われたりする可能性があります。私たちの業務機能が災害中や災害発生後に運営を継続し、災害や緊急時にこれらの計画を成功させるための十分な計画を立てることができなければ、私たちの業務、財務状況、運営結果は損なわれます。
災害時に移動およびウェブトラフィックをバックアップデータセンターに転送することを可能にする災害復旧計画を実施しました。これにより,問題が発生した場合にトラフィックを移動させることができ,短時間で回復することができる.しかし、災害復旧計画が災害時のタイムリーまたは完全な交通の流れを効果的に支援できない場合、私たちの業務や運営結果が損なわれる可能性があります。
システム障害によるプラットフォームへのアクセス中断が私たちの業務、財務状況、および運営結果に与える可能性のある潜在的な損害を含む、私たちの潜在的な重大な損失を補償するために十分な業務中断保険を提供していません。
46
不利なグローバル経済状況は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
私たちの経営業績は世界経済と世界金融市場の全体的な状況の悪影響を受ける可能性があります。深刻または長期的な経済低迷は、資本や信用市場の極端な変動や中断を招く可能性があり、私たちの業務や必要に応じて許容可能な条件で追加資本を調達する能力に様々なリスクをもたらす可能性がある。また、私たちが債務元金と利息を返済する義務は、経済や市場低迷の影響を受けやすいようにします。
地政学的事態の発展あるいはそのいずれの状況も起こりうるとの見方は、世界的な株式市場と通貨為替レートの大幅な変動、法律法規の日々の違いを含む世界的な経済と法的不確実性を招く可能性がある。
2022年2月、ロシアとウクライナの間の武力衝突はエスカレートした。2022年2月以降、米国および他の国が発表したロシアへの制裁には、影響を受けた地域での商品、サービスまたは技術の販売または輸入制限、および旅行禁止および資産凍結、ロシアの関連個人および政治、軍事、商業、金融機関に影響を与えることが含まれている。紛争がさらにエスカレートすれば、米国と他の国はより広範な制裁を実施し、他の行動をとるかもしれない。この紛争のより広範な結果は予測できず、その中には、さらなる制裁、禁輸、地域不安定、長期的なより高いインフレ、地政学的変化、およびマクロ経済状況、通貨レート、および金融市場への悪影響が含まれる可能性があり、これらはすべて、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
上記のいずれも私たちの業務を損なう可能性があり、現在の経済気候や金融市場の状況が私たちの業務に悪影響を及ぼす可能性のあるすべての方法を予見することはできません。
私たちとHercules Capitalとの融資協定には私たちの業務の柔軟性を制限する制限が含まれている。
2021年8月、私たちはHercules Capital,Inc.(“Hercules Capital”)と代理および貸手として融資および保証協定(“融資協定”)を締結した。融資協定は、5,000万ドルまでの優先担保定期融資手配(“定期融資手配”)を提供することを規定している。融資協定は、当社の子会社の株式、現在と将来の知的財産権、保険、貿易および会社間の売掛金、在庫と設備、および契約権を含む、私たちのほとんどの資産の保有権を担保としています。融資プロトコルは,以下に述べるように,特定の最低現金要求を満たすことを要求し,特定の種類の取引に従事する能力を制限する様々な肯定と否定契約を含む.これらの条約は慣例的な例外によって制限されており、Hercules Capitalによって事前に書面で同意されずに以下のいずれかの事項を実施する能力を制限している
私たちの取締役会や管理チームは、このような行動のいずれも私たちの最良の利益と私たちの株主の最適な利益に合致すると信じている。もしそうなら、もし私たちがHercules Capitalが同意を提供しなかったため、その中のいずれかの行動を達成できなかったら、これは私たちの業務、財務状況、そして運営結果に悪影響を及ぼすかもしれない。
さらに、2023年7月1日以降、私たちは、1つ以上の制御されたアカウントで少なくとも1,000万ドルの現金要約残高を維持することを要求される。もし私たちが一定の推定要求を達成したら、このような要求は終わるだろう。これらの口座は融資協定の下での私たちの義務を保証するために現金担保口座として保存されなければならない。これらの要求は融資協定に適用されるが、これらの制御された口座に保有されている現金金額を業務運営に使用する能力は限られる。
47
2021年10月28日には1000万ドルの定期融資手配を開始し、2022年5月には500万ドルの定期融資手配を発動した。私たちが残りの定期融資メカニズムを使用することができるかどうかは、私たちが上記の条約といくつかの他の条約とマイルストーンを遵守するかどうかにかかっている。私たちは2022年9月15日までに融資協定要求の2回目の重要な試験を開始していないため、会社は関連借款を得ることができなくなりました.
ローン契約の下で違約が発生した場合、私たちは期限が切れたときにいかなるお金を支払うことができなかったか、または私たちがローン協定のいかなる規定にも従わなかったことを含み、慣例の猶予期間の規定の下で、Hercules Capitalは、すべての未返済金額の即時満期と対応を宣言し、さらなる信用延長のすべての約束を終了することを選択することができる。もし吾等が融資合意項下の満期金を返済できなければ、Hercules Capitalはそれに付与された担保を担保とし、この債務を担保する可能性があり、これは吾等の業務、財務状況及び経営業績に悪影響を及ぼす可能性がある。
また、融資プロトコルには、Hercules Capitalが、我々の業務、財務状況、またはローン契約項目の返済のいずれかの債務の将来性などに重大な不利な変化が発生した場合に、融資プロトコル項目の予定期限および債務を加速させることができる主観的加速条項が含まれている。主観的加速条項を援用すると、Hercules Capitalは要求に応じて融資合意項下の未返済元金、利息、期末費用、前払い違約金を支払う。Hercules Capitalが未来に加速された条項を引用しないという保証はない。なぜならこれは私たちの業務と財務状況に悪影響を及ぼすからだ。
Hercules Capitalの貸手としての利益はいつも私たちの利益と一致しないかもしれない。もし私たちの利益がHercules Capitalの利益と衝突した場合、融資協定の下で違約した場合を含めて、Hercules Capitalは自分の利益に従って行動することを選択するかもしれないが、これは私たちの現在と未来のHercules Capitalとの協力努力の成功に悪影響を及ぼすかもしれない。
もし私たちが私たちの成長を効果的に管理できなければ、私たちは私たちの業務計画を実行できないかもしれません。競争挑戦に十分に対応できないか、あるいは私たちの企業文化を維持することができなければ、私たちの業務、財務状況、運営結果は損なわれます。
私たちの業務の成長と拡張は私たちの管理、運営、そして財務資源に大きな挑戦をもたらした。私たちの成長を効果的に管理するためには、私たちの運営、財務、管理プロセス、システムを引き続き改善し、従業員基盤を効果的に拡大、訓練、管理しなければならない。私たちの組織が大きくなるにつれて、私たちはより複雑な組織管理構造を実施することが要求され、私たちは私たちの企業文化のメリットを維持することがますます困難になっていることを発見するかもしれない。これは私たちの業務表現に否定的な影響を及ぼすかもしれない。
私たちは純営業損失繰越(“NOL”)と相殺を使って将来の課税収入を相殺する能力が何らかの制限を受ける可能性がある。
私たちのNOLは満期になって使用されない可能性があり、その限られた期限や米国税法の制限により、将来の所得税債務を相殺するためには使用できません。適用される米国連邦所得税法によると、2018年1月1日までの課税年度に発生するNOLは、20納税年度以内に繰り越すことが許可されている。米国の現行の連邦所得税法によると、2020年12月31日以降に開始される納税年度に生じるNOLは繰り越されない可能性がある。また、2017年12月31日以降に開始された納税年度に発生するNOLは無期限に繰り越すことができます。2022年12月31日まで、私たちは約5980万ドルのアメリカ連邦と州所得税NOLがあります。2020年1月1日から2022年12月31日までの間に米国連邦税務申告目的のために生成されたNOLは約5670万ドルであり,無期限である。2020年1月1日から2022年12月31日までの間に約300万ドルの州税収を申告するために発生したNOLは2035年に満期になる。
48
一般的に、改正された1986年の“国内税法”(以下、“規則”と呼ぶ)第382節によると、会社は“所有権変更”(この規則第382節と適用される財務省条例に基づいて定義されている。すなわち、ある会社のある株主が3年間スクロール期間中の持分所有権の変化が50ポイントを超える(価値で計算))であり、変更前の純額を利用して将来の課税所得額を相殺する能力が制限されている。吾らは当社の業務のNOLが規則382節の制限を受けているかどうかは確定していないが、既存資料の予備検討により、業務合併によるNOL属性を除いて、当社はそのNOLが現在382節に制限されているとは考えていない。私たちは過去に所有権の変化を経験したかもしれませんが、将来的には私たちの業務合併またはその後の株式所有権の変化を含む所有権の変化を経験することもあります(その中のいくつかは私たちの制御範囲内ではありません)。また、将来買収可能な会社のNOLを利用する能力が制限される可能性がある。我々の業務合併から繰越されるNOL属性は、第382条の制限を受けると予想される。2022年12月31日と2021年12月31日現在、この制限を受けたNOLは7.7万ドル。もう1つのリスクは、法規の変化、例えばNOLの使用停止または他の予見不可能な理由により、私たちの既存のNOLが満了する可能性があるか、または州税収目的のためを含む将来の所得税負担を低減するために使用できないということである。これらの理由により、利益を達成しても、私たちの貸借対照表に反映されたNOLの大部分を利用できない可能性があり、これは私たちの将来の納税義務を増加させ、私たちの経営業績や財務状況に悪影響を及ぼす可能性があります。
税法の変化は私たちや私たちの投資家に悪影響を及ぼすかもしれない。
米国連邦、州、地方所得税に関する規則は立法過程に参加する人員およびアメリカ国税局とアメリカ財務省の審査を受け続けている。税法の変化(これらの変化は追跡力を持つ可能性がある)は、私たちまたは私たちの普通株の所有者に悪影響を及ぼすかもしれない。例えば、守則第174条によれば、2021年12月31日以降の納税年度には、米国で発生した研究開発費が資本化·償却され、我々のキャッシュフローに悪影響を及ぼす可能性がある。近年、このような変化は多く発生しており、将来も変化し続ける可能性がある。税務法律、法規、および裁決がいつ、どのような形態、または発効日に公布、公布または発表されるかどうかは予測できません。これは、私たちまたは私たちの株主の納税責任を増加させるか、または税法の変化のいかなる悪影響を最大限に減少または軽減するために、経営方式を変更することを要求する可能性があります。
発見と発展に関するリスク
私たちの現在の候補製品は違う開発段階にある。私たちの候補製品は開発に失敗したり、遅延に遭遇したりして、その商業生存能力に悪影響を及ぼす可能性があります。FDAの新しい分類または許可を取得または維持し、BT−001または他の候補製品を販売することができない場合、またはそのような分類または許可が延期された場合、またはFDAが私たちの予想される用途を制限するか、または私たちのラベルに含まれる臨床データを制限する場合、私たちの業務は実質的に損害を受けるであろう。
規制を求める過程初めからやり直す医療設備を分類或いは審査して、それを市場に出すのは高価で時間がかかる。マーケティング許可が付与されることは保証されない。2022年10月FDAは私たちの初めからやり直すBT-001の分類要求を受けて実質的な審査を行った。FDAまたは他の任意の候補製品からBT-001のマーケティング許可をタイムリーに得ることができない場合、私たちは外国の監督管理機関の許可を得たり、大量の収入を生成することができず、運営を停止させることができないかもしれません。具体的には、私たちはBT-001のためにもっと多くの規制マーケティング許可を求めて、他の用途のために、もし私たちが初めて初めからやり直す分類を許可する。アメリカ食品医薬品局は初めからやり直す分類過程は申請者に部分的に広範なデータに基づいて安全性と有効性を証明することが要求され、臨床前、臨床試験、技術、製造とラベルデータを含むが、これらに限定されない。FDAの規制承認手続きは、申請者が発売する設備が安全かつ有効であることを証明すること、すなわち、合法的に販売されている設備と実質的に同等であることを要求する初めからやり直す分類手続きは,申請者に新規設備の安全性と有効性の証明を要求する.FDAは延期、制限、または否定することができる初めからやり直す様々な理由で装置を分類または許可すること、を含む
49
取得する初めからやり直すFDAまたは任意の外国規制機関の分類と承認は、予想外の巨額のコストをもたらし、管理職の時間や他の資源を消費する可能性がある。FDAは,提出された材料を補充し,より多くの非臨床データを収集し,より多くの臨床試験を行い,より多くの生産データや情報を用意したり,他の時間のかかる行動をとったり,いっそ私たちの申請を拒否することを要求することができる。例えば典型的な初めからやり直す審査過程は我々が予想したように,2023年2月,FDAからより多くの情報の提供を要求され,我々が提出した材料を審査した後,FDAはより多くの情報を提供する必要があると決定したことを通知した.この手紙は,我々が提出した材料には多くの欠陥があり,重大な欠陥と副次的な欠陥に分類されるFDAの観点を概説している。私たちは、指摘されたいくつかの主要な欠陥を明らかにし、これらの問題を解決するための選択について指導を求めるためにFDAとの会議を要求する。その会議も2月に行われた。会期中、FDAは有益な背景、明確化、そして指導を提供し、私たちは今FDAのコメントに答えるために私たちの反応をまとめている。私たちはFDAの問題を解決できると信じており、私たちがこれまで提供してきた指導意見は変わらない、すなわちFDAは2023年に決定を下すことが予想される。もし私たちがこれらの不足を解決できない場合、私たちは許可を求めている使用適応を修正する必要があるかもしれないし、および/または別の臨床試験を行う必要があり、BT-001の許可および商業発売は著しく延期または許可が拒否される可能性があるかもしれない。
さらに、マーケティング許可を取得した場合、当社のデバイスのいくつかの修正をマーケティングする前にFDAの追加のマーケティング許可または許可を取得する必要がある可能性があり、発売後のデータがセキュリティ問題または治療効果がないことを示す場合、FDAはマーケティング許可または許可を取り消すか、または他の制限を加える可能性がある。もし私たちが必要な規制権限と許可を得て私たちの製品を販売することができなければ、私たちの財務状況は悪影響を受ける可能性があり、私たちの国内と国際的に成長する能力は制限されるかもしれない。さらに、許可または発売が許可されても、BT-001は、商業化または利益に成功するために必要または必要な適応のマーケティング許可を得ることができない可能性がある。
私たちはFDAのBT-001の最初の分類およびBT-001のアメリカでの市場受容度に大きく依存しているが、私たちは私たちの業務に負の影響を与えるので、FDAのBT-001の最初の分類または市場承認を得ることができなかった。
設立以来、私たちのほとんどの努力はBT-001アプリケーションの開発に取り組んできましたが、承認されれば初めからやり直す分類は,将来の市場許可の基礎として,他の適応の追加用途に用いる。私たちが1つ持つと初めからやり直すBT-001の分類要求はFDAを待っていますが、まだ受け取っていません初めからやり直すFDAの分類によれば、BT−001は、任意の用途のために米国でマーケティングおよび販売されている。しかし、私たちはFDAがあるかもしれないので、私たちのビジネスチームと販売チームを設立するコストを含めてコストを発生し始めています初めからやり直す分類を付与しています。米国でBT-001をマーケティング·販売し、その後、米国で顕著な市場受容度を達成するためにFDAから必要な許可を得ることができなければ、許可を得られれば、米国はBT-001の主要市場になると予想されるので、我々の運営結果は悪影響を受けるであろう。さらにFDA以前に予想されたコストが発生したからです初めからやり直す分類すると、BT-001がFDAのマーケティング許可を得ていない場合、またはマーケティング許可を付与された場合、これらのコストを回収することができません初めからやり直す分類されたが、市場受け入れを得ることができなかった。FDAの510(K)許可経路から得られたマーケティング許可に依存する他のデジタル治療候補薬が開発されている初めからやり直す私たちの最初のBT-001候補製品の分類;したがって、私たちが成功できなかったら初めからやり直す私たちの未定のカテゴリ初めからやり直すBT-001の分類要求、私たちは求める必要があります初めからやり直すマーケティングの次のデジタル治療適応の分類を求めていますもし…初めからやり直すBT-001は上場許可を得ているが、その設計と期待用途によって、FDAも将来の候補通過を要求するかどうか初めからやり直す分類過程、これはより長い時間とより高い開発につながるだろう。私たちが販売を求めている任意のデジタル療法の開発または市場受け入れに関連する意外または深刻な合併症または他の予見できない負の影響は、私たちの業務に実質的かつ不利な影響を及ぼす可能性がある。
50
私たちの候補製品のマーケティング許可を得るために必要な臨床試験過程は長くて高価で、結果は不確定である。私たちが開発している任意のデジタル治療応用の臨床試験が、米国または他の場所での規制マーケティング許可または承認をサポートするために必要な結果を生成できない場合、または私たちの現在または未来の製品については、これらの製品を商業化することができず、これらの製品の商業化が完了または最終的に完了できない過程で追加コストまたは遅延が生じる可能性がある。
重要な臨床試験を終えました初めからやり直すFDAは2022年10月にT 2 D治療のBT−001分類要求を受け,実質的な審査に供した。実験設計の仮想には,電子メールやソーシャルメディアを用いた参加者募集と,遠隔医療アクセスを用いた研究がある.手に入れるために初めからやり直す分類は,臨床データを提出し,その製品候補の安全性と有効性を証明しなければならない。臨床試験は複雑で高価な過程であり,何年もかかる可能性があり,結果自体は不確定である。例えば、2022年7月にBT−001のキー臨床試験の結果を発表しましたが、FDAは最終的にこれらの結果が私たちに与えるのに十分な支援を提供するかどうかを決定します初めからやり直す分類要求。われわれは臨床試験に多大な費用をかけ,大量の時間を投入する可能性があるが,これらの試験に商業収入が生じるかどうかは確認できない。われわれは臨床試験において重大な挫折を経験する可能性があり,早期の臨床試験が有望な結果を示した後でも,失敗は臨床開発過程のいつでも起こる可能性がある。私たちのどの製品も故障或いは不良影響を与える可能性があり、私たち、IRBs或いは監督機関の中断、延期或いは臨床試験の停止を招く可能性がある。我々、IRBs、FDA、または他の規制機関は、試験参加者を受け入れられない健康リスクに曝露することを回避するために、いつでも臨床試験を一時停止または終了することができる。そのほか、早期先導研究の成功結果は必ずしも未来の臨床試験結果を暗示するとは限らず、以前の先導研究或いは臨床試験結果はその後の臨床試験で重複しない可能性がある。
また,中期結果や背線結果は臨床試験のデータを全面的に審査した後に変化する可能性がある。また,FDAはパイロット研究や臨床試験データの解釈に同意しない可能性があり,あるいは臨床試験設計,進行あるいは結果が安全性や有効性を証明するのに不十分であることが発見される可能性があり,より多くの臨床試験が要求される可能性があり,これはさらに遅れる可能性がある初めからやり直す私たちの候補製品の分類許可または許可。私たちが先導研究や臨床試験から収集したデータはFDAを支援するには不十分かもしれません初めからやり直す私たちの臨床試験で私たちの未来の製品の安全性と有効性を証明できなければ、私たちの製品の商業化に必要な規制許可を得ることができないだろう。
また、様々な臨床、規制、および他の製品開発目標の予想達成時間を推定して公開することができ、これらの目標は一般にマイルストーンと呼ばれる。これらのマイルストーンは、製品開発経路を検討するためにFDAに会議要求を提出すること、または適用可能であれば、我々の候補製品の臨床試験を開始するためにIDEを提出すること、患者が臨床試験に参加すること、臨床試験データの発表、EUにCEマークを貼り付ける権利を得ることを含むことができる。私たちの推定と比較して、このようなマイルストーンの実際の時間は大きく異なる可能性があり、場合によっては、原因は私たちの統制を超えている。私たちが予想されたマイルストーンに達することを保証することはできません。もし私たちが公開発表のこれらのマイルストーンに到達できなければ、私たちの製品の商業化は遅れるかもしれませんので、私たちの株価は下落するかもしれません。
臨床試験は支援するために必要です初めからやり直す分類要求およびいくつかの510(K)は、発売前に通知され、マーケティング許可を得た任意のデジタル治療装置の修正バージョンの後続の510(K)の提出をサポートするために必要である可能性がある。これは臨床試験の参加者として識別、募集、維持することが困難である可能性がある大量の適切な被験者を募集する必要がある。私たちの重要な試験や上場後の研究の不利な結果は、私たちが得たマーケティング許可を制限したり、撤回したりする可能性もあります。私たちは将来、私たちの製品がいくつかの外国で使用されることを許可するために、もっと多くの臨床研究を行う必要があるかもしれない。臨床テストは設計·実施が困難であり,何年もかかる可能性があり,コストが高い可能性があり,結果も確定していない。これらの実験のいずれかの起動と完了は,様々な理由で阻止,延期,停止される可能性がある.臨床試験中に、コスト、スケジュール、または成功に悪影響を及ぼす可能性があるいくつかのイベントに遭遇する可能性があります
51
臨床試験はFDAの適用法律法規や他の適用規制機関の法律要求,法規やガイドラインに基づいて行われ,これらの政府機関や臨床試験を行う医療機関のIRBsの監督を受けなければならない。もし著者らの臨床試験監視活動が著者らの臨床試験規程に符合しないことが発見された場合、或いは臨床試験の適用法律、法規、要求とガイドラインに符合しなければならず、著者らは将来臨床試験場所或いは研究者を中止せざるを得ないかもしれない。
また,われわれは臨床試験サイトに依存してわれわれの臨床試験を正確かつタイムリーに行うことを確保し,それらの承諾活動に合意しているが,それらの実際の表現への影響は限られている。われわれはわれわれのCROに依存して、良好な臨床実践(“GCP”)要求に従って臨床試験を行うことを支持している。もし私たちのCROがGCP標準に適合した研究を監視し、行うことを助けることができなかった場合、または試験実行中に完全登録を実現することを含む長い時間遅延された場合、コスト増加、計画遅延、または両方の影響を受ける可能性がある。また、アメリカ以外の国で行われた臨床試験は輸送コストの増加、追加の監督要求と非アメリカCROの参加によって私たちを更なる遅延と費用に直面させ、そして著者らはFDA未知の臨床研究者に関連するリスク、及び異なる診断、スクリーニングと医療標準に直面させる可能性がある。
52
失敗は臨床試験のどの段階でも起こる可能性がある。私たちの臨床試験は否定的あるいは不確定な結果を生むかもしれないし、あるいは私たちの候補製品が効果に欠けていることを証明するかもしれません。私たちは決定するかもしれないし、監督機関は私たちに計画に基づいて追加の臨床試験と非臨床試験を要求するかもしれない。私たちは、私たちが開発または将来開発可能な任意の候補製品の安全性と有効性を十分に証明することができず、規制されたマーケティング許可を得ることを阻止し、最終的に製品または使用指示の商業化を阻止する。私たちの未来の製品が承認されても初めからやり直すもし私たちの製品がアメリカで分類されたり、承認されたりすれば、私たちの製品の海外での商業化は、これらの国家規制機関のマーケティング許可を得る必要があるだろう。
異なる司法管轄区のマーケティング許可手続きは異なり、追加の試験的研究または臨床試験を含む米国とは異なる要求と行政審査期限、さらには米国の要求と行政審査期限を超える可能性がある。これらのいずれかは、私たちの業務、財務状況、および経営結果に悪影響を及ぼす可能性がある。
臨床試験で患者を登録と保留することは高価で時間のかかる過程であり、私たちがコントロールできない多種の要素によってより困難あるいは不可能になる可能性がある。
現在のスケジュールで任意の臨床試験を完了するために十分な数の患者を募集する際には、遅延や困難に遭遇する可能性があり、あるいは募集することができなくなっても、十分な数の患者を残すことができない可能性があります。われわれの臨床試験では登録が遅いことが我々の開発スケジュールやマイルストーンの遅延を招く可能性がある。
患者が臨床試験に参加し、患者のフォローアップを完成することは、患者群の規模、試験方案の性質、患者が医療看護を継続する能力、臨床試験の資格基準、患者コンプライアンス、競争的臨床試験と臨床医師、および研究中の製品の他の利用可能な治療法に対する潜在的な優位性に対する患者の見方を含む多くの要素に依存し、著者らが調査している適応のための任意の新しい治療法を許可される可能性がある。例えば、試験レジメンが、候補製品の安全性および有効性を評価するために、広範な治療後プログラムまたは後続検査を受けることを患者に要求する場合、または競合相手候補製品の同期臨床試験に参加するように説得される可能性がある場合、患者が我々の臨床試験に参加することを阻止する可能性がある。また,われわれの臨床試験に参加した患者は,試験終了前に退出したり,われわれの製品とは無関係な不良医療事件を経験したりする可能性がある。患者登録遅延或いは患者が引き続き臨床試験に参加できなかったことは臨床試験の開始或いは完成を遅らせる可能性があり、臨床試験コストの増加と遅延を招き、著者らのデータを更に解釈しにくくし、著者らの試験の動力を影響し、或いは臨床試験の失敗を招く。
計画中の患者登録または保留の遅延または失敗は、コスト増加、計画遅延、または両方をもたらす可能性があり、これは、候補製品を開発する能力に有害な影響を与える可能性があり、あるいはさらなる開発を不可能にする可能性がある。また,臨床試験サイトに依存してわれわれの臨床試験の速やかな進行を確保し,彼らのサービスを管理するプロトコルを締結しているが,実際の表現を迫る能力は限られている。
著者らは時々発表或いは公表した臨床試験の一時、“背線”と初歩的なデータは更に多くの患者データの獲得に従って変化する可能性があり、そして最終データの重大な変化を招く可能性のある確認、監査と検証プログラムの影響を受ける。
私たちは時々私たちの試験研究と臨床試験の初歩的或いは主要なデータを公開する可能性があり、これらのデータは当時利用可能なデータの初歩的な分析に基づいて、特定の研究或いは試験に関連するデータに対してより全面的な審査を行った後、結果と関連する発見と結論は変化する可能性がある。データ分析の一部として、私たちはまた仮定、推定、計算、および結論を下すだろうが、私たちはすべてのデータを全面的かつ詳細に評価する機会がないか、または機会がないかもしれない。したがって、私たちの報告の裏線または予備結果は、同じ研究の将来の結果と異なる可能性があり、またはより多くのデータを受信して十分に評価されると、異なる結論または考慮要因がこれらの結果を合格させる可能性がある。バックラインデータはまだ監査と確認手続きを受ける必要があり、これは最終データが私たちが以前に発表した予備データと大きく異なる可能性がある。したがって、最終データが利用可能になる前に、バックラインデータは慎重に表示されなければならない。私たちはまた臨床試験の中間データを時々開示するかもしれない。臨床試験の中期或いは初歩的なデータは患者登録と治療の継続及び更に多くの患者データの獲得に伴い、或いは著者らの臨床試験の患者が他の治療を継続することに従って実質的に変化する可能性がある。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。しかも、私たちまたは私たちの競争相手が中間データを開示することは私たちの普通株の価格変動を招くかもしれない。
53
さらに、規制機関を含む他の人は、私たちの仮定、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の潜在力、特定の候補製品のマーケティング許可または許可または商業化の可能性、私たちが許可または許可を得ている可能性のある任意の製品の商業的成功、およびわが社全体に影響を及ぼす可能性がある。さらに、私たちは、開示された特定の研究または臨床試験に関する情報を一般的に広範な情報から選択し、あなたまたは他の人は、私たちが決定した重要な情報または他の適切な情報が私たちの開示に含まれることに同意しない可能性がある。
もし私たちが報告した中期、バックライン、または予備データが実際の結果と異なる場合、または規制機関を含む他の人が結論に同意しない場合、私たちが許可を得て私たちの候補製品を商業化する能力が損なわれる可能性があり、これは私たちの業務、経営業績、将来性、または財務状況を損なう可能性がある。
私たちの長期成長は、マーケティングの許可と許可を得た後、私たちのデジタル治療製品を強化し、私たちの適応を拡大し、より多くの製品を開発し、それを商業化する能力にかかっている。
私たちの業務戦略については、BT-001の追加機能を強化し、将来的により多くの適応を増やし、許可を求め、新製品を開発し、発売することができるかもしれません。これは、私たちの業務戦略にとって非常に重要です。開発製品は高価で時間がかかり、経営陣のコア業務への関心を分散させる可能性がある。すべての新製品や製品の機能向上の成功は、私たちが能力があるかどうかを含むいくつかの要素に依存する
もし私たちが私たちの適応を拡大し、新製品や製品を開発して強化して商業化することに成功できなければ、私たちの収入を増加させる能力が損なわれる可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちの候補製品は新しいかつ革新的な潜在的治療分野を代表し、私たちが開発した任意の候補製品に対する否定的な見方は、私たちが業務を展開し、監督マーケティングの許可を得たり、このような候補製品のために代替規制経路を探す能力に不利な影響を与える可能性がある。
私たちのいくつかの候補製品は比較的新しくて新しい治療法と考えられている。私たちと彼らの成功は、私たちと彼らの候補製品が対象とする疾患を専門的に治療する医師に依存し、彼らは、よりよく知っている、より多くの臨床データがある可能性のある既存の治療方法を代替または補充するために、私たちと彼らの候補製品を使用することに関する潜在的な治療方法を開くだろう。接近はまた商業化された製品に対する消費者の受け入れと採用に依存するだろう。さらに、米国、州、または外国政府の公衆の否定的な見方または道徳的懸念に対する反応は、新しい法律または法規をもたらす可能性があり、任意の候補製品の開発または商業化、規制許可の獲得または維持、代替規制経路の決定、マーケティングまたは他の方法で利益を達成する能力を制限する可能性がある。
54
例えば,米国では,これまでCBTによる糖尿病,心臓病,他の心臓代謝性疾患の治療を目的とした処方デジタル治療候補薬は認可されていない。我々はFDA規制されたソフトウェアベースのPDT候補プラットフォームを開発しており、新しいCBT形式でこの疾患を治療している。FDAはCBTによる候補製品の安全性と有効性を評価する経験が不足している可能性があり、これは、規制審査プロセスが予想よりも長くなり、予想される開発コストを増加させ、候補製品の潜在的な商業化を延期または阻止する可能性がある。
私たちの知的財産権に関するリスクと潜在的な訴訟
私たちは知的財産権やプライバシー紛争を含む法的手続きや訴訟に直面する可能性があり、これらの紛争は弁護コストが高く、私たちの業務や運営結果に実質的な損害を与える可能性があります。
通常の業務過程で、私たちは訴訟と法的手続きの当事者かもしれない。このような問題はしばしば費用が高く、正常な商業運営に妨害を及ぼすだろう。私たちは、プライバシー、特許、宣伝、商標、著作権、および他の権利に関するクレームを含む、データプライバシー、安全、労働および雇用、消費者保護および知的財産権侵害に関する告発、訴訟および監督管理に関する問い合わせ、監査および調査に直面する可能性がある。私たちが使用している技術の一部はオープンソースソフトウェアを含み、私たちは、オープンソースソフトウェアまたはそのソフトウェアに関連する特許、私たちの知的財産権、またはオープンソースライセンス条項の発行を要求する材料部分、または他の方法で適用可能なオープンソースライセンスの強制実行を求める条項を要求することに直面する可能性があります。私たちはまた、私たちの業務の公開開示を含む、私たちの買収、証券発行、または商業実践に関連する告発または訴訟に直面する可能性がある。訴訟と規制手続き、特に私たちが直面する可能性のある特許侵害と集団訴訟は、長引く可能性があり、費用が高く、結果は予測が難しい。いくつかの事項には、巨額または不確定額の損害賠償の投機的クレームが含まれ、強制救済に対するクレームが含まれている可能性がある。しかも、私たちの訴訟費用は高いかもしれない。訴訟やそのような法的手続きに関連した不利な結果は、巨額の和解費用や判決、処罰、罰金をもたらす可能性があり、または製品の修正を要求したり、特定の製品の提供を停止することを要求したりする可能性があり、これらはすべて私たちの収入増加に悪影響を及ぼす可能性がある。私たちはまた定期監査を受けることができます。これは私たちのコンプライアンスコストを増加させ、業務慣行の変更を要求するかもしれません。これは私たちの収入増加に悪影響を及ぼすかもしれません。法的手続き、訴訟、監査を管理し、有利な結果を得ても時間がかかり、経営陣の私たちの業務への関心を移した。
監督管理手続き、訴訟、クレームと監査の結果は肯定的に予測できず、未解決訴訟とその他の法律、監督管理と監査事項の準備金を確定するには重大な判断が必要である。私たちの予想が正しいことが証明される保証はありません。これらの問題が私たちに有利な方法で解決されても、あるいは重大な現金和解がなくても、これらの問題と訴訟を提起したり、それらを解決するのに必要な時間と資源は、私たちの名声、業務、財務状況、運営結果、および私たちの普通株の市場価格を損なう可能性があります。
また、もし私たちの製品が発見されていないミスや類似の問題で正常に動作しなければ、私たちの業務は潜在的な製品責任クレームに直面させます。テストを行ったにもかかわらず、商業使用を開始した後、新製品に間違いが発見されないことは保証されません。また,我々の製品を誤用したり患者が操作ガイドラインを遵守できなかったりすると,死亡を含めて患者に重大な被害を与える可能性があり,製品責任クレームを招く可能性がある。製品責任訴訟とクレームは、合理的かどうかにかかわらず、私たちに巨額のコストを発生させる可能性があり、私たちの財務資源に重大な圧力を与える可能性があり、管理層の私たちの核心業務に対する注意力を移転し、私たちの名声を損害し、私たちの患者を吸引し、維持する能力に悪影響を与える可能性があり、これらはすべて私たちの業務、財務状況、運営結果に重大な不利な影響を与える可能性がある。
私たちは引き続き第三者製品責任保険を保険しますが、私たちに対するクレームは私たちの保険契約の範囲を超えるかもしれません。たとえ保険証書がいかなる製品の責任損失を保証しても、これらの保険証書は通常大量の賠償免除額があり、私たちはこれに責任を負わなければならない。
55
適用保険範囲を超えた製品責任クレームは、私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性があります。また、私たちの製品責任に対するいかなるクレームも、合理的かどうかにかかわらず、私たちの製品責任保険料を増加させる可能性があります。保険範囲のコストはそれぞれ異なり、入手が難しいかもしれません。将来私たちが受け入れられる条項や根本的に保険範囲を得ることができない保証はありません。
私たちの知的財産権を確立、保護、または実行できなかったことは、私たちの業務と運営結果を損なう可能性がある。
私たちは私たちの知的財産権が私たちの業務の重要な資産だと信じている。もし私たちが私たちの知的財産権を十分に保護しなければ、私たちのブランドと名声は損なわれる可能性があり、競争相手は私たちの技術を使用して、私たちが持つ可能性のあるいかなる競争優位性を侵食または否定する可能性があり、これは私たちの業務に実質的な損害を与え、私たちの市場地位にマイナスの影響を与え、プラットフォームを商業化する能力を制限し、利益を達成できないように延期または否定するかもしれない。費用対効果と有意義な方法で私たちの知的財産権を保護できなければ、私たちの競争能力に大きな悪影響を及ぼす可能性がある。私たちの商業秘密、著作権、商標、商業外観、データベース、ドメイン名、特許を保護することが私たちの成功の鍵だと思います。私たちは連邦、州、そして一般法の権利、そして外国の法律で規定されている他の権利に依存して私たちの知的財産権を保護するために努力している。このような法律はいつでも変わる可能性があり、私たちの知的財産権を保護または実行する能力をさらに制限することができる。また、私たちが業務を運営しているある外国の国の現行法は、アメリカの法律のように私たちの知的財産権を保護できないかもしれません。また、当社の従業員や請負業者と秘密および発明譲渡協定を締結し、当社の独自の情報へのアクセス、開示、使用を制限するために、当社の業務を展開している当事者と守秘契約を締結します。また、私たちは時々、任意の開発協力者との合意に基づいて達成されたオープンソースライセンスプロトコルおよび商標ライセンスを含む、ライセンス契約に従って、私たちの技術および他の知的財産権を他の人に提供し、私たちの製品またはサービスを共同でマーケティングすることを目的としている。しかしながら、これらの契約および私たちの知的財産権を保護するための私たちの他のステップは、私たちの独自情報の盗用、私たちの知的財産権の侵害、商業秘密および他の独自情報の漏洩、または類似または競争技術の独立開発、私たちの技術の複製、または私たちの特許をめぐる他の人の設計の努力を阻止することができず、このような流用または侵害事件が発生したときに十分な救済措置を提供できない可能性がある。
効果的な知的財産権を獲得して維持することは高価であり、私たちの権利を守る費用を含む。私たちは特定の技術のために特許保護を求め、いつ商業秘密保護に依存するかについて商業的決定を下し、私たちが選択した方法は最終的に不十分であることが証明される可能性がある。私たちは複数の管轄区域で著作権、商標、特許、ドメイン名申請を提出することによって、私たちのいくつかの知的財産権を保護することを求めています。この過程はコストが高く、すべての管轄区で成功するわけではありません。私たちの業務の拡大に伴い、私たちは様々な管轄区域での知的財産権保護を監視し、評価していきます。私たちが特許保護を求める場合であっても、それによって生成された特許が、私たちの製品、技術、または独自の情報のすべての重要な特徴を効果的に保護すること、または任意の競争優位性を提供することを保証することはできない。しかも、私たちは私たちのいかなる未解決の特許出願が発表されるか、または承認されることを保証できない。米国特許商標局(USPTO)はまた、特許出願中および特許発行後に、いくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効をもたらす可能性があり、それにより、関連する管轄区域の特許権の一部または全部が失われる可能性がある。このような状況が発生すれば、私たちの競争相手が市場に参入する可能性があり、これは私たちの業務に実質的な悪影響を及ぼすだろう。私たちが知的財産権を持っていても、それらが強制的に実行できない、あるいは強制的に実行可能な範囲が限られていることが後で発見されるかもしれない。しかも、私たちはすべての管轄区域でそのような保護を求めないかもしれない。特に、私たちは私たちのブランドを維持し、保護し、向上させることが重要だと思う。したがって、私たちはアメリカとアメリカ以外のいくつかの管轄区域でドメイン名、私たちの商標、サービスマークの登録を行うことができます。
第三者は、私たちの商標の使用に挑戦し、私たちの商標申請に反対するか、または特定の司法管轄区域で私たちの知的財産権を保護するための私たちの努力を阻害するかもしれない。もし私たちがある司法管轄区に私たちの商標を登録できなければ、私たちは私たちの製品ブランドを再形成することを余儀なくされるかもしれません。これはブランド認知度の低下を招き、広告と新しいブランドをマーケティングするために資源を投入する必要があるかもしれません。時間が経つにつれて、私たちは特許と同様の権利への投資によって、革新を保護するための私たちの投資を増加させることができ、この過程は高価で時間がかかる。
56
私たちの知的財産権を保護するために、私たちはこのような権利を監視して保護するために多くの資源が必要かもしれない。私たちはいつも私たちの知的財産権を侵害する行為を発見するのではなく、私たちの知的財産権を擁護または実行し、成功的に発見、起訴、命令、または救済しても、大量の財政と管理資源の支出を招く可能性がある。
私たちの知的財産権を実行し、私たちの固有の権利を保護し、または他人が要求する固有の権利の有効性および範囲を決定するためには、訴訟が必要かもしれない。このような性質の訴訟は、結果や事件にかかわらず、巨額の費用および管理および技術資源の移転を招く可能性があり、いずれも我々の業務および運営結果に悪影響を及ぼす可能性がある。私たちはまた、私たちのブランドや他の価値のある商標やサービスマークを模倣しようとしている人に対して私たちの商標を実施する過程で大きなコストを発生させることができる。また、私たちが知的財産権を実行する努力は、異議、当事者間の審査、付与後審査、再審、または他の発行後手続きのような抗弁、反訴、反訴、対抗手続きに遭遇する可能性があり、これらは私たちの知的財産権の有効性と実行可能性を攻撃する。任意の訴訟手続きに対する不利な裁決は、私たちの特許を無効または狭義に解釈されるリスクに直面させ、私たちの関連する係属中の特許出願を発行できないリスクに直面させる可能性がある。さらに、知的財産権訴訟は大量の開示を必要とするため、訴訟が発生すれば、私たちのいくつかの機密または敏感な情報は開示によって損害を受ける可能性がある。また,訴訟過程では,聴聞,動議や他の一時的な手続きや事態の発展の結果が公表される可能性がある.もし証券アナリストや投資家がこれらの結果がマイナスだと思っていれば、私たちの普通株の価格に大きな悪影響を及ぼす可能性がある。
もし私たちが私たちの知的財産権を維持、保護、向上できなければ、私たちの業務、経営業績、財務状況は損害を受ける可能性があり、私たちの普通株の市場価格は下落する可能性があります。
政府の規制に関連するリスク
私たちの製品と運営はアメリカと海外で広範な政府の監督と監督を受けています。もし私たちが適用された要求を守らなければ、私たちの業務を損なうかもしれません。
私たちと私たちの製品はアメリカと他のところで広く規制されています。FDAとその外国の同業者を含めて。他の事項を除いて、FDAと外国の監督機関は医療機器を監督する:設計、開発と製造、テスト、ラベル、内容と使用説明言語、臨床試験、製品安全、発売前許可と承認、機関登録と設備上場、マーケティング、販売と流通、苦情処理、記録保存プログラム、広告と販売促進、リコールと現場安全是正行動、上場後監督は、死亡または重傷と故障を報告することを含み、それらが再び発生した場合、死亡または重傷を招く可能性がある;上場後承認研究、および製品輸出入である。
私たちが統制された規制は複雑で、時間が経つにつれてもっと厳しくなることが多い。規制の変化は、予想以上のコスト、または予想を下回る売上高に、業務を継続または拡大する能力を制限する可能性がある。FDAは定期的な抜き打ち検査を通じてこのような規制要求を実行する。私たちは私たちが未来にFDAの検査や外国の規制機関によって検査されるかどうか分からない。適用された法規を遵守しないことは、私たちの製品を販売する能力を危険にさらし、例えば、警告状、罰金、禁止、民事処罰、流通の終了、製品のリコールまたは差し押さえ、製品の市場への投入の遅延、生産の全面的または部分的な一時停止、将来の許可またはマーケティング許可の付与を拒否すること、現在のマーケティング許可を撤回または一時停止することにより、私たちの任意のマーケティング製品の販売および流通を禁止することにつながり、最悪の場合、刑事罰を受けることになる。
私たちは必要なBT-001を最初から分類して支出することができないかもしれませんし、BT-001の将来の適応拡張の許可も得られないかもしれませんが、これらの規制の許可をタイムリーに得ることができなければ、私たちの業務成長能力に悪影響を与えます。
私たちの戦略は最初の初めからやり直すBT−001をFDAで分類し,米国市場でのマーケティング能力を付与した。米国では、新たな医療機器、又は新たな用途、新たなクレーム又は既存製品の重大な改正を販売することができる前に、まず“食品·医薬品法”第510条(K)条に基づく許可を得なければならない、又は根拠初めからやり直す免除が適用されない限り、FDAのFDAMAまたは上場前に承認またはPMAに追加された分類プログラムに基づいて。
57
♪the the the初めからやり直す分類プログラムはFDAとのBT-001の検討に必要な開発経路に基づいて、現在T 2 Dの治療のために計画されているため、一般的な制御或いは一般と特殊な制御のみが期待用途に合理的な安全性と有効性保証を提供する新しい医療設備を分類する方法を提供しているが、合法的に発売されている予測装置はない。A初めからやり直す分類はリスクに基づく分類過程であり初めからやり直す分類要求を販売し、将来の販売前通知510(K)によって提出される述語として使用することができる。
510(K)承認手順では、FDAは、装置が発売される前に、提案された装置が、510(K)のプロセスによって以前に承認された装置、1976年5月28日までに合法的に販売された装置(改訂前装置)、最初に承認されたPMAに従って米国市場に進出し、その後劣化した装置、または510(K)免除装置を含む、提案された装置が合法的に発売される“前提”装置“と実質的に同じ”と決定しなければならない。“実質的に同等”に達するためには、提案された装置は、述語装置と同じ予期される用途を有する必要があり、言語装置と同じ技術的特徴を有するか、または異なる技術的特徴を有し、言語装置とは異なるセキュリティまたは有効性の問題を引き起こさない必要がある。実質的な等価性論証を支援するために臨床データが必要となる場合がある。BT-001の拡張適応を増加させるために510(K)の承認手順を継続する予定である.
あそこだ初めからやり直す分類または510(K)承認経路は医療機器には適用されず,製造業者が上場前の許可を得ずに医療機器を販売することを許可する法執行裁量政策が存在しない場合には,PMA承認を得る過程が適用可能であり,医療機器上場承認を求める最も厳しい製品開発経路である。PMA出願を審査する際に、FDAは、PMAをサポートするために必要な臨床前、臨床試験、技術、製造、およびラベルデータを含むが、これらに限定されない広範なデータに部分的に基づいて、提案された装置がその予期される用途に対して安全かつ有効であることを決定しなければならない初めからやり直す分類要求または510(K)許可が提出される。生命を維持する、生命を維持する、または移植可能な装置のような最大のリスクを構成すると考えられる装置の場合、PMAプロセスが一般的に必要である。
PMAを通じて承認を申請した製品修正は通常FDA承認を必要とする。同様に、510(K)または初めからやり直す分類プロセスは、新しい510(K)の許可または新しいものを必要とする場合がある初めからやり直す分類要求。PMAの承認は初めからやり直す510(K)承認手続きは、高価で冗長で不確実である可能性がある。FDAの510(K)承認プロセスは、通常、3~12ヶ月を要するが、より長く続く可能性がある初めからやり直す分類要求過程は通常長く,臨床試験が必要である。PMAを獲得する過程はPMAを獲得するコストや不確実性よりもはるかに高い初めからやり直すまたは510(K)承認手続きは、通常、FDAに申請を提出する時間から計算される1~3年、さらにはより長い時間を必要とする。さらに、PMAは通常、1つ以上の臨床試験を行うことが要求される。時間、労力、コストが必要であるにもかかわらず、デバイスはFDAの承認、上場許可、または承認を得ない可能性がある。どんな遅延や必要な規制マーケティング許可を得られなかった場合も、私たちの業務を損なう可能性がある。さらに、私たちが規制許可、許可、または承認を与えられても、それらはデバイス指定用途の重大な制限を含む可能性があり、これはデバイスの市場を制限する可能性がある。
アメリカでは現在以下のようにBT-001を開発しています初めからやり直す経路を分類する。BT-001のいくつかの以前の許可されていない修正は、510(K)の上場前許可申請またはその後の提出を必要とする場合があります初めからやり直すマーケティング変更を実施する前の分類要求。FDAが将来の製品または既存製品の修正を私たちが予想よりも長く、より厳格に検討することを要求すれば、製品の導入または修正は延期またはキャンセルされる可能性があり、これは私たちの業務成長能力に悪影響を及ぼす可能性がある。
FDAは延期、制限、または否定することができる初めからやり直す様々な理由で装置を分類、許可、または承認することが含まれる
58
さらに、FDAはその政策を変更し、追加的な規定を取ったり、既存の規定を修正したり、または他の行動を取ることができ、これは阻止または延期される可能性がある初めからやり直す私たちが開発している未来の製品を分類、承認または承認したり、現在承認されている製品をタイムリーに修正する能力に影響を与えたりします。このような政策や規制の変化は、私たちに追加的な要求を加えることができ、私たちが新しい許可を得る能力を遅らせること、コンプライアンスコストを増加させること、または私たちが成功する可能性のある任意の許可を維持する能力を制限することができるかもしれない。
私たちはFDAの現在の法執行の自由裁量に基づいて、または米国の現在の“医療機器”の定義の外でデジタル製品を販売するかもしれない。
現在、FDAの規制フレームワークは、いくつかのデジタルアプリケーションおよび製品のマーケティングが、FDAのそのデバイス許可下での有効な規制を超えることを可能にするか、または他の場合、製品使用が“医療デバイス”の定義に適合していない場合、FDAの規制範囲を完全に超える。時々、私たちはFDAの現在の法執行裁量権の範囲や医療機器の定義以外の製品に属すると考えて開発して商業化するかもしれませんが、FDAは私たちの決定に同意しないかもしれません。FDAが私たちが下した任意のこのような決定に同意しない場合、私たちは、これらの製品の任意の必要な発売前の許可、承認または承認を得るまで、さらなるマーケティングまたは流通を停止することを要求されるかもしれません。私たちは、そのような製品のマーケティングおよび流通活動に関するFDAの無タイトルレターまたは警告状、ならびにFDAが利用可能な他の潜在的な法執行メカニズムを受信するかもしれません。
上場後の規制要件を守らなければ、巨額の罰金を含めて法執行行動を受ける可能性があり、市場からの製品のリコールやリコールを要求する可能性がある。
その後…初めからやり直すBT-001の分類が承認された場合、私たちは、デバイスの製造、マーケティング、ラベル、販売、販売促進、広告、医療機器報告、登録、流通、および発売を含む持続的かつ一般的な法規要件の制約を受ける。例えば、いくつかの有害事象について、私たちはFDAに報告書を提出しなければならない。このような報告書を提出できなかったり、報告書をタイムリーに提出できなかったりすると、FDAが法執行行動をとることになる可能性がある。これらの医療機器有害事象報告を審査した後、FDAは、より多くの情報の提供を要求するか、またはさらなる調査を開始することを要求する可能性がある。
また,われわれのデジタル療法は市販後の研究要求の影響を受ける可能性がある。IRBおよびインフォームドコンセント要求に応じて必要な研究を行うことができなかった場合、またはこれらの研究における不利な発見は、私たちが商業化する可能性のある任意の製品の修正またはマーケティング許可の撤回の理由にもなる可能性がある。
FDAとFTCもまた、私たちの声明が私たちの規制許可と一致し、これらの声明を確認するのに十分かつ合理的なデータを持っていることを保証するために、私たちの製品およびサービスの広告および販売促進を規制しており、私たちの販売促進ラベルおよび広告は偽りでも誤解性もない。FDAまたはFTCが、私たちの任意の広告または販促声明が誤っている、確認されていない、または許可されていないと判断した場合、私たちは警告状を含む法執行行動の影響を受ける可能性があり、私たちは私たちの販売促進声明を修正し、他の修正または元に戻すことを要求されるかもしれません。
私たちが統制された規制は複雑で、時間が経つにつれてもっと厳しくなった。規制の変化は、私たちが業務を継続または拡大する能力が制限される可能性があり、コストが予想を上回ったり、予想を下回ったりする可能性がある。私たちが適切な規制権限を得て設備を販売した後も、FDAの規定と適用される外国の法律法規に基づいて、私たちは持続的な責任を持っている。FDA、州、そして外国の規制機関は広範囲な法執行権力を持っている。もし私たちが適用される規制要件を守らない場合、FDA、州、または外国の規制機関が法執行行動を取る可能性があり、その中には以下のいずれかの制裁が含まれている可能性がある
59
これらの制裁のいずれも、予想以上のコストまたは予想よりも低い売上をもたらし、私たちの名声、業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。
糖尿病患者が管理する治療ガイドラインが変化したり、看護基準が変化したりする場合、私たちは再設計し、私たちの1つまたは複数の候補製品のためにFDAの新しいマーケティング許可を求める必要があるかもしれない。
糖尿病患者が管理する治療ガイドラインが変化したり、デジタル療法の開発を求めたり、その他の場合の看護基準が変化したりする場合には、適用可能な製品を再設計したり、開発候補製品を販売したり、求めたりする必要があり、新たなものを求める必要があるかもしれません初めからやり直すFDAからの分類、許可または承認、および外国の規制機関からの同等の資格。治療ガイドラインまたは看護基準が変化し、それによって異なる治療が望ましい場合、私たちの1つまたは複数の製品の臨床的効用が低下する可能性があり、私たちの業務は悪影響を受ける可能性がある。
もし私たちがこのような用途の普及に関与していると考えられれば、誤用やラベル外で私たちの製品を使用することは、私たちの市場での名声を損なう可能性があり、被害を招き、製品責任訴訟を招き、あるいは規制機関のコストの高い調査、罰金、または制裁を招く可能性があり、いずれも私たちの業務に代価を与える可能性がある。
私たちの製品(許可されて販売されている場合)は、デバイス設計の特定の治療用途のためにマーケティングされているにもかかわらず、私たちの人員は訓練を受け、私たちの製品をFDAによって承認された使用適応以外の用途、いわゆる“非ラベル用途”に拡張することはないが、私たちは医師が彼または彼女の独立した専門医学判断が適切だと思う方法で私たちの製品を使用することを阻止することはできない。もし初級保健医がラベルの外で私たちの製品を使用しようとすれば、患者の怪我のリスクを増加させるかもしれない。さらに、FDA認可、承認または承認または任意の外国規制機関許可以外の適応に使用することは、このような疾患を有効に治療できない可能性があり、これは、一次保健医および患者における私たちの市場的名声を損なう可能性がある。
BT-001または任意の他の候補製品の許可を得た後、FDAまたは任意の外国監督機関が、私たちの宣伝材料または訓練がラベル外使用を促進することを含むと判断した場合、訓練または宣伝材料を修正することを要求することができ、または無タイトルレターまたは警告状、禁止、差し押さえ、民事罰金または刑事罰を発行または適用することを含む規制または法執行行動を要求することができる。他の連邦、州、または外国の法執行機関が、私たちの業務活動がラベル外使用の普及を構成していると考えている場合、これは、刑事、民事および行政処罰、損害賠償、罰金、返還、政府医療計画から除外され、私たちの業務を削減することを含む重大な処罰を招く可能性があり、他の連邦、州または外国の法執行機関も、私たちが政府の清算を受けた任意の製品に対する虚偽申告法のような他の規制機関に基づいて行動する可能性がある。
また、患者が十分な訓練を受けていない場合、医師は患者に私たちの製品を乱用する可能性があり、これは製品の責任を傷つけ、増加させるリスクを招く可能性がある。もし私たちの製品が誤用されたら、私たちは患者や彼らの患者たちの高価な訴訟を受けるかもしれない。上述したように、製品責任クレームは、経営陣のコア業務に対する関心を分散させ、弁護コストが高く、私たちに対する巨額の損害賠償を招く可能性があり、これらの賠償は保険範囲内ではない可能性がある。
60
私たちの製品は不良医療事件を引き起こすか、またはFDAに報告する必要がある故障や故障を引き起こす可能性があり、そうしなければ、私たちは私たちの名声、業務、財務状況、および運営結果を損なう可能性のある制裁を受けるだろう。私たちの製品に深刻な安全問題があることが発見されたり、自発的またはFDAや他の政府機関の指示の下で私たちの製品をリコールすることは、私たちにマイナスの影響を与える可能性があります。
私たちは、FDAの医療機器報告法規と、私たちが販売する可能性のある任意のデバイスの同様の外国法規を遵守しなければならない。これらの法規は、私たちの1つまたは複数の製品が死亡または重傷または故障を引き起こす可能性があることを受信または合理的に示す場合に、故障が再び発生した場合、死亡または重傷を引き起こす可能性があるか、または死亡または重傷を引き起こす可能性があることをFDAに報告しなければならない。私たちの報告義務の時間は私たちが不良事件の日付とイベントの性質を知っていることによって触発される。私たちは規定された時間範囲内で私たちが知っている有害な事件を報告できないかもしれない。私たちはまた、私たちが報告可能な有害事象を認識していることを認識していないかもしれないが、特にそれが有害事象として報告されていない場合、またはそれが意外である場合、または製品を使用する際にタイムリーに除去された有害事象である場合には意識していないかもしれない。もし私たちが私たちの報告義務を履行できなかった場合、FDAは警告状、無見出し手紙、行政訴訟、刑事起訴、民事罰金、私たちの設備許可の撤回、私たちの製品の差し押さえ、または未来の製品の承認または承認を延期するなどの行動をとるかもしれない。
製品の設計又は製造に重大な欠陥又は欠陥がある場合、又は製品が健康に対して許容できないリスクを構成する場合、FDA及び外国監督機関は商業化製品のリコールを要求する権利がある。FDAがリコールを要求する権力は、この装置が合理的な可能性があることが深刻な傷害や死亡を招く可能性のある調査結果に基づいていなければならない。もしどんな重大な欠陥が発見されたら、私たちはまた自発的に製品をリコールすることを選択することができる。健康リスクは受け入れられない、部品故障、故障、製造欠陥、ラベル或いは設計欠陥、包装欠陥或いはその他の欠陥或いは適用法規を遵守できないため、私たちは政府の強制或いは自発的なリコールが発生する可能性がある。未来には製品の欠陥や他のミスが発生するかもしれない。
製品の欠陥や欠陥を是正するための私たちの修正措置によると、FDAは要求するかもしれません、あるいは私たちは、その装置の新しい許可、許可、または承認を得て、修正された装置を販売または流通することができると決定するかもしれません。このような許可、許可、または承認を求めることは、リコール設備をタイムリーに交換する能力を遅らせる可能性があります。さらに、私たちが私たちの設備に関連する問題を十分に解決していない場合、私たちはFDA警告状、製品差し押さえ、禁止、行政処罰、または民事または刑事罰金を含む追加の規制法執行行動に直面する可能性がある。
会社はFDAに報告する必要がなくても、いくつかのリコールと訂正の記録を保存することを要求されている。私たちは未来にFDAに通知する必要のない製品の自発的な撤回や修正を決定することができる。もしFDAが私たちの決定に同意しなければ、それは私たちにこのような行動をリコールとして報告することを要求することができ、私たちは法執行行動の影響を受けるかもしれない。将来のリコール声明は患者における私たちの名声を損なう可能性があり、私たちの製品責任に対するクレームを招き、私たちの販売にマイナス影響を与える可能性があります。任意の是正行動は、任意であっても非自発的であっても、訴訟において自己弁護するためには、時間と資金を投入し、経営陣の業務運営への関心を分散させ、私たちの名声や財務業績を損なう可能性がある。
もし私たちが国際市場で私たちの製品をマーケティングすることを求めたら、私たちの製品の国際規制登録やマーケティング許可を得て維持しなければ、私たちはアメリカ以外のところで私たちの製品をマーケティングして販売することができません。
私たちの製品のアメリカ以外での販売は外国の規制要求に制約されており、これらの要求は国によって異なる。また,FDAは米国からの医療機器輸出を規制している。一部の国の法規は、私たちの製品のマーケティングや販売に障害を設定したり、通知だけを要求したりしない可能性がありますが、他の国の法規は、特定の規制機関のマーケティング許可を得ることを要求しています。登録またはマーケティング許可を得ることを含む外国法規の要求を遵守することは、高価で時間がかかる可能性があり、私たちが製品を販売することを計画しているすべての国/地域で規制許可、許可または承認を得ることができないかもしれないし、タイムリーにそうすることができないかもしれない。他の国が要求する場合、登録または上場許可を得るのに要する時間はFDAが要求する時間よりも長くなる可能性があります初めからやり直す分類、承認または承認、およびこのような登録および上場許可の要件は、FDAの要件とは大きく異なる可能性がある。もし私たちが私たちの製品を修正すれば、私たちは追加の規制許可を申請して、修正された製品の販売を許可されるかもしれません。しかも、私たちは私たちが得た許可を維持するために必要な品質と安全基準を達成し続けることができないかもしれない。もし私たちが特定の国/地域で私たちの許可を維持できなければ、私たちはその国/地域で適用可能な製品を販売することができなくなるだろう。
61
監督管理初めからやり直すFDAの分類、承認または承認は、他の国の規制機関の登録または上場許可を保証するものではなく、1つまたは複数の外国規制機関の登録またはマーケティング許可は、他国の規制機関またはFDAの登録またはマーケティング許可を保証しない。しかしながら、1つの国で登録またはマーケティング許可を得ることができなかったり遅延したりすることは、他の国の規制プロセスに悪影響を及ぼす可能性がある。
米国食品医薬品局、米国証券取引委員会および他の政府機関の資金不足は、政府の閉店やこれらの機関の運営の他の中断を含め、重要な指導部や他の人員の能力を雇用·保留し、新製品やサービスのタイムリーな開発や商業化を阻止するか、あるいはこれらの機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを阻止することを阻害する可能性があり、これは私たちの業務に負の影響を与える可能性がある。
FDAの新製品の審査と承認能力は、政府予算と資金レベル、肝心な人員の雇用と維持及びユーザー費用の支払いを受ける能力、及び法定、監督と政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また、政府が米国証券取引委員会や我々の業務に依存する可能性のある他の政府機関に提供する資金は、研究開発活動に資金を提供する機関を含め、政治プロセスの影響を受けており、政治プロセス自体が不安定で予測不可能である。
FDAや他の機関の中断も、新製品候補製品が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。政府が長期的に停止すれば、FDAが私たちが提出した規制文書を適時に審査して処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に実質的な悪影響を及ぼす可能性がある。また、将来的に政府の閉店は、適切な資本化と事業継続のために、私たちが公開市場に進出し、必要な資本を得る能力に影響を与える可能性がある。
医療法律法規に関するリスク
新ライセンス製品の保険カバー範囲と精算状況は不確定です。もし私たちの任意の候補製品が十分な保証範囲と精算を獲得できなかった場合、マーケティング許可を獲得すれば、これらの製品をマーケティングする能力を制限し、収入を創出する能力を低下させる可能性があります。
米国や他の国の市場では,患者は通常第三者支払者によって治療に関連する費用の全部または一部を精算する。政府医療保健計画(例えば連邦医療保険や医療補助)や商業支払者の十分なカバーと精算は新製品の受容度に重要である。私たちが私たちの候補製品の商業化に成功するかどうかは、政府衛生行政部門、個人健康保険会社、他の組織がこれらの製品と関連治療に保険と十分な補償を提供する程度に依存し、広範な支払者から保険を受けることに成功しているかどうかにかかっている。政府当局や他の第三者支払人、例えば個人健康保険会社や健康維持組織は、どの製品に支払うかを決定し、精算レベルを確立する。米国では,新製品の精算に関する主な決定は通常HHS内のCMS機関によって行われる。CMSは新製品がどの程度連邦医療保険の下でカバーと精算されるかを決定し、個人支払者はよくCMSに大きく従う。政府や個人支払者が提供する保険範囲と精算範囲は,多くの患者が治療費を負担できるようにするために重要である。私たちが決定する可能性のある候補製品の販売は、私たちの候補製品の費用がどの程度健康維持、管理医療、薬局福祉、および同様の医療管理機関によって支払われるか、または政府衛生行政当局、個人健康保険会社、および他の第三者支払人によってどの程度精算されるかに大きく依存する。保険や十分な精算が得られない場合、あるいは限られたレベルに限られていれば、候補製品を商業化することに成功できないかもしれません。保険を提供しても、承認された精算金額が十分に高くない可能性があり、十分な投資リターンを実現するために十分な価格設定を確立したり維持したりするのに十分ではないかもしれません。また、幅広い支払者から保険を受けることに成功しなければ、候補製品を商業化することに成功した能力が影響を受ける可能性がある。
新規ライセンス、承認または承認された製品の保険カバー範囲や精算に関連する不確実性も大きく、カバー範囲はFDAや同様の外国規制機関が製品の発売を許可する目的よりも限られている可能性がある。
62
支払人が精算を決定する際に考慮する要素は、製品があるかどうかに基づいている
各支払者は、治療に保険を提供するか否かを決定し、どのような福祉の下で(薬局、医療、その他)、メーカーに治療の金額を支払うか、及びその薬局で処方されたどのレベル又はどの医療保険政策に基づいているかを決定する。支払者の保険薬品,生物製品と医療機器や処方リスト上の位置は,通常,患者が治療に要する共同費用を獲得することを決定し,患者や医師のこのような治療に強い影響を与える可能性がある。自分の病状に応じて処方治療を受けた患者やこのようなサービスを処方した提供者は,通常第三者支払者に依存してすべてまたは一部の関連医療費を精算する。患者は保険を提供しなければ、私たちの製品を使用することはあまりできません。私たちの製品の大きなコストを支払うのに十分な費用を精算するのに十分です。新しく発売された製品については、このような保険の獲得や精算に重大な遅延が生じる可能性があり、また保険範囲はFDAがこの製品の発売を許可する目的よりも限られている可能性がある。
さらに、保険および精算を受ける資格があることは、製品がすべての場合に支払いを受けることを意味するのではなく、研究、開発、知的財産権、製造、販売、および流通費用を含む、私たちのコストをカバーするレートで支払うことを意味するわけではない。新製品の臨時精算水準(適用すれば)も私たちのコストを支払うのに十分ではない可能性があり、恒久的にならない可能性があります。販売率は製品の使用や臨床環境によって異なる可能性があり,すでに低コスト製品のために設定された精算レベルに基づいている可能性があり,他のサービスの既存支払いにも組み込まれている可能性がある。製品の正味価格は、政府医療計画または個人支払者が要求する強制的な割引またはリベート、および将来的に製品価格を制限する任意の法律によって低下する可能性がある。
第三者支払者は、特定の製品のカバー範囲や精算金額を制限することでコストを抑制しようとしている。私たちが商業化したどの製品も保険と精算を受けることができることを確実にすることはできません。もし精算できるなら、清算レベルはいくらですか。保険と清算不足は私たちがマーケティングの許可を得た任意の製品の需要や価格に影響を及ぼすかもしれない。カバー範囲と十分な精算がなければ、あるいは限られたレベルだけが利用可能であれば、私たちの候補製品を商業化することに成功できないかもしれない。
また、一部の外国では、処方設備の提案価格は合法的に発売されるために承認されなければならない。製品の価格設定に対する各国の要求の差が大きい。例えば、欧州連合は、その国の健康保険制度が補償を提供する製品の範囲を制限し、人が使用する製品の価格を制御するために、その加盟国に様々な選択を提供している。精算或いは定価の承認を得るために、その中のいくつかの国は臨床試験の完成を要求する可能性があり、特定の製品のコスト効果を現在利用可能な治療法と比較する。加盟国は製品の具体的な価格を承認することができ、製品を市場に投入する会社の収益力を直接または間接的に制御する制度をとることもできる。製品の価格コントロールや精算制限がある国/地域が、私たちのどの候補製品に対しても有利な精算と定価手配を許可することは保証されません。歴史的に見ると、EUで発売された製品はアメリカの価格構造に従わず、通常価格ははるかに低くなることが多い。
63
私たちは、連邦および州医療詐欺および乱用法律、虚偽声明法律、健康情報プライバシーおよび安全法律、および他の医療法律および法規の制約を直接または間接的に受ける可能性がある。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。
私たちは、アメリカ連邦反リベート法規やFCAを含むが、これらに限定されない詐欺と乱用、および他の医療法律法規の制約を受けています。これらの法規は、私たちの製品の販売、マーケティング、流通の業務または財務配置と関係を制限するかもしれません。特に、医療プロジェクトおよびサービスの普及、販売およびマーケティング、ならびに医療業界のいくつかの商業的配置(例えば、ヘルスケア提供者、医師、および第三者支払者)は、詐欺、リベート、自己取引、および他の乱用を防止するための広範な法律によって制限されている。これらの法律および法規は、広範な価格設定、割引、マーケティングおよび販売促進、構造および手数料、特定の顧客インセンティブ計画、および他のビジネススケジュールを制限または禁止する可能性があります。私たちはまた、連邦政府と私たちが業務を展開している州と外国の司法管轄区域の患者情報、プライバシー、安全に対する規制を受ける可能性があります。私たちの運営能力に影響を与える可能性のある連邦、州、外国の医療に関する法律と法規は含まれていますが、これらに限定されません
64
また、他の事項以外に、著者らは上述の各医療法律と法規を遵守する州と国外等価物が必要であり、その中のいくつかの法律と法規の範囲はもっと広く、異なる支払人に適用する可能性がある。アメリカの多くの州は連邦反リベート法規とFCAのような法律を採用しており、研究、流通、販売またはマーケティング手配、および非政府支払人(個人保険会社を含む)によって精算される医療項目またはサービスに関するクレームを含むが、私たちのビジネス実践に適用可能である。いくつかの州はまた、他のマーケティング制限を実施したり、医療機器メーカーにその州へのマーケティングまたは価格開示を要求したりする。2018年5月に施行された欧州連合一般データ保護条例を含む国家法律および外国法は、健康情報のプライバシーやセキュリティを管理する場合もあり、その多くの法律は互いに大きく異なり、HIPAAに先を越されず、コンプライアンス作業を複雑化させることが多い。このような州の要求を守るために何が必要なのかは曖昧で、もし私たちが適用された州の法律要求を守らなければ、私たちは処罰されるかもしれない。最後に,健康情報のプライバシーや安全を管理する国や外国の法律もあり,その多くの法律は互いに大きく異なり,HIPAAに先を越されず,コンプライアンス作業を複雑にしていることが多い。
これらの法律の広汎性、および法定例外および利用可能な安全港の狭さのため、私たちのいくつかの商業活動は挑戦される可能性があり、1つ以上のこのような法律、法規、および指導に適合しないかもしれない。法執行部門は詐欺と法の乱用をますます重視しており、私たちのいくつかの接近はこのような法律の挑戦を受けるかもしれない。私たちの現在と将来の第三者との業務配置と、私たちの業務が全体的に適用される医療法律や法規に適合していることを確保するために努力しており、多くのコストがかかります。もし私たちの業務が、医師および他の医療提供者との手配を含めて、私たちに適用される任意のこのような法律または任意の他の政府法規に違反していることが発見された場合、私たちは、行政、民事および刑事罰、損害賠償、罰金、返還、契約損害、名誉損害、利益減少および将来の収益、私たちの業務の縮小または再編、連邦および州医療保健計画(例えばMedicareおよびMedicaid)から除外された参加、および監禁、および当社が誠実協定または他の合意に違反した場合、これらの法律違反に関する疑惑、および追加の報告義務および監督を解決するために罰を受ける可能性があります。いずれも私たちの業務運営能力と財務業績に悪影響を及ぼす可能性がある。
私たちは、保護された健康情報および支払カードデータを含む個人識別情報(保護された健康情報および支払カードデータを含む)の収集、使用、開示、または記憶に関するデータプライバシーおよびセキュリティに関する法律を遵守しなければなりません。これらの法律は、私たちおよび私たちの運営に制限を加えるかもしれません。もし私たちがこのような法律を完全に遵守できない場合、私たちは処罰を受けます。
多くの連邦と州の法律と法規は、保護された健康情報を含む個人識別情報の収集、使用、開示、保存、転送を管理する。これらの法令は、政府機関によるそれらの解釈を含め、しばしば変化し、私たちの業務に悪影響を及ぼす可能性がある。さらに、将来的には、連邦および州レベルの業界要件またはガイドライン、契約義務、および/または立法は、米国国外での健康情報の使用または伝播を制限、禁止、または規範化する可能性がある。これらの異なる解釈は、私たちと私たちのパートナーに複雑なコンプライアンス問題をもたらす可能性があり、私たちを追加的な費用、否定的な宣伝、そして責任に直面させる可能性があり、いずれも私たちの業務に悪影響を及ぼす可能性がある。
連邦と州消費者保護法はますます連邦貿易委員会と各州総検察長によって適用され、ウェブサイトまたは他の方法による個人または個人識別情報の収集、使用、記憶および開示を規範化し、ウェブサイトコンテンツの提示を規範化する。
65
プライバシーおよびデータ保護法に準拠することを確保するために当社と第三者サプライヤーおよび下請け業者が講じたセキュリティ対策は、セキュリティホール、破壊または窃盗、コンピュータウイルス、位置ずれまたは失われたデータ、プログラミングおよびヒューマンエラー、または他の類似した事件から私たちの施設やシステムを保護できない可能性があります。私たちは第三者サプライヤーとの合意を通じて適切な保護を提供しているにもかかわらず、私たちの彼らの行動と接近に対する制御は限られている。個人が識別できる健康情報のプライバシーまたはセキュリティを侵害することは、刑事責任および民事責任を含む、私たちに対する法執行行動をもたらす可能性があります。私たちはこのような事件が私たちの業務に及ぼす影響の程度を予測することができない。私たちに対する法執行行動は費用がかかる可能性があり、正常な運営を中断する可能性があり、これは私たちの業務に悪影響を及ぼすかもしれない。私たちは適用されたプライバシーやデータ保護法律に違反する通知を受けておらず、これらの法律を遵守していると信じていますが、将来このような通知を受けない保証はありません。
プライバシー擁護者、監督管理機関、その他の人はデータプライバシーとセキュリティ問題に注目し続け、データプライバシーとセキュリティ法律を制定する司法管轄区の数は増加している。さらに,アイデンティティ認識,匿名または仮名健康情報を廃止する基準が十分であるかどうか,再アイデンティティのリスクが十分小さいかどうか,患者のプライバシーを十分に保護するための公共政策検討が行われている。米国では、CCPAのようなプライバシー、データ保護、情報セキュリティに関する新たな提案と改訂された法律、法規、業界基準が引き続きあると予想される。また、カリフォルニアの有権者は2020年11月3日にCPRAを採択した。CPRAは、2023年1月1日に施行される(特定の条項は、2022年1月1日まで遡及効力を有する)個人情報の処理および記憶に追加的な義務を追加する。米国の他の州でも総合的なプライバシー立法の制定が考えられており,業界組織はこれらの分野で新基準を採用し提唱していることが多い.CCPAおよびCPRAには、HIPAAの下でPHIに関連するいくつかの活動の例外が含まれているが、CCPA、CPRA、または他のこのような将来の法律、法規、および基準が私たちの業務に及ぼす可能性のある影響を決定することはできない。
将来の法律、法規、基準、義務改正、および既存の法律、法規、標準および義務の解釈の変化は、私たちまたは私たちの顧客が患者または消費者に関連する情報(それによって生成された情報を含む)を収集、使用、または開示する能力を弱める可能性があり、これは、私たちのプラットフォームへの需要を減少させ、私たちのコストを増加させ、顧客基盤を維持し、増加させ、収入を増加させる能力を弱めるかもしれない。したがって、私たちは、私たちの業務活動ややり方を根本的に変更したり、私たちのソフトウェアやプラットフォームを修正するために大量の資源を費やしたり、他の方法でこれらの変化に適応する必要があることを発見することができるかもしれません。
さらに、私たちの患者は、法律、法規、または自律要件よりも厳しいプライバシーおよびデータセキュリティ要件を遵守することを期待しているかもしれませんし、私たちは契約上、データの処理または保護に関する他のまたは異なる基準を遵守する義務があるかもしれません。
私たちは、連邦または州の法律または法規、業界標準または他の法的義務、または任意の実際的または疑わしいプライバシーまたはセキュリティイベントを遵守できなかったか、または遵守できなかったと考えられており、不正アクセス、個人識別情報または他のデータの取得、配布、または移動を招くか否かにかかわらず、政府の法執行行動および起訴、個人訴訟、罰金および処罰または不利な宣伝を招き、私たちの顧客の信頼を失う可能性があり、これは私たちの名声や業務に悪影響を及ぼす可能性がある。私たちはビジネス的に合理的な方法で、あるいはこのような変更と修正をすることができないかもしれません。私たちが新製品を開発する能力は制限されるかもしれません。このような状況はどんな発展も私たちの業務、財政状況、そして運営結果を損なう可能性がある。プライバシーやデータセキュリティ上の懸念は,有効であるか否かにかかわらず,既存のクライアントが我々のプラットフォームを保持していることや,新たなクライアントが我々のプラットフォームを採用することを阻害する可能性がある.
66
医療立法改革措置や国家予算社会保障制度への制限は,我々の業務や運営結果に実質的な悪影響を及ぼす可能性がある。
米国や一部の外国司法管轄地域では、医療システムの立法や規制に多くの変化が生じており、製品販売の収益性に影響を与える可能性がある。特に、2010年にACAが公布され、その中で、他の事項に加えて、吸入、輸液、点滴、インプラントまたは注射の薬品計算メーカーの医療補助薬品還付計画の下での税金還付を解決する新しい方法が解決され、大多数のメーカーが医療補助薬品還付計画の下で不足している最低医療補助税金還付を増加させ、医療補助薬品還付計画を医療補助管理に登録された看護組織を使用する個人の処方に拡大し、メーカーにあるブランドの処方薬に新しい年会費と税を徴収することを要求した。新しいMedicare Part D引受切欠き割引計画を作成し、メーカーは保証不足期間中に条件を満たす受益者に50%(2018年両党予算法によって70%に増加し、2019年1月1日から発効)の販売時点割引を提供することに同意しなければならず、メーカーの外来薬物としてMedicare Part Dの条件を組み込む;そして連邦政府の比較有効性研究の計画を増加させるために激励を提供する。
ACAのいくつかの側面は公布以来、司法、国会、行政面の挑戦を受けてきた。2021年6月17日、米国最高裁はいくつかの州がACAに対して提出した最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。最高裁が裁決を下す前に,総裁·バイデンはACA市場による医療保険の取得を目的とした2021年2月15日から2021年8月15日までの特殊保険期間を開始する行政命令を発表した。行政命令はまた、特定の政府機関に、医療補助モデルプロジェクトおよび免除計画の再審査、および医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策を含む医療補助モデルプロジェクトおよび免除計画の再審査および見直し、医療補助またはACAによる医療保険のカバー範囲を制限する既存の政策およびルールを再検討するように指示する。バイデン政府の他の医療改革措置や他の挑戦,ACAの廃止または代替の努力(あれば)が我々の業務にどのように影響するかは不明である。
ACAが公布されて以来、アメリカはまた他の立法改正を提案し、採択した。その他の事項を除いて、2011年の“予算制御法”とその後の立法では、支出削減措置が制定され、各財政年度に提供者に支払われる医療保険の総減少幅は最大2%に達し、その後の立法改正案により、国会が追加的な行動を取らない限り、2030年まで有効になる。
2022年8月、2022年に“インフレ低減法案”(略称“アイルランド共和軍”)が法律に署名した。アイルランド共和軍には、IRAの様々な側面がどのように実施されているかに依存する、私たちの業務に影響を及ぼす可能性のあるいくつかの条項が含まれている。私たちの業務に影響を与える可能性のある条項は:連邦医療保険D部分の受益者の自己負担上限は2,000ドルであり、連邦医療保険D部分のすべての薬品に新しいメーカーの財務責任を適用し、アメリカ政府がある高コストの薬物と生物製品のB部分とD部分の定価について交渉することを許可し、模倣薬或いは生物類似の競争が存在せず、会社にインフレより速い薬品価格の増加のために連邦医療保険にリベートを支払うことを要求し、そして薬局福祉マネージャーを受益者にリベートすることを要求するリベート規則を延期する。Ireland共和軍が私たちの業務と医療産業全体に及ぼす影響はまだ明確ではない.
アメリカでは、製品の価格設定に関する立法と法執行の関心がますます大きくなっている。具体的には,米国議会は最近数回の調査を行い,製品定価の透明性を向上させ,連邦医療保険下の製品のコストを低減し,定価とメーカー患者計画との関係を審査し,政府計画の薬品精算方法を改革するための連邦と州立法を提案した。衛生·公衆サービス部はすでにその中のいくつかの措置についてフィードバック意見を求め始めており、同時に、その現有の権力に基づいて直ちに他の措置を実施している。このような立法と法執行関心が処方装置にどのような影響を与える可能性があるのかはまだ分からない。
これらの措置や将来採用される可能性のある他の医療改革措置は、より厳しいカバー基準を招き、私たちが販売している任意の設備の価格に追加の下振れ圧力を与える可能性があり、製品候補の患者に悪影響を及ぼす可能性があると予想される。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。
67
アメリカ外国、連邦と州の各レベルはすでに医療保健の獲得性を拡大し、医療保健コストを制御或いは低減するための立法と監督管理提案を引き続き提出することが可能である。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの製品の商業化を阻止するかもしれない。これらの改革は、私たちがマーケティング許可を受けることに成功し、規制された製品の予想収入に悪影響を及ぼす可能性があり、私たちの全体的な財務状況や候補製品を開発する能力に影響を及ぼす可能性がある。もし、私たちまたは私たちが接触する可能性のある任意の第三者が、既存の要求の変化に緩やかに適応できない場合、または新しい要求または政策を採用することができない場合、または私たちまたはそのような第三者が規制適合性を維持できない場合、私たちが現在または私たちが開発する可能性のある任意の未来の候補製品は、取得された可能性のある任意の規制マーケティング許可を失う可能性があり、利益を達成または維持することができないかもしれない。
私たちの従業員、独立請負業者、コンサルタント、商業協力者、主要な調査人員、サプライヤーとその他のエージェントは、規制基準と要求を遵守しないことを含む、不当な行為または他の不適切な活動に従事する可能性がある。
私たちは、従業員、独立請負業者、コンサルタント、商業協力者、主要な調査者、サプライヤー、および他の代理人が詐欺行為または他の不正活動に従事する可能性があるリスクに直面しています。これらの当事者の不正行為は、規制機関、製造基準、および米国連邦および州医療保健法律法規に真実、完全かつ正確な情報を報告することを要求する法律を含む、故意、無謀または不注意な行為、または適用法規に違反する不正な活動を開示することを含む可能性がある。特に、医療業界の販売、マーケティング、商業配置は、詐欺、リベート、自己取引、その他の乱用を防止するための広範な法律法規によって制約されている。アメリカ連邦反リベート法規と似たようなアメリカ州法律によると、私たちは責任に直面するかもしれない。これらの法律法規は、広範な価格設定、割引、マーケティングおよび販売促進、販売手数料、推薦、顧客インセンティブ計画、および他のビジネス計画を制限または禁止する可能性があります。これらの各方面の不正行為はまた、臨床試験過程で得られた情報を含むが、これらに限定されない個人識別情報の不適切な使用に関連する可能性があり、これは重大な規制制裁と私たちの名声を深刻に損なう可能性がある。さらに、不正行為が承認されていない(ラベル外)私たちの1つ以上の製品の使用を普及させることを含む場合、私たちは不正普及によって厳しい規制制裁に直面する可能性があり、FCAや同様の州法による厳しい処罰に直面する可能性がある。アメリカ以外の管轄区域にも似たような懸念があるかもしれない。従業員や他の第三者の不正行為を常に識別し、阻止することができるわけではなく、このような活動を検出し、防止するための予防措置は、未知または管理不可能なリスクや損失を効果的に制御することができないか、またはこれらの法律や法規を遵守できないことによる政府調査または他の行動または訴訟から私たちを保護することができない可能性がある。不正行為を発見し防止するための予防措置は、未知または管理不可能なリスクまたは損失を効果的に制御することができない可能性があり、または政府の調査または他の行動または訴訟の影響から私たちを保護することができない可能性があり、これらの調査または行動または訴訟は、そのような法律または法規を遵守できないことによるものである。もし私たちにこのような訴訟を提起し、私たちが私たちの権利を弁護または維持することに成功しなかった場合、これらの行動は、民事、刑事および行政処罰、損害賠償、罰金、監禁、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、追加の報告要件および監督(これらの法律違反の告発、契約損害、名声損害、利益および将来の収益減少、および私たちの業務削減を解決するために、会社の誠実な合意または同様の合意の制約を受けていれば)、これらのいずれも、私たちの業務運営能力、財務状況、および運営結果に悪影響を及ぼす可能性があります。
68
私たちの法律と規制環境に関するリスク
もし賄賂、反腐敗、そして反マネーロンダリングの法律を守らなければ、私たちは罰と他の不利な結果を受けるかもしれない。
私たちが業務を展開している司法管轄区では、米国の“反海外腐敗法”(“FCPA”)やその他の反腐敗、反賄賂、反マネーロンダリング法の制約を受けている。これらの法律は、一般に、私たちおよび私たちの従業員が、業務を獲得または保留し、業務を誰に回したり、いかなる不正な利益を得たりするために、政府関係者や商業団体に不正な方法で影響を与えることを禁止しています。“海外腐敗防止法”や適用されるような反賄賂や反腐敗法も、我々の第三者業務パートナー、代表、代理人が腐敗や賄賂行為に従事することを禁止している。私たちは、私たちの第三者業務パートナー、代表および代理と、政府機関または国有または付属実体の役人および従業員と直接的または間接的な相互作用があるかもしれない。私たちはこのような活動を明確に許可していなくても、これらの第三者業務パートナーと仲介、私たちの従業員、代表、請負業者、パートナー、代理人の腐敗や他の不正活動に責任を負わなければならないかもしれない。これらの法律はまた、正確な帳簿と記録を維持し、そのような行為を防止するための内部統制およびコンプライアンス手続きを維持することを要求している。このような法律のコンプライアンス問題を解決するための政策と手続きがありますが、私たちの従業員や代理人が私たちの政策に違反したり、法律を適用したりする行為をしないことを保証することはできません。最終的にはこれに責任を負うかもしれません。私たちの国際的な拡張と私たちが外国の管轄区域で販売と運営を始めるにつれて、私たちはこれらの法律に違反するリスクが増加するだろう。“海外腐敗防止法”または他の適用される反賄賂、反腐敗法律および反マネーロンダリング法に違反するいかなる行為は、告発者の苦情、メディアの不利な報道、調査、巨額の法律費用の徴収、輸出特権の喪失、厳しい刑事または民事制裁または米国政府契約の資格の一時停止または取り消し、管理層の関心の大量移転、株価下落、または私たちの業務に全体的に不利な結果をもたらす可能性があり、これらはすべて私たちの名声、業務、財務状況、および運営結果に悪影響を及ぼす可能性がある。
連邦、州、そして地方の雇用関連の法律法規は私たちの経営コストを増加させ、罰金と訴訟に直面させるかもしれない。
私たちの業務は、最低賃金、家庭医療休暇法、残業代、補償可能時間、記録保存その他の労働条件、民権法第七章、従業員退職収入保障法、アメリカ障害者法、国家労働関係法、平等雇用機会委員会条例、民権事務室条例、労働部条例、州総検察長条例、連邦と州賃金と労働時間法を含むが、米国公平労働基準法を含む様々な連邦、州、地方雇用に関する法律と法規によって制限されている。そして連邦や州政府によって公布された様々な類似した法律が、これらの他の雇用に関する事務を管理している。私たちの従業員は複数の州に分布しているので、これらの変化する連邦、州、地方法律法規を遵守することは、私たちの業務コストを大幅に増加させるかもしれません。そうしないと、罰金と訴訟に直面するかもしれません。私たちは現在、正常な業務過程で従業員に関する法的手続きの影響を受けている。可能性があり合理的に見積もることができると考えられる損失に対処する十分な準備金があると信じていますが、法的訴訟やクレームの最終結果は肯定的に予測できません。
有効な財務報告開示制御および内部統制制度を維持できない場合、タイムリーで正確な財務諸表を作成したり、適用法規を遵守する能力が損なわれる可能性があります。
上場企業として、私たちは“取引所法案”、2002年の“サバンズ-オキシリー法案”(以下、“サバンズ-オクスリー法案”)およびナスダック資本市場に上場基準を適用する規則と規定を守らなければならない。私たちは、これらの規則と条例の要求が引き続き私たちの法律、会計、財務コンプライアンスコストを増加させ、いくつかの活動をより困難にし、時間と費用を増加させ、私たちの人員、システム、そして資源に大きな圧力を与えると予想している。“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、私たちに効率的な開示制御と手続きと財務報告に対する内部統制を維持することを要求する。我々は、米国証券取引委員会に提出された報告で開示を要求した情報が、米国証券取引委員会規則及び表に指定された期間内に記録、処理、集計及び報告されることを確実にし、取引所法案に基づいて報告書に開示された情報が蓄積され、我々の主要幹部及び財務官に伝達されることを確実にするために、我々の開示制御及び他の手続きを継続して整備している。私たちはまた、このような手続きと統制を実施するために、より多くの会計や財務者を雇うことを含む、財務報告に対する私たちの内部統制を改善し続けている。財務報告書の開示制御および手続きおよび内部統制に対する私たちの有効性を維持し、向上させるために、会計に関連するコストおよび重要な管理監視を含む大量の資源が引き続きかかることが予想される。これらの新しいまたは改善された制御およびシステムのいずれかが予想されるように動作していない場合、私たちの制御は実質的な弱点に直面する可能性がある。
69
私たちの現在の統制と私たちが開発したどんな新しい制御も私たちの業務条件の変化によって十分ではないかもしれません。しかも、財務報告書開示統制と内部統制に関する私たちの弱点は未来に発見されるかもしれない。効果的な制御を開発または維持できなかった場合、または実施または改善中にいかなる困難に遭遇しても、私たちの経営業績を損なう可能性があり、または私たちの報告義務を履行できず、前の期間の財務諸表を再説明することにつながる可能性があります。財務報告を実施し、有効な内部統制を維持することができなくても、我々の財務報告の内部統制の有効性の定期管理評価や年間独立公認会計士事務所認証報告の結果に悪影響を及ぼす可能性があり、最終的には、米国証券取引委員会に提出する定期報告に含めることが求められる。無効な開示統制や手続き、財務報告の内部統制は、投資家が私たちの報告書の財務や他の情報に自信を失ってしまう可能性もあり、これは私たちの普通株の取引価格に悪影響を及ぼす可能性がある。しかも、もし私たちがこのような要求を満たし続けることができなければ、私たちはナスダックで上場し続けることができないかもしれない。我々は現在、サバンズ-オキシリー法案404条を実施する米国証券取引委員会規則を遵守することを要求されていないため、この目的のために我々の財務報告内部統制の有効性を正式に評価することも要求されていない。上場企業として、財務報告の内部統制の有効性に関する年次管理報告書を提供しなければなりません。私たちの第2の年次報告Form 10-Kから始めます.
私たちの独立公認会計士事務所は、2012年にJumpStart Our Business Startups Act(“JOBS Act”)で定義された“新興成長型会社”の後ではなく、財務報告の内部統制に対する私たちの有効性を正式に証明する必要はありません。このとき、私たちの独立公認会計士事務所が私たちの財務報告の内部統制の記録、設計、または操作レベルに満足していない場合、不利な報告書を発行する可能性があります。財務報告書の効率的な開示制御や内部統制を維持できなかった場合は、当社の業務や運営結果に悪影響を及ぼす可能性があり、一般株価格の下落を招く可能性があります。
もし私たちが財務報告に対する効果的な内部統制を確立し、維持することができなければ、私たちの財務結果を正確に報告できない可能性があり、これは投資家が私たちの報告した財務情報に自信を失い、私たちの株式の市場価格を下落させる可能性がある。
サバンズ-オキシリー法(Sarbanes-Oxley Act)404条(“第404条”)によると、私たちは私たちの財務報告書の内部統制に関する経営陣の報告書を提出しなければならない。しかし、私たちはまだ新興成長型企業であるにもかかわらず、私たちの独立公認会計士事務所が発表した財務報告書の内部統制に関する認証報告書を含むことは要求されません。規定された時間内に第404条を遵守するために、私たちは費用が高く挑戦的な財務報告書に対する私たちの内部統制を記録して評価する過程を行っている。この点では、外部コンサルタントを招聘することが可能な内部資源を継続的に提供する必要があり、詳細な作業計画により、財務報告内部制御の十分性を評価して記録し、適宜ステップ改善制御プログラムを採用し、制御措置がファイルのように機能しているかどうかをテストすることにより、財務報告内部制御の継続報告及び改善手順を実施する。私たちは努力したにもかかわらず、私たちは規定された時間枠内で結論を出すことができないかもしれない、すなわち私たちは財務報告書の内部統制に有効であり、404条の要求に適合する可能性がある。私たちは財務報告の内部統制に対する重大な弱点を発見しました。これはIPO終了時に引受業者に発行される株式の価値会計の不正確さ、およびいくつかの計算すべき費用と前払い費用の会計不正確さ、および会社が財務諸表を再説明してすべての償還可能な株式ツールを永久株式から一時株式に再分類することに関連しています。2021年の第3四半期(第3四半期を含む)まで、私たちの開示統制と手続きは無効だった。私たちは重大な弱点を補うための救済計画を実施したが、私たちが取った措置が将来の財務報告の内部統制のいかなる重大な弱点や欠陥を防ぐことを保証することはできない。私たちが私たちの統制や手続きを強化したと信じていても、将来的には、これらの制御および手続きは、違反やミスを防止したり、私たちの財務諸表の公正な列報を促進したりするのに十分ではないかもしれません。
私たちの組織構造に関連するリスクは
私たちの取締役会長David·ペリーは会社に大きな影響を与えた。
ペリーさんは2022年12月31日現在、我々の普通株式の約46%を流通株に保有している。ペリーさんが未完の投票権をかなりの割合で所有またはコントロールしている限り、取締役会の規模や取締役会の規模、当社の登録証や定款の変更、または当社の実質的にすべての資産の売却を含む合併やその他の主要企業取引の承認、ならびに当社のほとんどすべての資産を売却することを含め、すべての主要企業の取引を承認する能力を有しており、あなたとは異なる利益を有することができます。
デラウェア州の法律と私たちの管理文書には、株主が何らかの行動をとる能力を制限し、株主が有利と思われるかもしれない買収の試みを延期または阻止するいくつかの条項が含まれている。
70
私たちの管理文書とデラウェア州汎用会社法に含まれている条項は、私たちの取締役会が望ましくないと思っている買収をより困難にし、延期したり、阻止したりして、私たちの普通株の取引価格を下げるかもしれません。これらの規定は、我々の取締役会の現職メンバーによって指名されていない取締役や他の会社の行動を含む、株主が何らかの行動を取ることを困難にする可能性もあり、私たちの経営陣の変更を含む。他の事項に加えて、私たちの管理文書には以下の規定が含まれています
これらの条項は、単独または共同で、敵意の買収、統制権の変更、または取締役会または経営陣の変動を延期または阻止する可能性がある。
私たちの改正と再記述の定款は、私たちの株主によって開始される可能性のあるいくつかの訴訟の独占フォーラムとして特定の裁判所を指定し、これは、私たちの株主が有利な司法フォーラムを得ることが私たちとの紛争を処理する能力を制限することができる。
私たちの改正と再記述の規定によると、私たちが書面で代替裁判所を選択することに同意しない限り、デラウェア州衡平裁判所は、(1)私たちを代表して提起された任意の派生訴訟または訴訟、(2)私たちの取締役、上級管理職または他の従業員の私たちまたは私たちの株主に対する受託責任に違反すると主張する任意の訴訟、(3)デラウェア州会社法または私たちの会社登録証明書または定款の任意の規定(その解釈、有効性または実行可能性を含む)に基づいてクレームを提出する任意の訴訟に関連する。または(4)内務主義によって管轄される権利要件を主張する任意の訴訟。私たちは私たちの規約でこの条項をデラウェアフォーラム条項と呼ぶ。デラウェア州フォーラム条項は証券法や取引法によって発生したいかなる訴訟根拠にも適用されないだろう。私たちが書面で代替裁判所を選択することに同意しない限り、アメリカ連邦地域裁判所は、証券法に基づいて提起された任意の訴因を解決する唯一かつ独占的な裁判所であることをさらに規定し、再記述する。私たちは私たちの規定でこの条項を連邦フォーラム条項と呼ぶ。また、私たちが改正して再記載した定款規定は、私たちの株式株式の権益を購入または他の方法で獲得した個人または実体は、デラウェアフォーラム条項と連邦フォーラム条項に注目し、同意したとみなされるが、株主が米国連邦証券法およびその下の規則および法規の遵守を放棄するとはみなされない。
71
我々の規約におけるデラウェアフォーラム条項と連邦フォーラム条項は、株主にこのようなクレームを求める際に追加的な訴訟費用をもたらす可能性がある。さらに、これらのフォーラム選択条項は、私たちの株主が司法フォーラムで、私たちまたは私たちの役員、役員、または従業員との紛争のクレームに有利だと思う能力を提出することを制限する可能性があり、これは、私たちと私たちの役員、役員、および従業員に対する訴訟を阻止する可能性があり、訴訟が成功すれば、私たちの株主に利益をもたらすかもしれません。また、デラウェア州最高裁判所は2020年3月に、デラウェア州法律によると、証券法に基づいて請求を要求する連邦裁判所選択条項は表面的に有効であると判断したが、他の裁判所が我々の連邦フォーラム条項を実行するかどうかには不確実性がある。もし連邦フォーラムの条項が実行できないことが発見されたら、私たちはこのような問題の解決に関連した追加費用を発生させるかもしれない。連邦フォーラムの条項はまた、その条項が実行不可能または無効だと主張する株主に追加的な訴訟費用を適用するかもしれない。デラウェア州衡平裁判所と米国連邦地域裁判所もまた、訴訟の株主が存在するか、または訴訟を提起する裁判所を選択する可能性があり、これらの判決は、私たちの株主に多かれ少なかれ有利である可能性があることを考慮して、他の裁判所とは異なる判決または結果を下す可能性がある。
私たちの普通株に関するリスクは
私たちの普通株の価格は変動するかもしれません。
普通株の価格は様々な要素によって変動するかもしれません
これらの市場と業界要素は、私たちの経営業績にかかわらず、私たちの普通株の市場価格を大幅に下げるかもしれない。
72
不安定な市場や経済状況は、私たちの業務、財務状況、株価に深刻な悪影響を及ぼす可能性がある。
広く報道されているように、世界の信用と金融市場は過去数年間、流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の減速、インフレ率の上昇、失業率の上昇と経済安定の不確定性を含む極端な変動と破壊を経験しており、最近の状況は持続的かつ変化し続ける新冠肺炎の大流行および経済と政治的事態の発展(ウクライナ衝突、金利上昇と高インフレを含む)と関係がある。信用と金融市場のさらなる悪化と経済状況への自信が起こらない保証はない。私たちの全体的な業務戦略は、このような経済低迷、不安定なビジネス環境、または持続不可能で不安定な市場状況のいずれかの悪影響を受ける可能性がある。私たちの業務はまたウクライナ紛争のような地政学的事件による変動の影響を受ける可能性がある。現在の株式や信用市場が悪化したり改善されていない場合、任意の必要な債務や株式融資をより困難にし、コストがより高く、希釈度が高くなる可能性がある。また、私たちの株価は下落する可能性があり、一部の原因は株式市場の変動と全体的な経済低迷である。
適切かつ有利な条件で必要な融資を得ることができなければ、私たちの成長戦略、財務業績、株価に実質的な悪影響を及ぼす可能性があり、私たちの1つまたは複数の候補製品の開発と商業化を延期、削減、または停止すること、または潜在的な許可内または買収を求めることを延期することを要求するかもしれない。さらに、我々の現在の1つまたは複数のサービスプロバイダまたは他のパートナーは、経済的困難な時期を乗り切ることができない可能性があり、これは、時間通りおよび予算で運営目標を達成する能力に直接影響を与える可能性がある。
最近の資本市場の変動やわが証券の市場価格の下落は、普通株の売却や債務発行によって新たな資本を得る能力に影響を与える可能性があり、これは私たちの流動性を損なう可能性があり、私たちの成長業務の能力を制限し、私たちの運営インフラの買収や改善を求め、市場で競争する能力を制限することができる。
私たちの運営は大量の現金を消費し、私たちの候補製品を開発し、承認された後に商業化し、私たちの業務成長を支援し、現在の人員レベルを維持または拡大し、私たちの運営インフラを強化し、相補的な業務や技術を買収することができるように、大きな投資を継続していきたいと考えています。私たちの未来の資本需要は私たちの現在の見積もりと大きく異なるかもしれません。必要を含む多くの要素に依存します
したがって、私たちは私たちの資本需要を満たすために株式や債務融資を求める必要があるかもしれない。資本市場の不確実性と他の要素のため、このような融資は私たちに有利な条項で提供されないかもしれないし、根本的にはないかもしれない。もし私たちが株式または転換可能な債務証券をさらに発行することでより多くの資金を調達すれば、私たちの既存の株主は重大な希釈を受ける可能性があり、私たちが発行したいかなる新しい株式証券も普通株式保有者よりも高い権利、優遇、特権を持っている可能性がある。私たちが将来獲得するいかなる債務融資も、私たちの資金調達活動や他の財務·運営に関する制限条項に関連する可能性があり、これは、潜在的な買収を含めて、追加資本を獲得し、ビジネス機会を求めることをより難しくするかもしれない。もし私たちが十分な融資や満足できる条項で融資を受けることができなければ、私たちが私たちの業務に投資する能力は重大な制限に直面する可能性があり、そうでなければ、私たちの業務は損害を受けるだろう。
私たちの総流通株の大部分は市場に売却される可能性があり、これは私たちの業務が良好であっても、私たちの普通株の市場価格を大幅に低下させる可能性がある。
公開市場で私たちの大量の普通株を売ることはいつでも起こる可能性がある。これらの売却、あるいは市場で大量の株式保有者が株を売却しようとしているとの見方は、我々の普通株の市場価格を低下させる可能性がある。2022年12月31日現在、私たちは23,851,022株の普通株を発行しており、これらの普通株は直ちに公開市場で制限されずに転売することができるが、証券法第144条の制限を守らなければならない。もし私たちの株主が公開市場で私たちの普通株を売却したり、市場が私たちの株主が大量の普通株を売却しようとしていると思ったら、私たちの普通株の市場価格は大幅に低下する可能性があります.
73
私たちは融資、買収、投資、私たちの株式インセンティブ計画またはその他に関連する追加株式を発行し、他のすべての株主の権益を希釈します。
私たちは未来に追加的な株式を発行することが予想され、これは他のすべての株主の希釈につながるだろう。私たちは私たちの株式インセンティブ計画に基づいて従業員、役員、そしてコンサルタントに株式奨励を授与したい。私たちはまた未来に株式融資を通じて資金を調達するかもしれない。私たちの業務戦略の一部として、補完的な会社、製品、または技術に買収または投資し、そのような買収または投資のいずれかを支払うために株式証券を発行することができます。このような追加株式の発行は株主の所有権権益を著しく希釈する可能性があり、私たちの普通株の1株当たりの価値は低下する。
普通株に現金配当金を支払う計画はありませんので、ご購入価格より高い価格で普通株を販売しない限り、投資収益を得ることができないかもしれません。
私たちは現在私たちの普通株に現金配当金を支払う計画がない。未来のどんな配当金の発表、金額、そして支払いは私たちの取締役会によって全権的に決定されるだろう。私たちの取締役会は、一般的かつ経済的状況、私たちの財務状況と経営業績、私たちの利用可能な現金、現在と予想される現金需要、資本要求、契約、法律、税金と規制制限、株主または私たちの子会社への配当金の支払いへの影響、および私たちの取締役会が関連すると思う可能性のある他の要素を考慮するかもしれません。しかも、私たちとHercules Capitalとの融資協定条項は私たちが現金配当金を支払う能力を制限する。したがって、予測可能な未来に、私たちは私たちの普通株にどんな配当金も支払わないかもしれない。
私たちが未来に発行する債務や株式証券は私たちの普通株の市場価格に悪影響を及ぼすかもしれない。
将来、私たちは、普通株式を増発すること、または債務または他の株式証券(商業手形、中期手形、優先または二次手形、株式に変換可能な債務証券または優先株を含む)を発行することによって、融資を獲得するか、または資本資源をさらに増加させることを試みるかもしれない。未来の買収は現金を運営するのではなく、多くの追加資本を必要とするかもしれない。私たちは追加発行株式、会社債務、および/または運営現金の組み合わせで買収に必要な資本を得る予定だ。
普通株式または他の株式証券または株式に変換可能な証券は、私たちの既存の株主の経済的および投票権を希釈するか、または私たちの普通株の市場価格を低下させるか、またはその両方をもたらす可能性がある。清算後、このような債務証券および優先株の保有者および他の借金の貸金者は、普通株式保有者よりも優先的に利用可能な資産の分配を受けることになる。株式に変換可能な債務証券は転換比率に応じて調整することができ、これらの調整により、あるイベントは転換後に発行可能な株式証券の数を増加させる可能性がある。優先株が発行されると、清算分配よりも優先的または配当支払いよりも優先される可能性があり、これは、普通株式保有者に配当金を支払う能力を制限する可能性がある。私たちが未来のどの発行でも証券を発行する決定は、市場状況と他のコントロールできない要素に依存し、これらの要素は私たちの未来の発行金額、時間、性質に悪影響を及ぼすかもしれない。
一般リスク因子
私たちは私たちの上級管理チームに依存して、1人以上の幹部や重要な従業員を失ったり、高い技能従業員を引き付けることができず、私たちの業務に悪影響を及ぼす可能性があります。
私たちの成功は私たちの主要な行政者たちの持続的なサービスに大きく依存する。これらの幹部は勝手な従業員であるため、事前に通知することなくいつでも私たちとの雇用関係を終了することができる。私たちは運営、臨床とソフトウェア開発、情報安全、マーケティング、コンプライアンス及び一般と行政機能の面で私たちの指導チームに頼っている。時々、私たちの幹部管理チームは役員の採用や退職によって変化する可能性があり、これは私たちの業務を混乱させる可能性があります。
1人以上の上級管理チームのメンバーや他の重要な従業員を失うことは、私たちの業務を損なう可能性がある。私たちの役員または他の重要な従業員の1人以上を交換することは、多くの時間とコストを伴う可能性があり、業務目標の達成を大幅に延期または阻害する可能性があります。
74
私たちの成長戦略を継続的に実行するために、私たちはまた高い技能人材を誘致して維持しなければならない。合格した専門家に対する競争は非常に激しい。私たちは合格した人材を引きつけて維持し続けることができないかもしれない。私たちは過去に適切な経歴を持つ高技能者を募集したり引き留めたりする困難に直面しており、将来も困難に直面することが予想される。医療市場での勤務経験を持つ合格者チームは全体的に限られている。しかも、私たちがそれと競争している多くの会社は私たちよりも多くの資源を持っている。
また、私たちの成功は私たちの文化を発展させ、私たちの人材を私たちの業務需要と一致させ、私たちの従業員を引きつけ、私たちの従業員が変化と革新に開放的な態度を持つように激励することにかかっている。現在急速に変化している環境を考慮して、私たちの幹部と上級管理者の後継を十分に計画できなかった場合、あるいは私たちが重要な人材を有効に募集、統合、維持、発展させることができなかった場合、および/または私たちの人材を私たちの業務需要と一致させることができなければ、私たちの業務は不利な影響を受けるだろう。
私たちは“新興成長型会社”と“より小さい報告会社”の資格に適合しており、新興成長型会社やより小さい報告会社が獲得できるいくつかの開示要求免除を利用すれば、私たちの証券の投資家に対する魅力を低下させる可能性があり、私たちの表現を他の上場企業の表現と比較することを困難にする可能性がある。
我々は、“雇用法案”によって改正された“証券法”第2(A)(19)節で定義された“新興成長型企業”の資格に適合している。したがって、私たちが新興成長型企業であり続ける限り、(I)財務報告の内部統制に関する監査役認証要求免除、(Ii)給与発言権、頻度発言権および黄金パラシュート投票要求、および(Iii)私たちの定期報告および依頼書における役員報酬に関する開示義務の減少を含む、他の非新興成長型企業に適用される上場企業のいくつかの免除を利用する資格があり、利用しようとしている。我々は、(I)前期6月30日現在の非関連会社が保有する我々の普通株式の時価が7億ドルを超える事業年度の最終日まで新興成長型会社であり、(I)当該事業年度の総毛収入が12.35億ドルを超える事業年度の最終日まで、(Iii)私たちは、前の3年間に10億ドルを超える転換不可能債券を発行した日、または(Iv)最初の公募株(IPO)で私たちの普通株を最初に売却した日から5周年後の会計年度の最終日。また、雇用法案第107節では、新興成長型会社が新興成長型会社であれば、証券法第7(A)(2)(B)節に規定する免除を利用して新たなまたは改正された会計基準を遵守する機会を利用できると規定している。したがって、新興成長型企業は、これらの基準が民間会社に適用されるまで、いくつかの会計基準の採用を延期することができる。私たちは、新たなまたは改正された会計基準を遵守することを免除することを選択しているため、他の非新興成長型企業の公衆企業と同様に、同じ新しいまたは改正された会計基準を遵守しない可能性がある。投資家は私たちの普通株がそんなに魅力的ではないことを発見するかもしれません。私たちはこれらの免除に依存するので、これは私たちの普通株取引市場がそんなに活発ではなく、私たちの株価はもっと変動するかもしれません。
私たちも“小さな報告会社”であり、これは前年6月30日現在、非関連会社が保有するわが株の時価が7億ドル未満であり、最近終了した会計年度では、我々の年収が1億ドル未満であることを意味する。以下の場合、私たちはまだ小さな報告会社である可能性があります:(I)前年6月30日現在、非関連会社が保有する当社株の時価は2.5億ドル未満、または(Ii)最近終了した年度では、私たちの年収は1億ドル未満であり、前年6月30日現在、非関連会社が保有する当社株の時価は7億ドル未満である。もし私たちが小さな報告会社であれば、私たちがもう新興成長型会社ではない場合、私たちはより小さな報告会社が得ることができるいくつかの開示要求の免除に依存し続けるかもしれない。具体的には、小さな報告会社として、当社のForm 10-K年度報告書に最近の2つの財政年度の監査済み財務諸表のみを提示し、役員報酬の削減に関する開示義務を利用することを選択する可能性があります。
75
上場企業として、大幅に増加した費用や行政負担を招き続けることは、我々の業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
上場企業としては、上場企業としての法律、会計、行政、その他のコストや支出の増加に直面しており、これらのコストや支出は私たちが民間会社としては発生していない。サバンズ-オクスリ法案は、404節の要件と、後に米国証券取引委員会、2010年ドッド·フランクウォール街改革および消費者保護法、およびこの法案に基づいて公布され、公布される規則および条例(“上場企業会計基準”)および証券取引所によって実施される規則および条例を含み、上場企業に追加的な報告およびその他の義務を負担することを要求する。上場企業の要求を守ることはコストを増加させ、ある活動をより時間をかけることになる。その中のいくつかの要求事項は私たちが今までしたことのない活動を展開することを要求するだろう。また、米国証券取引委員会報告書の要求に関連した追加費用も発生する。さらに、これらの要求を遵守する上で任意の問題が発見された場合(例えば、監査人が財務報告の内部統制に重大な欠陥または重大な欠陥があることを発見した場合)、私たちはこれらの問題を是正するための追加コストを生じる可能性があり、これらの問題の存在は、私たちの名声または投資家の見方に悪影響を及ぼす可能性がある。役員や上級者責任保険を購入した方が高いかもしれません。上場企業として、私たちの地位に関するリスクは、私たちの取締役会に入ったり、役員になったりすることを引き付けたり、維持したりすることを難しくするかもしれません。これらの細則および条例で規定されている追加報告およびその他の義務は、法律および財務コンプライアンスコストおよび関連法律、会計および行政活動のコストを増加させるだろう。これらの増加したコストは、私たちに大量の資金を移転することを要求します。そうでなければ、これらの資金は業務の拡大と戦略目標の達成に使用することができます。株主や第三者の宣伝努力も、ガバナンスや報告要件のより多くの変化を促す可能性があり、コストをさらに増加させる可能性がある。
私たちがナスダックの持続的な発売基準を守ることができるという保証はない。
もしナスダックがナスダックの上場基準に達しずに私たちの普通株をその取引所で退市した場合、私たちと私たちの株主は重大な不利な結果に直面する可能性があります
アナリストが発表した報告書は、私たちの実際の結果とは異なる報告書での予測を含め、私たちの普通株の価格や取引量に悪影響を及ぼす可能性がある。
証券研究アナリストは私たちのために彼ら自身の定期的な予測を確立して発表するかもしれない。これらの予測は大きく異なる可能性があり,我々が実際に得た結果を正確に予測できない可能性がある.もし私たちの実際の結果がこれらの証券研究アナリストの予測と一致しなければ、私たちの株価は下落するかもしれない。同様に、私たちの報告書を書いてくれた一人以上のアナリストが私たちの株式格付けを引き下げたり、私たちの業務に関する不正確または不利な研究報告書を発表したりすれば、私たちの株価は下落するかもしれない。1人以上のアナリストが私たちへの報告を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの株価や取引量が低下する可能性がある。
項目1 B。未解決の従業員のコメント。
適用されません。
項目2.財産
私たちはどんな不動産も持っていないし、賃貸していません。私たちが運営しているのは仮想オフィスモデルで、私たちの業務郵送先は市場街548 Market Street、#49404、San Francisco、CA 94104です。
76
項目3.法的訴訟
私たちは現在どんな重大な法的手続きの当事者でもなく、解決策や脅威が提起される訴訟があることも知らない。正常な業務過程で、私たちは法的手続き、クレーム、そして訴訟の影響を受けるかもしれない。
第4項鉱山安全情報開示
適用されない
77
第II部
第五項登録者普通株式市場、関連株主事項及び発行者が株式証券を購入する。
普通株式市場情報
私たちの普通株はナスダック資本市場で看板取引をしています。コードはBTTXです。
記録保持者
2023年3月24日現在、我々の普通株には約62名の登録株主がいる。
配当政策
私たちは現在、すべての利用可能な資金と未来のどんな収益も維持し、私たちの業務の成長と発展に資金を提供するつもりだ。私たちは私たちの株のどんな現金配当金も発表したり支払ったりしたことがない。予測可能な未来に、私たちは私たちの株主に現金配当金を支払うつもりはない。しかも、私たちはHercules Capitalとの融資協定条項は私たちが配当金を支払うことを禁止する。投資家は現金配当金を得ることを期待して私たちの普通株を購入してはいけない。
将来配当を発表する任意の決定は、私たちの取締役会が適宜決定し、私たちの財務状況、経営業績、資本要求、一般業務状況、および私たちの取締役会が関連する他の要素に依存するかもしれません。
株式補償計画に基づいて発行された証券
表格10-K第5項に要求される株式報酬計画に関する資料は、本年度報告第3部第12項に組み込まれる。
最近売られている未登録証券
ない。
発行者とその関連者が株式証券を購入する
ない。
第六項です[保留されている]
78
第7項:経営陣の財務状況と経営成果の検討と分析。
以下、当社の財務状況と経営結果の検討·分析は、本年度報告第8項に含まれる我々の財務諸表と関連付記とともに読まなければならない。他の説明がない限り、すべての金額はドルで計算されます。1株当たりの金額を除いて、別の説明を除いて、すべての金額は千である。
概要
我々は処方デジタル治療会社であり,臨床検証されたソフトウェアに基づく新しいCBT形式を開発し,CMDXの根本的な原因を解決している。私たちの使命は行動変化の力によって人間の健康を促進することだ。我々はFDA規制のソフトウェアに基づくPDT特許プラットフォームを開発し,心臓代謝性疾患の根本的な原因を解決することでこれらの疾患を治療している。我々の最初の開発はT 2 D,高血圧,高脂血症,NAFLD,NASH,CKDに集中していた。私たちは2015年に設立され、幹部が指導し、数十億ドルの業務を設立した記録を持ち、開発と商業化治療の面で豊富な業界経験を持っている。
私たちは心臓代謝性疾患を私たちの初期目標市場として選択したのは、それらは1)生活様式行為を共通の根本的な原因とし、私たちのプラットフォームを多種の関連疾病に迅速に拡張させる可能性があるため、2)最も普遍的かつ最も高価な慢性病の列にランクインし、これらの慢性病は基本的に可逆的かつ予防可能であり、変革性影響を与える機会を提供した、3)重大な満たされていない需要領域を代表しており、現在の薬物は主に治療症状であり、根本的な原因を解決するのではなく、時間の経過とともに、疾病の進展とより高価な医療干与を招くことが多いからである。
われわれが臨床検証したPDTは医師が処方し,従来の薬物のように支払者が精算することを目的としている。我々のPDTに埋め込まれた行動パターンは,我々が治療を求める疾患を引き起こす特定の行動に対する新しいCBT形式である。われわれの光線力学療法が提供するCBTは,脳の神経経路を変化させ,行動の持続的な変化を可能にすることを目的としている。
著者らのリード処方デジタル治療製品候補製品BT-001は2022年7月に一流の開放ラベル、ランダム、対照、平行群の臨床試験を完成し、T 2 D患者の治療に応用し、そしてその主要と副次的な終点及び多くの探索性終点を満たすことに成功した。私たちは提出しました初めからやり直す2022年9月にFDAに分類要求を提出し、成人T 2 D患者の治療のためのBT-001のマーケティング許可を求め、2022年10月、FDAは私たちの初めからやり直す分類要求は実質的な検討のために受け入れられた。著者らの一部のデータは2022年10月の同業者評議定期刊行物“糖尿病看護”に発表された。典型的な初めからやり直す審査過程は我々が予想したように,2023年2月にFDAからより多くの情報の提供を要求され,我々が提出した材料を審査した後,FDAはより多くの情報を提供する必要があると決定し,審査を一時停止することを通知した.この手紙は,我々が提出した材料には多くの欠陥があり,重大な欠陥と副次的な欠陥に分類されるFDAの観点を概説している。私たちは、指摘されたいくつかの主要な欠陥を明らかにし、これらの問題を解決するための選択について指導を求めるためにFDAとの会議を要求する。その会議も2月に行われた。会期中、FDAは有益な背景、明確化、そして指導を提供し、私たちは今FDAのコメントに答えるために私たちの反応をまとめている。私たちはFDAの問題を解決できると信じており、私たちがこれまで提供してきた指導意見は変わらない、すなわちFDAは2023年に決定を下すことが予想される。もし私たちがこれらの不足を解決できない場合、私たちは許可を求めている使用適応を修正する必要があるかもしれないし、および/または別の臨床試験を行う必要があり、BT-001の許可および商業発売は著しく延期または許可が拒否される可能性があるかもしれない。
われわれのLivVita研究も積極的なトップライン結果を得ており,史上初の臨床研究であり,われわれがデジタル配信したCBTをNAFLDやNASHの潜在療法としての可能性を評価し,肝臓脂肪の低下と肝疾患バイオマーカーの改善を行った。現在,FDAはこれらの疾患の治療法を承認しておらず,これらの疾患は米国人の4分の1に影響し,毎年約1000億ドルの直接医療コストをもたらしている。満たされていない医療ニーズが多いため,2023年上半期にCBTのこれらの適応に基づく研究的治療プラットフォームのための画期的な設備指定をFDAに申請する予定である。我々は,この研究のデータとBT−001キー試験の探索的終点を用いて,T 2 D以外のCMDX適応におけるFDAの認可を支援するための追加的なキー試験の起動が可能な情報を提供する予定である。
79
私たちはPDT領域のいくつかの重要な側面が他の会社とは異なり、これらの側面は、以前に承認されたPDTよりも良い商業的業績と最高収入をもたらす可能性があると信じている:1)私たちは心臓代謝性疾患に集中しており、T 2 Dは私たちの主要な適応として、私たちは重大に満たされていない医療需要を有する非常に大きな患者集団を狙っている;2)私たちの研究PDTは、現在の糖尿病治療の臨床ガイドラインが治療の基礎であることを強調し、既存の治療例に適合した治療介入を提供することを目的としている。3)われわれが提案した療法は多大な健康経済効果をもたらす可能性があり,われわれPDTの使用は支払者の収益性を向上させる可能性がある,4)開発と商業化療法の面で豊富な業界経験を有するチームを有している。また,我々の内部で開発された新しいCBTは,デジタル治療分野でCBTの原則を取り入れた他の方法とは異なると信じている。
BT−001の臨床試験は,これまで光線力学療法に対する最大規模の無作為対照研究であり,体重指数25 mg/mの多様化した全国代表的な患者668名が組み込まれている2, 晩期と治療困難なT 2 Dは,平均ベースラインA 1 cは8.1%であった。試験参加者は長期(平均11年)、T 2 Dコントロールが良くなく、心血管リスクが高く、多種の合併症、多種の血糖降下薬物は1つの治療困難な患者群を代表した。研究が開始される前に,我々はいくつかの正式な会議インタラクションの中でFDAと実験設計の核心面を検討した.これらの本格的な会議インタラクションにおいて,適切な終点はBT−001群A 1 cの平均変化が対照群の平均変化に対して決定した臨床的意義のあるA 1 c変化であるとFDAと一致した。これらの議論の後、参加者は、BT−001の使用または使用しない標準的なケアをランダムに受け入れることを決定し、主要および副次的な治療効果の終点は、90日および180日におけるA 1 cの平均変化とベースラインとの差である。この研究のモチベーションは,Bt−001と対照群との間にA 1 cの0.4%以上の変化が90日で検出され,統計学的に有意な変化が認められたことである(p
われわれのBT−001臨床試験は主要と副次的終点ともに統計的に有意かつ臨床的に有意な変化を得た。主要な治療効果の終点は治療90日後の糖化ヘモグロビンの平均変化とベースラインの差異である。BT−001は主要終点に達し,対照群と比較してA 1 cは統計学的に有意に改善(−0.4%,n=610,p)した
LivVita研究は著者らが有力な肝臓臨床研究センターアリゾナ州肝臓健康センターと協力して行ったものであり、著者らの臨床研究はNAFLDとNASHの潜在療法としてデジタル配信されたCBTの可能性を評価した。この片腕介入コホート研究は22名の患者を募集し,CBTによる90日間の治療プラットフォームを獲得した。この臨床研究はその主要な終点に達し,統計学的に有意な陽性信号を示し,意向治療群(n=19)ではMRI−PDFFの平均が相対的に16%減少した(p=0.01)。また、臨床研究により:(I)アラニントランスアミナーゼ(ALT)は平均-17 IU/L低下し(p=0.002)、(Ii)FAST採点は平均20%(p=0.10)、(Iii)深刻な有害事象或いは設備に関連する有害事象がなく、(Iv)患者の治療に対する高い参加度と満足度、純Promoter採点+75,94%の被験者は90日後もこのアプリを使用している。NAFLDとNASHは米国で8000万人を超える成人に影響を与え,年間1000億ドルを超える直接医療コストを招いている。FDAが承認したNAFLDやNASHに対する治療法は現在のところない。
80
BT−001によるT 2 D治療に関する長期有効性と医療利用変化を評価するために,実世界のエビデンス研究も開始した。このランダム,対照,多点の研究では,患者を募集して少なくとも12カ月の治療を行う予定である。糖化ヘモグロビンと医療資源利用の変化を評価し,通常の看護と比較した。十分な数の患者が180日間の漸増治療を完了すると、中期研究結果は2023年第4四半期に報告される予定である。この研究は,支払者や提供者に実世界環境における使用や結果に関する長期データを提供することを目的としている.
財務概要
2015年の設立以来、私たちのほとんどの資源は発見と臨床前研究、私たちの知的財産権の確立と維持、人員の募集、資金の調達及びこれらの業務に一般と行政支持を提供することを含む研究開発活動に集中している。モバイルアプリケーションを含むデジタル治療計画を提供する個人医療保険提供者と連携したパイロット計画の収入を記録した。これまで、私たちの運営資金は、主に転換可能な手形と未来の株式を発行する簡単な合意(“SAFE”)、私たちの優先株の発行と売却、私たちの定期融資ツールからの借入金、MCADとの合併から資金を得ることにありました。
設立以来、私たちは毎年純損失を出している。2022年12月31日と2021年12月31日までの12ヶ月間の純損失はそれぞれ3980万ドルと4030万ドルだった。2022年12月31日と2021年12月31日までの累計赤字はそれぞれ1兆115億ドルと7170万ドルだった。我々のほとんどの純損失は,我々の研究や開発計画に関するコストと我々の運営に関する一般的かつ行政的コストによるものである.少なくとも今後数年以内に、巨額の費用と増加する運営損失を招き続けることを予想している。持続的な活動に関連する費用は大幅に増加すると予想されています
2021年4月6日、吾らは特殊目的買収会社MCADと合併協定(“合併協定”)を締結した。合併協定については,MCADは二零二一年四月六日にいくつかの機関および認可投資家と引受協定(“引受協定”)を締結し,これによりMCADは業務合併終了直前に私募で5,000,000株の普通株,1株10.00ドル(“管路株式”)を発行·売却することに同意した。2021年10月28日、私たちはMCADとの統合を完了した。MCADとの業務統合を完了した後、5900万ドルの資金を調達した。MCADは合併協定によりLegacy BTXの全流通株を買収し,MCADの15,174,729株と交換した。合併に関連して,MCADはBetter Treateutics,Inc.と改名した.
新冠肺炎の影響
2020年3月、世界保健機関は新冠肺炎を全世界大流行と発表した。新冠肺炎の疫病は私たちの業務に大きな影響を与えなかった。新冠肺炎の大流行或いは類似の衛生流行病の最終的な影響は高度に不確定であり、変化する可能性がある。私たちの業務、私たちの臨床試験、ヘルスケアシステム、あるいは世界経済への潜在的な遅延や影響のすべての程度はまだわかりません。しかし、これらの影響は私たちの運営を損なう可能性があり、私たちは引き続き新冠肺炎の大流行を注視していきたい。経営陣は、この病気が高度な不確実性と予測できない結果を持っているため、新冠肺炎が私たちの業務の将来の財務に与える影響を推定することができない。
81
経営成果の構成部分
収入.収入
私たちの主な収入源はアメリカ商業保険会社、Medicare、Medicaidと退役軍人管理局による私たちの治療の精算になると予想しています。私たちの最近の計画は、FDAが発売を許可すれば、私たちの最初のT 2 D、BT-001を治療するPDTは広範な精算範囲を得ることです。著者らは一連の全面的な証拠を展示と生成し、BT-001が臨床結果、総看護コストと効果持続性に与える影響によってBT-001の価値を実証し、有利な比率と広範な精算範囲を得ることを望んでいる。FDAのマーケティング許可を取得した場合、BT-001および私たちの他の候補製品が割引されたレートおよび広い精算範囲を獲得し、このような保険を取得する時間は非常に不確定である。したがって,候補製品を貨幣化することで確認される時間や収入金額は様々な要因によって異なる可能性が期待される.
私たちは業務発展に取り組んでおり、BT-001と私たちのプラットフォームの価値を非希釈で最大化しています。製薬、医療技術、技術会社と協力する機会を模索しており、これらの会社はCMDXのために伝統的な薬物療法をマーケティングしており、デジタル健康や私たちのプラットフォームの開発と商業化に成功した組織インフラを支援することに戦略的な興味を持っている。心臓代謝分野で運営する製薬会社と共同で新しい組合せ製品を開発する機会もある可能性がある。
運営費
運営費を,(I)研究開発費,(Ii)販売とマーケティング費用,(Iii)一般費用と行政費用の3つに分類した。
研究と開発
私たちの研究開発費には、私たちの研究活動や開発計画に関する外部と内部費用が含まれています。これらの費用には,非常勤管理や臨床試験を行うCROやコンサルタントに関する費用,ソフトウェア開発やライセンスに関する他の研究·開発費用,他の外部開発サービス,研究結果の分析·発表に関する費用が含まれている。また、私たちの研究開発費には、賃金と福祉費用、株式給与、特定の管理費用の分配を含む内部人員費用が含まれています。
我々は,アプリケーション開発段階で発生した我々のデジタル治療プラットフォームに関する研究開発内部使用ソフトウェアコストを資本化し,これらのコストを貸借対照表に個別に示すことを資本化ソフトウェア開発コストとした.プロジェクトの初期計画·評価段階で発生した研究·開発費用は、発生した費用に計上される。これまで、これらの費用の大部分は私たちの主要候補製品BT-001を推進するためでした。
予測可能な未来には,我々のプラットフォームや候補製品の開発に関する研究·開発活動に投資し続けるとともに,我々の候補製品が後期開発段階に入り,臨床試験を継続するにつれて,我々の研究開発費が大幅に増加することが予想される。私たちのプラットフォームと私たちの候補製品の開発成功は大きな不確実性を持っている。そのため、私たちの研究開発プロジェクトの持続時間と完成コストを決定することもできませんし、いつ、どの程度私たちの候補製品の商業化と販売から収入を得るかを決定することもできません。
販売とマーケティング
販売とマーケティング費用には主に人事に関する費用、広告と広報費用、コンサルティングサービスが含まれています。予測可能な未来には、BT-001の潜在的なビジネス発売に備えて、私たちの販売とマーケティング費用が増加すると予想されています。私たちの販売とマーケティングは一般意識とブランド普及活動を通じて支払人、患者、初級保健医を狙うことに集中する予定です。我々は当初,主に革新的な医療システムと統合配信ネットワークに焦点を当て,相当数の一次保健医や内分泌専門家に接触し,適度な規模の販売チームを持つことを計画していた。
82
一般と行政
一般と行政費用は主に人事に関する費用と専門サービスを含み、法律、監査と会計サービス及び商業保険を含む。人事に関連する費用には、賃金、福祉、株式ベースの給与が含まれる。我々は,予見可能な将来,我々の候補製品を抜擢するために期待される従業員数の増加と,上場企業運営の結果として,米国証券取引委員会規則,投資家関係活動,その他の行政·専門サービスの遵守に関する費用を含む一般的かつ行政的費用が増加することを予想している.
利子支出,純額
利息支出は、純額には主に2021年に締結された保証付き定期ローン手配に関する利息支出が含まれ、超過現金で稼いだ利息と相殺される。
経営成果
2022年12月31日までと2021年12月31日までの年次比較
以下の表は、本報告に記載した期間の業務結果(千計)をまとめたものである
|
|
12月31日までの12ヶ月間 |
|
|||||||||||||
|
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
||||
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発 |
|
|
16,440 |
|
|
|
19,436 |
|
|
|
(2,996 |
) |
|
|
-15 |
% |
販売とマーケティング |
|
|
6,979 |
|
|
|
2,336 |
|
|
|
4,643 |
|
|
|
199 |
% |
一般と行政 |
|
|
14,843 |
|
|
|
8,788 |
|
|
|
6,055 |
|
|
|
69 |
% |
総運営費 |
|
$ |
38,262 |
|
|
$ |
30,560 |
|
|
$ |
7,702 |
|
|
|
25 |
% |
運営損失 |
|
|
(38,262 |
) |
|
|
(30,560 |
) |
|
|
(7,702 |
) |
|
|
25 |
% |
利子支出,純額 |
|
|
(1,491 |
) |
|
|
(185 |
) |
|
|
(1,306 |
) |
|
|
706 |
% |
融資減免から利益を得る |
|
|
— |
|
|
|
647 |
|
|
|
(647 |
) |
|
|
-100 |
% |
金庫の公正価値変動 |
|
|
— |
|
|
|
(10,390 |
) |
|
|
10,390 |
|
|
|
-100 |
% |
所得税準備前の損失を差し引く |
|
|
(39,753 |
) |
|
|
(40,488 |
) |
|
|
735 |
|
|
|
-2 |
% |
所得税準備金 |
|
|
7 |
|
|
|
(153 |
) |
|
|
160 |
|
|
|
-105 |
% |
純損失 |
|
$ |
(39,760 |
) |
|
$ |
(40,335 |
) |
|
$ |
575 |
|
|
|
-1 |
% |
研究と開発費
2022年12月31日までの年度の研究開発支出は1,640万ドルだったが、2021年12月31日までの年度は1,940万ドルと300万ドル減少した。減少の要因は,BT−001キー試験の完成に伴い,2022年の臨床試験のコストが640万ドル減少したが,ソフトウェア開発能力の拡大に関連する人員コストが250万ドル増加し,資本化ソフトウェアコストの償却コストが76万ドル増加したことである。
販売とマーケティング費用
2022年12月31日までの年間販売·マーケティング費は700万ドルだったが、2021年12月31日までの年間230万ドルと460万ドル増加した。販売やマーケティング費用の増加は、主に人員関連の費用が120万ドル増加したことと、BT-001が発売される可能性のあるビジネス準備活動を支援することに関する相談やマーケティング費用が340万ドル増加したためである。
一般と行政費用
2022年12月31日までの年間では、一般·行政費は1480万ドルだったが、2021年12月31日までの年間は880万ドルと610万ドル増加した。一般と行政費用の全体的な増加は、主に上場企業の費用が増加し、相談、監査、法律費用を含む340万ドルの商業保険、160万ドルの人事関連費用、160万ドルの外部サービスが含まれているからだ。
83
利子支出,純額
2022年12月31日までの年間の利息支出純額は150万ドルだったが、2021年12月31日までの年間20万ドルと130万ドル増加した。利子支出純額の増加はHercules Capitalとの保証付き定期融資手配による利息支出によるものである。
金庫の公正価値変動
2022年12月31日までの年度は,金庫の公正価値変動に関する支出は0ドルであったが,2021年12月31日までの年度損失は1040万ドルであった。私たちの業務合併と金庫を普通株に変換したため、2022年の金庫の公正価値は変化しなかった。
融資減免から利益を得る
2020年5月9日,我々は2020年のコロナウイルス援助,救済,経済安全法案に基づいて設立されたPaycheck保護計画(PPP融資)に基づき,ケルト銀行から64万ドルの総融資収益を得た。2021年5月には、融資免除の承認を受け、免除日の元本残高と計上すべき利息に相当する64.7万ドルの融資免除収益を記録した。
流動性と資本資源
私たちは主に優先株、転換可能な手形、金庫とMCAD業務と合併した資金を売ることで、私たちの運営に資金を提供します。
2021年4月6日、私たちはMCADと合併協定を締結した。合併プロトコルについては,MCADはいくつかの機関および認可投資家と引受プロトコルを締結し,これにより,他の事項を除いて,MCADは業務合併終了直前に私募で合計5,000,000株のPIPE株式を発行および売却することに同意した.2021年10月28日、私たちはMCADとの統合を完了した。MCADとの業務統合を完了した後、5900万ドルの資金を調達した。MCADは合併協定によりLegacy BTXの全流通株を買収し,MCADの15,174,729株と交換した。
2021年8月18日、私たちはHercules Capital,Inc.と5000万ドルまでの優先保証定期融資手配を提供する保証定期融資合意に達した。定期貸出ツールの満期日は2025年8月1日で、2026年2月1日まで延長でき、私たちのほとんどの資産を担保にすることができます。定期ローンツールの満期支払いは2023年3月1日までに利息のみを払い(あるマイルストーンに達した場合は、2023年9月1日または2024年9月1日に延期できます)、その後、月額分割払いで元金を返済しなければなりません。利息は月ごとに利息を払い,滞納する.元金未返済の利息は(A)8.95厘または(B)8.95センチプラス最優遇金利3.25厘。ローン契約によると、前払金の未返済は許可され、何らかの前払い費用の制限を受ける。私たちは51.8万ドルの債務発行コストを発生させ、融資協議下の借金と関係がある。債務発行コストは定期貸出ツールが満期日までに償却され、貸借対照表上の長期債務の直接減少として報告されている。また、定期融資融資を返済する際には、本行は(A)893元および(B)5.95%の未返済元金総額のうち大きい者の期末費用を支払う必要があります。我々は融資契約期間内にこの期末費用を計上し,計上すべき残高は貸借対照表上の長期残高として直接増加する.2022年12月31日及び2021年12月31日までの12ヶ月間、債務発行コスト及び期末費用の増加に関する償却支出はいずれも利息支出、添付経営報告書及び全面赤字を差し引いた純額に計上され、総額はそれぞれ376,000元及び23,000元である。定期ローンの手配によると、私たちはいくつかのマイルストーンを完成した上で4回の借金をすることが許可されており、これらのマイルストーンは(ローン協定でより全面的に述べられているような):(I)私たちの業務グループが終了した時に1,500万ドルの借金をする;(Ii)いくつかの積極的な臨床試験結果を得た時、BT-001に関する最初の分類要求を提出し、2022年9月15日までに2回目の重要な試験を開始した時、1,000万ドルを借りるのに十分である。(Iii)1,000万ドル、私たちは血糖コントロールを改善するためにFDAからBT-001の販売を許可し、T 2 D患者に対する新しい適応の重要な試験を開始し、2023年3月15日までに株式融資から少なくとも4,000万ドルの現金純収益を得た;および(4)2023年6月15日またはそれ以前の1,500万ドルは、Hercules Capitalの承認を待たなければならない。2021年10月、私たちは融資協定に基づいて1000万ドルを借りた。2022年5月、私たちは融資協定に基づいて500万ドルを借りた。私たちは2022年9月15日までに融資協定要求の2回目の重要な試験を開始しなかったため、関連借款を得ることができなくなった。2022年12月31日と2021年12月31日現在、未償却債務発行コストを差し引いて計上すべき期末費用を含む未返済債務残高はそれぞれ1030万ドル、950万ドルである。2022年と2021年12月31日まで、金利はそれぞれ13.2%と8.95%で、2022年と2021年12月31日まで、相応の貸借対照表にはそれぞれ16.8万ドルと7.7万ドルの課税利息が計上されている。
84
融資協定は慣行陳述、保証、非金融契約、違約事件を含む。ローン協定にはまた主観的加速条項が含まれている。主観的加速条項を援用した場合、貸手は要求に応じて未返済の元金、利息、期末費用、事前返済罰金を支払う。これらの財務諸表が発表された日まで、貸手はまだ主観的加速条項を引用していない。当社財務諸表付記1に開示されているように、当社の流動資金や資本資源問題は、追加資金がない場合には、2023年12月31日までの1年間に財務契約に失敗する可能性があります。
2022年12月31日現在、1570万ドルの現金を持っており、累計赤字は1兆115億ドル。私たちの現金の主な用途は、運営費用に資金を提供することであり、その中には、主に私たちの主要候補製品BT-001に関連する研究および開発費用、臨床前計画、潜在的な商業発売のための準備活動(BT-001がマーケティングおよび一般および行政費用のために許可されている場合)が含まれている。運営費に資金を提供するための現金は、これらの費用を支払う時間の影響を受けており、これは私たちの未払い売掛金や売掛金の変化に反映されている。私たちは経営活動や投資活動から負のキャッシュフローを生み出し、過去の運営に大きな損失を出した。予測可能な未来には,我々の候補製品の開発と潜在的な商業化,進行中の内部研究·開発計画に巨額の費用が生じることが予想される。
私たちの現在の運営計画によると、2023年第1四半期の運営に資金を提供する十分な資本があると信じている。そのため、人々は私たちが継続的に経営している企業として継続する能力を大きく疑っている。私たちは、私たちの株式および/または債務証券の売却を含め、様々な融資源を通じてより多くの資金を求める予定で、他の非希釈融資選択を模索しています。もし私たちが追加資金を得ることができない場合、あるいは私たちが受け入れられる条件で十分な追加資金を集めることができなければ、私たちは私たちの製品開発計画や商業化計画を大幅に延期、減少、または中止しなければならないかもしれない。私たちはまた、私たちの業務を制限または終了し、私たちの従業員を削減し、私たちの開発計画を停止し、私たちの資産の全部または一部を清算したり、他の戦略的選択を求めたりすることを要求される可能性があります。
現金流量集計表
次の表に、以下の期間の現金および現金等価物の主な出所と用途を示す
|
|
現在までの年度 |
|
|
現在までの年度 |
|
||
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
経営活動用の現金 |
|
$ |
(28,930 |
) |
|
$ |
(30,818 |
) |
投資活動用の現金 |
|
|
(1,180 |
) |
|
|
(1,071 |
) |
融資活動で提供された現金 |
|
|
5,284 |
|
|
|
72,332 |
|
現金および現金等価物の純増加(減額) |
|
$ |
(24,826 |
) |
|
$ |
40,443 |
|
経営活動用の現金
2022年12月31日までの12ヶ月間、経営活動のための現金は2,890万ドルで、純損失3,980万ドルを含み、私たちの純運営資産と負債の630万ドルの減少と非現金費用460万ドルによって相殺された。営業資産と負債の純変化は主に前払い費用や他の資産が200万ドル減少したのに対し、売掛金や売掛金が420万ドル増加したためである。460万ドルの非現金料金には、主に株式ベースの給与料金および減価償却および償却費用が含まれています。
2021年12月31日までの12カ月間、経営活動に用いられた現金純額は3080万ドルで、4030万ドルの純損失と230万ドルの純運営資産と負債の増加を含むが、1180万ドルの非現金費用によって部分的に相殺された。営業資産と負債の純変化は前払い費用や他の資産が460万ドル増加したためだが、一部は売掛金と売掛金の230万ドルの増加で相殺された。1190万ドルの非現金料金には、株式ベースの給与料金、繰延所得税、減価償却および償却費用、金庫公正価値変動損失、購買力平価ローン減免収益が含まれています。
投資活動用の現金
85
2022年12月31日までの12カ月間、投資活動のための現金は120万ドルで、主に資本化された内部使用ソフトウェアコストに関係している。
2021年12月31日までの12カ月間,投資活動のための現金は110万ドルであり,主に資本化された内部使用ソフトウェアコストに関係している。
融資活動で提供された現金
2022年12月31日までの12カ月間、融資活動が提供した現金は530万ドルで、長期債務を発行し、私たちの2021年従業員株式購入計画(“2021年従業員株購入計画”)による株式発行と普通株式オプション行使による収益に関係している。
2021年12月31日までの12ヶ月間、融資活動が提供した現金は7230万ドルで、私たちの業務合併とパイプライン投資の純収益4410万ドル、金庫発行の純収益1870万ドル、長期債務を発行する純収益950万ドルを含む。
契約義務と約束
契約債務は私たちが正常な業務過程で締結したいくつかの契約の一部であり、私たちは現金金額を支払う義務がある。2022年12月31日まで、私たちは何の契約義務も他の約束もない。
表外手配
会社設立の日から、私たちは何の表外手配も行ったことがありません。
重要な会計政策、重大な判断と見積もりの使用
私たちの財務諸表はアメリカ公認の会計原則に基づいて作成されています。これらの財務諸表を作成するには、財務諸表の日付までの資産、負債および費用の報告金額、または資産および負債に関する開示に影響を与えるために、推定および仮定を作成する必要があります。我々の見積もりは,我々の歴史的経験,管理層による関連事実や状況の評価,および当時の状況で合理的と考えられる様々な他の要因に基づいており,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しており,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。
異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。以下で議論する会計政策は、これらの政策がより重要な分野に関連しているため、経営陣の判断と見積もりに関連しているため、我々の歴史や将来の業績を知るために重要であると考えられる。
我々の重要な会計政策は我々の財務諸表の付記に記載されているが、以下の重要な会計政策は、我々が報告した財務結果を理解し評価するために最も重要であると考えられる。
公正価値計量
私たちの金融商品は、現金等価物、売掛金、および売掛金を含み、その短期的な性質のため、その帳簿価値は公正価値に近い。私たちの融資協定には変動金利が含まれているので、公正な価値に近い。私たちのポートフォリオは公正な価値に基づいて入金された通貨市場基金で構成されている。私たちは帳簿価値が公正価値に等しいことを確定し、これらの投資を1級金融商品に分類した。
財産と設備、純額
財産及び設備、純額は、コンピュータ、設備及びソフトウェアを含み、コストから減価償却累計を引いて列記する。減価償却は直線法で計算され、耐用年数は3年と推定される。修理と保守支出は発生した期間内に支出される。
資本化された内部使用ソフトウェアコスト
内部使用のために我々のソフトウェアベースのプラットフォームを開発するために生じるコストには、主に従業員に関する直接コストと第三者請負業者コストが含まれ、ASC 350-40“内部使用ソフトウェア”による会計処理が行われる。その間に発生した費用
86
プロジェクトの前期計画と評価段階の費用は発生した費用に計上される。プロジェクトのアプリケーション開発段階で発生した費用は資本化され,推定耐用年数3年以内に償却される。
長期資産減価準備
1つの資産の帳簿金額が回収できない可能性がある場合には、長期資産の減価を検討します。これらの資産の回収可能性は、帳簿金額と、残りの利用可能年数内に資産が予想される将来の未割引キャッシュフローの合計との比較によって測定される。長期資産が回収可能なテストに合格できなかった場合、私たちはその資産の帳簿価値がその公正な価値を超える金額を測定する。二零二二年十二月三十一日までの十二ヶ月以内に、いかなる事件や業務環境の変化もなく、いかなる長期資産の帳簿額面は完全に回収できないことを示している。
株式ベースの報酬費用
我々は、ASC 718“報酬:株式報酬”に基づいて、従業員に付与された株式ベースの報酬スケジュールを計算し、付与日の公正価値を測定し、奨励期間中に発生した費用と交換するためにサービスの履行を要求されたことを確認する方法である。業績条件に達する可能性がある場合にのみ、株式による報酬支出が業績条件に制限された奨励として確認される。
我々はASU 2018-07“給与-株式報酬(ASC 718):非従業員株式支払い会計を改善する”規定の公正価値方法を用いて、非従業員に支給された株式報酬スケジュールを会計計算した。非従業員権益報酬の価値は授与日に公正価値に基づく計量方法を用いて計量した。
業績に基づく市場条件下でのオプションの付与日公正価値はモンテカルロ推定値シミュレーションを用いて決定された.サービス条件と市場条件に応じて付与された報酬については,直線法を用いてそれぞれのサービス期間の補償費用を確認した.業績条件を含む報酬については、予想される業績目標に基づいて適切な支出金額を決定し、将来の特定の目標の実現状況を予測することを含む判断を行う必要がある。業績条件を確定して実現可能な日に、累積費用の追跡を記録し、残りの費用は残りのサービス期間内に償却します。業績全体にわたって、推定されたパフォーマンスを再評価し、最終的に付与されると考えられるパフォーマンスベースの報酬の数を更新します。
2021年のESPPでの割引株式購入は、発行期間の初日にBlack-Scholesオプション定価モデルを用いて推定し、見返し準備金の公正価値と購入割引を計算する。私たちは2021年にESPPでの割引株購入を発売期間中に確認します。
没収が発生した時、私たちはそれを説明するつもりだ。必要なサービス期限終了前に没収された賠償金については,先に確認した補償費用を賠償金が没収されている間に戻す.
所得税
私たちは貸借対照法を用いて所得税を計算し、この方法では、繰延税項資産と負債は、資産と負債の財務報告と課税基準との差に基づいて決定され、純営業損失と税項相殺繰越を考慮した。繰延税金資産および負債は、予想通り差額逆転時に発効する税率計測が策定されている。
私たちは、繰延税金資産が将来の課税収入から回収される可能性を評価し、必要に応じて繰延税金資産を予想以上に現金化する可能性のある金額に減らすための推定支出を設定する。会計基準更新(“ASU”)2015-17号、所得税-貸借対照表繰延所得税分類を採用し、私たちの繰延所得税を貸借対照表で非流動所得税に分類した。
私たちは二段階法を使用して不確実な税金を確認して測定する。最初のステップは、取られたか、または取られることが予想される税務立場を評価することであり、方法は、既存の証拠の重みが、任意の関連控訴または訴訟手続きが解決された後、税務立場が監査において維持される可能性が高いことを示すかどうかを決定することである。二番目のステップは、税金優遇を最終和解時に実現可能な50%以上の最大金額と評価することだ。不確実な税金を評価するためには重大な判断が必要だ。私たちは定期的に私たちの不確実な税金状況を評価する。著者らの評価は一連の要素に基づいており、事実と状況の変化、税法の変化、監査過程中の税務機関との通信及び監査問題の有効な解決を含む。
87
普通株主は1株当たり純損失を占めるべきである
基本と償却1株当たり純損失は財務会計基準委員会(“FASB”)ASC第260号特別テーマの1株当たり利益に基づいて報告し、そして期内に発行された普通株の加重平均に基づいて計算した。1株当たりの償却計算には、純収益年度における普通株等価物の希薄化の影響が含まれる。我々はすでに提出期間中の純損失を報告しているため、すべての潜在的な希薄化証券は逆薄であるため、1株当たりの基本純損失は1株当たりの純損失を希釈することに等しい。
新興成長型企業と小さな報告会社の地位
我々は、“雇用法案”によって改正された“証券法”第2(A)(19)節で定義された“新興成長型会社”である。したがって、私たちが新興成長型企業であり続ける限り、(I)財務報告の内部統制に関する監査役認証要求免除、(Ii)給与発言権、頻度発言権および黄金パラシュート投票要求、および(Iii)私たちの定期報告および依頼書における役員報酬に関する開示義務の減少を含む、他の非新興成長型企業に適用される上場企業のいくつかの免除を利用する資格があり、利用しようとしている。
(I)財政年度の最終日(A)私たちの初公募株式(IPO)終了5周年後、(B)私たちの年間総収入が少なくとも12.35億ドル、または(C)“取引法”によると、私たちは“大型加速申告会社”とみなされ、最近完成した第2四半期の最終営業日までに、非関連会社が保有する私たちの普通株の時価が7.00億ドルを超えると、このような状況が発生するまで、新興成長型会社である。あるいは(Ii)前3年の間に10億ドルを超える転換不可能債務証券を発行した日。
また、雇用法案は、新興成長型会社は、延長された過渡期を利用して新たなまたは改正された会計基準を遵守することができると規定している。これは、これらの基準が民間企業に適用されるまで、新興成長型企業が特定の会計基準の採用を延期することを可能にする。私たちはこの延長された過渡期間を利用することを選択しているので、非上場企業では、他の上場企業が要求する日付ではなく、新しい会計基準や改訂された会計基準の関連日を採用する必要があるかもしれない。
また,S−K条例第10(F)(1)項で定義された“小さな報告会社”である。規模の小さい報告会社は、2年間の監査済み財務諸表のみを提供することを含む、いくつかの減少した開示義務を利用する可能性がある。私たちは、本会計年度の最終日まで、規模の小さい報告会社になります:(I)前年6月30日現在、非関連会社が保有する私たちの普通株の時価は2.5億ドルを超えていますか、または(Ii)この完了した会計年度中に、私たちの年収は1億ドルを超え、前年6月30日現在、非関連会社が保有している私たちの普通株の時価は7億ドルを超えています。
最近採用された会計公告
2022年12月31日現在の年次財務諸表付記2を参照。
第七A項。市場リスクに関する定量的で定性的な開示。
金利リスク
私たちの現金および現金等価物は、2022年12月31日と2021年12月31日まで、いつでも利用可能な小切手資金および通貨市場口座を含む。私たちは私たちの現金や現金等価物に重大な違約や流動性不足のリスクがあるとは思わない。私たちの現金と現金等価物には過度なリスクが含まれていないと信じていますが、将来どんな投資も市場価値の悪影響を受けないという保証は絶対にありません。しかも、私たちはある金融機関で連邦保険限度額を超える大量の現金と現金同等物を持っている。
2022年12月31日まで、私たちの債務は私たちを金利変動のリスクに直面させた。最優遇金利の引き上げに伴い、私たちの金利も増加します。最優遇金利が1%増加すると仮定すると、利息支出が15万ドル増加する。
88
インフレの影響
インフレが私たちの業務に与える影響を正確に特定することはできませんが、経営陣は経営業績への影響は大きくないと信じています。インフレが本報告で述べた期間の経営業績に実質的な影響を与えるとは考えられないが,賃金に関するコストや利息支出は除外した。
為替レート変動の影響
為替レート変動が本報告で述べたどの時期の経営業績に大きな影響を与えるとは思いません。
89
項目8.財務諸表と補足データ
財務諸表索引
独立公認会計士事務所報告 |
F-2 |
2022年12月31日現在と2021年12月31日現在の貸借対照表 |
F-3 |
2022年12月31日と2021年12月31日までの営業·全面赤字報告書 |
F-4 |
2022年12月31日現在と2021年12月31日までの年度株主権益(赤字)レポート |
F-5 |
2022年12月31日と2021年12月31日までの年間現金フロー表 |
F-6 |
財務諸表付記 |
F-7 |
F-1
独立公認会計士事務所報告
株主と取締役会
Better Treeutics社
カリフォルニア州サンフランシスコ
財務諸表のいくつかの見方
Better Treateutics社(当社)の2022年12月31日現在と2021年12月31日までの貸借対照表、同年度までの関連運営と全面赤字報告書、株主権益(損失)と現金流量、および財務諸表(総称して財務諸表)に関する付記を監査しました。財務諸表は,すべての重要な面で,会社の2022年12月31日と2021年12月31日までの財務状況と,それまでの年度までの経営成果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。
経営を続ける企業
添付財務諸表の作成は、同社が引き続き経営を継続する企業であると仮定している。財務諸表付記1で述べたように、当社は経営により経常赤字を被っており、大量の累積損失があります。これは同社が経営を続けている会社として経営を続ける能力に大きな疑いを抱かせた。付記1は、これらの事項における経営陣の計画も説明しています。財務諸表には、このような不確実性の結果に起因する可能性のある調整は含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても詐欺によるものであっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/
2021年以来、私たちは会社の監査役を務めてきた。
2023年3月30日
F-2
Better Treeutics社
残高電子フォーム
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
前払い費用 |
|
|
|
|
|
|
||
その他流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
資本化ソフトウェア開発コスト、純額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
その他長期資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主権益(赤字) |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
賃金総額を計算すべきである |
|
|
|
|
|
|
||
その他の課税費用 |
|
|
|
|
|
|
||
長期債務の当期部分 |
|
|
|
|
|
— |
|
|
流動負債総額 |
|
|
|
|
|
|
||
長期債務、当期債務と債務発行コストを差し引く |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
*(注14) |
|
|
|
|
|
|
||
株主権益 |
|
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益合計 |
|
|
( |
) |
|
|
|
|
総負債と株主権益(赤字) |
|
$ |
|
|
$ |
|
||
付記はこれらの財務諸表の不可分の一部だ。
F-3
Better Treeutics社
経営報告書と全面赤字
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
運営費用: |
|
|
|
|
|
|
||
研究開発 |
|
|
|
|
|
|
||
販売とマーケティング |
|
|
|
|
|
|
||
一般と行政 |
|
|
|
|
|
|
||
総運営費 |
|
|
|
|
|
|
||
運営損失 |
|
|
( |
) |
|
|
( |
) |
利子支出,純額 |
|
|
( |
) |
|
|
( |
) |
融資減免から利益を得る |
|
|
— |
|
|
|
|
|
金庫の公正価値変動 |
|
|
— |
|
|
|
( |
) |
所得税引当金控除前の損失 |
|
|
( |
) |
|
|
( |
) |
所得税準備金 |
|
|
|
|
|
( |
) |
|
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり基本と希釈して純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
加重-流通株、基本株と希釈株の平均 |
|
|
|
|
|
|
||
F-4
Better Treeutics社
(単位:千、共有データを除く)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
合計する |
|
|||||
|
|
|
|
|
|
|
|
その他の内容 |
|
|
|
|
|
積算 |
|
|||||
|
|
普通株 |
|
|
支払い済み |
|
|
積算 |
|
|
株主.株主 |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字.赤字 |
|
|
権益(赤字) |
|
|||||
2020年12月31日までの調整後残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
制限株を没収する |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
業務合併に関する普通株式発行、発行コストを差し引く#ドル |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
||||
持分激励計画に基づいて普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
シェアに基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
2021年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
持分激励計画に基づいて普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
シェアに基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|||
付記はこれらの財務諸表の不可分の一部だ。
F-5
Better Treeutics社
現金フロー表
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
経営活動のキャッシュフロー |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
||
減価償却および償却 |
|
|
|
|
|
|
||
金庫の公正価値変動 |
|
|
— |
|
|
|
|
|
財産と設備の核販売損失 |
|
|
|
|
|
— |
|
|
株式ベースの給与費用 |
|
|
|
|
|
|
||
所得税を繰延する |
|
|
— |
|
|
|
( |
) |
融資減免から利益を得る |
|
|
— |
|
|
|
( |
) |
経営性資産と負債変動状況: |
|
|
|
|
|
|
||
前払い費用と他の資産 |
|
|
|
|
|
( |
) |
|
売掛金 |
|
|
|
|
|
|
||
費用とその他の負債を計算すべきである |
|
|
|
|
|
|
||
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー |
|
|
|
|
|
|
||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
資本化された内部使用ソフトウェアコスト |
|
|
( |
) |
|
|
( |
) |
投資活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
融資活動によるキャッシュフロー |
|
|
|
|
|
|
||
外国為替手形を発行して得た金 |
|
|
— |
|
|
|
|
|
企業合併とパイプ投資の収益 |
|
|
— |
|
|
|
|
|
企業合併·パイプライン投資に関する普通株発行に直接起因するコストの支払い |
|
|
— |
|
|
|
( |
) |
長期債券を発行して得られる収益 |
|
|
|
|
|
|
||
起債コスト |
|
|
— |
|
|
|
( |
) |
従業員の株購入計画に基づいて株を発行して得た金 |
|
|
|
|
|
— |
|
|
株式オプションを行使して得られる収益 |
|
|
|
|
|
|
||
融資活動が提供する現金純額 |
|
|
|
|
|
|
||
現金と現金等価物の純変化 |
|
|
( |
) |
|
|
|
|
期初現金及び現金等価物 |
|
|
|
|
|
|
||
期末現金と現金等価物 |
|
$ |
|
|
$ |
|
||
キャッシュフロー情報の補足開示: |
|
|
|
|
|
|
||
利子を支払う現金 |
|
$ |
|
|
$ |
|
||
付記はこれらの財務諸表の不可分の一部だ。
F-6
Better Treeutics社
財務諸表付記
Better Treateutics,Inc.(“会社”または“Better”)はデラウェア州の処方デジタル治療会社であり、心臓代謝性疾患(“CMDX”)の根本的な原因を解決するために、臨床検証されたソフトウェアに基づく新しい認知行動療法(“CBT”)を開発した。同社の使命は行動の力を変えることで人間の健康を促進することです。同社は,米国食品医薬品局(FDA)が規制しているソフトウェアに基づく処方デジタル療法(PDTS)の独自のプラットフォームを開発しており,心臓代謝疾患の根本的な原因を解決することでこれらの疾患を治療している。同社の最初の開発重点は,2型糖尿病(T 2 D),高血圧,高脂血症,非アルコール性脂肪性肝疾患(NAFLD),非アルコール性脂肪性肝炎(NASH),慢性腎臓疾患(CKD)である。同社は2015年に設立され、数十億ドルの業務記録を持つ幹部が指導し、治療薬の開発と商業化に豊富な業界経験を持っている。
同社の主要な候補製品BT-001は2022年7月にT 2 D患者を治療する一流の開放ラベル、ランダム、対照、平行群の臨床試験を完成し、そしてその主要と副次的な終点及び多くの探索性終点を満たすことに成功した。その会社は1部提出した初めからやり直す2022年9月にFDAに分類要求を行い、成人T 2 D患者の治療のためのBT-001のマーケティング許可を求め、2022年10月に同社に通知した初めからやり直す分類要求は実質的な検討のために受け入れられた。同社の一部のデータは2022年10月に同業者評議定期刊行物“糖尿病看護”に発表された。典型的な初めからやり直す企業が予想する審査手順によると、会社は2023年2月にFDAからより多くの情報の提供を要求する要求を受け、会社が提出した資料を審査した後、FDAはより多くの情報を提供する必要があると判断し、審査を一時停止することを通知した。この手紙は,同社が提出した文書には多くの欠陥があり,重大な欠陥と副次的な欠陥に分類されるFDAの観点を概説している。同社は、指摘されたいくつかの主要な欠陥を明らかにし、これらの欠陥を解決するための選択について指導を求めるためにFDAとの会議を行うことを要求している。その会議も2月に行われた。会期中、FDAは、FDAのコメントに応答するためにその応答をまとめている有益な背景、明確化、および指導を提供している。同社はFDAの問題を解決できると信じており、以前に提供された指導意見は変わらない、すなわちFDAが2023年に決定すると予想されている。企業がこれらの欠点を解決できない場合、それは、許可を求めている使用適応を修正する必要がある可能性があり、および/または別の臨床試験を行う必要があり、BT−001の許可および商業開始は、著しく延期または許可が拒否される可能性がある。
同社はそのLivVita研究においても積極的な主な結果を得ており,初の臨床研究であり,そのデジタル配信されたCBTをNAFLDやNASHの潜在療法としての可能性を評価し,肝臓脂肪の低減と肝疾患バイオマーカーの改善を行った。現在FDAはこれらの疾患の治療を承認していませんこれらの疾患はアメリカ人の4分の1に影響を与え約$をもたらしています
同社はBT−001によるT 2 D治療に関する長期的有効性と医療利用変化を評価するために実世界のエビデンス研究を開始した。このランダム,対照,多点の研究では,患者を募集して少なくとも12カ月の治療を行う予定である。糖化ヘモグロビンと医療資源利用の変化を評価し,通常の看護と比較した。十分な数の患者が180日間の漸増治療を完了すると、中期研究結果は2023年第4四半期に報告される予定である。この研究は,支払者や提供者に実世界環境における使用や結果に関する長期データを提供することを目的としている.
私たちは遠く離れた“完全に分散した”会社で、オフィスがない。
F-7
流動性と資本資源
同社は発展段階にあり、その活動には主に資金調達と研究開発が含まれている。設立以来、同社は運営中に大きな損失を出した。2022年12月31日現在、会社は現金を持っている$
同社は過去の経営活動や投資活動で負のキャッシュフローを生み出し、過去の経営で大きな損失を出した。同社は,予見可能な将来において,その候補製品の開発と潜在商業化,進行中の内部研究·開発計画,一般·行政活動に巨額の費用が生じると予想している。現在、同社はその開発、潜在商業化、内部研究開発計画及び一般と行政活動の性質、時間或いは総金額を合理的に見積もることができない。しかしながら、その計画における製品開発を完了し、その候補製品のための規制許可または許可を得るプロセスを完了し、その候補製品を商業化するために必要と考えられる販売、マーケティング、および流通インフラを確立するためには、承認されれば、同社は将来的に多くの追加資金を必要とするであろう。現在の運営計画によると、同社は2023年第1四半期の運営に資金を提供するのに十分な資本を持っていると信じている。これらの要因は、同社の持続的な経営企業としての持続的な経営能力を大きく疑わせている。同社は、当社の株式および/または債務証券の売却を含め、様々な融資源を通じてより多くの資金を求める予定であり、他の非希釈案を模索している。企業が追加資金を得ることができない場合、または十分な額の追加資本を調達できない場合、またはその受け入れられた条項に従って追加資本を調達することができない場合、会社はその製品開発計画または商業化計画を大幅に延期、減少、または終了しなければならない可能性がある。同社はまた、その業務を制限または終了し、その従業員を削減し、その開発計画を停止し、その全または一部の資産を清算し、あるいは他の戦略的選択を求めることを要求される可能性がある。
重大なリスクと不確実性
同社はその業界でよく見られるリスク、およびスタートアップ会社によく見られるリスクに直面しており、その製品の開発やマーケティングに成功したり、技術が時代遅れになったり、競争したり、キーパーソンへの依存、そのノウハウの成功的な保護、政府法規の遵守、および必要に応じて追加融資を得ることができない可能性を含むが、これらに限定されない。
現在、新冠肺炎の疫病と経済と政治事態の発展に関連する不確定性は依然として存在しており、ウクライナの衝突、金利上昇と高インフレ、及び関連する対応措置の影響を含む。会社の業務、経営結果、財務状況へのいかなる影響も未来の事態の発展に大きく依存し、これらの事態の発展は高度な不確定性を持っており、例えば疫病の持続時間、業務中断及び新冠肺炎及び経済と政治事態の発展が金融市場と世界経済に与える最終的な影響を自信を持って予測することができない。
陳述の基礎
財務諸表及び付記は米国公認会計原則(“公認会計原則”)に基づいて作成されている。1株当たりと1株当たりの情報を除いて、金額は千で計算される。
総合損失
2022年12月31日まで及び2021年12月31日まで年度総合損失と純損失に差はなかった。
F-8
予算の使用
公認会計原則に基づいて財務諸表を作成することは、管理層が何らかの推定、判断および仮定を行うことを要求し、これらの推定、判断および仮定は、財務諸表日に報告された資産および負債の報告金額および関連開示、ならびに列報中に報告された収入および費用金額に影響を与える。添付の財務諸表で使用される見積もり数および仮定は、経営陣による事実および状況に関する評価に基づいている。このような推定、判断と仮定は、資本化内部使用ソフトウェアの推定コスト、株式に基づく奨励の公正価値、繰延税金資産の推定値準備と金庫の公正価値を含む。実際の結果はこれらの推定とは異なる可能性がある。これらの見積もり、判断、または仮定と実際の結果との間に大きな差がある場合、会社の財務諸表が影響を受ける。
新興成長型会社の地位
当社は2012年のJumpStart Our Business Startups Act(“JOBS法案”)で定義されている新興成長型会社である。雇用法案は、新興成長型会社は、延長された過渡期を利用して新たなまたは改正された会計基準を遵守することができると規定している。したがって、新興成長型企業は、これらの基準が民間会社に適用されるまで、いくつかの会計基準の採用を延期することができる。当社はこの延長された過渡期間を利用することを選択しているため、他の上場企業では新たな会計基準や改訂された会計基準の関連日を採用する必要があり、当社は民間会社の会計基準が当該等の基準を採用することを要求しない限り、当該等の基準を採用しない。
リスクが集中する
会社を信用リスクに直面させる可能性のある金融商品には、主に現金と現金等価物が含まれる。当社は主に信用品質の高い国内金融機関と現金を持っており、これらの機関は連邦預金保険会社の限度額を超える可能性がある。同社はその現金等価物を高格付けの通貨市場基金に投資した。当社はこのような勘定で何の損失も出ていません。当社は現金や現金等価物に重大な信用リスクは存在しないと考え,定期的に当該機関の信用状況を評価している。
公正価値計量
当社の金融商品の帳簿価値には、現金等価物、売掛金、売掛金、支払手形が含まれており、その短期的な性質により公正価値に近い。同社のポートフォリオは貨幣市場基金で構成されており、これらの基金は公正価値に基づいて入金されている。当社は帳簿価値を公正価値に等しいと決定し、これらの投資を一級金融商品に分類した。
当社は報告期間ごとに公正価値に応じて金融資産と負債を計量し、公正価値階層構造を採用し、観察可能な投入を使用し、観察できない投入を最大限に減少させることを要求している。当社は、公正価値を、計量日に資産を売却するか、または市場参加者間の秩序ある取引で負債を移転して支払う価格と定義している。公正価値は、公正価値を計量するための投入を3つのクラスに分類し、公正価値計量に重要な意味を有する利用可能な投入の最低クラスに基づいて分類される階層構造を適用することによって推定される
F-9
財産と設備、純額
コンピュータ設備やソフトウェアを含む財産や設備の純額はコストから減価償却累計を引いて列記します。減価償却は直線法を用いて計算した推定耐用年数である
資本化された内部使用ソフトウェアコスト
ソフトウェアの開発と我々の内部で使用するプラットフォームによって生じるコストは、主に従業員に関する直接コストと第三者請負業者コストを含み、ASC 350-40に従って会計処理を行う内部使用ソフトそれは.プロジェクトの初期計画と評価段階で発生した費用は発生時に費用を計上する。プロジェクトのアプリケーション開発段階で発生したコストは資本化され,推定された耐用年数内に償却される
長期資産減価準備
ある資産の帳簿価値が回収できない可能性があることを示す場合、当社は長期資産の減値を審査します。これらの資産の回収可能性は、帳簿金額と、残りの利用可能年数内に資産が予想される将来の未割引キャッシュフローの合計との比較によって測定される。1つの長期資産が回収可能試験に合格できなかった場合、当社はその資産の帳簿価値がその公正価値を超えた金額を計量する。2022年12月31日と2021年12月31日までの12ヶ月間、業務環境は何の事件も発生したり、変化したりしなかったこれはどんな長期資産の帳簿価値も完全に回収できないということを見せてくれる。
広告費
当社は発生した広告費用を確認し、これらの費用は営業報告書における販売とマーケティング費用に計上されています。2022年12月31日と2021年12月31日までの12ヶ月間の広告費用総額 $
株式ベースの報酬費用
米国会計基準第718条“報酬:株式報酬”によると、会社は従業員に付与された株式ベースの報酬スケジュールを会計計算し、その方法は、授与日の奨励の公正価値を測定し、従業員に報酬と引き換えにサービスの履行を要求する間に発生する費用を確認する。業績条件に達する可能性がある場合にのみ、株式による報酬支出が業績条件に制限された奨励として確認される。
当社は、ASU 2018-07“給与-株式報酬(ASC 718):非従業員株式支払い会計を改善する”に規定されている公正価値方法を用いて、非従業員に支給される株式報酬スケジュールを会計処理する。非従業員権益報酬の価値は授与日に公正価値に基づく計量方法を用いて計量した。
付与された各オプション奨励の公正価値は、授与日に推定される。サービス帰属条件を有するオプションの付与日公正価値は、Black−Scholesオプション定価モデルを使用して決定される。ブラック·スコアーズオプション定価モデルは、対象普通株の公正価値、オプションの期待期限、会社普通株価格の予想変動率、無リスク金利、および会社普通株の配当率を含む主観的仮定の入力を要求する。業績に基づく市場条件下でのオプションの付与日公正価値はモンテカルロ推定値シミュレーションを用いて決定された.
F-10
業績に基づく市場条件下でのオプションの付与日公正価値はモンテカルロ推定値シミュレーションを用いて決定された.サービス条件と市場条件に応じて付与された奨励について,会社は直線法を用いてそれぞれのサービス期間の補償費用を確認した。業績条件を含む奨励については、企業は期待された業績目標に基づいて適切な支出金額を決定し、将来の指定された目標の実現状況を予測することを含む判断を行う必要がある。業績条件が達成可能であることが確定した日には、会社は累積費用を記録して追いかけ、余剰費用は余剰サービス期間内に償却する。全業績期間中、会社は推定された業績を再評価し、最終的に付与されると考えられる業績に基づく報酬の数を更新する。
Better Treateutics,Inc.2021従業員株式購入計画(“ESPP”)での割引株式購入は,発行期間の初日にBlack-Scholesオプション定価モデルを用いて推定し,見返し条項に購入割引を加えた公正価値を計算した.ESPPでの割引株購入は発売期間中に確認します。
没収が発生した場合、会社はそれを計算します。必要なサービス期限終了前に没収された賠償金については,先に確認した補償費用を賠償金が没収されている間に戻す.
所得税
当社は貸借対照法を用いて所得税を計算し、繰延税項資産及び負債は資産及び負債の財務報告及び課税基準間の差異に基づいて決定され、営業純損失及び税項相殺繰越を考慮している。繰延税金資産および負債は、予想通り差額逆転時に発効する税率計測が策定されている。
当社は、将来の課税収入から繰延税金資産を回収する可能性を評価し、必要に応じて繰延税金資産を予想以上に現金化する可能性のある金額に減らすための推定支出を設定する。当社は会計基準更新(“ASU”)第2015−17号を用いて、所得税−貸借対照表繰延税項目を分類し、その繰延所得税を貸借対照表において非流動所得税に分類した。
同社は二歩法を用いて不確定な税務状況を確認·計量した。最初のステップは、取られたか、または取られることが予想される税務立場を評価することであり、方法は、既存の証拠の重みが、任意の関連控訴または訴訟手続きが解決された後、税務立場が監査において維持される可能性が高いことを示すかどうかを決定することである。二番目のステップは、税金優遇を最終和解時に実現可能な50%以上の最大金額と評価することだ。不確実な税金を評価するためには重大な判断が必要だ。当社は定期的にその不確定な税務状況を評価します。同社の評価は一連の要素に基づいており、事実と状況の変化、税法の変化、監査過程中の税務機関との通信及び監査問題の有効な解決を含む。
F-11
普通株主は1株当たり純損失を占めるべきである
基本と償却1株当たり純損失は財務会計基準委員会(“FASB”)ASC第260号特別テーマの1株当たり利益に基づいて報告し、そして期内に発行された普通株の加重平均に基づいて計算した。1株当たりの償却計算には、純収益年度における普通株等価物の希薄化の影響が含まれる。同社はすべての届出期間の純損失を報告しているため、すべての潜在的な希薄化証券は逆薄であるため、1株当たりの基本純損失は1株当たりの純損失を希釈することに等しい。
収入確認
2020年1月1日、会社は会計基準更新(ASU)第2014-09号、顧客との契約収入(主題606)(“ASC 606”)の要求を採択した。ASC 606は、約束された貨物またはサービスを顧客に譲渡する際に収入を確認する原則を確立し、その額は、これらの貨物またはサービスを交換するために受信された予想される対価格を反映する。ASC 606を採用することはまた、顧客との契約を延期することが規定されている他の資産および繰延コストであるASCサブトピック340~40を採用する必要がある。全体的に、本明細書で使用されるASC 606への参照は、ASC 606およびサブトピック340~40の両方を意味する。ASC 606のコア原則は、顧客に約束された商品またはサービスを譲渡することを記述するために収入を確認することであり、この金額は、エンティティがこれらの商品またはサービスを交換する権利があることが予想される対価格を反映する。この原則は,以下の5ステップ法を適用することで実現される
細分化市場報告
その会社の運営方法は
最近の会計公告
FASBは2016年2月、ASU第2016−02号リース(テーマ842)を発表し、テナントのリース会計を修正し、レンタルを運営するリース資産と負債を記録し、リース手配に関するキー情報を開示することにより、透明性と比較性を向上させた。2018年7月、FASBは、ASU番号2018-10、テーマ842、レンタルの編纂改善、およびASU番号2018-11、レンタル(テーマ842)を発表し、先に発表された指導のいくつかの態様に影響を与えた。2018年12月、FASBは、テナントへの販売税やその他の税収の徴収に関する指導意見を提供するASU第2018-20号、レンタル者レンタルの狭い範囲改善(テーマ842)を発表した。2019年12月、FASBはASU第2019-01号を発表し、テーマ842の編纂改善、レンタルを発表し、これは先に発表された指導のいくつかの側面に影響を与えた。改訂には、エンティティが採用された日に新しい基準を適用することを可能にし、利益剰余金期の初期残高の累積調整を確認することと、レンタル者への新たな実際の便宜策とを確認することができる追加の移行方法が含まれる。その会社の
F-12
2019年12月、FASBはASU第2019-12号を発表した所得税の会計計算を簡略化する(主題740)。このASUは、所得税の会計処理を簡略化し、他の事項に加えて、ASC 740におけるフランチャイズ税に関する一般的な方法に関するいくつかの既存の例外を除去し、中期会計年度におけるこれまでの赤字制限や税法変化の複雑さを低減し、営業権計税基盤の上昇を招く業務合併以外の取引の会計処理を明らかにした。移行要件は主に展望的であり、発効日は2021年1月1日である。その会社の
2020年8月にFASBはASU 2020-06を発表しました債務-転換および他のオプションを有する債務(ASC 470-20)および派生ツールおよびヘッジ- エンティティ自己資本における契約(ASC 815-40)それは.ASU 2020-06は、以下のような特徴を有するいくつかの金融商品の会計処理を簡略化します 変換可能なツールと実体自己資本との契約を含む負債および資本。ASU 2020−06は、GAAPにおける不要な複雑性を低減することを目的としたFASB簡略化計画の一部である。本ASUの改正案は,2023年12月15日以降の会計年度およびこれらの年度内の移行期間内に有効である。当社は現在、ASU 2020−06年度の財務諸表への影響を評価している。
当社はすべての現行およびその財務諸表に影響を与える可能性のある新しい会計声明を実施しており、発表された任意の他の新しい会計声明がその財務状況や経営業績に重大な影響を与える可能性があるとは考えていない。
当社は2021年4月6日に、特殊目的買収会社Mountain Crest Acquisition Corp.II(“MCAD”)と合併協定(“合併合意”)を締結した。合併協定については,MCADが締結した引受契約(“引受契約”)日は
2021年10月28日、MCADは、合併協定の条項に基づいて、MCADが元Better Treeutics,Inc.(“Legacy BTX”)と合併し、Legacy BTXはMCADの完全子会社として存続し、新しい名称はBetter Treateutics,Inc.(“業務合併”)である。その会社は$を集めた
当社は業務合併を逆資本再編として入金し,Legacy BTXがMCADの純資産として株式を発行し,資本再編に伴い,MCADは会計上買収会社とみなされている。会計目的については,MCADが“買収された”会社と決定された主な根拠は,業務合併後,Legacy BTXは合併後の会社の多数の投票権を持ち,Legacy BTXは合併後の実体のすべての継続運営を含み,合併後の会社の大多数の管理機関およびLegacy BTXsの高級管理者には合併後の会社のすべての高級管理者が含まれることである。MCADの純資産は歴史コストで記載されており、営業権やその他の無形資産は記録されていない。本稿に含まれる業務合併前に報告した運営結果はLegacy BTXの結果である。業務合併前に、Legacy BTXのすでに発行された転換可能な優先株、償還可能な転換可能な普通株及び普通株に関連する株式及び相応の資本金額及び1株当たりの損失はすでにさかのぼって重列し、反映する
業務合併では,会社による引受費と他の取引と考えられる直接と増量コストの合計は$である
F-13
パイプ融資(私募)
業務合併協定を遂行するとともに、当社はMCADと引受契約を締結した。引受プロトコルにより,PIPE投資家1人あたりの引受および購入,およびMCADが当該などの投資家に発行·販売することで合意する
磁石の針Y了解$
財産と設備は:
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
コンピュータ、デバイス、ソフトウェア |
|
$ |
|
|
$ |
|
||
家具と固定装置 |
|
|
|
|
|
|
||
財産と設備 |
|
|
|
|
|
|
||
減算:減価償却累計 |
|
|
( |
) |
|
|
( |
) |
財産と設備、純額 |
|
$ |
|
|
$ |
|
||
2022年12月31日までと2021年12月31日までの12ヶ月間の減価償却費用はい$です
資本化された内部使用ソフトウェアと累積償却状況は以下のとおりである
|
十二月三十一日 |
|
|||||
|
2022 |
|
|
2021 |
|
||
総帳簿金額 |
$ |
|
|
$ |
|
||
累計償却する |
|
( |
) |
|
|
( |
) |
大文字の内部使用ソフトウェア、ネットワーク |
$ |
|
|
$ |
|
||
|
|
|
|
|
|
||
会社は資本化された内部使用ソフトウェアに関する償却費用#ドルを記録している
2022年12月31日と2021年12月31日まで会社が開発した賃金税は売掛金を免除して$とします
|
十二月三十一日 |
|
|||||
|
2022 |
|
|
2021 |
|
||
なぜならサービス提供者は |
$ |
|
|
$ |
|
||
専門家のおかげです |
|
|
|
|
|
||
融資保険 |
|
|
|
|
|
||
応算利息 |
|
|
|
|
|
||
他にも |
|
|
|
|
- |
|
|
その他負債を計算すべき |
$ |
|
|
$ |
|
||
|
|
|
|
|
|
||
F-14
2020年5月9日(“始発日”)に、当社はドルを受け取りました
2021年8月18日、当社はHercules Capital,Inc.(“Hercules Capital”)と保証定期融資協定(“融資協定”)を締結し、最高$を提供した
融資協定は慣例的な陳述、保証、金融と非金融契約、および違約事件を含む。ローン協定にはまた主観的加速条項が含まれている。主観的加速条項を援用した場合、貸手は要求に応じて未返済の元金、利息、期末費用、事前返済罰金を支払う。これらの財務諸表が発表された日まで、貸手はまだ主観的加速条項を引用していない。付記1に開示されているように、会社の流動資金及び資本資源の問題は、追加資金なしで、2023年12月31日までの1年間の財務契約の失敗を招く可能性がある。
F-15
2022年12月31日までの長期債務の将来の支払状況は以下の通り
12月31日までの会計年度は |
|
金額 |
|
|
|
2023 |
|
|
|
|
|
2024 |
|
|
|
|
|
2025 |
|
|
|
|
|
債務総額 |
|
|
|
|
|
流動分の長期債務を減らす |
|
|
( |
) |
|
未償却債務発行コストを削減する |
|
|
( |
) |
|
期末費用を計算する |
|
|
|
|
|
長期債務総額,当期債務と債務発行コストを差し引く |
|
$ |
|
|
|
|
|
|
|
|
|
同社は2020年から将来の株式の簡単な合意(“SAFE”)を発表し、その運営に資金を提供している。金庫には、制御権変更が発生した場合に現金を償還することを許可する条項が含まれていますが、制御権変更は当社がコントロールできるものではありません。したがって、米国会計基準第480条によれば、金庫は、他の長期負債のうちの市価負債に分類される。
当社の外管局協定の公正価値は市場では観察できない重大な投入に基づいており、このツールは公正価値レベルの第三レベル計量に分類される。2021年12月31日までの年間で,金庫は公正価値と表記され,公正価値が変動し,損失#ドルと報告されている
普通株
2021年10月28日、業務合併について、レガシーBTXのすべての既存発行普通株は、交換比率で当社の新普通株と交換された
以下の表に基本損失と希薄損失の算出方法(1株当たりと1株当たりの金額を除く千単位)を示す
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
加重平均普通株式発行済株式数 |
|
|
|
|
|
|
||
減算:帰属された普通株式の加重平均株式 |
|
|
( |
) |
|
|
( |
) |
加重平均普通株流通株は、基本と希釈後の1株当たり株主が純損失を占めるべきであることを計算するために用いられる |
|
|
|
|
|
|
||
1株当たり基本と希釈して純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
2022年12月31日と2021年12月31日まで
F-16
2020年8月、会社はBetter Treateutics、Inc.2020株式オプションと奨励計画(“2020計画”)を採択し、上級管理者、取締役、コンサルタント、従業員に株式ベースのインセンティブを提供した。持分インセンティブには、奨励性株式オプション、非制限株式オプション、制限株式奨励、非制限株式奨励、および制限株式単位が含まれる。合計する
2021年10月、同社はBetter Treateutics OpCoを採用した。会社は、2021年株式オプション·インセンティブ計画(“2021年計画”)に基づいて、役員、取締役、コンサルタント、従業員に株式に基づくインセンティブを提供する。持分インセンティブは、奨励性株式オプション、非制限株式オプション、株式付加価値権、制限株式奨励、制限株式単位、非限定株奨励、現金奨励および配当等価権を含む。合計する
2021年10月、会社は従業員持株計画を採択し、条件に合った従業員に会社の普通株を購入する機会を提供した。合計する
2022年11月、会社はBetter Treateutics,Inc.2022年インセンティブ計画(“インセンティブ計画”)を通過し、現在会社に雇われていない将来の高級管理者と従業員に株式奨励を付与した。持分インセンティブは、非限定的株式オプション、株式付加価値権、限定株奨励、限定株式単位、非限定株奨励、および配当等価権を含む。合計する
株式オプション
株式オプションの発行期間は超えてはならない
|
|
未完成オプション |
|
|||||||||||||
|
|
|
|
|
|
|
|
重みをつける |
|
|
|
|
||||
|
|
株 |
|
|
重み付けの- |
|
|
平均値 |
|
|
|
|
||||
|
|
支配される |
|
|
平均値 |
|
|
残り |
|
|
骨材 |
|
||||
|
|
オプション |
|
|
トレーニングをする |
|
|
契約書 |
|
|
固有の |
|
||||
|
|
卓越した |
|
|
値段 |
|
|
寿命(年) |
|
|
価値がある |
|
||||
2021年12月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
授与する |
|
|
|
|
|
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
没収される |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
総内在価値とは、普通株関連株式の使用価格と公正価値との差額である。
2022年12月31日までの12ヶ月以内に従業員の加重平均授与日の購入持分公正価値を付与する2021年は$です
F-17
従業員に付与された各オプションの公正価値は、付与日にBlack−Scholesオプション定価モデルを用いて推定される。ブラック·スコアーズオプション定価モデルは、対象普通株の公正価値、オプションの期待期限、私たちの普通株価格の予想変動率、無リスク金利、会社普通株の配当率を含む主観的仮定を入力することを要求する。オプション報酬公正価値を決定するための仮定は、私たちの最適な推定値を表す。これらの推定は固有の不確実性と会社判断の適用に関するものだ。関連株式報酬費用は奨励に必要なサービス期間内に直線的に確認するのが一般的である
従業員に対する私たちの報酬を評価する際に、ブラック·スコアーズオプション定価モデルの仮定は以下の通りである
|
|
現在までの年度 |
|
|
現在までの年度 |
|
||
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
所期期間(年) |
|
|
|
|
|
|
||
予想変動率 |
|
|
% |
|
|
% |
||
無リスク金利 |
|
|
% |
|
|
% |
||
配当率 |
|
|
|
|
|
|
||
2022年7月、当社は当社の新行政総裁(“行政総裁”)に業績帰属条件を持つオプションを付与し、行政総裁に当社の普通株が連続して指定市価を達成した場合に普通株を購入する権利を持たせる
2022年12月31日まで12ヶ月以内に付与された市況を示す株式奨励の総授出日公平値はい$です
|
|
現在までの年度 |
|
|
|
|
十二月三十一日 |
|
|
|
|
2022 |
|
|
推定日株価 |
|
|
|
|
予想日は業績期末までだ |
|
|
|
|
予想変動率 |
|
|
% |
|
無リスク金利 |
|
|
% |
|
配当率 |
|
|
|
|
制限株
2022年12月31日までの12ヶ月間,
時間制限株に基づく株式ベースの報酬支出総額は$
従業員株購入計画
ESPPは条件を満たす従業員が以下の価格のうち小さい者に相当する1株当たり価格で会社普通株を購入できるようにする
F-18
株式ベースの報酬費用
業務表中の資本別給与費用の概要は以下の通り
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
研究開発 |
|
$ |
|
|
$ |
|
||
販売とマーケティング |
|
|
( |
) |
|
|
|
|
一般と行政 |
|
|
|
|
|
|
||
株式に基づく報酬支出総額 |
|
$ |
|
|
$ |
|
||
2022年と2021年12月31日までの12ヶ月間, $
同社は#ドルの所得税準備金を記録した
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
現在: |
|
|
|
|
|
|
||
連邦制 |
|
$ |
|
|
$ |
|
||
状態.状態 |
|
|
|
|
|
( |
) |
|
総電流 |
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
||
延期: |
|
|
|
|
|
|
||
連邦制 |
|
|
|
|
|
( |
) |
|
状態.状態 |
|
|
|
|
|
|
||
集計を延期する |
|
|
|
|
|
( |
) |
|
所得税引当金総額 |
|
$ |
|
|
$ |
( |
) |
|
連邦法定所得税率と会社の有効所得税率の入金は以下のとおりである
|
|
現在までの年度 |
|
|||||
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
連邦法定税率で計算される所期所得税割引 |
|
$ |
( |
) |
|
$ |
( |
) |
連邦福祉を差し引いた州税 |
|
|
( |
) |
|
|
( |
) |
信用やネットワークを研究開発しています |
|
|
|
|
|
— |
|
|
繰延税額は実際に向上しています |
|
|
|
|
|
— |
|
|
差し引かれない項目 |
|
|
|
|
|
|
||
評価免除額を変更する |
|
|
|
|
|
|
||
合計する |
|
$ |
|
|
$ |
( |
) |
|
F-19
会社の繰延税金資産の重要な構成要素の概要は以下の通りである
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
繰延税金資産: |
|
|
|
|
|
|
||
連邦と州政府の新たな営業赤字が繰り越す |
|
$ |
|
|
$ |
|
||
研究開発税収控除 |
|
|
|
|
|
|
||
減価償却および償却 |
|
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
|
||
第百四十四条費用 |
|
|
|
|
|
— |
|
|
課税項目と準備金 |
|
|
|
|
|
|
||
繰延税項目総資産 |
|
$ |
|
|
|
|
||
推定免税額を差し引く |
|
|
( |
) |
|
|
( |
) |
繰延税項目純資産 |
|
$ |
|
|
$ |
|
||
繰延税金負債: |
|
|
|
|
|
|
||
大文字の内部使用ソフト |
|
|
( |
) |
|
|
( |
) |
繰延税金純負債 |
|
|
( |
) |
|
|
( |
) |
繰延税金純負債 |
|
$ |
— |
|
|
$ |
— |
|
2022年12月31日までその会社は$を持っている
管理層は、管轄区域ごとに区分された最近の利益履歴と将来の課税収入を予想するなど、既存の証拠の重み記録に基づく繰延税金資産の現金化能力を定期的に評価する。当社が可変現金繰延税金資産金額の査定を変更した場合、当社はその推定値を調整し、この査定期間の所得税の準備に相応の影響を与える。当社の経営陣は、様々な要因に基づいて、繰延税金資産のすべてまたは一部が現金化できない可能性が高いと考えているため、2022年12月31日までの年度に、当社は当社の米国繰延税項純資産に推定準備金を提案した。2022年12月31日までの年間推定免税額純変動増加しました$
1986年に改正された“国内税法”(以下、“税法”)は、会社の“所有権変更”の場合の純営業損失の利用を制限した。そのため、会社が純営業損失を使用する能力は、規則第382節(“IRC第382節”)に規定されている制限を受ける可能性がある。会社が毎年使用している純営業損失額が制限されている可能性がある事件には含まれていますが、限定されず、累計所有権変更が超えています
2020年3月27日、CARE法案が成立して法律となった。CARE法案には、2019年と2020年に発生する純営業損失の課税収入制限の改正、ある商業利息支出の引き上げの控除制限、適格内装物件を購入するボーナス減価償却、ある会社の慈善寄付金の特別控除など、いくつかの重要な営業税条項が含まれている。同社はCARE法案の条項を分析し、あることを確定した
F-20
不確定税収状況
当社は申告表にすでに保有している或いは保有している不確定税務倉庫位を点検、評価及び測定し、関連税務機関の審査を経て維持できない或いは部分的に維持できない可能性がある当該等倉位の負債を記録しなければならない。
以下は、同社が確認していない税優遇総額の変化の概要である
|
|
|
|
|
|
|
|
|
|
2021年12月31日現在の残高 |
|
$ |
|
|
税収の増加に関係しています |
|
|
|
|
2022年12月31日現在の残高 |
|
$ |
|
|
2021年12月31日現在、税優遇総額は確認されていません
会社はアメリカで連邦と州所得税申告書を提出します。アメリカ連邦と州所得税の目的で、私たちのNOL繰り越しにより、訴訟時効は現在すべての年で有効です。その会社は現在どの管轄区でも検討を受けていない。
当社は時々正常な業務過程で発生したクレーム、サプライヤー紛争、その他の法律事項に触れます。このようなクレームが発生した時、会社はそれを調査するだろう。クレーム自体は予測不可能であるが、会社は現在何の事項も知らず、それに不利であると判定された場合、単独または合併は私たちの業務、運営結果、財務状況、またはキャッシュフローに重大な悪影響を及ぼす。損失が可能かつ計り知れない場合には、会社は法律やその他の事項の責任を記録する。2022年12月31日までの12ヶ月間同社は推定された負債#ドルを記録した
当社は通常業務中に異なるサプライヤーと契約を締結しており、これらの協定は一般的に通知後にキャンセルすることができます。キャンセル時に支払われるべき金額は、サービス提供者がキャンセルできない債務を含む、キャンセル日までに提供されるサービスの支払いまたは発生した費用のみを含む。
2021年3月、Armanino LLP前最高経営責任者、現最高経営責任者の近親者Andy Armaninoが取締役会に入社した。同社はArmanino LLPを使用して税務、評価、アウトソーシング会計サービスを提供している。2022年12月31日と2021年12月31日までの12ヶ月間会社が招く
2023年3月23日、会社は約35%のリストラを発表し、現金滑走路を改善し、会社の長期成功に専念するコスト削減措置の一部として他のコスト節約措置を発表した。同社は、2023年第2四半期の解散費や福祉に関する現金支出は約40万ドルと推計している。
F-21
第九項会計及び財務開示に関する変更と相違。
ない。
第9条。制御とプログラムです
情報開示制御とプログラムの評価
我々は、取引法に基づいて我々の報告書で開示されることを要求する情報が、米国証券取引委員会(SEC)の規則および表で指定された期間内に記録、処理、まとめ、報告されることを保証し、そのような情報を蓄積し、必要な開示について決定するために、我々の経営陣に伝達することを目的としている。また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.開示制御及びプログラムを設計·評価する際には、管理層は、任意の制御及びプログラムは、設計及び動作がどんなに良好であっても、予想される制御目標を達成するために合理的な保証を提供することしかできず、管理層は、可能な制御及びプログラムのコスト−収益関係を評価する際にその判断を運用しなければならないことを認識している。
報告された期間が終了するまで、我々は、最高経営責任者およびCEOを含む経営陣の監督·参加の下で、取引所法案規則13 a-15(E)および15 d-15(E)で定義されたような、開示制御および手順(取引所規則13 a-15(E)で定義された)の設計および動作の有効性を評価した。この評価に基づき、我々の最高経営責任者および最高財務責任者は、2022年12月31日までに、我々の開示統制および手続きが合理的な保証レベルで有効であると結論した。
財務報告の内部統制に関する経営陣の報告
我々の経営陣は、“取引法”ルール13 a-15(F)および15 d-15(F)に定義されている財務報告の十分な内部統制の確立と維持を担当している。その固有の限界により、財務報告の内部統制はすべての誤報を防止または発見できない可能性がある。したがって,有効と判定されたシステムであっても,財務諸表の作成や列報に合理的な保証を提供することしかできない.
私たちの経営陣は、2022年12月31日までの財務報告書の内部統制に対する我々の有効性を評価した。経営陣がこの評価を行う際に使用した枠組みは、テレデビル委員会後援組織委員会が発行した“内部統制--2013年総合枠組み”と題する文書で提出された基準である。この評価に基づき、我々の最高経営責任者と最高財務責任者は、2022年12月31日現在、財務報告の内部統制に有効であると結論付けた。
本年度報告には、財務報告の内部統制に関する我々の公認会計士事務所の証明報告は含まれていません。米国証券取引委員会の永久免除によると、経営陣の報告は、会社公認会計士事務所の認証を受けず、この免除は、本年度報告において経営陣の報告のみを提供することを許可する。
財務報告の内部統制の変化
最近の財政四半期内に、財務報告の内部統制に大きな影響を与えていないか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化が発生していません。
プロジェクト9 B。他の情報。
ない。
ITEM 9 Cです。検査を妨害する外国司法管轄区域を開示する。
適用されません。
86
第三部
プロジェクト10.取締役、行政、企業管理
次の表に2022年12月31日までの私たちの役員と役員に関する情報を示します。各取締役の履歴記述には,取締役会が現在その人が取締役を務めるべきかどうかについて結論を出す際に考慮される予定の具体的な経験,経歴,属性,スキルが含まれている
名前.名前 |
|
年ごろ |
|
ポスト |
役員/役人自 |
デヴィッド·ペリー |
|
55 |
|
取締役執行議長兼一級 |
2021年10月 |
フランク·カーベ |
|
54 |
|
最高経営責任者総裁と第2種役員 |
2022年6月 |
マーク·バーマン博士 |
|
47 |
|
首席医療官 |
2021年10月 |
クリスチャン·ウィンホルダー |
|
50 |
|
首席産品官 |
2021年10月 |
マーク·ヘニン |
|
53 |
|
財務主管兼臨時首席財務官 |
2021年10月 |
リチャード·カーモナ博士 |
|
73 |
|
第I類取締役 |
2021年10月 |
アンドリュー·アルマーニノ |
|
57 |
|
第三種役員 |
2021年10月 |
ジェフリー·パーカー |
|
58 |
|
第II類取締役 |
2021年10月 |
Risa Lavizzo-Mourey博士 |
|
68 |
|
第三種役員 |
2021年10月 |
エルド·グレンジャー博士 |
|
68 |
|
第三種役員 |
2021年11月 |
劉素英博士 |
|
34 |
|
第II類取締役 |
2020年7月 |
行政員
フランク·カーベ私たちの最高経営責任者で、彼は2022年6月以来この職を務めてきた。カベさんは、2016年9月から2021年8月までMyovant Sciences Ltd.の最高財務責任者、会計官を務めていました。カベさんは、2017年4月にMyovant Sciences,Inc.の最高財務責任者に任命され、2020年2月に社長および最高財務責任者に任命されました。カベさんは、2014年9月から2016年7月までの間に、グローバル·大衆参加活動プラットフォームThe Color Runの社長を務め、運営と財務機能を担当しています。カベさんは、2004年1月から2014年6月まで、バイオテクノロジー会社Exelixis,Inc.で執行副総裁兼チーフ財務責任者を務めた。カベさんはExelixisの在任中に、財務組織、内部および外部とのコミュニケーション、ビジネスの発展、情報技術、会社の戦略、および様々な運営機能を担当します。2004年にExelixisに加入する前に、Karbeさんは、ゴールドマン·サックスで投資銀行家を務めていたが、最近、このヘルスケアグループの社長を副社長に務め、企業融資やM&Aに関するアドバイスを顧客に提供している。カベさんは1997年にゴールドマン·サックスに加入する前に、ロイヤルオランダ·シェル·グループの欧州財務部門で複数のポストに就いていた。カベさんは2019年4月から2020年10月までAduro Biotech,Inc.で取締役マネージャーを務め、2010年から2018年までArbutus Biophma Corporationに勤務しており、現在は幻影製薬会社の取締役を務めている。カーベさんはドイツのコブレンツWHU-Otto Beisheim管理大学院からDiplom-Kaufmann号を取得しているy.
マーク·バーマン博士我々の首席医療官であり,我々の業務合併が終了して以来このポストを務め,2019年以来Legacy BTXで担当している。バーマン博士はこれまで、2015年から2019年までLegacy BTXの健康担当を務めてきた。これまでバーマン博士はOne Medicalで内科とライフスタイル内科医を務めていた。バーマン博士はマギル大学で理学療法を学び、エール大学で医学博士号を取得した。彼はハーバード大学ブリグラムと女性病院での入院治療を終え、カリフォルニア大学サンフランシスコ校で臨床研究奨学金を受け、そこではドリス·デューク臨床研究員だった。彼は研究員で、2013年から2016年までアメリカライフスタイル医学院取締役研究員を務めた。現在、バーマン博士は著者らのすべての臨床開発と交付を監督し、監督、研究と出版を指導している。2007年から2009年にかけて、バーマンさんは、ロバート·ウッド·ジョンソン財団の児童肥満問題のCEOおよび社長特別補佐を務めました。バーマン博士は社会起業家で、彼の仕事の重点は心臓代謝健康、植物性飲食とデジタル療法だ。
クリスチャン·ウィンホルダー私たちの首席製品官で、私たちの業務合併が終わってからこの職を務め、2019年以来Legacy BTXでこのポストを担当しています。ウィンホルダーはこれまで、2018年から2019年にかけてLegacy BTXの設計部担当を務めてきた。私たちに入社する前、彼女は製品開発コンサルティング会社Carbon Fiveで2011年から2018年まで7年間製品チーフデザイナーを務めていた。ウィンホルダーはシリコンバレーで生まれ育った人で、彼女は20年かけてスタートアップ企業、成長型企業、企業を助け、注目されたユーザー中心の製品を生み出した。彼女は通信、金融、ファッション、医療など、30以上の異なる分野の会社のデジタル製品発表に参加したり指導したりした。いくつかの有名な会社はSkype、The Gap、トンソンロイター、Moodys、Coinbase、スタンフォード健康、Grand Rundsを含む。Wynholdさんはカリフォルニア大学サンバラ校の臨床心理学学士号を持っている。
87
マーク·ヘニン私たちの財務担当者と臨時首席財務官で、彼は私たちの業務合併が終わってからこの職を務め、2021年1月以来Legacy BTXでこの職を務めています。海寧はベテランの金融人で、クラウドコンピューティングやデータベース管理など多くの分野の高度会計·財務監督職で10年以上の経験を持っている。海寧は2020年にOmnigo LLCの首席財務長官を務めた。これに先立ち、Heinenさんは、Trin Tech Inc.の上級副社長、グローバル企業のディレクター、臨時首席財務官を2017-2020年に務めます。Heinenさんは、Trin Tech Inc.を担当する前に、2013年から2016年までの間、Daegis Inc.首席財務官を担当しています。首席財務官を務めている間、海寧は上場企業と非上場企業の売却·買収を監督した。海寧さんは、上場企業および非上場企業で25年を超える財務と会計経験を持っています。ハニングさんは、オクラホマ大学の会計学の学士号、工商管理の修士号を取得しています。
役員.取締役
我々の取締役会は3つの互い違いの取締役レベルに分かれており、各取締役は3つのレベルのうちの1つに割り当てられている。毎回株主年次総会では、任期が3年で、任期が満了する同じ種類の取締役を引き継ぐ1種類の取締役が選ばれる。取締役任期は2025年に行われる株主総会で後継取締役を選出して資格を取得して満了し、第I類取締役、第II類取締役、第III類取締役はそれぞれ2025年、2023年、2024年に開催される。
各株主総会では、任期満了の取締役後継者の任期が当選と資格取得時から選挙後の第3回年次会議まで、その後継者が正式に選出され資格を取得するまでとなる。取締役会の決議は査定された役員数を変更することができる。取締役数の増加により増加した任意の取締役職は、各レベルが可能な限り3分の1の取締役で構成されるように、この3つのレベルに割り当てられる。取締役会のこのような分類はわが社の支配権や経営陣の変化を遅延または阻止する可能性があります。
デヴィッド·ペリーLegacy BTXの共同創業者の一人で、2015年以来Legacy BTX取締役会議長を務め、私たちの業務合併が終了してから取締役会の執行議長を務めています。ペリーは彼のキャリアの中で数十億ドルの3つの会社の創業者や創始CEOだった。Anacor PharmPharmticalsの創始最高経営責任者であり,2002年の設立から2014年まで会社をリードしてきたが,その間,2010年に初公募株を行い,2種類の感染(Tavborole)と炎症(Eucrisa)を治療する薬剤を開発し,その後FDAの承認と,複数の治療が無視された疾患の計画を得た。ファイザーは2016年に52億ドルでAnacorを買収した。最近、Indigo農業会社の最高経営責任者であり、そこで会社を率いて12億ドルを超える資金を調達し、10億ドルを超えると推定される初めての農業技術会社となった。Indigoは2019年のCNBCの最も破壊的な会社ランキングで1位にランクインした。彼のキャリアの初期、ペリーは1997年にB 2 B電子商取引の先駆者であるChemdexの創業者兼最高経営責任者を務め、同社はその後1999年に上場した。ペリー·さんは以前、Evelo生物科学社の取締役会のメンバーも務めていました。ペリー·さんはタルサ大学で化学工学の学士号、ハーバードビジネススクールのビジネスマネジメント修士号を取得しています。ペリーさんの管理、運営、資金調達、および会社創設の経験から、特に生命科学の分野では、ペリーさんは完全に会社の役員になる能力があると信じています。
88
リチャード·カーモナ博士私たちの業務合併が終了して以来、私たちの取締役会メンバーを務め、2017年以来Legacy BTXの取締役会メンバーを務めてきました。カモナ博士は2017年8月以来、生命増強会社Canyon Ranch Inc.の健康革新担当者を務めてきた。2006年10月から2017年8月まで、峡谷牧場副会長、峡谷牧場健康事業部の最高経営責任者、非営利組織峡谷牧場研究所の総裁を務めた。アリゾナ大学メルとエニード·ザックマン公衆衛生学院初の傑出した公衆衛生教授ですCanyon Ranchに加入する前に,Carmona博士は2002−2006年の間に米国第17代衛生局局長を務め,海軍中将の階級を獲得した。これまで、アリゾナ州南部地域緊急医療システム主席、アリゾナ大学外科、公衆衛生、家庭とコミュニティ医学教授、アリゾナ警察署ピマ県外科医兼副保安官であった。カーモナ博士はアメリカ陸軍と陸軍特殊部隊に従軍していた。カーモナ博士は以前、高楽氏社とAxon Enterprise,Inc.(前身はタイザー国際)の取締役を務め、現在は康宝ライ株式会社(2013年10月現在)とマケソン社(2021年9月現在)の取締役を務めている。カモナ博士はその50年以上のキャリアの中で個人と公共健康を助けることに力を入れ、看護師、創傷外科医、警察、公衆衛生官僚、戦闘勲章を受けたベトナム特殊部隊退役軍人など様々なポストを務めた。カモナ博士が取締役会にもたらした深さと広さの経験と知識を踏まえると、カーモナ博士は会社の役員の一員になる能力が完全にあると信じている。
アンドリュー·アルマーニノ私たちの業務合併が終了して以来取締役会メンバーを務めており、2021年3月以来Legacy BTXの取締役会メンバーを務めています。アルマーニノは現在、独立会計士事務所からなる会計·商業コンサルティングネットワークであるムーアグローバル国際会社の取締役会長である。コミュニティサービス組織アルマーニノ財団の取締役会メンバーでもあり、米国公認会計士協会理事会に勤務し、カリフォルニア商業銀行の取締役会メンバーでもある。アルマーニノは2005年から2018年まで、1500人の従業員を持つ会計士事務所Armanino LLPの管理パートナー兼最高経営責任者を務めてきた。2018年、アルマーニノは退職し、同社との関連はなくなった。彼はサンクララ大学の会計学学士号を持っている。我々は、アルマーニノさんのビジネス、会計、管理経験の深さと広さによって、彼は完全に会社の役員になる能力があると信じています。アルマーニさんは公認会計原則と監査基準についての深い理解を当社の取締役会に提供する豊富な会計経験を提供します。長年中小企業にサービスを提供してきた経験から、彼は私たちの取締役会に貴重な見解をもたらした。
ジェフリー·パーカー私たちの業務合併が終了して以来取締役会メンバーを務めており、2021年3月以来Legacy BTXの取締役会メンバーを務めています。パーカーさんは現在、ナスダック社(Tricida,Inc.)の最高財務責任者兼最高経営責任者です。パーカーは2017年にTricidaに加入した。これまで、パーカーさんは、2010年9月から2015年5月まで、Anacor PharmPharmticals,Inc.のチーフ財務官を務め、1997年4月から2009年4月までゴールドマン·サックスの取締役社長を務め、西海岸ヘルスケア投資銀行部を率いていました。パーカーは取締役Perrigo Company plc取締役会の取締役であり、同社監査委員会のメンバーでもある。パーカーさんは以前、ChemoCentryx社、遺伝子健康会社、Sunesis製薬会社、Genoptix社の取締役会で取締役を務めていました。パーカーさんは、ダートマス大学で経済学、工学科学の学士号、スタンフォード大学ビジネススクールのビジネスマネジメント修士号を取得しています。私たちは、パーカーさんは、経営、財務、運営の経験、特に生命科学の分野での経験を豊富に持っていると信じており、会社の役員業務に適任であると信じています.
Risa Lavizzo-Mourey博士私たちの業務合併が終了して以来取締役会メンバーを務めており、2021年4月以来Legacy BTXの取締役会メンバーを務めています。Lavizzo-Mourey博士は1986年から2021年までペンシルバニア大学教授を務め、2018年から2021年までロバート·ウッド·ジョンソン基金会の衛生公平と衛生政策教授を務めた。2003年から2017年にかけて、Lavizzo-Mourey博士はロバート·ウッド·ジョンソン財団の最高経営責任者を務め、同基金会の間、彼女は率先して児童肥満の流行を転換し、負担できる包括的な医療システムを作成し、健康影響に関連する社会的要素を解決するイニシアティブを展開した。1985年から1998年まで、Lavizzo-Mourey博士はまた豊富な政府経験を持ち、ホワイトハウス医療改革特別作業部会の共同議長と総裁を務める医療業界消費者保護と品質諮問委員会諮問委員会のメンバーを含む様々な職務を担当した。Lavizzo-Mourey博士は2018年以来インテル(ニューヨーク証券取引所株式コード:INTC)の独立取締役メンバーを務め、2020年以来メルク社(ニューヨーク証券取引所株式コード:MRK)の独立取締役メンバーを務め、2017年以来ゼネラル·エレクトリック(ニューヨーク証券取引所株式コード:GE)の独立取締役メンバーを務め、会社統治·公共事務委員会に勤務している。Lavizzo-Mourey博士はニューヨーク州立大学石渓校で学士号を取得し、ハーバード大学で医学博士号を取得し、ペンシルバニア大学でMBAを取得した。Lavizzo-Mourey博士の豊富な知識と経験により、医療分野における機能と思想指導力、および彼女の一次保健医師としての仕事と国家衛生政策の制定の仕事を含めて、Lavizzo-Mourey博士は会社の取締役会社の一員になる能力が完全にあると信じている。Lavizzo-Mourey博士は,ロバート·ウッド·ジョンソン財団(Robert Wood Johnson Foundation)の行動領域戦略への転換のリーダーである認知行動療法への情熱を示している。
89
エルド·グレンジャー博士2021年11月以来、私たちの取締役会のメンバーを務めてきた。米陸軍少将(退役)で、2009年8月から5 PS、LLCの最高経営責任者兼最高経営責任者、5 PS、LLCは医療、教育、リーダーシップコンサルティング会社である。2009年6月に退役する前、35年以上米国陸軍に従軍し、2005年12月から2009年6月にかけて、ワシントンD.C.の国防総省(衛生事務)事務室で取締役副主任兼TRICARE管理活動プロジェクト執行役を務めた。彼はアメリカ内科主管学会、アメリカヘルスケア主管学会、アメリカ医療品質委員会とアメリカ内科委員会、全国会社役員協会が発行した取締役会証明書であり、複数の医学認証を持っている。グランジャー博士は2018年から信ノ株式会社(ニューヨーク証券取引所株式コード:CI)の取締役会メンバーを務めており、2014年から道富銀行ホールディングス(ナスダック株コード:DLHC)の取締役会メンバーを務めており、これまでExpress Script Holding Company(2015年~2018年)とCerner Corporation(ナスダック株式コード:CERN)の取締役会メンバーを務めてきた。彼は1976年にアーカンソー州立大学で理学学士号を取得し、1980年にアーカンソー大学医学院で医学学位を取得した。グランジャー博士は、世界の制服サービス者の健康計画に関する医療政策、計画、予算、コンプライアンス、執行を含む医療管理と運営の面で豊富な経験を持っているため、会社の取締役社長を務める十分な条件を備えていると信じている。グランジャー博士はアメリカ陸軍と商業部門のキャリアの中で独特のリーダーシップと政策経験を持っています。
劉素英博士設立以来取締役会のメンバーを務め、MCADの会長兼CEOを務めてきた。劉博士は2021年2月から2021年8月まで取締役グループ(ナスダックコード:PLBY)と峰買収会社(ナスダックコード:MCAC)の業務合併が終了した。劉博士は2021年3月以来、山頂買収会社III(ナスダック株式コード:MCAE)の最高経営責任者、最高財務官、会長を務めてきた。また、2021年3月からMountain Crest Acquisition Corp.IV(ナスダックコード:MCAF)の会長、最高経営責任者、財務責任者を務め、2021年4月からMountain Crest Acquisition Corp.V(ナスダックコード:MCAG)の会長、最高経営責任者、財務責任者を務めている。彼は2020年5月から2020年9月までの間にハドソン資本会社(ナスダック:HUSN)企業戦略主管を務め、一般業務と特定成長分野での会社の戦略発展を指導した。2018年11月から2020年4月までの間に、劉博士はMansion Capital LLCの首席ストラテジストを務め、個人持株の不動産投資会社であり、ブローカーと物件管理業務を持ち、北米とアジアの顧客の米国不動産市場への投資にサービスを提供している。Mansion Capitalに加入する前に、劉博士は2015年7月から2018年10月までの間にモルガン大通会社の投資策略師を務め、私募株式、ヘッジファンドと保険会社にまたがるウォール街の主要機関に投資戦略を提供し、主に商業担保ローンに集中している。劉強東のキャリアは学術界で始まり、2013年1月から2015年5月までの間にワシントン大学奥林商学院で学士から幹部教育までの様々な学位課程を教授し、同時に博士課程を修了し、2015年5月に金融学博士号を取得した。劉博士は2012年12月に金融学修士号を取得し、2010年5月にワシントン大学で経済学と数学学士号を優秀な成績で取得した。劉博士の会社と投資戦略の豊富な経験に基づいて、私たちは彼が私たちの取締役会に就く資格があると信じています。
私たちのどの役員や役員の間にも家族関係はありません。過去5年間、本年報が特に指定した以外、当社のすべての取締役の主要な職業及び雇用された仕事はすべて当社の親会社、付属会社或いはその他の共同経営会社ではない会社或いは組織で行われた。私たちのどの取締役も他の人との間には何の手配も了解もありませんので、彼は取締役に選ばれます。吾等はいかなる取締役も利吾等又は吾等のいずれかの付属会社の一方の重大な法律手続を有しておらず、又はいずれも当該等の者が当該等の訴訟において吾等又は吾等の付属会社に不利な重大な権益を有している。
役員は自主独立している
ナスダック上場規則は私たちの取締役会の多くの会員たちが独立していることを要求する。“独立取締役”とは、一般的に、当社の主管者又は従業員以外、又は当社の取締役会が取締役責任を履行する際に独立判断を行使することを妨害すると考えられる他の任意の個人以外の者を指す。私たちの取締役会は、David·ペリー、フランク·カーベ、劉素英博士を除いて、私たちの取締役会のすべての個人が取締役上場基準での独立ナスダック資格に適合することを決定した。
取締役会会議と出席状況
2022年12月31日までの会計年度に、我々の取締役会は6回の会議を開催した。2022年12月31日までの財政年度中に、各取締役は、そのサービスする取締役会および取締役会委員会の少なくとも75%の会議に出席した(各会議は、その取締役メンバーおよび/または適用委員会メンバーの間に開催された)。会社は役員が株主総会に出席することを奨励しています。
90
取締役会各委員会
私たちの取締役会には三つの常設委員会があります:監査委員会、報酬委員会、指名、そして会社管理委員会です。各委員会は書面規定に従って運営されている。また、各委員会は、その定款の十分性を審査して評価し、その定款を取締役会に提出して承認する。各委員会規約のコピーは私たちのウェブサイトwww.bettertx.comの“投資家関係”の部分に掲示されている。当社のサイトに掲載されているまたは当社のサイトで閲覧できる資料は参考方式で本年報に組み込まれていません。閣下はこのような資料を本年報の一部と見なすべきではありません。
監査委員会
私たちの監査委員会のメンバーはアンドリュー·アルマーニノ、ジェフリー·パーカー、エルダー·グランジャー博士で、アンドリュー·アマニノが監査委員会の議長を務めています。ナスダック上場規則と適用される米国証券取引委員会規則によると、監査委員会には少なくとも3人のメンバーがいなければならない。ナスダック上場規則及び取引所法案第10 A-3条も、上場企業の監査委員会は、監査委員会にとって完全に独立した取締役で構成されなければならないことを要求しているが、適用される規則によると、監査委員会については、我々の監査委員会のメンバー全員が独立した取締役になる資格がある。アンドリュー·アルマーニノ、ジェフリー·パーカー、エルダー·グランジャー博士はいずれも財務に精通しており、アンドリュー·アルマーニノは米国証券取引委員会の関連規則で定義されている“監査委員会財務専門家”になる資格がある。監査委員会は、2022年12月31日までの財政年度中に4回の会議を開催した。監査委員会の役割には、以下のことが含まれる
報酬委員会
私たちの報酬委員会のメンバーはRisa Lavizzo-Mourey博士とRichard Carmona博士で、彼らは独立した役員であり、Risa Lavizzo-Mourey博士は報酬委員会の議長を務めている。給与委員会は、2022年12月31日までの会計年度に7回の会議を開催した。報酬委員会の役割には、
91
私たちの給与委員会は個人の報酬に関する問題を審議する責任がある。報酬委員会はまた、インセンティブに基づく報酬計画と株式ベースの計画の下での支出と奨励を審査·承認したが、私たちの最高経営責任者、執行議長、取締役は除外した。我々の最高経営責任者とCEOの場合、給与委員会は、彼らの報酬を決定する際に考慮すべき会社の目標と目的を審査·承認し、これらの目標と目的に基づいて彼らのパフォーマンスを評価し、評価に基づいて取締役会に報酬提案を行う。最高経営責任者及び最高経営責任者以外のすべての上級管理者について、給与委員会は、各級従業員に付与された持分ベースの計画下の報酬及び報酬のレベルからなる報酬行列を含む株式ベースの報酬を付与する政策及びプログラムを取締役会に提案する。
2022年には、賠償委員会は独立した賠償コンサルタントのサービスを保持し、賠償委員会が適切であると判断した場合には何らかの賠償事項に対する意見を審議する。賠償委員会は、その1人または複数のメンバーからなる1つまたは複数のグループ委員会を設置し、その義務を履行することを許可することができる。
指名と会社管理委員会
私たちの指名と会社統治委員会のメンバーはジェフリー·パーカーとリチャード·カーモナ博士で、彼らは独立取締役で、ジェフリー·パーカーが指名と会社管理委員会の議長を務めています。2022年12月31日までの会計年度において、指名·コーポレートガバナンス委員会は4回の会議を開催した。指名とコーポレートガバナンス委員会の役割には:
私たちは指名と会社統治委員会の構成と運営が“サバンズ-オキシリー法案”とすべての適用されたアメリカ証券取引委員会とナスダック規則と法規のすべての適用要件に適合すると信じている。私たちはこのような要求が私たちに適用される限り、未来の要求事項を守るつもりだ。私たちの委員会は時々他の委員会を設立するかもしれない。
取締役指名者の識別と評価
私たちの取締役会は自分のメンバーを選ぶ責任がある。取締役会は選考と指名過程を指名と会社管理委員会に委託し、取締役会と管理層の他のメンバーは適宜この過程に参加することを要求されることを期待している。
一般的に、私たちの指名やコーポレートガバナンス委員会は、経営陣と協議し、ヘッドハンティング会社や他のコンサルタントを使用して、株主から提出された推薦、または指名およびコーポレートガバナンス委員会によって候補者の決定に役立つと考えられる他の方法で取締役指名の候補者を決定する。候補者が確定すると、私たちの指名と会社管理委員会は、候補者が指名と会社管理委員会が設立され、取締役会によって承認された取締役指名のすべての基準に適合していることを確認します。指名およびコーポレートガバナンス委員会は、面接、詳細なアンケート調査、背景調査または指名、およびコーポレートガバナンス委員会が評価中に適切であると考えられる任意の他の方法で候補者の情報を収集することができる。そして、指名·コーポレートガバナンス委員会はグループ形式で会議を開き、各候補者の素質や技能を検討·評価し、個人的なものもあれば、我々取締役会の全体的な構成やニーズを考慮したものもある。審査過程の結果に基づいて、取締役会の任命又は選挙候補として、取締役会の任命又は選挙候補として指名及び会社管理委員会推薦候補を取締役会の承認に供する。
92
最低資格と取締役会の多様性
私たちの指名と会社管理委員会は取締役会候補者を取締役会候補と取締役会委員会のメンバーとして推薦する時、以下の最低資格、技能と属性を考慮する:被著名人は商業、政府、非営利組織或いは高い地位学術組織の戦略或いは意思決定レベルの経験を持つべきである;被著名人はそのそれぞれの領域で高度に達成すべきであり、優れた経歴と承認を持つべきである;著名人は社会で評価され、高い道徳基準で長期的に名声を得るべきである。被著名人は、私たちの事務に取り組むのに十分な時間と時間を持つべきであり、特に、この著名人が取締役会に在任する可能性があることを考慮すると、著名人が現在または以前に他の取締役会に在任している程度については、被著名人は取締役会会議において積極的に貢献する明らかな歴史を有するべきである。
潜在的な取締役候補を評価する際には、我々の指名およびコーポレートガバナンス委員会も、人種、性別、国籍、推薦された取締役候補のスキル、彼または彼女の専門経験の深さおよび広さまたは他の背景特徴、彼または彼女の独立性、および取締役会の必要性を含むが、多様性を含むが、これらに限定されない適切または提案されているすべての事実および状況を考慮するであろう。取締役会の多元化に関する正式な政策はありませんが、取締役会の多元化による異なる視点と経験が私たちの意思決定の質を高めたと信じています。また、多様性は、取締役会が患者、株主、従業員、他の利害関係者のニーズをより効率的に識別し、応答するのに役立つと信じている。
指名とコーポレートガバナンス委員会は株主推薦の取締役候補を考慮する。指名とコーポレートガバナンス委員会が採択した政策規定では、株主が推薦する候補者は他の候補者と同様に適切に考慮される。
非従業員役員会議
上記取締役会委員会会議を除いて、2022年12月31日までの財政年度中に、取締役会会議に関連する非従業員取締役が実行会議で5回の会議を開催した。
取締役会とのコミュニケーション
会社に懸念のある利害関係者は、取締役会又は私たちの取締役会議長又は指名及び会社管理委員会にこのような懸念を報告することができ、書面通知を提出し、取締役に注意を促すことができる。住所は以下のとおりである
C/o Better Treateutics社
市場街548番地49404
カリフォルニア州サンフランシスコ、郵便番号94104
アメリカです
あなたは匿名でまたは郵送であなたの懸念を秘密裏に提出することができます。株主か他の利害関係者かを明記することもできます。
そのような書面通信のコピーは、会社の法律顧問に転送されてもよく、そのような通信のコピーは、合理的な時間を保持することができる。取締役は、会社の法律顧問、独立顧問、非従業員取締役または会社経営陣とこのことを議論することができ、取締役が善意に基づいて、合理的な判断を使用して自ら決定した他の行動や行動を取らないこともできる。
通信が重要な実質的な事項に関連し、他の取締役が重要である可能性のあるアドバイスまたはコメントを含む場合、これらの通信を他の取締役に転送することができる。一般に、コーポレートガバナンスや長期会社戦略に関する通信は、一般的なビジネス、個人的不満、重複または重複通信を受信したことに関する通信よりも転送される可能性がある。
監査委員会監督会社が受信した会計、内部会計制御又は監査事項に関する苦情の受信、保留及び処理手続、並びに従業員が問題のある会計、内部会計制御又は監査事項について提出した秘密、匿名提出に関する苦情。
93
我が国の取締役会のリスク規制における役割
私たちの取締役会の主な機能の一つは私たちのリスク管理過程を知ることだ。私たちの取締役会は、それぞれの監督分野固有のリスクを処理する私たちの取締役会全体および私たちの取締役会の各常設委員会によって直接この監督機能を管理しています。特に、私たちの取締役会は戦略的リスクの監視と評価を担当しており、私たちの監査委員会は、私たちの主要な財務リスクの開放を考慮して検討する責任があり、私たちの経営陣はこれらの開口を監視·制御するためにどのような措置を取っていますか。監査委員会には、経営陣とともにリスク評価·管理を行う過程を審査し、法律や法規の要件を遵守している場合を監督し、財務報告の内部統制に十分かつ有効であるかどうかを審査する責任がある。当社の指名とコーポレートガバナンス委員会は、わが社が直面しているガバナンスリスクとわが社がこのようなリスクに対応するための政策とプログラムの十分性に基づいて、当社のコーポレートガバナンス政策と制度を定期的に評価しています。私たちの報酬委員会は、私たちの任意の報酬政策や計画が私たちの会社に実質的な悪影響を及ぼす可能性があるかどうかを評価して監視しています。
道徳的規則
私たちの取締役会は、私たちのすべての従業員、高級管理者、および取締役に適用され、私たちの最高経営責任者、最高財務官、および他の執行および高級財務官を含む商業行為および道徳的基準(私たちの“道徳基準”)を採択した。私たちの道徳基準の全文は、私たちのウェブサイトwww.bettertx.com“投資家関係”の部分の“投資家-管理-文書と定款”の部分で調べることができます。
私たちは、私たちのウェブサイトの同じ位置で、または私たちの道徳基準のいくつかの条項の将来の改訂を公開するか、または私たちの役員や幹部に関連するいくつかの条項の免除を開示するつもりです。当社のサイト上の情報は、本年度報告の一部を構成することは意図しておらず、引用的に本年度報告に組み込むつもりもありません。
第11項.行政職報酬
役員報酬の概要
この部分は、2022年に私たちの最高経営責任者を務める一人一人と、2022年の間に私たちのCEOを除いた最高報酬の役員2人を含む、2022年に私たちの“指定役員”に提供される役員報酬計画の主要な構成要素について議論します。これらの実行幹事は以下の者で構成される
私たちの役員報酬計画は
94
私たちの給与委員会は主に私たちの役員の役員報酬計画を担当している。私たちの最高経営責任者は、彼に仕事を報告する各幹部に報酬委員会に報酬提案をし、通常報酬委員会の会議に参加する。私たちの最高経営責任者は、会社全体の業績や役員個人のこれらの業績への貢献に基づいて、基本賃金と役員への短期·長期インセンティブについてこのような提案をしています(彼自身に対してではありません)。そして、私たちの報酬委員会は、様々な報酬調査データと私たちの同業者の公開データを含む提案や他のデータを検討し、各役員(私たちのCEOを含む)の目標の直接報酬総額および各報酬要素について決定します。報酬委員会は私たちのCEOのパフォーマンスを検討し、彼の報酬について取締役会に提案した。取締役会は私たちの最高経営責任者に報酬決定を下す権限を保持している。我々のCEOは通常、報酬委員会の会議に出席するが、報酬委員会は、CEOの報酬や他の問題を議論する際に、CEOがその場にいる場合に会議を開く。
私たちの給与委員会は、適切だと思う場合には、私たちの役員報酬計画と関連政策を確立するために、1人以上の役員報酬コンサルタントのサービスを維持することを許可されている。給与委員会は、技術とバイオテクノロジー業界で給与専門知識を持つ全国的な給与コンサルティング会社であり、役員と非役員報酬に関する市場情報、分析、その他の提案を提供し続けている給与管理有限責任会社を招聘する。報酬管理有限責任会社は、適切な同業者会社の構築に協力し、役員の適切な全体的な報酬レベルを決定し、各個別の報酬要素を評価して、私たちが役員に提供する報酬が個別報酬でも全体報酬でも競争力と公平性を有することを保証する。私たちは報酬管理有限責任会社の保留とそれがしたことがどんな利益の衝突をもたらすとは思わない。
2022報酬集計表
次の表には、2022年12月31日現在、2021年12月31日までの会計年度において、当社が様々な身分で会社に提供するサービスにより得られ、獲得、支給された総給与を以下の表に示す。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
非持分 |
|
|
全部 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
在庫品 |
|
|
選択権 |
|
|
激励計画 |
|
|
他にも |
|
|
|
||||||
|
|
|
|
賃金.賃金 |
|
|
ボーナス.ボーナス |
|
|
賞.賞 |
|
|
賞.賞 |
|
|
補償する |
|
|
補償する |
|
合計する |
|
||||||
名称と主要ポスト |
|
年.年 |
|
($) |
|
|
($) |
|
|
($) |
|
|
($)(2) |
|
|
($) |
|
|
($) |
|
($) |
|
||||||
フランク·カーベCEO |
|
2022 |
|
246,474(1) |
|
|
|
|
|
|
|
|
|
909,929 |
|
|
110,913(3) |
|
|
|
|
|
1,267,316 |
|
||||
ケビン·アペルボム共同創業者で元最高経営責任者です |
|
2022 |
|
272,064(1) |
|
|
|
- |
|
|
194,432(4) |
|
|
|
198,246 |
|
|
|
- |
|
|
571,331(5) |
|
|
1,236,073 |
|
||
|
|
2021 |
|
|
462,250 |
|
|
|
- |
|
|
|
- |
|
|
|
675,111 |
|
|
|
707,500 |
|
|
|
|
|
1,844,861 |
|
首席医療官マーク·バーマン博士 |
|
2022 |
|
421,875(1) |
|
|
|
- |
|
|
|
- |
|
|
|
98,413 |
|
|
151,875(3) |
|
|
|
|
|
672,163 |
|
||
|
|
2021 |
|
|
360,500 |
|
|
|
- |
|
|
|
- |
|
|
|
250,062 |
|
|
|
215,875 |
|
|
|
|
|
826,437 |
|
最高製品責任者クリスティン·ウィンホルダー |
|
2022 |
|
381,667(1) |
|
|
|
- |
|
|
|
- |
|
|
|
98,413 |
|
|
137,400(3) |
|
|
|
|
|
617,480 |
|
||
|
|
2021 |
|
|
329,375 |
|
|
|
- |
|
|
|
- |
|
|
|
219,681 |
|
|
|
257,125 |
|
|
|
|
|
806,181 |
|
95
報酬集計表の叙述的開示
基本給
任命された実行幹事ごとの基本給は、彼または彼女のスキル、経験、業績、役割、責任に見合っている。2022年1月1日から2022年3月まで、アペルボム、バーマン、ウィンホルダーの年間基本給はそれぞれ52万ドル、41万ドル、35万ドルだった。2022年3月より、アペルボーム氏、さん博士、バーマン博士、ウェンホルダー氏の年間基本給は、それぞれ54万ドル、42.5万ドル、39万ドルに増加しました。アペルボムさんは2022年7月に当社を退社。カベさんは2022年7月に働き始め、年明けの基本給は50万ドル。カベさんとアペールボームさんの2022年の給与は、当社のサービスの一部として2022年に使用できる年限に比例して計算されます。
現金ボーナス
Appelbaumさん、Karbeさん、Berman博士、Wynholdさんの目標年次ボーナスは、それぞれ、任命された役員の年間基本給の50%、50%、40%、40%にそれぞれ適用されます。
2022年、私たちの短期現金インセンティブ計画によると、私たちが任命した幹部は、2022年のある会社の業績目標の実現状況と個人業績に基づいて年間ボーナスを得る資格があります。当社の取締役会は、2022年の業績年度の終了後、会社の業績と個人的な目標が90%を達成したことを決定し、Karbeさん、Berman博士、Wynholdsさんにそれぞれ110,913ドル、151,875ドル、137,400ドルを支払いました。彼が2022年に会社を出たため、アペルボムは2022年の年間ボーナスを獲得しなかった。また、Karbeさんに支払う金額は、2022年期間に当社がサービスする一部の年度を反映するように比例配分します。
96
持分補償
2022年度には、任命された各役員に株式オプションを付与し、詳細は以下の“2022年度傑出株式賞年次総会”を参照されたい。
401(K)計画
私たちは、税務条件に適合した退職計画である401(K)計画を維持し、私たちが指定した役員を含む条件に適合した従業員のために、税金優遇に基づいて退職貯蓄の機会を提供する。計画参加者は、改正された“1986年国税法”(以下、“国税法”)に基づいて、適用される年間限度額に基づいて、条件に合った補償の支払いを延期することができる。従業員の税前支払いまたはRoth支払いは、各参加者の個人アカウントに割り当てられ、次いで、参加者の指示に応じて選択された投資選択に投資される。職員たちはすぐに彼らの貢献から完全に利益を得るだろう。私たちは適宜全額寄付を支払うことができるが、2022または2021年度には何の等額寄付もしていない。我々の401(K)計画は規則第401(A)節の規定に適合しているが、我々の401(K)計画の関連信託基金は規則第501(A)節の規定により免税である。
追加手当と個人福祉
私たちは一般的に私たちが指定した幹部たちに追加的な福祉や個人的な福祉を提供しないつもりだ。
私たちが指定した行政員の採用手配と
私たちは私たちが任命したすべての幹部たちと雇用協定や招聘書を締結した。また、企業統制権の変更により自発的に雇用関係を終了するのではなく、雇用終了時の何らかの支払いや福祉を規定する業務合併に関する役員離職計画(“役員離職計画”)を採択した。カベさん氏とアペルボームさん氏を除くすべての出席者が出席された幹部離職計画に参加し、もしあれば、役員離職計画の条項は、指名された役員招聘状の解散費条項に代わることになる。
雇用契約と招聘書
以下はカベさん、アペルボムさん、バーマン博士、ウィンホルダーさんと締結された雇用契約および招聘状の適用に関する具体的な条項です.
フランク·カーベそれは.同社は、Appelbaumさんが離職した日(後述)に、当社とFrank Karbeとの雇用契約(“Karbe雇用契約”)を、社長兼当社のCEOに委任し、2022年7月5日から発効させると発表しました。
Karbe雇用契約によると、Karbeさんは、初期年度の基本給500,000ドルを取得する権利があり、その年間の基本給の50%を目標とする年間業績ボーナスを受け取る資格を持っています。貝さん2022年のボーナスは、カベさんが2022年に当社に雇用する可能性のある日および年限に応じて割り当てられます。
また、取締役会は、以下の期日においてKarbeさんに権限を付与することを承認した:(I)効力発生日の1周年に25%のオプション株式が帰属する時期に基づいて普通株式472,200株式を購入するステップと、残りの部分は、今後3年以内に月額分割により、当該帰属日毎に引き続き当社に雇用されることを前提とする;(I)業績オプションに基づいて、708,300株の普通株式を購入し、当該期間に基づく帰属条件及びいくつかの業績に基づく帰属条件を満たした後に帰属することを承認する。(I)業績オプション(“業績オプション”)および(Iii)業績オプションは、472,200株の普通株を購入し、ある業績マイルストーンに達したときに帰属する(“業績補充オプション”)。Karbe雇用契約で定義された“支配権変更”の発生後、Karbeさんがその日に継続的に雇われた場合、すべての帰属および行使されていないことに基づく持分報酬(業績補足オプションを除く)は直ちに加速され、その日に完全に帰属し、行使可能になり、一方、補完的業績オプションはその日のすぐに失われるであろう。
97
また、“貝貝雇用契約”によれば、(1)貝さんの雇用が“理由”なしで終了した場合、または(2)貝さん雇用契約で定められた“支配期間変更”の外で辞任した場合、貝さんは、次の解散料を受け取る権利があるが、撤回できない退職契約を遵守し、雇用終了後60日以内に離職する必要がある。(A)雇用終了後、現在の基本給を12か月間継続して支給する。(B)当社が当社に提供する健康保険の毎月の雇用主への毎月の支払いに相当する、(C)Karbeさんが当社で採用されている最大12ヶ月に相当する、すべての目標ボーナスの毎月の支払い、および(D)その時点で完了していなかった、および転任されていなかったタイミングでの持分への移行を加速するための25%の報酬と、終了日から6ヶ月以内に業績または条件に到達した任意の業績奨励金に相当する。
(1)貝さんの雇用が“理由”なしに打ち切られた場合、または(2)上記福祉に代えて“支配権変更期間”内に辞任する場合には、貝さんは、その当時の基本給の2倍に相当する一括払いで、撤回できない離職契約を結んで終了した日から60日以内に解雇されることを条件に、次の解散料手当を受ける権利がある。(B)その当時の全年度の目標配当金の額の2倍(又はその直前の支配権変更前に有効であった目標配当金の2倍に相当する)の一回払い、(C)当社が継続して24ヶ月間雇用し続けた場合にあつては、当該会社が提供する健康保険を提供する雇用主への毎月の支払額、並びに(D)その時点で未償還及び未帰属持分奨励金の帰属を100%速める(補完業績オプションを除く)。
ケビン·アペルボムそれは.吾らはAppelbaumさん総裁兼CEOであるAppelbaumさんと、二零二一年四月六日に施行されたAppelbaumさんの役員採用契約(“Appelbaum採用契約”)を締結し、その中でいくつかの条項をわれわれの業務合併終了時に発効させた。Appelbaum雇用契約は、Appelbaumさんの雇用条項と条件を規定し、彼の初期年間基本給が520,000ドルであり、彼の目標ボーナス金額が彼の年間基本給の50%に等しいことを規定しており、取引およびその他のボーナスは、当社の業務統合の完了に応じて、彼が当社の株式インセンティブ計画に参加する資格があるかどうか、および彼が当社の福祉プログラムに参加する資格があるかどうかにかかっています。
また、アペルボーム雇用契約によれば、(1)アペルボームさんの雇用が“支配期間変更”のほかに理由なく中止された場合、(2)“支配期間変更”以外の“正当な理由”で辞任した場合、または(3)“アペールボーム雇用契約”で定義された“良好な離職終了”時に彼が辞任した場合、アペルボムさんは次の解散料を得る権利がある。もし彼が撤回できない退職協定に署名し、終了日後60日以内に釈放された場合、(A)雇用終了後12ヶ月以内に当時の基本給を受け取り続ける、(B)雇用終了後、本人とその扶養者にコブラ保険料を返済し、最大12ヶ月、(C)支払われていない時間ベースの持分奨励と業績ベースの帰属奨励を6ヶ月間加速させる。当該等の業績帰属奨励に応じて帰属する株式数は、当該等の業績帰属報酬に応じて帰属すべき株式数に等しいが、当社が終了日後6ヶ月以内に当該等の適用可能な業績帰属条件に到達するか否かに依存する。
“制御権変更”(Appelbaum雇用契約の定義参照)が完了し、Appelbaumさんがその日まで当社に継続的に雇用される場合には、業績に帰属するすべての株式は、比例配分することなく、目標に応じて時間基準の帰属報酬に変換され、制御権変更が完了した後も毎月ほぼ等しい月賦で(I)関連報酬契約に適用される履行期間が適用される残り時間、または(Ii)制御権変更が完了してから24ヶ月連続(等履行期間等)がない。
アペルボームさんの雇用が“アペールボーム雇用契約”に規定されている“支配権変更”(統制権変更期間)の後12ヶ月以内に終了したり、“十分な理由”で辞任した場合、アペルボムさんは次のような解散料の給付を受ける権利があるが、撤回できない別居合意を履行し、終了した日から60日以内に離職する必要がある:(1)当時の基本給に相当する24ヶ月の一括払い;(2)彼の当時の目標ボーナス機会の200%,(3)本人とその養育者の雇用終了後24カ月に及ぶコブラ保険料の精算と,(4)未返済の持分奨励を100%加速した。
98
守則第280 G条によると、Appelbaum雇用協定により提供される制御権変更に関する支払いや福祉は、当社の連邦所得税減額を得る資格がない可能性がある。“規則”4999条によると、これらの支払いや福祉には消費税が徴収される可能性もある。統制権変更により行政者1人当たりに支払わなければならない金や福祉が規則4999条で徴収された消費税で納税しなければならない場合、その金額や福祉は減額され、この減額は当該行政者に高い税引後純収益をもたらすことになる。
当社は2022年6月7日に、さん総裁、当社の最高経営責任者、および当社の取締役会のメンバーを辞任する2022年7月5日(発効日)から、アペルボームさん社長と合意しました。当社は、Appelbaumさんの離職について、当社とAppelbaumさんとの間で、当社およびその付属会社へのクレームを効果的に解除し、かつ、適用される限定的な契約を遵守し続ける資格があります(I)12ヶ月連続の基本給を取得する資格があります。(Ii)Appelbaumさんが効力発生日から最大12ヶ月以内に当社に雇用される場合、当社は、健康保険を提供するために支払われるべき毎月の雇用主に、(Iii)即時に、償還されていないいくつかの未償還株式に基づく持分報酬を帰属し、効力発生日から起算する。
マーク·バーマン博士それは.私たちはバーマン博士と2015年11月23日に招聘状を締結した(“バーマン招聘書”)。バーマンの招聘書はバーマン博士の仕事を規定し、彼の任期、職責、彼が株式補償を受ける資格があるかどうか、彼が私たちの福祉計画に参加する資格があるかどうかを明らかにした。バーマン博士は私たちの標準的な秘密情報協定に支配されている。
クリスチャン·ウィンホルダーそれは.私は2018年10月9日にWynholdさんと招聘状(“Wynhold招聘書”)を作成した。Wynholdの招聘書はWynholdさんの就職状況を規定し、彼女の雇用期間、職責、彼女が株式補償を受ける資格があるかどうか、そして彼女が私たちの福祉計画に参加する資格があるかどうかをリストした。Wynholdさんは私たちの標準的な秘密情報協定に支配されている。
役員離職計画
“役員離職計画”は、私たちが“原因”(役員離職計画の定義参照)、死亡または“障害”(役員離職計画の定義参照)以外の他の原因で雇用を終了した場合や、合格参加者が“十分な理由”(役員退職計画を参照)で退職した場合、いずれの場合も、“統制権変更”(すなわち、“統制権変更”の日からコントロール権変更一周年の日まで)以外のいずれかの場合には、離職契約の締結および交付契約を前提として、他の条項を除いて、参加者は、(1)会社に有利なクレームを効果的に解除し、離職計画を実行するように“制限契約協定”を再確認する権利がある(1)終了直前に発効した参加者の年間基本給に相当する9カ月の解散費に相当し、9ヶ月以内に支払うことができる。(2)最大9ヶ月の現金支払いは、適用された参加者が引き続き雇用されている場合に、適用される参加者に医療保険を提供する毎月の雇用主に支払うことに相当する。終了日の保険料で計算されます。
幹部離職計画はまた、吾等が非原因、死亡又は障害により雇用を終了したり、資格参加者が十分な理由で退職した場合には、統制権変更期間内に、いずれの場合も、参加者は、上記の支払いや福祉に代わる支払いや福祉を得る権利があり、会社に有利なクレームの効果的な解除と制限的契約の再確認を含む署名·交付離職協定の制約を受けることが規定されている。(I)終了直前に発効した参加者の年間基本給の100%に等しい過現金解散料(又は終了直前の年有効年次基本給が高い場合)。(Ii)は、その終了直前に発効した参加者の年間目標ボーナスの100%に等しい過現金解散費(又は高い場合は、支配権変更直前に発効する年間目標ボーナス)に相当する。(Iii)参加者が終了日後に12ヶ月間継続して雇用されている場合、終了日の保険料に基づいて、健康保険を提供する雇用主に毎月支払うことに相当し、(Iv)参加者によって所有されている時間帰属に基づく会社のすべての未償還および非帰属持分に対して、そのような報酬の付与を完全に加速することに相当する。条件は、任意の業績条件に制約された未完了および未帰属持分奨励は、適用奨励プロトコルに規定された範囲内で既得、行使可能、および/または没収不可能とすることができ、また、適用奨励プロトコルが業績条件制約を受けた未完了および未帰属持分奨励の待遇に関連していない場合、このような持分奨励に適用される業績条件は、適用奨励協定条項に規定された最高レベルが満たされるとみなされる。
99
“規則”第280 G条によると、“役員離職計画”に基づいて提供される統制権変更に関する支払及び福祉は、連邦所得税控除を受ける資格がない可能性がある。“規則”4999条によると、これらの支払いおよび福祉はまた、条件に適合する参加者に消費税を徴収する可能性がある。支配権変更に関連する適格参加者に支払われる支払いまたは福祉が、規則499条に従って徴収された消費税を支払う必要がある場合、このような減少が適用参加者により大きな税引後純収益をもたらす場合、これらの支払いまたは福祉は減額される。
2022年度末の未償還持分奨励
次の表には、2022年12月31日現在、私たちが任命された各役員が保有している未償還持分報酬の情報を示しています。
|
|
オプション奨励(1) |
|
|
株の奨励(2) |
|
||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
権益 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
激励措置 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
権益 |
|
|
平面図 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
激励措置 |
|
|
賞: |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
平面図 |
|
|
市場 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
権益 |
|
|
|
|
|
|
|
|
|
|
|
市場 |
|
|
賞: |
|
|
あるいは…。 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
激励措置 |
|
|
|
|
|
|
|
|
|
|
|
価値がある |
|
|
番号をつける |
|
|
支出.支出 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
平面図 |
|
|
|
|
|
|
|
|
番号をつける |
|
|
のです。 |
|
|
のです。 |
|
|
価値があります |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
賞: |
|
|
|
|
|
|
|
|
のです。 |
|
|
株 |
|
|
労せずして得る |
|
|
労せずして得る |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
番号をつける |
|
|
|
|
|
|
|
|
株 |
|
|
あるいは…。 |
|
|
株は、 |
|
|
株は、 |
|
|||||||||
|
|
|
|
|
|
量 |
|
|
量 |
|
|
のです。 |
|
|
|
|
|
|
|
|
あるいは単位 |
|
|
職場.職場 |
|
|
単位や単位 |
|
|
単位や単位 |
|
|||||||||
|
|
|
|
|
|
証券 |
|
|
証券 |
|
|
証券 |
|
|
|
|
|
|
|
|
在庫の |
|
|
在庫品 |
|
|
他にも |
|
|
他にも |
|
|||||||||
|
|
|
|
|
|
潜在的な |
|
|
潜在的な |
|
|
潜在的な |
|
|
|
|
|
|
|
|
それは |
|
|
それは |
|
|
権利.権利 |
|
|
権利.権利 |
|
|||||||||
|
|
|
|
|
|
体を鍛えていない |
|
|
体を鍛えていない |
|
|
体を鍛えていない |
|
|
選択権 |
|
|
|
|
|
ありますか |
|
|
ありますか |
|
|
彼らは持ってる |
|
|
彼らは持ってる |
|
|||||||||
|
|
|
|
帰属.帰属 |
|
オプション |
|
|
オプション |
|
|
労せずして得る |
|
|
トレーニングをする |
|
|
選択権 |
|
|
注釈 |
|
|
注釈 |
|
|
注釈 |
|
|
注釈 |
|
|||||||||
|
|
グラント |
|
発効日 |
|
(#) |
|
|
(#) |
|
|
オプション |
|
|
値段 |
|
|
満期になる |
|
|
既得 |
|
|
既得 |
|
|
既得 |
|
|
既得 |
|
|||||||||
|
|
日取り |
|
日取り |
|
練習可能である |
|
|
行使できない |
|
|
(#) |
|
|
($) |
|
|
日取り |
|
|
(#) |
|
|
($)(3) |
|
|
(#) |
|
|
($)(3) |
|
|||||||||
フランク·カーベ |
|
7/5/2022 |
|
7/5/2022 |
|
|
— |
|
|
472,200 (4) |
|
|
708,300 (5) |
|
|
|
1.68 |
|
|
7/5/2032 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|||
|
|
7/5/2022 |
|
7/5/2022 |
|
|
— |
|
|
|
— |
|
|
472,200 (6) |
|
|
|
1.68 |
|
|
7/5/2032 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
ケビン·アペルボム |
|
4/6/2021 |
|
4/6/2021 |
|
|
98,704 |
|
|
98,704 (7) |
|
|
|
— |
|
|
|
11.38 |
|
|
4/6/2031 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
マーク·バーマン博士 |
|
2/4/2019 |
|
12/7/2018 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
29,601 (8) |
|
|
|
32,709 |
|
|
|
— |
|
|
|
— |
|
|
|
|
4/6/2021 |
|
4/6/2021 |
|
|
36,574 |
|
|
51,167 (7) |
|
|
|
— |
|
|
|
11.38 |
|
|
4/6/2023 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
|
|
4/1/2022 |
|
4/1/2022 |
|
|
— |
|
|
116,700 (4) |
|
|
|
— |
|
|
|
1.97 |
|
|
4/1/2032 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
クリスチャン·ウィンホルダー |
|
8/14/2020 |
|
2/1/2020 |
|
|
20,134 |
|
|
8,291(4) |
|
|
|
— |
|
|
|
0.47 |
|
|
8/13/2030 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
|
|
4/6/2021 |
|
4/6/2021 |
|
|
32,126 |
|
|
49,955(7) |
|
|
|
— |
|
|
|
11.38 |
|
|
4/5/2031 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
|
|
4/1/2022 |
|
4/1/2022 |
|
|
— |
|
|
116,700 (4) |
|
|
|
— |
|
|
|
1.97 |
|
|
4/1/2032 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
||
100
従業員福祉と持分補償計画と手配
2020年株式オプションと贈与計画
私たちの2020計画は、私たちの従業員および私たちの子会社の任意の従業員に奨励株式オプションを付与し、私たちおよびその子会社の従業員、高級管理者、取締役、コンサルタントに奨励株式オプション、非制限株式オプション、制限株式、非制限株式および制限株式単位報酬を付与することを可能にします。我々の2020年計画は、我々の業務合併(“終了”)の終了により終了するため、終了後、2020計画によると、将来発行可能な株式はありません。私たちの2020計画はこの計画に基づいて授与された未完成の賞を管理し続けるだろう。
2020年計画によると、私たちは発行のために合計902,775株の普通株を予約しました。予約発行の普通株式数は、株式配当、株式分割または株式グループ(逆株式分割を含む)、資本再編または株式再構成を構成する他の資本構造変化が発生した場合に調整される可能性があり、奨励株式オプションによっては902,775株を超えない可能性がある。
2020計画は私たちの取締役会または取締役会によって任命された委員会によって管理される。その他の事項を除いて、計画管理人は、奨励を受ける資格のある個人の中から奨励が付与される個人を選択する権利が完全にあり、株式奨励の行使または授与時間を速め、2020年計画を改訂し、2020年計画の規定に基づいて各奨励の具体的な条項と条件を決定する。計画管理者は、2020計画下の未償還オプションの行使価格を低減するために、またはそのような未償還オプションを廃止し、キャンセルされたオプションの代わりにそのような所有者に新たな報酬を与えることによって再価格を再設定するために、その自由裁量権を行使することができる。
101
私たちの2020年計画によると、株式オプションは付与されることができる。すべてのオプションの1株当たりの発行権価格は、授与日に私たちの普通株の1株当たりの公平な市場価値の少なくとも100%に等しくなければならない。奨励株式オプションの期限は十年を超えてはいけません。参加者に付与された奨励株式オプションは、付与された日に私たちのすべての種類の株式総投票権の10%以上を有する場合、または任意の付属会社は、その期間が5年を超えてはならず、授与日に私たちの普通株式1株当たりの公平な市場価値の少なくとも110%の行使価格を有しなければならない。計画管理者は、現金、株式、またはいくつかの他の財産または計画管理者が許容可能な他の考慮要因を含む可能性があるオプション価格の支払い方法を決定するであろう。参加者がサービスを終了すると,参加者は一般にサービス終了日から90日以内に選択権を行使することができる.終了が死亡や障害のためであれば,終了日に与えられた範囲では,選択権は終了1周年まで一般的に行使可能である.しかし、どんな場合でも、オプションの行使はその任期満了より遅くなってはならない。終了に理由があれば、オプション受給者が終了した日に自動的に無効になります。
私たちの2020年計画によると、制限株式は付与されることができる。制限株式奨励は私たちの普通株に対する付与であり、譲渡可能性と没収条項の制限を含む様々な制限を受けている。計画管理人が制定した条項及び条件により、制限株の株式が付与され、このような株に対する制限は失効する。
私たちの2020年計画によると、非限定的な株式は付与されることができる。無制限株式報酬は、過去のサービスまたは他の有効な対価格を表彰するために参加者に付与することができ、その参加者に当然の現金補償の代替とすることができる。
私たちの2020年計画によると、制限株式単位は付与されることができる。限定株式単位は、私たちの普通株のいくつかをカバーした報酬であり、これらの株は、現金を獲得する際に対象株式または両方を発行することで決済される可能性がある。計画管理人は、付与された単位数、帰属基準(指定された業績基準を達成すること、または継続してサービスを提供することを含むことができる)および支払いの形態および時間を含む制限株式単位の条項および条件を決定する。
私たちの2020年計画では、一般的に譲渡や奨励の分配は許可されていません。計画管理人が直系親族、家族の利益のために設立された信託基金やそのような家族が唯一のパートナーの共同企業でなければ、受賞者だけが生きている間にこのような奨励を行使することができます。
もし私たちの資本が何らかの変化があれば、購入株権の制約を受けていない株式の行使価格と数量、および未償還報酬を受けた株式の購入価格と数量は比例して調整され、これは取締役会または私たちの株主が取る必要な行動に依存する。
“2020年計画”は、“2020年計画”の定義によると、“売却事件”が発効した後、買収側または後続エンティティは、2020年計画下の未完成奨励を負担、継続、または代替することができると規定している。2020年計画に基づいて付与された奨励が継承エンティティによって負担、継続または置換されていない場合、2020年計画に基づいて付与されたすべてのオプションおよび他のすべての奨励は終了しなければならない。このような終了の場合、オプションを有する個人は、販売活動の前(行使可能な範囲内)でそのようなオプションを行使することが許可される。また、売却イベントで2020計画を終了する場合には、(A)既得および行使可能なオプションの場合、(1)売却イベントにおいて株主に対応する1株当たりの現金対価格(計画管理者によって決定される)にオプションがキャンセルされた株式数を乗じた差額に等しい現金支払いまたは規定することができ、(2)オプションの総行権価格と、(B)限定株式および限定株式単位報酬の場合、売却イベントにおいて株主に付与される1株当たりの現金対価には、当該等の株式に報酬を付与しなければならない株式株数を乗じなければならない(売却事件発生時又は後で奨励金が付与された場合に支払われる)。我々の2020計画に基づいて発行された制限株が没収された場合、このような制限株は、そのような株式受取者が支払う元の1株当たりの買い取り価格に相当する1株当たりの価格で所有者から買い戻すべきである。また、取締役会は適宜決定することができ、任意のオプションに関する仮定オプションまたは支払いは、取引合意中の任意の信託、抑留、賠償、利益または類似条項によって制限されなければならず、このような条項は当社の普通株式所有者に適用される。取締役会は2020年の計画が終わった後に他の奨励金を与えないことを決定した。2022年12月31日現在、2020計画に基づき、最大530,611株の普通株を購入したオプションは返済されていない。
2015年株式インセンティブ計画
2015年6月、Better Treateutics LLC取締役会は2015年計画を採択した。当社が2020年に行う企業再編については、すべての普通株と利益権益単位奨励(2015年計画を定義する)が廃止され、その2020年計画に従って従来のBTXの普通株と制限的な株式で交換されている。当社は二零二年に企業再編を行った後、二零一五年計画の下で何の奨励も与えられません。
102
Better Treateutics、LLCおよびその子会社の従業員、役員、コンサルタントは2015年計画に参加する資格がある。
Better Treateutics,LLCの取締役会は2015年計画を管理している。計画管理人は、受賞者を選択し、奨励の規模、タイプ、条項を決定し、計画を説明し、規則を規定、改正、廃止し、2015年の計画を管理するために必要または望ましい他のすべての決定を下す権利がある。
2015年計画では最初に1,664,097の一般単位が保持されており,この計画に応じて奨励金として支給されることができる。奨励金が付与されずに没収された場合、2015年計画に基づいて将来的に基本共通単位を付与することができる。2015年計画に基づいて発行された奨励は、有限責任会社協定または運営協定の条項および条件、2015年計画の条項および条件のより良い治療によって制限される。
任意の資本再構成、再編、合併、共通単位の分割、Better Treateuticsの買い戻しまたは交換、LLCの公共単位または他の証券、または公共単位のBetter Treateutics、LLCの他の資本構造変化に影響を与える場合、計画管理者は、2015年計画の下で交付される可能性のある共通単位の数およびカテゴリ、および/または各未完了報酬によってカバーされる共通単位の数、カテゴリ、および分配敷居を調整する。“売却企業”の場合(経営協定で定義されているように)、2015年計画では、各未完成の報酬は、経営協定および企業売却を規範化するプロトコルに制限され、(1)報酬は、継承会社によって負担または置換されることと、(1)報酬は、継承会社が負担または置換することと、のうちの1つを規定することができる。(2)支払われていない賠償金は、(A)各利益利息単位の現金および/または財産と引き換えに終了され、当該単位は、売却企業内の1つの共通単位の価値から分配閾値を減算するか、または(B)他の権利によって置換されるか、または計画管理者によってその個別の適宜決定権に基づいて適切に選択される、(3)上記の任意の組み合わせ。2015年計画によると、未解決の賞はない。
遺言や世襲や分配法を除いて、2015年計画下の奨励は一般的に譲渡できない。2015計画下の報酬は、運営プロトコル(“運営プロトコル”)に記載されている譲渡制限、およびBetter Treeutics、LLC取締役会が決定した任意の特別な没収条件、買い戻し権利、優先購入権、または他の譲渡制限によって制限されなければなりません。
Better Treateutics,LLCの取締役会は2015年計画を随時修正または修正する権利がある;条件は、いかなる係属中の裁決下の権利に悪影響を与える修正も、この裁決保持者の同意を得る必要があるということである。2015年度計画は、当社が2020年に企業再編を行うことにより終了しました。
Better Treateutics,Inc.2021年株式オプションとインセンティブ計画
私たちの2021年は、終値前に取締役会で採択され、株主の承認が待たれ、終値前日(“2021年計画発効日”)に発効する予定です。2021年計画では、役員、従業員、役員、コンサルタントへの株式および持分ベースのインセンティブ奨励を可能にします。取締役会は、同社等に当社の直接株式を提供することで、当該等の人々の利益が当社および当社株主の利益とより緊密に一致することを確保し、当社を代表して努力することを刺激し、引き続き当社に残る意思を強化することを期待している。
2021計画(“初期限度額”)に基づいて奨励金を発行するために、360万株の当社普通株を予備的に予約しました。2021年計画では、2022年1月1日から、2021年計画に基づいて保留·発行可能な株式数は、12月31日までの会社普通株流通株式数の5%または計画管理人が決定した比較的小さい金額(“年度増加”)を自動的に増加させることが規定されている。この限度額は、再編、資本再編、再分類、株式分割、株式配当、非常に現金配当、逆株式分割、または会社資本の他の同様の変化時に調整することができる。2021年計画に基づいて奨励的株式オプションを行使して発行可能な会社普通株の最大総数は、2022年1月1日及びその後毎年1月1日に累計増加した初期限度額又は会社普通株3600,000株を超えてはならず、年間増加額の中の小さい者を基準とする。2021年計画または2020計画下の任意の奨励関連株式は、没収され、抹消され、オプションまたは決済奨励を行使する際に差し押さえられ、実行価格または源泉徴収の支払いのために差し押さえられ、当社が帰属前に再買収し、未発行株式の場合に満たされた場合、または他の方法で終了する(行使を除く)場合には、2021計画の下で発行可能な株式に再計上され、規則422節およびその下で公布された法規の許容範囲内で奨励株式オプションとして発行される株式である。
2021年計画には、任意の例年、2021年計画下のすべての報酬および会社が任意の非従業員取締役に支払う他のすべての現金報酬の価値が750,000ドルを超えてはならないという制限が含まれているが、非従業員取締役が最初に会社の取締役会メンバーに任命された場合、この額は1,000,000ドルとなる。
103
2021計画の条項によると、2021計画は、会社取締役会報酬委員会、会社取締役会、または他の同様の委員会によって管理されることができる。計画管理人は最初は取締役会の報酬委員会であり、他を除いて、報酬を獲得する資格のある個人の中から賞を授与する個人を選択し、参加者に対して任意の奨励組み合わせを行い、2021年計画の規定に基づいて各奨励の具体的な条項と条件を決定する権利がある。計画管理人は、1人以上の上級管理者(最高経営責任者を含む)からなる委員会に権限を付与することができ、取引法第16条の報告および他の条項に拘束されていない従業員および認可委員会のメンバーではない従業員に株式オプションおよび他の報酬の権限を付与することができるが、いくつかの制限およびガイドラインの制限を受ける必要がある。2021計画に参加する資格のある者は、計画管理人のために適宜選択した当社及びその付属会社の高級管理者、従業員、非従業員取締役及びコンサルタント。
“2021年計画”は、会社普通株を購入するオプションと、この基準第422条に規定する奨励株式オプション資格を満たしていないオプションとを付与することを許可する。2021計画により付与されたオプションは、奨励性株式オプションの資格を満たしていない場合、又は奨励性株式オプションの年間制限を超えた場合、不適格オプションとなる。奨励株式オプションは当社とその子会社の従業員にしか付与できません。
2021年計画によると、奨励を受ける資格のある人は誰でも非限定オプションを得ることができる。各オプションの実行権価格は計画管理人によって決定されるが、通常は付与された日の会社普通株公平時価の100%を下回ってはならず、10%株主に付与された奨励的株式オプションであれば、その株式公平時価の110%を下回ってはならない。各オプションの期限は、私たちの計画管理者によって決定され、付与された日から10年を超えてはいけません。計画管理者は、そのような選択権の付与を加速する能力を含む、いつまたは複数の時間に各選択権を行使することができるかを決定するであろう。
オプションを行使する際には、オプション行の権利価格は、現金、認証された銀行小切手、または計画管理者が許容可能な他のツール、またはオプション受給者によって権利を制限されずに所有されている会社の普通株式または公開市場で購入された方法で全額支払われなければならない。法律の適用に該当する場合には、仲買業者も引受人が取り消すことのできない指示に基づいて仲買業者に行使価格を渡すことができる。また、計画管理人は、オプション譲渡者が発行した株式数を最大総数に減少させ、その公平な市場価値が総権価格を超えない“純行権”を使用して制限されないオプションを行使することを許可することができる。
計画管理人は株式付加価値権を付与することができるが、計画管理人が決定可能な条件や制限の制限を受けることができる。株式付加価値権は、受給者に会社の普通株や現金を獲得する権利を持たせ、私たちの株価の行使価格に対する付加価値に相当する。執行権価格は一般的に付与日会社の普通株式公允時価の100%を下回ってはならない。各株式付加価値権の期限は計画管理人によって決定され、付与された日から10年を超えてはならない。計画管理人は、各株式付加価値権がいつまたは複数の時間に行使できるかを決定するだろう。
計画管理人は、会社普通株の制限株式及び制限株式単位を参加者に付与することができるが、その決定の条件及び制限の制限を受けることができる。これらの条件および制限は、いくつかの業績目標を達成すること、および/または特定の帰属中に私たちに雇用され続けることを含むことができる。計画管理人はまた、2021年計画のいかなる制限も受けない会社普通株を付与することができる。過去のサービスを表彰するために、または他の有効な価格で、参加者に無制限株式を付与することができ、参加者に支払われるべき現金補償の代わりに無制限株式を発行することができる。計画管理者は参加者に配当等価権を付与し,受給者が指定された数の会社普通株を保有している場合に支払われる配当金の信用を得る権利を有することができる.
計画管理人は2021年計画に基づいて参加者に現金による奨励を付与することができ、条件はいくつかの業績目標の実現である。2021年計画は,計画管理者に以下の条件を満たす普通株式数を適切に調整することを要求する
2021年計画、2021年計画におけるいくつかの制限、および株式配当金、株式分割、非常に現金配当金、および類似の事件を反映した任意の未償還報酬。
104
“2021年計画”は、“2021年計画”の定義に基づいて、買収側または後続エンティティが“2021年計画”に規定されている未完成奨励を負担、継続、または代替することができると規定している。“2021年計画”に基づいて付与された報酬が相続人エンティティによって負担されていない、継続または置換されていない範囲内で、“2021年計画”に基づいて付与されたすべての報酬は終了しなければならず、この場合、奨励協定に関する別の規定がある以外、販売活動の発効直前に付与されなかった、および/または行使可能な、時間的帰属条件または制限を有するすべての株式オプションおよび株式付加権は、販売イベントが発効したときから完全に帰属して行使可能であり、時間ベースの帰属条件または制限を有する他のすべての報酬は、販売イベントが発効したときから完全に帰属して没収することができなければならない。業績目標の達成に関する条件及び制限のすべての奨励は、取締役会が適宜決定することができ、又は関連する奨励協定に規定された範囲内で、販売活動に関連する場合には既得及び没収不可の奨励となる。このような終了の場合、オプションおよび株式付加価値権を有する個人は、(A)そのような報酬毎に現金または実物で支払いを受け、その金額は、売却イベントで株主に支払われた1株当たりの現金対価格から適用される1株当たりの行使価格を減算することに等しい(ただし、行使価格が売却イベントで株主に支払われた1株当たりの現金対価格以上である場合。当該等引受権または株式付加価値権は無償で廃止される)または(B)売却前の指定時間内に当該等引受権および株式付加価値権(行使可能な範囲内)の行使が許可される。計画管理人には,他の奨励金を持つ受贈者に現金または実物支払を支払う権利(その全権裁量権で)があり,その金額は,売却事件で株主に支払われた1株当たりの現金対価格にこのような奨励項を乗じた既得株式の数に等しい.
2021年計画の参加者は、オプションまたは株式付加価値権の行使または他の奨励を付与する際に、会社または当社の子会社に任意の連邦、州または地方税を支払うことを法律で要求する責任があります。計画管理人は会社または私たちの子会社の任意の源泉徴収義務の全部または一部を源泉徴収会社の普通株の適用実体によって履行させることができ、1つの裁決に基づいて、いくつかの株を発行し、その総公平市場価値は支払うべき源泉徴収金額を満たす。計画管理人はまた、会社または私たちの子会社の任意の源泉徴収義務の全部または一部を、任意の裁決に基づいて発行された一定数の株を直ちに売却し、売却した金を会社または我々の子会社に送金することを要求することができ、金額は満期の源泉徴収金額を満たすことになる。
2021年計画“は、遺言、相続法および分配法または家族関係令に基づく限り、一般に譲渡または譲渡奨励は許可されていないが、計画管理者は、贈与の方法で不適格な株式オプションを直系親族、家族の利益のための信託基金、またはこれらの家族が唯一のパートナーである共同企業に譲渡することを許可することができる。
計画管理人は、2021年計画を修正または終了することができ、計画管理人は、法律の変更または任意の他の合法的な目的を満たす目的で、未解決の裁決を修正またはキャンセルすることができるが、保持者の同意を得ず、そのような行動は、裁決下の権利に実質的かつ不利な影響を与えてはならない。2021年計画のいくつかの改正は会社の株主の承認を得る必要があるだろう。
2021年計画が発効した日から10年後、2021年計画に基づいて何の奨励も与えてはならない。2022年12月31日現在、2021年計画により、最大3,268,612株の普通株を購入するオプションが発行されている。
Better Treateutics Inc.2021従業員株式購入計画
私たちの2021年ESPPによると、全部で28万株が保留され、発行することができます。2021年ESPPは、2022年1月1日から、この計画に基づいて保留·発行可能な株式数を自動的に56万株の会社普通株のうち小さい者、12月31日直前の会社普通株発行済み株式数の1%、または計画管理人が決定したより小さい金額に増加させると規定している。もし我々の資本構造が株式配当、流通株分譲や類似事件によって変化すれば、2021年にESPPが発行可能な株式数に応じて適切に調整される。
2021年にESPPは、取締役会によって任命された1人以上の人によって管理されることができます。計画管理人は最初は取締役会の報酬委員会であり、2021年のESPPに関する規則と法規を制定、管理、解釈するための完全な権力を持っていた。
105
2021年のESPPに参加することを指定された会社または私たちの子会社のいずれの従業員も、その従業員が通常週20時間以上働いている限り、2021年のESPPに参加する資格がある。2021年ESPPに参加するために当社の普通株または自社普通株を保有または購入するオプションを所有または保有または保有する者は、合計して、当社または任意の親会社または子会社のすべてのカテゴリ株式総投票権または総価値の5%以上に相当し、2021年ESPPに参加する権利がある。従業員は、2021年の従業員持株計画に基づいて付与されたオプションを行使してはならず、このオプションは、従業員が毎年25,000ドルを超える会社の普通株式を購入することを可能にする(このオプションを付与した場合の株式の公平な市場価値決定を使用する)。
2021年のESPPへの参加は、2021年のESPP基本給に等しいライセンス賃金控除の全パーセントの適格社員に限られています。従業員は賃金控除を許可することができ、最低は基本給の1%、最高は基本給の15%である。従業員が2021年のESPPの参加者になると、従業員は、2021年にESPPを脱退し、2021年のESPPに参加する資格を満たしていない、またはその雇用が終了するまで、以下に説明する連続提供期間に自動的に参加する。
給与委員会が別途決定しない限り、2021年の従業員持株計画によると、会社の普通株の発売は24カ月間となり、これを“発売期間”と呼ぶ。各製品には1つ以上の購入期間が含まれるだろう。2021年のESPPによる発行は、一般に毎年12月1日以降の第1取引日に開始され、2年後の11月30日またはそれまでの最終取引日に終了する。また、2021年のESPPによる単独発行は、通常、毎年6月1日以降の第1取引日に開始され、2年後の5月31日またはそれ以前の最終取引日に終了する。計画管理者が別途決定しない限り、各製品は4つの購入期間に分けられる。株は購入期間ごとの最終営業日に購入され、この日は“行権日”と呼ばれる。計画管理者は、2021年のESPPに基づいて、異なる提供期間または行使日を決定することができる。
計画管理者が別の決定をしない限り、参加者は一度に1つの製品にしか参加できない。計画管理人が発売日前に自分で他の選択をし、複数の購入期間が発売されている範囲内で、適用法が許可されている範囲内で、発売中の任意の行使日の普通株の公平時価が発売日の普通株の公平時価を下回っている場合を除き、発売されたすべての参加者は、その行使日に選択権を行使した直後に自動的に発売を終了し、それに続く発売中に自動的に再登録し、前回の発売は発売初日に終了する。
購入期間ごとの権利日において、従業員は、以下の最低行権価格で当該引受権を行使しているとみなされる:(I)複数の自社普通株株式、その計算方法は、従業員の権利日の累積賃金減額または供出金を行権価格で割る;(Ii)自社普通株株式数、すなわち25,000ドルを発売初日普通株の公平市価で割るか、または(Iii)計画管理人が発売前に定めた数の少ない数である。執行権価格は(I)当社の普通株の要件期間初日の1株当たり公平時価の85%或いは(Ii)当社の行使日の1株当たり普通株公平時価の85%に等しく、両者は小さい者を基準とする。
一般に、1人の従業員がある行使日に参加者でなくなった場合、その従業員のオプションは自動的に終了し、その従業員の累積賃金控除金額を返金する。
事前に計画管理者の許可を得ない限り、参加者は、任意の購入期間中に彼または彼女の賃金減額を増加または減少させることはできないが、次の購入期間中の少なくとも15の作業日前に、彼または彼女の次の購入期間に関する賃金減額を増加または減少させるために新しい保険契約表を提出することができる。参加者はまた、次の提供期間の前に少なくとも15営業日前に新しい保険加入表を提出して、次の提供期間における賃金減額を増加または減少させることができる。参加者は、将来の発売期間に参加する資格に影響を与えることなく、いつでも発売期間を脱退することができる。参加者がある提供期間から退出した場合、参加者は、同じ提供期間に再参加することはできないが、その後の提供期間に登録することができる。従業員の退職は、2021年のESPPによる退職通知を計画管理者が受け取った日から次の給与期間から発効する。
106
“販売イベント”が完了した場合、計画管理人は、2021年ESPPまたは2021年ESPP下の任意の権利に従って、以下のいずれか1つまたは複数の行動をとるか、またはそのような取引またはイベントに便宜を提供することができる。(A)規定(I)は、一定額の現金(あれば)と交換するために、任意の未償還オプションを終了する。オプションが現在行使可能である場合、または(2)まだ行使されていないオプションを計画管理者がその全権で適宜選択する他のオプションまたは財産を使用する場合、そのオプションを行使する際に得られるべき額に相当する。(B)2021年特別引出権計画下の未償還引受権は、相続人又は存続法団又はその親会社又は付属会社が負担すること、又は相続人又は存続法団又はその親会社又は付属会社をカバーする類似引受権によって置換され、株式の数及び種類及び価格を適切に調整することができる。(C)当社の普通株式株式(又は他の証券又は財産)の数及び種類を調整するが、2021年の特別引出権計画下で引受権を償還していない規定及び/又は後日付与可能な未償還引受権及び引受権の条項及び条件の規定;(D)オプションに関連する要約および任意の適用された購入期間が短縮されることを規定する方法は、その日にこのような要約または適用の購入期間を終了する新たな行使日を設定することであり、および(E)行使されていないすべてのオプションは行使せずに終了すべきであり、参加者口座中のすべての金額は直ちに返却すべきであると規定する。
2021年のESPPは、2021年のESPP発効10周年で自動的に終了します。会社の取締役会は2021年のESPPを随時適宜終了または改訂することができる。
上級管理職現金奨励金計画
当社取締役会は“上級管理職現金奨励ボーナス計画”(以下、“ボーナス計画”と略す)を可決し、終値日から発効した。ボーナス計画は、我々の給与委員会が設定した業績目標の達成状況に応じて、現金ボーナスを支払うことを規定している。支払目標は、わが社の財務及び運営措置又は目標、又は会社の業績目標、並びに個人業績目標に関連する。
報酬委員会は、研究、臨床前、非臨床、開発、出版、臨床または規制マイルストーン、科学または技術進歩、研究開発能力、キャッシュフロー(経営キャッシュフローおよび自由キャッシュフローに限定されないが含む)、収入、会社収入、利息、税項目、減価償却および償却前の収益を差し引く;純収益(損失)(利息、税項目、減価償却および/または償却前または償却後)、会社普通株の市場価格変化、経済付加価値、許可証、協力、合弁または販売促進手配を含む買収または戦略取引の中から会社の業績目標を選択することができる。融資または他の融資取引、営業収入(損失)、資本、資産、株式または投資リターン、株主リターン、販売リターン、株主総リターン、毛利または純利益レベル、生産性、費用、効率、利益率、経営効率、重要な第三者への満足度またはそれに関連する他の業績指標、運営資金、会社普通株1株当たり収益(損失)、予約、新規予約または更新、販売または市場シェア、処方または処方医の数、カバー範囲決定、リーダーシップ発展、従業員留任、求人およびその他の人的資源事項;営業収入および/または年間経常純収入のいずれかは、(A)絶対値または任意の増分増加と比較することができ、(B)成長で測定し、(C)別の企業または同業グループの業績と比較して、(D)市場全体に対して、および/または適用可能な市場指数と比較して、および/または(E)税引前または税引後ベース(例えば、適用される)で測定することができる。
ボーナス計画に選ばれた各幹部は、業績期間ごとに目標ボーナス機会を設定する。ボーナス式は、各業績期間中に報酬委員会によって採用され、実行幹事一人ひとりに伝達される。会社の業績目標は、当社の財務報告発表後の各業績期間終了時または報酬委員会が決定した他の適切な時間に測定されます。会社の業績目標と個人業績目標を達成すれば、当該等業績期間終了後に早急に支払いを行うが、その業績期間が終了した会計年度終了後の2ヶ月半に遅れることはない。報酬委員会が別途決定しない限り、執行者と私たちとの間の任意の合意に記載された権利の規定の下で、執行者はボーナス支払い日に私たちに採用されなければならず、ボーナス支払いを受ける資格がある。ボーナス計画はまた、報酬委員会が役員への追加ボーナスの完全な承認を許可し、報酬委員会に適切と思われるボーナス額を適宜調整する権限を与えることも可能である。
役員報酬
非従業員役員報酬政策
我々の業務合併については、以下に述べる非従業員取締役報酬政策を承認し、報酬を当社の業務目標及び株主価値の創造と一致させるとともに、会社の長期的な成功に貢献した取締役を誘致、保留、激励、奨励することを目的としている。
107
この政策によると、私たちの非従業員取締役は、現金事前招聘金(一部のサービス年限内に比例して計算する)と以下に述べる持分報酬を得る資格がある
取締役会メンバーの年間採用費 |
|
|
|
|
取締役会の年間サービス |
|
$ |
40,000 |
|
非執行議長としての年間サービスの追加採用費 |
|
$ |
30,000 |
|
毎年取締役会の首席取締役を務める追加招聘 |
|
$ |
15,000 |
|
委員会メンバーの追加年間採用費 |
|
|
|
|
監査委員会の議長を務める年資 |
|
$ |
15,000 |
|
監査委員会のメンバーを務める年資(議長を除く) |
|
$ |
7,500 |
|
給与委員会の議長を務める年資 |
|
$ |
10,000 |
|
給与委員会のメンバーを務める年資(議長を除く) |
|
$ |
5,000 |
|
指名·管理委員会の議長を務める年間サービス |
|
$ |
8,000 |
|
指名及び管理委員会のメンバーを務める年資(議長を除く) |
|
$ |
4,000 |
|
また、私たちの政策では、最初の選挙または取締役会メンバーに任命された場合、各新しい非従業員取締役には、30,000株の私たちの普通株を購入するための非法定株式オプションが付与されます(“取締役初期付与”)。主任の初期贈与は、贈与日1周年に1/3が付与され、次の2年間はほぼ等しい毎月分割払いで授与されます。当社の業務合併完了後の株主周年総会日ごとに、大会後に非従業員取締役を継続する非従業員取締役ごとに、15,000株の自社普通株を購入する不正注文持分の年間奨励(“取締役年度付与”)が付与される。新たな非従業員取締役が株主年次会議の間に取締役会に加入する場合、当該非従業員取締役は、次の株主年次総会で取締役年間補助金の一部を比例して取得することになり、この割合は、取締役の任命と次の株主総会との間の時間に基づく。取締役年度贈与は,授与日の1周年記念日または我々の次年度株主総会の日(早い者を基準とする)に全額付与される。取締役初期授権額および取締役年度授権額は当社を売却した後に帰属を全面的に加速させる必要があります。上記株式オプションはすべて付与され、1株当たりの行使価格は付与された日の私たちの普通株の公平な市場価値に等しく、期限は10年である。
当社の任意の非従業員取締役は1つの例年期間に支払われた補償総額、株式補償及び現金補償を含み、この人が非従業員取締役になった最初の例年750,000ドルを超えないが、他の例年では1,000,000ドルを超えない。
私たちは取締役会またはその任意の委員会会議に出席して発生したすべての合理的な自己負担費用を精算します。
従業員役員はその役員のサービスのために追加的な報酬を得ないだろう。
執行議長その他の合意
我々の業務統合を完了する前に、我々はペリーさんと執行議長契約(“ペリー合意”)を締結し、取締役会の執行議長としての標準雇用条項を規定し、当初260,000ドルの年間基本給を含み、フルタイム社員に提供される医療·福祉サービスに参加する資格があり、28,300株の普通株式を購入する非限定的な株式オプション(“初期オプション”)を予備付与し、付与日の1周年に3分の1を付与し、翌2年以内に月平均月賦で月賦で付与することになった。ペリーさんが適用されるすべての帰属日について取締役会のメンバーを継続することに準じて;販売イベント(“ペリー合意”で定義されるように)が発生した場合、初期選択権は完全に付与されるべきである。最初の株式購入に加えて、会社の年次株主総会において、ペリーさんがその後も取締役会のメンバーを務めていれば、年度会議日に我々の普通株式を11,800株購入するための非法定株式オプションの付与を受けることになる(“年度付与”)。年次授与は(I)授与日の1周年又は(I)会社の次の年次株主総会の日(早い者を基準とする)に全額付与されるが,ペリーさんはその授与日に引き続き当社の取締役会のメンバーを担当しなければならない;当該年次付与は売却事件が発生した場合に完全に帰属するものとすることを前提とする。ペリー契約はペリーさんが会社標準フォーマットの制限契約契約を締結することを要求します。
108
当社は2022年6月7日に、AppelbaumさんとAppelbaumさんが発効日から当社の社長兼CEO兼取締役会のメンバーになることを中止することに同意しました。また、取締役会は、2022年6月8日に、Appelbaumさんの離職により生じた穴を埋めるため、2023年の株主総会またはその以前の辞任または免職までの任期を、Karbeさん取締役に委任します。
役員報酬表
次の表には、2022年度に我々の取締役会の取締役を務める各取締役の総報酬を示しています。
KarbeさんとAppelbaumさんは、取締役会でのサービスのために、会社から追加報酬を取得していません。カベさんとさん·アペルボームは、任命された役員報酬として上記の“役員報酬-2022年報酬合計表”に記載されている
|
|
稼いだ費用や |
|
|
在庫品 |
|
|
選択権 |
|
|
他のすべての |
|
|
|
|
|||||
|
|
現金で支払う |
|
|
賞.賞 |
|
|
賞.賞 |
|
|
補償する |
|
|
合計する |
|
|||||
名前.名前 |
|
($) |
|
|
($) |
|
|
($)(1) |
|
|
($) |
|
|
($) |
|
|||||
アンドリュー·アルマーニノ(2) |
|
|
55,000 |
|
|
|
— |
|
|
|
10,499 |
|
|
|
— |
|
|
|
65,499 |
|
リチャード·カーモナ博士(3) |
|
|
49,000 |
|
|
|
— |
|
|
|
10,499 |
|
|
|
— |
|
|
|
59,499 |
|
エルド·グレンジャー博士(4) |
|
|
47,500 |
|
|
|
— |
|
|
|
10,499 |
|
|
|
— |
|
|
|
57,999 |
|
Risa Lavizzo-Mourey博士(5) |
|
|
50,000 |
|
|
|
— |
|
|
|
10,499 |
|
|
|
— |
|
|
|
60,499 |
|
劉素英博士(6) |
|
|
40,000 |
|
|
|
— |
|
|
|
10,499 |
|
|
|
— |
|
|
|
50,499 |
|
ジェフリー·パーカー(7) |
|
|
55,500 |
|
|
|
— |
|
|
|
10,499 |
|
|
|
— |
|
|
|
65,999 |
|
デビッド·ペリー(8歳) |
|
|
— |
|
|
|
— |
|
|
|
10,499 |
|
|
260,000 (9) |
|
|
|
270,499 |
|
|
109
第12項:特定の実益所有者の保証所有権及び管理職及び関連株主事項。
ある実益は人の保証所有権を持っています
次の表は、2022年12月31日までの私たちの普通株式の実益所有権に関する私たちが知っているいくつかの情報を示しています。私たちが指定した各役員、すべての役員と取締役をグループとして、私たちが知っているすべての私たちの普通株式の5%以上を持っている実益所有者を含めてください。実益所有権は、米国証券取引委員会の規則に基づいて決定され、当該規則は、一人が当該証券に対して単独又は共有の投票権又は投資権を有する場合、彼又は彼女が当該証券の実益所有権を所有することが一般的に規定されている。これらの規則によれば、利益所有権は、個人または実体が2022年12月31日から60日以内に引受権証または株式オプションを行使することによって、または制限株式単位を付与することによって取得する権利を有する証券を含む。現在2022年12月31日から60日以内に行使または行使可能な引受権証またはオプションによって制限されている株式、または2022年12月31日から60日以内に帰属する制限株式単位によって制限されている株式については、その人の所有権パーセンテージを計算する場合には、当該等の株式承認証、オプションまたは制限株式単位を有する者が所有しているとみなされるが、任意の他の者の所有権パーセンテージを計算する際には、既発行株式とはみなされない。脚注に明記されているほか、適用されるコミュニティ財産法に適合する場合には、吾等に提供される資料に基づいて、以下の表に示す個人及び実体がその実益に対して所有するすべての株式に対して独占投票権及び投資権を有すると信じている。他の説明がない限り、私たちの各役員と幹部の営業住所はc/o Better Treeutics,Inc.,Market Street 548 Market Street,#49404,San Francisco,California 94104である。我々普通株の実益所有権パーセンテージは、2022年12月31日現在の23,851,022株発行普通株から計算される。
実益所有者の氏名又は名称及び住所 |
|
量 |
|
|
% |
|
||
所有者の5%以上が |
|
|
|
|
|
|
||
デヴィッド·P·ペリー2015信託(1) |
|
|
10,892,607 |
|
|
|
45.6 |
% |
ケビン·アペルボムは信託を取り消すことができる(2) |
|
|
2,511,673 |
|
|
|
10.5 |
% |
峰資本有限責任会社(3) |
|
|
1,388,250 |
|
|
|
5.8 |
% |
任命された行政員と役員: |
|
|
|
|
|
|
||
デヴィッド·ペリー(1) |
|
|
10,892,607 |
|
|
|
45.6 |
% |
フランク·カーベ(4) |
|
|
50,000 |
|
|
* |
|
|
マーク·バーマン博士(5) |
|
|
272,169 |
|
|
1.1% |
|
|
クリスチャン·ウィンホルダー(6) |
|
|
156,068 |
|
|
* |
|
|
リチャード·カーモナ博士(7) |
|
|
166,189 |
|
|
* |
|
|
アンドリュー·アルマーニノ(8) |
|
|
177,232 |
|
|
* |
|
|
ジェフリー·パーカー(9) |
|
|
105,903 |
|
|
* |
|
|
Risa Lavizzo-Mourey博士(10) |
|
|
22,570 |
|
|
* |
|
|
マーク·ヘニン(11) |
|
|
110,718 |
|
|
* |
|
|
劉素英博士(12) |
|
|
12,570 |
|
|
* |
|
|
エルド·グレンジャー博士(13) |
|
|
12,783 |
|
|
* |
|
|
全役員と上級職員(11人) |
|
|
11,978,809 |
|
|
|
50.2 |
% |
*1%未満。
110
株式補償計画に基づいて発行された証券
次の表は、2022年12月31日現在、我々の既存の持分補償計画に基づいて発行可能な普通株の情報を提供します。
|
|
|
|
|
|
|
|
余剰証券数 |
|
|||
|
|
発行予定証券の数 |
|
|
加重平均行権値 |
|
|
将来以下の条件で発行することができる |
|
|||
|
|
未償還オプションを行使する際に持分証を承認する |
|
|
未償還オプション·株式承認証 |
|
|
株式報酬計画(含まれていない |
|
|||
|
|
そして権利#(A) |
|
|
そして権利(B) |
|
|
(A)欄に反映された証券) |
|
|||
証券保有者が承認した持分補償計画(1) |
|
|
3,799,223 |
|
|
|
4.09 |
|
|
2,098,650(3)(4) |
|
|
証券保有者の許可を得ていない持分補償計画(2) |
|
|
200,000 |
|
|
|
1.43 |
|
|
|
400,000 |
|
合計する |
|
|
3,999,223 |
|
|
|
3.96 |
|
|
|
2,498,650 |
|
111
延滞金第16条報告
取引法第16条(A)条は,我々の上級管理者及び取締役,並びに我々の登録種別株式証券の10%以上を所有又は所有するグループに属する者は,米国証券取引委員会に所有権報告及び所有権変更報告を提出することを要求する。米国証券取引委員会の規定によると、上級管理者、取締役、および10%を超える株主は、彼らが提出したすべての第16条(A)条の表のコピーを提供しなければならない。
私たちの知る限り、私たちに提出された報告書のコピーの審査のみに基づいて、取引法第16条(A)の要求に基づいて、私たちの役員と役員、および私たちが発行した普通株式の10%を超えるすべての実益は、2022年度に私たちの証券の取引状況を報告し、すべての報告書をタイムリーに提出しなければなりません。
第十三条特定関係及び関連取引、並びに取締役の独立性。
給与および雇用に関する取り決めには、本年度報告で“役員報酬”および“役員報酬”と題する部分に記載されている予定と、後述する取引が含まれているほか、2021年1月1日以降、いかなる取引や一連の同様の取引も提案されていない
112
登録権協定の改正と再署名
私たちの業務合併については、吾らはケビン·アペルボムと信託会社(ケビン·アペルボムの関連会社、ケビン·アペルボムは私たちの元取締役最高経営責任者と実益所有者であり、私たちの5%以上の普通株を持っている)とDavid·P·ペリー2015信託会社(“David·P·ペリー信託”、取締役会長、私たちの普通株の実益所有者)の5%を超える関連会社、山冠資本有限責任会社(“MCADスポンサー”)は、改訂と重記された登録権協定(“改訂と重記の登録権協定”)を締結した。MCADスポンサーのいくつかの付属会社です改訂及び再予約された登録権協定改正及び当社、MCAD保険者及びその連属会社が二零二一年一月七日に締結した登録権協定を改訂及び再記載する。改訂及び再予約された登録権協定は、業務合併終了後30日以内に株主を代表して転売登録声明を提出することを吾等に要求する。登録権協定はまた、株主に何らかの要求登録権と搭載登録権を提供しているが、引受業者の削減と発行者の販売禁止期間の制限を受けなければならない。私たちは、改正および再署名された登録権協定の下での登録に関連するいくつかの費用と支出を支払うことに同意する。
PIPE購読契約と転売登録権
私たちの業務合併について、私たちはPerry Trustによって承認された100,000ドルと、Farallon Capital Management LLC(“Farallon”)によって管理されているエンティティが購入する13,500,000ドルを含むPIPE投資家と50,000,000ドルのPIPE投資引受契約を締結し、Farallon Capital Management LLC(“Farallon”)はこのような投資の実益所有者であり、私たちは5%以上の普通株を持っている。企業合併の終了に伴い、パイプライン投資も完了した。引受契約によると、吾らは業務合併完了後30暦以内に米国証券取引委員会に登録声明を提出し、配管投資家が私募で購入した普通株株式の再販売を登録することに同意した。
私募する
MCADが2021年1月12日に初公開されたことについては,MCAD保証人およびChardan Capital Markets LLC(“Chardan”)はMCADとの書面購入プロトコルにより185,000個の私募単位を購入し,総購入価格は1,850,000ドルであり,このうちMCAD保証人は135,000個人単位,Chardanは50,000個の個人単位を購入した。これらのプライベートユニットは,MCAD初公募時に販売される単位とまったく同じである.また,超過配給オプションを販売するとともに,追加15,000個の私募単位のプライベート販売を完了し,150,000ドルの総収益を生み出した.保証人及びChardanは、業務合併終了前に任意の私募機関又は関連証券を譲渡、譲渡又は売却しないことに同意する(インサイダー株式と同じ譲渡が許可された譲渡者を除き、かつ、譲渡者がインサイダー株式の許可を受けた譲渡者が同意しなければならない同じ条項及び制限を前提としており、各条項及び制限は上述したとおりである)。
MCAD株の売却に関する株式購入契約
MCAD,MCAD保証人およびPerry Trustは株式購入プロトコルを締結し,プロトコルにより,MCAD保証人は業務合併完了時に,MCAD保証人が保有する200,000株のMCAD普通株を180万ドルでPerry Trustに譲渡した.
安全融資
Legacy BTXは2020年8月14日から2021年9月7日まで、David·ペリーまたはその直系親族の以下の付属会社に金庫を発行した。ペリー信託基金に購入した総金額は22,101,878ドル、ベリンダ·バークレー-ホワイト社に購入した総金額は1,015,738ドルであった。上述したように、これらの金庫の中で、8 672 617ドルは、当時返済されていなかった転換可能なチケットを両替する際に発行されました。
Legacy BTXは2020年8月24日から2021年9月7日まで、アンドリュー·J·アルマーニノ3世とデニス·M·アルマーニノ家族信託基金への購入金額10万ドル、マット·アルマーニノへの購入金額10万ドル、アンドリュー·アルマーニノへの購入金額300,000ドルをデル·アルマーニノ家族信託基金に10万ドル、マット·アルマーニノまたはその直系親族に金庫を発行した。上述したように、これらの金庫のうち、300,000ドルは当時返済されていなかった転換可能なチケットを両替する際に発行されました。
Legacy BTXは、2021年4月7日から2021年9月9日まで、ジェフリー·M·パーカーと会社傘下のジェフリー·M·パーカーの付属会社ジル·G·パークRev信託基金に250,000ドル、会社役員のマーク·バーマン博士に100,000ドル、会社役員マーク·ハイニンに50,000ドル、ファラロン社に500万ドルを購入した関係者に金庫を販売·発行している。
113
関係者取引の政策と手順
我々の書面関連者取引政策は,関連者取引の承認や承認のために以下の政策と手順を規定している.
“関係者取引”とは,吾らや吾などの任意の付属会社がかつて,現在あるいは参加者になる取引,手配や関係のことであり,関連金額は120,000ドルを超え,任意の関係者はかつて,直接的あるいは間接的な重大な利益を持っていた.“関係者”とは
当社取締役会の監査委員会は、当社の5%以上の株式を保有する取締役、上級管理者及び持株者及びその直系親族との取引の審査を担当しています。取引の前に、関連側の取引における関係又は利益に関する重大な事実が取締役会が取引を考慮する前に開示され、取引と利害関係のない大多数の取締役が取引を承認しない限り、取引は取締役会の承認を得られないとみなされる。監査委員会の事前審査が不可能である場合は、監査委員会の次の定期会議で関連者取引を審査しなければならない。
監査委員会は、関連側取引リストを審査及び事前承認することができ、本政策の条項によれば、各事前に承認された取引は、監査委員会のさらなる審査を受けてはならない。監査委員会は、定期的な会議のたびに、監査委員会が審査するために、予め承認されているとみなされる任意の新たな関連者取引の概要(取締役及び役員報酬スケジュールを除く)を監査委員会に提供しなければならない。関連側の取引が行われている場合、監査委員会は、関連側と取引する際に従うように、会社経営陣のためのガイドラインを作成することができる。その後、監査委員会は、当該等が行っている関連側取引を少なくとも年1回審査·評価し、関連側との取引が監査委員会が策定した基準に適合していることを確認する。
第14項目主要会計費用とサービス
独立登録口座NG社はエリオット·デイビスLLCサウスカロライナ州グリーンビルPCAOB ID番号
独立公認会計士事務所は有料です
以下は,2022年12月31日と2021年12月31日までの財政年度,会社がエリオト·デイビス有限責任会社が提供する専門サービスに支払うことに同意した総費用の概要と説明である。
|
|
十二月三十一日までの年度 |
|||||||
費用別 |
|
2022 |
|
|
2021 |
|
|
||
料金を審査する(1) |
|
$ |
229,500 |
|
|
$ |
124,500 |
|
|
監査関連費用(2) |
|
|
- |
|
|
|
98,000 |
|
|
税金.税金(3) |
|
|
- |
|
|
|
- |
|
|
その他の費用 |
|
|
- |
|
|
|
- |
|
|
合計する |
|
$ |
229,500 |
|
|
$ |
222,500 |
|
|
114
以下は,当社がこれまでの独立監査師Marcum LLCに提供する専門サービスが2021年12月31日までの財政年度に支払う総費用の概要と説明に同意したものである。
|
|
十二月三十一日までの年度 |
|
|
費用別 |
|
2021 |
|
|
料金を審査する(1) |
|
$ |
57,000 |
|
監査関連費用(2) |
|
|
42,000 |
|
税金.税金(3) |
|
|
7,000 |
|
その他の費用 |
|
|
- |
|
合計する |
|
$ |
106,000 |
|
監査委員会は、2022年12月31日と2021年12月31日までの財政年度監査に関するすべての監査費用を事前に承認している。私たちの独立監査人が提供するすべての監査と非監査サービスは、監査委員会の事前承認を受け続けるだろう。
監査委員会はElliott Davis LLCとMarcum LLCが徴収する費用の性質と額を審議し、監査とは無関係な活動にサービスを提供することはその独立性を維持することに適合すると考えている。
承認前の政策と手順
私たちの監査委員会は、私たちの独立公認会計士事務所が提供するすべての非監査サービスが事前に承認されて、これらのサービスが監査人の独立性を損なわないようにするための手続きをとっています。これらのプログラムは一般に特定のサービスの実行を承認するが,このようなサービスすべてにコスト制限がある.この全体的な承認は、必要に応じて少なくとも年に1回修正されなければならない検討が行われなければならない。経営陣は、独立公認会計士事務所を採用して他の監査関連又はその他の非監査サービスを実行するたびに、事前に監査委員会の具体的な承認を得なければならない。監査委員会は、独立公認会計士事務所が提供するサービスを承認する責任をどの経営陣メンバーにも委託しない。
監査委員会が任意のタイプの非監査サービスまたは任意の具体的な採用が非監査サービスを提供することを承認するか否かを決定する際に採用される基準は、提供されるサービス、そのようなサービスのために支払われる報酬、および他の関連要因が、米国証券取引委員会基準および適用される専門基準に基づいて独立公認会計士事務所が有する独立性に適合するかどうかである。関連する考慮事項は、財務諸表を審査する間に、仕事の成果が監査プログラムの制約または関与を受ける可能性があるかどうか、独立公認会計士事務所が管理または提唱作用を発揮するかどうか、独立公認会計士事務所のサービス表現が私たちのリスクを管理または制御する能力を増強するか、または監査の質を向上させるかどうか、この表現が独立公認会計士事務所が私たちの業務、人員、文化、制度、リスク概況およびその他の要素を熟知しているために効率を向上させるかどうか、および関連する費用金額が含まれるかどうか。あるいは、その間に独立公認会計士事務所に支払われる総費用のうち、非監査サービス部分は、独立公認会計士事務所が監査を行う際に独立判断を行使する能力を低下させることが多い。
115
第4部
項目15.物証、財務諸表付表
(2)財務諸表の添付表は省略されており、その理由は、不要または適用されない、または資料が財務諸表または付記に含まれているからである。
(3)S-K条例第601項及び本年度報告第15(B)項に要求される証拠物は、以下の証拠物索引に列挙される。展示品索引に記載されている展示品は、引用されて本明細書に組み込まれる。
(B)展示品
116
展示品索引
展示品 番号をつける |
|
説明する |
2.1+ |
|
MCAD、合併子会社とBTXとの間の2021年4月6日の合併協定及び計画、期日2021年8月30日の合併協定及び計画修正案、及び期日が2021年9月27日の合併協定及び計画第2修正案(第424(B)(3)条に基づいて米国証券取引委員会に提出された委託書/目論見書添付ファイルAを参照して合併する)。 |
3.1 |
|
2021年10月28日に提出された2回目の改訂および再改訂されたBetter Treateutics,Inc.登録証明書(2021年11月3日に米国証券取引委員会に提出されたForm 8-Kの添付ファイル3.1を参照することによって統合される)。 |
3.2 |
|
Better Treateutics,Inc.の定款が改正され,再改訂され,2021年10月28日に施行された(2021年11月3日に米国証券取引委員会に提出された8−K表の添付ファイル3.2を引用して編入された)。 |
4.1 |
|
改正および再署名された登録権協定は、2021年10月28日に、Better Treateutics,Inc.およびその他の各株東方によって署名される。(2021年11月3日に米国証券取引委員会に提出されたテーブル8-Kの添付ファイル10.16を参照して組み込まれます)。 |
4.2 |
|
期日は2021年10月28日の引受協定はMCADとCowen and Company,LLCによって署名された。(2021年11月3日に米国証券取引委員会に提出されたForm 8-K表10.17を参照することによって組み込まれます)。 |
4.3 |
|
承認契約表は、2021年4月6日に、MCADと特定の機関および認可投資家との間で署名される(添付ファイル10.3を参照することにより、2021年4月7日に米国証券取引委員会に提出された8-K表に組み込まれている)。 |
4.4 |
|
登録者証券説明(我々が2022年3月28日に米国証券取引委員会に提出した10−K表年次報告書の添付ファイル4.4を参照)。 |
10.1 |
|
2021年従業員株購入計画(2021年11月3日に米国証券取引委員会に提出された8-K表の添付ファイル10.1を参照して組み込む)。 |
10.2 |
|
修正された2021年オプションおよび奨励計画およびその下の奨励プロトコルフォーマット(2021年11月3日に米国証券取引委員会に提出された8-K表の添付ファイル10.2を参照することによって組み込まれる)。 |
10.3 |
|
2020年株式オプション·付与計画(2021年11月3日に米国証券取引委員会に提出された8-K表の添付ファイル10.3を参照して組み込む)。 |
10.4* |
|
2022年インセンティブ計画。 |
10.5 |
|
役員離職計画(2021年4月23日に米国証券取引委員会に提出されたS-4表登録声明の添付ファイル10.16を参照することにより、第5号修正案により改正された)。 |
10.6 |
|
上級管理者現金インセンティブ·ボーナス計画(2021年11月3日に米国証券取引委員会に提出された8-K表の添付ファイル10.5を参照することにより組み入れられます)。 |
10.7 |
|
非従業員役員報酬政策(2021年11月3日に米国証券取引委員会に提出された8-K表第10.6部を引用することにより編入)。 |
10.8 |
|
取締役賠償協定表(2021年11月3日に米国証券取引委員会に提出された8-K表10.7号添付ファイルを参照して編入)。 |
10.9 |
|
上級乗組員賠償協定表(2021年11月3日に米国証券取引委員会に提出された表格8-Kの添付ファイル10.8を参照して編入)。 |
10.10 |
|
Better Treateutics,Inc.とDavid P.Perryの間の執行議長招待状は、2021年10月28日(私たちが2021年11月3日に米国証券取引委員会に提出した8-K表10.9号添付ファイルを参照して組み込まれています)。 |
10.11 |
|
Better Treateutics OpCo,Inc.(栄養開発グループ有限責任会社の後継者)とMark Bermanとの間の招待状は、2015年11月23日である(2021年4月23日に米国証券取引委員会に提出されたS-4表登録声明の添付ファイル10.17を参照して編入され、この表は第5号修正案によって改訂される)。 |
10.12 |
|
Better Treateutics OpCo.(Better Treateutics LLCの後継者)とKristin Wynholdとの間の招待状は、2018年10月9日である(2021年4月23日に米国証券取引委員会に提出されたS-4表登録声明の添付ファイル10.18を参照して編入され、その第5号改正により改訂される)。 |
10.13 |
|
Better Treateutics OpCo,Inc.(前身はBetter Treateutics,Inc.)の招待状Mark Heinenとは、日付は2021年5月7日である(2021年4月23日に米国証券取引委員会に提出されたS-4表登録声明の添付ファイル10.21を参照することにより、第5号修正案により改訂される)。 |
10.14 |
|
分離プロトコルは、Better Treateutics,Inc.,Better Treateutics OpCo.,Kevin Appelbaum,およびその中に列挙された他の当事者によって発行され、2022年7月5日から発効する(2022年6月13日に米国証券取引委員会に提出されたForm 8−K表10.1参照により組み込まれる)。 |
117
10.15 |
|
Better Treateutics,Inc.,Better Treateutics OpCo,Inc.およびFrank Karbeからの雇用招待状は,2022年7月5日である(2022年6月13日に米国証券取引委員会に提出された8-K表の添付ファイル10.2を参照して編入される)。 |
10.16 |
|
Better Treateutics OpCo,Inc.(前身はBetter Treateutics,Inc.)が締結した融資と保証契約Hercules Capital,Inc.と2021年8月18日に合併した(2021年4月23日に米国証券取引委員会に提出されたS-4表登録声明の添付ファイル10.23を参照することにより、この表は第5号修正案によって改正された)。 |
21.1 |
|
子会社リスト(2021年11月3日に米国証券取引委員会に提出された8-K表の添付ファイル21.1を参照して組み込まれます)。 |
23.1* |
|
独立公認会計士事務所Elliott Davis,LLCは同意した。 |
31.1* |
|
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
31.2* |
|
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
32.1** |
|
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条に規定されている最高経営責任者証明書。 |
32.2** |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による首席財務官の認証。 |
101.INS* |
|
連結されたXBRLインスタンス文書−インスタンス文書は、XBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 |
101.Sch* |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
101.カール* |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
101.定義* |
|
インラインXBRL分類拡張Linkbase文書を定義する |
101.実験所* |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
101.前期* |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
104* |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
*アーカイブをお送りします。
**関数で提供されます。“米国法典”第18編1350節によれば、本証明書は、本報告と共に提供されるのみであり、1934年改正された“取引法”第18節の目的のために提出されたものではなく、当該文書中の任意の一般的な合併言語にかかわらず、本文書の日付の前または後に提出されたものであっても、参照によって会社のいかなる文書にも組み込まれない。
+S-K規則601(B)(2)項によれば、本プロトコルのいくつかの添付表および証拠品は省略されています。任意の漏れたスケジュールおよび/または展示品のコピーは、要求に応じて米国証券取引委員会に提供される。
契約または報酬計画または手配を管理する。
(C)財務諸表添付表
必要または適用されないので、必要な資料が財務諸表またはその付記に含まれているので、財務諸表は提出されていない。
項目16.表格10-Kの概要
ない。
118
サイン
改正された1934年証券取引法第13又は15(D)節の要求に基づいて、登録者は、正式に許可された次の署名者がその代表を代表して本報告書に署名することを正式に手配した.
|
|
Better Treeutics社 |
|
|
|
|
|
日付:2023年3月30日 |
|
差出人: |
/s/フランク·カーベ |
|
|
|
フランク·カーベ |
|
|
|
最高経営責任者 |
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
名前.名前 |
|
タイトル |
|
日取り |
|
|
|
|
|
/s/フランク·カーベ |
|
役員、総裁、CEO |
|
2023年3月30日 |
フランク·カーベ |
|
(首席行政主任) |
|
|
|
|
|
|
|
/s/David P.ペリー |
|
取締役執行主席兼最高経営責任者 |
|
2023年3月30日 |
デヴィッド·ペリー |
|
|
|
|
|
|
|
|
|
/s/Mark Heinen |
|
財務主管兼臨時首席財務官 |
|
2023年3月30日 |
マーク·ヘニン |
|
最高財務官と首席会計官) |
|
|
|
|
|
|
|
/s/リチャード·カーモナ |
|
役員.取締役 |
|
2023年3月30日 |
リチャード·カーモナ |
|
|
|
|
|
|
|
|
|
/s/ジェフリー·パーカー |
|
役員.取締役 |
|
2023年3月30日 |
ジェフリー·パーカー |
|
|
|
|
|
|
|
|
|
/s/アンドリュー·アマニノ |
|
役員.取締役 |
|
2023年3月30日 |
アンドリュー·アルマーニノ |
|
|
|
|
|
|
|
|
|
Risa Lavizzo-Mourey |
|
役員.取締役 |
|
2023年3月30日 |
Risa Lavizzo-Mourey |
|
|
|
|
|
|
|
|
|
/s/劉素英 |
|
役員.取締役 |
|
2023年3月30日 |
劉素英 |
|
|
|
|
|
|
|
|
|
/s/Elder Granger |
|
役員.取締役 |
|
2023年3月30日 |
老グランジャー |
|
|
|
|
119