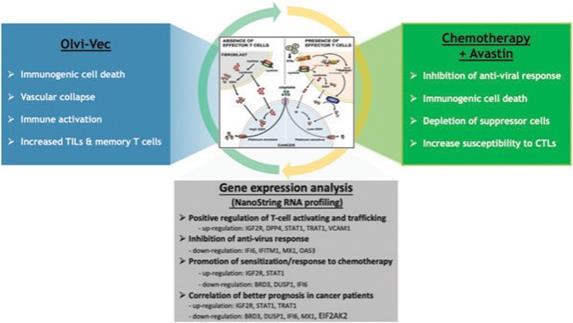
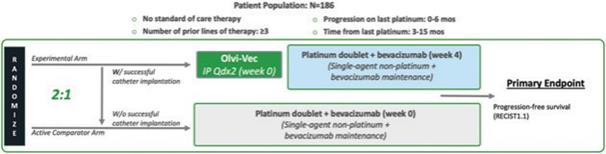
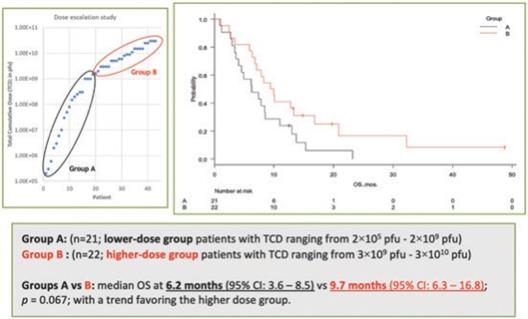
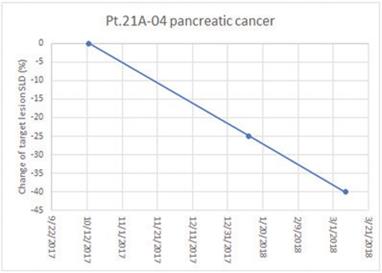
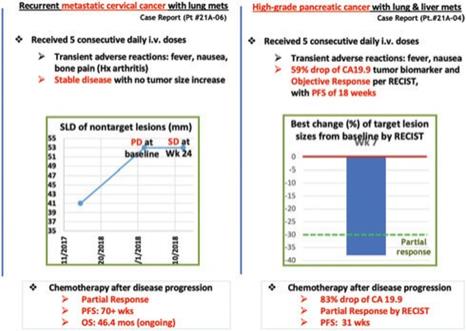
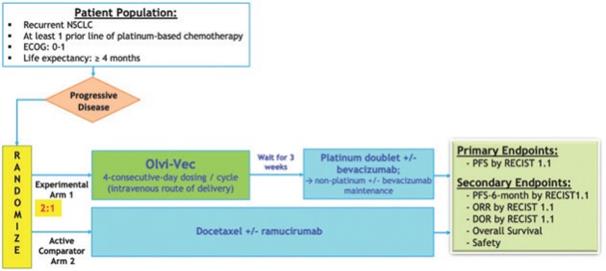
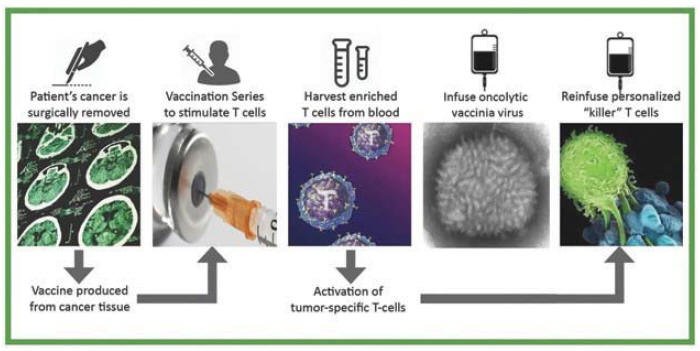
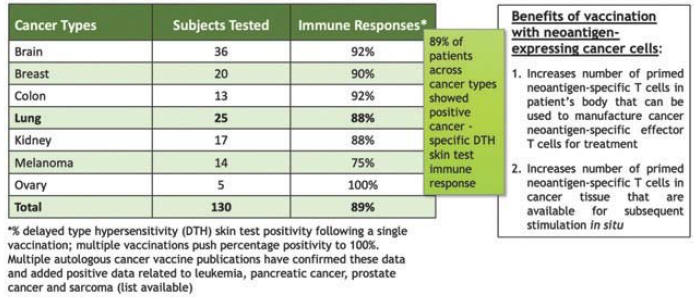
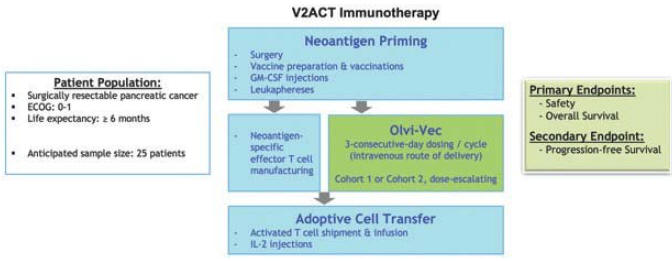
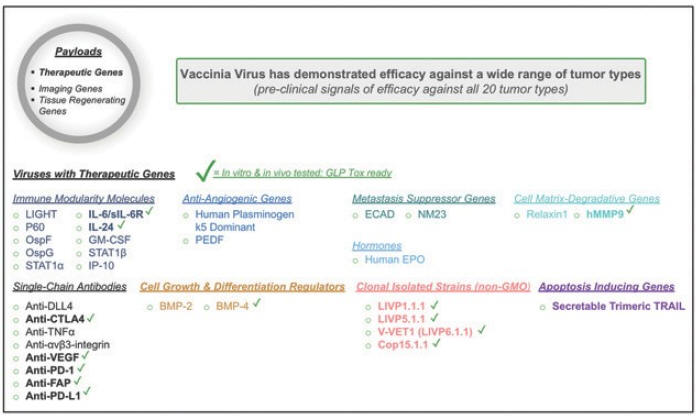
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表格10-K
|
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
2022年12月31日までの財政年度
あるいは…
| ☐ |
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
から
への過渡期
委員会ファイル第001-41599号
Genelux社
(登録者の正確な氏名はその定款に記載)
|
|
|
| デラウェア州 |
|
77-0583529 |
| (明またはその他の司法管轄権
会社や組織) |
|
(税務署の雇用主
識別番号) |
ダウンタウンスイート230号2625号
カリフォルニア州西湖村91361
(主にオフィスアドレスを実行)
(郵便番号)
(805)
267-9889
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
|
|
|
|
|
| クラスごとのタイトル |
|
取引
記号 |
|
各取引所名
それに登録されている |
| 普通株は一株当たり0.001ドルの価値があります |
|
GNLX |
|
ナスダック株式市場有限責任会社(ナスダック資本市場) |
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、違います
登録者が当該法第13又は15(D)条に基づいて報告書を提出する必要がない場合は,複選マークで示してください。はい、違います
再選択マークは、登録者が(1)過去12ヶ月以内に(または登録者がそのような報告の提出を要求されたより短い期間内に)1934年の証券取引法第13または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す。はい、違います
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す。はい、いいえ、☐
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法ルール12 b−2における大型加速申告会社、加速申告会社、小報告会社、新興成長型会社の定義を参照されたい
|
|
|
|
|
|
|
| 大型加速ファイルサーバ |
|
☐ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
| 非加速ファイルサーバ |
|
|
|
規模の小さい報告会社 |
|
|
|
|
|
|
|
|
|
|
新興成長型会社 |
|
|
新興成長型企業であれば、登録者が延長された移行期間
を使用しないことを選択したか否かをチェック番号で示して、“取引所法案”第13(A)節に提供される任意の新しいまたは改正された財務会計基準を遵守してください
登録者が報告書を提出したか否かを再選択マークで示し、その経営陣が“サバンズ·オクスリ法案”(“米国法典”第15編7262(B)節)第404(B)条に基づいて財務報告書の内部統制の有効性を評価したことを証明する。この内部統制は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に再記述があるかどうかをチェックマークで示すことは、登録者の任意の幹部が関連する回復中に受信したインセンティブベースの報酬を§240.10 D−1(B)に従って回復分析する必要があるかどうかを示す。☐
登録者が空殻会社であるかどうかをチェックマークで表す(br}法案第12 b-2条で定義される)。はい、違います
登録者の普通株の2023年3月27日の終値によると、登録者の非関連会社が保有する普通株の総時価は約5.051億ドルである
2023年3月27日現在、発行済み普通株は24,553,470株である
引用で編入された書類
本年度報告Form 10−K第III部分引用登録者は,その2023年株主総会に提出された最終委託書のいずれかの情報であり,登録者は2022年12月31日までの財政年度終了後120日以内に第14 A条
に基づいてこの依頼書(2023年依頼書)を提出する予定である。引用により本10-K表に明示的に含まれる情報を除いて,2023年に依頼書は本10-K表の一部として提出されたとはみなされない