
目論見書補足 |
規則424 (b) (5) に従って提出 |
(2020年12月29日付けの目論見書へ) |
登録番号 333-251645 |

株式会社ジャノン
361,000株の普通株式
当社は、この目論見書補足および添付の目論見書を通じて、1株あたり1.17ドルの募集価格で、額面1株あたり0.001ドルの普通株式361,000株(「普通株式」)を提供しています。
当社の普通株式は、ナスダック・キャピタル・マーケットに「JAN」のシンボルで上場されています。2023年3月22日、ナスダック・キャピタル・マーケットで報告された当社の普通株式の最終報告価格は、1株あたり1.28ドルでした。
当社の事業および普通株式への投資には高いリスクが伴います。当社の証券への投資に関連して考慮すべき情報の説明については、本目論見書補足のS〜7ページ、添付の基本目論見書の4ページに記載されている「リスク要因」というタイトルのセクション、および本目論見書補足および基本目論見書に参照により組み込まれた文書に記載されているリスク要因を参照してください。
当社は、H.C. Wainwright & Co., LLCに専属プレースメントエージェントとして委託し、合理的な最善の努力を払って本オファリングの対象となる有価証券の購入オファーを募集しています。プレースメントエージェントは、当社から証券を購入する義務も、特定の数または金額の証券の購入または売却を手配する義務もありません。当社は、下記の表に記載されているプレースメントエージェント手数料を支払うことに同意しました。これは、当社が保有するすべての有価証券を売却することを前提としています。
|
|
普通株式1株当たり |
|
|
合計 |
|
||
提供価格 |
|
$ |
1.17 |
|
|
$ |
422,370 |
|
紹介エージェント手数料 (1) |
|
$ |
0.0819 |
|
|
$ |
29,565.90 |
|
経費を差し引く前の収入、当社へ |
|
$ |
1.0881 |
|
|
$ |
392,804.10 |
|
証券取引委員会も州証券委員会も、これらの証券を承認または不承認にしたり、この目論見書補足の妥当性または正確性を伝えたりしていません。これと反対の表明は刑事犯罪です。
普通株式の投資家への引き渡しは、慣習的な取引条件が満たされることを条件として、2023年3月24日頃に行われる予定です。
H.C. ウェインライト・アンド・カンパニー
この目論見書補足の日付は2023年3月22日です
目次
目論見書補足
この目論見書補足について |
S-1 |
将来の見通しに関する情報に関する注意事項 |
S-1 |
目論見書補足要約 |
S-3 |
オファリング |
S-6 |
リスク要因 |
S-8 |
収益の使用 |
S-11 |
希釈 |
S-11 |
配当政策 |
S-12 |
当社が提供している有価証券の説明 |
S-12 |
配布計画 |
S-12 |
法律問題 |
S-14 |
専門家 |
S-14 |
詳細を確認できる場所 |
S-15 |
参照により組み込まれた情報 |
S-15 |
目論見書
|
ページ |
この目論見書について |
1 |
入手可能な情報 |
1 |
参照による特定の情報の組み込み |
2 |
将来の見通しに関する記述 |
3 |
リスク要因 |
4 |
ビジネス |
4 |
選択した連結財務データ |
37 |
当社が提供する可能性のある有価証券の説明 |
37 |
資本金の説明 |
38 |
優先株の説明 |
41 |
債務証券の説明 |
41 |
ワラントの説明 |
49 |
権利の説明 |
51 |
ユニットの説明 |
51 |
収益の使用 |
52 |
配布計画 |
53 |
法律問題 |
55 |
専門家 |
55 |
この目論見書補足について
この文書は、この目論見書補足とそれに付随する基本目論見書の2つの部分に分かれています。これらはいずれも、当社が「シェルフ」登録プロセスを使用して米国証券取引委員会(「SEC」)に提出したフォームS-3の登録届出書の一部です。最初の部分は目論見書補足で、この募集の具体的な条件を説明する参照文書も含まれています。第2部では、参照により組み込まれた文書を含む、添付の基本目論見書に、より一般的な情報が記載されています。投資する前に、この目論見書補足、添付の基本目論見書、本書およびそこに参照により組み込まれているすべての情報、およびこの目論見書補足のS-13ページの「詳細情報を見つけることができる場所」に記載されている追加情報をよくお読みください。これらの文書には、投資決定を行う際に考慮すべき情報が含まれています。この目論見書補足は、添付の基本目論見書に含まれる情報を追加、更新、または変更する場合があります。この目論見書補足に含まれる情報と、添付の基本目論見書またはこの目論見書補足の日付より前に提出された参照により組み込まれた文書に含まれる情報との間に矛盾がある場合は、この目論見書補足の情報に頼るべきです。これらの文書のいずれかの記述が、日付が遅い別の文書の記述と矛盾する場合(たとえば、この目論見書補足の日付以降に提出され、この目論見書補足および添付の目論見書に参照により組み込まれた文書)、日付の遅い文書の記述が以前の記述を変更または優先します。
この目論見書補足、添付の基本目論見書、および本募集に関連して当社がお客様に提供する可能性のある自由書の目論見書に含まれている、または参照により組み込まれた情報のみに頼ってください。当社は、他の人に異なる情報を提供することを許可していません。誰かがあなたに異なる情報や一貫性のない情報を提供したとしても、それに頼るべきではありません。当社は、募集および売却が許可されている法域でのみ、普通株式の売却を申し込み、購入の申し出を求めています。この目論見書補足の配布および特定の法域における普通株式の募集は、法律により制限される場合があります。この目論見書補足を保有する米国外の個人は、普通株式の募集およびこの目論見書補足の米国外への分配に関する制限について知り、遵守する必要があります。この目論見書補足は、本目論見書補足によって提供される有価証券を、その人がそのような申し出または勧誘を行うことが違法である法域の個人による売却の申し出または購入の申し出の勧誘を構成するものではなく、またそれに関連して使用することもできません。
さらに、添付の基本目論見書に参照により組み込まれている文書の別紙として提出される契約において当社が行った表明、保証、および契約は、場合によっては、かかる契約の当事者間でリスクを配分する目的を含め、当該契約の当事者の利益のみを目的として行われたものであり、お客様に対する表明、保証、または契約とはみなされないことにも注意してください。。さらに、そのような表明、保証、または契約は、作成日時点でのみ正確でした。したがって、そのような表明、保証、および契約は、当社の業務の現状を正確に表しているとは考えないでください。
本書で使用される「当社」、「当社」または「当社」とは、ネバダ州の法人であるJanOne Inc. およびその子会社を指します。
将来の見通しに関する情報に関する注意事項
基本目論見書およびこの目論見書補足に含まれている、または参照により組み込まれた情報には、改正された1933年の証券法(「証券法」)のセクション27Aおよび改正された1934年の証券取引法(「取引法」)のセクション21Eの意味における将来の見通しに関する記述が含まれています。これらの将来の見通しに関する記述は、将来の出来事または当社の将来の財務実績に関連するもので、既知および未知のリスク、不確実性、およびその他の要因が含まれ、その結果、当社の実際の業績、活動レベル、業績、業績が、これらの将来の見通しに関する記述によって表現または暗示される将来の結果、活動レベル、業績または成果と大きく異なる可能性があります。「信じる」、「期待する」、「予想する」、「見積もる」、「意図する」、「計画する」、「目標」、「可能性が高い」、「目指す」、「する」、「できる」、「すべき」、「予測」、「可能性」、「継続」などの表現やフレーズは、将来の見通しに関する記述を識別します。これらの将来の見通しに関する記述は、主に当社の財政状態、経営成績、事業戦略、および財務ニーズに影響を与える可能性があると考えられる現在の予想と将来の出来事および財務動向に基づいています。実際の結果は、さまざまな要因の結果として、そのような将来の見通しに関する記述で表明または暗示されているものと大きく異なる場合があります。当社は、法律で義務付けられている場合を除き、将来の見通しに関する記述を更新したり、将来の見通しに関する記述の改訂を発表したりする義務を負わず、またその義務を否認します。結果が将来の見通しに関する記述で予測されているものと大きく異なる原因となる可能性のある特定の要因には、以下に関する記述が含まれますが、これらに限定されません。
● 当社の損失および運転資本不足の履歴
● 継続企業として存続できる当社の能力
S-1
● 新型コロナウイルスのパンデミックが当社に及ぼした既知および未知の影響
● 主要人材への依存。
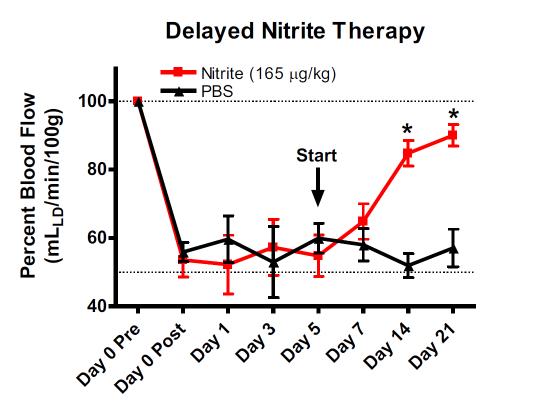
● 末梢動脈疾患の治療薬となる可能性のあるJAN101の第IIb相/IIIa相試験を完了するには、追加の資金が必要です。
● 新たに買収した複合性局所疼痛症候群の治療薬となるJAN123の継続的な開発のための資金が必要です。
● 規制上および法律上の不確実性
● 四半期決算が当社の普通株価に与える影響、および
● 未払いの普通株式オプションおよび制限付株式単元付与の行使による株主への希薄化。
普通株式に投資する前に、これらの要素を考慮することをお勧めします。この目論見書補足、添付の目論見書、およびその他の募集資料、またはこの目論見書補足、添付の基本目論見書、およびその他の募集資料に参照により組み込まれた文書に含まれる将来の見通しに関する記述は、目論見書補足、添付の基本目論見書、その他の募集資料、または参照により組み込まれた文書の日付の時点でのみ作成されています。これらおよびその他のリスクの詳細については、この目論見書補足の「リスク要因」、2022年4月1日にSECに提出された2022年1月1日に終了した2022会計年度のフォーム10-Kの年次報告書、およびその他のSECへの提出書類をご覧ください。
S-2
目論見書補足要約
以下の情報は、この目論見書補足および付随する基本目論見書の他の部分に含まれている、または参照により組み込まれたより詳細な情報の要約にすぎず、この目論見書補足および添付の基本目論見書の他の部分に含まれている、または参照により組み込まれた情報と一緒に読む必要があります。この概要では、当社および本サービスに関する厳選された情報に焦点を当てています。この要約には、あなたにとって重要な情報がすべて含まれていない場合があります。当社の普通株式への投資を決定する前に、この目論見書補足および添付の基本目論見書の「リスク要因」というキャプションに記載されている情報を含む、この目論見書補足および添付の目論見書に含まれている、または参照により組み込まれたすべての情報を注意深くお読みください。これらの情報は、「詳細情報の入手先」および「情報」に記載されています。この目論見書補足には「参考文献」が組み込まれています。
当社
将軍
JanOne Inc.(旧称Appliance Recycling Centers of America, Inc.)および子会社(総称して「当社」または「JanOne」)は、重度の痛みを引き起こす症状の治療法を見つけ、中毒性のない痛みを和らげる特性を持つ医薬品の市場投入に焦点を当てた製薬会社として、ビジネスの視野を広げました。私たちは、激しい痛みを引き起こす基礎疾患を治療することにより、危険なオピオイド薬の処方を減らすことを目指しています。Jan101と名付けられた最初の薬剤候補は、末梢動脈疾患(「PAD」)の治療薬です。末梢動脈疾患は激しい痛みを引き起こし、米国だけで850万人以上が罹患しています。現在Jan123と命名されている第2の薬剤候補は、一般的に腕や脚に重度の慢性疼痛を引き起こす適応症である複合性局所疼痛症候群(「CRPS」)の治療薬として開発中です。
最近の動向
2023年3月19日、当社はデラウェア州の企業であるVM7 Corporation(以下「買主」)と株式購入契約(以下「購入契約」)を締結しました。この契約に基づき、買主は(a)カリフォルニア州の企業であるARCA Recycling, Inc.(「ARCA」)、(b)ネバダ州の有限責任会社であるCustomer Connexx LLC(「Connexx」)の発行済み株式をすべて取得することに合意しました。c) ARCA Canada Inc.、カナダのオンタリオ州の法律に基づいて設立された法人(「ARCAカナダ」、およびARCAおよびConnexxと合わせて「子会社」)。買い手の責任者は、当社の最高財務責任者であるバーランド・A・ジョンソンです。購入契約に基づく子会社のすべての未払いの持分の買主への売却(「処分取引」)は、購入契約の締結と同時に完了しました。当社の取締役会は、購入契約と処分取引を満場一致で承認しました。
処分取引の経済的側面としては、(i) 連結貸借対照表上の負債を約1,760万ドル削減した(後述するカリフォルニア州の事業手数料および税務部門に関連するものを除く)、(ii)買主から毎月総額2,400万ドル以上の支払いを受ける予定であり、その支払いは子会社の将来の業績により増加する可能性がある、および(iii)今後5年間に、購入者に対し、毎月の総支払い額1ドルの前払いを要求する場合があります百万。また、決算時に各子会社の株式として1,000ドルを受け取りました。毎月の支払い額は、(a) 140,000ドル(または、15年間の支払い期間中の各1月と2月の各1月と2月の場合は100,000ドル)、または(b)パーセンテージに基づく毎月の支払い額(次のように計算されます)のいずれか多い方になります。(i)該当する月の最大200万ドルまでの子会社の総収入の5%、および(ii)2,000ドルの間にある子会社の総収益の 4% 該当する月の総収益が300万ドルを超える子会社の 3%、その月の総収益が300万ドルを超える子会社の 3%買主は、2023年3月19日以降に子会社が売主に支払った支払い、配分、または現金配当について、最初の毎月の支払い(2023年3月)の支払いに充てられます。
購入者は、将来の毎月の支払額の推定総額をいつでも合計で前払いすることができます。その金額は、今後予定される毎月の支払い額のその時点での現在価額を、年率 5% で割り引いた金額となります(「前払い価格」)。さらに、買主は、(i)ジョンソン氏が買主の資本金の75%未満を保有しているか、(ii)買主が実質的にすべての資産を売却したか、(iii)買主が子会社の資本金の50%未満を保有するか、(iv)子会社がそれぞれの資産の実質的にすべてを売却したかのいずれか早い時期に前払い価格を支払う必要があります。前払い価格を支払った時点で、買い手は売り手に対してそれ以上購入代金を支払う義務を負わないものとします。
S-3
処分取引のその他の条件は次のとおりです。(i) 当社は、買主が前払い代金を支払うか、毎月の支払いをすべて入札したのいずれか早い方まで、買主の取締役会のメンバーを1人任命する権利を有します。(ii) 買主の最高経営責任者としてのジョンソン氏の年間給与は、2023暦年の残りの期間、比例配分された40万ドルとし、その後毎年同額に調整されるものとします買主が前払い価格を支払うか、または入札するまでの早い方まで、子会社の総収益の1%まで毎月のすべての支払い、および (iii) 当社は、特定の税務当局の問題に関連する(継続的な毎月の支払いとは関係ない)購入者から追加の支払いを受けることになります。ARCAとカリフォルニア州の事業手数料・税務部門との間で継続している紛争が和解した場合(和解については保証できません)、ARCAは、現在の査定からそのような和解までの間の減額額の 50% を当社に支払います。支払いは、年率5%の利息が付いた3年間の約束手形によって記念されます。手形に基づく最初の支払いは、決済が行われる購入者の会計年度の最終日に行われ、それ以降は毎年残りの支払いが行われます。ARCAが以前に行われた支払いについて政府機関から払い戻しを受けた場合、ARCAは、この手続きについて弁護士に支払われる弁護士費用の減額後、当該払い戻しの25%に相当する金額を当社に支払うものとします。ARCAとConnexxは、コロナウイルス援助、救済、経済安全保障法および2020年の納税者確定および災害税控除法の従業員定着クレジット条項に関連して、総額約931,000ドルの支払いを内国歳入庁から2回受け取る予定です。これらの支払いは、ARCAまたはConnexxが受領してから10日以内に当社に提出する必要があります。
購入契約および2023年3月19日付けの株式および会員権質担保契約(以下「質権契約」)に基づく買主の義務を確保するため、ジョンソン氏は買主の全資本金(以下「買主資本金」)を当社に担保し、買主は当社に子会社の全持分(「対象証券」)を差し入れました。質権契約の条件に基づき、(質権契約で定義されている)債務不履行事由が発生した場合、当社に有利なその他の救済措置として、買主の資本金および対象証券の一部または全部を差し押さえることがあります。また、当社は、質権契約に記載されているとおり、当社に有利な取消不能な譲渡に従い、買主の資本株式および対象証券の所有権を自動的に当社に譲渡させる場合があります。自動譲渡の場合、購入者が購入契約の条件に従って以前に行った毎月の支払いはすべて、会社の資本ストックを希薄化することなく、会社の資本への拠出として特徴付けられます。
コンサルティングアレンジメント
2023年3月15日、ジョン・ボンフィリオ博士は、当社の完全子会社であるJanOne Biotech Holdings Inc.(「JanOne Biotech」)の暫定社長に任命され、当社を通じてPADおよびCRPS事業を行っています。ボンフィリオ博士が独立コンサルタントとしてJanOne Biotechの暫定社長に任命されたことに関連して、2023年3月15日にコンサルティング契約の条件に合意しました。両当事者は、近いうちに書面によるコンサルティング契約に合意する予定です。
ソイン・セラピューティクス合同会社の買収
2022年12月28日をもって、当社はデラウェア州の有限責任会社であるSoin Therapeutics LLC(「STLLC」)と、その製品である特許出願中の低用量ナルトレキソンの新規製剤であり、「JAN123」と名付けました。この製品はCRPSの治療用に開発されています。現在、CRPSの真に効果的な治療法はありません。CRPSに罹患している患者の数が比較的少ないため、米国食品医薬品局(「FDA」)は、CRPSの治療薬として承認されたすべての製品について希少疾病用医薬品の指定を与えています。この指定により、臨床試験の税額控除、ユーザー料金の免除、承認後7年間の市場独占権の取得が可能になります。さらに、現在、希少疾病用医薬品の開発では、研究できる患者数が限られているため、試験が小規模になり、承認までの時間が短縮されています。ただし、その製品がFDAの承認を受けることや、それが材料販売につながるという保証はありません。
今年の半ばまで、場合によっては今年末まで、STLLCの唯一のレガシーエクイティ保有者であるアモル・ソイン博士が引き続き最高医療責任者を務めます。
取引の完了時に、当社はシリーズS転換優先株式(「シリーズS株」)の100,000株をソイン博士に発行しました。この全株式取引の初期価値は13,000,000ドルで、123年1月までに生み出される収益にもよりますが、さらに17,000,000ドル増加して最大3,000,000ドルになる可能性があります。ソイン博士は、最終的に保有できるシリーズS株式の最大数に一定の制限を設けること、または当社の普通株式に転換したり、いつでも公開市場に売却したりできることに同意しました。(i) ソイン博士は、シリーズS株式を当社の普通株式に転換して、そのような転換の際に、当時の当社の普通株式の4.99%を超える株式を有益に所有するような金額で当社の普通株式に転換することはできません未払いの普通株式、および (ii) ソイン博士が最初に転換資格を得た日から始まる5年間の期間シリーズS株のすべての株式を当社の普通株式に
S-4
株式、彼は、いかなる取引日においても、当社の普通株式の1日の取引量の5%を超える金額で、そのような株式を公開市場に売却することはありません。
ソイン博士は、(y)FDAが疼痛治療用の低用量ナルトレキソンの新薬承認を発行するか、(z)決算から10年後のいずれか早い方に、シリーズS株式の最大1,000万ドル相当を当社の普通株式に転換することができます。さらに、クロージング後の10年間に、Dr. Soinは、製品の販売またはライセンス収入に関連して当社が受け取る総収益の5パーセントの割合で、最大1,700万ドルの価値を追加で転換する可能性があります。
2022年5月24日、当社はSPYR Technologies Inc. と資産購入契約を締結し、これに基づいて当社の完全子会社であるGeoTraq Inc.の実質的にすべての資産をSPYRに売却し、特定負債は売却しませんでした。GeoTraq資産の購入総額は1,350万ドルで、現金およびSPYRの普通株式で支払われました。2022年5月24日の取引完了時点で、SPYRは普通株式3,000,000株を当社に発行しており、当初の元本1,260万ドルの5年間の約束手形を当社に引き渡していました。約束手形には、年率8%の単純利息がかかり、四半期ごとに延滞利息が支払われ、違約金なしでいつでも前払いできます。
バイオテクノロジー
[概要]
私たちは臨床段階のバイオ医薬品企業であり、疼痛治療に対する満たされていない大きな医療ニーズに対応するために、オピオイド系で中毒性のない新しい治療法の特定、取得、ライセンス、開発、提携、および商品化におけるリーダーになることに重点を置いています。当社の最初の製品候補であるJAN101(旧称 TV1001SR)は、世界中で6,000万人以上が罹患している血管疾患である末梢動脈疾患(「PAD」)の治療薬となる可能性があります。また、世界中の多くの医師や当社が、COVID-19は血管系に直接影響を及ぼす呼吸器疾患であると考えているため、当社の化合物JAN101がCOVID-19の患者に与える潜在的な影響についても研究しています。PADの治療に関する第2b相臨床試験は、2023年秋までに開始される予定です。COVID-19血管合併症治療薬としてのJAN101の治験新薬申請(業界では「IND」と呼ばれる)は、2023年秋までに米国食品医薬品局に提出される予定です。
現在Jan123と命名されている第2の薬剤候補は、一般に腕や脚に重度の慢性的な痛みを引き起こす適応症であるCRPSの治療薬として開発中です。現在、CRPSの真に効果的な治療法はありません。CRPSに罹患している患者の数が比較的少ないため、FDAはCRPSの治療薬として承認されたすべての製品に希少疾病用医薬品の指定を与えています。この指定により、臨床試験の税額控除、ユーザー料金の免除、承認後7年間の市場独占権の取得が可能になります。さらに、現在、希少疾病用医薬品の開発では、研究できる患者数が限られているため、試験が小規模になり、承認までの時間が短縮されています。ただし、その製品がFDAの承認を受けることや、それが材料販売につながるという保証はありません。
JAN101
JAN101(以前はTV1001SRおよび/または当社の先進製品候補であるTV1001として知られていました)は、亜硝酸ナトリウムの特許取得済みの経口徐放性医薬組成物で、糖尿病やPADの血管合併症のある患者などの四肢への血流不良をターゲットとし、痛みを治療します。ヒトを対象とした一連の研究の結論によると、JAN101徐放性亜硝酸ナトリウムは、亜硝酸ナトリウムの即時放出製剤で治療された患者による頭痛の報告を防ぐことがわかりました。PAD患者を対象とした以前の研究では、即時放出型亜硝酸ナトリウムによる40mgのBID治療により、報告された疼痛が統計的に有意に軽減されたのに対し、80mgのBID治療は、生理活性と血管機能の尺度であるフロー媒介性拡張に対してより顕著な効果を示しました。しかし、両方の治療群の多くの被験者が、治療後に頭痛とめまいを報告しました。これによって被験者が治療を中止する結果には至らなかったが、JAN101はこの副作用を克服するために開発された。JAN101は、糖尿病性神経障害の被験者を対象としたブリッジング研究でテストされ、そのブリッジング研究中、被験者は頭痛やめまいを報告しませんでした。このブリッジ研究の被験者も治療後の痛みが軽減され、生理活性の改善(神経機能の尺度である定量的感覚検査)がPAD研究と同様で、80mgの用量投与群でフロー媒介拡張の改善が最も大きかった。JAN101のBID治療で痛みを緩和できることは、慢性疼痛に対する中毒性のない、鎮静作用のない新しい治療法として有望であると考えています。
S-5
JAN123
ソイン博士の会社を買収したことで、臨床段階の後期段階にある第2の資産が当社に提供されます。現在Jan123と名付けられているこの製品は、一般に腕や脚に重度の慢性的な痛みを引き起こす適応症であるCRPSの治療用に開発されています。CRPSには真に有効な治療法はなく、CRPSに罹患している患者数が比較的少ないこともあって、FDAは希少疾病用医薬品の指定を認めました。この指定により、JanOneは臨床試験の税額控除、ユーザー料金の免除、承認後7年間の市場独占権の取得が可能になります。さらに、希少疾病用医薬品の開発には、研究できる患者数が限られているため、試験が小規模になり、承認までの時間が短縮されます。
企業情報
当社は1983年にミネソタ州で設立されましたが、その前身を通じて、1976年にレガシーリサイクル事業の運営を開始しました。2018年3月12日、当社はネバダ州に再法人化されました。2019年9月10日より、社名をJanOne Inc.に変更しました。当社はJanOne Inc.、および当社の完全子会社であるJanOne BioTech Holdings, Inc.、Soin Technologies, LLCを通じて事業を運営しています。
当社を見つけることができる場所
当社の主任執行事務所は、ネバダ州ラスベガスのイースト・ウォーム・スプリングス・ロード325番地、スイート102番地89119番地にあり、電話番号は (702) 997-5968です。52週または53週間の会計年度について報告します。当社の2022年度事業年度は、2022年12月31日に終了しました。当社の2021会計年度は、2022年1月1日に終了しました。当社の2020会計年度は、2021年1月2日に終了しました。当社は、www.janone.comにコーポレートウェブサイトを運営しています。ここに具体的に記載されている場合を除き、当社のウェブサイトに表示される情報は、目論見書またはこの目論見書補足の一部ではありません。当社の事業、事業、および財務状況に関する追加情報については、2022年4月1日にSECに提出された2022年1月1日に終了した2022年1月1日に終了した2021会計年度のフォーム10-Kの年次報告書、およびその後のSECへのその他の提出書類をご覧ください。
オファリング
次の概要には、このサービスに関する基本情報が記載されています。要約は完全ではありません。この目論見書補足の他の部分に記載されている全文とより具体的な詳細を読む必要があります。
発行者 |
株式会社ジャノン |
|
|
当社が提供する普通株式 |
1株あたり1.17ドルの購入価格で361,000株。 |
|
|
募集前に発行された普通株式 |
3,253,937 (1) |
|
|
本募集後に発行される普通株式 |
3,614,937株 (1) |
|
|
ナスダック・キャピタル・マーケット・シンボル |
ジャン |
|
|
収益の使用 |
この募集による純収入は、運転資金および一般的な企業目的に使用する予定です。「収益の使用」を参照してください。 |
|
|
リスク要因 |
この投資には高いリスクが伴います。当社の普通株式への投資を決定する前に慎重に検討すべき特定の要因については、S〜7ページから始まるこの目論見書補足と、4ページから始まる添付の基本目論見書に含まれている、または参照により組み込まれている「リスク要因」およびその他の情報を参照してください。 |
S-6
S-7
リスク要因
普通株式の保有には高いリスクが伴います。ここに掲載されている当社の普通株式を受け入れることを決定する前に、この目論見書補足、基本目論見書、および本目論見書補足および基本目論見書に参照により組み込む文書に含まれるすべての情報を慎重に検討および評価する必要があります。特に、この目論見書補足および基本目論見書の「リスク要因」という見出し、または本目論見書および基本目論見書に参照により組み込まれている文書に記載されているリスクと不確実性を慎重に検討し、評価する必要があります。この目論見書補足および基本目論見書に記載されているリスクと不確実性は、当社がSECに提出し、参照により本目論見書補足または基本目論見書に組み込む年次報告書、四半期報告およびその他の報告書および文書によって更新され、当社の事業、経営成績および財務状態に重大かつ悪影響を及ぼす可能性があり、ひいては当社の普通株式の価値に重大かつ悪影響を及ぼす可能性があります。
本募集および普通株式の保有に関連するリスク
当社の普通株式の市場価格は、上場株式が小規模で取引量が少なく、利益がなく、バイオ医薬品開発に資金を提供するための資本が必要であることを考えると、特に変動しやすく、株価の大幅な変動につながる可能性があります。
当社の普通株式市場は、大規模な上場株式を保有する大規模で定評のある企業の株式と比較して、価格が大幅に変動することが特徴であり、当社の株価は、そのような期間中の当社の財政状態または事業に重大な変化を反映していない可能性はありますが、今後もこのような大規模で確立された企業の株式よりも変動が激しくなると予想されます。たとえば、2022年1月1日から2022年12月31日まで、報告されている当社の普通株式の売却価格は、1株あたり1.37ドルから4.19ドルの間で変動しました。このようなボラティリティは、さまざまな要因に起因する可能性があります。まず、前述のように、当社の普通株式は、このような大規模で定評のある企業の株式と比較すると、散発的で取引量が少なくなっています。たとえば、当社の普通株式の多くが相応の需要なしに市場で売却された場合、当社の普通株式の価格は急激に下落する可能性があります。第二に、これまでのところ利益が不足しているため、投機的または「リスクのある」投資です。このリスクの増大の結果として、リスクに逆らう投資家は、ネガティブなニュースや進展が見られない場合に投資の全部または大部分を失うことを恐れて、大規模な上場株式を保有する大規模で定評のある企業の株式よりも、より早く、大幅な値引きで株式を市場に売却する傾向が強まる可能性があります。これらの要因の多くは当社の管理が及ばないものであり、当社の業績にかかわらず、当社の普通株式の市場価格を下げる可能性があります。
当社の普通株式は、ボラティリティが高いことに加えて、以下を含むがこれらに限定されない、当社の制御が及ばない多くの要因に応じて大きく変動する可能性があります。
S-8
さらに、バイオ医薬品市場または株式市場全般が投資家の信頼を失った場合、当社の普通株式の取引価格は、当社の事業、財務状況、または経営成績とは無関係の理由で下落する可能性があります。また、当社株式の取引価格は、当社に直接影響を与えない場合でも、同業他社に影響を及ぼす事象に反応して下落する可能性があります。これらの各要因は、とりわけ、当社の普通株式の価値を損なう可能性があります。過去には、市場が不安定な時期が続いた後、証券集団訴訟が企業に対して提起されることがよくありました。このような訴訟が当社に対して提起された場合、多額の費用がかかり、経営陣の注意と資源が流用され、当社の事業、経営成績および財政状態に重大かつ悪影響を及ぼす可能性があります。
さらに、バイオ医薬品市場または株式市場全般が投資家の信頼を失った場合、当社の普通株式の取引価格は、当社の事業、財務状況、または経営成績とは無関係の理由で下落する可能性があります。また、当社株式の取引価格は、当社に直接影響を与えない場合でも、同業他社に影響を及ぼす事象に反応して下落する可能性があります。これらの各要因は、とりわけ、当社の普通株式の価値を損なう可能性があります。過去には、市場が不安定な時期が続いた後、証券集団訴訟が企業に対して提起されることがよくありました。このような訴訟が当社に対して提起された場合、多額の費用がかかり、経営陣の注意と資源が流用され、当社の事業、経営成績および財政状態に重大かつ悪影響を及ぼす可能性があります。
当社は、本サービスの収益の使用について幅広い裁量権を有しており、収益を効果的に使用しない場合があります。
募集書類に記載されている特定の例外を条件として、本募集による純収入を運転資金および一般的な企業目的に使用する予定です。本オファリングの純収益の申請については、かなりの裁量権を有します。投資判断の一環として、そのような収益がお客様の同意を得られる方法で使用されているかどうかを評価する機会はありません。本募集の純収益の適用については、当社の判断に委ねる必要があります。純収益は、当社の収益性の向上や普通株式の価格の上昇を伴わない企業目的に使用される可能性があります。このような収益は、収入を生み出さない投資や価値を失う投資に充てられることもあります。当社がそのような資金を効果的に使用しなかった場合、当社の事業、財政状態、経営成績およびキャッシュフローに重大な悪影響を及ぼす可能性があります。
本募集で当社の普通株式を購入した場合、お客様の株式の正味有形簿価が即時かつ大幅に希薄化する可能性があります。さらに、今後、株式または転換社債を追加発行する可能性があり、その結果、投資家がさらに希薄化する可能性があります。
募集中の普通株式の1株あたりの価格は、本募集前の発行済み普通株式の1株あたりの正味有形簿価よりも高い場合があります。2022年10月1日現在、当社の純有形簿価は1,140,000ドル、つまり1株あたり約0.36ドルでした。当社の普通株式総額361,000株は、1株あたり1.17ドルの価格で売却され、総収入は約422,000ドルです。当社が支払う予定の募集費用を差し引いた後、この募集の新規投資家は、1株あたり0.75ドルの希薄化を直ちに受けることになります。前述の詳細については、以下の「希釈」というタイトルのセクションを参照してください。未払いのストックオプションまたはワラントが行使されたり、シリーズA-1転換優先株式またはシリーズS転換優先株式の株式が転換されたりする限り、新規投資家がさらに希薄化する可能性があります。
将来、当社の普通株式の大幅な売却により、当社の普通株式の市場価格が下落する可能性があります。
近い将来、計画していた事業を継続するためには、多額の追加資本が必要になると予想しています。当社の普通株式のかなりの数の公開市場での売却、またはそのような売却が行われる可能性があるという認識は、当社の普通株式の市場価格を押し下げ、追加の株式の売却による資金調達能力を損なう可能性があります。このような売却が当社の株式の実勢市場価格に与える影響を予測することはできません。
当社は事業資金を調達しており、株式、ワラント、転換社債の発行により、事業、買収(もしあれば)、および戦略的関係の発展に引き続き資金を提供する予定です。これにより、既存の株主の所有率が大幅に低下する可能性があります。さらに、当社が確保する追加の資金調達には、当社の普通株式よりも優先、または同等の権利、優遇または特権の付与が必要になる場合があります。さらに、株式または株式連動証券を発行することにより、他の技術を取得したり、戦略的提携に資金を提供したりする場合があり、その結果、さらに希薄化する可能性があります。当社による株式の発行は、当社の普通株式の実勢市場価格と同等またはそれ以下である可能性があり、いかなる場合でもお客様の所有権に希薄化的な影響を及ぼし、その結果、当社の普通株式の市場価格が下落する可能性があります。また、負債の発生、または当社の普通株式よりも優先されるその他の証券または商品の発行または売却を通じて、追加の資金を調達する場合があります。当社が発行する可能性のある有価証券または証券の保有者は、当社の普通株式保有者の権利よりも優れた権利を有する場合があります。追加有価証券の発行により希薄化が生じ、新しい証券に普通株主よりも優れた権利を付与した場合、普通株式の取引価格に悪影響を及ぼす可能性があります。
S-9
当面の間、配当金の支払いは予定していません。配当が見込まれる場合は、当社の株式を購入しないでください。
私たちは普通株式に配当を支払ったことはありません。将来当社の普通株式に配当を支払うかどうかの決定は、当社の収益、財務状況、および取締役会が関連すると考える時点で当社に影響を及ぼすその他の事業的および経済的要因を含むがこれらに限定されないいくつかの要因に依存します。配当を支払わない場合、当社の普通株式の価値は低くなる可能性があります。これは、当社の株価が上昇した場合にのみ投資収益率が得られるためです。現在、事業を支援し、事業拡大の資金を調達するために将来の収益を維持する予定であるため、当面の間、普通株式に現金配当を支払う予定はありません。
株主の承認なしに優先株を発行する可能性があり、その結果、当時の株主の利益が希薄化され、議決権が損なわれる可能性があります。また、憲章文書の規定により、株主が有利と見なす可能性のある買収が妨げられる可能性があります。
改正された当社の定款により、取締役会が随時決定する指定、権利、優先権を備えた「空白小切手」優先株式の最大2,000,000株の発行が承認されています。当社の「シリーズA-1転換優先株式」の257,729株が承認され、そのうち217,402.65株が発行済みで、そのシリーズの37,141株が承認されているが未発行のまま残っています. 当社のシリーズS転換優先株式20万株が承認され、そのうち100,000株が発行済みであり、そのシリーズの100,000株は承認されているが発行されたままになります。当社には、指定および発行可能な「ブランクチェック」優先株式が1,540,271株残っています。当社の取締役会は、株主の承認なしに、配当、清算、転換、議決権、または普通株主の利益を希薄化したり、議決権を損なう可能性のある優先株式を1つ以上発行する権限を与えられています。一連の優先株の発行は、当社の支配権の変更を思いとどまらせたり、遅らせたり、防止したりする方法として使用できます。たとえば、当社の取締役会が議決権やその他の権利または優先権をもって優先株を発行する可能性があり、その結果、当社の支配権を変更しようとする試みの成功が妨げられる可能性があります。
証券アナリストや業界アナリストが、当社、当社の事業、または市場に関する調査やレポートを公開しない、または公開を停止した場合、または当社の普通株式に関する推奨事項を不利に変更した場合、当社の普通株価および取引量が下落する可能性があります。
当社の普通株式の取引市場は、業界アナリストまたは証券アナリストが当社、当社の事業、市場、または競合他社について発表する可能性のある調査レポートを含むがこれらに限定されない多くの要因の影響を受けます。この目論見書の日付現在、当社を取り上げているアナリストはいませんが、当社を取り上げた後、当社の普通株式に関する推奨を不利に変更したり、競合他社についてより有利な相対的な推奨を提供したりした場合、当社の株価は下落する可能性があります。当社を取り上げる可能性のあるアナリストが当社の取材を中止したり、当社に関するレポートを定期的に公開しなかったりすると、金融市場での可視性が失われ、ひいては当社の普通株価や取引量が減少する可能性があります。
未払いのオプションまたはワラントが行使された場合、または制限付株式ユニットが権利確定した場合、大幅な希薄化が発生します。
2023年3月24日現在、当社の普通株式11万株は発行済みストックオプションの基礎となっています。未払いのストックオプションまたはワラントが行使された場合、またはシリーズA-1転換優先株式またはシリーズS転換優先株式の株式が転換された場合、当社の株主に希薄化が発生し、大幅な希薄化が発生する可能性があります。
当社はSECの苦情の対象となっており、経営陣の焦点がそらされ、多額の訴訟費用が発生し、当社の事業、評判、財務状況、経営成績または株価に悪影響を及ぼす可能性があります。
現在、SECの苦情の対象となっています。2021年8月2日、米国証券取引委員会(「SEC」)は、米国ネバダ州地方裁判所に民事訴訟(「SEC訴状」)を提起し、当社とその執行役員の1人である当社の最高財務責任者であるVirland Johnsonを被告(総称して「被告」)として指名しました。
SECの訴状は、1934年の証券取引法(「取引法」)のセクション10(b)および規則10b-5に基づき、当社および執行役員に対する財務、情報開示、報告の違反を申し立てています。SECの訴状には、取引法のセクション13(a)、13(b)(2)(A)、13(b)(B)(B)および13(b)(5)および規則12b-20、13a-1、13a-13、13a-14、13b2-1、および13b2-2に基づく執行役員に対するさまざまな請求も記載されています。SECは、被告に対して恒久的な差止命令と民事罰を、執行役員に対する役員および取締役禁止を求めています。上記は、SECの苦情の一般的な概要に過ぎず、SECのWebサイトからアクセスできます。 https://www.sec.gov/litigation/litreleases/2021/lr25155.htm.
S-10
当社は、SECがこの問題を追求しても投資家に何の利益ももたらさず、代わりに中核事業から注意をそらすだけであると引き続き主張しています。2021年10月1日、当社は裁判所に訴状を却下する申立てを提出しました。SECは、2021年11月1日に申立てに反対する回答を提出しました。被告は、2021年11月15日にSECの異議申し立てに対する回答を提出しました。2022年9月7日、却下の申立ては裁判所によって却下されました。
被告は申し立てに強く異議を唱え、否定し、請求に対して精力的に弁護しています。SECと当社は現在、この訴訟に定められた問題について、2023年4月13日に調停を行う予定です。
当社は、知的財産、雇用、証券法、開示、税務、会計、集団訴訟、製造物責任に関連する事項を含む追加の調査、仲裁手続き、監査、規制調査、および同様の措置の対象となる場合があります。これらを総称して法的手続きと呼びます。特定の訴訟の結果や、進行中の調査が好意的に解決されるか、最終的に起訴または物的損害、罰金またはその他の罰則、執行措置、役員または取締役としての職務の禁止、SECでの実務の禁止、または当社または当社の上級管理職に対する民事または刑事訴訟につながるかどうかを予測することはできません。
法的手続き全般、特に証券訴訟や集団訴訟や規制調査は、費用がかかり、混乱を招く可能性があります。当社の保険は、当社に対して請求される可能性のあるすべての請求をカバーしているわけではなく、現在受けている法的手続きがいつまで続くかを予測することはできません。法的手続きの不利な結果は、当社の事業、財務状況、経営成績または株価に悪影響を及ぼす可能性があります。いかなる手続きも、利害関係者の間での当社の評判に悪影響を及ぼす可能性があります。さらに、進行中の法的手続きに関する宣伝は、たとえ当社にとって有利に解決されたとしても、当社に対する追加の法的手続きにつながるだけでなく、当社のイメージを損なう可能性があります。
収益の使用
この目論見書補足に基づいて提供された有価証券の売却による純収入は、当社が支払う予定の募集費用を差し引いた後、約368,600ドルになると推定されます。
当社は、株式の売却による純収入を運転資金およびその他の一般的な企業目的に使用する予定です。これには、買収が含まれる場合があります。当社が収益を使用する金額とタイミングは、当社の事業によって生み出されたまたは使用される現金の金額など、さまざまな要因によって異なります。そのため、本オファリングの純収益の配分については、当社が幅広い裁量権を有することになります。
本オファリングによる純収益が使用されるまでの間、純収益を短期、投資適格証券、有利子証券、米国政府証券など、さまざまな資本保全投資に投資する予定です。
希釈
本募集における普通株式の発行によるお客様の所有権は、本募集における普通株式1株あたりの募集価格と、本募集後の普通株式1株あたりの調整後の普通株式1株あたりの純有形簿価との差の範囲で、直ちに希薄化されます。
2022年10月1日現在の当社の過去の純有形簿価は1,140,000ドル、つまり普通株式1株あたり0.36ドルでした。1株あたりの過去の純有形簿価は、当社の有形資産総額から負債総額を差し引いた金額を、2022年10月1日現在の発行済み普通株式数で割ったものです。
1株あたり1.17ドルの募集価格に基づいて本募集における普通株式361,000株の発行を実施し、当社が支払う予定の募集費用を差し引いた後、10月現在の当社の調整後の純有形簿価額(当社の有形資産総額から、負債、優先株式の額面、およびのれん、特許、商標などの無形資産を差し引いたもの)2022年1月1日には、約1,508,000ドル、つまり1株あたり約0.42ドルだったでしょう。これは、既存の株主にとっては即座に1株当たりの有形簿価が0.06ドル増加し、新規投資家が本募集の普通株式を募集価格で購入する場合は1株あたり0.75ドルが即座に希薄化されることを意味します。次の表は、この希薄化率を1株当たりベースで示しています。
一株当たりの募集価格 |
|
|
|
$ |
1.17 |
2022年10月1日現在の1株あたりの正味有形簿価額 |
|
$ |
0.36 |
|
|
本オファリングの投資家に起因する1株当たりの純有形簿価の増加 |
|
|
0.06 |
|
|
本募集を実施した後の調整後の、1株当たりの純有形簿価として |
|
|
|
|
0.42 |
本募集で普通株式を購入する新規投資家への1株当たりの希薄化 |
|
|
|
$ |
0.75 |
S-11
上記の説明および表に反映されている当社の普通株式の総数は、2022年10月1日現在の発行済み普通株式3,150,230株に基づいていますが、その日付の時点で以下は含まれていません。(a) 1株あたり加重平均行使価格が1株あたり6.27ドルの発行済みストックオプションの行使時に発行可能な当社の普通株式11,000株、および (b) 将来に備えて留保されている当社の普通株式17,000株の追加株式2016年の株式インセンティブプランに基づく発行、および現在不確定な数の普通株式を当社のシリーズA-1転換優先株の株式は転換可能です。このような優先株式の保有者には、4.99% の転換制限が適用されます。
2023年3月23日現在、2016年の株式インセンティブプランでは未払いのオプションが90,000件、2011年の株式報酬プランでは未払いのオプションが20,000件ありました。各オプションは、当社の普通株式1株に対して行使可能です。当社の株式インセンティブプランに基づいて新しいオプションまたはその他の有価証券が発行される場合、または将来的に普通株式または優先株式を追加発行する範囲で、この募集では普通株式の発行対象者がさらに希薄化されます。さらに、現在または将来の事業計画に十分な資金があると考えられる場合でも、市況または戦略的考慮事項により、追加の資金調達を選択する場合があります。株式または転換社債の売却を通じて追加の資本を調達した場合、そのような有価証券の発行により株主にさらなる希薄化が生じる可能性があります。
配当政策
当社は、創業以来、普通株式の現金配当の申告または支払いを行っていません。ネバダ州の法律では、配当により通常の事業過程で支払期日を迎えたときに当社が債務を返済できなくなる場合、当社の総資産が負債総額に配当金の支払に必要な金額を足した金額を下回る場合、または優先権を有する株主の解散時に優先権を満たすために配当時に解散することになった場合、配当金の支払いは禁止されています。ディストリビューションを受け取る人よりも優れています。当社の取締役会は、適用されるネバダ州法の遵守を条件として、配当を支払うかどうかについて完全な裁量権を有します。取締役会が配当金の支払いを決定した場合でも、形式、頻度、金額は、当社の将来の事業と収益、資本要件と余剰金、一般的な財務状況、契約上の制約、および取締役会が関連すると考えるその他の要因によって異なります。取締役会は、配当に関する今後の決定を行う予定ですが、当社を取り巻く状況が変化した場合、当面の間、現金配当を支払う予定はありません。
当社が提供している有価証券の説明
当社は普通株式361,000株を発行しています。当社の普通株式の重要な条件と規定は、基本目論見書の44ページから始まる「資本株式の説明」というキャプションに記載されています。この目論見書補足の日付現在、当社の授権資本は、普通株式2億株(額面価格1株あたり0.001ドル)と、最大2,000,000株の空白小切手優先株式(額面価格0.001ドル)で構成されており、指定、権利、および優先権は取締役会が随時決定します。「シリーズA-1転換優先株式」の257,729株が承認されており、そのうち2株が承認されています 17,402.65株が発行済みで、そのシリーズの37,141株が承認されているが未発行のまま残っています。当社の200,000株シリーズS転換優先株式が承認され、そのうち100,000株が発行済みであり、そのシリーズの100,000株は承認されたが発行されたままになります。当社には、指定および発行可能な「ブランクチェック」優先株式が1,540,271株残っています。
配布計画
当社は、この目論見書補足および付随する基本目論見書に基づく普通株式の募集に関連して、合理的な最善の努力に基づき、H.C. Wainwright & Co., LLC(以下「プレースメントエージェント」)を当社の唯一のプレースメントエージェントとして雇用しました。本オファリングの条件は、市況および当社、プレースメントエージェント、および将来の投資家との間の交渉の対象となります。契約契約は、プレースメントエージェントによる有価証券の購入を約束するものではなく、プレースメントエージェントには、エンゲージメント契約に基づいて当社を拘束する権限はありません。プレースメントエージェントは、本募集において当社が提供する有価証券を購入するものではなく、特定の数または金額の有価証券を売却する必要はありませんが、合理的なベストエフォートに基づいて本募集を支援します。さらに、プレースメントエージェントは、将来の募集において新たな資本を調達できることを保証しません。プレースメントエージェントは、サブエージェントまたは特定のディーラーにオファーの支援を依頼する場合があります。プレースメントエージェントは、この目論見書補足および付随する目論見書に従って提供された有価証券を購入する義務はありません。当社は、本募集に関連して投資家と直接証券購入契約を締結し、当該投資家に当社からの一定の表明、保証、および契約を提供しており、証券購入契約を締結した投資家にのみ売却します。プレースメントエージェントは、サブエージェントまたは特定のディーラーを雇うことがあります
S-12
このオファーを手伝ってください。当社は、この目論見書補足に従って募集されている普通株式を、慣習的な取引条件が満たされることを条件として、2023年3月24日頃に引き渡す予定です。
当社は、紹介エージェントとしてのエージェントの活動に関連する、またはそれらから生じる特定の責任について、プレースメントエージェントを補償することに合意しました。
手数料と経費
当社は、本サービスに関連して、(i) 約29,566ドルの現金手数料、(ii) 約4,224ドル相当の管理手数料、および (iii) 20,000ドルの説明責任費用をプレースメントエージェントに支払うことに合意しました。このサービスに関連して当社が支払うべき総費用は、上記の紹介エージェント費用と費用を除くと、約35,000ドルと見積もられています。
次の表は、本目論見書補足および付随する目論見書に従って提供された有価証券の売却に関連して当社がプレースメントエージェントに支払う1株あたりおよび現金手数料の合計を示しています。ただし、ここに記載されているすべての有価証券の購入を前提としています。
|
|
普通株式1株当たり |
|
|
合計 |
|
||
提供価格 |
|
$ |
1.17 |
|
|
$ |
422,370 |
|
プレースメントエージェント手数料 |
|
$ |
0.0819 |
|
|
$ |
29,565.90 |
|
経費を差し引く前の収入、当社へ |
|
$ |
1.0881 |
|
|
$ |
392,804.10 |
|
さらに、プレースメントエージェントまたはその被指名人に、最大25,270株の普通株式を購入するワラントを発行します。プレースメントエージェントワラントの行使価格は1.4625ドルで、本募集の終了から5年間行使できます。
ロックアップ
当社が特定の投資家と締結した証券購入契約では、特定の例外を除いて、(i)普通株式または普通株式同等物(証券購入契約で定義されている)の株式の発行または登録届出書(フォームS-8を除く)の提出締切日から15日間、および(ii)締切日から12か月間、普通株式の発行を禁止しています。変動金利取引における株式または普通株式同等物(証券購入契約で定義されているとおり)。
第一拒絶の権利
また、当社は、本契約の日付から本募集の完了後12か月の記念日まで、引受会社またはプレースメントエージェントを使用して、登録直接募集を含む株式または株式連動証券の公募または私募募集において、該当する場合に唯一のブックランニングマネージャー、引受人またはプレースメントエージェントとして行動することをプレースメントエージェントに最初に拒否する権利を付与しました。
しっぽ
また、当社は、契約期間中にプレースメントエージェントから連絡または紹介された投資家が、プレースメントエージェントの契約の満了または終了後12か月以内に、公募または私募またはその他の資金調達または資金調達取引で当社に資本を提供した場合、本オファリングにおける現金およびワラント報酬と同等のテールフィーをプレースメントエージェントに支払うことに同意しました。
S-13
その他の関係
プレースメントエージェントおよびそれぞれの関連会社は、当社または当社の関連会社との通常の取引過程において、投資銀行取引、アドバイザリーおよびその他の商取引を行っており、今後行う可能性があります。これらの取引については、慣習的な手数料および手数料を受け取っており、今後も引き続き受け取る可能性があります。ただし、この目論見書補足に開示されている場合を除き、現在のところ、今後のサービスについて紹介エージェントとの取り決めはありません。
レギュレーション M
プレースメントエージェントは、改正された1933年の証券法(「証券法」)のセクション2(a)(11)の意味の範囲内で引受人とみなされる場合があり、プレースメントエージェントが受け取った手数料、およびプレースメントエージェントが元本を務めながら売却した有価証券の転売によって得られる利益は、証券法に基づく引受割引または手数料とみなされる場合があります。引受人として、プレースメントエージェントは、証券法に基づく規則415(a)(4)および取引法に基づく規則10b-5および規則Mを含むがこれらに限定されない、改正された1934年の証券法および証券取引法(「証券取引法」)の要件を遵守する必要があります。これらの規則および規制により、主体となるプレースメントエージェントによる有価証券の購入および売却のタイミングが制限される場合があります。これらの規則および規制に基づき、プレースメントエージェントは、(i)当社の証券に関連する安定化活動を行うことはできません。(ii)分配への参加が完了するまで、取引法で許可されている場合を除き、当社の有価証券に入札または購入したり、他人に当社の有価証券の購入を誘導したりすることはできません。
補償
当社は、職業紹介業者契約に基づく職業紹介業者の活動に関連する、または職業紹介業者契約に基づく職業紹介業者の活動から生じる特定の負債(証券法に基づく負債を含む)について、職業紹介業者および特定の個人を補償し、そのような負債に関して紹介代理店が行う必要のある支払いに拠出することに合意しました。
移管エージェントとレジストラ
普通株式の譲渡代理人および登録機関はEQ BY EQUINITIで、住所はミネソタ州セントポールスイート101センターポイントカーブ1110、電話番号は (855) 217-6361です。
上場
当社の普通株式は、ナスダック・キャピタル・マーケットに「JAN」のシンボルで上場されています。
ナスダック・キャピタル・マーケット・マーケット・リスト
当社の普通株式は、ナスダック・キャピタル・マーケットに「JAN」のシンボルで上場されています。2023年3月23日、ナスダック・キャピタル・マーケットで報告された当社の普通株式の最終報告価格は1株あたり1.25ドルでした。
法律問題
カリフォルニア州ロサンゼルスのClark Hill LLPは、本契約により募集される普通株式に関連する特定の法的事項について、当社に意見を提供します。Ellenoff Grossman & Schole LLP(ニューヨーク州ニューヨーク)は、本案件に関するプレースメントエージェントの弁護士を務めています。
専門家
2022年1月1日および2021年1月2日現在の監査済み連結貸借対照表、およびこの目論見書補足が含まれる登録届出書に参照により組み込まれた2022年1月1日および2021年1月2日に終了した年度の関連する連結営業計算書および包括損失、株主資本およびキャッシュフローの変動は、独立登録公認会計士事務所であるWSRP、LLCによる監査を受けています。それに、そのような会社の報告に頼るようになってきました会計と監査の専門家としての権限に基づいて与えられます。
S-14
詳細を確認できる場所
この目論見書補足は登録届出書の一部を構成します。SECの規則で認められているように、登録届出書の一部を構成するこの目論見書補足および基本目論見書には、登録届出書とその付属品に含まれるすべての情報が含まれているわけではありません。当社に関する追加情報は、登録届出書とその付属品に記載されています。この目論見書補足に記載されている法的文書に関する記述は必ずしも完全ではありません。そのような文書または事項をより完全に理解するには、登録届出書の別紙として提出された書類、またはその他の方法で当社がSECに提出した書類を読む必要があります。
年次報告書、四半期報告書、最新報告書、委任勧誘状、その他の情報をSECに提出します。当社のSEC提出書類は、SECのウェブサイト(www.sec.gov)から無料で一般に公開されています。当社のコーポレートウェブサイトはwww.janone.comです。当社のウェブサイト上の情報は、本目論見書補足、基本目論見書、または当社が提出するその他の目論見書補足には参照上組み込まれていないため、本目論見書補足、基本目論見書、またはその他の目論見書補足の一部と見なすべきではありません。
参照により組み込まれた情報
SECは、SECに提出した情報を参照して組み込むことを許可しています。つまり、これらの文書を参照することで、重要な情報を開示することができます。参照により組み込まれた情報は、本目論見書補足および基本目論見書の一部とみなされ、後でSECに提出された情報が更新され、この情報が優先されます。当社は、以前にSECに提出した以下の書類を参照して組み込んでいます。ただし、フォーム8-Kの最新報告書の項目2.02または項目7.01に基づいて提供された情報、またはそのような情報が提供されているが取引法に基づいて提出されていないことを示すその他の提出書類は、提出されたものとみなされず、参照によって本書に組み込まれることもありません。
また、取引法のセクション13(a)、13(c)、14、または15(d)に基づいて当社がSECに提出する将来の書類を、本目論見書補足および基本目論見書に参照により組み込んでいます(SECに「提出」されていないと見なされる情報は除きます)。
本目論見書補足または基本目論見書に参照により組み込まれた以前に提出された文書に含まれる記述は、この目論見書補足または基本目論見書の目的上、本目論見書補足または基本目論見書の目的で修正または置き換えられるものとみなされます。ただし、この目論見書補足または基本目論見書に含まれる記述が、本目論見書補足または基本目論見書、または本書に参照により組み込まれた後に提出された文書に含まれる記述がその記述を変更または優先する場合を除きます。
S-15
この目論見書補足および基本目論見書には、この目論見書補足または基本目論見書に参照により組み込まれた1つ以上の文書の情報を更新、変更、または反する情報が含まれている場合があります。参照により組み込まれた情報、またはこの目論見書補足または基本目論見書に記載されている情報のみに頼るべきです。当社は、他の誰にも異なる情報を提供することを許可していません。この目論見書補足または基本目論見書の情報が、この目論見書補足の日付または本目論見書補足または基本目論見書に参照により組み込まれた文書の日付以外の日付の時点で正確であると思い込まないでください。
当社は、この目論見書補足または基本目論見書が引き渡された受益者を含む各個人に、書面または口頭による要求に応じて、本登録届出書に参照により組み込まれた情報の一部およびすべてのコピーを、請求者に無料で提供します。これらの申告書のコピーは、(702) 997-5968までお電話いただくか、次の住所に郵送することにより、無料で請求できます。
株式会社ジャノン
325 E. ウォームスプリングスロード、スイート 102
ネバダ州ラスベガス89119
担当者:コーポレートセクレタリー
また、本目論見書補足および基本目論見書に参照により組み込まれている文書には、当社のWebサイト(www.janone.com)からアクセスすることもできます。当社のウェブサイトへの参照は、非アクティブなテキストによる参照のみであり、上記の特定の組み込み文書を除き、当社のウェブサイト上またはウェブサイトを通じて入手可能な情報は、この目論見書補足、基本目論見書、またはそれが一部となる登録届出書に組み込まれているとはみなされません。
S-16
目論見書

$100,000,000
普通株式
優先株式
債務証券
ワラント
権利
単位
当社は、普通株式(額面価格1株あたり0.001ドル)(「普通株式」)、優先株式、額面1株あたり0.001ドル(「優先株式」)、負債証券、ワラント、権利、およびこれらの証券のいずれかを含む単元を随時募集および売却する場合があります。優先株式またはワラントは、当社の普通株式、優先株の株式、または本契約に基づいて登録されているその他の証券に転換可能または行使できる場合があります。負債証券は、当社の普通株式または優先株式に転換可能または交換可能な場合があります。当社の普通株式はナスダック・キャピタル・マーケットに上場しており、「JAN」のシンボルで取引されています。
当社は、これらの有価証券を、継続的または遅延的に、1つ以上の引受人、ディーラー、代理人に、またはそれらを通じて、または購入者に直接提供および売却する場合があります。
非関連会社が保有する当社の発行済み普通株式の総市場価値は約2,186,586ドルでした。これは、2020年12月15日現在の発行済み普通株式1,829,982株(うち関連会社が保有していた約410,121株)と、2020年11月25日の普通株式の終値4.62ドルに基づいています。フォームS-3の一般指示I.B.6に従い、非関連会社が保有する普通株式の総市場価値が75,000,000ドル未満である限り、いかなる場合も、この目論見書に従って非関連会社が保有する普通株式の総市場価値の3分の1を超える有価証券を12か月間に売却することはありません。この目論見書の作成日以降、非関連会社が保有する当社の発行済み普通株式の総市場価値が7,500万ドル以上になった場合、売却の3分の1の制限は、この目論見書に従って行われた追加売却には適用されないものとします。この目論見書の日付を含む過去12か月間、当社はフォームS-3の一般指示I.B.6に従って有価証券を売却していません。
この目論見書には、これらの有価証券に適用される一般的な条件のいくつかと、それらの証券の一般的な提供方法が記載されています。提供される有価証券の具体的な条件およびそれらの提供の具体的な方法は、この目論見書の補足に記載されます。投資する前に、この目論見書と該当する目論見書補足をよくお読みください。
当社の証券に投資する前に考慮すべき特定のリスクについては、この目論見書の4ページの「リスク要因」セクション、SECへの提出書および該当する目論見書補足を参照してください。
証券取引委員会、州証券委員会、またはその他の規制機関のいずれも、これらの証券を承認または不承認にしておらず、この目論見書の正確性または妥当性を伝えたりしていません。これと反対の表明は刑事犯罪です。
この目論見書の日付は2020年12月29日です。
目次
|
ページ |
この目論見書について |
1 |
入手可能な情報 |
2 |
参照による特定の情報の組み込み |
3 |
将来の見通しに関する記述 |
4 |
リスク要因 |
4 |
ビジネス |
5 |
選択した連結財務データ |
42 |
当社が提供する可能性のある有価証券の説明 |
43 |
資本金の説明 |
44 |
優先株の説明 |
48 |
債務証券の説明 |
49 |
ワラントの説明 |
59 |
権利の説明 |
62 |
ユニットの説明 |
63 |
収益の使用 |
63 |
配布計画 |
64 |
法律問題 |
66 |
専門家 |
66 |
この目論見書について
この書類は目論見書と呼ばれ、当社が「シェルフ」登録プロセスを使用して証券取引委員会(「SEC」)に提出したフォームS-3の登録届出書の一部です。この発行登録手続きに基づき、当社は随時、この目論見書に記載されている有価証券の任意の組み合わせを1つ以上の募集として、当社が随時決定する金額で、総額100,000,000ドルを上限として売却する場合があります。
この目論見書には、当社が提供する可能性のある有価証券の概要が記載されています。この目論見書に記載されている種類またはシリーズの有価証券を提供するたびに、目論見書補足を提供したり、この目論見書または関連する自由書目論見書に参照して情報または文書を組み込んだり、必要に応じて、その時点で提供されている有価証券の条件に関するより具体的な情報を含む他の募集資料を使用します。また、当社は、これらの募集および有価証券に関する重要な情報を含む可能性のある1つ以上の関連する自由書目論見書をお客様に提供することを承認する場合があります。この目論見書には、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書またはその他の募集資料(該当する場合、当社がSECに提出します)には、これらの募集および有価証券に関連するすべての重要な情報が含まれています。また、これらの募集または有価証券、または特定の分配計画に適用されるリスク要因またはその他の特別な考慮事項についての説明を含め、この目論見書またはこの目論見書に参照により組み込む文書に含まれる情報を目論見書補足に追加、更新、または変更する場合があります。この目論見書の情報と、目論見書の補足または参照により組み込まれた情報または文書との間に矛盾がある場合は、その目論見書補足の情報または後日付けの組み込み情報に頼るべきです。提供されている有価証券を購入する前に、この目論見書、該当する目論見書補足、および関連する自由執筆目論見書またはその他の募集資料、および必要に応じて、「参照による特定の情報の組み込み」という見出しに記載されている参照によりここに組み込まれる情報を注意深く読むことをお勧めします。
お客様は、当社が本目論見書、該当する目論見書補足、および関連する自由執筆目論見書またはその他の提供資料(該当する場合)で提供した、または参照により組み込んだ情報のみに頼るべきです。当社は、お客様に別の情報を提供することを誰にも許可していません。ディーラー、営業担当者、またはその他の人物は、この目論見書、該当する目論見書補足、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)に含まれていない情報を提供したり、代表したりする権限がありません。
この目論見書の送付も、それに基づいて行われた売却も、当社の事業または業務に変更がないこと、またはこの目論見書の情報が本目論見書の作成日以降の時点で正しいことを意味するものではありません。この目論見書、該当する目論見書補足、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)の情報は、文書の前面の日付の時点でのみ正確であり、参照により組み込んだ情報は、この目論見書の送付時期、該当する目論見書補足、関連する自由執筆目論見書の送付時期に関係なく、参照により組み込まれた文書の日付時点でのみ正確であると考える必要があります。見書、またはその他の提供資料(該当する場合)、または売却セキュリティ。
この目論見書を含む登録届出書(登録届出書の別紙を含む)には、当社およびこの目論見書に基づいて提供される有価証券に関する追加情報および目論見書補足が記載されています。当社および当社の事業に関する情報を含む他の書類をSECに提出しており、今後も提出する予定です。また、この目論見書で提供される有価証券の条件を規定する法的文書を、SECに提出する報告書の証拠として提出します。登録届出書およびその他の報告書は、SECのインターネットサイトまたは「入手可能な情報」という見出しの下に記載されているSEC事務所で読むことができます。
この目論見書には、ここに記載されている一部の文書に含まれる特定の条項の要約が含まれていますが、完全な情報については実際の文書を参照してください。すべての要約は、実際の文書によって完全に認定されています。本書で言及されている書類の写しの中には、この目論見書が含まれる登録届出書の証拠として提出済み、提出予定、または参照により組み込まれるものがあります。これらの書類の写しは、以下の「入手可能な情報」に記載されている方法で入手できます。
入手可能な情報
この目論見書の対象となる証券に関して、証券法に基づくフォームS-3の登録届出書をSECに提出しました。この目論見書は、その登録届出書の一部であり、登録届出書またはそこに提出された展示品およびスケジュールに記載されているすべての情報が含まれているわけではありません。当社およびこの目論見書の対象となる有価証券に関する詳細については、登録届出書および登録届出書とともに提出された展示品をご覧ください。登録届出書の写しおよび登録届出書とともに提出された展示品は、ワシントンD.C. 20549北東100FストリートにあるSECが管理する公開資料室で無料で検査できます。パブリックリファレンスルームの運営に関する詳細については、SEC(1-800-SEC-0330)までお電話ください。SECは、報告書、委任勧誘状、情報明細書、およびSECに電子的に提出する登録者に関するその他の情報を含むインターネットWebサイトも運営しています。ウェブサイトのアドレスは http://www.sec.gov です。
1
当社は、改正された1934年の証券取引法(「取引法」)の情報および定期報告要件の対象となり、それに従い、定期報告、委任勧誘状、およびその他の情報をSECに提出します。このような定期報告書、委任勧誘状、およびその他の情報は、公開資料室および上記のSECのウェブサイトで閲覧およびコピーできます。当社は http://www.janone.com にウェブサイトを運営しています。フォーム10-Kの年次報告書、フォーム10-Qの四半期報告書、フォーム8-Kの最新報告書、および取引法のセクション13(a)または15(d)に従ってSECに提出された報告書の修正には、そのような資料が電子的にSECに提出または提出された後すぐに、当社のウェブサイトから無料でアクセスできます。当社のウェブサイトおよびそのサイトに含まれる、または当該サイトに接続されている情報は、この目論見書には組み込まれておらず、またその一部でもありません。
参照による特定の情報の組み込み
SECの規則により、参照情報をこの目論見書に組み込むことができます。つまり、別の文書を紹介することで、重要な情報を開示できるということです。このように言及された情報は、当社が文書を提出した日からこの目論見書の一部とみなされます。本目論見書の日付以降、かつ本目論見書による有価証券の提供が終了する日より前に当社がSECに提出した報告は、自動的に更新され、該当する場合は、この目論見書に含まれる情報、またはこの目論見書に参照により組み込まれた情報に優先します。
当社は、SECに提出された以下の書類または情報を参照してこの目論見書に組み込みます(いずれの場合も、SEC規則に従って提出されなかったと見なされる書類または情報を除きます)。
さらに、(i)最初の登録届出書の日付以降、登録届出書の発効前、および(ii)本目論見書の日付および本募集の終了または完了前に、取引法のセクション13(a)、13(c)、14、または15(d)に基づいて当社がSECに提出したすべての書類は、当該目論見書のそれぞれの提出日から参照により本目論見書に組み込まれたものとみなされます。文書。ただし、SECに「提供」されたが、「見なされない」文書または文書の一部が組み込まれていない場合を除きます。提出しました。」当社がその後SECに提出した上記の参照により組み込まれた情報は、自動的に更新され、この目論見書に含まれる以前の情報に優先します。
当社は、この目論見書が交付された受益者を含む各個人に、書面または口頭による要求に応じて、この目論見書に参照により組み込まれた、または組み込まれる可能性のある上記の文書のコピーを無料で提供します。ただし、それらの文書への展示は、それらの文書に参照により具体的に組み込まれている場合を除きます。書面または電話によるリクエストは、JanOne Inc.(325 E. ウォームスプリングスロード、スイート102、ネバダ州ラスベガス 89119)までお送りください。注意:コーポレートセクレタリー、電話:(702) 997-5968
2
将来の見通しに関する記述
この目論見書には、参照により組み込む文書を含め、証券法のセクション27Aおよび取引法のセクション21E、1995年の民間証券訴訟改革法(「PSLRA」)の意味における将来の見通しに関する記述またはSECが発表したリリースに含まれています。このような記述には、将来に関する当社の期待、希望、または意図に関する記述が含まれますが、これらに限定されません。歴史的事実ではない記述は将来の見通しに関する記述です。これらの将来の見通しに関する記述は、「期待」、「信じる」、「予想する」、「見通し」、「できる」、「ターゲット」、「プロジェクト」、「意図する」、「計画する」、「求める」、「見積もる」、「すべき」、「する」、「かもしれない」、「想定」などの言葉や、将来を指す言葉のバリエーションや類似の表現によって識別できることがよくあります。これらの注意書きは、証券法、取引法、およびPSLRAに従って、これらの法律の「セーフハーバー」条項の恩恵を受けることを目的として作成されています。
この目論見書に含まれている、または本目論見書に参照により組み込まれた将来の見通しに関する記述は、主に当社の予想に基づいており、当社の経営陣による見積もりと仮定を反映しています。これらの見積もりと仮定は、現在知られている市況やその他の要因に基づく当社の最善の判断を反映しています。このような推定や仮定は妥当であるとは考えていますが、本質的に不確実であり、特定のリスクと不確実性を伴い、その多くは当社の管理が及ばないものです。これらのリスクや不確実性のいずれかが顕在化した場合、実際の結果は、そのような将来の見通しに関する記述で説明されているものと大きく異なる可能性があります。実際の業績が将来の見通しに関する記述で説明されているものと大きく異なる原因となる要因には、以下の「リスク要因」という見出しで議論されているもの、「リスク要因」という見出しの下で議論されているもの、2019年12月28日に終了した年度のフォーム10-Kの年次報告書の他のセクションで説明されているもの、およびこの目論見書に参照により組み込まれているその他の報告書があります。これらの文書のコピーを入手する方法については、「入手可能な情報」および「参照による特定の情報の組み込み」を参照してください。
この目論見書およびこの目論見書に参照により組み込まれた文書に含まれる将来の見通しに関する記述は、将来の業績を保証するものではなく、そのような記述が実現すること、または将来の見通しに関する出来事や状況が発生することをどの読者にも保証できないことにご注意ください。実際の結果は、将来の見通しに関する記述で予想または暗示されているものと大きく異なる場合があります。この目論見書およびそれに参照により組み込まれた文書に含まれるすべての将来の見通しに関する記述は、その文書の日付時点で入手可能な情報に基づいて、それらが含まれている文書の日付時点でのみ作成されています。また、それらに関連するリスクと不確実性を考慮して、将来の見通しに関する記述に過度に依存しないように注意してください。法律で義務付けられている場合を除き、当社は、新しい情報、将来の出来事、またはその他の結果として、将来の見通しに関する記述を更新する義務を負わないものとします。
3
リスク要因
当社の証券への投資には重大なリスクが伴います。該当する目論見書補足、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)に含まれる、または組み込まれている「リスク要因」という見出し、および本書またはそこに参照により組み込まれている他の文書の同様の見出しに記載されているリスクと不確実性を注意深く確認する必要があります。言及されているリスクと不確実性はそれぞれ、当社の事業、業績、財務状態に悪影響を及ぼすだけでなく、当社の証券への投資額にも悪影響を及ぼす可能性があります。当社が目論見書補足に基づいて有価証券を募集および売却する場合、その有価証券に関連する追加のリスク要因を目論見書補足に含めることがあります。
ビジネス
将軍
2019年9月10日の時点で、JanOne Inc.(旧称アプライアンス・リサイクル・センターズ・オブ・アメリカ社)と子会社(総称して「当社」または「JanOne」)は、重度の痛みを引き起こす症状の治療法の発見と、中毒性のない鎮痛作用を持つ医薬品の市場投入に焦点を当てた製薬会社として、ビジネスの視野を広げました。当社は、激しい痛みを引き起こす基礎疾患を治療することにより、危険なオピオイド薬の処方を減らすことを目指しています。私たちの最初の薬剤候補は、末梢動脈疾患(「PAD」)の治療薬です。末梢動脈疾患は激しい痛みを引き起こし、米国だけで850万人以上が罹患しています。さらに、リサイクル部門では引き続きレガシー事業であるARCA Recycling, Inc.(「ARCA Recycling」)を、テクノロジー部門ではGeoTraq Inc.(「GeoTraq」)を運営しています。ARCA Recyclingは、電力会社やその他のエネルギー効率化プログラムのスポンサーにすぐに使える家電リサイクルおよび交換サービスを提供することにより、北米の主要な家電製品をリサイクルしています。GeoTraqは、セルラートランシーバーモジュールおよび関連するワイヤレスサービスの開発、設計、そして最終的には販売を行っています。
2019年9月10日、当社は社名をアプライアンス・リサイクル・センターズ・オブ・アメリカ社からJanOne Inc. に変更し、オピオイドの流行を終わらせるための革新的で新しいソリューションの開発を含め、事業視野を広げる意向を発表しました。デジタルテクノロジーから教育支援、年間数十億ドル規模の市場に対応する革新的な鎮痛薬まで、当社は毎年数万人の命を奪うオピオイド危機に対処するための新しい取り組みを推進する予定です。JanOneという新しい名前は、オピオイドの流行との闘いの「新しい日」の始まりを表すために戦略的に選ばれました。1月1日は新年の初日で、楽観的で決意と希望に満ちた日です。JanOneは、我が国史上最悪の薬物危機の終結を支援するための斬新な発想と革新的な手段に対する当社の新たな戦略的コミットメントを確認しています。当社はまた、ナスダックの新しいティッカーシンボルであるナスダック:JAN、新しいCUSIP番号03814F403、および新しいウェブサイトアドレス(www.janone.com)を採用しました。当社のウェブサイトに含まれている、または当社のウェブサイトからアクセスできる情報は、この目論見書には組み込まれていないため、この目論見書の一部と見なすべきではありません。この目論見書には、非アクティブなテキスト参照としてのみ当社のWebサイトのアドレスが含まれています。
2019年12月28日の時点で、当社の従業員数は208人で、そのうち199人が正社員でした。
当社は1983年にミネソタ州で設立されましたが、前身を通じて1976年にレガシーリサイクル事業の運営を開始しました。2018年3月12日、当社はネバダ州に再法人化されました。当社の本社は、ネバダ州ラスベガスのイースト・ウォーム・スプリングス・ロード325番地、スイート102番地89119にあります。
バイオテクノロジー
[概要]
私たちは臨床段階のバイオ医薬品企業であり、疼痛治療に対する満たされていない大きな医療ニーズに対応するために、オピオイド系および中毒性のない新しい治療法の特定、取得、ライセンス、開発、提携、商品化におけるリーダーになることに重点を置いています。当社の最初の製品候補であるJAN101(旧称 TV1001SR)は、世界中で6,000万人以上が罹患している血管疾患である末梢動脈疾患(「PAD」)の治療薬となる可能性があります。また、世界中の多くの医師と同様に、当社の化合物JAN101がCOVID-19の患者に与える潜在的な影響についても研究しており、当社は、COVID-19は血管系に直接影響を与える呼吸器疾患であると考えています。PADの治療に関する第2b相臨床試験は、2021年初頭に開始される予定です。COVID-19血管合併症治療薬としてのJAN101の治験中の新薬申請(「IND」)は、今後数週間以内に米国食品医薬品局(「FDA」)に提出される予定です。
JAN101
一般的に
4
JAN101(以前はTV1001SRおよび/または当社の先進製品候補であるTV1001として知られていました)は、亜硝酸ナトリウムの特許取得済みの経口徐放性医薬組成物で、糖尿病やPADの血管合併症のある患者などの四肢への血流不良をターゲットとし、痛みを治療します。ヒトを対象とした一連の研究の結論によると、JAN101徐放性亜硝酸ナトリウムは、亜硝酸ナトリウムの即時放出製剤で治療された患者による頭痛の報告を防ぐことがわかりました。PAD患者を対象とした以前の研究では、即時放出性亜硝酸ナトリウムによる40mgのBID治療により、報告された疼痛が統計的に有意に軽減されたのに対し、80mgのBID治療は、生理活性および血管機能の尺度であるフロー媒介拡張に対してより顕著な効果を示しました。しかし、両方の治療群の多くの被験者が、治療後に頭痛とめまいを報告しました。これによって被験者が治療を中止する結果には至らなかったが、JAN101はこの副作用を克服するために開発された。JAN101は、糖尿病性神経障害の被験者を対象としたブリッジング研究でテストされ、そのブリッジング研究中、被験者は頭痛やめまいを報告しませんでした。このブリッジ研究の被験者も治療後の痛みが軽減され、生理活性の改善(神経機能の尺度である定量的感覚検査)がPAD研究と同様で、80mgの用量投与群でフロー媒介拡張の改善が最も大きかった。JAN101のBID治療により疼痛を緩和する能力は、慢性疼痛に対する非中毒性かつ鎮静作用のない新しい治療法として有望です。
ヒトを対象とした臨床試験 JAN101 属性
JAN1010は痛みを隠すのではなく、組織や血管の機能不全を改善することで痛みの原因を治療します。
血管の健康に対する亜硝酸ナトリウムの利点
初期の研究では、亜硝酸ナトリウムは虚血組織の血流を効果的に回復させ、糖尿病、創傷治復、組織壊死など、血管新生の変化(新しい血管の発達)を伴うさまざまな病状に有効でした。有益な効果には、血管新生、内皮細胞増殖、および動脈新生の促進が含まれていました。また、循環中の亜硝酸塩濃度の低下とヒトの心血管疾患との間には強い関連性があります。亜硝酸ナトリウム/亜硝酸塩の関連性と有益な効果のいくつかを以下に説明します。
血漿亜硝酸塩レベルは心血管疾患と負の相関関係にあります


血漿亜硝酸塩レベルは、被験者が有する心血管リスク因子の数と反比例し、血漿亜硝酸塩の減少は、血流媒介性血管拡張(FMD)の減少および内膜内側内側厚さ(IMT)の増加(どちらも血管病変の指標)と関連していた。-クラインボンガードら(2006)フリーラジックバイオラルと医学 40:295-302
5
糖尿病患者とPAD患者では、血漿亜硝酸塩濃度が低下します
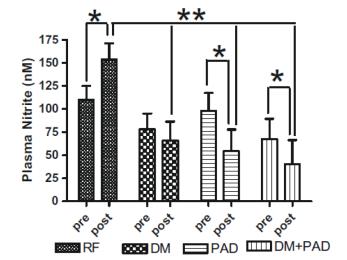
運動は、血漿亜硝酸塩の増加につながる内皮性一酸化窒素合成酵素活性、つまりNO産生を刺激することがよく知られています。アレンらの研究で、これらの著者らは、糖尿病(DM)またはDM+PADの患者では、亜硝酸塩のベースライン血漿レベルが低いことを明らかにしました。重要なことに、監視下での運動後、DM、PAD、またはDM+PAD患者のいずれにおいても、血漿亜硝酸塩レベルの上昇は観察されませんでした。これらのデータから、DM患者ではベースラインの亜硝酸塩の供給が損なわれていること、監視下での運動では血漿亜硝酸塩レベルを上げることはできないが、実際には亜硝酸塩が減少することが明らかになり、この分子の生理学的効率が浮き彫りになりました。-アレンら一酸化窒素 2009 20:231-237
重篤な四肢虚血患者における骨格筋の亜硝酸塩および代謝産物のレベルが低下する
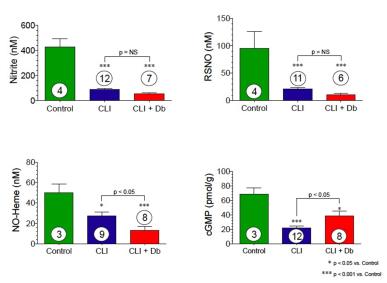
CLI患者では、骨格筋亜硝酸塩、ニトロソチオール、一酸化窒素ヘム、cGMPはすべて有意に減少します。CLIの糖尿病患者は、さらに亜硝酸塩の減少が見られます。
要約すると、さまざまな心血管疾患や血管疾患における亜硝酸塩レベルは、ヒトの疾患の重症度と反比例しているようです。
亜硝酸塩レベルが低いほど、心不全のレベルが高くなります。
PADの糖尿病患者では亜硝酸塩濃度が低いことが観察され、運動では補われない。そして
重症四肢虚血患者では筋肉中の亜硝酸塩濃度が低く、重症四肢虚血の糖尿病患者ではさらに低下する。
6
低濃度の循環亜硝酸塩とヒトの疾患との関連を考慮して、亜硝酸ナトリウムの補給は動物で前臨床的に研究されています。以下に、より重要な調査結果のいくつかを要約します。
アリアらから
亜硝酸塩療法は、NO依存的に虚血組織の血管密度を選択的に増加させます

慢性亜硝酸ナトリウム療法は、虚血組織の血管密度をNO依存的に増加させます。AとBは、7日目の亜硝酸ナトリウムと硝酸ナトリウムの虚血性脛腹筋組織からのCD31(赤)とDAPI核(青)染色の代表的な画像を示しています。CとDは、それぞれ165μg/kgの亜硝酸ナトリウム治療と硝酸塩治療の3日目と7日目の虚血性筋組織の血管密度を報告しています。EとFは、165μg/kgの亜硝酸ナトリウム+カルボキシPTIOによる3日目と7日目の虚血性筋組織の血管密度を示しています。(スケールバー、150μm)n = 治療群あたり10匹のマウス。クマール D. ら.パン; 2008; 105:7540-7545。
7
亜硝酸塩療法は虚血組織の動脈灌流を増強します

慢性亜硝酸ナトリウム療法は、虚血組織の血流を急激に増加させ、動脈新生を刺激します。AとBは、それぞれCpTiOの有無にかかわらず、さまざまな時点で165μg/kgの亜硝酸ナトリウムによって誘発される慢性虚血性組織の血流の急性変化を報告しています。Cは、PBS療法と亜硝酸塩療法の間の動脈分岐の数を報告しています。DとEは、それぞれ7日目の亜硝酸塩またはPBS処理したマウスの虚血性後肢における動脈血管系の血管キャストを示しています。*、P
亜硝酸塩療法は、糖尿病性虚血性後肢血流を回復させ、創傷治癒を促進します
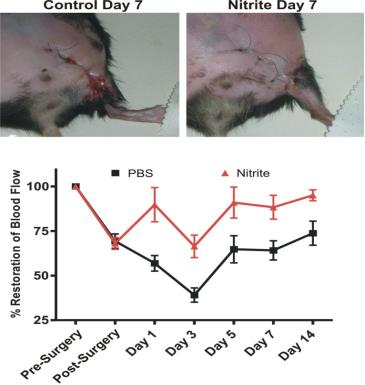
片側大腿動脈結節は、生後18〜20週齢の雄Db/Dbマウスで行われました。マウスは、IP注射によるPBS療法または亜硝酸ナトリウム(165μg/ kg)療法に1日2回ランダム化されました。レーザードップラー流量測定は、指定された時点で実施されました。7日目のPBS治療動物では創傷裂開の増加が認められたが、亜硝酸塩治療動物では認められなかった。(Bir ら糖尿病 2014, 63 (1): 270-81)
8
亜硝酸塩療法は糖尿病性虚血誘発性血管新生を増加させます
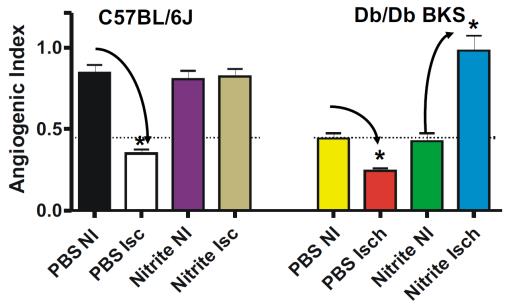
亜硝酸塩療法は、正常なC57BL/6J虚血性四肢における虚血媒介性内皮細胞密度の低下を防ぎました。亜硝酸塩療法は、非虚血性および虚血状態のPBS療法と比較して、糖尿病マウスの虚血性四肢の内皮細胞密度を正常なC57BL/6Jレベルに有意に回復させた。これらのデータは、亜硝酸塩療法が、代謝機能障害時に観察される一酸化窒素の喪失による微小血管狭窄を軽減するのに役立つ可能性があることを示唆している(フリスビー JC AJP Integr Comp Physiol 2005 289(2):R307-16; Steppら(マイクロサーキュレーション 2007 14(4-5):311-6)
遅発性亜硝酸塩療法は虚血性後肢血流を回復させる
大腿動脈結膜術後5日間虚血状態のままだった組織に亜硝酸塩媒介療法が有効かどうかを判断するための研究が実施されました。大腿動脈結節をC57BL/6Jマウスで行い、動物を動脈結節の5日後にPBS療法または亜硝酸ナトリウム療法のいずれかにランダム化しました。治療はI.P.注射によりB.I.D. を行いました。虚血性四肢血流量は、レーザードップラー流量測定を用いて測定した。(Bir ら糖尿病 2014, 63 (1): 270-81)
9
遅延亜硝酸塩療法はSPY血管造影動脈新生を増加させます
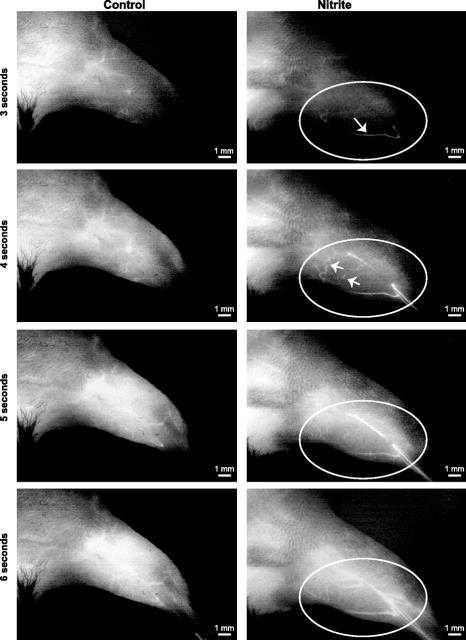
遅発性亜硝酸塩療法はSPY血管造影動脈新生を増加させます。代表的なSPY血管造影画像静止画(3~6秒)は、結膜後11日目と治療開始後6日後に示される(いずれか)
PBSまたは亜硝酸ナトリウム)。左:PBS コントロール血管造影右:ICG注射後の亜硝酸ナトリウム血管造影。n = コホートあたり5匹の動物。円は四肢の解剖学的血管が赤面している部分を示し、矢印は灌流した血管が時間の経過とともに徐々に進行していることを示します。
バール S C ら.Am J Physiol Heart Circ Physiol 2012; 303: H178-H188
10
亜硝酸塩療法は、高齢のDb/Dbマウスの組織壊死を防ぎます
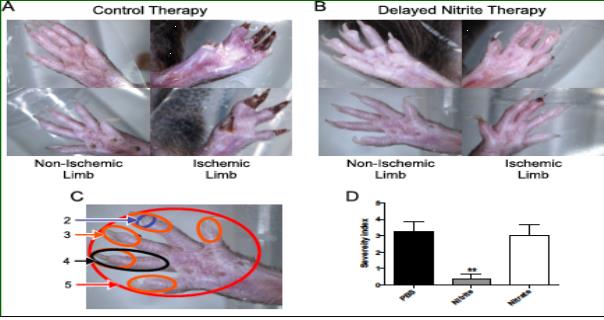
生後9か月のDb/Dbマウスにおいて、大腿動脈結節術の5日後に遅発性亜硝酸ナトリウム(165 ug/kg)または対照PBS療法が開始されました。亜硝酸塩療法は、対照PBS療法(パネルA)と比較して、組織壊死を有意に予防しました(パネルB)。パネルDでは、四肢および指への病変の程度に応じて組織壊死の重症度が報告されている。亜硝酸塩療法は、組織壊死を有意に予防したが、PBSコントロールまたは硝酸ナトリウムは治療しなかった。(Bir ら糖尿病 2014, 63 (1): 270-81)
亜硝酸塩および後肢虚血の概要
亜硝酸ナトリウムは強力な血管拡張薬(血管径を一時的に増加させる)として古くから知られており、急性に投与すると血圧が下がる可能性があります。上記の研究は、血管新生を刺激しない単回亜硝酸塩療法とは異なり、低用量での慢性投与は血管新生を促進することを示しています。さらに、これらの研究および上記で検討されていない他の多くの研究から、次のことが示されています。
当社の製品候補 JAN101
当社の製品候補は、血管機能の低下に関連する疾患の治療を目的としています。以下の表は、現在の製品候補パイプラインをまとめたものです。
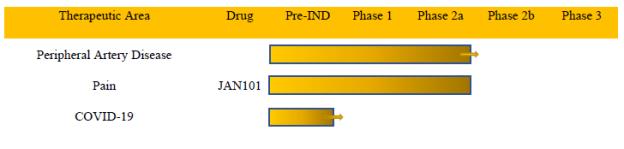
11
治療領域末梢動脈疾患疼痛COVID-19治療薬 JAN101 プレインドフェーズ 1 フェーズ 2a フェーズ 2b フェーズ 3
当社は、今後数週間以内にCOVID-19に関する治験INDをFDAに提出し、来年初めに末梢動脈疾患患者を対象とした大規模な第2相試験を実施するためのプロトコル改正を提出する予定です。
痛み
疼痛は、組織に実際に損傷があるか、または潜在的な損傷があるかを身体に警告する保護反応であり、必要な是正処置を講じることができます。国立衛生研究所(「NIH」)は、慢性疼痛を、傷害の通常の治癒期間を超えて持続する、または3か月以上続く痛みと定義しています。慢性疼痛は、米国では1億人、世界では15億人以上が罹患していると推定されています。したがって、慢性疼痛に苦しむ人の数は、糖尿病、心臓病、がんを合わせた数よりも多いと推定されています(2019年3月のCowen治療カテゴリー展望)。慢性疼痛は、治療やリハビリへの直接的な支出、労働者の生産性の低下、オピオイド系薬物中毒の蔓延など、患者とその家族にとって精神的および経済的負担という点で多大なコストを伴います。米国アカデミー医学研究所の報告によると、痛みは米国の重大な公衆衛生問題であり、社会に年間5,600億ドルから6,350億ドルの損害を与えています。疼痛の問題は深刻であるにもかかわらず、治療ソリューションの開発における革新はほとんど行われていません。2010年以降、疼痛治療薬としてFDAから20件の承認があり、そのうち12件はオピオイド系バリエーション、1件は徐放性ジェネリックコルチコステロイド、5件はアスピリンのバリアント、2件は他の既存薬の変異体でした。私たちは、慢性疼痛に苦しむPAD患者さんの現在の治療選択肢の限界を克服するために設計された新しい製品候補を開発しています。スタンフォード大学が行った研究によると、PAD患者の24%以上がオピオイドを大量に使用するリスクがあります。疼痛を根本から治療し、患者さんや医師により良い、より安全な代替治療法を提供することで、処方薬でのオピオイドの使用を最小限に抑えることができると期待しています。JAN101の特性を踏まえ、PADの根本的な原因を治療することにより、最初はPADに関連する痛みに焦点を当てるという戦略的決定を下しました。
末梢動脈疾患
末梢動脈疾患は、四肢への動脈血流が部分的に遮断される状態の総称です。四肢の血液量が需要に比べて少ないと、特にふくらはぎに筋肉痛や疲労が生じます。これは間欠性(間欠性)とも呼ばれます。多くの患者さんでは、安静によって痛みや疲労が緩和されます。PAD患者の約半数は無症状です。PAD/間欠性行の最も一般的な原因はアテローム性動脈硬化症です。糖尿病、慢性腎臓病、高血圧、喫煙はすべてPADの可能性を高める危険因子です。アテローム性動脈硬化症では、脂肪沈着(プラーク)が動脈壁に沿って蓄積し、脚の血流が減少します。脳につながる動脈が影響を受けると、これと同じプロセスが脳卒中を引き起こす可能性があります。
無症状患者の割合が高いため、有病率の数値は大きく異なります。世界中で最大2億人がPADを患っていると推定する人もいます。PADは、無症候性のものから重症なものまでさまざまです。有病率は患者の年齢に応じて増加し、60歳を過ぎると急激に上昇します。したがって、人口が高齢化している国では、PADの有病率は増加の一因となると予想されます。また、PADの有病率には民族的・人種的な要素が強く存在しますが、これは遺伝的差異とともに、食事や運動の文化的な違いによるものと考えられます。米国だけでも有病率が800万から1,200万人で、約3分の1が歩行時に痛みを感じ、休息すると改善すると示唆する人もいます。PADの診断は通常、四肢の痛みを訴える患者から始まります。患者さんがすでに糖尿病やその他の危険因子の治療またはモニタリングを受けている場合、医師は四肢の脈拍が弱いか脈拍がないかを確認します。血圧の低下、創傷治癒不良、(聴診器による)脚のシューという音も、PAD/間欠性(間欠性)の明らかな徴候です。血管造影、心電図、および超音波検査を使用して、診断の画像化と確認を行うこともできます。
12
PAD/間欠性(間欠性)の非薬物治療は、大きく分けて以下の4つのカテゴリーに分けられます:
ただし、基礎疾患は手術では対処できません。外科的アプローチでは、長期的には運動能力や歩行距離の改善にはつながりません。生活習慣の変化や薬物療法と相まって、運動そのものだけがこの恩恵を受けます。
基礎となるPADの治療のための処方薬は、基礎疾患と重症度に応じて複数のカテゴリーに分類されます。
13

PADの真に効果的な治療法がないことと、JAN101を用いたPAD患者の血管機能の改善と痛みの軽減の両方に関する有望な早期試験結果が得られたことで、この満たされていない大きな医療ニーズを治療する機会が生まれました。血管機能を改善することにより、JAN101は関連する痛みを軽減し、PAD患者の生活の質を改善する可能性があります。
COVID-19
コロナウイルス病(COVID-19)は、新たに発見されたコロナウイルスによって引き起こされる感染症です。
COVID-19ウイルスに感染したほとんどの人は、軽度から中等度の呼吸器疾患を経験し、特別な治療を必要とせずに回復します。高齢者、および心血管疾患、糖尿病、慢性呼吸器疾患、がんなどの基礎医学的問題を抱えている人は、重篤な疾患を発症する可能性が高くなります。COVID-19ウイルスは、感染者が咳やくしゃみをすると、主に唾液の飛沫または鼻からの分泌物を介して広がります。このフォーム10-Kの提出時点では、COVID-19に対する特定のワクチンや治療法はありません。しかし、潜在的な治療法やワクチンを評価する臨床試験が数多く進行中です。
COVID-19の重症例の特徴の1つは、急性呼吸窮迫症候群(「ARDS」)です。急性呼吸窮迫症候群(ARDS)は、肺の急速で広範囲にわたる炎症であり、呼吸不全や死に至る可能性があります。COVID-19に関連する肺損傷が広く報告されていることに加えて、世界中の臨床医は、この病気が患者に心臓損傷を引き起こし、場合によっては心停止につながる可能性があると報告しています。腎臓の損傷も、COVID-19患者の間で一般的に報告される問題になりつつあります。
イェール大学医学部の腎臓専門医であるアラン・クリガーは、初期データによると、ニューヨークと中国の武漢でICU COVID-19患者の14%から30%が腎機能を失い、後に透析が必要になったことを発見しました。同様に、ジャーナルKidney Internationalに掲載された研究では、武漢でCOVID-19で死亡した26人のうち9人が急性腎障害を起こし、7人の腎臓に新しいコロナウイルスのユニットがあったことがわかりました。
14
2020年5月28日にニューイングランドジャーナルに掲載された研究では、COVID-19で死亡した7人の患者の死後の特徴を詳述した研究が発表されました。これにより、血管の内壁への広範囲な損傷、肺の血管の異常な成長、広範囲にわたる血液凝固の証拠など、重要な洞察が得られます。ブリガムアンドウィメンズ病院の外科教授であるスティーブン・メンツァーが主導し、国際的な研究者チームと協力して組織分析を行ったこの研究では、COVID-19 の原因となるウイルスであるSARS-CoV-2に感染すると、血管の内側を覆う内皮細胞に深刻な損傷を与え、広範囲にわたる血液凝固を引き起こすことが示されました。研究チームはまた、COVID-19の一部の症例で、同じ重症度のインフルエンザウイルス感染に見られるパターンと比較して、血管疾患の進行パターンに特徴的なパターンが見られる兆候を特定しました。調査結果は次の重要なポイントを浮き彫りにしています。
血管の損傷は、他の問題の根底にある可能性もあります。例えば、COVID-19、小児多系統炎症症候群(MIS-C)、脳卒中、その他一見無関係に見えるCOVID-19の問題などです。
私たちのチーム
当社の最高科学責任者であるトニー・ジョルダーノ博士が2019年12月に入社しました。ジョルダーノ博士は、国内第2位の病院であるクリーブランドクリニックからJanOneに入社し、事業開発グループの特別プロジェクト担当シニアディレクターを務めました。ジョルダーノ博士は、プラットフォーム技術、がんワクチン、アルツハイマー病や心臓血管療法を開発する企業など、共同設立したバイオテクノロジー企業7社の副社長または社長を務め、商業化と医薬品開発において豊富な経験を持っています。彼は数多くの臨床試験や医療用食品の発売を管理してきました。ジョルダーノ博士はシュリーブポートのLSU Health Sciences Centerで准教授兼研究・事業開発担当副学部長も務め、キャンパスとアボット研究所でのライセンス業務を主導しました。同センターでは、上級研究科学者を務めたほか、技術評価活動にも携わっていました。ジョルダーノ博士は、オハイオ州立大学で分子遺伝学の博士号を取得し、NCIとNIAでフェローシップを修了しました。
当社の最高医療責任者であるアモル・ソイン博士は、2020年1月に入社しました。ソイン博士は、米国で最も優れた疼痛専門家の一人と見なされており、オハイオペインクリニックの創設者兼会長でもあります。ソイン博士は、神経障害性疼痛および慢性疼痛の治療に関する豊富な専門知識と、非オピオイド、非中毒性の疼痛ソリューションに関する豊富な研究経験をJanOneの経営陣にもたらします。最高医療責任者として、ソイン博士はJanOneの医薬品開発活動を指導し、臨床研究を管理し、患者の安全基準を設定し、規制遵守を確保します。さらに、ソイン博士は、同社がパイプラインを拡大する中で、パートナーシップの確立と医薬品候補の選定において不可欠な役割を果たす予定です。ソイン博士は、アクロン大学で学士号を、テネシー大学で経営学修士号を、ノースイースタンオハイオ大学医学部で医学博士号を、ブラウン大学で理学修士号を取得し、ダートマス大学でも学びました。麻酔科と疼痛医学の認定を受けたほか、世界疼痛研究所でインターベンショナル疼痛管理のフェローを務めたほか、米国で最も古く最大の学術疼痛管理部門であるクリーブランドクリニックで疼痛管理フェローを務めました。オハイオ州ペインクリニックの創設者兼会長であるソイン博士は、オハイオ州インターベンショナル疼痛医師会の会長、米国インターベンショナル疼痛医師協会財団の会長、インターベンショナル疼痛管理手術センター協会の会長、トライステート疼痛協会の次期会長など、いくつかの権威ある役職を歴任してきました。彼は2012年にケーシック知事から5年の任期でオハイオ州医療委員会に任命され、オハイオ州医療委員会の会長を務め、オピオイド危機に役立つ州全体の規則やガイドラインの可決に尽力しました。
2019年11月に科学諮問委員会(「SBA」)が設立され、現在以下の医師および科学者がSBAに参加しています。
科学諮問委員会委員長のクリス・ケビル博士 — 血管病態生理、PAD、一酸化窒素生物学の専門家として国際的に有名なケビル博士は、血管新生の促進における亜硝酸ナトリウムの役割を発見し、それが現在Jan101として知られているTV1001の開発につながりました。ケビル博士は、LSU Health Shreveportで分子細胞生理学の博士号を取得した後、アラバマ大学バーミンガム校(UAB)で酸化還元病態生理学に重点を置いたフェローシップを取得しました。LSU Health Shreveportの病理学科に戻り、末梢血管疾患のレドックス生物調節に関する最先端の研究プログラムを立ち上げました。これにより、グルタチオン、亜硝酸塩/一酸化窒素、硫化水素が虚血中の血管の健康をどのように調節するかについて、画期的な洞察が得られました。
エドガー・ロス、医学博士 — ロス博士は現在、ブリガムアンドウィメンズ病院の疼痛管理センターの所長であり、ハーバード大学医学部の麻酔教授でもあります。ロス博士は、5年連続でキャッスル・コノリーのアメリカのトップドクターとして認められています。ロス博士は、ファイザーの疼痛に関するパートナーシップの委員長を務めたほか、ブルークロスおよびブルーシールドのオピオイド処方政策委員会のメンバーも務めました。
15
ラケシュ・パテル博士 — パテル博士は現在、アラバマ大学バーミンガム校(UAB)の病理学部研究担当副議長およびフリーラジカル生物学センターの所長を務めています。最も注目すべきは、一酸化窒素の分子基盤と、臓器や赤血球との亜硝酸塩の相互作用を理解するための彼の研究です。パテルは、血流調節と肺機能に関連する生物学的プロセスへの影響を理解するための研究でも知られています。
ティモシー・ネス医学博士 — ネス博士は、アラバマ大学バーミンガム校(UAB)の麻酔科および周術期医学部の名誉教授であり、元疼痛治療部門長、疼痛研究部長、臨床研究担当副委員長であり、国立衛生研究所(NIH)、食品医薬品局(FDA)の諮問委員会で疼痛に関する臨床研究の専門家を務めてきました。、退役軍人局(VA)、およびさまざまな国際研究機関。米国疼痛学会および米国地域麻酔・疼痛医学会の理事を務めてきました。彼は現在、NIHから資金提供を受けています。
アラン・ケイ、医学博士、DABA、DABPM、DABIPP — ケイ博士は、2005年1月からニューオーリンズのLSUヘルスサイエンスセンターの麻酔科の教授兼会長を務めています。LSUに入社する前は、テキサス州ラボックにあるテキサス工科大学健康科学センター麻酔科の教授兼会長を務めていました。それ以前は、ニューオリンズのチューレーン大学医療センターでグレーター・ニューオリンズ・サージカル・センターのメディカル・ディレクター、レジデント・リクルート担当ディレクター、プログラム・ディレクター代理、麻酔科の主任スタッフを務めていました。アリゾナ大学で理学士号を2つと医学博士号を1つ取得しました。また、テキサス工科大学ヘルスサイエンスセンターで疼痛管理フェローシップを修了しました。彼は取締役です
麻酔科のコンサルタントとして認定され、米国麻酔科学会の疼痛管理に関する特別修了証も取得しています。また、米国疼痛医学委員会および米国インターベンショナル疼痛医師会の外交官でもあります。ケイ博士は1997年5月に薬理学の博士号を取得しました。彼の論文タイトルは「猫とラットの肺血管床におけるアンジオテンシンペプチドと非ペプチドアゴニストの薬理学」でした。全国学生研究フォーラムでレジデントとして第1位を獲得し、肺血管薬理学と麻酔学の分野で150以上の要約と200以上の原稿と本の章を執筆または共著しています。彼は生涯にわたり、医学生や研修医の教育と教育に関心を持ってきました。ASIPPやABIPPの全国理事会など、多くの国内委員会に参加しています。彼はジャーナルPain Physiciansの編集長であり、麻酔薬および鎮痛薬に関するFDA諮問委員会のメンバーでもあります。彼は麻酔科の全国副審査官でした
ジョン・クック医学博士 — ヒューストン・メソジスト研究所の心臓血管科学部長、心臓血管再生センターの所長、テキサス州ヒューストンのヒューストン・メソジスト・デバキー心臓血管センターのRNA治療プログラムの医学部長を務めています。彼は心臓血管医学の訓練を受け、メイヨークリニックで生理学の博士号を取得しました。彼はハーバード大学医学部に医学助教授として採用されました。1990年にスタンフォード大学に採用され、血管生物学と医学のプログラムの先頭に立ち、スタンフォード大学医学部の心臓血管医学部門の教授に任命され、2013年にヒューストン・メソジスト大学に採用されるまで、スタンフォード大学心臓血管研究所の副所長に任命されました。クック博士は、血管医学と生物学の分野で500以上の研究論文、ポジションペーパー、レビュー、書籍の章、特許を発表し、3万件以上引用されています。米国心臓協会、米国心臓病学会、血管医学会、国立心肺血液研究所など、心血管疾患を扱う国内外の委員会に参加してきました。彼は血管医学会の会長、米国血管医学委員会の理事、および血管医学の副編集長を務めてきました。
16
当社の戦略
私たちの使命は、慢性疼痛または疼痛の原因となる疾患の治療という未だ満たされていない重大な医学的ニーズに安全かつ効果的に対処するために、非オピオイド系で中毒性のない新しい治療法を開発し、商品化することです。この使命を達成するための私たちの戦略の主な要素は次のとおりです。
慢性的な痛み
NIHは、慢性疼痛を、傷害の通常の治癒期間を超えて持続するか、3か月以上続く痛みと定義しています。慢性的な痛みは重大な公衆衛生上の危機であると考えています。米国では、慢性疼痛は年間約4,000万人の成人に影響を及ぼしており、これは心臓病、がん、糖尿病のそれぞれの年間有病率を上回っています。また、痛みは毎年5,600億ドルから6,350億ドルの医療費と生産性コストの低下につながると推定されています。慢性的な痛みは、米国における長期にわたる障害の主な原因であり、米国では約2,300万人の成人が3か月間にわたって激しい痛みを経験しています。世界中で慢性疼痛の有病率はさらに高く、毎年世界中で10億人以上が罹患しています。一般的な慢性疼痛には、神経障害性および炎症性疼痛が含まれ、皮膚、筋肉、関節、骨、腱、靭帯、その他の軟部組織が関与することもあります。慢性疼痛は、関節炎、脊椎疾患、がん、線維筋痛症、糖尿病、外科的回復、内臓損傷、全身外傷など、さまざまな臨床症状を伴いますが、これらに限定されません。
痛みは、実際に組織に損傷があるか、あるいは潜在的な損傷があることを身体に警告し、必要な是正処置を講じるために必要な保護反応です。痛みは、侵害受容器または痛みを感知する線維と呼ばれる末梢神経系の特殊な細胞によって伝達されます。これらの痛みを感知する繊維は通常、体内のさまざまな場所から有害な強度に近づいたり超えたりする刺激に関する情報を脳に伝え、脳はこの情報を痛みの感覚として記録します。外傷または感染による組織損傷の場合、痛みは関連する炎症を伴い、炎症反応が続く間持続し、患部の使用を妨げることで治癒を助けます。
17
痛みは中枢神経系を変化させ、脳が過敏になり、刺激が少ないほど痛みが増すこともあります。これは中枢性感作と呼ばれます。中枢性感作が起こると、神経系はワインドアップと呼ばれるプロセスを経て、反応性の高い持続的な状態で調節されます。この持続的な、あるいは上向きに制御された反応性状態は、痛みの感覚の引き金となるものの閾値を低下させ、最初の傷害が治った後でも痛みの感覚をもたらす可能性があります。
痛みのシグナル伝達に機能不全、神経系の損傷、または治癒しない傷害があると、痛みはもはや単なる症状ではなく、それ自体が病気になります。
慢性疼痛の治療における現在の治療アプローチとその限界
NSAID
慢性炎症性疼痛の治療に最も広く使用されている治療法には、非ステロイド性抗炎症薬(NSAID)があります。NSAIDは、消化管出血、胃炎、高血圧、体液貯留、腎臓の問題、心臓の問題、発疹などの重大な副作用を引き起こす可能性があります。2005年4月7日、FDAは、すべてのNSAIDに潜在的な心血管リスクに関する箱入りの警告を義務付ける決定を発表しました。
コルチコステロイド
コルチコステロイド(またはステロイド)には抗炎症作用もあり、症状に応じて全身的または局所的に疼痛管理の実践によく使用されます。ステロイドは、炎症を抑え、免疫系の活性を低下させることによって作用します。ステロイドは一般的に使用されていますが、多数の重篤な副作用がある可能性があります。これらの副作用には、アレルギー反応または過敏反応、感染リスクの増加、副腎機能不全、糖尿病または耐糖能低下、高血圧、骨密度の低下、関節軟骨量の減少などがあります。さらに、ステロイドは体の自然な感染症と闘う免疫反応を阻害する可能性があるため、感染症が存在する場合はステロイドを投与しないでください。また、関節がすでに損傷しているか、慢性的な悪化が起こりやすい場合、IAステロイド注射は長期的な回復効果をもたらす可能性は低いです。上記の理由から、IAステロイド注射は通常、6週間おきに、1年に3〜4回以下の頻度で投与することが推奨されます。
オピオイド
オピオイドは、慢性および急性の疼痛に対して最も広く処方されている治療法の1つであり、これらの薬剤の売上高は1999年から2010年の間に4倍に増加しました。薬物使用と健康に関する全国調査の報告によると、2016年には、成人のアメリカ人の3分の1以上がオピオイドを処方され、その年に米国で2億3,000万件のオピオイド処方が作成されました。オピオイドは、脳、脊髄、その他の神経組織を含む全身の中枢神経系と末梢神経系の両方のニューロンにある特定の受容体に結合することによって作用します。オピオイドは疼痛緩和には効果的ですが、医療用途の増加に伴い、処方オピオイドの乱用や誤用も増加しています。さらに、吐き気、嘔吐、眠気、便秘などの多くの副作用に対する耐性が低く、長期間使用するとオピオイドの効果が低下する傾向があるため、ほとんどの患者にとって、オピオイドの慢性使用は不適切な選択肢です。米国疾病予防管理センター(CDC)によると、2014年には約200万人が処方オピオイドを乱用または依存していました。CDCの数値によると、オピオイド関連の過剰摂取による死亡者数は1999年から2010年の間に4倍に増加し、現在、米国におけるオピオイド過剰摂取による死亡の約40%が処方オピオイド系薬剤によるものです。米国での処方オピオイド関連の死亡者数の増加により、トランプ大統領は2017年10月にオピオイド危機を国家公衆衛生上の緊急事態と宣言しました。オピオイド乱用は米国で蔓延しており、米国で2番目に蔓延している違法薬物問題となっています。これらの主要な問題により、慢性疼痛の治療のための新しいアプローチを見つける必要が生じます。
PADと慢性疼痛の治療に対する当社のアプローチ
PADと慢性疼痛の治療に対する医学的ニーズが満たされていないのは、同等かそれ以上の有効性、許容できる程度の有害作用、および現在入手可能なものよりも乱用されやすい新しいクラスの鎮痛薬の開発に歴史的に失敗したことを反映しています。その理由には、慢性疼痛とそれに関連する症状の不均一性、および疼痛の根底にある病態生理学的メカニズムの複雑さと多様性が含まれます。しかし、痛みの神経生物学の理解が最近進んだことで、新しい薬剤ターゲットを特定し、新しい治療戦略を開発する機会が得られ始めています。
私たちは、痛みの病態生理学に関する理解を活用して、革新的で的を絞ったアプローチを慢性疼痛の治療法を特定してきました。疼痛はさまざまであり、例えば、炎症性または神経障害性の場合があり、体の特定の部位に限局する場合もあれば、全身に及ぶ場合もあります。慢性的な痛みを治療する最も効果的な方法は、痛みの信号の発生源を特異的に標的とする治療法を使用することだと考えています。痛みの信号の原因に関連する独自の作用機序に基づいて、各製品候補の可能性を最大限に引き出すよう努めています。
18
糖尿病性ニューロパチー患者に対する亜硝酸ナトリウム(SR-亜硝酸塩)の徐放性製剤の効果に関する無作為化二重盲検試験
バックグラウンド:バックグラウンド:亜硝酸ナトリウムは、慢性的な末梢痛の軽減に効果的であることが報告されています。
目的:糖尿病性ニューロパチーに罹患している患者における亜硝酸ナトリウム(SR-亜硝酸塩)の経口徐放性製剤40mgおよび80mg(BID)の安全性と有効性を評価し、SR-亜硝酸塩が同じ用量の即時放出製剤を投与された被験者によって以前に報告された頭痛の頻度を軽減するかどうかを判断すること。研究デザイン:第II相、単一施設、無作為化、二重盲検、プラセボ対照臨床試験。設定:オハイオペインクリニックとケタリングメディカルセンター。
方法:24人の患者を40mgまたは80mgのSR-亜硝酸塩またはプラセボに1日2回、12週間にわたってランダム化しました。主な目的は、SR-亜硝酸塩を使用することで頭痛が軽減されるかどうかを判断することでした。主要有効性評価項目は、神経障害性疼痛症状インベントリ(NPSI)の疼痛スコアのベースラインと12週間の治療後に報告された疼痛スコアの変化の平均差でした。副次的評価項目には、簡易疼痛インベントリ(BPI)尺度のベースラインからの変化、RAND 36アンケート、ショートフォームマギルアンケート、神経障害性疼痛の日次患者報告スコア、HbA1c、PulseOx、および定量的官能検査の変化が含まれていました。結果:有害事象を報告した被験者の数と有害事象の数は、用量によって変化しませんでした。治療に関連した頭痛の報告はありませんでした。アンケートに対する患者の回答に有意差は認められなかったが、傾向が認められた。NPSI評価では、40mgと80mgの用量群の患者は、プラセボ群の患者による8.4%の減少と比較して、それぞれ12.7%と22.0%の痛みの軽減を報告しました。BPIの総重症度スコアにも傾向が見られました。しかし、40mgの投与群では、マギル疼痛指数と毎日の疼痛スコアの患者記録による疼痛の軽減が最も大きかった。40mg群の被験者が報告した疼痛スコアの平均は41日目までに低下し、一般的に他の2つのグループの被験者が報告したスコアの平均よりも低いままでした。80 mgのSR-亜硝酸塩群の患者は、神経感覚コンダクタンスと神経感覚速度の両方が改善しました。HbA1cレベルまたはパルスOxに変化は観察されませんでした。
制限事項:サンプルサイズが小さい。
結論:徐放性亜硝酸ナトリウムは、亜硝酸ナトリウムの即時放出製剤で治療された患者による頭痛の報告が広まるのを防ぎます。末梢動脈疾患(PAD)患者を対象とした以前の研究では、40 mgのBID治療により、報告された疼痛の統計的に有意な減少がもたらされました。試験期間の終了時に、この研究で使用された疼痛に関する質問票のほとんどで同様の傾向が観察されました。80mgのBID治療は、生理活性に対してより顕著な影響を及ぼしました(定量的感覚検査)。これは、この用量群で口蹄疫が最も改善したPAD試験と同様でした {AU: spell out FMD}。SR-亜硝酸塩のBID治療で痛みを緩和できることは、慢性疼痛に対する中毒性のない、鎮静作用のない新しい治療法として有望であり、さらなる研究が必要です。
糖尿病患者によく見られる微小循環障害は、多くの問題を引き起こす可能性があります。これらの中で顕著なのは、糖尿病性末梢神経障害(DPN)です(1,2)。患者の約10%が初回評価時にDPNの証拠を示し、糖尿病患者のほぼ50%が最終的にDPNを発症します。DPNの糖尿病患者のうち、40%から50%が慢性的な痛み、感覚異常、感覚喪失、脱力感に苦しんでおり、同様の非糖尿病患者と比較して、遠位下肢切断を受けるリスクが少なくとも8倍高くなっています。内皮細胞は、血管拡張剤と血管収縮剤の両方を分泌することで血管緊張を維持するため、微小循環の調節に重要な役割を果たします。糖尿病性微小血管疾患(MVD)の中心的な特徴は内皮機能障害であり、これが今度はDPNの発症と進行に重要な役割を果たします。糖尿病の内皮機能障害を引き起こす病態生理学的要因には、慢性高血糖とタンパク質グリコール化、インスリン抵抗性、炎症、酸化ストレスの増加などがあります。現在、研究により、内皮機能障害と一酸化窒素(NO)のバイオアベイラビリティの低下との間に密接な関係があることが示されています。内生的に生成されたNOの半減期は秒単位で測定され、急速に酸化されて亜硝酸塩(NO2—)と硝酸塩(NO3——)の最終生成物になり、後者は生物学的に不活性です。ただし、微小循環性虚血および内皮細胞機能障害がある場合、eNOSによる内因性NO産生ははるかに制限されます。このような状況では、循環中のNO2-を非酵素的に還元して、NOの利用可能性を高めることができます。亜硝酸塩自体は、循環するNOリザーバーとして機能するだけでなく、in vitroおよびin vivoで直接的かつ強力な血管拡張作用を示すことも示されています。NO2—が直接的に、またNO生成を介して血管拡張を媒介するという発見により、DPNおよび内皮機能障害に関連する疾患の治療薬としての亜硝酸塩の潜在的な有効性への関心が高まっています。このような状態には、糖尿病性微小血管疾患、DPN、網膜症などがあり、NOとNO2-のレベルが低く、硝酸塩(NO3)のレベルが高いことから、NOのバイオアベイラビリティを回復するためのNO2-貯蔵量が不十分な糖尿病では、NOの完全な酸化が起こることが示唆されています。NaNaNO2の経口製剤を用いたこれまでのヒト試験では、1日2回投与すると血管機能が改善されることが示されています。末梢動脈疾患の研究では、低用量のNaNO2を投与された被験者が、疼痛の有意な軽減を報告しました。副作用は最小限でしたが、多数の被験者から頭痛とめまいが報告されました。これはおそらく、NaNo2の急速な放出が血管拡張につながったためです。これらの問題を克服するために、経口徐放性NaNO2(SR-亜硝酸塩)製剤が開発され、重篤な四肢虚血を伴うメタボリックシンドロームのブタモデルで試験されました。SR-亜硝酸塩治療動物は心筋NOの増加を示しました
19
虚血組織におけるバイオアベイラビリティ、酸化ストレスの減少、および細胞保護。重要なことに、血圧の24テロメトリー記録では、血管拡張の証拠は見られませんでした。本研究では、sRNitriteが即時放出製剤の投与後に患者に報告された頭痛を軽減または解消すると仮定しました。以前の研究で報告された末梢動脈疾患の糖尿病患者の疼痛軽減に関する有望な結果を踏まえ、この研究では糖尿病性ニューロパチーの患者を活用して、疼痛軽減の傾向が観察できるかどうかを判断しました。研究デザインは、糖尿病の被験者を対象に、亜硝酸ナトリウム(SR-Nitrite、Theravasc Inc.、米国オハイオ州クリーブランド)の経口徐放性製剤(SR-Nitrite、Theravasc Inc.、米国オハイオ州クリーブランド)を複数回投与した場合の安全性と潜在的な生物活性を調査するために、無作為化プラセボ対照二重盲検第II相試験が実施されました。下肢と足の神経障害性疼痛。この試験はコペルニクスIRBによって承認され、ClinicalTrials.gov(www.ClinicalTrials.gov/CT2/Show/NCT02412852)に掲載されました。この研究はTheravasc Inc.によって資金提供されました。
1月101日—規制戦略
亜硝酸ナトリウムは、シアン化物中毒解毒剤の有効成分の1つとして以前に承認されています。つまり、JAN101の承認経路は505 (b) (2) NDA (2) によるものであり、当社はこれを追求する予定です。
1月101日—コマーシャル戦略
現在、FDAの承認を得ることができれば、JAN101の商品化を効果的にサポートするために、米国の第三者プロバイダーやメーカーを利用する予定です。私たちは、PADに苦しむ患者にJAN101を費用対効果の高い方法で宣伝できると信じています。商業運営には、外部販売管理、外部販売サポート、流通サポート、および社内マーケティンググループが含まれる予定です。他に必要となる機能としては、マネージドケア組織、グループ購買組織、政府アカウントなどの主要アカウントの集中管理が含まれます。私たちは、開発のあらゆる面で提携してきたため、この分野で豊富な経験を持つ第三者と選択的に提携する予定です。
競争
バイオテクノロジーおよび製薬業界は、広範囲にわたる研究開発努力、急速に進歩する技術、激しい競争、および独自製品への強い重点を置いていることが特徴です。私たちは現在、PADの新規非オピオイド療法および非中毒性治療薬のアセットパイプラインの開発と商品化に注力しています。慢性PADに苦しむ患者の数は多く、増え続けています。製品候補と最高科学責任者の開発経験と科学的知識が競争上の優位性をもたらすと考えていますが、慢性疼痛の治療薬のマーケティングまたは開発において、製薬、バイオテクノロジー、専門製薬会社など、さまざまなソースとの潜在的な競争に直面しています。学術研究機関、政府機関、公的機関や民間機関も、競争力のある製品や技術の潜在的な供給源です。競合他社は、当社よりもはるかに多くの財源、強固な医薬品パイプライン、市場での存在感、研究開発、製造、前臨床および臨床試験、規制当局の承認と償還の取得、承認された製品のマーケティングにおける専門知識を持っている可能性があります。これらの競合他社は、有能な臨床、規制、科学、営業、マーケティング、管理担当者の採用と維持、臨床試験施設の開設、臨床試験の患者登録、および当社のプログラムを補完または必要とする技術の獲得においても、当社と競合しています。小規模または初期段階の企業も、特に大規模で確立された企業との協力体制を通じて、重要な競争相手となる可能性があります。すべての製品候補が承認されれば、その有効性、耐久性、安全性、価格、政府やその他の第三者からの償還の有無が成功を左右する主な競争要因となる可能性があります。
PADの疼痛分野には大きな競争が存在します。疼痛に対する新しい治療法を開発する当社のアプローチは、非ステロイド性抗炎症薬(「NSAID」)、コルチコステロイド、オピオイドなど、他のほとんどの既存または治験中の治療法とは一線を画していると考えていますが、開発が焦点を当てている適応の範囲内で、現在利用可能なすべての治療法および将来の治療法と競合する必要があります。JAN101に関しては、PAD疼痛の治療に使用できる市販製品の主なクラスには、NSAIDとオピオイドが含まれます。さらに、神経成長因子(NGF)阻害剤を標的とする多数のモノクローナル抗体が臨床開発中です。その中には、フェーズ3の製品候補が2つあります。
痛みの治療と管理のための治療法を開発または販売している企業は、現在の製品候補と競合する可能性があります。その中には、多くの大手製薬会社やバイオテクノロジー企業が含まれます。現在、承認されれば当社の製品となる治療法を販売または開発している企業のうち
競合する可能性のある候補者には、アコルダ・セラピューティクス、アサーティオ・セラピューティクス、バイオジェン、カーラ・セラピューティクス、イーライリリー・アンド・カンパニー、遠藤製薬、フレキシオン・セラピューティクス、グルーネンタール、ホライゾン・ファーマ、ヤンセン・リサーチ・アンド・ディベロップメント、メルク・アンド・カンパニー、ノバルティス、パチーラ・ファーマシューティカルズ、ペイン・セラピューティクス、ファイザー、パデュー・ファーマ、サノフィトレベナとバーテックスファーマシューティカルズ。
20
知的財産
当社の成功は、当社の製品および技術の専有保護を得て維持し、他者の所有権を侵害したり侵害したりすることなく事業を運営できるかどうかに大きく依存しています。私たちは、知的財産保護と、新薬に与えられる政府規制やマーケティングの独占権を組み合わせて、製品の保護に努めています。例えば、当社製品の保護に努めるには、とりわけ、当社の事業の発展と実施に重要な当社の独自技術、発明および改良に関連する米国および将来的には外国への特許出願を行うなどして、当社製品を保護するよう努めています。また、特に特許保護が適切または得られないと思われる場合は、機密情報、企業秘密、ノウハウ、商標など、他の形態の保護手段を使用して知的財産を保護します。
当社の製品候補、プロセス、ノウハウの所有権と保護は、当社の事業にとって重要です。私たちの方針は、知的財産権を追求、維持、擁護し、私たちの事業にとって商業的に重要な技術、発明、改良を保護することです。
企業秘密およびその他の専有情報
特許だけでなく、企業秘密やノウハウにもとづいて競争力を高め、維持しています。たとえば、徐放性亜硝酸ナトリウム錠をより効率的に製造する方法を開発しました。当社は、従業員、コンサルタント、科学顧問、請負業者、および商業パートナーとの秘密保持契約および発明譲渡契約により、当社の専有情報を保護するよう努めています。
LSU ライセンス契約
2019年11月19日、当社は、シュリーブポートのLSU健康科学センター(「LSU Health Shreveport」)を代表して、UAB研究財団(「UABRF」)、TheraVasc, Inc.(「TheraVasc」)、およびルイジアナ州立大学および農業機械大学の監督委員会と特許およびノウハウライセンス契約(「ライセンス契約」)を締結しました。UABRF および TheraVASC(以下「ライセンサー」といいます)。ライセンス契約に基づき、ライセンサーは、ライセンサーの亜硝酸ナトリウムの徐放性製剤に関連するライセンサーの特許権とノウハウについて、サブライセンス権を含む独占的かつ全世界規模のライセンスをJanOneに付与することに合意しました。ライセンス契約に基づき、最大約650万ドルの特定のマイルストーンを達成した時点で、返金不可の前払いライセンス料と特定のマイルストーン支払い、および特定のロイヤルティ支払いと年間ライセンス維持費を支払うことに合意しました。ライセンス契約では、JAN101の開発と商品化に商業的に合理的な努力を払うことが義務付けられています。
コマーシャル・オペレーション
現在、マーケティングおよび販売組織はありません。当社は、製品候補に関するグローバルな権利を保有しており、製品候補の1つがFDAによって承認されれば、米国市場への参入が見込まれます。当社の営業部隊は、販売管理、社内販売サポート、外部のマーケティンググループ、および流通サポートによってサポートされることを期待しています。私たちは、PAD患者を治療する専門医の専門分野にマーケティング活動を集中させることで、商業的能力に慎重に投資するつもりです。これらの医師には、疼痛管理の専門家、リウマチ専門医、外科医、スポーツ医学の医師が含まれますが、これらに限定されません。また、米国内外の他の販売チャネルや地理的市場への参入を支援するために、ライセンスや第三者との提携についても評価します。
政府規制
米国食品医薬品局(FDA)および州および地方裁判所、その他の国の規制当局は、当社が開発している医薬品の臨床開発、製造、マーケティング、流通に関わる企業に対し、相当かつ負担の大きい要件を課しています。これらの機関、およびその他の連邦、州、および地方機関は、とりわけ、製品候補の研究開発、試験、製造、品質管理、安全性、有効性、表示、保管、記録管理、承認、広告と宣伝、流通、承認後の監視と報告、サンプリングと輸出入を規制しています。
21
米国政府の医薬品規制
米国では、FDAはFDCAとその施行規則に基づいて医薬品を規制しています。規制当局の承認を取得し、その後、適用される連邦、州、地方、および外国の法令や規制を遵守するプロセスには、多大な時間と財源を費やす必要があります。製品開発プロセス中、承認プロセス中、または承認後に適用される米国の要件に従わなかった場合、申請者は、FDAによる保留中の申請の承認拒否、承認の取り消し、臨床保留、警告書の発行、製品リコール、製品の差し押さえ、生産または流通の全部または一部の停止、差し止め命令、罰金など、さまざまな行政上または司法上の制裁の対象となる可能性があります。、政府との契約の拒否、賠償、権利剥奪または民事または刑事罰則。
医薬品が米国で販売される前にFDAが要求するプロセスには、通常、次のものが含まれます。
前臨床試験
前臨床試験には、製品の化学的性質、毒性、製剤に関する実験室での評価や、潜在的な安全性と有効性を評価するための動物試験が含まれます。INDのスポンサーは、前臨床試験の結果を、製造情報、分析データ、入手可能な臨床データまたは文献などとともに、INDの一部としてFDAに提出する必要があります。一部の前臨床試験は、IND が提出された後も継続される場合があります。INDは、FDAが受領してから30日後に自動的に有効になります。ただし、それ以前にFDAが1件以上の提案された臨床試験に関して懸念または疑問を提起し、臨床試験を保留にしない限り、INDはFDAが受領してから30日後に自動的に有効になります。このような場合、臨床試験を開始する前に、INDスポンサーとFDAが未解決の懸念事項を解決する必要があります。その結果、INDを提出しても、FDAが臨床試験の開始を許可しない可能性があります。また、進行中または予定されている臨床試験に関する安全上の懸念、または特定のFDA要件への違反により、臨床試験の前または最中にいつでも臨床保留が課される場合があります。また、FDAが保留が解除されたことをスポンサーに通知するまで、試験を開始または継続することはできません。
臨床試験
臨床試験では、GCPの要件に従って資格を有する治験責任医師の監督の下、治験中の新薬をヒト被験者に投与します。これには、すべての研究対象者が臨床試験への参加についてインフォームドコンセントを書面で提出するという要件が含まれます。臨床試験は、とりわけ、試験の目的、安全性の監視に使用されるパラメーター、評価すべき有効性基準を詳述したプロトコルの下で実施されます。各臨床試験のプロトコルとその後のプロトコル修正は、INDの一部としてFDAに提出する必要があります。さらに、臨床試験に参加している各機関のIRBは、その施設で臨床試験を開始する前に、その臨床試験の計画をレビューして承認する必要があります。特定の臨床試験に関する情報は、特定の期間内に国立衛生研究所に提出して、www.clinicaltrials.gov Webサイトで一般に公開する必要があります。このウェブサイトに含まれている、またはこのウェブサイトを通じてアクセスできる情報は、この目論見書の一部を構成するものではありません。このウェブサイトのアドレスは、非アクティブなテキスト参照としてのみこの目論見書に記載しています。
22
ヒト臨床試験は通常、次の3つのフェーズに分けて実施されますが、これらのフェーズは重複する場合もあれば、組み合わせて行われる場合もあります。
承認後試験(フェーズ4試験と呼ばれることもあります)は、最初の市販承認後に実施される場合があります。これらの試験は、意図した治療適応症における患者の治療からさらなる経験を積むために用いられます。場合によっては、FDAはNDAの承認条件として第4相臨床試験の実施を義務付けることがあります。
FDAまたはスポンサーは、研究対象者または患者が容認できない健康リスクにさらされているという認定など、さまざまな理由でいつでも臨床試験を中断することができます。同様に、IRBは、臨床試験がIRBの要件に従って実施されていない場合、または薬剤が患者に予期せぬ重大な危害をもたらした場合、施設での臨床試験の承認を一時停止または終了することができます。さらに、一部の臨床試験は、データ安全性監視委員会または委員会と呼ばれる、スポンサーが組織する資格のある専門家からなる独立したグループによって監督されています。このグループは、その憲章によっては、治験の特定のデータへのアクセスに基づいて、指定されたチェックポイントで試験を進めるかどうかを決定する場合があります。
新薬の開発中、スポンサーには特定の時点でFDAと面談する機会が与えられます。これらのポイントは、IND の提出前、フェーズ 2 の終了時、および NDA の提出前に記載されている場合があります。それ以外の時間帯でのミーティングをお願いする場合もあります。これらの会議は、スポンサーがこれまでに収集したデータに関する情報を共有したり、FDAがアドバイスを提供したり、スポンサーとFDAが次の開発段階について合意に達したりする機会となります。スポンサーは通常、第2相試験の最後に行われる会議を利用して、第2相臨床結果について話し合い、新薬の承認に役立つと思われる重要な第3相臨床試験の計画を提示します。
臨床試験と並行して、企業は通常、追加の動物試験を実施するほか、薬剤の化学的および物理的特性に関する追加情報を開発し、cGMP要件に従って製品を商業的に製造するプロセスを完成させる必要があります。製造プロセスでは、製品候補の高品質なバッチを一貫して製造できなければならず、とりわけ、製造業者は最終医薬品の同一性、強度、品質、純度を試験する方法を開発する必要があります。さらに、適切なパッケージを選択してテストし、安定性研究を実施して、製品候補が賞味期限中に許容範囲を超える劣化を受けないことを実証する必要があります。
INDが活動中であり、承認される前には、前回の進捗報告以降に実施された臨床試験および非臨床試験の結果を要約した進捗報告を少なくとも年に1回FDAに提出する必要があります。また、重篤で予期しない有害事象が疑われる場合、INDの安全性報告を書面でFDAおよび研究者に提出する必要があります。他の研究からの所見では、同じまたは類似の薬剤に曝露されたヒトに重大なリスクがあることが示唆されています。動物または体外試験の結果から、重大な結果があることが示唆されています人体へのリスク、および臨床的に重要なリスクプロトコルまたは治験責任医師向けパンフレットに記載されているものと比較して、重篤な副作用の疑いのある発生率が高かった。
米国の審査および承認プロセス
製品開発、前臨床およびその他の非臨床試験および臨床試験の結果は、製造プロセスの説明、医薬品の化学的性質について実施された分析試験、表示案、その他の関連情報とともに、製品の販売承認を求める機密保持契約の一環としてFDAに提出されます。秘密保持契約書の提出には、多額のユーザー料金の支払いが必要です。このような手数料は、特定の限られた状況下では免除される場合があります。FDAは、製品のアイデンティティ、強度、品質、純度を保証および維持するために、製品が意図された用途に対して安全で効果的であるかどうか、製造がcGMPに準拠しているかどうかを判断するために、NDAを審査します。現在施行されている処方薬使用料法(PDUFA)のガイドラインでは、FDAは、標準NDAの「申請」日から10か月以内に、新しい分子エンティティの審査と提出に基づく対応を行うことを目標としています。この審査には通常、NDAがFDAに提出された日から12か月かかります。これは、FDAが申請書提出後約2か月以内に「申請」決定を下す必要があるためです。FDAは、提出後最初の60日以内にすべてのNDAについて予備審査を実施してから、実質的な審査を行うのに十分な完成度があるかどうかを判断します。FDAは、提出用のNDAを受け入れるのではなく、追加情報を要求する場合があります。この場合、追加情報を添えて NDA を再提出する必要があります。再提出された申請書も、FDAが申請を承認する前に審査の対象となります。
23
FDAは、新薬の申請を諮問委員会に照会する場合があります。諮問委員会とは、臨床医やその他の科学専門家を含む独立した専門家で構成される委員会で、申請が承認されるべきかどうか、どのような条件で承認されるべきかについて、審査、評価、勧告を行います。FDAは諮問委員会の勧告に拘束されることはありませんが、決定を下す際にはそのような勧告を慎重に検討します。
NDAを承認する前に、FDAは製品が製造されている1つまたは複数の施設を検査します。FDAは、製造プロセスと施設がcGMP要件に準拠しており、必要な仕様の範囲内で製品を一貫して生産するのに十分であると判断しない限り、申請を承認しません。さらに、NDA を承認する前に、FDA は 1 つ以上の臨床試験施設を検査して GCP 要件への準拠を確認する場合があります。
FDAがNDAを評価すると、承認書または完全回答書が発行されます。承認書は、特定の適応症の処方情報を記載した医薬品の商業的販売を許可します。A コンプリート
回答書には、申請の審査サイクルが完了し、現在の形式では申請が承認されないことが記載されています。Complete Response Letterには、通常、FDAが特定したNDAの具体的な欠陥が記載されており、重要な第3相試験の追加や、臨床試験、非臨床試験、製造に関連するその他の重要で時間のかかる要件など、追加の臨床データが必要になる場合があります。コンプリートレスポンスレターが発行された場合、スポンサーはNDAを再提出するか、レターに記載されているすべての不備に対処するか、申請を取り下げる必要があります。そのようなデータや情報が提出されたとしても、FDAはNDAが承認基準を満たしていないと判断する場合があります。
製品が規制当局の承認を受けた場合、承認が特定の疾患や投与量に大幅に限定されたり、使用適応症が制限されたりして、製品の商業的価値が制限される可能性があります。さらに、FDAはスポンサーに第4相試験の実施を義務付ける場合があります。第4相試験には、NDA承認後に医薬品の安全性と有効性をさらに評価するための臨床試験が含まれ、市販された承認済み製品の安全性を監視するための試験および監視プログラムを要求する場合があります。FDAは、医薬品の安全な使用を保証するために、REMSの要件など、他の条件を承認に出すこともあります。FDAがREMSが必要であると判断した場合、NDAのスポンサーはREMS案を提出しなければなりません。FDAは、必要に応じて承認されたREMSがないとNDAを承認しません。REMSには、投薬ガイド、医師のコミュニケーション計画、または配布方法の制限、患者登録、その他のリスク最小化ツールなど、安全な使用を保証するための要素を含めることができます。承認またはマーケティングに関するこれらの制限のいずれかにより、製品の商業的宣伝、流通、処方または調剤が制限される可能性があります。規制要件に違反した場合、または最初のマーケティング後に問題が発生した場合、販売承認が取り消される場合があります。
FDASIAは、小児研究公平法(PREA)を恒久化しました。これにより、スポンサーは、新しい有効成分、新しい適応症、新しい剤形、新しい投与計画、または新しい投与経路について、ほとんどの薬剤の小児臨床試験を実施することが義務付けられています。PREAでは、スポンサーが延期または免除を受けていない限り、元のNDAとサプリメントには小児科の評価が含まれている必要があります。必要な評価では、関連するすべての小児亜集団における適応症に対する製品の安全性と有効性を評価し、製品が安全で有効である各小児亜集団に対する投薬と投与を裏付ける必要があります。スポンサーまたはFDAは、小児亜集団の一部またはすべてを対象とした小児臨床試験の延期を要求する場合があります。延期が認められる理由はいくつかあります。たとえば、小児臨床試験が完了する前に成人への使用が承認される準備が整っていることや、小児臨床試験の開始前に安全性または有効性に関する追加のデータを収集する必要があることが判明した場合などです。FDAは、必要な評価を提出しなかったり、延期を最新の状態に保ったり、小児用製剤の承認申請を提出しなかったりするスポンサーには、コンプライアンス違反通知を送付する必要があります。
FDA 特別優先審査および承認プログラム
FDAには、重篤または生命を脅かす疾患または状態の治療を目的とした医薬品の開発およびFDA審査のプロセスを迅速化または簡素化し、満たされていない医療ニーズに対応できる可能性を示すことを目的として、ファストトラック指定、迅速承認、優先審査、画期的治療薬指定など、さまざまなプログラムがあります。これらのプログラムの目的は、FDAの標準的な審査手続きよりも早く、重要な新薬を患者に提供することです。
ファストトラック指定の対象となるには、FDAは、スポンサーの要請に基づいて、その製品が重篤または生命を脅かす疾患または疾患の治療を目的としており、満たされていない医療ニーズに対応できる可能性を示していると判断する必要があります。FDAは、その製品が、治療法がない場合や、有効性や安全性の要因に基づいて既存の治療法よりも優れている可能性がある治療法を提供する場合、まだ満たされていない医療ニーズを満たす製品であると判断します。FDAは、申請書全体が提出される前に、NDAのセクションを順次審査してファーストトラック製品について審査する場合があります。スポンサーがNDAの各セクションの提出スケジュールを提供した場合、FDAはNDAのセクションを受け入れることに同意し、スケジュールが許容範囲内であると判断し、スポンサーはNDAの最初のセクションの提出時に必要なユーザー料金を支払います。
24
FDAは、治療に大きな進歩をもたらす薬物、または適切な治療法が存在しない治療を提供する医薬品を優先審査の対象とする場合があります。優先審査とは、FDAが申請を審査する目標は、現在のPDUFAガイドラインに基づく10か月の標準審査ではなく、6か月であることを意味します。新しいPDUFA契約では、これらの6か月と10か月の審査期間は、新しい分子物質のNDAの受領日ではなく「申請」日から測定されます。これにより、通常、審査と決定の期限が提出日から約2か月長くなります。ファスト・トラック指定の対象となるほとんどの製品も、優先審査を受けるのが適切と考えられます。
さらに、重篤な疾患や生命を脅かす疾患の治療における安全性と有効性が研究され、既存の治療法よりも有意な治療上の利益をもたらす製品は、早期承認の対象となる場合があり、その医薬品が臨床的利益を予測する可能性がかなり高い代替エンドポイントに効果があることが立証された適切かつ十分に管理された臨床試験に基づいて承認される場合や、不可逆的な罹患率や死亡率よりも早く測定できる臨床エンドポイントに作用することが立証される場合もあります。かなり可能性が高い疾患の重症度、希少性または有病率、代替治療の利用可能性または欠如を考慮して、不可逆的な罹患率または死亡率、またはその他の臨床的利益への影響を予測する。承認の条件として、FDAは、早期承認を受けている医薬品のスポンサーに対し、不可逆的な罹患率または死亡率、またはその他の臨床エンドポイントに対する予測される影響を検証および説明するための市販後研究を実施するよう要求する場合があり、その医薬品は早期離脱手続きの対象となる場合があります。
さらに、FDASIAの規定により、スポンサーは「画期的な治療法」として製品候補の指定を要求することができます。画期的な治療法とは、単独で、または1つ以上の薬剤と併用して、重篤な疾患または生命を脅かす疾患または状態の治療を目的とした薬剤と定義されます。予備的な臨床証拠から、臨床開発の初期に観察された実質的な治療効果など、1つ以上の臨床的に重要なエンドポイントについて、既存の治療法よりも大幅に改善が見られる可能性があることが示されています。画期的な治療法として指定された医薬品も、早期承認の対象となります。FDAは、画期的な治療法の承認申請の作成と審査を早めることを目的として、時宜を得た会議の開催や助言の提供など、特定の措置を講じる必要があります。
製品がこれらのプログラムのうちの1つ以上の対象となる場合でも、FDAは後でその製品が認定条件を満たさないと判断したり、FDAの審査または承認の期間を短縮しないと決定したりする場合があります。必要に応じて、製品候補についてこれらの機会の一部を検討する場合があります。
承認後の要件
FDAの承認に基づいて製造または流通される医薬品は、記録管理、定期報告、製品のサンプリングと流通、広告と宣伝、製品に関する有害体験の報告に関する要件など、FDAによる広範囲かつ継続的な規制の対象となります。承認後、新しい適応症やその他の表示表示の追加など、承認された製品へのほとんどの変更は、事前のFDA審査と承認の対象となります。また、市販されている製品には、引き続き年間ユーザープログラム料金の要件があります。
FDAは、NDAの承認条件として、いくつかの事後承認要件を課す場合があります。たとえば、FDAは、製品化後の製品の安全性と有効性をさらに評価および監視するために、第4相臨床試験を含む市販後試験とサーベイランスを要求する場合があります。
さらに、承認された医薬品の製造および流通に関与する医薬品製造業者およびその他の団体は、その事業所をFDAおよび州機関に登録する必要があり、cGMP要件の遵守についてFDAおよびこれらの州機関による定期的な予告なしの検査の対象となります。製造プロセスの変更は厳しく規制されており、多くの場合、実施する前に事前にFDAの承認が必要です。FDAの規制では、cGMP要件からの逸脱の調査と修正も義務付けられており、スポンサーおよびスポンサーが使用することを決定する可能性のある第三者メーカーに報告および文書化の要件が課されています。したがって、メーカーは、cGMPコンプライアンスを維持するために、生産と品質管理の分野に時間、費用、労力を費やす必要があります。
医薬品または医療機器の承認が得られた後、規制要件や基準への準拠が維持されない場合、または製品が市場に出た後に問題が発生した場合、FDAは承認を取り消すことがあります。予期しない重症度や頻度の有害事象、製造プロセス、または規制要件への準拠の失敗など、これまで知られていなかった問題が後で発見された場合、承認された表示に新しい安全性情報を追加するよう強制的に改訂したり、新しい安全性リスクを評価するために市販後研究や臨床試験を課したり、REMSプログラムに基づく流通やその他の制限を課したりする可能性があります。その他の潜在的な影響には、とりわけ次のものがあります。
25
FDAは、市場に出される製品のマーケティング、表示、広告、宣伝を厳しく規制しています。医薬品や医療機器は、承認された適応症に対してのみ、承認されたラベルの規定に従って宣伝できます。FDAおよびその他の機関は、適応外使用の促進を禁止する法律および規制を積極的に施行しており、適応外使用の促進を不適切に実施したことが判明した企業は、重大な責任を負う可能性があります。
ハッチ・ワックスマン改正
ハッチ・ワックスマン法として知られる1984年の医薬品価格競争および特許期間回復法により、FDAの医薬品承認の経路が2つ追加されました。まず、Hatch-Waxmanの改正により、FDAはFDCAのセクション505(b)(2)に基づいて代替タイプのNDAを承認することが承認されました。第505 (b) (2) 条では、承認に必要な情報の少なくとも一部が、申請者自身または申請者のために行われた裁判から得られたものであり、申請者がデータ所有者から参照権を取得していない場合に、NDAの提出が認められています。申請者は、「上場医薬品」として作用する承認済み製品の安全性と有効性に関するFDAの調査結果を信頼することができます。FDAは、記載されている医薬品からの変更を裏付けるために、505人(b)(2)の申請者に対し、追加の研究または測定を行うよう要求する場合もあります。その後、FDAは、そのブランド参照薬が承認されたラベル適応症のすべてまたは一部、および505(b)(2)申請者が求める新しい適応症について、新製品候補を承認する場合があります。
第二に、FDCAのHatch-Waxman改正により、以前にFDAによって承認されたブランド医薬品(このような以前に承認された医薬品は「上場医薬品」と呼ばれる)の簡略化新薬申請(ANDA)の提出およびFDA審査および承認に関する法的手続きも確立されました。ANDAは、医薬品の有効成分、製剤、ジェネリック医薬品の仕様と安定性、分析方法、製造プロセスの検証データ、品質管理手順に関するデータと情報を含む包括的な提出書類です。ジェネリック医薬品の市販前申請は、一般的に安全性と有効性を実証するための前臨床および臨床データが含まれていないため、省略して呼ばれています。ただし、ジェネリック医薬品メーカーは通常、記載されている医薬品に対する試験製品の生物学的同等性試験を実施する必要があります。経口投与される全身用医薬品の生物学的同等性試験では、APIが医薬品から血流に吸収され、作用部位で利用可能になる速度と程度を評価します。生物学的同等性は、ジェネリック製品と記載されている薬剤の吸収速度と程度に有意差がない場合に確立されます。薬剤によっては、特に吸収速度や吸収の程度を測定することが困難または不可能な場合に、生物学的同等性を証明する他の手段がFDAによって要求されることがあります。FDAは、ジェネリック製品がイノベーター製品と比較して安全性と有効性について新たな疑問を投げかけないことが判明した場合、そのジェネリック製品をANDA申請に適したものとして承認します。FDAが基準となる革新薬と生物学的に同等ではないと判断した場合、その製品が別の用途を意図している場合、または承認された適合性申請の対象ではない場合、その製品はANDA承認の対象にはなりません。
505 (b) (2) NDAを含むNDAを通じて医薬品の承認を求める場合、申請者は申請者の製品を請求する特定の特許をFDAに登録する必要があります。NDAが承認されると、医薬品の申請に記載されている各特許がオレンジブックに掲載されます。オレンジブックに記載されている医薬品のジェネリック同等版の承認を求めるANDAまたはオレンジブックに記載されている医薬品を参照する505(b)(2)NDAを申請する申請者は、(1)申請の対象となる医薬品に関する特許情報がFDAに提出されていないこと、(2)当該特許の有効期限が切れていること、(3)当該特許の有効期限が切れていることをFDAに証明する必要があります。または、(4) 当該特許は無効であるか、申請が提出された医薬品の製造、使用、または販売によって侵害されることはありません。この最後の認証は、パラグラフIV認証と呼ばれます。パラグラフIV認証の通知は、認証の対象となる特許の各所有者と、ANDAまたは505 (b) (2) 出願が参照する承認済みNDAの保有者に提出する必要があります。出願人は、記載されている使用方法特許を証明するよりも、提案するラベルに特許取得済みの使用方法に関する文言が含まれていない(または切り抜かれている)ことを証明する「セクションviii」の声明を提出することもできます。
26
参照NDA保有者および特許所有者が、第IV項認証通知の受領後45日以内にオレンジブックに掲載された特許の1つに対して特許異議申し立てを行う場合、FDAは、第IV項認証の受領後、特許の有効期限、訴訟の和解、または出願人にとって有利な侵害訴訟の決定から30か月のいずれか早い時期まで、出願を承認することを禁じられます。ANDAまたは505 (b) (2) の申請も、オレンジブックに記載されているブランド参照医薬品の該当する非特許独占権の有効期限が切れるまで承認されません。
マーケティング独占権
FDCAの市場独占権条項により、特定のマーケティング申請の提出または承認が遅れる場合があります。FDCAは、新しい化学物質のNDAの承認を得る最初の申請者に、米国内での5年間の非特許販売独占権を与えています。同じ活性部分(原薬の作用を担う分子またはイオン)を含む他の新薬をFDAが以前に承認していない場合、医薬品は新しい化学物質です。独占期間中、FDAは、同じ活性部分に基づく別の医薬品について他社が提出した簡略化された新薬申請(ANDA)、またはセクション505(b)(2)に基づいて提出されたNDA(505(b)(2)に基づいて提出されたNDAを、その医薬品が元の革新的医薬品と同じ適応症を対象としているか、別の適応症を対象としているかにかかわらず、承認せず、審査のために受け入れることさえできません。申請者が承認に必要なすべてのデータを所有していないか、参照する法的権利を有していない場合。ただし、イノベーターNDA保有者がFDAに登録した特許のいずれかに対する特許無効または非侵害の証明が含まれている場合は、4年後に申請を提出できます。あるいは、申請者が実施または後援するバイオアベイラビリティ試験以外の新しい臨床試験(例えば、既存の医薬品の新しい適応症、投与量、または長所など)が申請の承認に不可欠であるとFDAが判断した場合、FDCAはNDAに対して3年間の販売独占権を与えるか、既存のNDAを補完します。この3年間の独占権は、新しい臨床試験に基づいて医薬品が承認された改変のみを対象としており、元の適応症または使用条件に対する有効成分を含む医薬品のANDAまたは505(b)(2)NDAを承認することをFDAが禁止するものではありません。5 年または 3 年の独占権があっても、完全な NDA の提出または承認が遅れることはありません。ただし、完全な機密保持契約書を提出する申請者は、安全性と有効性を実証するために必要なすべての前臨床試験および適切かつ十分に管理された臨床試験を実施または参照権を取得する必要があります。小児科の独占権は、米国で利用できるもう1つのタイプのマーケティング独占権です。小児科の独占権は、スポンサーがFDAからの書面による要請に応じて小児を対象に臨床試験を実施する場合、別の独占期間に付随してさらに6か月の販売独占権を与えるものです。書面による申請書の発行には、スポンサーが記載されている臨床試験を実施する必要はありません。さらに、前述のとおり、希少疾病用医薬品の独占販売は、特定の状況を除き、7年間の独占販売となる場合があります。
米国の補償範囲と償還
当社が規制当局の承認を求める可能性のある治療薬候補の補償範囲と償還状況については、大きな不確実性があります。米国での売上は、メディケア、メディケイド、TRICARE、退役軍人省などの政府医療プログラム、マネージドケア組織、民間の健康保険会社を含む第三者支払者からの適切な財政補償と償還の有無に一部依存します。当社またはお客様が治療薬候補の償還を求める価格は、支払者による異議申し立て、減額、または拒否の対象となる場合があります。
支払人が商品の補償を提供するかどうかを判断するプロセスは、通常、支払人が商品に対して支払う償還率を設定するプロセスとは異なります。支払人が商品の補償を提供することを決定したからといって、適切な償還率が得られるとは限りません。第三者支払者は、医療製品やサービスの安全性と有効性だけでなく、医療上の必要性や費用対効果についても検討し、価格設定に挑戦するケースが増えています。販売が承認される可能性のある製品の補償と償還を受けるには、規制当局の承認を得るために費やされる費用に加えて、あらゆる製品の医学的必要性と費用対効果を実証するために、費用のかかる薬理学的研究を実施する必要がある場合があります。第三者支払者は、当社の製品候補が他の利用可能な治療法と比較して医学的に必要または費用対効果が高いとは考えていない可能性があります。また、良好な補償を確保するために必要なリベートの割合が費用に対して十分なマージンを得られない場合や、医薬品開発への投資から適切な利益を得るのに十分な価格水準を維持できない場合があります。
27
医療改革
米国および一部の外国の法域では、医薬品候補の市販承認を妨げたり遅らせたり、承認後の活動を制限または規制したり、医薬品候補の収益性の高い販売に影響を与えたりする可能性のある、医療制度に関するいくつかの法律上および規制上の変更が行われており、現在も現在も続いています。
米国やその他の国の政策立案者や支払者の間では、医療費の抑制、質の向上、医療アクセスの拡大という目標を掲げて、医療制度の変化を促進することに大きな関心が寄せられています。米国では、製薬業界が特にこれらの取り組みの焦点となっており、主要な立法措置の影響を大きく受けています。2010年3月にACAが可決され、政府と民間保険会社の両方による医療費の調達方法が大きく変わり、米国の製薬業界に大きな影響を与えました。ACAは、とりわけ、(i) メディケイド医薬品リベートプログラムに基づいて製造業者が支払う最低メディケイドリベートを引き上げ、リベートプログラムをメディケイドマネージドケア組織に登録している個人にも拡大しました。(ii) 特定のブランドの処方薬および生物学的製剤を製造または輸入する事業体に対して、一部の政府医療プログラムにおける市場シェアに応じてこれらの事業体に配分される控除不可の年間手数料を設定しました。(iii) 3,400億ユーロの医薬品価格の下での低価格の提供の拡大プログラムに新たな事業体を追加することによるプログラム、(iv) メディケイド医薬品リベートプログラムに基づいて製造業者が支払わなければならない法定最低リベートの引き上げ、(v) メディケイドプログラムの適格基準の拡大、(vi) 臨床有効性比較研究を監督、優先事項の特定、実施するための新しい患者中心アウトカム研究所の設立、およびそのような研究への資金提供、および (vii) 医療センターの設立 CMSでのケアイノベーションでは、メディケアとメディケイドの支出を削減するための革新的な支払いおよびサービス提供モデルをテストしています。処方薬を含む可能性があります。
ACAの一部の条項はまだ実施されておらず、ACAの特定の側面について司法上および議会上の異議申し立てが行われているほか、トランプ政権がACAの特定の側面を廃止または置き換えるための最近の取り組みも行われています。議会は包括的な廃止法案を可決していないが、ACAに基づく特定の税の実施に影響を及ぼす法案が署名されて法制化された。2017年の減税および雇用法には、一般に「個人委任」と呼ばれる、対象となる健康保険を一年の全部または一部で維持できない特定の個人に対してACAが課す税ベースの責任分担支払いを2019年1月1日から廃止する条項が含まれています。さらに、2018年1月22日、トランプ大統領は2018会計年度の歳出に関する継続決議に署名しました。これにより、特定の高額な雇用主が後援する保険プランに対するいわゆる「キャデラック」税、市場シェアに基づいて特定の健康保険会社に課される年会費、免除対象外の医療機器に対する医療機器消費税など、ACAが義務付けている特定の手数料の実施が延期されました。
ACAが制定されて以来、医療提供者へのメディケア支払いを会計年度ごとに総額2%削減したり、いくつかの種類のメディケア提供者への支払いを削減したりするなど、他の法改正が提案され、採択されています。さらに、最近、製造業者が市場に出回っている製品の価格設定方法に対する政府の監視が強化されており、その結果、議会でいくつかの調査が行われ、とりわけ、製品価格の透明性を高め、価格設定と製造業者の患者向けプログラムとの関係を見直し、医薬品に対する政府プログラムの償還方法論を改革することを目的とした連邦法および州法が提案および制定されました。連邦レベルでは、トランプ政権の2019会計年度予算案には、さらなる医薬品価格管理措置が含まれています。提案された措置が有効になるためには追加の法律による承認が必要ですが、議会とトランプ政権はそれぞれ、医薬品コストを管理するための新しい立法措置および/または行政措置を引き続き模索することを表明しています。州レベルでは、価格または患者への償還の制約、割引、特定の製品へのアクセスとマーケティングコストの開示と透明性など、医薬品の価格を管理するための法律や規制を議会がますます可決し、実施しています。対策、場合によっては他国からの輸入や大量購入を促進するための措置もあります。
28
米国の医療詐欺および虐待に関する法律とコンプライアンス要件
連邦および州の医療法および規制は、製薬業界におけるビジネス慣行を制限しています。当社の事業能力に影響を及ぼす可能性のある米国の法律には以下が含まれます。
米国外の規制
承認された製品候補のいずれかが海外で販売される限り、当社は同様の外国の法律および規制の対象となる可能性があります。これには、安全監視、不正防止および乱用に関する法律、企業コンプライアンスプログラムの実施、医療専門家への支払いまたはその他の価値移転の報告など、適用される市販後の要件が含まれる場合があります。
将来の製品をEEAや他の多くの外国の管轄区域で販売するためには、別途規制当局の承認を得る必要があります。より具体的には、EEAでは、医薬品は販売許可(MA)を取得した後にのみ商品化できます。販売承認には次の 2 種類があります。
29
上記の手順に基づき、MAを付与する前に、EMAまたはEEA加盟国の管轄当局が、品質、安全性、有効性に関する科学的基準に基づいて、製品のリスクとベネフィットのバランスを評価します。
データおよびマーケティング独占権
EEAでは、販売が許可された新製品または参照製品には、8年間のデータ独占権と、販売承認によりさらに2年間の市場独占権の対象となります。データ独占期間により、ジェネリック医薬品またはバイオシミラーの申請者は、参照製品がEUで最初に承認された日から8年間、EUでジェネリック医薬品またはバイオシミラーの販売許可を申請する際に、参照製品の書類に含まれる前臨床試験および臨床試験データに頼ることができなくなります。市場独占期間により、ジェネリックまたはバイオシミラーの申請が承認された場合は、EUでの参照製品の最初の承認から10年が経過するまで、EUで製品を商品化することができません。10年間の市場独占期間は、その10年間のうち最初の8年間に、承認前の科学的評価において、既存の治療法と比較して有意な臨床的利益をもたらすと判断された1つ以上の新しい治療適応症の承認を取得した場合、最大11年間に延長できます。日本では、新しい投与経路による患者への投与が承認された医薬品は、6年間の市場独占権の対象となります。
臨床試験
欧州連合における医薬品の臨床試験は、欧州連合および各国の規制、およびGCPに関する国際調和会議(ICH)のガイドラインに従って実施する必要があります。特にトレーサビリティに重点を置いた欧州委員会によるその他のGCPガイドラインは、先進治療用医薬品の臨床試験にも適用されます。臨床試験のスポンサーが欧州連合内に設立されていない場合は、その法定代理人として行動する欧州連合内の団体を任命する必要があります。スポンサーは臨床試験保険に加入しなければならず、ほとんどのEU諸国では、治験中に負傷した被験者に「過失なし」の補償を提供する責任があります。
臨床試験を開始する前に、治験実施者は所管官庁から臨床試験の承認を得て、IECから肯定的な意見を得る必要があります。臨床試験の承認申請には、とりわけ、試験プロトコルのコピーと、調査中の医薬品の製造と品質に関する情報を含む治験薬関係書類を含める必要があります。現在、臨床試験の承認申請は、試験を実施する各EU加盟国の管轄当局に提出する必要があります。現在2019年に施行される予定の新しい臨床試験規則では、1つの国の当局が主導して申請を審査し、他の国の当局が限られた関与しか行わないという一元的な申請手続きが行われます。臨床試験申請書とともに提出された試験プロトコルまたはその他の情報に重大な変更がある場合は、関連する管轄当局および倫理委員会に通知するか、承認する必要があります。臨床試験に使用される医薬品は、cGMPに従って製造されなければなりません。その他の国内および欧州連合全体の規制要件も適用されます。
リサイクル
当社は1976年に中古家電小売業者として事業をスタートし、古くなった電化製品を修理して店舗で販売していました。Sears Roebuck and Co. や Montgomery Ward Inc. など、全国および地域の新家電小売業者との契約に基づき、小売業者のいずれかの店舗がミネアポリス/セントポール、マイアミ、またはアトランタの市場に新しい電化製品を納入したときに、交換した電化製品を小売業者のお客様の住居から回収しました。店舗で販売できなかった古い電化製品は、スクラップメタル加工業者に売られました。1980年代後半、環境規制が厳しくなり、不要な機器の廃棄に影響が出始め、危険な部品を含む電化製品を金属くず処理業者に持ち込むことができなくなりました。当時、金属加工業者が器具のシェルを受け入れて加工できるように、有害物質を除去するシステムや機器の開発を始めました。その後、家電メーカーや小売業者、廃棄物運搬会社、賃貸物件管理者、地方自治体、一般市民に、環境に配慮した方法で家電製品を処分するサービスを提供しました。
30
1989年、当社は電力会社と契約を結び、電力会社の省エネ活動を支援するためのターンキー家電リサイクルサービスを提供し始めました。それ以来、北米全土の約400の公益事業者やその他のエネルギー効率化プログラムプロバイダーにサービスを提供してきました。
現在、北米の約180の公益事業会社向けに、電化製品のリサイクル、または交換とリサイクルの契約を結んでいます。
エネルギー効率の悪い機器のリサイクルと交換の有効性を認識するエネルギー効率イニシアチブのスポンサーからの関心が引き続き寄せられています。今後は、電気、水道、ガス会社、公営住宅局、エネルギー効率管理会社に積極的に働きかけており、それに応じてさまざまな新しい家電製品のリサイクルおよび交換プログラムの提案を引き続き提出する予定です。ただし、さまざまな理由により、ユーティリティプログラムからの収益を予測する能力はまだ限られています。リサイクル量や、次年度に新規契約の獲得に成功するかどうかは予測できません。
米国とカナダに13か所のリサイクルセンターを運営しており、連邦、州、州、および地方のすべての規則と規制に従って古い電化製品を処理およびリサイクルしています。ARCAは、米国環境保護庁(EPA)RAD準拠の方法を使用して、CFC冷媒、水銀、ポリウレタンフォーム断熱材、鉄および非鉄金属、プラスチック、ガラスなどのリサイクル可能な材料を含む危険な成分や材料を除去し、適切に管理しています。当社の施設はすべてライセンスおよび許可の要件を満たしており、電化製品を処理する従業員は安全および危険物に関する広範なトレーニングを受けています。
米国の主要な家電製品には以下が含まれます。
冷蔵庫 |
|
衣類洗浄機 |
フリーザー |
|
衣類乾燥機 |
レンジ/オーブン |
|
ルームエアコン |
食洗機 |
|
除湿機 |
電子レンジ |
|
加湿器 |
多くの種類の主要な電化製品には環境に害を及ぼす可能性のある物質が含まれているため、古い電化製品を不適切に廃棄すると、空気、地面、水資源が脅かされます。これらの有害物質には以下が含まれます。
米国連邦政府は、機器の廃棄時に冷媒を回収することを義務付けており、家電製品に含まれる有害物質の管理も規制しています。ほとんどの州政府や地方自治体は、住民が不要な電化製品の処分方法に影響を及ぼす法律も制定しています。たとえば、多くの地域では、環境に有害な物質を除去するようにユニットが処理されていない限り、埋め立て地や金属くず処理業者が電化製品の受け入れを制限しています。そのため、古い電化製品は通常、通常の固形廃棄物システムから直接廃棄することはできません。
これらの固形廃棄物管理と環境問題に加えて、古い電化製品を適切に廃棄するもう1つの説得力のある理由は省エネです。2014 年 9 月に施行された米国エネルギー省の最新の家電製品エネルギー効率基準では、新しい冷蔵庫の効率は 1 年前に製造された冷蔵庫よりも 25 ~ 30% 高くなることが義務付けられています。現在製造されている冷蔵庫は、1970年代半ばに製造されたユニットの約5分の1の電力を消費します。
31
新しい冷蔵庫は家庭のエネルギーを大幅に節約できますが、米国の全世帯の 30% 以上が地下室またはガレージに2台目の冷蔵庫を設置しています。これらのユニットは通常15~25年前のもので、年間約750~1500キロワット時を消費するため、1世帯あたりの電気代は年間150ドル以上も上昇します。
電力会社は、システムのピーク需要を減らし、新しい発電容量の追加に伴う資本コストと環境コストを回避する方法として、エネルギー効率の悪い電化製品の処理において重要な役割を担っています。エネルギー効率の悪い電化製品を恒久的に使用停止にすることを奨励するために、多くの電力会社は、住宅顧客が稼働中の冷蔵庫、冷凍庫、ルームエアコンを廃止できるプログラムを後援しています。電力会社は、消費者が余剰機器の使用を中止したり、古くて効率の悪い電化製品を新しいより効率的なモデルに交換したりするための支援やインセンティブを提供することがよくあります。これを達成するために、一部の電力会社では、一部の顧客層向けに家電交換プログラムを提供しています。このプログラムでは、古いモデルのキッチン家電やランドリー機器をリサイクルし、新しい高効率の ENERGY STAR® ユニットを設置しています。
米国環境保護庁(EPA)は、収集された機器が環境に配慮した方法で管理されるように、家電製品のリサイクルプログラムを後援する電力会社やその他の団体による取り組みを支援してきました。2006年10月、環境保護庁は、オゾン層の保護と温室効果ガスの排出削減を支援することを目的とした自主的なパートナーシッププログラムである責任ある機器廃棄(「RAD」)プログラムを立ち上げました。このプログラムを通じて、RADパートナーはベストプラクティスを活用して、古い冷蔵庫、冷凍庫、ルームエアコン、除湿機からオゾン層破壊化学物質やその他の有害物質を回収しています。家電リサイクルの専門知識により、RADプログラムの設計に積極的に参加し、現在はRADパートナーである公益事業のお客様がリサイクルプログラムを通じて達成した環境上の利点を文書化した年次報告書をEPAに提出しています。
2009年10月、当社は4301 Operations, LLC(「4301」)と地域処理センター(「RPC」)の設立と運営に関する合弁契約(「合弁契約」)を締結しました。この合弁会社の設立当時、4301は主要な家電製品のリサイクルにおいて豊富な経験を持っていると考えており、それに関連して、4301は当時存在していた事業と設備を合弁事業に貢献しました。合弁契約に基づき、両当事者はARCA Advanced Processing, LLC(「AAP」)として知られる新しい法人を設立し、各当事者は50%の持分を保有していました。合弁会社の設立に関連して、当社は合弁事業に200万ドルを寄付しました。合弁会社は2010年2月8日に営業を開始しました。2017年8月15日、ARCAは4301と株式購入契約を締結し、80万ドルの現金と引き換えにAAPの50%の合弁持分を4301に売却しました。ARCAが記録した利益は81,000ドルでした。同日、別の関連取引において、ARCAはRecleim PA, LLC(「Recleim」)およびその他の当事者と資産購入契約を締結しました。この契約に基づき、ARCAは、ペンシルベニア州フィラデルフィアのノースデラウェアアベニュー4301番地またはRecleimが事業を行う場所から15マイル以内の後継施設で使用するために、特許番号8,931,289に基づく特定の知的財産をRecleimにライセンスすることに合意しました。2017年8月15日、Recleimは、(i) BB&T銀行に支払うべきすべてのAAP債務3,454,000ドルを全額返済し、(ii) 同日にRecleimがAAPから特定の機器および資産を購入した一環として、AAPおよびARCAの機器のすべての担保権を終了および解放し、(iii) AAP負債として約768,000ドルを引き受けました。ハイアール米国アプライアンスソリューションズ社(GEアプライアンス株式会社)に対するARCAのすべての負債
リサイクル事業の完全子会社には、2006年9月に設立されたカナダの企業であるARCA Canada Inc.、1991年11月に設立されたカリフォルニア州の企業であるARCA Recycling, Inc.、および2016年10月に設立されたリサイクル事業のコールセンターサービスを提供するネバダ州の有限責任会社であるCustomer Connexx, LLCが含まれます。
テクノロジー
2017 年 8 月 18 日、当社は GeoTraq を合併して買収しました。これは、当時使用していた家電製品のリサイクル能力を超えて、サービスを多様化するためです。この取引の結果、GeoTraqは当社の完全子会社となりました。この取引に関連して、当社はGeoTraqの3人の所有者に20万ドルを入札し、当時受益転換機能を含めて14,963,288ドル相当の当社のシリーズA転換優先株式288,588株を発行し、当初の元本総額80万ドルの1年間の無担保約束手形を3枚発行しました。これらの無担保約束手形は全額返済されました。さらに、GeoTraqの無形資産の購入に関連して、10,133,366ドルの繰延税金負債が発生しました。購入した無形資産の総額は、繰延税金負債を含めて26,096,654ドルでした。
32
GeoTraqは、位置情報サービス(「LBS」)を提供し、外部センサーをIoTに接続する革新的なワイヤレスモジュールを設計するモバイルモノのインターネット(IoT)テクノロジー企業です。GeoTraqは、一般に利用可能なグローバルモバイルIoTネットワークを使用した接続を可能にするワイヤレストランシーバーモジュールとサブスクリプションサービスの製造と販売を計画しています。GeoTraqは、導入コスト(ハードウェア、サービス、ロジスティクス)が高く、バッテリー寿命が限られており、フォームファクターが大きいため、現在既存のソリューションでは十分に活用されていない大規模なLBS市場セグメントに対応しています。LBS 市場には、既存のソリューションでは対応できないサービスの行き届いていない部分が大部分あると考えています。RFIDとWi-Fiは資産追跡のために近接する必要があるのに対し、GPSは多くのニーズに対応するにはかさばり、電力を大量に消費します。GeoTraq は、グローバルなモバイル IoT ネットワークから直接LBS を提供するテクノロジーを搭載したワイヤレストランシーバーモジュールを設計することで、その間の空白を解消します。GeoTraqのテクノロジーにより、ソリューションの大幅な低コスト、耐用年数の延長、小型フォームファクター、さらには使い捨てデバイスが可能になり、返品ロジスティクスのコストを大幅に削減できると考えています。
GeoTraqは、モバイルIoTワイヤレスモジュールの運用のさまざまな側面を対象とする特許第10,182,402号を申請し、付与されました。特許の特徴の説明には以下が含まれます。
33
GeoTraqの買収により、IoTデバイスを導入して、在庫やその他の資産の動きを特定、監視、追跡し、接続されたセンサーを監視できるようになる予定です。GeoTraqの子会社は、2019年12月28日に終了した会計年度を含め、これまでに収益を上げていません。
アプライアンススマート株式会社
2017 年 12 月 30 日以前は、ApplianceSmart® という名前で運営されている会社所有の小売店チェーンを通じて、米国で新品およびすぐに使える主要な家電製品を販売していました。2017年12月30日、当社は、当時の子会社であるApplianceSmart, Inc.(以下「ApplianceSmart」)とともに、ライブ・ベンチャーズ(ナスダック:ライブ)の完全子会社であるアプライアンス・スマート・ホールディングスLLC(以下「購入者」)と株式購入契約(以下「株式購入契約」)を締結し、これに基づいてすべて買主に売却しました 650万ドルと引き換えにApplianceSmartの資本金(「ApplianceSmart株式」)の発行済み株式および発行済み株式。2018年4月1日より、購入者は、購入価格の残高として、当初の元本390万ドルの3年間の約束手形(「ApplianceSmart Note」)を当社に発行しました。アプライアンススマートは、アプライアンススマートノートの返済を保証しています。2018年12月26日、ApplianceSmart Noteが修正および改訂され、ApplianceSmart Noteの満期日である2021年4月1日にすべての未払利息と元本が全額支払われるように返済条件を変更することと引き換えに、購入者、ApplianceSmart、およびApplianceSmart Contracting Inc. の資産に対する担保持分がARCAに付与されました。2019年3月15日、JanOneは第三者と劣後契約を締結しました。これに基づき、劣後契約から15日以内に最大120万ドルの支払いを受け取ることと引き換えに、ApplianceSmart Noteに基づく債務の支払いおよびApplianceSmartおよびその他の関連当事者の資産に対する担保権を劣後させることに合意しました。2019年12月9日、ApplianceSmartは、米国ニューヨーク州南部地区破産裁判所(「破産裁判所」)に、米国法典第11編第11章(「破産法」)に基づく救済を求める自主請願(「第11章訴訟」)を提起しました。2019年12月28日現在、ApplianceSmartがJanOneに負っている負債は約290万ドルです。ただし、JanOneは返済の不確実性により、負債の全額に対して全額評価引当金を計上しています。
リサイクルとテクノロジーの顧客と供給源
リサイクル:当社は、電力会社やそのプログラム管理者、その他のエネルギー効率プログラムのスポンサーと契約を結び、家電製品のリサイクルおよび交換サービスを幅広く提供して、エネルギー節約目標の達成を支援します。契約の期間は通常1〜3年で、ユーティリティのオプションによる更新の規定があります。一部の契約では、家電製品のリサイクルや交換プログラムの宣伝など、あらゆる面を管理しています。その他の契約では、回収やリサイクルなど、特定のサービスのみを提供しています。
電力会社のお客様との契約により、当社がお客様のプログラムを通じて受け取った電化製品または電化製品部品の修理および販売は禁止されています。これらの機器が再び使用されないことをお客様に保証するために、追跡および監査手順を定めています。
当社のエネルギー効率化プログラム契約の価格設定は、一般的にアプライアンス単位であり、次のようないくつかの要因によって異なります。
GeoTraq: GeoTraq には現在お客様がいません。GeoTraqは、電子チップ、コンピューター、ソフトウェアなどの原材料をさまざまな第三者から調達しています。GeoTraqのモジュールは単一のサプライヤーに依存しています。
リサイクルとテクノロジーに関する主な製品とサービス
2019 年 12 月 28 日の時点で、当社はリサイクルと副産物という 2 つの源泉から収益を上げました。リサイクル収益は、電力会社やその他のエネルギー効率化プログラムのスポンサーに家電製品の回収とリサイクルに料金を請求したことや、新しい ENERGY STAR® 電化製品を公益事業会社に販売して特定の顧客の家庭に設置することで生み出されました。副産物の収益は、私たちが回収してリサイクルした電化製品から出る金属やプラスチックなどのスクラップ材料を売ることによって生み出されました。
34
2019年度は、バイオテクノロジー、リサイクル、テクノロジーの3つの報告対象セグメントを運営しました。2018年度には、リサイクルとテクノロジーという2つの報告対象セグメントを運営しました(2017年8月18日開始)。当社のリサイクル部門には、公益事業やその他の顧客向けの電化製品の収集、リサイクル、設置にかかるすべての料金が含まれており、主に電化製品のリサイクルによって生み出される副産物収益も含まれています。当社のテクノロジーセグメントは、モバイルIoTモジュールとしても知られるセルラートランシーバーモジュールの開発、設計、そして最終的には販売を行う予定です。
リサイクルとテクノロジーの季節性
公益事業スポンサーがすべての広告を行うプログラムのプロモーション活動は、一般的に第2四半期と第3四半期に好調であり、その期間中のサービスに対する顧客の需要が高まります。その結果、第2四半期と第3四半期に事業が急増しますが、広告活動が再開されるまで、通常は第4四半期と第1四半期にかけて減少していきます。
2019年12月28日の時点で、当社のテクノロジーセグメントには顧客がいませんでした。
リサイクルとテクノロジーをめぐる競争
リサイクル:
大規模な家電製品のリサイクルおよび交換プログラムの運用に必要なインフラストラクチャを構築およびサポートするための十分な資源の確保など、多くの要因が業界の競争に影響を与えます。私たちは通常、他のいくつかの家電リサイクル企業、エネルギーサービス管理会社、新家電小売業者と契約をめぐって競合しています。また、プログラムの対象地域に拠点を置く小規模の運搬会社やリサイクル会社とも競合しています。「家電リサイクル業者」と名乗る中古家電販売業者を含め、これらの企業の多くは、リサイクル用に受け入れた中古家電の一定割合を流通市場で再販しています。販売不可のユニットは、環境に有害な物質を除去するための適切な処理が行われていない可能性があります。これらの企業には、当社が提供するすべてのサービスを提供できないためです。
既存および新規のお客様との電化製品のリサイクルおよび交換契約をめぐる主な競争相手は、次のようなさまざまな原因によるものになると予想されます。
さらに、電力会社やその他の顧客は、外部ベンダーと契約するのではなく、アプライアンスのリサイクルおよび交換プログラムの運営に必要なサービスの全部または一部を社内で提供することを選択できます。選択したどの市場でも利益を上げて競争できるという保証はありません。
テクノロジー
GeoTraqは、デバイスをIoTに接続するために設計された多数の競合技術で構成される業界セグメントでの事業展開を計画しています。同社のワイヤレスソリューションでは、LTE CAT-Mと、GSMA(GSMA)の3GPPリリース13標準で定義されている新しくリリースされたNB-IoTプロトコルに基づくIoTを使用しています。モバイル IoT 業界では、世界中のさまざまな政府規制機関から無線通信事業者にライセンスされている無線スペクトルを利用しています。モバイル IoT は競争が激しく、通信事業者、メーカー、ソリューションプロバイダーが IoT 市場にイノベーションをもたらすにつれ、絶えず変化しています。GeoTraq は、LBS やセンサー監視ソリューションを導入する複雑さ、サイクルタイム、コストを大幅に削減する「シンプルな IoT」ソリューションには、十分な機会がないと考えています。同社のトランシーバモジュールと関連するワイヤレス接続サブスクリプションサービスは、特にこれらの目的を達成することを目的としています。
リサイクルとテクノロジーに関する政府規制
リサイクル
連邦、州、および地方自治体は、アプライアンスの収集、リサイクル、および販売活動を規制しています。全国的に適用される要件もあれば、市場によって異なる要件もあります。家電製品のリサイクルに影響する多くの法律や規制には、埋め立て処分規制、有害廃棄物管理要件、大気質基準などがあります。たとえば、1990年の大気浄化法の改正により、電化製品の修理または廃棄中にすべての冷媒を排出することが禁止されています。
35
当社のリサイクル施設はそれぞれ、その場所で事業を行うための適切な登録、許可、ライセンスを保持しています。当社のリサイクルセンターを有害廃棄物発生業者としてEPAに登録し、有害廃棄物の管理に関する適切な地域および地域のライセンスをすべて取得しています。認可を受けた有害廃棄物会社は、当社が生成する有害物質を輸送、リサイクル、または処分します。当社の収集車両と輸送従業員は、米国運輸省(「DOT」)のすべてのライセンス要件を遵守する必要があります。
ARCA Recyclingのクライアントの約30%がEPAの自主的なRADプログラムに参加しています。これは、使用済みの冷凍機器を適切に廃棄することにより、オゾン層破壊物質と温室効果ガスの排出を削減するための最良の環境慣行を採用することを約束しています。収集した資料を定量化した年次RADレポートを作成し、お客様に代わってEPAに提出します。
家電リサイクル業界に対する政府のさらなる規制が当社にプラスの影響を与える可能性があると考えていますが、将来の法律の方向性を予測することはできません。たとえば、状況によっては、規制が強化されると、運用コストが大幅に増加したり、使用済み機器を廃棄する際の環境要件が減少したりする可能性があります。また、危険物を扱うため、状況によっては偶発的責任の対象となる場合があります。私たちは、危険物の取り扱いに関するすべての政府規制を遵守していると考えており、潜在的な偶発的責任の影響を軽減するために環境保険に加入しています。
テクノロジー
GeoTraqのモバイルIoTモジュールは、RFエネルギー波を放射する低電力ワイヤレス送信機を使用しています。RFエネルギー波は、連邦通信委員会(「FCC」)による規制の対象となり、他の国内および国際機関による規制の対象となる場合があります。GeoTraqは、FCC規則第15部、第20部、第22部、第24部、第27部が同社の製品に適用される可能性があると考えています。GeoTraqは、自社製品が安全であると確信しており、FCC認定の試験機関を利用して、モジュールがすべての必要な規制要件を満たしていることを検証および証明します。さらに、GeoTraqは、法律で義務付けられているように、FCCやその他の規制機関から必要なライセンスや許可を求め、取得する予定です。
36
選択した連結財務データ
次の表は、終了した期間または指定された日付の時点における一部の連結財務データを示しています。このような過去の連結財務データは、2020年4月6日にSECに提出され、参照により本書に組み込まれた2019年12月28日に終了した年度のフォーム10-Kの年次報告書に記載されている情報と併せて読む必要があります。
以下に示す2019年12月28日および2018年12月29日に終了した各年度の営業報告書データ、および2019年12月28日および2018年12月29日現在の貸借対照表データは、2019年12月28日に終了した年度のフォーム10-Kの年次報告書に含まれる監査済みの「連結財務諸表」から導き出されています。当社の過去の結果は、必ずしも将来の期間に予想される結果を示すものではありません。
(千単位、1株あたりの損失を除く)
|
|
終了した52週間の期間 |
|
|||||
運用明細書データ |
|
2019年12月28日 |
|
|
2018年12月29日 |
|
||
収入 |
|
$ |
35,097 |
|
|
$ |
36,794 |
|
収益コスト |
|
|
27,311 |
|
|
|
25,741 |
|
売上総利益 |
|
|
7,786 |
|
|
|
11,053 |
|
営業経費: |
|
|
|
|
|
|
|
|
販売費、一般管理費 |
|
|
20,217 |
|
|
|
17,150 |
|
営業損失 |
|
|
(12,431 |
) |
|
|
(6,097 |
) |
その他の収入 (費用): |
|
|
|
|
|
|
|
|
支払利息、純額 |
|
|
(1,480 |
) |
|
|
(668 |
) |
減損費用 |
|
|
(2,992 |
) |
|
|
— |
|
訴訟和解益 |
|
|
694 |
|
|
|
— |
|
その他の収益、純額 |
|
|
1,048 |
|
|
|
430 |
|
その他の費用合計、純額 |
|
|
(2,730 |
) |
|
|
(238 |
) |
所得税による利益を差し引く前の営業損失 |
|
|
(15,161 |
) |
|
|
(6,335 |
) |
所得税給付 |
|
|
3,197 |
|
|
|
727 |
|
純損失 |
|
$ |
(11,964 |
) |
|
$ |
(5,608 |
) |
一株当たり損失: |
|
|
|
|
|
|
|
|
1株当たりの基本損失と希薄化後損失 |
|
$ |
(6.78 |
) |
|
$ |
(3.75 |
) |
加重平均発行済普通株式: |
|
|
|
|
|
|
|
|
ベーシックと希釈 |
|
|
1,763,670 |
|
|
|
1,494,941 |
|
|
|
2019年12月28日 |
|
|
2018年12月29日 |
|
||
貸借対照表データ |
|
|
|
|
|
|
|
|
総資産 |
|
$ |
29,034 |
|
|
$ |
35,040 |
|
流動負債 |
|
|
17,573 |
|
|
|
9,684 |
|
長期負債 |
|
|
1,120 |
|
|
|
3,745 |
|
株主資本の総額 |
|
|
10,341 |
|
|
|
21,611 |
|
当社が提供する可能性のある有価証券の説明
当社は、以下の有価証券を1つ以上の募集で随時発行する場合があります。
この目論見書には、当社が提供する可能性のあるさまざまな証券の重要な一般条件の概要が含まれています。有価証券の具体的な条件は、目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載されます。これらの資料は、この目論見書に要約されている一般条件に追加される場合もあれば、異なる場合もあります。該当する場合、目論見書の補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料には、提供された有価証券に関連する米国連邦所得税の重要な考慮事項が記載され、提供された証券が証券取引所に上場されているか、または上場する予定であるかが示されます。の
37
この目論見書および目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)に含まれる要約には、役立つと思われる情報がすべて含まれていない場合があります。したがって、この目論見書に従って売却された有価証券に関する実際の文書を読む必要があります。これらの文書のコピーを入手する方法については、「入手可能な情報」および「参照による特定の情報の組み込み」を参照してください。
特定の募集の条件、新規募集価格、および当社への純収益は、目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、または該当する場合は当該募集に関連するその他の募集資料に含まれます。
資本金の説明
以下の当社の普通株式および優先株式の条件の概要は、現在施行されている当社の定款(「憲章」)および付則(「付則」)およびネバダ州改正法(「NRS」)の第78章に基づいています。この要約は完全ではなく、当社の憲章および付随定款の対象となり、全体としてその対象となります。当社の普通株式の条件および規定の詳細については、本目論見書の一部を構成する登録届出書の別紙として提出される当社の憲章および付則を参照してください。本セクション全体で「当社」、「当社」、および「当社」とは、JanOne Inc. およびその子会社を指します。これらの文書とNRSの該当する規定をよくお読みになることをお勧めします。
将軍
当社の授権資本金は、普通株式10,000,000株と優先株式2,000,000株で構成され、そのうち259,729株がシリーズA-1転換優先株式に指定されており、額面価格は1株あたり0.001ドルです。
2020年12月15日現在、当社の普通株式は1,829,982株が発行済みであり、シリーズA-1優先株式が259,729株が発行および発行されています。
普通株式および優先株式の承認済み株式および未発行株式は、適用法または当社の証券が上場される可能性のある証券取引所の規則によりそのような措置が義務付けられている場合を除き、株主による追加の措置なしに発行できます。株主の承認が必要でない限り、当社の取締役会(「取締役会」)は現在、当社の普通株式の発行および売却について株主の承認を求める予定はありません。
当社の資本金の発行済み株式および発行済み株式はすべて全額支払済みであり、評価対象外です。
普通株式
議決権、配当権、清算権
当社の普通株式の各保有者は、株主が議決すべきすべての事項について、発行済みおよび発行済み株式1株につき1議決権を有します。私たちの憲章は、取締役の選挙における累積投票を規定していません。シリーズA-1優先株式の保有者が当社憲章の規定に従って優先配当を受ける権利を条件として、当社の普通株式およびシリーズA-1優先株の保有者(憲章の条件に従って普通株式に転換された時点で)は、利用可能な資金から取締役会が随時申告する現金配当を受ける権利があります。会社の清算、解散、または清算時に、またその対象となる一連の優先株式に支払われる清算優先権がすべて満たされた後、当社の残りの資産は、普通株式のすべての保有者および清算優先権を受ける資格のない同様の状況にある株主に分配されるものとします。また、そのような株主に支払う金額が不十分な場合は、そのような保有者に比例して分配されるものとします。
先制権またはその他の権利
当社の普通株式には、先制権、転換権、または償還権はありません。
株主行動、特別会議
株主の行動は、年次株主総会または特別株主総会でのみ行うことができます。当社の付随定款では、(i)当社の最高経営責任者、(ii)取締役会のメンバー2人、または(iii)議決権を有する資本金の10%以上を保有する株主からの書面による要請があった場合にのみ、いつでも株主の特別会議を招集できると規定しています。
理事会、解任、欠員
当社の付則では、取締役の数は取締役会の過半数の投票によって決定されると規定されています。当社の取締役会は現在、5人の取締役で構成されています。私たちには機密扱いの委員会はありません。当社の付随定款およびNRSに従い、取締役は、任期満了後またはそれに近い次の定例会議まで、後任者が選出されて資格を得るまで、または早期に死亡、解任、または辞任するまで務めます。
38
責任の制限と補償
当社の憲章では、(i)故意の不正行為、詐欺、または故意の法律違反を伴う作為または不作為、または(ii)NRSのセクション78.300に違反して配布を許可したことに対する責任を除き、取締役または役員としての受託者責任違反による損害について、当社の取締役および役員が当社または株主に対して個人的に責任を負わないことを規定しています。当社の付則では、民事、刑事、行政、捜査を問わず、当社の取締役または役員の1人であること、または当社の要請により取締役、役員、従業員、または代理人を務めていることを理由に、民事、刑事、行政、または訴訟の当事者または証人となった役員または取締役は、NRSが許可する最大限の範囲で、当社が補償し、無害と見なすことを規定しています。補償を受ける権利には、NRSで認められている範囲で経費を前払いする権利が含まれるものとします。
上場および譲渡代理人
当社の普通株式は、ナスダック・キャピタル・マーケットに「JAN」のシンボルで上場されています。当社の普通株式の譲渡代理人および登録機関はEQ ShareOwner Servicesです。
シリーズ A-1 転換優先株式
当社によるGeoTraqの買収に関連して、当社はGeoTraqの当時の株主に対し、その他の対価として、当社のシリーズA転換優先株式(「シリーズA優先株式」)の合計288,588株を発行しました。シリーズA優先株の指定と発行を行うために、ミネソタ州務長官に指定証明書を提出しました。2017 年 11 月 9 日に、ミネソタ州務長官に訂正証明書を提出しました。2018年3月のミネソタ州からネバダ州への再編に関連して、当社は、2018年3月12日にネバダ州務長官に定款を、2018年8月7日にネバダ州務長官に修正証明書を提出しました(総称して「ネバダ州定款」)。2019年6月21日、当社はシリーズA-1転換優先株式(「シリーズA-1優先株式」)の権限、優先および権利に関する指定証明書(「シリーズA-1指定証明書」)をネバダ州務長官に提出しました。2020年10月1日、当社はシリーズA-1転換優先株式の権限、選好、および権利に関する修正および修正された指定証明書(「修正および改訂されたシリーズA-1指定証明書」)をネバダ州務長官に提出しました。以下のネバダ州定款および修正および改訂されたシリーズA-1指定証明書の要約は、完全を意図したものではなく、適用法の規定、およびネバダ州定款および修正および改訂されたシリーズA-1指定証明書を参照することにより、完全性を保証します。これらは、当初、SECに提出されたフォーム8-Kに関する当社の最新報告書の別紙3.3として提出されました。2018年3月13日、およびSECに提出されたフォーム8-Kに関する当社の最新報告書の別紙3.8 (a) としてそれぞれ、2020年10月2日。
シリーズA-1優先株は、ナスダックから受け取ったガイダンスに従って指定され、Nasdaq Stock Market LLCの上場資格スタッフが必要とする場合を除き、当社のシリーズA優先株とほぼ同じ権利、特性、および属性を有します(つまり、シリーズA-1優先株式の議決権についてはセクション3.2.5、トリガーイベントについてはセクション3.2.1(f)(その用語が定義されています)。その中で、そしてそれに関連して適用される公式)、それぞれの要件に関して、会社はすでに準拠しています。シリーズA-1指定証明書の提出は、2019年6月18日に取締役会によって満場一致で承認されました。シリーズA優先株式の保有者の過半数が、2019年6月19日頃に当該株式をシリーズA-1優先株式に交換することを承認しました。当社のシリーズA優先株式の3人の保有者は、シリーズA優先株式の発行済み株式を、シリーズA-1優先株式と同数のシリーズA-1優先株または合計259,729株と交換したとみなされます。修正および改訂されたシリーズA-1指定証明書の提出は、2020年10月1日に取締役会およびシリーズA-1優先株式の保有者の過半数によって満場一致で承認されました。
配当金
当社は、(定款で義務付けられている同意の取得に加えて)その時点で発行されているシリーズA-1優先株式の保有者が最初に総額の配当を受け取るか、同時に受け取る場合を除き、他のクラスまたはシリーズの資本株式の配当を申告、支払い、または取っておくことはできません。
シリーズA-1優先株式のその時点で発行された株式数と発行済み株式の数に関係なく1.00ドル。取締役会によって配分された残りの配当金は、発行済み普通株式およびシリーズA-1優先株式の保有者に(以下に定義する転換比率に従って普通株式に転換された場合の)1株あたり同額で分配されるものとします。
コンバージョン
シリーズA-1優先株式は、現在当社の完全子会社であるGeoTraq, Inc. の合計85.0%の株式に転換する権利を有します。
償還
39
シリーズA-1優先株の株式には償還権はありません。
プリエンプティブ・ライツ
シリーズA-1優先株式の保有者は、シリーズA-1指定証明書または当社が合意したその他の文書に記載されている場合を除き、当社の有価証券に関する先制権を受ける権利はありません。
議決権
シリーズA-1優先株式の各保有者は、(i)その保有者が保有するシリーズA優先株式の数と(ii)17を掛けて決定された議決権数を有します。シリーズA-1優先株式の保有者は、法律で個別のクラスまたはシリーズとしての議決が義務付けられている場合を除き、当社の普通株式保有者がとるすべての措置について、当社の他のすべてのクラスおよびシリーズの普通株式および優先株式とともに単一のクラスとして議決権を行使します。
保護規定
シリーズA-1優先株式の保有者の過半数の肯定的な承認を最初に得ない限り、当社は、直接的または間接的に(i)シリーズA-1優先株式の承認済み株式の総数を増減すること(償還または転換による場合を除く)、(ii)シリーズA-1優先株式の全部または一部の交換、再分類、または取り消しを行うことはできません。ただし、株式分割または株式併合は除きますまたは普通株式または優先株式の組み合わせ、(iii) 交換の実施、または交換権の創設別の種類の株式の全部または一部をシリーズA-1優先株式の株式に変更、または(iv)シリーズA-1優先株式の権利、優先または特権を変更して、シリーズA-1優先株式の株式に悪影響を及ぼすようにシリーズA-1優先株式の権利、優先または特権を変更すること(シリーズA-1指定証明書に記載されている権利を含む)。ただし、当社は、シリーズA-1優先株式の保有者の投票なしに、シリーズA-1指定証明書の技術的、是正的、管理的、または同様の変更で、そうでない場合個別に、または全体として、シリーズA-1優先株式の保有者の権利または選好に重大な悪影響を及ぼします。
憲章、細則、およびNRSの特定の条項の買収防止効果
NRSおよび当社の憲章および付随定款の特定の条項により、公開買付けなどによる当社の買収、および現職の役員および取締役の解任がより困難になる可能性があります。これらの規定は、特定の種類の強制的買収慣行や不適切な買付入札を思いとどまらせ、当社の支配権を取得しようとする人々を助長することが期待されます。
ビジネスコンビネーション
NRSのセクション78.411から78.444までの「企業結合」条項は、少なくとも200人の株主(そのうち少なくとも100人が登録株主でネバダ州の居住者)を持つネバダ州の企業が、利害関係のある株主になった取引日から3年間、利害関係のある株主とさまざまな「併合」取引を行うことを禁じています。ただし、
取引は、利害関係のある株主がそのような地位を取得した日より前、または以下の場合を除き、3年間の満了後に企業の取締役会によって承認されます。
「合併」とは、合併、統合、または売却、リース交換、抵当権、質権、譲渡、またはその他の処分を1つの取引または一連の取引に含み、「利害関係のある株主」の合計市場価値が(a)会社の資産の総市場価値の5%以上に相当し、(b)総市場価値が市場総額の 5% 以上に相当する「利害関係株主」と定義されます。法人のすべての発行済み株式の価値、または(c)法人の収益力または純利益の10%以上。
一般に、「利害関係株主」とは、関連会社および関連会社とともに、企業の議決権株式の10%以上を所有している(または3年以内に所有していた)人を指します。この法律は、合併、その他の買収、支配権の変更の試みを禁止または遅延させる可能性があり、したがって、そのような取引により当社の株主に実勢市場価格を上回る価格で株式を売却する機会が提供される場合でも、当社の買収の試みを思いとどまらせる可能性があります。
支配権の取得
40
ネバダ州の「支配権の取得」法(NRS 78.378~78.3793を含む)には、特定のネバダ州の企業の支配権の取得に関する規定が含まれています。これらの「支配株式」法は一般に、ネバダ州の特定の企業の「支配権」を取得した者は、その法人の利害関係のない株主の過半数が議決権を回復することを選択しない限り、議決権を拒否される可能性があると規定しています。これらの法律は、当社に登録されている株主が200人以上(そのうち少なくとも100人が、その直前の90日間、常にネバダ州の住所を株式台帳に記載している)、ネバダ州で直接または関連会社を通じて事業を行う場合、特定の日付をもって当社に適用されます。ただし、支配権の取得後10日目に施行される当社の憲章または付随定款に別段の定めがある場合を除きます。これらの法律は、NRSのこれらの規定の適用のためにその人が (1) 5分の1以上3分の1未満、(2) 3分の1以上過半数未満、または (3) 取締役選挙におけるその法人の議決権の全議決権の過半数以上を行使できる対象法人の株式を取得する場合は常に「支配持分」を取得すると規定しています。取得者がこれらの基準のいずれかを超えると、その基準値を超えた取引で取得した株式、および支配持分を取得または取得を申し出た日の直前90日以内に取得した株式は、上記の議決権制限が適用される「支配株式」になります。
優先株の説明
当社の優先株式は1つ以上のシリーズで発行される場合があり、取締役会は各シリーズの指定を決定し、株式数を固定する権限を有します。当社の取締役会はさらに、配当率、プレミアムまたは償還率、転換権、議決権、優先権、特権、制限、および完全に未発行の優先株式シリーズに付与または課されるその他のバリエーションを修正および決定する権限を有します。
一連の優先株式の発行に先立ち、当社の取締役会は決議を採択し、ネバダ州務長官に指定証明書を提出します。指定証明書には、各シリーズの株式の指定と数、および以下を含むがこれらに限定されない株式の権利、好み、特権、および制限が定められています。
上記の条件に加えて、当社は、募集中の優先株式シリーズに関連する以下の条件を、目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載します。
債務証券の説明
41
以下の説明は、該当する目論見書補足または関連する自由執筆目論見書またはその他の募集資料(該当する場合)に含まれる追加情報とともに、この目論見書に基づいて当社が提供する可能性のある債務証券の重要な条件および規定を要約したものです。以下に要約する条件は、この目論見書に従って当社が提供する可能性のある将来の債務証券に一般的に適用されますが、当社が提供する可能性のある債務証券の特定の条件については、該当する目論見書補足で詳しく説明します。当社が目論見書補足にその旨を記載する場合、当該目論見書補足に基づいて提供される債務証券の条件は、以下に説明する条件と異なる場合があり、目論見書補足に記載されている条件が下記の条件と異なる場合は、目論見書補足または関連する自由執筆目論見書またはその他の募集資料(該当する場合)に記載されている条件が優先するものとします。
当社は随時、この目論見書に基づく1つ以上の募集において、負債証券を1つ以上のシリーズで売却する場合があります。当社が発行する可能性のあるこれらの債務証券には、優先債務証券、優先劣後債務証券、劣後債務証券、転換債務証券、および交換可能な債務証券が含まれます。当社は、シニアインデンチャーに指名される受託者と契約するシニアインデンチャーに基づいて当該シニア債務証券を発行します。当社は、劣後付契約に基づいて当該劣後債務証券を発行します。劣後付契約は、劣後付契約に記載される受託者と締結します。当社では、該当する場合、「インデンチャー」という用語を、シニアインデンチャーまたは劣後インデンチャーのいずれかを指す場合に使用します。契約は、契約締結日に施行された1939年の信託契約法(「信託契約法」)に基づく資格となります。「社債受託者」という用語は、該当する場合、上級契約に基づく受託者または劣後契約に基づく受託者のいずれかを指す場合に使用します。
以下の要約説明は、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)に含める可能性のある追加情報とともに、完全を意図するものではなく、目論見書が含まれる登録届出書への別紙として提出された契約書の形態の対象となり、その完全性を参照して認定されます(補足される場合があります)随時追加、修正、修正されるほか、注記や補足事項目論見書を含む登録届出書の別紙として、または当社が債務証券を提供する場合はフォーム8-Kの最新報告書の別紙として参照により組み込まれる各シリーズの債務証券に関する契約。
将軍
本契約は、本契約に基づいて発行される債務証券の金額を制限するものではなく、各インデンチャーは、一連の債務証券の具体的な条件が、当該系列に関連する承認決議および/または補足契約(ある場合)に定められるか、それに従って決定されることを規定しています。
当社は、契約に基づいて発行された債務証券を「割引証券」として発行する場合があります。つまり、記載されている元本を下回る割引価格で売却される可能性があります。これらの債務証券、および割引価格で発行されないその他の債務証券は、利息支払いおよびその他の債務証券の特性または条件により、米国連邦所得税の目的で「当初発行割引」または「OID」を付けて発行される場合があります。OIDで発行された債務証券に適用される米国連邦所得税の重要な考慮事項は、該当する目論見書補足に詳細に記載されます。
当社は、該当する目論見書補足、関連する自由執筆目論見書、またはその他の募集資料に、必要に応じて、以下を含む一連の債務証券の条件を記載します。
42
当社は、契約条件に従って満期の加速が宣言された時点で、支払期日が定められている元本額よりも少ない金額を規定する債務証券を発行する場合があります。当社は、該当する目論見書補足、関連する自由執筆目論見書、またはその他の募集資料で、これらの債務証券に適用される連邦所得税の考慮事項およびその他の特別な考慮事項に関する情報を、該当する場合にお客様に提供します。
転換権または交換権
当社は、該当する目論見書補足、関連する自由書目論見書、またはその他の募集資料に、一連の債務証券を当社の普通株式、優先株式、またはその他の証券に転換または交換できる条件を記載します。当社には、転換または交換の際の決済、交換または交換が必須かどうか、保有者の選択によるか、または当社の選択によるかに関する規定が含まれます。当社には、当社の普通株式、優先株式、または一連の債務証券の保有者が受け取るその他の有価証券の数が調整の対象となる条項を含める場合があります。
43
統合、合併、売却。支配権の変更やレバレッジの高い取引の場合には保護されない
当社が目論見書の補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、または特定の一連の債務証券に適用されるその他の募集資料に別段の定めがない限り、契約には、当社が資産全体または実質的に全体として合併、統合、売却、譲渡、またはその他の方法で処分する能力を制限する契約が含まれます。存続法人、当該資産の後継者または取得者(当社の子会社を除く)を明示的に除く必要に応じて、契約または債務証券に基づくすべての義務を引き受けます。さらに、取引完了直後に、契約に基づく債務不履行事由がなく、通知後または時間の経過後、あるいはその両方後に契約に基づく債務不履行事由となる事象が発生し、継続していない限り、当社はそのような取引を完了することはできません。
特定のシリーズの債務証券に適用される目論見書補足、参照により組み込まれた情報または文書、関連する自由書式の目論見書、またはその他の提供資料に別段の定めがない限り、債務証券には、当社の支配権が変更された場合またはレバレッジの高い取引が行われた場合に(そのような取引が支配権の変更につながるかどうかにかかわらず)、債務証券の保有者に債務証券保護を与える条項は含まれず、悪影響を及ぼす可能性があります債務証券の保有者。
契約に基づく債務不履行事件
特定のシリーズの債務証券に適用される目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に別段の定めがない限り、当社が発行する可能性のある一連の債務証券に関して、契約に基づく債務不履行事由は次のとおりです。
特定のシリーズの債務証券に関する債務不履行事由は(特定の破産、破産、または組織再編の場合を除く)、必ずしも他のシリーズの債務証券に関する債務不履行事由とはみなされません。債務不履行事由の発生は、当社が随時締結している銀行信用契約に基づく債務不履行事由となる場合があります。さらに、契約に基づく特定の債務不履行または加速事由の発生は、随時未払いの当社のその他の債務の不履行事由となる場合があります。
未払いの時点でいずれかのシリーズの債務証券に関する債務不履行事由が発生し、継続している場合、受託者またはそのシリーズの未払い債務有価証券の元本の25%以上の保有者は、当社(および保有者から提供された場合は社債受託者)への書面の通知により、元本(または、そのシリーズの債務証券が割引証券の場合は)直ちに支払期日と支払い期限を宣言することができます。、元本(そのシリーズの条件で指定されている場合があります)および保険料および未払いの元本の一部そのシリーズのすべての債務証券に未払いの利息(ある場合)。いずれかのシリーズの債務証券に関して未払金の支払いに関する判決または判決が下される前に、そのシリーズの未払い債務証券の元本の過半数の保有者(または、定足数が存在する当該シリーズの保有者会議において、当該シリーズに出席する当該シリーズの債務証券の元本の過半数の保有者)は、すべての債務不履行事由が発生した場合、アクセラレーションを取り消し、取り消すことができます。加速元本、保険料(ある場合)、および利息(ある場合)の未払いを除く当該系列の債務証券については、該当する契約書に規定されているとおりに救済または免除されている(かかる加速の結果として支払期日が到来した元本、保険料、または利息に関する支払いまたは預金を含む)。当社は、割引証券である一連の債務証券に関する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料(該当する場合)を参照のうえ、債務不履行事由の発生時に当該割引証券の元本の一部を加速することに関する特定の規定についてご紹介します。
インデンチャーの条件に従い、インデンチャーに基づく債務不履行事由が発生し、継続する場合、社債受託者は、いずれかの要求または指示により、当該インデンチャーに基づく権利または権限を行使する義務を負わないものとします。
44
該当する一連の債務証券の保有者。ただし、そのような保有者が社債受託者に合理的な補償を申し出ている場合を除きます。シリーズを問わず、未払いの債務証券の元本の過半数の保有者は、そのシリーズの債務証券に関して、社債受託者が利用できる救済措置の手続きを行う時期、方法、場所を指示したり、社債受託者に付与された信託または権限を行使したりする権利を有します。ただし、
どのシリーズの債務証券の保有者も、以下の場合にのみ、契約に基づいて訴訟を起こす権利、受託者または受託者を任命する権利、またはその他の救済を求める権利を有します。
これらの制限は、当社が債務証券の元本、保険料(ある場合)または利息の支払いを怠った場合、債務証券の保有者が提起した訴訟には適用されません。
当社は、該当する契約に含まれる特定の規約の遵守について、該当する社債受託者に定期的に声明を提出します。
契約内容の変更、権利放棄
当社および社債受託者は、以下を含む特定の事項に関して、保有者の同意なしに、該当する契約を変更することができます。
45
さらに、インデンチャーに基づく一連の債務証券の保有者の権利は、各シリーズの未払いの債務証券の元本総額の過半数の保有者(または、定足数が存在する当該シリーズの保有者会議において、当該シリーズに代表される当該シリーズの債務証券の元本の過半数の保有者)の書面による同意を得て、当社および社債受託者が変更することができます。会議)が対象です。ただし、社債受託者および当社は、影響を受ける未払いの債務証券の各保有者の同意がある場合にのみ、以下の変更を行うことができます。
特定の規定を除き、いずれかのシリーズの未払いの債務証券の元本の過半数の保有者(または、定足数が存在する当該シリーズの保有者会議において、当該会議に出席する当該シリーズの債務証券の元本の過半数の保有者)は、そのシリーズのすべての債務証券の保有者に代わって、契約条項の遵守を放棄することができます。いずれかのシリーズの未払いの債務証券の元本の過半数の保有者は、当該シリーズのすべての債務証券の保有者に代わって、そのシリーズおよびその結果に関する契約に基づく過去の債務不履行を放棄することができます。ただし、そのシリーズの債務証券の元本、保険料、または利息の支払不履行、または契約または条項に関する同意なしに変更または修正することはできません。影響を受けるシリーズの各未払い債務証券の保有者の割合。ただし、どのシリーズの未払い債務証券の元本の過半数の保有者も、加速に起因する関連する支払い不履行を含め、加速とその結果を取り消すことができます。
退院、不履行、契約履行不履行
当社は、下記のとおり、契約に基づく義務を履行または軽減することができます。
当社は、解約のために受託者にまだ引き渡されておらず、期限が到来している、支払期日が到来している、または期限が到来している、または償還が予定されている一連の債務証券の保有者に対して、1年以内に債務を履行することができます。当社は、満期時、償還時またはその他の方法にかかわらず、債務証券および必須の減債基金の支払いの元本および保険料および利息を、期日までに支払うのに十分であると証明された金額を、信託基金として受託者に取消不能に預金することにより、解約を行うことができます。
該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に別段の定めがない限り、当社は、一連の債務証券の保有者に対する当社の義務の一部およびすべてをいつでも履行することができます。これを不履行と呼びます。また、当社は、未払いの一連の債務証券の契約および契約条項によって課される義務から解放される場合があり、信託申告書に基づく債務不履行事由を発生させることなく、これらの契約の遵守を省略することができます。これを契約不履行と呼びます。当社は、とりわけ以下の場合に限り、不承不承および契約不承不承を行うことができるものとします。
46
当社が不履行の場合、提出する意見は、発行された内国歳入庁の判決、または契約締結日以降に行われた米国連邦所得税法の変更に基づくものでなければなりません。そのような結果は、その日に施行されている米国連邦所得税法の下では発生しないためです。
当社は、前2項に記載されている契約に基づく義務を履行または軽減することができますが、とりわけ、一連の債務証券の譲渡または交換を登録する義務、一時的、切断された、破壊、紛失、または盗難された一連の債務証券を交換する義務、または一連の債務証券に関する事務所または機関を維持する義務を回避することはできません。
登録済みグローバル証券および帳簿入力システム
シリーズの債券は、全部または一部が記帳形式で発行され、完全に登録された1つ以上のグローバル証券によって代表されます。当社は、登録されたグローバル証券を預託機関または預託機関の候補者に、該当する目論見書補足資料、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載され、当該預託者または候補者の名前で登録された預託機関に預託します。このような場合、当社は、当該登録グローバル証券または有価証券が発行し、代表するシリーズのすべての債務証券の元本総額に等しい金額の登録グローバル証券を1つ以上発行します。つまり、各所有者に証明書を発行することはありません。
その全部または一部が正式な登録形態の債務証券と交換されない限り、登録されたグローバル証券は、全体として以下の場合を除いて譲渡することはできません。
一連の債務証券に関連する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料(該当する場合)には、登録されたグローバル証券が代表するシリーズのいずれかの部分を含む預託契約の具体的な条件が記載されています。以下の規定が債務証券のすべての預託契約に適用されると予想されます。
一部の州の法律では、特定の証券購入者が有価証券を最終形態で現物で引き渡すことが義務付けられている場合があります。これらの法律により、登録されたグローバル証券の所有、譲渡、または受益権の質入れが制限される場合があります。
登録グローバル証券の預託者またはその候補者が登録グローバル証券の登録所有者である限り、預託者またはそのような候補者は、場合によっては、インデンチャーに基づくあらゆる目的において、登録グローバル証券が代表する債務証券の唯一の所有者または保有者とみなされます。以下に定める場合を除き、登録済みのグローバル証券の受益権の所有者
47
したがって、登録グローバル証券の受益持分を保有する各人は、登録グローバル証券の預託機関の手続きに頼らなければならず、参加者でない場合は、その人が持分を所有する参加者の手続きに基づいて、インデンチャーに基づく保有者の権利を行使する必要があります。
既存の業界慣行に基づき、当社が保有者に何らかの措置を要求した場合、または登録グローバル証券の受益権の所有者が、保有者が契約に基づいて付与または取る権利を有する何らかの措置を講じることを希望する場合、登録グローバル証券の預託機関は、関連する受益権を保有する参加者にその措置を与えるまたは取ることを許可し、参加者は参加者を通じて所有する受益所有者に譲渡または取得を許可することを理解しています行動、またはそれに基づいて行動するそれらを通じた受益者の指示。
当社は、預託機関またはその候補者の名義で登録された登録グローバル証券に代表される債務証券の元本および保険料(ある場合)、および利息(ある場合)を、登録グローバル証券の登録所有者として、預託機関またはその候補者に支払います。当社も、受託者も、当社の他の代理人も、受託者も、登録されたグローバルセキュリティにおける受益所有権に関連する記録またはそれを理由に行われた支払いについて、または受益所有権に関連する記録の維持、監督、または審査について、一切責任を負わないものとします。
登録グローバル証券に代表される債務証券の預託者は、登録グローバル証券に関する元本および保険料、および利息(もしあれば)の支払いを受領した時点で、預託機関の記録に示されているように、登録グローバル証券におけるそれぞれの受益権に比例した金額の支払いを参加者の口座に直ちに入金することを期待しています。また、無記名で顧客の口座用に保有されている、または「ストリートネーム」で登録された有価証券の場合と同様に、参加者による参加者による参加者による参加者による参加者による参加者による参加者による支払いには、常設の顧客指示と慣習的慣行が適用されることを期待しています。また、これらの支払いのいずれかが参加者の責任となることを期待しています。
登録済みのグローバル証券に代表される債務証券の預託者が、いつでも預託者としての存続を望まない、またはできない場合、または取引法に基づいて登録された清算機関でなくなった場合、当社は適格な後継預託機関を任命します。当社が90日以内に適格な後継預託機関を指定しなかった場合、当社は、登録されたグローバル証券と引き換えに、確定的な形で債務証券を発行します。さらに、当社は、いつでも、独自の裁量により、1つ以上の登録済みグローバル証券に代表される一連の債務証券を一切保有しないことを決定することができます。その場合、当社は、当該債務証券を代表する登録グローバル証券のすべてと引き換えに、確定的な形でシリーズの債務証券を発行します。受託者は、参加者からの指示に基づき、預託機関が受託者に指示するように、登録されたグローバル証券と引き換えに、確定的な形で発行された債務証券を、1つまたは複数の名義で登録します。
社債受託者に関する情報
社債受託者は、該当する契約に基づく債務不履行事由の発生および継続中を除き、該当する契約書に具体的に定められている義務のみを履行することを約束します。契約に基づく債務不履行が発生した場合、当該契約に基づく社債受託者は、賢明な人が自らの業務を遂行する際に行う、または行うのと同じ程度の注意を払わなければなりません。この規定に従い、社債受託者は、発生する可能性のある費用、費用、および負債に対する合理的な担保および補償が提供されない限り、債務証券の保有者の要求に応じてインデンチャーによって付与された権限を行使する義務を負わないものとします。
支払いおよび支払いエージェント
該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由書目論見書、またはその他の提供資料に当社が別途記載しない限り、当社は、利息の支払い日に、利息の通常の基準日の営業終了時に債務証券または1つ以上の前身証券が登録されている人に、任意の利息支払日に債務証券の利息を支払います。
当社は、特定のシリーズの債務証券の元本および割増金および利息を、当社が指定した支払代理人の事務所で支払います。ただし、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に別段の記載がない限り、利息の支払いを小切手で行い、保有者に郵送します。目論見書に別段の記載がない限り
補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料。該当する場合、当社は、各シリーズの債務証券に関する支払いの唯一の支払い代理人として、社債受託者の企業信託事務所を指定します。当社は、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に、特定のシリーズの債務証券について最初に指定するその他の支払代理人を記載します。特定のシリーズの債務証券については、各支払場所に支払代理人を配置します。
48
当社が支払代理人または社債受託者に支払う債務有価証券の元本、または保険料または利息の支払期限が切れてから2年が経過しても請求されないままである債務証券の保険料または利息は、すべて当社に返済され、その後、証券の保有者はその支払いを当社のみに求めることができます。
準拠法
契約書および債務証券は、信託契約法が適用される場合を除き、ニューヨーク州の法律に準拠し、それに従って解釈されます。
劣後債務証券の劣後
劣後債務証券に基づく当社の債務は無担保であり、目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料(該当する場合)に記載されている範囲で、当社のその他の債務の一部に対して優先的に支払われるものとします。
未払い債務証券
2020年12月15日現在、当社には以下の未払い債務証券がありました。
ワラントの説明
将軍
当社は、負債証券、普通株式、優先株式、またはこれらの有価証券の任意の組み合わせを購入するワラントを発行する場合があります。当社は、ワラントを単独で、または原証券と一緒に発行する場合があり、ワラントは原証券と添付することも、別々に発行することもできます。また、ワラントエージェントと当社との間で締結される個別のワラント契約に基づき、一連のワラントを発行する場合があります。ワラント代理人は、当該シリーズのワラントに関連して当社の代理人としてのみ行動し、ワラントの保有者または受益者に対して、またはワラントの保有者または受益者に対する義務または代理関係を引き受けません。
以下の説明は、当社が発行する可能性のあるワラントに関連する一部の条項の概要です。要約は完全ではありません。将来、新株予約権が発行される場合は、目論見書補足資料、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料(該当する場合)に、それらの有価証券の特定の条件と、これらの一般規定が適用される範囲が説明されます。該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に記載されているワラントの特定の条件は、本条に記載されている一般条件を補足するものであり、該当する場合は、本条に記載されている一般条件を変更または置き換える場合があります。
この要約および該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に含まれるワラントの説明は、特定のワラント文書または契約のすべての条項の対象となり、参照することで完全に適格となります。これらの条項は、当社が本目論見書に参照して組み込むためにSECに提出します。令状書類の提出時にその写しを入手する方法については、「入手可能な情報」および「参照による特定の情報の組み込み」を参照してください。
一連のワラントとは、該当するワラント契約に基づいて同じシリーズの一部として発行されたすべてのワラントを意味します。
規約
該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料には、以下を含むがこれらに限定されない、当社が提供する可能性のある保証の条件が記載されている場合があります。
49
ワラント契約
当社は、1つまたは複数のワラント契約に基づき、ワラントを1つまたは複数のシリーズで発行する場合があります。各ワラント契約は、保証機関である銀行、信託会社、またはその他の金融機関と当社との間で締結されます。当社は、随時、保証エージェントを追加、交代または終了することがあります。また、当社独自の保証代理人として行動することもあれば、子会社を選んで保証代行を行うこともあります。
保証契約に基づく保証代理人は、その契約に基づいて発行されたワラントに関連して当社の代理人としてのみ行動します。ワラントエージェントは、これらのワラントの保有者に対して、またはそれらのワラントの保有者に対する代理権または信頼関係または義務または関係を引き受けません。ワラントの保有者は、他人の同意なしに、適切な法的措置により、自分に代わって、その条件に従ってワラントを行使する権利を行使することができます。ワラントが適切に行使されるまで、ワラントの保有者は、ワラントの行使時に購入可能なワラント資産の保有者の権利を受ける権利を有しません。
フォーム、交換、転送
ワラントは、登録フォームまたは無記名フォームで発行する場合があります。登録形式、つまり記帳形式で発行されたワラントは、預託機関の名前で登録されたグローバル証券によって代表され、預託機関が代表するすべてのワラントの保有者となります。グローバルワラントの受益権を保有する投資家は、預託機関システムの参加者を通じてその利益を取得するものであり、これらの間接所有者の権利は、預託機関とその参加者の該当する手続きによってのみ管理されます。さらに、当社はワラントを非グローバル形式、つまり無記名形式で発行する場合があります。ワラントが非グローバル形式で発行された場合、ワラント証明書は異なる額面の新しいワラント証明書と交換することができ、保有者はワラント代理人の事務所または該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載されているその他の事務所でワラントを交換、移転、または行使することができます。
ワラントの行使前は、債務証券に対して行使可能なワラントの保有者は、当該行使時に購入可能な債務証券の保有者の権利を一切有せず、また、当該行使により購入可能な債務証券の元本(または保険料がある場合はプレミアム)または利息(もしあれば)の支払いを受ける権利はありません。ワラントの行使前は、普通株式または優先株式に対して行使可能なワラントの保有者は、当該行使により購入可能な普通株式または優先株式の保有者の権利を有さず、配当金の支払い(もしあれば)、またはそのような行使により購入可能な普通株式または優先株式の議決権を受ける権利はありません。
ワラントの行使
ワラントにより、保有者は、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載される、または記載されているように決定可能な行使価格で有価証券を現金で購入することができます。ワラントは、最初の行使日からいつでも行使できます。これには、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載されている満了日の営業終了も含まれます。満了日の営業終了後、行使されなかった新株予約権は無効になります。ワラントは、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に記載されているとおりに償還される場合があります。
ワラントは、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に記載されているとおりに行使できます。支払いおよびワラント証明書を受け取った時点で、ワラントエージェントの企業信託事務所または目論見書補足、参照により組み込まれた情報または文書、関連する自由書による目論見書、またはその他の募集に記載されているその他の事務所で、適切に記入され、正式に執行されます。
50
資料(該当する場合)当社は、当該行使により購入可能な有価証券を可能な限り速やかに譲渡します。当該ワラント証明書に記載されたワラントのうち、行使されたワラントが全部未満の場合は、残りのワラントについて新しいワラント証明書が発行されます。
権利の説明
当社は、債務証券、普通株式、または優先株式を購入する権利を発行する場合があります。これらの権利は、単独で発行される場合も、本契約で提供されるその他の証券と併せて発行される場合があり、当該募集の権利を受領する株主が譲渡できる場合とできない場合があります。かかる権利の募集に関連して、当社は1人以上の引受人またはその他の購入者と予備契約を締結する場合があります。これに従い、引受人または他の購入者は、当該権利の募集後に未登録のまま残っている有価証券を購入するよう求められる場合があります。
一連の権利はそれぞれ、当社が権利代理人として銀行または信託会社と締結する個別の権利契約に基づいて発行され、その内容はすべて関連する募集資料に記載されます。権利代理人は、権利に関連する証明書に関連して当社の代理人としてのみ行動し、権利証明書の所有者または権利の受益者との代理または信頼関係を一切負わないものとします。
以下の説明は、当社が提供する可能性のある権利に関連する一部の条項の概要です。要約は完全ではありません。将来権利が提供される場合、それらの有価証券の特定の条件とこれらの一般規定が適用される範囲を説明する目論見書補足資料、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)が記載されています。目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に記載されている特定の権利条件は、該当する場合、本条に記載されている一般条件を補足するものであり、該当する場合は、本条に記載されている一般条件を変更または置き換える場合があります。
本要約および該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料における権利の記述は、すべて権利契約および権利証明書の対象となり、その条件を満たすものとします。当社は、これらの各書類を必要に応じてSECに提出し、一連の権利を発行する時またはそれ以前に、この目論見書が含まれる登録届出書の別紙として参照して組み込みます。提出時に書類のコピーを入手する方法については、上記の「入手可能な情報」および「参照による特定の文書の組み込み」を参照してください。
該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料には、以下が記載されている場合があります。
本条に記載されている規定、および上記の「—負債証券の説明」および「—資本金の説明」に記載されている条項は、該当する場合、当社が提供するすべての権利に適用されます。
ユニットの説明
将軍
51
当社は、(i)当社の負債証券、(ii)当社の普通株式、(iii)優先株式の株式、(iv)当社の債務証券、当社の普通株式、または優先株式の株式またはこれらの証券の任意の組み合わせを購入するワラント、および(v)当社の債務証券、普通株式、または優先株式の任意の組み合わせを購入する権利で構成されるユニットを発行する場合があります。ユニットの所有者がユニットに含まれる各証券の所有者でもあるように、各ユニットを発行します。その結果、ユニットの保有者は、含まれる各証券の保有者の権利と義務を有することになります。ユニットが発行されるユニット契約では、ユニットに含まれる有価証券を、特定の日付より前にいつでも、またはいつでも、個別に保有または譲渡することはできないと規定されている場合があります。
以下の説明は、当社が提供する可能性のあるユニットに関連する一部の条項の概要です。要約は完全ではありません。将来的に投資口が発行される場合、目論見書の補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料(該当する場合)に、それらの有価証券の特定の条件と、これらの一般規定が適用される範囲が説明されます。目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に記載されている各ユニットの特定の条件は、該当する場合、このセクションに記載されている一般条件を補足するものであり、該当する場合、本セクションに記載されている一般条件を変更または置き換える場合があります。
本要約および該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に含まれる各ユニットの説明は、該当する場合、ユニット契約、担保契約、および預託契約の対象となり、それらを参照することでその資格が認められます。必要に応じて、これらの文書をSECに提出し、この目論見書に参照して組み込みます。提出時に書類のコピーを入手する方法については、「入手可能な情報」および「参照による特定の情報の組み込み」を参照してください。
該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料には、以下が記載されている場合があります。
本条に記載されている適用規定、および「債務証券の説明」、「資本ストックの説明」および「ワラントの説明」に記載されている規定は、各ユニットおよび各ユニットに含まれる各証券にそれぞれ適用されます。
収益の使用
該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料に別段の記載がない限り、当社は有価証券の売却による純収入を一般的な企業目的に使用する予定です。
52
配布計画
当社は、引受会社またはディーラーを通じて、代理店を通じて、1人以上の購入者に直接、ライツ・オファリングなどを通じて証券を売却する場合があります。有価証券の募集条件は、目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、または該当する場合、以下を含むその他の募集資料に記載します。
目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料(該当する場合)に当社が指定する引受人のみが、それによって提供される有価証券の引受者です。
有価証券の分配は、以下を含む1つ以上の取引で随時行われる場合があります。
有価証券は、変更される可能性のある固定価格または売却時の市場価格、実勢市場価格に関連する価格、または交渉価格で売却される場合があります。対価は、現金でも、当事者が交渉した別の形式でもかまいません。代理人、引受人、またはブローカーディーラーには、有価証券の募集および売却に対する報酬が支払われる場合があります。その補償は、当社または有価証券の購入者から受け取る割引、譲歩、または手数料の形をとることがあります。有価証券の分配に参加するディーラーおよび代理人は引受人とみなされ、有価証券の転売時に受け取る報酬は、証券法に基づく引受割引および手数料とみなされる場合があります。そのようなディーラーまたは代理人が引受人とみなされた場合、証券法に基づく法定責任の対象となる可能性があります。
また、既存の株主に比例配分して分配される新株予約権を通じて直接販売を行う場合があり、譲渡可能な場合とできない場合があります。当社の株主への新株予約権の分配において、原証券のすべてが登録されていない場合、当社は、未購読証券を直接第三者に売却するか、予備引受人を含む1人以上の引受人、ディーラー、または代理人のサービスを利用して、未購読証券を第三者に売却する場合があります。
53
この目論見書を通じて当社が提供する有価証券の一部または全部は、取引市場が確立されていない新規発行の証券である可能性があります。当社が公募および売却のために証券を売却する引受会社は、それらの証券を市場化することができますが、そうする義務はなく、予告なしにいつでも市場形成を中止することができます。したがって、当社が提供する証券の流動性や取引市場の継続について保証することはできません。
代理人は、随時、有価証券の購入の申し出を募ることがあります。必要に応じて、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書またはその他の募集資料に、該当する場合、有価証券の募集または売却に関与する代理人を記載し、代理人に支払われるべき報酬を記載します。特に明記されていない限り、どのエージェントも任命期間中は最善を尽くして行動します。この目論見書の対象となる有価証券を売却する代理人は、証券法で定義されているように、有価証券の引受人とみなされる場合があります。
引受会社が募集に使用される場合、証券は引受会社が自己勘定で取得し、随時、交渉取引を含む1つ以上の取引で、固定の公募価格で、または売却時に決定された変動価格で、または遅延引渡契約またはその他の契約上の義務に基づいて転売される場合があります。有価証券は、1社以上の管理引受会社が代表する引受シンジケートを通じて、または引受会社として活動する1社以上の会社が直接公募する場合があります。引受会社が有価証券の売却に使用される場合、売却の合意に達した時点で、引受会社または引受会社との間で引受契約が締結されます。該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料には、特定の引受人または引受人に関するその他の引受会社およびその他の引受会社が記載され、引受会社およびディーラーの報酬を含む取引条件、および該当する場合は公募価格が定められます。引受会社は、目論見書、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の募集資料を使用して、証券を転売します。
証券の売却にディーラーを利用する場合、当社または引受会社が元本としてディーラーに証券を売却します。その後、ディーラーは、転売時にディーラーが決定するさまざまな価格で証券を一般に転売することができます。必要な範囲で、当社は目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)に、ディーラーの名前と取引条件を記載します。
当社は、証券の購入の申し出を直接勧誘したり、機関投資家などに直接証券を売却したりする場合があります。これらの人物は、有価証券の転売に関しては、証券法の意味の範囲内で引受人とみなされる場合があります。必要な範囲で、目論見書の補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)には、入札またはオークションプロセスの条件を含む、そのような販売条件が記載されています。
代理人、引受人、およびディーラーは、当社と締結される契約に基づき、証券法に基づいて発生した負債を含む特定の負債に対する補償、またはそのような負債に関して請求される可能性のある支払いへの拠出を受ける権利を有する場合があります。必要に応じて、目論見書の補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料(該当する場合)に、そのような補償または拠出の条件が記載されています。代理人、引受会社、ディーラー、またはそれらの関連会社の中には、通常の事業過程において、当社、当社の子会社、または関連会社の顧客であるか、取引を行ったり、サービスを行ったりする場合があります。
一部の州の証券法に基づき、この目論見書によって提供される証券は、登録または認可されたブローカーまたはディーラーを通じてのみそれらの州で販売される場合があります。
54
この目論見書を含む登録届出書に基づいて登録された普通株式の分配に参加する者は、取引法の適用条項および適用されるSEC規則および規制(とりわけ規則Mを含む)の対象となります。これにより、そのような人物による当社の普通株式の購入および売却のタイミングが制限される場合があります。さらに、規則Mは、当社の普通株式の分配に従事する者が、当社の普通株式に関する市場形成活動に従事する能力を制限する場合があります。これらの制限は、当社の普通株式の市場性と、当社の普通株式に関する市場形成活動に従事する個人または団体の能力に影響を与える可能性があります。
募集に参加する特定の個人は、取引法に基づく規則Mに従って、募集証券の価格を安定化、維持、またはその他の方法で影響を与えるオーバーアロットメント、安定化取引、ショートカバー取引、およびペナルティ入札を行う場合があります。そのような活動が行われる場合は、該当する目論見書補足、参照により組み込まれた情報または文書、関連する自由執筆目論見書、またはその他の提供資料に記載されます。
必要な範囲で、この目論見書は、特定の分配計画を説明するために随時修正または補足される場合があります。
普通株式以外のすべての証券は、取引市場が確立されていない新規発行の有価証券となります。どの引受会社もこれらの証券を市場化することができますが、そうする義務はなく、予告なしにいつでも市場形成を中止することができます。当社は、いかなる証券についても、取引市場の流動性を保証することはできません。
法律問題
該当する目論見書補足に別段の記載がない限り、カリフォルニア州ロサンゼルスのClark Hill PLCは、この目論見書によって提供される有価証券の有効性に関する意見を提供します。Clark Hill PLCは、その他の特定の事項について意見を述べることもあります。引受人、ディーラー、または代理人の有価証券の合法性は、該当する目論見書補足に明記されているように、弁護士によって引き継がれます。
専門家
2019年12月28日に終了した年度の登録者のフォーム10-Kの年次報告書を参照して本目論見書に組み込まれた連結財務諸表は、本書に参照により組み込まれた報告書に記載されているように、独立登録公認会計事務所であるWSRP, LLCによって監査されており、そのような報告および会計および監査の専門家などの会社の権限に基づいて組み込まれています。
2018年12月29日に終了した年度の修正された登録者のフォーム10-Kの年次報告書を参照して本目論見書に組み込まれた2018年12月29日の当社の連結財務諸表は、本書に参照により組み込まれた報告書に記載されているように、独立登録公認会計事務所であるSingerLeWak LLPによって監査されており、当該報告書および当該事務所の権限に基づいてそのように組み込まれています。会計と監査の専門家として。
55
|

株式会社ジャノン
361,000株の普通株式
目論見書補足
H.C. ウェインライト・アンド・カンパニー
この目論見書補足の日付は2023年3月22日です
概要レポート: Word の Litera Compare for 11.2.0.54 ドキュメント比較は 2023 年 3 月 23 日午後 8 時 51:19 に行われました |
|
スタイル名:デフォルトスタイル |
|
インテリジェントテーブル比較:アクティブ |
|
オリジナルファイル名:JAN Pro Supp.2.docx |
|
説明:3 |
|
修正済み DMS: iw: //clarkhill-Mobility.iManage.work/Clarkhill/271041751/3 |
|
変更: |
|
[追加] |
40 |
[削除] |
51 |
移動元 |
0 |
に移動 |
0 |
テーブルインサート |
3 |
テーブル削除 |
3 |
テーブルが次の場所に移動 |
0 |
テーブル移動元 |
0 |
組み込みグラフィックス (Visio、ChemDraw、イメージなど) |
0 |
埋め込みエクセル |
0 |
フォーマットの変更 |
0 |
変更総数: |
97 |