アメリカですアメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
あるいは…。
本財政年度末まで
あるいは…。
あるいは…。
この幽霊会社が報告した事件の日付が必要です
中国から中国への過渡期
手数料書類番号
万春医薬。
(登録者の正確な氏名はその定款に記載)
適用されない(登録者氏名英文訳)
万春医薬
(会社の連絡先名、電話、電子メールおよび/またはファックス番号および住所)
同法第12条(B)に基づいて登録又は登録される証券。
| クラスごとのタイトル | 取引記号 | 登録された各取引所の名称 | ||
| | | |
同法第12条(G)に基づいて登録又は登録される証券:なし
同法第15条(D)により報告義務を有する証券:なし
年次報告で述べた期間終了までの発行者が属する各種資本または普通株の流通株数を明記する
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい。☐
本報告が年次報告又は移行報告である場合は、登録者が1934年“証券取引法”第13又は15(D)節に基づいて報告を提出する必要がないか否かを勾印で示してください。はい。☐
注-上記チェックボックスを選択することは、これらの条項の下で、1934年の証券取引法第13条または15(D)条に基づいて報告書の提出を要求する任意の登録者の義務を解除しない。
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速ファイルサーバ,加速ファイルサーバ,非加速ファイルサーバであるか新興成長型会社であるかをチェックマークで示す.取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“新興成長型会社”の定義を参照されたい。
| 大型加速ファイルサーバ | ☐ | | ☒ |
| 非加速ファイルサーバ | ☐ | 新興成長型会社 | |
もし1つの新興成長型会社が米国公認会計原則に従ってその財務諸表を作成する場合、登録者が延長された過渡期間を使用しないことを選択したかどうかをチェック番号で示す場合、取引所法案第13(A)節に提供される任意の新しいまたは改正された財務会計基準を遵守する
“新又は改正財務会計基準”とは、財務会計基準委員会が2012年4月5日以降に発表したその会計基準編纂の任意の更新を意味する。
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって提出されている。(Ii)
登録者が本文書に含まれる財務諸表を作成する際にどのような会計基盤を使用しているかをチェックマークで示す
| |
国際会計基準理事会Otherが発表した国際財務報告基準
前の質問に答えたときに“その他”をチェックした場合は、登録者がどの財務諸表項目に従うかをチェックしてください。プロジェクト17プロジェクト18☐
これが年次報告書である場合は、登録者が空殻会社であるか否かをチェックマークで示してください(取引法第12 b-2条で定義されているように)。はい、そうです
(過去5年間の破産手続きに関する発行者にのみ適用)
裁判所が確認した計画に基づいて証券を分配した後、登録者が1934年“証券取引法”第12、13又は15(D)条に提出されたすべての書類及び報告書を提出したか否かをフックで示す。そうかどうか☐
カタログ
| 序言: |
1 | |
| 前向きに述べた |
1 | |
| 第1部: |
3 | |
| 第1項。 |
役員·上級管理職·コンサルタントの身分 |
3 |
| 第二項です。 |
見積統計と予想スケジュール: |
3 |
| 第三項です。 |
主な情報: |
3 |
| 第四項です。 |
会社に関する情報は、アクセスしてください |
67 |
| プロジェクト4 Aです。 |
未解決の従業員のコメント |
113 |
| 五番目です。 |
経営と財務回顧と展望 |
113 |
| 第六項です。 |
役員、上級管理職、従業員: |
126 |
| 第七項。 |
大株主および関連者が取引する |
141 |
| 第八項です。 |
財務情報 |
144 |
| 第九項です。 |
株式募集と上場 |
145 |
| 第10項。 |
より多くの情報: |
145 |
| 第十一項。 |
市場リスクに関する定性的で定量的な開示 |
158 |
| 第十二項。 |
株式証券を除く他の証券説明 |
158 |
| 第2部: |
160 | |
| 十三項。 |
約束違反、配当金滞納、延滞 |
160 |
| 14項です。 |
所有者を保証する権利と収益の使用を実質的に修正する: |
160 |
| 第十五項。 |
制御とプログラム: |
160 |
| プロジェクト16 | [保留されている] | 161 |
| プロジェクト16 A。 |
監査委員会財務専門家: |
161 |
| プロジェクト16 B。 |
“道徳的規則”: |
161 |
| プロジェクト16 Cです。 |
首席会計士費用とサービス料 |
161 |
| プロジェクト16 Dです。 |
“監査委員会上場基準”の免除 |
161 |
| プロジェクト16 E。 |
発行者と関連購入者が持分証券を購入する |
161 |
| プロジェクト16 Fです。 |
登録者の認証会計士を変更します |
162 |
| プロジェクト16 Gです。 |
会社の管理: |
162 |
| 16 H項です。 |
炭鉱の安全情報開示 |
162 |
| プロジェクト16 I。 | 検査妨害に関する外国司法管区の開示 | 162 |
| 第3部: |
163 | |
| 17項です。 |
財務諸表: |
163 |
| 第十八項。 |
財務諸表: |
163 |
| プロジェクト19. |
展示品: |
163 |
序言:序言
万春医薬会社は2014年にケイマン諸島の法律に基づいて免除会社に登録された。文意が別に指摘されている以外に、すべて“私たち”、“私たちの”、“万春医薬”、“私たち”、“当社”及び類似の呼称に言及する時、すべて当社内部の再編が完了する前の大連万春生物科技有限会社或いは本アメリカ子会社の前持株会社の万春生物科学技術及びその合併子会社、及び当社が2015年7月20日に内部会社の再編が完了した後の万春医薬及びその合併子会社を指す。別の説明がない限り、本年度報告20-F表で言及されている“ドル”、“ドル”、“ドル”はいずれもドルを指し、“人民元”はいずれも中国の法定通貨人民元を意味する。本20-F表年報で言及されている“中華人民共和国”または“中国”はすべて人民Republic of Chinaを指す。
前向きに陳述する
このForm 20-F年次報告書には、私たちの経営陣の信念と仮定と、私たちの経営陣が現在把握している情報に基づく前向きな陳述が含まれています。私たちはこれらの展望性陳述に反映される予想は合理的であると考えているが、これらの陳述は未来の事件或いは私たちの未来の財務表現に関連し、既知と未知のリスク、不確定要素とその他の要素に関連し、私たちの実際の結果、活動レベル、業績或いは業績を招く可能性があり、これらの展望性陳述中に陳述或いは暗示した任意の未来の結果、活動レベル、業績或いは成果とは大きく異なる。
歴史的事実以外のすべての陳述は前向きな陳述だ。これらの展望的陳述は、改正された1933年証券法第27 A条又は改正証券法及び1934年改正証券取引法第21 E条下の“安全港”条項及び1995年の“個人証券訴訟改革法”の規定に基づいてなされている。場合によっては、前向きな陳述は、“可能”、“予想”、“すべき”、“予想”、“意図”、“計画”、“予想”、“信じ”、“推定”、“予測”、“予測”、“潜在”、“継続”またはこれらの用語または他の同様の用語の否定的意味によって識別することができる。これらの声明はただ予測に過ぎない。あなたは展望的な陳述に過度に依存してはいけません。それらは既知と未知のリスク、不確実性、および他の要素に関連しているので、これらの要素は場合によっては私たちがコントロールできず、結果に大きな影響を与えるかもしれません。実際の結果がこれらの前向き陳述や示唆の結果と大きく異なる可能性のある具体的なリスクについては,“第3項.重要な情報−D.リスク要因”と本年度報告における20−F表の他の部分を参照されたい。これらのリスクまたは不確実性のうちの1つまたは複数が発生した場合、または私たちの基本的な仮定が正しくないことが証明された場合、実際のイベントまたは結果は、前向き陳述における示唆または予測と大きく異なる可能性がある。どんな展望的声明も未来の業績に対する保証ではない。本年度報告書のForm 20-Fおよび本年度報告書で引用されたForm 20-Fの文書を完全に読み、私たちの実際の未来の結果が、これらの前向きな陳述または示唆された任意の未来の結果と実質的に異なる可能性があることを理解しなければなりません。
本年度報告におけるForm 20−Fに関する前向きな陳述は、以下の記述を含むが、これらに限定されない
| ● |
私たちの動物研究と臨床試験の開始、時間、進展と結果、そして私たちの研究と開発計画 |
| ● |
私たちは候補製品を進出させ臨床試験を成功させることができます |
| ● |
私たちの臨床段階の候補製品の成功への依存は |
| ● |
記録と承認の時間や可能性を規制する |
| ● |
私たちは2021年11月に食品医薬品局(FDA)が発表した新薬申請(NDA)に関する完全返信で指摘された懸念を解決することができ、プリブリンと顆粒球コロニー刺激因子(G-CSF)の併用による化学療法による好中球減少症(CIN)の予防の承認を求める |
| ● |
承認されれば候補品の商業化 |
| ● |
私たちは販売とマーケティング能力を発展させ |
| ● |
もし承認されれば、私たちの候補製品の定価と精算 |
| ● |
私たちのビジネスモデルを実施しビジネスと技術戦略計画を立てます |
| ● |
私たちは私たちの製品候補と技術のための知的財産権保護範囲を確立することができます |
| ● |
私たちは第三者の知的財産権やノウハウを侵害することなく私たちの業務を運営することができます |
| ● |
知的財産権侵害、製品責任、その他のクレームに関連する費用; |
| ● |
規制はアメリカや中国などの管轄地域で発展しています |
| ● |
私たちの支出、将来の収入、資本需要、追加融資需要の推定 |
| ● |
戦略的協力協定の潜在的な利点と私たちの戦略的計画を達成する能力 |
| ● |
私たちは協力関係を維持したり追加的な資金を獲得する能力を維持したり |
| ● |
私たちの候補製品の市場受容率と程度 |
| ● |
競争療法を含む競争相手や私たちの業界の発展に関連しています |
| ● |
私たちは期待される成長能力を効率的に管理しています |
| ● |
私たちは合格した従業員とキーパーソンの能力を引きつけて維持します |
| ● |
“米国の創業法案”や“雇用法案”に適合する新興成長型企業への期待値は |
| ● |
将来の収入、採用計画、費用、資本支出、資本要求、株式業績に関する報告書 |
| ● |
私たちの普通株の将来の取引価格と証券アナリストの報告書がこれらの価格に与える影響 |
| ● |
全世界のコロナウイルス(新冠肺炎)の大流行及びその対応措置を含む広範な衛生事態の発展の影響は、著者らの臨床試験患者の登録、監督或いはその他の必要な検査の時間と完成、著者らの臨床試験のデータ読み取りと著者らの候補製品のある監督管理文書の予想スケジュール及び監督部門の審査と承認スケジュールに重大な不利な影響を与える可能性がある; |
| ● |
その他のリスクと不確定要素は、“項目3.重要な情報--D.リスク要素”に列挙されたリスクと不確定性を含む |
本20−F年度報告“項目3.主要な情報であるD.リスク要因”の項目は、我々が受けている主要または有および不確定要素について言及しており、本20−F年度報告に記載されている任意の前向き陳述を評価する際には、これらの要因を考慮すべきである。
本年度報告Form 20-Fにおける展望的陳述は、Form 20-F年次報告書が発表された日までの私たちの観点のみを代表しており、新しい情報、未来のイベント、または他の理由でいかなる前向きな陳述を公開または修正する義務はありません。私たちはその後に発生した事件と事態の発展が私たちの観点を変化させると予想している。しかし、私たちは未来のある時点でこのような前向きな陳述を更新することを選択するかもしれないが、私たちは現在、法律の要求が適用されない限りそうするつもりはない。したがって、あなたはこのような前向きな陳述に依存して、本年度報告書20-F表の日付までの私たちの任意の日付の観点を代表してはいけません。
このForm 20-F年度報告書には、業界出版物から得られた市場データと業界予測が含まれている。このようなデータは多くの仮定と制限と関連があり、あなたにこのような推定を過度に重視しないように想起させる。この20-F表年報に掲載されている市場地位、市場機会及び市場規模資料は大体信頼できると信じているが、これらの資料自体は正確ではない。
第I部
| 第1項。 |
役員·上級管理職·コンサルタントの身分 |
適用されません。
| 第二項です。 |
割引統計データと予想スケジュール |
適用されません。
| 第三項です。 |
重要な情報 |
| A. |
[保留されている] |
| B. |
資本化と負債化 |
適用されません。
| C. |
収益を提供し使用する理由は |
適用されません。
| D. |
リスク要因 |
リスク要因の概要
私たちの財務状況と追加資本需要に関連するリスク
| ● |
私たちの経営の歴史は限られていて、これは現在の業務を評価し、私たちの将来の業績を予測することを難しくするかもしれません。 |
| ● |
私たちが設立して以来、私たちは各時期に純損失が発生し、予測可能な未来に純損失が続くと予想される。 |
| ● |
私たちは私たちの未来の運営に資金を提供するために追加的な資金を得る必要があるだろう。もし私たちがそのような融資を受けることができなければ、私たちは私たちの現在または未来の候補製品の開発と商業化を達成できないかもしれない。 |
私たちの候補製品の臨床開発に関するリスク
| ● |
われわれはプリブリンの成功に大きく依存しており,多様な適応のために開発されている。プリプリンや私たちが開発した他の候補製品の臨床試験は成功しないかもしれない。もし私たちがプリプリンや私たちの他の任意の候補製品を商業化できない場合、あるいはそうする過程で重大な遅延に遭遇すれば、私たちの業務は実質的に損害を受けるだろう。 |
| ● |
FDAがCINのプリプリン連合G−CSFを予防するためのNDAを承認していない場合、またはFDAがこの適応に使用しているプリブリンのNDAの審査または承認が大幅に延期または延長された場合、またはこのような適応におけるプリブリンの開発が著しく延期または終了された場合、私たちの業務および運営結果は大きな悪影響を受ける可能性がある。 |
| ● |
われわれの現在のすべての臨床試験はプリブリンの複数の適応に関連しており,より多くの候補製品を決定または発見する努力では成功しない可能性がある。私たちの資源と資金を得るルートが限られているので、私たちは多くの適応に適応するために、過去に決定されたプリブリンを優先的に発展させなければならない。もし私たちが現在プリプリンに基づく候補製品が実行可能な製品になれない、あるいは適時に実行可能な製品になれなければ、私たちの業務は不利な影響を受けるだろう。 |
| ● |
われわれが臨床試験で患者を募集する際に困難に遭遇すると,われわれの臨床開発活動は延期されたり,他の悪影響を受けたりする可能性がある。 |
私たちの候補製品の規制承認に関するリスク
| ● |
アメリカ食品薬品監督管理局、国家医療製品管理局(その前身は中国食品薬品監督管理局)、ヨーロッパ薬品監督管理局(EMA)及びその他の類似の監督管理機関の監督管理審査過程は長く、時間がかかり、本質的に予測できず、もし私たちが最終的に私たちの現在の候補製品或いは私たちが開発する可能性のある任意の未来の候補製品に監督管理の許可を得ることができなければ、私たちの業務は深刻な損害を受ける。 |
| ● |
規制当局が私たちの候補製品の安全性または有効性を評価するために追加的な時間または研究を必要とする場合、私たちの1つまたはすべての候補製品または目標適応の規制承認は大幅に延期されるか、または得られない可能性がある。 |
| ● |
我々のCIN(保護-1および保護-2)および末期非小細胞肺癌(NSCLC)(ダブリン-3)の2/3期試験の結果は、私たちの候補製品のマーケティング申請の提出または承認をサポートするのに不十分である可能性がある。FDA、NMPA、EMA、または他の規制機関は、現在の臨床試験(保護-1、保護-2、およびダブリン-3)を支持するために、または私たちの候補製品が規制によって承認された条件を遵守するために、追加の臨床データを提供することを要求するかもしれません。 |
私たちの候補製品の商業化に関するリスクは
| ● |
もし私たちが必要な規制承認を得ることができない場合、あるいは私たちの候補製品を商業化することができなくなり、私たちの収益能力は深刻な損害を受けるだろう。 |
| ● |
たとえ私たちのすべての候補製品が監督部門の許可を得ても、それらは医者、患者、第三者支払人と医学界の他の人が商業成功に必要な市場受容度を達成できないかもしれない。 |
| ● |
私たちのどんな商業化努力も、第三者や内部との手配を通じて、販売、マーケティング、流通能力を発展させることを要求するだろう。もし私たちが第三者と合意できない場合、私たちの候補製品をマーケティングして販売したり、マーケティングと販売能力を確立したりすることができなければ、製品販売収入を生み出すことができないかもしれません。 |
私たちの知的財産権に関するリスクは
| ● |
私たちの知的財産権組合の一部には、現在、認可特許として発行されていない未解決の特許出願が含まれており、未解決の特許出願が発行されていない場合、私たちの業務は悪影響を受けるであろう。もし私たちの技術や薬物のために特許保護を得ることができなければ、私たちの競争相手は私たちと類似または同じ技術や薬物を開発し、商業化する可能性があり、私たちの技術と薬物を商業化することに成功する能力は不利な影響を受ける可能性がある。 |
| ● |
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。 |
| ● |
私たちは私たちの知的財産権を保護したり実行したりする訴訟に巻き込まれるかもしれないが、これは高価で時間がかかり、成功しないかもしれない。法廷または米国特許商標局(USPTO)または同様の非米国当局が疑問を提起した場合、候補製品に関連する特許権は、無効または強制執行不可能と認定される可能性がある。 |
私たちの第三者への依存に関するリスクは
| ● |
私たちは第三者に依存して動物研究と臨床試験を行う。もしこれらの第三者がその契約の責務を成功的に履行できない場合、あるいは予想される期限までに完了することができなければ、規制機関から候補製品の承認を得られないか、商業化される可能性があり、私たちの業務は深刻な損害を受ける可能性がある。 |
| ● |
私たちは第三者に依存して私たちの候補製品を生産したいです。承認されれば、第三者に依存して私たちの候補製品の製造過程を行うつもりです。第三者が私たちに十分な数の製品を提供できない場合、あるいは許容可能な品質レベルや価格で製品を提供できない場合、私たちの業務は損なわれる可能性があります。 |
| ● |
私たちはすでに形成され、将来的に協力、戦略同盟、買収を形成したり、許可手配を達成したりする可能性がありますが、私たちはこれらの手配のメリットを意識していないかもしれません。 |
私たちの業界、業務、運営に関するリスク
| ● |
私たちが提案できる販売促進声明は制限される可能性があり、承認されれば、重大な規制や法執行のリスクを招くことなく、競争療法に関する情報を使用してプリブリンを普及またはマーケティングすることができない可能性がある。 |
| ● |
私たちの中国内線のプリプリンに対する私たちの権利は限られている。 |
| ● |
私たちの未来の成功は私たちがCEOと他の主要な行政人員を維持し、合格した人員を誘致、維持、激励できるかどうかにかかっている。 |
私たちが中国でビジネスをしているリスクは
| ● |
現在の国際経済関係の緊張は私たちの臨床試験過程、私たちの運営コストと私たちの業務成長にマイナス影響を与える可能性がある。 |
| ● |
海外の監督管理機関は中国の調査や証拠取得が困難かもしれない。 |
| ● |
中国の製薬業界は高度な規制を受けており、これらの規定は変化する可能性があり、私たちの薬品の承認と商業化に影響を与える可能性がある。 |
| ● |
中国政府の政治·経済政策や中国と米国の関係の変化は、私たちの業務、財務状況、経営業績、私たちの普通株の市場価格に実質的な悪影響を及ぼす可能性がある。 |
| ● |
アメリカと中国の法規の変化は私たちの業務、私たちの経営業績、私たちの融資能力、そして私たちの普通株の市場価格に悪影響を及ぼすかもしれません。 |
私たちの普通株に関するリスクは
| ● |
私たちの普通株の取引価格は変動するかもしれません。これはあなたに大きな損失をもたらすかもしれません。 |
| ● |
公開市場で私たちの普通株を大量に販売したり売ることは私たちの普通株価格を大幅に下落させる可能性があります。 |
| ● |
私たちは予測可能な未来に配当金を発行しないと予想されているので、あなたは普通株の価格上昇に依存して投資収益を得なければなりません。 |
私たちの財務状況と追加資本需要に関連するリスク
私たちの経営の歴史は限られていて、これは現在の業務を評価し、私たちの将来の業績を予測することを難しくするかもしれません。
万春生物科学技術は私たちのアメリカ子会社の元持株会社で、2010年に設立された。これまで、私たちの業務は主に組織と会社のための人員、業務計画、資金の調達、私たちの知的財産権の組み合わせを構築し、プリプリンの権利の保護、およびプリブリンの動物研究と臨床試験を行うことに集中してきた。著者らの現在の治療方案は多種の適応のためのプリブリンを含み、CINを非小細胞肺癌の直接抗癌剤として予防し、ドセタキセルと併用する時、及び一連の臨床と臨床前免疫腫瘍候補製品を含む。大規模な重要な臨床試験を成功させ、規制部門の承認を得て、商業規模の薬物を製造したり、第三者代表を配置したり、商業化に必要な販売やマーケティング活動を成功させたりする能力があることは証明されていない。私たちはまだ規制部門から私たちの候補製品の承認を得ておらず、それを商業化する能力も見せていない。私たちは商業販売を許可された製品もなく、製品販売から何の収入も得ていない。したがって、私たちの業務と将来の業績の見通しを評価することは難しい。
我々は,高度に満足されていない医療ニーズ患者の臨床結果を改善するための革新的な癌療法の開発に焦点を当てている。私たちの限られた経営歴史、特に癌治療分野の急速な発展を考慮すると、現在の業務と将来の業績の将来性を評価することが困難になるかもしれません。私たちの短い歴史は私たちの未来の業績や生存能力に対するどんな評価も重大な不確実性の影響を受けるようにした。ビジネス活動を支援できる会社への転換を求める中で、急速な発展分野で初期段階にある会社がしばしば遭遇するリスクや困難に直面することになる。また、新しい業務として、経験が限られているため予見できない費用、困難、合併症、遅延に遭遇する可能性が高いかもしれません。もし私たちがこのような危険と困難に成功的に対応できなければ、私たちの業務は影響を受けるだろう。
私たちが設立して以来、私たちは各時期に純損失が発生し、予測可能な未来に純損失が続くと予想される。
薬品開発は高度に投機的であり、大量の前期資本支出が必要であり、候補製品が監督管理の許可を得られないため、商業実行可能性を実現し、患者、医者と支払人に受け入れられる重大なリスクである。私たちは大部分の財政資源を研究開発に投入し、動物研究と臨床試験を含む。今まで、私たちは製品販売から何の収入も得ていません。私たちは持続的な運営に関連する重大な開発とその他の費用を発生し続けています。したがって、私たちは利益を上げておらず、2010年の設立以来、どの時期も赤字になっている。2019年12月31日、2020年、2021年12月31日までの年度まで、純損失4030万ドル、6380万ドル、6820万ドルをそれぞれ報告し、2020年12月31日と2021年12月31日までの累計赤字はそれぞれ2兆778億ドルと3.42億ドルだった。我々のほとんどの運営損失は,我々の研究開発計画に関するコストと我々の運営に関する一般的かつ行政的コストによるものである.私たちは予測可能な未来に損失を被ることが予想され、私たちが引き続き私たちの候補製品を開発し、規制部門の承認を求め、承認された薬物を商業化し始めるにつれて、これらの損失は増加するだろう。通常,発見から患者治療に利用可能な新薬の開発には数年を要する。私たちは予測できない費用、困難、複雑な状況、遅延、その他の未知の要素に直面する可能性があり、これらの要素は私たちの支出を増加させ、私たちの収益能力に不利な影響を与えるかもしれない。私たちの将来の純損失の規模は私たちの業務を管理する能力にある程度依存するだろう。もし私たちの候補製品が臨床試験で失敗した場合、あるいは規制部門の承認を得なかった場合、あるいは承認され、市場の承認を得られなかった場合、私たちは決して利益を上げないかもしれない。例えば、2021年11月には、NDAに対するFDAの完全な返信を受け取り、CINの予防のためにプリプリンとG−CSFの併用を許可することを要求した。FDAと密接に協力し,CIN予防適応の将来可能な臨床と規制経路を考えたいが,FDAの承認を得ることに成功できない可能性があり,重大な損失を招く可能性がある。私たちが未来に利益を達成しても、私たちはその後の時期に利益を維持できないかもしれない。私たちの以前の損失と予想された未来の損失はすでに私たちの株主権益と運営資本に悪影響を与え続けるだろう。
私たちの研究と開発費用は引き続き大幅に増加することを予想しています。私たちは現在行われている臨床試験、現在の候補製品と私たちが開発する可能性のある任意の未来の候補製品に投資し続けるからです。米国での候補製品の規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価します。そのため、予測可能な未来には、重大かつ増加していく運営損失と負のキャッシュフローを受け続けることが予想される。これらの損失はすでに私たちの株主権益、財務状況、キャッシュフロー、運営資本に重大な悪影響を与え続けるだろう。
私たちは私たちの未来の運営に資金を提供するために追加的な資金を得る必要があるだろう。もし私たちがそのような融資を受けることができなければ、私たちは私たちの現在または未来の候補製品の開発と商業化を達成できないかもしれない。
私たちは株式発行、株主、第三者融資(銀行ローンを含む)および協力手配を通じて私たちの業務に資金を提供します。私たちは普通株と優先株を発行し、礼来会社の協力支払いを通じて、私たちの子会社SEED治療会社やSEEDの運営に資金を提供します。2021年12月31日現在、我々は約2.96億ドルの株式融資、1020万ドルの非持株発行、530万ドルの種子優先株発行、210万ドルの銀行ローンを調達し、そのうち60万ドルは2021年7月に免除され、150万ドルは2022年3月に返済され、250万ドルの第三者ローンは250万ドルで、うち100万ドルは株式投資、150万ドルは返済され、1440万ドルの株主ローンに転換された。その中の600万ドルはすでに返済して、840万ドルはすでに私たちのアメリカ子会社の前持株会社の万春生物科学技術は私たちの内部再編によって2015年7月20日に負担して、礼来会社は種子会社に1,000万ドルを前払いして、江蘇恒瑞製薬有限会社は私たちの一部の株式子会社大連万春布林製薬有限会社或いは江蘇恒瑞製薬有限会社に約3100万ドルを前払いした。私たちの候補製品は規制審査、重大なマーケティング努力と大量の投資を完成して、それから私たちに任意の製品の販売収入を提供することができます。
設立以来、私たちの業務は大量の現金を消費した。2019年12月31日現在、2020年と2021年12月31日までの年間、私たちの経営活動に用いられる現金純額はそれぞれ4,820万ドル、4,370万ドル、4,720万ドルです。新たな候補製品を発見するために多くの資金を費やし,候補製品の臨床開発を進めていく予定である。私たちは恒瑞と協力して、プリプリンを大中国で商業化した。我々が米国での候補製品の規制経路を決定した後、商業化パートナーを探すか、米国や世界の他の地域のための内部商業化能力を構築するかを評価する。
私たちは私たちの未来の運営に資金を提供するために追加的な資金を得る必要があるだろう。CINを予防するためのNDA承認を支援し、潜在的なNSCLCのNDA申請を支援するために、任意の追加の臨床試験の規制要件を満たすために、FDAが必要とする可能性のある追加の臨床試験を行うために追加の資金を調達する必要があります。また、将来の候補製品の開発と商業化を達成するために追加の資金を得る必要があります。また、私たちの運営費用と他の契約約束額は大きく、今後も増加すると予想される。
私たちの未来の資金需要は多くの要素に依存するだろうが、これらに限定されない
| ● |
私たちが現在計画しています将来可能な臨床試験のコストは |
| ● |
FDA、NMPA、EMA、および同様の規制当局の規制承認の結果、時間、およびコストは、私たちが要求される可能性のある任意の追加研究を含む |
| ● |
私たちの候補製品の商業化コストは |
| ● |
ビジネス規模のアウトソーシング製造活動を完了するコストと時間 |
| ● |
私たちは商業化に成功した候補品から利益を得ています |
| ● |
任意の特許権利要件および他の知的財産権の提出、起訴、弁護、および実行費用; |
| ● |
私たちが構築する可能性のある任意の潜在的な未来の協力、許可、または他の手配に関連する費用 |
| ● |
将来的に買収された現金需要は |
| ● |
上場企業としての運営コストは |
| ● |
技術や市場の発展に必要な時間とコスト |
| ● |
私たちが開発可能な候補製品の数量と特徴、そしてその開発に関連する費用。 |
私たちは株式と債務融資、潜在的な許可と協力手配、そして規制の承認を得た後に製品を販売することで、将来の現金需要に資金を提供することができる。私たちが追加的な株式証券を発行することは、私たちの既存の株主の株式を希釈させるかもしれない。商業ローンを獲得し、これらのローンが利用可能であると仮定すると、私たちの負債と将来の現金約束を増加させるだろう。全体的な市場状況とFDAの完全な返信は私たちが資本市場から融資を求めることを難しくするかもしれない。私たちは合理的な条項で資金調達を完了できないかもしれないし、資金調達を根本的に終わらせることができないかもしれない。もし私たちが受け入れられると思われる金額と条項で融資を受けることができなければ、業務と未来の成功は実質的で不利な影響を受けるだろう。もし私たちが必要な時や魅力的な条件下で資金を集めることができなければ、私たちは私たちの研究開発計画や将来の商業化努力を延期、減少または廃止することを余儀なくされるだろう。私たちは必要な時に追加的な資金を得ることができず、これは私たちの業務を深刻に損なうかもしれない。
追加資本の調達は私たちの株主に希釈し、私たちの運営を制限したり、私たちの技術や候補製品に対する権利を放棄することを要求するかもしれません。
私たちは株式と債務融資、潜在的な許可と協力手配、そして規制の承認を得た後に製品を販売することで追加資金を求めるかもしれない。どの株式や株式リンク証券の発行も、私たちの株主の株式を深刻に希釈させる可能性がある。追加債務の発生や特定の持分証券の発行は、固定支払義務の増加をもたらす可能性があり、追加債務を生成したり、追加株式を発行する能力が制限されたり、可能な知的財産権を得る能力が制限されたり、業務を展開する他の可能性のある能力に悪影響を与える可能性のある他の運営制限をもたらす可能性があります。また、追加株式証券を発行したり、このような証券を発行したりする可能性は、我々普通株の市場価格の下落を招く可能性がある。もし私たちが資金を調達するための協力や許可手配を達成すれば、不利な条項で私たちの技術や候補製品の権利を放棄することを第三者に与えることができるかもしれないという不利な条項を受け入れることを要求されるかもしれません。そうでなければ、私たちはより有利な条項を得ることができるかもしれません。
私たちは現在製品販売から収入を得ていないので、永遠に利益を上げないかもしれない。
私たちの収入と収益を創出する能力は、私たちが候補製品の開発を成功させ、必要な規制承認を得る能力と、私たちが開発する可能性のある未来の候補製品の能力に依存します。現在、商業販売に使用できる薬剤はありません。私たちは、私たちの候補製品と任意の未来の候補製品を商業化することで、引き続き大量かつ増加した損失を招くと予想している。私たちの候補製品はすべて中国、アメリカ、EU、あるいは任意の他の司法管轄区で発売されて承認されていません。私たちの候補製品は決してこのような承認を得ないかもしれません。私たちが収入を創出し、利益を達成する能力は、私たちの候補製品と私たちが開発した任意の未来の製品の開発を完成させ、必要な規制承認を得ること、および私たちの薬物を生産·成功的に販売する能力に依存する。
私たちの1つまたは複数の候補製品または1つまたは複数の将来の候補製品が監督管理許可およびマーケティング許可を得て商業販売のために使用されても、潜在的製品は、以下の点で成功しない限り、収入を全く生じない可能性がある
| ● |
第三者との商業的に実行可能な供給関係の確立と維持を含む、私たちの候補製品および任意の承認された製品のための持続可能かつ拡張可能な製造プロセスを開発すること |
| ● |
協力者や流通業者と直接または協力して、規制許可およびマーケティング許可を得た候補製品を発売し、商業化する |
| ● |
市場が私たちの候補品を可能な治療策として受け入れてくれます |
| ● |
お互いに競争するどんな技術と市場発展にも対応しなければならない。 |
しかも、私たちが利益を達成して維持する能力は私たちが発生した時間と費用の金額にかかっている。FDA、NMPA、EMA、または他の同様の規制機関が現在の予想に基づいて検討することを要求すれば、私たちの費用は大幅に増加するかもしれない。私たちの候補製品が商業販売のために承認されても、これらの薬物の商業発売に関連した巨額のコストが生じることが予想される。
たとえ私たちが開発する可能性のある製品を販売することで収入を生み出すことができても、私たちは持続可能な基礎の上で利益を得ることができないかもしれないし、利益を全く得られないかもしれない。もし私たちが利益を上げて利益を維持できなければ、わが社の価値を下げ、私たちの普通株の市場価格に悪影響を与え、これは私たちの資金調達、業務の拡大、あるいは運営を継続する能力を弱化させ、あなたの投資損失の全部または一部を招く可能性があります。
私たちの候補製品の臨床開発に関するリスク
われわれはプリブリンの成功に大きく依存しており,多様な適応のために開発されている。プリプリンや私たちが開発した他の候補製品の臨床試験は成功しないかもしれない。もし私たちがプリプリンや私たちの他の任意の候補製品を商業化できない場合、あるいはそうする過程で重大な遅延に遭遇すれば、私たちの業務は実質的に損害を受けるだろう。
私たちの業務と製品販売に関連した収入を生成する能力(あれば)は、プリプリンと、私たちが開発する可能性のある他の任意の候補製品の開発成功、規制承認、商業化に依存するだろう。私たちは現在の候補製品を開発するために多くの精力と財力を投入し、他の候補製品に投資する予定です。プリプリンと他の潜在的な候補製品の成功は多くの要素に依存するだろう
| ● |
動物研究と臨床試験に成功しました |
| ● |
第三者が安全で効率的で合意されたプロトコルに基づいて臨床試験を行う能力 |
| ● |
FDA、NMPA、EMA、および他の類似した規制機関から私たちの候補製品に対する監督管理許可をタイムリーに受けた |
| ● |
私たちは規制部門の目標適応を承認することができます |
| ● |
第三者メーカーと手配することで、商業製造能力を確立する |
| ● |
承認されれば候補製品の商業販売を開始します |
| ● |
私たちが第三者の特許、商業秘密、または他の知的財産権を侵害、流用、または他の方法で侵害しないことを確実にする |
| ● |
医師や患者が私たちの製品候補品を受け入れてくれました |
| ● |
もし私たちの製品候補が承認されたら、第三者支払者から精算を受けます |
| ● |
他の候補品や薬物と競争する能力は |
| ● |
規制部門の承認を得た後、私たちの候補製品のために許容可能な安全プロファイルを維持する |
| ● |
特許、商業秘密、および他の知的財産権保護と規制の排他性を獲得して維持する。 |
私たちは規制承認と商業化をタイムリーに達成できず、甚だしきに至っては達成できないかもしれない。もし私たちの候補製品が承認され、および/または商業化に成功する能力に重大な遅延が発生すれば、私たちの業務を深刻に損なうことになり、私たちは私たちの運営を継続するために十分な収入とキャッシュフローを生成できないかもしれない。
FDAがG-CSFと連携してCINのNDAを予防することを許可しない場合、またはFDA’このような適応に対するプリブリンの機密協定の審査または承認が大幅に延期または延長された場合、またはこのような適応におけるプリブリンの継続開発が大幅に延期または終了されれば、私たちの業務および経営業績は大きな悪影響を受ける可能性がある。
2021年11月、私たちはプリプリン連合G-CSF予防CINに関するFDAから完全な返信を受けた。FDAは、申請の審査期間が完了したことを示す完全な返信を発表したが、申請は現在の形で承認されることはできない。完全な返信の中で、FDAは、単一登録試験(保護性-2段階3)の結果は利益を証明するのに十分ではなく、CIN適応を支持する実質的な証拠要求を満たすために第二の良好な制御試験が必要であることを指摘した。著者らはFDAと密接に協力し、CIN予防適応の将来可能な臨床と制御経路を考慮することを望んでいる。FDAがCINのプリプリン連合G-CSFを予防するためのNDAを承認していない場合、またはFDAがこのような適応のためのプリブリンのNDAの審査または承認が著しく延期または延長されたか、またはプリプリンの継続開発が著しく延期または終了された場合、これは、私たちの業務、財務状態、および運営結果に実質的な悪影響を及ぼすであろう。
われわれの現在のすべての臨床試験はプリブリンの複数の適応に関連しており,より多くの候補製品を決定または発見する努力では成功しない可能性がある。私たちの資源と資金を得るルートが限られているので、私たちは多くの適応に適応するために、過去に決定されたプリブリンを優先的に発展させなければならない。もし私たちが現在プリプリンに基づく候補製品が実行可能な製品になれなければ、私たちの業務は不利な影響を受けるだろう。
将来的にはプリブリン以外の他の治療機会を探索しようとしているが、現在私たちは3つの候補製品と1つの薬物開発プラットフォームしか決定しておらず、プリブリンを含まず、これらの候補薬物の臨床試験はまだ始まっていない。プリブリンはNPBSIPO Liquiating TrustまたはNereusから得られたものであり、私たち自身が開発したものではない。私たちが最終的に成功するかどうかにかかわらず、候補製品を開発するには大量の技術、財力、人的資源が必要だ。我々の研究計画と著者らの協力者の研究計画は、最初は潜在的な適応および/または候補製品の決定に希望を示す可能性があるが、様々な原因で臨床開発結果を生成できなかった
| ● |
使用される研究方法は、潜在的な適応および/または候補製品を決定することに成功しない可能性がある |
| ● |
さらなる検討の後、潜在的な候補製品は、それらが有効な薬剤である可能性が低いことを示す有害な副作用または他の特徴を有することが証明される可能性がある;または |
| ● |
私たちの候補品のためにより多くの治療機会を決定するために、私たちが持っているより多くの人力と財力が必要かもしれないし、内部研究計画を通じて適切な潜在的候補製品を開発し、私たちの薬物組み合わせの能力を制限し、拡大することができるかもしれない。 |
私たちの財務と管理資源が限られているため、特定の適応の研究計画と製品候補に重点を置いています。私たちは私たちの努力と資源を潜在的な候補製品または最終的に成功しないことが証明された他の潜在的な計画に集中するかもしれない。私たちはまた、他の候補製品を探す機会を放棄または延期すること、または後に、より大きな商業的潜在力またはより大きな成功可能性を有することが証明された他の兆候を示す可能性がある。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。
したがって、私たちは内部研究計画を通じて私たちの候補製品のための追加の治療機会を決定したり、適切な潜在的候補製品を開発することができないかもしれません。これは、私たちの将来の成長と将来性、または私たちの協力に実質的な悪影響を及ぼすかもしれません。
われわれが臨床試験で患者を募集する際に困難に遭遇すると,われわれの臨床開発活動は延期されたり,他の悪影響を受けたりする可能性がある。
臨床試験方案に基づいて適時に臨床試験を完成し、他の事項以外に、著者らが十分な数の試験基準に符合する患者を募集する能力があるかどうかに依存し、試験終了前にずっと試験中に残っている。著者らの臨床試験では、著者らは適切な患者を募集と維持する困難に遭遇する可能性があり、原因は多くある
| ● |
大流行やその他の広範囲の衛生緊急事態が出現したり、新冠肺炎の大流行を含むこのような緊急事態が発生する可能性があることへの懸念は、特にウクライナと中国での患者登録に影響を与え、登録場所は他の臨床場所に移された。われわれの臨床試験では,われわれは全体的に患者登録の軽微な遅延と,臨床試験データ処理の軽微な遅延を経験した。新冠肺炎の疫病はまた必要な監督管理の臨床現場検査に影響を与え、これは監督管理の審査と承認を延期或いは他の方法で阻害する可能性がある |
| ● |
患者集団の規模、性質、地理的構成 |
| ● |
臨床方案で定義された患者資格基準; |
| ● |
実験の主な終点を統計分析するために必要な研究全体規模 |
| ● |
患者と試験場所の距離 |
| ● |
裁判のデザインと裁判のデザインを変えます |
| ● |
私たちは適切な能力と経験を持つ臨床試験研究者を募集することができます |
| ● |
類似療法や他の新しい療法の相互競争の臨床試験が存在し,我々が利用可能な患者の数やタイプを減少させる |
| ● |
現在研究されている候補製品の他の既存療法に対する潜在的な利点および副作用に対する臨床医および患者の見方は、我々が調査している適応のための任意の新薬または療法が承認される可能性がある; |
| ● |
患者の同意を得て維持する能力は |
| ● |
臨床試験に参加した患者は臨床試験を完了できない可能性がある |
| ● |
私たちの候補品と似たような治療法の利用可能性が承認された。 |
われわれの臨床試験で十分な数の患者を募集することができても,患者登録の遅延はコスト増加を招く可能性があり,あるいは計画された臨床試験の時間や結果に影響を与える可能性があり,これらの試験の完了を阻止し,候補製品開発を進める能力に悪影響を及ぼす可能性がある。
最近のロシアとウクライナの間の敵対行動と補助事態の発展は私たちの業務に悪影響を及ぼすかもしれない。
私たちのCIN臨床試験の一部(保護-1と保護-2)はロシアとウクライナで行われた。現在、ロシアやウクライナではいかなる臨床試験も行われていないにもかかわらず、最近の両国間の敵対行動は、患者募集の困難やサプライチェーン中断が私たちのコストを増加させ、将来の計画の臨床開発活動を混乱させる可能性があるため、これらの司法管轄区域での将来の臨床試験を避けることを要求するかもしれない。また、最近のロシアとウクライナ間の敵対行動は世界金融市場に大きな影響を与えており、有利な条件で資金を調達する能力に悪影響を及ぼす可能性がある。
臨床薬物開発は長く高価な過程に関連しており、この過程のどの段階でも失敗する可能性がある。われわれの臨床試験における経験は限られており,早期研究と試験の結果は将来の臨床試験では再現されない可能性がある。
臨床試験費用は高く、完成には数年かかるかもしれないし、臨床試験過程中にいつでも失敗する可能性がある。我々の候補製品の動物研究と早期臨床試験の結果は後期臨床試験の結果を予測できない可能性がある。CIN予防では2/3期臨床試験(保護−1と保護−2)と晩期非小細胞肺癌(ダブリン−3)の3期臨床試験を行い,小細胞肺癌(SCLC)を治療する三連療法の1期と2期臨床試験を開始し,いくつかの癌適応でBRAIN 1期研究を行ったが,プリブリンとドセタキセルの併用に関する1/2期臨床試験は行わず,101号研究も行っていない。研究101はNereusによって行われ,このような1/2期臨床試験がほぼ完了した後,Nereusからプリブリンを獲得した。動物試験と初歩的な臨床試験で進展を得たが、臨床試験後期段階の候補製品は期待された安全性と有効性特徴を示すことができないかもしれない。場合によっては、多くの要因により、同じ候補製品の異なる試験間の安全性および/または有効性結果に有意差が存在する可能性があり、レジメンに規定された試験手順の変化、患者集団の大きさおよびタイプの差(遺伝的差異を含む)、患者の投与レジメンに対するコンプライアンス、および患者退学率を含む。後期試験の結果も早期試験とは異なる可能性があり,このような試験はより多くの臨床試験地点や他の国/地域や言語に関連しているからである。また,臨床試験の設計はその結果が製品の承認を支持するかどうかを決定することができるが,臨床試験設計における欠陥は臨床試験の進展が良好で重大な費用が生じるまで明らかにならない可能性がある。
製薬と生物技術業界のいくつかの会社は高級臨床試験で重大な挫折を受け、早期の試験で人を奮い立たせる結果を得たが、証明の有効性或いは不良の安全性概況が不足しているためである。潜在製品に対する臨床試験はよく、開発努力を続けることは現実的ではない或いは実行不可能であることを表明する。例えば,101号研究の第2段階部分では,プリブリンガドセタキセル治療を受けたすべての患者の生存率の改善は統計学的に有意ではなかった。われわれは,プリブリンとドセタキセルの併用による晩期非小細胞肺癌治療の3期臨床試験(ダブリン−3号(以前は第103号研究))を継続することにしたが,これは特定の患者サブセットの一時的な分析に基づいており,FDAとの検討に基づいて修正した。これまでのサブセット分析に基づき,ダブリン−3では,白金ベースの化学療法に少なくとも1回失敗し,測定可能な病変を有する末期または転移性NSCLC患者を募集した。このように第3段階試験を設計することは、実験結果が我々が予想していたのとは異なるリスクを増加させる可能性がある。プリブリンダブリン−3とドセタキセルの併用による末期非小細胞肺癌治療の結果は統計学的に有意な治療効果を示したが,様々な潜在的原因,例えばこの研究の米国患者集団への適用性から,プリブリンのこの適応を承認できる保証はない。さらに、我々が行ったハイリスク化学療法(保護−2(従来は研究106)と呼ばれる)の予防によるCINの3期または任意の追加試験、または我々が行った他の試験は、これらの適応のうちの1つまたは両方の場合、NMPAまたはFDAがプリプリンを承認することを支持しない可能性がある。もしこのような状況が発生した場合、私たちは任意の失敗した試験を1つ以上の新しい試験で置き換える必要があり、これは大量の追加費用を必要とし、商業化の重大な遅延を招き、私たちの業務、財務状況、キャッシュフロー、および運営結果に大きな悪影響を及ぼすだろう。
我々の候補製品の臨床試験がFDA、NMPA、EMAまたは他の同様の規制機関を満足させる安全性および有効性を証明できなかった場合、または積極的な結果が生じなかった場合、私たちは、最終的に私たちの候補製品の開発および商業化を完了することができない中で追加のコストや遅延を生じる可能性がある。
規制機関の許可を得て任意の候補製品を販売する前に、私たちの候補製品の人体上の安全性と有効性を証明するために、広範な臨床試験を行わなければならない。臨床試験費用が高く,設計と実施が困難であり,完成まで数年かかる可能性があり,失敗する可能性もある。著者らの1つまたは複数の臨床試験の失敗はテストの任意の段階で発生する可能性があり、臨床試験の成功中期結果は必ずしも成功の最終結果を示唆するとは限らない。過去、患者はプリブリンによるいくつかの副作用が出現し、吐き気、嘔吐、疲労、発熱、腫瘍疼痛と一過性血圧上昇を含み、将来患者は類似或いは異なる副作用が出現する可能性があり、これは監督部門の承認を延期或いは阻止する可能性がある。私たちと私たちの契約研究機関あるいはCROは良好な臨床実践要求またはGCPを遵守しなければならない。これはFDA、NMPA、EMAおよび他の類似規制機関が臨床開発中のすべての薬物に対して実行する法規とガイドラインである。規制当局は,試験スポンサー,主要調査者,試験地点を定期的に検査することでこれらのGCPを実行している。GCPを遵守するコストが高い可能性があり、もし私たちまたは私たちのいかなるCROも適用されたGCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれません。FDA、NMPA、EMA、または同様の規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。
臨床試験中や臨床試験の結果では、規制部門の許可を得たり、候補製品を商業化したりすることを延期または阻止する可能性がある多くの予期しない事件に遭遇する可能性がある
| ● |
規制機関、機関審査委員会または倫理委員会は、私たちまたは私たちの研究者が予想される試験場所で臨床試験を開始したり、臨床試験を行ったりすることを許可してはならない |
| ● |
私たちの候補製品の臨床試験は否定的または不確定な結果をもたらす可能性があり、私たちは決定したり、監督機関が追加の臨床試験を要求したり、薬物開発計画を放棄することを要求するかもしれません |
| ● |
私たちの候補製品の臨床試験に必要な患者の数は私たちが予想していたより多いかもしれません。登録者数は私たちの予想よりも遅いかもしれません |
| ● |
私たちの第三者請負業者と調査者は、法規の要求を適時に遵守したり、私たちに対する契約義務を履行できなかったり、あるいは全く守らなかったりする可能性があります |
| ● |
様々な理由で、私たちは、臨床反応の不足、または参加者が受け入れられない健康リスクに直面していることを決定することを含む、候補製品の臨床試験を一時停止または終了しなければならないかもしれない |
| ● |
規制機関、IRBs、または倫理委員会は、様々な理由で、規制要件を満たしていないことを含む、私たちまたは私たちの研究者に臨床研究の一時停止または終了を要求する可能性がある |
| ● |
私たちの候補製品の臨床試験コストは予想以上に高いかもしれません |
| ● |
私たちの候補製品の供給または品質、または候補製品の臨床試験に必要な他の材料が不足または不足している可能性がある; |
| ● |
私たちの候補製品は不良事件、不良副作用、あるいは他の予期しない特徴を招く可能性があり、私たち、私たちの調査者、あるいは監督機関が試験を一時停止または終了させる可能性があります。 |
もし私たちの候補製品に対して、現在予想されている以上の追加の臨床試験または他の試験を行うことを要求されたら、もし私たちが候補製品の臨床試験または他の試験を成功させることができなければ、もしこれらの試験または試験の結果が陽性でないか、またはわずかな陽性である場合、またはそれらが安全問題を引き起こす場合、私たちは:
| ● |
私たちの候補製品に対する規制部門の承認を遅延させる |
| ● |
規制部門の承認を得ていません |
| ● |
承認された適応は予想ほど広くありません |
| ● |
薬品は監督部門の許可を得て下積みされた |
| ● |
追加の上場後のテスト要求を受けます |
| ● |
薬物の分配や使用方法によって制限されています |
| ● |
薬物使用の精算を受けることができない。 |
テストや承認の遅延は私たちの薬物開発コストを増加させるかもしれない。いずれの臨床試験が計画通りに開始されるかどうか,再構成が必要かどうか,予定通りに完成するかどうか,あるいは全く知られていない。臨床試験では陰性あるいは不確実な結果が生じる可能性がある。しかも、このような裁判は予想以上に延期されたり進行されたりするかもしれない。私たちの臨床試験の完成を遅延させることは私たちのコストを増加させ、私たちの候補製品の開発と承認過程を遅くし、私たちの製品販売と収入を創造する能力を危険にさらし、私たちはテストと承認過程を完成するのに十分な資金がないかもしれない。これらのすべての事件は、私たちの業務、財務状況、見通しを深刻に損なう可能性があり、私たちの候補製品が規制部門の承認を得ることができない、あるいは私たちの競争相手が私たちの前に薬物を市場に出すことを可能にし、それによって私たちが承認された後に薬物を商業化する能力を弱めることを可能にする。
私たちの候補製品の規制承認に関するリスク
FDA、NMPA、EMA、および他の同様の規制機関の規制承認過程は長く、時間がかかり、本質的に予測不可能であり、もし私たちが最終的に監督部門が現在の候補製品または私たちが開発する可能性のある未来の候補製品の承認を得ることができなければ、私たちの業務は深刻な損害を受けるだろう。
FDA、NMPA、EMA、または司法管轄区域に適用される同様の規制機関から、各薬剤を販売する規制の承認を受けない限り、候補製品を商業化することはできない。特定の司法管轄区域内で目標適応のための任意の候補製品の商業販売の規制承認を得る前に、私たちは、動物研究および制御された良好な臨床試験において、候補製品がこの目標適応に使用されることが安全かつ有効であり、製造施設、プロセス、および制御が十分であることを証明し、FDAが米国の承認に満足させなければならない。
FDA、NMPA、EMA、および他の類似規制機関の承認を得るのに要する時間は予測できないが、通常は動物研究と臨床試験開始後数年後に必要であり、監督機関のかなり大きな裁量権を含む多くの要素に依存する。また、承認政策、法規或いは承認を得るために必要な臨床データのタイプと数量は監督管理機関によって異なる可能性があり、候補製品の臨床開発過程で変化する可能性がある。私たちはどんな候補製品に対する規制部門の承認を受けていない。2021年11月、NDAに対するFDAの完全な返信を受け取り、CINの予防のためにプリプリンとG-CSFの併用を許可することを要求した。私たちの既存の候補製品や私たちが将来発見または買収する可能性のある任意の候補製品は、規制部門の承認を決して得られないかもしれない。私たちが一つの管轄区域で規制を受けても、私たちは他の管轄区域で承認を得ることができないかもしれないし、私たちは同じ適応や同じ条件で承認されないかもしれない。
私たちの候補製品は様々な理由でFDA、NMPA、EMA、または同様の規制機関の規制承認を得ることができない可能性があります
| ● |
私たちの臨床試験の設計や実施について規制機関とは意見が分かれています |
| ● |
候補製品が安全で有効であるか、または安全で純粋で有効であることを証明することができなかった |
| ● |
臨床試験結果は承認に必要な統計的意義レベルに達しなかった。例えば、101を研究した結果は統計的有意ではなかった |
| ● |
候補製品の臨床的および他の利益がその安全リスクよりも大きいことは証明されなかった |
| ● |
規制当局と動物研究や臨床試験データの解釈に食い違いがあります |
| ● |
私たちの候補製品の臨床試験から収集されたデータが不足しており、機密協定の提出や提出、または規制部門の承認を受けることを支持することができない |
| ● |
FDA、NMPA、EMAまたは同様の規制機関は、臨床および商業用品契約を締結した第三者メーカーの製造プロセスまたは施設に関連する欠陥を発見した |
| ● |
審査政策或いは法規の変化は、著者らの臨床前研究と臨床データが承認を得るのに十分ではない。 |
また、プリブリンに対するCINの予防と非小細胞肺癌治療の末期臨床試験(中国の多くの患者を含む)は、米国で提出された秘密協定文書に規制リスクをもたらす可能性がある。私たちの非小細胞肺癌臨床試験(ダブリン-3号)は559人の患者のうち、中国の患者は約87%、米国とオーストラリアの患者は13%である。我々のCIN臨床試験(保護−1および保護−2)は約500名の患者で行われ,そのうちの約50%の患者が中国におり,50%の患者が米国,ロシア,ウクライナにいる。米国人の中で利益を示さなければ,我々の研究結果が第3段階の研究データが集約される可能性のある評価を支持しない場合,あるいは組み込まれた患者集団が米国の看護基準や,他の潜在的な反対意見を反映していない場合,実験結果は米国患者に適用されない可能性があり,FDAは我々のNDAを承認しない可能性がある。
FDAは米国のマーケティング申請を支援するために単一国の外国データを使用することに賛成しないと表明した。最近、FDAは中国独自の臨床試験を通じて研究を行っている免疫療法製品のマーケティング申請を承認することを拒否した。この製品のマーケティング応用を評価するために開催されたFDA諮問委員会会議のブリーフィング文書は、現在単一国家試験からの外国データに基づいてFDAに提出されるマーケティング申請の傾向は、第一選択の多地域臨床試験方法に反することを指摘し、問題のある単一国家臨床試験からのデータは米国人口とアメリカ医療実践に適用できないことを指摘した。FDAが我々の臨床試験が類似の問題の影響を受けていると判断した場合、追加の臨床試験が必要となる可能性があり、これは多大な費用を費やし、プリプリンに対するFDAの上場承認の遅延を招くか、またはプリプリンに対する私たちのNDAの承認を拒否する可能性があり、これは私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼすだろう。
FDA、NMPA、EMA、または同様の規制機関のいずれかは、目標適応の承認を支援するための追加の臨床前研究または臨床データを含むより多くの情報を必要とする可能性があり、これは、承認および私たちの商業化計画を延期または阻止するか、または開発計画を放棄することに決定する可能性がある。例えば、我々が2021年11月に受信した完全返信では、FDAは、単一登録試験(保護-2段階3)の結果が利益を証明するのに不十分であり、CIN適応をサポートする実質的な証拠要件を満たすために第2の厳密に制御された試験が必要であることを示している。もし私たちが承認されれば、規制部門は私たちが要求しているものよりも少ないか制限された私たちの候補製品を承認するかもしれない。例えば,FDAは扁平上皮と非鱗状NSCLCを異なる疾患と見なしているため,NSCLCにおける3期試験結果からは,いずれかの疾患の承認しか得られない可能性がある。監督管理当局はまた、高価な発売後の臨床試験或いは他の発売後の要求の表現に基づいて承認することができ、あるいはラベルによる候補製品の商業化の成功が障害となる候補製品を承認することができる。さらに、我々の候補製品が不良副作用またはセキュリティ問題を生じる場合、FDAは、リスク評価緩和戦略またはREMSの確立を要求する可能性があり、またはNMPA、EMA、または同様の規制機関は、同様の戦略の確立を要求する可能性がある。例えば,このような戦略は,我々の候補製品の流通を制限し,患者や医師教育を要求したり,他の煩雑な実施要求を加えたりする可能性がある。
前述のいずれかまたは同様の状況は、私たちの候補製品のビジネス見通しに実質的な損害を与える可能性がある。
規制当局が私たちの候補製品の安全性または有効性を評価するために追加的な時間または研究を必要とする場合、私たちの1つまたはすべての候補製品または目標適応の規制承認は大幅に延期されるか、または得られない可能性がある。
私たちは計画通りに私たちの候補製品の開発を完成させたり、私たちが開発する可能性のある未来の製品候補製品の開発を開始したり、完成することができないかもしれません。我々は、CINを予防するためのNDA承認を支援し、プリブリンとドセタキセルとの併用NSCLC(ダブリン-3)の第3段階臨床試験を完了し、潜在的なNSCLCのNDA申請を支援するために、FDA要求の任意の追加の臨床試験を行うために追加の資金を調達する必要がある。私たちは、候補製品または任意の未来の候補製品の必要な承認ステップを達成するために、将来的に十分な資金を得ることができるかもしれない。
著者らの候補製品の安全性と有効性を証明するために必要な動物研究と臨床試験は時間も高価であり、完成するには数年或いはそれ以上の時間を要する。米国、中国、ヨーロッパまたは他の市場では、臨床試験の遅延、規制承認または規制承認申請が拒否されることは、多くの要因によって引き起こされる可能性がある
| ● |
予測不可能なコストや商業的決定による資金不足など、臨床試験を行うか継続するのに必要な十分な資金を得ることができない |
| ● |
FDA、NMPA、EMA、または他の規制機関と私たちの臨床試験の範囲または設計または規制承認過程の他の側面について合意できなかったか、またはこれらの監督管理機関が適用した条件を遵守できなかった |
| ● |
臨床保有、他の規制機関は、このような承認を必要とする国で臨床試験を開始するために、臨床試験の開始または継続に対する反対意見または条件、または規制部門の承認を得ることができない |
| ● |
必要な経験と専門知識を持つ将来のCROや裁判場所で受け入れられる条項と合意することはできません。その条項は広範な交渉が必要かもしれません。CROと裁判場所によって条項が大きく異なる可能性があります |
| ● |
IRBsや倫理委員会の承認を得ることができず、それぞれの場所で臨床試験を行うことができません |
| ● |
著者らは臨床試験に参加するのに十分な数の患者を募集することができず、これらの患者は臨床試験に適用される組み入れと排除基準に符合する |
| ● |
臨床試験で十分な数の患者を残すことはできません |
| ● |
私たちは法律の要求や臨床計画に基づいて臨床試験を行うことはできません |
| ● |
臨床サイトと調査者は試験規程から外れ、管理要求に応じて試験を行わず、退出あるいは試験を脱退するか、あるいは試験に参加する資格がない |
| ● |
十分な数の試験地点を決定し、維持することはできず、その多くは、同じ適応のために使用可能な試験地点を含む他の臨床試験計画に参加している可能性がある |
| ● |
新たな臨床試験場所の遅延や失敗を増加させる |
| ● |
私たちのCROまたは第三者臨床試験マネージャーは、契約の義務を履行できなかったか、または予想された期限内に達成されなかった |
| ● |
製造遅延または他の問題、品質問題、またはタイムリーに第三者から十分な数の候補製品を臨床試験のために得ることを含む製造問題 |
| ● |
治療後に患者と連絡を保つことが困難であり、データが不完全であることを招く |
| ● |
中間または最終結果が不明確または否定的であるか、または以前の結果と一致しない結果; |
| ● |
動物における臨床試験または支持的研究の不利または不確実な結果 |
| ● |
追加的な分析、報告、データまたは動物研究または臨床試験に対する規制機関の要求、またはデータ解釈に関する規制問題; |
| ● |
FDA、NMPA、EMA、IRB、データ安全監視委員会または同様の実体からのフィードバック、または動物または臨床試験の早期または同時研究からの結果、試験レジメンの修正または臨床試験の一時停止または終了を必要とする可能性のあるフィードバックを含む、我々の候補製品または他の医薬製品に関するフィードバック; |
| ● |
私たちの候補製品または他の医薬製品では受け入れられない利点-リスク状態または予見できない安全問題または副作用; |
| ● |
FDA、NMPA、EMA、IRB、比較可能エンティティまたは私たちの決定、またはデータセキュリティ監視委員会または比較可能な規制エンティティの提案は、セキュリティ問題または任意の他の理由でいつでも臨床試験を一時停止または終了することができる;および |
| ● |
薬物使用のメリットは証明できなかった。 |
規制要求および指導は、臨床試験開始後または監督許可申請を提出した後に、臨床試験案を修正したり、これらの変化を反映するために、監督管理機関に適用される他の材料に提出したりする必要があるかもしれない。修正案は,IRBsや倫理委員会に臨床試験案を再提出して再検討することを要求する可能性があり,臨床試験の完了に要するコストや時間が増加する可能性がある。
CIN(保護-1および保護-2)における2/3期試験および末期NSCLC(ダブリン-3)における我々の3期試験の結果は、候補製品の提出または承認のマーケティング申請をサポートするのに不十分である可能性がある。FDA、NMPA、EMA、または他の規制機関は、より多くの被験者を募集するか、またはより多くの臨床試験を行うことを要求するかもしれません。
2021年11月、私たちはプリプリン連合G-CSF予防CINに関するFDAから完全な返信を受けた。完全な返信の中で、FDAは、単一登録試験(保護性-2段階3)の結果は利益を証明するのに十分ではなく、CIN適応を支持する実質的な証拠要求を満たすために第二の良好な制御試験が必要であることを指摘した。我々のプリブリン連合G−CSF予防CINのNDAは現在米国国家食品·薬物管理局の審査を受けている。FDAと同様に、NMPA、EMA、または他の規制機関は、CINにおける2つの2/3期試験の結果が、このような適応を承認するのに十分であるとは思わないかもしれない。FDA、NMPA、EMA、または他の規制機関も、NSCLCに対する一期3期試験の結果が、このような適応を承認するのに十分であるとは考えていないかもしれない。特に、FDAは通常、1つの薬物を承認するために2つの重要な臨床試験を必要とする。しかし、腫瘍学領域では、FDAはある場合、深刻に医療需要を満たしていない場合にのみ1つの3期臨床試験を行い、薬物を承認することが要求される。FDAは通常、単一の臨床試験が重要な試験として十分であるとは考えず、それが非常によく制御されない限り、そして死亡率、不可逆的な発病率或いは潜在的に深刻な結果を持つ疾病の予防に臨床意義があることを証明し、しかも実践中或いは倫理的に検証性研究を行うことは不可能である。FDAから通知されているが、1つの2/3期試験は、(I)高い統計学的結果を有し、(Ii)関連亜群において一致した生存の臨床的有意な影響、および(Iii)許容可能な利益−リスクプロファイルは、FDAが通常2つの重要な臨床試験を必要とするため、抗癌薬としてプリブリンを承認するのに十分である可能性があり、NDA提出前にNSCLCのより大規模または複数の臨床試験、またはこのような適応の承認要求として要求される可能性がある。3期NSCLC試験で有利な結果が得られても,FDAはより多くの被験者を募集したり,より多くの臨床試験を行うことを要求する可能性があり,より大きな試料量や異なる臨床研究設計に関与する可能性があり,特にFDAが3期NSCLC試験の結果がNDA提出を支持するには不十分であると考えられる場合もある。
FDA、NMPA、EMA、または他の規制機関が追加的な研究を必要とする場合、私たちは上場承認過程でより多くのコストと遅延を招くことになり、利用可能な資源よりも多くの資源を必要とするかもしれない。さらに、FDA、NMPA、EMA、または他の規制機関は、成功したNDAまたは同様のマーケティングアプリケーションに必要な要素に対して異なる意見を持つ可能性があり、これは、開発、規制、または商業化戦略を変更する可能性がある。
2017年10月、中国共産党中央弁公庁、中国国務院は“審査評価審査制度改革の深化による薬品医療機器の革新の促進に関する意見”を通達した。この意見は、臨床に必要な薬品或いは医療機器に対して、審査過程を加速しなければならないことを提出した。(一)有効に治愈できない深刻な生命に危害を及ぼす疾病の治療に応用すること、或いは(二)公衆衛生を切実に必要とする薬品或いは医療器械に対して、その臨床試験の早、中期指標が治療効果と潜在臨床価値を示すのは、条件的にその上場を許可することができ、上場を希望する会社は適用の要求に従ってリスク制御計画を制定し、研究を行うべきである。2020年11月19日、“薬品条件審査技術指導原則(試行)”が薬品評価センター(CDEと略称する)によって発表され、当日から施行された。本公告は、生命を深刻に脅かす疾病と公衆衛生に必要な薬物の定義を規定し、申請者とCDEが発売後に承諾して完成した研究とその他の内容について討論し、共通認識を達成することを要求しているが、発売後の臨床研究計画の提出、予定完了日、臨床研究報告の提出日、発売後のリスク制御計画などを含むが、これらに限定されない。また、2019年12月1日、新たに改正された“人民Republic of China薬品管理法”または“中華人民共和国薬品管理法”の施行が開始された。“中華人民共和国薬品管理法”は繰り返し、(一)有効に治愈できない深刻かつ生命に危害を及ぼす疾病を治療するための薬物、或いは(二)公共衛生が必要な薬物は、条件的に承認することができ、条件はこれらの薬物の臨床試験指標はこれらの薬物が治療効果と潜在的な臨床価値を有することを表明する。すでに条件付き承認を得た薬品に対して、当該薬品の発売許可所持者は相応のリスク管理措置を採用し、そして規定の期限内に要求に従って関連研究を完成しなければならない。もし研究が規定された期限内に要求通りに完成できなかった場合、あるいはその利益がデメリットより大きいことを証明できなかった場合、最悪の場合は薬品発売許可証を取り消される可能性がある。国家市場監督管理総局が2020年1月22日に発表した新たに改訂された“薬品登録管理規定”はさらに上述の条件付き審査メカニズムを採用し、2020年7月1日から施行した。新しく改正された“薬品登録規定”は“中華人民共和国薬品管理法”が規定した上場許可所持者が果たすべき義務を再確認し、そして更に、条件が許可された薬品は関連発売後の臨床研究が完成した後に補充申請の形式で申告しなければならないと規定した。我々の2つの臨床試験、保護-1と保護-2の陽性結果に基づいて、著者らは2021年3月に中国がプリブリンとG-CSFの併用によるCIN予防を許可するための秘密保持協定を提出した。
私たちの候補製品は、不良事象や、その規制承認を遅延または阻止し、承認されたラベルの商業イメージを制限するか、または任意の規制承認後に重大な負の結果をもたらす可能性のある属性を引き起こす可能性があります。
私たちの候補製品または私たちが開発する可能性のある任意の未来の候補製品によって引き起こされる有害事象は、私たちまたは規制機関の臨床試験の中断、延期、または停止をもたらす可能性があり、より限られた適応、制限ラベルまたはFDA、NMPA、EMA、または他の同様の規制機関の規制承認遅延または拒否を引き起こす可能性がある。プリブリンによる副作用は、吐き気、嘔吐、疲労、発熱、腫瘍疼痛と一過性血圧上昇を含むことができるが、これらに限定されない。我々のどの開発段階での実験結果も,有害事象の深刻さや流行率が高いことを示す可能性があり,受け入れられない.このような状況が発生した場合、私たちの実験は一時停止または終了する可能性があり、FDA、NMPA、EMA、または他の同様の規制機関は、私たちの任意またはすべての目標適応を承認する候補製品の開発を停止または拒否するように命令することができる。プリブリンは著者らの現在すべての3種類の候補臨床製品の有効成分であり、そして著者らの現在のすべての臨床試験に影響を与える。したがって、プリプリンがもたらしたどんな深刻な影響も、私たちの現在のすべての候補製品に否定的な結果をもたらすだろう。薬物に関連する不良事件はまた患者募集或いは被験者が試験を完成する能力に影響を与える可能性があり、潜在的な製品責任クレームを招く可能性があり、そして私たちの名声、業務、財務状況と業務の将来性を深刻に損なう可能性がある。
さらに、もし私たちが現在または未来の1つまたは複数の候補製品が規制部門の承認を得て、私たちまたは他の人が後にこのような薬物による副作用を発見した場合、多くの潜在的な重大な負の結果を引き起こす可能性がある
| ● |
薬の販売を制限したり一時停止したりすることができます |
| ● |
規制当局はこの薬品の承認を取り消すことができる |
| ● |
規制部門はラベルに警告を追加することを要求するかもしれない |
| ● |
私たちは、薬物のためのREMSを制定することを要求されるかもしれない、または、REMSが到着している場合、REMS下の追加の要求を組み込むか、または同様の規制機関によって要求される同様の戦略を作成する |
| ● |
私たちは発売後の研究を要求されるかもしれません |
| ● |
私たちは起訴され被験者や患者への傷害に責任を負うかもしれません |
| ● |
私たちの名声は損なわれるかもしれない。 |
これらの事件のいずれも、特定の候補製品に対する市場の受け入れ度を達成または維持することを阻止することができ、承認されれば、私たちの業務、運営結果、および将来性を深刻に損なう可能性がある。
また,われわれのプリブリンとドセタキセルや他の化学療法薬を併用した臨床試験のような併用治療は,独自の有害事象に関与しており,単一療法の有害事象に比べてこれらの有害事象が進行する可能性がある。これらのタイプの有害事象は、私たちの候補製品によって引き起こされる可能性があり、私たちまたは規制機関の臨床試験の中断、延期または停止をもたらす可能性があり、より限られた適応または制限ラベルを引き起こすことができ、またはFDA、NMPA、EMA、または他の同様の規制機関の規制承認を延期または拒否する可能性がある。我々の実験結果は,有害事象の深刻さや流行率が高いことを示している可能性があり,受け入れられない.
私たちの候補製品が規制機関の承認を得ても、私たちは持続的な規制義務と持続的な規制審査の制約を受けることになり、これは多くの追加費用を招く可能性があり、もし私たちが規制要求を遵守していない場合、あるいは私たちの候補製品に予期せぬ問題が発生した場合、私たちは処罰を受けるかもしれない。
もし私たちの候補製品または私たちが開発した任意の未来の候補製品が承認された場合、それらは製造、ラベル、包装、貯蔵、広告、販売促進、サンプリング、記録保存、上場後研究、および安全性、有効性および他の上場後情報を提出することを含む持続的な法規要求の制約を受け、アメリカの連邦と州要求、および他の司法管轄区域の同様の規制機関の要求を含む。
薬品メーカーとメーカーの工場はFDA、NMPA、EMAと類似の監督管理機関の広範な要求を遵守しなければならず、アメリカで品質管理と製造プログラムが現在の良好な製造規範或いはcGMP法規に符合することを確保することを含む。したがって、私たちの契約製造業者は、任意の秘密協定、他のマーケティング申請で行われた約束、および検査意見に対する以前の応答を含むcGMPの遵守状況および約束の遵守状況を評価するために、持続的な審査および検査を受けるであろう。したがって、私たちと私たちと協力している他の人たちは、製造、生産、品質管理を含むすべての規制コンプライアンス分野で時間、お金、エネルギーをかけ続けなければならない。
私たちの候補製品に対して得られた任意の規制承認は、その薬剤が発売される可能性のある承認指示用途の制限または承認条件によって制限される可能性があり、または、候補製品の安全性および有効性を監視する第4段階の臨床試験および監視を含む、コストの高い上場後試験または他の上場後要求を含む可能性がある。FDAはまた、REMS計画を私たちの候補製品を承認する条件とすることを要求することができ、または私たちの候補製品を承認した後に新しいセキュリティ情報が発生した場合、これは、配布方法、患者登録、および他のリスク最小化ツールを制限するような、長期患者フォローアップ、薬物使用ガイドライン、医師コミュニケーション計画、または安全使用を確保する他の要素の要求を必要とする可能性がある。さらに、FDA、NMPA、EMA、または同様の規制機関が私たちの候補製品を承認した場合、例えば、承認後に行われた任意の臨床試験について、安全および他の上場後の情報および報告、登録、およびGCPおよびcGMPの要件に適合し続けることを遵守しなければならない。
規制要求や基準を遵守していない場合,あるいは薬物発売後に問題が発生した場合,FDAは同意法令の施行を強制したり,承認を撤回したりする可能性がある。承認後、私たちの候補製品には、予期しない深刻さや頻度の有害事象、または私たちの第三者製造業者または製造プロセス、または規制要件を遵守できなかったことが、新たなセキュリティ情報を追加するために承認されたラベルを改訂すること、新しいセキュリティリスクを評価するために発売後研究または臨床研究を実施すること、またはREMS計画に従って流通制限または他の制限を実施することをもたらす可能性があることが発見された。他の他の潜在的な結果には
| ● |
私たちの薬品の販売や製造を制限し、製品を市場からリコールするか、または自発的または強制的に製品をリコールする |
| ● |
罰金、タイトルや警告状がない、または臨床試験を一時停止する |
| ● |
FDAは、処理すべき出願の承認を拒否するか、または私たちが提出した承認された出願の追加を拒否するか、またはライセンス承認を一時停止または撤回する |
| ● |
製品が差し押さえられたり、差し押さえられたり、私たちの候補製品の輸入または輸出を許可することを拒否したり; |
| ● |
民事または刑事処罰を禁令または適用する。 |
FDAは市場に投入された製品のマーケティング、ラベル、広告、販売促進を厳格に規制している。承認の適応と承認のラベルの規定に基づいてのみ薬物を普及させることができる。FDA、NMPA、EMAなどの監督管理部門はラベル外使用を禁止する法律法規を積極的に実行し、ラベル外使用を不当に普及させていないことが発見された会社は重大な責任を負う可能性がある。
FDA、NMPA、EMA、および他の規制機関の政策は変化する可能性があり、私たちはアメリカや海外の将来の立法または行政行動によって生じる可能性のある政府規制の可能性、性質、または程度を予測することができない。もし私たちが既存の要求の変化に緩やかに適応できない場合、あるいは新しい要求や政策を採用することができなければ、あるいは私たちが規制適合性を維持できなければ、私たちは私たちが得る可能性のあるいかなる規制承認も失う可能性があり、私たちは利益を達成したり維持することができないかもしれない。
私たちの候補製品の商業化に関するリスクは
もし私たちが必要な規制承認を得ることができない場合、あるいは私たちの候補製品を商業化することができなくなり、私たちの収益能力は深刻な損害を受けるだろう。
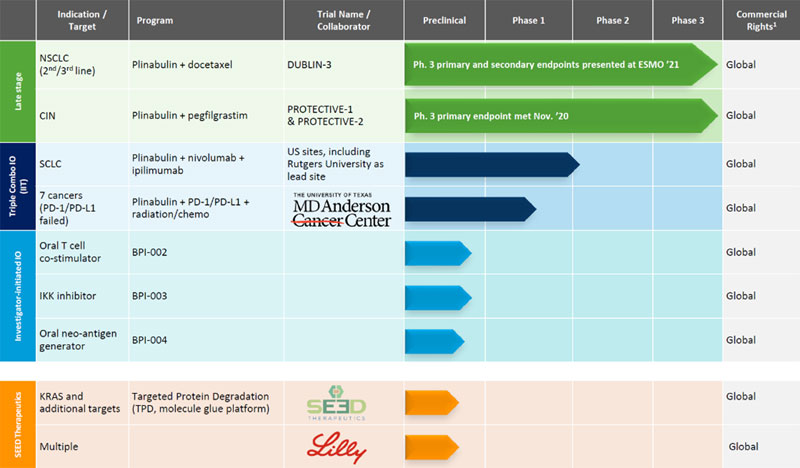
私たちは現在、規制部門の許可を得て、中国、アメリカ、EU、あるいは他のどの国でも販売されていない候補製品はありません。私たちは決して適切な薬を持っていないかもしれません。私たちの業務は、候補製品の開発を適時に完成させ、監督部門の承認を得て商業化に成功する能力に大きく依存している。FDA、NMPA、EMA、および同様の規制機関の規制承認を最初に得ない限り、候補製品を商業化することはできない。プリプリンは現在2つの臨床開発プロジェクトで研究されている。1つは,抗癌治療として2021年8月に報告されたトップクラスの最終データであり,2021年9月にヨーロッパ医学腫瘍学会(ESMO),非小細胞肺癌(ダブリン−3)からの3期試験に提出され,2022年後半に中国のNDA申請が提出される予定であり,将来の臨床的·規制的経路についてFDAとの議論が開始されている。もう一つはCINの予防であり、私たちは2021年3月にアメリカと中国で機密協定申請を提出し、この申請はアメリカ食品薬品監督管理局と国家食品薬品監督管理局の優先審査地位を獲得した。我々は2021年11月にCIN予防に関するFDAの完全返信を受け取り,NDAはNMPAの審査中である。そのほか、プリブリンはすでに臨床前モデルといくつかの研究者が開始した研究(1/2期試験)において研究を行い、免疫腫瘍学薬物と結合した治療潜在力を検討した。これらの試験と将来の試験は成功しない可能性があり,規制機関はこれまで行われてきた動物研究や臨床試験に関する我々の結論に同意しないかもしれない。
目標適応のための任意の候補製品の商業販売の規制承認を得る前に、動物研究および制御された良好な臨床試験において、候補製品が目標適応のために安全かつ有効であり、製造施設、プロセス、および制御が十分であることを証明しなければならないことはFDAを満足させなければならない。米国の承認に対して、NDAは、各目標適応に対する候補製品の安全性と有効性を決定するために、広範な臨床前研究および臨床データおよび支持情報を含まなければならない。秘密協定はまた薬物の化学、製造、そして制御に関する重要な情報を含まなければならない。秘密協定の承認を得ることは長く、高価で不確実な過程であり、承認を得ることができないかもしれない。FDAはまた私たちが提出した申請を受け入れないことを決定するかもしれない。
米国以外の規制機関、例えばEMAや新興市場の規制機関、中国など、商業販売のための薬物を承認する要求もあり、これらの地域が発売される前に、これらの要求を遵守しなければならない。各国の規制要求には大きな違いがある可能性があり、私たちの候補製品の発売が延期または阻止される可能性がある。一国で行われる臨床試験は、他の国の規制部門に受け入れられない可能性があり、一国で規制承認を得ることは、他のどの国でも規制承認を得ることを意味するものではない。承認の流れは国によって異なり、追加の製品テストと検証、追加の行政審査期間に関連する可能性があります。非米国規制機関の承認を求めるには追加の動物研究や臨床試験が必要かもしれないが、これは高価で時間がかかる可能性がある。非米国の規制承認プロセスには、FDA承認を得るのと類似したリスクと、司法管轄区域に適用される特定のリスクが含まれる可能性がある。これらのすべての理由で,非米国規制部門の承認をタイムリーに得ることができないか,あるいは個々の目標適応の承認を得ることができない可能性がある(あれば)。
具体的には、中国の案では、国家薬品監督管理局は、中国国内外で発売されていない革新的な化学薬物申請を1種類、海外で発売されている薬品申請を5種類に分類している。これまで、薬物が海外で承認されていなければ、多くの本土会社が国内で生産した薬品申請は1種類に分類されていた。中国食品薬品監督管理局が2016年3月に発表した“化学薬品登録種別改革案”によると、多くの多国籍製薬会社の薬品登録申請は現在の第5類である。国家薬品監督管理局は2020年6月に“化学薬品登録分類と申請材料要求に関する通知”(2020年7月発効)を発表し、改革方案が提出した化学薬品分類原則を再確認し、第5類のサブ分類に対して小幅な調整を行った。この2種類には異なる承認経路がある。中国市場では、1種類の薬物登録経路が5種類の薬物登録経路よりも速く、有効であると考えられています。各社は中国で臨床試験を行う前に、臨床試験申請の承認を得なければなりません。候補製品が特定の基準に適合する場合、この登録経路は、迅速な審査および承認メカニズムを有する。輸入薬品の登録経路は第5類に属し、通常は更に複雑で、しかも絶えず変化している。中国の5種類の登録申請は薬品が国家薬品監督管理局の許可を得て、主要な薬品監督機関(例えばFDA或いはEMA)が発行した薬品証明書(CPP)を獲得した後にしか提出できない。私たちは、“改革方案”、2020年に改正された“薬品登録規定”と“化学薬物登録分類及び申請材料要求に関する通知”に基づいて、私たちの主導資産であるプリプリンは中国の1種類の薬物とみなされるだろう。プリプリンは中国あるいは国外で発売されたことがないからだ。本年度報告20−F表までの日付は,NMPAのCIN予防適応でプリブリンに対するセキュリティプロトコルが受け入れられ,1種類に指定されている。しかし、米国国家薬品監督管理局は、私たちのすべての候補製品に1種類の称号を授与しないかもしれないし、撤回される可能性があり、あるいはより速い開発や監督審査や承認過程を招くことがないかもしれない。カテゴリー1の指定も、規制部門の承認を受ける可能性を増加させることはできません。
2015年8月、国務院は“薬品と医療機器の審査プロセスの改革に関する意見”という声明を発表し、その中には医薬業界に有利になる可能性のある政策変化がいくつか含まれている
| ● |
革新薬物の審査手続きを加速し、満足されていない医療需要が比較的に高い領域に重点的に注目し、HIV、悪性腫瘍、深刻な伝染病と孤児疾患を治療する革新薬物;国家科学技術重大特別プロジェクトと国家重大研究開発計画が援助した薬物;中国現地で生産される革新薬物;児童薬品使用;先進調合技術、革新治療方法或いは明らかな臨床治療効果を有する薬物を採用する。 |
| ● |
会社がマーケティング許可保持者として機能し、契約製造組織を雇用して薬品を生産することを可能にする政策をとる計画である。 |
| ● |
臨床試験の審査を完備し、企業が国外と同時に臨床試験を行うことを許可し、国内の臨床試験機関が国際多センターの臨床試験に参与することを奨励する。 |
2015年11月、全人代常務委員会は“国務院がいくつかの地区で上場許可所持者制度の試験と関連問題を展開することを許可する決定”を発表し、国務院が北京、天津、河北、上海、江蘇、浙江、福建、山東、広東、四川などの地区で上場許可所持者制度の試験を展開することを許可し、そして国務院に薬品登録種別の改革を行うことを許可した。2018年10月、全人代常務委員会は“複数の地域で薬品上場許可証所持者制度の試験期間を延長することに関する決定”を発表し、試験期間を2018年11月4日から2019年11月4日に延期した。
2015年11月、中国食品薬品監督管理局は“薬品登録審査のいくつかの政策に関する通知”を発表し、臨床試験の審査プロセスを簡略化と加速する可能性のある以下の政策を更に明確にした
| ● |
新薬の臨床試験申請に対して、一度に一括審査手続きを採用し、一度に新薬の臨床試験を許可するすべての段階を許可し、現在の段階的な審査手続きではない。 |
| ● |
以下の申請に薬品迅速登録或いは臨床試験承認経路を提供する:(1)HIV、悪性腫瘍、深刻な伝染病と孤児疾患などの革新的な新薬登録の治療と予防;(2)小児科薬物登録;(3)老年薬物と老年中国流行病治療の薬物登録;(4)国家科学技術重大特別プロジェクトと国家重大研究開発計画が援助した薬物登録、(5)臨床、先進技術、革新的な治療方法或いは明らかな臨床効果を有する薬物登録;(6)中国現地で生産された外国革新薬物の登録出願;(7)米国、EUで承認された新薬臨床試験同時出願、または米国、EUで発売を申請し、現場検査に合格し、中国の同じ生産ラインで生産された薬品は同時に薬品登録を申請する;(8)臨床で必要かつ特許が満期3年以内の臨床試験出願、臨床緊急かつ特許満了1年以内の上場許可出願。 |
2017年12月、中国食品薬品監督管理局は“薬品の革新を奨励し、優先審査制度を実行することに関する意見”を発表し、さらにある臨床試験或いは薬品登録審査の過程を加速する可能性がある以下の政策を明らかにし、これらの政策は私たちに利益を与えるかもしれない
| ● |
以下の臨床効果が明らかな薬品登録申請に対して、薬品迅速登録或いは臨床試験承認経路を採用することができる:(1)中国内外で販売されていない革新薬物登録;(2)中国製の革新薬物登録を譲渡する;(3)先進技術、革新治療方法或いは明らかな臨床治療優勢を有する薬物登録を採用する;(4)特許満期3年以内の臨床試験申請、1年以内の特許満期の上場許可申請;(5)米国、EUで承認された新薬臨床試験の同時申請、または米国、EUで発売許可を申請し、現場検査を通過し、中国の同じ生産ラインで生産された薬品は同時に薬品登録を申請する;(六)重大な疾病の予防と治療の地位が明確な漢方薬(民族薬を含む)。(七)国家科学技術重大プロジェクト、国家重大研究開発計画が援助した新薬登録と国家臨床医学研究センター管理部門が認可した臨床試験薬品登録。 |
| ● |
薬品登録審査の迅速な通路は薬品登録申請に用いることができ、以下の疾病の予防と治療に対して独特な臨床利益がある:HIV、肺結核、ウイルス性肝炎、孤児疾患、悪性腫瘍、小児科疾患と老年病。 |
2016年3月、元中国食品薬品監督管理局は上述したような改革方案を発表し、化学薬物応用の再分類について概説した。新しい分類の下で、中国内外の許可を得ず、中国で生産しようとしている革新薬物は依然として第1種類であるが、中国以外で中国で発売許可を求めることを許可した薬物は現在5種類目である。国家薬品監督管理局は2020年6月に“化学薬品登録分類と申請材料要求に関する通知”(2020年7月発効)を発表し、改革案が提出した化学薬品分類原則を再確認し、第5類の分類を比較的に小さく調整した。このような規則によると、5.1類は革新化学薬と改善された化学新薬であり、5.2類は模倣化学薬品である。これらの製品はすでに海外で発売されなければならないが、中国ではまだ承認されていない。
2016年5月、国務院弁公庁は“薬品上場授権者制度の試験展開に関する通知”、即ち41号通知を発行し、薬品上場授権者制度がついに実施されたことを示している。第41号通知は北京、天津、河北、上海、江蘇、浙江、福建、山東、広東、四川などの地区の薬品研究開発機構と研究専門家が薬品登録申請者を務め、薬品臨床試験と薬品発売申請を提出することを許可した。41号通知発効日後に新たに登録された薬品については,出願人が薬品臨床試験又は薬品上場申請を提出すると同時に薬品発売許可所持者となる出願を提出することを許可する。2016年7月、中国食品薬品監督管理局は“薬品上場許可所持者制度の試験事業の展開に関する通知”を発表し、第41号通知に規定された申請手続きをさらに規定した。2017年8月、中国食品薬品監督管理局は“薬品発売許可所持者制度試験の推進に関する事項に関する通知”を通達した。薬品発売許可所持者制度の試験を推進し、薬品発売許可所持者の権利と義務を明確にし、薬品生産過程の品質管理システムを健全化し、薬品生産経営サプライチェーン責任制を健全化するため、特に本通知を発表した。2018年10月、全人代常務委員会は“複数の地域で薬品上場許可所持者制度の試験期間を延長することに関する決定”を発表し、試験期間を2018年11月4日から2019年11月4日まで延長した。
2019年12月1日、新たに改正された“中華人民共和国薬品管理法”が正式に施行され、薬品上場授権者制度が全国範囲で正式に実施されたことを示している。“中華人民共和国薬品管理法”によると、企業と薬品研究開発機構を上場授権者として、薬品生産企業を招聘して薬品を生産することを許可する。また、薬品の発売許可保持者は薬品の品質保証システムを構築し、薬品の非臨床研究、臨床試験、薬品の生産経営、発売後の研究及び薬品の不良反応のモニタリング、報告と処理などの仕事を担当すべきであると規定した。
また、中国薬品管理法は、薬品登録審査過程において、早急に必要な臨床薬物と重大な伝染病、孤児疾患などの疾病の予防と治療のための新薬を優先すべきであると規定している。
2020年1月22日、国家市場監督管理総局は改訂後の“薬品登録管理規定”を発表し、2020年7月1日から施行した。新しく改訂された“薬品登録規定”によると、以下の重大な臨床価値を有する薬品は優先的に薬品の発売審査手続きを享受することができる:(1)臨床で必要な薬品と革新薬品及び重大な伝染病と孤児疾病を予防·治療するために開発した改良新薬;(2)児童の生理特徴に符合する児童薬品の新品種、剤形と規格;(3)疾病予防制御に必要なワクチンと革新ワクチン;(4)突破的治療薬品使用過程中の薬品;(5)条件審査要求に符合する薬品;(6)国家薬品監督管理局が更に規定したその他の情況。薬品登録申請者は国家薬品監督管理局に確認した後、薬品発売申請を提出すると同時に薬品優先審査申請を提出することができる。薬品発売許可優先プログラムを享受する薬品申請に対して、薬品発売審査期限は130営業日と規定した。2020年7月7日、国家薬品監督管理局は“薬品上場証明書優先審査議定書(試行)”を発表し、優先審査の手続きと詳細条件を規定し、同時に“薬品革新の奨励に関する意見”に代わって、中国食品薬品監督管理局が優先審査制度を実行することを示唆した。
国家薬品監督管理局は更に臨床試験の審査許可高速車線と薬品登録経路に関する詳細な政策を発表し、“中華人民共和国薬品管理法”と“薬品登録規定”の実施を促進する可能性があり、著者らは国家薬品監督管理局の審査プロセスは時間の経過とともに絶えず完備されると予想している。また,この承認手続きがどのように実施されるかは国家環境保護局のさらなる実践が待たれており,現時点では不明である。したがって,プリブリンがこれらのプロジェクトに参加する資格があるかどうかは不明であり,あれば最終的にどのような利点を提供する可能性があるかは不明である。
開発、監督部門の候補製品に対する承認を得て、それを商業化する過程は長く、複雑で、コストが高く、アメリカと中国国内外でもそうであり、しかも承認されない可能性がある。私たちの候補製品が規制部門の承認に成功したとしても、どの承認も承認された適応の使用を大幅に制限するか、または製品ラベルに予防措置、禁忌または警告を含むことを要求するか、または高価で時間のかかる承認後の臨床研究、監視、または他の措置を承認条件として要求する可能性がある。我々の候補製品の任意の商業販売が承認された後、製造プロセス、ラベルまたは製品宣言の変化のような薬物のいくつかの変化は、FDA、NMPAおよびEMA、および同様の規制機関の追加的な審査および承認を必要とする可能性がある。しかも、私たちのどんな候補製品の規制承認も撤回される可能性がある。もし私たちが1つ以上の司法管轄区域で私たちの候補製品のために規制された承認を得ることができない場合、または任意の承認に重大な制限や条件が含まれていれば、私たちの目標市場は減少し、私たちの候補製品のすべての市場潜在力を達成する能力は損なわれるだろう。さらに、私たちは、私たちの候補製品または私たちが開発する可能性のある任意の未来の候補製品を開発し続けるために、十分な資金を得ることができないか、または十分な収入およびキャッシュフローを生成することができないかもしれない。
たとえ私たちのすべての候補製品が監督部門の許可を得ても、それらは医者、患者、第三者支払人と医学界の他の人が商業成功に必要な市場受容度を達成できないかもしれない。
もし私たちの任意の候補製品または私たちが開発した任意の未来の候補製品が監督部門の許可を得た場合、それはまだ医師、患者、第三者支払人、および医学界の他の人の十分な市場受容度を得ることができないかもしれない。例えば,現在の癌治療法,例えば化学療法や放射線治療,現在の好中球減少症治療は医学界で成熟しており,医師はこれらの治療法に依存し続け,我々の候補製品を除外する可能性がある。さらに、医者、患者、そして第三者支払人は私たちの製品ではなく、他の新製品をもっと好むかもしれない。もし私たちの候補製品が十分な受容度に達していなければ、顕著な製品販売収入が生じないかもしれませんし、利益を上げることができないかもしれません。もし私たちの候補製品が商業販売に使用されることが許可されれば、市場の受け入れ度は多くの要素に依存するだろう
| ● |
私たちの候補製品が承認された臨床適応 |
| ● |
医師、病院、癌治療センター、患者は私たちの製品候補は安全で有効な治療法であると考えている |
| ● |
代替療法に対する私たちの候補品の潜在的で知覚可能な利点 |
| ● |
副作用の流行率や重症度は |
| ● |
FDA、NMPA、EMA、または他の同様の規制機関の製品ラベルまたは製品挿入要件; |
| ● |
FDA、NMPA、EMA、または他の同様の規制機関によって承認されたタグに含まれる制限または警告; |
| ● |
私たちの候補製品と競争薬の発売タイミングは |
| ● |
代替治療およびその相対的収益に関連する費用を含む治療費用; |
| ● |
医師が私たちの候補品を管理するのに必要な前期コストや訓練金額 |
| ● |
第三者支払者と政府当局は十分な保険、補償、価格設定を提供する |
| ● |
第三者支払者や政府当局が保険や補償を受けていない場合、患者は自己負担を希望する |
| ● |
代替療法や競争療法と比較して、相手の便や管理が容易であること |
| ● |
私たちの販売とマーケティング努力の有効性。 |
もし私たちの候補製品が承認されたが、医師、患者、病院、癌治療センターあるいは医学界の他の人の市場認可を得ることができなければ、私たちは相当な収入を得ることができないだろう。たとえ私たちの薬物が市場で受け入れられても、私たちの薬物よりも人気があり、より安い精算を得て、より費用効果があり、あるいは私たちの薬物を時代遅れにする新製品や技術が発売されたら、私たちは時間の経過とともに市場受容度を維持することができないかもしれない。
私たちのどんな商業化努力も、第三者や内部との手配を通じて、販売、マーケティング、流通能力を発展させることを要求するだろう。もし私たちの候補製品をマーケティングして販売するために第三者と合意できない場合、あるいはマーケティングと販売能力を確立することができなければ、製品販売収入を生み出すことができないかもしれません。
私たちは現在内部販売、マーケティング、そして流通能力を持っていない。
中国では,恒瑞と大区中国で独占商業化と共同開発協定を締結し,プリブリンを商業化し,CINの予防と非小細胞肺癌の治療,および任意の追加適応を許可されれば。“プロジェクト4.会社情報--B.業務概要--商業化”を参照。プリブリンはすでにアメリカ国家薬品監督管理局に突破的治療の称号を授与された。また、プリブリンは2017年の国家科学技術重大プロジェクト中国の地位、すなわち2017年度の援助を獲得した。2017年の許可により、プリブリンは中国で国家薬物重点審査評価リストに登録された。“中華人民共和国国民経済と社会発展第13次五カ年計画綱要”あるいは“Republic of China第13次五カ年計画要綱”によると、政府は新薬の研究、開発と生産を奨励し、許可された新薬は優先的に国家保険制度に組み入れられる。薬物の承認と中国政府との成功した価格設定交渉を待つ前に、この地位はプリブリンを国家保険制度に組み入れるのに役立つ可能性があり、これは患者とのより迅速な接触と精算を可能にすると信じている。“中華人民共和国国民経済と社会発展第14次五年計画綱要”或いは“中華人民共和国国民経済と社会発展第十四次五年計画綱要”によると、政府は革新薬品、ワクチンと医療器械の加速審査メカニズムを完備し、孤児の疾病と臨床に必要な疾病を治療する薬品と医療器械の審査を強化し、海外で販売する臨床至急必要な新薬と医療器械の国内販売を促進する。しかし、プリブリンが中国で販売を承認されても、完全な商業化や国家保険制度下の精算への移行に成功することはできないかもしれない。私たちは価格設定を交渉した経験がなく、価格設定について合意できないかもしれない。
米国や世界の他の地域では、我々の候補製品の米国での規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価し、プリプリンを商業化し、CINを予防し、NSCLCを治療する。
私たちは他の製薬会社と協力計画を立てたり維持することができないかもしれません。私たちがそうすることができても、これらの製薬会社には有効なマーケティング能力や私たちの業務に必要な他の能力がないかもしれません。私たちが得たどんな収入もこのような第三者の努力にかかっていて、これは成功しないかもしれない。また、他の製薬会社と達成できる手配の性質により、彼らのマーケティングや販売活動にほとんど支配権がない可能性があり、私たちの製品販売収入は私たち自身が候補製品を商業化する収入よりも低いかもしれません。私たちは私たちの候補製品の販売とマーケティングを助けるために第三者を探している時も競争に直面しています。
プリプリンをマーケティングするために私たち自身の商業組織を設立するには、大量の資本支出、資源と時間を管理する必要があるだろう。私たちは他の製薬とバイオテクノロジー会社と競争して、採用、採用、研修、マーケティングと販売員を維持しなければならないだろう。
第三者製薬会社と関係を構築したり、関係を維持したりして、いかなる製品の商業化に成功したり、内部販売や商業流通能力を発展させることができなければ、製品販売収入を生み出すことができない可能性がある。
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも早く、あるいはより成功的に薬物を発見、開発、または商業化することにつながるかもしれない。
新薬の開発と商業化競争は激しい。私たちの現在の候補製品は競争に直面しており、将来的には開発や商業化を求める可能性のある任意の候補製品も、世界各地からの主要な製薬会社や専門製薬やバイオテクノロジー会社の競争に直面することになるだろう。現在,多くの大手製薬やバイオテクノロジー会社が薬物をマーケティング·販売しているか,あるいは癌治療用の薬剤を開発しており,これらの薬剤のために候補製品を開発している。“プロジェクト4.会社情報-B.業務概要--競争”を参照。これらの競合的薬物および療法のいくつかは、我々の方法と同じまたは類似した科学的方法に基づいており、他のいくつかは、全く異なる方法に基づいている。潜在的な競争相手はまた学術機構、政府機関とその他の公共と個人研究組織を含み、これらの組織は研究を展開し、特許保護を求め、研究、開発、製造と商業化のための協力手配を確立する。また,癌遺伝子タンパク質を分子接着技術でユビキチンリガーゼで標識してこれらのタンパク質を破壊しても,この技術を用いて癌遺伝子タンパク質を標的化·破壊することを検討している癌治療の代替方法が研究されている。“プロジェクト4.会社に関する情報−B.業務概要−その他計画”を参照
もし私たちの競争相手が私たちが開発する可能性のある任意の薬物よりも安全で、より効果的で、副作用が少ない、より便利で、より安価な薬物を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。私たちの競争相手はまた、FDA、NMPA、EMA、または他の同様の規制機関の薬物の承認を私たちよりも早く得ることができ、これは、私たちの競争相手が私たちが市場に参入したり、私たちの規制承認を遅らせることができる前に強力な市場地位を確立することをもたらすかもしれない。
私たちと比較して、私たちが競争しているか、あるいは将来競争する可能性のある多くの会社は、研究開発、製造、動物試験、臨床試験を行い、監督管理許可とマーケティング承認薬物を獲得する上で、より多くの財務資源と専門知識を持っている。製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。規模の小さい会社や他のスタートアップ会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配されている。これらの第三者は合格した科学と管理人員を募集と維持し、臨床試験場を構築し、患者を募集して臨床試験を行い、補充或いは必要な技術を獲得する上で著者らと競争を展開している。
私たちは承認された薬品候補製品が予想以上に早く競争に直面する可能性があることを求めるつもりだ。
機密協定の下で承認された薬品(中国の薬品を含む)は、私たちの候補製品のように、承認されれば、予想よりも早く模倣薬競争に直面する可能性がある。2012年に可決された“後発薬使用料改正案”と2012年の“食品·薬物管理局安全·革新法案”は、FDAの後発薬審査計画に数億ドルの資金をもたらす使用料計画を確立した。ユーザーの有料計画からの資金は、FDAと後発薬業界の交渉が達成した業績目標に加えて、FDAの審査と後発薬申請を承認する時間枠組みを大幅に短縮する可能性がある。
また、各司法管轄区域では時々立法と監督管理提案が出現し、模造薬の早期かつ迅速な承認を更に奨励する。例えば、FDAは2017年に、処方薬市場の完成率を増加させ、低コストの後発薬の参入を促進するための一連の提案を含む薬品競争行動計画を発表した。いずれかのそのような提案が法律または政府法規または他の規制行動によって実施されれば、いずれかが承認されれば、我々の製品候補製品の競争が増加する可能性がある。例えば、FDAは薬品競争行動計画に関する一連の指導的文書を発表した。
私たちの製品のために十分な精算範囲を得なければなりません。私たちの候補製品や私たちが開発する可能性のある任意の未来の候補製品を商業化することに成功します。
もし私たちの候補製品や私たちが開発する可能性のある未来の候補製品をマーケティングするために必要な承認を得たら、私たちはまだ政府と他の第三者支払人に補償医師と患者が私たちの製品を管理して使用することを申請する必要があります。新たに承認された医療薬は、それらがカバーされるかどうか、それらの清算レベルにかかわらず、大きな不確実性に直面している。政府や連邦医療保険を含む他の医療保険支払者は,カバー範囲の制限や精算レベルを制限することで医療コストを抑制しようとしている。私たちの候補製品や私たちが開発する可能性のある未来の候補製品が規制機関の承認を得ても、政府や他の第三者支払人は保証を拒否するかもしれないし、提供される可能性のある精算料率は、私たちが薬物を供給するコストを支払うのに十分ではないか、あるいは私たちが期待している薬物収入を提供することができないかもしれない。彼らはまた、薬を管理する医師に医者の費用を支払うのに十分ではないマーケティング率を設定したり、他の方法で処方を抑制する動力を提供したりすることもできる。1つの第三者支払者が補償を提供することを決定し、他の第三者支払者も補償を提供するか、または同じレベルの補償を提供することを保証することはできない。さらに、カバー範囲および精算料率が決定されると、それらは将来的に変更または撤回される可能性がある。もし政府や他の医療支払者が私たちの候補製品または私たちが開発する可能性のある任意の未来の候補製品に十分な補償レベルを提供できなければ、彼らの市場受容度を低下させ、私たちの成長を制限し、私たちの収入と運営結果に影響を与える可能性がある。また、保険の確立や精算の遅れは、私たちの候補製品の商業化を延期し、私たちの成長、経営業績、財務状況に悪影響を及ぼすだろう。
多くの国では、中国と多くのヨーロッパ諸国を含め、価格は現地で規制されている。これらの管轄区域では、製品の上場承認を受けた後、政府当局と価格交渉を行うのにかなりの時間がかかる可能性がある。したがって、特定の国で薬品の規制承認を得ることができるかもしれませんが、価格規制の制約を受けて、これらの規制は、私たちの薬物商業発売を延期または阻止し、その国/地域からその薬剤を販売することができる収入(あれば)に悪影響を与えることができます。直接および間接価格制御の存在および私たちの候補製品への圧力は、私たちの財務見通しと業績に実質的な悪影響を及ぼす可能性があります。
最近公布された立法と将来の立法は、私たちが規制部門の承認を得て、私たちの候補製品を商業化する難しさとコストを増加させ、私たちが得る可能性のある価格に影響を与えるかもしれない。
中国、アメリカ、EU、その他のいくつかの司法管轄区では、医療システムに関する立法と監督管理の面でいくつかの変化が発生し、いくつかの変化を提出し、これらの変化は私たちの候補製品の規制承認を阻止または延期し、承認後の活動を制限または規範化し、規制承認を得た候補製品を収益的に販売する能力に影響を与える可能性がある。
2010年3月、オバマ前総裁は“患者保護·平価医療法案”、2010年の“医療·教育和解法案”、あるいは“平価医療法案”に署名し、医療保険の許容性を拡大し、医療支出の増加を減少または制限し、詐欺や乱用に対する救済措置を強化し、医療·医療保険業界の新たな透明性要求を増加させ、医療業界に新たな税費を徴収し、追加的な医療政策改革を実施することを目的とした包括的な法律である。
“平価医療法案”の条項の中で、私たちの潜在的な候補製品に重要な条項は以下の通りです
| ● |
指定されたブランド処方薬を製造または輸入する任意の実体に対して徴収される控除不可能な年会費; |
| ● |
医療補助薬品リベート計画によると、メーカーが支払わなければならない法定最低リベートを高める |
| ● |
“虚偽申告法”や“反リベート法令”、新たな政府調査権力、違反行為への懲罰の強化など、医療詐欺や法の乱用を拡大する |
| ● |
連邦医療保険D部分はノッチ割引計画をカバーし、メーカーは価格交渉に基づいて50%の販売時点割引を提供することに同意しなければならない |
| ● |
メーカーの医療補助税還付責任を延長する |
| ● |
医療補助計画の資格基準を拡大する |
| ● |
“公衆衛生サービス法”薬品定価方案に基づいて割引を受ける資格のある実体を拡大する |
| ● |
医師や教育病院の財務報告を求めています |
| ● |
製造業者および流通業者が医師に提供する薬品サンプルを毎年報告することを要求する |
| ● |
患者を中心とした結果研究所が,優先事項の監督·決定を担当し,臨床有効性比較研究を行い,そのような研究に資金を提供している。 |
また、“平価医療法案”が公布されて以来、米国では他の立法改正も提出され、可決された。例えば、2018年に両党予算法などは、ほとんどの連邦医療保険薬物計画におけるカバーギャップを埋めるために、2019年1月1日に施行される“平価医療法案”を改正し、2019年から医薬品メーカーが処方薬コストを割引しなければならない割合を現行法の50%から70%に引き上げなければならない。
“平価医療法案”や将来講じられる可能性のある他の医療改革措置は,より厳しいカバー基準を招き,承認された任意の薬物の価格に追加的な下振れ圧力をもたらす可能性が予想される。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの薬物の商業化を阻止するかもしれない。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。“平価医療法案”のいくつかの条項はまだ十分に実施されていないが、いくつかの条項は司法と国会の挑戦を受けている。例えば、米議会やトランプ前総裁は、“平価医療法案”の全部または一部の廃止や改正に多くの努力をしている。2017年5月、米国衆議院は“2017年米国医療法案”(American Health Care Act of 2017、略称AHCA)を可決し、この法案は“平価医療法案”の多くの条項を廃止する。参議院はAHCAや同様の措置を検討しているが,可決されなかったが,国会は平価医療法案の内容を廃止または代替するためにさらなる立法を検討する可能性がある。また、トランプ前総裁は2017年12月に法律となった税改正法案、すなわち減税と雇用法案に署名し、平価医療法案の個人医療保険認可を廃止したことが、平価医療法案の重要な構成要素とされている。そのため、“平価医療法案”やその内容に代わるいかなる法律の廃止、改正、あるいは私たちの業務への全面的な影響はまだ不明である。承認後の要求を拡大し、医薬品の販売や販売促進活動を制限するための立法·規制提案がなされている。私たちは、より多くの立法変化が公布されるかどうか、総裁·バイデンが他の計画を提出するかどうか、FDAの法規、指導、解釈が変わるかどうか、あるいはこれらの変化が私たちの候補製品の規制承認にどのような影響を与えるかもしれない(もしあれば)。また、米国議会のFDA承認過程に対するより厳格な審査は、規制承認を著しく延期または阻止する可能性があり、より厳しい製品ラベルと上場後のテストとその他の要求の影響を受ける可能性がある。米国では、公衆や政府も、米国上院および連邦·州検事の審査を含む薬品コストと薬品価格戦略の審査を強化している。米国議会と多くの州の立法機関は立法を考慮しており、これらの立法は薬品製造業者がその製品の価格を徴収することを許可されているか、あるいは薬品の価格設定のやり方の透明性の向上を要求する可能性がある。また、2018年5月、前総裁·トランプ氏は“トランプ政権の薬品価格の引き下げと現金コスト削減の青写真”、すなわち“青写真”を発表した。その中のいくつかの措置および他の提案された措置は追加の立法許可によって発効する必要があるが、国会とバイデン政府は薬品コストを制御するために新しい立法および/または行政措置を求め続けると表明した。例えば、バイデン政府の処方薬価格設定計画は衆議院で可決された“再建より良い法案”の一部であり、連邦医療保険が連邦医療保険B部分とD部分である高コスト処方薬の価格を交渉することを許可し、連邦医療保険との価格交渉を拒否する製薬業者に消費税を徴収し、連邦医療保険と個人保険の年間薬品価格の上昇を制限し、連邦医療保険D部分の公式を再設計するためのインフレリベートを要求することを目的としている。青写真中のいくつかの提案、及び青写真以来提出された関連薬品の価格設定措置は、製薬業の運営と精算に重大な変化を招く可能性がある。これらまたは他の変化のいずれかが実施されるかどうかはわかりません。もしそうであれば、もしそれらがアメリカで承認されれば、私たちの候補製品に受け取ることができる価格に影響を与えるかどうかはわかりません。
私たちは、適用される米国連邦および州逆控除法、虚偽申告法、医師支払い透明性法、詐欺および乱用法、または同様の医療および安全法律法規の制約を直接または間接的に受ける可能性があり、これは、私たちを刑事制裁、民事処罰、契約損害、名声被害、および利益および将来の収入の減少に直面させる可能性がある。
医療提供者、医師、そして他の人たちは、私たちが規制の承認を得た任意の製品の推薦と処方で主な役割を果たすだろう。もし私たちの候補製品がFDAの承認を得て、アメリカでこれらの薬物を商業化し始めたら、私たちの業務は連邦反リベート法規、連邦虚偽クレーム法案、医師支払い日光、その他の開示法律を含む様々な連邦と州詐欺と乱用法律の制約を受ける可能性があります。これらの法律は私たちの潜在的な販売、マーケティング、患者援助、教育計画などに影響を及ぼすかもしれない。また、私たちは連邦政府と私たちが業務を展開している州のデータプライバシーと安全規制によって制限されるかもしれない。私たちの運営能力に影響を与える可能性のある法律には
| ● |
他の事項に加えて、現金または実物を直接または間接的に、公開的または間接的に現金または実物で直接または間接的に要求し、受信し、提供し、提供するか、または任意の報酬(任意のリベート、賄賂またはリベートを含む)を支払い、誘導または交換として、個人を紹介するか、または購入、レンタル、注文または推薦することを禁止し、連邦医療保険および医療補助計画のような連邦医療保険および医療補助計画に従って支払い可能な任意の商品、施設、物品またはサービスを提供すること; |
| ● |
“虚偽清算法”を含む連邦民事および刑事虚偽申告法および民事金銭罰法は、民事告発者または法定訴訟によって行われ、連邦医療保険、医療補助または他の第三者支払人の支払いまたは承認を故意にまたは連邦政府に提出することを招く虚偽または詐欺的クレーム、または虚偽陳述によって連邦政府に資金を支払う義務を回避、減少または隠蔽する個人または実体に刑事および民事処罰を加えることができる“虚偽清算法”を含む |
| ● |
連邦刑法は、1996年の“健康保険転移性および責任法案”またはHIPAAによって制定され、支払人(例えば、公共または個人)にかかわらず、支払人(例えば、公共または個人)にかかわらず、支払者(例えば、公共または個人)にかかわらず、故意に、または医療福祉の交付または支払いに関連する重要な事実を故意に偽造、隠蔽または隠蔽し、または任意の重大な虚偽陳述を行うことを禁止し、故意に、または詐欺の任意の医療福祉計画の計画を実行または実行しようとする。医療に関連するプロジェクトやサービス |
| ● |
HIPAAは、2009年の“健康情報技術促進経済および臨床健康法”およびそれらのそれぞれの実施条例改正を経て、特定のカバーされた医療保健提供者、健康計画および医療情報交換所およびそれらのそれぞれの業務パートナーに要求を提出し、これらのサービスは、個人識別可能な健康情報の使用または開示に関し、個人識別可能な健康情報のプライバシー、安全および送信に関するものである |
| ● |
連邦医療保険、医療補助または児童健康保険計画に基づいて支払われる医薬品、生物製品、設備および医療用品の製造業者が、医師および教育病院への支払いおよび他の価値移転に関する情報、ならびに医師およびその直系親族が所有する所有権および投資権益を毎年米国の衛生公衆サービス部に報告することを要求する、一般的に医師支払い陽光法案と呼ばれる平価医療法案条項を含む、連邦透明性要件 |
| ● |
連邦消費者保護·不正競争法は、市場活動や消費者を損なう可能性のある活動を広く規制している。 |
これらの法律および同様の法律は改正または再解釈される可能性があり、実施条例は私たちの業務に大きな影響を与える可能性がある方法で修正または再解釈される可能性がある。例えば、元トランプ政権は2020年末にいくつかの反リベート法規の安全港の改正を含む最終規則を発表したが、これらの規則の実施は、2021年1月に発表された規制凍結とこれらの規則に挑戦する訴訟の影響を受け続ける可能性がある。さらに、他に加えて、私たちは、上記の各医療保険法の州および非米国等価物によって制約される可能性があり、いくつかの法律の範囲は、より広いまたは異なる可能性があり、任意の支払人に適用される可能性がある。アメリカの多くの州は連邦反リベート法規のような法律を通過しており、その中のいくつかの法律は転換患者が任意の出所で精算された医療サービスを受けるのに適しており、政府支払人だけでなく、個人保険会社を含む。また、いくつかの州は、製薬会社に、2003年4月の総監察長室の製薬メーカーに関するコンプライアンス計画ガイドラインおよび/または米国の製薬研究および製造業者の医療専門家との相互作用に関するガイドラインを遵守することを求めている。いくつかの州ではまた、他のマーケティング制限を実施したり、製薬会社にその州へのマーケティングまたは価格開示を要求したりしており、一部の州では独自のデータプライバシーおよびセキュリティ対策が採択されている。このような州の要求を守るために何が必要なのかは曖昧であり、もし私たちが適用された州の法律要求を守らなければ、私たちは罰や他の結果を受けるかもしれない。
これらの法律の範囲が広く、法定例外状況と選択可能な避難港が限られていることから、私たちの将来のいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。しかも、最近の医療改革法案はこのような法律を強化した。例えば、“平価医療法案”は他に加えて、連邦反リベート法規や刑事医療詐欺法規の意図要求を改正した。このような修正の結果として,個人や実体は,これらの法規やこれらの法規に違反する具体的な意図を実際に知る必要がなくなり,違反行為を実施することができる.また,“平価医療法”では,“虚偽申告法”については,連邦“反リベート条例”違反による物品やサービスを含むクレームが虚偽や詐欺的クレームを構成することが規定されている。
詐欺や法律に違反した行為は、連邦医療保険や医療補助のような連邦および州医療計画の罰則、罰金または排除または一時停止、米国政府との契約の禁止など、刑事または民事制裁を受ける可能性がある。また、連邦“虚偽申告法”やいくつかの州の虚偽申告法によると、個人は米国政府を代表して訴訟を起こす権利がある。
私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。政府当局は、私たちの業務やり方が現在または未来に適合していないと結論するかもしれないが、詐欺および乱用または他の医療保健法律および法規の適用に関する現行または未来の法規、法規または判例法に関連している。もし私たちにこのような訴訟を提起した場合、私たちは私たちの権利を弁護したり、維持することに成功しませんでした。これらの訴訟は、民事、刑事および行政処罰、損害賠償、返還、罰金、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、契約損害、名声損害、利益減少、および将来の収益減少、および私たちの業務を削減することを含むかもしれません。これらは、私たちの業務運営能力および運営結果に悪影響を及ぼす可能性があります。また,我々の任意の候補製品の米国国外での承認と商業化は,上記の医療保健法や他の非米国法の非米国等価物の制約を受ける可能性もある。
もし私たちがそれと業務往来があることを期待している任意の医師または他の提供者または実体が適用されない法律に適合していないことが発見された場合、彼らは政府の援助された医療計画から除外されることを含む刑事、民事または行政制裁を受ける可能性がある。これは私たちの業務運営能力と運営結果に悪影響を及ぼすかもしれない。
私たちの知的財産権に関するリスクは
私たちの知的財産権の組み合わせの一部は現在、ライセンス特許として発表されていない未解決の特許出願を含み、もし私たちの係属中の特許出願が発表されなかった場合、私たちの業務は悪影響を受けるだろう。もし私たちの技術や薬物のために特許保護を得ることができなければ、私たちの競争相手は私たちと類似または同じ技術や薬物を開発し、商業化する可能性があり、私たちの技術と薬物を商業化することに成功する能力は不利な影響を受ける可能性がある。
私たちの成功は、私たちが米国、中国、他の国で私たちの独自技術および候補製品の特許保護を獲得し、維持する能力に大きく依存する。2022年3月21日現在、我々は、プリブリンおよびプリブリン類似体に対する19件の米国特許を有しており、それらの合成および肺癌を含む様々な疾患の治療におけるそれらの使用。また、日本、韓国、中国、ヨーロッパなど39カ国·地域で輸出特許のライセンスを取得した。これらの米国特許は2023年から2037年の間に満期になる予定であり、特許期間の回復は含まれていない。我々は14のファミリーの特許出願が出願されており、これらの特許は、好中球減少の低減のためのプリブリン、RAS変異腫瘍および脳腫瘍の治療のためのプリブリン、プリブリンの様々な形態、プリブリンと検査点阻害剤との併用、プリブリンの免疫治療に関連する有害事象の低減、プリブリンの微小管結合化合物の治療、プリブリンの投与レジメン、血小板減少の治療、プリプリンとG−CSF併用治療、プリブリンの上皮増殖因子受容体の治療、またはEGFR、変異型腫瘍、および免疫反応の刺激におけるプリブリンの使用に関する。もしこのような申請が本当に発行された場合、それらの名義は2033年から2039年の間に満了するだろう。われわれには,プリブリンによる鉄障害の治療には,プリブリンを用いた免疫チェックポイント阻害剤やファルニキピロリン酸合成酵素(FPPS)との併用,プリブリンと抗CD 47薬の併用による癌治療のための未解決の特許協力条約,PCTの3つがある。これらのPCT出願に優先することを要求する出願が発行された場合、それらの名義は2040年から2041年の間に満了する。
いくつかの管轄区域(例えば、米国およびヨーロッパ)で発行された特許については、このような特許期限延長を取得する適用要件を満たす限り、特許期限延長を取得して特許期限日を延長する権利がある可能性がある。我々の特許地位を保護するために,米国で特許出願を提出し,PCTを介して我々の業務に重要であると考えられる新技術や候補製品に関する特許出願を提出した。この過程は非常に時間がかかり、私たちはすべての必要または望ましい特許出願をタイムリーに提出して起訴することができないかもしれない。我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.
私たちが待っている特許出願は、このような出願を待っている米国または非米国の管轄地域で特許を発行しないかもしれない。これらの出願のいずれかが確実に特許を発行しても、第三者はその有効性に疑問を提起する可能性がある。さらに、私たちは、第三者が私たちの候補製品との競争に成功することを阻止するために、これらの特許で十分な特許請求範囲を得ることができないかもしれない。私たちの特許出願が特許の形で発表されても、それらの発表形態は私たちに何の意味のある保護を提供してくれず、競争相手が私たちと競争することを阻止したり、他の方法で私たちにどんな競争優位性を提供してくれたりしないだろう。私たちの競争相手は、類似または代替技術または候補製品を非侵害的に開発することによって、私たちの特許を迂回することができるかもしれない。特許の発行はその範囲、有効性、または実行可能性に対して決定的ではなく、私たちの特許は米国と海外の裁判所または特許庁で挑戦される可能性がある。このような挑戦は、特許主張の縮小、無効、または実行不能をもたらす可能性があり、これは、類似または同じ候補技術および製品の使用を阻止または阻止する能力、またはそれを商業化する能力を制限するか、または我々の技術および候補製品の特許保護期間を制限する可能性がある。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちの特許の組み合わせは、他の会社が私たちと似ているか同じ候補製品を商業化することを排除するために、私たちに十分な権利を提供していないかもしれない。
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
世界各地で候補製品を申請、起訴、維持、保護する特許は、私たちにとって目を引くほど高価かもしれないし、いくつかの非米国国の知的財産権は米国とは異なる範囲と実力を持っている可能性がある。また、いくつかの非米国国の法律は知的財産権の保護程度は米国連邦や州法よりも劣る。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または非米国の管轄地域で私たちの発明を使用して製造された薬品を販売したり、輸入したりすることを阻止できないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区で私たちの技術を使用して彼ら自身の薬物を開発し、さらに他の侵害薬物を私たちが特許保護を持っているが執行権はアメリカの司法管轄区の他の管轄区に輸出することができます。これらの薬物は私たちの候補製品と競争する可能性があり、私たちの特許権や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
ある司法管轄区域では、多くの会社が知的財産権の保護と保護に重大な問題に直面している。一部の国の法律制度は特許、商業秘密、および他の知的財産権の実行を支持しておらず、これは私たちがこれらの管轄区域で私たちの特許や他の知的財産権の侵害を阻止したり、流用したり、私たちの専有権を侵害する方法で競争薬を販売することを困難にするかもしれない。非米国の管轄地域で私たちの特許や他の知的財産権を強制的に執行する訴訟は、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面に移す可能性がある。
また、このような訴訟は、私たちの特許が無効と発表され、強制執行できない、または狭義に解釈できないリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちに侵害または流用クレームを引き起こす可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが開発した知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。
私たちは私たちの知的財産権を保護したり実行したりする訴訟に巻き込まれるかもしれないが、これは高価で時間がかかり、成功しないかもしれない。もし法廷またはUSPTOなどの非米国当局の前で挑戦された場合、私たちの候補製品に関連する特許権は無効または実行不可能と認定される可能性がある。
競争相手は私たちの特許権を侵害したり、流用したり、他の方法で私たちの知的財産権を侵害したりする可能性がある。侵害または不正使用に対抗するためには、将来的には、私たちの知的財産権を強制または保護し、私たちの商業秘密を保護し、または私たち自身の知的財産権または他の人の独自の権利の有効性と範囲を決定するために、訴訟を提起する必要があるかもしれない。これは高くて時間がかかるかもしれない。私たちは侵害者からの任意のクレームに対しても、私たちが彼らの知的財産権を侵害していると主張するように、これらの当事者に反クレームを促す可能性があります。私たちと潜在的な多くの競争相手は、彼らの知的財産権を実行および/または保護するために、私たちよりも多くの資源を投入する能力を持っている。したがって、私たちは努力したにもかかわらず、私たちは第三者が私たちの知的財産権を侵害したり流用したりすることを防ぐことができないかもしれない。訴訟は巨額のコストと管理資源の移転を招く可能性があり、これは私たちの業務や財務業績を損なう可能性がある。さらに、侵害訴訟では、裁判所は、私たちが所有している特許権または他の知的財産権が無効であるか、または強制的に実行できないと判断することができ、または、我々の特許権または他の知的財産権が関連する技術をカバーしていないことを理由に、他方の関連技術の使用を阻止することを拒否することができる。任意の訴訟手続きにおける不利な結果は、私たちの特許と、将来私たちの係属中の特許出願から発行される可能性のある任意の特許が無効にされるか、強制的に実行できないか、または狭い解釈される可能性があるリスクに直面する可能性がある。さらに、知的財産権訴訟は大量の開示を必要とするため、私たちのいくつかの機密情報はこのような訴訟中に開示によって漏洩する可能性がある。
もし私たちが第三者に対して私たちの特許を強制的に執行するために法的訴訟を提起した場合、または将来私たちの特許出願から発行される可能性のある候補製品に関連する任意の特許があれば、被告はそのような特許権が無効であるか、または強制的に実行できないと反訴することができる。米国の特許訴訟では、被告が特許を無効または強制執行できないと主張する反訴が一般的であり、第三者は様々な理由に基づいて特許が無効または強制執行できないと断言することができる。第三者も米国や海外の行政機関に類似したクレームを出すことができ、訴訟範囲外でも同様である。このようなメカニズムには、一方的な再審、当事者間の審査、付与後の審査、派生と非米国司法管轄区における同等の手続き、例えば反対手続きが含まれている。このような訴訟は、私たちの候補製品をカバーして保護しないように、私たちの特許が撤回または修正される可能性がある。例えば、私たちの特許の有効性については、私たち、私たちの特許弁護士、および特許審査員が起訴中に意識していない無効な以前の技術が存在する可能性がある。もし被告が無効および/または強制執行できない法的主張に勝った場合、私たちは私たちの候補製品の少なくとも一部またはすべての特許保護を失うだろう。このような特許保護の喪失は私たちの業務に実質的な悪影響を及ぼすかもしれない。
私たちは、特に法律が米国のようにこれらの権利を十分に保護していないかもしれない国では、私たちの商業秘密や機密情報が盗用されることを防ぐことができないかもしれない。また、知的財産権訴訟に関連する大量の発見により、私たちのいくつかの機密情報は、このような訴訟中に開示によって漏洩する可能性がある。
私たちは私たちの特許と他の知的財産権発明権のクレームに疑問を受けるかもしれない。
私たちは現在、私たちの特許の発明権や私たちの知的財産権の所有権に疑問を提起するクレームに遭遇していませんが、私たちは将来、元従業員、協力者、または他の第三者が発明者または共同発明者として私たちの特許または他の知的財産権において権利を持っているというクレームを受ける可能性があります。例えば、私たちの候補製品開発に参加するコンサルタントや他の人の義務衝突によって在庫紛争が生じる可能性があります。訴訟はこれらと他の挑戦在庫のクレームに対抗するために必要かもしれない。もし私たちがこのようなクレームを弁護できなかった場合、金銭損害賠償の支払いに加えて、私たちの特許権や他の知的財産権の独占所有権や使用権などの権利を失う可能性があります。このような結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
もし私たちが第三者の知的財産権侵害を起訴されれば、このような訴訟は費用が高く時間がかかり、私たちの候補製品の開発や商業化を阻止または延期する可能性がある。
私たちのビジネス成功は私たちが第三者の特許や他の知的財産権の侵害を避けることにある程度かかっている。バイオテクノロジーと製薬産業では、特許と他の知的財産権に関する多くの訴訟がある。我々が候補製品を開発する分野には,第三者が所有する発行済み特許や未解決特許出願が多く存在する.バイオテクノロジーや製薬業界の拡張や特許の発行に伴い,我々の候補製品は他人の特許権侵害のクレームを引き起こすリスクが増加する可能性がある。
第三者は私たちが許可されていない状況で彼らのノウハウを使用していると主張するかもしれない。我々が現在知らない第三者特許、すなわち、私たちの候補製品の使用または製造に関連する材料、製剤、製造方法、または治療方法の請求項が存在する可能性がある。特許出願が発行されるまでに数年かかる可能性があるため、現在処理されている特許出願が存在する可能性があり、これらの出願は、我々の候補製品が発行された特許を侵害する可能性がある。さらに、第三者は将来的に特許を取得し、私たちの技術を使ってこれらの特許を侵害したと主張するかもしれない。管轄権のある裁判所が、私たちの任意の候補製品の製造プロセス、製造過程で形成された任意の分子または任意の最終薬物自体をカバーするために、任意の第三者特許を所有している場合、そのような特許の所有者は、適用特許に基づいて許可を得るか、またはそのような特許が満了するまで、最終的に無効または実行不可能であると判断されない限り、その候補製品を商業化することを阻止することができるかもしれない。同様に、管轄権のある裁判所が任意の第三者特許を有し、共同療法または患者が方法を選択することを含む、私たちの処方、製造プロセス、または使用方法の様々な態様をカバーする場合、任意の特許の所有者は、許可を得ること、使用を制限すること、またはその特許が満了するまで、または最終的に無効または実行不可能であると判断されない限り、適用可能な候補製品を開発し、それを商業化する能力を阻止することができるかもしれない。上記のいずれの場合も、このような許可は、商業的に合理的な条項では得られないか、または全く得られない可能性がある。
私たちの知的財産権を侵害して私たちに訴訟を起こした第三者は禁止または他の衡平法の救済を受ける可能性があり、これは私たちの1つ以上の候補製品の開発と商業化を阻止するかもしれない。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、当社の業務における従業員資源を大量に移転することになる。私たちの侵害または流用クレームが成功した場合、故意の侵害の場合の3倍の損害賠償と弁護士費を含め、第三者から1つ以上のライセンスを取得し、印税を支払うか、または私たちの侵害候補製品を再設計することが不可能であるか、または大量の時間とお金の支出を必要とする可能性があるかもしれない。このような訴訟のいずれかで不利な結果が生じた場合、訴訟なしでさえ、第三者からライセンスを取得して、私たちの研究を進めたり、候補製品の商業化を許可したりする必要があるかもしれません。必要なライセンスは全く取得できないかもしれないし、商業的に合理的な条項では得られないかもしれない。もし私たちがそのような許可を得ることができなければ、私たちは私たちの1つ以上の候補製品をさらに開発して商業化することができず、これは私たちの業務を深刻に損なう可能性がある。特許侵害請求を解決するために、または訴訟前に紛争を解決するために、ライセンス契約を締結することを選択することもできます。このようなライセンス契約は、印税や他の費用の支払いを要求する可能性があり、これは、私たちの業務を深刻に損なう可能性があります。
解決策が私たちに有利であっても、知的財産権クレームに関連する訴訟や他の法的手続きは、巨額の費用を発生させる可能性があり、私たちの技術者および/または管理者の正常な責任を分散させる可能性があります。さらに、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果を公開発表する可能性があり、証券アナリストや投資家がこれらの結果がマイナスであると考える場合、私たち普通株の市場価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や法的手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源を持っているので、私たちよりもこのような訴訟や訴訟の費用を効率的に負担するかもしれない。特許訴訟または他の訴訟の開始と継続によって生じる不確実性は、市場での競争能力に重大な悪影響を及ぼす可能性がある。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
発行された特許の定期維持費は,特許有効期間内にいくつかの段階で米国特許商標局および他の特許機関に支払われなければならない。米国特許商標局および様々な非政府特許機関は、特許出願中にいくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。多くの場合、適用される規則に基づいて、滞納金を支払うことによって、または他の方法で失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効を招き、関連法ドメインの特許権の一部または全部を喪失させる可能性がある。特許または特許出願の放棄または失効をもたらす可能性のある不正事件には、規定された期限内に公式行動に対応できなかったこと、費用が支払われていなかったこと、および適切に合法化され、正式な文書が提出されなかったことが含まれる。この場合、私たちの競争相手が市場に参入する可能性があり、これは私たちの業務に実質的な悪影響を及ぼすだろう。
私たちの特許条項は私たちの候補製品と業務を効果的に保護するのに十分ではないかもしれない。
私たちが出願したほとんどの国/地域では、米国を含め、発行された特許の有効期間は、一般に、適用国/地域非臨時特許出願の最初の出願日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品が特許を取得しても、薬物の特許有効期限が満了すると、他社からの競争や後発薬の競争に直面する可能性がある。プリンブリン物質組成物、その合成および使用を付与する米国特許計画は、潜在的な特許期間回復を含まず、2023年から2037年の間に満了する予定である。私たちが発行した特許または私たちの未解決特許出願で発行される可能性のある特許が満了した後、潜在的な競争相手にこのような特許権を主張することができなくなり、私たちの業務および運営結果は不利な影響を受ける可能性があります。
もし私たちがハッジ·ワックスマン修正案や他の国/地域のような立法によって追加的な保護を受けなければ、私たちの候補製品に関連する特許の期限を延長すれば、私たちの業務は実質的な損害を受ける可能性がある。
我々の候補製品に対するFDAの規制承認の時間、期限、および詳細によれば、私たちの1つ以上の米国特許が発行されれば、1984年の“薬品価格競争および特許期限回復法”(Hatch-Waxman修正案と略称する)に従って限られた特許期間を回復する資格がある可能性がある。ハッジ·ワックスマン改正案は、薬物開発やFDA規制審査の過程で失われた特許期間の補償として、特許期間を最大5年間延長することを許可している。しかし,特許期間の延長は特許の残存期間を延長することができず,FDAが薬物を承認した日から合計14年を超えることはできず,特定の薬物は1つの特許しか延長できない。
特許期間の延長出願は,米国特許商標局とFDAの承認を得る必要がある。適用の最終期限内に出願を提出できなかったこと,関連特許が満了する前に出願を提出できなかったことや適用の要求を満たしていなかったことなどにより延期が得られなかった可能性がある。しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特定の特許を得ることができない特許期間が延長されていない場合、あるいはどのような延長の期間が私たちが要求しているのよりも短い場合、私たちが私たちの薬物を独占的に販売する権利がある期間は短縮され、私たちの競争相手は競争薬の承認をより早く受ける可能性があり、私たちの収益能力は実質的な悪影響を受ける可能性がある。
特許法の変更は特許の全体的な価値を低下させ、候補製品を保護する能力を弱める可能性がある。
私たちの成功は知的財産権、特に特許権に大きく依存する。特許の取得および実施は、技術的複雑性と法律的複雑性との両方に関連するため、コストが高く、時間がかかり、内在的な不確実性を有する。また、米国は最近、広範囲な特許改革立法を公布し、実施している。米国最高裁判所の最近の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。このような事件の結合は,我々の将来の特許取得能力の不確実性の増加に加えて,いったん特許を取得する価値(あれば)の不確実性をもたらしている.米国議会、連邦裁判所、および米国特許商標局の決定によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を獲得したり、私たちの既存の特許と将来獲得可能な特許を強制的に執行する能力を弱める可能性がある。例えば、この場合、アソークです。分子病理学はMyriad Genetics,Inc.を訴える。しかし、米国最高裁判所は、天然物質に対するいくつかの主張は特許を申請できないと判断した。私たちが現在私たちの候補製品に対して発行している特許と、私たちの保留特許出願から発行される可能性のあるいかなる特許もこの決定によって無効と認定されるとは思いませんが、裁判所、アメリカ議会、またはアメリカ特許商標局の将来の裁決は、私たちの特許権の価値に影響を与える可能性があります。外国司法管区の法律は同様の変化がある可能性があり、私たちの特許権や他の知的財産権の価値に影響を与える可能性があります。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう。
私たちが発表した特許と係属中の特許出願に加えて、私たちは、私たちの競争的地位を維持し、私たちの候補製品を保護するために、非特許技術、技術、および他の独自の情報を含む商業秘密に依存しています。私たちは、これらの商業秘密を保護することを求めています。一部は、これらの商業秘密に触れることができる当事者と秘密保護協定を締結することによって、例えば、私たちの従業員、会社協力者、外部科学協力者、協賛研究者、契約製造業者、コンサルタント、コンサルタント、および他の第三者です。私たちはまた私たちの従業員とコンサルタントと秘密と発明または特許譲渡協定を締結します。しかし、このような当事者たちのいずれかは、このような合意に違反し、私たちの固有の情報を開示する可能性があり、私たちはこのような違反について十分な救済措置を得ることができないかもしれない。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかる可能性があり、結果は予測できない。もし私たちのビジネス秘密が競争相手によって合法的に取得または独立して開発された場合、私たちは彼らがその技術や情報を使用して私たちと競争することを阻止する権利がなく、私たちの競争地位は損なわれるだろう。
私たちは私たちの従業員がその前の雇用主によって言われた商業機密を間違って使用したり開示したりしたと告発されるかもしれない。
私たちは、私たちの従業員が私たちのために働いているときに他人の固有情報やノウハウを使用しないことを保証するために努力しているが、私たちは、商業秘密または他の固有情報を含む、私たちまたはこれらの従業員が、そのような任意の元雇用主の知的財産権を使用または開示しているという疑惑を受ける可能性がある。これらの事項や私たちの上級管理職の合意に関連した脅威や未解決のクレームがあることはわかりませんが、将来的にはこのようなクレームに対抗するために訴訟を提起する必要があるかもしれません。もし私たちがこのようなクレームを弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
また、私たちは通常、知的財産権開発に参加する可能性のある従業員、コンサルタント、請負業者に、このような知的財産権を譲渡する協定に署名することを要求していますが、実際に私たちが自分の知的財産権を開発しているすべての側とこのような合意を実行することができない可能性があり、このような知的財産権の所有権について私たちにクレームを出したり、私たちにクレームをつけたりする可能性があります。もし私たちがこのようなクレームを起訴したり、弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権を失う可能性がある。このようなクレームの起訴や抗弁に成功しても、訴訟は巨額の費用を招き、私たちの経営陣や科学者の注意を分散させる可能性がある。
私たちは買収とライセンス内で私たちの開発プロセスを取得したり維持するために必要な権利を得ることができないかもしれない。
私たちの計画はその後、第三者が保有する独占権を使用する必要がある他の候補製品を含む可能性があるので、私たちの業務の成長は、これらの独占権を使用するライセンスまたは他の権利を取得して維持する能力があるかどうかにある程度依存する可能性があります。私たちは、私たちが決定した第三者から、任意の成分、使用方法、または他の第三者知的財産権を得ることができるかもしれない。第三者知的財産権の許可·買収は競争分野であり、より多くの老舗企業が魅力的であると考えられる第三者知的財産権許可または買収戦略をとる可能性がある。これらの老舗会社は私たちより競争優位を持っているかもしれません。それらの規模、現金資源及びより強い臨床開発と商業化能力のためです。
しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資が適切な見返りを得るための条項の許可や第三者知的財産権を得ることができないかもしれない。もし私たちが必要な第三者知的財産権を得ることに成功しなければ、私たちの業務、財務状況、成長の見通しは影響を受ける可能性がある。
私たちの第三者への依存に関するリスクは
私たちは第三者に依存して動物研究と臨床試験を行う。もしこれらの第三者がその契約の責務を成功的に履行できない場合、あるいは予想される期限までに完了することができなければ、規制機関から候補製品の承認を得られないか、商業化される可能性があり、私たちの業務は深刻な損害を受ける可能性がある。
我々は,我々が行っている臨床前研究と臨床計画のデータを監視·管理する第三者CROに依存し,計画してきた。私たちはこれらの側面に依存して私たちの動物研究と臨床試験を実行し、彼らの活動のいくつかの側面だけを制御する。しかし、私たちは私たちのすべての研究が適用された合意、法律と法規の要求、そして科学的な基準に従って行われ、私たちのCROへの依存が私たちの規制責任を免除しないことを確実にする責任がある。私たちと第三者、例えば私たちのCROは、実験室手続きおよび危険材料および廃棄物の処理、使用、貯蔵、処理および処理を管理する法律と法規を含む多くの環境、健康および安全な法律と法規によって制約されている。
プリブリン薬物物質または医薬製品の製造は危険材料の使用に関するものだ。私たちは私たちの契約製造パートナーと第三者と契約を結び、これらの材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし危険な材料の使用による汚染や傷害があれば、私たちはそれによるいかなる損害に責任を負うかもしれません。どんな責任も私たちの保険範囲を超えている可能性があります。私たちはまた民事や刑事罰金と処罰に関連した巨額の費用を発生させるかもしれない。危険材料の使用や接触により従業員が負傷したコストや支出を支払うために労働者賠償保険を維持しているが、潜在的な責任を負うには不十分である可能性がある。私たちは私たちが生物または危険材料を貯蔵、使用、または処分することによって、私たちに提出された環境責任や有毒侵害の請求に保険を維持することはできない。
そのほか、その他の事項以外に、著者ら及び第三者は安全作業条件、製品管理及び環境保護を含む多くの国際、国家、市政及び地方環境、健康及び安全法律及び法規を遵守しなければならない。しかし、環境と社会的法律法規はますます厳しくなっている。世界的に環境や社会問題への関心が高まっており、中国はこれらの分野でより厳しい基準や新たな規定をとる可能性がある。未来に発生する規制の変化の程度は、私たちの費用を増加させるかもしれない。また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。このような現行または未来の法律法規は私たちの研究、開発、または生産努力を損なうかもしれない。私たちがこれらの法律法規を遵守しないことは、巨額の罰金、処罰、または他の制裁を招く可能性があり、私たちの業務、財務状況、運営結果、および将来の成長の見通しに重大な悪影響を及ぼす可能性がある。
われわれ,われわれの臨床研究者とわれわれのCROはGCPを遵守しなければならないが,これはFDA,NMPA,EMA,その他の類似規制機関がわれわれの臨床開発におけるすべての薬物に対して実行する法規とガイドラインである。規制当局は,試験スポンサー,主要調査者,試験地点を定期的に検査することでこれらのGCPを実行している。もし私たち、私たちの臨床研究者、または私たちの任意のCROが適用されたGCPを遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれません。FDA、NMPA、EMAまたは同様の規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。特定の監督管理機関の検査を受けた後、この監督管理機関は著者らの1つ以上の臨床試験がGCP規定に符合しないことを確定することができる。また,われわれの臨床試験はcGMP規定により生産された薬剤を用いて行わなければならない。私たちがこれらの規定を遵守しないことは、私たちが臨床試験を繰り返す必要があるかもしれないが、これは規制部門の承認過程を遅らせるだろう。
場合によっては、私たちのCROは私たちとの合意を終わらせる権利がある。もし私たちがこれらの第三者CROとの任意の関係が終了すれば、私たちは代替CROと合意したり、商業的に合理的な条項でそうすることができないかもしれない。また,われわれのCROはわれわれの従業員ではなく,CROが行っている臨床や臨床前研究に十分な時間と資源を投入していなければ,このようなCROとの合意による救済措置しか提供できない。CROまたは臨床研究者がその契約の義務または義務を成功裏に履行できなかった場合、または予想された期限内に達成できなかった場合、もし彼らが交換する必要がある場合、または彼らが得た臨床データの品質または正確性が私たちの臨床方案、法規の要求または他の理由に従わなかった場合、私たちの臨床試験は延長、遅延または終了される可能性があり、私たちは規制機関の私たちの候補製品の承認または商業化に成功することができないかもしれない。したがって、私たちの運営結果と私たちの候補製品のビジネス見通しが損なわれ、私たちのコストが増加する可能性があり、私たちの収入を創出する能力が延期される可能性がある。
CROを交換または追加することは、追加のコストをもたらし、管理時間と労力を必要とします。しかも、新しいCROが仕事を始める時、自然な過渡期がある。したがって,遅延が生じ,期待される臨床開発スケジュールを満たす能力に大きな影響を与える可能性がある。私たちはCROとの関係を慎重に管理しているにもかかわらず、私たちは将来的に似たような挑戦や遅延に直面する可能性があり、これらの遅延や挑戦は私たちの業務、財務状況、および見通しに実質的な悪影響を及ぼすかもしれない。
私たちは第三者に依存して私たちの候補製品を生産したいです。承認されれば、第三者に依存して私たちの候補製品の製造過程を行うつもりです。第三者が私たちに十分な数の製品を提供できない場合、あるいは許容可能な品質レベルや価格で製品を提供できない場合、私たちの業務は損なわれる可能性があります。
薬品の製造は複雑であり、先進的な製造技術と技術制御の開発を含む大量の専門知識と資本投資が必要である。私たちは外部サプライヤーに頼って供給品の製造と私たちの候補製品を加工するつもりです。私たちはまだ私たちの候補製品を商業規模の製造や加工をしていません。そして私たちの候補製品のためにそうすることができないかもしれません。
私たちの第三者製造業者への期待に依存して、私たちは次のようなリスクに直面します
| ● |
潜在的な製造業者の数が限られており、FDA、NMPA、EMA、または他の同様の規制機関が任意の製造業者を評価しなければならないので、私たちは許容可能な条項または製造業者を決定することができないかもしれない。この評価はアメリカ食品と薬物管理局、国家食品薬品監督管理局、環境管理局或いは他の類似規制機関が新しい検査とcGMPコンプライアンス検査を行う必要があり、これらの検査は新冠肺炎の大流行或いはその他の要素によって延期され、或いは他の方法で阻害される可能性がある。さらに、新しいメーカーは、私たちの薬品生産に関する訓練を受けたり、実質的に同じ生産プロセスを開発したりしなければならない |
| ● |
私たちのメーカーは私たちの候補製品を製造する経験がほとんどないかもしれませんので、私たちの候補製品を製造するために必要なインフラとプロセスを実施し、維持するために私たちの多くの支援が必要かもしれません |
| ● |
私たちの第三者製造業者は、私たちの臨床的および商業的需要(もしあれば)を満たすために、候補製品または生産に必要な数量および品質をタイムリーに生産できないかもしれない |
| ● |
私たちの契約製造業者は、私たちの製造手順と他の後方支援要求を正確に実行できないかもしれません |
| ● |
私たちの契約製造業者は約束に従って職責を履行していないかもしれないし、私たちの候補製品に十分な資源を投入していないかもしれないし、あるいは契約製造業務に滞在するのに必要な時間に私たちの臨床試験を供給したり、私たちの薬物の生産、貯蔵、流通に成功したりしないかもしれない |
| ● |
任意の潜在的な第三者製造業者は、最初に、連邦、州、または国際規制検査をタイムリーまたは費用効果的に通過できない可能性がある |
| ● |
製造業者は、cGMPおよび他の政府法規および対応する非米国の要求を厳格に遵守することを保証するために、FDAと米国の対応する州機関および他の規制機関の持続的な定期的な抜き打ち検査を受けており、私たちの第三者メーカーはこれらの法規と要求を遵守できないかもしれない |
| ● |
私たちは、候補製品の製造過程で第三者製造業者がした改善された知的財産権を所有していないか、または共有しなければならないかもしれない |
| ● |
私たちの第三者製造業者は私たちとの合意を違反または終了するかもしれない |
| ● |
私たちの契約製造業者と重要な試薬サプライヤーは悪天候と自然または人為的災害の影響を受ける可能性があります |
| ● |
私たちの契約製造業者は、受け入れられないまたは一致しない製品の品質、成功率、および生産量を有する可能性がある |
| ● |
私たちは、特に他の原材料やコンポーネントの供給源や供給者がいない場合には、製造過程で使用される適切または許容可能な原材料およびコンポーネントを得ることができないかもしれない。 |
これらのリスクの各々は、私たちの臨床試験の完了またはFDA、NMPA、EMA、または他の同様の規制機関の私たちの任意の候補製品の承認を遅延または阻止する可能性があり、コスト上昇をもたらし、または私たちの候補製品の商業化に悪影響を及ぼす可能性がある。
第三者メーカーやサプライヤーに頼って候補製品を生産するほか,第三者による候補製品のいくつかの仕様テストを行い,患者に渡す。もしこれらのテストが適切でなければ、テストデータは信頼できず、患者は深刻な傷害のリスクに直面する可能性があり、FDA、NMPA、EMA或いはその他の類似の監督管理機関は欠陥が修復されるまで、わが社に重大な制限を加える可能性がある。
現在、私たちの製造活動の原材料は複数の供給源の供給者によって供給されている。私たちはメーカーやサプライヤーと薬品材料を供給する協定を締結しており、これらのメーカーやサプライヤーは私たちの需要を満たすのに十分な能力があると思います。しかも、私たちはこのような供給を提供するのに十分な代替源があると思う。しかし、もし供給が中断されたら、私たちの業務に実質的な損害を与えるだろう。
私たちはプリブリンの現在の処方で使用されている安定剤Kolliphor HS 15の唯一の供給者としてバスフSEに依存している。もしバスフSEがKolliphor HS 15を供給できないか,供給したくなければ,私たちはバスフSEに代わることができず,プリブリンの再調製が要求される。FDAとの議論によると、Kolliphor HS 15の使用を継続しながら別のレシピを求める。私たちの候補製品の再作成は、これらに限定されないが、任意の代替エージェントのサプライヤーは、関連する規制機関の評価を経て、または関連する規制機関の資格を取得しなければならないことを含むが、これらに限定されず、この過程で、私たちは供給中断を経験する可能性がある。このような再開発は重大な遅延を招き、私たちの1つ以上の候補製品の全体的な活動を減少させることが予想される。そのようなサプライヤーと割引条項を交渉する時、私たちはまた成功しないかもしれない。したがって、私たちの財務状況と経営業績は不利な影響を受けるかもしれない。
薬品メーカーは生産過程において困難に直面することが多く,特に規模の拡大や縮小,生産過程の検証,生産過程の信頼性の確保(汚染なしを含む)の面である。これらの問題は、物流および輸送、生産コストおよび生産量の困難、品質管理(製品の安定性を含む)、製品テスト、オペレータミス、合格者の可用性、および厳格に実行されている連邦、州、非米国法規の遵守を含む。さらに、私たちの候補製品供給または製造施設で汚染物質が発見された場合、これらの製造施設は汚染を調査し、修復するために長い時間を閉鎖する必要があるかもしれない。将来的には安定性の故障や私たちの候補製品製造に関連する他の問題が発生する可能性がある。また,資源制限,労使紛争,あるいは不安定な政治環境により,我々のメーカーは製造困難に遭遇する可能性がある。もし私たちのメーカーがこれらの困難に遭遇したり、彼らの契約義務を履行できなかったりすれば、臨床試験中の患者に私たちの候補製品を提供する能力が脅かされる。例えば、バスフSEは十分な量の安定剤をタイムリーに生産できない可能性がある。臨床試験供給のいかなる遅延或いは中断は臨床試験の完成を延期する可能性があり、臨床試験計画の維持に関連するコストを増加し、そして遅延した時間帯に基づいて、著者らは追加費用で新しい臨床試験を開始或いは完全に臨床試験を中止することを要求する。
私たちはすでに形成され、将来的に協力、戦略同盟、買収を形成したり、許可手配を達成したりする可能性がありますが、私たちはこれらの手配のメリットを意識していないかもしれません。
私たちはすでに形成され、将来的に戦略連合を形成したり、合弁企業や協力を作成したりすることが可能だ。私たちはまた、贈呈された製品、知的財産権、技術または業務を得ることができ、または第三者と追加のライセンス契約を締結することができ、これは、私たちの候補製品および私たちが開発する可能性のある任意の未来の候補製品の開発および商業化に関する私たちの努力を補完または強化すると信じています。これらの関係のいずれも、非日常的な費用や他の費用を発生させ、私たちの短期的および長期的な支出を増加させ、私たちの株主の権益を希釈する証券を発行したり、私たちの管理と業務を混乱させたりすることを要求することができる。また、適切な戦略的パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑である。また、私たちの候補製品のための戦略的パートナーシップや他の代替計画を構築する努力は成功しない可能性があります。なぜなら、協力努力の開発段階が早すぎると考えられる可能性があるので、第三者は私たちの候補製品が安全性と有効性を示す必要な潜在力を持っていると思わないかもしれません。第三者と協力して候補製品を開発·商業化すれば、その候補製品の将来成功した制御権の一部または全部を第三者に譲ることが予想される。
さらに、私たちの候補製品に関する協力は、多くのリスクに直面する可能性があります
| ● |
協力者は彼らが協力の努力と資源に適用することを決定する上で大きな自由裁量を持っている |
| ● |
パートナーは、私たちの候補製品の開発および商業化を行わない可能性があり、臨床試験結果、競争薬の買収による戦略的重点の変化、資金の利用可能性、または他の外部要因(例えば、資源の移転または競争的優先順位を創出する業務統合)に基づいて、開発または商業化計画を継続または更新することを選択する可能性がある |
| ● |
協力者は臨床試験を延期し、臨床試験に十分な資金を提供し、臨床試験を停止し、候補製品を放棄し、新しい臨床試験を繰り返し或いは行うことができ、或いは新しい候補製品の調合に臨床試験を要求することができる |
| ● |
協力者は、第三者開発と直接または間接的に私たちの薬物または候補製品と競合する薬物を独立して開発または間接的に開発することができる |
| ● |
1つまたは複数の医薬品のマーケティングおよび分配権を有する協力者は、そのマーケティングおよび流通のために十分なリソースを投入していない可能性がある |
| ● |
協力者は、私たちの知的財産権を正しく維持したり守ったりしていないかもしれないし、私たちの知的財産権または固有の情報を何らかの方法で使用して、それによって実際または脅威の訴訟を引き起こし、それによって私たちの知的財産権または独自の情報を危険にさらしたり、私たちを潜在的な責任に直面させたりすることができる |
| ● |
私たちと協力者との間で紛争が発生する可能性があり、私たちの候補製品の研究、開発または商業化の遅延または終了、あるいは高価な訴訟や仲裁を招き、管理職の注意と資源を分散させる |
| ● |
協力は終了する可能性があり、終了すれば、適用される候補製品をさらに開発または商業化するために追加の資金が必要になる可能性がある |
| ● |
協力者は、私たちが彼らと協力して生成した薬物の知的財産権を持っているか、あるいは共同で所有しているかもしれません。この場合、私たちはこのような知的財産権を商業化する権利がありません |
| ● |
このような協力は、業務費用の増加または債務または負債の負担をもたらす可能性がある |
| ● |
協力計画は、キーパーソンの流出や、重要な業務関係を維持する能力の不確実性を招く可能性がある。 |
したがって、もし私たちが協力合意と戦略的パートナー関係を達成すれば、私たちの薬品、もし私たちがこれらの取引を私たちの既存の業務と会社文化と組み合わせることに成功できなければ、私たちはこのような取引のメリットを実現できないかもしれません。これは私たちのスケジュールを延期したり、他の方法で私たちの業務に悪影響を与えるかもしれません。戦略的取引または許可証の後、私たちはそのような取引の合理的な収入または特定の純収入を証明することができないかもしれない。もし私たちが適時に、受け入れ可能な条項によって、または適切なパートナーと合意できない場合、私たちは候補製品の開発を削減し、その開発計画または私たちの1つまたは複数の他の開発計画を減らしたり、その潜在的な商業化を延期したり、いかなる販売またはマーケティング活動の範囲を縮小したり、または私たちの支出を増加させ、自費で開発または商業化活動を行わなければならないかもしれない。もし私たちが自分で援助して開発や商業化活動に従事することを選択すれば、私たちはより多くの専門知識と追加的な資本を得る必要があるかもしれないが、これらは私たちが受け入れられない条件や根本的には得られないかもしれない。もし私たちが協力できず、必要な開発や商業化活動を展開するのに十分な資金や専門知識がなければ、私たちの候補製品をさらに開発したり、市場に出したり、製品販売収入を生成することができない可能性があります。これは、私たちの業務の見通し、財務状況、運営結果を損なうことになります。
著者らはすでにカリフォルニア大学サンディエゴ校(UCSD)とカリフォルニア大学サンディエゴ校の従業員兼首席研究員のLyudmila Bazhenova博士と研究者による臨床試験協定を達成し、ワシントン大学と研究者によるプリブリン連合百時美施貴宝PD-1抗体nivalumabの転移性非小細胞肺癌患者の1/2期研究に関連する臨床研究合意に達した。ワシントン大学の研究は用量レジメンの終点に達したため,研究地点は閉鎖されている。我々はまた,Hoosier癌研究ネットワーク会社やロッグス大学と研究者による研究協定を締結し,研究者による1期と2期の臨床試験に関連し,プリブリン,nivolumab,CTLA−4抗体ipilimumabからなる三連療法を用いて小細胞肺癌を治療した。また、テキサス大学MD Anderson癌センターあるいはMD Anderson癌センターと賛助研究協定を締結し、放射線治療と免疫チェックポイント抗体にプリブリンを加えるメリットを評価する研究と関係がある。著者らはすでにMD Andersonと賛助の臨床研究協定を締結し、このプロトコルは研究者が開始したプリブリン連合放射/免疫治療がPD-1或いはPD-L 1標的抗体進展後に一部の末期悪性腫瘍患者に対して行った1/2期研究と関係がある。“プロジェクト4.会社情報-B.業務概要-プリブリン、著者らの主要な候補薬物であるプリブリンと抗癌適応免疫腫瘍学薬物の結合--研究者は免疫腫瘍学におけるプリブリンの研究を開始した”これらの合意の各々は、研究で使用されるプリプリンに資金支援と使用を提供し、これらの研究に関連するいかなる知的財産権の開発も要求しないことを規定している。著者らの子会社SEEDはまた、標的タンパク質分解(TPD)によって治療利益をもたらす新しい化学実体を発見し、開発するために、礼来社と研究協力と許可協定を締結した。また,我々の子会社である万春プリンは,プリプリンのより多くの適応を開発するために,恒瑞と独占商業化と共同開発合意を達成している。
私たちの業界、業務、運営に関するリスク
私たちが提案できる販売促進声明は制限される可能性があり、承認されれば、重大な規制や法執行のリスクを招くことなく、競争療法に関する情報を使用してプリブリンを普及またはマーケティングすることができない可能性がある。
FDAや連邦貿易委員会(FTC)を含む複数の米国政府機関がFDAが承認した医療製品の宣伝や広告を規制している。宣伝材料と声明には虚偽や誤解があってはならない。他の面では,FDAは販促声明を“確実な証拠”を持って支持しなければならないことを要求しており,これには十分な良好なコントロールの臨床試験が必要である。販促クレームはまた、医療製品のリスクと収益の間の“公平なバランス”を反映しなければならない。FDAは,十分な制御が良好で対面比較実験支援がなければ,“虚偽と誤り性”と主張していることを発見した。
比較クレームを否定することは正面試験に基づく声明ではなく、責任者をFDA或いはFTC法執行行動から保護するのに十分ではない可能性がある。虚偽と誤解性の広告と販売促進は連邦食品、薬物、化粧品法案(FDCA)に違反し、警告状、禁止令、民事処罰、刑事起訴を含むがこれらに限定されない責任者を制裁させた。また,条例によると,責任のある側が競合薬物,装置または生物の面で虚偽または誤った誘導性の陳述をした場合,その製品は誤ったブランドに貼られる。
私たちの中国内線のプリプリンに対する私たちの権利は限られている。
万春プリンは一部の持株子会社であり、中国プリプリンの知的財産権を保有している。私たちは現在間接的に万春プリンの57.97%の株式を持っている。万春布林の37.99%の株式は私たちの最高経営責任者蘭·Huangと私たちの主要株主の賈林清が所有する中国有限責任会社の万春生物科学技術が保有し、残りの4.04%の株式はいくつかの他の投資家が持っている。したがって、私たちが完全に親会社として受け取ることはできません、そして、私たちが持っている任意のお金は、Dr.Huang、ジャさんおよび上述の投資家から間接的に利益を得るであろう。したがって、万春ブリングによって生成された任意の割り当ては、完全に私たちの親会社として受け取ることはできません。また、中国の法律、規則、法規によると、私たちが中国に登録している子会社は、それぞれの純資産の一部を配当金として株主に移転する能力が制限されている。中国では、登録株や資本積立金口座も抽出が制限されている。これらの制限された純資産は2021年12月31日までゼロである。
私たちの未来の成功は私たちがCEOと他の主要な行政人員を維持し、合格した人員を誘致、維持、激励できるかどうかにかかっている。
私たちは私たちの創始者、取締役会長兼最高経営責任者Huang博士、そして私たちの管理と科学チームの他の主要なメンバーに非常に依存している。私たちは私たちのほとんどの幹部と正式な雇用協定を持っているが、これらの合意は私たちの幹部が私たちとの雇用関係をいつでも終わらせることを阻止しない。私たちは私たちの役員や他の職員たちに“キーパーソン”保険を提供しない。これらの人たちの誰かを失ったサービスは、研究、開発、商業化目標の達成を阻害する可能性がある。
価値のある従業員をわが社に引き付けるために、賃金や現金インセンティブのほか、時間の経過とともに付与され、特定の業績目標を達成することに基づいて株式インセンティブを提供します。時間が経つにつれて、これらの株式付与による従業員への価値は、私たちの一般株価変動の大きな影響を受ける可能性があり、これらの変動は私たちの制御範囲を超えており、いつでも他社が提出したより利益のある見積もりを相殺するのに十分ではないかもしれない。私たちは私たちの重要な従業員と雇用契約を持っているにもかかわらず、事前に通知するかどうかにかかわらず、私たちのどの従業員もいつでも退職することができる。
合格した科学、臨床、販売とマーケティング担当者やコンサルタントを募集し、維持することも私たちの成功の鍵となるだろう。また、私たちは科学と臨床コンサルタントを含むコンサルタントとコンサルタントに依存し、私たちの発見と臨床前研究開発と商業化戦略の制定を助けてくれます。役員や他の重要な従業員やコンサルタントのサービスを失うことは、研究開発と商業化目標の達成を阻害し、業務戦略を成功させる能力を深刻に損なう可能性がある。
また、幹部や主要従業員やコンサルタントを交換することは困難かもしれませんし、私たちの業界では開発に成功し、規制部門の承認を得て候補製品を商業化するために必要なスキルや経験を持っている個人数が限られているので、時間がかかるかもしれません。この限られた人材バンクから募集する競争は非常に激しく、多くの製薬と生物技術会社の間の類似人員に対する競争を考慮して、私たちは受け入れ可能な条件でこれらの肝心な人員或いは顧問を採用、訓練、維持或いは激励することができないかもしれない。
私たちはまた、大学や研究機関から科学や臨床人を募集する競争に直面している。私たちのコンサルタントやコンサルタントは、私たち以外の雇用主に雇われる可能性があり、他のエンティティと締結された相談または相談契約に基づいて約束することができ、これは、私たちが彼らを得る機会を制限するかもしれない。もし私たちが引き続き高い素質の人材を誘致し、維持することができなければ、私たちが成長戦略を推進する能力は制限されるだろう。
2022年1月、FDAが最近NDAに完全な返信を出したため、私たちのいくつかの資源を現金滑走路の延長と長期持続可能性の維持に再集中させる組織簡素化計画を発表したので、プリプリンとG-CSFの併用によるCIN予防の承認を求めた。この簡素化された計画はいくつかの職員たちに影響を及ぼす部隊計画を減らすことを含む。このような組織の簡素化は、部隊削減計画の影響を直接受けていない従業員の自然減員を増加させる可能性がある。
私たちの長期成長戦略を満たすためには、私たちの組織の規模と能力を拡大する必要があり、私たちは私たちの成長を管理する上で困難に直面するかもしれない。
2022年3月21日現在、私たちは76人のフルタイム従業員がいます。これらの人のうち、45人がフルタイムの研究·開発·実験室業務に従事し、31人が常勤一般·行政機能に従事している。2022年3月21日現在、私たちは32人の従業員が中国にいて、44人がアメリカにいます。私たちはまた、非常勤従業員の独立請負業者を招いて運営に協力していく可能性があります。私たちの発展と商業化計画と戦略の発展に伴い、効果的な情報開示と財務制御を確立し、維持し、当社のコーポレートガバナンス実践の中で変更する必要があります。今後の成長は、経営陣のメンバーにより多くの重大な責任を負わせるだろう
| ● |
より多くの従業員を識別し、採用し、統合し、維持し、激励する |
| ● |
私たちの候補製品に対する臨床およびFDAまたは他の同様の規制機関の審査過程を含む、私たちの内部開発作業を効果的に管理し、同時に、請負業者および他の第三者に対する契約義務を遵守し、 |
| ● |
私たちの業務、財務、管理制御、報告システム、そして手続きを改善する。 |
私たちの将来の財務業績と候補製品を商業化する能力は、私たちが将来の成長を効果的に管理する能力にある程度依存し、私たちの経営陣はまた、これらの成長活動を管理するために、不比例な注意を日常活動から移しなければならないかもしれない。
現在、予測可能な未来に、私たちはいくつかの独立した組織、コンサルタント、コンサルタントに大きく依存していくつかのサービスを提供するだろう。これらの独立した組織、コンサルタント、およびコンサルタントは、必要なときに適時に提供することができないかもしれませんが、この場合、私たちは合格した代替者を見つけることができないかもしれません。さらに、私たちのアウトソーシング活動を効率的に管理できない場合、あるいはコンサルタントが提供するサービスの品質や正確性が何らかの理由で影響を受ける場合、私たちの臨床試験は延長、延期、または終了される可能性があり、私たちは規制機関の候補製品の承認や他の方法で私たちの業務を進めることができないかもしれません。さらに、私たちは、私たちの既存のコンサルタントを経済的に合理的な条件で管理したり、他の適任な外部請負業者やコンサルタントを見つけることができないかもしれません。
ある既存の従業員を維持し、将来の潜在的な新入社員を誘致し、私たちのコンサルタントや請負業者チームを利用することで、私たちの組織を効果的に維持することができなければ、私たちの候補製品のさらなる開発と商業化に必要な任務を成功させることができない可能性がありますので、私たちの研究、開発、商業化の目標を達成できないかもしれません。
当社の従業員、独立請負業者、コンサルタント、ビジネスパートナー、およびサプライヤーは、規制基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります。
私たちは従業員、独立請負業者、コンサルタント、ビジネスパートナー、サプライヤーの詐欺、不正行為、または他の不正活動のリスクに直面している。このような当事者の不正行為は、FDAおよび他の類似した非米国規制機関の法律を遵守することができなかった故意、無謀、および不注意な行為を含む可能性があり、FDAおよび他の類似した非米国規制機関に真実、完全かつ正確な情報を提供すること、私たちが制定した製造基準を遵守すること、米国の医療詐欺および乱用法律および同様の非米国詐欺的不正行為法律を遵守すること、または財務情報またはデータを正確に報告すること、または許可されていない活動を私たちに開示することができる。もし私たちの候補製品がFDAの承認を得て、米国でこれらの薬物の商業化を開始すれば、私たちはアメリカの法律によって直面する可能性のあるリスクが著しく増加し、私たちはこのような法律を遵守することに関連するコストも増加する可能性がある。これらの法律は現在著者らの主要な研究者と研究患者の活動、及び臨床試験患者の募集過程で得られた情報の使用、及び提案と将来の販売、マーケティングと教育計画に影響を与える可能性がある。特に、医療製品やサービスの普及、販売およびマーケティング、および医療業界のいくつかの商業的配置は、詐欺、リベート、自己取引、および他の乱用行為を防止するための広範な法律によって制限されている。これらの法律および法規は、広範な価格設定、割引、マーケティングおよび販売促進、構造および手数料、特定の顧客インセンティブ計画、および他のビジネススケジュールを制限または禁止する可能性があります。
従業員や他の当事者の不正行為を常に識別し、阻止することができるわけではなく、このような活動を発見し、防止するための予防措置は、未知または管理不可能なリスクや損失を効果的に制御することができないか、またはこれらの法律や法規を遵守できないことによる政府調査または他の行動または訴訟から私たちを保護することができないかもしれない。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は巨額の罰金や他の制裁を加えることを含めて、私たちの業務に大きな影響を与えるかもしれない。
有効な内部統制システムを維持できなければ、私たちの財務状況や経営結果を正確かつタイムリーに報告できない可能性があり、これは投資家の信頼に悪影響を与え、私たちの普通株価値に影響を与える可能性がある。
上場企業として、財務報告書の内部統制を維持し、このような内部統制におけるいかなる重大な弱点も報告することが求められている。2002年“サバンズ-オキシリー法案”(Sarbanes-Oxley Act)第404条は、財務報告の内部統制の有効性を評価し、決定し、財務報告の内部統制の管理報告書を提供することを要求する。サバンズ·オクスリー法案はまた、財務報告の内部統制に関する管理報告書を独立公認会計士事務所が証明することを求めており、ある程度、“私たちのビジネススタートアップ企業法案”や“雇用法案”で定義されている“新興成長型企業”ではなく、大規模加速申請者や加速申請者とみなされている。私たちは、私たちが新興成長型会社である限り、私たちの独立公認会計士事務所は、財務報告の内部統制に関する管理報告書を証明しないと予想しています。
我々の経営陣は、最高経営責任者と財務責任者の参加の下、本報告で述べた期間終了までの開示制御および手順(“取引所法案”第13 a-15(E)条で定義されているような)の有効性を評価し、2021年12月31日に我々の開示制御および手続きが発効すると結論した。私たちは過去に私たちの財務報告の内部統制に重大な欠陥があることを発見し、将来私たちの財務報告の内部統制にはより多くの重大な欠陥や重大な欠陥があることが発見されるかもしれない。より広く言えば、サバンズ-オキシリー法案404条の要求を遵守できなければ、財務報告の内部統制に有効であると断言できない場合、または将来必要に応じて、私たちの独立公認会計士事務所が財務報告の内部統制の有効性について意見を述べることができなければ、投資家は私たちの財務報告の正確性と完全性に自信を失う可能性があり、私たちの普通株式の市場価格は悪影響を受ける可能性があり、私たちは証券取引所、米国証券取引委員会、または他の規制機関の調査対象となる可能性があり、追加の財務および管理資源が必要になる可能性がある。
私たちは国際的にビジネスをする危険に直面している。
私たちは様々な国で業務を展開し、これらの国で業務を展開したいと思っていますが、これらの市場で私たちの製品を販売することができないかもしれませんし、これらの市場のための新製品の開発に成功することもできません。私たちは国際的にビジネスをする他のリスクに直面するかもしれません
| ● |
法律や法規の要件の意外な変化や強要; |
| ● |
インフレや政治的不安定を含む経済的疲弊が発生した |
| ● |
適用された非アメリカの税金構造の影響と潜在的な不利な税金結果 |
| ● |
第三者特許権を含む中国の知的財産権保護には差がある |
| ● |
契約規定を効率的に実行する上での困難を含む、様々な外国の法律を遵守する負担 |
| ● |
輸出許可証の取得が困難であること、関税および他の障害物および制限、より長い支払い周期がある可能性があり、売掛金の入金が困難であること、および不利になる可能性のある税金待遇による遅延; |
| ● |
海外の原材料供給や製造能力に影響を与えるいかなる事件による生産不足。 |
また、私たちが業務を展開している外国では、政治や経済不安定、国際敵対行動、外交·貿易関係の変化など、一般的な地政学的リスクに直面しており、これらのリスクは顧客の在庫レベルや消費者購入に影響を与える可能性があり、これは私たちの業績変動を招き、純売上高が低下する可能性があります。国際的に業務を展開する任意の1つまたは複数のリスクの発生は、単独でも全体的にも、我々の業務および運営結果に実質的な悪影響を及ぼす可能性がある。
もし私たちがアメリカの“海外腐敗防止法”や他の反賄賂法律を遵守できなければ、私たちの名声は損なわれる可能性があり、私たちは罰を受け、巨額の費用を支払い、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼすかもしれない。
私たちは一般に、業務を獲得または保留するために、米国ではない役人に不正な金を支払うことを禁止している“海外腐敗防止法”の制約を受けている。私たちはまた他の管轄区域の反賄賂法律、特に中国によって拘束されている。私たちの業務の拡大に伴い、“海外腐敗防止法”や他の反賄賂法の私たちの業務への適用性が増加します。私たちは反賄賂に対する規則的な手続きと統制措置を監督して、従業員や代理人の無謀や犯罪から私たちを守ることができないかもしれません。もし私たちが自分の意図的または意図的な行為または他の人の行為のために適用された反賄賂法律を遵守できなかった場合、私たちの名声が損なわれる可能性があり、私たちは刑事または民事処罰、他の制裁および/または巨額の費用を招く可能性があり、これは、私たちの財務状況、運営結果、キャッシュフロー、および将来性を含む、私たちの業務に実質的な悪影響を及ぼすかもしれない。
業務中断は私たちの将来の収入と財務状況を深刻に損害し、私たちのコストと支出を増加させるかもしれない。
我々の業務および我々の第三者研究機関協力者、CRO、サプライヤーおよび他の請負業者およびコンサルタントの業務は、地震、電力不足、電気通信故障、コンピュータウイルス破壊、重大なコンピュータシステム故障、水不足、洪水、ハリケーン、台風、火災、極端な天気条件、医学流行病、国際敵対行動および他の自然または人為的災害または業務中断の影響を受ける可能性があり、私たちは主にこれらの状況に自己保険を提供する。また、私たちは私たちの第三者研究機関の協力者が私たちの候補製品を研究·開発することに部分的に依存しており、彼らは政府の閉鎖や資金撤回の影響を受ける可能性がある。このような業務中断の発生は、私たちの運営と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある。私たちは私たちの候補製品を生産して加工するために第三者メーカーに依存する。これらのサプライヤーの運営が人為的または自然災害または他の業務中断の影響を受ける場合、候補製品の臨床供給を得る能力が妨害される可能性がある。私たちの契約メーカーの業務の大部分は一つの工場に設置されています。火災、自然災害、停電、通信障害、無許可進入またはその他のイベントにより、当社または契約製造業者の開発または研究施設の中断時間が破損または延長され、候補製品の一部またはすべての開発を停止または遅延させる可能性があります。
私たちは衛生流行病、大流行、そして他の疫病と関連したリスクに直面しており、これは私たちの行動を深刻に混乱させるかもしれない。
新冠肺炎の発生により、政府は企業とオフィスの閉鎖、個人の隔離、旅行禁止など、世界的に重大な措置を実施した。新冠肺炎拡散の影響、業務中断の持続時間、関連する財務影響は現在合理的には推定できず、私たちの業務はこれらの影響の悪影響を受ける可能性がある。例えば,我々のウクライナでの臨床試験の患者募集数は2020年に新冠肺炎疫病の深刻な影響を受け,募集地点は他の臨床地点に移された。われわれは臨床試験における患者登録においても軽微な遅延を経験しており,世界的に保護−2とダブリン−3研究の患者登録を達成する能力に影響を与えていない。また、私たちは第三者CROに依存して、私たちが行っている臨床前および臨床プロジェクトのデータを監視し、管理しているが、大流行は彼らが私たちのプロジェクトに十分な時間と資源を投入する能力に影響を与えるかもしれない。もしこれらのサプライヤーの運営が新冠肺炎の影響を受けるならば、私たちが候補製品の臨床供給を獲得する能力も妨害される可能性がある。また,新冠肺炎により,医療センターでの不必要な活動に不安を感じるのが一般的である。そのため、著者らの臨床試験とある規制文書の予想データ読み取りの予想スケジュールは負の影響を受ける可能性がある。例えば,新冠肺炎のため,臨床試験データの処理に軽微な遅延を経験した。また、新冠肺炎に関連する制限やその他の状況は、更に私たちの臨床或いは製造施設の審査前検査の遅延を招く可能性があり、それによって、私たちの候補製品の監督審査と審査スケジュールを遅延させた。
私たちの本社はアメリカニューヨークに設置されていて、北京と大連に業務があります。中国、私たちの一部の従業員は上海にいます。私たちはまたアメリカ、中国、オーストラリア、ロシア、ウクライナで臨床試験を行っている。したがって、私たちは不利な影響のいずれか1つ以上の場所の要素の影響を受けやすい。情勢は依然として不安定で発展を続けているため、現在新冠肺炎が私たちの業務全体に長期的な影響を与えることは確定できない。新冠肺炎のワクチンが開発されているが,このようなワクチンは持続的に有効ではない可能性があり,ワクチンを得るのに時間がかかり,有意義な規模で受け入れられることが予想される。その蔓延を抑制し、経済を安定させる措置が奏効しなければ、我々の業務、経営業績、財務状況に実質的な悪影響を及ぼす可能性がある。
我々の内部コンピュータシステム、または私たちのCROまたは他の請負業者またはコンサルタントが使用するシステムは、故障したり、セキュリティホールに遭遇したりする可能性があります。
セキュリティ対策が実施されているにもかかわらず,我々の内部計算機システムおよび我々のCROや他の請負者やコンサルタントの計算機システムは,コンピュータウイルスや不正アクセスの破壊を受けやすい.我々の知る限り,これまでこのような重大なシステム故障やセキュリティホールを経験したことはないが,このような事件が発生して我々の運営が中断されると,我々の開発計画や業務運営の実質的な中断を招く可能性がある.例えば、完成した或いは未来の臨床試験の臨床試験データの紛失は著者らの監督管理の承認作業を遅延させ、著者らのデータの回復或いは複製のコストを著しく増加させる可能性がある。同様に,我々は我々の第三者研究機関協力者に部分的に依存して候補製品を研究·開発し,他の第三者に依存して我々の候補製品を製造して臨床試験を行い,彼らのコンピュータシステムに関連する類似イベントも我々の業務に大きな悪影響を与える可能性がある.任意の中断またはセキュリティホールが、私たちのデータやアプリケーションを紛失したり、破損したり、機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの候補製品のさらなる開発および商業化は延期される可能性があります。
私たちに製品責任訴訟を提起すれば、私たちは多くの責任を負い、候補製品の商業化を制限することを要求されるかもしれません。
私たちの候補製品が臨床テストを行うため、私たちは固有の製品責任リスクに直面しています。どんな薬物を商業化すれば、私たちはもっと大きなリスクに直面します。例えば、私たちの候補製品が臨床試験、製造、マーケティング、または販売中に傷害をもたらすと思われるか、または他の態様では不適切であることが発見された場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、薬物固有の危険について警告、不注意、厳格な責任、または保証違反の告発を含む可能性がある。州消費者保護法によると、クレームも主張することができる。もし私たちが製品責任クレームで自分自身を弁護することに成功できなければ、私たちは重大な責任を招いたり、私たちの候補製品の商業化を制限することを要求されるかもしれません。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。事件がどうであっても最終的な結果がどうであろうと、賠償責任は次のようになるかもしれない
| ● |
私たちの薬品の需要は減少しました |
| ● |
私たちの名声を損なう |
| ● |
臨床試験参加者は脱退し、臨床試験を継続することができない |
| ● |
規制当局が調査を開始しました |
| ● |
関連訴訟の弁護費用 |
| ● |
経営陣の時間と資源を移転する |
| ● |
実験参加者や患者に多額の報酬を与え |
| ● |
製品のリコール、撤回またはラベル付け、マーケティング、または販売促進制限; |
| ● |
収入損失 |
| ● |
利用可能なすべての保険と私たちの資本資源を枯渇させる |
| ● |
候補品を商業化することはできません |
| ● |
私たちの普通株価は下落した。 |
潜在的な製品責任クレームを防止するために、許容可能なコストで十分な製品責任保険を得ることができず、これは、私たち単独またはパートナーと開発された薬物の商業化を阻止または阻害する可能性がある。私たちが現在保険を受けている製品責任保険の最高保険金額は合計約680万ドルですが、このような保険の保険金額が足りないかもしれません。このような保険を維持できないかもしれません。あるいは合理的な費用で追加または交換保険を受けることができないかもしれません(あれば)。私たちの保険証書にも様々な例外があるかもしれません。私たちは製品責任クレームの影響を受けるかもしれません。私たちは保険範囲を持っていません。私たちは私たちの保険範囲の制限を超えたり、私たちの保険カバー範囲内でない裁判所の裁決または和解合意で達成された任意の金額を支払う必要があるかもしれません。私たちはこれらの金額を支払うために十分な資本を持っていないか、または得ることができません。私たちが未来の会社のパートナーと合意しても、私たちは損害賠償を受ける権利があります。何かクレームがあれば、この賠償は利用できないか十分かもしれません。
私たちの保険範囲は限られていて、私たちの保険範囲を超えたすべてのクレームは私たちの巨額の費用と資源移転を招く可能性があります。
私たちは財産保険証書を維持し、保証建物及びその内装、設備、事務家具と在庫の有形損傷或いは損失を維持します。私たちの雇用主責任保険は一般的に従業員の死亡または労災保険を含む。私たちの場所で発生した第三者に関連するいくつかの事件と、取締役および上級管理者に対する何らかの法的行動による損失または前払い弁護費用を含む公的責任保険もあります。私たちは私たちの高級管理者やキーパーソンのために“キーパーソン”生命保険や業務中断保険に加入しません。私たちの保険カバー範囲は固定資産損失や従業員の負傷のいかなるクレームを支払うのに十分ではないかもしれません。私たちの保険範囲を超えた私たちの施設や人員に対するいかなる責任や損傷、あるいはそれによるいかなる責任や損傷も、私たちに巨額のコストと資源移転を招く可能性があります。
為替レートの変動は外貨両替損失を招く可能性があり、投資価値を大幅に下げる可能性があります。
私たちの一部の支出、そして未来に得られる可能性のある収入は、すべてドル以外の通貨、特に人民元である。そのため、私たちの経営結果とキャッシュフローは外貨為替レートの変動の影響を受けるため、外貨両替リスクに直面しています。例えば,われわれの臨床試験活動の大部分は米国以外で行われており,関連コストで試験を行っている国の現地通貨が発生し,これらのコストは通貨レート変動の影響を受ける可能性がある。私たちは現在、特定の外貨とドルの間の未来の為替レートの不確実性を防ぐためにヘッジ取引に従事していない。私たちが臨床試験を行っている国では、ドルの通貨に対する価値の低下は私たちの研究開発コストにマイナス影響を与える可能性がある。外国為替変動は予測できず、私たちの財務状況、経営業績、キャッシュフローに悪影響を及ぼす可能性がある。
人民元のドルやその他の通貨に対する価値は変動する可能性があり、中国や他の非米国政府がとる外貨政策などの政治的·経済的条件の変化の影響を受ける可能性がある。中国、米国またはその他の政府政策は、今後の人民元、ドル、その他の通貨間の為替レートに影響を与え、我々の業務に悪影響を及ぼす可能性がある。中国政府は依然として巨大な国際圧力に直面しており、より柔軟な通貨政策を要求しており、これにより人民元対ドルレートがより大きく変動する可能性がある。私たちのコストはドル、人民元、オーストラリアドルとユーロで計算して、私たちの大部分の金融資産はドルで価格を計算します。私たちの業務がドルを人民元に両替する必要がある程度では、人民元のドル高は私たちが獲得する人民元金額に悪影響を与えるだろう。逆に、私たちが私たちの人民元をドルに両替して私たちの業務あるいは他の商業目的に使用することを決定すれば、ドルの人民元の上昇は私たちが獲得するドル金額にマイナスの影響を与えます。
私たちの投資は損失につながる可能性のあるリスクの影響を受ける。
2021年12月31日と2020年12月31日までに、それぞれ4160万ドルと1.095億ドルの現金を持っています。私たちは現金を様々な金融商品に投資することができます。主に短期投資レベル、利下げツールです。2021年12月31日と2020年12月31日まで、私たちの短期投資はそれぞれ3070万ドルとゼロです。このすべての投資は信用、流動性、市場、そして金利リスクの影響を受ける。このようなリスクは、私たちの現金、現金等価物、および投資を持つ金融機関の倒産または深刻な財務的苦境を含み、私たちの流動性損失、私たちの投資減価、将来的に重大な損失または長期完全損失投資を達成する可能性があり、これは私たちの業務、運営結果、流動性、および財務状況に重大な悪影響を及ぼす可能性がある。私たちの金利リスクの開放は、私たちが預金から稼いだ利息収入と株主ローンから試算した利息支出の変動によって生まれました。リスクを管理するために、私たちの現金は私たちが高い信用品質を持つと考えられる金融機関に保管されている。私たちは私たちの現金状況が私たちを過度なリスクに直面させないと信じているが、未来の投資は市場価値の不利な変化の影響を受けるかもしれない。
私たちの開示統制と手続きはすべてのミスや詐欺を阻止したり検出できないかもしれない。
私たちは現在取引法の報告書の要求を受けている。我々の開示制御および手続きは、取引所法案に基づいて提出または提出された報告書において、開示された情報が蓄積され、管理層に伝達され、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されることを合理的に確保することを目的としている。任意の開示制御およびプログラムまたは内部制御およびプログラムは、発想および動作がどのように完全であっても、絶対的な保証ではなく、合理的な保証を提供することしかできず、制御システムの目標が達成されることを確保することしかできないと信じている。
これらの固有の限界は,意思決定過程における判断が誤りである可能性があり,簡単な誤りや誤りによって故障が発生する可能性があるという現実を含む.さらに、ある人の個人的な行動、2人以上の結託、または無許可超越制御は、制御を回避することができる。したがって,我々の制御システム固有の制限により,誤りや詐欺による誤り陳述が発生し,発見されない可能性がある.
私たちが中国でビジネスをしているリスクは
現在の国際経済関係の緊張は私たちの臨床試験過程、私たちの運営コストと私たちの業務成長にマイナス影響を与える可能性がある。
最近、米国と中国の緊張関係のような国際経済関係の緊張が高まっている。2018年7月以降、米国政府は、中国から輸入されたいくつかの製品に、中国の不公平な貿易行為を罰するために、特定の医療機器を含む追加、新しいまたはそれ以上の関税を課すことを提案し、提案している。中国の対応は、ある医療機器を含む米国から輸入されたいくつかの製品に追加、新たなまたはそれ以上の関税を課すことだ。2019年5月、米国政府は2000億ドル相当の中国輸入品に25%の関税を引き上げることを発表し、中国の対応はある米国商品に比較的小規模な関税を課すことであり、米国商品に追加関税を課すことを提案した。2019年6月1日、中国が2019年5月に発表した中国に負けた600億ドルの米国商品への追加関税が発効した。2019年7月9日、米国政府は一部の癌医療機器を含む110種類の中国製品に対して2018年7月6日に増加した25%の関税を免除すると発表した。この免除の有効期限は1年で、2019年7月9日から始まる。2019年8月、米国政府は総3000億ドル相当の中国輸入品に関税を課すことを提案し、その一部は2019年9月に実施される予定だ。2019年9月1日、発表されたように、米国政府は1250億ドルを超える中国の輸入品に関税をかけている。逆に、中国は中国に輸出された750億ドルの米国商品に追加関税を課している。2019年9月2日、中国は輸入関税問題について世界貿易機関に訴えた。2019年9月11日、中国は一部の抗がん剤を含む16種類の米国製品に対して最初の関税免除を実施することを発表した。2019年10月11日、米政府は、両国が2020年1月15日に署名した“第1段階合意”を達成したと発表した。それにもかかわらず、この合意が貿易戦争の経済圧力をどの程度緩和するかは不明だ。
既存と未来の措置により、私たちの臨床試験は影響を受けたり延期されたりする可能性がある。臨床試験を行うコストも増加する可能性がある。同様に、私たちは臨床試験や他の研究を支持するサプライチェーンもまた否定的な影響を受ける可能性がある。また、貿易戦争により、規制の承認を得たり、候補製品を商業化したりする上で、より多くの不確実性に直面する可能性があります。緊張のエスカレートは貿易関係にさらに影響を与え、世界経済の全体的な成長の鈍化を招く可能性がある。そのため、私たちの業務、財務状況、経営業績もマイナスの影響を受ける可能性があり、中米経済関係は引き続き悪化する可能性がある。
海外の監督管理機関は中国の調査や証拠取得が困難かもしれない。
米国でよく見られる株主クレームや規制調査は、中国では通常法律や実用性の観点から追及することは困難である。例えば、中国では、規制調査や中国以外で提起された訴訟に必要な情報を提供することには重大な法律や他の障害がある。中国当局は他の国や地域の証券監督管理機関と規制協力メカニズムを構築し、国境を越えた監督管理を実施することができるが、相互実務的な協力メカニズムがなければ、このような米国証券監督管理機関との協力は効率的ではない可能性がある。また、2020年3月に施行された“中国証券法”第177条又は第177条によると、海外証券監督管理機関は、中国国内で直接調査又は証拠取得活動を行ってはならない。第百七十七条の詳細な解釈や実施細則は公表されていないが、海外証券監督管理機関は中国内部で直接調査や検証活動を行うことができず、自分の利益を保護する上での困難をさらに増加させる可能性がある。
中国の製薬業界は高度な規制を受けており、これらの規定は変化する可能性があり、私たちの薬品の承認と商業化に影響を与える可能性がある。
中国の医薬業界は政府の全面的な監督管理を受けており、新薬の審査、登録、製造、包装、許可とマーケティングを含む。中国における現在及び計画における我々の業務活動に適用される規制要件の検討については、第4項.会社情報−B.業務概要−政府法規−中国法規を参照されたい。近年、中国の医薬業界に関する監督管理の枠組みは重大な変化が発生し、私たちはそれが引き続き重大な変化が発生することを予想している。このような変更や修正は、私たちの業務のコンプライアンスコストを増加させたり、中国での候補製品の開発や商業化の成功を遅延させたり、現在中国で薬物の研究開発や製造に及ぼすメリットを減少させたりする可能性があります。中国当局は製薬業界の法律を実行する上でますます警戒されており、私たちまたはパートナーが適用される法律や法規を遵守できなかったり、必要な許可や許可を取得して維持できなかったりすることで、中国での業務活動の一時停止または終了を招く可能性がある。私たちは私たちの戦略と方法が中国政府の政策と一致すると信じているが、私たちの戦略と方法が引き続き一致することを保証することはできない。
中国政府の政治·経済政策や中国と米国の関係の変化は、私たちの業務、財務状況、経営業績、私たちの普通株の市場価格に実質的な悪影響を及ぼす可能性がある。
私たちは中国に広範な業務を持っているため、私たちの業務、経営結果、財務状況と見通しは、中国の経済、政治、法律と社会条件、あるいは中国とアメリカや他の国家政府との関係変化の影響を大きく受ける可能性がある。貿易政策、条約、政府法規、関税の面で、米国と中国の間の未来の関係には重大な不確定性がある。中国の経済は先進国の経済と多くの違いがあり、政府が参加する数量、発展レベル、成長速度、外貨規制と資源配置を含む。
中国の経済は過去40年間に著しい成長を経験したにもかかわらず、異なる地域と異なる経済部門の成長はバランスがとれていない。中国政府は様々な措置を講じて経済発展を奨励し、資源配置を誘導している。その中のいくつかの措置は中国全体の経済に有利になるかもしれないが、私たちにマイナスの影響を与えるかもしれない。例えば、私たちの財務状況や経営結果は、政府の資本投資のコントロールや現在私たちに適用されている税収規制の変化の悪影響を受ける可能性があります。また、過去に中国政府は利上げを含むいくつかの措置を実施して経済成長速度をコントロールしてきた。これらの措置は中国の経済活動を減少させる可能性があり、これは私たちの業務や経営業績に悪影響を及ぼす可能性がある。
また、中国政府は、ある業界(例えば、教育やインターネット業界)に重大な影響を与える新しい政策を発表し、今後私たちの業界に関する法規や政策を発表する可能性を排除することはできません。これらの法規や政策は、中国で業務を継続するために中国当局の追加許可を得ることを要求する可能性があり、これは私たちの業務、財務状況、経営業績に悪影響を及ぼす可能性があります。
また、中国政府が最近発表した声明は、政府が中国で重要な業務を持っている会社の海外市場での上場に対する監督とコントロールを強化する意向があることを示している。例えば、2021年7月、中国政府は中国に本部を置く企業の中国海外融資に新たな指導意見を提供し、可変利益実体と呼ばれる手配を通じた。2021年12月24日、中国証監会は“国務院の国内会社の海外証券発行上場管理に関する規定(意見募集稿)”と“国内会社海外証券発行上場届出管理方法(意見募集稿)”を発表し、公開意見を求め、締め切りは2022年1月23日である。米国証券取引委員会はまた、米国証券取引委員会に証券登録を求める中国の会社に対して、より厳しい開示要求を実施している。私たちにはVIE構造はありませんが、私たちは中国に幅広い業務を持っているため、将来的には中国、アメリカ、あるいは他の法律法規が中国で広範な業務を持っている会社の融資や他の活動に制限を加え、私たちの業務や運営結果に悪影響を及ぼす可能性があります。国内や国際投資の観点から見れば、中国のビジネス環境が悪化したり、中国とアメリカや他の政府との関係が悪化したりすれば、中国政府は私たちの運営に介入する可能性があり、中国とアメリカでの業務、および私たちの普通株の市場価格も悪影響を受ける可能性がある。
アメリカと中国の法規の変化は私たちの業務、私たちの経営業績、私たちの融資能力、そして私たちの普通株の市場価格に悪影響を及ぼすかもしれません。
米国証券取引委員会を含む米国政府は声明を発表して行動し、米国と国際関係が変化し、中国製のある製品に数回の関税を課すこと、中国にある制裁と制限を実施すること、および中国で重要な業務を持っている会社の審査を強化することを含む米国や中国と関連のある会社に影響を与える。新しい立法、行政命令、関税、法律または法規、および新しい立法、行政命令、関税、法律または法規がどの程度通過するかどうかは不明であり、どのような行動が米国または中国、私たちの業界、または私たちと重大な関連のある会社にどのような影響を与えるかも不明である。私たちはアメリカと中国で臨床活動と業務運営を行っています。大量の中国業務を有する企業の審査、資本規制または関税の強化を含む国境を越えた関係および/または国際貿易における政府のいかなる不利な政策も、科学者および他の研究開発者の採用、薬物開発に関連する原材料の輸出入、私たちの融資能力、または私たちの普通株の市場価格に影響を与える可能性がある。また、米国証券取引委員会は、主に中国で大量の業務を有する会社を対象としたいくつかの声明を発表している。例えば、2021年7月30日、米国証券取引委員会のジャンスラー議長は中国の最近の事態の発展について投資家保護に関する声明を発表し、声明によると、ジェスラーは米国証券取引委員会の従業員に中国業務が重大な会社の届出文書に対して的確な追加審査を要求したと述べた。声明はまた、VIE構造を持つ会社の固有のリスクについて言及した。私たちはVIE構造もなく、中国の制限された外資所有権によって制限された業界にもいない。しかし、会社が米国証券取引委員会に提出した定期報告やその他の文書は、米国証券取引委員会の強化された審査を受ける可能性があり、このような追加的な審査は、米国での有効な融資能力に影響を与える可能性がある。
米国証券取引委員会の2021年7月30日の声明への対応として、中国証監会は2021年8月1日に発表した。“中米の監督管理機関は相互尊重、協力の原則に基づいて、引き続きコミュニケーションを強化し、中国の渡米上場会社の監督管理に関する問題を適切に解決し、安定した政策予想を形成し、市場のために良性のルール枠組みを創造すべきだと考えている”と述べた。中国証監会は引き続き投資家、会社、関連部門を含む異なる利害関係者と密接に協力し、政策と実施措置の透明性と確実性をさらに促進するが、それはずっと開放されており、会社が関連法律法規に基づいて国際或いは国内市場で上場することを選択させることを強調している
もし新たな立法、行政命令、関税、法律および/または法規が実施されれば、既存の貿易協定を再交渉すれば、米国または中国政府が最近の米中緊張のために報復行動を取った場合、または中国政府が米国で行われた証券発行により多くの監督と制御を加える場合、これらの変化は私たちの業務、財務状況および経営業績、資本調達能力、および私たちの普通株の市場価格に悪影響を及ぼす可能性がある。
中国の法律、規則、そして規制の解釈と実行には不確実性がある。
私たちの業務の一部は私たちの中国子会社を通じて中国で行われており、中国の法律、法規、法規の制約を受けています。私たちの中国子会社は外商投資中国に適用される法律、法規、法規の制約を受けている。中国の法制度は成文法規に基づく民法制度である。
1979年、中国政府は経済事務を全面的に管理する法律、法規と規則体系を公布し始めた。過去40年間の立法全体効果は中国の各種形式の外商投資に対する保護を著しく強化した。しかし、中国はまだ完全な法律体系を形成しておらず、最近公布された法律、規則、法規は中国の経済活動のあらゆる面をカバーするのに十分ではないかもしれないし、中国の監督管理機関の重大な解釈を受ける可能性がある。特に、これらの法律、規則、および条例は比較的新しいため、公表された決定の数が限られているため、これらの決定は拘束力がなく、法律、規則、規則および条例は、これらの法律、規則および条例をどのように実行するかに関する規制機関に重大な裁量権を与えることが多く、これらの法律、規則および条例の解釈と実行は不確実性に関連し、一致せず予測できない可能性がある。また、中国の法律体系はある程度政府政策と内部規則に基づいており、その中のいくつかは適時に公表されておらず、さらには全く公表されておらず、追跡力を持っている可能性がある。したがって、私たちは違反が発生してから、私たちがこのような政策と規則に違反していることを認識しなければならないかもしれない。
中国のいかなる行政訴訟と裁判所訴訟も長引く可能性があり、巨額のコストと資源の分流と管理注意力の移転をもたらす可能性がある。中国の行政と裁判所当局は法定と契約条項の解釈と実施に大きな自由裁量権を持っているため、行政と裁判所訴訟の結果および私たちが享受する法的保護レベルを評価することは、より発達した法制度よりも難しいかもしれない。これらの不確実性は、私たちが締結した契約を実行する能力を阻害し、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性があります。
中国住民投資オフショア会社に関する中国の規定は、私たちの未来の中国住民受益者あるいは私たちの中国子会社に責任を負わせたり、処罰を受けたりして、私たちが中国子会社に出資する能力を制限したり、私たちの中国子会社を制限したりする可能性がある’登録資本を増加させたり、利益を分配する能力がある。
2014年7月4日、国家外国為替管理局は“国内住民の海外投融資と特殊目的担体往復投資外貨管理に関する問題に関する通知”、すなわち“国家外国為替管理局第37号通知”を発表した。外匯局第37号通知は、中国住民が海外投資と融資を目的として、直接或いは間接的にオフショア実体を設立或いは間接的に制御し、その合法的に所有している資産或いは国内企業における持分或いはオフショア資産或いは利益は、外匯局第37号通知の中で“特殊目的担体”と呼ばれ、現地外匯局支店に登録しなければならないことを要求した。外管局第37号通達はさらに、特別目的担体にいかなる重大な変化が発生した場合、例えば中国個人出資の増減、株式譲渡或いは交換、合併、分立或いはその他の重大な事件は、改訂登録すべきであることを要求した。特殊目的担体権益を持つ中国株主が必要な外為局登録を完了できなかった場合、この特殊目的担体の中国子会社はオフショア親会社への利益分配が禁止され、後続の国境を越えた外国為替活動が禁止される可能性があり、この特殊目的担体がその中国子会社に追加資本を注入する能力が制限される可能性がある。また、上記の各種外管局登録要求を遵守しなければ、中国の法律により、外国為替規制逃れにより責任を負う可能性がある。
吾らは当社の株主であるHuang博士と賈林清さんと董亮さんは、外管局第37号通達で指示された中国住民だと信じている。Huang博士や賈林清さんや董亮さんは外管局第37号通達に基づき外貨登録を完了していますが、吾らはその3人の株主および我々の他の実益所有者に対して支配権を持っていませんが、吾らの中国住民実益所有者はそうではない可能性があり、または将来的には外管局第37号通達およびその後の実施規則を遵守しない可能性があります。中国住民実益所有者は、外管局第37号通告及びその後続実施規則に基づいてその安全登録を適時に登録又は改訂することができなかったか、又はわが社の将来の中国住民実益所有者が外管局第37号通告及び後続実施規則に規定された登録手続きを遵守できなかった場合、当該等の実益所有者又はわが中国子会社に罰金及び法的制裁を科す可能性がある。また、外管局第37号通達は、この規定や将来のオフショアや国境を越えた取引に関するいかなる規定がどのように中国の関連政府部門によってどのように解読、改訂、実施されるかを明らかにしておらず、これらの規定がどのように私たちの業務運営や将来の戦略に影響を与えるかを予測することもできない。関連要求を登録または遵守できなかったことも、私たちの中国子会社に追加資本を提供する能力を制限し、私たちの中国子会社が私たちに配当金を分配する能力を制限する可能性がある。これらのリスクは将来的に私たちの業務、財務状況、そして運営結果に実質的な悪影響を及ぼすかもしれない。
私たち従業員の株式激励計画に関する中国の法規を守らないいかなる行為も、中国の計画参加者や私たちに罰金やその他の法律制裁を受ける可能性がある。
わが社及びその役員、幹部及びその他の中国に1年間連続して居住し、限定株又はオプション権を獲得する取締役、役員及びその他の従業員は、外匯局が2012年2月に発表した“国内個人の海外上場会社株激励計画への参加に関する問題に関する外国為替管理に関する通知”を適用し、通知に基づいて、海外上場会社の株式激励計画に参加する中国公民又は非中国公民が中国に1年間連続して居住する従業員、取締役、監事及びその他の管理者は、限られた例外を除いて、国内の合格代理機関を通じて外国為替局に登録しなければならない。この機関は当該海外上場会社の中国子会社であり、いくつかの他の手続きを完了する可能性がある。また、海外受託機関を招聘して株式オプションの行使や売却、株式や権益の売買を処理しなければならない。外国為替局の登録を完了できなかった場合は罰金や法的制裁を受ける可能性があり、持分インセンティブ計画に基づいて配当金やそれに関連する販売収益を支払う能力、または中国の外商投資企業に追加資本を注入する能力を制限し、私たちの外商投資企業が私たちに配当金を分配する能力を制限する可能性もある。私たちはまた規制面の不確実性に直面しており、これは中国の法律に基づいて取締役と従業員のために追加の株式激励計画を実施する能力を制限する可能性がある。
また、国家税務総局は従業員の株式オプションまたは制限株に関する通知を発表した。これらの通知によると、中国で働く従業員が株式オプションまたはその制限的な株式帰属を行使すると、中国個人所得税が徴収される。海外上場会社の中国子会社は、従業員の株式オプション又は制限株式に関する書類を税務機関に申告し、従業員がその株式オプション又は制限株式に関連する個人所得税を代理納付する義務がある。従業員が所得税を納めていない場合、あるいは中国子会社が適用される所得税を源泉徴収できない場合、中国子会社は税務機関や他の中国政府部門の制裁に直面する可能性がある。
将来、私たちはオフショア現金と融資需要に資金を提供するために、私たちの主要な運営子会社の配当金と他の配当金分配にある程度依存するかもしれない。
私たちはケイマン諸島に登録して設立された持ち株会社で、将来は私たちの主要な運営子会社の配当金と他の株式分配にある程度依存して、私たちのオフショア現金と融資需要を満たすことができます。私たちの株主への配当金と他の現金分配、会社間融資に資金を提供し、中国以外で発生する可能性のあるいかなる債務の返済と私たちの費用を支払うのに必要な資金を含む。我々の中国子会社およびいくつかの他の子会社に適用される法律、規則および法規は、適用される会計基準および法規に従って決定された留保収益(ある場合)から配当金を支払うことのみを許可する。
中国の法律法規によると、私たちが中国に登録している各子会社は毎年、このような積立金の総金額が登録資本の50%に達するまで、その税引後利益から10%を法定積立金として抽出しなければならない。法定積立金が以前の年度の損失(あれば)を補うのに不十分であれば、子会社は法定積立金を計上する前に、その年の利益で赤字を補うべきである。株主の適宜決定により、法定積立金を計上した後、中国会計基準に基づいてその税引き後の利益の一部を適宜積立金に振り込むことができる。これらの法定積立金と自由に支配可能な積立金は、登録された持分とともに、現金配当金として分配してはならない。これらの法律、規則、規定により、私たちが中国に登録して設立した子会社は、それぞれの純資産の一部を配当金として株主に移転する能力に制限されている。また、中国では、登録株や資本公積口座の抽出も制限されている。これらの制限された純資産は2021年12月31日までゼロである。
“中華人民共和国企業所得税法”あるいは“企業所得税法”及びその実施細則はいずれも2008年1月1日に施行され、その後いくつかの改正を行い、その中で、中国からの外国企業が得た、例えば中国子会社がその非中国住民企業の持分所有者に支払う配当金は、通常10%の税率で中国源泉徴収税を徴収し、このような外国投資家の登録司法管轄区域が中国と異なる源泉徴収手配を規定しない限り、税収条約を締結することが規定されている。そのため、私たちの中国子会社が私たちに支払った配当金は10%の税率で中国の源泉徴収税を支払う予定です。
大陸部中国と香港特別行政区の所得に対する二重課税の回避及び脱税防止に関する手配或いは香港税務条約によると、万春医薬(香港)有限会社或いはわが中国付属会社の株主である万春医薬香港は香港税務住民として私たちの中国経営付属会社から受け取った配当金は5%の税率で源泉徴収税を徴収することができる。香港税務条約によると、いくつかの条件の規定の下で、受取人が香港税務住民であり、かつ配当の実益所有者であることを証明できれば、中国実体の配当金はこの引き下げられた予定税率を得ることができる。万春医薬香港は現在、香港税務局の香港税務住民証明書を持っていないため、引き下げられた源泉徴収税率を得ることができない可能性がある。
また、もし私たちが中国の子会社で将来自分の名義で債務が発生すれば、債務を管理する道具は、親会社である私たちに配当金や他のお金を支払う能力を制限することができるかもしれない。将来的に我々の子会社が親会社として配当金または他の支払いを割り当てる能力のいかなる制限も、私たちの業務に有益な投資または買収、配当金の支払い、または他の方法で私たちの業務に資金を提供し、業務を展開する能力に実質的かつ不利な制限を与える可能性がある。
“企業所得税法”によると、私たちは中国住民企業とみなされ、25%の税率で私たちの全世界の課税所得額に中国税を納める可能性がある。
企業所得税法によると、中国以外に設立され、中国内部に“事実上の管理機関”がある企業は“常駐企業”とされており、企業所得税の面で中国企業に似た扱いを受けていることを意味する。企業所得税法施行細則は“事実上の管理機関”を“企業の生産経営、人員、会計、財産に対して実質的かつ全面的な管理·制御を行う管理機関”と定義している。また、“事実管理機構に基づいて中制御オフショア会社企業が中華人民共和国税務住民企業であることを確定することに関する通知”或いは第82号通知は、ある中制御オフショア会社企業、即ち外国或いは地区の法律に基づいて登録された企業であり、その主要な持株株主は中国企業或いは企業グループの企業であり、例えば以下の各項目はすべて中国に位置又は居住し、住民企業に分類される:日常生産、経営と管理を担当する高級管理者と部門;財務と人事決定機関;キー財産、会計帳簿、会社印鑑と取締役会、株主総会紀要;そして半数以上が投票権を持つ上級管理者や役員。国家統計局は2011年7月27日、“中国資本海外登録住民企業所得税管理方法(試行)”を発表し、2011年9月1日から施行し、2018年6月15日に改訂を行い、第82号通知の実施をさらに指導した。公告45は中国住民企業の地位確定に関連するいくつかの問題を明らかにし、どの主管税務機関がオフショア登録の中国住民企業地位の確定、及び確定後の管理を担当しているかを含む。2014年、国家税務総局は“海外で登録した中制御企業がその実際の管理機関によって国内企業の関連問題と認められたことに関する公告”を発表し、認定国内企業の行政手続きに関する規定を補充したが、82号通知では国内企業に対する分類基準は変わらない。
私たちの知る限り、オフショア持ち株会社の会社構造は私たちの会社構造と似ていて、中国税務機関に中国の“住民企業”と認定されていません。したがって、私たちの会社や私たちのいかなる海外子会社も中国住民企業とみなされるべきだとは思いません。
もし中国税務機関が私たちのケイマン諸島持株会社が住民企業であると認定すれば、いくつかの不利な中国税収結果が生じる可能性があり、私たちは私たちの全世界の課税所得額に25%のEITを徴収し、EIT報告義務を負う必要があるかもしれない。この場合、私たちの中国子会社が親会社として支払ってくれた配当金は、中国の源泉徴収税を支払う必要がないかもしれません。
私たちの外国投資家に支払う配当金は中国の源泉徴収税を支払う必要があるかもしれませんが、私たちの外国投資家が私たちの普通株を売却する収益は中国税を支払う必要があるかもしれません。
もし私たちが中国住民企業、例えば“-企業所得税法によると、私たちは中国住民企業とみなされ、25%の税率で私たちの世界の課税所得額に中国税を納めることができる”とすれば、私たちの普通株が支払う配当金と私たちの普通株が達成したいかなる収益も、中国内部からの収入とみなされるかもしれない。そのため、非中国住民企業の一般株主に支払う配当金は10%の税率で中国源泉徴収税(非中国個人普通株主であれば20%)を支払う可能性があり、非中国住民企業一般株主が私たちの普通株を譲渡することで実現した収益は10%の税率で中国税を納める可能性がある(非中国個人一般株主であれば20%)。もし私たちまたは私たちが中国以外に設立した任意の子会社が中国住民企業とみなされていれば、私たちの普通株の所有者が中国が他の国や地域と締結した所得税条約や協定のメリットを享受できるかどうかは不明である。もし私たちの非中国投資家に支払った配当金やこのような投資家に私たちの普通株の収益を譲渡するには中国税を支払う必要があります。あなたの普通株への投資価値は大幅に低下する可能性があります。
中国住民企業の株式を間接的に譲渡したり、中国で設立された非中国会社の他の資産を譲渡したり、中国で設立された非中国会社の他の資産に帰属したりする上で、我々と我々の株主は不確実性に直面している。
2015年2月3日、国家税務総局は“非中国住民企業の間接譲渡資産に関する企業所得税問題に関する公告”または“公報7”を発表した。この公告によると、非中国住民企業は“間接譲渡”“中国課税資産”は、中国住民企業の持分を含み、このような手配に合理的な商業目的がなく、中国企業の所得税納付から逃れるために設立されたものであれば、再定性し、中国の課税資産を直接譲渡すると見なすことができる。そのため、このような間接移転から得られる収益は中国企業所得税を納める必要があるかもしれない。取引手配に“合理的な商業目的”があるかどうかを確定する際に考慮すべき要素は、オフショア企業の株式に関する主要な価値が中国の課税資産に由来するかどうか、オフショア企業の資産が主に中国への直接或いは間接投資であるかどうか、あるいはその収入が主に中国から来ているかどうか、オフショア企業及びその直接或いは間接的に中国課税資産を持っている子会社が真の商業性質を持っているかどうか、これはその実際の機能とリスク開放から証明することができる;商業モデルと組織構造の存在期限;直接譲渡中国課税資産による取引の回復可能性;そしてこのような間接譲渡と適用される税金条約や似たような配置の税金状況。2017年10月17日、国家税務総局は“源から非住民企業所得税の源泉徴収に関する国家税務総局の公告”すなわち第37号公告を発表し、2017年12月1日から施行した。37号公報はさらに、非住民企業所得税の代理徴収のやり方と手順を明らかにした。
超過納付適用税金は譲渡先に違約利息を負担させます。公告7の規定により、投資者が株式を売却して得られる収益は中国企業所得税を納付する必要がなく、当該等の株式は公開証券取引所取引により得られる。しかし、公告7によると、非中国住民企業が公共証券取引所以外で私たちの普通株を売却するには、中国企業所得税を納める必要がある可能性がある。
公告7の適用には不確実性がある。税務機関は、公告7が我々のオフショア子会社の株式の売却や中国の課税資産に関する投資に適用されると判断する可能性がある。譲渡先と譲り受け側は納税申告や差し止め代行義務を履行する必要があるかもしれませんが、私たちの中国子会社は申告協力を要求される可能性があります。さらに、我々、非住民企業および中国子会社は、公告7を遵守するために貴重な資源を要求される可能性があり、または、私たちおよび非住民企業が公告7に基づいて、私たちの前および将来の再編または我々オフショア子会社の株式の売却に課税すべきではないと判断することは、私たちの財務状況や経営業績に大きな悪影響を及ぼす可能性がある。
公告7によると、中国税務機関は譲渡された課税資産の公正価値と投資コストとの差額に応じて納税資本利益に応じて調整する権利がある。もし中国税務機関が公告7/公告37に基づいて取引の課税所得額を調整すれば、私たちはそのような潜在的な買収や処分に関連する所得税コストが増加し、これは私たちの財務状況や経営業績に悪影響を及ぼす可能性がある。
両替の制限は私たちが収入を有効に利用する能力を制限するかもしれない。
中国政府は人民元の外貨両替を規制し、場合によっては中国の送金通貨に対して規制を実施している。私たちの未来の収入の一部は人民元で価格を計算するかもしれない。使用可能な外貨の不足は、私たちのオフショア実体が配当金を支払うか、他のお金を支払うか、あるいは他の方法で私たちの外貨債務を履行するために、私たちの中国子会社が私たちのオフショア実体に十分な外貨を送金する能力を制限するかもしれない。人民元は現在、“経常項目”の下で両替することができ、“経常項目”には貿易·サービス関連の外国為替取引が含まれているが、“資本項目”では両替できず、“資本項目”には岸子会社から入手可能な融資を含む外国直接投資や融資が含まれている。現在、我が国外商投資企業の中国子会社は、外国為替局の許可を得ずに、一定の手続きに従って外貨購入を要求して“経常項目”の決済を行うことができる。しかし、中国の関連政府部門は、将来的に外貨を購入して経常口座取引を行う能力を制限または撤廃する可能性がある。私たちの将来の収入の一部は人民元で価格を計算する可能性があるので、いかなる既存と未来の通貨両替制限は、人民元で発生した収入を利用して中国以外の業務活動に資金を提供したり、外貨で私たちの株主に配当金を支払う能力を含めて私たちの株主に制限するかもしれません。資本項目下での外国為替取引は依然として制限されており、外管局や他の関連中国政府部門の承認や登録を得る必要がある。これは私たちが子会社のための債務や株式融資を通じて外貨を獲得する能力に影響を及ぼすかもしれない。
最近の中国の米国上場企業をめぐる訴訟と負の宣伝は、私たちがより厳格な監督審査を受け、私たちの普通株の取引価格にマイナスの影響を与える可能性があり、その運営結果、財務状況、キャッシュフロー、見通しを含む、私たちの業務に実質的な悪影響を及ぼす可能性がある。
米国に上場する中国事業会社をめぐる訴訟や負の宣伝は、このような会社の株価にマイナス影響を与えていると考えられる。複数の株式に基づく研究機関が中国会社に関する報告を発表し、これらの機関は中国の会社管理のやり方、関連側の取引、販売方法、財務諸表などを審査し、これらのやり方は全国取引所の特別調査と株式停止を招いた。私たちのどのような審査に対しても、その望ましくない点にかかわらず、管理資源と精力の分流、デマに対して自分を弁護する潜在的なコスト、私たちの普通株取引価格の低下と変動、および取締役と高級管理者の保険料の増加を招き、その運営結果、財務状況、キャッシュフロー、将来性を含む、私たちの業務に重大な悪影響を及ぼす可能性がある。
“外国持ち株会社問責法”によると、私たちの普通株はカードを外したり、アメリカでの取引が禁止されたりする可能性があります。私たちの普通株は、米国での退市や取引停止、またはそれが退市または禁止されている脅威は、あなたの投資の価値および/または流動性に重大かつ不利な影響を与える可能性があります。さらに、PCAOBは、私たちの監査人に対して全面的な検査や調査を行うことができず、このような検査や調査から得られた利益を投資家に奪われている。
“外国会社の責任追及法案”が2020年12月18日に公布された。HFCAAは、米国証券取引委員会が発行者が3年連続でPCAOB検査を受けていない公認会計士事務所が発行した監査報告を提出したと確定した場合、米国証券取引委員会は発行者の証券が米国全国証券取引所または場外取引市場での取引を禁止すべきであると規定している。
米国上場企業の監査役およびPCAOBに登録されている事務所として、我々の監査役は、本年度報告20−F表の他の部分に含まれる監査報告を発表する独立公認会計士事務所であり、米国の法律に基づいて、PCAOBが法律に基づいて定期的に検査を行い、適用される専門基準に適合しているか否かを評価する。我々の監査人は中国大陸に位置しているため、監査事務所リストに含まれており、PCAOBは1つ以上の当局の大陸中国での職位により全面的な検査や調査ができないため、PCAOBの決定を受け、現在PCAOBの検査を受けていないと考えている。
2021年5月、PCAOBは提案された規則6100を発表し、“HFCAA下の取締役会決定”を発表し、パブリックコメントを求めた。提案された規則は、PCAOBが司法管轄区域に位置する1つまたは複数の当局によって取られた立場のために、司法管轄区域に位置する完全に登録された公共会計士事務所を検査または調査することができないかどうかを決定する際に使用するためのフレームワークを確立するためのHFCAAにおけるPCAOBの責任に関する。提案された規則は2021年9月22日にPCAOBによって採択され、2021年11月5日に米国証券取引委員会の承認を得た。2021年12月2日、米国証券取引委員会は最終改正案を可決し、“海外腐敗防止法”における開示と提出要求を実施し、この改正案によると、発行者が公認会計士事務所が発行した監査報告を含む年次報告を提出した場合、PCAOBは外国司法管轄区のある当局の立場で当該発行者を完全に検査または調査できないと考えており、米国証券取引委員会はその発行者を証監会が認定した発行者と認定し、3年連続で証監会が認定した発行者と認定された後に取引禁止を実施する。もし私たちが欧州委員会が認定した出荷業者と認定され、“未検査”の年があれば、私たちが直ちに救済措置を取ることができる保証はない。2021年12月16日、PCAOBは、中国当局がこの2つの司法管轄区の職にあるため、PCAOBに登録されている会計士事務所を完全に検査または調査することができず、大陸部と香港に本部を置く中国を決定する報告書を発表した。
2021年6月22日、米国上院は、米国衆議院で可決され法律に署名すれば、HFCAAを改正し、HFCAA下の上場と取引禁止をトリガするために必要な連続不検査年数を3年から2年に減少させる“外国会社問責法案”を可決した。
米国証券取引委員会は、私たちの監査人がPCAOBの検査を受けなければ、これらのルールや指導が私たちに影響を与える可能性がある追加のルールや指導意見を提示するかもしれない。例えば、2020年8月6日、総裁の金融市場ワーキンググループは、当時の米国総裁に、中国会社の重大なリスクから米国投資家を保護することに関する報告書を発表した。本報告は、PCAOBに法定任務を履行するのに十分なチャネルを提供していない司法管轄区の会社を解決するために、米国証券取引委員会に5つの提案を実施することを提案する。これらの提案の中のいくつかの概念は“HFCAA”の公布に従って実行された。しかし、その中のいくつかの提案はHFCAAよりもっと厳しい。例えば、ある会社がPCAOB検査を受けなければ、会社の退市前の過渡期は2022年1月1日に終了することを報告する。
米国証券取引委員会はすでに、米国証券取引委員会のスタッフがHFCAAの実施に関する規則のための総合的な提案を作成し、工務課の報告書への提案を行っていると発表した。米国証券取引委員会がいつルール制定を完了するかは不明であり、これらのルールがいつ発効するか、PWGの提案が採択される(あれば)。米国証券取引委員会はまた、HFCAAの認証と開示要求に適応するために、各種年次報告表を修正することを発表した。もし私たちの監査人がPCAOBの検査を受けなければ、追加的な法規や立法要求や指導意見が私たちに影響を与えるかもしれない。HFCAAの要求に加えて、この可能な法規や指導の影響は不確定であり、この不確実性は、私たちの普通株の市場価格が重大で不利な影響を受ける可能性がある。
PCAOBは私たちの監査人を検査したり、全面的に調査することができないので、もし私たちが3年連続で委員会が指定した発行者に決定されたら、私たちはカードを取られるかもしれません。私たちの普通株はアメリカでの取引を禁止されるかもしれません。このような退市はあなたが私たちの普通株を売却または購入する能力を大幅に弱化させ、潜在的な退市に関連するリスクと不確実性は私たちの普通株価格にマイナスの影響を与える可能性がある。また、このような退市は、受け入れ可能な条項で資金を調達する能力に深刻な影響を与える可能性があり、それは、私たちの業務、財務状況、および将来性に大きな悪影響を及ぼすことになるかもしれない。
PCAOBが中国国外で他の監査会社に対して行った検査では、これらの会社の監査プログラムと品質制御プログラムに欠陥が存在し、これらの欠陥は検査過程の一部として解決され、未来の監査品質を高める可能性がある。もしPCAOBが私たちの監査人を検査したり、全面的に調査することができない場合、私たちと私たちの普通株の投資家はこのようなPCAOB検査のメリットを奪われるだろう。また、PCAOB検査を受けた監査人と比較して、PCAOBは監査人を検査または全面的に調査することができず、私たちの独立した公認会計士事務所監査プログラムまたは品質制御プログラムの有効性を評価することをより困難にし、投資家および潜在投資家が監査プログラムおよび報告された財務情報および私たちの財務諸表の品質に自信を失う可能性がある。
追加的な救済措置を押し付けたら“4大”アメリカ証券取引委員会が提起した行政訴訟で、私たちの独立公認会計士事務所を含む中国の会計士事務所はこれらの会計士事務所を告発しました’米証券取引委員会が文書提示要求について設定した具体的な基準を満たしていなければ、将来の財務諸表を“取引法”の要求に応じて速やかに提出できない可能性がある。
2012年12月、米国証券取引委員会は、私たちの独立公認会計士事務所を含む中国の5つの会計士事務所に対して行政訴訟を提起し、監査作業の下書きや他の米国証券取引委員会が調査している他の中国会社に関する文書の提示を拒否したと告発した。2014年1月22日、これらの会計士事務所に命じ、うち4つの会計士事務所が米国証券取引委員会の前で6ヶ月間勤務することを命じた予備行政法が発表された。米国証券取引委員会の審査·承認を得ない限り、この決定は最終決定でも法的効力もない。2月12日、中国の会計士事務所4社が米国証券取引委員会に上訴し、この決定を不服とした。2015年2月、我々の独立公認会計士事務所を含む4つの中国会計士事務所は、米国証券取引委員会の前に執行能力を一時停止されることを回避するために、米国証券取引委員会に非難と罰金を支払うことに同意した。これらの会社がそれぞれの顧客にサービスを提供し続ける能力は和解協定の影響を受けない。和解協議は、これらの事務所に詳細な手続きに従い、中国証監会を通じて米国証券取引委員会に中国事務所の監査文書を閲覧する方法を提供することを求めている。和解条項によると、和解が成立して4年後、この4つの中国に本部を置く会計士事務所に対する基本訴訟手続きは却下されたとみなされているが、偏見がある。4年の大台は2019年2月6日に発生した。
米国証券取引委員会が中国の4つの会計士事務所にさらに挑戦するかどうかは予測できないが、米国の監督管理機関が監査の原稿に米国の法律を遵守しているかどうか、あるいはこのような挑戦の結果、米国証券取引委員会の停職などの処罰を招くかどうかは予測できないが、これらの会計士事務所が追加的な救済措置を受けていれば、米国証券取引委員会が財務諸表を提出する能力に影響を受ける可能性がある。米国証券取引委員会が行政訴訟を再開すれば、最終結果に応じて、中国で主要業務を有する米国上場企業は、中国業務を保留することが困難または不可能である監査人を発見する可能性があり、財務諸表が可能な退市を含む取引所法の要件を満たしていないと判断する可能性がある。また、これらの監査会社に対する訴訟に関するいかなる負のニュースも、投資家が中国に本社を置く米国上場企業に不確実性をもたらす可能性があり、私たちの普通株の市場価格は悪影響を受ける可能性がある。
私たちの独立公認会計士事務所が拒否された場合、一時的であっても、アメリカ証券取引委員会の前に勤務する能力があり、また、別の公認会計士事務所を見つけて財務諸表を監査して意見を出すことができず、私たちの財務諸表は取引法の要件を満たしていないと判断することができる。このような決定は、最終的には、私たちの普通株がナスダック資本市場で退市すること、または米国証券取引委員会で登録をキャンセルすること、または両方を合併することをもたらす可能性があり、これは、米国での私たちの普通株の取引を大幅に減少または効果的に終了させることになる。これらは、私たちの普通株の市場価格に実質的な悪影響を与え、米国での普通株の取引を大幅に減少または効果的に終了させるだろう。
私たちがデータ保護の法律や法規を守らないことは、政府が私たちに法執行行動と重大な処罰を取り、私たちの経営業績に悪影響を及ぼす可能性があります。
世界的な個人情報の収集、使用、保護、共有、移転、その他の処理の規制枠組みは急速に変化しており、予測可能な未来にはまだ不確定である可能性がある。私たちが大中華区中国と他のアジア市場で運営しているほとんどの司法管轄区の監督管理機関はすでに実施され、個人データ保護に関する立法と監督管理提案を検討している。
中国の監督管理部門はすでにデータ保護に関する立法と規制提案を実施し、考慮している。例えば、2017年6月に施行された“中華人民共和国ネットワークセキュリティ法”や“ネットワークセキュリティ法”は、中国のために初の国家レベルデータ保護制度を作成し、ネットワーク事業者に適用され、中国国内のすべてのインターネットまたは他の情報ネットワークを介してサービスを提供する組織が含まれる可能性がある。
私たちは維持せず、将来も中国患者の個人が健康情報を識別できるように維持するつもりはない。しかし、私たちは臨床試験のための未識別または仮名の健康データを現地法規に基づいて収集し、維持している。これらのデータは、個人データまたは重要なデータと見なすことができる。中国が中国データに対する主権をますます強調することに伴い、臨床試験のための未識別或いは仮名の健康データの出口伝送は“ネットワーク安全法”、“データ安全法”(以下のように定義する)、“個人情報保護法”(以下のように定義する)及び各種の実施法規と標準を含む新しい国家安全法制度の制約を受ける可能性がある。
ネットワーク安全法と“国家医療ビッグデータ標準、安全とサービス方法(試行)”或いは“健康医療ビッグデータ管理方法”によると、ある個人情報、重要データと健康医療ビッグデータは必ず中国政府が行った或いは確定した安全評価を経てから、中国外で伝送することができる。中国政府は、2017年に発表された“個人情報と重要データの越境移転安全評価方法(意見募集稿)”や2019年に発表された“個人情報越境移転安全評価方法(意見募集稿)”などのいくつかの規定草案を提出し、評価の手続きを明確にし、より詳細なコンプライアンス要求を規定しており、場合によっては、このような情報とデータが中国国外で転送される前に、政府の承認を受ける必要がある。
また、中国全国人民代表大会常務委員会(SCNPCと略称する)は2021年6月10日に“人民Republic of Chinaデータ安全法”を公布し、2021年9月1日から施行した。“データセキュリティ法”は,データ処理活動に従事するエンティティと個人に対してデータセキュリティとプライバシー義務を規定し,データ分類と階層保護制度を導入している.データ分類の根拠は、経済と社会発展におけるデータの重要性であり、これらのデータが改ざん、廃棄、漏洩または不正に取得または使用された場合、国家安全、公共利益または個人または組織の合法的権益に損害の程度をもたらすことが予想される。セキュリティ評価メカニズムには、2021年8月に公布され、2021年11月1日に施行された個人情報保護法にも含まれ、ある個人情報の越境移転を監督するためのものである。
“個人情報保護法”は、個人情報処理に適用されるデータプライバシーと保護要求のセットを規定し、データ保護コンプライアンス義務を中国国内の組織と個人を含む個人情報の処理、中国国内の個人情報の処理に拡大し、処理の目的が中国国内の個人に製品やサービスを提供すること、あるいは中国国内の個人行為を分析·評価することである。個人情報保護法はまた、キー情報インフラ事業者と個人情報処理実体が処理する個人情報が中国サイバー空間監督管理機関が設定した数のハードルに達した場合、中国が生成或いは収集した個人情報を中国に保存し、中国ネットワーク空間監督管理機関を通じてこのような個人情報の安全評価を行わなければならないと規定している。最後に、個人情報保護法は、深刻な違反行為に対して5000万元または前年の年収5%に達する巨額の罰金を科すことを提案し、主管部門に関連活動の一時停止を命じられる可能性がある。私たちは維持せず、将来も中国患者の個人が健康情報を識別できるように維持するつもりはない。しかし、私たちは臨床試験のための未識別または仮名の健康データを現地法規に基づいて収集し、維持している。
“ネットワークセキュリティ法”と“データセキュリティ法”によると、データセキュリティとネットワークセキュリティリスクを監視し、適切に対応できるように、全面的なデータとネットワークセキュリティ管理制度を構築し、維持しなければならない。私たちは、私たちのデータ処理活動とネットワーク使用によるリスクに対応するために、分類して適切な措置をとる必要があるだろう。私たちは、影響を受けた個人と適切な中国の規制機関に通知し、任意のデータセキュリティとサイバーセキュリティ事件に対応する義務がある。このようなシステムの構築と維持には多大な時間、労力、コストが必要であり、必要に応じてこのようなシステムを構築し、維持することは、私たちの法的義務を遵守することを保証することができないかもしれません。私たちが投資したにもかかわらず、このようなシステムは私たちを完全に保護することができないかもしれませんし、私たちが直面しているすべてのデータセキュリティおよびネットワークセキュリティのリスクやイベントに適切に対応または緩和することができます。また、“データセキュリティ法”によると、政府当局はディレクトリの形で“重要データ”に分類されたデータを決定し、より高いレベルの保護で処理·処理を行う。“ネットワークセキュリティ法”や“データセキュリティ法”は重要なデータの概念を明確に定義していない.法定要求を遵守するためには,重要なデータを持っているかどうかを確認し,地方政府や部門が発表する予定の重要なデータリストを監視し,リスク評価を行い,適用規制機関に報告する義務を遵守することを確保する必要がある。私たちはまた、私たちが重要なデータを処理することに関する業務敏感またはネットワークセキュリティ敏感な詳細を規制機関に開示することを要求される可能性があり、オフショア受給者(外国許可者を含む)と重要なデータを共有するため、または中国以外の司法および法執行部門と中国に格納されたデータを共有するために、政府の安全審査または政府の承認を得る必要があるかもしれない。中国以外の司法·法執行部門が中国に格納されたデータの提供を要求した場合、必要な政府安全審査や必要な政府の承認を得ることができず、外国当局の要求を満たすことができない可能性がある。潜在的な法的義務紛争は中国内外での私たちの業務に悪影響を及ぼす可能性がある。
最近、中国が指導するネット信弁はいくつかの中国インターネット会社が米国証券取引所で初めて公募株(IPO)に行動した。その理由は、国家安全リスクと不当な中国データ主体の個人情報の収集と使用の疑いがあるからである。公式公告によると、この行動は“国家安全法”、“ネットワーク安全法”、“ネットワーク安全審査方法”に基づいて開始され、これらの法律法規は“国家データ安全リスクを防止し、国家安全を維持し、公共利益を守る”ことを目的としている。また、2021年12月28日、中国が指導する国家ネット信弁などの多部門は共同で新たに改訂された“ネットワーク安全審査方法”を発表し、その中で、インターネットプラットフォーム経営者は100万人を超えるユーザーの個人情報を持っており、海外証券取引所に上場しようとしているのは、ネットワーク安全審査を受けなければならないと規定している。新たに改訂された“ネットワークセキュリティ審査方法”は2022年2月15日から施行される。2021年11月14日、中国指導者のネット信弁は“データ安全管理方法意見募集稿”を公表し、その中で、百万以上のユーザーの個人情報を処理するデータ処理業者が海外で上場し、国家安全に影響或いは影響を与える可能性のあるデータ処理業者が香港で上場し、ネットワーク安全審査を申請しなければならないと規定した。データセキュリティ対策草案はまだ採択されておらず、将来採択される正式なバージョンにさらなる実質的な変化があるかどうかは不明であるため、これらの措置草案がどのように制定、解釈、または実施されるか、およびそれらがどのように私たちに影響を与えるかは決定されない。ネットワークセキュリティ審査要求や法執行行動がどれだけ広く,生命科学部門全体にどのような影響を与えるか,特に当社にどのような影響を与えるかは不明である。中国の監督管理機関は、規定を守らない会社に罰金や運営停止の処罰を科す可能性があり、米国株式市場から撤退する可能性がある。
国家安全法制度は個人情報と人類の健康関連データに対してより厳格なデータ現地化要求を提出し、そして私たちは個人情報と人類の健康関連データを中国に移転する前に、ネットワーク安全或いはその他の安全審査を経て、政府の許可或いは認証を獲得し、或いはある契約保護を実施しなければならないことを要求した。したがって、私たちまたは私たちの顧客、サプライヤー、臨床試験場所、医薬パートナーおよび他の第三者が中国で収集、生成または処理した個人情報、重要なデータ、および健康および医療データは、このようなデータの現地化要求と強化された監督と制御の制約を受ける可能性がある。これらの要求を遵守するために、中国にローカルデータセンターを設立し、セキュリティ評価を行ったり、中国政府の必要な承認を得たりして、このような制御された情報やデータを中国国外に送信することは、私たちの運営コストを著しく増加させたり、中国内外での業務運営の遅延や中断を招いたりする可能性がある。変化する国家安全法制度の規制解釈と実行は、運営やコンプライアンスコストの増加を招き、継続的な監視を求め、必要に応じて私たちの運営、政策、手順を変更することが求められる。もし私たちの業務または私たちのCRO、許可者またはパートナーの業務がこれらの要求に違反していることが発見された場合、私たちはデータの紛失や使用、製品の監督管理の承認の遅延、中国へのデータの移転ができない、私たちの契約要件を守れない、名声が損なわれた、または処罰される可能性があります。行政、民事と刑事処罰、損害、罰金、および私たちの業務を削減または再編します。いずれかの状況が発生すれば、我々の業務運営能力や財務業績に悪影響を及ぼす可能性がある。
国務院弁公庁は2018年3月に“科学データ管理方法”を採択し、科学データの収集、提出、保存、利用、秘密と安全に規範的な枠組みを提供した。科学データは自然科学、工学と技術分野の基礎研究、応用研究、実験と発展によるデータとして定義されている。科学研究活動のモニタリング、モニタリング、実地研究、検査とテストのための原始データと派生データも含まれている。すべての研究実体によって生成された科学データは、政府資金によって作成または管理された研究機関、高等教育機関および企業、または国家秘密、国家安全または社会公共利益に関連する任意の源によって援助されたものを含み、中国政府が指定したデータセンターに提出して統合されなければならない。科学的データの開示は規制機関によって検討されるだろう。
科学データの定義はかなり広いが、中国政府はまだ更なる指導意見を発表しておらず、臨床研究データが科学データの定義に属するかどうかを明らかにする。中国政府は生命科学会社に臨床研究データをどの政府が指定したデータセンターにアップロードすることを要求しておらず、臨床研究データの国境を越えた転送と共有を阻止していないことが分かった。現在、研究や開発活動を行う際に政府資金を使用するつもりはありませんが、将来的には何らかの形の政府援助や支援を求めることになるかもしれません。私たちはこの分野の法律と規制の発展に密接に注目して、科学的データをどのように解釈するかを理解することを計画しており、私たちは追加の規制要求を遵守し、このような要求の範囲(あれば)は不明であるにもかかわらず、私たちの許可者や外国の監督管理機関と臨床研究データを共有する必要があるかもしれない。
また、ある特定の業界の法律法規は中国の個人データの収集と移転に影響を与える。例えば、2019年7月1日から施行される国務院が公布した“ヒト遺伝資源管理条例”、すなわち“ヒト遺伝資源管理条例”は、収集に適用され、生物バンク;ヒト遺伝資源を使用して、器官、組織、細胞および他のヒトゲノム、遺伝子および他の遺伝物質を含む材料の遺伝材料、または中国生物標本;および派生データは、中国生物標本(中国生物標本とともに、中国生物標本と呼ばれる)であり、このような物品を外国当事者に提供する。“岸と海外の実体及び個人が設立或いは実際に制御する在岸及びオフショア機関は、中国でのいかなる中国由来の高GRの収集又は生物バンクの収集、及び中国からこのような中国由来の高GRを提供することを禁止する。中国の締約国は、いくつかの高GRの収集とすべての高GRのバイオバンクの承認を事前に得る必要がある。中国生物サンプルのいかなる輸出或いは国境を越えた譲渡も許可を得る必要があり、中国締結方向外国締約国或いはそれによって設立或いは実際に制御された実体譲渡派生データはまた、中国側が譲渡前に中国人類遺伝資源管理弁公室(HGRAO)にデータコピーを提出し、届出を行い、通知届出番号を得て譲渡する必要がある。“HGR条例”はまた、外国側当事者が中国側当事者が国際協力に十分に参加することを確保し、中国側当事者とすべての記録とデータを共有することを要求している。
もし中国側がデータ保護の法律、法規、実践基準を守らなければ、私たちの研究データは許可されていない人によって取得され、不適切に使用されたり、開示されたり、廃棄されたりすれば、私たちは私たちの機密情報を失い、訴訟と政府の法執行行動の影響を受ける可能性がある。これらの法律は、私たちまたは私たちの協力者の実践と一致しない方法で解釈および応用される可能性があり、関連して行われている臨床試験の一時停止または新しい試験の開始の遅延、中国由来のHGR、行政罰金の没収、違法な所得の返還または一時的または永久的に私たちまたは私たちの協力者の実体と担当者のさらなる臨床試験を禁止する可能性があり、それによって、事実上禁止されている実体が中国で新しい臨床試験を開始することを禁止する。現在まで、HGRAOはいくつかのHGR違反事件を開示してきた。あるケースでは、制裁された一方は多国籍製薬会社の中国子会社であり、同社は特定の未承認の研究を行うためにCROにある生物製剤を不正に転移させていることが発見された。HGRAOはこの多国籍製薬会社の中国子会社に修正措置を要求し、HGRAOが修正結果に満足するまで、HGRAOに任意の臨床試験申請を提出することを禁止し、禁止解除前に中国で新しい臨床試験を開始することができなかった。別の事件では、多国籍製薬会社の中国子会社が招聘したCROが、HGRAOの承認を加速するために道徳委員会の承認を偽造したことが発見された。この多国籍製薬会社の中国子会社とCROはそれぞれ6~12ヶ月以内に新しい申請を開始することを禁止されている。
中国HGRのコントロールを更に強化するため、全人代常務委員会は2020年12月26日に“人民刑法Republic of China修正案”を発表し、2021年3月1日から施行し、中国HGRを不法に収集し、中国HGRを中国国外に不法に移転し、安全審査評価を経ずに中国HGRを外国当事者或いはその設立或いは実際にコントロールする単位に移した行為を犯罪とした。上記のいずれかの違法行為を犯した個人は、規制、刑事拘留、最高7年の懲役および/または刑事罰金を受けることができる。2020年10月、全人代常務委員会は“人民Republic of China生物安全法”を採択し、2021年4月15日から施行した。“中華人民共和国生物安全法”はHGRと生物資源の安全監督管理を含む完全な制度を確立して中国の生物安全関連活動を規範化する。“中華人民共和国生物安全法”は初めて中国がその生物安全資源に対して主権を持つことを明確に宣言し、さらに“生物安全条例”を認可し、中国が海外機関に対して中国由来の生物安全資源を使用するために確立した基本的な監督管理原則と制度を認めた。“中華人民共和国生物安全法”はハイリスク遺伝子組換えに対していかなる具体的な新しい監督管理要求を提出していないが、これは中国の最高立法機関が通過する法律であるが、それは中国が存在するハイリスク遺伝子組換えの主要な監督機関である科学技術部--あるいは最大、明らかにより多くの権力と裁量権を与えてハイリスク遺伝子組換えを監督するため、中国由来のハイリスク遺伝子組換えの全体的な監督管理構造は変化し、より厳格かつ複雑になることが予想される。また、中国などではデータ保護法の解釈や適用は不確定で変化していることが多い。
また、米国では、連邦および州レベルで、香港、マカオ、シンガポール、韓国、台湾、タイを含む当社のライセンス製品候補製品の開発·商業化を計画し、計画している大陸以外の地域では、プライバシー、個人情報保護、データセキュリティに関する法律法規の制約を受けています。安全違反通知法、健康情報プライバシー法、および消費者保護法を含む多くの法律および法規、健康に関連する個人情報および他の個人情報の収集、使用、開示、および保護を管理する。これらの法律の多変性性と変化しつつある状態を考慮して、私たちは新しい要求の正確な解釈の不確実性に直面しており、私たちは規制機関や裁判所がその解釈で要求するすべての措置を成功させることができないかもしれない。
私たちは、これらのデータ保護と譲渡法律法規が将来的に規制機関からより多くの関心と注目を受けることが予想され、私たちは引き続き不確実性に直面する、すなわち、中国、アメリカ、そして私たちが業務を計画または展開する他の国/地域で変化していくデータ保護、プライバシー、セキュリティ法的義務を遵守するための努力が十分であるかどうか。
もし私たちが適用された法律および法規を遵守できなかったか、または遵守できなかった場合、名声の損傷や政府の実体、個人、または他の人が私たちに訴訟を提起したり、行動したりする可能性がある。これらの訴訟や行動は、私たちに重大な民事或いは刑事罰と負の宣伝を受けさせ、ある個人情報の遅延或いは移転停止或いは没収を招き、行われている臨床試験の一時停止或いは新しい試験の開始を招き、私たちに業務のやり方を変更し、コストを増加させ、私たちの業務、将来性、財務状況、運営結果に実質的な損害を与えることを要求する。さらに、私たちと将来の顧客、サプライヤー、医薬パートナー、および他の第三者との関係は、私たちに対する任意の訴訟または行動、または適用法(EU一般データ保護法規、ネットワークセキュリティ法、およびHGR法規を含む)によって彼らに課せられた現在または未来のデータ保護義務の負の影響を受ける可能性がある。さらに、個人情報(健康情報を含む)に影響を与えるデータ漏洩や適用要件を遵守できなかったことは、大量の管理リソース、法律および財務リスク、および名声被害を招く可能性があり、これは、私たちの業務および運営結果に大きな悪影響を及ぼす可能性がある。また、“データ安全法”による法的不確実性や中国政府の最近の行動は、米国市場での証券の後続発行への参加を含む、有利な条件で資金を調達する能力に重大な悪影響を及ぼす可能性がある。たとえ私たちのやり方が法的挑戦を受けなくても、プライバシー問題に対する見方は、有効かどうかにかかわらず、私たちの名声やブランドを損なう可能性があり、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
私たちの普通株に関するリスクは
私たちの普通株の取引価格は変動するかもしれません。これはあなたに大きな損失をもたらすかもしれません。
私たちの普通株の取引価格は変動する可能性があり、様々な要素によって大幅に変動する可能性があり、その多くの要素はコントロールできません。また、他の主要業務が中国に位置する米国上場企業の市場価格の表現や変動は、我々普通株の価格や取引量の変動に影響を与える可能性がある。その中のいくつかの会社は著しい変動を経験した。これらの中国会社株の上場時あるいは上場後の取引表現は、投資家の他のアメリカに上場している中国会社に対する全体的な感情に影響を与える可能性があり、それによって私たちの普通株の取引表現に影響を与える可能性がある。
市場と業界の要素を除いて、特定の商業的な理由で、私たちの普通株の価格と取引量は非常に不安定になる可能性があります
| ● |
承認された公告または完全な返信、または私たちの候補製品の使用のための特定のラベル表示または患者集団、または規制審査中の変更または遅延; |
| ● |
私たちや競争相手は革新や新製品の治療を発表します |
| ● |
規制当局が私たちの臨床試験、製造サプライチェーン、または販売、マーケティング活動に取った不利な行動 |
| ● |
私たちは製造業者やサプライヤーとの関係のどんな不利な変化もあります |
| ● |
私たちのテストと臨床試験の結果 |
| ● |
私たちはより多くの候補製品の結果を得るために努力しています |
| ● |
私たちの既存の候補製品や臨床前研究と臨床試験に関連する費用レベルの変化 |
| ● |
知的財産権侵害に関わっているかもしれません |
| ● |
私たちの競争相手や製薬業界全体の発表について |
| ● |
予想される製品販売と収益性を達成する |
| ● |
製造、供給、流通不足 |
| ● |
私たちの経営結果は違います |
| ● |
私たちの収益に関する公告はアナリストの予想と一致しない |
| ● |
第三者(政府統計機関を含む)が発表した運営または業界指標は、業界または財務アナリストの予想とは異なる |
| ● |
証券研究アナリストの研究報告と財務推定変動 |
| ● |
新しい製品とサービスの提供、買収、戦略関係、合弁企業または資本約束は、私たちまたは私たちの競争相手によって発表されます |
| ● |
私たちの業務に関する新聞記事は本当であろうとなかろうと |
| ● |
私たちの経営陣を増やしたり離れたりします |
| ● |
人民元の対ドルレートの変動 |
| ● |
私たちが発行した普通株式のロックまたは他の譲渡制限を解除または終了します |
| ● |
追加普通株の販売または潜在的な販売を期待する |
| ● |
私たち、私たちの幹部と役員、あるいは私たちの株主は未来に私たちの普通株を売却します |
| ● |
全体的な経済と市場状況と米国株式市場の全体的な変動 |
| ● |
会計原則の変化 |
| ● |
中国や世界的な規制環境の変化や発展。 |
これらの要素のいずれも、私たちの普通株の取引量と取引価格に重大で突然の変化をもたらす可能性がある。従来、ある会社の証券市場価格が変動した後、株主は通常、同社に対して証券集団訴訟を起こしていた。私たちが集団訴訟に巻き込まれれば、経営陣の注意を分散させる可能性があり、不利な裁決が下されれば、私たちの財務状況や運営結果に大きな悪影響を及ぼすことになる。
また,株式市場や小型製薬やバイオテクノロジー会社は極端な価格や数量変動を経験しており,これらの変動はこれらの会社の経営業績に関係なくあるいは比例しないことが多い。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格にマイナス影響を与える可能性がある。また、私たちがコントロールできない金融市場に関連する要素は、私たちの普通株価格を迅速かつ意外に下落させる可能性がある。
公開市場で私たちの普通株を大量に販売したり売ることは私たちの普通株価格を大幅に下落させる可能性があります。
公開市場で私たちの普通株や他の株式証券を売却したり、これらの売却が発生する可能性があると考えたりすることは、私たちの普通株の市場価格を大幅に低下させる可能性がある。2022年3月1日まで、私たちは38,928,922株の普通株が発行されました。これらの株式のうち、17,232,397株の普通株は証券法に基づいて登録されており、当社“連属会社”以外の者が自由に譲渡することができ、制限または登録を受けず、残りの発行済み株式は証券法に基づいて登録されておらず、有効な登録声明または既存の免除登録要求に基づいて発売または販売することができる。もしこれらの株が公開市場で販売されている場合、あるいはそれらが売却されると思われれば、私たちの普通株の取引価格は低下する可能性がある。
私たちは予測可能な未来に配当金を発行しないと予想されているので、あなたは普通株の価格上昇に依存して投資収益を得なければなりません。
私たちは私たちの利用可能な資金と収益の大部分(すべてでなければ)を保留し、私たちの業務の発展と成長に資金を提供するつもりだ。したがって、私たちは予測可能な未来に何の現金配当金も送らないと予想している。したがって、あなたは私たちの普通株への投資を未来の配当収入の源として依存してはいけない。
私たちの取締役会は配当金を分配するかどうかについて大きな裁量権を持っている。私たちの株主は一般決議で配当を発表することができるが、配当は取締役会が提案した額を超えてはならない。私たちの取締役会が配当金を発表して支払うことを決定しても、将来の配当の時間、金額、形式(あれば)は、私たちの将来の経営業績とキャッシュフロー、私たちの資本要求と黒字、私たちが子会社から得た割り当て金額(あれば)、私たちの財務状況、契約制限、取締役会が関連していると思う他の要素に依存します。したがって、貴社の私たち普通株への投資リターンは、普通株の将来のいかなる価格付加価値にも完全に依存する可能性があります。私たちの普通株は値上がりしないかもしれませんし、普通株を購入した時の価格さえ維持しないかもしれません。普通株への投資は報われないかもしれませんし、普通株へのすべての投資を失う可能性もあります。
私たちはケイマン諸島の免税会社です。ケイマン諸島法律の株主権利に対する司法判例は米国の法律よりも限られているため、株主が持つ株主権利は米国の法律下のものよりも少ない可能性がある。
当社の会社事務は、当社が改訂及び再記述した組織定款の大綱及び細則(時々改正されることがあります)、ケイマン諸島会社法(改正された)及びケイマン諸島一般法又は会社法によって管轄されています。株主が取締役を提訴する権利,少数株主の訴訟および取締役の受託責任はケイマン諸島普通法の管轄を大きく受けている。ケイマン諸島の一般法の一部は,ケイマン諸島の比較的限られた司法判例やイギリス一般法に由来しており,これらの裁判所の裁決はケイマン諸島の裁判所に説得力があるが,拘束力はない。ケイマン諸島の法律によると、私たちの株主の権利と役員の受託責任は、米国のある司法管轄区域の法規や司法前例のように明確に確立されていない。特に、ケイマン諸島の証券法システムは米国よりも発達している。米国のいくつかの州、例えばデラウェア州、会社法機関はケイマン諸島よりも完備されており、司法解釈も十分である。また、ケイマン諸島会社は米連邦裁判所で株主派生訴訟を起こす資格がないかもしれない。
また、ケイマン諸島免除会社の株主として、ケイマン諸島法律によると、我々の株主は、一般的に会社の記録を調べる権利がない(我々の組織定款大綱や定款細則、私たちの担保および抵当登記簿および私たち株主の特別決議を除く)、または私たちのメンバー登録簿の写しを得る。私たちの改正と再記述された組織規約によると、私たちの取締役は、私たちの株主がどのような条件で当社の記録を閲覧できるかを決定する権利がありますが、これらの記録を株主に提供する義務はありません。これは、株主が発議するために必要な任意の事実を決定するために、または依頼書競争について他の株主に依頼書を募集するために必要な情報を得ることを困難にする可能性がある。ケイマン諸島の免除会社として、私たちはアメリカ連邦裁判所でデリバティブ訴訟を提起する資格がないかもしれません。したがって、もしあなたが損害を受けた場合、あなたがアメリカ連邦裁判所で訴訟を提起する方法は、あなたが自分の利益を保護する能力を制限するかもしれません。また、ケイマン諸島会社の株主は、米連邦裁判所で株主派生訴訟を起こす資格がない可能性がある。
上記の理由により、公衆株主は、管理職、取締役会メンバー、または持株株主の行動に直面した場合、米国会社である公衆株主よりも自分の利益を保護することが困難になる可能性がある。
あなたはあなたの利益を保護する上で困難に直面するかもしれません。あなたがアメリカ連邦裁判所を通じてあなたの権利を保護する能力は制限されるかもしれません。なぜなら私たちはケイマン諸島の法律登録によって成立し、私たちの一部の役員はアメリカ以外に住んでいます。
私たちはケイマン諸島で免除会社として登録した。私たちの取締役の一部はアメリカ国外に住んでいて、彼らの資産の大部分はアメリカ国外にあります。したがって、あなたの権利がアメリカ証券法や他の方面から侵害されていると思うなら、あなたはケイマン諸島や中国で私たちやこれらの個人に訴訟を提起することが難しいか不可能かもしれません。あなたがこのような訴訟を提起することに成功しても、ケイマン諸島と中国の法律は、私たちの資産や私たちの役員や上級管理者に対する資産の判決を実行できないかもしれません。ケイマン諸島は、管轄権を有する外国裁判所の外国通貨判決を一般的に認め、執行するにもかかわらず、関連論争の是非を再検討することなく、米国または中国で得られた判決の法定承認を認めていないが、(1)判決に対する違約金の支払い責任を判定債務者に課すこと、(2)最終的であること、(3)税収、罰金、または罰金には触れないことを条件とする。そして(4)は何らかの方法で得られたものでもなく,自然正義やケイマン諸島の公共政策に違反した強制執行でもない.
私たちの会社の行動は私たちの役員、役員、その他の主要株主によって大きくコントロールされています。彼らは重要な会社事務に大きな影響を与えることができます。これは私たちの普通株の価格を下げ、普通株のプレミアムを得る機会を奪う可能性があります。
2022年3月1日現在、私たちの役員、役員、私たちの普通株の10%以上を持つ株主実益は、私たちの約42.05%の普通株を持っています。当社の行政総裁Huangおよび主要株主の賈林清さんも、万春生物科学技術実益を通じて万春プリン37.99%の株式を所有しています。これらの株主が一緒に行動すれば、取締役の選挙や重大な合併、買収、その他の商業合併取引などの事項の承認に大きな影響を与える可能性がある。このような所有権の集中は、わが社の支配権変更を阻害、延期、または阻止する可能性もあり、これは、わが社の株主がわが社を売却する過程で割増の機会を獲得し、私たちの普通株の価格を下げるという二重の影響を与える可能性がある。私たちの他の株主が私たちの普通株式保有者を含めて反対しても、このような行動は取られるかもしれない。しかも、この人たちは私たちから彼ら自身や他の人たちにビジネス機会を移すかもしれない。
上場企業として、私たちの運営コストが増加し、私たちの経営陣は、新しいコンプライアンス措置やコーポレートガバナンス実践を実施するために多くの時間を投入する必要があります。
上場企業として、私たちは巨額の法律、会計、その他の費用を招いた。サバンズ-オクスリ法案、ドッド-フランクウォール街改革と消費者保護法案、ナスダック資本市場の上場要求、その他の適用される証券規則と法規は上場企業に対して様々な要求を提出し、有効な開示、財務制御、会社管理のやり方を確立と維持することを含む。私たちの経営陣と他の人たちはこのようなコンプライアンス計画に多くの時間を投じた。
“サバンズ·オキシリー法”第404条によると、本年度報告書のForm 20-Fに関連する当社の経営陣が提出した財務報告書の内部統制に関する報告書を提出しなければならない。しかし、私たちはまだ新興成長型企業であるにもかかわらず、私たちの独立公認会計士事務所が発表した財務報告書の内部統制に関する認証報告書を含むことは要求されません。“サバンズ-オキシリー法”404条を遵守するために、私たちは費用が高く、挑戦的な財務報告書に対する私たちの内部統制の過程を記録して評価する過程に参加した。この点では、外部コンサルタントを招聘することが可能な内部資源を投入し続け、財務報告内部制御の十分性を評価·記録することにより、財務報告内部制御の十分性を評価·記録し、適宜ステップ改善制御プログラムを採用し、テストにより制御がファイルのように機能しているかどうかを検証し、財務報告内部制御の継続報告及び改善手順を実施する。私たちが努力したにもかかわらず、私たちは規定された時間枠内で結論を出すことができないかもしれない、すなわち、私たちは財務報告書の内部統制に有効であり、サバンズ-オキシック法404条の要求に適合するかもしれない。1つまたは複数の重大な弱点を発見すれば、財務諸表の信頼性に対する自信を失った金融市場の不良反応を招く可能性がある。
私たちは家族です“新興成長型会社”新興成長型企業に適用されるより低い開示要求を利用して、我々の普通株の投資家への吸引力を低下させる可能性がある。
私たちはJOBS法案で定義されている“新興成長型企業”であり、サバンズ-オックス法404(B)条の監査人認証要件の遵守が要求されないこと、役員報酬と株主承認までに承認されていない金パラシュート支払いに対する非拘束性相談投票の要求を免除することなど、“新興成長型会社”ではない他の上場企業に適用される様々な報告要件のいくつかの免除を利用する予定である。私たちは投資家が私たちがこのような免除に依存する可能性があるために私たちの普通株の吸引力が低下していることを発見するかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株取引市場はそれほど活発ではなくなる可能性があり、私たちの普通株の価格はもっと変動するかもしれない。私たちは私たちがこれ以上新興成長型会社ではないまで、このような報告書免除を利用するかもしれない。私たちは、2022年12月31日、つまり2017年3月14日5周年以降の会計年度の最後の日まで、新興成長型会社となります。
外国の個人発行者として、私たちは米国証券法で規定されている多くの規則に制約されておらず、米国会社よりも米国証券取引委員会に提出することが許可されている情報が少ない。これは私たちの普通株式保有者が得ることができる情報を制限するかもしれない。
我々は、米国証券取引委員会規則および条例で定義されている“外国個人発行者”であるため、米国内で組織された上場企業のすべての開示要求に適用される制約を受けない。例えば、取引法第14節以下の米国委託書規則を含む、取引法に基づいて登録された証券の委託、同意または許可に適用される開示義務および手続き要件を規範化した取引法下のいくつかの規則の制約を受けない。また、我々の上級管理者及び取締役は、我々の証券を購入及び販売する際には、取引法第16条及び関連規則の報告及び“短期”利益回収条項の制約を受けない。また,米国国内発行者のように頻繁にあるいは迅速に米国証券取引委員会に定期報告や財務諸表を提出する必要はなく,取引法に基づいてForm 10−Q四半期報告や現在のForm 8−K報告を提出することも要求されない。そのため、私たちが外国の個人発行者ではないよりも、わが社に関する公開情報が少ない。
外国の個人発行者として、私たちは会社の管理問題にいくつかのナスダック資本市場会社の管理上場基準とは大きく異なる母国のやり方を採用することを許可された。これらのやり方は、当社が上場基準を完全に遵守している場合に比べて、株主への保護が少ない可能性があります。
ナスダック資本市場に上場する海外民営発行者として、私たちは会社の管理上場基準の制約を受けている。しかし、規則は私たちのような外国の個人発行者が自国の会社管理慣行に従うことを可能にする。ケイマン諸島のある会社の管理やり方は会社の管理上場基準とは大きく異なるかもしれない。例えば、ケイマン諸島の法律によると、毎年年次株主総会を行う必要はありません。私たちは通常、母国の年次会議に関するやり方に従っており、2021年に年次株主総会を開催していません。我々は2021年3月15日に特別株主総会を開催し、株主に2017年総合インセンティブ計画(以下の定義)の承認を求めた。株主の承認を必要とする事項がある場合にのみ、将来的に年次株主総会を開催することを予想しています。
現在、私たちはナスダック資本市場会社の上場基準を完全に遵守し、引き続き完全に遵守し続けるつもりだ。また、上記の年次総会慣例を除いて、我々のコーポレートガバナンス慣行は、米国国内会社がナスダック株式市場規則に準拠しているコーポレートガバナンス慣行と有意差はない。しかし、私たちは未来に特定の母国の接近法に従うことを選択するかもしれない。そのため、米国国内発行者に適用されるコーポレートガバナンス上場基準に比べて、我々の株主が得る可能性のある保護は少ない。
私たちは未来に外国の個人発行者の地位を失うかもしれないし、これは多くの追加的な費用と支出を招くかもしれない。
私たちは現在、外国のプライベート発行者の資格を満たしていますが、外国のプライベート発行者の地位の決定は、発行者が最近完成した第2四半期の最終営業日に行われていますので、次回の決定は2022年6月30日に行われます。
将来的に、私たちが関連する決定日に外国の個人発行者の地位を維持するために必要な要求を満たしていなければ、私たちは外国の個人発行者の身分を失う。例えば、私たちの50%以上の証券をアメリカ住民が保有していれば、私たちの経営陣や取締役会のメンバーの50%以上がアメリカ住民や市民であり、私たちは外国の個人発行者の身分を失う可能性がある。
アメリカ証券法によると、私たちのアメリカ国内発行者としての規制とコンプライアンスコストは、外国の個人発行者としてのコストよりもはるかに高いかもしれません。もし私たちが外国の個人発行者でなければ、私たちはいくつかの点で外国の個人発行者が利用できる表よりも詳細で広いアメリカ国内発行者テーブルの定期報告書と登録説明書をアメリカ証券取引委員会に提出することを要求されるだろう。私たちは、米国内の発行者に関連するコーポレートガバナンスのやり方に適合するために、私たちのいくつかの政策の修正を要求されるだろう。また、私たちは、依頼書の募集に関連する手続き要求の免除のような、米国証券取引所が外国の個人発行者に提供するいくつかの企業統治要求の免除に依存できない可能性がある。
私たちはもっと大きな証券集団訴訟の危険に直面しているかもしれない。
歴史的に見ると、証券集団訴訟は通常、ある会社の証券市場価格が下落した後に提起される。このリスクは,バイオテクノロジーやバイオ製薬会社が近年大幅な株価変動を経験しているため,特に我々と関連している。もし私たちが起訴されれば、巨額のコストを招き、経営陣の注意と資源を移す可能性があり、これは私たちの業務を損なう可能性がある。
アメリカ連邦所得税の目的で、私たちは受動的な外国投資会社、あるいはPFICと呼ばれるかもしれません。これは私たちのアメリカ株主に不利なアメリカ連邦所得税の結果をもたらすかもしれません。
米国連邦所得税の場合、以下のいずれかの課税年度において、米国連邦所得税委員会と呼ばれる非米国会社は、(I)総収入の少なくとも75%が“受動的収入”であるか、または(Ii)その資産価値の少なくとも50%(通常は四半期平均値から決定される)が、受動的収入を生成するために所有されているかまたは所有する資産に起因することができる。私たちが個人私募株式投資会社であるかどうかは、課税年度終了後毎年行われている事実決定です。この決定は、我々の収入と資産の構成、および私たちの資産価値に依存する(通常、私たちの普通株の公開価格を参考にして決定され、普通株価格が大幅に変動する可能性がある)。
2021年12月31日までの納税年度ではPFICに分類されていない可能性が高いと考えられるが,数年前はPFICに分類されており,将来的には再びPFICに分類される可能性があり,米国株主に不利な米国連邦所得税結果をもたらす可能性がある。2022年12月31日までの本納税年度は,我々のPFIC地位は納税年度終了後に決定される。本課税年度または将来のいかなる課税年度内に、私たちは個人投資会社にならないことを保証できません。
もし私たちがアメリカ株主が私たちの普通株を保有する任意の納税年度のPFICであれば、これらのアメリカ株主は、私たちの普通株を売却して達成された収益を含む不利なアメリカ連邦所得税の結果の影響を受ける可能性があり、資本利益ではなく、個人アメリカ株主にとって、私たちの普通株から受けた配当に適した優遇料率が失われ、私たちの利息費用が私たちの分配と私たち普通株の販売収益に適用される。また。もし私たちが米国株主が私たちの普通株を持っている任意の納税年度のPFICであれば、これらのアメリカ株主にとっては、次の年にPFICに分類される上記テストのいずれにも適合しなくてもPFICとみなされ続ける。“付加情報-E.税金-米国連邦所得税の考慮事項”を参照してください
米国国税局(IRS)は、米国連邦所得税を納めるために米国会社とみなされるべきではないという結論に同意しないかもしれない。
米国の現行の連邦所得税法によると、会社は通常、その組織や会社の管轄内の税務住民とされている。したがって、ケイマン諸島の法律に基づいて設立された会社として、米国連邦所得税については、通常、非米国会社に分類されるべきである(したがって、非米国税務住民にも分類されるべきである)。しかし、場合によっては、改正された1986年の米国国税法第7874条またはこの法典によると、米国国外で設立された会社は米国会社とみなされる(したがって、米国税務住民とみなされる)。
2015年7月、私たちは内部再編を完了した。内部再編時の有効な規則によると、内部再編は、規則第7874条に基づいて米国連邦所得税の目的とされている米国会社にはつながらないと予想される。しかし,第7874条の規則や例外は複雑であり,事実や法的不確実性の影響を受けているため,米国連邦所得税会社とみなされない保証はない。“項目10.添付情報-E.税務-米国連邦所得税の注意事項-万春医薬会社の米国連邦所得税に関する居住税”を参照してください
| 第四項です。 |
会社についての情報 |
| A. |
会社の歴史と発展 |
万春医薬は2014年11月21日にケイマン諸島の法律により免除会社として登録された。2015年7月、私たちは内部再編を完了した。
私たちの主な実行事務室はニューヨーク自由街二十八号、三十九階、NY 10005にあります。電話番号は+1(646)3056387です。ケイマン諸島の登録事務所はケイマン諸島KY 1-1002 Grand Cayman KY 1-1002郵便ポスト10240号港湾広場4階ハニス信託(ケイマン)有限会社のオフィスにあります。わが社のアメリカでの代理はCT Corporation System、郵便番号:10005、郵便番号:ニューヨーク、自由街28号、42階です。私たちのサイトはwww.beyondspringpharma.comです。当社サイトに掲載されているか、本サイトで取得可能な情報は、本20-F表年次報告の一部を構成しておらず、参考までに含まれていません。
初公開、同時方向性増発、後続融資と業務発展
2017年3月には、初公募と同時に行われた私募を完了し、引受割引と手数料および費用と支出を差し引いた後、初公募株から174,286株の普通株を売却することと、今回の私募で2,541,048株の普通株を売却することから引受割引と手数料およびその他の発売費用を差し引く前に、5430万ドルの総収益を得た。私たちの普通株はナスダック資本市場に上場し、コードは“BYSI”です
2018年5月、著者らはいくつかの第三者投資家と複数の合意を締結し、739,095株の普通株を発行し、1株当たり額面0.0001ドル、総現金代価は2,000万ドルあるいは1株当たり2,706ドルであった。これまで、私たちは融資から1,400万ドルを獲得し、2021年10月に投資家から投資に関連して発行された221,729株の普通株を渡してくれましたが、私たちは現金の対価格を受け取っていません。
2019年5月21日、公開市場販売契約を締結しましたSMJefferies LLCを販売エージェントまたはエージェントとし、この販売プロトコルは、2020年2月7日に改訂されたか、または改訂された販売プロトコルは、我々の“市場割引”計画またはATM計画に関連する。販売契約によると、吾らは時々代理店を通じて合計最大2,202,080株の普通株を発売·販売することができる。本年度報告Form 20−Fの日までに,ATM計画により630,228株の普通株を売却し,総収益は1,320万ドルであった。
2019年6月と7月、私たちの一部の株式を持っている中国子会社の万春布林と万春生物科学技術はEfung Capitalをはじめとするある投資家にその株式或いは株式購入を売却することで最終合意に達した。持分購入契約によると、万春プリンは万春プリンの3.38%の株式を売却し、総現金対価は人民元7,000万元、または約1,010万ドルであり、その後発売費用を差し引く。
2019年7月、私たちは1回の引受発行を完了し、2,058,825株の普通株を売却し、引受割引と手数料、その他の発行費用を差し引く前に、3500万ドルの毛収入を得た。
2019年10月と11月に、1回の貸切発行を完了し、1,908,996株の普通株の売却から引受割引と手数料、その他の発行費用を差し引く前に、2,580万ドルの毛収入(引受業者の追加株式購入の選択権の行使を含む)を得た。
2020年6月には、1回のパッケージ発行と1回の同時指向増発を完了し、2,604,115株の普通株式の売却から引受割引と手数料およびその他の発行費用を差し引く前に、3,390万ドルの総収益(引受業者の追加株式購入の選択権の行使を含む)を獲得した。
2020年11月には、8,625,000株の普通株から引受割引と手数料、その他の発行費用を差し引く前に、8,630万ドルの毛収入(引受業者の追加株式購入の選択権を含む)を獲得した。
2020年11月、我々の子会社SEEDは礼来会社と研究協力と許可協定を締結し、TPDを通じて治療効果を産生できる新しい化学実体を発見と開発し、SEEDは1500万ドルの前払い現金と初期株式投資を獲得した。SEEDはまた,最高約7.8億ドルの潜在的臨床前と臨床開発,規制,ビジネスマイルストーン,および協力による製品純売上高の分級特許権使用料を得る資格がある。“プロジェクト4.会社に関する情報-B.業務概要-その他の計画-SEEDの標的蛋白分解(TPD)プラットフォーム”を参照
2021年8月、我々の株式の一部は中国子会社の万春布林と恒瑞と独占商業化と共同開発協定を締結し、ブリブリンの大中国でのさらなる開発と商業化を実現した。合意条項によると、万春プリンは恒瑞に独占的権利を付与し、大陸部中国及び香港、マカオ及び台湾を含む大中国市場で商業化及びプリブリンを共同開発する。万春プリンはブリブリンの大中国市場における製造権を保持し、プリブリンの同などの市場でのすべての販売純収益を獲得する。恒瑞は四半期ごとに所定の割合の純売上高を獲得する。万春プリンは2億元(約3100万ドル)の前金を獲得し、11億元(約1億71億ドル)にのぼる監督·販売マイルストーンを獲得する。恒瑞はブリブリンの大中国市場での商業化のすべての費用を担当する。合意条項によると、万春プリンはプリプリンの最初の2つの適応の100%臨床と監督管理コストを担当する:CINと非小細胞肺癌(EGFR野生型)の第二/三線治療の予防。恒瑞は大中国市場におけるプリブリンの追加適応に50%の臨床開発コストを提供し、そして1つの連合指導委員会が臨床戦略と優先事項を監督する。“プロジェクト4.会社情報--B.業務概要--商業化”を参照
| B. |
業務の概要 |
要約.要約
我々は臨床段階のグローバルバイオ製薬会社であり,革新的な癌療法の開発に専念し,高度に満たされていない医療ニーズの高い患者の臨床結果を改善する。我々の主要資産であるプリブリンは一流の選択的免疫調節微小管結合剤(SIMBA)であり,多くの癌適応の“薬物パイプライン”として開発されている。我々はまだ3種類の小分子免疫剤を開発しており,現在臨床前段階にある。また,我々の子会社SEEDは,独自の標的タンパク質分解(TPD)プラットフォーム,あるいは“分子ガム”技術を利用して,内部研究開発と協力により革新的な治療剤を開発している。種子会社は礼来会社と協力して、この独特なTPDプラットフォームを通じて新しい化学実体を発見と開発し、それによって治療効果を産生する。
まず、私たちは、CINの予防における潜在的利益を決定するために、パイオグリプチンを含むプリブリン単独またはG−CSFとの併用を検討している。2020年9月、この組み合わせはFDAとNMPAの画期的な治療称号を獲得した。保護性の2期3期登録研究結果に基づき,2021年3月にプリブリン連合G−CSF予防CINのNDAをFDAとNMPAに提出した。FDAと国家食品薬品監督管理局はNDA申請を受け入れ、優先審査地位を持っている。FDAは2021年11月、プリブリン連合G-CSFによるCIN予防の完全な返信を発表した。国家食品薬品監督管理局はCIN予防適応のNDAを審査している。
次に,プリブリンは抗癌薬としてドセタキセルと併用して非小細胞肺癌,EGFR野生型の二線および三線治療(ダブリン−3期3登録研究)のために使用されている。ダブリン-3号研究はすでに559人の患者の全世界募集を完了し、この研究の最終陽性背線結果は2021年8月と2021年9月にESMOで発表され、中国は2022年下半期にNDA申請を提出する可能性がある。
最後に,プリブリンは研究者による試験を行っており,様々な免疫腫瘍剤との併用治療の潜在力を研究しており,これらの薬剤は,1)カリフォルニア大学サンディエゴ校とワシントン大学でPD−1抗体nivolumabを併用して非小細胞肺癌を治療する,2)ロッグス大学と米国の他の臨床センターでnivolumabとCTLA−4抗体ipilimumabを併用して小細胞肺癌を治療する,3)PD−1あるいはPD−L 1抗体と放射線治療MD Anderson癌センターの各種癌を併用する。
私たちの主な執行事務所はニューヨークに設置され、ニュージャージー州、ペンシルベニア州、北京と大連、中国にも事務所が設置されている。私たちはケイマン諸島に登録して設立した。著者らの管理チームは生物、化学、薬物研究開発、臨床開発、監督管理と資本市場の面で豊富な経験と能力を持っている。
プリブリン私たちの主な候補薬は
プリブリンは海洋微生物から発見された天然化合物から抽出した一流の新しい小分子である。それは1種の選択的免疫調節微小管結合剤(SIMBA)であり、多種の治療機会を提供することができる。プリブリンは相対的に低分子質量の小分子薬物であり、製造は比較的に簡単である。プリプリンなどの天然産物とその誘導体の1つの利点は,他の人が類似した活性を有する構造の異なる分子を発見することが困難である可能性があることである。
プリブリンは免疫防御タンパク質を誘発しますHSPCへの影響は,プリブリンはCINを予防するだけでなく,患者循環中のCD 34+細胞を増加させることができると解釈できる。プリブリンは潜在的な“薬物チューブ”として様々な免疫腫瘍学的薬物と結合して広く研究されており,これらの薬剤はPD−1/PD−L 1抗体の効果を増強する可能性がある。このメカニズムの解明は,我々,バーゼル大学,マサチューセッツ州総病院とMD Andersonとの長年の協力努力である。
全体的に言えば,本年度報告20−F表の日付までに,プリブリンは700名以上の進行癌患者に使用されており,これまで全体的な耐性は良好であった。完成して行われている臨床試験からのデータから,プリブリンは末期NSCLCの治療とCIN予防に進む道があると考えられる。
プリブリンは子宮頚上皮内腫瘍を予防する
CIN概要
好中球減少症は好中球の血中濃度が異常に低い白血球であり,骨髄中の異常破壊率や白血球合成率の低さによる可能性がある。好中球減少症はその重症度によって分類されるが,重症度は通常好中球数に依存する。好中球絶対数は500個/mm~3(0.5×109/L)以下は4級好中球減少症であり、好中球数は500~1000個/mm~3(0.5~1.0×109/L)は3級好中球減少症である。好中球数が低い患者は細菌感染と敗血症が発生しやすく、これは癌患者の発病率と死亡率の重要な原因である。癌予防·コントロールセンターのデータによると,米国では年間6万人を超える患者が発熱による好中球減少症で入院しており,CIN領域で改善結果を提供できる製品の成長機会を表している。これらの患者の死亡率は9%から18%であった。
好中球減少は大多数の化学療法の重要な制限要素である。現在、好中球減少症を治療する標準はG-CSFに基づく生物薬物であり、G-CSFは好中球増殖、分化と成熟を刺激するヒト増殖因子である。1991年にNeupogen(非格司ティム)が承認されて以来、G-CSFを用いたCINの治療或いは予防は看護の基準となってきた。G−CSFはフィグリチウムとポリエチレングリコールモノクロナル抗体を含み,後者は長時間作用性のフィグリチウムである。単一療法G-CSFは深刻な好中球減少症(DSN)の持続時間を短縮したが、80%を超える患者は依然として4級好中球減少を経験し、これは化学療法の相対用量強度の減少、化学療法方案の低下、化学療法計画の延期と化学療法停止の最もよく見られる原因であり、これらはすべて患者の長期生存結果に負の影響を与える。また,G−CSFは化学療法の同日には投与できなかったが,単一療法G−CSF産生骨髄拡張は骨痛をきたした。発売後の患者調査によると、59%から71%の患者が骨痛を経験したことが報告されており、その約4分の1の患者が痛みが深刻であると述べている
2018年から2040年までの間に、第1周期化学療法の数は53%増加すると予想される。IQVIAからの業界報告(NPSデータ,2020年1月から12月)によると,現在米国CIN市場規模は約40億ドルであり,単位数は増加している。国家総合癌ネットワーク(NCCN)ガイドラインの変化に伴い、CINを予防する中等リスク化学療法患者を含み、潜在市場は100%以上増加し、著者らは腫瘍学者が引き続きこれらの中等リスク患者をより積極的に予防することに伴い、市場は引き続き増加することが予想され、これらの患者はCIN人口の約37%を占める。最新のNCCNガイドラインによると、米国では化学療法患者の70%以上がCINを予防する資格がある。IQVIA MidasとTF Securitiesの報告によると、中国のG-CSF販売収入は毎年約30%増加し、2019年の総売上高は人民元50億元(約7.8億ドル)、2020年は80億元(約12億ドル)となっている。中国は4種類の長期効果G-CSFしか承認しておらず、2019年の総売上高は30億元(約4.7億ドル)、2020年は人民元52億元(約8.2億ドル)となった。恒瑞の衰えないG-CSFは“中国”のベストセラートップ3にランクインした。
しかし,G−CSF治療の主な利点は化学療法後2週目である。化学療法後1週間は“好中球減少の脆弱性ノッチ”と考えられ,発熱性好中球減少,感染,入院,死亡を含む75%を超えるCIN関連臨床合併症が発生した。プリプリンは,CINの発生と発展を第1週に予防することにより,この“好中球減少脆弱性ギャップ”を埋める可能性がある。したがって,プリブリンとG−CSFの併用は化学療法サイクル全体で患者を最大限に保護できると考えられ,保護的な2期3登録研究で証明された。
保護−2期3期研究は,プリブリンとG−CSFを併用してCINを予防するためのNDA提出を支援する登録研究である。NDAの提出はこの研究の積極的なデータに基づいており,プリブリンとパイグリプチンの併用はパイグリチウム単独よりもCIN予防の利点を示していることが示唆された。この研究は主な終点に達し,4級好中球減少症の予防に統計的に有意な改善が認められ(13.6%から31.5%,p=0.0015),DSNや好中球絶対計数,あるいはANC最低点を含むすべての重要な副次的終点に達した。また,併用は発熱性好中球減少症の発生率と重症度,発熱性好中球減少症患者の発生率や入院期間などの臨床合併症を減少させた。この連合薬の耐性は良好で、パイ非グレル群と比べ、併用薬の4級治療緊急不良事件は20%以上減少した。NDAが提出した報告には5つの支持性試験があり,これらの試験は1200名以上の患者において,各種化学療法レジメンと癌患者のCIN予防が一致していることを示している。
これまで,プリブリンのCIN予防効果は6つの臨床試験で確認されており,研究101,ダブリン−3,保護−1(2期と3期)と保護性2(2期と3期)は,化学療法後1週間にCIN早期利益を予防するデータと一致している。
| ● |
第101期研究の第2段階では,データの回顧分析により,ドセタキセルの標準治療案にプリブリンを加えたところ,3級と4級好中球減少有害事象の発生率は統計学的に有意に低下し(p=0.002),ドセタキセル単独群の26%からプリブリンガドセタキセル群の7%に低下した。 |
| ● |
ダブリン−3,NSCLCの3期研究では,559名の患者の1日目8日目における4級好中球減少の副次的終点を評価し,プリブリンがドセタキセルによるNSCLC患者の4級好中球減少(P)を減少させることを証明した |
| ● |
我々のCIN登録計画では,Plinuminはすでに2つの2/3期臨床試験を行い,1つ目はPlinumin単一療法で高リスク因子を有する中等リスク化学療法によるCINの予防に用いられ,単独ではテソ帝(ドセタキセル)からなり,非小細胞肺癌,乳癌,前立腺癌患者(保護−1),2つ目はプリブリンとポリエチレングリコール単独で高リスク化学療法によるCINの予防,3種類の薬剤からなる骨髄抑制化学療法レジメンテソテミン(ドセタキセル),アドリアマイシン(ドキソルビシン),シクロホスファミド(シクロホスファミド),乳癌患者(保護性2)の2つの臨床試験が行われている。TACは高熱好中球減少症リスク化学療法の一例であり,すべてのG−CSF生物類似登録研究に用いられている案でもある。 |
保護性-1(プリブリン単薬治療と派非格司代替薬治療)
研究101で観察された臨床資料と著者らがFDAと検討した結果から,CINにおける2段階2/3試験の設計を改善した。最初の試験名はPROTECTURE-1であり、プリブリン単一療法とパイグリタグリプチン単一療法の2/3期試験であり、アメリカ、中国、ロシアとウクライナで行われた2期と3期の研究において、160名の患者はドセタキセル(高リスク因子を有する中等熱好中球減少症化学療法)の治療を受け、これらの癌は末期乳癌、ホルモン難治性前立腺癌と末期非小細胞肺癌患者を含む。
この試験の主要な終点はDSNが最初の化学療法周期において標準治療薬物Neulasta(1種のポリエチレングリコールモノクロナル抗体、1種の長時間効果G-CSF)と比べて遜色ないことである。DSNは患者に4級好中球減少が出現した日数を表す。臨床的に意義のあるDSNは1日未満であった。
2020年9月に“米国医学会腫瘍学”誌に発表された保護性−1期研究では,55名の非小細胞肺癌患者が初日(化学療法当日)にプリブリンを20 mg/平方メートルの用量で服用し,21日前の周期における重篤な好中球減少症(4級)の発生率あるいは発生率は1剤ニューラスター(6 Mg)を服用した患者と同様であった。プリブリンやNeulasta治療を受けた患者の14%に4級好中球減少が認められた。この結果は,4段階好中球減少発生率に基づく明確な用量反応と第2段階部分で見られたDSNである試験第3段階の推奨用量が40 mg(20 mg/平方メートルに相当)であることを決定した。また,保護−1の第二段階では,プリブリンは血小板減少を減少させることが証明され,早幼顆粒球や未成熟好中球データからNeulastaよりも良好な免疫状態を示した。
保護−1における評価の副次的な終点の1つは骨痛の減少である。骨痛はこのような患者にとって重要な問題であり、多くの患者の治療停止を招く。保護−1の第2段階では,20 mg/平方メートルプリプリン治療を受けた患者の骨痛の割合はNeulastaを用いた患者(35%)より少なかった(11%,または3日目から0%)。
保護−1の第2段階でNeulasta治療を受けた患者では,半数近く(45%)が第1周期で血小板減少症(いずれのレベル)を認めたのに対し,20 mg/m 2プリブリン治療を受けた患者では0%であった。プリブリンの血小板保護作用も全4サイクルで統計的に行われている。全4サイクルにおいて,ドセタキセルとプリブリン治療を受けた患者は,ドセタキセルやニューラスター治療を受けた患者と比較して,臨床的に有意な血小板減少症の発生率が低かった(p=0.019)。
さらに,われわれのデータは,プリブリンがG−CSFやPlerixaforとは異なる作用機序によりCD 34+前駆細胞を末梢血に動員することが,造血細胞移植に新たな選択を提供している可能性が示唆された。我々は、プリブリンの使用および使用を含む血中CD 34+細胞数を、ドセタキセル治療前および治療8日目の複数時点のCD 34+レベルを測定することによって評価した。プリブリン用量あたりの0日目と8日目には,少なくとも9名の患者がCD 34+検出を行った。プリブリン治療を受けた患者は8日目にCD 34+レベルが統計学的に上昇し、用量依存関係(p を呈した
保護性-1(二重盲検、能動対照)の第3期部分に、105例の非小細胞肺癌、乳癌と前立腺癌患者を組み入れ、DSNを主要な終点とし、プリブリンとNeulastaのCIN予防におけるメリットを比較した。保護性-1の第3段階は第1周期でDSNの非劣勢とNeulastaの主要な終点に達し、2018年12月に105名の患者が登録した予め指定された中期分析において統計学的意義があった。この結論は2019年1月に米国NCCN好中球減少症管理ガイドライン創設メンバーとCrawford博士が主宰したデータと安全モニタリング委員会会議で実証された。
保護-2(プリブリン+ペフィグリス用とペ非グレル用)
第二の試験、保護性-2は、プリブリン連合骨髄抑制化学療法方案の2/3期試験であり、この方案はテソ帝(ドセタキセル)、アドリアマイシン(アドリアマイシン)とシクロホスファミド(シクロホスファミド)の3種類の薬物からなり、中国とウクライナの336名の固形腫瘍(乳癌)患者の中で行った。この試験は,プリブリンとNeulasta(6 Mg)(プリブリン/Neulastaの組み合わせ)の奏効率を比較し,Neulasta単一療法と比較した奏効率の優位性を測定し,プロトコルにより4級好中球減少症予防比率が主な終点であった。
保護−2の第2段階部分に115名の患者を募集した。2018年10月,プリプリン/Neulasta併用治療によるレベル3と4級好中球減少の持続時間は臨床的に有意であり,第1周期では重篤な好中球減少(レベル3と4級好中球減少)がなかった患者率は統計学的に有意に増加し,骨痛は統計的に有意に減少し,第1周期におけるNeulasta単一療法に比べて免疫抑制が少なかった第2段階データを公表した。また,プリブリン/Neulasta併用投与は良好な耐性を有し,心臓安全に問題はなかった。われわれのデータは,プリプリンとNeulastaの併用は,好中球とリンパ球比率が5未満の患者のパーセンテージを低下させることにより,Neulastaの免疫抑制状況(p を逆転させたことを示している
保護性-2試験の第三段階(二重盲検、自主対照、登録優勢研究)の中で、221名の患者が入選し、プリブリンと派グリプチンの連合薬品使用と派グリプチン単独によるCIN予防効果を評価した。この研究はTAC治療を受けた乳癌患者におけるプリブリン(40 mg、1日目用量)とパイグリプチン(6 mg、2日目用量)と単量のパイグリプチン(6 mg、2日目用量)の安全性と有効性を比較することを目的としている。主な終点は4級好中球減少症を予防する比率であり,これは感染,菌血症,感染,発熱と死亡率が高いことと関連している。文献によると,TACとポリエチレングリコールモノクロナル抗体治療を受けた患者は依然として約83−93%の4級好中球減少の発生率,あるいは7−17%の患者が4級好中球減少を予防している。副次的終点はDSN周期1を含み、これはすべての生物類似G-CSF承認研究の伝統的な主要な終点である。また,重篤な好中球減少症の発生率と持続時間を評価した。文献によると,重篤な好中球減少により80%の患者が感染1週目に死亡し,48%が発熱,50%の人が感染する。
保護性-2期3登録研究により、すべての主要と重要な終点に符合するポリエチレングリコール単独使用と比べ、プリブリンとポリジフィグリスの併用によるCINの予防は優勢であることを示した。併用群(プリブリン+ポリエチレングリコール単用、n=111)とポリエチレングリコール群(ポリエチレングリコール単独使用、n=110)によるCIN予防効果の比較結果は以下の通りである。
| ● |
主な終点(4級好中球減少症予防):31.5%(COMBO)vs.13.6%(PEG)、95%信頼区間17.90(7.13、28.66)、P=0.0015; |
| ● |
階層テスト順に並べられた重要なサブ端末: |
| ● |
DSN周期1-8日目(ANC 9個/L):COMBOはPEGよりDSNを低下させ、p=0.0065; |
| ● |
平均ANC最低サイクル1(x 109(Cells/L):0.538(COMBO)vs.0.308(PEG)、p=0.0002; |
| ● |
グレード3およびグレード4の好中球減少がない患者のパーセンテージ:20.7%(連合)vs.4.6%(Peg)、p=0.0003; |
| ● |
DSN周期1:COMBOはPEGと比較してDSNが低下し、p=0.0324; |
| ● |
探索的端点: |
| ● |
重度好中球減少症周期1(ANC)の発生率 |
| ● |
重度好中球減少周期1の持続時間:0.34 d(連合)vs.0.63 d(Peg),p=0.0004; |
| ● |
重症好中球減少患者の発熱好中球減少の発生率:連合群は4.2%、対照群は13.7%であった |
| ● |
重症好中球減少患者の入院率:8.3%(COMBO)対11.8%(PEG)であった。 |
われわれの保護−2研究の積極的な結果に基づき,上記の他の5つの臨床研究の支持を得て,プリプリンとG−CSFを併用してCINを予防するためのNDA申請がFDAとNMPAに受け入れられた。われわれが探している適応は,“非髄系悪性腫瘍患者に骨髄抑制化学療法レジメンを併用してCINを予防する”における広範なラベルであり,FDAとNMPAの画期的な治療指定を得た適応である。FDAは2021年11月、プリブリン連合G-CSFによるCIN予防の完全な返信を発表した。国家食品薬品監督管理局はCIN予防適応のNDAを審査している。
プリプリンは末期非小細胞肺癌を治療しました
非小細胞肺癌疾患の概要
米国国立癌研究所のデータによると,米国では毎年約23万人の患者が肺癌と診断されている。肺癌患者の予後は比較的に悪く、5年生存率はわずか18.6%であった。肺癌はアメリカの癌死亡の主要な原因であり、全世界の健康問題でもあり、毎年約180万人が肺癌と診断されている。世界の約3分の1の肺癌患者は中国で、2015年に中国で確定診断された肺癌症例は約70万例である。腫瘍細胞の組織学的形態によって、これらの肺癌は通常2群-小細胞肺癌と非小細胞肺癌に分けられ、それらは異なる化学療法方法を用いて治療を行う。非小細胞肺癌は肺癌症例の約87%を占めている。世界の非小細胞肺癌市場は毎年10%の速度で増加しており、2021年と2026年の売上高はそれぞれ267億ドルと446億ドルと予想されている。中国では,2015年から2019年までの間に非小細胞肺癌新発例は66.9万例から76.1万例に増加し,2030年までに新発例は100万例以上に達すると予想されている。Frost&Sullivanのデータによると、中国では、2018年に非小細胞肺癌目標薬物の売上高が127億元(約20億ドル)、2019年には208億元(約33億ドル)、2020年には291億元(約46億ドル)に達した。
肺癌は通常臨床経過が遅いときに診断され,身体の他の組織に転移しているためである。これらの晩期症例では治療は治癒せず,患者は通常系統療法を用いて治療を行う。最初の治療は通常シスプラチンなどの広範な化学療法薬に基づいている。しかし,多くの患者はこれらの薬剤の使用に関連した全体的な生存増加はわずか2カ月であったため,長期的な利点は得られなかった。他の治療法はいくつかの大きく分類されています
| ● |
ドセタキセルやペメトラセのような他の化学療法薬 |
| ● |
EGFRキナーゼを含む、特定の遺伝子変異を有する細胞内酵素の阻害剤; |
| ● |
Ramucirumabのような腫瘍血管形成を破壊する薬; |
| ● |
Nivolumabなどのチェックポイント阻害剤を検査する。 |
チロシンキナーゼ阻害剤はEGFR突然変異患者にのみ有効である。EGFR野生型患者はアジア非小細胞肺癌人口の約70%を占め、西洋非小細胞肺癌人口の約85%を占める。4つの療法のみが二線および三線非小細胞肺癌患者のEGFR野生型のために承認された。この4つの療法にはPD−1/PD−L 1抗体,ペメトラセ,ドセタキセル,Ramucirumabにドセタキセルが含まれており,これらの治療法の治療効果は限られており,中位総生存期間(OS)は約6~12カ月である。
これらの療法のいずれも顕著な利点を提供する可能性があるが,特定の限界もある。例えば,ドセタキセルは40%までの患者に好中球減少症をきたす。ペメトレキセノールはドセタキセルと比較して生存益が限られている(OSのリスク比は0.99)。Ramucirumabは新血管形成を防止または緩和する抗血管新生剤であり,ドセタキセルと併用した場合,OSの発症率はやや増加し(1.4カ月,OSのリスク比は0.86),併用では49%の重篤な好中球減少が認められた。二、三線非小細胞肺癌患者はすべて末期癌患者であり、病状は比較的に弱く、深刻な好中球減少率は比較的に高く、患者の生活の質に深刻な影響を与える。最後に,nivolumabなどの検査点阻害剤は非小細胞肺癌で有意な活性を示したが,この活性は20%未満の患者に限られていた。したがって,多くの薬剤が非小細胞肺癌の治療に利用可能であるにもかかわらず,非小細胞肺癌では新たな治療法が必要であると考えられる。
また,現在の治療パターンの変化に伴い,PD−1抗体とペメトレキセド(Keytruda+白金+ペメトレセ)はNSCLCの第一線の治療として承認されているため,患者がこの治療に失敗した場合(約50%),第2および第3の線でPD−1またはPD−L 1抗体やペメトレキセドを使用することはできない。これにより,これらの患者の治療選択は,ドセタキセルとRamucirumabにドセタキセルを加えた2種類のドセタキセルによる療法のみに縮小した。両療法とも生存収益は限られており,重篤な好中球減少の発生率が高く(>40%),プリブリンとドセタキセルの併用治療はいずれも改善を目指している。
プリプリンは末期非小細胞肺癌を治療しました
プリブリンは1種の選択的免疫調節微小管結合剤(SIMBA)であり、それは免疫防御蛋白EF-H 1を活性化し、そして樹状細胞成熟とT細胞活性化(La Sala 2019;Kashyap 2019)を招き、抗癌に応用する。抗癌研究では、高地球環境基金-H 1免疫署名の患者は免疫署名の低い患者よりも長く生きている(Kashyap 2019)。
末期と転移性非小細胞肺癌の1/2期(研究101)
1/2期試験の2期部分の主な目的は、末期二線および三線非小細胞肺癌患者において、プリブリンとドセタキセルの併用治療とドセタキセル単独治療の潜在的な抗癌効果を評価することである。この試験は米国,オーストラリア,アルゼンチン,チリ,ブラジル,インドで163名の末期非小細胞肺癌患者を募集した。試験に参加した患者は切除不能,局所末期あるいは転移性癌を有しており,一部の患者では全身に拡散しなくても隣接リンパ節に拡散することを意味している。このような患者では,肺に測定可能な病変がない可能性がある。
希望治療或いはITT群に対して、的確な患者選択がなく、試験はプリブリンとドセタキセルの併用はドセタキセル単独治療と比較して統計的に全体の生存率を著しく改善する主要な終点に達しておらず、連合治療はドセタキセル単独治療と比べて軽微な1.2ケ月の生存期間のメリットしかなかった。しかし、著者らは1組の測定可能な肺病変患者(プリブリン機序標的患者)を確定し、これらの患者の中で、ドセタキセル単一治療と比べ、プリブリンとドセタキセルの連合治療は抗腫瘍活性を増強する可能性があり、生存期間は4.6ケ月延長した。この機序に基づくサブセット分析では,プリブリン併用ドセタキセルを服用した患者の中位OSは11.3カ月であったのに対し,ドセタキセルのみを用いた患者の中位OSは6.7カ月であった。また,プリブリン併用ドセタキセル治療群の客観的有効率(OOR)は18.4%であったが,ドセタキセル単独群の客観的有効率は10.5%であった。この亜群には各群38名の患者のみが含まれており,OS上統計学的有意差は得られなかった(p=0.29)。プリブリンとドセタキセルの併用治療を受けた患者も12.7カ月の有効期間であったのに対し,ドセタキセル単薬治療を受けた患者は1カ月のみであった(p=0.049)。このサブセット分析は2017年アメリカ臨床腫瘍学会-癌免疫治療学会(ASCO-SITC)会議で口頭陳述の形式で提出され、会議の5つのハイライトの一つに選ばれた。
末期と転移性非小細胞肺癌の3期治療(研究103またはダブリン−3)
2016年6月、著者らは1つの3期試験(ダブリン-3)をスタートし、これはランダム、能動対照、患者単盲の全世界試験であり、559名の二線と三線非小細胞肺癌患者を募集し、EGFR野生型、肺病変は測定できる。患者はドセタキセル(D,75 mg/m)で静脈点滴し,21日を1周期とした2 1日目)とプリプリン(P,30 mg/m21日目および8日目)またはドセタキセル(D,75 mg/mのみ)2 初日に)。この研究はアメリカ、中国、オーストラリアで行われている。
主な終点は,ドセタキセル単独患者と比較して,プリブリンとドセタキセルを服用した患者の総生存率である。二次終点は、4級好中球減少、OOR、無進行生存期間またはPFS、生存期間が2年以上、生存期間が3年以上の患者のパーセンテージ、反応持続時間、化学療法周期および生活の質を含む。私たちは559人の患者をこの研究に参加した。
1回に約439名の患者が死亡した事件では,試験の最終背線結果は2021年8月と2021年9月にESMOで報告された。ITT群ではOSの主な終点(連合(DP):n=278;ドセタキセル(D):n=281)に達した。次に背筋の結果をまとめた
メイン端末(オペレーティングシステム、ITTパッド):
| ● |
平均OS(SE)月(M):DP 15.08 M(0.848)vs.D 12.77 M月(0.676);p=0.0332 |
| ● |
中央値OS(95%CI):DP 10.5 M(9.3,11.9)vs D 9.4 M(8.4,10.7) |
| ● |
対数列p=0.0399;HR=0.82 |
重要なサブ端末(ITT人口):
| ● |
ORR(調査者コメントによる:DP:12.2%対D:6.7%;p=0.0275) |
| ● |
PFS(調査者審査に基づく): |
| o |
平均(SE):DP 6.0 M(0.4 vs.D 4.4 M 0.3);p=0.006 |
| o |
中央値(95%CI):DP 3.6 M(3.0,4.4)vs D 3.0 M(2.8,3.7) |
| o |
原木格 P=0.008;HR=0.76 |
| ● |
第4級好中球減少症の発生率は,第1周期8日目(DP:5.3%対D:27.8%;P |
| ● |
24カ月OS率:DP:22.1%対D:12.5%;p=0.0072 |
| ● |
36カ月OS率:DP:11.7%対D:5.3%;p=0.0393 |
| ● |
48ヶ月OS率:DP:10.6%対D:0%;p=計算不可能 |
| ● |
Q−twist(疾患や毒性症状のない品質調整時間):DP:12.4 M対D:10.47 M;Q−twistの相対収益18.43%,p=0.0393 |
抗癌適応におけるプリブリン併用免疫腫瘍薬の使用
臨床前研究はすでにプリブリンのいくつかの免疫系の刺激に関連する斬新かつ面白い活性を確定し、これはプリブリンが他の免疫腫瘍剤の活性を増強する能力と一致する。著者らはこれらの研究において、プリブリンが抗癌免疫活性化過程における複数の早期ステップに作用し、特に腫瘍抗原特異的T細胞を腫瘍に活性化と動員することを観察した。他の免疫腫瘍学的薬物活性を刺激する上でのプリブリンの潜在的作用は,以下に述べるいくつかの研究者による1/2段階試験で探索されている。
免疫腫瘍学の概要
免疫系は腫瘍細胞を識別と除去することができる;しかし、腫瘍はチェックポイント経路を調節することによって免疫反応を避けることができることがある。その1つの経路はPD−1によって駆動され,PD−1は免疫T細胞に発現する受容体である。いくつかの腫瘍、例えば黒色腫、肝細胞癌、結腸直腸癌および非小細胞肺癌は、35%~100%の細胞がPD-L 1を過剰発現し、これはPD-1に天然に結合する化合物である。PD−L 1とPD−1の結合は免疫活性化を抑制し,腫瘍は免疫系の破壊から逃れることができる。Nivalumab(Opdivo)のようなPD-1に対する免疫検査点癌療法は、黒色腫、非小細胞肺癌、腎細胞癌、古典的ホジキンリンパ腫、頭頸部扁平上皮癌、尿路上皮癌、結腸直腸癌、および肝細胞癌の治療のために許可されている。Nivalumabは一部の腫瘍に非常に有効であるが、腫瘍は多種の経路に依存して免疫系から逃避し、多くの腫瘍を引き続き増殖させる。
多くの癌の治療法と同様に,通常は治療効果を向上させるために併用治療が必要である。2020年、治療効果の向上に基づいて、PD-1抗体nivolumabとCTLA-4抗体ipilimumabの組み合わせが黒色腫の治療のために承認された。しかし、この連合治療はレベル3およびレベル4の不良事象の増加をもたらし、55%の併用治療患者がこのような状況を発生したのに対し、nivolumab単独で治療した患者とipilimumab単独で治療した患者の割合はそれぞれ16.3%と27.3%であった。Nivalumabのような免疫チェックポイント阻害剤にプリブリンを添加することは,重篤な有害事象発生率を増加させることなく活性を増加させたり,免疫に関連する副作用を潜在的に減少させたりする可能性が考えられる。
免疫腫瘍学におけるプリブリンを支持する臨床前研究データ
Nivolumabのようなチェックポイント阻害剤は、免疫過程全体の比較的遅い段階で−T細胞が癌細胞を認識する際に、免疫系の障害を緩和する。対照的に、臨床前研究により、プリブリンは免疫活性化過程中に複数のステップを前に免疫系を活性化するため、検査点阻害剤の活性を補充する可能性があることが示唆された。すでに発表されていることと発表されていない臨床前研究データは,プリブリンは樹状細胞提示癌抗原を増加させ,樹状細胞増殖を刺激し,ヘルパーT細胞レベルを増加させ,免疫抑制制御性T細胞レベルを低下させることで癌細胞に対する免疫反応を刺激できることを示している。多くの活性の中のどの活性或いはどの活性の組み合わせがプリブリンの免疫刺激活性に重要であるかは不明であるが、動物モデルにおける活性はPD-1チェックポイントに対する許可された免疫腫瘍学薬物nivalumabのような他の免疫腫瘍剤に匹敵する。
その一例は免疫能の高いマウスの結腸癌モデル(MC 38)である。プリプリンとPD−1抗体の組み合わせによる腫瘍は対照動物の腫瘍より約25%小さく,PD−1抗体とCTLA−4抗体の組み合わせのレベルと類似していた。プリブリン、PD−1抗体およびCTLA−4抗体の三重組み合わせによる腫瘍は、任意の他の研究薬またはその研究組み合わせで治療された動物の腫瘍よりも小さく、賦形剤対照群より約40%小さかった。
もう一つの例はPD−1無反応性腫瘍モデルであり,このモデルはスティーブン·リン博士がMD Andersonの実験室で行った。2020年6月、アメリカ癌研究協会仮想年会で、この臨床前研究の結果は“プリブリン、1種の微小管安定剤、免疫放射線治療と結合することによって樹状細胞成熟とCD 8 T細胞浸透を増強し、腫瘍制御を改善する”と題するポスターデモで強調された。データのハイライトは:
| ● |
臨床前治療効果:PD-1抗体のみに無効な乳癌モデルにおいて、プリブリン、抗PD-1と放射線治療(三連)の三重免疫腫瘍学の組み合わせは100%の完全応答を実現した。 |
| ● |
逐次効果:放射線治療前投与或いは1回目の放射線治療後に1回しか投与しないのと比べ、毎回放射線治療後にプリブリンを投与することは樹状細胞成熟に対する影響がもっと大きい。 |
| ● |
異常効果:プリブリン三連抗腫瘍は同じマウスの照射と非照射腫瘍に作用し、全身抗癌免疫反応が活性化されることを表明した。抗PD−1や単純放射線治療と比較して,三連投与群の未照射腫瘍におけるCD 8細胞レベルは前者のほぼ2倍であることに注意されたい。 |
| ● |
樹状細胞の主要な組織適合性複合体II類、あるいはMHC-II、発現上昇とT細胞腫瘍浸潤:プリブリン三併用投与は腫瘍中の樹状細胞MHC-IIの発現とT細胞浸潤を著しく増加させる。 |
| ● |
免疫腫瘍学機序:AP-1とNF-kB分子経路はプリブリン誘導樹状細胞成熟過程において重要な役割を果たしている。 |
樹状細胞の活性化は次のステップで免疫腫瘍学薬物の治療効果を増強するキーポイントであると考えられる。活性化した樹状細胞は外来腫瘍抗原をT細胞に送達し,腫瘍指向免疫攻撃を誘導する。そのため、免疫過程における樹状細胞活性化という重要なステップを免疫検査点抑制療法の既定効果と結合し、臨床上の全体的な抗癌治療効果の向上が期待できる。著者らの抗癌策略は樹状細胞とT細胞を活性化し、検査点を結合して抑制し、そして放射線治療の新しい抗原と免疫活性化を産生する利点を増加させることであり、プリプリンは逆転腫瘍がPD-1/PD-L 1抗体に反応しないキーポイントである。これらのデータは,この三連療法が抗PD−1/PD−L 1標的治療に失敗したり進展したりした患者を助ける可能性が強く示唆されており,深刻な満足されていない医療ニーズであると信じている。
研究者は免疫腫瘍学におけるプリブリンの研究を開始した
私たちはすでにプリブリンが臨床プロジェクトにおいて他の免疫腫瘍学の薬物活性を刺激する作用を探索し続けることを計画している
| ● |
非小細胞肺癌におけるプリブリン+PD−1抗体の使用 |
UCSDは2016年9月、研究者によるプリブリンとnivalumabの併用による転移性非小細胞肺癌患者の1/2期試験に参加する第1人の患者を募集した。UCSDは2022年4月1日までに18名の患者を募集している。さらに,フレッド·ハッジはワシントン大学とともに,以前の2回の治療に失敗した末期非小細胞肺癌患者の治療のための研究者によるプリブリン併用nivalumabの1/2期試験を開始した。ワシントン大学の研究は用量レジメンの終点に達したため,研究地点は閉鎖されている。この2つの試験の初歩的なセキュリティデータは2018年1月のASCO-SITC会議で発表された。評価した10名の患者では,併用治療耐性は良好であり,免疫に関する重篤な副作用は発生しなかった。2名の患者のみが免疫関連不良事件が出現し,1名の患者に1級事件が出現し,もう1名の患者にレベル2事件が出現した。
| ● |
小細胞肺癌におけるプリブリン+PD−1+CTLA−4抗体の発現 |
2018年10月、我々は、プリブリン、nivalumab(PD-1抗体)およびipilimumab(CTLA-4抗体)からなる三連療法を用いて二線および三線小細胞肺癌を治療する研究者による臨床試験の開始を発表した。この試験は10大癌研究連盟により行われ,この1/2期共同研究の第1段階では,ニュージャージー州ロッグス癌研究所と米国他の臨床センターで16名の患者を募集した。この研究では,プリブリンの添加がPD−1とCTLA−4抗体の免疫関連副作用の減少をもたらすかどうか,治療効果相乗効果を提供しているかどうかを調べた。2021年6月のASCO会議で、私たちはこの研究の陽性第一段階データを公表し、この研究は13名の二線及び以上の小細胞肺癌におけるPD-1/PD-L 1初治或いは薬剤耐性腫瘍の評価可能な患者に関連し、プリブリン連合nivalumabとipilimumabのOORは46%であった。また,プリブリン併用投与は腫瘍を免疫腫瘍療法に再感受性させることができ,従来PD−1/PD−L 1阻害剤で進展しており,ORRは43%であった。
2021年10月、私たちはこの研究者による研究の第2段階で第1人の患者を募集した。26人までの組織学的または細胞学的に確定診断された広範な小細胞肺癌患者は、少なくとも1つの白金系化学療法レジメンおよびチェックポイント阻害剤の後に進行し、プリプリン+nivalumab+ipilimumabの三重組み合わせを受ける。第二段階研究中の患者は、疾患が進展し、受け入れられない毒性が出現するまで、あるいはプロトコルで規定された治療停止の原因の一つになるまで治療を継続する。
| ● |
PD−1/PD−L 1失敗患者におけるプリブリン+PD−1/PD−L 1抗体+放射線治療の使用 |
2018年7月、我々はMD Andersonとスポンサー研究協定を締結し、放射線治療および免疫チェックポイント抗体に基づいてプリブリンを加える利点を評価した。臨床前研究により、プリブリン+放射+PD-1抗体三連療法は動物モデル腫瘍の縮小(100%腫瘍縮小)、腫瘍樹状細胞の成熟促進と腫瘍T細胞浸潤の増加などの面で明らかな優勢があることを表明した。
2021年6月、私たちはMD Andersonでこの1/2期研究を行った最初の患者、プリブリン+PD-1/PD-L 1抗体および放射線治療を用いた7つの異なる癌タイプのPD-1またはPD-L 1抗体治療が進行した患者の治療に使用した。癌タイプは膀胱癌、黒色腫、Merkle細胞癌、マイクロサテライト不安定-高癌(任意の組織学)、非小細胞肺癌、腎細胞癌と小細胞肺癌を含む。このプログラムは最近更新され、以前の抗PD-1/PD-L 1モノクロナル抗体治療+/-化学療法+/-化学療法または抗CTLA 4治療+/-第1段階でさらなる治療が必要な場合に進展する可能性がある検査点阻害剤の承認を得た腫瘍タイプが組み込まれている。プリブリン放射線治療は、免疫チェックポイント阻害剤の難治性腫瘍の免疫チェックポイント阻害剤耐性を逆転させ、免疫チェックポイント阻害剤単独による放射線治療よりも大きな反応を生じると信じられている。
その他の計画
プリブリンと免疫腫瘍学薬物を結合した治療潜在力を探索する以外に、著者らは一連の臨床前免疫腫瘍学候補製品を持ち、そして著者らの研究協力者を利用してこれらの計画を推進する。
BPI−002プログラム
我々のBPI−002計画は,T細胞の共刺激を増加させる経口小分子製剤に基づいている。その薬物動態学的半減期が短いため、CTLA-4阻害剤とPD-1/PD-L 1阻害剤の併用などの生物半減期が比較的に長い薬物と比べ、それは免疫関連不良事象をよりよく管理する潜在力を持っている。臨床前癌モデルでは,BPI−002は単一治療として検査点阻害剤と併用して有意な抗癌効果を示した。研究性新薬、あるいはINDと呼ばれ、製造と安全テストに関する研究と努力を開始した。
BPI−003プログラム
我々のIKKプログラム、BPI-003は、新しいIKK小分子阻害剤、プロテインキナーゼに基づく。IKKはいくつかの腫瘍細胞の生存に参与し、多種の腫瘍生存因子サイトカインと成長因子の産生にも参与している。われわれのIKK阻害剤は多くの膵癌動物モデルにおいて良好な活性を示した。
BPI-004プログラム
我々のBPI−004計画は,免疫細胞を含まない腫瘍が免疫系に浸透するように腫瘍細胞の新たな抗原産生を誘導する小分子に焦点を当てている。ヒト癌の大部分は免疫系が認識できる抗原を産生しない。したがって,これらの腫瘍は患者の免疫反応と相互作用することにより作用する治療には反応しない。例えば,これらの腫瘍はPD−1阻害剤の治療には反応しない。腫瘍細胞の抗原産生を誘導する治療方法であって、これらの癌をPD-1阻害剤に反応させる可能性がある治療方法。
種’S標的タンパク質分解(TPD)プラットフォーム
原因蛋白が早期分解として標識されている別の疾患を治療する方法も検討されている。この方法は,ユビキチンE 3リガーゼと呼ばれるタンパク質を用いて原因タンパク質の破壊を標的化し促進する。分解を誘発するために、標的タンパク質は特定のユビキチンリガーゼによってポリユビキチンとして標識される。ポリユビキチンはサイトプロテアソーム機構の指標タグとして,標的蛋白が破壊されるべきであることを示している。標的タンパク質を標識する1つの方法は,我々独自の“分子ガム”技術を用いてユビキチンリガーゼを標的タンパク質に結合させることである。
著者らはすでに子会社SEEDを設立し、この独特なTPD技術プラットフォームを探索し、“分子ゴム”を利用して設計し、以前薬物治療ができなかったと考えられていた目標を攻撃した。包括的な知的財産権組合の支持の下で,SEEDの使命は新たなタンパク質分解療法を創造することで人類の健康に積極的に影響し,現在患者とその家族が限られた様々な重篤な疾患を治療することである。この分野の世界をリードする学術専門家との持続的な協力を通じて、種子会社は潜在的な臨床と商業成功の道にますます多くの新薬候補薬物導管を構築している。
2020年11月、SEEDは礼来社と研究協力と許可協定、即ち協力協定を締結し、TPDを通じて治療利益を産生できる新しい化学実体を発見し、開発した。
協力協定の条項によると、種子会社は1500万ドルの前払い現金と初期持分投資を獲得した。SEEDはまた,最高約7.8億ドルの潜在的臨床前と臨床開発,規制,ビジネスマイルストーン,および協力による製品純売上高の分級特許権使用料を得る資格がある。
今回の協力では、私たちと私たちのいくつかの子会社は、あるプラットフォーム技術に関連するいくつかの契約および知的財産権を種子会社に譲渡し、私たちは種子会社にユビキチンプラットフォーム技術に関連する知的財産権および他の材料のいくつかの権利の独占的再許可を与えた。
私たちと礼来社はまた、種子会社と株式購入契約を締結し、種子会社の優先株を購入した。Seedは,我々とSeed Technology Limitedに合計1,194,030株のA−1系列優先株を売却するか,あるいは我々の多数の株式間接子会社(総称してBYSIエンティティと呼ぶ)にSEED Technologyを売却し,礼来社に1,990,000株のA−2系列優先株を売却することに同意し,1株当たりの現金購入価格は2.5125ドルである。初歩的に取引を完了した後、比亜迪実体がすでに保有している株式を計上した後、比亜迪実体は換算後の基準で計算し、種子全体の64.4%の株式を保留する。また、協力合意で述べたいくつかのマイルストーンが完了した後、いくつかの条件を満たしおよび/または免除した場合、比亜迪実体は集団で1,194,028株のA-1シリーズ優先株を購入し、礼来会社は1,990,000株のA-2シリーズ優先株を追加購入し、1株当たりの現金購入価格は1株2.5125ドルである。取引完了後、BYSIエンティティはSEEDの約60.1%の流通株権益を保有し、換算後基準で計算する(従業員持株計画または同様の手配によって保留可能ないかなる株式も含まれていない)。
私たちのパイプは
次の表に我々の製品開発ルートの現在の状況をまとめた。

私たちの戦略
| ● |
中国のリードする腫瘍学の研究開発と商業化会社恒瑞との協力価値を最大限に実現する。2021年8月、我々の株式の一部は中国子会社の万春布林と恒瑞と独占商業化と共同開発協定を締結し、ブリブリンの大中国でのさらなる開発と商業化を実現した。“--商業化”--2017年の支出獲得に伴い、プリブリンはすでに国家薬物優先審査リストに登録されている。第13次五カ年計画に基づき、政府は新薬の研究、開発と生産を奨励し、発売された新薬を優先的に国家保険制度に組み入れることを許可した。薬品審査と中国政府との定価交渉が成功する前に、2017年の支出はプリブリンを国家保険システムに組み入れるのに役立つ可能性があり、これは患者とのより迅速な接触と精算を可能にすると信じている。 |
| ● |
1つ以上のグローバル製薬会社と協力したり、私たち自身の販売チームを設立したりして、米国や世界の他の地域でプリプリンを商業化する。プリブリンが承認されれば,米国と世界的に巨大な商業潜在力を有し,G−CSFとの併用によるCIN予防,あるいは化学療法との併用を抗癌剤として免疫腫瘍剤として併用治療すると信じられている。著者らの臨床データは、プリブリンと化学療法の併用は抗腫瘍治療に付加価値を提供できることを示した。また,われわれの免疫腫瘍学における早期臨床結果は,プリブリンが三連免疫療法において重要な役割を果たし,現在の免疫腫瘍学的治療案の有効性を改善あるいは拡大する可能性が示唆された。米国での候補製品の規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価します。 |
| ● |
プリプリンを多様な癌適応における“薬物パイプライン”として開発した。われわれはプリブリンと免疫腫瘍学薬物の結合の潜在力を探索しており,われわれの科学協力者により他の免疫腫瘍学薬物のパイプラインを開発し続けている。プリブリンは新型の樹状細胞成熟小分子薬物であり、3期開発段階にある。著者らは、その独特な機序は検査点抑制剤と腫瘍抗原生成物、化学療法或いは放射線治療を含むと結合し、抗癌治療効果の潜在力を高めることを支持すると考えている。われわれは,われわれの研究協力者を用いて臨床試験でプリブリンを推進し,免疫腫瘍剤としての治療潜在力を検討している。我々はもう1つの研究を開始し、MD Andersonを用いて他の7つの腫瘍タイプにおけるプリブリンの抗癌効果を評価した。 |
| ● |
全世界の臨床試験を通じてプリブリンを推進し、アメリカと中国の監督管理の許可を得た。我々はCINの2/3期試験を完了し,米国と中国にNDAを提出した。我々はすでに非小細胞肺癌の3期試験を完成し、積極的な臨床データを報告し、中国は2022年下半期にNDA申請を提出する可能性があり、将来の臨床と監督経路をFDAと検討し始めた。我々のすべての臨床試験は,ICONやCovanceのような世界をリードするCROとの協力により行われ,データの質を確保している。私たちの世界的な発展戦略はすでに、より速い学生募集速度とより低いコストで中国で試験を行うことができることを含め、顕著な利点を提供し続けると信じている。また、中国は世界第2位の薬品市場であるため、中国の潜在的な承認を得ることはプリプリンに巨大なビジネス機会をもたらす可能性があると信じている。 |
| ● |
SEED標的タンパク質分解(TPD)技術プラットフォームの価値を最適化します。私たちの子会社SEEDを通じて、私たちは内部研究を行い、礼来社と協力して、TPDを通じて様々な疾患の中で治療効果を得ることができる新しい化学物質を発見し、開発しています。私たちはより多くのパートナー関係の構築を求め、私たちのTPDプラットフォームをいくつかの治療領域に拡張する。 |
商業化する
2021年8月、我々の株式の一部は中国子会社の万春布林と恒瑞と独占商業化と共同開発協定を締結し、ブリブリンの大中国でのさらなる開発と商業化を実現した。合意条項によると、万春プリンは恒瑞に独占的権利を付与し、大陸部中国及び香港、マカオ及び台湾を含む大中国市場で商業化及びプリブリンを共同開発する。万春プリンはブリブリンの大中国市場における製造権を保持し、プリブリンの同などの市場でのすべての販売純収益を獲得する。恒瑞は四半期ごとに所定の割合の純売上高を獲得する。万春プリンは2億元(約3100万ドル)の前金を獲得し、11億元(約1億71億ドル)にのぼる監督·販売マイルストーンを獲得する。恒瑞はブリブリンの大中国市場での商業化のすべての費用を担当する。合意条項によると、万春プリンはプリプリンの最初の2つの適応の100%臨床と監督管理コストを担当する:CINと非小細胞肺癌(EGFR野生型)の第二/三線治療の予防。恒瑞は大中国市場におけるプリブリンの追加適応に50%の臨床開発コストを提供し、そして1つの連合指導委員会が臨床戦略と優先事項を監督する。
米国や世界の他の地域では、米国における候補製品の規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価します。
知的財産権
著者らの候補製品及びその使用方法の独自性質と保護は著者らの開発と商業化新薬戦略の重要な構成部分であり、以下に述べる。私たちはすでに米国特許を取得し、米国および他の国で私たちのいくつかの候補製品に関連する特許出願を提出し、これらの製品および私たちの他の候補製品や技術のために追加的な特許保護を求めている。
私たちの成功は、私たちの候補製品および他の商業的重要性を有する製品、技術、発明およびノウハウのために特許および他の独自保護を取得および維持する能力、ならびに私たちの特許(私たちがすでにまたは可能性のある特許出願から得られた任意の特許を含む)を擁護し、実行する能力、私たちの商業秘密の機密性を保護し、他の当事者が効果的かつ実行可能な特許および独自の権利を侵害することなく運営する能力に大きく依存するであろう。
2022年3月21日現在、私たちは40の管轄区域で122件の特許を所有しているか、または共同で保有しており、21件の発行された米国特許を含む。私たちはまた、係属中の米国の非臨時特許出願14件と、他の管轄区域で係属中の対応する特許出願と、5つの係属中の米国仮特許出願とを有している。また,PCTによるプリブリンやプリブリン類似体に関する3つの未解決国際特許出願を有しており,プリプリンを用いた鉄障害の治療,プリブリンを用いた免疫チェックポイント阻害剤およびFPPS阻害剤との併用による癌の治療,プリブリンと抗CD 47薬の併用による癌の治療に向けて米国や他の管轄地域でこれらの出願を提出する予定である。私たちはまた、BPI-002に関連する未解決の国際特許出願を持っており、米国および他の司法管轄区で全国特許出願を提出する予定である。
2022年3月21日現在、私たちの特許組み合わせは、プリブリンおよびプリブリン類似体、それらの合成、および様々な疾患の治療における使用のための発行された19件の米国特許を含む。特に、私たちは15件の発行された米国特許を持っており、プリプリンの物質組成、プリブリンの合成方法、プリブリンの多形体、およびポリブチリンを用いて様々な疾患を治療する方法、ポリセタキセルによる好中球減少症およびいくつかの他のCIN、様々な癌、例えば肺癌、非小細胞肺癌、乳癌、皮膚癌、前立腺癌、骨髄腫、RAS変異腫瘍、脳腫瘍と真菌感染、およびプリプリンを用いて細胞増殖を抑制し、微小管解離を促進し、腫瘍血管崩壊を誘導する方法に関する。これらの米国特許は2023年から2037年の間に満期になる予定だったが、潜在的な特許期間の回復は含まれていなかった。特許組合はまた、日本、韓国、中国、ヨーロッパ、その他の国を含む39の外国司法管轄区で付与された対応特許を含む。
個別特許の期限は、これらの特許を取得する国によって異なる可能性がある。私たちが出願したほとんどの国/地域では、米国を含め、発行された特許の有効期間は、一般に、適用国/地域非臨時特許出願の最初の出願日から20年である。米国では、特許期限調整によって特許の期限を延長することができ、この調整は、米国特許商標局の行政遅延が、起訴中の特許出願人自身の遅延を超えていることを示すために特許の期限を延長することができ、または、1つの特許が共通所有特許の満期日が早いために最終的に放棄された場合、短縮することができる。さらに、場合によっては、FDA規制審査中に実際に失われた期間の一部を再取得するために、医薬製品が与えられた特許の期限を回復(延長)することができる。しかし,回復期は5年を超えることはできず,回復期を含む総特許期はFDA承認後14年を超えてはならない。私たちは私たちのアメリカ特許をプリブリンに拡張したり、適切な時にそれを使用することを求める計画だ。
一部の外国司法管轄区域でも、規制遅延の補償として似たような延期がある。特許によって提供される実際の保護は、特許のタイプ、そのカバー範囲、特許期間の延長または調整の利用可能性、特定の国の法的救済の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する。特に、EUと日本は最大5年間の延期を提供するかもしれない。私たちは適切な時に期限の延長を求める予定です。
さらに、我々が開発·商業化しようとしているバイオテクノロジーや製薬製品や方法の特許地位は、複雑な法律や事実問題に関連して一般的に不確実である。これまで、米国はこのような特許によって許容される権利要求の広さについて一貫した政策を制定していない。米国以外の特許保護範囲はさらに不確定である。米国および他の国の特許法または特許法解釈の変化は、私たちの発明を保護し、私たちの知的財産権を実行する能力をさらに弱める可能性があり、より広く言えば、知的財産権の価値に影響を与える可能性がある。
さらに、私たちは、私たちの候補製品に対するいくつかの発行された特許を取得しているが、私たちは、私たちの係属中の特許出願から発行される可能性のある特許請求の広さ、または他の会社が所有する特許および特許出願から発行される可能性のある権利要件の広さを予測することができない。数年来、私たちは私たちが重点的に開発した分野で大量の科学と商業研究を行い、他の各方面はこれらの分野に関連するいくつかの発行された特許と未解決の特許出願を持っている。米国および他の場所では、特許出願は、通常、優先日から18ヶ月後にのみ公表されるが、科学または特許文献で発見された公表は、通常、潜在的に発見された日よりもはるかに遅い。したがって、私たちの現在の候補品と同様の薬物、および私たちが開発する可能性のある任意の未来の薬物、発見または技術の特許および特許出願は、私たちの候補製品の商業化を阻止することができるかもしれない。
バイオテクノロジーと製薬産業の特徴は特許と他の知的財産権に関する広範な訴訟だ。私たちが候補製品や技術の独自の地位を維持して強化する能力があるかどうかは、有効なクレームを成功させ、承認された後にこれらのクレームを実行できるかどうかにかかっている。私たちは私たちが現在持っている、提出または許可可能な任意の未解決特許出願が任意の特許の発行につながるかどうか分からない。私たちが所有または将来獲得可能な公開特許は、挑戦、無効、または回避される可能性があり、任意の発行特許に基づいて付与される権利は、独自の保護または同様の技術を有する競争相手との競争優位性を提供してくれない可能性がある。さらに、私たちの競争相手は、私たちの特許を侵害することなく、類似した薬物を独立して開発し、商業化するか、または私たちの技術、ビジネスモデル、または戦略を複製することができるかもしれない。私たちが開発する可能性のある薬物の臨床開発と規制審査には多くの時間がかかるため、私たちの任意の候補製品が商業化できる前に、どの関連特許も商業化後に短期的に満期または有効に維持される可能性があり、それによって、どのような特許のいかなる利点も弱める可能性がある。
いくつかの限られた場合、私たちは商業秘密および非特許技術に依存して、私たちの技術の様々な側面を保護するかもしれない。しかし、商業秘密は保護するのが難しいかもしれない。コンサルタント、科学コンサルタント、請負業者とセキュリティ協定を締結し、従業員と発明譲渡協定を締結することによって、当社のノウハウおよびプロセスを保護することを求めています。また、私たちは私たちのビルの実体安全と、私たちの情報科学技術システムの実体と電子安全を維持して、私たちの資料と商業秘密の完全性とセキュリティを維持することに力を入れています。私たちはこのような個人、組織、そしてシステムに自信がありますが、合意や安全措置は違反される可能性があり、私たちはどんな違反にも対応する十分な救済措置がないかもしれません。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。私たちのコンサルタント、請負業者、または協力者が、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利について論争が生じる可能性がある。
私たちの商業的成功はまた他の当事者たちの所有権を侵害しないことにある程度依存するだろう。もし他の会社の特許が私たちの候補製品のいくつかの態様に関連しているか、または関連している場合、ビジネス戦略の開発を変更し、私たちの候補製品やプロセスを再設計し、許可を得たり、いくつかの活動を停止する必要があります。このようなライセンスは合理的なビジネス条項では得られないかもしれないし、全く得られないかもしれません。これは、私たちの候補製品の開発を中止したり、商業化したりすることを要求するかもしれません。また、私たちは、任意のライセンス契約に違反したり、私たちの候補製品を開発または商業化するために必要な独占権許可を得ることができなかったりすることは、私たちに大きな悪影響を与えます。もし他の人が米国で準備して提出した特許出願もまた、私たちが提出した特許出願の技術を要求するか、または他の方法で私たちの特許に挑戦することを望む場合、私たちは、要求された発明のような優先権またはそのような特許出願の有効性、ならびに私たち自身の特許出願および発行された特許を決定するために、米国特許商標局および他の特許庁の干渉、認可後審査、当事者間の審査、派生または他の手続きに参加しなければならないかもしれない。
これらのリスクや知的財産権に関する他のリスクに関するより多くの情報は,“第3項.キー情報であるD.リスク要因である我々の知的財産権に関するリスク”を参照されたい
競争
私たちの産業競争は激しく、迅速で重大な変化に直面している。私たちの開発と商業化経験、ビジネス戦略、突破的治療指定地位、科学知識、業界関係は私たちに競争優位を提供してくれると信じていますが、私たちは製薬とバイオテクノロジー会社(専門製薬会社を含む)、模倣薬会社、学術機関、政府機関、研究機関からの競争に直面しています。
現在,多くの大手製薬やバイオテクノロジー会社が薬物をマーケティング·販売しているか,あるいは癌治療用の薬剤を開発しており,これらの薬剤のために候補製品を開発している。EGFR野生型の非小細胞肺癌では、PD-1およびペメトレキセドはすでに一線治療に入っており、Ramucirumab/ドセタキセルとドセタキセルの併用のみが、二線/三線NSCLCの治療のために有効に承認されている。百時美施貴宝社とメルク社は現在それぞれOpdivo(Nivolumab)とKeytruda(Pembrolizumab)をマーケティングと販売しており、この2種類の薬物はいずれもPD-1阻害剤である。礼来社は現在Cyramza(Ramucirumab)をマーケティング·販売している。また,いくつかの追加薬物は現在第3段階臨床試験を行っており,非小細胞肺癌の第2および第3ラインの治療法として,規制部門の承認を得ていれば競争相手になる可能性がある。
著者らはプリブリンを抗癌薬物として開発する策略はその独特な機序を有効な樹状細胞成熟剤とし、腫瘍抗原特異性T細胞の活性化を招くことである。プリブリンは有効に全世界環境基金-H 1を活性化し、免疫防御蛋白であり、それはいくつかの癌患者の生存時間を延長できることが証明された。プリブリンの免疫機構は、より多くのT細胞を増加させること、または癌細胞を殺すために“ガスを打つ”ことに有効であり、知られているPD-1/PD-L 1抗体は、T細胞に“癌細胞を見ること、または”破損を放出すること“を可能にすることができる。そのため、プリブリンとPD−1/PD−L 1抗体の併用は抗癌効果を高める可能性がある。
好中球減少症はG−CSFによる予防または治療が可能であり,G−CSFは好中球の生存,増殖,分化を促進するタンパク質である。組換えG-CSF療法は通常CINの予防と治療に応用され、例えば短時間作用薬物フィグリタゾン(Neupogen)と長時間作用薬物ポリエチレングリコール非グリタゾン(Neulasta)である。これらの競争療法の主なメーカーは安進会社である。他に承認された長時間作用G−CSFにはCoherusのUdenyca,MylanのFulPhila,SandozのZitenzo,ファイザーのNyvepriaがあり,これらはすべてNeulastaの生体模倣薬である。また,G 1治療会社のCOSELA(Triaciclib)は小細胞肺癌におけるCINの治療に承認されている。
プリプリンとG−CSFの併用は,G−CSFとの併用であるため,老舗G−CSFメーカーとの最小競争に直面すべきであると考えられ,プリプリンとG−CSFの併用は,約30年後にCIN予防看護基準を向上させる最初の治療法となる可能性がある。
機能障害のタンパク質を分子ガム技術でユビキチンリガーゼで標識してこれらのタンパク質を破壊しても,この技術を用いて機能障害のタンパク質を標的·破壊することを検討している会社もある。
私たちと比べて、私たちの多くの競争相手はより長い経営歴史、より良い知名度、より強力な管理能力、より良いサプライヤー関係、より多くの技術者と販売チーム、そしてより多くの財務、技術、あるいはマーケティング資源を持っている。製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。もし私たちの競争相手が、私たちの現在の候補製品または私たちが開発する可能性のある任意の未来の候補製品よりも効率的で、より安全またはより低いコストの製品または他の新しい療法を開発または販売する場合、または私たちが現在の候補製品または任意のそのような未来の候補製品の承認を得るよりも早く規制部門の承認を得ることができれば、私たちのビジネス機会は減少または消失する可能性がある。私たちの成功は競争製品よりも安全で効果的な候補製品の組み合わせを識別、開発、管理する能力にある程度基づいているだろう。
政府の監督管理
アメリカ連邦、州と地方各級及びその他の国の政府当局は薬品の研究と臨床開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、販売促進、広告、流通、承認後のモニタリングと報告、マーケティング、定価、輸出入などに対して広範な監督管理を行った。一般的に、1種の新薬が発売できる前に、大量にその品質、安全性と有効性を証明するデータを得なければならず、これらのデータを組織して各監督管理機関の要求を満たし、各監督管理機関特有のフォーマットを採用して、監督管理機関の審査を提出し、監督管理機関の許可を得る。この過程は非常に長くて高価で、成功するかどうかはまだ確定されていない。
薬品はまた他の連邦、州、そして地方の法律法規によって制限されている。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発過程,承認過程又は承認後のいずれかの場合,出願人が適用される法規の要求を遵守できない場合は,行政又は司法処罰を受ける可能性がある。他の行動に加えて、これらの制裁は、規制当局が承認保留申請の拒否、承認の撤回、臨床封印、無タイトルまたは警告状、自発的な製品のリコールまたは市場からの撤回、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、弁護士資格の取り消し、罰金、政府契約の拒否、原状回復、返還、返還、または民事または刑事罰を含むことができる。このような行政や司法法執行行動は私たちに実質的な悪影響を及ぼす可能性がある。
アメリカの監督管理機関
アメリカ政府の規制と製品の承認
アメリカ連邦、州と地方の各級政府当局は著者らが開発している薬品の研究、開発、テスト、製造、品質管理、承認、ラベル、包装、貯蔵、記録保存、普及、広告、流通、承認後のモニタリングと報告、マーケティング、輸出入などの方面に対して広範な監督管理を行った。アメリカでは、FDAはFDCA及びその実施条例に基づいて薬品の監督管理を行い、FDCAと公衆衛生サービス法及びその実施条例に基づいて生物製品の監督管理を行う。
国会は時々草案、提出、立法を通過し、これらの立法はFDA規制製品の承認、製造、マーケティングの法定条項を著しく変える可能性がある。新しい立法に加えて、FDAの法規や政策は、当機関によってしばしば改正または再解釈され、その方法は、私たちの業務および私たちの候補製品、または私たちが開発する可能性のある任意の未来の候補製品に大きな影響を与える可能性がある。さらなる立法やFDA法規や政策変化、およびこれらの変化の影響が公布または実施されるかどうかは予測できない(あれば)。
アメリカの薬物開発プロセスは
規制の承認を得て、適切な連邦、州、地方法規と条例を遵守する過程を維持するには、多くの時間と財政資源が必要だ。製品開発過程、承認過程または承認後の任意の時間に適用される米国の要求を遵守できなかった場合、申請者が行政または司法制裁を受けたり、自発的な製品のリコールを招いたりする可能性がある。行政または司法制裁には、FDAによる未解決申請の承認拒否、承認撤回、臨床棚上げ、命名されていないまたは警告状、製品差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返還、返還、または民事または刑事罰が含まれる可能性がある。FDAが米国で発売される前に必要とされるプログラムは、一般に以下のような態様を含む
| ● |
“良好な実験室規範”或いはGLP規定に基づいて非臨床実験室テスト、臨床前研究と調合研究を完成する |
| ● |
ヒト臨床試験が開始される前に有効でなければならないINDをFDAに提出する |
| ● |
各臨床試験が開始される前に、各臨床場所で独立したIRBの承認を得る |
| ● |
GCPに基づいて十分かつ良好に制御されたヒト臨床試験を行い、提案製品の期待用途の安全性と有効性を決定する |
| ● |
医薬のNDAの製造およびFDAへの提出; |
| ● |
適用されれば、FDA諮問委員会の審査が満足的に完了する |
| ● |
CGMPに適合するかどうかを評価するために、生産製品またはその構成要素の1つまたは複数の製造施設に対するFDAの検査を良好に完了させること; |
| ● |
NDAに対する使用料とFDAの審査と承認を支払う。 |
テストと承認プロセスには多大な時間、労力、財力が必要であり、私たちの候補製品または私たちが開発する可能性のある未来の候補製品の任意の承認がタイムリーに承認されるかどうかを保証することはできません(もしあれば)。
開発する候補薬物製品が決定されると,非臨床試験段階に入る。非臨床試験は製品の化学、毒性、調合と安定性に対する実験室評価、及び臨床前研究を含む。INDスポンサーは、ヒトの任意の試験を開始する前に、INDの一部として、非臨床試験の結果を、製造情報、分析データ、および任意の利用可能な臨床データまたは文献と共にFDAに提出しなければならない。INDスポンサーはまた、臨床試験の目標、投与手順、被験者の選択と排除基準、安全性を監視するためのパラメータ、および最初の臨床試験が治療効果評価に適している場合に評価すべき有効性基準を詳細に説明するプロトコルを含まなければならない。IND提出後も,いくつかの非臨床試験が継続される可能性がある。INDはFDAが受領した30日後に自動的に発効し、FDAが提案された臨床試験に対して懸念または問題を提起しない限り、30日以内に試験を保留する。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。安全考慮または規定に適合しないために、FDAはまた、臨床試験の前または期間の任意の時間に臨床一時停止を強制的に実施することができ、特定のカテゴリーの製品中のすべての製品に対して臨床一時停止を強制的に実施することができる。FDAはまた、一部の臨床的保留を実施することができ、例えば、特定の持続時間または特定の用量の臨床試験の開始を禁止する。
われわれの現在の臨床試験は2つのINDで行われている。研究員主導の臨床試験に関する調査者は異なるINDで行われています
GCP規定によると、すべての臨床試験は1人以上の合格研究者の監督の下で行わなければならない。これらの規定には,すべての対象者に任意の臨床試験に参加する前に書面でインフォームドコンセントを提供することが求められている。また,臨床試験に参加する各機関を代表する内部審査委員会は,その機関が任意の臨床試験の計画を開始する前にその計画を審査·承認しなければならず,この委員会は少なくとも年に1回継続的な審査と再承認を行わなければならない。内部審査委員会は、臨床試験に参加する個人が直面するリスクが最小限に低減されているかどうか、期待利益について合理的であるかどうかを含む、臨床試験被験者の権利を保障する責任がある。IRBはまた、臨床試験に関する情報および同意書を承認し、これらの情報および同意書は、各臨床試験対象またはその法的代表に提供されなければならず、完成まで臨床試験を監視しなければならない。各新しい臨床レジメンおよびレジメンの任意の修正は、FDA審査を提出し、IRBs承認を提出しなければならない。
人体臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複或いは合併する可能性がある
| ● |
第1段階。製品は、最初に少量の健康なヒト対象または患者に導入され、安全性、用量耐性、吸収、新陳代謝、分布、および排泄を試験し、可能であれば、有効性の早期証拠を得る。いくつかの深刻または生命に危険な疾患の製品、特に製品が疑われるか、または有毒が避けられないことが知られている場合、最初の人体試験は患者に行われる可能性がある。 |
| ● |
第二段階:可能な副作用および安全リスクを決定するために、限られた患者集団に薬物を使用し、特定の標的疾患に対するこの製品の治療効果を初歩的に評価し、用量耐性および最適な用量およびスケジュールを決定する。 |
| ● |
第三段階:制御された良好な臨床試験において、薬物をより多くの患者集団に適用し、一般に地理的に分散された臨床試験場所であり、承認のために製品の有効性および安全性を評価するためのデータを生成し、製品の全体的な利益-リスクプロファイルを確立し、製品のラベルに十分な情報を提供する。 |
臨床試験結果を詳細に説明する進展報告は少なくとも毎年FDAに提出しなければならず、安全報告は15日以内にFDAと臨床調査者に提出しなければならず、深刻かつ意外な疑わしい有害事象、任意の臨床上重要な深刻な疑わしい副作用の発生率は方案或いは研究者マニュアルに記載された増加、或いは他の研究或いは動物或いは体外試験からの任意の発見を含み、候補薬物に暴露された人類は重大なリスクがあることを表明した。また、スポンサーは情報を受け取ってから7日以内にFDAに任意の意外な致命的あるいは生命に危害を及ぼす疑いのある副作用を通知しなければならない。第1段階、第2段階、および第3段階試験は、任意の指定された期間内に成功しない可能性がある(あれば)。FDA或いはスポンサーはいつでも様々な理由で臨床試験を一時停止或いは中止することができ、研究対象或いは患者が受け入れられない健康リスクに直面していることを発見することを含む。同様に、臨床試験がIRBの要求に従って行われない場合、または製品が対象に予期せぬ深刻なダメージを受けることに関連している場合、IRBは、その機関の臨床試験の承認を一時停止または終了することができる。
臨床試験と同時に、会社は通常追加の臨床前研究を完成し、また製品の化学と物理特性に関する追加情報を開発し、cGMP要求に基づいて最終的に商業大量生産製品の技術を確定しなければならない。製造過程は一貫して高品質の製品薬品ロットを生産できる必要があり、他の事項以外に、メーカーは最終製品の特性、強度、品質と純度をテストする方法を開発しなければならない。また,適切な包装を選択·試験し,製品薬物がその棚期間内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
アメリカの審査と承認の流れ
製品開発,非臨床研究と臨床試験の結果,および製造プロセス,製品の分析テスト,提案に関するラベルやその他の関連情報に関する他の詳細な情報は,NDAの一部としてFDAに提出され,この新薬の発売承認を要請した。改正された処方薬使用料法案によると、申請者はFDAに審査NDAの費用を支払わなければならない。これらの使用料や商業製造機関や承認された製品に必要な年会費が高くなる可能性があります。セキュリティプロトコル審査費だけで現在290万ドルを超えることができ,時間とともに増加する可能性が高い.ユーザ費用要求は、いくつかの限られた延期、免除、および減免によって制限される。
FDAは、提出後60日以内に提出されたすべてのNDAを検討して、それらが届出を受ける前に十分に完全であり、実質的な審査を行うことができることを保証する。FDAは秘密協定の申請を受け入れるのではなく、より多くの情報を提供することを要求するかもしれない。この場合、秘密協定と追加情報を再提出しなければならない。再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。
提出された申請が受け入れられると、FDAは深い実質的な審査を開始する。FDAの既定の目標は、6ヶ月以内に90%が“優先”状態とされたNDA出願を審査することであり、提案された製品が治療、診断または重篤な疾患の予防における安全性または有効性の面で著しく改善されることを示す証拠があれば、90%が“標準”状態とされている出願を10ヶ月以内に審査し、審査決定を行うことである。しかしながら、FDAはこれらの既定の目標範囲内で薬物を承認しない可能性があり、その審査目標は時々変わる可能性がある。FDAがNDAを審査する目的の1つは,製品がその期待用途に対して安全かつ有効であるかどうかを決定することである。FDAはまた、製品の特性、強度、品質、純度を確保するために、この製品の製造がcGMPに適合しているかどうかを評価する。セキュリティ協定を承認する前に、FDAは、通常、製品を生産しているか、または生産する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。FDAはまた、その申請を承認すべきかどうか、どのような条件下で承認すべきかを決定するために、諮問委員会にNDAを提出することができる。諮問委員会は臨床医や他の科学専門家を含む専門家グループであり、FDAの要求時にアドバイスとアドバイスを提供する。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を考慮するだろう。
承認プロセスが長く困難であり、適用される規制基準が満たされていない場合、または追加の臨床データまたは他のデータや情報が必要とされる可能性があり、FDAはNDAの承認を拒否する可能性がある。このようなデータや情報を提出しても,FDAはNDAが承認基準を満たしていないことを最終的に決定する可能性がある.臨床試験から得られたデータはつねに決定的ではなく,FDAのデータ解釈は我々の同じデータに対する解釈とは異なる可能性がある。FDAが現在の形のNDAを承認しないと決定した場合、FDAは完全な返信を発行するだろう。完全な返信は、一般に、NDAにおいてFDAによって発見されたすべての特定の欠陥を記述し、承認前にこれらの欠陥を満足的に解決しなければならない。決定された欠陥は微小である可能性があり、例えば、ラベル変更が必要であるか、または重大であり、例えば、追加の臨床試験が必要である。さらに、完全な返信状は、出願人がとり得る、申請を承認条件に置くための提案行動を含むことができる。完全な返信が発行された場合、出願人は、機密協定を再提出し、手紙で発見されたすべての不足点を解決するか、または申請を撤回するか、または聴聞機会を要求することができる。
1つの製品が規制部門の承認を得た場合、この承認は、特定の疾患および用量に明らかに限定される可能性があり、または使用の適応が制限される可能性があり、これは、製品の商業的価値を制限する可能性がある。さらに、FDAは、いくつかの禁忌症、警告、または予防措置を製品ラベルに含めることを要求する可能性がある。さらに、FDAは、NDA承認後の製品の安全性および有効性をさらに評価するための第4段階の臨床試験を含む承認後の研究を要求することができ、商業化された承認された製品の安全性を監視するための試験および監視計画を要求する可能性がある。FDAはまた、制限された配布方法、患者登録および他のリスク最小化ツールのような薬物ガイドライン、医師コミュニケーション計画、または他の安全使用を確保する要素によってのみ、NDAがリスクを低減するためのREMSを有することを承認することができると結論する可能性がある。
承認後に要求する
我々がFDAの承認を得たどの製品も、記録保存要求、製品副作用の報告、FDAへの最新の安全と治療効果情報の提供、製品サンプルと流通要件、特定の電子記録と署名要件の遵守、およびFDAの宣伝および広告要件を含むFDAの持続的な規制を受けるであろう。FDAは、上場製品のラベル、広告、販売促進、その他のタイプの情報を厳格に規制している。製品は承認された適応と承認されたラベルの規定でしか販売促進できません。また,メーカーはcGMP要求を遵守し続けなければならず,これらの要求は広く,遵守を確保するためにはかなりの時間,資源,継続的な投資が必要である.さらに、製造プロセスの変更は、通常、FDAの承認を得て事前に実施する必要があり、新たな適応および追加のラベル宣言を追加するなど、承認された製品の他のタイプの変更も、FDAのさらなる審査および承認を受ける必要がある。
承認製品の製造·流通に参加するメーカーおよび他のエンティティは、FDAおよびある州機関にその工場を登録し、cGMPおよび他の法律を遵守することを確実にするために、FDAおよび特定の州機関の定期的な抜き打ち検査を受けなければならない。CGMP要求は、製品の生産、加工、滅菌、包装、ラベル付け、貯蔵、および輸送を含む製造プロセスのすべての段階に適用される。製造業者は、製品が規格および法規要件に適合することを保証し、発表前に各製品ロットまたはロットの試験を行うために、検証されたシステムを構築しなければならない。私たちは依存し、引き続き第三者に依存して、私たちの候補製品と私たちが開発する可能性のある未来の候補製品の臨床数を生産することが予想されます。将来のFDAと州検査では、私たちの契約メーカー工場のコンプライアンス問題が発見されるかもしれませんが、これらの問題は生産や流通を混乱させたり、是正するために大量の資源が必要になる可能性があります。
規制要求を遵守していない場合や、製品発売後に問題が発生した場合、FDAは製品承認を撤回する可能性がある。その後、1つの製品に以前未知の問題が存在し、その製品のマーケティングが制限され、甚だしきに至っては完全に市場から撤退する可能性があることを発見した。さらに、規制要件を遵守しないことは、罰金、無タイトルまたは警告状、臨床試験の一時停止、製品差し押さえ、製品の輸出入許可の許可または拒否、指定された申請または補充剤の承認の拒否、マーケティングまたは製造の制限、禁止または同意法令、または民事または刑事罰、または自発的な製品リコールを引き起こす可能性がある行政または司法行動をもたらす可能性がある。
特許期間回復と市場排他性
FDAが私たちの候補製品または私たちが開発する可能性のある任意の未来の製品の使用を許可する時間、期限、および詳細によれば、私たちのいくつかの米国特許は、1984年の“薬品価格競争および特許期限回復法”(一般にHatch-Waxman Actと呼ばれる)に従って限られた特許期間を延長する資格があるかもしれない。ハッジ·ワックスマン法案は、製品開発およびFDA規制審査中に失われた特許期間の補償として、最長5年間の特許回復期限を許可する。しかし,特許期限の回復は特許の残存期間を延長することはできず,製品承認日から合計14年を超えることはできない。特許期間回復期は、一般にINDの発効日とNDAの提出日との間の時間にNDA提出日とその出願が承認されるとの間の時間の半分を加えるが、この審査期限は、出願人が職務調査を行わない任意の時間内に短縮される。承認された製品に適用される特許は1つのみ延期する資格があり,延期出願は特許が満了する前に提出されなければならない。米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。将来,可能であれば,臨床試験の期待長と関連するNDAの提出に関連する他の要因に基づいて,現在保有しているいくつかの特許出願の現在の満期日後に特許期間を回復させる予定であるが,このような延期は得られないかもしれない。
FDCAにおける市場排他性条項はまた、いくつかの申請の提出や承認を延期する可能性がある。FDCAは新しい化学実体秘密協定の承認を得た最初の申請者に5年間の米国内の非特許マーケティング排他性を提供した。FDAが以前に同じ活性部分を含む他の新薬を承認していなければ,薬物は新しい化学実体であり,活性部分は薬物物質の作用を担う分子やイオンである。排他期間内に、FDAは、出願人が承認のために必要なすべてのデータを合法的に参照する権利を有していない場合、FDAは、薬剤の別のバージョンのために別の会社に提出された簡略化された新薬出願またはANDAまたは505(B)(2)NDAを受け入れない可能性がある。しかしながら、出願が特許無効または非侵害の証明を含む場合、4年後に提出することができる。FDAが、出願人が行っているまたは後援する新しい臨床研究(バイオアベイラビリティ研究を除く)が承認申請に不可欠であると考えている場合、FDCAはまた、NDA、505(B)(2)NDAまたは既存のNDAの補充のために、既存の薬剤の新しい適応、用量または強度のような3年間の市場排他性を提供する。この3年間の排他性には,新たな臨床研究に関する使用条件のみが含まれており,FDAが原始活性物質を含む薬物のANDAを承認することは禁止されていない。5年と3年の排他性は完全な秘密協定の提出や承認を延期したり承認したりしないだろう。しかしながら、完全なNDAを提出する申請者は、安全性および有効性を証明するために、すべての非臨床研究および十分かつ良好に制御された臨床試験を参照する権利を行うか、または得ることを要求されるであろう。
臨床試験情報の開示
FDA規制製品(薬物を含む)の臨床試験スポンサーは、www.Clinicaltrials.gov上で公開して得ることができるいくつかの臨床試験情報を登録して開示しなければならない。製品、患者集団、調査段階、研究場所と研究者、および臨床試験の他の方面に関する情報は、その後、登録の一部として公開される。スポンサーも完成後にその臨床試験の結果を開示する義務がある。これらの試験結果の開示は,研究中の新製品や新適応が承認された後に延期することができる。競争相手はこれらの公開された情報を用いて開発計画の進捗状況を知ることができる.
薬品の保証範囲,定価と精算
私たちが規制承認を受ける可能性のあるどの製品のカバー範囲や精算状態にも、大きな不確実性がある。米国では、規制部門の承認を得て商業販売を行う可能性のある任意の製品の販売は、保証範囲の可用性と第三者支払者の補償にある程度依存する。第三者支払者には、政府当局、管理医療サービス提供者、個人健康保険会社、その他の組織が含まれる。支払者が製品に保険を提供するかどうかを決定するプロセスは、支払者が製品のために支払う支払率を設定するプロセスと分離することができる。第三者支払者は、承認されたリストまたは処方表上の特定の製品に保証範囲を制限することができ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。また、支払者が製品に保険を提供することを決定することは、十分な返済率を承認することを意味するものではない。製品開発への投資の適切な見返りを実現するために、十分な価格レベルを維持することができる十分な第三者精算がないかもしれない。
第三者決済者は、価格、医療製品およびサービスの医療必要性および費用効果、ならびにそれらの安全性および有効性を検討することにますます挑戦している。承認販売される可能性のある製品の保険や精算を得るためには、任意の製品の医療の必要性や費用効果、規制承認を得るのに必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。私たちの候補製品、または私たちが開発する可能性のある任意の未来の候補製品は、医学的に必要または費用効果があると考えられないかもしれない。第三者支払者が、製品が他の利用可能な療法と比較して費用対効果があると思わない場合、彼らは承認後にその製品をその計画の下の福祉としてカバーしないかもしれない、または、支払いレベルが会社にその製品を販売させて利益を得るのに十分ではない可能性があると思う場合がある。
アメリカ政府と州立法機関はコスト制御計画の実施に大きな興味を示し、政府が支払う医療コストの増加を制限し、価格制御、精算制限、ブランド処方薬の模倣薬の代替を要求し、薬品定価やり方の透明性を高めることを含む。例えば、“平価医療法案”に含まれる条項は、薬品の収益性を低下させる可能性があり、例えば、医療補助計画を精算する薬品のリベートを増加させ、医療補助リベートを医療補助管理の医療計画に拡大し、ある連邦医療保険D部分受益者に対して強制的に割引し、製薬会社の連邦医療保健計画における販売シェアに基づいて年会費を徴収する。公衆と政府もまた、米国上院および連邦と州検事を含む薬品コストと薬品価格戦略の審査を強化した。2018年5月、前総裁のトランプ氏は“青写真”を発表し、“青写真”以来提案されてきた関連薬品の定価措置は、医薬業界に運営と精算面の大きな変化をもたらす可能性がある。その中のいくつかの措置および他の提案された措置は追加の立法許可によって発効する必要があるが、国会とバイデン政府は薬品コストを制御するために新しい立法および/または行政措置を求め続けると表明した。例えば、バイデン政府の処方薬価格設定計画は衆議院で可決された“再建より良い法案”の一部であり、連邦医療保険が連邦医療保険B部分とD部分である高コスト処方薬の価格を交渉することを許可し、連邦医療保険との価格交渉を拒否する製薬業者に消費税を徴収し、連邦医療保険と個人保険の年間薬品価格の上昇を制限し、連邦医療保険D部分の公式を再設計するためのインフレリベートを要求することを目的としている。政府の統制と措置、および既存の制御と措置を有する司法管轄区域で制限的な政策を強化することは、私たちの候補製品を含む薬品への支払いを制限する可能性があり、あれば。
政府や第三者支払者が十分な保険や補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の製品の適正性が影響を受ける可能性がある。また,米国のコスト制御措置への重視度が向上しており,薬品定価の圧力を増加させ続けることが予想される。引受政策や第三者精算料率も随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
他の医療法とコンプライアンス要件
もし私たちの製品が規制部門の承認を得たら、私たちは医療業界の詐欺や乱用に対する様々な連邦や州法律の制約を受けるかもしれない。このような法律は私たちが提案した販売、マーケティング、そして教育計画などに影響を及ぼすかもしれない。また、私たちは連邦政府と私たちが業務を展開している州の患者プライバシー法規によって制限されるかもしれない。私たちの運営能力に影響を与える可能性のある法律には
| ● |
他の事項を除いて、誰もが知っている場合、または故意の場合、連邦医療保険および医療補助計画のような連邦医療保険および医療補助計画のような連邦医療保険および医療補助計画のような連邦医療保険および医療補助計画のような連邦医療保険および医療補助計画のような、現金または実物の形で直接または間接的に報酬を請求、受け入れ、提供または支払いすることを禁止する連邦反バックル法規 |
| ● |
個人または実体が虚偽または詐欺的な連邦医療保険、医療補助または他の第三者支払人の支払い請求を意図的に提出または提出すること、または虚偽クレームの支払いに対して虚偽陳述または記録材料を作成すること、または連邦政府への金銭支払い義務を回避、減少または隠蔽することを禁止する連邦民事および刑事虚偽申告法、虚偽陳述法および民事金銭罰法 |
| ● |
HIPAAは、詐欺の任意の医療福祉計画の実行と、医療事項に関する虚偽陳述を行う計画に連邦刑事と民事責任を課す |
| ● |
連邦透明性法律は、連邦医師支払い陽光法案を含み、これは“平価医療法案”の一部であり、適用される保険薬品製造業者に、医師および教育病院および医師所有権および投資利益への支払いおよび他の価値移転を開示することを要求する |
| ● |
“経済と臨床健康情報技術法”及びその実施条例の改正を経たHIPAAはまた、個人が健康情報を識別できるプライバシー、安全と伝送に対していくつかの要求を提出した |
| ● |
州法律は、製薬会社が製薬業界の自発的なコンプライアンスガイドラインを遵守することを要求する州法律と、場合によっては健康情報のプライバシーおよび安全を管理する州法とを必要とする任意の第三者支払人(商業保険会社を含む)の精算に適用可能な物品またはサービスのリベートおよび虚偽クレーム法律に相当し、HIPAAは先制されておらず、コンプライアンス作業を複雑化させる。 |
“平価医療法案”は詐欺や乱用法の適用範囲を拡大し,それ以外にも連邦“反リベート法規”の意図要求と,米国連邦法典第42編1320 a−7 b節に記載されている適用される刑事医療詐欺法規を改正した。法定修正案によると、個人または実体は、この法規やその法規に違反する具体的な意図を実際に知る必要がなくなり、違反行為を実施することができる。また,“平価医療法”では,連邦“反リベート条例”違反による物品やサービスのクレームが含まれており,“虚偽請求法”や“民事罰金法”については,虚偽や詐欺的クレームを構成している。これらの法律および同様の法律は、さらなる改正または再解釈を受ける可能性があり、実施条例は、我々の業務に大きな影響を与える可能性がある方法で改正または再解釈される可能性がある。例えば、2020年11月、米国衛生·公衆サービス部は、連邦反リベート法規を改正する規則を発表したが、これらの規則の実施は、現政府が2021年1月に発表した規制凍結とこれらの規則に挑戦する訴訟の影響を受け続ける可能性がある。多くの州は連邦反リベート法規のような法律を通過しており、その中のいくつかは連邦医療保険と医療補助計画だけではなく、転介患者に任意の出所精算の医療項目或いはサービスを得るのに適している。
支払者に直接クレームを提出しないにもかかわらず、連邦虚偽クレーム法案および他の医療保健法によると、メーカーが顧客に不正確な請求書やコード情報を提供したり、ラベル外で製品を宣伝したりすることによって“原因”とみなされて虚偽または詐欺的クレームを提出しているとみなされた場合、メーカーは責任を追及される可能性がある。また、製品を報告する卸売業者や推定小売価格、医療補助フィードバック情報を計算するための価格や他の製品連邦、州、第三者精算に影響を与える情報、製品の販売やマーケティングなど、今後の活動は、虚偽請求法案の審査を受けることになる。虚偽請求法案違反の処罰には,政府が実際に受けた被害の3倍,強制民事処罰が加えられており,連邦医療計画から除外される可能性がある。適用される民事罰金はインフレによって年ごとに増加する;2021年12月13日から1つの虚偽クレームに対する罰金は11,803ドルから23,607ドルの間である。また,連邦虚偽請求法は民事法規であるにもかかわらず,虚偽請求法違反を招く行為にも様々な連邦刑事法規が関与している可能性がある。また,個人は連邦虚偽申告法に基づいて訴訟を起こす能力があり,ある州では連邦虚偽申告法に倣って法律が制定されている。
患者保護と“平価医療法案”
2010年3月に公布された“平価医療法案”には、米国政府や民間保険会社が医療に資金を提供する方法が著しく変更されたり、大幅に変更されたりする措置が含まれている。“平価医療法案”の製薬業にとって最も重要な条項は以下のとおりである
| ● |
医療補助薬品還付計画は製薬業者が衛生と公衆サービス部部長と締結し、全国的な税金還付協定を発効することを要求し、各州がメーカーが医療補助患者に提供する外来薬物の連邦マッチング資金を獲得する条件とする。“平価医療法案”は、薬品メーカーの大多数のブランド処方薬に対する税金還付責任をメーカーの平均価格の15.1%からメーカーの平均価格の23.1%に引き上げ、ブランド製品の固体経口剤形シリーズの延長に対する新しい税金還付計算を増加させ、メーカーの平均価格の法定定義を修正した。平価医療法案は,製薬業者に医療補助管理のための医療使用に対する還付金の支払いを要求することにより,医療補助薬物福祉を受ける資格のある人口を拡大し,薬品税還付制限を受けた医療補助使用範囲を拡大した。 |
| ● |
医薬品がMedicare Part BとMedicaid計画の下で連邦補償を受けたり、米国政府機関に直接販売されるためには、メーカーは340 B薬品の定価計画に参加する資格のある実体に割引を提供しなければならない。“平価医療法案”は340億ユーロの割引定価を取得する資格のある実体タイプを拡大した。 |
| ● |
“平価医療法案”はブランド薬品メーカーが医療保険Dの一部の患者に発行したブランド薬品の交渉価格に基づいて50%の割引を提供して、保険不足(即ち“ドーナツ不足”)を補うことを要求する。 |
| ● |
“平価医療法案”は、特定のブランドの処方薬を生産または輸入する任意のエンティティに控除できない年間費用を徴収し、この費用は、孤児の適応のために許可された特定の製品の販売には適用されないが、特定の政府医療計画におけるこれらのエンティティの市場シェアに基づいてこれらのエンティティ間で分担される。 |
これらの規定に加えて、“平価医療法案”にはいくつかの機関が設置されており、これらの機関の仕事はある薬品の市場に将来的な影響を与える可能性がある。その中には,患者を中心とした結果研究所が設立され,優先順位を監督·決定して臨床有効性比較研究を行うこと,連邦医療保険·医療補助サービスセンター内の医療保険·医療補助革新センターを設立し,革新的な支払い·サービス交付モデルをテストし,連邦医療保険·医療補助支出を低減することである。
“平価医療法案”は挑戦されてきており,現在もこの法案の全部または一部の廃止や改正に努めている。2016年11月の米大統領選以来、米議会およびトランプ前総裁は、平価医療法案の全部または一部を廃止または修正するために多くの努力をしてきた。例えば、トランプ前総裁は2017年12月に法律となった“減税·雇用法案”に署名し、“平価医療法案”の個人医療保険認可を廃止し、この法案は“平価医療法案”の重要な構成要素とされている。また,2018年12月,米国テキサス州北区地方裁判所は,(I)税法の一部として関連税罰が国会で廃止され,個人強制令が違憲である,(Ii)個人強制令は平価医療法案の他の部分と分離できないため,平価医療法案全体が無効と判断した。2019年12月、米国第五巡回控訴裁判所は下級裁判所の裁決を維持し、その後米国最高裁判所に上訴した。2021年6月17日、米国最高裁は、州および個人原告はACAの個人権限条項に挑戦する資格がないと判断し、このような判決では、最高裁は、この条項の有効性またはACA全体の有効性に関するより大きな憲法問題を考慮していない。そのため、“平価医療法案”やその内容に代わるいかなる法律が私たちの業務に与える全面的な影響はまだ不明である。これらの法律や他の法律は医療資金のさらなる減少を招く可能性があり,いずれかの承認を得られれば,我々候補製品の顧客に実質的な悪影響を与える可能性がある。既存の法律を実施したり、医療や他の立法改革に基づいて追加法律を公布することが私たちの業務に与えるすべての影響を予測することはできませんが、私たちが承認されれば、私たちの製品の精算を減らしたり、私たちの製品のカバー範囲を制限する立法や法規が、医療提供者がどれだけ開いたり、どのような場合に私たちの候補製品を発行したり管理したりすることに悪影響を及ぼす可能性があると信じています。
中国の監督管理
中国では、私たちはますます複雑になっている法律と規制環境で運営されている。私たちは様々な中国の法律、規則、法規の制約を受けて、これらの法規は私たちの業務の多くの方面に影響を与えている。この部分は、私たちの業務と運営に関する主な中国の法律、規則、法規をまとめている。
中国食品薬品監督管理局通則
中国では、国家薬品監督管理局は薬品及び医療機器と設備の管理を監視·監督している。国家薬品監督管理局の主要な職責は:新薬、模倣薬、輸入薬品と漢方薬に対して審査、登録と審査を行う;薬品と医療機器の製造、輸出と輸入許可証の許可と発行;薬品生産と流通企業の設立を許可する;化粧品、薬品と医療設備監督管理の行政法規と政策を制定する;これらの製品に関連する重大な事故を処理することを含む。地方省級薬品監督管理部門は本行政区域内の薬品監督管理を担当している。
1984年全国人民代表大会常務委員会が公布した“中華人民共和国薬品管理法”は、それぞれ2001年、2013年、2015年と2019年に改正され、及び2002年に国務院が公布した“中華人民共和国薬品管理法実施方法”は、それぞれ2016年と2019年に改正され、薬品管理の法律枠組みを規定し、薬品の研究、開発と製造を含む。
“中華人民共和国薬品管理法”はそれぞれ2001年2月、2013年12月、2015年4月と2019年8月に改正された。改訂の目的は薬品の監督と管理を強化し、人が使用する薬品の品質と安全を確保することである。改正された“中華人民共和国薬品管理法”は薬品の開発、生産、経営、応用と監督管理活動に適用される。それは医療機関の薬物製剤の管理及び薬品の開発、研究、製造、流通、包装、定価と広告の枠組みを規範と規定した。最新に改正された“中華人民共和国薬品管理法”は薬品の発売許可保持者制度に組み入れられ、いくつかの薬品が条件的に薬品の発売審査手続きを許可或いは優先的に享受できることを再確認し、臨床試験の許可に対していわゆる黙示許可制度を実行し、そしていくつかの証明要求を取り消した。国務院が公表した改正後の“中華人民共和国薬品管理法実施方法”は2002年9月から施行され、それぞれ2016年と2019年に改正され、改正後の“中華人民共和国薬品管理法”に対して詳細な実施規定が制定された。
これらの規定により、著者らは非臨床研究、臨床試験、新薬生産において関連規定を遵守する必要がある。
非臨床研究の良好な実験室実践認証
動物研究の質を高めるため、中国食品薬品監督管理局は2003年に“非臨床実験室良好な実験室操作管理方法”を公布し、2017年7月に改訂を行い、GLP認証計画を実施し始めた。2007年4月、CFDAは“良好な実験室操作規範認証措置に関する通知”を発表し、即ちCFDA第214号通知であり、NMPAが非臨床研究機関の認証を担当することを規定した。中国薬品監督管理局第214号の通知によると、国家薬品監督管理局は機構の組織管理、研究者、設備と施設及び非臨床薬物プロジェクトの運営と管理状況に基づいて、この機関が薬物非臨床研究を行う資格があるかどうかを決定する。すべての要求が満たされていれば,国家薬監局はGLP証明書を発行し,結果は国家薬監局のウェブサイトで公表される。
現在,われわれが行っているすべての項目について,Joinn実験室が運営するNMPA認証GLP実験室と連携し,NMPAの要求に応じてGLP後の研究を行っている。
臨床試験と新薬生産を承認する
国家市場監督管理総局が2020年に発表した“薬品登録管理規定”、2020年6月に国家薬品監督管理局の“化学薬品登録分類及び申請材料の要求に関する通知”、2019年全国人民代表大会常務委員会が公布した“薬品管理法”、2009年に中国薬品監督管理局が発表した“新薬登録特別審査規定に関する通知”、中国薬品監督管理局が2013年に発表した“薬品臨床試験情報発表プラットフォームに関する通知”によると、臨床試験と新薬生産は以下の手続きに従わなければならず、いくつかの承認を取得しなければならない。
良好な臨床試験実践
臨床試験の品質を高めるため、中国薬品監督管理局は2003年8月に“薬品臨床実践品質管理方法”を公布した。“薬品臨床実践品質管理規程”によると、臨床試験は考察された薬物の作用、副作用及び/或いは吸収、分布、代謝と排泄状況を証明或いは掲示するために、被験者(患者或いは健康ボランティア)に対して行った薬物システム研究である。臨床試験の目的はこの薬物の治療効果と安全性を確定することである。
2020年4月、国家薬品監督管理局と国家衛生健康委員会は改訂後の“薬品臨床実践品質管理規則”を公布し、そして2020年7月から施行し、臨床試験の品質と人体被験者の安全を更に確保する。改訂後の“薬品臨床実践品質管理細則”は中国臨床試験の設計と実施に対して全面的、実質的な要求を提出した。特に、改訂後の“薬品臨床実践品質管理規則”は研究対象の保護を強化し、臨床試験で採集した生物サンプルの制御を強化した。
改訂後の“薬品臨床実践品質管理規則”はまた、臨床試験に参加する研究者とセンターの資格と要求を規定し、(I)臨床試験センターの専門認証、臨床試験の専門知識、訓練経験と能力を含み、要求に応じて最新の履歴書と関連資格文書を提供することができる;(Ii)試験方案、研究者マニュアルと申請者が提供した試験薬物に関する情報を熟知し、遵守する;(Iii)改訂された“薬品臨床実践品質管理規則”と臨床試験に関連する法律法規を熟知し、遵守する。(4)研究者が署名した仕事分配授権表のコピーを保存する;(5)研究者と臨床試験センターは申請者組織の監督検査と薬品監督部門の検査を受けるべきである;(6)研究者と臨床試験センターは他の個人或いは機関が臨床試験に関連する責任と機能を担うことを許可し、その個人或いは機関の合格を確保し、そして完全な手続きを確立し、職責と機能を十分に履行し、信頼できるデータを生成することを確保すべきである。
臨床試験応用
研究機構は非臨床研究を完成した後、必ず臨床試験を申請した後に臨床試験を行うことができる。
2018年7月24日、国家薬品監督管理局は“薬物臨床試験の審査プロセスの調整に関する公告”を発表し、その中で、申請を受理し、申請費を納付した日から60営業日以内に、CDEに申請を提出し、しかもCDEのマイナス或いは疑わしい意見を受けていない者は、臨床試験がすでに承認されたとみなすことを規定した。
2019年12月1日、新たに改正された“中華人民共和国薬品管理法”が施行され、上記黙示許可制度を国家立法レベルに組み入れた。規定によると、国務院医療製品行政主管部門は臨床試験申請を受理した日から60営業日以内に承認の有無を決定し、そして決定を臨床試験申請者に通知しなければならない;期限を過ぎて臨床試験申請者に通知しなかった者は、承認とみなす。
2020年1月22日、国家市場監督管理総局は改訂された“薬品登録管理規定”を発表し、2020年7月1日から施行した。“規定”によると、疾病管理センターは受理した日から60営業日以内に臨床試験申請を許可するかどうかを決定しなければならない。期限が過ぎて出願人に通知されなかった者は,承認とみなす。
国内の第一種類の薬品特別審査
国内の第1類新薬は第一選択プログラムを獲得する資格があります
国家薬品監督管理局が2020年に公布した“薬品登録規定”によると、薬品は3種類に分けられ、即ち化学薬品、生物製品と漢方薬である。そして、国家薬品監督管理局が2020年6月29日に公表し、2020年7月1日から施行する“化学薬品登録分類と申請材料要求に関する通知”に基づいて、化学薬品を5種類に分類した。1種類の薬物はどの国にも発売されていない新薬である。本年度報告20−F表までの日付は,米国国家食品薬品監督管理局に提出されたCIN予防適応でプリブリンに対する秘密保持協定が受け入れられ,1種類に指定されている。
改正された“薬品登録規定”によると、生命に深刻な危害を及ぼす疾患又は生活の質に深刻な影響を与える疾患のための新薬臨床試験期間中に、他に有効な治療方法がない場合、又は当該新薬が既存の治療方法よりも明らかな臨床的優位性を有することを証明する十分な証拠があれば、出願人は突破的な治療薬プログラムを申請することができる。画期的な治療薬物プログラム下の臨床試験は、以下の優先権を有することができる:(1)申請者は薬物臨床試験の重要な段階でCDEにコミュニケーション申請を提出することができ、CDEは審査者と申請者とのコミュニケーションを手配すべきである;(2)申請者は段階的にCDEに研究材料を提出することができる;(3)CDEは既存の研究材料に基づいて、次の研究方案に対して意見或いは提案を提出し、申請者にフィードバックすべきである。2020年12月10日、国家薬品監督管理局は改訂後の“薬品開発と技術審査評価コミュニケーション管理方法”を発表し、コミュニケーションの手順を詳細に規定した。
改訂後の“薬品登録規定”によると、以下の重大な臨床価値を有する薬品は優先的に薬品の発売審査手続きを享受することができる:(一)臨床で必要な薬品と革新薬品及び重大な伝染病と孤児疾病を予防·治療するために開発した改善新薬;(2)児童の生理特徴に符合する児童薬品の新品種、剤形と規格;(三)疾病予防と制御に必要なワクチンと革新ワクチン;(四)突破的な治療薬物プログラム中の薬品;(五)条件審査要求に符合する薬品;(六)国家薬品監督管理局が更に規定したその他の情況。薬品登録申請者は国家薬品監督管理局に確認した後、薬品発売申請を提出すると同時に薬品優先審査申請を提出することができる。薬品発売許可優先プログラムを享受する薬品申請に対して、薬品発売審査期限は130営業日と規定した。2020年7月7日、国家薬品監督管理局は“突破的治療薬物審査認可議定書(試行)”、“薬品上場申請条件付き承認承認議定書(試行)”と“薬品上場証明書優先審査議定書(試行)”を発表し、それぞれ突破的治療薬物手続きと優先審査手続き、上場条件付き承認条件に符合する薬品の手続き規則、優先審査の手続きと細則を規定した。
プリブリンはすでにアメリカ国家薬品監督管理局から突破的な治療称号を授与され、これは私たちがもっと早く中国で許可を得、そしてもっと早く治療方法を患者にもたらすことができるかもしれない。
5種類の薬物に対する1種類の新薬の優位性
“改革案”制定前、第三類薬品はすでに多国籍企業によって海外で販売されていたが、中国ではまだ承認されていない薬品であり、現在“改革方案”に基づいて第三類薬品を第五類薬品に再分類している。国家薬品監督管理局は2020年6月に“化学薬品登録分類及び申告材料の要求に関する通知”(2020年7月から施行)を発表し、“改革方案”が提出した化学薬品分類原則を再確認し、第5類の亜類に対して小幅な調整を行った。この規則によると、5.1類は革新化学薬品と改良新薬、5.2類は模倣薬であり、すべて国外で発売されるべきであるが、中国ではまだ承認されていない。5種類の薬品を申請するのと比べ、1種類の国産新薬を申請する登録経路はもっと単刀直入である。国家薬品監督管理局が2020年12月10日に発表した“薬品登録規定”と“薬品開発と技術審査評価のコミュニケーション管理方法”によると、突破的な治療薬物のプログラムと優先プログラムを承認する者は、臨床試験と発売申請を優先的に処理し、そしてCDEとのコミュニケーションを強化する。
対照的に、国家薬品監督管理局が2020年に公布した“薬品登録管理規定”によると、第5種類の薬品の登録経路は複雑かつ絶えず変化している。第5種類の薬物申請は会社がNDAの許可を得て、主要な監督機関(例えばFDA或いはEMA)の許可を得たCPP後にしか提出できない。多国籍企業は多地域の臨床試験を申請する必要があるかもしれないが、これは会社が中国患者と看護標準に適した臨床試験を設計する柔軟性がないことを意味する。また,さらに地元臨床試験の要求は数年の市場参入を延期し,国際NDAの承認を得る可能性がある。また、国務院が2015年8月に発表した“薬品と医療機器の審査手続きの改革に関する意見”によると、これは未来の立法と国家薬品監督管理局の審査の指導意見であり、すでに国外で発売された薬品は将来中国の法律で規定された新薬に指定されなくなる可能性があるため、いかなる新薬優遇待遇を受けることができない可能性がある。この指導意見を徹底して実行するため、2016年3月、元中国食品薬品監督管理局は“改革方案”を発表し、“薬品登録規定”に規定されている化学薬品登録種別を変更した。元中国食品薬品監督管理局が発表した“改革方案解釈”によると、新薬とは中国或いは国外で発売されたことのない薬物を指す。国家薬品監督管理局が2020年に公布した“薬品登録管理規定”と国家薬品監督管理局が2020年6月29日に公表し、2020年7月1日から施行する“化学薬品登録分類と申請材料の要求に関する通知”に基づいて、新薬解釈も採用された。
私たちの候補製品はすべて新しい治療剤で、私たちの現在のすべての候補製品は第一種類の申請プログラムに属すると予想されます。規制枠組みの前に、臨床開発の各段階を開始する前に単独の臨床試験申請を承認することが要求されているが、2015年12月、CFDAは、プリブリンとドセタキセルの併用による非小細胞肺癌の直接抗癌薬とCINを予防するすべての段階の臨床試験を含むわれわれの臨床試験申請を承認した。
レビューと承認プロセスの変更
2015年8月、国務院は“薬品と医療機器の審査プロセスの改革に関する意見”を発表し、医薬業界に有利になる可能性のある政策変化をいくつか提出した
| ● |
革新薬物の審査を加速し、特殊な審査手続きを実行し、満足されていない医療需要が比較的に高い領域に重点的に注目し、HIV、悪性腫瘍、深刻な伝染病、孤児疾患を治療する革新薬物;国家科学技術重大特別プロジェクトと国家重大研究開発計画が援助した薬物;中国で現地で生産される革新薬物;児童薬物;先進調合技術、革新治療方法或いは明らかな臨床治療効果を有する薬物を採用する; |
| ● |
会社がマーケティング許可保持者として働き、契約製造組織を雇って薬品を生産することを許可する政策を計画している |
| ● |
臨床試験の審査制度を完備し、企業が国外と同時に中国で臨床試験を展開することを許可し、国内の臨床試験機関が国際多センターの臨床試験に参与することを奨励する。 |
| ● |
2015年11月、全人代常務委員会は“国務院が一部の地区で薬品上場許可所持者制度の試験と関連問題を展開することを許可する決定”を発表し、国務院は北京、天津、河北、上海、江蘇、浙江、福建、山東、広東、四川などの地区で薬品発売許可所持者制度の試験を展開し、国務院に薬品登録種別の改革を許可した。2018年10月、全人代常務委員会は“複数の地域で薬品上場許可証所持者制度の試験期間を延長することに関する決定”を発表し、試験期間を2018年11月4日から2019年11月4日に延期した。 |
| ● |
2015年11月、中国食品薬品監督管理局は“薬品登録審査のいくつかの政策に関する通知”を発表し、臨床試験の審査プロセスを簡略化と加速する可能性のある以下の政策を更に明確にした |
| ● |
新薬の臨床試験申請に対して、一度に一括審査手続きを採用し、一度に新薬の臨床試験を許可するすべての段階を許可し、現在の段階的承認手続きではない |
| ● |
以下の申請に薬品迅速登録または臨床試験承認経路を提供する:(1)HIV、悪性腫瘍、深刻な伝染病と孤児疾患などの革新的な新薬登録の治療と予防、(2)小児科薬物登録、(3)中国で流行している老年病を治療する老年薬物登録、(4)国家科学技術重大特別プロジェクトと国家重大研究開発計画によって援助された薬物登録、(5)臨床緊急、先進技術の使用、革新的な治療方法の使用、または明らかな臨床効果を有する薬物登録;(6)中国現地で生産しようとする外国革新薬物登録;(7)すでにアメリカ、EUで許可された新薬臨床試験同時申請、あるいはすでにアメリカ、EUで発売を申請し、現場検査に合格し、中国の同じ生産ラインで生産された薬品は同時に薬品登録を申請する;(8)3年以内に臨床で必要かつ特許が満期になった薬品の臨床試験申請、1年以内に臨床で必要かつ特許期限が切れた薬品の上場許可申請。 |
2017年12月、中国食品薬品監督管理局は“薬品の革新を奨励し、優先審査制度を暗黙的に承認することに関する意見”を発表し、さらに優先審査範囲を規定した。次の薬品は優先的に審査と承認を受ける権利がある
| ● |
(1)非中国または海外で発売されている革新薬品の登録出願、(2)中国現地で生産される予定の革新薬品の登録出願、(3)先進剤形技術、革新的治療方法または明らかな臨床効果を有する薬品を用いた登録出願、(4)特許有効期間3年以内に満了する特許薬品臨床試験出願および1年以内に満了する特許薬品の生産出願のうちの1つがある。(5)米国、EUで承認された新薬臨床試験同時申請、または米国、EUで発売許可を申請し、現場検査を通過し、中国の同じ生産ラインで生産された薬品は同時に薬品登録申請を申請する;(六)深刻な疾病の予防と治療の臨床方向が明確な漢方薬(民族薬を含む)の登録申請;(七)国家科学技術重大特別プロジェクト、国家重大研究開発計画の援助、国家臨床医学研究センターによる臨床試験を行い、国家臨床医学研究センターの管理部門に認可された新薬登録申請。 |
| ● |
以下の疾患の予防と治療において臨床治療効果が明らかな薬物:(1)HIV;(2)肺結核;(3)ウイルス性肝炎;(4)孤児疾患;(5)悪性腫瘍;(6)小児科薬物;(7)老年病。 |
2020年7月7日、国家薬品監督管理局は“突破的治療薬物審査評価議定書(試行)”、“薬品上場申請条件付き審査審査議定書(試行)”と“薬品上場証明書優先審査議定書(試行)”を発表し、“薬品革新の奨励に関する意見”に代わり、優先審査制度を隠れている。
2016年5月、国務院弁公庁は41号通知を印刷配布し、薬品上場授権者制度がついに実施されたことを示した。第41号通知は北京、天津、河北、上海、江蘇、浙江、福建、山東、広東、四川などの地区の薬品研究開発機構と研究専門家が薬品登録申請者を務め、薬品臨床試験と薬品発売申請を提出することを許可した。41号通知発効日後に新たに登録された薬品については,出願人が薬品臨床試験又は薬品上場申請を提出すると同時に薬品発売許可所持者となる出願を提出することを許可する。2016年7月、中国食品薬品監督管理局は“薬品上場許可所持者制度の試験事業の展開に関する通知”を発表し、第41号通知に規定された申請手続きをさらに規定した。2017年8月、中国食品薬品監督管理局は“薬品発売許可所持者制度試験の推進に関する事項に関する通知”を通達した。本通知は薬品発売許可所持者制度の試験を推進し、薬品発売許可所有者の権利と義務を明確にし、薬品生産過程の品質管理システムを健全化し、薬品生産経営サプライチェーン責任制を完備することを目的としている。2018年10月、全人代常務委員会は“複数の地域で薬品上場許可所持者制度の試験期間を延長することに関する決定”を発表し、試験期間を2018年11月4日から2019年11月4日まで延長した。
2019年12月1日、新たに改正された“中華人民共和国薬品管理法”が正式に施行され、薬品上場授権者制度が全国範囲で正式に実施されたことを示している。“中華人民共和国薬品管理法”によると、企業と薬品研究開発機構を上場授権者として、薬品生産企業を招聘して薬品を生産することを許可する。また、薬品の発売許可保持者は薬品の品質保証システムを構築し、薬品の非臨床研究、臨床試験、薬品生産経営、発売後の研究と不良反応のモニタリングなどを担当すべきであると規定した。
また、中国薬品管理法は、薬品登録審査過程において、臨床不足薬品と重大な伝染病、孤児疾病などの疾病の予防と治療に用いる新薬を優先すべきであると規定している。
2020年1月22日、国家薬品監督管理局は改訂後の“薬品登録管理規定”を発表し、2020年7月1日から施行した。改訂後の“薬品登録規定”によると、以下の重大な臨床価値を有する薬品は優先的に薬品の発売審査手続きを享受することができる:(1)臨床で必要な薬品と革新薬品及び重大な伝染病と孤児疾病を予防·治療するために開発した改良新薬;(2)児童の生理特徴に符合する児童薬品の新品種、剤形と規格;(3)疾病予防制御に必要なワクチンと革新ワクチン;(4)突破的な治療薬品使用プログラム中の薬品;(5)条件審査要求に符合する薬品;(6)国家薬品監督管理局が更に規定したその他の情況。薬品登録申請者は国家薬品監督管理局に確認した後、薬品発売申請を提出すると同時に薬品優先審査申請を提出することができる。薬品発売許可優先プログラムを享受する薬品申請に対して、薬品発売審査期限は130営業日と規定した。2020年7月7日、国家薬品監督管理局は“薬品上場証明書優先審査議定書(試行)”を発表し、優先審査の手続きと詳細条件を規定し、同時に“薬品革新の奨励に関する意見”に代わって、中国食品薬品監督管理局が優先審査制度を実行することを示唆した。
2021年3月11日、全人代は14、5計画を発表し、その中で、政府は革新薬品、ワクチンと医療器械の加速審査メカニズムを完備し、孤児の疾病と臨床に必要な疾病を治療する薬品と医療器械の審査を強化し、海外で販売されている臨床早急に必要な新薬と医療器械の国内販売を促進することを規定した。
2021年4月27日、国務院弁公庁は“薬品監督能力建設の全面的な強化に関する実施意見”を発行した。それは当局の技術的検討能力を向上させなければならないと規定している。地域協調発展戦略の需要に着目し、現有の監督管理資源を統合し、漢方薬材、生物製品(ワクチン)検査機構の設置を最適化し、専門技術能力を強化する。革新薬品と臨床で必要な薬品、医療機器の研究開発協同作業メカニズムを完備し、新技術の応用と新製品の研究開発を奨励する。専門家諮問委員会の審査決定作用を十分に発揮し、法律に基づいて専門家の意見、評価結果と評価報告を公開すべきである。コミュニケーション方式とルートを完備し、革新薬物と医療機器大会のコミュニケーション頻度を増加させ、申請者に対する技術指導とサービスを強化する。臨床で緊急に必要な海外上場薬品の輸入制度を完備する。
非コンプレックス基準
中国案では、1つの薬物は主要な終点で優位性を示すことなく、監督部門の承認を得る可能性がある。逆に、1つの薬剤がその主要終点で非劣勢を示し、第2の終点で優位性を示す場合、その薬剤の使用が承認される可能性がある。
承認または条件付き承認を加速する
2017年10月、中国共産党中央弁公庁、国務院は“審査評価審査制度改革の深化による薬品医療機器の革新の促進に関する意見”を通達した。本意見は、他の事項を除いて以下の事項を規定している
| ● |
臨床で必要な薬品或いは医療機器に対して、審査過程を加速しなければならない |
| ● |
(一)有効に治愈できない重篤、生命に危害を及ぼす疾病の治療に応用し、或いは(二)公共衛生が必要な薬品、医療器械に対して、上述の薬品、医療器械の臨床試験の早、中期指標が治療効果と潜在臨床価値を示すのは、条件的にその上場を許可することができ、上場を希望する企業は適用の要求に従ってリスク制御計画を制定し、研究を行うべきである |
| ● |
臨床試験や承認手続きが新薬の発売遅延を招く可能性があるため、いくつかの試験中の新薬に関連する特許の保護期間を延長する |
| ● |
国際多センターから得られた臨床試験データは、中国薬品医療機器登録適用条件に符合するものであり、中国薬品医療機器登録に用いることができる。 |
2017年12月、中国食品薬品監督管理局は“医療需要を満たしていない薬品条件審査技術ガイドライン”の意見募集稿を発表し、それに対して更なる改訂を行い、“医療需要を満たしていない薬品条件審査技術ガイドライン”と改名し、2019年11月にCDEによって再発表され、公衆の意見を求めた。2019年11月19日、CDEは“薬品条件付承認技術指導原則公告(試行)”を発表し、当日から施行した。本公告は生命を厳重に危害する疾病と公共衛生需要の薬物の定義を規定し、申請者とCDEに発売後に承諾して完成した研究とその他の内容について討論し、共通認識を達成することを要求し、発売後の臨床研究計画の提出、予定完成日、臨床研究報告の提出日と上場後のリスク制御計画などを含むが限定されない。
2019年12月1日、新たに改正された“中華人民共和国薬品管理法”が施行され始め、同法は繰り返し、(一)有効に治癒できない深刻かつ生命に危害を及ぼす疾病を治療するための薬品、あるいは(二)公衆健康を改善する必要がある薬品は、条件的に承認することができ、条件はこれらの薬物の臨床試験指標が治療効果と潜在的な臨床価値を示すことである。すでに条件付き承認を得た薬品に対して、当該薬品の発売許可所持者は相応のリスク管理措置を採用し、そして規定の期限内に要求に従って関連研究を完成しなければならない。もし研究が規定された期限内に要求通りに完成できなかった場合、あるいはその利益がデメリットより大きいことを証明できなかった場合、最悪の場合は薬品発売許可証を取り消される可能性がある。
2020年1月22日、国家薬品監督管理局は改訂後の“薬品登録管理規定”を発表し、2020年7月1日から施行した。改訂後の“薬品登録規定”は上述の条件付き審査メカニズムを採用し、上述の2種類の薬品以外に、国家衛生健康委員会が確定した重大な突発公共衛生事件に対応するために必要なワクチン或いはその他の評価された利益がデメリットのワクチンよりも大きく、条件承認も可能である。薬品の条件が承認された後、上場許可所持者は相応のリスク管理措置を採用し、規定期限内に要求に従って臨床試験などの関連研究を完成し、そして補充申請の形式でこの薬品登録を申請しなければならない。
2020年10月17日、改正された“中華人民共和国特許法”は全国人民代表大会常務委員会によって発表され、2021年6月1日から施行される。改正後の“中華人民共和国特許法”では,新薬の発売承認にかかる時間を補償するために,特許行政部門は特許権者の請求に基づいて,中国が上場を承認した新薬に関する発明特許に対して特許権期限の補償を与えることが規定されている。
2020年7月7日、国家薬品監督管理局は“薬品上場申請条件付き審査認可議定書(試行)”を発表し、条件付き審査の手続きと具体的な条件を規定した。
2021年3月12日、全人代は“十四五計画”を印刷配布し、その中で、革新薬物、ワクチン、医療機器の加速審査メカニズムを完備することを規定した。臨床で必要な或いは珍しい病気用薬品、医療機器の審査を推進する。臨床で緊急に必要な海外発売新薬と医療機器の輸入にも便利を提供しなければならない。
臨床試験の4段階
臨床試験は第1段階、第2段階、第3段階、第4段階を含む。第1段階は最初の人体臨床薬理学と安全性評価研究を指す。第二段階は候補薬物の患者特定適応下の治療効果と安全性の初歩的な評価であり、第三段階の臨床試験の設計に証拠と支持を提供し、そして投与方案を確定する。第三段階とは,1つの薬物の治療効果を確認するための臨床試験である。第三段階は、目標適応を有する患者に対する薬物の治療効果と安全性をさらに検証し、薬物の全体的な利益-リスク関係を評価し、最終的に薬物登録申請の審査に十分な証拠を提供するために使用される。第四段階とは、新薬が広く使用されている時の発売後の研究であり、この薬物の広範な使用時の治療効果と副作用を評価し、一般の人や特定の集団で使用した場合の全体的な利益-リスク関係を評価し、投与量の調整などを指す。2020年7月1日、改正された“薬品登録規定”が発効し、最新バージョンはこの4段階の定義を削除した。
薬物臨床勤務認証
臨床試験の品質を高めるため、中国薬品監督管理局は2003年8月に“薬品臨床実践品質管理方法”を公布し、2020年4月23日に国家薬品監督管理局と国家衛生委員会(前身は衛生部或いは国家衛生と計画出産委員会)によって更なる改訂を行った。改訂後の“薬品臨床実践品質管理方法”は2020年7月1日から施行される。
2004年2月、中国食品薬品監督管理局は“薬品臨床実践機構の認証方法に関する通知(試行)”を発表し、国家薬品監督管理局が臨床試験機関の認証を担当し、国家衛生健康委員会がその職責範囲内の臨床試験機関の認証仕事を担当することを規定した。“薬品臨床勤務機関の認証方法に関する通知(試行)”に基づいて、国家薬品監督管理局と国家衛生健康委員会は機関の組織管理、研究者、設備施設、管理制度と標準操作規則の評価に基づいて、機関が薬物臨床試験を展開する資格を持っているかどうかを決定した。すべての要求が満たされた場合、国家薬監局はGCP認証を発行し、結果は国家薬監局のサイトで公表される。
2019年12月1日,新たに改正された“中華人民共和国薬品管理法”が施行され,薬品臨床試験機関が届出制を実施することが規定され,上記証明は施行されなくなった。これにより、国家薬品監督管理局と国家衛生健康委員会は2019年11月29日に共同で“薬品臨床試験機関管理規定の発表に関する公告”を発表し、薬品臨床試験機関GCP認証制度を届出制に変更し、“薬品臨床実践機関認証方法に関する通知(試行)”を凌駕した。臨床試験機関は自己或いは第三者に薬物臨床試験を展開する資格があるかどうかを評価することを委託しなければならない。このような評価がこの機関が条件を満たしていると判断した場合、国家薬監局が動作する新たに構築された届出システムに申請を提出する必要がある。
新薬申請
臨床試験の第1段階、第2段階、および第3段階が完了した後、出願人は国家薬監局に機密協定の承認を申請しなければならない。そして,国家薬監局は国家薬監局CDEが提供した総合評価意見に基づいて,申請を承認するか否かを決定した。プリブリンとドセタキセルの併用による非小細胞肺癌治療の臨床試験申請はすでに中国で承認され、2016年6月に臨床試験を開始した。私たちの薬品が中国市場で生産と販売できる前に、私たちは秘密保護協定の承認を得なければならない。
良好な製造規範
中国の臨床あるいは製品販売のためのすべての施設と技術は国家薬品監督管理局が制定したcGMPガイドラインに従って操作しなければならない。適用された要求を守らなければ、生産終了と巨額の罰金を招く可能性がある。国家薬品監督管理局は2018年7月に“臨床試験薬品使用良好生産規範”(意見募集稿)を発表し、臨床試験薬品使用の品質管理、人員、施設設備、包装などの方面に対して要求を提出した。そのような露出草案はまだ施行されていない。
動物試験許可証
1988年11月に国務院の許可を得て国家科学委員会によって公表され、2011年1月、2013年7月と2017年3月に改正された“実験動物事務管理条例”、及び2001年12月にMOSTなどの監督部門が発表した“動物実験証明書(試行)管理方法”に基づいて、動物実験を行うには“実験動物使用証明書”が必要である。申請者は以下の条件を満たさなければならない
| ● |
実験動物は合格し、実験動物の生産許可証を持つ機関から来なければならない |
| ● |
動物の生活、繁殖の環境と施設は国の要求に適合しなければならない |
| ● |
動物の飼料と水は国家の要求に適合しなければならない |
| ● |
動物飼育および実験は、専門家、専門技術者、または他の訓練された人員が行わなければならない |
| ● |
管理制度は効果的で効率的でなければならない |
| ● |
適用単位は中国の法律、法規で規定されている他の条件を守らなければならない。 |
国際多センター臨床試験条例
2015年1月30日、中国食品薬品監督管理局は“国際多センター臨床試験ガイドライン(試験)の発表に関する通知”を発表し、2015年3月1日から施行し、国際多センター臨床試験の中国における応用、実施と管理を規範化するために指導を提供することを目的とした。多センター臨床試験ガイドラインによると、国際多センター臨床試験申請者は同じ臨床試験方案を使用して、異なるセンターで同時に臨床試験を行うことができる。申請者は国際多センター臨床試験資料を利用して国家薬品監督管理局に国家薬品監督管理局の許可を申請する予定であり、“中華人民共和国薬品管理法”及びその実施条例、“薬品登録管理規定”と関連法律法規の要求に符合する以外に、以下の要求を満たすべきである
| ● |
申請者はまず全世界の臨床試験データに対して全体評価を行い、更にアジアと中国の臨床試験データに対して傾向分析を行うべきである。中国の臨床試験データを分析する際、申請者は研究対象の代表性、即ち研究に参加する患者を考慮すべきである |
| ● |
申請者は中国の研究対象の数量が臨床試験薬物の安全性と有効性を評価し、判定するのに十分であるかどうかを分析し、統計と関連する法律の要求を満たすべきである |
| ● |
国内と海外の国際多センター臨床試験研究センターは中華人民共和国政府主管機関の現場検査を受けるべきである。 |
国際多センター臨床試験は国際通行のGCP原則と倫理要求に従うべきである。申請は臨床試験結果の真実性、信頼性と信頼性を保証すべきである;研究者は関連する臨床試験を行う資格と能力を備えるべきである;倫理委員会は試験に対して持続的な審査を行い、被験者の利益と安全を保護すべきである。国際多中心臨床試験の実施前に、申請者は臨床試験を行う地方法規の要求に従って臨床試験の許可を獲得或いは記録を完成し、そしてNMPA薬物臨床試験情報プラットフォームに登録し、すべての主要な研究者、臨床試験機関の情報を開示しなければならない。
申請者は国際多中心臨床試験データを用いて中国新薬の研究開発を支持する時、ICH-CTD(国際協調会議-汎用技術文書)の内容とフォーマットの要求に従って、完全な全世界臨床試験報告、統計分析報告とデータベース、及び関連支持データを提出すべきである;同時に同時にグループ化研究成果の総括と比較分析を行うべきである。
2020年4月、国家薬品監督管理局と国家衛生健康委員会は改訂後の“薬品臨床実践品質管理規則”を公布し、2020年7月から施行した。改訂後の“薬品臨床実践品質管理規則”は多センター臨床試験を開始する要求をまとめ、即ち多中心臨床試験を開始する前に:(一)申請者はすべての臨床試験に参加するセンターが試験規程に符合することを確保すべきである;(二)申請者は各センターに同じ試験方案を提供し、各センターは同じ臨床試験と実験室データ統一評価基準と同じ病例報告表ガイドラインに符合すべきである;(3)各センターは同じ病例報告表を使用して試験期間中の各人体被験者のデータを記録すべきである。(4)臨床試験を開始する前に,各センター研究者の役割を明確にするための書面が必要である,(5)出願人は各センター研究者間のコミュニケーションを確保すべきである。
国際多センター臨床試験で得られた臨床試験データを利用して、著者らは不必要な重複臨床試験を避けることができ、それによって中国のNDA過程を更に加速することができる。
患者を集めて利用する’人間の遺伝資源と派生データ
1998年6月、衛生部は元衛生部と共同で“中国人類遺伝資源管理暫定方法”を制定した。2015年7月、衛生部は“人類遺伝資源のサンプリング、採集、取引、出力審査サービスガイドライン”を発表し、その中で、外国実体は臨床試験中に患者の人類遺伝資源を収集と使用し、そのオンラインシステムを通じてHGRAOに事前に許可すべきであると規定した。
2017年10月、科学技術部は“人類遺伝資源の行政審査の最適化に関する通知”を発行し、中国薬品の上場許可を求めることを目的として人類の遺伝資源を利用する審査プロセスを簡略化した。
2019年5月、国務院は“HGR条例”を発表し、内外の実体が研究協力を展開する審査要求を規定した。この新規定によると,臨床研究地点で中国患者の生物試料を用いて国際臨床試験を行う際には,このような生物試料を中国以外の地域に輸出することには触れない新たな届出制度(従来の事前承認方法とは逆)が実施される。このような臨床試験を行う前に,バイオ殺虫剤のタイプ,数量,用途が規定された通知書類をHGRAOに提出する必要がある。輸出に関する基礎科学研究の国際協力では,中国患者の生物試料を収集,使用,外転移するにはHGRAOの事前承認が必要である。
2020年10月、全人代常務委員会は“中国生物安全法”を公布し、2021年4月15日から施行された。中国生物安全法は“中国生物安全条例”が規定した監督管理要求を再確認するとともに、中国人類の遺伝資源の収集、保存或いは輸出の疑いのある外国実体に対する行政罰金を大幅に高める可能性がある。
データプライバシーとデータ保護
中国はネットワークセキュリティ、データ保護、個人情報(個人健康情報を含む)に対する監督管理を絶えず強化している。例えば、2020年5月に全国人民代表大会によって公布され、2021年1月に施行される“中華人民共和国民法典”では、自然人の個人情報は法律で保護されていると規定されている。いかなる組織や個人が他人の個人情報を取得する必要がある場合は,合法的に取得し,情報の安全を確保し,他人の個人情報を不正に収集,使用,加工,転送してはならず,他人の個人情報を不正に売買,提供,公開してはならない.
2016年11月、全人代常務委員会は“ネットワークセキュリティ法”を公布し、2017年6月から施行した。“ネットワークセキュリティ法”は、ネットワーク運営者がネットワークセキュリティ保護に関するいくつかの機能を履行し、ネットワーク情報管理を強化することを要求する。例えば、“ネットワークセキュリティ法”によると、キー情報インフラのネットワーク事業者が中国国内で運営している間、一般に中国国内で収集·生成された個人情報や重要なデータを格納すべきである。ネットワーク運営者は,個人情報を収集·利用する際には,“ネットワークセキュリティ法”の規定に従い,合法的,正当,必要な原則を遵守しなければならない.ネットワーク運営者は,個人情報を収集·利用し,収集·使用ルールを公表し,収集·使用の目的,方式,範囲を明示し,個人情報を収集する人の同意を得るべきである。ネットワーク事業者は,それが提供するサービスとは無関係な個人情報を収集してはならないし,法律,行政法規の規定に違反したり,それと合意したりした合意に違反して個人情報を収集·使用してはならず,法律,行政法規の規定とそれと合意した合意に従って蓄積された個人情報を処理してはならない.ネットワークオペレータは、その収集された個人情報を開示、改ざんまたは廃棄してはならない、または個人情報を収集していない人は、特定の人の識別および情報が回復されることを防止するために情報が処理されていない限り、その情報を他人に開示することに事前に同意してはならない。個人発見ネットワーク事業者は、個人情報が法律、行政法規又は経営者と個人との間の合意に違反していることを収集し、使用する場合、ネットワーク事業者にその個人情報を削除することを要求する権利があり、ネットワーク事業者が収集して蓄積したこのような情報に誤りがあることを発見した場合、ネットワーク事業者に修正を要求する権利がある。オペレータは情報を削除したり、エラーを修正する措置を取らなければならない。いかなる個人や組織も,盗みやその他の不正な方法で個人情報を取得してはならず,不正に販売したり,他人に個人情報を提供したりしてはならない.
2018年7月、国家衛健委員会は“健康医療ビッグデータ管理方法”を公布し、健康医療ビッグデータの標準管理、安全管理、サービス管理に対して指導思想と原則を提出した。“健康と医療ビッグデータ管理方法”によると、中華人民共和国公民が中華人民共和国国内で発生した医療データは国家の国家戦略安全と中華人民共和国公民の生命健康利益の目的から管理と使用を行うことができ、前提は国家が中華人民共和国公民それぞれの知る権利、使用権と個人プライバシー権を保障することである。
2021年12月28日、中国サイバー空間管理局、国家発展改革委員会などの多部門は共同で“ネットワークセキュリティ審査方法”を発表し、2022年2月15日から施行され、2020年4月公布、2020年6月から施行される“ネットワークセキュリティ審査方法”に代わって実施される。“ネットワーク安全審査方法”によると、肝心な情報インフラ経営者はインターネット製品とサービスを購入し、インターネットプラットフォーム経営者は国家の安全に影響を与える或いは影響する可能性のあるデータ処理活動に従事し、必ずネットワーク安全審査を行い、百万以上のユーザーの個人情報を持っていて、外国証券取引所に上場しようとしているインターネットプラットフォーム経営者はネットワーク安全審査を受けなければならない。
2021年6月、全人代常務委員会は“データ安全法”を公布し、2021年9月1日から施行された。“データセキュリティ法”は,データの重要性に応じてデータ保護の階層制度を構築した。“重要データ”に属するデータは政府当局が目録の形で決定し、より高いレベルの保護を与えるべきだ。具体的には、“データセキュリティ法”では、重要なデータの処理者は“データセキュリティ担当者”と“管理部門”を指定してデータセキュリティを担当しなければならないと規定されている。また、この情報処理業者は、そのデータ活動のリスクを定期的に評価し、関係監督部門に評価報告を提出しなければならない。“データセキュリティ法”は比較的新しいため、その解釈と実施にはまだ不確実性が存在する。
2017年に発表された“個人情報と重要なデータ越境移動安全評価方法(意見募集稿)”、2019年に発表された“個人情報越境移動安全評価方法(意見募集稿)”、2021年8月に公布された“個人情報保護法”、2021年11月1日に施行された“データ越境移転安全審査方法(意見募集稿)”を含むデータプライバシーやデータ保護に関する追加法規、ガイドライン、措置が通過または発効すれば、いずれもコンプライアンス要求がより厳しい傾向にあることを示している。個人健康情報を中国に送信する前に、安全評価と審査を行う必要がある。
私たちの子会社は中国にあるので、私たちは中国のネットワークとデータ保護制度の要求を守らなければならない。また、私たちの正常な業務過程で、私たちの臨床試験被験者、顧客、中国人従業員の個人情報を含む個人情報を収集して保存します。私たちは、中国以外の子会社、許可者、パートナー、または請負業者とこのような個人情報を共有する必要があるかもしれない。中国のネットワークやデータ保護制度は進化しつつあり、私たちはこれらの要求を守るための努力が十分であるかどうかという不確実な要素に直面し続けている。我々は,これらの要求を維持するためのコンプライアンスプロトコルや制御を開発·維持しているが,これらのプロトコルや制御を開発·維持するコストは高い.また,我々のCRO,許可側,パートナーもこれらの法律を遵守することを要求されており,我々が彼らと合意した合意はこれらの要求を遵守することを要求しているが,これらの要求を完全に遵守できない可能性があるリスクがある.
“中華人民共和国企業所得税法”とその実施
企業所得税法及びその実施細則はあるハイテク企業が一定の資質基準を満たす場合に優遇された企業所得税税率を享受することを許可する。私たちの中国子会社はこのような税金優遇を受けました。
2016年3月23日、財政部、国家税務総局は“営業税の増値税徴収試験事業の全面的な押しのけに関する通知”を通達した。2016年5月1日から、中国税務機関は営業税の代わりにすべての地域と業界で付加価値税を徴収している。2008年11月に国務院が公布し、2016年と2017年にそれぞれ改正された“中華人民共和国付加価値税暫定条例”第2条第2項に含まれていない貨物と有形財産レンタルサービスを提供し、営業税税率と17%に代わる付加価値税の税率を6%適用し、2018年5月1日から2019年3月31日まで16%に調整し、2019年4月1日から13%に調整した。増値税一般納税者が課税期間中に販売する貨物又は提供される課税労務に納められる増値税は、当該期間の増値税を差し引いた当該期間のピン増値税純残高である。
知的財産権に関する条例
特許
一般情報
“中華人民共和国特許法”(最近2020年10月に改正された)とその実施細則(最近一度改正された二零一零年1月)によると、中国の特許は3種類に分類され、すなわち発明特許、実用新案特許及び意匠特許である。発明特許とは、製品、方法、またはその改善に対して提案された新しい技術方案であり、実用新案は、製品の形状、構造または両方の組み合わせに対して提案された実行可能な新しい技術方案であり、外観設計特許は、ある製品の全体または部分に対して形状、パターンまたは両方の組み合わせ、および色、形状、パターンの組み合わせにおいて美学的に工業応用に適した新しい設計を意味する。“中華人民共和国特許法”によると,特許保護期間は特許出願の日から計算される。実用新案や意匠に関する特許は最初の出願日から10年以内に有効であり,意匠に関する特許は最初の出願日から15年以内に有効であり,発明に関する特許は最初の出願日から20年以内に有効である。中華人民共和国特許法は“先出願”の原則,すなわち同一発明が複数人で特許を出願した場合,先に特許を出願した者が特許を取得する。
また,新薬の発売承認にかかる時間を補償するために,特許行政部門は特許権者の請求に基づいて,中国が上場を承認した新薬関連発明特許に特許権期限補償を与える。補償期間は5年を超えてはならず,特許権は新薬の発売が許可された日からの総有効期間は14年を超えてはならない。
2008年に改正された“中華人民共和国特許法”と比較して,2020年改正後の“特許法”の変化は,(1)発明者や設計者の職務発明に関するインセンティブメカニズムを明らかにしたこと,(2)意匠特許の期限を延長したこと,(3)新たな“開放許可”制度を構築したこと,(4)インターネットサービスプロバイダのネットワーク特許侵害に対する連帯責任を強化したこと,(5)特許侵害事件の立証責任配分を改善したこと,(6)特許侵害の賠償を増加させたこと,である。(7)特許出願審査における中国国家知的財産権局の遅延を補償するための特許期限調整。
既存の特許は、新規性の欠如、および/または技術的に創造性の欠如、および特許出願上の欠陥を含む、様々な要因のために失効または強制的に実行できない可能性がある。中国の考えでは、特許は新規性、創造性、そして実用性を持たなければならない。中国特許法によれば、新規性とは、特許出願が提出される前に、中国国内外のいずれの出版物においても同じ発明又は実用新案が開示されておらず、また、同じ発明又は実用新案を記載する出願が中国内外で任意の他の方法で開示されていないことを意味し、同じ発明又は実用新案を記載する出願を特許当局に提出し、出願日後に発表された特許出願書類又は特許文書に記録されている。発明ステップとは、従来技術と比較して、発明が顕著な実質的な特徴を有し、顕著な進歩を表し、実用新案が実質的な特徴を有し、任意の進歩を表すことであり、実用適用性とは、発明または実用新案が製造または使用可能であり、積極的な結果をもたらす可能性があることを意味する。中国の特許は国家知的財産権局に提出された。通常,国家知的財産権局は出願後18ヶ月に発明特許公告を公表し,出願人は公告時間の短縮を要求することができる.出願人は,出願日から3年以内に国家保監局に実質審査を申請しなければならない。
“中華人民共和国特許法”第19条は,中国で完成した発明又は実用新案は,いかなる出願人(中国の会社及び個人だけではない)が中国国外で特許出願を提出する前に,まず国家知的財産権局に提出して秘密審査を行わなければならないと規定している。この要求を遵守しないことは、主題発明または実用新案のいずれかの中国特許を拒否することになる。国家知的財産権局が増加した機密審査要求は、中国で研究開発活動を行ったり、研究開発活動を中国サービスプロバイダにアウトソーシングしたりする外国会社の懸念を引き起こしている。現在、国家知的財産権局が許可した発明特許15件、出願中の発明特許22件を取得している。
特許法執行
特許権者の同意を得ずに特許を無断で使用し,他人の特許を偽造し,又は他の特許権侵害行為に従事する場合は,侵害者の侵害責任を追及する。他人に属する特許を偽造する深刻な犯罪は刑事罰を受ける可能性がある。
特許権者の特許権侵害により紛争が発生した場合,中国の法律は当事者にまず双方の協議による紛争解決を試みることを求めている。しかし,協議ができない場合は,特許権者又は当該特許が侵害されたと考えられる利害関係者は,特許行政に関する行政部門に民事訴訟を提起することができ,特許行政機関に行政申し立てを行うこともできる。中国裁判所は,特許権者又は利害関係者の請求に基づいて,訴訟を提起する前又は訴訟中に予備禁止を発することができる。侵害損害賠償は,特許権者が侵害行為により受けた損失又は侵害者が侵害行為から得た利益に基づいて計算される。このように損害賠償を決定することが困難であれば、契約許可項における許可料の合理的な倍数を使用して損害賠償を決定することができる。故意に特許権を侵害した場合,賠償額は前項の規定により決定された額の1~5倍である。特許権者の損失、侵害者の利益及び特許の許可料が確定しにくい場合には、人民法院は特許権の種類、侵害性質及び筋等の要因に基づいて、3万元以上500万元以下の賠償額を決定することができる。他の管轄区域と同様に、注目すべき例外を除いて、中国案の特許権者は、その特許が侵害されたことを証明する責任がある。しかし、新製品の製造方法の発明特許の所有者がその特許を侵害したと主張した場合、告発された侵害者は、その侵害がないことを証明する立証責任がある。私たちが知っている限り、私たちはいかなる第三者特許を侵害する論争も存在しない。
医療特許強制許可
“中華人民共和国特許法”によると,公衆衛生の目的のために,国家特許庁は特許薬品を生産して中国に輸出する関連国際条約でカバーされている国又は地域に強制許可を付与することができる。
無許可製造、使用、販売または輸入特許薬の免除
“中華人民共和国特許法”は,無許可製造,使用,販売又は輸入特許薬品に対して5種類の例外を規定している。次の場合はいずれも特許権侵害とはみなさず,誰も勝手に次の特許薬品を製造,使用,販売,輸入してはならない
| ● |
特許権者又はその許可の単位又は個人が特許製品又は特許方法に従って直接取得した製品を販売した後,当該製品を使用,販売,販売又は輸入することを承諾した者; |
| ● |
特許出願日の前に同じ製品が製造されたか、同じ方法が使用されたか、または製造または使用のために必要な準備がなされたものは、製造を継続するか、または元の範囲内でのみ使用される |
| ● |
中国領土、領海、領空を一時的に経由する外国交通施設は、中国と当該外国交通施設所属国が締結した合意または双方が締結した国際条約、あるいは対等の原則に基づいて、特許をその装置や施設に使用し、自分のニーズに利用する |
| ● |
科学研究や実験目的のために特許を使用している人や |
| ● |
行政審査に必要な資料を提供するために製造、使用、特許薬品、特許医療機器を輸入するか、または上記の者のために特許薬品、特許医療機器を製造、使用、輸入する。 |
しかしながら、“中華人民共和国特許法”に規定されている特許薬品が無許可製造、使用、販売又は輸入免除を理由に特許薬品を使用しても、特許権者の許可を得ていない場合は、いかなる商業目的のために当該等の特許薬品を製造、使用、販売又は輸入してもならない。
商標
商標は1982年8月23日に採択され、1993年2月22日、2001年10月27日、2013年8月30日と2019年4月23日に改正された“中華人民共和国商標法”または“中華人民共和国商標法”、および2002年8月3日に国務院が採択され、2014年4月29日に改正された“中華人民共和国商標法実施条例”によって保護されている。国家知的財産権局商標局は商標登録を行い,登録商標の有効期間は10年であり,最初または任意の継続展の10年の期限が満了した場合,さらに10年の期限を与える。“中華人民共和国商標法”は商標登録に対して“先届出”原則を実行する。
商業秘密
1993年9月に公布され、2017年11月と2019年4月23日にそれぞれ改正された“中華人民共和国反不正競争法”によると、商業秘密とは、公衆に知られていない、商業価値のある技術情報、商業経営情報、その他の商業情報を指し、その権利者はすでにそれに対して相応の秘密保護措置を講じている。
本法では,経営者が(1)窃盗,教唆,脅迫,電子侵入などの不正な手段で合法所有者又は所有者から商業秘密を取得する方法をとることを禁止する,(2)前項(1)項で不正に取得した商業秘密の漏洩,使用,使用又は許可,(3)守秘義務又は合法所有者又は所有者の商業秘密秘密の要求に違反し,商業秘密の漏洩,使用又は他人の商業秘密の使用を許可する方法;(四)他人が権利者の商業秘密を使用することを指示、誘導、他人の獲得、漏洩、使用または許可するのは、守秘義務または合法的所有者または権利者の商業秘密に対する秘密保持の要求に違反する。企業法人以外の自然人、法人その他の非法人組織が前項の規定に違反した場合は、商業秘密を侵害するとみなす。第三者は、前項に規定する違法行為を知っているか、又は知るべきであるが、他人の商業秘密を取得、使用又は漏洩した者は、当該第三人が他人の商業秘密を横領したと認定することができる。商業秘密が侵害された当事者は行政改正を申請することができ、監督部門は違法行為を制止することができ、侵害者に10万元以上100万元以下の罰金を科すことができ、重大な侵害行為を構成する場合は、50万元以上500万元以下の罰金を科すことができる。あるいは、商業秘密が流用された者は、商業秘密流用による損失や損害の賠償を求める訴訟を中国裁判所に提起することができる。
商業秘密を保護するための措置には、口頭、書面協定、または他の合理的な措置が含まれており、合法的な所有者または所有者の従業員、またはそれと業務往来のある人が商業秘密を秘密にすることを要求する。合法的な所有者または権利者が他人に商業秘密を保存し,合理的な保護措置をとることを要求する者は,請求者に商業秘密を守る責任がある.
外国為替と配当分配に関する規定
外国為替監督管理
“外貨管理条例”は中国が外貨両替を管理する主要な条例であり、最近改正されたのは2008年8月である。中国の外貨規定によると、経常項目の支払い、例えば貿易やサービスに関する外国為替取引は、外貨で支払うことができ、外国為替局の事前承認を必要とせず、特定の手続き要求を遵守する。対照的に、人民元を外貨に両替して中国から送金して外貨ローンの返済などの資本支出を支払う場合には、相応の政府部門の承認や登録を得る必要がある。
2012年11月、外匯局は“外商直接投資外貨管理政策の更なる整備と調整に関する通知”を発表し、現行の外貨管理手続きを大幅に整備·簡略化した。本通知によると、設立前費用口座、外国為替資本口座、担保口座などの各種専用外国為替口座の開設は、外国投資家が中国の人民元収益に再投資し、外商投資企業がその外国株主に外貨利益と配当金を送金し、外国為替局の承認や確認を必要とせず、同一実体が異なる省に複数の資本口座を開設することができ、これまでは不可能であった。また、外匯局は2013年5月に“海外投資家の国内直接投資外貨管理規定に関する通知”及びセット文書を発表し、外匯局或いはその地方支店が海外投資家の中国直接投資に対する管理に対して登録管理方式を採用し、銀行の中国直接投資に対する外国為替業務は、外匯局及びその支店が提供した登録情報で処理しなければならないことを明らかにした。
外匯局が2014年1月10日に発表した“資本項目下の外貨管理政策の更なる改善と調整に関する通知”によると、2014年2月10日から施行され、国内機関の利益流出の管理はさらに簡略化された。原則として,銀行が国内機関が5万ドル以下の同値利益の流出を処理する場合には,取引伝票を審査する必要はない.同値5万ドル以上の利益流出を行う際には、原則として銀行が国内機関の財務監査報告と検資報告を審査することを要求しないが、取引の真実性の原則に従って、今回の利益流出に関連する取締役会利益分配決議(あるいはパートナー利益分配決議)及びその納税届出表の原本を審査しなければならない。利益が流出するたびに、銀行は関連税務届出表の原本に印鑑と裏書きを加え、利益流出の実際の金額と日付を明記しなければならない。
2015年3月30日、外匯局は“外商投資企業の外国為替資金決済管理方法の改革に関する通知”、すなわち“外為局第19号通知”を発表し、2015年6月1日から施行した。外匯局第19号通知によると、外商投資企業の外国為替資金は適宜決済することができ、即ち外商投資企業の資本項目の中で現地外匯局が貨幣出資権益(又は銀行記帳登録)を確認した外国為替資金は、外商投資企業の実際の経営ニーズに応じて銀行で決済することができる。このような情状と和解の割合は一時的に100%に決定された。外国為替資本から両替された人民元は指定された口座に入金され、外商投資企業がその口座からさらに支払う必要がある場合、依然として証明書類を提供し、銀行と審査手続きを行う必要がある。
また、外管局第19号通知は、外商投資企業が資金を使用するには企業経営範囲内の真実、自己使用の原則を堅持しなければならないと規定している。外商投資企業の資本金と外商投資企業が決済を通じて取得した人民元資金は、以下の用途に使用することができない
| ● |
企業の経営範囲または法律、法規によって支払いが禁止されている資金を直接または間接的に使用する |
| ● |
直接または間接的に証券投資に使用されるものは、関連する法律、法規に別途規定されているものを除く |
| ● |
業務範囲の許可を除いて、直接或いは間接的に人民元委託ローンの発行、企業間借入金(第三者立て替え金を含む)、第三者に転貸した人民元銀行ローンの返済に用いる |
| ● |
非自家用不動産の購入に関する費用を支払うのは、外商投資不動産企業を除く。 |
2016年6月9日、外匯局は“資本項目決済管理政策の改革と規範化に関する通知”、すなわち“外管局第16号通知”を発表し、同日から施行した。外管局第16号通知によると、外商投資企業の外国為替資金、外債、海外上場で調達した資金は適宜決済することができ、銀行で決済することもできる。このような情状と和解の割合は一時的に100%に決定された。外貨両替に関連した人民元は指定口座に入金され、国内企業はさらにこの口座から支払う必要があれば、依然として証明書類を提供し、銀行と審査手続きを行う必要がある。
また、外管局第16号通知は、国内企業の資金使用は企業経営範囲内の真実、自己使用の原則を堅持しなければならないことを再確認した。国内企業が決済を通じて取得した資本項目の外貨収入と人民元は以下の用途に使用することができない
| ● |
企業の経営範囲または法律、法規によって支払いが禁止されている資金を直接または間接的に使用する |
| ● |
法律、法規が別に規定がある以外、直接或いは間接的に証券投資と投資信託商品投資に使用する場合、元金保証の銀行投資信託商品は除外する |
| ● |
業務範囲の許可を除いて、非関連企業への委託融資のために直接または間接的に使用される |
| ● |
非自家用の不動産を建設または購入するためのものは、外商投資不動産企業を除く。 |
2017年1月26日、外匯局は“真実性とコンプライアンス審査の強化と外国為替管理業務の更なる推進に関する通知”を発表し、その中で国内機関が海外機関に利益を送金することに対していくつかの資本規制措置を規定し、(一)真実取引原則の下で、銀行は取締役会の利益分配決議、納税申告記録原本と監査された財務諸表を照合すべきである;(2)国内機関は利益を送金する前に数年前の損失に対して収入計算を行うべきである。また、外国為替局通知3によれば、国内実体は、資金源及び使用スケジュールを詳細に説明し、出国送金登録手続きを完了したときに理事会決議、契約、その他の証明を提供しなければならない。
2019年10月23日、外管局は“国境を越えた貿易投資の円滑化のさらなる推進に関する通知”を発表したか、又は外管局第28号通知と称した。引き続き投資性外商投資企業(外商投資会社、外資創業投資企業と外資株式投資企業を含む)が法に基づいて登録資本を規則的に使用して国内株式投資を行うことを許可した上で、外匯局第28号通知は非投資性外商投資企業に対する制限を廃止し、非投資性外商投資企業が既存の“ネガティブリスト”と国内持分投資の真実性、適合性に違反することなく、登録資本を国内株式投資に使用することを許可した。外匯局第28号通知はさらに、非投資性外商投資企業外貨登録資本を国内株式投資に使用する2つの方式、すなわち貨幣原貨で外貨登録資本を譲渡する方式と外貨決済方式で外貨登録資本を使用することを明らかにした。2019年10月23日、外管局は“外国為替口座の削減に関する通知”を発表し、略称29号通知を発表し、2020年3月2日から施行した。“国家外貨管理局第29号通函”付録Bは“国家外国為替管理局第28号通書”に操作ガイドラインを提供した。外管局第二十九号通知はさらに、第二十八号通知に規定されている国内持分投資は、国内企業への直接投資に限らず、“株式譲渡”方式で行われる株式投資も含まれていることを明らかにした
我々の中国子会社のオフショア親会社への分配と国境を越えた外貨活動の展開は上述した各種外国為替局の登録要求に符合すべきである。
株式オプション規則
中国人民銀行中国銀行が2006年12月25日に発表した“個人外貨管理方法”によると、中国公民が参加する従業員の持株計画と株式オプション計画に関連する外貨については、すべて外匯局或いはその許可支店の許可を経なければならない。また、外匯局が2012年2月15日に発表した“国内個人が海外上場会社の株式激励計画に参加することに関する問題に関する通知”によると、中国住民が株式激励計画に基づいて海外証券取引所上場会社の株式或いは株式オプションを獲得した場合は、(1)外匯局或いはその現地支店に登録しなければならない;(2)合格した中国代理人を1名保留することは、海外上場会社の中国子会社であってもよいし、中国子会社が選択した他の合格機関であってもよく、参加者を代表して外匯局株激励計画の外国為替局登録などの手続きを行うことができる。(三)海外機関を招聘して株式オプションの行使、株式又は権益の売買、資金移転等の手続きを代行する。
中国住民または公民がオフショア特殊目的会社を保有する外国為替局の規定
2014年7月4日、外管局は“国家外国為替管理局第37号通知”を発表した。“国家外国為替管理局第37号通達”は、中国住民が特殊目的担体(SPV)を使用して海外投融資及び中国で往復投資を行う外貨を求めることを規定している。外管局第37号通知によると、SPVは中国住民或いは実体が海外投融資を目的として、中国住民が合法的に所有する資産或いは持分或いは海外資産或いは権益を設立或いは間接的に設立或いは制御する海外実体であり、“往復投資”とは中国住民がSPVを通じて中国に直接投資を行い、即ち外商投資企業を設立し、所有権、制御権と経営権を獲得することを指す。国家外匯局第37号通知によると、中国住民は特殊な目的機関に入る前に、外匯局あるいはその所在地の支店で外貨登録をしなければならない。中国外管局第37号通達はさらに、特殊目的担体に関連するいかなる重大な変化が発生した場合、例えば中国個人出資の増減、株式譲渡或いは交換、合併、分立或いはその他の重大な事件が発生した場合、登録を改訂することを要求した。外管局第37号通達で規定されている登録手続を遵守しない、又は往復投資によって設立された外商投資企業の制御者に対して虚偽の陳述又は開示を行うことは、そのオフショア親会社又は関連会社に配当金及びその他の分配を支払うことを含む関連外商投資企業の外国為替活動が制限される可能性があり、例えば、その海外親会社又は共同経営会社に任意の減資、株式譲渡又は清算の収益を支払うこと、及びオフショア親会社からの資本流入を招き、中国外国為替管理規定に基づいて関連する中国住民を処罰することが可能である。
国家外匯局第37号通知によると、海外非上場会社の株式激励計画に参加した中国住民は外匯局或いはその国内支店にオフショア特殊目的機関の外貨登録申請を提出することができる。国家外国為替管理局第37号通達の遵守に関するより多くの情報は、“第3項.主要な情報-D.リスク要因-私たちの中国での事業に関連するリスク-中国住民投資オフショア会社の中国法規は、私たちの未来の中国住民実益所有者または私たちの中国子会社が責任を負うか、処罰される可能性があり、私たちの中国子会社への出資能力を制限したり、私たちの中国子会社がその登録資本を増加させたり、利益を分配する能力を制限したりする可能性がある”を参照されたい
我々はHuang博士、賈林清さん、董亮さんの中国住民の外国為替登録を完了しました。
配当分配の監督管理
中国の外商投資企業の配当分配に関する主要な法律、規則、規則は、最近2018年10月に改正された“中華人民共和国会社法”、2020年1月1日に発効した“外商投資法”とその2020年1月1日に施行された実施条例である。これらの法律法規によると、外商投資企業は中国の会計基準と法規に従って確定した累積利益の中から配当金を支払うことしかできない。中国国内の会社と外商投資の中国企業は毎年、それぞれの累計税引き後利益の10%(あれば)から一定の法定積立金を抽出し、これらの積立金の総額が企業登録資本の50%に達するまで抽出しなければならない。外商投資企業の株主は適宜法定積立金を計上した後、中国会計基準に基づいてその税引き後の利益の一部を自由に支配可能な積立金に振り込むことができる。前期のいかなる損失を相殺する前に、中国企業はいかなる利益も分配してはならない。前会計年度に留保された利益は、本会計年度の分配可能利益とともに分配することができるが、法定積立金と自由支配可能な積立金は現金配当金として分配することはできない。
労働法と社会保険
1994年7月に公布され、2009年8月と2018年12月に改正された“中華人民共和国労働法”、及び2007年6月に公布され、2012年12月に改正された“中華人民共和国労働契約法”によると、使用者は常勤従業員と書面労働契約を締結しなければならない。すべての雇用主たちは地域の最低賃金基準を守らなければならない。“中華人民共和国労働契約法”と“中華人民共和国労働法”に違反し、もしストーリーが深刻であれば、罰金及びその他の行政と刑事責任を科すことができる。
また、2010年10月に公布され、2018年12月29日に改正された“中華人民共和国社会保険法”および1999年4月に公布され、それぞれ2002年3月と2019年3月に改正された“住宅積立金管理条例”によると、中国の子会社などの使用者は、従業員に養老保険、失業保険、生育保険、労災保険、医療保険、住宅積立金をカバーする福祉計画を提供しなければならない。
外商投資法
2019年3月15日、全人代は外商投資法を採択し、2020年1月1日から施行され、中国の現行規範外商投資の3つの法律、すなわち“中外合弁経営企業法”、“中外合作経営企業法”、“外商独資企業法”及びその実施細則と付属法規に代わった。2019年12月26日、国務院は“中華人民共和国外商投資法実施条例”を可決し、2020年1月1日から施行した。外商投資法及びその実施細則は予想される中国の監督管理傾向を体現し、即ち国際通行のやり方に基づいてその外商投資監督管理制度を整理し、立法を通じて外資と内資投資の会社の法律要求を統一するために努力している。外商投資法によると、外商投資とは、外国の1つまたは複数の自然人、経営主体または他の組織が中国で直接または間接的に行う投資活動を指す。
2021年12月27日、“外商投資法”に基づき、中華人民共和国商務部、国家発展改革委員会は“外商投資参入特別管理措置(ネガティブリスト)(2021年版)”を公表し、あるいは“ネガティブリスト”と呼び、2022年1月1日から施行される。ネガティブリストは外商投資に対して一定の制限がある業界範囲を規定しており、例えば市場参入クリアなどである。“ネガティブリスト”業界に入っていない外商投資に国民待遇を与える。
世界の他の地域の規制
米国や中国以外の他の国では,臨床試験の進行,薬物許可,定価,精算の要求は国によって異なる。すべての場合,臨床試験はGCP要求と適用の法規制要件および“ヘルシンキ宣言”起源の倫理原則に従って行われなければならない。
もし私たちが適用される外国監督管理要求を遵守できない場合、私たちは罰金、規制許可の一時停止または撤回、製品のリコール、製品の差し押さえ、経営制限、刑事起訴などに直面する可能性がある。
製造と供給
プリブリンの有効薬物成分の生産を外部サービスプロバイダのジョンソンマタイ製薬サービス会社(JMPS)とAsymchem実験室(Asymchem)にアウトソーシングし,最終医薬製剤の生産を製薬国際会社(PII)にアウトソーシングし,応急計画の目的で他の契約製造機関とも関係を築いた。Plinumin開発の継続的な要求を満たすために、契約メーカーとアウトソーシング関係を維持したい。我々は,これらの外部サービスプロバイダとフレームワークプロトコルを締結し,これらのプロトコルに基づいて,短期的,個々のプロジェクトでサービスを提供している.また、PIIと長期商業供給協定を締結し、承認された後に商業供給に備えている。
現在、私たちの契約メーカーは、私たちの需要を満たすのに十分な能力があると考えている複数のサプライヤーから、彼らが私たちのために行う製造活動に必要な材料を獲得しています。しかも、私たちはこのような供給を提供するのに十分な代替源があると思う。しかし、供給中断が私たちの業務に実質的な損害を与える危険がある。私たちは通常注文を購入した上で材料とサービスを注文して、長期専用生産能力或いは最低供給手配を締結しません。
私たちはプリブリンの現在の処方で使用されている安定剤Kolliphor HS 15の唯一の供給者としてバスフSEに依存している。もしバスフSEがKolliphor HS 15を供給できないか,供給したくなければ,私たちはバスフSEに代わることができず,プリブリンの再調製が要求される。FDAとの議論によると、Kolliphor HS 15の使用を継続しながら別のレシピを求める。
薬品生産は広範な法規制約を受け、これらの法規は記録保存、生産過程と制御、人員、品質管理と品質保証などの方面に対して各種のプログラムと文書要求を提出した。我々は、現在の候補製品または私たちが開発する可能性のある任意の未来の候補製品を生産するための契約製造組織を計画しており、cGMP条件下で運営することが要求される。これらのcGMP条件はヒトに使用される薬物生産に対する規制要求である。
法律訴訟
私たちは時々法的手続きに巻き込まれたり、私たちの正常な業務過程でクレームを受けるかもしれない。吾らは現在、いかなる法的手続きにも関与していないが、当該等の法律手続が吾等に不利であると判断されると、個別又は合併は吾等の業務、経営業績、財務状況又はキャッシュフローに重大な悪影響を与える。結果にかかわらず,弁護や和解コスト,管理資源分流などにより,訴訟は我々に悪影響を与える可能性がある。
| C. |
組織構造 |
次の図は、2015年7月に完了した内部再編の結果である我々の現在の組織構造を示している。

| D. |
財産·工場·設備 |
私たちは今ニューヨークでオフィス空間を借りています。総面積は七二三平方フィートです。レンタル契約は2023年12月に満期になります。私たちの現在のレンタル料は毎月35,888ドルで、2023年2月に302ドル増加します。レンタル項目の下の支払いはレンタル期間中に直線的に支出されます。レンタル条項は含まれていませんレンタル料、更新、購入選択があります。
2021年9月以来、ニュージャージー州でオフィススペースを借りました。総面積は9,727平方フィートです。レンタル契約は2027年2月に満期になります。私たちの今のレンタル料は毎月24,723ドルです。2023年から、私たちの年間レンタル料は1平方フィート当たり0.5ドル増加します。私たちはまた公共事業費用と私たちが負担しなければならない建築不動産税と建築運営費用を支払う。レンタル契約での支払いはレンタル期間内に直線的に計算されます。
私たちは現在大連でオフィス面積が860.12平方メートルで、中国で、レンタル料は毎月約2,874ドルです。レンタル契約は2022年8月31日に満期になります。
私たちは現在北京でレンタルオフィス面積は222.68平方メートルで、中国では、レンタル料は毎月約12,000ドルです。レンタル契約は2022年4月21日に満期になります。
我々の子会社SEEDはUbiquitinプラットフォーム技術の研究開発を支援するためにウェット実験室を建設している。Seedは2021年9月以降、ペンシルバニア州で一時空間と永久オフィス空間と実験室空間を借りた。永久空間建設が完了するまでにレンタルされた仮空間の敷地は約2 043平方フィート,固定賃貸料は月7661ドルであり,レンタル期間は永久空間建設が完了して終了した。永久空間の敷地は約10 086平方フィートで、固定賃貸料の初乗り料金は毎月37 823ドルで、2022年5月に永久空間工事がほぼ完了してから6ヶ月でレンタル料の支払いが開始される予定だ。2023年から、私たちの年間レンタル料は3%上昇するだろう。また、Seedは公共事業コストと、比例配分された建築不動産税と建築運営費用を支払い、賃貸者を代表して賃貸物件の改善に約80万ドルを支払う。レンタル契約での支払いはレンタル期間内に直線的に計算されます。また,2021年12月31日現在,種子会社は約240万ドルの実験室設備を購入している。
| プロジェクト4 Aです。 |
未解決従業員意見 |
適用されません。
| 第5項。 |
経営と財務回顧と展望 |
以下、我々の財務状況及び経営結果の検討及び分析は、我々が監査した総合財務諸表及び本年度報告書20-F表に含まれる他の部分に含まれる付記とともに読まなければならない。この議論は、リスクと不確実性に関連した現在の予想に基づく前向きな陳述を含む。各種の要素の影響により、著者らの実際の結果はこれらの展望性陳述の中で予想された結果と大きく異なる可能性があり、これらの要素は“プロジェクト3.重要な情報--D.リスク要素”と題する節と本年度報告20-F表の他の部分で議論された要素を含む。私たちの総合財務諸表はアメリカ公認の会計原則あるいはアメリカ公認会計原則に基づいて作成されています。万春医薬の機能通貨はドルです。
| A. |
経営実績 |
概要
我々は臨床段階のグローバルバイオ製薬会社であり,革新的な癌療法の開発に専念し,高度に満たされていない医療ニーズの高い患者の臨床結果を改善する。我々の主要資産であるプリブリンは一流の選択的免疫調節微小管結合剤(SIMBA)であり,多くの癌適応の“薬物パイプライン”として開発されている。中国を除いて、私たちはすべての国でプリブリンの世界中継権を持っている。私たちは中国子会社の57.97%の株式を所有し、後者は中国プリプリン100%の権利を持っている。我々はまだ3種類の小分子免疫剤を開発しており,現在臨床前段階にある。我々の子会社SEEDは独自のTPDプラットフォームあるいは“分子ゴム”技術を利用して、内部研究開発と協力を通じて革新的な治療剤を開発している。Seedは礼来会社と協力して、私たちの独特なTPDプラットフォームを通じて新しい化学実体を発見と開発し、それによって治療効果を産生する。また,我々の子会社である万春プリンは,プリプリンのより多くの適応を開発するために,恒瑞と独占商業化と共同開発合意を達成している。
まず、私たちは、CINの予防における潜在的利益を決定するために、パイオグリプチンを含むプリブリン単独またはG−CSFとの併用を検討している。2020年9月、この組み合わせはFDAとNMPAの画期的な治療称号を獲得した。保護性の2期3期登録研究結果に基づき,2021年3月にプリブリン連合G−CSF予防CINのNDAをFDAとNMPAに提出した。FDAと国家食品薬品監督管理局はNDA申請を受け入れ、優先審査地位を持っている。FDAは2021年11月、プリブリン連合G-CSFによるCIN予防の完全な返信を発表した。国家食品薬品監督管理局はCIN予防適応のNDAを審査している。
次に、プリブリンは抗癌薬としてドセタキセルと併用して二線と三線非小細胞肺癌EGFR野生型研究(ダブリン-3期3登録研究)に使用された。ダブリン-3号研究はすでに559人の患者の全世界募集を完了し、この研究の最終陽性背線結果は2021年8月と2021年9月にESMOで発表され、中国は2022年下半期にNDA申請を提出する可能性がある。
最後に、プリブリンは現在研究者による臨床試験を行っており、各種の免疫腫瘍剤との連合治療潜在力を研究しており、これらの薬物は、1)カリフォルニア大学サンディエゴ校とワシントン大学でPD-1抗体nivalumabを併用して非小細胞肺癌を治療する、2)ロゲス大学とアメリカの他の臨床センターでnivolumabとCTLA-4抗体ipilimumabを併用して小細胞肺癌を治療する、3)PD-1或いはPD-L 1抗体と放射線治療MD Anderson癌センターの各種癌を連合して治療する。
著者らの戦略は一連のプリブリンを多種の適応に応用する候補製品を開発し、その他の潜在力があり、プリブリンを多薬結合免疫検査点抑制剤制度の重要な構成部分の候補製品にし、癌患者の抗癌効果を高め、そしてプリブリンの強力な樹状細胞成熟機序の支持を得ることである。我々の戦略を実施するために,我々は1種の斬新で効率的なビジネスモデルを用いて,米国と中国の臨床資源を統合した。我々はICONやCovanceなどのグローバルCRO社と協力し,米国GCPによる研究によりデータ品質を確保している。著者らの薬物開発能力はアメリカの臨床研究者の深い興味、及び著者らの中国製薬業界、臨床資源と監督管理システムに対する理解のおかげである。このモデルは,CIN予防適応におけるFDAとNMPAのプリブリンの画期的な治療指定への支持を得ている。また、アメリカと中国は世界最大の2つの薬品市場であるため、このモデルはプリプリンにとって重要なビジネス機会である。
NSCLCとCINのプリブリンの臨床開発計画以外に、著者らは著者らの研究協力を利用して、プリブリンの臨床試験における進展を推進し、免疫腫瘍剤としての治療潜在力を探索している。我々は,これらの研究者による各種臨床試験やプリブリンの薬物供給に資金支援を提供している。プリブリンと免疫腫瘍学薬物を結合した治療潜在力を探索する以外に、著者らは著者らの子会社SEEDの中で一連の臨床前免疫腫瘍学候補製品と一から薬物発見のルートを持っている。私たちは礼来会社との協力がこのTPDプラットフォームと未来の潜在力を検証するのに役立つと信じている。私たちはこのようなプロジェクトを推進するために私たちの研究協力を有効かつ効率的に利用した。
承認されれば、私たちは恒瑞と協力して、私たちの子会社の万春プリンを通じてプリブリンを中国で商業化しました。中国はプリブリンを国家科学技術重大特別プロジェクト“基本新薬研究開発”としている。また、2017年の贈与に伴い、プリブリンは国家薬物優先審査リストに登録されている。薬品審査と中国政府との定価交渉が成功する前に、2017年の支出はプリブリンを国家保険システムに組み入れるのに役立つ可能性があり、これは患者とのより迅速な接触と精算を可能にすると信じている。米国や世界の他の地域では、米国における候補製品の規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価します。
2010年に私たちのアメリカ子会社の元持株会社の万春生物科学技術が設立されて以来、私たちの業務の重点は私たちの会社、業務計画、資金の調達、私たちの知的財産権の組み合わせを構築することであり、プリプリンの権利の保護、およびプリブリンの動物研究と臨床試験を行うことを含む。私たちは候補製品の販売が許可されていないし、製品販売から何の収入も得られていない。私たちは株式融資、株主、第三者融資(銀行ローンを含む)および協力手配を通じて私たちの業務に資金を提供します。
2021年12月31日現在、私たちは株式融資を通じて約2.96億ドルを調達し、1020万ドルの非持株権益を発行し、530万ドルの種子優先株を発行し、210万ドルは銀行融資から来ており、その中の60万ドルは2021年7月に免除され、150万ドルは2022年3月に返済され、250万ドルの第三者ローンは、そのうち100万ドルは株式投資、150万ドルは返済され、1440万ドルの株主ローンに転換された。その中の600万ドルはすでに返済され、840万ドルはすでに私たちのアメリカ子会社の前持株会社の万春生物科学技術が私たちの内部再編に基づいて2015年7月20日に負担し、礼来会社は種子会社に1,000万ドルを前払いし、恒瑞は万春布林に約3,100万ドルを前払いした。2021年12月31日現在、私たちは4160万ドルの現金と現金同等物を持っている。
設立以来、私たちは経営赤字を被ってきた。2019年12月31日、2020年、2021年12月31日までの年度の純損失はそれぞれ4,030万ドル、6,380万ドル、6,820万ドルです。2020年12月31日と2021年12月31日までの累計赤字はそれぞれ2兆778億ドルと3.42億ドルだった。私たちのほとんどの損失は私たちの臨床試験を援助し、私たちの薬物製品を生産し、私たちの研究開発計画と私たちの運営に関連する一般的かつ行政コストによるものだ。私たちは予測可能な未来に巨額の費用と運営損失が続くと予想している。私たちは持続的な活動に関連した費用が増えると予想しています
| ● |
著者らのプロジェクトの臨床前研究と臨床開発を継続し、非小細胞肺癌、CINと免疫薬物の共同研究を含むプリブリン臨床開発プロジェクトに関連している |
| ● |
人員を増任する |
| ● |
私たちの知的財産権の組み合わせを維持し、拡大し、保護する |
| ● |
もし私たちがパートナー関係がなければアメリカでプリプリンを発売し商業化します |
| ● |
候補新製品の発見と開発に資金を提供する |
| ● |
上場企業の運営に関連した追加コストが発生する。 |
私たちは臨床開発を通じて私たちの候補製品を推進し、規制部門の承認を求め、任意の候補製品のために準備し、任意の候補製品が承認されれば、商業化を開始するために、私たちの運営活動を支援するために多くの追加資金が必要になるだろう。受け入れ可能な条件で、私たちは十分な資金を得ることができないかもしれないし、全く持っていないかもしれない。特に、新冠肺炎の流行と最近のロシアとウクライナの間の敵対行動は市場変動をもたらし続けることが予想されており、このような市場条件下では、合理的な条項や根本的に融資を完了できない可能性がある。新冠肺炎疫病はすでに私たちの業務に影響を与え、私たちのいくつかの業務活動と業績にマイナスの影響を与え続ける可能性がある。詳しくは“プロジェクト3.重要な情報-D.リスク要因-私たちの業界、業務、運営に関連するリスク-私たちは健康流行病、流行病、その他、私たちの業務の疫病を深刻に混乱させる可能性がある他のリスクに直面している”と“−私たちの候補製品の臨床開発に関連するリスク-最近のロシアとウクライナ間の敵対行動および付属事態の発展は私たちの業務に悪影響を及ぼす可能性がある”と述べた。新冠肺炎疫病及びロシアとウクライナ間の敵対行動は依然として不安定で変化し続けているため、現在このような事件が著者らの業務、財務状況と運営結果に与える最終的な影響を合理的に推定することができない。
2022年1月、FDAが最近NDAに完全な返信を出したため、私たちのいくつかの資源を現金滑走路の延長と長期持続可能性の維持に再集中させる組織簡素化計画を発表したので、プリプリンとG-CSFの併用によるCIN予防の承認を求めた。この簡素化された計画はいくつかの職員たちに影響を及ぼす部隊計画を減らすことを含む。私たちは現金資源を節約するためにアメリカで約35%の従業員を削減した。リストラの影響を受けたすべての従業員は、従業員の私たちのサービス年限に基づく解散費を得る資格があり、解雇後18ヶ月以内に自費で団体健康保険を継続することを選択することができます。影響を受けたすべての従業員が解散費福祉を受ける資格があるかどうかは、その従業員が離職協定を実行するかどうかに依存し、その中には私たちに対する請求を全面的に解除することが含まれている。リストラに関連する使い捨て費(すなわち、発生すると予想される現金支出)は約100万ドルと予想され、その大部分は2022年第1四半期に支払われている。解散費に関する費用は多くの仮説の影響を受けており,実際の結果は大きく異なる可能性がある。リストラやリストラに関連した事件が発生する可能性があるため、現在考慮されていない他の費用や現金支出も発生する可能性がある。
経営成果の構成部分
収入.収入
これまで、私たちは製品販売から何の収入も得ておらず、予測可能な未来にも製品販売から何の収入も得られないだろう。2021年、私たちはSEEDと礼来社の研究協力と許可協定を通じて140万ドルの収入を生み出し、万春プリンと恒瑞の独占商業化と共同開発協定を通じてゼロ収入を生み出した。万春布林が恒瑞から受け取った2億元の前払いは繰延収入として記録され、製品承認後に交付単位進捗を用いて収入として確認された。将来、私たちは製品販売、精算、前払い、マイルストーン支払い、既存と将来の協力に関連する印税から収入を得ることができるかもしれない。もし私たちが私たちの候補製品の開発をタイムリーに完成させなかったり、彼らの規制の承認を得られなかったら、私たちは未来に収入を生むことはできないだろう。
費用.費用
研究と開発費
歴史的に見ると、私たちの総運営費用の最大の構成要素は私たちの研究開発活動への投資です。研究開発費には,Nereusからプリブリンの全世界著作権の購入,プリブリンの臨床前研究と臨床試験,および我々の免疫腫瘍学候補製品パイプラインの開発,および我々のユビキチン媒介分解プラットフォームを用いた新薬発見が含まれている。研究·開発費には、以下のような活動も含まれている
| ● |
従業員に関する費用は、賃金、福祉、株式給与、研究開発者の出張費用を含む |
| ● |
臨床試験や臨床前研究を行って支援するCRO,契約製造組織,コンサルタントとの合意による費用; |
| ● |
臨床前研究や開発活動に関連する費用 |
| ● |
規制業務に関連するコスト |
| ● |
知的財産権の保護に関わるコスト |
| ● |
従業員、役員、非従業員コンサルタントに株式報酬を提供し、 |
| ● |
その他の費用には、研究及び開発活動のためのレンタル料、保険及び他の用品の直接及び分配された費用が含まれている。 |
研究開発活動は私たちのビジネスモデルの核心だ。臨床開発後期段階にある候補製品は通常,臨床開発早期段階の候補品よりも高い開発コストを有しており,これは主に後期臨床試験の規模と持続時間が増加しているためである。今後数年間、より多くの臨床前研究と臨床試験を通じて私たちの製品ラインを開発し続けるにつれて、私たちの研究開発費用は引き続き大幅に増加し、プリプリンの商業生産ロットは承認前に在庫を蓄積するコストを生成すると予想される。
研究開発費が発生すると、私たちはそれらを使います。著者らは被験者登録、臨床サイト活性化或いはサプライヤーが私たちに提供した情報などのデータを用いて、特定の任務を達成する進捗評価に基づいて、ある開発活動(例えば臨床試験)のコストを記録した。
多くの要素は研究と開発コストに影響し、未来の臨床試験と各種の監督管理要求を含み、その中の多くの要素は現在著者らの開発段階によって正確に確定できない。また、私たちがコントロールできない将来のビジネスニーズと規制要因は、私たちの臨床開発計画と計画に影響を与えるだろう。私たちの候補製品が開発に成功するかどうかは大きな不確実性を持っている。候補製品の臨床前研究、臨床開発および商業化自体の予測不可能性のため、任意の他の候補製品開発を完了するために必要な努力の性質、タイミングおよびコスト、またはいつ(あれば)大量の現金純流入を開始する可能性があることを合理的に推定または知ることはできない。この予測不可能性は、候補製品の臨床試験および商業化の持続時間およびコストに関連する多くのリスクおよび不確実性のためであり、これらのリスクおよび不確実性は、プロジェクトの全ライフサイクルにおいて大きく異なる
| ● |
臨床試験に組み込まれた場所の数は |
| ● |
裁判のデザインと裁判のデザインを変えます |
| ● |
適切なセキュリティプロファイルを構築すること |
| ● |
適切な患者を募集するのに要する時間の長さ |
| ● |
最終的に試験に参加した患者数は |
| ● |
患者が受ける用量の数 |
| ● |
患者のフォローアップ時間の長さ |
| ● |
臨床試験の結果 |
| ● |
第三者製造業者と手配する |
| ● |
関連規制部門の上場承認を受けた |
| ● |
単独でも他人と協力しても、承認されれば候補製品を商業化することができる |
| ● |
私たちの候補製品のために特許と商業秘密保護および規制排他性を獲得し、維持する |
| ● |
製品が承認された後に持続的に許容可能な安全状態;および |
| ● |
重要な研究開発者を引き留める。 |
我々の任意の候補製品の開発に関連するこれらの変数のいずれかの結果の変化は、候補製品の開発に関連するコスト、タイミング、および生存能力を著しく変化させるであろう。
一般と行政費用
一般費用と行政費用には主に人件費が含まれ、行政、財務、人的資源機能、情報技術、シェアで計算される給与費用が含まれる。その他の一般および行政費用には、法律、相談、監査、税務サービスの専門費用、および一般および行政活動で使用されるレンタル料、保険および用品の他の直接費用が含まれる。2022年1月には、報酬コストの低減や、他の運営コストの削減に努めるための、複数の従業員に影響を与える効果的なリストラ計画を含む組織簡素化計画を発表した。私たちは現在、近い将来に重大な商業化前のコストが発生しないと予想している。米国での候補製品の規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価します。上場企業に関する法律、コンプライアンス、会計、役員、上級管理職保険、投資家や広報費用を招くこともあります。
その他の収入(費用)
その他の収入は主に現金利息収入、外国為替収益、ローン減免収益、短期投資収益を含む。
その他の料金には主に利息料金が含まれています。
経営成果
2021年12月31日までと2020年12月31日までの年次比較
次の表は、2021年12月31日現在と2020年12月31日までの年度の経営結果と、これらの項目の百分率変化をまとめています
| 十二月三十一日までの年度 |
||||||||||||
| 2021 |
2020 |
変わる |
||||||||||
| (千ドル単位(“$”) |
% |
|||||||||||
| 収入.収入 |
1,351 | 180 | 651 | % | ||||||||
| 運営費 |
||||||||||||
| 研究開発 |
(36,888 | ) | (41,793 | ) | -12 | % | ||||||
| 一般と行政 |
(30,703 | ) | (22,598 | ) | 36 | % | ||||||
| 運営損失 |
(66,240 | ) | (64,211 | ) | 3 | % | ||||||
| その他の収入 |
||||||||||||
| 純為替収益 |
231 | 355 | -35 | % | ||||||||
| 利子支出 |
(87 | ) | (85 | ) | 2 | % | ||||||
| 利子収入 |
98 | 116 | -16 | % | ||||||||
| その他の収入、純額 |
1,360 | 4 | 33900 | % | ||||||||
| その他収入合計 |
1,602 | 390 | 311 | % | ||||||||
| 所得税前純損失 |
(64,638 | ) | (63,821 | ) | 1 | % | ||||||
| 所得税費用 |
(3,570 | ) | — | — | ||||||||
| 純損失 |
(68,208 | ) | (63,821 | ) | 7 | % | ||||||
研究と開発
2021年12月31日までの年間研究開発(R&D)費用は3690万ドルだが、2020年12月31日までの年間は4180万ドル。490万ドルの減少は、主に臨床開発費用および非現金シェアに基づく補償費用によって減少したが、より高い人員費用、臨床前および専門サービス費用、およびFDAに支払われた290万ドルのNDA申請料によって部分的に相殺され、この費用は2022年上半期に返金される予定である。
| 研究開発活動(1) |
十二月三十一日までの年度 |
|||||||||||
| 2021 |
2020 |
変わる |
||||||||||
| (千ドル単位(“$”) |
% |
|||||||||||
| ダブリン-3 |
3,987 | 6,800 | -41 | % | ||||||||
| 保護-1 |
1,953 | 2,968 | -34 | % | ||||||||
| 保護-2 |
1,969 | 9,955 | -80 | % | ||||||||
| 臨床前 |
3,517 | 1,014 | 247 | % | ||||||||
| 他の臨床試験 |
826 | 905 | -9 | % | ||||||||
| 従業員関連の費用 |
8,287 | 5,978 | 39 | % | ||||||||
| 株式ベースの報酬 |
901 | 4,124 | -78 | % | ||||||||
| 顧問その他 |
15,448 | 10,049 | 54 | % | ||||||||
| 総研究開発 |
36,888 | 41,793 | -12 | % | ||||||||
| (1) |
臨床前と臨床開発自体の予測不可能性のため,主に人員,早期研究,製造,開発に関連しているため,プロジェクトごとにすべての内部研究開発費を追跡していないため,これらの費用は複数の開発中のプロジェクトに配置されている。したがって,これらの費用は単独で示されている. |
一般と行政費用
2021年12月31日までの年間、一般·行政(G&A)支出は3070万ドルだが、2020年12月31日までの年間は2260万ドル。810万ドルの増加の大部分はプリプリンの商業化前の費用の増加によるものだ。私たちは来年も商業化前の費用が発生しないと予想している。人員費用、D&O保険、出張、その他の費用も増加したが、非現金シェア給与支出の減少により部分的に相殺された。
その他の収入
2021年12月31日までの年度の他の収入には、主に60万ドルの融資免除収益、40万ドルの長期契約公正価値変動の未実現収益、20万ドルの外国為替収益、10万ドルの短期投資未実現収益、10万ドルの投資収入、10万ドルの利息収入が含まれる。2020年12月31日現在の年度のその他の収入には、主に40万ドルの外貨収益と10万ドルの利息収入が含まれている。
2020年12月31日までと2019年12月31日までの年度比較
次の表は、2020年12月31日と2019年12月31日期の経営業績、およびこれらの項目の百分率変動をまとめています
| 十二月三十一日までの年度 |
||||||||||||
| 2020 |
2019 |
変わる |
||||||||||
| (千ドル単位(“$”) |
% |
|||||||||||
| 収入.収入 |
180 | — | — | |||||||||
| 運営費 |
||||||||||||
| 研究開発 |
(41,793 | ) | (31,342 | ) | 33 | % | ||||||
| 一般と行政 |
(22,598 | ) | (8,965 | ) | 152 | % | ||||||
| 運営損失 |
(64,211 | ) | (40,307 | ) | 59 | % | ||||||
| その他の収入 |
||||||||||||
| 純為替収益 |
355 | (4 | ) | -8,975 | % | |||||||
| 利子支出 |
(85 | ) | (206 | ) | -59 | % | ||||||
| 利子収入 |
116 | 184 | -37 | % | ||||||||
| その他の収入 |
4 | — | — | |||||||||
| その他の収入合計 |
390 | (26 | ) | -1,600 | % | |||||||
| 所得税前純損失 |
(63,821 | ) | (40,333 | ) | 58 | % | ||||||
| 所得税割引 |
— | — | — | |||||||||
| 純損失 |
(63,821 | ) | (40,333 | ) | 58 | % | ||||||
研究と開発
2020年12月31日までの年度の研究開発(R&D)支出は4,180万ドルだったが、2019年12月31日までの年度の研究開発(R&D)支出は3,130万ドルだった。1050万ドルの増加は,主に臨床試験費用が380万ドル増加し,非現金株式ベースの報酬が350万ドル増加し,270万ドル増加したためであり,主にコンサルタントや他の人にNDA申請を支援する金額が支払われたためである。
| 研究開発活動(1) |
十二月三十一日までの年度 |
|||||||||||
| 2020 |
2019 |
変わる |
||||||||||
| (千ドル単位(“$”) |
% |
|||||||||||
| ダブリン-3 |
6,800 | 7,516 | -10 | % | ||||||||
| 保護-1 |
2,968 | 2,250 | 32 | % | ||||||||
| 保護-2 |
9,955 | 6,144 | 62 | % | ||||||||
| 臨床前 |
1,014 | 1,206 | -16 | % | ||||||||
| 他の臨床試験 |
905 | 1,298 | -30 | % | ||||||||
| 従業員関連の費用 |
5,978 | 4,953 | 21 | % | ||||||||
| 株式ベースの報酬 |
4,124 | 630 | 555 | % | ||||||||
| 顧問その他 |
10,049 | 7,345 | 37 | % | ||||||||
| 総研究開発 |
41,793 | 31,342 | 33 | % | ||||||||
| (1) |
臨床前と臨床開発自体の予測不可能性のため,主に人員,早期研究,製造,開発に関連しているため,プロジェクトごとにすべての内部研究開発費を追跡していないため,これらの費用は複数の開発中のプロジェクトに配置されている。したがって,これらの費用は単独で示されている. |
一般と行政費用
2020年12月31日までの年間、一般·行政(G&A)支出は2260万ドルだが、2019年12月31日までの年間は900万ドル。1360万ドルの増加は、主に商業化前のコストが560万ドル増加し、商業·管理者の給料と福祉が450万ドル増加し、いくつかの一次奨励支払いを含め、非現金株式報酬支出が260万ドル増加し、専門サービスおよびその他の支出が90万ドル増加したためである。
その他の収入
2020年12月31日現在の年度のその他の収入には、主に40万ドルの外貨収益と10万ドルの利息収入が含まれている。2019年12月31日現在の年度のその他の支出には、主に20万ドルの利息支出と20万ドルの利息収入が含まれている。
“雇用法案”
雇用法第107条(B)によれば、“新興成長型企業”は、これらの基準が民間企業に適用されるまで、新たな又は改正された会計基準の採用を延期することができる。私たちはこの免除を利用しないことを撤回できないことを選択したので、他の非新興成長型企業の上場企業と同時に新しいまたは改正された会計基準を採用する。私たちは現在雇用法案によって提供された他の免除と減少の報告書要件を評価している。例えば、新興成長型企業としては、取引所法案14 A(A)および(B)条の制約を受けず、そうでなければ、(1)役員報酬問題を株主相談投票に提出することを要求し、“報酬発言権”、“頻度的に言えば”および“黄金パラシュート”、および(2)役員報酬と業績との関連性、および私たちの最高経営責任者報酬と私たちの従業員報酬中央値との比較など、いくつかの役員報酬に関する項目を開示することを要求する。我々は、サバンズ·オキシリー法第404条(B)条に基づいて、財務報告の内部統制に関する監査人証明報告に関する規則を提供し、PCAOBが通過する可能性のある強制監査会社のローテーションに関する任意の要求に関する規則の免除、または監査及び財務諸表に関する追加情報を提供する監査師報告書の追加を監査人議論及び分析と呼ぶことを要求する予定である。2022年12月31日、つまり2017年3月14日5周年後の今年度最後の日まで、“新興成長型企業”となります。
外国人個人発行者の地位を持つ非米国会社として、我々は“取引所法案”の報告要求を遵守している。私たちが新興成長型会社になる資格がなくなった後であっても、私たちが取引所法案の下の外国の個人発行者になる資格がある限り、私たちは、米国内の上場企業に適用されるいくつかの条項の制約を受けない
| ● |
取引法では、取引法に基づいて登録された証券募集依頼書、同意または許可の章について規範化されている |
| ● |
取引法の条項は、その株式所有権および取引活動に関する公開報告書および短時間で取引から利益を得た内部者に対する責任を内部人に提出することを要求する |
| ● |
指定された重大な事件が発生した場合に、監査されていない財務および他の指定された情報を含む10-Q表四半期報告、または現在の8-K表報告を米国証券取引委員会に提出することを要求する取引法に規定されている規則 |
| ● |
FDを規制し、発行者が重大な情報を選択的に開示することを規制する。 |
| B. |
流動性と資本資源 |
設立以来、私たちの運営は純損失とマイナスキャッシュフローになりました。私たちのほとんどの負のキャッシュフローは、私たちの研究開発計画に資金を提供することと、私たちの運営に関する一般的かつ行政コストから来ています。2021年12月31日、2020年、2019年12月31日までの年度で、それぞれ6820万ドル、6380万ドル、4030万ドルの総合純損失が発生した。2021年12月31日と2020年12月31日までの累計赤字はそれぞれ3.42億ドルと2兆778億ドルだった。私たちの現金の主な用途は研究開発コストと一般と行政コストに資金を提供することです。2021年12月、2020年、2019年12月までの年間で、私たちの経営活動はそれぞれ4720万ドル、4370万ドル、4820万ドルの現金を使用しています。私たちは株式発行、株主、第三者融資(銀行ローンを含む)および協力手配を通じて私たちの業務に資金を提供します。2021年12月31日までの年間で、私たちが株式証券の売却から得た現金純収益総額はゼロです。
我々の流動性は融資活動,臨床試験,研究開発および一般と行政費用の影響を受けている。他の事項に加えて、私たちは追加的な資本資源が必要だ。私たちは、株式と債務融資、潜在的な許可と協力手配、規制部門の承認を得た後に製品を販売するなど、私たちの運営に資金を提供する様々な融資プログラムを評価している。必要なときに資本が私たちの運営資金要求を満たすことが保証されない、あるいは資本があれば、私たちが受け入れられる条項で行われる保証はありません。私たちが追加的な株式証券を発行することは、私たちの既存の株主の株式を希釈させるかもしれない。商業ローンを獲得し、これらのローンが利用可能であると仮定すると、私たちの負債と将来の現金約束を増加させ、金融契約や制限を含む可能性がある。もし私たちが受け入れられると思われる金額と条項で融資を受けることができなければ、私たちの業務と未来の成功は実質的で不利な影響を受けるだろう。
私たちの現在の財務資源は、2023年第2四半期の運営費用と資本支出を満たすことができると予想している。
キャッシュフロー
次の表では、2021年12月31日、2020年、2019年12月31日までの年間キャッシュフロー情報を提供します
| 十二月三十一日までの年度 |
||||||||||||
| 2021 |
2020 |
2019 |
||||||||||
| (千ドル単位(“$”) |
||||||||||||
| 経営活動のための現金純額 |
(47,242 | ) | (43,745 | ) | (48,162 | ) | ||||||
| 投資活動のための現金純額 |
(20,413 | ) | (52 | ) | (4 | ) | ||||||
| 融資活動が提供する現金純額 |
1 | 117,835 | 80,171 | |||||||||
| 為替レート変動の純効果 |
(258 | ) | (434 | ) | 39 | |||||||
| 現金と現金等価物純額(減少)/増加 |
(67,912 | ) | 73,604 | 32,044 | ||||||||
経営活動に使われている現金純額
2021年12月31日現在,2020年および2019年12月31日までの年度の経営活動に用いられた現金は,主に非現金費用および運営資本構成要素の変動調整後の純損失6,820万ドル,6,380万ドルおよび4,030万ドルに由来している。2021年の間、これらの非現金費用には、主に320万ドルの非現金株式報酬が含まれる。2021年12月31日までの1年間、経営活動で使用された純現金は4720万ドルだったが、2020年12月31日までの年間は4370万ドルだった。350万ドルの増加は主に年内運営現金支出の増加によるものだが、恒瑞が独占商業化と共同開発協定に基づいて受け取った3100万ドルの前金部分によって相殺された。2020年12月31日までの1年間、経営活動で使用された純現金は4370万ドルだったが、2019年12月31日までの年間は4820万ドルだった。450万ドルの減少は,主に運営資金割引や非現金費用の増加による相殺運営損失の増加と,協力合意に基づいて礼来会社から1,000万ドルの前払いを受けるためである。
本報告で述べた間、私たちの現金の主な用途は、私たちの研究開発、規制および他の臨床試験コスト、商業化前のコスト、および関連する行政コストに資金を提供することである。私たちのサプライヤーへの前金とその他の流動資産、売掛金と売掛金残高はすべてサプライヤーが領収書を発行する時間と支払いのスケジュールの影響を受けます。
投資活動のための現金純額
2021年12月31日までの年度の投資活動用現金純額は2,040万ドル,2020年12月31日までの年度投資活動用現金純額は52,000ドルであるのに対し,2019年12月31日までの年度投資活動用現金純額は4,000ドルである。2021年の間、現金純額は、主に短期投資の購入と長期資産の獲得に使用され、設備やリースの改善を含む。2020年から2019年までの間、純現金は主に長期資産の買収に用いられる。
融資活動が提供する現金純額
2021年12月31日までの1年間で、融資活動が提供する純現金は2020年12月31日現在の1兆178億ドルからゼロに減少した。2020年12月31日までの年度、融資活動が提供する現金純額は、2019年12月31日現在の8,020万ドルから1兆178億ドルに増加し、3760万ドルに増加した。増加の要因は,公開発売と私募から得られた純収益1.116億ドルと,非持株権益を償還可能な総収益530万ドルを発行したことである。
流動資金と材料現金需要
私たちが規制部門の承認を得て、私たちの現在のどの候補製品も商業化しない限り、私たちは相当な収入が発生しないと予想される。予測可能な未来には、引き続き赤字が発生し、現在の候補製品の開発を継続し、規制部門の承認を求めるにつれて、損失が増加すると予想される。米国での候補製品の規制経路を決定した後、商業化パートナーを探すか、内部商業化能力を確立するかを評価します。したがって、私たちは私たちの未来の業務に関連した追加資金が必要になると予想する。
私たちの流動性は融資活動、臨床試験、研究開発、商業化前および一般と管理費用の影響を受ける。必要なときに資本が私たちの運営資金要求を満たすことが保証されない、あるいは資本があれば、私たちが受け入れられる条項で行われる保証はありません。当社の増発持分証券は、その既存株主の持分を希釈する可能性がある。商業ローンを獲得し、これらのローンが利用可能であると仮定すると、私たちの負債と将来の現金約束を増加させ、金融契約や制限を含む可能性がある。もし私たちが受け入れられると思われる金額と条項で融資を受けることができなければ、私たちの業務と未来の成功は実質的で不利な影響を受けるだろう。したがって、私たちは私たちの業務活動を継続するために追加的な資本を調達しなければならない。私たちの推定は間違っていることが証明される可能性があるという仮定に基づいており、私たちは現在予想されているよりも早く私たちが利用できる資本資源を使用するかもしれない。私たちの候補製品の開発や商業化に関連する多くのリスクや不確実性のため、候補製品の開発や商業化に必要な増加した資本支出や運営支出の金額を見積もることができません。
私たちの将来の資本需要は多くの要素に依存します
| ● |
審査と承認の費用、時間、結果を規制する |
| ● |
私たちの候補製品が臨床開発で進展する能力に成功しました |
| ● |
私たちの他のプロジェクトと潜在的な製品候補の動物研究と臨床試験の開始、進展、時間、コストと結果 |
| ● |
私たちが求めている候補製品の数量と特徴は |
| ● |
特許出願を準備し、提出し、起訴し、私たちの知的財産権を維持し、実行し、知的財産権に関するクレームを弁護するコスト; |
| ● |
他の製品や技術をどの程度手に入れているのか |
| ● |
私たちは他の製薬会社と私たちの資産の開発、許可、商業化についてパートナーシップを構築し、維持することができます |
| ● |
私たちは有利な条件で協力計画を維持して確立することができ、もしあれば。 |
これまで、相当な製品収入を生み出すことができれば、株式や債務融資、潜在的な許可、協力手配、規制承認を得た後に製品を販売することで、現金需要に融資する予定です。私たちが株式または転換可能な債務証券を売却することで追加資本を調達する場合、私たちの株主の所有権権益は希釈され、これらの証券の条項は清算または他の株主の権利に悪影響を及ぼす特典を含む可能性がある。債務融資が可能であれば、関連する可能性のある合意には、追加債務を招く、資本支出を行う、または配当を発表するなど、私たちが具体的な行動をとる能力を制限または制限する契約が含まれており、株式承認証を発行する必要がある可能性があり、これは私たち株主の所有権権益を希釈する可能性がある。もし私たちが協力、戦略連合、マーケティング、または流通手配、または第三者との許可手配によって追加資金を調達する場合、私たちは、私たちの技術、将来の収入源、または研究計画の貴重な権利を放棄しなければならないか、または私たちに不利になる可能性のある条項で許可を付与しなければならないかもしれない。もし私たちが必要な時に株式や債務融資を通じてより多くの資金を調達できない場合、私たちは私たちの製品開発や将来の商業化努力を延期、制限、減少または終了することを要求されるかもしれません。あるいは私たちが開発とマーケティングをより望んでいた製品または候補製品を開発し、マーケティングする権利を与えることができます。
契約義務と約束
賃貸承諾額
私たちの主な約束は事務空間と実験室空間の運営賃貸に対する義務を含む。
私たちは私たちのすべての施設を借りて、私たちの既存の施設は私たちの需要を満たすのに十分だと信じている。私たちの主な執行事務所はニューヨークに設置され、ニュージャージー州、ペンシルベニア州、北京と大連、中国にも事務所が設置されている。
私たちは今ニューヨークでオフィス空間を借りています。総面積は七二三平方フィートです。レンタル契約は2023年12月に満期になります。私たちの現在のレンタル料は毎月35,888ドルで、2023年2月に302ドル増加します。借約項の下の支払いはレンタル期間ごとに直線的に計算され、賃貸契約条項にはレンタル料、継続期間、または購入選択権が含まれていないか、またはある。
2021年9月以来、ニュージャージー州でオフィススペースを借りました。総面積は9,727平方フィートです。レンタル契約は2027年2月に満期になります。私たちの今のレンタル料は毎月24,723ドルです。2023年から、私たちの年間レンタル料は1平方フィート当たり0.5ドル増加します。私たちはまた公共事業費用と私たちが負担しなければならない建築不動産税と建築運営費用を支払う。レンタル契約での支払いはレンタル期間内に直線的に計算されます。
私たちは現在大連でオフィス面積が860.12平方メートルで、中国で、レンタル料は毎月約2,874ドルです。レンタル契約は2022年8月31日に満期になります。
私たちは現在北京でレンタルオフィス面積は222.68平方メートルで、中国では、レンタル料は毎月約12,000ドルです。レンタル契約は2022年4月21日に満期になります。
我々の子会社SEEDはUbiquitinプラットフォーム技術の研究開発を支援するためにウェット実験室を建設している。Seedは2021年9月以降、ペンシルバニア州で一時空間と永久オフィス空間と実験室空間を借りた。永久空間建設が完了するまでにレンタルされた仮空間の敷地は約2 043平方フィート,固定賃貸料は月7 661.25ドルであり,レンタル期間は永久空間建設が完了した後に終了する。永久空間の敷地は約10 086平方フィートで、固定賃貸料の初乗り料金は毎月37 823ドルで、2022年5月に永久空間工事がほぼ完了してから6ヶ月でレンタル料の支払いが開始される予定だ。2023年から、私たちの年間レンタル料は3%上昇するだろう。また、Seedは公共事業コストと、比例配分された建築不動産税と建築運営費用を支払い、賃貸者を代表して賃貸物件の改善に約80万ドルを支払う。レンタル契約での支払いはレンタル期間内に直線的に計算されます。
融資協定
2019年3月、私たちの子会社である万春生物科技(大連)有限公司(前身は万春生物科技(深セン)有限公司)中国建設銀行と3年間の人民元10,000,000元(1,500,000ドル)の融資協定を締結し、融資金利は中国金融機関の人民元貸出基準変動金利である。2021年12月31日現在、貸出金利は5.25%である。このローンは私たちの株主である深セン市三ゲル資本管理有限会社と劉木龍によって保証されます。このローンは2022年3月に返済された。
2020年5月3日、私たちの子会社の万春医薬はアメリカの小企業管理局が始めた支払い小切手保護計画に基づいて、北米シティバンクから元金60万ドルの2年間定期ローンを獲得した。このローンの年利率は1%です。Paycheck保護計画によると、私たちは2021年5月にいくつかの合格コストの合計に相当するローンの免除を申請し、2021年7月にローンを免除した。
その他契約義務
私たちは正常な業務過程でCROや機関と協定を締結し、知的財産権を許可します。事前に書面で通知した場合、私たちはいつでもこれらの契約をキャンセルすることができます。
| C. |
研究開発、特許、ライセンスなど。 |
研究と開発
我々の研究開発費には,主に研究開発活動を行うコスト,関係者やコンサルタントの給料,福祉と関連コスト,候補製品を開発する原材料や用品,特許出願提出による特許関連コスト,臨床開発活動や試験を行う外部サプライヤーを招聘する外部コストが含まれている。“--A.経営成果--経営成果の構成要素--費用--研究と発展費用を参照”
知的財産権
2022年3月21日現在、私たちは40の管轄区域で122件の特許を所有しているか、または共同で保有しており、21件の発行された米国特許を含む。私たちはまた、係属中の米国の非臨時特許出願14件と、他の管轄区域で係属中の対応する特許出願と、5つの係属中の米国仮特許出願とを有している。また,PCTによるプリブリンやプリブリン類似体に関する3つの未解決国際特許出願を有しており,プリブリンによる鉄障害の治療,プリブリンと免疫チェックポイント阻害剤およびファルニキピロリン酸合成酵素阻害剤との併用による癌の治療,プリブリンと抗CD 47薬の併用による癌の治療に関与する予定である。私たちはまた、BPI-002に関連する未解決の国際特許出願を持っており、米国および他の司法管轄区で全国特許出願を提出する予定である。“プロジェクト4.会社情報--B.業務概要--知的財産権”を参照
| D. |
トレンド情報 |
私たちは臨床段階の会社で、どの程度の正確性で私たちの研究と開発の結果を予測することができません。そのため、私たちはいかなる重大な傾向、不確定性或いは事件を正確に予測することができず、これらの傾向、不確定性或いは事件は私たちの純損失、流動性或いは資本資源に重大な影響を与える可能性があり、或いは財務情報が未来の経営業績或いは財務状況を反映できない可能性がある。しかしながら、可能な範囲内で、いくつかの傾向、不確実性、需要、承諾およびイベントは、本“プロジェクト5.経営および財務回顧と展望”に記載されている
| E. |
肝心な会計見積もり |
私たちの財務状況と経営結果の討論と分析は私たちの財務諸表に基づいています。これらの報告書はアメリカ公認会計基準に基づいて作成されています。これらの財務諸表を作成する際には、資産、負債、収入、コスト、費用報告金額に影響を与える推定、仮説、判断を行う必要があります。私たちは私たちの推定と判断を絶えず評価して、私たちの実際の結果はこのような推定とは違うかもしれない。我々は過去の経験、既知の傾向及び事件、契約マイルストーン及びその他の当時の状況に属すると考えられる合理的な要素に基づいて推定し、その結果は資産及び負債の帳簿価値を判断する基礎を構成し、当該等の資産及び負債の帳簿価値は他の出所から容易に見られるものではない。
これらの推定のいくつかは、重大な推定不確実性に関連し、我々の総合財務諸表に重大な影響を与える可能性があるので、重要であると考えられる。私たちの重要な会計推定は以下のようにまとめられる。当社の主要会計政策の説明については、本年度報告書に含まれる総合財務諸表付記2を参照されたい。
契約コストと計上項目を検討する
我々はすでに中国、アメリカ、ヨーロッパ、オーストラリアの研究機関や他社と様々な研究開発契約を締結している。関連支払いは発生時に研究と開発費用を計上する。我々は推定されている進行中の研究コストの計上項目を記録した。計算すべき負債の十分性を評価する際に、イベントの段階または完了状況、受信された請求書、および契約コストを含む研究の進行状況を分析する。いずれの報告期間終了時の当計残高を決定する際には,重大な判断と見積もりを行う。実際の結果は私たちの推定とは違うかもしれない。我々の従来の計算すべき項目見積もりと実コストに大きな差はなかった。
所得税
繰延税金資産とは、来年度の課税所得額を減らすために使用できる金額のことです。このような資産の発生は,資産と負債の財務報告と課税基盤との一時的な違いと,純営業損失と税収控除の繰越によるものである。私たちは、一時的な差の逆転、予測された営業収益、および利用可能な税務計画戦略を含む、すべての供給源からの将来の予想課税収入の十分性を評価することによって、これらの将来の税収控除および控除の回収可能性を評価する。これらの収入源は、歴史経験と短期と長期業務予測を含む一連の要素に基づく推定に深刻に依存している。繰延税金資産の一部または全部が現金化できない可能性が高い場合には、推定準備を提供する。
最近の会計公告
最近の会計声明については、本年度報告書に含まれる総合財務諸表付記2を参照されたい。
| 第6項。 |
役員、上級管理者、従業員 |
| A. |
役員と上級管理職 |
以下は,我々の共同創業者,役員,役員(万春医薬米国会社または万春医薬米国会社の幹部を含む)の名前と年齢である。2022年3月1日まで、それぞれのビジネス経験を簡単に紹介した。万春医薬アメリカ会社役員、高級職員及び高級職員のオフィス住所はNY 10005、ニューヨーク自由街28号、39階万春医薬です。
| 名前.名前 |
年ごろ |
ポスト(s) |
||
| 行政員 |
||||
| ラン·Huang博士です |
51 |
共同創業者、会長兼CEO |
||
| エリザベス·チェレパーカーMBA |
66 |
首席財務官 |
||
| Ramon W.Mohanlal医学博士博士 |
63 |
首席医療官、研究開発·取締役執行副総裁 |
||
| G.ケネス·ロイド博士 |
78 |
首席科学官 |
||
| ゴードン·L·スクリー博士 |
75 |
首席監督官 |
||
| 非従業員取締役 |
||||
| ブランドン·ドレニMBA |
47 |
役員.取締役 |
||
| パトリック·ファビオMBA |
54 |
役員.取締役 |
||
| マシュー·コクビー修士です |
53 |
役員.取締役 |
||
| マーク·サントスRPh |
61 |
役員.取締役 |
||
| ジェフリー·ヴァシカ医学博士F.A.C.P. |
53 |
役員.取締役 |
||
| 謝彦斌、医学博士。 |
63 |
役員.取締役 |
||
| クリスチャン·趙穎MBA |
49 |
役員.取締役 |
||
| ダニエル·L·ザブロフスキー博士です |
62 |
役員.取締役 |
行政員
Huang博士は私たちの共同創業者、会長兼最高経営責任者で、2014年11月以来ずっと私たちの取締役会のメンバーです。Dr.Huangは中国とアメリカのバイオテクノロジー業界で15年以上の創業経験を持っている。2010年、Dr.Huangは人と共同で万春生物科学技術を設立し、これは私たちのアメリカ子会社の元ホールディングスです。2007年、Dr.Huangは他人と共同で無錫美泰生物科学技術有限会社を創立し、2010年に会社の最高経営責任者を務め、そして引き続き取締役を務めた。中国ポリペプチド薬物開発とマーケティングに関連する権利は2010年に上海医薬グループに販売され、この薬物はDr.Huangが無錫美泰生物科技有限会社で設計された。また,2008年,Dr.Huangは世界の生物製薬と医療機器会社のための臨床試験を行うCROであるParamax International Inc.を他者と共同で設立した。Paramax国際会社は2009年にResearch Pharmtics Services,Inc.に買収された。1998年から2002年まで、Dr.Huangはスローン-キャトリン癌センターで訓練を受け、そこで彼女は最初のE 2-E 3ユビキチンリガーゼを解決し、これはP 53分解に関連する癌シグナル経路の重要な発見である。この論文は科学それは.彼女はRASに関する癌シグナル経路の翻訳研究を2期に分けて発表した自然界書類です。彼女は腫瘍学や皮膚科適応のためのバイオテクノロジー製品を発明し、複数の特許を持っている。Dr.Huangは学士号を取得し優秀な成績で最高の栄誉を得るローレンス大学出身のPhi Beta Kappaさんも、2012年から2015年まで同校の受託者を務めていた。彼女はカリフォルニア大学バークレー校の化学博士号を取得し、そこで働く女性サービス国際組織から国際レベルの女性機会賞を受賞した。彼女は上海復旦大学、中国にも通っていた。
エリザベス·チェレパーカーMBAは2020年9月以来最高財務官を務めていますCzerepakさんは大型製薬、バイオテクノロジー、そしてリスク投資分野で30年以上の経験を持っている。1982年から2000年にかけて、メルク社、ロー氏、バズフ製薬/ノール製薬会社で財務·業務発展の指導者を務め、ロー氏がSyntex社を54億ドルで買収し、バズフ製薬会社を69億ドルでアボット社に売却する取引で重要な役割を果たした。その後、2000年から2008年にかけて、Czerepakさんはモルガン大通とベルストンで取締役を務め、ベルストン健康リスク投資基金の一般パートナーも務めた。BSHIでは、彼女は13社のバイオテクノロジー会社への投資を指導し、6つの取締役会に勤めている。Czerepakと彼女のパートナーは、このポートフォリオが数億ドルを調達するのを助け、初公募や買収によって大部分の撤退を実現した。最近、Czerepakさんは4つのバイオテクノロジー会社の首席財務官を務め、その中には2つのスタートアップ会社Isarna Treateutics GmbHとGenevant Sciences,Inc.と彼女が上場した2社:癌遺伝会社とAltimmune,Inc.が含まれている。Czerepakは現在Delcath Systems Inc.とSorrento Treateutics,Inc.の取締役会メンバーであり、これまでSpectrum PharmPharmticals,Inc.の取締役会メンバーを務めてきた。Czerepakさんはロゲス大学のMBA学位と文学学士号を持っている優秀な成績で最高の栄誉を得るマーシャル大学の出身です2001年から2008年まで、彼女は金融業監督局(FINRA)(前身は全国証券取引業者協会またはNASD)シリーズ7およびシリーズ63の登録代表である。Czerepakさんは最近2020年にハーバードビジネススクールが発行した企業役員証明書を取得した。
Ramon W.Mohanlal,医学博士は,2015年10月から我々の首席医療官を務め,2020年1月から取締役会のメンバーを務めている。モハンラル博士は研究·発展部常務副総裁も務めている。2015年7月から2015年10月まで、モハンラル博士はアスリカン免疫腫瘍学プロジェクトの顧問を務め、多くの1/2期と2/3期の研究を支持と管理している。これに先立ち、2012年1月から2015年7月まで、モハンラル博士は全世界の医療保健会社ノワ製薬で既定製品腫瘍学の臨床主管を務めた。モハンラル博士は2009年から2012年までバイオ製薬会社Syntium Inc.でコンサルタントを務め、薬物開発資産をめぐる協力、取引の達成、ビジネス計画の策定を担当している。2007年から2009年まで、Mohanlal博士はBioPremiere,Inc.の最高経営責任者兼最高医療官を務め、同社は生物製薬会社であり、深刻な疾患を治療する生物製剤の開発に専念し、拠出と協力活動を担当している。2005年から2007年まで、Mohanlal博士はIL Genetics,Inc.で首席医療官を務め、薬物開発と診断開発を担当し、同社は個性化健康会社であり、個性化健康市場のための遺伝子テストを開発した。Mohanlal博士はイリノイ州のアメリカ大陸間大学でMBAの学位を取得し、オランダのライトン大学で実験心血管薬理学の医学博士と博士号を取得した。
Tonra博士の辞任後,G.Kenneth Lloyd博士は2021年3月に我々の首席科学官を再担当した。ロイド博士は2020年1月から2021年3月まで私たちの首席科学官と上級顧問を務めています。ロイド博士は2015年6月から2019年12月まで私たちの首席科学官を務めた。2013年から2014年まで、ロイド博士は万春生物科学技術の首席科学官も務め、万春生物科学技術は私たちのアメリカ子会社の元持株会社である。2012年から2015年まで、ロイド博士は三段階加速器会社の科学顧問を務め、同社は臨床開設と対外許可腫瘍学資産に集中している。2000年から2012年まで、ロイド博士はNereusの首席科学官を務め、同社のプリブリンの開発を含む同社の研究開発と薬物発見プロジェクトを担当した。人と共同創業したコンサルティング会社GKOL Inc.の取締役を務めるほか、ロイドはVerne Mandel Medical Corporationで取締役を務めている。Verne Mandel Medical Corporationはミトコンドリア変性疾患を治療する候補薬の開発に専念している。彼は定期刊行物に広く発表されています科学, 自然界そして“ニューイングランド医学雑誌”それは.ロイド博士はマギル大学で生化学学士号と修士号を取得し、トロント大学で薬理学と毒理学博士号を取得した。彼は羅氏でポストドクター奨学金を完成させた。
ゴードン·L·スクリー博士は2016年9月以来、私たちの首席監督官を務めてきました。スクーリー博士は2013年から2016年9月まで、私たちの規制事務上級副総裁も務めた。2008年6月から2016年6月まで、スクーリー博士は高度分析·情報学有限責任会社の社長を務めた。2008年から2009年までスクーリー博士はプロゲン製薬会社の取締役を務め、2005年から2009年まで監督·生物統計コンサルタントを務めた。スクーリー博士は1999年1月から2008年6月までSkyePharma PLCとPacira製薬会社で首席科学官と臨床と監督事務部の高級副総裁を務め、1989年1月から1999年1月までAlliance PharmPharmticals Inc.で臨床と監督事務部総裁の副主任を務めた。スコリー博士は楊百ガム大学で学部訓練と修士号を受け、ミシガン大学公衆衛生学院で生物統計学と医療保健組織と管理に関する博士号を取得した。
非従業員取締役
MBAブレンダン·ドレニは2021年7月以来、私たちの取締役会に勤めてきた。デレーニさんは、25年以上にわたって世界的な製品戦略と発売経験を持ってきたビジネス機関のために、リーダーシップを持っています。彼は現在Aadi Bioscienceの首席運営官を務めている。Aadi Bioscienceに加入する前に、星座製薬の首席商務官を務め、2021年6月、星座製薬はMorPhoSysに14億ドルで買収された。星座に入る前に、デレニーさんは免疫医療会社の首席ビジネス官で、マーケティング、販売、市場アクセス、ビジネス運営チームの構築をリードしています。彼はTrodelvyの成功の発売に重要な役割を果たし、これは最初のtrop-2誘導抗体-薬物結合体であり、三陰性乳癌の治療に用いられる。免疫医学会社は2020年9月に吉利徳科学社に210億ドルで買収された。これまでCelgene社で米国血液腫瘍科総裁副主任を務めていた。Celgeneに加入する前に、ノバ腫瘍学や遺伝子テークで様々なビジネス職を務めていたが、そこで彼はいくつかの爆発的なブランドの成功した製品発表をリードした。デレーニさんはまた、米国有数の医療メディア企業の一つMJH生命科学の取締役会に在籍しています。彼はニューヨーク大学ステインビジネススクールのMBA学位とロッグス大学の生物学学士号を取得した。
パトリック·ファビオMBAは2018年1月以来私たちの取締役会に勤めていますファビオさんは現在ラファエルホールディングスの最高財務責任者です。ファビオさんは上場企業と上場していない生命科学製薬会社で25年以上の財務、運営、取引の指導者経験を持っています。ファビオさんはラファエロホールディングスに加入する前に、WindMIL治療会社の首席財務官であった。これまでは、Electrcore Medical LLC Progenics製薬会社の首席財務官、NPS製薬会社の財務副社長、カタレント製薬ソリューション会社の財務、革新、成長副社長、およびイカノール治療会社の首席財務官を務めていた。彼の以前の他の財務職はセノフィ、UniPath Diagnostics、BioMatrix、Coppers&Lybrandを含む。彼はペス大学で会計学学士号を取得し、ニューヨーク大学ステインビジネススクールで工商管理修士号を取得した。
マシュー·コクビー、修士は、2016年10月から私たちの取締役会に勤めています。コクビーさんは私たちの取締役会に20年以上の銀行経験を持ってきました。彼はロンドン、香港、シンガポールで高級管理職を務めたことがある。コクビー·さんは、2015年から2016年までの間、HSBC香港銀行アジア太平洋地域の企業の銀行業務担当者を務めています。2012年から2015年にかけて、コクビー·さんは聯昌国際北アジア区の最高経営責任者兼香港聯席投資銀行の業務担当者を務めた。彼は2008年から2010年までスコットランドロイヤル銀行で取締役社長兼ECMと企業融資グローバル主管を務め、2010年から2012年までスコットランドロイヤル銀行で取締役グローバル銀行アジア太平洋区の主管を務めた。1999年から2007年まで、コクビーはオランダ銀行で複数のポストを務めた。彼は現在取締役や複数の民間企業の顧問です。彼は英オックスフォード大学ペンブローク学院で法学修士号を取得した。
マーク·サントス、RPhは2021年10月から私たちの取締役会に勤めています。サントスさんは現在、OneOncology医薬戦略と契約部門の上級副社長です。彼は才能あふれる総裁で、ビジネスと思想指導者で、製薬や医療業界で30年以上の実行経験を持っている。サントスさんは、アメリカ癌協会ヒューストン分会とテキサス州白血病ヒューストン分会の理事です。サントスさんは腫瘍学、リウマチ学、眼科、腎臓病および胃腸疾患の分野で幅広い知識を持っています。彼のヘルスケアへの情熱とキャリアは1983年に臨床薬剤師を務めたオーウェン医療会社から始まった。彼は化学療法薬剤師,コミュニティ実践担当者を務め,急速な成長と市場リードの時期に総裁としてIONのGPOをリードしていた。サントスさんはアラバマ州とルイジアナ州の登録薬剤師であり、ニューオーリンズのザビエル大学で薬学の学士号を取得しています。
Jeffrey Vacirca,M.D.,F.A.C.P.は2020年12月以来我々の取締役会に勤務している.Vacirca博士は取締役会の認証を受けた血液学者と腫瘍学者であり、ニューヨーク癌·血液専門家委員会の最高経営責任者と議長を務めている。彼はコミュニティ腫瘍学連盟(COA)執行取締役会のメンバーであり、国際腫瘍学ネットワーク(ION)、Mt.でもある。シネ医療ネットワークと長島エイズ看護(LIAC)。ヴァシカ博士はSpectrum製薬会社、OneOncology社、大ニューヨーク米赤十字の取締役会メンバーである。ワシルカ博士はニューヨーク癌基金会の創始者と議長であり、この基金会は癌治療を受けた患者に経済援助を提供する。ワシルカ博士は国家翻訳研究グループの共同創始者と総裁である。ワシルカ博士は傑出した患者看護の提供に努力したことで無数の賞と賞賛を獲得し、アメリカ赤十字会に年間人道主義賞に選ばれ、患者看護への傑出した貢献でセオドア·ルーズベルト賞を受賞し、ニュース日報の最優秀医師にノミネートされた。また,Liacスタッフが最先端のHIV検査をニューヨークにもたらす役割を表彰された。ヴァシルカ博士はオルバニ大学で学士号を取得し、セントジョージ大学医学部で医学学位を取得した。
謝彦斌さん、医学博士は、2016年5月からずっと私たちの取締役会に勤めています。謝博士は薬物開発研究に長いキャリアを持っています。謝博士は2018年1月からAscentawits製薬有限会社の共同席最高経営責任者を務めた。2011年から2018年1月1日まで、謝博士はICON臨床研究(北京第二)有限会社の総経理を務め、前身は北京ウィッツ医療コンサルティング有限公司で、同社はバイオテクノロジー、製薬、医療機器業界にアウトソーシング開発サービスを提供している。ICONでは、謝博士は戦略目標と発展、管理チームを調整し、法規遵守を監督している。1997年、謝博士は北京ウィッツを創立し、中国初の合弁企業CROであり、臨床試験の国際標準を中国にもたらすことを目標とした。謝博士は1995年以来北京ウィッツ科技有限公司で取締役を務めています。謝博士は太原山西医科大学を卒業し、医学博士中国で、臨床医学を主に攻撃している。
趙穎、MBAは、2016年10月からずっと私たちの取締役会に勤めています。趙薇は現在Tiedmann Advisorsの首席財務官を務めており、これは高純資産個人、家族理財室、信託基金と寄付基金にサービスを提供する独立投資管理と富コンサルティング会社である。彼女もアイザック買収会社(ナスダック:ADOC)の首席財務官兼取締役、D&Zメディア買収会社(ニューヨーク証券取引所コード:DNZ)の取締役と監査委員会議長、ジャガーグローバル成長I会社(ナスダック:JGGCU)の取締役と監査委員会メンバー、および金融科学技術民間会社Urban FT Group,Inc.の取締役でもある。2016年以来、彼女は医療に専念してきたVC/PEファンド元明資本のリスクパートナーだった。趙薇はこれまで、百世グループの首席財務官を務めていた。(現在ニューヨーク証券取引所:BEST)趙さんはこれまで、米銀行で取締役社長を務め、モルガン·チェースで取締役幹部を務め、モルガン·チェースでグローバル企業や投資銀行部門の上級職(地域首席財務官や首席運営官を含む)を務めていた。趙さんは、ニューヨーク、ロンドン、シンガポールの米運通の戦略や企業リスク投資、香港のゴールドマン·サックス投資銀行業務、米フェデックス社の企業発展など、多くの会社で様々な職務を担当している。彼女は4大陸のチームを管理しているため、取締役会に独特の管理経験をもたらした。趙さんはまた、中国金融協会(TCFA、全世界で7000人を超えるメンバーを持つ非営利組織)とアジア太平洋アメリカ人提唱者(OCA)Westchester&Hudson Valley分会を含むいくつかの非営利委員会に勤めている。趙薇はフランチャイズ金融アナリストで、ハーバード商学院工商管理修士号と上海復旦大学経済学学士号中国を持っている。
Daniel·L·ザブロフスキー博士は2020年1月から私たちの取締役会に勤めてきた。ザブロフスキーは現在、徳成資本のリスクパートナーで、2016年7月以来同社で働いている。ザブロフスキー博士はM 2 SCコンサルティング有限責任会社の創業者でもある。ザブロフスキー博士は現在、エンドジーナ治療会社の独立取締役、Nimble治療会社の執行議長、Actuate治療会社の独立取締役を務めている。徳誠に加入する前、ザブロフスキー博士は羅氏で20年以上の多くの重要なグローバルリーダーを務めており、監督管理事務のグローバル主管、開発運営グローバル主管、羅氏製薬協力グローバル主管、ベンタナ医療システム会社の総裁、羅氏シークエンシング部門の総裁を含む。業務開発·診断部門在任中、ザブロフスキー博士と彼のチームは300件以上の買収と協力協定を達成した。また、彼は中外製薬会社の取締役会のメンバーでもある。羅氏に加入する前に,Zabrowski博士はSyntex,Fujisawa(現在Astellas),G.D.Searleの製薬研究開発機関で働き,シカゴイリノイ大学薬学院でアルバイトアシスタント教授を務めていた。ザブロフスキー博士はインディアナ大学ブルーミングトン校で有機化学博士号を取得し、セントルイス大学で化学学士号を取得した。
取締役会の多様性
次の表は、本年度報告日までの取締役会の多様性に関するいくつかの情報を提供します。
| 取締役会多様性行列 |
||||
| 主要国家執行機関: |
アメリカです。 |
|||
| 外国の個人発行業者 |
はい、そうです |
|||
| 母国法律で開示が禁止されている |
違います。 |
|||
| 役員総数 |
10 |
|||
| 女性は |
男性 |
非バイナリ |
性別は明かさなかった |
|
| 第1部:性別同意 |
||||
| 役員.取締役 |
3 |
7 |
0 |
0 |
| 第2部:人口統計的背景 |
||||
| 母国管内に在任人数が足りない個人 |
5 |
|||
| LGBTQ+ |
0 |
|||
| 人口統計の背景は明らかにされていない |
0 |
|||
| B. |
補償する |
2021年の役員と役員の報酬
2021年12月31日までに、吾等及び吾等付属会社が2021年12月31日までに年度に在任している役員及び役員に支払う現金報酬総額(実物利益を含む)は410万ドルであり、吾等及び付属会社が取締役及び役員及び役員に支払う持分報酬総額は50万ドルである(行使された購入権及び帰属した制限株式を含む。詳細は下記“-2017総合インセンティブ計画”を参照)。この金額には、このような人に精算するビジネス旅行、移転、専門、商業協会の会費と費用、および私たちの業界内の会社が通常精算または支払う他の福祉は含まれていません。2021年12月31日までの年間では、この金額は、雇用主による米国401(K)退職計画へのマッチング支払いの形態の年金、解散費、退職または同様の福祉または支出を提供するための予約または計上約2.3万ドルを含む。上級管理職(場合によっては)は、一般に他の全職従業員と同様に401(K)退職計画に参加する。
役員報酬
“役員”協力協定
私たちはすべての非従業員役員と取締役協定や役員協定を締結しました。各取締役協定(2020年7月1日に改正された)の条項によると、非従業員取締役に支払われるべき報酬は、以下のように含まれる
| ● |
年間40000ドルに相当する現金事前雇用費(サービスのいずれか1年未満) |
| ● |
委員会に勤務している追加現金事前招聘費(比例計算)は以下の通りである:給与委員会:6,000ドル(議長であれば12,000ドル)、指名と会社管理委員会の4,000ドル(議長であれば8,000ドル);監査委員会、8,000ドル(議長であれば16,000ドル) |
| ● |
20,000株の取締役の最初の12ヶ月の普通株を購入するための無制限購入株権を初歩的に付与した |
| ● |
各財政年度開始時には、毎年10,000株の普通株を購入する非制限株式オプションが付与される。 |
この等購入株権は2020年9月18日までに改訂及び再記載された万春医薬2017年度総合激励計画或いは2017年度総合激励計画に基づいて授与され、1株当たりの行使価格は授与日の1株当たり公平時価に等しい。新役員の初期株式購入権付与(取締役サービスの最初の12月発行)は、サービス開始日または前後に発行され、授出日の最初の3周年日に3回の均等額が付与されるが、取締役は適用される帰属日まで引き続き我々の取締役サービスとして機能しなければならない。取締役年度補助金は、適用される財政年度開始時に財政年度をベース(取締役任期内に開始された最初の完全財政年度について比例配分し、取締役開始日から1周年から当該財政年度終了時までのサービス年限)を付与し、授与日1周年に授与されるが、取締役は帰属日期間中に引き続き我々の取締役としてサービスを提供する。すべての取締役オプション付与は、2017年総合インセンティブ計画の条項と条件、およびこのような付与を記念する適用オプション付与協定の制約を受けている。
ジェフリー·ヴァシカ相談協定
上記の取締役協議のほか、ヴァシカ博士は2021年1月26日に締結された諮問協定にも参加している。彼のコンサルティングプロトコルによると、Vacirca博士は、プリブリンおよび他のパイプラインプロジェクトの臨床、規制、または商業的性質に関する一般的なコンサルティングサービスを提供する。相談料として、Vacirca博士は関連授与年度の1月1日に12万ドルのオプションの年間贈与を受け、四半期ごとの初日に四半期ごとに4回の均等分割払いを行い、Vacirca博士が授与日までサービスを継続することを条件としている。Vacirca博士の2022年1月1日に関するオプションは2022年1月1日に付与され、35,190件のオプションからなり、1株当たりの行使価格は4.53ドルである。
ブレンダン·デルニーは契約書に問い合わせました
デレーニさんは、上述した役員契約のほか、2021年11月6日に締結される諮問協定を締結しています。彼の諮問協定によると、ドレニーはプリナブリンや他のパイプラインプロジェクトにビジネス的な一般的なコンサルティングサービスを提供する。彼は毎年12万ドルの相談費を得ており、彼は(前年の12月31日より遅くなく)現金や不適格株式オプションの形で獲得し、Black-Scholesオプション定価モデルを用いて評価することができる。デレーニは、比例して計算された2021年の相談費をオプション形式で支払い、2022年の相談費を現金で支払うことを選択した。デレーニの2021年の非制限株式オプションについては、2673オプションを含む2021年11月6日に付与され、1株当たりの権益は15.18ドル。
役員傑出株式賞
2021年、私たちは非従業員取締役に以下のオプションを付与した
| ● |
2021年1月1日、以下の非従業員役員に、以下の役員合意に従って付与された2021会計年度オプション(上記1年帰属:Fabbioさん10,000オプション;Kirkbyさん10,000オプション;Majeti博士4,166オプション(2020年8月開始日に基づく計算)、宋博士10,000オプション、Vacirca博士833オプション(2020年12月開始日に基づく比例計算)、博士10,000件のオプション、趙博士10,000件のオプション、Zabrowski博士オプション10,000件を付与した。宋博士とマゲティ博士はそれぞれ2021年7月と2021年12月に退職により補助金を取り消された。 |
| ● |
2021年7月7日、我々は、デレーニ·さんの取締役契約(上述した3年間に帰属することに制限されている)に従って、制限されない株式20,000件を彼に付与した。 |
| ● |
2021年10月14日、我々は、サントスさんの役員契約(上述した3年間の帰属を受けることになる)に従って、制限なしオプション20,000件をサントスさんに付与した。 |
また、2022年1月1日に、以下のオプションを非従業員取締役に付与し、次のオプションを、2022年度に取締役合意に従って享受する年間オプション権利(上記の年に帰属することによって制限された);Delaneyさん5,000(2021年7月開始日ベースの割合を反映);Fabbioさん,10,000オプション;Kirkbyさん,10,000オプション;Santosさん(2021年10月開始日ベースの割合);Vacirca博士,10,000オプション;ありがとう博士、10,000件のオプション;趙さん、10,000件のオプション;およびZabrowski博士号10,000件に関するオプションを付与した。
2022年3月1日現在、私たちの非従業員取締役は以下の数のオプションと制限株を持っています
| オプション |
未帰属の販売制限株 | |||||||||||||||||||
| 非従業員役員.取締役 |
既得 |
未帰属の |
行権価格 |
満期になる日取り |
|
|||||||||||||||
| ブランドン·ドレニ |
— | 20,000 | $ | 9.62 | 07/07/2031 |
— | ||||||||||||||
| 2,673 | — | $ | 15.18 | 11/06/2031 |
— | |||||||||||||||
| — | 5,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| パトリック·ファビオ |
— | — | — | — | 1,759 | |||||||||||||||
| 5,000 | — | $ | 11.03 | 08/01/2030 |
— | |||||||||||||||
| 10,000 | — | $ | 12.20 | 01/01/2031 |
— | |||||||||||||||
| — | 10,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| マシュー·コクビー |
— | — | — | — | 1,759 | |||||||||||||||
| 5,000 | — | $ | 11.03 | 08/01/2030 |
— | |||||||||||||||
| 10,000 | — | $ | 12.20 | 01/01/2031 |
— | |||||||||||||||
| — | 10,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| マーク·サントス |
— | 20,000 | $ | 16.71 | 10/14/2031 |
— | ||||||||||||||
| — | 2,500 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| ジェフリー·ワシルカ |
6,666 | 13,334 | $ | 11.30 | 12/15/2030 |
— | ||||||||||||||
| 833 | — | $ | 12.20 | 01/01/2031 |
— | |||||||||||||||
| 15,209 | — | $ | 13.45 | 01/26/2031 |
— | |||||||||||||||
| — | 10,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| — | 35,190 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| 謝彦斌 |
— | — | — | — | 1,564 | |||||||||||||||
| 5,000 | — | $ | 11.03 | 08/01/2030 |
— | |||||||||||||||
| 10,000 | — | $ | 12.20 | 01/01/2031 |
— | |||||||||||||||
| — | 10,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| クリスティン·趙穎 |
— | — | — | — | 1,759 | |||||||||||||||
| 5,000 | — | $ | 11.03 | 08/01/2030 |
— | |||||||||||||||
| 10,000 | — | $ | 12.20 | 01/01/2031 |
— | |||||||||||||||
| — | 10,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
| ダニエル·ザブロフスキー |
— | — | — | — | 907 | |||||||||||||||
| 5,000 | — | $ | 11.03 | 08/01/2030 |
— | |||||||||||||||
| 10,000 | — | $ | 12.20 | 01/01/2031 |
— | |||||||||||||||
| — | 10,000 | $ | 4.53 | 01/01/2032 |
— | |||||||||||||||
2017年の総合インセンティブ計画の下での株式ベースの贈与については、“-2017総合インセンティブ計画”を参照されたい
雇用協定(2021年度行政幹事)
最高経営責任者ラン·ハング
私たちの共同創業者で、会長兼最高経営責任者のHuang博士は、万春医薬アメリカ会社が2016年11月10日に改訂し、再記述した雇用協定の一方であり、この協定は2020年1月1日、2021年1月19日、2022年1月11日に発効した書簡改正案によって改正された。Dr.Huangの雇用協定は2020年度から年間基本給を520,000ドルと規定しており、会社の政策に応じて審査·調整を行う必要がある(2021年は変わらないが、Dr.Huangがシード会社から獲得した基本給額は以下のように減少する可能性がある)。Dr.Huangの年間基本給は2022年度から540,800ドルに増加し、生活費調整後の4%のコカコーラに相当する。Dr.Huangは任意のボーナス計画に参加する資格があり、その基礎は彼女のいるレベルの他の従業員に適用されるボーナス計画と一致し、会社の政策(2021年度業績ボーナス目標は基本給の50%)に適合する。2021年のボーナス13万ドル(2022年初めに支払う)が目標の50%を占めている。Dr.Huangも医療保険の全額費用を受ける資格がある。Dr.Huangの採用は任意で、私たちはいつでも終了することができて、Dr.Huangも3ヶ月前に通知することができます。Dr.Huangの雇用協定には、2年間の非募集従業員協定、秘密条項、知的財産権譲渡条項が含まれている。雇用協定によると。2022年1月11日に改正案が発効し、会社がDr.Huangの雇用を理由なく中止したり、Dr.Huangが“十分な理由”(雇用契約で定義されているような)で雇用を終了する権利があれば、Dr.Huangは(彼女の実行と債権解除を撤回しないことを条件に)支払い(I)終了日から9(9)ヶ月間の基本給、または分割払いを得る権利がある。当社の通常給与慣行によると、離職期間内に定期的に分割払いし、および(Ii)実績に応じて、終了日年度に稼いだ任意のボーナスの比例部分を比例して支払い、他の上級管理者と同時に支払う。
Dr.HuangもSEED付属会社と独立雇用協定を締結し,この合意により,Dr.HuangはSEED勤務(2021年7月1日までの勤務時間の約12%および2021年7月1日から施行される勤務時間の20%)にアルバイトを割り当て,SEEDから底給104,000元を受け取り,本業での底給を削減する。Dr.Huangが種子会社から得た基本給は2021年7月1日までに6.24万ドルとされている。もしDr.HuangのSEEDでの雇用関係が他の理由で終わったら、Dr.Huangは私たちのフルタイムで仕事を再開し、彼女の基本給は私たちから回復するだろう。Dr.Huangの種子に対する作業時間は,2022年1月12日から20%から35%に向上することを約束した。この増加した時間約束と関連して、Dr.Huangの基本給はSEEDから189,280ドルに増加した。
エリザベス·チェレパーカー最高財務官
2020年9月21日から、Elizabeth Czerepakさんは私たちの首席財務官になった。Czerepakさんの雇用合意日は2020年9月11日であり,改正後,年間基本給は43万ドルと規定されており,会社政策(2021年は不変)による審査·調整が可能である。Czerepakの年間基本給は2022年度から447,200ドルに増加し、生活調整費用の4%に相当する。企業政策によると、Czerepakは年間業績ボーナス(2021年度毎の目標年間ボーナスは基本給の45%)を取得する資格がある。2021年のボーナスは96,750ドル(2022年初めに支払う)で、目標の50%を占めている。
Czerepakさんの雇用は自由であり、私たちはいつでも終わらせることができ、Czerepakさんは3ヶ月前に通知することができる。もし私たちがCzerepakさんを解雇した理由が(彼女の雇用協定の定義による)ではない場合、または死亡や障害のため、またはCzerepakさんが正当な理由(彼女の雇用協定の定義)や統制権の変更(2017年の総合インセンティブ計画の定義に基づいて)彼女の雇用を終了する場合、Czerepakさんは(彼女の実行とクレームを撤回しないことによって制限される):(I)9ヶ月の賃上げ;(Ii)他の上級管理者と同時に支払われる,実績結果に基づいて解雇されその年に稼いだ任意のボーナスに比例して分配される部分である.Czerepakさんの雇用協定には、2年間の非従業員募集協定、秘密条項、および知的財産権譲渡条項が含まれている。
Ramon Mohanlal医学博士首席医療官研究開発執行副社長
我々の首席医療官Ramon Mohanlal博士は,万春医薬米国会社と2016年11月10日に改訂され再声明された雇用協定の一方であり,2019年7月1日に発効した書簡修正案と期日2022年1月11日の書簡合意で改訂されている。Mohanlal博士の雇用協定では年間基本給は43万ドルと規定されており、会社政策に応じた審査·調整が可能(2021年は不変)。モハンラルの年間基本給は2022年度から447,200ドルに増加し、生活調整費の4%に相当する。会社政策によると、Mohanlal博士は年間業績ボーナス(2021年度目標年間ボーナス45%)を取得する資格がある。2021年のボーナスは96,750ドル(2022年初めに支払う)で、目標の50%を占めている。モハラールには毎月最高500ドルの医療保険料を受ける資格があります。2022年1月11日に施行された改正案の雇用合意によると、Mohanlal博士の雇用が会社によって無断で終了されたり、Mohanlal博士がMohanlal博士によって“十分な理由”(雇用協定で定義されているように)で終了された場合、Mohanlal博士は(彼の執行とクレームの撤回の制限を受けない)支払いを受ける権利がある(I)当時のサービス期間中の基本給の支払いを受ける権利がある。当社の通常給与慣行によると、離職期間内に定期的に分割払いし、および(Ii)実績に応じて、終了日年度に稼いだ任意のボーナスの比例部分を比例して支払い、他の上級管理者と同時に支払う。Mohanlal博士は2021年11月10日まで最善を尽くすことを要求されたが、彼の採用は自由で、私たちはいつでも彼の仕事を終わらせることができ、Mohanlal博士は3ヶ月前に私たちに通知することができる。Mohanlal博士の雇用協定には、2年間の非求職者、秘密保護条項、および知的財産権譲渡条項が含まれている。
ゴードン·L·スクーリー最高監督官
私たちの首席監督官Gordon Schooley博士は、2020年1月1日に施行された書簡修正案と2022年1月11日の書簡協定改正を経て、2016年11月10日に改訂され、再記載された雇用協定を万春医薬と締結した。スクーリー博士の雇用協定で定められた年間基本給は30万ドルで、会社政策(2021年は変わらない)に基づいて審査·調整を行う。スクーリー博士の年間基本給は2022年度から31.2万ドルに増加し、生活調整費の4%に相当する。会社の政策によると、スクーリー博士は年間業績ボーナス(2021年度目標年間ボーナスは基本給の35%)を取得する資格がある。2021年のボーナスは52,500ドル(2022年初めに支払う)で、目標の50%を占める。スクリーには彼と彼の妻のために支払われた医療保険料を得る資格があります。2022年1月11日に施行された改正案の雇用協定によると、会社がスクーリー博士の雇用を理由なく中止したり、スクーリー博士が“十分な理由”(雇用協定に定義されているように)で雇用を中止すれば、モハンラル博士は(彼の署名とクレームを撤回せずに)当時のサービス期間の基本給を支払う権利がある。当社の通常給与慣行によると、離職期間内に定期的に分割払いし、および(Ii)実績に応じて、終了日年度に稼いだ任意のボーナスの比例部分を比例して支払い、他の上級管理者と同時に支払う。スクーリー博士の採用は勝手です。いつでも終わります。スクーリー博士も三ヶ月前に知らせてくれます。スクーリー博士の雇用協定には、2年間の非従業員募集協定、秘密条項、知的財産権譲渡条項が含まれている。
最高経営責任者リチャード·J·デイリー
当社の最高経営責任者であるRichard Dalyさんは、2021年12月31日までの間に、2018年6月8日までの雇用契約を、2019年9月24日、2019年12月20日、2021年1月19日、2021年10月12日までのいくつかの改訂後に改訂されました。Dalyさんの雇用契約は、年間基本給を430000ドルと規定しています(2021年は不変のままですが、DalyさんはSEEDから取得した基本給の額を以下のように減少させています)。会社の方針によると、Dalyさんは、業績ボーナス(2021年度目標年次ボーナス)を基本給の45%として取得する資格があります。また、Dalyさんは、ビジネスの開発や世界的な販売に関連する様々なマイルストーンの完了状況に基づいて、いくつかの実績に基づく報酬ボーナスを得る資格を持っています。利益が出た場合、その25%は完全に既存の普通株で支払い、残りの75%はデイリーの選択に従って現金または完全に既存の普通株で支払う。デイリーさんは2022年1月11日のリストラの影響を受けた従業員。このため、上記業績に基づくインセンティブ措置は一つも得られていない。
Dalyさんの雇用を終了する場合、Dalyさんは、当社の給与慣行に応じて支払わなければならない9ヶ月間の連続賃金を、2022年1月27日に署名した退職契約を基準とする権利を有する。Dalyさんは、別居と解放協定を提供する2年間の非招待書条約、守秘条項、知的財産権譲渡条項を遵守しなければなりません。Dalyさんは離職前に、DalyさんがSEEDパートタイム(2021年7月1日までにその労働時間の約14%を占める、2021年7月1日現在、約20%)の個別雇用契約を締結し、SEEDから86,000ドル(2021年7月1日までは60,200ドル)の基本給を受け取ることで、当社から基本給を引き下げた。
留任手配
2022年1月13日に、吾らはDr.Huangさん、Czerepakさん、Mohanlal博士とSchooley博士とそれぞれ留任合意を締結し、これにより、もし業績が満足できれば、当社の幹部は以下の留任報酬金を得ることができる:Dr.Huang,520,000ドル;Czerepakさん、387,000ドル;Mohanlal博士、387,000ドル;及びSchooley博士,210,000ドル。稼ぎの範囲内で、Dr.Huang、Czerepakさん、Schooley博士については、留任支払いは現金で40%、オプションで60%、Mohanlal博士では100%をオプション形式で支払った。
相談手配
G.ケネス·ロイド博士
2012年12月16日以来、著者らの首席科学官G.Kenneth Lloyd博士はずっと万春医薬アメリカ会社及び万春医薬アメリカ会社が設立される前の子会社の万春製薬にコンサルティングサービスを提供してきた。ロイド博士は2019年12月31日まで私たちの首席科学官を務め、2021年3月15日に復職した。労合社博士と締結し、随時改訂されたコンサルタントサービス契約によると、2021年12月31日までの年間で、労合社がサービスを提供するコンサルタントサービス料は323,750元である。2022年に首席科学官を務めると、ロイド博士の年間相談費は18万ドルとなり、30%のボーナス機会が加わる。彼の相談協議の一部として、ロイド博士はまた、彼と妻の医療保険費用といくつかの相談費用の補償を受けた。
2017総合インセンティブ計画
初公募では、選定された役員、上級管理者、従業員、コンサルタントに追加インセンティブを提供し、当社がこれらの個人のサービスを獲得し、保留できるように2017年の総合インセンティブ計画を採択しました。時々改訂された2017年総合インセンティブ計画は、私たちの役員、従業員、コンサルタントに制限株式、非制限株式オプション、奨励株式オプション、その他の奨励を付与することができます。2017年の総合激励計画下の奨励によると、5,277,197株の普通株が付与され、2022年3月1日まで、残りの783,529株の普通株は奨励に用いることができる。報酬は奨励協定に基づいて行われ、帰属と取締役会の決定の他の制限を受ける可能性がある。2022年3月1日現在、下記“-その他株式ベースの奨励”に記載されている他の株式ベースの奨励のほか、840,257株の発行済み制限株式および2,947,472件の未償還株式権がある。
制限株式賞
私たちは、2017年の総合インセンティブ計画に基づいて、当社の役員(上記“-取締役合意”を参照)と、特定の役員を含む当社の従業員やコンサルタントに制限株式報酬を付与しました。販売制限株式奨励協定の条項によると、1人の行政者が“制御権変更”後12ヶ月以内に“由”なしに終了された場合(いずれも2017年総合インセンティブ計画の定義を参照)、任意の帰属していない時間基準の限定株式は終了日に全数帰属する。行政者の雇用または雇用が死亡または障害により終了した場合、次の帰属すべき時間制限株式は終了日に全数帰属し、終了日までに任意の残りの非帰属時間制限株式は没収される。任意の他の雇用または採用が終了した場合、終了日までのすべての非帰属時間制限株式は没収される。任意の理由でサービスが終了すると、終了日までのすべての帰属されていない業績ベースの制限株は没収される。
2021年度に、私たちは私たちの幹部に制限的な株式奨励を与えなかった。
2022年3月1日現在の我々の役員が保有する制限株式総数については、次の“-未償還制限株式及びオプション”を参照されたい。
オプション大賞
2017年の総合インセンティブ計画によると、私たちは、私たちの一部の役員を含むISOと非制限株式オプションを私たちの普通株式を購入するために、または“オプション”と呼んでいます。当社役員に付与されるオプションは、個人化された時間ベースの帰属と業績ベースの帰属(適用オプション付与プロトコルに規定されているような)とを組み合わせなければならず、その役員が帰属日を適用する前に引き続き私たちにサービスする条件に制限されなければならない。この等購入株権の行使価格は、1株当たり当社の普通株の授出日に下回ることができない公平な市価であり、授出日10周年(例えば、比較的早い行使や没収)で満了する。
2017年の総合インセンティブ計画及びオプション合意の条項によると、(I)制御権変更において当該等オプションを仮定又は置換する場合、行政者が制御権変更後12ヶ月以内に無断で終了する場合、任意の帰属していないオプションは帰属となり、終了日後90日以内に行使可能であり、(Ii)当該等オプションが制御権変更中に仮定又は代替されていない場合は、任意の帰属していないオプションは制御権変更後に帰属し、他の方法で計画管理人によって決定される。
もし行政者の雇用または雇用が死亡または障害によって終了した場合、行政者が適用された帰属日に依然として雇用または招聘された場合、帰属すべき次の時間ベースオプションは、終了日に全数帰属し(終了後1年以内に行使可能である)、任意の残りの帰属していない時間ベースオプションは没収される。私などの都合で本契約を終了した場合、すべての既得与未承認権は没収されます。任意の他の理由で終了した場合、既得オプションは終了日から3ヶ月以内に行使することができる。雇用が終了すると、終了日までに付与されていない業績ベースのオプションは没収される。
2021年度には、私たちの幹部に次の選択肢を与えました
| ● |
モハンラル博士:30万件の奨励的株式オプションが、2021年5月21日に授与され、行権価格は1株10.18ドル。 |
| ● |
ロイド博士:115,000件の非制限株式オプションは、2021年5月21日に授与され、行権価格は1株10.18ドルである。 |
| ● |
スクーリー博士:135,000件の奨励的株式オプションは、2021年5月21日に授与され、行権価格は1株10.18ドルである。 |
| ● |
Czerepak:13万部の奨励的株式オプションは、2021年5月21日に付与され、行権価格は1株10.18ドルである。 |
2022年3月1日現在の我々の役員が保有するオプション総数については、次の“-未償還限定株式及びオプション”を参照されたい。
発行された制限株とオプション
次の表は、2022年3月1日現在の我々の役員が保有する制限株とオプションの数を示しています
| オプション |
無帰属限定株 | |||||||||||||||||||||||
| 執行者将校.将校(1) |
既得 |
未帰属の |
鍛えられた |
行権価格 |
満期になる日取り |
|
||||||||||||||||||
| ラン·Huang |
224,000 | 496,000 | — | $ | 11.03 | 08/01/2030 |
— | |||||||||||||||||
| — | 102,844 | — | $ | 4.69 | 01/11/2032 |
— | ||||||||||||||||||
| エリザベス·チェレパーカー |
80,156 | 144,844 | — | $ | 15.23 | 09/21/2030 |
— | |||||||||||||||||
| — | 130,000 | — | $ | 10.18 | 05/21/2031 |
— | ||||||||||||||||||
| — | 76,539 | — | $ | 4.26 | 01/11/2032 |
— | ||||||||||||||||||
| ラモン·モハラル |
— | — | — | — | — | 75,000 | ||||||||||||||||||
| 180,000 | — | — | $ | 17.94 | 01/14/2030 |
— | ||||||||||||||||||
| 80,000 | 220,000 | — | $ | 10.18 | 05/21/2031 |
— | ||||||||||||||||||
| — | 118,377 | — | $ | 4.26 | 01/11/2032 |
— | ||||||||||||||||||
| ゴードン·スクリー |
95,000 | — | — | $ | 17.94 | 01/14/2030 |
— | |||||||||||||||||
| 20,000 | 115,000 | — | $ | 10.18 | 05/21/2031 |
— | ||||||||||||||||||
| — | 41,533 | — | $ | 4.26 | 01/11/2032 |
— | ||||||||||||||||||
| G.ケネス·ロイド |
— | — | 74,000 | $ | 17.94 | 01/14/2030 |
— | |||||||||||||||||
| — | 105,000 | 10,000 | $ | 10.18 | 05/21/2031 |
— | ||||||||||||||||||
| (1) |
デイリーさんは2022年1月11日にリストラで解雇され、その際の不正オプションは没収された。彼の6万件の既得オプションは2022年4月11日までに清算されずに行使可能であり,行使しなければこれらのオプションは没収される。 |
現金長期インセンティブ(“現金LTI”)
私たちは2017年の総合的なインセンティブ計画に基づいて、私たちのいくつかの幹部に現金長期インセンティブを付与した。我々幹部に付与された現金長期インセンティブ計画は,CINとNSCLC適応薬物計画の研究,開発,テスト,実現における様々なマイルストーン(適用される現金長期インセンティブ協定に規定されている)に依存し,その役員が適用日に達するまでサービスを継続していることを前提としている。
現金長期奨励協定の条項によると、実行幹事が何らかの理由で終了された場合、奨励協定は終了した日から終了し、もはや何の効力も持たない。適用マイルストーンに達していない任意のマイルストーン支払いの任意およびすべての権利は没収され、適用マイルストーンに達した任意の未払いマイルストーン支払いは終了日から支払われなければならない。
2021年度には、以下の現金LTIを幹部に付与しました
| ● |
Dr.Huang:最高2,725,000ドル |
| ● |
モハンラル博士:最大1500,000ドル |
| ● |
ロイド博士:最大95万ドル |
| ● |
スクリー博士:最大1175,000ドル |
| ● |
Czerepakさん:最大120万ドル |
Dr.Huangの合意によれば、任意の稼いだマイルストーン支払いの25%は完全に普通株式に帰属して支払い、残りの75%は現金または完全帰属普通株で支払い、Dr.Huangによって選択される。他の会社の合意によると、稼いだすべてのマイルストーン支払いは現金で支払わなければならない。関連するマイルストーンの完成状況によると、幹部たちは2021年に現金信託基金に関する収入は以下の通りだ:Dr.Huangは150,000ドル、モハンラル博士は150,000ドル、ロイド博士は50,000ドル、スクリー博士は50,000ドル、チェレパーカーさんはゼロを稼いだ。
他の株式ベースの報酬
私たちは2017年の総合インセンティブ計画に基づいて、Dr.Huangとモハンラル博士を含む他の株ベースの報酬を私たちの従業員やコンサルタントに授与した。株式ベースの報酬は、いくつかの株式またはドルの金額で計算され、いくつかのサービスベースおよび/または業績ベースのマイルストーンに達したときに普通株で稼いで支払うことができる。モハンラル博士の株ベースの奨励は以下の通りです。
2017年4月11日、私たちは2017年総合インセンティブ計画に基づいてMohanlal博士に株式ボーナス奨励機会を授与した。Mohanlal博士は最大300,000株分割払いの普通株を取得する資格があり、薬物BPI-002の研究、開発、テスト、実現の様々な構成要素のマイルストーンに関する特定金額の累積純収入を確認することを条件に、各適用マイルストーンを実現することで雇用を継続することを条件としている。Mohanlal博士はまた、薬物BPI-004の研究、開発、テスト、実現の様々な構成要素のマイルストーンに関する特定金額の累積純収入を確認することを条件に、最大300,000株分割払いの追加普通株を取得する資格があり、適用マイルストーンごとに採用され続けることを条件としている。
適用される株式配当奨励協定の条項によると、Mohanlal博士の採用が何らかの理由(以下に述べる支配権変更に関するものを除く)で終了した場合、終了日までに適用マイルストーンに達していないいかなるボーナスも没収され、吾らがMohanlal博士の採用を理由なく終了し、雇用終了後6ヶ月以内に何らかのマイルストーンに達した場合、そのマイルストーンに達したときに獲得する普通株式数を取得する資格があることが前提となる。支配権変更後12ヶ月以内(2017年の総合インセンティブ計画の定義により)Mohanlal博士の雇用を理由なく終了し、後任エンティティが株式配当奨励協定を担当する場合、次のマイルストーンに達したときに支払われるべき次の配当は終了日に完全に帰属することになる。支配権変更中の後継エンティティが株式配当奨励協定を担当していない場合、次のマイルストーンに達したときに支払われるべき次の配当は、制御権変更の日に完全に帰属する。
| C. |
取締役会の慣例 |
取締役会
私たちの取締役会は現在10人のメンバーで構成されており、彼らは私たちの現行の定款選挙に基づいて選出された。私たちの指名と統治委員会と取締役会は、多様性が含まれる可能性があるが、人種、性別、国籍に限定されない著名人の資格や背景に関連する幅広い要素を考慮している。私たちは理事会の多様性に関する公式的な政策を持っていない。私たちの指名と管理委員会と取締役会は取締役会のメンバーを選択する際に、どの人が彼や彼女の既定の専門的な成果、取締役会メンバー間の協力文化に積極的に貢献する能力、私たちの業務に対する理解、競争構造の理解、そして私たちの成長戦略に関する専門と個人の経験と専門知識を通じて私たちの株主の利益を促進するかを決定することを優先します。
ケイマン諸島には、役員を任命する決議が任命に任期をかけない限り、取締役に一定の任期を在任して再選に立候補しなければならない法律はない。当社の定款規定を改正·再述し、私たちの取締役はその後継者が選出され資格を持つまでその任期が満了するまで在任します。
取締役は、通常決議により選出され、取締役会の仮の空きを埋めたり、既存の取締役会のメンバーを増加させたりすることができる。また、取締役会会議に出席し、会議で投票した他の取締役は、簡単な賛成多数で、取締役会の仮空きを埋めるために、または既存の取締役会に加入するために、任意の者を随時取締役に任命する権利があり、我々が適用されるナスダック資本市場会社のガバナンス規則に要求される取締役指名手続きを遵守する限り、わが社の証券がナスダック資本市場で取引される限りである。取締役の任期満了前に、一般決議により随時その職務を罷免することができる。取締役合意は吾ら取締役へのサービス提供を中止することについて何の利益も提供していません。
役員は自主独立している
ナスダック資本市場の規則によると、我々の取締役会は、ブランドン·デレーニ、パトリック·ファビオ、マシュー·コクビー、マーク·サントス、ジェフリー·ヴァシカ、謝彦斌、クリスティーナ·趙穎、Daniel·ザブロフスキーを独立取締役とすることを決定した。このような独立性決定を下す際に、私たちの取締役会は、各非従業員取締役と私たちとの関係、および取締役会が彼らの独立性の決定に関連すると考えているすべての他の事実と状況を考慮して、各非従業員取締役の私たちの株式に対する実益所有権、および“第7項.大株主と関連側取引-B.関連側取引”に記載されている彼らに関連する取引を含む。私たちの取締役会と各委員会の構成と運営はナスダック資本市場のすべての適用要件とアメリカ証券取引委員会の規則に適合しています。私たちのどの役員や役員の間にも家族関係はありません。
取締役会委員会
我々の取締役会は、監査委員会、報酬委員会、指名及びコーポレートガバナンス委員会を設立し、各委員会は、我々の取締役会が採択した個別の定款に基づいて運営されている。私たちのすべての委員会の構成と運営は“サバンズ-オキシリー法案”、“ドッド·フランクウォール街改革と消費者保護法案”、“ナスダック”資本市場、“アメリカ証券取引委員会規則と条例”のすべての適用要件を遵守している。
監査委員会
パトリック·ファビオ、マシュー·コクビー、ブランドン·デレニは現在監査委員会に勤めており、この委員会はファビオが議長を務めている。我々の取締役会は、監査委員会の各メンバーが監査委員会にとって“独立”であることを決定しており、この用語は“米国証券取引委員会”規則および“ナスダック”資本市場適用規則に定義されている。監査委員会の役割には、以下のことが含まれる
| ● |
私の独立公認会計士事務所を選択して指定し、私の独立公認会計士事務所が提供する監査と許可された非監査サービスを承認します |
| ● |
我が国の独立公認会計士事務所の業績と独立性を評価する |
| ● |
財務諸表の完全性を監督し、財務諸表または会計事項に関する法律および法規の要求を遵守する場合 |
| ● |
私たちの会計と内部統制政策と手続きの十分性と有効性を検討する |
| ● |
会計に関連する苦情および懸念を受信し、保留し、処理する手続きを確立する |
| ● |
独立公認会計士事務所と年末監査結果を審査·検討し、審査·検討に基づいて、財務諸表がForm 20-F形式の年次報告書に含まれるべきかどうかを取締役会に提案します |
| ● |
関連するすべての取引に潜在的な利益衝突状況が存在するかどうかを検討し、そのようなすべての取引を承認することと; |
| ● |
当社の収益プレスリリースに含まれる情報の種類および提示方法、およびアナリストや格付け機関に提供される財務情報および収益指針を検討します。 |
報酬委員会
マシュー·コクビー、謝彦斌、趙穎、Daniel·ザブロフスキーは現在給与委員会に勤めており、同委員会はコクビーが議長を務めている。私たちの取締役会は、報酬委員会の各メンバーが“独立している”と決定し、この用語は“ナスダック”資本市場適用規則に明確に定義されている。報酬委員会の役割には、
| ● |
私たちの役員報酬計画の目標と目的を検討し、これらの目標と目的に応じて私たちの役員報酬計画を検討します |
| ● |
役員報酬計画の目標と目的に基づいて私たちの役員の業績を評価し、私たちの役員の報酬について取締役会に提案します |
| ● |
これらの目標と目標に基づいて、私たちの一般給与計画と他の従業員福祉計画の目標と目標、ならびに私たちの一般給与計画および他の従業員福祉計画を検討する |
| ● |
コンサルタントの報酬を保留して承認します |
| ● |
ナスダック上場規則に基づいて株主承認を提出したすべての株式報酬計画を審査し、株主の承認要求を免除するすべての株式報酬計画を審査する |
| ● |
非従業員取締役が取締役会および取締役会委員会の職務を担当する適切な報酬レベルを評価すること |
| ● |
私たちの年間報告書Form 20-Fの役員報酬説明を審査して承認します。 |
指名と会社管理委員会
マシュー·コクビー(Matthew Kirkby)、謝彦斌(Yanbin Xie)と趙穎は現在指名と会社管理委員会のメンバーで、同委員会は趙薇が議長を務める。私たちの取締役会は、指名とコーポレートガバナンス委員会の各メンバーが“独立”であることを決定しており、この用語は“ナスダック”資本市場適用規則で定義されている。指名とコーポレートガバナンス委員会の役割には:
| ● |
取締役会が取締役の潜在的な指名人選を決定することに協力し、株主選挙や取締役会の任命に指名することを推薦する |
| ● |
定期的に会社の管理法律と実践の重大な発展及び私たちの適用法律と法規の遵守状況について取締役会に提案を提供し、すべての会社の管理事項と任意の必要な是正措置について取締役会に提案する |
| ● |
私たちの取締役会の評価を監督し |
| ● |
当社の取締役会の各委員会のメンバーを推薦します。 |
私たちの委員会は時々他の委員会を設立するかもしれない。
| D. |
従業員 |
2021年12月31日現在、私たちは103人のフルタイム従業員を持っている。これらの人のうち、58人がフルタイムの研究開発と実験室運営に従事し、45人が商業化前の仕事に取り組む従業員を含むフルタイムの一般的かつ行政的機能に従事している。2021年12月31日現在、私たちは36人の従業員が中国にいて、67人がアメリカにいます。私たちはまた、非常勤従業員の独立請負業者を招いて運営に協力していく可能性があります。私たちの職員たちは労働組合代表もなく、集団交渉協定のカバー範囲もない。私たちは雇用に関連したいかなる停止も経験したことがなく、私たちは私たちが従業員と良い関係があると思う。次の表は過去3年間の職能別従業員総数を示している。
| 2019 |
2020 |
2021 |
||||||||||
| 研究開発と実験室運営 |
37 | 49 | 58 | |||||||||
| 一般機能と行政機能 |
24 | 42 | 45 | |||||||||
人的資本資源
私たちは研究と開発に専念するバイオテクノロジー組織で、第三者と協力してその最初の製品を発売することを計画しています。著者らの研究開発従業員は異なる職責を履行し、臨床研究研究の管理、臨床試験データの分析、法規文書の準備と製造プロセスの拡大を含む。私たちの他の職員たちは財務、会計、そして人的資源などの支援機能に集中している。
私たちは大手老舗製薬会社や規模の小さい新興バイオテクノロジー会社で経験のある従業員の採用を重視しています。私たちは従業員たちに大きな組織では通常彼らに提供されない幅広い責任と高度な管理職を提供する。私たちは機敏でチームに基づく組織で画期的な療法に取り組む情熱を中心に参加文化を作ることを奨励している。私たちの給与と福祉プログラムは、短期(すなわち競争力のある基本給とボーナス)と長期的なインセンティブ(すなわち株に基づく報酬)を使用することで、トップレベルの人材を誘致し、維持することを目的としている。
私たちは従業員に全額支払いの良質な医療福祉を提供し、私たちの401(K)貯蓄計画に6%のマッチングを提供する。私たちは従業員に会社の有給の主な休暇と有給個人と病気休暇を提供します。私たちは職員たちが職業指導から利益を得ることができる指導者プログラムを持っている。
| E. |
株式所有権 |
わが役員と役員の株式所有権に関する情報は、“項目7.大株主と関連側取引であるA大株主”を参照されたい。取締役、役員および他の従業員への株式発行に関する情報は、“第6項役員、高級管理者および従業員-B.報酬-役員報酬-取締役合意”および“第6項役員、高級管理者および従業員-B.報酬-2017年総合インセンティブ計画”を参照されたい
| 第七項。 |
大株主と関係者が取引する |
| A. |
大株主 |
次の表は、2022年3月1日までの私たちの普通株式の実益所有権情報を示しています
| ● |
私たちが知っている実益は、私たちが発行した普通株式の5%以上のすべての人または関連者のグループを持っている |
| ● |
私たちのすべての役員と行政は単独です |
| ● |
私たちのすべての幹部と役員はチームです。 |
我々普通株の実益所有権は、一般に、個人が投票権または投資権を単独または共有する任意の株式を含み、2022年3月1日から60日以内に行使可能な株式オプションによって発行可能な普通株式を含む米国証券取引委員会規則に基づいて決定される。株式オプションに基づいて発行された普通株は、そのオプションを持つ者の割合を計算する際に発行された普通株式とみなされるが、他の人の割合を計算する際には未発行の普通株とはみなされない。2022年3月1日現在、株式オプションにより発行可能な普通株は804,162株であり、60日以内に行使可能である。
下表の実益が持つ普通株率の計算は、2022年3月1日現在の38,928,922株発行普通株に基づいている。別の指示のほか、吾らは当該等所有者が吾等に提供した資料に基づいて、以下に掲げる普通株の実益所有者が当該等の株式に対して独占投資及び投票権を有すると信じている。
以下に他の説明がない限り、各株主の住所はニューヨーク自由街28号39階万春医薬、郵便番号:10005である。
| 実益所有者の氏名または名称 |
量普通だよ株有益な持っている |
% |
||||||
| 株主の5% |
||||||||
| 徳成資本の所属実体(1) |
4,958,142 | 12.74 | ||||||
| 仙鷹投資有限公司(2) |
4,620,000 | 11.87 | ||||||
| 永富華グループ有限公司(2) |
3,660,000 | 9.40 | ||||||
| 行政員および役員** |
||||||||
| ラン·Huang(2) |
10,594,523 | 27.06 | ||||||
| エリザベス·チェレパーカー(3) |
87,187 | * | ||||||
| レイモンド·W·モハンラル(4) |
486,098 | 1.24 | ||||||
| G.ケネス·ロイド(5) |
40,641 | * | ||||||
| ゴードン·L·スクリー(6) |
120,137 | * | ||||||
| ブランドン·ドレニ(7) |
2,673 | * | ||||||
| パトリック·ファビオ(8) |
25,451 | * | ||||||
| マシュー·コクビー(9) |
21,297 | * | ||||||
| マーク·サントス(10) |
— | * | ||||||
| ジェフリー·ワシルカ(11) |
40,302 | * | ||||||
| 謝彦斌(12) |
20,581 | * | ||||||
| クリスティン·趙穎(13) |
23,447 | * | ||||||
| ダニエル·ザブロフスキー(14) |
16,360 | * | ||||||
| 全役員及び行政員(13名) |
11,478,697 | 29.31 | ||||||
*これらの企業の総金額は、発行済み普通株式の1%未満です。
*リチャード·デイリー·さんは2022年1月11日より最高経営責任者を解任。
| (1) |
徳成資本管理III(ケイマン)有限公司が所有する4,958,142株の普通株からなる。 |
| (2) |
当社の共同創設者、主席兼行政総裁のHuang博士は永豪集団有限公司の唯一の支持者である。Dr.Huangの配偶者賈林清さんは鷹仙子投資有限会社とバラ時代控股有限公司のために唯一の支持を持っている。Dr.Huangと賈躍亭は合わせて万春生物科学技術100%の株式を持っている。Dr.Huangおよびジャさんは、永富集団有限公司、鷹仙子投資有限公司、バラ時代控股有限公司、および万春生物科技がそれぞれ保有する株式と、ジャさんが保有する137,037株の帰属制限株式に対して共通の投票権および処分権を有すると見なすことができる。この金額には、蘭Huang 2020によって人保留年金信託が直接所有する171,686株の普通株と、蘭Huang 2021によって人に付与された保持年金信託が直接所有する428,314株の普通株も含まれており、Dr.Huangは受託者としてこの信託に対して唯一の投票権および処分権を持っている。 |
| (3) |
(I)2017総合インセンティブ計画により付与された80,156株の普通株を購入する既存オプションと、(Ii)2022年3月1日から60日以内に付与される2017総合インセンティブ計画により付与される7,031株の普通株を購入するオプションとを含む。 |
| (4) |
(I)220,098株の制限株式(うち145,098株が帰属し、Ramon W.Mohanlal博士が2017年総合インセンティブ計画に基づいて付与された)、(Ii)2017年総合インセンティブ計画に基づいて付与された260,000株の普通株を購入する既存オプション、および(Iii)Ramon W.Mohanlal博士が公開市場から購入した6,000株の普通株を含む。 |
| (5) |
(I)20,000株すべての帰属制限株式を含み、Dr.Kenneth Lloyd記録により保有され、2017年度総合激励計画により付与された、および(Ii)2017年度総合激励計画によりDr.Kenneth Lloydに付与された84,000株普通株の既存オプションを行使するために発行された20,641株普通株。 |
| (6) |
(I)完全に帰属された137株の制限株式、2017年の総合インセンティブ計画に従ってGordon Schooley博士によって付与された記録、(Ii)2017年総合インセンティブ計画に従って付与された115,000株の普通株式を購入可能な既存オプション、および(Iii)Gordon Schooley博士が公開窓口中に公開市場から購入した5,000株の普通株式を含む。 |
| (7) |
2017年の総合インセンティブ計画により付与された2,673株の普通株を購入する既得オプションを含む。ブレンダン·ドレニーさんは私たちの顧問としてこれらの選択を受けた。 |
| (8) |
(I)限定株式1,875株(うち1,875株が帰属しており、2017年度総合奨励計画に従ってパトリック·ファビオさんによって付与された)、(Ii)2017年度総合奨励計画に従って付与された15,000株の普通株式を含む制限株式、および(Iii)パトリック·ファビオさんが公開窓口で公開市場から購入した5,000株の普通株式を含む。 |
| (9) |
(I)2,721株が帰属している限定株式6,297株、Matthew Kirkbyさんにより2017年総合インセンティブ計画に従って付与された記録、および(Ii)2017年総合インセンティブ計画に従って付与された15,000株の普通株式の既存株式購入オプションを含む |
| (10) |
マーク·サントスさんは、普通株式、既得オプション、または2022年3月1日から60日以内に帰属するオプションを保有していません。 |
| (11) |
(I)2017総合インセンティブ計画により付与された31,505株の普通株を購入する既存オプションと、(Ii)2017総合インセンティブ計画により付与される2022年3月1日から60日以内に付与される8,797株普通株を購入するオプションとを含む。このうち、32,803株の普通株を購入するオプションは、私たちの顧問であるJeffrey Vacirca博士に授与された。 |
| (12) |
(I)5,581株の制限株式(うち2,402株は帰属しており、謝彦斌博士が2017年総合激励計画に基づいて付与した)および(Ii)2017年総合激励計画に基づいて付与された15,000株の普通株を購入する既存購入株を含む。 |
| (13) |
(I)6,297株の制限株式(うち2,721株は帰属しており、クリスティンYing趙さんが2017年総合インセンティブ計画に基づいて付与された)、(Ii)2017年度総合インセンティブ計画に基づいて付与された15,000株の普通株を購入する既存オプション、および(Iii)クリスティンYing趙さんの配偶者が公開窓口中に公開市場から購入した2,150株の普通株を含む。 |
| (14) |
さんDaniel·ザブロフスキーが保有する制限株式1,360株(うち、453株が帰属している)は、2017年総合インセンティブ計画に基づき付与され、(Ii)2017年総合インセンティブ計画に基づき付与された15,000株の普通株式の既存株式購入オプションを記録しています。 |
私たちは普通株を持っていて、私たちの普通株式のすべての所有者は1株当たり1票を持つ権利がある。私たちの株主は他の株主とは違う投票権を持っていない。
2022年3月1日現在,我々の発行済み普通株のうち約26,593,729株は56名の米国記録保持者が保有している。
私たちはその後の日付でわが社の統制権の変更を招く可能性があるという予定があることを知りません。
| B. |
関係者取引 |
2021年1月1日以来、私たちはいかなる重大な取引または一連の類似の重大な取引を行うことを提案していないが、吾のような任意のメンバーまたは高級管理者、10%を超える普通株を有する任意の者、または前述の者のいずれかの直系親族は、直接的または間接的な重大な利益を有することになるであろう(以下に説明する取引を除く)。
雇用協定
“項目6.役員、上級管理職、従業員--B.給与--雇用協定(2021財政年度執行幹事)”を参照
相談手配
項目6.役員、上級管理職、および従業員--B.報酬--相談スケジュールを参照
役員協議
“項目6.取締役、上級管理者及び従業員--B.報酬--取締役報酬--取締役合意”を参照
2017総合インセンティブ計画
“プロジェクト6.役員、上級管理職、従業員--B.報酬--2017年総合インセンティブ計画”を参照
賠償協定
ケイマン諸島の法律は、ケイマン諸島裁判所がこのような規定が公共政策に違反していると考えない限り、例えば民事詐欺や犯罪結果について賠償を提供するなど、会社の組織定款大綱や定款細則が高級管理者や役員に対して賠償を行う程度を制限していない。改正及び再記述された組織定款の大綱及び定款細則は、当社がその時及び時々取締役、代取締役、秘書、アシスタント秘書又はその他の上級者(ただし、当社の原子力師を含まないが)及び上記の者の遺産代理人に、当該保障された者が当社の業務又は事務(任意の判断ミスを含む)を処理しているか、又はその職責、権力を実行又は履行する際に招く又は被ったすべての行動、法的手続き、費用、費用、支出、損失、損害又は法的責任を賠償することが規定されているが、当該保障されている者自身の不誠実、故意の違約又は詐欺行為(任意の判断ミスを含む)又はその職責、権力の執行又は履行によって引き起こされたすべての法的責任は、授権又は適宜決定権は、上記一般性を損なうことなく、当該保障を受けた者がケイマン諸島又は他の地方のいずれの裁判所においても吾等又は吾等の事務に関連するいかなる民事訴訟について抗弁するか(成功するか否かにかかわらず)により招くいかなる費用、支出、損失又は債務を含む。この行為基準は一般的にデラウェア州会社が許可するデラウェア州会社の行為基準と同じだ。
また、私たちは私たちのすべての役員や幹部と賠償協定を締結し、これらの人たちに私たちが改訂して再説明した組織規約の大綱と定款細則に規定された追加賠償を提供しました。
証券法による責任の賠償は、吾等の役員、上級管理者、または上記条項に基づいて吾等を統制する者を許可する可能性があることから、米国証券取引委員会は、このような賠償は証券法が表明した公共政策に違反しているため、強制的に執行することはできないとしている。
| C. |
専門家と弁護士の利益 |
適用されません。
| 第8項。 |
財務情報 |
| A. |
連結財務諸表およびその他の財務情報 |
“プロジェクト18.財務諸表”を参照
法律訴訟
“プロジェクト4.会社情報--B.業務概要-法律手続き”を参照されたい
配当政策
私たちは株主に現金配当金を支払うことを発表したり、予測可能な未来に現金配当金を支払うつもりはありません。私たちはどんな収益も私たちの業務を開発して拡大することに再投資するつもりだ。将来、私たちの配当政策に関連する任意の決定は、私たちの取締役会が適宜決定し、将来の収益、私たちの財務状況、経営結果、契約制限、資本要求、業務見通し、私たちの戦略目標と業務拡大計画、適用される法律、および私たちの取締役会が関連すると考える可能性のある他の要素を含む多くの要素に依存します。
“プロジェクト3.主要な情報-D.リスク要素--私たちの普通株に関連するリスク--私たちは予測可能な将来に配当金を発行しないと予想されているので、あなたは普通株の価格上昇に依存してあなたの投資収益を得なければならない”と“プロジェクト10.補足情報-B.組織定款大綱--配当”を参照してください
私たちはケイマン諸島に登録して設立された持株会社です。私たちは私たちのアメリカ、オーストラリア、中国子会社の配当金にある程度依存して、私たちの株主に任意の配当金を支払うつもりです。中国法規は私たちの中国子会社が私たちにこのような配当金を支払う能力を制限するかもしれない。“プロジェクト3.重要な情報-D.リスク要素-私たちが中国で商売をすることに関連するリスク--未来、私たちはある程度私たちの主要な経営子会社の配当金と他の配当権分配に依存し、オフショア現金と融資需要に資金を提供するかもしれない”と“プロジェクト4.会社情報-B.業務概要-政府法規-中国法規-外国為替と配当分配法規-配当分配法規”を参照する
| B. |
重大な変化 |
本年度報告Form 20−Fが開示されている以外は,本年度報告がForm 20−F列で総合財務諸表を審査した日から,吾らは何の大きな変動も経験していない。
| 第9項。 |
見積もりと発売 |
| A. |
割引と発売詳細 |
私たちの普通株は2017年3月9日からナスダック資本市場に上場し、取引コードはBYSIである
| B. |
配送計画 |
適用されません。
| C. |
市場 |
私たちの普通株は2017年3月9日からナスダック資本市場に上場し、取引コードはBYSIである
| D. |
売却株主 |
適用されません。
| E. |
薄めにする |
適用されません。
| F. |
債券発行の支出 |
適用されません。
| 第10項。 |
情報を付加する |
| A. |
株本 |
適用されません。
| B. |
定款の大綱および定款細則を組織する |
当社はケイマン諸島が免除された有限責任会社であり、我々の事務は当社の組織定款大綱及び定款細則(時々改正及び重記されている)及びケイマン諸島会社法(以下、会社法と呼ぶ)及びケイマン諸島普通法によって管轄されている。
以下は,我々が現在改訂および再記述している組織定款大綱および細則の主要な条文概要であり,このなどの定款大綱および細則は,我々が2017年3月に初公開発売を完了する直前に発効したが,我々の普通株の重大な条項と関係がある。
当社の趣旨
我々が改訂·再記述した組織定款大綱及び定款細則によると、当社の趣旨は制限されず、我々はケイマン諸島の法律で禁止されていないいかなる趣旨を執行する十分な権力と権限を持っている。
取締役会
“プロジェクト6.取締役、高級管理者と従業員--C.取締役会慣例”を参照
普通株
私たちの普通株は登録形式で発行され、私たちの会員名簿に登録された時に発行されます。私たちの非ケイマン諸島の住民株主は彼らの株式を自由に保有して投票することができる。
配当をする
私たちの普通株式の保有者は私たちの取締役会が発表する可能性のある配当金を得る権利がある。また、私たちの株主は一般決議で配当を発表することができますが、いかなる配当も私たちの取締役が提案した金額を超えてはいけません。ケイマン諸島法律によると、配当金は、いかなる場合も配当金を支払うことができないことを前提として、合法的な利用可能な資金からしか発表されて支払うことができない、すなわち利益または私たちの株式割増口座からしか支払うことができず、もしこれが私たちの会社が通常の業務過程で満期になった債務を返済できないことをもたらす。
投票権
どの株主総会での投票も投票が要求されない限り手を挙げて投票する。総会議長またはいずれか1人以上が当社の10%以上の議決権持株を持つ株主は、自らあるいは代表を委任して会議に出席させ、投票方式での採決を要求することができる。
株主総会に必要な定足数には、一人以上の出席者が含まれており、当社が発行したすべての議決権株を保有している株主は多数以上の株主である。株主は自ら出席または代表出席を依頼することができ,株主が法人実体であれば,その正式に許可された代表が出席することができる。株主総会は当社の取締役会が自主的に開催することができ、あるいは保管申請の日に当社が発行した議決権持分の10%以上の株主を持って取締役に要求することができる。当社は株主周年大会及び他の任意の株主総会を開催するには、少なくとも7つの暦日前に通知を出さなければならない。
株主が会議で採択した一般決議は会議で普通株式に投票した簡単な多数票の賛成票を必要とし、特別決議は会議で普通株式に投票した3分の2以上の賛成票を必要とする。一般決議案及び特別決議案は、“会社法”及び我々が改正·再述した組織定款大綱及び定款細則が許可された場合にも、当社の全株主が一致して書面決議に署名して採択することができる。名称の変更や改訂及び再記述された組織定款の大綱及び定款細則などの重要事項を変更する場合、特別な決議案が必要となる。普通株式保有者は、その他の事項を除いて、一般決議によりその株式を分割または合併することができる。
普通株の譲渡
以下に掲げる制限の規定の下で、当社の任意の株主は、その全部または任意の普通株式を、通常または通常の形態の譲渡文書または当社取締役会によって承認された任意の他の形態で譲渡することができる。
当社の取締役会は、その絶対的な情動権を行使することができ、未納持分または当社の保有権を有する普通株の譲渡を拒否することができます。取締役会は普通株式の譲渡を拒否することもできます
| ● |
譲渡書は私の行に提出し、それに関連する普通株式証明書とわが社の取締役会が合理的に要求する可能性のある他の証拠を添付して、譲渡者が譲渡を行う権利があることを証明します |
| ● |
譲渡文書は1種類の株式にのみ適用される |
| ● |
必要があれば、譲渡文書には適切な印紙が押されている |
| ● |
連名所有者に譲渡された、普通株が譲渡した連名所有者の数は四人を超えない |
| ● |
これについてナスダック資本市場が査定する可能性のある最高額の費用や吾ら取締役が時々要求する低い金額の費用を吾等に支払う。 |
もし私たちの取締役が譲渡の登録を拒否した場合、彼らは譲渡文書を提出した日から2ヶ月以内に、譲渡者と譲受人にそれぞれ拒否通知を出さなければならない。
ナスダック資本市場の要求に従った任意の通知の後、当社の取締役会が時々決定した時間と期間内に譲渡登録とログアウト登録を一時停止することができますが、いずれの年も、譲渡登録の一時停止とログアウト登録の期間は30日を超えてはなりません。
清算する
清算またはその他の場合(株式の転換、償還または購入を除く)の資本リターンの場合、普通株式保有者に割り当て可能な資産は、比例して我々の普通株式保有者の間で分配されなければならない。もし私たちが分配できる資産がすべての実収資本を返済するのに十分でなければ、これらの資産は損失を私たちの株主が比例して負担するために分配されるだろう。
株式の引渡しと株の没収
当社取締役会は、時々、指定された支払い時間または時間の前に少なくとも14の暦の前に、株主に任意の未払い株式金の支払いを要求する通知を株主に発行することができる。償還されたがまだ支払われていない株は没収されるだろう。
普通株の償還·買い戻し·返納
当社は自社又はその所有者が当該等の株式を償還する条項を選択して株式を発行することができ、発行条項及び方式は当社取締役会が当該等の株式を発行する前に決定することができる。当社は当社の任意の株式(任意の償還可能な株式を含む)を買い戻すこともできますが、買い戻しの方法及び条項は、当社の取締役会或いは当社の株主の一般決議案の承認、又は当社の改訂及び再記載された組織定款の大綱及び細則をその他の方法で許可しなければなりません。会社法によれば、任意の株式の償還又は買い戻しは、自社の利益から支払うことができ、又は償還又は買い戻し目的で発行された新株の収益から支払うことができ、又は資本(株式割増口座及び資本償還備蓄を含む)から支払うことができ、会社が支払後直ちに通常業務過程で満了した債務を償還することができることを前提とする。さらに、“会社法”によれば、このような株式は、(A)完全に納付されていない限り、(B)償還または買い戻しがない場合には、流通株がないことになるか、または(C)会社が清算を開始した場合には、これらの株式を償還または買い戻すことができない。また、当社は未納株式の任意の株式を無料で引き渡すことができます。
株式権利の変動
任意のカテゴリ又は系列株式に付随する権利(当該カテゴリ又は系列株式の発行条項が別途規定されていない限り)、吾等の改訂及び再記載された組織定款大綱及び細則の規定の下で、当該カテゴリ又は系列株式を保有している発行済み株式の3分の2以上の所有者が書面で同意し、又は当該カテゴリ又はシリーズ株式所有者が株主総会で可決した特別決議案の承認の下で、変更することができる。当該カテゴリ株式の発行条項に明文規定がない限り、発行された任意のカテゴリ株式所有者に付与される権利は、当該既存カテゴリ株式と同等の株式を増設又は発行することにより変更されてはならない。
増発株
当社の改訂及び再記述された組織定款大綱及び定款細則は、当社取締役会が既存の許可を得ているが発行されていない株式の範囲内で、当社取締役会が決定した普通株を随時増発することを許可している。
私たちはまた、組織規約の大綱と定款の細則を修正し、再記述し、また、私たちの取締役会が時々1つ以上の優先株シリーズを設立することを許可し、任意のシリーズの優先株についてこのシリーズの条項と権利を決定することを含む
| ● |
このシリーズの名前; |
| ● |
このシリーズの株の数 |
| ● |
配当権、配当率、転換権、投票権 |
| ● |
優先権の償還と清算の権利と条項。 |
私たちの取締役会は、私たちの株主が行動する必要がなく、許可されているが発行されていない範囲で優先株を発行することができる。これらの株を発行することは普通株式保有者の投票権を希釈するかもしれない。
帳簿と記録を調べる
ケイマン諸島法律によると、私たちの普通株式の所有者は、私たちの株主リストまたは私たちの会社記録のコピーを閲覧または取得する権利がないだろう(私たちの組織規約の大綱と定款の細則、私たちの担保と抵当登録簿、そして私たちの株主の特別決議を除く)。しかし、私たちは株主に年間監査された財務諸表を提供するつもりだ。“-H.表示された文書”を参照されたい
反買収条項
私たちが修正し、再記述した組織定款の大綱および定款のいくつかの条項は、以下の条項を含む株主が有利と思われる可能性のある会社または経営陣の支配権変更を阻害、延期、または阻止する可能性がある
| ● |
私たちの取締役会が1つまたは複数のシリーズの優先株を発行することを許可し、これらの優先株の価格、権利、優遇、特権、および制限を指定し、私たちの株主がさらなる投票や行動を必要とすることなく、 |
| ● |
株主要求と株主総会を開催する能力を制限する。 |
しかし、ケイマン諸島法律によると、私たちの役員は、正当な目的と、彼らがわが社の最良の利益に適合していると心から思っている場合に、私たちの組織定款大綱と定款細則が彼らに与える権利と権力を行使することしかできません。
株主総会と株主提案
私たちの株主総会はケイマン諸島内外の取締役会が適切な場所で開催されることができる。
ケイマン諸島の免除会社として、会社法に基づいて株主総会を開く義務はありません。当社は改訂及び追記された組織定款大綱及び細則により、当社は年に1回の株主総会を当社の周年株主総会とすることができる(ただし義務はない)と規定している。
株主周年大会および他のいかなる株主総会も当社の取締役会の多数のメンバーが招集することができる。当社取締役会は、通知を出した日(又は当社取締役が決定した他の議事録日)に当社の株主名簿メンバーに名を連ねた者に、七歴以上の書面株主総会通知を行い、総会で投票する権利を有するものとする。
ケイマン諸島法律は,株主に株主総会の開催を要求する有限の権利のみを与え,株主に株主総会にいかなる提案も提出する権利を与えない。しかし、このような権利は会社の定款で規定されることができる。吾等の改訂及び重述された組織定款大綱及び定款細則は、自社が発行した投票権株の10%以上の株式を保有する株主が株主特別総会の開催を要求することを許可し、この場合、吾等の取締役は株主特別総会を開催し、収用された決議案を当該等の総会で議決する責任がある。ただし、吾等の改訂及び重述された組織定款大綱及び定款細則は、吾等の株主に株主周年総会又は当該等の株主が開催しない特別株主総会にいかなる提案を行う権利も与えない。
免除会社を得る
会社法によると、私たちは免除された有限責任会社だ。“会社法”は一般住民会社と免除会社を区別した。ケイマン諸島に登録していますが主にケイマン諸島以外で業務を経営している会社は、免除会社として登録を申請することができます。免除された会社に対する要求は、基本的に一般会社と同様であり、免除会社のみである
| ● |
会社登録処長に株主周年申告書を提出する必要はない |
| ● |
検査のためにメンバー登録簿を開く必要はありません |
| ● |
年次株主総会を開催する必要はない |
| ● |
流通株、無記名株、または無額面価値の株を発行することができる |
| ● |
未来の税金を徴収しない約束を得ることができる(このような約束は通常、最初に20年を与える) |
| ● |
他の法域で登録を継続し、ケイマン諸島で登録を取り消すことができる |
| ● |
存続期間の限られた会社として登録することができる |
| ● |
独立したポートフォリオ会社に登録することができる。 |
“有限責任”とは、各株主の責任が、株主が会社の株式に対して未払いの金額に限定されていることを意味する(詐欺、代理関係の構築または不正または不正目的に関連している場合、または裁判所が会社のベールを剥がす可能性がある他の場合を除く)。
会員登録簿
ケイマン諸島の法律によると、私たちはメンバー登録簿を保存し、その中に登録しなければならない
| ● |
メンバーの名称および住所、および各メンバーの保有株式の説明は、(I)各メンバーの株式の支払または同意が支払われた金額とみなされるかどうか、(Ii)各メンバーが保有する株式の数およびカテゴリ、および(Iii)メンバーが保有する各関連カテゴリの株式が、会社規約に規定された投票権を有するか否かを確認しなければならない |
| ● |
誰かの名前が登録記録書に登録されて会員になった日; |
| ● |
誰ももう会員の日ではありません。 |
ケイマン諸島法律によると、当社の株主名簿は、その中に記載されている事項の表面的証拠(すなわち、株主名簿は上記事項について事実推定を提出し、覆されない限り)であり、株主名簿に登録されているメンバーは、株主名簿上のその名称に対する株式の法定所有権を有するものとみなされる。我々の会員名簿が更新されると,会員名簿に登録されている株主は,その氏名に対応する株式の合法的な所有権を所有しているとみなされる.
もし誰かの名前が誤って当社の株主名簿に記入されたり漏れたりした場合、または登録簿に登録されたときに何かのミスや不必要な遅延が発生した場合、誰ももはや当社のメンバーではなく、屈託を感じた人またはメンバー(または当社または当社自身の任意のメンバー)は、ケイマン諸島大法院に訂正登録簿を申請することができ、裁判所はその申請を拒否することができ、または信納事件の公正性のように、訂正登録簿を訂正することができる。
| C. |
材料契約 |
2020年6月18日、私たちは引受業者の代表であるJefferies LLCとWilliam Blair&Company、L.L.C.と合計2219,500株の私たちの普通株の発行に関連し、引受業者が1株13.00ドルの公開発行価格で追加289,500株を購入することを含む私たちの普通株の選択権を全面的に行使することを含む引受契約を締結した。二零二年六月十八日、吾らも徳誠資本の連属実体と株式引受協定を締結し、1株13.00ドルの公開発行価格で計384,615株の普通株を売却し、別の私募取引とした。引受割引と手数料及びその他の発売費を差し引く前に、公開発売及び方向性増発の総収益は3,390万元である。
2020年11月12日、私たちの子会社SEEDは礼来会社と協力協定を達成し、TPDを通じて治療利益をもたらす新しい化学実体を発見し、開発した。協力協定の条項によると、種子会社は1500万ドルの前払い現金と初期持分投資を獲得した。SEEDはまた,最高約7.8億ドルの潜在的臨床前と臨床開発,規制,ビジネスマイルストーン,および協力による製品純売上高の分級特許権使用料を得る資格がある。私たちと礼来社はまた、種子会社と株式購入契約を締結し、種子会社の優先株を購入した。SEEDは(I)合計1,194,030株のA-1シリーズ優先株の売却に同意し、私たちと万春医薬の多数の株式間接子会社種子科学技術有限会社、及び(Ii)1,990,000株A-2シリーズ優先株の贈呈に同意し、1株当たりの現金購入価格は2.5125ドルであった。初歩的に取引を完了した後、著者らと種子科学技術がすでに持っている株式を計上した後、著者らと種子科学技術はSEEDの64.38%の株式を保留し、換算後の基礎で計算した。また、協力協定に記載されているいくつかのマイルストーンを実現した後、いくつかの条件を満たし、および/または放棄した場合、私たちは種子科学技術と共同で追加の1,194,028株のA-1シリーズ優先株を購入し、礼来社は1,990,000株のA-2シリーズ優先株を追加的に購入し、1株当たりの現金購入価格は1株2.5125ドルである。これらの取引が完了した後、私たちと種子科学技術はSEEDの約60.1%の流通株権益を保有し、転換後の基礎で計算することが予想される(従業員の持株計画や同様の手配によって保留可能ないかなる株式も含まれない)。
2020年11月18日、私たちはアメリカ銀行証券会社、Jefferies LLC、Evercore Group L.L.C.と引受業者の代表として、引受業者が1株10.00ドルの公開発行価格で追加1,125,000株を購入することを含む合計8,625,000株の私たちの普通株の発行に関連して、私たちの普通株の選択権を全面的に行使することを含む。引受割引や手数料、その他の発売費用を差し引くまで、公開発売の総収益は約8,630万ドル。
2021年8月25日、私たちの一部の保有する中国子会社の万春布林は恒瑞と独占商業化と共同開発協定を達成し、ブリブリンの大中国でのさらなる開発と商業化を達成した。合意条項によると、万春プリンは恒瑞に独占的権利を付与し、大陸部中国及び香港、マカオ及び台湾を含む大中国市場で商業化及びプリブリンを共同開発する。万春プリンはブリブリンの大中国市場における製造権を保持し、プリブリンの同などの市場でのすべての販売純収益を獲得する。恒瑞は四半期ごとに所定の割合の純売上高を獲得する。万春プリンは2億元(約3100万ドル)の前金を獲得し、11億元(約1億71億ドル)にのぼる監督·販売マイルストーンを獲得する。恒瑞はブリブリンの大中国市場での商業化のすべての費用を担当する。合意条項によると、万春プリンはプリプリンの最初の2つの適応の100%臨床と監督管理コストを担当する:CINと非小細胞肺癌(EGFR野生型)の第二/三線治療の予防。恒瑞は大中国市場におけるプリブリンの追加適応に50%の臨床開発コストを提供し、そして1つの連合指導委員会が臨床戦略と優先事項を監督する。“プロジェクト4.会社情報--B.業務概要--商業化”を参照
| D. |
外国為替規制 |
“第四項会社情報-B.業務概要-中国法規-外国為替と株式分配関連規定”を参照
| E. |
税収 |
以下は,我々の普通株の所有権と処分に関するケイマン諸島,中国,米国連邦所得税考慮事項の概要である。この要約は、任意の特定の潜在的投資家に対する法律または税務提案として解釈されてはならないし、意図されていない。本要約は,本20-F表の日までの法律とその関連解釈をもとに,これらのすべての法律や解釈が変化したり,異なる解釈があったりする可能性があり,遡及効力を持つ可能性がある本要約は、例えば、米国州または地方税法またはケイマン諸島、中国および米国以外の司法管轄区の税法による考慮など、当社の普通株への投資に関するすべての可能な税務考慮要因には触れない。潜在的投資家は、私たちの普通株式の所有権と処置に関する考慮事項について彼らの税務顧問に相談しなければならない。ケイマン諸島税法については、ケイマン諸島特別法律顧問Maples and Calder(Hong Kong)LLPのみを代表する意見を検討し、中国税法については、ケイマン諸島特別法律顧問の韓坤法律事務所の意見のみを代表することを検討した。
ケイマン諸島の税金
ケイマン諸島には現在、利益、収入、収益または付加価値に基づいて個人や会社に課税されておらず、相続税や相続税の性質の税収もない。ケイマン諸島政府が徴収する他の税金は私たちにとって実質的ではないかもしれないが、ケイマン諸島司法管轄区域内で署名または署名後に署名された文書の印紙税は除外される可能性がある。ケイマン諸島はわが社またはわが社によって支払われたいかなる金にも適用される二重課税条約の締約国ではない。ケイマン諸島には外国為替規制や通貨制限がない。
普通株に関する配当及び資本の支払いはケイマン諸島で納税する必要はなく、普通株のいかなる所有者に配当或いは資本を支払うことも(状況に応じて)源泉徴収する必要はなく、普通株を売却して得られる収益もケイマン諸島の所得税や会社税を支払う必要はない。
人民Republic of China税
“企業所得税法”によると、中国以外に設立され、中国内部に“事実上の管理機関”がある企業は“住民企業”とされており、これは企業所得税において、当該企業が中国企業に類似した方式で扱われており、その世界的な所得に統一された25%の企業所得税率が適用されることを意味する。“企業所得税法実施細則”は、“事実上の管理機関”を、企業の生産経営、人事、会計帳簿及び資産を実質的かつ全面的に管理·制御する管理機関と定義しているが、現在この定義に対する唯一の公式指導意見は、中国が制御するオフショア登録企業の税務居留地位を決定するために指導を提供した国家税務局によって発表された82号通知であり、当該企業は外国又は地域の法律に基づいて登録され、中国企業又は企業グループを主要持株株主とする企業と定義されている。万春医薬は中国企業或いは企業グループを著者らの主要な持株株主としていないため、第82号通達が指す中国制御の海外登録企業でもないが、著者らの指導意見に特化して適用されていないため、著者らはすでに第82号通達に掲載された指導意見を用いて万春医薬有限会社及び中国国外に設立された子会社の税務滞在地位を評価した。
第82号通告によると、中国が支配するオフショア登録企業は、中国に“事実上の管理機関”が設置されていることで中国税務住民とみなされ、以下のすべての条件を満たす場合にのみ、その全世界の収入は中国企業所得税を納める必要がある
| ● |
企業の日常経営管理と高級管理部門の高級管理者の職務の主な場所は中国にある |
| ● |
企業財務、人的資源に関する決定は、中国の組織、人員によって行われるか、または承認される |
| ● |
企業の主要資産、会計帳簿、公印、取締役会、株主総会紀要は中国に設置または保存されている |
| ● |
投票権のある取締役会のメンバーや役員の50%以上が習慣的に中国に住んでいる。 |
現在、私たちの管理チームの何人かの会員たちは中国にいる。しかし、私たちは私たちが前節で述べたすべての条件を満たしているとは思わない。万春医薬とその海外子会社は中国国外で登録設立された。持ち株会社として、私たちの重要な資産や記録は、私たちの取締役会の決議や議事録、私たちの株主の決議や議事録を含めて、中国の外に位置して保存されています。また、私たちの知る限り、オフショア持ち株会社の会社構造がわが社の構造と似ていることはなく、中国税務機関に中国の“住民企業”と認定されています。したがって,第82号通告で“事実上の管理機関”に関する基準が我々に適用されれば,中国税務については,万春医薬とそのオフショア子会社は“住民企業”と見なすべきではないと考えられる。しかし、企業の税務居留地位は中国の税務機関が決定しなければならないため、“事実上の管理機関”という意味は私たちのオフショア実体に適用され、依然として不透明な要素が存在し、私たちは引き続き私たちの税務状況を監視します。
“企業所得税法実施細則”では,(一)配当金を分配する企業が中国を住所とするもの,又は(二)中国を住所とする企業の持分を譲渡して収益を実現する場合は,当該配当金又は資本利益を中国由来の収入で処理することが規定されている。“企業所得税法”の下で“住所”をどのように解釈するかは不明であり、企業が納税住民のいる管轄区域と解釈される可能性もある。したがって、中国の税務目的について言えば、私たちは中国の税務住民企業とみなされ、私たちが海外の株主に支払う任意の配当金と、その株主が私たちの株式を譲渡することで実現した収益は中国由来の収入とみなされる可能性がある。もし私たちが中国税務機関に“非住民企業”と認定されれば、私たちの中国子会社が私たちに支払った配当金は10%の源泉徴収税がかかります。企業所得税法はまた、外商投資企業が中国国外の直属持株会社に発行した配当金に対して10%の源泉所得税を徴収し、当該直接持株会社が非住民企業とみなされ、中国国内に設立或いは場所がない場合、あるいは受け取った配当金は当該直接持株会社の中国国内での設立或いは場所に関係なく、当該直接持株会社の登録管轄権が中国と税収条約を締結しない限り、異なる源泉徴収手配を規定している。私たちは設立されたケイマン諸島と中国にそのような税金条約を登録していない。香港税務条約によると、配当を受けた香港住民企業は非中国税務住民企業とみなされ、実益として配当金を分配する中国企業の少なくとも25%の持分を直接保有していれば、配当金の事前引き上げ税率を5%に下げることができるが、中国現地税務機関の許可を得なければならない。しかし、適用される中国税務法規に基づいて、当該香港住民企業が当該配当金の実益所有者とみなされなければ、当該等配当金は10%の税率で源泉徴収税を徴収することができる。2018年2月、国家税務総局は“税収協定における”利益所有者“に関する問題に関する公告”を公布し、“利益を得るすべての人”の認定基準を規定した。“利益を得る者”を決定する際には,具体的な事件の実態に合わせて総合的に分析すべきである。そのため、万春医薬香港は税務規則と法規下の関連条件に符合し、規定に従って承認を取得すれば、中国付属会社から受け取った配当金について5%の源泉徴収税税率を享受することができる。
アメリカ連邦所得税の考慮要素
以下は,我々の普通株式所有権と処分に一般的に適用される米国連邦所得税の考慮要因の概要である.別の説明がない限り、本要約は、米国連邦所得税の目的のために、私たちの普通株を“資本資産”(通常は投資のために保有する財産)とする米国の保有者(以下のように定義される)のみである。本要約は、“法典”、それに基づいて公布された“米国財務省条例”または条例、司法裁決、行政声明、米国と中国との間の所得税条約、または条約およびその他の関連当局に基づいており、これらの内容はすべて本文書の発行日に発効し、それらは異なる解釈や変更を受ける可能性があり、トレーサビリティがある可能性がある。
この要約は、私たちの普通株式の所有権または処置に関連する米国連邦財産、贈与または他の非所得税考慮要因、代替的最低税収、特定の純投資収入に徴収される連邦医療保険税、または任意の州、地方または非米国税考慮要因に関連するものではなく、特定の米国連邦所有者の特定の状況に関連する可能性のある米国連邦所得税のすべての態様、または米国連邦所得税法によって特殊な待遇を受ける可能性のある特定のタイプの米国連邦所得税、例えば、米国連邦所得税に関連する可能性がある米国連邦所得税に関連するものではない
| ● |
銀行や他の金融機関 |
| ● |
保険会社 |
| ● |
年金計画 |
| ● |
協同組合 |
| ● |
規制された投資会社 |
| ● |
不動産投資信託基金 |
| ● |
証券や貨幣取引業者 |
| ● |
時価計算の会計方法を使用するトレーダーを選択する |
| ● |
元アメリカ市民や長期住民もいました |
| ● |
個人基金を含む免税実体; |
| ● |
任意の従業員株式オプションまたは他の補償方法に従って普通株を獲得する者 |
| ● |
私たちの普通株式を国境を越えた、ヘッジアップ、転換、建設的販売、または米国連邦所得税目的のための他の総合取引の一部として持っている人; |
| ● |
ドル以外の機能通貨を持っている人は |
| ● |
私たちの10%以上の株式(投票または価値)を実際にまたは建設的に所有する人; |
| ● |
組合企業又は他の実体が課税すべき手配は、米国連邦所得税目的の組合企業又はそのような実体を介して普通株を保有する者である。 |
各潜在投資家はその特殊な状況に基づいて、アメリカ連邦、州、地方と非アメリカ収入及び私たちの普通株の所有権と処分に関連する他の税務について考慮し、その税務顧問に相談しなければならない。
本議論の目的で、“U.S.Holder”とは、私たちの普通株の実益所有者、すなわち米国連邦所得税の目的である
| ● |
アメリカ市民や住民の個人です |
| ● |
米国、その任意の州またはコロンビア特区の法律またはその法律に基づいて設立または組織された会社(または米国連邦所得税の目的のために会社の他のエンティティとみなされる) |
| ● |
その収入は、その出所にかかわらず、米国連邦所得税総収入に含まれる遺産を含むことができる |
| ● |
(1)米国内の裁判所の主な監督を受け、1人以上の米国人のすべての重大な決定に対する支配を受けるか、または(2)適用条例に基づいて米国人とみなされることを効果的に選択する信託。 |
組合企業(または米国連邦所得税において組合企業の他の実体または手配とみなされる)が我々の普通株を所有している場合、組合企業におけるパートナーの米国連邦所得税待遇は、一般にパートナーの地位とパートナーの活動に依存する。私たちの普通株を持っている共同企業とそのパートナーは普通株に投資することについて税務顧問に相談しなければなりません。
万春医薬の納税居住地は、アメリカ連邦所得税の目的に使われています
米国の現行の連邦所得税法によると、会社は通常、その組織や会社の管轄内の税務住民とされている。したがって、ケイマン諸島の法律に基づいて設立された会社として、米国連邦所得税については、通常、非米国会社に分類されるべきである(したがって、非米国税務住民にも分類されるべきである)。しかし、場合によっては、この法第7874条によれば、米国国外で設立された会社は米国会社とみなされる(したがって、米国税務住民とみなされる)。
2015年7月、私たちは内部再編を完了した。内部再編時の有効な規則によると、内部再編は、規則第7874条に基づいて米国連邦所得税の目的とされている米国会社にはつながらないと予想される。しかし,第7874条の規則や例外は複雑であり,事実や法的不確実性の影響を受けているため,米国連邦所得税会社とみなされない保証はない。
本議論の残りの部分は、米国連邦所得税については、米国会社とはみなされないと仮定している。
分配する
米国の株主は、私たちの普通株式について受け取った任意の割り当てられた総金額(中国の源泉徴収税について源泉徴収された任意の金額を含む)は、一般に、私たちの現在または累積された収益および利益から配当金として支払われ(米国連邦所得税の原則に基づいて決定される)、米国の株主が実際に受け取ったまたは建設的に受け取った当日の毛収入に含まれる。このような配当金は、この基準に基づいて米国会社が通常取得することを許可する配当金控除の資格に適合しないだろう。以下の議論では、どの配当金もドルで支払われると仮定する。私たちの現在と累積された収益と利益の分配を超える分配は資本の免税リターンとみなされ、アメリカの保有者は私たちの普通株式で調整された税金ベースの範囲内で、その後は通常資本収益とみなされる。私たちはアメリカ連邦所得税の原則に基づいて私たちの収入と利益を決定するつもりはないので、私たちが支払う任意の分配の全額は一般的にアメリカ連邦所得税の目的の配当とみなされるだろう。
普通株式の個人または他の非会社米国保有者は、以下の低減された配当税率を享受する資格がある可能性がある:(I)適格外国企業から受信された配当金は、適格外国企業が配当金を支払う納税年度または前の納税年度にPFICでもなく(以下のように定義される)場合、米国持株者ともみなされず、(Ii)特定の保有期間および他の要求を満たす。普通株が支払う配当金については、外国会社は通常合格した外国会社とみなされており、普通株であればいつでも米国の成熟した証券市場で取引できる。私たちの普通株はナスダック資本市場に上場していますが、私たちの普通株はその年あるいはその後数年はいつでも成熟した証券市場で取引できるとみなされないかもしれません。以下の“受動外国投資会社”の節で述べたように,いかなる納税年度におけるPFICの地位も保証されていないが,2021納税年度はPFICではないと信じている。したがって,配当金を支払う納税年度や前納税年度が当該等の米国株主のPICでなければ,我々普通株が個人や他の非会社米国株主に支払う配当金は,税率引き下げを受ける資格のある“適格配当収入”を構成する可能性がある。
アメリカの外国税収控除の目的で、私たちの普通株から得られた配当金は通常外国からの収入とみなされ、通常は受動的な種類の収入を構成する。もし中国企業所得税法(人民Republic of China税参照)によれば、私たちは中国住民企業とみなされ、アメリカの株主はこの配当金について中国源泉徴収税を支払う必要があるかもしれない。いくつかの条件及び制限の規定の下で、合資格のアメリカ持株者は、当社の普通株式配当金について支払い又は源泉徴収したいかなる中国所得税についても外国税の控除を申請する権利があり、当該等の税項が本条約に基づいて返却されない限り。あるいは、米国所有者は、その課税所得額を計算する際にこのような税金を差し引くことを選択して、米国連邦所得税目的に使用することができる。米国の保有者は、外国税控除を申請するのではなく、関連納税年度に支払うまたは計上されるすべての控除可能な外国所得税に適用される外国税を控除することを選択する。外国の税金控除と外国の税金控除に関する規則は複雑だ。すべてのアメリカの保有者は、彼らが条約の資格を満たしているかどうかにかかわらず、彼らの具体的な状況に基づいて、外国税収控除と外国税収控除の可用性について彼らの税務顧問に相談しなければならない。
普通株式を売却するか、またはその他の方法で処分する
アメリカの保有者は一般的に私たちの普通株の収益や損失を売却または他の方法で処理することを確認し、その金額は売却時に現金化された金額とアメリカの保有者が私たちの普通株で調整した税ベースとの差額に等しい。米国の保有者が普通株式を売却する際の保有期間が1年を超える場合、どのような収益または損失も通常、長期資本収益または損失となる。個人と他の非会社の米国保有者の長期資本収益は、通常、より低い税率を享受する資格がある。資本損失の控除額は制限される可能性がある。
“-人民Republic of China税務”が述べたように、もし中国企業所得税法に基づいて、吾らは中国住民企業とみなされ、吾などの普通株の収益を売却或いはその他の方法で処分するには中国所得税を納めなければならない可能性があり、しかも通常はアメリカからの収益であり、これは米国所有者がどのような収益について徴収した中国所得税について外国税務控除を申請する能力を制限する可能性がある。しかし,本条約の利益を享受する資格のある米国保有者は,本条約を適用し,このような収益を中華人民共和国の源と見なすことができる。それにもかかわらず、最近発表された法規によると、本条約に適用されない条約の資格を満たした米国の所持者と、本条約に基づいて福祉を受ける資格のない米国の所有者は、私たちの普通株を売却または処分するために徴収されたいかなる中国税項目についても外国税の免除を申請することができない可能性がある。外国の税金控除と外国の税金控除に関する規則は複雑だ。アメリカの保有者は、彼らの特殊な状況と、彼らが条約によって福祉の資格と最近発表された法規の潜在的な影響を得ることができるかどうかに基づいて、外国の税金控除あるいは代替控除として、彼らの税務顧問に相談することができるかどうかを判断しなければならない。
もし私たちの普通株の処分に外国税を徴収する場合、アメリカの持株者は彼らの特定の状況に応じて外国税控除を受けることができるかどうかを含む彼らの税務顧問に相談しなければならない。
受動的対外投資会社
当社のように、米国連邦所得税の任意の納税年度に分類されるPFICは、任意の納税年度において、(I)その年度の総収入の75%以上が特定のタイプの“受動的”収入からなる場合、または(Ii)その年間の資産価値の50%以上(四半期平均値に基づいて決定される)は、受動的収入を生成するために保有する資産に起因することができる。
受動的収入には、一般に、配当金、利息、特許権使用料、レンタル料、年金、売却または交換によってそのような収入を生成する財産の純収益および純外国為替収益が含まれる。受動資産とは,投資のために保有する資産や,現金,随時現金に変換可能な資産,および(ある例外を除く)運営資本を含む受動的収入を生じる資産である.わが社の営業権や他の未登録無形資産が考慮され、そのような資産が生成または保有されることによって生じる収入に応じて、能動的または受動的に分類される可能性がある。私たちは、その株式の25%以上(価値で計算)の他の会社の資産と収入の割合シェアを直接、間接的、または建設的に所有するとみなされる。
我々の収入と資産価値の分析から,2021年12月31日までの納税年度ではPFICではなく,この分析は高度な事実的性質を持つにもかかわらず保証できないと考えられる。我々の2022年12月31日までの本納税年度のPFIC地位は同年度終了後に決定され,本納税年度と将来納税年度のPFICに分類される可能性がある。私たちは2016-2020納税年度の毎年PFICであり、私たちは以前の納税年度もPFICかもしれないと信じています。しかし、本課税年度や将来のいかなる課税年度もPFICの地位は保証できません。我々がPFICになるかどうかの決定は不確実であり,これは年に1回密な事実調査が行われているため,部分的には我々の収入や資産の構成に依存する。私たちの普通株市場価格の変動は、本課税年度以降の納税年度がPFICに分類されるかどうかに影響を与える可能性があります。資産テストにおける資産価値は、時々私たちの普通株の市場価格を参考にして決定される可能性があります(当社のようなバイオ製薬会社では、どの製品も商業化されていないので、不安定かもしれません)。私たちの収入と資産の構成はまた私たちが流動資産を使用する方式と速度の影響を受ける可能性がある。受動的収入を生じる活動からの収入が非受動的収入を生じる活動の収入に対して増加した場合,あるいは現金を能動的な目的に用いないことにした場合,PFICに分類されるリスクは大幅に増加する。しかも、私たちの任意の候補薬物が商業化される前に、利息と他の受動的収入は私たちの任意の納税年間総収入の75%以上を占めるかもしれない。
もし我々が米国株主が我々の普通株の任意の課税年度のPFICを保有している場合、米国株主は、米国株主が以下に説明する“時価計算”の選択をしない限り、米国株主が我々の普通株から取得した任意の“超過分配”に関連し、米国株主が我々の普通株式から確認した任意の収益を受けるであろう。以下の特別税務規則によると、米国の保有者が納税年度に受信した普通株式割り当ては、米国所有者が前の3つの納税年度に受信した年平均分配の125%を超えるか、または、短い場合、米国所有者の私たちの普通株の保有期間は超過割り当てとみなされる
| ● |
超過した分配または収益は、米国の保有者が私たちの普通株式を保有している間に比例的に分配される |
| ● |
超過分配または販売または他の処置に割り当てられた課税年度の金額と、PFICに分類された最初の納税年度(“PFIC前年度”)前の米国保有期間内の任意の課税年度の金額とは、一般収入として納税される |
| ● |
本納税年度またはPFIC前年度を除く前の納税年度に割り当てられた金額は、この年度に米国所有者に適用される最高税率で課税され、これらの額は、これらの年度が繰延とされることによる税収の利息に相当する追加税金を増加させる。 |
もし私たちが米国の保有者が私たちの普通株のいかなる課税年度のPFICを持っていれば、将来の納税年度には、(I)私たちがPFICではなく、(Ii)米国の所有者がPFIC規則に基づいて“売却と見なす”選択をした限り、この米国の保有者の普通株のPFICとみなされ続ける。もし米国の持株者が売却とみなされる選択をした場合、この米国の保有者はPFICとしての最後の年の最後の日に、その公平な市場価値で私たちの普通株を売却したとみなされるだろう。上記の超過割当ルールの制約の下で、このような売却とみなされる任意の収益は、超過割り当てとみなされる。
代替的に、PFICの“販売可能株”(定義は後述)を持つ米国所有者は、前述の第2段落に記載した税収待遇から撤退するために、PFICの株式を時価で選択することができる。米国株主が我々の普通株を有効に時価で選択すれば、米国株主は毎年収入に当該米国株主の納税年度終了時の我々普通株に相当する公平な時価値を計上し、米国株主の当該普通株に対する調整基準の金額を超える(あれば)。米国保有者が当該米国保有者の我々普通株における調整基準が納税年度終了時にその公平な市場価値を超える部分を差し引くことを許可する。しかし、私たちの普通株式のいずれかの時価で計算された純収益が米国保有者以前の納税年度収入に含まれている場合にのみ、控除が許可される。時価で選挙された米国の保有者の収入に計上された金額と、実際に売却したり、他の方法で処分したりした収益は、一般収入とされている。普通損失処理は、我々普通株の任意の市価損失の控除可能部分と、実際に私たちの普通株を売却または処分する際に現金化されたいかなる損失にも適用され、そのような損失の金額が当該普通株が先に計上した収益の市価純収益を超えない限り。アメリカの保有者は私たちの普通株式に基づいて、このような任意の収入や損失金額を反映するように調整する。米国の保有者がこのような時価建ての選択をすれば、非PFIC社の分配に適用される税収ルールも我々の分配に適用される(ただ適格配当収入の低い適用資本利益税は適用されない)。もし米国の保有者が効率的な時価建ての選択をし、その後PFICに分類されなくなった場合、私たちがPFICに分類されない間、この米国の保有者は上述した時価での収入や損失を考慮することを要求されないだろう。
時価ベースの選択は、“販売可能株”にのみ適用され、すなわち、各カレンダー四半期内に少なくとも15日以内に合格取引所または他の市場(“定期取引”)で取引数が最低数でない株については、適用法規の定義に基づいている。私たちの普通株はナスダック資本市場に上場し続けると予想されていますが、これらの目的については、これは適格な取引所ですので、私たちの普通株が定期的に取引されていると仮定して、アメリカの保有者が私たちの普通株を持っていれば、もし私たちがPFICになったり、そのアメリカの保有者が時価建ての選挙を行うことができると予想しています。
また、技術的には、私たちが所有する可能性のある任意の低いレベルのPFICに対して時価での選挙を行うことができないため、米国所有者の私たちが持っている任意の投資における間接的権益はPFIC規則の制約を受け続ける可能性があり、米国連邦所得税の目的で、これらの投資はPFICの持分とみなされる。
米国の保有者が適格選挙基金選挙を行うために必要な情報を提供するつもりはなく,あれば,上記PFICに対する一般税待遇とは異なる税収待遇につながる。
もし私たちが米国所有者が私たちの普通株を保有しているいかなる課税年度のPFICであれば、(I)私たちがPFICではなく、(Ii)米国所有者がPFIC規則に基づいて“売却と見なす”選択をした限り、米国所有者の普通株とみなされるPFICを続ける。
私たちがPFICである任意の納税年度内に私たちの普通株を持っているアメリカの保有者は通常彼らがこのような株を持っていることに関する年間報告書をアメリカ国税局に提出しなければなりません。もし私たちがPFICになった場合、アメリカの保有者は、私たちの普通株を保有して処分するアメリカ連邦所得税考慮事項について、時価建ての選挙が可能かどうかを含む税務コンサルタントに相談しなければならない。
上記のアメリカ連邦所得税考慮事項の概要は参考に供するだけであり、税務提案を構成していない。アメリカ持株者はその具体的な状況に基づいて、私たちの普通株式所有権と処分に適用されるアメリカ連邦、州、地方と非アメリカ税収考慮事項について彼らの税務顧問に相談しなければならない。
| F. |
配当金と支払代理人 |
適用されません。
| G. |
専門家の発言 |
適用されません。
| H. |
展示された書類 |
我々はこれまでに、我々の普通株式に関連する改訂されたF-1表登録説明書(書類第333-214610号)を米国証券取引委員会に提出した。米国証券取引委員会が許可した場合、本年度報告書20−F表の第19項において、我々が先に米国証券取引委員会に提出したいくつかの情報を引用的に組み込んだ。これは、米国証券取引委員会に別途提出された別の文書を推薦することで、重要な情報を開示することができることを意味します。参照によって組み込まれた資料は、本年度報告書20−F表の一部とみなされる。
私たちは取引法の定期的な報告書と他の情報要求事項を守らなければならない。取引法によると、私たちはアメリカ証券取引委員会に報告書と他の情報を提出しなければならない。米国証券取引委員会には、米国証券取引委員会に電子的に提出された登録者の報告書や他の情報が含まれているウェブサイトwww.sec.govがある。我々が米国証券取引委員会に提出した20-Fフォーム年次報告書およびその他の情報は、本サイトを介して取得することができる。
外国の個人発行者として、取引法第16条に記載されている報告書及び短期運転利益回収条項の制約を受けず、我々の高級管理者、取締役及び主要株主も、“取引法”第16条に記載されている報告書及び短期運転利益回収条項の制約を受けない。また、取引法によれば、取引法に基づいて証券を登録している米国の会社のように、年度、四半期、現在の報告書および財務諸表を米国証券取引委員会に頻繁またはタイムリーに提出する必要はありません。しかしながら、各会計年度終了後4ヶ月以内、または米国証券取引委員会が要求した適用期間内に、独立公認会計士事務所が監査した財務諸表を掲載したForm 20−F年度報告書を米国証券取引委員会に提出し、各財政年度前3四半期に監査されていない四半期財務情報をForm 6−Kで米国証券取引委員会に提出しなければならない。
私たちはウェブサイトを維持していますウェブサイトはwww.beyondspringpharma.comですナスダック証券市場規則第5250条(D)条によると、当社のサイトでForm 20-Fの形で本年度報告を発表します。当社のウェブサイトに掲載されている資料は、本20-F表の年次報告に参考的に組み込まれていません。また、株主の要求に応じて、20-F表の年次報告書のハードコピーを無料で提供します。
| I. |
子会社情報 |
適用されません。
| 第十一項。 |
市場リスクに関する定性的と定量的開示 |
利子と信用リスク
私たちは債務返済と債務返済コストに対する金利の典型的なリスク、すなわち金利の影響に直面していない。私たちの金利リスクの開放は私たちが預金から稼いだ利息収入の変動によって生まれました。2021年12月31日と2020年12月31日までに、それぞれ4160万ドルと1.095億ドルの現金を持っています。2021年12月31日と2020年12月31日まで、私たちの短期投資はそれぞれ3070万ドルとゼロです。私たちの現金と短期投資は私たちが高い信用品質を持つと思う金融機関に持っています。私たちは私たちのポートフォリオで派生金融商品を使用しなかった。利息を稼ぐ道具はある程度の金利リスクを持っている。市場金利の変化により、私たちは重大なリスクの影響を受けておらず、大きなリスクの影響を受けることも期待されていません。しかし、市場金利の変化により、私たちの未来の利息収入は予想を下回るかもしれない。
外貨為替リスク
私たちは様々な通貨リスクの開放によって生じる外国為替リスクに直面している。私たちの機能通貨は主にドルですが、私たちの一部の経営取引と資産と負債は人民元とオーストラリアドルのような他の通貨です。私たちは現在、私たちに重大な直接外国為替リスクがあるとは思いませんし、このようなリスクを解決するために派生金融商品を使用していません。
人民元は自由に資本項目取引のための外貨に両替できません。人民元の米ドルやその他の通貨に対する価値は、中国の政治経済条件や中国の外貨価格変化などの要素の影響を受けている。私たちの業務でドルを人民元に両替する必要がある場合、人民元のドル高は私たちが両替から得た人民元金額に悪影響を与えます。逆に、人民元をドルに両替し、普通株の配当金や他の商業目的を支払うことにした場合、ドルは人民元の上昇が私たちが利用できるドル金額にマイナス影響を与えるだろう。
| 第十二項。 |
株式証券を除くその他の証券説明 |
| A. |
債務証券 |
適用されません。
| B. |
株式証明書と権利を認める |
適用されません。
| C. |
その他の証券 |
適用されません。
| D. |
アメリカ預託株 |
適用されません。
第II部
| 十三項。 |
違約、延滞配当金、延滞配当金 |
ない。
| 14項です。 |
保証所有者の権利と収益使用の実質的な改正 |
当社の普通株式保有者権利の説明については、“第10項.補足資料--B.組織覚書及び定款細則”を参照し、当該等の権利は不変である。
| 第十五項。 |
制御とプログラム |
| (a) |
制御とプログラムを開示する |
我々の経営陣は、最高経営責任者と財務責任者の参加の下、本報告で述べた期間終了までの開示制御および手順(取引所法第13 a-15(E)条で定義されているような)の有効性を評価し、2021年12月31日に我々の開示制御および手続きが発効すると結論した。
| (b) |
経営陣財務報告内部統制年次報告書 |
我々の経営陣は、取引所法案第13 a-15(F)及び15 d-15(F)条の規定に基づいて、財務報告の十分な内部統制を確立·維持する責任がある。我々の財務報告に対する内部統制は、米国公認会計原則に基づいて、当社の財務報告の信頼性と、外部目的の財務諸表作成のための合理的な保証を提供することを目的としたプロセスであり、(1)当社の資産取引および処分を合理的かつ詳細に正確かつ公平に反映する記録の保持に関連する政策および手順、(2)米国GAAPに基づいて連結財務諸表を作成するために必要な取引が記録され、わが社の収入および支出は、私たちの経営陣および取締役の許可のみに基づいて行われる合理的な保証を提供する。(3)連結財務諸表に重大な影響を及ぼす可能性のある不正買収、使用または処分について、当社の資産を防止またはタイムリーに発見することについて合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来の間にどのような有効性評価を行うかの予測には,条件の変化により制御が不十分になる可能性や,政策やプログラムの遵守度が悪化する可能性があるというリスクがある.
“サバンズ·オキシリー法案”第404条と米国証券取引委員会が公布した関連規則の要求に基づき、最高経営責任者や最高財務責任者を含む経営陣は、テレデビル委員会後援組織委員会が発表した報告“内部統制-総合枠組み(2013)”で提出された基準を用いて、2021年12月31日までの財務報告の内部統制の有効性を評価した。この評価によると、経営陣は、財務報告書に対する内部統制は2021年12月31日から有効であると結論した。
2021年12月31日現在、当社の独立公認会計士事務所安永華明法律事務所は、財務報告の内部統制を評価する必要はありません。
| (c) |
公認会計士事務所認証報告 |
上文(B)節の陳述を参照。JOBS法案で定義されている“新興成長型会社”としては、サバンズ·オクスリ法案404節の監査人認証要件(およびその下の“米国証券取引委員会”規則および条例)を含む様々な報告要件を遵守するために、いくつかの臨時免除を利用することができる。このような免除が適用を停止した場合、私たちは追加費用が発生することが予想され、これらの免除を遵守することを保証するためにより多くの管理努力が投入される。
| (d) |
財務報告の内部統制の変化 |
本20-F表年次報告書がカバーしている間、私たちは財務報告の内部統制に大きな影響を与えないか、または合理的に私たちの財務報告の内部統制に大きな影響を与える可能性のある変化はありません。
| 第十六項。 |
[保留されている] |
| プロジェクト16 A。 |
監査委員会財務専門家 |
取締役独立役員、監査委員会のパトリック·ファビオは監査委員会の財務専門家。
| プロジェクト16 B。 |
道徳的規則 |
私たちの初公募株について、私たちは私たちのすべての役員、幹部、従業員に適用される書面道徳基準を採択しました。道徳基準は、当サイトの投資家部分(www.beyondspringpharma.com/コーポレート·ガバナンス)で取得することができます。
| プロジェクト16 Cです。 |
チーフ会計士費用とサービス |
以下の指定カテゴリは,我々の主要な非常勤原子力数師安永華明法律事務所が指定期間中に提供するいくつかの専門サービスに関する費用総額を示す.
| 十二月三十一日までの年度 |
||||||||
| 2020 |
2021 |
|||||||
| (千ドル単位(“$”) |
||||||||
| 料金を審査する(1) |
$ | 513 | $ | 800 | ||||
| 監査関連費用(2) |
150 | 8 | ||||||
| 税金.税金(3) |
- | - | ||||||
| 他のすべての費用(4) |
- | - | ||||||
| 合計する |
$ | 663 | $ | 808 | ||||
| (1) |
“監査費用”とは、2021年の財務諸表の中間審査および年度監査、その他の保証サービスの総費用を意味します。 |
| (2) |
“監査関連費用”とは、我々の主要監査人に提供される保証及び関連サービスのために列挙された各会計年度の費用総額を意味し、これらの費用は、我々の財務諸表の監査又は審査のパフォーマンスと合理的に関連しているが、“監査費用”の項では報告されていない |
| (3) |
“税料”とは、我々の主な監査人が提供する専門税務サービスについて記載された各会計年度の総費用をいう。 |
| (4) |
“その他すべての費用”とは、我々の主な監査人が提供するサービスの総費用を意味するが、“監査費用”、“監査関連費用”、“税費”の項目で報告されるサービスは除外される |
監査委員会があらかじめ承認した政策と手続き
私たちの監査委員会は、この政策に基づいて、監査委員会が事前にそのサービスを承認しない限り、私たちの監査人を招いていかなる非監査サービスも実行しない政策を採択した。
| プロジェクト16 Dです。 |
監査委員会の上場基準の免除 |
適用されません。
| プロジェクト16 E。 |
発行者および関連購入者が株式証券を購入する |
適用されません。
| プロジェクト16 Fです。 |
登録者の認証会計士を変更する |
適用されません。
| プロジェクト16 Gです。 |
会社の管理 |
ケイマン諸島がナスダック資本市場に上場することを免除している会社として、私たちはナスダック社の上場基準の制約を受けています。しかし、ナスダック規則は私たちのような外国の個人発行者がその母国の会社統治慣行に従うことを可能にする。ケイマン諸島(私たちの祖国)のいくつかの会社管理のやり方はナスダック社の上場基準とは大きく異なるかもしれない。Maples and Calder(Hong Kong)LLP、私たちのケイマン諸島法律顧問は、ケイマン諸島の法律によって、私たちが毎年年次株主総会を開催する必要がないことを証明する手紙をナスダック株式市場に提供しました。我々は年次会議では一般に母国のやり方に従っており,2021年に年次株主総会は開催されていない。我々は2021年3月15日に特別株主総会を開催し、株主に2017年総合インセンティブ計画の承認を求めた。株主の承認を必要とする事項がある場合にのみ、将来的に年次株主総会を開催することを予想しています。さらに、私たちは将来、株式報酬計画の重大な修正(発行された株式オプションの再定価を許可する重大な変化に関する修正を含む)が株主の承認を得なければならないというナスダックの要求に従わないことを選択するかもしれない。
上記の年次総会の慣例を除いて、わが社の管理慣例はアメリカ国内の会社がナスダック株式市場規則に従う会社管理慣例と有意差はない。
しかし、もし私たちが将来的に他の母国のやり方に従うことを選択すれば、私たちの株主が獲得した保護は、米国国内発行者に適用されるナスダック社の上場基準よりも少なくなる可能性がある。“第3項、主要な情報-D.リスク要素-私たちの普通株に関連するリスク--外国の個人発行者として、著者らはナスダック資本市場会社の管理上場標準と大きく異なる会社管理事項にある母国のやり方を採用することを許可された。企業管理の上場基準を完全に守れば、これらのやり方は株主の保障が少ないかもしれない“と述べた
| プロジェクト16 Hです。 |
炭鉱安全情報開示 |
| プロジェクト16. |
検査妨害に関する外国司法管区の開示 |
適用されません。
第III部
| 17項です。 |
財務諸表 |
私たちはプロジェクト18に従って財務諸表を提供することを選択した。
| 第十八項。 |
財務諸表 |
万春医薬の連結財務諸表は,本年度報告末のForm 20−Fに含まれている。
| 第19項。 |
陳列品 |
| 1.1(1) |
“万春医薬会社定款”を改正し、再制定する。 |
| 2.1(1) |
万春医薬普通株証明書サンプル。 |
| 2.2(2) |
取引法第12条により登録された証券説明 |
| 4.1(1) |
万春医薬とGKOL Inc.の間のコンサルティング協定は、2013年6月18日である。 |
| 4.2(1) |
万春医薬、万春医薬アメリカとGKOL Inc.の間のコンサルティング協定第一修正案は、日付は2014年3月30日である。 |
| 4.3(11) |
万春医薬アメリカ会社とGKOL Inc.が2021年1月1日に調印した諮問協定の第11項改正案。 |
| 4.4(11) |
2021年3月15日現在、万春医薬米国会社とGKOL Inc.の間の諮問協定第12修正案。 |
| 4.5(2) |
2022年1月1日現在、万春医薬米国会社とGKOL Inc.の間の諮問協定第13修正案。 |
| 4.6(1) |
万春医薬、万春生物科学技術とNereusの間の終了協定は2015年2月2日である |
| 4.7(2) |
万春医薬アメリカ会社と蘭Huangの間の二回目の改訂と再署名の雇用協定は、期日は2022年1月11日です |
| 4.8(2) |
2回目の改正と再署名の雇用協定は、2022年1月11日に、万春医薬米国会社とラモン·モハラールが署名した |
| 4.9(2) |
万春医薬アメリカ会社とゴードン·L·スクーリーの間の第二次改正と再署名の雇用協定は,2022年1月11日である |
| 4.10(1) |
役員と役員の賠償協議形式 |
| 4.11(1) |
万春医薬2017年総合インセンティブ計画と関連フォーマット協定 |
| 4.12(11) |
万春医薬2017年総合インセンティブ計画改正案は、2020年9月18日から施行される |
| 4.13(10) |
“役員”協議形式 |
| 4.14(10) |
“役員合意修正案”形式 |
| 4.15(4) |
万春医薬会社とラモン·モハラル社2017年4月11日現在の公衆宣伝局-002マイルストーン株式ボーナス賞に関する書面合意 |
| 4.16(4) |
万春医薬会社とラモン·モハラル社2017年4月11日現在の公衆宣伝局-004マイルストーン株式ボーナス賞に関する書面合意 |
| 4.17(5) |
万春医薬アメリカ会社とリチャード·デイリーの間の雇用協定は、2018年6月8日です |
| 4.18(6) |
万春医薬とジェフリー有限責任会社の間の公開市場販売協定は、2019年5月21日となっています |
| 4.19(7) |
万春医薬会社とジェフリー有限責任会社との間の期日が2020年2月7日の公開市場販売協定の第1号改正案 |
| 4.20(8) |
大連万春歩林製薬有限会社、万春生物科学技術有限公司と深セン市恩豊第九創業投資センター(有限組合)の増資協議の英訳本は、2019年6月14日 |
| 4.21(8) |
大連万春歩林製薬有限公司、万春生物科技有限公司と南京泰文投資組合企業(有限組合)の増資協議の英訳本は、2019年7月3日 |
| 4.22(9) |
万春医薬アメリカ社とリチャード·デイリー社が2019年9月24日に署名した雇用協定改正案 |
| 4.23(9) |
万春医薬米国とリチャード·デイリーが2019年12月26日に署名した雇用協定第2修正案 |
| 4.24(2) |
万春医薬米国とリチャード·デイリーが2021年10月12日に署名した雇用協定第3修正案 |
| 4.25(2) |
万春医薬アメリカと蘭Huangの間の書簡協定、期日は2022年1月13日です |
| 4.26(2) |
万春医薬アメリカ会社とラモン·W·モハンラルが2022年1月13日に署名した書簡協定 |
| 4.27(2) |
万春医薬アメリカ会社とゴードン·スクリー社が2022年1月13日に署名した書簡協定 |
| 4.28(2) |
初めて改訂·再署名された雇用協定は、2022年1月11日に、万春医薬米国会社とエリザベス·チェレックが署名した |
| 4.29(2) |
万春医薬アメリカ会社とエリザベス·チェルパーク間の書簡合意、期日は2022年1月13日 |
| 4.30(11) |
万春医薬会社とジェフリー·ヴァシカとの間のコンサルティング契約は、2021年1月26日です |
| 4.31(2) |
万春医薬会社とブランドン·ドレニ間のコンサルティング契約は、2021年11月6日となっています |
| 4.32(2) |
万春医薬アメリカ社とリチャード·デイリー社が2022年1月27日に調印した別居協定 |
| 8.1(2) |
万春医薬の子会社リスト。 |
| 12.1(2) |
首席執行幹事は2002年のサバンズ·オキシリー法第302条に基づいて発行された証明書 |
| 12.2(2) |
2002年サバンズ·オクスリ法第302条に基づく首席財務官の証明 |
| 13.1(3) |
主任執行役員は2002年のサバンズ·オキシリー法第906条に基づいて発行された証明書 |
| 13.2(3) |
2002年サバンズ·オキシリー法第906条に基づく最高財務官の証明 |
| 15.1(2) |
安永華明法律事務所同意 |
| 15.2(2) |
Maples and Calder LLP同意書 |
| 15.3(2) |
韓坤法律事務所は同意しました |
| 101.INS |
XBRLインスタンスドキュメントを連結する |
| 101.書院 |
イントラネットXBRL分類拡張アーキテクチャ文書 |
| 101.カール |
インラインXBRL分類拡張計算リンクライブラリ文書 |
| 101.def |
インラインXBRL分類拡張Linkbase文書を定義する |
| 101.介護会 |
XBRL分類拡張ラベルLinkbase文書を連結する |
| 101.Pre |
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
| 104 | 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) |
| (1) |
表F−1(文書番号333−214610)と共に以前に提出された登録声明は、改訂され、2016年11月15日に最初に提出され、参照によって本明細書に組み込まれる。 |
| (2) |
本年度報告書とともに提出されたテーブル20−F。 |
| (3) |
本年度報告書は20-F表で提供される。 |
| (4) |
万春医薬を参考に2017年4月28日に米国証券取引委員会に提出されたForm 20-F 2016年年報が合併された。 |
| (5) |
万春医薬を引用して2019年4月30日に米国証券取引委員会に提出された2018年年報20-F表を引用した。 |
| (6) |
これまで万春医薬に提出されていたForm 6−Kは,2019年5月22日に米国証券取引委員会に提出され,引用により本明細書に組み込まれた。 |
| (7) |
これまで万春医薬に提出されていたForm 6−Kは,2020年2月7日に米国証券取引委員会に提出され,引用により本明細書に組み込まれた。 |
| (8) |
これまで万春医薬に提出されていたForm 6−Kは,2019年7月10日に米国証券取引委員会に提出され,引用により本明細書に組み込まれた。 |
| (9) |
万春医薬を引用して2020年4月30日にアメリカ証券取引委員会に提出した2019年年報20-F表を提出した。 |
| (10) |
これまで万春医薬に提出されていたForm 6−Kは,2020年7月24日に米国証券取引委員会に提出され,引用により本明細書に組み込まれた。 |
| (11) |
引用万春医薬会社は2021年4月30日に米国証券取引委員会に提出された2020年年次報告Form 20−Fを引用した。 |
本年度報告書20−F表の添付ファイルとしての合意を検討する際には、これらの合意は、私たちまたは合意の他の当事者に関する任意の他の事実または開示情報を提供するためではなく、その条項に関する情報を提供するためのものであることを覚えておいてください。
協定は適用されたプロトコルのすべての当事者の陳述と保証を含むことができる。これらの陳述と保証は、完全に合意を適用する他の当事者の利益のために行われ、:
| ● |
すべての場合、事実の明確な陳述とみなされるべきではなく、事実証明が不正確である場合に一方の当事者にリスクを割り当てる方法である |
| ● |
これらの開示は、必ずしも合意に反映されるとは限らないが、適用合意の交渉に関連する他方への開示によって制限される |
| ● |
重要性基準は、あなたまたは他の投資家が重要とみなされる可能性のある基準とは異なる方法で適用することができる |
| ● |
適用されるプロトコルの日付またはプロトコルに規定されている他の1つまたは複数の日付のみが行われ、最近の事態の発展に依存する。 |
したがって、これらの陳述および保証は、それが行われた日まで、または任意の他の時間における実際の状況を説明してはならない。
サイン
万春医薬はここで、同社が20-F表を提出するすべての要求に符合し、そして以下の署名者が本20-F表の年次報告書に署名することを促進し、許可したことを証明した。
| 万春医薬。 | |||
| 差出人: | /s/蘭·Huang | ||
| 名前: | ラン·Huang | ||
| タイトル: | 最高経営責任者 | ||
日付:2022年4月14日
連結財務諸表索引
| ページ |
|
| 万春医薬が監査された合併財務諸表。 |
|
| 独立公認会計士事務所レポート(PCAOB ID: |
F-2 |
| 2021年12月31日現在と2020年12月31日現在の連結貸借対照表 |
F-3 |
| 2021年,2020年と2019年12月31日までの総合全面損失表 |
F-5 |
| 2021年まで、2020年と2019年12月31日までの年度株主権益(赤字)総合レポート |
F-6 |
| 2021年、2020年、2019年12月31日終了年度統合キャッシュフロー表 |
F-7 |
| 連結財務諸表付記 |
F-8 |
独立公認会計士事務所報告
万春医薬の株主と取締役会へ。
財務諸表のいくつかの見方
添付万春医薬(当社)の2021年12月31日まで、2021年12月31日と2020年12月31日までの合併貸借対照表、2021年12月31日までの各年度の関連総合損失表、株主権益(損失表)とキャッシュフロー表および関連付記(総称して“合併財務諸表”と呼ぶ)を監査しました。総合財務諸表は,2021年12月31日と2020年12月31日の会社の財務状況,および2021年12月31日までの3年度の経営結果とキャッシュフローをすべての重要な面で公平に反映しており,米国公認会計原則に適合していると考えられる。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/
2015年以来、当社の監査役を務めてきました。
2022年4月14日
万春医薬。
合併貸借対照表
(金額は千ドル(“$”)単位で、株式数や1株当たりのデータは含まれていません)
| 12月31日まで | ||||||||||||
| 注意事項 | 2020 | 2021 | ||||||||||
| $ | $ | |||||||||||
| 資産 | ||||||||||||
| 流動資産: | ||||||||||||
| 現金と現金等価物 | ||||||||||||
| 短期投資 | 3 | |||||||||||
| 仕入先への前払い | ||||||||||||
| 前払い費用と他の流動資産 | ||||||||||||
| 流動資産総額 | ||||||||||||
| 非流動資産: | ||||||||||||
| 財産と設備、純額 | 5 | |||||||||||
| 経営的リース使用権資産 | ||||||||||||
| 他の非流動資産 | 14 | |||||||||||
| 非流動資産総額 | ||||||||||||
| 総資産 | ||||||||||||
| 負債と権益 | ||||||||||||
| 流動負債: | ||||||||||||
| 売掛金 | ||||||||||||
| 費用を計算する | ||||||||||||
| 賃貸負債の当期部分を経営する | 13 | |||||||||||
| 収入を繰り越す | 4 | |||||||||||
| 長期ローン、今期の部分 | 6 | |||||||||||
| その他流動負債 | 14 | |||||||||||
| 流動負債総額 | ||||||||||||
| 非流動負債: | ||||||||||||
| 長期ローン | 6 | |||||||||||
| リース負債を経営する | 13 | |||||||||||
| 収入を繰り越す | 4 | |||||||||||
| 他の非流動負債 | ||||||||||||
| 非流動負債総額 | ||||||||||||
| 総負債 | ||||||||||||
| 引受金とその他の事項 | 18 | |||||||||||
万春医薬。
合併貸借対照表(続)
(金額は千ドル(“$”)単位で、株式数や1株当たりのデータは含まれていません)
| 12月31日まで | ||||||||||||
| 注意事項 | 2020 | 2021 | ||||||||||
| $ | $ | |||||||||||
| 中間株権 | ||||||||||||
| 非持ち株権を償還することができます | 15 | |||||||||||
| 権益 | ||||||||||||
| 普通株(普通株)額面価値ライセンス株;そして2020年12月31日と2021年12月31日にそれぞれ発行·発行された株) | ||||||||||||
| 追加実収資本 | ||||||||||||
| 赤字を累計する | ( | ) | ( | ) | ||||||||
| その他の総合損失を累計する | 17 | ( | ) | ( | ) | |||||||
| 万春医薬合計株主権益 | ||||||||||||
| 非制御的権益 | ( | ) | ( | ) | ||||||||
| 総株 | ||||||||||||
| 総負債、中間所有権、権益 | ||||||||||||
付記はこれらの連結財務諸表の構成要素である。
万春医薬。
総合総合損失表
(金額は千ドル(“$”)単位で、株式数や1株当たりのデータは含まれていません)
| 十二月三十一日までの年度 | ||||||||||||||||
| 注意事項 | 2019 | 2020 | 2021 | |||||||||||||
| $ | $ | $ | ||||||||||||||
| 収入.収入 | 4 | |||||||||||||||
| 運営費 | ||||||||||||||||
| 研究開発 | ( | ) | ( | ) | ( | ) | ||||||||||
| 一般と行政 | ( | ) | ( | ) | ( | ) | ||||||||||
| 運営損失 | ( | ) | ( | ) | ( | ) | ||||||||||
| 為替で利益を損ねる | ( | ) | ||||||||||||||
| 利子支出 | ( | ) | ( | ) | ( | ) | ||||||||||
| 利子収入 | ||||||||||||||||
| その他の収入、純額 | ||||||||||||||||
| 所得税前損失 | ( | ) | ( | ) | ( | ) | ||||||||||
| 所得税費用 | 8 | ( | ) | |||||||||||||
| 純損失 | ( | ) | ( | ) | ( | ) | ||||||||||
| 差し引く:非持株権益は純損失を占めるべき | ( | ) | ( | ) | ( | ) | ||||||||||
| 万春医薬は純損失を占めなければならない. | ( | ) | ( | ) | ( | ) | ||||||||||
| 1株当たり純損失 | ||||||||||||||||
| 基本的希釈の | 9 | ( | ) | ( | ) | ( | ) | |||||||||
| 加重平均流通株 | ||||||||||||||||
| 基本的希釈の | 9 | |||||||||||||||
| その他の総合損失、税引き後純額はゼロ | ||||||||||||||||
| 外貨換算調整損益 | 17 | ( | ) | ( | ) | |||||||||||
| 未達成保有収益 | 17 | |||||||||||||||
| 総合損失 | ( | ) | ( | ) | ( | ) | ||||||||||
| 差し引く:非持株権益の総合損失 | ( | ) | ( | ) | ( | ) | ||||||||||
| 万春医薬による総合的な損失。 | ( | ) | ( | ) | ( | ) | ||||||||||
付記はこれらの連結財務諸表の構成要素である。
万春医薬。
合併株主権益報告書(損失)
(金額は千ドル(“$”)単位で、株式数や1株当たりのデータは含まれていません)
| 万春医薬の株主 | ||||||||||||||||||||||||||||||||
| 積算 | ||||||||||||||||||||||||||||||||
| その他の内容 | 他にも | ありません | ||||||||||||||||||||||||||||||
| 普通株 | 支払い済み | 積算 | 全面的に | 制御管 | 合計する | |||||||||||||||||||||||||||
| 株 | 金額 | 資本 | 赤字.赤字 | 収益を損ねる | 小計 | 利益. | 株権 | |||||||||||||||||||||||||
| $ | $ | $ | $ | $ | $ | $ | ||||||||||||||||||||||||||
| 2019年1月1日の残高 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||||
| 普通株の発行 | ||||||||||||||||||||||||||||||||
| 非持株権益出資 | - | |||||||||||||||||||||||||||||||
| 株式ベースの報酬(付記10) | ||||||||||||||||||||||||||||||||
| 非持株権益出資 | - | ( | ) | ( | ) | |||||||||||||||||||||||||||
| その他全面収益(赤字) | - | ( | ) | |||||||||||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||||
| 2019年12月31日の残高 | ( | ) | ||||||||||||||||||||||||||||||
| 普通株の発行 | ||||||||||||||||||||||||||||||||
| 非持株権益出資 | - | |||||||||||||||||||||||||||||||
| 株式ベースの報酬(付記10) | ||||||||||||||||||||||||||||||||
| 非持株権益出資 | - | ( | ) | ( | ) | |||||||||||||||||||||||||||
| その他総合損失 | - | ( | ) | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||||
| 2020年12月31日の残高 | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||||||
| 株式ベースの報酬(付記10) | ||||||||||||||||||||||||||||||||
| 没収された制限株と普通株の解約 | ( | ) | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||||
| 購入権を行使する | ||||||||||||||||||||||||||||||||
| 非制御的権益の増加もあります | - | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||||||
| その他総合損失 | - | ( | ) | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||||
| 純損失 | - | ( | ) | ( | ) | ( | ) | ( | ) | |||||||||||||||||||||||
| 2021年12月31日の残高 | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||||||
付記はこれらの連結財務諸表の構成要素である。
万春医薬。
統合現金フロー表
(金額は千ドル(“$”)単位で、株式数や1株当たりのデータは含まれていません)
| 十二月三十一日までの年度 | ||||||||||||||||
| 注意事項 | 2019 | 2020 | 2021 | |||||||||||||
| $ | $ | $ | ||||||||||||||
| 経営活動のキャッシュフロー: | ||||||||||||||||
| 純損失 | ( | ) | ( | ) | ( | ) | ||||||||||
| 純損失と業務活動で使用されている現金の照合の調整: | ||||||||||||||||
| 減価償却費用 | 5 | |||||||||||||||
| 株式ベースの報酬 | 10 | |||||||||||||||
| 非現金でレンタル料金を扱っております | ||||||||||||||||
| 使用権資産終了損失確認 | ||||||||||||||||
| 賃金保障計画ローン免除 | 6 | ( | ) | |||||||||||||
| 短期投資の未実現収益 | 3 | ( | ) | |||||||||||||
| 長期契約における公正価値の変動 | 16 | ( | ) | |||||||||||||
| 資産と負債の変動状況: | ||||||||||||||||
| 短期投資 | ( | ) | ||||||||||||||
| 仕入先への前払い | ( | ) | ||||||||||||||
| 関係者が支払うべき金 | 7 | |||||||||||||||
| 前払い費用と他の流動資産 | ( | ) | ( | ) | ||||||||||||
| 他の非流動資産 | ( | ) | ( | ) | ( | ) | ||||||||||
| 売掛金 | ( | ) | ( | ) | ( | ) | ||||||||||
| 費用を計算する | ( | ) | ( | ) | ||||||||||||
| リース負債を経営する | ( | ) | ( | ) | ( | ) | ||||||||||
| その他流動負債 | ( | ) | ||||||||||||||
| 収入を繰り越す | ||||||||||||||||
| 他の非流動負債 | ||||||||||||||||
| 経営活動のための現金純額 | ( | ) | ( | ) | ( | ) | ||||||||||
| 投資活動によるキャッシュフロー: | ||||||||||||||||
| 財産と設備を購入する | ( | ) | ( | ) | ( | ) | ||||||||||
| 短期投資を購入する | ( | ) | ||||||||||||||
| 短期投資を売却する | ||||||||||||||||
| 短期投資の満期日から | ||||||||||||||||
| 投資活動のための現金純額 | ( | ) | ( | ) | ( | ) | ||||||||||
| 資金調達活動のキャッシュフロー: | ||||||||||||||||
| 普通株を発行して得られる収益は,引受割引と手数料を差し引く | ||||||||||||||||
| 非制御権益を償還して得られた金を発行するか,発行コストを差し引くことができる | ||||||||||||||||
| 非持株権益出資 | ||||||||||||||||
| 長期契約を発行して得られた収益 | 16 | |||||||||||||||
| 持分を行使して得た金 | ||||||||||||||||
| 要約費用を支払う | ( | ) | ( | ) | ( | ) | ||||||||||
| 非制御資本の発行コストを支払うか、または償還可能な発行コスト | ( | ) | ||||||||||||||
| 融資収益 | 6 | |||||||||||||||
| 関係者が収益を借り入れる | 7 | |||||||||||||||
| ローンを返済する | 6 | ( | ) | |||||||||||||
| 関係者の借金を返済する | 7 | ( | ) | ( | ) | |||||||||||
| 融資活動が提供する現金純額 | ||||||||||||||||
| 為替レート変動の影響 | ( | ) | ( | ) | ||||||||||||
| 現金および現金等価物の純増加(減額) | ( | ) | ||||||||||||||
| 年初現金および現金等価物 | ||||||||||||||||
| 年末現金および現金等価物 | ||||||||||||||||
| キャッシュフロー情報の補足開示 | ||||||||||||||||
| 支払の利子 | ||||||||||||||||
| 受け取った利息 | ||||||||||||||||
| 非現金活動: | ||||||||||||||||
| 経営リース賃貸負債の経営と引き換えに使用権資産 | ||||||||||||||||
| 経営的リース資産を経営的リース負債と交換する | ( | ) | ||||||||||||||
付記はこれらの連結財務諸表の構成要素である。
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 1. | 業務的性質 |
万春医薬(“当社”)は翌年ケイマン諸島に登録設立された2014年11月21日当社とその付属会社(総称して“当グループ”)は,革新的な癌療法の開発に重点を置いた臨床段階バイオ製薬活動に主に従事している。当社は登録が成立して以来、賈林清さんとHuang博士夫妻(総称して“創設者”と呼ばれる)によってコントロールされています。
開ける2017年3月14日会社は“ナスダック”資本市場での初公募株を完成させた。
開ける2019年5月21日当社はJefferies LLC(“Jefferies”)と販売協定を締結し、代理で自社普通株を市場発売計画(“ATM”)で売却している。自分から2021年12月31日同社が受け取った毛収入総額は#ドルだった
開ける2019年6月14日そして2019年7月3日深セン恩豊をはじめとするある投資家第九創業投資センター(有限組合)(“恩豊資本”)は当社の付属会社大連万春布林薬業有限公司(“万春プリン”)と投資協定を締結し、$を投資する
開ける2019年6月25日SEED治療会社(“SEED”)は英領バージン諸島(“英領バージン諸島”)に当社の子会社として登録されている。
はい2019年7月当社は公募株の発行を完了した
はい10月そして2019年11月、当社は公募株の発行を完了した
開ける2019年12月9日種子科学技術有限公司(“種子科学技術”)は英領バージン諸島に登録して設立され、万春布林の完全な付属会社である。
はい2020年6月当社は公募株の発行を完了した
開ける2020年6月18日当社は株式引受契約を締結し,共同販売を行っている
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 1. | 業務性質(継続) |
はい2020年11月当社は公募株の発行を完了した
開ける2020年11月25日Seed Treateutics US,Inc.(“SEED US”)が米国で登録成立した。SEEDの完全子会社として。
自分から2021年12月31日当社の付属会社は以下の通りです
| 会社名 | 登録設立場所 | 日取り 法団に成立する | パーセント 所有権の から 会社 | 主な活動 |
| 万春医薬(アメリカ)会社(“万春医薬アメリカ”) | アメリカデラウェア州 | 2013年6月18日 | | 臨床試験活動 |
| 万春医薬有限公司 | 英領バージン諸島 | 2014年12月3日 | | 持株会社 |
| 万春医薬(香港)有限会社(“万春医薬香港”) | 香港.香港 | 2015年1月13日 | | 持株会社 |
| 万春生物科技有限公司(“BVI Biotech”) | 英領バージン諸島 | 2015年4月1日 | | 持株会社 |
| 万春生物科技集団(深セン)有限公司(“万春深セン”) | 中華人民共和国 | 2015年4月23日 | | 持株会社 |
| 大連万春布林製薬有限会社(以下、万春プリン) | 中華人民共和国 | 2015年5月6日 | | 臨床試験活動 |
| 万春医薬オーストラリア製薬有限会社(“万春医薬オーストラリア”) | オーストラリア | 2016年3月3日 | | 臨床試験活動 |
| 北京万春医薬科技有限公司(“北京万春”) | 中華人民共和国 | 2018年5月21日 | | 持株会社 |
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 1. | 業務性質(継続) |
| 会社名 | 登録設立場所 | 日取り 法団に成立する | パーセント 所有権の から 会社 | 主な活動 |
| 種子治療会社(Seed Treateutics Inc.) | 英領バージン諸島 | 2019年6月25日 | | 臨床前開発と活動 |
|
| ||||
| 種子科技有限公司(“種子科学技術”) | 英領バージン諸島 | 2019年12月9日 | | 持株会社 |
|
|
| |||
| Seed Treateuticsアメリカ社(“SEED US”) | アメリカデラウェア州 | 2020年11月25日 | | 臨床前開発活動 |
| 2. | 重要会計政策の概要 |
陳述の基礎
当社の総合財務諸表は米国公認会計原則(“GAAP”)に基づいて作成されています。
経営を続ける企業
会計基準に基づいて編集する(“ASC”)205-40, 財務諸表の列報−継続経営−(“ASC205-40”)は、経営陣は、いくつかの条件やイベントが存在するか否かを評価しなければならず、全体的に見て、これらの状況や事件は、会社が継続的に経営している会社として経営を継続する能力に大きな疑いを抱かせる1つは財務諸表の発表日から1年。この評価は最初はこうでした注釈経営陣計画の潜在的緩和効果を考慮すると、これらの計画は注釈財務諸表の発表日から全面的に実施する。この方法により重大な疑いがある場合、経営陣は、その計画の緩和効果が、会社の持続経営企業としての持続経営能力に対する重大な疑いを緩和するのに十分であるかどうかを評価する。しかし、経営陣計画の緩和効果は、以下の2つの場合にのみ考慮される1)これらの計画は#年内に有効に実行される可能性が高い1つは財務諸表の発表日から1年後、および(2)これらの計画が実施されると、関連条件またはイベントを緩和する可能性が高く、これらの条件またはイベントは、実体に対して継続的な経営を継続する能力があるかどうかを企業として提供することができる1つは財務諸表の発表日から1年。
設立以来、同社は運営により営業損失とマイナスキャッシュフローを出してきた。これまで会社は違います。製品収入と経営陣は、予見可能な将来、運営損失が継続し、主に株式融資を通じてこれらの損失に資金を提供すると予想している。同社は#ドルの純損失が発生した
会社の現金と現金等価物および手元に基づく短期投資2021年12月31日経営陣はそうします注釈会社が継続的に経営している企業として1つはこれらの財務諸表が発表された日から1年。これらの財務諸表は持続的な経営に基づいて作成されている。
強固な基礎
連結財務諸表には、当社及びその子会社の財務諸表が含まれている。当社とその子会社との間のすべての会社間取引と残高は合併時に打ち消されます。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
予算の使用
公認会計基準に従って連結財務諸表を作成することは、報告の資産および負債額、財務諸表の日付、または有資産および負債の開示および報告の期間費用額に影響を与えるために、管理層に推定および仮定を要求する。経営陣が主観的な判断を使っている分野には注釈本報告が述べた期間内に、財務報告に掲載された資料は株式補償、臨床試験課税項目、繰延税金項目資産推定準備、推定不確定な税務状況、使用権資産及び賃貸負債の計量、金融商品の公正価値、推定信用損失準備、長期資産減値及び物件及び設備の使用年限推定に限らない。管理層は過去の経験、既知の傾向及び合理を信じている他の各種仮定に基づいて推定し、その結果は資産及び負債帳簿額面を判断する基礎を構成する。実際の結果はこれらの推定とは異なる可能性がある。
研究と開発(“研究開発”)コスト
会社はASCに従って研究開発コストを計算している730, 研究と開発それは.研究開発コストには,研究開発活動を行うことによるコスト,関係者およびコンサルタントの報酬,福祉および関連コスト,候補製品開発に必要な原材料や用品,特許出願提出による特許関連コスト,臨床承認に関するコスト,および招聘されて臨床開発活動や試験を行う外部サプライヤーの外部コストが含まれる。会社は研究開発費が発生した時に研究開発費を支払う。
将来の研究開発活動のための商品またはサービスの払戻不可能な前払いに関連するコストは繰延資本化される。資本化金額関連貨物の引渡し又はサービス提供時、又は会社が交付又は実行した場合には、研究開発コストとして支出する注釈それは貨物を配送したり、サービスを提供する必要があると予想される。
契約コストと計上項目を検討する
同社はすでに主に中国、アメリカ、ウクライナ、オーストラリアにある研究機関や他の会社と各種の研究·開発契約を締結している。関連金は研究·開発費に計上し,発生時に費用を計上する。同社は想定されている進行中の研究コストの計上項目を記録している。計算すべき負債の十分性を評価する際に、会社は、イベントの段階または完了状況、受信された請求書、および契約コストを含む研究の進捗状況を分析する。いずれの報告期間終了時の当計残高を決定する際には,重大な判断と見積もりを行う。実際の結果は会社の見積もりとは違うかもしれません。当社の歴史的計画制は注釈実際のコストとは大きく異なる。
外貨両替と取引
機能通貨
当社は現在ドルをそのすべての実体の機能通貨としているが、中国の実体とオーストラリア万春医薬を除いて、前者は人民元をその機能通貨、後者はオーストラリアドルをその機能通貨としている。ASCの基準に基づいてそれぞれのビットコインを決定する830, 外貨事務それは.その会社はその報告通貨としてドルを使用している。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
外貨両替と取引(続)
本位貨幣換算
本位貨幣は注釈ドルで計算すると、当社はその年の平均為替レートと貸借対照表の日の為替レートを用いて、経営業績と財務状況をそれぞれ報告通貨ドルに換算する。換算差額は株主権益における累積その他総合損失に計上される。機能通貨以外の通貨建ての取引を取引日の為替レートで換算して機能通貨とする。外貨建ての金融資産と負債を貸借対照表日の為替レートで再計量する。為替損益は総合全面損失表に計上される。
現金と現金等価物
現金と現金等価物には、手元現金と銀行預金、および元の満期日が含まれている三つ購入した日に6ヶ月を超えず、その公正な価値に近いコストで申告する。すべての現金と現金等価物の引き出しと使用は制限されない。
短期投資
元の満期日が大きいように投資する三つ数ヶ月ですが12個月、商業銀行が発行した金融商品は来年度に現金形式で現金化される予定です12個数ヶ月は短期投資に含まれている。
会社の債務証券への投資は米国会計基準に従って会計処理される320-10, 投資する–債務証券:全体(“ASC320-10”)である。当社は債務証券の投資を“満期まで保有”、“取引”または“売却可能”に分類し、その分類はASCが規定するそれぞれの会計方法を決定した320-10.各種証券投資の利子収入を収益に計上する。短期投資を売却した実現損益は特定の識別方法で決定され,損益を実現している間は収益に反映される。
当社には満期日までの債務証券を保有する積極的な意思と能力があり、満期日証券を保有することに分類され、償却コストから信用損失を差し引いて列報を準備している。
主に短期的に販売するために購入·保有する債務証券は取引証券に分類される。取引証券は公正価値で入金される。未実現損益の変化は,毎期収益を他の収入や支出の一部として記録する。取引債務証券は商業銀行が発行した金融商品を含む。
債務証券注釈取引または満期まで保有する証券に分類され、販売可能な証券に分類される。売却可能な債務証券を公正価値に従って列報し、損益控除税引きを実現しなかった後、累計他の総合損失の中に報告する。売却可能な債務証券には、商業銀行が発行する定期預金や金融商品が含まれる。
当社は債務証券への投資減価を定期的に評価している。未実現損失の一部が純損失中の信用損失と対応する信用損失に起因する場合、当社は債務証券の売却に備えられることを確認した。“会社”ができたすべての列報期間中の短期投資の減価損失または信用損失を記録して準備する。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日20120そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
仕入先への前払い
仕入先への前払いには、次のサービス及び材料を購入するための請負業者及び仕入先に支払う現金が含まれています注釈提供されたり受け取ったりします。仕入先への前払いを定期的に審査して、その帳簿価値が減値されたかどうかを決定する。もしサプライヤーがサービスや材料を提供できるかどうかができれば、当社は資産が減価されたと考えている。自分から2020年12月31日そして2021,いくつありますか
賃貸借証書
効き目がある2019年1月1日会社はASCを採用した842,賃貸借証書(“ASC 842”)修正された遡及移行方法を使用して、注釈比較期間を改めて述べる。会社は最初から賃貸契約かどうかを確定しています。当社はリース及び非リース組成物とリース契約を締結し、会社がそのリース合併リース及び非レンタル組成物の政策選択に基づいて、これらの組成物が単一賃貸組成物に計上される。ASCの確認基準によると、レンタルは経営的賃貸または融資的賃貸に分類されます842, 賃貸借証書(“ASC 842”)である。会社のレンタルグループはすべて経営的リースで構成されており、現在まで2020年12月31日そして2021.その会社のレンタル契約はある注釈すべての重大な剰余価値保証または重大な制限契約が含まれている。
レンタル開始日に、当社は存在する関連要因に基づいてレンタルの分類を決定し、使用権(“ROU”)資産と賃貸負債を記録する。純収益資産とはリース期間内に対象資産を使用する権利であり,リース負債とはリースによるリース金の支払い義務である。純収益資産と賃貸負債は賃貸支払いの現在値で計算される注釈でもお金を払いました。可変レンタル料注釈ある指数または比率に依存する資産およびリース負債は、ROU資産およびリース負債計算に含まれず、これらの支払いの債務が発生している間に費用で確認される。会社の賃貸契約に隠されている金利は注釈同社は通常いつでも利用可能であり、レンタル開始日に利用可能な情報に基づく逓増借入金利を用いてレンタル支払いの現在値を決定している。この逓増借款金利は、当社が類似経済環境下で同じ通貨、類似期限、担保方式で借金した固定金利を反映している。純収益資産には、任意のレンタル前金が含まれており、レンタルインセンティブによって減少している。レンタル支払いの経営リース料金はレンタル期間内に直線法で確認します。レンタル条項はレンタルの撤回できない期限に基づいています5月.会社がその選択権を行使すると合理的に確定した場合に賃貸借を延長する選択権を含む。
契約の条項と条件が実質的に変化するたびに、会社は契約がレンタルに属するかどうか、あるいはレンタルを含むかどうかを再評価する。これらの変化には注釈テナント変更の定義に適合する修正に限定され、賃貸変更は、テナントの範囲または価格を変更することを特徴とする特定のタイプの修正である。修正が完了すると注釈賃貸借契約修正の定義に適合し、会社は契約がテナントであるか否か又はテナントを含むか否かを再評価するが、注釈契約がリースであるか否か又はテナントを含む結論が変更されていない場合には,テナント修正枠組みが適用される。もし賃貸契約の修正があれば、会社は賃貸契約修正に単独の契約が生じるかどうかを考慮します。もしそうであれば、元の未修正契約を除いて、会社の単独契約に対する会計処理方式は、任意の他の新しいリース契約と同じである。そうでなければ、会社は、契約中の残りの対価格を再計量および再分配し、改正発効日におけるリース契約の分類を再評価し、テナントに支払うか、またはテナントによって支払う任意の初期直接コスト、リースインセンティブ、および他の支払いを計上する。修正が既存のリースを完全にまたは部分的に終了した場合、当社はレンタル負債を再計量し、既存のレンタルを全部または部分的に終了する割合でROU資産の帳簿価値を減少させ、リース負債の減少とROU資産の減少との間の任意の差額を損益で確認する。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
賃貸借契約を結ぶ
経営リース総合貸借対照表に計上されている経営リース、使用権資産、リース負債。以下の期間満了の賃貸負債1つは貸借対照表の年間は流動負債に分類される。
レンタル契約の初期レンタル期間は12月以下の時間は注釈総合貸借対照表に計上する。これらのレンタル契約のレンタル料金はレンタル期間内の直線に基づいて確認します。
政府支出
資産に関連する政府支出は、受信時に総合貸借対照表で確認され、関連資産の加重平均耐用年数内に他の収入に償却される。次の収入に関連する政府補助金:違います。会社の条件や継続的な義務履行は受信時に他の収入であることを確認する。
財産と設備
財産と設備はコストから減価償却累計と償却を差し引く。減価償却は直線法で計算され、各資産の推定使用年数は以下のように計算される
| カテゴリー | 使用寿命を見込む |
| 事務設備 |
|
| 実験室装置 |
|
| 機動車 |
|
| 賃借権改善 |
|
メンテナンス·メンテナンスコストは発生時に費用を計上し,工場や設備の使用寿命を延長する更新·改善コストは関連資産の補充資本化とした。資産の廃棄·売却·処分は,資産や減価償却口座からコストと減価償却累計を差し引くことで記録されており,いずれも総合全面損失表に反映されている。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
長期資産減価準備
長期資産の減価や処置に関する権威的な指針に基づいて、長期資産の減値審査を行う。長期資産を審査して,その帳簿価値で発生したイベントや環境変化を決定する5月.注釈取り戻すことができます。長期資産は、帳簿価値または公正価値から売却コストを差し引いたより低い者に報告される。ここ数年で2019年12月31日、2020そして2021,“会社”ができたその長期資産の任意の減価損失を記録する。
公正価値計量
当社はASCを採用しております820, 公正価値計量と開示(“ASC820”)は、公正価値を計量する。ASC820公正価値を定義し、公正価値計量の枠組みを構築し、公正価値計量を開示することを要求する。
ASC8201つを作ることです三つ--公正価値レベルは、公正価値を計量する際に使用される投入を優先順位付けして以下のようになります
| • | 水平1-観察可能活発な市場における同じ資産または負債の見積もり(調整されていない)の投入を反映する。 |
| • | 水平2-その他市場で直接または間接的に観察できる投入。 |
| • | 水平3-見えない少数またはサポートの入力違います。市場の活発度。 |
ASC820説明する三つ資産と負債の公正な価値を計量する主な方法:1)市場方法2)収入法と(3)コスト法。市場法は、同じまたは比較可能な資産または負債に関する市場取引によって生成される価格および他の関連情報を使用する。収益法は推定技術を用いて将来の金額を単一の現在価値金額に変換する。この計量は、このような未来の金額に対する現在の市場の予想に基づいて示された価値だ。コスト法は,現在資産の入れ替えに必要な金額に基づいて決定される.
当社の金融商品には、主に現金及び現金等価物、関連先への短期投資、売掛金、償還可能な非持株権益、長期契約、長期ローンが含まれています。償還可能な非持株権益は最初に発行コストを差し引いた発行価格で入金される。当社は償還価値変動が発生した場合に直ちに確認し、各報告期間終了時に非制御権益を償還可能な帳簿価値を償還価値と等しくなるように調整する。当社は、関連銀行が公表した引受·償還見積をもとに、公正価値に応じて商業銀行が発行した金融商品を恒常的に計量する。長期契約の公正価値は独立機関の協力の下で日常的な基礎の上で確定される第三に-当事者評価会社。現金および現金等価物,支払金,関連先金,定期預金および長期融資当期部分の帳簿価値は短期的な性質により公正価値に近い。
自分から2020年12月31日長期ローンの非流動部分の帳簿総額は#ドルである
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
公正価値計量(継続)
資産と負債は公正な価値で恒常的に計量され,現在まで十二月一日31, 2020そして2021要約は以下のとおりである
| 公正価値計量 | ||||||||||||||||
| 繰り返し現れる 公正価値計量 | いつも公平である 価値がある | 活発な市場での見積もりは同じだ資産 (レベル1) | 大切な他の人観察できるのは入力 (レベル2) | 意味が重大である見えない入力 (レベル3) | ||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 2020年12月31日まで | ||||||||||||||||
| 負債: | ||||||||||||||||
| 長期契約(付記16) | ||||||||||||||||
| 2021年12月31日まで | ||||||||||||||||
| 資産: | ||||||||||||||||
| 売却可能な債務証券 | ||||||||||||||||
| 商業銀行発行の投資信託商品 | ||||||||||||||||
| 取引債務証券 | ||||||||||||||||
| 商業銀行発行の投資信託商品 | ||||||||||||||||
| 長期契約(付記16) | ||||||||||||||||
| 公正価値に応じて計量された総資産 | ||||||||||||||||
長期契約の公正価値は定式化推定方法を用いて推定され,この方法は割引キャッシュフローを組み合わせて推定される1つ目は実体株価の公正価値を推定し、確率に基づく推定方法で長期契約の公正価値を推定する。重大な観察不可能な投入には、達成または目標の可能性、市場性の欠如、割引、変動性、および各報告期間終了時の加重平均資本コストが含まれる2020年12月31日そして2021.
次の表は長期契約の公正な価値を推定するための重大な観察できない入力を表す2020年12月31日そして2021:
| 射程距離 | |||||||||||
| 技術を評価する | 観測不可能な入力 | 12月31日まで | |||||||||
| 2020 | 2021 | ||||||||||
| 長期契約 | 現金流を割引する | 即売性に欠けて割引する | % | % | |||||||
| 波動率 | % | % | |||||||||
| 加重平均資金コスト | % | % | |||||||||
| 確率に基づく評価方法 | 偶発的な目標を達成する確率 | % | % | ||||||||
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
公正価値計量(継続)
次の表は,重大で観察できない投入(レベル)を用いて公平な価値で恒常的に計量する長期契約の入金を示している3)が提供された年。
| 長期契約 | ||||
| $ | ||||
| 2019年12月31日現在の残高 | ||||
| 年内に認可される | ( | ) | ||
| 価値変動損益を公正に承諾する | ||||
| 2020年12月31日現在の残高(負債) | ( | ) | ||
| 価値変動収益を公正に承諾する | ||||
| 2021年12月31日現在の残高(資産) | ||||
市場と地理情報を細分化する
会社の経営意思決定者、最高経営責任者は、資源の分配と会社全体の業績評価に関する決定を行う際に、ASCにより合併結果を審査する280, 細分化市場報告この会社は1つは運営と報告可能な部門。その会社はやった注釈内部報告の目的のために、市場や細分化市場を区別する。
ここ数年で2019年12月31日、2020そして2021,当社が確認した収入は $
| 十二月三十一日 | ||||||||
| 2020 | 2021 | |||||||
| 財産と設備純額: | $ | $ | ||||||
| 中華人民共和国 | ||||||||
| アメリカです。 | ||||||||
| 合計する | ||||||||
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
収入確認
ASCの下で606, 取引先と契約した収入(“ASC606”)と、1つのエンティティは、そのクライアントが約束された貨物またはサービスの制御権を取得したときに収入を確認し、その額は、エンティティがこれらの貨物またはサービスの交換から得られると予想される対価格を反映する。決定エンティティがASC範囲内のスケジュールの収入確認を決定する606,このエンティティは以下の操作を実行する5人手順:(1)顧客との契約を決定する,(2)契約中の履行義務を決定する,(3)可変対価格(あれば)を含む取引価格を決定する,(4)契約に取引価格を割り当てる履行義務,および(5)エンティティが履行義務を履行する際に収入を確認する.当社は適用されます5人エンティティが顧客に譲渡された貨物またはサービスと交換するために、取得する権利のある対価格を受け取る可能性が高い場合、契約のステップモード。
契約がASCの範囲内に決定されると606契約開始時に、会社は、どの履行義務を交付しなければならないか、およびこれらの履行義務のうちどれが異なるかを決定するために契約を審査する。当社は、履行義務ごとに当該履行義務に割り当てられた取引価格の金額が収入であることを確認している。
会社は、実体実績と顧客支払との関係に基づいて、合併貸借対照表において契約資産又は契約負債を確認する。契約負債とは、受け取った支払が稼いだ対価格に対する超過部分であり、合併貸借対照表に繰延収入として入金される。その会社は所有している違います。記載期間の契約資産。
協力収入
契約開始時に、会社はその協力スケジュールを分析して、それらがASCの範囲内にあるかどうかを評価する808, 協力手配(“ASC808”)このような配置が、活動の積極的な参加者であり、重大なリスクおよび報酬に直面している締約国の共同経営活動に関連しているかどうかを決定することは、これらの活動の商業的成功に依存する。ASCの範囲内の連携スケジュールに適用される808複数の要素を含む会社1つ目は連携のどの要素がASCの範囲内とみなされるかを決定する808そしてサプライヤーとお客様の関係をより反映してASCの範囲内のプロジェクト606.ASC入金による連携手配要素について808,適切な認識方法を決定し,つねに適用した.
会社が各協議の義務を履行する際に確認すべき適切な収入額を決定するときは、会社は履行する5人-ASCでのSTEPモデル606以上のように。
協力的手配5月.含まれる内容が超過する1つは会計単位は、知的財産権ライセンスの付与、研究開発サービスの提供に関する合意及びその他の成果の交付を含む義務を履行する。取引価格には、一般に、契約開始時に満了した前金と、会社サービスおよび材料の形態で支払いされる可変対価格と、指定されたイベントを実現する際に支払われるべきマイルストーン支払いとが含まれる。一般に,履行義務に割り当てられた対価格は,財の納入やサービス提供による義務履行時に確認され,限定される注釈制約を受ける。収入確認のすべての関連基準が満たされる前に受信された払い戻し不可能な支払いは、繰延収入として記録される。
知的財産権許可証:会社の知的財産権許可に割り当てられた払戻不可能な前払いを評価して、許可が手配中に決定された他の履行義務とは異なるかどうかを決定する。ユニークと判定されたライセンスの場合、会社は、ライセンスが許可者に譲渡され、ライセンスを使用することができ、そこから利益を得ることができる時点で、ライセンスに割り当てられた払戻不可能な前払い費用の収入を確認する。特定されたのは注釈当社は、他の承諾された商品やサービスとは異なり、ライセンスを付与する承諾を他の承諾された商品又はサービスと共に単一の履行義務と見なし、義務を履行することが一定期間内であるかある時点で履行されるかを決定する際に、合併後の商品又はサービスの性質を考慮する。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
収入確認(継続)
協力収入(続)
研究開発サービス:研究開発サービス実績義務に割り当てられた前払い払戻不可金は支払いを延期し,連携収入残業であることを確認した。
マイルストーン支払い:マイルストーン支払いを含む各手配の開始時に、当社はマイルストーンが達成可能であると考えられているかどうかを評価し、可能な金額法を用いて取引価格に含まれる金額を推定する。収入が著しく逆転すれば注釈このような状況が発生した場合、関連するマイルストーン価値は取引価格に含まれる。これらの発見または開発に基づく目標に関連する不確実性を満たすため、それらは、通常、契約開始時に完全に制約される。会社は発見と臨床試験の事実と状況に基づいて、各報告期間内に可変対価格が完全に制限されているかどうかを評価する。発見や開発マイルストーンに関する制約が変化すると,確認された収入が大きく逆転した場合,可変対価格は取引価格に計上される注釈発生する予定です。
印税:販売ベースの特許使用料を含む手配については、販売レベルに基づくマイルストーン支払いを含み、許可が特許権使用料に関連する主要項目とみなされる場合、当社は、(I)関連販売が発生した場合、または(Ii)特許権使用料の一部または全部が割り当てられた履行義務が履行された(または部分的に履行されている)ときに収入を確認する。
総合損失
総合損失は,会社が一定期間取引やその他の事件や状況により発生する権益変動と定義されており,所有者投資や所有者への分配による取引は含まれていない.列報の各期間において、会社の全面赤字には、純損失、外貨換算調整、売却可能な債務証券に関する未実現保有収益が含まれ、総合全面赤字報告書に記載されている。
所得税
当社は貸借対照法を用いて所得税を計算します。この方法によれば、繰延税金資産および負債は、財務報告と資産および負債の税ベースとの間の差に基づいて決定され、差の予想が逆転したときに発効する制定された税率を使用して計量される。推定免税額は以下の場合に提供されます注釈繰延税金資産の一部または全部は注釈実現されました。すべての繰延所得税資産および負債は、総合貸借対照表において非流動資産に分類される。
会社はASCの規定を使用して不確定な税務状況を評価する740, 所得税やそれは財務諸表で確認する前に達成されなければならない税務頭寸の確認限界を規定する。当社は財務諸表において税収頭寸の利益を確認し、当該税収頭寸は“比”そうじゃない“職位の技術的利点のみに基づいて審査を行い、税務機関がすべての関連情報を把握して審査を行うと仮定する。確認閾値を満たす税務頭寸は累積確率法を用いて測定され、その税収割引の最大金額は50歳和解時に現れる可能性。当社の政策は、未確認の税収割引に関する利息と罰金(あれば)を所得税費用の構成要素として確認することです。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
株式ベースの報酬
当社はASCを採用しております718, 補償する—株の報酬(“ASC718”)を説明するために、従業員および非従業員への株式ベースの支払いを示す。ASCによって718,当社は奨励金を分類して責任奨励または持分奨励に計上すべきかどうかを決定した。株式分類株式奨励は、付与日によって公正価値が財務諸表で確認される。負債分類は授権日に奨励された公正価値によって計量され、各報告期間に公正価値によって再計量され、賠償決済まで奨励される。当社は、この報酬が実質的にすべてのサービス条件階層に基づいて帰属されたすべての従業員持分報酬に対する多重報酬であるように、各個別帰属部分の必要なサービス期間内に報酬支出を直線的に確認することを選択した。同社は業績および/または市場条件に応じて付与されたすべての賞に対して加速方法を使用している。業績条件を満たす可能性がある場合にのみ、業績条件を含む報酬の報酬支出が確認される。同社は没収発生期間中に精算し、費用を削減することを選択した。
裁決の修正、置換、または取り消し
裁決条項や条件の変更は裁決の修正とみなされる。逓増補償コストとは、修正された裁決の公正価値が、その条項が修正される直前の元の裁決の公正価値を超える部分(ある場合)であり、修正日の裁決の公正価値及び他の関連要素に基づいて計算される。既得奨励については、会社は修正発生期間中の増分補償コストを確認した。帰属されていない補償については、当社は、残りの必要なサービス期間内に増分補償コストと修正日元補償の残りの未確認補償コストとの和を確認する。修正された裁決の公正価値が改正前の元の裁決の公正価値よりも低い場合、会社が確認した最低補償コストは、元の裁決のコストである。裁決を撤回するとともに裁決または他の価値のある代償を与える(または提案付与)ことは,取消された裁決条項の修正と見なすべきである。同時に代替裁決を付与または提供することなく裁決を取り消すことは和解とみなされる違います。掛け値をつける。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
1株当たり損失
1株当たりの損失はASCで計算する260, 1株当たりの収益それは.普通株1株当たりの基本損失の計算方法は、普通株株主が純損失を除した期間内に発行された普通株の加重平均である。
1株当たり償却損失の計算方法は、償却等値株式(ある場合)の影響調整後の普通株株主が、純損失を除いて期間内に発行された普通株と希薄同値株式の加重平均を占めるべきである。普通株等値株式には、株式および帰属制限株式を在庫株方法で変換して発行可能な普通株が含まれる。普通株等価物の影響が逆希釈である場合、普通株等価物は1株当たりの希薄損失の計算に計上されない。普通株の基本損失と赤字は会社の総合全面損失表に記載されています。
リスクが集中する
信用リスクが集中する
会社を集中的な信用リスクに直面させる可能性のある金融商品には、主に現金と現金等価物、短期投資が含まれる。同社の現金と現金等価物および短期投資は、経営陣が高い信用品質を持つと考えられる金融機関に保管されている。自分から2020年12月31日ほとんどの現金と現金等価物はアメリカにある金融機関が持っています2021年12月31日現金と現金等価物の大部分は米国にある金融機関が保有し、短期投資は米国と中国にある金融機関が保有している注釈これまで現金と現金等価物および短期投資で何の損失もありました。その会社はやった注釈異常信用リスクの影響を受け、商業銀行関係に関連する正常信用リスクを超えていると考えられる。
ビジネス、顧客、政治、社会、経済リスク
同社は活力に満ちたハイテク業界に参加し、以下の任意の分野の変化は会社の将来の財務状況、経営結果またはキャッシュフローに重大な悪影響を及ぼす可能性があると考えている:サービスと製品全体の需要の変化;新規参入者による競争圧力;新技術と業界標準の進歩と新しい傾向;臨床研究機関の変化;いくつかの戦略関係や顧客関係の変化;規制考慮;著作権法規;および会社がその成長を支持するために必要な従業員の能力に関連するリスクを誘致し、維持する。同社の経営は、中国や中国と米国の関係における重大な政治、経済、社会の不確実性の悪影響を受ける可能性もある。
業務リスク
その会社は第三に締約国は臨床開発活動、試験と候補製品の製造過程を支持する。もしこれが第三に各方面がそうしている注釈契約の履行に成功するか、または予想された期限内に任務を達成するか、会社5月.注釈会社の候補薬が規制部門の承認を得ることができれば、会社の業務は大きな影響を受ける可能性がある。同社の主な業務はアメリカと中国です。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
リスクが集中する
貨幣両替リスク
当社の一部の費用はドル以外の通貨、特に人民元で支払います。開ける1994年1月1日中国政府は双為替制度を廃止し、人民銀行中国銀行が毎日オファーする単一為替制度を実行した。しかし、為替レートの統合は確かにそうだ注釈人民元を暗示する5月.いつでもドルや他の外貨に両替できます。すべての外国為替取引は、中国人民銀行または他の中国人民銀行がオファーした為替レートで外貨を売買することを許可された銀行を通じて引き続き行われる。中国人民銀行又はその他の機関は外貨支払いを許可し、支払申請書、及び仕入先の領収書、出荷伝票と署名した契約書を提出する必要がある。
また、人民元の価値は中央政府の政策の変化や中国外国為替取引システムの市場需給に影響する国際経済と政治発展の影響を受けている。
外貨為替リスク
自自2005年7月21日人民元が1かごの特定外貨に対して狭い、管理されている区間で変動することを許可する。人民元の対ドル切り下げ幅は約
当社が資本支出及び運営資金その他の業務目的のためにドルを人民元に両替する必要がある場合、人民元対ドル高は当社が両替から得た人民元金額に悪影響を与える。逆に、当社が人民元をドルに両替して普通配当金、戦略買収や投資あるいはその他の商業目的の支払いに使用することを決定した場合、ドルの人民元切り上げは当社のドル利用可能金額にマイナス影響を与える。また人民元の対ドルレートは大幅に下落しました5月.会社の収益や損失に相当するドルを大幅に減らす。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 2. | 重要会計政策概要(続) |
最近の会計声明
採用された新しい会計基準
はい2019年12月、FASBはASUを発表しました2019-12, 所得税(主題)740): 所得税の会計計算を簡素化するそれは.この更新は、財務会計基準委員会が会計基準の複雑さを低減する全体的な取り組みの一部である所得税の会計処理を簡略化する。修正案にはASC一般原則の一部の例外を削除することが含まれている740,所得税、その他いくつかの分野の簡略化、収入に基づくフランチャイズ税(又は類似税)の会計計算など。本更新におけるいくつかの修正は遡及適用または遡及修正であり、他のすべての修正は前向きに適用されなければならない。会社は以下の点でこの基準を採用した2021年1月1日あったことがある違います。採用後は会社の財務状況や経営結果に大きな影響を与える。
新しい会計基準はすでに注釈まだ採択されていない
はい2021年11月FASBはASUを発表しました2021-10, 政府援助(主題)832):政府援助に対する商業実体の開示それは.この更新要求は、毎年政府とのいくつかの取引を開示し、これらの取引は、贈与金や寄付会計モデルを適用することによって類比計算される。この更新は,次の日以降の年次期間に有効である2021年12月15日早期に申請することを許可しています本ガイドラインは,初回適用日に財務諸表に反映されるすべての取引,初回適用日以降に締結された新たな取引,またはこれらの取引に遡ることに前向きに適用すべきである。その会社はやった注釈新指針の採用は会社の連結財務諸表に実質的な影響を与えることが予想される。
| 3. | 短期投資 |
現在までの短期投資2021年12月31日以下の内容を含む
| 償却する コスト | 毛収入 実現していない 利得 | 毛収入 実現していない 損 | 公正価値 (帳簿純額) | |||||||||||||
| $ | $ | $ | $ | |||||||||||||
| 取引債務証券 | ||||||||||||||||
| 商業銀行発行の投資信託商品 | ||||||||||||||||
| 売却可能な債務証券 | ||||||||||||||||
| 定期預金 | ||||||||||||||||
| 商業銀行発行の投資信託商品 | ||||||||||||||||
| 合計する | ||||||||||||||||
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 4. | 協力収入 |
礼来会社
開ける2020年11月12日同社の子会社SEEDは礼来社(“礼来”)と研究協力と許可協定(“礼来協力協定”)を締結した。礼来会社の協力協定によると、種子会社は、ユビキチンリガーゼアゴニストスクリーニングプラットフォーム技術に関連する知的財産権および他の材料のいくつかの権利を制御し、礼来会社および種子会社は、製造、識別および/または最適化のために、商業的に合理的な努力を使用して研究および開発計画を行うべきである違います。超過三つ礼来社が選択した目標(“礼来目標”)は、礼ごとに目標を適用する研究計画に基づいて、Ubプラットフォーム技術を使用する。
礼来社の協力協定によると、礼来社は種子会社に払い戻し不可能な前払い費用を支払った
ASCの下で606,同社はUbプラットフォーム技術でのライセンスは注釈合成産出物の生産および納入の投入、すなわち化合物を識別するために使用されるため、契約の範囲内では異なる。当社は,研究計画項の下での研究·開発活動が完了するまでの比較的短時間で礼来社に研究·開発サービスを提供する常備義務を有することを決定した三つ礼来会社の目標や契約期間7何年もです。研究開発サービスに割り当てられた取引価格は、顧客が固定期間内に履行する利益を同時に獲得し、消費するため、一定期間にわたって直線的に収入として確認される。臨床前発見、臨床と監督開発マイルストーン支払いは契約開始時に完全に制限され、注釈出来高に含まれています。
礼来会社の協力協定について、当社及び種子科学技術(総称して“BYSIエンティティ”)はいくつかの契約、ノウハウ、材料及び設備及びノウハウプラットフォームに関する文書を種子に譲渡する
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 4. | 協力収入(継続) |
現金収益総額は$
| 2020年12月31日 | ||||
| $ | ||||
| 協力手配 | ||||
| A-2系列優先株の公正価値(付記15) | ||||
| 長期公正価値(付記16) | ||||
| 現金収益総額 | ||||
同社が確認した協力収入は
江蘇恒瑞薬業有限公司。
開ける2021年8月25日当社付属会社の万春プリンは江蘇恒瑞製薬有限公司(“恒瑞”)と独占商業化及び共同開発協定(“恒瑞協力協定”)を締結し、これにより、万春プリンは恒瑞独占経営権を付与し、内地中国及び香港、マカオ及び台湾(“大中国”)でプリブリンのすべての適応(“プリブリン製品”)を販売する。恒瑞協力協定の条項によると、恒瑞はプリブリン製品のすべての商業化責任を負う2021年9月22日販売とマーケティングを含めて、万春プリンはプリプリン製品の製造と供給を含む恒瑞にサービスを提供することに同意した。万春プリンと恒瑞5月.さらにプリプリン製品の研究と開発に関与し,化学療法による好中球減少症(CIN)以外の他の適応と2/3位非小細胞肺癌(NSCLC)の線治療は誰もが共有します50%研究開発コストの一部です恒瑞協力協定はプリブリンのすべての製品関連知的財産権の特許保護期間が満了するまで有効になるだろう。
恒瑞協力協定によると、恒瑞は万春プリンに払い戻しできない前払い費用を支払った
恒瑞協力協定はASCの範囲に属する808双方とも積極的な参加者であるため、直面するリスクとリターンは、合意に基づいて行われる活動の商業的成功に依存する。同社は合意に基づいて以下の材料部品を決定した1)プリブリン製品の独占商業化権利ライセンス(以下、ライセンスと略す)、(2)プリンプリン製品の製造および供給(“製造および供給サービス”);および(3)他の適応のためのプリブリン製品の研究および開発。当社はさらに,プリプリン製品の独占商業化権利の許可およびプリンプリン製品の製造と供給がサプライヤーと顧客の関係を反映していることを決定したため,ASCの範囲に属する606,他の適応のためのプリプリン製品の研究と開発注釈ASCの範囲内でのお客様への約束606.
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 4. | 協力収入(継続) |
江蘇恒瑞薬業有限公司。(続)
同社はライセンスと製造と供給サービスは注釈それらはお互いに違って、単一の義務を代表している。この手配された取引価格は前金#ドルです
| 5. | 財産と設備、純額 |
財産と設備は:
| 十二月三十一日 | ||||||||
| 2020 | 2021 | |||||||
| $ | $ | |||||||
| 事務設備 | ||||||||
| 実験室装置 | ||||||||
| 機動車 | ||||||||
| 賃借権改善 | ||||||||
| 減算:減価償却累計 | ( | ) | ( | ) | ||||
| 財産と設備、純額 | ||||||||
年度までの減価償却費用2019年12月31日、2020そして2021はい$です
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 6. | 長期ローン |
開ける2019年3月28日その会社は一つ借り入れた-元金$の1年間の定期ローン
開ける2020年5月3日その会社は獲得した-元金$の1年間の定期ローン
| 7. | 関係者取引 |
各列報年度の関連先取引は以下のとおりである
関係者への融資
はい2018年12月会社は#ドルの総額無利子融資を提供した
関係者ローン
はい2019年3月、会社が借り入れた無利子融資総額は#ドルである
はい2019年4月、当社は深セン市三ゲル智創投資有限公司と合意し、ドルを借り入れます
はい2019年7月当社は会社の非持株株主大連万春生物科技株式有限公司(“万春生物科学技術”)と契約を締結し、1つのプロジェクトを借り入れる1つは-1年間の無利子融資
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 7. | 関係者取引(継続) |
関係者ローン(続)
はい2019年10月、その会社は一つ借り入れた三つ-毎月の無利子融資$
はい10月そして2019年12月、会社が借り入れた60-1日の無利子融資総額$
はい二月四月そして2020年6月会社が借り入れた60-1日の無利子融資総額$
| 8. | 所得税 |
ケイマン諸島
その会社はケイマン諸島に設立され注釈ケイマン諸島の現行法に基づいて所得税を払います。
英領バージン諸島
万春医薬有限会社、英領バージン諸島バイオテクノロジー会社、種子と種子技術会社はすべて英領バージン諸島に加入しています注釈英領バージン諸島の現行法に基づいて所得税を納める。
アメリカです。
万春医薬アメリカ会社と種子アメリカ会社はアメリカデラウェア州で設立されました。それらはアメリカ連邦法定企業所得税を納めなければなりません。税率は
オーストラリア
万春医薬オーストラリア会社はオーストラリアで登録して設立されました。企業所得税を払う必要があります。税率は
香港.香港
万春医薬香港有限公司は香港に登録して設立された。香港に登録されている会社は、香港関連税法によって調整されたそれぞれの法定財務諸表に提出された課税収入について香港利得税を納めなければならない。適用される税率は
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 8. | 所得税を繰り越す |
中華人民共和国
深セン万春、万春布林、北京万春の法定税率は
所得税前損失の構成は以下のとおりである
| 十二月三十一日までの年度 | ||||||||||||
| 2019 | 2020 | 2021 | ||||||||||
| $ | $ | $ | ||||||||||
| ケイマン諸島 | ||||||||||||
| アメリカです。 | ||||||||||||
| 中華人民共和国 | ||||||||||||
| 英領バージン諸島 | ||||||||||||
| オーストラリア | ( | ) | ( | ) | ||||||||
| 所得税前損失 | ||||||||||||
年間当期所得税準備金2021はい$です
| 十二月三十一日までの年度 | ||||||||||||
| 2019 | 2020 | 2021 | ||||||||||
| $ | $ | $ | ||||||||||
| 当期所得税 | ||||||||||||
| 所得税を繰延する | ||||||||||||
| 所得税費用 | ||||||||||||
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 8. | 所得税を繰り越す |
所得税費用と米国連邦企業所得税率を適用して計算された金額との差額を調節する21%何年もの間2019, 2020そして2021具体的には以下のとおりである
| 十二月三十一日までの年度 | ||||||||||||
| 2019 | 2020 | 2021 | ||||||||||
| $ | $ | $ | ||||||||||
| 所得税前損失 | ||||||||||||
| 所得税割引を期待する | ||||||||||||
| 税率の違い | ( | ) | ( | ) | ( | ) | ||||||
| 差し引かれない費用 | ( | ) | ( | ) | ( | ) | ||||||
| 税収控除を検討する | ||||||||||||
| 免税所得 | ||||||||||||
| 税収割引 | ||||||||||||
| 他の人は | ( | ) | ( | ) | ||||||||
| 評価免除額を変更する | ( | ) | ( | ) | ( | ) | ||||||
| 所得税費用総額 | ( | ) | ||||||||||
繰延税項純資産2020年12月31日そして2021以下の内容を含む
| 十二月三十一日 | ||||||||
| 2020 | 2021 | |||||||
| $ | $ | |||||||
| 繰延税金資産: | ||||||||
| 純営業損失が繰り越す | ||||||||
| 研究開発費控除の税額を延期する | ||||||||
| 株式ベースの報酬 | ||||||||
| 収入を繰り越す | ||||||||
| 税収控除を検討する | ||||||||
| リース負債を経営する | ||||||||
| 課税項目と準備金 | ||||||||
| 繰延税金資産総額 | ||||||||
| 繰延税金負債: | ||||||||
| 未実現収益 | ( | ) | ||||||
| 減価償却 | ( | ) | ||||||
| 経営的リース使用権資産 | ( | ) | ( | ) | ||||
| 繰延税金負債総額 | ( | ) | ( | ) | ||||
| 繰延税項目の総資産総額 | ||||||||
| 減算:推定免税額 | ( | ) | ( | ) | ||||
| 繰延税項目純資産 | ||||||||
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 8. | 所得税を繰り越す |
当社はいくつかの付属会社を通して運営しており、個別基準で付属会社1室あたりの推定免税額を考慮している。当社は同等の付属会社の繰延税金資産計について見積を準備しています三つ-年間累積損失、または累積損失および注釈予測可能な将来の利益を予測して2020年12月31日そして2021.自分から2021年12月31日当社は引き続き、当社の外国子会社への投資において税ベースを超えた財務報告基数に対して無期限再投資を行っています。繰延税金負債#ドル
自分から2021年12月31日同社の米国と中国での繰り越し税務損失は約$
自分から2020年12月31日そして2021,同社は未確認の税金割引#ドルを持っている
| 十二月三十一日までの年度 | ||||||||||||
| 2019 | 2020 | 2021 | ||||||||||
| $ | $ | $ | ||||||||||
| 期初残高、1月1日現在 | ||||||||||||
| 前納税年度に係る納税額に基づく付加額 | ||||||||||||
| 前納税年度に係る納税頭寸に基づく減税 | ( | ) | ||||||||||
| 本納税年度に係る納税頭寸の増加に基づく | ||||||||||||
| 12月31日までの期末残高 | ||||||||||||
同社は所得税支出で確認されていない税収割引に関する利子と罰金を確認した。ここ数年で2019年12月31日、2020そして2021,“会社”ができた所得税支出で確認されていない税収割引に関する確認は利息と罰金を計上しなければならない。その会社は約ドルを持っている
その会社はやった注釈既存の未確認税収割引の金額は来年度に大きな変化が予想されます12何ヶ月になりますか。会社のアメリカ、オーストラリアと中国の子会社はそれぞれアメリカ、オーストラリアと中国で所得税申告書を提出します。米国における実体については,#年からの納税年度内に,納税申告書は税務機関が米国連邦と州所得税を審査しなければならないオーストラリアでの実体については、オーストラリア税務局は#年からの納税年度内に納税申告書を審査することができます中国国内の実体については,以下の納税年度の納税申告書中国税務機関の審査に供することができます。
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 9. |
1株当たり純損失 |
普通株株主は1株当たりの基本純損失と希釈後の1株当たり純損失を以下のように計算する
| 十二月三十一日までの年度 |
||||||||||||
| 2019 |
2020 |
2021 |
||||||||||
| 分子: |
||||||||||||
| 万春医薬の純損失に帰することができる。-基本と屋台 |
$ | ( |
) |
$ | ( |
) |
$ | ( |
) |
|||
| 分母: |
||||||||||||
| 発行済み普通株式加重平均−基本と希釈後の普通株式 |
||||||||||||
| 1株当たり純損失--基本損失と赤字 |
$ | ( |
) |
$ | ( |
) |
$ | ( |
) |
|||
すべての株式購入および非帰属制限株式の影響は、1株当たりの償却損失の計算には含まれておらず、それらの影響はこの年度末までに反希薄化されるからである2019年12月31日、2020そして2021.
| 10. | 株式ベースの報酬 |
一般情報
開ける2017年2月24日初公募について,会社の取締役会と株主は持分補償計画を承認した2017総合奨励計画(“2017計画は#年に発効する2017年3月9日いくつかの条件では、会社が選択した高級社員、従業員、非従業員取締役、独立請負業者、およびコンサルタント(“参加者”)に追加のインセンティブを提供する。下にある2017計画では、会社が発行する普通株式の最高数は
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 10. | 株式に基づく報酬(継続) |
販売制限株
下表は会社員の株制限活動をまとめたものです2017計画:
| 番号をつけるの株 | 加重平均付与日公正価値 | |||||||
| $ | ||||||||
| 2018年12月31日現在返済しておりません | ||||||||
| 授与する | ||||||||
| 既得 | ( | ) | ||||||
| 没収される | ||||||||
| 2019年12月31日現在返済しておりません | ||||||||
| 授与する | ||||||||
| 既得 | ( | ) | ||||||
| 没収される | ||||||||
| 2020年12月31日現在返済していません | ||||||||
| 授与する | ||||||||
| 既得 | ( | ) | ||||||
| 没収される | ( | ) | ||||||
| 2021年12月31日現在の未返済債務 | ||||||||
| 2021年12月31日に帰属する予定です | ||||||||
自分から2021年12月31日1元ある
この年度までに帰属する制限株式の公正価値総額2019年12月31日、2020そして2021はい$です
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 10. | 株式に基づく報酬(継続) |
株式オプション
次の表に当社を掲載します2017計画:
| 番号をつける選択肢の数 | 重みをつける平均値トレーニングをする値段 | 重みをつける平均補助金期日公正価値 | 重みをつける平均値残り契約書用語.用語 | 骨材固有の価値がある | ||||||||||||||||
| $ | $ | 年.年 | $ | |||||||||||||||||
| 2018年12月31日現在返済しておりません |
| |||||||||||||||||||
| 授与する | ||||||||||||||||||||
| キャンセルします | ( | ) | ||||||||||||||||||
| 2019年12月31日現在返済しておりません | ||||||||||||||||||||
| 授与する | ||||||||||||||||||||
| 没収される | ( | ) | ||||||||||||||||||
| 2020年12月31日現在返済していません | ||||||||||||||||||||
| 授与する | ||||||||||||||||||||
| 鍛えられた | ( | ) | ||||||||||||||||||
| 没収される | ( | ) | ||||||||||||||||||
| 2021年12月31日現在の未返済債務 | ||||||||||||||||||||
| 2021年12月31日から行使可能 | ||||||||||||||||||||
| すでに帰属しており,2021年12月31日に帰属する予定である | ||||||||||||||||||||
自分から2021年12月31日1元ある
この年度までに年度内に帰属する株式購入の公平な値総額2019年12月31日、2020そして2021はい$です
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 10. | 株式に基づく報酬(継続) |
オプションの公正価値
ブラック-スコイルズ-マートン式は、市場条件なしに付与された株式オプションの推定公正価値を決定するために適用される。このモデルは、推定された予想株価変動および予想される報酬条件を含む高度な主観的仮定を入力する必要がある。これらの推定は、固有のリスクと不確実性、および経営陣判断の応用に関する。歴史的に見ると、同社は一致した早期トレーニング行為を証明するために使用できる歴史データが限られている。報酬の期待期限を決定するために,会社は簡略化された方法を採用し,様々な業績条件の実現時間とそのそれぞれの確率やオプションの契約期限などを考慮した。オプション予想期間内の無リスク金利は米国国庫券金利に基づいている。変動率は,会社の株価の履歴変動性から推定されると仮定する.会社の経営陣は最終的にその株式購入の推定公正価値を確定する責任がある。
次の表に、Black-Scholes-Merton式において、列挙された年間に付与された株式オプションの公正価値を推定するための仮定を示す
| 十二月三十一日 | |||||||||||||||
| 2019 | 2020 | 2021 | |||||||||||||
| 普通株主公正価値 | | ~ | | ~ | |||||||||||
| 無リスク金利 | | ~ | | ~ | | ~ | |||||||||
| 所期期間(年) | | ~ | | ~ | | ~ | |||||||||
| 予想変動率 | | ~ | | ~ | |||||||||||
| 期待配当収益率 | |||||||||||||||
| 契約期間(年) |
|
|
| ||||||||||||
モンテカルロシミュレーションモデルは、市場条件の影響を受ける株式オプションの推定公正価値を決定するために使用される。このモデルには6人最低考慮事項:1)オプションの発行価格、2)オプションの契約条項、3)標的権益の現在の公正価値4)会社株価の履歴変動率から推定されるオプション契約期間内の対象株式価値の予想変動率、5)株式承認予想期間内に対象株式の予想配当金および6)オプション契約期間の無リスク金利は、米国債金利に基づく。
合計する
| 2021年12月31日 | ||||
| 行権価格 | ||||
| 普通株主公正価値 | ||||
| 無リスク金利 | % | |||
| 契約期間(年) | ||||
| 予想変動率 | % | |||
| 期待配当収益率 | % | |||
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 10. | 株式に基づく報酬(継続) |
長期的激励
.の間に2021,会社に長期インセンティブ賞が授与されます(合計金額は$
長期的なインセンティブ奨励は責任報酬に分けられる。この年度までに2021年12月31日同社は$を確認した
下表は,この年度までに確認された株式ベースの報酬支出総額をまとめたものである2019年12月31日、2020そして2021:
| 十二月三十一日までの年度 | ||||||||||||
| 2019 | 2020 | 2021 | ||||||||||
| $ | $ | $ | ||||||||||
| 研究開発 | ||||||||||||
| 一般と行政 | ||||||||||||
| 合計する | ||||||||||||
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 11. | 従業員定義支払い計画 |
当社の中国における常勤従業員は政府が規定した固定供出計画に参加し、この計画に基づいて、従業員にいくつかの退職金福祉、医療、従業員住宅積立金及びその他の福祉を提供する。中国の労働法規は、会社の中国子会社は従業員の給料の一定割合で政府にこれらの福祉を納めなければならないことを要求している。その会社は所有している違います。寄付以外の福祉には法的義務がある。このような従業員福祉の支出総額は#ドルだ
| 12. | 制限純資産 |
会社が配当金を支払う能力5月.当社がその中国子会社から資金配分を受けることにかかっています。関連する中国の法律と法規は、当社の中国付属会社が中国の会計基準及び法規に基づいて定めた留保収益(あればある)から配当金を支払うことを許可するだけである。米国公認会計原則に基づいて作成された総合財務諸表に反映される経営結果は、当社の中国子会社の法定財務諸表に反映されている結果とは異なる。
“中華人民共和国外商投資企業及びその定款”の規定によると、中国で設立された外商投資企業は一定の法定準備金を提供しなければならず、これらの準備金は企業が中国の法定口座で報告した純利益から支給される。外商投資企業は少なくとも規定に従って配置しなければならない10%その年度税引き後利益をその備蓄金に達するまで一般備蓄金に計上する50%企業の中国での法定口座に基づく登録資本。すべての外商投資企業について、他の資金の分配は取締役会によって決定される。上記の備蓄は特定の用途にのみ使用可能であり、注釈現金配当金として分配することができる。万春深センは外商投資企業であるため、上記の強制的に利益を分配できる制限を受けている。
また、“中華人民共和国会社法”の規定により、国内企業は少なくとも提供しなければならない10%その年度税引き後利益はこの備蓄金に達するまで50%企業の中国での法定口座に基づく登録資本。国内企業はまた取締役会の決定に基づいて、企業中華人民共和国法定口座に従って確定した利益から自由に支配可能な黒字積立金を抽出しなければならない。上記の備蓄は特定の用途にのみ使用可能であり、注釈配当金として分配することができる。万春林と北京万春は内資企業として設立されたため、上記のような強制的な分配可能利益の制限を受けている。
中国の外国為替及びその他の法規は、当社の中国付属会社が融資、立て替え金又は現金配当金の形で当社に資金を移転することをさらに制限している。自分から2020年12月31日そして2021,当社の中国付属会社の有限純資産はそしてそれぞれ分析を行った。
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 13. | レンタルする |
同社はアメリカと中国のオフィスの運営賃貸契約を持っており、残りの賃貸借約款は約
賃貸負債満期日を経営する2021年12月31日具体的には以下のとおりである
| $ | ||||
| 2022年12月31日までの年度 | ||||
| 2023年12月31日までの年度 | ||||
| 2024年12月31日までの年度 | ||||
| 2025年12月31日までの年度 | ||||
| 2026年12月31日までの年度 | ||||
| 賃貸支払総額 | ||||
| 差し引く:推定利息 | ( | ) | ||
| 賃貸負債現在価値 |
賃貸契約に関する他の補足資料の概要は以下のとおりである
| 十二月三十一日までの年度 | ||||||||
| 2020 | 2021 | |||||||
| $ | $ | |||||||
| レンタル経営のための経営キャッシュフロー | ||||||||
| 12月31日まで | ||||||||
| 2020 | 2021 | |||||||
| 加重平均残存賃貸年限(年) | ||||||||
| 加重平均割引率 | % | % | ||||||
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 14. | 貸借対照表情報を補完する |
他の非流動資産には:
| 十二月三十一日 | ||||||||
| 2020 | 2021 | |||||||
| $ | $ | |||||||
| 財産と設備の前払い | ||||||||
| 付加価値税を差し引くことができる | ||||||||
| 他の人は | ||||||||
| 合計する | ||||||||
他の流動負債には
| 十二月三十一日 | ||||||||
| 2020 | 2021 | |||||||
| $ | $ | |||||||
| 報酬と関係がある | ||||||||
| 専門サービス | ||||||||
| 所得税に対処する | ||||||||
| その他は税金を払うべきだ | ||||||||
| 長期負債 | ||||||||
| 他の人は | ||||||||
| 合計する | ||||||||
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 15. | 非持ち株権を償還することができます |
SEEDが発行する優先株の主な権利、特典、特権は以下の通りです
清算割引
種子会社に自発的または非自発的清算、解散または清算が発生した場合、または清算イベントとみなされる場合、種子会社の資産は以下の順序で割り当てられなければならない
| (1) | Aシリーズの所有者に何かを支払う前に1優先株または普通株式、1株当たりの額は、(I)適用された元の発行価格に、発表されたが支払われていない任意の配当金を加えるか、または(Ii)すべてのA系列であれば-2優先株は、清算、解散、清算、または清算事件とみなされる直前に普通株に変換される。 |
| (2) | Aシリーズの割り当て可能または支払うべき金額を全額支払った後-2優先株、Aシリーズの所有者-1当時発行された優先株は,その株主に割り当てられる種子資産から支払う権利があり,清算事件とみなされる場合には,A系列の保有者-1当時発行された優先株は対価格から支払う権利がある注釈Aシリーズの所持者に支払います2優先株または余剰利用可能な収益(誰が適用されるかに応じて)、普通株式所有者の所有権によって任意の金が支払われる前に、1株当たりの金額は、(I)適用された元の発行価格に、発表されたが支払われていない任意の配当金に等しいか、または(Ii)全Aシリーズであれば-1優先株は、清算、解散、清算、または清算事件とみなされる直前に普通株に変換される。 |
| (3) | 優先株の割り当て可能または支払金が全額支払われた後、株主に割り当てられた種子余剰資産、または所属が清算事項とされている場合は、代価とすることができる注釈優先株保有者または余剰利用可能な収益に支払う(場合によっては)5月.普通株式保有者間で分配し、普通株式保有者ごとに保有する普通株数に比例して分配しなければならない。 |
償還権
Aシリーズ-2優先株は種子会社の方式で償還しなければならず,償還価格は適用される1株当たりの原始発行価格に相当する
転換権
優先株保有者の選択によると、1株当たりの優先株は、以下の初期転換比率で計算された十分な配当金と評価すべきでない普通株数に随時かつ時々変換することができる1:1株式分割、株式配当、資本再編、類似取引に基づいて調整する。
1株当たり優先株は自動的に普通株に変換しなければならない,1つは-そのために-1つは(A)“証券法”に基づく有効な登録声明に基づいて,公開発行を受けた会社の承諾1933,改正され、ナスダック株式市場の全国市場、ニューヨーク証券取引所または種子会社取締役会が承認した他の取引所または市場では、1株当たりの価格は少なくとも$である
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 15. | あるいは非持株権を償還することができる |
投票権
発行済み優先株保有者1人あたりには,その保有者がその事項について投票する権利がある株主を決定する記録日に変換可能な全普通株数に相当する投票数を投じる権利がある.
Aシリーズの会計-2優先株
同社はAシリーズを決定しました2SEEDが発行する優先株は償還可能な非制御資本であり、中間株式に分類されているからである5月.種子が完全に制御できない約束日または後に、所持者の選択に応じて償還する。同社の結論はAシリーズは2Seedの優先株は現在は償還可能だが、償還可能になる可能性が高い。当社は、償還価値変動が発生した場合にこれらの変動を確認し、報告期間終了時の償還価値と等しくなるように非制御権益を償還可能な帳簿金額を調整することを選択した。
シリーズの所有者-2SEEDの優先株はこのツールをSEEDの普通株に変換する能力がある。当社は全体工具法を使用して、混合ツールにおける主な契約の性質が債務に類似しているか、株式に類似しているかを決定する。同社はAシリーズの組み込み変換オプションを評価した2SEEDの優先株は,分流を必要とする埋め込みデリバティブがあるかどうかを決定し,有益な変換特徴(“BCF”)があるかどうかを決定する.Aシリーズの変換オプション-2種の優先株は確かにそうです注釈分岐会計を行う資格があり,転換オプションはホストツールや普通株と明確に関連しているため注釈公開取引も、簡単に現金に両替することはできません。Aシリーズや償還があります2種の優先株は確かにそうです注釈SEEDの基礎普通株は注釈公開取引も、簡単に現金に両替することはできません。ここにあります違います。他に分岐の埋め込み導関数が必要である.
違います。BcfはAシリーズとして認められています2種子優先株は,種子の普通株当たりの公正価値が$であるからである
Aシリーズの公正な価値のせいで2優先株が償還額より高い2020年12月31日
年度末までに非持株権益を償還することができる2020年12月31日そして2021要約は以下のとおりである
| 非持ち株権を償還することができます | ||||
| $ | ||||
| 2019年12月31日現在の残高 | ||||
| 発行する. | ||||
| 2020年12月31日の残高 | ||||
| 償還価値を増やす | ||||
| 2021年12月31日現在の残高 | ||||
万春医薬
連結財務諸表付記
2021年12月31日現在,2020年および2019年12月31日まで年度
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 16. | 長期契約 |
Aシリーズ債券の発行について-2優先株2020年11月12日Seedは礼来会社に売却して追加のを発行することに同意した
長期は種を代表してAシリーズを売るか義務がある独立したツールである-2礼来会社に優先株を渡す。ASCによれば、長期は負債または資産に分類される480, 負債と持分を区別するなぜなら、標的Aシリーズの償還機能は2優先株は資産を移転することで種子がその株を買い戻す必要があるかもしれない。同社は変換機能を評価し、違います。有益な変換機能。ここにあります違います。他に分岐の埋め込み導関数が必要である.この長期は最初に公正価値#ドルの負債として確認された
| 17. | その他の総合収益を累計する |
累計その他の総合収益(損失)の変動は以下のとおりである
| 外貨換算 調整する | 未実現収益 簡単に売ることができる証券 | 合計する | ||||||||||
| $ | $ | $ | ||||||||||
| 2019年12月31日 | ||||||||||||
| 当期その他総合損失 | ( | ) | ( | ) | ||||||||
| 2020年12月31日 | ( | ) | ( | ) | ||||||||
| 今期のその他総合収入 | ( | ) | ( | ) | ||||||||
| 2021年12月31日 | ( | ) | ( | ) | ||||||||
| 18. | 引受金とその他の事項 |
法律手続き
時々私たちは5月.通常の業務過程で法的手続きに巻き込まれたり、クレームの影響を受けたりする。私たちは注釈現在は任意の法的手続きの一方であり、私たちに不利であると判定された場合、単独または合併は、私たちの業務、運営結果、財務状況、またはキャッシュフローに重大な悪影響を与えます。
万春医薬
連結財務諸表付記
ここ数年で2021年12月31日2020そして2019
(金額は数千ドル(“ドル”)と人民元(“人民元”)
株式数と1株当たりのデータを除く)
| 18. | 引受金及び又は有事項(継続) |
その他賃貸承諾額
はい2021年9月会社はオフィスと実験室の賃貸契約を締結し、レンタルは#年に開始予定です2022.さらに、同社は$を支払うことを約束した
次の表は、以下の日までの経営賃貸での将来最低支払いをまとめています2021年12月31日:
| $ | ||||
| 2022年12月31日までの年度 | ||||
| 2023年12月31日までの年度 | ||||
| 2024年12月31日までの年度 | ||||
| 2025年12月31日までの年度 | ||||
| 2026年12月31日までの年度 | ||||
| 2027年12月31日までとその後の年度 | ||||
| 支払総額 |
| 19. | 後続事件 |
開ける2022年1月11日同社は会社の最も価値の高い業務活動を優先的に処理することに重点を置いた組織簡素化計画を発表し、米国の従業員数を削減した