| Momentum—Pemvidutide第2相肥満試験 第24週中間分析 NASDAQ:ALT M・スコット・ハリス医学博士、最高医療責任者 ルイ・アロンヌ医学博士、主任研究者 サンフォード・I・ウェイル代謝研究教授 ウェイル・コーネル・メディシン臨床医学教授 2023年3月21日 |
| 将来の見通しに関する記述 セーフハーバーステートメント このプレゼンテーションはAltimmune, Inc.(「当社」、「当社」、「当社」、「当社」)が作成したもので、1995年の民間証券訴訟改革法の意味における特定の 「将来の見通しに関する記述」が含まれています( 将来の財務または事業実績、条件、計画に関する記述を含む)、展望、トレンド、戦略、およびその他の財務上および事業上の事項(当社の臨床資産の主要なマイルストーンのタイミング、そのタイミングを含むがこれらに限定されない)ペムビダチドの第2相肥満臨床試験 、進行中および将来の臨床試験における当社の薬剤候補のパフォーマンス、規制当局の承認の見通し、 あらゆる製品または薬剤候補の商品化または販売。さらに、本プレスリリースで「可能性がある」、「できる」、「すべき」、「予想する」、「信じる」、「見積もる」、「期待する」、「意図する」、「計画する」、「予測する」などの表現とその変種は、当社に関連しているため、将来の見通しに関する記述を特定できる場合があります。当社は、これらの将来の見通しに関する記述には、時間の経過とともに変化する多数の仮定、リスク、および不確実性の影響を受けることに注意しています。実際の業績が将来の見通しに関する記述または過去の経験で説明されている結果と 大きく異なる原因となる可能性のある重要な要因には、リスクと不確実性が含まれます。 規制審査の遅れ、製造およびサプライチェーンの中断、臨床施設へのアクセス、登録、 医療制度への悪影響、世界経済の混乱などのリスクと 体重を含むベースライン特性が将来の試験の成功、関連する研究結果の信頼性人体への安全性と、当社の製品候補の投与から生じる可能性のある有害作用、臨床試験 材料を予定どおりに製造できる当社の能力、および将来の臨床試験の成功を含む将来の製品進歩の成功。 当社の事業、財務状況、および経営成績に影響を与える可能性のある要因とリスクに関する詳細情報 は、当社が米国証券取引委員会に提出した書類に記載されています。これには、www.sec.gov で入手可能な当社の最新の年次報告書フォーム10-Kおよびその他のSECへの提出書類の「リスク要因」 という見出しが含まれます。 2 |
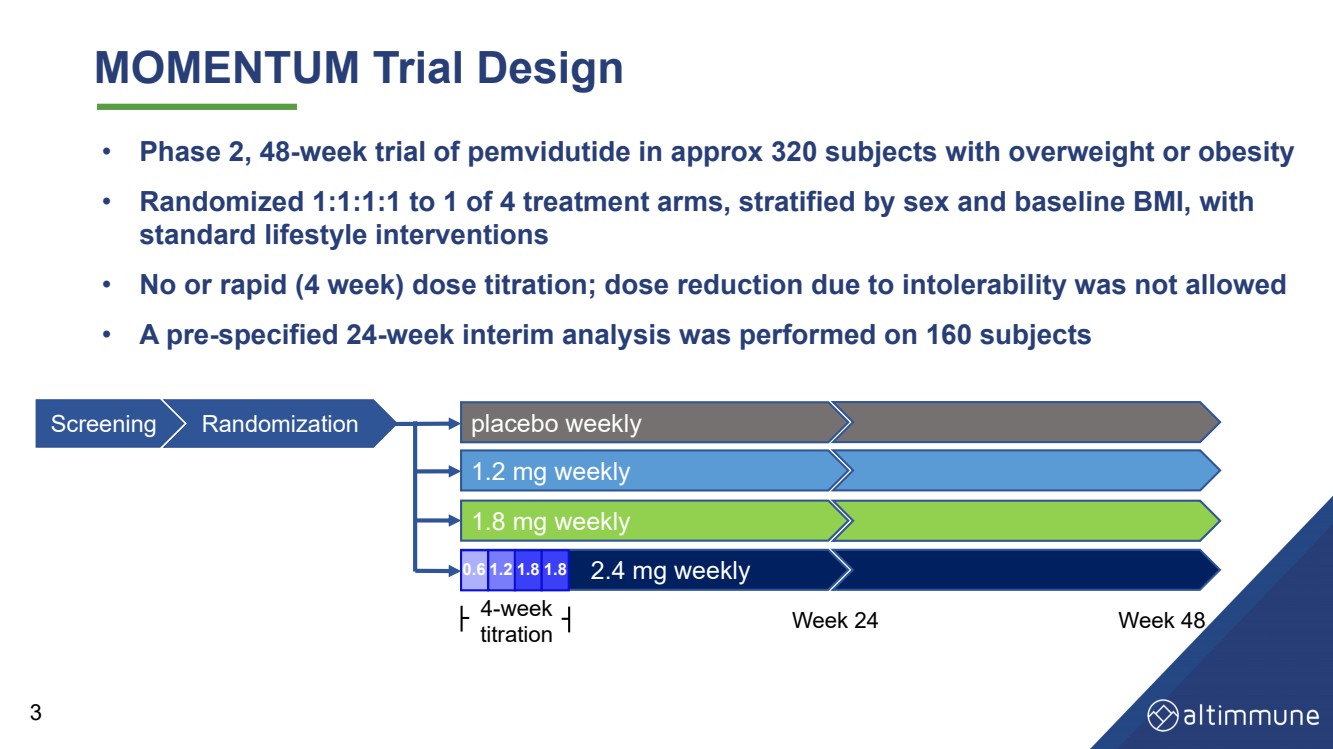
| MOMENTUM Trial Design • 太りすぎまたは肥満の約320人の被験者を対象としたペムビジュチドの第2相試験 • 4つの治療群のうち1つに 1:1:1:1 でランダム化、性別とベースラインのBMIで層別化 • 用量滴定なしまたは迅速な(4週間)用量滴定を行わないか、耐え難いために用量を減らせなかった • 160人の被験者に対して事前に指定された24週間の中間分析が実施されました 0。 6 1.2 1.8 1.8 プラセボウィークリー 1.8 mg ウィークリー 2.4 mg ウィークリー ウィークリー 1.2 mg ウィークリー 4 週間 滴定 24 週目 48 週スクリーニングランダム化 0.6 1.2 1.8 1.8 3 |
| 研究対象集団—主要な適格基準 • 18~75歳の男性と女性 • BMIが30 kg/m2以上またはBMIが27 kg/m2以上で、肥満に関連する併存疾患が1つ以上ある -心血管疾患の病歴 -高血圧 -脂質異常症 -糖尿病前症 -閉塞性睡眠時無呼吸 • 非糖尿病:HbA1c ≤6.5%、空腹時血糖≤125 mg/dL • 少なくとも1回の減量の試みが失敗しました • 被験者の少なくとも約25%が男性でした 4 |
| 研究エンドポイント 有効性 • 主要評価項目: • ベースラインからの相対的な体重変化(%) • 主な副次評価項目: • 体重が 5% 以上、10% 以上、15% 以上の体重減少を達成した被験者の割合(%) • ベースラインからの胴囲、血清脂質、血圧の変化 安全性 • 広告有害事象(AE) • 重度および重度のAE • 中止につながるAE • 消化管(GI)AE • 心拍数 • グルコースホメオスタシス 5 |
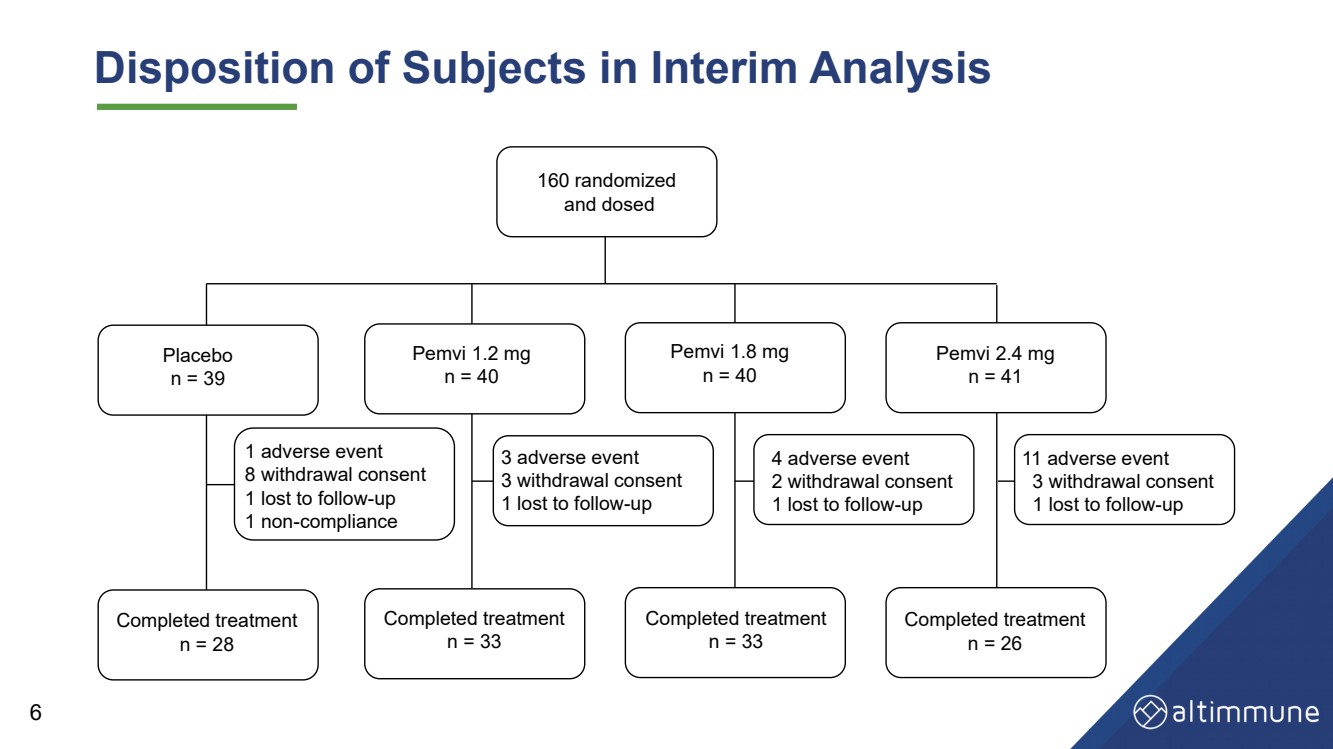
| 中間分析における被験者の処分 160 無作為化 およびプラセボ n = 39 Pemvi 1.2 mg n = 40 Pemvi 1.2 mg n = 40 Pemvi 2.4 mg n = 41 治療完了 n = 28 治療完了 n = 33 治療完了 n = 33 治療完了 n = 26 3 有害事象 3 離脱同意 1 フォローアップへの喪失 4 有害事象 2 離脱同意 1 フォローアップへの喪失 2 離脱 c2 治療完了 n = 33 1 有害事象 8 離脱同意 1 フォローアップ不履行 1 不履行 11 有害事象 3 離脱同意 1 喪失フォローアップへ 6 |
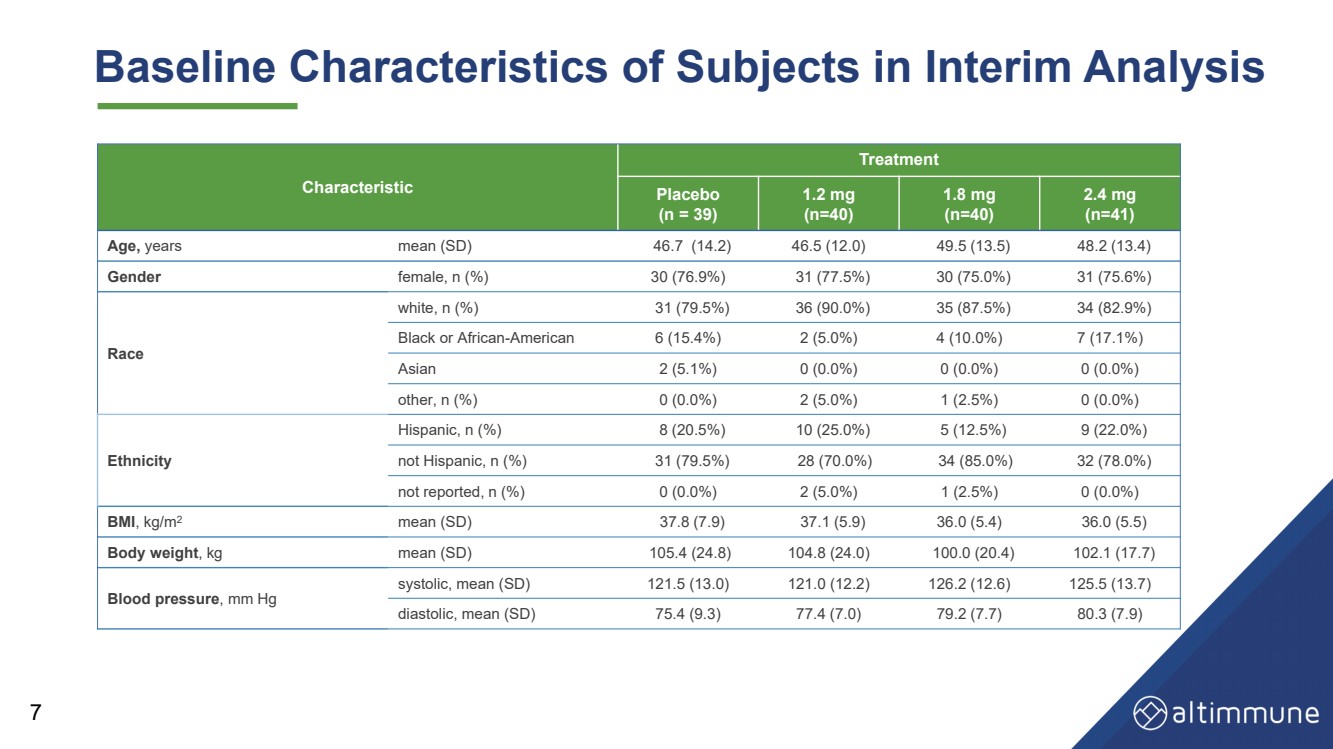
| 中間分析における被験者のベースライン特性 7 特徴 治療 プラセボ (n = 39) 1.2 mg (n=40) 1.8 mg (n=40) 2.4 mg (n=41) 年齢、平均年齢 (SD) 46.7 (14.2) 46.5 (12.0) 49.5 (13.5) 48.2 (13.4) 性別女性、n (%) 30 (76.9%) 31 (77.5%) 30 (75.0%) 31 (75.6%) 人種 人種 白、n (%) 31 (79.5%) 36 (90.0%) 35 (87.5%) 34 (82.9%) 黒人またはアフリカ系アメリカ人 6 (6 15.4%) 2 (5.0%) 4 (10.0%) 7 (17.1%) アジア人 2 (5.1%) 0 (0.0%) 0 (0.0%) 0 (0.0%) その他、n (%) 0 (0.0%) 2 (5.0%) 1 (2.5%) 0 (0.0%) 民族 ヒスパニック, n (%) 8 (20.5%) 10 (25.0%) 5 (12.5%) 9 (22.0%) 非ヒスパニック、n (%) 31 (79.5%) 28 (70.0%) 34 (85.0%) 32 (78.0%) 報告なし、n (%) 0 (0.0%) 2 (5.0%) 1 (2.5%) 0 (0.0%) BMI、kg/m2 平均 (SD) 37.8 (7.9) 37.1 (5.9) 36.0 (5.5) 体重、kg平均 (SD) 105.4 (24.8) 104.8 (24.0) 100.0 (20.4) 102.1 (17.7) 血圧、mm Hg 収縮期、平均 (SD) 121.5 (13.0) 121.0 (12.2) 126.2 (12.6) 125.5 (13.7) 拡張期、平均 (SD) 75.4 (9.3) 77.4 (7.0) 79.2 (7.7) 80.3 (7.9) |
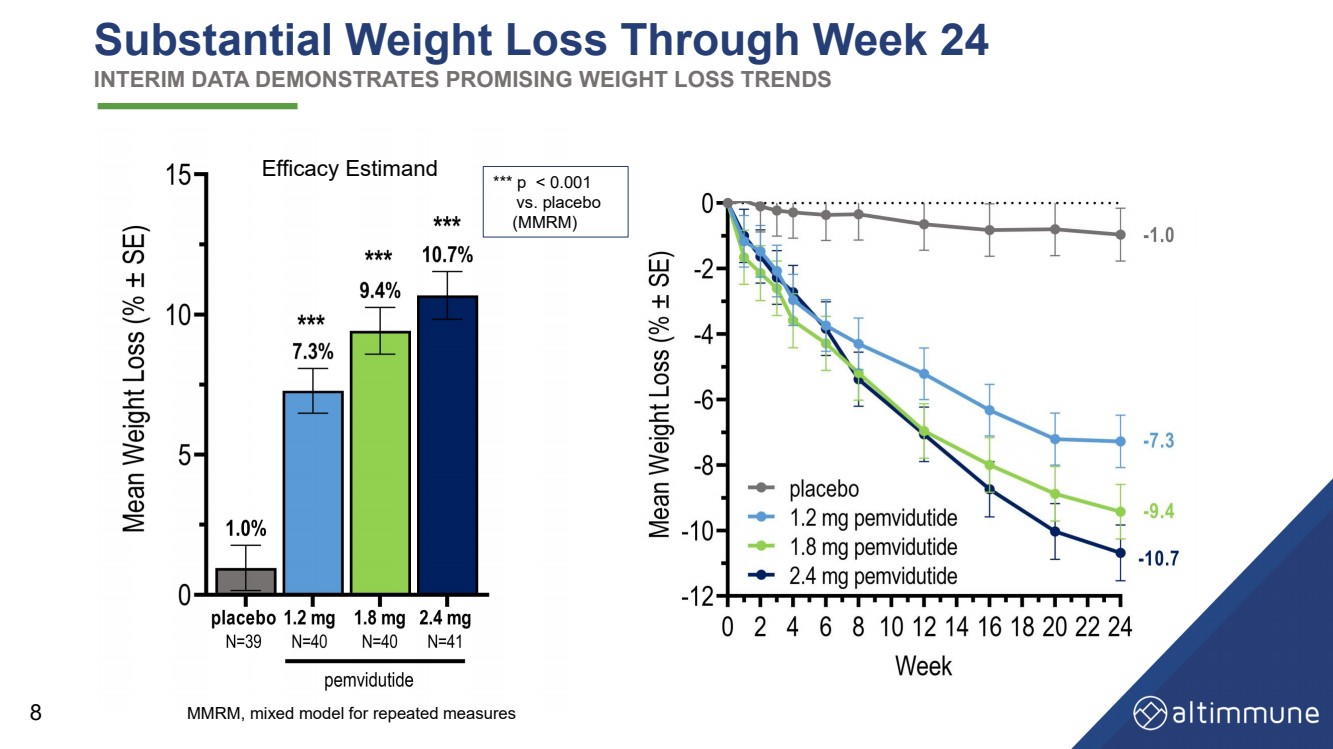
| 24週目までの大幅な減量中間データにより有望な減量傾向が示されました 8 有効性エスティマンド MMRM、反復測定の混合モデル *** p |
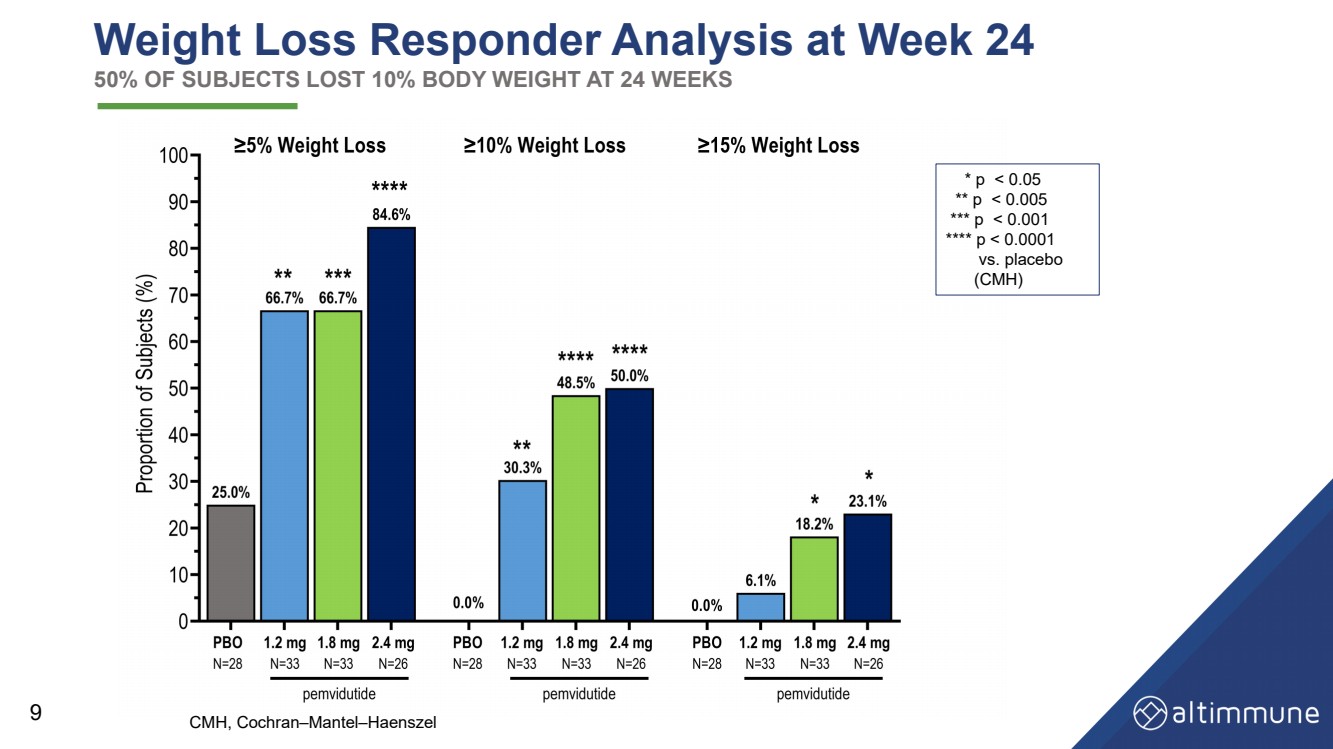
| 24週目の減量反応者分析:被験者の50%が24週で体重を10%減らしました 9 * p |
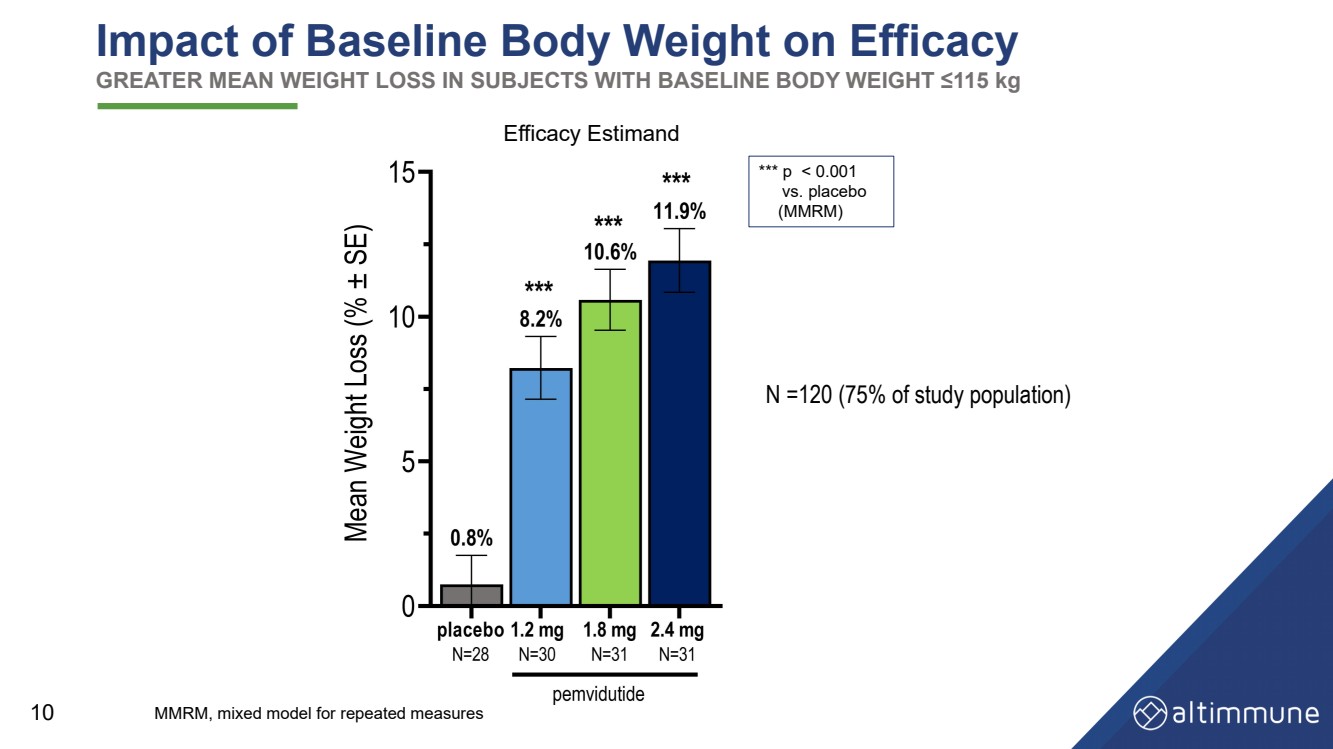
| 10 ベースライン体重が有効性に及ぼす影響 ベースライン体重が115 kg 以下の被験者における平均体重減少の増加 有効性推定値 N =120(研究対象集団の 75%) *** p |
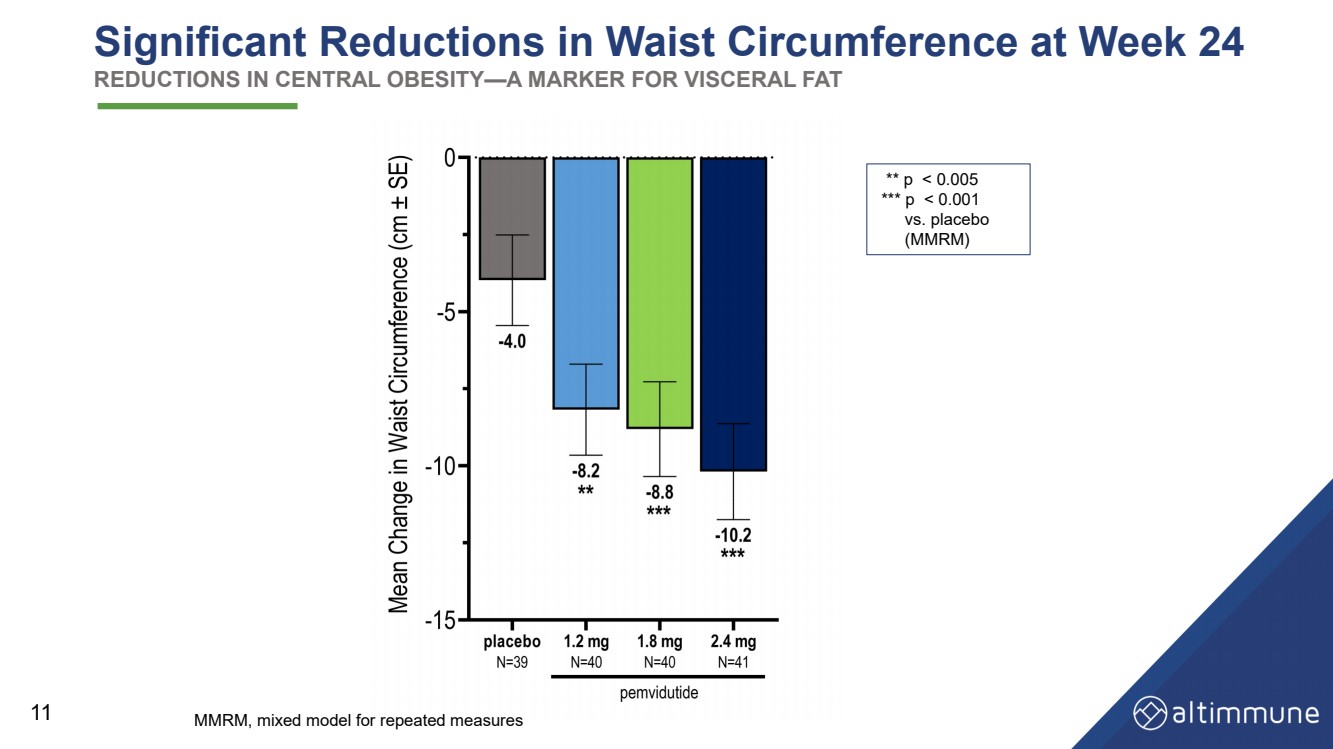
| 24週目の胴囲の大幅な減少中心性肥満の減少(内臓脂肪のマーカー) 11 ** p |
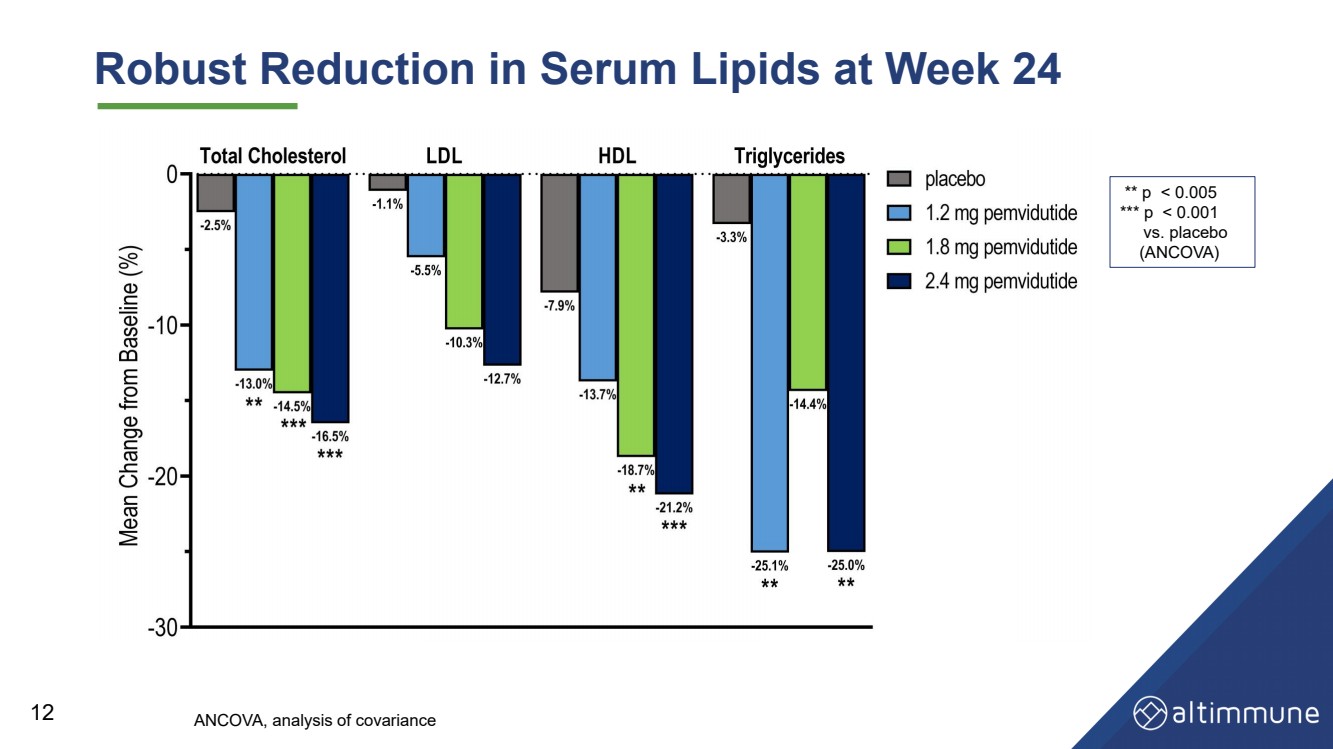
| 24週目の血清脂質の大幅な減少 12 ** p |
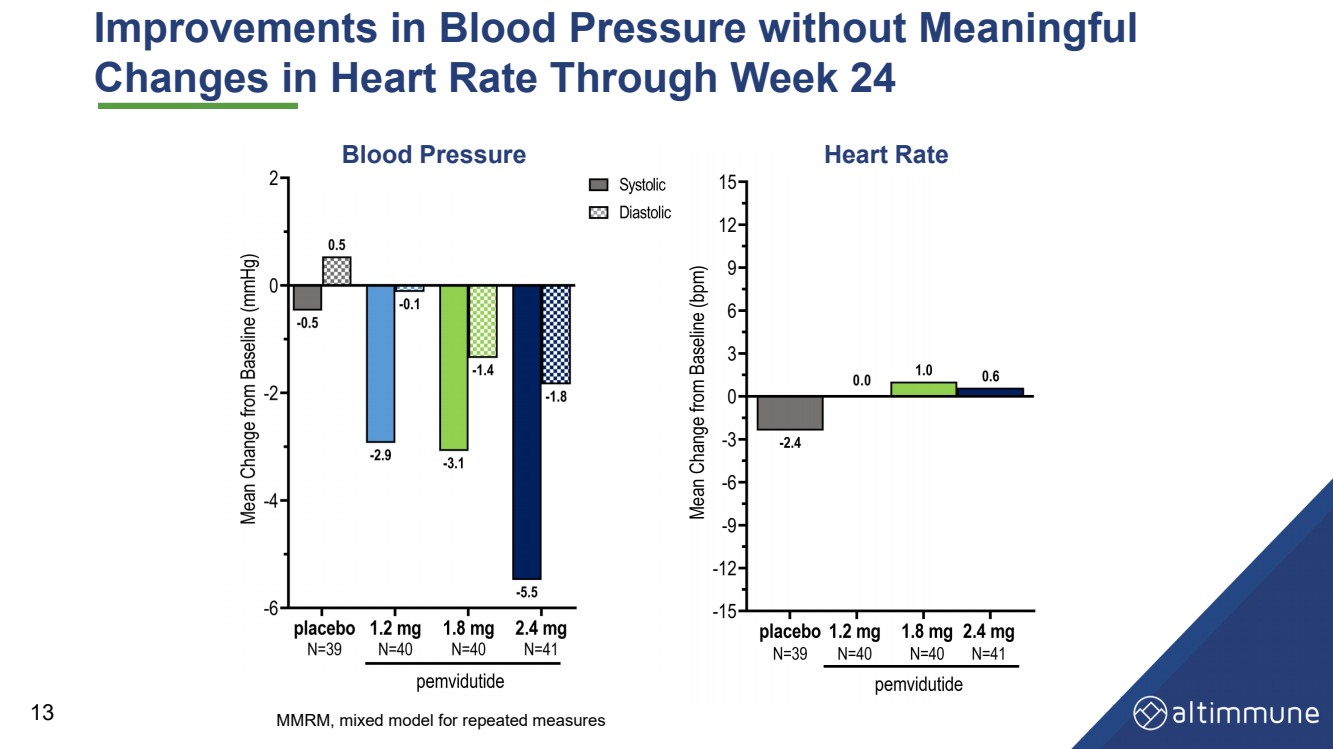
| 24週目から13週目までの心拍数に有意な 変化を伴わない血圧の改善血圧心拍数 MMRM、反復測定用混合モデル |
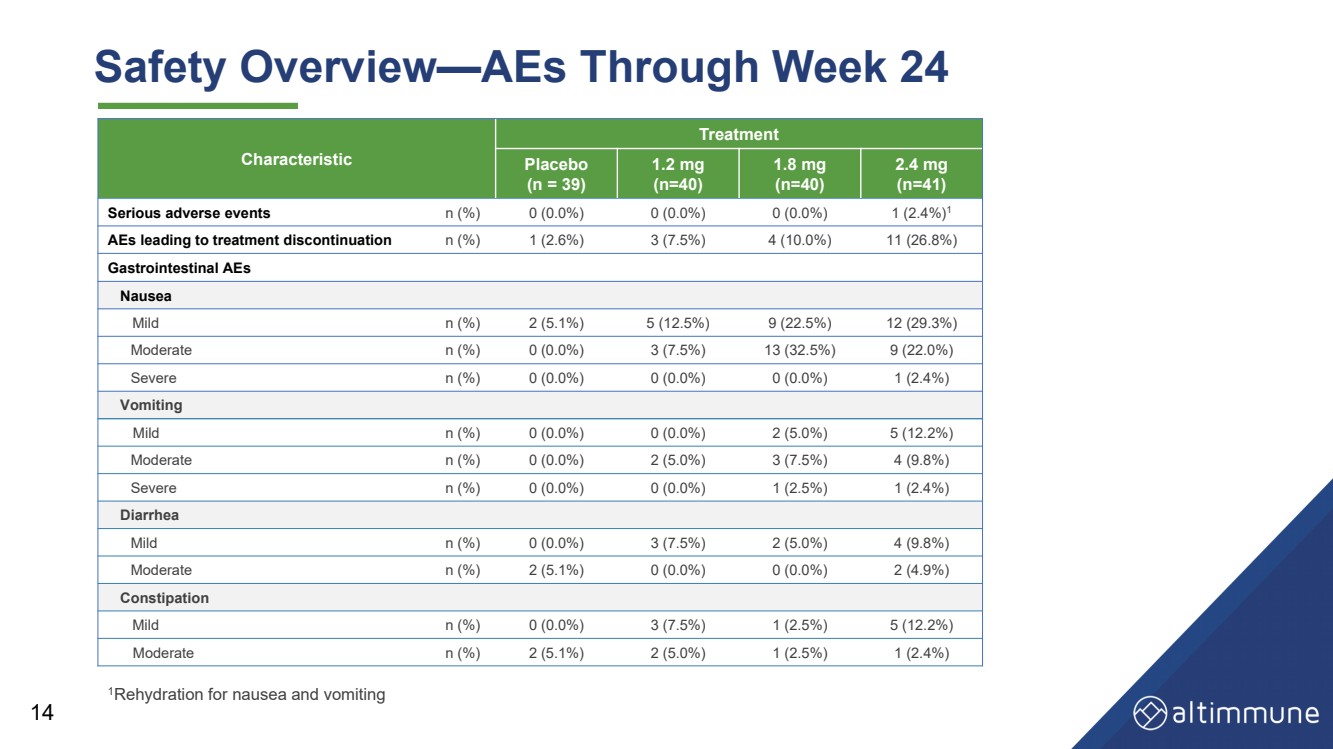
| 14 安全性の概要—24週目までのAES 1吐き気と嘔吐の水分補給 特徴 治療 プラセボ (n = 39) 1.2 mg (n=40) 1.8 mg (n=40) 2.4 mg (n=41) 重篤な有害事象 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (2.4%) 1 (2.4%) 1 (2.6%) 3 (7.5%) 4 (10.0%) 11 (26.8%) 消化器系AE 吐き気 軽度 n (%) 2 (5.1%) 5 (12.5%) 9 (22.5%) 12 (29.3%) 中等度 n (%)) 0 (0.0%) 3 (7.5%) 13 (32.5%) 9 (22.0%) 重度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (2.4%) 嘔吐 軽度 n (%) 0(0.0%) 0 (0.0%) 2 (5.0%) 5 (12.2%) 中程度 n (%) 0 (0.0%) 2 (5.0%) 3 (7.5%) 4 (9.8%) 重度 n (0.0%) 0 (0.0%) 1 (2.5%) 1 (2.4%) 下痢 軽度 n (0.0%) 0 (0.0%) 3 (0.0%) 5%) 2 (5.0%) 4 (9.8%) 中程度 n (%) 2 (5.1%) 0 (0.0%) 2 (4.9%) 便秘 軽度 n (%) 0 (0.0%) 3 (2.5%) 5 (12.2%) 中程度 n (%) 2 (5.0%) 1 (5.0%) 1 (2.0%) 1 (2.0%) 5%) 1 (2.4%) |
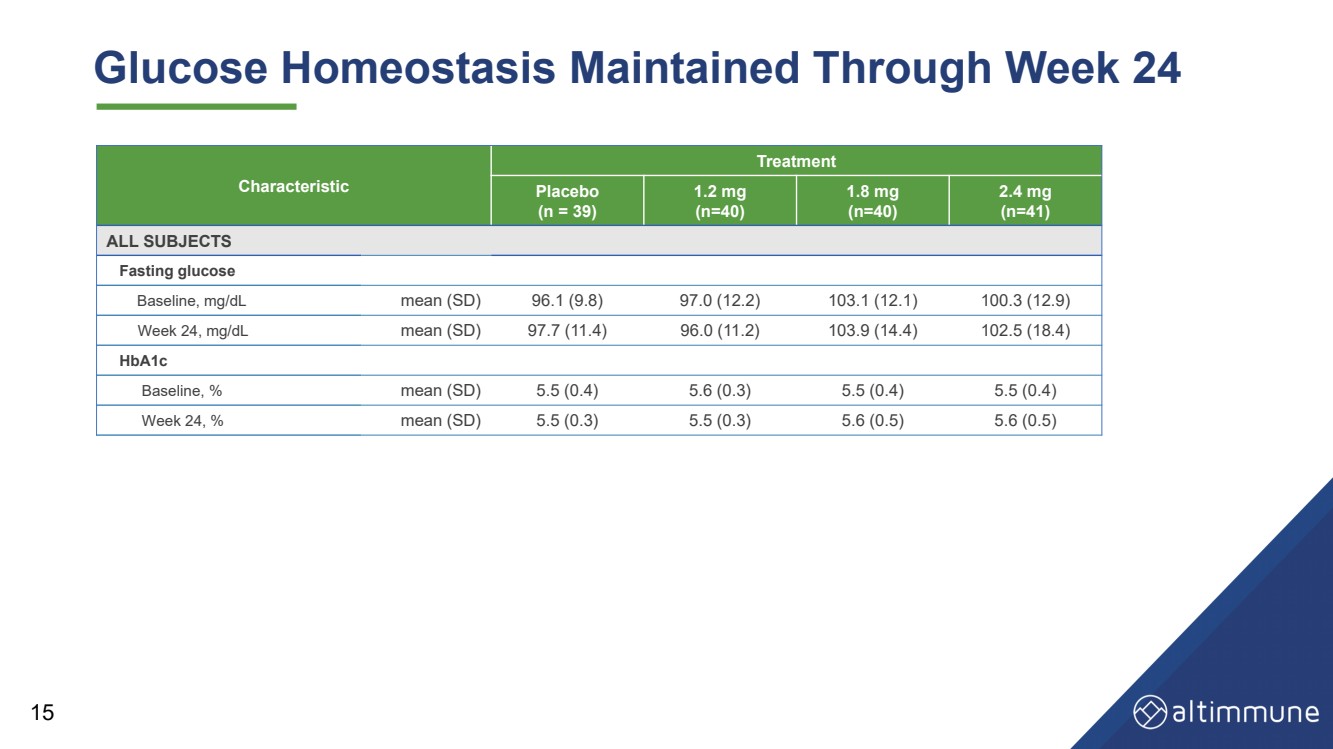
| 24週目まで維持されるグルコースホメオスタシス 15週目特徴 治療 プラセボ (n = 39) 1.2 mg (n=40) 1.8 mg (n=40) 全被験者 空腹時血糖値 ベースライン、mg/dL 平均(SD)96.1 (9.8) 97.0 (12.2) 103.1 (12.1) 100.3 (12.9) 24週目、mg/dL 平均 (SD) 97.7 (11.4) 96.0 (11.2) 103.9 (14.4) 102.5 (18.4) HbA1c ベースライン、% 平均 (SD) 5.5 (0.4) 5.6 (0.3) 5.5 (0.4) 5.5 (0.4) 24週目、% 平均 (SD) 5.5 (0.3) 5.5 (0.3) 5.6 (0.5) 5.6 (0.5) 5.6 (0.5) 5.6 (0.5) |
| 要約と結論 • 24週目までの2.4 mgおよび1.8 mgでの10.7%および9.4%(プラセボ調整後:9.7%および8.4%)• ベースライン体重が115kg以下の被験者における2.4mgおよび1.8mgでの体重減少 • 被験者の約50%が10%以上を失った体重と被験者の約20%が24週目までに2.4 mgと1.8 mgで15%以上体重が減少しました。• 胴囲、血清脂質、血圧の大幅な低下 安全性と忍容性 •以前のペムビジュチド試験や他のインクレチンベースの薬剤と同等の消化管AE率 • 2.4 mgの用量でのAE中止率-用量を減らし、 用量滴定を延長することで軽減できる可能性がある • 心拍数の有意な増加はない • グルコース恒常性の維持 16 |
| 肥満または太りすぎおよび2型糖尿病の 被験者を対象としたペンビジュチドの12週間第1b相試験 NASDAQ:ALT |
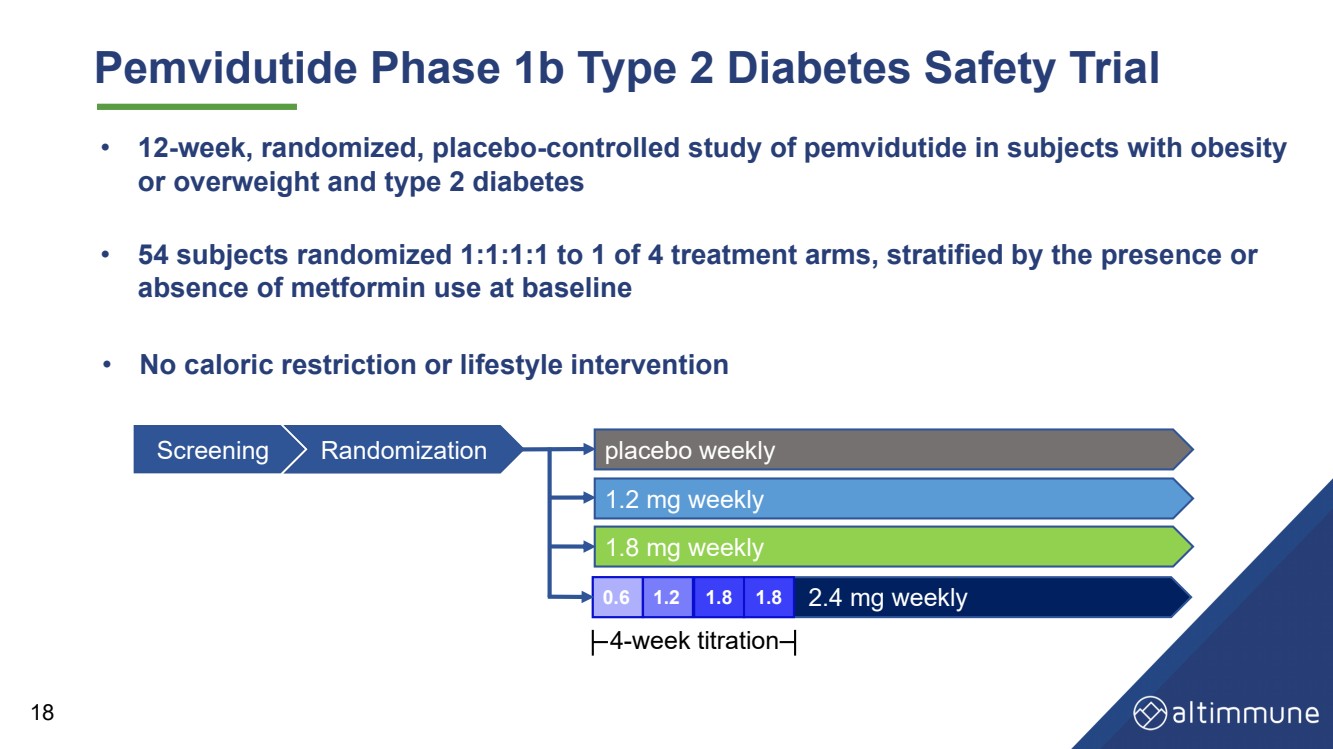
| Pemvidutideの第1b相2型糖尿病安全性試験 • 54人の被験者を4つの治療群のうち1群に 1:1:1 でランダム化し、ベースラインでのメトホルミン使用の有無 で層別化 • 肥満 または太りすぎ、2型糖尿病 の被験者を対象としたペンビジュチドに関する12週間のランダム化プラセボ対照試験 18 • カロリーなし c 制限または生活習慣介入 スクリーニングランダム化プラセボ週次 1.8 mg 週次 毎週 2.4 mg 毎週 1.2 mg 0.6 1.2 1.8 1.8 4週間滴定 |
| 研究対象集団—主要な適格基準 • 18~65歳の男性と女性 • BMI ≥ 28 kg/m2 • スクリーニングの前に少なくとも3か月間、安定した血糖コントロールレジメンを受けている2型糖尿病 • 血糖コントロールレジメンには以下のうち少なくとも1つが含まれていました。 — 食事と運動 — 胃腸症状がないか軽度のメトホルミン — SGLT-2 療法 19 |
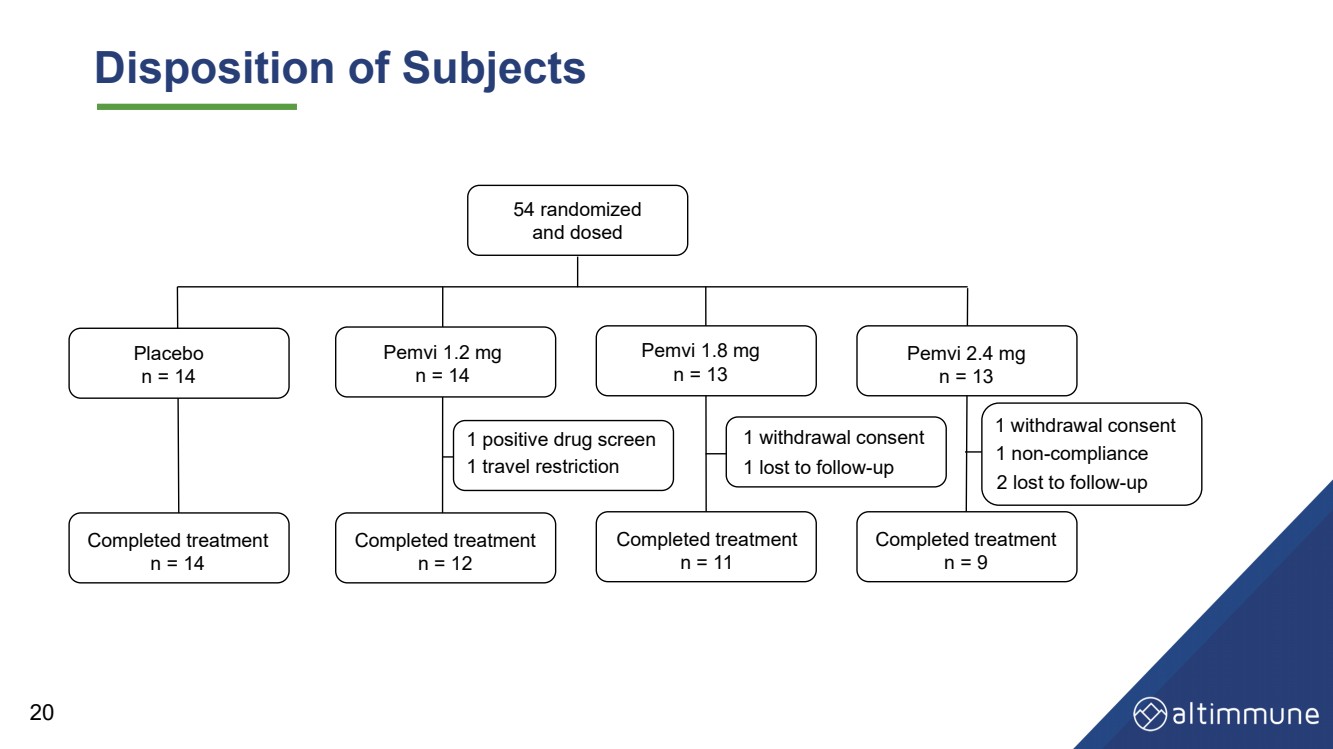
| 被験者の処分 プラセボ n = 14 Pemvi 1.2 mg n = 14 Pemvi 1.8 mg n = 13 Pemvi 2.4 mg n = 13 Pemvi 2.4 mg n = 13 治療完了 n = 12 治療完了 n = 9 1 取り消し同意 n = 11 54 ランダム化 そして 1件の離脱同意 1件の不服与 1件のフォローアップによる喪失 1件のフォローアップによる喪失 1件の薬物検査陽性 20 1件の旅行制限 |
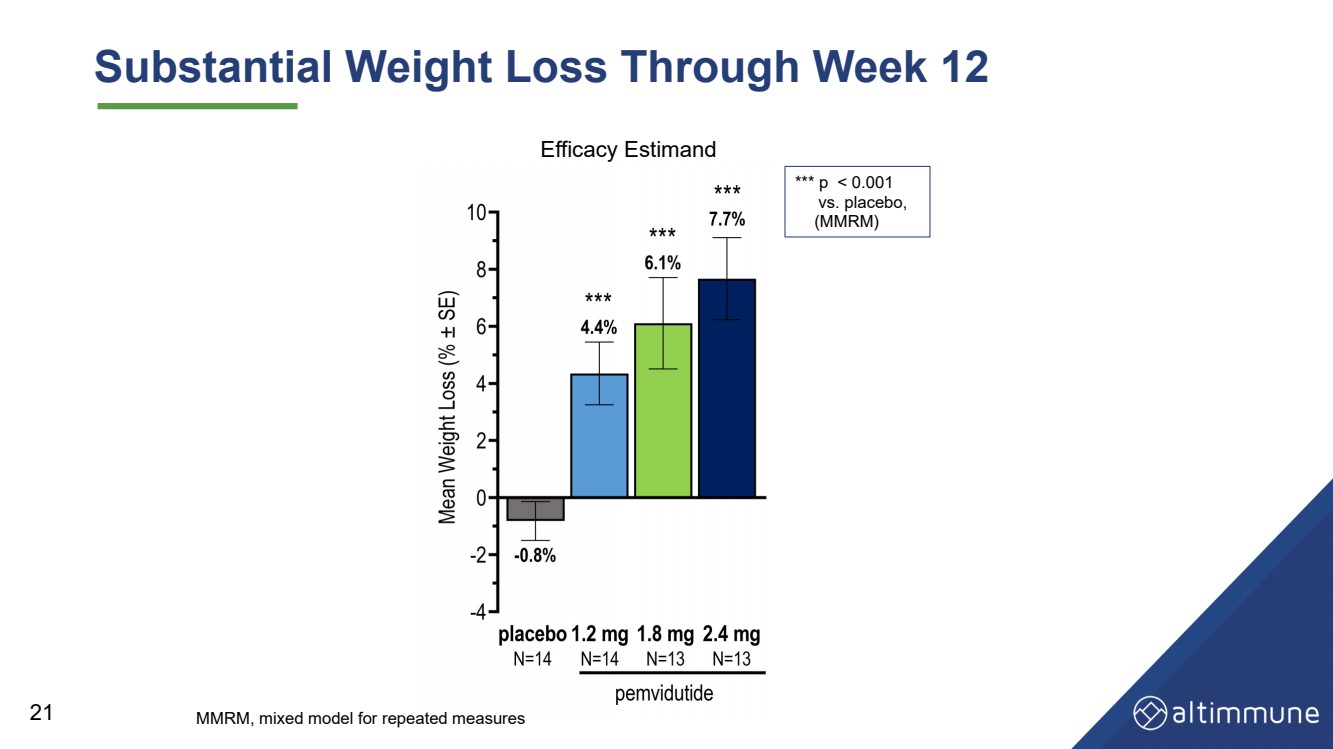
| 12週目までの大幅な減量 21 *** p |
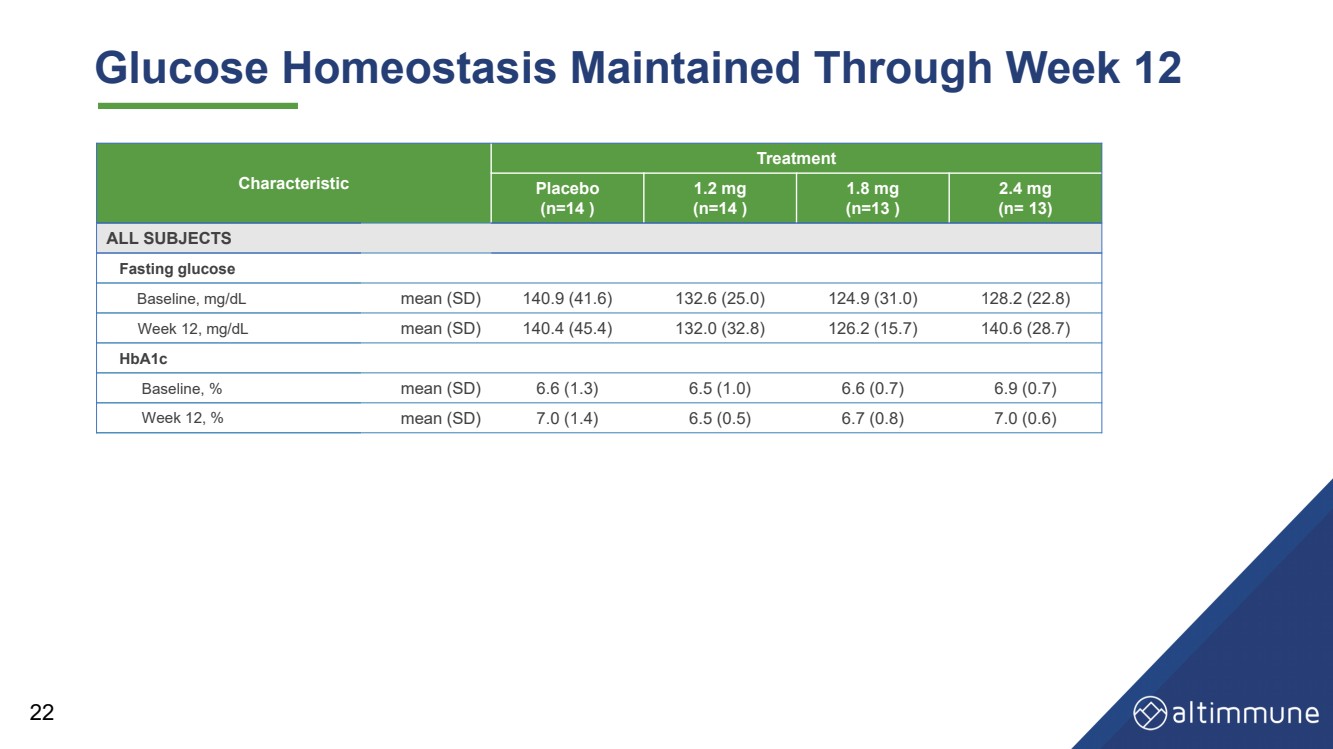
| 22 特徴 治療 プラセボ (n=14) 1.2 mg (n=14) 1.8 mg (n=13) 全被験者 空腹時血糖値 ベースライン、mg/dL 平均 (SD) 140.9 (41.6) 132.6 (25.6) 0) 124.9 (31.0) 128.2 (22.8) 12週目、mg/dL 平均 (SD) 140.4 (45.4) 132.0 (32.8) 126.2 (15.7) 140.6 (28.7) HbA1c ベースライン、% 平均 (SD) 6.6 (1.3) 6.5 (1.0) 6.6 (0.7) 6.6 (0.7) 6.9 (0.7) 12週目、%平均(SD)7.0(1.4)6.5(0.5)6.7(0.8)7.0(0.6) グルコースホメオスタシスは12週目まで維持 |
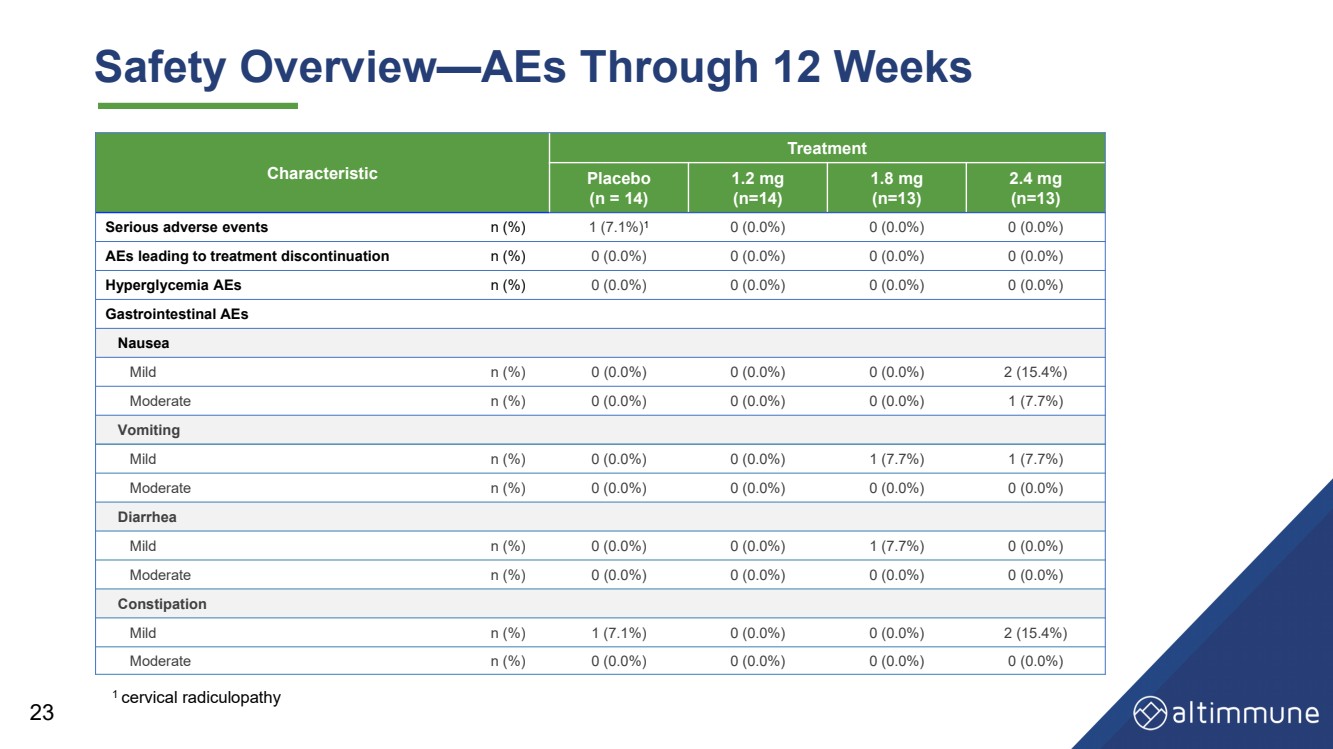
| 23 安全性概要—12週間にわたるAES 治療 プラセボ (n = 14) 1.2 mg (n=14) 1.8 mg (n=13) 2.4 mg (n=13) 重篤な有害事象 n (%) 1 (7.1%) 1 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%)%) 0 (0.0%) 治療中止につながるAE n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 高血糖 AE n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 消化管AE 吐き気 軽度 n (%) 0 (0.0%)) 0 (0.0%) 0 (0.0%) 2 (15.4%) 中程度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 嘔吐 軽度 n (%) 0 (0.0%) 1 (7.7%) 0 (0.0%) 1 (7.7)%) 中程度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 下痢 軽度 n (%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 0 (0.0%) 中程度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 便秘性ペレーション 軽度 n (%) 1 (7.1%) 0 (0.0%) 0 (0.0%) 2 (15.4%) 中等度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 子宮頸部神経根障害 |
| Summary and Conclusions Safety and tolerability • Excellent tolerability with low GI AE rates • No discontinuations due to AEs 24 Glucose control • Glucose homeostasis maintained, with no significant changes in fasting glucose or HbA1c through Week 12 • No hyperglycemia AEs Weight loss • 7.7% (placebo-adjusted 8.5%) weight loss at 2.4 mg through Week 12, with potential for robust weight loss at later timepoints |
| NASDAQ: ALT Questions pertaining to this presentation: Rich Eisenstadt, CFO reisenstadt@altimmune.com |