

炎症とがんの治療を変革する企業プレゼンテーション 2023年3月別紙99.2

法的免責事項このプレゼンテーションに記載されている歴史的事実の記述ではない記述は、将来の見通しに関する記述です。このような将来の見通しに関する記述には、RAPT Therapeutics, Inc.(以下「当社」または「当社」)の研究および臨床開発計画、現在および将来の薬剤候補、事業戦略および計画、規制経路、および特定のマイルストーンを達成する当社の能力に関する記述が含まれますが、これらに限定されません。「信じる」、「予想する」、「計画する」、「期待する」、「する」、「かもしれない」、「近日公開」、「マイルストーン」、「可能性」、「ターゲット」などの言葉、またはこれらに類する表現は、将来の見通しに関する記述を識別することを目的としていますが、すべての将来の見通しに関する記述に必ずしもこれらの識別語が含まれているわけではありません。これらの将来の見通しに関する記述は、将来の出来事や傾向に関する当社の経営陣の現在の信念に基づいており、既知および未知のリスクと不確実性の影響を受けます。これには、証券取引委員会に提出された最新のフォーム10-Kの「リスク要因」セクションに記載されているものや、その後提出される最新および定期的な報告など、当社の実際の業績または成果が、明示または黙示を問わず、将来の業績または成果と大きく異なる可能性があります。の将来の見通しに関する記述によるこのプレゼンテーション。これらの将来の見通しに関する記述は、予測または約束として解釈されるべきではありません。また、そのような将来の見通しに関する記述がなされた仮定が正確または網羅的であることを暗示したり、保証したり、そのような仮定の場合はプレゼンテーションに完全に記載したりすることを暗示するものでもありません。これらの将来の見通しに関する記述は、このプレゼンテーションが行われた日付の時点でのみ述べられているため、過度に信頼しないようご注意ください。将来の見通しに関する記述に反映されている信念や仮定は妥当であると考えていますが、将来の業績や成果を保証することはできません。法律で義務付けられている場合を除き、当社は、理由の如何を問わず、このプレゼンテーションの日付以降に将来の見通しに関する記述を公に更新する義務を負わないものとします。このプレゼンテーションでは、臨床研究中であり、米国食品医薬品局による販売がまだ承認されていない薬剤候補について説明します。当該薬剤候補が研究されている用途における薬剤候補の安全性または有効性については、いかなる表明も行っていません。

DISCOVERY 疾患の重要な免疫ドライバーを標的とする経口薬 RPT193(炎症):炎症性Th2細胞を標的とする経口薬ADのフェーズ1b:安全性と忍容性に優れたすべての主要な探索的エンドポイントに対する有効性ADのフェーズ2bは継続中、2024年半ばにデータが期待される喘息のフェーズ2aを開始する計画(2023年第1四半期)FLX475(オンコロジー):免疫抑制性腫瘍Treg/PoC フェーズ 2 (モノおよびコンボ活性) フェーズ 2 データ更新予定 2023年下半期 HPK1 (オンコロジー) その他の炎症と腫瘍の標的 CLINICAL 独自の創薬エンジン多様なパイプライン大きな市場機会臨床的にリスクの少ない資産戦略的コラボレーション
独自の創薬および開発エンジン R 創薬臨床開発標的とバイオマーカーを特定するための臨床的に重要なビッグデータセットへの迅速な調査データに基づく臨床的成功の可能性の向上 A 分析 P 患者選択 T ターゲティング
RPT193: 炎症性疾患に対するCCR4アンタゴニスト
RPT193: 炎症性疾患用経口Th2阻害剤幅広いアレルギー疾患におけるTH2炎症を安全に軽減するように設計された、非常に強力で選択的な1日1回の経口CCR4拮抗薬中等度から重度のアトピー性皮膚炎におけるフェーズ1bの徴候や症状に対する明らかな有益性良好な安全性と忍容性:検査室での安全性モニタリングやブラックボックス警告が不十分な場合、第一選択薬としての位置づけが期待される CSおよび注射前の米国特許は、少なくとも2039年までの米国特許の対象範囲であり、2024年半ばに予定されているADフェーズ2bのデータと2025年に開始が予想される重要な研究:AD病変性皮膚2023年第1四半期に第2a相喘息試験を開始予定
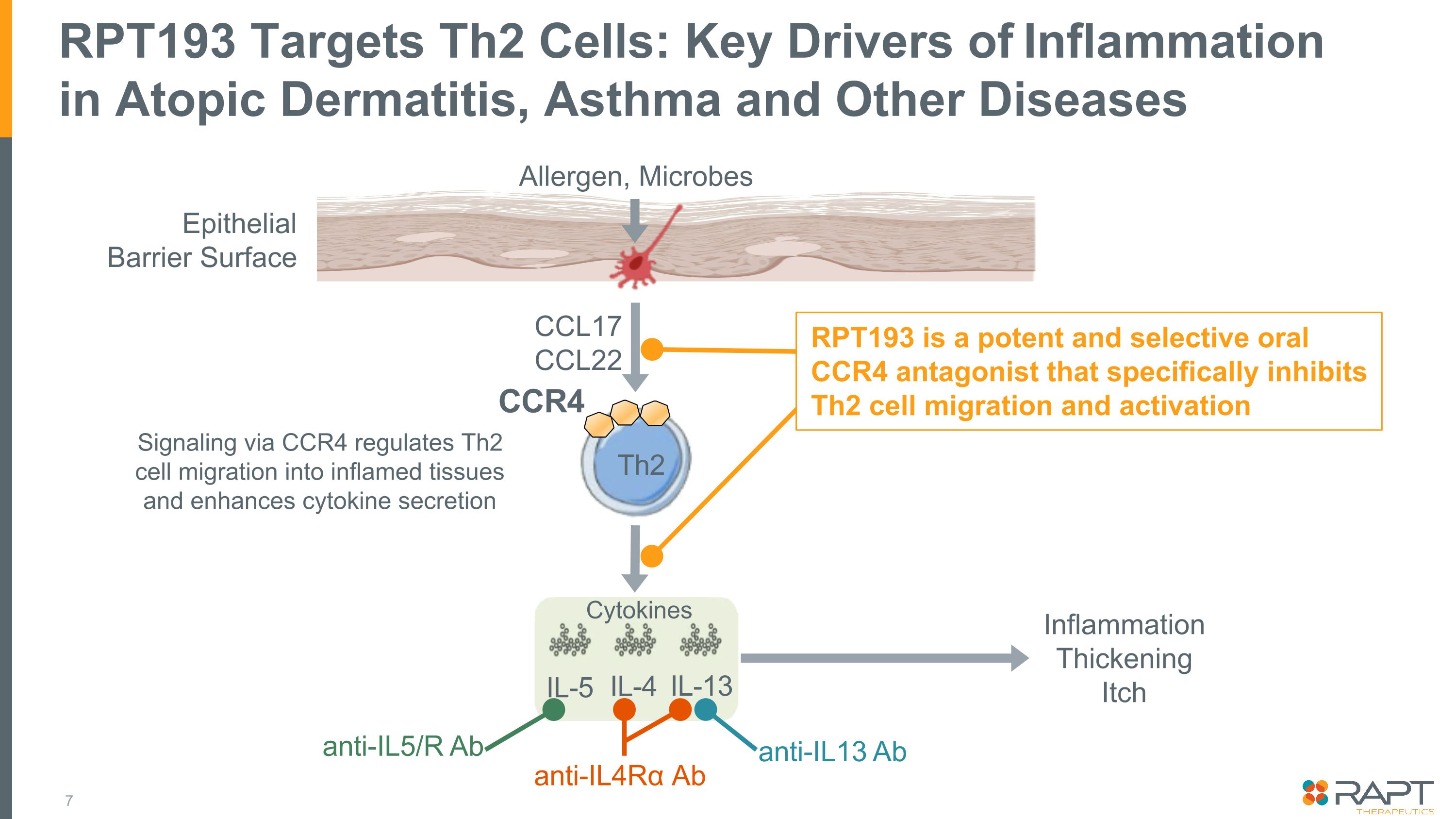
RPT193はTh2細胞を標的とします:アトピー性皮膚炎、喘息、その他の疾患における炎症の主な要因上皮バリア表面 CCR4 Th2 IL-5 IL-4 IL-13 炎症の肥厚によるかゆみシグナル伝達は、炎症組織へのTh2細胞の移動を調節し、サイトカイン分泌を促進します。サイトカイン、アレルゲン、微生物 RPT193は強力で選択的な経口剤です。Th2 細胞の遊走と活性化を特異的に阻害する CCR4 アンタゴニスト CCL17 CCL22 抗IL4Rα Ab 抗IL5/R Ab 抗IL13 Ab
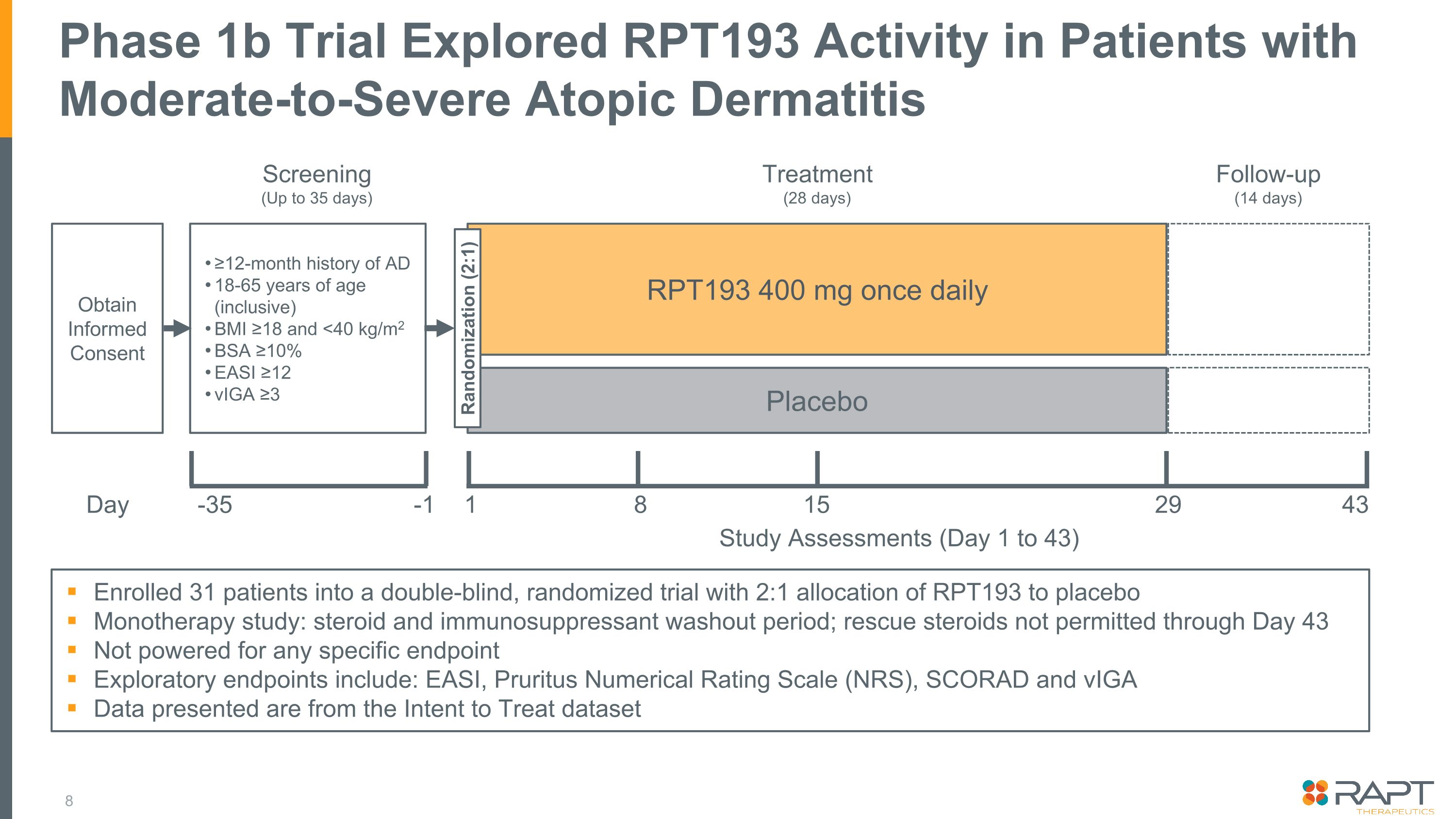
31人の患者を二重盲検ランダム化試験に登録し、RPT193をプラセボ単剤療法研究に 2:1 で割り当て:ステロイドと免疫抑制剤のウォッシュアウト期間、レスキューステロイドは43日目まで使用不可特定のエンドポイントには投与されない探索的エンドポイントとしては、EASI、掻痒症数値評価尺度(NRS)、SCORAD、およびVigAのデータは治療意向データセットフェーズのものです 1b試験では、中等度から重度のアトピー性皮膚炎患者におけるRPT193活性を調査しました。18〜65歳のAD歴が12か月以上(BMIを含む)、インフォームドコンセントを取得(BMIを含む)≥18 と
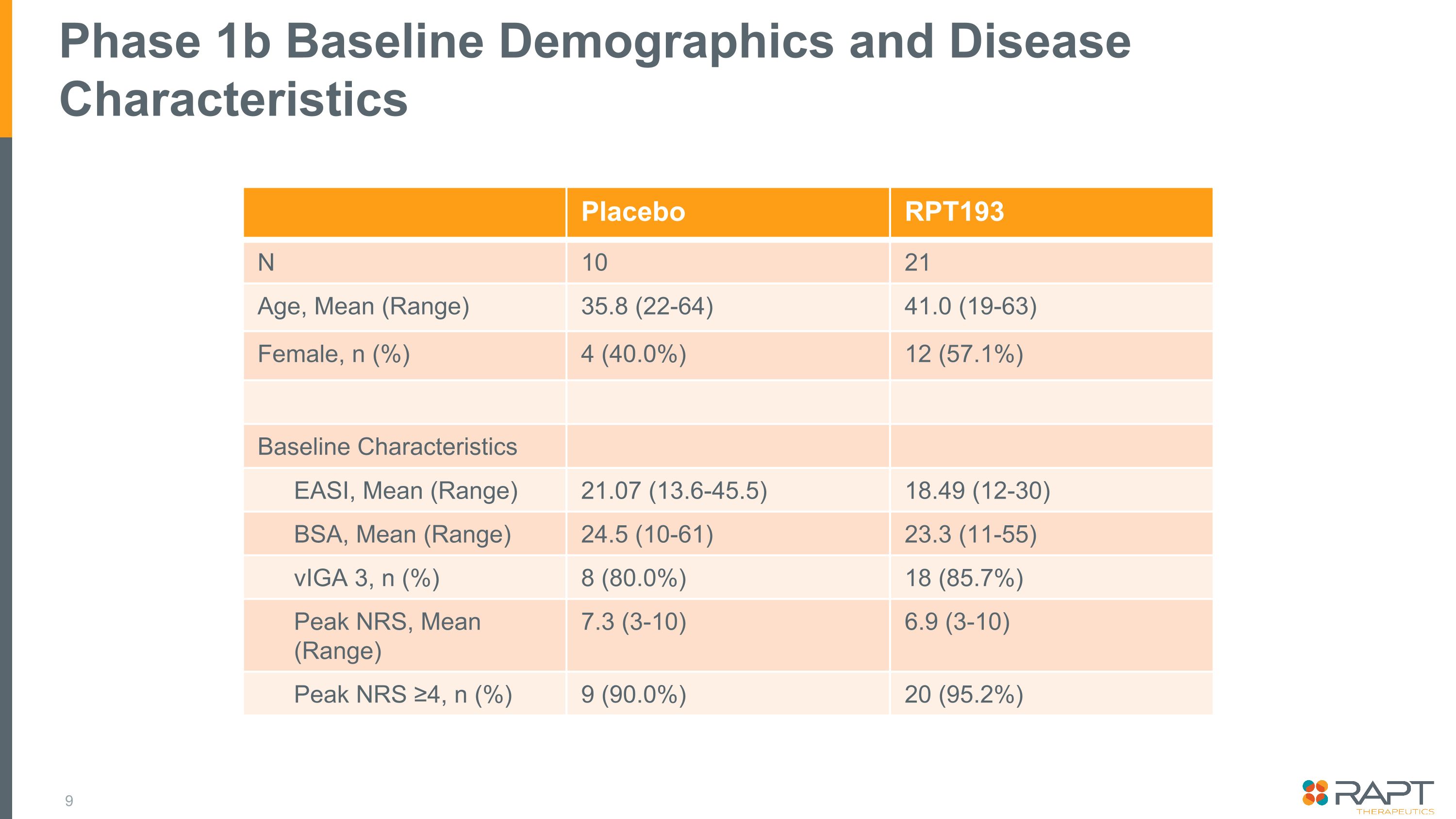
フェーズ 1b ベースラインの人口統計と疾患特性プラセボ RPT193 N 10 21 年齢、平均 (範囲) 35.8 (22-64) 41.0 (19-63) 女性、n (%) 4 (40.0%) 12 (57.1%) ベースライン特性 EASI、平均 (範囲) 21.07 (13.6-45.5) 18.49 (12-30) BSA、平均 (範囲) 24.5 (10-61) 23.3 (11-55) VigA 3、n (%) 8 (80.0%) 18 (85.7%) ピークNRS、平均 (範囲) 7.3 (3-10) 6.9 (3-10) ピークNRS ≥4、n (%) 9 (90.0%) 20 (95.2%)
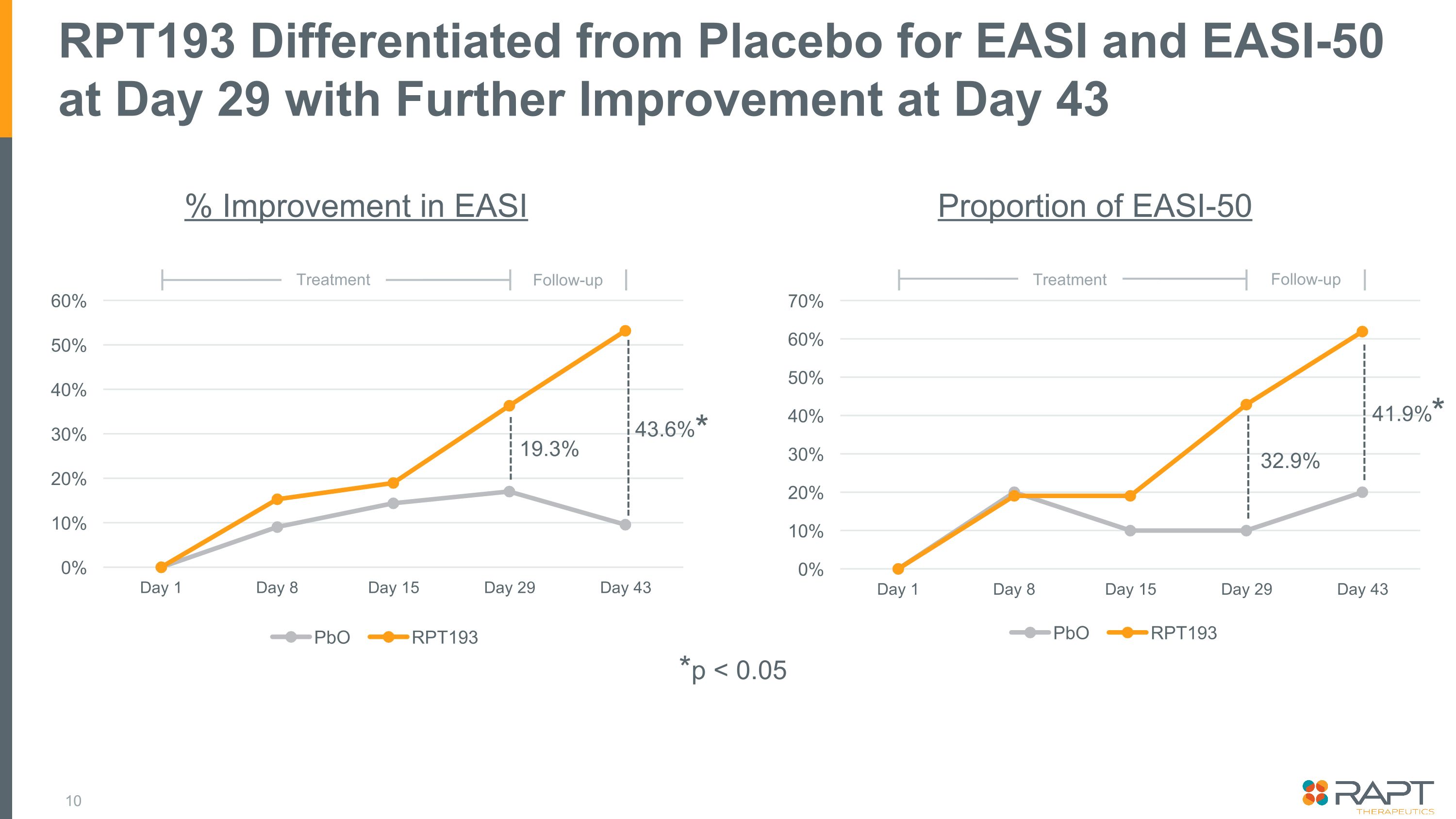
RPT193 EASIおよびEASI-50を29日目にプラセボと区別し、43日目にさらに改善しました。EASI-50のEASI比率が19.3% 43.6% 32.9% 41.9%フォローアップ治療フォローアップ治療フォローアップ治療*p
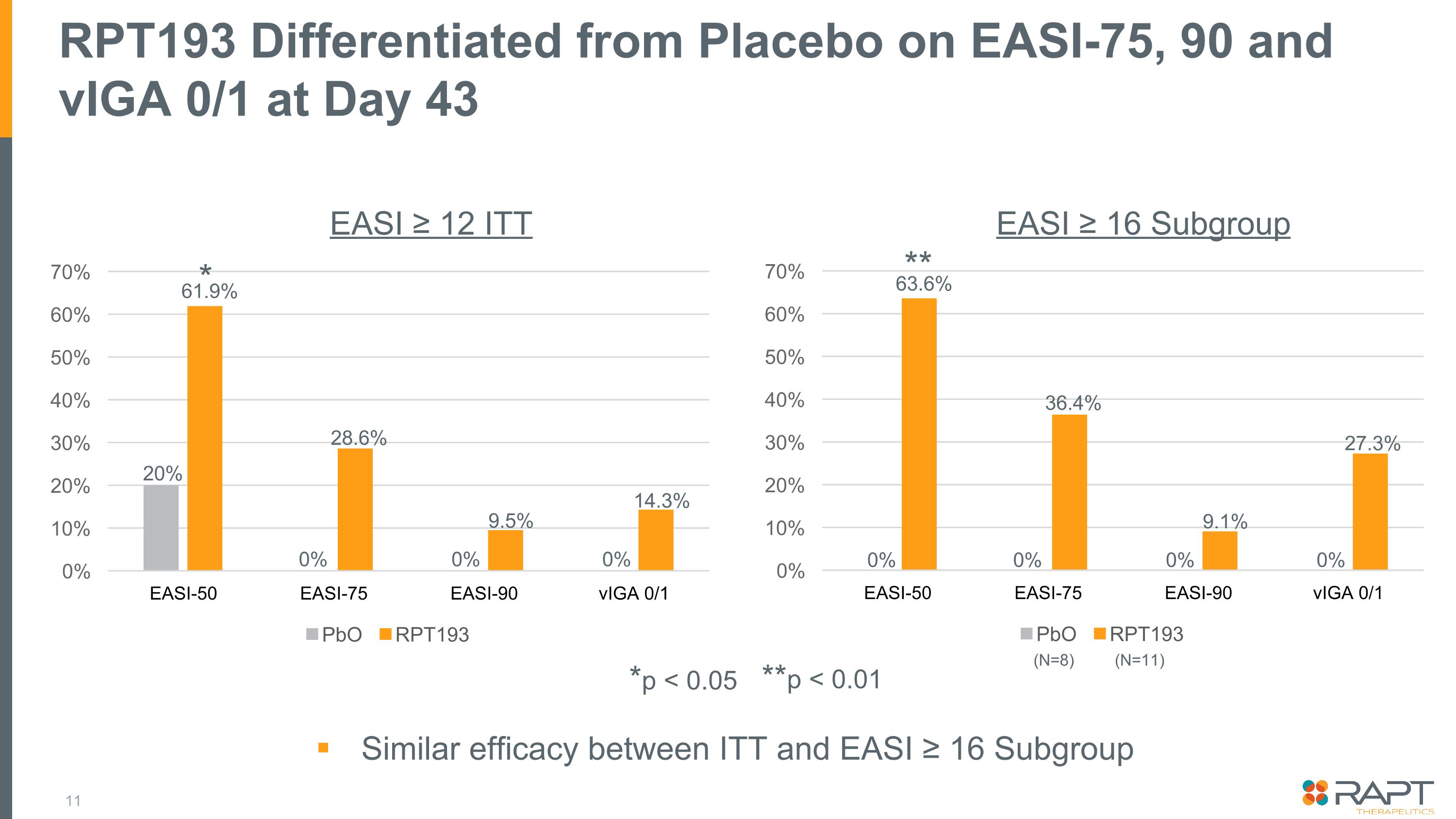
RPT193 は 43 日目に EASI-75、90、および VigA 0/1 でプラセボと区別されました *p

RPT193は、皮膚のAD関連遺伝子シグネチャーの有意な改善を示しました MADAD:メタアナリシスから導き出されたアトピー性皮膚炎スコア***(p
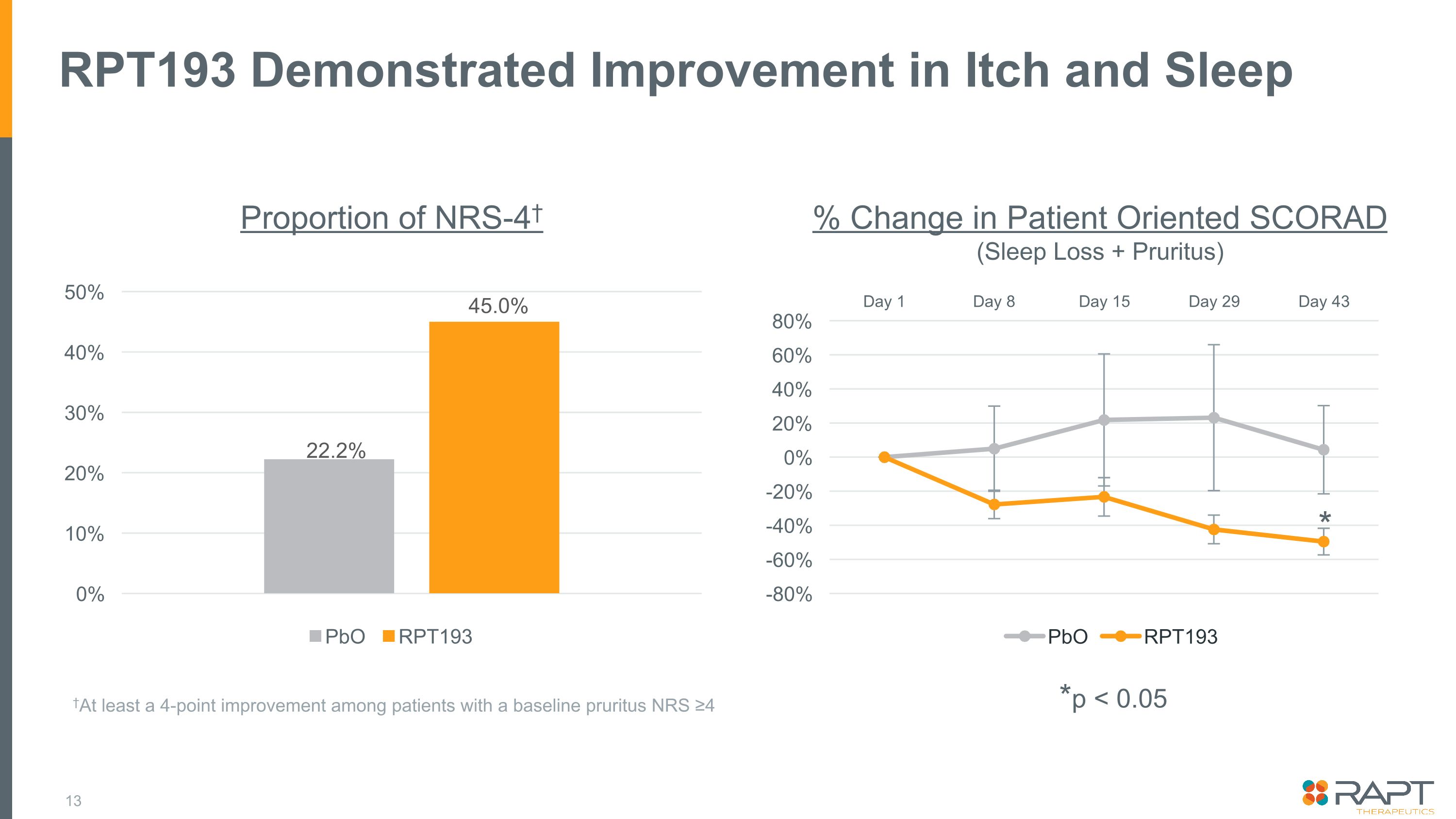
RPT193は、NRS-4のかゆみと睡眠の割合の改善を示しました 22.2% 45.0% ベースラインのかゆみのあるNRSの患者では、少なくとも4ポイントの改善が見られました(NRS)患者志向のSCORADの変化(睡眠不足+そう痒症)*p
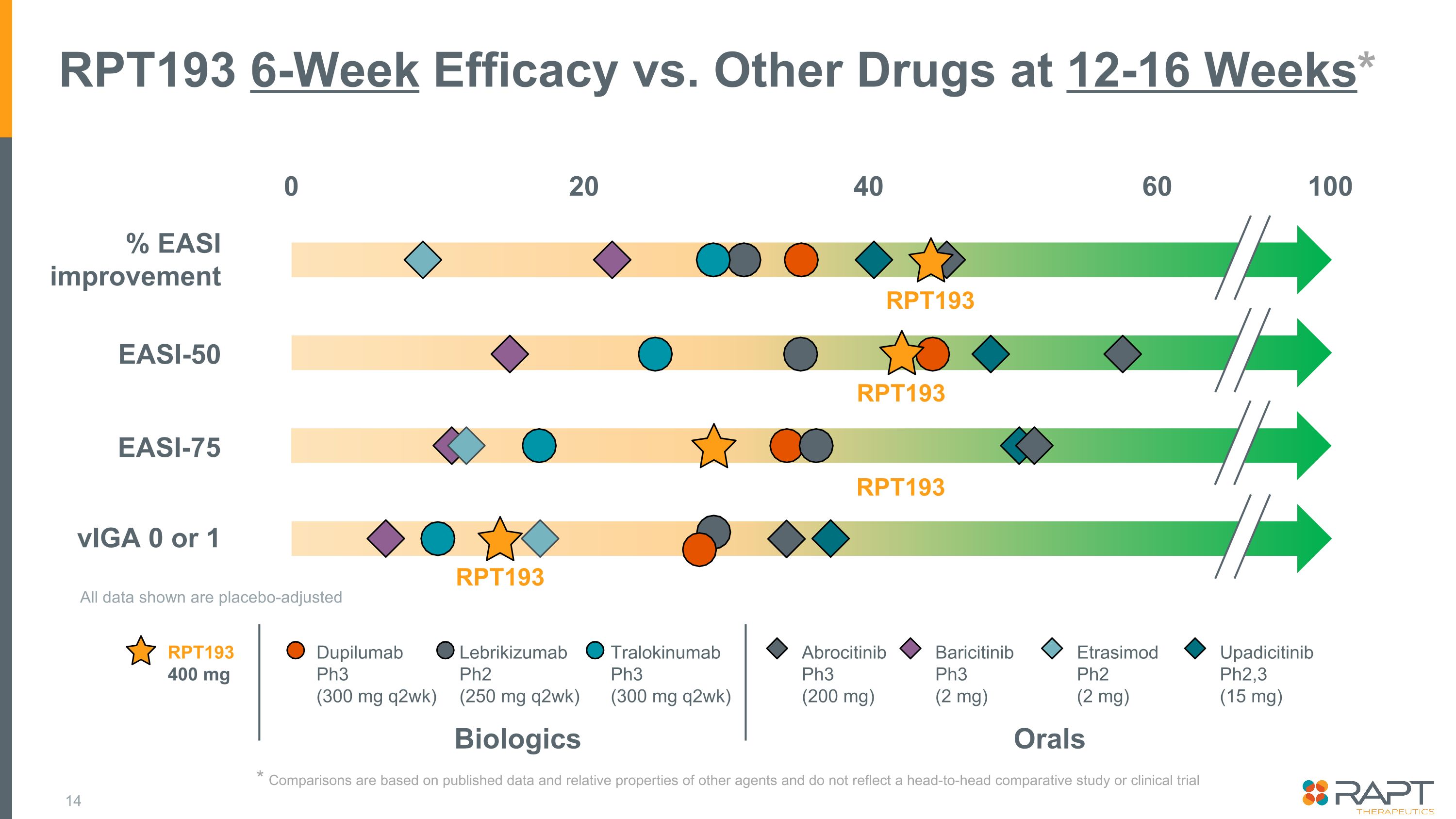
RPT193 6週間の有効性と12〜16週での他の薬剤* RPT193 RPT193 400 mg生物製剤経口デュピルマブ Ph3(300 mg q2週)レブリキズマブ Ph2(250 mg q2wk)トラロキヌマブ Ph3(300 mg q2wk)アブロシチニブ Ph3(200 mg)バリシチニブ b Ph3 (2 mg) エトラシモド Ph2 (2 mg) ウパディシチニブ Ph2,3 (15 mg)% EASI 改善 EASI-50 VigA 0 または 1 100 RPT193 RPT193 0 40 20 60 記載されているデータはすべてプラセボ調整済みです。* 比較は公表されているデータと他の薬剤の相対的特性に基づいており、直接比較研究または臨床試験 EASI-75 RIPT 193

RPT193 フェーズ 1b 安全性 SAE の報告なし報告されたAEはすべて軽度または中等度の強度で、臨床的に有意な安全性検査異常は認められませんでした。全体的な安全性プロファイルから、実験室での安全性モニタリングを必要としない耐容性の高い経口薬であることが示唆されています。

中等度から重度のアトピー性皮膚炎患者を対象とした継続的な用量決定第2b相単剤療法試験 169 18〜75歳のADの12か月以上の病歴のインフォームドコンセントの取得 BMI ≥18 BSA ≥ 10% EASI ≥ 16 VigA ≥3 スクリーニング(最長5週間)-35 -1 RPT193 400 mg 1日1回 RPT193 200 mg 1日1回 RPT193 50mgを1日1回プラセボランダム化(1:1:1)治療(16週間)フォローアップ(最大8週間)1 113 29 57 85 127件の研究評価(1日目から169日目)14 141 目標登録:268人の患者、1群あたり約67人の単剤療法研究:ステロイドをウォッシュアウトするための標準プロトコル/免疫抑制剤および治療薬主要評価項目:EASI 副評価項目:EASI 副評価項目:EASI-50/75/90、VigA、掻痒性NRS
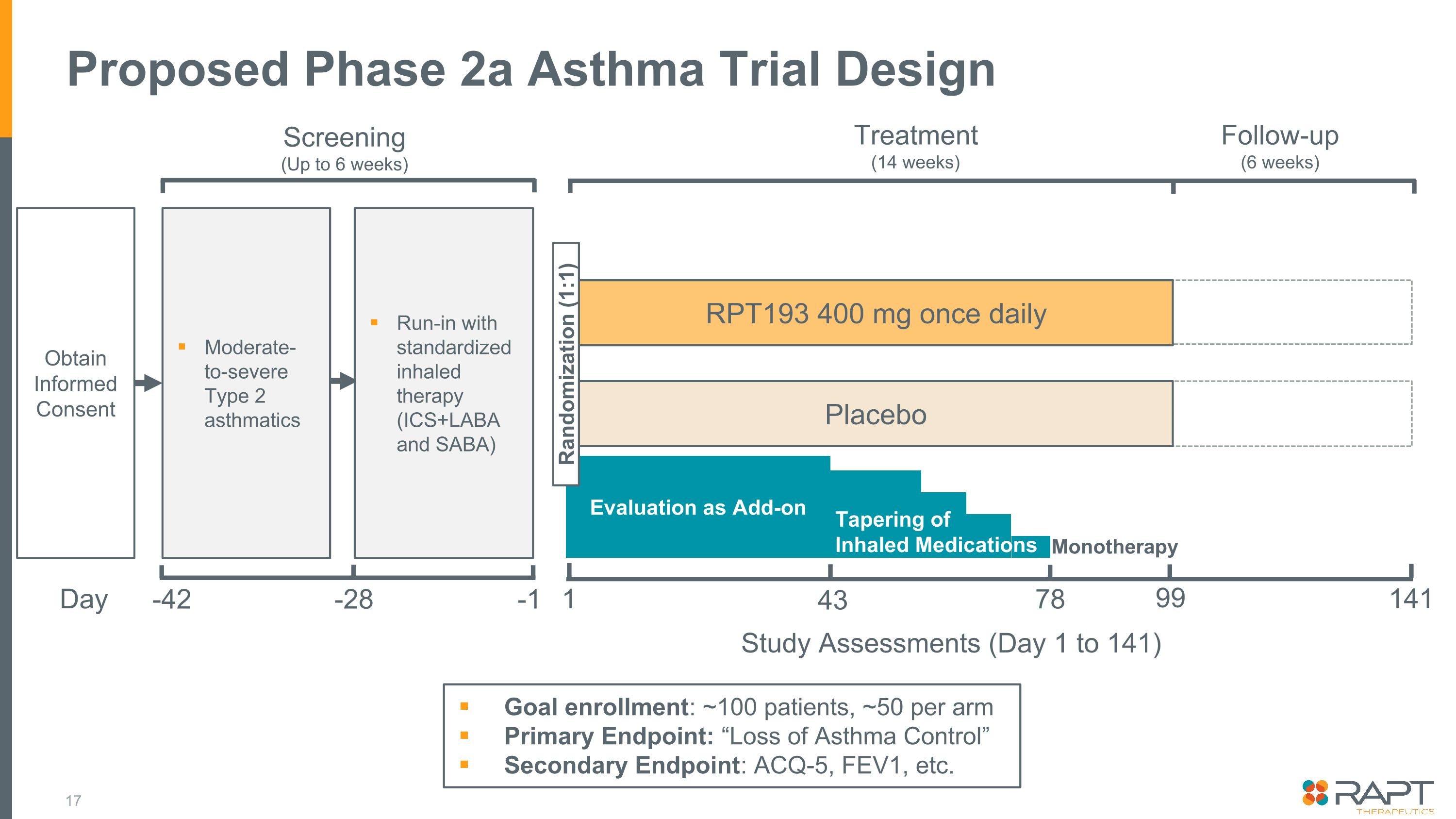
提案されている第2a相喘息試験デザイン機密目標登録:患者数約100人、1群あたり約50人主要評価項目:「喘息コントロールの喪失」副評価項目:ACQ-5、FEV1などインフォームドコンセントの取得中等度から重度の2型喘息患者スクリーニング(最大6週間)-42 -1 RPT193 400mg 1日1回プラセボ治療(14週間)フォローアップ(6週間)1 141 研究評価(1日目から141日目)吸入薬単剤療法のアドオンテーパリングとしての評価 43 78 99 標準化された吸入療法(ICS+LABAおよびSABA)によるランダム化(1:1)-28
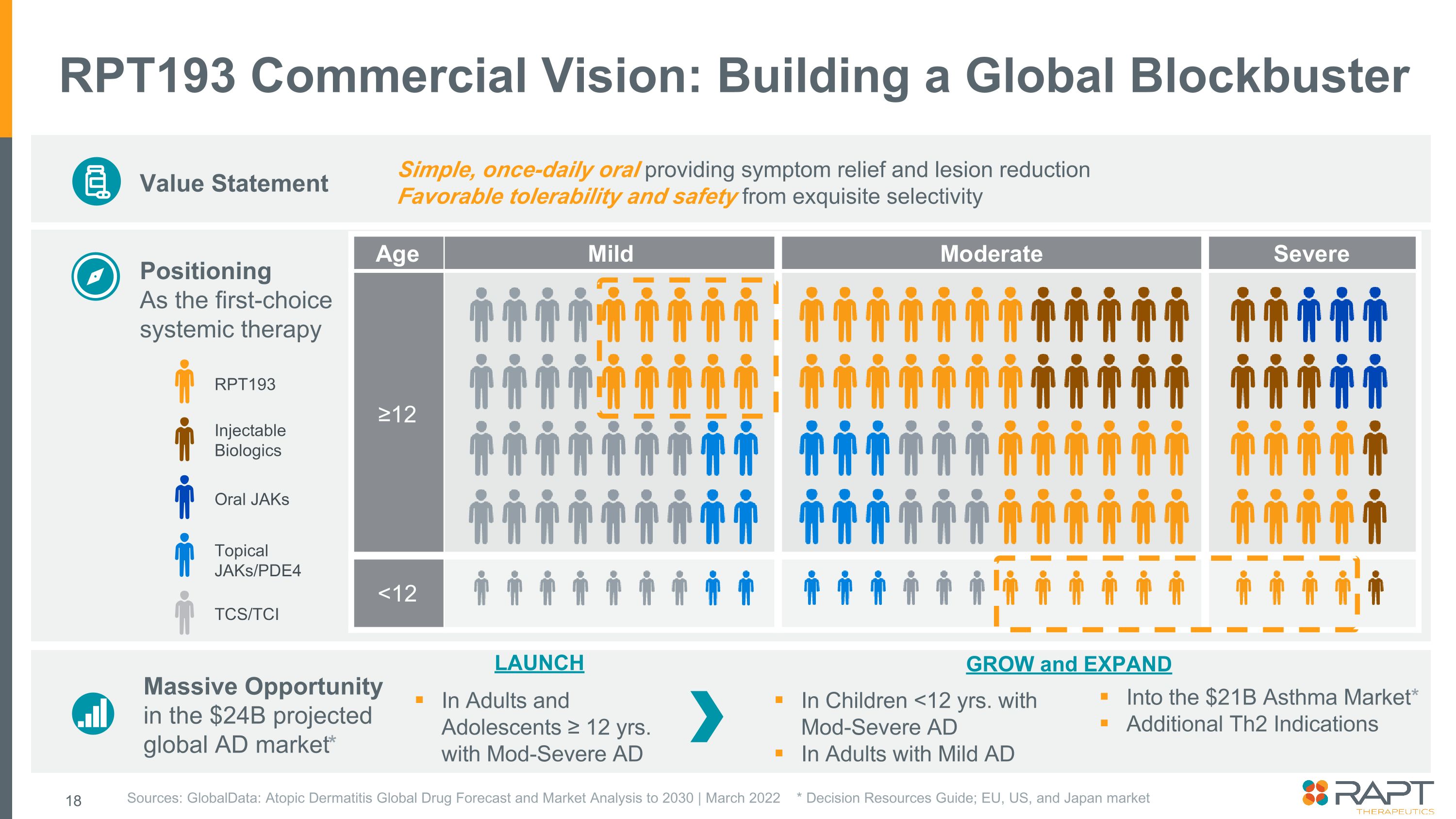
RPT193商業ビジョン:世界的大ヒットバリューステートメントの構築第一選択全身療法としての位置づけ出典:GlobalData: アトピー性皮膚炎2030年までの世界の医薬品予測と市場分析 | 2022年3月* 意思決定資料ガイド; EU、米国、日本市場症状緩和と病変軽減をもたらすシンプルな1日1回の経口投与絶妙な選択性による良好な耐容性と安全性 RPT193 注射用生物製剤経口薬外用剤/PDE4 TCS/TCI 240億ドル規模が予測される世界の広告市場における大きなチャンス* 12歳以上の成人および青少年中程度の重症ADが210億ドル規模の喘息市場に参入* Th2適応症を追加発売、小児の成長と拡大
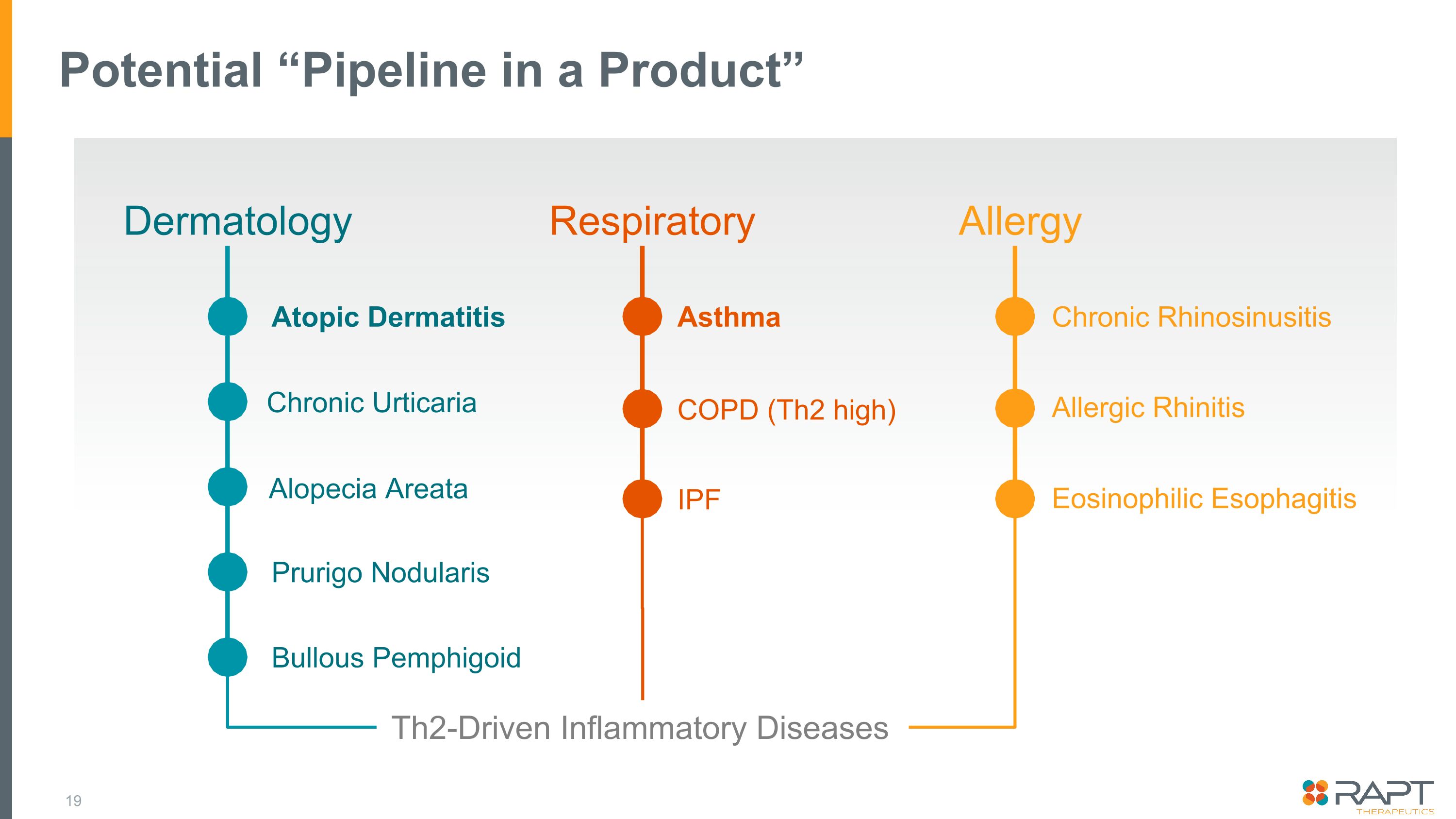
潜在的な「製品パイプライン」皮膚科呼吸器慢性鼻副鼻腔炎アレルギー好酸球性食道炎掻痒性結節性水疱性類天疱瘡円形脱毛症喘息COPD(Th2高)IPFアトピー性皮膚炎アレルギー性鼻炎 Th2駆動性炎症性疾患慢性じんましん

RPT193プログラムの概要ADの徴候と症状に明らかな効果をもたらす経口選択的Th2阻害剤耐容性良好で安全性も良好ですプロファイルは注射剤や経口JAKに先んじて競争上の地位を確立しますAD、喘息、その他のTh2適応症における大きな商業的機会ADでの16週間の第2b相試験が進行中で、トップラインデータ 2024年半ばに予定されている生物学的効果は商業的成功には必要ありません(第2a相試験を開始予定)喘息 2023年第1四半期

FLX475: オンコロジー用CCR4アンタゴニスト
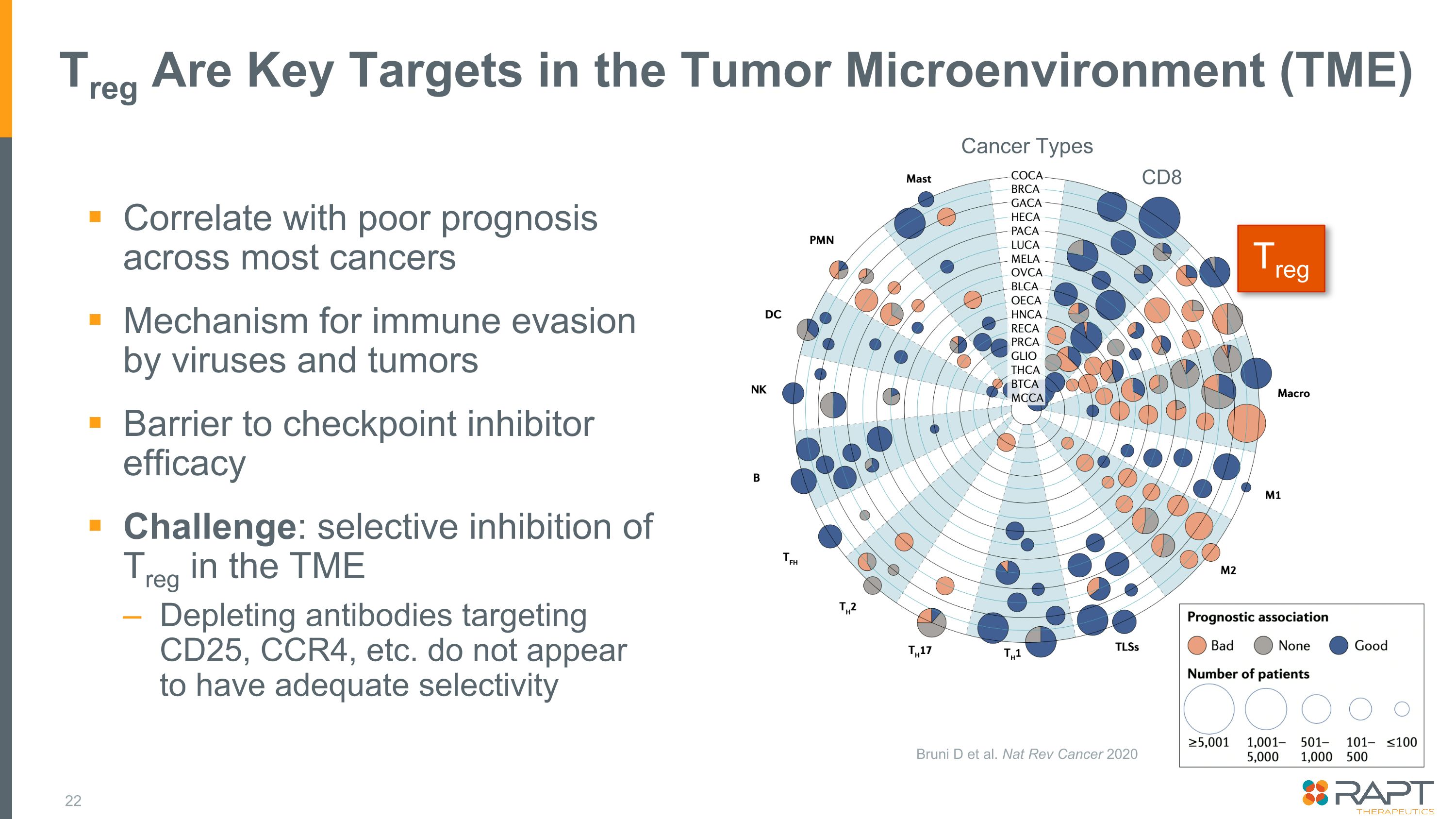
TREGは腫瘍微小環境(TME)の主要な標的であり、ほとんどのがんの予後不良と相関関係ウイルスや腫瘍による免疫回避のメカニズムチェックポイント阻害薬有効性の障壁:TMEにおけるTregの選択的阻害 CD25、CCR4などを標的とする抗体の枯渇には適切な選択性がないようです TregCD8 がんタイプ Bruni D et al.ナット・レヴ・キャンサー 2020
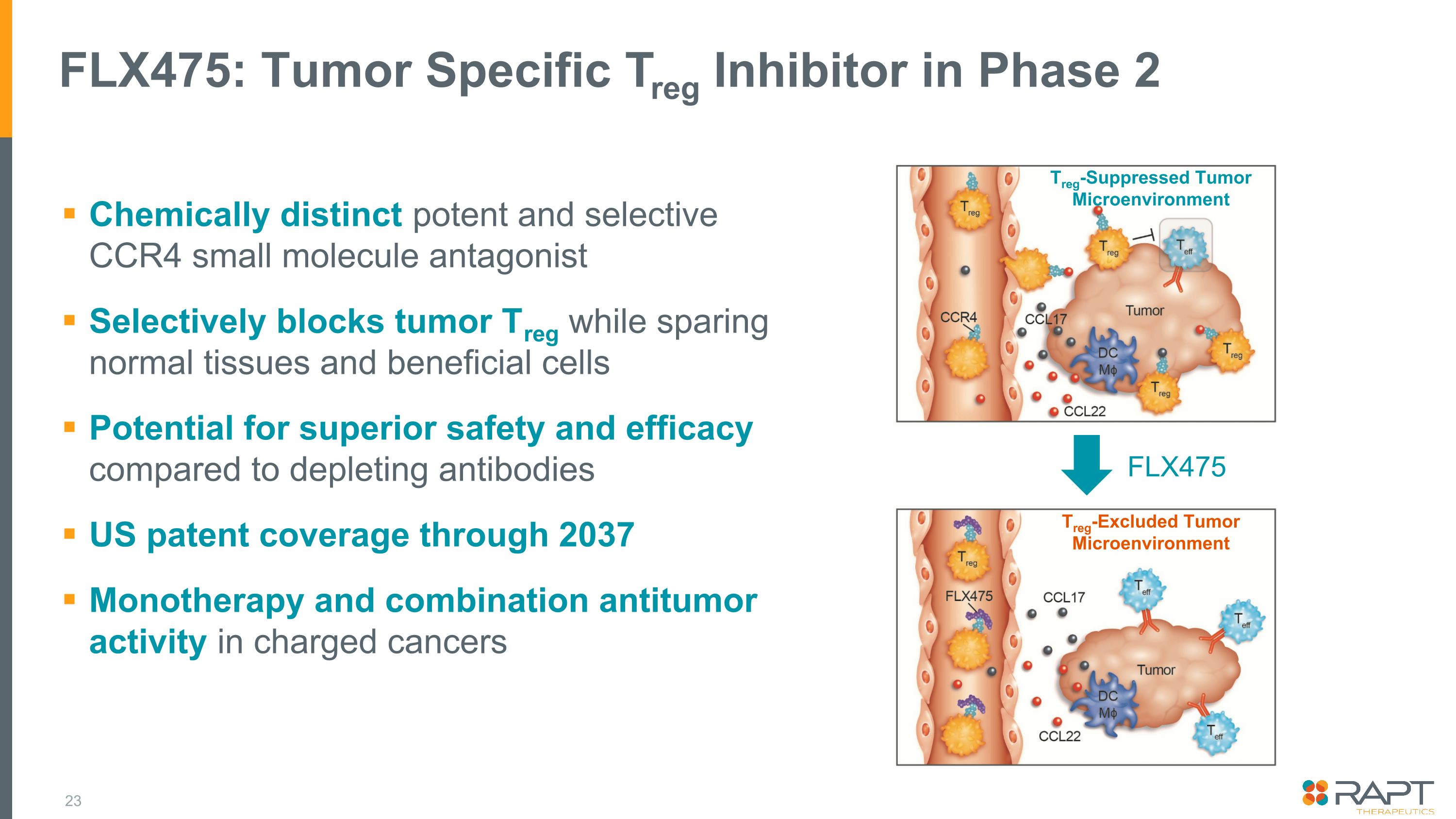
FLX475: フェーズ2の腫瘍特異的Treg阻害剤化学的に異なる強力で選択的なCCR4小分子アンタゴニストは、正常組織と有益な細胞を温存しながら腫瘍Tregを選択的に遮断します。抗体を枯渇させる場合と比較して優れた安全性と有効性が期待できます。2037年までの米国特許被ばく帯電がんにおける単独療法と併用抗腫瘍活性 Treg除外腫瘍微小環境 Treg抑制腫瘍微小環境 FLXX 475
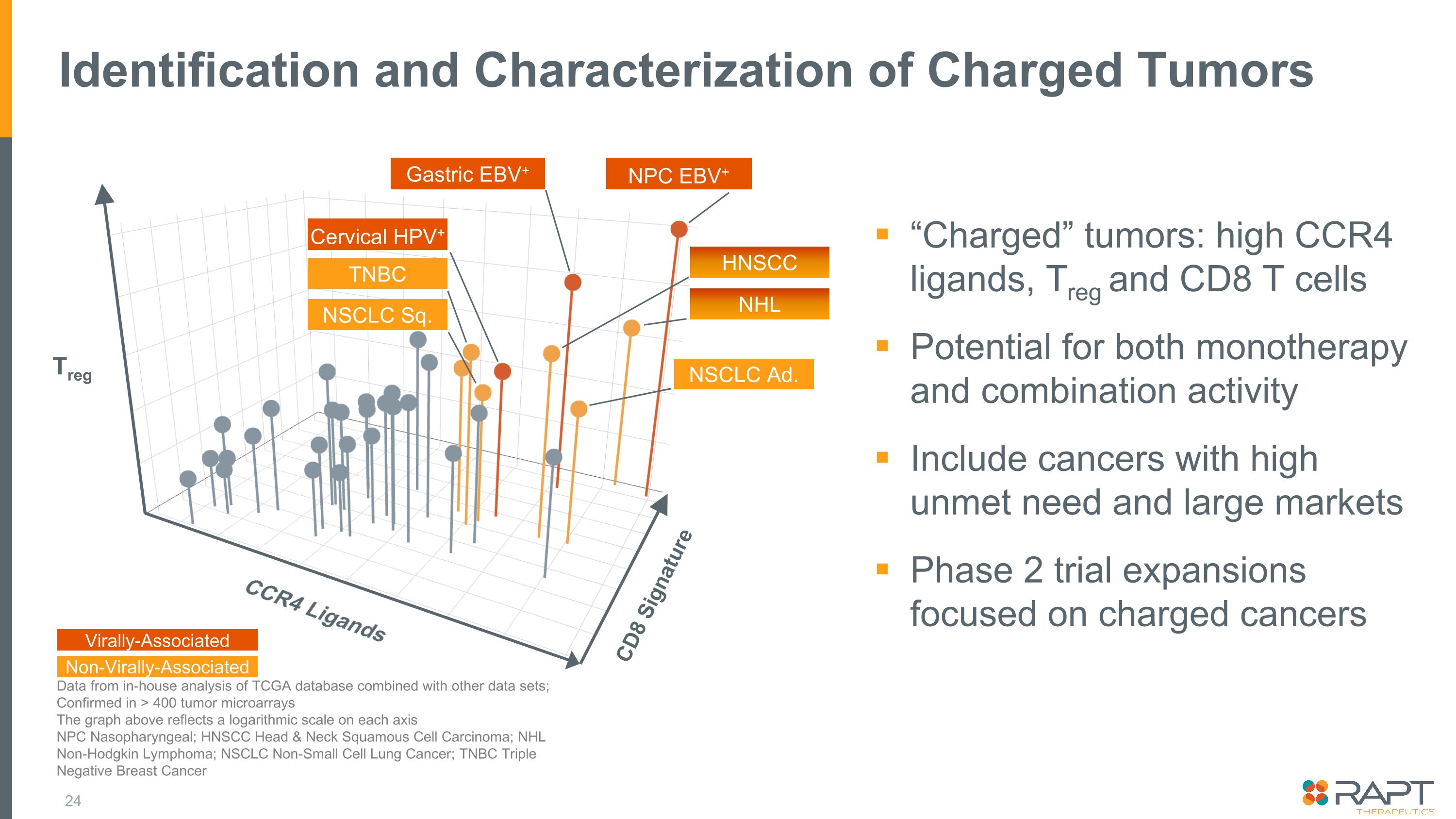
荷電性腫瘍「帯電」腫瘍の同定と特性評価「帯電した」腫瘍:高CCR4リガンド、TregおよびCD8 T細胞、単剤療法と併用活性の両方の可能性満たされていないニーズが高く市場が大きいがんを対象とする第2相試験の拡大 TCGAデータベースと他のデータセットを組み合わせた社内分析データ。400を超える腫瘍マイクロアレイで確認上のグラフは、各軸の対数スケールを示しています (NPC) 鼻腔鏡です。咽頭; HNSCC頭頸部扁平上皮がん; NHL非ホジキンリンパ腫; NSCLC非小細胞肺がん;TNBC トリプルネガティブ乳がんトレッグ CCR4 リガンド CD8 シグネチャー胃EBV+ NPC EBV+ NSCLC Sq.TNBC 子宮頸部HPV+ HNSCC 非小細胞がん広告ウイルス関連非ウイルス関連NHL
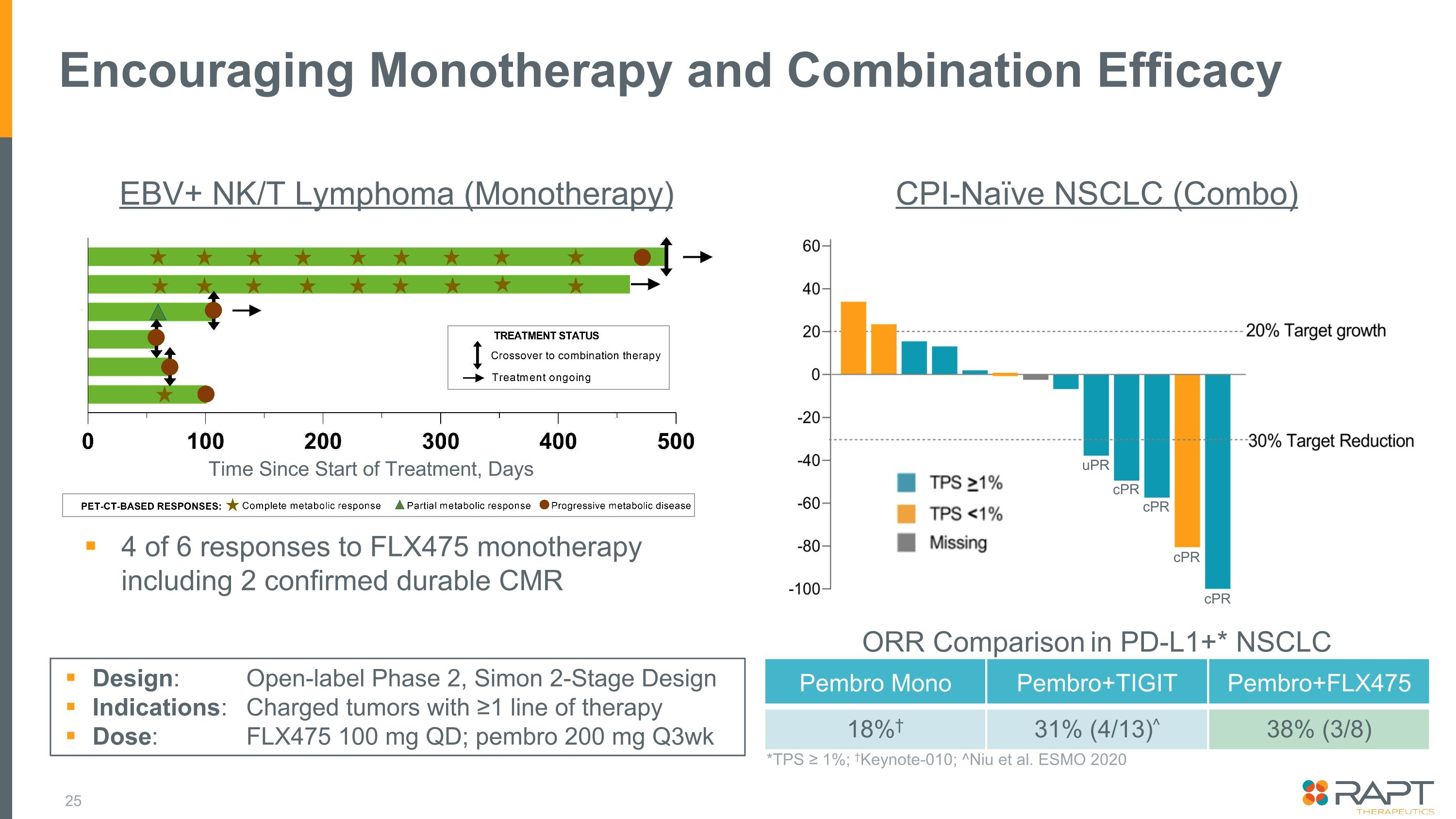
有望な単剤療法と併用効果ペンブロモノペムブロ+チギットペンブロ+FLX475 18% 31% 31% (4/13) ^ 38% (3/8) PD-L1+* NSCLC*TPS ≥ 1%; Keynote-010; ^Niu らESMO 2020 CPI未投与NSCLC(コンボ)EBV+ NK/T リンパ腫(単剤療法)FLX475単剤療法に対する6件の奏効のうち4回(2件の持続性が確認されたCMRを含む)設計:非盲検第2相、サイモン2段階設計適応症:治療開始から1日100mg、ペムブロ200mg(週3週間に1回)デイズ心肺蘇生CPR 心肺蘇生法

FLX475 プログラムの概要生物製剤とは異なる高選択性腫瘍Treg阻害薬単剤療法およびペムブロリズマブとの併用による早期有効性が期待安全性と便利な経口投与は幅広い併用可能性を裏付ける CPI未使用のNSCLCパートナーであるハンミ・ファーマシューティカルズ社は、EBにおけるFLX475+ペムブロに関する有望なデータを報告した。V+ 胃がんデータの更新は 2023 年下半期に予定されています

主な成果と今後のマイルストーン RPT193: 幅広い炎症性疾患向けに設計された安全な経口薬剤、AD FLX475 での決定的な第2b相試験中:選択性の高い腫瘍 Treg阻害薬を、単剤療法として、またはペムブロリズマブとの併用として複数の第2相拡大療法として検討中:2023年第1四半期:RPT193 第2a相喘息試験が2023年下半期に開始:FLX475 フェーズ 2 データアップデート 2024 年中旬:RPT193 フェーズ 2b AD トップラインデータ

ありがとう