ovid-20221231誤り00016366512022会計年度00016366512022-01-012022-12-3100016366512022-06-30ISO 4217:ドル00016366512023-03-10Xbrli:共有00016366512022-12-3100016366512021-12-31ISO 4217:ドルXbrli:共有0001636651アメリカ公認会計基準:ライセンスメンバー2022-01-012022-12-310001636651アメリカ公認会計基準:ライセンスメンバー2021-01-012021-12-310001636651Ovid:関連先メンバ2022-01-012022-12-310001636651Ovid:関連先メンバ2021-01-012021-12-3100016366512021-01-012021-12-310001636651アメリカ-公認会計基準:第一選択株式メンバー米国-GAAP:転換可能な第一選択株メンバー2021-12-310001636651アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001636651US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001636651アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001636651アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001636651アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001636651US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001636651アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001636651アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001636651アメリカ-公認会計基準:第一選択株式メンバー米国-GAAP:転換可能な第一選択株メンバー2022-12-310001636651アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001636651US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001636651アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001636651アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001636651アメリカ-公認会計基準:第一選択株式メンバー米国-GAAP:転換可能な第一選択株メンバー2020-12-310001636651アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001636651US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001636651アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310001636651アメリカ-公認会計基準:前払いメンバーを保留2020-12-3100016366512020-12-310001636651アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001636651US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001636651アメリカ-公認会計基準:第一選択株式メンバー米国-GAAP:転換可能な第一選択株メンバー2021-01-012021-12-310001636651アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-3100016366512014-04-012022-12-310001636651OVID:ライセンスと連携プロトコルのメンバー2014-04-012022-12-310001636651Ovid:RoyaltyAndTerminationAgreementメンバー2014-04-012022-12-310001636651OVID:Marinus TreateuticsIncMember2022-12-310001636651Ovid:PromissoryNoteesMembers2022-03-17Xbrli:純0001636651Ovid:MoneyMarketFundsAndShortTermInvestmentsメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001636651Ovid:MoneyMarketFundsAndShortTermInvestmentsメンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2021-12-310001636651アメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001636651アメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001636651Ovid:年金計画マッチングシーンOneMember2022-01-012022-12-310001636651Ovid:年金計画マッチングシーン2人のメンバー2022-01-012022-12-310001636651SRT:最小メンバ数Ovid:年金計画マッチングシーン2人のメンバー2022-01-012022-12-310001636651Ovid:年金計画マッチングシーン2人のメンバーSRT:最大メンバ数2022-01-012022-12-310001636651アメリカ公認会計基準:現金会員2022-12-310001636651アメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001636651アメリカ公認会計基準:現金会員2021-12-310001636651アメリカ公認会計基準:MoneyMarketFundsMembers2021-12-31オヴィッド:投資0001636651アメリカ-GAAP:家具と固定機器のメンバー2022-12-310001636651アメリカ-GAAP:家具と固定機器のメンバー2021-12-310001636651アメリカ-公認会計基準:リース改善メンバー2022-12-310001636651アメリカ-公認会計基準:リース改善メンバー2021-12-3100016366512022-03-10Utr:SQFT00016366512022-03-102022-03-100001636651US-GAAP:LetterOfCreditMember2022-12-310001636651OVID:SeriesAConvertiblePferredStockMember2022-12-31オヴィッド:投票0001636651Ovid:ATMaccesementMemberOvid:CowenAndCompanyLLCMメンバーSRT:最大メンバ数2020-11-300001636651Ovid:ATMaccesementMemberOvid:CowenAndCompanyLLCMメンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001636651OVID:SeriesAConvertiblePferredStockMember2021-12-310001636651OVID:SeriesAConvertiblePferredStockMember2022-01-012022-12-310001636651SRT:最小メンバ数OVID:SeriesAConvertiblePferredStockMember2022-12-310001636651OVID:SeriesAConvertiblePferredStockMemberSRT:最大メンバ数2022-12-310001636651OVID:SeriesAConvertiblePferredStockMember2021-03-012021-03-310001636651アメリカ-アメリカ公認会計基準:普通株式メンバー2021-03-012021-03-310001636651Ovid:2千と7千の株式インセンティブ計画のメンバー2022-12-310001636651Ovid:2千と7千の株式インセンティブ計画のメンバー2022-01-012022-12-310001636651Ovid:2千と7千の株式インセンティブ計画のメンバー2021-01-012021-01-010001636651Ovid:2千と7千の株式インセンティブ計画のメンバー2021-01-012021-12-310001636651Ovid:2千と7千の株式インセンティブ計画のメンバー2022-01-012022-01-010001636651Ovid:2千と7千の株式インセンティブ計画のメンバーアメリカ公認会計基準:副次的事件メンバー2023-01-012023-01-010001636651Ovid:2700人の従業員株式購入計画メンバー2022-12-310001636651Ovid:2700人の従業員株式購入計画メンバー2022-01-012022-12-310001636651Ovid:2700人の従業員株式購入計画メンバー2021-01-012021-12-310001636651Ovid:2700人の従業員株式購入計画メンバー2021-01-012021-01-010001636651Ovid:2700人の従業員株式購入計画メンバー2021-12-310001636651アメリカ公認会計基準:パフォーマンス共有メンバー2022-12-310001636651アメリカ公認会計基準:パフォーマンス共有メンバー2021-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2022-01-012022-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2021-01-012021-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2022-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembers2021-12-310001636651アメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembersアメリカ公認会計基準:パフォーマンス共有メンバー2022-01-012022-12-310001636651アメリカ-GAAP:ShareBasedPaymentArrangementNonEmployeMembersアメリカ公認会計基準:パフォーマンス共有メンバー2021-01-012021-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementEmployeeMembers2022-01-012022-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementEmployeeMembers2021-01-012021-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementEmployeeMembers2022-12-310001636651米国-公認会計基準:従業員株式オプションメンバーアメリカ-GAAP:ShareBasedPaymentArrangementEmployeeMembers2021-12-310001636651アメリカ-GAAP:ShareBasedPaymentArrangementEmployeeMembersアメリカ公認会計基準:パフォーマンス共有メンバー2022-01-012022-12-310001636651アメリカ-GAAP:ShareBasedPaymentArrangementEmployeeMembersアメリカ公認会計基準:パフォーマンス共有メンバー2021-01-012021-12-310001636651米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001636651米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001636651アメリカ-公認会計基準:販売一般と管理費用メンバー2022-01-012022-12-310001636651アメリカ-公認会計基準:販売一般と管理費用メンバー2021-01-012021-12-310001636651Ovid:株式オプションメンバー2022-01-012022-12-310001636651Ovid:株式オプションメンバー2021-01-012021-12-310001636651Ovid:EmployeStockPurche ePlanMember2022-01-012022-12-310001636651Ovid:EmployeStockPurche ePlanMember2021-01-012021-12-3100016366512020-01-012020-12-310001636651米国-GAAP:国内/地域メンバー2022-12-310001636651アメリカ-公認会計基準:州と地方法律法規のメンバー2022-12-310001636651アメリカ-公認会計基準:ニューヨーク州税務署と財務メンバー2022-12-310001636651OVID:ライセンスプロトコルのメンバーオヴィッド:西北大学のメンバー2016-12-012016-12-310001636651OVID:ライセンスプロトコルのメンバーオヴィッド:西北大学のメンバー2017-12-310001636651OVID:ライセンスプロトコルのメンバーオヴィッド:西北大学のメンバーSRT:最大メンバ数2017-12-31オヴィッド:製品0001636651オヴィッド:アスリカンのメンバー2021-12-302021-12-300001636651オヴィッド:アスリカンのメンバー2021-12-300001636651オヴィッド:アスリカンのメンバー2021-01-012021-12-3100016366512021-12-300001636651Ovid:HLundbeckASMembers2021-12-302021-12-3000016366512022-08-012022-08-310001636651OVID:ライセンスプロトコルのメンバーSRT:最大メンバ数2022-08-310001636651オヴィッド:アンジェレニーのメンバー2022-01-012022-12-310001636651オヴィッド:アンジェレニーのメンバーOVID:ライセンスプロトコルのメンバー2020-12-310001636651オヴィッド:アンジェレニーのメンバーOVID:ライセンスプロトコルのメンバー2022-01-012022-12-310001636651オヴィッド:アンジェレニーのメンバー2021-01-012021-12-310001636651Ovid:武田製薬有限会社のメンバーアメリカ-公認会計基準:連携性手配メンバー2022-12-310001636651Ovid:武田製薬有限会社のメンバーアメリカ-公認会計基準:連携性手配メンバー2021-03-290001636651Ovid:武田製薬有限会社のメンバーSRT:最大メンバ数アメリカ-公認会計基準:連携性手配メンバー2021-03-292021-03-290001636651Ovid:武田製薬有限会社のメンバーアメリカ-公認会計基準:連携性手配メンバー2022-01-012022-12-310001636651Ovid:武田製薬有限会社のメンバーアメリカ-公認会計基準:連携性手配メンバー2021-01-012021-12-310001636651OVID:Healxライセンスとオプションプロトコルのメンバー2022-02-012022-02-010001636651OVID:Healxライセンスとオプションプロトコルのメンバー2022-01-012022-12-310001636651Ovid:Marinus PharmPharmticals IncMemberOvid:Marinusライセンス契約メンバー2022-03-010001636651Ovid:Marinus PharmPharmticals IncMemberOVID:Patentライセンスプロトコルのメンバー2022-03-012022-03-010001636651米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001636651米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001636651OVID:SeriesAConvertiblePferredStockMember2022-01-012022-12-310001636651OVID:SeriesAConvertiblePferredStockMember2021-01-012021-12-31 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
_________________________________
表10-K
_________________________________
(マーク1)
x 1934年証券取引法第13条又は15条に基づいて提出された年次報告
本財政年度末まで十二月三十一日, 2022
あるいは…。
o 1934年証券取引法第13条又は15条に基づいて提出された移行報告
そこからの過渡期について
依頼書類番号:001-38085
__________________________________
オヴィッド治療会社です。
(登録者の正確な氏名はその定款に記載)
__________________________________
| | | | | | | | | | | | | | |
| デラウェア州 | | 2834 | | 46-5270895 |
(明またはその他の司法管轄権 会社や組織) | | (主な標準工業 分類コード番号) | | (税務署の雇用主 識別コード) |
第九大通り441号, 14階 ニューヨークです, ニューヨークです10001
(646) 661-7661
(登録者の主な行政事務室の住所、郵便番号と電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| | | | | | | | | | | | | | |
| クラスごとのタイトル | | 取引 記号 | | 登録された各取引所の名称 |
| 普通株は一株当たり0.001ドルの価値があります | | オヴィッド | | ナスダック株式市場有限責任会社 |
同法第12条(G)により登録された証券:なし
_____________________________________
I登録者が証券法規則405で定義されている有名な経験豊富な発行者であれば、再選択マークで表記してください。はい、そうですo 違います。x
登録者が証券法第13又は15(D)節に基づいて報告書を提出する必要がない場合は、複選マークで示してください。はい、そうですo 違います。x
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内に届出要件に適合しているかどうかを示すはい、そうですx違いますo
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうですx違いますo
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法12 b-2規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照してください
| | | | | | | | | | | |
| 大型加速ファイルサーバ | o | ファイルマネージャを加速する | x |
| 非加速ファイルマネージャ | o | 比較的小さな報告会社 | x |
| 新興成長型会社 | o | | |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引法第13(A)節に提供された任意の新しいまたは改正された財務会計基準を遵守するo
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるx
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する¨
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す¨
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうですo違いますx
2022年6月30日現在,すなわち登録者が最近完成した第2財期の最終日,登録者の非関連会社が保有する普通株総時価は約$である124.9登録者普通株の2022年6月30日の終値に基づく。この計算には,登録者が保有する現役員,役員,株主が保有する普通株は含まれておらず,登録者はこれらの株式を登録者の関連会社と考えている.付属会社の地位を確定するのは他の目的ではない。
2023年3月10日までに70,491,510普通株式の株式を発行しました。
引用で編入された書類
登録者は,登録者が2022年12月31日までの財政年度後120日以内に第14 A条に基づいて証券取引委員会に提出した2023年株主年次総会の最終依頼書の一部の内容を,本年度報告の第3部Form 10−Kに引用して組み込む予定である。
カタログ
| | | | | | | | |
| | ページ |
前向き陳述に関する特別説明 | 1 |
| | |
| 第1部 | |
第1項。 | 業務.業務 | 3 |
第1 A項。 | リスク要因 | 22 |
項目1 B。 | 未解決従業員意見 | 57 |
第二項です。 | 属性 | 57 |
第三項です。 | 法律訴訟 | 57 |
第四項です。 | 炭鉱安全情報開示 | 57 |
| | |
| 第II部 | |
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 58 |
第六項です。 | [保留されている] | 59 |
| | |
第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 59 |
第七A項。 | 市場リスクの定量的·定性的開示について | 67 |
第八項です。 | 財務諸表と補足データ | 67 |
第九項です。 | 会計と財務情報開示の変更と相違 | 67 |
第9条。 | 制御とプログラム | 67 |
プロジェクト9 B。 | その他の情報 | 68 |
プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 68 |
| 第三部 | |
第10項。 | 役員·幹部と会社の管理 | 69 |
第十一項。 | 役員報酬 | 69 |
第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 69 |
十三項。 | 特定の関係や関連取引、取締役の独立性 | 69 |
14項です。 | チーフ会計士費用とサービス | 69 |
| | |
| 第4部 | |
第十五項。 | 展示と財務諸表明細書 | 70 |
第十六項。 | 表格10-Kの概要 | 72 |
前向き陳述に関する特別説明
このForm 10-K年度報告書には、1933年の証券法(改正)第27 A条または“証券法”および改正された“1934年証券取引法”第21 E条または“取引法”の意味に適合する前向きな陳述が含まれている。本年度報告10-K表については、歴史的事実陳述を除くすべての陳述が“前向き陳述”である。場合によっては、“目標”、“予想”、“仮定”、“信じ”、“考慮”、“継続”、“可能”、“設計”、“予想”、“目標”、“意図”、“可能”、“目標”、“計画”、“位置”、“潜在”、“予測”、“プロジェクト”などの用語によって識別することができる。“すべき”、“目標”、“将”、“会する”またはこれらの用語の否定または複数、および類似の表現。
前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
•私たちはより大きなビジネス潜在力を持つ新しい化合物を識別したり許可を得たりすることができます
•より多くの候補を得ることができる合理的な条項で成功することができます
•費用、将来の収入、資本需要、追加融資需要の推定
•私たちは規制部門の現在と未来の候補薬の承認を得ることができる
•このような候補薬の潜在的な市場規模と市場受容率と程度の予想は
•私たちは運営資金の需要に資金を提供する能力
•私たちのビジネスと候補薬のためにビジネスモデルと戦略計画を実施します
•私たちの知的財産権や他の固有の権利に関する開発や論争;
•私たちは協力関係を維持したり、追加資金を得る能力を維持したりする
•私たちは政府と第三者支払者の保証範囲と精算への期待を持っている
•私たちがサービスする市場で競争する能力は
•政府の法律法規の影響
•私たちの競争相手や業界の発展と
•私たちの財務業績に影響を及ぼす要素があるかもしれない
実際の結果が現在の予想と大きく異なることをもたらす可能性のある要因には、他にも、本報告の第1の部分1 A項“リスク要因”に記載されている要因と、本年度報告書10−K表の他の部分で説明された原因とが含まれる。本年度報告Form 10-Kの任意の前向きな陳述は、未来の事件に対する私たちの現在の見方を反映し、私たちの運営、運営結果、業界、および未来の成長に関連するこれらおよび他のリスク、不確実性、および仮定の影響を受ける。このような不確実性を考慮して、あなたは未来の事件の予測としてこのような前向きな陳述に依存してはいけない。私たちは展望性陳述に反映された予想は合理的だと考えているが、私たちは未来の結果、活動レベル、業績或いは成果を保証することができない。法的要求がない限り、私たちは未来に新しい情報があっても、これらの前向きな陳述を任意の理由で更新または修正する義務がない。
このForm 10-K年間報告書はまた、これらの市場の推定規模、それらの予測成長率、およびいくつかの医療条件の発生率に関するデータを含む、私たちの業界、私たちの業務、およびいくつかの薬品および消費財の市場の推定、予測、および他の情報を含む。推定、予測、予測、または同様の方法に基づく情報は、不確定要因の影響を固有に受けており、実際のイベントまたは状況は、その情報が反映するイベントおよび状況とは大きく異なる可能性がある。他に明確な規定がない限り、私たちは、報告、研究調査、研究、および第三者によって準備された類似データ、業界、医療および一般出版物、政府データ、および同様のソースから、これらの業界、商業、市場、および他のデータを取得し、私たちは、第三者ソースからこれらのデータを独立して確認していない。いくつかの場合、私たちはこのようなデータの出所を明確に言及しなかった。
このForm 10−K年次報告では、他に説明や文脈が要求されない限り、言及された“Ovid”、“当社”、“私たち”、“私たち”および同様の提案法は、Ovid治療会社およびその完全子会社を意味する。このForm 10-K年次報告書には私たちの商標と所属も含まれています
他の実体です便宜上、言及された商標および商号は、ロゴ、芸術品、および他の視覚的表示を含み、商標記号またはTM記号を伴わなくてもよいが、このような参照は、それらのそれぞれの所有者が、適用法に従ってこれらの商標および商品に対する権利を最大限に主張しないことを意味するわけではない。私たちは、任意の他の会社との関係を暗示するために、または他の会社が裏書きしたり、私たちを賛助したりすることを示唆するために、他の会社の商号や商標を使用または展示することを意図していない。
第1部
プロジェクト1.ビジネス
概要
Ovidはバイオ製薬会社であり,てんかん発作の減少に取り組み,まれなてんかんやてんかん関連神経障害の影響を受ける人の生活を有意義に改善している。てんかんは科学的にも商業的にも大きな機会だと考えられます過去10年間に、神経細胞の興奮性の潜在生物学とてんかんの病理生理学的科学的理解はすでに向上した。このような疾患の理解は,臨床前研究ツールの進歩に加え,早期研究の予測潜在力を高めており,抗てんかん薬(“ASM”)の臨床開発成功の可能性を増加させる可能性がある。世界の巨大なてんかん市場のチャンスは医療と経済の潜在力を反映している。今日、てんかん治療薬は世界で80億ドルの市場を代表しており、この市場はまた成長すると予想されている。この機会を支持する証拠は最近のてんかん資産の買収の数を含む。その中には、10億ドルを超える単一のマーケティング製品で珍しいてんかん会社を買収することが含まれている。 てんかんの影響を受けた人のニーズはまだ満たされておらず,現在約300万人のアメリカ人がてんかんを患っている。
我々はASMの成功した臨床開発に検証された能力と専門知識を持っている。著者らは著者らの知識を用いて差別化薬物導管を構築し、潜在的な一流或いは最適な薬物作用機序(“MOA”)を持っててんかんを治療した。このパイプは,一流のMOASである可能性のある2つのてんかんプロジェクトと,一流のMOAである可能性のあるてんかんプロジェクトを2つ生成している。これらの計画には,Soticlestat,新規コレステロール24ヒドロキシ酵素阻害剤がある。武田はわれわれのSoticlestatの権利を購入し,Drawe症候群とLennox Gastaut症候群の2つの重要な3期試験を評価している。OV 350は潜在的なKCC 2トランスポーター直接活性化剤であり、著者らの製品の組み合わせ中の多くのKCC 2活性化剤化合物の一つでもある。TV 329は次世代GABAアミノトランスフェラーゼ(“GABA−AT”)阻害剤であり,同種の中で最も良い可能性が考えられる。現在、第1段階の研究評価が行われている。
私たちのてんかん開発計画は、短期と中期に投資家のために一連の価値創造のマイルストーンを作る予定だ
機会:てんかんとてんかん関連神経疾患
てんかんは4千年前に人類が記録した最初の疾病の一つであるが、今日のてんかんは依然としてよく見られる、よく治愈しにくい医学診断である。世界では約5000万人がてんかんを患っており,その中で米国では300万人の成人がてんかんを患っていると推定されている
現代薬物発見作業は過去100年間に30種類以上の抗てんかん薬が生産されているが,相当数のてんかん患者(約30%-40%)は破壊的な画期的なてんかん発作を経験し続けている。この人たちの多くは珍しいてんかんを患っている。彼らが受けたてんかん発作は患者とその家族に壊滅的な影響を与え、恒久的な運動、認知と発育遅延、てんかんの発生を引き起こす可能性があり、これは下落したてんかん発作であり、より多くのてんかん発作を引き起こす。一部の発育性てんかん脳症を有する患者は、薬物治療に抵抗力のあるより高い難治性てんかん発作を経験している
てんかん診断の70%が20歳以下の人で発生しており,てんかん発作の早期有効な治療が必要であり,病態悪化や恒久的な晩年障害の緩和に重要であると推定されている。てんかんのコントロールを実現するためには,約半数の患者が5つ以上のASMからなる多剤レジメンを採用しており,薬物副作用や相互作用を慎重に管理する必要がある。てんかん発作を制御するために多くの薬物療法を必要とする患者や,画期的なてんかん発作の持続率は,有効な新薬が早急に必要であることが示唆された。
遺伝子検査の有用性を含む科学的進歩は,てんかん発作の遺伝子基礎を解明している。今日、1000個以上の遺伝子がてんかんに関連している。巨大な満たされていない医療需要と科学進歩は潜在的な神経治療の波に基礎を築いており、これは抗てんかん薬物によってリードされると信じている。
オヴィッド戦略
過去10年間、脳新薬の発見と開発の背後にある科学は根本的な変化を遂げてきた。これらの疾患の生物学的進展を知る上での大きな進展は,多くのてんかんを含む満たされていない需要の重要な分野が現在解決可能であり,巨大な医療やビジネス潜在力を提供していることを意味していると考えられる。我々のチームは,てんかん発作を引き起こすMOASの理解と潜在的な治療法の策定に成熟した専門知識を持っている
まれなてんかんを治療する。このようなノウハウは、てんかんおよびてんかん関連神経疾患を治療する刺激的で連続的な新薬を提供することに非常に集中する方法でOvidを確立することができる
われわれの戦略は,広範な抗てんかん薬物パイプラインを推進することにより,持続可能な長期価値を創出することである。我々の長期目標は、重要な業務開発活動により、より多くの資産で既存のパイプラインを補完し、最終的に複数の商業薬と臨床段階計画を有する完全に統合されたてんかん会社の基礎を形成することである。この会社戦略は具体的な研究開発、財務、業務発展戦略に基づいている。また、当社は、当社のパイプライン、戦略的協力、パートナーシップにおける臨床的およびビジネス的マイルストーンを通じて、株主価値を保護するために多様な潜在的収入源を創出することを求めています
私たちがてんかん専門権を確立する方法は、武田が開発し、その後、私たちのSoticlestat権利を買い戻すことに成功した。2017年には,Soticlestatの株式の50%を2600万ドルで獲得し,さらに5700万ドルを投資してSoticlestatの早期および中期臨床試験を設計·実行した。2021年には、6ヶ月前に鼓舞的な第2段階調査結果を提出した後、特許権使用料、許可、終了協定(“RLT協定”)を締結し、この協定により、Soticlestatの権利を武田に再販売した。RLT協定は、soticlestatが承認され商業化に成功した場合、2021年第1四半期に支払う1.96億ドルを提供してくれます。最高6.6億ドルの売上高と規制マイルストーン支払い、および潜在的純売上高の最高20%分級特許権使用料支払いを受ける資格があります。RLTプロトコルは私たちに潜在的な非希釈資本流を提供してくれる。この取引から得られた資金は、私たちが資金コストが高すぎると思う時期に私たちの組織に投資できるようにしてくれます
2022年には,まれなてんかんやてんかん関連疾患に注目することに伴い,戦略計画と組織審査を行った。これは私たちが非コアプログラムを許可または終了することを決定し、私たちはこのようなプログラムを実行している。また、組織再構築を決定し、その後実行し、従業員数を約20%減少させた
専門家チームとカスタマイズされたインフラ
2022年に実施された戦略的変化により、高度に専門化された集中的なインフラを構築し、選択されたてんかん分野で支援を提供し、てんかん関連神経疾患において価値のある候補薬や研究プラットフォームを求めたい先行生物製薬会社の第一選択パートナーになると信じている。このインフラは研究、開発、交付、商業と市場参入戦略などの重要な分野にまたがっている。
てんかんや神経疾患の専門知識を持っている様々な専門チームを募集しましたこれにはてんかん専門家、内科医、学術科学者、商業と生物製薬業界のリーダーが含まれている。全体的には,医学博士号を持つ個人5名と博士号を持つ専門家13名が科学研究に特化している。私たちの運営とビジネスリーダーは、リード神経薬の市場参入と販売を促進する上で豊富な経験を持っている。全体的に言えば、著者らのチームの集団専門経験は25種類の中枢神経系薬物の成功開発或いは商業発売に関連し、その中にいくつかのてんかん製品を含む。
てんかんとてんかん発作における私たちの凝集力は、私たちの専門的な経験と差別化された資産ルートに加えて、私たちの使命を成功させる自信を持っている。
研究開発戦略y
著者らは科学駆動、患者を中心とした方式でてんかんとてんかん関連疾患の研究と開発に従事し、業務発展と学術協力を通じて強化された。一部のてんかん開発者は1つの生物標的に明確に注目しているが、てんかん発作の異なる原因を治療するためには複数のMOAが必要であると考えられる。そのため、著者らは独特な化合物と機序を蓄積し、開発することを求めており、これらの化合物と機序は共に差別化され、リードするてんかん専門権となる。
管焦点
著者らは一連の潜在的な一流或いは潜在的な一流MOAを利用して、てんかん発作を引き起こす神経細胞の興奮性を遮断と軽減するパイプを育成した。このパイプラインは、まれな遺伝性てんかんの治療のためのアンチセンスオリゴヌクレオチドを含む新規小分子化合物および遺伝子療法を含む。全体的に、私たちの差別化チャネルは、潜在的に価値を創造する複数の薬物プロジェクトを含む
2014年の私たちの設立以来、私たちの発展努力は、逮捕量を減らす可能性のある三つのMOASを生み出してきた。我々の異なる開発計画の組み合わせは、異なるタイプのてんかん発作と神経細胞の過度興奮の潜在的原因を治療することによって、治療機会を最大限に増加させるとともに、任意の単一計画に関連する予測不可能な挫折が発生する可能性のある潜在リスクを低減するために努力している。われわれの開発計画は,てんかん発作を効果的に減少させる目標の提供を追求するとともに,安全性と耐性の良好な副作用プロファイルの獲得に努めている。てんかん患者や臨床医にとっては,多剤併用レジメンに関連する副作用を定期的に処置しなければならず,耐性が良く,薬物間相互作用の少ない薬剤を使用することが望ましい
われわれの薬物開発法は,一般にまれな難治性てんかんを最初の“歩哨”適応としている。まれなてんかん発作条件の追求は,難治性てんかんにおける我々の化合物の迅速な概念検証を証明することができるとともに,有効な調節経路やインセンティブを探索することができる。以前の抗てんかん薬物のライフサイクル管理の例研究により、難治性てんかん発作の減少はよく見られ、より治療しやすいてんかん発作タイプに対する治療効果を表明することを表明した。簡単に言うと、高度抵抗性てんかん発作の有効な治療結果は、一般に、類似しているがそれほど深刻ではないてんかんタイプの治療に良い兆しである。
抗てんかん薬物領域の発展に伴い、著者らはてんかん発作の根本的な原因は多くの人たちに影響する他の神経疾患との間に関連がある可能性があると信じている。著者らの戦略は最初に、稀なてんかん発作状況に影響する経路と標的に対する著者らの研究薬物の評価に重点を置いた。まれな疾患に有効であれば,この成功をMOAが治療意義を持つ可能性のあるより広範な脳状況に拡張することを探索することを目的としている。したがって,将来的には,我々の知識や薬物計画を他の神経疾患に拡張することが望まれる。この方法は研究の支持を得ており,今日10種類以上のASMが他(非てんかん)神経疾患の治療に用いられていることが示唆されている。
科学駆動
私たちは科学的に駆動する方法を採用して、私たちのパイプラインのための有望な候補薬を決定する。著者らは既知の興奮性生物学原理の存在に基づいて、これらの原理は通常有効な標的に関連し、そして明確な終点、例えばてんかん発作、臨床試験研究に応用されている我々のポートフォリオを構築している。われわれの神経学的深い理解を利用して,最初の候補薬のために差別化したMOAを決定した。著者らは非臨床と臨床評価を通じて著者らの候補薬物を推進することに伴い、著者らは1種の系統的な方法を応用して新興ツール、動物モデルと試験設計を使用して化合物のリスクを下げる。この例は絶えず情報を獲得し、絶えず出現する科学と臨床知見に伴い改善され、期待計画と試験の開発リスクを強化し、低減する。
具体的には、私たちの方法は以下の科学的原則によって駆動される
•検証されたものと新しい目標を追求する。てんかんの潜在的な病因と表現は広範かつ多様であるため、引き続き多種の薬物MOASがてんかんを治療する必要がある。我々はてんかんの検証と新たに出現した生物標的を含む異なるMOAを代表する治療開発プロジェクトの導管を構築している。私たちは以下のように概念検証を確立した生物学的経路または根拠目標を求めている 体外培養動物モデルでもありますまた,コレステロール24ヒドロキシ酵素,GABA−AT,KCC 2共輸送体など,中枢神経系に唯一発現する標的を優先した
•血液脳関門(“BBB”)浸透剤。脳は人体内で最も治療が難しい器官の一つであり、一部の原因は血液脳関門を貫通する挑戦である。Ovidの薬物開発計画には潜在的な小分子療法があり,血液脳関門およびアンチセンスオリゴヌクレオチドを透過できることが証明されている
•臨床翻訳可能な臨床前モデルそれは.遺伝学の最新の進展は予測を利用することができます体外培養そして 体内にあるてんかんやてんかん関連疾患の遺伝モデルですこれらの予測モデルは,ヒト試験を開始する前に候補薬物の潜在活性を評価·観察できると信じている。これらのモデルを応用することで,われわれの研究のために最も関連する適応やてんかん終点を選択し,臨床成功の可能性を高めることができると信じている。
•主端点と割合をクリアする. 我々は,主にてんかん関連症状やてんかん発を特徴とする疾患に注目している。多くのてんかん発作タイプは明確な観察可能な終点とバイオマーカーを提供し、著者らの候補薬物の臨床影響を捕捉と測定する証拠を提供する。私たちの開発専門家チームは、てんかん障害によく見られる他の症状を測定するために尺度表を設計する上で豊富な経験を持っています
認知機能減退、動作欠陥と行為表現。これらの技能は私たちの薬物開発の願望と能力を支持し、これらの薬物は患者の健康の多方面で臨床的利益を提供するかもしれない。
•実験設計は概念検証の早期観察を可能にした。高度に相関し、意義のある臨床利益の臨床終点を検出することを目的とすることにより、著者らの多くの研究は臨床開発において早期概念検証を提供し、それによって私たちの資本を後期成功確率の高いプロジェクトに使用する可能性が予想される
•刺激的で接近可能な患者集団です 我々の目標は,積極性と獲得性を有する患者群に対する障害項目である。てんかんやてんかん障害の影響を受ける患者や介護者が診断や遺伝子検出を得る機会が増えていると考えられる。また、多くの人がソーシャルメディアの熱狂的なユーザーであり、ソーシャルメディアを通じて自分の病状の新しい見解を知り、関連情報や経験を共有している。著者らはデジタルプラットフォーム上で患者疾病コミュニティの外連と活動を展開し、臨床試験の新しい患者を有効に識別し、疾病意識を高め、そして患者と看護人員との関係を構築することを助ける
規律の厳正な業務発展と学術協力を通じてルートを強化する
私たちの戦略を支持するために、私たちはより多くの適応、治療資産、技術を含むために、私たちのルートを強化し、拡大する予定です。我々は,2つの相補的な努力により,我々のパイプライン拡張を促進しようとしている:(1)その分野の外部リーダーや学術協力者と協力した内部研究開発努力,および(2)我々が選定した差し押さえ領域内でライセンスまたはパートナー資産の業務発展活動を行う
Ovidは限られた内部薬物発見を行い、より低い実験室施設コストを維持するのに役立つ。逆に,他の組織パイプラインに存在すると考えられる未開発価値の化合物の識別を求め,このような資産の安全確保と臨床開発の推進のための許可内や協力合意を求めている。この戦略は,価値創造が得意なところの努力を指導しており,特に我々の治療分野の翻訳や臨床段階の発展を形作っている。私たちのプロセスの一つの構成要素は学術研究センターと協力して、私たちのプロジェクトに翻訳専門知識の支援を提供することです。
私たちは、私たちの管理チームの広範な経験とネットワークによって、私たちの業務発展戦略をうまく実行できると信じています。具体的には、私たちの幹部チームのメンバーはバイオ製薬業界で幅広い業務発展キャリアを持っている。全体的に、私たちの上級管理職は数百件の許可内取引と協力を処理した。
病人を中心に
Ovidは候補製品を開発しており,これらの製品はてんかんや関連神経疾患患者の生活を変える可能性があると信じている。われわれの治療候補は,有害なてんかん発作を有意に減少させ,負担症状を軽減し,疾患の進展を潜在的に変化させることができる可能性があると信じており,特に進行性てんかん条件下での生命早期使用が可能であれば
患者共同体は私たちに方法のあらゆる面を知らせるために必須的だ。我々が開発している潜在的な神経療法のいずれの疾患も重篤な発症リスクを有する疾患であり,患者家族,介護者,医師,患者提唱団体の広範かつ専門的な参加が必要である
われわれの戦略は,患者を中心とした以下の原則が強化された
•大規模な臨床試験で評価できる十分に解決されていないまれな疾患が求められている
•患者コミュニティ、介護者、家庭、疾病基金会と主要なオピニオンリーダーの発展と密接な関係があり、これらの疾病の歴史をよりよく理解し、認識を高め、患者を識別し、臨床試験の登録を促進する
•てんかん発作、認知と行為尺度を含む臨床上意義のある終点を確定し、これらの尺度は患者コミュニティ及びその医師と看護人員の投入に基づいている;及び
•私たちがサービスしている患者コミュニティを深く理解し、それと接触するためにデジタル化能力を発展させる。
財務戦略
私たちは株主に長期的な価値を提供することに集中している。私たちの財務戦略は、差別化された抗てんかん薬のパイプラインを推進するために、私たちの資本を集中的に適用することを求めており、これは、データから複数の価値創造のマイルストーンを生成し、最終的に商業販売を生成する可能性があると信じている
経営陣は、2025年上半期までOvidの運営に資金を提供する十分な現金滑走路を持っていると信じている。武田がSoticlestatを承認して商業化することに成功すれば、潜在的なマイルストーン支払いと特許権使用料で追加資本を得る資格がある。これらの潜在的な支払いは、将来の非希釈資本源を提供し、私たちの運営や業務発展活動に資金を提供するかもしれない
Ovidパイプ
私たちの努力は候補薬を概念から検証して人体臨床試験に持ち込んだ。今日,我々はてんかんに集中している少数の会社の一つであり,てんかん発作に対する3種類の異なるMOAを研究·開発している。私たちはこのような潜在的な一流或いは潜在的な一流機序は私たちを目立たせ、潜在的な小分子てんかん薬物の魅力的な特許経営に基礎を提供したと信じている
以下の表(図1)に我々の候補薬物計画とその開発状況,MOAと予想される近未来マイルストーンを示す
図1.Ovid治療製品ライン
Soticlestat:武田製薬とRLT合意したため、財務持分を取得する資格があります
Soticlestatは新規なコレステロール24ヒドロキシ酵素(CH 24 H)阻害剤であり,難治性てんかん患者の治療に有用であり,われわれはその成功の早期と中期開発計画に役割を果たしているため,Soticlestatへの重大な財務的興味を保持している。Soticlestatは脳中のコレステロール新陳代謝に対する一流の化合物になる可能性があると信じている。それは脳中の炎症を徐々に減少させ、間接的にN-メチル-D-アスパラギン酸(NMDA)経路に作用することが証明された。この二重機序は,てんかん関連の興奮シグナルを調節し,てんかん発作を抑制する上で重要な役割を果たしていると考えられる。
Soticlestatは現在武田製薬会社がLennox Gastaut症候群(LGS)とDraveTM症候群(DS)患者に対する2つのグローバルキー3期試験を行っている。武田は2023年第1四半期に
これらの研究が成功すれば,これらの適応へのSoticlestatの応用を支援するために,2024年財政年度(2024年4月~2025年3月)に新薬申請(“NDA”)が提出される予定である
Soticlestatが規制の承認を得て商業化されれば、RLT協定によると、6億6千万ドルまでの規制と商業マイルストーン支払い、潜在的純売上高の20%までの分級特許権使用料を得る資格がある。特許権使用料支払いはすべての地域とすべての未来指標の純売上高に適用されます。マイルストーン支払いには、2021年3月に私たちが受け取った1.96億ドルの初期前払いは含まれていない
武田印税·許可·終了協定の背景
Soticlestat開発プロジェクトは2017年1月に始まり,我々と武田との間のまれなてんかんに対する許可と協力協定である。最初の合意により、OvidはSoticlestat 50%の所有権株式を保有し、武田は残りの50%の株式を保持する。我々が率いる第2段階開発計画が成功した後,2021年3月にRLT協定を締結した。RLT協定の条項によると、吾らは武田との元の協力協定を終了し、武田はその後、Soticlestatでの株式の50%を買い戻すために独占許可と知的財産権を取得した。代わりに、私たちは1.96億ドルの前払いを受けた。さらに、soticlestatが規制部門の承認を得て商業化に成功した場合、私たちは6.6億ドルまでの追加規制と商業マイルストーン支払いを得る資格があり、soticlestatの純売上高の潜在的な等級別特許権使用料は、割合が低い2桁から20%まで様々であり、場合によっては標準的に低下させることができる。特許権使用料は,当該製品が同国で初めて商業販売された日から当該製品がその国の特許権が満了した日から当該製品の初商業販売の指定周年日までの期間内に国及び製品ごとに支払われる
この合意の結果として,武田はDravet症候群やLennox Gastaut症候群を含む発育およびてんかん脳症の治療のためのSoticlestatの開発と商業化のすべての世界的権利を獲得した。また,武田はSoticlestatに関するすべての開発と商業化コストを担っている。私たちには持続的な費用や義務がない
OV 329−新世代GABA−AT阻害剤
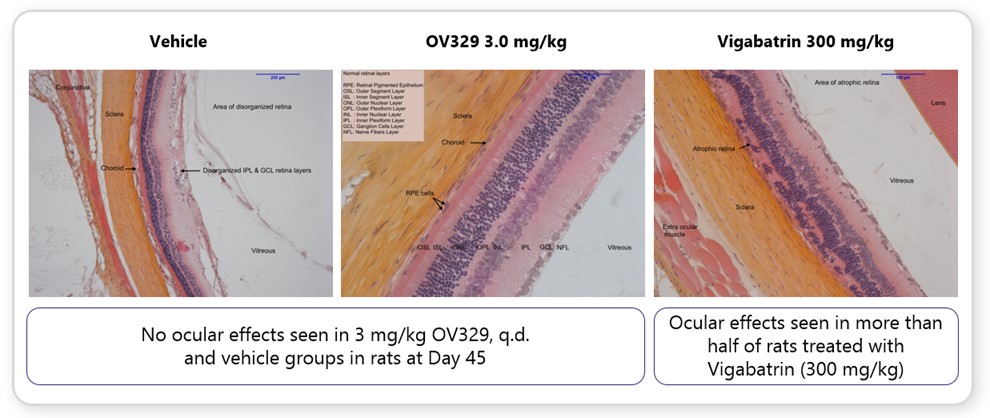
OV 329は、成人および小児てんかん疾患の治療のための、我々が開発している研究における次世代GABA-AT阻害剤である。OV 329はVigabatrinの置換を目的とした潜在的な同種の最適なGABA-AT阻害剤であり、後者はアメリカとEUが許可した乳児痙攣を治療する薬物である。Sabril(Vigabatrin)は著明なてんかん発作の減少を示し,Lundbeckは米国のみで3億ドルを超える売上を達成した。しかし、 治療窓口が不足しているため、その臨床と商業応用はずっと制限されている。具体的には、Vigabatrinはいくつかの患者の中で有害な眼効果を産生し、網膜退化と不可逆的な視力喪失を含み、これは重大な発売後の制限とモニタリングを招く。
OV 329はVigabatrinとは異なる化学構造を有する改良されたGABA−AT阻害剤であると考えられる。OV 329は標的結合部位でより高い効力と効率を提供する可能性があり、著者らの臨床前研究により、OV 329の効力はその200倍以上であることが示唆された。この前臨床データが臨床環境で証明されていれば、OV 329は(Vigabatrinと比較して)提供する可能性があると信じている
•てんかん発作の治療効果を減少させ
•安全状況を改善すること
•第一選択(低い)投与量。
我々のOV 329計画の1つの利点はてんかん発作の有効な薬物標的に作用することである。具体的には,GABA−ATの活性を大幅に低下させることにより作用し,GABA−ATは脳の主要抑制性神経伝達物質GABAの分解を担う重要な酵素である。TV 329はその代謝を抑制することによりGABA濃度が上昇する。てんかんの特徴は神経細胞が過度に興奮していることから、GABAレベルの上昇はこの興奮性シグナルを抑制し、てんかん発作を減少させる可能性がある。
2022年医学会議で提出された6種類の動物てんかんモデルはOV 329のてんかん減少潜在力を示した(図2参照)。慢性および急性てんかんモデルにおけるこれらの発見は、ヒトにおけるOV 329の治療潜在力に追加の自信を提供した。
図2.6の臨床前モデルは、難治性てんかん発作モデルを含むOV 329がてんかん発作を減少させる活動を繰り返している
OV 329の潜在的臨床開発を更に支持するため、著者らの臨床前仕事は任意の潜在的な眼影響を含むその安全性と耐性を広く表現することを試みた。臨床的に翻訳可能な白化SDラットモデルを用いて、プラセボと比較して、OV 329およびVigabatrinの予測治療用量に関連する任意の眼変化が観察されるかどうかを決定する。このげっ歯類モデルは,米国FDAがVigabatrinを用いて治療したヒトに見られる眼効果の代替モデルである。図3に我々の研究結果を示す
Vigabatrinおよび予想される治療用量OV 329(3 mg/kg)を45日投与した後、モデルはTV 329を服用した動物では眼効果を示さなかったが、治療用量のVigabatrin(300 mg/kg)を服用した動物では網膜細胞の破壊が見られた。このモデルでは,TV 329の眼輪郭はプラセボに類似しているように見え,予想される治療量で網膜の破壊は見られなかった。これらのモデルは、OV 329がVigabatrinによって提供される治療ウィンドウを介しててんかん発作を有意に減少させる利点を提供する可能性があると信じているにもかかわらず、ヒト研究において確認されなければならない。
図3.予想される治療用量OV 329(3 mg/kg)を用いて治療されたげっ歯類動物は眼の変化がなかった
2022年下半期、OV 329に対する研究新薬申請(IND)は米国食品医薬品局(FDA)の承認を得、その後、第1段階試験を開始した。この研究は現在デューク大学医学院で行われており、単回増加用量と複数回増量用量部分を含む2つの部分に分けて行われる。EndPointsは、健康ボランティアが増加しているOV 329用量に関連する薬物動態、安全性、耐性、および標的参加を評価する。著者らは2024年上半期にこの研究の完全な結果があり、磁気共鳴スペクトル(MRS)測定による予想目標参加レベルを含む予定である。以前の研究では治療後のGABA濃度レベルでのMRS測定の増加が報告されている
以前のGABA−AT阻害剤計画において、てんかん発作の治療効果の減少に関連することが証明されているGABA−AT阻害剤。OV 329が第1段階研究において目標を効果的に吸引し、許容可能なセキュリティプロファイルを示すことが証明された場合、これらの指標は、計画の後期開発に情報を提供する可能性がある
第一段階計画の結果から,TV 329は結節性硬化症に関連するてんかん,乳児けいれん,焦点性てんかん発作に関連する他のてんかんの治療にさらに検討できると予想される。OV 329の安全性と有効性が積極的であれば,より広範なてんかん適応におけるライフサイクル管理戦略も考えられる
OV 329は2016年12月に私たちの研究開発過程に入り、当時私たちは西北大学と独占的なグローバルライセンス協定を締結した。OV 329の物質組成特許は、潜在的な規制延長を含まず、2036年に満了する。私たちはまた、OV 329の合成およびOV 329の治療方法に関する複数の特許ファミリーを出願して所有する。
OV 350を含むKCC 2輸送タンパク質活性化剤製品の組み合わせ
2021年12月、私たちはアスリカンから中枢神経系にのみ発現する生物標的の直接活性化剤である大量の化合物の許可を得た:K-Cl共トランスポーター(KCC 2)。この組み合わせは生物製薬業界で唯一KCC 2トランスポーターを直接活性化する小分子プロジェクトを代表していると信じている。KCC 2は神経細胞内の塩素定常状態を調節するチャネルであるため、神経細胞の興奮性とてんかん発作の制御に潜在的な重要な作用を持っている。この製品の組み合わせには,先導化合物TV 350と,薬物開発に適していると考えられる他のいくつかの化合物が含まれている。てんかんおよび行動、神経病的疼痛または神経変性に関連する他の可能な神経疾患におけるKCC 2の組み合わせにおける複数の候補薬剤の発展を分析する予定である。
生体内動物における概念検証研究では,KCC 2の活性回復がてんかん感受性やてんかん誘発死亡率を低下させることが明らかにされている。1つの臨床前モデルにおいて、てんかん持続状態(SE)の急性発作状態をシミュレーションすることを目的とし、TV 350終了状態と安定のSE発作に対する治療効果を回復したが、単用地西潘治療はてんかん発作を阻止できなかった。臨床前機序の研究により、TV 350の耐性は良好であり、鎮静を誘導しないことが示唆された。現在,これらの発見を検討し,人体で検証しなければならない。
2022年には、KCC 2製品の組み合わせ中のいくつかの化合物を評価し、様々な可能な配合を得るために、主要候補化合物TV 350の最適化を開始した。私たちの願いはTV 350の静脈と経口投与処方を実現することだ。病院で救急を受け,外来環境でてんかん緩和を維持する必要がある患者にとっては,二重配合が最適である。この計画の推進に伴い,臨床前実験を継続し,この製品の組合せにおけるてんかんや他の神経疾患のための他の化合物の開発に情報を提供する。私たちはこの計画の最初のINDが2024年に提出されると予想している。OV 350を含むKCC 2トランスポーターのための早期小分子ライブラリーは、世界的に提出された未解決物質組成出願において、発表されれば、2041年に満了し、任意の潜在的な規制延期を排除するであろう。
遺伝子研究プロジェクト
私たちの開発活動の大部分は小分子プロジェクトに取り組んでいる。しかし,遺伝子薬は遺伝性てんかんや神経疾患の長期的な将来の治療に重要な役割を果たすと信じられている。そこで,次世代遺伝子治療開発者Gensaicを含むいくつかの協力者と適切な規模の早期研究プロジェクトを行った(以下の許可と協力部分の説明を参照)
OV 815およびOV 825
2022年、私たちはコロンビア大学との協力の一部として、研究計画OV 815とOV 825を含むアンチセンスオリゴヌクレオチド(ASO)とRNAi薬物の候補薬物の進展を続けている。OV 815はKIF 1 Aに関連する神経疾患(KAND)に関連する変異に集中している。研究はすでに表現型画像を利用し,KANDに関連する大量の変異に対する潜在配列を決定した。同様に、OV 825はすでに稀な神経発育疾患HNRNPH 2の潜在的候補主導識別に入っている。HNRNPH 2はベイン症候群とも呼ばれ,X連鎖遺伝子であり,影響を受ける人の多くは女性である。新しい遺伝子突然変異の患者は精神運動発育、知的障害、深刻な言語障害、てんかん発作、行為異常、獲得性小頭奇形、及び全体的な発育不良の飼育問題を遅延させる。我々は、影響を受けた細胞中の細胞質に誤って局在するHNRNPH 2タンパク質の変異形態を標的とするRNAi治療方法を求めた
個人です。2023年末までには,これらのプロジェクトに対して“通過”または“通過しない”という決定を下すことができる十分な研究成果が予想される。
OV 882
OV 882はショートヘアクリップ状RNAであり,Angelman症候群の潜在的疾患修飾遺伝子療法として評価されている。Angelman症候群の最もよく見られる原因はUBE 3 A遺伝子母体コピーの欠陥による機能性UBE 3 A蛋白の損失である。我々の目的は,UBE 3 Aアンチセンス遺伝子の発現を減少させ,父本遺伝子複製によりUBE 3 Aの発現を回復する疾患修飾ベクターを開発することである。われわれのOV 882の研究は早期段階であり、穏健な自然病歴と、以前にガボサドールに対して行ったAngelman症候群の臨床試験のベースラインデータから利益を得た。この先の計画により,Angelmanの病態を深く理解し,約100名のAngelman患者が行った臨床試験のベースラインデータの所有権を保持した。私たちはこのような固有の見解が私たちのOV 882計画に役立つことを願う。
ファージステント:Gensaic研究協力
2022年8月,我々はGensaic(Gensaic連携協定)と研究協力を達成し,Gensaicは遺伝子療法を開発している民間バイオテクノロジー会社である。具体的には,GensaicはM 13バクテリオファージをプラットフォームとして用いて遺伝子配列を伝達するバクテリオファージ展示科学を応用している。まだ初期段階であるが,現在の腺関連ウイルス(AAV)ベクターのプラットフォーム代替品と比較して,バクテリオファージによる足場は遺伝子伝達において有意な優位性を提供する可能性があると信じている
AAV遺伝子療法は神経系疾患を治療する最適な方法ではない。具体的には,AAV遺伝子療法のクローン能力は限られており,大量の遺伝子貨物輸送への使用が制限されている。また,これらは免疫反応性であり,血液脳関門透過性が悪く,標的細胞への走向性が相対的に悪い。対照的に、バクテリオファージは、より大きな遺伝子(20 kbまで)を伝達すること、血液脳関門を越えて特定のタイプの細胞に貨物を輸送するように改造されたこと、免疫系反応を回避して再定位を達成すること、より費用効果的な方法で生産することの潜在力を有すると考えられる。したがって,バクテリオファージによる遺伝子療法は遺伝性てんかんや神経系疾患の治療においてより良い可能性があると信じられている。私たちはGensaicと協力して、最大3つの遺伝子目標を追求することができる。
許可と協力協定
2022年のGensaicの研究協力と株式投資
私たちがGensaic投資家として達成した株式合意条項によると、私たちはGensaicの転換可能な優先株と交換するために510万ドルを投資した。Gensaic連携プロトコルも締結しており,Gensaic独自のPDPプラットフォームを用いて,我々の興味のある神経適応に対する最大3種類の遺伝子薬を開発することが可能である。Gensaicはそのプラットフォーム技術のすべての権利を維持する。合意された条項によると、私たちはそれによって産生されるバクテリオファージ由来遺伝子療法を許可し、開発する商業的権利を持つだろう。私たちはまた未来の株式融資に投資する権利を保持している。
2022年にMarinus PharmPharmticalsと締結された外部ライセンス契約
2022年3月1日、私たちはMarinusと独占特許許可協定(“Marinusライセンス協定”)を締結した。Marinusライセンス協定によれば、我々は、CDKL 5欠乏症の治療のために、香港(米国、ヨーロッパ経済地域、イギリスおよびスイスからなる)で開発、製造、製造、商業化、普及、流通、販売、販売および輸入許可製品を提供するために、Marinusに独占的、譲渡不可能(明示的に規定されていない限り)、印税が権利を負担し、Ganaxoloneに関連するOvid特許下の許可を付与する。食品と薬物管理局が2022年3月18日に香港初の特許製品の監督管理許可を受けた日の後、Marinusは会社の選択によって123,255株のMarinus普通株を発行し、1株当たり0.001ドルの価値がある。Marinusライセンス協定はまた、Marinusが販売しているすべてのこのような許可製品の純売上高に1桁の印税を支払うことを規定している。
2022年にHealxとライセンスおよびオプション契約を締結
2022年2月1日、Healx,Ltdと独占ライセンス選択権協定(“Healx許可と選択権協定”)を締結しました。Healx許可と選択権協定の条項によると、Healxは1年間の選択権を獲得し、2 A期臨床試験における脆性X症候群潜在的併用療法の一部としてガボサド(OV 101)を研究し、他の適応の治療として50万ドルを前払いし、関連知的財産権の起訴と維持を支援しています。2023年2月、Healxライセンスとオプション協定を修正し、オプション期間を3ヶ月延長しました。オプション期限終了時にHealxを選択することができる
200万ドルの追加支払い、開発、ビジネスマイルストーンの支払い、ミドルエンドの2桁の印税と引き換えに、私たちの関連知的財産権下の独占許可権を獲得した。特許権使用料は,当該製品が同国で初めて商業販売された日から当該製品がその国の特許権が満了した日から当該製品の初商業販売の指定周年日までの期間内に国及び製品ごとに支払われる。
選択権行使後,Healxはガ博多の開発と商業化のすべての責任とコストを負う。我々は、臨床2 B期の積極的な読み取り終了時にHealxまたはOvidと権利共同開発および共同商業化計画の選択権に参加することを選択し、マイルストーンおよび特許権使用料の代わりに純利益および損失を共有する。私たちはガ博多の追加的な実験をするつもりはない。Healx許可およびオプション合意の期限が(A)すべての関連印税条項の満了まで継続される場合、またはHealxがHealx許可およびオプションプロトコルで定義されたオプション期間内またはオプション期限内にそのオプションを行使しない場合、またはHealxがオプション期間内にそのオプションを行使し、加入期間を選択し、加入期間内を選択するか、または加入条項を選択して他の方法で終了しなければならない場合、あるいは(C)Healxが選択期間内に選択権を行使し,選択期間内にOvidの選択権を行使した場合,HealxもOvidもGaboxadolを利用し続けることはない.Lundbeckとの契約義務の一部として,Ovidの選択権を行使しなければ,LundbeckがHealxから受け取ったすべてのマイルストーンと特許権使用料のシェアを欠く.我々がOvidの選択権を行使し,Healxと共同開発·共同事業化すれば,Lundbeckに純利益分の一部を支払う.
H.Lundbeck A/Sとのライセンス契約
2015年3月にLundbeckとライセンス契約を締結し、2019年5月、2020年7月、2022年2月にそれぞれ修正しました。Lundbeckプロトコルの一部として,我々はLundbeckからヒト疾患を開発,製造,商業化し,治療するTV 101(gaboxadolとも呼ばれる)の世界的独占的許可(いくつかの保持された非商業的権利に制約されている)を取得した.
私たちはその後2021年初めにAngelman症候群を治療するためのOV 101(ガボサド)計画を閉鎖した。2022年2月1日、Healx許可とオプション協定に基づいてパフォーマンスを行うことを可能にするために、レンベック協定の第3号修正案、または第3号改正案に署名した。第3号改正案の条項によると,Healxがその選択権を行使し,Ovidの選択権を行使しないことを選択した場合,LundbeckがHealxから受け取ったすべてのマイルストーンと特許権使用料のシェアを欠くことになる.Ovidの選択権を行使し,Healxとこの計画を共同開発して共同商業化することを選択すれば,Lundbeckに純利益分の一部を支払う
2021年のアスリコンとの独占ライセンス協定
2021年12月30日、アスリコンと独占ライセンス契約、すなわちアスリコン独占ライセンス契約を締結しました。アスリコン独占許可協定の条項によると、私たちはKCC 2トランスポーターの初期小分子化合物の組み合わせに対する世界的な権利を獲得しており、私たちの先導化合物OV 350を含む。アスリーカンへの500万ドルの現金前払いと730万ドルの普通株の交換として,商業的に合理的な努力を利用して,てんかんや潜在的な他の神経性疾患に対してKCC 2トランスポーター活性化剤のすべての将来開発と商業化を行う責任がある。800万ドルまでの潜在的臨床開発マイルストーン,4500万ドルにのぼる規制マイルストーンと1.5億ドルにのぼる総ビジネスマイルストーン,純売上高1桁から10%までの階層特許使用料の支払いをアスリコンに支払う義務がある。臨床治療効果を証明する時、アスリコンはOvidと共同開発と共同商業化KCC 2トランスポーター活性化剤の第一交渉権利を選択する権利がある。ライセンスオプションはすべての関連印税条項が満了するまで続くだろう。
西北ナンバープレート
二零一六年十二月に、吾らは西北大学と許可協定を締結し、これにより西北大学は吾等のいくつかの発明の独占的な世界特許権又は西北特許権を付与し、当該等の特許権は、特定の化合物(OV 329)及び当該等の化合物に関する使用方法、及び西北特許が主張する発明の実践に関するいくつかの技術的ノウハウに関するものである。
西北大学の協定によると、西北大学特許権を利用してすべての用途の製品研究、開発、製造、商業化を行う独占権利が付与される。私たちは、西北大学の特許権を使用して癌を治療する製品を開発しないことに同意しますが、西北大学はこの技術の権利を他の人に癌に適用しないかもしれません。われわれには合意期間内に行使できる選択権がある
ライセンスプロトコルの主題の主要化合物と同じまたは同様のMOAを有する新規化合物を含む、いくつかの知的財産権下での独占的許可。西北大学は、自分及び他の非営利機関を代表して西北大学特許権を教育及び研究目的に使用し、その中で主張されている発明を実践する権利を保持し、西北大学特許権がカバーする発明に関する情報を発表する。
西北協定を締結した後、私たちは75,000ドルの一次ライセンス発行費用を前払いし、毎年20,000ドルのライセンス維持費を支払う必要があります。この費用は契約の下で初めて商業許可製品を販売した後、西北大学に支払ういかなる印税から差し引かれます。私たちは西北特許のすべての持続費用の提出、起訴、維持を担当していますが、私たちはまた私たち自身の特許弁護士を使用してこのような活動を制御する権利があります。西北協定に基づいて付与された権利を考慮すると、西北特許がカバーする第1の製品のいくつかの開発および規制マイルストーンが実現されたときに、合計530万ドルを西北に支払う必要があり、このような製品の商業化の後、西北に会社、その関連会社、または所有者が低い中央桁のパーセンテージで中央桁のパーセンテージで西北にこれらの製品の等級別特許使用料を支払うことを要求される。私たちの特許使用料義務は、その国の適用製品をカバーするライセンス特許の最後に満了した有効な権利要件が満了したときと、そのような製品が同国で初めて商業販売されてから10年後まで、製品および国/地域に基づいて継続される。Ovidが西北大学特許権を再許可した場合、より高いビット数から低い青少年まで、指定された割合の再許可収入を西北大学に支払う義務があります
西北大学協定は、西北大学特許権によって保護された少なくとも1つの製品を開発および商業化するために、商業的に合理的な努力を使用することを要求している
事前に終了しない限り、西北大学の協定は、この合意に基づいて負担する支払い義務が満了するまで有効になるだろう。私たちは事前に書面で通知した場合、任意の理由で合意を終了したり、西北航空会社が修復していない重大な違約行為を停止する権利があります。ノースウエスト航空は私たちが治癒していない実質的な違約或いは債務不履行のために合意を中止するかもしれません
販売とマーケティング
私たちの発展段階を考慮して、私たちはまだ商業組織や流通能力を確立していない。しかし、私たちは内部市場参入と商業戦略能力を持っており、これは私たちのパイプライン戦略と実行に根拠を提供している。私たちのパイプライン資産が将来臨床に入るにつれて、私たちは的確な能力を確立し、てんかんとてんかん関連疾患のプロジェクトに集中して商業化するつもりだ。商業化が私たちにとって資本効率が低いかもしれない市場では、私たちの候補薬物のビジネス潜在力を最大限に発揮するために、第三者との戦略的協力を選択的に求めることができるかもしれない
製造と供給
私たちは現在、すべての製造業務をアウトソーシングし、予測可能な未来に私たちの協力者と契約メーカーを使用するつもりです。しかし、私たちのいくつかの経営陣メンバーは製造面で豊富な経験を持っており、私たちはこれが競争優位を提供するかもしれないと信じている。
競争
Soticlestat,OV 329およびOV 350では,Zgenix,Inc.(2022年にUCBに買収),Jazz PharmPharmticals plc,Sage Treateutics,Inc.,Marinus PharmPharmticals,Inc.,Mallinckrodt plc,SK BiopPharmticals Inc.,Epygenix Treateutics,Inc.,Stoke Treateutics,Inc.とXenon PharmPharmticals,Inc.が最も直接的なライバルであると考えられる
薬物開発競争は激しく、迅速かつ重大な技術進歩の影響を受けている。私たちの競争能力は、私たちが必要な臨床試験を完成させ、承認手続きを監督する能力と、私たちが成功する可能性のある任意の薬物を効果的に販売する能力に大きく依存するだろう。私たちの現在と未来の潜在的な競争相手は製薬とバイオテクノロジー会社、学術機関、そして政府機関を含む。著者らが発売許可を得る可能性のある任意の候補薬物の商業成功を影響する主要な競争要素は有効性、安全性と耐性、投与利便性、価格、カバー範囲と精算を含む。私たちの多くの既存あるいは潜在的な競争相手は私たちよりも多くの財力、技術、人材を持っており、候補薬物の発見と開発、およびこれらの候補薬物に対するアメリカと外国の規制承認を得る上でも明らかに多くの経験がある。
私たちは現在、潜在的な未来の競争相手とより多くの経験を持っており、発売が承認された薬物を商業化している。製薬とバイオテクノロジー産業の合併と買収は、私たちの少数の競争相手により多くの資源を集中させる可能性がある。
したがって、私たちの競争相手は私たちよりも治療の規制承認を得ることに成功し、彼らの薬物が市場に広く受け入れられるようにするかもしれない。私たちの競争相手が狙っている疾患に対して、治癒またはより効果的な治療法を開発することも可能であり、これは、現在または将来の候補薬を競争力を失ったり、時代遅れにしたり、開発および商業化費用を回収することができる前に候補薬の需要を減らすことができるかもしれない。
知的財産権
私たちのビジネス成功は、私たちが現在および未来の候補薬、新しい発見、製品開発技術、およびノウハウのために独自の保護を獲得し、維持する能力があるかどうかにある程度依存し、他人の固有の権利を侵害することなく運営し、他の人が私たちの固有の権利を侵害することを防止する。私たちの政策は、米国と外国特許の提出または許可、および私たちの業務の発展および実施に重要な技術、発明、改善に関連する特許出願などの方法によって、私たちの独自の地位を保護することを求めています。私たちはまた、商標、商業秘密、著作権保護、ノウハウ、持続的な技術革新、および潜在的な許可内機会に依存して、私たちの独自の地位を発展させ、維持しています
既存の特許出願において広範なカバー範囲を求めているが、製品またはプロセスの変更が、侵害クレームを回避するために競争相手に十分な基礎を提供する可能性があるというリスクが常に存在する。さらに、特許出願において要求されるカバー範囲は、特許発行前に大幅に減少することができ、裁判所は、特許発行後に特許範囲を再解釈することができる。さらに、米国を含む多くの司法管轄区域は、第三者が行政訴訟において発行された特許に挑戦することを可能にし、特許主張のさらなる縮小やキャンセルを招く可能性がある。さらに、私たちは、私たちの未決または任意の未来の出願から任意の特許が付与されること、または発行可能な特許が私たちの知的財産権を十分に保護することを保証することはできない。
我々は、多結晶OV 101およびその製造およびOV 101の製造および製造方法のためのLundbeckの一連の発行された米国および国際特許を独占的に許可した。また、OV 101の治療方法および処方に関する複数の特許ファミリーを出願し、所有している
OV 329は西北大学から許可を得た。OV 329の物質組成物特許は、規制延期を含まず2036年に満了する。また、OV 329の合成およびOV 329の治療法に関する複数の特許ファミリーを出願して所有する
OV 350を含むKCC 2トランスポーターの初期小分子ライブラリーは、アスリカンのIn許可を得ている。これらの分子は、世界的に提出された未解決物質組成出願に含まれており、発表された場合、2041年に満了し、潜在的な規制延期は含まれていない。
さらに、UBE 3 A、KIF 1 a、HNRNPH 2およびPDP 2 RDに対する固有遺伝子配列ライブラリーがある。私たちは私たちの潜在的な開発候補ライブラリを保護するために私たちの知的財産権の組み合わせを拡大し続けている。
個別特許の展示期間は、特許出願の提出日又は特許発行日及び特許を取得した国の特許法律期限に応じて定められる。一般に,米国で提出された出願のために発行された実用新案特許の有効期限は,非臨時特許出願の最初の有効出願日から20年である。さらに、場合によっては、特許期間を延長して、米国特許商標局(USPTO)が特許の発行を遅延させた部分時間と、FDA規制審査期間によって実際に損失した部分期間とを再取得することができる。しかしながら、FDAの構成要素については、回復期間は5年を超えることはできず、回復期限を含む総特許期間はFDA承認後14年を超えてはならない。外国特許の有効期限は適用される現地法の規定によって異なるが,通常は最も早い有効出願日から20年である。特許によって提供される実際の保護は、各国の異なる製品によって異なる可能性があり、特許のタイプ、そのカバー範囲、規制に関連する延長の利用可能性、特定の国の法的救済措置の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する可能性がある。
また、私たちはビジネス秘密と技術ノウハウ、持続的な技術革新によって、私たちの競争地位を発展させ、維持しています。私たちは、当社の従業員やコンサルタント、および任意の潜在的なビジネスパートナーおよび協力者との秘密協定および発明譲渡の一部を使用して、私たちの独自の情報を保護することを求めています
私たちの従業員と契約を結びます。また、私たちが選択したコンサルタントおよび任意の潜在的なビジネスパートナーとセキュリティ協定または発明譲渡協定を締結または実行しようとしています。これらのプロトコルは、我々の独自の情報を保護し、発明譲渡プロトコルの場合、第三者との関係によって開発された技術の所有権を付与することを目的としている。このような合意は違反されるかもしれないし、私たちはどんな違反にも対応する十分な救済策がないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。もし、私たちのビジネスパートナー、協力者、従業員、およびコンサルタントが、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利について論争が生じる可能性がある。
私たちのビジネス成功はまた第三者の独占権を侵害しないことにある程度依存するだろう。いかなる第三者特許を発行することが、私たちの開発や商業戦略、あるいは私たちの薬物やプロセスを変更し、許可を得たり、いくつかの活動を停止することを要求するかどうかはまだ確定されていません。私たちは、私たちの将来の薬物の開発または商業化のために、私たちが必要とする可能性のある独占権許可を得ることができなかったり、私たちの将来の薬物を開発または商業化することができません。米国および他のいくつかの司法管轄区域の特許出願は18ヶ月以上秘密にされており、科学的または特許文献における発見は、実際の発見よりも遅れていることが多いため、係属中の特許出願によってカバーされる発明の優先度を決定することができない。さらに、私たちは、第三者によって提起された、またはUSPTOによって発表された干渉、派生、再試験、付与後審査、当事者間審査、または反対手続きに参加しなければならないかもしれない。
政府の監督管理
FDAと州と地方司法管轄区および他の国の規制機関は、薬物の臨床開発、製造、マーケティング、流通に参加する会社に対して、私たちが開発している会社のような大量かつ重い要求を提出した。これらの機関と他の連邦、州と地方実体は薬品と候補薬物の研究開発、テスト、製造、品質管理、安全、有効性、ラベル、貯蔵、記録保存、承認、広告と販売促進、流通、承認後の監視と報告、サンプリングと輸出入などの方面に対して監督管理を行う。
アメリカ政府の規制
米国では,FDAは連邦食品,薬物と化粧品法案(FDCA)とその実施条例に基づいて薬品を規制している。規制の承認を得て、その後、適用される連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発プロセス、承認プロセスまたは承認後のいずれかの場合、出願人が適用される米国の要求を遵守できない場合、FDAが未解決の新薬申請(NDA)または生物製品ライセンス申請(BLAS)の承認を拒否する、承認の撤回、臨床一時停止の実施、警告状の発行、製品リコール、製品差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金、政府契約の拒否、原状回復、返品または民事または刑事罰のような様々な行政または司法制裁を受ける可能性がある。
FDAが米国で医薬品を発売する前に必要なプログラムは通常、以下のいくつかの態様を含む
•臨床前実験室テスト、動物研究と調合研究を完成し、FDAの良好な実験室実践或いはGLP法規に符合する。
•ヒト臨床試験開始前に発効しなければならないINDをFDAに提出する。
•各臨床試験が開始される前に、各臨床場所で独立機関審査委員会またはIRBによって承認される。
•良好な臨床実践或いはGCP要求に基づいて十分かつ良好に制御された人体臨床試験を行い、各適応の提案薬物製品の安全性と有効性を確定する。
•NDAまたはBLAをFDAに提出する。
•適用されれば、FDA諮問委員会の審査が満足的に完了される。
•現在の良好な生産実践またはcGMP要件に適合するかどうかを評価し、施設、方法、および薬物の特性、強度、品質、および純度を維持するのに十分な施設、方法および制御を保証するために、FDAの生産製品の1つまたは複数の製造施設の検査を満足的に完了させる;
•NDAまたはBLAに対するFDAの審査と承認。
臨床前研究
臨床前研究は製品の化学、毒性と調合に対する実験室評価、及び潜在的安全性と有効性を評価する動物研究を含む。INDスポンサーは,臨床前試験の結果を製造情報,分析データ,任意の利用可能な臨床データや文献などとともにINDの一部としてFDAに提出しなければならない。IND提出後も,いくつかの臨床前試験が継続される可能性がある。INDはFDAが受信した30日後に自動的に発効し、それ以前にFDAが1つまたは複数の提案された臨床試験に対して懸念または問題を提起しなければ、臨床試験を保留する。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。したがって,INDの提出はFDAが臨床試験の開始を許可しない可能性がある。
臨床試験
臨床試験はGCP要求に符合する合格した研究者の監督の下でヒト患者に研究用新薬を服用することに関連し、その中にはすべての研究患者に書面で任意の臨床試験に参加することを要求するインフォームドコンセントを提供することが含まれている。臨床試験は,試験目標を詳細に説明し,安全性をモニタリングするためのパラメータと評価する有効性基準のシナリオで行った。INDの一部として,各臨床試験の案と任意の後続の案修正案をFDAに提出しなければならない。また,臨床試験に参加する各機関のIRBは,その機関が臨床試験を開始する前に任意の臨床試験の計画を審査·承認しなければならない。ある臨床試験に関する情報は,そのwww.Clinicaltrials.govサイト上で公開されるために,特定の時間枠で米国国立衛生研究院(NIH)に提出されなければならない。
人体臨床試験は通常3つの連続段階に分けて行われ、この3つの段階は重なる可能性があり、合併する可能性もある
•第一段階臨床試験:この薬剤は、健康なヒトボランティアまたは標的疾患または状態を有する患者に最初に導入され、その安全性、用量耐性、吸収、代謝、分布、排泄を試験し、可能であれば、その有効性の早期兆候を得る。
•第二段階臨床試験:この薬物は、可能な副作用と安全リスクを決定するために限られた患者集団に使用され、特定の標的疾患に対する製品の治療効果を初歩的に評価し、用量耐性と最適用量を決定する。
•第三段階臨床試験:この薬物は良好に制御された臨床試験において、通常地理的に分散した臨床試験地点で、より多くの患者群を管理し、十分なデータを生成し、統計的に製品の有効性と安全性を評価し、承認され、製品の全体的なリスク-利益概況を構築し、そして製品のラベルに十分な情報を提供する。
臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出しなければならず,深刻な有害事象が発生すればより頻繁に提出される。第1段階、第2段階、および第3段階の臨床試験の各々は、任意の指定された期間内に成功するか、または全く成功しない可能性がある。そのほか、FDA或いはスポンサーはいつでも様々な理由で臨床試験を一時停止或いは中止することができ、研究患者が受け入れられない健康リスクに直面していることを発見することを含む。同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬剤が患者に予期せぬ深刻な傷害を与えた場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。
上場承認
必要な臨床試験,臨床前研究と臨床試験の結果,製品の化学,製造,制御,アドバイスに関するラベルに関する詳細な情報を成功させると仮定し,
このうち、NDAまたはBLAの一部としてFDAに提出され、1つまたは複数の適応に対する製品の発売承認を要求する。多くの場合,秘密保持プロトコルやBLAの提出には高額な申請使用料が必要となる.現在発効している処方薬使用料法案(PDUFA)ガイドラインによると,FDAは標準NDA提出日から10カ月以内に新たな分子実体を審査させて提出したNDAに行動させることを目標としている。この審査には通常12カ月が必要であり,NDAがFDAに提出された日から計算すると,FDAは約2カ月で“届出”決定を下すことができるからである。
FDAは、届出を受ける前に、提出後の最初の60日以内にすべてのNDAを予備審査して、それらが十分に完全であるかどうかを決定し、実質的な審査を行うことができる。FDAは秘密協定の申請を受け入れるのではなく、より多くの情報を提供することを要求するかもしれない。この場合、申請は追加情報と共に再提出されなければならない。再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。提出された申請が受け入れられると、FDAは深い実質的な審査を開始する。FDAは、薬物が安全かつ有効であるかどうか、および薬物を製造、加工、包装、または保有する施設が、製品の持続的な安全、品質、および純度を確保するための基準に適合しているかどうかを決定するために、秘密保持プロトコルを検討する。
さらに、改正および再許可された2003年の“小児科研究公平法”によれば、いくつかの研究は、すべての関連する小児科亜群において主張される適応の安全性および有効性を評価し、安全で有効な各小児科亜群に対する製品の投与および投与をサポートするのに十分なデータを含まなければならない。FDAは、成人のために製品が使用されるか、または小児科データ要件を完全にまたは部分的に免除するまで、申請者の要求に応じて、または小児科データの一部または全部の提出を延期することを許可することができる。
FDAはまた、薬物の利点がそのリスクよりも大きいことを確実にするために、リスク評価および緩和戦略、またはREMS計画の提出を要求する可能性がある。REMS計画は、制限された分配方法、患者登録、または他のリスク最小化ツールのような薬物ガイドライン、医師コミュニケーション計画、評価計画、または安全使用を確保する要素を含むことができる
FDAは新薬の申請を諮問委員会に提出するかもしれない。諮問委員会は,臨床医や他の科学専門家を含む独立した専門家からなるグループであり,申請を審査,評価し,申請を承認すべきかどうか,どのような条件でアドバイスを提供すべきかを担当する。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
NDAまたはBLAを承認する前に、FDAは、通常、製品を製造する1つまたは複数の施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、申請を承認しないであろう。さらに、NDAまたはBLAを承認する前に、FDAは、GCP要件に適合することを確実にするために、1つまたは複数の臨床試験場所を検査する可能性がある。
申請およびすべての関連情報を評価した後、諮問委員会の提案(ある場合)および製造施設および臨床試験地点に関する検査報告を含めて、FDAは承認状を発行するか、または場合によっては完全な返信を発行する可能性がある。完全な返信は、一般に、NDAまたはBLAの最終承認を保証するために満たされなければならない特定の条件を含む声明を含み、FDAが出願を再検討するために追加の臨床または臨床前試験が必要とされる可能性がある。この補足情報を提出しても、FDAは最終的にその申請が承認された規制基準を満たしていないと決定する可能性がある。もしこのような条件がFDAの満足を得たら、FDAは通常承認書を発行するだろう。この薬物の商業マーケティングを許可し、特定の適応の具体的な処方情報を提供する。
FDAが製品を承認しても、承認された製品使用適応を制限することができ、製品ラベルに特定の禁忌症、警告または予防措置を含むことを要求し、承認後に薬物の安全性をさらに評価するための第4段階の臨床試験を含む承認後の研究を要求することができ、製品の商業化後に製品を監視するための試験および監視計画を要求するか、または流通および使用制限またはREMS下の他のリスク管理メカニズムを含む他の条件を適用することが、製品の潜在的な市場および収益性に大きな影響を与える可能性がある。FDAは発売後の研究或いはモニタリング計画の結果に基づいて、製品の更なるマーケティングを阻止或いは制限することができる。承認後、新たな適応の追加、製造変更、および追加のラベル宣言など、承認された製品のいくつかのタイプの変更は、さらなるテスト要件およびFDAの審査および承認を受けるであろう。
“孤児薬物法案”
1983年の“孤児医薬品法”によれば、FDAは、米国では20万人未満または米国で20万人を超える影響を与える疾患または疾患であり、合理的な期待はなく、米国でこのような疾患または疾患を治療する薬剤を開発および提供するコストは、米国での販売から回収される、まれな疾患または疾患の治療のための医薬または生物を孤児として指定することができる。NDAやBLAを提出する前に,指定孤児薬を申請しなければならない。FDAが孤児薬物指定を承認した後、FDAは、スポンサーの名称、薬物または生物の識別およびその潜在的な孤児の使用を開示する。孤児薬物の指定は監督審査或いは承認過程の持続時間を短縮することはできないが、確かにPDUFA費用の免除、FDAスタッフとの接触を強化し、小児科研究要求を免除する可能性があるなどの利点を提供した。
孤児薬物指定を有する製品がその後、そのような指定された疾患を有するFDAの最初の承認を得た場合、この製品は、孤児製品の独占経営権を得る権利があり、これは、FDAが、完全なNDAまたはBLA、または略称NDA(ANDA)またはBiosimiilar出願を含む他の任意の出願を承認しない可能性があり、限定された場合でなければ、例えば、孤児薬物独占性よりも優れた臨床的製品を示さない限り、同じ活性部分を有する医薬または生物学的製剤を7年以内に販売することを意味する。孤児薬物排他性は、FDAが同じ疾患または状態に対する異なる薬物または生物学的製剤、または異なる疾患または状態に対する同じ薬物または生物学的製剤を承認することを妨げるものではない。孤児薬物を指定する他の利点は、いくつかの研究の税金控除と使用者申請費用の免除を含む。指定された孤児薬物が孤児が指定された適応よりも広い用途で承認された場合,孤児薬物の排他性を得ることはできない。さらに、FDAが指定された要求に重大な欠陥があると後に判断した場合、または製造業者がこのような稀な疾患または疾患患者の需要を満たすのに十分な数の製品を保証できない場合、米国での独占営業権を失う可能性がある。
承認後に要求する
FDAによって生産または流通を許可された薬品はFDAの普遍的かつ持続的な監督管理を受けなければならず、その中には記録保存、定期報告、製品サンプリングと流通、広告と販売促進、および製品の不良反応の報告に関連する要求が含まれている。承認後、承認された製品の大多数の変更は、新たな適応または他のラベル宣言を追加するなど、FDAの審査および承認を事前に受けなければならない。どのような上場製品やそのような製品を製造する機関に対しても,継続的な年間使用料要件と,臨床データ補充応用に対する新たな出願料がある。
FDAは上場許可を承認する条件として、いくつかの承認後の要求を強要するかもしれない。例えば、FDAは、第4段階の臨床試験を含む上場後試験を要求し、製品の商業化後の安全性と有効性をさらに評価し、監視するために監視を行う可能性がある。
また,医薬品メーカーや他の承認された薬品の生産·流通に参加するエンティティは,FDAや州機関にその機関を登録し,FDAやこれらの州機関の定期的な抜き打ち検査を受け,cGMP要求を遵守することを保証しなければならない。製造プロセスの変更は厳しく規制されており,通常FDAが事前に承認して実施する必要がある。FDA法規はまた、cGMP要求との任意の偏差を調査および是正し、スポンサーおよびスポンサーが使用を決定する可能性のある任意の第三者製造業者に報告および文書要求を提出することを要求する。そのため、メーカーはcGMPコンプライアンスを維持するために、生産と品質管理に時間、お金、労力をかけ続けなければならない。
承認された場合、規制要求や基準の遵守が維持されていない場合、または製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、製品には、予期されない深刻度または頻度の不良事象、または生産プロセス、または法規要件を遵守できなかったことを含む、以前に未知の問題が存在することが発見され、新しいセキュリティ情報を追加するために承認されたラベルの強制改訂をもたらす可能性がある;新しい安全リスクを評価するために発売後研究または臨床試験を実施すること、またはREMS計画に従って流通または他の制限を実施することが可能である。他の他の潜在的な結果には
•製品の販売や製造を制限し、市場から製品を完全に撤回したり、製品をリコールしたりする
•承認後の臨床試験には罰金、警告状、一時停止を科す
•FDAは、関連する保留申請または承認済み申請の追加申請を拒否するか、または製品承認を一時停止または撤回する
•製品を差し押さえたり、差し押さえたり、製品の輸出入を許可することを拒否したりする
•民事または刑事処罰を禁令または適用する。
FDAは市場に投入された製品のマーケティング、ラベル、広告、販売促進を厳格に規制している。承認の適応と承認のラベルの規定に基づいてのみ薬物を普及させることができる。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。
保証と精算を請け負う
私たちの候補薬物の販売は、承認されれば、このような製品が政府医療計画、商業保険、管理医療組織のような第三者支払者のカバーをどの程度受けるかにある程度依存する。これらの第三者決済者は、医療製品やサービスのカバー範囲を制限したり、精算を減らしたりすることが増えている。また、米国政府、州立法機関、外国政府は価格制御、精算制限、代替後発薬の要求を含むコスト制御計画を継続して実施している。第三者支払人は彼らがどのような治療費用を支払い、精算レベルを確立するかを決定する。第三者支払者が自己の保険·精算政策を設定する際には,通常連邦医療保険引受政策と支払制限に依存する。しかも、アメリカには統一された保険と精算政策がない。したがって,我々が開発した任意の候補薬物のカバー範囲や精算金額の決定は支払者ごとに決定する。各支払者は,治療に保険を提供するかどうか,治療のためにメーカーにどの程度の金額を支払うか,処方のどの層に置かれるかを決定する。支払人の保険薬物リストあるいは処方リスト上の位置は通常、患者が治療を獲得するために支払う共通費用を決定し、患者と医師がこのような治療を採用することに強い影響を与える可能性がある。価格制御とコスト制御措置を講じ,既存の統制·措置の管轄区域でより限定的な政策をとる, 私たちの純収入と業績をさらに制限するかもしれない。私たちの候補薬物に対する第三者精算或いは第三者支払人が私たちの候補薬物をカバーしないことを決定し、承認されると、医師の私たちの候補薬物に対する使用を減少させ、私たちの販売、運営結果、財務状況に実質的な悪影響を与える可能性がある。保証政策と第三者支払人の販売率はいつでも変化する可能性があります。したがって,有利なカバーや精算状態が得られても,将来的にはあまり有利でないカバー政策や精算料率が実施される可能性がある。
他の医療保険法
私たちは現在と未来の医療保健専門家、主要な研究者、コンサルタント、顧客と第三者支払者の手配を受けているため、私たちはまた連邦政府と私たちが業務を展開している州と外国政府の医療法規と法執行を受けて、私たちの臨床研究、提案された販売、マーケティング、教育計画を含む
他にも、私たちの運営能力に影響を与える可能性のある米国の法律は、“経済および臨床健康情報技術法案”によって改正された1996年の連邦健康保険可搬性および問責法、またはHIPAAを含み、カバーエンティティまたはカバーエンティティが個人のアイデンティティ健康情報を作成、受信、維持または送信することを表す“カバーエンティティ”の行動として管理されており、特定の医療保健提供者、健康計画および医療情報交換所、およびそれらのそれぞれの“ビジネスパートナー”を含み、それらのカバー下請け業者を含む。特定の電子保健取引について、保護された保健情報の安全とプライバシーを保護する。健康情報のプライバシーおよびセキュリティを管理するいくつかの国の法律では、いくつかの法律はHIPAAよりも厳しく、多くの法律は互いに大きく異なり、同じ効果を持たず、遵守作業を複雑にする可能性がある。他の事項に加えて、個人または実体が、連邦医療保険および医療補助計画のような連邦医療保険および医療補助計画に従って支払うことができる任意の商品またはサービスを交換または誘導するために、個人または実体が直接または間接的に報酬を要求、受け入れ、提供、または支払うことを禁止する連邦反バックル法規。連邦虚偽請求法および民事罰金法は、他の事項に加えて、個人または実体が虚偽または詐欺的な連邦医療保険、医療補助または他の第三者支払人の支払い請求の提出を意図的または誘導することを禁止する;連邦刑法は、詐欺の任意の医療福祉計画または医療保健事項に関連する虚偽陳述の計画を実行することを禁止する;“医師支払い陽光法案”, いくつかの薬品、機器、生物製品、医療用品のメーカーが毎年
アメリカ衛生·公衆サービス部は医師(医師、歯科医師、検眼師、足科医師と脊椎マッサージ師を含む)、いくつかの他の医療保健専門家(例えば医師アシスタントと看護師従業員)と教育病院への支払いと他の方法で価値を移転する情報、並びに医師及びその直系親族が持つ所有権と投資権益を定義する
また、多くの州には、逆控除や虚偽申告法のような類似した法律があり、医療補助や他の州が計画して精算するプロジェクトやサービスを除いて、これらの法律の範囲はより広く、支払者が誰であろうと適用可能である。しかも、私たちの製品が外国で販売されていれば、私たちは似たような外国の法律に制約されるかもしれない。
これらの法律を遵守しなければ、民事、刑事と行政処罰、損害賠償、返還、罰金、連邦医療保険加入、医療補助、その他の連邦医療保健計画から除外される可能性があり、監禁および誠実な監督と報告義務を含む重大な処罰を受ける可能性がある。
医療改革
現在および将来的にヘルスケアをさらに改革したり、医療コストを低減する立法提案は、私たちの製品の精算を減少させる可能性があります。支払者や提供者が実施しているコスト制御措置や,将来実施されるどの医療改革の取り組みの影響も,我々の製品販売の収入を大幅に減少させる可能性がある。
例えば,“患者保護と平価医療法案”の実施は,“医療·教育協調法案”,“平価医療法案”あるいは“平価医療法案”の共同改正により,政府や民間保険会社の医療融資や提供方式を大きく変え,製薬業に大きな影響を与えている。他の事項以外にも、PACAは特定のブランドの処方薬や生物製剤を生産または輸入する実体に対して控除できない年間費用を規定し、メーカー欠州と連邦政府の医療補助薬品還付計画下の外来薬物還付を計算する方法を改訂し、大多数のメーカーが医療補助薬品還付計画の下で不足している最低医療補助税金還付計画を高め、医療補助薬物還付計画を医療補助管理の看護組織に登録された個人を使用する処方に拡大し、連邦政府の比較有効性研究の項目に激励を提供し、後続の生物製品のための許可証保障枠組みを作成した。公布以来、PACAのいくつかの側面は行政、司法、国会の挑戦を受けてきた。例えば、トランプ総裁は、PPACAのいくつかの条項の実施を延期したり、PPACAに規定されているいくつかの医療保険要求を回避したりするためのいくつかの行政命令および他の命令に署名した。同時に、国会はPACAの全部または一部を廃止または廃止し、代替する立法を審議した。国会ではまだ全面的な廃止立法は成立していないが、PACAの下にある税収実施に影響を与えるいくつかの法案が署名されて法律となっている。2017年の減税·雇用法案、または税法は、2019年1月1日から施行される廃止条項を含む, PACAは、1年の全部または一部の期間にわたって合格健康保険を維持できなかったいくつかの個人に対して実施された税収ベースの分担責任支払いであり、一般に“個人強制”と呼ばれる。2021年6月17日、米国最高裁は、PPAAは“個人権限”が国会で廃止されたため、全体的に違憲だと弁明した手続き理由に基づく挑戦を却下した。また、2022年8月16日、総裁·バイデンは2022年インフレ削減法案に署名し、個人がPPACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は,受益者の最大自己負担コストの著しい低減と新たなメーカー割引計画の作成により,連邦医療保険D部分計画下の“ドーナツ脆弱性”を解消した。PPACAは未来に司法や国会で挑戦される可能性がある。このような挑戦やバイデン政府の医療改革措置がPPACAにどのように影響するかは不明である。
また、PACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月、当時総裁だったオバマ氏は、赤字削減合同特別委員会を創設し、国会に支出削減提案を提案する“2011年予算制御法案”に署名した。合同特別委員会は2013年から2021年までの少なくとも1.2兆ドルの赤字削減目標を実現せず、いくつかの政府プロジェクトの自動削減を触発した。これには、2013年4月に施行された各年度に提供者に支払われる連邦医療保険の2%が含まれており、その後の立法改正により、BBAを含め、追加の国会行動がとられない限り、2031年まで有効となる。現在の立法によると、医療保険支出の実際の減少幅は2022年の1%から本自動減額の最終年度の4%まで様々になる。また、2013年1月、当時の総裁·オバマ氏は、いくつかの医療サービス提供者への医療保険の削減を含む2012年の米国納税者救済法に署名し、訴訟時効を延長した
政府はサプライヤーへの多額の支払いを三年から五年以内に回収するよう要求しています。議会はまた追加的な医療改革措置を考慮している。
また、政府はメーカーがその市場製品の価格設定の方式をより厳格に審査した。例えば、大統領行政命令、国会調査、提出·公布された連邦と州立法があり、これらの立法は、薬品定価の透明性の向上、価格設定とメーカー患者計画との関係の審査、政府の薬品に対する計画精算方法の改革を目的としている。例えば、2021年7月、バイデン政府は“米国経済における競争を促進する”という行政命令を発表し、その中には処方薬に対する条項が複数ある。バイデン行政命令への対応として,2021年9月9日,米国衛生·公衆サービス部(HHS)は高薬価に対応する総合計画を発表し,その中で薬品定価改革の原則を概説し,国会がとりうる各種潜在立法政策と,HHSがとることができるこれらの原則を推進する潜在行政行動を示した。また、アイルランド共和軍は他の事項を除いて、(I)連邦医療保険(Medicare)がカバーするいくつかの高支出、単一由来の薬物と生物製品の価格について衛生·公衆サービス部に交渉し、(Ii)連邦医療保険B部分とD部分にリベートを徴収し、インフレを超える価格上昇を処罰するよう指示した。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。また、バイデン政府は2022年10月14日に追加の行政命令を発表し、HHS報告書がどのように連邦医療保険と医療補助革新センターをさらに利用して連邦医療保険と医療補助受益者の薬品コストを下げる新しいモデルをテストすることを指示した。私たちは未来にもっと多くの連邦と州と外国の医療改革措置を取ることを予想しています, いずれも私たちの製品に対する需要の減少や追加的な価格設定圧力を招く可能性がある。
人的資本管理
私たちの従業員は、てんかんやてんかん関連疾患の影響を受けた人や家庭の生活に有意義な改善を提供するために、薬物の開発と送達に取り組んでいます。 2022年12月31日現在、私たちは44人の常勤従業員を持っており、その大部分は主に研究開発活動に従事しており、その中には医学博士号を持つ個人5人と博士号を持つ専門家13人が含まれており、科学的な仕事に特化している。これらの専門家の多くはてんかんや神経学的経験を豊富に持っている。全体的に、私たちの管理チームでは、私たちの同僚は、Ztalmy、Fintepla、Brineura、Gilenya、Tysabri、Tecfideraを含む多くの重要な市場神経学とASMの開発または商業化に取り組んでいる。
私たちの未来の成功は、私たちが高技能従業員を引きつけ、維持し続ける能力に大きくかかっていると信じている。私たちは、従業員の尊敬度、発展と訓練、人材獲得と維持、従業員の健康、多様性、包摂性、報酬と公平を含む、私たちの人的資本資産の管理における一連の措置と目標を強調します
多様性と包容性のある文化を発展させることは、私たちの成長戦略を実現するために必要なトップレベルの人材を引き続き誘致し、維持するために重要だと考えている。したがって、私たちは私たちの従業員を鼓舞し、溶け込み、強い帰属感を享受する労働環境に投資している。これにはDeib委員会を通じて具体的な従業員尊敬度を通じて、私たちの多様性、公平性、包摂性、帰属感(Deib)計画を従業員チーム全体に拡張することが含まれている。会社の従業員の約50%が女性で、取締役会のメンバーの3分の1も女性だ。私たちの組織の約半分は多文化的だ
私たちは従業員がいつまでも満足しない好奇心を大切にし、科学的発見を革新薬物に転化し、彼らが障害を克服する勇気と根性、及び患者が使命感と緊迫感で操作する勇気と根性を代表する。これらの指導原則に基づいて、私たちは、私たちの同僚たちが尊重され、重要視され、彼らの潜在力を最大限に発揮することができる協力環境を構築したと信じている
私たちは、株式ベースの報酬奨励と現金ベースの報酬奨励を付与することで、選択された従業員、コンサルタント、取締役を吸引、維持、激励し、これらの個人を激励してできる限りのことをし、私たちの目標を実現することで、株主価値と会社の成功を増加させることを目的とした持分インセンティブ計画を持っている。
また、私たちのガバナンスは、独立して多様な取締役会によって監督され、彼らは私たちの専門知識を提供し、補完し、わが社の戦略や業績を監督するのを手伝っています。私たちの取締役会では、6人のメンバーのうち5人が独立している。全体的に、私たちの取締役会は私たちの企業の業績と成長に重要な意義を持つ分野で洞察力と専門知識を提供して、以下の経験を含む:上場企業の高級運営者上場会社における財務、取引と監督経験;実証された生物製薬と神経科学経験;薬物開発における研究と監督の鋭敏性;及び会社管理。
施設
ニューヨーク九番街441号十四階にある主な実行オフィスの空間を借りました。2022年6月、私たちは混合作業政策を正式に制定した。2022年には、従業員に十分な資源、支援、柔軟性を確保しながら、混合作業環境への円滑な移行という目標を達成しました。
ニューヨークにある本社オフィス施設はLEEDプラチナ認証を受けました。
会社やその他の情報
私たちは2014年4月にデラウェア州で登録設立された。私たちの主な実行事務室はニューヨーク九番街441号、14階にあります。New York 10001、私たちの電話番号は(646)661-7661です。私たちの会社のサイトの住所はwww.ovidrx.comです。本年度報告に含まれるまたは当社のサイトから取得可能な情報は本年度報告の一部ではなく、本年度報告に含まれる当社のサイトアドレスは非能動的なテキスト参照のみである。
我々は、我々のForm 10-K年次報告、Form 10-Q四半期報告、Form 8-K現在の報告、および取引法第13(A)または15(D)節に提出または提出されたこれらの報告書の修正案を、米国証券取引委員会または米国証券取引委員会に電子的に提出する。私たちのウェブサイトではWwwv.ovidrx.com“投資家”の項の下で、投資家は、これらの報告をアーカイブまたは米国証券取引委員会に提出した後、合理的で実行可能な範囲内でこれらの報告のコピーをできるだけ早くコピーする。
第1 A項。リスク要因
私たちの証券に投資することは高度な危険と関連がある。私たちの普通株式への投資を決定する前に、私たちが監査した総合財務諸表とこれに関連する付記を含む、以下のリスクに関する情報と、本年度報告書の他の10-K表に出現する他の情報をよく考慮しなければなりません。以下のいずれのリスクの発生も、私たちの業務、財務状況、経営結果、および将来の成長見通しに重大な悪影響を及ぼす可能性があり、または、私たちの実際の結果は、本報告および私たちが時々行う可能性のある前向きな陳述に含まれる結果とは大きく異なる可能性がある。この場合、私たちの普通株の市場価格は下落する可能性があり、あなたは投資の全部または一部を失うかもしれない。私たちはあなたに次のように議論されたどんな事件も起こらないという保証がありません。
我々の業務に関する選定リスクの概要
私たちの業務は重大な危険と不確実性に直面している。以下のいずれかのリスクが発生すれば、私たちの業務、財務状況、経営結果は重大な悪影響を受ける可能性があります。私たちが直面しているより大きなリスクは
•歴史的に見て、私たちはすでに重大な運営損失が発生しており、予測可能な未来には引き続き重大な運営損失を受け、決して利益を達成したり維持したりすることはないかもしれない。
•私たちの経営の歴史は私たちの業務のこれまでの成功度を評価することを難しくするかもしれませんし、私たちの未来の生存能力を評価することも難しいかもしれません。
·私たちの運営に資金を提供するために追加の資金が必要になります。これらの資金は、全くなければ受け入れられる条項では提供できないかもしれません。必要なときに必要な資金を得ることができなければ、いくつかの薬物開発努力や他の行動を延期、制限、または中止させることができるかもしれない。
·現在、候補薬物の開発は早期段階にあり、すべての候補薬は臨床前開発段階にある。もし私たちが開発に成功し、規制部門の私たちの候補薬の承認を得て商業化できない場合、あるいは他の候補薬の開発に成功できない場合、あるいは開発過程で重大な遅延に遭遇した場合、私たちの業務は損害を受けるだろう。
·私たちの将来の成功は、現在および将来の候補薬剤の臨床開発、規制承認、および商業化の成功にかかっています。もし私たちまたは私たちの許可者が必要な規制承認を得ることができなければ、私たちまたは私たちの被許可者は私たちの候補薬物を商業化することができず、私たちの収益能力は不利な影響を受けるだろう。
·前臨床研究または早期臨床試験の結果が必ずしも将来の結果を示唆するとは限らないので、私たちの候補薬剤は、計画中または将来の臨床前研究または臨床試験において有利な結果が得られない可能性があるか、または規制部門の承認を得られない可能性がある。
·私たちが時々発表または公表している臨床試験の一時的なバックラインおよび初歩的な結果は、より多くの患者データの取得に伴って変化し、監査および検証手順の影響を受ける可能性があり、最終データの大きな変化をもたらす可能性がある。
·臨床前研究や臨床試験は非常に高価で時間がかかり、設計や実施が困難であり、不確定な結果にも及ぶ。そのほか、著者らの臨床試験は重大な遅延に遭遇する可能性があり、あるいは著者らは臨床前研究と臨床試験において安全性と有効性を証明できず、適用する監督管理機関を満足させることができないかもしれない。
·より多くの候補薬の発見、開発、商業化に成功できなければ、業務拡大と戦略目標を達成する能力が損なわれる。
·私たちの候補薬は、副作用を引き起こす可能性があり、または他の特性を有し、規制部門の承認を延期または阻止し、商業可能性を制限するか、または任意の潜在的な上場承認後に重大な負の結果をもたらす可能性があります。
·現在または将来の候補薬が発売承認されても、医師、患者、第三者支払人、または医学界の他の人の市場受け入れを得ることができない可能性があり、これは商業的成功に必要である。
·RLTプロトコルにより、soticlestatの開発および商業化に関する特許使用料とマイルストーン支払いを得る権利があります。武田が進展せず、Soticlestatの開発を延期したり中断したりすれば、このような支払いの一部または全部を受け取ることができない可能性があり、我々の業務に実質的な損害を与えることになる。
•私たちと顧客、医師、第三者支払者との関係は、連邦と州医療詐欺と乱用法律、虚偽クレーム法律、医療情報プライバシーと安全法律、その他の医療法律法規の制約を直接または間接的に受ける可能性がある。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。
·現在または将来の候補薬は、承認されれば、保険および十分な精算が得られない可能性があり、利益販売を困難にする可能性がある。
·現在または将来の候補薬剤のために特許保護を取得し、維持することができない場合、または取得された特許保護範囲が十分に広くない場合、私たちは市場で効果的に競争することができない可能性がある。
·私たちは、高価で時間がかかり、成功していないかもしれない、私たちの特許、ライセンシーの特許、または私たちの他の知的財産権を保護または強制する訴訟に巻き込まれる可能性があります。
·私たちには自分の製造能力がなく、現在および将来の候補薬物生産の臨床および商業的供給に依存する第三者に依存する。
·私たちの臨床前研究および臨床試験を第三者に依頼し、監督し、監督するつもりですが、これらの第三者の表現が満足できなければ、業務を損なう可能性があります。
·私たちの組織を拡大する必要があるかもしれませんが、このような成長を管理する上で困難になる可能性があり、運営を乱す可能性があります。
·私たちは多くのプライバシーやセキュリティ法律に制約される可能性があり、私たちが守らないと罰や名声の被害につながる可能性があります。
私たちの財務状況と追加資本需要に関連するリスク
私たちは予測可能な未来に巨額の運営損失が続き、永遠に実現したり利益を維持したりしないかもしれないと予想している。
歴史的に、私たちは深刻な運営損失を起こしたことがある。2022年12月31日までの1年間の純損失は5420万ドルだった。2022年12月31日現在、私たちの累計赤字は2億255億ドルです。私たちは予測可能な未来に運営損失が増加し続けると予想している。設立以来、私たちはほとんどの努力を私たちの候補薬物の研究と臨床前と臨床開発に投入し、従業員の募集と私たちのインフラ建設に投入してきた。
私たちは商品化された薬を許可されておらず、薬品販売から何の収入も得られていない。私たちの候補薬の多くはまだ臨床前試験段階にある。数年かかるかもしれませんもしあれば1つを持つことができます
商業化された薬品です今後数年は引き続き巨額の費用と運営損失が発生することが予想され、私たちが発生した純損失は四半期ごとに毎年大きく変動する可能性がある。私たちは次の場合、私たちの費用が大幅に増加すると予想している
•私たちの候補薬が行われている臨床前と臨床開発を続けています
•薬物、候補薬物、または技術の買収を続けることで、候補薬物の組み合わせを確立することができるかもしれない
•臨床前研究と臨床試験を開始し、未来に追求する可能性のある他の任意の候補薬物を提供する
•現在と未来に臨床試験を成功させた候補薬物のために発売許可を求める
•販売、マーケティング、流通インフラを構築し、上場承認を得る可能性のある任意の候補薬物を商業化する
•私たちの知的財産権の組み合わせを開発し、維持し、拡大し、保護する
•業務、財務、管理システムを実施すること
•より多くの行政、臨床、監督と科学者を誘致、採用し、維持する。
このような開発や規制プロセスを完成させても,現在および将来の候補薬剤の発売と商業化に関連した巨額のコストが生じることが予想される。
もし私たちが確実に利益を達成したら、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。もし私たちが実現して利益を維持できなければ、会社の価値を下げ、資金を調達し、研究開発努力を維持し、業務を拡大し、あるいは運営を継続する能力を弱める可能性がある。
私たちの経営の歴史は私たちの業務のこれまでの成功度を評価することを難しくするかもしれませんし、私たちの未来の生存能力を評価することも難しいかもしれません。
私たちの設立以来、私たちの業務は大量の現金を消費しました。主に私たちの候補薬物の研究と開発、私たちの会社を組織し、それのために人員、業務計画、資金の調達、資産の買収によるものです。市販承認を得たり、商業規模の薬物を製造したり、商業化に成功するために必要な販売やマーケティング活動はまだ証明されていません。したがって、もし私たちがより多くの候補薬を開発した経験があれば、私たちの将来の成功や生存能力のいかなる予測もそんなに正確ではないかもしれない。
様々な要因により、私たちの財務状況と経営業績は各四半期と毎年変動し続け、その多くの要素は私たちがコントロールできないと予想しています。私たちは最終的に研究開発に専念する会社からビジネス活動を展開する能力のある会社に転換する必要がある。私たちは予期せぬ費用、困難、複雑さ、遅延に直面するかもしれないし、そのような移行では成功しないかもしれない。
私たちは私たちの運営に資金を提供するための追加の資本が必要であり、これらの資金は全くなければ受け入れられる条件で提供できないかもしれない。必要なときに必要な資金を得ることができなければ、いくつかの薬物開発努力や他の行動を延期、制限、または中止させることができるかもしれない。
設立以来、私たちの業務は大量の現金を消費した。私たちが臨床前研究と臨床試験を通じて私たちの現在と未来の候補薬物を推進し、私たちの候補薬物を商業化し、他の任意の候補薬の買収や許可を求めることに伴い、私たちの費用は増加すると予想される。FDAあるいは他の監督管理機関が現在予想されている基礎の上で臨床前研究或いは臨床試験を行うことを要求すれば、私たちの費用は予想を超える可能性がある。しかも、私たちの候補薬が発売されても、それらは商業的成功を達成できないかもしれない。私たちの収入は、もしあれば、薬物の販売から来ます。これらの薬物は数年以内に商業的に使用されないと予想されます。もし私たちが開発または他の方法で獲得した任意の候補薬が発売承認されれば、製造、マーケティング、販売、流通に関連する巨額の費用が発生すると予想される。
2022年12月31日現在、私たちの現金、現金等価物、有価証券は1.29億ドル、累計赤字は2億255億ドル。私たちは、私たちの既存の現金、現金等価物、および有価証券が、私たちの現在の運営計画に少なくとも12ヶ月の資金を提供し、本年度報告書からForm 10-Kを提出すると信じている。しかし、私たちの現在知られていない多くの要素のために、私たちの運営計画は変化するかもしれません。私たちは計画よりも早く追加の資金を求めて、公共またはプライベート株や債務融資、第三者融資、マーケティング、
流通スケジュール、および他の協力、戦略連合および許可スケジュール、またはこれらの方法の任意の組み合わせ。
私たちはより多くの資金を必要とし、臨床前と臨床開発を推進し、監督部門の承認を得て、監督部門の承認後、私たちの現在または未来の候補薬物を商業化する。いかなる追加的な資金調達努力も、私たちの経営陣の彼らの日常活動に対する関心を移す可能性があり、これは、私たちの現在と未来の候補薬を開発し、商業化する能力に悪影響を及ぼすかもしれない
新冠肺炎の流行もロシアとウクライナの衝突の長期経済影響も評価或いは予測は困難であるが、これらの事件はすべて全世界の金融市場に重大な妨害をもたらし、全世界経済の普遍的な減速を招いた。しかも、インフレ率は最近数十年間見たことのない水準まで上昇した。インフレ上昇は運営コスト(労働コストを含む)を増加させる可能性があり、私たちの運営予算に影響を与える可能性がある。また、米連邦準備委員会(Federal Reserve)は金利を引き上げており、インフレへの懸念に応えるためにさらに金利を上げる見通しだ。金利上昇、特に政府支出の減少や金融市場の変動に加えて、経済の不確実性をさらに増加させ、これらのリスクを悪化させる可能性がある。中断と減速が深まったり持続したりすれば、優遇条件で追加資本を得ることができず、追加資本を得ることができない可能性があり、将来的には私たちの財務状況や私たちの業務戦略を実施する能力に悪影響を及ぼす可能性がある。
もし私たちが必要な時にもっと多くの資金を集めることができなければ、私たちは私たちの薬物開発や将来の商業化努力を延期、制限、減少または中止すること、あるいは私たちが自ら開発し、マーケティングするはずだった候補薬物の開発とマーケティングの権利を与えることが要求されるかもしれない。
私たちは純営業損失(“NOL”)を利用して繰越及びある他の税務属性を利用して将来の課税収入を相殺する能力が制限される可能性がある。
私たちのNOL繰越は満期になって使用されない可能性があり、その限られた期限や米国税法の制限により、将来の所得税負担を相殺するためには使えません。適用される米国税法によると、私たちが2017年12月31日までの納税年度に発生した連邦NOLは、20年間の繰り越しのみを許可しています。コロナウイルス援助,救済·経済安全法案やCARE法案により改正された減税·雇用法案や税法により,2017年12月31日以降の課税年度に発生する連邦NOLは無期限に繰り越すことができるが,2020年12月31日以降に開始される課税年度による連邦NOLの利用は限られている。
また、改正後の1986年の“国内税法”(以下、“税法”と略す)第382節および第383節および州法の該当条項によると、ある会社が所有権変更を経験した場合、変更前のNOL繰り越しや他の変更前の税収属性(例えば税収控除を検討する)を用いて変更後の収入を相殺する能力が制限される可能性がある。第382条“所有権変更”は、通常、当社株の少なくとも5%を保有する1つ以上の株主またはグループ株主が、3年間のスクロール期間の最低持分率に基づいて50ポイント増加する(価値で計算される)。私たちは過去に所有権の変化を経験したことがあるかもしれませんが、未来は私たちの株式所有権の変化(いくつかは私たちの制御範囲内ではない)のために所有権の変化を経験するかもしれません。したがって,純課税所得額を稼ぐと,変動前のNOLを用いてこのような課税収入を相殺する能力が制限される可能性がある。州税法の似たような規定はまた私たちが累積的な州税収属性を使用することを制限するのに適用されるかもしれない。さらに、州レベルでは、NOLの使用を一時停止または制限する時期がある可能性があり、これは州の課税税を加速または永久的に増加させる可能性がある。
2022年と2021年12月31日までの年間で、米国連邦と州所得税のゼロと130万ドル、税引き前損失5420万ドル、税引き前収入1億242億ドルをそれぞれ記録した。2022年12月31日現在,マサチューセッツ州の所得税目的に約1億535億ドルの未使用NOL繰り越し,マサチューセッツ州の所得税目的に1300万ドル,ニューヨーク所得税目的に1億641億ドルの未使用NOL繰越,および将来の課税所得額に1億639億ドルの未使用NOL繰越がある。私たちのNOL繰り越しは非常に限られているため、将来的に利益を実現すれば、大部分のNOL繰り越しを利用できない可能性があり、キャッシュフローや運営業績に大きな悪影響を及ぼす可能性がある。
私たちまたは私たちの顧客に不利な税金法律または法規の変化は、私たちの業務、キャッシュフロー、財務状況、または経営結果に重大な悪影響を及ぼす可能性があります。
新しい税金法律、法規、規則、規則、または条例はいつでも公布されることができる。例えば、最近公布された“インフレ低減法案”は、他の規定を除いて、ある大企業の帳簿収入に15%の最低税率を徴収し、ある会社の株買い戻しに1%の消費税を徴収する。さらに、既存の税金法律、法規、規則、条例、または条例は、いつでも異なる方法で解釈、変更、廃止、または修正することができる。どのようなものでも
制定、解釈、変更、廃止、または修正は私たちに悪影響を及ぼす可能性があり、追跡力を持っている可能性がある。特に、会社税率の変化、私たちの繰延純資産の現金化、外国収益の課税、および“CARE法案”または任意の将来の税制改正立法によって改正された税法下の費用控除は、私たちの繰延税金資産の価値に実質的な影響を与え、重大な一次費用を招き、将来の税収支出を増加させる可能性がある。
私たちの候補薬物の開発と商業化に関するリスク
我々の開発は非常に早期の段階にあり,われわれの候補薬物の多くは臨床前開発段階にある。もし私たちがこれらや任意の他の適応に対して開発に成功し、監督部門の承認を得て、私たちの候補薬物を商業化することができなければ、あるいは他の任意の候補薬の開発に成功したり、この点で重大な遅延に遭遇した場合、私たちの業務は損害を受けるだろう。
我々の開発はまだ初期段階にあり,我々がコントロールしている候補薬物の多くの開発と商業責任はまだ臨床前開発段階にある。例えば,2022年から3年以内に3つの試験新薬(IND)申請を提出する予定であることを公表していたが,このようなすべてのIND申請を実現するために臨床前開発成功を保証することはできなかった。INDが認められた後、私たちのすべての候補薬物は臨床開発を通じて監督管理の承認を得る必要があり、私たちはまた製造と供給に関する問題を解決する必要があり、これは私たち自身の能力と専門知識を建設することに関連するかもしれない。規制部門の承認を得た製品を商業化するためには、商業組織を構築したり、商業化アウトソーシングに成功したりする必要があり、これらすべては薬品販売から任意の収入を生み出すことができるように、大量の投資と大量のマーケティング努力が必要となる。私たちは商業的な販売が許可されている薬は何もありません。私たちは決して適切な薬を開発したり商業化することができないかもしれません。
私たちが医薬品販売から収入を得て利益を達成する能力は、私たち単独または任意の現在または未来のパートナーと私たちの現在および未来の候補薬剤の開発を成功させ、必要な規制承認を得る能力に依存する。私たちは今後数年間薬品販売から収入を得られないと予想しています。もしあれば。医薬品販売から収入を得る能力は、以下の分野での私たちまたは任意の現在または未来のパートナーの成功に大きく依存するが、これらに限定されない
•現在と未来の候補薬物の臨床前と臨床開発を適時かつ成功的に完成させた
•現在と未来に臨床試験に成功した候補薬の承認を得ました
•販売チーム、マーケティング、流通インフラ、または商業化パートナーと協力することによって、私たちが監督管理の許可を得た任意の候補薬物を発売し、商業化する
•米国や国際的に規制されている任意の候補薬については、政府と第三者支払者の保険と十分な補償を受ける資格がある
•現在と未来の候補薬物のための開発、検証、商業上実行可能、持続可能、拡張可能、反復可能かつ譲渡可能な製造技術は、現在の良好な生産実践(“cGMP”)に適合している
•臨床開発を支援するのに十分な量および品質の薬物およびサービスを提供するために、第三者と供給および製造関係を確立し、維持し、承認されれば、現在および将来の候補薬物の市場需要を支援する
•もし承認されれば、市場に現在または任意の未来の候補薬物を受け入れさせ、実行可能な治療選択として、医師、患者、第三者支払人、医学界の他の人が選択する
•競争する技術や市場の発展に効果的に対応しています
•必要に応じてより多くの内部システムとインフラを実施する
•私たちが達成可能な任意の協力、許可、または他の手配で有利な条件を交渉し、これらの手配に基づいて私たちの義務を履行する
•私たちの現在と未来に規制部門によって承認された任意の候補薬物の孤立薬物排他性を獲得し、維持する
•特許、商業秘密、およびノウハウを含む、私たちの知的財産権の組み合わせを維持、保護、拡大します
•第三者の妨害または侵害クレームを回避し、それを抗弁すること;
•アメリカ、EU、そして他の国で適切な価格設定が行われることを確実にする。
もし私たちがこれらの要素の1つまたは複数の側面でタイムリーまたは根本的に成功できなければ、私たちは重大な遅延を経験したり、私たちが開発した候補薬物を商業化することに成功しない可能性があり、これは私たちの業務に実質的な損害を与えるだろう。もし私たちが開発したすべての候補薬が発売承認されなければ、私たちは運営を続けることができないかもしれない。
私たちの未来の成功は私たちの現在と未来の候補薬物の成功した臨床開発、監督管理の承認と商業化にかかっている。もし私たちまたは私たちの許可者が必要な規制承認を得ることができなければ、私たちまたは私たちの被許可者は私たちの候補薬物を商業化することができず、私たちの収益能力は不利な影響を受けるだろう。
私たちは規制部門の承認を受けた薬を何も持っていない。私たちの業務は私たちが臨床前と臨床開発を成功的に完成させ、監督部門の承認を得て、承認を得た場合、直ちに私たちの現在と未来の候補薬物の商業化に成功するかどうかにかかっている。我々の現在と将来の候補薬物の開発と商業化に関する活動は,FDAや米国の他の規制機関,米国以外の同様の規制機関によって全面的に規制されている。米国や他の管轄地域の規制承認が得られなければ、現在と将来の候補薬物を商業化し、マーケティングすることはできないだろう。私たちの現在と未来の候補薬を効果的に開発し、商業化できなければ、私たちの業務、財務状況、運営結果、成長の見通しに悪影響を及ぼす可能性がある。
Soticlestatは我々が開発を支援している最先端の化合物であり,武田社が開発を継続しており,現在重要な試験計画中である。もし重要な試験が成功しなかった場合、またはその化合物が承認されなかった場合、私たちはRLT協定の記念碑的支払いと特許権使用料を受けないだろう。これらの資金がなければ、私たちは現在と未来のパイプを開発して商業化するために、大量の追加資金を調達する必要があるかもしれない。
また,我々の現在と将来の候補薬物の開発と商業化に関する活動は,FDAや米国の他の規制機関,米国以外の同様の規制機関によって全面的に規制されている。米国や他の管轄地域の規制承認が得られなければ、現在と将来の候補薬物を商業化し、マーケティングすることはできないだろう。
FDAおよび同様の外国規制機関による現在および将来の候補薬剤の承認を得ても、どの承認も、特定の年齢層の使用制限、警告、予防措置または禁忌症に関連する重大な制限、または重い承認後の研究またはリスク管理要件の制約を受ける可能性がある。もし私たちが規制部門の承認を得ることができない場合、あるいはいかなる承認にも重大な制限が含まれていれば、私たちはその候補薬剤の開発を継続するために十分な資金を得ることができないか、または私たちが将来許可、開発または買収する可能性のある他の任意の候補薬を継続することができないかもしれない。場合によっては、私たちの第三者ライセンシーは、ライセンスカバーの国/地域で規制承認を受ける責任があり、私たちの製品を商業化するために必要な承認を得るために、彼らの努力に依存します。将来の許可者がその開発と許可製品の規制承認を受ける義務を履行できない場合、影響を受けた国/地域で私たちの製品を商業化することができないかもしれないし、私たちの能力が大きく遅れる可能性がある。
また,現在および将来の候補薬が規制部門の承認を得ても,商業的に実行可能な価格設定構造を構築し,第三者や政府支払者から十分な補償の承認を得るための商業組織を発展させる必要がある。もし私たちが現在と未来の候補薬を商業化することに成功できなければ、私たちは私たちの業務を継続するのに十分な収入を生むことができないかもしれない。
臨床前研究或いは早期臨床試験の結果が必ずしも未来の結果を予測できるとは限らないため、著者らの候補薬物は計画或いは未来の臨床前研究或いは臨床試験において有利な結果がない可能性があり、或いは監督部門の承認を得られない可能性がある。
臨床前試験と早期臨床試験の成功は、その後の臨床試験が類似した結果を産生することを保証することができず、或いは候補薬物の有効性と安全性を証明するのに十分なデータを提供する。通常,早期臨床試験で有望な結果を示す候補薬は,その後の臨床試験で大きな挫折を経験した。例えばOV 101の海王星試験では従来の候補薬の1つはその要求に達していません
著者らの第二段階試験STARは以前に鼓舞的な結果を得たが、OV 101はAngelman症候群患者に対するOV 101の治療効果を評価する最初の臨床試験である。我々は2021年初めにAngelman症候群に対するOV 101プロジェクトを終了した。著者らは現在と未来の候補薬物の臨床前研究結果はこれらの化合物の後期臨床試験における効果を予測できないかもしれない。候補薬剤の臨床試験で有利な結果が観察されなければ,候補薬剤の臨床開発を延期または放棄することに決定する可能性がある。このような遅延や放棄は、私たちのビジネス、財務状況、運営結果、および将来性を損なう可能性があります。
我々の候補遺伝子治療製品の開発とその後に監督部門の承認を得る時間とコストを予測することは困難である。
私たちの未来の成功は私たちの早期候補遺伝子治療製品の成功開発にある程度かかっている。私たちは持続可能で複製可能で拡張可能な製造プロセスの開発や内部および外部の商業生産基地へのプロセスの移転に遅延がある可能性があり、これは私たちが臨床試験を開始したり完成したりすることを阻止したり、私たちの候補製品が適時または利益を得て商業化することを阻止するかもしれない。
我々のような新しい遺伝子治療製品の規制承認過程は,他のタイプの製品よりも高価である可能性があり,かかる時間も長く,これらの製品タイプはこれまでより広く知られているか,より広く研究されている。遺伝子治療製品の監督管理方法と要求は引き続き変化しており、監督管理機関がより多くの豊富な経験を持つ技術と比べ、いかなる変化も製品開発と承認に重大な遅延と予測不可能をもたらす可能性がある
また,臨床試験が1地点で登録を開始できる前に,各臨床地点の機関審査委員会(“IRB”)とその機関生物安全委員会は,その地点での臨床試験に適しているかどうかを評価するために提案された臨床試験を審査しなければならない。さらに、他の人が行った遺伝子治療製品の臨床試験における不良事件はFDA或いはアメリカ以外の他の監督管理機関が私たちの任意の候補製品に対する人体研究或いは承認の要求を変えることを招く可能性がある。
否定的な世論と遺伝子治療および遺伝子研究の規制審査の強化は、私たちの候補製品に対する大衆の見方を損なう可能性があり、あるいは私たちの業務を展開したり、私たちの候補製品のマーケティング承認を得る能力に悪影響を及ぼす可能性がある。
公衆の認知は遺伝子療法が安全でないという説の影響を受ける可能性があり,遺伝子療法は公衆や医学界の受け入れを得られない可能性がある。より厳格な政府法規または否定的な世論は、私たちの業務や財務状況にマイナスの影響を与え、候補製品の開発や商業化、あるいは私たちが開発する可能性のある任意の製品の需要を遅延または損害する可能性がある。早期バージョンのレトロウイルスベクターを用いた実験では,このベクターを宿主細胞のDNAに統合し,宿主細胞のDNAを変化させ,いくつかのよく知られている有害事象を招いた。深刻な有害事象のリスクは依然として遺伝子治療の懸念される問題であり、私たちはそれが私たちの未来のいかなる臨床試験でも起こらないことを保証することはできない。また,遺伝物質や遺伝物質を携帯するための製品の他の成分の持続的生物活性により,遺伝子治療製品に接触した後に不良事象を遅延させる潜在的リスクがある。
私たちまたは他の側が行った試験や研究における有害事象は、最終的に私たちの候補製品に起因することができなくても、それによって生じる宣伝は、政府の監督管理の増加を招く可能性があり、大衆は私たちの否定的な見方に不利であり、私たちの候補製品のテストや承認は規制遅延が生じる可能性があり、承認された候補製品に対するラベル要求はより厳しく、このような候補製品に対する需要は減少する。
著者らが時々発表或いは公表した臨床試験の一時的な背線と初歩的な結果はより多くの患者データの獲得に伴い変化する可能性があり、そして監査と検証プログラムの影響を受け、これは最終データの重大な変化を招く可能性がある。
時々、私たちはすでに将来的に私たちの臨床試験の初歩的または中期的なデータを公表し、報告することができる。私たちおよびパートナーからの臨床試験の初期または中期データは、試験の最終結果を表すことができず、患者登録の継続および/または複数の患者データの出現に伴って、1つまたは複数の臨床結果が重大に変化する可能性のあるリスクに直面する可能性がある。初歩的な結果または主要な結果は依然として監査とチェック手続きを遵守しなければならず、これは最終データが私たちが以前に公表したり報告した初歩的なデータと大きく異なる可能性がある。したがって、最終データを得る前に、予備データまたは中間データを慎重に考慮すべきである。初期または中期データと最終データとの違いは、私たちの業務の将来性を深刻に損なう可能性があり、私たちの普通株の取引価格を大幅に変動させる可能性があります。
臨床前研究と臨床試験は非常に高価で、時間がかかり、設計と実施が困難であり、しかも不確定な結果に関連している。そのほか、著者らの臨床試験は重大な遅延に遭遇する可能性があり、あるいは著者らは臨床前研究と臨床試験において安全性と有効性を証明できず、適用する監督管理機関を満足させることができないかもしれない。
私たちは現在すべての候補薬物が早期臨床あるいは臨床前開発段階にあり、彼らが失敗するリスクが高い。私たちは長い、複雑で高価な臨床前テストと臨床試験によって証明しなければならない。私たちが規制部門の承認のために新薬申請(“NDA”)または生物製品許可証申請(“BLA”)を提出しようとする前に、私たちのすべての候補薬はその予想される適応に対して安全かつ有効である。私たちは、いつ、私たちの任意の候補製品にNDAまたはBLAを提出することができるか、またはそのような任意の申請がFDAの承認を得ることができるかどうかを決定することができない。人体臨床試験は非常に高価で、設計と実施が困難であり、一部の原因は彼らがアメリカと他の国の多くの政府当局の厳格な審査と監督管理の要求を受けて、私たちはこれらの国で私たちの候補製品をテストし、マーケティングするつもりである。例えば、FDAは、将来の任意の候補製品の臨床試験のために提案された終点に同意しない可能性があり、このような臨床試験の開始を遅らせる可能性がある。
私たちの候補製品の臨床試験を成功させるには少なくとも数年かかると思います。もっと長くなければ。もしあれば、どんな臨床試験も計画通りに行われるか、予定通りに完成することは保証できません。また,失敗は任意の段階で起こる可能性があり,臨床試験の放棄や重複を招く問題に遭遇する可能性がある。成功を妨げたり、臨床開発をタイムリーに完成させたりする可能性のある事件は、
•臨床試験の開始を支援するのに十分な臨床前、毒理学、または他のデータを生成することはできません
•病気に関連した臨床的ゴールを開発し検証することはできません
•遅延と規制当局は試験設計について合意した
•遅延と期待される臨床研究機関(“CRO”)と臨床試験場所は受け入れ可能な条項について合意した
•調査地点の開放を遅延させ
•適切な患者を募集し、著者らの臨床試験に参加することに遅延或いは困難が発生した
•監督管理部門は深刻な不良事件、1種類の候補薬物に対する懸念或いは著者らの臨床試験操作或いは試験地点の検査のため、強制的に臨床一時停止を実施した
•患者を完全に試験或いは治療後のフォローアップに参加させることを遅延させた
•候補薬物に関連する深刻な有害事象の発生は、その潜在的な利点を超えていると考えられている
•新しい臨床プログラムの規制要件およびガイドラインの変化を修正または提出する必要がある;または
•戦争、またはロシアとウクライナの間で続く戦争、テロ、自然災害、または公衆衛生危機を含む敵対行動が来る可能性があると考える地政学的行動による業務中断。
また,Angelman症候群のようないくつかの疾患に対する臨床終点は決定されていないため,新たなモデルを開発したり,既存の終点を修正して治療効果を評価しなければならない可能性があり,臨床試験の開始や完成に要する時間が増加する可能性がある。また,現在これらの疾患を治療する薬剤が不足しているため,この分野の研究者がこの分野で試験を行った経験が不足している可能性があり,研修研究者や臨床サイトを開放する時間や費用が増加する可能性があると考えられる。
臨床前と臨床開発を成功させることができないいかなる状況も、私たちの追加コストを招き、あるいは未来の薬物販売および規制と商業化のマイルストーンから収入を創出する能力を弱める可能性がある。さらに、私たちの候補薬の生産や処方変更を行う場合、私たちの修正された候補薬を早期バージョンに接続するために追加的なテストを行う必要があるかもしれない。臨床試験の遅延はまた、候補薬物を商業化する独占的な権利を持つ可能性のある任意の期限を短縮することができ、あるいは私たちの競争相手が私たちの前に類似の薬物を市場に出すことを可能にすることは、候補薬物の商業化に成功する能力を弱める可能性があり、私たちの業務、財務状況、運営結果、将来性を損なう可能性がある。
さらに、私たちの臨床試験結果が確定していない場合、あるいは候補薬に関連する安全問題や深刻な有害事象があれば、
•もし可能であれば、上場承認を得るために遅延される
•承認された適応や患者集団は期待や期待ほど広くない
•重大な使用または流通制限または安全警告を含むラベルの承認を得ること;
•追加の上場後のテスト要求を受けます
•追加の臨床試験を行うことを要求され、追加の上場後の試験要求を承認または受け入れることを支持する
•規制当局に薬物の承認を撤回または一時停止させるか、または修正されたリスク評価および緩和戦略(“REMS”)の形態でその流通に制限を加える
•警告や禁忌症のようなタグ付け説明
•起訴される
•私たちの名声は損なわれた。
もし私たちがテストや発売承認を得る上で遅延に遭遇すれば、私たちの薬物開発コストも増加するだろう。われわれのいかなる臨床前研究あるいは臨床試験が計画通りに開始されるかどうか、再構成が必要かどうか、あるいは計画通りに完成するかどうかは分からない。
さらに、私たちまたは私たちの協力者が規制要件(FDAの現在の良好な臨床現場(“GCP”)の規定を含む)に従って試験を行うことができなかった場合、または参加者を受け入れられない健康リスクに直面させたり、FDAが私たちのIND申請またはこれらの試験の進行に欠陥があることを発見した場合、私たち、FDAまたはIRBはいつでも臨床試験を一時停止することができます。したがって,将来の臨床試験の開始と完了スケジュールを確実に予測することはできない。もし私たちの臨床試験の開始が遅れたり完成したりすれば、もし私たちが完成する前に臨床試験を中止すれば、私たちの候補薬物の商業的将来性は負の影響を受ける可能性があり、候補薬物から収入を得る能力は延期される可能性がある。
より多くの候補薬の発見、開発、商業化に成功できなければ、業務拡大と戦略目標を達成する能力が損なわれる。
著者らの現在の戦略の重要な要素の1つはてんかん、てんかん関連障害と稀な神経疾患を治療する候補薬物を組み合わせて商業化する可能性があることを発見、開発し、開発することである。しかし,我々の業務開発活動や研究活動は,てんかんやてんかん関連疾患以外に魅力的な機会を提供する可能性があり,会社や我々の株主の最良の利益に合致すると考えられる他の疾患を含む他の興味のある分野で候補薬を求めることを選択する可能性がある。我々は,我々の戦略を検討し,我々が求めている魅力的な興味や資産分野を選択して必要な修正を行う予定である.我々は,許可と有力生物製薬会社や学術機関との連携により,我々の候補薬物の組み合わせを開発し,新たな候補薬物を開発する予定である。新しい候補薬剤を決定するには、最終的に任意の候補薬剤が決定されたか否かにかかわらず、大量の技術、財政、人的資源が必要である。最初に希望を示した候補薬を決定しても,許可やこれらの資産を得ることができない可能性があり,多くの理由でこれらの候補薬の開発や商業化に成功できない可能性がある
•使用された研究方法は、潜在的な候補薬剤の決定に成功しない可能性がある
•競争相手は代替薬を開発して私たちが開発した候補薬を時代遅れにするかもしれません
•私たちが開発した任意の候補薬はまだ第三者特許または他の独占的権利によって保護されている可能性がある
•さらなる研究では、候補薬剤は、有害な副作用または他の特徴を有することが証明される可能性があり、有効ではないか、または適用されない規制基準に適合していない可能性があることを示している
•候補薬剤は、許容可能なコストで商業的に量産できないか、または生産できない可能性がある
•候補薬物は承認されても医師,患者,医学界あるいは第三者支払人に安全かつ有効である可能性がある。
私たちの財政と管理資源は限られているので、私たちは他の候補薬を探す機会を放棄したり、延期したり、後により大きな市場潜在力を持つ他の適応を証明する機会を遅らせるかもしれない。私たちの資源分配決定は私たちが実行可能な商業薬や利益のある市場機会を利用できないかもしれない。特定の候補薬剤の商業的潜在力や目標市場を正確に評価していなければ、協力、許可、または他の特許権使用料の手配によって、候補薬剤に貴重な権利を放棄する可能性があり、この場合、候補薬剤の独占的開発および商業化権利を保持することがより有利になる。
もし私たちがより多くの候補薬を識別して開発することができなければ、あるいはそれができなければ、私たちの重要な成長戦略と業務は損なわれるだろう。
臨床試験で患者を登録と保留することは高価で時間のかかる過程であり、私たちがコントロールできない多種の要素によってより困難あるいは不可能になる可能性がある。
患者を確定し、著者らの臨床試験に参加する資格を持たせることは著者らの成功のキーポイントである。我々が追跡しているてんかん関連疾患やまれな神経疾患の患者数は少なく,正確な決定は得られていない。もしこれらの疾患の実際の患者数が予想より少ない場合、私たちは患者を募集して臨床試験に参加する時に困難に直面する可能性があり、それによって私たちの候補薬物の開発と承認を延期または阻止する。一度登録しても、私たちは私たちのどんな実験も完了するのに十分な数の患者を維持できないかもしれない。患者の臨床試験における登録と保留は多くの要素に依存し、患者群の大きさ、試験方案の性質、既存の安全性と有効性データ、同一適応の競争療法と行われている競争療法の臨床試験の数と性質、患者と臨床場所との距離および試験の資格基準を含み、このような登録問題はいずれの登録問題も著者らの候補薬物の開発と承認が延期または阻止される可能性がある。著者らはてんかんに関連する疾患と稀な神経疾患の解決に集中しているため、選択できる患者の数は限られており、適時かつ費用効果のある方法で著者らの臨床試験を完成した。また,患者コミュニティとの関係構築努力は成功しない可能性があり,われわれの臨床試験における患者登録の遅延を招く可能性がある。さらに、候補薬剤の臨床試験で報告された任意の負の結果は、同じ候補薬剤の他の臨床試験において患者を募集し、維持することを困難または不可能にする可能性がある。計画中の患者登録または保留の遅延または失敗は、コスト増加、計画遅延、または両方をもたらす可能性がある, これは,我々が候補薬物を開発する能力に有害な影響を与える可能性があり,あるいはさらなる開発が不可能になる可能性がある。
私たちの候補薬物は不良副作用あるいは他の特性を招く可能性があり、その規制承認を延期または阻止し、商業潜在力を制限し、あるいは任意の潜在的な上場承認後に重大な負の結果を招く可能性がある。
臨床試験を行っている間、患者は病気、傷害、不快感を含む彼らの健康変化を彼らの医師に報告した。通常,研究中の候補薬がこれらの状況を招いているかどうかを決定することは不可能である。規制当局は異なる結論を出すかもしれないし、もしそれらが発生したら、これらの決定を確認するために追加的なテストを要求するかもしれない。さらに、より大きく、より長く、より広い臨床項目で候補薬剤を試験する場合、またはこれらの候補薬剤の使用がより広くなるにつれて(規制部門の承認を得た場合)、被験者は、早期試験で観察された疾患、傷害、不快感、および他の有害事象、および従来の試験では発生しなかったか、または検出されなかったことを報告する。多くの場合,研究薬が大規模な3期試験で試験された後,あるいは承認後に商業規模の薬物を患者に提供した後にのみ,副作用が検出される場合がある。例えば,われわれの従来の候補薬であるOV 101やSoticlestatのいくつかの臨床試験では有害事象が報告されている。臨床試験はVigabatrinに対してOV 329が眼部安全利益があることを証明しないかもしれない。もし臨床経験が、私たちの任意の候補薬物が不良事件または深刻または生命に危害を及ぼす有害事象を招く場合、その候補薬物の開発は失敗または遅延する可能性があり、あるいは、候補薬物が監督管理の承認を得た場合、承認を撤回する可能性があり、これは私たちの業務、将来性、経営業績、および財務状況を損なうことになる。
さらに、私たちが候補薬剤の任意の臨床試験を延期、一時停止、または終了することを選択または要求された場合、私たちの候補薬剤の商業的将来性は損なわれる可能性があり、販売によって収入を得る能力は延期またはキャンセルされる可能性がある。このようなどんな状況でも、私たちの業務、財政状況、そして見通しに大きな被害を及ぼす可能性がある。
さらに、私たちの任意の候補薬剤が発売承認された場合、FDAは、利益がそのリスクよりも大きいことを保証するために、ブラックボックス警告をラベルに含めるか、またはそのリスクよりも大きい利益を保証することを要求することができ、薬物が患者に配布されるリスクを概説する薬物ガイドラインおよびコミュニケーション計画を含むことができる
衛生保健従事者。さらに、もし私たちまたは他の人が後に私たちの候補薬が不良な副作用をもたらしたことを発見すれば、いくつかの潜在的な重大な負の結果をもたらす可能性がある
•規制部門は候補薬物の承認を一時停止または撤回することができる
•規制部門はラベルに警告を追加することを要求するかもしれない
•候補薬の投与方法を変更したり追加の臨床試験を行うことが求められるかもしれません
•私たちは起訴され、患者への傷害に責任を負うかもしれない
•リコールが必要かもしれません
•私たちの名声は損なわれるかもしれない。
これらの事件のいずれも、私たちの候補薬物に対する市場の受け入れを達成または維持することを阻止し、私たちの業務、将来性、財務状況、および運営結果を深刻に損なう可能性がある。
もし私たちの候補薬物の市場機会が私たちが思っているより小さいなら、候補薬が承認されたと仮定しても、私たちの業務は影響を受ける可能性がある。著者らの候補薬物市場での患者数は少ない可能性があり、評価が困難であるため、著者らは患者の識別に成功し、かなりの市場シェアを獲得しなければならず、利益と成長を実現することができる。
我々は,てんかん,てんかん関連疾患,まれな神経疾患の治療に関する研究と薬物開発に焦点を当てている。われわれの目標疾患を有する患者数が少ないことを考慮すると,われわれの条件に適合した患者数や定価は,候補薬の実際の市場とは大きく異なる可能性がある。これらの疾患を有する人数および候補薬物治療から利益を得る可能性のあるこれらの疾患患者のサブセットの予測は、私たちの信念と推定に基づいている。これらの推定は科学文献、患者基礎或いは市場研究を含む様々な源から来ており、不正確であることが証明されている可能性がある。また、新しい研究はこれらの疾病の推定発病率或いは流行率を変える可能性がある。患者数は予想より少ないかもしれない。同様に、私たちの各候補薬の潜在的にアドレス指定可能な患者集団は限られているかもしれないか、または私たちの候補薬物治療を受け入れられない可能性があり、新しい患者はますます識別または接触が困難になる可能性があり、これは私たちの運営結果および私たちの業務に悪影響を及ぼすだろう
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも前に、あるいは私たちよりも薬の開発や商業化に成功する可能性がある。
新薬の開発と商業化競争は激しい。私たちの現在の候補薬物は競争に直面しており、将来私たちは開発あるいは商業化を求める可能性のある他の候補薬物も世界各地の主要な製薬会社、専門製薬会社、バイオテクノロジー会社からの競争に直面する。現在,いくつかの大手製薬やバイオテクノロジー会社が薬物をマーケティング·販売しているか,あるいは我々が求めている適応を治療するための候補薬を開発している。潜在的な競争相手はまた学術機構、政府機関とその他の公共と個人研究組織を含み、これらの組織は研究を展開し、特許保護を求め、研究、開発、製造と商業化のための協力手配を確立する。
より成熟した会社は私たちより競争優位になるかもしれません。それらの規模、資源、そして機関の経験が大きいからです。特に、これらの会社は清算、政府契約、重要なオピニオンリーダーとの関係の確保、テストと臨床試験を行い、市場製品の監督許可と流通関係を獲得と維持し、マーケティング承認の薬品の面でより多くの経験と専門知識を持っている。これらの会社の研究とマーケティング能力も私たちよりずっと優れている。もし私たちが既存と潜在的な競争相手と効果的に競争できなければ、私たちの業務や財務状況は損なわれる可能性がある。
これらの要因により、私たちの競争相手は、私たちの前に規制機関から彼らの薬物の承認を受けるかもしれません。これは、私たちの候補薬物を開発または商業化する能力を制限するかもしれません。私たちの競争相手はまた私たちより安全で効果的で、広く受け入れられ、より安い治療法を開発するかもしれないし、彼らの薬物を製造してマーケティングする上で私たちよりも成功するかもしれない。これらの明らかな利点は、私たちの候補薬を時代遅れにしたり、これらの候補薬の開発と商業化費用を回収できる前に競争力を失うかもしれない。
製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。規模の小さい他の初期段階の会社も証明される可能性があります
重要な競争相手となり、特に大企業や老舗会社との協力で手配する。これらの第三者は合格した科学、管理と商業人員を募集と維持し、臨床試験場と臨床試験の被験者登録を確立し、著者らの計画と相補的或いは必要な技術を獲得する面で私たちと競争を展開している。
現在或いは未来の候補薬物が発売許可を得ても、それらは医者、患者、第三者支払人或いは医学界の他の人の市場受け入れを得ることができない可能性があり、これは商業成功に必要である。
私たちが現在或いは未来の候補薬物が発売許可を得ても、それらは医者、患者、第三者支払人と医学界の他の人の十分な市場受容度を得ることができないかもしれない。もし彼らが十分な受容度に達していなければ、私たちは大量の薬物収入を発生させないかもしれないし、利益を上げないかもしれない。現在または将来の候補薬に対する市場の受容度は、商業販売のために承認されれば、多くの要素に依存するが、これらに限定されない
•代替療法や治療法と比較した治療効果と潜在的優位性
•代替療法や治療法と比較して候補薬の安全性は
•販売とマーケティングの有効性
•患者コミュニティとの関係の力は
•任意の類似した非特許療法を含む代替療法および療法に関連する治療費用
•競争力のある価格でこのような薬を販売することができます
•代替療法や療法と比較して,投与の利便性と簡便性
•対象患者群が新たな療法を試みる意欲と,医師がこれらの治療法を処方する意欲
•有力なマーケティングと流通支援
•第三者保険と適切な補償を提供する
•どんな副作用の流行や重症度も
•この薬を他の薬と一緒に使用するためのいかなる制限もない。
私たちが医師、患者、第三者支払人、医学界の他の人に私たちの候補薬物のメリットを理解するように教育する努力は大量の資源を必要とするかもしれないし、永遠に成功しないかもしれない。私たちの候補薬物の複雑さと独自性のため、このような努力は通常よりも多くの資源を必要とするかもしれない。私たちの候補薬が承認されれば、販売は予測可能な未来にほとんどの薬物収入を生むと予想されているので、もし私たちの薬が市場の受け入れを得られなければ、私たちの業務を損なうことになり、追加の融資を求める必要があるかもしれない。
私たちが現在または未来の候補薬に対するFDAの承認を得て維持しても、私たちは決してアメリカ以外の地域の私たちの現在または未来の候補薬の承認を得ないかもしれません。これは私たちの市場機会を制限し、私たちの業務を損なう可能性があります。
米国では、FDAが候補薬剤を承認することは、その候補薬剤が他の国または司法管轄区の規制機関の承認を得ることを保証することはできず、外国規制機関の承認も、他国の規制機関またはFDAの承認を確保することができない。私たちの現在と未来の候補薬物のアメリカ以外での販売は臨床試験と上場承認に関する外国の監督管理要求の制約を受ける。FDAが候補薬物の発売を承認しても,外国の比較可能な規制機関は候補薬物のこれらの国での製造とマーケティングを承認しなければならない。審査手続きは司法管轄区域によって異なり、アメリカの要求と行政審査期限とは異なる可能性があり、しかもアメリカの要求と行政審査期限よりも煩雑であり、後者は追加の臨床前研究或いは臨床試験が必要である可能性がある。米国以外の多くの国では,候補薬物は精算承認を得なければならず,その国での販売が許可されている。場合によっては、私たちは任意の候補薬に対して価格を徴収する予定であり、承認されれば、承認も必要だ。欧州医薬品局の意見によると、欧州委員会の現在と将来のEUにおける候補薬物の承認を得て、もし私たちがそこで上場許可申請を提出することを選択すれば、長くて高価な過程になるだろう。FDAと類似の外国の監督管理機関はこの薬物が発売される可能性のある適応を制限する権利があり、薬物ラベルに広範な警告を貼り付けること、あるいは高価で時間のかかる追加の臨床試験或いは報告を承認条件として要求することを要求する。外国の情報を得る
規制の承認と外国の監督管理要求の遵守は、私たちに重大な遅延、困難、コストをもたらす可能性があり、いくつかの国と地域での現在と未来の候補薬の発売を延期または阻止する可能性がある。場合によっては、私たちは、影響を受けている国/地域で私たちの製品を商業化する能力を遅延または阻害する可能性がある第三者に依存して、このような外国の規制承認を得ることができます。
また、一国で行われた臨床試験は、他の国の規制機関に受け入れられない可能性がある。しかも、私たちの候補薬物の規制承認は撤回されるかもしれない。もし私たちが規制要求を守らなければ、私たちの目標市場は減少し、私たちが現在と未来の候補薬物の完全な市場潜在力を達成する能力は損なわれ、私たちの業務、財務状況、運営結果、将来性は損なわれるかもしれない。
私たちが現在または未来の候補薬をアメリカ以外の場所で商業化することを承認することを求めれば、国際業務に関連する様々なリスクが私たちの業務を損なう可能性がある。
もし私たちが現在または未来にアメリカ以外の候補薬を承認することを求めるなら、私たちは商業化の面で追加のリスクに直面することが予想されます
•外国の治療承認に対する様々な規制要求;
•知的財産権の保護を減らすことです
•国際司法管轄区で追加臨床研究を行う潜在的な要求
•関税、貿易障壁、規制要求の意外な変化
•インフレ、特に外国経済と市場の政治的不安定を含む経済的疲弊
•外国に住んだり旅行したりする従業員は税収、雇用、移民、労働法を遵守する
•外国為替変動は、営業費用の増加と収入の減少、他の国での業務展開に付随する他の義務を招く可能性がある
•海外清算、定価、保険制度
•労働騒乱がアメリカよりも一般的な国では労働力の不確実性
•海外の原材料の供給や製造能力に影響を与える事件による生産不足;
•戦争や敵対行動が来る可能性がある(ロシアとウクライナの間で行われている戦争のような)、テロ、自然災害、または公衆衛生危機を含む地政学的行動による業務中断。
私たちは以前このような分野で経験がなかった。また、ヨーロッパ内外の多くの国は複雑な規制、税金、労働者、その他の法律要求を提出しており、私たちはこれらの要求を遵守する必要がある。多くのバイオ製薬会社は、海外で自分の製品を売り込む過程が非常に挑戦的であることを発見した。
私たちに対する製品責任訴訟は、私たちが大きな責任を負うことを招き、私たちが開発する可能性のある任意の候補薬物の商業化を制限する可能性があります。
私たちは臨床試験において、現在と未来の候補薬物のテストに関連する固有の製品責任リスクに直面しており、もし私たちが開発する可能性のある任意の候補薬物を商業化すれば、私たちはより大きなリスクに直面するかもしれない。もし私たちが自分自身を弁護することに成功できなければ、このような候補薬物による傷害の疑いに反対すれば、私たちは重大な責任を招くかもしれない。是非曲直や最終結果にかかわらず、賠償責任は
•開発可能な候補薬の需要を減らすことができます
•収入損失
•実験参加者や患者に多額の報酬を与え
•関連訴訟を弁護するための重要な時間と費用
•臨床試験参加者の脱退
•私たちが開発可能な候補薬を商業化することはできません
•私たちの名声とメディアの深刻な否定的な関心を害した。
私たちは製品責任保険範囲を維持していますが、この保険は私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれません。私たちは臨床試験を始めるたびに、どの候補薬を商業化することに成功すれば、私たちの保険範囲を増やす必要があると予想しています。保険範囲はますます高くなっています。私たちは可能などんな責任にも対応するために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。
許可や連携手配に関するリスク
RLTプロトコルにより,soticlestatの開発と商業化に関する特許使用料とマイルストーン支払いを得る権利がある.武田が進展しなかったり、Soticlestatの開発を停止したりしなければ、このような支払いの一部または全部を受け取ることができない可能性があり、私たちの業務に実質的な損害を与えることになります。
2021年3月、武田は武田から最初に獲得した許可であるSoticlestatの世界シェア50%の権利を獲得し、関連知的財産権に基づいて武田にグローバル独占許可を付与し、発育·てんかん脳症(Dravet症候群およびLennox−Gastaut症候群を含む)の治療のための研究薬Soticlestatを開発·商業化した。Soticlestatのすべての権利は現在武田が所有しているか、または私たちが独占的に武田に権限を与えています。RLTプロトコル終了後、武田はSoticlestatの開発·商業化のすべての責任とコストを負担し、マイルストーン支払いや将来の開発·商業化コストを含む元の協力協定に基づいて武田に対していかなる財務義務も負うことはなくなった。RLT合意完了後、1.96億ドルの一括払いを受け取り、Soticlestatが開発に成功すれば、武田が特定の規制·販売マイルストーンを実現した後に6億6千万ドルを追加する資格がある。また、soticlestatが規制部門の承認を受けた場合、私たちは低い2桁からsoticlestatの20%までの等級別印税を得る権利があるだろう。当該製品が同国で初商業販売された日から当該製品が当該国の特許権満了日及び初商業販売の指定周年日までの期間内に、国及び製品毎に使用料を支払う。
RLTプロトコルの条項によると,武田は現在Soticlestatの開発と商業化に対して唯一の裁量権を持っている.武田が何らかの理由で進展しなかった場合や,RLTプロトコルで想定されているSoticlestatの開発を終了することを選択したり,Soticlestatの開発や商業化が武田に延期されたり奪われたりした場合,そのプロトコルの下の特許使用料の一部または全部のマイルストーン支払いを受けることができない可能性がある.武田のような開発の進展とそれによる支払いに依存して、現在と将来の候補薬の規制開発を支援しています。もし私たちが他の収入源を見つけることができなければ、私たちはRLTプロトコルに従って特許使用料やマイルストーン支払いを受け取ることができず、私たちの業務と運営結果にマイナスの影響を与えるだろう。
候補薬物の許可或いは獲得に関連するリスクは著者らの候補薬物の臨床前と臨床開発過程における重大な遅延を招く可能性がある。
私たちが引き続き私たちのルートを構築することに伴い、私たちは以前にすでに獲得して、私たちは未来に臨床前あるいは臨床開発に応用できるかもしれない候補薬物を獲得するかもしれない。第三者とのこのような手配は、私たちに、勤勉、開発と商業化義務、マイルストーン支払い、特許権使用料支払い、賠償、その他の義務を課すことができるかもしれません。私たちの許可側にマイルストーン、特許使用料、その他のお金を支払う義務は巨大である可能性があり、これらの支払いの金額と時間は候補薬物の開発と商業化を推進する能力に影響を与える可能性がある。私たちが許可された知的財産権を使用する権利は、任意のこのような合意条項の継続と遵守によって制約される可能性がある。さらに、私たちは、私たちまたは第三者から取得された知的財産権を付与する権利について議論する可能性がありますが、これらに限定されない
•任意の許可または他のプロトコルに含まれる知的財産権の範囲と、その許可または他のプロトコルの下で付与される権利と;
•このようなプロトコルに従って特許および他の権利を再許可する;
•すべての許可協定の下での私たちの義務を守る
•私たちが独自にまたはライセンス者および協力者と知的財産権を創造または使用することによって生成された発明およびノウハウの所有権;
•私たちの支払い義務の範囲と期限、そして私たちが滞納された時にこのようなお金を支払う能力
•私たちは第三者から追加の知的財産権を得る必要があり、これはこのような合意に従って支払われるべきお金に影響を与える可能性がある
•私たちはこのような合意の権利を終了することを許可します
•この合意の終了時の私たちの権利と義務;
•合意当事者の排他的義務の範囲と期限。
我々が第三者から許可または取得したか、または将来可能な許可または取得された知的財産権および他の権利の論争は、許容可能な条項で任意のこのような配置を維持する能力を阻止または弱める可能性があり、我々の臨床前研究および臨床試験の開始または完了遅延をもたらし、影響を受ける候補薬剤の開発および商業化に成功する能力に影響を与える可能性がある。もし私たちが将来のいかなる許可プロトコルでの義務を履行できなかった場合、これらの合意は終了されるかもしれないし、あるいはこれらのプロトコルの下での私たちの権利範囲は縮小される可能性があり、私たちはこれらのプロトコルによって許可された任意の製品を開発、製造、または販売できないかもしれない。
私たちは私たちの候補薬物の開発と商業化の重要な権利と制御権を未来の協力者に譲ることを要求されるかもしれない。
私たちの現在と未来の協力は私たちを多くのリスクに直面させるかもしれない
•私たちは多くの業務、財政、そして管理資源の支出を負担する必要があるかもしれない
•私たちは株主の所有権パーセントを希釈する株式証券の発行を要求されるかもしれない
•私たちは相当な実際的または負債を負担することを要求されるかもしれない
•私たちの戦略的パートナーが候補薬の開発や商業化に投入される資源の数とタイミングをコントロールできないかもしれません
•戦略協力者は臨床試験を延期し、不足した資金を提供し、臨床試験を中止したり、候補薬物を放棄したり、新しい臨床試験を繰り返したり、あるいは新しいバージョンの候補薬物に臨床試験を要求することができる
•戦略パートナーは、戦略協力計画による製品のさらなる開発と商業化を行ってはならない、あるいは研究開発計画を停止することを選択することができる
•戦略協力者は候補薬をマーケティングして流通させるのに十分な資源を投入していないかもしれませんこれらの製品から得られる潜在的な収入を制限しています
•私たちは現在の協力者に依存して薬品と薬品を生産して、未来の協力者はそうするかもしれません。これは紛争や遅延を招く可能性があります
•私たちと私たちの戦略パートナーとの間で紛争が発生し、候補薬剤の研究、開発または商業化の遅延または終了、または高価な訴訟や仲裁を招き、経営陣の注意を分散させ、資源を消費する可能性がある
•私たちと現在または未来のパートナーとの間には、私たちが参加する可能性のある任意の協力、許可、または他のビジネス開発計画を終了することによって紛争が生じる可能性があります
•戦略的パートナーは財務的な困難に直面するかもしれない
•戦略的パートナーは、私たちの知的財産権を正確に維持したり、守ったりすることができないかもしれないし、私たちの固有の情報を危険にさらしたり、無効にしたり、潜在的な訴訟に直面させる可能性がある方法で私たちの固有の情報を使用する可能性があります
•業務合併または戦略協力者の業務戦略の重大な変化はまた、戦略協力者が任意の手配の下でその義務を履行する意志または能力に悪影響を及ぼす可能性がある
•戦略協力者は、独立するか、または我々の競争相手を含む他の人と協力して競争相手の候補薬を開発することを決定することができる
•戦略的パートナーはこの計画を終了したり、期限を許可したりする可能性があり、これは開発を延期し、候補薬物の開発コストを増加させる可能性がある。
もし私たちが将来の買収や戦略協力に従事すれば、これは私たちの資本要求を増加させ、私たちの株主を希釈し、私たちに債務を発生させたり、負債を負担したり、他のリスクに直面させたりする可能性がある。
私たちの業務計画は、薬物、知的財産権、技術、または業務の許可または買収を含む様々な買収と戦略的パートナーシップを評価し続けることです。潜在的な買収や戦略的パートナーシップは、多くのリスクをもたらす可能性がある
•業務費と現金需要が増加した
•追加の債務や負債を負担しています
•買収された会社の業務、知的財産権、薬品を吸収し、新しい人員の統合に関する困難を含む
•私たちの経営陣の関心を既存の薬物計画とこのような戦略的パートナーシップ、合併または買収を求めるイニシアチブから移してください
•重要な従業員の保留、キーパーソンの流出、そして私たちがキー業務関係を維持する能力の不確実性
•そのような取引の他方に関連するリスクおよび不確実性は、その当事者およびその既存の薬剤または候補薬剤の将来性および規制承認を含む
•取得した技術および/または薬から十分な収入を得ることができず、買収の目標を達成することができず、関連する買収や維持コストを相殺することもできない
•買収された企業を統合したり、一般的な戦略取引の利益を達成したりすることに関する課題;
•潜在的な国際買収取引に関連するリスクは、私たちが現在実質的に存在していない国を含む。
また、将来の買収や戦略協力に従事すれば、希釈証券を発行し、債務を負担または発生させ、巨額の使い捨て費用を発生させ、重大な将来の償却費用を招く可能性のある無形資産を買収する可能性がある。さらに、適切な買収機会を見つけることができない可能性があり、このような私たちの業務発展に重要な技術や薬物を得ることができない能力は、私たちの能力を弱める可能性があります。
私たちは絶対に達成されたり失敗したりしない他の戦略的協力を探るかもしれない。
私たちのビジネス戦略は、てんかん、てんかん関連疾患、およびまれな神経疾患に対する化合物の取得または許可に基づいている。したがって,より多くの候補薬剤や資源を得るために,様々な可能な追加戦略協力を定期的に探索する予定である。現在、私たちはこのような戦略的協力がどのような形を取る可能性があるのか予測できない。適切な戦略的パートナーを探す上で、私たちは激しい競争に直面する可能性があり、戦略協力の交渉と記録は複雑で時間がかかる可能性がある。私たちは受け入れ可能な条件で戦略的協力を交渉することができないかもしれないし、根本的にできないかもしれない。私たちは、これらの協力の確立に関連する多くのリスクと不確実性のため、いつ(もしあれば)私たちが追加的な戦略的協力に参加するか予測できない。また,我々の業務開発活動や研究活動は,てんかんやてんかん関連疾患以外に魅力的な機会を提供する可能性があり,会社や我々の株主の最良の利益に合致すると考えられる他の疾患や疾患を含む他の興味のある分野で候補薬を求めることを選択する可能性がある。我々は,我々の戦略を検討し,我々が求めている魅力的な興味や資産分野を選択して必要な修正を行う予定である.
コンプライアンスに関するリスク
私たちと顧客、医者、第三者支払者との関係は、連邦と州の医療詐欺と乱用法律、虚偽クレーム法律、健康情報プライバシーと安全法律、その他の法律の制約を直接または間接的に受ける可能性があります
医療法律法規です。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。
米国や他の地域の医療提供者や第三者支払者は,我々が上場承認を得た任意の候補薬の推薦や処方において主な役割を果たすであろう。私たちの現在と未来の医療専門家、主要な調査者、コンサルタント、顧客、および第三者支払者の手配は、連邦反バックル法規、連邦民事と刑事虚偽クレーム法律、および一般的に医師支払い陽光法案と法規と呼ばれる法律を含む、様々な連邦および州詐欺と乱用法律および他の医療保健法律の制約を受ける可能性がある。これらの法律は私たちの臨床研究、提案された販売、マーケティングと教育計画などに影響を与えるだろう。さらに、私たちは連邦政府と私たちが業務を展開したり、業務を展開する可能性のある州の患者プライバシー法の制約を受けるかもしれない。私たちの運営に影響を与える法律は含まれているが、これらに限定されない
•連邦反リベート法規は、個人または実体が直接または間接的に、現金または実物で直接または間接的に、公開的または隠蔽的に請求、受信、提供、または任意の報酬(任意のリベート、賄賂またはリベートを含む)を請求、推薦、レンタル、または提供することを禁止し、連邦医療保険および医療補助計画のような連邦医療計画下で精算可能な物品またはサービスを提供する。この法規は,一方が薬品メーカーである一方で,処方者,購入者,処方管理人の間の手配に適用されると解釈されている。“保健·教育和解法案”(総称して“PPACA”と呼ぶ)改正された“患者保護·平価医療法案”は連邦“反リベート法令”の意図要求を改正した。個人またはエンティティは、この法規または法規に違反する具体的な意図を実際に理解する必要がなく、違反を実施することができる
•連邦民事および刑事虚偽精算法は、“虚偽精算法”および民事金銭罰法を含むが、これらに限定されず、他の事項に加えて、個人または実体が虚偽または詐欺的な連邦医療保険、医療補助または他の政府支払者の支払いまたは承認クレームの提出を意図的に、または隠蔽することを禁止し、または虚偽陳述によって連邦政府に金銭を支払う義務を回避、減少または隠蔽することを禁止する。PACAの規定によると、最近の薬品と医療機器メーカーの政府案件に対する支持の観点は、連邦反リベート法規の違反といくつかのマーケティングやり方は、ラベル外販売促進を含み、虚偽クレーム法案に関連している可能性がある
•1996年の連邦“健康保険移行性と責任法案”(“HIPAA”)は、支払い人が誰であろうと(例えば、公共または個人のような)任意の医療福祉計画をだますために、誰が意図的かつ意図的に計画を実行したり、虚偽または詐欺的な陳述をしたりすることを禁止する追加の連邦刑事法規を制定した
•HIPAAは、“健康情報技術促進経済と臨床健康法”(“HITECH”)及びその実施条例を改正し、HIPAA最終総合規則の再改正を経て、HITECHと“遺伝情報非差別法”に基づいてHIPAAのプライバシー、安全、実行と通知規則の違反を修正した。HIPAAの他の修正は、2013年1月に発表され、健康計画、医療情報交換所、および特定のヘルスケア提供者のようなルールに拘束されたエンティティは、カバーエンティティと呼ばれ、カバーエンティティに代わって特定のサービスを実行する個人またはエンティティを代表して、個人識別可能な健康情報およびその使用、開示、または他の方法で個人識別可能な健康情報を使用または開示することに関連する下請け業者であり、適切な許可なしに、個人識別可能な健康情報のプライバシー、セキュリティ、および送信に何らかの要求を加える
•“医師支払い陽光法案”は、いくつかの薬品、器具、生物製品、および医療用品の製造業者が、(I)医師(医師、歯科、検眼師、足科医師および脊医を含む)、いくつかの他の医療専門家(例えば、医師アシスタントおよび勤務看護師)および教育病院への費用または他の“価値移転”を定義することに関する情報を医療保険および医療補助サービスセンター(CMS)に毎年報告することを要求するPACAの一部である。(2)医師及びその直系親族が保有する所有権及び投資権益
•州と外国の法律は上記のすべての連邦法律、州法律に相当し、これらの法律はメーカーに医師や他の医療従事者への支払いや他の価値移転に関する情報の報告を要求する
サプライヤーまたはマーケティング支出および/または薬品定価に関する情報、州法律は、製薬会社が製薬業界の自発的コンプライアンスガイドラインおよび連邦政府が公布した関連コンプライアンスガイドラインを遵守すること、または州法律法規に規定されたコンプライアンス計画を採用すること、または他の方法で医療保健提供者への費用の支払いを制限することを要求し、州法律法規は、医薬品メーカーに薬品定価およびマーケティング情報に関する報告を提出することを要求し、州および地方の法律は医薬品販売代表登録を要求する;
•健康情報のプライバシーや安全を管理する国や外国の法律がある場合もあり、その多くの法律は互いに大きく異なり、HIPAAに先を越されず、コンプライアンス作業を複雑化させることが多い。
これらの法律の広汎性、および既存の法定例外状況と安全港の規制の狭さのため、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。
政府当局は、私たちの業務実践が現在または未来に適用される詐欺および乱用または他の医療保健法律および法規に関連する現行または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの運営がこれらの法律または任意の他の私たちに適用される可能性のあるすべての政府法規に違反していることが発見された場合、私たちは重大な民事、刑事と行政処罰、損害賠償、罰金、返還、監禁、MedicareおよびMedicaidなどの政府援助に参加する医療計画から除外され、追加の報告要求および監督に直面する可能性があり、もし私たちが会社の誠実な合意または同様の合意の制約を受けて、これらの法律違反に関する告発を解決し、私たちの業務を削減または再構築することができる。
私たちはこれらの法律に違反するリスクが増加していることが発見された。その多くの法律は規制部門や裁判所の十分な説明を受けておらず、それらの条項は様々な解釈ができるからだ。私たちが第三者の業務配置と適用される医療法律や法規に適合するように努力することは、多くのコストに関連することを確実にします。これらの法律に違反して私たちにとった行動は、たとえ私たちが弁護に成功しても、巨額の法的費用を招き、私たちの経営陣の業務運営への注意をそらす可能性があります。持続的に変化するコンプライアンス環境、および異なるコンプライアンスおよび/または報告要件を有する複数の司法管轄区域の必要性に適合するために、強力かつ拡張可能なシステムを確立し、維持することは、医療会社が1つまたは複数の要件と衝突する可能性を増加させる。
私たちの現在または未来の候補薬は保険と十分な精算を受けることができないかもしれません。これは承認されれば利益を得ることを難しくするかもしれません。
私たちが商業化している任意の候補薬物の市場受容度と販売量は、承認されれば、これらの薬物と関連治療の保険範囲と十分な補償は、政府衛生行政部門、医療組織の管理、その他の個人医療保険会社を含む第三者支払者から得られる。第三者支払人は彼らがどのような治療費用を支払い、精算レベルを確立するかを決定する。第三者支払者が自己の保険·精算政策を設定する際には,通常連邦医療保険引受政策と支払制限に依存する。しかし,我々が開発した任意の候補薬のカバー範囲や精算金額に関する決定は支払者ごとに行われる。第三者支払者は、1つの薬品に保険を提供することを決定し、他の支払者も当該薬品に保険及び適切な補償を提供することを保証することができない。また、第三者支払者が治療に保険を提供することを決定することは、十分な販売率を承認することを意味するものではない。各第三者支払者は,治療に保険を提供するかどうか,治療のためにメーカーにどの程度の金額を支払うか,その処方のどの層に置かれるかを決定する。第三者支払者の保険薬品リスト或いは処方リスト上の位置は通常、患者が治療を獲得するために支払うべき共通費用を決定し、患者と医者がこのような治療を採用することに強い影響を与える可能性がある。自分の病状に応じて処方治療を受けた患者やこのようなサービスを処方した提供者は,通常第三者支払者に依存してすべてまたは一部の関連医療費を精算する。患者は保険を提供しない限り、私たちの薬物を使用することはあまり不可能であり、私たちの薬物コストを支払うのに十分な部分を精算する。
アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。私たちが商業化したどんな薬も保険と精算を受けることができることを確実にすることはできません。もし精算できるなら、清算レベルはいくらですか。不十分な保険と精算は、私たちが発売許可を得た任意の薬物の需要や価格に影響を及ぼす可能性がある。カバー範囲や十分な精算がなければ,あるいは限られたレベルだけでは,現在および将来開発されている候補薬剤を商業化することに成功しない可能性がある。また、引受政策や第三者支払人の売出し率は随時変化する可能性がある
有利なカバーや精算状態が得られても、将来的にはあまり有利でないカバー政策や精算料率が実施される可能性がある。
医療立法改革措置は私たちの業務と運営結果に否定的な影響を及ぼすかもしれない。
米国や一部の外国司法管轄地域では、医療システムに関するいくつかの立法や規制の変化や提案された変化が継続されており、これらの変化は、候補薬物の上場承認を阻止または延期し、承認後の活動を制限または規範化し、上場承認された候補薬物を収益的に販売する能力に影響を与える可能性がある。
米国や他の地方の政策立案者や支払者の中で,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上および/または参入拡大を既定の目標としている。米国では、製薬業はこれらの努力の重点であり、重大な立法計画の大きな影響を受けてきた。2010年3月,PACAが採択され,政府や民間保険会社が医療保険に融資する方式を大きく変更し,米国製薬業に大きな影響を与えた。
PACAのいくつかの側面は行政、司法、国会、行政から挑戦されている。例えば、トランプ総裁は、PPACAのいくつかの条項の実施を延期したり、PPACAに規定されているいくつかの医療保険要求を回避するための行政命令および他の命令に署名した。同時に、国会はPACAの全部または一部を廃止または廃止し、代替する立法を審議した。国会はまだ全面的な廃止立法を通過していないが、PPACAが医療保険を購入する個人の許可を遵守していないため、PPACAの一部の条項を改正するための法律を制定している。PPACAが医療保険を購入する個人権限を遵守していないため、PPACAの規定されたいくつかの費用の実行を延期し、Medicare D部分に参加する製薬業者が不足している販売時点割引を増加させる。2021年6月17日、米国最高裁は手続き理由に基づく挑戦を却下し、PPACAは国会が廃止したため全体的に違憲であると弁明した。また、バイデン政府のいくつかの医療改革措置はPACAに影響を与えた。例えば、2022年8月16日、総裁·バイデンは、2022年の“インフレ低減法案”(IRA)に署名し、法律にした, PACA市場で医療保険を購入した個人への増強補助金を2025年に延長する。2025年からアイルランド共和軍は,受益者の最大自己負担コストの著しい低減と新たなメーカー割引計画の作成により,連邦医療保険D部分計画下の“ドーナツ脆弱性”を解消した。PPACAは未来に司法や国会で挑戦される可能性がある。このような挑戦とバイデン政府の医療改革措置がPPACAと著者らの業務にどのように影響するかはまだ不明である。
PACAが公布されて以来、他の立法改正も提案され、採択された。これらの変化には、2013年に開始された2011年予算制御法に基づいて、提供者に支払われる医療保険支払いが前期当たり合計2%減少することが含まれており、その後の法規の立法改正により、追加の国会行動がとられない限り、2031年まで有効となる。現在の立法によると、医療保険支出の実際の減少幅は2022年の1%から本自動減額の最終年度の4%まで様々になる。2012年の“米国納税者救済法”は,病院や癌治療センターを含むいくつかの医療サービス提供者に支払う医療保険費用をさらに減少させ,政府が医療サービス提供者に多額の金を取り戻す訴訟時効を3年から5年に延長した。
我々の業務に影響を与える可能性のある他の変化は、2015年の“連邦医療保険アクセスとチップ再許可法案”(“MACRA”)に基づいて医師の業績計画に連邦医療保険を支払うなど、新しい計画の拡張を含む可能性があり、この法案は法定処方の使用を終了し、品質支払い計画とも呼ばれる品質支払い計画を確立した。2019年11月、CMSは最終ルールを発表し、最終的に品質支払い計画の変化を決定した。現在、品質支払い計画の導入が全体の医師精算に与える全面的な影響はまだ不明である。
そのほか、政府は最近薬品メーカーがその上場製品に価格を設定する方式に対して更に厳格な審査を行い、いくつかの大統領行政命令、国会調査を招き、連邦と州立法を提出し、公布し、製品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府の薬品に対する計画精算方法を改革することを目的とした。連邦レベルでは、2021年7月、バイデン政府は“米国経済における競争を促進する”という行政命令を発表し、その中には処方薬に対する条項が複数ある。バイデン行政命令への対応として、2021年9月9日、アメリカ衛生·公衆サービス部(HHS)は高薬価に対応する総合計画を発表し、その中で薬品定価改革の原則を概説し、国会が取る可能性のある各種の潜在立法政策及び潜在的な行政行動を示した
衛生と公共サービス部はこのような原則を推進するための措置を取ることができる。また、アイルランド共和軍は他の事項を除いて、(I)連邦医療保険(Medicare)がカバーするいくつかの高支出、単一由来の薬物と生物製品の価格について衛生·公衆サービス部に交渉し、(Ii)連邦医療保険B部分とD部分にリベートを徴収し、インフレを超える価格上昇を処罰するよう指示した。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。また、バイデン政府は2022年10月14日に追加の行政命令を発表し、HHS報告書がどのように連邦医療保険と医療補助革新センターをさらに利用して連邦医療保険と医療補助受益者の薬品コストを下げる新しいモデルをテストすることを指示した。州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品参入の制限、およびマーケティングコスト開示および透明性措置を含む価格または患者の精算制限、割引、およびマーケティングコスト開示および透明性措置を含む薬品および生物製品の定価を制御するための法規をますます多く通過および実施しており、場合によっては、他の国からの輸入および大量購入を奨励することを目的としている。これらの措置や将来講じられる可能性のある他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受けた任意の承認された薬物の価格に追加的な下振れ圧力をもたらす可能性があると予想される。例えば、最近の行政命令によると、バイデン政府は薬品価格を下げるために何らかの政策措置をとるつもりだと表明した。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの薬物の商業化を阻止するかもしれない。
私たちは私たちの候補薬物の孤立した薬物名や排他性を獲得または維持することができないかもしれないが、これは私たちの候補薬物の潜在的な収益性を制限するかもしれない。
米国を含むいくつかの管轄区域の規制機関は、患者数が相対的に少ない薬物を孤児薬に指定する可能性がある。1983年の“孤児薬物法案”によると、薬物がまれな疾患または疾患を治療するための薬剤である場合、FDAはこの薬剤を孤児薬として指定することができる。米国では、まれな疾患または疾患は、通常、患者数が20万人未満と定義されている。一般に、孤児の薬物名を有する薬物がその後、指定された適応の最初の発売許可を得た場合、その薬物は、限られた場合を除いて、適用される規制当局が同じ薬物の同じ適応の別の販売申請を承認することができないように、市場排他期を有する権利がある。小分子薬物の場合、FDAは、“同一の薬剤”を、同じ活性部分を含み、前記薬剤と同じ用途を有する薬剤として定義する。指定された孤児薬物が孤児が指定された適応よりも広い用途で承認された場合,孤児薬物の排他性を得ることはできない。
孤児の薬物名を得ることは私たちのビジネス戦略に重要だ;しかし、孤児の薬物名を得ることは困難かもしれないし、私たちはこれに成功できないかもしれない。私たちが候補薬物のために孤児薬物指定を受けても、私たちは孤児の排他性を獲得しない可能性があり、この排他性は同じ場合の異なる薬物の競争から効果的に保護できない可能性があり、異なる薬物は排他的な間に承認される可能性がある。さらに、孤児薬物が承認された後、FDAが、後の薬剤がより安全で、より効果的であることが証明され、または患者ケアに重大な貢献を果たしたと結論した場合、FDAは、その後、同じ薬剤の別の同じ適応の申請を承認することができる。FDAが後に指定要求に重大な欠陥があると判断した場合、または製造業者がこのようなまれな疾患または疾患を有する患者の需要を満たすのに十分な量の薬剤を保証できない場合、孤児薬の米国における独占営業権も失われる可能性がある。私たちが開発する可能性のある任意の候補薬のための孤立した薬物指定を得ることができず、適用期間中にその指定を維持することができなかったり、孤立薬物の排他性を得ることができなかったり、適用候補薬の十分な販売を低下させて、私たちの開発によって生じる費用をバランスさせる能力を低下させる可能性があり、これは私たちの運営業績や財務状況に悪影響を及ぼすだろう。
私たちの現在または未来の候補薬が規制部門の承認を受けても、それらは持続的な監督によって監視されるだろう。
現在または未来の候補薬物に対して任意の規制許可を得ても、このような承認は、製造、ラベル、包装、貯蔵、広告、販売促進、サンプリング、記録保存、および安全および他の発売後の情報の提出に関する持続的な規制要件に制限される。現在または将来の候補薬物のために得られた任意の規制承認は、REMS、その薬剤が発売される可能性のある承認指示用途の制限または承認条件によって制限される可能性があり、または第4段階試験、および薬物の品質、安全性および有効性を監視することを含む、可能性の高い発売後試験への要求を含む可能性がある。
また、医薬品製造業者およびその施設は使用料を支払わなければならず、FDAおよび他の規制機関は、cGMP要件に適合しているかどうかを継続的に審査し、定期的に検査し、NDA、BLAまたは外国マーケティング申請で行われた約束を遵守しているかどうかを確認しなければならない。もし私たちまたは規制機関が以前に知られていない問題、例えば予想されていない重症度や頻度の不良事象、または薬物生産施設の問題を発見した場合、または規制機関が販売促進、マーケティング、またはラベル付けに同意しない場合
このような薬剤の場合、規制当局は、リコールを要求するか、または市場から薬剤を撤回するか、または生産を一時停止することを含む、薬剤、製造施設、または私たちに制限を加えることができる。
もし私たちが現在または未来の候補薬が承認された後、私たちは適用される規制要求を遵守できなければ、規制機関はできる
•私たちが法律に違反していると主張するタイトルのない手紙や警告状を出した
•禁令または行政、民事または刑事罰または罰金を求める
•規制承認の一時停止または撤回;
•進行中の臨床試験を一時停止します
•私たちまたは私たちの戦略パートナーが提出した未解決の機密協定または同様の海外マーケティング申請(またはその任意の追加)の承認を拒否する;
•薬の販売や生産を制限し
•医薬品を差し押さえたり、差し押さえたり、または他の方法で医薬品を市場から撤退させることを要求している者;
•候補薬物の輸入または輸出を拒否する;または
•政府契約を含めて私たちが供給契約を締結することを許可することを拒否する。
また、FDAは薬品の販売促進の可能性のある声明に対して厳格な監督管理を行った。特に、製品は、当該製品が承認されたラベルに反映されるように、FDA承認されていない用途に使用されてはならない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な民事,刑事,行政処罰を受ける可能性がある。
政府は違法の疑いのあるいかなる調査にも対応するために多くの時間と資源を必要とする可能性があり、否定的な宣伝が生じる可能性がある。上述した任意の事件または処罰が発生することは、現在または未来の候補薬物を商業化する能力を抑制し、私たちの業務、財務状況、運営結果、および将来性を損なう可能性がある。
さらに、FDAの政策および同等の外国規制機関の政策は変化する可能性があり、追加の政府法規が公布される可能性があり、薬品審査過程の変化や遅延を招く可能性があり、あるいは私たちの候補薬物の規制承認を一時停止または制限する可能性がある。米国や海外の将来の立法や行政行動によって生じる可能性のある政府規制の可能性、性質、程度を予測することはできない。もし私たちが既存の要求の変化に適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは規制コンプライアンスを維持できない場合、私たちは私たちが得る可能性のあるマーケティング承認を失う可能性があり、私たちは利益を達成したり維持することができないかもしれません。これは私たちの業務、財務状況、運営結果、将来性を損なうことになります
私たちの知的財産権に関するリスクは
現在または未来の候補薬剤のために特許保護を獲得し、維持することができない場合、または取得された特許保護範囲が十分に広くない場合、私たちは私たちの市場で効果的に競争することができないかもしれない。
我々は,特許,商業秘密保護,秘密保護プロトコルの組合せによって,我々の開発計画や候補薬物に関する知的財産権を保護している.私たちの成功は、私たちが現在および任意の未来の候補薬物に対する特許保護を獲得し、維持する能力に大きく依存している。我々は,現在および将来の開発計画や候補薬物に関連する特許出願を米国や海外に提出することで,我々の特許地位を保護することを求めている。特許起訴過程は高価で時間がかかり、私たちはすべての必要または望ましい特許出願を合理的なコストでまたはタイムリーに提出して起訴することができないかもしれない。
我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.私たちが所有しているまたは許可されている特許出願は、発行された特許を生成できない可能性があり、その声明は、現在または将来の米国または他の国/地域における候補薬剤をカバーしている。我々の特許および特許出願に関連するすべての潜在的に関連する既存技術が発見されていることは保証されず、これらの技術は、特許を無効にするか、または係属中の特許出願から特許が発行されることを阻止する可能性がある。たとえ特許が確実に発行されたとしても、これらの特許が私たちの現在または未来の候補薬をカバーしていても、第三者は彼らの
有効性、実行可能性、または範囲であり、これは、そのような特許が縮小され、無効であるか、または実行不可能であることをもたらす可能性がある。これらの特許または私たちが所有または許可してくれた任意の他の特許に対する成功的な反対は、任意の候補薬物または私たちが開発する可能性のある補助診断方法を商業化することに成功するために必要な権利を奪う可能性がある。また、規制承認に遅延が生じた場合、特許保護の下で候補薬や診断セットを販売する期間が短縮される可能性がある
もし私たちが私たちの開発計画や候補薬に関連する特許出願を持っているか、または許可されていない場合、それらの保護の広さや強度が脅かされている場合、または現在または任意の未来の候補薬に意味のある排他性を提供できなければ、会社が私たちと協力して候補薬を開発することを阻止し、将来の薬物を商業化する能力を脅かすかもしれない。どんなそのような結果も私たちの業務に否定的な影響を及ぼすかもしれない。
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。しかも、外国の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。例えば,欧州特許法は米国法よりも人体治療法に対する特許性制限が多い。科学文献中の発見発表は往々にして実際の発見より遅れており,米国や他の管轄区の特許出願は通常出願18カ月後に発表され,時にはまったく発表されないこともある.したがって、私たちは、私たちが所有または許可している特許または出願中の特許出願において最初に要求された発明であるか、またはそのような発明のための最初の特許保護であるかを正確に知ることができない。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの未解決および未来の特許出願は、私たちの技術または薬物の全部または一部を保護するために、または他社が競争相手の技術および薬物を商業化することを効果的に阻止するために、特許の発行を招くことができないかもしれない。米国や他の国の特許法や特許法解釈の変化は,我々の特許の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。
最近の特許改革立法は、私たちの特許出願をめぐる起訴や、私たちが発行した特許の実行または保護をめぐる不確実性とコストを増加させる可能性があります。2011年12月16日、“ライシー·スミス米国発明法”(略称“ライシー·スミス法案”)が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を及ぼす可能性もある。米国特許庁は最近、“ライシー·スミス法案”の管理を管理するための新たな法規やプログラムを制定し、“ライシー·スミス法案”に関連する特許法の多くの実質的な改正、特に最初の提出条項の改正は、2013年3月16日に発効した。したがって,Leahy-Smith法案が我々の業務運営にどのような影響を与えるかは不明である(もしあれば).しかし、Leahy-Smith法案とその実施は、私たちの特許出願をめぐる起訴と、私たちが発行した特許の実行または保護の不確実性とコストを増加させる可能性があり、これらのすべては私たちの業務と財務状況を損なう可能性がある。
さらに、我々は、第3の方向の米国特許商標局(“USPTO”)が既存技術の発行前に提出するか、または反対、派生、再審査、当事者間の審査、付与後審査または妨害訴訟に参加し、私たちの特許権または他の人の特許権に挑戦する可能性がある。このような提出、訴訟、または訴訟における不利な裁決は、私たちの特許権の範囲を縮小したり、無効にしたりして、第三者が私たちに支払うことなく、私たちの技術または薬物を商業化し、私たちと直接競争することを可能にしたり、第三者の特許権を侵害することなく薬物を製造または商業化することができなくなるかもしれません。さらに、私たちの特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、会社が私たちと協力して、現在または未来の候補薬剤の許可、開発、または商業化を阻止する可能性がある。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有し、許可している特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。任意のこのような挑戦において不利な裁決を下すことは、排他性喪失または特許主張の全部または部分的な縮小、無効、または実行不能をもたらす可能性があり、これは、他人が類似または同じ技術および薬物を使用することを阻止するか、またはそれを商業化する能力を制限するか、または我々の技術および薬物の特許保護期間を制限する可能性がある。しかも、特許の寿命は限られている。米国では,特許の自然失効期間は一般に非臨時特許出願が最初に提出された日から20年である。様々な延期があるかもしれない;しかし、特許の有効期限とその提供される保護は限られている。もし私たちが現在または未来の候補薬が特許保護を持っていなければ、私たちはそのような薬物からの模倣薬の競争に直面するかもしれない。新薬候補薬の開発、試験、規制審査に要する時間を考慮すると、これらの候補薬物を保護する特許は、これらの候補薬物の商業化前または直後に満了する可能性がある。したがって、私たちが持っている特許と許可された特許の組み合わせは、他の会社が私たちと類似または同じ薬物を商業化することを排除するために十分な権利を提供してくれないかもしれない。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
私たちが所有および許可する特許および/またはアプリケーション、ならびに私たちが将来所有または許可する可能性のある任意の特許権の有効期間内に、定期保守費、継続費、年金費用、および特許および/またはアプリケーションに関する様々な他の政府費用は、米国特許商標局および米国以外の様々な政府特許機関に支払われる。私たちは私たちの外部法律顧問や私たちの許可パートナーに依存して、これらの費用を非アメリカ特許機関に支払います。米国特許商標局および様々な非米国政府特許機関は、特許出願中にいくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。私たちは私たちの遵守を助けるために信用の良い法律事務所や他の専門家を招いて、私たちが許可を得た知的財産権に関するこれらの要求を守るために必要な行動をとることにも依存しています。多くの場合、不注意は、滞納金を支払うことによって、または規則を適用する他の方法によって救済することができる。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効される可能性があり、それにより、関連法ドメインの特許権の一部または全部が失われる可能性がある。この場合、潜在的な競争相手が市場に参入する可能性があり、この場合は私たちの業務を損なう可能性がある。
特許条項は候補薬物に対する私たちの競争地位を十分に長く保護するのに十分ではないかもしれない。
新薬候補薬の開発、試験、規制審査に要する時間を考慮すると、これらの候補薬物を保護する特許は、これらの候補薬物の商業化前または直後に満了する可能性がある。私たちはアメリカで特許期間の延長を求めたいと思っていますが、もしあれば、特許を起訴している他の国でも延長を求めます。米国では、1984年の“医薬品価格競争および特許期限回復法”は、特許期間が正常に満了した後に最大5年間の延長を許可するが、承認された適応(または延長期間に承認された任意の他の適応)に限定される。しかし、適用当局は、米国のFDAおよびUSPTO、および他の国/地域の任意の同等の規制機関を含み、このような延期が利用可能かどうかの評価に同意しない可能性があり、私たちの特許延期の承認を拒否するか、または私たちが要求したよりも限られた延期を承認する可能性がある。このような状況が発生すれば、私たちの競争相手は私たちの臨床と臨床前データを参考にすることで、私たちの開発と臨床試験への投資を利用し、他の場合よりも早く彼らの薬物を発売することができるかもしれない。
知的財産権は私たちの業務が直面しているすべての潜在的な脅威を解決できるとは限らない。
私たちの知的財産権の将来提供される保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できない可能性がある。以下の例は例示的である
•他の人は、私たちの候補薬物と同様の化合物または処方を製造することができるかもしれないが、もし彼らが私たちが所有または制御している任意の特許を発行した場合、これらの化合物または処方はいかなる特許要求の範囲内でもない
•私たちまたは任意の戦略的パートナーは、私たちが所有または制御している発表された特許または係属中の特許出願がカバーする最初の発明をした会社ではないかもしれない
•私たちは最初に特許出願を提出した人ではないかもしれません。これらの出願は私たちのいくつかの発明をカバーしています
•他の人は私たちの知的財産権を侵害することなく、類似または代替技術を開発したり、私たちの任意の技術を複製したりすることができる
•私たちが処理している特許出願は発行された特許を生成しない可能性がある
•私たちが所有または制御している発行された特許は、私たちにいかなる競争優位性を提供してくれないかもしれないし、法的挑戦のために無効または実行不可能と認定されるかもしれない
•私たちの競争相手は、米国や他の国で研究·開発活動を行い、特定の研究·開発活動に特許侵害疑惑からの避風港を提供し、特許権のない国で研究·開発活動を行い、これらの活動から得られた情報を利用して競争力のある薬物を開発し、私たちの主要な商業市場で販売する可能性がある
•私たちは他の特許を申請できるノウハウを開発しないかもしれない
•他の人たちの特許は私たちの業務に悪影響を及ぼすかもしれない。
我々が開発した大脳孤児疾患の潜在的な疾患関連生物経路の独自地図は特許保護に適していないため,我々はビジネス秘密に依存して我々の業務を保護している。
第三者は私たちが彼らの知的財産権を侵害したことを告発する法的訴訟を提起する可能性があり、その結果は不確定であり、私たちの業務成功にマイナスの影響を与える可能性がある。
私たちのビジネス成功は、私たちおよび私たちの現在または未来のパートナーが現在および未来の候補薬剤を開発、製造、マーケティング、および販売する能力にある程度依存し、第三者の固有の権利および知的財産権を侵害することなく、私たちの独自技術を使用する。バイオテクノロジーと製薬業界の特徴は特許と他の知的財産権に関する訴訟が広くて複雑だということだ。私たちは将来、妨害手続き、認可後の審査、USPTOへの当事者間審査を含む、私たちの現在および任意の未来の候補薬物および技術の知的財産権に関連する対抗手続きまたは訴訟に参加または脅かされる可能性がある。第三者は、既存の特許または将来付与される可能性のある特許に基づいて、その是非曲直にかかわらず、侵害請求を私たちに提起するかもしれない。第三者が彼らの特許権を強制的または他の方法で主張するために私たちと訴訟を行うことを選択する可能性があるリスクがある。このような主張に法的根拠がないと考えても,管轄権のある裁判所は,これらの第三者特許が有効で強制的かつ侵害されていると判断することができ,現在および将来の候補薬物を商業化する能力に悪影響を及ぼす可能性がある。連邦裁判所でこのような米国特許の有効性に挑戦することに成功するためには,有効性推定を克服する必要がある。この負担が重いため,このような米国特許主張の無効について明確で納得できる証拠を提出することが求められているため,管轄権のある裁判所がこのような米国特許の主張の無効を宣言する保証はない.もし第三者の効果的で実行可能な知的財産権の侵害が発見されたら, 私たちは第三者から許可証を取得して、私たちの候補薬物と技術を開発、製造、マーケティングし続ける必要があるかもしれない。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。私たちが許可を得ることができても、それは非排他的である可能性があり、私たちの競争相手や他の第三者が私たちに許可された同じ技術にアクセスできるようにするためには、大量の許可と印税を支払う必要があるかもしれない。私たちは裁判所の命令、開発、製造、商業化の権利侵害技術または候補薬物の開発を中止することを余儀なくされるかもしれない。さらに、私たちが特許や他の知的財産権を故意に侵害していることが発見された場合、私たちは3倍の損害賠償と弁護士費を含む金銭損害賠償責任を負われる可能性がある。侵害行為の発見は、私たちの現在または任意の未来の候補薬物の製造および商業化を阻止するか、または私たちに業務運営の一部または全部を停止させる可能性があり、これは私たちの業務に実質的な損害を与える可能性がある。第三者の機密情報や商業秘密を盗用したと主張することは、私たちの業務、財務状況、運営結果、将来性に類似した負の影響を与える可能性があります。より多くの情報については、“法的手続き”と題する本文の部分を参照されたい。
私たちは、私たちの従業員、コンサルタント、またはコンサルタントが、彼らの現在または前任雇用主たちのいわゆる商業機密を誤って使用または開示したと主張するか、または私たち自身の知的財産権を持っていると主張するかもしれない。
私たちの一部の従業員、コンサルタント、またはコンサルタントは、現在または以前、私たちの競争相手または潜在的な競争相手を含む大学または他のバイオテクノロジーまたは製薬会社に雇われている。私たちは、私たちの従業員、コンサルタント、およびコンサルタントが、私たちのために働いているときに他人の固有情報またはノウハウを使用しないことを保証するために努力しているが、私たちは、商業秘密または他の固有情報を含む任意のそのような個人の現職または前任雇用主の知的財産権を使用または開示していると告発される可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。
また、私たちの政策は、知的財産権の概念や開発に参加する可能性のある私たちの従業員と請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求しているにもかかわらず、実際に私たちが自分の知的財産権と見なしているすべての当事者とこのような合意を実行することができないかもしれない。知的財産権の譲渡は自動的に実行されない可能性があり、あるいは譲渡協定が違反される可能性があり、私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起する可能性のあるクレームを弁護したりすることができます。
私たちは私たちの特許、ライセンシーの特許、または私たちの他の知的財産権を保護または強制する訴訟に巻き込まれるかもしれません。これは高価で、時間がかかり、成功しないかもしれません。
競争相手は私たちの特許、私たちの許可側の特許、または私たちの他の知的財産権を侵害または他の方法で侵害する可能性がある。権利侵害や不正使用に対抗するために、私たちは高価で時間がかかるかもしれない法的請求を要求されるかもしれない。さらに、侵害訴訟では、裁判所は、私たちまたは私たちのライセンシーの特許が無効であるか、または強制的に実行できないと判断することができ、または、私たちの特許が関連技術をカバーしないことを理由に、他方の関連技術の使用を阻止することを拒否することができる。任意の訴訟または弁護手続における不利な結果は、私たちの1つまたは複数の特許を無効または狭義に解釈されるリスクに直面させ、私たちの特許出願を発行できないリスクに直面させる可能性がある。第三者へのクレームは、私たちの特許が無効または強制的に実行できないと主張するような第三者からの反クレームを引き起こす可能性もある。米国の特許訴訟では,被告が無効または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由は、新規性の欠如、明らかな、実施できない、または法定テーマの欠如を含む、いくつかの法定要求のいずれかを満たすことができなかったと言われている可能性がある。主張を実行できない理由は,特許訴訟に関連する人が起訴期間中に米国特許商標局に重要な情報を隠蔽したり,重大な誤解を持つ声明をしたりしたからであろう.第三者は、一方的な再審、当事者間の審査または付与後の審査、または米国国外の同様の手続に反対または米国国外の同様の手続のような、付与された手続において米国特許商標局に同様の有効性要件を提出することもできる, 訴訟と並行して、さらに訴訟の範囲外にある。法的に無効と実行不可能と断言された後の結果は予測できない。私たちは無効な以前の技術がないことを確認することができず、私たちと特許審査員は起訴中にこれを認識しなかった。私たちが許可した特許および特許出願については、第三者の挑戦を防ぐために、限られた権利またはいかなる許可特許の弁護に参加する権利もないかもしれない。もし被告が無効または実行不可能な法的主張で勝訴した場合、私たちは、私たちの現在または未来の候補薬物の任意の未来の特許保護の少なくとも一部、さらには全てを失うだろう。このような特許保護の喪失は私たちの業務を損なうかもしれない。
私たちは、特に米国のようにこれらの権利を十分に保護していないかもしれない国では、私たちの知的財産権の盗用を単独でまたは許可者と一緒に防ぐことができないかもしれない。訴訟で勝訴した側が商業的に合理的な条項でライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。私たちの知的財産権を強制的に執行する訴訟や他の手続きは失敗する可能性があり、成功しても巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性があります。
さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。聴聞、動議、または他の一時的手続き、または事態発展の結果を公開することもできる。もし証券アナリストや投資家がこれらの結果がマイナスだと思ったら、私たちの普通株の価格に悪影響を及ぼすかもしれない。
米国特許法または他の国または管轄区域特許法の変化は、特許の全体的な価値を低下させ、現在および任意の将来の候補薬物を保護する能力を弱める可能性がある。
米国は最近、広範囲な特許改革立法を公布し、実施した。近年、米国最高裁判所はいくつかの特許事件に対して裁決を下し、場合によっては利用可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかを決定している。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、連邦裁判所、および米国特許商標局の行動によれば、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を獲得したり、私たちが許可または将来獲得可能な特許を実行する能力を弱める可能性がある。同様に、他の国または管轄区域の特許法および法規の変化、またはそれらの政府機関の変化を実行するか、または関連する政府当局が特許法律または法規を実行する方法の変化は、私たちが新たな特許を取得したり、私たちが許可または将来獲得する可能性のある特許を実行する能力を弱める可能性がある
私たちは世界各地で私たちの知的財産権を保護できないかもしれないが、これは私たちの業務に否定的な影響を及ぼすかもしれない。
私たちの現在と未来の世界各地の候補薬物をカバーする特許の申請、起訴、そして擁護は目を引くほど高価になるだろう。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して彼ら自身の薬物を開発することができ、また、他の侵害薬を特許保護を得ることができるが、特許執行力がアメリカに及ばない地域に輸出することもできる。これらの薬は
私たちが特許が発行されたかもしれない司法管轄区域が私たちの薬品と競争していない場合、将来のいかなる特許主張や他の知的財産権も、それらのような競争を効果的にまたは阻止するのに十分ではないかもしれない。
第三者に依存して私たちのビジネス秘密を共有することを要求し、これは、競争相手がこれらの秘密または私たちのビジネス秘密が流用または開示されていることを発見する可能性を増加させる。
もし私たちが現在または任意の未来の候補薬を製造または商業化するために第三者に依存する場合、またはより多くの第三者と協力して私たちの現在または任意の未来の候補薬を開発すれば、私たちは時々彼らと商業秘密を共有しなければならない。共同研究開発計画を行うことも可能であり、研究開発パートナーシップや同様の合意の条項に基づいてビジネス秘密を共有することが求められるかもしれない。独自の情報の研究または開示を開始する前に、当社のコンサルタント、従業員、第三者請負業者およびコンサルタントと秘密協定、材料譲渡協定、コンサルティング協定、または他の同様の合意を締結することによって、当社のノウハウを部分的に保護することを求めています。これらの協定は、一般に、私たちの商業秘密を含む、第三者が私たちの機密情報を使用または開示する権利を制限する。第三者と協力する際に契約条項が採用されているにもかかわらず、商業秘密および他の機密情報を共有する必要は、そのような商業秘密が私たちの競争相手に知られ、無意識に他の人の技術に組み込まれているか、またはこれらの合意に違反した場合に開示または使用されるリスクを増加させる。私たちの独自の地位が私たちのノウハウおよびビジネス秘密にある程度基づいていることを考慮すると、競争相手は、私たちのビジネス秘密または他の許可されていない使用または開示が、私たちの業務および運営結果に悪影響を及ぼす可能性があることを発見します。
さらに、これらの合意は、通常、私たちのコンサルタント、従業員、第三者請負業者、およびコンサルタントが、私たちのビジネス秘密に関連する可能性のあるデータを発行する能力を制限します。私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、私たちの競争相手は、私たちと第三者との合意、独立開発、または任意の第三者協力者が情報を発表することによって、私たちのビジネス秘密を発見するかもしれない。競争相手は私たちのビジネス秘密が私たちの業務を損なうことを発見した。
私たちの第三者への依存に関するリスク
私たちは自分の製造能力がなく、第三者に依存して、現在と未来の候補薬物生産の臨床と商業供給を提供するだろう。
私たちは所有したり運営したりすることもなく、薬品製造、薬品調合、貯蔵、流通、テストのための施設を所有したり運営したりすることも望んでいない。私たちは過去に私たちの候補薬の臨床供給を生産するために第三者に依存し続けてきた
また,第三者メーカーに依存して十分な数の候補薬を提供してくれ,承認されれば商業化に用いる。第三者メーカーを交換する必要があるため、行っている臨床試験の候補薬物或いはその原材料の供給にいかなる重大な遅延が発生しても、著者らの臨床試験、製品テスト及び著者らの候補薬物の潜在的な監督管理許可の完成を大幅に延期する可能性がある。
また、第三者メーカーへの依存はリスクをもたらし、もし私たちが自分で候補薬を製造すれば、私たちはこれらのリスクの影響を受けません
•私たちの薬品の規格と品質の要求を一貫して満たすことはできない
•十分な製造能力を遅延または調達できないか、または拡大することができない
•生産規模の拡大に関する問題
•規模拡大に必要な新設備と施設のコストと検証
•CGMPや類似の海外標準に適合していない
•ビジネス上合理的な条件で第三者と製造協定を交渉することはできない
•私たちに代価または損害を与える方法で、または時間的に第三者との製造プロトコルを終了または更新しない;
•単一由来の薬物成分に依存しています
•現在、単一または単一源サプライヤーから調達された部品は合格した予備サプライヤーが不足している
•当社の第三者製造業者またはサプライヤーの運営は、製造業者またはサプライヤーの倒産を含む、当社の業務または運営とは無関係な条件によって妨害される可能性があります
•私たちが統制できない航空会社は中断したり、費用を増加させたりする。
これらの事件のいずれも臨床試験の遅延を招く可能性があり、監督部門の承認を得ることができない、あるいは一旦承認されると、現在あるいは任意の未来の候補薬物の商業化に成功する能力に影響を与える。いくつかのイベントは、禁止、リコール要求、差し押さえ、または生産の完全な一時停止、または部分的な一時停止を含むFDAの行動の基礎となる可能性がある。
私たちは第三者に依存して、私たちの臨床前研究と臨床試験を監督するつもりで、これらの第三者の表現が満足できなければ、私たちの業務を損なう可能性があります。
著者らは現在独立して任意の臨床前研究或いは臨床試験を行う能力がない。われわれはCROと臨床試験地点によりわれわれの臨床前研究と臨床試験の適切かつタイムリーな進行を確保する予定であり,それらの実際の表現への影響は限られていると予想される。我々はCROにより我々の臨床プロジェクトのデータ,および将来の臨床前研究の実行を監視·管理する予定である。私たちは私たちのCRO活動のいくつかの側面だけを統制することを望んでいる。しかし、私たちはすべての臨床前研究あるいは臨床試験が適用された方案、法律、法規、科学標準に基づいて行われていることを保証し、私たちのCROへの依存は私たちの監督責任を軽減しないことを保証する。
我々と我々のCROは、FDAが実行する法規およびガイドラインであり、欧州経済圏加盟国の主管当局および同様の外国規制機関が、臨床前および臨床開発段階にある任意の候補薬剤を国際調整理事会ガイドラインの形で要求する良好な実験室操作規範(GLP)およびGCPの遵守を要求されるであろう。監督管理当局は定期的に試験スポンサー、主要な研究者、臨床試験地点を検査することによってGCPを実行する。我々はCROに依存してGCPに適合した臨床試験を行うが、著者らはすべてのGLP臨床前研究と臨床試験がその研究計画と方案及び適用された法律法規に従って行われることを保証する責任があり、そして著者らのCROへの依存は私たちの監督責任を免除しない。もし私たちまたは私たちのCROがGCPに従わなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられるかもしれませんが、FDAまたは同様の外国の規制機関は、私たちのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれません。したがって,われわれのCROがこれらの規定を遵守できなかった場合や,十分な数の被験者を募集できなかった場合には,臨床試験の重複が要求される可能性があり,規制承認過程が遅れる。
私たちは彼らの活動を管理する合意がありますが、私たちのCROは私たちの従業員ではなく、私たちは彼らが私たちの未来の臨床と臨床前プロジェクトに十分な時間と資源を投入するかどうかを制御しません。これらのCROはまた、私たちの競争相手を含む他の商業実体と関係がある可能性があり、彼らはまた、これらの実体のための臨床試験または私たちの業務を損なう可能性のある他の薬物開発活動を行っているかもしれない。私たちはCROが私たちの知的財産権を不正に開示または流用する可能性があるというリスクに直面しており、これは私たちのビジネス秘密保護を低下させ、私たちの潜在的な競争相手が私たちのノウハウを訪問して利用することを可能にするかもしれない。もし私たちのCROがその契約の職責や義務を成功裏に履行できず、期待された期限内に達成できなかった場合、あるいは彼らが得た臨床データの品質または正確性が私たちの臨床方案や法規の要求または任意の他の原因を遵守できなかった場合、私たちの臨床試験は延長、延期または終了される可能性があり、私たちは監督部門が私たちが開発した任意の候補薬物の承認を得ることができないか、あるいは商業化に成功できないかもしれない。したがって、私たちの財務業績と私たちが開発した任意の候補薬のビジネス見通しは損なわれ、私たちのコストは増加する可能性があり、私たちが収入を生む能力は遅れるかもしれない。
また,われわれの臨床試験の首席研究員は時々私たちの科学コンサルタントやコンサルタントを務め,このようなサービスに関する報酬を得る可能性がある。場合によっては、私たちはその中のいくつかの関係をFDAに報告することを要求されるかもしれない。FDAは結論を出すかもしれないが,我々と主要研究者との経済関係は利益衝突をもたらしたり,他の方法で実験の解釈に影響を与えたりしている。したがって,FDAは適用された臨床試験地点で生じるデータの完全性を疑問視する可能性があり,臨床試験自体の効用が脅かされる可能性がある。これはFDAが私たちの上場申請を承認または拒否することを遅延させ、最終的に私たちの現在および未来の候補薬が上場承認を拒否されることを招く可能性がある。
もし私たちがこのようなCROとの関係が終わったら、私たちは他のCROと合意できないかもしれないし、商業的に合理的な条項でそうすることができないかもしれない。追加のCROを交換または増加させることは、多くのコストに関連し、管理時間と重点を必要とする。しかも、新しいCROが仕事を始める時、自然な過渡期がある。したがって,遅延が生じ,期待される臨床開発スケジュールを満たす能力に悪影響を及ぼす可能性がある。CROとの関係を慎重に管理するつもりですが、私たちがそうしないという保証はありません
将来的に挑戦や遅延、あるいはこのような遅延や挑戦は、私たちの業務、財務状況、および見通しに悪影響を与えないだろう。
私たちの業務運営、従業員事務、管理成長に関するリスク
私たちは私たちの会長兼最高経営責任者Jeremy Levin博士を含む私たちの高級管理チームのサービスに高度に依存しています。もし私たちがこれらの管理チームのメンバーを維持したり、より多くの管理、臨床と科学者を募集したりすることができなければ、私たちの業務は損害を受けます。
私たちは私たちの会長兼最高経営責任者のレヴィン博士を含む私たちの高級管理チームに強く依存している。私たちがこの人たちと締結した雇用協定は、彼らがいつでも私たちに雇用されたことを終わらせることを阻止しない。これらの人々のいずれかを失ったサービスは、研究、開発、運営、財務、商業化目標の達成を阻害する可能性がある。
また、私たちは引き続き高い素質の追加管理、臨床と科学者を吸引、維持、激励する能力に依存している。私たちの経営陣を維持し、受け入れ可能な条件でより多くの適格な人材を誘致して私たちの業務を発展させることができなければ、私たちは私たちの運営や成長を維持できないかもしれません。わが社の本社所在地ニューヨーク市の求人市場競争が特に激しいことから、このリスクはさらに拡大する可能性がある。
生物技術、製薬などの業界の人材に対する激しい競争のため、私たちは未来に人材を誘致或いは維持できないかもしれない。私たちと適格な人材やコンサルタントを競争している多くの他の製薬会社は、私たちよりも多くの財務や他の資源、異なるリスク状況、およびより長い業界歴史を持っています。それらはまた職業発展にもっと多様な機会とより良い機会を提供するかもしれない。このような特徴の中のいくつかは私たちが提供したより高い素質の候補者と顧問を引き付けるかもしれない。私たちの業務目標を達成するために、高い素質のある人員とコンサルタントを吸引、維持、激励し続けることができなければ、候補薬物の速度と成功率と私たちの業務が制限されることを発見し、開発することは、私たちの発展目標が制限される可能性がある。
私たちの将来の業績は、新たに採用された幹部を私たちの管理チームに組み入れることに成功するかどうか、および上級管理職の間で効果的な仕事関係を築くことができるかどうかにある程度かかっています。私たちはこれらの人たちを統合し、彼らと他の経営陣のメンバーとの間に有効な仕事関係を構築することができず、私たちの候補薬物の開発と商業化効率の低下を招き、将来の規制承認、私たちの候補薬物の販売、そして私たちの運営結果を損なう可能性がある。また、私たちは現在、私たちの役員や従業員の生命維持のために“キーパーソン”生命保険を提供していません。
私たちは私たちの組織を拡張する必要があるかもしれないし、このような成長を管理する時に困難に直面する可能性があり、これは私たちの運営を混乱させるかもしれない。
2022年12月31日までに、私たちは44人のフルタイム従業員がいる。現在の候補製品の開発と商業化計画と戦略の発展に伴い、より多くの管理、運営、販売、マーケティング、財務、法律、その他の資源が必要であると予想される。私たちの経営陣は、不比例な注意を日常運営から移し、これらの成長活動を管理するために多くの時間を投入する必要があるかもしれない。私たちは私たちの業務の拡張を効果的に管理できないかもしれません。これは私たちのインフラが弱く、運営効率が低下し、ビジネス機会を失うこと、従業員の流失、余剰従業員の生産性の低下を招く可能性があります。私たちの予想成長は大量の資本支出を必要とするかもしれないし、私たちの現在と潜在的な将来の候補薬物の開発のような他のプロジェクトから財政資源を移すことができるかもしれない。私たちの経営陣が私たちの成長を効果的に管理できなければ、私たちの費用は予想以上に増加する可能性があり、私たちの収入を創出し成長する能力は低下する可能性があり、私たちは私たちの業務戦略を実施できないかもしれない。私たちの将来の財務業績、候補薬物を商業化し、拡張可能なインフラと効果的な競争を開発する能力は、私たちが未来の任意の成長を効果的に管理する能力にある程度依存する。
私たちの従業員、主要な調査者、コンサルタント、ビジネスパートナーは、規制基準と要求を遵守しないこと、およびインサイダー取引を含む不正行為または他の不正活動に従事する可能性があります。
私たちは従業員、コンサルタント、流通業者、および協力者が詐欺や不法活動に従事する可能性のあるリスクに直面している。これらの当事者の不正行為には、このような規制機関に真実、完全かつ正確な情報を報告することを要求する法律、製造基準、およびそのような規制機関に真実、完全かつ正確な情報を報告することを含む、故意、無謀または不注意な行為、またはFDAおよび非米国規制機関の規定に違反する不正な活動が開示される可能性がある
米国と国外の医療詐欺と法律法規の乱用、あるいは財務情報やデータを真実、完全かつ正確に報告することを要求する法律。特に、医療保健業界の販売、マーケティングと商業手配は、薬品販売を含め、詐欺、不当行為、リベート、自己取引とその他の濫用行為を防止するための広範な法律法規の制約を受けている。これらの法律法規は、広範な価格設定、割引、マーケティングおよび販売促進、販売手数料、顧客インセンティブ計画、および他のビジネス計画を制限または禁止する可能性があります。私たちはいつも私たちの従業員や他の第三者の不適切な行為を識別し、阻止することができるわけではなく、私たちがこのような活動を発見し、防止するための予防措置は、未知または管理できないリスクや損失を効果的にコントロールできないかもしれないし、政府の調査やこれらの法律や法規を遵守できないことによる他の行動や訴訟から私たちを保護することができないかもしれない。また、私たちの混合作業政策のため、通常保護されている情報は、会社の機密情報を含めて、それほど安全ではないかもしれません。もし私たちに行動すれば、私たちは自分自身を弁護したり、私たちの権利を維持したりすることに成功しなかった。これらの行動は、民事、刑事および行政処罰、損害賠償、罰金、監禁、連邦医療保険、医療補助および他の連邦医療保健計画への参加から除外される可能性があり、追加の報告義務および監督をもたらす可能性がある(もし私たちが会社の誠実な合意または他の合意の制約を受けて、これらの法律違反に関する告発、契約損害、名声損害、利益減少、および将来の収益減少および業務削減を解決するために), いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります。私たちがこのような行動や調査を正当化することに成功したかどうかにかかわらず、法的費用を含む巨額のコストが発生し、管理層のこのようなクレームや調査が自分を弁護することへの注意を移す可能性がある。
私たちの情報技術システムまたはデータセキュリティイベントの重大な中断は、私たちに重大な財務、法律、規制、商業、名声の損害をもたらす可能性があります。
私たちは私たちの業務を運営するためのモバイル技術を含む情報技術システムとインフラにますます依存している。私たちの通常のビジネスプロセスでは、知的財産権、独自業務情報、個人情報、および他の機密情報を含む大量の敏感な情報を収集、記憶、処理、送信します。重要なのは、私たちはこのような敏感な情報の機密性、完全性、そして利用可能性を維持するために、安全な方法でそうしなければならないということだ。我々はまた,我々の業務要素(我々の情報技術インフラの要素を含む)を第三者にアウトソーシングするため,我々のコンピュータネットワークや我々の機密情報にアクセスする可能性がある第三者サプライヤーを管理している.さらに、これらのサード·パーティの多くは、その責任の一部を第三者に下請けまたはアウトソーシングする。すべての情報技術サービスは、生まれつき意図的または意図的なセキュリティホール、イベント、攻撃および暴露の影響を受けやすいが、我々の情報技術システムのアクセス可能性および分散性、およびこれらのシステム上に格納された敏感な情報は、これらのシステムが我々の技術環境に対する意図的または悪意のある内部および外部攻撃を受けやすいようにする。しかも、私たちの混合作業環境のため、私たちはネットワーク攻撃を受けやすいかもしれない。当社の従業員、第三者サプライヤー、ビジネスパートナー、または悪意のある第三者の不注意または故意の行為は、潜在的な脆弱性を利用する可能性があります。このような性質の攻撃は,頻度,持続性,複雑性,強度の面で増加しており,広範な動機(工業スパイ活動を含むがこれらに限定されない)や専門知識を持つ複雑で組織的な団体や個人によって実施されている, 組織犯罪集団、ハッカー活動家、民族国家、その他の組織が含まれている。敏感な情報を抽出することに加えて、このような攻撃は、サービス信頼性、脅威情報の機密性、完全性、および利用可能性に影響を与えるために、有害マルウェア、恐喝ソフトウェア、サービス拒否攻撃、社会工学、および他の手段の配備を含む可能性がある。さらに、モバイルデバイスの一般的な使用は、データセキュリティイベントのリスクを増加させる。
当社、第三者サプライヤーおよび/またはビジネスパートナーの情報技術システムの重大な中断または他の同様のデータセキュリティイベントは、私たちの業務運営に悪影響を及ぼす可能性があり、および/または敏感な情報の損失、流用および/または不正アクセス、使用または開示をもたらし、またはアクセスを阻止する可能性があり、これは、財務、法律、規制、商業および名声の損害をもたらす可能性があります。また,情報技術システムの中断は,我々の技術環境への攻撃からも,コンピュータウイルス,自然災害,テロ,戦争,電気通信,電子故障からも,我々の発展計画や業務運営が実質的に破壊される可能性がある.例えば、完成した或いは未来の臨床試験の臨床試験データの紛失は著者らの監督管理の承認作業を遅延させ、著者らのデータの回復或いは複製のコストを著しく増加させる可能性がある。
私たちがまだ発見されていないデータセキュリティ事件を経験したかどうかを正確に知ることはできない。状況がこうなると信じる理由はないが,攻撃者はシステムのアクセス権限を隠蔽する方式で非常に老練になっており,攻撃を受けた多くの会社は自分が攻撃されたことを知らない.不正なアクセス、使用、または個人情報の漏洩を招く事件は、私たちの患者や従業員に関する個人情報を含むが、これらに限定されず、私たちの業務を乱し、私たちの名声を損なう可能性があり、私たちに強要される可能性がある
適用される連邦および/または州が通知法律と外国と同等の法律に違反し、時間がかかり、注意力が散漫でコストの高い訴訟、監督調査と監督、強制的な是正行動に直面するようにし、データベースの内容の正確性を確認するか、または他の方法で法律、法規、契約義務(個人情報のプライバシーおよび安全を保護する法律、法規、契約義務を含む)の責任を負わせることを要求する。これは私たちのコストを増加させ、重大な法律および財務リスクおよび/または名声被害を招く可能性がある。さらに、私たちまたは私たちのサプライヤーまたはビジネスパートナーは、第三者に対するプライバシー、秘密またはデータセキュリティに関する私たちの法律または他の義務、または任意のさらなるセキュリティイベントまたは他の不適切なアクセスイベントを遵守できなかったか、または第三者への敏感な情報(個人識別情報を含む可能性がある)をアクセス、配布または送信することを招き、政府の調査、法執行行動、規制罰金、訴訟または提唱団体または他の人の私たちに対する公開声明をもたらす可能性があり、臨床サイト、監督機関、または現在および潜在的なパートナーを含む第三者を引き起こす可能性があります。私たちへの信頼を失って、そうでなければ、私たちはプライバシーや守秘に関する義務に違反していると第三者の告発を受ける可能性があり、これは私たちの業務や将来性に実質的な悪影響を及ぼす可能性があります。さらに、データセキュリティイベントおよび他の不適切なアクセスを検出することは困難である可能性があり、それらを識別するための任意の遅延は、上述したタイプの被害を増加させる可能性がある。我々の情報技術システムやインフラを保護するためのセキュリティ対策を実施しているが,これらの措置がサービス中断やセキュリティイベントの防止に成功する保証はない.
私たちは多くの異なるプライバシーと安全法律の制約を受けるかもしれません。私たちが守らないことは罰と名声の損害を招く可能性があります。
私たちは、データのプライバシーと個人情報(健康情報を含む)の保護に関する法律と法規によって制限されている。プライバシーとデータ保護の立法と規制構造は引き続き発展し、人々はますます私たちの業務に影響を与える可能性のあるプライバシーとデータ保護問題に注目している。アメリカでは、私たちは州安全違反通知法、州健康情報プライバシー法、連邦と州消費者保護法の制約を受ける可能性があり、これらの法律は個人情報の収集、使用、開示、および伝送を要求している。これらの法律のすべては裁判所と政府機関の異なる解釈を受けて、私たちに複雑なコンプライアンス問題をもたらしてくれた。もし私たちが適用された法律や法規に従わない場合、私たちは故意にHIPAAの許可または許可されていない方法で保証エンティティから個人の身分の健康情報を取得したり、HIPAA違反行為を協力して教唆したりすることで罰または制裁を受ける場合、刑事罰を含む罰や制裁を受ける可能性がある。
他の多くの国でも個人情報の収集、使用、転送を管理する法律が制定されたり、制定されたりしている。EU加盟国と他の司法管轄区はデータ保護法律と法規を通過し、重大なコンプライアンス義務を規定している。例えば、2016年5月、EUはGDPRと略称する“一般データ保護条例”を正式に採択し、2018年5月25日からすべてのEU加盟国に適用され、元のEUデータ保護指令に代わった。この法規はEUに新たなデータ保護要求を導入し、データ保護規則に違反した行為に巨額の罰金を科す。GDPRはEU加盟国によって国家法律に施行されなければならず,臨床試験や有害事象報告からの健康データを含む個人データの収集,分析,送信能力に厳しい義務と制限を加えている。異なるEU加盟国からのデータ保護当局のプライバシー法の解釈は異なり、これはEUが個人データを処理する複雑さを増加させ、実施およびコンプライアンスに関するガイドラインはしばしば更新されるか、または他の方法で修正される。GDPRやEU加盟国の関連国の法律を遵守しないいかなる規定も、政府が私たちに法執行行動と重大な処罰を取り、私たちの経営業績に悪影響を及ぼす可能性がある。GDPRは個人データの処理における私たちの責任と責任を増加させ、EUデータ保護ルールの遵守を確保するための追加的なメカニズムを構築する必要があるかもしれません。
また、カリフォルニア州はカリフォルニア消費者プライバシー法(CCPA)を公布し、この法律は米国初のGDPRに似た法律と呼ばれている。CCPAは、カリフォルニア州住民に、彼らの個人情報をアクセスおよび削除するためのより多くの権利を与え、特定の個人情報共有から退出することを選択し、カバーする会社がカリフォルニアの消費者に新しい開示(例えば、この用語の広義の定義)を提供し、これらの消費者に特定の個人情報販売から撤退することを選択する新しい方法を提供することによって、その個人情報がどのように使用されるかに関する詳細な情報を取得する。CCPAは違反行為に対する民事処罰と,データ漏洩に対する個人訴権を規定しており,データ漏洩訴訟が増加すると予想される。CCPAは私たちのコンプライアンスコストと潜在的な責任を増加させるかもしれない
上場企業に関するリスク
私たちは“小さな報告会社”であり、このような会社に適用される開示要求が低下し、私たちの普通株の投資家に対する吸引力を低下させる可能性があります。
我々は現在、1934年に改正された“証券取引法”(以下、“取引法”と略す)で定義されている“比較的小さい報告会社”である。私たちは、(I)私たちの非関連会社が保有する投票権と無投票権普通株の時価が第2四半期の最終営業日に2.5億ドル未満、または(Ii)(A)最近終了した会計年度の年収が1.00億ドル未満であれば、(B)非関連側が保有する投票権と無投票権普通株の時価が第2四半期の最終営業日に7.00億ドル未満であれば、より小さい報告会社となり、より小さい報告会社で得られる削減開示を利用することができる小さな報告会社となる。
規模の小さい報告会社として、他の発行者と比較して、米国証券取引委員会に提出された文書において、定期的な報告書や依頼書における役員報酬に関する開示義務を含む削減開示義務を履行することが許可されている。私たちはより小さな報告会社に利用可能な便利さを採用することを選択した。私たちが規模の小さい報告会社でなくなる前に、私たちがアメリカ証券取引委員会に提出した文書の縮小開示は、わが社に関する情報が他の上場企業よりも少ないことになります。投資家が私たちの普通株がそんなに魅力的ではないと思うなら、私たちはより小さい報告会社が縮小開示を可能にするやり方を使うことを選択しているので、私たちの普通株取引市場はそんなに活発ではなく、私たちの株価はもっと変動するかもしれません。
規模の小さい報告会社が使用できるいくつかの削減開示を利用することができるかもしれませんが、これらに限定されません
•役員報酬の手配に関する開示義務の削減;
·任意の規定されていない中期財務諸表を除いて、2年間の監査済み財務諸表のみを提供し、それに応じて“経営陣の財務状況および業務成果の検討および分析”の開示を減少させる。
2022年12月31日から、私たちはもはや“新興成長型企業”ではなく、コストと管理への要求を増加させるだろう。
2022年12月31日、私たちは2012年JumpStart Our Business Startups Actで定義された新興成長型会社(“EGC”)ではなくなりました。また、2022年6月30日現在の非関連会社が保有する普通株の時価により、規模の小さい報告会社や加速申告会社になる資格もあります
私たちがEGCアイデンティティを脱退したことと、私たちの規模の小さい報告会社としての資格も加速申告者に分類されるため、私たちは以前私たちのEGCアイデンティティのために私たちに適用されなかったいくつかの他の上場企業に適用される開示とコンプライアンス要件を守らなければならない。これらの要件は含まれているが、これらに限定されない
•2002年サバンズ·オクスリ法第404条(B)条(“第404条”)による財務報告に対する内部統制の有効性を証明するために、独立公認会計士事務所に要求する
·役員報酬について拘束力のないコンサルティング投票を行うこと、役員報酬についてこのようなコンサルティング投票を行う頻度、およびこれまで承認されていなかった金パラシュート支払いは株主の承認を得なければならないことが要求される。
これらの追加要求を遵守することは、我々の法律や財務コンプライアンスコストを増加させ、経営陣や他の人員が運営や他の業務事項から上場企業報告要件により多くの時間を投入することに注意を向ける可能性があると予想される。また、変化する要求をタイムリーに満たすことができなければ、私たちの普通株の市場価格は下落する可能性があり、私たちはナスダック株式市場有限責任会社、アメリカ証券取引委員会、または他の規制機関の制裁や調査を受ける可能性があり、これには追加の財務と管理資源が必要になるだろう。
もし私たちが将来財務報告に対して有効な内部統制システムを維持できなければ、私たちの財務状況、運営結果、あるいはキャッシュフローを正確に報告できないかもしれません。これは投資家に私たちの自信に悪影響を与え、私たちの普通株の価値に影響を与える可能性があります。
“サバンズ-オキシリー法”(Sarbanes-Oxley Act)は、財務報告および開示制御および手続きに対して効果的な内部統制を維持することを要求する。第404条によれば、財務報告書の内部統制に対する私たちの有効性を含む報告書を管理職が提出しなければならない。この評価には、財務報告の内部統制で発見された私たちの経営陣の重大な弱点を開示することが必要になるだろう。第404条はまた、一般的に、財務報告書の内部統制に対する私たちの独立公認会計士事務所にも有効性を証明することを要求する
私たちがEGCの時、私たちの独立公認会計士事務所は、財務報告書の内部統制に対する私たちの有効性を第404条に基づいて証明する必要はありません。2022年12月31日から、この免除はこれ以上私たちに適用されない。したがって、この10-K表の年次報告書から、私たちの独立公認会計士事務所によって提供された財務報告書の内部統制に対する私たちの有効性に関する証明書を含まなければならない。私たちは404条を遵守することで、私たちに多くの費用を発生させ、多くの管理努力を要求するだろう。私たちは現在内部監査チームを持っておらず、この機能を支持する経験豊富なコンサルタントに依存している。我々は、第404条を遵守し続けるために、適切な上場企業の経験及び技術会計知識を有するより多くのコンサルタント又は会計及び財務者を招聘する必要があるかもしれない。私たちは評価、テスト、そして必要などんな救済措置もタイムリーに達成できないかもしれない。評価·テスト過程において、私たちの財務報告内部統制に1つ以上の重大な弱点があることが発見された場合、私たちの財務報告内部統制が有効であるとは断言できないだろう。私たちはあなたに私たちの財務報告書に対する内部統制が未来に重大な欠陥や重大な欠陥が発生しないということを保証することはできません。財務報告を内部統制できなかったいかなる行為も、財務状況、運営結果、またはキャッシュフローを正確に報告する能力を深刻に抑制する可能性がある。私たちの財務報告の内部統制が有効であると判断できなければ、あるいは私たちの独立公認会計士事務所が私たちの財務報告の内部統制に重大な欠陥や重大な欠陥があると判断した場合, 私たちは投資家が私たちの財務報告の正確性と完全性に自信を失うかもしれません。私たちの普通株の市場価格は下落するかもしれません。私たちはナスダック株式市場有限責任会社、アメリカ証券取引委員会、または他の規制機関の制裁や調査を受けるかもしれません。財務報告の内部統制のいかなる重大な欠陥を補うことができなかったり、上場企業に必要な他の効果的な制御システムを実施または維持できなかったりすることは、将来的に資本市場に参入する機会を制限する可能性もある。
私たちの普通株式所有権その他の一般事項に関連するリスク
私たちの普通株の市場価格は大きく変動する可能性があり、これは私たちの普通株に大きな損失を招く可能性があります.
私たちの普通株の市場価格はずっと変動していて、引き続き変動するかもしれない。株式市場全体、特にバイオ製薬や製薬会社の市場は、極端な変動を経験しており、この変動は、最近行われている新冠肺炎の大流行に関連する変動を含む特定の会社の経営業績とは無関係であることが多く、それらの基本的なビジネスモデルや見通しが根本的に変わっていないにもかかわらず、多くの会社の株価を下落させている。潜在的な経済状況の悪化や、新たなまたは持続的な公共健康危機または他のインフレ要因に関連する他の悪影響または事態の発展を含む幅広い市場および業界要因は、我々の実際の経営実績にかかわらず、我々の普通株の市場価格にマイナス影響を与える可能性がある。このような変動のため、あなたはあなたがあなたが購入した株より高い価格であなたの株を売ることができないかもしれないので、私たちの普通株へのすべてまたは一部の投資を失うかもしれません。私たちの普通株の市場価格は多くの要素の影響を受けるかもしれません
•現在の候補薬や競争相手の臨床試験結果と
•競争薬や治療法の成功は
•アメリカや他の国の法規や法律の発展
•特許出願、発行された特許または他の固有の権利に関連する発展または紛争;
•キーパーソンの採用や退職
•現在と未来の候補薬や臨床開発計画に関連する費用レベル
•私たちはより多くの候補薬の結果を発見し開発し得るように努力しています
•財務結果、発展スケジュール、または証券アナリストの提案に関する推定の実際または予想変化;
•承認された薬の供給を十分に受けたり遅延したりすることはできませんし許容可能な価格で得ることができません
•特許、訴訟事項、および私たちの技術のための特許保護を得る能力を含む、専有権に関する論争または他の発展;
•特許または株主訴訟を含む重大な訴訟;
•私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い
•医療支払い制度の構造を変え
•製薬とバイオテクノロジー部門の市場状況
•一般的な経済、産業、市場状況;
•“リスク要因”の節で述べた他の要因。
また、過去には、株主はこれらの会社の株の市場価格が変動した後、これらの会社に対して集団訴訟を起こしていた。私たちにこのような訴訟を起こすと、巨額の費用が発生し、経営陣の注意力や資源を分散させる可能性があります。
不安定な市場や経済状況は、私たちの業務、財務状況、株価に深刻な悪影響を及ぼす可能性がある。
信用と金融市場を含む全世界経済は極端な変動と破壊を経験し、流動性と信用供給の深刻な減少、消費者自信の低下、経済成長の低下、失業率の上昇、インフレ率の上昇及び経済安定性の不確定性を含む。例えば、新冠肺炎の大流行は広範な失業、経済減速と資本市場の極端な変動を招く。同様に、露烏戦争はすでに全世界の資本市場を極度に変動させ、グローバルサプライチェーンとエネルギー市場を混乱させることを含む世界経済にさらに影響を与えると予想される。このような変動と中断は、私たちまたは私たちが依存している第三者に不利な結果をもたらすかもしれない。政治的動揺や戦争の結果を含む株式市場や信用市場が悪化した場合、任意の必要な債務や株式融資をタイムリーまたは有利な条件で得ることが難しくなり、コストが高く、または希釈作用がある可能性がある。
私たちのAシリーズ転換可能優先株は公開市場がありません.
私たちのAシリーズ転換可能優先株は成熟した公開取引市場がなく、市場も発展しないと予想されています。また、どの国の証券取引所または他の国でも認められている取引システムにA系列転換可能な優先株を上場することを申請するつもりはありません。活発な市場がなければ、Aシリーズ転換可能優先株の流動性が制限される。
私たちは私たちの業務に資金を提供するために追加の株式や債務証券を売却したり、他の手配を達成したりすることができ、これは私たちの株主が希釈され、私たちの業務に制限または制限を加える可能性がある。
私たちが薬品販売から相当な収入を得ることができるまで、もしあれば、株式と債務融資、戦略連合、および任意の協力に関する許可と開発協定によって、私たちの現金需要を満たすことが予想される。私たちは約束された外部資金源を持っていない。私たちが追加株式証券を発行する範囲では、私たちの株主は大量の希釈を経験する可能性があり、これらの証券の条項は清算または他の特典を含む可能性があり、株主としての権利に悪影響を及ぼす可能性がある。さらに、追加的な複合資産権利を得るための対価格として、株式または債務証券を発行することができる。
2020年11月には、市場発売計画に基づいて7,500万ドルまでの普通株の発行と販売を含む合計2.5億ドルの普通株、優先株、債務証券および/または株式承認証(“S-3登録声明”)を発行することを可能にするS-3表(登録番号333-250054)を提出した。2022年12月31日現在、当社のS-3登録声明には、当社のATM計画に基づいて利用可能な7500万ドルが含まれている2.5億ドルが利用可能です。債務および株式融資に関連する可能性のある合意には、私たちの特定の行動をとる能力を制限または制限する契約、例えば、私たちの株を償還する、投資を行う、追加の株式を発行する、追加債務を招く、資本支出を招く、配当金を発表する、または私たちが可能かもしれない知的財産権を取得、販売する能力に制限を加える、および私たちの業務を展開する能力に悪影響を及ぼす可能性のある他の運営制限が含まれる。もし私たちが将来の協力、戦略連合、または第三者許可手配を通じてより多くの資本を調達すれば、私たちは私たちの知的財産権、未来の収入源、研究プロジェクトまたは候補薬物に対する貴重な権利を放棄しなければならないかもしれない
許可を与える条項は私たちに不利かもしれない。このようなどんな事件も私たちの業務、財政状況、そして見通しを深刻に損なう可能性がある。
あなたは任意のAシリーズ未償還転換優先株の転換と未償還オプションの行使によって希釈されます。
2022年12月31日現在、私たちは未償還オプションを持っており、合計12,961,238株の普通株を購入することができ、加重平均行権価格は1株4.13ドルであり、発行されたAシリーズ転換可能優先株を転換する際に発行可能な1,250,000株の普通株は、追加の対価格を必要としない。このようなA系列転換可能優先株は随時その所有者の選択権に応じて変換することができるが、本10−K年度報告に記載されている財務諸表付記7に記載されている実益所有権制限を遵守する必要がある。このようなオプションを行使し、Aシリーズ転換可能な優先株を私たちの普通株に変換する株は、あなたの投資をさらに希釈し、私たちの普通株の市場価格に悪影響を及ぼす可能性があります。さらに、もし私たちが未来に普通株または普通株に変換可能な証券を発行すれば、あなたはさらなる希釈を経験するかもしれない。このような希釈の結果、清算が発生すると、あなたが受け取った株は、あなたが株式に支払った全額買い取り価格をはるかに下回る可能性があります。
私たちの普通株の所有権は私たちの役員、役員、主要株主に集中しており、新しい投資家が重大な会社の意思決定に影響を与えることを阻止する可能性がある。
2022年12月31日までに発行された普通株の株式によると、発行済み普通株総数の5%を超える当社の役員、取締役、株主実益が保有する株式は、発行済み普通株の約45.2%を占めています。
武田は、株式保有者の5%以上が、(I)ポーズ条項に同意し、(Ii)その株式の売却または譲渡を制限する能力、(Iii)我々普通株の多数の株式保有者に基づいていくつかの事項でその株式を投票すること、および(Iv)RLT協定の条項に基づいて、所有する可能性のある発行された普通株式の割合を制限する。
私たちの役員、役員、私たちが発行した普通株の5%以上を持つ株主が共同で行動すれば、彼らは、私たちのすべての資産またはほとんどの資産を合併、合併、または売却を承認することを含む、株主の承認を必要とするすべての事項に著しく影響を与えることができるかもしれません。投票権の集中、武田ポーズ条項、投票義務、譲渡制限は、他の株主がわが社の経営陣が他の株主が同意しないようにわが社の条項を希望または買収する可能性があることを延期または阻止する可能性があります。
もし証券アナリストが私たちの業務に関する研究や報告を発表しなければ、あるいは彼らが私たちの株に対するマイナス評価を発表したら、私たちの株価は下落するかもしれません。
私たちの普通株の取引市場は、業界や金融アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存している。私たちは現在、最近2人のアナリストが研究報告を撤回したにもかかわらず、いくつかの業界や金融アナリストが研究報告を提供している。私たちはこのアナリストたちに何の統制権も持っていない。もし私たちの業務を追跡している一人以上のアナリストが私たちの株に対する彼らの評価を引き下げたら、私たちの株価は下落するかもしれない。もし多くのアナリストが私たちの株を追跡したり、定期的に報告書を発表できなければ、私たちの株は市場で可視性を失う可能性があり、これは逆に私たちの株価を下落させるかもしれない
私たちは予測可能な未来に私たちの株に現金配当金を支払わないと予想されているので、資本増加(あれば)があなたの唯一の収益源になるだろう。
私たちは私たちの株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、私たちの未来のすべての収益を維持するつもりで、もしあれば、私たちの業務の成長と発展に資金を提供します。しかも、未来のどんな債務協定の条項も私たちが配当金を支払うことを阻止するかもしれない。したがって、私たちの普通株の資本付加価値は(もしあれば)あなたが予測可能な未来に唯一の収益源になるだろう。
わが社の定款書類やデラウェア州法律の条項は、私たちの買収をより困難にする可能性があり、これは私たちの株主に有利になる可能性があり、私たちの株主が現在の経営陣を交換または更迭しようとすることを阻止するかもしれません。
当社の定款と当社の定款における条項は、株主が本来行う可能性のある取引を含む、私たちに有利と考えられる合併、買収、または他の統制権変更を阻止、延期または阻止する可能性があります
あなたの株の割増を受け取りました。これらの条項はまた、投資家が将来私たちの普通株に支払いたいかもしれない価格を制限し、それによって私たちの普通株の市場価格を下げる可能性がある。また、我々の取締役会が責任を持って我々の管理チームのメンバーに命じているため、これらの規定は、株主が取締役会のメンバーを交換する難しさを増やすことで、現在の経営陣の任意の試みを交換または罷免することを阻害または阻止する可能性がある。他にもこれらの条項には
•すべての取締役会が選挙で生まれたわけではなく、分類された取締役会を設立する
•取締役会の決議を経て、当社が許可した取締役数を変更することができる
•取締役会から取締役を罷免することを制限する方法
•株主提案の事前通知要求を作成し、株主会議と取締役会の指名で行動することができる
•株主に要求する行動は、正式に開催される株主総会で行われ、株主の書面同意の下での行動を禁止しなければならない
•誰が株主総会を開催できるかを制限する
•私たちの取締役会は、株主の承認なしに優先株を発行することを許可し、これは、潜在的な敵意の買収者の株式を希釈し、私たちの取締役会によって承認されていない買収を効果的に防止するために、株主権利計画、またはいわゆる“毒丸”を制定するために使用される可能性がある
•私たちの定款または定款のいくつかの条項を修正または廃止するために、すべての株主が投票する権利のある少なくとも662/3%の株主の承認を得ることを要求する。
また、私たちはデラウェア州に登録して設立されたので、私たちはデラウェア州会社法第203条の規定によって管轄されています。この条項は、規定された方法で合併または合併が承認されない限り、私たちが発行した議決権のある株を15%以上保有している人が取引日後3年以内に私たちと合併または合併することを禁止しています。
さらに、RLTプロトコルにおける武田ポーズ条項および譲渡制限は、お客様の株式から割増取引を得る可能性があることを含む、株主が有利と考える合併、買収、または他の制御権変更を遅延または阻止する可能性があります。
私たちは証券訴訟の影響を受けるかもしれませんが、これは高価で、経営陣の注意をそらすかもしれません。
私たちの普通株の市場価格は変動するかもしれない。過去に、株式市場の価格変動を経験した会社は証券集団訴訟の影響を受ける。私たちは未来にこのような訴訟の目標になるかもしれない。私たちに対する証券訴訟は巨額のコストを招き、私たちの経営陣の注意を他の業務から移す可能性があり、これは私たちの業務を深刻に損なう可能性があります。
私たちの憲章文書やデラウェア州法律のいくつかの条項は反買収効果がある可能性があり、買収が私たちの株主を利益にしても、他の会社が私たちを買収することを阻止し、私たちの株主が現在の経営陣を交換または更迭しようとするのを阻止するかもしれない。
当社の会社登録証明書の改訂及び再記述の定款の条項、並びにデラウェア州法律における条項は、第三者が我々を買収したり、買収コストを増加させたりすることを困難にする可能性があり、そうしても、私たちの株主に利益を与えたり、現在の経営陣を罷免したりすることができる。これらの規定には
•“空白小切手”優先株の発行を許可し、私たちが設立できる条項と、株主の承認なしに発行できる株
•役員選挙での累積投票は禁止されており、そうでなければ多数の株主投票で取締役候補を選挙することは許されない
•株主が書面の同意の下で行動することを禁止し、すべての株主の行動が私たちの株主会議で行われなければならないことを要求する
•株主が株主特別会議を開催する能力を廃止する
•取締役会への指名又は株主総会で行動可能な事項の事前通知要求を行うことを規定する。
これらの規定は、株主が責任を持って私たちの経営陣に命じられた取締役会のメンバーを交代させることを難しくし、株主が現在の経営陣を交代または罷免しようとしていることを挫折または阻止する可能性がある。私たちはデラウェア州で登録されているので、私たちはデラウェア州会社法第203条(“DGCL”)の条項によって管轄されています。この条項は、これが私たちの株主の意志に合っているかどうか、あるいは私たちに有利であるかどうかにかかわらず、誰かが私たちを買収したり、私たちとの合併を阻止したり、阻止したり、阻止したりするかもしれません。DGCLの規定によると、一般的に、会社は、その株式の15%以上の所有者と業務合併を行ってはならない。当該株式を保有する株主が当該株式を3年間保有しているか、又は他の事項を除いて、当該取引は取締役会の承認を受けている。私たちが改正して再記載した会社登録証明書または改正および再記述された定款またはデラウェア州法律の遅延または抑止権変更を有するいかなる条項も、私たちの株主が彼らが保有する普通株から割増の機会を得ることを制限する可能性があり、一部の投資家が私たちの普通株に支払いたい価格に影響を与える可能性もある。
私たちの普通株を公開市場で売る大量の株は私たちの普通株の市場価格を大幅に低下させる可能性があります。
公開市場で私たちの大量の普通株を売ることはいつでも起こる可能性がある。これらの売却、あるいは市場で大量の株式保有者が株を売却しようとしているとの見方は、我々の普通株の市場価格を低下させる可能性がある。いくつかの条件に適合する場合、私たち証券の一部の所有者は、彼らの株式に関する登録声明を提出すること、または彼らの株式を自分または他の株主のために提出する可能性のある登録声明に含めることを要求する権利がある。これらの株を登録することは、証券法の制限を受けずに株式を自由に取引できるようになりますが、私たちの関連会社が持っている株は除外されます。これらの株主のどの証券売却も我々普通株の取引価格に実質的な悪影響を及ぼす可能性がある。
項目1 B。未解決従業員意見
ない。
項目2.財産
私たちは現在、2022年3月からの十年間のレンタル契約に基づいて、ニューヨーク第九通り441号にある主な実行オフィスの空間を借りています。私たちは私たちの施設が現在の需要を満たすのに十分だと信じている。
項目3.法的訴訟
私たちは現在、実質的な法的手続きの影響を受けていない。
プロジェクト4.鉱山安全情報開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
市場情報
私たちの普通株は2017年5月5日にナスダック世界ベスト市場で取引を開始し、コードはOVIDです
比較株表現図
以下の業績グラフ及び関連情報は“募集材料”とみなされてはならず、米国証券取引委員会への“届出”とみなされてはならず、引用によりこのような情報を将来的に証券法又は取引法に基づいて提出されたいかなる文書にも組み入れてはならない。次の図は我々の普通株であるナスダック総合指数とナスダックバイオテクノロジー指数-2017年12月31日から2022年12月31日までの累積総リターンを示している。
同図は、2017年12月31日の初期投資を100ドルと仮定している。グラフ中の比較は,我々の普通株の将来可能性を予測したり指示したりするための表現ではない.
記録保持者
2023年3月10日までに、私たちは約13人の普通株式保有者がいます。一部の株式は“街頭名義”で保有されているため、このような株式の実益所有者の人数は知らず、前述の数字にも含まれていない。登録されている株主数には、その株式が他の実体が信託形式で保有する可能性のある株主も含まれていない。
配当政策
私たちは普通株式に対するどんな現金配当金も発表したり支払ったりしたことがない。私たちは現在、未来の収益を維持し、私たちの業務の発展と成長に資金を提供するつもりだ。私たちは予測可能な未来に何の現金配当金も支払わないと予想している。任意の未来配当金の決定は私たちの取締役会が適宜決定し、私たちの財務状況、経営業績、契約制限、資本要求、業務見通しと私たちの取締役会が関連すると考える可能性のある他の要素を含む当時の条件に依存するだろう。
最近売られている未登録証券
ない。
第六項です[保留されている]
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
以下の議論と分析は,我々の財務諸表と本年度報告(Form 10−K)に含まれる他の部分に含まれる付記とともに読まなければならない。本議論および分析および本年度報告Form 10−Kの他の部分は、現在の信念、計画、および予想に基づく前向きな陳述を含み、これらの陳述は、リスク、不確実性および仮定、例えば、私たちの計画、目標、予想、意図、および予測に関する陳述を含む。いくつかの要因のため、我々の実際の結果および選択されたイベントの時間は、“リスク要因”および本年度報告Form 10−Kの他の部分に列挙された要因を含むこれらの前向き陳述において予想されるものと大きく異なる可能性がある。本年度報告書のForm 10-Kの“リスク要因”の部分をよく読んで、実際の結果が私たちの前向きな陳述と大きく異なる可能性のある重要な要素を理解しなければなりません。また“前向きな陳述に関する特別な説明”と題する節を参照されたい
概要
著者らは生物製薬会社であり、科学駆動、患者を中心とする方式でてんかんと稀な中枢神経系疾患の薬物発見と開発に集中し、そして集成と規律厳明な方法と結合して研究、臨床開発と業務発展を行う。著者らのチームは稀なてんかんとてんかんに関連する神経疾患に対して豊富な経験と理解があり、著者らはこれらの疾病の背後の異なる分子機序と経路がどのように患者の症状に影響するかを深く理解し続けた。Ovidはこの分野のリーダーとなり始めており、異なるてんかんやてんかん発作の原因に対する3つの新しい作用機序が含まれている差別化されたチューブを開発している。我々が小分子開発計画により獲得したてんかん疾患の生物学的·病理学的知見は,現在,他の関連遺伝子標的や分子経路の追求に寄与しており,これらがてんかん発作の原因である。時間の経過に伴い、著者らはすでに拡張可能な科学プラットフォームと効率的なてんかん開発能力を構築し、明確な臨床終点に集中した。我々は当初,加速開発計画を利用できるため,まれな疾患の治療資産を求めていた。まれに開発·販売に成功すれば,これらの資産を探索し,より広範な神経学的適応を得る予定である。てんかんとてんかん発作における私たちの結束力は、多様な新薬を開発し、生産し、私たちのインフラを拡大し、私たちの使命を達成することができるという私たちの信念を強化した。
2014年4月の設立以来、私たちはほとんどの努力を組織と計画、私たちの管理と技術チームの構築、運営資産の買収、資金調達に投入しています。
2022年と2021年12月31日までの会計年度では、それぞれ150万ドルと2.084億ドルの許可とその他の収入を創出した。2021年12月31日までの1年間に発生した収入は、主に武田との許可·協力協定に由来している。それに加えて、私たちは主に株を売ることで私たちの業務に資金を提供する。2022年12月31日現在、転換可能な優先株と普通株を売却することで2億754億ドルの純収益を集めた。2022年12月31日現在、私たちは1.29億ドルの現金、現金等価物、有価証券を持っている。2022年12月31日と2021年12月31日の年度までに、それぞれ5420万ドルの純損失と1億228億ドルの純利益を記録した。2022年12月31日現在、私たちの累計赤字は2億255億ドルです。
少なくとも今後数年以内に、巨額の費用と増加する運営損失を招き続けることを予想している。私たちの純損失は異なる時期に大きく変動する可能性があり、これは私たちが計画した臨床試験の時間と私たちの他の研究開発と商業開発活動の支出にかかっている。時間が経つにつれて支出が大幅に増加すると予想しています
•私たちの候補薬が行われている臨床前と臨床開発を続けています
•薬物、候補薬物或いは技術の開発、買収を通じて候補薬物の組み合わせを確立することができるかもしれない
•臨床前研究と臨床試験を開始し、未来に追求する可能性のある他の任意の候補薬物を提供する
•現在と未来に臨床試験を成功させた候補薬物のために発売許可を求める
•販売、マーケティング、流通インフラを構築し、上場承認を得る可能性のある任意の候補薬物を商業化する
•私たちの知的財産権の組み合わせを開発し、維持し、拡大し、保護する
•業務、財務、管理システムを実施すること
•より多くの行政、臨床、監督管理、製造、商業と科学者を誘致、採用し、維持する。
重大なリスクと不確実性
世界経済の減速、世界の医療システムの全面的な中断、公衆衛生危機に関連する他のリスクと不確定性、およびロシアとウクライナの間の持続的な戦争は、私たちの業務、財務状況、運営結果、成長の見通しに実質的な悪影響を及ぼす可能性がある。これによる高インフレ率は、私たちの業務およびそれに応じた財務状況とキャッシュフローに大きな影響を与える可能性がある。インフレ要因、例えば我々の臨床試験材料や用品コストの増加、金利及び間接コストは我々の経営業績に悪影響を及ぼす可能性がある。金利上昇は最近の米国経済に影響を与える課題でもあり、将来的に受け入れ可能な条件で伝統的な融資を得ることを難しくするかもしれない。また、経済状況は株価に下振れ圧力を与えている。これまで、インフレが私たちの財務状況や経営結果に実質的な影響を与えているとは考えていなかったが、サプライチェーン制限、ロシアとウクライナ間の持続的な戦争による世界的な地政学的緊張、世界的なマクロ経済状況の悪化、従業員の獲得性、および賃金上昇により、私たちの運営コストは近い将来に増加する可能性があり(特にインフレ率が高位に維持されたり、再び上昇し始めたりする場合)、私たちの労働コストと研究開発コストを含め、これは私たちの運営資本資源が追加的な圧力に直面する可能性がある。
さらに、私たちは、私たちの業務と私たちの戦略を実行する能力に関連する他の挑戦とリスク、および製薬業界が開発と商業運営に従事している会社によく見られるリスクおよび不確定要素に直面しているが、以下に関連するリスクおよび不確実性に限定されない:候補製品を識別、買収すること、候補製品の規制承認を得ること、医薬製品開発と臨床成功の内在的不確実性、および私たちの知的財産権の保護と向上、適用される規制要件の遵守の挑戦に直面している。
財務運営の概要
収入.収入
我々は,RLTプロトコルとAngeliniライセンスプロトコルにより収入と,他のライセンスプロトコルからの象徴的な金額を生成した.私たちは商業薬物販売から何の収入も生まれておらず、規制部門の承認を得て、私たちの現在または未来の1つ以上の候補薬物を商業化するか、または私たちの許可協定から収入を得る権利があれば、さらなる収入は生じないと予想される。将来的には、研究開発支払い、許可料、および他の前払いまたはマイルストーン支払いの組み合わせから収入を得ることも求められるかもしれない。
研究と開発費
研究と開発費用は主に私たちの研究活動によって発生するコストを含み、私たちの製品発見努力と私たちの候補製品開発を含み、その中には:
•従業員に関する費用には、賃金、福祉、株式ベースの報酬費用が含まれる
•私たちの薬物開発や規制に直接関連するサービスコンサルタントに支払う費用は
•契約研究組織,契約製造組織および臨床前研究と臨床試験を行うコンサルタントと合意して発生した費用
•臨床前活動や開発活動に関する費用
•技術や知的財産権ライセンスに関連するコスト
•マイルストーン支払いおよびその他の費用、ならびに許可協定、研究協定および協力協定の下での支払い;
•研究·開発活動に用いられる資産の減価償却費用。
研究や開発活動に関するコストは発生時に費用を計上する。いくつかの開発活動(例えば、臨床試験)のコストは、特定のタスクを達成する進捗を評価した上で確認され、これらの評価に使用されるデータは、患者登録、臨床サイト活性化、またはサプライヤーから提供される他の情報を含む。
研究開発活動は今、将来も私たちのビジネスモデルの核心になり続けるだろう。予測可能な未来には,前臨床研究や臨床試験による現在と将来の候補薬物の推進に伴い,我々の研究·開発費用が増加することが予想される。臨床前研究と臨床試験を行うことは監督部門の許可を得るために必要であり、この過程は高価で時間がかかる。我々が行う可能性のある任意の臨床前研究あるいは臨床試験の持続時間とコストを決定することは困難である。臨床試験計画の持続時間、コストと時間、そして私たちの現在と未来の候補薬物の開発は様々な要素に依存し、以下の要素を含むが、これらに限定されない
•承認が必要な臨床試験の数と任意の延長試験の要求
•患者1人当たりの試験コストは
•臨床試験に参加した患者の数
•臨床試験に組み込まれた場所の数
•臨床試験を行った国·地域
•条件に適合する患者を登録するのに要する時間長;
•患者が受ける投与量
•患者の中退率や中途停止率
•潜在的な追加的な安全監視または規制機関が要求する他の研究;
•患者のフォロー時間
•候補薬の有効性と安全性。
さらに、私たちの現在または未来の任意の候補薬物の成功確率は、競争、製造能力、商業可能性を含む多くの要素に依存するだろう。各候補薬物の科学的および臨床的成功、および各候補薬物の商業的潜在力の評価に基づいて、どのような計画を推進するか、および各計画にどれだけの資金を提供するかを決定する。
一般と行政費用
一般と行政費用は主に従業員に関連する費用を含み、賃金、福祉、株式ベースの給与費用を含み、私たちの幹部、財務、業務発展と支援機能と関係がある。他の一般的および行政的費用には、以下に説明する上場企業の運営に関連する費用、出張費用、会議費用、監査専門費用、税務および法律サービス費用、および施設に関連する費用が含まれる。
その他の収入,純額
その他の収入(支出)、純額は主に私たちの現金、現金等価物、有価証券で稼いだ利息収入、および私たちの短期投資の割引増加を含む。
再分類する
今期の新聞と一致するように、前号のある額を再分類した。これらの改訂は報告の業務結果に影響を与えなかった。
経営成果
2022年と2021年12月31日終了年度比較
以下の表に示した時期における我々の業務成果をまとめる
| | | | | | | | | | | | | | | | | |
| 2022年12月31日までの年度 | | 2021年12月31日までの年度 | | 金額を変更する |
| (単位:千) |
| 収入: | | | | | |
| ライセンスとその他の収入 | $ | 1,503 | | | $ | 12,383 | | | $ | (10,880) | |
| 収入関係者を許可する | — | | | 196,000 | | | (196,000) | |
| 総収入 | 1,503 | | | 208,383 | | | (206,880) | |
| 運営費用: | | | | | |
| 研究開発 | 24,618 | | | 46,940 | | | (22,322) | |
| 一般と行政 | 32,433 | | | 37,234 | | | (4,410) | |
| 総運営費 | 57,051 | | | 84,174 | | | (26,732) | |
| 営業収入(赤字) | (55,548) | | | 124,209 | | | (180,148) | |
| その他の収入,純額 | 1,379 | | | (46) | | | 1,425 | |
| 所得税未払いの収入 | (54,169) | | | 124,163 | | | (178,723) | |
| 所得税支給 | — | | | 1,329 | | | (1,329) | |
| 純収益 | $ | (54,169) | | | $ | 122,834 | | | $ | (177,394) | |
| | | | | |
収入.収入
2022年12月31日までの会計年度の許可その他の合意に関連した収入は150万ドル。RLTプロトコルとAngeliniライセンスプロトコルの終了により,2021年12月31日までの年間収入は2.084億ドルであった.
研究と開発費
| | | | | | | | | | | | | | | | | |
| 2022年12月31日までの年度 | | 2021年12月31日までの年度 | | 金額を変更する |
| (単位:千) |
| 臨床前と開発費用 | $ | 9,715 | | | $ | 30,386 | | | $ | (20,671) | |
| 給与明細と給与明細に関する費用 | 11,498 | | 13,454 | | (1,956) | |
| その他の費用 | 3,405 | | 3,101 | | 304 |
| 総研究開発 | $ | 24,618 | | | $ | 46,940 | | | $ | (22,322) | |
2022年12月31日までの年間研究·開発費は2460万ドルだったが、2021年12月31日までの年間は4690万ドルだった。2,230万ドル削減の要因は,OV 101の開発中止や武田が負担するOV 935の開発中止を含む我々が行っている開発計画に関する活動の減少であるが,この部分は2021年にアスリコンから小分子KCC 2化合物の許可を得た1230万ドルの費用によって相殺される。2022年12月31日までの年間で,研究·開発費には970万ドルの臨床前·開発費,1150万ドルの賃金·賃金関連費用が含まれており,そのうち180万ドルは株式給与と関連しており,340万ドルの他の費用が含まれている。2021年12月31日までの年間で,研究·開発費には3040万ドルの臨床前·開発費,1350万ドルの賃金·賃金関連費用が含まれており,そのうち170万ドルは株式給与と関連しており,310万ドルの他の費用が含まれている。
一般と行政費用
| | | | | | | | | | | | | | | | | |
| 2022年12月31日までの年度 | | 2021年12月31日までの年度 | | 金額を変更する |
| (単位:千) |
| 給与明細と給与明細に関する費用 | $ | 16,071 | | | $ | 14,008 | | | $ | 2,063 | |
| 弁護士費と弁護士費 | 9,253 | | 17,071 | | (7,818) | |
| 一般事務費 | 7,108 | | 6,154 | | 1,345 |
| 一般と行政の合計 | $ | 32,432 | | | $ | 37,234 | | | $ | (4,409) | |
2022年12月31日までの年間の一般·行政費は3240万ドルであるのに対し、2021年12月31日までの年間は3720万ドルである。440万ドル削減の主な原因は法律と専門費用の減少だが、非現金補償費用の増加と新オフィス賃貸に関する費用増加分によって相殺される。
所得税
2022年と2021年12月31日までの年度の所得税支出はそれぞれゼロと130万ドルであり、実際の税率はそれぞれ0.00%と1.07%である。2021年の所得税支給は、武田がRLT協定により大量の金を一括前払いしたことと、純営業損失の使用が認められなかったためである。我々は従来から営業損失を出し、繰延税項目の純資産の全額評価を維持するために準備してきた。2022年12月31日と2021年12月31日までの推定手当はそれぞれ約7370万ドルと6330万ドル。
流動性と資本資源
概要
2022年12月31日現在、私たちの現金、現金等価物、有価証券の総額は1.29億ドルですが、2021年12月31日現在の現金と現金等価物は1.78億ドルです。私たちの現金、現金等価物、および有価証券は、2022年12月31日まで、本年度報告書がForm 10-K形式で発表されてから少なくとも12ヶ月以内に、私たちが予想する運営費用と資本支出需要を満たすと信じている。
開発段階にある他のバイオテクノロジー会社と同様に、私たちが生み出した収入は限られている。2021年12月31日までの年間収入は、主に武田がRLT協定に基づいて支払った重大な一括払いによるものである。そうでなければ、私たちは設立以来のほとんどの年が赤字になり、運営キャッシュフローは負であり、少なくとも今後数年以内に損失が続くと予想される。2022年12月31日と2021年12月31日までの年間で、それぞれ約5420万ドルの純損失と約1億228億ドルの純収益が発生した。2022年12月31日までの累計赤字は2億255億ドル、運営資金は1兆244億ドル。
将来の資金需要
私たちの利用可能な現金、現金等価物、および有価証券は、2025年第1四半期の既存および計画中の現金需要を満たすのに十分だと信じている。私たちの資本の主な用途は、給与と関連費用、第三者臨床研究開発サービス、臨床コスト、法律とその他の規制費用、一般管理費用であると予想されています。私たちの推定は不正確であることが証明される可能性があるという仮定に基づいており、私たちは現在予想されているよりも早く私たちの資本資源を使用することができる。また,臨床試験で候補薬物を試験する過程はコストが高く,これらの試験の進展時間も不確定である。私たちの候補製品の開発と商業化に成功した実際の金額を見積もることはできませんし、いつ利益を得ることができるかどうかを見積もることもできません。
2022年12月31日現在、私たちはサービス提供者と長期債務がなく、実質的なキャンセル不可能な調達約束もありません。私たちは通常キャンセル可能な調達注文に基づいて契約を締結しています。私たちは、私たちが潜在的または支払いを受けているかどうか、あるいは私たちが臨床、規制、商業活動(状況に応じて)を完了した後の時間、あるいは私たちが様々なエンティティと締結したライセンス契約に基づいて支払う使用料支払いが必要かもしれません。この合意によると、私たちは、アスリコンABおよび西北製薬との協定を含む、いくつかの知的財産権を契約義務または約束として内部許可を行っています。本許可証によると
協定によると、いくつかの開発、規制、販売マイルストーンを実現する際に合計2.793億ドルの記念碑的支払いを支払うことに同意した。このような支払いの時間、可能性、金額(ある場合)を合理的に見積もることができないので、これらまたはある支払いを連結財務諸表から除外します。
2021年9月、私たちは会社本社のために10年間の賃貸契約を締結し、レンタル期間は2022年3月10日から、ニューヨークハドソン公地約19,000平方フィートのオフィススペースを借ります。レンタル契約はレンタル期間内に月ごとにレンタル料を支払うことになっています。レンタル契約で規定されている基本レンタル料は現在年間230万ドルです。レンタル料は2023年1月10日から支払いを開始し、レンタル料開始日から10年以内に引き続き支払います。私たちは賃貸契約を実行する際に190万ドルの信用状を発行し、総合貸借対照表に制限的な現金として反映された。リース契約に規定されている支払い義務には、2022年12月31日以降の12ヶ月以内に約170万ドルの支払いと、合意期間内に約2350万ドルの支払いが含まれています。詳細については、当社の連結財務諸表“リース”というタイトルの付記5を参照してください
今まで、私たちはまだ商業販売の製品を承認していませんし、製品販売から何の製品収入も得ていません。これまで、相当な製品収入を生み出すことができれば、株式発行、債務融資、および許可および協力手配からの追加資金によって、私たちの現金需要を満たす予定です。私たちの協力者が私たちと彼らとの合意に基づいて私たちの研究開発費を返済したり、マイルストーンや特許使用料を支払う義務を果たしたりする以外に、外部流動資金源は何も約束されていません。将来の株式発行または債務融資により追加資本を調達する場合、所有権権益は希釈される可能性があり、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての権利に悪影響を及ぼす可能性がある。債務および持分融資が可能であれば、追加債務を招く、資本支出を行う、または配当を発表するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含むいくつかの合意に関連する可能性がある。私たちはこのような資金調達が受け入れられる条件で得られることを保証できない。また、新冠肺炎の疫病或いはロシアとウクライナの衝突の長期経済影響は評価或いは予測が困難であるにもかかわらず、これらの事件はすべて全世界の金融市場に重大な妨害をもたらし、全世界経済の普遍的な減速を招いた。しかも、インフレ率は最近数十年間見たことのない水準まで上昇した。また、米連邦準備委員会(Federal Reserve)は金利を引き上げており、インフレへの懸念に応えるためにさらに金利を上げる見通しだ。金利上昇、特に政府支出の減少と金融市場の変動の場合, 経済的不確実性をさらに増加させ、このような危険を悪化させるかもしれない。中断や減速が深まったり持続したりすれば、優遇条件で追加資本を得ることができず、追加資本を得ることができない可能性があり、将来的には事業戦略を実施する能力に悪影響を及ぼす可能性がある。もし私たちが第三者との協力、戦略的連合、または第三者との許可協定によって、私たちの現在または未来の候補薬剤のための追加資金を調達する場合、私たちは、私たちの技術、将来の収入源、研究計画、または候補薬剤に対する貴重な権利を放棄するか、または私たちに不利になる可能性のある条項でライセンスを付与することを要求されるかもしれない。私たちが必要な時に資金を調達できなかったことは、私たちの財務状況と私たちの業務戦略を実行する能力に実質的な悪影響を及ぼすだろう。私たちの資本要件に関連する追加リスクについては、“リスク要因”を参照されたい。
市場に計画を提供する
2020年11月には、市場発売計画に基づいて7,500万ドルまでの普通株の発行と販売を含む合計2.5億ドルの普通株、優先株、債務証券および/または株式承認証(“S-3登録声明”)を発行することを可能にするS-3表(登録番号333-250054)を提出した。2022年12月31日現在、当社のS-3登録声明には、当社のATM計画に基づいて利用可能な7500万ドルが含まれている2.5億ドルが利用可能です。
キャッシュフロー
次の表は、示す期間のキャッシュフローをまとめたものである
| | | | | | | | | | | |
| 2022年12月31日までの年度 | | 2021年12月31日までの年度 |
| (単位:千) |
| 提供された現金純額(使用): | | | |
| 経営活動 | $ | (55,170) | | | $ | 118,612 | |
| 投資活動 | (87,940) | | | (1,821) | |
| 融資活動 | 181 | | | 904 | |
| 現金、現金等価物、および制限的現金純増加 | $ | (142,930) | | | $ | 117,694 | |
経営活動が提供する現金純額
2022年12月31日までの1年間、経営活動に用いられた現金純額は5520万ドルで、5420万ドルの純損失を含み、100万ドルの各種非現金費用と運営現金変化純額によって相殺され、その中で最も重要なのは株による報酬660万ドルおよび売掛金と売掛金の830万ドルの減少である。2021年12月31日までの年度、経営活動が提供する現金純額は1.186億ドルで、各種の非現金費用と現金変化で相殺された1億228億ドルの純収入、主に株式発行と現金による資産買収に関する1230万ドル、500万ドルの株式ベースの給与支出、1240万ドルの繰延収入が逆転した。
投資活動のための現金純額
2022年12月31日までの年度、投資活動のための現金純額は8790万ドルであり、これは主に米国国庫基金への純投資と長期持分投資の購入と関係がある。2021年12月31日までの年間で、180万ドルが投資活動に使用され、主に長期持分投資の購入が含まれている。
融資活動が提供する現金純額
2022年12月31日と2021年12月31日までの年度、融資活動が提供する現金純額はそれぞれ20万ドルと90万ドルで、主にオプションを行使する収益と従業員の株式購入計画による購入と関係がある。
重要な会計見積もりと政策
我々の経営陣の財務状況と経営結果の議論と分析は、私たちの財務諸表に基づいており、これらの報告書は米国公認の会計原則に基づいて作成されている。これらの財務諸表を作成するには、財務諸表日に報告された資産および負債の報告金額およびまたは有資産および負債の開示、ならびに報告期間内に発生する収入および費用に影響を与えるために、推定および仮定を行う必要がある。持続的な基礎の上で、私たちは私たちの推定と判断を評価する。我々は,歴史的経験と当時の状況で合理的であると考えられる様々な他の要因を推定した結果,資産や負債の帳簿価値の判断の基礎を構成しているが,これらの判断は他のソースからは明らかではない.推定数の変化は既知期間の報告結果に反映されている。
異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。見積もりと判断を下す際には、経営陣は重要な会計政策を採用する。我々のキー会計政策は、本年度報告書(Form 10−K)に含まれる監査された総合財務諸表の付記2により詳細に記載されている。
私たちの連結財務諸表に最大の潜在的影響があると考えられる重要な会計見積もりを以下に示します。歴史的に見ると、私たちの肝心な会計見積もりに対して、私たちの仮説、判断と見積もりは実際の結果と実質的な差はない
収入確認
我々は,ASC 606の収入によって確認された従属許可プロトコルによって収入を確認し,このプロトコルはAngeliniライセンスプロトコルとRLTプロトコルに適用される.この範囲内の合意条項は、ライセンスおよび研究開発活動を含むが、これらに限定されない複数の履行義務を含むことができる。ASC 606は、異なる履行義務を決定するために、これらのプロトコルを評価することを要求する。払い戻し不可能な前払い費用は、将来のいかなる表現にも依存せず、私たちがそれに応じて継続的に参加する必要もなく、許可期限の開始と許可のデータ、技術または製品の交付時に収入として確認される。履行義務が履行されていない場合、払い戻し不可能な前払い費用の確認を延期します。
2021年3月29日に完了したRLT協定について、1.96億ドルの前金を受け取りました。取引価格は1.96億ドルの前払い費用に等しく、成約日が満たすいくつかの重要な条件と関連していることを確認した。終了プロトコルで概説した具体的な条件を満たした後,締め切りに収入として1.96億ドルを全額前払いすることを確認した.
2021年3月29日、私たちはAngelini許可協定を終了する通知を受けた。その後、Angeliniと共同で6ヶ月の終了通知条項を放棄することに同意し、Angelini許可協定は2021年3月31日に終了した。私たちは義務履行を解除して、Angelini許可協定によると、私たちはこれ以上未来のマイルストーン支払いを得る権利がないだろう。義務履行を免除したため,終了日に1,240万ドルの収入を確認し,進行中の試験に関する540万ドルの許可収入と,Angeliniの将来の試験コスト潜在35%の資金に関する700万ドルを含めた。
2022年12月31日までの年間で,約150万ドルの収入が確認され,その間に達成した許可合意に関係している。
研究と開発応計
私たちの連結財務諸表を作成する際には、私たちが計算すべき研究と開発費用を見積もりなければなりません。このプロセスは、未完了契約を検討することと、私たちを代表して実行されるサービスを決定することと、請求書を受信していない場合、または他の方法で実際のコストを通知する場合に、実行されたサービスレベルおよびサービスによって生じる関連コストを推定することとを含む。著者らが第三者と締結したいくつかの契約に基づいて支払う費用は、例えば一定数の患者の募集に成功し、サイト起動と臨床試験マイルストーンの完成などのいくつかの要素に依存する。
研究や開発費を蓄積する際には,サービスを提供する時間帯と時間ごとにかかる努力レベルが予想される.可能であれば、私たちは私たちのサービスプロバイダから未払いサービスに関する情報を直接取得します。しかし、私たちは私たちが把握している情報だけに基づいてこのようなサービスのコストを推定することを要求されるかもしれない。特定の時点で試験またはサービスに関連するコストを過小評価または過大評価すれば、将来的に研究開発費を調整する必要があるかもしれない。歴史的には,我々が想定すべき研究と開発費用は実際に発生した費用とほぼ同じである.
比較的小さな報告会社の状態
取引法の定義によると、私たちは規模の小さい報告会社です。私たちは、規模の小さい報告会社が入手可能ないくつかの比例して開示された情報を利用して、(I)私たちの非関連会社が保有する投票権と非投票権普通株が第2四半期の最終営業日に2.5億ドル未満である限り、または(Ii)最近終了した会計年度の年収が1.00億ドル未満であり、私たちの非関連会社が保有する投票権および非投票権普通株が第2期の最終営業日に7.00億ドルを下回る限り、これらの比例開示された情報を利用することができる。
規模の小さい報告会社として、他の発行者と比較して、米国証券取引委員会に提出された文書において、定期的な報告書や依頼書における役員報酬に関する開示義務を含む削減開示義務を履行することが許可されている。規模の小さい報告会社が利用可能な便利な措置を採用することを選択しましたが、これらに限定されません
•役員報酬の手配に関する開示義務の削減;
·任意の規定されていない中期財務諸表を除いて、2年間の監査済み財務諸表のみを提供し、それに応じて“経営陣の財務状況および業務成果の検討および分析”の開示を減少させる。
第七A項それは.市場リスクに関する定量的で定性的な開示。
私たちの投資活動の主な目標は流動性を保障して資本を保存することだ。2022年12月31日現在、私たちは1.29億ドルの現金、現金等価物、有価証券を持っている。私たちの市場リスクに対する主な開口は金利感受性であり、金利敏感性はアメリカの金利全体の水準変化の影響を受けている。私たちの現金等価物と有価証券の満期日が短いこと、および私たちの投資のリスクが低いため、金利が直ちに100ベーシスポイント変化することは、私たちの現金等価物と有価証券の公平な市場価値に実質的な影響を与えない。将来のリスクを最小限に抑えるために、米国財務省と米国財務省が支援する買い戻し協定、国債と質の高い短期社債を含む機関市場基金で私たちの現金等価物と有価証券ポートフォリオを維持するつもりだ。
第八項です。 財務諸表と補足データ
私たちの財務諸表は、私たちの独立公認会計士事務所の報告とともに、F-1ページから、表格10-Kの形で本年度報告に登場します。
プロジェクト9. 会計と財務情報開示の変更と相違
ない。
第9条。制御とプログラム
経営陣の私たちの開示制御と手続きの評価
我々は、1934年の証券取引法(以下、“取引法”という。)に基づいて提出または提出された報告書に開示すべき情報を確保するために開示制御および手続きを維持し、(1)米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告すること、(2)開示すべき情報をタイムリーに決定するために、我々の経営陣に蓄積して伝達することを目的としている。
2022年12月31日現在、我々の経営陣は、最高経営責任者と財務責任者の参加の下で、“取引法”ルール13 a-15(E)および15 d-15(E)で定義されているような、開示制御および手順の有効性を評価している。我々の経営陣は,どのような制御やプログラムも,どんなに設計や操作が良好であっても,その目標を実現するために合理的な保証を提供することしかできず,管理層は,可能な制御とプログラムのコスト-収益関係を評価する際にその判断を適用しなければならないことを認識している.我々の最高経営責任者及び最高財務責任者は、上記の評価に基づいて、2022年12月31日現在、我々の開示制御及び手続は合理的な保証レベルで有効であると結論した。
経営陣財務報告内部統制年次報告書
我々の経営陣は、取引法第13 a-15(F)および15 d-15(F)条で定義されているように、財務報告の十分な内部統制の確立と維持を担当している。我々の経営陣は、最高経営責任者と財務会計官の監督の下、テレデビル委員会後援組織委員会が発表した内部統制枠組みである総合枠組み(2013年枠組み)に基づいて、2022年12月31日までの財務報告内部統制の有効性を評価した。評価結果によると、経営陣は、財務報告に対する内部統制は2022年12月31日から有効であると結論した。
公認会計士事務所認証報告
独立公認会計士事務所ピマウェイ会計士事務所は、本Form 10−K年度報告書に含まれる総合財務諸表を監査し、F−2ページから始まる“独立公認会計士事務所報告”に登場し、引用により本明細書に組み込まれた2022年12月31日現在の財務報告の内部統制の有効性に関する証明報告を発表した。
財務報告の内部統制の変化
2022年12月31日までの直近の四半期では、財務報告の内部統制に変化はなく、これは我々の財務報告の内部統制に大きな影響を与えたり、合理的な可能性に大きな影響を与えたりしている。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
適用されません。
第三部
本年報には、第14 A条の規定、または2023年の委託書に基づいて、我々の財政年度終了後120日以内に最終的な依頼書を米国証券取引委員会に提出するため、第III部分の要求されたいくつかの情報が漏れており、その中に含まれるいくつかの情報が参照によって本明細書に組み込まれる。
プロジェクト10.取締役、上級管理者、および企業管理
本プロジェクトに要求される情報は,我々が2023年の依頼書に“提案1--役員選挙”,“執行者”,“取締役会と会社管理に関する情報”と“延滞16(A)条の報告”と題する部分の情報を参考にして格納したものである
本プロジェクトによって要求される私たちの商業行為および道徳的基準または行動基準に関する情報は、“取締役会および会社のガバナンスに関する情報-商業行為および道徳的基準”と題する2023年の委託書に含まれ、本明細書に参照によって組み込まれる。もし私たちが行動基準を実質的に修正したり、任意の幹部または役員に行動基準のある条項の任意の免除を付与したりすれば、私たちは直ちにそのウェブサイトで修正または免除の性質を開示するだろう。私たちの行動規範の全文は私たちのサイトの投資家の部分で調べることができますWwwv.ovidrx.comそれは.当社のサイトアドレスへの引用は、当社のサイトに掲載されているか、または本サイトを介して提供される情報への引用とはなりませんので、本年度報告の一部と見なすべきではありません。
プロジェクト11.役員報酬
本プロジェクトで要求される情報は、2023年の依頼書の“役員と役員報酬”と題する節の情報を参考にしました。
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
本プロジェクトに要求される情報は、2023年の委託書に“何らかの実益所有者および経営陣の保証所有権”と題する“持分補償計画情報”の節の情報を参照して組み込まれています。
第十三項特定関係及び関連取引及び取締役独立性
本プロジェクトに要求される情報は、2023年の依頼書の“関係者との取引”と“取締役会と会社のガバナンスに関する情報--取締役会の独立性”という節の情報を参考にして組み込まれています。
プロジェクト14.チーフ会計士費用とサービス
本プロジェクトに要求される情報は,提案4の“独立公認会計士事務所費用”と“2023年依頼書”に掲載されている“承認前政策とプログラム”の節の情報を参考にして組み込む.
第4部
プロジェクト15.証拠品と財務諸表および添付表
(A)(1)財務諸表。
(A)(2)財務諸表付表。
これらは必要ではないので、または財務諸表または付記に必要な資料が提供されているので、すべての付表は省略される。
(A)(3)展示品。
以下に示す証拠は,本年度報告書10−K表の一部として提出されたものである。
| | | | | | | | |
| 番号をつける | | 説明する |
| | |
| 3.1 | | 改訂および再発行された会社登録証明書(2017年5月10日に会社が委員会に提出した8-Kフォーム現在報告書(ファイル番号001-38085)の添付ファイル3.1を参照して本明細書に組み込む)。 |
| | |
| 3.2 | | 訂正、改訂、および再発行されたAシリーズ変換可能優先株指定証明書(会社が2019年9月24日に米国証券取引委員会に提出した8-Kフォーム(ファイル番号001-38085)添付ファイル3.1を参照して本明細書に組み込む)。 |
| | |
| 3.3 | | 改訂および再改訂された定款(2017年5月10日に会社が委員会に提出した現在の8-K表報告書(文書番号001-38085)の添付ファイル3.2を参照して本明細書に組み込む)。 |
| | |
| 4.1 | | 会社普通株式証明書表(本文は、会社が2017年4月25日に委員会に提出したS-1/A表登録説明書(文書番号333-217245)の添付ファイル4.1を参照して本明細書に組み込む)。 |
| | |
| 4.2 | | 当社及びそのいくつかの株主が2017年1月6日に締結した2件目の改訂及び再予約された“投資家権利協定”(2017年4月10日に証監会に提出された当社S-1表登録説明書添付ファイル4.2(第333-217245号文書)) |
| | |
| 4.3 | | Ovid Treateutics Inc.の証券記述(引用会社が2020年3月12日に委員会に提出したForm 10-K年度報告書の添付ファイル4.3(文書番号:001-38085)によりこれに統合される)。 |
| | |
| 4.4 | | Aシリーズ優先株証明書テーブル(ここでは、当社が2019年2月21日に委員会に提出した8-Kフォーム現在報告(ファイル番号001-38085)の添付ファイル4.1を参照)。 |
| | |
| 10.1+ | | 当社とその役員と上級管理者との賠償協議表(当社が2017年4月10日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル10.1(第333-217245号文書)を参照して統合したもの)。 |
| | |
| 10.2+ | | 2017年株式インセンティブ計画(本文は、会社が2017年5月22日に委員会に提出したS-8表登録説明書(ファイル番号001-38085)添付ファイル4.12を参照して組み込まれます)。 |
| | |
| 10.3+ | | 2017年株式インセンティブ計画下のオプション付与通知及びオプション協定の表(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書(第333-217245号ファイル)添付ファイル10.3を参照して編入)。 |
| | |
| 10.4+ | | 改訂された2014年株式インセンティブ計画(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書(書類番号333-217245)添付ファイル10.5を参照して組み込む)。 |
| | |
| | | | | | | | |
| 10.5+ | | 2014年株式インセンティブ計画改正案は、2015年3月9日から施行された(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書添付ファイル10.6(文書番号333-217245)を参照して組み込む)。 |
| | |
| 10.6+ | | 2014年株式インセンティブ計画改正案は、2015年6月4日から施行された(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書添付ファイル10.7(文書番号333-217245)を参照して組み込む)。 |
| | |
| 10.7+ | | 2014年株式インセンティブ計画修正案は、2015年7月28日から施行された(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書(書類番号333-217245)添付ファイル10.8を参照して組み込む)。 |
| | |
| 10.8+ | | 2014年株式インセンティブ計画改正案は、2016年2月11日から施行された(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書添付ファイル10.9(文書番号333-217245)を参照して組み込む)。 |
| | |
| 10.9+ | | 2014年株式インセンティブ計画下の限定株式購入プロトコル表(本明細書では、会社が2017年4月10日に委員会に提出したS-1表登録説明書(文書番号333-217245)の添付ファイル10.10を参照して組み込む)。 |
| | |
| 10.10+ | | 株式オプション協定表-2014年株式インセンティブ計画に従って(2017年4月10日に会社が委員会に提出したS-1表登録説明書(文書番号333-217245)添付ファイル10.11を参照して編入)。 |
| | |
| 10.11+ | | 2014年株式インセンティブ計画下の株式オプション協定表(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書(第333-217245号文書)添付ファイル10.12を参照して編入)。 |
| | |
| 10.12+ | | 2017年従業員株購入計画(本文は、会社が2017年5月22日に委員会に提出したS-8表登録説明書(ファイル番号001-38085)添付ファイル4.14を参照して組み込まれます)。 |
| | |
| 10.13+ | | 非従業員役員報酬政策(本明細書では、会社が2021年11月10日に米国証券取引委員会に提出した10-Q四半期報告書(ファイル番号001-38085)添付ファイル10.1を参照して組み込む)。 |
| | |
| 10.14+ | | 非従業員役員報酬政策(本明細書では、会社が2022年5月10日に米国証券取引委員会に提出した10-Q四半期報告書(ファイル番号001-38085)添付ファイル10.1を参照して組み込む)。 |
| | |
| 10.15+ | | 登録者とJeremy M.Levinが2015年6月5日に締結した幹部採用協定(本文は、会社が2017年4月10日に委員会に提出したS-1表登録説明書(第333-217245号文書)添付ファイル10.13を参照して本明細書に組み込まれる)。 |
| | |
| 10.16+ | | 当社がジェフ·ローナと締結した役員採用協定は、2021年6月2日から発効する(当社が2021年3月15日に米国証券取引委員会に提出した10−K年度報告添付ファイル10.17(文書番号001−38085)を参照して本明細書に組み込む)。 |
| | |
| 10.17+ | | 会社とJason Tardioとの間の役員採用協定は、2019年10月21日に施行された(本稿では、2021年3月15日に委員会に提出された会社10-K年間報告書(文書番号001-38085)添付ファイル10.18を参照して本明細書に組み込まれる)。 |
| | |
| 10.18+ | | 改訂および再署名された会社とThomas Peroneとの間の役員採用協定は、2020年1月1日から施行される(本明細書では、会社が2021年3月15日に委員会に提出した10-K表年次報告書(文書番号001-38085)の添付ファイル10.19を参照して本明細書に組み込まれる)。 |
| | |
| 10.19† | | 西北大学と会社の間で締結された許可協定は、2016年12月15日。(参照会社によって2017年4月10日に委員会に提出された10-Kフォーム年次報告書(ファイル番号001-38085)の添付ファイル10.19を本明細書に組み込む)。 |
| | |
| | | | | | | | |
| 10.20^ | | 特許使用料,許可および終了協定は,会社と武田薬品工業株式会社が締結し,日付は2021年3月2日である(会社が2021年5月13日に米国証券取引委員会に提出した10-Q表(文書番号001-38085)添付ファイル10.1)を引用した. |
| | |
| 10.21^ | | Ovid Treateutics Inc.とアスリコンABの間で署名された2021年12月30日のライセンス契約(本明細書では、同社が2022年1月3日に米国証券取引委員会に提出した8-K表(ファイル番号001-38085)添付ファイル10.1)を引用した。 |
| | |
| 23.1 | | 独立公認会計士事務所の同意 |
| | |
| 24.1 | | 授権書(この報告書の署名ページに含まれる) |
| | |
| 31.1 | | 2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
| | |
| 31.2 | | 2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
| | |
| 32.1 | | 2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による最高経営責任者と最高財務官の認証。 |
| | |
| 101.INS | | XBRLインスタンスドキュメントを連結する |
| | |
| 101.書院 | | イントラネットXBRL分類拡張アーキテクチャ文書 |
| | |
| 101.カール | | インラインXBRL分類拡張計算リンクライブラリ文書 |
| | |
| 101.def | | インラインXBRL分類拡張Linkbase文書を定義する |
| | |
| 101.介護会 | | XBRL分類拡張ラベルLinkbase文書を連結する |
| | |
| 101.Pre | | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
| | |
| 104 | | 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) |
| | |
| | |
| | |
| | |
| | |
| | |
*手紙に従って提供され、改正された1934年証券取引法(“取引法”)第18条(“取引法”)について“アーカイブ”されたとはみなされず、参照によって、文書に含まれる任意の一般的な登録言語にかかわらず、改正された1933年証券法または取引法(表10-Kの日付の前または後に行われたものにかかわらず)に組み込まれたものとみなされてはならない。
+管理契約または補償計画を示します。
この展覧会のいくつかの部分は秘密保護待遇を受けた。このような部分は省略され、米国証券取引委員会に個別に提出された。
^米国証券取引委員会が公布したS-K法規第601(B)(10)(Iv)項によれば、本展示品の一部が編集されている。登録者は、米国証券取引委員会の要求に応じて、編集されていない本展覧会のコピーを提供することに同意する
項目16.表格10-Kの概要
適用されません。
サイン
1934年の証券取引法の要求によると、登録者は正式に本表格10-Kの報告を正式に許可された署名者が登録者を代表して署名するように促した。
| | | | | | | | |
| オヴィッド治療会社です。 |
| | |
日付:2023年3月13日 | 差出人: | ジェレミー·M·レヴィン |
| | ジェレミー·M·レヴィン |
| | 最高経営責任者 (首席行政主任) |
| | |
日付:2023年3月13日 | 差出人: | /s/ジェフリー·ローナ |
| | ジェフリー·ローナ 首席業務と財務官 (首席財務会計官) |
授権依頼書
各個人署名は、以下のような個人署名を現在許可し、Jeremy M.Levin、DPhil、MB BChir、およびJeffrey Ronaに委任し、それぞれ完全な代替および再代替の権力を有し、他の人なしに真および合法的な事実受権者および代理人として完全な権力を有し、彼または彼女の名義、場所および代替で行動し、各人の名義および各人を代表する名義および以下に説明する各アイデンティティを立て、本報告の任意およびすべての修正をテーブル10-Kで提出し、その報告をすべての証拠物およびこれに関連する他の文書と共に証券取引委員会に提出する。上記の事実代理人および代理人およびその各々に、物事の全ての権力および権力としてそれぞれのことを行い、実行し、上記の事実代理人および代理人またはそれらのいずれかまたはそれらのいずれかまたはそれらの代替者を承認および確認することは、合法的に行われることができ、または結果として行われたすべての行為および事柄を行うことができる。
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
| | | | | | | | | | | | | | |
| サイン | | タイトル | | 日取り |
| | | | |
| /Jeremy M.Levin、DPhil、MB BChir | | 取締役CEO兼最高経営責任者 (首席行政主任) | | March 13, 2023 |
| ジェレミー·M·レヴィンDPhil MB BChir | | | |
| | | | |
| /s/ジェフリー·ローナ | | 首席業務と財務官 (首席財務会計官) | | March 13, 2023 |
| ジェフリー·ローナ | | | |
| | | | |
| カレン·バーンスタイン博士 | | 役員.取締役 | | March 13, 2023 |
| カレン·バーンスタイン博士 | | | | |
| | | | |
| /s/Barbara Duncan | | 役員.取締役 | | March 13, 2023 |
| バーバラ·ダンカン | | | | |
| | | | |
| /s/バート·フリードマン | | 役員.取締役 | | March 13, 2023 |
| バート·フリードマン | | | | |
| | | | |
| ケビン·フィッツジェラルド博士 | | 役員.取締役 | | March 13, 2023 |
| ケビン·フィッツジェラルド博士 | | | | |
| | | | |
| ロバート·マイケル·プール医学博士FACP | | 役員.取締役 | | March 13, 2023 |
| ロバート·マイケル·プール医学博士FACP | | | | |
オヴィッド治療会社です。
連結財務諸表索引
| | | | | |
独立公認会計士事務所報告(KPMG LLP,New York,NY PCAOB ID:185) | F-2 |
合併貸借対照表 | F-4 |
連結業務報告書 | F-5 |
総合収益表 | F-6 |
合併株主権益変動表 | F-7 |
統合現金フロー表 | F-8 |
連結財務諸表付記 | F-9 |
独立公認会計士事務所報告
株主や取締役会に
オヴィッド治療会社:
連結財務諸表と財務報告の内部統制に関する意見
Ovid治療会社とその子会社(当社)の2022年12月31日現在と2021年12月31日までの連結貸借対照表、2022年12月31日までの2年間の年間関連総合経営報告書、全面(赤字)収入、株主権益変化と現金流量、および関連する付記(総称して総合財務諸表と呼ぶ)を監査した。テレデビル協賛組織委員会が発表した“内部統制-総合枠組み(2013)”で確立された基準に基づき、2022年12月31日までの財務報告内部統制を監査した。
上記の総合財務諸表は、すべての重要な点において、会社の2022年12月31日と2021年12月31日までの財務状況、および2022年12月31日までの2年間の毎年の経営結果と現金流量を公平に反映しており、米国公認会計原則に適合していると考えられる。また,テレデビル委員会後援組織委員会が発表した“内部統制−総合枠組み(2013)”で確立された基準に基づき,2022年12月31日現在,会社はすべての実質的な面で財務報告に対する有効な内部統制を維持していると考えられる。
意見の基礎
当社経営陣は、これらの総合財務諸表を作成し、財務報告に対する有効な内部統制を維持し、添付されている経営陣財務報告内部統制年次報告に含まれる財務報告内部統制の有効性を評価する。私たちの責任は、会社の連結財務諸表について意見を発表し、私たちの監査に基づいて会社の財務報告内部統制に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、連結財務諸表に重大なミスがないかどうか、エラーによるものであっても詐欺であっても、すべての重大な点で財務報告に対する有効な内部統制が維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の連結財務諸表の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。我々の財務報告の内部統制の監査には、財務報告の内部統制を理解すること、重大な弱点があるリスクを評価すること、評価されたリスクテストに基づいて内部統制の設計と運営有効性を評価することが含まれる。私たちの監査はまた、私たちがこのような状況で必要だと思う他の手続きを実行することを含む。私たちは私たちの監査が私たちの意見に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)会社の資産の取引および処分を合理的かつ詳細かつ正確に反映した記録を保存することに関連する政策および手順、(2)公認された会計原則に従って財務諸表を作成するために必要に応じて取引を記録するための合理的な保証を提供すること、および会社の収入および支出が管理職および管理職のみに基づくための合理的な保証を提供することが含まれる
(3)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用または処分会社の資産を防止またはタイムリーに発見することについて合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
重要な監査事項
重要な監査事項とは、連結財務諸表を当期監査する際に生じた、伝達された、または監査委員会に伝達された事項である:(1)総合財務諸表に対して重大な意義を有する勘定または開示に関連する;(2)私たちが特に挑戦的で、主観的または複雑な判断に関連する。私たちは重要な監査事項が存在しないと確信する。
/s/ ピマウェイ会計士事務所
2015年以来、当社の監査役を務めてきました
ニューヨーク、ニューヨーク
March 13, 2023
第1部-財務情報
項目1.財務諸表
オヴィッド治療会社です。
合併貸借対照表
| | | | | | | | | | | |
| | | |
| 十二月三十一日
2022 | | 十二月三十一日
2021 |
| 資産 | | | |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 44,867,846 | | | $ | 187,797,532 | |
| 有価証券 | 84,133,565 | | | — | |
| 前払い費用と他の流動資産 | 2,379,280 | | | 2,681,597 | |
| 流動資産総額 | 131,380,691 | | | 190,479,129 | |
| | | |
| 長期持分投資 | 5,622,547 | | | 1,631,992 | |
| 制限現金 | 1,930,753 | | | 1,930,753 | |
| 使用権資産、純額 | 14,922,669 | | | — | |
| 財産と設備、純額 | 1,147,963 | | | 242,757 | |
| その他の資産 | 261,191 | | | 260,126 | |
| 総資産 | $ | 155,265,814 | | | $ | 194,544,757 | |
| | | |
| 負債と株主権益 | | | |
| 流動負債: | | | |
| 売掛金 | $ | 1,952,910 | | | $ | 7,127,046 | |
| 費用を計算する | 4,504,669 | | | 7,671,275 | |
| 当期分、賃貸負債 | 533,946 | | | — | |
| 流動負債総額 | 6,991,525 | | | 14,798,321 | |
| | | |
| 長期負債: | | | |
| リース責任 | 16,001,725 | | | — | |
| 総負債 | 22,993,250 | | | 14,798,321 | |
| | | |
| 株主権益: | | | |
優先株、$0.001額面価値10,000,000ライセンス株式;Aシリーズ転換優先株10,000株式を指定し1,2502022年12月31日及び2021年12月31日に発行及び発行された株式 | 1 | | | 1 | |
普通株、$0.001額面価値125,000,000ライセンス株;70,466,885そして70,364,912それぞれ2022年12月31日及び2021年12月31日に発行及び発行された株式 | 70,467 | | | 70,359 | |
| 実収資本を追加する | 357,770,825 | | | 351,033,589 | |
| その他の総合損失を累計する | (42,187) | | | — | |
| 赤字を累計する | (225,526,542) | | | (171,357,513) | |
| 株主権益総額 | 132,272,564 | | | 179,746,436 | |
| 総負債と株主権益 | $ | 155,265,814 | | | $ | 194,544,757 | |
これらの連結財務諸表の付記を参照してください
オヴィッド治療会社です。
連結業務報告書
| | | | | | | | | | | |
| 2022年12月31日までの年度 | | 12月31日までの年度
2021 |
| 収入: | | | |
| ライセンスとその他の収入 | $ | 1,502,748 | | | $ | 12,382,779 | |
| 収入関係者を許可する | — | | | 196,000,000 | |
| 総収入 | 1,502,748 | | | 208,382,779 | |
| 運営費用: | | | |
| 研究開発 | 24,618,399 | | | 46,939,583 | |
| 一般と行政 | 32,432,510 | | | 37,234,104 | |
| 総運営費 | 57,050,909 | | | 84,173,687 | |
| 営業収入(赤字) | (55,548,161) | | | 124,209,092 | |
| その他の収入,純額 | 1,379,132 | | | (45,690) | |
| 所得税未払いの収入 | $ | (54,169,029) | | | $ | 124,163,402 | |
| 所得税支給 | — | | | 1,328,818 | |
| 純収益 | $ | (54,169,029) | | | $ | 122,834,584 | |
| 1株当たりの純収益は,基本的に | $ | (0.77) | | | $ | 1.78 | |
| 薄めて1株当たり純収益 | $ | (0.77) | | | $ | 1.76 | |
| 加重平均は普通株式を発行しています | 70,424,819 | | | 67,479,403 | |
| 加重平均は普通株式を発行し、希釈した後 | 70,424,819 | | | 68,067,992 | |
これらの連結財務諸表の付記を参照してください
オヴィッド治療会社です。
総合収益表
| | | | | | | | | | | |
| 12月31日までの年度
2022 | | 12月31日までの年度
2021 |
| 純収益 | $ | (54,169,029) | | | $ | 122,834,584 | |
| その他の全面的な損失: | | | |
| 有価証券は赤字を実現していない | (42,187) | | | — | |
| 総合収益 | $ | (54,211,216) | | | $ | 122,834,584 | |
これらの連結財務諸表の付記を参照してください
オヴィッド治療会社です。
合併株主権益変動表
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| オープンカー
優先株 | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
損 | | 積算
赤字.赤字 | | 合計する |
| 株 | | 金額 | | 株 | | 金額 | | | | |
| バランス、2021年12月31日 | 1,250 | | | $ | 1 | | | 70,364,912 | | | $ | 70,359 | | | $ | 351,033,589 | | | $ | — | | | $ | (171,357,513) | | | $ | 179,746,436 | |
| 株式オプション行使と従業員株購入計画普通株発行 | — | | | — | | | 101,973 | | | 108 | | | 180,550 | | | — | | | — | | | 180,658 | |
| 株に基づく報酬費用 | — | | | — | | | — | | | — | | | 6,556,686 | | | — | | | — | | | 6,556,686 | |
| その他総合損失 | — | | | — | | | — | | | — | | | — | | | (42,187) | | | — | | | (42,187) | |
| 純損失残高 | — | | | — | | | — | | | — | | | — | | | — | | | (54,169,029) | | | (54,169,029) | |
| バランス、2022年12月31日 | 1,250 | | | $ | 1 | | | 70,466,885 | | | $ | 70,467 | | | $ | 357,770,825 | | | $ | (42,187) | | | $ | (225,526,542) | | | $ | 132,272,564 | |
| | | | | | | | | | | | | | | |
| オープンカー
優先株 | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
損 | | 積算
赤字.赤字 | | 合計する |
| 株 | | 金額 | | 株 | | 金額 | | | | |
| バランス、2020年12月31日 | 3,250 | | | $ | 3 | | | 65,743,170 | | | $ | 65,743 | | | $ | 337,758,007 | | | $ | — | | | $ | (294,192,097) | | | $ | 43,631,656 | |
| 資産買い入れにおける普通株の発行 | — | | | — | | | 2,272,727 | | | 2,273 | | | 7,297,727 | | | — | | | — | | | 7,300,000 | |
| 株式オプション行使と従業員株購入計画普通株発行 | — | | | — | | | 349,015 | | | 343 | | | 925,396 | | | — | | | — | | | 925,739 | |
| Aシリーズ転換可能優先株を普通株に変換する | (2,000) | | | (2) | | | 2,000,000 | | | 2,000 | | | (1,998) | | | — | | | — | | | — | |
| 株に基づく報酬費用 | — | | | — | | | — | | | — | | | 5,054,457 | | | — | | | — | | | 5,054,457 | |
| 純収入 | — | | | — | | | — | | | — | | | — | | | — | | | 122,834,584 | | | 122,834,584 | |
| バランス、2021年12月31日 | 1,250 | | | $ | 1 | | | 70,364,912 | | | $ | 70,359 | | | $ | 351,033,589 | | | $ | — | | | $ | (171,357,513) | | | $ | 179,746,436 | |
これらの連結財務諸表の付記を参照してください
オヴィッド治療会社です。
統合現金フロー表
| | | | | | | | | | | |
| | | |
| 十二月三十一日までの年度
2022 | | 十二月三十一日までの年度
2021 |
| 経営活動のキャッシュフロー: | | | |
| 純収益 | $ | (54,169,029) | | | $ | 122,834,584 | |
| 純(損失)収入と業務活動で使用されている現金を照合する調整: | | | |
| 非現金研究開発費 | — | | | 7,300,000 | |
| ライセンス契約取引で受け取った非現金対価格 | (945,366) | | | — | |
| 株式投資は赤字を実現していない | 454,811 | | | — | |
| 有価証券の利子収入と割引が増加する | (1,211,311) | | | — | |
| 株に基づく報酬費用 | 6,556,686 | | | 5,054,457 | |
| 減価償却および償却費用 | 512,505 | | | 237,079 | |
| 使用権資産の償却 | 869,100 | | | — | |
| リース責任の増加 | 936,927 | | | — | |
| 営業資産と負債の変動: | | | |
| 前払い費用と他の流動資産 | 109,292 | | | 40,503 | |
| 売掛金 | (5,174,136) | | | 1,702,497 | |
| 費用を計算する | (3,166,606) | | | (4,361,410) | |
| 収入を繰り越す | — | | | (12,382,779) | |
| 関係者対応 | — | | | (2,432,192) | |
| 関係者の売掛金 | — | | | 141,763 | |
| 長期前払い費用 | — | | | 477,171 | |
| 経営活動が提供する現金純額 | (55,227,127) | | | 118,611,673 | |
| | | |
| 投資活動によるキャッシュフロー: | | | |
| 有価証券を購入する | (172,964,441) | | | — | |
| 有価証券の販売/満期日 | 90,000,000 | | | — | |
| 長期株式投資を購入する | (2,500,000) | | | (1,631,992) | |
| 短期受取手形を発行する | (1,000,000) | | | — | |
| 財産と設備を購入する | (1,224,379) | | | (184,008) | |
| ソフトウェア開発やその他の資産 | (194,397) | | | (5,400) | |
| 投資活動のための現金純額 | (87,883,217) | | | (1,821,400) | |
| | | |
| 資金調達活動のキャッシュフロー: | | | |
| ATM機とその他のサービス費用 | — | | | (21,314) | |
| オプション行使と従業員の株購入計画の収益 | 180,658 | | | 925,396 | |
| 融資活動が提供する現金純額 | 180,658 | | | 904,082 | |
| | | |
| 現金、現金等価物、および制限的現金純増加 | (142,929,686) | | | 117,694,355 | |
| 期初現金、現金等価物、および限定現金 | 189,728,285 | | | 72,033,930 | |
| 期末現金、現金等価物、および制限現金 | $ | 46,798,599 | | | $ | 189,728,285 | |
| | | |
| 非現金投資と融資活動: | | | |
| 資産を使用して賃貸負債と交換する | $ | 15,791,769 | | | $ | — | |
| 短期受取手形を長期持分投資に転換する | $ | 1,000,000 | | | $ | — | |
これらの連結財務諸表の付記を参照してください
オヴィッド治療会社は
連結財務諸表付記
NOTE 1 – 業務的性質
Ovid Treateutics Inc.(“会社”)はデラウェア州の法律登録により設立され,2014年4月1日(設立日)に運営を開始し,ニューヨーク州ニューヨークにその主要執行事務所を保持している。同社はバイオ製薬会社であり,現在てんかん患者やてんかん関連神経疾患患者や家庭のために有効な薬剤の開発に専念している。
設立以来、会社は業務発展、研究開発、管理と技術者の募集及び資本調達に力を入れ、転換可能な優先株(“優先株”)、普通株とその他の株式ツールを発行することでその運営に資金を提供してきた。同社は生物技術業界の早期会社によく見られるリスクと不確定要素の影響を受け、開発と監督管理の成功、競争相手の新技術革新に対する開発、肝心な者への依存、ノウハウの保護、政府法規の遵守及び追加資本を獲得して運営に資金を提供する能力を含むが、これらに限定されない。
歴史的に見ると、同社の主要な現金源は、許可収入、各種公開と非公開発行株の収益および利息収入であった。2022年12月31日までに同社は129.0百万の現金、現金等価物、そして有価証券。設立以来,その会社はすでに生まれた222.5100万ドルの収入は主に25.0会社とAngelini Pharma珍しい病気株式会社(“Angelini”)の許可と協力協定(“Angeliniライセンス契約”)によって受信された百万ドル、一括払い$196.0当社が武田薬品工業株式会社(“武田”)と締結した特許権使用料,許可および終了協定(“RLTプロトコル”)によると,当社は100,000,000ドルを受け取っている。歴史的には,同社は経常的な損失を受け,恒常的な負の運営キャッシュフローを経験し,その業務計画を実行するために大量の現金資源が必要である。同社の累積赤字は#ドルです225.52022年12月31日までの運営資金は124.4100万ドルで経営活動に現金を使っています55.22022年12月31日までの1年間で
同社は#ドルの純損失を記録した54.22022年12月31日までの会計年度において、同社は、少なくとも今後数年以内にその後の数年以内に損失が生じると予想し、株式発行、債務融資、協力、戦略連合、許可協定、または任意のそのような取引の組み合わせによって追加資金源を見つける能力に強く依存している。経営陣は、会社が2022年12月31日までの既存の現金、現金等価物、および有価証券は、会社が10-K表年次報告書を提出した日から少なくとも12ヶ月以内に現在の運営計画に資金を提供するのに十分であると信じている。会社は受け入れ可能な条項や完全に十分な追加資金を得ることができないかもしれない。必要なときに資金を調達できなかったことは、会社の財務状況やその業務戦略を実施する能力にマイナス影響を与える可能性がある。会社は、研究および開発計画を延期、縮小、またはキャンセルすること、または協力者または他の人との手配によって資金を得ることを要求される可能性があり、これらの手配は、会社にいくつかの候補薬剤の権利を放棄することを要求する可能性があり、そうでなければ、会社は独立開発または商業化を求める可能性がある
会社は、会社の業務とその実行戦略の能力に関する他の挑戦とリスク、および製薬業界が開発と商業運営に従事している会社によく見られるリスクと不確定要素に直面しており、以下に関連するリスクおよび不確定要素を含むが、これらに限定されない:会社の候補製品供給の遅延または問題、単一供給源サプライヤーを失ったり、製造法規を遵守できなかったり、もしかしたら他の製品や候補製品を識別、買収することができるかもしれない;薬品開発と臨床成功の内在的不確実性;会社の知的財産権の保護と強化の挑戦;適用される法規要件の遵守;そして当社の任意の候補製品に対する規制機関の承認を得ます。
NOTE 2 – 重要会計政策の概要
(A) 列報と合併の基礎
添付されている総合財務諸表はアメリカ公認会計原則(“GAAP”)に基づいて作成され、オヴィッド治療有限会社及びその全額付属会社オヴィッド治療香港有限会社の勘定を含む。すべての会社間取引と残高は合併で販売された。
(B) 予算の使用
公認会計基準に従って財務諸表を作成することは、財務諸表の日に報告された資産および負債額、開示または資産および負債、および報告期間内に報告された費用額に影響を与えるために、管理層に推定および仮定を要求する。実際の結果はこのような推定とは大きく異なるかもしれない。
(C) 総合収益
総合(赤字)収益には,純(赤字)収益および売却可能証券の未実現損益が含まれる。
(D) 有価証券
有価証券には米国債への投資が含まれており、これらの証券は売却可能な証券とされている。当社は貸借対照表の日から1年以内に満期となる有価証券を総合貸借対照表の流動資産に分類します。一時的に決定されたこれらの証券の未実現収益と損失は、株主権益として他の全面的損失を累積する単独構成要素として報告される。
(E) 制限現金
同社は長期債務を担保するために質入れされたすべての現金と、契約規定により使用が制限されたすべての現金を制限現金に分類している。今後12ヶ月以内に制限が解除されると予想されない限り、金額は非流動金額として報告される。
(F) 長期持分投資
長期持株投資は個人持株会社Gensaic,Inc.(前身はM 13治療会社)優先株への株式投資を含む。優先株は実質普通株とはみなされず、投資はコストに応じて計上され、観察可能な価格変化や減価に基づいて調整され、我々の総合貸借対照表では長期持分投資に分類され、我々の総合経営報告書上の他の収入(費用)で確認される。当社はすでに株式投資が確定しやすい公正な価値を持っていないことを確定し、計量代替方案を選択した。したがって、株式投資の帳簿金額は、同一発行者の同じまたは同様の投資の次に見える価格変化が見られる場合、または減価が確認されたときに公正価値に調整される。各報告期間内に、会社は投資が減値するかどうかを評価するための定性的な評価を行う。評価には,最近の経営結果と傾向,最近の被投資者証券の販売/買収,および他の公開的に得られるデータの審査が含まれている。投資減額の場合、当社はその推定公正価値に減記します。2022年12月31日と2021年12月31日までの株式投資の帳簿価値は$5.1百万ドルとドル1.6それぞれ100万ドルです
長期株式投資には、2社が署名した2022年3月に発効した許可協定条項に基づいて非現金対価として受け取ったMarinus製薬会社(“Marinus”)の普通株への株式投資も含まれている。株式は報告日ごとに市価で計算され、公正価値の変化は会社総合貸借対照表に投資された帳簿価値と会社総合経営報告書上の他の収益(支出)純額に反映される。2022年12月31日現在,Marinusへの株式投資の帳簿価値は約$である0.5百万ドルです。
違います。2022年12月31日までと2021年12月31日までの年度で減値を確認した。
(G) 受取手形
2022年3月17日、会社は元金ドルの転換可能なチケットを発行します1.0100万ウォンの試合です。手形には、会社が追加株式を取得することを可能にする機能や現金で手形を決済する機能が含まれている。2022年8月、当社はGensaicと手形を追加株式に変換し、総合貸借対照表に長期株式投資として入金する協定を結んだ。会社は本チケットに転換可能な利息を受け取りました。利率は1.5転換日までの年利%です。
(H) 金融商品の公正価値
財務会計基準委員会の指導意見は評価技術の投入が観察可能か観察不可能かに基づいて、評価技術の階層構造を規定した。観察可能な投入は独立源から得られた市場データを反映しており,観察できない投入は市場仮説を反映している。階層構造は最も高い優先度を与える
同じ資産又は負債の活発な市場に対する未調整見積(第1レベル計量)と、観察できない投入に対する最低優先度(第3レベル計量)とを比較する
公正価値レベルの3つの階層は以下のとおりである
•第1レベル-報告エンティティは、計量日に同じ資産または負債を取得することができ、アクティブ市場における未調整オファーを取得する。第一級には、取引所取引商品や上場株など、市場オファーに基づく価値に基づく金融商品が主に含まれる。同社の一級資産には,米国国庫通貨市場基金や株式証券への投資が含まれており,総額は約$である42.52022年12月31日まで。同社の一級資産には通貨市場基金と短期投資が含まれ、総額は#ドルに達する181.42021年12月31日まで
•第2レベル-直接または間接的に観察可能な第1レベルの資産または負債のオファー以外の投入(例えば、アクティブ市場における同様の資産または負債のオファー、または非アクティブ市場における同じまたは同様の資産または負債のオファー)。第2レベルには,モデルや他の推定方法を用いて評価を行う金融商品がある.同社の二級資産は総額約1ドルのアメリカ国庫券からなる84.12022年12月31日まで。2021年12月31日現在、会社には二級資産や負債がない
•レベル3-資産または負債の観察不可能な入力。価格設定モデル、割引キャッシュフロー、または同様の技術を使用して公正価値が決定され、少なくとも1つの重要なモデル仮説または投入が観察できない場合、金融商品は第3レベルとみなされる。その会社は所有している違います。2022年12月31日または2021年12月31日までの3級資産または負債。
総合貸借対照表に報告されている現金、現金等価物および有価証券、他の流動資産、売掛金および売掛金の帳簿価値は、これらのツールの短期満期日に応じてその公正価値に近い。
(I) 賃貸借証書
当社は最初から1つの手配がレンタルであるかどうかを決定し、ASC 842レンタル会計に基づいてレンタルを確認した。経営リースには、会社総合貸借対照表における使用権資産、当期部分、賃貸負債、長期賃貸負債が含まれています。ROU資産はリース期間内に対象資産を使用する権利を表し,リース負債は会社を代表してリースによるリース金の支払い義務を表す。レンタルROU資産および負債はレンタル開始日にレンタル期間内にレンタル支払いの現在値を確認します。当社は、当期賃貸負債部分を当期末に計算した賃貸負債と今期から12ヶ月間に予測された賃貸負債との差額として決定します。
(J) 財産と設備
財産と設備をコストに応じて列記し,その推定耐用年数内に減価償却する3年直線法を用いる。修理とメンテナンス費用は費用に計上されています。事件や環境変化が長期資産の帳簿価値が回収できない可能性があることを示した場合、当社は、関連する耐用年数を含むすべての長期資産の回収可能度を検討する。
(K) 研究と開発費
当社は発生した研究·開発費の支払いに用いられている。研究開発費には,臨床試験コスト,臨床および臨床前材料の製造コスト,契約サービス,許可費,その他の外部コストが含まれている。研究開発費には、アスリコンABからのOV 350の買収など、第三者から買収されたライセンス契約のコストも含まれる。将来の研究·開発活動のために使用される商品およびサービスの前払いは、ASC 730の“研究·開発”の規定に基づいて、活動が行われたときまたは貨物を受け取った場合に支出され、払い戻しはできない。
(L) 株に基づく報酬
当社は、ASC 718“報酬-株式報酬”に基づいて、従業員サービスに付与される株式ベースの報酬の会計処理を確立し、従業員サービスに付与される株式ベースの報酬の会計処理を行う株式ベースの報酬を会計処理する
会社は必要なサービス期間内にこのような奨励金の推定公正価値を支出する。同社はブラック·スコアーズ推定値モデルを用いて付与されたすべての奨励金の公正価値を推定した。重要な入力と仮定には、オプションの予想期限、株価変動性、無リスク金利、配当率、株価、行権価格が含まれる。多くの仮定は重大な判断を必要とし、どんな変化も株式に基づく報酬費用の決定に影響を与える可能性がある。同社は発生した没収行為を記録するための会計政策を選択した。会社は、付与された日の奨励の公正価値に基づいて、株式に基づく従業員の報酬支出を確認する。補償費用は直線法で授権期間内に確認します。
当社はASC 718に基づいて非従業員顧問と取締役に付与されたオプション奨励を計算します。発行されたまたは約束されたオプションの公正価値は、受信されたサービスの公正価値よりも信頼できるので、取引を測定するために使用される。公正価値は取引相手の履行承諾達成または取引相手の履行完了日が早い会社の普通株奨励価値によって計量される。
(M) 所得税
当社は貸借対照法に基づいて所得税を計算し、この方法は繰延税金資産と負債が既存の資産と負債の財務諸表の帳簿金額とそれぞれの計税基礎との差異及び純営業損失の繰越と研究開発控除に基づいて、推定された将来の税収結果に起因することを確認することを要求した。繰延税金資産の一部または全部が現金化できない可能性が高い場合、推定免税額を算出する。税法変更の影響は法律公布期間中に記録されている。
(N) 1株当たり純収益
1株当たりの純(損失)収入は、普通株株主が純(損失)収入をその期間に発行された基本と希釈後の加重平均普通株で割ることで決定される。当社は二級法を採用して普通株と出株証券の間に収益を分配します
普通株株主は1株当たり純(損失)収入を希釈して普通株株主を調整し、1株当たりの基本収益と普通株加重平均を占めるべきであり、在庫株方法を採用した株式オプションの潜在的希薄化影響とIF転換法を採用した優先株の潜在影響を計上すべきである。
(O) 退職計画
当社は1つを維持する401(K)--退職計画改正された1986年米国国税法(以下、“準則”という。)第401(A)及び501(A)条の規定に基づく。会社はすべての在職従業員に100一致した支払い率は3従業員が条件を満たした繰延報酬の割合と50以下の従業員の支払いの一致支払率3%和5従業員の合格繰延給与の割合。このような避難港の寄付金は直ちに授与された。2022年12月31日と2021年12月31日までの年度で、会社が貢献した339,405そして$438,043それぞれ,である.
(P) 収入確認
ASC 606によれば、収入確認によれば、1つのエンティティは、そのクライアントが約束された商品またはサービスの制御権を取得したときに、エンティティがこれらの商品またはサービス交換から得られることが予想される対価格を反映する収入を確認する。ASC 606を適用すると、会社は、(1)顧客との契約を決定するステップと、(2)契約における承諾および履行義務を決定するステップと、(3)取引価格を決定するステップと、(4)取引価格を契約に割り当てる履行義務と、(5)履行義務が履行されたときに収入を確認するステップと、の5つのステップを実行する。会社が顧客に譲渡された商品やサービスと交換するために獲得する権利のある価格を受け取る可能性がある場合にのみ、会社は5ステップモードを契約に適用する。契約開始時に、契約がASC 606の範囲内にあると決定されると、会社は、各契約において約束された商品またはサービスを評価し、どれが義務を履行しているかを決定し、各約束された商品またはサービスが異なるかどうかを評価する。そして、会社は、履行義務を履行する際にそれぞれの履行義務に割り当てられた取引価格の金額が収入であることを確認する。
収入を確認する前に、同社は制限された可変対価格を含めて取引価格を推定する。可変対価金額は取引価格に含まれています
可変対価格に関する不確実性がその後解決された場合,確認された累積収入額は大きな逆転が生じない可能性が高い。
複数の異なる履行義務が存在すれば,当社はその相対的に独立した販売価格に応じて取引価格をそれぞれ異なる履行義務に割り当てる.独立販売価格は、一般に、予想されるコストおよび比較可能な取引を使用して決定される。一定期間に確認された業績義務収入は、投入措置を用いて業績義務完全履行の進捗状況を測定することで確認される。
ライセンスに割り当てられた払戻不可能な前払い費用は、将来のいかなる表現にも依存せず、企業の対応する継続的な参加も必要とせず、ライセンス期限開始および許可のデータ、技術または製品交付時に収入として確認される。履行義務が履行されていない場合、会社は前払い許可料の確認を延期する。
(Q) 最近の会計公告
同社は最近発表された会計基準を審査し、適用される会計基準を採用する予定だ。同社はこれらの基準を採用することは、その財務状況、経営業績、あるいはキャッシュフローに実質的な影響を与えないと予想される。
当社は発表時に当社に適用されるGAAPに関する新公告を採用しており、これらの公告はその発効日よりも早い可能性があります。経営陣は、最近発表されたがまだ発効していない会計基準は、現在採用されていれば、添付の財務諸表に実質的な影響を与えないと考えている。
(R) 再分類する
今期の新聞と一致するように、前号のある額を再分類した。これらの改訂は報告の業務結果に影響を与えなかった。
NOTE 3 – 現金、現金等価物、有価証券
次の表は、2022年12月31日と2021年12月31日までの現金、現金等価物と有価証券の公正価値および未実現持株損益総額をまとめた
| | | | | | | | | | | | | | | | | | | | | | | |
| 2022年12月31日 |
| 原価を償却する | | 未実現持株収益総額 | | 未実現保有損失総額 | | 公正価値 |
| 現金 | $ | 2,853,042 | | | $ | — | | | $ | — | | | $ | 2,853,042 | |
| 貨幣市場基金 | 42,014,804 | | | — | | | — | | | 42,014,804 | |
| 有価証券 | 84,175,752 | | | — | | | (42,187) | | | 84,133,565 | |
| 現金、現金等価物、有価証券総額 | $ | 129,043,599 | | | — | | | $ | (42,187) | | | $ | 129,001,411 | |
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021年12月31日 |
| 原価を償却する | | 未実現持株収益総額 | | 未実現保有損失総額 | | 公正価値 |
| 現金 | $ | 6,425,889 | | | $ | — | | | $ | — | | | $ | 6,425,889 | |
| 貨幣市場基金 | 181,371,643 | | | — | | | — | | | 181,371,643 | |
| 有価証券 | — | | | — | | | — | | | — | |
| 現金、現金等価物、有価証券総額 | $ | 187,797,532 | | | $ | — | | | $ | — | | | $ | 187,797,532 | |
“会社”ができた注釈2022年12月31日までと2021年12月31日までに12カ月を超える損失を達成していないどの証券も保有している。
いくつありますか違います。2022年12月31日と2021年12月31日までの年度内に、証券売却可能な重大な損益が実現した。
NOTE 4 – 財産と設備及び無形資産
財産と設備の概要は以下のとおりである
| | | | | | | | | | | |
| 十二月三十一日
2022 | | 十二月三十一日
2021 |
| 家具と設備 | $ | 1,423,032 | | | $ | 504,965 | |
| 賃借権改善 | 306,312 | | | — | |
| 減価償却累計を差し引く | (581,381) | | | (262,208) | |
| 財産と設備の合計 | $ | 1,147,963 | | | $ | 242,757 | |
減価償却費用は$319,173そして$76,8712022年,2022年および2021年12月31日まで年度を終了する。
累計償却を差し引いた無形資産は#ドル222,100そして$164,092それぞれ2022年と2021年12月31日まで、他の資産に計上する。償却費用を$とする193,333そして$160,2082022年12月31日までおよび2021年12月31日まで年度を終了する。
NOTE 5 – 賃貸借証書
2021年9月に当社は1つの項目を作成した10年間会社本部賃貸契約、レンタル期間は2022年3月10日から、レンタル期間は約19,000ニューヨークハドソン公地の一平方フィートのオフィススペースです。レンタル契約はレンタル期間内に月ごとにレンタル料を支払うことになっています。レンタルした基本レンタル料は現在#ドルです2.3年間百万ドルです。レンタル料はすでに支払い始めました10賃貸契約開始日から数ヶ月、あるいは2023年1月10日に継続します10レンタル料が始まった日から年を数える。家賃も含まれています2か月レンタル料開始日後の六ヶ月目と七ヶ月目には無料レンタル料を受けます。会社は#ドルの信用状を発行した1.9リース契約の実行に関連する現金;信用状の特徴は、会社総合貸借対照表上の限定的な現金である。
ハドソン公地賃貸契約の残りの借地期間は10年には追加の追加オプションが含まれています5年それは.当社は賃貸負債を計算する際に継続選択権を賃貸期間に計上していません。当社は継続選択権を行使するかどうかを合理的に決定できないためです。レンタル支払いの現在価額は逓増借款金利で計算されています7.02%です。リース費用は総合経営報告書の一般と行政および研究開発費に計上されている。
当社の経営リースに関する純収益資産と賃貸負債は以下の通りです
| | | | | |
| 十二月三十一日
2022 |
| 使用権資産 | $ | 14,922,669 | |
| 流動賃貸負債 | 533,946 | |
| 長期賃貸負債 | $ | 16,001,725 | |
2022年12月31日終了年度の経営リース費用構成は以下の通り
| | | | | |
| 十二月三十一日
2022 |
| リースコストを経営する | $ | 1,806,028 | |
| 可変リースコスト | — | |
| 短期賃貸コスト | — | |
レンタルを取り消すことができない将来の最低承諾額は以下の通りです
| | | | | |
| 2023 | $ | 1,672,886 | |
| 2024 | 2,316,303 | |
| 2025 | 2,316,303 | |
| 2026 | 2,316,303 | |
| 2027 | 2,316,303 | |
| その後… | 12,347,235 | |
| $ | 23,285,333 | |
NOTE 6 – 費用を計算する
計算すべき費用には以下が含まれている
| | | | | | | | | | | |
| 十二月三十一日
2022 | | 十二月三十一日
2021 |
| 給料とボーナスの掛け金 | $ | 3,233,802 | | | $ | 3,764,666 | |
| 研究と開発に応じたプロジェクト | 395,247 | | | 1,795,190 | |
| 専門費用を計算する | 682,664 | | | 1,564,955 | |
| 他にも | 192,956 | | | 546,464 | |
| 合計する | $ | 4,504,669 | | | $ | 7,671,275 | |
NOTE 7 – 株主権益と優先株
会社の資本構造は普通株と優先株で構成されている。当社の改訂及び再記載された改訂された会社登録証明書によると、当社は最も多くの発行を許可しています125,000,000普通株と普通株10,000,000優先株株。当社はすでに指定しました10,000のです10,000,000無投票権のA系列転換可能優先株である授権優先株(“A系列優先株”)。
普通株保有者には権利がある1つは保有する株式1株に投票する。普通株保有者には優先引受権や他の引受権がなく、普通株の償還や債務返済基金に関する規定もない。任意の発行された優先株シリーズに適用可能な特典に基づいて、普通株式保有者は、非累積ベースで発表された任意の配当金を比例的に取得する権利がある。A系列優先株の株式は、普通株が実際に支払った配当と同じ配当率(普通株に転換することを想定した上で)を獲得し、同じ形態および方法で配当を得る権利がある。会社清算、清算、解散時の権利については、普通株はすべての系列優先株に従属する。優先株のすべての清算優先権が満たされた後、普通株式保有者は清算収益を得る権利がある。
2020年11月には、当社はCowen and Company,LLC(“Cowen”)と販売協定(“2020年ATM協定”)を締結し、この合意により、当社は随時適宜“市場発売”の総発行価格を最高$に一任することができます75.0コーエンを通じて販売代理を担当します。2022年12月31日までに会社は注釈2020年のATM協定に基づいてどんな普通株も売却された
いくつありますか1,2502022年12月31日と2021年12月31日までに発行されたAシリーズ優先株。Aシリーズ優先株の1株当たりは1,000保有者はいつでも普通株の株式を選択することができる。しかし,ある例外を除いて,所有者はA系列優先株の株式を普通株に変換することを禁止され,転換の結果として,所有者とその関連会社が所有者が書面で選択した場合に所有する株式が超えることになる9.99%または14.99その時点で発行された普通株式総数のパーセンテージは、所有者によって選択された以下の任意の他の数字に変更することができる19.99%On61当社への通知の日数61この通知が送達された日後,当該実益所有権制限は,どの実益も以下のいずれかの所有者を所有する場合には適用されない10.0%または15.0上記所持者の予備書面選択に基づいて、当該通知が発行される直前及び発行された普通株式総数の割合を決定する。会社清算、解散、または清算の場合、Aシリーズ優先株の保有者は$に相当する0.001任意の収益を普通株式保有者に分配する前に、Aシリーズ優先株の1株当たり収益。
2021年3月には、会社のある株主選択が合計される2,000この等所有者が所有するA系列優先株株式の合計は2,000,000会社普通株の株です。
配当をする
違います。普通株の配当金は、優先株の配当が発表され、支払われない限り、発表されて支払われなければならない。2022年12月31日までに会社は注釈どんな配当も発表した。
NOTE 8 – 株に基づく報酬
会社取締役会は“2014年株式インセンティブ計画”(“2014年計画”)を採択し、承認し、許可会社は株式オプション、非法定株式オプション、株式付加権、制限株式、制限株式単位を奨励する形で普通株株式を付与した。株式奨励の種類は、株式購入権金額、条項及び行使付与の規定を含み、会社取締役会が決定する。
会社の取締役会が可決し、会社の株主の承認を得た2017年度株式激励計画(“2017年度計画”)が2017年5月4日に発効した。2017年計画普通株式の初期準備金は3,052,059株式です。2017年計画では、奨励的株式オプション、非法定株式オプション、制限的株式奨励、制限株式単位奨励、株式付加価値権、業績株式奨励などの形式の株式奨励を付与することが規定されている。また、2017年計画では業績現金奨励を付与することが規定されている。会社の従業員、上級管理職、役員、コンサルタント、コンサルタントは2017年計画下の奨励を受ける資格があります。2017年計画が採択された後、2014年計画に基づいて他の奨励金は与えられなくなるだろう。2017年計画の条項によると、毎年1月1日、計画限度額は(X)の中の小さい者を増加させなければならない5(Y)取締役会は、より少ない数を適宜決定することができる。2021年1月1日別の項目3,287,1582017年計画によると、株式は発行のために予約されている。2021年12月31日までに4,397,0672017年の計画に基づいて発行された会社の普通株式を予約する。2022年1月1日、別の項目1,000,0002017年計画によると、株式は発行のために予約されている。2022年12月31日までに3,187,0692017年の計画に基づいて発行された会社の普通株式を予約する。2023年1月1日別の項目3,523,3442017年計画によると、株式は発行のために予約されている。
会社の取締役会は、2017年5月4日から発効する2017年度従業員株購入計画(“2017従業員持株計画”)を株主が承認したことを可決した。2017年にESPPが発行可能な普通株式の初期備蓄によると279,069株式です。2017年従業員持株計画は、従業員が1年間の価格で会社の普通株を購入することを許可する15購入日を指定した市場価格の%割引をします。2022年と2021年12月31日までの年間で76,455そして60,490株式は2017年の従業員持株計画に基づいて購入され、会社が記録した費用は#ドルです85,319そして$83,787それぞれ,である.2017年にESPPが発行のために予約した普通株式数は毎年1月1日に自動的に増加し、2018年1月1日から2027年1月1日まで(2027年1月1日を含む)まで、以下の小さい者を基準とする1前の年の12月31日に当社が発行した株式総数のパーセンテージ,(二)550,000または(Iii)当社取締役会が決定した当該等の少ない株式数。取締役会は2023年1月1日までに行動し、規定されている違います。2017年にESPPによって発行のために予約された株式の数を増加させる。2022年と2021年12月31日までに416,607そして493,0622017年にESPPによると保有会社の普通株を発行します。
個別オプション協定が別途規定されていない限り、2014年計画および2017年計画によって付与された株式オプションは、通常、10年期限と年限4年制段階的行権期。転帰規定は一般に引受人が転帰期間中に当社のサービスを継続することを条件としています。付与されると,すべての付与されたオプションは,付与された日から満期まで行使することができる.オプション付与は譲渡できない.既得オプションは一般的にも存在する90オプション所有者が当社へのサービスを終了してから数日後です。株式購入所有者が当社に雇用されたり、当社にサービスを提供している間に死亡または障害があった場合、行使期間を12ヶ月に延長することができます
業績に基づくオプション報酬は、通常、同様の帰属条項を有し、帰属は、業績条件が達成された日に発生し、合意された特定の条項によって満了する。2022年と2021年12月31日には100,000そして150,000業績に基づく未完了オプションと未付与オプションには,それぞれ何らかの研究と開発マイルストーンを実現する際に付与されるオプションが含まれる
2022年12月31日と2021年12月31日までの年度内に付与されたオプションの公正価値は,ブラック−スコアーズオプション推定モデルを用いて推定した。ブラック·スコアーズオプション評価モデルの投入には経営陣の重大な仮定が必要であり、詳細は次の表に示す。無リスク金利は付与日の米国債金利をもとにしており、満期日は付与日の期待寿命にほぼ等しい。平均寿命は“米国証券取引委員会職員会計公報”に基づいているテーマ14 D。予想変動率は、公開獲得可能な同業者会社の履歴変動率情報に基づいて推定される
付与日非従業員オプション公正価値を計算するためのすべての仮定は、一般に、従業員のオプションを付与するために使用される仮定と一致する。会社がその任意のコンサルティングプロトコルを終了した場合、プロトコルベースとなる未帰属オプションもキャンセルされる。
その会社は授与したゼロそして170,000それぞれ2022年12月31日と2021年12月31日までの年度内に非従業員コンサルタントに株式オプションを提供する。いくつありますか127,459そして181,2502022年12月31日と2021年12月31日まで、付与されていない非従業員オプションは返済されていない。2022年12月31日までおよび2021年12月31日まで年度非従業員株式オプションに関する確認総支出は$575,995そして$584,092それぞれ,である.非従業員株式オプションに関する未確認報酬支出総額は$626,977そして$67,471それぞれ2022年と2021年12月31日まで。2022年12月31日と2021年12月31日までの年間で違います。非従業員業績オプション報酬の費用が確認されました。
その会社は授与した4,575,641そして1,875,913それぞれ2022年12月31日までおよび2021年12月31日までに従業員に株式オプションを提供する。いくつありますか6,090,889そして4,407,3082022年12月31日と2021年12月31日まで、従業員のオプションはそれぞれ返済されていない。2022年12月31日までおよび2021年12月31日まで年度従業員株式オプションに関する確認支出総額は$5.9百万ドルとドル4.4それぞれ100万ドルです従業員株式オプションに関する未確認報酬支出総額は$11.5百万ドルとドル10.3それぞれ2022年12月31日と2021年12月31日まで。2022年12月31日及び2021年12月31日まで、当社は確認しました118,075そしてゼロ従業員業績オプション報酬の費用の中で。
会社の株式給与支出は営業費用の中で以下のように確認された
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 研究開発 | $ | 1,770,599 | | | $ | 1,679,183 | |
| 一般と行政 | 4,786,087 | | | 3,375,274 | |
| 合計する | $ | 6,556,686 | | | $ | 5,054,457 | |
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 株式オプション | $ | 6,471,367 | | | $ | 4,970,670 | |
| 従業員株購入計画 | 85,319 | | | 83,787 | |
| 合計する | $ | 6,556,686 | | | $ | 5,054,457 | |
2022年12月31日と2021年12月31日までの年間に付与された従業員オプションの公正価値は、以下の仮定に基づいて推定される
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 重みをつける
平均値 | | 重みをつける
平均値 |
| 波動率 | 87.16 | % | | 84.38 | % |
| 予想期限(年単位) | 6.07 | | 6.03 |
| 配当率 | 0.00 | % | | 0.00 | % |
| 無リスク金利 | 2.21 | % | | 0.90 | % |
| 日オプションの公正価値を付与する | $ | 2.12 | | | $ | 2.50 | |
2022年12月31日と2021年12月31日までの年間に付与され再計量された非従業員オプションの公正価値は、以下の仮定に基づいて推定される
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 重みをつける
平均値 | | 重みをつける
平均値 |
| 波動率 | 0.00 | % | | 80.43 | % |
| 予想期限(年単位) | 0 | | 6.23 |
| 配当率 | 0.00 | % | | 0.00 | % |
| 無リスク金利 | 0.00 | % | | 1.03 | % |
| 日オプションの公正価値を付与する | $ | — | | | $ | 2.49 | |
次の表は、未平倉オプション数と加重平均行重み値をまとめています
| | | | | | | | | | | | | | | | | | | | | | | |
| 量
株 | | 重みをつける
平均値
トレーニングをする
値段 | | 重みをつける
平均値
残り
契約書
年単位の寿命 | | 骨材
固有の
価値がある |
| 未償還オプション2020年12月31日 | 10,403,420 | | | $ | 5.26 | | | 7.59 | | $ | 652,438 | |
| 2020年12月31日に帰属して行使可能です | 5,395,658 | | | $ | 6.45 | | | 6.13 | | $ | 445,599 | |
| 授与する | 2,045,913 | | | 3.53 | | | 9.47 | | |
| 鍛えられた | (288,525) | | | 2.36 | | | | | |
| 没収または期限切れ | (1,384,050) | | | 4.08 | | | | | |
| 2021年12月31日未償還オプション | 10,776,758 | | | $ | 4.97 | | | 6.07 | | $ | 2,389,890 | |
| 2021年12月31日に帰属し、行使可能です | 6,188,200 | | | $ | 5.98 | | | 4.63 | | $ | 1,531,907 | |
| 授与する | 4,575,641 | | | 2.89 | | | 9.26 | | |
| 鍛えられた | (25,518) | | | 1.91 | | | | | |
| 没収または期限切れ | (2,365,643) | | | 5.56 | | | | | |
| 2022年12月31日未償還オプション | 12,961,238 | | | $ | 4.13 | | | 7.42 | | $ | 62,158 | |
| 2022年12月31日に帰属して行使可能です | 6,742,890 | | | $ | 5.05 | | | 6.20 | | $ | 61,214 | |
2022年12月31日に$12.1百万未償却株式の給与支出に基づいて、残りの平均帰属期間中に確認される見通し2.26何年もです。2021年12月31日に$10.4百万未償却株式の給与支出に基づいて、残りの平均帰属期間中に確認される見通し2.61何年もです。
NOTE 9 – 所得税
2022年12月31日まで、同社は米ドルが使えます153.5百万ドルとドル177.1未使用の純営業損失(“NOL”)はそれぞれ連邦と州の税収目的に繰り越し、将来の課税所得額に用いることができる。その会社は$を持っている163.9数百万人の未使用NOL繰り越しはニューヨーク市の目的で使用されている。2035年までに使用しなければ、NOL繰り越しは2035年に満期になる。
1986年の国税法第382節と第383節によると、会社が所有権変更が発生した場合、会社が変更前の純資産繰越や他の変更前税収属性を用いて変更後の収入を相殺する能力が制限される可能性がある。2015年8月10日と2019年2月22日に、会社は所有権変更を経験した。同社はその変更前のNOLの大部分は限られると予想しているが,第382条の本格的な分析は完了していない
当社はその繰延税項目の純資産維持全額評価について準備しています。推定免税額は#ドル増加した10.4百万ドルで$が減りました26.52022年と2021年はそれぞれ100万である。2022年の推定準備金増加の主な原因はNOL繰り越しと資本化研究と実験コストの増加である。
繰延税金資産と負債の一時的な差をもたらす税務影響は以下の通りである
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 繰延税金資産/負債: | | | |
| 純営業損失が繰り越す | $ | 55,472,573 | | | $ | 49,086,998 | |
| 無形資産 | 6,332,176 | | | 7,121,484 | |
| 資本化研究開発コスト | 4,246,071 | | | — | |
| 株に基づく報酬 | 4,384,751 | | | 4,663,578 | |
| リース責任 | 3,544,624 | | | — | |
| 研究開発税収控除 | 3,046,253 | | | 2,422,331 | |
| 補償すべきである | — | | | (28,243) | |
| 慈善寄付金 | — | | | 87,672 | |
| 減価償却 | (241,096) | | | (51,920) | |
| 使用権資産 | (3,198,857) | | | — | |
| 他にも | 97,494 | | | — | |
| 繰延税項目の総資産/負債総額 | 73,683,989 | | | 63,301,900 | |
| 推定免税額 | (73,683,989) | | | (63,301,900) | |
| 繰延税項目純資産(負債) | $ | — | | | $ | — | |
米国連邦法定税率と会社の有効税率の入金は以下の通りである
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 法定税率の連邦所得税割引 | 21.00 | | | 21.00 | |
| 州所得税、連邦福祉を差し引いた純額 | (0.27) | | | 1.05 | |
| 永久品 | (1.26) | | | 0.53 | |
| 評価免除額を変更する | (18.50) | | | (21.39) | |
| 研究開発税収控除 | 1.28 | | | (1.05) | |
| 他にも | (2.25) | | | 0.93 | |
| 有効所得税料金率 | 0.00 | % | | 1.07 | % |
当社の税収関連準備金は、当社がその税務申告または立場で得た税収割引がどれだけあるかを決定し、税収割引に関連する任意の潜在的または有事項を解決した後に実現される可能性が高いことに基づいています。2022年12月31日及び2021年12月31日まで、当社は違います。確認されていない税金の割引または関連する利息と罰金は計算されなければならない。同社は所得税の計上で利益が確認されていないことに関連する利子と罰金を確認する。当社がまだ確定していない不確定税務状況は、関連税務機関がまだ審査すべき年度に関係する。当社は赤字繰越状況にあるため、当社は通常、赤字繰越のあるすべての納税年度に米国連邦、州、地方所得税当局の審査を受けなければならない。
NOTE 10 – 引受金とその他の事項
許可協定
西北大学許可協定
二零一六年十二月に、当社は西北大学(“西北大学”)とライセンス契約を締結し、これにより、西北大学は、特定化合物及び当該化合物に関する使用方法、及び西北特許権が主張する発明実践に関するいくつかの独自技術に関するいくつかの発明特許権(“西北特許権”)のグローバル独占許可を当社に付与する。同社はこの合意に基づいてOV 329を開発している。
西北大学の協定によると,同社は西北大学特許権を用いてすべての用途の製品研究,開発,製造,商業化を行う独占権利を付与されている。同社は、西北大学の特許権を使用して癌治療製品を開発しないことに同意しているが、西北大学はこの技術の権利を他の人に癌に適用してはならない。同社はまた、合意期間内にある知的財産権下の独占許可を行使することができ、許可プロトコルの主要化合物と同じまたは類似した作用機序を有する新しい化合物をカバーする選択権を持っている。西北大学は、自分及び他の非営利機関を代表して西北大学特許権を教育及び研究目的に使用し、その中で主張されている発明を実践する権利を保持し、西北大学特許権がカバーする発明に関する情報を発表する。
西北協定を締結した後、会社は入金できない使い捨て許可証発行費を前払いしました75,000毎年$のライセンス維持費の支払いを要求されています20,000これは、協定に基づいて初めて商業販売許可製品を販売した後に西北大学に支払われる任意の特許権使用料から差し引かれる。同社は西北特許権の提出、起訴、維持のすべての継続費用を担当しているが、自分の特許弁護士を用いてこのような活動を制御する権利もある。西北協定により当社に付与された権利の対価格として、当社は西北に総額$までの支払いをしなければなりません5.3西北特許権がカバーする最初の製品がいくつかの開発と規制マイルストーンを実現した後、及びこのような製品の商業化の際には、会社、その関連会社又は分被許可者による当該製品の純売上高について中央値までの割合で西北に分級特許権使用料を支払うことが要求されるが、基準の減少と相殺を遵守しなければならない。会社の特許使用料義務は、その国の適用製品をカバーするライセンス特許の最後に満了した有効な権利要件が満了したときと、その製品が同国で初めて商業販売されてから10年後まで、製品および国/地域で継続して行われる。会社が西北大学特許権を再許可した場合、会社が受信した指定された割合の再許可収入を西北大学に支払う義務があり、高い1桁から低い10代までの範囲である。
西北大学の合意は会社に商業的で合理的な努力を使って少なくとも開発と商業化を要求している1つは西北特許権に保護されている製品。
事前に終了しない限り、西北大学の合意は、当社が当該合意に基づいて負担する支払い義務が満了するまで有効である。当社は、事前に書面で通知した場合には、任意の理由で合意を終了したり、ノースウエスト航空が治癒していない重大な違約行為により合意を終了する権利があります。ノースウエスト航空は会社が治癒していない重大な違約或いは債務不履行のために協議を中止する可能性がある。
アスリーカンABライセンス契約
2021年12月30日、同社はアスリコン社と独占許可協定に署名し、主要な候補TV 350を含むKCC 2トランスポーターに対する早期小分子ライブラリーを構築した。契約を実行する際には、同社は現金#ドルを前払いする義務がある5.0百万株と発行済み会社の普通株で、金額は$に相当する7.3百万ドルは、取引実行日直前の30営業日前の会社普通株の出来高加重平均価格に基づいている。アスリーカンライセンス契約で買収された無形資産は将来的に代替用途がないため,発生するすべてのコストは研究開発費とみなされる。同社は合わせて#ドルを記録した12.32021年12月の間、本協定に関連する研究開発費は100万ドルである。
アスリコン許可協定によると、同社は$までの潜在的なマイルストーンの支払いに同意した203.0いくつかの開発、法規、販売マイルストーンを実現した上で、100万ユーロに達した。最初の支払いは$です3.0100万ドルは,第1段階臨床研究でバイオマーカー読み取り数が陽性となった後,特許製品の第1段階第2臨床研究に成功したためである。
Gensaic連携とオプションプロトコル
当社は2022年8月にGensaicと協力およびオプション協定(“協力協定”)を締結した。協力プロトコルは、Gensaicの独自のプラットフォーム上で、ある中枢神経系の稀な疾患標的に対するバクテリオファージ由来粒子(PDP)製品の研究と開発に関連する。
Gensaicは、協力協定に基づいて、特定の識別された鉛PDP製品に関する独占的許可を得るために、選択権の満了前の任意の時間に行使することができる独占的選択権を当社に付与する。ある製品が会社によって十分な効果が証明されたと判断されると、会社はそのPDP製品の特定の研究計画に対してその選択権を行使することができる。
会社はGensaicが決定したPDP製品の特定研究計画に関する研究費用を補償しなければならない。研究計画と予算は双方が共同で合意しなければならない,超えてはならない
$3.0どの研究年度にも百万ドルあります。研究費が発生している間、会社はこれらの精算金を研究·開発費として記録する。
製品が本合意により最終的に商業化された場合,会社は許可されたすべてのPDP製品の特許権使用料期間内の純売上に応じて,中央桁から下位2桁までの階層的特許権使用料をGensaicに支払う必要がある。同社は最高可達$の潜在的な等級別マイルストーン支払いも担当しています452.0百万ドルは、3つ以上の製品のいくつかの販売マイルストーン事件と開発マイルストーン承認の実現に基づいている。Gensaicはまた,Gensaicがその選択権を行使した日から会社コストの一定割合で徴収される費用と引き換えに,PDP製品開発と商業化のパートナーとなることを選択することができる.もしGensaicがその選択権を行使することを選択した場合、会社はこれ以上Gensaic特許権使用料やマイルストーン支払いを支払う必要がないだろう。
当社は終了日の90日前にGensaicに書面で通知し、本合意を終了することができます。
2022年12月31日まで、これらや支払いは可能とは考えられない。
事件があったり
クレーム、評価、訴訟、罰金、罰金、および他のソースによるまたは損失のある負債は、負債が発生し、金額が合理的に推定できる可能性が高い場合に記録される。損失の有無に関する法的費用は発生時に費用を計上する。当社は現在、正常な業務過程で生じる法的事項については何も触れていません。
それぞれの雇用協定条項によると、会社の各任命された幹部は、“原因”や“永久障害”や“十分な理由で退職”する資格がない場合に解散費や福祉を得る資格があり、任命された幹部が会社に満足できるクレームを提出することと、任命された幹部が終了日後2年以内に競業禁止·入札制限の条約を遵守することに依存する。
NOTE 11 – 協力協定
Angelini協力
2020年7月9日,当社はAngelini許可協定を締結し,これにより,当社はAngeliniに独占的権利を付与し,ヨーロッパ経済地域およびスイス,イギリス,ロシアおよびトルコ(“ヨーロッパ領土”)でAngelman症候群の治療に用いられるGABAA受容体選択性アゴニストOV 101を開発·商業化した。
2021年3月29日、当社はAngeliniライセンス契約の終了通知を受け取りました。その後、アンジェリーニは当社と共同で6ヶ月の終了通知条項を放棄することに同意したが、アンジェリーニ許可協定は2021年3月31日に終了した。当社はその履行責任を解除し、Angeliniライセンス契約に基づいて将来のマイルストーン支払いを得る権利はありません。
同社はAngeliniライセンスプロトコルを評価し、それがASC 808であるかどうか、連携スケジュールの目的の連携スケジュールであるかどうかを決定する。同社は,Angeliniはライセンスの最終決定者や合法的な所有者ではないため,Angeliniは積極的な参加者とはみなされないため,AngeliniライセンスプロトコルはASC 808の範囲内ではないと結論している.同社の結論は,Angeliniは合併許可と研究開発活動の顧客であるため,AngeliniライセンスプロトコルはASC 606に基づいて評価すべきである.
同社はAngeliniライセンス協定に基づき,(1)OV 101に関連する知的財産権許可,(2)いくつかの行われている試験の完了,(3)特定の数の化合物と関連情報の譲渡,(4)潜在的資金,の重大な約束を決定した35アンジェリーニの将来の試験費用の%は、$に制限されています7.0(5)製造プロセス技術移転を完了する。
その会社はこのドルを7.0100万は顧客に支払われた潜在的なお金を表し、延期された。複合体と関連情報の譲渡はマイルストーンの支払いとみなされ,Angeliniがマイルストーンを受け取ったときに確認される.同社はさらに、ライセンスと行われている試験の完了が異なることを確認しており、いずれも相手の価値がないためである。したがって、ASC 606の場合、会社は、この2つの重大な約束が異なる履行義務を代表すると認定する。
Angeliniライセンス契約および2020年12月31日までの年度末までに、Angeliniは当社に前払い金$を提供します20.0百万ドルです。アンジェリーニは指定された数の化合物と関連情報を譲渡して受け取った後、アンジェリーニは会社に#ドルを追加的に支払った5.0百万ドルです。この履行義務は可変対価格として決定され、制限され、前払い取引価格割り当ての一部とはみなされない。同社は取引価格が前払い費用#ドルに等しいことを確認した20.0百万ドルです。取引価格はライセンスの独立販売価格と行っている試験に基づいて分配される。
2022年12月31日までの年間で違います。収入はAngelini許可プロトコルによって確認された。2021年12月31日までの年度中にAngeliniライセンス契約終了後に発効し、当社は確認しました12.4100万ドルの収入があります5.4現在行われている試験に関する許可収入は百万ドルです7.0潜在力に関連した百万人35アンジェリーニの将来の試験費用の%資金。
武田が協力する
二零一七年一月六日、当社は武田と許可及び協力協定を締結し、この合意に基づき、当社はいくつかの地域でSoticlestatを開発及び商業化するために武田にいくつかの独占的権利を付与した。
2021年3月に当社は武田とRLT協定を締結し、これにより武田は当社を取得しました50同社は関連する知的財産権に基づいて武田にSoticlestatグローバル独占許可を授与し、発育とてんかん脳症(Drave症候群とLennox-Gastaut症候群を含む)の治療のための研究薬Soticlestatを開発·商業化した
RLTプロトコルによると、Soticlestatのすべての権利は武田が所有しているか、または当社が独占的に武田に許可している。武田はSoticlestat開発と商業化のすべての責任とコストを担っており、当初の協力協定によると、会社はマイルストーン支払いや将来の開発·商業化コストを含めて武田に対していかなる財務義務も負うことはなくなった。2021年3月29日、RLT協定が完了した後、会社は前金#ドルを受け取りました196.0Soticlestatが開発に成功すれば、最高の追加$を得る資格があります660.0武田は開発、規制、販売マイルストーンを実現した上で、100万ユーロを獲得した。また、同社は低い2桁から始め、最高で20規制部門の承認を得ると、Soticlestatの売上高は1%となる。当該製品が当該国で初めて商業販売された日から当該製品が当該国/地域の特許権が満了した日から当該製品が初めて商業販売された指定周年日までの間、Soticlestatが当該製品の使用及び販売を許可されたことを示す標識は、国及び製品の具体的な状況に応じて印税を支払う。
会社はRLT協定に基づいて、(1)RLT合意終了前の第2営業日(“締め切り”)に遅れないこと、会社と武田は2021年3月31日までの元の協力協定に基づいて計算すべき開発費用または計算すべき開発費用の推定で合意しなければならないことを決定した。(2)締め切りにおいて、会社は、(I)Soticlestat計画に関連する材料、情報、およびデータを武田に提供し、譲渡しなければならない。RLTプロトコルにさらに規定された臨床試験データおよび結果を含み、(Ii)Soticlestat計画に適用されるいくつかのプロトコルを武田に譲渡し、(Iii)元の協力協定に従って開発または作成され、締め切りに会社および武田によって共同所有されるすべての知的財産権のうち、すべての知的財産権における権利、所有権および権益を武田に譲渡する。(3)2021年3月31日以降45日以内に、会社と武田は、相手が指定した財務者に書面報告を提出し、2021年3月31日までの最終課税開発費用総額をリストアップし、この報告を受けてから10営業日以内に、財務者は武田会社または会社が武田会社に支払うべき純決算について合意しなければならない。および(4)締め切り後75日以内に,締め切りが提供されていない範囲では,(I)Soticlestat計画に関する任意の材料,情報,データ,RLTプロトコルでさらに規定されている臨床試験データと結果を含む,(Ii)Soticlestat計画に関する開発·開発に必要な他の文書(すべての満期プロトコルおよびプロトコルに基づいて作成された関連データを含む)を武田に提供すべきである, Soticlestatの商業化と製造、例えばRLTプロトコルにおけるさらなる規定、および(Iii)Ovid制御の知的財産権の任意の有形表現は、武田がSoticlestatプログラムを利用するために合理的に必要であり、使用または保有している。
同社は取引価格が前払い費用#ドルに等しいことを確認した196.0この額は100万ドルで、上記で決定されたすべての4つの履行義務と関係がある。なお,履行義務3と履行義務4に関するインクリメンタル作業は無視でき,“地域土地利用協定”の範囲でも実質的ではなく,すべての情報が当社の既存情報の協力期間に関係しているためである。したがって,これらはRLTプロトコルでは実質的ではないため,全額前払い費用は成約時に履行される2つの履行義務に割り当てられる.
2022年12月31日までの年間で違います。料金はRLTプロトコルによって確認されました。2021年12月31日までの年間で、会社は研究開発費のローンが#ドルであることを確認した2.5100万ドルで$と確認しました0.1一般および行政支出、すなわち武田が当社に支払うコストは、百万元である。
Healxライセンスとオプションプロトコル
2022年2月1日、会社はHealx許可とオプション協定を締結した。Healx許可とオプション合意の条項に基づき、Healx,Ltd.は1年間の選択権を獲得し、ガボサドール(OV 101)を研究し、2 A期臨床試験における脆性X症候群潜在連合療法の一部、及びその他の適応の治療として、前払いを$とした0.5100万ドルと、会社の関連知的財産権の起訴と維持を支援する費用。1年間の選択期間が終了したとき、Healxは追加の$と交換するために、会社の関連知的財産権から独占ライセンスを取得する権利がある2.0百万ドル、開発と商業マイルストーンの支払い、そして中低レベルの二桁印税。2023年2月1日から、このオプションの期間はさらに3ヶ月延長される。適用される場合は,当該製品が当該国で初めて商業販売された日から当該製品が当該国の特許権の満了日及び第1次商業販売の指定周年日までの期間内に,国毎及び製品毎に使用料を支払わなければならない
選択権行使後,Healxはガ博多の開発と商業化のすべての責任とコストを負う。同社はHealxとの共同開発と共同商業化計画の選択権(“Ovid Opt−in Right”)を保持し、臨床2 B期の積極的な読み取り終了時に、マイルストーンや特許権使用料の支払いの代わりに純利益と損失を共有する。Ovid-opt-inの権利を行使すれば、会社はHealxに支払うことを要求されます50開発コストの%です。同社はガ博多のさらなる試験を行うつもりはない。Healx許可およびオプション合意の期限が(A)すべての関連特許権使用料条項が満了するまで継続する場合、またはHealxがHealx許可およびオプション合意で定義されたオプション期限(“オプション期限”)内でそのオプションを行使しない場合、その期限が満了したとき、または(B)Healxがオプション期間内にそのオプションを行使し、会社が加入期限(“加入期限を選択”)内にOvidを行使しないことを選択した場合、または加入条項を他の方法で終了することを選択した場合、すべての支払い義務が満了したとき、あるいは(C)Healxがオプション期間中にオプションを行使し,会社がオプション加入期間中にOvidの選択権を行使した場合,HealxもOvidもガボサドールの採掘を継続しない.
2022年12月31日までに、当社は収入$を記録しました0.5Healx許可とオプションプロトコルに関する100万ドル。
Marinus PharmPharmticals許可プロトコルを終了します
当社は2022年3月1日にMarinusと独占特許ライセンス契約(“Marinusライセンス契約”)を締結した。Marinusライセンス協定によれば、会社は、CDKL 5欠乏症の治療のために、香港(米国、ヨーロッパ経済地域、イギリスおよびスイスからなる)で開発、製造、製造、商業化、普及、流通、販売、販売および輸入許可製品を提供するために、Marinusに独占的、譲渡不可能(明記されていない限り)、印税が権利を負担し、Ganaxoloneに関連するOvid特許下の許可を付与する。Marinusは、2022年3月18日にFDAによるこの地域初の許可製品の規制承認を受けた日から、会社の選択に基づいて発表した123,255Marinus普通株額面$0.001一株につき、お支払いになります。Marinusライセンス契約はまた,Marinusが販売するこのようなライセンス製品ごとの純売上高に応じて会社に1桁の特許権使用料を支払うことを規定している。
同社が記録した収入と持分証券への関連投資は約#ドルである0.92022年3月18日の特許許可協定に関する百万ドルは、2022年3月1日のMarinus普通株の価格に基づいている。同社はMarinus普通株で#ドルの赤字を達成していない0.52022年12月31日までの年度純額は、株式証券が赤字を達成していないと記入し、他の収入(支出)に反映させ、総合経営報告書では純額とした。
付記12--関連先取引
2021年3月、当社は武田とRLT協定を締結した。RLTプロトコルに関する説明は,付記11を参照されたい.
NOTE 13 – 1株当たり純収益
1株当たり基本純(損失)収益は、期内に発行された普通株の加重平均から計算され、まだ帰属していない既発行株式オプションは含まれていない。希釈して1株当たりの純収益は
計算根拠は,期内に発行された普通株の加重平均に期内に発行された加重平均普通株同値株式の希薄化の影響を加えたのは,在庫株方法で決定された既発行株式オプションの行使を仮定し,優先株を普通株に変換すると仮定してIF-変換法で決定したためである.1株当たりの純損失は、発行された購入株権と転換可能な優先株を除去することによる1株当たりの基本純損失に相当し、これらの証券を組み入れることは1株当たりの金額に逆償却効果が生じるからである。
普通株の基本純(損失)収益と希釈後純(損失)収益は,証券と多種類株に参加するために必要な2段階法に基づいて報告されている。当社はその優先株を参加証券と見なしている。
当社が純収益を記録している任意の期間において、普通株株主が純収益を占めるべきであると判断した場合には、参加証券に割り当てられた未分配収益を純収益から減算する。未分配収益は、当年の収益が分配されたように、優先株と普通株の参加権によって分配される。会社が純損失を確認している期間については、未分配損失は普通株にのみ割り当てられており、参加した証券は契約に基づいて会社の損失に参加しないためである。1株当たり基本純(損失)収益の算出方法は,普通株株主に帰属する純(損失)収益を当期発行普通株の加重平均数で割ることである。
下表は、1株当たりの基本と赤字(赤字)収益の算出方法をまとめたものである
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 純収益 | $ | (54,169,029) | | | $ | 122,834,584 | |
| 証券参加者は純収益を占めなければならない | — | | | (2,997,344) | |
| 普通株主は純収入を占めなければならない | $ | (54,169,029) | | | $ | 119,837,240 | |
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 普通株主は純収入を占めなければならない | $ | (54,169,029) | | | $ | 119,837,240 | |
| 加重平均発行された普通株式 1株当たりの純収益を計算する-基本 | 70,424,819 | | | 67,479,403 | |
| 加重平均発行された普通株式 1株当たりの純収益を計算する-減額する | 70,424,819 | | | 68,067,992 | |
| 1株当たりの純収益は,基本的に | $ | (0.77) | | | $ | 1.78 | |
| 薄めて1株当たり純収益 | $ | (0.77) | | | $ | 1.76 | |
以下の希釈可能な証券は、逆希釈されるので、加重平均流通株を希釈する計算から除外されている
| | | | | | | | | | | |
| 12月31日までの年度 |
| 2022 | | 2021 |
| 普通株購入株式オプション | 12,961,238 | | | 10,776,758 | |
| Aシリーズ転換優先株変換後に発行可能な普通株 | 1,250,000 | | | 1,250,000 | |