
カタログ表
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,郵便番号:20549
表
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
_から_への過渡期
手数料書類番号
(登録者の正確な氏名はその定款に記載)
|
||
(明またはその他の司法管轄権 |
|
アメリカ国税局の雇用主は |
|
|
|
|
||
(主な行政事務室住所) |
|
(郵便番号) |
(
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引コード |
|
各取引所の名称 |
|
|
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい。☐
登録者が当該法第13条又は第15条(D)に従って報告書を提出する必要がないか否かを、再選択マークで示す。はい。☐
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−Tルール405に従って提出されなければならないと規定されている各対話データファイルを電子的に提出したかどうかを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社か小さい報告会社かを再選択マークで示した。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”の定義を参照されたい。(1つを選択):
大型加速ファイルサーバ |
|
☐ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|||
|
☑ |
|
比較的小さな報告会社 |
|
||
|
|
|
|
|||
|
|
|
|
新興成長型会社 |
|
|
もし新興の成長型会社の場合、登録者は、取引法第13(A)節に従って提供された任意の新しいまたは改正された財務会計基準を遵守するために、延長された移行期間を使用しないことを選択したかどうか
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる。
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意のエンタルピーCER幹部が相関回復期間内に§240.10 D−1(B)に基づいて受信したインセンティブベースの補償に基づいて回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、違います
非関連会社が保有する登録者普通株の総時価は#ドルである
2023年3月2日までに
1
カタログ表
引用で編入された書類
登録者2023年株主総会の委託書部分は,本年度報告の表格10−Kの第III部に引用的に組み込まれる。
2
カタログ表
ALaunos治療会社は
表格10-Kの年報
2022年12月31日までの財政年度
表札LE of CONTENTS
|
|
|
|
ページ |
|
|
第1部 |
|
|
|
|
||
|
|
|
||||
第1項。 |
|
業務.業務 |
|
|
7 |
|
第1 A項。 |
|
リスク要因 |
|
|
25 |
|
項目1 B。 |
|
未解決従業員意見 |
|
|
52 |
|
第二項です。 |
|
属性 |
|
|
52 |
|
第三項です。 |
|
法律訴訟 |
|
|
52 |
|
第四項です。 |
|
炭鉱安全情報開示 |
|
|
52 |
|
|
|
|
||||
第II部 |
|
|
|
|
|
|
|
|
|
||||
五番目です。 |
|
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
|
|
53 |
|
第六項です。 |
|
[保留されている] |
|
|
53 |
|
第七項。 |
|
経営陣の財務状況と経営成果の検討と分析 |
|
|
54 |
|
第七A項。 |
|
市場リスクの定量的·定性的開示について |
|
|
63 |
|
第八項です。 |
|
財務諸表と補足データ |
|
|
64 |
|
第九項です。 |
|
会計·財務開示面の変更と会計士との相違 |
|
|
64 |
|
第9条。 |
|
制御とプログラム |
|
|
64 |
|
プロジェクト9 B。 |
|
その他の情報 |
|
|
65 |
|
プロジェクト9 C |
|
検査妨害に関する外国司法管区の開示 |
|
|
65 |
|
|
|
|
||||
第三部 |
|
|
|
|
|
|
|
|
|
||||
第10項。 |
|
役員·幹部と会社の管理 |
|
|
66 |
|
第十一項。 |
|
役員報酬 |
|
|
66 |
|
第十二項。 |
|
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
|
|
66 |
|
十三項。 |
|
特定の関係や関連取引、取締役の独立性 |
|
|
66 |
|
14項です。 |
|
チーフ会計士費用とサービス |
|
|
66 |
|
|
|
|
||||
第4部 |
|
|
|
|
|
|
|
|
|
||||
第十五項。 |
|
展示品と財務諸表の付表 |
|
|
67 |
|
第十六項。 |
|
表格10-Kの概要 |
|
|
70 |
|
|
|
サイン |
|
|
71 |
|
|
|
財務諸表 |
|
|
F-1 |
|
3
カタログ表
前向き陳述に関する特別説明
本年度報告は,改正された“1995年個人証券訴訟改革法”で定義された前向き陳述を含むForm 10−Kまたは年次報告の形式である。前向きな陳述は、本年度報告に含まれるすべての非歴史的事実の陳述を意味し、場合によっては、“予想”、“信じる”、“推定”、“予想”、“予測”、“意図”、“可能”、“計画”、“プロジェクト”、“目標”、“将”、および他の意味的に類似した語および用語によって識別することができる。
これらの陳述は、経営陣の現在の信念と仮定、および経営陣が現在把握している情報に基づいている。これらの表現はリスク、不確定要素と他の要素に関連し、実際の結果、活動レベル、業績或いは業績を招く可能性があり、これらの前向き表現と明示或いは暗示の情報は大きく異なる。私たちはこれらの展望的陳述に反映される予想が合理的だと信じているが、これらの陳述は私たちが現在知っている事実と要素、そして私たちの未来の予測に基づいており、私たちはこれらの事実と要素を決定することができないということを想起させます。本年度報告書の展望的な陳述は、以下の陳述を含むが、これらに限定されない
本年度報告中の10-K表の任意の前向き陳述は、既知と未知のリスク、不確定性およびその他の要素に関連し、未来の事件または私たちの未来の財務表現に対する私たちの現在の見方を反映しており、私たちの実際の結果、業績または業績は、これらの展望的陳述と明示的または暗示的な任意の未来の結果、業績または業績とは大きく異なる可能性がある。実際の結果が現在の予想と大きく異なることをもたらす可能性のある要因は、第I部分第1 A項“リスク要因”と、本年度報告10−K表の他の部分に記載されている要因とを含む。このような不確実性を考慮して、あなたはこのような前向きな陳述に過度に依存してはいけない。法的要求がない限り、私たちは未来に新しい情報があっても、これらの前向きな陳述を任意の理由で更新または修正する義務がない。
文意が別に指摘されている以外に、本年度報告で言及されている“ALaunos”、“会社”、“私たち”、“私たち”または“私たち”はALaunos治療会社とその子会社を指す。
4
カタログ表
当社の会社名、ロゴ、サイト名を含む、当社の業務運営に関連する商標、サービスマーク、商品名を所有または使用する権利があります。私たちはALaunos?、Ziopamm、Huntr商標、私たちのサイトのグラフィック商標を持っています。本年度報告でForm 10−K形式で出現した他の商標,サービスマーク,商号はいずれもそれぞれの所有者の財産である。便宜上、本年度報告にForm 10−K形式で記載されているいくつかの商標、サービスマーク、および商号は使用されていないが、適用法に基づいて、私たちの商標、サービスマーク、および商号に対する私たちの権利を最大限に維持します。
5
カタログ表
我々の業務に関する選定リスクの概要
私たちの業務は重大な危険と不確実性に直面している。以下のいずれかのリスクが発生すれば、私たちの業務、財務状況、経営結果は重大な悪影響を受ける可能性があります。閣下は、本年度報告第I部第1 A項“リスク要因”の節の当社リスク要因の全面的な検討を慎重に検討し、考慮すべきである。より重大なリスクには以下のリスクが含まれています
6
カタログ表
第1部
プロジェクト1.ビジネス
概要
著者らは臨床段階の腫瘍学に集中する細胞治療会社であり、TCR工学T細胞療法、或いはTCR-Tを開発し、大量の癌患者群の中で臨床需要を満たしていない多種の固形腫瘍タイプを治療することを目的とした。私たちは癌ホットスポット変異TCRライブラリーと独自の非ウイルスを利用しています寝美人遺伝子転移プラットフォーム、患者に対する細胞療法、重要な発癌遺伝子に対するよく見られる腫瘍関連変異から産生される新しい抗原を設計と製造するKRAS, TP 53そしてEGFR.EGFRそれは.テキサス大学MDアンダーソン癌センター(MD Anderson)と協力し、現在患者を募集して1/2期臨床試験に参加し、12個のTCRの突然変異に対する反応を評価しているKRAS, TP 53そしてEGFR.EGFR著者らのTCRバンクは非小細胞肺癌、結腸直腸癌、子宮内膜癌、膵臓癌、卵巣癌と胆管癌の研究治療に用いられ、著者らはTCR-Tバンクの1/2期試験と呼ばれる。
米国では固形腫瘍は新診断癌の約90%を占めている。2023年に米国では約200万人が癌と診断され,2023年には米国では約61万人が癌で死亡すると予想されている。われわれのTCR−Tライブラリー1/2期試験では,われわれが対象としたいくつかの癌は2023年に米国で診断された最も一般的な癌の一つになると予想されている。2023年には238,340人が肺癌と気管支癌,153,020人が結腸直腸癌,66,200人が子宮内膜癌,64,050人が膵癌,19,710人が卵巣癌,約8,000人が胆道癌と診断されると予想される。遺伝子の変異KRAS, TP 53そしてEGFR.EGFR遺伝子は通常多くの癌で発現される。
次の表に私たちの多様な固形腫瘍パイプライン計画を示します。

固形腫瘍に対するTCR-T計画は
我々のTCR-T計画は他の固形腫瘍の細胞治療方法よりいくつかの潜在的な優勢があると信じており、CAR-Tと腫瘍浸潤性リンパ球、あるいはTILを含む。CAR−Tと比較して,これらの潜在的な利点は,我々のTCR−T計画が細胞内および細胞外の新しい抗原を対象としているのに対し,CAR−Tは主に細胞外抗原を対象としていることを含む。TILと比較して、これらの潜在的な利点は、我々のTCR-T計画が製造に使用される遺伝子工学から標的特異性を定義することを含むが、TILでは、特異性は、導入された免疫受容体ではなく内因性TCRに由来することが一般的である。
7
カタログ表
TCRの背景について
我々の戦略はTCRsを通じて癌ゲノムの不安定なマーカーを狙うことである。癌細胞中の遺伝子はタンパク質の産生を引き起こすことができ,その後これらのタンパク質は細胞によってポリペプチドと呼ばれるタンパク質断片に処理される。これらのポリペプチドは、癌細胞表面の特殊な分子のセットからT細胞に渡され、ヒト白血球抗原、またはヒト白血球抗原系と呼ばれる。ポリペプチドが提示されるとTCRを介してT細胞が活性化し,これらのポリペプチドは抗原と呼ばれる。
これらの免疫原ペプチドがタンパク質由来であり、タンパク質が腫瘍細胞のみで変異した遺伝子によって発現されている場合(例えば、胚系ではなく癌ゲノム内でコードされている)、新規抗原と呼ばれる。ヒト白血球抗原により新たな抗原を提示する腫瘍細胞はT細胞の標的である。T細胞は新しい抗原を呈する癌細胞を認識して殺すことができる。この方法は伝統的なCARSと異なり、CARSは直接に悪性B細胞表面の抗原、例えばCD 19を識別し、HLA提示を必要としない。
一般に,免疫系は主に免疫寛容と呼ばれる過程で身体自身の健康細胞を標的とすることを回避しており,この過程により,T細胞は正常タンパク質由来のHLA含有ポリペプチドに反応しない。TCRがヒト白血球抗原系に提示するポリペプチドの識別は重要な免疫機序であり、人体は癌を含む外来脅威に反応し、身体自身の健康細胞を目標とすることを避けることができる。
腫瘍は各種の策略を利用して宿主免疫システムを逃避と抑制する。これは通常腫瘍内に存在するT細胞を招き、TILと呼ばれ、無効であり、腫瘍特異性TCRsを発現するにもかかわらず、その効果機能を回収して腫瘍を殺すことができない。免疫抑制を克服するためには,末梢血液中に発見されたT細胞のようなより健康なT細胞が必要である可能性がある。しかしながら、これらの循環中のT細胞は、通常、十分な数の腫瘍特異的TCRを発現しない。
新しい抗原は腫瘍特異的突然変異遺伝子によってコードされ、これらの遺伝子は通常各患者に唯一無二である。これらの独特な新しい抗原を標的とするには患者の基礎の上でTCRを産生する必要がある。癌の発生と発展過程において、腫瘍細胞は自然に発生する遺伝子突然変異を獲得し、これらの遺伝子は転化を担当し、駆動突然変異と呼ばれる。その中のいくつかの駆動突然変異はホットスポットと呼ばれる共通の位置で発生し、腫瘍タイプの間と個体の間で共有する突然変異である。ドライバ変異は予見可能であるため,患者が必要とする前にTCRを用意し,ライブラリ中のTCRライブラリを形成する可能性がある。
新しい抗原に対する私たちの方法は
固形腫瘍の治療に成功するためには、1つまたは複数の新しい抗原を標的とするトランスジェニックT細胞が、(1)一群の患者において、すべての腫瘍が腫瘍間異質性と呼ばれる新しい抗原を発現するわけではない、(2)単一の患者において、すべての腫瘍細胞が標的抗原を発現するわけではなく、腫瘍内異質性と呼ばれる、という事実を解決する必要があると考えられる。腫瘍間の異質性は治療資格のある受容者の数を制限しているが,腫瘍内の異質性は抗原脱出変異のリスクをもたらし,癌再発の可能性を増加させている。したがって,新たな抗原に対するT細胞療法を開発する会社は,腫瘍内と腫瘍内の異質性を同時に解決しなければならないと考えられる。
著者らは末梢血由来のT細胞を遺伝子修飾し、腫瘍由来抗原、特に新しい抗原に特異的なTCRを発現し、投与前に十分な数まで増殖させた。我々の目標は新しい抗原を標的とする重要な挑戦を克服することであり、方法はDNAプラスミドを用いてT細胞を再プログラミングし、患者に基づいて導入したTCRを発現することである。これは腫瘍の異質性を解決するのを助けるためだ。
我々のTCR−T細胞は,効果性および記憶性T細胞を含む複数の異なるT細胞亜群を含む。効果性T細胞は即時の抗腫瘍活性と関係がある。効果性T細胞に対して、記憶性T細胞はより大きな成長潜在力を持っている。我々のいくつかのTCR-T細胞はT記憶幹細胞であり、他のT細胞集団に対して最大の成長および更新能力を有するように記述されている。
8
カタログ表
私たちのTCR-T製造技術は
次図に我々の現在のTCR−T候補製品の製造フローを説明した。
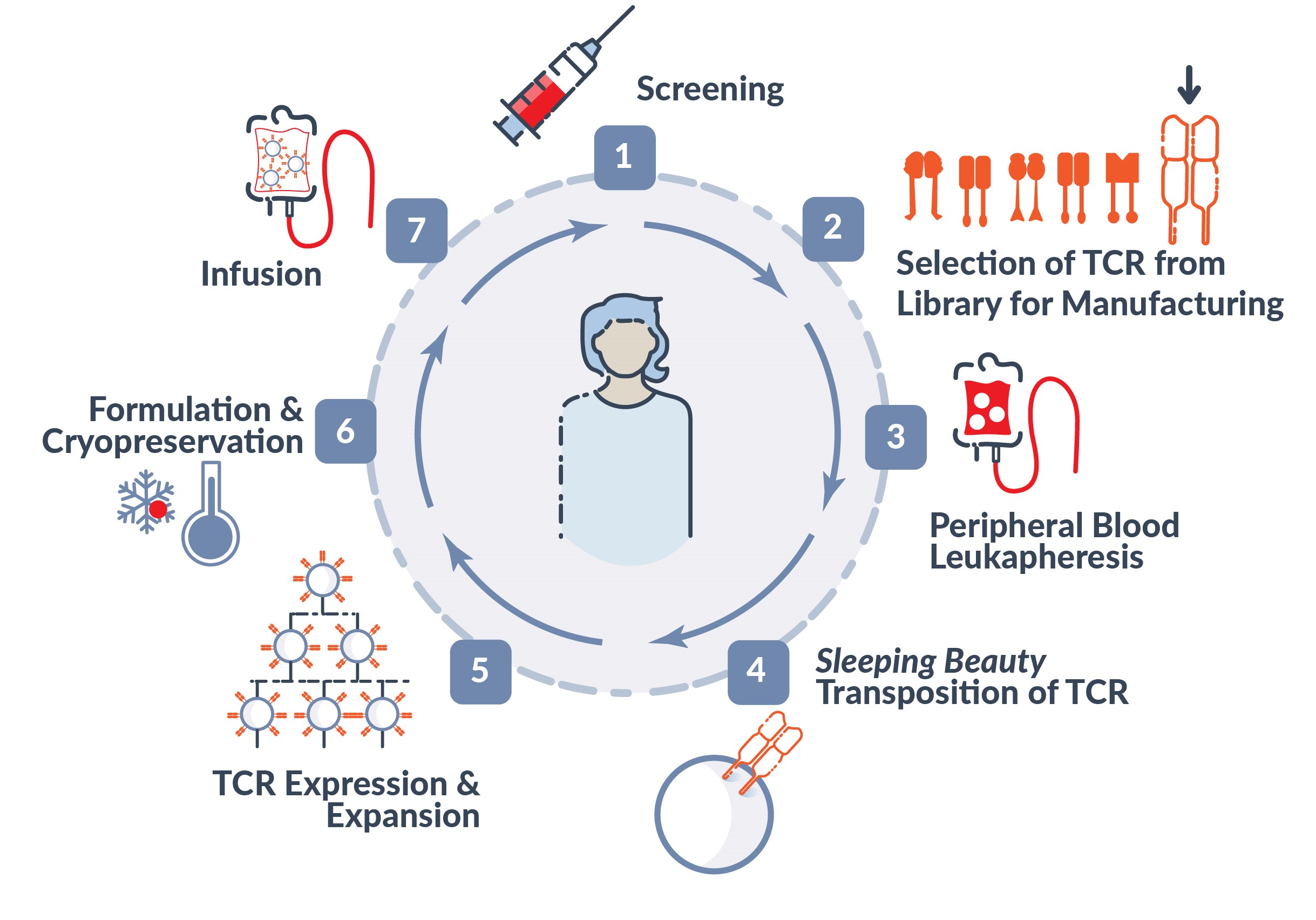
我々のTCR-T方法は癌の中で最も重要で最も普遍的な腫瘍特異的標的であると考えられることに集中している。ホットスポットと呼ばれるターゲット変異は一般的にKRAS,TP 53そしてEGFR、非小細胞肺癌、結腸直腸癌、子宮内膜癌、膵臓癌、卵巣癌と胆管癌に多種の異なる対立遺伝子を発見することができる。これらの駆動遺伝子は細胞分裂、成熟と死亡の調節に重要な役割を果たしているが、これらの遺伝子の突然変異はある癌の発展に重要な役割を果たしていることが観察された。我々のライブラリーTCR-T方法の利点は、固形腫瘍患者の亜群を標的とする新しい抗原スクリーニングを行うことによって、彼らを迅速に治療することができることである(例えば、KRAS, TP 53そしてEGFR.EGFR)を用いて、患者のヒト白血球抗原を認識し、これらの結果をライブラリー内のTCRと一致させる。各種の異なる癌(例えば非小細胞肺癌、結腸直腸癌、子宮内膜癌、膵臓癌、卵巣癌と胆管癌)の患者は腫瘍シークエンシング、患者の腫瘍突然変異鑑定とヒト白血球抗原分類を通じて、著者らの絶えず増加するTCRライブラリーと一致する患者をスクリーニングすることができる。TCRライブラリーとの一致が確認されると、末梢血白血球分離によって患者の白血球の一部を収集し、テキサス州ヒューストンに位置する現在の良好な製造実践またはcGMP製造工場に送信する。
私たちのTCRライブラリーから必要なプレハブTCRトランスポゾンを選択すると、私たち独自の非ウイルストランスポゾンを利用します寝美人遺伝子工学技術は患者のT細胞(CD 4+とCD 8+を含む)を変化させることができる。われわれは末梢血由来のT細胞を用いてわれわれのTCR−T細胞を産生し、T細胞は腫瘍に局在するT細胞と比較して、より若く健康な表現型を有する。これまで治療を受けてきた患者におけるTCR−T細胞の初歩的な臨床細胞動態を考慮すると,これらの修正されたTCR−T細胞は注入後にレシピエントで生存すると信じられている。前臨床研究ではT細胞遺伝子工学が寝美人技術は導入した新しい抗原特異性TCRの迅速かつ安定発現を招いた。高レベルのTCRを発現するトランスジェニックT細胞は増幅され、患者特有の或いは自己のTCR-T細胞製品を産生する。そして製造過程から候補製品を取得し,調製,凍結保存,病院施設に移し,解凍後に患者に注入した。
非ウイルス睡眠美人遺伝子転移プラットフォームの利点は
我々の寝美人遺伝子転移プラットフォームは、以下に説明するものを含むいくつかの利点を提供する。
9
カタログ表
臨床前と臨床発展
我々のTCR−T候補製品の臨床前開発
すべての許可されたTCRを独立して評価しました寝美人ホームです。臨床翻訳の候補TCRは従来に基づいている体外培養免疫学的に測定する。我々は,2021年米国癌研究協会(AACR)と癌免疫治療学会(SITC)年次総会でこれらのデータを公表した。我々がTCRを選択した理由の一部は,T細胞表面での発現能であり,健康細胞を対象とせずに変異の標的を特異的に認識するためである。キラーT細胞として指定されたTCRについて,われわれの臨床前データは,これらのTCR−T細胞が新規抗原を標的とする適切な腫瘍細胞株を死滅させることを示している。著者らの臨床前研究において、TCR-T細胞が対応するヒト白血球抗原と新しい抗原と一致する時、一致しない腫瘍細胞と関連する新しい抗原特異的TCRを発現しない不整合T細胞と比較して、TCR-T細胞の腫瘍細胞に対する殺傷作用は著しく増加することが観察された。
選定した許可TCRもT細胞上のmBIL−15と共発現した。これは,1つのトランスポゾンを転移させて3つの独立した遺伝子(TCRpha,TCRbeta,mBIL−15)をT細胞に転移させることで達成される。我々はこれら3つの遺伝子の定位順序とMBIL-15 TCR-T細胞を産生する特定の成長条件を最適化した。上述した類似した標準免疫学的読み取りを用いて、MBIL-15 TCR-T細胞は伝統的なTCR-T細胞と類似した特異性と効力特徴を示すことが観察されたが、増加が観察された体外培養TCR−T細胞に関連するすべての追加的な支持がない場合、特にT記憶幹細胞集団におけるMBIL−15 TCR−T細胞の生存。我々はすでにこれらの発見をめぐって国際特許出願を提出し,2022年の米国遺伝子·細胞治療学会会議でこのプロジェクトの臨床前データを提出した。MBIL−15は悪い腫瘍微小環境におけるTCR−T細胞の生存率を向上させ,臨床反応を深化させる可能性があると信じている。私たちは2023年下半期に関連研究新薬申請、あるいはINDと呼ばれるように努力している。
TCR−Tライブラリ1/2期試験
2021年2月、我々はFDAの承認を得て、わが社が協賛したINDが1/2段階の開放ラベル、用量増加試験を開始することを許可し、この試験は最初にMD Andersonで行われた。2022年1月,患者のスクリーニング後,われわれのTCR−T図書館1/2期試験に登録を開始し,試験中に最大180名の成人を募集する予定である。我々は、我々のTCRライブラリ中の1つのTCRの標的であり、進行性または再発性固形腫瘍を有し、少なくとも1つの以前の標準治療に失敗した一致したヒト白血球抗原およびホットスポット変異を有する患者のみを募集する。この実験は新しい抗原に対する12のライブラリーTCRを評価していますKRAS, TP 53そしてEGFR.EGFR単一試験では、非小細胞肺癌、結腸直腸癌、子宮内膜癌、膵臓癌、卵巣癌、胆管癌を含む広範な固形腫瘍患者の変異。私たちはすでに使用し、私たちのHunTR発見エンジンを使用して、私たちの実験室の同定に合格したので、新しいTCRを私たちのライブラリおよび臨床計画に追加する予定です。これらの患者は、彼らの癌によって3つの異なる用量レベルに分けられてグループ化される。第一段階の主要な終点は、用量制限毒性または推奨される後続の臨床試験の最大耐性用量を決定することである。試験第2段階の主要な終点は客観応答率を決定し,他の方法で安全性と耐性を評価する予定である。著者らはまた臨床試験においてTCR-T細胞の持続性をモニタリングし、そして多種の常規の免疫モニタリング分析を行い、それらの患者における持続性を評価する。2022年12月31日までに,3人の患者を募集し,薬を処方した。
われわれはCRI−Enci−AACR国際癌免疫治療会議において,2022年9月に治療を受けた上位2名の情報を公表した。われわれが治療した最初の患者は肺腺癌を有しており,以前に複数の一連の治療を受けており,検査点阻害剤には無効であった。われわれが治療した2人目の患者は結腸癌と診断され,様々な基準の先行治療を受けた。2022年12月,われわれのTCR−Tライブラリー1/2期試験では,複数の標準治療経路に無効と診断された3人目の進行膵癌患者に投与することに成功した。我々は、潜在的な組み合わせおよび多重変換を含む次世代TCR-T治療方法を指導するために、我々のTCR-T細胞の生物活性を評価するための翻訳評価を継続する
10
カタログ表
TCR−T細胞療法。これらのデータは早期臨床検証の可能性を提供していると考えられます寝美人高価値適応のTCR−T細胞治療であったが,需要は有意に満たされていなかった。
われわれのTCR−Tライブラリー1/2期試験では,患者1に至るまでKRAS−G 12 Dとヒト白血球抗原A*11:01特異的TCR−T細胞治療による客観的臨床反応が報告されている。患者1輸液製品の品質は良く、生存率は97.3%、CD 3+純度は99.7%、TCR陽性は95.2%であった。ベースラインと比較して,患者1の目標皮膚損傷は6週で46%,12週で51%,24週で46%減少した。治療6ケ月後、右肺で測定できない疾患の選択的腫瘍生検は腫瘍細胞の持続的な存在を示し、KRAS-G 12 D変異とヒト白血球抗原-A*11:01対立遺伝子を示し、7ケ月時に再び選択的スキャンで進行性疾患を実証した。患者1は現在試験を中止し、モニタリングを受けており、著者らの長期フォローアップ方案の一部としている。
患者2の治療はヒト初例である寝美人TP 53ホットスポット突然変異に対するTCR-T細胞療法は、全体的な耐性は良好であった。患者2は高純度のTCR−T細胞(生存率92.5%,CD 3+純度99%,TCR陽性92%)を受けた。投与後6週で標的病変はベースラインより15%減少したが,6週目の測定から病変増加21.8%,12週目に新たな肝と肺転移が認められ,患者2が進行性疾患であることが示唆され,この進展により患者2は試験から除外された。
2022年第4四半期にIND修正案をFDAに提出し,われわれの臨床試験に2つの新しいTCRを追加し,頻回変異とHLAに対して,われわれのTCR−Tライブラリの1/2段階試験の潜在市場を2倍に拡大する可能性がある。MD Anderson癌センターがスクリーニングした700人以上の胃腸或いは肺癌患者のうち、著者らの適合率は約5%から10%以上に向上し、約5分の1の患者が現在のライブラリ中の2つのTCRと一致することを含む。これらの新しいTCRの増加は、既存の変異(KRAS-G 12 VおよびHL A-DRB 1*07:01)および標的遺伝子ファミリー(TP 53-R 273 CおよびHL A-DPI 1*04:02)においてより多くのHLAを増加させることを示唆している。2023年には,我々のライブラリーをさらに拡大し,繰り返し出現するホットスポット突然変異に対するTCRを独占的に発売する予定であるKRAS,TP 53そしてEGFR.EGFRTCRを15個まで。私たちは引き続きTCR-Tライブラリ1/2期試験目標の中で積極的に患者を募集しますKRAS,TP 53そしてEGFR.EGFR6種類の固形腫瘍適応中のホットスポット突然変異。私たちは2023年上半期に複数の患者を募集する予定だ。IND修正案はまた,われわれの治療とスクリーニング案を組み合わせ,登録を簡略化し,患者も医師も容易にすることが可能である。改訂されたINDはまた,スクリーニングと治療の間に6カ月間隔で腫瘍突然変異を再検査する必要があるという要求をキャンセルした。2023年に仮臨床データ更新を提供し,TCR−Tライブラリ1/2期試験を2期に進める努力を予定しており,2023年末までに2期試験を完了する予定である。
IL-12計画
私たちが2021年5月に発表したように、私たちは再発性多形性神経膠芽腫の治療のための制御されたIL-12臨床計画を徐々に終了している。私たちはこの計画を発展させ続けるために協力パートナーを積極的に探している。
製造業
テキサス州ヒューストンにあるcGMP工場にALaunosの人員が配備されていて、私たちのを生産することができます寝美人初期臨床試験の遺伝子転移プラットフォームです私たちは引き続き第三者に依存して私たちの候補製品を生産するためのDNAプラスミドを生産する。
私たちのライブラリーTCR-T方法は、私たちの各合格したライブラリーTCRに対応するDNAプラスミドを予め作製することによって、T細胞製造過程を簡略化することを可能にした。その後、これらのTCRは、患者固有の自己TCR−T候補製品を製造するために使用される。われわれの内部TCR−T製造施設は,われわれの研究開発能力を統合することができ,発見から臨床試験までの患者治療時間を潜在的に減少させた。この統合は、遅延を最大限に削減し、以下のリスクを低減することを目的としています
11
カタログ表
薬物開発過程で遭遇する可能性のある問題は、第三者が必要な製品の生産に成功できなかったこと、技術移転周期が長いこと、注文納期が長いことを含む。私たちは製造能力と効率を拡大するために、私たちの多管的な戦略を継続して実行する。私たちの製造能力は2022年に2倍になり、2種類の製品の同時生産が可能になった。IND改正案を提出し,新鮮製品から低温保存製品に移行し,2023年上半期にこの変化を実施した。凍結保存した細胞製品を用いて製造過程の時間を30日から26日に減少させ,13%減少させるとともに,患者スケジューリングと治療の柔軟性を増加させる予定である。私たちはプロセスを最適化し、製造時間をさらに減らすための措置を取っている。
私たちはプロセスと分析開発を通じて、私たちの製造と発表ワークフローの改善を求めています。著者らの流れは引き続き最適化し、効率を高め、新しい技術を採用し、患者の治療時間を減少させる。
知的財産権
私たちの目標は、私たちの候補製品、配合、プロセス、方法、および他の独自技術のための特許、保守、および商業秘密保護を獲得し、実行することです。私たちは私たちの商業秘密と他の機密情報を保護し、他の権利を侵害することなく運営するために努力している。我々の政策は,ライセンス契約と所有する特許を組み合わせることで,米国でも海外でも,我々の技術や候補製品のために可能な限り強力な知的財産権保護を積極的に求めることである.
特許を持っている
2022年12月31日まで、私たちは5つのシリーズの保留特許出願があり、私たちのTCR-Tライブラリ、製品と技術をカバーしています。私たちは現在許可された特許を持っていない。
特許期限は,特許出願又は付与された日及び特許保護を受けた国の法律特許条項に基づいて異なる期間を延長する。特許提供の実際の保護は国によって異なり,これは特許のタイプ,そのカバー範囲,提出された権利要件,およびその国に法的救済策があるかどうかに依存する。
1984年の“薬品価格競争と特許期限回復法”、すなわち“ハッジ·ワックスマン改正案”によると、私たちのいくつかの特許は、いくつかの条件下で、薬物開発およびFDA規制審査中に失われた特許期間の補償として、特許期間を5年間延長する資格がある可能性がある。しかし,この延長期間は薬物承認日から14年を超えてはならない。特許期間回復期は、通常、IND出願発効日または特許発行日との間の期間の半分であり、両者はより遅い日を基準とする。新薬出願の提出日、またはNDAに加えて、NDA出願日または特許発表日(遅いものを基準とする)とFDA承認との間の期間。米国特許商標局、又はUSPTOは、FDAと協議し、任意の特許期限の延長又は回復の出願を審査及び承認する。私たちはこの規制の利点を求めるつもりだが、私たちがこのような利点を得ることができるという保証はない。
私たちはまた、私たちの科学および技術従業員、ならびに私たちのコンサルタント、コンサルタント、および他の請負業者のスキル、知識、経験に依存しており、これらは特許を申請できないかもしれない。特許を出願できないノウハウを保護し、特許の実行が困難である可能性のある発明を支援するために、私たちは現在、商業秘密保護および秘密保護協定に依存して私たちの利益を保護し続けている。そのため、私たちは、一般に、従業員、コンサルタント、コンサルタント、および他の請負業者に機密情報の開示を禁止し、適用された場合には、私たちの業務に重要な考え、発展、発見、および発明を開示および譲渡することを要求する。
私たちの特許地位と所有権は一定の危険と不確定要素の影響を受ける。どうぞお読みください“私たちの知的財産権に関するリスクは”私たちの特許地位および独占権に影響を及ぼす可能性のあるいくつかのリスクおよび不確実性に関するさらなる情報は、一部を参照されたい。
許可協定
PGEN治療会社と独占許可合意に達しました
2018年10月5日、PGEN治療会社またはPrecigen Inc.の完全子会社PGENまたはPrecigen(前身はIntrexon Corporation)と独占ライセンス契約またはライセンス契約を締結しました。ライセンス契約の条項によると,我々は,(I)癌治療のための新しい抗原のTCR製品,(Ii)癌治療用PrecigenのRheoSwitch遺伝子スイッチと呼ばれる製品,IL−12製品,および(Iii)(A)癌治療用CD 19 CD 19の自動車製品,CD 19製品,および(B)癌治療用BCMAを有し,PrecigenとARES取引会社との間で2015年3月27日に発効した許可·協力協定に基づき,何らかの義務を果たしてこの目標を追求しなければならない。メルクKGaAの子会社は,PrecigenからPGENに譲渡される.ライセンス契約によると、私たちはまた、以下の内容に関連するいくつかの特許のグローバル独占権を持っています寝美人癌治療のための新しい抗原と抗原を共有するTCR製品を研究、開発、商業化し、TCR製品と呼ばれる。
私たちは独自に癌治療の独占的なライセンス製品のすべての方面の研究、開発、商業化を担当している。我々は、ライセンスプロトコルで定義されているように、IL-12製品、CD 19製品、およびTCR製品を開発および商業化するために、商業的に合理的な努力を要求されている。
12
カタログ表
PGENによって付与されたライセンスおよび他の権利を考慮して、PGENに毎年10万ドルの許可料を支払い、PGENライセンス番組のいくつかの歴史的コストを精算する。
後期臨床試験を開始し,異なる管轄区で独占許可製品を承認した場合には,独占許可計画ごとに合計5250万ドルまでの記念碑的支払いを追加する。また,任意の承認されたIL−12製品および自動車製品の販売純売上に応じて,下位から1桁までの階層印税をPGENに支払う。また、任意の承認されたTCR製品の販売純売上高に応じて下位から1桁までのPGEN印税を支払い、合計最高印税額は1.00億ドルとなる。私たちはまた、特許製品に関する任意の再許可収入の20%をPGENに支払います。私たちはすべての許可製品に関連したすべての開発費用を担当している。
PGENはPGEN自動車製品販売の純売上高に応じて下位から1桁までの特許権使用料を支払い、最高特許使用料金額は1.00億ドルとなる。
2020年10月には、特定の材料の譲渡およびPGENがIL-12製品に関する移行援助を提供する義務に関連するライセンス協定修正案に署名した。
ライセンス契約と2015年研究開発協定−テキサス大学MDアンダーソンがんセンター
2015年1月13日、私たちはPrecigenと共にMD Anderson(PrecigenをPGENに譲渡)とこの特定の許可契約、すなわちMD Anderson許可を締結した。MD Andersonの許可によると、我々はPGENと共にMD Andersonが所有し許可するいくつかの技術のグローバル独占許可を持っており、これらの技術はLaurence Cooper、M.D.,Ph.D.,2015年5月から2021年2月まで私たちの最高経営責任者を務め、MD Anderson小児科学の生涯教授であった。
2015年8月17日、当社、PrecigenおよびMD Andersonは、MD AndersonがMD Andersonライセンスの条項に基づいて、いくつかの既存の研究プロジェクトおよび関連技術権利の範囲およびプログラムを譲渡すること、ならびに将来的に協力して新しい研究および進行中の研究プロジェクトを研究·開発する条項および条件を正式に決定するために、研究開発協定を締結した。Precigenの2015年研究開発協定下の権利と義務は、2019年9月19日に発効した2015年研究開発協定第4修正案または発効日が2018年10月5日である第4改正案に基づいて譲渡されました。2015年の研究開発協定下の活動は、わが社の2人のメンバーとMD Andersonのメンバーの1人で構成された共同指導委員会によって指導された。
MD Andersonライセンスの規定によると、2015年の研究開発協定下の研究計画を支援する研究開発活動に資金を提供し、3年間、金額は1,500万ドル以上、毎年2,000万ドルを超えない。2017年11月14日、我々は2015年研究開発協定修正案に署名し、その有効期限を2021年4月15日に延長し、2019年10月22日に2015年研究開発協定修正案に署名し、その有効期限を2026年12月31日に延長し、MD Andersonが2015年の研究開発協定に基づいて手元にある現金資源を2019年の研究開発協定または2019年10月22日にMD Andersonと締結した2019年の研究開発協定項目の開発コストに使用することを許可したことにより、TCRプロジェクトについて協力することに同意した。
MD Anderson許可の有効期限は、(A)MD Anderson許可によるすべての特許が満了するか、または(B)MD Anderson許可の日付が20周年後に最後に発生したときに満了するが、MD Anderson許可期間が満了した後、私たちとPrecigenは、その許可された知的財産権を使用するために、全額納付、印税免除、永久、撤回不可能、および再許可可能な許可を有する。MD Andersonの許可日から10年後、90日間の治療期間内に、MD AndersonはMD Anderson許可を非独占許可に変換する権利があり、もし私たちとPrecigenがケースベースで商業的に合理的な努力を使用しなければ、許可された知的財産権を商業化する。MD Andersonライセンスの日から5年後、私たちとPrecigenがこのような融資協定または契約における職務調査要件を満たしていない場合、MD Andersonは、政府によって資金援助されているか、または第三者契約によって制約されている特定の技術に対するMD Andersonのライセンスを終了する権利があり、期限は180日である。MD Andersonはまた、私たちとPrecigenの重大な違約がこのような通知を受けてから60日以内に修正されなければ、書面通知を受けた場合にプロトコルを終了することもできます。また、MD Andersonライセンスは、私たちとPrecigenの両方でいくつかの破産事件が発生した時に終了し、私たち、Precigen、MD Andersonの両方の書面合意によって終了することができます。
2019年の研究開発協定-テキサス大学MDアンダーソンがんセンター
2019年の研究開発協定に基づき,MD Andersonと協力して我々のTCRライブラリを拡大し,臨床試験などのプロジェクトを行う。2019年の研究開発協定の下での活動は、わが社の2人のメンバーとMD Andersonのメンバーの1人で構成された共同指導委員会によって指導されます。
我々は、2019年の研究開発プロトコルに従って開発されたすべての発明と知的財産権を有し、2019年の研究開発プロトコルに従って非ウイルス遺伝子転移技術を用いて生産された腫瘍学製品のすべての知的財産権を保持し、特許の出願が可能であるか否かにかかわらず、すべての知的財産権を保持する
13
カタログ表
私たちのも含めて寝美人技術我々はすでにMD Andersonにこのような知的財産権の独占許可を付与し,ウイルス遺伝子転移技術を用いて製造された自己TCR製品,および腫瘍学分野以外の任意の製品の開発と商業化を許可し,ウイルスベースの技術を用いて製造された同種異体TCR製品の非独占許可を付与した。
2019年の研究開発協定によると、2021年1月1日から、2015年の研究開発協定の資金が枯渇した後、2019年の研究開発協定で合計2000万ドルにのぼる開発コストをMD Andersonに返済することに同意した。また,MD AndersonにTCR製品の純売上高の特許使用料を支払い,税率は低い1桁とした。私たちはそのTCR製品に関する臨床と規制基準の達成に成功した後、業績に応じてお金を支払うことを要求された。潜在的な基準支払い総額は3650万ドルで、そのうち300万ドルだけが私たちのTCR製品の初発売承認前に満期になります。何らかの事件が発生した場合,MD Andersonの特許使用料や基準支払いが減少する可能性がある.私たちはまた、私たちのTCR製品を割引価格でMD Andersonに販売し、私たちのTCR製品が初めて商業販売された後の限られた時間内に、テキサス州で私たちのTCR製品をMD Andersonに独占販売することに同意しました。
2019年の研究開発協定は2026年12月31日に終了し、いずれの方も書面で重大な違約が発生した後に2019年の研究開発協定を終了することができます。“2019年研究開発協定”には、賠償義務、守秘などの事項に関する習慣条項も含まれている。
2019年の研究開発協定の調印について、私たちは2019年10月22日にMD Andersonに引受権証を発行し、3,333,333株を購入して、私たちの普通株をMD Anderson株式承認証と呼びます。MD Anderson引受権証の初期行使価格は1株0.001ドルであり、2026年12月31日に満期になり、そしてある臨床マイルストーンが出現した時に4つの部分が授与される。2022年12月31日まで、マイルストーンはまだ達成されていない。
MD Anderson株式承認証及びMD Anderson引受権証行使後に発行される普通株は、改正された“1933年証券法”に基づいて登録されておらず、登録又は適用された登録免除を受けていない場合は、米国で発売又は販売してはならない。
NCIとのライセンス契約
2019年5月28日、我々はNCIと特許ライセンス契約、すなわち特許ライセンス契約を締結した。特許ライセンスによると、私たちは、トランスポゾン媒介遺伝子転移によって変異に対するTCR反応を発現する患者由来(自家)の末梢血液T細胞治療製品を開発および商業化するために、いくつかの知的財産権のグローバル独占ライセンスを持っているKRAS, TP 53そしてEGFR.EGFR新しい抗原です。さらに、特許ライセンスによれば、我々は、非ウイルス遺伝子転移によって設計されたTCRを発現する自己体外周囲血液T細胞治療製品、およびいくつかの追加製造技術の非独占的グローバルライセンスを開発および商業化するために、製造技術のいくつかの知的財産権の独占的グローバルライセンスを持っている。2019年5月29日、2020年1月8日、2020年9月28日、2021年4月16日、2021年5月4日、2021年8月13日に、変異に反応するTCRを含むTCRライブラリを拡張するために特許許可証を修正しましたKRASそしてTP 53NCIから許可を得た新しい抗原。
特許許可の条項は、NCIが年間30万ドルの最低使用料を支払うことを要求し、私たちが支払う最低年間使用料の総額が150万ドルになると、その金額は10万ドルに減少する。
特許製品に関する臨床·規制基準の達成に成功した後、業績に応じて金を支払うことも求められている。このような支払いでは、潜在的基準支払い総額は430万ドルであり、そのうち300万ドルの支払い総額は、米国またはヨーロッパ、日本、オーストラリア、中国またはインドがマーケティング許可を得た後にのみ支払われるべきである。最初の基準支払い10万ドルは2022年に我々のTCR-Tライブラリの1/2期試験開始時に支払われ、特許許可条項によると、これは合格した1期臨床試験である。
また、特許製品の総純売上高が2.5億ドルから10億ドルの間のいくつかの総純売上高の後、NCI一次基準支払いを要求された。このような基準支払いの潜在的な総金額は1200万ドルだ。特許ライセンスがカバーする製品の純売上高にNCI印税を支払わなければならないが,料率は低いものから中央値まで,具体的にはライセンス製品に含まれる技術に依存する。私たちが締結した特許製品に関する再ライセンス契約については、再ライセンス時の特許製品の開発段階に応じて低下するサブライセンス譲受人から受信したすべての対価格の一定の割合をNCIに支払う必要がある。
事前に終了しない限り、特許許可は、特許権に含まれる最後の特許が満了したときに失効する。重大な違約が発生した場合、NCIは、特定の日までにいくつかのマイルストーンに達していない場合、またはそのような違約または破産事件を書面で通知した後90日後も治癒されていないいくつかの破産事件を含む特許許可を終了または修正することができる。NCIに60日間の書面通知を出した後、私たちはいつでも特許許可の終了またはその任意の部分を自ら決定することができます。さらに、NCIには、(I)私たちが必要な健康および安全需要を合理的に満たしていない場合、(Ii)連邦法規によって規定された公共使用要件を満たしていない場合を含む、特定の条件下で特許許可がカバーされている候補製品に再許可する権利を要求する権利がある。
14
カタログ表
NCIとの協力研究と開発プロトコル
2017年1月9日、私たちはNCIと協力研究開発協定に署名した。この協力の目的は固形腫瘍治療のための個性化TCR-T方法を推進することである。私たちのを使って寝美人技術、NCIは患者自身の癌細胞を分析し、その独特の新しい抗原とこれらの新しい抗原に反応するTCRを認識し、そして私たちのを使用する寝美人再注入のための1つまたは複数のTCRをT細胞に置換する技術。CRADA下での研究はNCI外科支部長Steven A.Rosenberg医学博士が指導し,われわれの研究者と協力する。
CRADAに基づいて検討し,最終的に臨床試験を行うために必要な試験材料をNCIに提供する責任がある。“CRADA”の規定を履行する研究計画に関連して発見または生産された発明、データおよび材料は、依然としてその発見を生じる側の独自の財産である。双方は研究計画の下で共同で発見されたすべての発明を共同で持つだろう。CRADA下の任意の発明の所有者は、その発明に関連する特許を提出することを決定するであろうか、または共同所有の発明である場合、私たちは、その発明に関する特許を提出する最初の機会があるであろう。私たちの決定をNCIに通知することができなかった場合、または共同発明をカバーする特許を提出しないことが決定された場合、NCIは出願する権利がある。NCIによって独占的に所有されているか、またはNCIおよび我々が共同で製造された任意の特許出願について、米国公衆衛生サービスは、独占的選択または非独占的商業化許可証を付与する。NCIによって単独で所有されているか、またはNCIおよび我々が共同で所有する上記の条項に従って許可された発明については、本発明を世界各地で実施するために、またはそれに代わって本発明を実施するために、非独占的、譲渡不可能、撤回不可能、および有料ライセンスを米国政府に付与することに同意する。また、この発明を実施するために、または世界各地で独占的に所有されている任意の発明を実施するために、非排他性、譲渡不可能、撤回不可能、および支払済みの許可証を米国政府に付与しなければならない。いずれの当事者も60日前に書面で本協定を終了することに同意することができる。
NCIは彼らがこの裁判を開始することを許可する合格したINDを持っている。私たちが知っている限りでは、実験はまだ登録されていない。この試験の進展とスケジュールは,患者への服薬スケジュールも含めてNCIの制御下にある。
2019年2月、私たちはNCIとCRADAを2022年1月9日に延長し、この計画に500万ドルを追加提供することを約束した。2022年3月には、2022年1月9日にさかのぼってCRADAの期限を2023年1月9日に延長するCRADA改正案に署名した。2022年6月、CRADAの任期を2025年1月9日に延長することを含むCRADA第4改正案に署名した。CRADA第4修正案については、2023年第1四半期から毎年100万ドルを寄付し、四半期ごとに支払うことに同意しました。
TCR-Tプラットフォームライセンス
2015年1月、私たちはMD Andersonからいくつかの非ウイルスに対する知的財産権を含む技術組み合わせの許可を得ました寝美人技術及びTCR-T細胞治療と生物処理技術。協定条項によると、著者らはある知的財産権技術に対して独占許可を持ち、ある知的財産権技術に対して共同独占許可を持ち、ある知的財産権技術に対して非独占許可を持っている。MD Anderson知的財産権に対する私たちの権利はPGENとの合意を通じて私たちの手に流れている。
2019年5月、私たちは、TCR-T細胞バンクに関連する知的財産権を含むNCIから特許組み合わせの許可を得ました。協定条項によると、著者らはある知的財産権の独占的な全世界許可を持ち、患者由来(自己)の末梢血液T細胞治療製品を開発、製造、商業化することができ、これらの製品はトランスポゾンを介した遺伝子転移によって突然変異に対するTCR反応を発現するKRAS, TP 53そしてEGFR.EGFR新しい抗原です。さらに、我々は、非ウイルス遺伝子転移によって設計された特定のTCRを発現するための自己体外周囲血液T細胞治療製品、およびいくつかの追加製造技術の非独占的グローバルライセンスを開発および商業化するために、製造技術のある知的財産権の独占的グローバル許可を持っている。
政府規制と製品審査
生物製薬会社として、私たちは広範囲な規制を受けている。我々の遺伝子工学T細胞候補製品は生物製品として規制されている。この分類があれば,我々の製品の商業生産は生物製品のcGMPに適合するように登録·許可された施設で行う必要がある。
ヒト免疫治療製品は新しい治療方法である。FDAは人体細胞或いは組織に基づく製品を最低限操作或いは最低操作以上に分類し、最低限操作を超える製品は製品の安全性と有効性を証明する臨床試験を必要とすることを確定し、発売許可を得るためにBLAを提出した。
アメリカ(連邦、州と地方各級)とその他の国家と司法管轄区の政府当局は生物製薬製品の研究、開発、臨床前と臨床試験、製造、品質管理、ラベル、包装、貯蔵、記録保存、販売促進、広告、販売、流通、承認後のモニタリングと報告、マーケティング及び輸出入などの方面に対して広範な監督管理を行っている。私たちの候補製品はFDAの承認を得なければ、アメリカで合法的に発売され、適切な外国監督管理機関の許可を得て、国外で合法的に発売することができる。一般的に、私たちの他の国での活動は、アメリカと類似した性質と範囲によって規制されるだろう
15
カタログ表
重要な違いがあるかもしれませんが。規制マーケティングの承認を得て、その後適用される連邦、州、地方、外国法規を遵守する過程には大量の時間と財力が必要だ。
アメリカ製品開発プロセス
米国では,FDAは公衆衛生サービス法(PHSA)と連邦食品,薬物と化粧品法(FDCA)とその実施条例に基づいて生物製品を規制している。製品はまた他の連邦、州、そして地方法律法規によって制限されている。規制の承認を得て、その後、適切な連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発過程,承認過程又は承認後のいずれかの場合,出願人が適用される米国の要求を遵守できない場合には,行政又は司法制裁を受ける可能性がある。FDAの制裁には、承認保留申請の拒否、承認撤回、臨床封印、警告状及び同様の法律違反の疑いに関する公告、製品のリコール又は市場からの撤回、製品差し押さえ、生産又は流通の全部又は一部の一時停止、罰金、政府契約の拒否、元の回復、利益の返還、又は民事又は刑事罰が含まれる可能性がある。どんな機関や司法法執行行動も私たちに実質的な悪影響を及ぼすかもしれない。FDAが米国で生物製品を発売する前に必要なプログラムには、一般に以下のような態様が含まれる
人体で任意の生物候補製品をテストし、私たちの候補製品を含む前に、候補製品は厳格な臨床前テストを経なければならない。臨床前試験は非臨床研究とも呼ばれ、実験室評価や体外培養候補製品の潜在的安全性と有効性を評価するための動物研究となっている。臨床試験スポンサーはまずINDをFDAに提出しなければならず,その後米国で臨床試験を開始することができる。INDは臨床前試験の結果、生産情報、分析データ、任意の利用可能な臨床データ或いは文献、提案された臨床方案、研究者マニュアル、サンプルインフォームドコンセント、および他の材料を含まなければならない。臨床試験方案は、ある有害事象の発生時に臨床試験が停止する停止規則を確保することを含む、臨床試験の目標、投与手順、被験者の選択と排除基準、および被験者の安全性を監視するためのパラメータを詳細に説明した。各スキームおよびスキームの任意の修正は、INDの一部としてFDAに提出されなければならない。いくつかの前臨床試験、例えば毒性研究は、IND提出後も継続する可能性がある。
INDはFDAが承認された臨床試験に対して懸念または問題を提起しない限り、FDAが受信後30日以内に自動的に発効するか、または30日以内に試験を保留する。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。FDAはまた、臨床試験の前または期間のいつでも、安全考慮または規定に適合しない理由で、候補生物製品に臨床的制限を加えることができる。FDAが臨床一時停止を強制した場合、試験はFDA許可なしに再開されず、その後、FDA許可の条件下でのみ再開される可能性がある。
さらに、各臨床試験は、臨床試験を行う各機関に位置するか、またはサービスする独立した機関審査委員会またはIRBによって審査および承認されなければならない。IRBは試験参加者の福祉や権利の保障を担当し,臨床試験に参加する個人のリスクが最低に低下するかどうか,期待利益と比較して合理的かどうかなどの項目を考慮している。IRBはまた、各臨床試験対象またはその法律代表によって署名されなければならないインフォームドコンセントの形態および内容を承認し、完成まで臨床試験を監視しなければならない。組換え又は合成核酸分子に関する臨床試験もまた機関生物安全委員会又はIBCによって審査されなければならず、IBCは地方機関委員会であり、基礎及び臨床の審査及び監督を担当する
16
カタログ表
その機関で行われている研究。IBCはこの研究の安全性を評価し、公衆の健康または環境に対する任意の潜在的リスクを決定する。
臨床試験は,合格した調査者の監督の下で健康なボランティアや患者に候補生物製品を服用することに関連し,これらの調査者は通常,試験スポンサーに雇用されたりコントロールされていない医師である。臨床試験はFDAがGCP要求を含む規定に従って行い、モニタリングしなければならない。
人体臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複或いは合併する可能性がある
第1段階、第2段階、および第3段階の臨床試験は、もしあれば、任意の指定された時間で成功しない可能性がある。
承認後の臨床試験は,4期臨床試験と呼ばれることがあり,最初の上場承認後に行われる可能性がある。これらの臨床試験は,治療適応が予想される患者の治療から追加的な経験を得るためのものであり,特に長期安全なフォローアップのためである。
臨床開発のすべての段階において、監督管理機関はすべての臨床活動、臨床データと臨床試験調査人員に対して広範なモニタリングと監査を行うことを要求している。臨床試験結果を詳細に説明する年次進展報告はFDAに提出しなければならない。書面のIND安全報告書は、深刻かつ意外な有害事象、他の研究の任意の発見、実験室動物試験または体外培養人類患者に重大なリスクがあることを表明したテスト、或いは方案或いは研究者マニュアルに記載されたテストと比べ、深刻な不良反応の疑いの発生率は臨床上のいかなる重要な増加である。スポンサーは15日以内にINDセキュリティ報告書を提出し,スポンサーがその情報有資格報告を確定した後でなければならない。スポンサーはまた、スポンサーが初めて情報を受け取ってから7日以内に、任意の意外、致命的、あるいは生命に危害を及ぼす疑いのある副作用をFDAに通知しなければならない。FDA或いはスポンサー或いはそのデータ安全監視委員会は独立した専門家グループであり、研究データの安全性を評価し、そして臨床試験の継続、修正或いは終了について提案を提出し、いつでも臨床試験を一時停止或いは終了することができ、その理由は研究患者が受け入れられない健康リスクに直面していることを発見することを含み、他の無関係な免疫療法試験から推定したリスクを含む。同様に,臨床試験がIRBの要求に沿って行われていない場合,あるいは生物製品が患者に予期せぬ深刻な被害を受けた場合,IRBはその機関の臨床試験の承認を一時停止または終了することができる。
臨床試験と同時に、会社は通常追加の非臨床研究を完成しなければならず、生物製品の物理特性に関する追加情報を開発し、cGMP要求に基づいて商業大量生産製品のプロセスを最終的に決定しなければならない。PHSAは,生物製品を用いた外来製剤導入のリスク低減を支援するために,属性が正確に定義できない製品の製造制御の重要性を強調した。製造過程は一貫して高品質の候補製品ロットを生産することができなければならず、他の以外に、スポンサーは最終生物製品の特性、強度、品質、効力と純度をテストする方法を開発しなければならない。また,適切な包装を選択·試験し,候補生物製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
FDAには、特定の基準に適合する新薬または生物製品の審査過程を加速または促進することを目的とした迅速チャネル指定計画がある。具体的には、新薬または生物製品が、深刻または生命に危険な疾患または状態を治療することを意図し、その疾患または状態が満たされていない医療需要を解決する潜在力を示す場合、迅速なチャネル指定を得る資格がある。高速チャネル製品の場合、FDAは、完全な申請を提出する前にBLAを審査する部分をスクロールすることを考慮することができ、スポンサーがBLA部分を提出するスケジュールを提供した場合、FDAはBLAの部分を受け入れることに同意し、スケジュールが許容可能であると判断し、スポンサーはBLAの第1の部分を提出する際に任意の必要な使用料を支払う。
生物製品の臨床試験が完了した後,生物製品の商業販売の前に,FDAによるBLAの承認を得なければならない。BLAには,製品開発,実験室と動物研究,人体試験の結果,製品製造と成分の情報,アドバイスのラベル,その他の関連情報が含まれていなければならない。
改正された処方薬使用料法案(PDUFA)によると、各BLAは相当な使用料を伴わなければならない。FDAは毎年PDUFAユーザ料金を調整する。PDUFAは承認された生物製品に年間計画費も徴収している。場合によっては、小企業が初めて出願した出願料を免除することを含む、費用を免除または減免することができる。
17
カタログ表
また,孤児薬として指定された製品については,この製品が孤児適応も含まれていない限り,BLASに対して使用料を評価しない。
出願提出後60日以内に、FDAは、機関が提出を受け入れる前に実質的に完了したかどうかを決定するために、提出されたBLAを審査する。FDAは、それが不完全であるか、または提出時に適切に審査できないと考えられる任意のBLAの提出を拒否することができ、より多くの情報の提供を要求することができる。この場合,BLAおよび付加情報を再提出しなければならない.再提出された申請はFDAが届出を受ける前にも審査を行わなければならない。提出された申請が受け入れられると,FDAはBLAの深い実質的な審査を開始する。FDAは、提案された製品が安全であるかどうか、有効であるかどうか、および/またはその予期される用途に有効であるかどうか、許容可能な純度プロファイルを有するかどうか、および製品がcGMPに従って製造されているかどうかを決定して、製品の特性、安全性、強度、品質、効力および純度を確保および保存するためにBLAを審査する。FDAは、新規な生物製品または安全性または有効性の問題を提起する生物製品の申請を諮問委員会に提出することができ、一般に、申請を承認すべきかどうか、およびどのような条件下で承認すべきかを審査、評価および提案するための臨床医および他の専門家を含むグループである。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。バイオ製品の承認中に、FDAはまた、製品の利益がリスクよりも大きいことを保証し、生物学的製品の安全な使用を保証するために、リスク評価および緩和戦略を策定する必要があるかどうかを決定するであろう。ここには、投与ガイドライン、医師のコミュニケーション計画、または分配方法を制限するような安全な使用を保証する要素が含まれている可能性がある, 患者登録簿と他のリスク最小化ツール。FDAは具体的な状況に応じてREMSに対する要求および具体的なREMS条項を決定する。FDAがREMSが必要であると結論した場合,BLAのスポンサーは提案したREMSを提出しなければならない。必要であれば、FDAはREMSのないBLAを承認しないだろう。
BLAを承認する前に、FDAはこの製品を生産する施設を検査する。FDAは、製造プロセスおよび施設がcGMP要件に適合していることを決定し、要求された仕様の下で製品が一貫して生産されることを保証するのに十分でない限り、この製品を承認しないであろう。免疫療法製品については,メーカーが適用範囲内でGTPSに適合していなければ,FDAもこの製品を承認しない。これらは、ヒト細胞、組織、および細胞および組織ベースの製品またはHCT/Pを製造するための方法および製造のための施設および制御を管理するFDAの法規および指導文書であり、HCT/Pは、ヒトレシピエント内に移植、移植、注入または転移するためのヒト細胞または組織である。GTP要求の主な目的は,細胞や組織に基づく製品の製造方式の確保であり,感染症の導入,伝播,伝播を防止することを目的としている。FDA GTP条例はまた、組織機関がFDAにそのHct/Pを登録し、リストし、適用時にスクリーニングとテストを通じてドナーを評価することを要求する。さらに、BLAを承認する前に、FDAは通常、IND試験要求およびGCP要求に従って臨床試験が行われることを確実にするために、1つまたは複数の臨床場所を検査する。
関連データおよび情報が提出されたにもかかわらず、FDAはBLAがその承認された規制基準を満たしていないことを最終的に決定する可能性がある。機関が現在の形態のBLAを承認しないことを決定した場合、FDAは、FDAによって決定されたBLA内の特定の欠陥を一般的に要約し、追加の臨床または他のデータを必要とするか、または申請の最終承認を保証するために満たされなければならない他の条件を適用する完全な返信を発行するであろう。決定された欠陥は微小である可能性があり、例えば、ラベル変更が必要であるか、または重大であり、例えば、追加の臨床試験が必要である。追加の情報が提出されても、FDAは最終的にその申請が承認された規制基準を満たしていないと決定する可能性がある。完全な返信が発行された場合、出願人は、BLAを再提出し、手紙で決定されたすべての不足点を解決するか、または出願を撤回することができる。
FDAは、製品ラベルにいくつかの禁忌症、警告または予防措置を含むことを要求することができ、または他の方法で任意の承認の範囲を制限することができる。そのほか、FDAは発売後の臨床試験を要求する可能性があり、時々第四段階の臨床試験と呼ばれ、生物製品の安全性と有効性を更に評価することを目的とし、そして商業化された承認製品の安全性を監視するためにテストと監督計画を要求する。承認後、新たな適応の追加、製造変更、および追加のラベル宣言など、承認製品の多くのタイプの変更は、さらなるテスト要件およびFDAの審査および承認を受けなければなりません。
さらに、小児科研究公平法またはPREAによれば、BLAまたはBLA補充剤は、すべての関連する小児科亜群において主張される適応の安全性および有効性を評価し、各安全で有効な小児科亜群に対する製品の用量および投与をサポートするためのデータを含まなければならない。FDAはデータの提出を延期することを許可するか、またはすべてまたは部分的な免除を与えることができる。
承認後に要求する
我々がFDAの承認を得たどの製品もFDAの持続的な規制を受け、その中には記録保存要求、製品副作用の報告、FDAへの最新の安全と治療効果情報の提供、製品サンプリングと流通要求、およびFDAの宣伝と広告要求を遵守することが含まれる。
また、品質管理及び製造プロセスは、製品の長期安定性を確保するために、承認された後も適用される製造要件に適合し続けなければならない。私たちは依存し、第三者がcGMP法規に従って私たちの製品を生産する臨床と商業数に依存し続けることが予想される。CGMPは,他の事項のほかに,品質管理と品質保証およびそれに応じた記録やファイルメンテナンスが要求され,cGMPと一致しない場合を調査·是正する義務があると規定している.製造業者と他の承認された製品の製造と流通に参加する実体は必ず
18
カタログ表
FDAとある州機関にその機関を登録し、cGMPや他の法律を遵守することを確保するために、FDAおよびある州機関の定期的な抜き打ち検査を受ける。そのため、メーカーはcGMPコンプライアンスを維持するために、生産や品質管理の分野で時間、お金、労力をかけ続けなければならない。承認後に製品が発見された問題は、市場からの製品のリコールまたは撤回を含む製品、製造業者、または承認されたBLA所有者に制限を加える可能性がある。
FDAはまた、上場後テスト、いわゆる第4段階テストを要求し、許可された製品の効果を監視するために監視を行う可能性がある。製品に以前に未知の問題が存在することを発見し、予想されていない深刻度或いは頻度の不良事件、製造過程中の不良事件、或いは適用されたFDA要求を遵守できなかった場合、負の結果が生じる可能性があり、マイナスの宣伝、司法或いは行政執行、市場からの完全撤退、製品リコール、FDAの警告状、強制要求の是正広告或いは医師とのコミュニケーション、製品差し押さえ或いは差し押さえ、禁止及び民事或いは刑事罰などを含む。新たに発見または開発された安全性または有効性データは、新たな警告や禁忌症を増加させることを含む製品承認のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要がある可能性もある。また、新しい立法による要求、またはFDAの政策が変更される可能性がある新しい政府要求を確立することが可能であり、規制部門が私たちが開発している製品を承認することを延期または阻止する可能性がある。
さらに、FDAは製品のマーケティング、ラベル、広告、および販売促進を厳格に規制している。薬品は承認された適応にしか使用できず,承認されたラベルの規定に基づいて普及しており,医師が実践的に未承認の適応のために承認された薬剤を処方することができるにもかかわらず。しかし、会社はラベルと一致する真で誤解されない情報を共有するかもしれない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な責任を負う可能性がある。
アメリカマーケティング排他性
生物製品価格競争および革新法案、またはBPCIAは、PHSAを改正し、FDAに類似のバージョンを承認することを許可する革新的な生物製品であり、一般に生物模倣薬と呼ばれる。生物模倣薬は1種の簡略化された経路によって承認され、申請者は完全な臨床前と臨床データを提出する必要がなく、承認はある程度FDAの原始生物(即ち参考製品)に対する安全性、純度と効力の発見に基づく。参考製品は製品が初めて許可を得た時から12年の独占特許権を取得する資格があり、これはFDAが簡略化経路で参考製品のいかなる生物模倣薬を承認することを阻止したが、完全なパケットが添付され、参照製品に依存しないBLASの承認を阻止しなかった。もし製品が参考製品と高度に類似していれば、臨床不活性成分は微小な差があるにもかかわらず、安全性、純度と効力の面で参考製品と臨床意義の差がなければ、生物類似製品を許可することができる。
小児科排他性はアメリカのもう一つの規制市場排他性だ。小児科専有権が付与された場合、既存の専有期間と特許条項を6ヶ月増加させる。この6カ月間の専門権は,他の排他的保護または特許期間終了時から,FDAが発表したこのような試験の“書面請求”によって小児科試験を自発的に完了させることにより付与することができる。
孤児薬名
孤児医薬品法によれば、FDAは、米国で20万人未満の影響を与える稀な疾患または疾患の治療のための医薬または生物製品を孤児の称号を与えることができ、米国で20万人を超える影響を与える場合、米国でそのような疾患または疾患を治療する薬剤または生物製品を開発および製造するコストが製品の販売から回収されることを合理的に予想することができない。マーケティング申請を提出する前に、孤児としての指定を要求しなければならない。FDAが孤児の称号を付与した後、FDAは、治療剤の識別およびその潜在的な孤児の使用を開示する。指定孤児は、規制審査および承認過程においていかなる利点も伝達されず、規制審査および承認過程の継続時間を短縮することもない。
孤児として指定された製品がその後、このような指定された疾患または状況を有するFDAの最初の承認を得た場合、この製品は、孤児製品の排他性を得る権利があり、これは、FDAが7年以内に任意の他の出願を承認することができず、限られた場合、例えば孤児に対して排他的な製品に対する臨床的優位性を示すか、または十分な数の製品を生産できない限り、同じ適応で同じ薬剤または生物物品を販売することを意味する。このような薬物の指定はまた、締約国に臨床試験費用、税収優遇、およびユーザ費用減免のための贈与資金の機会を提供するなどの財政的奨励を受ける権利がある。しかしながら、競合他社は、孤児製品に対して排他的な指示を有することによって、異なる製品の承認を得るか、または同一製品に対して排他的であるが孤児製品に対して排他的な異なる指示の承認を得る可能性がある。競合他社がFDAで定義された同じ製品の承認を得た場合、または私たちの候補製品が競合他社の製品に含まれていると判定された場合、同じ適応または疾患のために使用される場合、孤立排他性も7年以内に私たちの製品が承認されることを阻止する可能性がある。指定された孤児製品が発売承認された場合,その適応範囲は指定された範囲よりも広く,孤児排他性を得る資格がない可能性がある。連合での孤児薬物の地位はこの司法管轄区域で似ているが違う利点がある。
19
カタログ表
保証範囲·定価·精算
私たちが規制部門の承認を得た任意の候補製品のカバー範囲と精算状態には、重大な不確実性がある。米国や他の国·地域の市場では、規制機関の承認を得て商業販売を行う任意の製品の販売は、第三者支払者が保険を提供する程度に大きく依存し、そのような製品のための十分な精算レベルを確立する。米国では,第三者支払者には連邦や州医療計画,個人管理のヘルスケア提供者,医療保険会社,その他の組織が含まれている。第三者支払者が製品に保険を提供するかどうかを決定するプロセスは、製品価格を決定するプロセス、または第三者支払者が製品のために支払うべき支払率を決定するプロセスから分離することができる。第三者支払者は、承認リスト上の特定の製品に保証範囲を制限することができ、処方表とも呼ばれ、FDAによって承認された特定の適応のすべての製品を含まない可能性がある。また、米国では、第三者支払者の間に統一された薬品保険や精算政策はない。そのため、薬品の保証範囲と精算範囲は支払人によって異なる。第三者決済者は価格に挑戦し,医療製品,療法,サービスの医療必要性と費用対効果を検査し,その安全性と有効性を疑問視するようになってきている。
精算は、市場で承認された任意の候補製品の需要および/または価格に影響を及ぼす可能性がある。第三者支払いが人為的に与えられた候補製品が保険や精算を獲得したとしても,それによる精算支払率が十分に高くない可能性があり,あるいは患者が受け入れられないと考える高い共済額が必要となる可能性がある。自分の病態を治療するために処方薬を服用している患者とその処方を行う医師は,通常第三者支払者に依存してこれらの薬物に関する費用の全部または一部を精算する。患者が製品を使用することはあまり不可能であり、医師は保険を提供しなければ、製品の全部または大部分のコストを支払うのに十分な費用を精算しない限り、製品処方を発行することができないかもしれない。したがって、カバー面と十分な精算は新薬製品の受容度に重要である。
全体的には,医療コスト,特に処方薬や生物製品の下振れ圧力が非常に大きくなっている。各国政府はコスト制御計画の実施に大きな興味を示し、価格制御、精算制限と代替後発薬の要求を含む。そのため、新製品の参入にはますます高い壁が設けられている。政府や第三者支払者が有利な保証範囲と十分な補償を提供できない場合、規制部門の承認を得て商業販売を行う任意の候補製品の適正性が影響を受ける可能性がある。また,米国の管理式医療への重視が増加しており,医療定価の圧力を増加させ続けることが予想される。保証政策と第三者精算料率は随時変化する可能性がある。規制部門の承認を得た1つまたは複数の製品が有利な引受·精算状態を獲得しても、将来的にはあまり有利ではない引受政策や精算料率が実施される可能性がある。
医療サービス提供者とのインタラクションを管理する医療保健法
米国の医療保健提供者と第三者支払者は薬品の推奨や処方に主な役割を果たしている。医療保健提供者、第三者支払者と顧客との手配は、虚偽クレーム、プライバシーと安全、価格報告と医師日光法律或いは法規を含む製薬業者に広範に適用される詐欺と濫用及びその他の医療保健法律に直面させる可能性がある。私たちのいくつかの商業前活動はその中のいくつかの法律によって制限されている。製薬業者の運営能力に影響を与える可能性のある連邦、州、外国の医療保険の法律および法規は含まれているが、これらに限定されない
20
カタログ表
商業計画が適用された医療保険法に適合することを確実にするための努力は多くのコストに関連する。政府および法執行当局は、医薬品製造業者の商業行為が、詐欺および乱用または他の医療保健法律および法規を適用する現在または未来の法規、法規または判例法に適合していないと結論するかもしれない。製薬メーカーに対してこのような訴訟を提起した場合、その製造業者は、自分の権利を弁護または維持することに成功しなかった場合、重大な民事、刑事および行政処罰、損害賠償、返還、罰金、監禁、連邦医療保険、医療補助および他の連邦医療保健計画への参加から除外される可能性があり、契約損害、名声損害、利益および将来の収益の減少、業務削減、および会社の誠実な合意または他の合意に適合すれば、これらの法律の不遵守疑惑を解決するために追加的な報告義務および監督を受ける可能性がある。また,薬品の米国国外での承認と商業化は,製薬業者が上記医療保健法や他の外国法の外国等価物の制約を受ける可能性もある。
医療改革努力
アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。過去数年間、連邦と州の提案と立法は薬品と生物製薬製品の定価を公布し、薬品と他の医療製品のカバー範囲と精算を制限し、アメリカの医療融資と医療サービスの提供を変更した。
2010年3月、オバマ総裁は、政府や民間保険会社の医療資金調達のあり方を著しく変えた“医療改革法案”に署名した。その他の事項以外に、ACAは新しい方法を実施し、即ち吸入、注入、点滴、移植或いは注射の薬品計算メーカーが医療補助薬品還付計画の下での税金還付を増加し、医療補助薬品還付計画の下でメーカーが不足している最低医療補助還付を増加し、還付計画を医療補助管理の看護組織に登録した個人に拡大し、1つの条項を増加し、製品ラインの延長或いは薬物の再調合の医療補助還付を増加し、あるブランドの処方薬と生物製剤のメーカーと輸入業者に対する年会費を創立し、新しい連邦医療保険D部分カバーギャップ割引計画を普及させた。公衆衛生サービス法案に基づいて薬品定価計画により割引を受ける資格のある実体を拡大し,製薬会社と医療従事者の相互作用に関する実質的な新しいコンプライアンス条項を多く実施した。ACAはまた、医療補助計画の資格を拡大し、患者を中心とした新たな結果研究所を導入し、優先事項を監督、決定し、臨床有効性比較研究を行い、このような研究に資金を提供し、CMSに新たな医療保険·医療補助革新センターを設立し、革新的な支払い·サービス交付モデルをテストし、医療保険や医療補助支出を低減する。
ACAのいくつかの側面は行政、法律、そして政治的側面の挑戦に直面している。例えば、トランプ総裁は、ACA要求のいくつかの要求を延期、回避、または緩和するためのいくつかの行政命令および他の命令に署名した。同時に、国会はACAの全部または一部を廃止または廃止し、代替する立法を審議した。国会ではまだ立法廃止が成立していないが、ACAの下にある税収実施に影響を与えるいくつかの法案が署名されて法律となっている。2017年の減税·雇用法案、または税法は、2019年1月1日からACAが1年の全部または一部で合格医療保険を維持できなかった個人に対して実施された税収ベースの分担責任支払いを廃止する条項を含み、これは一般に“個人強制”と呼ばれている。また,2020年1月1日から2020年の連邦支出案が永久的に廃止され,ACAが規定している雇用主支援の高コスト医療保険や医療機器税に対する“キャデラック”税や,2021年1月1日からも医療保険会社税が廃止された。2018年に両党予算法案(BBA)などがACAを改正し,2019年1月1日から施行され,連邦医療保険Dに加入する一部の製薬メーカーが不足している販売時点割引を50%から70%に引き上げ,多くの連邦医療保険薬物計画のカバーギャップ,すなわち通常言われている“ドーナツ穴”を縮小した。また、バイデン総裁は、仕事の要求を含む医療補助モデルプロジェクトおよび免除計画の再検討、医療補助またはACAによる医療保険カバーの獲得に不必要な障害をもたらす政策を含む、特定の政府機関に医療保健の取得を制限する既存の政策およびルールの見直しを指示する行政命令を発表した。さらに進む, バイデン政府の一連の医療改革措置はACAに影響を与えた。例えば,2022年8月16日,総裁·バイデンはインフレ率低減法案に署名し,個人がACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は受益者の最高自己負担コストの大幅な削減と新たな設立を実施することで
21
カタログ表
メーカー割引計画。ACAは未来に司法や国会で挑戦される可能性がある。このような挑戦やバイデン政府の医療改革措置がACAと我々の業務にどのように影響するかは不明である。いかなる医療改革措置がアメリカ医療業界の最終内容、時間或いは影響に与えるかはまだ不明である。
また,ACAが公布されて以来,米国は他の連邦医療改革措置を提案し採択した。例えば、2011年の“予算制御法案”により、医療サービス提供者の前期ごとの医療保険支払いが2%減少し、2013年4月1日に施行された。この2%の減少幅は新冠肺炎大流行中に一時停止されたが、その後回復し、国会および/または行政が追加行動を取らない限り、2030年4月から徐々に増加し、2031年4月には4%に達し、2031年10月に自動減額が終了する。また、2012年の“米国納税者救済法”は、いくつかの医療サービス提供者への医療保険支払いを減少させ、政府が提供者に多額の支払いを取り戻す訴訟時効期間を3年から5年に延長した。2015年の“連邦医療保険アクセスとチップ再許可法案”はまた品質支払い計画を提出し、この計画によると、ある医療保険提供者は新しい計画の品質標準に基づいて一定の激励或いは処罰を受ける。2019年11月,CMSは最終ルールを発表し,Medicare Quality Payment Programの変化を決定した.
また、処方薬や生物製品のコストが上昇していることを受けて、米国政府は薬品定価のやり方の審査を強化した。このような審査は最近のいくつかの国会調査を招き、製品価格の透明性の向上、価格設定とメーカー患者計画との関係の審査、政府の製品に対する計画補償方法の改革を目的とした連邦と州立法を提案し、採択した。連邦レベルでは、トランプ政権はいくつかの手段を用いて、連邦予算提案、行政命令、政策措置を含む薬品定価改革を提出または実施している。例えば、2020年7月24日と2020年9月13日に、トランプ政権は処方薬の定価に関するいくつかの行政命令を発表し、政府のいくつかの提案を実施しようとしている。FDAはまた,2020年11月30日から発効し,輸入行政命令の一部を実施し,各州がカナダからの薬品輸入計画の策定と提出に指導を提供した最終規則を発表した。また、2020年11月30日、米国衛生·公衆サービス部(HHS)は、製薬業者からD部分までの計画スポンサーの値下げ安全港保護を廃止し、法律が値下げを要求しない限り、直接または薬局福祉マネージャーを通過する規定を決定した。Ireland共和軍はこの規定された施行期間を2032年1月1日に延期した。この規定はまた、販売所での値下げを反映するための新しい避難港を創出し、薬局福祉マネージャーとメーカーとの間のいくつかの固定費用手配のための新しい避難港を創出し、これらの条項の実施もアイルランド共和軍によって2032年1月1日に延期された。さらに2021年3月11日には, 総裁·バイ登は“2021年米国救援計画法案”に署名し、2024年1月1日から法定の医療補助薬品税還付価格上限を撤廃し、現在単一源と革新者多源製品の薬品メーカー平均価格は薬品平均価格の100%である。また、2021年7月、バイデン政府は処方薬に対する複数の条項を含む行政命令を発表した。バイデンの行政命令に応えるため、2021年9月9日、衛生と公衆サービス部は高い薬価に対応する総合計画を発表し、その中で薬品価格改革の原則を概説した。この計画は,国会がとりうる様々な潜在的立法政策と,HHSがとりうる行政行動を示している。このような原則を施行するための立法や行政行動はまだ最後に決定されていない。また、国会は予算調整過程の一部として薬品定価を検討している。また、アイルランド共和軍は他の事項を除いて、(I)HHSに連邦医療保険がカバーするいくつかの高支出、単一由来の薬物と生物製品の価格について交渉するよう指示し、医薬品メーカーに提供価格が法律で定められた協議の“最高公平価格”以下であることで民事罰金と潜在的な消費税を受け、(Ii)連邦医療保険B部分と連邦医療保険D部分に基づいてリベートを実施し、インフレを超える価格上昇を処罰するよう要求した。アイルランド共和軍は衛生と公共サービス部が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。アイルランド共和軍がどのように実施されるかは不明であるが,製薬業に大きな影響を与える可能性がある。
州レベルでは、立法機関は、価格または患者の精算制限、割引、ある製品への参入の制限、およびマーケティングコスト開示と透明性措置を含む、薬品および生物製品の価格を制御するための法規をますます公布し、実施しており、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。また,地域医療当局や個別病院では,どの薬品やサプライヤーが処方薬や他の医療計画に含まれるかを決定するために入札プログラムが使用されるようになってきている。
米国の“海外腐敗防止法”、イギリスの“贈賄法”などの法律
“海外腐敗防止法”は、いかなる米国の個人または企業が、いかなる外国人官僚、政党または候補者に直接的または間接的に支払い、支払いを提供または許可するか、または任意の価値のあるものを提供することを禁止し、その個人または企業が業務を獲得または保持することを支援するために、外国の実体の任意の行為または決定に影響を与えることを目的としている。“海外腐敗防止法”はまた、証券が米国に上場している会社に会計規定を遵守し、会社(国際子会社を含む)のすべての取引の帳簿や記録を正確かつ公平に反映し、国際業務のために適切な内部会計制御制度を制定·維持することを要求している。“海外腐敗防止法”に違反した活動は、米国以外で完全に発生しても、刑事や民事、罰金、監禁、返還、監督、政府契約の資格取り消しを招く可能性がある。
私たちの業務はまた、イギリスの2010年の反賄賂法や“反賄賂法”のような非米国の反腐敗法律の制約を受けている。海外腐敗防止法と同様に、これらの法律は、一般に、業務を獲得または保留するために、私たちおよび私たちの従業員および仲介機関が、業務を獲得または保留するために、不正または禁止されたお金または任意の他の価値のあるものを直接または間接的に許可、承諾、提供または提供することを禁止している
22
カタログ表
他のいくつかの業務的優位性を獲得する。反収賄法によると、私たちはまた、私たちと関連のある人が賄賂犯罪を犯すことを阻止できなかったために責任を負う可能性がある。
私たちはまた、イギリス、アメリカ政府とEU当局が管理する法規を含む、私たちの国際業務を管理する他の法律と法規を遵守しなければなりません。適用される輸出規制法規、特定の国と人員に対する経済制裁と禁輸、反マネーロンダリング法律、輸入と税関要求、通貨両替法規を含み、総称して貿易規制法律と呼ばれます。
“収賄法”、“海外腐敗防止法”及びその他の反腐敗法律及び貿易規制法を遵守しなければ、刑事及び民事処罰、返還及びその他の制裁及び救済措置、並びに法的費用を受ける可能性がある。
競争
著者らの新型HunTR発見エンジンは独自のTCRを識別する能力があることを証明し、著者らのパイプライン、開発中の複数の固形腫瘍計画をさらに拡張と推進できると信じている。また私たちの非ウイルストランスポゾンがTCRsを発現する方法は寝美人私たちの多くの競争相手のウイルス方法と比較して、それはそんなに複雑ではない。最後に、私たちのTCR-Tステージ1/2ライブラリー試験は、私たちが多くの異なる適応の下で迅速かつ有効に腫瘍突然変異を治療し、私たちのライブラリの1つ以上のTCRと一致する患者を治療することを目的としており、私たちはこれが私たちに明らかな競争優位をもたらすと信じている。しかし,癌治療の新製品の開発と商業化は,我々が求めている適応を含め,競争が非常に激しく,主要製薬,バイオテクノロジー,専門癌会社からのかなりの競争が存在する。その中の多くの会社は臨床前と臨床開発、製造、監督管理と全世界の商業化の面でより多くの経験を持っている。業界の中で迅速に発展と変化する科学と技術を考慮すると、彼らは人員を募集し、臨床研究場所を確立し、臨床試験患者を募集し、著者らの計画と相補的或いは必要な技術と許可証を調達する面で私たちと競争する可能性がある。癌分野で研究を行っている学術機関,政府機関,民間組織とも競争している。
われわれの固形腫瘍に対するTCR−T細胞療法はTCRとCAR技術分野で複数の会社とそのパートナーからの激しい競争に直面している。270 Bio、Achilles Treeutics、Adaptimmune Treateutics、Affini-T Treeutics、Annoca、ArsenalBio、Athenex、BioNTech、百時美施貴宝、Immatics、Iovance BioTreatetics、Kite(ギレドの会社)、Lion TCR、Lyell Immunophma、Medigene、Nurix Treeutics、Neogene Treateutics(アスリーカングループのメンバー)、Nexmune、Pact、Parma、Trecetica、Trecetics、TreceCR、Takmune、Paract、Parma、Trecetics、Trecetics、Takmune、Paract、Parma、Trecetics、Trecetics、Taknel、Pact、Parma、Trecetics、TreceCR、Tectre2治療会社,T−Cure生物科学社,T−ナイフ治療会社,Triumvira免疫学社,TScan治療会社,Turnstone生物製品社,ゼルナー免疫治療会社などである。これらの会社の多くは,生殖系抗原に対するTCR−T細胞を検討しているか,腫瘍浸潤性リンパ球を利用している。一部の人はCAR-T細胞による固形腫瘍の治療を研究している。逆に,固形腫瘍における体細胞変異による新しい抗原に対するTCR−T細胞製品の開発に焦点を当てている。
T細胞治療領域に著者らと類似した標的発見プラットフォームを持つ会社は適応生物技術会社、Affini-T治療会社、Enara Bio社、Immatics社、Neogene治療会社(アスリーカングループのメンバー)、PACT Pharma社、T-ナイフ治療会社、TScan治療会社と3 T生物科学会社を含む。Advaxis,Amgen,BioNTech,Geneos Treeutics,Gritstoneを含むいくつかの会社が固形腫瘍の新しい抗原に対するワクチンプラットフォームを求めている。他社はポセイダ治療会社やCRISPR技術を開発しているいくつかの会社,リーダーT細胞やCrispr治療会社を含む非ウイルス遺伝子療法を開発している。
いくつかの会社は,同種遺伝子療法,Atara生物療法,Precision Biosciencesを含む同種異体CAR−T療法を開発しており,我々の候補製品と競合する可能性がある。Athenex,Fate Treeutics,ImmunityBio,IN 8 Bio,Nkarta Treeutics,武田製薬など,T細胞以外の細胞を用いた療法を開発した会社からの競争にも直面している。他のライバルはFate TreeuticsやObsidian Treeuticsのようなサイトカインを有するT細胞を開発している。最後に、私たちはまた他社から提供された非細胞治療の競争に直面して、例えば安進、アスリコン、百時美施貴宝、Immatics、免疫コア、Incell、メルク、Miratiと羅氏。また,IL−12やCAR−T計画に関連するパートナーを探す能力は,これらの会社や他の生物製薬会社からの激しい競争の影響を受ける可能性がある。
著者らは手術、放射線および他の薬物療法、例えば化学療法、ホルモン療法、生物療法、例えばモノクロナル抗体および二重特異性抗体、またはこれらの治療法の組み合わせなど、より一般的で、より費用効果があり、精算可能なより広範な腫瘍学市場で競争に直面している。われわれのいずれかのTCR−T療法が承認されれば,これらの療法と組み合わせて使用されるため,他の療法のように競争力がない可能性がある。保険会社と他の第三者支払人もいくつかの製品の使用を奨励する可能性がある;そのため、私たちの任意のTCR-T療法の市場受容度或いは市場シェアを獲得することは困難をもたらす可能性がある。最後に、私たちの候補製品の臨床開発過程において、看護標準は変化あるいは変化する可能性がある。
さらに、もし私たちの競争相手が、より安全で、より効果的で、副作用が少なく、管理しやすい、またはより安い薬を開発して販売すれば、私たちのTCR-T候補薬にはあまり有利ではない市場機会を見ることができるかもしれない。私たちの競争相手も私たちよりも早くFDAや他の規制機関の彼らの製品の承認を得ることができ、これは私たちの製品を商業化する前に先発優位性と強力な市場地位を得ることができるかもしれない。承認されれば、私たちのTCR-T候補者の成功に影響を与える可能性のある重要な競争要素は、彼らの有効性、安全性、管理しやすさ、価格及び保険或いは政府の精算である可能性がある。
従業員と人的資本
23
カタログ表
2023年2月15日現在、私たちは34人の常勤従業員がいて、アルバイトはありません。そのうち28人が研究開発活動に従事し、6人が行政管理に従事しています。私たちは一人の従業員たちが集団交渉協定の制約を受けていないし、私たちは私たちが従業員と良い関係があると信じている。
私たちの人的資本目標は、私たちの既存の、より多くの従業員を識別、採用、維持、激励、統合することを含む。
性別、人種、その他の保護された特徴にかかわらず、私たちは最も優秀な人材を募集し、職場差別に適したすべての法律を十分に守ることを政策としています。私たちの多様性、公平、そして包括性の原則はまた私たちの従業員訓練と政策に反映される。
私たちの株式激励計画の主な目的は株に基づく報酬奨励と現金に基づく業績ボーナス奨励を授与することによって、選定された従業員、顧問と取締役を吸引、維持、激励することである。
企業情報
1998年9月にコロラド州に登録されました(名称はNet Escapes,Inc.)その後私たちの名前を“EasyWeb,Inc.”に変更しました一九年二月。私たちは2005年5月16日にデラウェア州に同じ名前で再登録した。2005年9月13日、私たちはデラウェア州の個人持株に対するZiopharm,Inc.の“逆”買収を完了した。この取引を達成するために、私たちは私たちの完全子会社ZIO Acquisition Corp.とZiopharm,Inc.との合併、Ziopharm,Inc.を私たちの完全子会社として存続させた。合併後、私たちはZiopharm,Inc.を私たちと合併し、私たちの会社に組み込むことを促し、私たちの名前を“Ziopharm Oncology,Inc.”に変更しました。そのため、ツィオパム社は米国証券取引委員会または米国証券取引委員会の登録者となり、ツィオパム社の歴史財務諸表は我々の歴史財務諸表となる。2022年1月25日、私たちはデラウェア州国務長官に証明書の改訂と再登録の修正証明書を提出し、私たちの名前をALaunos Treeutics,Inc.に変更した。
私たちの主な実行事務室はテキサス州ヒューストンエルリオ街8030号にあります。郵便番号:77054、電話番号は(346)355-4099です。
利用可能な情報
私たちのサイトの住所はwww.alaunos.comです。我々のサイトやサイトに含まれているか,あるいは我々のサイトにリンクされている情報は,本Form 10-K年次報告の一部ではない.私たちはアメリカ証券取引委員会に報告書を提出し、私たちのウェブサイトで無料で提供します。これらの報告には、Form 10-K年間報告、Form 10-Q四半期報告、Form 8-K現在の報告、およびこのような報告の修正が含まれており、各報告は、これらの材料を電子的にアーカイブまたは米国証券取引委員会に提供した後、合理的で実行可能な範囲内でできるだけ早く私たちのサイト上で提供される。また、米国証券取引委員会には、米国証券取引委員会に電子的に届出された報告、依頼書、情報声明、その他の発行者に関する情報が含まれたサイト(www.sec.gov)が設けられている。
24
カタログ表
第1 A項。リスク要因
私たちの普通株に投資するのは危険がある。この10-K表の年次報告書の他の情報を除いて、私たちと私たちの業務を評価する際には、以下のリスク要因を慎重に考慮すべきです。以下のリスク要因で述べたいずれかの事件が発生すれば、我々の業務、財務状況、経営業績、および将来の成長見通しは重大な悪影響を受ける可能性がある。この場合、私たちの普通株の取引価格は下がるかもしれません。あなたは私たちの普通株へのすべてまたは一部の投資を損失するかもしれません。したがって、私たちはあなたに報告書全体を慎重に検討し、以下の議論の危険要素を考慮することを促します。しかも、以下に説明する危険は私たちが直面している唯一の危険ではない。私たちは今知らないか、あるいは私たちが今どうでもいいと思っている他のリスクはまた私たちの業務、財務状況、経営業績、あるいは将来性に影響を与える可能性があります。私たちは今知らないか、あるいは私たちが現在どうでもいいと思う他の危険もまた私たちの業務を損なうかもしれない。以下のいくつかの陳述は展望的な陳述だ。本年度報告書の“前向き陳述に関する特別な説明”を参照されたい。
私たちの業務に関わるリスク
私たちは持続的な経営企業として、私たちの候補製品を開発し続け、私たちの業務目標を達成するために多くの追加財源が必要になります。もし私たちが必要な時にこれらの追加資源を得ることができなければ、私たちは候補製品の臨床試験を含めて、私たちの計画の運営を延期または停止させることを余儀なくされるかもしれません。
設立以来、私たちは毎年大きな収入を生み出しておらず、重大な純損失を生み出している。2022年12月31日までの1年間の純損失は3770万ドルで、2022年12月31日までの2003年成立以来の累計赤字は8.806億ドルだった。我々が行っている臨床試験と我々の内部研究開発能力により,我々の運営支出と純損失は大幅に増加すると予想される。私たちの候補製品をさらに開発するには私たちの費用が大幅に増加する必要があります
2022年12月31日現在、改正された融資および保証協定(以下の定義)に関連する1,390万ドルの制限現金を含む約5,300万ドルの現金および現金等価物を持っています。現在の発展計画と現金管理努力を考慮して、現金資源は2023年第4四半期の運営に資金を提供するのに十分であると予想されています。私たちは現在約束された追加資金源を持っていない。会計基準の編纂やASCテーマ205-40の指示に従って財務諸表の列報−継続経営−私たちが財務諸表の発行日後に経営を続けている企業として1年間経営を続ける能力があるかどうかを確認します。現在の現金予測によると、経営陣は、財務諸表が発表された日から少なくとも1年以内に、私たちの既存の資本資源が私たちの計画運営に資金を提供していると判断しており、持続的な経営企業としての継続的な経営能力が疑われている。
現金資源の予測はリスクと不確実性を含む前向きな情報であり、私たちの実際の現金需要は、現在の多くの他の要素に対する予想と実質的な差があるかもしれないが、これらの要素は、私たちの開発計画の重点と方向の変化、私たちの研究開発の進展速度、および/または予想よりも速い、政府法規の変化、競争と技術の進歩、候補製品開発に関連するコストの上昇、パートナーの手配を得る能力、訴訟、起訴、弁護、そして私たちの知的財産権を実行するコストを含むかもしれない。世界の政治と経済事件は、新冠肺炎の疫病とインフレの激化を含み、すでに全世界の金融市場の深刻な混乱を招いている。このような干渉が持続的に深まれば、追加資本を得ることができない場合や、利用可能な融資条項の吸引力を低下させることができない場合があり、将来的には私たちの運営に悪影響を及ぼす可能性がある。もし私たちが予想よりも資本備蓄の速度を使い果たした場合、どんな理由であっても、私たちが受け入れられる条項で追加的な融資を得ることができない、あるいは追加的な融資を得ることができない場合、私たちは私たちの製品開発や将来の商業化努力を延期、制限、減少、または中止する必要があるかもしれないし、私たちが開発とマーケティングをより望んでいた候補製品を開発し、マーケティングする権利を与える必要があるかもしれない。
私たちは私たちの運営を支援するためにもっと多くの資金を集めなければならない。私たちが追加的な資金を調達する方法は私たちの普通株に対するあなたの投資価値に影響を及ぼすかもしれない。
これまで、私たちが相当な収入を生み出すことができれば、株式発行、債務融資、許可と協力協定の組み合わせで私たちの現金需要を満たす予定です。私たちは約束された外部資金源を持っていない。資本市場の予測不可能性は、私たちが必要な期間内に、または私たちが受け入れられると思う条件で資金を調達することを深刻に阻害するかもしれない。特に、私たちの普通株の市場価格の下落は私たちをもっと難しくするかもしれない
25
カタログ表
未来に、私たちが適切だと思う時間と価格。さらに、現在の1つまたは複数の候補製品を早期または後期臨床試験に進めることができず、私たちの1つまたは複数の候補製品を商業化することに成功しなかった場合、または新たな候補製品を開発することができなかった場合、投資家を引き付けることが困難になる可能性があり、そうでなければ、投資家は追加の融資源となる可能性がある。
2021年8月6日、私たちはシリコンバレー銀行とそのいくつかの付属会社(SVBと略称する)と融資と保証協定を締結した。融資と安全協定は、取引終了時に2,500万ドルの初期定期融資を提供し、2022年8月31日またはSVB融資メカニズムの前にいくつかの資金と臨床マイルストーンを達成すれば、2,500万ドルの追加融資を受けることができると規定している。最初の借金については,SVBに引受権証を発行し,1株2.22ドルの使用価格で最大432,844株の普通株を購入した。融資および担保協定はその後改正されたか、または改正された融資および保証協定は2021年12月28日に施行され、その中には、私らが抽出した2,500万ドルをSVB融資の下で使用可能なすべての金とする追加部分の廃止が含まれている。したがって、私たちはSVB融資メカニズムの下で選択できる他のお金を持っていない。改正された融資と担保協定の締結については、株式承認証も改訂·再記載した。これらの改正と再記載された引受権証は、1株当たり1.16ドルの使用価格で最大649,615株の私たちの普通株を購入することを規定している。改訂された融資と担保協定も、2022年8月31日までにいくつかの株式調達と臨床マイルストーンを完成できなかった場合、当時返済されていなかったSVBローン元本総額の半分に、SVBローンの原始元本の5.75%に相当する金額を担保にすることを要求した。私たちはこのようなマイルストーンには達していません, 改訂された融資及び保証契約の条項に基づいて、1,390万元をSVBの担保口座に入金する。担保現金は私たちの現金と現金等価物の大きな部分を占めていて、私たちは私たちの運営に資金を提供するためにこれらの現金と現金等価物を得ることができず、私たちの貸借対照表で制限的な現金に分類されます。
もし私たちが株式証券を発行することで追加資本を調達すれば、私たちの既存株主の所有権は希釈され、これらの証券の条項は清算または他の優遇を含む可能性があり、私たちの普通株主の権利に悪影響を及ぼす。債務融資および優先株融資に関与する可能性のある協定は、追加債務の発生、留置権の設定、資本支出の実施、または配当の発表など、特定の行動をとる能力を制限または制限する契約を含む。もし私たちが第三者との協力、戦略連合またはマーケティング、流通または許可手配を通じてより多くの資金を調達するならば、私たちは私たちの技術、将来の収入源、研究計画、または候補製品に対する貴重な権利を放棄しなければならないかもしれないし、私たちに不利になる可能性のある条項でライセンスを付与しなければならないかもしれない。
私たちは債務を発生させ、これは私たちの業務に悪影響を与え、私たちの運営と財政的柔軟性を制限するかもしれない。
改正された融資·担保協定には、我々およびどの子会社にも適用される慣行肯定および消極的な契約および違約事件が含まれている。平権条約は、政府の承認を維持し、特定の財務報告書を提出し、保険範囲を維持し、重大な知的財産権などを保護することを要求する(および私たちの子会社に要求している。負の契約は、私たちと私たちの子会社が担保を譲渡すること、私たちの業務を変更すること、合併または買収を行うこと、追加債務を発生させること、現金配当金を支払うこと、または他の分配を行うこと、投資を行うこと、留置権を作成すること、資産を売却し、任意の二次債務を支払う能力を制限する。修正された融資と保証協定の制限的な契約は、特定の許可手配の締結、柔軟な現金管理手配の維持、特定の支配権取引の変更などを含む、私たちまたは私たちの株主が有益と思うビジネス機会を求めることができない可能性がある。
私たちの債務に私たちの他の財務義務と契約約束を加えることは、私たちの業務に重大な悪影響を及ぼす可能性があります
私たちは私たちの既存の現金と現金等価物、そして私たちが将来債務と株式融資によって調達する可能性のある任意の追加金額で私たちの債務超過義務を履行するつもりだ。私たちがSVBローンの満期金を支払う能力は私たちの未来の表現にかかっており、これは経済、財務、競争条件、他の私たちがコントロールできない要素の影響を受ける。私たちは十分な資金を持っていないかもしれないし、私たちの既存の債務の満期金額を支払うために追加的な融資を手配できないかもしれない。また,改正された融資および担保協定では,吾らは当時返済されていなかったSVB融資元金金額の50%に相当する無制限および無担保現金をSVBの現金担保口座に入金しなければならず,金額は元元金金額の5.75%に相当すると規定されている。2022年12月31日現在、改正された融資·担保協定の条項に基づき、現金担保口座に1390万ドルの現金を入金した。SVB融資によって満期になった任意のお金を支払うことができず、改訂された融資および保証プロトコルを遵守できなかった場合、または私たちの業務、運営または状況(財務または他の側面)に重大な悪影響を及ぼすことが合理的に予想される事件が発生し、違約事件を招く。違約事件の発生と継続は利息の
26
カタログ表
この金利は、他の方法で適用される金利に3.00%(SVB選択がより小さい幅の増加を適用しない限り)、SVB融資下のすべての債務を加速させるSVB権利を与え、SVB融資を担保とする資産の停止を含む、SVB融資の担保および修正された融資および担保プロトコル下の他の債務行使救済措置を吾等および担保SVB融資の担保および修正された融資および担保プロトコル下の他の債務に対して救済する。また、改正された融資および担保協定の下のチノと、私たちのほとんどの資産(私たちの知的財産権を含まない(改正された融資および担保協定に従って負の質権を必要とする)を融資の担保とすることは、追加債務融資を取得する能力を制限する可能性がある。
私たちは以前に内部統制の重要な弱点を発見し、このすべての弱点が修復された。吾らは将来的に他の重大な弱点を発見したり、有効な内部制御システムを維持できなかったりして、吾等の財務諸表に重大な誤報を招いたり、吾等の業務や証券取引価格に重大な悪影響を与えたりする可能性がある。
我々は、1934年に改正された証券取引法または取引法、2002年のサバンズ-オキシリー法案またはサバンズ-オクスリー法案の報告要件、およびナスダックの世界的な精選市場の規則と規定を遵守しなければならない。サバンズ·オキシリー法404条によると、私たちの財務報告の内部統制のシステムとプロセス評価とテストを行い、私たちの経営陣が私たちの財務報告の内部統制の有効性を報告できるようにしなければならない。私たちはまた、私たちの独立公認会計士事務所に、財務報告の内部統制に対する私たちの有効性について毎年意見を発表するように要求されるかもしれません。
過去、私たちは財務報告書の内部統制で重大な弱点を発見した。重大な欠陥とは、財務報告の内部制御に欠陥或いは欠陥の組み合わせが存在し、著者らの財務諸表の重大なミス報告が合理的な可能性があり、適時に防止或いは発見できないようにすることである。
過去に発見された重大な弱点が修復されたにもかかわらず、私たちが取ったまたは未来にとりうるどんな措置も、未来の潜在的な重大な弱点を回避するのに十分であることを保証することはできません。もし私たちが将来の重大な欠陥を補うことに成功し、効果的な内部統制を維持できなければ、私たちは十分、正確、またはタイムリーな財務情報がないかもしれないし、私たちはサバンズ-オキシリー法案を含む上場企業としての報告義務を履行できないかもしれないし、私たちは私たちの将来の財務業績を正確に報告できないかもしれないし、アメリカ証券取引委員会、ナスダックまたはサバンズ-オキシック法案が要求する時間枠でそれらを報告することができないかもしれない。適用された場合に“サバンズ-オキシリー法案”を遵守できなければ、米国証券取引委員会や他の規制機関の制裁や調査を受ける可能性もある。必要な新しいまたは改善された制御を維持または実施できなかったいかなる困難も、私たちがこれらの制御を実施する際に遭遇したいかなる困難も、私たちに他の重大な弱点や重大な欠陥を発見させ、私たちの報告義務を履行できなかったり、私たちの財務諸表に重大な誤報を招いたりする可能性がある。また、信頼できる財務報告を提供したり、詐欺を防止することができなければ、私たちの業務や運営結果が損なわれる可能性があり、投資家は私たちが報告した財務情報に自信を失う可能性があります。
我々は,非ウイルスのTCR−T細胞療法を用いた計画を開発·商業化し,癌治療の新しい方法と見なすことができ,その開発成功は大きな挑戦を受けている。
我々は,上記MD Anderson許可に基づいてMD Andersonから許可を得る技術,ライセンスプロトコルに従ってPGENから取得する技術,および上記特許許可に基づいてNCIから取得した技術を用いて,T細胞およびTCRに基づく非ウイルス細胞療法の開発と商業化を追求し,固形腫瘍悪性腫瘍に対するものである。これは癌免疫療法と癌治療の新しい方法であるため、候補製品の開発と商業化は私たちを多くの挑戦に直面させている
27
カタログ表
私たちはこれらの挑戦に成功的に対応できることを保証することはできません。これらの挑戦は私たちの研究、開発、商業化目標の達成を阻害するかもしれません。
私たちの現在の候補製品は新しい技術に基づいて、限られた臨床データの支持を得て、私たちの現在と計画中の臨床試験は規制部門がその中の1つ以上の候補製品を承認することを支持するデータを生成することを保証することはできません。
著者らの遺伝子組換えTCR-T細胞候補製品は限られた臨床データの支持を得ており、その中のいくつかのデータはMD AndersonとNCIによる試験によって生成され、私たち自身だけではない。我々は、我々のTCR-T細胞候補製品の全体的な臨床および規制開発を制御しており、新しいINDのスポンサーを得ることができなかったり、またはこれらまたは他の任意の候補製品にINDを提出することを決定した場合は、潜在的な将来の臨床試験の時間に負の影響を与える可能性がある。このような時間への影響は、研究およびプロセス開発コストを増加させ、私たちの候補製品が規制部門の承認を得ることを延期または阻止する可能性があり、両方の場合は、私たちの業務に実質的な悪影響を及ぼす可能性がある。われわれは2022年1月から患者を募集してわれわれのTCR−Tライブラリ1/2期試験に参加した。
また,我々はこれまでのすべての実験の設計や進行を制御していない.FDAはこれらの以前の試験を受け入れないかもしれないが、それらは未来の臨床試験に十分な支持を提供していると考えられ、原因は候補製品の安全性、純度と効力、製品表現の程度、以前の試験の設計或いは実行要素、安全問題、または他の試験結果を含むため、我々によっても第三者によって制御されている。私たちはまた、これらの以前の試験に参加した患者の任意の治療に関連する傷害または副作用によって責任を負うことができる。したがって,我々の潜在的な将来の臨床試験では,予見できない第三者クレームや遅延の影響を受ける可能性がある。私たちはまた、以前にMD Andersonまたは他のエンティティによって行われた臨床試験を全部または部分的に繰り返すことを要求される可能性があり、これは高価であり、私たちの任意の候補製品の提出および許可または他の規制承認を延期するだろう。
また、著者らはアメリカで候補TCR-T細胞製品に対して臨床試験を行う時、多くの監督管理要求は引き続き満たさなければならない。これらの監督管理機関は候補製品の安全性と有効性を決定するための基準であり、潜在製品のタイプ、複雑性、新規性と期待用途と市場によって大きく異なり、常に変化する。このような要求を満たすには多くの時間、エネルギー、そして財政資源が必要になるだろう。FDAはこれまで商業化のための養子細胞療法をいくつか承認してきた。細胞療法を採用するのは比較的に新しいが、著者らの候補製品は新しい遺伝子発現と細胞技術を採用しているため、監督管理機関は著者らのライブラリTCR-T候補製品のような候補製品を評価する経験が不足している可能性がある。この新規性は、FDAがIND申請を提出する際に私たちのIND申請を審査するのに要する時間、私たちの開発コストを増加させ、候補製品の商業化を延期または阻止することを含む、私たちの治療法の規制審査または規制審査過程を強化するかもしれない。これらの要素は私たちの候補製品が規制部門の承認を得るのにどのくらいの時間がかかるかを決定することを困難にする。私たちが臨床候補製品と他の最終的に成功しない早期製品開発計画に費やしたいかなる時間、精力、財力は私たちの業務に不利な影響を与える可能性がある。
私たちはいくつかの臨床試験の中間データを報告しましたが、中期データが将来の中期結果や最終研究結果を予測することは保証できません。また,われわれの前臨床研究やわれわれの候補製品の他の早期臨床試験から最終的に得られた結果は,将来の結果を予測できない可能性がある。
我々の業務の一部として,一時臨床試験データに関する更新が含まれている可能性がある我々の候補製品開発に関する更新を提供する。著者らは、著者らの臨床試験は比較的に小さい患者群に関連し、サンプル量が小さいため、これらの臨床試験とすべての臨床試験の中期結果は非常に大きな変異を受ける可能性があり、未来の中期結果或いは最終結果を予測できないかもしれない。
著者らは2022年1月にわれわれのTCR−Tライブラリ1/2期試験に参加し、2022年9月に1人目の患者の早期臨床データを発表し、2022年11月に上位2名の患者の早期臨床データを発表した。その後の疾病進展のため、著者らのTCR-Tバンクの1/2期試験に登録された最初の2人の患者はすでに試験から除去された。この段階では,この試験でより多くの患者からの患者反応データが有利であるかどうかは不明であり,臨床試験の初歩的な成功はこれらの試験完了後に得られた結果を示すことができない可能性がある。私たちの候補製品は臨床開発で期待される安全性と有効性を示すことができないかもしれません。未来のどんな試験結果も私たちの候補製品の価値と有効性を証明することは保証できません。私たちの臨床試験が計画通りに完成しても、彼らの結果が私たちの候補製品を支持するかどうかは確認できません。
28
カタログ表
固形腫瘍に対する工学化TCR−T細胞免疫療法は現在のところ承認されていない。私たちの候補製品はある固形腫瘍に有効である可能性があると信じ、これらの特定の固形腫瘍の候補製品の開発を計画している。私たちの候補製品が固形腫瘍に接触したり、固形腫瘍微小環境で任意の機能を示すことができるという保証はありません。免疫抑制細胞の存在、体液要素と栄養物質獲得の制限などの要素により、固形腫瘍細胞が成長する細胞環境は通常T細胞に不利である。また、固形腫瘍環境では、候補製品の安全性が異なる可能性がある。もし私たちの候補製品を固形腫瘍で機能させることができなければ、私たちの開発計画と業務は深刻な損害を受けるだろう。
予備データはまだ監査とチェック手続きを守らなければならないが、これは最終データが私たちが以前発表した予備データと大きく異なる可能性がある。初期データまたは中間データと最終データとの間の負の差は、このようなデータ更新の影響を受ける任意の候補製品の将来性に重大な悪影響を及ぼす可能性がある。
また,我々の候補製品のいずれの臨床前研究の結果も臨床試験の結果を予測できない可能性がある。例えば、腫瘍学細胞治療に応用される臨床前モデルは臨床環境を十分に代表することができないため、臨床活動或いはすべての潜在リスクを予測することができない。
私たちは合格者を募集、採用、維持する必要があり、私たちは引き続き肝心な科学と医療顧問に依存して、彼らの業務と技術の専門知識に対する理解は取って代わることができないだろう。
生物科学技術、製薬とその他の業界の合格人材に対する激しい競争のため、著者らは合格した管理と商業、科学、製造と臨床人材を吸引或いは維持できない可能性がある。私たちが必要な人員を引き付けて維持することができなければ、私たちの業務目標を達成するための制限があるかもしれません。これらの制限は、私たちの開発目標の実現、追加資本を調達する能力、そして私たちが業務戦略を実施する能力を深刻に阻害します。
私たちは私たちの主要な科学、規制、そして医療コンサルタントに強く依存している。私たちのすべてのキーパーソンを失ったことは、製品開発の遅延、キーパーソンやパートナーの損失、管理資源の移転を招く可能性があり、これは私たちの経営業績に悪影響を及ぼす可能性があります。私たちはどんな高級職員や重要な従業員にも“キーパーソン”生命保険をかけない。
私たちは他の生物製薬会社からの激しい競争に直面しており、これは他社が私たちよりも早く、あるいはより成功して製品を発見、開発、商業化することにつながる可能性がある。
われわれの固形腫瘍に対するTCR−T細胞療法はTCRとCAR技術分野で複数の会社とそのパートナーからの激しい競争に直面している。270 Bio、Achilles Treeutics、Annoca、Adaptimmune Treeutics、Affini-T Treeutics、ArsenalBio、Athenex、BioNTech、百時美施貴宝、Immatics、Iovance BioTreatetics、Kite(ギレドの会社)、Lion TCR、Lyell Immunophma、Medigene、Neogene Treeutics(アスリーカングループのメンバー)、NexImmune、Nurix Treeutics、Parma、PrecePha、Trecetics、TreceCR、Tecx Temetics、Parma、Trecetics、Treceticio、Tech Taketics、Parma、Trecetics、TrecteCR、TrecteCR2治療会社,T−Cure生物科学社,T−ナイフ治療会社,Triumvira免疫学社,TScan治療会社,Turnstone生物製品社,ゼルナー免疫治療会社などである。これらの会社の多くは,生殖系抗原に対するTCR−T細胞を検討しているか,腫瘍浸潤性リンパ球を利用している。一部の人はCAR-T細胞による固形腫瘍の治療を研究している。逆に,固形腫瘍における体細胞変異による新しい抗原に対するTCR−T細胞製品の開発に焦点を当てている。
T細胞治療分野では,我々と類似した標的発見プラットフォームを持つ会社には,適応バイオテクノロジー会社,Affini−T治療会社,Enara Bio,Immatics,新治療会社(アスリコングループのメンバー),PACT Pharma,T−ナイフ治療会社,TScan治療会社,3 T生物科学会社があると考えられる。Advaxis,Amgen,BioNTech,Geneos Treeutics,Gritstoneを含むいくつかの会社が固形腫瘍の新しい抗原に対するワクチンプラットフォームを求めている。他社はポセイダ治療会社やCRISPR技術を開発しているいくつかの会社,リーダーT細胞やCrispr治療会社を含む非ウイルス遺伝子療法を開発している。
いくつかの会社は,同種遺伝子療法,Atara生物療法,Precision Biosciencesを含む同種異体CAR−T療法を開発しており,我々の候補製品と競合する可能性がある。Athenex,Fate Treeutics,ImmunityBio,IN 8 Bio,Nkarta Treeutics,武田製薬など,T細胞以外の細胞を用いた療法を開発した会社からの競争にも直面している。他のライバルはFate TreeuticsやObsidian Treeuticsのようなサイトカインを有するT細胞を開発している。最後に、私たちはまた他社から提供された非細胞治療の競争に直面して、例えば安進、アスリコン、百時美施貴宝、Immatics、免疫コア、Incell、メルク、Miratiと羅氏。また,IL−12やCAR−T計画に関連するパートナーを探す能力は,これらの会社や他の生物製薬会社からの激しい競争の影響を受ける可能性がある。
規制部門の潜在的TCR製品の承認を得ても、私たちは初めて市場に進出した会社ではないかもしれませんが、これは私たちの潜在的な製品の価格や需要に影響を与える可能性があります。既存または将来の競合製品は、特定の適応により大きな治療利便性または臨床的または他の利点を提供するか、または我々の潜在的な製品よりも少ない副作用を提供するか、またはより低いコストで同様の性能を提供する可能性がある。また、競争相手製品の供給と価格は、潜在的な製品に対する私たちの需要と価格を制限し、それによって私たちのビジネス機会を減少または除去するかもしれません。もし価格競争や医者が既存の治療方法から私たちの潜在的な製品に転換したくない場合、あるいは医者が他の新薬や生物製品に転換したり、私たちの潜在的な製品を保留することを選択した場合、私たちの商業計画を実施することができないかもしれない。また、ライバルはFDAから当該競合他社製品に関する孤立製品独占経営権を得ることができる。もし競争相手の製品が私たちの潜在的な製品の一つと同じと決定されれば、これは私たちがfdaの潜在的な製品の承認を得ることを阻止するかもしれない
29
カタログ表
同様の適応は7年間持続したが,限られた場合は除外した。もし私たちの潜在的な製品が市場シェアを占領して維持できなければ、私たちは十分な製品収入を得ることができないかもしれないので、私たちの業務は影響を受けるだろう。
私たちは完全に統合された製薬会社や大手製薬会社、学術機関、政府機関、他の公共·民間研究組織と協力する小さな会社と競争している。その中の多くの競争相手の製品は承認されたり開発されている。さらに、これらの競争相手の多くは、単独で、またはそのパートナーと共により大きな研究開発プロジェクトを運営しているか、または私たちよりもはるかに多くの財務資源を有しており、以下の側面の経験を著しく豊富にしている
多くの場合、私たちの競争能力は、非特許製品の使用を奨励しようとする保険会社または他の第三者支払人の影響を受ける可能性がある。
PGEN、MD Anderson、または国立癌研究所との私たちのライセンスを終了したり、MD Andersonおよび国立癌研究所との私たちの研究開発協定を終了したりすることは、重要な権利の喪失を招き、私たちの候補製品を開発し、商業化する能力を損なう可能性があります。
我々は,他社,特にMD Anderson,PGEN,NCIから許可された特許,ノウハウ,ノウハウ,およびMD Andersonが我々の開発プロトコルに応じた貢献に依存している.これらの許可または研究開発協定の任意の終了は、重大な権利の喪失を招く可能性があり、候補製品を商業化する能力を損なう可能性がある。私たちとこれらのライセンシーとの間では、ライセンス契約に拘束されている知的財産権についても論争が生じる可能性があります
私たちが許可している知的財産権をめぐる紛争が、私たちが既存の許可スケジュールを維持する能力を妨げたり、特にMD Anderson、PGEN、NCIと許容可能な条項で行われている許可スケジュールを妨害したり、私たちが影響を受けた潜在的な製品の開発に成功して商業化することができないかもしれません。私たちは通常、私たちが持っている知的財産権のように、私たちが許可している知的財産権保護と同じすべてのリスクに直面している。もし私たちまたは私たちの許可者がこの知的財産権を十分に保護できなければ、私たちは適用許可に基づいて潜在製品を商業化する能力が影響を受ける可能性がある。バイオテクノロジーおよび製薬業界には、米国特許商標局における干渉、派生および再審手続き、または外国司法管轄区における反対および他の同様の手続きを含む、特許および他の知的財産権に関する訴訟、および特許に挑戦する行政訴訟が多くある。最近、特許改革と呼ばれる米国の法律の変化により、新しい手続きは各方面間審査および認可後の審査が実施され、これは、将来的に私たちまたは私たちの許可者の特許に挑戦する可能性の不確実性を増加させる。
私たちは、MD Andersonが私たちおよびPGENに権限を与えた権利、または国立癌研究所がTCR-T細胞療法および他の関連技術に関連する権利を付与してくれた権利を保持できないかもしれない。
MD Anderson許可によれば、我々は、新規CAR−T細胞およびTCR−T細胞療法に関連する技術、およびいくつかの関連技術下での共通排他的または非独占的許可を含む、PGENと共にMD Andersonが所有および許可するいくつかの技術の独占的グローバル許可を取得した。これらの特許方法および技術、ならびにPGEN技術キット中の他の技術および技術、ならびにPGENが我々に許可した他の方法および技術は、トランスジェニックTCR-T細胞療法の将来性を実現するのに役立つ可能性があり、方法は、体内の細胞拡張および活性化を制御し、非標的効果および不必要な標的効果および毒性を最大限に減少させるとともに、治療効果を最大限に向上させることである。
30
カタログ表
MD Anderson許可の有効期限は、(A)MD Anderson許可によるすべての特許の満了または(B)MD Anderson許可の日の20周年後に最後に満了する。しかし、期限が満了した後、私たちとPGENは、その項で許可された知的財産権を使用するために、全額納付、印税免除、永久、撤回不可能、および再許可可能な許可を有する。
MD Andersonの許可日から10年後、90日間の治療期間内に、MD AndersonはMD Anderson許可を非独占許可に変換する権利があり、もし私たちとPGENがケースベースで商業的に合理的な努力を使用しなければ、許可された知的財産権を商業化する。MD Andersonライセンスの日から5年後、私たちとPGENがこのような融資協定または契約における職務調査要件(状況に応じて)を満たしていない場合、MD Andersonは、政府によって資金援助されているか、または第三者契約によって制約されている特定の技術を含むMD Andersonライセンスを終了する権利がある。もし私たちやPGENが書面通知を受けてから60日以内に重大な違約行為を是正しなかった場合、MD Andersonは書面で合意を終了することもできます。さらに、MD Andersonライセンスは、私たちまたはPGENの両方で何らかの破産事件が発生したときに終了し、私たち、PGEN、MD Andersonの両方の書面合意によって終了することができます。
特許許可によれば,NCIから何らかの知的財産権と特許のグローバル独占許可を得ており,トランスポゾンに基づく遺伝子工学を用いてTCRをT細胞に導入することができる。起動すれば、これらのT細胞は、我々のTCR-Tライブラリー1/2期試験または後続の臨床試験に使用することができる。特許許可の有効期限は、許可された最後の特許と同時に終了する。NCIが、要求された日前に定義されたマイルストーンに到達できず、そのような違反の疑いのある通知を受けてから90日以内にそのような違反を是正しなかったことを含む特許許可に深刻な違反を認めた場合、NCIは特許許可を終了または修正することができる。NCIはまた、私たちがいくつかの破産事件の書面通知を受けた後、すぐに特許許可を終了することができる。特許許可はまた、これらの共通使用要件を満たしていない場合、NCIは、いくつかの候補製品の再許可を要求するか、または特許許可を終了または修正することを要求することができるいくつかの共通使用要求によって制約される。もし私たちが必要な基準支払いや年間最低使用料支払いを支払うことができない場合、NCIも特許許可を終了することができる。
MD Anderson許可や特許許可の下で成功的に実行できる保証はありません。MD Anderson許可や特許許可が終了すれば、私たちの業務目標の達成を阻害する可能性があります。
著者らはある程度国家癌研究所が著者らのいくつかの候補製品に対して研究開発と早期臨床テストを行うことに依存している。
我々の一部の研究開発は,2018年3月,2019年2月,2022年3月,2022年6月に改訂されたNCIが2017年1月に締結したCRADAに基づいて行った。CRADAによると,NCIはSteven A.Rosenberg博士を首席研究員として利用を担当している寝美人固形腫瘍治療のためのTCRs発現システム。著者らはNCI臨床試験の性質或いは時間の制御が限られており、彼らの日常活動に対して、彼らがどのようにT細胞治療を提供し、実施するかを含む可視性も限られている。例えば、私たちが援助した研究はNCI全体の研究のほんの一部しか占めていない。また,ローゼンボガー博士が行っている他の研究は,我々のプロジェクトの研究よりも高い優先度を得る可能性がある.この試験の進展とスケジュールは,患者への服薬スケジュールも含めてNCIの制御下にある。
CRADAは2022年1月9日に満期となる。2022年3月には、2022年1月9日にさかのぼってCRADAの期限を2023年1月9日に延長するCRADA改正案に署名した。2022年6月、CRADAの任期を2025年1月9日に延長することを含むCRADA第4改正案に署名した。CRADA第4修正案については、2023年第1四半期から毎年100万ドルを寄付し、四半期ごとに支払うことに同意しました。
私たちはどんな製品も商業化できないかもしれないし、相当な収入を生むこともできないし、利益を得ることもできないかもしれない。
今まで、私たちの候補製品はどの国でも商業販売の承認を受けていません。潜在候補製品の開発、監督機関の承認を得て、それを商業化する過程は長く、複雑でコストが高い。FDAおよび/または他の外国規制機関の私たちの候補製品に対する承認を得ない限り、私たちは私たちの製品を販売することができず、製品収入もありません。私たちの1つ以上の候補製品が規制部門の承認を得ても、私たちの製品を商業化することに成功できなければ、利益を達成したり維持したりするのに十分な収入を生み出すことができない場合や、大量の追加資本を調達することなく私たちの業務を継続することができず、これらの追加資本は得られない可能性がある。私たちは収益性を達成したり維持できなかったので、普通株の取引価格にマイナス影響を与えるかもしれません。
私たちの経営の歴史は私たちの業務と将来性を評価することを難しくさせる。
われわれはこれまで何の重要な臨床試験も完成しておらず,BLAは提出されておらず,どの候補製品の商業化に成功するための機能も証明されていない。候補製品の商業化に成功するには、様々な機能を果たす必要があります
31
カタログ表
私たちの業務は私たちの会社を組織と配備し、私たちの特許候補製品を獲得し、開発し、確保し、私たちの候補製品に対して臨床前と臨床試験を行うことに限られている。これらの業務は、私たちが候補製品を商業化する能力と、私たちの証券に投資するのが賢明かどうかを評価するために限られた基礎を提供します。
私たちは開発と商業化協力の構築に成功しないかもしれませんが、これは私たちが候補製品を開発する能力に悪影響を与え、製品の開発を禁止するかもしれません。
バイオ製薬製品や補完技術の開発,臨床試験,マーケティング承認の取得,製造能力の確立,マーケティング承認の製品は高価であるため,代替技術,より多くの資源,より多くの経験を持つ第三者との協力を探る予定である。候補製品や相補技術について開発·商業協力計画を達成する場合には、候補製品や技術の第1次協力計画に係る地域以外の地域における開発·商業化の追加協力を確立することも求められる可能性がある。潜在的なパートナーの数は限られており、私たちは適切なパートナーを探す上で競争に直面すると予想される。合理的かつ許容可能な条項で任意の開発および商業協力および/または販売およびマーケティング計画を行うことができない場合、私たちの候補製品の成功的な開発および規制承認を求めることができない可能性があり、および/または米国以外のいくつかまたはすべての地域で将来承認された製品を効果的にマーケティングおよび販売することができない場合(ある場合)、そうでなければ価値があるかもしれない。
私たちが開発と規制能力を拡大するにつれて、私たちは私たちの成長を管理することができないかもしれません。これは私たちの運営を混乱させるかもしれません。
私たちの候補製品を推進し、臨床試験を通じて、私たちの開発、監督、製造、マーケティング、販売能力を拡大し、あるいは第三者と契約を締結して、これらの能力を提供する必要があります。私たちの将来の財務業績と私たちが候補製品を商業化し、効果的に競争する能力は、私たちが未来の成長を効果的に管理する能力にある程度依存するだろう。この成長を管理するために、私たちは私たちの施設を拡大し、私たちの運営、財務と管理システムを強化し、臨床前と臨床研究とテスト、製造、政府監督、そして最終販売とマーケティングの専門知識を持つより多くの合格者を募集し、訓練しなければならない。
私たちの業務は私たちを危険材料と化学品の使用に関連した責任クレームリスクに直面させるだろう。
私たちの契約研究と開発活動は危険材料と化学品の制御された使用と関連があるかもしれない。私たちがこれらの材料を使用、貯蔵、運搬、処分する安全手続きは連邦、州と現地の法律法規に適合していると信じているが、これらの材料による意外な損傷や汚染のリスクを完全に除去することはできない。このような事故が発生した場合、私たちはそれによるいかなる損害に責任を負う可能性があり、いかなる責任も私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。さらに、危険または放射性材料および廃棄物製品の使用、製造、貯蔵、処理および処理を管理する連邦、州、地方法律法規は、私たちの請負業者に大量のコンプライアンスコストを要求する可能性があり、これは私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性がある。
私たちは重大な責任を招く可能性があり、製品責任訴訟に対応するために、私たちの製品の商業化を制限することを要求されるかもしれない。
医療製品のテストとマーケティングは固有の製品責任リスクをもたらし、私たちが開発可能な任意の薬物を商業化販売すれば、より大きなリスクに直面するだろう。もし私たちが製品責任クレームで自分を弁護することに成功できなければ、承認されれば、私たちは重大な責任を招いたり、私たちの製品の商業化を制限することを要求される可能性があります。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。事件がどうであっても最終的な結果がどうであろうと、賠償責任は次のようになるかもしれない
32
カタログ表
私たちが現在加入しているのは合理的と考えられる臨床試験保険と製品責任保険ですが、これは私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれません。もし私たちが受け入れ可能なコストで保険証を更新したり、十分な保険を得ることができなければ、私たち単独またはパートナーと開発した薬品の商業化を阻止または阻害するかもしれない。
業務中断は私たちの将来の収入と財務状況を深刻に損害し、私たちのコストと支出を増加させるかもしれない。
私たちの業務と私たちの臨床研究者、請負業者と顧問の業務は主にテキサス州のヒューストンに設置されています。これらの業務は、電力不足、電気通信障害、水不足、ハリケーン、洪水、地震、火災、極端な気象条件、医療流行病、その他の自然または人為的災害、または業務中断の影響を受ける可能性があり、これらの場合には、適切と考えられる通常の保険証書を維持します。このような業務中断の発生は、私たちの運営と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある。もし私たち自身またはサプライヤーの業務が人為的あるいは自然災害または他の業務中断の影響を受ける場合、私たちは候補製品のために臨床用品を生産する能力が妨害される可能性がある。規定を満たしていないのがメーカーが制御できない要因であれば,我々の第三者への追跡権は限られている可能性がある.
私たちは2021年に優先されていない候補製品を開発し続けるための適切なパートナーを見つけることができないかもしれません。これは、これらの候補製品から意味のある収入を得ることを阻止するかもしれません。
2021年、私たちは私たちの図書館TCR-T計画を優先し、私たちの資本資源を保護するために、制御されたIL-12およびCAR-T計画に関連する活動を大幅に減少させた。我々の制御されたIL−12やCAR−T計画の活動の決定を大幅に減少させることは、これらの計画の潜在力に悪影響を及ぼす可能性があり、これは我々の業務に実質的な悪影響を及ぼす可能性がある。我々は,それらの持続的な発展を支援するために,我々が制御しているIL−12とCAR−Tプロジェクトの協力機会を積極的に模索している。適切な戦略パートナーを決定できない場合や、そのようなパートナーと交渉や許可や販売協定を改善することができなければ、この2つの計画の開発を進めることは困難であり、これらの資産から何の意味のある収入も得られない可能性が高くなる。
私たちはTriArm Treateutics Ltd.やTriArmと共同でエデン生物細胞合弁企業の解散に同意した。合弁協定は終了し、エデン生物細胞実体は解散している。
我々の業務,運営と臨床開発計画およびスケジュールは,健康流行病(新冠肺炎大流行を含む)が我々あるいは我々と業務往来のある第三者(われわれの契約メーカー,CRO,受託者およびその他を含む)による製造,臨床試験およびその他の業務活動に影響を受ける可能性がある。
私たちがどこに臨床試験場所や他の業務を運営していても、私たちの業務は衛生流行病の悪影響を受ける可能性がある。さらに、健康流行病は、私たちの製造業務または将来依存または依存する可能性のある第三者製造業者、CRO、および他の第三者の運営に大きな中断をもたらす可能性がある。
私たちはグローバルサプライチェーンに依存して、私たちの臨床前研究と臨床試験のための製品を生産します。我々が受ける可能性のある隔離、庇護または同様の政府命令、または発生する可能性が予想されるそのような命令、閉鎖または他の制限については、新冠肺炎または他の感染症に関連しているか否かにかかわらず、米国および他の国の製造工場または第三者製造工場の人々、または材料の利用可能性またはコストに影響を与え、それによって私たちのサプライチェーンを乱す可能性がある。
もし私たちとサプライヤーまたは他のサプライヤーとの関係が新冠肺炎疫病または他の衛生流行病によって中止または削減された場合、私たちは代替サプライヤーまたはサプライヤーと手配を達成したり、商業的に合理的な条項であるいは適時にそうすることができないかもしれない。より多くのサプライヤーまたはサプライヤーを交換または増加させることは、多くのコストに関連しており、経営陣の時間と労力を必要とする。また、新しい仕入先や仕入先が作業を開始すると、自然な過渡期もある。したがって,遅延が生じる可能性があり,必要な臨床開発や任意の将来の商業化スケジュールを満たす能力に悪影響を及ぼす可能性がある。サプライヤーとサプライヤーとの関係を慎重に管理しているにもかかわらず、将来的に挑戦や遅延に遭遇しないこと、またはこれらの遅延や挑戦が私たちの業務を損なわないことを保証することはできません。
また,われわれの臨床前研究とMD Andersonが行っているTCR−Tライブラリー1/2期試験はすでに新冠肺炎の大流行の影響を受け続けている可能性がある。臨床サイトの起動、患者募集と臨床サイトへのアクセスが必要な活動は、データモニタリングを含み、すでに延期される可能性があり、原因は病院資源の新冠肺炎大流行に対する優先順位、あるいは患者が大流行期間中に臨床試験に参加することに対する懸念である。もし隔離が患者の行動を阻害したり、医療サービスを中断したりする場合、いくつかの患者は臨床試験方案のいくつかの態様に従うことが困難である可能性がある。同様に,医療提供者である患者,首席調査者,現場スタッフの募集と維持に成功できなければ,新冠肺炎への接触が増加しているか,あるいは彼らの施設,都市,州の追加的な制限を受けている可能性があり,我々の臨床試験運営は悪影響を受ける可能性がある。
33
カタログ表
私たちの候補製品の臨床試験、政府規制、製造に関連するリスク
われわれが臨床試験で患者を募集する際に困難に遭遇すると,われわれの臨床開発活動は延期されたり,他の悪影響を受けたりする可能性がある。
新しい冠肺炎の大流行による可能性のある影響を含む様々な理由から,我々が行っているTCR−Tライブラリー1/2期試験や任意の将来の臨床試験で患者を募集する困難を経験し続けている可能性がある。臨床試験方案に基づいて適時に臨床試験を完成し、他の要素以外に、著者らが十分な数量の患者を募集して臨床試験に残ることができるかどうかにかかっている。患者の登録は多くの要素に依存している
私たちの臨床試験は、私たちのいくつかの潜在的な患者が私たちの競争相手のうちの1つによる臨床試験に参加することを選択するかもしれないので、私たちの候補製品と同じ治療分野の製品を他の臨床試験と争奪するであろう。また、生物技術業界の不良事件の負の宣伝或いはその他の原因により、患者は著者らの研究に参加したくないかもしれない。合格臨床研究者の数が限られているため、著者らはいくつかの競争相手が使用した同じ臨床試験地点で著者らのいくつかの臨床試験を行うことが予想され、これは著者らがこれらの臨床試験地点で臨床試験を行うことができる患者数を減少させる。さらに、私たちの候補製品はよりよく使われる癌治療方法と異なるため、潜在的な患者と彼らの医師は、患者を任意の未来の臨床試験に参加するのではなく、化学療法や造血幹細胞移植などの伝統的な療法を使用する傾向があるかもしれない。また,われわれの臨床試験は再発/難治性癌患者で行われているため,われわれの将来の臨床試験は再発/難治性癌患者で行われる可能性があり,患者は通常疾患の末期にあり,我々の候補品とは独立した疾患進展を経験する可能性があり,臨床試験では評価できず,追加の患者登録が必要となる。
患者登録の遅延は、コスト増加を招く可能性があり、または、これらの臨床試験の完了または開始を阻止し、候補製品開発を進める能力に悪影響を及ぼす可能性がある、または計画中の臨床試験の時間または結果に影響を与える可能性がある。
私たちの候補製品は広範な規制とコンプライアンスを受けなければならない。これは高価で時間がかかり、このような規制は予期せぬ遅延を招き、あるいは私たちの候補製品を商業化するために必要な承認を受けることを阻止する可能性がある。
著者らの候補製品の臨床開発、製造、ラベル、包装、貯蔵、記録保存、広告、販売促進、輸出入、マーケティング、流通と不良事件報告は、安全とその他の情報の提出を含み、すべてアメリカFDAと国外市場の類似外国監督機関の広範な監督管理を受けている。規制の承認を受ける過程は費用が高く、しばしば臨床試験の開始後に何年もかかる必要がある。審査政策或いは法規は変化する可能性があり、FDAは薬品の審査過程中にかなりの自由裁量権を持ち、多種の原因で延期、制限或いは承認候補製品を拒否する権利がある。規制部門の承認は決して保証されなかった。
承認された候補製品を米国または海外で商業化する前に、私たちまたは私たちの協力者は、十分かつ良好に制御された臨床試験によって大量の証拠を提供し、FDAまたは同様の外国の規制機関に、これらの候補製品が安全かつ有効であること、または候補生物製品に関して、安全、純粋かつ有効であり、その予想される用途に使用することができることを満足的に証明しなければならない。
FDAまたは同様の外国の規制機関は、多くの理由で、承認候補製品を延期、制限、または拒否することができる
34
カタログ表
この長い承認過程と、臨床試験結果の予測不可能性は、規制部門の承認を得ることができず、私たちのどの候補製品も市場に出すことができず、私たちの業務、運営結果、将来性を深刻に損なう可能性がある。さらに、私たちの候補製品が規制機関の承認を得ても、規制機関は私たちの任意の候補製品の適応が私たちが要求するものよりも少ないか、または限られていることを承認する可能性があり、狭い適応、警告、またはリスク評価および緩和策(REMS)の形で重大な制限を加えることができる。
ある上場生物薬品の安全性に対する疑問を引き起こす事件はFDAと類似の外国の監督管理機関が安全性、有効性或いはその他の監督管理に基づいて新薬或いは生物製品を審査することを考慮する時に更に慎重であり、そして監督管理の許可を得る重大な遅延を招く可能性がある。適用可能な規制承認を得るか得られないかのいずれの遅延も、私たちまたは未来の任意の潜在的パートナーが私たちの候補製品を商業化することを阻止するだろう。
私たちの開発はまだ非常に早い段階にある。私たちの最先端の候補製品は初期臨床試験の段階にしかありません。これは非常に高価で時間がかかります。私たちはいつFDAにBLAを提出できるか、私たちの候補製品の臨床試験を完了できなかったり遅延したりすることができなくても、私たちの業務を損なう可能性があります。
我々の候補製品は異なる開発段階にあり,広範な臨床試験が必要である。我々の最先端の候補製品は我々のTCR−Tライブラリ1/2期試験であり,この試験は現在募集と患者への調剤を行っている。人体臨床試験は非常に高価で、設計、起動と実施が困難であり、一部の原因はそれらが厳格な監督管理要求を受けているからである。現在、私たちは既存のすべての候補製品のために臨床試験計画を制定しており、完成には数年かかると予想されるが、予想されるスケジュール内で追加的な試験を開始したり、これらの試験の結果を見ることができないかもしれない。失敗は臨床試験の任意の段階で発生する可能性があり、著者らは私たちの臨床試験の延期、放棄或いは重複を招く問題に直面する可能性がある。いくつかの著者らの臨床試験の開始遅延或いは完成を招く可能性のある要素は:監督機関の追加の非臨床データに対する要求、予見できない安全問題、投与量の問題、臨床試験期間中の有効性の不足、患者の募集或いはモニタリングの困難、或いは臨床製品の製造困難などの要素を含む。
それらが開発の後期段階に入るにつれて、私たちの候補製品は通常、第三段階の臨床試験に入る候補製品に対するFDAの化学、製造と制御の要求を含むより厳しい規制要求を受ける。FDAが早期臨床試験で研究した候補製品の第三段階臨床試験を開始することは保証されない。
FDAが我々の候補製品が後期臨床試験に入ることを許可しない場合、または第3段階の臨床試験を開始する前に、私たちの候補製品の配合または生産を変更することを要求する場合、私たちは、そのような候補製品をさらに開発または承認する能力が実質的な影響を受ける可能性がある。したがって、私たちは規制機関が私たちを承認するためにBLAを提出することができるかどうかを確実に予測することはできません
35
カタログ表
製品候補やそのようなBLAが受け入れられるかどうか.1つ以上のBLAを提出し、その後必要なFDA承認を得るまでは収入が生じないと予想されるため、承認に関するBLA提出時間およびFDAの決定は、収入を生み出すことができるかどうか、いつ収入を生み出すことができるかどうかに直接影響を与える。
私たちの候補製品は、不良な副作用、またはその規制承認を遅延または阻止する可能性があり、承認されたラベルを制限する商業イメージ、または任意の潜在的な市場承認後に重大な負の結果をもたらす特性をもたらす可能性がある。
多くの製薬や生物製品と同様に、私たちの候補製品の治療はサイトカイン放出に関連する潜在的な不良副作用を含む不良副作用或いは副作用或いはイベントを産生する可能性がある。もし私たちの候補製品または類似製品または第三者が開発している候補製品が受け入れられない不良事象を示す場合、私たちは候補製品のさらなる臨床開発を停止または延期することを要求されるかもしれない。FDAまたは他の外国規制機関は、私たちの任意またはすべての目標適応を承認する候補製品の開発を停止または拒否するように命令することができる。もし著者らのTCR-Tライブラリ1/2期試験中に深刻な不良事件が発生すれば、FDAは臨床試験を一時停止する可能性がある。
製品に関連する副作用は、患者の募集または患者の試験完了能力に影響を与える可能性があり、あるいは潜在的な製品責任クレームを招く可能性がある。また、治療医療従事者は、これらの副作用を適切にまたは適時に識別または管理することができない可能性があり、特に私たちと協力する機関以外には、私たちの新しい技術による毒性が一般患者集団や医療従事者に遭遇しない可能性がある。私たちの候補製品を使用する医療従事者を訓練して、彼らの副作用状況を理解して、私たちが計画している臨床試験においても、どの候補製品の商業化後も。私たちの候補製品の潜在的な副作用を認識または管理する上での訓練不足は、死亡を含む患者の副作用を引き起こす可能性がある。さらに、私たちの1つまたは複数の候補製品が発売承認され、私たちまたは他の人が、私たちの候補製品を使用して治療を受けることを提案または要求する患者の任意の長期追跡観察期間内に、多くの潜在的な重大な負の結果をもたらす可能性があることを後に発見した場合、
承認されれば、上記のいずれも、特定の候補製品に対する市場受容度を達成または維持することを阻止することができる。しかも、このようなどんな状況も私たちの業務、財務状況、そして見通しに大きな被害を及ぼす可能性がある。
我々の細胞治療免疫腫瘍学候補製品は、試薬、専門設備、および他の特殊な材料およびインフラの利用可能性に依存しており、これらは私たちが受け入れられない条項または根本的には得られないかもしれない。これらの試薬、設備、および材料について、私たちは独占的なサプライヤーまたは限られた数量のサプライヤーに依存しているか、または依存する可能性があり、これは私たちが製品を製造して供給する能力を弱めるかもしれない。
私たちの候補製品を製造するためには、多くの試薬が必要であり、これらの試薬は、私たちの製造中に化学反応または生物反応を引き起こすための物質、および他の特殊な材料および装置であり、その中のいくつかは、商業生物製品の生産を支援するために、資源および経験の限られた小さな会社によって製造または供給される。私たちは現在、私たちのTCRをヒトT細胞に挿入するベクターとして使用するDNAプラスミドを含む、限られた数の供給者に依存して、私たちの候補製品を生産するためのいくつかの材料および装置を提供する。その中のいくつかのサプライヤーは、生物製薬会社が現在の良好な製造実践の下で生産した商業製品を支持する能力がないかもしれない、あるいは装備が不足している可能性があり、私たちの需要を支持できないかもしれない。私たちもその中のいくつかのサプライヤーと供給契約を締結していません。受け入れ可能な条件や供給契約を全く得られないかもしれません。したがって、私たちは臨床または商業製造を支持する重要な材料と設備の受け入れに遅延があるかもしれない。
これらの試薬、装置、インフラ、および材料のいくつかについては、私たちは依存しており、将来的には単一ソースの供給者または限られた数の供給者に依存する可能性がある。これらのサプライヤーから製品を調達し続けることができない、または商業合理的な条項で製品を調達することができないのは、サプライヤーの規制行動や要求、サプライヤーが経験した不利な財務または他の戦略発展、労使紛争または不足、意外な需要、サプライチェーン問題または品質問題に影響を与える可能性があり、候補製品の需要を満たす能力に悪影響を及ぼす可能性があり、これは私たちの臨床試験を行う能力に悪影響と実質的な影響を与える可能性があり、これは私たちの業務を深刻に損なう可能性がある。
しかも、私たちが使用しているいくつかの試薬と製品は同じサプライヤーに保存されている可能性がある。単一サプライヤーの材料が失われた、あるいはそのサプライヤーが私たちの規範に基づいて臨床製品を生産できなかったことは、私たちが行っている或いは計画中の臨床試験と私たちの製品を開発し続ける能力に影響を与える。また,代替材料を製造するには高価である可能性があり,多くの時間が必要であり,われわれの臨床計画にさらに影響を与える可能性がある。
36
カタログ表
私たちの製造プロセスの発展と拡大に伴い、私たちはこのプロセスの一部として使用されるいくつかの材料と設備の追加の権利と供給を得る必要があると予想される。私たちは商業的に合理的な条項やそのような材料に対する権利を全く維持できないかもしれません。もし私たちがそのような材料の使用を避けたり、適切な代替品を見つけることを避けるために、商業的に実行可能な方法で私たちのプロセスを変えることができなければ、これは私たちの業務に実質的な悪影響を及ぼすでしょう。他の材料や設備を使用するために私たちのプロセスを変えることができても、このような変化は、私たちの臨床開発および/または商業化計画の遅延をもたらす可能性がある。すでに臨床試験中の候補製品がこのように変化していれば,このような変化は体外比較性研究を行い,より高度な臨床試験を行う前に患者からより多くのデータを収集する必要があるかもしれない。
著者らは少なくともある程度臨床研究機関と他のCROに依存して臨床テストと/或いは研究開発活動を行うため、著者らの臨床試験とこのような研究活動の結果はある程度著者らの制御範囲を超えている。
我々は,大学や医療機関のような独立した研究者や協力者に大きく依存し,我々との合意に基づいて臨床試験を行っている。また、著者らはCROを招いて、臨床試験の管理、データの収集と臨床サンプルの分析を支援した。この協力者たちは私たちの従業員ではなく、私たちは彼らが私たちのプロジェクトに投入した資源の数やスケジュールを制御することができない。これらの調査者たちは、私たち自身がこのようなプロジェクトを行う時のように私たちのプロジェクトを優先しないかもしれませんし、私たち自身のように勤勉にこれらのプロジェクトを追求することもありません。もし外部協力者が私たちの製品開発計画に十分な時間と資源を投入していない場合、または彼らの表現が目標に達していない場合、私たちFDAの申請(ある場合)の承認と私たちの新製品の発売は延期されるだろう。これらの機関はまた、それらが私たちの計画を推進する能力を制限する政策と手続きを制定したり、未来に実施したりすることができる。これらの協力者たちはまた他の商業実体と関係がある可能性があり、その中のいくつかは私たちと競争する可能性がある。もし私たちの協力者が私たちの競争相手を助けて私たちの利益を損なうなら、私たちの競争地位は損なわれるだろう。
私たちは私たちの候補製品を生産して供給することについて経験が限られている。臨床試験で患者を治療するために必要な規格や数量を満たすために、私たちの候補製品を一貫して生産することができないかもしれない。
生物製薬製造に対する私たちの経験は限られている。2021年、テキサス州ヒューストンにある賃貸本部の内部良好な製造実践(CGMP)製造工場で候補製品の生産を開始しました。私たちの候補製品を作る能力は、適切な背景を持つ人員を見つけて維持することと、従業員と日常運営施設の訓練にかかっています。もし私たちがこの人たちを見つけたり維持したりすることができない場合、私たちは必要な役割を埋めるために、または外部請負業者と接触するために、より多くの人員を訓練する必要があるかもしれない。細胞治療経験のある人は少なく、これらの人たちの競争は激しい。
具体的には,細胞療法製造施設の運営は複雑な作業であり,知識のある人が必要であり,これまでクリーンルーム環境で成功した経験がある。細胞治療施設は,他の生物製剤製造施設と同様に,設計どおりに動作していることを証明するために適切なデバッグや検証活動が必要である。また、各製造プロセスは、施設、人員、設備、およびプロセスが設計通りに動作することを保証するために、プロセス検証動作の性能によって検証されなければならない。我々はすでに内部チームを用いて独自の製造プロセスを開発しているが,内部製品製造に関する時間リスクの増加につながる。
私たちの候補製品の製造は複雑で、先進的な製造技術とプロセス制御の開発を含む大量の専門知識と資本投資が必要だ。細胞治療製品のメーカーは生産において困難に直面することが多く,特に規模拡大や初期生産の検証や汚染のない確保が行われている。これらの困難は生産コストと生産量、品質管理(製品の安定性を含む)、品質保証テスト、オペレータミス、合格者不足及び厳格に実行されている連邦、州と外国法規を遵守することを含む。また、私たちの候補製品供給中や私たちの製造施設で汚染物質が発見された場合、汚染を調査·修復するために製造施設の閉鎖時間を延長する必要があるかもしれない。未来には私たちの候補製品の製造に関連した安定性や他の問題が発生するかもしれない。われわれは最近,われわれの臨床試験INDを改正し,凍結保存による臨床製品を用いて貯蔵した。この過程は新たであり,この変化により,十分な数の臨床製品を製造失敗したり,生産することが困難であるという問題に遭遇する可能性がある。
私たちの候補製品は現在、患者ベースで生産され続けるだろう。生産遅延は各患者の治療に不利な影響を与える可能性があり、現在或いは未来の臨床試験を阻害する可能性がある。著者らはまだ著者らの候補臨床試験製品を大規模に生産しておらず、自分で大規模な臨床試験或いは商業製造と加工を実現できない可能性があり、著者らの任意の候補製品の期待する臨床試験或いは商業需要を満たす。我々の現在の製造と加工方法は,我々の早期臨床製品開発を支援するのに適していると考えられるが,T細胞工学過程を管理する上での経験は限られており,われわれの過程は予想以上に困難か高価である可能性がある。私たちが採用した製造技術は安全で効果的な候補製品を生成しないかもしれない。もし私たちの候補製品のために十分な数のTCR-T細胞を生産できなければ、私たちの開発は延期され、これは私たちの業務と将来性に不利な影響を与えるだろう。
私たちの製造事業はFDAの審査と監督を受けている。我々はFDA,薬品監督管理局,対応州機関の持続的な定期抜き打ち検査を受けており,cGMPや他の政府法規の厳格な遵守を確保している。私たちの候補製品製造許可証は持続的な規制検討を受けている。
37
カタログ表
私たちはまだ候補製品の商業製造と加工コストを確実に見積もるための十分な情報がありません。ビジネス規模で私たちの候補製品を製造し加工する実際のコストは、私たちの候補製品の商業実行可能性に実質的な悪影響を及ぼす可能性があります。したがって、私たちは商業的に実行可能な製品を開発することができないかもしれない。
患者材料を収集し,我々の製造現場に搬送し,候補製品を患者に戻す物流を管理することもできない可能性がある。物流および輸送遅延および問題は、私たちまたは私たちのサプライヤーによって引き起こされるかどうかにかかわらず、候補製品の患者への配送を阻止または遅延する可能性がある。
私たちが臨床試験のために日々多様化している患者群から私たちの候補製品を生産する時、私たちの製造過程を検証することは困難かもしれない。
私たちの製造技術開発過程で、私たちのTCR-T細胞候補製品は1ロットから別のグループまで、そしてドナーからドナーまで一貫性を証明した。しかし,われわれの試料量は小さく,われわれの臨床前開発作業で使用されている出発材料は健康なドナー由来である。患者群から抽出した白血球を処理する際には,不健康なドナーから材料を抽出し,不健康な患者から白血球を採取する固有の挑戦を含む予見できない困難に遭遇する可能性がある。
私たちの現在の製造プロセスは私たちの臨床開発と商業化に拡張できると信じていますが、もし私たちの任意の候補製品が承認されたり、商業化されたりすれば、製品出発材料の異質性によって、私たちのプロセスを検証する時に挑戦に直面する可能性があります。しかし,臨床試験の早期段階では,これらの違いを考慮して,よりロバストな過程を生じるように私たちの過程を調整することができると予想される。出発材料の異質性に関連する他の問題が候補製品を商業化生産する能力に影響を与えないことは保証できません。
候補製品を生産するための睡眠美人系の遺伝子転移ベクターは,患者T細胞の遺伝物質を誤って修正する可能性があり,新たな癌や他の有害事象を引き起こす可能性がある。
TCR-T細胞は私たちの寝美人TCR構造をコードする遺伝情報を患者のT細胞に挿入する非ウイルスベクター。そして,TCR構造は主に患者ゲノム中のチミン−アデニンやTAジヌクレオチド部位に統合され,タンパク質として発現すると患者T細胞の表面に輸送される。遺伝子転移ベクターがT細胞の遺伝情報を修正しているため,理論的には修正がT細胞遺伝子コードの誤った位置に発生し,ベクターに関連する挿入癌が発生し,T細胞癌化をきたすリスクがある。癌T細胞がその後患者に注射されると、癌T細胞は患者の新しい癌の発展を引き起こす可能性がある。非ウイルスベクターを用いて遺伝情報をT細胞に挿入すると,ウイルスベクターに比べてT細胞が腫瘍に挿入されるリスクは低いと考えられる。しかし,挿入発癌のリスクは依然として遺伝子治療の問題であり,われわれが行っているか計画中のどの臨床試験でもこのようなことは起こらないことを保証することはできない。遺伝物質あるいは遺伝物質を携帯するためのベクターの他の構成要素は持続的な生物学的活性を有するため、遺伝子治療製品に接触した後に遅延不良事象が発生する潜在的なリスクが存在する。我々は非ウイルスベクターを用いているが,FDAはレンチウイルスベクターが不良事象を遅延させる可能性の高いリスクがあるという特徴を指摘している。もし私たちの非ウイルスベクターにこのような有害事象が発生した場合、私たちの臨床前研究または臨床試験のさらなる進展は停止または延期される可能性があり、これは私たちの業務と運営に重大な悪影響を与える。
私たちが上場承認を得た任意の候補製品は、発売後に市場から制限されたり、撤退したりする可能性があり、もし私たちが規制要求を守っていない場合、あるいは私たちの製品が予期せぬ問題に遭遇した場合、その中のどの製品が承認された場合、処罰を受けるかもしれません。
私たちが発売許可を得た任意の候補製品、及びその製品の製造プロセス、承認後の臨床データ、ラベル、広告と販売促進活動は、FDAと他の監督管理機関の持続的な要求と審査を受ける。他にも、これらの要件は、セキュリティおよび他の発売後の情報および報告の提出、登録および上場要件、製造、品質管理、品質保証および記録およびファイルの対応する維持に関連するcGMP要件、医師へのサンプルの配布および記録の保存に関する要求を含む。候補製品の上場が承認されても、承認は、制限された流通システムの要件を含むREMSの実施要件を含む、製品が発売される可能性のある指定された用途の制限または承認条件によって制限される可能性がある。もし私たちの候補製品が発売承認された場合、付随するラベルは承認の用途を制限する可能性があり、これはその製品の販売を制限する可能性がある。
FDAはまた、我々が承認した製品の安全性または有効性を監視するために、高価な発売後の研究または臨床試験およびモニタリングを要求する可能性がある。FDAは、承認された適応販売のみを確保し、承認されたラベルの規定に適合することを確実にするために、製品の承認後のマーケティングおよび販売促進を密接に規制する。しかし、会社はラベルと一致する真で誤解されない情報を共有するかもしれない。FDAはラベル外使用に関するメーカーのコミュニケーションに厳しい制限を加えており、もし私たちが彼らが承認した適応外で私たちの製品を販売すれば、私たちはラベル外マーケティングの法執行行動を受けるかもしれない。処方薬の促進に関する“連邦食品、薬物、化粧品法”違反は調査につながる可能性があり、連邦や州医療詐欺や法律乱用、州消費者保護法違反を告発している。
38
カタログ表
さらに、私たちの候補製品、製造業者、または製造プロセスは、以前に未知の有害事象または他の問題が発生したり、法規要件を遵守できなかったりすることが発見され、様々な結果が生じる可能性がある
安全モニタリングや薬物警戒の要求を守らないことも重大な経済的処罰を招く可能性がある。同様に、小児科群のための製品の開発と個人の健康情報の保護に関する米国と外国の監督管理要求を守らないことも重大な処罰と制裁を招く可能性がある。
候補製品を商業化する能力に関するリスク
もし私たちが必要なアメリカや世界的な規制承認を得て任意の候補製品を商業化できなければ、私たちの業務は影響を受けるだろう。
私たちは私たちの候補製品を商業化するために必要な承認を得ることができないかもしれないし、将来的に商業販売のための任意の候補製品を買収または開発することができるかもしれない。私たちの候補製品を米国で商業化するためにはFDAの承認が必要であり、これらの司法管轄区域で私たちの候補製品を商業化するためには、FDAに相当する外国司法管轄区域規制機関の承認を得る必要がある。任意の候補製品に対するFDAの承認を得るためには、候補製品が人間にとって安全であり、その期待用途に有効であることを証明するBLAをFDAに提出しなければならない。この論証には重要な研究と動物試験が必要であり,これは臨床前研究,およびヒト試験と呼ばれ,臨床試験と呼ばれる。候補製品のタイプ、複雑性と新規性によって、FDAの監督管理要求を満たすには通常数年を要し、大量の資源を研究、開発とテストに使用する必要がある。我々の研究,開発,臨床方法がFDAが人間の安全で期待用途に有効であると考えている製品が生成されるかどうかは予測できない。FDAは承認過程において大きな裁量権を有しており,追加の臨床前研究や臨床試験,あるいは上場後研究が求められる可能性がある。承認プロセスは、私たちの規制審査の前または間に発生した政府法規、将来の立法または行政行動の変化、またはFDA政策の変化によって遅延する可能性もあります。遅延は規制部門の承認を得ることができるかもしれない
たとえ私たちがFDAのすべての要求を遵守したとしても、FDAは最終的に私たちの1つ以上のBLASを拒否するかもしれない。私たちは私たちのどの候補製品も規制部門の承認を受けると確信できない。もし私たちの候補製品がFDAの承認を得られなかった場合、私たちの業務を深刻に損なうことになります。私たちは適切な製品がないので、別の候補製品が開発されるまで潜在的な収入源がありません。私たちが他の候補製品を開発したり得ることができる保証はないし、もし私たちがそうすることができれば、FDAの承認を得ることができるかどうか。
39
カタログ表
外国の管轄区域では、私たちはまた私たちの任意の候補製品を商業化するために、規制機関の適用の承認を受けなければならない。外国規制承認手続きには、通常、上述したFDA承認手続きに関連するすべてのリスクが含まれる。
販売、マーケティング、流通能力を作ることも、第三者と合意してこれらの機能を実行することもできなければ、私たちの候補製品を商業化することに成功できないだろう。
私たちは現在マーケティング、販売、または流通能力を持っていない。現在または将来の候補製品を商業化できることを合理的に決定すれば、北米やいくつかの他の地域でのマーケティング、販売、流通に資源を割り当てることが予想されますが、私たちが私たちの製品を成功的にマーケティング、販売、流通できる保証はありません。私たちの将来の成功は、私たちがこれらの能力のために協力関係を構築し、維持する能力と、開発されている候補製品に対する協力者の戦略的興味と、これらの協力者がどのような製品を成功的にマーケティングし、販売することを奨励する能力にもある程度依存するかもしれない。私たちは私たちのいくつかの候補製品の販売とマーケティングについていくつかの協力手配を達成しようとしているが、私たちが協力手配を確立したり維持したりすることができる保証はないし、もし私たちがそうすることができれば、私たち自身の販売努力を行うことができるかどうか。また、第三者パートナーとの関係を構築したり、維持したり、内部販売や流通能力を発展させることができる保証もありません。私たちが第三者に依存してマーケティングや流通を行う程度では、私たちが得たどんな収入もこれらの第三者の努力にかかっており、このような努力が必ず成功する保証はない。また、私たちがアメリカや海外で私たちの候補製品をマーケティングして販売できるという保証はありません。
第三者と協力できなければ、販売やマーケティング担当者の募集や販売·マーケティングインフラの構築に成功しなければ、私たちの候補製品を商業化することは困難であり、業務を損なうことになります。もし私たちが成熟した流通システムを持つ製薬やバイオテクノロジー会社に依存して私たちの製品を販売すれば、私たちは協力関係の手配を確立し、維持する必要があり、私たちは受け入れ可能な条件や根本的にこれらの手配を達成できないかもしれない。私たちが共同販売促進や他の計画を達成する限り、私たちが得たどんな収入も第三者の努力にかかっており、これらの努力は成功しない可能性があり、私たちの統制下に部分的にしかないかもしれない。
もし医師や患者が私たちの候補製品を受け入れて使用しなければ、承認されると、製品販売から収入を創出する能力は深刻な損害を受けるだろう。
FDAおよび/または海外の同業者が私たちの候補製品を承認したとしても、医師や患者はそれらを受け入れて使用することができない。工学T細胞を潜在的な癌治療方法として使用することは比較的に新しい発展であり、医師、患者、病院、癌治療センター、第三者支払人と医学界の他の人に広く受け入れられない可能性がある。私たちの製品を受け入れて使用するかどうかは複数の要素に依存します
現在の候補製品の販売が予想され,承認されれば,予見可能な将来にほとんどの製品収入が生じるため,製品が市場承認を得ることができないことは我々の業務を損なうことになり,将来の候補製品の開発に資金を提供するために追加の融資を求める必要があるかもしれない。私たちの製品が市場に認められても、私たちの製品より人気があり、費用効果があり、あるいは私たちの製品を時代遅れにする新製品や技術が発売されたら、時間の経過とともに市場受容度を維持することができないかもしれません。
もし私たちの製品が支払人から保険と十分な補償を受けなければ、私たちは製品収入を作る能力が弱まるだろう。
私たちの候補製品を商業化する能力があるかどうかは、承認されれば、単独またはパートナーと協力すれば、政府や健康管理機関、個人健康維持組織、健康保険会社、他の支払人を含む第三者支払者が保険や精算を提供する程度にある程度依存するだろう。自分の病状を治療するために処方された患者は、通常、その処方薬に関する費用の全部または一部を精算するために第三者支払者に依存する。十分な保証範囲と第三者支払人の十分な精算は新製品の受け入れ度に重要です。保証の決定は臨床と
40
カタログ表
より成熟またはより低コストの治療代替製品がすでにまたはその後利用可能である場合、新薬製品の経済基準はサポートされない。第三者支払者が我々のような新しい遺伝子や細胞治療製品のカバー範囲や補償決定を行うとは予測が困難である。私たちの候補製品のために保険を受けても,それによる精算支払率が十分でない可能性があり,あるいは患者が受け入れられないと思う高い共済額が必要となる可能性がある。患者は保険を提供しない限り、私たちの候補製品を使用することはあまりできません。そして、私たちの候補製品を支払うのに十分なコストの大部分を精算します。
さらに、規制承認を受ける可能性のある候補製品の市場は、FDAによって承認された特定の適応のすべての薬剤が含まれていない可能性がある第三者支払者の薬物処方または第三者支払者が保険および精算の薬剤リストを提供するかどうかに大きく依存する。このような処方に組み込まれた業界競争は往々にして製薬会社に下振れ価格圧力をもたらす。さらに、価格の低い後発薬または他の代替品がある場合、第三者支払者は、その処方に特定のブランド薬を含むことを拒否するか、または他の方法で患者がブランド薬を得ることを制限する可能性がある。
第三者決済者は,外国でも国内でも,政府のも商業的にも,ますます複雑な方法を開発して医療コストを抑えている。また、米国では、第三者支払者の間に統一された薬品保険や精算政策はない。そのため、薬品の保証範囲と精算範囲は支払人によって異なる。そのため、保証範囲の確定過程は通常時間がかかり、高価な過程であり、各支払人にそれぞれ私たちの製品を使用する科学的かつ臨床的な支持を提供する必要があり、承認を得ることが保証されない。もし私たちが第三者支払者から私たちの候補製品の保証範囲と十分な支払いレベルを得ることができない場合(承認された場合)、医師は彼らが私たちの製品の金額や状況を制限したり管理したりするかもしれません。患者はこれらの製品の購入を拒否するかもしれません。これは逆に私たちが製品を商業化する能力に影響を与え、私たちの収益性、経営結果、財務状況、未来の成功に影響を与えるかもしれない。
また、多くの外国、特にEU諸国では、処方薬の定価は政府によってコントロールされている。一部の非アメリカ司法管轄区では、薬物の提案価格は必ず承認されなければならず、合法的に発売されることができる。各国の薬品定価に対する要求は大きく異なる。例えば、EUは、その加盟国に様々な選択を提供し、その国の健康保険制度が補償を提供する医療製品の範囲を制限し、人が使用する医療製品の価格を制御する。加盟国は医薬製品の具体的な価格を承認することができ、医薬製品を市場に投入する会社の収益力に対して直接或いは間接的に制御制度をとることもできる。私たちは海外からの低価格製品の競争に直面するかもしれません。これらの製品は薬品に対して価格規制を実施しています。また、私たち自身の製品と競争する外国製品を輸入する可能性があり、これは私たちの収益性にマイナスの影響を与える可能性がある。
私たちの候補製品の市場機会は、以前の治療に適合していないか、または通過できなかった患者に限定される可能性があり、小さい可能性がある。
癌療法は1線、2線、または3線と記述されることがあり、FDAは通常、最初に三線使用の新しい療法のみを承認する。癌が十分に早く発見された時、第一線の治療は治愈を必要とすることなく、癌を治癒したり、生命を延長するのに十分であることがある。第一線の治療が成功しないことが証明された場合,通常は化学療法,ホルモン治療,手術あるいはこれらの療法の組み合わせであり,二次治療が施行される可能性がある。二線治療は、一般に、より多くの化学療法、放射線、抗体薬物、腫瘍標的小分子、またはこれらの薬剤の組み合わせを含む。三線治療は骨髄移植、抗体と小分子標的治療、より侵襲性のある手術形式と新しい技術を含むことができる。われわれは最初に,他の承認療法に失敗した患者を治療する三線療法として,我々の候補製品の承認を求める予定である。
その後,十分有益であることが証明された候補品については,あれば二次療法としての承認を求め,一次療法として可能であるが,我々の候補製品は保証されず,承認されても二次療法や一次療法として承認される。また、二線または一線治療の承認を得る前に、追加の臨床試験を行わなければならないかもしれない。
私たちの目標癌患者数の予測と、治療を受ける能力があり、私たちの候補製品治療から利益を得る可能性があるこれらの癌患者のサブセットは、私たちの信念と推定に基づいている。これらの推定は様々な源から来ており、科学文献、診療所調査、患者基金会或いは市場研究を含み、正しくないことが証明されている可能性がある。また,新たな研究はこれらの癌の推定発症率や流行率を変える可能性がある。患者数は予想より少ないかもしれない。さらに、私たちの候補製品の潜在的にアドレス指定可能な患者集団は限られているかもしれないし、または私たちの候補製品の治療を受け入れられないかもしれない。私たちの市場機会はまた市場に参入する可能性のある競争相手の治療によって制限されるかもしれない。
医療立法改革措置は私たちの業務と運営結果に実質的な悪影響を及ぼす可能性がある。
近年、米国や一部の外国司法管轄地域では、多くの立法や規制法規が医療システムを変更し、将来的に私たちの候補製品を販売する能力に影響を与える可能性がある。
また,連邦と州レベルでは医療コストの低減を図るためのいくつかの取り組みが継続されるであろう。何よりも、2010年3月、オバマ総裁は“医療改革法案”に署名し、その中に含まれている措置は、政府や民間保険会社が医療に融資する方法を著しく変えた。他にも、ACAは、医療補助薬品バックル計画の下で製造業者が不足しているバックルが吸入、注入、点滴、インプラント、または吸入、注入、点滴、移植または計算される新しい方法を実施する
41
カタログ表
これらの措置には,医療補助薬品還付計画下でメーカーが不足している最低医療補助税還付を増加させ,税金還付計画を医療補助管理の看護組織に登録されている個人に拡大し,1つの条項を増加させ,製品ラインの拡張や薬物の再配合に対する医療補助還付を増加させ,あるブランドの処方薬や生物製剤のメーカーや輸入業者に対する年会費を確立し,新たな連邦医療保険D部分カバーギャップ割引計画を促進し,公衆衛生サービス法案に基づく薬品定価計画に基づいて割引を受ける資格のある実体を拡大し,製薬会社と医療従事者との相互作用に関連する重大な新規条項を多く実施することがある。ACAはまた、医療補助計画の資格を拡大し、患者を中心とした新たな結果研究所を導入し、優先事項を監督、決定し、臨床有効性比較研究を行い、このような研究に資金を提供し、CMSに新たな医療保険·医療補助革新センターを設立し、革新的な支払い·サービス交付モデルをテストし、医療保険や医療補助支出を低減する。
ACAのいくつかの側面は行政、法律、そして政治的側面の挑戦に直面している。例えば、トランプ総裁は、ACA要求のいくつかの要求を延期、回避、または緩和するためのいくつかの行政命令および他の命令に署名した。同時に、国会はACAの全部または一部を廃止または廃止し、代替する立法を審議した。国会ではまだ全面的な廃止立法は成立していないが、ACAの下にある税収実施に影響を与えるいくつかの法案が署名されて法律となっている。2017年12月、国会は個人がACA規定を維持できなかった医療保険に対する税罰を廃止し、これは税法の一部であり、2019年1月1日から施行された。また、バイデン総裁は、仕事の要求を含む医療補助モデルプロジェクトおよび免除計画の再検討、医療補助またはACAによる医療保険カバーの獲得に不必要な障害をもたらす政策を含む、特定の政府機関に医療保健の取得を制限する既存の政策およびルールの見直しを指示する行政命令を発表した。また,バイデン政府のいくつかの医療改革はACAに影響を与えている。例えば、2022年8月16日、総裁·バイデンはアイルランド共和軍に署名し、法律にした, ACA市場で医療保険を購入した個人への増強補助金を2025年に延長する。2025年からアイルランド共和軍は,受益者の最大自己負担コストの著しい低減と新たに構築されたメーカー割引計画の実施により,連邦医療保険D部分計画下の“ドーナツ脆弱性”を解消した。ACAは未来に司法や国会で挑戦される可能性がある。このような挑戦やバイデン政府の医療改革措置がACAと我々の業務にどのように影響するかは不明である。いかなる医療改革措置がアメリカ医療業界の最終内容、時間或いは影響に与えるかはまだ不明である。
また、米国は特殊薬品の価格設定に対する立法と法執行への興味もますます大きくなっている。そのため、アメリカ議会は数回の調査を行い、連邦と州立法を提出し、公布し、薬品定価の透明性を高め、定価とメーカー患者計画との関係を審査し、政府計画の薬品精算方法を改革することを目的とした。連邦レベルでは、トランプ政権はいくつかの手段を用いて、連邦予算提案、行政命令、政策措置を含む薬品定価改革を提出または実施している。例えば、2020年7月24日と2020年9月13日に、トランプ政権は処方薬の定価に関するいくつかの行政命令を発表し、政府のいくつかの提案を実施しようとしている。
FDAはまた,2020年11月30日から発効し,輸入行政命令の一部を実施し,各州がカナダからの薬品輸入計画の策定と提出に指導を提供した最終規則を発表した。また、2020年11月30日、HHSは薬品メーカーが連邦医療保険D部分下の計画スポンサーの値下げに対する安全港保護を廃止し、法律が値下げを要求しない限り、直接あるいは薬局福祉マネージャーを通過する法規を決定した。Ireland共和軍はこの規定された施行期間を2032年1月1日に延期した。この規定はまた、販売所での値下げを反映するための新しい避難港を創出し、薬局福祉マネージャーとメーカーとの間のいくつかの固定費用手配のための新しい避難港を創出し、これらの計画の実施も2032年1月1日に延期された。また、2021年3月11日、総裁·バイ登は2021年米国救援計画法案に署名し、2024年1月1日から法定の医療補助薬品還付価格上限を廃止し、現在単一源と革新者多源製品の薬品メーカー平均価格は100%である。また、2021年7月、バイデン政府は処方薬に対する複数の条項を含む行政命令を発表した。バイデンの行政命令に応えるため、2021年9月9日、衛生と公衆サービス部は高い薬価に対応する総合計画を発表し、その中で薬品価格改革の原則を概説した。この計画は,国会がとりうる様々な潜在的立法政策と,HHSがとりうる行政行動を示している。このような原則を施行するための立法や行政行動はまだ最後に決定されていない。また、国会は予算調整過程の一部として薬品定価を検討している。また、アイルランド共和軍は、他の事項を除いて、(I)いくつかの高支出の価格を交渉するように衛生·公衆サービス部に指示した, 連邦医療保険がカバーする単一由来薬物および生物製品は、法律で規定された協議の“最高公平価格”以下の価格を提供することによって、薬品メーカーを民事罰金と潜在的な消費税に直面させ、(Ii)連邦医療保険B部分とD部分に基づいてリベートを徴収し、インフレを超える価格上昇を処罰する。アイルランド共和軍は衛生と公共サービス部が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。これらの規定は法的挑戦を受ける可能性があるにもかかわらず、2023年度から段階的に施行されるだろう。アイルランド共和軍がどのように実施されるかは不明であるが,製薬業に大きな影響を与える可能性がある。米国の個別州も、価格または患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示および透明性措置を含む立法および実施により、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。
将来的にとりうる医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受ける可能性のある任意の承認された製品の価格に追加の下振れ圧力を与える可能性があると予想される。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制策を実施したり
42
カタログ表
他の医療改革は、私たちが収入を創出し、利益を達成することを阻止するかもしれないし、あるいは規制部門の承認を得たら、私たちの製品は商業化できないだろう。
もし私たちが詐欺と乱用、健康情報のプライバシーと安全法を含む連邦と州医療保険法を守らなければ、私たちは重大な処罰に直面する可能性があり、私たちの業務、運営結果、財務状況、見通しは不利な影響を受ける可能性がある。
製薬会社として、私たちが医療サービスの紹介をコントロールしたり、Medicare、Medicaid、または他の第三者支払者に請求書を発行したりすることはできません。いくつかの詐欺や乱用、および患者の権利に関連する連邦および州医療法律法規は、現在も将来も私たちの業務に適用されます。例えば、私たちは連邦政府と私たちが業務を行っている州の医療詐欺や虐待、患者のプライバシーに規制されるかもしれない。私たちの運営能力に影響を与える可能性のある法律には
これらの法律の広さ、および法定例外状況および利用可能な避難港の狭さのために、私たちのいくつかの商業活動は、株式または株式オプションをそのサービス補償として得る可能性のある医師との任意の諮問協定を含み、1つまたは複数のそのような法律の挑戦を受ける可能性がある。しかも、最近の医療改革立法はこのような法律をさらに強化した。例えば、ACAは他に加えて、連邦反リベート法規およびいくつかの刑事医療詐欺法規の意図要件を修正した。個人や実体はこの規制やそれに違反する具体的な意図を実際に理解する必要はない。また、“反リベート法”では、政府は、“虚偽申告法”の規定により、連邦“反リベート条例”違反による物品又はサービスのクレームが虚偽又は詐欺的クレームを構成することを含むと主張することができる。
もし私たちのすべての候補製品が最終的に外国で販売されれば、私たちは似たような外国の法律法規の制約を受けるかもしれない。
私たちの業務計画が適用された医療保険法に適合するように努力することは多くのコストに関連している。政府と法執行当局は、私たちの業務慣行は、詐欺や乱用または他の医療保健法律および法規を適用する現在または未来の法規、法規または判例法に適合していないと結論するかもしれない。もし私たちにこのような訴訟を提起し、私たちが自分の権利を弁護したり、維持することに成功しなかったら、私たちは行政、民事と刑事処罰、損害賠償、罰金、MedicareとMedicaid、返却、監禁、誠実な監督と報告義務のような米国連邦または州医療計画から除外され、私たちの業務を削減または再構築することを含む重大な処罰を受ける可能性があり、いずれも私たちの業務運営能力および財務業績に重大な悪影響を及ぼす可能性がある。コンプライアンスは可能ですが
43
カタログ表
これらの法律に違反する行為を調査·起訴するリスクを減らし、これらのリスクを完全に解消することは不可能である。これらの法律に違反して私たちにとった行動は、たとえ私たちが弁護に成功しても、巨額の法的費用を招き、私たちの経営陣の業務運営への注意をそらす可能性があります。また、適用される連邦と州のプライバシー、安全、詐欺法律の遵守を実現し、維持することは費用が高いことが証明される可能性がある。
著者らの免疫腫瘍学候補製品は未来に生物模倣薬および/または新技術からの競争に直面する可能性がある。
“2009年生物製品価格競争と革新法”(BPCIA)は後続の生物製品の審査に簡明な方法を提供した。BPCIAによると、バイオ類似製品の申請は、最初のブランド製品がBLAによって承認されて12年後にのみFDAの承認を得ることができる。しかし,米国議会はこの排他的期限を著しく短縮するためにBPCIAを修正する可能性があり,予想よりも早く模倣薬競争の機会を創出する可能性がある。また,このデータ排他性は,別の会社がオリジナルブランド製品と高度に類似した製品を開発し,自分のデータを生成して承認を求めることを妨げるものではない.データ排他性は,別の会社がイノベーター申請中のデータに依存して生体類似製品の承認を支援できないことを保証することしかできない.
私たちは情報技術に大きく依存しています。この技術の任意の故障、不足、中断またはセキュリティホールまたはデータ損失は、任意のネットワークセキュリティイベントを含み、私たちの業務に関連する敏感な情報を危険にさらし、私たちの重要な情報へのアクセスを阻止し、あるいは私たちに責任を負わせ、それによって私たちの業務を効果的に運営する能力を損害し、私たちの業務と名声に悪影響を与える可能性があります。
私たちの正常な業務過程で、私たち、私たちのCRO、および私たちが依存する他の第三者は、法律によって保護された患者の健康情報、私たちの従業員の個人識別情報、知的財産権、および独自の業務情報を含む敏感なデータを収集して保存します。私たちは現場システムを使用して私たちのアプリケーションとデータを管理して維持する。これらのアプリケーションおよびデータは、研究開発情報および業務および財務情報を含む様々な業務キー情報を含む。
これらの重要な情報のセキュリティ処理、保存、維持、転送は、当社の運営およびビジネス戦略に重要です。セキュリティ対策が実施されているにもかかわらず、私たちの内部コンピュータシステムおよび私たちと契約した第三者のコンピュータシステムは、ネットワーク攻撃、コンピュータウイルス、侵入、許可されていないアクセス、従業員のエラーまたは汚職または他の中断による中断、または自然災害、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。このようなイベントは、私たちのネットワークを危険にさらす可能性があり、そこに格納されている情報は、不正な当事者によってアクセスされ、開示され、紛失され、または盗まれる可能性がある。このようなセキュリティイベントやプライバシーやセキュリティタスク違反を発見して対応するための措置をとっているにもかかわらず,これらの措置がどのようなセキュリティイベントを防ぐことに成功するかは保証されない.このような情報の取得、開示、または他の損失は、法的クレームまたは訴訟、個人情報のプライバシーを保護する法的責任、政府の法執行行動、および規制処罰をもたらす可能性がある。不正なアクセス、紛失、または伝播は、私たちが研究、開発、商業化活動を行う能力、会社の財務情報を処理し、準備する能力、私たちの業務の様々な一般的かつ行政的な能力を管理し、私たちの名声を損なう可能性があり、また、修復するための大量の資源が必要である可能性があり、これらはいずれも私たちの業務に悪影響を及ぼす可能性がある。臨床試験データの紛失は著者らの監督管理審査の遅延を招く可能性があり、そして著者らのデータの回復或いは複製のコストを著しく増加させる。しかも、私たちがこのような破壊やセキュリティホールを迅速に検出することは保証されない, もし本当にあれば。私たちのHuntr発見エンジンをサポートする技術がネットワークイベントに遭遇し、当社の独自のスクリーニングソフトウェアまたはTCRライブラリが漏洩または盗まれた場合、私たちのビジネスは実質的な負の影響を受ける可能性があります。私たちは今までこのような重大なシステム障害、事故、セキュリティホールがあることを知りませんでしたが、もしどんな中断やセキュリティホールが私たちのデータやアプリケーションを紛失したり、あるいは機密や独自の情報を適切に開示しなかった場合、私たちは責任を招く可能性があり、私たちの研究、開発、商業化の努力は延期される可能性があります。
私たちの知的財産権に関するリスクは
もし私たちまたは私たちのライセンシーが私たちの知的財産権を十分に保護または実行し、他人の特許権利を確保できなければ、私たちの知的財産権の価値は低下し、私たちの製品を商業化することに成功する能力は損なわれる可能性がある。
私たちの成功、競争地位、そして将来の収入は、私たちの能力と私たちの許可者が私たちの製品、方法、プロセス、および他の技術の特許保護、商業秘密を含む機密情報の保護、第三者の私たちの独占権の侵害を防止し、第三者の独占権を侵害することなく運営する能力にある程度依存するだろう。
これまで、私たちは癌治療分野でいくつかのアメリカと外国の知的財産権の独占的な権利を持っていて、MD AndersonとNCIのいくつかの細胞治療と関連技術、PGEN技術を含む寝美人それは.MD Andersonライセンスによれば、将来の特許出願は、MD Anderson、PGEN、および私たちそれぞれの同意を得る必要があり、MD Andersonは、双方が同意しなければ、私たちまたはPGENがそのような活動を制御することができる限り、そのような特許出願の準備、提出、および起訴を制御する権利がある。MD Andersonの許可に基づいて、MD Andersonは、許可特許および特許出願に対して可能性のある任意の合理的な意見を審査し、組み込むことに同意しているにもかかわらず、私たちの意見が求められたり実施されることは保証されない。NCIのいくつかのTCRに対する特許許可に基づいて、NCIは、私たちに許可された特許出願および特許を準備、提出、起訴、および維持する責任がある。特許ライセンスによると、NCIは問い合わせが必要ですが
44
カタログ表
私たちが準備、提出、起訴、そしてそのすべての特許出願と私たちに付与された特許を維持しているので、私たちの意見が求められたり実施される保証はありません。PGENとの私たちのライセンス契約によると、PGENは権利がありますが、私たちが許可を得た特許および特許出願を準備、提出、起訴、維持する義務はありません。これらの行動に関連するすべての費用を負担しなければなりません。PGENは私たちと交渉し、私たちに付与された特許および特許出願の状態を合理的に理解し、任意の関連書類や通信を提出する前に私たちと協議しなければならない。ライセンス契約によれば、PGENは、これらの特許および特許出願に対して可能な任意の意見を誠実に考慮して私たちと協議することに同意しているが、私たちの意見が求められたり従うことは保証されない。許可内の特許や特許出願を直接制御することがない場合には、MD Anderson、NCIまたはPGEN(場合によっては)に依存して、特に起訴情報を公開できない可能性のある外国司法管轄区域では、起訴状況を随時通報してくれます。私たちは、私たち、NCI、そしてPGENがアメリカと他の司法管轄区でより多くの特許出願を提出すると予想している。しかしライセンス内の特許の組み合わせやALaunosの特許の組み合わせを予測したり保証することはできません
特許起訴過程は高価で時間がかかり、私たちは合理的なコスト、タイムリー、または根本的に必要または望ましいすべての特許出願を提出して起訴することができないかもしれない。我々は,特許保護を得るのが遅くなるまで,我々の研究開発成果で特許を申請できることを確認できない可能性もある.さらに、場合によっては、私たちは、第三者から許可された技術を含む特許出願の準備、提出、起訴、または特許を維持する権利がない。私たちはまた、許可された特許権を実行するために許可者の協力が必要である可能性があり、このような協力は提供されない可能性がある。したがって、このような特許および出願は、私たちの業務の最適な利益に合った方法で起訴され、強制されてはならない。
バイオテクノロジーと製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなってきた。しかも、他の管轄区域の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。例えば、米国で特許資格を有する治療方法は、多くの他の法域では権利要件がない可能性があり、いくつかの特許庁(例えば、欧州特許庁)は、治療方法の権利要件を特許資格に適合する“医療用途”フォーマットとして再起草することを可能にする可能性があり、他の特許庁(例えば、インド特許庁)は、そのような権利要件のいかなる再起草フォーマットも受け入れない可能性がある。
米国や他の管轄区域の特許法または特許法解釈の変化は,我々の知的財産権の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。2011年9月、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律となり、米国特許法にいくつかの大きな変化が生じた。このような変化は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を与える可能性もある。また、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下し、場合によっては入手可能な特許保護範囲を縮小したり、場合によっては特許権者の権利を弱めたりしている。この一連の事件はいったん特許を取得した価値と私たちの将来の特許を得る能力に不確実性をもたらした。USPTOがLeahy-Smith法案を継続的に実施するにつれて、連邦裁判所はLeahy-Smith法案、特許を管理する法律と法規、および特許調達に関する規則が予測不可能な方法で変化する可能性があり、新しい特許を獲得したり、私たちの既存の特許と私たちが将来獲得する可能性のある特許を強制的に執行する能力を弱める可能性がある。
私たちの研究と開発計画で使用されているいくつかの技術はすでに公共分野にある。さらに、我々の多くの競争相手は、私たちの業務に関連する技術、成分および使用方法の技術を開発しているか、または特許出願を提出しているか、または特許を取得しており、これらの技術、構成および使用方法は、私たちが所有または許可している特許出願、技術または製品候補、または私たちが所有または許可している特許出願、技術または製品と衝突している可能性がある。このような葛藤は私たちが獲得する可能性のある特許の範囲を制限するかもしれない。米国および多くの外国司法管轄区の特許出願は、通常、提出後18ヶ月後に発表されるか、または場合によっては全く発表されず、科学文献で発見された出版物自体が実際の発見自体に遅れているため、私たちおよび私たちの許可者は、他の人が私たちが使用している技術または私たちの未解決の特許出願に含まれている技術について特許出願を提出していないと判断することはできない。私たちは、私たちが最初に私たちが所有している特許の組み合わせで要求された発明を製造して出願したかどうか、または私たちの許可者が私たちが許可した特許の組み合わせで要求された最初の発明を申請した人かどうかを正確に知ることができない。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの未解決および未来の特許出願は、私たちの技術または製品の全部または一部を保護するために、または他社が競争力のある技術および製品を商業化することを効果的に阻止するために、特許の発行を招くことができないかもしれない。さらに、私たち自身が以前に提出した特許および出願またはMD Anderson、NCIまたはPGENの特許および出願は、私たちが後に取得した特許の範囲(あれば)を制限する可能性がある。第三者が特許出願を提出または提出した場合、または技術特許を取得した場合, 私たちのビジネスに関連し、私たちが所有または許可している特許出願、技術または候補製品と競合する成分および使用方法については、そのような保護に挑戦すること、そのような保護の影響を受ける私たちのプログラムを終了または修正すること、またはそのような第三者からライセンスを取得することが要求される可能性があり、これらのライセンスは、許容可能な条項で提供できないか、または全く得られない可能性がある。
45
カタログ表
私たちが所有し許可された特許出願が特許の形で発表されても、それらの発表形態は私たちに何の意味のある保護も提供してくれず、競争相手が私たちと競争することを阻止したり、他の方法で私たちにどんな競争優位性を提供してくれたりしない。私たちの競争相手は、非侵害的に類似または代替技術または製品を開発することによって、私たちの所有または許可された特許を迂回することができるかもしれない。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有し、許可している特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。このような挑戦は、私たちの特許が縮小され、失効され、または実行できないために排他的損失を招く可能性があり、これは、他人が類似または同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または私たちの技術および製品の特許保護期間を制限する可能性がある。新製品候補製品の開発、テスト、規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または後に満了する可能性がある。したがって、私たちが持っている特許と許可された特許の組み合わせは、他社が私たちと似ているか同じ製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
もし私たちが私たちの機密情報の機密性を保護できなければ、私たちの業務と競争地位は損なわれるだろう。
私たちの成功はまた、私たちの科学と技術者、私たちのコンサルタントと顧問、そして私たちのライセンシーと請負業者のスキル、知識、経験にかかっています。私たちのノウハウと私たちの発明を保護するために、私たちは特許を取得できないか、または得られないかもしれませんし、私たちの競争的地位を維持するために、私たちは商業秘密保護と秘密保護協定に依存しています。そのため、私たちの一般的な政策は、私たちの従業員、コンサルタント、コンサルタント、請負業者に合意を締結し、機密情報の開示を禁止し、適用された場合には、私たちの業務に重要なアイデア、発展、発見、および発明の開示および譲渡を要求することである。他人が私たちの商業秘密、ノウハウ、機密情報、または他の固有情報を不正に使用または開示または合法的に開発している場合、これらのプロトコルは、私たちの商業秘密、ノウハウ、機密情報、または他の固有情報を十分に保護することができない可能性がある。しかも、私たちはこのような合意に違反したどんな行動についても十分な救済措置を得ることができないかもしれない。我々の商業秘密または他の機密情報は、我々の物理的またはコンピュータセキュリティシステムを破壊するような他の方法で第三者によって取得される可能性もある。一方が商業秘密や他の機密情報を不正に開示または流用する主張を強制することは困難であり,高価で時間がかかり,結果的には予測できない.しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。もし私たちの商業秘密や他の機密情報が競争相手によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らが情報を伝達する人がその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちのビジネス秘密が, 独自技術または他の固有情報が開示される場合、私たちのビジネス秘密、ノウハウ、および他の固有権利の価値は深刻な損害を受け、私たちのビジネスおよび競争的地位は影響を受けるだろう。
第三者は知的財産権侵害には多くの時間とお金がかかると主張し、私たちの製品の開発や商業化を阻止する可能性がある。
特許権を保護または執行するために、私たちは第三者に対して特許侵害訴訟を提起することができる。同じように、私たちは他の人たちに特許侵害を理由に起訴されるかもしれない。私たちはまた、干渉、派生、支出後の審査、各方面間復習し、あるいは再検査する。他の管轄区域では、私たちの特許権は、授権前と認可後の反対、無効、撤回手続きなどを受ける可能性があります。知的財産権訴訟の費用が高く、技術と管理者の正常な責任を主張し、防御する。
私たちのビジネス成功は、私たちと私たちの協力者が第三者の独占権を侵害することなく、私たちの候補製品を開発、製造、マーケティング、販売する能力にかかっています。バイオテクノロジーと製薬産業では、かなり多くの知的財産権訴訟がある。私たちに対してこのような訴訟を提起していませんが、第三者の知的財産権を侵害していると判断された裁判所もありませんが、私たちの製品や製品の使用が侵害されないか、第三者の特許が侵害されないと断言されない保証はありません。私たちはまた、関連する第三者特許または出願を決定できない可能性があり、または公表されていない第三者特許出願は、後で私たちの業務に関連する特許の付与につながる可能性があります。別の可能性は、第三者特許または特許出願は、最初に、私たちの業務とは無関係な権利要件を含むが、その後、それが確実に関連するように再発行または修正されることである。
我々の研究、開発および商業化活動、ならびに任意の製品候補またはこれらの活動によって生成された製品は、許可証または他の権利を持っていない特許または特許出願を侵害または主張される可能性がある。特許を有することは,特許権者が保護を要求する発明を実施する権利を与えるものではなく,他の所有者の特許を侵害して起訴されないように特許権者を保護しない。私たちの特許地位は私たちが侵害していないことを保証することもできないし、他人の特許権を侵害していると断言されることもない。
免疫腫瘍学領域の特許構造は特に複雑である。米国や外国の特許や,免疫腫瘍製品に対する組成物,使用方法,製造方法の第三者が出願している特許が多く知られている。しかも、私たちが知らない分野の特許と特許出願があるかもしれない。我々がMD Anderson,NCI,PGENから許可を得た技術は早期技術であり,この技術を用いて製品を設計·開発している.有効で実行可能であると考えられる任意の第三者特許主張を侵害する可能性のある製品の開発を避けることを求めているにもかかわらず、それはできないかもしれません。さらに、#年特許および係属特許出願における特許請求の範囲および数を考慮する
46
カタログ表
免疫腫瘍学分野とその関連の複雑さや不確実性を考慮すると,第三者はこのような主張が価値があると信じなくても特許主張を侵害していると主張する可能性がある。
特許侵害請求があれば、クレームの解決を保証することはできません。もしあれば、商業合理的な条項で関連製品をマーケティングし続けることができます。私たちはこのような行動を成功させるのに十分な資源がないかもしれない。もし私たちがどちらかの権利侵害行為を弁護することに成功しなかった場合、あるいは私たちが主張する第三者特許の無効または実行不可能を宣言できない場合、私たちは巨額の金銭損害賠償を支払わなければならないかもしれません。侵害が故意とみなされる場合、損害賠償金は2倍に増加する可能性があり、および/または影響を受けた製品の商業化および開発を停止または著しく延期することを要求される可能性があります。
私たちまたは私たちの協力者に対して損害賠償を要求し、影響を受けた製品に関連する開発またはマーケティング活動を禁止しようとする任意の法的行動は、潜在的な損害賠償責任を負わせるだけでなく、影響を受けた製品の開発、製造、またはマーケティングを継続するために、私たちまたは私たちの協力者に許可証を取得することを要求する可能性がある。このような許可は商業的に合理的な条項で私たちに提供できないかもしれないし、全く得られないかもしれない。
私たちが所有または許可している知的財産権に関連した訴訟で不利な裁決を下すことは、生物類似または模倣薬代替品を含む私たちの製品の代替品の市場への参入を可能にするかもしれない。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
年金および他の同様の費用は、世界各地の大多数の司法管轄区域の特許(または特許および特許出願)を維持するために、それぞれの特許当局に支払われなければならない。さらに、世界各地の司法管轄区域の特許当局は、特許出願過程において、いくつかの手続き、文書、費用支払い、およびその他の同様の規定を遵守することを要求する。多くの場合、適用規則に従って滞納金を支払うか、または他の方法で不注意を是正することによって失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効され、関連法ドメインの特許権の一部または全部の喪失をもたらす可能性がある。特許または特許出願が放棄または失効する可能性のある規定を遵守しないイベントには、規定された期限内に公式行動に応答できなかったこと、費用が支払われていないこと、公証および合法化など、必要な正式な要求を有する文書が提出されていないことが含まれるが、これらに限定されない。この場合、私たちの競争相手が市場に参入する可能性があり、これは私たちの業務に実質的な悪影響を及ぼすだろう。
私たちは私たちの業務に重要な製品と技術の権利を許可し、私たちは未来にもっと多くの許可を得ることを望んでいる。例えば、MD Andersonライセンス、特許ライセンス、およびライセンスプロトコル下のライセンス内特許および特許出願を持っています。これらの協定によると、商業化と開発、再許可、特許権使用料、特許起訴と維持、保険に関する一連の義務を負わなければならない。
もし私たちが必要な許可を得ることができず、これらの義務を履行できなかったり、私たちの許可合意に違反した場合、許可側は全体の許可を終了し、許可の独占的な性質を終了し、または損害賠償を請求する権利がある可能性があります。このような終了またはクレームは、私たちの財務状況、運営結果、流動性、またはビジネスに重大な悪影響を及ぼす可能性があります。私たちがこのような終了またはクレームに異議を唱えて最終的に勝訴しても、このような紛争は潜在的な製品の開発または商業化の遅延を招き、時間と高価な訴訟または仲裁を招く可能性がある。終了時に、私たちは私たちが開発した任意の関連知的財産権を許可者に許可することを要求されるかもしれない。
さらに、場合によっては、私たちに許可された権利は、私たちに許可された許可者の第三者の権利だ。この場合、我々のライセンス者がそのようなライセンス下での義務を履行しない場合、ライセンス側とのライセンス契約下での権利は悪影響を受ける可能性がある。
また、第三者知的財産権の許可や買収は競争の激しい分野であり、一部の成熟した企業も魅力的または必要と考えられる第三者知的財産権許可または買収戦略をとっている。これらの老舗会社はその規模、資本資源及び更に強い臨床開発と商業化能力のため、私たちより競争優位を持っているかもしれない。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資を適切なリターンを得るための条項で許可したり、第三者の知的財産権を取得することができないかもしれないし、全くできないかもしれない。もし私たちが必要な第三者知的財産権を得ることに成功したり、私たちの既存の知的財産権を維持することができなければ、関連計画や候補製品の開発を放棄しなければならないかもしれません。これは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
私たちは、私たちの従業員や私たちが彼らの知的財産権を流用したと主張したり、私たち自身の知的財産権の所有権を要求したりする第三者のクレームを受けるかもしれない。
私たちの多くの従業員は以前、私たちの競争相手や潜在的な競争相手を含む大学や他のバイオテクノロジーや製薬会社に雇われていた。私たちは、私たちの従業員が私たちのために働いているときに他人の固有情報やノウハウを使用しないことを保証するために努力しているが、私たちは、これらの従業員または私たちが商業秘密または他の固有情報を含む任意のそのような従業員の前の雇用主の知的財産権を使用または開示しているという疑惑を受ける可能性がある。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。
47
カタログ表
また、私たちの政策は、知的財産権開発に参加する可能性のある私たちの従業員と請負業者が、このような知的財産権を私たちに譲渡する協定に署名することを要求していますが、実際に私たちが自分たちの知的財産権を開発しているすべての側とこのような合意を実行することができないかもしれません。私たちと彼らの譲渡協定は自動的に実行されないかもしれないし、違反される可能性があります。私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権とみなされていることを確認するために、私たちが提起するかもしれないクレームを弁護したりすることができます。
もし私たちがこのようなクレームを起訴したり、弁護することができなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このようなクレームの起訴や抗弁に成功しても、訴訟は巨額の費用を招き、経営陣の注意を分散させる可能性がある。
わが社に関係する他のリスク
私たちの株価はずっと変動していて、変動し続けるかもしれない。
私たちの普通株の市場価格の変動は大きく、私たちはコントロールできない要素によって大幅に変動するかもしれません
48
カタログ表
また、株式市場全体、特に私たちの株は、進行中の新冠肺炎の大流行に関連する価格や出来高変動を含む特定の会社の経営業績とは無関係な重大な価格や出来高変動を時々経験しており、それらの基本的なビジネスモデルや見通しが根本的に変わっていないにもかかわらず、多くの企業の株価下落を招いている。公開債務と株式市場、特にナスダック世界の精選市場は、極端な価格と出来高の変動を経験し、すでに多くの生物製薬会社の株式証券の市場価格に影響を与え続けている。
多くのバイオ製薬会社の株価変動はこれらの会社の経営業績に関係なく、あるいは比例しない。過去、市場変動期間中、株式市場は証券集団訴訟を起こした。もし私たちが証券訴訟に巻き込まれれば、私たちは巨額のコストと私たちの資源を生むかもしれないし、経営陣の注意は私たちの業務から移ってしまうかもしれない。
われわれの同意を得ず,試験参加者や臨床研究者などの第三者が現在または将来の臨床試験について発表した公開声明は,われわれの株価に悪影響を及ぼす可能性がある。私たちはこれらの第三者声明を作成する際に知らないかもしれませんが、これらの第三者声明に対応できないかもしれませんし、候補製品に対する私たちの発言が制限されて、私たちの業務や公衆の合法的な利益を守ることができないかもしれません。これは私たちの株価変動を招くかもしれません。もしこのような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を負い、規制行動に直面したり、私たちの業務に他の損害を与える可能性があります。
もし私たちが適用される上場基準を満たしていなければ、私たちの普通株はナスダック世界から精選された市場から撤退するかもしれない。退市は私たちが普通株のために活発で、流動的で秩序のある取引市場を維持することを阻害するかもしれない。
もし私たちがナスダック世界の精選市場から撤退した場合、あるいは上場取引を別の株式市場に移すことができなければ、私たちが株式証券を公開または個人的に売却する能力および私たちの普通株の流動性は不利な影響を受ける可能性がある。2023年1月4日、ナスダック株式市場有限責任会社(略称ナスダック)から、ナスダック世界ベスト市場に引き続き上場する上場規則第5450(A)(1)条に違反したと通知を受けた。上場証券の最低入札価格は30営業日連続で1株1ドルを下回ったからである。ナスダック上場規則第5810(C)(3)(A)またはコンプライアンス規則によると、入札価格要件を再遵守するために、180暦または2023年7月3日または適合日が提供されます。コンプライアンス日の前のいつでも、私たちの普通株の入札価格は、コンプライアンス規則の要求に従って少なくとも10営業日以内に1.00ドル以上に収まり、ナスダックは、ナスダックが自由裁量権を行使してこの10日間の期限を延長しない限り、入札価格要求を再遵守したことを書面で通知します。
この180日間の間、逆株式分割を含む最低入札価格ルールを再遵守するために、私たちの選択を検討する予定です。2023年3月2日、私たちの普通株の終値は1株当たり0.57ドルです。もし私たちがナスダック世界の精選市場に上場する要求を満たし続けることができなければ、私たちはナスダック資本市場に私たちの普通株を上場することを申請することができます。これはまた最低入札価格規則を再遵守するために最大180日の追加時間を与えるかもしれません。ナスダックはナスダック資本市場での上場申請を受け入れなければなりません。私たちは他の上場基準を遵守していることを証明し、ナスダックに書面で通知して、私たちが入札価格不足の問題を補うつもりだと表明する必要があります。もしナスダックが私たちがナスダック資本市場に上場する資格がないと認定した場合、あるいは私たちがナスダック資本市場に移転する申請を提出しないことを選択した場合、私たちは書面で通知を受けます。私たちの普通株は発行されます。その時、私たちはこの決定に控訴する機会があります。もし私たちの普通株がナスダックによって発行された場合、私たちの普通株価格に悪影響を与えることを含む多くの負の影響を招く可能性があり、経営者が私たちの普通株式市場で経営者を阻止すること、あるいは他の方法で私たちの普通株への興味を求めたり、私たちの普通株の波動性を増加させること、私たちの普通株の流動性を減少させること、連邦政府の州証券法に対する優先購入権を失うこと、融資を獲得することのもっと難しいことを含むかもしれない。退市はまた、私たちの顧客、協力者、サプライヤー、サプライヤー、従業員の信頼を失う可能性があり、これは私たちの業務と将来の見通しを損なう可能性があります。
もし私たちの普通株がナスダックによって買収された場合、私たちの普通株の価格は下落する可能性があります。私たちの普通株は場外取引掲示板(別の場外見積システム)やピンクのシーツで取引する資格があるかもしれませんが、投資家は彼らの普通株を処分することがもっと難しいことを発見したり、私たちの普通株の時価に関する正確なオファーを得ることができます。また、私たちの普通株が退市すれば、州青空法律によって、私たちの証券の売却に関連する追加コストが発生するだろう。これらの要求は私たちの普通株の市場流動性と、私たちの株主が二級市場で私たちの普通株を売る能力を深刻に制限するかもしれない。
私たちの定款とデラウェア州法律の反買収条項は私たちの買収をより困難にするかもしれません。これは私たちの株主に有利かもしれません。
私たちは、会社の登録証明書や定款の条項、およびデラウェア州の法律の条項を改正して再記述することは、第三者が私たちを買収することを難しくするかもしれません。そうしても、私たちの株主に利益を与えます。これらの規定は、流通株数を増加させ、買収を阻害しようとしている者を制限し、株主特別会議を開催することができる者を制限するために、“空白小切手”優先株を発行することを許可している。また、デラウェア州会社法第203条、又は第203条は、一般に、デラウェア州上場企業がその少なくとも15%の普通株式を有する一方と商業合併を行うことを禁止しており、当該企業合併が当該人が15%の所有権を得る前に我々の取締役会の承認を得ない限り、
49
カタログ表
その取締役会と3分の2の株主が株式を保有するか、または後で持ち株する。第203条は、株主が彼らの最適な利益に適合すると認めることができる制御権変更を延期、延期、又は防止する効果がある可能性がある。
私たちの改正と再記述の規定は、デラウェア州衡平裁判所は、私たちと私たちの株主とのほとんどの紛争の独占法廷となり、これは、私たちまたは私たちの役員、上級管理者、または従業員との紛争を処理するために、私たちの株主が有利な司法フォーラムを得ることを制限するかもしれません。
私たちが書面で代替裁判所を選択することに同意しない限り、我々が書面で代替裁判所を選択することに同意しない限り、デラウェア州衡平裁判所は、(I)私たちが提起した任意の派生訴訟または法的手続きを代表する、(Ii)私たちの任意の取締役、高級職員または他の従業員の私たちまたは私たちの株主に対する受託責任を主張するいかなる訴訟、(Iii)デラウェア州会社法、私たちの改正および再記載された会社登録証明書、または私たちの改正および再記載された定款の任意の規定に基づいて、私たちまたは私たちの任意の取締役、上級職員または他の従業員のクレームに対する任意の訴訟;(Iv)会社法がデラウェア州衡平裁判所に管轄権を与える任意のクレームまたは訴訟理由、(V)会社法がデラウェア州衡平裁判所に管轄権を与える任意のクレームまたは訴訟理由、または(Vi)私たちまたは私たちの任意の取締役、上級管理者、または他の内部事務原則によって管轄される従業員に対する任意の訴訟を求める、解釈、適用、強制執行または再記載された会社登録証明書または当社の定款の有効性を求める任意の訴訟。
これらの規定は、取引法で規定されている義務または責任を執行するための訴訟には適用されない。また、証券法第22条は、連邦裁判所及び州裁判所は、証券法のすべての訴訟に対して同時管轄権を有すると規定している。したがって、州裁判所と連邦裁判所はこのようなクレームを受理する管轄権を持っている。
これらの排他的フォーラム条項は、司法フォーラムにおいて、私たちまたは私たちの役員、役員、または他の従業員との紛争に有利であると考える株主のクレームを提出する能力を制限する可能性があり、これは、私たちと私たちの役員、役員、および他の従業員に対する訴訟を阻止するかもしれない。もし裁判所が排他的法廷条項が訴訟で適用されないか実行できないことを発見した場合、私たちは他の管轄区域で紛争を解決するためにより多くの重大な追加費用を発生する可能性があり、これらすべては私たちの業務を深刻に損なう可能性がある。
私たちは配当金を支払わないと予想されますので、あなたがあなたの株を売って利益を得ない限り、あなたは私たちの普通株に投資することから何の収入も得られません。
私たちは私たちの普通株に配当金を支払ったことがなく、私たちは予測可能な未来にも私たちは何の配当も支払わないと予想している。したがって、あなたが私たちの普通株の株式を売却した時にのみ、私たちへの投資はどんな見返りも達成することができます。もしあれば。
私たちは純営業損失の繰越と税収控除を検討して将来の納税を減らす能力が制限される可能性があります。
設立以来,我々の損失と我々が行った研究活動により,大量の純運営損失(NOL)と研究開発税収控除(R&D)が生じた。著者らは通常NOLと研究開発控除を繰り越して、今後数年間の納税負担を減らすことができる。しかしながら、NOLおよびR&D積分を使用する能力は、それぞれ1986年に改正された国内税法第382および383節またはこの法規の規則によって制限される。これらの条項は一般に“所有権変更”後のNOLと研究開発信用限度額の使用に制限されている。その他の事項を除いて、直接又は間接的に会社普通株の5%以上の株主(又は特定の株主集団)を直接又は間接的に所有していた場合、又は規則第382節及びこれに基づいて公布された米国財務省法規により5%の株主の株主とみなされ、適用された試験期間内に、当該会社の株式に対する総所有率がこれらの株主の保有株式の最低百分率よりも50ポイント以上増加した場合、所有権変更が発生する。所有権変更の場合、規則第382節は会社がNOL繰越で相殺できる課税所得額に年間制限を適用し、コード第383節は会社の利用可能な業務信用(研究開発控除を含む)の繰越相殺の税額に年間制限を加える。
私たちは過去に規則382条で言及された“所有権変更”を経験したことがあり、私たちが未来にこれ以上の所有権変更を経験しないことを保証することはできない。したがって、私たちのNOLと商業信用(研究開発信用を含む)は制限される可能性があり、私たちのNOLや研究開発信用が無料で使用する場合よりも早く、より大きな金額で納税する必要があるかもしれません。
もし証券および/または業界アナリストが私たちの業務に関する研究報告を発表し続けることができなかった場合、彼らが彼らの提案を変えた場合、あるいは私たちの運営結果が彼らの期待に達していなければ、私たちの株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は、業界または証券アナリストが発表した私たちまたは私たちの業務に関する研究と報告の影響を受けるだろう。もしこれらのアナリストのうちの1人以上がわが社への報告を停止したり、私たちに関する報告書を定期的に発表できなかった場合、私たちは金融市場での可視度を失う可能性があり、逆に私たちの株価や取引量を低下させる可能性がある。また、今後のある時期には、我々の経営業績は証券アナリストや投資家の予想を下回る可能性が高い。もし私たちの1人以上のアナリストを追跡して私たちの株式格付けを下げた場合、あるいは私たちの運営結果が彼らの期待に達しなければ、私たちの株価は下落するかもしれない。
私たちの業務は維権株主の行動によって否定的な影響を受けるかもしれない。
2021年には,水ミル資産管理会社(Water Mill Asset Management Corp.)が先頭に立った同意募集活動に参加し,取締役会には3人の新取締役が追加された。私たちは未来に他の株主急進主義を経験するかもしれません。別の同意を求めたり、代理を依頼したりすることも含めて
50
カタログ表
試合をします。維権株主はわが社が何らかのガバナンスと戦略的変革を行うことを主張するかもしれない。株主急進主義の場合、特に私たちの取締役会が受託責任を行使する際に同意しないことや行動しないことを決定する事項において、私たちの業務は不利な影響を受ける可能性があります。維権株主の行動に対応することはコストが高く時間がかかる可能性があり、私たちの運営を乱し、経営陣の注意をそらすことができ、また、私たちの未来の方向性の不確実性は潜在的なビジネス機会を失う可能性があり、合格者、業務パートナー、顧客を引き付けることをより困難にする可能性があります。
また、同意や依頼書を求める競争に直面した場合、競争すべき論争や論争に戻ることができない可能性があり、これは私たちの業務を混乱させます。個人が異なる議題で私たちの取締役会に選ばれた場合、戦略計画を効果的かつタイムリーに実施し、株主のための追加価値を創出する能力は悪影響を受ける可能性がある。
流通権証の行使と株式発行奨励は私たちの株に希釈効果を与え、私たちの普通株の価格にマイナス影響を与える可能性がある。
2022年12月31日現在、私たちは22,922,342株発行された普通株の権証を持っており、加重平均行権価格は1株5.62ドルである。私たちの2020年の株式インセンティブ計画によると、私たちは株式オプション、制限株式、制限株式単位、株式付加価値権、配当株、業績奨励を与えることができます。2022年12月31日現在、2020年持分インセンティブ計画と2012年持分インセンティブ計画によると、10,408,622 株式は発行済みオプションを行使した後に発行可能であり,加重平均行権価格は1株1.84ドルである.
私たちの主要株主、役員、取締役は会社に対してかなりの支配権を持っています。これはあなたと他の株主が重大な会社の決定に影響を与えることを阻止し、私たちの普通株の市場価格を損なう可能性があります。
2022年12月31日現在、私たちの役員、役員、および5%以上の発行済み普通株を持っている保有者は、私たちが発行した普通株の33.2%を実益する。これらの株主は、私たちの他の株主と利益の衝突がある可能性があり、一緒に行動すれば、彼らは、私たちの株主に承認された事項に提出された結果、取締役の選挙および罷免、および任意の合併、合併、または私たちのすべての資産の売却または売却を含む能力がある。したがって、このような所有権集中は、以下のように私たちの普通株の市場価格を損なう可能性がある
また、投資家がこのように持分が集中している会社で普通株を保有することは不利であると考えている場合、このような持分の高度集中は私たち普通株の取引価格に悪影響を及ぼす可能性がある。
2017年に法律となった“減税·雇用法案”に署名したことを含む会社税立法の変化は、私たちのビジネスや財務状況に悪影響を及ぼす可能性がある。
税法には会社税に対する重大な変化が含まれており、会社税率を最高限界税率の35%から21%の統一税率に引き下げ、利息支出の減税を調整後の収益の30%(ある小企業を除く)に制限し、NOL減税を今年度の課税収入の80%に制限し、NOL繰り越しを廃止し、オフショア収益を一度に減税し、国内に送金するか否かにかかわらず、アメリカの外国収益に対する税収を廃止する(ある重要な例外状況を除いて)。一定期間の経過とともに減価償却費用を控除するのではなく、ある新たな投資に対して直ちに控除し、多くの業務控除や信用を修正または廃止する。2020年に公布されたコロナウイルス援助、救済、経済安全法案、またはCARE法案は、その中のいくつかの税収変化を修正し、会社に適用される他の税金変化を公布した。企業所得税税率が低下しているにもかかわらず、税法やCARE法案の全体的な影響は不確定であり、我々の業務や財務状況は悪影響を受ける可能性がある。また,各州がどの程度税法やCARE法を遵守するかは不明である。現在、国会で提出されている法案には、“再建より良い法案”が含まれており、法人税への追加的な変化が含まれており、これは私たちのビジネスや財務状況に悪影響を及ぼす可能性がある。税法、CARE法案、そして任意の他の税金立法が私たちの普通株式保有者に与える影響も不確実であり、不利かもしれない。私たちの株主は、この立法と私たちの普通株に投資したり、私たちの普通株を持っている潜在的な税金結果について、彼らの法律と税務顧問と協議することを促します。
私たちは“小さな報告会社”であり、より小さい報告会社に適用される情報開示要求が低下し、私たちの普通株の投資家への吸引力を低下させる可能性がある。
取引法第12 b-2条によると、私たちは“小さな報告会社”と考えられている。したがって、私たちは、選択された財務データおよび役員報酬情報の提供を免除するなど、いくつかの減少した開示要件に依存する権利がある。私たちは規模の小さい報告会社なので、これらの免除と私たちがアメリカ証券取引委員会に提出した文書で開示された減少は、私たちの監査人が財務報告に対する私たちの内部統制を審査する必要がないことを意味し、投資家が私たちの運営結果や財務見通しを分析することを難しくするかもしれません。私たちは投資家が私たちがこのような免除に依存する可能性があるために私たちの普通株の吸引力が低下していることを発見するかどうか予測できない。もし一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株と私たちの普通株はそんなに活発でない取引市場があるかもしれません
51
カタログ表
株価の変動はもっと大きくなるかもしれない。私たちは、最近完成した第2四半期の最終営業日までの公開流通株が2.5億ドルを超え、最近完成した会計年度の年収が1億ドル以上であれば、または最近終了した年度で1億ドルを下回る場合、最近終了した第2四半期の最終営業日に7億ドルを超えるまで、規模の小さい報告会社となる。
項目1 B。未解決従業員意見
ない。
項目2.財産
私たちの会社のオフィスはテキサス州ヒューストンエルリオ街8030号にあります。郵便番号:77054です。私たちのヒューストンオフィスビルは2019年のレンタルと2020年のレンタルによってレンタルされています。以下に述べるように、総面積は約17,265平方フィートです。2021年12月、私たちはマサチューセッツ州ボストンにある元会社のオフィスを閉鎖することにしました。私たちはまだボストンの賃貸契約の側で、一部の空間を転用しました。私たちは引き続きボストン借約の残りの部分の受け入れ可能な分譲人を求めて、テナントになり、および/または私たちの賃貸契約の下での義務を負担します。
2019年10月、MD Andersonと合意し、MD Andersonパークの実験室とオフィススペース、または改訂された2019年の賃貸契約をレンタルします。私たちはこの位置を使って私たちの実験室、cGMP臨床製造施設、MD Anderson園区のオフィス空間を収容します。2019年の賃貸契約は2027年2月に満了します。MD Andersonと締結された2019年の賃貸契約の毎月の賃貸料は、2021年第3四半期までMD Andersonでの前払いから差し引かれ、その時から、毎月MD Andersonにレンタル料を支払います。
2020年12月、MD Andersonと2つ目の協定を締結し、MD Andersonパークの追加スペースをレンタルしたり、改訂された2020年のレンタル契約を締結しました。2020年の賃貸借契約は2028年4月に満了し、私たちの選挙でさらに5年延長される可能性がある。2022年4月、2020年のレンタル契約を修正し、レンタル面積を18,111平方フィートから3,228平方フィートに削減しました。添付財務諸表付記8を参照してください賃貸借契約もっと詳細を知っています。
私たちは私たちの既存の施設が私たちの現在の需要を満たすのに十分だと信じている。
項目3.法的訴訟
通常業務中には、継続的な業務活動に関する法的手続きやクレームの影響を定期的に受ける可能性がある。訴訟やクレームの結果は確実に予測できず、不利な解決策が可能であり、我々の運営結果、キャッシュフロー又は財務状況に重大な影響を与える可能性がある。また,結果にかかわらず,弁護コスト,管理資源分流などにより,訴訟は我々に悪影響を与える可能性がある.
私たちは、単独でも全体でも、経営陣は、私たちの運営業績、財務状況、キャッシュフローに大きな悪影響を及ぼすと考えている未解決の訴訟は何もありません。
プロジェクト4.鉱山安全情報開示
適用されません。
52
カタログ表
第II部
項目5.登録者が株式を共有する市場株式·関連株主事項と発行者による持分証券の購入
普通株市場
私たちの普通株はナスダック世界の精選市場で取引され、コードは“TCRT”です
記録保持者
2023年2月15日現在、約240人の普通株式保有者がおり、そのうちの1人はCELDE&Co.であり、預託信託会社(DTC)の著名人である。金融機関が受益者として著名人や“街道名”で保有している普通株をDTCの参加者口座に入金し、CEDE&Co.が株主として保有していると考えられる。
配当をする
私たちは普通株の現金配当金を発表したり支払ったりしたことがなく、予測可能な未来にもいかなる現金配当金も支払わないだろう。
未登録証券販売
2022年12月31日までの3ヶ月間、証券法に基づいて登録されていない株式証券は販売または発行されていません。
第六項です[保留されている]
53
カタログ表
プロジェクト7.経営陣の議論と分析財務状況と経営実績
以下では、本年度報告書10-K表の他の部分の財務諸表と関連付記とともに読むべきである。歴史財務情報以外に、以下の討論には、私たちの計画、推定、信念を反映した前向きな陳述が含まれている。私たちの実際の結果は、任意の前向きな陳述に含まれたり暗示されたりする結果とは大きく異なるかもしれない。これらの差異を引き起こす可能性がある要因は、第I部分第1 A項に列挙された“リスク要因”および“前向きな陳述に関する特別な説明”項または本年度報告10−K表の他の部分の要因を含む。
概要
著者らは臨床段階の腫瘍学に集中した細胞治療会社であり、TCR-T細胞療法に続いて、大量の癌患者群で満足されていない臨床需要を治療するための多種の固形腫瘍タイプを開発した。私たちは癌ホットスポット変異TCRライブラリーと独自の非ウイルスを利用しています寝美人遺伝子転移プラットフォーム、患者に対する細胞療法、重要な発癌遺伝子に対する共有腫瘍特異的変異産生の新しい抗原を設計·製造することを含むKRAS, TP 53そしてEGFR.EGFRそれは.MD Andersonと協力して、現在患者を募集と治療して1/2期の臨床試験を行い、12個のTCRの突然変異に対する反応を評価しているKRAS,TP 53そしてEGFR.EGFR著者らのTCRバンクは非小細胞肺癌、結腸直腸癌、子宮内膜癌、膵臓癌、卵巣癌と胆管癌の研究治療に用いられ、著者らはTCR-Tバンクの1/2期試験と呼ばれる。
2022年12月31日現在、私たちは約5300万ドルの現金、現金等価物、および限定的な現金を持っている。私たちの1390万ドルの制限された現金は改正された融資と保証協定と関連がある。私たちの現在の発展計画を考慮して、私たちの現金資源は、2023年第4四半期まで、私たちの運営に資金を提供するのに十分であると予想され、私たちは現在、約束された追加資本源を持っていない。参照してください“流動性と資本資源.”
設立以来、私たちは何の製品収入も発生せず、毎年重大な純損失が出ている。2022年12月31日までの1年間の純損失は3770万ドルで、2022年12月31日現在、2003年の成立以来累計で約8.806億ドルの赤字が生じています。私たちは引き続き巨大な運営支出と純損失が発生すると予想している。私たちの候補製品をさらに開発するには、私たちの費用を大幅に増やす必要があるかもしれない
私たちは引き続きより多くの財政資源を求め、私たちの候補製品のさらなる開発に資金を提供する。もし私たちが十分な追加資本を得ることができなければ、そのうちの1つ以上のプロジェクトが延期される可能性があり、私たちは計画通りに運営を続けることができず、運営を減らすことを余儀なくされるかもしれない。製品開発に関連する多くのリスクや不確実性のため、費用が増加する時間や金額を予測することもできず、いつ実現したり、利益を維持したりすることができるかどうかも予測できない。
2022年の発展
2022年第4四半期にIND修正案をFDAに提出し,われわれの臨床試験に2つの新しいTCRを追加し,頻回変異とHLAに対して,われわれのTCR−Tライブラリの1/2段階試験の潜在市場を2倍に拡大する可能性がある。これらの新しいTCRの増加は、既存の変異(KRAS-G 12 VおよびHL A-DRB 1*07:01)および標的遺伝子ファミリー(TP 53-R 273 CおよびHL A-DPI 1*04:02)においてより多くのHLAを増加させることを示唆している。2023年には,我々のライブラリーをさらに拡大し,繰り返し出現するホットスポット突然変異に対するTCRを独占的に発売する予定であるKRAS,TP 53そしてEGFR.EGFRTCRが15個含まれています
私たちは引き続きTCR-Tライブラリ1/2期試験目標の中で積極的に患者を募集しますKRAS,TP 53そしてEGFR.EGFR6種類の固形腫瘍適応中のホットスポット突然変異。2022年9月,非ウイルスを用いたTCR−T細胞療法の最初の客観的臨床反応を発表した寝美人ターゲットは固形腫瘍です2022年12月には,試験中の3人目の患者への投与に成功し,2023年上半期には複数の患者を募集する予定である。第4四半期IND修正案はまた著者らの治療とスクリーニング方案を結合し、登録を簡略化し、患者と医師を容易にする可能性がある。改訂されたINDはまた,スクリーニングと治療の間に6カ月間隔で腫瘍突然変異を再検査する必要があるという要求をキャンセルした。2023年に仮臨床データ更新を提供し,TCR−Tライブラリ1/2期試験を2期に進める努力を予定しており,2023年末までに2期試験を完了する予定である。
私たちは製造能力と効率を拡大するために、私たちの多管的な戦略を継続して実行する。私たちの製造能力は2022年に2倍になり、2種類の製品の同時生産が可能になった。IND改正案も提出し,新鮮製品から低温保存製品に移行し,2023年上半期にこの変化を実施する予定である。冷凍保存された細胞製品の用途は
54
カタログ表
製造過程時間を30日から26日に減少させ,13%減少させるとともに,患者スケジューリングと治療の柔軟性を増加させる予定である。私たちはプロセスを最適化し、製造時間をさらに減らすための措置を取っている。
われわれはTCR−T細胞治療計画を進めており,2023年下半期にIND申請を提出する予定である。MBIL−15は悪い腫瘍微小環境におけるTCR−T細胞の生存率を向上させ,臨床反応を深化させる可能性があると信じている。さらに,潜在的な併用および多重TCR−T細胞治療を含む次世代TCR−T治療法を指導するために,治療を受けた患者の形質転換性評価を継続した。
財務概要
協力収入
私たちは業績予想期間の研究と開発資金収入を確認します。今まで、私たちはまだ製品収入を生み出していない。FDAおよび/または他の規制機関の私たちの候補製品に対する承認を得ない限り、私たちは私たちの製品を販売することができず、製品収入もありません。
研究と開発費
私たちの研究開発費は主に人員の給料と関連費用、契約製造サービスのコスト、施設、試薬と設備のコスト、専門サービス提供者に支払う臨床試験費用、契約研究機関に支払う臨床試験費用、契約研究機関に支払う費用、研究開発のための材料コスト、コンサルティング、許可証とマイルストーン費用、および第三者に支払う賛助研究費用を含む。
私たちが将来支援する現在と未来の計画の研究開発費は、完成時間とコストの面で多くの不確実性の影響を受けるだろう。著者らは多くの臨床前研究の中で潜在製品の安全性、毒理学と有効性をテストした。私たちはすべての製品に対して複数の臨床試験を行うかもしれない。私たちが試験から結果を得た時、私たちは私たちの資源をより将来性のある製品または適応に集中させるために、いくつかの製品の臨床試験を停止または延期することを選択するかもしれない。臨床試験の完成には数年或いはそれ以上の時間を要する可能性があり、時間の長さは通常製品のタイプ、複雑性、意外性と期待用途によって大きく異なる。いずれのタイプの製品の臨床前や臨床開発にも大量の資源が必要であることはまれではない。
臨床開発過程の違いにより、臨床試験の持続時間とコストはプロジェクトのライフサイクル全体で大きく異なる可能性がある
上記で議論した不確実性のため、私たちの計画の持続時間と完成コストを決定することができず、いつ、製品の商業化と販売からどの程度現金を得るかを決定することもできません。私たちは私たちの計画をタイムリーに達成できなかったり、適切な協力合意に達しなかったりすることができず、私たちの資本要求を著しく増加させ、私たちの流動性に悪影響を及ぼす可能性がある。これらの不確実性は、私たちの製品開発戦略を継続するために、時々追加の外部融資源を求めることを強要するかもしれない。私たちは追加資本を集めることができない、あるいは私たちが合理的に受け入れられる条件で追加資本を集めることができなくて、これは私たちの業務の未来の成功を脅かすだろう。
一般と行政費用
一般及び行政支出は主に賃金、福祉及び株式に基づく給与、顧問費及び専門費用を含み、特許関連コスト、一般会社コスト及び施設コストを含むが、研究開発費或いは製品収入コストは含まれていない。
その他の収入(費用)
その他の収入(支出)には、主に、我々が改正した融資·担保協定に関する利息支出(以下の定義)と、2022年7月1日から計算すべき転貸収入が含まれる。
55
カタログ表
2022年と2021年12月31日までの財政年度の運用結果
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
協力収入 |
|
$ |
2,922 |
|
|
$ |
398 |
|
運営費用: |
|
|
|
|
|
|
||
研究開発 |
|
|
25,018 |
|
|
|
49,643 |
|
一般と行政 |
|
|
13,142 |
|
|
|
27,564 |
|
契約修正による収益 |
|
|
(133 |
) |
|
|
— |
|
財産と設備および使用権資産の減価 |
|
|
— |
|
|
|
740 |
|
総運営費 |
|
|
38,027 |
|
|
|
77,947 |
|
運営損失 |
|
|
(35,105 |
) |
|
|
(77,549 |
) |
その他の収入(支出): |
|
|
|
|
|
|
||
利子支出 |
|
|
(3,154 |
) |
|
|
(1,189 |
) |
その他の収入,純額 |
|
|
529 |
|
|
|
(13 |
) |
その他の収入,純額 |
|
|
(2,625 |
) |
|
|
(1,202 |
) |
純損失 |
|
$ |
(37,730 |
) |
|
$ |
(78,751 |
) |
協力収入
2022年12月31日と2021年12月31日までの年間協力収入は以下の通り
|
|
十二月三十一日までの年度 |
|
|
|
|
|
|
|
|||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||||||
(千ドル) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
協力収入 |
|
$ |
2,922 |
|
|
$ |
398 |
|
|
$ |
2,524 |
|
|
|
634 |
% |
2022年12月31日までの年度連携収入は290万ドルであったが,2021年12月31日までの年間連携収入は0.4ドルであった。この増加は,主にSolasia Pharma K.Kとの記念碑的な許可と協力合意によって確認された290万ドルによるものである.
研究と開発費
2022年12月31日と2021年12月31日までの年間における研究·開発費は以下のとおりである
|
|
十二月三十一日までの年度 |
|
|
|
|
|
|
|
|||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||||||
(千ドル) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究開発費 |
|
$ |
25,018 |
|
|
$ |
49,643 |
|
|
$ |
(24,625 |
) |
|
|
(50 |
)% |
2021年12月31日までの年度と比較して,2022年12月31日までの年度の研究開発費が2460万ドル減少したのは,主に計画に関連するコストが970万ドル減少したためであり,主にIL−12やCAR−T計画が徐々に減少し,従業員数が減少したため,従業員関連費用が1550万ドル減少し,外部サービスプロバイダへの使用が減少したため,相談費用が140万ドル減少し,2022年には不動産足跡が減少した後,施設やその他の費用が50万ドル減少したためである。私たちのライセンス契約条項によると、Solasiaがマイルストーンを実現したため、MD Andersonの一度費用250万ドルはこれらの減少を部分的に相殺した。
2021年12月31日までの年度内に、我々の戦略的再編活動により約60人の常勤従業員が解雇され、従業員に関する支出が減少した。私たちは現在、未来に似たような事件が起こらないと予想している。
一般と行政費用
2022年と2021年12月31日終了年度の一般·行政費用は以下の通り
|
|
十二月三十一日までの年度 |
|
|
|
|
|
|
|
|||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||||||
(千ドル) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
一般と行政費用 |
|
$ |
13,142 |
|
|
$ |
27,564 |
|
|
$ |
(14,422 |
) |
|
|
(52 |
)% |
2021年12月31日までの年度と比較して,2022年12月31日までの年度の一般·行政費は1,440万ドル減少し,主に我々の従業員数が1.7ドル減少し,従業員関連費用が1,240万ドル減少したためである
56
カタログ表
法律コストの低減とコンサルタントの使用減少により、相談費用は100万ドル減少し、2022年には私たちの不動産敷地面積が減少した後、施設やその他の費用は30万ドル減少した。
2021年12月31日までの年度内に、我々の戦略的再編活動により約60人の常勤従業員が解雇され、従業員に関する支出が減少した。私たちは現在、未来に似たような事件が起こらないと予想している。
契約修正による収益
2022年12月31日と2021年12月31日までの年間賃貸借改定収益は以下の通り
|
|
十二月三十一日までの年度 |
|
|
|
|
|
|
|
|||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||||||
(千ドル) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
契約修正による収益 |
|
$ |
(133 |
) |
|
$ |
— |
|
|
$ |
(133 |
) |
|
|
100 |
% |
2022年12月31日までの年間では、レンタル改正収益は10万ドルだったが、2021年12月31日までの年度は0ドルとなった。2022年第2四半期に不動産賃貸が改正されたため、関連賃貸負債と使用権資産は改訂後の賃貸支払いによって再計量され、収益10万ドルが生じた。
値を減らす
2022年12月31日までと2021年12月31日までの減値は以下の通り
|
|
十二月三十一日までの年度 |
|
|
|
|
||||||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||||||
(千ドル) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
財産と設備および使用権資産の減価 |
|
$ |
— |
|
|
$ |
740 |
|
|
$ |
(740 |
) |
|
|
100 |
% |
2022年12月31日までの年度では減値はなかったが、2021年12月31日までの年度は0.7ドルだった。我々ボストン事務所の予想用途が変化したため、2021年12月31日までの1年間に、60万ドルの使用権資産減価費用と10万ドルのリース改善とその事務所に関連する他の資産の減価費用が確認された。
その他の収入(費用)
2022年と2021年12月31日終了年度のその他の収入(支出)は以下の通り
|
|
十二月三十一日までの年度 |
|
|
|
|
|
|
|
|||||||
|
|
2022 |
|
|
2021 |
|
|
変わる |
|
|||||||
(千ドル) |
|
|
|
|
|
|
|
|
|
|
|
|
||||
利子支出 |
|
$ |
(3,154 |
) |
|
$ |
(1,189 |
) |
|
$ |
(1,965 |
) |
|
|
165 |
% |
その他の収入,純額 |
|
|
529 |
|
|
|
(13 |
) |
|
|
542 |
|
|
|
(4169 |
)% |
合計する |
|
$ |
(2,625 |
) |
|
$ |
(1,202 |
) |
|
$ |
(1,423 |
) |
|
|
118 |
% |
2022年12月31日までの年度は、2021年12月31日までの年度と比較して、純収入(支出)総額が140万ドル増加したのは、改正された融資や保証協定に関する追加利息が200万ドル支出されたが、我々の現金残高利息が増加したため、2022年12月31日までの年間で確認された利息収入が50万ドル増加し、その増加を部分的に相殺したためである。
流動性と資本資源
流動資金源
私たちは製品販売から何の収入も得ていません。設立以来、私たちの運営は純損失とマイナスキャッシュフローになりました。
これまで、私たちは主に私たちの普通株の公開、私たちの転換可能な株式証券、定期債務、協力を公募することで、私たちの業務に資金を提供してきました。2022年12月31日現在、私たちが株式発行から得た総金額は7.291億ドル、改訂された融資と保証契約から得られた総金額は2500万ドルである。
57
カタログ表
私たちはASCテーマ205-40の指示に従いました財務諸表の列報−継続経営−私たちが財務諸表の発行日後に経営を続けている企業として1年間経営を続ける能力があるかどうかを確認します。私たちの現在の発展計画と現金管理努力を考慮して、私たちの現金資源は2023年第4四半期の運営に資金を提供するのに十分であると予想される。私たちの現在の現金資源が枯渇した後、私たちが運営を継続できるかどうかは私たちが追加資金を得る能力にかかっているが、これは保証されない。我々の研究開発計画の重点と方向、競争と技術進歩、特許発展、法規変化或いはその他の発展により、現金需要は現在の計画とは大きく異なる可能性がある。必要に応じて十分な追加資金が利用できない場合、経営陣は、現金を節約するために、その開発努力や計画中の業務を削減する必要があるかもしれない。
現在の現金予測によると、経営陣は、財務諸表が発表された日から少なくとも1年以内に、私たちの既存の資本資源が私たちの計画運営に資金を提供していると判断しており、持続的な経営企業としての継続的な経営能力が疑われている。この現金資源と計画業務の予測は展望性情報であり、リスクと不確定要素に関連し、実際の支出金額は多種の要素によって重大な不利な影響を与える可能性がある。
2022年公募株
2022年11月29日、私たちは唯一の引受業者であるCantor Fitzgerald&Co.または引受業者と引受契約を締結し、引受販売発行または発行の方法で引受業者に24,228,719株の普通株または会社株を発行および販売することに関連し、価格は1株0.6191ドルである。
引受割引と手数料および我々が支払うべき発売費用を差し引いた後、今回の発行から得られた純収益は1,470万ドル(以下に述べる部分を差し引いて引受業者の選択権を行使する前)である。
請負契約の条項に基づいて、吾らは、会社株式と同じ1株当たり最大3,634,307株の普通株を購入するか、または会社の株式と一緒に株式を購入するために、引受業者に30日間の選択権を付与する。2023年1月5日、引受業者は216,294株の普通株を購入する選択権を行使した。
今回の発行で売られているすべての株は私たちが売っています。
2022年株式分配協定
2022年8月12日、パイパー·サンダーラー社(Piper Sandler&Co.)やパイパー·サンドラー社(Piper Sandler)と株式分配協定を締結し、この合意によると、パー·サンダーラーを販売代理として派遣することで、時々私たちの全権で決定し、パー·サンドラーを販売代理として派遣することで、総発行価格5000万ドルに達する普通株を発売することができる。パイパー·サンドラーは、株式分配協定に従って売却された任意の普通株式総収益の3.0%の手数料を得る。2022年12月31日までの年度内に、持分割当合意に基づいて当社の普通株を売却することはありません。株式分配協定を締結することについては、私たちが先の“市場で発売する”計画に適用される2022年8月12日に2019年6月21日の“公開市場販売協定”を同時に終了することに等しい。
2021年ローンと保証契約
2021年8月6日、私たちは“ローンと保証協定”を締結した。融資と安全協定は、取引完了時に2500万ドルの初期定期融資を提供し、2022年8月31日までに特定の資金と臨床マイルストーンに達した場合、2500万ドルの追加資金を提供すると規定している。2021年12月28日から、改正された融資·担保協定、または改正された融資·担保協定を締結した。
改訂されたローンと担保協定の条項によると、改訂されたローンと担保ローンはすでに改訂され、まだ資金を提供されていない追加部分を廃止し、最初の2,500万元だけをローンと抵当ローンの全数として残す。SVBローンは未償還ローンで年変動金利で利息を計算し、月ごとに支払い、(A)7.75%と(B)現行公表されている米国の最優遇金利と4.5%の保証金の両者の中で大きい者で計算される。改正された融資と担保協定は、2022年8月31日までの受取利息のみの期限を規定している。2022年9月1日から、未返済ローン総額は12ヶ月連続の等額元本加算利息分期で返済されます。
改正された融資と保証協定によると、すべての未返済債務は2023年8月1日に満期になり、支払われる。私たちはまたSVB元元金の5.75%を最後の支払いとして借りている。私たちは最大2回の前払いを許可されましたが、SVB融資1.00%から2.00%までの前払い割増価格を前払いしなければなりません。1件の前払いは最低500万ドルで、前払い部分のすべての未払いと未払い利息が追加されます。
2022年8月31日あるいはそれまでに改訂された融資と担保協定で指定されたいくつかのマイルストーンに達しなかったため、吾らは当時返済されていなかったSVB融資元金総額の半分にSVB融資元元金の5.75%に相当する金額を抵当に入れなければならない。2022年12月31日現在、私たちは1390万ドルを担保しており、これは私たちの貸借対照表で制限的な現金に分類されている。違約事件が発生しない限り、残りの部分に関連するいくつかの他の条項の制限を受ける
58
カタログ表
SVBローン項目の未返済残高を返済した後、担保戸籍は8回目に期限通りに元金と利息を支払った後、担保戸籍から250万元を支出し、10回目の期限に元金と利息を支払った後、さらに400万元を支出する。改訂された融資及び担保プロトコル項下のSVB融資及び関連責任は吾などのすべての財産、権利及び資産を担保とするが、その知的財産権は除外する(改訂された融資及び担保プロトコルの下の負の質権制約を受けなければならない)。また、改正された融資と保証協定は慣例的な陳述、保証、違約事件、そしてチェーノを含む。
融資および担保協定の締結については、吾らは(I)最大432,844株の普通株を購入するためにSVBに引受権証を発行し、(Ii)いくつかの臨床マイルストーンに達していれば、最大432,842株の普通株を追加購入することができ、それぞれの場合の行使価格は1株2.22ドルである。改訂された融資及び担保協定を締結するため、著者らはすでにSVBに発行された引受権証を改訂及び再記載した。改訂と重述を経た後、この等株式証は1株1.16ドルの行権価格で最大649,615株の自社普通株を購入するか、あるいはSVB株式証を承認する。SVBの引受権証は2031年8月6日に満期になる。
キャッシュフロー
次の表は、2022年12月31日と2021年12月31日までの年間現金と現金等価物の純増加(減少)状況をまとめたものである
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
(千ドル) |
|
|
|
|
|
|
||
提供された現金純額(使用): |
|
|
|
|
|
|
||
経営活動 |
|
$ |
(29,232 |
) |
|
$ |
(61,468 |
) |
投資活動 |
|
|
(193 |
) |
|
|
(3,323 |
) |
融資活動 |
|
|
6,367 |
|
|
|
25,776 |
|
現金と現金等価物の純減少 |
|
$ |
(23,058 |
) |
|
$ |
(39,015 |
) |
経営活動のキャッシュフローとは,投資や融資活動以外のすべての活動に関する現金収入と支出のことである。営業キャッシュフローは私たちの純損失を調整することで得られます
2022年12月31日までの年度の経営活動用現金純額は2920万ドルだったが、2021年12月31日現在の年度は6150万ドルだった。この減少は主に我々の純損失が4,110万ドル減少したが,非現金調整と運営資本の影響の程度によって部分的に相殺されたためである。
2022年12月31日までの年度の経営活動に用いられる現金純額は主に当社の純損失3,770万ドルであり、減価償却、株式報酬及び使用権資産帳簿額面の減少など960万ドルの非現金項目調整後、売掛金は110万ドル減少し、前払い支出及びその他の資産は100万ドル減少したが、未払い支出は70万ドル減少及びリース負債250万ドル減少に相殺された。2021年12月31日までの年度において、経営活動で使用されている現金純額は、主に私たちの純損失7880万ドル、減価償却や株による報酬などの非現金プロジェクト調整後の1450万ドル、および売掛金が1050万ドル減少したが、売掛金が360万ドル減少し、前払い費用とその他の資産が940万ドル減少し、売掛金が30万ドル増加したことで相殺された。
投資活動用の現金純額は0.2ドルです 2022年12月31日までの年間330万ドルですが、2021年12月31日までの年間330万ドルです。2021年12月31日までの年度と比較して,2022年12月31日までの年度の投資活動のための現金純額が減少したのは,主に2021年上半期に利用可能な現金を使用してテキサス州ヒューストン施設での内部細胞治療能力を拡大することに決定したためである。
2022年12月31日までの1年間で、融資活動が提供した純現金は640万ドルだったが、2021年12月31日までの年間は2580万ドルだった。2022年12月31日までの1年間に、融資活動が提供する640万ドルは、主に普通株の発行(引受業者の選択権を部分的に行使する前)の1470万ドルの純収益に関係しているが、830万ドルの長期債務返済によって相殺されている。2021年12月31日現在,融資活動が提供する現金純額は2,580万ドルであり,主に我々のSVB融資2,500万ドルの収益と株式オプション行使の収益は1百万ドルに相当する。
運営資本および資本支出要求
私たちは予測可能な未来に損失が続くと予想している。2022年12月31日現在、我々の累計赤字は約8.806億ドル。多くの要素のため、私たちの実際の現金需要は計画と大きく異なるかもしれません
59
カタログ表
2022年12月31日現在、私たちは約5300万ドルの現金、現金等価物、および限定的な現金を持っている。私たちの1390万ドルの制限された現金は改正された融資と保証協定と関連がある。私たちの現在の発展計画を考慮して、私たちの現金資源は2023年第4四半期まで私たちの運営に資金を提供するのに十分であると予想される。私たちが予測した滑走路の外で私たちの業務を継続するためには、私たちは追加資本を集める必要があり、現在私たちは約束した追加資本源を持っていない。現金資源の予測は展望性情報であり、リスクと不確定要素に関連し、私たちの実際の支出金額は多くの要素によって重大な変化と不利な影響が発生する可能性がある。私たちの推定は間違っていることが証明される可能性があるという仮定に基づいており、私たちの支出は私たちの現在の予想よりもはるかに高いことが証明されるかもしれない。経営陣は、もしあれば、追加的な融資条項が私たちに有利または受け入れられるかどうかを知らない。必要に応じて利用可能な十分な追加資金がない場合、またはパートナー合意に成功して我々の候補製品をさらに開発することができなかった場合、管理層は、その開発努力や計画の運営を削減する必要があるかもしれない。
2022年12月31日現在、限定現金を含まない運営資本は1,570万ドルで、3,990万ドルの流動資産と2,420万ドルの流動負債が含まれている。2021年12月31日現在、運営資本は6,280万ドルで、そのうち流動資産は7,880万ドル、流動負債は1,600万ドルである。
賃貸借契約を経営する
私たちの運営賃貸に対する約束はテキサス州ヒューストンの実験室と事務空間とマサチューセッツ州ボストンのオフィス空間に関するものです。2015年12月21日と2016年4月15日、ボストンオフィススペースのレンタルを2021年8月31日に更新しました。2021年4月22日、ボストンオフィスのオフィススペースの一部を2026年8月31日に変更します。
2019年3月12日、私たちはヒューストンMD Andersonで2021年4月までのオフィススペース賃貸契約を締結しました。2019年10月15日、ヒューストンでオフィスと実験室スペースを増やし、2027年2月までレンタル期間を増やす別のレンタル契約を締結しました。2020年4月7日、私たちは既存の賃貸契約を改訂し、ヒューストンの追加事務と実験室空間をレンタルし、レンタル期間は2027年2月まで。2020年6月と9月、私たちはヒューストンで短期賃貸契約を締結し、オフィスと実験室空間を増加させた。2020年12月15日、MD Andersonとヒューストンで2つ目のレンタル契約を締結し、2028年4月までの追加オフィスと実験室スペースを提供してくれました。
2022年4月、我々はMD Andersonと2020年12月15日に署名した不動産賃貸契約を修正した。修正後、私たちのレンタル面積は18,111平方フィートから3,228平方フィートに減少しました。そのため、関連賃貸負債と使用権資産は改訂された賃貸支払いによって40万ドルに再計量される。
二十二年六月、私たちは契約に調印して、ボストンで借りた四七七二平方フィートのオフィス空間を転用しました。分譲期間は2022年7月1日から2025年6月30日までで、分譲者に2026年7月31日まで延長する選択権を提供する。2022年12月31日までの1年間に、営業報告書では他の収入(費用)純額に分類された10万ドルの賃貸収入が確認された。
特許使用料と許可料
2019年5月28日、私たちはNCIと特許許可を締結した。特許許可の条項はNCIが年間30万ドルの最低使用料を支払うことを要求して、私たちが支払う最低年間使用料の総額が150万ドルになると、私たちは10万ドルに減少します。2022年12月31日までの年度では,特許許可により30万ドルの特許使用料支払いが確認され,2021年12月31日までの年度で30万ドルの特許使用料支払いが確認された。2022年12月31日までに、特許許可に基づいて合計50万ドルの最低年間使用料を支払いました。
特許許可によると、私たちはまた許可製品に関連する臨床と監督基準の成功を条件として業績支払いを行わなければならない。このような支払いでは、潜在的基準支払い総額は430万ドルであり、そのうち300万ドルの支払い総額は、米国またはヨーロッパ、日本、オーストラリア、中国またはインドがマーケティング許可を得た後にのみ支払われるべきである。最初の基準支払い10万ドルは私たちのTCR-T図書館の第1/2段階試験開始時に支払いました。また、特許製品の総純売上高が2.5億ドルから10億ドルの間のいくつかの総純売上高の後、NCI一次基準支払いを要求された。このような基準支払いの潜在的な総金額は1200万ドルだ。2022年12月31日までの年間で10万ドルが支払われており、2021年12月31日までの年間では何も支払われていない。
60
カタログ表
2018年10月5日、私たちはPGENとライセンス契約を締結しました。ライセンス契約により,PGENに年間10万ドルのライセンス料を支払う義務があり,合意条項による支払いが予定されており,PGENのいくつかの歴史的コストを返済することにも同意しており,最高100万ドルに達する。2022年12月31日と2021年12月31日までの年度内に,合意条項に従って許可料を支払った。
ライセンス契約の条項によると、私たちは、後期臨床試験の開始と、異なる管轄区域で独占ライセンス製品を承認する際に、各独占ライセンス計画に合計5250万ドルまでの追加支払いまたはマイルストーン支払いを担当しています。また,任意の承認されたIL−12製品および自動車製品の販売純売上に応じて,下位から1桁までの階層印税をPGENに支払う。また、任意の承認されたTCR製品の販売純売上高に応じて下位から1桁までのPGEN印税を支払い、合計最高印税額は1.00億ドルとなる。私たちはまた、特許製品に関する任意の再許可収入の20%をPGENに支払います。私たちはすべての許可製品に関連したすべての開発費用を担当している。PGENはPGEN自動車製品販売の純売上高に応じて下位から1桁までの特許権使用料を支払い、最高特許使用料金額は1.00億ドルとなる。
2022年6月、SolasiaはDarinparsinが日本の厚生労働省によって再発または難治性末梢T細胞リンパ腫の治療に許可されたと発表した。2022年12月31日までの年間で,Solasia許可と協力協定により290万ドルの協力収入を記録しており,主にSolasiaが日本で何らかの販売ベースのマイルストーンを実現していることに関係しているが,2021年12月31日までの年度は40万ドルである。
重要な会計政策と重大な見積もり
私たちの経営陣は私たちの財務状況と経営結果の討論と分析は私たちの財務諸表に基づいています。これらの報告書はアメリカで公認されている会計原則に基づいて作成されています。これらの財務諸表を作成する際には、財務諸表の日付の報告された資産および負債額、または有資産および負債の開示および報告期間内に報告された費用に影響を与える推定および仮定を行う必要がある。私たちは持続的な基礎の上で私たちの推定と判断を評価する。異なる仮定または条件では、実際の結果は、これらの推定値と大きく異なる可能性がある。
以下は財務諸表を作成する際に使用されるより重要な見積もりと判断だと信じています
研究開発コスト/臨床試験費用
財務諸表作成過程の一部として、私たちが計算すべき研究開発費を見積もる必要があります。このプロセスは、未締結契約および調達注文を審査し、私たちの担当者とコミュニケーションして、私たちに代わって実行されるサービスを決定し、インボイスを受け取っていない場合、または他の方法で実際のコストを通知している場合に、実行されたサービスレベルおよびサービスによって生じる関連コストを推定することを含む。私たちのほとんどのサービスプロバイダは予定のスケジュールに従って、あるいは契約マイルストーンに達した時に私たちに借金の領収書を発行しますが、前金が必要な少数もあります。私たちは、当時私たちが知っている事実と状況に基づいて、財務諸表において、各貸借対照表の日付までの課税費用を推定します。計算すべき研究および開発費用の推定例には、以下の者に支払われる費用が含まれる
我々は,我々を代表して臨床試験を行って管理している複数のCROとのオファーと契約に基づいて,受信したサービスや費用の見積もりに基づいて,臨床前研究や臨床試験に関する費用を計算した。これらの合意の財務条項は交渉が必要であり、契約によって異なり、支払いの不均衡を招く可能性がある。場合によっては、私たちのサプライヤーに支払われる費用は、提供されたサービスレベルを超え、それによって、臨床費用の前払いをもたらす可能性がある。その中のいくつかの契約下の支払いは臨床試験マイルストーンの完成などの要素に依存する。サービス料を受け取る際には、サービスを提供する時間帯、患者登録人数、有効な場所数、および各期間に必要な努力の程度を見積もります。実際に発生した金額と実質的に異なることはないと予想されるが,実行されたサービスの実際の状態や時間に対する実行サービスの状態や時間の理解が異なる可能性があり,我々の前のものにつながる可能性がある
61
カタログ表
私たちはこれがかなり信頼できると思っていたと思う。これまで,我々が先に対応した研究や開発費用の見積もりについては何の重大な調整も行っていない.
連携プロトコルからの収入確認
私たちは主に戦略パートナーと候補製品の開発と商業化について協力することで収入を創出しています。2018年1月1日から、財務会計基準委員会(FASB)ASCテーマ606に従って収入を確認しました取引先と契約した収入 (“ASC 606”),ASC 605の代わりに多元素配列歴史的な年代に使われていますASC 606のコア原則は、エンティティは、約束された商品および/またはサービスを顧客に譲渡する金額を記述するために収入を確認すべきであり、その金額は、これらの商品および/またはサービスと交換するために、エンティティが獲得する権利が予想される対価格を反映すべきである。ASC 606の範囲内の手配で確認すべき適切な収入金額を決定するために、(I)顧客との契約を決定するステップ、(Ii)契約における履行義務を決定するステップ、(Iii)取引価格を決定するステップ、(Iv)契約に取引価格を割り当てる履行義務、および(V)各履行義務を履行する際に収入を確認するステップを実行する。
我々は、ASC 606の範囲内のいくつかの許可または協調プロトコルに従って協調収入を確認する。私たちの顧客との契約には、通常、知的財産権許可、研究開発サービス、および追加商品および/またはサービスの購入に関する約束が含まれています。私たちの知的財産権許可が手配で決定された他の履行義務とは異なると判定された場合、許可が許可者に譲渡され、被許可者が許可を使用して利益を得ることができるときに許可に割り当てられた払戻不可能な前払い費用の収入を確認する。他の約束とバンドルされたライセンスについては、合併履行義務が時間の経過とともに履行されるか、ある時点で履行されるかを決定するために、合併履行義務の性質を評価する判断を利用し、時間の経過とともに進行を測定する適切な方法を決定して、払い戻し不可能な前払い費用からの収入を確認する。追加の貨物および/またはサービスを取得するオプションを含む契約は、契約を締結することなく得られない実質的な権利が顧客に提供されたかどうかを決定するために評価される。もしそうであれば,そのオプションは単独の履行義務として入金される.そうでなければ、このオプションはマーケティングオファーとみなされ、顧客が選択した後に個別の契約として計算される。
私たちの顧客との合意条項は、一般に、(I)払い戻し不可能な前払い、(Ii)開発、規制、および商業マイルストーン支払い、(Iii)将来の選択および(Iv)製品の純売上の印税を許可することのうちの1つまたは複数を含む。したがって、取引価格には、通常、契約開始時に満了する固定料金と、特定のイベントが完了したときに支払われるマイルストーン支払い形式の可変対価格と、顧客が特許製品の純売上高を確認する際に得られる階層的特許権使用料とが含まれる。私たちは、約束された商品および/またはサービスを顧客に移転するために、私たちが獲得する権利があると予想された対価格金額に基づいて取引価格を測定します。私たちは最も可能な金額法を使って可変対価金額を推定し、私たちが獲得する権利がある対価金額を予測する。可変対価格額は取引価格に計上され,可変対価格に関する不確実性がその後解決されれば,確認された累積収入が大きく逆転しない可能性が高い。開発と規制マイルストーン支払いを含む各手配の開始時に、関連イベントが実現可能であると考えられているかどうかを評価し、可能な金額法を用いて取引価格に含まれる金額を推定する。トリガイベントが発生する前に、規制の承認を受けた支払いに依存するような、私たちまたは許可者の制御範囲内ではないマイルストーン支払いは、実現可能であるとは考えられない。各報告期間の終了時に、各マイルストーンおよび任意の関連する制限を達成する可能性を再評価し、必要に応じて, 私たちの総出来高の見積もりを調整します。いずれの調整も累積追跡原則で入金されており、これは調整期間中の収入と純損失に影響する。販売ベースの特許使用料を含む手配については、製品販売が一定のレベルに達したことに基づくマイルストーン支払いを含む場合、(I)関連販売が発生した場合、または(Ii)支払いの一部または全部に割り当てられた履行義務が履行された(または部分的に履行されている)場合に、以下の遅い時間に収入を確認する。オプション商品および(または)サービスの対価格は、契約開始時の取引価格には含まれない。
私たちは相対的に独立した販売価格に基づいて契約で決定されたすべての履行義務に取引価格を割り当てます。しかしながら、可変対価格のいくつかの部分は、以下の2つの基準が満たされる限り、契約内の1つまたは複数の特定の履行義務に特化したものであり、(1)支払い条件は、具体的には、履行義務または独自の貨物またはサービスの譲渡の努力に関連し、(2)可変対価格を履行義務または固有の貨物またはサービスに完全に割り当てることが標準的な分配目標を満たし、したがって、割り当てられた金額は、譲渡承諾された貨物またはサービスと交換するために、エンティティが獲得する権利が予想される対価格金額を記述する。我々が開発した仮定は,契約ごとに決定された契約義務ごとの独立販売価格を決定するために判断を用いる必要がある.契約義務ごとの独立販売価格を決定する際に用いるキー仮説には,収入予測,開発スケジュール,推定された研究開発コスト,割引率,行使の可能性,技術と規制成功の可能性がある可能性がある。
収入は、義務履行時又は義務履行時に約束された貨物及び/又はサービスを顧客に譲渡することにより、義務履行毎に割り当てられた取引価格の金額に基づいて確認される。長期的に履行される履行義務については、関連商品および/またはサービスの制御権を顧客に移転する実績を記述した単一の進捗を測定する方法を用いて履行義務の完全履行の進展を測定することで収入を確認する。私たちは入力方法を用いて一定期間義務を完全に履行する進捗状況を測定した。私たちは評価した
62
カタログ表
各報告期間で進捗状況を測定し、必要に応じて業績測定と関連収入確認を調整する。いずれの調整も累積追跡原則で入金されており、これは調整期間中の収入と純損失に影響する。
株式報酬の会計計算
株式に基づく報酬コストは、付与された日に報酬の推定公正価値をもとに計量し、従業員に必要なサービス期間の費用を確認する。株式ベースの報酬支出は、最終的に付与される見込みの報酬数に基づいており、没収が発生した場合に減少する。数年前と同様に、会社は、オプション保有者がオプションを行使する前にオプションの予想期限を保留することと、予想期間内の会社普通株価格の推定変動性とを推定する必要があるBlack-Scholesオプション定価モデルを使用する。
我々の推定仮説を定期的に検討しているため,将来の期間に付与された株式ベースの報酬を評価するための推定仮定を変更する可能性がある.これらの変化は、私たちが確認した株式ベースの支払いに関する費用に大きな変化をもたらす可能性がある。
我々の仮定は以下のように推定される
所得税
私たちの財務諸表を作成する際には、私たちの実際の当期税収支出を推定し、税収と財務報告目的のプロジェクトの処理によって生じる一時的な違いを評価することで、私たちが経営している各司法管轄区の所得税負債を推定します。これらの違いは繰延税金資産と負債を招き、推定準備が必要かどうかを考慮する前に、これらの資産や負債は私たちの貸借対照表に計上されている。私たちの繰延税金資産の現金化能力を評価する際には、重大な経営陣の判断力が必要だ。この評価を行う際には、繰延税金資産の一部または全部が現金化できない可能性が高いかどうかを考慮します。繰延税金資産の最終的な現金化は、これらの一時的差額控除可能期間中に生成された将来の課税所得額に依存する。この決定を下す際には、適用される財務会計基準に基づいて、繰延税金負債の予定引抜き、将来の課税所得額、および税務計画戦略の影響を考慮することが許可される。私たちの将来の課税収入の推定には、他の項目を除いて、株式オプションの行使に関する将来の所得税控除の推定が含まれています。もし実際の結果が私たちの見積もりと違う場合、私たちは今後の間に私たちの推定を調整し、私たちは推定手当を確立する必要があるかもしれません。これは私たちの財務状況と運営結果に大きな影響を与えるかもしれません。
不確定な税収状況を確認·解決するために“より可能性の高い”敷居を用いて、不確定な税収状況を計算する。不確定税務状況の評価根拠の要素は、税法の変化、納税申告書に採用されたまたは予想される税収状況の測定、監査すべき事項の効果的な解決、新しい監査活動、および税収状況に関連する事実または状況の変化を含むが、これらに限定されない。我々は、不確定な税務状況を毎年評価し、不確定な状況をめぐる関連事実の任意の後続変化を反映するように負債レベルを調整する。税務機関への支払いや訴訟時効が満了することにより法的に解消または発生する可能性がある場合にのみ、納税状況を確定しない責任が免除され、その状況に関連する利益の確認が“より可能性がある”というハードルに達するか、またはその責任が審査手続きによって効果的に解決される。私たちは、税務機関がそのすべての規定または予想される審査手続きを完了すると、すべての控訴および行政カバーを含むと考え、私たちは税務状況のいかなる側面についても控訴または訴訟を提起する計画はない;私たちは税務機関が関連する税務状況を審査または再検討する可能性は極めて低いと思う。私たちはまた、所得税支出で確認されていない税金優遇に関する潜在的な利息と罰金を計算しなければならない。
最近の会計公告
新会計基準に関する議論は、添付財務諸表の付記3を読んでください重要会計原則の概要本報告に含まれます。
第七A項。量と質市場リスクの開示について
取引法第12 b-2条の定義によると、小さな報告会社として、本プロジェクト7 A項の情報を提供する必要はない。
63
カタログ表
プロジェクト8.財務諸表データを補充します
本プロジェクト8によって要求される情報は、本年度報告のF−1~F−26ページに記載され、参照されて本明細書に組み込まれる。
項目9.変更と異議会計·財務開示に関する会計士
ない。
第9条。制御とプログラム
情報開示制御と手続きの評価。
我々の経営陣の監督·参加の下で、我々の最高経営責任者および最高財務官、ならびに我々の最高会計官を含めて、2022年12月31日までに、取引法によって公布された規則13 a-15(E)または15 d-15(E)によって定義された我々の開示制御およびプログラムの有効性を評価した。この評価に基づき、我々の最高経営責任者と最高財務責任者は、2022年12月31日まで、以下に述べるように、開示制御および手続きが有効であると結論した財務報告の内部統制に関する経営陣の報告.”
財務報告の内部統制に関する経営陣の報告
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。取引法に基づいて公布された規則13(A)-15(F)および15(D)-15(F)は、財務報告の内部統制を、私たちの主要幹部および主要財務官と私たちの主要会計官が設計またはその監督下で、私たちの取締役会、管理層、その他の人員によって実施されるプログラムと定義し、公認された会計原則に基づいて財務報告の信頼性と外部目的のための財務諸表の合理的な保証を作成するために、以下の政策および手続きを含む
最高経営責任者、最高財務責任者、最高会計責任者を含む経営陣の監督と参加の下、トレデビル委員会後援組織委員会(COSO)が発表した“内部統制-総合枠組み(2013)”で確立された財務報告の有効な内部統制基準に基づいて、2022年12月31日までの財務報告内部統制を評価した。私たちの経営陣の財務報告の内部統制の有効性の評価には、私たちの内部統制の設計と操作の有効性のテストと評価が含まれています。経営陣は、上記基準に基づき、2022年12月31日現在、財務報告に対して有効な内部統制を維持しているとしている。
内部統制の内在的限界
私たちの経営陣は、私たちの最高経営責任者とCEO、そして私たちの最高会計責任者を含めて、私たちの開示統制や手続き、または私たちの内部統制がすべてのミスやすべての詐欺を防止することを期待していません。発想や動作がどんなに良くても、絶対的な保証ではなく、合理的な保証しか提供できず、制御システムの目標が実現されることを確保する制御システム。すべての制御システムの固有の限界により,どの制御評価もわが社内のすべての制御問題や不正事件(あれば)が発見されていることを絶対に保証することはできない.これらの固有の限界は、意思決定過程における判断が誤っている可能性があり、簡単なエラーまたはエラーによって故障が発生する可能性があるという現実を含む。また、ある人の個人的な行動、2人以上の結託、または制御の管理によって、制御を回避することができる。任意の制御システムの設計も、将来のイベント可能性のいくつかの仮定に部分的に基づいており、どの設計もすべての潜在的な未来の条件でその目標を成功的に達成することが保証されていない。時間の経過とともに,制御が条件の変化により不十分になったり,政策やプログラムへの遵守度が悪化したりする可能性がある.将来的にどのような有効性評価を行うかの予測には,条件の変化により制御が不十分になる可能性がある,あるいは政策やプログラムを遵守する程度が悪化する可能性があるというリスクがある.費用対効果を有する制御システムの固有の制限により、エラーまたは詐欺によるエラー陳述が発生し、発見されない可能性がある。
財務報告の内部統制の変化
64
カタログ表
2022年12月31日までの財政年度中に、財務報告の内部統制(取引法第13(A)-15(F)条の定義に基づく)に大きな影響を与えなかったか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化を生じなかった。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。以下の内容について開示する検査を阻止した外国司法管区
ない。
65
カタログ表
第三部
プロジェクト10.取締役、執行役上級管理職と会社管理
第10項に要求される情報は、我々が米国証券取引委員会に提出した2023年年次総会に関する我々の最終委託書に含まれ、参照により本明細書に組み込まれる。
プロジェクト11.役員報酬
第11項に要求される情報は、2023年年次総会に関する我々が米国証券取引委員会に提出した最終委託書に含まれ、参照により本明細書に組み込まれる。
プロジェクト12.セキュリティ所有権一部の実益所有者と経営陣および関連株主について
第12項に要求される情報は、2023年年次総会に関する我々が米国証券取引委員会に提出した最終委託書に含まれ、参照により本明細書に組み込まれる。
プロジェクト13.特定の関係関連取引や役員の独立性と
第13条に要求される情報は、2023年年次総会に関する我々が米国証券取引委員会に提出した最終委託書に含まれ、引用により本明細書に組み込まれる。
プロジェクト14.総会計士費用とサービス
第14条要求された情報は、2023年年次総会に関する我々が米国証券取引委員会に提出した最終委託書に含まれ、引用により本明細書に組み込まれる。
66
カタログ表
第4部
項目15.物証、財務諸表付表
(1)財務諸表:
本年度報告書第8項は、本第15項の財務諸表の提出を要求し、以下のとおりである
|
|
|
|
|
|
|
ページ |
|
|
独立公認会計士事務所報告 |
|
|
F-1 |
|
2022年12月31日現在と2021年12月31日現在の貸借対照表 |
|
|
F-3 |
|
2022年と2021年12月31日までの年度の業務報告書 |
|
|
F-4 |
|
2022年と2021年12月31日までの年度株主権益変動表 |
|
|
F-5 |
|
2022年12月31日と2021年12月31日までの年間現金フロー表 |
|
|
F-6 |
|
財務諸表付記 |
|
|
F-7 |
|
(2)財務諸表付表:
添付表は、適用されないか、必要ではないか、または財務諸表およびその付記にこれらの情報が含まれているため、これらの付表は省略される。
(三)展示品:
証拠品番号: |
|
書類説明 |
|
|
|
2.1 |
|
登録者(前“易趣網”)、ZIO Acquisition Corp.及びZIOPHARM,Inc.が2005年8月3日に締結した合併協定及び計画(2005年8月9日に提出された登録者Form 8−Kを参照することにより、米国証券取引委員会アーカイブ第000−32353号添付ファイル10.1に編入)。 |
|
|
|
3.1 |
|
証明書の改正及び再登録及びそのすべての改訂(2022年3月30日に提出された登録者年次報告書10-K表の添付ファイル3.1、米国証券取引委員会文書第001-33038号を参照することにより)。 |
|
|
|
3.2 |
|
2005年9月13日の合併証明書は,ZIO Acquisition Corp.とZIOPHARM,Inc.の合併に関連している(2005年9月19日に提出された登録者Form 8−Kを参照して,米国証券取引委員会文書第000−32353号の添付ファイル3.1を合併した)。 |
|
|
|
3.3 |
|
登録者の所有権証明書(前身はEasyWeb,Inc.)日付は2005年9月14日であり,ZIOPHARM,Inc.が登録者と合併して登録者に組み込まれ,登録者の会社名をEasyWeb,Inc.からZIOPHARM Oncology,Inc.(添付ファイル3.2を参照して登録者が2005年9月19日に提出した8−K表,米国証券取引委員会文書第000−32353号)に変更された。 |
|
|
|
3.4 |
|
改訂·再発行されたシリーズ1優先株の指定、優先及び権利証明書は、2016年7月1日にデラウェア州国務長官に提出された(2016年7月1日に提出された登録者が現在報告している8-K/A表の添付ファイル3.1、米国証券取引委員会文書第001-33038号を参照)。 |
|
|
|
3.5 |
|
改正·再改訂された登録者定款は、日付が2020年9月21日である(添付ファイル3.1を参照して登録者の現在の報告書の表格8-Kに組み込まれ、米国証券取引委員会文書第001-33038号、2020年9月22日に提出される)。 |
|
|
|
4.1 |
|
普通株式証明書サンプル(2005年10月14日に届出された登録者登録明細書中の表SB−2を参照して、米国証券取引委員会文書第333−129020号の添付ファイル4.1を参照して編入)。 |
|
|
|
4.2 |
|
普通株購入のオプション表は2004年8月30日であり,テキサス大学M.D.アンダーソン癌センターに発行されている(2006年3月20日に提出された登録者年次報告10−KSB表の添付ファイル4.6,米国証券取引委員会文書第000−32353号を参照)。 |
|
|
|
4.3 |
|
普通株式の購入を決定する重大オプション条項の付表(2006年3月20日に提出された登録者年次報告書10−KSB表の添付ファイル4.7、米国証券取引委員会文書第000−32353号を参照)。 |
|
|
|
4.4 |
|
普通株式承認証表を購入する(2018年11月13日に提出された登録者が現在報告している表格8-K米国証券取引委員会文書第001-33038号の添付ファイル4.1を参照して編入)。 |
|
|
|
4.5# |
|
テキサス大学M.D.アンダーソンがんセンターに発行された普通株購入権証(登録者年次報告10−K表の添付ファイル4.7を引用することにより,米国証券取引委員会文書第001−33038号,2020年3月2日に提出)。 |
|
|
|
4.6 |
|
普通株式承認証表の購入日は、2021年12月28日(登録者年次報告10-K表に編入された添付ファイル4.6、米国証券取引委員会アーカイブ番号001-33038、提出日は2021年12月28日)である。 |
|
|
|
4.7 |
|
改正された1934年証券取引法第12節に登録された証券説明によれば(2022年3月30日に提出された登録者年次報告書10−K表の添付ファイル4.7を引用することにより、米国証券取引委員会アーカイブ第001−33038号)。 |
|
|
|
10.3+ |
|
ZIOPHARM Oncology,Inc.2012年株式インセンティブ計画は、改訂された(2018年9月24日に提出された登録者が現在報告している8-K米国証券取引委員会文書第001-33038号の添付ファイル10.1を参照して組み込まれる)。 |
|
|
|
67
カタログ表
10.4+ |
|
ZIOPHARM腫瘍学会社の2012年株式インセンティブ計画に基づいて付与された制限株式プロトコル表(2012年6月26日に提出された登録者が現在報告している8-K米国証券取引委員会文書第001-33038号添付ファイル10.2を参照して編入される)。 |
|
|
|
10.5+ |
|
ZIOPHARM腫瘍学会社の2012年株式インセンティブ計画に基づいて付与されたオプションプロトコル表(参照登録者が2012年6月26日に提出した表格8-K米国証券取引委員会文書第001-33038号の添付ファイル10.3を参照して編入)。 |
|
|
|
10.7+ |
|
誘導奨励付与通知及び誘導奨励付与協定のフォーマット(登録者登録宣言の添付ファイル99.3を参照して編入され、表S−8、米国証券取引委員会文書第333−238090号、2020年5月8日に提出)。 |
|
|
|
10.8+ |
|
ZIOPHARM腫瘍学会社2020年株式激励計画(添付ファイル10.1を参照して登録者が現在報告している表格8-Kアメリカ証券取引委員会文書第001-33038号を参照することにより、2020年7月1日に提出)。 |
|
|
|
10.9+ |
|
ZIOPHARM腫瘍学会社の2020年株式激励計画に基づいて付与された制限的株式プロトコル表(添付ファイル10.9を参照して登録者年次報告表格10-Kに組み込むことにより、米国証券取引委員会文書第001-33038号、2021年3月1日に提出)。 |
|
|
|
10.10+ |
|
ZIOPHARM腫瘍学会社の2020年株式インセンティブ計画に基づいて付与された株式オプションプロトコル表(添付ファイル10.10を参照して登録者年次報告書10-K表に組み込むことにより、米国証券取引委員会文書第001-33038号、2021年3月1日に提出)。 |
|
|
|
10.11+ |
|
取締役及び役員賠償協議表(登録者の現在の報告書の添付ファイル99.1を参照して編入され、表8-K、米国証券取引委員会アーカイブ第001-33038号、2013年1月31日に提出)。 |
|
|
|
10.16+ |
|
登録者とオールドケビン·S·ボイルとの間で2021年8月24日に締結された雇用協定(添付ファイル10.1を参照して登録者が現在報告しているタブ8−Kに組み込むことにより、米国証券取引委員会アーカイブ第001−33038号、2021年8月30日に提出)。 |
|
|
|
10.23# |
|
留任ボーナス協議表(登録者年次報告書10-K表の添付ファイル10.20を引用することにより、米国証券取引委員会アーカイブ第001-33038号、2021年3月1日に提出)。 |
|
|
|
10.24# |
|
登録者、Intrexon Corporationと、テキサス大学M.D.アンダーソン癌センターを代表するテキサス大学システム取締役会との間で2015年1月13日に署名された許可協定(2015年1月28日に提出された登録者が現在提出している報告の8−K表を参照することにより、米国証券取引委員会文書第001−33038号の添付ファイル10.5に編入される)。 |
|
|
|
10.25 |
|
登録者,Precigen,Inc.とIntrexon Corporationとの間の独占ライセンス契約は,2018年10月5日である(2018年11月9日に提出された登録者10−Q四半期報告書の添付ファイル10.1,米国証券取引委員会文書第001−33038号を参照)。 |
|
|
|
10.26# |
|
登録者及びPGEN Treateutics,Inc.(前身はPrecigen,Inc.)が2020年10月15日に締結した独占ライセンス契約の第1号改正案(2020年11月5日に提出された登録者の10−Q米国証券取引委員会四半期報告第001−33038号の添付ファイル10.2を参照して編入)。 |
|
|
|
10.27 |
|
登録者、Intrexon CorporationとAres Trading S.A.との間の許可および協力協定は、2015年3月27日(2015年4月2日に提出された登録者の現在の報告書の表8−Kを参照することにより、米国証券取引委員会文書第001−33038号の添付ファイル10.1に編入される)。 |
|
|
|
10.28# |
|
登録者、Intrexon Corporationとテキサス大学M.D.アンダーソン癌センターとの間で2015年8月17日に署名された研究開発協定(2015年8月21日に提出された登録者の現在の報告書の表8−Kを参照することにより、米国証券取引委員会文書第001−33038号の添付ファイル10.1に組み込まれる)。 |
|
|
|
10.29 |
|
登録者、Intrexon Corporationとテキサス大学M.D.アンダーソンがんセンターとの間で2016年8月30日に署名された研究開発協定の第1改正案(添付ファイル10.21を参照して登録者年次報告書Form 10−Kに組み込むことにより、米国証券取引委員会文書第001−33038号、2019年3月5日提出)。 |
|
|
|
10.30 |
|
登録者、Intrexon Corporationとテキサス大学M.D.アンダーソンがんセンターとの間で2017年1月17日に署名された研究開発協定の第2改正案(添付ファイル10.21を参照して登録者年次報告書Form 10-Kに組み込むことにより、米国証券取引委員会文書第001-33038号、2019年3月5日に提出)。 |
|
|
|
10.31 |
|
登録者、Intrexon Corporationとテキサス大学M.D.アンダーソンがんセンターとの間で2017年11月14日に署名された研究開発協定の第3改正案(2019年3月5日に提出された登録者10−K表年次報告書の添付ファイル10.23、米国証券取引委員会文書第001−33038号を引用することにより)。 |
|
|
|
10.32 |
|
研究開発協定第4修正案は、日付が2019年9月19日であり、登録者、テキサス大学MDアンダーソン癌センター、Precigen,Inc.(登録者の10-Q表四半期報告書の添付ファイル10.7を参照して編入され、米国証券取引委員会アーカイブ番号001-33038、2019年11月7日に提出される)。 |
|
|
|
10.33# |
|
研究開発協定第5修正案は、日付が2019年10月22日であり、登録者とテキサス大学MD Andersonがんセンターとの間の合意(添付ファイル10.20を参照して登録者の10−K表年次報告書に組み込むことにより、米国証券取引委員会文書第001−33038号、2020年3月2日に提出)。 |
|
|
|
10.34# |
|
登録者とテキサス大学MD Andersonがんセンターとの間で2019年10月22日に署名された2019年研究開発協定(添付ファイル10.21を参照して登録者が2020年3月2日に提出した10−K表年次報告書、米国証券取引委員会文書第001−33038号を参照)。 |
|
|
|
10.35# |
|
特許許可協定は、日付が2019年5月28日であり、登録者と国立癌研究所とが締結され、日付は2019年5月28日である(2019年8月8日に提出された登録者10-Q四半期報告書の添付ファイル10.3、米国証券取引委員会文書第001-33038号を参照)。 |
|
|
|
10.36# |
|
特許許可協定第1修正案は,日付が2020年1月8日であり,登録者と国立癌研究所との間で署名されている(添付ファイル10.23を参照して登録者に組み込まれた10−K表年次報告書のうち,米国証券取引委員会文書第001−33038号,2020年3月2日に提出)。 |
|
|
|
68
カタログ表
10.37# |
|
特許許可協定第2修正案は、日付が2020年9月28日であり、登録者と国立癌研究所との間で署名される(添付ファイル10.1を参照して登録者に組み込まれた10−Q表四半期報告書のうち、米国証券取引委員会アーカイブ番号000−33038は、2020年11月5日に提出される)。 |
|
|
|
10.38# |
|
特許許可協定第3修正案は,日付が2021年4月16日であり,登録者と国立癌研究所との間で署名されている(添付ファイル10.38を参照して登録者に組み込まれた10−K表年次報告書のうち,米国証券取引委員会文書第001−33038号は,2022年3月30日に提出されている)。 |
|
|
|
10.39# |
|
特許許可協定第4改正案は,日付が2021年5月4日であり,登録者と国立癌研究所との間で署名されている(添付ファイル10.39を参照して登録者に組み込まれた10−K表年次報告書のうち,米国証券取引委員会文書第001−33038号は,2022年3月30日に提出されている)。 |
|
|
|
10.40# |
|
第五改正特許許可協定は、期日が2021年8月13日であり、登録者と国家癌研究所との間で署名される(添付ファイル10.40を参照して登録者の10−K表年次報告書に組み込まれ、米国証券取引委員会文書第001−33038号により、2022年3月30日に提出される)。 |
|
|
|
10.41# |
|
登録者、国立癌研究所とIntrexon社との間で署名された2017年1月9日の共同研究·開発協定(添付ファイル10.1を参照して登録者が現在報告しているタブ8-K米国証券取引委員会文書第001-33038号を参照して、2019年9月26日に提出)。 |
|
|
|
10.42 |
|
“共同研究開発協定第一修正案”は、2018年3月23日に、登録者、国立癌研究所、Intrexon Corporation、Precigen,Inc.(2019年9月26日に提出された登録者を参照して現在8-K米国証券取引委員会文書第001-33038号の添付ファイル10.2を参照して編入されている)。 |
|
|
|
10.43# |
|
国立がん研究所、登録者、Precigen,Inc.が2019年2月1日に署名した“共同研究開発協定第2修正案”(添付ファイル10.3を参照して登録者の現在の報告書に組み込まれているタブ8-K米国証券取引委員会文書第001-33038号は、2019年9月26日に提出される)。 |
|
|
|
10.44 |
|
国立がん研究所と登録者の間で2022年3月15日に署名された“共同研究開発協定第3改正案”(添付ファイル10.44を参照して登録者年次報告表格10-Kに組み込むことにより、米国証券取引委員会アーカイブ第001-33038号、2022年3月30日に提出)。 |
|
|
|
10.45 |
|
国立がん研究所と登録者の間で2022年6月24日に署名された“協力研究開発協定第4修正案”(添付ファイル10.1を参照して登録者に組み込まれた10-Q表四半期報告書には、米国証券取引委員会アーカイブ番号001-33038が、2022年8月15日に提出されている)。 |
|
|
|
10.46 |
|
登録者とテキサス大学システム取締役会代表テキサス大学M.D.アンダーソンがんセンターが締結した2019年10月15日の賃貸契約(2021年3月1日に提出された登録者年次報告書10-K表第001-33038号米国証券取引委員会添付ファイル10.39を参照して編入)。 |
|
|
|
10.47 |
|
登録者とテキサス大学システム取締役会代表テキサス大学M.D.アンダーソンがんセンターが締結した2019年10月15日の賃貸契約の第1改正案(2021年3月1日に提出された登録者10-K表年次報告第001-33038号米国証券取引委員会の添付ファイル10.40を参照して編入)。 |
|
|
|
10.48 |
|
登録者とテキサス大学システム取締役会代表テキサス大学M.D.アンダーソンがんセンターが締結した2019年10月15日の賃貸契約の第2改正案(2021年3月1日に提出された登録者年次報告書10-K表第001-33038号米国証券取引委員会添付ファイル10.41を参照して編入)。 |
|
|
|
10.49 |
|
第三修正案は、期日が2020年12月15日であり、登録者とテキサス大学システム取締役会代表がテキサス大学M.D.アンダーソンがんセンターを代表して署名し、2019年10月15日の賃貸契約を締結した(2021年3月1日に提出された登録者年次報告Form 10-Kを参照して、米国証券取引委員会文書第001-33038号の添付ファイル10.42を参照して編入される)。 |
|
|
|
10.50 |
|
2020年12月15日に登録者とテキサス大学システム取締役会がテキサス大学M.D.アンダーソン癌センターを代表して締結した賃貸契約(2021年3月1日に提出された登録者10−K表年次報告書の添付ファイル10.43を参照することにより、米国証券取引委員会第001−33038号書類に編入される)。 |
|
|
|
10.51 |
|
登録者、水ミル資産管理会社とロバート·W·ボスマとの間で2021年2月4日に署名された協定(添付ファイル10.1を参照して登録者の現在の8−K表報告書に組み込まれ、米国証券取引委員会アーカイブ番号001−33038は、2021年2月5日に提出される)。 |
|
|
|
10.52 |
|
登録者,融資先,行政代理と担保代理であるシリコンバレー銀行によって締結された融資·担保協定は,2021年8月6日である(2021年11月8日に提出された登録者10−Q四半期報告の添付ファイル10.1,米国証券取引委員会アーカイブ第001−33038号を参照)。 |
|
|
|
10.53 |
|
登録者、融資先とシリコンバレー銀行との間の融資及び担保協定第1修正案は、期日が2021年12月28日である(2022年3月30日に提出された登録者年次報告Form 10−Kを参照して、米国証券取引委員会アーカイブ第001−33038号添付ファイル10.52に編入)。 |
|
|
|
10.54 |
|
パイパー·サンドラー社と登録者との間で2022年8月12日に署名された株式分配協定(登録者2022年8月15日に提出された10-Q表四半期報告書の添付ファイル10.2、米国証券取引委員会文書第001-33038号を参照することにより)。 |
|
|
|
69
カタログ表
10.55 |
|
引受契約は、2022年11月29日に、Cantor Fitzgerald&Co.と登録者との間で締結される(登録者の現在の報告書の添付ファイル1.1を参照することによって組み込まれ、米国証券取引委員会アーカイブ番号001-33038は、2022年11月30日に提出される)。 |
|
|
|
23.1* |
|
独立公認会計士事務所の同意. |
|
|
|
24.1* |
|
授権書(本年度報告の10-Kフォーム署名ページを参照). |
|
|
|
31.1* |
|
2002年サバンズ-オキシリー法第302節で可決された“取引法”第13 a-14(A)または15(D)-14(A)条による最高経営責任者の認証。 |
|
|
|
32.1** |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による最高経営責任者と最高財務官の認証。 |
|
|
|
101.INS* |
|
XBRLインスタンスドキュメントを連結する |
|
|
|
101.SCH* |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
101.CAL* |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
|
101.DEF* |
|
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
|
101.LAB* |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
101.PRE* |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
|
104* |
|
表紙相互データファイル-表紙相互データ内蔵XBRL文書または添付ファイル101に含まれる |
|
|
|
* |
|
本局に提出します。 |
|
|
|
** |
|
手紙で提供する。 |
|
|
|
+ |
|
契約または補償計画を管理すること。 |
|
|
|
|
|
アメリカ証券取引委員会は本文書のいくつかの部分を秘密に処理した。 |
|
|
|
# |
|
本文書の部分内容(“から”[***])は省略され、このような情報は実質的な情報ではなく、登録者が個人または機密とみなす情報タイプであるからである。 |
項目16.表格10-Kの概要
ない。
70
カタログ表
標札題材.題材
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、次の署名者が代表して本報告書に署名することを正式に許可した。
|
|
ALAUNOS治療会社 |
|
|
|
|
|
日付:2023年3月7日 |
|
差出人: |
/s/ケビン·S·ボイル |
|
|
|
ケビン·S·ボイル老 |
|
|
|
取締役CEO兼最高経営責任者 |
|
|
|
(首席行政官と首席財務官) |
|
|
|
|
日付:2023年3月7日 |
|
差出人: |
/s/マイケル·Wong |
|
|
|
マイケル·Wong |
|
|
|
総裁副財務長 |
|
|
|
(首席会計主任) |
このような陳述を通じて、私はすべての人が、以下に署名したすべての人が共通して個別に構成され、古いケビン·S·ボイルとマイケル·Wongをその真の合法的な事実代理人と代理人として任命し、十分な代替および再代理の権力を有し、彼または彼女の名義、場所、代替、任意およびすべての身分で、本報告書の任意およびすべての修正に署名し、すべての証拠物およびこれに関連する他の文書と共に証券取引委員会に提出することを知っている。上記の代理弁護士および代理人には、その場所内および周囲で必要または行わなければならない各項目を和として行うために十分な権力および権限が付与され、ここでは、上記の代理弁護士および代理人、またはその代替者、またはその1人または複数の代理人が、作成されたすべての行為および事柄を合法的にまたは手配することができることを承認および確認することができる。
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
サイン |
|
タイトル |
|
日取り |
/s/ケビン·S·ボイル |
|
|
|
|
ケビン·S·ボイル老 |
|
取締役CEO兼最高経営責任者(首席行政官と首席財務官) |
|
March 7, 2023 |
/s/マイケル·Wong |
|
|
|
|
マイケル·Wong |
|
総裁副財務長(首席会計主任) |
|
March 7, 2023 |
クリストファー·ボデン |
|
|
|
|
クリストファー·ボデン |
|
役員.取締役 |
|
March 7, 2023 |
/ジェームズ·Huang |
|
|
|
|
ジェームズ·ハング |
|
役員.取締役 |
|
March 7, 2023 |
/s/ロバート·W·ボスマ |
|
|
|
|
ロバート·W·ボスマ |
|
役員.取締役 |
|
March 7, 2023 |
/s/メアリー·アザミ |
|
|
|
|
メアリー·アザミ |
|
役員.取締役 |
|
March 7, 2023 |
/s/Jaime Vieser |
|
|
|
|
Jaime Vieser |
|
役員.取締役 |
|
March 7, 2023 |
/s/Holger Weis |
|
|
|
|
ホルガー·ウェス |
|
役員.取締役 |
|
March 7, 2023 |
71
カタログ表
ALaunos治療会社は
財務諸表索引
|
|
|
|
|
|
|
ページ |
|
|
独立公認会計士事務所報告( |
|
|
F-1 |
|
2022年12月31日現在と2021年12月31日現在の貸借対照表 |
|
|
F-3 |
|
2022年と2021年12月31日までの年度の業務報告書 |
|
|
F-4 |
|
2022年と2021年12月31日までの年度株主権益変動表 |
|
|
F-5 |
|
2022年12月31日と2021年12月31日までの年間現金フロー表 |
|
|
F-6 |
|
財務諸表付記 |
|
|
F-7 |
|
カタログ表
“独立報告書”公認会計士事務所
アルナオス治療会社の株主と取締役会に
財務諸表のいくつかの見方
ALaunos治療会社とその子会社(当社)の2022年12月31日現在と2021年12月31日までの貸借対照表、同年度までの関連経営報告書、株主権益と現金流量、および財務諸表(総称して財務諸表と呼ぶ)に関する付記を監査した。財務諸表は,すべての重要な面で,会社の2022年12月31日と2021年12月31日までの財務状況と,それまでの年度までの経営成果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。
会社が経営を続ける企業として経営を続ける能力
添付財務諸表の作成は、同社が引き続き経営を継続する企業であると仮定している。財務諸表付記1に記載されているように、当社は設立以来経常的な経営損失が発生しており、追加資本を調達して運営を支援することが求められている。これは同社が経営を続けている会社として経営を続ける能力に大きな疑いを抱かせた。付記1は、これらの事項における経営陣の計画も説明しています。財務諸表には、このような不確実性の結果に起因する可能性のある調整は含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、次の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
臨床試験とその他の研究·開発費用の計上プロジェクト
財務諸表付記3に記載されているように、当社は資産負債表の日までに発生したが、まだ臨床研究機関、臨床研究場所、コンサルタント或いは他のサプライヤーが領収書を発行するコスト推定に基づいて、臨床試験コストとその他の研究開発費用を計算しなければならない。このプロセスは、未締結契約および調達注文を審査することと、実行されたサービスを決定するためにサプライヤーおよび内部スタッフとコミュニケーションすることと、企業に領収書を発行していない場合、または会社に実際のコストを通知していない場合に、実行されたサービスレベルおよびサービスによって生じる関連コストを推定することとを含む。付記6に開示されているように,2022年12月31日現在,同社の臨床試験と臨床前研究費は総額240万ドルである。
臨床試験と他の研究開発費の課税項目は重要な監査事項であると考えられ、監査会社の監査項目は複雑であり、見積もりに必要な情報は複数のソースから蓄積されているため、臨床研究場所と他のサプライヤーの領収書は遅延する可能性があり、あるいは支払いは臨床試験マイルストーンの完成などの要素に依存する可能性がある。さらに、場合によっては、プロバイダが請求書を発行する時間およびモードが、提供されるサービスレベルと一致しない可能性があるので、これを判断する必要がある。
私たちが監査でどのようにこの問題を解決したのか
臨床試験と前臨床研究費用計項目の監査プログラムをテストします
F-1
カタログ表
/s/RSM US LLP
2010年以来、当社の監査役を務めてきました。
ボストン、マサチューセッツ州
March 7, 2023
F-2
カタログ表
ALaos治療会社は
貸借対照表
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
資産: |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
制限現金 |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
使用権資産 |
|
|
|
|
|
|
||
預金.預金 |
|
|
|
|
|
|
||
他の非流動資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
長期債務、流動債務 |
|
|
|
|
|
|
||
費用を計算する |
|
|
|
|
|
|
||
賃貸負債、流動 |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
長期債務 |
|
|
|
|
|
|
||
賃貸負債、非流動 |
|
|
|
|
|
|
||
他の非流動負債 |
|
|
|
|
|
|
||
総負債 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|||
株主権益 |
|
|
|
|
|
|
||
普通株$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこれらの財務諸表の不可分の一部だ。
F-3
カタログ表
ALaos治療会社は
運営説明書
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
12月31日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
|
||
協力収入 |
|
$ |
|
|
$ |
|
||
運営費用: |
|
|
|
|
|
|
||
研究開発 |
|
|
|
|
|
|
||
一般と行政 |
|
|
|
|
|
|
||
契約修正による収益 |
|
|
( |
) |
|
|
|
|
財産と設備および使用権資産の減価 |
|
|
|
|
|
|
||
総運営費 |
|
|
|
|
|
|
||
運営損失 |
|
|
( |
) |
|
|
( |
) |
その他の収入(支出): |
|
|
|
|
|
|
||
利子支出 |
|
|
( |
) |
|
|
( |
) |
その他の収入,純額 |
|
|
|
|
|
( |
) |
|
その他の収入,純額 |
|
|
( |
) |
|
|
( |
) |
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
1株当たりの基本と償却純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
加重平均発行済み普通株式、基本普通株式、希釈後普通株 |
|
|
|
|
|
|
||
付記はこれらの財務諸表の不可分の一部だ。
F-4
カタログ表
ALaos治療会社は
変更に関する声明株主権益
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
普通株 |
|
|
追加実収資本 |
|
|
赤字を累計する |
|
|
株主権益総額 |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
|
|
|
|
|
|
|
|
|||||
2020年12月31日残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
従業員株式オプションの行使 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
普通株発行 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
制限株奨励 |
|
|
|
|
|
|
|
|
( |
) |
|
|
— |
|
|
|
— |
|
||
ログアウト制限普通株 |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
株式承認証を発行する |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2021年12月31日の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
制限株奨励 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
ログアウト制限普通株 |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
従業員株式オプションの行使 |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
普通株買い戻し |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
普通株を発行して費用を差し引く |
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
2022年12月31日の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
付記はこれらの財務諸表の不可分の一部だ。
F-5
カタログ表
ALaos治療会社は
の声明ですキャッシュフロー
(単位:千)
|
|
12月31日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
経営活動のキャッシュフロー: |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
||
減価償却 |
|
|
|
|
|
|
||
財産と設備および使用権資産の減価 |
|
|
|
|
|
|
||
融資コストの償却 |
|
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
|
||
使用権資産帳簿額が減少する |
|
|
|
|
|
( |
) |
|
契約修正による収益 |
|
|
( |
) |
|
|
|
|
設備販売損失 |
|
|
|
|
|
|
||
(増加)減少: |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
他の非流動資産 |
|
|
|
|
|
|
||
増加(減少): |
|
|
|
|
|
|
||
売掛金 |
|
|
( |
) |
|
|
|
|
費用を計算する |
|
|
( |
) |
|
|
( |
) |
賃貸負債 |
|
|
( |
) |
|
|
|
|
他の非流動負債 |
|
|
|
|
|
|
||
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
財産と設備を売却して得た収益 |
|
|
|
|
|
|
||
投資活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
||
長期債務借款収益 |
|
|
|
|
|
|
||
起債コスト |
|
|
|
|
|
( |
) |
|
株式オプションを行使して得られる収益 |
|
|
|
|
|
|
||
普通株発行の収益 |
|
|
|
|
|
|
||
普通株買い戻し |
|
|
( |
) |
|
|
|
|
長期債務を償還する |
|
|
( |
) |
|
|
|
|
融資活動が提供する現金純額 |
|
|
|
|
|
|
||
現金、現金等価物、および限定的な現金純減少 |
|
|
( |
) |
|
|
( |
) |
期初現金、現金等価物、および限定現金 |
|
|
|
|
|
|
||
現金、現金等価物、制限された現金、期末 |
|
$ |
|
|
$ |
|
||
キャッシュフロー情報の追加開示: |
|
|
|
|
|
|
||
利子を支払う現金 |
|
$ |
|
|
$ |
|
||
財産及び設備に関する未払い費用及び売掛金に含まれる額 |
|
$ |
|
|
$ |
|
||
付記はこれらの財務諸表の不可分の一部だ。
F-6
カタログ表
ALaunos治療会社は
財務諸表付記
ALaunos治療会社は臨床段階の腫瘍学に集中する細胞治療会社であり、臨床需要を満たしていない大型癌患者群中の多種の固形腫瘍タイプを治療するために、TCR療法を開発した。2022年1月25日、同社はその会社名をZIOPHARM Oncology,Inc.からALaunos Treateutics,Inc.に変更した。同社は独自の非ウイルスを利用している寝美人遺伝子転移プラットフォーム及びその新型癌突然変異ホットスポットTCRライブラリーを設計し、重要な発癌遺伝子によく見られる腫瘍関連突然変異による新しい抗原に対する個性化細胞療法を設計と製造するKRAS,TP 53そしてEGFR。
これまで、同社の業務は主に研究と開発を行い、資金を集めてこれらの努力に資金を提供してきた。2021年5月、同社は再発性多形性神経膠芽腫の治療のためのその既存の制御されたIL-12臨床計画を段階的に終了することを発表した。その会社はその計画のためのパートナーを探し続けるだろう。
会社の改訂と再記載された会社登録証明書はその発行を許可する
添付財務諸表は持続経営を基礎として作成され、正常業務過程における資産の現金化及び負債の返済及び負担を考慮する。当社は会計基準編纂またはASCテーマ205-40の指導に従い、財務諸表の列報−継続経営−財務諸表発表日から1年以内に継続経営企業として経営を継続する能力に重大な疑いがあるかどうかを決定する。この評価は,当初,財務諸表発行日までに十分に実行されていなかった経営陣計画の潜在的緩和効果を考慮していなかった。重大な疑いがある場合、経営陣は、その計画の緩和効果が、会社の持続経営企業としての持続経営能力に対する重大な疑いを緩和するのに十分であるかどうかを評価する。しかし、経営陣計画の緩和効果は、(I)計画が財務諸表発表日から1年以内に有効に実施される可能性が高い場合、(Ii)計画は実施時に関連条件やイベントを緩和する可能性が高く、これらの条件や事件は、実体が財務諸表発表日から1年以内に経営を継続する能力に大きな疑いを抱かせることが考えられる。
同社は2003年の設立以来赤字状態が続いており、恒常的な運営収入はない。同社は、予見可能な未来には赤字が続くと予想している。2022年12月31日までに同社は
現在の現金予測と、当社は既存資源が枯渇した後に追加融資を受けてその運営に資金を提供する能力(この点は確定できない)に依存しており、経営陣は、当社の現在の資本資源はその計画の運営に資金を提供するのに十分ではなく、財務諸表が発表された日から少なくとも1年以内に、会社が経営を継続する企業として経営を継続する能力に大きな疑問がある。現金資源に対するこの予測は前向き情報であり、リスクと不確定要素に関連し、実際の支出金額は多種の要素によって重大な悪影響を与える可能性がある。
F-7
カタログ表
ALaunos治療会社は
財務諸表付記
2021年ローンと保証契約
2021年8月6日、当社はシリコンバレー銀行およびその付属会社(または総称してSVBと呼ぶ)と融資および担保協定、または融資および担保協定を締結した。“融資·担保協定”に規定されている初期定期融資は#ドルである
当社は2021年12月28日から融資·担保協定第1改正案を締結した。改正された“融資·担保協定”を改正された“融資·担保協定”と呼ぶ。
改正された融資·担保協定は、利息期限のみを2022年8月31日まで延長する。当社は2022年8月31日までに改訂融資および担保協定で指定されたいくつかのマイルストーンを達成できなかったため、利息期限だけで2022年8月31日以降に延期されていない。改正された融資と担保契約は期限B部分も廃止され、この部分はまだ資金を得ておらず、期限A部分、すなわちSVBローンしか残っていない。改訂された融資と保証協定によると、SVBローンは2023年8月1日に満期になる。
付記4を参照してください借金を抱えさらに“融資·担保協定”および改正された“融資·担保協定”について議論する。
2022年株式分配協定
2022年8月12日、当社はPiper Sandler&Co.またはPiper Sandlerと株式分配協定を締結し、この合意により、当社は随時適宜普通株株式を発売することができ、総発行価格は最高$に達する
2022年公募株
2022年11月29日、当社は唯一の引受業者であるCantor Fitzgerald&Co.あるいは引受業者と引受契約または引受契約を締結し、パッケージ販売または発行での発行および販売に関する
同社の純収益を$として発売されたのは初めてです
引受契約の条項に基づいて,当社は引受業者に一つの選択権を付与し,行使することができる
今回発売されたすべての株式は当社が販売しております
陳述の基礎
添付の財務諸表は米国公認会計原則または米国公認会計原則に基づいて作成された。
予算の使用
米国公認会計原則に基づいて財務諸表を作成し、財務諸表日の資産及び負債額及び又は有資産及び負債の開示、並びに報告期間内の収入及び支出の報告金額に影響を与えるために、管理層に推定及び仮定を行うことを要求する。同社はこれらの推定を定期的に評価しているにもかかわらず、実際の結果はこれらの推定とは異なる可能性がある。推定された変化は、それらが知られている期間に記録される。
F-8
カタログ表
ALaunos治療会社は
財務諸表付記
同社が財務諸表を作成する際に使用する最も重要な見積もりと判断は、
後続事件
会社は貸借対照表日から今年度報告10-K表日までのすべてのイベントと取引を評価した。その会社はその財務諸表や開示に影響を与える重大な後続事件を持っていない。
現金と現金等価物
現金等価物には主に普通預金口座、預金証書と短期アメリカ国債通貨市場共同基金の預金が含まれる。現金等価物はコスト別に列報され、公平な市価に近い。
信用リスクの集中度
会社を集中的な信用リスクに直面させる可能性のある金融商品には、主に現金と現金等価物が含まれる。当社は商業銀行に現金口座を開設しており、連邦保険の限度額を超える場合があります。当社はこのような勘定で何の損失も出ていません。同社は、現金や現金等価物に重大な信用リスクに直面しないとしている。
財産と設備
財産と設備はコストから減価償却累計と償却を差し引く。メンテナンス·メンテナンスの支出は費用を記入し、重大な改善の費用は資本化に記入する。減価償却および償却は、資産の推定使用年数を表す期間を直線的に計算する
● |
|
オフィス及びコンピュータ装置 |
|
|
● |
|
ソフトウェア |
|
|
● |
|
実験室装置 |
|
|
● |
|
賃借権改善 |
|
コストには,建設中資産に関する何らかの設計,建造,設置コストが含まれており,その期待用途に備えており,建設工事として入金され,対象資産が投入されるまで減価償却は行われていない.未延長資産寿命のメンテナンス·メンテナンスは、発生時に費用を計上する。これらの資産を売却、廃棄、または他の方法で処分する場合、コストおよび関連する減価償却はそれぞれの口座から差し引かれ、処置された任意の収益または損失は営業報告書に計上される。
長寿資産
トリガイベントの発生や状況変化が資産の帳簿金額が回収できない可能性があることを示すたびに、長期資産の評価およびそのような長期資産の残存利用可能年数について減値評価を行う。1つまたは1つの資産のセットによって予想される未割引推定純現金流量がその帳簿価値よりも少ない場合、資産は減値とみなされる。確認減値とは、資産使用に関連する予想される将来の現金流量に基づく現在値である減価資産または一組の資産の公正な市場価値を超える金額である。
細分化市場を運営する
経営部門は企業の構成要素として決定され、会社の首席運営決定者は、資源配分に関する意思決定及び業績評価を行う際に、これらの部門に関する単独の離散財務情報を得て評価することができる。同社は、ある運営部門でその運営を確認し、その業務を管理している。
株式承認証
F-9
カタログ表
ALaunos治療会社は
財務諸表付記
当社は発行された引受権証が派生ツールとして入金される必要があるかどうかを評価します。会社は株式承認証(1)会社自身の株式にリンクすること、(2)財務会計基準委員会(FASB,ASCテーマ815)に基づいて株主権益に分類することを決定した派生ツールおよびヘッジそれは.そのため、当社は株式証明書が例外範囲に適合していると考え、このツールが派生商品として会計処理を行う必要があるかどうかを確定し、株主権益に分類すべきである。
公正価値計量
当社には公正価値記録された金融資産および負債がいくつかあり、公正価値計量会計基準に記載されている公正価値階層では1、2または3級に分類されている。
2022年12月31日と2021年12月31日まで、公正価値に応じて経常的および非日常的に計量された資産と負債は以下のとおりである
(千ドル) |
|
|
|
|
報告日の公正価値計量使用 |
|
||||||||||
説明する |
|
締め切りの残高 |
|
|
見積もりはありますか |
|
|
意味が重大である |
|
|
意味が重大である |
|
||||
現金等価物 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
||
(千ドル) |
|
|
|
|
報告日の公正価値計量使用 |
|
||||||||||
説明する |
|
締め切りの残高 |
|
|
見積もりはありますか |
|
|
意味が重大である |
|
|
意味が重大である |
|
||||
現金等価物 |
|
$ |
|
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
||
現金等価物は当座預金口座と米国短期国庫通貨市場共同基金の預金であり、活発な市場で見積され、1級資産に分類される。2022年12月31日および2021年12月31日までの年間で,推定方法に変動はなかった。会社は2022年12月31日と2021年12月31日までの年間で、2級または3級の金融資産または負債に分類されていない。
非金融商品の公正価値
当社は、イベントや環境変化が減値指標の存在を示すたびに、その資産の減値を評価する。この等評価では、当社は、各資産(または資産群)によって生成された将来の未割引現金流量と、資産(または資産群)の帳簿価値とを比較して、減価費用が必要か否かを判定する。キャッシュフローテストに失敗した場合、当社は、減値を決定するために、資産(または資産グループ)の公正価値を推定する。
2021年、会社が戦略再編とさらなるコスト削減を行った後、会社はボストン事務所の予想用途の変化が減値指標であり、減値費用が#ドルとなると判断した
連携プロトコルからの収入確認
2022年12月31日までの年間収入には
F-10
カタログ表
ALaunos治療会社は
財務諸表付記
同社は主に戦略パートナーと候補製品の開発と商業化について協力することで収入を得ている。当社はASC 606に基づいて収入を確認し、顧客と契約を結ぶ収入、またはASC 606。ASC 606のコア原則は、エンティティは、約束された商品および/またはサービスを顧客に譲渡する金額を記述するために収入を確認すべきであり、その金額は、これらの商品および/またはサービスと交換するために、エンティティが獲得する権利が予想される対価格を反映すべきである。会社がASC 606の範囲内で手配して確認すべき適切な収入額を決定するために、会社は、(I)顧客との契約を決定するステップ、(Ii)契約における履行義務を決定するステップ、(Iii)取引価格を決定するステップ、(Iv)契約に取引価格を割り当てる履行義務、および(V)各履行義務を履行する際に収入を確認するステップを実行する。
同社は、ASC 606の範囲内のいくつかの会社の許可または協力協定に基づいて、協力収入を確認する。同社と顧客との契約には、一般に、知的財産権許可、研究および開発サービス、および追加商品および/またはサービスの購入の選択権に関する約束が含まれる。当社の知的財産権許可が手配中に決定された他の履行義務とは異なると判定された場合、当社は、許可が被許可者に譲渡され、被許可者が許可を使用して利益を得ることができるときに許可に割り当てられた払戻不可能な前払い費用の収入を確認する。他の約束とバンドルされたライセンスの場合、会社は、合併履行義務が時間の経過とともに履行されるか、ある時点で履行されるかを決定するために、合併履行義務の性質を評価する判断を利用し、時間が経過するにつれて、払い戻し不可能な前払い費用からの収入を確認するために、進行を測定する適切な方法を決定する。
追加の貨物および/またはサービスを取得するオプションを含む契約は、契約を締結することなく得られない実質的な権利が顧客に提供されたかどうかを決定するために評価される。もしそうであれば,そのオプションは単独の履行義務として入金される.そうでなければ、このオプションはマーケティングオファーとみなされ、顧客が選択した後に個別の契約として計算される。
企業と顧客との合意条項は、一般に、(I)払戻不可能な前払い、(Ii)開発、規制、および商業マイルストーン支払い、(Iii)将来の選択および(Iv)特許製品の純売上の特許権使用料のうちの1つまたは複数を含む。したがって、取引価格には、通常、契約開始時に満了する固定料金と、特定のイベントが完了したときに支払われるマイルストーン支払い形式の可変対価格と、顧客が特許製品の純売上高を確認する際に得られる階層的特許権使用料とが含まれる。同社は、約束された貨物および/またはサービスを顧客に譲渡するために、その予想される対価格金額に基づいて取引価格を測定する。当社は可能金額法を用いて可変対価金額を推定し、その獲得権のある対価金額を予測する。可変対価格額は取引価格に計上され,可変対価格に関する不確実性がその後解決されれば,確認された累積収入が大きく逆転しない可能性が高い。開発と規制マイルストーン支払いを含む各手配の開始時に、会社は、関連イベントが実現可能であると考えられているかどうかを評価し、可能な金額法を用いて取引価格に含まれる金額を推定する。トリガイベントが発生する前に、規制部門の承認を受けた支払いに依存するような当社または被許可者の制御範囲内でのマイルストーン支払いは、実現可能であるとはみなされない。各報告期間の終了時に、会社は各マイルストーンの実現確率と任意の関連制限を再評価し、必要であれば、, 全体の取引価格の見積もりを調整する。いずれの調整も累積追跡原則で入金されており、これは調整期間中の収入と純損失に影響する。販売ベースの特許使用料を含む手配については、一定レベルの製品販売を達成することに基づくマイルストーン支払いを含む場合、当社は、以下の遅いときに収入を確認する:(I)関連販売が発生した場合、または(Ii)支払いの一部または全部によって割り当てられた履行義務が履行された(または部分的に履行されている)場合。オプション商品および(または)サービスの対価格は、契約開始時の取引価格には含まれない。
当社は、相対的に独立した販売価格に基づいて、契約で決定された個々の履行義務に取引価格を割り当てる。しかしながら、可変対価格のいくつかの部分は、以下の2つの基準が満たされる限り、契約内の1つまたは複数の特定の履行義務に特化したものであり、(1)支払い条件は、具体的には、履行義務または独自の貨物またはサービスの譲渡の努力に関連し、(2)可変対価格を履行義務または固有の貨物またはサービスに完全に割り当てることが標準的な分配目標を満たし、したがって、割り当てられた金額は、譲渡承諾された貨物またはサービスと交換するために、エンティティが獲得する権利が予想される対価格金額を記述する。同社が作成した仮説は、契約ごとに決定された契約義務ごとの独立販売価格を決定するために判断を使用することを要求している。契約義務ごとの独立販売価格を決定する際に用いるキー仮説には,収入予測,開発スケジュール,推定された研究開発コスト,割引率,行使の可能性,技術と規制成功の可能性がある可能性がある。
収入.収入確認は、約束された貨物および/またはサービスを顧客に譲渡して義務を履行する場合、または義務を履行する際にそれぞれに割り当てられた取引価格の金額に基づいて確認される。長期的に履行された業績義務について、会社は業績義務を完全に履行する進捗状況を測定することで収入を確認する
F-11
カタログ表
ALaunos治療会社は
財務諸表付記
使用進行度を測定する単一の方法であって、関連商品および/またはサービスの制御権を顧客に転送するパフォーマンスを記述する。会社は入力方法を用いて一定期間義務を完全に履行する進捗状況を測定した。当社は報告期間ごとに進捗指標を評価し、必要に応じて業績指標と関連収入確認を調整します。いずれの調整も累積追跡原則で入金されており、これは調整期間中の収入と純損失に影響する。
研究開発コスト
会社の財務諸表作成過程の一部として、会社は研究や開発費用を見積もる必要がある。このプロセスは、未締結契約および調達注文を審査することを含み、担当者は、会社を代表して実行されたサービスを決定し、実際のコストが会社に発行されていない場合、または他の方法で実際のコストを通知していない場合に、実行されるサービスレベルおよびサービスによって生じる関連コストを推定することを含む。会社のほとんどのサービスプロバイダは、所定のスケジュールに従って、または契約マイルストーンに達したときに、延滞サービスの請求書を会社に発行するが、少数のサービスプロバイダは前払い金を必要とする。当社は、その当時知られている事実と状況に基づいて、その財務諸表において、貸借対照表毎の日付までの計上費用を推定する。計算すべき研究および開発費用の推定例には、以下の者に支払われる費用が含まれる
同社は,それを代表して臨床試験を行って管理しているCROとのオファーと契約に基づいて,受信したサービスや費用の見積もりに基づいて,臨床前研究や臨床試験に関する費用を計算している。これらの合意の財務条項は交渉が必要であり、契約によって異なり、支払いの不均衡を招く可能性がある。場合によっては、会社のサプライヤーに支払われるお金は、提供されたサービスレベルを超え、それによって臨床費用の前払いをもたらす可能性がある。その中のいくつかの契約下の支払いは臨床試験マイルストーンの完成などの要素に依存する。サービス料を計算する際には,サービスを提供する時間帯,患者登録人数,活性化されたサイト数,および期間ごとにかかる努力度を見積もる。実際にサービスを実行する時間または努力の程度がその推定と異なる場合、会社は、それに応じて前払い費用の計算すべき金額または金額を調整する。当社は、実際に発生した金額と実質的に差がないと予想しているが、提供されたサービスの実際の状態および時間に対する提供サービスの状態および時間の理解が異なる可能性があり、その報告された金額が任意の特定の時期に高すぎたり、低すぎたりする可能性がある。これまで、同社は研究や開発費用の先行見積もりにどのような重大な調整も行っていない。
所得税
所得税は負債法で計算される。繰延税金資産と負債は、財務諸表の帳簿額面とそのそれぞれの税額との間の一時的な差異による将来の税務結果を推定することについて確認した。繰延税項資産および負債は制定税率計量を採用し,回収または一時的な差額の決済が予想される年度の課税所得額に適用される予定である。当社はその繰延税金資産の現金化能力を評価し、すべてまたは一部の繰延税金資産が現金化できない可能性が高い場合には、評価準備を設定する。
同社は“より可能性のある”敷居を用いて不確定な税務状況を確認·解決し、不確定な税務状況を会計処理する。不確定税務状況の評価は、税法の変化、納税申告書に採用されたまたは予想される税収状況の測定、監査すべき事項の効果的な解決、新しい監査活動、および税収状況に関連する事実または状況の変化を含むが、これらに限定されない様々な要素に基づく。当社は毎年この税務状況を評価しています。当社はまた、所得税支出のうち税収割引に関する潜在的な利息と罰金を計上しなければならない(付記12参照所得税).
株式報酬の会計計算
株式に基づく報酬コストは,付与日に報酬の推定公正価値をもとに計量し,従業員に必要なサービス期間の費用を確認した。株式ベースの報酬支出は、最終的に付与される見込みの報酬数に基づいており、没収が発生した場合に減少する。数年前と同様に、会社は、オプション保有者がオプションを行使する前にオプションの予想期限を保留することと、予想期間内の会社普通株価格の推定変動性とを推定する必要があるBlack-Scholesオプション定価モデルを使用する。
F-12
カタログ表
ALaunos治療会社は
財務諸表付記
同社は、2022年12月31日と2021年12月31日までの年度運営報告書で、株式に基づく従業員報酬計画のすべての影響を確認しており、このようなコストは貸借対照表に計上されていない。同社は$を確認した
|
|
十二月三十一日までの年度 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
研究開発 |
|
|
|
|
|
|
||
一般と行政 |
|
|
|
|
|
|
||
株に基づく報酬費用 |
|
$ |
|
|
$ |
|
||
各株式オプションの公正価値は、付与された日にブラック·スコアーズオプション定価モデルを用いて推定される。2022年12月31日までに,従業員に付与された株式オプションの推定加重平均公正価値は約$である
|
|
十二月三十一日までの年度 |
||
|
|
2022 |
|
2021 |
無リスク金利 |
|
|
||
所期寿命 |
|
|
||
予想変動率 |
|
|
||
期待配当収益率 |
|
—% |
|
—% |
1株当たり純損失
普通株1株当たりの基本純損失の計算方法は、普通株株主に適用される純損失を当期発行普通株の加重平均株式数で割る。1株当たり純損失は、期内に発行された普通株の加重平均に基づいて、未償還オプションと引受権証の償却効果を加えて、在庫株方法と会社普通株の適用期間中の平均市価を用いて計算され、1株当たりの純損失に対する影響が反償却されない限り、計算される。1株当たりの普通株式償却純損失の計算の影響は、株式オプション、非帰属制限株、および引受権証を転換することによって生じる任意の潜在的に発行可能な普通株株式に対して逆償却であるため、計算から除外されている。
1株当たりの基本純損失と償却純損失の計算方法は以下のとおりである
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
加重平均発行済み普通株式、基本普通株式、希釈後普通株 |
|
|
|
|
|
|
||
1株当たり基本と希釈して純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
|
|
|
|
|
|
||
当社が一部発行した普通株式オプション、未帰属制限株および株式承認証に関するいくつかの株式は、2022年12月31日および2021年12月31日までの年度の1株当たり償却損失には計上されておらず、逆償却の結果となるからである
F-13
カタログ表
ALaunos治療会社は
財務諸表付記
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
普通株式オプション |
|
|
|
|
|
|
||
誘導性株式オプション |
|
|
|
|
|
|
||
無帰属制限株 |
|
|
|
|
|
|
||
株式承認証 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
新会計公告
2021年11月、FASBは、会計基準の更新、またはASU、2021-10、政府援助(テーマ832):企業エンティティの政府援助に関する開示を発表し、企業エンティティには、彼らが獲得したいくつかの政府援助に関する情報の開示が要求される。エンティティが(1)入金モードまたは(2)贈与モードに基づいて政府エンティティとの取引を類推的に計算する場合、それらは新たな開示要求を遵守しなければならない。本基準は2022年1月1日から施行され、採用後は実質的な影響を与えない。
2021年7月、FASBは、指数またはレートに依存しない可変賃貸報酬のレンタルを経営的賃貸として分類することを要求する賃貸者-いくつかのレンタル報酬可変レンタルを提供するASU 2021-05を発表し、別の分類(すなわち、販売型または直接融資)が開始日(“初日”)販売損失をもたらす可能性がある。本基準は2022年1月1日から施行され、採用後は実質的な影響を与えない。
2021年5月、FASBは、ASU 2021-04、1株当たり収益(主題260)、債務修正および補償(主題470-50)、補償-株式補償(主題718)、およびエンティティ自身の株式のデリバティブおよびヘッジ契約(主題815-40):権利証修正、修正または交換後に株式分類を維持する独立株式分類書面コールオプション(例えば、権利証)のいくつかの修正または交換に対する発行者の会計処理を明らかにした。本基準は2022年1月1日から施行され、採用後は実質的な影響を与えない。
4.債務
当社の債務の帳簿価値は以下のとおりである
|
|
十二月三十一日 |
|
|||||
(千ドル) |
|
2022 |
|
|
2021 |
|
||
融資と保証協定 |
|
$ |
|
|
$ |
|
||
融資と保証契約の未償却割引 |
|
|
( |
) |
|
|
( |
) |
債務総額 |
|
|
|
|
|
|
||
差し引く:長期債務、現在 |
|
|
( |
) |
|
|
( |
) |
長期債務 |
|
$ |
|
|
$ |
|
||
2021年8月6日、当社は“融資と担保協定”を締結した。“融資·担保協定”に規定されている初期定期融資は#ドルである
改訂されたローンと担保協定の条項によると、改訂されたローンと担保ローンはすでに改訂され、まだ資金がない追加の2,500万元の部分を廃止し、最初の2,500万元だけをローンと抵当ローンメカニズム下の全数金として残す
改正された融資及び担保協定の下のすべての未済債務は
F-14
カタログ表
ALaunos治療会社は
財務諸表付記
2022年8月31日までに改訂された融資と保証協定が示したいくつかのマイルストーンに到達できなかったため、当社は当時返済されていなかったSVBローンの元金総額の半分を担保にしなければならず、それに等しい
融資および担保契約の締結については、当社は(I)を購入するためにSVBに引受権証を発行する
改訂された融資及び担保協定の締結については、当社はSVBへの引受権証を改訂及び再記載する。改訂と再確認を経て、株式証明書の有効期限は最高で達することができる
“融資·担保協定”の発行費用は、改訂された“融資·担保協定”を含め、約#ドルである
改正された融資と保証協定は2022年12月31日までの公正価値がその額面に近い。
財産と設備の純額は以下の各項目からなる
|
|
十二月三十一日 |
|
|||||
(千ドル) |
|
2022 |
|
|
2021 |
|
||
オフィス及びコンピュータ装置 |
|
$ |
|
|
$ |
|
||
ソフトウェア |
|
|
|
|
|
|
||
賃借権改善 |
|
|
|
|
|
|
||
実験室装置 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減算:減価償却累計 |
|
|
( |
) |
|
|
( |
) |
財産と設備、純額 |
|
$ |
|
|
$ |
|
||
2022年12月31日までの年間減価償却費用は
計算すべき費用には以下が含まれている
(千ドル) |
|
2022 |
|
|
2021 |
|
||
臨床.臨床 |
|
$ |
|
|
$ |
|
||
従業員報酬 |
|
|
|
|
|
|
||
専門サービス |
|
|
|
|
|
|
||
臨床前サービス |
|
|
|
|
|
|
||
製造業サービス業 |
|
|
|
|
|
|
||
その他の問い合わせサービス |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
F-15
カタログ表
ALaunos治療会社は
財務諸表付記
Vineti Inc.と連携する.
2020年7月9日、会社はVineti,Inc.またはVinetiとプライマリサービス契約および作業説明書を締結した。プロトコルによると、Vinetiは、会社T細胞療法(TCR-T)臨床プロジェクトの注文、細胞収集および製造プロセスを調整および調整するためのソフトウェアプラットフォームを開発している。2019年6月に会社役員となり、2021年11月2日に辞任し、2021年2月25日に会社臨時最高経営責任者に任命され、2021年8月30日に辞任したハイジ·ハーゲンはVinetiの共同創業者と元幹部である。2022年12月31日までの年間で、当社は
水ミル和解協議
2021年2月4日、当社は水ミル資産管理会社とロバート·W·ボスマまたは水ミルの双方と合意または和解協定を締結した。和解協議に基づき、当社は取締役会数を8名から9名に増やし、新たに設立された役員ポストをポスターマさんに委任します。
和解合意に基づき、会社は最大#ドルまでの費用を水ミル各方面に返済することに同意した
TriArm Treateutics/Eden Biocellと合弁企業を設立
2018年12月18日、会社はTriArm Treateutics、Ltd.またはTriArmとEden Biocell、Ltd.またはEden Biocellを設立し、合弁企業として会社をリードした寝美人産生されたCAR-T療法は人民Republic of China(マカオと香港を含む)、台湾と韓国にある。会社はエデン生物に第3世代中国の権利を与えた寝美人−CD 19抗原に対するCAR-T療法。Eden Biocellは当社とTriArmが二分して持ち、双方が意思決定権を共有している。TriArmは$を貢献した
エデン生物細胞は2022年12月31日と2021年12月31日までの年間純損失を計上しており,会社は引き続きその運営に資金を提供することを約束していない。TriArmとALaunosは2021年9月、Eden Biocell合弁企業の解散に共同で同意した。合弁協定は終了し、エデン生物細胞実体は解散している。付記15を参照してください合弁企業より詳細な情報を知るために。
賃貸借契約を経営する
2012年6月、当社はマサチューセッツ州ボストンにあるオフィスの総賃貸契約を締結し、#年満期を予定していました
2019年3月12日、当社はテキサス州ヒューストンMD Andersonにあるオフィスと実験室空間について賃貸契約を締結し、レンタル方式は
F-16
カタログ表
ALaunos治療会社は
財務諸表付記
はい平均毎月のレンタル料は約$
2020年12月15日、当社はMD Andersonと2つ目の合意を締結し、MD Andersonパークの追加スペース(“2020賃貸借契約”)をレンタルした。同社は最初に約#ドルのレンタル料を支払う必要がありました
2022年4月、会社は2020年の賃貸契約を修正し、会社のレンタルスペースを
レンタル料金の構成は以下のとおりである
|
|
十二月三十一日までの年度 |
|
|||||
(千ドル) |
|
2022 |
|
|
2021 |
|
||
リースコストを経営する |
|
$ |
|
|
$ |
|
||
総賃貸コスト |
|
$ |
|
|
$ |
|
||
加重平均残存賃貸年限(年) |
|
|
|
|
|
|
||
加重平均割引率 |
|
|
% |
|
|
% |
||
その会社は$を支払った
2022年12月31日現在、当社の具体的な数字は以下の通り(千計)
賃貸負債満期日 |
|
|
|
|
賃貸借契約を経営する |
|
|
2023 |
|
|
|
|
|
|
|
2024 |
|
|
|
|
|
|
|
2025 |
|
|
|
|
|
|
|
2026 |
|
|
|
|
|
|
|
2027 |
|
|
|
|
|
|
|
その後… |
|
|
|
|
|
||
賃貸支払総額 |
|
|
|
|
|
|
|
差し引く:推定利息 |
|
|
|
|
|
( |
) |
賃貸支払いの現在価値 |
|
|
|
|
$ |
|
|
2022年6月に当社は転貸協定に調印した
PGEN治療会社と独占許可合意に達しました
同社は、2018年10月5日、PGEN治療会社またはPrecigen Inc.の完全子会社PGENまたはPrecigen(前身はIntrexon Corporation)と独占ライセンス契約またはライセンス契約を締結した。“によると
F-17
カタログ表
ALaunos治療会社は
財務諸表付記
ライセンス契約によると、会社は、(I)癌治療のための新しい抗原のTCR製品、(Ii)PrecigenのRheoSwitch遺伝子スイッチまたはRTSを用いた癌治療製品、IL-12製品、および(Iii)(A)癌治療用CD 19、CD 19製品、および(B)癌治療用BCMAを有し、我々、PrecigenおよびARES Trading S.A.(Merck KGaAの子会社)との間で2015年3月27日に発効した許可·協力協定に基づいて、これらの目標を追求する義務がある。PrecigenからPGENに割り当てられる.ライセンス契約によると、会社はまた、以下の内容に関連するいくつかの特許のグローバル独占権利を有している寝美人癌治療のための新しい抗原と抗原を共有するTCR製品を研究、開発、商業化し、TCR製品と呼ばれる。
同社は独自にがん治療の独占ライセンス製品のすべての研究·開発·商業化を担当している。同社はライセンス契約の規定に従って、ビジネス上の合理的な努力を用いてIL-12製品、CD 19製品、TCR製品を開発と商業化しなければならない。
PGENが付与したライセンスとその他の権利を考慮して,会社はPGENに毎年#ドルのライセンス料を支払う
同社は記念碑的な支払いを支払い、総額は追加の$に達します
PGENはPGEN自動車製品を販売する純売上高ごとに低桁から中桁までの特許権使用料を会社に支払い,最高特許使用料金額は$とする
2020年10月,当社はある材料の譲渡に関する許可協定改正案と,PGENがIL−12製品に関する移行援助を提供する義務を締結した。
ライセンス契約と2015年研究開発協定−テキサス大学MDアンダーソンがんセンター
開ける
2015年8月17日、当社、Precigen、MD Andersonは、MD AndersonがMD Andersonライセンスの条項に基づいていくつかの既存の研究プロジェクトと関連技術権利の範囲とプロセスを譲渡すること、および将来の協力研究と開発が新たかつ進行中の研究プロジェクトの条項および条件を正式に決定するために、2015年の研究開発協定を締結した。Precigenが二零一零年九月十九日に締結した2015年研究開発協定第四改正案(“第四修正案”)は、Precigenを二零一五年研究開発協定項下の権利及び義務を当社に譲渡し、発効日は2018年10月5日である。2015年の研究開発協定項目の下の活動は、当社の2人のメンバーとMD Andersonの1人のメンバーからなる共同指導委員会によって指導された。
MD Andersonライセンスの規定によると、会社は2015年の研究開発協定下の研究計画を支援する研究·開発活動に3年間資金を提供し、金額は$以上である
MD Anderson許可の有効期限は(A)MD Anderson許可によるすべての特許が満了したときまたは(B)MD Anderson許可の日の最後の発生時に満了するが,MD Andersonの期限が満了した後であることが条件である
F-18
カタログ表
ALaunos治療会社は
財務諸表付記
許可後、会社とPrecigenは、その項で許可された知的財産権を使用するために、全額支払い、印税免除、永久的、取消不能、再許可可能な許可を有することになる。MD Anderson許可の日から10年後、90日間の治療期間内に、MD AndersonはMD Anderson許可を非独占許可に転換する権利があり、会社とPrecigenが商業的に合理的な努力をしていなければ、ケースベースで許可された知的財産権を商業化する。MD Andersonライセンスの日から5年後、180日の治療期間内に、MD Andersonは、会社およびPrecigenがこのような融資契約または契約における職務調査要件を満たさなかった場合(場合によっては)政府によって援助されたまたは第三者契約によって拘束された特定の技術とのMD Andersonライセンスを終了する権利があるであろう。MD Andersonはまた、会社とPrecigenの重大な違約時に書面通知を出して合意を終了することができ、その違約がこのような通知を受けてから60日以内に是正されなければならない。また、MD Andersonライセンスは、当社とPrecigenで何らかの倒産事件が発生した場合に終了し、当社、PGEN、MD Andersonの双方の書面合意で終了することができます。
2019年の研究開発協定-テキサス大学MDアンダーソンがんセンター
2019年の研究開発協定によると、同社とMD Andersonは協力して会社のTCRライブラリを拡大し、臨床試験などのプロジェクトを行う。2019年の研究開発協定項目の下の活動は、当社の2人のメンバーとMD Andersonのメンバーの1人からなる共同指導委員会が指導します。
当社は2019年の研究開発プロトコルに従って開発されたすべての発明と知的財産権を有し、当社は2019年の研究開発プロトコルに従って非ウイルス遺伝子転移技術を用いて生産された腫瘍学製品のすべての権利を保持し、特許の出願が可能か否かにかかわらず、当社の寝美人技術同社はすでにMD Andersonにこのような知的財産権の独占許可を付与しており,ウイルス遺伝子転移技術を用いて製造された自己TCR製品,および腫瘍学分野以外の任意の製品の開発と商業化を許可し,ウイルスに基づく技術を用いて製造された同種異体TCR製品の非独占許可を付与している。
2019年の研究開発協定によると、同社は2021年1月1日からMD Andersonへの返済総額が$に達することに同意した
2019年の研究開発協定は2026年12月31日に終了し、いずれの方も書面で重大な違約が発生した後に2019年の研究開発協定を終了することができます。“2019年研究開発協定”には、賠償義務、守秘などの事項に関する習慣条項も含まれている。
2019年の研究開発協定の署名について、会社は2019年10月22日にMD Andersonに引受権証を発行し、購入する
NCIとのライセンス契約
2019年5月28日、会社はNCIと特許ライセンス契約または特許ライセンス契約を締結した。特許許可によると、同社は特定の知的財産権を有する独自のグローバルライセンスを有し、トランスポゾンを介した遺伝子転移によって変異に対するTCR反応を発現する患者由来(自家)の末梢血液T細胞治療製品を開発および商業化することができるKRAS,TP 53そしてEGFR.EGFR新しい抗原です。さらに、特許許可によれば、同社は、非ウイルス遺伝子転移によって設計されたTCRを発現する自己体外周囲血液T細胞治療製品、およびいくつかの追加製造技術の非独占的グローバル許可を開発および商業化するために、いくつかの製造技術の知的財産権に対して独占的な世界的許可を有する。2019年5月29日、2020年1月8日、2020年9月28日、2021年4月16日、2021年5月4日、2021年8月13日に、同社は、変異に反応するTCRをより多く含むように、そのTCRライブラリーを拡張するために特許許可証を修正したKRASそしてTP 53NCIから許可を得た新しい抗原。
特許許可の条項は会社にNCIの最低年間使用料を支払うことを要求し,金額は$である
F-19
カタログ表
ALaunos治療会社は
財務諸表付記
同社は特許製品に関する臨床·規制基準の達成に成功した後、業績に応じて金を支払うことも求められている。このような支払いでは、潜在的な基準支払い総額は#ドルだ
また、特許製品の総純売上高がある総純売上高範囲が$$の間である場合、会社はNCI一次基準支払いを要求されている
事前に終了しない限り、特許許可は、特許権に含まれる最後の特許が満了したときに失効する
2022年12月31日までに当社が発生します
NCIとの連携研究·開発プロトコル(CRADA)
同社は2017年1月9日、CRADAと略称するNCIと協力開発協定を締結した。この協力の目的は固形腫瘍治療のための個性化TCR-T方法を推進することである。使用会社の寝美人NCIは患者自身の癌細胞を解析し,そのユニークな新抗原とこれらの新抗原に反応するTCRを認識し,同社の寝美人再注入のための1つまたは複数のTCRをT細胞に置換する技術。CRADAによる研究はNCI外科支部長Steven A.Rosenberg医学博士が指導し,同社の研究者と協力する。
同社はCRADAによるNCIへの研究と最終的な臨床試験に必要な試験材料の提供を担当している。“CRADA”の規定を履行する研究計画に関連して発見または生産された発明、データおよび材料は、依然としてその発見を生じる側の独自の財産である。双方は研究計画の下で共同で発見されたすべての発明を共同で持つだろう。CRADAに規定されているいずれかの発明の所有者は、当該発明の特許を出願することを決定するか、又は共同所有の発明である場合、会社は当該発明の特許を出願する第1の機会を有するであろう。会社がその決定をNCIに通知することができなかった場合、またはその共同発明に関連する特許を提出しないことを決定した場合、NCIは出願を提出する権利がある。NCIによって独占的に所有されているか、またはNCIと会社によって共同で製造され、特許を出願している任意の発明について、米国公衆衛生サービスは、独占的または非独占的商業化許可を選択するために会社に独占的選択権を付与する。上記の条項に従って許可を得たNCI固有またはNCIおよび会社が共同所有する発明の場合、会社は、世界各地で発明を実践または代表して実施するために、非独占的、譲渡不可能、撤回不可能、および支払い済みの許可証を米国政府に付与することに同意する。会社はまた、この発明を実施するために、または同社を代表して世界各地で同社の任意の単独発明のために発明を実施するために、非排他的、譲渡不可能、撤回不可能、および支払い済みの許可証を米国政府に付与しなければならない。いずれの当事者も60日前に書面で本協定を終了することに同意することができる。
NCIは承認された研究新薬申請、またはINDを持っており、これは彼らがこの試験を開始することを可能にするだろう。会社の知る限り、試験はまだ登録されていない。この試験の進展とスケジュールは,患者への服薬スケジュールも含めてNCIの制御下にある。
2019年2月、会社はNCIとのCRADAを2022年1月9日に延長し、追加的な$提供を約束した
F-20
カタログ表
ALaunos治療会社は
財務諸表付記
CRADA2023年1月9日まで。当社は2022年6月、CRADAの任期を2025年1月9日に延長することを含むCRADA第4改正案に署名した。CRADA第4修正案について、同社は#ドルの寄付に同意しました
特許と技術ライセンス契約−テキサス大学MDアンダーソンがんセンターとテキサスA&M大学システム
2004年8月24日,会社はMD AndersonとテキサスA&M大学システムと特許と技術ライセンス契約を締結し,会社はこの2つのシステムを総称して許可側と呼んでいる。この協定によると、同社は、人間および動物の使用のために、2種類の有機兵器薬(水および脂質基)を製造および商業化する権利(米国および外国特許および特許出願、ならびに関連する改善および技術的ノウハウを含む)を世界的に独占的に取得する権利を取得した。水性有機軍火薬のカテゴリーはダリーナヘパリンを含む。
契約条項によると、会社はいくつかのマイルストーンを実現する際に許可者に異なる金額の追加金を支払うことを要求される可能性があり、累積すると追加の$まで達する可能性があります
Solasia Pharma K.K.との協力協定。
2011年3月7日、当社は、Solasia Pharma K.K.またはSolasiaと、2014年7月31日に独占的なグローバル許可を含むように改訂され、2021年10月14日に特定の支払いスケジュールの詳細、またはこのように修正されたSolasia許可および協力協定を修正する許可および協力協定を締結した。Solasia許可と協力協定によると,同社はSolasiaに独占許可を与え,静脈と経口形式のDarinparsinおよび関連する有機ヒ素分子を開発·商業化し,ヒト使用のすべての適応に用いている。
ライセンスの対価格として、当社はSolasiaから開発と販売のマイルストーンに基づいて特許権使用料を取得する資格があり、これを商業化すると、Darinparsin純売上の特許権使用料と、Solasiaによる任意の再許可収入の一定の割合を得ることができる。SolasiaはDarinparsinの開発、製造、商業化に関するすべてのコストを担当する。上述したように、Solasiaライセンスおよび提携協定に規定されている会社ライセンス者は、Solasiaがライセンシーと締結したSolasiaライセンスおよび提携契約の条項に基づいて会社に支払うすべてのマイルストーンおよび特許権使用料の一部を受け取る。
2022年6月、SolasiaはDarinparsinが日本の厚生労働省によって再発または難治性末梢T細胞リンパ腫の治療に許可されたと発表した。2022年12月31日までの年間で会社が稼いでいる
会社の2018年11月の私募に関連して、当該私募が提供する純収益は約
2019年7月26日及び2019年9月12日に、当社は既存投資家と合意を締結し、これに基づいて投資家が2018年11月の株式承認証を行使して合算した
会社は投資家に新しい引受権証を発行して、最も多く購入します
F-21
カタログ表
ALaunos治療会社は
財務諸表付記
2019年10月22日、会社はMD Andersonと2019年の研究開発協定を締結した。2019年の研究開発協定の署名について、会社はMD Anderson株式承認証を発表して購入しました
2021年8月6日、当社はSVBと融資及び担保協定を締結した。付記4を参照してください債務それは.融資及び担保契約について、当社はSVB株式承認証を発行して購入します
同社はSVB承認株式証がデリバティブとして会計処理を行う必要があるかどうかを評価している。当社は、SVB引受権証(1)自社自身の株にリンクすること、(2)ASC 815により株主権益に分類することを決定した派生ツールおよびヘッジそれは.そのため、当社はSVB承認株式証が例外範囲に適合していると考え、このツールが派生商品として会計処理を行う必要があるかどうかを確定し、株主権益に分類すべきである。
同社は、2021年9月27日、業務戦略調整に関連する既存のコスト構造を低減するために、有効な戦略削減を発表し、2021年11月30日までにサービスを終了しようとしている約60人のフルタイム従業員に通知した。通知された特定の従業員たちは解散費福祉を増加させる雇用協定を規定している。解散費給付は,ある会社が支払う12カ月にわたる連続医療福祉を除いて,2021年に支払われる。残りの福祉は2022年に支払われ、計上される解散費福祉は#ドルに減少した
戦略的リストラを実施したため、会社では退職福祉支払いに関する以下の費用が発生した
|
|
十二月三十一日 |
|
|
|
(千ドル) |
|
2021 |
|
|
|
研究開発 |
|
$ |
|
|
|
一般と行政 |
|
|
|
|
|
解散費総額 |
|
$ |
|
|
|
あそこ当社は設立以来営業赤字となっておりますので、所得税準備金は扱っておりません。2022年12月31日と2021年12月31日までの年次報告書の所得税支出額は,国内連邦法の適用による金額とは異なる
F-22
カタログ表
ALaunos治療会社は
財務諸表付記
税金.税金税引前損失の主な原因は推定支出の変化だ
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
繰延税金資産: |
|
|
|
|
|
|
||
純営業損失が繰り越す |
|
$ |
|
|
$ |
|
||
開始と臨床前研究 |
|
|
|
|
|
|
||
研究開発信用繰り越し |
|
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
|
||
資本化買収コスト |
|
|
|
|
|
|
||
リース責任 |
|
|
|
|
|
|
||
減価償却 |
|
|
|
|
|
|
||
資本化研究費 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
推定免税額を差し引く |
|
|
( |
) |
|
|
( |
) |
繰延税金資産総額 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
使用権資産 |
|
|
( |
) |
|
|
( |
) |
繰延税金負債総額 |
|
$ |
( |
) |
|
$ |
( |
) |
繰延税金純額 |
|
$ |
|
|
$ |
|
||
繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する。2022年12月31日現在、同社が繰り越した連邦税収純営業損失総額は約$
同社は繰延税項目の純資産の全金額に推定準備金を提供しており、これらの将来のメリットは実現できない可能性が高いからだ。しかしながら、これらの繰延税金資産は、将来の所得税負債および費用を相殺するために使用されることができる。推定免税額は#ドル増加した
連邦法定所得税率を用いた所得税が会社の実際の税率と異なるのは,主に会社の株式承認証の発行に関する差し引くことのできない支出および繰延税項資産推定値免税額の変化によるものである。
法定連邦所得税率で計算される所得税費用(福祉)と財務諸表に反映される所得税の入金は以下のとおりである
|
|
十二月三十一日までの年度 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
法定税率で徴収される連邦所得税 |
|
|
% |
|
|
% |
||
連邦税優遇後の州所得税を差し引く |
|
|
% |
|
|
% |
||
研究開発単位 |
|
|
% |
|
|
% |
||
実態を研究·開発する |
|
|
- |
% |
|
|
% |
|
株に基づく報酬 |
|
|
- |
% |
|
|
- |
% |
連邦/州金利の変化 |
|
|
- |
% |
|
|
- |
% |
評価免除額を変更する |
|
|
- |
% |
|
|
- |
% |
実際の税率 |
|
|
% |
|
|
% |
||
会社はASC 740を採用した税務状況の不確定な会計処理開ける2007年1月1日。ASC 740は、FASB 109号に基づいて“所得税の会計処理”を宣言し、企業財務諸表で確認された所得税の不確実性の会計処理を明らかにした。ASC 740は、納税申告書において採用されるまたは予期される税収の確認閾値および測定基準を規定する。♪the the the
F-23
カタログ表
ALaunos治療会社は
財務諸表付記
会社ASC 740を採択した後、税務責任を確定しないためのいかなる追加準備金も確立されなかった。いくつありますか
会社の純営業損失と税収相殺は繰り越すことができるため、会社は経営報告書で利息や罰金を何も確認していない。必要に応じて、会社は、連邦と州所得税の支出の一部として、不確定な税収状況に関する利息と罰金を計上する。同社は利益が確認されていない額は今後12カ月以内に大きな変化はないと予想している。
会社は現在、米国国税局と各州司法機関が訴訟時効に基づいて1999年12月31日から2022年までの年度を監査しているが、純営業損失は2022年に繰り越される。
2022年から、2017年の減税及び雇用法案、又は税法は、発生した1年間に研究開発支出を直ちに差し引く選択を廃止し、納税者にIRC第174条に基づいて5年以内に資本化及び償却を行うことを要求する。当社の損失状況及び全額評価のため、強制的な資本化要求は全体の繰延税金資産に影響を与えません。
会社は2012年5月に2012年株式インセンティブ計画、または2012年計画を採択した。その後の増加を含めて、会社は予約しました
同社は2020年6月に2020年株式インセンティブ計画、または2020年計画を採択した。当社は保留します
株式オプションは一般的に3年または4年以内に四半期または年間分割払いに比例し、付与日の1周年から契約条項は10年となる。取締役の株式オプションは通常1年から2年に比例して付与され、契約条項は10年となる。株式オプションはブラック−スコアーズオプション定価モデルを用いて推定され,補償は付与期間の公正価値に基づいて直線的に確認された。
2022年12月31日までに年度内にオプションを行使して得られた金は$
2022年12月31日と2021年12月31日までの年間、会社株式オプション計画下の株式オプション活動は以下の通り
(千単位で1株当たりおよび1株当たりのデータは含まれていない) |
|
株式数 |
|
|
加重平均行権値 |
|
|
加重平均契約期間(年) |
|
|
内在的価値を集める |
|
||||
優秀で2020年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
授与する |
|
|
|
|
|
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
キャンセルします |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
未返済、2021年12月31日 |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授与する |
|
|
|
|
|
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
キャンセルします |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
未返済、2022年12月31日 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
オプションを行使でき、2022年12月31日 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
オプションを行使でき、2021年12月31日 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||
将来の支出が可能なオプション、2022年12月31日 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日現在,未取得株式オプションに関する未確認補償費用総額は#ドルである
F-24
カタログ表
ALaunos治療会社は
財務諸表付記
制限株
2022年12月31日までに当社が発行します
2022年12月31日と2021年12月31日までの制限株式状況の概要は以下のとおりである
|
|
株式数 |
|
|
加重平均付与日公正価値 |
|
||
許可されていない、2020年12月31日 |
|
|
|
|
|
|
||
授与する |
|
|
|
|
|
|
||
既得 |
|
|
( |
) |
|
|
|
|
キャンセルします |
|
|
( |
) |
|
|
|
|
帰属していない、2021年12月31日 |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
|
|
||
既得 |
|
|
( |
) |
|
|
|
|
キャンセルします |
|
|
( |
) |
|
|
|
|
帰属していない、2022年12月31日 |
|
|
|
|
$ |
|
||
2022年12月31日までに
同社は合格した401(K)退職計画を開始し、この計画によると、従業員はその給料の一定の割合で支払うことができ、最高でIRC第401(K)条または401(K)計画によって許容される最高割合に達する。当社は401(K)計画に貢献することを自ら決定することができる。その会社は約$を貢献した
2018年12月18日、当社はTriArmと枠組み協定を締結し、いくつかの薬物の臨床開発と商業化をリードするためにEden Biocellを発売することに同意した寝美人−個々の許可プロトコルに規定されたCAR-T療法。
2019年1月3日、エデン生物細胞は香港で個人会社として登録設立された。当社はTriArmと2019年1月23日に株式引受契約を締結し、当社およびTriArmは、Eden Biocellにいくつかの知的財産権、サービスおよび現金(TriArmのみを含む)を提供し、Eden Biocell株式のいくつかの新規発行の普通株式を承認することに同意した。
取引は2019年7月5日に完了した。フレームワーク協定および株式引受協定はそれぞれ改訂され、その日から発効する。合弁企業が完成した後、エデン生物細胞は当社とライセンス契約を締結し、この合意に基づいて、当社は第三世代エデン生物細胞の権利を許可した寝美人CD 19抗原に対するCAR−T療法は,中国地域(マカオと香港を含む),台湾,韓国に適している。TriArmと会社はそれぞれ1部を受け取りました
当社はエデン生物細胞が可変利益実体とみなされていることを確定し、それは可変利益実体の主要な受益者ではなく、可変利益実体の活動を指導する権限がないからであると結論した。そのため、当社は権益会計方法によってエデン生物細胞の持分を計算し、それは重大な影響を行使する能力があるからである。
エデン生物細胞は2021年3月,台湾FDAが2020年12月に承認したINDに基づき,同社の研究CD 19 RPM CAR−T細胞療法を用いた臨床試験中の患者の治療を開始した。2021年上半期、2人の患者はこの試験で治療を受けた。台北国立台湾大学の首席研究員は,両患者とも重篤な副作用は発生していないと報告している。実験室の結果は先に発表されたように非ウイルスです寝美人遺伝子転移は自己T細胞の遺伝子修飾に有効である。患者は遺伝子転移2日後に注入し、回転時間を短縮し、ウイルス方法より優位性を示した。
F-25
カタログ表
ALaunos治療会社は
財務諸表付記
2021年3月から5月までの間に発生した上位2名の患者の実験室データによると,TriArm/Edenチームは研究者や会社と共同で結論を出し,さらなるプロセス開発が必要である。
エデン生物細胞は2022年12月31日と2021年12月31日までの数年間に純損失を出した。TriArmと当社は2021年9月、合弁企業の解散に共同で合意し、現在終了している。エデン生物細胞実体は解散の過程にある。
F-26