
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
そこからの過渡期について
手数料書類番号
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引 記号 |
|
登録された各取引所の名称 |
|
|
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してくださいはい、そうです ☐
登録者が当該法第13条又は第15条(D)に従って報告書を提出する必要がないか否かを、再選択マークで示すはい、そうです ☐
登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13または15(D)節に提出されたすべての報告を提出したかどうか、および(2)このような提出要求を過去90日以内に遵守してきたかどうかを、再選択マークで示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバ |
|
☐ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|||
|
☒ |
|
規模の小さい報告会社 |
|
||
|
|
|
|
|
|
|
新興成長型会社 |
|
|
|
|
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)はい、そうです ☐ 違います。
2022年6月30日現在,登録者の非関連会社が保有する投票権と無投票権普通株の総時価は約#ドルである
2023年2月15日現在、登録者の発行済み普通株式数は
引用で編入された書類
米国証券取引委員会に提出された登録者最終委託書のうち登録者2023年株主総会に関連する部分は、本表格10−Kの第3部で引用される。このような依頼書は,登録者が2022年12月31日までの財政年度終了後120日以内に証券取引委員会に提出される。参照により明示的に組み込まれた情報を除いて,依頼書は本年度報告10-Kテーブルの一部として提出されるとはみなされない.
カタログ表
|
|
ページ |
第1部 |
|
|
第1項。 |
業務.業務 |
1 |
第1 A項。 |
リスク要因 |
26 |
項目1 B。 |
未解決従業員意見 |
85 |
第二項です。 |
属性 |
85 |
第三項です。 |
法律訴訟 |
85 |
第四項です。 |
炭鉱安全情報開示 |
85 |
|
|
|
第II部 |
|
|
五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
86 |
第六項です。 |
[保留されている] |
86 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
87 |
第七A項。 |
市場リスクの定量的·定性的開示について |
97 |
第八項です。 |
財務諸表と補足データ |
98 |
第九項です。 |
会計と財務情報開示の変更と相違 |
127 |
第9条。 |
制御とプログラム |
127 |
プロジェクト9 B。 |
その他の情報 |
128 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
129 |
|
|
|
第三部 |
|
|
第10項。 |
役員·幹部と会社の管理 |
130 |
第十一項。 |
役員報酬 |
130 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
130 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
131 |
14項です。 |
チーフ会計士費用とサービス |
131 |
|
|
|
第4部 |
|
|
第十五項。 |
展示と財務諸表明細書 |
132 |
第十六項。 |
表格10-Kの概要 |
136 |
i
前向き陳述に関する特別説明
以下の議論と分析は、我々の連結財務諸表および本年度報告書の他の表格10-Kに含まれるこれらの報告書の付記とともに読まなければならない。この10-K表年次報告書には、1933年“証券法”(改正)第27 A節又は“証券法”及び改正された“1934年証券取引法”(又は“取引法”)第21 E節に該当する前向きな陳述が含まれている。これらの前向きな陳述は、我々の経営陣の信念と仮定及び我々の経営陣が現在把握している情報に基づいている。この10-K表年次報告では、“私たち”、“私たち”、“私たち”はRxSight,Inc.を指す。
前向き陳述は,主に本10−K年度報告第1部1 A項における“リスク要因”の節と本10−K年度報告第2部第7項の“経営陣の財務状況と経営成果の検討と分析”の節に含まれる。前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
II
前向きな陳述は、非歴史的事実の陳述を含み、“可能”、“将”、“すべき”、“可能”、“将”、“予想”、“計画”、“意図”、“予想”、“信じ”、“推定”、“予測”、“プロジェクト”、“潜在的”または“継続”などの用語、またはそのような用語は、他の同じ用語との否定によって識別されることができる。
展望性陳述は既知および未知のリスク、不確定性および他の要素に関連し、これらのリスク、不確定性およびその他の要素は、私たちの実際の結果、表現または成果と展望性陳述の明示的または暗示的な任意の未来の結果、表現または成果とは大きく異なる可能性がある。私たちはこの10-K表年次報告書の第1部1 A項目“リスク要因”でこれらのリスクをより詳細に議論した。このような不確実性を考慮して、あなたはこのような前向きな陳述に過度に依存してはいけない。しかも、私たちの運営環境は競争が激しく、変化が迅速だ。新しいリスクが時々発生する。私たちはすべてのリスクを予測することはできないし、すべての要素が私たちの業務に与える影響を評価することもできないし、任意の要素または要素の組み合わせは、実際の結果が私たちが行う可能性のある任意の前向き陳述に含まれる結果と大きく異なる程度をもたらす可能性がある。これらのリスク、不確実性、および仮定を考慮して、本年度報告で議論された10-K表で議論された未来のイベントおよび傾向は発生しない可能性があり、実際の結果は前向き陳述で予想または示唆された結果と大きく異なる可能性がある。
本年度報告におけるForm 10−K形式での前向き陳述は,陳述が行われた日までの事件のみに触れている。法的要件がない限り、私たちは、未来に新しい情報があっても、これらの前向き陳述で予想される結果と大きく異なる理由で、これらの前向き陳述を更新する義務がない、または実際の結果を更新する義務はない。
三、三、
わが国の財政状況の検討と分析
私たちの財務状況と経営結果の討論と分析は、米国公認会計原則(“公認会計原則”)に基づいて作成された我々の総合財務諸表に基づいている。これらの財務諸表を作成する際には、資産、負債、収入、費用報告金額に影響を与える見積もりと判断を行う必要があります。私たちは、収入確認、所得税資産の現金化、税金負債推定に関する推定、古い、過剰、緩やかな流動の在庫を含む私たちの推定を評価し続けている。我々は過去の経験や当時の状況では合理的な様々な他の仮定を推定していると考えられるが,これらの仮定の結果は資産や負債の帳簿価値を判断する基礎となっており,これらの資産や負債の帳簿価値が他の源から現れることは容易ではない.実際の結果はこれらの推定とは大きく異なる可能性がある。
業界、商業、市場データ
このForm 10-K年次報告書には、推定された市場規模に関するデータを含む、当社の業界、当社の業務および市場機会の推定、予測、およびその他の情報も含まれています。見積り,予測,予測,市場研究や類似方法に基づく情報自体は不確定要素の影響を受け,実際のイベントや状況はその情報に反映されるイベントや状況とは大きく異なる可能性がある.他に明確な説明がない限り、私たちは、報告、研究調査、研究、および市場研究会社および他の第三者によって準備された類似データ、業界、医療および一般出版物、政府データ、および同様のソースから、これらの業界、商業、市場、および他のデータを取得する。
商標、サービスマーク、商号
このForm 10-K年次報告書は、他のエンティティに属する商標およびサービスマークへの参照を含む。便宜上、本年度報告においてForm 10−K形式で参照される商標および商号は、商標またはTM記号を有さない可能性があるが、このような参照は、適用許可者が適用法に従ってこれらの商標および商号に対する権利を最大限主張しないことを意味するわけではない。他の会社との関係を示唆するために、他社の商標、商標またはサービスマークを使用または展示するつもりはありません。または他の会社が裏書きしたり、賛助したりするつもりはありません。
四
第1部
プロジェクト1.ビジネス
概要
我々は商業段階の医療技術会社であり,白内障手術後の患者の視力改善に取り組んでいる。私たち独自のRxSight®光線調節可能レンズシステム(“RxSightシステム”)は第一種であり、商業上利用可能な良質な白内障技術であり、医師が手術後の患者のために視力をカスタマイズと最適化できるようにする。RxSightシステムはRxSight光線調整可能レンズで構成されています® (“LAL®“)、RxSight Light Delivery Device(”LDD“)およびアクセサリ。我々のLALは1種の良質な眼内レンズ(“IOL”)であり、独自の感光性材料から作られ、LDDが産生する特定の紫外線(“UV”)モードによって形状を変えることができる。
著者らが設計したRxSightシステムは、競争的に良質なIOL技術の欠点を解決し、医師が信頼できる解決策を提供し、視覚効果を改善し、高いレベルの患者満足度を実現することを目的としている。競争的良質眼内レンズは患者が手術前に彼らの視力優先順位を明確にすることを要求し、これらの選択に関連する各種の光学的トレードオフを受け入れたい。患者が競争力のある良質な眼内レンズを選択すると、外科医師は一連の術前診断テストと予測式に依存して適切な水晶体屈折力を選択しなければならない。もし医師の予測が理想的でない場合、患者は望ましくない結果を経験する可能性があり、これは視力目標を達成するために、その後の角膜屈折手術或いはいくつかの他の妥協を必要とする可能性がある。
これに対し,RxSightシステムを用いて,外科医は任意の他の白内障手術のようにLALを移植し,術後数週間に患者の入力から屈折不正を決定し,LDDを用いて患者が望む視力結果を実現するために必要な正確な視覚矯正によりLALを修正することができる。著者らは、著者らのRxSightシステムは医師と患者にもっと多くの自信と安心を提供し、それは競争性良質な眼内レンズによく見られる高リスク術前推測を除去し、そして患者がカスタマイズされた術後調整を通じて彼らの最終視力特徴を繰り返すことを可能にするからであると信じている。
白内障は目の自然水晶体が透明度を失い、視力がぼんやり或いはぼんやりし、最終的に失明を招く可能性がある。60歳になると,約50%の人が何らかの形の白内障を発症し,通常は両眼であり,罹患率は加齢とともに増加する。世界で最もよく見られる手術の中で、白内障手術は混濁した自然水晶体を除去し、そして透明な人工水晶体を代わりに使用することを含む。手術前に、患者は球面単焦点眼内レンズを選択することができ、これは通常視力を改善するが、眼鏡をかけて最適な視力を得ることができ、あるいは良質な眼内レンズを選択することができ、それはまた乱視及び/或いは老眼を矯正することができ、それによって眼鏡への依存を減少させることができる。アメリカでは、連邦医療保険(Medicare)と個人保険会社は通常球形眼内レンズ手術のすべての費用を負担し、保険料IOL手術は患者の自己負担費用を要求し、使用する具体的な保険料IOLによって、費用は通常1眼1000ドルから4000ドルまで様々である。アメリカは世界最大の良質人工水晶体市場であり、市場範囲2022年の良質白内障手術市場の報告によると、2022年の良質手術はすべての白内障手術の約25%を占め、約7.6億ドルの収入を創出し、2027年までにこの数字は12%の複合年間成長率(CAGR)で増加すると予想されている。
医師はすべての条件に適合する患者に競争性良質眼内レンズを推薦したくないため、患者は競争性良質眼内レンズとの関連トレードオフと副作用を評価する際に困惑しているため、良質白内障手術市場はまだ十分に浸透していないと考えられる。競争力のある良質な眼内レンズは,眼鏡をかけない一連の距離に対する患者の高品質視力への期待を満たすことができないことが多いと考えられる。私たちの最新の第4段階商業データでは、90%以上の患者が眼鏡をかけずに20/20以上の距離を達成することができ、これは任意の置換眼内レンズの約2倍である。また,90%以上の患者は視力に近い状態で5ポンドのフォントを読むことができ,これは通常1ページの脚注の大きさである。
われわれのRxSightシステムは医師と患者により信頼できる方法を提供し,最適で完全にカスタマイズされた視覚結果を継続的に提供することができ,ほとんど妥協せず,最終的に広範な採用を推進し,良質白内障手術の看護基準として確立したと信じている。私たちの解決策の主な利点は
1
私たちのビジネス努力は2019年に始まり、主にアメリカに集中しています。私たちはアメリカで“カミソリとブレード”のビジネスモデルを構築して、新しい顧客の採用と持続的なLAL販売量の増加を推進しています。私たちのアメリカの商業機関はLDD販売員とLAL顧客マネージャーからなる直販チームと、臨床専門家、現場サービスエンジニアとマーケティング人員を含みます。著者らの販売仕事は約3000名のアメリカ白内障外科医師に集中し、彼らが行ったハイエンド人工水晶体手術はすべてのハイエンド人工水晶体手術の70%-80%を占めている。2022年12月31日現在,眼科実践で400 LDDSの装着基盤を構築しており,我々が設立してから2022年12月31日までに外科医は42,000個を超えるLALを移植している。
我々は,主に我々のLDDクライアント群の規模を拡大することで我々の業務を発展させ,われわれのRxSightシステムが患者に提供する卓越した臨床結果に対する認識を高めることで,われわれのLAL利用率を向上させる予定である。ハイエンド人工水晶体市場における競争地位を引き続き強化するため、著者らの研究開発活動は主に臨床結果の改善、顧客体験の改善、著者らの使用適応の拡大、製造コストの低減とライフサイクル管理のプロジェクトに集中している。
我々の市場や業界は
白内障や他のよく見られる視力状況
よく見られる視力状況は,1)典型的な発症年齢,2)このような状況は角膜との関係がより密接であり,角膜が眼の3分の2の焦点調節能力を制御している前面であるか,虹彩の後方に位置する自然水晶体であるか,眼の残りの焦点調節能力を担当しているかの2つの定義因子に大別される。子供の頃から四番目の十年まで、主に角膜に関連する屈折状態である近視、遠視、乱視--通常視力に最も影響を与え、通常眼鏡とコンタクトレンズを着用する必要がある。これらの疾患を有する成人では,LASIKのような角膜手術は眼鏡やコンタクトレンズへの依存を減少させることができる。
50歳になると老眼も多く出現し,眼鏡やコンタクトレンズを着用しない場合には近距離と中距離の視力が増加することを示している。老眼の発生は,自然水晶体が弾性を失ったため,近傍の物体に光を集束させる能力を失ったためである。60歳になると,約半分の人が何らかの形の白内障に罹患しており,この場合,通常透明な結晶状体得は透明度を失い,光線の網膜への進入を阻害あるいは妨害するようになってきている。その結果,視力がぼやけたりぼやけたりして光線に対する感度が増加し,特に夜には眼鏡やコンタクトレンズで治療することができなかった。白内障は不可逆的で進行性であり,通常両眼に影響する。白内障は日常活動を厳重に妨害し、生活の質に影響を与え、最終的に
2
失明する。国立眼科研究所のデータによると,有効な手術治療があるにもかかわらず,白内障は世界的に失明の要因である。

白内障手術
白内障手術は世界で最もよく見られる外科手術の一つであり、透明な人工水晶体で患者の自然混濁した水晶体を置換することに関連する。米国では通常外来環境で行われており,非臥床手術センター(ASC)のように白内障手術に特化した眼科医が行い,通常5分から15分で完了する。多くの場合、手術の開始は超音波乳化と呼ばれる過程によって白内障水晶体を除去することである。超音波乳化手術において、眼科医師は角膜上に小さい手術切り口を行い、1つの超音波プローブを挿入し、水晶体を破砕或いは乳化させ、同時に中空針は水晶体破片を取り出した(以下図1参照)。白内障摘出後,外科医は同じ手術切り口で眼内レンズを移植した(以下図2参照)。インプラント後,人工水晶体は虹彩後方にしっかりと固定されている(以下図3参照)。
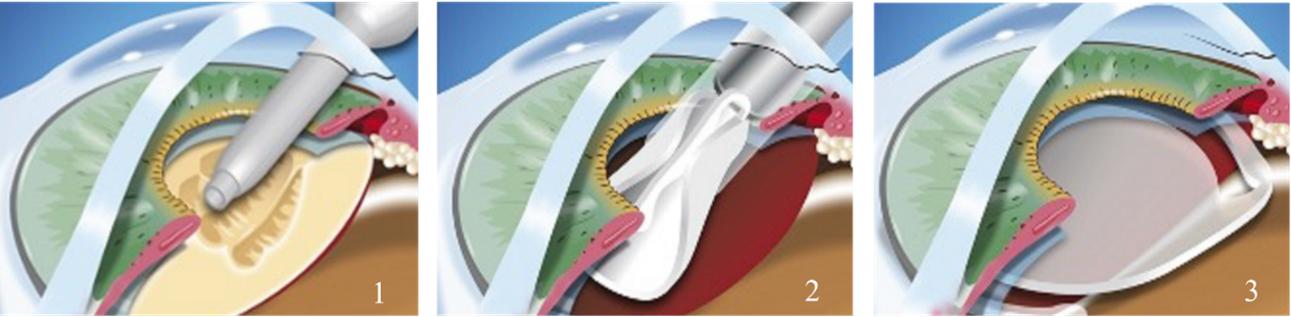
従来の白内障手術と良質白内障手術の比較
人工水晶体のタイプによって、白内障手術は通常2種類に分けられ、以下の通りである
医療支払者は通常,従来の白内障手術の全費用を支払う。米国では、医療支払者(主に医療保険および医療補助サービスセンター(CMS))は、通常、従来の単焦点眼内レンズのコストを含む約500ドルの外科医費用および約1000ドルの施設費用の補償を従来の白内障手術に提供する。CMS精算削減およびインフレ·精算を計上する
3
1991年以来、金利は3分の2低下した。手術費用はすべての白内障術前検査、白内障手術と3ケ月のフォローアップ看護を含む。
米国の良質白内障手術の場合、医療支払者(主にCMS)は同じ外科医および施設費用を精算するが、患者は環状眼内レンズを移植するために外科医に1,000~2,000ドルの追加費用を支払い、他の良質水晶体を移植するために平均2,000~4,000ドルを支払い、その中に良質な眼内レンズのコストを含む。したがって,従来の白内障手術に比べて良質白内障手術は医師や眼科診療所への利益が10から15倍高く,販売率変化の影響は小さい。同時に、良質白内障患者は自腹を切って追加費用を支払うため、彼らは往々にして外科医が高品質、無眼鏡視力に対する渇望を満たすことに高い期待を抱いている
私たちの市場のチャンスは
“2022年ハイエンド白内障手術市場報告”と“2022年市場範囲人工水晶体報告”によると:
著者らは、現在伝統的な白内障手術を受けている医師と患者を転換することによって、著者らはハイエンド人工水晶体市場で市場シェアを獲得し、ハイエンド人工水晶体のより広範な市場における浸透率を増加させる機会があると信じている。著者らは、医師はすべての条件に符合する患者に良質な眼内レンズ製品を推薦したくないため、患者は商業上得られる広範な良質眼内レンズ製品と関連するトレードオフを評価する時に困惑し、良質白内障手術市場は依然として浸透が不足していると考えられる。また、現在調節できない良質なIOL製品はしばしば患者の期待を満たすことができない、すなわち眼鏡に依存しなければ、彼らは近、中、遠隔の眼内レンズを見たいと信じており、そして懸念される副作用、例えばめまい、ハローとコントラスト感受性の喪失を避ける。
私たちは現在、私たちのRxSightシステムのハイエンド白内障市場における知名度と浸透率を推進することに集中しており、主に私たちの最近の商業努力をアメリカに集中させている。米国は最も魅力的な市場であり,医療保険が60歳以上の個人を多くカバーしているため,良質な人工水晶体を提供する経験の豊富な白内障外科医の集中基盤,高1人当たりの国内総生産,および有利な米国の医療補償制度は,白内障手術費用の一部を支払う長い歴史があると考えられる。
調節不可能な良質な眼内レンズとその限界
我々のRxSightシステムが商業化される前に、医師と患者は2つの主要な良質な眼内レンズの中から選択した
4
患者のために良質白内障手術を準備する時、外科医師は利用可能な良質眼内レンズ選択を全面的に理解し、どのように患者を彼らの優先順位に符合する技術と最適に一致させる必要がある。患者の決定はいくつかの要素に基づいており,外科医のアドバイスに大きな影響を受けることや,患者が眼鏡をかけない動機や副作用を容認する意思がある。最初の相談では、外科医はしばしば患者に彼らの視力経験と期待に関する調査を記入して、患者が優れた良質な眼内レンズ候補であるかどうかを決定するように要求する。もしそうであれば、外科医師は患者の生活様式と彼らが最も重視する視力タイプ(即ち近、中或いは遠)に基づいて、適切な良質な眼内レンズの選択を助ける。一般に、良質な眼内レンズの各視覚結果に関する患者の様々なトレードオフを教育するためには、多くの時間が必要である。回診後、手術は通常数週間か数ヶ月以内に予定されている。
手術前に、外科医が最適な術後結果を達成するのに最適な水晶体焦点調整倍数を予測するのを助けるために、1つまたは複数の診断装置を使用して患者の眼を測定する。焦点力は,屈折力(D)で表され,レンズがどのように光線を一点(球面度数)や直線(シリンドリカルまたは収差)に集束させるかを指す。水晶体度数を正確に予測することは術後の残留屈折不正を減少し、最適な視覚効果を提供するキーポイントである。競争性良質眼内レンズ移植後の水晶体屈折力は変化できないため、医師は一連の術前診断テストと予測式に基づいて水晶体屈折力を確定した。通常,患者は術後1日に戻って目を検査し,回復を確保している。約1カ月後,結果に満足していない良質白内障患者は眼鏡をかけたり,2回目の修復手術を選択したりして,予想される視力目標を達成する可能性がある。LASIK単独手術は白内障手術後の残存視力を矯正する最もよく見られる手術である。
これらの競争性良質眼内レンズの1つの重要な制限はそれらが手術後に調整できないことであり、そのため、患者に手術前に期待した視覚結果を達成することを要求する。しかし,術前に患者と視力最適化案を検討する際には,異なる視覚結果を効率的に示すことは困難である可能性がある。良質な眼内レンズを選択すると、もう一つの肝心な制限は外科医師が正確な水晶体度数を正確に予測できるかどうかであり、それから患者の期待結果に必要な精度レベルに達する人工水晶体を移植することである。また,混濁した水晶体を除去して人工水晶体を移植するための切開やそれによる癒合過程は通常余分な乱視をもたらし,白内障手術前には正確には予測できない。
術前に視力結果を確定する必要や術後の限られた調整能力が良質な人工水晶体透過率を低下させる重要な要素であると考えられる。術後視力や眼鏡に依存しない期待が達していない場合,患者は失望することが多い。そのため、白内障患者の60%は白内障手術後に眼鏡をかけないことが非常に重要であると考えているにもかかわらず、外科医は往々にして彼らの患者に現有の良質な人工水晶体を推薦したくない。
私たちの解決策は
著者らが設計したRxSightシステムは、現有の良質なIOL技術の欠点を解決し、医師が信頼する解決策を提供し、視覚効果を改善し、高いレベルの患者満足度を実現することを目的としている。私たちは2019年にアメリカで私たちの解決策を商業化し、良質なIOL手術の看護基準としてRxSightシステムを構築することに集中した。われわれは2022年12月31日現在,眼科実践に400台のLDDSを有するクライアント群を有し,設立以来,われわれのRxSightシステムは42,000例を超える手術を行ってきた。
RxSightシステムの概要
著者らのRxSightシステムはFDAが許可した第一項であり、唯一のIOL技術であり、医師が白内障手術後の患者のために視力をカスタマイズと最適化できるようにした。RxSightシステムを用いて,医師は標準的な白内障手術を行いLALを移植し,治癒完了後に患者の入力に応じて屈折不正を決定し,LDDを用いて再構築した
5
LALは患者が期待する視力効果を達成する。私たちのRxSightシステムは2つの重要なコンポーネントと他の術中と術後の付属品から構成されている

私たちの基礎技術は
過去20年間に、著者らはRxSightシステムを開発し、光学、材料科学、化学、ソフトウェアとハードウェア工学を含む複数の学科の専門知識とノウハウを融合した。独自のRxSight技術は術後の調整可能性を実現し,光化学原理に基づいている。LALは感光性材料で作られており,特定のパターンの紫外光がLALに伝送されると形状や電力が変化する。
我々のLALは我々独自のシリカゲル配合を用いて製造し,シリカゲル独自の材料特性を利用した。有機ケイ素分子は、無機ケイ素-酸素主鎖からなり、ケイ素と酸素原子とから交互になる鎖であり、鎖中の各ケイ素原子に結合した一対の有機分子である追加のペンダント基を有する。重合と呼ばれるプロセスによって、シリコーンモノマー(短鎖分子)が一緒に反応してシリコーンポリマー(長鎖分子)を形成し、これらのポリマーは、線状構造ではなく、複数の点で架橋して三次元構造を形成することができる。鎖長,連結側基,架橋設計を変更することにより,独自の性能を有するシリコーンポリマーをカスタマイズすることができ,広く応用されている。著者らは白内障手術後の患者の視力を向上させるために、人工水晶体の機械と光学性能を最適化するシリカゲルの新しい応用を開発した。
LALを製造するために,シリコーンポリマーとモノマーの混合物を用い,後者は“巨大分子”と呼ばれ,光活性分子や他の化合物と混合した。我々のレンズ材料の初期成分はレンズ金型中で熱硬化した粘性液体である。熱硬化および光重合はそれぞれ温度と紫外光を用いて重合反応を開始および伝播する。組成物中のマクロモノマー重合を避けるために,より低い温度で熱硬化を行った。LALの部分重合は固体であるが柔軟なシリカゲルレンズを形成し,感光性マクロモノマーを脱重合させてレンズ全体に分布させる。得られたレンズは光学的に透明であるが,高分子や光活性分子はレンズ内を自由に移動することができる。
包装と消毒後,LAL準備は患者の天然水晶体の代わりに標準白内障手術プログラムの一部として移植された。傷口の癒合が完了すると、LALに対して短い紫外線露光を行い、水晶体の屈折特性を調整する。紫外光が水晶体の特定の部分に照射されると、水晶体のこの部分が露光した高分子重合体は収束して静止状態になる。これは,レンズの未露光部分に過剰な遊離マクロモノマーを生成し,未重合マクロモノマーが集中領域から不集中領域に移動する拡散勾配を確立した。次の1~2日で未重合マクロモノマーは
6
均一な分布を実現するためにショット内に再分散する.マクロモノマーの再分布は、水晶体の露出部分が水晶体の未露光部分に対して膨張し、屈折力を変化させることができる。
マクロモノマーの運動はレンズ曲率の高さが予測可能な変化をもたらす。水晶体の中央部分が紫外光に曝露されると,水晶体外周の未重合高分子は中央部に移動する。その結果,水晶体の中央部が膨張し,遠視を矯正する水晶体形状を形成した。逆に,水晶体の外周が紫外線にさらされると,水晶体中央部の未重合高分子は周辺に移動する。その結果,水晶体の周辺は膨張し,近視を矯正する水晶体形状を形成した。近視または遠視の球面矯正に加えて、乱視を矯正するために、レンズの任意の軸に対してカスタマイズされた柱面調整を行うことができる。
LALにおいて必要な屈折変化を達成するために、我々のLDDは、ノモグラムと呼ばれる所定の光パターンに従って水晶体の特定の部分を重合する短時間の紫外線露光処理を提供するために特許ソフトウェアおよびアルゴリズムを使用する。ノモグラムは眼鏡やコンタクトレンズ患者の屈折の調整増量、類似屈折精度を有するLASIKなどの他の屈折手術のように、0.25屈折力増分で球面と柱面屈折力を調整することを可能にしている。LDDは医師室に置くために設計されており,標準スリットランプとデジタルプロジェクタの組み合わせである。スリットランプ部分は,医師が患者の眼の内部を見ることができ,LALにビームを向けることができる。デジタルプロジェクタ部分は、メモリに記憶された画像を表すために電子的に活性化された約250,000個のマイクロミラーを有するDLP技術を使用してLAL上に画像を投影する。
毎回紫外光治療は水晶体中の一部のマクロモノマーのみを消費し、何度もLALの調整を許可する。この過程は患者と医師が満足するまで数週間で3回繰り返すことができる。そしてレンズ全体を集めて安定した矯正を提供します。調整光処理が完了した後、1つまたは2つのロック光処理を適用して、全ての残りのマクロモノマーおよび光活性化合物を消費する。最終ロック処理後,ショット度数を再調整することができない.
私たちの方法は
RxSightシステムを用いて,外科医は標準的な眼内レンズ移植プログラムを実行し,LALで患者の天然水晶体を置換した。術後2~3週間,患者は医師室に行って標準的な術後屈折検査を行い,眼鏡処方のための視力テストに類似していた。伝統的な屈折不正と視力表を用いて,臨床医は必要な屈折不正と処方を決定し,LDDのグラフィカルユーザインタフェースに情報を入力する。LDDの前に座って光線治療を行うと,患者の目が拡大され,コンタクトレンズを眼に応用した。LDDは、処方入力に基づいて、プログラムされた所定の紫外光露光を生成する。約100秒の間,光は無痛と非侵襲的にインプラントのLALを再構築し,測定した屈折不正を是正した。治療経過は5分もかかりませんでした患者は約3~5日後に戻って追加の光線治療を受けて、必要であれば、または水晶体をロックするために、彼らの視力をさらに調整する。患者は最大3回の調整が可能であったが,われわれFDA臨床試験の平均調整回数は1.6回であった。
RxSightシステムは患者の視力を最適化し、視力をテストし、LALのための最終処方を選択する前に可能な結果を比較するために、完全な相互作用と反復の過程を実現した。FDAの承認以来、臨床実践において、約60%が複数回の調整を受けた患者は彼らの最初の球形目標を変更することを要求し、調整可能性とカスタマイズ化の価値を強調した。手術時間からLALロック後24時間まで紫外線保護眼鏡をかけており,無保護光線曝露によりLALが制御できない変化が生じている。2021年末以来、著者らはすべての眼内レンズにActivShield技術を採用し、この技術は水晶体表面に追加の紫外線保護層を提供し、そして患者の保護眼鏡依存性への依存を減少した。
RxSightシステムが患者にもたらす主なメリット
7
RxSightシステムが医師にもたらす主なメリットは
私たちの成長戦略は
われわれは,われわれのRxSightソリューションの有形かつ納得できる利点を利用して,われわれの技術の広範な採用を実現し,良質な白内障手術の看護基準として確立している。私たちの成長戦略は
8
9
FDAの臨床研究
2016年7月、著者らは600名の被験者に対するFDA第三段階の重要なランダム臨床研究を完成し、術後球面と柱状屈折不正を矯正するための光治療の安全性と有効性を評価することを目的とした。この研究では,391名の被験者が片方の眼にLALを移植し,術後6カ月のフォローアップで193名の被験者が片方の眼に単焦点対照IOLを移植したことと比較した。LALはすべての主要な治療効果の終点に達し、2017年11月22日にFDAによって最初の商用調節可能な眼内レンズとして許可された。この研究では,70.1%のLAL被験者が20/20以上の単眼裸眼遠隔視力を得たが,単焦点制御性眼内レンズを移植した被験者では36.3%であった。統計学的に対照眼内レンズより明らかに優れている以外、裸眼距離視力が20/20以上の眼内レンズの観察率はすべての許可された眼内レンズの中で最も高く、FDAのそれらの承認を招く肝心な研究の中で、2種類の最も人気のある乱視矯正人工水晶体の類似患者集団における観察率は約2倍であった(AlconのAcrysof Toricは38.4%、強生のTecennis Toricは43.6%)。また,LAL患者はグレアやハローの発生率が低いことを報告しており,これは良質な眼内レンズがよく報告されている視覚副作用である。
私たちは500目の展望性、ランダム、制御されたマルチセンターの承認後の研究を行っており、これは私たちの上場前の承認(“PMA”)の要求である。被験者はLALまたは単焦点眼内レンズを2:1の割合でランダムに受け入れた。対象者は6ヶ月間追跡されるだろう。結果:エキシマレーザー眼内レンズと単焦点眼内レンズの有効性と安全性を比較する。私たちは2024年に登録を完了する予定だ。
販売とマーケティング
我々は2019年から米国で我々のRxSightシステムを発売し,最初は3000人の外科医を推定し,70%~80%の良質な白内障手術を行うことに集中した。これらの外科医は通常,複数の白内障外科医からなる大型眼科診療所の一部である。彼らは通常LASIKを提供する屈折手術実践があり、より良い視覚結果を提供することに基づく良質な手術の販売を得意としている。私たちのアメリカ商業機関はLDD販売員とLAL顧客マネージャーからなる直販チームと、臨床専門家、現場サービスエンジニアとマーケティング人員を含みます。私たちは私たちの集中した商業組織を通じて私たちの集中した目標市場を効果的にカバーできると信じているが、私たちは時々高い素質の人員と、販売員と臨床専門家の戦略的組み合わせを増加させ、白内障外科医の更なる認識と浸透を推進する。
我々のビジネス努力は、規模の大きいLDD実装基盤を構築することによって、LALプログラム量の持続的な増加を推進し、“カミソリとブレード”のビジネスモデルを作成することを目的としている。LDD販売員は医師との関係を構築し、新しい顧客を得ることを担当している。新しい顧客契約には、通常、約115,000ドルから120,000ドルの間のLDD販売、1個当たり約1,000ドルのLAL販売およびLAL委託契約が含まれる。LDDを装着すると,われわれの臨床専門家は診療所の医師,技術者,スタッフと密接に協力し,訓練された熟練したLAL提供者であることを確認した。著者らのLAL顧客マネージャーはこの過程を監督し、そして持続的に実践に参加し、患者の意識と教育計画、高効率な患者流動プロセスとその他の措置の開発に協力する。白内障外科医の中でRxSightシステムを広く理解するために、著者らは業界と社会会議、教壇講演、ソーシャルメディアと教育ネットワークシンポジウムで販売促進を行い、著者らのRxSightシステムの異なる優勢を重点的に紹介する各種のマーケティング計画を展開した。
私たちのRxSightシステムはメキシコとカナダで規制部門の承認を受けた。私たちは最近流通パートナーを通じてカナダで限られた販売活動を始めました。
研究開発
我々の研究開発活動は,臨床結果の改善,顧客体験の改善,使用適応の拡大,製造コストの低減,ライフサイクル管理の計画に焦点を当てている。FDAが2017年11月に2022年12月31日までに初めて承認して以来、これらの目標の実現を促進するために、約20件の追加承認を受けています。
FDAは2023年1月31日、設備の製造コストを低減するために、LDDのPMAサプリメントの様々な修正を承認した。このような製造コストの低いLDDは,米国以外の国でも承認を提出する必要があると予想される.
2022年12月31日と2021年12月31日までの年度の研究開発費はそれぞれ2600万ドルと2450万ドル。
10
製造と供給
私たちは現在、カリフォルニア州Aliso Viejoにある園区のLALのためのカスタマイズされた注射器システムを含むLALとLDDと様々な付属品を生産、組み立て、テストと輸送しています。この園区には4つの施設があり、総面積は約121,000平方フィートです。著者らは垂直集成の製造戦略を推進し、著者らの製品品質を制御し、強力な研究開発と品質チームを利用して迅速な製品反復を行うことを含む重要な優勢を提供する。私たちの現在の製造能力は、私たちの現在の少なくとも今後12ヶ月以内の予想需要を満たすのに十分だと信じている。
私たちはFDAで医療機器メーカーに登録され、カリフォルニア州の許可を得て、私たちの医療機器を製造·流通することができます。私たちはFDAの品質体系法規(“QSR”)(21 CFR 820)に従って私たちの製品を生産しなければならない。FDAは定期検査によりQSRを実行し,我々サプライヤーの施設を検査することも可能である。私たちは2016年4月から現在カリフォルニア州Aliso Viejoにある工場に引っ越し、これらの工場はFDA、カリフォルニア州、欧州通知機関(イギリス標準協会)に登録され、医療機器の製造と流通に使用されている。
私たちの品質管理システムは国際標準化組織13485:2016年に認証されました。ISO認証には通常,3年ごとの再認証審査,定期的な年度監督審査,定期的な抜き打ち審査が含まれる。著者らはまた、医療機器単一審査計画(“MDSAP”)の品質体系認証を取得し、アメリカ、カナダ、ブラジル、日本とオーストラリアなどの司法管轄区域をカバーした。MDSAP認証は国際標準化組織13485:2016年認証スケジュールに従っている。最近の再認証と監督監査は2022年7月に行われた。
LALはシリカゲル眼内レンズであり,化学成分をカスタマイズした特許混合物から作られている。化学成分サプライヤーは原材料を生産し、私たちはそれを検査、混合、更に精製、加工し、未硬化のシリコーン混合物に調製した。この未硬化シリカゲルを用いて2つの7級クリーンルームの1つの部屋にレンズを成形しました硬化後,成形されたレンズは検査と包装を経て第三者エチレンオキシド滅菌供給者に送られる。消毒後、レンズは最終検査、包装、出荷を行ってくれました。
我々のLDDは紫外線投射医療機器であり,眼前節生物顕微鏡,光治療を行うためのコンピュータコントローラ,生体認識設計の患者インタフェースと手術台からなる。光学素子は、エポキシ樹脂を用いてベースに接着された後、ベーキング硬化され、主光学ハウジングに組み立てられ、独自の精密位置合わせステーション上で最適化される。完成した坊主頭は、コンピュータ、電源、他の電気機械部品とともにテーブルに集積された。LDDで使用しているケーブルと回路基板を認証された専門契約メーカーにアウトソーシングします。完全に組み立てられたLDDは、電気安全と最終検収試験過程を通過し、品質管理審査を経て、梱包し、私たちの顧客に直接インストールします。
また,医師のLAL移植を支援するために,カスタマイズされた挿入システムやコンタクトレンズを含むいくつかの添付ファイルを提供した。挿入システムは,使い捨てカートリッジと再使用可能なシリンジヘッドからなる。使い捨てカートリッジは著者らが加工、検査と包装を行い、同時に第三者サプライヤーがエチレンオキシド滅菌を行う。再使用可能なインジェクタ携帯電話は第三者サプライヤーによって製造され、私たちが検査と包装を行います。再使用可能なコンタクトレンズを製造、検査、包装し、紫外線治療にも使用しています。エンドユーザは,我々が提供した使用説明と実際の操作訓練に応じて注射器携帯電話やコンタクトレンズの清掃·消毒を担当している。また、第三者サプライヤーが製造したカスタマイズUVメガネを提供し、私たちが検査を行い、私たちの施設からお客様に出荷します。
我々は、内部製造と外部調達コンポーネントの組み合わせを使用して、LAL、LDD、カスタマイズ挿入システム、他のアクセサリ製品を生産します。外部調達されたコンポーネントは、合格および承認されたサプライヤーによって提供される既製の化学品、材料、プリント回路基板およびケーブルに組み込まれたマイクロチップ、アセンブリ、およびカスタマイズされた部品を含む。私たちはまた第三者消毒業者を招いた。いくつかの構成要素は単一のソースまたは唯一のソースの供給者によって提供される。私たちの任意の単一ソースコンポーネントを製造または提供することができる他のサプライヤーがありますが、当社のサプライヤーの品質および生産能力を定期的に評価し、適切な場合に供給および品質プロトコルを実行し、ソースコンポーネントの納期および在庫レベルを積極的に管理することによって、単一ソース仕入先のリスクを管理することを求めています。さらに、私たちは現在、二重または複数のソースのいくつかのLAL原材料およびLDDコンポーネントの代替サプライヤーを探して承認しています。私たちは通常、任意の供給中断を緩和し、別の供給源を見つけて同定することができるように、十分な供給レベルを維持することを求めている。外部調達コンポーネントの発注量と納期は我々の予測に基づいており,この予測は歴史的需要と予想される将来の需要に基づいている.注文の大きさ、部品の製造とテストに要する時間、サプライヤーの具体的な要求、および現在の市場の材料、部品、部品に対する需要によって、部品の納期が異なる可能性があります
11
部品です。また、新冠肺炎は、米国、EU、イギリス、中国の単一および唯一の供給元サプライヤーの生産中断を招き、これまでに、選択された製品の前払い、費用の加速、代替サプライヤーからの調達、第三者サプライヤーと特定のチップセットの注文を分離することで、このような状況を緩和し、供給および長期注文を確保することができるようになった。
私たちのサプライヤーは、当社のサプライヤー品質計画の一部として評価、合格、承認を行い、私たちのサプライヤーがFDAおよびISO規格および私たち自身の仕様と要求に適合することを確実にするための検証および監視プログラムを含む。私たちは内部ポリシーと手続き支援の厳しいプロセスの下で外部ソースのコンポーネントをチェックして検証します。私たちは、事前審査と承認を受けずに、いかなる製品やプロセスの変更も実施されないことを保証するために、厳格な変更制御政策を堅持します。
第三者精算と患者料金
双方向支払いモード
米国では、CMSは、乱視矯正および老花矯正(高級)IOLによって提供される追加の屈折矯正が保証福祉に属さないことを決定している。CMSの2つの裁決(CMS 05−01とCMS 1536−R)に記載されているように,プレミアムIOLはカバーの側面もあれば,非カバーの側面もあり,“両面支払いモード”にフレームワークを提供している。2005年から、このモードはCMSが医者或いは機関に良質なIOLと関連する追加費用を精算しないことを意味し、同時に伝統的なIOL手術の費用をカバーする。対照的に、良質なIOLを選択した患者は、医師および施設からの追加費用を担当し、これらの費用は、これらのプロバイダの各々によってCMSに提出された従来のIOLによって挿入された従来の費用を超える。CMSは2017年までにLALを乱視矯正(プレミアム)IOLとして認め,両面支払いモードに適合させた。多くの商業支払者は連邦医療保険の規定を反映しているが,これは支払者によって異なる可能性がある。
プログラムコードと支払い
米国では主に外来外科センター(ASC)にLAL製品を販売し,たまには病院にも販売している。これらの顧客は、商業支払人、州と政府支払人、および患者と医師が各患者に直接提供するサービスに課金するなど、様々な第三者支払者にさらに様々な第三者支払者を提供する。
第三者支払者は、医師および病院に、米国医学会(AMA)によって作成および維持された現在のプログラム用語またはCPTコードを使用して、補償を求めるサービスを識別するように要求する。白内障手術で最もよく見られる特定のCPTコードは66984(ステージ上で眼内レンズ手術を行う)と66982(白内障手術,複雑)である。これらのコードに関連する施設費用は、150ドルまでの伝統的な眼内レンズの支払いを含む。この機構は、良質なIOLのみが追跡目的に使用されていることを示すために、CMSクレームに特定のHCPCSコードをリストしている(V 2787またはV 2788はそれぞれIOLの乱視矯正または老花矯正機能のために使用されている)。同様に、医師は、屈折不正の矯正に関連する延長ケア費用を示すために、Medicare(または他の第三者)に対する彼らのクレームにHCPCSコードA 9270(非引受品またはサービス)を含む。
事前受益者通知(“ABN”)またはMedicare Benefitsの通知(“NEMB”)を受ける必要はないが、ほとんどのプロバイダは、CMS(または非Medicare支払い者)がプレミアムIOLに関連する追加料金をカバーしないように患者に警告し、患者がこれらの費用を支払うことに同意するようにABNまたはNEMB通知を発行する。そして,医師とASCはこれらの費用の請求書を患者に直接発行する。場合によっては、医師は患者にのみ料金を請求し、その後、追加の良質な眼内レンズ費用をASCに精算する。
商業支払人と政府計画の保証範囲
双方向支払いモデルは15年以上使用されているが,商業保険などの非政府第三者支払者と管理する医療機関ではこのモデルを使用する程度が異なる可能性がある。第三者決済者の決定は、他の支払人もこのモデルに従うことを保証することはできない。したがって、保証範囲決定プロセスは、製造業者が各支払者に製品を使用するための追加的なサポートを個別に提供することを要求することができる。これは時間のかかるプロセスである可能性があり、両方のモデルが一貫して適用されることは保証されない。
アメリカ国外の精算
国際市場では,精算や医療保険支払い制度も国によって異なり,多くの国で特定製品や療法に価格上限が設定されている。多くの国では、すでに二重CMS裁決のような決定を下し、国家衛生システムが白内障手術を部分的にカバーすることを許可し、患者は自腹を切って良質なIOLと関連する屈折サービスを購入する。他の国ではこの二重身分は
12
発行を許可せず,良質な眼内レンズを使用すれば,患者は白内障手術と眼内レンズのすべての費用を支払わなければならない。このような市場では,医師は白内障手術の一部ではなく,光線治療の費用を単独で徴収する可能性がある。この方法は、米国で現在使用されている課金方法とは異なる課金方法を使用する必要があり、米国では、LALを購入する際に光処理を含む。これらの方法が許容されるか、または十分な支払いレベルが決定されることは保証されず、第三者支払者の補償政策が製造業者の製品を販売する能力に悪影響を与えない保証もない。
知的財産権、ライセンス契約、その他の材料協定
私たちの成功は、私たちの特許権を含み、私たちの商業秘密を秘密にし、侵害、流用、あるいは他の方法で他人の知的財産権を侵害することなく運営し、他人の侵害、流用、あるいは他の方法で私たちの知的財産権を侵害することを防止する能力があるかどうかにかかっています。私たちは特許、商標、商業秘密、著作権、その他の知的財産権と措置によって、私たちの業務に重要だと思う製品と技術を保護します。私たちはまた独自技術と持続的な技術革新に依存して私たちの競争地位を発展させて維持する。
私たちの政策は、アメリカやアメリカ以外の管轄地域で、私たちの技術、発明、改善、製品に関連する特許保護などの方法を求めて獲得することによって、私たちの特許地位を保護することであり、これらの技術、発明、改善、および製品は、私たちの業務発展と実施に重要である。私たちの特許の組み合わせは、LDD、LAL、および関連デバイスおよび方法の様々な態様をカバーしています。
個別特許の期限は特許を取得した国の法的期限に依存する。一般に、米国では、発行された特許の有効期限は、最初に主張された非一時的または特許協力条約(“PCT”)出願日から20年である。場合によっては、特許期間は、FDA規制審査期間(特許期限延長、またはPTE)によって実際に失われた期限、またはその両方を示すために、米国特許商標局(“USPTO”)、特許出願を審査する際(特許期限調整、またはPTA)によって延長されてもよい。さらに、特許が最終的に放棄された場合、以前に提出された特許ではなく、特許期間が短縮される可能性がある。しかし、特許の寿命と提供される保護は限られている。さらに、私たちの未決または未来の出願が任意の特許を付与すること、または発行された任意の特許が私たちの現在と未来の製品を十分に保護することを保証することはできない。私たちはまた、私たちが所有または許可された特許において許容または強制される可能性のあるクレームの広さ、またはそのようなクレームが発行された場合、私たちの製品をカバーするか、十分な競争相手保護を提供するか、または他の方法で任意の競争優位性を提供するかどうかを予測することができない。私たちが将来所有するか、または許可された任意の発行された特許は、挑戦、無効、縮小、強制執行不可能、侵害、または回避される可能性がある。
2022年12月31日現在、私たちの特許権は、私たちのLALとLDD、レンズ調整プログラムおよび他の技術を含む、私たちのプログラムと技術の様々な側面についてです。発行または承認された米国または外国特許は、可能な特許期限の調整または延長を考慮することなく、2023年から2041年までの異なる日に満了する予定であり、すべての適切な保守、更新、年金、および他の政府費用が支払われると仮定する。以下に示すように、我々の特許組み合わせのいくつかの部分のさらなる詳細については、以下に示すように、我々が所有および独占的に許可された発行された特許および特許出願を含む。
我々が2015年10月29日にQAD,Inc.(以下“QAD”)と締結した合意(“QADプロトコル”)によると,我々は,我々の実装ソフトウェアの実際の位置で何らかのQADソフトウェアを使用できる非排他的で譲渡不可能な永久許可を得た.契約に基づき、このようなQADソフトウェアを個人注文(“調達注文”)で購入し、それぞれ
13
購入注文にはそれぞれの支払い費用と維持費があります。我々はQADプロトコルで許可されたソフトウェアを用いて在庫、出荷、受信、販売注文、作業注文、計画、財務取引を行います。ソフトウェアのメンテナンスはQADによって提供されており,我々は毎年購入することができ,この購入は協定の初年度に強制的である.1年目以降、本プロトコルに従って購入されたメンテナンスは、任意の更新期間の有効日の60日前に終了しない限り、1年間自動的に更新されます。また,QADソフトウェアの使用を検証するためのQAD審査権を付与し,このような監査を行った後,QADソフトウェアの使用が我々の許可範囲を超えていれば,コンプライアンスに必要な金額をQADに支払う義務がある。QADは、ソフトウェアに限られた保証を提供し、QADソフトウェアのすべての知的財産権を保持していますが、私たちが行った任意の修正を使用する許可を得ます。事前に終了しない限り、QADプロトコルの期限は永久的である。便宜上、双方は90日前に他方に合意の終了を書面で通知する権利があり、この終了は付与されたライセンスに影響を与えない。プロトコルのいずれか一方が合意に深刻に違反し,所定の期限内に是正されていない場合,プロトコルのいずれか一方は通知の下でプロトコルを終了することができる.また、いずれか一方が破産または役人を任命してその財務事務を管理すると判定された場合、いずれか一方は終了することができる。事情が終わったら、私たちはすべてのソフトウェアの使用を直ちに停止しなければならない。
私たちは私たちの技術と現在と未来の製品に関連するいくつかの技術的ノウハウと商業秘密を持っていると信じています。私たちは私たちの現在と未来の製品に関連する技術のいくつかの側面を保護するために商業秘密に依存している。しかし、商業秘密と技術的ノウハウを保護することは難しいかもしれない。私たちは、従業員、コンサルタント、科学コンサルタント、サービスプロバイダ、請負業者と秘密協定を締結することで、私たちのビジネス秘密およびノウハウを部分的に保護しようとしていますが、これらの合意は意味のある保護を提供できない可能性があり、私たちがすべての適用可能な取引相手とこのような合意を実行したことを保証することはできません。このような合意はまた違反される可能性があり、私たちはこのような違反に対応するための十分な救済策を持っていないかもしれない。また、私たちは私たちのビルの実体安全と、私たちの情報科学技術システムの実体と電子安全を維持して、私たちの資料と商業秘密の完全性とセキュリティを維持することに力を入れています。私たちは私たちのビジネス秘密およびノウハウを保護するための措置を取っているにもかかわらず、第三者は私たちのビジネス秘密およびノウハウを独立して開発または他の方法で取得することができる。
知的財産権に関するリスクに関するより多くの情報は、本年度報告第I部第1 A項の“リスク要因−知的財産権に関するリスク”を参照されたい。
競争
眼科手術市場の競争は非常に激しく、主に技術革新と世界各地の肝心な市場で製品の商業化に必要な監督管理許可によって推進されている。新しい製品や改善された製品を開発することは、既存製品の魅力を低下させ、商品状態に低下させ、甚だしきに至っては時代遅れにする可能性がある。私たちの市場での主な競争要因は
ビジネスの観点から見ると、私たちの白内障人工水晶体市場における主要な競争相手はエルコン、ジョンソン、博士倫を含む良質な人工水晶体サプライヤーに代わることであると考えられる。市場範囲によって、全世界の白内障人工水晶体市場は高度に集中し、この3社はアメリカのハイエンド白内障手術市場の約78%を占め、全世界のメーカー市場収入の約61%を占めている。私たちの競争相手は私たちよりずっと大きくて、もっと多くの財務、マーケティング、販売と人的資源、より良いブランド認知度を持っています
14
より長い運営の歴史があります私たちの効果的な競争能力は、私たちが必要な商業インフラを建設する能力に依存し、私たちのRxSightシステム独特の価値に対する人々の認識を効果的かつ経済的に効率的に推進すると信じている。
また,LALを受けた患者は最終的にロックされるまで紫外線保護眼鏡の装着を要求され,術後約4−5週間である。従来の白内障手術と比較して,2回から3回の診療所を受診する必要がある。追加診療所受診は非手術であるが,確実に患者の目を大きくする必要がある。これらの追加要求により,LALの市場受容度が影響を受ける可能性がある.
白内障治療に許可された3種類の最も人気のある良質な眼内レンズはエルコンのPanoptix,エルコンのVivitiとジョンソンのTecnisである。市場範囲2022年のプレミアム報告によると、エルコン、ジョンソン、博士倫は上位3大人工水晶体メーカーであり、2022年の世界のハイエンド人工結晶市場における収入シェアはそれぞれ約51%、25%と2%と予想される。PanoptixとTecnisシリーズの眼内レンズには、単焦点Toric、多焦点Toric、EDOF Toricの3種類のバージョンがある。これらのレンズのPCとToricバージョンは2022年に販売されたすべての良質多焦点眼内レンズの半分以上を占めている。残りの市場シェアはいくつかの規模の小さい会社が共有しており、どの会社の市場シェアも5%未満だ。技術的には,LALは従来の良質乱視矯正と良質老花矯正レンズを含むほとんどの既存のIOLと競合していると考えられる。
政府の監督管理
私たちの製品と運営はFDAが連邦食品、薬物と化粧品法案(“FDCA”)とその実施条例、アメリカの他の連邦、州と地方監督機関、外国規制機関による広範かつ持続的な監督管理を受けている。FDAは米国の製品設計と開発、臨床前と臨床試験、製造、包装、ラベル、貯蔵、記録保存と報告、承認或いは承認、マーケティング、流通、販売促進、輸出入と発売後の監督などの方面に対して監督を行い、予想される使用される医療製品の安全性と有効性を確保する。
FDAの医療機器の規制
適用免除が適用されない限り、米国の商業流通の各新しいまたは重大な改装された医療機器は、FDCA第510(K)条(510(K)許可とも呼ばれる)に従って商業流通許可を得るか、またはPMA申請に対するFDAの承認を得る必要があることをFDAに通知する必要がある。510(K)許可およびPMAプロセスの両方は、リソース集約型、高価かつ冗長である可能性があり、免除がない限り、多くの使用料を支払う必要がある。
FDAは,個々の医療機器に関するリスクの程度や安全性と有効性を合理的に保証するために必要な制御程度に応じて,医療機器をI類,II類あるいはIII類の3つに分類している。
クラスIデバイスは、FDAの医療デバイスに対する一般的な制御を遵守することによって、その安全性および有効性を合理的に確保することができるデバイスであり、これらの制御は、品質システム法規またはQSRに反映されるようなFDAの現在のデバイスの良好な製造実践に適合する適用部分、機関登録およびデバイスリスト、不良イベントおよび障害の報告、ならびに適切、真および非誤解性のラベルおよび宣伝材料を含む。一部のI系デバイスは、Iクラス予約デバイスとも呼ばれ、FDAが以下に述べる510(K)上場前通知プログラムによる上場前承認を行う必要もある。ほとんどのタイプのI製品は発売前の通知要求に制限されていません。
第2のタイプのデバイスは、デバイスの安全性および有効性を保証するために、FDAの一般的な制御およびFDAによって必要とされる他の特別な制御を受けるデバイスである。これらの特殊な制御は、性能基準、患者登録、製品固有のFDAガイドファイル、特殊ラベル要件、および発売後の監視を含むことができる。II類設備の多くは510(K)上場前通知プログラムを介してFDAの上場前審査と承認を受けなければならない。
クラスIIIデバイスは、生命を維持または維持するデバイス、または移植可能デバイスなど、FDAが最大のリスクを構成すると考えられるデバイスと、510(K)プロセス後に実質的に同等ではないと考えられるデバイスとを含む。クラスIIIに関連するリスクレベルのため,FDAの一般的な制御や特別な制御自体は,それらの安全性や有効性を確保するには不十分である。クラスIIIに配置されたデバイスは、一般に、デバイスの安全性および有効性を証明するためにPMA申請を提出する必要があり、この出願は、発売前にFDAの承認を得る必要があるか、または510(K)を受けて最初から分類される必要があり、デバイスをクラスIまたはクラスIIに再分類することが規定されている
15
PMA承認プロセスは、通常、510(K)プロセスよりも高価で時間がかかる。PMA出願過程では,出願人はデータと情報を提出しなければならず,当該装置の期待用途の安全性と有効性が合理的に保証され,FDAを満足させなければならない。そのため、PMA応用は通常、設備設計と開発に関する大量の技術情報、臨床前と臨床試験データ、製造情報、ラベルと財務開示情報を含むが、これらに限定されず、設備研究中の臨床研究者の使用に供する。PMA出願は、FDAがその期待用途に対する安全性および有効性が合理的に保証されていることを満足的に証明するために、有効な科学的証拠を提供しなければならない。
新しい医療デバイスが510(K)販売前通知プロセスに適合していない場合、それと実質的に同等の述語デバイスを決定できないので、デバイスは自動的にIIIクラスに分類される。1997年の“食品·医薬品局現代化法案”は、述語デバイスがないためにIIIクラスに自動的に分類される低リスクから中等リスクまでの医療デバイスのために、“自動IIIクラス指定の評価要求”と呼ばれる、市場に参入する新しいアプローチを確立するか、または最初から分類プロセスを開始する。このプロセスは、その新しいデバイスがクラスIIIに自動的に分類される製造業者が、そのデバイスが低または中リスクが存在することに応じて、PMAの提出および承認を必要とすることなく、その医療デバイスをクラスIまたはクラスIIに格下げすることを要求することを可能にする。製造業者がクラスIIに再分類することを求める場合、製造業者は、医療機器の安全性と有効性を合理的に保証するために必要な特別な制御の提案草案を含まなければならない。FDAが510(K)計画に適した合法的に市販されている述語デバイスを決定した場合、またはデバイスが低~中リスクであり、PMAを必要としないと判断した場合、または一般的な制御措置がリスクを制御するのに不十分であり、特別な制御措置を開発することができない場合、FDAは再分類申請を拒否する可能性がある。
FDAのマーケティング許可を得て、最初から分類を下げたり、医療設備を承認したりすることは高価で不確定であり、数年かかるかもしれず、通常大量の科学と臨床データを必要とする。
装置の流れを調べる
米国では、いくつかの限られた例外がなければ、医療機器の承認または承認を支援するためのヒト臨床試験にはIDEアプリケーションが必要です。あるタイプの研究には“非重大なリスク”が存在すると考えられ,ある要求を解決し,IRBの承認を得ると,承認された統合開発環境があると考えられる。FDAの定義によれば、このデバイスが人間の健康に“重大なリスク”を構成する場合、スポンサーはFDAにIDE申請を提出し、人体臨床試験を開始する前にIDEの承認を得なければならない。IDEアプリケーションは、動物および実験室テスト結果のような適切なデータサポートを必要とし、人体上でデバイスをテストすることが安全であり、テストスキームが科学的に合理的であることを示している。特定の数の被験者の場合、IDEアプリケーションは、FDAの承認を事前に取得しなければなりません。通常,IDE申請がFDAの承認を得ると,研究案やインフォームドコンセントが臨床試験地点の適切な機関審査委員会の承認を得て,重大なリスク機器の臨床試験を開始することができる。IDEの提出は、IDEの承認が特定の数の被験者の臨床試験を可能にすることを許可しているにもかかわらず、IDEの提出が臨床試験を開始する能力をもたらす保証はないが、これは、試験が予想される成功基準を満たしていても、製品の安全性および有効性を証明するのに十分であると考えられる。
すべての臨床試験はFDAのIDE法規に従って行わなければならず、この法規は研究設備のラベルを管理し、普及を禁止し、研究スポンサーと研究調査者の一連の記録保存、報告と監督責任を明確にした。臨床試験は更にFDAの良好な臨床実践規定に符合し、機関審査委員会の許可を得、そしてインフォームドコンセントと他の人類被験者の保護を得なければならない。必要な記録と報告書はFDAの検査を受けなければならない。
臨床試験の結果は不利である可能性があり、あるいは、予想される安全性および有効性の成功基準に達しても、FDAに製品の発売を承認または承認させるのに十分ではないと考えられる可能性がある。様々な理由により、任意の臨床試験の開始または完了が延期または一時停止される可能性があり、または以下の理由を含むが、PMA出願の承認をサポートするのに十分ではない
16
510(K)承認プロセス
510(K)フローによれば、製造業者は、当該装置が法規で定義されている合法的に上場する予測装置と“基本的に等”であることを証明するために、上場前通知をFDAに提出しなければならない。
判定装置とは,発売前に承認されなかった合法的な上場装置,すなわち1976年5月28日までに合法的に発売され,PMAを必要としない装置(修正前装置)であり,クラスIIIからクラスIIやI類に再分類された装置,あるいは先に510(K)過程でほぼ同等の装置が発見された装置である。述語デバイスの場合、1つのデバイスが同じ予期される用途を有し、(I)同じ技術的特徴、または(Ii)異なる技術的特徴を有するが、510(K)の提出書に提供される情報は、デバイスが述語デバイスとは異なるセキュリティまたは有効性の問題を引き起こさないことを示す場合、デバイスは実質的に等しいとみなされる。臨床データは時々必要であるが、必ずしも必要ではなく、実質的な等価性を支持する。
FDAが510(K)の上場前通知を受ける前に実質的な審査を行う前に、FDAは、提出された文書が最低許容可能閾値を満たすかどうかを最初に評価する。FDAが510(K)に提出された文書が実質的な審査に必要な情報が不足していると判断した場合、FDAは、実質的な審査を可能にし、実質的な等価性について決定するために必要な情報として、FDAが“受け入れを拒否する”手紙を発行する。出願人は、提出された情報を追加的に検討するために、要求された情報を提出しなければならない。510(K)提出が実質的な審査を受けた場合、医療機器ユーザ料金修正案は、FDA審査510(K)が提出した業績目標を90日間に設定するが、FDAが審査中に問題を提起したり、より多くの情報を提供することを要求したりする場合、審査時間が遅れる可能性がある。実際の問題として、通関には通常より長い時間がかかり、通関は決して保証されないだろう。そのため、実際の問題として、通関には通常90日以上の時間がかかる。多くの510(K)計画の発売前通知が臨床データなしに承認されているにもかかわらず、FDAは決定するために臨床データを含むさらなる情報を必要とする可能性がある
17
実質的な等価性については、これは審査過程を大幅に延長する可能性がある。FDAが装置が実質的に等価であることに同意する場合、それは装置が商業的に販売されることを許可するであろう。
FDAがデバイスが“実質的に同等”の述語デバイスではないと判断した場合、またはデバイスが自動的にクラスIIIに分類された場合、デバイススポンサーは、PMA承認プロセスにおけるより厳しい発売前要求を満たすか、または最初からのプロセスによってデバイスの再分類を求めなければならない。製造業者が適切な判定装置を決定できず、装置の新しい装置または新しい用途に中程度または低リスクがある場合、製造業者は、直接最初から審査する請願書を提出することもできる。
医療機器は承認または承認された適応に基づいてしか販売できない。デバイスが510(K)許可を取得した後、そのセキュリティまたは有効性に著しく影響を与える可能性のある任意の修正、またはその予期される用途を構成する新しいまたは重大な変化の任意の修正は、新しい510(K)許可を必要とするか、または修正によっては、PMA出願または最初から分類を開始する必要がある場合がある。修正がこのような変更を構成するかどうかに関する決定は、最初に製造業者によって既存のFDAガイドラインを使用して決定されるが、FDAは、修正された製品の規制状態を評価するために、この決定を随時再検討することができ、新しい510(K)許可またはPMA承認を得るまで、製造業者に販売を停止し、修正された装置をリコールするように要求することができる。FDAが既存のデバイスの修正が新しい上場前提出を必要とするかどうかに関する製造業者の決定に同意しない場合、FDAは、PMA出願510(K)の承認または承認を得るまで、製造業者に販売停止および/または修正されたデバイスのリコールを要求することができる。製造業者たちはまた規制部門の巨額の罰金や処罰を受ける可能性がある。
PMA承認プロセス
PMA出願を受信した後、FDAは、実質的な審査を可能にするために、申請が十分に完全であるかどうかを決定するために行政審査を行う。そうでなければ、機関はPMAの提出を拒否するだろう。もしそうであれば、FDAは届出申請を受け入れ、実質的な審査を開始するだろう。規制および法規によれば、FDAは、出願の審査がより長い期間に生じることが多いにもかかわらず、180日間の審査が提出されたPMA出願を有する。この審査の間、FDAは、提供された情報をより多く提供することを要求するか、または提供された情報を明らかにすることを要求することができ、FDAは、FDAによって伝達された欠陥に応答するように、出願人に重大な欠陥手紙を発行することができる。出願人が合計360日以内にFDAの情報要求(例えば、重大な欠陥手紙)を返信できなかった場合、FDAは、PMAまたはPMA補充剤が自発的に撤回されたと考えている。PMAを承認または拒否する前に、FDA諮問委員会は、公開会議でPMAを審査し、FDAが提出を承認すべきかどうかに関する委員会の提案、承認または承認しない提案をFDAに提供することができる。FDAは諮問委員会の提案に制限されていないが、それは決定を下す時にこれらの提案を慎重に考慮するだろう。
PMAを承認する前に,FDAは臨床試験データや臨床試験地点の検査,製造施設やプロセスの検査を行うことができる。全体的に、PMA出願に対するFDAの審査には通常、1~3年が必要であるが、より長い時間がかかる可能性がある。FDAは、多くの理由で、PMA出願の承認を延期、制限、または拒否することができる
FDAがPMAの評価に有利である場合、FDAは、PMAの最終承認を保証するために、一般に満たされなければならないいくつかの条件を含む承認状または承認状を発行するであろう。これらの条件がFDAによって満足された場合、この機関はPMA批准書を発行し、当該設備が商業マーケティングを行うことを許可するが、承認条件と承認書に規定されている制限を遵守しなければならない。PMA申請または製造施設に対するFDAの評価があまり有利でない場合、FDAは、PMAの承認を拒否するか、または承認できない書簡を発行する。FDAはまた、追加の試験または臨床試験を行う必要があると判断することができ、この場合、PMAの承認は、数ヶ月または数年延期される可能性があり、同時に試験を行い、PMAの修正案にデータを提出するか、またはデータが利用可能なときにPMAを撤回して再提出する可能性がある。PMAプロセスは高価で、不確定で長い可能性があり、多くの他の会社がFDAの承認を求めた設備はFDAの上場承認を得たことがない。
18
PMAプロセスによって承認されたデバイスの製造プロセス、デバイスまたは施設、品質制御プログラム、滅菌、パッケージ、有効期限、ラベル、デバイス仕様、成分、材料または設計には、新しいPMAアプリケーションまたはPMA補充物が必要である。PMAサプリメントは、一般に、初期PMA出願と同じタイプの情報の提出を要求するが、補足物は、承認されたPMA出願がカバーする装置の任意の変更をサポートするために必要な情報に限定され、提案された変更の性質に応じて、広範な技術または臨床データまたは諮問グループを必要とするか、または必要としない場合がある。
PMA出願を承認する際に、承認の条件として、FDAはまた、申請者が特定の患者集団を追跡研究または追跡し、必要に応じてこれらの患者の臨床状態をFDAに定期的に報告して、公衆の健康を保護するため、または装置のための追加的またはより長期的な安全性および有効性データを提供するために、何らかの形態の承認後研究または上場後監視を行うことを要求する可能性がある。FDAはまた、インプラントまたはデバイスユーザ施設の外で使用される生命を維持するか、または生命を維持するデバイスのような510(K)通知で許可されたいくつかのデバイスの上場後監視を要求することができる。FDAはまた、PMA出願を承認し、装置の安全および有効性を保証するために、他の承認後条件を追加することができ、例えば、他に加えて、ラベル、販売促進、販売、流通、および使用を制限することができる。PMAプロセスで承認された設備の製造プロセス,ラベル,設計を重大に修正するには,発売前に新たなPMA申請やPMA補充を提出する必要がある可能性がある。
FDAが行っている規制は
FDAが1つの装置の発売を許可した後も、多くの規制要求が適用されるが、これらに限定されない
デバイスが510(K)許可を取得した後、そのセキュリティまたは有効性に著しく影響を与える可能性のある任意の修正、またはその予期される用途を構成する可能性のある重大な変化は、新しい510(K)または可能なPMAを必要とするであろう。FDAは各メーカーに最初にこの決定を行うことを要求しているが、FDAはどのような決定も審査することができ、メーカーの決定に同意しなくてもよい。FDAが私たちが新しい510(K)承認を求めない決定に同意しない場合、FDAは510(K)の承認または可能なPMAを求めることを要求する可能性がある。FDAはまた、510(K)の許可を得るまで、またはPMAを取得するまで、マーケティングおよび流通および/または修正されたデバイスのリコールを停止することを要求することができる。しかも、このような状況で、私たちは巨額の規制罰金と処罰を受けるかもしれない。
19
承認されたPMAデバイスのいくつかの変更は、適応、ラベル、または製造プロセスまたは施設の変更を含み、変更を実施するためには、新しいPMA申請またはPMAサプリメント(場合によっては)を提出し、FDAの承認を得る必要がある。PMAの補足は、一般に、元のPMA申請を提出するために必要な同じタイプの情報を必要とするが、補足は、通常、元のPMAによってカバーされるデバイスの提案変更をサポートするために必要な情報に限定される。FDAは,PMAサプリメントを審査する際に,原始PMA申請を審査するのと同様の手順と行動を使用する。
FDAの規定は私たちがFDAで医療機器メーカーに登録することを要求する。さらに、いくつかの州はまた、州で業務を行う医療機器製造業者および/または流通業者が州ライセンスを州に登録または申請することを要求しており、これは、QSRおよび任意の適用可能な州要件に適合することを保証するために、私たちの施設が州検査およびFDAの定例検査を受けることを可能にするかもしれない。これらの規定は私たちの製品を生産し、規定された方法で製造、テスト、制御活動に関連するファイルを保存することを要求します。さらに、FDAは私たちにラベルに関するFDAの様々な規定を遵守することを要求する。私たちまたは私たちのサプライヤーが適用される規制要件を遵守できない場合、FDAまたは州当局が法執行行動を取る可能性があり、その中には以下のいずれかの処罰が含まれている可能性があります
新たに発見または開発されたセキュリティまたは有効性データは、新たな警告や禁忌症を増加させることを含む製品のラベルを変更する必要がある場合があり、他のリスク管理措置を実施する必要がある可能性もある。さらに、新しい立法によって生成された要求を含む新しい政府要求が確立される可能性があり、またはFDAの政策が変更される可能性があり、規制部門が私たちが開発している製品の承認または承認を延期または阻止する可能性がある。
我々の施設,記録,製造プロセスはFDAの定期不定期検査を受けている。適用される米国の医療機器規制要件を遵守しないことは、警告状、命名されていない手紙、罰金、禁止、同意法令、民事処罰、意外な支出、修理、交換、払い戻し、製品のリコールまたは差し押さえ、経営制限、生産の全部または一部の一時停止、FDAは、他国での販売のために必要な製品の輸出証明書の発行を拒否し、FDAは、将来の上場前の許可または承認の付与を拒否し、現在の製品の許可または承認を撤回または一時停止し、刑事起訴を拒否する可能性がある。
FDAが検査を行う場合、検査者は、検査観察通知の形態またはFDA 483の形態で、存在すると考えられる任意の欠陥を決定する。検査後に検査意見や欠陥に関するFDAの通知を受けた場合、書面での対応が要求され、FDAまたは他の規制機関の懸念を解決するための是正および/または予防または他の措置が要求されるだろう。FDAの懸念を解決できなければ、警告状や他の法執行または行政行動をもたらす可能性がある。
国際医療機器発売前の許可手続き
EUは多くの指令と標準を採択し、医療機器の設計、製造、臨床試験、ラベルと不良事件報告を規範化した。EU指令93/42/EECによると,医療機器指令(“MDD”)とも呼ばれ,我々の製品はEUで医療機器として規制されている。MDDはEUの医療機器の基本的な規制枠組みを規定している。医療機器を管理するシステムは,医療機器ごとの認証で動作する。認証された各デバイスにはCEフラグが表示されており、これは、デバイスが合格証明書を有することを示す。各加盟国には、その管轄範囲内のミレニアム開発目標の実行状況を監督する主管当局と呼ばれる国家機関がある。以下の要求を実現する手段
20
CEフラグはデバイスの性質によって異なる.設備はその知覚されたリスクによって分類され,米国のシステムに類似している。製品の等級は,製品にCEマークを置く前に必要な適合性評価を決定した。私どもの製品はMDDの要求に応じて適合性評価を行っています。すべての会員国はその管轄範囲内で通知機関を任命することができる。ある加盟国の通知機関が適合性証明書を発行した場合、その装置は、他の加盟国でさらなる適合性試験を行う必要がなく、EU全体で販売することができる。CEマークは、適用される法規とISO 13485規格の品質システム要件を遵守し続けるかどうかに依存する。
新しいEU医療機器法規2017/745、あるいはEU MDRは、2017年5月に発表され、過渡期は3年であり、MDDに代わって、MDDの発売前と発売後の義務を拡大と改正する。EU MDRの申請日は2024年5月26日に延期され,実施日は医療機器のリスク分類に基づいている。最近、欧州委員会は、新規則の移行期間を2024年5月26日から2027年12月31日に延長し、高リスク設備の移行期間を2028年12月31日に延長し、中低リスク設備の過渡期間を2028年12月31日に延長することを含む立法改正提案を提出した。EU MDRは医療機器製品の臨床評価過程、安全性、分類と性能に対して追加的な要求を提出する。EU MDRの登録が行われており、実施日までに完了する予定であるため、EU MDRは私たちの現在と未来の製品に影響を与えないだろう。同社はMDRアップグレード評価により、何の観察結果もなく、2021年12月に欧州通知機関の認証勧告を採択した。FDAや他の規制機関の検査に加え,我々が設計·製造した医療機器および我々が協賛する臨床試験の規制要求に適した欧州通知機関の定期検査を受けている。米国、カナダ、日本、ブラジルなどの管轄地域の医療機器単一審査計画(MDSAP)認証も通過しました, オーストラリアとは、これらの管轄区域の品質システムをカバーするために、通知機関による単一監査を許可する。イギリスのEU離脱(Brexit)とスイスがEUとの共同協定(SwExit)を終了したことによるすべての登録と認証は、これらの国の要求されたスケジュールに従って完了し、これらの過程で公表された更新スケジュールに従って継続される。
他のアメリカの規制事項
医療機器会社は連邦政府およびそれらが業務を展開している州と外国司法管轄区当局の追加医療監督と法執行を受けている。製品の承認または承認後の製造、販売、販売促進とその他の活動は、FDA以外に、CMS、衛生と公衆サービス部の他の部門、司法省、消費財安全委員会、連邦貿易委員会、職業安全と健康管理局、環境保護局、州と地方政府を含む米国の多くの監督管理機関の規制を受けている。例えば、米国では、販売、マーケティング、科学教育プロジェクトはまた、州および連邦の詐欺および乱用、虚偽声明のリベート、透明性、政府価格報告、反腐敗、および健康情報プライバシーおよびセキュリティ法律法規を遵守しなければならない。国際的には,他の政府もその医療精算計画や医療プロジェクトやサービスの提供について規制を実施している。これらの法律には以下の内容が含まれている
21
22
これらの法律の汎用性、および利用可能な法定および規制免除または避難港の範囲が狭いため、私たちと相談協定を締結した医師に支払われる株式オプション報酬など、私たちのいくつかの活動は、1つまたは複数のこのような法律の挑戦を受ける可能性がある。私たちの業務や販売組織の成長やアメリカ以外での私たちの拡張は、これらの法律または私たちの内部政策や手続きに違反する可能性を増加させる可能性があります。多くの法律法規が規制部門や裁判所の十分な説明を受けていないため、その条項には様々な解釈が可能であるため、これらまたは他の法律法規に違反するリスクがさらに増加していることが発見された。これらの法律や法規に違反して私たちに提起されたいかなる訴訟も、弁護に成功しても、巨額の法的費用を招き、経営陣の業務運営への注意をそらす可能性があります。しかも、私たちは個人告発者が連邦や州政府を代表して提起した個人“Qui Tam”訴訟を受けるかもしれない。もし私たちの業務が上記の任意の連邦、州、外国の法律、または任意の現在または未来の詐欺および乱用、または私たちに適用される他の医療保健法律および法規に違反していることが発見された場合、私たちは、損害賠償、罰金、返還、個人監禁、MedicareおよびMedicaidのような政府援助に参加する医療計画から除外された重大な民事、刑事および行政処罰を含む罰を受ける可能性があり、誠実な監督と報告義務、契約損害、名声損害、利益減少と将来の収入、禁止、リコール請求、製品差し押さえ、差し押さえ。全部または部分的に生産停止, 政府契約を含めて製品の承認を拒否したり撤回したり、会社の供給契約を許可したりすることを拒否したり、運営を縮小または停止することを要求される可能性があります。このようなどんな結果も私たちの業務と財政的業績を深刻に損なう可能性がある。
アメリカの医療改革
医療政策の変化は私たちのコストを増加させ、私たちに追加的な規制要求を受ける可能性があり、これらの要求は私たちの現在と未来の解決策の商業化を中断するかもしれない。現在および将来的にヘルスケアをさらに改革したり,医療コストを低減したりする立法提案は,我々の製品の使用に関するプログラムのカバー範囲を制限したり,これらのプログラムの精算を減少させたりする可能性がある。支払者や提供者が実施しているコスト制御措置や,将来実施されるどの医療改革の取り組みの影響も,我々の製品販売の収入を大幅に減少させる可能性がある。米国ACAの実施または廃止の変化を含む医療政策の変化は、私たちのコストを増加させ、私たちの収入を減少させ、私たちの現在と未来の製品の販売、精算、保険に影響を与える可能性がある。ACAのいくつかの側面は公布以来、司法と国会の挑戦を受けてきた。特に、2018年12月14日、テキサス州の地方裁判所判事は、ACA法案全体が違憲であり、税法の一部として国会が“個人強制令”を廃止したと判断した。また、2019年12月18日、米国第5巡回控訴裁判所は、ACAの残りの条項も無効であるかどうかを決定するために、個人強制令が違憲である地域裁判所の判断を維持し、事件を地域裁判所に返送した。2020年3月2日、米最高裁はこの事件の審査を求める移審令の要望書を承認し、2020年11月に口頭弁論を行った。2021年6月、米最高裁はテキサス州と他の挑戦者がACAの法的地位に挑戦していないと判断し、手続きを理由にこの事件を却下したが、ACAの合憲性を具体的に裁くことはなかった。だから、, ACAは現在の形で引き続き効果的になるだろう。最高裁のこの裁決,将来の訴訟,バイデン政府の医療対策がACAや我々の業務にどのように影響するかは不明である。ACAが公布されて以来、会計年度ごとにプロバイダに支払われる医療保険総額の2%の減少と、いくつかのタイプの医療保険提供者への支払い金額の減少とを含む他の立法変化も提案され、採択され、これらの変化は、国会の追加行動なしに2031年まで有効であり、国会が追加行動を取らない限り、2020年5月1日から2022年3月31日まで新冠肺炎の大流行により支払いを停止することを除外する。現在の立法によると、医療保険支出の実際の減少幅は2022年の1%から本自動減額の最終年度の4%まで様々である。また、政府は最近、メーカーが販売する製品の価格設定の仕方をより厳しく審査し、国会で数回の調査を行い、製品価格の透明性を向上させるための立法を提案·公布した。任意の新しい法律を遵守したり、ACAに従って実施された変化を逆転させることは、多くの時間およびコストを費やし、私たちのビジネスに大きな悪影響を及ぼす可能性があります。
米国や一部の外国司法管轄区域は、医療システムを変更するために、いくつかの立法および規制提案を検討または公布しており、その方法は、私たちの製品販売の収益性に影響を与える可能性がある。米国や他の地方の政策立案者や支払者の中では,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上や参入拡大を目指している。現在と未来の医療をさらに改革したり、医療コストを低減する立法提案は、カバー範囲を制限したり、精算範囲を下げたりする可能性がある
23
私たちの製品を使用することに関するプログラム。支払者や提供者が実施しているコスト制御措置や,将来実施されるどの医療改革措置の効果も,我々の製品販売の収入に影響を与える可能性がある。
連邦と州の両レベルの立法者,規制機関,第三者支払者は,個人医療福祉を拡大しながらコスト低減を提案し続けると信じている。その中のいくつかの変化は、私たちの現在と未来の製品が受け取るレート、または私たちの現在と未来の製品が政府機関または第三者支払人から得ることができる精算金額に追加的な制限を加えるかもしれない。現在と将来の医療改革立法と政策は、私たちの業務や財務状況に実質的な悪影響を及ぼす可能性がある。
データのプライバシーとセキュリティ
医療機器会社はアメリカ連邦と州の健康情報プライバシー、安全とデータ漏洩通知法律の制約を受ける可能性があり、これらの法律は健康に関連する情報と他の個人情報の収集、使用、開示と保護を管理する可能性がある。
HIPAAは、“保証エンティティ”(健康計画、医療情報交換センターおよび特定の医療提供者)およびそれらのそれぞれの業務パートナー、保護された健康情報を作成、受信、維持または送信する個人またはエンティティ、および保証エンティティまたはその代表にサービスを提供することに関連する個人またはエンティティに対して、個人識別可能な健康情報に関するプライバシー、安全および違反報告義務を規定する。HIPAAは,米国衛生·公衆サービス部(“HHS”)が影響を受けた個人に何らかの健康情報漏洩事件を報告することを要求し,漏洩の規模が十分大きければメディアに報告する。安全でない保護された健康情報やPHI、プライバシー慣行への苦情やHHSの監査に違反してHIPAAに違反するエンティティが発見され、HHSとの解決合意や是正行動計画が必要であれば、HIPAAに対する不遵守の告発を結び、巨額の民事、刑事、行政罰金および/または追加の報告と監督義務を受ける可能性がある。
HIPAAが適用されない場合でも,消費者の個人情報セキュリティを保護する適切な措置をとることができず,不公平な行為ややり方を構成する可能性があり,連邦貿易委員会法第5(A)条,すなわち“米国法典”第15編第45(A)節に違反する可能性がある。連邦貿易委員会は、ある企業のデータセキュリティ対策が、消費者情報の感度および数、その業務の規模および複雑さ、および安全性の向上および脆弱性を低減するために使用できるツールのコストのために合理的かつ適切になると予想している。個人が識別可能な健康情報は敏感なデータと考えられ,より強力に保護されるべきである。消費者個人情報の適切な保護に関する連邦貿易委員会の指導はHIPAAセキュリティルールが要求するものと類似している。
また、ある州の法律は、場合によっては健康情報のプライバシーやセキュリティを管理しており、その中のいくつかの法律はHIPAAよりも厳しく、その多くの法律は互いに大きく異なり、同じ効果が生じず、コンプライアンス作業を複雑にする可能性がある。実際にまたはこれらの法律を遵守していないと考えられる場合、個人クレーム、要求および訴訟、規制調査および他の訴訟を招き、重大な民事および/または刑事罰および他の救済を適用する可能性がある。例えば、カリフォルニア州は2020年1月1日に施行される“カリフォルニア消費者プライバシー法”(CCPA)を公布した。CCPAは他にも、カバーする会社のための新たなデータプライバシー義務を創出し、その情報を開示しない権利を選択することを含むカリフォルニア住民に新たなプライバシー権を提供する。CCPAはまた、特定のデータ漏洩に対して法定損害賠償を有する個人訴権を作成し、それにより、データ漏洩に関連するリスクを潜在的に増加させる。
また、2020年11月、カリフォルニア州有権者は2020年カリフォルニアプライバシー権法案(CPRA)を可決した。2023年1月1日に施行されたCPRAは、消費者に関連するいくつかのデータの追加義務を増加させ、データ最小化および記憶制限などの追加義務の導入を含むCCPAを大幅に拡張し、個人情報の修正および追加的な選択脱退権利などの消費者に追加的な権利を付与し、法律を実施および実行するための新しいエンティティ、カリフォルニアプライバシー保護局を作成する。CCPAとCPRAは私たちのコンプライアンスコストと潜在的な責任を増加させるかもしれない。CCPAを除いて、他の多くの州の立法機関は、持続的なコンプライアンス努力と投資を必要とする類似の法律を通過または考慮している。
EUにも、EUの一般データ保護条例、またはGDPRを含むEU個人から取得された個人データを収集、使用、処理するための法律や法規がある。これらの法律法規は米国の法律法規よりも厳しく、ある要求を満たさない限り、米国への個人データの移転を制限することが多い。GDPRは、EU加盟国は、遺伝的、生体認証、または健康データの処理を制限する独自のさらなる法律法規を制定することができ、これは、個人データを使用して共有する能力を制限するか、または私たちのコストを増加させ、私たちの業務や財務状況を損なう可能性がある。さらにイギリスのEU離脱は
24
イギリスのデータ保護規制の側面で不確実性をもたらした。我々は,英国の一般データ保護条例と2018年の英国データ保護法に制約されており,GDPRをイギリスの国家法律に保持し,GDPRのような処罰構造を提供している。データプライバシーおよびセキュリティに関連する法律、法規、基準、および他の義務の解釈および適用はまだ不確定であるため、これらの法律、法規、基準、および他の義務の解釈および適用は、私たちのデータ処理実践および政策と一致しない可能性がある。もし私たちのやり方が法律、法規および標準の変化、または既存の法律、法規および標準の新しい解釈または適用と一致しないか、または一致しないとみなされる場合、私たちはまた罰金、監査、調査、通報者の苦情、不利なメディア報道、調査、訴訟、輸出特権の喪失、厳しい刑事または民事制裁、または他の処罰を受ける可能性がある。
従業員と人的資本
2022年12月31日までに、292人のフルタイム従業員がいます。私たちのすべての従業員はフルタイムで、私たちの従業員の中の一人も労働組合によって代表されていないし、集団交渉協定によって保護されている人もいない。
私たちの人的資本目標には、私たちの既存と新しい従業員、コンサルタント、コンサルタントを識別、採用、維持、激励、統合が含まれている。私たちの株式と現金インセンティブ計画の主な目的は、株式と現金に基づく報酬奨励を付与することで、これらの従業員を激励してできる限りのことをし、私たちの目標を実現することで、株主価値と会社の成功を増加させることです。
施設
私たちの会社はカリフォルニア州のAliso Viejoに本社があります。そこで4つの施設を借りて、私たちの本社、製造、研究開発、行政事務室を収容しました。これらの施設のレンタル総面積は約121,000平方フィートです。レンタル契約は以下の日で終了する:(A)2024年9月30日、継続5年を選択することができる;(B)2026年1月31日、各継続5年を選択することができる;(C)2023年3月31日、各5年継続することができる;および(D)2024年8月31日、継続期間5年を選択することができる。私たちは既存の施設が私たちの短期的な需要を満たすのに十分だと信じているが、私たちの発展に伴い、もっと多くの空間が必要だと予想される。私たちは後日商業的に合理的な条件によって、必要に応じて適切な追加的あるいは別の用地を提供すると信じています。
法律手続き
時々、私たちは訴訟や他の法的手続きに巻き込まれるかもしれない。私たちは現在、私たちの経営陣が私たちの業務に重大な悪影響を及ぼす可能性があると考えている訴訟や法的手続きに参加していません。結果にかかわらず、弁護や和解コスト、管理資源の移転などの要因により、訴訟は私たちに悪影響を及ぼす可能性がある。
企業情報
我々は1997年3月5日にカリフォルニア州にCalhoun Vision,Inc.として登録設立し,2016年10月にRxSight,Inc.と改称した。2021年7月6日にデラウェア州に再登録しましたwww.rxsight.comのサイトを維持しています当サイトに含まれている情報は、当10-Kフォーム年次報告書または米国証券取引委員会に提出された他のいかなる文書にも引用されません
25
第1 A項。リスク要因
私たちは多くの不確実な要素と危険が含まれている急速に変化する環境で運営している。本年度報告Form 10-Kに含まれる他の情報に加えて、以下のリスクおよび不確定要因は、当社の業務、財務状況、経営業績または株価に重大な悪影響を及ぼす可能性があります。これらのリスクおよび不確実性、ならびに本10−Kフォーム年次報告書に参照される方法で含まれるまたは組み込まれた他のすべての情報を慎重に考慮しなければならない。以下に説明するリスクと不確実性は、私たちが直面している唯一のリスクと不確実性ではないかもしれない。もし私たちが直面している任意のリスクや不確実性が発生すれば、私たちの証券の取引価格は下落する可能性があり、あなたは投資の全部または一部を損失するかもしれません。このForm 10-K年次報告書には、リスクと不確実性要因に関する前向きな陳述も含まれている。本年度報告の他の部分で“前向き陳述に関する特別説明”と題する章を参照されたい。本報告の以下および他の部分に説明される要因のため、我々の実際の結果は、前向き陳述で予想される結果とは大きく異なる可能性がある。
リスク要因をまとめる
以下のリスクおよび不確実性は、私たちが直面している最も重大なリスクおよび不確実性のうちの1つであるが、本節で決定されたリスクおよび不確実性は、私たちが直面している唯一のリスクおよび不確実性ではなく、本明細書で説明するすべてのリスク要因に完全に適合している
私たちの業務や製品に関するリスク:
知的財産権に関するリスク:
政府の規制に関連するリスク:
26
第三者依存に関連するリスク:
私たちの普通株に関連するリスク:
一般的なリスク要因:
新冠肺炎関連リスク:
私たちの業務や製品に関するリスク
私たちの経営の歴史は限られていて、私たちの販売チームを効果的に訓練し、私たちの販売とマーケティング能力を高めることができなければ、あるいは費用効果のある方法で広範なブランド知名度を発展させることができれば、私たちの成長は阻害され、私たちの業務は影響を受けるだろう。
私たちは1997年3月に登録設立され、2019年下半期から私たちの製品を商業化し、LALとLDDの全面発表を開始しました。したがって、私たちの限られた商業化経験と限られた承認または承認された製品数は、私たちの現在の業務を評価し、私たちの将来性を評価することが困難になる。私たちの現在の販売とマーケティング経験も限られている。もし私たちが効果的な販売とマーケティング能力を確立したり、拡大することができなければ、もし私たちが私たちのいかなる製品を商業化できなければ、私たちは十分な製品収入、持続的な収入増加、そして効果的な競争を生むことができないかもしれない。今後の成長を創出するために、私たちの販売·マーケティングインフラを拡大し、利用して、私たちの顧客基盤を増やし、私たちの業務を発展させる予定です。
合格した販売とマーケティング担当者を探して募集し、私たちの製品、適用された連邦と州の法律法規、そして私たちの内部政策と手続きについて彼らを訓練するには、多くの時間、費用、エネルギーが必要です。販売代表者は通常、十分な訓練を受け、作業効率を向上させるために数ヶ月以上の時間を要する。販売チームの拡大と訓練の努力がそれに応じた収入増加を生むことができない場合、あるいは製品需要が意外に低下した場合にコストを下げることができなければ、私たちの業務は損なわれる可能性があります。才能のある販売とマーケティング担当者を募集、育成、維持することができず、合理的な時間内に予想された生産性レベルを達成できなかった、あるいは適時に私たちの固定コストを利用することは、私たちの業務、財務状況と運営結果に重大な悪影響を与える可能性がある。しかも、私たちの直販チームの会員たちは好きなような職員たちだ。このような人員が競争相手や他の側面に流出することは私たちの業務に実質的な損害を与えるかもしれない。もし私たちの直売者を維持したり、同等の技術専門と資質を持つ人員で彼らの代わりにすることができなければ、あるいは私たちが代替者に技術専門長を注ぎ込むことに成功できなければ、私たちの収入と運営結果は実質的な損害を受ける可能性がある。
私たちが顧客基盤を拡大し、私たちの製品をより広く市場に受け入れることができるかどうかは、マーケティング努力の能力を拡大することにも大きく依存します。もし私たちのマーケティング努力と支出が相応の収入増加をもたらすことができなければ、私たちの業務は損害を受けるかもしれない。また、我々のブランドに対する広範な認識を経済的に効率的に発展させ、維持することは、我々の製品が新たな顧客に広く受け入れられ、浸透するために重要であると考えられる。ブランド普及活動は患者や医師の知名度を高めたり、収入を増加させたりしない可能性があり、あっても、いかなる収入の増加も、ブランドを構築する際に生じるコストや支出を相殺できない可能性がある。もし私たちが私たちのブランドを普及、維持、保護することに成功できなければ、私たちは医者の承認を引き付けることができないかもしれない
27
私たちのブランド建設努力の十分な見返りを実現するためには、あるいは私たちの製品の広範な採用に重要なブランド知名度レベルを達成するためには、そうする必要があります。
これらの要因はまた、機能を増加させ、製品販売コストを低減し、私たちの商業製品の組み合わせを拡大する能力を含む追加製品の開発に成功し、米国または国際市場で当社の計画または将来の製品を商業化、マーケティングおよび販売するために、国内および国際適用法(FDA 510(K)許可または発売前承認またはPMAを含む)に基づいて必要な規制承認および許可を得る能力を含む多くの不確実性の影響を受ける。私たちが直面しているリスクや不確実性に対する私たちの仮定が正しくない場合、あるいは私たちの業務や市場の状況によって変化したり、もし私たちがこれらのリスクにうまく対応していなければ、私たちの運営や財務結果は私たちの予想と大きく異なる可能性があり、私たちの業務は影響を受けるかもしれません。
私たちは純損失の歴史があり、私たちは未来も赤字が続くと予想している。もし私たちが利益を達成したら、私たちは持続できないかもしれない。
私たちは設立以来運営で損失を被っており、将来的には運営による損失を被ることが予想される。2022年12月31日と2021年12月31日までに、私たちが報告した運営損失はそれぞれ6330万ドルと5280万ドルです。これらの損失のため、2022年12月31日現在、私たちの累計赤字は5.46億ドルです。私たちは、製品の採用率を増加させ、顧客との既存の関係を拡大し、私たちの計画または未来の製品のために規制許可または承認を得るためにマーケティング努力を拡大し、私たちの既存と計画中または未来の製品の臨床試験を行い、新製品を開発したり、既存製品に新しい機能を追加したりすることに伴い、引き続き大量の販売とマーケティング、研究開発、監督管理、その他の費用が発生すると予想される。また、上場企業に関連するコストにより、我々の一般的かつ行政的費用が増加すると予想される。
私たちがもたらした純損失は違う時期に変動するかもしれない。私たちは収益性を達成して維持するために相当な追加収入を作らなければならないだろう。私たちが利益を達成しても、私たちは長い間利益を維持していると確信できない。
私たちの持続的な運営と業務の成長を支援するために、私たちは受け入れ可能な条項で私たちに提供できないかもしれない、あるいは全く得られないかもしれない追加の資本の調達を求めるかもしれない。
私たちは、私たちの業務を継続して経営し、私たちのインフラ、商業運営、研究開発活動を拡大するにつれて、今後数年間の資本支出と運営費用が増加すると予想しています。私たちの資本の主な用途は、私たちの商業組織への投資と関連費用、臨床研究開発サービス、実験室と関連用品、法律とその他の規制費用、一般行政コストと運営資本に引き続き使用される予定です。さらに、私たちは将来、私たちの製品の組み合わせを補完または拡大し、私たちの技術能力を強化し、または他の方法で成長機会を提供することができると考えられるより多くの業務、製品、サービス、または技術に買収または投資を求めることができるかもしれません。
これらやその他の要因により,将来的には純損失と運営キャッシュフローが負になることが予想される。私たちの未来の流動資金と資本資金需要は多くの要素に依存するだろう
28
もし私たちが追加的な資金を調達する必要があると判断すれば、私たちは株式や債務融資によって達成されるかもしれないが、必要な時や私たちが有利だと思う条項の下で、私たちはこれらの融資を得ることができないかもしれない。もし私たちが株式または転換可能な債務証券を売却することによって追加資本を調達する場合、私たちの株主の所有権権益は希釈され、これらの証券の条項は清算または普通株主の権利に悪影響を及ぼす他の特典を含む可能性がある。債務融資および優先株融資に関与する可能性のある協定は、追加債務を招く、買収または資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含む。もし私たちが十分な財務資源を維持できなければ、私たちの業務、財務状況、および経営結果は、私たちにいくつかの製品発見と開発活動または将来の商業化努力の延期、制限、減少、または終了を要求する可能性があることを含む実質的で不利な影響を受けるだろう。
しかも、もし私たちが資金を調達するための協力や許可手配に達したら、私たちは不利な条項を受け入れることを要求されるかもしれない。これらの協定は、私たちが製品や技術の権利を放棄することを不利な条項で第三者に与えることを要求するかもしれません。そうでなければ、私たちは自分の製品や技術を開発または商業化したり、将来の潜在的な計画のためにいくつかの機会を維持することを求めます。その時、私たちはより有利な条項を得ることができます。私たちはもっと多くの資金を集めることができないかもしれないし、優遇条件でこのような合意や手配を達成できない、あるいは全くできないかもしれない。我々の追加資金調達能力は、潜在的な世界経済状況の悪化の悪影響を受ける可能性があり、最近持続的な新冠肺炎の大流行、東欧衝突などにより、米国と世界各地の信用と金融市場の中断と変動を招く可能性がある。
2022年12月31日と2021年12月31日までに、それぞれ1.058億ドルと1.593億ドルの現金、現金等価物、短期投資を持っています。私たちの既存の現金、現金等価物、短期投資、および私たちの製品販売によって生成された予想現金は、本10-K表の年次報告日後少なくとも12ヶ月の予想現金需要を満たすのに十分であると信じていますが、必要な時に十分な流動資金を発生させることができることを保証することはできません。さらに、企業が将来アメリカ証券取引委員会に提出された10-Kフォーム年次報告や10-Qフォーム四半期報告書に開示されているように、追加資本を調達したり、追加債務を招いたりする必要はないと予想されているが(有利な場合にはATM施設を使用する機会があるかもしれないが)、私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定を行い、私たちは現在予想されているよりも早く私たちの資本資源を使用することができるかもしれない。変化する状況-その中のいくつかは私たちの制御を超えているかもしれない--私たちの資本消費速度は私たちの現在の予想よりも大きく速く、私たちは計画よりも早く追加資金を求める必要があるかもしれない。私たちはあなたに私たちが必要な時に十分な流動性を作ることができるということを保証することができない。
29
米国の信用格付けの引き下げを含む世界経済、政治、市場状況は、私たちの収入増加と収益力を含む、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
現在のグローバル経済·金融環境、および米国や世界各地の様々な社会·政治的緊張は、市場変動を激化させる可能性があり、米国や世界金融市場に長期的な影響を与える可能性があり、米国や世界経済の不確定または悪化を招く可能性がある。格付け機関が米国政府の主権信用格付けやその公認された信用を引き下げ、政府が閉店する可能性のある影響は、米国や世界の金融市場や経済状況に悪影響を及ぼす可能性がある。米国の債務上限と予算赤字への懸念は、信用格付けのさらなる引き下げ、経済減速、米国経済の衰退の可能性を増加させた。また、連邦予算をめぐる食い違いは米連邦政府の一時停止を招いた。持続的な不利な政治的および経済的状況は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
世界経済状況の悪化は世界金融市場の不安定を招き、インフレと金利上昇、欧州と新興市場司法管轄区域のいくつかの国の巨額の主権債務と財政赤字、欧州銀行貸借対照表上の不良融資レベル、イギリスのEU離脱の影響、資本市場の不安定および新冠肺炎が大流行している可能性があることを含む。
米国と世界各地の様々な社会·政治環境(戦争や他の形態の衝突、テロ行為、安全行動および火災、洪水、地震、竜巻、ハリケーン、世界衛生流行病などの壊滅的な事件を含む)も、米国と世界各地の市場変動や経済不確実性または悪化を悪化させ、私たちの業務、財務状況、運営結果、見通しに実質的な悪影響を及ぼす可能性がある。
私たちが改訂した定期融資条項は、私たちの経営と財務柔軟性に制限を加え、定期ローンを管理する協定の契約やいくつかの条件を守らなければ、私たちの返済義務の加速と私たちの質資産の担保償還権の廃止を招く可能性があり、これは私たちの流動性、財務状況、経営業績、業務と見通しを深刻に損害し、私たちの証券価格を下落させる可能性があります。
オックスフォード金融会社との改正定期融資(“改正定期融資”)は、我々の信用手配とも呼ばれ、2027年2月1日に満期を予定する6000万ドルの定期融資手配を提供し、そのうち4000万ドルが2022年5月3日に元の定期融資から全額資金を提供している。改正された定期ローンの条項と条件によると、2023年第2四半期に最大1,000万ドルを借り入れ、2023年第3四半期に最大1,000万ドルを借り入れることができます。
改正された定期融資により、私たちの支払い義務は、運営資本、資本支出、研究開発、一般会社の需要を支払うために利用できる現金を減少させた。また、改正された定期融資項下の債務は変動金利で利回りされており、市場金利上昇の影響を受けやすい。市場金利が上昇すれば、私たちはこの債務に追加の利息を支払わなければならなくなり、これは私たちの他の業務需要に利用できる現金をさらに減らすだろう。
私たちの改正された定期融資下の債務は、私たちのほとんどの資産(知的財産を含まない)を担保にしている。私たちの資産に付与された保証権益は、私たちが追加債務融資を受ける能力を制限するかもしれない。改正された定期融資はまた、追加の債務を招くこと、担保融資の担保を阻害すること、取得、所有または投資を行うこと、任意のカテゴリの株式または他の持分を買い戻すこと、または任意の現金配当金または任意のカテゴリの株式または他の持分を現金分配することを宣言または支払いすること、私たちの資産の一部を処分すること、他の業務を買収すること、および任意の他の組織との合併または合併、または他の方法で制御権変更を発生させることを含む他のいくつかの契約(肯定的および否定的)を遵守することを要求するが、例外的な状況によって制限される。
他の指定違約イベントに加えて、貸手は、任意の事件が発生したときに違約イベントを発表することができ、これらのイベントは、本プロトコルの下での担保の留置権に重大な欠陥をもたらす、または私などの業務、運営または状況(財務または他の側面)に重大な不利な変化が発生するか、または本プロトコルに従って吾などの義務を償還する吾などの見通しに重大な欠陥をもたらすと理解される。もし私たちが信用手配の下で約束を破ったら、融資者は私たちのすべての返済義務を加速させるかもしれません。もし私たちがこれらの義務を履行したり、私たちの合意を再交渉するための資金を得ることができなければ、
30
貸主は私たちの資産を統制することができて、私たちはすぐに運営を停止しなければならないだろう。違約事件が続いている間、当時元金残高を返済していなかった当時の適用金利は5.0%増加する。約束違反が発生すると、貸手は、私たちが借りたすべての定期ローンの前払いの5.0%の最終支払い費用、その他の費用を直ちに返済することを要求することもできます。もし私たちがこのような状況で合意を再交渉すれば、条項は私たちに不利になるかもしれない。もし私たちが清算されれば、貸手が返済を得る権利は、私たちの株主が清算から任意の収益を得る権利よりも優先されるだろう。融資者の違約事件に対するいかなる声明も私たちの流動性、財務状況、経営業績、業務と将来性を深刻に損害し、そして私たちの証券の価格の下落を招く可能性がある。
私たちは未来にもっと多くの借金を招くかもしれない。このような債務を管理する債務ツールには、私たちの既存の債務を管理する条項と同じまたはより限定的な条項が含まれている可能性がある。もし私たちが満期になった時に私たちの債務を返済、再融資、あるいは再編できなければ、貸金人は担保を訴訟したり、私たちに破産や清算を強要したりするかもしれない。
私たちの成功は私たちのRxSightシステムに大きくかかっている。私たちのRxSightシステムのマーケティングと販売に成功できなければ、私たちの業務の将来性は深刻な損害を受け、私たちは収入増加を達成できないかもしれません。
私たちの将来の財務的成功は、私たちのRxSightシステムを効果的かつ利益的に眼科診療所にマーケティングし、販売する能力に大きく依存するだろう。私たちのRxSightシステムと私たちの計画または未来の任意の製品のビジネス成功は、以下の要素を含む多くの要素に依存します
31
もし私たちが私たちの製品をうまくマーケティングして販売できなければ、私たちは私たちの収入を増加させたり、利益を達成することができなくなり、これは私たちの業務、財務状況、経営業績に実質的な悪影響を与えるだろう。私たちの今後の収入増加は、私たちの目標市場への浸透に成功し、私たちのRxSightシステムと私たちが発売した任意の新製品または製品マークの販売能力を増加させることに依存し、これは、ユーザー基盤の拡大と製品のより多くの使用推進における私たちの成功にある程度依存するだろう。新製品や製品適応はまた、我々が目標としている任意の国際市場でFDAと同様の非米国規制機関の承認または承認を得て、それを商業化する必要がある。もし私たちが収入増加を達成したり、利益を達成したり維持できなければ、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼすかもしれない。
私たちの製品を採用することは医師に対する適切な訓練に依存し、訓練不足はマイナスの患者結果を招き、私たちの製品の採用に影響を与え、そして私たちの業務に不利な影響を与える可能性がある。
私たちの製品の成功は、私たちの顧客が私たちの研修者が行う訓練コースの中で適切な患者を選択し、適切な技術を提供することを主張することにある程度依存します。例えば、私たちは私たちのRxSightシステムが正しく使用されることを確実にするために顧客を訓練します。しかし、医師は彼らの以前の医学訓練と経験に依存しており、これらのすべての医師が私たちの製品を有効に利用するために必要な技能や訓練があることを保証することはできない。私たちはどの医者が私たちの製品を使用するか、あるいは彼らがどれだけの訓練を受けたかをコントロールしませんが、私たちの訓練課程を終えていない医者は私たちの製品を使用しようと試みるかもしれません。また,医師が我々の製品を使用する方法は彼らのラベル適応と一致しない可能性があり,訓練が利用可能ではない。もし医師が私たちの製品を使用する方法が彼らの標識の適応と一致しなければ、使用するコンポーネントは私たちの製品と互換性がない、あるいは私たちの訓練課程を堅持または完成していなければ、彼らの患者の結果は他の医師や私たちの臨床試験で得られた結果と一致しないかもしれない。この結果は、患者の利益と安全性に負の影響を与え、私たちの製品への採用を制限する可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を与える。
私たちは現在、限られた製品使用訓練が必要です。私たちは主に私たちの設備を使用するために必要な特定の技術について経験豊富な医師に向けています。もし私たちの製品に対する需要が引き続き増加すれば、経験の少ない医者は私たちの製品を使用するかもしれません。これはより多くのダメージと製品責任クレームのリスクを増加させる可能性があります。私たちの製品を使用したり誤用したりすることは将来合併症を招く可能性があり、製品責任クレームを招く可能性があります。
私たちのRxSightシステムのビジネス成功は、これらの製品が患者と医師の間で著しい市場受容度を得ることに依存するだろう。
私たちの成功は人々が私たちのRxSightシステムを受け入れるかどうかにある程度依存し、安全で効果的であり、医者にとってコスト効果がある。患者、医者、支払い人がどれだけ速いか(あれば)私たちのRxSightシステムを受け入れてくれるか、あるいは受け入れられたら使用される頻度を予測できません。私たちのRxSightシステムおよび私たちが開発またはマーケティングする可能性のある計画または未来の製品は、私たちの目標適応の一部またはすべてのために広く市場に受け入れられないかもしれません。患者と医者は、私たちの製品が代替治療法よりも良い利点を提供すると信じなければならない。これまで、私たちの製品の販売と収入の大部分は、私たちのRxSightシステムを採用した限られた数の顧客から来ています。私たちの将来の成長と収益力は、私たちのRxSightシステムや製品に対する医師の認識を高める能力、および患者や医師がこれらのシステムを採用する意欲を高めることに大きく依存しています。これらの締約国は、経験、臨床データ、医学会提案、および他の分析から、私たちの製品が安全で有効であることを決定することができない限り、当社の製品を採用してはいけません。提供者にとって、独立性および競争相手の製品に対して、私たちの製品はコスト効果があります。患者と
32
医者は私たちの製品が他の治療法よりもっと良いと信じなければならない。私たちが認識を高めることができても、医師は彼らの医療やり方を変える上で行動が遅く、様々な理由で私たちの製品を選びたくないかもしれません
医師に我々のRxSightシステムを使用させるためには,彼らはLDDを購入するために大量の前期投資を行わなければならない。これはより長い販売期間を招く可能性があり、広範な交渉と管理時間を必要とする。もし私たちがサプライヤーにLDDSを販売することに成功しなければ、私たちの売上は下がるかもしれません。私たちの経営業績は損害を受ける可能性があります。
医師は患者の治療過程を決定する上で重要な役割を果たしているため、利用され、患者に提供される治療タイプを決定する。私たちの販売、マーケティング、教育は主に医者に集中していて、私たちの目標は回診医を教育して、私たちの製品から利益を得る患者群を知ってもらうことです。しかし、私たちはあなたに私たちが医師たちに広い市場で受け入れられるということを保証することはできません。
例えば、一部の医師は、彼らの総患者集団の一部のみで私たちのRxSightシステムを使用することを選択するか、または私たちのRxSightシステムを全く採用しないかもしれない。私たちのRxSightシステムの広範な患者での使用が有益であることを効果的に証明できなければ、私たちの製品の採用は制限され、私たちが予想したように迅速に発生しないかもしれないし、根本的には起こらないかもしれないが、これは私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼすだろう。私たちはあなたに私たちの製品が医者に広く市場に認められることを保証することはできません。さらに、我々の製品が市場に受け入れられても、競争相手の製品、プログラム、または技術がより安全で、より費用対効果的、またはより優れていると考えられる場合、時間の経過とともに、そのような市場受容度を維持することができない可能性がある。もし私たちの製品が十分な需要を産生しなかった場合、あるいは意味のある市場受容度と浸透率を得ることができなかった場合、私たちの将来の見通しを損ない、私たちの業務、財務状況、経営業績に重大な悪影響を与えるだろう。
既存または潜在的な顧客および医師における私たちの名声も、製品リコールを含む、私たちまたは私たちの製品の安全または顧客満足度の問題に関連する負の影響を受ける可能性があります。将来の製品リコールや当社の名声に関連する他のセキュリティや顧客満足度の問題は、当社の製品を広く採用している能力を確立または維持することに悪影響を与える可能性があり、私たちの将来の見通しを損なうことになり、私たちの業務、財務状況、運営結果に大きな悪影響を与えることになります。
われわれのRxSightシステムは手術リスクに関連しており,ある患者では禁忌であり,採用を制限する可能性がある。
我々の製品を使用するリスクには白内障手術や人工水晶体移植に関連するリスクがある。LDDを用いた紫外線により,一時的あるいは長期的な視力変化を含めて合併症が出現する可能性もあるが,このことはまれである。私たちはRxSightシステムのいくつかの特性や機能が広範な市場採用を阻止する可能性があることに気づきました
33
医師が新しいプログラムを採用する必要があることや、医師の訓練が私たちの製品を効率的に操作できるようにする必要があるだろう。
私たちは激しい競争に直面しています。もし効果的な競争ができなければ、著しい市場浸透率を達成できないかもしれませんし、私たちの運営業績を高めることもできません。
医療機器業界の競争は激しく、変化は迅速であり、業界参加者の新製品とその他の市場活動の著しい影響を受けている。私たちは良質で伝統的な人工水晶体の製造業者とディーラーと競争している。私たちの眼内レンズ分野で最も重要な競争相手はエルカン、ジョンソン視力、博士課程を含む。私たちの多くの競争相手は資本の豊富な大手会社で、私たちよりずっと大きい市場シェアと資源を持っています。したがって、彼らは製品開発、マーケティング、販売、その他の製品計画に私たちより多くのお金を使うことができる。規模の小さい医療機器会社とも競争していますが、これらの会社は一つの製品か限られた製品の範囲しかありません。また,LALを受けた患者は最終的にロックされるまで紫外線保護眼鏡の装着を要求され,術後約4~5週間である。従来の単焦点性白内障手術と比較して,2回から3回の診療所を受診する必要がある。追加診療所受診は非手術であるが,確実に患者の目を大きくする必要がある。これらの追加要求により,LALの市場受容度が影響を受ける可能性がある.私たちの市場での主な競争要因は
私たちの主な競争基盤は、私たちの製品はより多くの医師がより効率的により多くの患者を治療できるようにすることです。私たちの持続的な成功は私たちの能力にかかっています
34
私たちは私たちが新製品の開発に成功したり、市場の受け入れを得る方法でそれを商業化することを保証することはできない。もし私たちが新製品を開発すれば、これらの製品の販売は私たちの既存製品の収入を減らすかもしれない。また、私たちの製品発表のどんな重大な遅延も、特定の市場への参入や特定の市場での競争能力を深刻に阻害する可能性があり、これらの製品から生じる売上を減らすことができるかもしれません。私たちは製品開発の任意の段階で遅延に遭遇するかもしれません。研究開発、臨床試験、監督審査、製造とマーケティング期間を含む。製品発売の遅延は私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性があります。
また,多くの医療機器会社が統合されており,より大きな市場力を持つ新会社を創出している。医療機器業界の統合に伴い,業界参加者への商品やサービスの提供競争がより激しくなる。これらの業界参加者たちは彼らの市場力を利用して私たちの製品の価格譲歩や値下げを交渉しようとするかもしれない。もし私たちが医療業界の統合で価格を下げると、私たちの収入が減少する可能性があり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
もし私たちの施設が損傷したり、運営できなかったり、あるいは施設を空けてほしいと要求された場合、私たちは私たちの製品を生産できないかもしれません。あるいは生産遅延やコストが増加する場合があります。これは私たちの運営結果に悪影響を及ぼすかもしれません。
私たちは現在カリフォルニア州のAliso Viejoで私たちの研究開発、製造、行政業務を維持しており、私たちには余分な施設がない。私たちは4つの異なる施設で運営されており、単一製造施設に指定されており、いずれかの施設が自然災害や人為的災害(例えば、地震、火災(カリフォルニアでは両方ともによく見られる)や他の事件によって深刻に破損または破壊された場合、移転や再建に数ヶ月かかる可能性があり、その間、私たちの従業員は他の職場を探す可能性があり、私たちの研究開発および製造は停止または遅延し、私たちの製品は利用できないかもしれない。当該工場の製造作業に重大な中断が発生すれば、我々の運営能力に実質的な影響を与えることになる。連邦、州、非米国の監督管理要求に基づいて新工場での生産に要する時間を許可するため、生産能力を交換することができても、直ちに生産を再開できない可能性がある。私たちは財産や業務中断保険を維持していますが、このような保険には限界があり、地震による損失や私たちの製品が競争相手の製品に取って代わられることによる可能な損失を含めてすべての損失をカバーしません。もし私たちの施設が稼働できなくて、私たちの研究、開発と製造活動を実行できなければ、私たちの限られた材料、部品、完成品の在庫に加えて、医者が私たちの製品の使用を停止したり、私たちの名声を損なう可能性があり、私たちは将来このような医師と関係を再構築できないかもしれません。したがって、私たちの既存施設や未来の施設で発生する悲劇的な事件は、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼすかもしれません。
また,我々の4施設の既存賃貸契約は,(I)2024年9月30日,5年継続可能,(Ii)2026年1月31日,各5年継続可能,(Iii)2023年3月31日,各5年継続可能,(Iv)2024年8月31日,5年間継続可能である。私たちは商業的に合理的な条項で契約を更新したり、新しい施設を見つけたり、契約を更新できないかもしれません。もし私たちが提案されたレートで更新することができないか、または更新することができない場合、私たちの製造施設の移転は、キー製造設備の移動と設置、および規制機関への任意の必要な再認証に関連する巨額の費用に関連します。このような移転が遅延しないか、または他の方法で私たちの製造活動や経営結果に悪影響を及ぼすことを保証することはできません。もし私たちの製造能力がこのような措置によって損なわれたら、私たちは適時に製造と出荷できないかもしれません。これは私たちの業務に悪影響を与えます。
技術変化は私たちの製品の販売に悪影響を及ぼす可能性があり、私たちの製品を時代遅れにする可能性があります。
医療機器市場の特徴は研究開発が広く、技術変革が迅速であることである。既存の競争相手や新規参入者を含む他の会社が、我々の製品よりも効率的な製品の開発やマーケティングに成功したり、我々の製品を時代遅れにしたり、競争力の乏しい製品を開発したりすることは保証されない。また,我々の製品の重要性を代替あるいは低減するために,新たな外科手術プログラム,薬物,その他の療法を開発することができる。もし私たちが革新に成功できなければ、私たちの製品は時代遅れになるかもしれません。私たちの顧客が競争相手の製品を購入するにつれて、私たちの収入は下がります。私たちが新製品、アプリケーションあるいは機能を開発できなかったのは、現金資源が不足し、従業員の流動率が高く、十分な技術技能を持つ人員を募集できないこと、他の研究開発資源が不足していること、あるいはその他の制限による可能性がある。私たちは十分な研究開発資源を投入できなかったり、現在或いは未来の競争相手の研究開発プロジェクトと有効に競争することができず、私たちの業務、財務状況と運営結果に重大な不利な影響を与える可能性がある。
35
我々のRxSightシステムの安全性と有効性については,我々のデータや経験は限られている.早期研究の結果は将来の臨床試験結果を予測できない可能性があり,計画中の研究は我々のRxSightシステムや他の計画や将来の製品のために十分な安全性や有効性プロファイルを構築できない可能性があり,これは我々のRxSightシステムの市場受容度に影響を与える。
われわれのRxSightシステム技術は比較的新しい治療法であり,白内障手術後に視力を最適化することができるため,限られた患者群でのみ臨床試験を行った。大量の患者の中で著者らの製品を使用する長期効果はまだ研究されておらず、このような製品の短期臨床使用結果は必ずしも長期臨床利益を予測でき、或いは長期副作用を示すとは限らない。これまでにわれわれの製品に対して行ってきた臨床前研究や臨床試験の結果や,われわれの現在,計画や将来の製品に対する進行中あるいは将来の研究や試験の結果は,その後の臨床試験の結果を予測できない可能性があり,臨床試験の中期結果も最終結果を予測できるとは限らない。われわれの臨床試験のデータや結果の解釈は,将来の他の患者群の臨床試験においても類似した結果が得られることは保証されていない。そのほか、臨床前と臨床データはよく各種の解釈と分析の影響を受けやすく、多くの会社は彼らの製品は臨床前研究と早期臨床試験で満足できると考えているが、その後の臨床試験では結果を複製できず、その後も発売許可を得られなかった。非臨床研究と早期臨床試験を通じて進展が得られたが、臨床試験後期段階の製品は期待される安全性と有効性を示すことができないかもしれない。
もし私たちの臨床試験が成功しなかったり、深刻な遅延があったり、あるいは私たちが臨床試験を終えていなければ、私たちの業務は損害を受ける可能性があります。
臨床開発は長く、高価で不確定な過程であり、遅延を受ける可能性があり、製品は最終的にそれらの設計の適応を治療する上で安全でない或いは無効なリスクが証明される可能性がある。我々は現在RxSightシステムの発売後の臨床試験を行っている。臨床試験の完成には数年以上かかるかもしれない。臨床試験は様々な原因で延期される可能性があり、監督部門の許可を得て試験を開始すること、予想される場所で受け入れられる臨床試験条項と合意すること、各場所で機関審査委員会の許可を得ること、患者の試験参加を募集すること、あるいは十分な臨床試験材料の供給を得ることを含む。私たちは私たちの臨床試験を成功または適時に登録することを保証することはできません。私たちの臨床試験はそれらの主要な終点に達するか、あるいはこれらの試験あるいはその結果はFDAや外国の監督機関によって受け入れられます。
臨床試験中または臨床試験過程のために、私たちは、新製品、既存製品の修正、または既存製品の新しい適応の規制承認または承認を得ることを延期または阻止する可能性がある多くの予見不可能な事件に遭遇する可能性がある
36
私たちの臨床試験における失敗または失敗と考えられる失敗は、私たちの製品開発と規制承認過程を延期し、阻止し、私たちの業務の将来性を損害し、私たちの名声と競争地位にマイナスの影響を与える可能性がある。
許可されていない第三者は、私たちのデバイスまたは他の製品およびサービス、または関連するデバイス、製品、およびサービスにアクセスし、私たちFDAの許可および承認に適合しない方法でそれらを修正または使用しようと試みる可能性があり、これはユーザにリスクをもたらす可能性がある。
医療機器は、医療の機能を改善し、医療提供者が患者を治療し、患者を治療する能力を向上させるために、インターネット、病院ネットワーク、および他の医療機器にますます接続されている。現在、我々のRxSightシステムは、他のデバイス、ローカルネットワーク、およびインターネットとの双方向接続および相互運用性が有効にされていないが、この状況は将来的に変化する可能性がある。これらの機能を有効にすることは、ネットワークセキュリティリスクおよび第三者の不正アクセスおよび使用のリスクを増加させる可能性があります。例えば、許可されていない第三者は、私たちのデバイスまたは他の製品およびサービス、または関連するデバイス、製品およびサービスにアクセスし、私たちFDAの許可および承認に適合しない方法でそれらを修正または使用しようと試みる可能性があり、これは、ユーザにリスクをもたらし、会社にリスクを与える可能性がある。
特定の製品または適応を追求するために限られた資源がかかる可能性があり、より利益または成功の可能性の高い製品または適応を利用することはできない。
私たちの財務と管理資源が限られているので、私たちは特定の製品と適応に集中している。したがって、私たちは他の人たちと協力する他の機会を求めることを放棄したり延期したりするかもしれないが、これらの機会はより大きなビジネス潜在力を持つことができる。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。現在および将来の特定の適応または強化された研究および開発計画への支出は、いかなる商業的に実行可能な製品も生じないかもしれない。もし私たちが特定の潜在的製品の商業的潜在力や目標市場を正確に評価しなければ、私たちは将来の協力、許可、その他の同様の計画を通じてその潜在製品に対する貴重な権利を放棄するかもしれないが、この場合、その潜在製品の独占開発権と商業化権利を維持することは私たちに有利である。
私たちは新製品を開発、許可したり、獲得したりすることができない可能性があり、迅速に変化する技術や顧客の要求に追いつくために既存製品の能力を強化することができず、新製品への移行を成功的に管理することもできず、いずれも私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性がある。
私たちの成功は、私たちがより多くの製品を開発、許可、または買収し、それを商業化し、既存および新しい市場で私たちの技術のために新しいアプリケーションを開発することに依存し、同時に、私たちの既存製品の性能と費用効果を高め、すべての場合に現在と予想される顧客ニーズを満たすことができます。私たちは、私たちの研究開発計画や許可、あるいは第三者からより多くの製品や技術を得ることで、より多くの製品を開発し、商業化するつもりです。私たちの成功は、機能性、競争力のある価格設定、使いやすさ、私たちの製品の安全性と有効性、および私たちが受け入れられる条項で製品および技術的権利を識別、選択、獲得する能力を含むいくつかの要素に依存する。
37
医療機器業界の特徴は迅速な技術変革と革新だ。私たちの現在または未来の製品と比較して、新しい技術、技術、または製品が出現する可能性があり、これらの技術、技術、または製品は、より良いコストパフォーマンスの組み合わせを提供するか、または顧客のニーズをよりよく満たすことができる。競争相手は私たちよりも多くの財務、マーケティング、および販売資源を持っているかもしれません。彼らは私たちよりも速く、より効率的に新しいまたは変化する機会、技術、標準、または顧客要求に応答するかもしれません。我々は、広範な臨床試験およびFDAおよび適用される外国規制機関の承認または承認を含む、内部開発、許可または買収のための任意の新製品が、商業販売の前に追加の開発作業を必要とする可能性があると判断した。新製品を市場に出すには大量の納期と複雑性が必要であるため、私たちは新製品の商業実行可能性について多くの仮定と推定を行う必要がある。これらの仮定と推定は正しくないことが証明される可能性があり、私たちが発売した製品は発表時に競争力がない。既存の会社や競争相手が新しい製品や改善した製品を開発し、新会社が新技術を持って市場に参入するにつれて、将来的にますます激しい競争に直面することを予想しています。私たちが販売価格の下振れ圧力を緩和する能力は、私たちが医者や支払人に提供する価値を維持または増加させる能力にかかっている。すべての新製品は医療機器製品開発に固有の失敗リスクに直面しやすく、製品は十分な安全かつ有効であることが証明されない可能性があり、監督管理機関の承認や承認を得られない可能性がある。しかも、私たちはあなたに保証することができません。どのような承認または承認されたこのような製品は経済的な方法で生産または生産されます, 商業化に成功したり、市場で広く受け入れられたりする。不成功な製品開発又は発表活動に関連する費用又は損失、又は我々の新製品が市場受容度に不足していることは、我々の業務、財務状況及び運営結果に悪影響を及ぼす可能性がある。
私たちが新しい顧客を引き付ける能力は、既存製品の強化と改善、注目された新製品を発売する能力に大きく依存しています。著者らの製品のいかなる改善が成功するかはいくつかの要素に依存し、医師の採用と継続使用、競争力のある定価と全体の市場受容度を含む。我々が開発したいかなる新製品もタイムリーあるいは費用効果のある方法で発売されない可能性があり、欠陥がある可能性があり、あるいは大量の収入を発生させるために必要な市場受容度を得ることができない可能性がある。もし私たちが新製品の開発、許可、あるいは獲得に成功できなければ、私たちの既存製品を改善して顧客の要求を満たすため、あるいは他の方法で市場の承認を得ることができなければ、私たちの業務、財務状況、経営業績は損害を受けるだろう。
新医療機器製品の典型的な開発周期は長く複雑である可能性があり,複雑な技術と工程が必要である可能性がある。このような開発は,外部サプライヤーやサービスプロバイダに関連し,開発プロジェクトの管理を複雑にし,スケジュール,必要な部品やサービスのタイムリーな配信,そのような部品や組立製品の満足できる技術性能などに関するリスクや不確実性の影響を受ける可能性がある.私たちが要求された技術規範に達していない場合、あるいは新製品開発プロセスの管理に成功したり、開発作業が計画通りに行われていなければ、これらの新技術や製品は悪影響を受ける可能性があり、私たちの業務や経営結果は損なわれる可能性があります。
もし私たちが他の製品を識別、買収、開発できなければ、私たちは私たちの業務を発展させることができないかもしれない。
私たちの成長戦略の重要な構成要素として、私たちは、私たちの研究開発計画を通じて、あるいは許可によって、あるいは第三者からより多くの製品と技術を獲得することで、より多くの製品を開発し、商業化するつもりです。この戦略の成功は、私たちが受け入れられる条件で製品および技術を獲得する権利を識別、選択、獲得する能力があるかどうかにかかっている。
我々が決定、許可、または取得した任意の製品は、商業販売の前に、広範な臨床試験およびFDAおよび適用される外国規制機関の承認または承認を含む追加の開発作業が必要となる可能性がある。すべての製品は医療機器製品開発に固有の失敗リスクに直面しやすく、製品は十分な安全かつ有効であることが証明されない可能性があり、監督管理機関の承認や承認を得られない可能性がある。また、承認または承認されたどのような製品も経済的に生産または生産され、商業化に成功したり、市場に広く受け入れられたりすることを保証することはできません。
経済的に実行可能な製品や技術買収を提出、交渉、実施することは長く複雑な過程であるかもしれない。他の会社には、より多くの財務、マーケティング、販売資源を持つ会社が含まれており、承認または承認可能かもしれない製品の買収を競争している可能性がある。私たちは、私たちが受け入れられると思う条項や他の承認または承認された製品を得ることができない権利を得ることができないかもしれない。
内部研究計画や第三者から権利を得ることによって適切な潜在的製品を開発することができなければ、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
38
私たちは他の会社や技術を買収するかもしれません。これは商業製品を生成したり、収入を増加させたり、私たちの経営陣の注意を移し、私たちの株主へのさらなる希釈を招き、他の方法で私たちの運営を混乱させ、私たちの経営業績を損なう可能性があります。
私たちは現在、合意したり、このような取引を完了することを約束していませんが、将来的には、私たちの製品の組み合わせを補完または拡大し、私たちの技術力を強化し、または成長機会を提供することができると考えられる業務、アプリケーション、または技術に買収または投資を求めることができます。しかし、私たちが選択した任意の買収を成功させることができるか、または費用効果と非破壊的な方法で任意の買収された業務、製品、技術を成功的に統合できることを保証することはできません。潜在的買収の追求は経営陣の注意をそらす可能性があり、これらの買収が完了しているかどうかにかかわらず、適切な買収を決定、調査、求める際に様々なコストや支出が生じる可能性がある。理想的な買収目標を決定できないことや、任意の特定の目標との合意に成功できないことや、任意の買収や投資から期待されるメリットを得ることができない可能性がある。
これまで、我々の業務の成長は基本的に有機的であり、他の業務や技術を買収する上での経験は限られていた。買収した人員、運営、技術の統合に成功したり、買収後に合併後の業務を効率的に管理することはできないかもしれません。買収は株式証券の希釈発行、現金の使用や債務の発生を招く可能性もあり、これは私たちの経営業績を損なう可能性がある。また、買収された企業が私たちの予想に達しなければ、私たちの経営業績、業務、財務状況が影響を受ける可能性があります。
私たちの製品は、十分な市場で保証範囲、十分な精算、および/または患者が実際に受け取った価格と精算金額との差額を支払う能力を得ることができない可能性があり、これは私たちの売上を減少させたり、製品を販売する能力に影響を与える可能性があります。
アメリカと非アメリカ市場で、私たちは私たちの製品を商業化して市場に認められることに成功するかどうかは、医者と外科センターが十分な経済報酬を得ることができるかどうかに大きく依存する。この報酬は、米国の連邦医療保険および医療補助計画、管理型医療機関、および個人健康保険会社のような第三者支払者を含む様々な源から来ることができる。第三者支払人は彼らがどのような治療を受けるかを決定し、これらの治療のための販売率を確立する。それらはまた、良質な眼内レンズの配置に関連するサービスのような追加のサービスを受ける費用を患者が追加的に支払うことを阻止することができる。私たちの製品は医者が購入して、彼らは第三者支払人と患者に私たちの製品を使った手術の補償を求めます。国際市場での精算制度と患者請求規則はいくつかの国内で国や地域によって大きく異なり、国/地域に基づいて精算および/または不精算承認を受けなければならない。ある国際市場では、製品は清算承認を受けなければならず、その国での販売が許可されることができる。また,多くの国際市場には政府が管理する医療システムがあり,新設備やプログラムの精算を制御し,未精算設備やプログラムの費用を患者に直接徴収している。ほとんどの市場には、個人保険システムもあれば、政府が管理するシステムもある。
第三者支払者は、現在承認または承認されている製品を使用して行われている一部の手術の費用を現在負担して精算しているが、これらの第三者支払人が未精算部分に保険と十分な精算を提供し続けることを保証することはできないし、医師が治療を必要とする患者に私たちの製品を使用する手続きを提供することを可能にするのに十分な支払いを可能にする。もしアメリカや私たちが参入したどの国際市場でも、私たちの製品を使った手術は、患者の支払いを実現するのに十分なカバー範囲と精算または柔軟性がなければ、私たちの製品の需要と私たちの収入に悪影響を受けるだろう。
さらに、白内障および眼屈折不正を治療するための製品およびプログラムの総精算金額は、現在のレベルに維持されているか、または将来的に低下する可能性がある。医師が我々の製品を用いた手術の保証範囲と十分な補償、および患者の費用を獲得し、維持できなければ、私たちの業務、財務状況、運営結果に重大な悪影響を与える。
第三者支払者が保険·支払決定を行う際には、安全性と有効性に加えて、製品の費用対効果を審査することが多くなっている。第三者支払者はまた,価格規制や制御,競争的定価計画の使用など,医療コストの増加を制限する取り組みを策定している。一部の第三者支払人はまた、無作為臨床試験に基づいて、またはカバー範囲を事前に承認した上で、新しいまたは革新的な設備またはプログラムのために優位性を証明し、その後、そのようなデバイスまたはプログラムを使用する医療提供者に精算する必要がある。
39
また、米国には統一された保険や精算政策がなく、支払者によって引受や精算が大きく異なる可能性がある。第三者支払者は,自分の精算料率を設定する際には通常連邦医療保険カバー政策や支払い制限に依存するが,連邦医療保険確定に加えて,独自の方法や承認プロセスもある。私たちの現在の製品または任意の計画または将来の製品が、任意の特定の司法管轄区域でそのような製品が使用されるプログラムの保険範囲および十分な補償レベルを保証するために、十分な費用対効果を有するとみなされるかどうか(または継続的にみなされる)かどうかは不明である。
もし私たちに製品責任訴訟を提起すれば、私たちは重大な責任を負い、私たちの製品のマーケティングと販売を制限または停止することを要求されるかもしれません。私たちの製品に生じる責任、保険の費用と潜在的な獲得不可能性は私たちと私たちの製品を販売する能力を損なう可能性があります。
私たちの製品のマーケティングと販売のため、私たちは固有の製品責任リスクに直面しています。例えば、私たちの製品が製造、マーケティング、または販売中にダメージを与えたり、不適切なことが発見されたりした場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、製品固有の危険について警告、不注意、厳格な責任、または保証違反の告発を含む可能性がある。また,表面的なダメージが他人の行動や患者の本来の健康状態によるものであっても,我々に対するクレームを受ける可能性がある。例えば、患者に私たちの製品を使用する場合、私たちは医者に依存する。もしこれらの医師が適切な訓練や不注意を経ていなければ、私たちの製品の能力が低下したり、患者が重傷を負う可能性があります。私たちはまた、部品とサブアセンブリのサプライヤーを提供するなど、サプライヤー活動によるクレームを受ける可能性があります。
もし私たちが製品責任クレームで自分を弁護することに成功できなければ、私たちは重大な責任を招いたり、私たちの製品の商業化を制限または停止することを要求されるかもしれません。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。事件がどうであっても最終的な結果がどうであろうと、賠償責任は次のようになるかもしれない
私たちは私たちが十分な製品責任保険を持っていると信じているが、それは私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれない。保険範囲はますます高くなっています。私たちは発生する可能性のあるどんな責任も支払うために、合理的な費用や十分な金額で保険を維持または獲得することができないかもしれない。私たちの保険証書には各種の免責条項が含まれています。私たちは製品責任クレームの影響を受けるかもしれませんが、私たちは保険範囲を持っていません。許容可能なコストで十分な商品責任保険を得ることができず、製品責任クレームを防止することができない可能性があり、これにより、我々が開発した製品のマーケティング及び販売を阻止又は抑制することができる。私たちは、私たちの保険範囲の制限を超えて、または私たちの保険カバー範囲内でない裁判所の裁決または和解合意で達成された任意の金額を支払う必要があるかもしれませんし、これらの金額を支払うために十分な資本がないか、または得ることができないかもしれません。これは、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼすでしょう。さらに、私たちの製品責任クレームは、合理的であるか否かにかかわらず、私たちの製品責任保険料率を増加させるか、または持続的な保険を得ることを阻止し、業界における私たちの名声を損なうことができ、私たちの費用を著しく増加させ、製品販売を減少させることができる。
私たちのいくつかの顧客と潜在的な顧客はまた、彼らの運営と私たちの製品の使用をカバーするために責任保険を購入したり維持したりすることが困難かもしれません。医療事故運送業者はある州の保険範囲を撤回したり、保険料を大幅に引き上げたりしている。この傾向が続いたり悪化したりすれば、私たちの顧客は私たちの使用を中止するかもしれません
40
製品と潜在顧客はコストや保険を購入できないため、私たちの製品を購入しないことを選択するかもしれません。
私たちは将来的に製品の国際販売を拡大しようとしていますが、承認されても、規制部門の承認を得たり、私たちの製品を国際的に成功させたりすることで困難に直面する可能性があります。私たちの製品を国際的にマーケティングすることに関連する様々なリスクは私たちの業務に実質的な悪影響を及ぼす可能性があります。
私たちの製品のアメリカ以外での販売は臨床試験と上場承認を管理する外国の監督管理要求に制約されます。私たちは国際拡張に多くの費用を発生させるだろう。海外での運営に関連する他のリスクは
これらの他の国際業務に関連するリスクは、国際市場で利益業務の能力を獲得または維持することに重大な悪影響を及ぼす可能性があり、これは私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす。
また、私たちの製品はアメリカと外国の輸出規制、貿易制裁、輸入法律法規によって制約される可能性がある。私たちの製品の輸出入に対する政府の規制、あるいは私たちの製品のために必要な輸出入許可を得ることができなかったり(適用されれば)、私たちの国際販売を損なう可能性があり、私たちの収入に悪影響を及ぼす可能性があります。私たちの製品輸出に関する適用法規の要求を遵守することは、私たちの製品の国際市場での発売を遅延させるかもしれません。あるいは場合によっては、私たちの製品のいくつかの国への輸出を完全に阻止するかもしれません。また、米国の輸出規制法と経済制裁は、米国の制裁対象国、政府、個人に特定の製品やサービスを輸送することを禁止している。もし私たちが輸出入条例とこのような経済制裁を守らなければ、罰金および/または特定の輸出特権の剥奪を含む罰を受けるかもしれない。さらに、新しい輸出または輸入制限、新しい立法、または既存の法規の実行または範囲内、またはこれらの法規が対象とする国、個人、または製品において方法を変更することは、既存または潜在的な国際顧客によって私たちの製品が使用されることを減少させるか、または既存または潜在的な国際顧客に私たちの製品を輸出する能力を低下させる可能性がある
41
行動する。私たちの製品の使用が減少したり、私たちの輸出や販売製品の能力に制限があったりすることは、私たちの業務に悪影響を及ぼす可能性があります。
また、我々の製品が目標国際市場での販売の承認を得ることは保証されず、承認されても何の販売も保証されない。FDAが製品の発売を承認したとしても、外国の比較可能な規制機関は、これらの国での製品の製造またはマーケティングを承認しなければならない。アメリカまたは他の任意の管轄区域での承認は、他の管轄区域で承認されることを保証しない。外国の承認を得ることは私たちの重大な遅延、困難、コストを招く可能性があり、追加の実験と追加費用が必要だ。各国の規制要求には大きな違いがある可能性があり、これらの国での製品の発売が延期される可能性がある。一国で行われる臨床試験は他の国に受け入れられない可能性があり、一国の規制承認は他のどの国でも規制承認を受けることを意味するものではない。もし私たちがこのような規制要求を遵守できなかったり、必要な承認を得られなかったりすれば、私たちの目標市場は減少し、私たちの収入を作る能力は弱まるだろう。私たちは私たちが望むすべての国際市場に成功し、世界的に業務を管理することができなくて、私たちの業務、財務業績、運営業績にマイナスの影響を与えるかもしれません。
私たちは満足できる製品の価格と利益率を達成したり維持することができないかもしれない。
医療機器メーカーは価格競争の歴史があり、私たちの製品が満足できる価格に達することを保証することができません。あるいは価格を私たちの歴史的に達成したレベルに維持することはできません。支払い者が白内障手術を行う医師に支払う精算金額の任意の低下、または患者への非精算手術の柔軟性の低下は、顧客を説得して私たちのLDDに前期投資を行うことを困難にする可能性があり、患者が私たちのLALに関連する追加コストを支払うことを決定する上で追加の価格設定圧力を生じる可能性があり、RxSightシステムを使用して実行される手術数および対応するLDDS、LAL、部品およびサービスの販売を減少させる可能性がある。もし私たちが製品価格の低下を余儀なくされれば、私たちの収入と毛金利は低下し、これは私たちの投資と事業発展の能力に悪影響を及ぼすだろう。もし私たちが私たちの価格を維持できないなら、あるいは私たちのコストが増加すれば、私たちは私たちの価格上昇でこの成長を相殺することができなくて、私たちの利益率は侵食されるかもしれない。私たちは私たちの業務、財務状況、そして運営結果を損なう可能性がある巨大な価格設定圧力を受け続けるだろう。
私たちの現在と未来の製品の市場規模はまだ正確に確定されていません。私たちが推定したものより小さいかもしれません。
現在の製品と開発中の製品の年間潜在市場総量の推定は,白内障手術を受けた患者数を含むが,RxSightシステムを販売している想定価格を含むいくつかの内部および第三者推定に基づいている。我々の仮説と我々の推定を支持するデータは合理的であると信じているが,これらの仮定と推定は正しくない可能性があり,我々の仮説や推定を支持する条件は随時変化し,これらの潜在的要因の予測正確性を低下させる可能性がある.また,白内障手術患者群規模の推定には,我々の製品を用いた治療には決して適していない可能性のある患者が含まれている。したがって、現在または未来の製品の年間潜在市場総量の推定は正しくないことが証明されるかもしれない。もし私たちの製品から利益を得る実際の患者の数、私たちが未来の製品を販売することができる価格、あるいは私たちの製品の年間潜在市場総量が私たちの推定を下回っていれば、私たちの販売増加を弱化させ、私たちの業務に悪影響を及ぼすかもしれません。
国家法規と検眼実践の解釈、私たちの製品と関連手続きの公共健康保険カバー範囲と政府精算料率、および/または私たちの製品を使用して手術を行う医師の医療または専門事故保険カバー範囲の変化は、私たちの製品の採用と私たちの将来の収入に影響を与える可能性がある。
州ごとに検眼士が行うプログラムタイプを含む検眼実践を管理する。もし国家が検眼実践の範囲を変更または縮小した場合、または彼らが私たちのRxSightシステムに関連するLDDプログラムを実行する資格がある人の視光範囲の解釈を行う場合、このような州法規または政策は、どの医師が私たちのRxSightシステム、私たちの顧客基盤および市場シェア、ならびに私たちのRxSightシステムの採用に実質的な影響を与える可能性がある。また、支払人が私たちのRxSightシステムを使用するプログラムの保証範囲および/または精算レベルの制限は、私たちの製品の採用や製品の定価に悪影響を及ぼす可能性があり、これは私たちの収益性に実質的な影響を与える可能性がある。我々の製品を用いて手術を行う医師の医療や専門医療事故保険政策の変更は,我々の製品の使用に関する医療事故責任保険の引受拒否を含め,我々の製品の採用や我々の業務運営に大きな影響を与える可能性がある。私たちは
42
州検査委員会が検眼面で実施した措置や、医療事故保険保証人と支払人が私たち、私たちの業務運営、私たちの顧客の業務に対する政策を含む、現在と未来の連邦と州立法、行政、行政行動の影響は保証されない。コスト制御措置の実施や他の政策や法規の変化は、私たちが収入を創出し、利益を達成したり、私たちの製品を商業化したりすることを阻止するかもしれない。
連邦政府はどのように変えるかを考えており、米国の医療サービスの支払い方法を変えている。個別州でも医師への医療補助金の支払いに影響を与える立法が制定される可能性がある。さらに、CMSは毎年医師のための医療保険支払いレベルを確立し、これは、そのようなエンティティへの支払いを増加または減少させることができる。国際的には、医療精算制度は国によって異なり、一部の国は固定予算を通じて医療センターの支出を制限し、患者の治療レベルを考慮することなく、他の国は政府或いは第三者精算の申請と承認を要求している。そのほか、異なる国が直接患者に良質な眼内レンズと関連サービス費用を受け取る能力も大きく異なり、更に多くの制限を受ける可能性がある。私たちが私たちの製品を国際市場に投入することに成功しても、将来の医療政策、法律、法規、そして個人市場実践に関する不確実性は、商業的に許容可能な数量で製品を販売する能力に影響を与える可能性がある。
私たちの四半期と年度業績は大きく変動する可能性があり、私たちの業務の基本的な表現を完全に反映できないかもしれません。
私たちの四半期と年間運営実績は、私たちの収入、収益力、キャッシュフローを含めて、将来大きく異なる可能性があり、私たちの運営業績を期間間の比較を行うことは意味がないかもしれません。したがって、いずれの四半期や期間の業績も将来の業績の指標として依存してはならない。私たちの四半期と年度の財務結果は様々な要素によって変動する可能性があり、その中の多くの要素は私たちがコントロールできないため、私たちの業務の基本的な表現を完全に反映できないかもしれません。四半期と年度業績の変動は私たちの普通株の価値を下げるかもしれません。我々の四半期業績は変動する可能性があるため,期間と期間の比較は我々の業務の潜在結果の最適な指示ではない可能性があり,我々の業務表現を決定する1つの要因とすべきである.
私たちは、当社の販売やマーケティング能力の拡大を含め、当社の組織を大幅に拡張し、上場企業としての運営を支援するための追加のインフラを作成することが予想され、そのため、経営成長を管理することが困難になる可能性があり、運営を混乱させる可能性があります。
私たちは、特に販売とマーケティング、財務および会計の分野で、私たちの従業員数と業務範囲が著しく増加することを予想しています。私たちが予想している将来の成長を管理するためには、私たちの管理、運営、財務システムを継続して実施し、改善し、私たちの施設を拡大し、より多くの合格者を募集し、訓練し続けなければならない。私たちの限られた財政資源とこのような予想される成長を管理する経験が限られているため、私たちは私たちの業務の拡張や採用やより多くの合格者を効率的に管理することができないかもしれません。私たちの業務の拡張は巨大なコストを招く可能性があり、予期しない方法で私たちの管理と業務発展資源を移転または拡張する可能性があります。成長を管理できないどんな状況も、私たちの業務計画の実行を延期したり、私たちの運営を妨害したりする可能性がある。
季節的な要素のため、私たちのいくつかの経営業績と財務指標は予測できないかもしれない。
私たちの業績はまだ著しい季節的変化を経験していませんが、私たちの業界では、夏の月と年末の休日シーズンの収入に季節的な疲弊が見られることは珍しくありません。私たちは将来、特に私たちの業務の成熟に伴い、悪天候(これが進行する選択的手術の数に影響を与える可能性がある)を含む他の季節的傾向の影響を受ける可能性がある。また、このような季節性が私たちの収入に反映される程度ははるかに小さく、すぐには現れないかもしれない。私たちがこのような季節性を経験する程度では、それは私たちの経営業績と財務指標に変動を招き、私たちの将来の経営業績と財務指標を予測することをより困難にする可能性がある。
43
私たちは私たちの純営業損失の繰越といくつかの他の税務属性を使用して、未来の課税収入を相殺する能力はいくつかの制限を受けるかもしれません。
2022年12月31日現在、約3億004億ドルの連邦純営業損失が繰り越し(“NOL”)しており、これらの純損失は2023年から2037年にかけて満期を迎える。私たちのNOLは満期になって使用されない可能性があり、その限られた期限や米国税法の制限により、将来の所得税債務を相殺するためには使用できません。コロナウイルス援助、救済、経済安全法案やCARE法案により改正された“減税·雇用法案”(以下、“税法”)によると、2017年12月31日までの納税年度に発生する連邦NOLは無期限に繰り越すことができるが、このような連邦NOLが2020年12月31日以降に開始する納税年度の控除額は課税収入の80%に制限されている。各州がCARE法案により改正された税法をどの程度遵守しているかは不明である。
また、改正された1986年の“国内税法”(以下、“規則”と略す)第382条及び383条によると、ある会社が“所有権変更”(通常“5%の株主”と定義されている3年間のスクロール期間内に私たちの所有権に対する累計変更が50ポイントを超える)を経験した場合、同社は変更前のNOLと何らかの変更前の税収属性を用いて変更後の収入や税項を相殺する能力が制限される可能性がある。似たような規則は州税法に適用されるかもしれない。私たちは過去にこのような所有権変化を経験したことがありますが、将来私たちはその後の株式所有権の変化のために所有権の変化を経験するかもしれません。その中のいくつかの変化は私たちの制御範囲内ではありません。私たちは私たちの株式所有権のこのような変化がもたらす可能性のある年間制限(あれば)を決定するために何の研究も行っていない。これらのNOLを利用する能力は,上記のような“所有権変更”によって制限される可能性があるため,我々のNOLの大部分や何らかの他の税収属性を利用できない可能性があり,これは我々のキャッシュフローや運営結果に実質的な悪影響を与える可能性がある.
知的財産権に関するリスク
もし私たちが私たちの技術や製品のために特許および他の知的財産権保護を獲得、維持、保護、実行できない場合、あるいは取得した特許と他の知的財産権保護の範囲が十分に広くなければ、私たちは私たちの市場で効果的に競争することができないかもしれない。
私たちの成功は、私たちが開発した製品や技術について、アメリカや他の国で特許や他の知的財産権保護を獲得、維持、保護、実行する能力に大きく依存している。もし私たちが私たちの知的財産権を獲得、維持、保護、実行できなければ、第三者は私たちとより効果的に競争する可能性があり、私たちは私たちの技術や競争優位性を失うかもしれないし、私たちは私たちの知的財産権の使用を取り戻すか制限しようとする時に巨額の訴訟費用を招くかもしれない。
我々は,我々の製品に関連する知的財産権を付与し,米国や海外で我々の技術や製品に関連する特許出願を提出することで,我々の地位を保護することを求めており,これらの技術や製品は我々の業務に非常に重要である.私たちはまた契約条項、秘密手続き、著作権の組み合わせに依存しています 商標、商業秘密、および他の知的財産権は、私たちのブランド、製品、技術、およびデータの固有の側面を保護するために使用されます。これらの法的措置は、限られた保護、競争相手または他の人が、私たちの知的財産権および独自の情報を取得または使用することができるだけを提供することができる。私たちの成功は、特許、著作権、商標、商業秘密、データおよびノウハウ、および他の知的財産権の取得と維持にある程度依存するだろう。
私たちは、私たちの業務に必要な知的財産権や他の固有の権利を獲得して維持することができない場合があり、または私たちが競争優位性を提供する形で知的財産権または他の所有権を獲得して維持することができないかもしれません。例えば、私たちのビジネス秘密、データ、およびノウハウは、私たちの従業員、コンサルタント、請負業者、顧客、および他のサプライヤーと秘密保護協定を締結するために努力しているが、これらの情報にアクセスすることができ、そうでなければ、第三者に知られているか、または独立して発見される可能性があるが、不正に使用、流用、または不正者に漏洩される可能性がある。さらに、特許訴訟過程は高価で、時間がかかり、複雑であり、私たちは合理的なコストですべての必要または望ましい特許出願を適時に提出、起訴、維持、実行または許可することができないかもしれないし、商業的優位性を持つ可能性のあるすべての司法管轄区域を保護するか、または私たちの知的財産権を全く保護できないかもしれない。私たちは私たちの知的財産権を保護しようと努力しているにもかかわらず、許可されていない当事者たちは私たちが独自と考えている情報を取得して使用することができるかもしれない。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有しており、許可されていない発行された特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。 例えば、私たちは第3の方向のUSPTO提出既存技術の制約を受けて、私たちが持っている1つ以上のクレームの有効性に疑問を提起することができるかもしれない
44
特許が付与されていますこのような提出は、我々が所有しているか、または許可されていない係属中の特許出願に基づいて特許が付与される可能性を排除するために、特許発行前に提出されてもよい。
我々の研究開発成果における出願可能な特許の側面をタイムリーに決定できず,特許保護を得ることができない可能性もある.私たちは、私たちの従業員、コンサルタント、請負業者、協力者、サプライヤー、および他の第三者などと、私たちの研究開発成果の機密または特許可能な当事者と秘密および秘密協定を締結する権利がありますが、これらの当事者のいずれかは、合意に違反し、特許出願を提出する前にこのような成果を開示し、特許保護を求める能力を危険にさらす可能性があります。私たちは、このような特許出願および発行された特許が公有分野の開示に属するため、特許出願および発行された特許を取得または維持することができない可能性があり、公有分野における任意の技術を当社の技術と競合する第三者の使用を阻止することができないかもしれない。また、科学文献で発表された発見は実際の発見よりも遅れがちであり、米国および他の司法管轄区の特許出願は通常、出願18ヶ月後に発表され、時には全く発表されない場合もある。したがって、私たちは、私たちが所有または許可されていない発行または係属中の特許出願において最初に特許請求を提出した発明であるか、または私たちがそのような発明のために特許保護を申請した最初の会社であることを決定することはできない。第三者が私たちまたは私たちの許可者がそのような発明のために最初にまたは最初に特許保護を行った者でないことを証明することができる場合、私たちの所有または許可中の特許出願は特許として発行されない可能性があり、発行されても、疑問および無効または実行できない可能性がある。
医療機器会社の特許地位は一般に高度に不確定であり,複雑な法律や事実問題に関連しており,近年多くの訴訟の対象となってきた。米国および他の国の特許法またはその解釈の変化は、私たちの発明、取得、維持、および私たちの知的財産権を保護する能力を弱める可能性があり、より広く言えば、私たちの知的財産権の価値に影響を与えたり、私たちが所有し許可している特許の範囲を縮小したりする可能性がある。ライセンス内で所有されている知的財産権については、私たちと私たちのライセンシーが現在求めている特許出願が任意の特定の管轄区域で特許として発行されるかどうか、または何かがあるかどうかを予測することはできません 発行された特許は競争相手の攻撃から十分な保護を提供するだろう。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.
また、特許出願において要求されるカバー範囲は、特許発行前に大幅に縮小することができ、その範囲は特許発行後に再解釈することができる。私たちが現在または将来許可または所有している特許出願が特許の形態で発表されても、それらは、私たちに任意の意味のある保護を提供し、競争相手または他の第三者が私たちと競争することを阻止し、または他の方法で私たちに任意の競争優位性を提供する形で発表されることはない。私たちが持っているまたは許可されている任意の特許は、第三者によって挑戦され、範囲を縮小され、または無効にされる可能性がある。さらに、我々の競争相手または他の第三者は、同様の技術または代替技術または製品を非侵害的に開発することによって、私たちの特許を回避することができるかもしれない。第三者はまた私たちが私たち自身の製品をマーケティングし、私たち自身の技術を実践することを阻止する特許を持っているかもしれない。あるいは、第三者は、私たちの製品と似たような、または他の方法で私たちの製品と競合する彼ら自身の製品の販売を承認することを求めることができる。この場合、私たちは訴訟を提起することによって特許侵害を告発することを含む、私たちの特許を擁護および/または主張する必要があるかもしれない。このような訴訟のいずれにおいても、管轄権のある裁判所または機関は、私たちの特許が無効であるか、強制的に実行されないか、または侵害されていないことを発見することができ、この場合、私たちの競争相手および他の第三者は、製品を販売し、私たちと実質的に類似した製造および分析プロセスを使用することができるかもしれない。私たちが効果的かつ強制的に実行可能な特許を持っていても、これらの特許は、私たちの業務目標を達成するのに十分な競争製品やプロセスを保護することができない可能性がある。
特許出願が提出されてから一定期間秘密であることを考慮すると、私たちは私たちの製品に関連する特許出願を初めて提出した会社であることを確認することができません。競争相手はまた、米国特許商標局または適用される他の外国特許エージェント機関に、この発明がオリジナルではないこと、新規ではないこと、または明らかであることを証明することによって、私たちの特許に異議を提起することができる。訴訟では、競争相手は、もし私たちの特許が発行されたら、様々な理由で、私たちの特許は無効だと主張するかもしれない。もし裁判所が同意すれば、私たちはこのような疑問視された特許の権利を失うだろう。
また、新製品の開発、テスト、規制審査に要する時間を考慮すると、このような製品を保護する特許は、このような製品の商業化前または直後に満了する可能性がある。したがって、私たちの知的財産権は他の人たちが私たちと似ているか同じ製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。さらに、私たちが持って許可されたいくつかの特許と特許出願は将来的に第三者と共同で所有されるかもしれない。もし私たちがこのような第三者の共同所有者のそのような特許または特許出願における権利の独占的な許可を得ることができない場合、これらの共通所有者は、私たちのを含む他の第三者にその権利を許可することができるかもしれない
45
競争相手、私たちの競争相手は競争相手の製品と技術を販売することができます。さらに、私たちは、第三者に対してそのような特許を強制的に実行するために、私たちの特許のどのような共通所有者の協力も必要とするかもしれませんが、そのような協力は私たちに提供されないかもしれません。
私たちの他の知的財産権は、私たちの商標を含めて、第三者の挑戦、無効、侵害、回避される可能性もあり、私たちの商標も希釈され、汎用商標として発表されたり、他の商標の侵害が発見されたりする可能性があり、この場合、私たちは私たちの製品を再命名することを余儀なくされ、ブランド認知度の喪失を招き、広告や新しいブランドを広告し、他の競争被害を受けるために資源を投入することを要求する可能性がある。第三者はまた私たちと似たような商標を採用する可能性があり、これは私たちのブランドのアイデンティティを壊し、市場の混乱を招く可能性がある。
私たちは将来また私たちの元従業員、コンサルタント、または請負業者からクレームを受けるかもしれません。これらのクレームは私たちの特許または特許出願の所有権を主張し、これは彼らが私たちを代表して仕事をした結果です。私たちは一般に、私たちのすべての従業員、コンサルタント、請負業者、および私たちのノウハウ、情報または技術にアクセスできる他のパートナーまたは協力者に、その発明の同様の権利を譲渡または付与することを要求していますが、私たちは、私たちがすべての人とこのような合意に署名したとは確信できません 私たちはまた、私たちとこのような当事者たちとの間の合意が潜在的な挑戦に直面した時に維持されるかどうか、あるいは違反されないかどうか、十分な救済策がないかもしれないということを確信できない。
私たちの業務に必要な特許、商標、その他の知的財産権を獲得し、維持することができず、私たちの知的財産権の使用を保護、監視、制御できなかったことは、私たちの競争能力にマイナスの影響を与え、巨額の費用を発生させる可能性がある。米国と私たちが依存している他の司法管轄区域の知的財産権法および他の法定および契約手配は、将来的には、私たちの特許、商標、データ、技術および他の知的財産権の侵害、使用、違反または流用を防止するために十分な保護を提供できない可能性があり、もし私たちの知的財産権が侵害され、流用され、または他の方法で侵害された場合、十分な救済措置を提供できない可能性もある。上記のいずれも、我々の競争地位、業務、財務状況、経営結果、および見通しに重大な悪影響を及ぼす可能性がある。
さらに、私たちが持っている特許および許可中の特許は、1つまたは複数の第三者の権利によって保持されるかもしれない。例えば、私たちが所有または許可しているいくつかの特許権利および技術の研究部分が米国政府によって援助されている場合、このような場合がある。したがって,政府はこれらの特許権や技術に対して一定の権利,あるいは進行権を持つ可能性がある.政府資金で新しい技術を開発する場合、政府は、政府が非商業目的のために発明を使用することを許可する非独占的許可を含む、生成された任意の特許のいくつかの権利を得ることができる。これらの権利は、政府が第三者に私たちの機密情報を開示し、第三者が私たちが許可した技術を使用または許可する先行権を行使することを可能にするかもしれない。政府が政府援助の技術の実用化を実現できなかったため、健康や安全需要を緩和し、連邦法規の要求を満たすために行動する必要があると考えている場合、あるいは米国工業を優先しなければならないため、政府はそのデモ権利を行使することができる。さらに、このような発明に対する私たちの権利は、そのような発明を含む製品を米国で製造するいくつかの要件によって制約される可能性がある。政府がこのような権利を行使することは、私たちの競争地位、業務、財務状況、経営結果、そして将来性を損なう可能性がある。
さらに、私たちの知的財産権の一部は1つ以上の第三者から取得された。私たちはこのような買収について職務調査を行いましたが、私たちは大部分の知的財産権の開発や起訴に参加していないため、私たちの職務遂行調査が潜在的な所有権エラー、そのような知的財産権を起訴する過程における潜在的なエラー、および私たちがこのような知的財産権を実行する能力を制限する可能性のある潜在的財産権負担を含む、このような知的財産権に関連するすべての問題を発見および/または救済することは保証できません。
特許条項は十分な時間で技術的な競争地位を保護するのに十分ではないかもしれない。
特許の寿命は限られている。米国では、すべての維持費が直ちに支払われる場合、特許の自然失効時間は、通常、最初に主張された米国非一時的または特許協力条約出願が提出された日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの製品をカバーする特許を取得しても、製品の特許有効期限が切れたら、私たちは競争に開放的になるかもしれません。新製品の開発、テスト、規制審査に要する時間を考慮して、このような製品の特許を保護する
46
このような製品が商業化される前または近いうちに期限が切れるかもしれない。したがって、私たちの特許の組み合わせは、他の会社がかなり長い間、または私たちと同じ製品を商業化していないことを排除するために、十分な権利を提供してくれないかもしれない。
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
発行された特許および特許出願の定期維持費、継続費、年会費、および様々な他の政府費用は、このような発行された特許および特許出願の有効期間内に、いくつかの段階に分けて米国特許商標局および他の外国特許代理機関に支払われなければならない。米国特許商標局および様々な外国国または国際特許機関は、特許出願中にいくつかのプログラム、文書、費用支払い、および他の同様の規定を遵守することを要求する。多くの場合、適用規則に従って滞納金を支払うか、または他の方法で不注意を是正することによって失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効され、関連法ドメインの特許権の一部または全部の喪失をもたらす可能性がある。特許権の放棄または失効を招く可能性のある不正事件には、我々の国際特許出願に基づいて国および地域段階の特許出願をタイムリーに提出できなかったこと、規定された期間内に公式行動に応答できなかったこと、費用が支払われていなかったこと、および適切に合法化され、正式な文書を提出することができなかったことが含まれるが、これらに限定されない。私たちは、私たちのいくつかの許可内の知的財産権に関するこれらの要求を遵守するために必要な行動を取るために私たちの許可側に依存しており、もし私たちまたは私たちの任意の現在または未来の許可者が、私たちのRxSightシステムまたは任意の未来の製品をカバーする特許および特許出願を維持できなければ、私たちの競争相手は市場に入ることができるかもしれません。これは、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼすでしょう。
関連する第三者特許を識別できないか、または第三者特許の関連性、範囲、または満了時間を誤って解釈することができない可能性があり、これは、私たちが製品を開発およびマーケティングする能力に悪影響を及ぼす可能性がある。
私たちは、関連特許の識別、特許請求の範囲、または関連特許の満了を含めて、私たちのいかなる特許検索または分析も保証することはできず、私たちは、私たちの現在および未来の製品の任意の司法管轄区域における商業化に関連する、または必要な、米国および海外のすべての第三者特許および係属中の特許および係属中の出願を識別したことを保証することはできない。
特許請求の範囲は、法律の解釈、特許における書面開示、および特許の起訴履歴に依存する。特許または保留出願の関連性または範囲の解釈は正しくない可能性があり、これは私たちの製品を販売する能力に悪影響を及ぼす可能性がある。私たちの製品が第三者特許のカバー範囲内にないか、または第三者の保留出願が関連範囲のクレームを出すかどうかを誤って予測する可能性がある。私たちが関連する特許の満期日の決定は正しくないかもしれませんが、関連特許を識別して正確に解釈できなければ、私たちが製品を開発し、マーケティングする能力に悪影響を及ぼすかもしれません。
私たちの将来の第三者への依存は、競争相手がこれらの秘密や私たちのビジネス秘密が流用または開示されていることを発見する可能性を高めるために、私たちのビジネス秘密を共有することを要求するかもしれない。
私たちは第三者に頼ってRxSightシステムや任意の未来の製品を生産したいので、第三者と協力して私たちのRxSightシステムや任意の未来の製品を開発し続けたいので、ビジネス秘密を共有しなければならないことがあります。CROとのパートナーシップや合意の条項に基づいてビジネス秘密を共有することが求められる可能性のある研究開発プロジェクトも展開したいと考えています。私たちのノウハウを保護するために、私たちは、ノウハウを開示する前に、当社のコンサルタント、従業員、請負業者、CMO、CRO、他のサービスプロバイダおよびコンサルタントと、秘密および使用制限および義務を含む合意を締結しました。これらの協定は、一般に、私たちの商業秘密を含む、第三者が私たちの機密情報を使用または開示する権利を制限する。契約規定があるにもかかわらず 第三者と協力する際に採用される条項によれば、商業秘密および他の機密情報を共有する必要は、そのような商業秘密が私たちの競争相手に知られ、意図せずに他の人の技術に組み込まれるか、または開示されるか、またはこれらの合意に違反して使用されるリスクを増加させる。私たちの独自の地位が私たちのノウハウおよびビジネス秘密にある程度基づいていることを考慮すると、競争相手は、私たちのビジネス秘密または他の許可されていない使用または開示が私たちの競争地位を損なうことを発見し、私たちの業務および運営結果に悪影響を及ぼす可能性があります。
47
さらに、これらのプロトコルは、一般に、いくつかの限られた発行権を含む可能性があるが、当社のコンサルタント、従業員、第三者請負業者、CMO、CRO、他のサービスプロバイダ、およびコンサルタントが、いくつかの限られた発行権を含む可能性があるが、私たちのビジネス秘密に関連するデータを発行する能力を制限する。私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、私たちの競争相手は、私たちと第三者との合意、独立開発、または私たちの任意の第三者協力者が情報を発表することによって、私たちのビジネス秘密を発見するかもしれない。競争相手は私たちのビジネス秘密が私たちの競争地位を損なうことを発見し、私たちの業務に悪影響を及ぼすだろう。
私たちは、私たちまたは私たちの従業員が商業秘密やノウハウを含む第三者の知的財産権を盗用した、または私たちの競争相手との競争禁止または入札協定に違反し、第三者が私たち自身の知的財産権の所有権権益を要求する可能性があると告発されるかもしれません。
私たちの多くの従業員とコンサルタントは以前、私たちの競争相手または潜在的な競争相手を含む他の医療機器、バイオテクノロジー、または製薬会社に雇われていた。その中のいくつかの従業員、コンサルタント、請負業者は、以前の雇用に関する独占権、秘密、および競業禁止協定に署名したかもしれない。私たちの従業員およびコンサルタントが、私たちのために働いているときに他人の知的財産権、独自の情報、技術的ノウハウ、または商業秘密を使用しないことを確実にするために努力しているにもかかわらず、私たちまたはこれらの個人は、これらの元雇用主または競争相手の知的財産権を無意識にまたは他の方法で流用したとして告発されるか、またはいわゆる商業秘密または他の固有情報を開示している可能性がある。これらのクレームに対して訴訟を提起する必要があるかもしれませんが、もし私たちがこのようなクレームを弁護することができなければ、金銭的損害賠償を支払う以外に、貴重な知的財産権を失う可能性があります。しかも、私たちはそのようなクレームのために人員を失うかもしれない。このような訴訟またはその脅威は、私たちが従業員を雇うか、または独立請負業者と契約を締結する能力に悪影響を及ぼす可能性がある。キーパーソンまたは彼らの作業製品の流出は、製品を商業化する能力を阻害または阻止する可能性があり、これは、私たちの業務、運営結果、財務状況、および見通しに実質的な悪影響を及ぼすだろう。
さらに、私たちは第三者からクレームを受ける可能性があり、私たちが自分の知的財産権の所有権と見なしている権利に疑問を提起するかもしれません。これらのクレームは、私たちの従業員またはコンサルタントが、発明を別の雇用主、前の雇用主、または他の人または実体に譲渡する義務に違反していることに基づいています。訴訟は、任意の他のクレームを弁護するために必要かもしれないが、それは必要かもしれないし、私たちはそのようなクレームを解決するために許可を得ることを望んでいるかもしれないが、もし可能であれば、商業的に合理的な条項で許可を得ることができる保証はない。もし私たちがこのようなクレームの弁護に失敗した場合、金銭的損害賠償の支払いに加えて、裁判所は、これらの技術または機能が以前の雇用主の商業秘密または他の固有の情報を含むことが発見されたか、または由来することを前提として、私たちの製品に重要な技術または機能の使用を禁止することができる。
さらに、私たちまたは私たちのライセンス者は、将来、私たちが所有しているまたは許可されていない発行された特許または特許出願の所有権を主張する元従業員、コンサルタント、または他の第三者からクレームを受ける可能性がある。このような任意の提出または手続きにおける不利な裁決は、排他的または運営の自由を失うことをもたらす可能性があり、または特許主張の全部または部分的な縮小、無効または実行不能をもたらす可能性があり、これは、他人が私たちに支払うことなく、同様の技術および療法を使用することを阻止するか、またはそれを商業化する能力を制限するか、または我々の技術の特許保護期間を制限する可能性がある。このようなものは 挑戦はまた、第三者特許権を侵害することなく、私たちの技術を開発、製造、商業化することができない可能性があります。さらに、私たちが所有または許可されていない特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、会社が現在または将来の製品を許可、開発、または商業化することを阻止するかもしれない。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
私たちの製品に重要または必要な技術や機能を統合できないことは、私たちの業務、財務状況、運営結果に重大な悪影響を与え、私たちの製品の販売を阻止する可能性があります。しかも、私たちは貴重な知的財産権や人員を失うかもしれない。これらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。どんな訴訟やその脅威も、私たちが従業員を雇ったり、独立販売代表と契約を結ぶ能力に悪影響を及ぼす可能性があります。キーパーソンや彼らの作業製品の流失は、製品を商業化する能力を阻害または阻止する可能性があり、これは私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
48
私たちは知的財産権訴訟または行政訴訟の当事者になる可能性があり、これらの訴訟または行政訴訟は費用が高く、私たちの製品の販売とマーケティングの能力を妨害する可能性があります。
医療機器業界の特徴は特許、商標、商業秘密とその他の知的財産権をめぐる広範な訴訟であり、この業界の会社は知的財産権訴訟を利用して競争優位を獲得している。第三者によって制御される米国および外国特許および係属中の特許出願、著作権または商標は、私たちの製品をカバーすることで告発される可能性があり、または第三者の商業機密の盗用として告発される可能性がある。また、私たちの製品には、サプライヤーから購入したコンポーネントが含まれており、私たちが直接制御できない設計コンポーネントが含まれている可能性があります。我々の競争相手は、その多くがより大きな資源を有し、特許組合、商業秘密、著作権、商標、および競合技術に多くの投資を行い、出願または取得された可能性があり、または将来的に特許、著作権または商標を出願または取得する可能性があり、これらの特許、著作権または商標は、私たちの製品の製造、使用、販売、および/または輸出または製品名を使用する能力を阻止、制限、または他の方法で妨害するであろう。特許出願は、発行されるまでに数年かかる可能性があり、一般に一定期間秘密にされる可能性があるので、現在、私たちが知らない係属中の出願が存在する可能性があり、これらの出願は、後に発行された特許が私たちの1つまたは複数の製品をカバーすることをもたらす可能性がある。また、近年、非執行実体である通称“特許痴漢”と呼ばれる個人や団体が特許やその他の知的財産権資産を購入し、和解を図ることを目的としている。私たちは時々脅迫状、通知、または“免許招待状”を受け取るかもしれない, または私たちの製品や業務が他人の知的財産権を侵害したり侵害したりすることを告発する標的になる可能性がある。私たちは非執行実体の特許侵害請求に直面する可能性があり、これらのエンティティは関連する製品収入がないので、私たちが持っているまたは許可された特許の組み合わせは彼らに抑止力がないかもしれない。私たちは将来的に訴訟や訴訟に対抗する側になるかもしれませんが、これらの訴訟では、私たちの競争相手または他の第三者は、私たちの製品やサービスの侵害、流用、または特許と商業秘密を含む他の方法で彼らの知的財産権を侵害していると主張するかもしれません。これらの問題を弁護するのに時間がかかる可能性があり、訴訟で弁護するコストが高く、経営陣の注意と資源を分散させ、私たちの名声やブランドを損ない、巨額の費用を発生させたり、巨額のお金を支払ったりする可能性がある。ハードウェアまたはソフトウェアを購入したサプライヤーは、そのようなハードウェアまたはソフトウェアが第三者の特許または商標の侵害または第三者の商業秘密の盗用として告発された場合には、私たちを賠償することができない場合があり、またはそのようなプロバイダによって付与されたいかなる賠償も、そのようなクレームによって生じるいかなる責任および費用を解決するのに十分ではないかもしれない。さらに、訴訟に関連する顧客またはビジネスパートナーに賠償し、ライセンスを取得したり、購読料を払い戻したりする義務がある可能性があり、これはさらにリソースを枯渇させる可能性があります。
第三者の知的財産権主張に法的根拠がないと考えても,裁判所が特許の侵害,有効性,実行可能性または優先権問題を含めて勝訴を裁定する保証はない.私たちの弁護力は、主張された特許、これらの特許の解釈、および私たちが主張した特許の無効を宣言する能力に依存するだろう。管轄権のある裁判所は、これらの第三者特許が有効で、強制的に実行可能であり、侵害されていると判断することができ、これは、私たちが開発する可能性のある任意の製品または技術、および主張する第三者特許がカバーする任意の他の製品または技術を商業化する能力に実質的な悪影響を及ぼす可能性がある。連邦裁判所でこのような米国特許の有効性に挑戦することに成功するためには,有効性推定を克服する必要がある。これは重い負担であるため,このような米国特許権利要件の無効について明確で納得できる証拠を提出することを要求するため,管轄権のある裁判所がこのような米国特許権利要求を無効にすることは保証されない.逆に、特許所有者は証拠優勢によって侵害行為を証明するだけであり、これはより低い立証責任である。
さらに、特許、商標、著作権、または商業秘密が私たちに不利であることを成功的に主張された場合、これは私たちの業務を損なう可能性があり、私たちの開発、製造、マーケティング、または私たちの製品の販売を禁止する禁止、または許可料、損害賠償金、弁護士費、法廷費用の支払いの義務を招く可能性があり、これは巨額である可能性がある。また、第三者の特許や商標の故意の侵害や商業秘密の流用が発見された場合、損害賠償金の3倍、その他の処罰を請求される可能性があります。
医療機器分野の特許、著作権、商標、商業秘密、および他の知的財産権紛争は、通常、許可または同様の手配によって解決されるが、そのような手配に関連するコストは、持続的な使用料を含む可能性が高い可能性がある。私たちはもしあれば、満足できる条項で必要な許可証を得ることができないかもしれない。さらに、もし私たちが得た任意の許可が非排他的であれば、私たちの競争相手や他の第三者がこのような許可によってカバーされた知的財産権や技術を使用して私たちと競争することを阻止できないかもしれない。必要なものが得られなければ
49
許可、私たちは権利侵害を避けるために私たちの製品を再設計できないかもしれない。これらの事件のいずれも、私たちの業務、財務状況、および経営結果に実質的な悪影響を及ぼす可能性がある。
同様に、第三者によって引き起こされるか、または米国特許商標局によって提起された干渉または派生プログラムは、我々の特許、特許出願、商標または商標出願の優先権を決定するために必要である可能性がある。私たちはまた、再審、当事者間の審査、派生、またはUSPTOまたは他の司法機関で行われる、私たちの知的財産権または他の人の知的財産権に関する異議手続きのような他の手続きに参加することができる。司法または行政訴訟における不利な裁決または必要なライセンスを取得できなかったことは、私たちの製品の生産または製品名の使用を阻止する可能性があり、これは私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼすだろう。
さらに、私たちは、私たちの特許または他の知的財産権を保護または実行するために、訴訟を提起したり、他の訴訟を起こしたりするかもしれないが、これは高価で、時間がかかり、成功しないかもしれない。競争相手は私たちが発行した特許や他の知的財産権を侵害するかもしれないが、私たちはいつもこれを発見できるわけではないかもしれない。権利侵害や不正使用に対抗するために、私たちは費用が高く時間がかかるかもしれない侵害請求を要求されるかもしれない。私たちが認定された侵害者に対するいかなるクレームも、私たちが彼らの知的財産権を侵害したと主張したり、私たちの知的財産権が無効または実行不可能だと主張したりするように、これらの当事者たちに反訴を促す可能性がある。有効性を疑問視する理由は、新規性の欠如、明らかな、または実施できないことを含む、いくつかの法定要件のいずれかを満たしていないと言われているからかもしれない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.第三者は、訴訟の範囲外であっても、米国または海外の行政機関に、私たちの所有または許可されていないいくつかの特許主張の有効性について疑問を提起する可能性がある。このようなメカニズムには、再審査、認可後審査、当事者間の審査、介入手続き、派生手続き、および外国法ドメインにおける同等の手続き(例えば、反対手続き)が含まれる。どのようなものでも 訴訟または他の手続きでは、裁判所または他の行政機関は、私たちの特許の全部または一部が無効または実行不可能であると判断し、その特許の権利要件を狭く解釈するか、または私たちの特許が関連する技術をカバーしないことを理由に、他方の関連する技術の使用を阻止することを拒否することができる。
法的に無効と実行不可能と断言された後の結果は予測できない。もし第三者が法的に無効または強制執行できないと主張した場合、私たちは少なくとも部分的、さらにはすべて、私たちの製品または私たちが開発する可能性のある製品の特許保護を失うだろう。もし私たちの特許が有効で侵害されていることが発見された場合、裁判所は侵害者に対する禁制令救済を拒否することができ、私たちに金銭損害賠償および/または持続的な印税を与えることができる。このような金銭賠償は市場での侵害者の競争が私たちの業務に与える損害を十分に相殺するのに十分ではないかもしれません。任意の訴訟または他の手続きにおける不利な結果は、私たちの1つまたは複数の特許を無効または狭義に解釈されるリスクに直面させる可能性がある。これらの事件のいずれも、私たちの業務、財務状況、および経営結果に実質的な悪影響を及ぼす可能性がある。
解決策が私たちに有利であっても、知的財産権クレームに関する訴訟や他の手続きは、私たちに巨額の費用を発生させ、私たちの人員の正常な責任を分散させる可能性があります。また、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスだと思う場合、私たちの普通株の価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や訴訟手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源とより成熟して発展した知的財産権の組み合わせを持っているので、このような訴訟や法的手続きの費用を私たちよりも効率的に負担するかもしれない。さらに、知的財産権訴訟は大量の開示を必要とするため、訴訟が発生すれば、私たちのいくつかの機密または敏感な情報は開示によって損害を受ける可能性がある。特許および他の知的財産権訴訟または他の訴訟の開始および継続によって生じる不確実性は、私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。
50
訴訟の費用と不確実性のため、私たちは第三者に対して私たちの知的財産権を強制的に実行できないかもしれない。
訴訟の費用と不確実性のため、第三者が私たちの所有または許可内の特許を侵害、流用、または他の方法で侵害しても、私たちの将来の特許出願または他の知的財産権によって発行される可能性のある任意の特許は、そのようなクレームや訴訟を提起し、実行するリスク調整コストが高すぎる可能性があり、またはわが社または私たちの株主の最適な利益に適合しない可能性があると結論するかもしれない。この場合、私たちは、状況を簡単に監視するか、または他の非訴訟の行動または解決策を開始または求めることで、より慎重なやり方を決定するかもしれない。
私たちが製品を開発し商業化する権利は、他人が私たちに付与する許可証の条項と条件にある程度制限されている。
私たちは、第三者からの特定の特許権、独自技術、および他の知的財産権の許可にある程度依存しており、これらは、私たちの製品および技術の開発に重要または必要である。私たちの現在の製品のさらなる開発と商業化、そして任意の未来の製品の開発には、追加の許可や協力協定を締結する必要があるかもしれません。これらの許可および他の許可は、すべての関連する使用分野および将来的に私たちの技術および製品の開発、またはそれを商業化するすべての地域でそのような知的財産権および技術を使用することを望む独占的な権利を提供しない可能性がある。したがって、私たちは競争相手が私たちのすべてのライセンスに含まれる地域で競争製品を開発し、商業化することを阻止できないかもしれない。
さらに、私たちは、第三者から許可された技術をカバーする特許および特許出願の準備、提出、起訴、維持、実行、および弁護を制御する権利がないかもしれない。したがって、私たちはこのような特許と特許出願の準備、提出、起訴、維持、強制執行、弁護が私たちの業務の最適な利益に合致しているかどうかを決定することができない。さらに、我々のライセンシーまたは別のライセンシーによって提起された訴訟において、または私たちのライセンシーまたは別の許可者がそのような訴訟または他の理由に応答して、私たちのライセンシーまたは別のライセンシーに提起された行政訴訟では、私たちに付与された特許は、無効が宣言されるか、または狭義に解釈されるリスクに直面する可能性がある。もし私たちの許可者がこれらの特許を起訴、維持、強制執行および保護できなかった場合、またはこれらの特許または特許出願の権利を失った場合、私たちが許可を得た権利は減少またはキャンセルされる可能性があり、私たちはそのような許可権利によって制限された任意の製品の権利を開発および商業化することは不利な影響を受ける可能性がある。
私たちのライセンス者は第三者コンサルタントや協力者または第三者からの資金に依存する可能性がありますので、私たちのライセンス者は私たちが許可した特許の唯一および独占所有者ではありません。これは私たちの業務、財務状況、そして経営結果に実質的な悪影響を及ぼすかもしれない。
我々は現在、第三者から知的財産権や技術許可を得るプロトコルは複雑であり、このようなプロトコルのいくつかの条項は様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利の範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させることができるかもしれません。私たちが最善を尽くしたにもかかわらず、私たちの許可側は、許可協定に深刻に違反し、許可協定を終了し、これらの許可協定がカバーする製品や技術を開発し、商業化することができないと結論するかもしれません。これらの許可内で終了された場合、または基礎特許が予想される排他性を提供できなかった場合、競争相手は、規制部門の承認を求め、私たちと同じ製品を販売する権利がある。さらに、我々は、我々の許可者からより多くの許可を得ることを求めることができ、このような許可を得る際には、第三者(我々の競争相手を含む可能性がある)が私たちの既存の許可によって制限されている知的財産権の一部の許可を得ることを許可する条項を含む、許可者に有利な方法で既存の許可を修正することに同意するかもしれない。また、我々が許可している知的財産権紛争が、商業的に許容可能な条項で他の許可手配を維持する能力を阻害したり、弱体化したりすれば、影響を受けた製品の開発に成功し、商業化することができない可能性がある。これらの事件のいずれも、私たちの業務、財務状況、および経営結果に実質的な悪影響を及ぼす可能性がある。
51
将来的に、私たちは知的財産権へのアクセスまたは共有の許可や協力を提供することに関する合意に達するかもしれない。もし私たちがいかなる許可、協力、または他の合意の下での義務を履行できなかった場合、私たちは損害賠償金の支払いを要求され、現在および未来の製品の開発と保護に必要な知的財産権を失う可能性があります。
私たちは現在、将来的に第三者から私たちの現在および未来の製品に関連するいくつかの知的財産権の許可を取得し続けるかもしれない。もし私たちがそうするなら、私たちはこのような許可者たちに一定の義務があるかもしれない。もし私たちがいかなる重大な義務に違反したり、許可された知的財産権を無許可で使用した場合、私たちは損害賠償金の支払いを要求される可能性があり、許可側は許可を終了する権利があるかもしれません。これは、許可技術がカバーする製品を開発、製造、販売できない、あるいは競争相手が許可技術を得ることができるようにすることができます。
ライセンス契約によると、私たちと将来のライセンス者との間で知的財産権に関する紛争が発生する可能性があります
もし私たちが将来許可する知的財産権紛争が許容可能な条項で許可スケジュールを維持する能力を阻害したり、損害を与えたりすれば、影響を受けた製品の開発に成功し、商業化することができない可能性があり、これは私たちの業務に大きな悪影響を及ぼすだろう。
さらに、私たちが将来第三者と達成するいくつかの合意は、私たちがいくつかの取引を達成する能力を制限または延期するかもしれないし、これらの取引の価値に影響を与えるかもしれないし、あるいは私たちが何らかの活動に従事する能力を制限するかもしれない。例えば、将来的に譲渡または譲渡不可能なライセンス契約を締結したり、譲渡または譲渡を行うことができるライセンス契約を許可者が明確に同意する必要がある場合があります。
さらに、私たちまたは将来のライセンシー(もしあれば)は、開発および商業化活動の過程で行われた発明の特許可能な側面を識別できない可能性があり、そうでなければ遅すぎて、特許保護を得ることができないかもしれない。したがって、私たちは私たちの特許地位を強化する予想された潜在的な機会を逃すかもしれない。我々の特許または特許出願の準備または提出中に、例えば、適切な優先権請求、リスト、特許請求の範囲、または特許期限調整要求に関して、将来的に生じる可能性のある形態的欠陥が存在するか、または将来的に生じる可能性がある。もし私たちまたは私たちの将来の許可者がそのような特許および他の知的財産権を確立、維持、または保護できなかった場合、そのような権利は減少またはキャンセルされる可能性がある。もし私たちの将来の許可者がいかなる特許権を起訴、維持または実行する上で完全に協力していないか、または私たちの意見に同意しない場合、これらの特許権は損害を受ける可能性がある。私たちの特許または特許出願が形態、準備、起訴または実行において重大な欠陥がある場合、そのような特許は無効および/または強制的に実行できない可能性があり、そのような出願は有効で強制的に実行可能な特許を決して生成しない可能性がある。これらの結果のいずれも、第三者の競争を阻止する能力を弱める可能性があり、第三者競争は私たちの業務に悪影響を及ぼす可能性がある。
さらに、私たちが特許の起訴と、将来の第三者許可下の特許出願を制御する権利があっても、私たちの前任者は、私たちが特許起訴を制御する前の人およびその弁護士の行動または不作為の悪影響または損害を受ける可能性がある。
私たちが未来に様々な第三者から取得または許可された技術は保存された権利の制約を受けるかもしれない。私たちの前任者は彼らと私たちの合意に基づいて、基礎を使用することを含むいくつかの権利を維持することができるかもしれません
52
非商業的学術及び研究のための技術は、当該技術に関する研究の一般的な科学的発見を発表し、当該技術に関する情報を通常の科学及び学術的に開示する。私たちの先輩や将来の許可者が彼らの技術の使用をこれらの用途に制限しているかどうかを監視することは困難であり、悪用すれば、許可技術の権利を強制的に執行するための多くの費用が発生する可能性がある。
もし私たちが獲得したまたは未来の許可された技術を利用する能力が限られている場合、あるいは将来の重要なライセンス内技術の権利を失った場合、私たちは私たちの製品を開発、許可を超え、マーケティング、販売することに成功できないかもしれません。これは新製品の発売を阻止または延期するかもしれません。我々のビジネス戦略は,得られた技術を商業製品に開発することに成功し,将来的には許可された技術を商業製品に開発する可能性がある.したがって、私たちがこれらの技術を利用する能力に対するいかなる制限も、私たちの開発、許可、あるいはマーケティングと私たちの製品を販売する能力を損なう可能性があります。
私たちは買収とライセンス内で開発されたどんな製品も必要な権利を得ることに成功できないかもしれない。
私たちは既存のライセンス側から追加の許可を得る必要があるかもしれないし、他の方法で第三者から取得する必要があるかもしれません。私たちの製品に必要な任意の知的財産権が必要だと思います。私たちは合理的なコストや合理的な条項で任意の追加的な許可を得ることができないかもしれないし、そのような知的財産権を得ることができないかもしれない。第三者知的財産権の許可または買収は競争分野であり、より多くの老舗企業は、魅力的または必要と考えられる第三者知的財産権許可または買収戦略をとることができる。これらの老舗会社はその規模、資本資源及び更に強い臨床開発と商業化能力のため、私たちより競争優位を持っているかもしれない。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資を適切なリターンを得るための条項で許可したり、第三者の知的財産権を取得することができないかもしれないし、全くできないかもしれない。この場合、私たちは、私たちの技術、製品、またはそれらを製造する方法を再設計するために多くの時間と資源を必要とするか、または代替技術を開発または許可する必要があるかもしれません。これらは、技術的にも商業的にも不可能かもしれません。もし私たちがそれができなければ、私たちは影響を受けた製品を開発したり商業化することができなくなり、これは私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼすかもしれない。
私たちが将来達成する可能性のあるどんな協力や協力計画も成功しない可能性があり、これは私たちが製品を開発し、それを商業化する能力に悪影響を及ぼすかもしれない。
私たちが未来に行ったどんな協力も成功しないかもしれない。私たちの協力計画の成功は私たちの協力者の努力と活動に大きく依存するだろう。協力は多くのリスクに直面しています
53
私たちは私たちの特許と他の知的財産権発明権のクレームに疑問を受けるかもしれない。
私たちまたは私たちの許可者は、以前のコンサルタント、請負業者または他の第三者が、発明者または共同発明者として、私たちの所有または許可内の特許、商業秘密、または他の知的財産権において権益を有するというクレームを受ける可能性がある。私たちの政策は、知的財産権の概念や開発に参加する可能性のある私たちの従業員、コンサルタント、請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求していますが、実際に私たちが自分の知的財産権と見なしているすべての当事者とこのような合意を実行することはできないかもしれません。知的財産権の譲渡は自動的に実行されない可能性があり、あるいは譲渡協定が違反される可能性があり、私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起する可能性のあるクレームを弁護したりすることができます。もし私たちまたは私たちのライセンシーがこのようなクレームを弁護できなかった場合、金銭損害賠償を支払うことに加えて、私たちの製品の重要な知的財産権の独占所有権や使用権などの貴重な知的財産権を失う可能性があります。さらに、我々と発明譲渡協定を実行する個人は、学術機関のような第三者に対して予め存在または相互競争する義務を負う可能性があるので、私たちと達成された合意は、その個人が開発した発明の所有権を完全にする上で無効になる可能性がある。このようなどんな事件も、私たちの業務、財務状況、そして運営結果に重大な悪影響を及ぼす可能性がある。
もし私たちが私たちの商業秘密と他の固有情報の機密性を保護できなければ、私たちの業務と競争地位は損なわれるかもしれない。
特許保護に加えて、私たちは、商業秘密の保護、および他の出願不可能な特許、または私たちが特許を出願しない独自の情報を選択することを含む他の固有の権利にも依存する。しかし、商業秘密を保護することは難しいかもしれないが、アメリカ国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、あるいは保護したくない。私たちのビジネス秘密と独自の情報を秘密にするために、私たちは、私たちの従業員、コンサルタント、協力者、他の人たちと私たちと関係を作り始めたときに彼らと締結された契約における秘密条項に大きく依存しています。私たちは私たちが可能であるか、または私たちの商業秘密またはノウハウとプロセスに接触したすべての当事者とこのような合意に到達したことを保証することができない。私たちは、一般的にこれらの秘密制限があるにもかかわらず、このような第三者が許可されていない開示または私たちの技術知識または他の商業秘密を使用することを阻止できないかもしれない。許可されていない、商業秘密、ノウハウ、または他の固有情報を流用、または漏洩する場合、これらの契約は、私たちのビジネス秘密、ノウハウ、または他の固有情報を有意義に保護することができない可能性があります。これらの第三者が彼らと私たちとの合意に違反しないことを保証することはできず、私たちがいかなる違反行為に対して十分な救済措置を持っていることも保証できないし、私たちの商業秘密が競争相手に知られたり、独立して開発されないことを保証することもできない。私たちは私たちの知的財産権や他の固有の権利を保護しているにもかかわらず、不正使用を監視し、私たちの知的財産権を開示することは困難であり、私たちは私たちが取った知的財産権または他の固有の権利を保護するステップが十分かどうか分からない。また、, 多くの外国の法律はアメリカの法律のように私たちの知的財産権や他の固有の権利を保護しないだろう。したがって、私たちは私たちのノウハウが海外で利用されることを防ぐことができないかもしれないが、これは私たちの国際市場への拡張能力に影響を与えるかもしれないし、私たちの技術を保護するために高い努力を払わなければならないかもしれない。
もし私たちの知的財産権や他の固有の情報保護が不完全であれば、私たちはより大きな直接競争の危険に直面するだろう。第三者は、我々の製品または技術を不正に複製または他の方法で取得して使用することができ、または同様の技術を開発することができる。私たちの競争相手は私たちの製品を購入して、いくつかをコピーしようとするかもしれません
54
保護された技術をめぐる開発努力や設計から得られたすべての競争優位性。私たちは私たちの知的財産権を保護、保護、実行することができず、私たちの製品、ブランド、業務の価値を深刻に損なうかもしれません。私たちのビジネス秘密や他の機密ビジネス情報を盗んだり、不正に使用したりすることは、私たちの製品の差別化を低下させ、私たちの業務を損なう可能性があり、開発や業務買収における投資価値が減少する可能性があり、第三者がその機密または独自情報の損失について請求する可能性があります。上記のいずれも、我々の業務、財務状況、経営結果に重大な悪影響を及ぼす可能性がある。
さらに、他の人は、同じまたは同様の技術を独立して開発するか、または他の方法で我々の非特許技術を取得する可能性があり、この場合、私たちは、そのような当事者またはそのような商業秘密を伝える人に対して任意の商業秘密権利を主張することができない。私たちの商業秘密権および関連秘密および秘密条項の範囲を実行して決定するには、高価で時間のかかる訴訟が必要となる可能性があります。もし私たちが商業秘密保護を獲得したり維持したり、私たちの競争相手が私たちの商業秘密を獲得したり、私たちや私たちと競争する技術と同様の技術を独立して開発しなければ、私たちの競争市場の地位は実質的で不利な影響を受ける可能性がある。さらに、いくつかの裁判所は、多くの法域では実行が困難であり、場合によっては実行できない可能性がある競業禁止に関する商業秘密および合意条項をあまり望んでいないか、または保護したくない。
我々はまた,我々のオフィスの実体セキュリティと我々の情報技術システムの実体と電子セキュリティを維持することで,我々のデータや他の機密情報の完全性とセキュリティの維持に努めている.我々はこれらの個人,組織,システムに自信があるが,プロトコルやセキュリティ措置が違反される可能性があり,機密情報の漏洩や流用行為を検出し,一方が機密情報を不正に開示したり流用したりすることは困難であり,高価で時間がかかり,結果的には予測できない.しかも、私たちはどんな違反についても十分な救済措置を得ることができないかもしれない。
米国特許法または他の国または管轄区域特許法の変化は、特許の全体的な価値を低下させ、製品を保護する能力を弱める可能性がある。
米国特許法または特許法解釈の変化は、特許出願をめぐる起訴および発行された特許の実行または弁護の不確実性およびコストを増加させる可能性がある。米国は広範囲な特許改革立法を制定して実施してきた。特許性の他の要件が満たされていると仮定すると,2013年3月までに,米国では,まず発明により保護された発明を発明した者が特許を取得する権利があり,米国以外では,最初に特許出願を提出した者が特許を取得する権利がある。2013年3月以降、2011年9月に公布された“ライシー·スミス米国発明法”または“米国発明法”によれば、米国は、第1の発明者が特許を出願する制度に移行し、すなわち、他の特許性要件を満たすと仮定して、最初に特許出願を提出した発明者は、要求された発明が第三者が最初に発明したものであるか否かにかかわらず、発明の特許を取得する権利がある。米国発明法にはいくつかの重大な変化も含まれており、これらの変化は特許出願の起訴方法に影響を与え、特許訴訟に影響を与える可能性もある。これらの措置には、特許訴訟中に第3の方向に米国特許商標局が以前の技術を提出することを可能にすることと、付与後審査、当事者間の審査、および派生手続を含む、米国特許商標局によって管理される付与後手続きが特許有効性に疑問を提起する追加の手続きが含まれる。米国発明法およびその実施は、私たちの特許出願をめぐる起訴および私たちが発行した特許の実行または保護をめぐる不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
さらに、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下し、場合によっては入手可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかを決定している。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.裁判所、アメリカ議会、またはアメリカ特許商標局の裁決や行動が私たちの特許価値にどのように影響するかを予測することはできません。国会、連邦裁判所、および米国特許商標局の行動によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を獲得したり、私たちが許可または将来獲得可能な特許を実行する能力を弱める可能性がある。同様に、他の国または管轄区域の特許法および法規の変化、またはそれらの政府機関の変化を実行するか、または関連する政府当局が特許法律または法規を実行する方法の変化は、私たちが新たな特許を取得したり、私たちが許可または将来獲得する可能性のある特許を実行する能力を弱める可能性がある。上記のいずれも、当社の業務、財務状況、経営結果、見通しに重大な悪影響を及ぼす可能性があります。
55
私たちは世界各地で私たちの知的財産権を保護できないかもしれないが、これは私たちの業務を損なうかもしれない。
私たちをカバーするRxSightシステムと世界各地の任意の未来の製品をカバーする特許の申請、起訴、保護は恐ろしい高価になり、私たちのアメリカ以外のいくつかの国の知的財産権は米国の知的財産権を広く持っていないだろう。場合によっては、私たちまたは私たちの許可者は、米国以外のいくつかの技術の特許保護を受けることができないかもしれない。また、いくつかの外国の法律は知的財産権の保護の程度はアメリカの連邦や州法律に及ばない。したがって、私たちまたは私たちのライセンス者が確かに特許保護を求めている司法管轄地域であっても、米国以外のすべての国/地域で、私たちまたは私たちのライセンス者が発明を使用して製造した製品を米国または他の管轄区域で販売または輸入することを阻止することはできないかもしれない。競争相手は、私たちまたは私たちの許可者が特許保護を受けていない司法管轄区域で私たちの技術を使用して彼ら自身の製品を開発することができ、また、他の侵害製品を私たちが所有または特許保護を受ける可能性があるが、特許執行力がアメリカに及ばない地域に輸出することもできる。これらの許可されていない製品は、これらの司法管轄区域で私たちの製品と競争し、私たちの市場シェアを奪うことができるかもしれません。私たちには、可能なかもしれない特許が発行されていないので、将来の任意の特許主張や他の知的財産権は、彼らのような競争を効果的にまたは阻止するのに十分ではないかもしれません。
多くの会社は外国の管轄区域で知的財産権の執行と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許、商業秘密、および他の知的財産権保護の実行を支持しておらず、これは、私たちの特許侵害を阻止したり、全体的に私たちの専有権を侵害する方法で競争製品を販売することを困難にするかもしれない。外国の管轄区域で私たちまたは私たちのライセンシーの特許権を強制的に執行する訴訟は、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移転させる可能性があり、私たちの特許を無効または狭義に解釈されるリスクに直面させる可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者が私たちにクレームを提起する可能性がある。私たちまたは私たちの許可者は、私たちまたは私たちの許可者が起こしたいかなる訴訟でも勝利しないかもしれませんし、判決された損害賠償または他の救済措置(ある場合)は商業的な意味がないかもしれません。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。
多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちまたは私たちの任意の許可者が第三者に私たちの業務に関連する任意の特許のライセンスを付与することを余儀なくされた場合、私たちの業務、財務状況、運営結果、および見通しは実質的で不利な影響を受ける可能性があります。
2023年6月1日より早くなく、ヨーロッパの特許出願はすぐに特許付与後に単一特許裁判所(UPC)によって管轄される単一特許となる権利がある。これは欧州特許実践の大きな変化になるだろう。UPCは新しい裁判所制度であるため、裁判所には前例がなく、いかなる訴訟の不確実性も増加している。RxSightはケースに基づいてUPCに関する選択を考慮し、直ちに外国人弁護士と調整する。
知的財産権は必ずしも私たちの競争優位に対するすべての潜在的な脅威を解決できるとは限らない。
私たちの知的財産権が提供する将来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。以下の例は例示的である
56
私たちの将来の“オープンソースソフトウェア”の使用は、私たちの独自ソフトウェアを全面的に発表し、私たちの製品を販売する能力に悪影響を与え、訴訟に直面する可能性があります。
私たちは、オープンソースソフトウェアを、私たちが許可、開発、および/または配布する未来の製品または技術に統合する予定です。オープンソースコードソフトウェアは、一般に、オープンソースコードライセンスに従って、その著者または他の第三者によって許可される。いくつかのオープンソースライセンスは、オープンソースソフトウェアを修正したソースコードを公開することを要求し、このような修正を第三者に無料で許可することを要求します。場合によっては、オープンソースソフトウェアに関連する場合、私たちのソフトウェアを配布するには、ソフトウェア中の私たちの固有のソースコードの一部または全部を公開して許可し、特定のオープンソースソフトウェアを使用した製品をユーザに無料で配布する必要がある場合があります。私たちは、私たちの専用ソースコードの下での開示やライセンス付与を要求する方法で使用されないように、オープンソースソフトウェアの使用を監視するつもりですが、このような努力が成功することは保証されません。オープンソースコード許可条項は通常曖昧であり、このような使用は無意識に発生する可能性がある。これらの許可の多くの条項の解釈は法的前例がほとんどなく、これらの条項が私たちの業務に与える潜在的な影響は、私たちの製品と技術に関する予期しない義務を招く可能性がある。過去、オープンソースソフトウェアをその製品に組み入れた会社は、オープンソースソフトウェアの所有権を要求するクレームと、その製品にオープンソースソフトウェアの所有権を含めることを主張するクレームに直面していた。このようなオープンソースソフトウェアを配布している著者や他の第三者がオープンソースライセンスの条件を遵守していないと主張すれば、このような疑惑を正当化するための巨額の法的費用を招く可能性がある。もしこのようなクレームが成功すれば, 私たちは重大な被害を受けたり、私たちの製品を販売することが禁止されるかもしれない。また、私たちの独自ソフトウェアとオープンソースソフトウェアを何らかの方法で組み合わせると、いくつかのオープンソース許可の下で、私たちの独自ソフトウェアのソースコードの配布が要求される可能性があり、これは、私たちの競争相手が私たちと似ているか、より良い製品を開発し、他の側面で私たちの業務に悪影響を与えることを大きく助けることができます。これらのリスクは除去や管理が困難である可能性があり,処理しなければ,我々の業務,財務状況,運営結果を損なう可能性がある。
もし私たちの商標、サービスマーク、商標名が十分に保護されなければ、私たちは私たちの市場で知名度を作ることができないかもしれません。私たちの業務は不利な影響を受けるかもしれません。
私たちは商標、サービスマーク、商標名、ブランド名によって私たちの製品を競争相手の製品と区別し、これらの商標の登録または登録を申請しました。私たちはあなたに私たちの商標とサービスマーク申請が承認されることを保証することができません。商標とサービス商標登録手続きで、私たちは拒否を受けるかもしれない。私たちはこのような拒否に答える機会があるにもかかわらず、私たちはこの拒否を克服できないかもしれない。また、米国特許商標局や多くの外国司法管轄区の類似機関の訴訟手続では、第三者は、係属中の商標やサービス商標出願に反対し、登録商標やサービス商標のキャンセルを求める機会がある。私たちの商標とサービスマークに反対またはキャンセル訴訟を提起するかもしれません。私たちの商標とサービスマークは継続できないかもしれません。もし私たちの商標とサービスマークが成功的に挑戦されれば、私たちは私たちの製品ブランドを再形成することを余儀なくされるかもしれません。これはブランド認知度の喪失を招き、広告と新しいブランドをマーケティングするために資源を投入する必要があるかもしれません。時々、競争相手は私たちと似たような商号、商標、サービスマークを採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。私たちの商標とサービス表記権を強化し、侵害や他の侵害を防止するために、第三者にクレームを出したり、反対訴訟を起こしたりすることを要求される可能性があります。これは高いかもしれません
57
そして時間がかかります。さらに、他の登録商標、サービス商標、または当社の登録または未登録商標またはサービスマーク変異体を含む商標またはサービス商標の所有者は、商標またはサービス商標侵害クレームを提起する可能性がある。私たちの現在または未来のいくつかの商標またはサービスマークは、それらの使用が一般的になり、商標またはサービスマークの保護が失われるように一般的に知られるようになるかもしれない。長期的に見れば、私たちが私たちの商標、サービスマーク、商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務、財務状況、経営結果は不利な影響を受ける可能性がある。
政府の規制に関連するリスク
もし私たちが私たちの製品に対する必要な規制許可または承認を得て維持できなかった場合、または将来の製品および適応の許可または承認が延期された場合、または発表されなかった場合、私たちの商業運営は損なわれるだろう。
私たちの製品は米国でFDAによって広く規制されており、私たちが業務を展開することを選択する可能性のある他の国では、私たちの製品も規制機関によって広く規制されている。医療機器に対する政府法規は広範囲にわたっている
新しい医療機器または既存製品の新しい予期される用途が米国で発売される前に、会社は、適用免除が適用されない限り、FDCA第510(K)条によるFDAの承認、またはFDAの上場前承認またはPMA申請を最初に提出し、取得しなければならない。
多くの場合、PMA承認を得るプロセスは、510(K)の承認プロセスよりも厳しく、コストが高く、時間が長く、および不確定である。510(K)の承認中、FDAは、提案された装置が提案された装置が発売されることを承認するために、市場で合法的に販売されている装置“実質的に等しい”、いわゆる“述語”装置を決定しなければならない。“実質的に同等”に達するためには、提案された装置は、述語装置と同じ予期される用途を有する必要があり、言語装置と同じ技術的特徴を有するか、または異なる技術的特徴を有し、言語装置とは異なるセキュリティまたは有効性の問題を引き起こさない必要がある。実質的な等価性を支援するために臨床データが必要となる場合がある。PMA承認過程において、FDAは技術、臨床前、臨床試験、製造とラベルデータを含む大量のデータに基づいて、提案された設備を決定しなければならず、その期待用途に対して安全かつ有効である。510(K)フローが使用できず、最大リスクを構成すると考えられるデバイスの場合、PMAプロセスが一般的に必要とされる。PMA申請によって承認された製品修正は、通常、FDAがPMA補充剤を事前に承認する必要がある。同様に、510(K)によって承認された製品のいくつかの修正は、新しい510(K)を必要とする場合があり、またはこのような修正は、デバイスをレベルIIIに配置し、PMA承認を必要とする可能性がある。FDAの510(K)承認プロセスは、通常、3~12ヶ月を要するが、より長く続く可能性がある。PMAを取得するプロセスは、通常、PMAがFDAに提出されてから承認を得るまでに1~3年、さらにはより長い時間を要する。必要な規制承認や許可を得ることができなかった遅延や許可は、私たちの業務、財務状況、運営結果に重大な悪影響を及ぼすだろう。
FDAは、多くの理由で、承認または承認装置を延期、制限、または拒否することができる
58
同様に、監督管理機関は、著者らと主要な研究者との財務関係は感知或いは実際の利益衝突を招き、すでに研究の解釈、臨床試験場所に適用して発生したデータの完全性或いは臨床試験自体の効用に影響している可能性があると認定するかもしれない。私たちが規制許可や承認を与えられても、それらは製品指定用途の重大な制限を含む可能性があり、これは製品の市場を制限する可能性がある。また、FDAとEUの監督管理機関は、競争相手製品に対する製品の比較と優勢主張を含む、医療機器のラベル、販売促進と広告を厳格に監督する。
PMA出願を承認する条件として、FDAはまた、申請者がいくつかの患者集団を追跡研究または追跡し、必要に応じてこれらの患者の臨床状態をFDAに定期的に報告して、公衆の健康を保護するため、または装置に追加の安全性および有効性データを提供するために、何らかの形態の承認後研究または上場後監視を要求することができる。適用法規による承認後の検討ができなかったり,必要な承認をタイムリーに完了できなかったり,他の承認後の要求を遵守したりすることで,PMAの承認が撤回される可能性があり,我々の業務を損なうことになる.
さらに、我々は、MDRを含む様々な報告書をFDAにタイムリーに提出することを要求されており、我々の製品が死亡または重傷を引き起こす可能性があるかどうか、または障害が再び発生した場合、死亡または重傷の障害を引き起こす可能性があるかどうかを監督機関に報告することが要求される。これらの報告書を直ちに提出しなければ、規制機関は制裁を実施する可能性があり、私たちは製品責任や規制法執行行動の影響を受ける可能性があり、これらはすべて私たちの業務を損なう可能性がある。
もし私たちが私たちの製品に対して是正または除去行動を取り始めたら、私たちの製品の健康構成に対する重大なリスクを減少させ、私たちはFDAに公開的な是正と除去報告書を提出することを要求され、多くの場合、他の規制機関にも同様の報告書を提出する必要がある。この報告書はFDAによって設備リコールに分類される可能性があり、これはFDA、他の国際規制機関、および私たちの顧客が私たちの製品の品質と安全をより厳格に審査することをもたらす可能性がある。さらに、これらの報告書を提出することは、競争相手によって私たちに反対するために使用される可能性があり、医師の手続きの延期やキャンセルにつながる可能性があり、これは私たちの名声を損なう可能性がある。
FDAと連邦貿易委員会(FTC)もまた、私たちの製品の広告、販売促進、およびラベルを規制して、私たちが提案した声明が私たちの規制許可と承認と一致し、これらの声明を確認するのに十分かつ合理的な科学的データを持っており、私たちの販売促進ラベルと広告がどのような点でも虚偽や誤解性がないことを保証する。FDAやFTCが私たちの広告や販促声明が誤っていると判断した場合
59
証明されていない場合、または許可されていない場合、不良宣伝や警告状を含む法執行行動の影響を受ける可能性があり、私たちの販売促進クレームを修正し、他の訂正を行ったり、元に戻すことを要求される可能性があります。
FDAと州当局は広範囲な法執行権力を持っている。適用される規制要件を遵守しない場合、FDAまたは州政府機関が法執行行動をとる可能性があり、その中には以下のいずれかの制裁が含まれている可能性がある
もしこのような事件のいずれかが発生したら、私たちの業務と財政状況は損害を受ける可能性がある。さらに、FDAや他の規制機関の政策が変わる可能性があり、我々の製品に対する規制承認を阻止、制限、または延期するための追加の政府法規が公布される可能性がある。私たちが既存の要求の変化に緩やかに適応できない場合や、新しい要求や政策を採用することができない場合、または規制コンプライアンスを維持できない場合、私たちが得る可能性のあるマーケティング承認を失う可能性があり、利益を達成したり維持したりすることができない可能性があり、これは私たちの業務、財務状況、および運営結果に悪影響を及ぼすだろう。
私たちの製品と運営はアメリカで広く政府の規制と監督を受けている。
FDAによって規制されている医療機器が“一般規制”によって制限されていることは、FDAに登録することと、FDAに商業的に配布された製品を列挙することと、QSR下のすべての適用要件を遵守することと、医療機器報告条例下の器具に関連するいくつかのタイプの有害事象の報告をFDAに提出し、関連記録を保存することと、機器ラベルが機器ラベル要件に適合することを保証することと、特定の器具現場の除去および是正をFDAに報告することと、装置が発売される前に510(K)の許可を得ることと、を含む。“510(K)免除”と呼ばれるいくつかのデバイスは、事前のマーケティング許可またはFDA承認なしに上場することができる。“一般制御”以外に、いくつかの二級医療機器も特定の指導文書の遵守と性能基準の遵守を含む“特殊制御”を受けている。III族デバイスの多くは510(K)の許可を得るのではなく,PMAの影響を受ける。
我々の製品は特定の患者集団に対する米国FDAの監督管理許可または許可を得ているが、それらは製造、ラベル、包装、貯蔵、広告、販売促進、サンプリング、記録保存、発売後の研究と提出安全性、有効性および他の発売後の情報の持続的な規制要求の制約を受け、米国の連邦と州要求、および私たちが参入する任意の国際市場を選択する非米国監督管理機関の要求を含む。
私たちの製品のために得られた任意の規制許可または承認は、製品がマーケティングおよび普及のために使用される可能性のある承認または承認された指示用途によって制限され、承認条件によって制限されるか、またはコストの高い上場後のテスト要件が含まれるであろう。私たちはFDAと似たような外国の規制機関に特定の不良事件と生産問題を報告することを要求された。製品安全問題を解決するどんな新しい立法も、コンプライアンスを確保するコストを増加させる可能性がある。FDAおよび米国司法省を含む他の機関は、製品の承認後または承認後のマーケティングおよび販売促進活動を密接に監督し、承認または承認の適応のみに対する製品の販売および流通を保証し、承認または承認のラベルの規定に適合することを保証する。私たちは製品広告と販売促進に関する要求を守らなければならない。
機器に関連する販売促進情報は、様々な法律や法規によって制限されており、製品承認または承認されたラベルの情報と一致しなければならない。私たちは製品を普及させないかもしれません
60
無許可または承認のための適応または使用。角膜乱視>0.75度かつ黄斑病変のない成人患者では,超音波乳化により白内障天然水晶体を摘出し,眼内レンズをポケットに移植し,残留乱視を減少させて裸眼視力を向上させるためのLALとLDDに対するPMAを受けた。コンタクトレンズの510(K)の許可も得ており,我々のコンタクトレンズが目の前のセグメントの可視化と治療を行うためであることを示している。私たちは私たちのマーケティングと販売チームを訓練し、私たちの製品を承認または承認するための使用適応以外の用途、いわゆる“ラベル外使用”を防止する。しかし,医師は我々の製品を非ラベル目的に利用し,医師の独立した専門医学判断が適切と考えられる場合に医師にそうすることを許可することができる。FDAが、我々の宣伝材料や訓練がラベル外または他の不正使用の普及を構成していると判断した場合、または私たちの内部政策およびプログラムが、そのようなラベル外使用を防止するのに十分でないと判断した場合、以下で議論する規制または法執行行動を受ける可能性がある。
また,対面の比較臨床研究を行わずに,われわれの製品を任意の代替療法の使用と比較することはできず,高価で時間がかかるであろう。FDAが販売代表または医師に提供する販売促進、精算または訓練材料が非ラベル使用の宣伝を構成していると判断した場合、FDAは、民事罰金および刑事罰を含む、私たちの訓練、販売促進または精算材料の修正、および/または無タイトル書簡の発行、警告状、禁止、差し押さえ、利益の返還、重大な処罰を含む規制または法執行行動を修正することを要求することができる。他の連邦、州、または外国政府機関も行動する可能性があり、もし彼らが私たちの販売促進、精算または訓練材料がラベル外使用の販売促進を構成していると思った場合、虚偽精算を禁止する法律のような他の法定機関の巨額の罰金や処罰を招く可能性がある。私たちの販売者は私たちの製品をラベル外の用途に普及させないように訓練していますが、私たちのすべての市場での使用説明は、私たちの製品が使用を許可または承認した適応以外の用途に使用してはいけないと規定していますが、FDAや他の規制機関は、ラベル外の販売促進活動に従事していると結論するかもしれません。例えば、政府は、非ラベル販売促進によりラベル外使用に対する不適切な補償を招き、連邦民事虚偽クレーム法案に違反し、政府は巨額の民事罰金を科し、刑事訴訟を起こす可能性があるという立場をとる可能性がある。これらの可能な場合、私たちの名声は損なわれる可能性があり、製品の採用も影響を受けるかもしれない。
もし監督管理機関がある製品に以前未知の問題、例えば意外な深刻性や頻度の不良事件があることを発見した場合、あるいは私たちが製品を生産する施設に問題がある場合、あるいは製品の販売促進、マーケティングまたはラベルと一致しない場合、規制機関は製品の市場からの撤退を要求することを含む、製品または私たちに制限を加える可能性がある。
もし私たちが適用される規制要求を遵守できなければ、規制機関や法執行当局は他の措置を取るかもしれない
また,FDCA違反が承認された製品の普及に関する行為は,連邦や州医療詐欺や濫用やその他の法律や州消費者保護法違反を告発する調査につながる可能性がある。
61
政府は違法の疑いのあるいかなる調査にも対応するために多くの時間と資源を必要とする可能性があり、否定的な宣伝が生じる可能性がある。現行の法規の要求を守らないいかなる行為も、私たちの製品の商業化と創造能力に重大な悪影響を及ぼす可能性がある。規制制裁を実施したり、規制の承認や承認を撤回したりすれば、私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす。
私たちの製品の実質的な修正は、新しい510(K)の許可または発売前の承認を必要とするか、または許可または承認が得られるまで、私たちの製品のリコールまたは販売の停止を要求するかもしれません。
製品の予期される用途または技術的特性の変更など、承認または承認された製品の安全性および有効性の修正に著しく影響を与える可能性があり、新しい510(K)許可またはPMAが必要とされるか、またはこれらの許可または承認が得られるまで、修正された装置のリコールまたは販売停止を要求するであろう。FDAが発表したガイドラインによれば、FDAは、デバイス製造業者に、新しい承認、追加承認または許可が必要かどうかを最初に決定し、記録することを要求するが、FDAは、製造業者の決定を審査することができる。FDAによって承認された装置の任意の修正は、そのセキュリティまたは有効性に著しく影響を与える可能性がある場合、またはその予期される用途の大きな変化を構成する場合、新しい510(K)承認または可能なPMAが必要とされるであろう。私たちは、新しい製品または私たちの製品の修正または他の適応をタイムリーにまたは根本的に得ることができないために、適用される外国の司法管轄区域で必要な510(K)の許可またはPMA、PMA補充または同様のマーケティング許可を得ることができないかもしれない。将来必要な許可や承認を遅らせることは、私たちが新製品を適時に発売したり、製品の能力を強化したりすることに悪影響を与え、逆に未来の成長を損なうことになる。私たちは過去に私たちの製品を修正したことがあり、将来的には私たちが追加的な承認や承認を必要としないと思う追加的な修正が行われる予定だ。FDAや同様の外国規制機関がこれらの修正の新たな承認や承認を要求しない場合、このような修正された製品のリコールおよび販売停止やマーケティングを要求される可能性があり、運営結果を損なう可能性があり、そのような製品の再設計を要求する可能性がある。このような状況で、私たちは重大な法執行行動の影響を受けるかもしれない。
私たちの現在と未来の製品に対する規制承認を1つの管轄区域で獲得し、維持することは、他の管轄区域で私たちの現在と未来の製品の規制承認を得ることに成功するという意味ではありません。FDAと他の類似した外国規制機関は、その管轄外で行われた試験データを受け入れない可能性がある。
1つの管轄区域で現在および将来の製品の規制承認または許可を取得し、維持することは、他の任意の司法管轄区で規制承認を得ることができるか、または維持することができる保証はない。例えば、FDAが現在または将来の製品の上場または承認を承認しても、外国司法管轄区の比較可能な規制機関は、これらの国または地域における現在または将来の製品の製造、マーケティング、販売促進、および精算を承認または承認しなければならない。しかし、1つの管轄区域で規制承認を得ることができなかったり、遅延したりすることは、他の管轄区域の監督管理承認過程にマイナス影響を与える可能性がある。承認手続きは司法管轄区域によって異なり、1つの管轄区で行われる臨床試験は他の管轄区の監督機関に受け入れられない可能性があるため、米国とは異なる要求と行政審査期限に関連する可能性がある。アメリカ以外の多くの管轄区域では、製品は精算許可を得なければ、その管轄区で販売が許可されることができない。場合によっては、私たちが私たちの製品のために受け取る価格もまた承認されなければならない。
RxSightシステムは、裸眼視力を改善するために承認され、−2.0~+2.0の球面屈折力および-3.0~−0.50の柱面屈折力を含むLAL屈折力を調整し、レンズ曲率を変化させることによって制御可能な球差(+/−1ミクロン)および中心付近のADD(2.0までの屈折力)を導入し、これもイギリス、カナダ、メキシコのMHRAに登録されている。私たちが現在または未来に業務を展開している司法管轄区域では、EU MDRの要求など、より多くの外国規制の承認を得て、外国の規制要求の遵守を確立し、維持することは、私たちに重大な遅延、困難、コストをもたらす可能性があり、私たちの製品がある国/地域で発売されることを延期または阻止する可能性がある。もし私たちまたは未来のパートナーが国際市場の規制要求を遵守できなかったり、適用されたマーケティング承認や許可を得られなかったりすれば、私たちの目標市場は減少し、現在および未来の製品の完全な市場潜在力を達成する能力は損なわれるだろう。
62
また,我々はすでにメキシコで臨床試験を行い,さらなる国際臨床試験を選択する可能性がある。FDAまたは他の類似した外国規制機関がそれぞれの管轄外で行われた臨床試験を受ける研究データは、いくつかの条件によって制限される可能性がある。もし外国の臨床試験のデータがアメリカの上場承認の基礎として使用しようとする場合、FDAは通常外国のデータだけに基づいて申請を許可しないで、(1)データがアメリカ人群とアメリカの医療実践に適用されない;(2)試験は公認能力の臨床研究者が行い、そして現在の良好な臨床実践法規に符合する;及び(3)監督機関の臨床データに対する監査は重大なデータ完全性問題を発見しなかった。また,研究した患者群の十分性と統計能力を含むFDAの臨床試験要求を満たさなければならない。また、このような外国裁判は、裁判を行う外国司法管轄区に適用される現地法によって管轄されている。FDAまたは任意の適用可能な外国規制機関がその適用管轄権以外で行われた試験のデータを受け入れることは保証されない。FDAまたは任意の適用可能な外国規制機関がこのようなデータを受け入れない場合、追加の試験が必要となり、これは高価で時間がかかり、私たちの業務計画の様々な側面を遅延させ、私たちの製品が適用司法管轄区域で商業的な承認や許可を得ることができない可能性がある。
当社の製品はFDAまたは外国の承認または許可を得た後にリコールされる可能性があり、これは管理や財務資源を移転し、私たちの名声を損ない、私たちの業務に悪影響を及ぼす可能性があります。
FDAや同様の外国政府当局は、適用される法律や法規を遵守できなかったり、設計や製造に欠陥があったりするため、私たちの製品のリコールを要求する権利がある。私たちが強制的または自発的に行う政府製品のリコールは、部品故障、設備故障、または重傷または死亡のような他の有害事象、または製造ミスまたは設計またはラベル欠陥のような品質に関連する問題によって引き起こされる可能性がある。将来的に私たちの製品に対するいかなるリコールも管理と財務資源を移転し、私たちの名声を損ない、私たちの業務に悪影響を及ぼす可能性があります。
もし私たちがデバイスの健康に対するリスクを減らすために私たちのデバイスのうちの1つに対して是正または除去を開始すれば、私たちはFDAに公開された是正と除去報告書を提出することを要求され、多くの場合、他の規制機関にも同様の報告書を提出する必要がある。この報告書はFDAによって設備リコールに分類される可能性があり、これはFDA、他の国際規制機関、および私たちの顧客が私たちの設備の品質と安全をより厳格に審査することをもたらす可能性がある。また、これらの報告書を提出し、競争相手が競合状況で私たちに対抗するために使用される可能性があり、顧客が購入決定を延期したり、注文をキャンセルしたりし、私たちの名声を損なう可能性がある。
さらに、私たちは、ある製品が死亡または重傷を引き起こす可能性があるか、またはそれが故障していることを認識していれば、故障が再び発生した場合、死亡または重傷を引き起こす可能性があるとFDAまたは同様の外国政府機関に報告することを要求する医療機器報告法規の制約を受ける。報告すべきイベントを正確に識別することができなかったか、または直ちに報告書を提出することができず、FDAが満足できるすべての観察結果を処理することができなかったことは、警告状およびリコールを含む制裁および罰を受ける可能性がある。
医者は規制部門に似たような報告書を提出するかもしれない。このような報告は、FDAまたは同様の外国規制機関の調査を引き起こす可能性があり、これは、管理および財務資源を移転し、私たちの名声を損なう可能性があり、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
私たちまたは私たちのサプライヤーがFDAのQSRまたは適用される外国法規を遵守できなかった場合、私たちの製造または流通業務は遅延または閉鎖される可能性があり、私たちの収入は影響を受ける可能性があります。
私たちの製造と設計過程と私たちの第三者部品サプライヤーの製造と設計過程は、米国でのわが製品の設計、テスト、生産、制御、品質保証、ラベル、包装、貯蔵、輸送のプログラムと文書をカバーするFDAの品質体系法規(QSR)に準拠しなければなりません。私たちはまた、同様の国の要求とライセンスを遵守し、私たちの運営において、ヨーロッパでのCEマークを維持するために、設計、製造、サービスを含む国際標準化組織13485標準を継続的に遵守しています。さらに、私たちは広範な記録保存と報告を行わなければならず、政府機関が定期的に抜き打ち検査するために、FDA、国家当局、EU通知機関、および他の国の類似機関を含む私たちの施設と記録を提供しなければならない。もし私たちが規制検査を通過しなければ、私たちの運営は中断されるかもしれないし、私たちの製造は中断されるかもしれない。不利な監督検査に対して適時かつ十分な是正措置をとることができなければ、私たちの製造或いは製品流通業務の閉鎖、巨額の罰金、マーケティング許可の一時停止、及び
63
私たちの設備、操作制限、刑事起訴を承認、差し押さえ、またはリコールし、これらはすべて私たちの業務に影響を与えるだろう。また、私たちのキー部品サプライヤーは現在、適用された法規要件を遵守し続ける可能性があり、これは私たちの製品の生産遅延を招き、私たちの収入を低下させる可能性があります。
FDAは広範囲な上場後と規制法執行権を持っている。FDAとカリフォルニア公共衛生部食品·薬物支部(“CDPH”)と私たちの通知機関の抜き打ち検査を受けて、私たちが設計·製造施設でQSRや他の法規に適合しているかどうかを確認しています。これらの検査には私たちのサプライヤーの製造施設が含まれている可能性があります。
私たちは私たちがQSRを実質的に遵守し続けるという保証がない。FDA、CDPH、またはEUまたはイギリスの任意の適用通知機関が私たちの任意の施設を検査し、コンプライアンス問題を発見した場合、適切な救済措置を取って監査結果を是正することができるまで、生産と製品流通を停止しなければならないかもしれません。是正措置をとるのは高価で時間がかかるかもしれませんし、経営陣の注意を分散させます。もし私たちの製造施設に遅延があれば、私たちの製品を生産できないかもしれません。これは私たちの業務を損なうことになります。
医療改革措置やその他の行政や立法提案は、主要市場における私たちの業務、財務状況、運営結果、キャッシュフローに悪影響を及ぼす可能性がある。
連邦政府、州政府、監督機関と第三者支払人はずっと提案を続けて、医療コストの増加を制御或いは管理し、より広範に言えば、アメリカの医療システムを改革する。その中のいくつかの提案は私たちの製品のために受け取ることができる価格あるいは私たちの製品の保証と精算範囲を制限し、私たちの製品の受容度と可用性を制限するかもしれません。コストを抑える提案を採択することは、私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす可能性があります。
例えば,米国では,2010年3月に“医療·教育和解法案”により改正された“患者保護·平価医療法案”,および“平価医療法案”が公布された。ACAは,米国国内の医療保険カバー範囲を拡大することを目的とした包括的な措置であり,主に雇用主や個人に対して医療保険認可を実施することにより,医療保険取引所が提供する計画に参加する適格個人に補助金を提供し,医療補助計画を拡大するものである。ACAは既存の政府医療計画に影響を与え、新しい計画の発展を招いた。
ACAのいくつかの条項は司法と議会によって挑戦された。例えば、ACAの様々な部分は、第5巡回控訴裁判所の法的手続きを含む法律および憲法挑戦の対象となってきた。2021年6月、米最高裁はテキサス州と他の挑戦者がACAの法的地位に挑戦していないと判断し、手続きを理由にこの事件を却下したが、ACAの合憲性を具体的に裁くことはなかった。したがって、ACAは現在の形態で継続的に有効であるだろう。バイデン政府が公布したこの最高裁判所の裁決、未来の訴訟と医療保健措置がACA、著者らの業務、財務状況と運営結果にどのように影響するかはまだ不明である。任意の新しい法律を遵守したり、ACAに従って実施された変化を逆転させることは、多くの時間およびコストを費やし、私たちのビジネスに大きな悪影響を及ぼす可能性があります。
さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。2011年8月2日、2011年予算統制法が署名され、提供者に支払われる医療保険支払いを前期当たり平均2%削減することが含まれ、2013年4月1日に施行され、その後の立法改正案により2031年まで有効となるが、国会がさらに行動しない限り、様々な新冠肺炎救済立法に基づいて2020年5月1日から2022年3月31日まで支払いを停止する。現在の立法によると、医療保険支出の実際の減少幅は2022年の1%から本自動減額の最終年度の4%まで様々である。2013年1月、オバマ総裁は、いくつかの医療サービス提供者に支払う医療保険を減らし、政府が提供者に多額の支払いを取り戻す訴訟時効を3年から5年に延長する2012年の米国納税者救済法に署名した。これらの新しい法律は、連邦医療保険や他の医療資金のさらなる減少を招く可能性があり、承認されれば、私たちの製品の顧客および私たちの財務運営に実質的な悪影響を及ぼす可能性がある。現在公布されているACAや
64
今後の改正は私たちの業務や財務業績を損なうことはなく、将来の医療改革に関連する連邦や州立法や行政変化が私たちの業務にどのように影響するかを予測することはできません。
連邦と州レベルでは、医療コストを抑制または低減するための立法と規制提案が引き続き提案される可能性がある。私たちは未来に取られる可能性のある計画やそのすべての影響を予測できない。政府、保険会社、管理医療組織、その他の医療サービス支払者が医療コストをコントロールまたは低減するための継続的な努力は、損害を与える可能性がある
また,最近,政府はメーカーが販売する製品に価格を設定する方式をより厳しく審査し,米国議会でいくつかの調査を行い,製品価格の透明性を向上させ,政府医療計画下の製品やサービスコストを低減するための連邦立法を提案·公布した。その中のいくつかの措置は発効するために追加の許可を必要とするかもしれないが、国会と連邦政府はそれぞれ、医療コストを制御するための新たな立法および/または行政措置を求め続けると表明している。また、アメリカ各州もますます立法を通じて製品の価格を制御するための法規を実施しており、価格或いは患者の精算制限、割引、ある製品への参入とマーケティングコスト開示の制限、透明性措置を含む。また,地域医療当局や個別病院では,どの製品を購入するか,どのサプライヤーがその医療計画に組み込まれるかを決定するために入札プログラムが使用されるようになってきている。価格制御および他のコスト制御措置、および既存の制御および措置を持つ司法管轄区域でより制限的な政策をとることは、収入の創出と収益を実現する能力を阻害または制限する可能性がある。連邦や州レベルでは,様々な新たな医療改革提案が出現している。通過可能な連邦および州医療の新しい措置は、連邦および州政府が医療製品およびサービスに支払う金額を制限する可能性があり、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
もし私たちがアメリカ連邦や州の詐欺や乱用や他の医療保健の法律や法規を守らなければ、私たちは巨額の処罰に直面する可能性があり、私たちの業務運営や財務状況は悪影響を受ける可能性がある。
医療提供者と第三者支払者は、私たちが市場許可や承認を得た任意の医療機器を配布、推薦、注文、購入する上で主な役割を果たしている。私たちの主要な調査者、医療専門家、第三者支払者と顧客との手配を通じて、私たちは広範に適用される反詐欺と乱用、反リベート、虚偽クレームと他の医療保健法律と法規に直面しています。これらの法律と法規は私たちの業務、私たちの手配と顧客との関係、そして私たちがどのようにマーケティング、販売、流通している医療機器を制限することができます。コンプライアンス計画、行動基準、関連政策や手続きがありますが、常に従業員や他の第三者の不正行為を識別して阻止できるわけではありません。私たちが違反を発見し、防止するための予防措置は、適用される詐欺や乱用や他の医療保健の法律や法規に準拠できないので、政府の調査から効果的に保護できないかもしれません。
アメリカでは、連邦医療保険反リベート法規や連邦民事虚偽請求法案を含む様々な州と連邦反詐欺と乱用法律の制約を受けています。他の国にも似たような法律がある。私たちの現在と将来の医療保健提供者、第三者支払者、顧客、その他の人との手配は、私たちがマーケティングの承認を得た任意の製品の業務または財務配置と関係を制限する可能性があり、広範に適用される詐欺と乱用、および他の医療法律法規に直面する可能性があります。医療詐欺や法律や関連法規の乱用は複雑で、軽微な違反であっても法規違反や禁止のクレームを引き起こす可能性がある。私たちの運営能力に影響を与える可能性のある法律には
65
州と連邦規制·法執行機関は医療法律法規違反行為を積極的に調査し続け、米国議会は法執行ツールの武器庫を強化し続けている。最近、2018年に両党予算法(“BBA”)は“反リベート法令”を含むいくつかの連邦医療保険法違反に対する刑事と民事処罰を増加させた。法執行機関はまたこのような法律に基づいて新しい責任理論を求め続けている。特に、政府機関は最近、リベート法規、連邦民事虚偽請求法案、HIPAAの医療詐欺およびプライバシー条項に基づく刑事告発または民事法執行行動を含む、メーカー精算支援活動および患者支援計画に対する規制審査および法執行活動を強化した。
これらの法律の汎用性、および利用可能な法定および規制免除または避難港の範囲が狭いため、私たちと相談協定を締結した医師に支払われる株式オプション報酬など、私たちのいくつかの活動は、1つまたは複数のこのような法律の挑戦を受ける可能性がある。これらの法律や法規に違反して私たちに提起されたいかなる訴訟も、弁護に成功しても、巨額の法的費用を招き、経営陣の業務運営への注意をそらす可能性があります。私たちは個人告発者が連邦や州政府を代表して提起した個人“Qui Tam”訴訟を受けるかもしれない。
私たちの業務や販売組織の成長やアメリカ以外での私たちの拡張は、これらの法律または私たちの内部政策や手続きに違反する可能性を増加させる可能性があります。私たちはこれらの違反や
66
他の法律法規はさらに増加しており、多くの法律法規が規制部門や裁判所の十分な解釈を受けていないため、その条項は様々な解釈が可能である。これらや他の法律や法規に違反して私たちに提起された訴訟は、たとえ抗弁に成功しても、巨額の法的費用を招き、経営陣の業務運営への注意をそらす可能性があります。私たちの業務が上記の任意の連邦、州、外国の法律に違反していることが発見された場合、または私たちの他の現在または将来の詐欺および乱用または他の医療関連法律および法規に適用される場合、私たちは重大な刑事、民事および行政処罰、損害賠償、罰金、個人監禁、連邦医療保険や医療補助などの政府計画から除外され、私たちの業務の削減または停止を要求される可能性があります。このようなどんな結果も私たちの業務と財政的業績を深刻に損なう可能性がある。
適用された連邦と州の反詐欺と乱用に対する法律の遵守を達成して維持することは費用が高いことが証明される可能性がある。もし私たちまたは私たちの従業員が上記のいずれの法律に違反していることが発見された場合、私たちは監禁、連邦医療保険および医療補助計画から除外されたこと、および巨額の罰金、罰金、没収、返還と損害、契約損害、名声損害、行政負担、利益および将来の収益の減少、および私たちの業務の削減または再編を含む重大な刑事罰を受ける可能性があり、これらはいずれも私たちの業務運営能力と私たちの財務業績に悪影響を及ぼす可能性がある。これらの医療詐欺や法律乱用に対する私たちのいかなる行動や調査も、弁護に成功しても、巨額の法的費用を招く可能性があり、業務運営への我々の経営陣の注意をそらす可能性がある。連邦民事虚偽請求法案、反リベート法規、または民事罰金法律事件を解決する会社は、MedicareおよびMedicaidのような連邦医療計画の参加から除外されることを回避するために、OIGと会社誠実協定を締結することを要求される可能性もある(すなわち、その製品の保険範囲を失う)。会社の誠実な合意は通常、コンプライアンスを確保するために会社に巨額のコストをもたらす。このような行動を防御するには費用がかかり、時間がかかる可能性があり、大量の人的資源が必要となる可能性があり、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
CMS料金表の変化は私たちの収入と経営業績を損なう可能性があります。
CMSや保険会社などの政府支払者は,医療サービスコストの抑制,利用,提供の努力を増大させている。米国議会は時々予算立法とともに協力医療費表の改正を検討·実施している。連邦医療保険や医療補助は,我々の製品を用いたプログラムの精算が減少したり,これらのプログラムのカバー範囲に関する政策変化が,支払い要求の増加や事前許可など,時々実施される可能性がある。他の第三者支払者の返済率も低下する可能性があり、支払い政策も変化する可能性がある。過去の類似変化は、医療機器製品を使用したプログラム支払いの減少、コスト増加を招き、より複雑な規制と行政要求を増加させた。連邦、州、地方、第三者支払人の法規や政策のさらなる変化は、私たちの製品の需要と私たちの業務に実質的な悪影響を及ぼす可能性があります。保険を監督する機関の行動又は他の法律、法規又は政策の変化も、我々の業務、財務状況及び経営結果に実質的な悪影響を及ぼす可能性がある。
立法や規制改革は、私たちの計画または将来の製品に対する規制機関の承認または承認を得ることを難しくし、承認または承認を得た後に私たちの製品を製造、マーケティング、流通させるかもしれない。
国会は時々立法を起草し、提出することは、規制された製品の承認、製造、マーケティング、あるいはその精算を規制する法定条項を著しく変える可能性がある。さらに、FDAは、FDAの法規およびガイドラインをしばしば改正または再解釈し、その方法は、私たちの業務および私たちの製品に大きな影響を与える可能性がある。任意の新しい規制または既存の法規の改正または再解釈は、計画または将来の製品のコストを増加させるか、または審査時間を延長する可能性がある。立法変化が公布されるかどうか、あるいはFDAの法規、ガイドラインや解釈が変わるかどうか、およびこれらの変化が生じる可能性のある影響は予測できない(あれば)。
我々の現在、計画、および将来の製品に関連する承認プロセスを管理する法律または法規の任意の変化は、新製品の承認または承認または生産、マーケティング、流通を得ることをより困難かつ高価にする可能性がある。私たちの新製品は、承認または承認を得る上で大きな遅延が発生したり、承認または承認を得られなかったりすることは、私たちの業務拡大能力に悪影響を及ぼすだろう。
67
EUの医療機器法規、イギリスの適用法規、その他の適用された外国法規、および既存の法規に対するいかなる変更も、私たちの業務に高いコストと破壊的な影響を与え、私たちをより多くの責任に直面させる可能性がある。
2017年、欧州連合(EU)は新たなEU医療機器法規(MDR)(2017/745)を発表し、I類設備(最低リスク)については2021年5月26日に延期され、他のすべてのカテゴリー設備(高リスク機器)については2024年5月26日に延期された。新しい規制は以前の指示に代わって、規制の世界的な統合を強調する。医療機器指令(“MDD”)のMDRへの移行に伴い,通知機関は新たな法律下に指定された合格評価機関を求めなければならない。我々は現在MDRを遵守し、認証をMDDからMDRに移行しているが、現在製品を商業化しているか、将来商業化しようとしているEUまたは他の司法管轄区の任意の新しい法規や変化の法規を遵守することは時間のかかる過程であり、私たちの製品に対して全面的な品質システムの審査と新しい合格評定認証を行う必要があるかもしれない。主な変化は以下の通りです
“医療機器条例”の施行により,EUの医療機器メーカーが遵守しなければならない義務が大きく変化した。合格評定過程では,高リスク医療機器の追加審査が行われる。我々が将来開発する可能性のあるいかなる製品に対しても、これらの新規定を遵守することは、欧州の“第一市場”目的地としての吸引力の低下を招く可能性がある。マーケティング許可時間はもっと長くなり、ヨーロッパでの運営コストは増加するだろう。はるかにコストの高いコンプライアンスの道が予想される。
私たちの臨床試験は私たちの製品の安全性と有効性の合格と信頼できる証拠を証明できないかもしれません。これは私たちが開発している製品の商業化を阻止または延期します。
私たちは臨床研究を要求されるかもしれません。私たちの製品が安全で有効であることを証明して、それから私たちの製品を商業化することができます。臨床試験費用は高価であり,完成まで数年かかる可能性があり,その結果自体も確定していない。私たちが計画した臨床試験や他の未来の臨床試験が成功するかどうかは確認できない。また,このような臨床試験が成功しても,FDAや外国規制機関が我々のように結果を解読することは保証されず,製品を承認する前に,より多くの試験が必要となる可能性がある。試験結果がFDAや外国規制機関を満足させてマーケティング申請を支援できない場合、追加の試験を行うためには、入手できない可能性のある大量の資源をかけて、我々の製品の潜在的な承認を支援する必要があるかもしれません。私たちのどの製品も規制部門の承認を得ても、このような承認の条項は私たちの製品の範囲と用途を制限する可能性があり、これはそれらの商業的潜在力を制限するかもしれない。
私たちの製品に関連する欠陥や故障は、リコール、安全警報または訴訟、ならびに巨額のコストおよび負の宣伝をもたらす可能性があります。
我々の業務は、患者が設計欠陥或いは製造欠陥による製品の誤用或いは故障による深刻な負傷或いは死亡のリスクを含む、人体内に配置された医療機器の製造、流通、使用に関連する重大なリスクに直面している。さらに、部品故障、設計欠陥、ラベル外使用、または製品に関連する情報を十分に開示しないことも、不安全な状況または患者の死傷を招く可能性がある。これらの問題は、リコールや市場撤回、または私たちの製品に関連する安全警報を発表し、巨額のコスト、負の宣伝、および不利な競争圧力をもたらす可能性がある。♪the the the
68
リコールを招く状況は予測不可能であり、既存または将来の製品に対するいかなるリコールも、当社の業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。
私たちの製品に材料欠陥がなく、規格に適合していることを保証し、欠陥が発生した時にLDDを修理し、欠陥があるLALの購入価格を交換または返品することを保証します。したがって、私たちは私たちの製品に保証クレームを出す可能性のあるリスクを負担します。もし私たちが私たちのサプライヤーまたはサプライヤーに私たちの保証クレームに関連する費用の一部または全部を取り戻すことを試みた場合、私たちはクレームを成功させることができないかもしれません。あるいはそのサプライヤーまたはサプライヤーから得られたいかなる回収も不十分または利用できない可能性があります。
医療機器業界は従来から製品責任クレームにより広く訴訟されてきた。もし私たちの製品が表面的に損傷や死亡をもたらしただけであれば、医師のミスであっても、製品責任クレームの影響を受ける可能性があります。さらに、私たちのサプライヤーの活動(例えば、コンポーネントおよび原材料を提供するサプライヤー)または私たちの製品と組み合わせて使用される治療のいずれかの態様(例えば、補充薬または麻酔)による傷害または死亡は、たとえ私たちの製品がこのような傷害または死亡の実際の原因でなくても、私たちの製品を購入または使用する患者、医師、または他の人が私たちにクレームする根拠になる可能性がある。私たちは間違いが私たちの製品の故障によるものではないと思っても、どのようなクレームを解決するかを選択することができます。私たちの製品に関する不利な結果は、このような製品または任意またはすべての他の製品に対する市場の受容度および需要を低下させ、私たちのブランドと名声および将来の製品をマーケティングする能力を損なう可能性があります。場合によっては、当社の製品の設計、製造、またはマーケティングによって引き起こされる、またはそれに関連する有害事象は、当社の発売前通知またはマーケティング申請の規制審査の一時停止または延期をもたらす可能性があります。上記のいずれの問題も私たちの業務を混乱させ、私たちの業務、財務状況、経営業績に重大な悪影響を及ぼす可能性があります。
私たちはアメリカと私たちが業務を展開している他の国/地域で臨床試験や製品マーケティングを含む製品責任保険に加入していますが、このような保険が利用可能であるか、またはいかなるクレームを満たすことができるか保証することはできません。製品責任保険は高価で、重大な免責額と免責額の制限を受けており、しかも受け入れ可能な条項では得られない可能性があり、全くなければ。もし私たちが許容可能な費用で、あるいは許容可能な条項で保険を獲得または維持できず、十分な保証範囲がある場合、あるいは他の方法で潜在的な製品責任クレームに対して保障を提供することができなければ、私たちは重大な責任に直面する可能性がある。製品責任クレームリコールまたは未保険負債または保険負債金額を超える他のクレームは、当社の業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。訴訟を弁護するために、その是非曲直や最終結果にかかわらず、コストが高くなる可能性があり、経営陣の私たちの業務への注意を移し、負の宣伝を招く可能性があり、これは、私たちの製品の市場での受容度の低下、製品のリコール、または市場撤回を招く可能性がある。
我々は、FDAのウェブサイト上で公開されることができる医療機器報告またはMDR法規に従ってFDAに有害事象報告を提出することを要求される。もし私たちの製品が深刻な傷害または死亡を引き起こすか、または再び故障が発生した場合、深刻な傷害または死亡を引き起こすか、または促進する可能性がある場合、私たちはMDRを提出しなければならない。このようなMDR報告書の重大な有害事象は否定的な宣伝をもたらす可能性があり、これは私たちの名声と将来の販売を損なう可能性がある。もし私たちが規定された時間内にFDAに報告すべき事件を報告しなかった場合、あるいは全くなかった場合、FDAは法執行行動を取って私たちに制裁を施行するかもしれない。私たちの製品に関連する任意のこのような有害事象は、リコールや顧客通知、または検査または法執行行動などの機関行動のような将来の自発的な是正行動をもたらす可能性もあります。任意の是正行動は、任意であっても非自発的であっても、訴訟で自分を弁護するためには、私たちの時間と資金が必要となり、経営陣が私たちの業務を運営する関心を分散させ、私たちの名声を損なう可能性があり、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
当社の従業員、独立請負業者、コンサルタント、ビジネスパートナー、流通業者、およびサプライヤーは、法規基準および要件を遵守しないことを含む不適切な行為または他の不適切な活動に従事する可能性があります。
私たちは、従業員、独立請負業者、コンサルタント、ビジネスパートナー、流通業者、およびサプライヤーが詐欺または不正活動に従事する可能性があるリスクに直面しています。これらの当事者の不正行為は、(I)FDAおよび他の同様の外国規制機関の法律に違反し、意図的、無謀、および/または不注意な行為、または(I)FDAおよび他の同様の外国規制機関の法律に違反し、そのような規制機関に真、完全かつ正確な情報を報告することを要求する法律、(Ii)製造基準、(Iii)米国の医療詐欺および乱用法律、および同様の外国詐欺的不正行為法律、または(Iv)財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む可能性がある。このような法律は未来の販売、マーケティング、教育プロジェクトなどに影響を及ぼすかもしれない。特に、医療製品やサービスの普及、販売およびマーケティング、および医療業界のいくつかの商業的配置は、詐欺、リベート、自己取引、および他の乱用行為を防止するための広範な法律によって制限されている。これらの法律法規は、広範な定価、割引、マーケティング、販売促進、構造、および
69
手数料、特定の顧客激励計画、そして他の一般的な業務計画。これらの法的拘束を受けた活動は,患者を募集して臨床試験を行う過程で得られた情報の不正使用に関するものである。
私たちはビジネス行為と道徳的規範を制定していますが、常に私たちの従業員や他の第三者の不正行為を識別し、阻止できるわけではありません。私たちがこれらの活動を発見し、防止するための予防措置は、未知または管理できないリスクや損失を効果的に制御できないか、あるいはこのような法律や法規を遵守できないことによる政府の調査や他の行動や訴訟から私たちを保護することができない可能性があります。もし私たちにこのような訴訟を提起した場合、私たちは私たちの権利を弁護したり、維持することに成功しませんでした。これらの行動は、民事、刑事および行政処罰、損害賠償、罰金、返還、個人監禁、追加の誠実な報告および監督義務の適用、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性があり、契約損害、名声損害、利益減少および将来の収益減少、および業務削減を含む可能性があり、いずれも私たちの業務運営能力および運営結果に悪影響を及ぼす可能性があります。私たちがこのような訴訟や調査を正当化することに成功したかどうかにかかわらず、法的費用を含む巨額のコストが発生し、経営陣がそのようなクレームや調査を弁護する関心を移す可能性があり、これらのクレームまたは調査は、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性がある。
環境健康と安全法は私たちの運営に責任、費用、制限をもたらすかもしれない。環境法律法規を遵守しないことは私たちに重大な責任を負わせるかもしれない。
私たちの研究開発と製造業務は危険物質の使用に関連し、危険物質の貯蔵、使用、排出、処置、救済、人類暴露に関連する様々な連邦、州、地方、外国の環境法律と法規、および危険物質を含む製品の販売、ラベル、収集、回収、処理、処分に関連する。環境法や条例で規定されている責任は連帯責任であり、過ちや不注意を考慮しないことができる。環境法律法規の遵守は代償が高い可能性があり、遵守しないことは重大な責任、罰金と処罰、人身傷害と第三者財産損失クレーム及び巨額の調査と救済費用を招く可能性がある。時間が経つにつれて、環境法律法規はより厳しくなり、より大きなコンプライアンスコストを招き、違反に関するリスクや処罰を増加させる可能性がある。人為的なミス、事故、設備の故障、その他の原因で、未来にはこれらの法律法規に違反したことがないことや過去に発生したことがないことを保証することはできません。環境規制や救済に関連する費用は、私たちの財務状況や経営業績を損なう可能性があります。
環境保全,有害物質および人間の健康と安全に関する連邦,州,地方,外国の法律は我々の業務に悪影響を及ぼす可能性がある。我々の研究開発·製造業務は危険物質の使用に関連し,危険物質の貯蔵,使用,排出,処分と救済,および人間の危険物質への曝露および危険物質を含む製品の販売,ラベル,収集,回収,処理,処分に関する各種連邦,州,地方,外国の環境法律·法規を遵守している。これらの操作は規制部門の許可を得ており,発生した廃棄物は環境法律や法規に適合した材料で処分されている。我々の業務で危険物質を使用することは,使用,貯蔵,輸入,運搬あるいは処分による傷害,汚染,その他の責任のリスクに直面する。もし私たちまたは私たちのサプライヤーの運営が環境汚染を招いたり、個人を危険物質に暴露したりする場合、私たちは損害賠償と罰金の責任を負う可能性があり、どんな責任も私たちの保険範囲を大幅に超え、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性があります。環境法や条例で規定されている責任は連帯責任であり、過ちや不注意を考慮しないことができる。環境法律と法規を遵守することはコストが高い可能性があり、守らないことは重大な責任、罰金と処罰、人身傷害と第三者財産損害クレーム及び重大な調査と救済費用を招く可能性がある。時間が経つにつれて、環境法律法規はもっと厳しくなるかもしれません, より大きなコンプライアンスコストをもたらし、違反に関連するリスクと処罰を増加させる。人為的なミス、事故、設備の故障、その他の原因で、未来にはこれらの法律法規に違反したことがないことや過去に発生したことがないことを保証することはできません。環境規制や修復に関連する費用は、私たちの業務、財務状況、運営結果を損なう可能性があります。
私たちはデータの収集と使用に関連するリスクに直面しており、これは、調査、照会、訴訟、罰金、立法、規制行動、および私たちのプライバシーおよびデータ保護に関する否定的なニュースをもたらす可能性がある。
私たちの業務はいくつかの健康関連データを含む個人データを処理する。臨床試験を行う際には,汎用規則(GCP)ガイドラインやFDAヒト被験者保護条例を含む法律法規に適合した方法で試験参加者のデータ,特に健康データを収集するリスクに直面している。私たちはまた大量のデータを処理し、これらのデータの安全を保護することに固有の危険に直面している。私たちは私たちに
70
システムの外部や私たちのサービス提供者や従業員の詐欺や不適切な行為。第三者はまた、盗難または推定された証拠、コンピュータマルウェア、ウイルス、迷惑メール、ネットワーク釣り攻撃、または他の手段を使用してユーザのアカウントにアクセスし、そのようなアクセスを使用してユーザの個人データを取得するか、またはそのアカウントの使用を阻止することができる。データ漏洩は、適用される米国と国際プライバシー、データ保護およびその他の法律に違反する可能性があり、私たちに個人または消費者集団訴訟、およびアメリカ連邦、州と地方監督実体および国際規制実体の政府調査と訴訟を受け、それによって重大な民事および/または刑事責任に直面させる。また、私たちの一般責任保険と会社リスク計画は、私たちが直面しているすべての潜在的なクレームを含まないかもしれませんし、私たちが適用する可能性のあるすべての責任を補償するのに十分ではないかもしれません。
このようなリスクはいくつかの管轄区域で激化し、私たちが国内と国際的に業務を拡大するにつれて、私たちは他の管轄区域の追加的な法律によって制限されるかもしれない。プライバシーおよびデータ保護の法律、規則、法規を遵守できなかったか、または遵守できなかったと考えられ、政府の実体または他の人が私たちに訴訟を提起したり、行動したりする可能性があります。これらの訴訟や行動は、私たちに重大な処罰と否定的な宣伝を受けさせ、私たちのビジネス慣行を変え、私たちのコストを増加させ、私たちの業務を深刻に混乱させることを要求するかもしれない。米国では、消費者金融保護局や連邦貿易委員会などの政府機関を含む複数の連邦·州規制機関が、個人情報やデータセキュリティに関する法律法規を通過し、プライバシーや情報セキュリティの侵害を法執行行動の優先事項とすることを検討している。また、米国では、カリフォルニア州は2020年1月にCCPAを採択し、カリフォルニアの消費者情報を処理するいくつかの会社がカリフォルニアの消費者に新たな開示を提供することを要求し、これらの消費者に新たな能力を与えて、彼らの個人情報に関するいくつかの権利を行使し、特定の個人情報の販売から撤退することを選択し、また、彼らの情報を使用する能力を厳格に制限している。CCPAは、違反行為に対する民事処罰と、いくつかの個人情報損失を招くデータ漏洩行為に対する個人訴権を規定している。CCPAの様々な条項がどのように解釈され実行されるのかまだ分からない。また、2020年11月、カリフォルニアの有権者はCPRAを可決し、2023年1月1日に施行された。CPRAはカバーする会社に追加的な義務を課し、CCPAを大きく修正した, カリフォルニア州住民の特定の敏感な個人情報に対する権利を拡大することを含む。他の州はCCPAやCPRAのようなデータプライバシー法を通過または計画しており,法的構造をさらに複雑化させている。また、すべての50州の法律は、データ漏洩によりアクセスまたは個人情報を取得した消費者に企業に通知を提供することを要求している(場合によっては、規制当局に通知する必要もある)。CCPA、CPRA、および他のこのようなプライバシー法の影響は重大かもしれませんが、私たちのデータ処理のやり方と政策を修正し、遵守するために大量のコストと支出を生成する必要があるかもしれません。
さらに、私たちは多くの司法管轄区域の国際法、法規、標準の制約を受けており、これらの法律、法規、標準は個人情報の収集、使用、保留、安全、開示、移転、および他の処理に広く適用されている。例えば、EUが採択し、2018年5月に施行された“個人資料保護法”は、個人資料の管理者や処理者に適用され、個人資料の制御者や処理者にいくつかの厳しい要求が加えられている。例えば、個人の同意を得てその個人資料を処理する上でより高い基準があり、個人資料の開示がより厳しく、個人データ権利制度が強化され、データ漏洩通知の時間が短縮され、保留情報の制限があり、特殊種別の個人資料や仮名(すなわち鍵コード)データに対する要求が増加し、第三者処理者と個人資料の処理契約を締結する際の追加義務となる。
GDPRは、EU加盟国は、特別なカテゴリのデータ(例えば、人種または民族出身、政治的観点、宗教または哲学的信仰)および(Ii)個人のプロファイル分析および自動個人決定を含む個人データの処理を制限し、(I)個人データまたは他のデータを使用および共有する能力を制限することができ、私たちの業務および財務状況を損なう可能性があると規定している。GDPRを守らないと2000万ユーロまたは全世界の総収入の4%までの罰金を含む重大な処罰を受け、両者は金額の大きい者を基準とする。EU加盟国地方データ保護機関のGDPRに対する解釈は、この制度自体の複雑さに加え、法律の解釈と実行に不確実性をもたらし、EU加盟国間に不一致が存在する可能性がある。EU以外の他の管轄地域でも同様にプライバシーやデータセキュリティに関する法律や法規が導入または強化されており、このような法律の遵守に関するリスクが増加している。また、連合王国のEU離脱決定は連合王国のデータ保護規制に不確実性をもたらした。我々は,英国の一般データ保護条例と2018年の英国データ保護法に制約されており,GDPRをイギリスの国家法律に保持し,GDPRのような処罰構造を提供している。これらの最新の開発は、私たちが個人データを処理する法的手段を検討し、修正することを要求し、他の修正が必要かもしれません。GDPRや他の進化している立法の実施と実行は、実行リスクに直面する可能性があり、いくつかのデータ収集を変更することが求められています, 加工と他の政策と接近法。私たちはこのようなクレームの調査と弁護の巨額の費用を招く可能性があり、もし私たちが責任があると判断されれば、重大な損害賠償も発生します。もしこのような事件のいずれかが発生すれば、私たちの業務と財務業績は不利な影響を受けるかもしれない。
71
また、欧州経済地域(“EEA”)、スイス、イギリス以外の移転プロフィールに関する法律を含む、国境を越えた個人資料の移転に関する法律と法規を遵守しなければならない。私たちはEU標準契約条項(“SCC”)を含む、これらの法律によって許可された譲渡メカニズムに依存している。近年、このようなメカニズムはより厳格な規制と司法的検討を受けている。EU裁判所は2020年に、欧州経済圏とスイスが米国に個人データを移転する行為が無効であることを発表し、SCCを使用する会社に追加的な義務を課した。欧州委員会は新たなSCCを採択し,時間の経過とともに実施することを要求し,連合王国は新たな標準契約条項を採択し,時間の経過とともに実施することも求められている。2021年6月、欧州委員会は、契約や他の追加措置をとることなく、EU加盟国からイギリスへのデータ転送の継続を可能にする英国のデータ保護枠組みに関する十分な決定を発表した。計画は少なくとも4年間継続されているにもかかわらず、欧州委員会はいつでも充足率決定を撤回する可能性があり、このような状況が発生すれば、追加的なコストを招き、私たちの全体的なリスクを増加させる可能性がある。これらの開発と他の規制指導や発展は、ヨーロッパ経済区、スイス、イギリスからの個人データの移転に追加の義務を課すかもしれません。これらのすべては、これらの司法管轄区での私たちの活動を制限し、これらの管轄区域で製品とサービスを提供する能力を制限し、私たちの政策とやり方を修正し、追加の契約交渉を行うことを要求します, 私たちのコストや義務を増加させ、ヨーロッパ経済圏、スイス、イギリスから米国に個人データを効率的に送信する能力に制限を加えたりします。これは、私たちがサービスを提供する方法に悪影響を与え、私たちの運営や財務業績に大きな影響を与える可能性があります。
データプライバシーおよびセキュリティに関連する法律、法規、基準、および他の義務の解釈および適用はまだ不確定であるため、これらの法律、法規、基準、および他の義務の解釈および適用は、私たちのデータ処理実践および政策と一致しない可能性がある。もし私たちのやり方が法律、法規および標準の変化、または既存の法律、法規および標準の新しい解釈または適用と一致しないか、または一致しないとみなされる場合、私たちはまた罰金、監査、調査、通報者の苦情、不利なメディア報道、調査、訴訟、輸出特権の喪失、厳しい刑事または民事制裁、または他の処罰を受ける可能性がある。私たちは私たちの公開声明と文書を守るために努力しているにもかかわらず、私たちは時々遵守できないかもしれないし、非難されて守られていないかもしれない。私たちのプライバシー政策やデータのプライバシーおよびセキュリティに約束と保証を提供する他の声明の発表は、彼らが詐欺的、不公平、または私たちの実際のやり方を歪曲していることが発見されれば、潜在的な政府または法的行動に直面する可能性がある。私たちのデータプライバシーやセキュリティ慣行に対するいかなる懸念も、根拠がなくても、私たちの業務の名声を損なう可能性があり、潜在的なユーザが私たちの製品やサービスを使用することを阻害する可能性がある。上記のいずれも、我々の業務、財務状況、経営結果、および見通しに悪影響を及ぼす可能性がある。
FDAや他の政府機関の資金不足は、重要な指導部や他の人員を採用して保持する能力を阻害し、新製品やサービスのタイムリーな開発や商業化を阻止したり、これらの機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを阻止したりすることができ、これは私たちの業務にマイナスの影響を与える可能性がある。
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、肝心な人員の雇用と維持及びユーザー費用の支払いを受ける能力、及び法律、法規と政策の変化を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。
FDAおよび他の機関の中断は、新冠肺炎の疫病、旅行制限、人員不足による遅延または中断を含み、必要な政府機関による新しい医療機器の審査および/または承認に要する時間を遅らせる可能性もあり、これは私たちの業務に悪影響を及ぼすだろう。例えば、2018年と2019年には、米国政府は何度も閉店し、FDAなどのある規制機関はキー従業員を休暇させ、キー活動を停止せざるを得ない。また、新冠肺炎疫病に対応するため、2020年3月に国内外の施設の検査は基本的に保留されて以来、アメリカ食品と薬物管理局は常規のモニタリング、生物研究モニタリングと審査前検査の回復に優先的に努力してきた。2020年と2021年に、一部の会社はFDAがその申請の必要な検査を完了できなかったため、完全な返信を受け取ったと発表した。FDAは国内の承認前検査に大きく追いついているが、滞っている外国検査の処理を続けている。しかしながら、FDAは、現在の検査速度を継続できない可能性があり、または審査期間内に必要な検査を完了できない可能性があり、これは、臨床開発を延期し、完全な返信をもたらす可能性がある。アメリカ以外の監督管理機関は類似の制限或いは他の政策措置を取って新冠肺炎疫病に対応する可能性があり、監督活動の中で遅延に遭遇する可能性がある。最近、総裁·バイデン総裁は、政府が2023年5月11日に新冠肺炎国家と公衆衛生突発事件を終了する予定であることを発表した。突発公共衛生事件の終了がFDAとその他の監督管理政策と運営に与える全面的な影響はまだ不明である。もし政府が長時間停止したり他の中断が発生したら, これはFDAのタイムリーな審査に深刻な影響を及ぼすかもしれません
72
私たちの規制提出を処理することは、私たちの業務に実質的な悪影響を及ぼすかもしれない。また、将来的に政府の閉店は、適切な資本化と事業継続のために、私たちが公開市場に進出し、必要な資本を得る能力に影響を与える可能性がある。
私たちのグローバル業務は、“海外腐敗防止法”やイギリスの“収賄法”など、反賄賂や反腐敗法など、時に衝突する多くの法律や規制要件に直面する可能性があり、これらの要求に違反することは、巨額の処罰と起訴を招き、私たちの業務を損なう可能性がある。
我々はRxSightシステムを米国以外の場所で商業化しており,各コンポーネントはイギリスのMHRAに登録されている.私たちが業務を展開している国/地域では、健康と安全基準、マーケティングと販売促進活動、反腐敗、輸出入規制、内容要件、貿易制限、関税、税収、制裁、移民、内部と開示制御義務、証券監督、反競争、データプライバシー、労使関係など、様々な事項に含まれる多くの法制度の制約を受けています。これは私たちが法制度をよく知らないかもしれない新興市場を含む。私たちはこのような法律法規を遵守して維持するために努力している。他の法的要求事項を遵守することは高価で、時間がかかり、大量の資源を必要とする。私たちの業務展開中にそのうちの1つ以上の規定に違反することは、巨額の罰金、私たちまたは私たちの役人に対する刑事制裁、業務の展開を禁止し、私たちの名声を損なう可能性があります。お客様に対する私たちの義務を履行する際に、これらの規定に違反することは、重大な金銭的損失、罰金および/または刑事起訴、不利な宣伝およびその他の名声被害、私たちの情報処理能力が制限されていること、および私たちの顧客またはディーラーが契約義務を履行していないことを告発する可能性があります。私たちの国では法制度の発展度がそれぞれ異なるため、現地の法律は私たちの権利を保護するのに十分ではないかもしれない。
我々の米国以外の業務は、“海外腐敗防止法”、イギリス“反賄賂法”や世界各地の類似法のような様々な厳格に執行されている反賄賂や反腐敗法律の制約を受けている。これらの法律は、一般に、米国会社およびその従業員および中間者が、業務を取得または保持するために、または任意の利点を得るために、不正な金を外国政府関係者に提供、承諾、許可、または支払うことを禁止する。もし私たちが、私たちの第三者業務パートナーや仲介機関を含めて、“海外腐敗防止法”や他の反腐敗·反賄賂法律を遵守できなかったら、私たちは重大なリスクに直面するだろう。いかなる法執行行動や関連調査への対応は、経営陣の関心や資源の重大な移転、巨額の弁護費用および他の専門費用を招く可能性がある。“海外腐敗防止法”または他の適用される反賄賂、反腐敗または反マネーロンダリング法に違反するいかなる行為は、告発者の苦情、メディアの不利な報道、調査、輸出特権の喪失、厳しい刑事または民事制裁、および“海外腐敗防止法”について、米国政府契約の資格を一時停止または廃止する可能性があり、これは私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
私たちの国際業務は、法律、貿易法規、労働者、雇用法規の変化、そして私たちの製品と解決策の承認、製品と解決策、定価、精算とマーケティングの手続きと行動、および政府間紛争の影響を受ける可能性があります。このような変化のいずれも私たちの業務に悪影響を及ぼす可能性がある。潜在的な貿易障壁を含む新しい法律や法規を実施することは、私たちの運営コストを増加させ、私たちの運営に制限を加えるかもしれません。あるいは可能であれば、新しいルールを遵守するために追加の資金が必要です。これは、私たちの財務状況や運営結果に悪影響を及ぼすかもしれません。
第三者に依存するリスク
私たちは時々外部機関を招いて、私たちのいくつかの臨床研究と試験に関連するサービスを提供します。もしこれらの第三者がその契約の義務を成功的に履行できない場合、あるいは予想される期限までに完了することができなければ、規制部門から私たちの製品の承認を得たり、商業化することができないかもしれません。
著者らは時々コンサルタントを招いて、著者らのいくつかの臨床研究と試験の結果を設計、監視と分析することを助けた。著者らが招聘した顧問は臨床研究者と交流し、患者を著者らの臨床試験に参加させた。著者らはこれらのコンサルタントと臨床研究者に依存して臨床研究と試験を行い、そして研究或いは試験の研究計画と方案に基づいて、そしてGCPガイドライン、共通規則とFDA人類被験者保護条例などの適用された法規と標準を遵守し、これらの研究と試験のデータをモニタリングと分析する。もしこれらの各方面が適時、コンプライアンス、あるいは適任的に義務を履行しなければ、私たちは監督審査過程で遅延に直面する可能性がある。これらの第三者がその責務を成功裏に履行できなかった場合、または予想される期限内にタスクを達成することができなかった場合、または彼らが取得したデータの品質、完全性または正確性が、我々の臨床試験レジメンまたは他の理由を遵守できなかったために損害を受けた場合、私たちの臨床研究または試験は、延長、遅延または終了する可能性があり、または他の方法で証明される可能性がある
73
成功しなければ、私たちの製品の商業化に必要な規制許可や承認を得るために、私たちのコストを著しく増加させる追加の研究を行わなければならないかもしれない。
私たちと私たちの部品サプライヤーは私たちの製造プロセスに適用される規制品質基準を満たしていないかもしれません。これは私たちの業務、財務状況、運営結果に悪影響を及ぼすかもしれません。
医療機器メーカーとして、私たちは私たちの製品商業化の司法管轄区域でFDAと非アメリカ監督機関に登録し、FDAと外国監督機関の定期検査を受けて、設計制御、製品検証と検証、プロセステスト、品質制御プログラム、文書プログラムを含むいくつかの良好な製造実践に適合することを保証しなければならない。適用される規制要求の遵守状況は継続的に審査され、FDAと外国規制機関の定期検査によって厳格に監視される。私たちのメーカー、コンポーネントとサブコンポーネントサプライヤーも、その製造プロセスに適用されるいくつかの基準を満たさなければなりません。
私たちまたは私たちのコンポーネントサプライヤーがすべての規制要件を遵守し続けることができるか、または引き続き遵守できることを保証することはできません。私たちまたは私たちのコンポーネント供給者のうちの1つがこれらの要件または品質基準に適合しているか、または維持できない場合、新しい仕入先が決定および評価されるまで、需要を満たすのに十分な製品を提供する能力を破壊する可能性があります。もし私たちまたは私たちの任意のコンポーネントサプライヤーが適用された法規を遵守できなかった場合、警告状、罰金、禁止、民事処罰、規制機関が私たちの製品の上場、遅延、承認または許可の一時停止または撤回、許可証の取り消し、製品の差し押さえやリコール、運営制限、刑事起訴を含む制裁を加えることになる可能性があり、これらは私たちの業務を損なう可能性があります。私たちはあなたに保証することはできません。もし私たちが私たちの業務要求を満たすために新しいサプライヤーを雇う必要があれば、合理的なコストと許容可能な時間フレームワークで規制要件に合った新しいサプライヤーを見つけることができます。もし私たちがこれをできなければ、私たちの業務、財務状況、そして運営結果に実質的な悪影響を及ぼすかもしれない。
現在EUやイギリスで流通またはマーケティングされている製品、およびマーケティングに適用されている将来の製品については、特定の国際標準化機関(ISO)の認証を維持しなければならず、我々の製品を販売するためには、BSIなどの通知機関の定期的な検査を受けて、これらの認証を取得し、維持しなければならない。もし私たちがこれらの検査を通過できなかったり、これらの規制基準を達成できなかったりすれば、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
私たちは単一サプライヤーと独占サプライヤーを含む第三者に依存し、RxSightシステムのいくつかのコンポーネントとサブコンポーネントを製造することで、供給中断や価格変動の影響を受けやすくなります。
私たちは単一および独占サプライヤーを含む第三者に依存して、私たちの製品のいくつかのコンポーネントとサブコンポーネントを製造します。私たちは単一の供給源と唯一の供給者を含む私たちの供給者と、長期的な供給協定もなく、約束も保証されていない。私たちのほとんどのサプライヤーは18~24ヶ月の中期購買注文または一括注文を使用します。私たちは私たちのサプライヤーが直ちに私たちと私たちの顧客に私たちと彼らの品質、数量とコスト要求を満たす材料を提供することに依存していますが、新冠肺炎の流行とそれによるサプライチェーン制限が始まって以来、サプライヤーは予想された納期を逃し、納期を延長し、あるいは場合によっては調達注文をキャンセルします。これらのサプライヤーは様々な理由で製造過程で問題に遭遇する可能性があり、そのいずれも私たちの需要を満たす能力を遅延または阻害する可能性があります。全世界の交付期間の拡大、特にヨーロッパとアジアでは、新冠肺炎の疫病と関係があり、中国は再びコロナウイルスに関連する工場を閉鎖し、そして最近ウクライナの軍事衝突は、半導体、コンピュータ、ディスプレイ電子部品、金属、包装、接着剤、化学品、樹脂と下請け塗装部品を含む原材料の不足を招いた。あるサプライヤーは、供給不足によって支払われたより高い大口商品価格を支払い、納期を延期するために、より高い価格、追加料金、および特急運賃を転嫁した。また、これらのサプライチェーン制限のために、テスト、検証、文書を必要とし、内部コストを増加させ、他のプロジェクトのエンジニアリングリソースを転送する新しい仕入先を決定したり、代替コンポーネントを同定したりします。2023年1月31日, FDAは、設備製造コストの削減を目的とした様々な改正のために、低コストLDDの発売前承認補充を承認した。しかし,低コストLDDを市場に出す時間を2023年下半期に延期したのは,低コストLDDに比べて既存のLDDのためのコンポーネントやサブコンポーネントの調達が困難であるためである.現在、同じ機能を持つ2つのLDDのための材料を調達しています。経営陣の予想は、我々の毛金利は、この2種類のLDDを生産し続ける決定の影響を受けることであり、潜在的なサプライチェーン問題を緩和するために必要である。標準納期の増加、特急料金の支払い、限られた数量の調達注文のキャンセル不可、キー部品の早期交付など、業務連続性リスクを低減する措置を講じています
74
第二に、私たちのサプライヤーは私たちが彼らから購入した部品の生産を停止するか、あるいは他の方法で私たちとのビジネスを停止することを決定するかもしれない。私たちのサプライヤーの任意の供給が中断されたり、私たちの製品で使用されている任意のコンポーネントまたはサブコンポーネントのためにより多くのサプライヤーを得ることができないことは、私たちの現在および新製品を生産する能力を制限し、私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。
第三者がその契約、法規、その他の義務を履行できなかった場合、私たちの業務に悪影響を及ぼす可能性があります。
私たちはサプライヤー、サプライヤー、アウトソーシングパートナー、コンサルタント、その他の第三者に依存して、私たちの製品を研究、開発、製造し、商業化します。これらの第三者の使用は、(I)彼らが私たちの標準または法的要件に適合していない可能性がある、(Ii)彼らは信頼できる結果を生じないかもしれない、(Iii)彼らは直ちに履行できないかもしれない、(Iv)彼らは私たちの固有の情報を秘密にしていないかもしれない、(V)私たちのパートナーが開発した技術の所有権に関する紛争が発生する可能性があり、(Vi)分岐は、私たちの製品の研究、開発または商業化の遅延または終了、または訴訟や仲裁をもたらす可能性がある、などの多くのリスクをもたらすだろう。また、現在の法律と規制環境を踏まえると、国別プライバシーやデータセキュリティリスクのほか、一部の第三者がいる市場は政治的·社会的リスク、腐敗、インフラ問題、自然災害に直面している。第三者がその契約、法規、その他の義務を履行できなかったことは、私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性があります。
私たちの普通株に関するリスクは
私たちの株価は変動するかもしれません。あなたはあなたの投資の全部または一部を失うかもしれません。
私たちの普通株の取引価格はずっと高度に変動し続ける可能性があり、様々な要素の広範な変動を受ける可能性があり、その中のいくつかの要素は私たちがコントロールできない。私たちが初めて株式を公開した日から2023年3月1日まで、私たちの普通株のナスダック世界市場での取引価格は8.8ドルに下がり、19.67ドルに達した。全体的に、株式市場は極端な価格と出来高変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績に関係なく、あるいは比例しない。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格にマイナス影響を与える可能性がある。この“第1部1 A項”“リスク要因”および本10−K表年次報告の他の部分で議論されている要因を除いて、これらの要因は、以下のような要素を含む
75
この部分I,Item 1 A“リスク要因”に記載されているリスクを含む、上記の任意のリスクまたは任意の広範な他のリスクを実現することは、私たち普通株の市場価格に大きな悪影響を及ぼす可能性がある。
また、株価変動を経験した会社も証券集団訴訟の影響を受けている。私たちは未来にこのような訴訟の目標になるかもしれない。私たちに対する証券訴訟は巨額のコストを招き、私たちの経営陣の注意を他の業務から移す可能性があり、これは私たちの業務を深刻に損なう可能性があります。
証券や業界アナリストが私たちの業務に不利な研究報告を発表しなければ、私たちの株価や取引量は低下する可能性がある。
私たちの普通株の取引市場は株式研究アナリストが発表した私たちと私たちの業務に関する研究と報告にある程度依存するだろう。私たちはアナリストや彼らの報告書に含まれている内容と意見を何も統制しないつもりだ。1つ以上の株式研究アナリストが私たちの株式格付けを引き下げたり、他の不利なコメントや研究を発表したりすれば、私たちの株価は下落する可能性がある。1つ以上の株式研究アナリストがわが社への報道を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの株に対する需要が減少する可能性があり、逆に私たちの株価や取引量を低下させる可能性がある。
私たちの普通株に活発で流動的で秩序のある取引市場が存在するかどうかはわかりませんし、私たちの普通株の市場価格がいくらなのかもわかりませんので、あなたが持っている私たちの普通株の株を売ることは難しいかもしれません。
私たちの普通株は現在ナスダック世界市場で取引されていますが、将来ナスダック世界市場あるいは他の取引所で活発な取引市場を維持できる保証はありません。活発な取引市場が発展または維持されていない場合、または私たちがどんな理由でもナスダック世界市場の持続的な上場基準または適用される米国証券取引委員会規則を満たしていない場合、私たちの証券は取得され、あなたはあなたが購入した私たちの普通株を売ることができないかもしれません。活発な取引市場の不足はあなたが売りたい時や合理的だと思う価格であなたの株を売る能力を弱めるかもしれません。活発な取引市場の不足はまたあなたの株の公平な市場価値を下げるかもしれません。また、活発でない取引市場は、普通株を売却することで資金を調達する能力を弱める可能性があり、戦略的協力を達成したり、私たちの普通株を対価格で会社、技術、または他の資産を買収する能力を弱める可能性がある。
公開市場で私たちの大量の普通株を売ることは私たちの株価を下落させるかもしれない。
公開市場で私たちの大量の普通株を売ることはいつでも起こる可能性がある。これらの売却、あるいは市場で大量の株式保有者が株を売却しようとしているとの見方は、我々の普通株の市場価格を低下させる可能性がある。
2022年12月31日まで、私たちは28,268,389株の普通株を発行·発行した。これらの株はすべて公開市場で販売することができるが、規則144による当社関連会社の制限を受けている。
2021年7月30日、私たちは証券法に基づいてS-8表登録声明を提出し、7,473,839株の普通株式を登録発行し、私たちの株式激励計画の下で将来の発行のためのオプションまたは他の株式奨励のために発行または予約された制約を受けた。
2022年3月8日、証券法に基づいてS-8表の追加登録声明を提出し、2021年株式インセンティブ計画(“2021年計画”)下の1,094,670株追加普通株の発売と販売、および2021年従業員株式購入計画(“2021年従業員株購入計画”)下の273,667株普通株の追加発売を登録した。S-8表登録声明に基づいて登録された株式は発行時に公開市場で自由に販売することができるが,関連会社に適用される数量に制限される.登録株式数は、2022年度から各事業年度初日からの年次増加を表し、算出方法は、2021年度計画に基づき、前期最終日には、我々普通株式流通株の4%と我々
76
2021年ESPPによると、前期最終日までの普通株式。私たちは私たちの株式計画に基づいて今後の年間成長のために追加のS-8表登録報告書を提出する予定です。
2022年8月8日、2022年8月12日に発効した2億ドルの棚登録声明を提出しました。棚登録声明の有効期間は三年で、普通株、優先株、債務証券、権証および/または単位の総価値は2億ドルに達することができます。登録保留宣言は、市場条件が一致した時に追加資本を得るための柔軟性を提供することを目的としている。2億ドルの棚登録声明を含め、“市場で”(“ATM”)を通じて私たちの普通株を発売し、総価値は5000万ドルに達する目論見説明書補足資料を提出した。これらの株はアメリカ銀行証券会社を通じて販売代理として発売されている。本年度報告Form 10−Kの日までに,ATMにより発行·販売された普通株は計1,355,216株であり,純収益総額は1,710万ドルであり,このうち879,341株の普通株,純収益は1,110万ドルで2023年1月に売却された。
2023年2月7日、我々は米国銀行証券会社と引受合意に達し、2022年8月12日に発効を宣言した棚上げ登録声明に基づき、400万株の普通株を公開発行·売却することに同意した。普通株は1株12.50ドルで一般に販売されている。引受契約の条項に基づいて、吾らも引受契約日から30日以内に同じ条項と条件で最大600,000株の普通株を追加購入できる選択権を引受業者に付与した。今回の公募株は2023年2月10日に終了した。引受業者のオプションは2023年2月10日に全面的に行使され、2023年2月14日に締め切られた。
また,本10-K表を提出するとともに,証券法により表S-8に1,130,735株普通株を登録発行し,2021計画により将来発行のために発行されるオプションや他の株式奨励の制約を受ける.登録すべき株式数は、2022年度から各事業年度初日からの年次増加を表し、算出方法は、2021年度計画に基づき、前期最終日には、我々普通株式流通株の4%を算出する。
ATMや公開で発売された普通株の発行価格は、これらの発売前に発行された普通株の1株当たりの有形帳簿純値を大きく上回っているため、株主普通株の有形帳簿純値は直ちに大幅に希釈された。ATMでより多くの株を発行すれば、株主は追加的な希釈を受けるだろう。
さらに、将来的には、融資、買収、訴訟和解、および従業員手配、または他の態様のために、追加の普通株または他の普通株に変換可能な株式または債務証券を発行することができるかもしれない。このような発行は私たちの既存の株主の大量の希釈を招き、私たちの株価を下落させる可能性がある。
私たちの主要株主と経営陣は私たちのかなりの割合の株を持っており、株主の承認が待たれる事項に大きな制御を加えることができるだろう。
2022年12月31日現在、我々の役員、取締役、5%以上の普通株の保有者及びそれぞれの関連会社実益は、私たちの約48%の投票権を有する普通株を有しています。したがって、この株主たちはこの所有権地位を通じて私たちを統制することができるだろう。この株主たちは株主の承認を必要とするすべての事項を決定することができるかもしれない。例えば、これらの株主は、取締役選挙を制御し、私たちの組織文書を修正したり、任意の合併、資産の売却、または他の重大な会社取引を承認することができます。これは、私たちの株主の一つとして、あなたの最適な利益に合致すると思うかもしれませんので、私たちの普通株に対する能動的な買収提案や要約を阻止または阻止することができます。このような株主の利益は常にあなたの利益や他の株主の利益と一致しているわけではないかもしれません。彼らの行動は彼らの最適な利益を促進するかもしれません。必ずしも他の株主の利益ではなく、彼らの普通株のためのプレミアムを求め、私たちの普通株の現行の市場価格に影響を与える可能性があります。
77
私たちは“新興成長型企業”と“小さな報告会社”であり、新興成長型企業やより小さい報告会社に適用される報告要件を下げることが投資家に対する私たちの普通株の魅力を低下させるかどうかを判断することはできません。
“雇用法案”の定義によると、私たちは“新興成長型会社”です。私たちが新興成長型企業であり続ける限り、他の非新興成長型企業に適用される上場企業の各種報告要求の免除を利用しようとしている
私たちは投資家が私たちがこのような免除に依存する可能性があるために私たちの普通株の吸引力が低下していることを発見するかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株はそれほど活発ではない取引市場がある可能性があり、私たちの株価はもっと変動するかもしれない。
(I)初公募完了5周年(すなわち2026年12月31日)後の今年度最後の日、(Ii)本年度総収入が少なくとも12.35億ドルの会計年度の最終日まで、新興成長型会社となる。(Iii)取引法第12 b-2条の規定により、“大型加速申請者”とみなされる日付は、当該年度第2四半期の最後の営業日までに、非関連会社が保有する当社の普通株式の時価が7.00億ドルを超える場合が発生する。または(Iv)前3年間に10億ドルを超える転換不可能債務証券を発行した日。
雇用法案によると、新興成長型企業は、これらの基準が民間企業に適用されるまで、新たな会計基準の採用や改正された会計基準の採用を延期することもできる。私たちは、新しい会計基準や改正会計基準の免除を受けないことを撤回できないことを選択したので、他の非新興成長型企業の公衆企業と同様に、同じ新しい会計基準を遵守したり、会計基準を修正したりする。そのため、アメリカで公認されている会計原則の規則或いはその解釈の変化、新しい指導を採用したり、既存の指導を応用して私たちの業務を変えることは私たちの財務状況と経営結果に重大な影響を与える可能性がある。
“取引法”の定義によると、私たちも“小さな報告会社”です。私たちがもう新興成長型会社ではなくても、私たちは規模の小さい報告会社であり続けるかもしれない。私たちの非関連会社が保有する投票権と無投票権のある普通株が第2四半期の最終営業日に2.5億ドルを下回るか、または最近終了した会計年度の年収が1.00億ドル未満である限り、関連者が保有していない投票権と無投票権のある普通株が第2四半期の最終営業日に7.00億ドルを下回る限り、規模の小さい報告会社が利用できるいくつかの割合で開示された情報を利用することができ、これらの割合で開示された情報を利用することができる。
上場企業として、私たちの運営コストが増加し、私たちの経営陣は、新しいコンプライアンス措置やコーポレートガバナンス実践に多くの時間を投じています。また、適切かつ効率的な内部統制を維持できなければ、正確な財務諸表をタイムリーに作成する能力が損なわれる可能性がある。
上場企業として、多くの法律、会計、その他の費用を招いており、私たちが“新興成長型会社”でなくなった後、これらの費用はさらに増加する可能性がある。我々は、“取引所法案”、“サバンズ-オキシリー法案”、“ドッド·フランクウォールストリート改革と保護法”の報告要件、および米国証券取引委員会とナスダックが採択され、成立する規則を遵守する。私たちの経営陣と他の人たちはこのようなコンプライアンス計画を実施するために多くの時間を投入する必要があるだろう。また、これらのルールや規制は、私たちの法律や財務コンプライアンスコストを大幅に増加させ、いくつかの活動をより時間とコストを高くすることで、私たちの運営費用を増加させることが予想されます。例えば、私たちはこのような規則と規定が私たちをもっと難しくて高価にすると予想している
78
役員と上級職員責任保険は、十分な保険範囲を維持するために多くの費用が発生する可能性があります。私たちは、これらの要求に応答して生成される可能性のある追加コストの金額または時間を正確に予測または推定することができない。これらの要求の影響は、私たちの取締役会、取締役会委員会、または役員に参加することをより難しくし、合格した人を引き付け、維持することを可能にするかもしれない。
また、上場企業として、サバンズ·オクスリ法案第404条を実施する米国証券取引委員会規則を遵守するために、追加のコストと義務を発生させることが求められている。これらの規則によると、私たちは財務報告の内部統制の有効性を正式に評価しなければなりません。もし私たちが新興成長型会社でなくなったら、私たちが加速申告者や大型加速申告者であれば、私たちの独立公認会計士事務所が発行した財務報告内部統制認証報告を含むことを要求されます。規定された時間内に第404条の規定を遵守するために、費用が高く挑戦的な財務報告書に対する私たちの内部統制を記録して評価するプロセスを展開する。この点では、外部コンサルタントを招聘し、財務報告の内部統制に対する十分性を評価·記録するために詳細な作業計画を採用することが可能な内部資源を引き続き投入し、制御プログラムを適宜改善し、試験により制御措置の設計と効率的な動作を検証し、継続的な報告を実施し、財務報告の内部統制を改善するプログラムを実施する必要がある。
管理管理層は、財務報告の内部統制に達成しなければならない基準を評価するルールは複雑であり、規則下の詳細な基準を満たすためには、大量の文書、テスト、および可能な救済措置が必要である。テスト過程で、私たちの経営陣は重大な欠陥や欠陥を発見する可能性があり、これらの欠陥または欠陥は適時に修復できない可能性があり、“サバンズ-オックススリー法案”に規定されている期限内に完成できない可能性がある。私たちの財政報告書に対する内部統制はすべてのミスと詐欺を阻止したり発見したりしないだろう。設計および動作がどんなに良好であっても、絶対的な保証ではなく、合理的な保証しか提供できず、保証制御システムの目標が実現される制御システム。すべての制御システムの固有の限界により,どの制御評価も誤りや不正による誤り陳述が発生しないことは絶対に保証されず,すべての制御問題や不正が発見されることは絶対に保証されない.
もし私たちがサバンズ-オキシリー法案404条の要求を適時に守ることができなければ、あるいは適切で効果的な内部統制を維持できなければ、私たちはタイムリーで正確な財務諸表を作成できないかもしれない。このような状況が発生すれば、私たちの株式の市場価格は下落する可能性があり、私たちは普通株のある証券取引所、米国証券取引委員会、または他の規制機関の制裁や調査を受ける可能性がある。
私たちは私たちの普通株に配当金を支払うつもりはないので、どんな見返りも私たちの株の価値に限定されるだろう。
私たちは普通株式に対するどんな現金配当金も発表したり支払ったりしたことがない。私たちは現在、事業の発展、運営、拡張のために未来の収益を保留し、予測可能な未来に現金配当金を発表または支払うことはないと予想している。したがって、株主へのいかなる見返りも、その株式価値のいかなる付加価値にも限定されるだろう。
わが社の登録証明書、定款、デラウェア州法律の条項は、わが社の支配権の変更やわが経営陣の変更を阻止、延期または阻止する可能性がありますので、私たちの普通株の市場価格を下げることになります。
私たちの会社登録証明書や定款に含まれる条項は、私たちの普通株の市場価格を下げる可能性があります。これらの条項は、会社の統制権の変更や会社株主が有利と思う経営陣の変更を阻止、延期、または阻止する可能性があるからです。他にも、これらの規定には、
79
また、デラウェア州一般会社法(“DGCL”)第203条は、デラウェア州上場企業と利害関係のある株主(通常、その関連会社と所有しているか、または過去3年以内に議決権株を有する者の15%を有する者)が、取引日後3年以内に業務合併に従事することを禁止し、当該業務合併が所定の方法で承認されない限り。
当社の会社登録証明書の改訂と再記載、改訂と再記載の会社定款やデラウェア州法律の遅延または制御権の変更を防止する条項は、私たちの株主が彼らが保有する私たちの株式の株式から割増の機会を得ることを制限する可能性があり、一部の投資家が私たちの普通株に支払う価格に影響を与える可能性もあります。
私たちの定款は、会社が代替法廷を設立することに書面で同意しない限り、デラウェア州衡平裁判所は、私たちと株主との間のほとんどの紛争の独占法廷となり、これは、私たちまたは私たちの役員、役員、または従業員との紛争において有利な司法裁判所を得ることを制限することができる。
私たちの別例規定は、私たちが書面で代替裁判所を選択することに同意しない限り、デラウェア州衡平裁判所(または、裁判所に管轄権がない場合、デラウェア州の別の州裁判所またはデラウェア州地域の連邦地域裁判所)は、以下の事件の独占的な裁判所である
デラウェア州裁判所のこの条項は、司法裁判所で株主が私たちまたは私たちの役員、役員、または他の従業員と紛争する請求に有利だと考える株主の能力を制限する可能性があり、これは私たちと私たちの役員、幹部、および他の従業員に対する訴訟を阻止するかもしれない。任意の個人またはエンティティが、私たちの任意の証券の任意の権益を購入または他の方法で取得することは、本条項に了承され、同意されたとみなされるべきである。もし裁判所がデラウェア州裁判所のこの条項が訴訟で適用または実行できないことを発見した場合、私たちは複数および/または他の管轄区域でこのような紛争訴訟を提起することに関連する追加費用が発生する可能性があり、これは私たちの業務を深刻に損なう可能性がある。
私たちの定款は、私たちが書面で代替裁判所を選択することに同意しない限り、アメリカ合衆国連邦地域裁判所は、改正された1933年の証券法に基づいて誰に対しても会社証券発売に関連する誰かの訴えを解決するための独占的なフォーラムであるが、任意の監査人、引受業者、専門家、統制者、または他の被告に限定されない。連邦裁判所のこの条項は、司法裁判所で株主が有利と思われる証券法クレームを提出する能力を制限する可能性があり、これは私たちと私たちの役員、上級管理職、および他の従業員に対する訴訟を阻止するかもしれない。私たちの任意の証券の任意の権益を購入または他の方法で獲得した者は、この規定に了承され、同意されたとみなされるべきである。デラウェア州最高裁判所はこれらの条項が表面的に有効であると考えているが、これはデラウェア州の法律の問題であり、いくつかの州の初審裁判所はこれらの条項を執行し、証券法のクレームを主張する訴訟は連邦裁判所に提起しなければならないが、控訴裁判所がこれらの条項の執行可能性を確認する保証はない。もし裁判所が連邦裁判所のこの条項が訴訟で適用されないか実行できないことを発見した場合、私たちは州裁判所または州と連邦裁判所訴訟証券法のクレームに関連する追加費用を発生させる可能性があり、これは私たちの業務を深刻に損なう可能性がある。
80
デラウェア州裁判所のこの規定は、連邦裁判所がこのようなクレームに対して排他的管轄権を持っているため、1934年の“証券取引法”に基づいて提起された訴訟には適用されない。
税務機関は成功的に断言するかもしれないが、私たちは販売と使用税、付加価値税、または類似税を徴収すべきであり、私たちは過去または未来の販売に責任を負う必要があるかもしれない。これは私たちの経営業績に悪影響を及ぼすかもしれない。
我々は第三者ソフトウェアに依存して州と地方の税率を計算し,税率が変化した場合に更新する.医療機器やサービスの州免除(適用されれば)にも依存しており、これは、各州の処方医療に関する販売税の法律や法規を管理層が審査して決定されている。しかし、法律や法規の変化に伴い、これらの免除は、各課税管轄区の製品に適用され続ける可能性があるか、または適用されない可能性がある。ある司法管轄区域では、私たちの製品の販売にこのような税金を徴収しませんが、その後、これらの税金が適用されていると断言するかもしれません。これは納税評価、罰金、利息を招く可能性があり、私たちは未来にこのような税金を徴収することを要求されるかもしれません。このような納税評価、罰金、利息、または未来の要求は私たちの運営結果に悪影響を及ぼすかもしれない。
私たちの取締役会は、株主の承認なしに追加系列の優先株を発行して指定する権利があります。
当社の会社登録証明書は、当社取締役会が当社の株主の承認を得ずに自社優先株の株式を発行することを許可しているが、法律、規則及び規則及び当社が改正及び再記載された会社登録証明書の条文に規定されている制限を受けなければならず、優先株系列の株式として、当該等系列毎の株式数を随時特定し、当該系列毎の株式の名称、権力、優先権及び権利及びその資格、制限又は制限を定める必要がある。これらの追加的な優先株シリーズの権力、優先権、および権利は、私たちの普通株に優先するか、または私たちの普通株と同等である可能性があり、これはその価値を低下させるかもしれない。
私たちまたは私たちの顧客に不利な税金法律または法規の変化は、私たちの業務、キャッシュフロー、財務状況、または経営結果に重大な悪影響を及ぼす可能性があります。
“税法”は米国税法に対して多くの重大な改正を行ったが、その結果はまだ完全に確定されていない。会社税率の変化、わが米国業務に関連する繰延税項純資産の現金化、外国収益の課税、税法やその他の税制改革立法に含まれる費用の控除は、私たちの繰延税金資産の価値に大きな影響を与える可能性があり、本納税年度や将来の納税年度の大量の使い捨て費用を招き、将来の米国税費を増加させる可能性があります。例えば、2022年から、税法は現在すぐに研究開発支出を差し引くオプションを廃止し、税法第174条に基づいて納税者に5年または15年以内に研究開発支出の資本化と償却を要求することは、2022年または今後数年間の有効税率と現金納税義務に影響を与える可能性がある。バイデン政府が提案した米国の税収改革は規制や立法の発展を招く可能性があり、バイデン政府はいくつかの企業所得税制度の変更を提案しており、採択されれば、私たちの商業運営の税収増加を招く可能性がある。どのような変化が実施されるか、私たちの業務や財務業績への影響には、不確実性がある。上記項目、及び将来の税法のいかなる変化も、我々の業務、キャッシュフロー、財務状況又は経営結果に重大な悪影響を及ぼす可能性がある。また、経済協力開発機構が提案した15%の世界最低税率を含む国際税制改革の影響を監視·評価していきたい。最後に、2022年の“インフレ低減法案”(略称“アイルランド共和軍”)が2024年度から発効する。私たちは現在、アイルランド共和軍が私たちの所得税負担に実質的な影響を与えないと予想している。
一般リスク因子
私たちの成功は私たちが高い技能幹部と従業員を引き付ける能力に大きく依存している。
成功するためには、管理チームを構築すると同時に、合格した管理者を募集、維持、管理、激励しなければならないが、私たちは経験豊富な人員に対する激しい競争に直面している。私たちは経営陣の主要メンバーに強く依存しており、現在と将来の製品を商業化し、上場企業としての運営を管理できるリーダーチームを構築する計画であるため、運営と商業化の経験を持つ幹部を増やす必要がある。適格な人材、特に経営陣を誘致·維持することに成功しなければ、業務計画を実行する能力に悪影響を与え、経営実績を損なう可能性がある。特に、適切な後継者を速やかに募集できなければ、執行幹事を1人以上失うことは私たちに不利になる可能性がある。医療機器と眼科領域の合格人材に対する競争は非常に激しいため、私たちは未来の業務成功に必要な合格人材を引き続き吸引し、維持することができないかもしれない。私たちは
81
将来的に経験者をわが社に誘致することは困難であり、大量の財務資源をかけて私たちの従業員を募集し、維持する必要があるかもしれない。
私たちと合格した人材を競争する多くの他の医療機器やバイオテクノロジー会社は、私たちよりも多くの財務や他の資源、異なるリスク状況、そしてより長い業界の歴史を持っている。それらはまた職業発展にもっと多様な機会とより良い将来性を提供するかもしれない。このような特徴の中のいくつかは私たちが提供したより高い素質の応募者を引き付けるかもしれない。もし私たちが引き続き高い素質の人材を誘致し、維持することができなければ、私たちは現在と未来の製品の速度と成功が制限され、私たちの業務を成功的に発展させる潜在力が損なわれることを発見、開発、商業化する。
システム障害、セキュリティホール、事故が発生すれば、私たちの業務と運営は影響を受けるだろう。
私たちのコンピュータシステムおよび私たちの請負業者およびコンサルタントのコンピュータシステムは、コンピュータウイルス、恐喝ソフトウェアおよび他の悪意のコード、許可されていないアクセス、自然災害(ハリケーンを含む)、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。このような事件が発生して私たちの運営が中断されれば、私たちのRxSightシステムと私たちの未来の製品商業化の実質的な中断を招く可能性があります。例えば、完了した、進行中、または計画中の試験からの前研究または臨床試験データの損失、破損、または利用不可能は、私たちの規制承認作業を遅延させる可能性があり、データを回復または複製するコストを著しく増加させる可能性がある。任意の中断またはセキュリティホールまたはイベントは、私たちのデータまたはアプリケーションの損失、利用不可能または破損、または不適切な開示または個人、機密または独自の情報の他の処理をもたらし、私たちに責任を負わせ、私たちのRxSightシステムの商業化および現在および未来の製品のさらなる開発を延期させる可能性があると信じているか、または報告されていると考えられる。
このような情報の安全な処理、維持、そして伝達は私たちの行動に必須的だ。私たちはセキュリティ措置を取っているにもかかわらず、私たちの情報技術とインフラはハッカーや内部非行者の攻撃を受けやすいかもしれないし、技術的脆弱性、従業員のミス、汚職、または他の中断によって破られやすいかもしれない。私たちが知っている限り、私たちは今までそのような重大なセキュリティホールを経験していませんが、どのセキュリティホールやセキュリティイベントも、私たちのネットワークを危険にさらす可能性があり、そこに格納されている情報がアクセスされる可能性があり、公開され、開示され、紛失され、盗まれ、または不正に他の処理が行われる可能性があります。このような実際または知覚された情報アクセス、開示または他のセキュリティホールまたは事件、失われたまたは許可されていない情報処理(私たちまたは第三者サービス提供者に影響を与える)は、法的クレームおよび訴訟、規制調査、個人情報のプライバシーを保護する法律規定の他の訴訟および責任、重大な規制処罰または他の罰金または救済措置をもたらす可能性があり、このような事件は、私たちの運営を乱し、私たちの名声を損なう可能性があり、人々の自信を失い、製品を商業化し、臨床試験を行う能力を失うことは、私たちの名声に悪影響を与え、RxSightシステムの商業化および現在および未来の製品の臨床開発を延期する可能性がある。
ネットワーク攻撃および情報技術システムの侵入を行うための技術および複雑さ、ならびにこれらの攻撃のソースおよびターゲットは、様々な形態(ネットワーク釣り、社会工学、サービス攻撃、恐喝ソフトウェア、マルウェア、または他の悪意のコードを含む)を拒否または低減することが可能であり、しばしば変化し、そのような攻撃を開始するか、または実施した後に発見されることが多い。さらに、私たちとの業務往来があるか、または私たちの従業員、請負業者、または第三者に業務運営をアウトソーシングすることは、規制されている、保護されている、または個人が識別可能な情報を流用するために、私たちのセキュリティ措置を迂回しようと試みる可能性があり、意図的または意図的に、そのような情報の漏洩または漏洩を引き起こす可能性がある。第三者には、我々が収集、格納、または送信した情報のセキュリティを破壊する技術またはノウハウがある可能性があり、私たちそれぞれのセキュリティ対策および第三者サービスプロバイダのセキュリティ対策は、他の人が不正な方法でこれらの情報にアクセスすることを効果的に阻止できない可能性がある。コンピュータおよびソフトウェア機能および暗号化技術、新しいツール、および他の発展の進歩は、このような侵入、事故または危害のリスクを増加させる可能性がある。我々または我々の第三者プロバイダが実施する任意のセキュリティプログラムまたは制御措置は、データセキュリティに関連するイベントの発生を防止するのに十分である保証はない。
私たちは、潜在的、意図的、または既存のセキュリティホール、事故または故障、およびその結果を防止、対応し、そこから回復するために、大量の資本と他の資源を必要とするかもしれない。データセキュリティに関連する脅威が継続して発展するにつれて、私たちは、私たちの保護措置を修正したり、強化したり、任意の情報セキュリティホールを調査して修復したりするために、多くの追加資源を必要とするかもしれません。私たちは、すべての情報セキュリティホールの調査と救済、法律と規制クレームの防御と解決、通知義務の遵守など、セキュリティホールや事件に対応するために多くの財政と運営資源を費やすことを余儀なくされる可能性があり、これらは資源と私たちの管理層とキーパーソンの注意を分散させる可能性があります
82
従業員が私たちの業務運営から離れ、私たちの業務、財務状況、運営結果に悪影響を与えます。しかも、私たちの救済努力は成功しないかもしれないし、私たちは十分な保障措置を実施、維持、アップグレードできないかもしれない。
経済状況は私たちの業務に悪影響を及ぼすかもしれない。
世界経済、政治と市場状況は、新冠肺炎の疫病、東欧の衝突と全体の経済低迷に関連する状況を含み、私たちの業務にマイナスの影響を与える可能性がある。私たちの顧客の流動資金や財務状況の大きな変化は、彼らの購入と私たちの売掛金に不利な傾向を招く可能性があり、追加の準備金が必要になる可能性があり、これは私たちの業務、財務状況、経営業績に悪影響を及ぼす可能性があります。不利なグローバル経済状況は、私たちのサプライヤーが材料や部品を提供する能力にも悪影響を及ぼす可能性があり、これは私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす可能性があります。
訴訟と他の法的手続きは私たちの業務に悪影響を及ぼすかもしれない。
私たちは時々、特許や他の知的財産権に関する法的訴訟、製品責任クレーム、従業員クレーム、権利侵害または契約クレーム、連邦規制調査、証券集団訴訟、その他の法的訴訟や調査に巻き込まれる可能性があり、これは私たちの名声、業務、財務状況に悪影響を与え、私たちの経営陣の業務運営に対する注意をそらす可能性がある。訴訟は本質的に予測不可能であり、過度または意外な裁決および/または禁止救済を招き、我々の業務運営方式に影響を与える可能性がある。私たちは判決を招いたり、金銭損害クレームに対する和解を招いたり、合意に達して私たちの業務運営方式を変更したり、両方を持っている可能性があります。これらの事項の範囲が拡大する可能性があり、または将来的により多くの訴訟、クレーム、法的手続きまたは調査がある可能性があり、これは私たちの業務、財務状況および運営結果に実質的な悪影響を及ぼす可能性がある。私たちの規制や法的行動に関する否定的な宣伝は、私たちの名声とブランドイメージを損なう可能性があり、私たちの顧客の信頼を弱化させ、規制や法的行動に根拠がなくても、私たちの製品に対する長期的な需要を減少させ、あるいは私たちの運営に実質的な影響を与えないかもしれない。
業務中断は私たちの将来の収入と財務状況を深刻に損害し、私たちのコストと支出を増加させるかもしれない。
私たちの業務は地震、電力不足、電気通信故障、水不足、洪水、ハリケーン、台風、火災、悪天候条件、医療流行病とその他の自然或いは人為的災害或いは業務中断の影響を受ける可能性があり、私たちは主に自己保険です。私たちは第三者メーカーに依存して私たちの製品を生産する。もしこれらのサプライヤーの運営が人為的あるいは自然災害や他の業務中断の影響を受ける場合、私たちが製品の臨床供給を獲得する能力は妨害される可能性がある。また、当社の本社はカリフォルニア州Aliso Viejoにあり、主要地震断層と火域に近く、主要地震断層と火域の近くに位置し、ある地理的地域で強固にされていることが最終的な影響は不明です。このような業務中断の発生は、私たちの運営と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある。
お客様の私たちの製品に対する需要を正確に予測し、私たちの在庫を管理できなければ、私たちの運営結果は実質的な損害を受ける可能性があります。
著者らは供給中断の影響から自分を保護するために十分な在庫レベルを維持することを求めているが、全世界の納期の拡大、特にヨーロッパとアジアのため、新冠肺炎の疫病と関係があり、半導体、コンピュータ、ディスプレイ、電子部品、金属、包装、接着剤、化学品、樹脂と下請け塗装部品を含む原材料の不足を招き、それによって私たちが正常な情況下で理想的な手元の部品、部品、材料と完成品の在庫を維持する能力を制限した。十分な在庫供給を確保し、第三者メーカーやサプライヤーとの運営を管理するために、予想される材料需要とわが製品の需要を予測して在庫需要を予測し、これらの予測に基づいてサプライヤーに注文する。私たちの製品に対する需要を正確に予測する能力は、私たちの限られた歴史的な商業経験、急速な成長、私たちの拡張戦略を正確に管理できなかった、全世界の納期の拡大、競争相手の製品の発売、顧客の私たちの製品に対する需要の増加或いは減少、私たちは顧客の新製品に対する受け入れ程度、全体の市場状況或いは監督事項の意外な変化及び経済状況或いは消費者の未来の経済状況に対する自信が弱まることを含む多くの要素のマイナス影響を受ける可能性がある。
83
私たちが発売した製品の改善を含めて、お客様の需要を超える在庫レベルは、私たちの在庫の一部が時代遅れになったり期限切れになったり、在庫を減記したりログアウトしたりする可能性があり、これは私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす可能性があります。逆に、私たちの製品に対する顧客の需要や私たち自身のコンポーネント、コンポーネント、材料の需要を過小評価した場合、私たちの第三者製造業者とサプライヤーは、私たちの要求を満たすためにコンポーネント、コンポーネント、材料を渡すことができないかもしれません。これは、在庫レベルの不足やお客様への配送の中断、遅延、またはキャンセルを招く可能性があります。これらは、私たちの名声、顧客関係、およびビジネスを損なう可能性があります。また、私たちの製品に含まれるいくつかのコンポーネント、コンポーネント、および材料は、長い注文納期を必要とし、必要な場合、私たちが受け入れられる条項で追加の供給または材料を提供することができない可能性があり、私たちの第三者製造業者とサプライヤーは、私たちの増加した需要を満たすために十分な生産能力を割り当てることができない可能性があり、そのいずれも、私たちの製品および私たちの業務、財務状況、および運営結果の需要を満たす顧客の能力に悪影響を及ぼす可能性があります。
新冠肺炎関連リスク
我々の業務、財務状況、運営結果と成長はすべて新冠肺炎疫病の影響を受け、引き続き損害を受ける可能性がある。
私たちは新冠肺炎に関連する世界的な大流行のような公衆衛生危機に関連するリスクに直面している。新冠肺炎疫病は私たちのRxSightシステムの販売数量を減少させることによって、すでに私たちの運営と収入及び全体の財務状況に負の影響を与える可能性がある。
新冠肺炎の疫病は全世界の納期の延長を招き、原材料の不足を招き、半導体、コンピュータ、ディスプレイ電子部品、金属、包装、接着剤、化学品、樹脂と下請け塗装部品を含む。いくつかのサプライヤーは、供給不足によって支払われたより高い大口商品価格を支払うために、より高い価格、追加料金、および特急運賃を転嫁した。私たちのサプライヤーは私たちが彼らから購入した部品の生産を停止したり、私たちとの業務往来を停止することにするかもしれません。私たちのサプライヤーの任意の供給が中断されたり、私たちの製品で使用されている任意のコンポーネントまたはサブコンポーネントのためにより多くのサプライヤーを得ることができないことは、私たちの現在および新製品を生産する能力を制限し、私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。
新冠肺炎による潜在的な経済的影響や持続時間は評価や予測が困難である可能性があるが、大流行はすでに世界金融市場の深刻な混乱を招き続け、私たちの資本獲得能力を低下させる可能性があり、これは将来的に私たちの流動性に負の影響を与える可能性がある。私たちは、すべての新しい原位置亡命政策と全世界の選択的外科手術に対する制限は短期的に私たちの収入に大きな影響を与えると予想している。新冠肺炎の流行期間中、医師を含む私たちの顧客は経済的困難を経験し、その中のいくつかは完全に回復できない可能性がある。これは、一部の顧客が一時的または永久的に閉鎖され、破産を申請したり、より大きな医療システムによって買収されたりして、プログラムおよび/または私たちの製品の追加価格圧力を減少させる可能性がある。新冠肺炎の大流行は米国の失業者数を大幅に増加させ、大流行後もこの状況が続く可能性がある。このようなイベントの発生は,可処分所得や医療保険を取得する機会の減少を招く可能性があり,大流行終了後に販売されるRxSightシステムの数に悪影響を及ぼす可能性がある。
84
項目1 B。未解決の従業員のコメント。
ありません
項目2.財産
私たちは現在カリフォルニア州のAliso Viejoで4つの施設を借りて、私たちの本部、製造、研究開発、行政事務室の所在地としています。これらの施設のレンタル総面積は約121,000平方フィートです。レンタル契約はそれぞれ以下の日で終了する:(I)2024年9月30日、継続期間5年を選択することができる;(Ii)2026年1月31日、各継続5年を選択することができる;(Iii)2023年3月31日、各5年継続することができる;および(Iv)2024年8月31日、5年間継続することができる。私たちは私たちの施設が私たちの現在の需要を満たすのに十分だと信じている。
項目3.法的訴訟
時々、私たちは訴訟や他の法的手続きに巻き込まれるかもしれない。上述した以外に、当社は現在、経営陣が当社の業務に重大な悪影響を及ぼす可能性があると考えているいかなる訴訟や法的手続きにも関与していない。結果にかかわらず、弁護や和解コスト、管理資源の移転などの要因により、訴訟は私たちに悪影響を及ぼす可能性がある。
第4項鉱山安全情報開示
ありません
85
第II部
情報技術EM 5.登録者普通株、関連株主事項、発行者が株式証券を購入する市場
市場情報と保有者
私たちの普通株は2021年7月30日からナスダックグローバル市場で公開取引され、取引コードはRXSTである。その前に、私たちの普通株は市場を公開しなかった。
株主.株主
2023年2月15日現在、私たち普通株の登録株主は約221人です。実際の株主数はこの記録保持者の人数を超えており、受益者である株主を含むが、その株式は仲介人や他の被命名者が街頭名義で保有している。この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
配当政策
私たちは私たちの普通株式または任意の他の証券の任意の現金配当金を発表したり支払ったりしたことがない。私たちは、私たちの業務運営のために、すべての利用可能な資金と任意の将来の収益を維持し、予測可能な未来に現金配当金を支払わないと予想しています。私たちが修正した定期融資は私たちが配当金を支払う能力を制限する。しかも、私たちが未来に発行する債務ツールは私たちが普通配当金を支払う能力を実質的に制限するかもしれない。将来の現金配当金の支払い(あれば)は、私たちの取締役会が様々な要素を考慮して適宜決定します。これらの要素は、私たちの財務状況、経営業績、現在と予想される現金需要、当時の既存債務ツールの要求、および私たちの取締役会が関連していると考えている他の要素を含みます。
未登録株式証券販売
ない。
発行者が株式証券を購入する
ない。
第六項です[保留されている]
86
第7項:経営陣の財務状況と経営成果の検討と分析。
以下、我々の財務状況と経営結果の検討と分析は、我々の連結財務諸表および本年度報告書の他の部分がForm 10-K形式で含まれるこれらの報告書に関する付記とともに読まなければならない。歴史財務情報を除いて、以下の議論と分析には、リスク、不確定性、および仮説に関連する前向きな陳述が含まれている。多くの要素、第1の部分1 A項“リスク要因”および本年度報告10-K表の他の部分で議論された要因を含むため、選択されたイベントに対する実際の結果および時間は、これらの前向き陳述において予想されるものと大きく異なる可能性がある。“前向きな陳述に関する特別な説明”を参照されたい
概要
我々は商業段階の医療技術会社であり,白内障手術後の患者に質の高いカスタマイズ視力を提供することに取り組んでいる。私たち独自のRxSight®光線調節可能レンズシステム(“RxSightシステム”)は第一種であり、商業上利用可能な良質な白内障技術であり、医師が手術後の患者のために視力をカスタマイズと最適化できるようにする。RxSightシステムはRxSight光線調整可能レンズで構成されています® (“LAL”®)、RxSight Light Delivery Device(“LDD”)およびアクセサリ。我々のLALは1種の良質な眼内レンズ(“IOL”)であり、独自の感光性材料から作られ、LDDが産生する特定の紫外線(“UV”)モードによって形状を変えることができる。
著者らが設計したRxSightシステムは、競争的に良質なIOL技術の欠点を解決し、医師が信頼できる解決策を提供し、視覚効果を改善し、高いレベルの患者満足度を実現することを目的としている。競争的良質眼内レンズは患者が手術前に彼らの視力優先順位を明確にすることを要求し、これらの選択に関連する各種の光学的トレードオフを受け入れたい。患者が競争力のある良質な眼内レンズを選択すると、外科医師は一連の術前診断テストと予測式に依存して適切な水晶体屈折力を選択しなければならない。もし医者の予測が正確でなければ、患者は理想的ではない結果を経験する可能性があり、これはその後の角膜屈折手術或いはいくつかの他の妥協を必要とし、視力目標を達成する可能性がある。
これに対し,RxSightシステムでは,外科医は標準的な白内障手術にLALを移植し,術後数週間に患者の入力に応じて屈折不正を決定し,LDDを用いて正確な視覚矯正によりLALを修正し,患者に必要な視力結果を実現する。著者らは、著者らのRxSightシステムは医師と患者にもっと多くの自信と安心を提供し、それは競争性良質な眼内レンズによく見られる高リスク術前推測を除去し、そして患者がカスタマイズされた術後調整を通じて彼らの最終視力特徴を繰り返すことを可能にするからであると信じている。
私たちはアメリカのIOL市場で競争しています。LALはプレミアムIOLで、連邦医療保険によると、部分的に精算することができ、場合によっては個人支払人が精算することもできます。良質眼内レンズの販売価格は伝統的な眼内レンズより高く、それらは屈折矯正を提供するため、伝統的な人工水晶体は自然水晶体のみを透明水晶体で置換する(これは医療保険精算の標準である)。われわれのRxSightシステムはメキシコとカナダで承認され,LAL屈折力を調整することで術後残存屈折不正を矯正し,未矯正視力を向上させることができる。私たちは将来的にこれらの承認を受けた他の地域でビジネス拡張を選択的に行い、私たちが大きな潜在的な機会があると考えている市場を優先するかもしれない。アジアなどの規制プロセスがより複雑な大型白内障市場でも,新たな承認が求められる可能性がある。
私たちはカリフォルニア州のAliso Viejoに本社を置くデラウェア州の会社で、オランダのアムステルダムに完全子会社があります。この全額付属会社はイギリスに登録支店を設置し、ドイツに全額付属会社を設置している。
私たちのビジネス努力は2019年に始まり、主にアメリカに集中しています。私たちはアメリカで“カミソリとブレード”のビジネスモデルを構築して、新しい顧客の採用と持続的なLAL販売量の増加を推進しています。私たちのアメリカは 商業組織はLDD販売員とLAL顧客マネージャーからなる直販チーム、及び臨床専門家、現場サービスエンジニアとマーケティング人員を含む。著者らの販売仕事は約3000名のアメリカ白内障外科医師に集中し、彼らが行ったハイエンド人工水晶体手術はすべてのハイエンド人工水晶体手術の70%-80%を占めている。2022年12月31日現在,眼科実践で400 LDDSの装着基盤を構築しており,我々が設立してから2022年12月31日までに外科医は42,000個を超えるLALを移植している。
このようなビジネスモデルは、集中的な販売チームによって解決できる魅力的で集中的な市場機会を提供すると信じている。私たちは私たちの販売とマーケティング組織に大きな投資を続けるつもりだ。販売代表、実践開発者、臨床訓練者の数を選択的に増加させることは、既存の顧客が私たちの製品をさらに採用することを促進し、新顧客の私たちの製品に対する認識を拡大するのに役立つと信じている。私たちは主にLDDクライアント群の規模と推進を拡大することで
87
われわれのRxSightシステムが患者に提供する優れた臨床結果に対する認識を高めることにより,われわれのLALを利用した。ハイエンド人工水晶体市場における競争地位を引き続き強化するため、著者らの研究開発活動は主に臨床結果の改善、顧客体験の改善、著者らの使用適応の拡大、製造コストの低減とライフサイクル管理のプロジェクトに集中している。
著者らの最近の研究開発活動はRxSightシステムの増強に集中し、患者と医師の体験を改善し、治療可能な患者の範囲を拡大し、RxSightシステムの適応を拡大し、採用を推進する。時間の経過とともに,我々の調節可能なレンズ解決策は,今日の従来の白内障手術を選択していた患者を含め,広範な白内障手術患者の解決に利用できると信じている。さらに多くの開発と臨床研究が予定されており、私たちの既存と未来の世代の製品の安全性と有効性に臨床証拠を提供することを目的としている。最後に、私たちは将来、他の業務、製品または技術の買収または投資を求めることができ、これらの業務、製品または技術は、私たちのポートフォリオを補完または拡大し、私たちの技術能力を強化したり、他の方法で成長機会を提供したりすることができると思います。
私たちは引き続き私たちの販売とマーケティング組織に投資するつもりです。主に販売代表、臨床応用専門家と技術サービススタッフで、新しい顧客とアップグレード、及びLAL顧客マネージャーをサポートして、既存の顧客の中で私たちのLALを採用することを促進します。私たちは、より多くの印刷とデジタル、ソーシャルメディア、および他の顧客ツールを通じて、彼らのローカル広告を拡大し、私たちのマーケティング努力を拡大します。私たちはまた、私たちの既存の製品を強化するために、研究開発と臨床費用に大きな投資を行います。上場企業として、以前に発生したことがない、または以前より低いレートで発生したコスト、従業員に関する費用、役員と高級職員保険料、監査と法律費用、投資家関係費、取締役会メンバー費用、上場会社の報告要求を遵守する費用を発生させる。これらやその他の要因により,将来的には純損失と運営キャッシュフローが負になることが予想される。
私たちの既存の現金と現金等価物および短期投資は、私たちの運営費用と資本支出に資金を提供することができ、少なくとも本10-K表年次報告書が提出された日から12ヶ月以内に私たちの定期ローン契約要求を満たすことができると信じています。追加資本の調達や追加債務を招いて経営から利益を得る必要はないと予想されるが、企業が将来的に米国証券取引委員会に提出する10-Kフォーム年次報告または10-Qフォーム四半期報告で上記のことを開示する可能性があるが、公開発行または私募株式発行または債務融資、信用または融資スケジュール、またはパートナー関係または1つ以上のこのような資金源の組み合わせを構築することで、私たちの流動性要件を満たすために追加資本を調達することが要求される可能性がある。私たちは有利な状況で私たちの市場(“ATM”)施設を日和見的に使用することも可能である。もし私たちが株式証券を発行することでより多くの資金を調達すれば、私たちの株主は希釈されるかもしれない。
サプライチェーン制約、インフレと新冠肺炎が大流行
私たちは単一および独占サプライヤーを含む第三者に依存して、私たちの製品のいくつかのコンポーネントとサブコンポーネントを製造します。私たちは単一の供給源と唯一の供給者を含む私たちの供給者と、長期的な供給協定もなく、約束も保証されていない。私たちのほとんどのサプライヤーは18~24ヶ月の中期購買注文または一括注文を使用します。私たちは私たちのサプライヤーが直ちに私たちと私たちの顧客に私たちと彼らの品質、数量とコスト要求を満たす材料を提供することに依存していますが、新冠肺炎の流行とそれによるサプライチェーン制限が始まって以来、サプライヤーは予想された納期を逃し、納期を延長し、あるいは場合によっては調達注文をキャンセルします。これらのサプライヤーは様々な理由で製造過程で問題に遭遇する可能性があり、そのいずれも私たちの需要を満たす能力を遅延または阻害する可能性があります。全世界の交付期間の拡大、特にヨーロッパとアジアでは、新冠肺炎の疫病と関係があり、中国は再びコロナウイルスに関連する工場を閉鎖し、そして最近ウクライナの軍事衝突は、半導体、コンピュータ、ディスプレイ電子部品、金属、包装、接着剤、化学品、樹脂と下請け塗装部品を含む原材料の不足を招いた。あるサプライヤーは、供給不足によって支払われたより高い大口商品価格を支払い、納期を延期するために、より高い価格、追加料金、および特急運賃を転嫁した。また、これらのサプライチェーン制限のために、テスト、検証、文書を必要とし、内部コストを増加させ、他のプロジェクトのエンジニアリングリソースを転送する新しい仕入先を決定したり、代替コンポーネントを同定したりします。2023年1月31日, FDAは、設備製造コストの削減を目的とした様々な改正のために、低コストLDDの発売前承認補充を承認した。しかし,低コストLDDを市場に出す時間を2023年下半期に延期したのは,低コストLDDに比べて既存のLDDのためのコンポーネントやサブコンポーネントの調達が困難であるためである.現在、同じ機能を持つ2つのLDDのための材料を調達しています。経営陣の予想は、我々の毛金利は、この2種類のLDDを生産し続ける決定の影響を受けることであり、潜在的なサプライチェーン問題を緩和するために必要である。私たちはすでに措置を講じていますが
88
標準納期の増加、加工費の支払い、限られた数量の調達注文のキャンセル不可、キーコンポーネントの事前交付および二回目の調達を含む業務連続性リスクを低減し、私たちのサプライヤーは私たちが彼らから購入したコンポーネントの生産を停止するか、あるいは私たちとの業務往来を停止することを決定するかもしれない。私たちのサプライヤーの任意の供給が中断されたり、私たちの製品で使用されている任意のコンポーネントまたはサブコンポーネントのためにより多くのサプライヤーを得ることができないことは、私たちの現在および新製品を生産する能力を制限し、私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。
不確定なマクロ経済状況は、最近のインフレ圧力や金利上昇を含め、米国経済·資本市場に大きな不確実性をもたらし、この状況は2023年以降も継続し、我々の財務業績や流動性に悪影響を及ぼす可能性が予想される。
重要な業務指標
私たちは、私たちの業務を評価し、私たちの業績を評価し、私たちの業務に影響を与える傾向を決定し、私たちの業務計画を策定し、戦略的決定を行うために、いくつかの運営·財務指標を定期的に検討する。LDDS装着数,インプラントLAL数およびわれわれの製品を用いて手術を行う医師数は,収入の採用と創造能力を推進する指標であると信じている。私たちはこれらが私たちの業務の重要な指標だと信じている。私たちはまだ季節性や他の傾向を正確に評価できないかもしれませんが、今後もこれらや他の財務指標を使用して私たちの業務を評価しながら、私たちの業務の傾向を観察していきたいと思います。
各四半期に販売されたLDDの数量と四半期ごとの終了時に私たちのLDDクライアント群は重要な指標であると信じています。それらは私たちがLALを販売できる顧客群を代表しているからです。
|
|
2022 |
|
|
2021 |
|
|
||||||||||||||||||||||||||
|
|
Q1 |
|
|
Q2 |
|
|
Q3 |
|
|
Q4 |
|
|
Q1 |
|
|
Q2 |
|
|
Q3 |
|
|
Q4 |
|
|
||||||||
LDDS販売 |
|
|
40 |
|
|
|
49 |
|
|
|
49 |
|
|
|
57 |
|
|
|
13 |
|
|
|
25 |
|
|
|
31 |
|
|
|
45 |
|
|
期末顧客群 |
|
|
246 |
|
|
|
294 |
|
* |
|
343 |
|
|
|
400 |
|
|
|
105 |
|
|
|
130 |
|
|
|
161 |
|
|
|
206 |
|
|
* 2022年第2四半期にクライアント群から1 LDDを減算します。
四半期ごとに販売されたLAL数(患者体内への移植と報告)は,われわれのRxSightシステムの採用と使用状況を測る重要な指標であると考えられる。
|
2022 |
|
|
2021 |
|
|
||||||||||||||||||||||||||
|
Q1 |
|
|
Q2 |
|
|
Q3 |
|
|
Q4 |
|
|
Q1 |
|
|
Q2 |
|
|
Q3 |
|
|
Q4 |
|
|
||||||||
販売したLAL |
|
4,166 |
|
|
|
5,400 |
|
|
|
6,595 |
|
|
|
9,123 |
|
|
|
1,567 |
|
|
|
1,825 |
|
|
|
1,977 |
|
|
|
2,959 |
|
|
2021年に比べて2022年には我々のLDD売上高が81個増加し,LAL売上高が16,956個増加したのは,診療所や医師がわれわれのRxSightシステムを大量に採用し,LDD設備容量の増加に加えたためである。
業務成果の構成部分
売上高
私たちの販売には、白内障手術のための眼内レンズの販売、必要に応じて術後水晶体を調整するために眼内レンズに光線を投影するためのLDDS、およびサービスおよびアクセサリが含まれる。収入は主に製品の販売から来ており、主にアメリカである。顧客には主に眼科診療所(LDD販売)と外来手術センター(LAL販売)がある。私たちは、販売組織と販売エリアを拡大し、顧客を増加させ、私たちの製品を使用して訓練された医師の基礎を拡大することと、医師が私たちの製品を使用してより多くのプログラムを実行することと、新しい顧客と既存の顧客の中で私たちの製品に対する認識を拡大することによって、私たちの収入は絶対ドルで増加すると予想しています。
LALは委託方式でクライアント現場に保存されている.単一の履行義務を履行し,LALを患者に移植したことを顧客に通知した際にLALの収入を確認した。
我々のLDD契約は、1つの取引価格にバンドルされた複数の履行義務を含み、すべての義務は通常1年以内に履行される。LDD資本資産および関連コンポーネント収入は、インストールおよび顧客検収時に確認され、トレーニング収入は、少なくとも1人の医師がトレーニングを完了したときに確認され、初期保証およびサービスプロトコルは、サービス期間内に比例して確認される。1年目以降、サービス契約は単独で購入することができます。このようなサービス協定の収入は各契約期間内に確認されるだろう。
89
2022年12月31日と2021年12月31日までの年度において、顧客と締結されたサービス契約の契約負債には、
|
|
十二月三十一日までの年度 |
|
|
|||||
|
|
2022 |
|
|
2021 |
|
|
||
|
|
|
|
|
|
|
|
||
期初残高 |
|
$ |
540 |
|
|
$ |
345 |
|
|
期内の新規人数 |
|
|
2,052 |
|
|
|
793 |
|
|
期内確認の収入 |
|
|
(1,405 |
) |
|
|
(598 |
) |
|
期末残高 |
|
$ |
1,187 |
|
|
$ |
540 |
|
|
2022年12月31日と2021年12月31日までの1年間、それぞれ収入の10%以上を占める顧客はいません。
販売コスト
販売コストには、生産会社製品の内部材料、労働力、製造費用、輸送·運搬コストが含まれる。間接費用には、品質保証費用、材料調達費用、在庫制御費用、施設、設備、業務監督·管理費用、在庫に基づく補償費用が含まれる。販売コストには、生産設備の減価償却費用と、輸送コスト、特許権使用料、許可料費用などのいくつかの直接コストも含まれる。顧客から受け取った輸送コストは売上に含まれている。私たちは収入の増加とより多くの製品の販売に伴い、絶対ドルで計算する販売コストが増加すると予想しています。
私たちは毛利/(損失)を売上高で割って毛利を計算します。私たちの毛金利はずっと各種の要素の影響を受けて、平均販売価格、製品販売組み合わせ、生産と発注量、製造コスト、製品生産量、従業員数とコスト削減戦略を含む。新製品の発売と新しい製造技術と技術の採用に伴い、私たちの毛利率は四半期の変化によって変動するかもしれません。
多くの医療機器資本設備製品と同様に,我々のLDD毛金利は低く,LDDの材料コストが高いため,総製造コストの50%以上を占めている。また,販売されたLDDがLALプログラムを生成するため,LDDを大幅に値上げすることはない.私たちのLAL毛金利は高く、材料コストは低いが、固定間接コストは高い。LAL生産量の増加に伴い、毛金利が著しく改善される可能性が予想されます。
運営費
販売、一般、行政費用
販売、一般および行政費用またはSG&A費用は、主に給与、奨励ボーナス、株式報酬、行政、販売およびマーケティング機能に関連する福祉、医師教育プロジェクト、商業運営および分析、財務、情報技術および人的資源機能を含む人員関連費用を含む。その他のSG&A費用には、販売手数料、出張費用、販売促進活動、市場普及活動、市場研究と分析、会議·貿易展覧会、医師研修、専門サービス料(例えば、法律、特許登録費用、会計、監査および税費、取締役会費用、保険費用、一般会社費用および施設関連費用)が含まれる。予想される収入の増加を推進し、支援するための販売·マーケティング組織およびインフラの拡大に伴い、追加の法律、会計監査および税費、保険および他の上場企業に関連する費用に伴い、SG&A費用は絶対ドル計算で増加し続けると予想される。
研究開発費
研究と開発費用には,新製品と技術,臨床研究と法規提出及びコンプライアンスのための研究と開発及び工程活動による費用が含まれている。これらの費用には、給与、奨励ボーナス、株式ベースの報酬および福祉、臨床試験場所で発生する費用、規制および製造工程費用、各種実験室および研究設備および用品に関する費用、臨床試験および研究目的のための事前承認在庫の費用、資本化価値を超える製造プロセス開発費用、コンサルタントおよび契約臨床組織に支払われる費用、FDA上場前の承認提出準備に関連する直接FDA関連コストが含まれる。研究·開発費は発生時に費用を計上する。研究と開発を期待しています
90
費用が収入に占める割合は時間の経過とともに変化し,これは我々の新製品開発事業のレベルと時間,およびわれわれの臨床開発,臨床試験と登録,その他の関連活動に依存する。
株式許可証は価値変動を公正に許可する
株式承認証の公正価値変動は、各貸借対照表の日に優先株式証負債の公正価値を再計量することによる収益と損失を含む。私たちは引き続き優先株式証の推定公正価値を調整し、関連する転換可能な優先株が普通株に変換されるまで、これは2021年7月に最初の公募株が完成する前に発生した。
利子支出
利息支出には、主に私たちの未返済債務による利息と、私たちの債務に関連する債務割引及び発行コストの償却に関する非現金利息が含まれています。
利息とその他の収入,純額
利息と他の収入は、純額は主に私たちの現金と現金等価物で稼いだ利息収入からなります。
総合損失
全面赤字のすべての構成要素は、純損失を含めて、確認期間中の連結財務諸表に報告されている。全面損失は、短期投資と外貨換算調整の未実現収益と損失を含む一定期間内に非所有者源の取引やその他の事件や状況によって発生する権益変化と定義されている。
行動の結果
2022年と2021年12月31日終了年度比較
次の表は、2022年12月31日と2021年12月31日までの年度の業務結果と、これらの項目のドル増減とパーセント変化をまとめています
|
|
|
|
|
|
||||||||||
|
12月31日までの年度、 |
|
|
変わる |
|
||||||||||
(百分率を除いて千単位) |
2022 |
|
|
2021 |
|
|
($) |
|
|
(%) |
|
||||
売上高 |
$ |
49,005 |
|
|
$ |
22,593 |
|
|
$ |
26,412 |
|
|
|
116.9 |
% |
販売コスト |
|
27,677 |
|
|
|
18,076 |
|
|
|
9,601 |
|
|
|
53.1 |
|
毛利 |
$ |
21,328 |
|
|
$ |
4,517 |
|
|
$ |
16,811 |
|
|
|
372.2 |
% |
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
||||
販売、一般、行政 |
|
58,665 |
|
|
|
32,805 |
|
|
|
25,860 |
|
|
|
78.8 |
|
研究開発 |
|
25,981 |
|
|
|
24,499 |
|
|
|
1,482 |
|
|
|
6.0 |
|
総運営費 |
|
84,646 |
|
|
|
57,304 |
|
|
|
27,342 |
|
|
|
47.7 |
|
運営損失 |
$ |
(63,318 |
) |
|
$ |
(52,787 |
) |
|
$ |
(10,531 |
) |
|
|
19.9 |
% |
その他の収入(費用)、純額: |
|
|
|
|
|
|
|
|
|
|
|
||||
株式許可証は価値変動を公正に許可する |
|
— |
|
|
|
2,717 |
|
|
|
(2,717 |
) |
|
|
(100.0 |
) |
令状の有効期間が満了する |
|
— |
|
|
|
5,018 |
|
|
|
(5,018 |
) |
|
|
(100.0 |
) |
利子支出 |
|
(4,946 |
) |
|
|
(3,682 |
) |
|
|
(1,264 |
) |
|
|
34.3 |
|
利子とその他の収入 |
|
1,517 |
|
|
|
54 |
|
|
|
1,463 |
|
|
|
2,725.4 |
|
その他の収入総額、純額: |
|
(3,429 |
) |
|
|
4,107 |
|
|
|
(7,536 |
) |
|
|
(183.5 |
)% |
所得税前損失 |
|
(66,747 |
) |
|
|
(48,680 |
) |
|
|
(18,067 |
) |
|
|
37.1 |
|
所得税費用 |
|
9 |
|
|
|
8 |
|
|
|
1 |
|
|
|
19.1 |
|
純損失 |
$ |
(66,756 |
) |
|
$ |
(48,688 |
) |
|
$ |
(18,068 |
) |
|
|
37.1 |
% |
その他総合損失 |
|
|
|
|
|
|
|
|
|
|
|
||||
短期投資の未実現損失 |
|
(66 |
) |
|
|
(7 |
) |
|
|
(59 |
) |
|
|
829.9 |
|
外貨換算損失 |
|
(9 |
) |
|
|
(10 |
) |
|
|
1 |
|
|
|
(5.3 |
) |
その他総合損失合計 |
|
(75 |
) |
|
|
(17 |
) |
|
|
(58 |
) |
|
|
347.5 |
|
総合損失 |
$ |
(66,831 |
) |
|
$ |
(48,705 |
) |
|
$ |
(18,126 |
) |
|
|
37.2 |
% |
91
売上高
2022年12月31日までの年間売上高は2,640万ドル増加し116.9%となり,2021年12月31日現在の2,260万ドルから4,900万ドルに増加した。売上高の増加は,2021年に比べて2022年のLDDSの売上高が81個増加し,LALが16,956個増加したことが,我々のLDDSクライアント群の増加や医師や患者の我々に対するLALの採用増加によるものである。
販売コスト
2022年12月31日までの年間販売コストは,2021年12月31日現在の1,810万ドルから2,770万ドルに増加し,53.1%と増加しており,これは主にその間に販売されているLALとLDDSの数が増加しているためである。毛金利は2021年12月31日期の20.0%から2022年12月31日期の43.5%に増加したが,高い利益率LALからの収入が2021年の売上高の34%から2022年の56%に増加したことと,最新のLALおよびActivShield技術の導入により,2021年12月31日までに240万ドルの備蓄が記録され,主に超過LAL在庫に用いられたためである。
販売、一般、行政費用
2022年12月31日までの1年間で、販売、一般、行政費は2590万ドル増加し、78.8%増加し、2021年12月31日現在の3280万ドルから5870万ドルに増加した。この増加は,主に販売やマーケティングスタッフコストが1,510万ドル増加したためであり,主に従業員数が増加し,240万ドルの市場後研究コストが増加したことと,LDD売上高の増加により230万ドルの出張コストが増加し,2021年12月31日までの年度に比べて110万ドル増加したためである。一般·行政費が490万ドル増加したのは、主に人員費用の増加と株式報酬の増加により360万ドル増加したことと、上場企業経営に関する170万ドル増加の費用が増加したためである。
研究開発費
2022年12月31日までの年度の研究開発費は150万ドル増加し、2021年12月31日現在の2450万ドルから2600万ドルに増加し、6.0%増となった。増加の要因は,臨床研究費が190万ドル増加し,人員費が90万ドル増加したが,減少した120万ドルの材料費によって部分的に相殺されたことである。
その他の収入(費用)
2022年12月31日までの年間で、他の純収益は750万ドル減少し、支出は340万ドルだったが、2021年12月31日までの年間収入は410万ドルであり、これは主に270万ドルの権証負債の公正価値が有利に変化したためであり、2021年12月31日までの年間権証満期収益は500万ドルであり、2022年の利息支出が130万ドル増加したのは、主に改正後の定期融資の金利上昇によるものである。2022年には、短期投資金利の上昇により利息収入が150万ドル増加し、他の費用の増加を部分的に相殺した。
流動資金と資本資源
流動資金源
設立以来、深刻な運営損失と運営キャッシュフローが負の状況が発生しており、将来的には重大な損失が予想される。
2022年12月31日現在、私たちは1.058億ドルの現金と現金等価物、9400万ドルの短期投資、4020万ドルの長期債務、5.46億ドルの累積赤字を持っている。2022年12月31日と2021年12月31日までの年度の運営純損失はそれぞれ63.3ドルと5280万ドルだった。2022年12月31日までの年度の売上高は4900万ドル、純損失は6680万ドルだったが、2021年12月31日現在の売上高は2260万ドル、純収益は4870万ドルだった。
私たちが2021年7月にIPOを完了するまで、私たちの主な資金源は私募優先株、戦略パートナーとの構造的取引、債務融資、当社製品の販売です。
2021年7月29日、我々は初公募株を完成し、引受業者の超過配給選択権を行使して1株16.00ドルのIPO価格で販売した898,549株を含む8,248,549株の普通株を発行·売却した。920万ドルの引受業者割引と手数料および320万ドルの発行コストを差し引いた後、IPOから約1.196億ドルの純収益を得た。
92
定期ローン
2022年5月3日、定期融資第2改正案(第2改正案改正)(“改正定期融資”)を締結した。改正された定期融資は融資と担保協定を6,000万ドルに増加させ、そのうち4,000万ドルは2022年5月3日までに原始定期融資から全額資金を獲得する。改訂された定期ローンによると、適用される引き出し条件を満たすことを前提として、2023年6月30日までに1,000万ドルを追加借入することができ、合意に規定されている2023年3月31日までの測定期間で十分な12ヶ月の過去売上高を実現することができる。定期融資の条項と条件を改訂することにより、2023年9月30日までに1,000万ドルを追加借入することもできます。適用された引き出し条件を満たしていることを前提に、2023年6月30日までの試算期間で十分な12ヶ月の売上高を実現しています。改訂された定期融資の年利率は(I)9.25%または(Ii)1ヶ月保証隔夜融資金利(SOFR)(あるいは高い場合は0.16%)プラス適用保証金9.09%の大きい者に等しい。改正された定期ローンで違約事件が発生した場合、5%の追加利息を支払う必要があります。改正された定期融資は、2025年10月1日に満期を予定していた融資と保証契約の満期日を2027年2月1日に延長する。その会社は6000万ドルの改正定期融資をその信用手配としている。本年報に掲載されている総合財務諸表付記中の付記8-定期ローンを参照。
予備信用状
一次経営リースに必要な保証として、2024年9月30日に満期になった予備信用状を発行する金融機関もあります。2022年12月31日と2021年12月31日まで、信用状の総金額はそれぞれ30万ドルだった。
棚登録表
2022年8月8日、2022年8月12日に発効した2億ドルの棚登録声明を提出しました。棚登録の有効期限は三年で、普通株、優先株、債務証券、権証および/または単位の総価値は2億ドルに達することができます。棚登録宣言の目的は、市場条件が合ったときに追加資本を得るための柔軟性を提供することだ。2億ドルの棚登録声明に含まれ、ATMで私たちの普通株を発売し、総価値は5000万ドルに達する株式募集説明書の付録も提出した。ATM株はアメリカ銀行証券会社を通じて販売代理として提供されています。本年度報告Form 10−Kの日までに,ATMにより発行·販売された普通株は計1,355,216株であり,純収益総額は1,710万ドルであり,このうち879,341株の普通株,純収益は1,110万ドルで2023年1月に売却された。
2023年2月7日、米国銀行証券会社と引受合意に達し、2022年8月12日に発効する棚上げ登録声明に基づき、400万株の普通株の公開発行と売却で公開することに同意した。普通株は1株12.50ドルで一般に販売されている。引受契約の条項に基づいて、吾らも引受契約日から30日以内に同じ条項と条件で最大600,000株の普通株を追加購入できる選択権を引受業者に付与した。今回の公募株は2023年2月10日に終了した。引受業者の選択権は2023年2月10日に全面的に行使され、2023年2月14日に締め切られた。350万ドルの引受業者割引と手数料および30万ドルの発売費用を差し引いた後、公開発売から約5370万ドルの純収益を得た。
資金需要
私たちの未来の流動資金と資本資金需要は多くの要素に依存するだろう
93
2023年1月、ATMで879,341株の普通株を発売し、引受割引と手数料を差し引いた純収益は1110万ドルだった。また、2023年2月には、公募で460万株の普通株を売却し、350万ドルの引受業者割引と手数料、30万ドルの発売費用を差し引くと、約5370万ドルの純収益を得た。
私たちは、10-K表を提出する日まで、私たちの現在の現金、現金等価物、および短期投資、および調達された追加資本は、私たちの業務に少なくとも今後12ヶ月の資金を提供するのに十分であると予想しています。現在計画されている業務によれば、企業が将来米国証券取引委員会に提出される10-Kフォーム年次報告や10-Qフォーム四半期報告に開示されているように、追加資本を調達したり、追加債務を招いたりする必要はないと予想されるが、我々の流動性要求を満たすためには、公開発行または私募株式発行または債務融資、クレジットまたは融資スケジュールによってより多くの資本を調達するか、またはこれらの資金源のうちの1つまたは複数の資金源との組み合わせでより多くの資本を調達する必要があるかもしれない。私たちはまた有利な状況で私たちの(“ATM”)施設を日和見的に使用することができる。
当社の巨額資本要件に関連する追加リスクについては、本年度報告第I部のForm 10−K第1 A項(リスク要因)と、第II部の連結財務諸表付記における付記12−リース及び付記15−後続事件を参照して、より多くの情報を理解する。
現金流量集計表
以下の表に、以下の各期間の現金、現金等価物、および限定的な現金の主なソースおよび用途を示す
|
|
12月31日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
提供された現金純額(使用): |
|
|
|
|
|
|
||
経営活動 |
|
$ |
(58,850 |
) |
|
$ |
(44,708 |
) |
投資活動 |
|
|
39,950 |
|
|
|
(81,907 |
) |
融資活動 |
|
|
6,332 |
|
|
|
137,342 |
|
為替レートが現金·現金等価物に及ぼす影響 |
|
|
(9 |
) |
|
|
(10 |
) |
現金、現金等価物、および制限的現金純増加 |
|
$ |
(12,577 |
) |
|
$ |
10,717 |
|
経営活動用の現金
2022年12月31日までの1年間、経営活動に用いられた現金純額は5880万ドルで、主に純損失6680万ドル、営業資産と負債変化740万ドルを含み、一部は株式ベースの非現金報酬1140万ドルおよび減価償却·償却390万ドルで相殺された。
2021年12月31日までの年度の経営活動に用いられる現金純額は4,470万ドルであり,主に経営損失4,870万ドル,引受権証未行使満期時の非現金収益500万ドルを含み,増加している
94
業務資産と負債は270万ドルで、760万ドルの非現金株給与、400万ドルの減価償却と償却、240万ドルの古い在庫準備金と超過準備金で相殺される。
投資活動によって提供される現金
2022年12月31日までの年度、投資活動が提供する現金純額は4,000万ドルで、その中には4,230万ドルの短期投資純満期額および240万ドルの財産と設備購入が含まれている。
2021年12月31日までの年度の投資活動用現金純額は8190万ドルで、純購入1.6億ドルの短期投資と190万ドルの財産や設備の購入が含まれており、これらの純現金は8000万ドルの短期投資満期日部分で相殺されている。
融資活動で発生した現金
2022年12月31日までの年間、融資活動の現金純額は630万ドルで、主に市場で発売された600万ドルの純収益と、従業員の株式購入計画に基づいて行使された株式オプションと普通株発行の180万ドルの収益が含まれているが、我々の棚上げ登録表提出に関する60万ドルの従業員税と60万ドルの発売費用部分はこの純収益を相殺している。
2021年12月31日までの年度の融資活動の現金純額は1.373億ドルで、主に初公募株の純収益1.196億ドル、会社の定期融資から引き出した1500万ドル、株式オプション行使の収益160万ドルを含む。
重要な会計政策、重大な判断と見積もり
私たちの財務状況と経営結果の討論と分析は、アメリカ公認会計原則またはアメリカ公認会計原則に基づいて作成された我々の総合財務諸表に基づいており、これは、資産、負債、販売および費用報告金額、または資産と負債に関する開示に影響を与える推定を行うことを要求する。一般に,我々の推定は歴史的経験と米国公認会計原則に適合した様々な他の仮定に基づいており,これらの仮定は当時の場合には合理的であると考えられる。実際の結果はこれらの見積もりとは異なる可能性があり,このような違いは財務状況や業務結果に大きな影響を与える可能性がある。
私たちの重要な会計政策は“S”にもっと詳しく説明されていますが会計政策の概要” はい。 付記2本年報10-K表第II部第8項に記載されている総合財務諸表付記では、当社の総合財務諸表の作成に使用する判断及び推定に以下の会計政策が最も重要であると考えている。
95
収入確認
私たちの販売収入は、白内障手術のための調光可能な眼内レンズLalと、必要に応じて術後にレンズを調整するために、眼に光を伝達するために専用に設計された機械である光線送達装置(“LDD”)からのものである。販売収入はアメリカとヨーロッパで販売されている製品から確認します。顧客は主に外来手術センター,病院,開業医診療所から構成されている。
約束された商品やサービスが、これらの商品やサービスの対価格と交換する権利があることを反映した取引価格で顧客に譲渡された場合、販売収入を確認します。具体的には,(I)顧客との契約の決定,(Ii)契約における履行義務の決定,(Iii)取引価格の決定,(Iv)契約に取引価格を割り当てる履行義務,および(V)契約履行義務を履行した場合,販売収入を確認する5つのステップを用いて販売収入を確認する.私たちは5段階モデルを契約に適用して、契約が顧客に転送された商品やサービスと交換するために、それが獲得する権利のある対価格を受け取る可能性が高い。契約開始時には、各顧客契約で約束された貨物を評価し、その製品供給における単一の交付可能物を個別の履行義務として決定し、各約束された貨物またはサービスが異なるかどうかを評価する。取引価格は、予想される対価格、契約手配の規定価値または非契約手配によって徴収される推定現金に基づいて決定される。販売収入が履行義務を履行する際にそれぞれの履行義務に割り当てられた取引価格の金額であることを確認し,これがある時点で発生したかどうか,あるいは時間の経過とともに発生したかどうかを考慮した.私たちは、約束されたサービスではなく、輸送コストを履行コストとして計算し、顧客から受け取った任意の政府当局に送金された税金を収入から除外することを選択した。
我々のLDD契約は、1つの取引価格でバンドルされた複数の履行義務を含み、すべての義務は通常1年以内に履行される。これらのバンドル配置については、個々の製品およびサービスが異なる場合、すなわち、製品またはサービスがバンドルされたパケット内の他の項目とは別に識別することができ、顧客が個別に利益を得ることができる場合、または顧客がいつでも利用可能な他のリソースを利用することができる場合、個別製品およびサービスを個別の履行義務として計算する。我々のLDD契約には、以下の業績義務の組み合わせが含まれています:(1)LDD資本資産と関連コンポーネント、(2)トレーニングと(3)デバイスサービス(最初の年)。この三つの履行義務は違うと考えられている。LDD資本資産は、顧客がそれおよび顧客がいつでも利用可能な他の資源から利益を得ることができるので、独特である。機械使用トレーニングは、LDD設置後に独自の活動として提供され、業界の専門家に最適な実践を提供させ、顧客の特定のニーズに応じてトレーニングをカスタマイズすることによって、顧客が機械を使用する能力を向上させる。各LDDには、予防的メンテナンス、計画外サービス(人工および部品)、ソフトウェア更新が含まれる12ヶ月の製造業者保証(サービス型)があります。1年目以降、サービス契約は単独で購入することができます。私たちは収入を製品やサービスの制御権を顧客に移すことで義務を履行することを確認した。具体的には,LDD資本資産の収入は実装時のある時点で確認される.訓練収入もある時点で記録されており,通常は設置後60日である。設備サービスの収入はインストール後に比例して確認します, 普通は12ヶ月です。私たちは取引価格が領収書価格であり、調整があれば純額であることを確定した。単独の履行義務への分配は比較的独立した販売価格に基づいている.独立販売価格は私たちが製品やサービスを単独で販売する観察可能な価格に基づいています。著者らは市場評価方法を用いて独立販売価格を推定し、市場状況と実体の特定の要素を考慮し、製品とサービスの特性と機能、地理位置、顧客タイプと市場状況を含むがこれらに限定されない。会社は必要に応じて独立した販売価格を定期的に審査して更新します。
LALは委託方式でクライアント現場に保存されている.単一性能義務を履行し,LALを患者に移植したことを顧客に通知した際にLALの販売収入を確認した。2022年と2021年12月31日までの1年間では、価格表価格の返品やリベートに関するポイントは顕著ではない。
当社は契約を得るために発生した費用を直接支払うことを可能にする実際の便宜策を講じており、このような費用の償却は1年以上の間に発生し、ほとんどの会社の契約に適用される。
96
賠償協定
私たちは正常な業務過程で標準的な賠償計画を達成した。これらの手配によると、私たちは賠償、無害を維持し、補償された第三者がその技術について提出した任意の商業秘密、著作権、特許または他の知的財産権侵害、流用または他の侵害クレームによって受けたまたは発生した損失を賠償することに同意する。このような賠償協定の期限は一般的に協定締結後のいつでも永久的に有効だ。このような計画によると、私たちが未来に支払わなければならない最高金額は確定できないかもしれない。私たちは訴訟を弁護したり、このような賠償協定に関連したクレームを解決する費用を負担したことがない。したがって、私たちはこのような合意の公正な価値がわずかだと思う。
最近の会計声明
“”というタイトルの部分を参照会計政策の概要--最近の会計公告“本年度報告の表格10-K第II部第8項に記載されている総合財務諸表付記2では、他の資料を参照してください。
新興成長型企業と小さな報告会社の地位
私たちは2012年のJumpStart Our Business Startups ActやJOBS Actで定義されているように“新興成長型会社”です。したがって、他の非新興成長型企業の上場企業の様々な報告要件に適用される資格免除があり、サバンズ-オクスリー法案第404条の監査人認証要件の遵守、役員報酬に関する開示義務の削減、および役員報酬や金パラシュート手配についての非拘束性相談投票の要求を免除することが含まれている。我々は、本10-Kフォーム年次報告書のいくつかの減少した開示義務を利用することを選択し、将来的に米国証券取引委員会に提出された文書において、他の減少した報告要件を利用することを選択する可能性がある。したがって、私たちが株主に提供する情報は、あなたが株式を持っている他の公共報告会社から得られる情報とは異なる可能性があります。
JOBS法案は、“新興成長型会社”が延長された過渡期を利用して、上場企業に適用される新たなまたは改正された会計基準を遵守することを許可している。しかし、私たちは撤回不可能に“選択脱退”という延長された移行期間を選択したので、非新興成長型会社に新たな会計基準の採用や改訂された関連日にそれなどの基準を遵守することを要求する。
(I)初公募完了5周年(すなわち2026年12月31日)後の今年度最後の日、(Ii)本年度総収入が少なくとも12.35億ドルの会計年度の最終日まで、新興成長型会社となる。(Iii)取引法第12 b-2条の規定により、“大型加速申請者”とみなされる日付は、当該年度第2四半期の最後の営業日までに、非関連会社が保有する当社の普通株式の時価が7.00億ドルを超える場合が発生する。または(Iv)前3年間に10億ドルを超える転換不可能債務証券を発行した日。
“取引法”の定義によると、私たちも“小さな報告会社”です。私たちがもう新興成長型会社ではなくても、私たちは規模の小さい報告会社であり続けるかもしれない。私たちの非関連会社が保有する投票権と無投票権のある普通株が第2四半期の最終営業日に2.5億ドルを下回るか、または最近終了した会計年度の年収が1.00億ドル未満である限り、関連者が保有していない投票権と無投票権のある普通株が第2四半期の最終営業日に7.00億ドルを下回る限り、規模の小さい報告会社が利用できるいくつかの割合で開示された情報を利用することができ、これらの割合で開示された情報を利用することができる。
第七A項。市場リスクに関する定量的で定性的な開示。
小さな報告会社として、私たちはこの項目の下で情報開示を提供する必要はない。
97
項目8.財務諸表と補足データ
連結財務諸表索引
独立公認会計士事務所報告 (PCAOB ID: |
99 |
合併貸借対照表 |
100 |
合併経営報告書と全面赤字 |
101 |
普通株、株式オプション、転換可能優先株および権益表の連結報告書を償還可能 |
102 |
統合現金フロー表 |
103 |
連結財務諸表付記 |
104 |
98
独立公認会計士事務所報告
RxSight,Inc.の株主と取締役会へ
財務諸表のいくつかの見方
RxSight,Inc.(当社)2022年12月31日と2021年12月31日までの連結貸借対照表、2022年12月31日までの2年度の関連総合経営表と全面赤字、償還可能普通株、株式オプション、転換可能優先株と株主権益及び現金流量及び関連付記(総称して“総合財務諸表”と呼ぶ)を監査した。総合財務諸表は、すべての重要な面で、2022年12月31日と2021年12月31日までの会社の財務状況と、2022年12月31日までの2年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/
2015年以来、当社の監査役を務めてきました。
March 6, 2023
99
RxSIGHT,Inc.
合併貸借対照表
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
短期投資 |
|
|
|
|
|
|
||
売掛金純額 |
|
|
|
|
|
|
||
棚卸しをする |
|
|
|
|
|
|
||
前払い資産と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
経営的リース使用権資産 |
|
|
|
|
|
|
||
制限現金 |
|
|
|
|
|
|
||
その他の資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
費用とその他の流動負債を計算しなければならない |
|
|
|
|
|
|
||
賃貸負債 |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
長期賃貸負債 |
|
|
|
|
|
|
||
定期ローン,純額 |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
株主権益: |
|
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
|
||
優先株、$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
その他の総合損失を累計する |
|
|
( |
) |
|
|
( |
) |
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこれらの連結財務諸表の構成要素である。
100
RxSIGHT,Inc
合併経営報告書と全面赤字
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
|
|
|
|
|
|
||
|
|
|
十二月三十一日までの年度 |
|
|||||
|
|
|
2022 |
|
|
2021 |
|
||
売上高 |
|
|
$ |
|
|
$ |
|
||
販売コスト |
|
|
|
|
|
|
|
||
毛利 |
|
|
|
|
|
|
|
||
運営費用: |
|
|
|
|
|
|
|
||
販売、一般、行政 |
|
|
|
|
|
|
|
||
研究開発 |
|
|
|
|
|
|
|
||
総運営費 |
|
|
|
|
|
|
|
||
運営損失 |
|
|
|
( |
) |
|
|
( |
) |
その他の収入(費用)、純額: |
|
|
|
|
|
|
|
||
株式許可証は価値変動を公正に許可する |
|
|
|
|
|
|
|
||
令状の有効期間が満了する |
|
|
|
|
|
|
|
||
利子支出 |
|
|
|
( |
) |
|
|
( |
) |
利子とその他の収入 |
|
|
|
|
|
|
|
||
所得税前損失 |
|
|
|
( |
) |
|
|
( |
) |
所得税費用 |
|
|
|
|
|
|
|
||
純損失 |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
|
|
|
|
|
|
|
||
その他総合損失 |
|
|
|
|
|
|
|
||
短期投資の未実現損失 |
|
|
|
( |
) |
|
|
( |
) |
外貨換算損失 |
|
|
|
( |
) |
|
|
( |
) |
その他総合損失合計 |
|
|
|
( |
) |
|
|
( |
) |
総合損失 |
|
|
$ |
( |
) |
|
$ |
( |
) |
1株当たり純損失: |
|
|
|
|
|
|
|
||
普通株のせいで、基本的に希釈した後 |
|
|
$ |
( |
) |
|
$ |
( |
) |
加重平均流通株は |
|
|
|
|
|
|
|
||
普通株のせいで、基本的に希釈した後 |
|
|
|
|
|
|
|
||
付記はこれらの連結財務諸表の構成要素である。
101
RxSIGHT,Inc.
普通株、株式オプション、
転換可能優先株と株主権益
(単位:千、株式数を除く)
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
オープンカー |
|
|
|
|
|
|
|
|
|
|
|
受取手形 |
|
|
積算 |
|
|
|
|
|
|
||||||||||||||||
|
|
普通株を償還できる |
|
|
償還すべき受取手形 |
|
償還可能である |
|
|
優先株 |
|
|
|
普通株 |
|
その他の内容 |
|
|
普通株上 |
|
|
他総合的の |
|
積算 |
|
|
株主合計 |
|
||||||||||||||||||||||
|
|
株 |
|
|
金額 |
|
|
普通株式を発行した |
|
株式オプション |
|
|
株 |
|
|
金額 |
|
|
|
株 |
|
|
金額 |
|
資本 |
|
|
発表されました |
|
|
損 |
|
赤字.赤字 |
|
|
株権 |
|
|||||||||||||
2020年12月31日残高 |
|
|
|
|
$ |
|
|
$ |
( |
) |
$ |
|
|
|
|
|
$ |
|
|
|
|
|
|
$ |
- |
|
$ |
- |
|
|
$ |
- |
|
|
$ |
( |
) |
$ |
( |
) |
|
$ |
( |
) |
||||||
株式オプションと帰属制限株式単位を行使するために発行された株式 |
|
|
|
|
|
|
|
|
- |
|
|
( |
) |
|
|
|
|
|
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||||||
株に基づく報酬費用 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||
受取手形収益 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
|
- |
|
|
- |
|
|
|
|
|||
交換として普通株を渡す |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
( |
) |
|
|
- |
|
|
( |
) |
|
|
|
|
|
- |
|
|
- |
|
|
|
- |
|
||
再分類する |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
- |
|
|
- |
|
|
|
|
|||||
償還可能な普通株式オプションを普通株式オプションに再分類する |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||||
受取手形変動 |
|
|
- |
|
|
|
- |
|
|
|
( |
) |
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
|
|
- |
|
|
- |
|
|
|
|
||
優先株式証の行使は |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
- |
|
|
( |
) |
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
( |
) |
||
優先株を転換する |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||||
年発行普通株 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||||
その他総合損失 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
( |
) |
|
- |
|
|
|
( |
) |
純損失 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
( |
) |
|
|
( |
) |
2021年12月31日の残高 |
|
|
- |
|
|
$ |
- |
|
|
$ |
- |
|
$ |
- |
|
|
|
- |
|
|
$ |
- |
|
|
|
|
|
|
$ |
|
$ |
|
|
$ |
- |
|
|
$ |
( |
) |
$ |
( |
) |
|
$ |
|
||||
株式オプションと帰属制限株式単位を行使するために発行された株式 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
- |
|
|
|
|
|||||
従業員税の差し押さえで償還された株 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
( |
) |
|
|
|
|
( |
) |
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
( |
) |
|
株に基づく報酬費用 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||
従業員のために発行予定の株を購入する |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
||||
市場で普通株を発行し,発行コストを差し引いた純額 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
- |
|
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
|
|||
その他総合損失 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
( |
) |
|
- |
|
|
|
( |
) |
純損失 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
- |
|
|
|
- |
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
( |
) |
|
|
( |
) |
2022年12月31日の残高 |
|
|
- |
|
|
$ |
- |
|
|
$ |
- |
|
$ |
- |
|
|
|
- |
|
|
$ |
- |
|
|
|
|
|
|
$ |
|
$ |
|
|
$ |
- |
|
|
$ |
( |
) |
$ |
( |
) |
|
$ |
|
||||
付記はこれらの連結財務諸表の構成要素である。
102
RxSIGHT,Inc.
統合された現金フロー表
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
経営活動: |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
||
減価償却および償却 |
|
|
|
|
|
|
||
賃貸資産を使用して償却する |
|
|
|
|
|
|
||
債務発行コストと割増償却 |
|
|
|
|
|
|
||
株式許可証は価値変動を公正に許可する |
|
|
|
|
|
( |
) |
|
株式証明書が満期になったときの収益 |
|
|
|
|
|
( |
) |
|
短期投資は割引して償却する |
|
|
( |
) |
|
|
( |
) |
株に基づく報酬 |
|
|
|
|
|
|
||
超過と古い在庫準備金 |
|
|
|
|
|
|
||
営業資産と負債の変動: |
|
|
|
|
|
|
||
売掛金 |
|
|
( |
) |
|
|
( |
) |
棚卸しをする |
|
|
( |
) |
|
|
( |
) |
前払い資産とその他の資産 |
|
|
|
|
|
( |
) |
|
売掛金 |
|
|
|
|
|
|
||
費用とその他の負債を計算すべきである |
|
|
|
|
|
|
||
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
投資活動: |
|
|
|
|
|
|
||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
短期投資満期日 |
|
|
|
|
|
|
||
短期投資を購入する |
|
|
( |
) |
|
|
( |
) |
投資活動提供の現金純額 |
|
|
|
|
|
( |
) |
|
融資活動: |
|
|
|
|
|
|
||
定期融資収益 |
|
|
|
|
|
|
||
債務発行コストの支払い |
|
|
( |
) |
|
|
( |
) |
優先持分証を行使して得た金 |
|
|
|
|
|
|
||
従業員の株式購入計画に基づいて株式オプションの行使と普通株発行による金 |
|
|
|
|
|
|
||
株式報酬に関する従業員税を支払う |
|
|
( |
) |
|
|
|
|
初公開の収益は,引受割引と手数料および発行コスト後の純額を差し引く |
|
|
|
|
|
|
||
普通株で得た金を市場で発行する |
|
|
|
|
|
— |
|
|
融資リース負債の元金支払い |
|
|
( |
) |
|
|
( |
) |
繰延発行費用の支払い |
|
|
( |
) |
|
|
|
|
発行された普通株償還可能な受取手形変動 |
|
|
|
|
|
|
||
普通株式を発行して得た金 |
|
|
|
|
|
|
||
融資活動が提供する現金純額 |
|
|
|
|
|
|
||
現金、現金等価物および制限現金に及ぼす為替レートの影響 |
|
|
( |
) |
|
|
( |
) |
現金、現金等価物、および制限的現金純増加 |
|
|
( |
) |
|
|
|
|
現金、現金等価物、制限現金--期初 |
|
|
|
|
|
|
||
現金、現金等価物、制限された現金--期末 |
|
$ |
|
|
$ |
|
||
キャッシュフロー情報の追加開示: |
|
|
|
|
|
|
||
賃貸負債に含まれる金額を計量するために支払う現金: |
|
|
|
|
|
|
||
レンタル経営からの経営キャッシュフロー |
|
|
|
|
|
|
||
所得税の現金を納める |
|
|
|
|
|
|
||
融資リース利息のための現金 |
|
|
|
|
|
|
||
定期ローンの利息を支払う現金 |
|
|
|
|
|
|
||
非現金投資と融資活動: |
|
|
|
|
|
|
||
レンタル義務と引き換えに使用権資産: |
|
|
|
|
|
|
||
レンタルを経営する |
|
|
|
|
|
|
||
融資リース |
|
|
|
|
|
|
||
資産記録を使用するための賃貸債務: |
|
|
|
|
|
|
||
レンタルを経営する |
|
|
|
|
|
|
||
融資リース |
|
|
|
|
|
|
||
売掛金と売掛金に計上された財産と設備を購入する |
|
|
|
|
|
|
||
売掛金と売掛金に含まれる繰延発売コスト |
|
|
|
|
|
|
||
受取手形元金を計上した実物支払利息収入 |
|
|
|
|
|
|
||
権利証負債から引受権証を行使する追加実収資本への再分類 |
|
|
|
|
|
|
||
再分類する |
|
|
|
|
|
|
||
償還可能な普通株式オプションを普通株式オプションに再分類する |
|
|
|
|
|
|
||
初公開時に優先株を普通株に転換する |
|
|
|
|
|
|
||
繰延発行コストは追加実収資本に再分類される |
|
|
|
|
|
|
||
付記はこれらの連結財務諸表の構成要素である。
103
RxSIGHT,Inc.
連結財務諸表付記
注1--列報の組織と根拠
業務説明
RxSight®Inc.(“会社”)はカリフォルニア州アリソ·ヴィエホに本社を置くデラウェア州の会社です
当社の製品は調光レンズ(“LAL”を含んでいます®)と、光を目に伝達するために専用に設計された機械、すなわち光伝送装置(LDD)とを備える“),米国が承認する(”米国“)米国食品医薬品局(“FDA”)は主に米国で販売され、米国、ヨーロッパ、カナダ、メキシコで規制承認を受けている。同社は2019年にその製品の販売を開始した。LALは1種の良質な眼内レンズ(IOL)であり、医療保険によって部分的に精算することができる。同社は米国とヨーロッパのハイエンド市場で他の人工水晶体と競争している。
列報根拠と合併原則
添付されている総合財務諸表は、オランダに位置するRxSight,Inc.およびその完全子会社RxSight,B.V.およびドイツに位置するRxSight GmbHの勘定を含む米国公認会計原則(“GAAP”)に基づいて作成される。同社は資産と負債の期末レートと報告期間ごとの経営業績の平均レートを用いて海外子会社の財務諸表に換算している。すべての重大な会社間残高と取引は合併で販売された。
細分化市場を運営する
同社が経営部門を決定した根拠は,内部で業績を評価する際に用いた基礎と同じである。会社の最高経営決定者(“CODM”)は会社の最高経営責任者であり、会社の総合経営結果を審査し、資源を分配し、財務業績を評価する。
同社はその業務(その非米国子会社を含む)を経営·管理することを決定した
流動性
初公開(“初公募株”)
2021年7月22日、会社取締役会は、会社普通株式(GシリーズおよびWシリーズ普通株を含まない)および変換可能優先株の株式逆分割を実現するために、会社登録証明書の改訂を許可した
開ける
104
初公募が完了する直前に、(I)
棚登録表
2022年8月8日に同社は
2022年12月31日と2021年12月31日まで、会社は現金、現金等価物、短期投資を持っている$
同社は2019年から本営業務から収入を生み出している。同社の経営歴史は限られており、会社の業務や市場の収入と収入の潜在力はまだ実証されていない。設立以来、同社の経営活動は純損失とマイナスキャッシュフローが続いている。2022年12月31日及び2021年12月31日まで、当社は$
添付されている総合財務諸表の作成仮説会社は引き続き経営を継続する企業となる。当社は、既存の現金資源は、添付の連結財務諸表の発表日から少なくとも12ヶ月の予想経営需要を満たすのに十分であると信じている。2022年12月31日現在、会社は引き続き現金、現金等価物、短期投資を使用して運営損失に資金を提供する計画だそして、株式または債務融資、他の第三者融資、協力、戦略連盟および許可手配、またはこれらの手配の組み合わせによって、その将来の資本融資需要を満たす。その会社が受け入れ可能な条件で追加的な融資を受けることができるか、あるいは全くできないという保証はない。会社が十分な追加資金を得ることができない場合、会社は支出を削減し、サプライヤーとの支払い期限を延長し、資産を可能な限り清算し、および/または計画を一時停止または削減する計画を迫られる可能性がある。これらの行動のいずれも、会社の業務、経営結果、将来の見通しに実質的な損害を与える可能性がある。
注2-会計政策の概要
予算の使用
公認会計原則に従って合併財務諸表を作成することは、経営陣に合併財務報告金額に影響を与えるインフォームドコンセント、判断と仮定を行うことを要求する
添付の連結財務諸表日までの付記に記載されているレポート及び開示。継続的な基礎の上で、経営陣は最も重要な見積もりと仮定が合理的に継続されているかどうかを評価する。これらの推定および仮定は、多くの予測困難な要因の判断に関連する。異なる仮定または条件では、実際の結果は、添付の総合財務諸表を作成する際に使用される推定数字と大きく異なる可能性がある。
会社の2022年12月31日まで及び2022年12月31日までの総合財務諸表は、インフレ、金利上昇、為替変動と新冠肺炎疫病の影響を含む会社のマクロ経済環境への影響の推定を反映している。これらの状況の持続時間と範囲は予測できない;したがって、これらの状況が会社の業務、運営結果、および財務状況にどの程度直接的または間接的に影響を与えるかも不確定である。当社では、特定のイベントや状況がその推定、判断および仮定を更新する必要があること、または本書類の提出日までの当社の資産または負債の帳簿価値を改訂する必要があることを知りません。
105
現金等価物
現金等価物は通貨市場口座への投資を含む。当社は、購入日の元満期日が3ヶ月以下のすべての高流動性投資を現金等価物と見なし、事前通知や罰金なしに清算することができる。現金等価物は額面あるいはコストで記録され、公正な市場価値に近い。
短期投資
短期投資は関連証券の満期日によって分類される。資産の性質に応じて、当社の短期投資(政府証券)は、売却可能な資産に分類され、貸借対照表の日と同じまたは類似した証券の価格で決定される推定公正価値に入金される。同社の短期投資には公正価値レベルの二次金融商品が含まれている。損益を総合貸借対照表の株主権益内の他の全面的な損失構成要素に計上することを実現していない。他の収入(費用)として付随する総合経営報告書と全面損失表に損益を計上した。証券を売却することができる達成された損益のコストは、特定の識別に基づいて決定される。経営者は、購入時にその投資の適切な分類を決定し、各貸借対照表の日付にこの決定を再評価する。当社は、その投資における信用損失以外の未実現損失と、事件や状況変化が資産の帳簿価値を回収できない可能性があることを定期的に審査しています。帳簿価値が回収できるかどうかを決定する際、管理層は以下の要素を考慮する
同社は$を確認した
各報告日において、会社は、未実現の損失が信用損失によるものであるか否かを決定するために減価評価を行う。“会社”ができた
制限現金
限定現金には、信用証担保としての現金、将来の施設賃貸支払いの担保として、会社銀行の会社クレジットカードが含まれている。制限現金が減少した$
106
下表総合貸借対照表内に報告された現金と現金等価物および制限現金と年度までの総合現金フロー表で報告された金額とを照合する2022年12月31日と2021年12月31日(単位:千)。
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
制限現金 |
|
|
|
|
|
|
||
統合現金フロー表の現金、現金等価物、および制限現金 |
|
$ |
|
|
$ |
|
||
信用リスクその他のリスクと不確定要因が集中している
会社を集中的な信用リスクに直面させる可能性のある金融商品には、主に現金、現金等価物、短期投資、売掛金が含まれる。同社の政策は、米国政府の機関通貨市場基金や有価証券に現金を投資し、信用の開放を制限することだ。同社は現在、現金等価物と通貨市場基金と米国国庫券の短期ポートフォリオを持っている。また,同社はその投資とその満期日の多様化に関するガイドラインを策定し,元本の維持と流動性の最大限の向上を目指している。同社は現金等価物や短期投資で大きな損失は見られなかった。
同社の製品はFDAと外国規制機関の承認を得て、商業販売を開始する必要がある。同社の製品がこれらのすべての必要な承認を得ることは保証されない。このような承認の拒否または延期は、会社の業務に重大な悪影響を及ぼす可能性があり、将来の業務に影響を及ぼす可能性がある。また、FDA承認後も、設備承認中に発生しない有害事象の持続的なリスクが存在する。
同社は、新技術革新、臨床開発リスク、適切なビジネスパートナーシップの構築、ノウハウの保護、政府と環境法規の遵守、同社の製品受容度に対する市場の不確実性、製品責任、追加融資の需要を含む医療機器業界会社と同様のリスクに直面している。
売掛金
売掛金とは、顧客と締結した契約であり、これらの顧客は正常な業務過程で当社の信用を獲得し、信用損失を差し引いて準備する。売掛金は通常領収書を発行してから30日から90日以内に満期になります。同社は外来手術センターを含む顧客が必要なお金を支払うことができないことによる信用損失のための準備金を保留している。信用損失は四半期ごとに計算し、そして売掛金の年齢によって計算する予定であり、その中の売掛金は満期日によって異なるカテゴリに分け、そして各カテゴリに対して歴史損失パーセンテージを適用し、各カテゴリは現在の売掛金構成、取引相手と特定リスク及び現行の経済状況と支持可能な予測経済状況に基づいて調整を行う。売掛金が入金努力が尽きた後に回収できないと考えられると、信用損失準備からログアウトします。当社は顧客の信用品質を密接に監視しており、売掛金の回収を経験したことがありません。同社は一般的に売掛金の担保やその他の保証を必要としない。
同社は多様な顧客群を持っており、2022年12月31日と2021年12月31日までその会社には顧客のいない個人収入の占める割合がそれを超えている
金融商品の公正価値
公正価値は、計量日の市場参加者間の秩序ある取引において、資産の売却または資産または負債の移転の元金または最も有利な市場上の負債のために支払われる価格である。市場や収入やコストと一致した推定方法
107
方法は公正な価値を計量するために用いられる。公正価値階層構造は、公正価値を評価するための評価技術の入力を3つのレベルに分類する
第1レベル-アクティブ市場の未調整オファーのような観察可能な投入は、計量日に同じ制限されない資産または負債を得ることができる。
第2レベル-市場データとの関連により、実質的に全体の資産または負債期間内に、資産または負債に対して直接または間接的に観察可能な投入(第1レベルに含まれる見積を除く)。これらは、市場における同様の資産または負債のオファー、非アクティブ市場における同じまたは同様の資産または負債の見積もり、および評価モデルまたは他の価格設定方法の入力を含み、これらは、モデルで使用される入力、例えば金利および変動率が、容易に観察される市場データによって確認されることができるので、重大な判断を必要としない。
第三段階--1つまたは複数の重大な投入は観察できず、市場活動の支援が少なく、または全くなく、重大な管理判断と仮定の使用を反映している。第3レベルの資産および負債は、その公正価値計量が、定価モデル、割引キャッシュフロー法または同様の推定技術、および重大な経営陣が判断または推定した資産および負債を使用することである。その中には、予想変動率、無リスク金利、期待期限などの入力を用いて公平な市場推定値を決定するブラック·スコアーズオプション定価モデルが含まれている。
資産と負債は,公正価値計測に重要な意味を持つ最低投入レベルによって分類される。当社は報告日ごとに価値階層分類を審査審査します。評価投入の能力の変化を観察することは公正価値階層構造内のある資産或いは負債のレベルの再分類を招く可能性がある。列報年度内に、当社は公正価値計量レベルの間でいかなる資産及び負債移転も行っていません。
これらの資産と負債の短期的な性質のため、現金、現金等価物、売掛金、売掛金はその推定公正価値列帳に記載されている。当社の政府証券に対する短期投資は公正価値に記載されており、公正価値は同一証券の計量日における公開見積市場価格に基づいて決定される。当社は、リース負債及び定期融資の2022年12月31日及び2021年12月31日の公正価値を経営していると考えているこの日までの類似条項までの融資の利用可能な借入金利に基づいて、その帳簿価値を見積もる。
棚卸しをする
在庫には原材料、製品、生産品が含まれている。原材料は同社のレンズ,カートリッジ,LDDSを製造するための化学品と部品からなる。完成品はレンズ、インクカートリッジ、部品、LDDSからなる。在庫はコストまたは現金化可能な純価値の中で低いもので価格を計算します。コストは標準コストを用いて計算され,標準コストは先進的に先行したうえで実コストを近似する.指標が在庫コストが帳簿価値を超えていることを示し、管理層が在庫を現金化可能な値に調整するたびに、在庫の帳簿価値を審査し、潜在的な減値があるかどうかを決定する。完成品と製品におけるコストは、原材料、直接人工、その他の直接コストと関連する生産間接費用からなり、これらのコストが生産された製品の可変純価値を超えない限り。当社は在庫に潜在的な減値があるかどうか、時代遅れ、材料の期限切れや在庫切れや過剰在庫の見積もり損失があるかどうかを定期的に審査し、関連決定を下す際に在庫コストを可変純価値に減記します。可変現価値は正常業務過程中の推定販売価格から完成と処分の推定コストを引いて決定する。
長寿資産
物件及び設備及び賃貸改善は減価償却及び償却後のコストで入金される。財産や設備は一般に関連資産の推定耐用年数内で減価償却される至れり尽くせり
全部業務中のイベントや変化などの状況が1つの資産や資産グループの帳簿価値が未割引の未来に基づいて回収できない可能性があることを示す限り、長期資産の減価審査を行う
108
運営中ですその使用から得られたキャッシュフロー。減値審査をトリガする可能性のある重要な要素は、当期経営損失またはキャッシュフロー損失または経営損失またはキャッシュフロー損失の歴史、および長期資産または資産グループの使用に関連する持続損失または収入不足を示す予測または予測を含む。その他の要素は資産使用方式の重大な変化或いは業界或いは経済傾向の重大な負の影響を含む。この評価は,経営活動の見積もりに基づいて将来のキャッシュフローと関連資産の帳簿価値を割引して行った。割引されていない将来の現金流量が帳簿価値よりも少ない場合、減値損失を確認し、帳簿価値と資産の推定公正価値との差額で測定する。公正価値は主に資産使用による割引キャッシュフローを用いて決定される。予想キャッシュフローを作成する際には、将来の経営業績の予測には大量の経営陣の判断が必要である。
賃貸借証書
リース使用権資産代表会社がリース期間内に対象資産を使用する権利は、リース負債代表会社がリースにより発生したリース金を支払う義務がある。賃貸使用権資産および負債を経営して当社が賃貸物件を引き継ぐ場合(“発効日”)は賃貸期間内の賃貸支払いの現在値で確認します。当社は自身の債務融資コスト、現在の市場金利と見積もりやリースに隠されている金利に基づいて借入金金利を逓増すると推定しています。レンタル使用権資産を経営するには、レンタル開始時または前に支払う任意のレンタル支払いも含まれており、受信されたレンタル報酬は含まれていません。使用権資産および関連賃貸負債を計算するための賃貸条項には、会社が選択権を行使することを合理的に決定する際に、賃貸の選択権を延長または終了することが含まれる。将来予定賃貸料が増加することが知られている取消不可能な賃貸料支出を含め,施行日からの各賃貸契約の期限内に直線法で入金する。賃貸料支出と支払われた賃貸料との差額は、添付された総合貸借対照表に経営賃貸使用権資産の構成要素として入金される。所有者改善手当やその他のようなリースインセンティブ措置は、財産や設備及びリース資産使用権の減少として記録され、直線法で償却され、運営リースコストの減少となる。初期リース期間が12ヶ月以下のリースは発生時に費用を計上し、総合貸借対照表には使用権資産として入金しない。
1株当たり純損失
1株あたりの基本純損失の計算方法は、普通株株主が純損失を当期発行普通株の加重平均シェアで割るべきであり、潜在的な希薄化証券は考慮しない。1株当たり純損失の計算方法は、普通株株主が純損失を在庫株とIF割引法で決定した期間の普通株と潜在希薄化証券の加重平均シェアで割るべきである。1株当たり純損失の算出方法は,純損失を当期に発行された普通株と潜在希薄化証券の加重平均で割ったものである。
以下に発行された潜在的希薄化証券は、在庫株方法における影響が本報告に記載されている間に逆償却されているので、普通株主の1株当たりの純損失の計算には含まれていない
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
Calhoun Visionによると,Inc.2006年株式計画,Calhoun Vision,Inc.2015年持分インセンティブ計画と2021年株式激励計画発行と発行の株式オプション |
|
|
|
|
|
|
||
制限株式単位 |
|
|
|
|
|
|
||
2021年従業員株購入計画によると発売期間中に発行可能な株 |
|
|
|
|
|
|
||
同社の収入は、白内障手術のためのLALと、手術後に必要に応じて水晶体を調整するために、眼に光を伝達するために専門的に設計された機械LDDから来ている。収入確認はアメリカとヨーロッパでの製品販売からです。顧客は主に外来手術センター,病院,開業医診療所から構成されている。
109
約束された商品またはサービスが、会社の予想を反映してこれらの商品およびサービスの対価格の取引価格を顧客に譲渡する権利がある場合、会社は収入を確認する。具体的には,会社は,(I)顧客との契約を決定する,(Ii)契約中の履行義務を決定する,(Iii)取引価格を決定する,(Iv)契約に取引価格を割り当てる履行義務,および(V)会社が契約履行義務を履行する際に収入を確認する,の5つのステップを採用している.会社が顧客に譲渡する商品やサービスと交換するために獲得する権利のある対価格を受け取る可能性が高い場合、会社は5ステップモデルを契約に適用する。契約開始時に、会社は、各顧客契約で約束された貨物を評価して、その製品供給において個別に義務を果たす個別交付可能物として決定し、各約束された貨物またはサービスが異なるかどうかを評価する。取引価格は、予想される対価格、契約手配の規定価値または非契約手配によって徴収される推定現金に基づいて決定される。会社は収入を義務履行時に相応の義務履行に割り当てられた取引価格の金額と確認し,これがある時点または時間とともに発生するかどうかを考慮する。同社は、輸送コストを約束したサービスではなく履行コストとして計算し、顧客から受け取った任意の政府当局に送金された税金を収入から除外することを選択した。
同社のLDD契約には、1つの取引価格で束ねられた複数の履行義務が含まれており、すべての義務は通常1年以内に履行される。これらのバンドル配置については、個別製品およびサービスが異なる場合、すなわち、製品またはサービスがバンドルパッケージ内の他の項目とは別に識別することができ、顧客が個別に利益を得ることができ、または顧客がいつでも利用可能な他のリソースを利用することができる場合、会社は、個別製品およびサービスを別個の履行義務として会計処理することができる。会社のLDD契約は、以下の履行義務の組み合わせを含む:(I)LDD資本資産および関連構成要素、(Ii)訓練および(Iii)設備サービス(最初の年)。この三つの履行義務は違うと考えられている。LDD資本資産は、顧客がそれおよび顧客がいつでも利用可能な他の資源から利益を得ることができるので、独特である。機械使用トレーニングは、LDD設置後に独自の活動として提供され、業界の専門家に最適な実践を提供させ、顧客の特定のニーズに応じてトレーニングをカスタマイズすることによって、顧客が機械を使用する能力を向上させる。各LDDには、予防的メンテナンス、計画外サービス(人工および部品)、ソフトウェア更新が含まれる12ヶ月の製造業者保証(サービス型)があります。1年目以降、サービス契約は単独で購入することができます。会社は収入を製品やサービスの制御権を顧客に移すことで義務履行義務を果たしていることを確認した。具体的には,LDD資本資産の収入は実装時のある時点で確認される.訓練収入もある時点で記録されており,通常は設置後60日である。設備サービスの収入はインストール後に比例して確認します, 普通は12ヶ月です。当社は取引価格が調整後の領収書価格(あれば)を差し引くことを決定しました。単独の履行義務への分配は比較的独立した販売価格に基づいている.独立販売価格は、会社が製品やサービスを単独で販売する観察可能価格に基づいています。同社は市場評価方法を用いて独立販売価格を推定し、この方法は、製品およびサービスの特性および機能、地理的位置、顧客タイプ、および市場状況を含むが、これらに限定されない市場状況と実体固有の要素を考慮している。会社は必要に応じて独立した販売価格を定期的に審査して更新します。
LALは通常委託方式でクライアント地点で保持される.単一の履行義務を履行し,LALを患者に移植したことを顧客に通知した際にLALの収入を確認した。2022年12月31日と2021年12月31日までの年度では、価格表価格の返品やリベートに関するポイントは顕著ではない。
当社は契約を得るために発生した費用を直接支出することを可能にする実際の便宜策を講じており、このような費用の償却は1年以上発生し、ほとんどの会社の契約に適用される。サービス契約の収入は契約期間ごとに比例して確認されます。
110
ここ数年で2022年12月31日および2021年12月31日、会社総合貸借対照表に負債として記録されている販売活動契約負債には、以下の内容が含まれている(千計)
|
|
十二月三十一日までの年度 |
|
|
|||||
|
|
2022 |
|
|
2021 |
|
|
||
|
|
|
|
|
|
|
|
||
期初残高 |
|
$ |
|
|
$ |
|
|
||
期内の新規人数 |
|
|
|
|
|
|
|
||
期内確認の収入 |
|
|
( |
) |
|
|
( |
) |
|
期末残高 |
|
$ |
|
|
$ |
|
|
||
2022年12月31日まで及び2021年12月31日まで年度当社には個別比率を超えるお客様は何もいません
販売コスト
販売コストには、生産会社製品から発生する材料、労働力、製造費用、輸送·運搬コストが含まれる。間接費用には、在庫で計算された報酬を含む品質保証、材料調達、在庫制御、施設、設備、および業務監視および管理の費用が含まれる。販売コストには、特許権使用料や許可料費用など、生産設備の減価償却費用や特定の直接コストも含まれる。
研究と開発費
研究·開発費は発生時に費用を計上する。研究·開発費には,協力者への前期費用とマイルストーン,新製品や技術の研究·開発活動にかかる費用が含まれている。これらの費用には,給与や福祉,株式ベースの報酬,招聘された研究プロジェクトを実行するコンサルタント,臨床試験場所で発生するコスト,FDA上場前承認提出準備に関する規制や製造工程コスト,各種実験室や研究用品,臨床試験や研究目的のための事前承認在庫のログアウト,資本化価値を超える製造プロセス開発コスト,契約研究機関に支払う費用,FDAに関する直接コストが含まれる。同社はまた、終了または終了した計画に関連して行われている臨床試験のコストを計算しなければならず、これらの計画は、その計画の終了または終了を決定する際に将来の経済的利益がない。
株に基づく報酬
会社は、推定付与日に基づいて、従業員、取締役会、およびコンサルタントに付与された持分ベースの報酬の補償費用が、奨励に基づく公正価値に基づいて株式オプション、制限株式単位、および従業員株式計画購入を含むことを確認する。オプション報酬の公正価値はブラック·スコアーズオプション定価モデルを用いて推定し,必要なサービス期間(通常4年)内の総合経営報告書と総合損失表で費用として確認した。当社のサービス条件に基づく持分奨励の株式報酬は、奨励帰属期間中に直線的に償却される。業績条件を有する株式オプションの補償コストは、当該業績条件が満たされる確率に基づいて確認される。付与されていない株式オプション報酬の没収は発生時に費用の減少が確認された。
ブラック·スコアーズオプション定価モデルは、会社の普通株の公平な市場価値、無リスク金利、配当収益率、予想期限、および予想変動率のようないくつかの変数に関する仮定を使用することを必要とする
111
所得税
所得税は貸借対照法で計算される。繰延税項資産及び負債は、既存資産及び負債の帳簿価額及びそれぞれの課税基礎と営業損失及び税項相殺繰越との差額による将来の税額影響を確認する。税金資産及び負債を繰延して税率計量を策定し、その等の一時的な差額を回収又は決済する予定の年度の課税収入に適用されることが予想される。潜在的な繰延税金資産に関連する税金優遇を実現する可能性を評価し、繰延税金資産の全部または一部が現金化できない可能性が高い場合、繰延税金資産を減少させるために推定値を確認する。繰延税金資産と負債は年初と年末に計算される;年度内の繰延税金項目資産、推定準備と繰延税金項目の負債の合計の変化は一般に繰延税金項目の支出または収益であることが確認された。税率変動が繰延税金資産および負債に及ぼす影響は、公布日を含む期間内に総合経営および全面赤字報告書で確認された。
当社の所得税、繰延税金資産、負債準備、繰延税項目純資産計上に対する推定準備を決定する際には、重大な判断が必要である。当社は繰延税金資産が将来の課税所得額から差し引かれる可能性を評価します。評価手当の必要性の評価は、すべての既存のプラスおよび負の証拠を審査することを含む各管轄区域に基づいて行われる。審査の要素は将来の税引き前帳簿収入の予測、恒久的差異後の累計税前帳簿収入の確定、利益歴史と予測の信頼性を含む。繰延税金資産がこれらの日付で現金化されない可能性が高いことを評価した後、同社は2022年12月31日と2021年12月31日までの繰延税金資産推定準備を確認した。
当社は、総合財務諸表で確認された所得税における不確実性を会計評価し、任意の部分収益を総合財務諸表に計上する前に、適切な税務機関の審査を経て、納税状況を維持することが可能かどうかを決定します。税収優遇を維持する“不可能”な税収については、何の税収も確認されない。適用された場合、関連利息と罰金も記録されます。その会社は所有している
112
同社の所得税申告書は計算と仮定に基づいており、これらの計算と仮定は米国国税局や他の税務機関の審査を受けている。また、当社の税務負債を計算する際には、複雑な税務条例の適用における不確定要素の処理に関わる。同社は2段階の手続きに基づいて税務頭寸の負債が確定していないことを確認した。最初のステップは、関連する控訴または訴訟手続きの解決を含む監査において、既存の証拠の重みがその地位が監査においてより維持される可能性が高いことを示すかどうかを決定することによって、確認のために納税状況を評価することである。二番目のステップは、税金優遇を決済後に50%を超える可能性のある最大金額として測定することだ。当社は申告表上の立場が適切に支持されていると信じているが、当社は税務機関審査の潜在的な結果を定期的に評価し、その所得税支出の十分性を決定する。同社は改訂可能な可能性と金額を評価し続け、改正を引き起こした事実が知られている間に所得税の計上、所得税、繰延税金の支払いを調整している。
その会社はアメリカ、イギリス、ドイツ、オランダで連邦と州所得税申告書を提出しなければならない。これらの所得税申告書を作成する際には、会社はこれらの管轄区に適用される税収法律や法規を説明する必要があり、支払われた税額に影響を与える可能性がある。所得税申告表で採用されたか、または予想されて採用された任意の不確定な税務頭寸について、利息および罰金を含む追加の税金負債を推定し、金額を累算しなければならない。より明確な情報が得られた場合、税務頭寸を確定しない課税項目が更新されます。
総合損失
全面赤字のすべての構成要素は、純損失を含めて、確認期間中の連結財務諸表に報告されている。全面損失は、有価証券と外貨換算調整の未実現収益と損失を含む一定期間内に非所有者源の取引やその他の事件や状況によって発生する権益変化と定義されている。
細分化市場を運営する
運営部門は、資源配分決定および業績評価を行うために首席運営決定者が評価することができる離散財務情報の構成要素として定義されている。同社はその業務(その非米国子会社を含む)を経営·管理することを決定した
新興成長型会社の地位
同社は,2012年のJumpStart Our Business Startups ActやJOBS Actの定義に基づく新興成長型会社である。“雇用法案”によると、新興成長型企業は、これらの基準が民間企業に適用されるまで、“雇用法案”公布後に発表された新たなまたは改正された会計基準の採用を延期することができる。当社はこの免除を受け入れないことを撤回できないことを選択しているため、他の非新興成長型会社の公衆会社では、新たなまたは改訂された会計基準の関連発効日にこのような基準を採用しなければならない。
最近の会計公告
GAAPの変更は、財務会計基準委員会(FASB)によって会計基準更新(ASU)の形で決定される。以下に記載されていないASUSは評価後に適用しないことを決定し、あるいは予想が当社の総合財務諸表に与える影響は非常に少ない。
FASBは2020年6月にASU第2020-06号を発表しました“変換および他のオプションを有する債務(特別テーマ470-20)および派生ツールおよびヘッジ--エンティティ自己資本の契約(特別テーマ815-40):エンティティ自己資本の変換可能な手形および契約の会計、” (“ASU変換可能手形の会計処理を簡略化することを目的としている。この新しいガイドラインは埋め込まれた転換特徴を単独で計算する必要があるモードを取り消し、実体自身の持分中の契約を株式分類するいくつかの条件を取り消した。したがって,他に特徴がない限りデリバティブとして区別して確認する必要がある限り,転換可能債務ツールは償却コストに応じて計測された単一負債として入金される.新しいガイドラインは、修正された遡及移行方法または完全に遡及移行方法によって採用することができる。ASU 2020-06は、以下の公共業務エンティティに有効です
113
財政.財政2021年12月15日以降の年度は、これらの財政年度内の移行期間を含む。当社はASU 2020-06を採用し、2022年1月1日から施行され、改正トレーサビリティ法を採用しており、当社の総合財務諸表に大きな影響を与えていません。
付記3--短期投資
短期投資は、主にアメリカの国庫券で、以下の(千計)を含むことができる
|
|
2022年12月31日まで |
|
|||||||||
|
|
原価を償却する |
|
|
未実現損失,純額 |
|
|
公正価値を見積もる |
|
|||
アメリカ国債 |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
2021年12月31日まで |
|
|||||||||
|
|
原価を償却する |
|
|
未実現損失,純額 |
|
|
公正価値を見積もる |
|
|||
アメリカ国債 |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
2022年と2021年12月31日までに保有するすべての売却可能な証券彼は成熟期に達していない
各報告日において、会社は、未実現の損失が信用損失によるものであるか否かを決定するために減価評価を行う。損害は個人の安全レベルで評価される。損失が信用損失或いはその他の要素に由来するかどうかを決定する時、考慮する要素は会社が投資を持ってその余剰コスト基礎が回収されるまでの意図と能力、公正価値が余剰コスト基礎より低い程度、公正価値がコスト基礎より低い時間長と程度、発行者の財務状況、発行者は従来から予定の利息或いは元金を支払うことができなかった、格付け機関の証券格付けに対するいかなる変化、発行者或いは発行者業界に影響する不利な法律或いは監督管理事件、及び経済状況の任意の重大な悪化を含む。
損失の中の信用に関連する部分及びいかなる後続の改善を実現しておらず、信用損失を通じて合併経営報告書に利息支出を計上する準備をしている。信用に関係のない未実現損益は他の総合損失を積算する。2022年12月31日と2021年12月31日まで、売却可能な債務証券の未実現損失は顕著ではなく、主に市場信用利差を含む金利の変化によるものであり、特定の証券に関連する信用リスクの増加によるものではない。また、当社は当該等の投資を売却するつもりはありませんが、当社がその償却コスト基準を回収する前に当該等の投資を売却することを要求される可能性はあまりありません。そのため同社は
注4-在庫
在庫には以下の内容(千計)が含まれている
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
完成品 |
|
$ |
|
|
$ |
|
||
原料.原料 |
|
|
|
|
|
|
||
製品の中で |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減算:超過と時代遅れの在庫準備金 |
|
|
( |
) |
|
|
( |
) |
|
|
$ |
|
|
$ |
|
||
2022年12月31日と2021年12月31日まで、生産品には$
114
注5-財産と装置
財産と設備は以下の部分から構成される(千計)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
機械と設備 |
|
$ |
|
|
$ |
|
||
賃借権改善 |
|
|
|
|
|
|
||
建設中の工事 |
|
|
|
|
|
|
||
コンピュータハードウェアとソフトウェア |
|
|
|
|
|
|
||
生産金型 |
|
|
|
|
|
|
||
家具と固定装置 |
|
|
|
|
|
|
||
設備を使用する |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減算:減価償却累計と償却 |
|
|
( |
) |
|
|
( |
) |
|
|
$ |
|
|
$ |
|
||
“会社記録”$
注6-公正価値計測
以下の表及び開示資料(千計)は、当社の公正価値に応じて恒常的に計量された資産及び負債に関する資料を提供し、当社が当該等の公正価値を特定するための推定技術の公正価値階層を示す。
通貨市場基金は流動性投資であり、取引は活発だ。これらの投資ツールの定価情報は容易に入手でき、計量日に独立して検証することができる。この方法は、これらの証券を公正価値レベルの第1レベルに分類することをもたらす。アメリカ政府証券は第二級投入を使用して公正な価値で計量した。同社は各測定日からこれらの投資の取引活動と定価を検討している。同じ証券の十分な見積が得られない場合、当社は、様々な第三者データプロバイダから取得した類似証券の市場定価や他の観察可能な市場情報を使用する。これらの投入は,活発な市場における類似資産の見積もりを表しているか,あるいはこれらの投入は観察可能な市場データから得られている.この方法は、これらの証券を公正価値レベルの第2レベルに分類することをもたらす。
|
|
2022年12月31日まで |
|
|||||||||
|
|
I級 |
|
|
クラスII |
|
|
合計する |
|
|||
資産: |
|
|
|
|
|
|
|
|
|
|||
貨幣市場証券 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|||
公正な価値で計算された総資産 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
|
|
2021年12月31日まで |
|
|||||||||
|
|
I級 |
|
|
クラスII |
|
|
合計する |
|
|||
資産: |
|
|
|
|
|
|
|
|
|
|||
貨幣市場証券 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
アメリカ国債 |
|
|
|
|
|
|
|
|
|
|||
公正な価値で計算された総資産 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
2021年12月31日までの年間で、Wシリーズ株式承認証は2021年3月31日に満期になり、行使されず、残りの公正価値は$となる
115
当社は2021年7月に初公募を完了した後、すべて
優先株式証の公正価値は管理層によって決定され、そして第三者推定専門家が意見と協力を提供し、確率加重期待リターンモデル/オプション定価モデル(“PWERM/OPM”)混合推定モデルを採用した
“会社”ができた
以下の表は、重大な観察不可能な投入を用いて測定された同社の権証負債の推定公正価値の変化を示す
|
|
現在までの年度 |
|
|
|
|
2021年12月31日 |
|
|
期日の初め |
|
$ |
|
|
優先株式証の行使 |
|
|
( |
) |
普通株式証書の期限が切れる |
|
|
( |
) |
優先株式証の公正価値変動 |
|
|
( |
) |
期末 |
|
$ |
|
|
注7-課税費用およびその他の流動負債
計算すべき費用および他の流動負債には、以下の項目が含まれる(千で計算)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
従業員補償と福祉 |
|
$ |
|
|
$ |
|
||
契約責任 |
|
|
|
|
|
|
||
応算利息 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
注8-定期ローン
当社は2020年10月に融資手配(“定期融資”)を締結し、最初の引き出し金は#ドルとなった
当社は2022年5月3日に定期融資(第2改正案改正)に対して第2改正案(“改正定期融資”)を締結した。改正された定期融資は融資と保証協定を#ドルに増加させる
116
改訂された定期融資は、会社の知的財産権を除くほとんどの個人財産を担保としているが、売掛金、その他の借金、いかなる知的財産権収益も含まれている。当社はまた、担保代理と貸手と負の質権手配を締結し、そのいかなる知的財産権も担保しないことに同意した。改訂後の定期ローンはまた、ある慣例陳述と保証、肯定と否定契約及び違約事件を含み、会社にある最低純売上高の財務業績と計画を実現することを要求する契約を含み、過去12ヶ月で計算する。会社は2022年12月31日と2021年12月31日までにすべての条約を遵守した。
その会社は$を支払った
自分から2022年12月31日、改正された定期融資によると、将来支払うべき年間元本は以下の通り(千単位)
十二月三十一日までの年度 |
|
|
|
|
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
合計する |
|
|
|
|
追加:脱退費用と未償却発行コスト |
|
|
|
|
定期ローン,純額 |
|
$ |
|
|
この年度までに2022年12月31日と2021年12月31日に改訂された定期ローンと定期ローンで支払われる現金利息と実金利は以下の通り
117
|
|
12月31日までの年度 |
|
||||
|
|
2022 |
|
2021 |
|
||
支払現金利息 |
|
|
% |
|
% |
||
実利率 |
|
|
% |
|
% |
||
付記9--株式ベースの報酬費用
会社には三つの持分インセンティブ報酬計画、すなわちCalhoun Vision、Inc.2006株式計画、Calhoun Vision、Inc.2015持分激励計画、2021年株式激励計画(総称して“計画”と呼ばれる)がある。
2006年株式計画
当社の2006年株式計画(“2006年計画”)は最初に当社の取締役会で採択され、2006年に当社の株主の承認を得た。当社は2006年に当社の2015年計画を採択して2015年に終了する予定ですので、2006年計画に基づいて新たな奨励を出すことはありません。しかし、2006年計画は、2006年計画に基づいて以前に授与されていなかった賞の条項や条件を管理し続ける。
2015年株式インセンティブ計画
当社の2015年度株式インセンティブ計画(“2015計画”)は最初に取締役会で採択され、2015年に当社の株主の承認を得た。2015年計画が最近改訂されたのは2021年3月だった。2021年7月に、初の公募が完了した後、2015年計画は“2021年株式激励計画”の発効前に終了し、未来の奨励に関する授与。しかし、2015年計画では、2015年までに2015年計画に基づいて授与されたまだ授与されていない賞の条項や条件を管理し続ける。
2021年株式インセンティブ計画
2021年7月28日、会社“2021年株式インセンティブ計画”(以下、“2021年計画”と略す)は、初公募前に会社の取締役会と株主を経て可決され、発効した。2021年計画では、従業員および任意の付属会社の従業員に奨励的株式オプションを付与し、従業員、取締役およびコンサルタントおよび子会社の従業員およびコンサルタントに非法定株式オプション、株式付加価値権、制限株式、制限株式単位(“RSU”)および業績奨励を付与することを規定する。2021年計画によると、会社が本来発行可能な普通株式数は
常緑樹供給
2021年計画によると発行保留の普通株式数は各財政年度の初日に自動的に増加し、2022年財政年度から、取締役会が2021年計画を承認した日の10周年まで、増加数は少なくとも:(1)に等しい
2021年従業員株購入計画
2021年7月28日、会社取締役会と株主は、2021年従業員株式購入計画(以下、2021年ESPPと略す)を可決し、承認した。2021年の株主特別引出権によると、当社の普通株が本来発行可能な株式数は
2021年ESPPは会社とその子会社の合資格従業員に機会を提供し、以下の購入価格で会社普通株を購入する
118
大体のところ12ヶ月ごとに2ヶ月から6ヶ月の調達期間を提供します:5月1日から10月31日まで、11月1日から4月30日まで。初期購入期間は2021年11月1日から開始される。
常緑樹供給
ESPP計画によると、2021年のESPP計画によると、発行保留の普通株式数は、2022年度から各年度の最初の日に自動的に増加し、増加数は、少なくとも(I)に等しい
株に基づく報酬費用
2021年計画および2021年ESPPの目的は、条件に適合した株式奨励受給者が普通株式価値の増加から利益を得る機会を与え、従業員、取締役会メンバー、コンサルタントのサービスを保持または獲得し、会社の成功を促進し、会社の目標を達成するためのインセンティブを提供することである。
現在と終了年度にこれらの計画に関する株式オプション活動の概要2022年12月31日と2021年12月31日の状況は以下の通り
|
|
オプション数 |
|
|
重みをつける |
|
|
重みをつける |
|
加重平均 |
|
||||
2021年12月31日現在の未返済オプション |
|
|
|
|
$ |
|
|
|
|
$ |
|
||||
授与する |
|
|
|
|
|
|
|
$ |
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|||
没収される |
|
|
( |
) |
|
|
|
|
|
|
|
|
|||
期限が切れる |
|
|
( |
) |
|
|
|
|
|
|
|
|
|||
2022年12月31日までの未返済オプション |
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日から行使可能 |
|
|
|
|
$ |
|
|
|
|
$ |
|
||||
本年度までの限定株式単位活動概要2022年12月31日と2021年12月31日の状況は以下の通り
|
|
|
|
|
重みをつける |
|
||
|
|
|
|
|
平均値 |
|
||
|
|
量 |
|
|
授与日 |
|
||
|
|
株 |
|
|
公正価値 |
|
||
2021年12月31日に帰属していません |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
|
|
||
既得 |
|
|
( |
) |
|
|
|
|
没収される |
|
|
( |
) |
|
|
|
|
2022年12月31日に帰属していない |
|
|
|
|
$ |
|
||
2022年12月31日と2021年12月31日まで付与されたオプションの内在的価値は$である
119
株式報酬費用は、添付されている総合経営報告書と総合収益(損失)で以下のように分類される(千単位)
|
|
12月31日までの12ヶ月間 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
研究開発 |
|
$ |
|
|
$ |
|
||
販売、一般、行政 |
|
|
|
|
|
|
||
販売原価 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
2022年12月31日と2021年12月31日までいくつありますか
2022年12月31日と2021年12月31日までただし,未帰属限定株式単位に関する未確認費用総額は約#ドルである
次の表に、ブラック·スコアーズオプション定価モデルにおける株式オプション公正価値を決定するための範囲と加重平均仮定を示す
|
|
12月31日までの12ヶ月間 |
||||||
|
|
2022 |
|
2021 |
||||
|
|
射程距離 |
|
加重平均 |
|
射程距離 |
|
加重平均 |
予想変動率 |
|
|
|
|
||||
無リスク金利 |
|
|
|
|
||||
予想寿命(年) |
|
|
|
|
||||
期待配当収益率 |
|
|
|
|
||||
付与日公正価値 |
|
$ |
|
$ |
|
$ |
|
$ |
注10-株主資本
棚登録表
2022年8月8日に同社は
120
将来の発行のために保留される普通株式には以下が含まれる
|
|
2022年12月31日 |
|
|
2021年12月31日 |
|
||
株式計画に基づいて発行された株式オプション |
|
|
|
|
|
|
||
制限株式単位 |
|
|
|
|
|
|
||
従業員株購入計画 |
|
|
|
|
|
|
||
後日発売可能な株を市価で発売する(1) |
|
|
|
|
|
— |
|
|
普通株式総株式数を保留する |
|
|
|
|
|
|
||
(1)終値に基づいて#ドルです
注11-所得税
所得税前損失の構成は以下のとおりである(千計)
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
アメリカ税前損失 |
|
$ |
( |
) |
|
$ |
( |
) |
外国の税引き前収入 |
|
|
|
|
|
|
||
所得税前損失 |
|
$ |
( |
) |
|
$ |
( |
) |
年度までの所得税支出2022年12月31日および2021年12月31日には、以下の内容(千単位)が含まれる
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
現在: |
|
|
|
|
|
|
||
連邦制 |
|
$ |
|
|
$ |
|
||
状態.状態 |
|
|
|
|
|
|
||
外国.外国 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
延期: |
|
|
|
|
|
|
||
連邦制 |
|
|
( |
) |
|
|
( |
) |
状態.状態 |
|
|
( |
) |
|
|
( |
) |
外国.外国 |
|
|
|
|
|
|
||
|
|
|
( |
) |
|
|
( |
) |
評価免除額を変更する |
|
|
|
|
|
|
||
所得税費用 |
|
$ |
|
|
$ |
|
||
121
会社の繰延税金純額を構成する重要な構成要素は以下の通り(千計)
|
|
十二月三十一日までの年度 |
|
|||||
繰延税金資産: |
|
2022 |
|
|
2021 |
|
||
純営業損失 |
|
$ |
|
|
$ |
|
||
償却する |
|
|
|
|
|
|
||
R&D支出資本化 |
|
|
|
|
|
|
||
株に基づく報酬 |
|
|
|
|
|
|
||
信用を研究開発する |
|
|
|
|
|
|
||
使用権責任 |
|
|
|
|
|
|
||
減価償却 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
繰延税項目総資産 |
|
|
|
|
|
|
||
減算:推定免税額 |
|
|
( |
) |
|
|
( |
) |
繰延税項目純資産総額 |
|
$ |
|
|
$ |
|
||
繰延税金負債: |
|
|
|
|
|
|
||
使用権資産 |
|
|
( |
) |
|
|
( |
) |
繰延税金負債総額 |
|
|
( |
) |
|
|
( |
) |
繰延税項目純資産 |
|
$ |
|
|
$ |
|
||
所得税準備金と所得税引当金を差し引く前の損失に連邦法定所得税税率を適用して算出した期待所得税の入金計算は以下の通り(千単位)
|
|
2022年12月31日 |
|
|
2021年12月31日 |
|||||||||||
|
|
料率率 |
|
|
金額 |
|
|
料率率 |
|
金額 |
|
|
||||
連邦法定税率で所得税を計上する |
|
|
% |
|
$ |
( |
) |
|
|
% |
$ |
( |
) |
|
||
連邦福祉を差し引いた州税 |
|
|
% |
|
|
( |
) |
|
|
% |
|
( |
) |
|
||
研究開発単位 |
|
|
% |
|
|
( |
) |
|
|
% |
|
( |
) |
|
||
株に基づく報酬 |
|
|
( |
)% |
|
|
|
|
|
( |
)% |
|
|
|
||
他に差し引かれない永久プロジェクト |
|
|
( |
)% |
|
|
|
|
|
% |
|
( |
) |
|
||
期限切れ税種属性 |
|
|
( |
)% |
|
|
|
|
|
( |
)% |
|
|
|
||
他にも |
|
|
% |
|
|
|
|
|
% |
|
( |
) |
|
|||
評価免除額を変更する |
|
|
( |
)% |
|
|
|
|
|
( |
)% |
|
|
|
||
所得税費用 |
|
|
% |
|
|
|
|
|
% |
$ |
|
|
||||
繰延税金資産の大部分を生じる項目の税務影響は主に繰り越しの純営業損失である。当社は、繰延税金資産の回収可能性を評価し、将来、既存の繰延税金資産を使用するために十分な将来課税収入が生じるかどうかを評価するために、すべての利用可能なプラスおよび負の証拠を評価する。すべての証拠の重みによると、営業損失の歴史と、これらの資産を実現するために会社が将来の課税収入を生成する能力が含まれており、このような資産の実現が不確定であるため、繰延税項純資産を相殺するために全額推定準備金が計上されている。同社の見積手当は#ドル増加した
2022年12月31日まで会社には連邦純営業損失がドルに繰り越されています
122
2022年8月16日には企業代替最低税(CAMT)が盛り込まれた“2022年インフレ率低減法案”が署名された。これらの変化は2022年12月31日以降の納税年度に影響を及ぼすだろう。新税は会社に連邦所得税の目的のために2回の単独計算を計算し、新しい最低税額またはその通常の納税義務のうちの大きい1つを支払うことを要求する。同社は、2022年12月31日以降の数年間に会社に影響が出るかどうかを確認するために、同法案の影響を監視する。CAMT法案は会社の総合財務諸表に実質的な影響を与えないと予想される。
2022年8月9日、国内半導体製造の促進と米国の研究活動の奨励を目的とした“2022年有利なインセンティブを創出する半導体(チップ)生産法案”が法律に署名された。この法案は
繰越純営業損失の使用は、1986年に改正された“国税法”(以下、“国税法”)第382節および同様の国の規定によって要求されるように、所有権変更制限が発生した可能性があるか、または将来発生する可能性があるため、重大な年次制限を受ける可能性がある。これらの所有権変更は、将来の課税所得額と税額をそれぞれ相殺するために毎年使用できる純営業損失繰越額を制限する可能性があります。一般的に、“規則”第382条の定義によれば、“所有権変更”とは、3年以内に発生する1回または一連の取引を指し、特定の株主または公衆団体の所有権変更が会社が発行した株式の50ポイントを超えることを意味する。
税収割引総額が確認されていない期初と期末金額(利息や罰金を含まない)の入金は以下の通り(千で計算)
|
|
十二月三十一日までの年度 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
未確認税利期初め残高 |
|
$ |
|
|
$ |
|
||
今年度の税収の増加 |
|
|
|
|
|
|
||
期末残高 |
|
$ |
|
|
$ |
|
||
未確認の税額割引は、確認された場合、推定免税額によって年間有効税率に影響を与えません。同社が確認していない税収割引は繰延税金資産の減少として記録されている。当社は、今後12ヶ月以内に、当社が確認していない税収割引が大きな増加や減少はないと予想しています。推定免税額の存在により、企業は税収割引の将来の変化が会社の実際の税率に影響を与えないことを確認していない。本報告日現在、当社では所得税に関する重大な利息や罰金は発生していません。
その会社はアメリカ連邦と各州の所得税を払わなければならない。2019年から2022年までの連邦納税申告書はまだ審査できますが、2018年から2022年までの州納税申告書は審査を受ける必要があります。訴訟時効が閉鎖された年に生じる繰越属性は、国税局または他の税務機関の審査後に調整することができる。他のすべての州の管轄区域はまだ検討を受けることができる。ここにあります
123
注12-賃貸借契約
その会社は施設と特定の設備の運営と融資リースを持っている。初期リース期間が12ヶ月以下の賃貸契約は総合貸借対照表に計上されていない。経営的リースのレンタル料金はレンタル期間内に直線法で確認します。当社はレンタル料金を確認する際にレンタルと非レンタル部分を統合しません。
同社のレンタルには約3年に及ぶ取消不能な賃貸契約条項があり、その中のいくつかの条項には約15年にわたるレンタル延長の選択権が含まれている。当社はレンタル継続選択権を行使するかどうかを自ら決定することができます。当社は、賃貸料祝祭日、賃貸料上昇条項及び/又はそれを行使できないなどの選択権が経済罰のオプション期間をキャンセルすることを含む、予想レンタル期間内の最低賃貸支払いの賃貸料支出を直線的に確認する。
2022年12月31日まで当社は持っています
2022年4月4日、当社は契約を締結しました
以下の表は、連結貸借対照表内の賃貸残高(単位:千)を示しています
|
|
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
賃貸借証書 |
|
分類する |
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
|
|
|
||
資産 |
|
|
|
|
|
|
|
|
||
運営中です |
|
経営的リース使用権資産 |
|
|
|
|
$ |
|
||
|
財産と設備、純額 |
|
|
|
|
$ |
|
|||
リース資産総額 |
|
|
|
|
|
|
|
|
||
負債.負債 |
|
|
|
|
|
|
|
|
||
現在のところ |
|
|
|
|
|
|
|
|
||
|
賃貸負債 |
|
|
|
|
|
|
|||
|
賃貸負債 |
|
|
|
|
|
|
|||
非電流 |
|
|
|
|
|
|
|
|
||
|
長期賃貸負債 |
|
|
|
|
|
|
|||
|
長期賃貸負債 |
|
|
|
|
|
|
|||
リース総負債 |
|
|
|
$ |
|
|
$ |
|
||
当社のレンタルにおける暗黙的な金利は容易に得られないため、逓増借入金金利は、レンタル開始日に将来のレンタル支払いの現在値を決定する際に得られる情報に基づいて決定される。
124
|
|
|
|
十二月三十一日までの年度 |
|
|||||
レンタル料 |
|
分類する |
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
|
|
|
||
リースコストを経営する |
|
販売コスト |
|
$ |
|
|
$ |
|
||
|
|
研究開発 |
|
|
|
|
|
|
||
|
|
販売、一般、行政 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
融資リースコスト |
|
研究開発 |
|
|
|
|
|
|
||
|
|
販売、一般、行政 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
融資リースコスト |
|
利子支出 |
|
|
|
|
|
|
||
当社の経営および融資リース負債は2022年12月31日、状況は以下の通り(単位:千):
|
|
運営中です |
|
|
金融 |
|
||
十二月三十一日までの年度 |
|
賃貸借証書 |
|
|
賃貸借証書 |
|
||
2023 |
|
$ |
|
|
$ |
|
||
2024 |
|
|
|
|
|
|
||
2025 |
|
|
|
|
|
|
||
2026 |
|
|
|
|
|
|
||
2027 |
|
|
|
|
|
|
||
賃貸支払総額 |
|
|
|
|
|
|
||
差し引く:推定利息 |
|
|
( |
) |
|
|
( |
) |
リース総負債 |
|
$ |
|
|
$ |
|
||
加重平均残存リース期間と加重平均割引率は,当社との現在までの決定に用いられる2022年12月31日と2021年12月31日は:
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
レンタル期間と割引率 |
|
2022 |
|
|
2021 |
|
||
加重平均残存賃貸年限(年) |
|
|
|
|
|
|
||
賃貸借契約を経営する |
|
|
|
|
|
|
||
融資リース |
|
|
|
|
|
|
||
加重平均割引率 |
|
|
|
|
|
|
||
賃貸借契約を経営する |
|
|
% |
|
|
% |
||
融資リース |
|
|
% |
|
|
% |
||
注13-約束およびまたは事項
信用状
当社には2024年9月30日に満期になった予備信用状があり、ある金融機関が発行し、経営リースの必要な保証として保証されている。信用状の総金額は$です
法律事務
当社は、知的財産権、雇用、規制、製品責任および契約事項に関連する訴訟を含むが、これらに限定されない通常の業務プロセス中に出現するいくつかの法的手続きまたは規制事項に時々関与する可能性がある。当該等の訴訟又は事項については、当社は、当該等の訴訟又は事項の発展状況に基づいて、発生する可能性のある問題の可能性及び金額(又は範囲)を定期的に評価する。損失が発生した可能性があり、損失の金額(または範囲)が合理的に推定できると判定された場合、連結財務諸表に負債が計上される。
125
未解決の訴訟や事項に関する不確実性のため、会社は現在、その最終結果を予測することができず、責任が生じていない法的訴訟や規制事項については、不利な結果による可能な損失(または損失範囲)を合理的に推定することはできない。2022年12月31日と2021年12月31日にいくつありますか
付記14-従業員福祉計画
401(K)退職貯蓄計画
同社は、特定の資格要件に適合する従業員に、その指定された行政職員を含む固定拠出金401(K)退職貯蓄計画を維持している。401(K)計画によれば、条件を満たす従業員は、“規則”に規定された限度額内で、401(K)計画に支払うことによって、税引前または税引後(Roth)に基づいて一部の報酬の支払いを延期することを選択することができる。401(K)計画は、“規則”第401(A)および501(A)節の規定に適合することが意図されている。税務条件に適合した退職計画として、401(K)計画の税前納付およびこれらの税前納付の収入は、401(K)計画から分配される前に従業員に納税すべきではなく、Rothが納付した収入は、401(K)計画から分配された場合には課税されない。2021年7月、会社はガンダムの提供を開始した
注15-後続の活動
公開発行する
2023年2月7日、会社はアメリカ銀行証券会社と引受契約を締結し、会社は発行と販売に同意した
ATMサービス
本年度報告Form 10-Kの日までにATMで発売され、共有されています
126
情報技術EM 9.会計及び財務開示面の変更と会計士との相違。
ない。
ITEM 9 Aです。制御とプログラムです
開示制御とプログラムの評価
2022年12月31日現在、我々の経営陣は、最高経営責任者と財務責任者の参加と監督の下で、我々の開示制御および手順を評価している(“取引法”規則13 a-15(E)および15 d-15(E)で定義されている)。この評価に基づき、我々の最高経営責任者および最高財務責任者は、2022年12月31日までに、我々の開示統制および手続きが合理的な保証レベルで有効であると結論した。取引法規則13 a-15(E)および15 d-15(E)に定義されている用語“開示制御および手順”は、取引法に従って提出または提出された報告において開示を要求する会社の情報が米国証券取引委員会規則および表によって指定された期間にわたって記録、処理、集約および報告されることを保証するための会社の制御および他のプログラムを意味する。開示制御および手続は、開示要求に関する決定をタイムリーに行うために、会社が取引所法案に基づいて提出または提出された報告書に開示を要求する情報が蓄積され、会社管理層(その主要幹部および主要財務官を含む)に伝達されることを保証するための制御および手順を含むが、これらに限定されない。経営陣は、どのような制御やプログラムも、どんなに設計や操作が良好であっても、その目標を実現するために合理的な保証を提供することしかできず、管理層は、可能な制御とプログラムの費用対効果関係を評価する際にその判断を運用しなければならないことを認識している。
財務報告の内部統制の変化
2022年12月31日までの四半期内に、財務報告の内部統制(“外国為替法案”規則13 a-15(F)および15 d-15(F)の定義に基づく)に大きな影響を与えなかったか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化はなかった。
制御措置の有効性に対する制限
制御システムの発想や操作がどのように整備されていても,その設計は合理的であるが絶対的な保証ではなく,制御システムの目標が実現されることを確保するためである.また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.すべての制御システムの固有の限界により,どの制御評価もすべての制御問題や不正イベントが発見されたことを絶対に保証することはできない.任意の制御システムの固有の制限により、エラーまたは詐欺によるエラー陳述が発生し、発見されない可能性がある。
財務報告の内部統制に関する経営陣の年次報告
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。我々の財務報告に対する内部統制は、米国が公認している会計原則に基づいて財務報告の信頼性と外部目的の財務諸表作成に合理的な保証を提供することを目的としたプログラムである。その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。したがって,有効と決定されたシステムであっても,その制御目標を実現するために合理的な保証を提供するしかない.最高経営責任者と財務官の参加の下、我々の経営陣は、テレデビル委員会(“COSO”)協賛組織委員会が提出した基準に基づいて、2022年12月31日までの財務報告内部統制の有効性を評価し、この基準は、テレデビル委員会(“COSO”)2013年の内部統制-総合枠組み枠組みに基づいて提案された。このような評価に基づき、我々の経営陣は、COSO枠組み基準に基づいて、2022年12月31日まで、財務報告に対して有効な内部統制を維持していると結論した。
この10-K表の年報には、私たちの公認会計士事務所の財務報告の内部統制に関する認証報告は含まれていません。2002年の“サバンズ-オキシリー法案”第404(B)節の非加速申告者の免除によると、経営陣の報告は私たちの公認会計士事務所の認証を受けません。
127
情報技術EM 9 B。他の情報。
2023年3月2日、我々の取締役会(“取締役会”)は、我々の報酬委員会の提案に基づき、2023年3月1日から、任命された各役員に2023年度の基本給を増加させることを承認した。取締役会は、2023年3月1日から、(I)Eric Weinberg、Ilya Goldshreger、Shelley Thunenのそれぞれの基本給が425,000ドルから460,000ドルに増加し、(Ii)我々の最高経営責任者Ron Kurtzの基本給が575,000ドルから645,000ドルに増加することを承認した。
私たちの取締役会は、2023年3月2日、給与委員会の提案に基づき、任命された幹部一人ひとりに年間目標現金報酬(“2022年現金ボーナス”)を支払うことも承認した。2022年の現金ボーナスは、取引所法案第16 a-1(F)条で定義されているように、取締役会または取締役会が任命した委員会が、取引所法案16 a-1(F)条で定義されているように、当社の役員インセンティブ報酬計画(“総ボーナス計画”)に基づいて発行されます。当該総花紅計画は管理者に機会を提供し、取締役会が決定した予め定められた業績指標に基づいて、現金配当を稼ぐ。取締役会は、参加する幹部ごとの確認性招聘状や招聘状(場合によって決まる)に基づいて、目標ボーナスを年間基本給のパーセンテージとする。2022年末以降、取締役会は私たちの指標実現状況を審査し、実際の支出を確定し、適宜上方または下方に調整することができる。総ボーナス計画によると、取締役会は任命された幹部に、2022年現金ボーナスを承認した:(I)ロン·クルツは2022年現金ボーナス457,566ドル、ボーナス目標は年間基本給の85%、目標達成95.7%;(Ii)Eric Weinbergは2022年現金ボーナス214,042ドル、ボーナス目標は年間基本給の55%、目標達成93.4%。(3)イリヤ·ゴッドスライグは、年間基本給の55%、目標達成の95.7%を目標とした2022年現金賞金219,313ドル、および(4)シェライ·トゥニンから2022年現金賞金223,667ドルを獲得した, ボーナス目標は年間基本給の55%、目標達成の97.6%。取締役会はまた、ウィンバーグ、ゴールドシュレッガー、トゥニンが基本給の55%から基本給の65%に増加し、クルツ博士の年間目標現金報酬を基本給の85%から基本給の90%に増やすことを承認した。
私たちの総ボーナス計画は、取締役会または報酬委員会が取締役会または報酬委員会によって策定した業績目標に基づいて、取締役会または報酬委員会が選択した従業員(我々の役員を含む)に報酬報酬を付与し、通常現金で支払うことを可能にする。私たちの総ボーナス計画によると、私たちの取締役会または報酬委員会は、研究開発、規制マイルストーンまたは規制に関連する目標、毛金利、財務マイルストーン、新製品または業務開発、運営利益率、製品発表スケジュールまたは他の製品特定のマイルストーン、出版物、キャッシュフロー、調達、貯蓄、内部構造、リーダーシップ発展、プロジェクト、機能または投資組合特定のマイルストーン、許可または研究協力協定、融資、初公開公募株準備、同業者評議または他の主観的または客観的基準のような特許性および個人目標。異なる参加者と異なる賞の業績目標が異なる可能性がある。私たちの取締役会または報酬委員会は、私たちの総ボーナス計画を管理し、任意の場合に、参加者の実際の報酬を適宜増加、減少またはキャンセルすることができ、および/または、特定の業績中にボーナスプールに割り当てられた金額を増加、減少またはキャンセルすることができる。実際の報酬は、参加者の目標報酬よりも低いか、または参加者の目標報酬よりも高く、管理者自身が決定することができる。管理者は、その考慮された要因について任意の割り当てまたは重み付けを決定することなく、関連すると考えられる要因に基づいて、任意の増加、減少、またはキャンセルの額を決定することができる。実際の報酬は一般に得られた後にのみ現金(または同値)で支払われる, 管理者が別途決定しない限り、実際の報酬を得るためには、参加者は実際の報酬が支払われる日まで私たちが雇用しなければならない。当社の取締役会または報酬委員会は、当社の当時の持分補償計画に基づいて実際の裁決を終わらせるために持分奨励を付与する権利を保持することができ、当該持分報酬は、帰属を含む当社取締役会または報酬委員会が決定した条項および条件を有する可能性がある。報酬は奨励を受けた後にできるだけ早く支払われるが、私たちの総ボーナス計画に規定された日より遅くない。私たちの取締役会と私たちの報酬委員会は、報酬を受けた任意の参加者の既存の権利を損なわないことを前提として、私たちの総ボーナス計画を修正、一時停止または終了する権利がある。
本開示は、表格8-K第5.02(E)項の下の開示の代わりに、本部分第II部分第9 B項に規定されている。
128
プロジェクト9 Cです。検査を妨害する外国司法管轄区域を開示する。
ない。
129
第三部
情報技術EM 10.取締役、行政者、会社管理。
本プロジェクトが提供を要求する情報は、2022年12月31日までの財政年度から120日以内に米国証券取引委員会に提出された株主年次総会依頼書(以下、委託書と略す)に記載され、引用により本明細書に組み込まれる。
ビジネス行為と道徳的基準
本プロジェクトが提供を要求する情報は、2022年12月31日までの財政年度から120日以内に米国証券取引委員会に提出された株主年次総会依頼書(以下、委託書と略す)に記載され、引用により本明細書に組み込まれる。
私たちの取締役会は、会社のすべての従業員、高級管理者、取締役に適用される商業行為と道徳基準を採択しました。私たちのビジネス行動と道徳基準は投資家関係サイトに掲載されていますHTTPS://Investors.rxsight.com/コーポレート·ガバナンス/ガバナンス-概要。私たちはそのウェブサイトで私たちの商業行為と道徳基準の任意の改正またはその要求に対する免除を公表するつもりだ。
付例を改訂および再制定する
我々が2022年12月9日に米国証券取引委員会に提出した現在の8-K表報告書の5.03項に開示されているように、我々の取締役会は、会社管理·指名委員会の提案に基づいて、私たちの改正と再記述の定款を改訂し、再記述し、直ちに発効した。添付例は、他の事項を除いて改訂および再記載されている
前述の説明は、修正および再作成された付則を参照して全体的に限定され、そのコピーは、2022年12月9日に提出されたForm 8−Kの添付ファイル3.1アーカイブとして添付され、参照によって本明細書に組み込まれている。
情報技術EM 11.役員報酬。
本プロジェクトで要求される情報は、当社の依頼書に含まれる“取締役会および会社管理”および“役員報酬”に含まれる適用情報を参照します。
情報技術EM 12.特定の実益所有者の保証所有権および管理層および関連する株主事項。
本条項によって要求される情報は、当社の委託書に含まれる“特定の利益を受けるすべての人および管理職の保証所有権”に記載された適用情報を参照する。
130
情報技術EM 13.何らかの関係や関連取引,および取締役の独立性.
本プロジェクトで要求される情報は、当社の依頼書に含まれる“何らかの関係および関連者取引”および“取締役会およびコーポレート·ガバナンス”に含まれる適用情報を参照します。
イットM 14.チーフ会計士費用とサービス料。
本プロジェクトに必要な情報は、依頼書に含まれる“承認独立公認会計士事務所”からの適用情報を参照する。
131
第4部
情報技術EM 15.表示と財務諸表明細書
(A)本年度報告の一部として提出された以下の書類を表格10-Kに列挙する:
これらの資料は、財務諸表またはその付記に記載されているので、または本条に従って適用されないか、または必要ではないので、他のすべての添付表は省略されている。
展示品索引
展示品 |
|
引用で編入する |
|||
番号をつける |
説明する |
表 |
書類番号. |
展示品 |
提出日 |
|
|
|
|
|
|
3.1 |
登録者登録証明書の改訂と再予約。 |
10-Q |
001-40690 |
3.1 |
2021年11月10日 |
3.2 |
登録者の付例を改訂して再編成する。 |
8-K |
001-40690 |
3.1 |
2022年12月12日 |
4.1 |
登録者の株式証明書サンプル。 |
S-1/A |
333-257790 |
4.2 |
July 26, 2021 |
4.2 |
普通株説明。 |
10-K |
001-40690 |
4.2 |
March 8, 2022 |
10.1+ |
登録者とその各役員と行政者との間の賠償協定フォーマット。 |
S-1 |
333-257790 |
10.1 |
July 9, 2021 |
10.2+ |
改訂された登録者2015年株式インセンティブ計画とその合意フォーマット。 |
S-1/A |
333-257790 |
10.2 |
July 26, 2021 |
10.3+ |
改正された登録者の2021年株式インセンティブ計画とその合意フォーマット。 |
10-Q |
001-40690 |
10.2 |
2021年11月10日 |
10.4+ |
登録者の2021年従業員の株式購入計画。 |
10-Q |
001-40690 |
10.3 |
2021年11月10日 |
10.5 |
登録者、オックスフォード金融有限責任会社と付表1.1に記載された融資者間の融資と担保協定は、2020年10月29日である。 |
S-1 |
333-257790 |
10.5 |
July 9, 2021 |
10.6 |
登録者、オックスフォード金融有限責任会社と別表1.1に掲げる貸主との間の同意及び第1修正案融資及び担保協定は、2021年7月6日とする。 |
S-1/A |
333-257790 |
10.6 |
July 26, 2021 |
10.7# |
“融資·担保協定第二修正案”、登録者オックスフォード金融有限責任会社を担保代理とし、 |
10-Q |
001-40690 |
10.3 |
May 5, 2022 |
132
|
貸出先は、期日は2022年5月3日。 |
|
|
|
|
10.8# |
登録者とカリフォルニア工科大学との間の許可協定は,2015年7月28日である。 |
S-1 |
333-257790 |
10.6 |
July 9, 2021 |
10.9 |
QAD,Inc.及びその子会社と登録者との間の許可及び保守協定は,日付が2015年10月29日である。 |
S-1 |
333-257790 |
10.8 |
July 9, 2021 |
10.10 |
QADは戦略情報グループと登録者の間で内部プロジェクト提案書を主宰し,日付は2015年10月29日である。 |
S-1 |
333-257790 |
10.9 |
July 9, 2021 |
10.11 |
QAD,Inc.及びその子会社と登録者との間のクラウドサービス協定は,2021年5月28日である。 |
S-1
|
333-257790
|
10.10 |
July 9, 2021 |
10.12 |
登録者とAccuride International Inc.との間の賃貸借契約は、2015年10月27日であり、2015年11月23日の特定第1改正案により改正され、特定賃貸第2改正案、日付は2015年12月22日、特定第3改正案、日付は2016年1月18日、コロンビア100−150号、Suites 100及び200、Aliso Viejo、California 92656に位置する特定の第4改正案。 |
S-1 |
333-257790 |
10.11 |
July 9, 2021 |
10.13 |
太平洋公園投資会社と登録者の間の賃貸契約は、日付は2020年3月27日で、借約はカリフォルニア州アリソヴィエホコロンビア75号、郵便番号:92656にある。 |
S-1 |
333-257790 |
10.12 |
July 9, 2021 |
10.14 |
登録者とClifford D.Downとの間のリースは,日付が2018年1月10日であり,日付が2018年2月22日の特定開始日メモで改訂され,テナントは5 Columbia,Aliso Viejo,California 92656に位置する. |
S-1 |
333-257790 |
10.13 |
July 9, 2021 |
10.15 |
転貸日は2022年4月4日で,登録者とコンパス聖書教会の間の転貸は,5コロンビア,Aliso Viejo,カリフォルニア州92656に位置する。 |
10-Q |
001-40690 |
10.1 |
May 5, 2022 |
10.16 |
テナント付録,日付は2022年4月5日,登録者とClifford D.Downの間のテナント付録は,5 Columbia,Aliso Viejo,California 92656に位置する. |
10-Q |
001-40690 |
10.2 |
May 5, 2022 |
10.17 |
改正案1は、2022年6月8日に登録者とコンパス聖書教会の間で5コロンビア、Aliso Viejo、カリフォルニア州92656にある不動産を分譲する。 |
10-Q |
001-40690 |
10.1 |
2022年8月8日 |
10.18* |
第2号修正案、期日は2023年1月16日、 |
|
|
|
|
133
|
登録者と羅針盤聖書教会堂は5コロンビア、アリソヴィエホ、カリフォルニア州九二六56にあります。 |
|
|
|
|
10.19+ |
登録者とロン?クルツの間の確認性招聘状は、2021年7月8日だった。 |
S-1 |
333-257790 |
10.14 |
July 9, 2021 |
10.20+ |
登録者とシェライ·トゥニンとの確認性招聘状は、日付は2021年7月8日。 |
S-1 |
333-257790 |
10.15 |
July 9, 20211 |
10.21+ |
登録者とエリックWeinbergとの間の確認的雇用書簡は,期日は2021年7月8日である。 |
S-1 |
333-257790 |
10.16 |
July 9, 2021 |
10.22+ |
登録者とイリヤ·ゴッドスライグとの確認性招聘状は、2021年7月8日。 |
S-1 |
333-257790 |
10.17 |
July 9, 2021 |
10.23+ |
登録者とロン?クルツ間の制御とサービス協定の変更は、2021年7月8日。 |
S-1 |
333-257790 |
10.18 |
July 9, 2021 |
10.24+ |
登録者とシェライ·トゥニンとの間の“制御とサービス変更協定”は,2021年7月8日である。 |
S-1 |
333-257790 |
10.19 |
July 9, 2021 |
10.25+ |
登録者とエリックWeinbergとの間の制御とサービスプロトコルの変更は,日付は2021年7月8日である。 |
S-1 |
333-257790 |
10.20 |
July 9, 2021 |
10.26+ |
登録者とイリヤ·ゴッドスライグとの間の“支配権と譲渡協定変更”は、2021年7月8日。 |
S-1 |
333-257790 |
10.21 |
July 9, 2021 |
10.27 |
登録者とYelroc Consulting,Inc.との間の諮問協定は,日付が2019年1月1日であり,2020年12月16日までの諮問協定第1号改正案により改正された。 |
S-1 |
333-257790 |
10.22 |
July 9, 2021 |
10.28 |
登録者とYelrocコンサルティング会社との間の終了合意は,2021年8月3日である。 |
S-1/A |
333-257790 |
10.24 |
July 26, 2021 |
10.29 |
登録者とDaniel·シュワルツ医学博士が締結した諮問協定は、日付は2019年1月1日、日付は2020年12月16日の特定改正案第1号で改正された。 |
S-1 |
333-257790 |
10.23 |
July 9, 2021 |
10.30 |
登録者とDaniel·シュワルツ間の保証全請求権本票の改正と再署名は、2019年4月18日となった。 |
S-1 |
333-257790 |
10.24 |
July 9, 2021 |
134
10.31 |
株式没収·解除協定は、登録者とDaniel·シュワルツが署名し、2021年7月23日となっている。 |
S-1/A |
333-257790 |
10.27 |
July 26, 2021 |
10.32 |
BML Management,LLCと登録者の間のリース,日付は2022年3月7日,借約はカリフォルニア州Aliso Viejo,コロンビア125号,郵便番号:92656である. |
10-K |
001-40690 |
10.28 |
March 8, 2022 |
10.33 |
ATM株発売SM会社と米銀行証券会社との販売協定は、2022年8月8日となっている。 |
S-3 |
333-266651 |
1.2 |
2022年8月8日 |
10.34 |
引受協定は、会社と米銀行証券会社が署名し、期日は2023年2月7日。 |
8-K |
001-40690 |
1.1 |
2023年2月7日 |
10.35* |
役員奨励的報酬計画 |
|
|
|
|
21.1 |
登録者の子会社。 |
10-K |
001-40690 |
21.1 |
March 8, 2022 |
23.1* |
独立公認会計士事務所が同意します。 |
|
|
|
|
31.1* |
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
|
31.2* |
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
|
|
|
32.1 |
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条に規定されている最高経営責任者証明書。 |
|
|
|
|
32.2 |
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による首席財務官の認証。 |
|
|
|
|
101.INS |
連結されたXBRLインスタンス文書−インスタンス文書は、XBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 |
||||
101.書院 |
インラインXBRL分類拡張アーキテクチャ文書. |
||||
101.カール |
インラインXBRL分類拡張はリンクベース文書を計算する. |
||||
101.def |
XBRLソート拡張を連結してLinkbase文書を定義する. |
||||
101.介護会 |
XBRL分類拡張ラベルLinkbase文書を連結する. |
||||
101.Pre |
XBRL分類拡張プレゼンテーションLinkbaseドキュメントを内部接続する. |
||||
135
104 |
カバーインタラクションデータファイル(イントラネットXBRL文書)を埋め込む. |
* |
本局に提出します。 |
|
手紙で提供する。 |
+ |
契約または補償計画または手配を管理することを指す。 |
# |
S-K条例第601(B)(10)項によれば、一部の展示品は省略される。会社は米国証券取引委員会に漏れた部分のコピーを提供することを要求しなければならないことに同意した。 |
項目16.表格10-Kの概要
ない。
136
サイン
改正された1934年証券取引法第13又は15(D)節の要求に基づいて、登録者は、正式に許可された次の署名者がその代表を代表して本報告書に署名することを正式に手配した.
|
|
RxSight,Inc. |
|
|
|
|
|
日付:2023年3月6日 |
|
差出人: |
ロン·クルツ医学博士 |
|
|
|
ロン·クルツ医学博士 |
|
|
|
最高経営責任者 |
|
|
|
(首席行政主任) |
授権依頼書
このような陳述によってすべての人を認識し、以下の署名のすべての人は、ロン·クルツ、医学博士、シェライ·トゥニンをその個人の真実かつ合法的な事実上の受権者として構成し、指定し、その個人の代理人を任意およびすべての身分で完全に置換し、本10-K表年次報告書の任意およびすべての修正案(発効後の修正案を含む)に署名し、それをすべての証拠品および他の関連文書と共に米国証券取引委員会に提出し、事実上上記の権利を付与し、委託書及び代理人は、それに関連するすべての必要及び必要な行為及び事柄を完全に作成及び実行する権利があり、すべての意図及び目的について、本人が可能又は自ら行うことができるように、上記の受託者、委託書及び代理人又は当該個人の代理人が、本条例に従って合法的に又はそれに至るすべてのことを承認及び確認することができる。
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
137
名前.名前 |
|
タイトル |
|
日取り |
|
|
|
|
|
|
|
|
|
|
ロン·クルツ医学博士 |
|
社長と取締役CEO |
|
March 6, 2023 |
ロン·クルツ医学博士 |
|
(首席行政主任) |
|
|
|
|
|
|
|
/s/シェライ·ソニン |
|
首席財務官 |
|
March 6, 2023 |
シェライ·ソニン |
|
(首席財務会計官) |
|
|
|
|
|
|
|
アンディ·コーリー |
|
取締役会議長 |
|
March 6, 2023 |
アンディ·コーリー |
|
|
|
|
|
|
|
|
|
/s/William Link、博士 |
|
役員.取締役 |
|
March 6, 2023 |
ウィリアム·リンク博士です |
|
|
|
|
|
|
|
|
|
/s/Juliet Tammenom Bakker |
|
役員.取締役 |
|
March 6, 2023 |
ジュリエット·タメンノムス·ベック |
|
|
|
|
|
|
|
|
|
/s/ジュリー·アンドレース |
|
役員.取締役 |
|
March 6, 2023 |
ジュリー·アンドレース |
|
|
|
|
|
|
|
|
|
ロバート·彭明盛 |
|
役員.取締役 |
|
March 6, 2023 |
ロバート·彭明盛 |
|
|
|
|
|
|
|
|
|
/s/ロバート·ワーナー |
|
役員.取締役 |
|
March 6, 2023 |
ロバート·ワーナー |
|
|
|
|
|
|
|
|
|
/s/Sheta Singh Maniar |
|
役員.取締役 |
|
March 6, 2023 |
シュヴィータ·シンガー·マニアール |
|
|
|
|
|
|
|
|
|
/s/Tamara R.Fountain,M.D. |
|
役員.取締役 |
|
March 6, 2023 |
タマラ·R·フォンダン医学博士 |
|
|
|
|
|
|
|
|
|
138