10-KHttp://Fasb.org/us-GAAP/2022#その他の負債は現在ではありませんP 3 Y0001531978誤り会計年度Http://Fasb.org/us-GAAP/2022#その他負債P 3 YHttp://Fasb.org/us-GAAP/2022#その他の資産Http://Fasb.org/us-GAAP/2022#その他の負債現在0001531978アメリカ公認会計基準:RevolvingCreditFacilityMembersFNA:MidCapCreditAgreementメンバーUS-GAAP:SecuredOvernightFinancingRateSofrOvernightIndexSwapRateRateメンバー2022-11-092022-11-090001531978米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001531978FNA:SecuredTermLoanFacilityMemberUS-GAAP:SecuredOvernightFinancingRateSofrOvernightIndexSwapRateRateメンバー2022-03-242022-03-240001531978FNA:MidCapCreditAgreementメンバーFNA:MidCapTerm融資メンバーUS-GAAP:SecuredOvernightFinancingRateSofrOvernightIndexSwapRateRateメンバー2022-11-092022-11-090001531978FNA:MidCapTerm融資メンバー2022-12-310001531978SRT:最大メンバ数2022-01-012022-12-310001531978FNA:BankOfIrelandNotePayableMembers2020-06-120001531978FNA:DisiorLtd.メンバー2022-01-100001531978FNA:TwentyElevenOmnibus StockOptionAndAwardPlanAndTwentyTwentyOneIncentiveAwardPlanMember2021-12-310001531978US-GAAP:SettledLitigationMembersアメリカ公認会計基準:副次的事件メンバーFNA:StrykerCorporationのメンバー2023-01-132023-01-130001531978米国-GAAP:販売コストメンバー2022-01-012022-12-310001531978米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2020-01-012020-12-3100015319782020-12-310001531978アメリカ公認会計基準:利息支出メンバーFNA:MidCapCreditAgreementメンバー2020-01-012020-12-310001531978SRT:最大メンバ数FNA:TwentyTwentyOneIncentiveAwardPlanMember2021-10-190001531978US-GAAP:クライアント関係メンバSRT:最小メンバ数2021-01-012021-12-310001531978SRT:最小メンバ数米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:前払いメンバーを保留2020-01-012020-12-310001531978SRT:最大メンバ数FNA:EmployeStockPurche ePlanMember2021-10-190001531978US-GAAP:ロンドン銀行間同業借り換え金利LIBORメンバーFNA:MidCapCreditAgreementメンバーFNA:MidCapTerm融資メンバー2021-05-062021-05-060001531978US-GAAP:AdditionalPaidInCapitalMembers2020-01-012020-12-310001531978US-GAAP:クライアント関係メンバSRT:最小メンバ数2022-01-012022-12-310001531978米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001531978アメリカ-公認会計基準:業界名メンバーFNA:DisiorLtd.メンバー2022-01-012022-12-310001531978FNA:ライセンス契約メンバーSRT:役員メンバー2022-01-012022-12-310001531978FNA:ライセンス契約メンバーSRT:役員メンバー2021-01-012021-12-310001531978US-GAAP:SettledLitigationMembersFNA:StrykerCorporationのメンバーFNA:SettlementInstallmentTwoMember2022-11-282022-11-280001531978アメリカ公認会計基準:利息支出メンバーFNA:MidCapCreditAgreementメンバー2021-01-012021-12-310001531978FNA:MidCapCreditAgreementメンバー2021-05-060001531978米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001531978FNA:DisiorLtd.メンバー2020-01-012020-12-310001531978FNA:AmendedAndRestatedLoanAgreementメンバー2020-03-272020-03-270001531978米国-GAAP:国内/地域メンバー2021-12-310001531978US-GAAP:クライアント関係メンバSRT:最大メンバ数2022-01-012022-12-310001531978アメリカ-GAAP:機械とデバイスのメンバー2022-01-012022-12-310001531978米国-GAAP:特許メンバー2022-01-012022-12-310001531978アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001531978US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001531978FNA:外科器具のメンバー2021-12-310001531978アメリカ公認会計基準:副次的事件メンバー2023-01-302023-01-300001531978US-GAAP:SettledLitigationMembersFNA:StrykerCorporationのメンバー2022-11-282022-11-280001531978US-GAAP:ComputerEquipmentMembers2022-01-012022-12-310001531978FNA:ライセンス契約メンバーSRT:役員メンバー2020-01-012020-12-310001531978US-GAAP:SettledLitigationMembersFNA:SettlementInstallmentThreeMemberFNA:StrykerCorporationのメンバー2022-11-282022-11-280001531978国:アメリカ2021-01-012021-12-310001531978アメリカ公認会計基準:負債メンバーを計算すべき2022-01-012022-12-310001531978米国-公認会計基準:従業員株式オプションメンバーFNA:ある従業員と請負業者のメンバーは2022-01-012022-12-310001531978FNA:付加整形外科LLCMメンバー米国-GAAP:技術的権利の発達したメンバー2022-01-012022-12-310001531978FNA:MidCapCreditAgreementメンバーFNA:TermLoanFirstCommentMembers2021-05-060001531978米国-GAAP:国内/地域メンバー2021-01-012021-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー米国-GAAP:IPOメンバー2021-10-192021-10-190001531978FNA:EmployeStockPurche ePlanMember2020-01-012020-12-310001531978FNA:BankOfIrelandNotePayableMidcapTerm LoanAndZion sFacilityMembers2022-12-310001531978SRT:最大メンバ数米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001531978FNA:SecuredTermLoanFacilityMember2020-01-012020-12-310001531978アメリカ-アメリカ公認会計基準:建設中のメンバー2021-12-310001531978FNA:SecuredTermLoanFacilityMember2021-01-012021-12-310001531978SRT:最大メンバ数米国-公認会計基準:従業員株式オプションメンバー2020-01-012020-12-310001531978FNA:ある従業員役員と請負業者のメンバーはFNA:時間ベースの株式オプションメンバー2022-01-012022-12-310001531978US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001531978FNA:BankOfIrelandNotePayableMembers2022-01-012022-12-310001531978アメリカ-公認会計基準:会計基準更新201912メンバー2022-12-310001531978米国-GAAP:特許メンバー2021-01-012021-12-310001531978米国-GAAP:制限株式単位RSUメンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:本土メンバー2022-12-310001531978SRT:最小メンバ数2022-01-012022-12-310001531978アメリカ公認会計基準:その他無形資産メンバー2021-01-012021-12-310001531978米国-公認会計基準:従業員株式オプションメンバー2020-01-012020-12-310001531978US-GAAP:ComputerEquipmentMembers2022-12-310001531978FNA:付加整形外科LLCMメンバー2021-05-280001531978アメリカ-アメリカ公認会計基準:普通株式メンバーアメリカ公認会計基準:副次的事件メンバー2023-01-302023-01-300001531978FNA:TermLoanSecond委員会のメンバーFNA:MidCapCreditAgreementメンバー2021-05-060001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001531978FNA:ライセンス契約メンバーSRT:役員メンバー2021-12-310001531978米国-公認会計原則:商標メンバー2022-12-310001531978US-GAAP:SettledLitigationMembersFNA:StrykerCorporationのメンバー2022-01-012022-12-310001531978US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001531978FNA:他のメンバー2022-12-310001531978アメリカ公認会計基準:利息支出メンバーFNA:MidCapCreditAgreementメンバー2022-01-012022-12-3100015319782021-12-310001531978アメリカ公認会計基準:超過割当オプションメンバーSRT:最大メンバ数アメリカ公認会計基準:副次的事件メンバー2023-01-302023-01-300001531978FNA:ユダヤ人国家連盟のメンバー2022-12-310001531978FNA:SeriesBConvertiblePferredStockMember2020-07-310001531978アメリカ-公認会計基準:販売一般と管理費用メンバー2021-01-012021-12-310001531978米国-GAAP:特許メンバー2021-12-310001531978FNA:ライセンス契約メンバーSRT:役員メンバー2022-12-310001531978アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001531978アメリカ-GAAP:機械とデバイスのメンバー2021-12-310001531978アメリカ-GAAP:非アメリカのメンバー2021-12-310001531978米国-公認会計基準:従業員株式オプションメンバーFNA:ある従業員と請負業者のメンバーは2020-01-012020-12-310001531978米国-公認会計基準:財務省株式構成員2020-12-310001531978FNA:SecuredTermLoanFacilityMember2022-01-012022-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー米国-GAAP:IPOメンバー2021-10-190001531978アメリカ-公認会計基準:州と地方法律法規のメンバー2022-12-310001531978SRT:最小メンバ数米国-公認会計基準:従業員株式オプションメンバー2020-01-012020-12-310001531978米国-GAAP:国内/地域メンバー2022-01-012022-12-310001531978米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2022-01-012022-12-310001531978米国-GAAP:特許メンバー2022-01-012022-12-3100015319782020-01-012020-12-310001531978FNA:一部の従業員や請負業者のメンバーはFNA:時間ベースの株式オプションメンバー2022-12-310001531978FNA:DisiorLtd.メンバー2022-01-102022-01-100001531978米国-GAAP:IPOメンバー2021-01-012021-12-3100015319782019-12-310001531978US-GAAP:AdditionalPaidInCapitalMembers米国-GAAP:IPOメンバー2021-01-012021-12-310001531978米国-GAAP:会計基準更新201613メンバー2022-12-310001531978US-GAAP:ComputerEquipmentMembers2021-12-310001531978FNA:付加整形外科LLCMメンバー2021-05-282021-05-280001531978米国-GAAP:制限株式単位RSUメンバー2022-12-310001531978SRT:最小メンバ数アメリカ-GAAP:OfficeEquipmentMembers2022-01-012022-12-310001531978アメリカ-公認会計基準:リース改善メンバー2022-12-310001531978アメリカ-公認会計基準:第一選択株式メンバーFNA:SeriesBConvertiblePferredStockMember2021-01-012021-12-310001531978SRT:シーン先に報告されたメンバFNA:DisiorLtd.メンバー2022-01-1000015319782021-10-080001531978国:アメリカ2022-01-012022-12-310001531978FNA:TwentyTwentyOneIncentiveAwardPlanMember2022-12-310001531978SRT:最小メンバ数FNA:外科器具のメンバー2022-01-012022-12-310001531978国:アメリカ2021-12-310001531978US-GAAP:SettledLitigationMembersFNA:SettlementInstallmentOneMemberFNA:StrykerCorporationのメンバー2022-11-282022-11-280001531978アメリカ公認会計基準:その他無形資産メンバー2022-01-012022-12-310001531978アメリカ-公認会計基準:第一選択株式メンバーFNA:SeriesBConvertiblePferredStockMember2020-01-012020-12-310001531978アメリカ-公認会計基準:会計基準更新201602メンバー2022-12-310001531978アメリカ公認会計基準:副次的事件メンバーアメリカ-アメリカ公認会計基準:普通株式メンバーFNA:Second darySharesMember2023-01-302023-01-300001531978US-GAAP:AdditionalPaidInCapitalMembers2019-12-310001531978FNA:SecuredTermLoanFacilityMember2022-11-102022-11-100001531978US-GAAP:クライアント関係メンバFNA:付加整形外科LLCMメンバー2022-01-012022-12-310001531978米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2021-12-310001531978FNA:TwentyElevenOmnibus StockOptionAndAwardPlanAndTwentyTwentyOneIncentiveAwardPlanMember2022-01-012022-12-310001531978米国-公認会計原則:商標メンバー2021-12-310001531978米国-GAAP:特許メンバー2022-12-310001531978FNA:TwentyTwentyOneIncentiveAwardPlanMember2022-01-012022-12-310001531978SRT:最大メンバ数米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2022-01-012022-12-310001531978アメリカ公認会計原則:他の総合収入メンバーを累計2020-01-012020-12-310001531978US-GAAP:非競争プロトコルメンバFNA:付加整形外科LLCMメンバー2022-01-012022-12-310001531978アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001531978アメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-3100015319782020-04-072020-04-070001531978US-GAAP:ロンドン銀行間同業借り換え金利LIBORメンバーアメリカ公認会計基準:RevolvingCreditFacilityMembersFNA:MidCapCreditAgreementメンバー2022-11-092022-11-090001531978FNA:SeriesBConvertiblePferredStockMember2020-01-012020-12-310001531978米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001531978FNA:SecuredTermLoanFacilityMember2022-03-240001531978米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2021-01-012021-12-310001531978SRT:最小メンバ数米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2022-01-012022-12-310001531978米国-GAAP:技術的権利の発達したメンバー2022-12-310001531978米国-公認会計基準:財務省株式構成員2019-12-310001531978FNA:SeriesAConvertiblePferredStockMember2012-02-012012-02-290001531978FNA:PrimarySharesMemberアメリカ公認会計基準:副次的事件メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2023-01-302023-01-300001531978米国-GAAP:販売コストメンバー2021-01-012021-12-310001531978FNA:SeriesAConvertiblePferredStockMemberアメリカ-アメリカ公認会計基準:普通株式メンバー米国-GAAP:IPOメンバー2021-10-190001531978FNA:MidCapCreditAgreementメンバー2022-12-310001531978アメリカ-公認会計基準:リース改善メンバー2022-01-012022-12-310001531978FNA:MidCapCreditAgreementメンバーFNA:MidCapTerm融資メンバー2021-05-060001531978FNA:一部の従業員や請負業者のメンバーはFNA:時間ベースの株式オプションメンバー2022-01-012022-12-310001531978FNA:SeriesAConvertiblePferredStockMember2012-11-300001531978アメリカ公認会計基準:その他無形資産メンバー2021-12-3100015319782021-01-012021-12-310001531978アメリカ公認会計基準:RevolvingCreditFacilityMembersFNA:MidCapCreditAgreementメンバー2021-05-062021-05-060001531978米国-公認会計基準:従業員株式オプションメンバー2022-12-310001531978米国-GAAP:技術的権利の発達したメンバーFNA:DisiorLtd.メンバー2022-01-012022-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001531978FNA:EmployeStockPurche ePlanMember2021-10-190001531978アメリカ-公認会計基準:外国人メンバー2022-01-012022-12-310001531978アメリカ公認会計基準:超過割当オプションメンバーアメリカ-アメリカ公認会計基準:普通株式メンバーアメリカ公認会計基準:副次的事件メンバー2023-01-302023-01-300001531978SRT:最大メンバ数FNA:外科器具のメンバー2022-01-012022-12-310001531978FNA:TermLoanMemberFNA:DisiorLtd.メンバー2022-01-102022-01-1000015319782022-06-300001531978FNA:DisiorLtd.メンバー2021-01-012021-12-310001531978SRT:最大メンバ数アメリカ-GAAP:OfficeEquipmentMembers2022-01-012022-12-310001531978FNA:SeriesBConvertiblePferredStockMember2020-01-012020-12-310001531978米国-公認会計基準:従業員株式オプションメンバーFNA:ある従業員と請負業者のメンバーは2020-12-310001531978FNA:TwentyTwentyOneIncentiveAwardPlanMember2021-10-192021-10-190001531978米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:販売一般と管理費用メンバー2022-01-012022-12-310001531978US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001531978米国-公認会計基準:財務省株式構成員2022-12-310001531978FNA:ある従業員役員と請負業者のメンバーはFNA:時間ベースの株式オプションメンバー2021-12-310001531978アメリカ-公認会計基準:州と地方法律法規のメンバー2022-01-012022-12-310001531978アメリカ公認会計基準:その他無形資産メンバー2022-12-310001531978FNA:VectraTermLoanFacilityMembers2022-12-3100015319782023-02-270001531978アメリカ-アメリカ公認会計基準:建設中のメンバー2022-12-310001531978アメリカ-GAAP:非アメリカのメンバー2022-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー米国-GAAP:IPOメンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:第一選択株式メンバーFNA:SeriesAConvertiblePferredStockMember2020-12-310001531978アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001531978アメリカ-公認会計基準:販売一般と管理費用メンバーFNA:付加整形外科LLCMメンバー2021-01-012021-12-310001531978FNA:MidCapTerm融資メンバー2021-12-310001531978米国-GAAP:技術的権利の発達したメンバー2022-01-012022-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバーアメリカ公認会計基準:副次的事件メンバー2023-01-3000015319782022-12-310001531978米国-公認会計基準:財務省株式構成員2020-01-012020-12-310001531978FNA:BankOfIrelandNotePayableMembers2021-12-310001531978FNA:EmployeStockPurche ePlanMember2022-12-310001531978米国-GAAP:国内/地域メンバー2022-12-310001531978アメリカ公認会計基準:副次的事件メンバーFNA:Second darySharesMember2023-01-302023-01-300001531978アメリカ-GAAP:機械とデバイスのメンバー2022-12-310001531978アメリカ公認会計基準:RevolvingCreditFacilityMembersFNA:MidCapCreditAgreementメンバー2021-05-060001531978アメリカ-公認会計基準:前払いメンバーを保留2019-12-310001531978FNA:他のメンバー2022-01-012022-12-310001531978国:アメリカ2022-12-3100015319782021-10-082021-10-080001531978FNA:SeriesAConvertiblePferredStockMember2011-12-310001531978FNA:SeriesAConvertiblePferredStockMember2012-02-290001531978FNA:SecuredTermLoanFacilityMember2022-03-242022-03-240001531978アメリカ-GAAP:OfficeEquipmentMembers2021-12-310001531978SRT:メンバの再調整FNA:DisiorLtd.メンバー2022-01-100001531978アメリカ-GAAP:OfficeEquipmentMembers2022-12-310001531978アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001531978アメリカ-公認会計基準:販売一般と管理費用メンバーFNA:DisiorLtd.メンバー2022-01-012022-12-310001531978FNA:SeriesBConvertiblePferredStockMember2021-10-190001531978アメリカ公認会計原則:他の総合収入メンバーを累計2019-12-310001531978FNA:TwentyTwentyRevolvingLoanMembersFNA:2,200件の融資期限メンバー2020-03-270001531978FNA:AmendedAndRestatedLoanAgreementメンバーFNA:2,200件の融資期限メンバー2020-03-270001531978米国-公認会計基準:財務省株式構成員2021-01-012021-12-310001531978アメリカ-公認会計基準:本土メンバー2022-01-012022-12-310001531978FNA:外科器具のメンバー2022-12-310001531978アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001531978FNA:EmployeStockPurche ePlanMember2021-10-192021-10-190001531978米国-GAAP:制限株式単位RSUメンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:第一選択株式メンバーFNA:SeriesAConvertiblePferredStockMember2021-01-012021-12-310001531978FNA:EmployeStockPurche ePlanMember2022-01-012022-12-310001531978FNA:TwentyElevenOmnibus StockOptionAndAwardPlanAndTwentyTwentyOneIncentiveAwardPlanMember2022-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001531978US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001531978アメリカ公認会計基準:RevolvingCreditFacilityMembersFNA:MidCapCreditAgreementメンバー2022-11-090001531978米国-GAAP:制限株式単位RSUメンバーFNA:TwentyTwentyOneIncentiveAwardPlanMember2022-12-310001531978アメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2019-12-310001531978FNA:TwentyElevenOmnibus StockOptionAndAwardPlanAndTwentyTwentyOneIncentiveAwardPlanMember2021-01-012021-12-310001531978FNA:SeriesBConvertiblePferredStockMemberアメリカ-アメリカ公認会計基準:普通株式メンバー米国-GAAP:IPOメンバー2021-10-190001531978FNA:SeriesAConvertiblePferredStockMember2012-11-012012-11-300001531978アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001531978US-GAAP:クライアント関係メンバSRT:最大メンバ数2021-01-012021-12-310001531978FNA:ある従業員役員と請負業者のメンバーはFNA:時間ベースの株式オプションメンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:第一選択株式メンバーFNA:SeriesBConvertiblePferredStockMember2020-12-310001531978アメリカ公認会計基準:超過割当オプションメンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-10-192021-10-190001531978アメリカ-公認会計基準:リース改善メンバー2021-12-310001531978FNA:MidCapCreditAgreementメンバーFNA:MidCapTerm融資メンバー2021-05-062021-05-060001531978FNA:BankOfIrelandNotePayableMembers2022-12-310001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001531978アメリカ-GAAP:BuildingMembers2022-01-012022-12-310001531978FNA:AmendedAndRestatedLoanAgreementメンバー2020-03-270001531978アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001531978FNA:EmployeStockPurche ePlanMember2021-01-012021-12-310001531978FNA:SeriesBConvertiblePferredStockMember2020-07-012020-07-310001531978アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-3100015319782022-01-012022-12-310001531978アメリカ-公認会計基準:第一選択株式メンバーFNA:SeriesAConvertiblePferredStockMember2019-12-310001531978アメリカ-GAAP:BuildingMembers2022-12-310001531978アメリカ-アメリカ公認会計基準:建設中のメンバー2022-01-012022-12-310001531978SRT:メンバの再調整FNA:DisiorLtd.メンバー2022-01-102022-01-100001531978FNA:SeriesAConvertiblePferredStockMember2020-01-012020-12-310001531978米国-GAAP:制限株式単位RSUメンバー2020-01-012020-12-310001531978FNA:特許と商標のメンバー2022-01-012022-12-310001531978アメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310001531978FNA:BankOfIrelandNotePayableMembers2020-06-112020-06-120001531978国:アメリカ2020-01-012020-12-310001531978FNA:DisiorLtd.メンバー2022-01-012022-12-310001531978US-GAAP:クライアント関係メンバ2021-12-310001531978アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001531978FNA:付加整形外科LLCMメンバー2022-01-012022-12-310001531978米国-GAAP:販売コストメンバー2020-01-012020-12-310001531978FNA:年間支払閾値メンバーFNA:ライセンス契約メンバーSRT:最小メンバ数SRT:役員メンバー2022-12-310001531978米国-GAAP:技術的権利の発達したメンバー2021-01-012021-12-310001531978US-GAAP:ロンドン銀行間同業借り換え金利LIBORメンバーアメリカ公認会計基準:RevolvingCreditFacilityMembersFNA:MidCapCreditAgreementメンバー2021-05-062021-05-060001531978アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001531978アメリカ-公認会計基準:外国人メンバー2022-12-310001531978米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001531978FNA:EmployeStockPurche ePlanMember2022-01-012022-12-310001531978US-GAAP:クライアント関係メンバ2022-12-310001531978FNA:SeriesAConvertiblePferredStockMember2011-12-012011-12-310001531978アメリカ-公認会計基準:販売一般と管理費用メンバー2020-01-012020-12-310001531978米国-公認会計基準:財務省株式構成員2021-12-310001531978米国-GAAP:技術的権利の発達したメンバー2021-12-31Xbrli:純FNA:お客様Xbrli:共有FNA:国/地域ISO 4217:ドル
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表10-K
(マーク1)
|
|
☒ |
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2022
あるいは…。
|
|
☐ |
1934年証券取引法第13条又は15(D)条に基づいて提出された |
手数料書類番号001-40902
Paragon 28,Inc.
(登録者の正確な氏名はその定款に記載)
|
|
デラウェア州 |
27-3170186 |
(明またはその他の司法管轄権 会社や組織) |
(税務署の雇用主 識別番号) |
草原大通り14445号 エンゲルウッド, 会社 |
80112 |
(主にオフィスアドレスを実行) |
(郵便番号) |
登録者の電話番号、市外局番を含む:(720) 912-1332
同法第12条(B)に基づいて登録された証券:
|
|
|
|
|
クラスごとのタイトル |
|
取引コード |
|
登録された各取引所の名称 |
普通株は、1株当たり0.01ドルです |
|
FNA |
|
♪the the theニューヨーク証券取引所 |
同法第12条(G)により登録された証券:なし
登録者が証券法第405条に規定する有名な経験豊富な発行者である場合は、再選択マークで表示してください。はい。☐違います。 ☒
登録者がこの法第13又は15(D)条に従って報告書を提出する必要がないか否かを、再選択マークで示す。はい。☐違います。 ☒
登録者が(1)過去12ヶ月以内(または登録者がそのような報告を提出する必要があるより短い期間)に1934年の証券取引法第13条または15(D)条に提出されたすべての報告書を再選択マークで示すかどうか、および(2)このような提出要求を過去90日以内に遵守してきたはい、そうです ☒ No ☐
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうです ☒ No ☐
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
|
|
|
|
|
|
大型加速ファイルサーバ |
|
☐ |
|
ファイルマネージャを加速する |
|
☒ |
非加速ファイルサーバ |
|
☐ |
|
規模の小さい報告会社 |
|
☐ |
新興成長型会社 |
|
☒ |
|
|
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する☐
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる☐
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意のエンタルピーCER幹部が関連する回復期間中に§240.10 D−1(B)に基づいて受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、違います☒.
登録者非関連会社が保有する投票権と無投票権普通株の総時価は、2022年6月30日のニューヨーク証券取引所における普通株の終値に基づいている$として520.9百万ドルです。
2023年2月27日現在、登録者の普通株流通株数は88,218,207.
引用で編入された書類
登録者は,2022年12月31日までの財政年度終了後120日以内に第14 A条に基づいて最終委託書を提出する予定であるそれは.この最終依頼書の部分内容は,本年度報告の表格10−Kの第III部分に引用的に組み込まれている。
前向き陳述に関する特別説明
このForm 10-K年次報告書には、重大なリスクと不確定要因に関する私たちと私たちの産業に関する前向きな陳述が含まれている。本Form 10-K年度報告に含まれる歴史的事実の陳述を除いて、他のすべての陳述は、私たちの戦略、将来の財務状況、将来の運営、予想コスト、見通し、計画、管理目標、および予想市場成長に関する陳述を含み、すべて前向きな陳述である。場合によっては、“目標”、“予想”、“仮定”、“信じ”、“考慮”、“継続”、“可能”、“設計”、“満了”、“推定”、“予想”、“目標”、“意図”、“可能”、“目標”、“計画”、“位置”、“潜在”、“予測”、“求める”などの用語によって識別することができる。“すべき”、“目標”、“将”、“将”および他の同様の表現は、未来のイベントおよび将来の傾向の予測または指示、またはこれらの用語または他の同様の用語の否定である。これらの前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
•私たちの総目標市場の推定と市場動向に対する私たちの期待
•私たちの製品、技術(Smart 28を含む)、およびビジネスのビジネスモデルおよび戦略計画は、私たちの実施を含む
•私たちの製品はビジネス成功と市場認識度を得ることができます
•私たちは競争力のある会社と技術と私たちの業界全体に期待している
•持続的な新冠肺炎の大流行或いはアメリカ或いは全世界の他の任意の大流行、流行病或いは伝染病の爆発が私たちの業務、財務状況と経営業績に与える影響;
•私たちは私たちのビジネス組織を拡大し、既存と新しい顧客への販売を増加させることで、私たちの業務を管理し、発展させることができます
•私たちは政府と第三者支払者の保証範囲と精算への期待を持っている
•十分な品質で十分な量の製品を生産することができます
•私たちの製品に対する顧客の需要を正確に予測し、私たちの在庫を管理することができます
•私たちは私たちの製品のために知的財産権保護を確立し、維持したり、未来の侵害クレームを避けることができます
•FDAまたは米国または医療産業に影響を与える米国または外国の規制行動は、米国の医療改革措置を含む
•インフレ、金利、全体的な経済状況と不確実性の変化を含む様々なマクロ経済事件
•私たちはキーパーソンの能力を採用して維持しています
•私たちは将来発行される可能性のある株で追加融資を受ける能力があります
•私たちはさらなる臨床試験や臨床研究を行う予定です
•私たちはニューヨーク証券取引所の広範な要求とアメリカと国際の法律と政府規則を遵守します
•私たちは雇用法案に基づいて新興成長型会社になる時期への期待を持っている
これらの展望性陳述は主に私たちの現在の未来の事件と財務傾向に対する予想、推定、予測と予測に基づいており、私たちはこれらの事件と財務傾向は私たちの財務状況、経営結果、業務戦略と財務需要に影響を与える可能性があると考えている。これらの展望性陳述に重大な不確定性が存在することを考慮して、あなたは未来の事件の予測として展望性陳述に依存してはならない。本年度報告の10-K表に含まれる各前向き陳述には合理的な基礎があると考えられるが、前向き陳述に反映された将来の結果、活動レベル、業績または事件および状況が実現または根本的に発生しないことは保証されない。我々の実際の結果と前向き陳述で明示または示唆された結果とが大きく異なる可能性のある重要な要因に関する議論は,“リスク要因要約”と“リスク要因”の部分を参照されたい。しかも、もし私たちの展望的な陳述が不正確であることが証明されたら、この不正確さは実質的である可能性がある。法的要求がない限り、私たちは新しい情報、未来の事件、または他の理由でも、いかなる前向きな陳述も公開更新する義務はない。
あなたはこのForm 10-K年次報告書と私たちがForm 10-K年次報告書で引用した文書を読み、これらの文書は証拠として完全にアーカイブされており、私たちの将来の実際の結果は私たちが予想していたものと大きく異なる可能性があることを理解しなければなりません。我々は,これらの警告的声明により,本年度報告の10-K表中のすべての前向き陳述を限定した.
リスク要因の概要
次に,我々の証券投資にリスクや投機的な最も重大なリスクを持たせることをまとめた.以下のいずれかのリスクが発生または持続的に存在すれば、私たちの業務、財務状況、経営結果は重大な悪影響を受ける可能性があり、私たちの普通株価格は大幅に下落する可能性がある。本要約は“リスク要因”と題する部分とともに読むべきであり,我々が直面している重大なリスクの詳細な要約とすべきではない
•もし私たちが私たちの成長を効果的に管理できなければ、私たちの業務は実質的な悪影響を受けるかもしれない。
•私たちの融資協定条項は、私たちがいくつかの経営と財務契約を遵守し、私たちの経営と財務柔軟性に制限を加えることを要求する。もし私たちが債務融資を通じて追加資本を調達すれば、どんな新しい債務の条項も私たちが業務を運営する能力をさらに制限するかもしれない。
•必要であれば、許容可能な条項で追加資本を得ることができないかもしれない(もしあれば)。
•私たちの業務計画は私たちの製品の市場に対するいくつかの仮定に依存している;しかし、私たちの目標市場の規模と期待成長は正確に決定されておらず、私たちが推定したものよりも小さいかもしれない。たとえ目標市場が私たちが推定したほど大きくても、私たちはもっと多くの市場シェアを奪うことができないかもしれない。
•私たちの業務は病院、医者と患者の私たちの製品に対する広範な採用に依存しています。
•私たちは競争の激しいビジネス環境で経営していますが、既存または潜在的な競争相手と競争できなければ、私たちの業務、財務状況、経営結果は不利な影響を受ける可能性があります。
•私たちの業務の季節性は私たちの四半期の収入の差をもたらして、私たちの財務業績を比較したり予測したりすることは難しいです。
•私たちの長期的な成長は私たちの製品を適時に改善し、私たちの適応を拡大し、より多くの製品を開発と商業化できるかどうかにかかっている。もし私たちが革新できなければ、私たちは新製品をタイムリーに開発したり利用したりして競争力を維持することができないかもしれない。
•特定の製品または適応を追求するために限られた資源がかかる可能性があり、より利益または成功の可能性の高い製品または適応を利用することはできない
•私たちは製品責任クレームのリスクに直面しており、これは費用が高く、経営陣の注意を分散させ、私たちの名声と業務を損なう可能性がある。私たちは十分な製品責任保険を維持できないかもしれない。
•業界動向は、医療サービスや製品の価格下振れ圧力を増大させ、現在の業務戦略を支援するために必要な価格で製品を販売する能力に影響を与える可能性がある。
•私たちの製品を入手または維持することができない場合、または私たちが商業化を求める可能性のある任意の未来の製品の手続きの第三者支払者が提供する保険または十分な精算レベルが得られなければ、足首の専門家および患者は私たちの製品を使用したくない可能性があり、私たちの業務は影響を受けるだろう。
•私たちは、当社の足首製品を構成するすべての要素を生産および包装するために第三者契約製造業者およびサプライヤー(その中のいくつかは単一源)に依存しており、これらのサプライヤーおよび製造業者が私たち、私たちの製品またはそのコンポーネントまたはサブコンポーネントに十分な数量または全く供給を供給できない場合、私たちの業務、財務状況、および運営結果に実質的な悪影響を与えるだろう。
•もし私たちまたは私たちのライセンス者が私たちの製品のために重要な特許や他の知的財産権保護を獲得して維持することができない場合、あるいは私たちの特許や他の知的財産権の範囲が十分に広くなく、私たちの製品を十分に保護できない場合、私たちの競争相手は私たちと類似または同じ製品を開発し、商業化する可能性があり、私たちは著しい市場シェアを得ることができず、利益を上げて私たちの業務を運営することができないかもしれない。
•私たちは多くの政府によって規制されており、これは私たちの業務に実質的な悪影響を及ぼすかもしれない。
•私たちの経営業績にかかわらず、私たちの普通株の市場価格は大幅に変動したり低下したりする可能性があり、これはあなたの一部または全部の投資損失を招く可能性があります
•もし私たちが財務報告書に対して適切かつ有効な内部統制を維持できなければ、私たちが正確かつ適時に財務諸表を作成する能力は損害を受ける可能性があり、これは私たちの経営業績、投資家の私たちに対する見方を損なう可能性があり、それによって私たちの普通株の価値を損なう可能性がある
カタログ表
|
|
|
|
|
ページ |
第1部 |
|
|
第1項。 |
業務.業務 |
2 |
第1 A項。 |
リスク要因 |
39 |
項目1 B。 |
未解決従業員意見 |
86 |
第二項です。 |
属性 |
86 |
第三項です。 |
法律訴訟 |
86 |
第四項です。 |
炭鉱安全情報開示 |
87 |
|
|
|
第II部 |
|
|
五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
88 |
第六項です。 |
[保留されている] |
89 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
90 |
第七A項。 |
市場リスクの定量的·定性的開示について |
102 |
第八項です。 |
財務諸表と補足データ |
103 |
第九項です。 |
会計と財務情報開示の変更と相違 |
133 |
第9条。 |
制御とプログラム |
133 |
プロジェクト9 B。 |
その他の情報 |
134 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
134 |
|
|
|
第三部 |
|
|
第10項。 |
役員·幹部と会社の管理 |
135 |
第十一項。 |
役員報酬 |
135 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
135 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
135 |
14項です。 |
チーフ会計士費用とサービス |
135 |
|
|
|
第4部 |
|
|
第十五項。 |
展示品と財務諸表の付表 |
136 |
第十六項。 |
表格10-Kの概要 |
138 |
第1部
プロジェクト1.ビジネス
概要
私たちは最先端の医療機器会社で、足部と足首整形外科市場に集中し、患者の生活改善に取り組んでいます。著者らの革新的な整形外科解決方案、プログラム方法と器械は各種の足部と足首疾患をカバーし、骨折固定、前足或いは親指外反を含む--母嚢炎とハンマー足指、足首、平足或いは漸進性陥没性足部奇形(PCFD)、シャコット足部と整形生物を含む。これらの苦痛、虚弱、さらには生命を脅かす疾患を治療するために、手術用インプラントおよび使い捨てデバイス、ならびに手術器具を含む包括的な解決策の組み合わせを提供する。2022年12月31日まで、私たちの広範な外科的解決キットは、各患者および手術の特定の需要を満たすのを助けるために、約9,200個のSKUを含む75個の製品システムを含む。著者らは私たちのすべての製品を設計する時に患者と外科医を考慮し、結果を改善し、疾病の再発と合併症の発生率を減少させ、そしてプログラムをもっと簡単で、一致と重複できるようにすることを目標とした。私たちは足と足首市場に対する情熱、専門知識と独占的な集中は私たちが患者と医者の需要をもっとよく理解することができて、これは私たちが革新と増強の解決策を創造し、足と足首市場を転覆し、変えることができると信じている。したがって、私たちの業務は著しい成長と勢いを経験した。
2022年には,足部や足首手術のための外科用インプラントやデバイスの世界市場は約46億ドルであり,毎年約7%のペースで増加し,2026年には約60億ドルに達し,整形外科領域で最も成長が速い市場であると予想される。アメリカは依然として足部と足首手術の最大の市場であり、2022年には世界市場の約55%を占め、私たちの最大の製品販売市場でもある。私たちの世界の足首市場の推定は内部と第三者データに基づいている。著者らは足部と足首市場が人口高齢化、肥満と糖尿病の発病率の増加、及びより広範な患者群がより積極的な生活方式を追求する願望を含む全体的な傾向から利益を得ることを予想している。専門化への関心の高まりや患者の予後改善技術の進歩に伴い,足部や足首市場の増加が加速する可能性も考えられる。
足首市場は若く、比較的に新しい外科専門であり、少数の老舗会社が主導し、これらの会社はより広範な医療機器と整形外科市場で業務を展開している。限られた数の市場参加者の整形外科への広範な関心が緩やかな技術やプログラムの進歩を招いたのは,以下の理由によるものと考えられる
•足部と足首疾患を治療する臨床教育、理解と一致する技術は限られている
•専門的で臨床に集中した販売チームが不足しています
著者らは足部と足首に集中することによって市場を覆し、変化させ、差別化された高品質の整形外科解決策、先進的なプログラム方法と器械を開発と商業化することに力を入れており、これらはすべて共同設計であり、外科医師が一致、重複可能かつ有効な結果を提供できるようにすることを目的としている。私たちの発展戦略はこのプログラムのすべての側面を統合し、インプラント以外の支援システムの強化を求めている。インプラントおよび器具に対する有意義な改善および専門的な設計、ならびに強化された手術技術および臨床支援を含む、特定のプログラムのための解決策を開発する。我々は公正で臨床的、研究優先的な方法で新製品を開発し、破壊的な技術を開発することができる。私たちの各システムは、患者の結果を改善し、結果の再現性を増加させるとともに、外科医に手術全体にわたって強化されたユーザ体験を提供することを目的としている。著者らはこのような革新と進歩を医学教育と結合し、著者らの組織内の外科医、患者と利益関係者を支持するとともに、臨床に集中した販売チームを通じて私たちの製品を渡した。
2
著者らは足部と足首手術システムとプログラム技術の全面的な製品の組み合わせを開発し、足部と足首で手術を行う必要がある多くの情況を解決し、骨折固定を含む;前足或いは親指外反-親指とハンマー足指を含む;足首;PCFD或いは平足;Charcot Foot;及び正生物を含む。各システムは、一般に、多くの鋼板、ねじ釘、先進的な関節および骨代替物、正骨生物学的製剤、および他のインプラント器具および使い捨て装置を含む。我々が人道主義的機器免除(HDE)の許可によって発売された全距骨アイソレータに加えて,我々が販売している製品は,米国食品医薬品局(FDA)から特定の適応のためのクラスII医療機器の承認を得るか,一般的な整形外科用途のためのIクラス免除のための医療機器である。三種類の医療機器製品はありません。設立以来、私たちは約6,800個のインプラント、1,400個の機器、および1,000個の使い捨ておよび他のSKUを含む75個の製品システム、約9,200個のSKUを設計して販売しました。私たちの製品は患者の解剖と外科需要を最大限に満たすために、様々なサイズと構成が選択できます。
設立以来、私たちはすでに多くの重要な技術革新と新製品を発売し、これらの革新と製品は私たちの業界の現状を推進し、挑戦してきた。したがって、私たちの多くの解決策は先に市場に投入された。私たちは足と足首の手術解決策の組み合わせを拡大し、推進し、次世代製品を市場に投入することに力を入れている。
私たちの製品の組み合わせ以外に、著者らはSmart 28を用いて、人工知能、データ分析、患者特定アルゴリズム、3-Dモデリングとその他のイネーブル技術などの先進技術を利用することにより、足部と足首治療の各方面に対して近代的な改造と改善を行った。Smart 28により,患者の結果やプログラムの再現性をさらに改善し,患者が治療を得る機会を増加させることを目標としている。我々のSmart 28技術は,術前計画,術中支援,術後評価を提供することにより,われわれの解決策の組み合わせにまたがることが予想される。
私たちの開発プロセスは私たちの情熱と約束によって推進され、私たちは患者の結末を改善し、手術効率を創造するための製品の設計に取り組んでいる。私たちは尊敬業の設計と開発エンジニアチームを持っていて、彼らは私たちが持続的な革新を推進する研究理念と協力システムを体現して、私たちは私たちが利用して迅速に顧客フィードバックに応答して、新しい概念と製品の反復の開発を推進することができるようにした。これらの措置は、2011年以来、2022年に発売された10の製品ラインを含む75近くの製品ラインを発表し、迅速かつ持続的に製品セットを拡大するのを助けてくれた。私たちは現在25種類以上の製品とシステムが開発中で、ほとんどの製品とシステムは今後24ヶ月以内に商業的に使用されると予想されています。私たちはまた、最近Additive OrthopedicsやDisior Oyを買収したなど、許可プロトコルとプラグイン買収によって私たちの製品を強化しました。
私たちは販売、マーケティング、医学教育からなる有力なビジネス組織を構築するために大量の資源を投入した。私たちの創業と臨床志向の文化は私たちにリードした販売チームを創立させて、2022年12月31日までに、234人のアメリカ販売代表がいると信じています。私たちは生産型販売代表を四半期ごとのすべての3ヶ月間に少なくとも1つのケースの収入を記録する販売代表と定義する。私たちのアメリカ販売チームは主に独立した販売代表で構成されていますが、その多くは専任販売代表です。2022年の間、私たちのアメリカでのほとんどの収入は私たちの生産販売代表によって作られました。私たちは2016年末にアメリカ以外の地域で販売を開始した。2022年12月31日現在、私たちは22カ国で私たちの製品を販売し、2022年には、私たちの国際業務は約13%の収入に貢献しました。私たちはアメリカでも国際的にも、既存と新しい地域で市場シェアを占め続ける重要な機会を持っていると信じている。
私たちのビジネス拡張と私たちの解決策の臨床的利益に対する認識を支持するために、私たちは私たちのインフラおよび教育と訓練計画に多くの投資を行った。私たちは今まで数千人の外科医と他の専門家たちを訓練してきた。私たちは本部で250人の講堂と40の職場の身体実験室を含む複数の訓練プロジェクトを提供し、毎年5000人以上の訓練が可能であり、また、地域的なプロジェクトや仮想シンポジウムも提供しています。私たちの教育と訓練計画の広さは、私たちがより大規模な外科医や他の利害関係者集団に合わせることができ、時間と場所において極めて大きな柔軟性を持っている。
3
成功要因
私たちは以下の成功要素が患者の体験と結果を改善する使命に重要であり、私たちの持続的な成功と成長の重要な要素になると信じている
膨大、絶えず増加と未発達の足首市場は、大量の満足されていない臨床需要がある。
2022年には,足部や足首手術用インプラントやデバイスの世界市場は約46億ドルであり,毎年約7%のペースで増加し,2026年には60億ドルに達し,整形外科領域で最も成長が速い市場であると予想される。アメリカは依然として足部と足首手術の最大の市場であり、2022年には世界市場の約55%を占め、私たちの最大の製品販売市場でもある。私たちの世界の足首市場の推定は内部と第三者データに基づいている。技術の進歩及び足部と足首疾患に対する日々の関心と専門化に伴い、足部と足首市場の増加は加速する可能性があると信じている。著者らはまた、足部と足首市場は人口高齢化、肥満と糖尿病発病率の増加、及びより広範な患者群がより積極的な生活様式を追求する願望を含む全体的な傾向から利益を得ることを予想している。
著者らの市場は医療器械とインプラントから構成され、約6つの核心カテゴリと条件に関連し、骨折固定、前足或いは親指外反を含む--親指とハンマー指、足首、PCFD或いは平足、夏科特足部と整形生物製剤を含み、これらの製品の多くのサプライヤーにおける浸透率はそれぞれ異なる。そのほか、この市場は軟組織、運動医学、矯正生物製剤と分析解決方案から構成され、これらのサブカテゴリのそれぞれをカバーしている。現在の製品があまり理想的でない患者結果を提供していることは,解剖学的特定の技術や定義の技術が不足しているため,足部や足首内の広範な適応にさらに拡張·浸透する大きな機会があると信じている。また,より良い臨床結果や外科医体験を推進するために必要な革新が不足していると考えられる。有意義な研究,データ分析,人工知能に後押しされて,新技術はより高いプログラム成功率を招き,プログラム量の増加を促す可能性が予想される.
足と足首市場を独占的に注目して深く理解する。
我々は2010年にParagon 28を設立し,足部や足首市場に特化した会社として,我々の多くのライバルのように資源を分散させ,複数の整形外科適応に集中している。わが社の名前は、“Paragon”は卓越または完璧なモデルであり、“28”は人の足の骨の数であることを表している。我々の目標は,この専門を再発明する革新的な技術やプログラムを導入することにより,患者の予後を改善することである。著者らは足部と足首に対する情熱、専門知識と独占的な集中は患者と医者の需要を深く理解することができ、これは広範な革新と増強の解決方案を推進したと信じている。このような足と足首への奉仕は私たちの成功に重要な役割を果たしている。
包括的な製品の組み合わせを持つ全体的な解決策提供者。
著者らは足部と足首市場に広範かつ全面的な手術解決策の組み合わせを提供した。我々の各製品は患者や医師を中心に設計されており,全過程で強化されたユーザ体験を提供するとともに,患者結果を改善し,結果の再現性を増加させる。我々の現在の製品組合せは75個の製品システムから構成されており,各適応に顕著な深さを提供している。2022年12月31日まで、私たちは401件の発表または申請されている特許が私たちの製品の組み合わせをカバーしています。私たちの現在のインプラントキットは鋼板、鋼板システム、ねじ釘、釘、釘と整形生物製品を含みます。他の先進的な技術解決策の中で、著者らは著者らの医師に一連の術前計画と術中支援システムを提供し、レーザー位置合わせツール、患者専用器械、および他の医師の体験を改善し、プログラムの効率を向上させることを目的とした先進的な技術解決策を含む。2011年以来、私たちは製品の組み合わせを迅速かつ持続的に拡大し、2022年に発売された9つの製品ラインを含む80近くの製品ラインを発売した。また、2021年6月にAdditive Orthopedicsの資産を買収し、2022年第1四半期にDisior Oyを買収することを含むライセンス契約とプラグイン買収によって私たちの製品を強化しました。
深い臨床専門知識。
著者らの臨床専門知識は著者らが足部と足首手術看護標準を高めることに成功した基礎である。私たちは患者と医師の特定の需要を理解し、新しい解決策の開発を助けるために大量の時間と資源を投入した。我々は偏りのない,臨床,研究優先の方法で我々のポートフォリオにおける新製品を開発し,破壊的技術を開発することができた。我々の使命を支援するために,異なる経験と教育背景を持つチームを構築し,最も前向きであると考えられる足部と足首の専門家との協力関係を構築し,様々な適応に触れた。足部や足首コミュニティのすべての利害関係者との協力は製品の進歩に重要であり,この分野の破壊者としての成功の推進力であると信じている。
4
医学教育に力を入れる。
私たちは私たちの患者と外科医に全面的な教育経験を提供するために努力している。私たちの利害関係者を支援するために、現場教育や訓練のために250人の講堂と40職場の身体操作実験室を建てた。本社が提供する教育や訓練の機会に加え、幅広い地域的なプロジェクトや仮想シンポジウムを開発し、提供しています。私たちの教育と訓練計画の広さは、私たちがより大規模な外科医と販売者グループに合わせることができ、アメリカと国際的に極めて大きな時間と場所の柔軟性を持っている。私たちが設立して以来、何千人もの外科医と利害関係者が私たちの教育と訓練課程に参加して、現場と私たちの他のサービスを通じて。
独自の洞察力を利用した大規模な研究開発チーム。
私たちは55人の開発エンジニアからなる巨大で壮大な敬業チームを持ち、思想のリードする足と足首の専門家、第三者開発専門家と協力し、私たちの使命を前進させている。我々の強力な研究開発チームは,既存のプログラムや製品を再考するとともに,足首障害の打破を求めている。私たちは新しい概念と製品の反復の発展を推進するために、顧客フィードバックに利用し、迅速に応答できるように、協力文化とシステムを発展させた。
成長と価値創造を示しています
2015年から2022年まで、私たちは37%の収入複合年間成長率を推進した。2022年、私たちの収入は23%増加し、1兆814億ドルに達した。我々の目標は引き続き新製品とリードする医学教育計画の発売、流通ルートの拡大、マーケティング計画と的確な業務開発活動を通じて収入増加を推進することである。私たちは財政担当の文化を維持するつもりで、このような文化の中で、私たちはこれらの成長計画を推進するためにどのように資源を配置し、どのように選択しているのか。
私たちの成長戦略は
私たちが使命を達成し持続的な成長を推進する戦略的レバレッジは
結果をさらに改善し、私たちの潜在市場を拡大するために研究開発に投資し続ける。
私たちは新製品の開発と商業化に深い歴史を持っている。プログラムを重視した製品開発方法を維持しようとしており,2022年12月31日までに25件を超えるプロジェクトが進行中であり,その大部分が今後24カ月以内に開始されると予想される。私たちの能力は、510(K)承認およびHDEを含む一連の規制経路にわたる製品を開発することができます。私たちはまたAdditive Orthopedicsの資産を買収し、2022年第1四半期にDisiorを買収することによって、私たちの製品の組み合わせとSmart 28製品を拡大し、これは術前計画、術中支持と術後評価を支持する技術生態系である。Additiveがあり、著者らは承認されたHDEアプリケーションによって発売された唯一の3 D印刷の患者専用全距骨スペーサ、及び専用の術前手術計画プラットフォームを獲得した。Disiorのおかげで,フィンランドヘルシンキのリーディング3次元分析術前計画ソフトウェア会社を買収した。これらの取引は,術前と術中足部と足首の連続看護段階におけるわれわれの能力を拡大し,潜在的にアドレス指定可能な患者総数を拡大した。私たちはSmart 28に引き続き投資する予定だ。
私たちのSmart 28計画を利用することによって、足首手術経験と臨床結果を向上させ、それによって足首市場を変化させる。
Smart 28は著者らのイニシアティブであり、人工知能、データ分析、患者特定アルゴリズム、3-Dモデリングとその他のイネーブル技術などの先進技術を利用して、足部と足首治療のあらゆる面を改善する。私たちはこの計画の需要と方向を詳しく説明する業界専門家チームを結成し続けていくつもりだ。Smart 28計画の一部として、我々は現在、3 D印刷技術の独自の解決策およびプラットフォーム、3 Dモデリングソフトウェア、患者固有のガイドおよびインプラントおよびレーザ位置合わせツール、ならびに私たちが完全に有効にするエンドツーエンドクラウドベースのインフラおよびAIプラットフォームを含むいくつかの革新的な技術を提供している。このプラットフォームを用いた各プログラムのデータ点の収集に伴い,これらの分析ツールは,筋骨格系や周囲軟部組織への影響を矯正する情報など,改良されつつあると信じている。このような反復的なデータ駆動の改善は手術結果の改善をもたらすと信じている。
市場シェアを奪取するために、世界的に私たちの商業インフラに投資し続けている。
私たちのアメリカでのビジネスの足跡は全50州に及んでいる。私たちの製品はまだ22カ国·地域で商業販売されており、これらの国と地域はより多くの成長機会があると予想されています。アメリカでは約2400人の整形外科医が
5
世界保健機関の足部と足首専門医は約2 300名,足部と足首を治療する小児科と創傷外科医は約2 300名,足部外科医は約9,000名であり,その約半分が足部と足首手術を行っている。著者らは引き続き大量の資源を臨床とプログラム訓練及び著者らの商業組織の発展に投入し、著者らの外科医の顧客に質の高い病例支持を提供する。新しい医者に製品を販売し、医師の既存の解決策と新しい解決策の利用を増やすことによって、私たちは現在のアメリカと国際での売上を増加させる機会があると信じています。しかも、私たちはアメリカでの私たちの販売組織とネットワークを拡大し続ける予定だ。私たちはまた、私たちのグローバルネットワークの拡大に集中しており、規模や機会などの要因の評価に基づいて、既存と選定された新しい国際市場での販売足跡を拡大しています。
医学教育と的確なマーケティング活動を推進する。
我々は,さらにコミュニティに幸福をもたらし,外科医にツールや知識を与え,臨床結果の改善を推進するための最先端の計画や施設を開発した。私たちはこのような計画と施設を利用して私たちの解決策の意識を効果的に広める計画だ。私たちの顧客に的確な医学教育コースを提供し、私たちの顧客に私たちの製品に関する持続的な教育を提供し、新しい手術方法を教えることを目的とした対面と仮想授業、シンポジウム、データベースの授業を作成しました。私たちの臨床教育方法は結果を誘導し、強力なデータ支持があり、これは私たちがより正確かつ定量化可能な情報とフィードバックを通じてより広範なコミュニティの信頼を得ることができると信じている。私たちは教育の進歩に対する私たちの関心が足首市場と私たちの業務の全体的な成長に役立つと信じている。足部や足首療法の患者教育にも取り組み,直接患者向けマーケティングに資源を投入している。私たちの計画や施設のほかに、ソーシャルメディア活動や会議展覧会など、患者の意識を高めるための幅広いツールを持っています。私たちは私たちの広範な授業と訓練機会、そして患者に対する方向性の普及を通じて、私たちの臨床教育への関心は私たちの解決策と製品の持続的な採用を推進すると信じている。
業務発展の機会を積極的に評価して探す。
私たちは戦略的パートナーシップの構築に成功し、新しい解決策とプラットフォームを買収し、これらの解決策とプラットフォームは私たちの核心業務と高度に補完している。最近、私たちは許可されたHDEアプリケーションによって発売された唯一のTotal Talus Spacer、およびいくつかの先進技術を含むAdditive Orthopedicsの資産の買収と統合に成功し、私たちのSmart 28生態系に利益を得た。また,2022年第1四半期にDisiorを買収することにより,フィンランドヘルシンキのリーディング3次元分析術前計画ソフトウェア会社を買収した。これらの取引は,術前と術中足部と足首の連続看護段階におけるわれわれの能力を拡大し,潜在的にアドレス指定可能な患者総数を拡大した。私たちは私たちの解決策の組み合わせと流通ルートを強化するために、ターゲットを絞った外部機会を探し続けるつもりだ。私たちの業務発展方法は高度に自律的で、顧客に新しい方法と先進的な技術をもたらすことに集中して、それによって医者により良い体験をもたらし、私たちの患者にもっと良い結果をもたらす。足部や足首市場の臨床結果を改善する使命と一致した企業やチームのパートナーや買収者として有利な立場にあると信じている。
私たちの業界は
足と足首は複雑な構造であり,30個の骨を含み,その中には足だけで28個,34関節と100個以上の腱,筋肉,靭帯からなるネットワークがある。多くの足部と足首問題は手術せずに成功的に解決できるが、多くの問題も長期に存在する痛み、奇形或いは疾病組織の矯正を解決するために手術干与が必要である。米国では、足や足首の状態を解決するプログラムは、通常、以下の手順で実行される
•足と足首を治療する小児科と創傷外科医約2300人と
•アメリカには約9000人の外科足科医師がいる;アメリカの約半分の外科足科医師は足部と足首手術を行っている
足部および足首手術で使用される製品は、一般に、ネジ、ワイヤおよび釘、鋼板、釘、固定器、釘、関節インプラント、軟組織インプラントおよび整形生物製剤を含む。道具の多様性に加え,足部や足首疾患を治療する方法も様々である。道具や治療法の多様性は,足部や足首手術の複雑さを増加させ,患者の結果の違いを増加させていると考えられる。
6
足と足首市場の定義には次のような治療があります
|
|
|
|
|
|
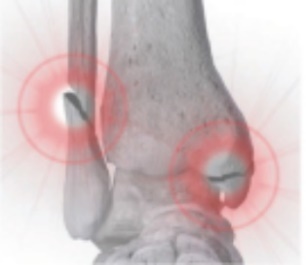
骨折固定 |
|
|
|
(足首骨折は図のように
(上図) |
条件:骨折、または骨切断は、怪我または過使用(応力性骨折)によって足部および足首の任意の骨に発生する可能性がある。 治療:骨折の外科的治療には,整復,あるいは骨を再結合し,鋼板やネジなどのインプラントで骨折を固定することがある。 |
母指外反や母嚢炎 |
|
|
|
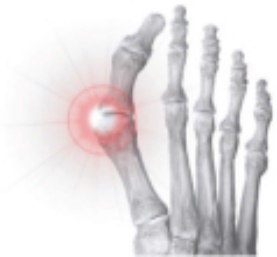
|
条件:一般的な足部奇形であり,大足指関節における足部内側に隆起が認められた。このような状況は深刻な機能喪失、痛み、生活の質の低下に発展する可能性がある。 治療:奇形の重症度、患者要素と外科医師の好みによって、母嚢炎手術はある程度異なるかもしれないが、主に骨切断、骨融合と/或いは軟組織矯正によって解決される。 |
|
|
足の指 |
|
|
|
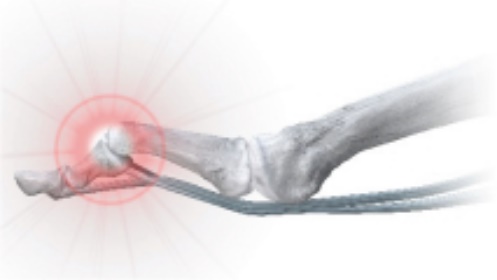
|
条件:槌状趾はすべての足指に影響を与えますが、通常は2つの足指に影響を与えます発送する, 3研究開発、と4これは…。足の指は、腱がアンバランスになると足の指が曲がって収縮します。通常母嚢炎とつながっています 治療:槌状足指の外科治療は釘、ネジ或いは他のインプラントを用いて直接に骨を融合し、或いは直接に腱/軟組織のアンバランス問題を解決することによって実現できる。 |
|
|
足首.足首 |
足関節には足関節周囲のすべての非骨折の足関節状況があり,周囲の軟部組織を含む。下に足首を強調して表示しております |
|
|
足首-くるぶし関節炎 |
|
|
|
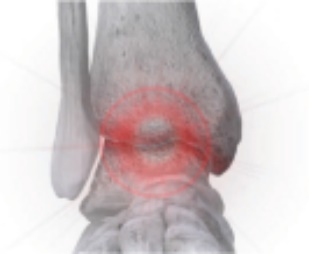
|
条件:足首関節炎の最もよく見られる原因は足首の創傷であり、例えば繰り返しの足首捻挫や以前の足首骨折である。 治療:足関節関節炎は通常足関節融合術や全足関節形成術で治療され,前者はネジ釘,鋼板および/または髄内釘で足関節を固定し,後者は骨内釘であり,何の突起もない。全果関節置換と足関節融合術は足関節の痛みを軽減するためであったが,足関節置換は足首の継続を可能にした。 |
|
|
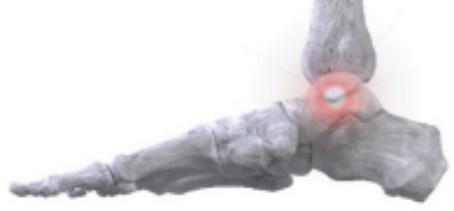
足関節−足関節の虚血性壊死 |
|
|
|
|
条件:距骨は脛骨下方に位置し,足首関節の底部を構成している。距骨骨折や何らかの薬物がその骨への血液の流れを妨害した場合,距骨からの血液供給が中断する可能性があり,虚血性壊死と呼ばれる。もしこの骨に血液がなければ、骨は死んで最終的に崩壊するだろう。この骨頭の壊死部分は痛みを引き起こし,常に切除しなければならない。 治療:最悪の場合、治療には切断が含まれる可能性があるが、骨からのスペーサーの代わりに複雑な融合または置換などの他の選択がある。 |
7
|
|
|
|
|
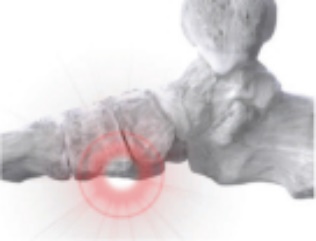
進行性陥没足奇形(PCFD)、または平足と呼ぶ |
|
|
|
条件:本質的に漸進的な3次元足部奇形であり,足部の異なる部位に影響を与え,“落下したアーチ”の外観を創出する。 治療:扁平足の矯正は、骨を切断と再定位し、骨を融合させ、および/または損傷した軟組織を修復することを含む可能性がある。 |
|
|
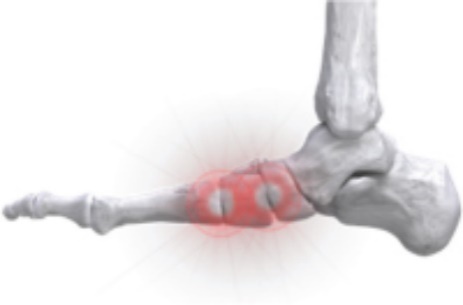
シャコット足 |
|
|
|
|
条件:これは稀な疾患であり、糖尿病患者あるいは他の末梢神経病変が長期に存在する患者、すなわち手足の知覚を失うことができる。シャコ特足を有する患者では,骨が虚弱,骨折および/または脱臼となり,足を感じなかった。 治療:外科治療は骨を切開して足部の再調整を助け、潰瘍予防/治療の圧力点を減少させることを含む複雑である可能性がある。骨は内固定、例えば鋼板、釘、横梁とネジ、外固定、または両方の組み合わせで固定することができる。 |
|
|
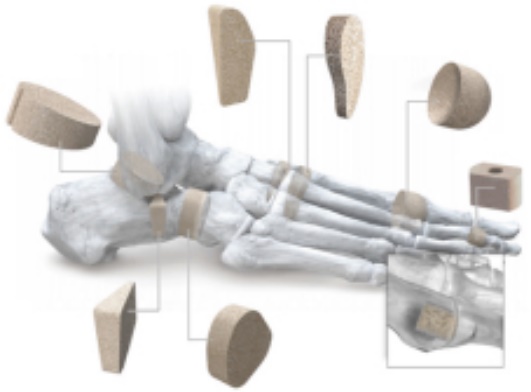
整形生物学 |
|
|
|
|
正生物製剤は1種の生物物質であり、足部と足首内のすべての主要なプログラムセグメントの損傷と状況のより迅速な癒合を助けるために使用される。正骨生物製剤は様々な形態があり、骨楔形、移植片、脱灰骨基質、骨空隙充填物、合成材料、羊膜製品と生体適合性コラーゲン基質を含む。 |
私たちの市場のチャンスは
著者らは私たちの市場を足部と足首手術のための外科インプラントとデバイスの市場と定義し、骨折固定、前足或いは親指外反を含むすべての主要な適応をカバーしている--母嚢炎とハンマー趾、足首、PCFD或いは平足、夏科特足部と整形生物を含む。各細分化市場と正生生物は自分の市場チャンスを代表しており、成長率はそれぞれ異なると信じている。2022年、足部と足首手術のための外科用インプラントと設備の世界市場は約46億ドルであり、毎年約7%の速度で増加し、2026年には60億ドルに達すると予想されており、これは整形外科領域で最も成長が速い市場である可能性がある。アメリカは依然として足部と足首手術の最大の市場であり、2022年には世界市場の約55%を占め、私たちの最大の製品販売市場でもある。私たちの世界の足首市場の推定は内部と第三者データに基づいている。
8
下表は各主要な適応と矯正生物製品のより広範な全世界の足部と足首市場機会を示した。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
推定数 |
|
|
推定数 |
|
|
予定されている |
|
|
|
2022年市場規模 |
|
|
2026年市場規模 |
|
|
2022-2026 |
|
足首市場細分化市場 |
|
(単位:百万) |
|
|
年間複合成長率 |
|
骨折固定 |
|
$ |
1,400 |
|
|
$ |
1,700 |
|
|
|
5 |
% |
前足や親指の外反(1) |
|
$ |
1,500 |
|
|
$ |
2,200 |
|
|
|
9 |
% |
足首.足首(2) |
|
$ |
500 |
|
|
$ |
700 |
|
|
|
9 |
% |
平足またはPCFD |
|
$ |
400 |
|
|
$ |
400 |
|
|
|
3 |
% |
シャコット足 |
|
$ |
200 |
|
|
$ |
200 |
|
|
|
4 |
% |
整形生物学(3) |
|
$ |
600 |
|
|
$ |
800 |
|
|
|
6 |
% |
世界の市場総量 |
|
$ |
4,600 |
|
|
$ |
6,000 |
|
|
|
7 |
% |
------------------------------------------
(1) 前足は母指外反(外反)と槌足指を含む。
(2)足関節は足関節周囲のすべての非骨折の足関節状況を含み、周囲の軟組織を含む
(3) 足部と足首市場に特化した整形生物製剤を代表する。
患者が経験した高い失敗率と再発率により,足部や足首市場は現在も十分に浸透していないと考えられる。例えば,インプラントにかかわらず,全果関節置換術5年後の修復率は21.8%,10年後は43.5%であったのに対し,股関節と膝関節手術3年後の修復率はそれぞれ約0.9%と1.4%であった。他の足部と足首手術の修復率はそれぞれ異なるが,通常は他の整形外科市場よりも高い。ある足部と足首手術の修復率は約20%から70%に達する可能性があると推定されている。
失敗率は非常に高いにもかかわらず、技術の進歩及び足部と足首疾患に対する更なる関心と専門化により、患者の予後と患者の使用可能な治療に対する認識を改善し、足部と足首市場の増加は加速すると信じている。また、市場は人口高齢化、肥満と糖尿病の発病率の増加、及びより広範な患者群がより積極的な生活様式を追求する願望を含む全体的な傾向から利益を得ることが予想される。
足と足首市場の既存の方法の限界は
足首外科インプラントと設備市場は整形外科市場の中の比較的に新しい細分化市場であり、少数の現有企業が主導し、彼らもより広範な医療技術と整形外科市場で業務を展開している。私たちは、この市場の技術進歩と成長は、業界のある傾向によって制限されていると考えている
•足と足首の市場結果の改善への集中と奉仕が不足しています.
現在の多くの現有のサプライヤーは整形外科と他の医療技術領域の多くの部門で業務を展開しており、彼らは伝統的に足部と足首外科医のために設計した技術を作っていない。通常、これらの現職者は、彼らの足部および足首製品をより広範な整形外科部門に含み、販売および開発チームは、足部および足首以外の複数の解剖学的領域の広範な解決策に時間および資源を割り当てる。
•全面的な教育と足部と足首疾患を治療する最適な方法に対する認識が不足し、更に高い失敗と再発率を招く。
足首は整形外科の1つの新興領域であり、その患者の再発率と失敗率は比較的に高く、多種の合併症と関係があるかもしれない。強力な医療や臨床教育プラットフォームや授業の開発への関心が乏しく,足部と足首に幸福をもたらすための重要な利害関係者であると考えられる。
他の業界参加者の広範な関心を考慮して、足部と足首外科医師は通常直接全線整形外科販売代表と交際し、専門の足部と足首販売専門家ではない。より多くの農村市場では,非専門的な販売チームが一般的であるが,より集中した市場では,この動きが顧客サービスや注目度の悪さを招く可能性があると考えられる。
9
複雑な足部および足首疾患を有する患者を治療する医師は、通常、各患者のために別の解決策を再設計する必要があり、これは患者の結果が一致しない可能性がある。また,個々の患者やプログラムをカスタマイズする補助ツールや機器が一般的に不足している。外科医師による患者治療の選択権は限られており、これは問題があり、病状の範囲が広く、重症度がそれぞれ異なるため、患者特有の複雑な要素、例えば年齢、体重と活動レベルである。このような選択の不足状況は高重症度と低重症度患者がすべて類似した、よく最適な治療を受けることを招く可能性があり、患者が得た解決策は患者の特定の要素を解決していない。
•多くの既存の解決策は他の大型関節解剖から用途を再調整するものである。
今日足部および足首を治療するためのいくつかの選択は、股関節、膝、または一般的な創傷のような他の解剖学的に使用されるインプラントおよび器具に由来するか、または類似していると考えられる。これらの技術はその主要な解剖構造の中でよく高度に重視されているが、それらは設計時に足部と足首の特定と複雑な解剖構造を考慮していない。より大きな力需要と通常最小の軟組織被膜があり、これは足部と足首を治療する複雑性を増加させる可能性がある。解剖学的特定の設計やインプラントの欠如が,我々の市場経験の高い改修や失敗率を招いた原因の一つであると考えられる。
足首市場は3−D機器やインプラント印刷,データ分析,人工知能やロボットなどの先進技術への投資が限られていると考えられる。サプライヤーは,プログラムの効率向上を支援し,患者により再現性とより良い結果を提供するために,これらの技術を得る必要があると考えられる。また,多くの足部や足首外科医は,術前計画から術中解決策,最後から術後フィードバックまでの全手術過程における手術支持を補完するために,先進的なデータ分析解決策をますます必要としていると考えられる。
ほとんどの人は 今日足部や足首用インプラントは,特定の研究に基づくニーズを考慮せずに開発されている。足部や足首で行われている多くの研究プロジェクトは,マーケティングを支援するため,あるいは既存製品やプログラム技術の採用を支援するためであると考えられ,このような研究には偏見がある可能性がある。このような潜在的偏見から,鍵となる利害関係者を再配置し,有意義で公正な臨床研究に基づいて製品やプログラムを設計する必要があると考えられる。
これらの制限の結合は製品革新の不足と患者に対する解決策の不足を招き、大量の満足されていない需要を招くと考えられる。
Paragon 28では、私たちの組織のすべての機能をカバーする足と足首市場全体を転覆して改善することを目標としています。私たちはもっぱら足部と足首に集中して、私たちの製品開発理念は既存の足部と足首製品とプログラムの局限性を改善することを中心に、看護標準を高めます。
私たちの差別化特徴は、現在の市場制限を解決し、患者の結果を改善できると信じています
•偏りのない研究によって決定された問題を解決するために製品開発と設計
•医師の操作体験を改善するために努力し、用途を再調整する解決策ではなく、すべての患者のニーズを満たすための一連の特定のオプションを提供する
•私たちの特定の足と足首の解決策がケアの基準になることを野心的に望んでいます
10
私たちの解決策は
私たちはすでに全面的で全線の足首矯正器具会社を設立した。手術全体と患者体験を克服し改善する最適な解決策を決定するために、手術の需要と限界が私たちが開発したシステムと技術を支配させた。私たちは患者と外科医の観点からすべての種類の手術を処理する。各新しい解決策の目標は患者の予後を改善し、疾病の再発と合併症の発生率を減少させ、そして各患者の特定の需要を満たす選択可能性を提供することである。我々は,2人の患者が同じでないことを尊重し,この点を考慮して,一連のオプションを持つ解決策を開発した。外科医師の各新しい解決方案の目標は手術をもっと簡単、より一致、より再現性させ、そしていくつかの局限性の奇形矯正を解決する新しい方法を見つけることである。
私たちはこの方法に対する私たちの約束が足と足首業界の革新者としてのブランドと名声を確立させたと信じている。設立以来、私たちはすでに多くの重要な技術進歩と革新製品を発売し、これらの技術進歩と革新製品は私たちの業界の現状を推進し、挑戦してきた。
著者らは外科医師の顧客に提供した専門的に構築した解決方案と臨床価値の差別化は著者らの商業成功と成長に現れていると信じている。私たちの最初の内部開発製品である保持骨楔が2011年に発売されて以来、75個の製品システムを商業化しています。また,我々は現在25種類以上の製品やシステムが開発中であり,その大部分は今後24カ月以内に商業化されると予想されており,斬新で破壊的な解決策により製品の組合せを強化することに取り組んでいることを示している.私たちはまた、私たちの世界的な知的財産権の組み合わせを迅速に拡大し、私たちが本当に独特だと思うものだけに特許を申請することに集中し続けます。
私たちのSmart 28生態系は

私たちの内部のSmart 28生態系を強化するために、私たちは2021年にAdditive Orthopedicsの資産を買収し、私たちの顧客に承認されたHDEアプリケーションに従ってマーケティングを許可した唯一の3 D印刷の患者専用全距離骨スペーサーに独占アクセスを提供した。私たちはまた専用の術前手術計画プラットフォームを買収し、これは人工知能を利用して臨床結果を改善する能力を著しく加速する可能性があると信じている。また,2022年第1四半期にDisiorを買収することにより,フィンランドヘルシンキにあるリーディング3次元分析術前計画ソフトウェア会社を買収した。Additive OrthopedicsやDisiorの加入に伴い,われわれは現在術前と術中連続看護段階の能力を有している。
手術後の解決策を開発するとともに,術前と術中段階で我々の能力や製品をさらに増強することを目的としてSmart 28への投資を継続する予定である。
11
私たちはプログラムのシステムに集中しています
我々はすでに全面的な足部と足首手術システムの組み合わせを開発した。各システムは、一般に、鋼板、ねじ釘、高級関節および骨代替物、正骨生物学的製剤、および特定の外科システムのために設計された他のインプラント器具および使い捨て装置のうちの1つまたは複数を含む。インプラントからプログラム方法や器具まで,我々の工学的努力を我々の外科システムの各コンポーネントに平等に集中させる。設立以来、私たちは75個の製品システムと約9,200個のSKUを設計して販売しました。私たちは約6,800個のインプラント、1,400個の器具、1,000個の使い捨ておよび他のSKUを開発しました。私たちの製品は患者の解剖と手術要件を最大限に満たすために、様々なサイズと構成が選択できます。
我々の電気めっきシステムは
我々は現在,ゴリラ鋼板システム,ベビーゴリラ鋼板システム,銀背足関節融合鋼板システムの3種類の鋼板システムを提供している。これらの鋼板システムは足部と足首産業のすべての主要なプログラム部分に使用されている。私たちの鋼板は患者と外科医のために設計され、ハードウェア刺激と鋼板操作の需要を除去し、手術結果の向上を助けることを目的としている。我々の鋼板は一般的に最適化され、異なる程度の手術操作に適応し、各患者と手術の解剖要求を最もよく満たす。我々の解剖輪郭鋼板は機械輪郭であり,より強固でバランスのとれた構造が生じ,プレス,圧延あるいは屈曲した鋼板よりも適していると信じている。われわれの平板を補完し、臨床的価値を向上させ、再現性を向上させるために、外科医が手術に使用する可能性のあるインプラントと、手術に固有の器具とを含む一体型キャディーを提供する。私たちの多くの電気めっきシステムは多くの特許機能を含む。
我々の主な電気めっきシステムはゴリラめっきシステム(Gorilla)である。ゴリラは最も全面的な足部と足首鋼板システムの1つであり,290個を超える鋼板オプションと様々な鋼板専用ネジがある。
|
|
|
|
 |
ゴリラ板専用ネジ -14システム、61パターン、および293個のパネルオプションを有する最も包括的な製品のうちの1つは、ユニークでカスタマイズ可能な機器を有しています 2.7 mm、3.5 mm、および4.2 mmロックまたは非ロック可変角板ネジ、R 3 CONおよびTUFFNEKネジオプションを提供 可変角度鋼板ねじの設計は、より大きな手術柔軟性を可能にし、15°までの軸外ロック配置を収容することができる 私たちの補強ネジネックはTUFFNEKと呼ばれ、最高応力点で構造の曲げ強度を増加させています |
12
ゴリラボードシステムには次のようなシステムがあります
|
|
|
|
 |
リスフランク鋼板システム 5つの解剖学的輪郭設計 28の製品をご提供しております 軟部組織への刺激を最小限にすることを目指しています |
|
|
 |
ラピデス電気めっきシステム その解剖学的輪郭は ガイドレールは、板ネジの軸方向の配置を維持しながら十字ネジを置くことができます |
|
|
 |
柱側板システム その解剖学的輪郭は 鋼板とねじ構造設計側柱の解剖的整列を保持するための設計 |
|
|
 |
踵骨スケートボードシステム 角度のあるネジはロックネジを収容することができ、安定性を高めます *ハードウェアの取り外しが減少する可能性があります 小児患者の踵骨成長板を破壊しないように設計されています |
|
|
 |
NC融合鋼板システム(足中内側2枚の骨の融合) その解剖学的輪郭は 複数の関節にまたがる圧縮を実現することを目的としている *位置合わせテンプレートの内蔵 |
Baby Gorillaめっきシステムは、26種類の異なるめっきスタイルと92種類の異なるめっきオプション、および独特なカスタマイズ可能な装置を含む全面的な足部と足首専用めっきシステムである。ゴリラと同様に,乳児ゴリラシステムはモジュール化,オプション性,特異性を鋼板と結合しており,これらの鋼板は手術のために設計されており,足部の小さい骨の解剖と大きさに合わせるために,より狭い鋼板とより小さいネジが必要である。また,Baby Gorillaシステムの作成は主に様々な創傷固定手順を解決するためであるが,足部や足首再建プログラムのための様々な加圧鋼板も含まれている。
13
|
|
|
|
 |
ベビーゴリラ専用ネジ 2.0 mmおよび2.5 mmロックまたは非ロック可変角板ネジを提供 可変角度鋼板ねじの設計は、より大きな手術柔軟性を可能にし、15°までの軸外ロック配置に適応できる |
私たちのベビーゴリラめっきシステムには次のようなシステムがあります |
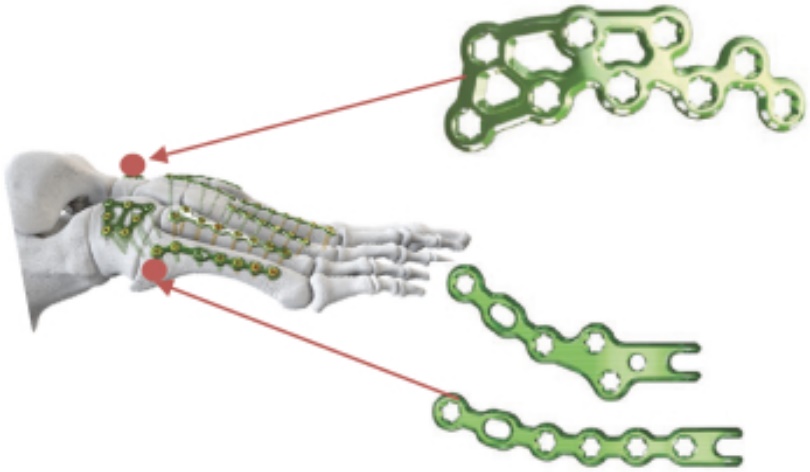 |
このシステムは骨折や手術に特化したオプションを提供します 舟骨骨折板 4つの製品をご提供しております 一般的な形の舟骨(足首の骨)骨折の周りに設計された孔パターン |
5これは…。中足骨フック鋼板 そのデザインは解剖的に5人に適していますこれは…。中足骨 鋭いフックを含み、鋼板が近位端の破片をつかんで骨に固定できるようにしている |
私たちが資金援助した遡及研究では、私たちはデータ収集や最終発表に参加していません国際足首協会2019年,われわれのゴリラ鋼板システムは強力な臨床価値と手術効率を示し,ハードウェア解体が少なく,骨癒合率が高く,固定生物力学が安定していた;ゴリラ踵骨スライド鋼板治療を受けた81例の患者のうち,100%の癒合率が注目され,1枚の鋼板のみが表在傷感染による取り出し(1.2%),ハードウェア故障による鋼板の取り出しはなかった。この遡及性研究は統計学的意義を持っていない。創部破裂と鋼板曝露により金物を取り出した1例が報告されている。すべての骨切り術は癒合し、転位或いはステントが無効であった。
ゴリラ鋼板システムとベビーゴリラ鋼板システムは、骨折または骨切り術の安定と固定のために許可されている;関節内と関節外骨折、関節陥凹と多発性断片骨折、修復プログラム、関節融合と足、足と足首の小骨の再建、脛骨遠位端、距骨と踵骨、そして指、手と手首を含む。このシステムは成人患者にも小児患者にも使用可能である。我々は2012年第4四半期にゴリラめっきシステムとベビーゴリラめっきシステムの開発を開始し,2014年4月に初歩的な510(K)の許可を得た。ゴリラ平板システムとベビーゴリラ平板システムは上記の適応に適合したII系医療機器に除去され,関連機器はI系医療機器に除去された。
我々のSilverback足関節融合鋼板システム(Silverback)は62個の独特な低輪郭前、側と後側鋼板設計、5つのねじ直径、及び強力な関節準備器械を提供し、脛骨距離(TT)、脛骨踵(TTC)或いは脛骨距離(TC)関節融合術を解決する。めっきシステムはII型陽極酸化チタン合金で設計されており,疲労性能を改善し,輪郭と平面オプションによる多点固定を可能にしている。
14
|
|
|
|
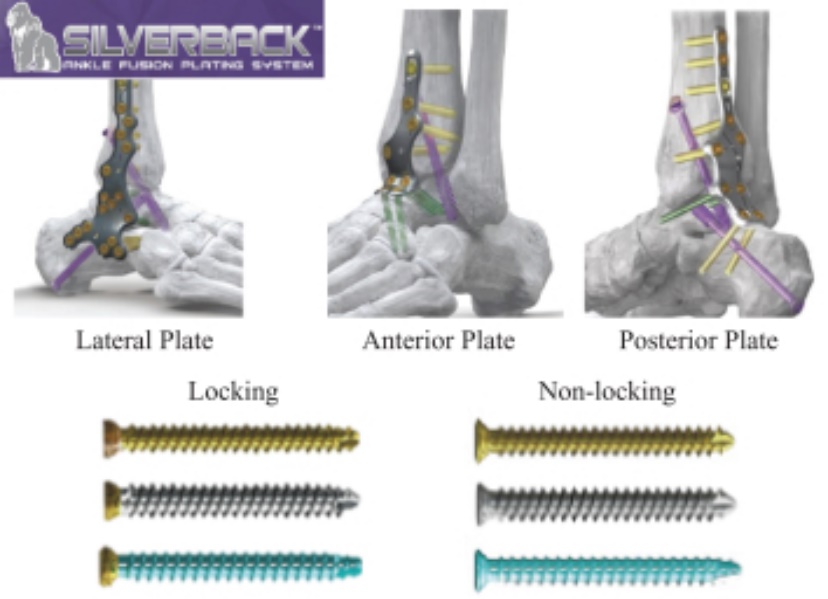 |
銀めっきシステム 銀背鋼板オプションは足関節融合術時の異なる解剖構造を解決するために専門的に設計されています 3.5 mmおよび4.2 mmロックおよび非ロックねじ、4.5 mmおよび5.2 mmロックおよび非ロック銀背面ねじオプション、および4.7 mmコンパクトな銀背ねじオプションを提供 コンパクト型銀背ネジは脛骨近位端によく見られる緻密な骨のために設計された。 |
Silverback Gorilla鋼板システムは、骨折または骨切り術を安定および固定するために使用することができ、関節内および関節外骨折、関節陥凹および多発性断片化骨折、修復手術、関節融合および足、足および足首の小骨を再建することができ、脛骨遠位端、距骨および踵骨、ならびに指、手および手首を含む。このシステムは成人患者にも小児患者にも使用可能である。我々は2017年第3四半期に銀背ゴリラめっきシステムの開発を開始し,2018年9月に予備510(K)の許可を得た。これらの適応に対しては,銀背ゴリラめっきシステムがII系医療機器,関連機器がI系医療機器として承認されている。
私たちの精密ガイド技術は
Precision Guideは我々の特許機器技術であり,手術結果を改善し,様々な技能レベルや経験の外科医がわれわれのインプラントを用いて一貫性および反復可能な手術を可能にすることを目標としている。この技術は手術室の時間を節約し,透視(1種の医用画像)の使用量を削減した。
多くの足と足首の手術には鋼板のほかに十字ネジが必要だ。いくつかの手術では、外科医が十字ネジを埋め込む時、彼らは素手でネジを挿入したり、私たちの精密なガイドを使用することができる。素手ねじ留置は術中のハードウェア衝突或いは何度もねじを再配向して衝突を避けることを招く可能性があり、これは不要な修正、より長い手術時間、および患者の回復が遅い可能性がある。
各精密ガイドレールの変化は、それに対応するプログラム焦点鋼板またはインプラントと協働するために唯一無二である。鋼板ねじを挿入すると、外科医は簡単な手動ねじで精密ガイドレールを鋼板に固定する。精密ガイドアームは、既存の鋼板や鋼板ねじとの衝突を回避し、方向を最適化して理想的な構造強度を得ることを目的とした、外科医に予め算出された3次元角度に位置決めされたドリルガイドを提供する。
私たちは、1つ以上の十字ねじまたはインプラントを必要とする特定のプログラムのためにカスタマイズされた6つの異なるPrecision Guideを持っている。著者らのPrecision Guide技術は以下の手術に応用できる:MTP融合術(親指両骨融合奇形を処理する手術)、第一中足骨関節融合術(Lapidus鋼板)と中足骨切骨矯正術、内側柱梁再建Charcot足部、足関節融合鋼板と舟骨楔形関節融合術。
Monster、Mini Monster、Joustビームネジシステム
私たちの電気めっきシステムを補充し、外科医にフルセットの製品を提供するために、私たちは様々な革新的な独立したネジシステムを作った。私たちのネジシステムは足と足首産業のすべての主要な手続き部分に使用されている。ネジ設計では,ピッチ,ピッチから頸錐角(予圧勾配)まで,個々の詳細を詳細に検討し,患者や外科医のニーズを満たす差別化されたネジを提供することを目的とした。我々が提出した510(K)計画を支援するために,我々のねじは独自のチューニングと良好なバランスを経て最適な強度と挿入鋭度を得るとともに,優れたインプラントを維持しながら,予測装置よりも予測の引き抜き強度が大きい工学的分析を行った。
15
我々のMonsterとMini Monsterネジシステムは中空の中実スクリューシステムであり,広いサイズと機能オプションを持っている。著者らは多種類の長さ増加と多種のねじ長オプションを提供し、骨切り、骨折と関節融合術の固定に多機能性を持たせる。私たちのネジ製品は強力な工具と器具の組み合わせによって支持され、手術結果の一致性と正確性の向上を助けることを目的としている。
著者らのJoustビームねじシステムは中空と中心梁から構成され、各種の大きさと機能を持ち、異なる患者の解剖構造に適応するように最適化され、そして外科医師が最終的に配置する時にもっと大きな柔軟性を持たせる。Joustネジは,我々のMonsterネジシステムに比べて長さが長く,主にCharcot Footのような1つの関節を超えたプログラムを安定させる必要があるために用いられている.また,我々のJoustねじ釘は第三者臨床研究で実証されたII型陽極化チタンから作られており,より良い疲労強度を提供することができ,より良い患者予後をもたらす可能性がある。
手術要求や外科医の好みに応じて,我々のねじは単独のインプラントとして使用することも可能であり,他のねじと一緒に使用したり,鋼板システムと一緒に使用したりすることも可能である。著者らがねじ釘を設計する心理状態は包容と各外科医師の好みを理解することであり、1つ以上の方法が成功できることを知っている。私たちは私たちが外科医に最も広いネジ選択の一つを提供していると信じています。頭部と無頭ネジ、全ネジと部分ネジを含み、これらはすべて異なるサイズを持っています。私たちのねじの他の主な特徴は、ねじの取り外しに役立つ逆方向ねじ山である逆切断溝ねじと、ねじ挿入中にねじパターンを作成し、ねじ自動タップを可能にする順方向切断溝とを含む。
Monsterねじシステムは骨再建、骨切り、関節融合術、関節融合、靭帯固定、骨折修復と骨折固定に使用され、設備の大きさに適している。成人および小児科患者に使用可能なJoust横梁ねじシステムを含むMonsterねじシステム。我々は2011年第3四半期にモンスターネジシステムの開発を開始し、2013年4月に初歩的な510(K)計画許可を得た。これらの適応では,モンスターネジ系はII系医療機器,関連機器はI系医療機器に除去された。
Joust横梁ねじシステムは骨再建、骨切り、関節融合術、関節融合、靭帯固定、骨折修復と骨折固定に適しており、設備の大きさに適している。我々は2017年第4四半期にジュール横梁ネジシステムの開発を開始し、2019年4月に予備510(K)の許可を得た。Joust横梁ねじシステムは成人患者に使用可能である。これらの適応に対して,Joust横梁ネジシステムはII系医療機器に除去され,関連機器はI系医療機器に除去された。
頂点3 D全足関節置換術(TAR)
APEX 3 Dはわれわれの全足関節置換システムであり,最初に2020年7月にFDAの承認を得た。APEX 3 Dシステムは次世代全足関節置換を示し、多孔質3 D印刷インプラントと高度架橋ポリエチレンのビタミンEの注入などの先進的な技術を採用していると信じている。APEX 3 Dインプラントは異なるサイズと設計構成があり、汎用のポリエチレンロック機構を含み、外科医に多種のインプラントサイズを提供し、患者の需要を最大限に満たす。APEX 3 Dシステムは1世紀余りの総合臨床経験と先端生物力学研究に基づいて、全足関節置換と関連する内在的な挑戦を解決することを目的とし、臨床結果は脛骨プロテーゼの動揺率が12%~38%の間であり、病理性摩耗、関節プロテーゼが不完全な整列情況下で過度な制約、整列敏感性研究が限られ、患者の歩行状態の著しい変化、不安定と持続性疼痛を含む。また,APEX 3 Dシステムは,部品の動揺や応力を引き起こすと考えられる要因を解決することを目的としている。私たちはこれが最初の真の解剖学的二重錐設計であり、CT研究に基づいて、疾患と健康解剖をめぐると信じている。
APEX 3 D全足関節置換システムは深刻なリウマチ、創傷後或いは退行性関節炎により損傷した足関節患者の初回手術の全足関節置換に使用されることが許可された。これらの患者の改修手術は十分な骨量を有する患者にも適している。APEX 3 D全果置換システムは成人患者にも小児患者にも使用できる。著者らは2016年第4四半期にAPEX 3 D全足関節置換システムの開発を開始し、2020年7月に初歩的な510(K)許可を得た。これらの適応に対して,APEX 3 D全足関節置換システムはII級医療機器,関連機器はI級医療機器として承認されている。
SMART 28全足関節置換術
われわれのAPEX 3 D全足関節置換インプラントを補完し,さらにわれわれの全足関節置換術を区別するために,FastracとMAVENの2つの先進的な技術を開発し,術中使用に用いた。FastracまたはMAVENは、医師の好みや手術需要に応じて、術後の手術結果を向上させるために、最適なインプラント位置を確保することを目的としている。FastracとMAVENは,我々が最初にTARに特化したSmart 28ツールである.著者らはTAR看護連続システム全体の中で更にツールと機能を開発し、著者らのAPEX 3 D患者の臨床結果を更に高めるつもりである。
16
Fastracは我々独自の脛骨遠位端位置合わせシステムであり、レーザ技術を用いて、部品位置合わせ中に正確な視覚基準点を提供し、これはTAR中に最適なインプラント位置を確立する重要なステップである。加速および視覚的な位置合わせを強化することに加えて、システムは、脛骨に追加の釘を挿入することを除去することによって、またはCTスキャンを行うことによって、手術技術を簡略化する。Fastracシステムは,内反/外反整列および内部外部整列を検証するように設計されている.Fastracは、我々のAPEX 3 D全足関節置換システムと同様の使用が許可され、成人患者集団に使用することができる。我々は2018年第2四半期にFastracの開発を開始し,2020年11月に予備510(K)計画の承認を得た。Fastracは上記の適応に適合したII系医療機器として承認され,関連機器はI系医療機器として承認された。
Mavenは著者らの独自の患者に対する器械製品であり、外科医師に正確かつ簡単に使用しやすい手術計画技術を提供する。これは、インプラントの長期生存に重要な、高度なCTベースの座標システムを利用して、再位置合わせおよび正確なインプラント配置のために設計されている。Mavenはその解剖設計特徴によって患者に対する技術進歩を推進し、それによって定位の正確性、安定性と理想的な移植位置を高めた。Mavenは荷重CTと伝統的なCTスキャン技術と互換性があり、膝から足底までの1回の連続スキャンを有し、正確な生物力学データを得る。患者に対するCT情報、輪郭ガイドとAPEX 3 Dインプラント設計を結合し、外科医師に患者の予後を最適化するための卓越した技術を提供した。著者らのMAVEN患者専用器具は患者の特定の手術器具として使用し、術中に全果関節置換プロテーゼを定位し、切断前に骨マーカーを指導することを目的としている。Mavenは成人患者にも小児患者にも使用できる。我々は2018年第4四半期にMAVENの開発を開始し、2021年1月に予備510(K)の承認を得た。これらの適応に対してMAVENはII系医療機器,関連機器はI系医療機器として承認されている。
患者特定総距骨間隔
私たちは、承認されたHDEアプリケーションによって発売された最初の患者専用の全距骨スペーサーを持っています。このインプラントは距骨の置換を目的としており,距骨は脚部と足部を結ぶ足首骨である。この独特な製品は患者がより積極的な生活様式を維持することを可能にし、著者らの外科医に切断或いは伝統的な足首融合療法を代替する新しい方法を提供した。我々は我々の先進技術を利用して,CTスキャン画像データに基づいて,人工知能の支援の下で,患者の特定のインプラント形状を作成した。画像化データは、その後、患者の特定の解剖学的構造に適合する設計を自動的に作成するために、我々の独自のソフトウェアアプリケーションで処理される。次にレーザー焼結技術を用いてこの設計を製造し,コバルトクロム金属合金を用いて材料を硬化させる技術である。
独立した臨床研究において、患者の特定のTalus Spacer治療を受けた患者は、ベースライン視覚シミュレーションスコア疼痛スコア(痛みを測定する標準単一次元スコア)と比較して、患者の疼痛軽減、活動範囲の改善、およびすべての足首結果スコア(FAOS)サブスケールに基づく機能結果の改善を示し、痛み、他の症状、日常生活機能、運動および娯楽活動機能、および足首関連生活の質を含む。この研究では31例中32例を評価した。主な安全終点は二次後続手術干与(SSSI)を受ける患者の割合である。評価された他のセキュリティ終点は、有害事象、装置またはプログラムに関連する有害事象、重症度別に分類された有害事象、および深刻な有害事象を含む。利益を得る可能性のある終点は、視覚シミュレーションスコア(VAS)を使用して疼痛を治療する術後ベースラインレベルの疼痛減少であり、これは、デバイスの使用によってもたらされる可能性のある健康利益が、その罹患または損傷のリスクを超えることを証明するために、HDEアプリケーションにおいて使用される終点である。評価の副次的に利益を得る可能性のある終点は、足関節活動範囲(ROM)およびFAOSを含む。FAOSサブスケール,痛み,症状(硬直,腫脹),日常生活能力(ADL),運動やレクリエーションを行う能力(Sports/Rec)および足部/足首に関する生活の質(QOL)も評価した。これらの研究では,患者特定の骨間スペーサーを移植した患者は,この装置から臨床的に意義のある可能な利益を得ている。研究により、術後ベースラインVAS疼痛採点は-2.8 cm低下し、6.9 cm(中度から重度疼痛)から4.1 cm(軽度疼痛)まで低下した。読み出し専用メモリの平均性能も向上している, 特に分析は,少なくとも1年間のフォローアップがあり,したがって十分な時間が回復した患者に限られている。FAOSスケールによる機能結果も改善され,運動/記録を除いて,すべてのスケールの平均改善が関連するMIC閾値を上回っている.再手術率は低く,再手術率は9.4%であった。疼痛や機能指標の改善は,低再手術率に伴い,限られた融合や切断を受ける必要がある高リスクの距骨動静脈奇形患者を選択するために特に意義がある。重篤な有害事象は報告されておらず,3件の有害事象のみが報告されており,1件は瘢痕形成,2件はインプラント関連痛であった。この研究は意味があるためではない。
全距骨スペーサーは承認されたHDE申請に基づいて販売され,足関節虚血性壊死の治療に用いられている。患者専用の骨間スペーサーを設計と製造するために必要な解剖標識はCTスキャン上に存在し、識別できる必要がある。全距骨間隔システムは成人患者にのみ適用される。Additive Orthopeadicsは2016年第1四半期に全距骨間隔棒の開発を開始し,最初のHDE申請は2021年2月に承認された。
17
前足またはHallux内反矯正システム
私たちは母嚢炎を治療するための様々な製品とシステムを開発した。このような複雑な軟組織と骨奇形の融合に対して、一刀両断の方法がなく、著者らは異なる重症度の母指嚢炎と他の患者の特定の考慮要素、例えば体重、年齢と必要な活動のレベルを治療する一連の手術方案を開発した。ヘルニア手術を選択する際には、手術と奇形の重症度とタイプを一致させることが重要であり、同時に医療合併症、軟組織、年齢と活動レベルなどの要素を考慮する。手術選択が不適切であることは足部の矯正不足、再発、合併症或いは生物力学的変化を招く可能性がある。いずれのヘルニア手術の目標も奇形を最大限に矯正するとともに,健康組織や骨の破壊を最大限に減少させることであると考えられる。著者らの広範な製品組み合わせは外科医師が患者に解決策を提供し、彼らの個体奇形の軽度から中度から深刻と末期までの適切な干与レベルを解決することを可能にした。
以下に我々の2つの異なる母指内反症矯正システム,PROMO三平面Hallux内反矯正システムとPhantom髄内釘システムを重点的に紹介した
現在100種類以上の外科技術は母嚢炎の治療に応用できる。異なる出版物の中で、母嚢炎術後の再発率は3%から70%まで様々であり、これは伝統的な治療方法の著しい変異性とプログラム制限を代表する。著者らは関節融合を必要とせず、一致と有効に母嚢炎奇形を招くすべての3つの平面次元を治療するために、著者らの近位回転中足骨骨切り術或いはPROMO三平面Hallux内反矯正システム(PREMO)を設計した。また,我々の宣伝システムを開発し,外科医に特定の奇形に適合させ,広範な母指奇形を是正する機会を可能にする柔軟なカスタマイズプログラムを提供した。また,PROMOプログラムに特化したツールや機器を開発し,外科医にプログラムの再現性と正確性を提供した。また,関節健康や患者の活動能力が強くない場合には,われわれのPROMO手術はTMT関節や足部の頬骨関節を融合させる必要はなく,すべての奇形平面を扱う。
ある研究で発表されました足と足首診療所2019年、著者は60例の1年間フォローアップした患者と25例のフォローアップ2年間の患者にPROMO手術を使用した経験を報告した。著者は奇形再発率は3%、癒合率は100%であることを指摘した。先に“ウォール·ストリート·ジャーナル”に発表された前向き研究では足首整形外科2018年の結果から,Promoo技術は安定した骨切り手術により内反と内反を確実に矯正し,任意の健康な関節の融合を回避していることが分かった。術後1年、25例の患者はすべて手術に満足し、再発と合併症はなかった。著者らは,足骨短縮の欠如を含めた放射線学的測定の著明な改善を報告し,Lapidus松果体切除術で発生する可能性がある。私たちはこの研究を支援していないし、データ収集や発表にも参加していない。この研究には大きな意味もなく、有害事件の報告もない。
PROMOシステムは、骨折または骨切り術の安定および固定、関節内および関節外骨折、関節陥凹および多発性断片骨折、改修手術、足指、足部および足首(脛骨遠位端、距骨および踵骨を含む)、ならびに指、手および手首の小骨の関節融合および再建に使用される。Promooシステムは成人患者にも小児患者にも適用可能である。我々は2017年第2四半期に販売促進システムの開発を開始し、2017年12月に予備510(K)の承認を得た。これらの適応に対しては,プロモーションビデオシステムはII系医療機器に除去され,関連機器はI系医療機器に除去された。
幻影髄内釘システムによる重度Hallux内反治療
私たちのHallux Valgus(親指外反)製品の組み合わせはまた私たちのPhantom髄内釘システムを含み、これは1つ目のTMT関節を融合することによって親指外反奇形を矯正するために設計された新しい専用髄内釘装置である。釘とねじ釘構造は多種の長さが選択でき、患者の解剖の違いに適応し、釘とねじ釘構造は骨の下方に位置し、ゼロ輪郭で、Lapidus手術期間中の軟組織破壊を最大限に減少する。この設計の目的は,従来の鋼板システムのハードウェア突出に関する苦痛を軽減するとともに,骨膜(血液供給)の破壊を最大限に減少させることである。このシステムは,再発した母指外反と足底裂開に抵抗するために,すべての解剖平面に比例した力を加えている。釘およびねじ構造は、近位端および遠位端の交差ねじ固定を提供し、融合部位の安定性を提供し、早期荷重を可能にする。システム内で提供される器具はまた、外科医が各患者の具体的な状況に応じて適切な量の押圧を入れることを可能にし、この押圧は解剖学的センターを通って直接行われることが理想的な位置である。
また、このシステムの一部として、釘や釘の正確な配置や位置決めに目標ガイドを提供する独自の機器を提供する。
18
足底裂開防止能力に対する異なる固定装置の有効性を分析するための臨床研究において、著者らの幻影髄内釘は内側壁板構造と交差ねじ構造よりも良い性能を示し、同時に軟組織刺激を回避した。ニューヨークタイムズに発表された研究は足首整形外科2019年に,我々の4孔Phantom髄内釘,3孔Phantom髄内釘,Gorilla Lapidus鋼板と身体組織中の2つの交差ねじ構造を循環荷重下で比較し,歩行時に発生する足部重複荷重をシミュレーションした。3孔と4孔Phantom髄内釘およびGorilla Lapidus鋼板は統計学的に交差ねじの足底隙間拡大よりもはるかに小さく,ねじ固定よりも良い骨癒合環境を提供する可能性があることが分かった。
Phantom髄内釘システムは足部と足首の小骨を安定と固定し、修復、関節融合或いは再建手術による骨折、骨切り、骨不連、偽関節と奇形癒合の治療に用いられる。幻影髄内釘システムは成人にも児童患者にも応用できる。著者らは2013年第4四半期に幻影髄内釘システムの開発を開始し、2017年6月に初歩的な510(K)の承認を得た。これらの適応では,幻髄内釘系はII系医療機器に除去され,関連機器はI系医療機器に除去された。
整形生物学
骨楔形、移植片、脱灰骨基質、骨空隙充填剤、合成材料、羊膜製品、および生体適合性コラーゲン基質を含む様々な骨生物製剤を提供する。我々の旗艦矯正生物学製品は著者らの特許保護骨移植システムであり、このシステムは8種類のプログラムに特定の形状を持ち、40種類以上の寸法変化を有し、潜在的な移植片成形需要を著しく減少させた。PROVAREには様々なサイズ測定装置が搭載されており、外科医が理想的な移植片の大きさおよび位置を決定し、必要な矯正を実現することができる。
われわれの保存同種異体骨は緻密な松質骨から作られており,これは通常骨末端に発見されている海綿状部分である。研究により、松質骨の新陳代謝活性は皮質骨の8倍であり、皮質骨は骨の緻密な外表面であり、癒合率はもっと高いことが分かった。また,移植片の質と性能を向上させるために,骨の生物力学的特性を保持するのに役立つ無菌処理技術を応用し,ドナー池を最高品質の骨のみに縮小した。我々のプロセスは、ガンマ照射や過酸化水素のような伝統的な端末滅菌技術を使用しない。研究により、終末滅菌技術は骨を更に脆化させ、骨の骨形成誘導能力に負の影響を与え、移植片の結合を遅延させ、甚だしきに至っては移植片の不癒合を招く可能性がある。われわれの過程は移植片の機械的完全性を保つことを可能にしているため,皮質辺縁を使用する必要はなく,逆に移植後の移植片統合をより良く知ることができ,統合速度を向上させることができる。著者らは、著者らの独特な特許形状と加工技術は鮮度を優れた製品にし、著者らの患者の臨床結果を改善すると信じている。
ある研究で発表されました足首整形外科2016年、著者らは、加工中にガンマ放射線を使用することが、緻密な松質骨の静的試験における弾性率(弾性)、最大圧縮歪み、および応力およびエネルギーを著しく低下させるかどうかを決定した。その目的も,緻密な松質骨の動態テストにおいて,加工過程でガンマ線を用いることが同種移植片のストレインエネルギーを著しく低下させるかどうかを決定することである。静的試験の結果,無菌処理試料と比較してガンマ照射された試料の弾性率は27%,最大応力では26%,最大応力では15%,エネルギーは37%低下した。
公衆衛生·サービス法(PHSA)第361条に基づき,保存骨移植システムをヒト細胞や組織製品(HCT/P)として管理している。保存骨移植システムは、同じ使用のためにのみ使用され、これは、レシピエントの細胞または組織を組織ベースの製品で修復、再建、置換または補充することを意味し、これらの製品は、レシピエントにおいてドナーと同じ基本的な機能を実行することを意味する。私たちは2013年第1四半期に保存骨移植システムの開発を開始した。
その他の製品
上で強調した製品以外にも、様々なプログラム重点と差別化システムがあります。
19
|
|
|
|
プログラム.プログラム:ハンマー頭  |
外科医に紡錘状軟組織固定の代替選択を提供する 上部と底の足指腱のバランスを再調整するために設計されています小さな切り口で-骨切断は必要ありません |
プログラム.プログラム:ハンマー頭  |
足指矯正用モノリシックスプレーチタンPEEK(ポリエーテルエーテルケトン)インプラント 標準的または逆行的技術と無菌または非無菌機器オプションを可能にします |
|
|
プログラム.プログラム:母嚢炎、平足 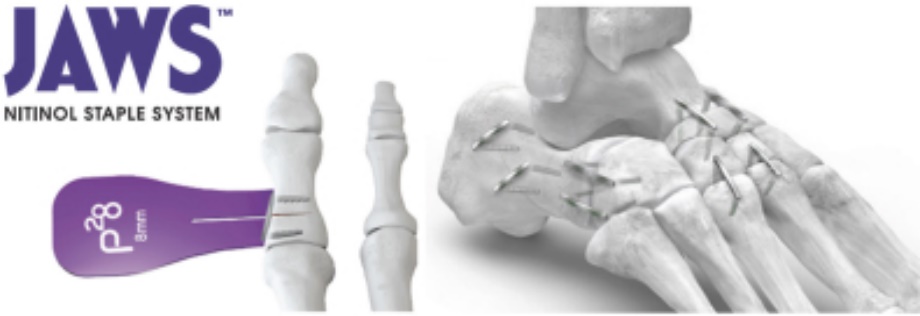 |
超弾性ニッケルチタン合金、骨切り部位で剛性圧縮を得ることができる簡単な挿入方法を有する 強固なオプション性があり、ホッチキスのサイズは8 mm~25 mmと様々であり、直線的であっても角度的であってもよい(Akinサイズに対して) |
|
|
プログラム.プログラム:骨折固定  |
設計上、関節癒合後にねじ断裂が発生した場合、ねじ釘は空隙中の切欠き点できれいに破断する :3人の患者に関連するケース研究により、ねじが純空中で破断した場合、位置を改善する可能性があり、取り外しハードウェアの需要を減少させる可能性があることが示された |
|
|
|
足関節固定が直面している挑戦としては,関節突関節骨折の安定性が不明であり,外科医の正確な配列を指導する情報が少なく,失敗率や修復率が高いこと,足関節圧力が変化する動的軟組織環境がある 軟組織が癒合し始めたところで、工事ねじは最初の剛性を解放して固定した;最適な範囲で、環境の解剖機能を最もよく回復する R 3 LEASEネジヘッドは完璧な設計で、足首骨折鋼板システムに適しています |
プログラム.プログラム:足の骨折 |
プログラムの課題を解決するために設計された特許曲面楽器 |
20
|
|
 |
*ネジは、120種類以上の固有のインプラントを提供し、固有のサイズおよび中実/中空オプションを提供します |
製品開発とルート
私たちは足と足首の解決策の組み合わせを拡大し、次世代製品を市場に出すことに力を入れています。私たちの開発プロセスは私たちの情熱と約束によって推進され、私たちは患者の結末を改善し、手術効率を創造するための製品の設計に取り組んでいる。私たちは尊敬業の設計と開発エンジニアチームを持っていて、彼らは私たちの絶えず革新する研究理念を体現しています。私たちの内部工学チームは55人の高素質の人員で構成されていて、必要な時、私たちは第三者資源を利用してテーマ専門知識を利用して私たちのチームを強化して支持します。私たちの研究理念は市場での競争優位性を提供し、以下の原則を含むと信じています
•既存のプログラムや製品を見直すために偏りのない研究を行う
•すべての製品が市場で最高であることを目指しています
•技術的に柔軟で、適応ごとに最適なニーズを考えることができます
我々の目標は,大学パートナーと連携して有意義で公正な研究を行い,さらに我々の製品開発に情報を提供し,より広範な足部や足首コミュニティに利益を得ることである。この研究は私たちの既存製品とは関係のない出版物を生み出し、既存技術を分析するツールとして使用することができ、そして私たちのエンジニアと足と足首外科医のために創造力と学習機会を刺激する。
私たちは新製品を市場に出すリズムを作った。2011年に初めて商業発表されて以来、私たちは約9,200個のSKUを含む75個の製品システムを市場に発売した。私たちはこのような安定した新製品開発と発表リズムを維持し続けることを願う。私たちは現在25種類以上の製品とシステムが開発中で、ほとんどの製品とシステムは今後24ヶ月以内に商業的に使用されると予想されています。
C臨床型 O垂直ビュー
臨床エビデンスへの投資を継続し,足部や足首領域の思想指導者として認められている医師を参加させることに取り組んでいる。これらの努力は引き続き大量の出版物を生み出し,最終的に我々の製品の採用を推進し,足部や足首手術に対する認識を高め,われわれの製品を看護基準として確立することを目指していると信じている。設立以来,我々は一連の広範な発表された研究を開発しており,これらの研究は当業界の思想指導者としての地位を強固にすると信じている.私たちの製品の安全性と臨床性能は、出版された52件を超える臨床白書や研究の支持を得ており、その約半分はParagonによって援助され、私たちの従業員が行っている。
私たちは引き続き臨床前と承認後あるいは認証後の研究に投資して、私たちの製品の使用を推進する予定です。私たちの臨床戦略の一部として、機械移植テストを含む内部で私たちの製品の性能テストを強調し、内部で私たちの声明を確認し、私たちの臨床的意義のあるシステムのマーケティングを支援するために努力します。
商業的方法
私たちは販売、マーケティング、医学教育からなる有力なビジネス組織を構築するために大量の資源を投入した。私たちは私たちの企業家精神と臨床志向の文化が私たちのビジネスチームを成長させることができると信じている。
21
私たちのビジネス拡張と私たちの解決策の臨床的利益に対する認識を支持するために、私たちは私たちの教育と訓練計画に多くの投資を行った。私たちは今まで数千人の外科医と他の専門家たちを訓練してきた。また、2019年には、250人収容可能な講堂と、40の職場を有する身体実験室を含む新たな企業、研究開発、臨床本部を開設し、毎年5000人までの研修が可能です。米国では,約2400名の足部と足首を専門とする整形外科医,約2300名の足部と足首を治療する小児科や創傷外科医,約9000名の足部外科医が信じられており,その約半分が足部と足首手術を行っている。本部が提供する教育や訓練の機会に加え、地域的なプロジェクトや仮想シンポジウムを含む幅広い選択肢を採用している。私たちの教育と訓練計画の広さは、範囲の広い外科医と販売者に合わせることができ、時間と場所において極めて大きな柔軟性を持っている。
私たちの商業組織に対する教育は広く持続的だ。私たちの広範な訓練計画は私たちの販売代表に臨床専門知識を提供し、足部と足首外科医の信頼できるパートナーになることができると信じている。
私たちのアメリカ販売チームは主に独立した販売代表で構成されていて、その大多数は独占的です。2022年12月31日までの1年間、米国でのほとんどの収入は234人の生産販売代表から来ている。私たちは生産型販売代表を四半期ごとのすべての3ヶ月間に少なくとも1つのケースの収入を記録する販売代表と定義する。2022年12月31日まで、私たちの国際販売チームは13の非在庫販売店、8つの在庫販売店、1つの直売市場から構成されている。私たちは2016年からアメリカ以外の地域で販売しています。私たちはアメリカでも国際的にも、既存と新しい地域で市場シェアを占め続ける重要な機会を持っていると信じている。私たちは私たちの世界販売チームを拡大して強化するために意味のある資源を投入し続けることを願う。
競争
足首市場は若く、比較的に新しい外科専門であり、少数の老舗会社が主導し、これらの会社はより広範な医療機器と整形外科市場で業務を展開している。私たちが現在販売している製品は競争の制約を受けており、未来に商業化されたどの製品も競争されるだろう。私たちの市場の主な競争要因は
•足と足首の連続ケアにデータ駆動ツールを使用する技術の進歩
•製品の品質と基準は私たちの顧客の名声を含めています
下肢市場において、私たちの主要な競争相手は、Stryker Corporation(Stryker)、Artherx,Inc.(Artherx)、Smith&Nephew plc(Smith And Nephew)、ジョンソン(J&J)、チマー生物科学技術ホールディングス(Zimmer Biomet)、およびEnovis Medical(Enovis)、CrossRoads Extreity Systems LLC(CrossRoads)、Medline Industries、Inc.(Medline)、Conmed Corporation(Concepmation)、InvevStep(Novace)、InTrevace(InTreace)、InTreace(InTreace)、InTreace、InTrevace、InTreace、InTreace、InTrece、InTreace、InTrece、InTreace、InTrevace、InTrece、InTrevace、InTrevace、InTrece、InTreace、InTrece、InTreace、InTrevace、InTreace、InTrevStep(ConTrece)、InTrece、InTreace、InTreace、InTrevStep(ConTrece)、InTrevace、InTrevace、InTre
私たちの多くの多国籍競争相手は豊富な財力を持っていて、足と足首の市場シェアを争奪する以外に、彼らは合格した販売とマーケティング専門人員、合格した研究開発専門知識、製品発表の速度とリズム及び新技術を獲得して、その現有のポートフォリオを拡大する方面で私たちと競争しています。
国際的な影響力がますます大きくなっているため,米国以外の医療機器メーカーとも競争している。これらの競争相手は効果的またはより安価な製品を開発し、私たちの前に規制許可や認証を受けるかもしれない。
22
知的財産権
私たちは、アメリカと外国市場の特許、商業秘密、商標、著作権を利用して、私たちの業務に重要だと考えている技術、発明、改善を積極的に求めています。
2022年12月31日まで、私たちの特許の組み合わせは262個の自己所有と発行された特許を含む。私たちの特許では
•19の特許は、使用される関連ツールおよびインプラントに関連する設計特許であり、9つは米国特許であり、5つはイギリス特許であり、5つはEU特許であり、これらの特許は2028年に満了する。
•13の特許は、私たちの爪で使用される技術に関連しており、そのうちの5つは設計特許であり、8つは実用特許であり、1つは外科技術であり、7つは関連ツールおよび/またはインプラントであり、6つは米国特許、2つは欧州特許、2つはイギリス特許、1つはスイス特許、1つはドイツ特許、1つは日本特許であり、これらの特許は2030年に満了する。
•164件の特許は、我々の電気めっきシステムで使用される技術に関連しており、そのうち116件は設計特許、48件は実用特許であり、これらの特許はすべて関連ツールに関連しており、そのうちの1つは手術技術にも関連しており、71件は米国特許、37件はEU特許、40件はイギリス特許、4件はドイツ特許、4件はフランス特許、3件はスペイン特許、3件はオランダ特許、1件はオーストラリア特許であり、これらの特許は2028年に満了する
•10個の特許は私たちのネジ使用の技術と関連がある;その中の2つは設計特許、8つは実用特許であり、これらのすべての特許は使用されている道具をカバーしている;3つはアメリカ特許、2つはイギリス特許、1つはEU特許、1つはドイツ特許、1つはスペイン特許、1つはフランス特許、1つはオランダ特許であり、これらの特許は2035年に満期になる
•47個の特許は、ハンマーインプラント、チタン楔、軟組織固定器を含む他の製品で使用される技術に関し、15個が設計特許、32個が実用特許であり、これらのすべてが関連するツール、システムおよび/またはインプラントに関連しており、そのうちの2つも手術技術をカバーしており、20件が米国特許、7つがイギリス特許、4つがEU特許、3つがドイツ特許、3つがスペイン特許、3つがフランス特許、3つがオランダ特許、1つがデンマーク特許、1つがアイルランド特許、1つがカナダ特許、1つがノルウェー特許である
•9つの特許は、私たちの足関節置換システム全体で使用される技術と関連があり、これらはすべて移植システムおよび使用ツールを含む米国の実用特許であり、これらの特許は2029年に満了する。
我々が所有している特許のほかに,我々とBiedermann Technologies GmbH&Co.Kg(“Biedermann”)との合意に基づいて獲得された9つの登録特許があり,2つの登録特許はExtreity Medical,LLC(“Extreity”)とのプロトコルに基づいて獲得されている.ビードマンのすべての特許は,我々のJAWS製本システムで用いられている技術に関連している.ビードマンが付与した特許のうち、6つは米国特許、1つはEU特許、1つは中国特許、1つは日本特許である。ビードマンから許可を得た特許は2033年に満期になる。Extemityから許可された2つの特許は実用特許であり,我々のPhantom Lapidus髄内釘システムで使用されている技術に関連している。Extemityから許可された特許は2030年に満期になる。
我々は2017年7月にBiedermannとライセンス契約(“Biedermannライセンス契約”)を締結した。ビードマンライセンス協定によると、ライセンス知的財産権に関する純収入の4%(4%)の使用料を、初回販売日から15年以内に年間最低250,000ドルの支払いを含めて支払わなければならない。この協定の期限は20年であり,その後5年間自動的に更新される。2022年、2021年、2020年12月31日までの数年間、本ライセンス契約によりピータマンに支払われた金の総額はそれぞれ24.9万ドル、8.7万ドル、11.1万ドルだった。2022年12月31日と2021年12月31日までに、ピータマンに支払うべき金額はそれぞれ164,000ドル、163,000ドルです。我々は2021年11月にExtreityライセンス契約(“Extremeライセンス契約”)を締結した。Extemityによりプロトコルを許可する.私たちは、最終満期の特許が満期になるまで、ライセンス知的財産権に関連する純売上高の4%(4%)の使用料の支払いを要求された。本ライセンス契約によりExtemityに支払われる金額の総額は,2022年12月31日と2021年12月31日までの年間でそれぞれ64,000ドルと0ドルである.ビードマン許可プロトコルもExtreityライセンスプロトコルも我々の業務には重要ではないと考えられる.
23
2022年12月31日現在、世界で231件の未解決特許出願があり、そのうち74件が米国にあります。これらの特許出願に加えて、私たちはビードマンとのライセンス契約に基づいて提出された4つの係属中の特許出願を持っている。ビードマンとのライセンス契約によると,すべての特許出願は実用特許であり,我々のJAWS製本システムに関する技術をカバーしている.これらの特許出願のうち、2つは米国特許、2つはEU特許である。これらの特許出願は最初に出願された日から20年以内に満期になる。したがって、これらの特許は最も早く満期になる可能性があり、もし発表されれば、早ければ2035年になるだろう。未解決の特許出願は、競争相手が現在市場で提供されている製品の革新を実践することを阻止し、将来の潜在的な商業化機会を保護し、戦略的に競争相手の可能な融通方法を阻止することを目的としている。
私たちは“Paragon 28”、“Monster”、“Gorilla”、“Phantom”を含む米国で最も重要な商標登録をいくつか持っている。他にも“APEX 3 D”、“MAVEN”、“Silverback”、“R 3 ACT”を含む他の材料商標の米国商標登録出願がある
個別特許の期限は,特許を付与した国の特許法的期限に依存する。米国を含む多くの国では,実用新案特許の特許期間は,適用国非臨時特許出願の最初の要求提出日から20年であるのが一般的である。私たちは、私たちのどの係属中の出願も特許を取得することを保証することができません。あるいは特許が発行された場合、それらは十分な範囲または実力を持ち、私たちの技術に意味のある保護を提供することができます。特許保護の範囲を得ることができるにもかかわらず,競合他社は我々の特許に含まれていない競争力のある治療法や装置を開発することができ,そのような治療法や装置を商業化することを阻止できない可能性がある。また,我々が製品を開発している分野には,第三者が所有する米国や外国から発行された特許や特許出願が多く存在する.特許出願は発表するのに数年かかるかもしれないので、私たちが知らない出願があるかもしれません。これらの出願は、私たちの既存または未来の製品または技術が侵害されたと告発される可能性のある発行された特許をもたらす可能性があります。
医療機器業界では、特許や他の知的財産権に関する多くの訴訟が発生している。将来的には、私たちに発行または許可された特許を強制的に執行し、私たちの商業秘密またはノウハウを保護し、他人のいわゆる権利を侵害または流用するための弁護、またはいわゆる他人の固有の権利の範囲および有効性を決定するための訴訟を行う必要があるかもしれない。このような訴訟はいずれも巨額の費用を招く可能性があり、他の機能と責任に対する私たちの注意と資源を分散させる可能性がある。また,我々の特許が有効で侵害されていることが発見されても,裁判所は侵害者への禁令救済を拒否することができ,金銭損害賠償および/または継続的な印税を与えることができる.このような金銭賠償は市場での侵害者の競争が私たちの業務に与える損害を十分に相殺するのに十分ではないかもしれません。
訴訟における不利な裁決は、私たちが第三者に重大な責任を負わせる可能性があり、第三者に許可を求め、このような第三者に巨額の印税を支払う必要があるかもしれないし、私たちの製品や技術の製造、販売、または使用を阻止する可能性があり、いずれも私たちの業務を深刻に損なう可能性がある。
私たちの製造技術、材料と製品設計に関する知識と経験、アイデア製品開発、マーケティング担当者と商業秘密情報は、私たちの独自製品ラインを維持する上で私たちの特許と同じように重要です。雇用条件として、すべての従業員と主要請負業者に、私たちの独自の情報を秘密にし、雇用中に作られた発明や他の知的財産権を私たちに譲渡する義務があることを規定する協定に署名することを要求します。詳しくは“リスク要因-私たちの知的財産権に関連するリスク”を参照されたい
24
製造と供給
我々は現在、複数の第三者製造関係を利用して、高品質、低コストの生産を確保し、同時に資本効率の高いビジネスモデルを維持している。私たちの多くの外科的解決策の重要な部品は複数の供給源を持っている。私たちのほとんどの供給協定は最小限の製造や調達義務を持っていない。したがって、私たちは一般的に特定の数量の製品を購入する義務がありません。私たちのサプライヤーは通常私たちに特定の数量の製品や私たちの製品の部品を販売したり、製造したりする義務はありません。ほとんどの場合、私たちのすべての製品は余分な製造能力があります。私たちはいくつかのインフレ圧力と前期延長を経験し始めましたが、主に原材料と労働力に限られています。新冠肺炎の流行が最も深刻な時期を除いて、私たちは需要を満たすために必要な製品或いは製品部品を獲得する上で何の重大な困難にも直面しておらず、私たちはサプライヤーが要求した納期前に製品を供給することが困難な限られた状況に遭遇したことがある。私たちは予測可能な未来に、製造能力は私たちの製品に対する市場の需要を満たすのに十分だと信じている。
仕入先から調達した部品の発注量と納期は、歴史的需要と予想される未来需要による予測に基づいています。注文の大きさ、製造に要する時間、特定のサプライヤーの要求、および現在の市場の部品、部品、材料に対する需要によって、部品の納期が異なる可能性があります。第三者契約製造業者およびサプライヤーに関連するリスクに関する議論は、その中のいくつかは単一のソースであり、“リスク要因-行政、組織および商業運営および成長に関連するリスク-私たちは、足首製品を構成するすべての要素を生産および包装するために第三者契約製造業者およびサプライヤー(その中のいくつかは単一源)に依存しており、これらのサプライヤーおよび製造業者が私たち、私たちの製品またはそのコンポーネントまたはサブコンポーネントに十分な量または全く供給しないことができない場合、私たちの業務、財務状況および運営結果に実質的な悪影響を及ぼすだろう”と述べた
政府の監督管理
私たちの製品、候補製品、運営はFDAとアメリカの他の連邦と州当局、外国司法管轄区の類似当局によって広く規制されています。私たちの製品はアメリカでFDAによって施行され実行されている“連邦食品、薬物と化粧品法案”(FDCA)の医療機器によって規制され、外国の管轄区域に適用される規制機関によって実施され、実行されている類似の法規の制約を受けている。
アメリカの法規
FDAは医療機器の開発、設計、非臨床と臨床研究、製造、安全性、有効性、ラベル、包装、貯蔵、設置、サービス、記録保存、発売前の承認或いは承認、不良事件報告、広告、販売促進、マーケティングと流通及び輸出入を監督し、国内流通の医療機器がその期待用途に対して安全かつ有効であることを保証し、その他の方法でFDCAの要求を満たす。
FDA上場前の承認要求
適用免除が適用されない限り、米国の商業流通の各医療機器は、FDAが510(K)の発売を承認する前に通知する必要がある初めからやり直す分類、またはPMAの承認。FDCAによると,医療機器は,I,IIまたはIIIの3つに分類され,各医療機器に関連するリスクの程度と,その安全性と有効性を確保するために必要なメーカーや規制制御の程度に依存する。クラスIは、患者に対するリスクが最も低いデバイスを含み、FDAによる医療デバイスの一般的な制御を遵守することによって、その安全性および有効性を保証することができるデバイスであり、これらの制御は、品質システム法規(QSR)の適用部分、施設登録および製品発売、不良医療イベントの報告、ならびに真および非誤解性のラベル、広告および宣伝材料を含む。第2のタイプのデバイスは、デバイスの安全性および有効性を確保するために、FDAの一般的な制御およびFDAによって必要とされる特別な制御を受ける。これらの特殊な制御は性能標準、発売後のモニタリング、患者登録とFDA指導文書を含むことができる。
第1のタイプのデバイスの多くは、510(K)の発売前通知の要求を受けないが、ほとんどの第2のタイプのデバイスの製造者は、FDCA第510(K)条に従ってFDAに上場前通知を提出し、デバイスの商業販売を可能にすることを要求しなければならない。FDAは、510(K)の発売前に通知によって制限された商業販売を可能にするデバイスは、一般に510(K)許可と呼ばれる。FDAが最大のリスクを構成すると考えられるデバイス、例えば、生命維持、生命維持、またはいくつかの移植可能デバイス、または新しい予期される用途を有するデバイス、または合法的に販売されているデバイスと実質的に同等ではない先進技術を使用するデバイスは、クラスIIIに分類され、PMAの承認を得る必要がある。いくつかの修正前の設備は非機密であるが、FDAの上場前通知および承認手続きを経なければ商業配信ができない。私たちが現在販売している製品の多くは、510(K)の許可を必要としないいくつかのクラスI免除装置と、承認されたHDEに従って販売されているIII級製品も販売していますが、510(K)の許可に適合するIIクラスIIデバイスです
25
申請します。私たちはまた私たちのパイプライン製品を開発しています。発売前に、この製品はPMAの承認要求を受けると信じています。
510(K)クリア·マーケティング·パス
510(K)の承認を得るためには、提案された装置が合法的に発売された予言的設備と“ほぼ同等”であることを証明する上場前通知提出をFDAに提出しなければならない。判定装置とは、発売前に承認されなかった合法的な販売装置、すなわち1976年5月28日までに合法的に販売された装置(改訂前装置)であり、PMAを必要としない装置、クラスIIIからクラスIIまたはI類に再分類された装置、または510(K)のプロセスによってほぼ同等の装置を発見することである。FDAの510(K)承認プロセスは、通常、3~12ヶ月を要するが、より長い時間を要する可能性がある。FDAは実質的な同等性を決定するために、臨床データを含むより多くの情報を必要とするかもしれない。また,FDAは何らかの医療機器提出の使用料や医療機器機関の年会費を徴収している。2023年度には、510(K)の販売前にアプリケーションに通知される標準ユーザ料金は19,870ドルである。
FDAが装置が現在の市場の予測装置に実質的に相当することに同意する場合、510(K)の装置の商業マーケティングを承認する。FDAが、デバイスが以前に承認されたデバイスと“実質的に同等ではない”と判断した場合、デバイスは自動的にクラスIIIデバイスとして指定される。そして、デバイススポンサーは、より厳しいPMA要求を満たすことができなければならない、またはそれに応じて初めからやり直す分類過程は,低中リスクの新しい医療機器が市場に参入する経路であり,述語機器とほぼ同等ではない。
デバイスが510(K)許可を取得した後、そのセキュリティまたは有効性に著しく影響を与える可能性のある任意の修正、またはその予期される用途に重大な変更または修正を構成する可能性のある任意の修正は、新しい510(K)許可を必要とするか、または修正に従ってPMA承認または修正されるであろう初めからやり直す分類する。FDAは、提案された変更が510(K)の発売前通知を提出する必要があるかどうかを各メーカーに決定することを要求し、要求する初めからやり直すしかしFDAはそのような決定を検討することができ、製造業者の決定に同意しない。FDAが製造業者の決定に同意しない場合、FDAは、510(K)市場許可、PMA承認、または発行まで、製造業者に販売を停止し、および/または修正された装置のリコールを要求することができる初めからやり直す分類する。しかも、このような場合、製造業者は規制部門の巨額の罰金や処罰を受ける可能性がある。
ここ数年間、FDAは510(K)承認手続きを改革した。例えば、FDAは、2019年9月に改訂された最終ガイドラインを発表し、オプションの“セキュリティおよび性能に基づく”販売前審査経路を記載し、“いくつかのよく知られているデバイスタイプ”の製造者は、そのようなデバイスがFDAによって確立された客観的な安全および性能基準に適合することを証明することによって、510(K)の許可経路下での実質的等価性を証明し、それにより、製造業者が許可中にその医療デバイスの安全性および性能を特定の予測デバイスと比較する必要性を除去する。FDAは、“セキュリティおよび性能に基づく”経路に適したデバイスタイプリストを作成し、維持し、各デバイスタイプの性能基準を決定し、実行可能な場合に推奨される試験方法を決定するために、製品固有のガイダンスファイルを開発し続ける。
PMA承認経路
クラスIIIデバイスは、FDAがPMAのいくつかの修正前のIIIデバイスが510(K)プロセスによって承認されることを要求していないにもかかわらず、発売前にPMA承認を必要とする。PMAプロセスは510(K)販売前通知プロセスよりも要求が高い.PMAでは,製造者はこの装置が安全かつ有効であることを証明しなければならず,PMAは臨床前研究やヒト臨床試験のデータを含む大量のデータ支援を必要とする。PMAはまた、装置およびその構成要素の完全な記述、製造のための方法、施設および制御のための完全な記述、および提案されたラベルを含む必要がある。PMAを受信した後、FDAは、実質的な検討を可能にするために、申請が十分に完全であるかどうかを判断する。FDAが審査申請を受ける場合、FDCAによれば、PMAの審査を完了するのに180日の時間があり、実際にはFDAの審査は通常より長い時間を必要とし、数年を要する可能性がある。FDA以外の専門家コンサルタントグループを集めて申請を審査·評価し、装置の承認についてFDAに提案を提供することができる。FDAは専門家グループの提案を受けるかもしれないし、そうではないかもしれない。さらに、FDAは、通常、QSRに適合することを確実にするために、出願人またはその第三者製造業者またはサプライヤーの製造施設を承認前に検査する。PMA出願はまた使用料を支払う必要があり、2023年度の使用料には441,547ドルの標準出願料が含まれています。
FDAがPMA内のデータおよび情報が有効な科学的証拠を構成し、装置がその予期される用途に対して安全かつ有効であることを合理的に保証すると判断した場合、FDAは、新しい装置が商業配信のために使用されることを許可するであろう。FDAは、ラベル、普及、販売および配布、および患者からの長期フォローアップデータの収集の制限を含む、装置の安全性および有効性を保証するために、承認された条件を有するPMAを承認する可能性がある
26
PMAの承認を支持するか、または承認後の追加の臨床研究を要求する臨床研究において。FDAは、ある形態の発売後監視を条件とする可能性があり、公衆の健康を保護する必要があると考えられる場合、またはより大規模な人々において装置を長時間使用する必要があると考えられる場合、装置に追加のセキュリティおよび有効性データを提供する。この場合、製造業者は、いくつかの患者集団を数年間追跡し、これらの患者の臨床状況を定期的にFDAに報告することを要求される可能性がある。承認条件を守らないことは承認を撤回することを含む実質的な不利な法執行行動につながる可能性がある。
承認されたデバイスのいくつかの変更、例えば、製造施設、方法または品質制御プログラムの変更、または設計性能仕様の変更は、デバイスの安全性または有効性に影響を与え、PMA補足材料を提出する必要がある。PMAサプリメントは、一般に、PMAと同じタイプの情報を提出する必要があるが、サプリメントは、元のPMAがカバーするデバイスの任意の変更をサポートするために必要な情報に限定され、広範な臨床データを必要としないか、または諮問グループを開催する必要がある可能性がある。承認されたデバイスの他のいくつかの変更は、例えば、設計変更が異なる予期される用途、動作モード、および動作技術ベースをもたらす場合、または設計変更が新しい世代のデバイスを開発するように重大である場合、および元のPMAと共に提出されたデータが、セキュリティおよび有効性の合理的な保証を証明するために、変更に適用されないように、新しいPMAを提出する必要がある。私たちの製品は現在PMAで販売されていません。
デノボ分類
FDAが従来I類,II類またはIII類に分類されていなかった医療機器タイプは,それらの構成リスクレベルにかかわらず自動的にIII類に分類される。1997年の食品·医薬品局近代化法案は、“自動III類指定の評価要求”、または“自動III類指定の評価要求”と呼ばれる述語装置の不足により自動的にIII類に分類される低中リスクの医療機器のための市場進出経路を構築した初めからやり直す分類プログラム。本プログラムは、その新しいデバイスがクラスIIIに自動的に分類されることを可能にする製造業者は、そのデバイスが低または中リスクがあることに応じて、PMAの提出および承認を必要とすることなく、その医療デバイスをクラスIまたはクラスIIに格下げすることを要求する。2012年7月に“食品·薬物管理局安全·革新法案”(FDASIA)が公布されるまで、医療機器は適合するしかなかった初めからやり直す製造業者が最初に510(K)の発売前通知を提出し、FDAの決定を受信した場合、すなわち装置が実質的に同じ装置ではない場合、装置は分類されるであろう。FDASIAは簡略化しました初めからやり直す製造業者が分類パスを要求することを可能にすることで初めからやり直す510(K)の発売前通知を最初にFDAに提出するのではなく、直接分類し、実質的に同等ではない決定を受信する。
人道主義的設備免除経路
HDEは、人道主義的用途デバイス(HUD)として指定することができるデバイスのマーケティング経路である。HUDは、米国で毎年8000人未満の数で発生する疾患または状態を治療または診断することを目的としたFDAから指定された装置である。HUDを市場に投入するためには、この装置はFDAのHUD指定を取得し、HDE申請に従ってFDAの承認を得なければならない。HDEの承認は、出願人が同様の装置が利用可能でないことを証明し、提案されたHUDの健康に対する可能な利点が、それの使用によってもたらされる損傷または疾患のリスクを超え、そのような場合または疾患のために利用可能な代替治療を考慮することに基づく。しかしながら、HDEによって承認された医療機器は有効性の要求に制限されず、PMAによって承認されれば、その装置は有効性の要求によって制限され、有効性を証明する臨床研究は承認を支持する必要はない。承認されたHDEは免責声明を貼らなければならず、この装置の有効性はまだ確定されていないことを宣言する。
さらに、HUDの承認を得たHUDは、限定された場合、例えば、HUDが治療しようとしている疾患または状態が小児科患者または亜集団で発生しない限り、利益を得ることができず、装置は、この使用のために標識されている。疾患または状況が小児科集団ではなく成人で発生する場合(または小児科集団で発生する数が非常に多く、これらの集団のために装置を開発することは不可能であり、非常に実行不可能であるか、または安全でない)場合、装置は利益を得ることもできる。しかしながら、この2つの場合、利益のためにデバイスを販売する場合、HDE所有者は、利益を目的としてFDA販売意図を通知しなければならず、毎年販売可能な収益デバイスの数が制限される。
HDE承認後にHUDを使用する前に、HDE保有者は、HUDの使用が工場IRBの承認を得たことを確実にしなければならない。承認後の臨床研究も必要かもしれない。我々の総距骨スペーサーは承認されたHDEの許可に基づいて発売され、承認後の研究を要求した。
臨床試験
臨床試験ではPMAやHDEアプリケーションや初めからやり直す分類要求は、510(K)の提出をサポートする必要がある場合がある。安全性と有効性を決定するためのすべての装置の臨床研究は必要である
27
FDAの研究設備免除(IDE)法規に基づいて行われ、この法規は研究設備ラベルを管理し、研究設備の普及を禁止し、研究スポンサーと研究調査者の一連の記録保存、報告とモニタリング責任を規定する。FDAの定義によれば、このデバイスが人間の健康に“重大なリスク”を構成する場合、FDAはデバイススポンサーにIDE申請を提出することを要求し、この申請はヒト臨床試験を開始する前に発効しなければならない。評価を受けたデバイスが人体の健康に大きなリスクとならない場合、デバイススポンサーは、ヒト臨床試験を開始する前にFDAにIDE申請を提出する必要はないが、このような試験を行う際には、簡略化されたIDE要件を遵守しなければならない。重大な危険装置とは、患者の健康、安全または福祉に対して深刻な危険を構成する装置、または移植、ヒトの生命を支持または維持するための、疾患の診断、治癒、軽減または治療、または他の方法でヒトの健康を損なうことを防止する上で非常に重要な装置、または他の方法で対象に対して深刻な危険の潜在的危険を構成するための装置である。IDEアプリケーションは、動物および実験室テスト結果のような適切なデータサポートを必要とし、人体上でデバイスをテストすることが安全であり、テストスキームが科学的に合理的であることを示している。FDAが同社に通知して調査を開始しない場合がない限り、IDEはFDAが通知を受けてから30日後に自動的に有効になります。FDAがIDEに欠陥または他の修正すべき問題があると判断した場合、FDAは臨床試験を条件付き承認の下で行うことを可能にする可能性がある。
医療機器のリスクの程度にかかわらず,臨床研究は各臨床地点の機関審査委員会(IRB)の承認を得てその監督下で行わなければならない。内部審査委員会は集積開発環境の予備的かつ継続的な審査を担当し,研究の追加要求を行うことが可能である。IDE申請がFDAおよび1つまたは複数のIRBsの承認を得た場合、ヒト臨床試験は、FDAによって承認された特定の数の研究場所および特定の数の患者において開始される可能性がある。この装置が患者に重大なリスクがない場合、スポンサーは、FDAの単独承認を得ることなく、1つまたは複数のIRBsの試験の承認を得た後に臨床試験を開始することができるが、調査を監督し、研究者がインフォームドコンセントおよびラベルおよび記録保存要件を得ることを保証するなど、簡略化されたIDE要件に従わなければならない。IDEの申請を受けてレビューを行うことは、FDAがIDEの発効を可能にする保証はありません。実際に有効である場合、FDAは、試験からのデータ支援デバイスの安全性および有効性を決定するか、または臨床試験の継続を保証することができない可能性があります。スポンサーまたは研究者が研究計画に対してその科学的合理性、研究計画またはヒト被験者の権利、安全または福祉に影響を与える可能性のある変更を行う前に、IDE補充材料はFDAに提出され、FDAの承認を得なければならない。
研究中、スポンサーは、例えば、試験モニタリング、臨床研究者を選択し、研究計画を提供すること、IRB審査、有害事象報告、記録保存、および研究装置の普及を禁止すること、またはそれのための安全性または有効性宣言を提示することを含むFDAの適用要件を遵守することを要求される。臨床研究中の臨床研究者はまたFDAの規定を守らなければならず、患者のインフォームドコンセントを得て、研究計画と研究方案を厳格に遵守し、研究設備の処置を制御し、そしてすべての報告と記録保存要求を守らなければならない。また,試験開始後,われわれ,FDAまたはIRBは,対象者のリスクが期待収益よりも大きいと考えられることを含め,様々な理由で随時臨床試験を一時停止または終了することができる。
Hct/Psに対する米国の規制
私たちのいくつかの製品はHct/Psとして規定されている。PHSA第361条は、伝染病の導入、伝播又は伝播を防止するためにFDAに法規を発行することを許可している。HCT/Pを処理、保存、貼付し、配布する際には、FDA登録施設と製品、組織ドナー資格のスクリーニングとテスト及び良好な組織規範(CGTP)に関する要求を遵守し、必要なラベル情報、厳格な記録保存と不良イベント報告を含む。具体的には,cGTPはHCT/Pの製造に使用される方法,施設,制御を導入,伝播あるいは伝播を防止するように管理する要求である。第361条HCT/Pは、発売前にFDAによるマーケティング申請の承認を必要としない。しかしながら、第361条HCT/Pとして管理するためには、この製品は、他の事項に加えて、“最小限の処理”を経なければならず、これは、構造的組織製品については、製造プロセスが再構成、修復または置換のための組織の元の関連特性を変更しないことを意味し、細胞または非構造組織製品については、製造プロセスが細胞または組織の関連生物学的特性を変化させないことを意味する。第361条HCT/Pはまた、“相同使用”のために使用されなければならず、レシピエント内でドナーと同じ基本機能を実行するHCT/Pを使用して、レシピエント細胞または組織を修復、再構成、置換、または補充することを意味する。361節の基準を満たさないHCT/PはPHSA 351節により管理される.第361節とは異なる, “351条項”として管理されているHCT/Pは、FDAの上場前審査と上場許可の要求を受け入れなければならない。
2017年11月、FDAは“ヒト細胞、組織、細胞と組織製品の監督管理考慮:最小操作と同源使用--工業と食品薬品監督管理局スタッフガイドライン”と題する指導文書を発表した。このガイドラインは,361条HCT/Pで販売されているといわれるすべての製品が最低限操作されているといわれるFDAの立場を概説しているため,米国で合法的に販売されるためにはマーケティング承認が必要である。指導意見はまた,食品·医薬品局はリスクに基づく方法を用いてINDに対して法執行裁量権を行使することを指摘している
28
マニュアルが発表された日から36ヶ月以内に、製造業者がINDを追求することを可能にし、および/またはマーケティング許可を求めることを可能にするために、いくつかの塩化水素化合物/製品の申請および発売前の承認要件を要求する。この方法により,FDAは,高リスク製品や用途が即時実行行動の影響を受ける可能性を示している。FDAは2020年7月、その裁量権施行期間を2021年5月31日まで延長した。FDAは2021年6月1日からこれらの製品に対するINDと上場前承認要求の実行を再開した。
どこにでもある持続的な市場後規制
1つの製品が承認または承認された後(またはその製品が肯定的なマーケティング許可を必要としない場合)、多くの一般的な規制要件が適用され続ける。これらの措置には
•QSR要件は、設計および製造プロセスのすべての点で厳格な設計、テスト、制御、文書、および他の品質保証手順に従う第三者製造業者およびサプライヤーを含む製造業者に要求する
•ラベル条例およびFDAは、研究用製品を普及させることを禁止するか、または承認または承認された製品の“ラベル外”使用を促進することを禁止する
•510(K)ライセンスデバイスの製品修正を承認または承認することは、セキュリティまたは有効性に著しく影響を与える可能性があるか、または当社のライセンスデバイスのうちの1つの予期される用途に大きな変化を構成するか、またはPMA承認デバイスまたはHDE経路に従って上場を許可するデバイスのいくつかの修正を承認することになる
•医療機器報告条例は、製造業者に、その販売された装置が死亡または深刻な損傷をもたらしたか、または障害を発生させた可能性があり、故障が再び発生した場合、その販売された装置または同様の装置が死亡または深刻な損傷をもたらす可能性があるか、または促進する可能性があることをFDAに報告することを要求する
•製造業者に現場修正および製品リコールまたは除去をFDAに報告し、健康構成に対する設備のリスクを低減するため、または健康にリスクを構成する可能性のあるFDCA違反を救済するために、製造業者に現場修正および製品リコールまたは除去を要求する
•FDAのリコール権限は、この権力に基づいて、設備メーカーに管理法律法規に違反した製品を市場からリコールするように命令することができる
•上場後のモニタリング活動と法規は、FDAが公衆の健康を保護したり、設備に追加の安全と有効性データを提供することが必要だと考えた場合、これらの活動と法規を適用する
医療機器の製造プロセスは、設計、製造、テスト、生産、プロセス、制御、品質保証、ラベル、包装、流通、設置および修理人用完成機器の方法、施設および制御を含むQSRの適用部分に適合しなければならない。QSRはまた、機器マスタファイル、デバイス履歴ファイル、クレームファイルなどの保守を要求する。メーカーとして、私たちはFDAの定期計画や計画外検査を受けます。QSR要求を守らないと,製造業務の閉鎖や制限,市場製品のリコールや差し押さえを招く可能性がある。任意の市販製品には、予期せぬ有害事象またはますます深刻化するまたは頻度が高くなっている有害事象を含む以前に未知の問題が存在することが発見され、医師がその許可範囲内でまたはラベルの外で装置を使用することによるものであっても、製品を市場から除去または自発的または強制的にリコールすることを含む装置の制限を引き起こす可能性がある。
FDAは広範囲な規制コンプライアンスと法執行権力を持っている。FDAが、製造業者が適用された規制要件を遵守できないと判断した場合、様々なコンプライアンスまたは法執行行動をとることができ、これは、以下のいずれかの処罰をもたらす可能性がある
•警告状、無見出し状、罰金、禁止、同意法令、民事処罰
•私たちの製品をリコール、撤回、行政拘留、または差し押さえます
•510(K)の上場許可またはPMAが新製品または改良製品を承認することを拒否または遅延させる要求;
29
•承認された510(K)許可、HDE、またはPMA承認を撤回すること;
EUの医療機器の規制
欧州連合(EU)は具体的な指令と条例を採択し,医療機器の設計,製造,臨床調査,合格評価,ラベル,有害事象報告を管理している。
2021年5月25日まで、医療機器は、廃止され、(EU)第2017/745規制(EU医療機器規制)によって置き換えられた理事会指令93/42/EEC(EU医療機器指令)によって規制されている。我々の現在の証明書はEU医療機器指令に基づいて付与·更新されており,その制度は以下のとおりである。しかし、2021年5月26日から、EU医療機器法規のいくつかの要求はEU医療機器指令中の経済経営者と器械登録、上場後の監督、市場監督と警戒要求に関する相応の要求に取って代わった。EUで医療機器マーケティングを推進することは,我々の機器が現在の証明書が満期になったときに,EU医療機器法規に規定されている新制度に基づいて認証を行うことを特に要求する。
EU医療機器指令
EU医療機器指令によると、EU市場で販売されているすべての医療機器は、医療機器の設計と製造を含むEU医療機器指令添付ファイルIに列挙された関連する基本的な要求に適合しなければならず、患者の臨床状況や安全、または使用者と他の人の安全と健康を損なわない必要がある。さらに、装置は、製造業者が予期する性能を達成し、適切な方法で設計、製造、および包装を行わなければならない。欧州委員会は医療機器に適用される様々な基準を採択した。これらの基準には、医療電気機器の滅菌および安全、およびいくつかのタイプの医療機器の製品基準のような共通要求を管理する基準が含まれる。設計や製造に関する統一的な基準もある。強制的ではないが、これらの基準を遵守することは、基本的な要求を満たす最も簡単な方法とみなされ、基本的な要求を満たす装置である覆すことのできる推定を作成するためである。
EU医療機器指令添付ファイルIに規定されている基本的な要求に適合することを証明するためには,医療機器メーカーは医療機器のタイプとそのリスク分類によって異なる合格評価プログラムを受けなければならない。一般に,医療機器とそのメーカーが基本的な要求に適合していることの証明は,他に加えて,製品の正常使用条件下での安全性や性能を支援する臨床データの評価に基づいていなければならない。特に、製造業者は、デバイスが通常の使用条件下でその予期される性能を達成し、その予期される性能の利点とトレードオフした場合、既知および予測可能なリスクおよび任意の有害事象が最小化および許容可能であり、デバイスの性能およびセキュリティに関する任意の宣言が適切な証拠支持を有することを証明しなければならない。低リスク医療機器(I類非無菌、非測定機器)以外に、メーカーはその製品が基本的な要求に適合しているかどうか(無菌或いは計量に関連する任意の部品を除く)を自己評価することができ、合格評価プログラムは機関の干与を通知する必要がある。通知機関はEU加盟国が指定した独立組織であり、設備が市場に投入される前にその適合性を評価する責任がある。通報された機関は通常,製品の技術アーカイブやメーカーの品質システムを監査·審査する(通報された機関は,関連協調基準を実施する品質システムである医療機器品質管理システムのISO 13485:2016年−これらの要求に適合することを想定しなければならない)。関連製品が関連する基本的な要求に適合していると考えられた場合,通知機関は合格証明書を発行する, 製造業者はそれ自体の適合性宣言の基礎として使用する.次いで、製造業者は、CEフラグをデバイスに適用して、デバイスがEU全体にわたって市場に投入されることを可能にすることができる。
合格証明書の全有効期間内に、メーカーは定期的な監督監査を受け、引き続き適用要件に適合しているかどうかを検証する。具体的には、通知機関は関連証明書を更新する前に新たな監査を行う。
EU医療機器法規
医療機器に関するEUの規制構造は最近変化した。2017年4月5日、EUは、国民の健康と患者の安全をより良く保護するための近代的で健全なEU立法枠組みの構築を目的とした“医療機器条例”を採択した。EUの医療機器規制は他のものを除いて
30
EUの範囲内で統一、透明、予測可能と持続可能な医療機器の監督管理枠組みは、高いレベルの安全と健康を確保し、同時に革新を支持する。EU医療機器指令とは異なり、EU医療機器法規はEU加盟国に直接適用され、加盟国が国家法律として実施する必要はない。これは連合全体の協調性を向上させることを目的としている。
EUの医療機器条例は2021年5月26日に施行された。
2021年5月26日までEU医療機器指令に基づいて合法的に市場に投入された機器は、2025年5月26日まで市場で販売または投入され続けることができ、過渡的な条項の要求を満たすことを前提としている。特に,問題のある証明書は依然として有効でなければならず,問題のある機器を実質的に変更することはできない.しかしながら、このような場合であっても、製造業者は、EU医療機器法規に規定されているいくつかの新しいまたは強化された要求、特に以下に説明する義務を遵守しなければならない。
EU医療機器条例は,カスタマイズ機器以外の機器を市場に投入する前に,メーカー(およびライセンス代表や輸入業者などの他の経済経営者)は,登録されていない限りEudameに身分情報を提出することで登録しなければならないことを要求している。製造業者(および許可代表)によって提出された情報は、コンプライアンスを規制する1人以上の担当者の名前、住所、および連絡先をさらに含む。新しい規定はまた、カスタマイズされたデバイス以外のデバイスを市場に投入する前に、製造業者がデバイスに一意の識別情報を割り当て、他のコアデータと共に一意のデバイス識別(UDI)、データベースに提供しなければならないことを要求する。これらの新しい要求は、装置をよりよく識別して追跡することを確実にすることを目的としている。各装置−が適用される場合、各パケットは、2つの部分からなるUDI:装置固有の装置識別子(UDI−DI)と、製造装置のユニットを識別する生産識別子(UDI−PI)とを有する。メーカは特にUDIデータベースを含めてEudameに必要なデータを入力し,その最新を保持する責任がある.Eudame登録の義務は後で適用される(Eudameはまだ完全に機能していないため)。Eudameが完全に機能する前に、EU医療機器指令の対応条項は、条項に規定されている情報交換に関する義務を履行するために引き続き適用され、特に機器登録及び経済経営者に関する情報を含む。
EUに医療機器を市場投入するすべてのメーカーはEU医療機器警戒制度を遵守しなければならず,EU医療機器条例の強化を受けている。この制度によると、深刻な事故と現場安全是正行動(FSCA)はEU加盟国の関連当局に報告しなければならない。これらの報告書はEudameによって提出されなければならず、EU加盟国の関連当局に報告するほか、サプライチェーン内の経済事業者など他の行為者にも状況を通報することを目的としている。Eudameが完全に機能するまで、EU医療機器指令の対応条項は引き続き適用されるだろう。製造業者は、市場で入手可能な医療機器の使用に関連する深刻な事故のリスクを防止または低減するために、技術的または医療的理由のための任意の是正行動として定義されているFSCAをとることが求められている。深刻な事故とは、市場上のデバイスの特性または性能の任意の故障または悪化(例えば、製造業者によって提供される情報が不十分で、副作用)であり、これは、患者、使用者、または他の人の死亡または健康を直接的または間接的に深刻に悪化させるか、または公衆健康に深刻な脅威となる可能性がある。FSCAは、リコール、修正、交換、廃棄、またはリフォーム設備を含むことができます。FSCAは、現場セキュリティ通知を介してそのクライアントおよび/またはデバイスのエンドユーザに製造業者またはその法律によって代表されなければならない。同じデバイスまたはデバイスタイプで発生する同様の深刻なイベントの場合、その根本的な原因は、FSCAが決定または実施されているか、またはイベントが一般的であり、良好な記録を有している, 製造業者は個別の深刻な事件報告書ではなく、定期的な総括報告書を提供することができる。
医療機器の広告と販売促進はEU立法で規定されているいくつかの一般的な原則によって制限されている。EU医療機器法規によると、CEマークが表示されている機器のみが、その予想される用途に応じてEUでマーケティングと広告を行うことができる。誤った広告および比較広告に関する第2006/114/EC号命令および不公平な商業行為に関する第2005/29/EC号命令は、医療機器広告に特化されているわけではないが、その広告にも適用され、例えば、広告には証拠、バランス、および誤り性が要求される一般的なルールが含まれている。具体的な要求は国家レベルで決定された。EU加盟国の医療機器広告や販売促進に関する法律は司法管轄区域によって異なり、一般大衆への製品の宣伝と普及を制限または制限する可能性があり、医療保健専門家の販売促進活動に制限を加える可能性がある。
ヒト細胞や組織を含む製品に適用される追加要件
EUには、米国のHCT/Psに類似した人体組織や細胞を含む製品を管理する全体的な法律や法規がない。しかし、人体細胞や組織、特に医療機器などの製品に使用する際には、具体的な要求がある。EUの法律によると、人類が使用するための人体組織と細胞の寄付、調達、検査、加工、保存、貯蔵と分配、および
31
このような細胞および組織からの完成品は現在、2004/23/EC番号指令(EU組織と細胞指令)によって管轄されている。
製品が別のEU法規または指令によってカバーされる範囲内では、関連製品に適用されるEU関連法規または指令によって規定される要求を除いて、EU組織および細胞指令の寄付、調達および検出に関する要求のみが適用される。
医療機器に関しては、一般原則として、EU“医療機器条例”は、組織または細胞またはその誘導体(すなわち、製造プロセスによってこのような組織または細胞から抽出された非細胞物質、最終物質段階ではいかなる細胞または組織も含まない)、またはそのようなヒト材料からなる製品には適用されない。
しかし、EUの医療設備法規は確かに人体組織或いは細胞の誘導体を用いて製造された設備に適用され、このようなヒト材料が生存不可能である限り、或いは生存不可能である。この場合,適用される要求は,設備部品とそれに含まれる人工材料の動作に依存する.装置が生存不可能なヒト細胞および組織またはその誘導体を含み、それらの行動が補助装置である場合、(I)EU組織および細胞命令における寄付、調達および試験に関する関連規定は、装置に含まれるヒト組織および細胞に適用され、(Ii)EU医療機器法規の適用要件は、装置の評価および認証に適用される。しかしながら、ヒト組織または細胞(またはその誘導体)の作用がデバイスの補助作用でない場合、デバイスはEU組織および細胞命令によってのみ管轄され、EU医療機器法規によって規定される一般的な安全および性能要件は、製品に関連するデバイス部分の安全および性能にのみ適用される。
EU組織と細胞指令は人体細胞と組織に関連する活動の一般的な品質と安全要求を規定した。EU指令はこのような活動に直接適用されないため、これらの要件は各EU加盟国の国内法によって実行されるため、適用される要求は、各加盟国がEU組織および細胞指示に規定されている措置よりも厳しい措置を自由に実施することができるので、EU加盟国によって異なる可能性がある。他の事項を除いて、EU組織と細胞指示は以下のように要求される
•組織と細胞の調達とテストは適切な訓練と経験豊富な人員によって行われなければならない
•組織および細胞機関は、(I)国家主管当局の認可、指定、許可または許可を得、(Ii)適用要件の遵守を確保するために適切な制御を実施し、(Iii)その活動の記録を維持し、(Iv)欧州委員会が制定した良好なやり方の原則に基づく品質システムを実施しなければならない
•組織および細胞がドナーから受容者に遡ることができるようにトレーサビリティシステムを実施しなければならず、組織および細胞の適切なマーカーを含む追跡システムを実施しなければならない
•ヒト組織と細胞の輸出入は、国家主管当局によって正式に認可され、指定され、許可され、または許可された機関によって行われなければならず、これらの組織および細胞はEU組織および細胞指令の規定の要求に適合しなければならない
•深刻な有害事象と反応の通報制度が実行されなければならない
2022年7月14日、欧州委員会はヒト由来物質(SOHO)規制に関する提案(SOHO提案)を発表した。指示とは異なり、すべてのEU加盟国では、規制が直接適用され、すべてのEU加盟国でこれらの法規を実施するEU加盟国の法律を通過する必要はない。SOHO提案は、ヒト血液、組織および細胞に適用される既存の規制フレームワークを廃止、置換、集約することを目的としており、このフレームワークは、血液および血液成分に関する指令2002/98/ECおよびEU組織および細胞指令からなる。最終文書が採択されると、SOHO提案は、ほとんどの条項が適用される前に2年間の過渡期があるにもかかわらず、いくつかの条項が適用される前に3年間の過渡期があるだろう。SOHO提案の要求は医療機器への適用の程度がそれぞれ異なる。SOHOが医療機器を製造するために使用される場合、SOHOドナー募集、ドナー履歴審査および資格評価、ドナー資格テストまたは適合目的の規定、ならびにドナーまたは患者からSOHOを収集するために適用される規定が一般的に適用される。しかしながら、不可能なSOHOまたはその派生商品が医療機器を構成要素として統合し、実行不可能なSOHOまたはその派生商品の行動が主であり、その機器に付属しない行動である場合、不可能なSOHOまたはその派生商品は、SOHO提案によって管轄される(EU医療機器法規の適用条項に適合する)。SOHO提案では,異なる枠組みを管理する主管当局間の協議と協力を改善し,協調した監督を確保することも求められている。
EUでは、規制当局は、会社、サプライヤーおよび/または下請け業者、および必要に応じて専門ユーザーの施設を発表および発表していない検査を行う権利がある。規制要件を遵守しないには、規制当局の意見に応えるために時間と資源が必要となる可能性がある
32
修正と予防措置を適宜取る。規制当局は広範なコンプライアンスと法執行権力を有しており、これらの問題が満足できる解決が得られなければ、無見出しまたは警告状、罰金、同意法令、禁止または民事または刑事罰を含む様々な行動をとることができる。
上記のEU規則は、27のEU加盟国にノルウェー、リヒテンシュタイン、アイスランドを加えた欧州経済圏(EEA)に一般的に適用されている。
英国が退欧する
2021年1月1日の離脱移行期間が終了して以来、イギリス(イングランド、スコットランド、ウェールズ)はEU法律の直接的な制約を受けていないが、アイルランド/北アイルランド議定書の条項によると、EU法律は北アイルランドに一般的に適用されている。二次立法で連合王国法律に転換されたEU法律は依然としてイギリスに適用されている。しかし、現在イギリス議会に提出されている“2022年保留EU法律(撤回と改革)法案”によると、いかなる保留EU法律も明確に保留され、国内法によって国内法として吸収されていない場合、または部級法規によって延長され(2026年6月23日より遅くない)、自動的に失効し、2023年12月31日までに撤回される。しかも、EU医療機器条例などの新しい立法はイギリスには適用されない。
英国政府は、医療製品や医療機器分野の既存の法規を改正または補完するために、国務大臣または適切な機関に権限を付与する新しい“2021年薬品·医療機器法”を可決した。これにより,人間の薬物,臨床試験,医療機器分野の規制格差や将来の変化を解決する上で柔軟性を許すことを目的として,今後二次立法で新たなルールを導入することが可能となる。
EU·英国貿易·協力協定(TCA)は2021年1月1日に発効した。TCAは医療機器について具体的に言及していないが、市場監督、法執行活動と措置、標準化関連活動、官僚交流、製品リコール(または他の類似行動)を含む製品安全とコンプライアンス分野での協力と情報交流を規定している。現地で製造されているが他国の部品を使用している医療機器については,“原産地規則”基準の審査が必要となる。北アイルランド市場に医療機器を投入するルールはイギリスとは異なる。
2021年1月1日から、薬品と保健品監督局(MHRA)はイギリスを担当する主権監督機関となった。新法規では,すべての医療機器がMHRAに登録されなければならないことが要求されており,2022年1月1日からイギリス以外に本部を置くメーカーは,イギリスに登録営業場所があるイギリスの担当者にMHRAに機器を登録することを求められている。
2022年6月26日、MHRAはイギリスの離脱後の医療機器と診断規制の枠組みに対する10週間の相談への対応を発表した。MHRAは“2002年イギリス医療機器条例”(The UK MDR)(引き続きEU医療機器条例前のEU立法を基礎とし、主にEU医療機器指令とEU体外診断医療機器指令、即ち指令98/79/EC)の改正を求め、特に新しい獲得経路を作成して革新を支持し、医療機器としてのソフトウェアと人工知能を監督する革新的な枠組みを作成し、体外診断医療機器の監督管理を改革し、医療機器の再使用と再製造を通じて持続可能な発展を促進する。新制度を実施する規定は2023年7月に施行される予定だったが、政府は最近、この日が2024年7月に延期されたことを明らかにした。EU医療機器条例や医療機器指令によると,EU通知機関が発行する有効な認証を持つ機器は過渡的な手配の制約を受ける。MHRAはそのコンサルティング応答の中で、将来のイギリス法規はEU医療機器法規によって認証された設備がイギリス市場でCEマークで発売されることを許可し、証明書の満期或いは新法規の発効後5年まで、比較的に早い者を基準とする。“医療機器指令”によって認証された設備は、証明書の満期または新しい法規が施行されてから3年後、早い者を基準とするまで、市場に投入されることができる。これらの過渡期の後, すべての医療機器にはイギリス合格評定(UKCA)マークが必要と予想される。製造業者は規制が施行される前に自発的にUKCAマークを使用することを選択することができる。しかし、2024年7月から、EU医療機器指令またはEU医療機器法規によると、既存かつ有効なCE認証の製品がないため、過渡的な手配の制約を受けず、イギリス市場で販売する場合には、イギリスのKCAマークを持つことが要求される。UKCAマークは連合で認められないだろう。北アイルランドはイギリスの一部であり,その医療機器が市場に投入されるルールはイギリス(イングランド,スコットランド,ウェールズ)のルールと異なり,依然としてEUの法律に基づいている。
北アイルランド議定書の条項によると、北アイルランドは北アイルランドで販売されている医療機器や機器についてEUの規制制度に基づいて評価する必要があるというEUのルールに従っている。この評価は、EU通知機関によって行うことができ、この場合、EUまたは北アイルランド市場にデバイスを投入する前に、CEマークを取得する必要がある。あるいはもし1つが
33
英国通知機関は、北アイルランド市場でしか販売できず、EU市場で販売できない“UKNI”マークを適用した評価を行っている。
ヒト細胞と組織を含む製品に適したイギリスの要求
イギリスのMDRは、一般に、ヒト起源の組織または細胞、またはヒト起源の組織または細胞を合併または由来する製品には適用されない。製品が動物組織を用いて製造され、動物組織が不活性であるか、または動物組織から抽出された不活性製品である場合、製品はイギリスMDRに適合することが要求される。イギリスMDRは、動物由来の組織を使用して製造された装置について、関連承認機関は、EU保持法の一部である欧州委員会第722/2012号に記載された手続きに従わなければならないと規定している。特に,医療機器のメーカーは,この機器のメリットがリスクよりも大きいことを確認することができなければならないとともに,考慮している
•リスクの低い組織や合成代替品を考慮して,動物組織や誘導体を使用する理由;
•製造業者による原材料、完成品、生産プロセス、テストおよび下請け業者の制御;
•動物組織や誘導体の由来や加工に関する事項を監査し,サプライヤーによる活動を含めて病原体を除去または不活化する過程を監査する必要がある。
2004年の“人体組織法”はイングランド、ウェールズと北アイルランドの人体組織の除去、貯蔵と使用に対して監督を行い、その根拠の原則は、一連の“予定目的”は同意を得なければならないことであり、これらの目的は移植、解剖検査と人体機能障害或いは機能に関連する研究を含む。ヒト組織“は、ヒト由来であり、ヒト細胞からなるか、または含む材料として定義される。もう一つの立法である2006年の“人間組織法(スコットランド)法”がスコットランドに適用された。
2007年に人体組織(人体応用品質と安全)条例(改正された)はEU組織と細胞指令の要求を実施し、そして人体組織と細胞を貯蔵と輸入して人類に使用する活動は人体組織管理局(HTA)が発行する適切な許可証を持つ機関でしか行われないことを規定した。以下のアクティビティは、適切なHTAライセンスの下で行うことができる:調達、テスト、加工、輸出、および流通。代替的に、以下の場合、列挙されたアクティビティは、サード·パーティ·プロトコルの許可の下で行うことができる
•その活動を行う機関は、適切な許可を得た機関を代表して行動する
•第三者プロトコルが“患者治療のためのヒト組織および細胞の品質および安全保証ガイドライン”に規定されている基準に適合する場合には、HTA第001/2021命令に従って実施される。
2007年に人体組織(人類応用の品質と安全)規則(改訂された)はカードを持つ場所に対して更なる条件を提出し、例えば規定の遵守を確保するために重要な役割を果たす“指定個人”を要求し、深刻な有害事象または深刻な副作用を発見した後24時間以内にHTAに深刻な不良事件または深刻な副作用を報告することを要求した。
輸出組織と細胞の機構は輸出組織或いは細胞が2007年の“人体組織(人類応用品質と安全)条例”(改訂された)に規定された品質と安全基準に符合することを証明しなければならない。そのほか、輸入組織と細胞の機構は輸入した組織或いは細胞が“2007年人体組織(人類応用品質と安全)条例”(改訂本)に規定された品質と安全標準に符合することを証明しなければならない
2021年7月1日以来、イギリスに本部を置く機関は、イギリスとヨーロッパ経済区のある国との間でヒト応用のためのヒト組織または細胞を輸入または輸出し、HTAの許可証を取得しなければならない。英国離脱後,組織や細胞をイギリスから北アイルランド受容者に送信する許可要求は変わらなかった。
34
データプライバシーとセキュリティ法
多くの州、連邦と外国の法律は個人情報の収集、伝播、使用、取得、秘密と安全を規範化し、健康に関する情報を含む。米国では、データ漏洩通知法、健康情報プライバシーおよびセキュリティ法、消費者保護法律および法規(例えば、FTC法案第5条)を含む多くの連邦および州の法律および法規が、健康関連情報および他の個人情報の収集、使用、開示および保護を管理しており、これらの法律および法規は、私たちの運営または私たちのパートナーの運営に適用される可能性がある。また,外国の法律は個人情報のプライバシーやセキュリティを規範化しており,場合によっては健康に関する情報を含めており,その多くの法律は互いに大きく異なり,同様の効果が生じず,遵守努力を複雑化させる可能性がある.適用される場合には、これらの法律を遵守しない場合には、重大な民事及び/又は刑事罰及び私的訴訟を引き起こす可能性がある。プライバシーとセキュリティ法律、法規、その他の義務は絶えず変化し、互いに衝突し、コンプライアンス作業を複雑化させ、調査、訴訟あるいは行動を招き、重大な民事および/または刑事罰およびデータ処理の制限を招く可能性がある。
保証と精算を請け負う
米国では,現在承認されている製品は通常整形外科手術で使用されている一般用品とされており,第三者支払者が支払う場合は手術手順の一部として支払われる。米国以外にも、個人支払者や政府計画による精算計画が多い。一部の国では、政府の精算は患者と病院が獲得できる主要な計画だ。私たちのビジネスの成功は、政府当局、個人健康保険会社、他の第三者支払人が私たちの製品を使用する手続きに保険を提供し、十分な補償レベルを確立するかにある程度依存します。医師、病院、外来手術センター、私たちの製品の他のユーザーは、私たちの製品を使用する手続きについて第三者支払者から十分な保険と精算を受けることができなかったか、あるいは政府と個人第三者支払者の保険と精算政策が不利に変化し、私たちの業務、財務状況、運営結果、将来性に大きな悪影響を及ぼす可能性がある。
われわれのこれまでの経験によると,第三者支払者は通常,患者が既定の手術医療の必要性基準を満たしている場合にのみ,われわれの製品を使用した手術手順の精算を行う。一部の支払人は管理医療システムに移行しており,外科手術の認可を制限することで,われわれの装置を用いた選択的手術を含む医療コストを制御している。アメリカでは支払人の間に統一的な保証と精算政策がなく、異なる支払人の保証と精算手続きは大きく異なる可能性があるが、特定の第三者支払人の精算決定は多くの要素に依存する可能性があり、支払人の製品使用状況の決定を含む
第三者支払者は、医療製品およびサービスの課金を監査および挑戦することが増えており、アップコード、エラーコード、不適切な修飾子の使用、または不適切なケア設定の課金が懸念されている。一部の第三者支払者は、新しいまたは革新的な設備またはプログラムの保証範囲を承認しなければならず、その後、製品や療法を使用する医療提供者に精算される。新製品がFDAによって商業流通のために承認されたり、外国の司法管轄区域で認証されたりしても、政府や個人第三者支払者の精算許可を得ない限り、その製品に対する需要が限られていることが分かる可能性がある。
医師および他のサービス(私たちの製品を使用するプログラムを含む)が適切な支払い金額を受信することを保証する重要な要素の1つは、製品を使用するプログラムを記述するための現在のプログラム用語(CPT)コードが存在するかどうかである。支払いを得るためには,衛生保健従事者はこれらのコードを用いて保険会社に医療サービス支払いクレームを提出しなければならない。CPTコードはアメリカ医学会及びそのCPT編集委員会によって分配、維持と毎年更新される。我々の製品を用いて実行されるプログラムに適したCPTコードが変更または削除されると,これらのプログラムの性能精算に悪影響を受ける可能性がある.
米国では,一部の加入者がメンバーが獲得するサービスを監視する管理式医療計画に参加しており,通常は事前承認が必要である。一部の管理型医療計画は,1人当たり(患者)をもとにその提供者に費用を支払うことで,提供者がその患者に提供するサービスにより財務リスクに直面し,これらの提供者にメンバーごとに毎月予定されている費用を支払うため,これらの提供者が我々の製品を使用する意思を制限する可能性がある。
35
政府や個人健康保険で支払われる医療製品やサービスの全体的なコストが上昇しており,医療·医療機器業界がより大きな圧力に直面し続けており,製品やサービスのコスト低減が求められていると考えられる。すべての第三者精算計画はますます複雑な方法を開発して医療コストを制御しており、予想精算と人頭建て計画、団体購入、福祉の再設計、重大な手術前に第二者の意見を求め、請求書を慎重に審査し、より健康な生活様式とその他の予防的サービスを奨励し、更に費用効果のある医療保健提供方法を探索することを含む。
保険政策をめぐる不確実性のほか、精算水準は定期的に変化する。第三者支払者は定期的に返済額を更新し、返済額を決定するための方法を時々改訂する。これには,我々の製品を使用したプログラムを医師,病院,外来手術センターに支払う通常の更新が含まれている。このような更新は私たちの製品の需要に直接影響を及ぼすかもしれない。
医療改革
医療政策の変化は、私たちのコストを増加させ、私たちの収入を減少させ、私たちの現在と未来の製品の販売と精算に影響を与えるかもしれない。米国や一部の外国司法管轄区域は、医療システムを変更するために、いくつかの立法および規制提案を検討または公布しており、その方法は、私たちの製品販売の収益性に影響を与える可能性がある。米国や他地域の政策立案者や支払者の中では,医療システムの改革を推進し,医療コストを抑え,質の向上やカバー範囲の拡大を既定の目標としていることが大きな興味を持っている。現在および将来的にヘルスケアをさらに改革したり、医療コストを低減したりする立法提案は、我々の製品の使用に関連するプログラムのカバー範囲を制限したり、精算を低減したりする可能性があります。支払者や提供者が策定しているコスト制御措置や,将来実施されるどの医療改革の取り組みの効果も,我々の製品販売の収入に影響を与える可能性がある。
例えば,米国では,ACAの実施は政府や民間保険会社の医療融資や提供方式を大きく変え,医療機器メーカーに大きな影響を与えている。他の以外に、ACAは連邦政府の比較有効性研究の項目を増加させるために激励を提供し、そして全国支払いバンドル試験計画を含む支払い制度改革を実施し、病院、医者と他の提供者がバンドル支払いモードを通じてある医療保健サービスの協調性、質と効率を高めることを奨励する。また,ACAは医療補助計画の資格基準を拡大し,患者を中心とした新たな結果研究所を作成し,優先順位を監督·決定して臨床有効性比較研究を行い,そのような研究に資金を提供している。
ACAのいくつかの側面は公布以来、司法と国会の挑戦を受けてきた。2021年6月17日、米国最高裁はACAに対する最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。最高裁が裁決を下す前に,総裁·バイデンはACA市場による医療保険の取得を目的とした2021年2月15日から2021年8月15日までの特殊保険期間を開始する行政命令を発表した。行政命令はまた、作業要求を含む医療補助モデル項目および免除計画の再検討、医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策の再検討、医療補助またはACAによる医療保険の取得を制限する既存の政策および規則の見直しを指示する。
さらに、ACAが公布されて以来、他の立法改正も提案され、採択された。例えば、2011年の予算統制法は、他の事項を除いて、2013年4月1日に施行された提供者への医療保険支払いを削減し、その後の立法改正により、国会が追加的な行動を取らない限り、2020年5月1日から2022年3月31日まで一時的に一時停止する2032年まで有効となる。また,2012年の“米国納税者救済法”は,病院を含むいくつかの医療サービス提供者に支払う医療保険費用を減少させ,政府が医療サービス提供者に多額の金を取り戻す訴訟時効を3年から5年に延長した。2015年の“連邦医療保険アクセスとチップ再許可法案”は連邦医療保険が医師に対して年間支払い調整を行う公式を廃止し、代わりに固定的な年間更新と新しい奨励支払いシステムであり、このシステムは各種の業績測定基準と医師の代替支払いモードへの参加、例えば責任看護組織に基づいている。
私たちは将来、より多くの州と連邦医療改革措置を取ることが予想され、特に新しい大統領政府を考慮すると、その中のいくつかの措置は連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの製品に対する需要の減少や追加の価格設定圧力を招く可能性がある。外国の管轄区域は似たような改革措置を取るかもしれない。例えば,2021年12月,EUは衛生技術評価(HTA)に関する第2021/2282号条例を採択し,第2011/24/EU指令を改正した。この規定は2022年1月に施行されたが、2025年1月から適用され、その間に実施に関する準備と手順が取られるだけである。この条例は施行されると、関連製品を対象に段階的に実施されるだろう。この規定は、衛生技術(いくつかの高リスク医療機器を含む)の評価におけるEU加盟国の協力を促進し、提供することを目的としている
36
これらの分野で共同臨床評価を行うためにEUレベルの協力基盤を提供する。この法規は、EU加盟国がEU範囲内で汎用的なHTAツール、方法、およびプログラムを使用することを可能にし、患者に最大の潜在的影響を有する革新的な衛生技術の共同臨床評価を含む4つの主要分野で協力することを可能にし、科学コンサルティングを連合し、開発者はHTA当局にアドバイスを求め、新興衛生技術および将来性のある技術を決定し、他の分野で自発的な協力を継続することができる。個別EU加盟国は、衛生技術の非臨床(例えば、経済、社会、倫理)の評価を引き続き担当し、定価と精算について決定する。
連邦、州、外国の詐欺と乱用と医師の支払い透明法
FDAと外国の薬品と設備のマーケティングと普及の制限のほか、他の連邦、州、外国の法律も私たちの商業行為を制限している。これらの法律には、外国、連邦、州の逆控除および虚偽申告法、および医療提供者への支払いまたは他の価値項目に関する透明性法律が含まれているが、これらに限定されない。
連邦反リベート法規は、他の事項に加えて、故意または故意に提供、支払い、請求または任意の報酬(任意のリベート、賄賂またはリベートを含む)を受け取り、直接または間接的に現金または実物の形態で誘導または隠蔽して、購入、レンタル、注文、手配または推薦購入、レンタル、手配または推奨購入、レンタルまたは手配または推薦購入、レンタルまたは手配または手配、連邦医療保険、医療補助または他の連邦医療保険計画に従って精算可能な任意の商品、施設、物品またはサービスの見返りとして注文することを禁止する。いくつかの法定例外状況と規制安全港保護のいくつかの一般的な活動は起訴されないが、例外状況と安全港の範囲は狭い。特定の適用された法定例外や安全港を規制するすべての要求を満たすことができなかったことは、連邦反リベート法規に基づいて、このような行為自体が不法であることを意味するわけではない。代わりに、そのすべての事実と状況の累積審査に基づいて、この手配の合法性を逐案的に評価する。いくつかの裁判所はこの法規の意図要求を、報酬の手配に関連する任意の目的が連邦医療保険カバーの業務への転換を誘導することであれば、連邦反リベート法規に違反すると解釈した。また,個人や実体は,法規や法規違反の具体的な意図を実際に知る必要がなく,違反行為を実施することができる.ほとんどの州でも反リベート法があり、同様の禁止が確立されており、場合によっては、商業保険会社や自費患者を含む任意の第三者支払者がカバーするプロジェクトやサービスにより広く適用される可能性がある。
連邦民事虚偽請求法は、任意の個人または実体が虚偽または詐欺的支払いまたは承認クレームの提出を意図的に連邦政府に提出するか、または故意に連邦政府に提出し、使用するか、虚偽記録または陳述を作成または使用することを禁止することを禁止し、これらの虚偽記録または陳述は、虚偽または詐欺的クレームに重要な意味を有する。2009年の“詐欺法執行·回収法案”の改正により、クレームには、米国政府に提出された金銭又は財産に対する“任意の請求又は要求”が含まれている。また、連邦民事虚偽請求法によれば、連邦反リベート法規違反による物品やサービスのクレームが虚偽または詐欺的クレームを構成することが含まれる。個人当事者は、政府の名義で連邦民事虚偽請求法案に基づいて任意の個人または実体に対して告発者訴訟を提起し、訴訟収益を共有することができる。
さらに、ある例外を除いて、民事罰金法規は、共同支払いおよび控除可能な金額(またはその任意の部分)を免除することを含む、連邦医療保険または州医療計画受益者への報酬の提供または移転を禁止し、これが、連邦医療保険または州医療計画によって精算可能な特定の提供者、従事者またはサプライヤーの選択に影響を与える可能性があることを知っているか、または知るべきである。
HIPAAはまた、個人第三者支払人を含む詐欺任意の医療福祉計画(個人第三者支払人を含む)の計画を故意に実行または実行しようとする追加の連邦刑法を制定し、医療福祉計画を故意に流用または窃取し、医療保健犯罪に対する刑事調査を故意に阻害し、および重大な事実を故意に偽造、隠蔽または隠蔽または隠蔽し、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する重大な虚偽、架空または詐欺的陳述を行うことを禁止する。連邦反リベート法規と同様に、個人または実体は、この法規やこの法規に違反する具体的な意図を実際に知る必要がなく、違反を実施することができる。また、多くの州で同様の詐欺や法律や法規の乱用があり、医療補助や他の州が計画して精算するプロジェクトやサービスに適用されたり、いくつかの州では支払者にかかわらず適用されている。
また、最近、外国、連邦、州政府の衛生保健専門家或いは実体への支払いと価値移転に対する監督管理を強化する傾向が現れている。連邦“医師支払い陽光法案”は、ある薬品、生物製品、医療用品および器械メーカーに対して年間報告要求を規定し、これらの薬品、生物製品、医療用品および設備メーカーは、連邦医療保険、医療補助または医療補助計画に基づいて医師(定義は医師、歯科医師、光線師、足科医師と脊椎マッサージ師を含む)、ある非医師従事者(医師アシスタント、勤務看護師、臨床看護師専門家、勤務看護師麻酔科医、麻酔科医アシスタントと執業看護師助産師を含む)と教育病院支払いおよび他の価値移転、および医師およびその直系親族の所有権と投資権益を直接または間接的に医師に提供することができる。EUでは、多くのEU加盟国はすでに具体的な反贈与法規を採択し、医療機器の商業行為、特に医療保健専門家や組織に対する商業行為をさらに制限している。また、最近では支払いの強化や
37
医療専門家または実体に提供される価値移転および多くのEU加盟国は、医療機器メーカーに対する米国の要求と同様に、報告および透明性要件(通常は年に1回)を規定する全国的な“サンシャイン法案”を採択した。一部の外国とアメリカ州はまた、商業コンプライアンス計画を強制的に実施し、設備メーカーのマーケティング行為に制限を加え、医療保健専門家および実体に支払われたプレゼント、報酬、およびその他の報酬を追跡して報告することを要求している。
上記の任意の医療保健法に違反するか、または私たちに適用される任意の他の政府法規に違反する処罰は、民事、刑事および/または行政処罰、損害賠償、罰金、返還、監禁、連邦医療保険および医療補助などの政府計画から除外されたこと、禁止、政府契約の締結、契約損害、名声損害、行政負担、利益減少および将来の収益の減少、および実体業務の削減または再編を許可することを許可することを含むが、これらに限定されない。
従業員と人的資本
2022年12月31日現在、私たちは463人のフルタイム従業員を持っている。私たちは、私たちの業務の成功は私たちが合格した人材を誘致し、維持する能力にある程度依存すると信じている。私たちの従業員はすべて労働組合の代表でもなく、集団交渉合意の側でもなく、私たちの従業員は仲がいいと信じています。
私たちの人的資本目標には、適用された場合、既存の従業員と追加的な従業員を識別、採用、維持、激励、統合することが含まれる。私たちの株式激励計画の主な目的は株に基づく報酬奨励と現金に基づく業績ボーナス奨励を授与することによって、選定された従業員、顧問と取締役を吸引、維持、激励することである。
施設
2022年1月、コロラド州エンゲルウッド草原大通り14445号にある本部を購入しました。買収に関連した取引が完了する前に、私たちはアンバル草原有限責任会社からこの建物を借りた。この施設は、私たちの現在と予想されている短期的な需要を満たすのに十分であり、必要に応じて商業的に合理的な条件でより多くの空間を得ることができると信じている。
企業情報
私たちは2010年8月にコロラド州に有限責任会社を設立し、2011年3月にコロラド州会社に転換し、2021年10月にデラウェア州会社に再登録した。私たちの主な実行オフィスは14445 Grassland Drive、Englewood、CO 80112、電話番号は(7209121332)です。私たちのサイトの住所はwww.toplon 28.comです。私たちは、1934年の証券取引法(改正された)または取引法に基づいて、米国証券取引委員会または米国証券取引委員会に提出または提出されたいくつかの報告書と、これらの報告書の改正を、私たちのウェブサイト上で提供します。これらの報告には,Form 10−Kに関する我々の年次報告,Form 10−Qに関する我々の四半期報告,および我々の現在のForm 8−Kに関する報告,取引法第13(A)または15(D)節に提出または提出された報告書の修正が含まれている。私たちが電子的に情報をアーカイブしたり、アメリカ証券取引委員会に提供したりした後、私たちは合理的で実行可能な範囲でできるだけ早く私たちのサイトでこれらの情報を無料で提供します。私たちのウェブサイトのアドレスへの参照は、参照によってウェブサイト上に組み込まれた情報を構成するものではなく、ウェブサイトに含まれる情報は、本ファイルまたは米国証券取引委員会に記録または提供される任意の他のファイルの一部でもない。米国証券取引委員会は、www.sec.govで提出した文書に関する報告書、依頼書、情報声明、その他の情報を含むウェブサイトをグローバルサイトに設置している。
38
第1 A項。リスク要因です
私たちの普通株に投資することは高い危険と関連がある。私たちの普通株に投資するかどうかを決定する前に、以下に説明するリスクおよび不確実性、および本Form 10-K年次報告に含まれるすべての他の情報をよく考慮しなければなりません。“経営陣の財務状況および経営結果の議論および分析”と題する部分と、本Form 10-K年次報告書に含まれる他の場所に含まれる財務諸表およびその関連する注釈を含みます。以下に説明する危険は私たちが直面している唯一の危険ではない。以下の任意のリスクまたは他のリスクおよび不確定要因の発生は、私たちの業務、財務状況、経営結果、および将来の見通しに重大な悪影響を及ぼす可能性があります。この場合、私たちの普通株の市場価格は下落するかもしれません。あなたはあなたの全部または一部の投資を失うかもしれません。また、“前向きな陳述に関する特別な説明”というタイトルの章を参照してください
私たちの財務状況と資本要求に関連するリスク
もし私たちが私たちの成長を効果的に管理できなければ、私たちの業務は実質的な悪影響を受けるかもしれない。
私たちは最近急速な成長を経験し、さらに増加すると予想されている。この成長は私たちの管理、財務、運営、技術、および他の資源に大きな需要を提供し、私たちの成長は引き続き私たちの管理と他の資源に重大な需要を提出し、私たちの運営、財務、その他の内部統制を引き続き発展させ、改善することを要求するだろう。特に、持続的な成長は、私たちの直販チームのために十分な熟練者を募集し、十分な訓練と監督を提供し、私たちの質の高い基準を維持し、私たちの文化や価値観を維持することを含む、多くの分野に関連する挑戦を増加させる。私たちは費用効果的な方法でこのような挑戦に対応できないかもしれないし、根本的に対応できないかもしれない。私たちの収入目標を達成するためには、予想される顧客ニーズを満たすために、第三者メーカーの製品供給を増加させることにも成功しなければならない。将来、私たちは品質管理困難、部品供給困難、人材不足などの問題に直面するかもしれない。このような問題は製品供給の遅延と費用の増加を招く可能性がある。このような遅延や増加した費用は私たちの収益能力に悪影響を及ぼす可能性がある。しかも、急速で顕著な成長は私たちの行政と運営インフラに圧力を与えるだろう。私たちの業務と成長を管理するためには、私たちの業務と管理制御、採用プロセス、報告、情報技術システム、財務内部制御プログラムを引き続き改善する必要があります。もし私たちが私たちの成長を効果的に管理できなければ、私たちの業務計画を実行し、競争圧力に対応し、市場機会を利用して、顧客の要求を満たしたり、高品質の製品供給を維持することができないかもしれません, これは私たちの業務、財務状況、そして運営結果に実質的な悪影響を及ぼすかもしれない。
私たちの融資協定条項は、私たちがいくつかの経営と財務契約を遵守し、私たちの経営と財務柔軟性に制限を加えることを要求する。もし私たちが債務融資を通じて追加資本を調達すれば、どんな新しい債務の条項も私たちが業務を運営する能力をさらに制限するかもしれない。
MidCap Financial TrustおよびZion Bancorporationとの融資協定の条項によると、“経営陣の財務状況と経営結果の議論と分析--流動性と資本資源--長期義務”と題する節では、本10-K表年次報告の第2部分では、融資者の同意なしに何らかの追加債務の発生、特定の留置権の作成、支配権変更取引、およびいくつかの分配および投資を行う能力を制限するいくつかの肯定的かつ否定的な条項によって制約されている。私たちの貸主はまた、債務を返済しない、不正確な陳述と保証、重大な債務条項および重大な合意を遵守できなかった、破産および資金不担保、統制権変更および/または重大な不利な変化など、いくつかのタイプの事件によって私たちが違約したことを発表することができる。この場合、私たちの貸手は違約事件を発表することができ、これは彼らにすべての未返済の借金、および未払いの利息および費用を発表し、直ちに満期および支払いを支払う権利を持たせることになる。しかも、私たちの貸手は私たちが融資協定に従って担保として提供した資産に対して訴訟を提起する権利があるだろう。例えば、私たちの融資協定によると、特定の違約が発生した場合、貸手は、私たちのほとんどの資産(知的財産権を含まない)の留置権と保証権益を強制的に執行する権利がある。もし私たちのいかなるローン協定でも債務が加速すれば、私たちは債務を返済するのに十分な現金や十分な資産を売ることができないか、あるいは私たちの成長計画を削減しなければならないかもしれません。これは私たちの業務と財務状況を損なうことになります。
必要であれば、許容可能な条項で追加資本を得ることができないかもしれない(もしあれば)。
私たちは私たちの業務を維持して拡大するために追加的な資金が必要かもしれない。私たちの業務は資本集約型で、私たちの販売チームの拡大、研究開発努力、製品供給に伴い、増加が予想されます。次のような方法で追加資金を集めると
39
株式、株式リンク証券または債務証券を発行する場合、これらの証券は私たちの普通株より優先する権利、優遇または特権を持つ可能性があり、私たちの既存の株主は希釈される可能性がある。私たちが将来獲得するどんな債務融資も、このような債務の利息と元本を支払うために、私たちの運営キャッシュフローの大部分を要求する可能性があり、これは、他の業務活動のための利用可能な資金を減少させる可能性があり、私たちの資金調達活動および他の財務および運営事項に関する制限的な契約に関連する可能性があり、追加の資本を得ることを困難にし、ビジネス機会を探すことができないかもしれない。さらに、私たちが第三者と達成した任意の未来の協力は短期的に資金を提供する可能性があるが、私たちの未来の潜在的なキャッシュフローと収入を制限するだろう。もし私たちが戦略的パートナー関係と連合と第三者との許可手配を通じてより多くの資金を調達すれば、私たちは私たちの技術や候補製品に対する貴重な権利を放棄したり、私たちに不利な条項で許可を与えなければならないかもしれない。私たちは私たちが本当にできれば、割引された条件で追加的な融資を受けることができるかどうかを確認することができない。もし私たちが受け入れ可能な条件で資金を調達できなければ、必要であれば、私たちの業務を発展させることができないかもしれませんし、競争圧力や意外な要求にも対応できないかもしれません。これは私たちの業務を深刻に損なう可能性があります。
私たちのビジネスや産業に関するリスクは
私たちの業務計画は私たちの製品の市場に対するいくつかの仮定に依存している;しかし、私たちの目標市場の規模と期待成長は正確に決定されておらず、私たちが推定したものよりも小さいかもしれない。たとえ目標市場が私たちが推定したほど大きくても、私たちはもっと多くの市場シェアを奪うことができないかもしれない。
現在の製品および未来の製品の潜在的市場の推定は、足部および足首疾患の流行率、足部および足首疾患患者の治療(手術を含む)を受け入れることの難しさを含む、多くの内部および第三者の推定および仮定に基づいている。私たちは私たちの仮説と私たちの推定を支持するデータが合理的だと信じているが、これらの仮定と私たちの推定は正しくないかもしれない。例えば,全体的な人口高齢化,肥満,糖尿病発症率の上昇,ますます活発な生活様式が継続し,これらの傾向は我々の製品やプログラムへの需要を増加させると考えられる。しかし、もし私たちのこれらの傾向に対する仮説と医学界の私たちの製品に対する受け入れが不正確であるか実現されていないことが証明されている場合、あるいは非手術治療や他の外科技術がより広く受け入れられていれば、私たちの足と足首の解決策とプログラムの実行可能な代替案として、私たちの製品に対する予測需要は実際の需要と実質的に異なる可能性がある。また,手術を選択した足部や足首疾患患者の数が予想通りに増加しても,技術や医学の進歩は足部や足首疾患を解決する代替案を提供し,足部や足首手術への需要を減少させることができる。したがって、現在または未来の製品と手続きの潜在的な市場に対する私たちの推定は正しくないことが証明されるかもしれない。私たちの現在と未来の製品やプログラムの潜在的な市場総量が私たちが予想しているほど大きくても、追加の市場シェアを奪取するために既存市場に浸透できない可能性があり、この部分の議論の原因は“リスク要因”の節で議論される。足と足首の患者の実際の数が私たちの製品から利益を得るなら, 将来の製品を販売することができますし、私たちの製品の潜在市場の価格が私たちの推定よりも低い場合、あるいは潜在市場の総規模が私たちが予想したように大きい場合、私たちは追加の市場シェアを奪うことができません。これは私たちの業務、財務状況、運営業績に大きな悪影響を及ぼす可能性があります。
私たちの業務は病院、医者と患者の私たちの製品に対する広範な採用に依存しています。
私たちの将来の成長と収益力は私たちの製品に対する医師と患者の認識を高める能力と、医者と病院が私たちの製品を採用する意欲にかかっています。医者は私たちの製品を採用しないかもしれません。彼らが経験、臨床データ、医学会提案とその他の分析によって私たちの製品が足部と足首疾患に安全かつ有効な治療を提供することを確定できない限り。医師の意識を高めることができても、彼らが医療を変えるスピードは遅いかもしれません。様々な理由で私たちの製品を選ぶことをためらうかもしれません
•私たちの製品は経験が足りなくて、市場で比較的新しいことを心配しています
•他の製品を販売する会社や流通業者と長期的な協力関係を維持する
•代替療法サプライヤーからの競争反応と否定的な販売努力
•私たちの製品を熟知し、熟知するのに必要な時間、約束、およびスキルの発展に対する見方;
•通常、新製品の使用および治療選択に関する知覚的責任リスク
40
•長期データを含む十分な臨床的証拠が不足しているか、または不足していると考えられ、既存の療法に対する私たちの製品の臨床的利益または費用対効果を支持する;
•重要なオピニオンリーダーは、私たちの製品についてアドバイスを提供できなかったか、または医師、患者、および医療支払者に、私たちの製品を他の治療案の魅力的な代替案として保証することができなかった
私たちの製品を効果的にマーケティングし、販売するためには、私たちの製品の安全性、有効性、必要性、効率、および私たちの製品を使用して利益を得る可能性のある患者群を理解するように医学界に教育していく必要があります。私たちはあなたに私たちが医者の中で広範囲な教育や市場受け入れを達成するということを保証することはできません。さらに、一部の医師は、その全患者集団の一部のみで私たちの製品を使用することを選択するか、あるいは私たちの製品を全く採用しないかもしれない。もし私たちの製品が広範な患者に有益であることを効果的に証明できなければ、私たちの製品の採用は制限され、私たちが予想していたように迅速に発生しないかもしれないし、全く起こらないかもしれません。これは私たちの業務、財務状況、そして運営結果に実質的な悪影響を及ぼすでしょう。私たちの製品が病院、医者、そして患者の広い市場で受け入れられることを保証することはできません。もし私たちの製品が需要を満たしていない場合、あるいは意義のある市場受容度と浸透率を得ることができなければ、すべて私たちの将来の見通しを損ない、私たちの業務、財務状況と経営業績に重大な悪影響を与える。
私たちは競争の激しいビジネス環境で経営していますが、既存または潜在的な競争相手と競争できなければ、私たちの業務、財務状況、経営結果は不利な影響を受ける可能性があります。
私たちの既存の足と足首製品とプログラム、そして私たちが開発と商業化した任意の新しい足と足首製品やプログラムは、激しい競争の影響を受けるだろう。私たちが経営している業界は競争が激しく、いつでも変化し、業界参加者が新製品、プログラム、あるいは他の市場活動を発売することに非常に敏感だ。私たちが競争に成功できるかどうかは、私たちの足首製品とプログラムを使用して知名度を高め、教育と訓練を継続して足首の専門家を獲得し、彼らの受け入れを得ることができるかどうかにかかっている;足首製品とプログラムを改善し、私たちの製品供給を適時に拡大するために、より多くの製品とプログラムを開発する;第三者支払者から十分な保険と精算を得る;そして私たちの競争相手の製品やプログラムよりも使いやすく、より安全で、侵襲性が小さく、より効果的な製品を提供する。また、私たちが顧客基盤を拡大し、私たちの製品をより広く市場に受け入れることができるかどうかは、マーケティング努力の能力を拡大することに大きく依存します。私たちは私たちのマーケティング計画に大量の資源を投入する計画だ。もし私たちのマーケティング努力と支出が相応の収入増加を生むことができなければ、私たちの業務、財務状況、運営結果にマイナスの影響を与えるだろう。また、私たちの製品に対する広範な認識を経済的に効率的に発展させ、維持することは、私たちの製品の広範な受け入れと国内と国際的な拡張を実現するために重要であると考えられる。販促活動は患者や医師の知名度を高めず,収入を増加させない可能性があり,それでもどの収入の増加もブランド構築時に生じるコストや支出を相殺できない可能性がある。もし私たちのブランドを普及させ、維持し、保護することができなければ, 私たちは私たちのブランド建設努力の十分な見返りを達成するために、あるいは私たちの製品の広範な採用に重要なブランド知名度レベルを達成するために、医者の認可を引き付けたり維持することができないかもしれない。
足と足首市場で、私たちはStryker、Artrex、Smith&Neppew、ジョンソンとZimmer Biomet、およびEnovis、CrosRoads、Medline、Conmed、NovaStepとTreaceのような大型多国籍企業と競争している。私たちはまた、学術機関、政府機関、公共と個人研究機関を含む多くの異なる源からの潜在的な競争に直面している。
いつでも、これらの競争相手および他の潜在的な市場参入者は、私たちの製品を時代遅れにしたり、競争力を欠いたりするために、新しい製品、プログラム、または治療代替案を開発するかもしれない。さらに、1つまたは複数のこのような競争相手は、私たちよりも早く競争製品、プログラム、または治療代替案を開発し、それのために特許を申請し、私たちよりも早く規制許可、承認または認証を得るか、または私たちよりも低い価格で競争製品を販売し、市場優位性を得ることができるかもしれない。医学研究により、ある足部および足首疾患を改善または治癒するための代替療法または技術が発見された場合、手術の代替案として、例えば足部中部の不安定な関節を自然矯正することによって、薬物または画期的なバイオテクノロジー革新または療法を使用すると、私たちの収益性は、売上の低下や市場シェアが競争相手に奪われる可能性がある。予防方法を発見し、あるいは他の代替方法を開発して、私たちが治療したいくつかの足と足首疾患を解決することは私たちの製品に対する需要の減少を招く可能性があり、それによって私たちの業務、財務状況と運営結果に実質的な不利な影響を与える可能性がある。私たちと潜在的な多くの競争相手は私たちよりも多くの販売と財務資源、より成熟した流通ネットワーク、より広範な製品供給、外科医と流通業者との強固な関係、および発売、マーケティング、流通と製品または治療代替案の発売におけるより豊富な経験を持っている。
私たちはまた、私たちの競争相手と競争して、独立販売代表のサービスを獲得しています。これらの販売代表は、現在私たちと協力している人もいれば、拡張後に協力したい人もいます。また、買収で競争相手と競争を展開しています
41
技術的および技術的許可は、私たちの製品やプログラムを補完するか、または私たちの業務に有利です。もし私たちが既存または潜在的な競争相手との競争に成功できなければ、私たちの業務、財務状況、運営結果は不利な影響を受ける可能性があり、私たちは全く成長していなければ、予想された速度で成長できないかもしれない。
私たちの業務の季節性は私たちの四半期の収入の差をもたらして、私たちの財務業績を比較したり予測したりすることは難しいです。
私たちの収入は季節的に変動し、これは私たちの異なる時期の業績の比較可能性に影響を与える。特に、私たちはすでに私たちの業務の季節性を経験し、引き続き経験する予定で、第4四半期のアメリカでの販売量はもっと高いです。私たちの第四四半期のアメリカでの販売量はよく高くなります。多くの患者は年間賠償免除額に達し、冬休み期間中に回復した後に手術を受ける時間があるからです。
私たちの長期的な成長は私たちの製品を適時に改善し、私たちの適応を拡大し、より多くの製品を開発と商業化できるかどうかにかかっている。もし私たちが革新できなければ、私たちは新製品をタイムリーに開発したり利用したりして競争力を維持することができないかもしれない。
私たちの製品の市場競争は激しく、活力に満ちており、迅速かつ実質的な技術発展と製品革新を象徴としている。新規参入者や既存の競争相手は私たちと直接競争する製品の開発を試みることができます。競争力を維持するために、私たちは新製品を開発して市場に出さなければならない。競争相手が提供する同等以上の製品や技術によって、私たちの製品と将来の関連製品の需要が減少する可能性があります。もし私たちが革新に成功できなければ、私たちの製品は時代遅れになるかもしれません。私たちの顧客が競争相手の製品を購入するにつれて、私たちの収入は下がります。開発製品は高価で時間がかかり、経営陣のコア業務への関心を分散させる可能性がある。私たちの解決策の任意の新製品や製品強化機能の成功は、私たちが能力があるかどうかを含むいくつかの要素にかかっています
•より多くの製品を獲得または発見するのに十分な資源を集め;
•必要があれば、臨床前と臨床研究および臨床試験のデータを用いて新製品の安全性と有効性を証明する
•適応、新製品または製品修正を拡大するために必要な規制許可、承認または認証を得る
•米国食品医薬品局(FDA)の規定を完全に遵守し、外国の新設備や改装製品に対するマーケティング規定を完全に遵守する
•私たちの製品の潜在的なユーザーに十分な訓練を提供します
•私たちの製品に対する手術は十分な保険と補償を受けています
•効率的で尊敬する販売とマーケティングチームを育成する
もし私たちが現金資源の不足、従業員の流動率が高く、十分な技術技能を持つ人員を雇うことができない、あるいは他の研究開発資源が不足しているなどの制限により、製品、アプリケーション或いは機能を開発或いは改善することができなければ、私たちは他社と比較した競争地位を維持できないかもしれない。また、我々の多くの競争相手は、より多くの資金を彼らの研究開発プロジェクトに投入することができ、そうしていない会社はより大きな会社に買収される可能性があり、これらの会社はより多くの資源を研究開発プロジェクトに割り当てることができる。私たちは十分な研究開発資源を投入したり、競争相手の研究開発プロジェクトと効果的に競争することができず、私たちの業務を損なう可能性があります。
42
さらに、最終的に成功しないことが証明された潜在的な製品または適応に、私たちの努力および資源を集中させるか、または私たちの財務的予想に適合しないマーケティング製品を許可または購入することを選択することができます。したがって、我々は、実行可能な商業製品または利益の市場機会を利用することができず、他の潜在的製品または他の疾患を追求する機会を放棄または延期することが要求される可能性があり、これらの製品または疾患は、後により大きな商業的潜在力を有することが証明される可能性があり、または、私たちが独占的に開発および商業化する権利を保持することが有利である場合、協力、許可または他の特許権使用料によって、そのような潜在的製品の貴重な権利を放棄することは、私たちの業務、財務状況、および運営結果に悪影響を及ぼす可能性がある。
特定の製品または適応を追求するために限られた資源がかかる可能性があり、より利益または成功の可能性の高い製品または適応を利用することはできない。
私たちの財務と管理資源が限られているため、私たちは私たちが決定した特定の適応の研究計画と製品に集中している。したがって、私たちは他の製品を探す機会を放棄したり、後でより大きな商業潜在力を持っていることが証明された他の兆候を探す機会を放棄したり延期したりするかもしれない。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会をタイムリーに利用できないかもしれない。私たちの現在と未来の特定の適応に対する研究開発計画と製品への支出はいかなる商業的に実行可能な製品も生じないかもしれない。もし私たちが特定の製品の商業的潜在力や目標市場を正確に評価していなければ、私たちは協力、許可、または他の特許権使用料によって製品の貴重な権利を放棄することができ、私たちがその製品の独占開発権と商業化権利を保留すれば、より有利になるかもしれない。
私たちは製品責任クレームのリスクに直面しており、これは費用が高く、経営陣の注意を分散させ、私たちの名声と業務を損なう可能性がある。私たちは十分な製品責任保険を維持できないかもしれない。
私たちの業務は私たちを医療機器テスト、製造とマーケティング過程に固有の製品責任クレームリスクに直面させます。このようなリスクは、設備がFDAによって商業販売のために承認または承認されたり、外国司法管轄区域で承認または認証されたりしても、FDAまたは適用される外国規制機関の許可および規制された施設で生産されるリスクがある。私たちの製品は重要な身体機能と過程に影響を与えることを目的としています。私たちの製品の未来のどんな強化も重要な身体機能と過程に影響を与えるように設計されます。私たちの製品に関連するどんな副作用、製造欠陥、誤用、または乱用は、患者の負傷または死亡を招く可能性がある。医療機器業界は歴史上製品責任クレームによって広範な訴訟を受け、著者らは製品責任訴訟に直面する可能性がある。もし私たちの製品が表面的に患者の損傷や死亡をもたらした場合、私たちは製品責任クレームの影響を受けるかもしれません。また、私たちのサプライヤーの活動によるダメージは、部品や原材料を提供してくれるサプライヤーのように、私たちにクレームする根拠になる可能性があります。製品責任クレームは、患者、医療提供者、または販売または他の方法で私たちの製品に接触した他の人によって提出される可能性があります。もし私たちが製品責任クレームで自分を弁護することに成功できなければ、私たちは重大な責任と名声の損害を招くだろう。さらに、製品責任クレームは、是非曲直や最終結果にかかわらず、以下のようになる可能性がある
•私たちの主な業務に対する管理職の関心を分散させる
•私たちの製品を商業化して私たちの製品を改善することはできません
43
さらに、製品の材料設計や製造故障、品質システムの故障、他の安全問題、または一部の製品をリコールするためのより厳しい規制審査が必要となる可能性があります。私たちは自発的にリコールしたり、市場から欠陥のある製品を撤回したりすることで、私たちの製品責任リスクを管理しようとするかもしれませんが、私たちの製品に対するいかなるリコールや市場撤回も、私たちの顧客へのこれらの製品の供給を遅延させ、私たちの名声に影響を与える可能性があります。我々は、将来必要となる可能性のある適切な市場リコールや市場撤退努力を成功させることができない可能性があり、これらの努力は、製品の故障やそれに伴う製品責任を防止するために期待される効果を生じない可能性がある。このようなリコールおよび撤回は、私たちの競争相手によって、私たちの安全名声を損なうために使用される可能性があり、または私たちの製品の使用を考慮する際に患者によって安全リスクとみなされる可能性があり、両方とも、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
適切と思われる製品責任保険と臨床研究責任保険がありますが、この保険は賠償免除額と保険範囲の制限を受けています。私たちの現在の製品責任保険は引き続き受け入れ可能な条項で私たちに提供されないかもしれません。もしあれば、保証範囲は私たちを未来のいかなる製品責任クレームから保護するのに十分ではないかもしれません。許容可能なコストまたは許容可能な条項で保険を受けることができない場合、または潜在的な製品責任クレームに対して他の方法で保護を提供することができなければ、私たちは重大な責任に直面する可能性がある。製品責任クレーム、リコール、または未保険負債または保険負債金額を超える他のクレームは、当社の業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性があります。また、このような製品責任問題は、将来的に保険範囲または費用効果のある保険範囲を得る能力に悪影響を及ぼす可能性がある。
業界動向は、医療サービスや製品の価格下振れ圧力を増大させ、現在の業務戦略を支援するために必要な価格で製品を販売する能力に影響を与える可能性がある。
購買意思決定と業界統合をまとめることで医療コストを抑える傾向や,管理型医療組織の発展により,より費用対効果のある医療療法の提供が重視されるようになってきている。例えば:
•医療機関と医療機器購入者の間に統合が見られ,特に米国では。このような統合の結果の1つは、共同購入組織(GPO)、総合配信ネットワーク、大型単一口座がその市場力を利用して調達決定を統合することであり、これは医療保健提供者と他の業界参加者に製品とサービスを提供する競争を激化させ、より大きな価格設定圧力を招き、いくつかのサプライヤーを重要な細分化市場から除外することである。例えば、いくつかのGPOはそのメンバー病院のために価格設定を交渉し、いくつかの製品に割引を提供したり、価格を向上させる能力を制限したりすることを要求している
•外科医はますます独立した外来診療所から病院と他の大きな医療保健機関の雇用或いは従属関係に転換し、これは外科医師の製品選択を機関提供者の価格敏感性と一致させ、定価圧力を増加させた。病院および保健機関は、固定価格式および頭文字および構造定価を含む保健コストを制御するために、その契約に新しい価格設定構造を導入し続けることが可能である
•ある病院は医師に財政激励を提供し、病院コスト(収益共有と呼ばれる)を下げ、医師の効率(医師概況と呼ばれる)を奨励し、医療保健サービスと商品提供業者とパートナーシップを構築してコストを下げることを奨励する
•国内および国際市場では、既存かつ提案された法律、条例および業界政策規範、または販売およびマーケティング慣行および保健業界会社の定価および収益性の規制を強化しようとしている
44
より広く言えば、“平価医療法案”(ACA)の条項は、米国の医療保健の発展と提供方式に深刻な影響を与え、私たちの業務や運営結果に悪影響を及ぼす可能性がある。最終的に連邦や州レベルで実施される医療計画や法規、あるいはアメリカや他の場所で将来任意の立法や法規の影響を正確に予測することはできない。しかしながら、政府医療計画および他の第三者支払者の減少に影響を与えるいかなる影響も、我々の製品を使用するプログラムの精算または医療プログラム量の減少の変化は、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。支払人が私たちの製品を顧客に精算する金額のいかなる低下も、顧客が私たちの製品を使用し続けたり、採用したりすることを困難にし、追加の価格設定圧力をもたらす可能性があります。もし私たちが製品価格を下げることを余儀なくされたら、あるいはシステムでより多くのコンポーネントを増加させれば、私たちの毛金利は低下し、これは私たちの投資と業務を発展させる能力に悪影響を及ぼすだろう。もし私たちが私たちの価格を維持できないなら、あるいは私たちのコストが増加すれば、私たちは私たちの価格上昇でこの成長を相殺することができなくて、私たちの利益率は侵食されるかもしれない。
また、複数の製品フランチャイズ権を有する最大の医療機器会社は、大量割引や長年の手配を提供することによって、フランチャイズの顧客との契約を利用して広く締結する努力を強化しており、これらの手配は、これらの顧客に接触することを阻止したり、価格競争を困難にしたり不可能にしてしまう可能性がある。
独立販売代表および任意の他のコンサルタント、任意の未来のサービスプロバイダおよび他のサプライヤーを含む当社の従業員および独立請負業者は、規制基準および要件を遵守しないことを含む不適切な行為または他の不適切な活動に従事する可能性があり、これは私たちの運営結果に悪影響を及ぼす可能性があります。
私たちは、独立販売代表および任意の他のコンサルタント、任意の将来の商業協力者、および他のサプライヤーが不正行為または他の不正活動に従事する可能性があるリスクを含む、当社の従業員および独立請負業者に直面しています。これらの当事者の不正行為は、連邦、州、現地または外国の法律および法規、ならびにFDAなどの規制機関の法律、法規および規則に違反する故意、無謀および/または不注意な行為、または連邦、州医療詐欺および乱用、データプライバシー法および他の同様の非米国法、または財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む可能性がある。従業員や他の第三者の不正行為を常に識別し、阻止することができるわけではなく、このような活動を発見し、防止するための予防措置は、未知または管理不可能なリスクや損失を効果的に制御することができないか、またはそのような法律や法規を遵守できないことによる政府調査または他の行動または訴訟から私たちを保護することができない可能性がある。さらに、私たちは、一人や一人の政府が、起こらなくても、このような詐欺や他の不適切な行為を告発する可能性があるというリスクに直面している。もし私たちにこのような訴訟を提起した場合、私たちは私たちの権利を弁護したり、維持することに成功しませんでした。これらの訴訟は、重大な民事、刑事および行政処罰、損害賠償、金銭的損害、罰金、引き渡し、Medicare、Medicaidおよび他の米国または非米国保健計画に参加することから除外される可能性があり、他の制裁、監禁、契約損害、名声損害、利益減少、および将来の収益減少、および私たちの業務縮小を含む、私たちの業務および財務結果に重大な影響を与える可能性があります, いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります。
行政、組織、商業運営と成長に関連するリスク
病院、外来手術センター、他の医療機関が私たちの製品の使用を許可しなければ、私たちの売上は増加しないかもしれません。
足部や足首の専門家が病院,外来手術センター,他の医療機関で我々の製品を使用するためには,通常これらの病院,外来手術センター,医療機関の承認を得る必要がある。通常,病院,外来手術センター,医療機関は施設で使用されている製品の相対的な有効性とコストを審査する。衛生保健機構の構成と評価手続きの差は非常に大きく、関連する衛生保健機構の承認を得ることは長く、高価で時間のかかる仕事であるかもしれない。また,病院,外来手術センター,他の医療施設,GPOが複数の施設の調達を管理しており,調達契約を締結し,その行政調達プロセスの多くの要素を満たすことが求められる可能性もあり,長く,高価で時間のかかる作業である可能性もある。もし私たちが病院、外来手術センター、他の医療施設の参入を適時に得ることができない場合、あるいは彼らの承認や購入契約手続きを全く通過できない、あるいは他の方法、あるいは適時に承認を得ることができない場合、あるいは全くできない場合、私たちの運営コストは増加し、私たちの売上は低下する可能性があり、私たちの運営結果は不利な影響を受ける可能性がある。また,これらの高価で時間のかかる流れに多大な労力を費やす可能性があるが,これらの病院,外来手術センター,医療施設,GPOから必要な承認や調達契約を得ることができない可能性がある。
45
もし私たちが病院施設に入れなければ、私たちの売上は下がるかもしれない。
アメリカでは、医者に私たちの製品を使用させるために、これらの医者が患者を治療する病院施設は通常私たちに調達契約を締結することを要求すると予想されています。この過程は長くて時間がかかるかもしれないし、広範囲な交渉と管理時間が必要だ。欧州連合(EU)では、特定の機関が司法管轄区域によって異なる指定されたコストハードルを超える購入約束をすることを考えている場合、契約入札手続きに参加することを要求するかもしれない。このような過程は特定の期間だけ開放され、私たちは入札過程で成功しないかもしれない。もし私たちがこれらの請負手続きや他の方法で病院施設に入ることができなければ、あるいは契約や落札を得ることができなければ、私たちの売上は下がる可能性があり、私たちの経営業績は損なわれる可能性があります。また,これらの時間のかかる過程に多大な労力を費やす可能性があるが,これらの病院から調達契約を得ることができない可能性がある。
運送会社の性能問題、サービス中断、または価格上昇は、私たちの業務に悪影響を与え、私たちの名声と適時に製品を提供する能力を損なう可能性があります。
迅速で信頼できる輸送は私たちの運営に必須的だ。私たちは輸送サービス提供者に大きく依存して、私たちの製品の信頼性と安全な場所を私たちの顧客に輸送し、これらの輸送を追跡するつもりです。もし運送業者が製品の紛失、破損あるいは破損などの納品性能の問題に遭遇した場合、適時に私たちの製品を交換するのに費用がかかり、私たちの製品を使用する手術が延期またはキャンセルされる可能性があり、このような事件は私たちの名声を損なう可能性があり、私たちの製品に対する需要が減少し、私たちの業務のコストと支出を増加させる可能性がある。また、運賃の大幅な向上は、私たちの運営利益率や運営結果に悪影響を及ぼす可能性があります。同様に、ストライキ、悪天候、自然災害、または私たちが使用する配送サービスに影響を与える他のサービス中断は、製品の注文をタイムリーに処理する能力に悪影響を与えます。
私たちの製品を入手または維持することができない場合、または私たちが商業化を求める可能性のある任意の未来の製品の手続きの第三者支払者が提供する保険または十分な精算レベルが得られなければ、足首の専門家および患者は私たちの製品を使用したくない可能性があり、私たちの業務は影響を受けるだろう。
アメリカでは、私たちの製品を購入する医療提供者は通常第三者支払者に依存しており、主に連邦政府が援助したMedicare、州政府が援助したMedicaidと個人健康保険計画であり、足と足首手術、およびこれらの手術で使用された製品の全部または一部の費用を支払う。第三者支払者が私たちの製品を使用するプログラムの現在の精算レベルを保証または低下させることを拒否した場合、利益に基づいて私たちの製品を販売することができないかもしれませんし、商業化された任意の未来の製品を求めることができないかもしれません。支払者は、その既存および新しい療法の保証政策を検討し続け、私たちの製品の使用、または商業化を求める可能性のある任意の未来の製品を含む治療保証を拒否する可能性がある。第三者決済者は,外国でも国内でも,政府のも商業的にも,ますます複雑な方法を開発して医療コストを抑えている。また,我々の解決策を用いた手続きは,第三者支払者に統一された保証範囲や精算政策はない.そのため、私たちの製品を使ったプログラムの保証範囲や精算範囲は支払人によって異なる可能性があります。
さらに、米国のいくつかの医療提供者は、提供者が固定された一人当たりの費用で包括的な保健サービスを提供する契約を結んでいる支払い方法および/または管理保健システムをバンドルすることを検討している。ヘルスケア提供者は、足部および足首手術を含む、より少ない選択的手術を許可することによって、コストを制御しようと試みるか、または利用可能な最も安価な手術の使用を要求するかもしれない。また,第三者決済者は医療機器がコスト効果があることを証明することを要求することが増えており,この要求を満たすことができなければ,第三者支払者が我々の製品を使用する手続きをカバーしない可能性があり,第三者支払者の精算に依存した医療提供者への我々の製品の販売を減少させる可能性がある。保険政策や医療コスト制御計画の変化を制限したり、わが製品を使用するプログラムの精算を制限したりすることは、私たちの業務に悪影響を及ぼす可能性があります。
米国以外では,国によって患者の精算レベルが大きく異なる。精算源は様々であり、政府スポンサー、病院予算、公開入札/入札、個人健康保険計画あるいはそれらの組み合わせを含む。私たちは参加して適用されなければならない国で適切な市場アクセスを確立した。将来の医療政策、法律、法規の不確実性、および私たちの特定の製品の使用を禁止する可能性のある個人市場のやり方や外国法規は、商業的に許容可能な数量で製品を販売する能力に影響を与える可能性がある。
46
私たちの大部分の販売チームは独立した販売代表で構成されています。もし私たちの独立販売代表ネットワークを維持して拡大できなければ、予想される売上を生み出すことができないかもしれません。
私たちの収入と収益力は私たちの販売チームの販売とマーケティング努力に直接依存しています。私たちは主に独立販売代表からなる販売チームを利用して、外科医、病院、診療所、足と足首の専門家と他のエンドユーザーに私たちの製品を販売し、私たちの製品とプログラムに対する市場の受け入れを促進し、これらの製品とプログラムに対する需要を作るのを助けてくれます。私たちがマーケティングに力を入れるにつれて、私たちは私たちが雇用している販売代表の数を保留し、発展させ、増加させる必要があります。私たちの業務の拡大に伴い、販売代表の募集と育成、臨床代表の育成に大量の資金を投入する予定です。関連医療機器販売経験のある販売者に対する競争は非常に激しい。1人以上の販売代表と合理的なビジネス条項を達成できなければ、予想される販売レベルを生成することができず、従業員として販売員を雇用するためにより多くの資本資源が必要になる可能性がある。採用されると、訓練過程は長いかもしれません。新しい販売代表に対して大量の訓練を行う必要があり、足部と足首専門家の著者らの製品に対する臨床能力レベルに達する必要があるからです。研修を終えた後、私たちの販売代表は通常、彼らの顧客ネットワークを拡大し、どの地域でも達成することを期待している作業効率レベルに達するために、現場で準備時間を提供する必要がある。さらに、私たちの製品を使用することは、通常、私たちが手術室で助けを提供する販売代表を含む、私たちの直接支援を必要とするか、または利益を得る。
もし私たちが販売チームを拡大して訓練する努力が相応の収入増加を生むことができなければ、私たちの固定コスト上昇は、製品需要が突然低下した場合にコストを下げる能力を遅らせる可能性があり、これは私たちの業務、財務状況、運営結果にマイナスの影響を与えるだろう。才能のある販売員を募集、育成、維持することができなければ、合理的な時間内に予想される生産性レベルに達したり、適時に固定コストを下げたりすることができなければ、すべて私たちの業務、財務状況と運営結果に負の影響を与える可能性がある。
私たちがより多くの販売代表を引き付けることができても、私たちの販売代表が私たち独自のものではない場合、私たちと契約した販売代表は、私たちの製品と直接競争する製品を含む他の医療機器会社の製品を優先することができ、あるいは大きな医療機器会社に私たちの製品の提供を停止することを要求される可能性があります。私たちは私たちの独立販売ルートを私たちの製品にさらに集中させる計画を立てていますが、これらの計画は私たちが期待している売上高や浸透率の増加に転化しないかもしれません。販売代表が必要な資源を投入することは保証されず、私たちの製品に効果的な販売促進支援を提供します。また、競争相手の販売代表を招聘すれば、適用される競業禁止条項や義務が満了するまで待たなければならないかもしれません。それにもかかわらず、私たちは未来にこのような新入社員が不当に募集され、その前の雇用主の独自または他の機密情報を漏らしたという疑惑を受ける可能性がある。また、経験のある販売者市場の競争が激しいため、私たちの競争相手は私たちの販売代表を採用しようとするかもしれません。成功すれば、私たちはこのような欠員を募集、補填、訓練するために特別に要求されるだろう。これらの人員が競争相手の手に流出したり、他の方面に流出したりすることは、私たちの業務、財務状況、運営結果にマイナスの影響を与えるだろう。もし私たちの直販者を維持したり、同等の技術専門と資質を持つ人員で彼らの代わりにすることができなければ、あるいは私たちが代替者にこのような技術専門長を注入することに成功できなければ、これは私たちの業務に否定的な影響を与えるかもしれない, 財務状況と経営結果。
私たちは、当社の足首製品を構成するすべての要素を生産および包装するために第三者契約製造業者およびサプライヤー(その中のいくつかは単一源)に依存しており、これらのサプライヤーおよび製造業者が私たち、私たちの製品またはそのコンポーネントまたはサブコンポーネントに十分な数量または全く供給を供給できない場合、私たちの業務、財務状況、および運営結果に実質的な悪影響を与えるだろう。
私たちは合格した医療機器契約メーカーとサプライヤーを利用して、その中のいくつかは単一源で、私たちの足と足首製品を構成するすべての要素を生産と包装します。私たちの重要な単一サプライヤーは、私たちのGorilla電気めっきシステムで使用されている部品を供給するTech Metalsを含み、QTSは、私たちの複数の製品に洗浄、包装、消毒サービスを提供します。3 D Systemsは、APEX 3 D全足関節置換システムで使用される部品を提供します。Seaway、私たちのドリルガイドレールの部品を提供します。蘭、Apex Talusインプラントで使用されている部品を提供します。これらの単一ソースの供給者を交換するのに約6ヶ月かかる可能性があると予想されるが、いくつかの例では、代替の第2のソース供給者は容易に入手できない可能性がある。私たちは、供給中断を緩和し、通常、サプライヤーを失ってから90~180日以内に製造して、異なる需要の組み合わせに適応し、私たちの部品に対してより効率的な量産価格を実現するために、戦略的に十分な在庫レベルを維持することを求めています。しかし、私たちの推定は正確ではないかもしれません。これは、在庫不足や在庫過剰、在庫の古いおよび期限切れのリスクを招く可能性があります。また、サプライチェーンの強化に努めるためにいくつかの供給契約を締結していますが、取引相手供給商会がこれらの合意の条項を遵守する保証はありません。
47
私たちのサプライヤーは、特定の合意および手順に従わなかったこと、適用された法律および法規の要件を遵守できなかったこと、設備の故障および環境要因、自分の業務を正しく処理できなかったこと、および第三者の知的財産権を侵害することなど、様々な理由で問題に遭遇する可能性があり、これらのいずれも、私たちの要求を満たす能力を遅延または阻害する可能性がある。私たちの第三者製造業者と第三者サプライヤーへの依存はまた私たちを他のリスクに直面させます。これらのリスクは私たちの業務を損なう可能性があります。もし私たちが自分で製品を製造すれば、私たちはこれらのリスクの影響を受けません
•私たちは私たちの多くのサプライヤーの主要な顧客ではないかもしれないので、これらのサプライヤーは私たちより他の顧客の需要を優先するかもしれません
•第三者は私たちのサプライヤーに対する彼らの知的財産権を脅したり強制したりする可能性があり、これは輸送中断や遅延を招く可能性があり、あるいは私たちのサプライヤーに私たちとの業務往来を停止させる可能性があります
•私たちはタイムリーにあるいは商業的に合理的な条件で十分な部品供給を得ることができないかもしれない
•私たちのサプライヤー、特に新しいサプライヤーは、製造過程でエラーが発生し、それによって私たちの製品の有効性や安全性に負の影響を与え、あるいは出荷遅延を招く可能性があります
•代替供給者を見つけて鑑定するのは難しいかもしれません
•部品やサプライヤーを交換するには、製品を再設計する必要があり、FDA、通知機関、または他の外国規制機関に提出される可能性があり、これは私たちの商業活動を深刻に阻害または延期する可能性がある
•私たちの1つまたは複数の単一ソース供給者は、私たちの製品のコンポーネントを望んでいるか、または供給できないかもしれません
•他の顧客は、サプライヤーの使用を阻害するために、公平または不公平な交渉戦略または圧力を使用するかもしれない
•火災、自然災害、または他の災害、またはウクライナとロシアの間の戦争のような地政学的衝突が発生し、それによって引き起こされる任意の制裁または他の行動は、私たちの1つまたは複数のサプライヤーに影響を与え、彼らが直ちに私たちに製品を渡す能力に影響を与える可能性がある
•新冠肺炎の影響は運営能力を制限することによって、あるいは製造過程に参加する肝心な従業員を傍観させることによって、彼らが適時に私たちに製品を渡す能力に影響し、それによって製造施設に影響を与える可能性がある
•私たちのサプライヤーは私たちの需要とは関係のない財務や他の業務の困難に直面する可能性があり、これは彼らが私たちの注文を履行し、私たちの要求を満たす能力を抑制するかもしれない
•私たちのサプライヤーは私たちの固有の情報を秘密にしないかもしれない;そして
•垂直統合された会社に比べて、製造と製品コストが高い
これらの要因のいずれも、商業化およびマーケティング、規制提出または必要な承認、許可または認証の遅延または一時停止をもたらす可能性があり、またはより高いコストを発生させる可能性がある。また、契約メーカーが必要な商業数量の完成品を商業的に合理的な価格で納入できず、実質的に同じコスト、実質的に同じ生産量、品質でタイムリーに生産できる1つ以上の代替メーカーを見つけることができない場合、私たちの製品に対する需要を満たすことができない可能性があり、潜在的な収入を損失します。第三者製造業者を探して雇用する上でのいかなる困難、または私たちの製品を必要とする時間と数量の供給能力に関する第三者メーカーのいかなる困難も、私たちの業務に実質的な悪影響を及ぼす可能性がある。我々の製品のための代替供給源を確立し、FDAまたは外国規制機関または通知機関の許可を得るために、大量の時間および資源(コストを含む)が必要となる可能性がある。私たちのいくつかの単一ソース供給者への依存を考慮して、私たちは現在供給者を代替していないので、特に供給不足の影響を受けやすい。
また、現在の法律と規制環境を踏まえると、国別プライバシーやデータセキュリティリスクのほか、一部の第三者がいる市場は政治的·社会的リスク、腐敗、インフラ問題、自然災害に直面している。第三者がその契約、法規、その他の義務を履行できなかったことは、私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性があります。これらの事項のいずれも、私たちの業務、財務状況、および経営結果に実質的な悪影響を及ぼす可能性がある。
48
お客様の私たちの製品に対する需要を正確に予測し、私たちの在庫を管理できなければ、私たちの運営結果は実質的な損害を受けることになります。
私たちが販売している製品の種類が多く、数量が多いことから、これらの製品を効果的にマーケティングと販売するためには、大量の在庫と手術器械を維持しなければなりません。したがって、私たちが運営に使用している大量の現金は、このような在庫水準を維持することと関係がある。十分な在庫供給を確保するためには、在庫需要を予測し、将来の需要の見積もりに基づいて私たちの製品を生産しなければなりません。私たちは私たちの製品の需要に対する能力が多くの要素のマイナス影響を受ける可能性があることを正確に予測して、私たちは私たちの拡張戦略、競争相手の製品の発売、顧客の私たちの製品或いは競争相手製品に対する需要の増加或いは減少、私たちは顧客の新製品に対する受け入れ程度、全体的な市場状況或いは監督事項の意外な変化及び経済状況或いは消費者の未来の経済状況に対する自信の弱まることを正確に予測できなかった。在庫水準が顧客の需要を超えると在庫出荷や打ち抜きを招く可能性があり、これは私たちの毛金利に悪影響を与え、私たちのブランド力を損なう可能性があります。逆に、私たちの製品に対する顧客の需要を過小評価していれば、私たちの内部製造チームは私たちの要求を満たす製品を渡すことができないかもしれません。これは私たちの名声と顧客関係を損なう可能性があります。また、私たちの需要が大幅に増加すれば、必要に応じて、私たちが受け入れられる条項で追加の原材料供給または追加の製造能力を提供できない可能性があり、あるいはサプライヤーやサプライヤーが私たちの増加した需要を満たすために十分な生産能力を割り当てることができない可能性があり、これは私たちの業務、財務状況、運営結果に悪影響を及ぼすだろう。
私たちは供給中断から身を守るために十分な在庫レベルを維持することを求めている。したがって、私たちは在庫の一部が時代遅れまたは期限切れになるリスクに直面しており、これは在庫の古い費用とそのような在庫の交換に必要なコストに関連するコストのため、私たちの収益やキャッシュフローに大きな悪影響を及ぼす可能性がある。
私たちは第三者と協力、許可手配、合弁企業、戦略連合、またはパートナーシップを行う可能性があり、これらの協力、許可手配、合弁企業、戦略連合、またはパートナーシップは、商業可能性のある製品の開発、製品の改善、または相当な将来の収入をもたらすことはないかもしれない。
私たちの正常な業務過程で、私たちは新製品を開発したり、製品を改善したり、新しい市場を求めたりするために、協力、許可手配、合弁企業、戦略連合、パートナーシップ、または他の手配を行うことができる。提案、交渉、協力、許可手配、合弁企業、戦略連合、またはパートナーシップの実施は長く複雑な過程である可能性がある。他の会社は、より多くの財務、マーケティング、販売、技術、または他の業務資源を持っている会社を含み、これらの機会や手配を競争してくれるかもしれません。私たちは、費用対効果に基づいて、許容可能な条項または根本的に不確実で、そのような取引または手配をタイムリーに、保証または完了しないかもしれない。これらの業務発展活動における機関の知識や経験は限られており、このような取引や手配の期待的なメリットを実現することもできないかもしれません。特に、これらの協力は、商業成功または実行可能な製品の改善または大量の収入をもたらす製品の開発を招くことなく、任意の製品を開発する前に終了する可能性がある。
さらに、私たちは取引や計画に対して唯一の意思決定権を行使できない可能性があり、これは意思決定が行き詰まっている潜在的なリスクをもたらす可能性があり、私たちの将来の協力者は私たちの商業的利益や目標と一致しない、または一致しなくなる可能性のある経済的または商業的利益または目標を持っているかもしれない。業績マイルストーンを達成することに関する衝突、または協力中に形成される財務的義務または知的財産権の所有権または制御権に関連する用語のような任意の合意の下で重要な用語の解釈など、我々の協力者と衝突する可能性がある。もし未来の協力者とどんな衝突があれば、彼らは自分の利益のために行動するかもしれないし、これは私たちの最良の利益に反するかもしれないし、彼らは私たちに対する彼らの義務に反するかもしれない。さらに、私たちは、任意の未来の協力者が私たちまたは彼らの未来の製品に投入する資源の数と時間を限られた制御をすることができる。
49
私たちと私たちの協力者との間の紛争は訴訟や仲裁を招く可能性があり、これは私たちの費用を増加させ、私たちの経営陣の注意をそらすだろう。さらに、このような取引およびスケジュールは契約特性に属し、一般に適用されるプロトコルの条項に従って終了することができ、この場合、吾等は、そのような取引または手配に関連する製品を所有する権利を継続することができない場合があり、またはそのような権利をプレミアムで購入する必要がある可能性がある。もし私たちが入国式知的財産権許可協定を締結すれば、私たちは許可された知的財産権を完全に保護したり、これらの許可を維持することができないかもしれない。将来のライセンス者は、私たちが許可された知的財産権を提訴して擁護する権利を保持することができ、この場合、私たちは、許可された知的財産権の知的財産権保護を取得、維持、実行する能力に依存する。これらの許可者は、他社に訴訟を提起しないことを決定したり、私たちのように積極的に訴訟を提起しないかもしれません。さらに、このようなライセンス契約を締結することは、様々な職務調査、商業化、特許権使用料、または他の義務を負わせる可能性があります。将来のライセンス側は、私たちが彼らとのライセンス協定に違反していると主張し、したがって、私たちの許可を終了することを求めることができ、これは私たちの競争業務の地位に悪影響を与え、私たちの業務の将来性を損なう可能性があります。
私たちは、新しいまたは相補的な業務、製品または技術に買収または投資することによって、第三者または他の戦略連合から製品または技術の許可を得ることによって業務成長を実現することを求めることができ、買収、投資、許可または他の戦略連合を管理できない場合、または既存の業務と統合できない場合、私たちの経営業績に重大な悪影響を与え、私たちの株主所有権を希釈し、私たちの債務を増加させ、または私たちに大きな支出をもたらす可能性がある。
私たちの成功は絶えず変化する臨床医師と患者の需要、競争技術と市場圧力に対応するために、私たちの製品供給を絶えず強化し、拡大することにかかっている。したがって、私たちは時々買収、投資を考慮して、私たちの能力を強化し、私たちの既存の製品と技術を補充したり、私たちの市場や顧客基盤の広さを拡大したりするために、他の技術、製品、および業務を考慮することができるかもしれない。例えば2022年初頭にDisior Oyを買収しました今回の買収の潜在的なメリットを実現し、資産を統合する能力は成功しないかもしれないし、予想されたスケジュールでは実現されないかもしれない。潜在的かつ完了した買収、戦略投資、許可証、および他の連合は、多くのリスクを含む:
•取得または許可された技術、製品、従業員、または業務運営を吸収または統合することは困難である
•統一された基準、手続き、統制、そして政策を維持する問題;
•未知または負債を負担すること、および債務を生成すること、または将来の無形資産または営業権をログアウトすることを含む、買収または戦略同盟に関連する意外な費用;
•私たちの中核業務に対する管理職の注意を移し、進行中の運営を混乱させる
•サプライヤー、販売代表、保健機関、足と足首の専門家、および他の保健提供者との既存の業務関係に悪影響を及ぼす
•私たちの経験が限られているか経験のない新しい市場に入ることに関連するリスク
•任意の目標の予期されていないまたは開示されていない負債;
•買収やコンプライアンスに関連した法律と会計コストが増加する
適切だと思う買収や戦略関係を決定することができるかどうか、有利な条件でこのような取引を成功させることができるかどうか、または任意の買収された業務、製品または技術を私たちの業務に統合すること、または任意の重要な人員、サプライヤー、販売代表、医療施設、外科医、または他の医療提供者を維持することができるかどうかを知ることができるかどうか。私たちが戦略取引を通じて成功的な成長を達成する能力は、適切な目標業務、技術または製品、および必要な融資を得る能力を識別、交渉、完成、統合する能力に依存する。これらの努力は高価で時間がかかる可能性があり、私たちが行っている業務を混乱させ、経営陣が私たちの運営に集中できないかもしれない。
もし私たちがいかなる海外買収を求めるならば、上記のリスクに加えて、それらは通常、異なる文化、言語、法律、規制環境にまたがる業務統合に関するリスク、為替レートリスク、および特定の国に関連する特定の経済、政治、規制リスクを含む独特のリスクに関連する。
50
いかなる買収、投資、または戦略連合に資金を提供するために、私たちは対価格として普通株を発行することを選択する可能性があり、これは私たちの株主の所有権を希釈するかもしれない。もし私たちの普通株価格が低いか変動が大きいなら、私たちは私たちの普通株を犠牲にしていかなる買収、投資、あるいは戦略連合を完成させることができないかもしれない。追加的な資金は私たちに有利な条項で提供されないかもしれないし、全くそうではないかもしれない。
私たちは私たちのブランドを構築したり強化することができないかもしれない。
Paragon 28とSmart 28を含む様々な足と足首手術ブランドを確立し、強化することは、私たちの足と足首製品と手術の広範な受け入れを実現するために非常に重要であり、特に類似製品の市場競争が非常に激しいためであると信じている。私たちの製品の品質と信頼性はアメリカと海外で足と足首製品と解決策のための医師の支持を確立するために重要であり、私たちの製品とプログラムの品質や信頼性に関する負の宣伝は私たちの市場での名声を深刻に損なう可能性があると信じています。業務を展開する過程で、製品に含まれる第三者コンポーネントの欠陥を含む製品に起こりうる品質問題を十分に解決しなければならない。品質問題が生じる可能性のあるリスクを最大限に低減するために内部手続きを構築しているが、これらの問題や関連責任の発生を解消または減少させることができない可能性がある。また,品質に問題がない場合でも,我々の製品性能が医師や患者の期待に適合していなければ,クレームや責任の制約を受ける可能性がある。
また、私たちのブランドを普及と定位することは、私たちの医学教育努力の成功と、足と足首の専門家と患者を教育する能力に大きく依存する。これらのブランド普及活動は販売増加をもたらさない可能性があり、あっても、どの販売増加もブランドを普及させるための私たちの費用を相殺できないかもしれない。もし私たちがブランドの普及と維持に成功しなかった場合、あるいは私たちが私たちのブランドを普及して維持する試みに失敗した時に巨額の費用が発生した場合、私たちの足と足首の解決策は医者や患者に受け入れられないかもしれません。これは私たちの業務、手術結果、財務状況に悪影響を及ぼすでしょう。
私たちは医療専門家と契約関係を保つことができず、これは私たちの研究開発と医学教育プロジェクトに負の影響を与えるかもしれない。
著者らは病院、個人診療所と大学で尊敬されている医師と医療関係者と契約関係を維持し、彼らは臨床研究、製品研究と開発に協力し、そして私たちの製品を安全かつ有効に使用することについて足部と足首の専門家に対して訓練を行った。私たちは引き続き臨床研究、特許製品の開発と製品変更を通じて、私たちの足と足首製品とプログラムのメリットを検証して、私たちの製品ラインを開発し、これらの製品に関する高品質の訓練を提供します。もし私たちがこれらの関係を維持できなければ、私たちは新しい製品と改善された製品を開発·マーケティングし、これらの製品の使用を訓練する能力が低下する可能性があり、将来の経営業績は不利な影響を受ける可能性がある。同時に、医療機器業界と医師の関係はアメリカ衛生と公衆サービス部監察長事務室(OIG)、アメリカ司法省(DOJ)、州総検察長とその他の国内外の政府機関の日々の厳格な審査を受けている。私たちは業界と医師関係の要求を守らない、あるいはOIG、アメリカ司法省、州総検事、他の政府機関が私たちのコンプライアンスを調査して、私たちの業務、財務状況、運営結果にマイナスの影響を与える可能性があります。“リスク要因-規制事項に関連するリスクを参照してください-私たちと顧客、足首専門家、および第三者支払者との関係は、連邦および州医療詐欺および乱用法律、虚偽クレーム法律、医師支払い透明性法律、および他の医療法律法規によって制限されています。私たちまたは私たちの従業員、独立請負業者、コンサルタント、ビジネスパートナー、またはサプライヤーがこれらの法律に違反した場合、私たちは巨額の処罰に直面する可能性があります
足部や足首の専門家や主要なオピニオンリーダーに競争相手に対する製品や技術の利点を示し続けることはできない可能性があり,我々の製品や技術を看護基準として確立し,市場に認められることが困難になる可能性がある。
足部と足首の専門家は治療過程の確定及び最終的に患者の製品タイプを治療する上で主要な役割を果たしている。したがって、私たちの成功は、足部と足首の専門家に効果的にマーケティングし、競争相手に対する私たちの製品および方法の利点を示す能力に大きく依存する。私たちの製品と方法を受け入れるかどうかは足部と足首の専門家を訓練することに依存して、彼らに私たちの製品、プログラムと技術が競争相手と比べた独特の特徴、臨床効果、安全性とコスト効果、及び足部と足首の専門家を訓練して私たちの製品を正確に使用することを理解させます。足と足首の専門家が私たちの製品と方法の利点を信じるように説得することができなければ、あるいは彼らに私たちの製品を使用するように教育することができなければ、彼らは私たちの製品を使用しないかもしれません。あるいは私たちの製品を有効に使用できないかもしれません。私たちは私たちの売上を増加させ、私たちの成長を維持し、あるいは利益を達成し、維持することができないかもしれません。
51
さらに、私たちの多くの足と足首のプログラムと製品は新しいので、いくつかの足と足首の専門家は彼らの外科的治療方法を変更したくないかもしれません
•競合他社と競争力のある製品を販売する流通業者との既存の関係;
•追加的な患者福祉を支援する証拠が不足していることや感覚が不足している
•通常、新製品およびプログラムの使用に関連する責任リスクを感知する
•第三者支払者が提供する保険および補償は、競合製品や他の技術を使用するプログラムと比較して、それほど魅力的ではない
これらの理由は、私たちの足首製品とプログラムの採用速度、そして私たちが提供する可能性のある未来の製品と技術に影響を与えるかもしれません。
また,外科医,足部と足首の専門家,業界の他の主要なオピニオンリーダーによる我々の製品や技術の推薦と支援は,市場が我々の製品やプログラムを受け入れ,看護基準として確立するために重要であると信じている。このような外科医、足首の専門家、および他の主要なオピニオンリーダーの支持を得ていない場合、長期データが私たちの製品およびプログラムを使用する利点を示していない場合、または私たちの製品およびプログラムが提供するメリットがそのコストが合理的であることを証明するのに十分でなければ、足首の専門家、病院、および他の保健機関は私たちの製品を使用しない可能性があり、私たちの製品およびプログラムを看護基準として確立し、市場の承認を受け続けることができないかもしれない。
もし足と足首の専門家が私たちの製品を安全かつ適切に使用できない場合、あるいは足科医と整形外科医を訓練して私たちの製品を安全かつ適切に使用することができなければ、予想される販売、成長、あるいは利益を達成できないかもしれません。
私たちの販売過程の重要な部分は、私たちが足科医と整形外科医を選別して識別する能力を含み、彼らは私たちの製品を安全かつ適切に使用するために必要な訓練と経験を持っていて、十分な数の足と足首の専門家を訓練し、彼らに十分な製品使用指導を提供する。足と足首の専門家は訓練を経て、私たちの製品の安全と適切な使用をマスターすることができます。この訓練過程は予想以上に長い時間を必要とするかもしれない。足部や足首の専門家を説得して必要な時間と精力を投入して適切な訓練を行うことは挑戦的であり,これらの努力に成功しない可能性がある。連邦反リベート法規によると、連邦政府の医学教育プロジェクトに対する指導は最近変化し、これは著者らが足科医師と整形外科医師を訓練する能力を制限する可能性もあり、このようなプロジェクトは連邦反リベート法規の挑戦を受ける可能性がある。“リスク要因-規制事項に関連するリスクを参照してください-私たちと顧客、足首専門家、および第三者支払者との関係は、連邦および州医療詐欺および乱用法律、虚偽クレーム法律、医師支払い透明性法律、および他の医療法律法規によって制限されています。私たちまたは私たちの従業員、独立請負業者、コンサルタント、ビジネスパートナー、またはサプライヤーがこれらの法律に違反した場合、私たちは巨額の処罰に直面する可能性があります
また、臨床医が適切な訓練を受けていなければ、彼らは私たちの製品を乱用したり無効にしたりするかもしれない。私たちの製品に対するいかなる不当な使用も、不満な結果、患者の負傷、否定的な宣伝、あるいは私たちに対する訴訟を招く可能性があり、その中のいずれも私たちの名声を損なう可能性があり、未来の製品販売に影響を与える可能性がある。したがって、足と足首の専門家が私たちの製品を安全かつ適切に使用できない場合、あるいは足と足首の専門家を訓練して私たちの製品を安全かつ適切に使用することができなければ、予想される販売、成長、あるいは利益を達成できないかもしれません。
52
私たちの実行管理チームのどのメンバーの流失、あるいは販売管理、マーケティングチーム、エンジニアの中の高いスキルのメンバーを誘致し、維持することができないのは、私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性があります。
私たちの成功は、私たちの実行管理チームメンバーのスキル、経験、表現、特に私たちの共同創業者、会長、総裁、最高経営責任者アルバート·ダコスタにかかっています。我々が既存製品を商業化し,新製品や技術を開発し,我々のビジネス活動を拡大することに伴い,これらの役員の個人や集団努力が重要となる。もし私たちが合格後継者の採用に困難に直面した場合、私たちの管理チームの既存メンバーの喪失や能力喪失は、私たちの業務、財務状況、運営結果に大きな悪影響を及ぼす可能性があります。私たちは私たちの役員や重要な職員たちに“キーパーソン”保険を提供しない。
私たちの商業、品質と研究開発計画と運営は私たちが高技能チームのメンバーを誘致し、維持する能力にかかっている。私たちは合格したチームのメンバーを引き付けたり維持したりすることができないかもしれない。私たちのすべてのアメリカ人従業員は勝手で、これは私たちまたは従業員がいつでも彼や彼女の雇用関係を終わらせることができるということを意味する。肝心な従業員の流失、いかなる肝心な従業員の表現が良くなく、私たちは必要に応じて技術従業員を吸引と維持することができない、あるいは私たちは有効に肝心な従業員の後継計画を計画と実施することができなくて、すべて私たちの業務、財務状況と運営結果に重大な不利な影響を与える可能性がある。
私たちの知的財産権に関するリスクは
もし私たちまたは私たちのライセンス者が私たちの製品のために重要な特許や他の知的財産権保護を獲得して維持することができない場合、あるいは私たちの特許や他の知的財産権の範囲が十分に広くなく、私たちの製品を十分に保護できない場合、私たちの競争相手は私たちと類似または同じ製品を開発し、商業化する可能性があり、私たちは著しい市場シェアを得ることができず、利益を上げて私たちの業務を運営することができないかもしれない。
私たちの成功は、私たちと私たちのライセンス側が私たちの製品のために独自の地位を獲得し、維持し、強化する能力に大きく依存し、これは、特許、商業秘密、著作権、独自技術、商標、ライセンス契約、および契約条項によって私たちの知的財産権保護を確立し、私たちの製品を保護することを含む、有効な知的財産権保護における私たちと私たちの許可者の成功に依存するであろう。しかし、このような法的手段は限られた保護しか提供できず、私たちの権利を完全に保護できないかもしれない。私たちの製品に関連する特許および他の知的財産権保護を取得または維持できなかったいかなる行為も、私たちの業務、財務状況、および経営結果を損なう可能性があります。
2022年12月31日現在、私たちの特許の組み合わせは、262個の所有および登録された特許と、11個の認可内特許を含む。そのうち56件の特許は米国の公共事業特許だ。2022年12月31日現在、世界で231件の未解決特許出願があり、そのうち74件が米国にあります。米国以外では,我々はヨーロッパ,オーストラリア,カナダ,南アフリカ,ブラジル,日本,および我々のPCT出願(出願中の米国特許出願に計上されている)により出願されている特許を有している。私たちは私たちの知的財産権の地位が挑戦されないという保証もなく、私たちが申請したすべての特許が付与されるという保証もない。特許請求の範囲の有効性および広さは、複雑な法律および事実の問題に関連するため、高い不確実性を有する可能性がある。私たちが直面している不確定要素とリスクは
•私たちの未解決または未来の特許出願は特許の発行を招くことができないかもしれない
•既存または将来の特許保護の範囲は、競争相手を排除したり、競争優位を提供したりしてはならない
•その後挑戦された場合、私たちの特許は有効または強制的に実行されない可能性がある
•私たちの競争相手は特許権のない国で研究や開発活動を行い、これらの活動から学んだ情報を利用して競争力のある製品を開発し、私たちの主要な商業市場で販売するかもしれません
•私たちは他の特許を申請できる独自技術を開発しないかもしれない
•私たちが所有しているまたは許可中の特許出願が発行された特許をもたらすかどうかを含む、私たちの特許出願に基づいて発行される任意の特許の保護範囲を予測することはできない
•我々の特許出願に基づく任意の特許発行の請求項は、競合他社または任意の競争優位性の保護を提供しない場合があり、または第三者の挑戦を受ける可能性がある
53
•いくつかの商業秘密またはノウハウを保護するために特許を出願しないことを選択することができ、第三者はその後、そのような知的財産権をカバーする特許を提出する可能性がある
•私たちは私たちの商標と商業機密を十分に保護して規制することができないかもしれない
•他の当事者は、私たちの製品および設計が他人の独自の権利を侵害していると主張するかもしれない。私たちが私たちの特許および独自の権利を守ることに成功しても、このような訴訟の費用は私たちの業務に悪影響を及ぼす可能性がある
•他の当事者は似たような製品を開発し、私たちの製品をコピーしたり、私たちの特許を中心に設計したりするかもしれません
特許訴訟プロセスは高価で時間がかかり、私たちおよび私たちの許可者は、すべての必要または望ましい特許または特許出願を、合理的なコストまたはタイムリーまたはすべての司法管轄区域で提出、起訴、維持、強制実行または許可することができない可能性がある。我々は、我々の研究開発成果の機密または特許出願可能な態様を取得する権利を有する当事者と秘密および秘密協定を締結しているが、これらの当事者のいずれも、このような合意に意図せず、または故意に違反し、特許出願を提出する前にそのような成果を開示し、特許保護を求めて獲得する能力を危険にさらしている可能性がある。私たちは、特定の革新のために特許保護を求めないことを選択することができ、特定の司法管轄区で特許保護を求めないことを選択することができ、特定の司法管轄区の法律に基づいて、特許または他の知的財産権が入手できないか、または範囲が制限される可能性がある。特許保護を受ける前に,我々が開発した出願可能な特許の態様を識別できない可能性もある.さらに、有効かつ強制的に実行可能な特許を取得して保持する能力は、私たちの発明と従来技術との差が、私たちの発明が従来技術よりも高い特許を得ることを可能にするかどうかにある程度依存する。さらに、科学文献で発見された発表は、実際の発見よりも遅れがちであり、米国および他の司法管轄区域の特許出願は、通常、出願後18(18)ヶ月以内に発行されるか、または場合によっては全く発行されない。したがって、私たちは私たちがこのような発明のために特許保護を申請した最初の会社だと確信できない。しかも、外国の管轄区域の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。例えば, アメリカ以外のある国では人体を治療する方法のための特許出願は許可されていません。これは、私たちが米国で取得したか、または将来獲得可能な方法特許と同様の範囲を米国以外で獲得することを阻止するかもしれない。これは私たちの手続きと製品をカバーするいくつかの重要な方法特許を含む。米国および他の国の特許法または特許法解釈の変化は、私たちの発明、取得、維持、および私たちの特許権を保護する能力を弱める可能性があり、より広く言えば、私たちの特許の価値に影響を与える可能性がある。また,我々が現在求めている特許出願が任意の特定の司法管轄区域で特許として発行されるかどうか,あるいは発行された特許の権利主張が競争相手や第三者からの攻撃から十分な保護を提供するかどうかを予測することはできない.
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、我々の特許は、米国および海外の裁判所または特許庁で挑戦される可能性があるため、十分な特許保護または類似製品を有する競争相手に対する競争優位性を提供することができない可能性がある。さらに、第三者が既存技術を米国特許商標局(USPTO)または外国司法管轄区の特許庁に提出することの制約を受けたり、反対、派生、再審に参加したりする可能性がある各方面間私たちの特許権または他人の特許権の介入手続きを審査、許可後に審査または挑戦します。このような挑戦は、独占的または経営の自由を失うこと、または特許主張の全部または部分的な縮小、無効、または実行できないことをもたらす可能性があり、これは、他人が私たちに支払うことなく、同様または同じ製品および技術を使用または商業化する能力を阻止することを制限するか、または我々の技術の特許保護期間を制限する可能性がある。
私たちは私たちが第三者が持っているいかなる特許や他の専有権も侵害しないということを確実にすることはできない。もし私たちの製品が他方のいかなる独占権を侵害していることが発見された場合、私たちはその他方に巨額の損害賠償または許可料を支払い、および/またはこれらの製品の生産、マーケティング、および流通を停止することを要求されるかもしれない。訴訟はまた、第三者の侵害主張を擁護したり、私たちが持っている特許権を実行したり、私たちが持っている商業秘密または技術を保護するために必要かもしれない。さらに、特許出願が発表されるまでには数年の時間がかかる可能性があり、係争出願の公表スケジュールは司法管轄区域によって異なるため、現在または未来の製品が発行された特許を侵害する可能性がある我々の知らない係属中の出願が存在する可能性がある。さらに、発行された特許出願の請求項は、発行と特許付与との間で変化する可能性があるため、発行された特許出願が最終的に私たちが侵害する権利請求書と共に発行される可能性がある。
54
私たちはまた商業秘密と他の特許を取得していないノウハウに依存している。私たちは、ビジネス秘密および他の非特許ノウハウ上の私たちの権利を確実に保護することができる保証はありませんし、他の人が実質的に同等の独自製品またはプロセスを独立して開発しない、または他の方法で私たちのノウハウを得ることができない保証はありません。従業員やコンサルタントと締結された守秘·発明譲渡協定により、守秘義務と有効で現在緊張している知的財産権譲渡義務を含む当社の商業秘密やノウハウや技術を部分的に保護することを求めています。しかしながら、合意が違反されない保証はなく、いかなる違反行為に対しても十分な救済措置がある保証はなく、または競争相手が我々の商業秘密を発見したり、同様の知的財産権を独立して開発したりすることはない。さらに、訴訟は所有権を獲得したり、所有権に挑戦するクレームに対抗するために必要かもしれない。私たちまたは私たちの許可者がこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの経営陣や他の従業員の注意を分散させる可能性があり、このようなクレームは私たちの業務、財務状況、運営結果を損なう可能性があります。
さらに、場合によっては、私たちは、第三者から許可された技術を含む特許出願の準備、提出および起訴を制御する権利がないかもしれません。したがって、私たちのライセンシーに依存し、将来のライセンシーまたは被許可者に依存して、私たちの業務で使用されるいくつかの知的財産権を保護することができます。もし私たちのライセンシーや未来のライセンシーやライセンシーがこの知的財産権を十分に保護できなければ、私たちの製品商業化能力が影響を受ける可能性がある。例えば、現在のライセンス者に依存して特許を維持し、第三者とのライセンス契約に基づいて許可されている知的財産権を他の方法で保護しています。このような許可者は、そのような特許および知的財産権を起訴、維持および保護することに成功しないかもしれないし、またはこれらの権利を侵害する第三者を訴訟しないことを決定するか、または私たちのように積極的に訴訟を提起しない可能性がある。
私たちのいくつかの特許と特許出願は未来に第三者と共同で所有するかもしれない。もし私たちがこのような第三者共同所有者のこのような特許または特許出願における権利の独占的許可を得ることができない場合、これらの共通所有者は、私たちの競争相手を含む他の第三者にその権利を許可することができ、私たちの競争相手は、競争相手の製品および技術を販売することができる。さらに、私たちは、第三者に対してそのような特許を強制的に実行するために、私たちの特許のどのような共通所有者の協力も必要とするかもしれませんが、そのような協力は私たちに提供されないかもしれません。上記のいずれも私たちの業務、財務状況、そして経営結果を損なう可能性があります。
知的財産権保護の獲得と維持は、政府機関が提出した各種の手続き、書類提出、費用支払い、その他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの知的財産権保護は減少または撤廃される可能性がある。
特許および/または特許出願の有効期間内に、定期維持費、継続費、年会費、および特許および/または特許出願に関する様々な他の政府費用を、いくつかの段階に分けて米国特許商標局および外国特許代理機関に支払わなければならない。米国特許商標局、米国著作権局(USCO)および各種外国政府機関は、知的財産権出願過程において、いくつかのプログラム、文書、費用支払い、およびその他の同様の条項を遵守することを要求している。さらに、知的財産権登録の定期維持費、継続費、年会費、および様々な他の政府費用は、通常、知的財産権登録および/または申請、および将来入手可能な任意の知的財産権の有効期間内にUSPTO、USCO、および外国機関に支払われなければならない。知的財産権登録または出願の予期しない失効は、我々または私たちの特許維持サプライヤーへの新冠肺炎疫病の影響を含み、多くの場合、滞納金を支払うことによって、または規則を適用する他の方法で救済することができるが、場合によっては、規則を遵守しないことは、登録または出願の放棄または失効を招き、関連する司法管轄区域の一部または全ての知的財産権を喪失させる可能性がある。登録放棄または申請の失効を招く可能性のある不遵守事件には、所定の期限内に正式な行動に回答できなかったこと、費用が支払われていなかったこと、および登録または申請を適切に合法化し、正式な文書を提出することができなかったことが含まれるが、これらに限定されない。もし私たちの製品をカバーする知的財産権登録とアプリケーションを維持できなければ、競争相手の開発とマーケティングが私たちの製品と同じか似ている製品を阻止することができないかもしれません, これは私たちの業務に実質的な悪影響を及ぼすだろう。
関連する第三者特許を識別できないか、または第三者特許の関連性、範囲、または満了時間を誤って解釈することができない可能性があり、これは、私たちが製品を開発およびマーケティングする能力に悪影響を及ぼす可能性がある。
私たちは私たちの技術や製品に関連する可能性のある第三者特許の全面的な検索や分析を行っていません。完全かつ完全な検索ができない可能性があり、すべての関連する第三者特許を識別できない可能性があり、特許請求の範囲または特許発表の関連第三者特許出願の有効期限として完全に予測できない可能性がある。アメリカと海外が私たちの製品の任意の司法管轄区域での商業化に関連しているか、または必要なすべての第三者特許および処理すべき出願を知っていることを確認することはできません。
55
特許請求の範囲は、法律の解釈、特許における書面開示、および特許の起訴履歴に依存する。特許または保留出願の関連性または範囲の説明は正しくないかもしれませんが、これは私たちの候補製品をマーケティングする能力に悪影響を及ぼすかもしれません。私たちの製品が第三者特許のカバー範囲内にないか、または第三者の保留出願が関連範囲のクレームを出すかどうかを誤って予測する可能性がある。私たちが関連する特許の満期日の決定は、アメリカまたは海外のどのようなものでも正しくないかもしれません。これは、私たちの候補製品を開発し、マーケティングする能力に悪影響を及ぼす可能性があります。私たちは関連特許を識別して正確に解釈することができず、私たちが製品を開発し、マーケティングする能力に悪影響を及ぼすかもしれない。
さらに、知的財産権または技術を第三者または第三者に許可するプロトコルは複雑であり、そのようなプロトコルのいくつかは様々な解釈の影響を受ける可能性がある。可能性のある契約解釈の相違の解決は、関連する知的財産権または技術に対する私たちの権利と考えられる範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させる可能性があり、いずれも、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。また、我々が許可している知的財産権をめぐる紛争が、商業的に許容可能な条項で現在の許可手配の能力を維持していることを阻害したり、損害を与えたりすれば、影響を受けた製品の開発に成功し、商業化することができない可能性がある。
いずれかの将来のライセンシーがライセンス条項を遵守できなかった場合、ライセンシーが侵害第三者に対してライセンス特許を強制的に実行できなかった場合、ライセンス特許又は他の権利が無効または強制執行できないことが発見された場合、または許容可能な条項で必要なライセンスを締結できない場合、私たちの業務も影響を受けるであろう。さらに、私たちの許可者は私たちに許可されていない知的財産権を所有したりコントロールしたりする可能性がありますので、その是非にかかわらず、私たちは私たちが許可者の権利を侵害しているか、または他の方法で侵害しているというクレームを受ける可能性があります。
私たちは他人が許可した特許や他の知的財産権に依存し、将来的には他人が許可する他の特許または他の知的財産権に依存する可能性がある。もし私たちが私たちの業務に重要な知的財産権ライセンスを失ったら、私たちは私たちの製品を開発したり販売したりすることができないかもしれない。
私たちは、特許やノウハウを含む、私たちの業務に必要または有用な第三者知的財産権を得る権利があるように許可されています。私たちの製品をカバーするライセンス契約は、私たちのいくつかの製品を販売するために一定の印税を支払う義務を含む様々な義務を加えています。私たちの1つ以上の許可者は、私たちが彼らとの許可協定に違反したと主張し、したがって、私たちの許可を終了することを求めるかもしれない。したがって、ライセンスがカバーする製品を販売することができない可能性があり、これは重大な権利の損失を招き、特定の製品を商業化する能力を制限し、私たちの競争業務の地位に悪影響を与え、私たちの業務の将来性を損なう可能性があります。また、私たちの許可者は、私たちが提起したいかなるクレームに対しても費用が高く、時間がかかる可能性があり、私たちの経営陣とキーパーソンの私たちの業務運営に対する注意を移すかもしれません。
知的財産権許可は複雑な法律、商業と科学問題に関連し、当業界の科学発見の迅速な発展によって複雑になった。ライセンス契約によると、知的財産権に関する論争が発生する可能性があります
•ライセンス契約に従って付与された権利の範囲および解釈に関する他の問題;
•私たちの技術とプロセスは、ライセンス契約に拘束されていないライセンス側の知的財産権をどの程度侵害しているか
•私たちの協力開発関係に基づいて、特許と他の権利を再許可する
•私たちのライセンス契約の下での義務と、どのような活動がこれらの職務義務を満たしていますか
•私たちの現在または将来の任意の許可者と、私たちおよびそのパートナーが、知的財産権によって生成された発明およびノウハウの所有権を共同で創造または使用すること;
もし私たちが将来許可を得ることができる知的財産権紛争が、許容可能な条項で現在または未来の許可スケジュールを維持する能力を阻害したり、弱化したりすれば、影響を受けた候補製品の開発に成功し、商業化することができないかもしれない。私たちは通常、私たちが持っている知的財産権のように、私たちが許可する可能性のある知的財産権保護に関するすべてのリスクに直面している。もし私たちまたは私たちの現在または未来のいかなる許可者もこの知的財産権を十分に保護できなければ、私たちの製品を商業化することはできないだろう。
56
私たちは以前特許や他の知的財産権に関する訴訟に参加していましたが、将来的には特許や他の知的財産権に関する他の訴訟や行政訴訟に参加する可能性があります。もし私たちが任意の知的財産権訴訟で敗訴すれば、裁判所は私たちに巨額の損害賠償金の支払いを要求し、および/または私たちの製品の販売を阻止することを要求するかもしれない。
医療機器業界は特許、商標、商業秘密、その他の知的財産権で競争が激しく、訴訟を起こしやすい。医療機器業界の会社は知的財産権訴訟を利用して競争優位を獲得している。私たちのビジネスの成功は、当社および私たちの契約製造業者およびサプライヤーが、当社の製品を製造、マーケティングおよび販売し、第三者の独自の権利または知的財産権を侵害、流用、または他の方法で侵害することなく、当社のノウハウを使用する能力にある程度依存します。私たちは未来に私たちの製品および未来の製品や技術に関連する知的財産権訴訟または訴訟の当事者になるか、または脅威になる可能性があります。私たちが第三者の権利を侵害しているかどうか、流用するか、または他の方法で侵害するかどうかにかかわらず。
私たちは将来、是非曲直にかかわらず、私たちの特許や他の知的財産権に関する他の訴訟や他の行政訴訟の当事者になるかもしれない。結果にかかわらず、法的手続きは予測不可能であり、通常コストが高く時間がかかり、解決策が私たちに有利であっても、大量の財務資源を枯渇させ、私たちの経営陣の時間とエネルギーを分散させる可能性がある。私たちの知的財産権を擁護または起訴するための長引く訴訟は、訴訟が解決されるまで、私たちの顧客または潜在的な顧客が影響を受けた製品の購入または使用を延期または制限することをもたらす可能性がある。また、公聴会、動議、または他の一時的な手続きや事態の発展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスだと思う場合、私たち普通株の市場価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や法的手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源とより成熟して発展した知的財産権の組み合わせを持っているので、このような訴訟や法的手続きの費用を私たちよりも効率的に負担するかもしれない。特許訴訟または他の訴訟の開始と継続によって生じる不確実性は、市場での競争能力に重大な悪影響を及ぼす可能性がある。
もし私たちが第三者の知的財産権を侵害していることが発見された場合、私たちは第三者からライセンスを取得して、私たちの製品や技術を販売、開発、販売し続けることを要求される可能性があります。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。第三者知的財産権の取得または許可は競争分野であり、私たちの競争相手は、魅力的または必要だと思う第三者知的財産権獲得戦略を取ることができるかもしれない。必要な第三者知的財産権の獲得に成功したり、既存の知的財産権を保持したりすることができなければ、関連製品の開発を放棄したり、知的財産権侵害の疑いのある製品を再設計したりしなければならない可能性があり、これは私たちの業務、財務状況、運営結果を損なう可能性があります。我々が許可を得ることができても,非排他的である可能性があり,我々の競争相手が我々に許可された同じ技術にアクセスできるようにする.私たちは裁判所の命令を含めて権利侵害技術や製品の商業化を停止させることを余儀なくされるかもしれない。さらに、もし私たちが故意に特許を侵害したことが発見された場合、私たちは3倍の損害賠償と弁護士費を含む金銭損害賠償責任を負われる可能性がある。権利侵害の判決は私たちにいくつかの業務運営を停止させる可能性があり、これは私たちの業務に実質的な損害を与えるかもしれない。我々が第三者の機密情報や商業秘密を盗用したと主張することは,我々の業務に類似した負の影響を与える可能性がある.知的財産権訴訟は不利な宣伝を招き、私たちの名声を損ない、私たちの普通株の市場価格を下落させる可能性がある。
我々の業界の競争は非常に激しいため、競争相手は私たちが発行した特許、私たちの許可側の特許、または他の知的財産権を侵害したり、他の方法で侵害したりする可能性がある。権利侵害や不正使用に対抗するために、私たちは権利侵害請求を要求されるかもしれません。これは高価で時間がかかる可能性があり、私たちの技術と管理者の正常な責任を分散させる可能性があります。私たちは侵害者と思われるいかなるクレームに対しても、これらの当事者に私たちの特許が無効または実行不可能な反クレームを提出させるか、または私たちに行政訴訟を提起し、私たちが彼らの特許を侵害したことを告発する可能性がある。さらに、特許侵害訴訟では、裁判所は、私たちの特許の全部または一部が無効または強制的に実行できないと判断し、その特許の権利要件を狭く解釈するか、または私たちの特許が関連する技術をカバーしないことを理由に、他方の関連技術の使用を阻止することを拒否することができる。任意の訴訟手続きまたは行政行動の不利な結果は、私たちの1つまたは複数の特許が無効または狭義に解釈されるリスクに直面する可能性がある。私たちの競争相手は、新規性、明確性、使用不可能性の欠如、書面記載の不足、または私たちの製品に関連する特許出願を最初に提出した出願人ではないことを含む様々な理由で無効である可能性がある。特許侵害請求を解決するために、または訴訟前に紛争を解決するために、ライセンス契約を締結することを選択することができ、このようなライセンス契約は、印税および他の高額な費用の支払いを要求する可能性がある。さらに、知的財産権訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報が開示によって漏洩する可能性がある。
57
私たちの競争相手の多くは、特許の組み合わせ、商業秘密、商標、および相互競争の技術面で多くの投資を行っており、彼らはすでに出願または取得されている可能性があり、または将来、特許または商標を出願または取得する可能性があり、これらの特許または商標は、私たちの製品の製造、使用、販売および/または輸出を阻止、制限、または妨害することができるか、または我々の技術または製品名を使用する能力を阻止し、制限するか、または他の方法で妨害する可能性がある。また、非執行実体の個人や団体は、一般に“特許痴漢”と呼ばれ、特許や他の知的財産権資産を購入し、和解を図るために侵害クレームを提出することを目的としている。私たちは時々脅迫状、通知または“許可招待状”を受け取ったり、私たちの製品や業務が他人の知的財産権を侵害したり、侵害したりするクレーム対象になる可能性があります。これらの問題を弁護するのに時間がかかる可能性があり、訴訟で弁護するコストが高く、経営陣の注意と資源を分散させ、私たちの名声やブランドを損ない、巨額の費用を発生させたり、巨額のお金を支払ったりする可能性がある。さらに、訴訟の結果は不確定であり、このような訴訟は、私たちが呼ばれる知的財産権侵害の疑いのある製品または技術の製造、販売、または使用を停止させることを余儀なくされる可能性があり、その知的財産権の侵害が発見される可能性がある側に大量の損害賠償または使用料を支払うこと、または権利侵害の疑いがある製品を含む製品を再設計することは、高価で破壊的または不可能である可能性があること、または第三者から関連する知的財産権の許可を得ようとすることは、合理的な条項では得られないかもしれない、または第三者から得ることができない可能性がある。また、, 第三者は私たちの顧客に侵害請求をするかもしれない。これらのクレームは、私たちの顧客を代表して、長引く費用の高い訴訟を開始したり、または、これらのクレームの是非にかかわらず、私たちの顧客が自ら発起または弁護する権利侵害請求に関連する任意の費用を賠償することを要求するかもしれません。これらのクレームのいずれかが成功または和解に達した場合、私たちは私たちの顧客に代わって損害賠償または和解金を支払うことを余儀なくされるか、または彼らが使用する製品のために許可証を取得することを要求される可能性がある。もし私たちが商業的に合理的な条項ですべての必要な許可を得ることができなければ、私たちの顧客は私たちの製品の使用を停止させることを余儀なくされるかもしれない。
私たちが知的財産権開発に参加している従業員や請負業者と発明譲渡協定を実行できなかったり、私たちのビジネス秘密の機密性を保護できなかったりすると、私たちの製品価値や私たちの業務や競争地位が損なわれる可能性があります。
特許保護に加えて、商標、著作権、商業秘密、非特許技術ノウハウ、技術などの機密および独自情報の保護に依存して、私たちの競争地位を維持しています。私たちは通常、従業員、コンサルタント、第三者が私たちと関係を作り始めた時に、彼らと秘密と発明譲渡協定を締結します。しかし、私たちの知的財産権開発に参加しているすべての従業員、コンサルタント、第三者とこのような合意を締結しないかもしれません。さらに、これらのプロトコルは、許可されていない使用または私たちの商業秘密または他の機密情報を開示するために意味のある保護を提供することができず、許可されていない使用または開示が発生した場合、十分な修復措置が存在しない可能性がある。私たちの従業員、私たちの施設を共有する第三者従業員、または私たちが採用した第三者コンサルタントおよびサプライヤーの任意の意図的または意図的な開示、または第三者が私たちのビジネス機密および他の固有情報(例えば、ネットワークセキュリティホールを介して)を流用することは、私たちの競争優位性を損なうことになり、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性があります。特に、私たちの独占権を保護できなかったことは、競争相手が私たちの製品やプログラムをコピーすることを可能にする可能性があり、これは私たちの定価と市場シェアに悪影響を及ぼす可能性がある。さらに、他の締約国は、実質的に同じノウハウおよび技術を独立して開発することができる。
契約措置に加えて、私たちは公認された物理的および技術的セキュリティ措置を使用して、私たちの固有の情報の機密性を保護しようと努力している。例えば、従業員またはアクセス許可権限を有する第三者が商業秘密を盗用する場合、このような措置は、私たちの独自の情報に十分な保護を提供しない可能性がある。私たちの安全対策は、従業員やコンサルタントが私たちのビジネス秘密を盗用して競争相手に提供することを阻止できないかもしれませんが、このような不正行為に対する追跡権は、私たちの利益を十分に保護するための十分な救済措置を提供できないかもしれません。許可されていない当事者たちはまた、複製や逆工事をしようとするかもしれないし、私たちは独自の製品のいくつかの側面だと思う。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかる可能性があり、結果は予測できない。一般的に受け入れられている安全措置を使用しているにもかかわらず、商業秘密の侵害は往々にして州法律の問題であり、司法管轄区によって商業秘密を保護する基準が異なる可能性がある。また,ビジネス秘密は,我々の法的追跡を阻止するように他の人によって独立して開発されている可能性がある.私たちは私たちの従業員、コンサルタント、第三者と合意し、彼らの発明を私たちに譲渡する義務がありますが、これらの合意は自動的に実行されない可能性があり、すべての従業員やコンサルタントがこのような協定を締結することができるわけではありません、あるいは従業員またはコンサルタントがこれらの協定の条項に違反したり、違反したりする可能性があり、このような違反や違反に対応するための十分な救済措置がないかもしれません。もし私たちの任意の知的財産権または機密または独自の情報が、私たちの商業秘密のような、開示または流用されている場合、またはそのような情報が競合他社によって独立して開発されている場合, これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
58
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの競争地位は損なわれるかもしれません。
私たちは私たちの商標、商品名、ブランド名に依存して、私たちの製品を競争相手の製品と区別し、その中の多くの商標を登録または登録申請しました。私たちは私たちの商標申請が承認されることを保証できない。商標登録過程で、私たちは米国特許商標局または他の外国司法管轄区から私たちの出願の拒絶を受けることができる。私たちはこのような拒否に答える機会があるだろうが、私たちはこの拒否を克服できないかもしれない。さらに、第三者はまた、私たちの商標申請に反対したり、他の方法で私たちの商標の使用に挑戦したりするかもしれない。我々の登録および未登録商標、商号、およびブランド名は、挑戦、侵害、回避、汎用商標として発表されるか、または他の商標の侵害または侵害として決定される可能性がある。私たちはこれらの商標、商号、ブランド名に対する私たちの権利を保護できないかもしれません。私たちはこれらの商標、商号、ブランド名に依存して、私たちが関心のある市場における潜在的なパートナーと顧客の間で知名度を確立します。もし私たちの商標が成功的に挑戦されれば、私たちは私たちの製品ブランドを再形成することを余儀なくされるかもしれません。これはブランド認知度の低下を招き、広告と新しいブランドをマーケティングするために資源を投入する必要があるかもしれません。しかも、競争相手が私たちの商標を侵害しない保証はなく、私たちが私たちの商標を実行するのに十分な資源を持っている保証もない。私たちはまた私たちの商標と商号を流通業者のような第三者に許可することができる。これらのライセンス契約は、私たちの商標や商号をどのように使用するかに指針を提供する可能性がありますが、ライセンシーは、これらの合意に違反したり、私たちの商標およびビジネス番号を乱用したりすることで、私たちの権利を危険にさらしたり、私たちの商標や商号に関連する商標の名誉を弱める可能性があります。
特許条項は私たちの製品と業務を十分な時間で効果的に保護するのに十分ではないかもしれない。
特許の寿命は限られている。米国では、すべての保守費が直ちに支払われる場合、実用新案特許の自然失効時間は、一般に、その最初の有効な非一時出願日の後20年であり、意匠特許の自然失効時間は、一般に、出願日が2015年5月13日または後に発生しない限り、その発行日の後14年であり、この場合、意匠特許の自然失効時間は、一般に、その発行日の後15年である。しかしながら、特許によって提供される実際の保護は、国によって異なり、特許のタイプ、そのカバー範囲、規制に関連する延長の利用可能性、特定の国の法的救済の利用可能性、および特許の有効性および実行可能性を含む多くの要因に依存する。様々な延期がある可能性があるが、特許の期限とその提供の保護は限られている。私たちのノウハウとその用途をカバーする特許を取得しても、特許が満期になると、競争に開放的になる可能性があり、これは私たちの業務の将来性を損なう可能性があります。さらに、米国で特許を発行する際には、“米国特許商標法”によるいくつかの遅延に基づいて特許の有効期限を延長することができるが、特許出願人が特許訴訟中にもたらすいくつかの遅延によれば、このような延長は、低減またはキャンセルすることができる。米国は規制遅延に基づく特許期限の延長を持つかもしれない。しかし、各上場承認は1つの特許しか延長できず、1つの特許は単一製品に対して1回しか延長できない。また,特許期間延長期間の保護範囲は,特許請求の範囲のすべてまで延長されるのではなく,承認された製品範囲に限定される。外国の管轄区域管理のような特許期限延長の法律の違いは大きい, 1つの特許家族から複数の特許を取得する能力を管理する法律も同様である。さらに、試験段階または規制審査中に職務調査を行うことができず、適用の締め切り内に出願を提出することができず、関連する特許が満了する前に出願を提出することができなかった場合、または他の方法で適用の要求を満たすことができなかった場合、延期されることはないかもしれない。新製品の開発、テスト、監督審査に要する時間を考慮すると、このような製品を保護する特許は、このような製品の商業化の前または直後に満期になる可能性がある。もし私たちが私たちの製品、ノウハウ、およびその用途を保護するのに十分な特許条項がなければ、私たちの業務は深刻な損害を受けるだろう。私たちの特許が満期になるにつれて、私たちの特許保護範囲は縮小され、これは私たちの特許の組み合わせが提供する任意の競争優位性を減少または除去することができるだろう。したがって、私たちが減少した特許の組み合わせは、他の会社が私たちと類似または同じ製品を商業化することを排除するのに十分な権利を提供してくれないかもしれない。
米国または外国特許法またはその解釈の変化は、私たちが私たちの特許を獲得、維持、保護、および/または実行する能力を制限するかもしれない。
特許改革立法は、私たちの特許出願をめぐる起訴と、私たちが発表した特許の実行または保護の不確実性とコストを増加させるかもしれない。“ライシー·スミス米国発明法”(Leahy-Smith Act)は、米国特許法の多くの重大な修正を含む。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟にも影響を与える。米国特許商標局は、“ライシー·スミス法案”を管理する法規や手続き、および“ライシー·スミス法案”に関連する特許法の多くの実質的な変化、特に2013年3月16日に発効した第1弾条項を制定した。第1の出願の条項は、発明者が発明特許を出願する権利を制限し、発明特許出願を最初に提出した者でなければ、このような発明が第1の発明であってもよい。したがって,Leahy-Smith法案が我々の業務運営にどのような影響を与えるかは不明である(もしあれば).
59
しかしながら、ライシー·スミス法案およびその実施は、我々が発行する特許の実行および保護をめぐる不確実性およびコストを増加させる可能性がある。例えば、ライシー·スミス法案は、特許裁判及び控訴委員会(PTAB)という行政裁判所が特許の有効性を疑問視する場を提供し、費用が地域裁判所訴訟よりもはるかに低く、時間もはるかに速いと規定されている。PTAB訴訟手続きが我々の業務運営にどのような長期的な影響を与えるかは不明であるが、PTABが2013年に成立して以来提起された特許挑戦訴訟の初歩的な結果は、多くの米国特許主張を無効にしている。PTABは、より低コストで、より高速で、より強力な特許挑戦法廷として、私たち自身の特許が挑戦される可能性を増加させ、それによって、これらの特許の維持および実行の不確実性およびコストを増加させる可能性がある。
米国発明法にはいくつかの重大な変化も含まれており、これらの変化は米国特許出願の起訴方法に影響を与え、特許訴訟にも影響を与える可能性がある。これらの措置には、第三者が特許訴訟中に米国特許商標局に以前の技術を提出することを可能にすることと、米国特許商標局によって管理されたライセンス後のプログラム(ライセンス後審査を含む)が特許有効性を攻撃することを可能にする追加のプログラムとが含まれる各方面間審査と派生手続き。
USPTO訴訟における証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続きにおいて、USPTOが権利要求を無効とするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって、米国発明法およびその実施は、我々の特許出願をめぐる起訴および我々が発行した特許の実行または保護の不確実性およびコストを増加させる可能性がある。また、米国議会、連邦裁判所、米国特許商標局の将来の行動は、特許を管理する法律や法規が予測不可能な方法で変化する可能性がある。上記のいずれも私たちの業務、財務状況、そして経営結果を損なう可能性があります。
私たちの外国の知的財産権は限られていて、世界的に私たちの知的財産権を実行できないかもしれない。
私たちのアメリカ以外の知的財産権は限られている。世界のすべての国で私たちの製品と未来の製品の申請、起訴、特許や商標を守る費用は目を引くほど高く、外国の法律はアメリカの法律のように私たちの権利を保護できないかもしれない。したがって、私たちは、第三者が米国以外のすべての国/地域で私たちの発明を実施したり、私たちの商標を使用したり、米国または他の司法管轄区で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。競争相手は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を持っているが法執行力がアメリカに及ばない地域に輸出することもできる。これらの製品は私たちの製品や未来の製品と競争する可能性があり、私たちの特許や他の知的財産権はこれらの管轄区域での彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
いくつかの外国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。ある外国司法管轄区では、多くの会社が知的財産権の保護と保護に重大な問題に直面している。これは私たちの外国特許の侵害や、私たちの他の知的財産権の流用を阻止することを難しくするかもしれない。例えば、一部の外国国には強制許可法があり、これらの法律によると、特許権者は第三者に許可を付与しなければならない。また、一部の国は、政府機関または政府請負業者を含む第三者に対する特許の実行可能性を制限している。このような国では、特許は限られた利点を提供するかもしれないし、利益さえないかもしれない。特許保護は最終的には国ごとに求めなければならないが,これは高価で時間のかかるプロセスであり,結果は不確定である。したがって、私たちは特定の国で特許保護を求めないことを選択することができ、私たちはこれらの国で特許保護の利点を享受しないだろう。
外国の管轄区域で私たちの特許権を強制執行する訴訟は巨額のコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移すことができます。したがって、このような国で知的財産権を保護するための私たちの努力は十分ではないかもしれない。また、米国や外国の法律や裁判所の法的裁決の変化は、私たちの技術や知的財産権の執行のために十分に保護されている能力に影響を与える可能性がある。
60
私たちは現在または将来、私たちまたは私たちの従業員が商業秘密やノウハウを含む第三者の知的財産権を流用している、または私たちの競争相手との競争禁止または入札協定に違反している可能性があり、第三者は私たち自身の知的財産権の所有権権益を要求するかもしれない。
私たちは将来、私たちまたは私たちの従業員が無意識に、または他の方法で前の雇用主または競争相手のいわゆる商業秘密または他の機密情報を使用または漏洩したという疑惑を受けるかもしれない。私たちの多くの従業員やコンサルタントは以前、私たちの競争相手や潜在的な競争相手を含む他の医療機器会社に雇われたり、他の医療機器会社に雇われたりした。これらの従業員、コンサルタント、および請負業者の一部は、以前の雇用に関する独占権、秘密、およびスポーツ禁止協定に署名した可能性がある。私たちの従業員およびコンサルタントが私たちのために働いているときに他人の知的財産権、独自情報、技術ノウハウ、または商業秘密を使用しないことを確実にするために努力しているにもかかわらず、私たちまたはこれらの個人は、これらの元雇用主、競争相手、または他の第三者の知的財産権を意図的にまたは他の方法で流用したとして告発されるか、またはいわゆる商業秘密または他の固有情報を開示している可能性がある。さらに、私たちは、例えば、知的財産権を私たちの従業員またはコンサルタントに譲渡する義務がある契約と無効であるか、または他の雇用主、前の雇用主、または別の人またはエンティティに発明を譲渡する以前または競合する契約義務と競合する私たちのクレームに基づいて、元従業員、協力者、または他の第三者が私たち自身の知的財産権の所有権権益または発明権とみなすことに対するクレームを受ける可能性がある。特許出願上適切な発明者が示されていないことは、その上で発行された特許が強制的に実行できない可能性がある。発明権紛争は,発明者に指定された異なる個人への貢献,外国国民が特許標的開発に参加した外国法律の影響などに対する相互矛盾した見方による可能性がある, 我々の候補製品を開発する際に関連する第三者の義務衝突、または潜在的な共同発明の共同所有権の問題に起因する。訴訟は、請求を解決するために必要であるかもしれないし、必要であるかもしれないし、許可証を取得してそのようなクレームを解決することを望んでいるかもしれませんが、可能であれば、商業的に合理的な条項でライセンスを取得できる保証はありません。もし私たちがこれらのクレームの弁護に失敗した場合、金銭的損害賠償または和解金の支払いに加えて、裁判所は、これらの技術または機能が以前の雇用主の商業秘密または他の固有情報を含むか、または由来することを前提として、私たちの製品に重要な技術、機能、または他の知的財産権の使用を禁止することができる。私たちの製品に重要または必要不可欠な技術、機能、または他の知的財産権を統合できないことは、私たちの業務や競争地位に重大な悪影響を与え、製品の販売を阻止する可能性があります。しかも、私たちは貴重な知的財産権や人員を失うかもしれない。これらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。どんな訴訟やその脅威も、私たちが従業員を雇ったり、独立販売代表と契約を結ぶ能力に悪影響を及ぼす可能性があります。キーパーソンまたは彼らの作業製品の流失は、製品を商業化する能力を阻害または阻止する可能性があり、これは、私たちの業務、財務状況、経営業績、キャッシュフロー、および将来性に重大かつ不利な影響を与える可能性がある。
また、私たちの政策は、知的財産権の概念や開発に参加する可能性のある私たちの従業員と請負業者が合意に署名し、このような知的財産権を私たちに譲渡することを要求しているにもかかわらず、実際に私たちが自分の知的財産権と見なしているすべての当事者とこのような合意を実行することができないかもしれない。知的財産権の譲渡は自動的に実行されない可能性があり、あるいは譲渡協定が違反される可能性があり、私たちは第三者にクレームをつけさせられたり、私たちが私たちの知的財産権の所有権だと思うことを決定するために、私たちが提起する可能性のあるクレームを弁護したりすることができます。このようなクレームは、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性があります。
もし私たちの第三者製造パートナーが私たちの知的財産権と商業秘密を尊重せず、私たちの設計または知的財産権を使用して競争力のある製品を生産すれば、私たちの業務、財務状況、運営結果は損なわれるだろう。
私たちの第三者製造パートナーとの合意は、通常、彼らが私たちの知的財産権や商業秘密を乱用したり、私たちの設計を使用して競争相手のために製品を製造したりすることを防ぐことを目的としているにもかかわらず、私たちはこれらの製造パートナーに対して私たちの知的財産権を監視し、実行することに成功することができず、市場の偽造品が私たちの製品として、あるいは私たちの知的財産権を使用して競争相手のために生産された未来の製品として市場で販売されていることを発見することができるかもしれない。私たちは偽物を阻止する措置を取っているにもかかわらず、私たちは成功しないかもしれません。これらの偽造品を購入したネットワーク事業者は製品の欠陥や故障に遭遇し、私たちの名声とブランドを損害し、未来の販売損失を招く可能性があります。上記のいずれも私たちの業務、財務状況、そして経営結果を損なう可能性があります。
61
規制事項に関するリスク
私たちは多くの政府によって規制されており、これは私たちの業務に実質的な悪影響を及ぼすかもしれない。
私たちの製品と業務はアメリカと国外の多くの政府機関の広範な規制と審査を受けています。アメリカと外国の法規は著者らの製品の設計、開発、テスト、臨床研究、発売前承認、認証、安全、登録、製造、包装、貯蔵、報告、販売、流通、マーケティング、ラベル、販売促進、医療保健専門家との関係、記録保存プログラム、発売後監督、発売後研究及び製品輸出入を管理している。規制過程は私たちの製品を市場に出すために多くの時間、エネルギー、支出を必要とし、私たちのどの製品も発売されることを保証することはできない。私たちが統制された規制は複雑で、時間が経つにつれてもっと厳しくなることが多い。規制の変化は、予想以上のコスト、または予想を下回る売上高に、業務を継続または拡大する能力を制限する可能性がある。FDAや他の規制機関は定期的な抜き打ち検査などでこれらの規制要求を実行している。私たちは私たちが未来のどんな規制検査でもコンプライアンスが発見されるかどうか分からない。しかも、FDAと他の当局は広範囲な法執行権力を持っている。
私たちが適用された規制要件を遵守できなかったことは、次のような結果になるかもしれない
•FDAからの不良宣伝、警告状、見出しのない手紙、または“私たちの注意を引いた”手紙、または外国の規制機関からの規定を遵守しないと主張する類似の手紙
•生産制限、一部生産停止、あるいは全面的な生産停止
•規制部門の新製品の承認、承認または認証、新しい予期される用途、または既存製品の修正の要求を拒否する
•許可および/または取得された規制許可、承認または認証を撤回または一時停止する
これらの事件のいずれも、予想以上のコストまたは予想よりも低い売上をもたらす可能性があり、私たちの名声、業務、財務状況、および経営結果に重大な悪影響を及ぼす可能性がある。
私たちと顧客、医師、第三者支払者との関係は、連邦、州、外国の医療詐欺と乱用法律、虚偽クレーム法律、医師支払い透明性法律、その他の医療法律法規によって制限されている。もし私たちまたは私たちの従業員、独立請負業者、コンサルタント、ビジネスパートナー、またはサプライヤーがこれらの法律に違反した場合、私たちは重大な処罰に直面する可能性があります。
私たちと顧客、医師、第三者支払者との関係は、連邦、州と外国の医療詐欺と乱用法律、虚偽クレーム法律、医師および他の免許を持つ医療専門家への支払いおよび他の価値移転に関する透明性法律、および他の医療法律法規によって制限されている。特に、保健プロジェクトおよびサービスの販売促進、販売およびマーケティングは、詐欺、リベート、自己取引、および他の乱用を防止するための広範な法律および法規によって制限されている。これらの法律法規は、広範な定価、割引、マーケティングおよび販売促進、販売手数料、顧客インセンティブなどの業務スケジュールを制限または禁止することができる。私たちの運営能力に影響を与える可能性のあるアメリカの医療法律は含まれていますがこれらに限定されません
•任意の個人またはエンティティが、インフォームドコンセントおよび意図的な場合に、連邦医療保険、医療補助、または他の連邦医療計画に従って精算可能な任意の物品またはサービスを購入、リースまたは手配、レンタルまたは注文するために、現金または実物で直接または間接的に提供、開示または隠蔽的に提供、支払い、請求または任意の報酬を受け取ることが禁止されている連邦反バックル法規。“報酬”という言葉は価値のあるものを含むと広く解釈されている。いくつかの法定例外状況と規制安全港保護のいくつかの一般的な活動は起訴されないが、例外状況と安全港の範囲は狭い。公平な市場価値を超える任意の支払いを含む購入または推薦を誘導するための方法が告発される可能性があり、例外または避難港の資格に適合していなければ審査される可能性がある。さらに、個人またはエンティティは、法規または法規違反の具体的な意図を実際に理解する必要がなく、違反を実施することができる
62
•連邦民事虚偽請求法案および民事金銭罰法を含む連邦民事および刑事虚偽請求法であって、個人または実体が知られている場合に虚偽または詐欺的な連邦保険、医療補助または他の連邦政府計画の支払いまたは承認請求の提出または提出を引き起こすことを禁止するか、または連邦政府(連邦医療計画を含む)への資金支払いの義務を不当に回避、減少または隠蔽するために、故意に虚偽陳述を行うことを禁止する、連邦民事および刑事虚偽請求法。また、政府は、連邦民事虚偽請求法については、連邦反リベート法規違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言することができる
•連邦1996年“健康保険携帯·責任法案”(HIPAA)は、個人第三者支払人を含む任意の医療福祉計画の計画を知り、故意に実行または実行しようとすることを禁止し、または虚偽または詐欺的な言い訳、陳述または約束によって、任意の医療福祉計画が所有または保管または制御する任意の金銭または財産を取得することを禁止し、故意に偽造、隠蔽または隠蔽し、任意のトリック、計画または装置、重要な事実、または交付または支払いに関連する任意の重大な虚偽、架空、または詐欺的陳述を行う新しい連邦民事および刑事法規を制定した。医療福祉プロジェクトサービスです連邦反リベート法規と同様に、個人または実体は、この法規または法規違反の具体的な意図を実際に理解する必要がなく、違反を実施することができる
•市場活動を広く規制し、消費者の活動を損なう可能性がある連邦消費者保護法と不正競争法
•連邦医師は、ある薬品、器具、生物製品、および医療用品の製造業者が、医師(医師、歯科医師、視光師、足科医師および脊椎マッサージ師を含むと定義されている)、ある非医師従事者(医師アシスタント、看護師従業員、臨床看護師専門家、登録看護師麻酔科医、麻酔科医アシスタントおよび登録助産師を含む)および教育病院および教育病院に支払うか、または他の方法で価値を移転することに関する情報を毎年政府に報告することを要求する日光法案を支払う
•州および外国の等価物、いくつかの法律の範囲はより広い可能性があり、これらに限定されないが、州反リベートおよび虚偽請求法は、民間保険会社を含む非政府第三者支払者によって償還される医療プロジェクトまたはサービスの販売またはマーケティング手配およびクレームに適用することができ、または支払者にどのように適用されるか、または支払者にどのように適用されるかにかかわらず、州法律は、設備会社に業界自発的コンプライアンス基準および連邦政府によって発行された関連コンプライアンスガイドラインを遵守することを要求する;州法律は、デバイスメーカーに医師および他の医療保健提供者への支払いおよび他の価値移転に関する情報、マーケティング支出を報告することを要求する。そして州や地方の法律では,設備販売や医療代表登録が求められている。医療機器業界のマーケティング行為をより厳しく審査し,政府各部門が複数回の政府調査を行っており,この全業界の法執行活動が継続されることが予想される。変化する規制環境と、異なるかつ困難なコンプライアンスおよび報告要件を有する複数の司法管轄区域の要求を遵守することは、1つ以上の法律と衝突する可能性を増加させる。このような規制要件を遵守する費用はもっと高くなっており、私たちの収益性にも影響を及ぼすだろう
63
これらの法律の広さ、および既存の法定例外および安全港の規制の狭さのため、私たちのいくつかの業務活動、患者外展計画、または独立販売代表および顧客との私たちの手配は、1つまたは複数のこのような法律の挑戦を受ける可能性がある。私たちはまた、私たちが所有権を持っている権利および/または彼らが行った手術で私たちの製品の注文または使用に影響を与えるいくつかの医師を含む相談および特許使用料協定を締結した。その中のいくつかの計画の補償は株式または株式オプションを提供することを含む。もし規制機関が私たちとこれらの医師との財務関係が適用法に違反していると認定すれば、私たちは不利な影響を受けるかもしれない。医療機器業界のマーケティング行為をより厳しく審査し,政府各部門が複数回の政府調査を行っており,この全業界の法執行活動が継続されることが予想される。変化する規制環境と、異なるかつ困難なコンプライアンスおよび報告要件を有する複数の司法管轄区域の要求を遵守することは、1つ以上の法律と衝突する可能性を増加させる。このような規制要件を遵守する費用はもっと高くなっており、私たちの収益性にも影響を及ぼすだろう。従業員の不正行為や業務違反を常に識別し、阻止できるわけではなく、不正行為を発見し、防止するための予防措置は、未知または未管理のリスクや損失を効果的に制御できない可能性があり、あるいはこのような法律や法規に準拠していないことによる政府の調査や他の行動や訴訟から私たちを保護することができないかもしれない。もし私たちまたは私たちの従業員、代理店、独立請負業者、コンサルタント、ビジネスパートナー、サプライヤーがこれらの法律に違反したら, 私たちは、重大な民事、刑事および行政処罰、損害賠償、返還、罰金、監禁、連邦医療保険、医療補助および他の連邦医療保健計画から除外される可能性がある、契約損害、名声損害、利益減少および将来の収益、追加の報告要件および/または監督を含む調査、法執行行動、および/または重大な処罰を受ける可能性があり、もし私たちが会社の誠実な合意または同様の合意の制約を受けて、これらの法律違反に関する疑惑を解決し、および/または私たちの業務を削減することを含む。いずれも私たちの業務運営能力と運営結果に悪影響を及ぼす可能性があります。
私たちは、将来の製品または現在の製品の修正に必要な許可、承認または認証を受けていないか、または遅延している可能性があり、将来の製品または現在の製品の修正に必要な承認、承認または認証をタイムリーに受けることができなければ、私たちの業務成長能力に悪影響を与えます。
米国では、新たな医療機器、または新たな用途を販売することができ、既存の医療機器製品を新たな声明または重大な修正を行う前に、免除を申請しない限り、連邦食品、医薬品および化粧品法(FDCA)第510(K)条の承認またはFDAの発売前承認(PMA)を最初に取得しなければならない初めからやり直す分類する。510(K)承認プログラムでは、装置が発売される前に、FDAは、510(K)のプロセスによって以前に許可された装置、1976年5月28日までに合法的に販売された装置(改訂前装置)、最初に承認されたPMAに従って米国市場に進出し、その後劣化した装置、または510(K)免除装置を含む、提案された装置が合法的に発売される“前提”装置“と実質的に同じ”と判断しなければならない。“実質的に同等”に達するためには、提案された装置は、述語装置と同じ予期される用途を有する必要があり、言語装置と同じ技術的特徴を有するか、または異なる技術的特徴を有し、言語装置とは異なるセキュリティまたは有効性の問題を引き起こさない必要がある。実質的な同等性を支援するための臨床データが必要な場合がある。PMA承認を得る過程で、FDAは、技術、臨床前、臨床試験、製造、およびラベルデータを含むが、これらに限定されない大量のデータに部分的に基づいて、提案された装置を決定することは、その予期される用途に対して安全かつ有効である。生命を維持する、生命を維持する、または移植可能な装置のような最大のリスクを構成すると考えられる装置の場合、PMAプロセスが一般的に必要である。
はい初めからやり直す分類プロセスでは、製造業者の新しいデバイスは、FDCAの下で自動的にクラスIIIに分類され、発売前にPMAを提出して承認を得ることを要求し、製造業者は、デバイスの低または中リスクの基礎に基づいて、デバイスをクラスIまたはクラスIIに格下げすることを要求することができる。FDAが最初からの分類要求を承認した場合、出願人は装置を販売する許可を得るであろう。その後、デバイスタイプは、将来510(K)にコミットされる述語デバイスとして使用することができる。
64
承認された人道主義装置免除(HDE)によって発売されたTOTAL距骨アイソレータも取得した。HDEは、米国で毎年8,000人以下の疾患または疾患に影響を与えているときに患者が利益を得ることを目的としたFDA指定医療装置である人道主義的使用装置、またはHUDの販売を可能にする。HUDを市場に投入するためには、この装置はFDAのHUD指定を取得し、HDE申請に従ってFDAの承認を得なければならない。HDEの承認は、出願人が同様の装置が利用可能でないことを証明し、提案されたHUDの健康に対する可能な利点が、それの使用によってもたらされる損傷または疾患のリスクを超え、そのような場合または疾患のために利用可能な代替治療を考慮することに基づく。しかしながら、HDEによって承認された医療機器は有効性の要求に制限されず、PMAによって承認されれば、その装置は有効性の要求によって制限され、有効性を証明する臨床研究は承認を支持する必要はない。承認されたHDEは免責声明を貼らなければならず、この装置の有効性はまだ確定されていないことを宣言する。さらに、HDEの承認を得たHUDは、限られた場合を除いて利益を上げて販売することはできない。いずれの場合も、利益のためにデバイスを販売する場合、HDE所有者は、利益を販売する意図をFDAに通知しなければならず、毎年販売可能な収益デバイスの数が制限される。HDE承認後にHUDを使用する前に、HDE保有者は、HUDの使用が工場IRBの承認を得たことを確実にしなければならない。承認後の臨床研究も必要かもしれない。われわれのすべての距骨スペーサーはHDE承認条件としての承認後の研究の要求を満たしていなければならない。
PMAを通じて承認を申請した製品修正は通常FDA承認を必要とする。同様に、HDEによって承認された製品のいくつかの修正は、FDA承認、510(K)によって承認された製品または根拠を必要とする初めからやり直す分類には、新しい510(K)の許可が必要となる場合がある。マーケティング許可過程は高価で、長くて不確実かもしれない。FDAの510(K)承認プロセスは、通常、3~12ヶ月を要するが、より長く継続する可能性もある。PMAを取得するプロセスは、510(K)の承認プロセスコストよりもはるかに高く、不確実であり、通常、出願からFDAに提出されるまで1~3年、さらにはより長い時間を必要とする。さらに、PMAは通常、1つ以上の臨床試験を行うことが要求される。時間、労力、コストが必要であるにもかかわらず、デバイスはFDAの承認または承認を得ない可能性がある。どんな遅延や必要な規制承認や承認を得られなかった場合も、私たちの業務を損なう可能性がある。さらに、私たちが規制許可や承認を与えられても、それらは設備指定用途の重大な制限を含む可能性があり、これは設備の市場を制限する可能性がある。
米国では、総距骨間隔を除いて、私たちのすべての非免除製品は510(K)許可プログラムによって許可されている。これらの製品の任意の修正は、以前に承認されなかった場合、新しい510(K)の発売前の通知を提出して承認を得るか、またはPMAを提出してFDAの承認を得て、変更を実施する必要がある場合があります。特に、510(K)の許可を得た装置の任意の修正は、その安全性または有効性に深刻な影響を与える可能性がある場合、またはその予期される用途、設計、または製造を構成する重大な変化である場合には、新しい510(K)の許可が必要であるか、またはPMAの承認を得る必要がある場合がある。FDAは各メーカーに最初にこの決定を下すことを要求するが、FDAはどのメーカーの決定も検討することができる。FDAは新しい許可や承認が必要かどうかに関する私たちの決定に同意しないかもしれない。私たちは過去に510(K)承認された製品を修正し、適用されたFDA法規およびガイドラインの審査に基づいて決定されたが、場合によっては新しい510(K)承認またはPMA承認を必要としない。私たちは将来、新しい510(K)承認またはPMA承認を必要としないと考えられる追加機能を修正または追加するかもしれません。FDAが我々の決定に同意せず、新たな510(K)上場前通知またはPMA申請を提出して以前に承認された製品の修正を要求した場合、新たな承認や承認を行う必要はないと考えられ、承認または承認を得るまで、マーケティングの停止や修正された製品のリコールを要求される可能性があり、巨額の規制罰金や処罰を受ける可能性がある。FDAが将来の製品や既存製品の修正を要求すれば、私たちが予想していたより長く、より厳しい検査を行うことができます, 製品紹介や修正は延期またはキャンセルされる可能性があり、これは私たちの業務成長能力に悪影響を及ぼす可能性があります。FDA、適用可能な外国規制機関、および通知機関は、様々な理由で、承認、承認、または認証装置を遅延、制限または拒否することができる
•FDAまたは適用可能な規制エンティティまたは通知機関に、私たちの製品がその予期される用途に対して安全または有効であることを証明することはできません
•FDAまたは適用される外国の規制機関は、著者らの臨床試験または臨床研究の設計または実施、または臨床前研究、臨床試験または臨床研究のデータの解釈に同意しない
•私たちの臨床試験や臨床研究で参加者が経験した深刻で予期せぬ不良装置効果
•この装置の臨床的で他の利点がリスクよりも大きいことを証明することはできません
•私たちが使用している製造プロセスや施設は、適用される要件に適合していない可能性があります
65
•FDAまたは適用される外国の監督管理機関の承認または認証政策や法規に重大な変化が生じる可能性があり、私たちの臨床データや監督文書が承認、承認または認証を得るのに十分ではない
2021年5月25日まで、医療機器は、2021年5月26日に施行された(EU)第2017/745規制(EU医療機器規制)によって置き換えられた議会指令93/42/EEC(EU医療機器指令)によって規制されている。私たちの現在の証明書はEUの医療機器指針に基づいて付与され、更新されている。2021年5月26日までEU医療機器指令に基づいて合法的に市場に投入された機器は、2025年5月26日まで市場で販売または投入され続けることができ、過渡的な条項の要求を満たすことを前提としている。特に,問題のある証明書は依然として有効でなければならず,問題のあるデバイスを大きく変更することはできない.しかし、2021年5月26日から、EU医療機器法規の要求を遵守し、EU医療機器指令における経済経営者と器械登録、上場後の監督、市場監督と警戒要求に関する相応の要求を代替しなければならない。
EUで医療機器マーケティングを推進することは,我々の機器が現在の証明書が満期になったときに,EU医療機器法規に規定されている新制度に基づいて認証を行うことを特に要求する。
もし私たちが適用されるEUの法律を遵守できなければ、私たちは引き続き私たちの製品にCEマークを貼ることができなくなり、これはEUと欧州経済地域(EEA)(27のEU加盟国にノルウェー、リヒテンシュタイン、アイスランドからなる)内でこれらの製品を販売することを阻止するだろう。上記の規定を守らなくても私たちがこの三つの国で私たちの製品を販売することを阻止します。
イギリスが離脱した後、連合法はこれ以上イギリスに直接適用されない。英国の医療機器に関する条例は依然として主にEU医療機器条例以前の3つのEU指令に基づいており、国家法律に組み込まれている。しかし、アイルランド/北アイルランドに関する議定書の条項によると、EUの医療機器条例は確かに北アイルランドに適用される。したがって、イギリスは北アイルランドとEUと比較して現在違う規定を持っている。この二つの規制の要求事項を持続的に遵守することは私たちの業務の費用を増加させるかもしれない。
また,イギリス政府は現在現行法の改正を起草しており,これらの改正は近い将来イギリスの規則をさらに改正する可能性がある。例えば,有効な認証設備の過渡期の制限を受けて,新しいイギリス法規はイギリス市場に投入された医療機器や静注薬品はイギリスで承認された機関の“UKCA”認証を経なければ,合法的に市場に投入されることが要求される可能性がある。イギリス政府は、改正された法規が2024年7月から適用される可能性があり、任意の新しい要求を理解し、遵守することが、私たちの業務にさらなる複雑性とコスト増加をもたらす可能性があると述べた。もしイギリスが承認した機関の能力が不足していれば、私たちの製品認証は延期される可能性があり、これは私たちがそれぞれの過渡期後にイギリスで製品を販売する能力に影響を与えるかもしれない。
ヒト細胞、組織、細胞または組織に基づくいくつかの製品(HCT/P)も販売している。アメリカでは、PHSA第361条とFDAに規定されている21 CFR第1271部分に基づいてHCT/Pを販売しています。私たちはこれらのHCT/P製品を生産しませんが、それらのディーラーとしてです。いわゆる第361条HCT/Pは現在FDAの要求を受けておらず、それらがFDA条例に規定されているいくつかの基準に適合している限り上場許可を得ることができる。現在、“361 HCT/Ps”と規制されているHCT/Pは、HCT/Pを処理、保存、ラベル、配布する際に、FDAの登録施設と上場製品、組織ドナー資格のスクリーニングとテスト、現在の良好な組織実践要求或いはcGTPに関連する要求を遵守しなければならず、必要なラベル情報、厳格な記録保存と不良イベント報告を含む。もし私たちまたは私たちのサプライヤーがこれらの要求を遵守できなかった場合、私たちは警告状、罰金、禁止、製品のリコール、または差し押さえを含むFDAの法執行行動の影響を受ける可能性があり、最悪の場合、刑事罰を受ける可能性もある。第361条HCT/Psとして規制するためには,これらの製品はFDAの基準に適合しなければならず,“最低限の操作”と考えられ,“相同用途”,その他の要求に用いる予定である。第361条に規定するHct/Pに適合しないHct/Pは、FDAが医療機器、正生生物製剤又は薬物に適用する法規的要件によって制約される。設備、整形生物或いは薬物HCT/Pは必ず第361節のHCT/Pに専門的に適用される要求に符合しなければならず、それ以外にも上場許可要求を含む他の要求に符合しなければならない。例えば、第361条Hct/Pは、510(K)許可、PMA承認、バイオ製品ライセンス申請、またはBLAの承認を必要としない, または発売前にFDAの他の上場前の許可を得る。我々のHCT/PはPHSA 361条のみによって規制されていると考えられるため,510(K)の許可,PMA承認,またはBLAを介してこのようなHCT/Pのライセンスを取得することは求められていない。
66
FDAは、これらの人体組織製品が第361条HCT/Pに適合し、これらの製品がBLAの正生製品または510(K)の許可またはPMA承認を必要とする医療機器であると判断し、そのような製品の販売を停止し、および/またはそれらをリコールすることを要求し、FDAの適切な承認、承認または許可を待つことを要求する可能性がある、すなわち、これらの人体組織製品が第361条のHCT/Pに適合するという我々の結論に同意しないかもしれない。マーケティングを中止しなければならない場合、および/または第361条のいずれかのHCT/P製品をリコールしなければならない場合、私たちの純売上高は低下し、これは私たちの業務、運営結果、および財務状況に悪影響を及ぼすだろう。361節の基準を満たさないHCT/PはPHSA 351節により管理される.Hct/Pは、第361条に規定されているHct/Pとは異なり、Hct/PがFDAの上場前審査及び承認を受けるように規制されている。2017年11月、FDAは“ヒト細胞、組織、細胞と組織製品の監督管理考慮:最小操作と同源使用--工業と食品薬品監督管理局スタッフガイドライン”と題する指導文書を発表した。ガイドラインは、FDAがリスクに基づく方法を用いて、第361条に規定されているいくつかのHCT/Pとして不正に販売されていると考えられるIND申請と上場前承認に法執行自由裁量権の行使を要求し、ガイドライン発表日から36ヶ月以内にメーカーにIND申請を提出することを許可することを指摘している。この方法により,FDAは,高リスク製品や用途が即時実行行動の影響を受ける可能性を示している。FDAは2021年6月1日から、これらの製品に対する調査新薬申請と発売前承認要求の実行を再開した。
さらに、FDAは、将来的には、第361条HCT/Pの執行裁量に関する範囲を修正するか、現在または将来の製品に対して第361条HCT/Pに適合する立場を変更するか、またはFDAの執行裁量政策に基づいて、我々のHCT/P製品の一部または全てを合法的に販売できないと決定する可能性がある。いかなる規制変更も私たちに不利な結果をもたらす可能性があり、これらの製品の上場前の承認或いは承認を要求し、追加の上場後の監督管理要求を遵守することによって、私たちの業務をもっと展開しにくくしたり、コストを高くしたりする。
EUでは、人体組織や細胞を含む製品には適用されていないが、独立した規制枠組みがある。しかしながら、EU加盟国が実施する2004/23/EC号指令(EU組織および細胞指令)によれば、このような人体材料の寄付、調達、検出、加工、保存、保存、配布には、上述した人体細胞および組織に関連する活動の一部または全部に適用される一般的な品質および安全要件を規定する具体的な要求がある。EUの医療機器規制nのようなEUの他の法規および指示に規定されている追加の要求は、特にそれらの特性に依存する、我々の人体組織または製品を含む細胞にも適用可能である。
EU加盟国の国家主管部門は、私たちがどのような要求が私たちの製品に適用されるかを決定することに同意しないかもしれないし、私たちが人体細胞と組織を含む製品に追加的な要求を適用することを決定するかもしれない。これらの要求を遵守しないことは、私たちの製品を販売する能力を危険にさらし、法執行行動を招く可能性があり、これは私たちの名声、業務、財務状況、運営結果、将来性を損なう可能性がある。
また、人体組織や細胞に関する規制当局の政策が変化する可能性があり、追加の政府法規が公布される可能性がある。例えば、EUは人体組織や細胞に関連した規制構造が変化している。2022年7月、欧州委員会は人間由来物質の管理に関する提案を採択した。このような規制の変化は私たちに不利な結果をもたらし、ヨーロッパ経済圏での業務をより困難にしたり、高価にしたりする可能性がある。
我々の組織と細胞輸入業者はイギリスに本部を置いているため,イギリス人体組織管理局の許可制度の制約を受けている。私たちの輸入業者のいかなる規定を守らないこともその許可状態に影響を与える可能性があり、いくつかの製品の輸入と流通に必要な組織と細胞の能力に影響を与える可能性がある。
当社で発売されている医療機器製品の修正には、新たな510(K)許可、PMA承認または認証が必要となる場合があり、許可、承認または認証が得られるまで、修正された製品のマーケティング停止またはリコールが要求される可能性があります。
510(K)の許可またはPMAを含む、510(K)の許可を現在取得している任意の製品の修正には、510(K)の許可またはPMAを含む新しい規制承認または許可が必要であるか、またはこれらの許可または承認が得られるまで、修正されたシステムのリコールまたは販売停止が要求される可能性がある。FDAは、設備製造業者に、修正が新たな承認、追加、または承認を必要とするかどうかを最初に決定し、記録することを要求する。製造業者は、修正は安全性または有効性に著しく影響を与えず、その予期される用途の大きな変化を表すこともないので、新しい510(K)許可を必要としないと判断することができる。しかし、FDAは製造業者の決定を検討することができ、同意しないかもしれない。FDAはまた新しい承認や承認を必要とすることを自発的に決定することができる。私たちは過去に私たちの製品を修正したことがあり、未来に私たちが追加的な承認や承認を必要としないと思う他の修正を修正するかもしれない。FDAが修正に同意し、修正の新しい許可または承認を要求しない場合、修正された製品のリコールおよび販売停止を要求される可能性があり、製品の再設計および/または新しいマーケティング許可を求め、私たちの運営結果を損なう可能性があります。このような状況で、私たちは重大な法執行行動の影響を受けるかもしれない。FDAがより長く厳格な
67
将来の製品の検査や既存製品の修正が私たちの予想を超えていれば、製品の導入や修正が延期またはキャンセルされる可能性があり、これは私たちの業務成長能力に悪影響を及ぼす可能性があります。
製造業者がFDAによって承認されたデバイスの修正がそのセキュリティまたは有効性に著しく影響を与える可能性があると判断した場合、またはその予期される用途に大きな変化をもたらすであろう場合、製造業者は、新しい510(K)許可または可能なPMA出願を申請しなければならない。私たちの製品の修正に新しい510(K)の許可またはPMA申請が必要だと判断した場合、修正または他の適応の追加的な許可または承認をタイムリーにまたは根本的に得ることができない可能性があります。承認と承認を得ることは時間のかかる過程である可能性があり,将来必要な承認や承認を遅延させることは,我々が新製品をタイムリーに発売したり,製品の能力を強化したりすることに悪影響を与え,逆に将来の成長を損なうことになる.
EUでは、2021年5月26日までEU医療機器指令に基づいて合法的に市場に投入された機器は、2025年5月26日まで市場で販売または投入され続けることができ、過渡的な条項の要求を満たすことを前提としている。特に,問題のある証明書は依然として有効でなければならず,設備を実質的に変更してはならず,このような変更はEU医療機器法規による新たな認証義務をトリガするため,機関に機器の新たな適合性評価を通知する必要がある。我々の医療機器がEU医療機器法規に基づいて認証されると、EUおよび欧州経済地域で販売または販売されている医療機器の適合性評価を行う通知機関に通知しなければならず、私たちの品質システムまたは医療機器の任意の計画における重大な変化は、EU医療機器法規付属書Iに規定されている一般的な安全および性能要件のコンプライアンスに影響を与える可能性があり、または機器がCEマークを取得した予期される用途の大きな変化をもたらす可能性がある。そして、通知機関は、計画中の変更を評価し、それらが製品がEU医療機器法規に適合し続けているかどうかを検証する。評価が有利であれば、通知機関は新しいCE適合性証明書或いは既存の証明書の付録を発行し、EU医療機器法規付属書に規定されている一般的な安全と性能要求及び品質体系の要求に符合することを証明する。通知機関は、私たちが提案した変更提案に同意しない可能性があり、製品紹介や修正が延期またはキャンセルされる可能性があり、これは私たちの業務を発展させる能力に悪影響を及ぼす可能性があります。
上場後の規制要件を守らなければ、巨額の罰金を含めて法執行行動を受ける可能性があり、市場からの製品のリコールやリコールを要求する可能性がある。
その他の事項以外に、著者らは持続及び普遍的な監督管理規定を遵守し、設備の製造、市場普及、広告、医療機器報告、販売、普及、輸出入、登録及び上場などの事項を管理しなければならない。例えば,医療機器メーカーは上場許可を得る条件としてFDAに定期報告を提出しなければならない。これらの報告書は、デバイス通過後の障害およびいくつかの有害事象に関する情報を含む。このような報告書を提出できなかったり、報告書をタイムリーに提出できなかったりすると、FDAが法執行行動をとることになる可能性がある。定期的な報告書を検討した後、FDAは、より多くの情報を提供することを要求するか、またはさらなる調査を開始することを要求するかもしれない。しかも、私たちが付与されたどんなマーケティング許可も許可された使用適応に限定される。また、製品の製造施設は定期審査と検査を受けなければならない。その後、製品、製造業者、または製造施設の問題が、製品、製造業者または製造施設の制限、市場からの製品のリコール、または他の法執行行動をもたらす可能性があることが分かった。
私たちが統制された規制は複雑で、時間が経つにつれてもっと厳しくなった。規制の変化は、私たちが業務を継続または拡大する能力が制限される可能性があり、コストが予想を上回ったり、予想を下回ったりする可能性がある。また、FDAや他の州や外国の規制機関などは広範な法執行権力を持っている。もし私たちが適用される規制要件を守らない場合、FDA、州、または外国の規制機関が法執行行動を取る可能性があり、その中には以下のいずれかの制裁が含まれている可能性がある
•私たちの製品をリコール、流通中止、行政拘留、または差し押さえます
•新製品、新用途、または既存製品を修正した将来の許可または承認または海外マーケティング許可または認証の承認を遅延または拒否する要求;
68
•私たちの現在の510(K)許可またはHDE承認または認証を撤回または一時停止し、私たちの製品の販売を禁止します
•FDAは、他国で販売するために必要な証明書を外国政府に発行することを拒否した
これらの制裁のいずれも、予想以上のコストまたは予想よりも低い売上をもたらし、私たちの名声、業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。さらに、FDAは、その承認政策を変更し、追加の法規を採用したり、既存の法規を改正したり、他の行動をとることが可能であり、これは、将来開発中の製品の承認や承認を阻止または延期したり、現在承認されている製品をタイムリーに修正する能力に影響を与えたりする可能性があります。このような変化はまた私たちが製品を販売する外国司法管轄区で起こるかもしれない。このような政策や法規の変化は、私たちに追加的な要求を加える可能性があり、新しい許可、承認または認証を得る能力を延期し、コンプライアンスコストを増加させるか、または既存製品の許可または認証を維持する能力を制限するかもしれない。
また、私たちはいくつかの製品の安全性や有効性を監視するために、発売後のテストと監督を要求されています。もし私たちの製品が後に以前に未知の問題を発見した場合、予期しない有害事象または意外な深刻度または頻度の不良事件、製造問題、または規制要件(例えばFDAの品質システム法規(QSR))を遵守できなかった場合、ラベル変更、このような製品または製造過程の制限、製品の市場からの撤回、自発的または強制リコール、修理、交換または流通を要求する任意の医療機器のコスト、罰金、監督管理許可または認証の一時停止、製品差し押さえ、禁止または民事または刑事処罰を招く可能性があり、それによって私たちの業務、経営業績および将来性に悪影響を及ぼす。
立法や規制改革は私たちに実質的な悪影響を及ぼすかもしれない。
国会は時々立法を起草し、提出することは、医療機器の規制を管理する法定条項を著しく変える可能性がある。さらに、FDAは、その承認政策を変更し、追加の法規を採用したり、既存の法規を改正したり、他の行動をとることができ、これは、将来開発中の製品の承認や承認を阻止または延期したり、現在承認されている製品をタイムリーに修正する能力に影響を与えたりする可能性があります。例えば、FDAは2022年2月23日に国際標準化機構(ISO)の標準とより緊密に一致するために、医療機器メーカーのための現在の良好な製造実践要求を確立した改訂QSRの提案規則を発表した。この提案はまだ最終的に決定されたり採択されていない。したがって、この提案または他の任意の提案が採択されれば、どの程度私たちに追加的または異なる規制要件を適用し、コンプライアンスコストを増加させるか、または他の方法で競争を引き起こし、それによって私たちの業務に否定的な影響を与える可能性があるかどうかは不明である
さらに、2019年9月、FDAは、オプションの“セキュリティおよび性能に基づく”販売前審査経路を記載し、“いくつかのよく知られているデバイスタイプ”の製造者が、そのようなデバイスがFDAによって確立された客観的な安全および性能基準に適合することを証明することによって、510(K)の許可経路下での実質的等価性を証明することによって、製造業者が許可中にその医療デバイスの安全性および性能を特定の予測デバイスと比較する必要性を除去するための改訂されたガイドラインを発表する。FDAは、“セキュリティおよび性能に基づく”経路に適したデバイスタイプリストを保持し、各デバイスタイプの性能基準を決定し、実行可能な場合に推奨される試験方法を決定するために、製品固有のガイダンスファイルを作成し続ける。FDAは、我々または我々の競争相手のために、または現在許可されているデバイスカテゴリのための性能基準を確立する可能性があり、このような性能基準が確立されれば、新しい510(K)の許可を得る能力にどの程度影響を与えるか、または他の方法で私たちのトラフィックに悪影響を与える可能性のある競争にどの程度影響を与えるかは不明である。
さらに、FDAおよび他の外国当局は、しばしば、我々の業務および製品に重大な影響を与える可能性がある方法で、FDAおよび外国の法規およびガイドラインを改訂または再解釈する。任意の新しい規制、法規、または既存の法規の改正または再解釈は、任意の将来の製品のコストを増加させたり、審査時間を延長したり、私たちの製品が許可、承認または認証、製造、マーケティング、または流通を得にくくする可能性があります。私たちは法規、法規、法律解釈、あるいは政策の変化を確定することができず、公布、公布、採用すれば、私たちの未来の業務にどのような影響を与えるかもしれません。このような変更は、許可、承認または認証を得るために追加のテストを必要とする場合があります。製造方法の変更、当社製品のリコール、交換、または生産停止、または記録を追加的に保存します。
69
もし私たちが既存の要求の変化に緩やかに適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは規制コンプライアンスを維持できない場合、私たちは法執行行動の影響を受ける可能性があり、利益を達成したり維持したりすることができないかもしれない。
医療機器に関するEUの構造は最近変化した。2017年4月5日、EU“医療機器指令”と理事会指令90/385/EEC(EU能動植え込み型医療機器指令)を廃止し、代替するEU“医療機器条例”が採択された。EU加盟国の国家法律で施行されなければならない指令とは異なり、この法規は、EU加盟国がそれを国家法律として実施する必要がなく、EU加盟国間の現在の医療機器規制の違いを除去するために直接適用される。欧州連合の医療機器条例は欧州経済地域にも適用される。EU医療機器法規の目的の1つはEU全体の範囲内で統一、透明、予測可能かつ持続可能な医療機器監督枠組みを構築し、革新を支持すると同時に高いレベルの安全と健康を確保することである。
この新しい法規による改正は、私たちがEUとヨーロッパ経済圏で業務を展開する方法に影響を与えるかもしれない。例えば、新制度への移行により、通知機関の審査時間が延長され、製品発売が遅れる可能性があり、これは我々の業務をタイムリーに発展させる能力に悪影響を及ぼす可能性がある。
また,近年の医療コストの増加に対応するために,連邦政府,州政府,規制機関,第三者支払者がこれらのコストを抑制するために提案を続けてきたが,より広く言えば,米国医療システムの改革である。その中のいくつかの提案は私たちの製品に対して受け取る価格あるいは私たちの製品の精算金額を制限し、私たちの製品の受容度と可用性を制限するかもしれません。
2010年3月、連邦政府はACAを公布した。他の条項では,ACAは新たな価値に基づく支払い計画を構築し,比較有効性研究への資金を増加させ,回避可能な再入院や病院獲得条件に対する病院支払いを減少させ,看護協調を促進する代替支払い方法を評価するパイロット計画(例えば,バンドル医師や病院支払い)を評価した。また、提供者に支払う連邦医療保険支払いも減少し、2013年4月1日から施行され、国会が追加的な行動を取らない限り、2020年5月1日から2022年3月31日まで支払いを停止する2032年まで有効となる。
ACAのいくつかの側面は公布以来、司法、行政、そして国会の挑戦を受けてきた。2021年6月17日、米国最高裁はいくつかの州がACAに対して提出した最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。最高裁が裁決を下す前に,総裁·バイデンはACA市場による医療保険の取得を目的とした2021年2月15日から2021年8月15日までの特殊保険期間を開始する行政命令を発表した。行政命令はまた、作業要求を含む医療補助モデル項目および免除計画の再検討、医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策の再検討、医療補助またはACAによる医療保険の取得を制限する既存の政策および規則の見直しを指示する。他の州や連邦医療改革措置も考慮されており、これらの措置は将来的に私たちの業界や私たちの顧客に実質的な悪影響を及ぼす可能性がある。最終的に連邦や州レベルでどのような医療計画や法規が実施されるかを予測することはできず、将来のいかなる立法や法規の効果も予測できない。しかし、私たちの製品の精算を下げ、医療機器の税金を増加させ、私たちまたは医療部門の他の人のコストを増加させ、圧力をコントロールしたり、医療プログラム量を減少させる法規や法律の変化は、私たちの業務、財務状況、運営結果、あるいはキャッシュフローに悪影響を及ぼす可能性があります。
EUでは、認証を受けると、似たような事態が製品を利益にして商業化する能力に影響を与える可能性がある。2021年12月,衛生技術評価に関する第2021/2282号条例が可決され,第2011/24/EU号指令が改正された。この規定は2022年1月に施行されたが、2025年1月から適用され、その間に実施に関する準備と手順が取られるだけである。この条例は施行されると、関連製品を対象に段階的に実施されるだろう。この規定は、いくつかの高リスク医療機器を含む衛生技術の評価におけるEU加盟国の協力を促進し、これらの分野の共同臨床評価にEUレベルの協力基盤を提供することを目的としている。この法規は、EU加盟国がEU範囲内で汎用的なHTAツール、方法、およびプログラムを使用することを可能にし、患者に最大の潜在的影響を有する革新的な衛生技術の共同臨床評価を含む4つの主要分野で協力することを可能にし、科学コンサルティングを連合し、開発者はHTA当局にアドバイスを求め、新興衛生技術および将来性のある技術を決定し、他の分野で自発的な協力を継続することができる。個別EU加盟国は、衛生技術の非臨床(例えば、経済、社会、倫理)の評価を引き続き担当し、定価と精算について決定する。
70
私たちの製品は連邦と州の品質法規に従って生産し、FDAと外国の検査を受けなければなりません。もし私たちがこれらの法規を守らなければ、罰金、製品リコール、製品責任クレーム、未来の製品許可、名声損害、その他の悪影響を招く可能性があります。
私たちの製品生産に使用する方法と施設はFDAのQSRと海外の要求に適合しなければならない。これらの要求は複雑な監督管理方案であり、医療機器の設計、テスト、生産、過程制御、品質保証、ラベル、包装、運搬、貯蔵、流通、設置、サービスと輸送のプログラムと文書をカバーする。また、サプライヤーの施設、プログラム、運営が私たちの品質基準と適用された法規要件に適合しているかどうかを検証する必要があります。FDA、外国規制機関、および通知機関は、医療機器製造施設を定期的に発表または抜き打ち検査または監査することによって、下請け業者の施設を含む可能性があるQSRを実行する。
私たちまたは私たちの第三者製造業者は、適用された法規を遵守するために必要なステップを取らないかもしれませんが、これは、私たちの製品の納品遅延を招く可能性があります。さらに、適用されるFDAまたは外国規制要件を遵守できなかったか、または後に、私たちの製品または製造プロセスに以前に未知の問題があることが発見され、(I)警告状または無タイトル状、(Ii)罰金、禁止または民事処罰、(Iii)承認、許可または認証の一時停止または撤回、(Iv)顧客通知または修理、交換、払い戻し、差し押さえ、差し押さえまたはリコール、(V)生産または流通の完全または部分的一時停止、(Vi)行政または司法制裁;(Vii)FDAまたは外国当局または通知機関は、私たちの製品に未定または将来の許可、承認または認証を付与することを拒否し、(Viii)臨床保有、(Ix)私たちの製品輸出入を許可することを拒否し、(X)私たちまたは私たちの従業員に刑事訴訟を提起する。このような行動のいずれも私たちの製品の供給に大きな否定的な影響を及ぼすかもしれない。もしこれらの事件のいずれかが発生すれば、私たちの名声は損なわれるかもしれません。私たちは製品責任クレームに直面するかもしれません。私たちは顧客を失い、収入が減少し、コストが増加する可能性があります。
もし私たちがこのような用途の普及に関与していると考えられれば、誤用やラベル外で私たちの製品を使用することは、私たちの市場での名声を損なう可能性があり、被害を招き、製品責任訴訟を招き、あるいは規制機関のコストの高い調査、罰金、または制裁を招く可能性があり、いずれも私たちの業務に代価を与える可能性がある。
我々の全距骨アイソレータがHDEでの販売を許可されていることと、我々の保持骨移植システムのような私たちの整形生物製品がHCT/Psとして規制されていることに加えて、私たちが販売している製品は、FDAによって承認された特定の適応のII種類の医療器具であるか、または一般的な整形外科用途のためのクラスI免除である。三種類の医療機器製品はありません。私たちは私たちのマーケティング担当者と直売者を訓練し、私たちの設備のFDA以外の用途や外国から許可された使用適応、いわゆる“ラベル外使用”については宣伝しません。しかし,医師が彼や彼女の独立した専門医療判断が適切であると思っていれば,ラベルの外で医師が我々の設備を使用することを阻止することはできない。もし医者がラベルの外で私たちの設備を使用しようとすれば、患者の怪我のリスクを増加させるかもしれない。さらに、FDAまたは通知機関が承認、承認または認証の適応に加えて、私たちのデバイスを使用することは、このような疾患を効率的に治療することができない可能性があり、これは、医師および患者における私たちの市場的名声を損なう可能性がある。
FDAまたは外国規制機関が、私たちの宣伝材料または訓練が非ラベル使用の宣伝を構成していると判断した場合、私たちの訓練または宣伝材料を修正することを要求することができ、または警告状、禁止、差し押さえ、民事罰金、または刑事罰を必要としない違反者のための無見出し手紙の発行または実施を含む規制または法執行行動を要求することができる。私たちは外国の規制機関の行動によって似たような結果に直面するかもしれない。他の連邦、州、または外国の法執行機関が私たちの商業活動がラベル外使用の普及を構成していると考えていれば、他の規制機関(例えば虚偽申告法)に基づいて行動する可能性もあり、これは刑事、民事と行政処罰、損害賠償、罰金、返還、政府医療計画から除外され、私たちの業務が削減されることを含む重大な処罰を招く可能性がある。
また、医師が十分な訓練を受けていない場合、彼らは私たちの製品を乱用したり、不適切な技術を使用したりする可能性があり、これは製品の責任を傷つけ、増加させるリスクを招く可能性がある。もし私たちの設備が誤用されたり、不適切な技術が使用されたりすれば、私たちは私たちの顧客や彼らの患者たちの高価な訴訟を受けるかもしれない。上述したように、製品責任クレームは、経営陣のコア業務に対する関心を分散させ、弁護コストが高く、私たちに対する巨額の損害賠償を招く可能性があり、これらの賠償は保険範囲内ではない可能性がある。
71
私たちの医療機器製品は、不良医療事件を引き起こすか、または故障したり、故障したりする可能性があり、FDAまたは外国の規制機関に報告しなければなりません。そうしなければ、私たちは私たちの名声、業務、財務状況、および運営結果を損なう可能性のある制裁を受けます。私たちの製品に深刻な安全問題があることが発見されたり、自発的またはFDAや他の政府機関の指示の下で私たちの製品をリコールすることは、私たちにマイナスの影響を与える可能性があります。
我々は、FDAの医療機器報告法規および同様の外国法規によって制約されており、これらの法規は、私たちの1つまたは複数の医療機器製品が死亡または深刻な傷害または故障を引き起こす可能性があることを受信または合理的に示す場合に、故障が再び発生した場合、死亡または深刻な傷害を引き起こす可能性があるか、または死亡または深刻な傷害を引き起こす可能性があることをFDAおよび同様の外国法規に報告することを要求する。私たちの報告義務の時間は私たちが不良事件の日付とイベントの性質を知っていることによって触発される。私たちは規定された時間範囲内で私たちが知っている有害事象を報告できないかもしれない。私たちはまた、私たちが報告可能な有害事象を認識していることを認識していないかもしれないが、特にそれが有害事象として報告されていない場合、またはそれが意外である場合、または製品を使用する際にタイムリーに除去された有害事象である場合には意識していないかもしれない。もし私たちが私たちの報告義務を履行できなかった場合、FDAまたは外国規制機関は、警告状、無見出し手紙、行政行動、刑事起訴、民事罰金、私たちの設備許可の撤回、承認または認証、私たちの製品の差し押さえ、または未来の製品の整理、承認または認証を延期することを含む行動を取ることができる。
製品の設計又は製造に重大な欠陥又は欠陥がある場合、又は製品が健康に対して許容できないリスクを構成する場合、FDA及び外国監督機関は商業化製品のリコールを要求する権利がある。FDAがリコールを要求する権力は、この装置が合理的な可能性があることが深刻な傷害や死亡を招く可能性のある調査結果に基づいていなければならない。もしどんな重大な欠陥が発見されたら、私たちはまた自発的に製品をリコールすることを選択することができる。健康リスクは受け入れられない、部品故障、故障、製造欠陥、ラベル或いは設計欠陥、包装欠陥或いはその他の欠陥或いは適用法規を遵守できないため、私たちは政府の強制或いは自発的なリコールが発生する可能性がある。未来には製品の欠陥や他のミスが発生するかもしれない。製品の欠陥や欠陥を是正するための我々の是正措置によると、FDAまたは外国規制機関は、修正された設備を販売または流通することができるように、その装置の新しい許可、承認または認証を得る必要があると決定することができるかもしれない。このような許可、承認、認証を求めることは、リコール設備をタイムリーに交換する能力を遅らせる可能性があります。さらに、もし私たちが私たちの設備に関連する問題を十分に解決していない場合、私たちはFDAまたは外国規制機関の警告状、製品差し押さえ、禁止、行政処罰、または民事または刑事罰金を含む追加の規制法執行行動に直面する可能性がある。
会社はFDAや外国当局に報告する必要がなくても、いくつかのリコールと訂正の記録を保持することを要求されている。私たちは将来的にFDAや外国当局に通知する必要がない製品を自発的に撤回または修正する必要がないと判断することができる。FDAや外国当局が私たちの決定に同意しなければ、それは私たちにこれらの行動をリコールとして報告することを要求するかもしれないし、私たちは法執行行動の影響を受けるかもしれない。将来のリコール声明はお客様の名声を損なう可能性があり、私たちの製品責任に対するクレームを招き、私たちの販売にマイナス影響を与える可能性があります。しかも、私たちは過去と未来に私たちの製品や手続きに関連した不良事件の報告を持っている。医療機器や外科手術業界は固有であるが,頻繁な有害事象は名声被害を招き,我々の販売に負の影響を与える可能性がある。任意の是正行動は、任意であっても非自発的であっても、訴訟において自己弁護するためには、時間と資金を投入し、経営陣の業務運営への関心を分散させ、私たちの名声や財務業績を損なう可能性がある。
資金不足や世界的な健康問題によるFDA、他の政府機関、通知機関の中断は、重要な指導部や他の人員の採用、保留または配置の能力を阻害する可能性があり、あるいは新製品や修正された製品が開発、承認、承認または商業化できない他の方法で阻止する可能性があり、これは私たちの業務にマイナスの影響を与える可能性がある。
FDA、外国規制機関および通知機関が新製品を審査·承認、承認または認証する能力は、政府予算および資金レベル、法律、法規および政策の変化、FDAまたは他の機関がキーパーソンを雇用および保留する能力、ユーザ費用の支払いを受け入れること、およびFDAまたは他の機関が日常的な機能を果たす能力に影響を与える可能性がある他のイベントを含む様々な要因の影響を受ける可能性がある。したがって、FDAや他の機関の平均審査時間は近年変動している。また,他の研究開発活動を援助する政府機関への政府の援助は政治過程の影響を受けており,この過程は本質的に不安定で予測不可能である。FDA、他の機関、および通知機関の中断も、必要な政府機関の審査を受けるために、または通知機関による認証に要する時間を遅らせるために、または承認または許可された医療機器の必要な修正を遅らせる可能性があり、これは、私たちの業務に悪影響を及ぼす。例えば、ここ数年間、米国政府は何度か閉鎖されており、FDAのようないくつかの規制機関は、FDAのキー従業員を休暇にし、キー活動を停止しなければならない。
72
また、新冠肺炎の流行に対応するため、アメリカ食品薬品監督管理局は国内外の異なる場所の製造施設の大部分の検査を延期した。FDAはすでに実行可能な情況下で国内施設に対する標準検査操作を回復したが、FDAは依然としてその検査活動の変化を監視と実施し、その従業員及び監督会社の安全を確保し、絶えず変化する新冠肺炎疫病に適応し、ウイルスの灰再発或いは新変種の出現は更なる検査遅延を招く可能性がある。新冠肺炎疫病に対して、米国以外の規制機関はすでに類似した制限または他の政策措置を取っている可能性がある。もし政府が長期的に停止した場合、あるいは世界的な健康問題がFDA、他の監督管理機関、または通知機関が定期的な検査、監査、審査または他の監督活動を阻止し続ける場合、FDA、他の監督管理機関、通知機関が私たちの規制提出を適時に審査し、処理する能力に深刻な影響を与える可能性があり、これは業務に重大な悪影響を及ぼす可能性がある。
EUでは,通知機関はEU医療機器法規に基づいて製品やサービスを認証するために正式に指定されなければならない。いくつかの通知機関が指定されているが,新冠肺炎の流行はそれらの指定過程を大幅に緩和しており,現在指定された通知機関は新法規による認証の大量要求に直面しており,その結果,審査期間が延長されている。このような状況はEUと欧州経済地域で事業を発展させる私たちの能力に影響を及ぼすかもしれない。
臨床研究過程は長くて高価で、結果は不確定であり、早期研究の結果は未来の臨床試験或いは臨床研究結果を予測できない可能性があり、また著者らの製品に有利な安全性或いは有効性データを提供することができない。
我々が行っている発売後の臨床研究あるいは将来行われる可能性があるあるいは賛助する任意の他の臨床研究が成功することは保証できず、しかもこのような臨床研究は長時間持続する可能性があり、しかも行うのは非常に高価である。臨床テストは設計·実施が困難であり,何年もかかる可能性があり,コストが高い可能性があり,結果も確定していない。臨床研究はFDA、他の適用規制機関、外国当局の法律要求、法規またはガイドラインに基づいて行われ、これらの政府機関と臨床研究を行う医療機関の機関審査委員会または他の審査機関の監督を受けなければならない。また,我々は今後も契約研究組織(CRO)と臨床研究サイトに依存して,我々の臨床研究が正確かつタイムリーに行われることを確保する可能性があり,彼らが約束した活動に合意しているが,彼らの実際の表現への影響は限られている。もし著者らの協力者或いはCROが著者らの臨床研究のために参加者を募集できなかった場合、必要な良好な臨床実践標準に従って研究を行うことができなかった場合、或いは研究実行過程中に完全登録を実現することを含む長い時間遅延され、著者らはコスト増加、計画遅延或いは両者の影響を受ける可能性がある。
いかなる臨床研究の起動と完成は各種の原因によって阻止され、遅延或いは停止される可能性があり、これは著者らの臨床研究のコスト、スケジュール或いは成功の完成に不利な影響を与える可能性がある。また,新冠肺炎の大流行による中断は,我々が開始,募集,われわれの計画中や進行中の臨床研究を開始,進行している際にこのような困難や遅延に遭遇する可能性を増加させる可能性がある。このようなどんな状況でも、私たちの業務、財政状況、そして見通しを深刻に損なうかもしれない。
また、患者の臨床研究への参加と患者フォローアップの完成は、患者群の規模、研究方案の性質、患者と臨床場所の接近程度、臨床研究の資格基準、患者コンプライアンス、相互競争の臨床研究と臨床医師、および研究中の製品の他の利用可能な治療法に対する潜在的な優位性に対する患者の見方を含む多くの要素に依存し、著者らが調査している適応のための任意の新しい治療法が承認される可能性がある。
もし私たちが臨床研究を行い、私たちの臨床前開発を助けてくれた第三者が要求或いは予想通りに行わなければ、私たちは規制許可、承認或いは認証を得ることができず、私たちの製品を商業化することもできないかもしれない。
私たちは未来の製品のために独立して臨床前と臨床研究を行う能力がないかもしれません。私たちはCRO、医療機関、協力者、臨床研究者と契約実験室などの第三者に依存してこのような試験を行う必要があるかもしれません。しかし、私たちは私たちのすべての研究が適用された合意、法律と法規の要求、そして科学的な基準に従って行われ、私たちの第三者への依存が私たちの規制責任を免除しないことを確実にする責任がある。我々とこれらの第三者はGCP要求を遵守しなければならず,これらの要求はFDAや同様の外国規制機関が臨床開発中の製品に対して実行する法規やガイドラインである。規制機関は、定期的に研究スポンサー、主要調査者、研究場所を検査することで、これらのGCP要求を実行する。
もし私たちまたはこれらの第三者のいずれかが適用されたGCP規定を遵守できなかった場合、私たちの臨床研究で生成された臨床データは信頼できないと考えられる可能性があり、FDAまたは同様の外国の規制機関または他の機関は私たちに実行を要求するかもしれない
73
私たちのマーケティング申請を承認または承認したり、私たちの製品を認証したりする前に、より多くの臨床研究が必要です。検査後、これらの監督機関は私たちの未来の任意の臨床研究あるいは臨床試験がGCP規定に適合しているかどうかを確認することを保証することはできません。もし私たちの協力者やCROが私たちの臨床研究のために参加者を募集できなかった場合、GCP標準に従って研究を行うことができなかった場合、または試験実行中に長期にわたって遅延され、感染症の爆発、例えば新冠肺炎の大流行、または他の場合を含む完全登録を達成することを含む場合、コスト増加、計画遅延、または両方の影響を受ける可能性があり、したがって、生成された任意のデータは信頼できないか、または規制目的に使用できない可能性があり、私たちは法執行行動の影響を受ける可能性がある。
これらの第三者が彼らの契約義務または監督義務を成功裏に履行できなかった場合、または予想された最終期限内に完了した場合、これらの第三者が交換する必要がある場合、または彼らが得たデータの品質または正確性が、私たちの臨床方案や規制要件または他の理由に従わなかった場合、私たちの臨床前開発活動または臨床研究は延長、延期、一時停止または終了する可能性があり、私たちは直ちに監督部門の承認や認証を得ることができないか、あるいは私たちの製品を商業化することに成功できず、私たちの業務、運営結果、将来性は不利な影響を受ける可能性がある。
実際または予想されるように、適用されるデータ保護、プライバシーおよびセキュリティ法律、法規、基準、およびその他の要求を遵守できないことは、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
私たちの運営過程で、私たちは、私たちの従業員および私たちと業務を展開する第三者からの情報を含む、ますます多くの個人情報を収集、使用、記憶、開示、移転、および他の方法で処理することができるかもしれません。私たちと私たちのパートナーは、連邦、州、および外国のデータ保護法律および法規(すなわち、データプライバシーおよびセキュリティに関する法律および法規)によって制約される可能性があります。米国では、データ漏洩通知法、健康情報プライバシー法、および消費者保護法律法規(例えば、FTC法案第5条)が、データ漏洩通知法、健康情報プライバシー法、および消費者保護法律法規(例えば、FTC法案第5条)を含む健康関連情報および他の個人情報の収集、使用、開示および保護を管理する多くの連邦および州法令に適用される可能性がある。我々はまた,FDAのガイドラインを含む医療機器のデータ安全に関する米国連邦規則,法規,ガイドラインを遵守することが可能である。また,HIPAA(改訂された)のプライバシーやセキュリティ要求に制約された第三者(臨床試験データを取得した研究機関を含む)から健康情報を取得する可能性がある。事実および状況によれば、HIPAAによってカバーされるエンティティまたはビジネスパートナーによって維持される個別に識別可能な健康情報をHIPAAの許可または許可されていない方法で取得、使用、または開示する場合、私たちは重大な処罰を受ける可能性がある。世界各地のデータプライバシーとセキュリティ規制の枠組みは絶えず変化と発展しているため、予測可能な未来に、基準の解釈と実施及び法執行のやり方は依然として不確定である可能性がある。
一部の州では、同様のプライバシーおよびセキュリティ法律法規が採択され、健康に関する個人情報や他の個人情報のプライバシー、処理、保護が管理されている。これらの法律と法規は、異なる裁判所や他の政府当局によって解釈され、私たちおよび未来の顧客と戦略パートナーに潜在的な複雑なコンプライアンス問題をもたらすだろう。例えば、カリフォルニア州は2018年6月28日に“カリフォルニア消費者プライバシー法”(CCPA)を制定し、2020年1月1日に施行した。CCPAはカリフォルニアの消費者のためのプライバシー権を創出し、ある個人情報を処理するエンティティのプライバシーとセキュリティ義務を増加させた。CCPAは,違反行為に対する民事処罰と,データ漏洩訴訟の可能性や関連リスクを増加させたデータ漏洩に対する個人訴権を規定している。また、カリフォルニアプライバシー権法案(CPRA)は2023年1月1日に正式に施行され、CCPAに対して重大な改正が行われ、カバーする企業に追加の消費者権利プロセス、データ使用の制限、高リスクデータの新しい監査要求、および特定の敏感なデータ使用からの選択を含む追加のデータ保護義務が加えられた。それはまた、実質的な法規の発行を許可し、プライバシーと情報セキュリティ法執行の強化につながる可能性がある新しいカリフォルニア州データ保護機関を作成した。追加的なコンプライアンス投資と潜在的なビジネスプロセスの変更が必要になる可能性があります。バージニア州、コロラド州、コネチカット州、ユタ州でも似たような法律が可決され、他の州と連邦政府も類似の法律を提出した, アメリカのより厳格なプライバシー立法の傾向を反映している。このような法律の公布は相互衝突の要求があり、コンプライアンスを挑戦的にする可能性がある。もし私たちがHIPAA、CCPA、CPRA、または他の国内プライバシーおよびデータ保護法律の制約または影響を受けた場合、これらの法律の要求を遵守できなかったために負う任意の責任は、私たちの財務状況に悪影響を及ぼす可能性があります。
EUでは、“EU一般データ保護条例”(GDPR)が2018年5月に施行され、欧州経済域内の個人データの処理に厳しい要求が出された。GDPRを遵守しなければならない企業は、より強力なデータ保護要件の規制法執行、および不正があれば2000万ユーロまたは不適合会社の世界年収の4%までの罰金が科される可能性があるコンプライアンス義務およびリスクに直面しなければならない。
他の要件では、GDPR規制は、GDPRによって制約された個人データを、このような個人データに対して十分な保護を提供することが発見されていない第3国に移し、2020年7月、欧州連合裁判所(CJEU)制限組織が、以下の方法で個人データを欧州経済地域から米国に合法的に転送する方法を提供する
74
国際譲渡を目的としたEU−米国プライバシー保護枠組みは無効であり,標準契約条項(SCC)の使用にさらに制限を加えている。2022年3月、米国とEUは無効な法規の代わりに新たな規制制度を発表したが、バイデン総裁が2022年10月7日に署名した米国の信号情報活動の保障強化に関する行政命令を除いて、この新たなEU-米国データプライバシーの枠組みはまだ実施されていない。欧州裁判所と規制機関は2020年7月16日のCJEU裁決後に下した決定で、国際データ転送に制限的なやり方をとった。規制当局が個人資料出力メカニズムについてさらなる指針を出すのに伴い、SCCが使用できない場合、および/または法執行行動を開始すると、追加コスト、クレームおよび/または規制調査または罰金を受ける可能性があり、および/または他の方法で私たちが業務を展開している国と地域の間で個人資料を移転できない場合、これは私たちがサービスを提供する方法、地理的位置、または私たちの関連システムと業務の隔離に影響を与え、私たちの財務業績に悪影響を及ぼす可能性がある。
これに関連して、イギリスの欧州経済圏とEU離脱、および2021年1月1日からの移行期間の終了に伴い、会社はイギリスの国家法律に組み込まれたGDPRとGDPRを同時に遵守しなければならず、後者はそれぞれ1,750万GBまたは世界売上高4%の罰金を科す権利がある。もし私たちがGDPRとイギリスデータ保護法に規定された義務を守らなければ、私たちは上記の罰金に直面するかもしれない。さらに、私たちは訴訟および/または負の宣伝の対象になる可能性があり、これは私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性がある。
政府の規制に加えて、プライバシー擁護者や業界団体は、将来的に時々自己規制基準を提出する可能性がある。このような基準と他の産業基準は法的または契約的に私たちに適用されるかもしれないし、私たちはこのような基準を遵守することを選択するかもしれない。データプライバシーとセキュリティに関する新たな提案された法律法規が引き続きあると予想されていますが、これらの将来の法律、法規、基準が私たちの業務にどのような影響を与える可能性があるのかを決定することはできません。
私たちは、私たちのプライバシーポリシー、私たちのウェブサイトで提供された情報、およびニュース声明を通じて、私たちが個人情報を使用して開示することを宣言します。私たちは私たちの公開声明と文書を守るために努力しているにもかかわらず、私たちは時々遵守できないかもしれないし、非難されて守られていないかもしれない。私たちのプライバシー政策やデータのプライバシーおよびセキュリティに約束と保証を提供する他の声明の発表は、彼らが詐欺的、不公平、または私たちの実際のやり方を歪曲していることが発見されれば、潜在的な政府または法的行動に直面する可能性がある。私たちのデータプライバシーやセキュリティ慣行に対するいかなる懸念も、根拠がなくても、私たちの業務名声を損なう可能性があり、私たちの業務、財務状況、運営結果を損なう可能性があります。
適用される法律、法規、基準、私たちの契約義務、および他の法的義務を遵守するために努力しているにもかかわらず、これらの要求は、異なる司法管轄区域で不一致な方法で修正、解釈、適用される可能性があり、お互いまたは私たちが遵守しなければならない他の法的義務と衝突する可能性がある。私たちまたは私たちの従業員、代表、請負業者、コンサルタント、協力者、または他の第三者は、そのような要求を遵守できなかったか、またはプライバシーおよびセキュリティ問題を十分に解決できなかったと考えられ、根拠がなくても、私たちの追加コストおよび責任を招き、私たちの名声を損なうことができ、私たちの業務および運営結果に悪影響を及ぼす可能性があります。さらに、我々のやり方が法律および規制要件と一致しない場合、または一致しないとみなされ、法律、法規および基準の変化、または既存の法律、法規および基準の新しい解釈または適用を含む場合、私たちはまた、監査、調査、通報者の苦情、不利なメディア報道、調査、刑事または民事制裁の対象となる可能性があり、これらはすべて私たちの業務、財務状況、および運営結果を損なう可能性がある。
私たちの普通株式所有権に関連するリスク
私たちの経営業績にかかわらず、私たちの普通株の市場価格は大幅に変動したり低下したりする可能性があり、これはあなたの一部または全部の投資損失を招く可能性があります。
私たちの普通株の市場価格は非常に不安定かもしれません。様々な要素によって大幅に変動したり下落したりする可能性があります。その中のいくつかの要素は私たちの制御範囲内にない、あるいは複雑な方法で関連しています
•アナリストの見積もりの変化、投資家の見方、証券アナリストの提案、あるいは私たちはアナリストの推定を実現できなかった
•足と足首の製品やプログラムの商業化の遅れや挫折を行っています
•既存または新しい競争力のある製品または技術の成功;
75
•特許出願、発行された特許または他の固有の権利に関連する発展または紛争;
•追加的な資金調達努力が発表されるか、または予想される
•私たちまたは私たちの競争相手は、重大な業務発展、買収、新製品、ライセンス、戦略的パートナーシップ、合弁企業、または資本約束を発表します
•選択的プログラム実行状況に及ぼす新冠肺炎または他の流行病の影響
•ウクライナとロシアの間の戦争、ロシア、アメリカとヨーロッパ諸国、中国などの他の国との間のこのような紛争による対応する緊張のような政治的不安定、自然災害、テロおよび/または戦争事件の影響
•私たち、私たちの内部人、または他の株主は私たちの普通株を売却します
•私たちの財務業績や私たちと似ていると思われる会社の財務業績の違い
•インフレ、金利、全体的な経済状況と不確実性の変化を含む様々なマクロ経済事件
•私たちの製品の返品率を高めたり、保証クレームを増やしたりします
•景気後退や減速を含む全体的な経済、業界、そして市場状況
近年,株式市場,特に医療機器会社の市場は重大な価格や出来高変動を経験しており,これらの変動はその株式がこれらの価格や出来高変動を経験した会社の経営業績の変化に関係なくあるいは比例しないことが多い。また、様々なマクロ経済事件により、株式市場は全体的に高度に変動してきた。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格に深刻な影響を与える可能性がある。ある会社の証券市場価格にこのような変動が生じた後、同社に対して証券集団訴訟が提起されることが多い。私たちの株価の潜在的な変動性のため、私たちは未来に証券訴訟の目標になるかもしれない。証券訴訟は巨額のコストを招き、経営陣の注意と資源を私たちの業務から移す可能性がある。
もし私たちの特定の時期の経営と財務表現が私たちが大衆に提供したいかなる指導にも適合しなければ、私たちの普通株の市場価格は低下するかもしれない。
私たちは未来期間の予想された経営と財務業績について公開的な指導を提供した。このような指導は、本Form 10-K年次報告および我々の他の公開文書および公開声明に記載されたリスクおよび不確実性の影響を受ける前向き陳述からなるであろう。私たちの実際の結果は、特に経済的に不確実な時期に、いつも私たちが提供したどんな指導と一致したり超えたりするわけではないかもしれない。もし私たちの未来のある時期の経営または財務業績が私たちが提供したいかなる導きや投資アナリストの予想に合わなければ、あるいは私たちが未来の時期の導きを減らすならば、市場は
76
私たちの普通株の価格は下がるかもしれません。たとえ私たちが本当に大衆の指針を出しても、私たちが未来にそうすることを保証することはできない。
もし私たちが財務報告書に対して適切かつ有効な内部統制を維持できなければ、私たちが正確かつ適時に財務諸表を作成する能力は損害を受ける可能性があり、これは私たちの経営業績、投資家の私たちに対する見方を損なう可能性があり、それによって私たちの普通株の価値を損なう可能性がある。
2002年のサバンズ·オキシリー法404条によると、私たちの経営陣は財務報告書の内部統制に対する私たちの有効性を報告しなければならない。私たちが新興成長型会社でなくなると、私たちの独立公認会計士事務所も財務報告の内部統制に対する私たちの有効性を証明することを要求されるだろう。財務報告書の内部統制を評価する際に適合しなければならない基準のルールは複雑であり、大量の文書、テスト、および可能な救済措置が必要である。財務報告に対する私たちの内部統制を評価する際には、情報技術を含む私たちのシステムをアップグレードする必要があるかもしれません。より多くの財務および管理制御、報告システム、および手続きを実施し、より多くの会計および財務者を雇用する必要があります。
必要な新しい制御措置や改善された制御措置を実施できなかったり、実行中に遭遇した困難は、私たちの報告義務を履行できない可能性があります。さらに、2002年の“サバンズ·オクスリー法案”第404条に基づく我々の独立公認会計士事務所による任意のテストは、財務報告の内部統制の欠陥を明らかにすることができ、これらの欠陥は実質的な弱点と考えられるか、または私たちの財務諸表を前向きまたは追跡的に変化させる必要があるか、またはさらなる関心または改善が必要な他の分野を発見する必要があるかもしれない。悪い内部統制はまた、投資家が私たちが報告した財務情報に自信を失う可能性があり、これは私たちの普通株の取引価格にマイナス影響を与える可能性がある。内部統制の欠陥はまた私たちが未来に財政的業績を再説明することにつながるかもしれない。私たちは株主または他の第三者訴訟の対象となる可能性があり、米国証券取引委員会、私たちの証券上場の証券取引所または他の規制機関の調査は、追加の財務および管理資源が必要となり、罰金、停止、損害賠償の支払い、または他の救済措置を招く可能性がある。
本年度報告Form 10-K第II部第9 A項で述べたように、我々は以前、財務報告の内部統制に大きな弱点があることを発見したが、これは、私たちが有効な制御環境を設計または維持していないことに関連しており、主な原因は、手動日記帳分録に関する適切な制御の不足と、複雑な取引を分析、計算、開示するための正式な会計政策、プログラム、および制御の不足である。当社の経営陣は、2022年12月31日までに、重大な弱点を招く欠陥を補うために財務報告内部統制の変更を確認し、実施していますが、このような変化により、当社経営陣は重大な弱点が救済されたと結論し、財務報告の内部統制は2022年12月31日から発効します。私たちが今まで取ってきた措置と私たちが将来取る可能性のある行動が未来の潜在的な重大な弱点を防止または回避することを保証することはできません。
また、上場企業として、取引法に基づいて、米国証券取引委員会に四半期·年次報告書をタイムリーかつ正確に提出しなければならない。私たちの財務業績を正確かつタイムリーに報告できなかったいかなる行為も、制裁、訴訟、私たちの株がニューヨーク証券取引所から退市したり、私たちの業務に実質的な損害を与えたりする他の不良な結果を招く可能性がある。
もし証券アナリストが私たちの業務に関する研究や報告を発表しない場合、あるいは彼らが私たちの業務に関するマイナスまたは不正確な研究を発表した場合、私たちの普通株価格と取引量は低下する可能性がある。
私たちの株価と取引量は、アナリストや投資家が私たちの財務情報や他の開示情報の解読方式に影響を受けるだろう。私たちの普通株の取引市場は、証券や業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存している。私たちはこのアナリストたちに何の統制権も持っていない。もし私たちをカバーするアナリストの数が減少すれば、私たちの普通株に対する需要は減少する可能性があり、私たちの普通株価格と取引量は低下するかもしれない。
正確性にかかわらず、私たちの財務情報や他の公開開示に対する不利な解釈は、私たちの株価に悪影響を及ぼす可能性がある。もし私たちの財務業績がアナリストの予想を達成できなかった場合、上記のいずれの理由でも、あるいは私たちを追跡している1人以上のアナリストが私たちの普通株格付けを引き下げたり、私たちの普通株に対する彼らの見方を変えたりすれば、私たちの株価は下落する可能性がある。もしこのようなアナリストの一人以上が私たちの株を追跡しなければ、私たちは市場での私たちの株の可視性を失うかもしれないし、これは逆に私たちの株価を下落させるかもしれない。
77
私たちは過去に配当がなく、未来も配当を期待していなかったので、どんな投資収益も私たちの株価の上昇に限られるかもしれない。
私たちは現金配当金を支払ったことがなく、予測可能な未来にも私たちの普通株に現金配当金を支払わないだろう。配当金の支払いは、私たちの収益、資本要求、財務状況、将来の収益の見通し、および私たちの取締役会が関連する他の要素に依存するかもしれない。さらに、私たちの融資協定は、私たちが配当金または他の分配または普通株を支払う能力を制限し、それぞれの場合、いくつかの例外的な状況によって制限される。もし私たちが配当金を支払わなければ、私たちの株はもっと価値がなくなるかもしれません。私たちの株価が値上がりして、あなたが私たちの普通株を売った時だけ、あなたの投資は見返りを生むからです。私たちの普通株が値上がりし、保有者が購入した時の価格を維持する保証はありません。さらに、私たちの融資協定は、私たちが配当金を支払うか、または他の分配を行うか、または普通株を支払う能力を制限し、それぞれの場合、いくつかの例外的な場合によって制限される。
将来的に私たちの株式を売却して発行したり、株式を購入する権利は、私たちの株主の所有権パーセンテージをさらに希釈させ、私たちの普通株の価格を低下させる可能性があります。
私たちは追加の証券を発行するかもしれない。将来的に私たちの株を売却して発行したり、私たちの株を購入する権利は、私たちの既存の株主の株式を希釈する可能性があります。私たちは1回または複数回の取引で普通株、転換可能証券、その他の株式証券を販売することができ、価格と方式はいつでも私たちが決定して、運営を援助し、新製品を開発し、他の戦略を加速し、買収または他の活動を支援することができる。私たちがどのような未来の発行で債券や株式証券を発行するかの決定は市場状況と他の私たちがコントロールできない要素に依存するため、私たちは任意の未来に発行される金額、時間、または性質を予測または推定することができない。もし私たちがその後の取引でこのような証券を販売すれば、投資家は深刻に希釈されるかもしれない。これらの後続取引の新しい投資家は、私たちの普通株式保有者よりも優先的な権利、特典、および特権を得ることができる。
内部の人々は私たちに大きな影響力を持っていて、これはコントロール権の変更を含む重要な取引結果に影響を与える能力を制限する可能性があります。
2022年12月31日現在、私たちの役員、高級管理者、ある株主、およびそれぞれの関連会社は、私たちが発行した普通株の大部分を持っています。したがって、これらの株主が一緒に行動すれば、取締役選挙や重大な会社取引の承認を含む株主の承認を必要とするすべての事項に影響を与えることができる。このような所有権集中はわが社の支配権の変更を遅延または阻止し、私たちの普通株の市場価格に影響を与える可能性があります。
私たちが3回目に改訂して再記載した会社登録証明書、改訂と再記載された会社定款、およびデラウェア州法律における反買収条項は、わが社の支配権の変更や私たちの経営陣の変更を阻止するかもしれません。
私たちの3回目の改正と再記載された会社登録証明書と定款には、私たちの経営陣が買収をボイコットできるようにする条項が含まれています。これらの規定には
•株主会議に適用される事項の事前通知要求、及び株主通知の形式及び内容に関する要求;
•私たちが修正し、再記述した会社の登録証明書および定款のいくつかの条項の絶対多数の株主投票要求を修正し、
•潜在的敵意買収者の株式を希釈するために使用される可能性がある株主の承認なしに優先株を発行する権利
•大多数の株主が正当な理由がある場合にのみ取締役を罷免することを許可した
•査定された役員数を変更するには取締役会の決議を経なければならない
•新たに設立された役員職を含め、当時在任していた大多数の取締役が賛成票を投じ、定足数に満たなくても、法律に別途要求があるものは除外した
78
•私たちの株主は、書面での同意ではなく、株主の年次または特別会議でしか行動できないことを要求する
•フォーラムをデラウェア州に制限していくつかの訴訟を提起しました
•株主特別会議を招集できる者を、取締役会、取締役会議長、CEO又は総裁に制限し、CEOが欠席した場合には、取締役会を招集することができる
これらの規定は、わが社の統制権の変更や経営陣の変更を阻害、延期、または阻止する可能性があります。これらの条項の存在は、普通株式保有者の投票権に悪影響を及ぼす可能性があり、投資家が将来私たちの普通株に支払うことを望む可能性のある価格を制限する。また,我々はデラウェア州に登録設立されているため,デラウェア州会社法(DGCL)第203条の規定により,デラウェア州会社が株主が“利害関係のある”株主になった日から3年以内に任意の“利害関係のある”株主と広範な業務統合を行うことを一般的に禁止している。
私たちの役員と上級管理者の賠償要求は、成功した第三者からのクレームを満たすために、私たちの利用可能な資金を減らすことができ、私たちの利用可能な資金を減らすことができます。
当社の第三次改正及び再記載された会社登録証明書及び改正及び再記載の定款規定は、デラウェア州法律で許容される最大程度の取締役及び上級管理者に対して賠償を行います。
また、DGCL第145条の許可の下、取締役及び上級管理職と締結された改正及び再記載の付例、並びに私たちの賠償協定規定:
•私たちはデラウェア州の法律で許可されている最大範囲で、これらの身分で私たちにサービスしたり、私たちの要求に応じて他の商業企業にサービスしている役員と上級管理者に対して賠償を行います。デラウェア州の法律では、その人が善意に基づいて行動し、その人が登録者の最大の利益に適合または反対しないと合理的に信じ、いかなる刑事訴訟についても、その人の行為が不法であると信じる合理的な理由がなければ、会社はその人を賠償することができる
•法律の適用が許可された場合、私たちは従業員と代理人を適宜賠償することができる
•私たちは、訴訟弁護に関連する費用を取締役や上級管理者に前借りすることを要求されていますが、最終的にその人が賠償を受ける資格がないと判断された場合、その役員または上級管理者は、前金の返済を約束しなければなりません
•私たちが改正して再説明した法規によると、私たちは、私たちの取締役会が許可した訴訟や賠償権利を執行するための訴訟でなければ、誰かが私たちまたは私たちの他の賠償者に提起した訴訟についてその人に賠償する義務はありません
•私たちが改正して再説明した規定によって与えられた権利は排他的ではなく、私たちは私たちの役員、上級管理職、従業員、代理人と賠償協定を締結し、これらの人たちを賠償するために保険を受けることを許可された
•私たちは取締役、高級管理者、従業員、代理人に対する私たちの賠償義務を減らすために、私たちの法律条項をさかのぼって再記述しないかもしれない
79
私たちの3回目の改正と再記載の会社登録証明書および改正および再記載の法律規定は、デラウェア州衡平裁判所は、私たちの株主とのほとんどの紛争の唯一かつ独占的なフォーラムであり、これは、私たちまたは私たちの役員、上級管理職、または従業員との紛争を処理するために、私たちの株主が有利な司法フォーラムを得ることを制限するかもしれない。
私たちの3つ目の改正および再記載された会社登録証明書および改正および再記載の法律規定は、デラウェア州衡平裁判所(または衡平裁判所に管轄権がない場合、デラウェア州連邦地域裁判所またはデラウェア州の他の州裁判所)は、私たちを代表して提起された任意の派生訴訟または訴訟、受託責任違反を主張する任意の訴訟、DGCLによる私たちに対するクレームの任意の訴訟、私たちの3つ目の改正および再記載された会社登録証明書または私たちの修正と重述の付例、または私たちのクレームに対する任意の主張の独占裁判所である。しかし、デラウェア州衡平裁判所が商標管轄権の欠如によって任意のこのような訴訟を却下した場合にのみ、デラウェア州の別の州または連邦裁判所でこのような訴訟を提起することができる。我々の第三次改正及び再記載された会社登録証明書及び改訂及び再記載の定款はまた、アメリカ合衆国の連邦地域裁判所は、証券法に基づいて提起された任意の被告に対する訴訟理由の苦情を解決するための独占フォーラムであることを規定している。これらの規定は、引受業者および本10-K年間報告書の専門家またはエンティティを準備または認証することを含む、当社、上級管理者および取締役、従業員および代理人を利益にし、実行される可能性があることを目的としています。裁判所条項の選択は、取引法に規定されているいかなる責任または義務を強制的に執行するための訴訟にも適用されず、連邦裁判所が排他的管轄権を有する他のいかなるクレームにも適用されない。
私たちは、これらの規定が私たちに利益をもたらすかもしれないと信じている。これらの規定は、総理と裁判官をデラウェア州法律と連邦証券法の適用においてより一致させ、特に会社の紛争解決の経験が豊富で、他の裁判所に比べて、より速いスケジュールで事件を効率的に管理し、多裁判所訴訟の負担から保護するためである。これらの裁判所条項の選択は、株主が司法裁判所において、私たちまたは私たちの任意の取締役、役員、他の従業員または株主との紛争に有利であると考えられるクレームを提出する能力を制限する可能性があり、これは、このようなクレームに関連する訴訟を阻止するか、またはそのような訴訟が株主にとってコストをより高くする可能性があり、私たちの株主は、連邦証券法およびその規則および条例の遵守を放棄したとみなされないが、これらの裁判所の選択は、我々の連邦証券法およびその規則および条例の遵守を放棄したとみなされない。また,他社の会社登録証明書の中で類似した場所条項を選択する実行可能性が法的手続きで問われており,裁判所はこれらのタイプの条項が適用されないか実行不可能であると考える可能性がある.デラウェア州裁判所は、このような選択された裁判所条項が事実上有効であることを決定しているが、株主は、専属裁判所条項が指定された場所以外の場所でのクレームを求めることができ、これらの規定がこれらの他の法域の裁判所によって実行されることを保証することはできない。裁判所が、私たちが改正および再記載した会社登録証明書および改正および再記載された法律に含まれる1つまたは複数の選択された裁判所条項が訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の司法管轄区域でそのような訴訟を解決することに関連する追加費用を発生させる可能性があり、これは私たちの業務を深刻に損なう可能性がある。
一般リスク因子
不利な世界的および地域経済、政治的、健康状態は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
私たちの経営結果は世界的または地域経済、政治、そして衛生状況の悪影響を受けるかもしれない。世界金融危機または世界的または地域の政治経済不安定(インフレ、金利および全体の経済状況および不確実性の変化を含む)、戦争、テロ、内乱、疾病発生(例えば、新冠肺炎)、その他の予期せぬ事件(例えば、サプライチェーン制限や中断)は、我々のコストを増加させ、私たちの業務を混乱させる可能性がある。業務中断は、サプライチェーンまたは流通制限または挑戦、臨床登録、臨床サイト利用可能性、患者獲得性、および私たちの臨床試験の進行、ならびに私たちのサプライチェーンにおける私たちの施設およびサプライヤーまたは契約製造業者の施設の一時的な閉鎖を含むことができるが、私たちのビジネス活動の中断に限定されない。例えば、これらのマクロ経済要因は、私たちの既存または潜在的な未来の製造業者、独占的または単一ソース供給業者、ライセンシーまたはライセンシーが経営を継続する能力、または私たちの製品に関連する部品、材料、またはサービスを他の方法で製造または供給する能力に影響を与える可能性がある。もし彼らのどれも経営を続けることができなければ、私たちの製品を製造したり、製品の需要を満たす能力に影響を与える可能性があります。さらに、インフレやその他の要因が私たちの業務コストを著しく増加させれば、私たちは価格上昇を私たちの顧客に転嫁できないかもしれない。金利と信用市場に入る能力はまた私たちの顧客が私たちの製品を購入する能力に悪影響を及ぼす可能性があります。
さらに、いくつかの危機および事件の間、患者は、彼らのいくつかまたはすべての治療および/または薬物ではなく、他の項目を優先することができ、これは、私たちの商業販売に負の影響を与える可能性がある。新冠肺炎の発生は、後の新冠肺炎変異を含み、多くの国の金融市場に大きく影響し、未来に各種の連邦、州と地方命令、指導と制限を招く可能性がある。現在、新冠肺炎の発生が私たちが行っている臨床試験や他の業務に与える具体的な程度、持続時間、あるいは全面的な影響を予測することはできません
80
私たちの商業化活動も含めて運営されている。新冠肺炎疫病が私たちの業務と財務業績に悪影響を与える程度について言えば、本“リスク要素”の節で述べた多くの他のリスクを増加させる効果がある可能性がある。
また、現在のロシアとウクライナの間の地政学的緊張と衝突、および最近ロシアがウクライナに侵入したため、米国、EU、日本、その他の管轄区域の政府は最近、ロシアとある影響を受けた地域のある工業部門と当事側への制裁を発表し、特定の製品や業界への輸出規制を強化している。これらの制裁および任意の追加の制裁および輸出規制、ならびにロシアまたは他の司法管轄区域政府のいかなる反制措置も、世界のサプライチェーンに直接的または間接的に悪影響を与え、原材料や部品の供給や価格、および世界の金融市場や金融サービス業に悪影響を及ぼす可能性がある。
深刻または長期的な経済低迷、政治的動揺、または不利な健康状態は、必要なときに受け入れ可能な条件で資金を調達する能力(あれば)を含む、私たちの業務に様々なリスクをもたらす可能性がある。上記のいずれも私たちの業務を損なう可能性があり、政治的または経済的環境や金融市場の状況が私たちの業務に悪影響を及ぼす可能性のあるすべての方法を予見することはできません。
私たちの運営は自然災害や他の災害、停電、ストライキ、他の私たちがコントロールできない事件で中断や損失を受けやすい。
重大なハリケーン、火災、または他の災害(例えば、大洪水、地震またはテロ)は、私たちの本社または私たちの他の施設または私たちのサプライヤーや製造業者の施設に影響を与え、私たちの運営を深刻に混乱させ、私たちのサプライヤーおよび製造業者の破損施設を修理、再建、または交換するのに必要な時間内に製品の出荷や設置を遅延または阻止する可能性があり、これは長くて高価かもしれない。私たちはコロラド州エンゲルウッドに新しい本部施設を開設して、私たちの商業拡張、教育、訓練計画を支持します。我々の施設、設備、在庫の交換コストは高く、修復や交換には大量の前準備時間が必要かもしれません。もし私たちの顧客のどの施設も災害のマイナス影響を受けたら、私たちの製品の出荷が遅れるかもしれません。また、顧客は運営が正常に戻るまで、私たちの製品の購入を延期することができる。災害に迅速に対応できても、災害の影響は私たちの業務運営にいくつかの不確実性をもたらす可能性がある。テロへの懸念、テロ、または政治的動揺の影響は、私たちの業務、私たちのサプライヤーと製造業者、そして私たちの顧客に否定的な影響を及ぼすかもしれません。
私たちに対する訴訟は高価で時間のかかる弁護になるかもしれないし、追加的な責任を招くかもしれない。
私たちは時々法的手続きや通常の業務過程または他の側面で発生したクレーム、例えば、私たちの顧客がビジネス紛争について提起したクレームや、私たちの現職または前任従業員が提出した雇用クレームの影響を受ける可能性がある。クレームは、政府機関、患者、または私たちの顧客のサプライヤーまたは株主を含む様々な他の当事者によってまたは代表されてもよい。また、過去には、証券集団訴訟は、ある会社の証券市場価格が下落した後に提起されることが多く、このリスクは、特に重大な株価変動を経験した業界と関係がある。私たちに関連する訴訟は、巨額のコストを招き、運営上私たちの業務を制限し、経営陣の注意力や資源を分散させる可能性があり、これは私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性があります。
81
上場企業としての要求は、私たちの成長戦略や他の業務に対する私たちの経営陣の関心をそらすかもしれません。
上場企業として、私たちは取引所法案の報告要件を遵守し、サバンズ-オクスリ法案と2010年ドッド·フランクウォール街改革と消費者保護法案の適用要件、ニューヨーク証券取引所の上場要求、その他の適用される証券規則と法規を守らなければならない。これらの規則と法規を遵守することは、私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をより困難にし、時間やコストを高くし、私たちのシステムと資源に対する需要を増加させるだろう。その他の事項に加えて、“取引所法案”は、当社の業務及び経営結果に関する年次、四半期及び現在の報告書を提出し、効率的な開示制御及び手続、並びに財務報告の内部統制を維持することを要求する。この基準を達成するために、必要に応じて財務報告の開示制御およびプログラムおよび内部制御を維持し、改善するためには、大量の資源および管理監視が必要となる可能性がある。したがって、経営陣の関心は、私たちの成長戦略の実行や他の業務の管理から移行する可能性があり、これは、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性があります。私たちはこのような要求を守るためにより多くの従業員を雇用しているが、私たちは将来的により多くの従業員を雇用する必要があるかもしれないが、これは私たちのコストと支出を増加させるだろう。また、上場企業としては、取締役や上級管理職責任保険を購入するコストが高く、低減された保証範囲を受け入れたり、より高い保険コストを発生させたりすることが求められる可能性がある。このような要素は、私たちが特に私たちの監査委員会と給与委員会に勤めていること、および合格した役員を引き付けて維持することをより難しくするかもしれない。
上場企業として、私たちの運営コストは高く、私たちの実行管理チームは上場企業コンプライアンスプロジェクトに多くの時間を投入しています。
上場企業として、サバンズ·オクスリ法案および米国証券取引委員会やニューヨーク証券取引所で実施されている規則を遵守することを含む、私たちに適用される法規や開示義務を遵守するため、多くの法律、会計、その他の費用が発生しています。株主急進主義、現在の政治環境、および現在の高度な政府介入と規制改革は、大量の新しい法規と開示義務をもたらす可能性があり、これは追加のコンプライアンスコストを招き、現在予測できない方法で私たちの業務運営方法に影響を与える可能性がある。私たちの実行管理チームや他の人たちは、これらのコンプライアンス計画と上場企業の報告義務の監視に多くの時間を投入しています。ドッド·フランクウォール街改革と消費者保護法案が新しいコーポレートガバナンスと役員報酬に関する規則、法規、ガイドラインを推進し、将来的にはより多くの法規と開示義務があると予想されているため、私たちはこれらのコンプライアンス計画と規則を遵守するためにより多くの時間とコストを投入する必要があるかもしれません。これらの規制は私たちに巨大な法律と財務コンプライアンスコストを招く可能性があり、いくつかの活動をより時間的で高価にするかもしれない。
我々は米国の“海外腐敗防止法”や、輸出規制、税関法制裁、その他の貿易法律法規(総称して貿易法と呼ぶ)を含む米国の反賄賂、反腐敗、反マネーロンダリング法に支配されている。私たちは違反によって深刻な結果に直面するかもしれない。
私たちが国際的な存在と世界的な業務を拡大するにつれて、私たちはますますアメリカ、EU、他の政府や組織から加えられた貿易と経済制裁、その他の制限を受けるだろう。米国司法省、商務省、国務院、財務省、その他の連邦機関や当局は、経済制裁法、輸出規制法、米国“反海外腐敗法”(FCPA)および他の連邦法規(外国資産制御弁公室(OFAC)が制定した法規を含む)に違反した会社や個人に広範な民事·刑事罰を加えることを求める可能性がある。また、イギリスでは2010年の反収賄法(“収賄法”)は国内と国際賄賂、民間·公共部門の賄賂を禁止している。組織と関連のある誰もが賄賂を行うことを阻止できなかった組織は、その組織が賄賂を防止するために十分な手続きが実施されていることを証明することができない限り、“収賄法”によって起訴されることができる。これらの腐敗防止法は、一般に、会社およびその従業員、代理人および中間者が、公的または民間部門の受容者に腐敗または不当な支払いまたは任意の他の価値のあるものを提供、提供、提供または提供することを直接的または間接的に禁止する。私たちは、私たちが明確に権限を持っていなくても、実際にそのような活動を理解していなくても、私たちの代理人と仲介機関の腐敗や不法活動に責任を負わなければならないかもしれない。私たちはまた、米国の他の輸出規制に関する法律と法規、特定の国と個人に対する経済制裁と禁輸を受けている。
82
貿易法違反は、巨額の刑事罰金と民事処罰、監禁、貿易特権の喪失、資格取り消し、税収の再評価、契約違反と詐欺訴訟、名誉損害、その他の結果を招くことができる。同様に、潜在的な貿易法違反に対するいかなる調査も、私たちの名声、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性がある。
私たちの政策と手続きが十分であるか、あるいは役員、上級管理者、従業員、代表、コンサルタント、代理人がなくても、私たちが責任を負う可能性のある行為に従事しないことを保証することはできません。私たちの業務パートナーが私たちの契約義務を履行する能力に大きな影響を与える可能性のある行為に従事しないことを保証することもできません。さらに、このような行為に対して責任を負うことになります。“海外腐敗防止法”、“海外腐敗防止法”、“贈収賄法”または他の輸出規制、反腐敗、反マネーロンダリング、反テロ法律や法規に違反する行為は、厳しい刑事や民事制裁を招く可能性があり、他の責任を負う可能性もあり、これは私たちの業務、財務状況、運営結果にマイナスの影響を与える可能性がある。
私たちと私たちのサプライヤーは様々な情報技術システムに依存しており、これらのシステムの故障、中断、または不正な改ざんは、私たちの業務に実質的な悪影響を及ぼす可能性があります。
当社およびプロバイダは、相互接続サイト、データホスティングおよび処理施設およびツール、物理セキュリティシステムおよび他のハードウェア、ソフトウェアおよび技術アプリケーションおよびプラットフォームを含む情報技術システム、ネットワークおよびサービスに広く依存しており、いくつかは第三者またはそのプロバイダによって管理、ホスト、提供または使用されている。これらのシステムは、サプライヤーから材料を注文および管理すること、材料を完成品(サプライヤー)に変換すること、顧客に製品を出荷すること、取引を処理すること、運営結果をまとめて報告すること、法規の遵守、法律または税務要件の遵守、データセキュリティの提供、および当社の業務を管理するために必要な他のプロセスを含むが、これらに限定されない。
私たちのスタッフ、私たちのシステムにアクセスする権利のある他の人、または許可されていない人による重要な情報技術システムまたはインフラの深刻な崩壊、侵入、腐敗、破壊、または中断は、業務に悪影響を及ぼす可能性があります。クラウドの使用は、我々または我々のサード·パーティ·プロバイダのシステム、携帯型メディア、または記憶装置に格納された機密情報を伝播または意図的に破壊するための機会を創出する。セキュリティ対策が取られているにもかかわらず、私たちの情報技術システムおよび私たちの請負業者、コンサルタント、および協力者の情報技術システムは、ネットワーク攻撃、“ネット釣り”攻撃、故意または意外な行為、または脆弱性、コンピュータウイルスおよびマルウェア、不正アクセス、自然災害、テロ、戦争、および電気通信および電気故障の破壊をもたらしやすい。情報技術システムへの攻撃は頻度,持続性,複雑性,強度の面で増加しており,動機や専門長の異なる複雑で組織的な団体や個人によって実施されている.新冠肺炎の流行により、私たちはまたより多くのネットワークセキュリティリスクに直面するかもしれません。私たちのインターネット技術への依存と私たちの遠隔作業の従業員の数のために、これはネット犯罪者の抜け穴を利用するためにもっと多くの機会を作るかもしれません。さらに、不正アクセスまたはシステム破壊のための技術はしばしば変化し、一般に目標に対して起動されるまで識別されるため、これらの技術を予測したり、十分な予防措置を実施することができない可能性がある。私たちはまたセキュリティホールに遭遇する可能性があり、このような抜け穴は長い間発見されないかもしれない。身元が確認されても, 攻撃者は、制御を回避し、法医学的証拠の検出を回避し、除去または混同するためのツールおよび技術をますます使用しているため、事件または違反を十分に調査または修復することができない可能性がある。
私たちと私たちの特定のサービス提供者たちは時々ネットワーク攻撃とセキュリティ事件の影響を受ける。私たちはこれまで重大なシステム故障、事故、セキュリティホールを経験してきたとは思いませんが、もし私たちのシステムが様々な原因(災害的な事件、停電からセキュリティホールへ)によって破損したり、正常に動作を停止したり、私たちの業務連続計画が効果的にタイムリーに補償できない場合、私たちの運営管理能力を中断し、金融資産や訴訟や潜在的な責任を含む損失リスクに直面する可能性があり、これは私たちの業務、財務状況、運営結果、見通しに大きな悪影響を及ぼす可能性があります。
83
私たちの契約における責任条項の任意の制限が強制的または十分であるか、または他の方法で安全不注意や違反に関連する任意の特定のクレームの任意の責任または損害から私たちを保護することを保証することはできません。ネットワーク保険を含む一定の保険範囲を維持していますが、私たちの保険は、そのような攻撃によって生じるすべての責任をカバーするのに不十分であるか、またはそのような攻撃によって生じるすべての責任を含まない可能性があります。私たちはまた、私たちの保険カバー範囲が実際に発生したデータ処理やデータ安全責任を支払うのに十分であるかどうかを確認することができません。私たちは経済的に合理的な条項で保険を受け続けることができますか、あるいはどの保険会社も将来のクレームを拒否しないかどうか。利用可能な保険範囲を超える1つまたは複数の多額のクレームを提出することに成功したか、または保険料の増加または多額の賠償免除または共同保険要件の実施を含む、私たちの保険証書が変化したことは、私たちの財務状況、経営業績、名声を含む私たちの業務に重大な悪影響を及ぼす可能性がある。
私たちの保険証書は高くて、いくつかの商業リスクから私たちだけを保護して、これは私たちを重大な未保険債務に直面させます。
私たちは私たちの業務が直面する可能性のあるすべての種類のリスクに保険をかけない。私たちは現在一般責任保険、労働者補償保険、役員及び高級者責任保険と製品責任保険があり、これらの保険の損害額と保険範囲の制限があります。許容可能なコストまたは許容可能な条項で保険を受けることができない場合、または潜在的な製品責任クレームに対して他の方法で保護を提供することができなければ、私たちは重大な責任に直面する可能性がある。製品責任クレーム、リコール、または未保険負債または保険負債金額を超える他のクレームは、当社の業務、財務状況、および運営結果に悪影響を及ぼす可能性があります。私たちは特定の危険廃棄物保険を受けていません。私たちの財産、意外と一般責任保険は危険廃棄物の暴露或いは汚染による損害と罰金は明確に含まれていません。したがって、私たちは損害賠償責任を負うことを要求されるか、あるいは私たちの資源を超えた罰金を科される可能性があり、私たちの臨床研究、臨床試験、または監督管理の承認は一時停止される可能性がある。しかも、私たちはネットワーク保険を購入しません。これは私たちをいくつかの潜在的な損害損失に直面させたり、私たちの資源を超えた罰金につながるかもしれません。
上場企業としては、取締役や上級管理職責任保険をより難しく、より高価にすることも予想され、同じまたは同様の保証範囲を得るために、低減された保険限度額や保証範囲を受け入れることが要求される可能性があります。したがって、私たちは合格した人を私たちの取締役会、取締役会委員会に参加したり、役員にしたりすることがもっと難しいかもしれない。しかし、私たちは私たちが既存の保険を維持し、十分な保険を提供できるかどうか分からない。どんな重大な未加入責任も私たちが大量の費用を支払う必要があるかもしれません。これは私たちの業務、財務状況、運営結果にマイナスの影響を与えます。
私たちの業績は外貨為替レートの変化の影響を受けるかもしれません。
私たちの売上の大部分はアメリカ以外のところにあります。その大部分は外貨建てで、通貨為替レートの変化を含む外貨リスクに直面しています。私たちは現在どんな期間保証取引にも従事していない。もし私たちがこれらのリスクや挑戦に効果的に対応できなければ、私たちの国際業務は成功しないかもしれませんし、私たちの業務は損なわれる可能性があります。
政府の輸出や輸入規制は海外市場での私たちの競争能力を制限する可能性があり、もし私たちがこれらの規制に違反すれば、私たちは責任を負うだろう。
私たちの製品はアメリカの輸出規制を受けるかもしれません。もし適用されれば、政府は私たちの製品の輸出入に対する規制、あるいは私たちの製品のために必要な輸出入の許可を得ることができず、私たちの国際販売を損なうことになり、私たちの収入に悪影響を与えます。私たちの製品輸出に関する適用法規の要求を遵守することは、私たちの製品の国際市場での発売を遅延させるかもしれません。あるいは場合によっては、私たちの製品のいくつかの国への輸出を完全に阻止するかもしれません。また、米国の輸出規制法と経済制裁は、米国の制裁対象国、政府、個人に特定の製品やサービスを輸送することを禁止している。もし私たちが輸出入条例とこのような経済制裁を守らなければ、私たちは特定の輸出特権を奪うことを含む罰金や他の処罰を受けるかもしれない。さらに、新しい輸出または輸入制限、新しい立法、または既存の法規の実行または範囲内、またはそのような法規が対象とする国、個人、または技術における方法の変化は、私たちの製品の使用量を減少させ、または国際業務を持つ既存または潜在的な顧客に私たちの製品を輸出する能力を低下させる可能性がある。私たちの製品の使用が減少したり、私たちの製品を輸出したり販売したりする能力が制限されていても、私たちの業務、財務状況、運営結果にマイナスの影響を与える可能性があります。
84
私たちまたは私たちの顧客に不利な税金法律や規制の変化は私たちの業務を深刻に損なう可能性があります。
新しい収入、販売、使用、または他の税金法律、法規、規則、法規または法令はいつでも公布される可能性があり、これは私たちの将来のいかなる国内および海外収入の税収処理に影響を与える可能性がある。どんな新しい税金も、私たちの国内と国際業務運営、そして私たちの業務と財務業績に悪影響を及ぼす可能性があります。さらに、既存の税金法律、法規、規則、法規または条例は、私たちの不利な場合に解釈、変更、修正、または適用される可能性があり、追跡力を持つ可能性がある。
私たちは純営業損失を利用して将来の課税収入を相殺する能力が制限されるかもしれません。
改正後の1986年の国内税法第382条と383条及び州法の相応条項によると、ある会社が“所有権変更”を経験した場合、特定株主が3年間の間にその持分所有権の累計変更が50%(価値計算)を超えると定義され、同社は変更前の純営業損失繰越(NOL)と他の変更前税収属性(例えば、税収控除を検討する)を用いて変更後の収入や税収を相殺する能力は限られている可能性がある。私たちは過去に所有権の変化を経験したことがあるかもしれませんが、私たちは未来の株式所有権の変化のために所有権の変化を経験するかもしれません。その中のいくつかは私たちの制御範囲内ではないかもしれません。したがって、今後の課税収入や税収を相殺するために、変更前の連邦NOLや他の税収属性を使用する能力が制限される可能性がある。これらの理由で、私たちはNOLの大きな部分を利用できないかもしれません。たとえ利益を実現しても、これは私たちの業務、財務状況、キャッシュフローに悪影響を及ぼす可能性があります。
私たちの業務の国際拡張に伴い、私たちは米国以外での業務展開に関連する市場、規制、政治、運営、金融、経済リスクに直面する。
私たちの長期的な戦略は私たちの国際的影響力を増加させることだ。この戦略には,米国以外で医師の外展や教育能力の確立と維持,国際支払者との関係の拡大が含まれている可能性がある。国際的な業務展開には多くのリスクが含まれている
•私たちの国際業務を人員構成と管理する上で困難に直面している
•より多くの製品や手続きが規制の承認を受けたり、他の方法で自由に国際市場に進出したりするため、競争が激化している
•知らない外国で効果的なマーケティング活動を展開することは困難である
•税法、プライバシー法、輸出入制限、就業法、監督管理要求と他の政府の許可、許可と許可などの多重、相互衝突と絶えず変化する法律法規;
•一部の国は知的財産権の保護を減らしたり変えたりしている
•各国が必要とする場合には外国認証と規制許可を得る
•これらの国のサーバ上でデータを維持し、これらのデータを処理するための要求
•複数の支払人精算制度、政府支払人または患者自己支払いシステムの管理に関連する複雑さ
•もし私たちが現地で生産された製品を好むなら、あるいは私たちが現地で私たちの製品を生産することを要求されたら、私たちは国際市場に進出する能力が制限されます
•金融リスク、例えば、長い支払い周期、売掛金の回収が困難なこと、外国税法と外国付加価値税制度の複雑さ、地方と地域の財政圧力が私たちの製品の需要と支払いに与える影響、外貨レートの変動の影響を受ける
85
•私たちの製品を使用するサービス場所の制限とそれに関連する医師、提供者、支払人の経済問題
•ウクライナとロシアとの間の戦争、それによる任意の制裁または他の行動、テロ、政治的動乱、疾病の発生(新冠肺炎の大流行の影響を含む)、ボイコット、貿易および他の市場制限の削減、および自然災害、政治的、経済的不安定
•監督管理とコンプライアンスリスクは、正確な情報の保持と1977年の“米国反海外腐敗法”あるいは“海外腐敗防止法”、2010年イギリス“反賄賂法”および他の国と地域の類似法律法規の規制を受ける活動の制御に関する
これらの要素のいずれも、私たちの将来の国際拡張と運営を深刻に損なう可能性があり、それによって、私たちの業務、財務状況、運営結果に重大な悪影響を及ぼす可能性がある。
私たちのサービスは、企業市民権およびESG事項および/またはそのような事項に対する私たちの報告に否定的な影響を受ける可能性があります。
機関、個人および他の投資家、代理コンサルティングサービス、規制当局、消費者、および他の利害関係者は、会社の環境、社会および管理、またはESG実践にますます注目している。変化するESG指標の識別、測定、報告に対応する基準を求めると、私たちの努力はコストの大幅な増加を招く可能性がありますが、投資家や他の利害関係者の期待および変化する基準や規制要件を満たすことができない可能性があり、これは、私たちの財務業績、私たちの名声、従業員を引き付けるまたは維持する能力、サービスプロバイダ、投資またはビジネスパートナーとしての私たちの魅力にマイナスの影響を与え、あるいは政府の法執行行動、個人訴訟、株主または利害関係者としての訴訟に直面させる可能性があります。
ない。
情報技術EM 2.財産.
私たちの会社の本社はコロラド州のエンゲルウッドにあります。そこで私たちは約105,000平方フィートのオフィス空間を所有して占めています。私たちは現在この施設の現在使用されていない一部を拡張している。私たちはまたミシガンとニュージャージーに国内事務所を設置し、アイルランド、南アフリカ、オーストラリア、フィンランド、ドイツ、イタリア、イギリスに国際事務所を設置しています。私たちの既存の施設は私たちの最近の需要を満たすのに十分だと信じています。
イットM 3.法的訴訟
前述したように,2018年3月23日頃,後にStryker Corp.に買収されたライト医療技術会社(総称して“ライト医療”と呼ぶ)は米国コロラド州地方裁判所に同社の訴えを提起し,案件番号18−cv−00691−stv(“コロラド訴え”)であった。改訂されたコロラド州起訴状は,会社(I)がWright Medicalの9つの特許を侵害し続けていること,(Ii)Wright Medicalの商業秘密や機密材料を流用して流用し続けていること,(Iii)Wright Medicalとの不公平な競争,およびWright Medical契約を故意に妨害していることを主張している。改正後のコロラド州起訴状は,(A)判決会社がWright Medical特許を侵害し,Wright Medicalの商業秘密を流用,使用,開示したこと,(B)Wright Medical特許の侵害,Wright Medical特許侵害の疑いのある製品の製造,販売または流通,Wright Medical特許侵害の疑いのある製品の製造,販売または流通,およびWright Medicalの商業秘密や機密情報の流用,(C)懲罰性と法定の補強性損害賠償,(D)弁護士費,(E)上記のいずれかの利息,など,提出されたクレームに対する常習的救済措置を要求している。(F)裁判所は、将来の特許権使用料支払いを含むことができる公正かつ公平な任意の救済を認める。また,Wright Medicalは2021年12月23日頃に米国デラウェア州地方裁判所に同社に対する別の訴えを提起し,事件番号1:21−cv−01809−MNは,同社が何らかの他の特許を侵害していると告発した(“デラウェア州訴え”)。
2022年11月28日、会社はStryker Corp.と和解合意に達し、コロラド州の訴訟、デラウェア州の訴訟、任意の会社の反クレームを終わらせ、会社がStryker Corp.に支払う総金額は2,600万ドル(“和解金額”)となった。当社は、(I)2022年12月16日またはそれまでに500万ドルを支払うことと、(Ii)2023年1月1日から2023年1月16日までの間の任意の時間に800万ドルを支払うことと、(Iii)2023年4月1日から2023年4月17日の間の任意の時間に1300万ドルを支払うこととを含む3期に分けて和解金額を支払う予定である。
86
和解協定は、会社が業務を継続する能力に影響を与えず、会社の既存の製品ラインを何も変える必要もない。和解金額は唯一支払われた対価格であり、同社は将来的にStryker Corp.にいかなる金額も支払う必要はない。
同社が和解協定に署名したのは、完全に訴訟の負担、費用、気晴らし、不確実性を解消するためだ。和解協定はそうではなく、責任や会社がいかなる不法、侵害、または不法活動に従事していることを認めると解釈されてはならない。
上記に加えて、当社は、正常な業務過程において第三者からの様々なクレームに直面する可能性があり、当社は、知的財産権および雇用事項およびその製品の安全性または有効性に関連するクレームを含む、その権利を維持するための法的行動を時々提出することができる。これらのクレームのいずれも当社に巨額のコストを発生させる可能性があり、当社は多くの異なるタイプの債務をカバーするのに十分な保険があると考えられているが、その保険会社は保証を拒否する可能性があり、資本が不足している可能性があり、有効なクレームを支払うことができない場合があり、あるいは当社の保険限度額はいかなる関連コスト、損害賠償または和解を完全に満たすのに十分ではない可能性がある。このような状況が発生した場合、どのような賠償の支払いも、会社の運営、キャッシュフロー、財務状況に重大な悪影響を及ぼす可能性がある。また、このようなクレームは、成功するか否かにかかわらず、会社の名声や業務を損なう可能性がある
情報技術EM 4.鉱場安全を開示する
適用されません。
87
第II部
情報技術EM 5.登録者普通株、関連株主事項、発行者が株式証券を購入する市場
普通株式市場情報
我々の普通株は2021年10月15日からニューヨーク証券取引所で“FNA”のコードで取引されている。その前に、私たちの普通株は市場を公開しなかった。
株式表現グラフ
次の図は,2021年10月15日(我々の普通株取引開始日)から2022年12月31日までの,(1)我々の普通株投資の累積総株主リターン,(2)ラッセル2000指数の累積総リターン,(3)標準プル500ヘルスケア指数の累積総リターンを比較したものである。この図は初期投資を100ドルとし,すべての配当金が再投資を行っていると仮定している。そのような見返りは歴史的結果に基づいており、未来の財政的表現を代表するものではない。
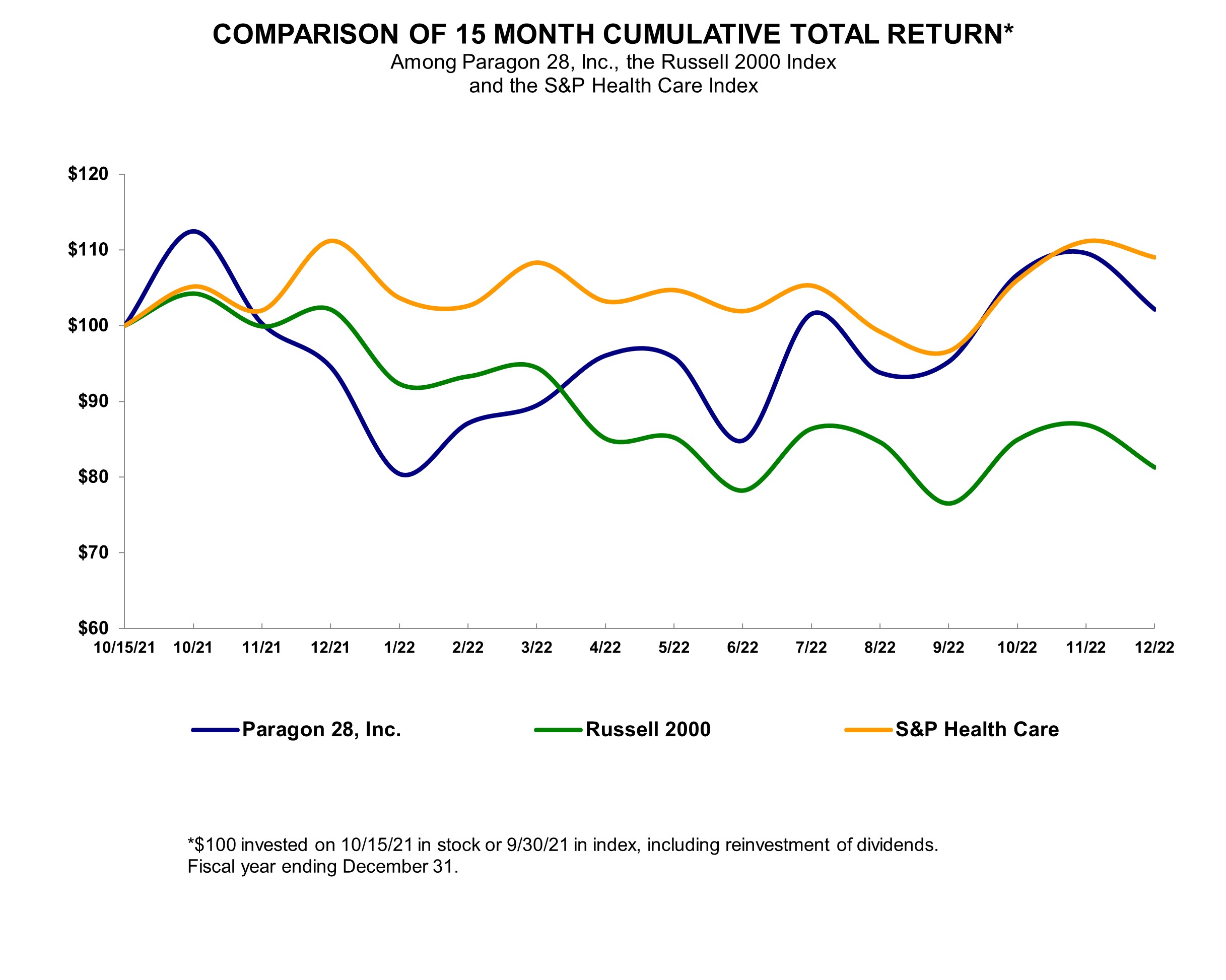
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10/15/21 |
|
10/21 |
|
11/21 |
|
12/21 |
|
1/22 |
|
2/22 |
|
3/22 |
|
4/22 |
|
5/22 |
|
6/22 |
|
7/22 |
|
8/22 |
|
9/22 |
|
10/22 |
|
11/22 |
|
12/22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Paragon 28,Inc. |
|
|
100.00 |
|
|
112.45 |
|
|
100.27 |
|
|
94.55 |
|
|
80.44 |
|
|
87.12 |
|
|
89.47 |
|
|
96.04 |
|
|
95.78 |
|
|
84.82 |
|
|
101.55 |
|
|
93.80 |
|
|
95.24 |
|
|
106.73 |
|
|
109.57 |
|
|
102.14 |
|
ラッセル2000 |
|
|
100.00 |
|
|
104.25 |
|
|
99.91 |
|
|
102.14 |
|
|
92.31 |
|
|
93.29 |
|
|
94.45 |
|
|
85.09 |
|
|
85.22 |
|
|
78.21 |
|
|
86.38 |
|
|
84.61 |
|
|
76.50 |
|
|
84.92 |
|
|
86.91 |
|
|
81.27 |
|
標準医療 |
|
|
100.00 |
|
|
105.16 |
|
|
102.01 |
|
|
111.17 |
|
|
103.66 |
|
|
102.60 |
|
|
108.31 |
|
|
103.21 |
|
|
104.70 |
|
|
101.91 |
|
|
105.29 |
|
|
99.21 |
|
|
96.63 |
|
|
106.02 |
|
|
111.12 |
|
|
109.00 |
|
88
株主.株主
2023年2月27日現在、107名の普通株保有者がいる。株主の実際の数は受益者である株主を含む記録保持者の数を超えているが、その株は仲介人や他の被著名人が街頭名義で保有している。この数の登録所有者は、その株式が他のエンティティが信託形式で保有する可能性のある株主も含まれていない。
配当政策
私たちは宣言したり支払ったりしたことがなく、予測可能な未来にも私たちの株の現金配当金を発表したり支払うことはないだろう。将来的に配当金の発表と支払いに関する任意の決定は、適用される法律に依存し、適用される法律に依存し、当社の財務状況、経営業績、契約制限、資本要件、業務見通し、および私たちの取締役会が関連すると考えられる他の要因を含む当時の既存の条件に依存するであろう。
株式補償計画に基づいて発行された証券
証券の発行許可に関する情報は、本年度報告表の第10-K第III部分に“特定の利益を受けるすべての人の担保所有権及び管理層及び関連株主事項”と題する章を参照されたい。
未登録の証券を売却する
ありません
発行人が株式証券を購入する
ありません
第六項です[保留されている]
89
イットM 7.経営陣の議論と分析財務状況と経営実績。
本年度報告書(Form 10-K)の他の部分の私たちの財務状況と経営結果の議論と分析、および私たちの財務諸表および関連付記を読まなければなりません。本議論および本報告の他の部分は、私たちの経営陣の信念に基づいた私たちの計画、目標、期待、および意図の陳述、ならびに私たちの経営陣がしている仮説および現在入手可能な情報のようなリスクおよび不確実性に関する前向きな陳述を含む。私たちの実際の結果はこのような前向きな陳述で議論された結果と大きく違うかもしれない。このような差異をもたらすか、または促進する可能性のある要因には、本年度報告10−K表に“リスク要因”と題する節で説明された要因が含まれるが、これらに限定されない。
概要
私たちは最先端の医療機器会社で、足部と足首整形外科市場に集中し、患者の生活改善に取り組んでいます。著者らの革新的な整形外科解決方案、プログラム方法と器械は各種の足部と足首疾患をカバーし、骨折固定、前足或いは親指外反を含む--母嚢炎とハンマー足指、足首、平足或いは漸進性陥没性足部奇形(PCFD)、シャコット足部と整形生物を含む。これらの苦痛、虚弱、さらには生命を脅かす疾患を治療するために、手術用インプラントおよび使い捨てデバイス、ならびに手術器具を含む包括的な解決策の組み合わせを提供する。私たちの広範な外科的解決キットは、各患者および手術の特定の需要を満たすのを助けるために、約9,200個のSKUを含む75個の製品システムを含む。著者らは私たちのすべての製品を設計する時に患者と外科医を考慮し、結果を改善し、疾病の再発と合併症の発生率を減少させ、そしてプログラムをもっと簡単で、一致と重複できるようにすることを目標とした。私たちは足と足首市場に対する情熱、専門知識と独占的な集中は私たちが患者と医者の需要をもっとよく理解することができて、これは私たちが革新と増強の解決策を創造し、足と足首市場を転覆し、変えることができると信じている。したがって、私たちの業務は著しい成長と勢いを経験した。
2021年にAdditive Orthopedicsと2022年第1四半期にDisiorを買収し、会社が術前計画、術中支持と術後評価のためのイネーブル技術生態系SMART 28を拡大した。Additiveを買収することによって、著者らは許可されたHDEアプリケーションによって発売された唯一の3 D印刷の患者専用全距骨スペーサ、及び専用の手術前計画プラットフォームを獲得した。Disiorのおかげで,フィンランドヘルシンキのリーディング3次元分析術前計画ソフトウェア会社を買収した。これらの取引は,術前と術中足部と足首の連続看護段階におけるわれわれの能力を拡大した。足部と足首患者の予後を改善するためにSmart 28への投資を継続する予定である。
私たちの広範なビジネスの足跡はアメリカのすべての50カ国と他の22カ国に広がっている。米国では,主に独立販売代表からなるネットワークを介して病院や外来手術センターに製品を販売しており,その多くは独占販売されている。米国以外では,主に販売代表と在庫流通業者ネットワークを介して病院や外来手術センターに販売している。私たちはアメリカの新しい分野に拡張するために、私たちの販売組織とネットワークを効果的に拡大する予定です。私たちはまた、私たちのグローバルネットワークの拡大に集中しており、私たちの規模と機会の評価に基づいて、既存と選定された新しい国際市場での販売足跡を拡大しています。
我々は現在、複数の第三者製造関係を利用して、資本効率の高いビジネスモデルを維持しながら、低コスト生産を確保している。私たちの多くの外科的解決策の重要な部品は複数の供給源を持っている。私たちのほとんどの供給協定は最小限の製造や調達義務を持っていない。したがって、私たちは一般的に特定の数量の製品を購入する義務がありません。私たちのサプライヤーは通常私たちに特定の数量の製品や私たちの製品の部品を販売したり、製造したりする義務はありません。ほとんどの場合、私たちのすべての製品は余分な製造能力を持っている。新冠肺炎の流行が最も深刻な時期を除いて、私たちは需要を満たすために必要な製品或いは製品部品を獲得する上で何の重大な困難にも直面しておらず、私たちはサプライヤーが要求した納期前に製品を供給することが困難な限られた状況に遭遇したことがある。私たちは予測可能な未来に、製造能力は私たちの製品に対する市場の需要を満たすのに十分だと信じている。
2022年12月31日までの年間純収入は1兆814億ドルだったが、2021年12月31日までの年間純収入は1兆475億ドルだった。
2022年12月31日までの年度純損失は6730万ドルだったが、2021年12月31日までの年度純損失は1370万ドルだった。
90
調整後のEBITDAは2022年12月31日までの年間マイナス1070万ドルであるのに対し,2021年12月31日までの年間は310万ドルである。調整後のEBITDAは米国公認会計原則(GAAP)下の財務測定基準ではない。この非GAAP財務指標及び最も直接比較可能なGAAP財務指標との入金をどのように計算するかについては、“-非GAAP財務指標”を参照してください。
2022年と2021年12月31日まで、私たちの現金はそれぞれ3850万ドルと1.094億ドルで、利益剰余金(赤字)はそれぞれ6780万ドルと50万ドルです。設立から2022年12月31日まで、私たちの主な資本源は運営キャッシュフロー、私募証券、公開発行収益と債務です。
2023年1月30日、我々は650万株の普通株の公開発行を完了し、発行価格は1株当たり17.00ドル(以下、発行と略す)。今回の発売は、吾らが発行·売却した3,750,000株の普通株(“主要株式”)と、売却証券保有者によって販売された2,750,000株の普通株(“第2株”)を含む。引受業者と締結した引受契約条項によると、吾ら及び売却証券所持者は、30日以内に行使可能な選択権を引受業者に付与し、公開発売価格で2023年2月17日に行使された引受割引及び手数料を引いた後、それぞれ最大562,500株及び412,500株の普通株(“株式購入株式”)を追加購入する。引受割引と手数料および支払うべき発売費用を差し引いた後、今回の発行から約6830万ドルの純収益を得た。私たちは証券保有者が普通株を売却するための何の収益も受けなかった。
私たちは私たちの既存の現金と利用可能な債務借金が私たちの資本要求を満たすのに十分で、少なくとも今後12ヶ月で私たちの運営に資金を提供すると信じている。
我々は,我々の販売·マーケティング機能の研究·開発および拡大に多くの資金を投入し,これらの分野への大量投資を継続する予定である。我々は,米国証券取引委員会の規則や法規の遵守やニューヨーク証券取引所の上場基準に関する費用,追加の保険費用,投資家関係活動,その他の行政·専門サービスなど,上場企業として運営されている一般的かつ行政的費用にも大量の投資を行っている。私たちは一般的な行政費用の面で大きな増分投資をしないと予想される。これらと他の要素のために、今のところ予想されていないにもかかわらず、私たちは私たちの運営と計画中の成長に資金を提供するために追加の資金が必要かもしれない。私たちはまた追加的な資金調達を日和見に求めるかもしれない。私たちは、パートナー関係を構築することによって、または公共またはプライベートエクイティ発行または債務融資、クレジットまたはローン手配、またはこれらの資金源のうちの1つまたは複数の組み合わせによって任意の追加資本を調達することを求めることができる。もし私たちが株式証券を発行することでより多くの資金を調達すれば、私たちの株主は希釈されるかもしれない。
われわれの経営業績に影響を与える要素
私たちは私たちの業績と持続的な成功が大きな機会を提供するいくつかの要素にかかっていると信じている。これらの要素には
Smart 28を含む製品開発と革新への投資
私たちは引き続き私たちの業務への投資を通じて長期的な収入増加に集中する予定だ。研究開発において、私たちのチームは絶えず新製品と既存製品の繰り返しを開発しています。また,既存製品の強化と先進技術を用いた新製品や関連サービスの創出により患者結果を改善するためにSmart 28に大量の投資を継続する予定である。私たちは足と足首の解決策の組み合わせを拡大し、次世代製品を市場に出すことに力を入れています。研究開発と臨床テストは時間も高価であるが、私たちは新しい適応に拡張し、製品の改善を実施し、そして引き続き臨床データを通じて著者らの製品の有効性、安全性とコスト効果を証明することは、私たちの解決策の採用率を増加させるために重要であると信じている。私たちは引き続きプロジェクトに投資し、足と足首を治療する医師を教育して製品の優位性を知っています。したがって、短期的には、これらの活動は私たちの運営費用を増加させることが予想されますが、長期的には、私たちの業務や運営結果に積極的な影響を与えることが予想されます。
91
アメリカと国際市場での持続的なビジネス拡張
販売やマーケティングでは、アメリカや国際市場でのビジネスチームを拡大するために有意義な資源も投入します。私たちのアメリカでの第一の商業任務は販売チームを拡大し、私たちの外科医の顧客基盤を拡大し、販売チームのルート生産性を高め、外科医の利用率を増加させることを含む。我々の国際市場における第一のビジネス課題は、既存国での市場シェアを拡大し、新たな国を狙うことを含み、そこで強力な平均販売価格(ASP)と利益率を最大限に向上させることができる。私たちの現在の拡張目標はブラジル、コロンビア、ドイツ、イタリア、日本を含む。この過程は私たちの商業チームに対して大量の教育と訓練を行い、医者の私たちの製品に対する技術能力レベルを達成し、私たちの製品に対する需要を確立する経験を得る必要がある。研修を終えた後、私たちのビジネスチームは通常、彼らの顧客ネットワークを拡大し、彼らの生産性を私たちが予想するレベルまで向上させるために現場での時間が必要だ。成長を実現するためには、より多くの販売代表を採用、訓練、維持することに成功する必要があり、これには大量の投資が必要だ。
病院施設の利用を継続·拡大する方法
米国では,医師に我々の製品を使用させるために,これらの医師が患者を治療する病院施設は,通常,病院施設や病院施設が属するGPOと直接調達契約を締結することが求められている。この過程は長くて時間がかかるかもしれないし、広範囲な交渉と管理時間が必要だ。アメリカ以外の市場では、私たちは私たちの製品を販売するために契約入札過程を要求されるかもしれません。そこでは入札過程は特定の時間帯にのみ開放されて、私たちは入札過程で成功しないかもしれません。
在庫、外科機器、サプライチェーン管理
私たちが販売している製品の種類が多く、数量が多いことから、これらの製品を効果的にマーケティングと販売するためには、大量の在庫と手術器械を維持しなければなりません。したがって、大量の現金は在庫と手術器具に使われている。時々、私たちは在庫が私たちの製品の要求に合わないことを確認するかもしれない。私たちはまた必要な部品の数量を過大評価したり過小評価したりする可能性があります。この場合、追加の資源がかかるか、あるいは調達できる最終製品の数量に制限されるかもしれません。このような要素は私たちを時代遅れで期限切れの危険に直面させ、これは減価費用を招くかもしれない。また、私たちが改善や追加機能を含む次世代製品を発表するにつれて、前の世代の製品は時代遅れになる可能性があります。
季節性
私たちはすでに経験して、引き続き私たちの業務の季節を経験する予定で、私たちのアメリカでの最高販売量は第四のカレンダー四半期に現れました。私たちの第四四半期のアメリカでの販売量はよく高くなります。多くの患者は年間賠償免除額に達し、冬休み期間中に回復した後に手術を受ける時間があるからです。
新冠肺炎の大流行の影響
2020年3月、世界保健機関は新冠肺炎疫病を大流行と発表し、それに応じて、アメリカ国内のある州は選択性手術の延期を要求する現地亡命規定を実施した。そのため、私たちの収入増加は悪影響を受けており、特に2020年3月から2020年5月まで、このような現地避難制限が緩和されている。2022年第1四半期初め、新冠肺炎のオミック変異体は手術を延期し、これらの不利な要素は2月中旬から減弱した。その時以来、私たちは選挙手続き環境が引き続き改善されていることを見てきた;しかし、この大流行病は市場、サプライチェーン、そして世界とアメリカ経済の深刻な中断を招き、この状況は続くかもしれない。私たちはこのような影響が私たちの業務に及ぼす持続時間や深刻さを合理的に推定することができない。
新興成長型会社
雇用法案によると、新興成長型企業として、他の非新興成長型企業に適用される上場企業の各種報告要件の特定の免除を利用する資格がある。私たちはこの免除を利用することを選択しているので、私たちは新興成長型企業であるにもかかわらず、新たな会計基準や改正された会計基準を他の非新興成長型企業の上場企業に適用しながら、これらの会計基準に適用することはありません。したがって、我々の財務諸表および中期財務諸表は、新たなまたは改訂された会計声明を遵守する会社と比較できない可能性がある。
92
我々は、(I)我々の第1年度の最終日まで新興成長型企業であり、我々の年間総収入が12.35億ドル以上に達し、(Ii)1934年の“証券取引法”(改正)の下の第12 b-2条の規則で定義される“大規模加速申告会社”の第1年度の最終日となり、当該事業年度の第2四半期の最終営業日終了まで、非関連会社は少なくとも7.00億ドルの株式を保有し、(Iii)我々は任意の3年間に株式を発行し、10億ドルを超える転換不可能債務証券、または(Iv)私たちの財政年度の最後の日、すなわち私たちが初めて発行完了した日の5周年後の最後の日です。
非公認会計基準財務指標
非公認会計基準財務指標の使用とその限界
私たちがアメリカ公認会計原則に基づいて確定した業績と業績測定基準以外に、私たちはいくつかの非公認会計原則の財務指標が私たちの複数の時期の財務と運営表現を評価と比較し、私たちの業務に影響を与える傾向を識別し、業務計画を制定し、戦略決定を行う上で非常に有用であると考えている。
調整後のEBITDAは我々の経営陣が財務業績を評価するための重要な業績指標であり、内部計画と予測にも用いられる。
調整後のEBITDAは、純収益(損失)の調整に加え、私たちの業務の潜在的な傾向を識別するのに役立ち、投資家が私たちの会社を異なる資本構造、税率または異なる形式の従業員報酬を持つ可能性のある他の会社と比較するのを助けると信じている。したがって、調整後のEBITDAは、投資家や他の人が私たちの経営業績を理解し、評価するために有用な情報を提供し、私たちの過去の業績と未来の見通しに対する全体的な理解を強化し、私たちの経営陣が財務と運営決定に使用する重要な財務指標により高い透明性を持たせると考えられる。分析ツールとして調整後EBITDAを使用することには限界があり、これらの測定基準を孤立的に考慮したり、米国公認会計基準に基づいて報告された我々の財務業績分析の代替指標としたりするべきではありません。いくつかの潜在的な制限は
•他の会社は,我々の業界に類似した業務手配がある会社を含めて,調整後のEBITDAや類似名称の測定基準を報告する可能性があるが,計算方法が異なり,比較測定基準としての有用性を低下させている
•減価償却や償却費用は非現金費用であるが、減価償却や償却中の資産は将来的に交換が必要になる可能性があり、調整後のEBITDAはこのような交換や新たな資本支出要求の現金資本支出を反映していない
•調整後のEBITDAも、我々の運営資金需要の変化や現金需要を反映しておらず、株による報酬の潜在的な希釈影響も反映していない
•調整後のEBITDAは,我々が発生する可能性のある債務の利息支出や利息や元金の支払いに必要な現金需要を反映していない。
これらおよび他の制限のため、あなたは、私たちの非GAAP測定基準のみを、他のGAAPベースの財務測定基準の追加とみなさなければなりません。調整後のEBITDAと最も比較可能なGAAP財務指標との完全入金については,“-GAAPと非GAAP指標との入金”を参照されたい。
GAAPと非GAAP測定基準との間の入金
調整後のEBITDAを,利子控除費用,所得税費用(福祉),減価償却と償却前の収益(損失),株式報酬費用,従業員株式購入計画費用,非日常料金,その他の非現金費用と定義した。2022年12月31日と2021年12月31日までの年度調整後EBITDAと最も比較可能なGAAP財務指標との完全入金については、次の表を参照されたい。
93
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
|
2022 |
|
|
2021 |
|
|
|
(単位:千) |
|
純損失 |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
利子支出 |
|
|
4,129 |
|
|
|
1,719 |
|
所得税(福祉)費用 |
|
|
(64 |
) |
|
|
713 |
|
減価償却および償却費用 |
|
|
13,728 |
|
|
|
8,987 |
|
株に基づく報酬費用 |
|
|
10,365 |
|
|
|
4,948 |
|
従業員株購入計画費用 |
|
|
213 |
|
|
|
— |
|
オーバーフロー負債公正価値変動(1) |
|
|
1,280 |
|
|
|
440 |
|
法律和解(2) |
|
|
27,000 |
|
|
|
— |
|
調整後EBITDA |
|
$ |
(10,675 |
) |
|
$ |
3,114 |
|
------------------------------------------
(1)オーバーフロー負債公正価値を代表する非現金変動
(2)ライト医療訴訟を解決する非日常的な費用を代表して
私たちの運営結果の構成要素は
純収入
私たちの収入は足と足首整形外科の解決策を販売しています。主にインプラントです。また、顧客から受け取った任意の運賃を収入として記録し、実際の輸送コストを販売済み商品のコストとして記録する。私たちは販売、使用、付加価値税、政府当局による評価、顧客からの税金など、取引価格の測定からすべての税金を除外することを選択した。したがって、収入はこのような税金を差し引いた純額として確認されなければならない。また、私たちは不良債権推定損失を差し引いた収入を記録した。2022年、2021年、2020年12月31日までの数年間、私たちの純収入の10%以上を占める単一顧客はいません。私たちは予測可能な未来に、私たちの販売範囲の拡大、新しい顧客の増加、既存の顧客の私たちの製品への使用の増加に伴い、私たちの純収入は様々な要素によって変動する可能性がありますが、精算の可用性、私たちの販売チームの規模と成功度、私たちの製品を知って使用する病院と医者の数、季節性を含むかもしれません。
販売原価
販売コストには、主に第三者サプライヤーから購入された完成品、輸送コスト、余分かつ時代遅れの在庫調整および特許権使用料が含まれています。インプラントは主にアメリカの第三者サプライヤーによって私たちの仕様に従って生産されます。販売コストはインプラントが外科手術に使用された場合に確認され,関連収入は確認された。手術に使用する前に、私たちのインプラントコストは在庫として記録され、純額は私たちの総合貸借対照表に計上される。販売コストは増加する見通しで、主な原因は販売量の増加だ。
私たちが毛利を計算する方法は純収入から販売コストを引いて、毛利は毛利を純収入で割ることです。私たちは予測可能な未来に、純収入の増加に伴い、私たちの毛利益は増加すると予想されています。私たちの毛利益と毛利率はずっと様々な要素の影響を受け続けていますが、主に平均販売価格、第三者製造コスト、顧客組合の変化、過剰と時代遅れの在庫調整、特許権使用料と私たちの業務の季節性です。平均販売価格が高いため、私たちがアメリカで販売している製品の毛金利は国際的に販売されている製品よりも高い。しかし、上記の要素と季節性に基づいて、私たちの毛金利は異なる時期に変動すると予想される。
運営費
研究と開発
研究開発費には、新製品と持続的な製品開発活動に関連する工学コストと研究プロジェクト、臨床研究と試験費用、品質と監督管理費用、および研究開発機能に関する給料、ボーナスと福祉が含まれている。我々は,プログラムに重点を置いた製品開発手法を継続し,複数の足部や足首適応にまたがる新しいシステムを増加させ,既存のシステムに追加的な機能を追加するプロジェクトを行っている。私たちはより多くの人員を招いて新製品と製品強化機能を開発することに伴い、Smart 28を含めて、私たちの研究開発費は増加すると予想しています。
94
販売、一般、管理
販売、一般および行政費用は、主に米国の販売代表に支払われる手数料、販売、マーケティング、一般および行政機能に関連する賃金、ボーナスおよび福祉、および株に基づく報酬を含む。さらに、販売、一般および行政費用には、マーケティング活動、医師および販売者医療教育計画、手術器具減価償却、出張費用、専門サービス料(法律、財務、監査および税金を含む)、保険費用、施設費用、および他の一般会社費用に関連するコストが含まれる。
予測可能な未来には、四半期ごとに変動する可能性があるにもかかわらず、当社の業務の持続的な増加に伴い、販売、一般、管理費用が増加し続けることが予想されます。また、従業員数の増加に伴い、上場企業としての私たちの運営を支援するための施設や業務プロセスを拡大し、株式ベースの報酬費用を含めて管理費が増加すると予想しています。私たちの業務の季節性と私たちは新しい地域で直接販売エリアマネージャーを増加し続けるため、私たちの販売、一般、行政費用は時間の経過とともに変動する可能性があります。
法律和解
法律和解費用には私たちとライト医療会社との和解と関連する法的費用が含まれています。
利子支出
利子支出には報告期間内に発生した利息と融資コストの償却が含まれている。
経営成果
2022年12月31日まで及び2021年12月31日まで年度
以下に示す期間の業務成果を表にまとめる.2021年12月31日と2020年12月31日までの年度の財務状況と経営業績の検討·分析は,2022年3月8日に米国証券取引委員会に提出された2021年12月31日現在の年次報告10−K表の第2部第7項で見つけることができる。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
|
|
2022 |
|
|
2021 |
|
|
金額 |
|
|
% |
|
|
|
(単位:千) |
|
純収入 |
|
$ |
181,383 |
|
|
$ |
147,464 |
|
|
$ |
33,919 |
|
|
|
23 |
% |
販売原価 |
|
|
32,457 |
|
|
|
28,024 |
|
|
|
4,433 |
|
|
|
16 |
% |
毛利 |
|
|
148,926 |
|
|
|
119,440 |
|
|
|
29,486 |
|
|
|
25 |
% |
運営費 |
|
|
|
|
|
|
|
|
|
|
|
|
研究開発 |
|
|
24,650 |
|
|
|
16,128 |
|
|
|
8,522 |
|
|
|
53 |
% |
販売、一般、管理 |
|
|
159,323 |
|
|
|
114,087 |
|
|
|
45,236 |
|
|
|
40 |
% |
法律和解 |
|
|
27,000 |
|
|
|
— |
|
|
|
27,000 |
|
|
* |
|
総運営費 |
|
|
210,973 |
|
|
|
130,215 |
|
|
|
80,758 |
|
|
|
62 |
% |
営業損失 |
|
|
(62,047 |
) |
|
|
(10,775 |
) |
|
|
(51,272 |
) |
|
* |
|
その他の費用 |
|
|
(1,214 |
) |
|
|
(486 |
) |
|
|
(728 |
) |
|
|
150 |
% |
利子支出 |
|
|
(4,129 |
) |
|
|
(1,719 |
) |
|
|
(2,410 |
) |
|
|
140 |
% |
所得税前損失 |
|
|
(67,390 |
) |
|
|
(12,980 |
) |
|
|
(54,410 |
) |
|
* |
|
所得税(福祉)費用 |
|
|
(64 |
) |
|
|
713 |
|
|
|
(777 |
) |
|
|
(109 |
)% |
純損失 |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
|
$ |
(53,633 |
) |
|
* |
|
------------------------------------------
*意味がない
次の表は,2022年12月31日までと2021年12月31日までの年度の地理的地域別純収入総額をそれぞれ示している。
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
|
2022 |
|
|
2021 |
|
アメリカです |
|
$ |
158,105 |
|
|
$ |
130,112 |
|
国際的に |
|
|
23,278 |
|
|
|
17,352 |
|
純収入合計 |
|
$ |
181,383 |
|
|
$ |
147,464 |
|
95
純収入それは.純営業は2021年12月31日までの年間1億475億ドルから2022年同期の1兆814億ドルに増加し、3390万ドルと23%増となった。前年と比較して、ドル安は2022年12月31日までの1年間の純収入増加を1.5%減少させた。米国の純収入は2022年12月31日までの1年間で1億581億ドルで、前年比22%増加した。米国の純収入の増加は主に販売チームの生産性向上の結果であり、主に新製品の発売及び医療教育と訓練及び販売チームの拡張によるメリットによって推進されている。国際収入は2330万ドルで、前年比34%増加した。ドル安で2022年12月31日までの年間の国際純収入増加は前年に比べて約12.3%減少した。国際収入の増加は主に私たちの3つの最大の国際市場オーストラリア、南アフリカ、イギリスによって推進されている。
売品コストと利回りそれは.販売コストは2021年12月31日までの年間2800万ドルから2022年同期の3250万ドルに増加し、440万ドルと16%増となった。販売コストの増加は主に販売量の増加による販売商品の変動コストの増加である。2022年12月31日までの年間毛金利は82.1%に増加したが、2021年同期は81.0%であり、主に在庫過剰と陳腐費用が低いためである。
研究と開発費用。研究開発費は2021年12月31日までの年間1,610万ドルから2022年同期の2,470万ドルに増加し、850万ドルと53%増となった。研究開発費の増加は、主に新製品開発事業と我々の品質管理システムへの追加投資によるものであり、従業員数の増加と2022年第1四半期のDisior買収により増加した人員費用を含む。
販売、一般、管理費用それは.販売·一般·行政費は2021年12月31日までの年度の1億141億ドルから2022年同期の1億593億ドルに増加し、4520万ドルと40%増となった。前年と比較して、販売、一般および管理費用の増加は、主に販売とマーケティングへの投資、対面による米国のマーケティングや医学教育活動、米国と私たちの国際市場におけるビジネスチームの拡張、米国の純収入増加に関連する可変販売代表手数料支出の増加、および2021年第4四半期に上場企業のコストとなることにより増加した一般および管理費用である。
法律和解費用それは.2022年12月31日までの1年間に,Wright Medicalと2022年11月28日に和解合意に達し,法的和解費用は2700万ドルであった。
利子支出それは.2022年12月31日までの1年間、利息支出は2021年12月31日現在の170万ドルから410万ドルに増加したが、これは主に未返済債務水準の上昇によるものだ。
流動性と資本資源
2022年と2021年12月31日まで、私たちの現金はそれぞれ3850万ドルと1.094億ドルで、利益剰余金(赤字)はそれぞれ6780万ドルと50万ドルです。設立から2022年12月31日まで、私たちの主な資本源は運営キャッシュフロー、私募証券、公開発行収益と債務です。
2021年10月19日、8984,375株の普通株の初公募株を完成させ、一般公開価格は1株当たり16.00ドルとなった。初公募の総収益は約1兆438億ドルで、引受割引と手数料、支払うべき発売費用を差し引いた。全費用を差し引いた純収益は1億291億ドルだった。
2023年1月30日、私たちは6,500,000株の普通株の発行を完了し、発行価格は1株17.00ドルで、その中に3,750,000株の初期株と2,750,000株の二級株が含まれている。引受業者と締結した引受契約条項によると、吾ら及び売却証券所持者は、30日以内に行使可能な選択権を引受業者に付与し、公開発売価格で2023年2月17日に行使された引受割引及び手数料を引いた後、それぞれ最大562,500株及び412,500株の普通株(“株式購入株式”)を追加購入する。引受割引と手数料および支払うべき発売費用を差し引いた後、今回の発行から約6830万ドルの純収益を得た。私たちは証券保有者が普通株を売却するためのいかなる収益も受けないだろう。
発売で得られた純額を運営資金,資本支出,その他の一般会社用途として利用する予定である。私たちはまた、今回発行された純収益の一部を利用して、私たちの業務と補完し、私たちの戦略目標の製品、技術、業務を買収または投資することも可能です。しかし、私たちは現在どんな合意にも達成したり、そのような取引を完了することを約束していない。
96
2022年12月31日、私たちは中型定期ローン(定義は以下参照)の項目の下で3,000万ドルの元金未返済と1,000万ドルの借金能力があり、中型資本循環ローン(定義は以下参照)は0ドルの未返済元金と5,000万ドルの借金能力がある。2022年12月31日現在、私たちはザイオン基金(以下、定義)の下でも約1600万ドルの未返済金を持っている。
私たちは、私たちの既存の現金、私たちが修正した中型信用協定(以下のように定義する)で追加的に利用可能な借入金と期待収入は、私たちの資本金要求を満たし、今後12ヶ月の運営に資金を提供すると信じています。しかし、上記で議論した発売のように、私たちの業務のさらなる成長を支援するために追加資金を調達することにするかもしれません。
長期債務
中型株信用協定
2021年5月6日,吾らはMidCap Financial Trustと新たな信用協定を締結し,最大3,000万ドルの循環融資(“MidCap循環融資”)および最大4,000万ドルの定期融資(“MidCap Term Loan”)を含む合計7,000万ドルの借款を提供し,我々のほぼすべての資産を担保とした(“MidCapクレジット合意”)。MidCap定期融資には2ロットが含まれ、第1弾は1,000万ドルの承諾額を提供し、第2弾は3,000万ドルの承諾額を提供する。MidCap定期ローンとMidCap循環ローンの変動金利はそれぞれLIBORプラス6%とLIBORプラス3%であり、2026年5月1日または制御権変更イベント(“終了日”)が早い時期に満期になる。MidCap循環融資とMidCap定期融資の全元金残高は終了日に満期となる。利息は月ごとに支払い、MidCap信用協定により、元金の前払いを選択することが許可されています。中型株信用協定は、以前の12ヶ月間の最低製品純売上高および最低総合EBITDA(各用語は中型株信用協定で定義されている)を維持することを要求する。
2022年11月9日、私たちはMidCapクレジット協定に対する修正案に署名した。MidCap循環ローンの改訂は5,000万ドルまでの総借款能力を提供した。MidCap改訂案はMidCap信用協定を改訂し,LIBOR金利プラス適用保証金からSOFR金利プラス適用保証金への移行に関する条文を加え,MidCap定期融資項目の6%の適用保証金を維持し,MidCap循環融資項での適用保証金を3%から3.75%に引き上げた。そのほか、MidCapはMidCap信用協定中のいくつかのチノ、条項及び条文を改訂し、その中に最低製品純値販売財務チノレベルの修正、及び最低総合EBITDA財務契約の廃止を含む。2022年12月31日現在、改正された中型株信用協定下のすべての財務契約を遵守しています。
コロラド州Vectra銀行融資協定
2020年3月27日、コロラド州のVectra銀行と改訂·再署名された融資協定(“Vectra融資協定”)を締結した。Vectraローン協定は、私たちの既存の定期ローンと既存の買い取りローンを元金総額6,802ドルの単一定期ローン(“2020年定期ローン”)に再融資し、既存のサイクルローンの最高元金金額を15,000,000ドルに引き上げます(“2020年循環ローン”、2020年の定期ローン“2020年ローン”)と併せてです。この2つのローンの満期日はいずれも2020年9月30日であり、その後2023年10月5日まで延長された。Vectraローン協定は私たちのほとんどの資産を担保にしている。Vectraローンプロトコルには金融と他の習慣契約が含まれており、金利は3%である。私たちは2021年に2020年に中型株信用協定の締結に関連した融資を返済した。
2022年3月24日、我々はZion Bancorporation,N.A.dba Vectra Bank Coloradoと元金1,600万ドルの保証定期融資手配(“Zionローン”)を締結した。Zionローン(I)は変動年利で利息を計算し、金利は(A)1ヶ月期SOFR金利プラス(B)1.75%に相当し、月ごとの調整及び(Ii)は2037年3月24日に満期になる。元金と利息は月ごとに支払い、事前返済を選択することを許可し、保険料や罰金を支払う必要がありません。私たちはシリンスファンドを使ってコロラド州デンバー市の本部を購入するために資金を提供します。
2022年11月10日から、私たちは“ザイオン基金第一修正案”に署名した。Zion融資メカニズムの修正案は財務契約を修正し、(I)流動性比率を維持することを要求し、過去3ヶ月をベースに測定された任意の四半期の最終日の現金流量が0ドル以下であり、(Ii)固定費用カバー率が過去4四半期をベースに計算され、現金流量が0ドルより大きい場合、一定の流動性レベルを維持する。また、四半期ごとの最終日から年単位で計算する純収入増加契約も追加された。2022年12月31日まで、私たちは改訂されたザイオン基金下のすべての金融契約を守った。
97
資金需要
私たちは現金を使って私たちの業務に資金を提供します。その中には主に私たちの足と足首整形外科インプラントと使い捨てデバイスと関連器具を購入するコストと、研究開発と販売、一般と行政費用を含む私たちの運営費用が含まれています。私たちは、予測可能な未来に、私たちの研究·開発計画の拡大に投資し続けるとともに、予想される販売増加を推進し、支援するために、私たちの販売·マーケティングインフラや計画を拡大し続け、私たちの運営費用が増加することを予想しています。私たちの運営費の時間と金額は多くの要素に依存します
•私たちは私たちの既存製品を改善し、新製品と解決策を開発するための研究と開発活動を行う予定だ
•私たちがアメリカや他の場所で行っている商業化活動のコストは、領土の拡大、販売とマーケティング担当者の増加、実際および予想される製品販売、マーケティング、製造、流通を含む
•既存のビジネスと相補的なビジネス、製品、技術への買収や投資を求めているかどうかにかかわらず、
•任意の特許請求書および他の知的財産権の費用の提起、起訴、弁護、および実行;
•私たちはもっと多くのインフラと内部システムを実施する必要がある
•様々なコンピュータ化された情報システムを実施しています
•新冠肺炎の流行が私たちの運営と業務に及ぼす影響。
98
私たちは間違っていることが証明される可能性があるという仮定に基づいてこの推定をして、私たちは期待よりも早く利用可能な資本資源を利用することができる。予想していなかったにもかかわらず、私たちは、公開または私募株式発行または債務融資、クレジットまたはローン手配、またはこれらまたは他の資金源のうちの1つまたは複数の組み合わせによって、任意の必要な追加資本を調達することを求めるかもしれない。私たちは受け入れ可能な条項や追加的な資金を得ることができないかもしれない。もし私たちが必要な時に受け入れ可能な条件で必要な資本を得ることができない場合、あるいは根本的にできなければ、私たちは私たちの製品開発計画、商業化努力、または他の運営を延期、制限、減少、または終了させることを余儀なくされるかもしれない。もし私たちが株式証券を発行することで追加資金を調達すれば、私たちの株主は希釈され、どの融資条項も私たちの株主の権利に悪影響を及ぼす可能性がある。また、私たちに追加資金を提供する条件として、将来の投資家は、既存の株主よりも高い権利を要求し、付与される可能性がある。もし私たちが協力協定、許可手配、あるいはマーケティングと流通手配を通じてより多くの資本を調達すれば、私たちは私たちの技術、将来の収入源、研究プロジェクト、または製品に対する貴重な権利を放棄しなければならないかもしれません。あるいは私たちに不利になる可能性のある許可を与えなければなりません。債務融資が可能であれば、将来の業務活動の柔軟性を制限する制限契約に関連する可能性が高く、破産が発生した場合、債務保有者は、当社の株式証券保有者がわが社の資産の任意の分配を受ける前に返済されることになります。
キャッシュフロー
次の表に次の期間の主な現金源と用途を示す
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
|
|
2022 |
|
|
2021 |
|
|
金額 |
|
|
% |
|
|
|
(単位:千) |
|
提供された現金純額(使用): |
|
|
|
|
|
|
|
|
|
|
|
|
経営活動 |
|
$ |
(49,181 |
) |
|
$ |
(3,317 |
) |
|
$ |
(45,864 |
) |
|
|
(1,383 |
)% |
投資活動 |
|
|
(60,693 |
) |
|
|
(35,490 |
) |
|
|
(25,203 |
) |
|
|
(71 |
)% |
融資活動 |
|
|
39,487 |
|
|
|
131,096 |
|
|
$ |
(91,609 |
) |
|
|
(70 |
)% |
為替レートの影響
現金の変化 |
|
|
(497 |
) |
|
|
(438 |
) |
|
|
(59 |
) |
|
|
(13 |
)% |
現金が純増する |
|
$ |
(70,884 |
) |
|
$ |
91,851 |
|
|
$ |
(162,735 |
) |
|
|
(177 |
)% |
経営活動に使われている現金純額
2022年12月31日までの年度、経営活動のための現金純額は4,920万ドルで、主に純損失6,730万ドルと2,670万ドルの非現金支出を含み、その中には主に1,370万ドルの減価償却と償却、1,040万ドルの株式補償支出と130万ドルの現金負債公正価値の変化、および2,150万ドルの在庫購入と1,200万ドルの売掛金の増加を含む860万ドルの運営資本の負の変化が含まれ、一部は売掛金の法的決済2,200万ドルとその他の運営資本の300万ドルの減少によって相殺される。
2021年の業務活動のための現金純額は330万ドルで、主に1370万ドルの純損失と1920万ドルの非現金支出を含み、その中には主に900万ドルの減価償却と償却、280万ドルの超過と古い在庫準備金、490万ドルの株式給与支出、880万ドルの運営資金の負の変化が含まれている。主に在庫購入により増加した在庫1110万ドルと売掛金650万ドルの増加を含み、売掛金の340万ドル増加と売掛金およびその他の流動負債増加710万ドル分から相殺される。
投資活動のための現金純額
2022年12月31日までの年度,投資活動のための現金純額は6,070万ドルであり,主に1,850万ドルでDisior(当社の定期融資から引き出した2,000万ドルから資金)を買収し,1,830万ドルでデンバー本社ビル(一部の資金は1,600万ドル担保融資から),1,270万ドルで手術機器を購入し,SAP発売に関連する資本支出430万ドルと,ある特許コストの資本化を含んでいる。
2021年の投資活動のための現金純額は3,550万ドルであり、主に私たちがAdditive Orthopedicsの資産を1,500万ドルで購入することと、主に手術器具の購入を含む1,830万ドルの財産および設備購入を含む。
99
融資活動が提供する現金純額
2022年12月31日までの1年間、融資活動が提供する現金純額は3950万ドルで、会社のMidCap定期融資から抽出した2000万ドル、Disiorの買収に資金を提供し、1600万ドルの融資、会社のデンバー本社の購入、株式オプションを行使するための収益530万ドルを含み、一部は100万ドルのプレミアム債務支払いによって相殺された。
融資活動が2021年に提供する現金純額は1.311億ドルであり、主に初回公募による得られた金の純額1.294億ドル及び中型株の定期融資で得られた金1,000万ドルを含むが、他の長期債務による600万ドルの返済及び債務発行コスト310万ドルの支払いによって部分的に相殺される。
肝心な会計政策
経営陣は私たちの財務状況と経営結果の討論と分析は私たちの財務諸表に基づいています。これらの報告書はアメリカ公認会計原則に従って作成されています。これらの財務諸表を作成するには、報告書の資産、負債、収入、費用、および関連開示の金額を推定し、仮定する必要があります。我々の見積もりは,我々の歴史的経験と,当時の状況では合理的な様々な他の要因に基づいており,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性があり、そのような違いは、いずれも実質的である可能性がある。
以下は私たちの最も重要な会計見積もりを討論し、これらの見積もりは私たちの財務状況と経営結果に対して最も重要で、私たちは最も困難で、最も主観的で、最も複雑な判断をする必要がある。
収入確認
我々は、ASC主題606に基づいて、顧客との契約収入(“ASC 606”)に従って収入を会計処理する。収入は主に私たちのインプラントと使い捨て用品の販売で、次は私たちの手術器具の販売です。私たちは従業員販売員を通じて私たちの製品を販売し、アメリカでの独立販売代表。アメリカ以外での販売は独立した販売代表と在庫流通業者を通じて。私たちは特定の流通業者と病院と委託契約を締結した。私たちの顧客は主に病院と外科センターです。
私たちの履行義務が履行された時、すなわち私たちの顧客が製品の所有権を獲得した場合、通常製品が外科手術に使用された場合、収入は記録され、不良債権の推定損失が差し引かれる。私たちは一般的に顧客と価格と私たちの標準条項と条件を含む書面契約を締結します。私たちが提供するどんな割引も私たちの顧客契約にリストされています。割引は購入時にわかりますので、収入を確認する際に見積もりを必要としません。輸送·搬送コストは販売貨物のコストとして記録され、顧客に発行された輸送·搬送コストの金額を収入に記入する。顧客に支払われた任意の輸送·運搬費用を収入として記録し、実際に発生した輸送コストを販売貨物のコストとして記録する。我々は、政府当局によって評価され、顧客に徴収されるすべての税(例えば、販売、使用、付加価値税)を取引価格の測定から除外することを選択した。したがって、収入はこのような税金を差し引いた純額として確認されなければならない。我々は、ASC 606によって許可された実際の方便を使用して、顧客が承諾貨物制御権を取得した後に発生する輸送および運搬活動を履行コストとして使用することを選択したので、取引価格の一部を輸送サービス義務に割り当てることはない。販売代理店がその割当を超えて獲得した手数料は、契約に署名していなければこのコストが生じないため、契約を取得する増分コストに分類される。私たちは実際の便宜計を使ってこれらの費用を支払うことを選択しました。これらの費用は資本化すべきです。これらの費用の償却期間は一年未満ですから。
私たちの製品の性質のため、返品はわずかで、返品の見積もりは重要ではありません。収入を確認する時間は、お客様に領収書を発行する時間とは異なる可能性があります。2022年12月31日と2021年12月31日現在、経営陣の判断に関わる未開債権を記録しており、それぞれ450万ドルと360万ドルです。
在庫、純額
在庫は完成品とされ、第三者契約メーカーから購入する。これらの在庫にはインプラント、ハードウェア、消耗品が含まれており、私たちの倉庫に保管されており、第三者の独立販売代表や流通業者が保存したり、直接病院に送ったりしています。
100
在庫はコスト(加重平均コスト法)または可現純値の中で低い者に列報する。販売時には,在庫は加重平均コストで空になる.我々は製品需要の見積もり予測に基づいて在庫の帳簿価値を評価し,製品のライフサイクルを考慮した。需要や製品開発の著しい減少は手元の過剰在庫量の増加を招く可能性があり、過剰や時代遅れの在庫に対する追加料金を招く可能性がある。同社は現在の在庫レベル、歴史販売、将来予想需要に基づいて古いと移動の遅い在庫の備蓄を推定した。超過と古い在庫の費用は商品販売コストに含まれ、2022年、2021年、2020年12月31日までの年間はそれぞれ50万ドル、290万ドル、750万ドルとなる。2022年と2021年12月31日現在、在庫備蓄はそれぞれ1,680万ドルと1,940万ドル。
大量在庫を維持する必要が過剰と古い在庫の見積もりに影響を与えています。我々の各インプラントシステムは、外科医が患者の解剖サイズに関連する需要を満たすために、異なる大きさと形状を含む移植可能製品として設計されている。通常,外科手術ごとに少量のSETコンポーネントが使用される。使用パターンに基づいて、各セット内のいくつかのコンポーネントは、他のコンポーネントの前に時代遅れになる可能性がある。私たちは必要に応じて在庫値を調整して、これらの使用パターンとライフサイクルを反映します。
株に基づく報酬
従業員および非従業員請負業者に付与されたすべての株式奨励は、付与株式、株式オプション、制限株式単位(“RSU”)、業績株式単位(“PSU”)および従業員株式購入計画(“ESPP”)による普通株購入の選択権を含み、付与日の公正価値に応じて計量され、関連帰属期間中にASCテーマ718(“ASC 718”)に基づいて確認される。非従業員への株式奨励は、業績期間中の販売、一般、行政費用として確認されている。このような奨励は付与された日の公正価値に応じて計量される。また,直ちに付与された奨励については,奨励は公正価値に応じて計量され,付与された日にすべて確認される。
同社は、株価変動、オプションの期待寿命、無リスク金利、配当率などの仮定を組み合わせたBlack-Scholesオプション推定モデルを用いて、日サービスおよび/または業績条件を付与する株式奨励を含む公正価値を推定した。当社はオプション定価モデルとしての履歴変動率の入力に依存しており、経営陣はこの比率がオプション予想期間内の将来変動率を代表すると考えているからである。行権前の期待期限は、付与されたオプションが未償還と予想される加重平均時間帯を表し、帰属スケジュールと自社の歴史的行権モデルを考慮する。無リスク金利は、付与時に発効した米国債収益率曲線に基づいている。当社は設立以来何の配当も派遣しておらず、予測可能な未来にはいかなる配当も発行されないと予想されているため、配当率はゼロと仮定している。没収は発生時に記録され,発生した場合,以前に確認された補償費用は没収期間中に打ち切られる。オプション奨励は、通常、付与された日会社普通株の公正価値に等しい行使価格で付与される。
初公募後、その持分奨励の基礎となる会社普通株の公正価値は、日社普通株に付与された見積市場価格に基づいている。初公募前に、当社の普通株は公開市場がなかったため、株式奨励関連普通株の公正価値は従来、株式オプションを付与する際にいくつかの客観的かつ主観的な要素を考慮することで決定されていたが、これらの要素は普通株の販売、第三者評価、会社運営の重要な発展、実際の経営業績と財務業績、医療機器業界と全体経済の状況、上場会社の株価表現、変動性、市場能力の不足による割引の仮定などを含む。
101
利益対価格があるかもしれない
事業合併には、購入価格の一部として、いくつかのマイルストーンを達成した後、売り手に将来のお金を支払う収益対価格が含まれるか、またはある場合があります。または収益対価格の公正価値は、購入日に予想または支払いの現在値で推定される。評価には,シーンに基づくモデルとモンテカルロシミュレーションの2つの方法が考えられる.SBMは、複数の結果に依存して、将来の価格に対してリターンを得る可能性があるか、または推定する可能性がある。そして得られたプレミアム報酬を確率的に重み付けし,適切なリスク調整比率で割引し,期待されるプレミアム報酬の現在値を得る.モンテカルロシミュレーションは、予測された財務指標に基づいて非線形または考慮要因を推定するために使用される。モンテカルロシミュレーションの試行ごとに仮定した基礎指標分布から1つの値を抽出した.シミュレーションごとの報酬は,基礎指標の特定のシミュレーション経路から計算し,無リスク金利を用いて現在値に割引し,取引相手の信用リスクに応じて調整する.フラッディング値はすべてのシミュレーションの平均値と推定される.公正価値見積りには観察不可能な入力を用い,これらの入力は買収された業務が計算に用いる目標基準と割引率を達成する能力に対する我々の仮定を反映している.観察されていない入力は、ASC主題820“公正価値計量および開示”において第3レベル入力として定義される。
我々はプレミアムマイルストーンの実現確率を検討し、プレミアムがプレミアム期間内に四半期ごとに計算される公正価値に与える影響を決定する。実際の結果は,我々の予測に用いた推定と実現確率と比較した.買収業務の実際の結果が、我々の推定および仮定と比較して増加または減少した場合、または適用される契約限度額まで、収益対価格負債の推定公正価値が増加または減少する。あるいは,収益対価格推定公正価値の変動が総合経営報告書や全面(赤字)収益に他(費用)収入に記録され,これらの変動が確認されている期間に反映される.あるいは収益対価格の見積もり公正価値の変化は私たちの経営業績に重大な影響を与えたり、変動をもたらす可能性があります。
最近発表された会計公告
本報告日までに採用されていない新しい会計声明については、本年度報告に他の箇所のForm 10−Kに含まれる合併財務諸表付記2を参照されたい。
イットM 7 A。量と質市場リスクの開示について。
金利リスク
私たちの投資活動の主な目標は保証と流動性を提供することだ。我々の経営結果は投資に依存しないため,金利変動に関するリスクは我々のポートフォリオに限られており,想定した10%の金利変化は本年度報告書の他の部分の財務諸表に大きな影響を与えないと信じている。私たちは現在私たちのポートフォリオで金融派生商品を使用することを計画していないし、計画していない。私たちは現在ヘッジ取引をして私たちの金利リスクの開放を管理していませんが、変動金利ツール上の金利変化が私たちの経営業績に大きな影響を与えるとは思いません。
外貨リスク
私たちの業務は主にドルを使います。外貨で行われる可能性のある取引は、私たちの運営結果、財務状況、あるいはキャッシュフローに実質的な影響を与えないと予想される。私たちの国際的な拡張に伴い、私たちの経営業績とキャッシュフローはますます外貨為替レートの変化の影響を受けるかもしれません。
102
プロジェクト8.金融技術アトマンTSと補足データ
連結財務諸表索引
|
|
独立公認会計士事務所レポート(PCAOB ID番号)34) |
104 |
|
|
2022年と2021年12月31日までの連結貸借対照表 |
105 |
|
|
2022年,2021年と2020年12月31日までの総合経営報告書と全面(赤字)収益 |
106 |
|
|
2022年12月31日、2021年12月31日および2020年12月31日までの転換可能優先系列株と株主権益連結レポート |
107 |
|
|
2022年、2021年、2020年12月31日までの統合現金フロー表 |
108 |
|
|
連結財務諸表付記 |
109 |
103
独立公認会計士事務所報告
Paragon 28,Inc.の株主と取締役会へ。
財務諸表のいくつかの見方
Paragon 28,Inc.及びその子会社(“当社”)の2022年12月31日と2021年12月31日までの連結貸借対照表、2022年12月31日までの3年度の関連総合経営表と全面(赤字)収益、転換可能な優先株系列持分と株主権益、現金流量及び関連付記(総称して“財務諸表”と呼ぶ)を監査した。財務諸表は,すべての重要な面で,会社の2022年12月31日と2021年12月31日までの財務状況,および2022年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/ 徳勤法律事務所
コロラド州デンバー市
March 2, 2023
2020年以来、当社の監査役を務めてきました。
104
Paragon 28,Inc.そして付属会社
合併貸借対照表
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
|
|
|
|
|
|
|
|
|
12月31日まで |
|
|
|
2022 |
|
|
2021 |
|
資産 |
|
|
|
|
|
|
流動資産: |
|
|
|
|
|
|
現金 |
|
$ |
38,468 |
|
|
$ |
109,352 |
|
売掛金 |
|
|
37,687 |
|
|
|
25,939 |
|
在庫、純額 |
|
|
60,948 |
|
|
|
40,241 |
|
課税所得税 |
|
|
615 |
|
|
|
920 |
|
その他流動資産 |
|
|
4,658 |
|
|
|
3,078 |
|
流動資産総額 |
|
|
142,376 |
|
|
|
179,530 |
|
|
|
|
|
|
|
|
財産と設備、純額 |
|
|
61,938 |
|
|
|
32,181 |
|
|
|
|
|
|
|
|
無形資産、純額 |
|
|
22,387 |
|
|
|
16,505 |
|
商誉 |
|
|
25,465 |
|
|
|
6,329 |
|
|
|
|
|
|
|
|
所得税を繰延する |
|
|
148 |
|
|
|
— |
|
|
|
|
|
|
|
|
その他の資産 |
|
|
1,795 |
|
|
|
— |
|
|
|
|
|
|
|
|
総資産 |
|
$ |
254,109 |
|
|
$ |
234,545 |
|
|
|
|
|
|
|
|
負債と株主権益 |
|
|
|
|
|
|
流動負債: |
|
|
|
|
|
|
売掛金 |
|
$ |
14,939 |
|
|
$ |
13,028 |
|
費用を計算する |
|
|
26,807 |
|
|
|
18,232 |
|
応計法和解 |
|
|
22,000 |
|
|
|
— |
|
その他流動負債 |
|
|
3,844 |
|
|
|
1,929 |
|
長期債務当期満期日 |
|
|
728 |
|
|
|
153 |
|
所得税に対処する |
|
|
184 |
|
|
|
615 |
|
流動負債総額 |
|
|
68,502 |
|
|
|
33,957 |
|
|
|
|
|
|
|
|
長期負債: |
|
|
|
|
|
|
長期債務純額は当面の満期日が少ない |
|
|
42,182 |
|
|
|
7,476 |
|
その他長期負債 |
|
|
1,628 |
|
|
|
840 |
|
所得税を繰延する |
|
|
342 |
|
|
|
78 |
|
所得税に対処する |
|
|
527 |
|
|
|
— |
|
総負債 |
|
|
113,181 |
|
|
|
42,351 |
|
|
|
|
|
|
|
|
引受金とその他の事項(注14) |
|
|
|
|
|
|
|
|
|
|
|
|
|
株主権益: |
|
|
|
|
|
|
普通株、$0.01額面は300,000,000ライセンス株;
78,684,107そして77,360,806発行された株式と77,770,588そして76,447,287
2022年12月31日と2021年12月31日までの流通株 |
|
|
776 |
|
|
|
763 |
|
追加実収資本 |
|
|
213,956 |
|
|
|
197,868 |
|
赤字を累計する |
|
|
(67,789 |
) |
|
|
(463 |
) |
その他の総合収入を累計する |
|
|
(33 |
) |
|
|
8 |
|
在庫株は、コストで計算する913,5192022年12月31日現在と2021年12月31日現在の株 |
|
|
(5,982 |
) |
|
|
(5,982 |
) |
株主権益総額 |
|
|
140,928 |
|
|
|
192,194 |
|
総負債と株主権益 |
|
$ |
254,109 |
|
|
$ |
234,545 |
|
付記はこれらの連結財務諸表の構成要素である。
105
Paragon 28,Inc.そして付属会社
統合された運営説明書全面的な損失があります)収入
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
純収入 |
|
$ |
181,383 |
|
|
$ |
147,464 |
|
|
$ |
110,981 |
|
販売原価 |
|
|
32,457 |
|
|
|
28,024 |
|
|
|
25,099 |
|
毛利 |
|
|
148,926 |
|
|
|
119,440 |
|
|
|
85,882 |
|
|
|
|
|
|
|
|
|
|
|
運営費 |
|
|
|
|
|
|
|
|
|
研究開発コスト |
|
|
24,650 |
|
|
|
16,128 |
|
|
|
11,171 |
|
販売、一般、管理 |
|
|
159,323 |
|
|
|
114,087 |
|
|
|
72,641 |
|
法律和解 |
|
|
27,000 |
|
|
|
— |
|
|
|
— |
|
総運営費 |
|
|
210,973 |
|
|
|
130,215 |
|
|
|
83,812 |
|
|
|
|
|
|
|
|
|
|
|
営業収入 |
|
|
(62,047 |
) |
|
|
(10,775 |
) |
|
|
2,070 |
|
|
|
|
|
|
|
|
|
|
|
その他の収入 |
|
|
|
|
|
|
|
|
|
その他の収入 |
|
|
(1,214 |
) |
|
|
(486 |
) |
|
|
3,557 |
|
利子支出,純額 |
|
|
(4,129 |
) |
|
|
(1,719 |
) |
|
|
(602 |
) |
その他の収入総額 |
|
|
(5,343 |
) |
|
|
(2,205 |
) |
|
|
2,955 |
|
|
|
|
|
|
|
|
|
|
|
所得税前収入 |
|
|
(67,390 |
) |
|
|
(12,980 |
) |
|
|
5,025 |
|
所得税(福祉)費用 |
|
|
(64 |
) |
|
|
713 |
|
|
|
1,527 |
|
|
|
|
|
|
|
|
|
|
|
純収益 |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
|
$ |
3,498 |
|
減算:Bシリーズ転換可能優先株の累積配当 |
|
|
— |
|
|
|
— |
|
|
|
(812 |
) |
普通株主は純収入を占めなければならない |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
|
$ |
2,686 |
|
外貨換算調整 |
|
|
(41 |
) |
|
|
(815 |
) |
|
|
817 |
|
総合収益 |
|
$ |
(67,367 |
) |
|
$ |
(14,508 |
) |
|
$ |
3,503 |
|
発行済み普通株式加重平均株式数: |
|
|
|
|
|
|
|
|
|
基本的な情報 |
|
|
76,766,100 |
|
|
|
52,916,711 |
|
|
|
43,510,185 |
|
薄めにする |
|
|
76,766,100 |
|
|
|
52,916,711 |
|
|
|
60,406,180 |
|
普通株主1株当たり純(損失)収益: |
|
|
|
|
|
|
|
|
|
基本的な情報 |
|
$ |
(0.88 |
) |
|
$ |
(0.26 |
) |
|
$ |
0.06 |
|
薄めにする |
|
$ |
(0.88 |
) |
|
$ |
(0.26 |
) |
|
$ |
0.04 |
|
付記はこれらの連結財務諸表の構成要素である。
106
Paragon 28,Inc.そして付属会社
統合された変換可能優先系列権益表&株主情商UITY
(単位:千株、株数を除く)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
保留する |
|
|
積算 |
|
|
|
|
|
|
|
|
|
Aシリーズオープンカー |
|
|
Bシリーズオープンカー |
|
|
|
|
|
|
|
|
|
その他の内容 |
|
|
収益.収益 |
|
|
他にも |
|
|
|
|
|
合計する |
|
|
|
優先株 |
|
|
優先株 |
|
|
|
普通株 |
|
|
実納- |
|
|
(累計) |
|
|
全面的に |
|
|
財務局 |
|
|
株主の |
|
|
|
株 |
|
|
金額 |
|
|
株 |
|
|
金額 |
|
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字) |
|
|
損 |
|
|
在庫品 |
|
|
権益 |
|
バランス、2020年1月1日 |
|
|
13,812,500 |
|
|
$ |
4,250 |
|
|
|
— |
|
|
$ |
— |
|
|
|
|
42,066,700 |
|
|
$ |
421 |
|
|
$ |
16,723 |
|
|
$ |
9,732 |
|
|
$ |
6 |
|
|
$ |
(3,884 |
) |
|
$ |
22,998 |
|
純収入 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
3,498 |
|
|
|
— |
|
|
|
— |
|
|
|
3,498 |
|
普通株発行 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
319,015 |
|
|
|
3 |
|
|
|
1,839 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
1,842 |
|
普通株買い戻し |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
(239,760 |
) |
|
|
(2 |
) |
|
|
2 |
|
|
|
— |
|
|
|
— |
|
|
|
(1,538 |
) |
|
|
(1,538 |
) |
Bシリーズ転換債券を発行する
優先株,純額
発行コストは$1,970 |
|
|
|
|
|
|
|
|
6,608,700 |
|
|
|
36,030 |
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
Bシリーズは優先的に両替できます
株の配当 |
|
|
|
|
|
|
|
|
|
|
|
812 |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
(812 |
) |
|
|
— |
|
|
|
— |
|
|
|
(812 |
) |
行使のオプション |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
4,592,585 |
|
|
|
45 |
|
|
|
1,735 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
1,780 |
|
外貨換算 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
817 |
|
|
|
— |
|
|
|
817 |
|
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
1,808 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
1,808 |
|
バランス、2020年12月31日 |
|
|
13,812,500 |
|
|
$ |
4,250 |
|
|
|
6,608,700 |
|
|
$ |
36,842 |
|
|
|
|
46,738,540 |
|
|
$ |
467 |
|
|
$ |
22,107 |
|
|
$ |
12,418 |
|
|
$ |
823 |
|
|
$ |
(5,422 |
) |
|
$ |
30,393 |
|
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
(13,693 |
) |
|
|
— |
|
|
|
— |
|
|
|
(13,693 |
) |
普通株発行 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
151,515 |
|
|
|
1 |
|
|
|
1,000 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
1,001 |
|
普通株発行
IPOに関連して純額は
発行コストは$4,304 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8,984,375 |
|
|
|
90 |
|
|
|
129,294 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
129,384 |
|
普通株買い戻し |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
(85,049 |
) |
|
|
(1 |
) |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
(560 |
) |
|
|
(561 |
) |
AシリーズとAシリーズの変換
Bシリーズ優先株
普通株に換える |
|
|
(13,812,500 |
) |
|
|
(4,250 |
) |
|
|
(6,608,700 |
) |
|
|
(36,842 |
) |
|
|
|
20,421,200 |
|
|
|
204 |
|
|
|
40,076 |
|
|
|
812 |
|
|
|
— |
|
|
|
— |
|
|
|
41,092 |
|
行使のオプション |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
236,706 |
|
|
|
2 |
|
|
|
443 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
445 |
|
外貨換算 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
(815 |
) |
|
|
— |
|
|
|
(815 |
) |
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
4,948 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
4,948 |
|
残高2021年12月31日 |
|
|
— |
|
|
$ |
— |
|
|
|
— |
|
|
$ |
— |
|
|
|
|
76,447,287 |
|
|
$ |
763 |
|
|
$ |
197,868 |
|
|
$ |
(463 |
) |
|
$ |
8 |
|
|
$ |
(5,982 |
) |
|
$ |
192,194 |
|
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
(67,326 |
) |
|
|
— |
|
|
|
— |
|
|
|
(67,326 |
) |
初公募株に関する発行コスト |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
(266 |
) |
|
|
|
|
|
|
|
|
|
|
|
(266 |
) |
行使のオプション |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
1,284,333 |
|
|
|
13 |
|
|
|
5,258 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
5,271 |
|
外貨換算 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
(41 |
) |
|
|
— |
|
|
|
(41 |
) |
従業員株購入計画 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
38,968 |
|
|
|
— |
|
|
|
731 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
731 |
|
株に基づく報酬 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
— |
|
|
|
— |
|
|
|
10,365 |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
10,365 |
|
バランス、2022年12月31日 |
|
|
— |
|
|
$ |
— |
|
|
|
— |
|
|
$ |
— |
|
|
|
|
77,770,588 |
|
|
$ |
776 |
|
|
$ |
213,956 |
|
|
$ |
(67,789 |
) |
|
$ |
(33 |
) |
|
$ |
(5,982 |
) |
|
$ |
140,928 |
|
付記はこれらの連結財務諸表の構成要素である。
107
Paragon 28,Inc.そして付属会社
統合された現金フロー表
(単位:千)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
経営活動のキャッシュフロー |
|
|
|
|
|
|
|
|
|
純収益 |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
|
$ |
3,498 |
|
純(損失)収入を経営活動に提供する現金純額に調整する: |
|
|
|
|
|
|
|
|
|
減価償却および償却 |
|
|
13,728 |
|
|
|
8,961 |
|
|
|
6,384 |
|
不良債権準備 |
|
|
155 |
|
|
|
1,022 |
|
|
|
636 |
|
超過と古い在庫準備金 |
|
|
485 |
|
|
|
2,821 |
|
|
|
7,467 |
|
株に基づく報酬 |
|
|
10,365 |
|
|
|
4,948 |
|
|
|
1,808 |
|
従業員株購入計画 |
|
|
213 |
|
|
|
— |
|
|
|
— |
|
債務発行原価償却 |
|
|
599 |
|
|
|
576 |
|
|
|
134 |
|
オーバーフロー負債の公正価値変動 |
|
|
1,280 |
|
|
|
440 |
|
|
|
— |
|
所得税を繰延する |
|
|
(514 |
) |
|
|
170 |
|
|
|
1,307 |
|
財産·設備の損失を処分する |
|
|
(71 |
) |
|
|
237 |
|
|
|
554 |
|
他にも |
|
|
477 |
|
|
|
31 |
|
|
|
113 |
|
その他の資産や負債の変動、買収を差し引く: |
|
|
|
|
|
|
|
|
|
売掛金 |
|
|
(12,013 |
) |
|
|
(6,461 |
) |
|
|
386 |
|
棚卸しをする |
|
|
(21,512 |
) |
|
|
(11,098 |
) |
|
|
(14,831 |
) |
その他の資産 |
|
|
(3,012 |
) |
|
|
(2,468 |
) |
|
|
944 |
|
売掛金 |
|
|
1,895 |
|
|
|
3,431 |
|
|
|
(6,238 |
) |
費用を計算する |
|
|
2,317 |
|
|
|
7,095 |
|
|
|
(815 |
) |
応計法和解 |
|
|
22,000 |
|
|
|
— |
|
|
|
— |
|
課税/課税所得税 |
|
|
391 |
|
|
|
671 |
|
|
|
(236 |
) |
その他負債 |
|
|
1,362 |
|
|
|
— |
|
|
|
— |
|
経営活動が提供する現金純額 |
|
|
(49,181 |
) |
|
|
(3,317 |
) |
|
|
1,111 |
|
|
|
|
|
|
|
|
|
|
|
投資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
オフィスビルを買う |
|
|
(18,300 |
) |
|
|
— |
|
|
|
— |
|
財産と設備を購入する |
|
|
(22,813 |
) |
|
|
(18,296 |
) |
|
|
(9,653 |
) |
財産と設備を売却して得た収益 |
|
|
897 |
|
|
|
799 |
|
|
|
522 |
|
無形資産を購入する |
|
|
(1,973 |
) |
|
|
(2,993 |
) |
|
|
(1,187 |
) |
買収,受け取った現金の純額を差し引く |
|
|
(18,504 |
) |
|
|
(15,000 |
) |
|
|
— |
|
投資活動のための現金純額 |
|
|
(60,693 |
) |
|
|
(35,490 |
) |
|
|
(10,318 |
) |
|
|
|
|
|
|
|
|
|
|
融資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
支払手形支払い-関連先 |
|
|
— |
|
|
|
— |
|
|
|
(3,000 |
) |
循環信用で支払いを手配する |
|
|
— |
|
|
|
— |
|
|
|
(9,821 |
) |
定期ローンの収益を引き出す |
|
|
20,000 |
|
|
|
— |
|
|
|
— |
|
長期債券を発行して得られる収益 |
|
|
16,000 |
|
|
|
10,000 |
|
|
|
458 |
|
長期債務を償還する |
|
|
(570 |
) |
|
|
(6,034 |
) |
|
|
(1,686 |
) |
債務発行コストの支払い |
|
|
(732 |
) |
|
|
(3,139 |
) |
|
|
(53 |
) |
普通株式を発行して得た金 |
|
|
— |
|
|
|
1,001 |
|
|
|
1,842 |
|
初公募株収益は、発行コストを差し引く |
|
|
— |
|
|
|
129,384 |
|
|
|
— |
|
Bシリーズの株を発行して得た金は発行コストを差し引く |
|
|
— |
|
|
|
— |
|
|
|
36,030 |
|
在庫株買い戻しの支払い |
|
|
— |
|
|
|
(561 |
) |
|
|
(1,538 |
) |
株式オプションを行使して得られる収益 |
|
|
5,271 |
|
|
|
445 |
|
|
|
1,780 |
|
従業員の株購入計画の収益 |
|
|
518 |
|
|
|
— |
|
|
|
— |
|
割増負債の支払い |
|
|
(1,000 |
) |
|
|
— |
|
|
|
— |
|
融資活動が提供する現金純額 |
|
|
39,487 |
|
|
|
131,096 |
|
|
|
24,012 |
|
|
|
|
|
|
|
|
|
|
|
為替レート変動が現金に与える影響 |
|
|
(497 |
) |
|
|
(438 |
) |
|
|
86 |
|
現金が純増する |
|
|
(70,884 |
) |
|
|
91,851 |
|
|
|
14,891 |
|
期初の現金 |
|
|
109,352 |
|
|
|
17,501 |
|
|
|
2,610 |
|
期末現金 |
|
$ |
38,468 |
|
|
$ |
109,352 |
|
|
$ |
17,501 |
|
|
|
|
|
|
|
|
|
|
|
キャッシュフロー情報の補足開示: |
|
|
|
|
|
|
|
|
|
税金の現金を納める |
|
$ |
1,103 |
|
|
$ |
678 |
|
|
$ |
453 |
|
利子を支払う現金 |
|
|
3,073 |
|
|
|
1,086 |
|
|
$ |
395 |
|
売掛金に入れた財産と設備を購入する |
|
|
3,402 |
|
|
|
881 |
|
|
$ |
120 |
|
Bシリーズは優先株式配当金に転換できる |
|
|
— |
|
|
|
— |
|
|
$ |
812 |
|
付記はこれらの連結財務諸表の構成要素である。
108
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
注1.業務説明の基礎となります
業務.業務
Paragon 28,Inc.(その子会社と総称して“私たち”、“P 28”または“会社”と呼ばれる)は、整形外科インプラント市場の足部および足首部分において医療機器を開発、流通、および販売する。我々の製品開発方法はプログラム化されており,足部と足首の解剖設計に特化した全シリーズのプログラムに特化した足部と足首製品が生じている。私たちの製品と製品シリーズは鋼板と鋼板システム、ねじ釘、釘と釘を含み、骨折固定、前足または親指外反を含むすべての主要な足と足首手術を解決することを目的としている-親指とハンマー足、足首、平足または進行性陥没足奇形(PCDF)、Charcot足部と整形生物を含む。P 28はアメリカ(“U.S.”)コロラド州に本社を置く会社、コロラド州のエンゲルウッドに本社を置く。私たちの販売代表とディーラーは世界に広がっています。その大部分はアメリカ、オーストラリア、南アフリカとイギリスに集中しています。
初公募株
2021年10月、同社は初公募株式(IPO)を完成させ、その中で発行·販売した8,984,375その普通株の公開発行価格は$である16.001株当たり、1,171,875引受業者が追加株式を購入する選択権を行使する際には、その普通株の株式を取得する。当社は保証割引と手数料を差し引いて得られた金の純額f $133,688それは.会社が招く $4,304 発売費用は2021年12月31日までの年間収益と相殺される。初公募に関連して,会社が発行した転換可能優先株の全株式を自動的に合計に変換する20,421,200普通株の株です。
列報と合併の基礎
添付されている連結財務諸表は、Paragon 28、Inc.およびその子会社の勘定を含み、これらはすべて完全所有である。すべての会社間の残高と取引はすでに合併中に販売されている。添付されている総合財務諸表は、米国公認会計原則(“米国公認会計原則”)に従って作成された。
新冠肺炎が大流行する
2020年3月31日までの第1四半期には,コロナウイルス(“新冠肺炎”)の伝播への懸念が世界的な業務中断および我々の運営中断をもたらし始めた。2020年3月11日、世界保健機関は新冠肺炎を全世界大流行と発表した。米国と世界の国、州、地方の各レベルの政府は、ウイルスの伝播を減少させるための積極的な行動を取っており、これらの行動には、封鎖と保護施設の命令があり、不要な人員の集まりを制限し、すべての不要な旅行を一時停止し、特定の企業や政府機関に物理的な場所での不要な業務を停止するように命令することが含まれている。2020年と2021年には、新冠肺炎の蔓延により米国と国際市場が大幅に変動した。
新冠肺炎疫病に対応するため、支払い小切手保護計画(PPP)はコロナウイルス援助、救済と経済安全法(CARE法案)によって設立され、アメリカ小企業管理局(SBA)が管理している。PPP規定の資格要件を満たしている会社はPPP資金を取得する資格があり、資金が条件に合った賃金、レンタル料、公共事業費の支払いに完全に使用されている場合、CARE法案の条項により、SBAは受け取った金額を免除する。同社はPPP資金#ドルを獲得した3,7472020年4月7日。2021年6月、小企業管理局は全額ローンを免除した。会社は2020年12月31日までの年度総合経営報告書と総合(赤字)収入で受け取った資金を他の収入として確認した。
109
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
付記2.主要会計政策の概要
予算の使用
アメリカ公認会計原則に従って財務諸表を作成して管理層に報告金額に影響を与える推定と仮定を要求する財務諸表の日までの資産と負債及び報告期間中に報告された収入及び支出額。将来のイベントとその影響が正確に決定できないため,実際の結果はこれらの見積り値と大きく異なる可能性がある.これらの見積もりのどんな変化も会社の総合財務諸表に反映されるだろう。このような推定および仮定によって制約される重要な項目は、売掛金の回収可能性の決定、在庫の古い、長期資産の減価、商業権および無形資産の回収可能性、または収益負債、所得税、および株式ベースの補償を決定することを含む。
外貨換算
連結財務諸表をドルで列記する。同社の非米国子会社は、ドルではなく、主に経営活動を行う通貨(すなわち、主に経営活動を行う通貨)を有しており、通常はこれらの子会社の所在国の通貨である。これらの子会社の資産と負債は年末レートでドルに換算され、収入と支出は1日の終値レートに基づく年内平均レートに換算される。子会社のビットコインからドルに両替した金額による調整は、累計他の全面(赤字)収入から税金を差し引いて報告します。
企業合併
我々は,買収日の推定公正価値に基づいて,買収対価格を想定した無形資産と負債を含む買収された識別可能な純資産に分配する。購入対価格の公正価値は、資産および負債が確認可能な公正価値(例えば、ある)の部分計上営業権を超える。買収日から最大1年間の計量期間内に、吾等は、取得した買収日が既に存在している事実及び状況に関する新資料を反映するために、買収日に確認された暫定金額を調整することができる。
買収した資産と負担する負債の公正価値を決定するには、収益法、コスト法、市場法を含む推定方法を選択することを含む重大な判断が必要である。これらの手法で用いられている重要な仮定には,基礎指標の期待値,基礎指標に埋め込まれたシステムリスク,対象指標の変動性、無リスク金利、取引相手リスク。異なる推定方法や仮定を用いることは主観性と内的不確実性が高いため,実際の結果は推定値と大きく異なる可能性がある.
現金
現金には元の満期日が3ヶ月以下の高流動性投資が含まれている。現金の使用には契約や他の制限はありません。
売掛金から不良債権を差し引いて準備する
売掛金とは、正常貿易条件で満期になった未担保顧客債務であり、領収書発行日から30日以内に支払いを要求し、顧客に発行された金額に応じて表示される。
売掛金には顧客からの未開票売掛金も含まれており,これらの売掛金は未完成の手術症例を表し,顧客からの調達注文を待っている。これらの請求書が発行されていない売掛金は、一般に手術のために使用され、可能な入金として決定される顧客との合意によってカバーされている。
当社は、売掛金対応の現状、歴史経験、その他必要な要因の評価に基づき、不良債権準備を想定しています。会社の不良債権の準備は変わる可能性があると思います。
110
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
不良債権準備に関する活動には、以下のことが含まれる
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
2022 |
|
|
2021 |
|
不良債権準備、年明け |
$ |
1,032 |
|
|
$ |
1,296 |
|
収入または費用から差し引かれた追加料金 |
|
1,853 |
|
|
|
1,027 |
|
控除額 |
|
(1,197 |
) |
|
|
(1,291 |
) |
不良債権準備,年末 |
$ |
1,688 |
|
|
$ |
1,032 |
|
在庫、純額
在庫は完成品とされ、第三者契約メーカーから購入する。これらの在庫にはインプラント、ハードウェア、消耗品が含まれており、私たちの倉庫に保管されており、第三者の独立販売代表や流通業者が保存したり、直接病院に送ったりしています。
在庫はコスト(加重平均コスト法)または可現純値の中で低い者に列報する。販売時には,在庫は加重平均コストで空になる.我々は製品需要の見積もり予測に基づいて在庫の帳簿価値を評価し,製品のライフサイクルを考慮した。需要や製品開発の著しい減少は手元の過剰在庫量の増加を招く可能性があり、過剰や時代遅れの在庫に対する追加料金を招く可能性がある。同社は現在の在庫レベル、歴史販売、将来予想需要に基づいて古いと移動の遅い在庫の備蓄を推定した。超過と古い在庫の費用は、販売された貨物のコストに含まれ、#ドルです485, $2,850そして$7,467ここ数年で2022年12月31日、2021年12月31日、2020年12月31日。在庫備蓄w$として16,804 aND$19,374時点でそれぞれ2022年12月31日と2021年12月31日です。
大量在庫を維持する必要が過剰と古い在庫の見積もりに影響を与えています。我々の各インプラントシステムは、外科医が患者の解剖サイズに関連する需要を満たすために、異なる大きさと形状を含む移植可能製品として設計されている。通常,外科手術ごとに少量のSETコンポーネントが使用される。使用パターンに基づいて、各セット内のいくつかのコンポーネントは、他のコンポーネントの前に時代遅れになる可能性がある。私たちは必要に応じて在庫値を調整して、これらの使用パターンとライフサイクルを反映します。
財産と設備、純額
財産と設備はコストから減価償却累計を引いて入金されます。生産能力の大幅な増加又は資産使用寿命の更新及び改善支出が資本化され、合併貸借対照表に財産及び設備純額が計上される。維持·メンテナンス支出は、発生時に費用を計上し、連結経営報告書と全面(赤字)収入に販売費用、一般費用、行政費用を計上する。設備が廃棄または売却された場合、コストおよび関連減価償却は勘定から抹消され、それによって生じる収益または損失は、総合経営報告書および総合(損失)収入のうちの販売、一般および行政収入に計上される。
減価償却は資産の耐用年数に基づいて直線法で計算され,耐用年数は3年から3年まで25年これは,使用パターンを最も反映している.その会社は減価償却手術器具を、一度使えば、1年を超えます5年制期限とケースは、一度利用可能になったら、1年以内に3年制ピリオド。術中に使用した手術器具の減価償却には,総合経営報告書と総合(損失)収入における販売,一般,管理費用が含まれている。リース改善直線法を採用して資産使用年数やレンタル期間の短い時間に償却する。
資産グループの帳票価値が回収できない可能性があることを示すイベントをトリガした場合,財産や設備の減価評価を行う.回収能力は,帳簿金額と資産グループの期待使用と最終処分による将来の未割引純現金流量との比較により測定した。資産グループの帳票価値が回収不可能であると判定された場合,確認された減値を帳票金額が資産グループの公正価値を超えて計測する違います。財産や設備に関する減価費用は列報のいずれの期間にも記録されている。
111
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
無形資産
特許や商標の出願に関連するコストは資本化される。特許は直線的に償却し,特許の経済又は法律生命期中の比較的短い時間で償却する17年それは.資本化特許に関するコストには、第三者弁護士費及び他の第三者費用、並びに特許出願の準備、政府届出及び登録費、図面、コンピュータ検索及び特定特許に関する翻訳に関連するコストが含まれる。将来的には10年ごとに更新され、寿命は無期限で、償却しないが、毎年減値テストを行っている。商標がこれ以上更新されないと判断されると,商標は商標登録期間の残りの時間内に償却される。取引先関係は見積もりの耐用年数内に償却する三つ至れり尽くせり7年になる直線の上にありますその他の無形資産は、主に競業禁止手配からなり、推定使用年数内に償却する3年直線の上にあります開発された技術は推定寿命内に償却される12年直線の上にあります
無形資産の償却は、資産の帳簿価値が回収できない可能性があることを示すイベントをトリガした場合に減値を評価すべきである。回収可能性は、帳簿額面と関連資産予想による将来の未割引現金流量正味値との比較で評価される。資産の帳簿価値が回収不可能と判定された場合、確認すべき減値は、帳簿金額が無形資産公正市場価値の金額を超えて計量される違います。償却資産に関する減価費用は年度末までに入金されているDecember 31, 2022, 2021 and 2020.
毎年または発生するイベントや状況の変化が資産の帳簿価値が回収できない可能性があることを示すたびに、無期限に存在する商標資産を減値審査する。当社は、無期限無形資産がより減少する可能性があるかどうかを決定するために、最初にオプションの定性的減値評価を適用することを選択することができる。定性的減値評価に基づいて、あるエンティティが無期限無形資産が減値された可能性が高いと断言する場合、当社は、減値テストのために資産の公正価値を計算することを要求されるであろう。資産の帳票価値がその公正価値を超えていれば,減価損失を確認する.
定性的評価は、短期·長期金利の傾向や資本獲得能力などのマクロ経済や他の特定業種の要因、および創収活動の傾向や合併や買収活動などの企業固有の要因を考慮している。もし当社がその寿命が不定な無形資産をスキップして定性的に評価したり、無形資産の公正価値がその帳簿価値を超える可能性が低い場合、管理層はその無形資産の公正価値を推定し、帳簿価値と比較する。無形資産の推定公正価値は、1つ以上の無形資産の将来の経営業績と現金流量に対する重大な仮定を含む割引現金流量モデルに基づく収益法を用いて構築された。
同社は2022年10月1日までの年間テスト日である無期限無形資産を定性分析することを選択した。当社は定性分析を行った後、無形資産の公正価値が帳簿より低いという証拠はないことを確定した。したがって,定量的損傷テストを行う必要はない。
商誉
営業権とは、取得した純資産と負担する負債に対する購入価格の公正価値の超過部分である。営業権は償却されないが、毎年あるいは減値の兆候がある場合に減値テストを行う。もし報告単位の公正価値がその帳簿価値を超える可能性があれば、私たちは商業権を定性的に減値評価することを選択することができる。
報告単位の帳簿金額は、商業権を含み、その公正価値を超える場合、減値が存在し、この超過部分(ではなく)を招く販売権を超える帳簿価値)。減値が確定した場合は、整理期間中に総合経営報告書及び全面(損失)収益に営業費用に記入する。
112
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
利益対価格があるかもしれない
事業合併には、購入価格の一部として、いくつかのマイルストーンを達成した後、売り手に将来のお金を支払う収益対価格が含まれるか、またはある場合があります。または収益対価格の公正価値は、購入日に予想または支払いの現在値で推定され、その後、各貸借対照表の日に再計量される。評価には,シーンに基づくモデルとモンテカルロシミュレーションの2つの方法が考えられる.SBMは、複数の結果に依存して、将来の価格に対してリターンを得る可能性があるか、または推定する可能性がある。そして得られたプレミアム報酬を確率的に重み付けし,適切なリスク調整比率で割引し,期待されるプレミアム報酬の現在値を得る.モンテカルロシミュレーションは、予測された財務指標に基づいて非線形または考慮要因を推定するために使用される。モンテカルロシミュレーションの試行ごとに仮定した基礎指標分布から1つの値を抽出した.シミュレーションごとの報酬は,基礎指標の特定のシミュレーション経路から計算し,無リスク金利を用いて現在値に割引し,取引相手の信用リスクに応じて調整する.フラッディング値はすべてのシミュレーションの平均値と推定される.公正価値見積りには観察不可能な入力を用い,これらの入力は買収された業務が計算に用いる目標基準と割引率を達成する能力に対する我々の仮定を反映している.観察されていない入力は、ASC主題820“公正価値計量および開示”において第3レベル入力として定義される。
我々はプレミアムマイルストーンの実現確率を検討し、プレミアムがプレミアム期間内に四半期ごとに計算される公正価値に与える影響を決定する。実際の結果は,我々の予測に用いた推定と実現確率と比較した.買収業務の実際の結果が、我々の推定および仮定と比較して増加または減少した場合、または適用される契約限度額まで、収益対価格負債の推定公正価値が増加または減少する。見積もり展示会変動または収益対価格の価値があり、総合業務表および全面(損失)収入に他の(費用)収入を記入し、それらを決定する期間に反映させる。あるいは収益対価格の見積もり公正価値の変化は私たちの経営業績に重大な影響を与えたり、変動をもたらす可能性があります。
所得税
当社は、財務諸表に含まれている事件の予想される将来の税務結果の繰延税金資産と負債を確認することを要求する貸借対照法に従って所得税を計算する。この方法によると、当社は財務諸表と資産及び負債の税ベースとの差異に基づいて、予想差を計上する年度の現行税率を採用し、繰延税金資産及び負債を特定する。税率変動が繰延税金資産や負債に及ぼす影響は、公布日を含む期間の収入で確認されている。
当社はその繰延税金資産の回収可能性を定期的に審査し、繰延税金資産の一部または全部が現金化できない可能性が高い場合には、評価準備を設ける。繰延税金資産が現金化されるかどうかに関する決定は司法管轄に基づいて行われ、積極的かつ消極的な証拠に基づいている。これらの証拠には,歴史上の課税収入,予想される将来の課税収入,既存の一時的な差異を転換する期待時間,税収計画戦略の実施がある。
税務負債の計算は、複数の法域で複雑な税収法および条例を適用する際の不確実性を処理することに関する。会計基準編纂(ASC)第740号には、不確定な税収状況が審査後に維持される可能性が高く、その技術的価値に基づいて任意の関連する控訴または訴訟手続を解決することを含む場合、その税収状況の税収利益を確認することができる。米国会計基準第740条によれば、同社は、未確認の税収利益を負債として記録し、管理層の判断が評価以前に得られなかった新たな情報によって変化した場合にこれらの負債を調整する。いくつかの不確実性の複雑さのため、最終的な解決策は、税金優遇負債が確認されていない現在の推定とは大きく異なるお金の支払いをもたらす可能性がある。これらの差は、新しい情報が得られる間に所得税費用の増加または減少として反映されるであろう。
当社は会計基準編纂(“ASC”)テーマ740に基づいて不確定な税務倉位を記録し、(1)当社は税務倉位の技術的利点に基づいて当該等の税務倉位を維持するか否かを決定すること、及び(2)確認の可能性が大きい税務倉位については、当社が最大額の税務特典を確認すること、すなわち、2段階に分けて行う50%以上関連税務機関との最終決済時に現金化される可能性が高い。
113
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
当社は、不確定な税務頭寸に対応する必要があるかどうかを決定するために、所得税申告書に保有される税務頭寸を評価しているか、または予想されている。利息と罰金が発生した場合、会社は所得税費用の構成要素として確認されるだろう。
収入確認
我々は、ASC主題606に基づいて、顧客との契約収入(“ASC 606”)に従って収入を会計処理する。収入は主に私たちのインプラントと使い捨て用品の販売で、次は私たちの手術器具の販売です。私たちは従業員販売員を通じて私たちの製品を販売し、アメリカでの独立販売代表。アメリカ以外での販売は独立した販売代表と在庫流通業者を通じて。私たちは特定の流通業者と病院と委託契約を締結した。私たちの顧客は主に病院と外科センターです。
収入は不良債権を差し引いて損失を見積もって入金します私たちの性能義務が履行された時、つまり私たちの顧客が製品の所有権を獲得する時、通常製品が外科手術に使用される時です。私たちは一般的に顧客と価格と私たちの標準条項と条件を含む書面契約を締結します。私たちが提供するどんな割引も私たちの顧客契約にリストされています。割引は購入時にわかりますので、収入を確認する際に見積もりを必要としません。輸送·搬送コストは販売貨物のコストとして記録され、顧客に発行された輸送·搬送コストの金額を収入に記入する。顧客に支払われた任意の輸送·運搬費用を収入として記録し、実際に発生した輸送コストを販売貨物のコストとして記録する。我々は、政府当局によって評価され、顧客に徴収されるすべての税(例えば、販売、使用、付加価値税)を取引価格の測定から除外することを選択した。したがって、収入はこのような税金を差し引いた純額として確認されなければならない。我々は、ASC 606によって許可された実際の方便を使用して、顧客が承諾貨物制御権を取得した後に発生する輸送および運搬活動を履行コストとして使用することを選択したので、取引価格の一部を輸送サービス義務に割り当てることはない。販売代理店がその割当を超えて獲得した手数料は、契約に署名していなければこのコストが生じないため、契約を取得する増分コストに分類される。私たちは当選する実際の便宜的な計算を使用して資本化すべきコストを支出するのは,このコストの償却期限が少なくなるからである1年.
私たちの製品の性質のため、返品はわずかで、返品の見積もりは重要ではありません。収入確認の時間は、お客様に領収書を発行する時間とは異なる場合がございますそれは.経営陣の判断に関する未開請求書を記録しました。これは、この時間差#ドルと関係があります4,511そして$3,637時点で2022年12月31日と2021年12月31日それぞれ,である.
販売原価
販売コストには、主に第三者サプライヤーから購入した製品、送料、送料、余分かつ時代遅れの在庫料、特許権使用料が含まれています。インプラントは第三者サプライヤーによって私たちの仕様に従って製造されます。インプラントの多くはアメリカで生産されています。販売インプラントの販売コストはインプラントが手術に使用されているときに確認され、関連収入も確認されています。術中使用前には,インプラントを委託するコストが在庫として記録され,われわれの総合貸借対照表で純額となった。
株に基づく報酬
従業員および非従業員請負業者に付与されたすべての株式奨励は、付与株式、株式オプション、制限株式単位(“RSU”)、業績株式単位(“PSU”)および従業員株式購入計画(“ESPP”)による普通株購入の選択権を含み、付与日の公正価値に応じて計量され、関連帰属期間中にASCテーマ718(“ASC 718”)に基づいて確認される。非従業員への株式奨励は、業績期間中の販売、一般、行政費用として確認されている。このような奨励は付与された日の公正価値に応じて計量される。また,直ちに付与された奨励については,奨励は公正価値に応じて計量され,付与された日にすべて確認される。
114
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
同社は、株価変動、オプションの期待寿命、無リスク金利、配当率などの仮定を組み合わせたBlack-Scholesオプション推定モデルを用いて、日サービスおよび/または業績条件を付与する株式奨励を含む公正価値を推定した。当社はオプション定価モデルとしての履歴変動率の入力に依存しており、経営陣はこの比率がオプション予想期間内の将来変動率を代表すると考えているからである。行権前の期待期限は、付与されたオプションが未償還と予想される加重平均時間帯を表し、帰属スケジュールと自社の歴史的行権モデルを考慮する。無リスク金利は、付与時に発効した米国債収益率曲線に基づいている。当社は設立以来何の配当も派遣しておらず、予測可能な未来にはいかなる配当も発行されないと予想されているため、配当率はゼロと仮定している。没収は発生時に記録され,発生した場合,以前に確認された補償費用は没収期間中に打ち切られる。オプション奨励は、通常、付与された日会社普通株の公正価値に等しい行使価格で付与される。
初公募後、その持分奨励の基礎となる会社普通株の公正価値は、日社普通株に付与された見積市場価格に基づいている。初公募前に、当社の普通株は公開市場がなかったため、株式奨励関連普通株の公正価値は従来、株式オプションを付与する際にいくつかの客観的かつ主観的な要素を考慮することで決定されていたが、これらの要素は普通株の販売、第三者評価、会社運営の重要な発展、実際の経営業績と財務業績、医療機器業界と全体経済の状況、上場会社の株価表現、変動性、市場能力の不足による割引の仮定などを含む。
研究と開発
研究開発費には、新製品と技術の内部研究と開発、臨床研究と試験、監督費用、従業員に関連する報酬と費用が含まれる。我々は,プログラムに重点を置いた製品開発手法を堅持し,新製品を我々の既存システムに追加し,複数の足部や足首適応に新システムを追加するプロジェクトを行っている。
賃貸借証書
契約開始時に、会社は、一定期間内の価格と交換するために、確認された資産が存在するかどうか、および契約が確認された資産の使用権を譲渡するか否かを評価することによって、契約がレンタルを含むか否かを決定する。両基準が該当する場合、当社はレンタル開始時にレンタル期限に見合った借入金金利に基づく割引率で関連賃貸負債及びそれに応じた使用権資産を計算します。当社は、賃貸支払いに関する時間長に基づいて、賃貸負債を流動負債または長期負債に計上する。当社はその経営リース使用権資産を他の資産に計上しています。
事件があったり
もし債務の額が現在未知であるが、いくつかの不確定な未来事件の発生により、将来知っているかもしれない場合、負債は負債であるか、または負債がある。潜在的損失が発生する可能性が高く、金額が合理的に推定できると判断すれば、損失は責任を負うと推定される。確率決定とリスク開放の金額が合理的に評価されているかどうかを決定する際には,重大な判断が必要であり,利益を計算すべきは判断した場合に我々の経営陣が入手できる情報のみに基づいている。私たちは損失に関連した法的費用を含む法的費用を支出する。
金融商品の公正価値
公正価値は、市場参加者間の秩序ある取引において資産を売却するか、または負債を移転して受け取った金額を表す脱退価格である。したがって、公正価値は市場に基づく計量であり、資産または負債の定価のために市場参加者が使用する仮定に基づいて決定されるべきである。公正価値を計量する際に、評価方法で使用される投入を優先する三級公正価値レベルがある
第1レベル-アクティブ市場における同じ資産または負債の見積もり(未調整)の観察可能な投入を反映する。
第2レベル--市場で直接または間接的に観察可能な他の投入、例えば、アクティブ市場における同様の資産および負債のオファー、非アクティブ市場における同じまたは同様の資産および負債のオファー、または観察可能または観察可能な市場データによって確認される他の投入を含む。
レベル3-市場活動が少ないか、または市場活動支援の観察不可能な投入がない。
115
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
金融商品(主に現金、売掛金、売掛金及び売掛金)はコスト別に帳簿に記載されており、当該等のツールの満期日が短いため、コストは公正価値と一致する。私たちの債務はコストで計算されており、私たちの債務に関連する可変金利のため、このコストは公正な価値に近い。当社の階層構造は、2022年12月31日、2022年12月31日および2021年12月31日までの年度まで、1級または2級種別の資産や負債は何もなく、2022年、2021年および2020年12月31日までの年間で、当社の階層構造には何の変動もありません.
会計公告を出す
2016年2月、財務会計基準委員会は、契約双方(すなわちテナントとレンタル者)のレンタルの確認、計量、列報、開示の原則を規定したASU 2016-02、レンタル(特集842)(“ASC 842”)を発表した。新基準はテナントに二重の方法を採用することを要求し、レンタルが実際にテナント融資購入であるかどうかの原則に基づいて、レンタルを融資リースまたは経営的賃貸に分類する。この分類は,レンタル料金が有効利子法に基づくかレンタル期間に基づく直線ベースで確認されるかをそれぞれ決定する.テナントはまた、そのカテゴリにかかわらず、すべてのレンタル期間が12ヶ月を超えるテナントの使用権資産と賃貸負債を記録することを要求されている。レンタル期間が12ヶ月以下の借約は、現在のテナントを経営するガイドラインと類似している。ASU 2016-02は従来のレンタル標準ASC 840レンタルに代わっています。ASU 2016-02は、その後、様々な技術問題を改正した後、2021年12月15日以降の財政年度においてプライベート企業の採用日後の新興成長型企業および2022年12月15日以降の財政年度の中期有効性について、エンティティが比較期間内に既存のリース指導を適用し続け、提出された最初の期間ではなく採用期間に累積効果調整を行うことにより、新たなレンタル要件を適用することができるオプションの移行方法を選択することを可能にする。会社(The Company)通過する標準的な2022年1月1日. Aこれは養子縁組の一部です
•我々は,2022年1月1日発効時にASC 842における過渡要求を適用することを選択し,最初にASC 842を適用した効果は,採択期間内の留保報酬の累積影響調整として確認された.
•我々は,新基準における移行指導が許可する一括実践方便を選択し,会社がリース定義,リース分類,初期直接コストをめぐってASC 840評価を行うことができるようにした。
•私たちはレンタル期間と使用権資産の減価を決定するために事後実際の便宜的な方法を選択していません。
•私たちは短期賃貸例外を選択しました。これにより、期限が12ヶ月以下のレンタルを既存の運営リースと同様の口座に計上することができます。これらのレンタルのコストは、使用権資産と賃貸負債残高では確認されません。ASC 842の要求によれば、12ヶ月又は12ヶ月以下の賃貸契約は開示に含まれない。
•私たちは非レンタルコンポーネントを分離しないことを選択した。この便宜的な措置は、レンタルと非レンタル構成要素を分離することができず、この2つの構成要素を1つの単独のレンタル構成要素として計算し、貸借対照表で確認することができるようにする。これは賃貸負債と賃貸資産の増加を招く。この選択はすべてのカテゴリの基礎資産に適用される
この基準を採用することは私たちの財務状況と経営結果に実質的な影響を与えない。付記14--支払引受及び又は事項を参照私たちの開示について、私たちは詳細な情報を提供します。
2016年6月、財務会計基準委員会は、歴史的経験、現在の条件、および合理的かつサポート可能な予測に基づいて、報告日に保有する特定のタイプの金融商品(売掛金を含む)のすべての予想される信用損失を推定するように、金融商品の信用損失の計量(“ASU 2016-13”)を発表した。更新の指針はまた、財務諸表の使用者が実体の仮定、モデルと方法を理解できるように開示要求を拡大し、このツールが初めて確認した日から契約期間中に予想される信用損失を推定する。ASU 2016-13はその後、各種技術問題に対して改正され、民間企業の会計年度採用日以降の新興成長型企業や、2022年12月15日以降に開始されるこれらの事業年度内の移行期間に適用され、早期採用が許可されている。その会社は採行ASU 2016-13発効2023年1月1日それは.本指導意見の採択は注釈会社の総合財務諸表や関連開示に大きな影響を与える。
116
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
FASBは、財務諸表ユーザに提供する情報の有用性を維持または向上させながら、会計基準を適用するコストおよび複雑さを低減することを目的として、FASB全体簡略化計画の一部であるASU 2019−12、所得税(特定テーマ740)(“ASU 2019−12”)を発表した。ASU 2019-12は、期間内分配、繰延納税負債、中期年初から現在までの赤字、特許経営税、営業権計税基礎の向上、単独の実体財務諸表及び税法又は税率変化の中期確認の会計指導を簡略化した。ASU 2019-12は新興成長型企業に有効であり、民間会社は2021年12月15日以降の年度に採用され、2022年12月15日以降の年度における移行期間は、早期採用が許可されている。その会社は採行ASU 2019-12有効2023年1月1日それは.本指導意見の採択は注釈会社の総合財務諸表や関連開示に大きな影響を与える
注3.業務統合
ディシオール
2022年1月10日(“Disior買収日”)に、当社はDisior Ltdと証券購入協定(“SPA”)を締結した。“Disior”と買収100Disiorの発行済み株式の割合(“Disior買収”)Disiorはリードする3次元分析術前計画ソフトウェア会社であり、本部はフィンランドヘルシンキに設置され、複雑な足部と足首解剖に集中している。Disiorを買収することで,会社は足部と足首ケアの術前と術中段階でその能力を拡大し,会社のSmart 28生態系を拡大できるようにした。
Disior買収の総購入価格は約1ドルです26,246公正価値#ドルの稼いだ準備金も含めて6,550ある運転資本の純額調整と支払い延期との合計支払額#ドル222それは.“SPA”は、Disior買収の日から2周年の間、ある異なる満期日を持つマイルストーンの実現について、売り手は潜在的な収益対価格を得ることができると規定している。得られた金額の最高支払額は$を超えない8,000全体的に言えば。個人マイルストーンが指定されたマイルストーンの満期日までに達していない場合は、その特定のマイルストーンに関する収益は支払われません。今回の買収の資金は主に1ドルから来ている20,000会社の定期ローンを使う。
同社はすでにASCテーマ805“業務合併”(“ASC 805”)の下でDisiorへの買収を説明している。Disiorの経営結果はDisior買収日2022年1月10日以降の連結財務諸表に含まれる。
以下のタブLEは購入価格をまとめた:
|
|
|
|
支払いの掛け値 |
|
|
現金で値段を合わせる |
$ |
19,696 |
|
値段が合うかもしれない |
|
6,550 |
|
総掛け値 |
$ |
26,246 |
|
買収に関する費用は、コンサルティング、法律、会計サービスの費用を含めて#ドルです7612022年12月31日までに、当社の総合全面赤字報告書内の販売、一般および行政支出を計上します違います。買収関連コストは2021年12月31日まで及び2020年12月31日までに発生する。
117
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
以下は…次の表は、Disior買収日までの買収資産と負担する負債の公正価値をまとめています
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
測定測定 |
|
|
|
|
|
初歩的な分配 |
|
|
期間調整 |
|
|
調整後の分配 |
|
買収した資産: |
|
|
|
|
|
|
|
|
現金と現金等価物 |
$ |
1,192 |
|
|
$ |
— |
|
|
$ |
1,192 |
|
その他流動資産 |
|
410 |
|
|
|
— |
|
|
|
410 |
|
無形資産 |
|
4,900 |
|
|
|
1,900 |
|
|
|
6,800 |
|
商誉 |
|
20,343 |
|
|
|
(1,207 |
) |
|
|
19,136 |
|
買収した総資産 |
$ |
26,845 |
|
|
$ |
693 |
|
|
$ |
27,538 |
|
|
|
|
|
|
|
|
|
|
負債を抱えています |
|
|
|
|
|
|
|
|
課税項目およびその他の流動負債 |
$ |
615 |
|
|
$ |
— |
|
|
$ |
615 |
|
繰延税金負債,純額 |
|
287 |
|
|
|
390 |
|
|
|
677 |
|
負担総負債 |
$ |
902 |
|
|
|
390 |
|
|
$ |
1,292 |
|
取得した純資産 |
$ |
25,943 |
|
|
$ |
303 |
|
|
$ |
26,246 |
|
2022年12月31日まで私たちは2回の計算期間調整を行った。一つ目は#ドルを調整したことです303購入プロトコル定義に基づく運営資金調整は,最終決済声明における買収価格の一部とする.第二項は、無形資産に関する推定値が#ドル増加した当社の最終公正価値報告書の審査に基づくものである1,900したがって、繰延税金負債は#ドル増加した390.
確認された無形資産には商号と開発の技術が含まれている。米国会計基準第805条によると、外部評価専門家の協力のもと、収入法、市場法、コスト法、特許権使用料減免法を総合的に運用して各項目の公正価値を決定する。購入対価格は、買収日に基づいて公正価値を推定して買収する識別可能な純資産に分配される。2022年12月31日現在、購入対価格とその分配が最終となっている。購入対価格の公正価値は、資産および負債が確認可能な公正価値(例えば、ある)の部分計上営業権を超える。この名声は会社の既存業務との期待との相乗効果に起因する無形資産の耐用年数は経営陣によって決定される無形資産に対する会社の政策に合致する。次の表はこの2つの決定を概説する
|
|
|
|
|
|
|
公正価値 |
|
|
使用寿命を見込む
(単位:年) |
発達した技術 |
$ |
6,400 |
|
|
12 |
商標名 |
|
400 |
|
|
不定である |
|
$ |
6,800 |
|
|
|
フィンランド所得税法によると、商標権に割り当てられた全購入価格は所得税目的から差し引くことはできません。
会社への非実質的な影響のため,Disior買収の経営結果を補足形式で紹介していない2022年12月31日まで及び2021年12月31日までの年度総合業務.
118
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
整形外科を付加する
2021年5月28日(“成約日”)、当社はAdditive Orthopedics,LLC(“Additive”または“売り手”)と資産購入プロトコル(“APA”)を締結し、Additiveのほとんどの運営および無形資産の買収を完了し、総現金コストは$である15,000事件が解決した時。行政手続法では,売り手がプロジェクトベースと収入ベースのマイルストーンを含む何らかのマイルストーンを実現した場合,報酬を得ることが可能であり,満期日はそれぞれ異なり,締め切りは締め切り4周年と規定されている。得られた金額の最高支払額は$を超えない9,500とにかく、とにかく。個人マイルストーンが指定されたマイルストーンの満期日までに達成されていなければ、その特定のマイルストーンに関する収益の満期はありません。利益対価格の推定公正価値は#ドルであったりする2,870締め切りまでです。買収に関連するコストは$8222021年12月31日までの年度内総合経営報告書と総合(赤字)収益のうち販売、一般、行政費用を計上した違います。今年度末までに買収関連コストが発生した2022年12月31日。
Additiveな3 D印刷患者専用距骨アイソレータはアメリカ食品と薬物管理局が許可した唯一の虚血性壊死の治療のための患者専用全距骨置換インプラントである。Additiveの買収は同社を患者専用インプラント市場にさらに拡張させた。
同社はすでにASCテーマ805“業務合併”(“ASC 805”)の項目で買収Additiveを会計処理している。Additiveの経営結果は、買収日2021年5月28日以降の連結財務諸表に含まれている。
次の表は、買収Additiveに関する購入対価格をまとめたもので、以下を含む
|
|
|
|
支払いの掛け値 |
|
|
現金で値段を合わせる |
$ |
15,000 |
|
値段が合うかもしれない |
|
2,870 |
|
総掛け値 |
$ |
17,870 |
|
次の表は、決算日までに購入された資産と負担する負債の公正価値をまとめたものである
|
|
|
|
買収した資産: |
|
|
売掛金 |
$ |
761 |
|
在庫品 |
|
113 |
|
無形資産 |
|
11,560 |
|
商誉 |
|
6,329 |
|
買収した総資産 |
|
18,763 |
|
|
|
|
負債を抱えています |
|
|
売掛金 |
|
796 |
|
費用を計算する |
$ |
97 |
|
負担総負債 |
|
893 |
|
取得した純資産 |
$ |
17,870 |
|
119
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
確定された無形資産には、eスポーツ禁止協定、顧客関係、開発の技術が含まれる。米国会計基準第805条によると、各項目の公正価値は、外部評価専門家の協力のもと、収入法、市場法、資産法を組み合わせた推定方法を用いて決定される。購入対価格は、買収日に基づいて公正価値を推定して買収する識別可能な純資産に分配される。購入対価格の公正価値は、資産および負債が確認可能な公正価値(例えば、ある)の部分計上営業権を超える。この名声は会社の既存業務との期待との相乗効果に起因する。国内所得法第197条によると、営業権に割り当てられた全購入価格は15年以内に所得税から控除される。耐用年数の決定は経営陣が当社の資産政策に基づいて行います。表にこの2つの決定方法を概説した以下は以下のとおりである
|
|
|
|
|
|
|
公正価値 |
|
|
使用寿命を見込む
(単位:年) |
競業禁止手配 |
$ |
30 |
|
|
3 |
取引先関係 |
|
240 |
|
|
3 |
発達した技術 |
|
11,290 |
|
|
12 |
|
$ |
11,560 |
|
|
|
Additive買収は当社の年度までの総合業務に大きな影響を与えているため,Additive買収の経営結果を補足的に述べていない2022年12月31日と2021年12月31日.
付記4.財産と設備
現在の財産と設備2022年12月31日と2021年12月31日は以下からなる
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
|
予想寿命
(単位:年) |
|
2022 |
|
|
2021 |
|
外科器具 |
|
3 - 5 |
|
$ |
44,625 |
|
|
$ |
38,820 |
|
土地 |
|
不定である |
|
|
3,625 |
|
|
|
— |
|
建物.建物 |
|
25 |
|
|
14,178 |
|
|
|
— |
|
賃借権改善 |
|
多種多様である |
|
|
7,961 |
|
|
|
7,850 |
|
コンピュータとソフトウェア |
|
5 |
|
|
11,562 |
|
|
|
4,791 |
|
機械と設備 |
|
5 |
|
|
2,815 |
|
|
|
2,396 |
|
事務設備と家具 |
|
5 - 7 |
|
|
2,049 |
|
|
|
2,040 |
|
建設中の工事 |
|
多種多様である |
|
|
5,817 |
|
|
|
3,551 |
|
他にも |
|
多種多様である |
|
|
1,046 |
|
|
|
— |
|
|
|
|
|
|
93,678 |
|
|
|
59,448 |
|
減算:減価償却累計 |
|
|
|
|
(31,740 |
) |
|
|
(27,267 |
) |
財産と設備、純額 |
|
|
|
$ |
61,938 |
|
|
$ |
32,181 |
|
減価償却費用は、総合経営報告書と総合(赤字)収入表に含まれる販売、一般及び行政費用であり、減価償却費用は10,824, $7,615そして$6,232ここ数年でDecember 31, 2022, 2021 and 2020それぞれ分析を行った。
付記5.営業権と無形資産
商誉
私どもの年間減価テスト日は10月1日です。当社は定性分析を行った後、営業権の公正価値が帳簿価値よりも帳簿価値よりも低い可能性があるという証拠はないと考えています。したがって,定量的損傷テストを行う必要はない自分から2022年12月31日と2021年12月31日商業的な名声は$25,465そして$6,329それぞれ,である.2022年の活動は以下の通り
|
|
|
|
|
|
|
バランス、2021年12月31日 |
|
|
|
$ |
6,329 |
|
買収する |
|
|
|
|
19,136 |
|
バランス、2022年12月31日 |
|
|
|
$ |
25,465 |
|
120
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
無形資産
目に見えない2022年12月31日現在の資産は以下の通り
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
使用寿命を見込む
(単位:年) |
|
総帳簿金額 |
|
|
累計償却する |
|
|
帳簿純額 |
|
商標と商号は無期限に存在する |
|
不定である |
|
$ |
901 |
|
|
$ |
— |
|
|
$ |
901 |
|
固定生命期の特許 |
|
16.5 |
|
|
6,671 |
|
|
|
2,370 |
|
|
|
4,301 |
|
取引先関係 |
|
3-7 |
|
|
1,733 |
|
|
|
279 |
|
|
|
1,454 |
|
発達した技術 |
|
12 |
|
|
17,690 |
|
|
|
1,973 |
|
|
|
15,717 |
|
その他無形資産 |
|
3 |
|
|
30 |
|
|
|
16 |
|
|
|
14 |
|
無形資産総額,純額 |
|
|
|
$ |
27,025 |
|
|
$ |
4,638 |
|
|
$ |
22,387 |
|
Disior無形資産を含まない無形資産は#ドル増加した1,973年末までに年度を終える2022年12月31日、新しい特許、顧客関係、および私たちの特許および商標に関連する追加の法的費用を購入したため。
2021年12月31日現在の無形資産は以下の通り
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
使用寿命を見込む
(単位:年) |
|
総帳簿金額 |
|
|
累計償却する |
|
|
帳簿純額 |
|
商標、無期限-生命期間 |
|
不定である |
|
$ |
413 |
|
|
$ |
— |
|
|
$ |
413 |
|
固定生命期の特許 |
|
13.2 |
|
|
5,335 |
|
|
|
1,133 |
|
|
|
4,202 |
|
取引先関係 |
|
3-7 |
|
|
1,167 |
|
|
|
47 |
|
|
|
1,120 |
|
発達した技術 |
|
12 |
|
|
11,290 |
|
|
|
549 |
|
|
|
10,741 |
|
その他無形資産 |
|
3 |
|
|
35 |
|
|
|
6 |
|
|
|
29 |
|
無形資産総額,純額 |
|
|
|
$ |
18,240 |
|
|
$ |
1,735 |
|
|
$ |
16,505 |
|
償却費用には販売、一般、管理費用が含まれており、#ドルです2,904, $1,372そして$152ここ数年で2022年12月31日、2021年12月31日、2020年12月31日。
予想どおりである将来の償却費用は以下の通り
|
|
|
|
|
|
|
2023 |
|
|
|
$ |
2,045 |
|
2024 |
|
|
|
|
1,993 |
|
2025 |
|
|
|
|
1,954 |
|
2026 |
|
|
|
|
1,954 |
|
2027 |
|
|
|
|
1,953 |
|
違います。無形資産及び営業権に関する減価費用はこの年度末までに入金される十二月三十一日、二日022, 2021 and 2020.
付記6.課税料金
計算すべき費用には以下が含まれている2022年12月31日および2021年12月31日:
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
|
2022 |
|
|
2021 |
|
手数料を計算する |
|
$ |
6,026 |
|
|
$ |
5,077 |
|
補償すべきである |
|
|
8,569 |
|
|
|
4,512 |
|
弁護士費を計算する |
|
|
462 |
|
|
|
464 |
|
購入に応じて購入する |
|
|
204 |
|
|
|
3,036 |
|
配当金 |
|
|
6,500 |
|
|
|
1,000 |
|
その他の課税費用 |
|
|
5,046 |
|
|
|
4,143 |
|
費用総額を計算する |
|
$ |
26,807 |
|
|
$ |
18,232 |
|
121
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
別注7.または収益対価格がある
下表は本年度までの3級収益負債に対する入金を提供している2022年12月31日:
|
|
|
|
バランス、2021年12月31日 |
$ |
2,310 |
|
買収期日に負債の公正価値を稼ぐ |
|
6,550 |
|
完成したマイルストーンは支払いました |
|
(1,000 |
) |
完成したマイルストーンを課税費用に再分類する |
|
(5,500 |
) |
収益負債公正価値変動 |
|
1,280 |
|
バランス、2022年12月31日 |
$ |
3,640 |
|
または収益負債の現在部分が他の流動負債に計上され、非流動部分が総合貸借対照表の他の長期負債に計上される。2022年12月31日まで現在の部分は$です3,386非流動部分は$254. 2022年12月31日までの年度中に、純減少につながる利益負債の見積もりを見直したf $1,280連結経営報告書にその他の収入と同年度までの全面(赤字)収入を記入する2022年12月31日。また,2022年12月31日現在,Disior買収に関する3つのプロジェクトマイルストーンと,Additive買収に関する3つのプロジェクトマイルストーンを完成させた.Additiveマイルストーンのうち2つは2022年12月31日までの年間で現金で支払われる残りの4つは全部で$です5,5002022年12月31日までの総合貸借対照表の課税費用に計上されている。
注8.債務
現在の長期債務2022年12月31日および2021年12月31日には、以下が含まれる
|
|
|
|
|
|
|
|
|
|
|
2022 |
|
|
2021 |
|
中規模株の定期ローン |
|
$ |
30,000 |
|
|
$ |
10,000 |
|
アイルランド銀行支払手形 |
|
|
86 |
|
|
|
245 |
|
威達定期ローン手配 |
|
|
15,573 |
|
|
|
— |
|
|
|
$ |
45,659 |
|
|
$ |
10,245 |
|
差し引く:繰延発行コスト |
|
|
(2,749 |
) |
|
|
(2,616 |
) |
総債務、発行コストを差し引く |
|
|
42,910 |
|
|
|
7,629 |
|
マイナス:現在の部分 |
|
|
(728 |
) |
|
|
(153 |
) |
長期債務,純額,当面の満期日を差し引く |
|
$ |
42,182 |
|
|
$ |
7,476 |
|
中型株信用協定
2021年5月6日、当社はMidCap Financial Trustと新たな信用協定を締結し、合計を提供します70,000ガンダム$を含めて30,000循環ローン(“MidCap循環ローン”)は、最高$に達する40,000当社のほとんどの資産を担保とした定期融資(“MidCap定期融資”(“MidCap信用協定”)である。MidCap定期融資は2つのロットからなり、第1弾は#ドルの承諾額を提供した10,000第二の負担額は30,000それは.MidCap定期ローンとMidCapサイクルローンの変動金利はLIBORプラス6%とLIBORプラス3%であり、以前のMay 1, 2026あるいはイベントの変更(“終了日”)を制御する.MidCap循環融資とMidCap定期融資の全元金残高は終了日に満期となる。利息は月ごとに支払い、MidCap信用協定により、元金の前払いを選択することが許可されています。中型株信用協定は、以前の12ヶ月間の最低製品純売上高および最低総合EBITDA(各用語は中型株信用協定で定義されている)を維持することを要求する。
2022年11月9日、当社は“中型株信用協定”を改訂した。中型企業の循環ローンの改訂Nは最大$を提供50,000総借入能力の面で。MidCap改訂案MidCap信用協定を改訂し,LIBOR金利プラス適用保証金からSOFR金利プラス適用保証金への移行に関する条文を加え,維持した6%と保証金を適用します3%から3.75MidCap循環ローンの下の%です。そのほか、MidCapはMidCap信用協定中のいくつかのチノ、条項及び条文を改訂し、その中に最低製品純値販売財務チノレベルの修正、及び最低総合EBITDA財務契約の廃止を含む。2022年12月31日現在、改正された中型株信用協定下のすべての財務契約を遵守しています。MidCapクレジット協定に関連する債務発行総コストは#ドル2,558それは.このような債務発行コストに関する償却費用は合計#ドルである586, $576そして$0
122
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
適用することができますそれぞれ2022年,2021年および2020年12月31日までの年度に,総合経営報告書および全面(損失)収益の利子支出を計上した。
コロラド州Vectra銀行融資協定
当社は2020年3月27日にコロラド州Vectra銀行と改訂および再締結された融資合意(“Vectraローン合意”)を締結した。Vectraローン協定は、会社の既存の定期融資と既存の買収融資を元金総額#ドルの単一定期融資に再融資する6,802(“2020年定期融資”)を行い、既存の循環融資の最高元金額を#ドルに引き上げる15,000(“2020年循環ローン”および“2020年定期ローン”)。両ローンの満期日はいずれも2020年9月30日その後拡張されました2023年10月5日それは.Vectraローン協定は会社のほとんどの資産を担保にしている。Vectraローンプロトコルには財務と他の習慣契約が含まれており、金利は#です3%です。当社は2021年に中型株信用協定の締結に関する2020年ローンを返済する。
2022年3月24日、会社はコロラド州Zion Bancorporation,N.A.dba Vectra Bankと元金#ドルの保証付き定期融資手配(“Zion融資”)を締結した16,000それは.シオン基金(一)項の融資は変動年利率で利息を計算する(A)1か月間SOFR金利プラス(B)1.75%は、月ごとに調整される;および(Ii)満期March 24, 2037それは.元金と利息をまかなう月に1回前金を選択することを許可して、保険料や罰金はかかりません。
同社は2022年11月10日から“ザイオン基金第1改正案”に署名した。Zion融資機構の修正案は財務契約を改正し、任意の四半期最終日の現金流量(従来の3カ月ベース)が#ドル以下の流動資金比率を維持することを会社に要求した0そして(Ii)E固定費用カバー率は、四半期ごとの最終日に計算され、連続4四半期をベースとし、一定の流動性レベルで、キャッシュフローが$より大きければ0それは.また、四半期ごとの最終日から年単位で計算する純収入増加契約も追加された。2022年12月31日まで、私たちは改訂されたザイオン基金下のすべての金融契約を守った。ザイオン基金に関連した債務発行費用の総額は#ドルだ236それは.このような債務発行コストに関する償却費用の合計 $13, $0そして$0 それぞれ2022年,2021年および2020年12月31日までの年度に,総合経営報告書および全面(損失)収益の利子支出を計上した。
アイルランド銀行支払手形
2020年6月12日、会社はアイルランド銀行と#ドルの定期融資を締結した474(“アイルランド銀行支払手形”)アイルランド銀行の手形の年利率は4%および同値形式で期限切れになります月に1回月賦が1か月を超える36-利息を含む1ヶ月の期限。アイルランド銀行の手形には金融契約と他の習慣的な契約が含まれている。
債務期日
総合貸借対照表の日付後、アイルランド銀行の手形、中型株定期融資、Zionローンに必要な元本は以下のように支払われる
|
|
|
|
|
2023 |
|
$ |
728 |
|
2024 |
|
|
640 |
|
2025 |
|
|
640 |
|
2026 |
|
|
30,640 |
|
2027 |
|
|
640 |
|
その後… |
|
|
12,371 |
|
合計する |
|
$ |
45,659 |
|
注9.転換可能優先株権と株主権益
2021年10月8日、会社はデラウェア州州務卿に改訂証明書を提出し、この証明書に基づいて、会社は完成した5-For-1長期株式分割には、会社の許可、発行された普通株式、会社の許可、発行されたAシリーズの変換可能優先株、および会社の許可された、発行されたBシリーズの転換可能な優先株(“株式分割”)が含まれる。添付されている総合財務諸表に記載されているすべての株式金額および1株当たりデータは、すべての期間の長期株式分割を反映するように遡及調整されている
123
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
進呈しましたその改訂と再登録された会社証明書によると,その会社は共有している310,000,000株式の発行を許可しています300,000,000普通株、額面$0.011株当たり、そして10,000,000転換可能な優先株の新株、額面は$0.01一株ずつです。
普通株
“会社”ができた違います。2022年12月31日までの1年間、私は普通株を発行しないつもりだ。
普通株の保有者一人一人が株主投票で投票するすべての事項において、普通株を持つごとに一票を投じる権利があり、株主がとるすべての行動には多数票が必要である。普通株には優先購入権がなく、累積投票権もなく、償還や転換条項もない。普通株式保有者は取締役会が発表した時間と条件で配当金を得る権利がある。
Aシリーズ転換優先株
2011年12月、当社は発行しました3,250,005そのAシリーズ転換可能優先株の価格は1ドルです0.307691株当たりの総収益は約$である1,000.
2012年2月と11月、当社は共発行しました10,562,495そのAシリーズ転換可能優先株の価格は1ドルです0.307691株当たりの総収益は約$である3,250.
2021年10月、IPOに関連して、会社が発行したAシリーズ転換可能優先株の全株式が自動的に合計に変換される13,812,500普通株の株です。2020年12月31日現在、会社のAシリーズ転換可能優先株は、添付の総合貸借対照表において一時株式に分類されている。会社の取締役会席の大部分は転換可能な優先株株主が担当しているため、これらの席は一部の会社がコントロールできない事件を引き起こす可能性があり、会社は転換可能な優先株を償還する義務がある。
Bシリーズ転換可能優先株
2020年7月に当社は6,608,700そのBシリーズ転換可能優先株の価格は1ドルです5.751株当たり、純収益総額は約#ドルです36,030,発行コストを差し引く$1,970.
初公募に関連して、会社が発行したBシリーズ転換可能優先株の全株式を自動的に合計に変換する6,608,700普通株の株です。Bシリーズの転換優先株発売の条項によると、2,328Bシリーズ優先株を普通株に転換した後、2021年10月19日までに現金配当金を計上すべき部分が解約された。2020年12月31日現在、会社のBシリーズ転換可能優先株は、対応する貸借対照表において一時株式に分類されている。会社の取締役会席の大部分は転換可能な優先株株主が保有しているため、それらは会社に転換可能な優先株を償還する義務があり、一部の会社がコントロールできない事件を引き起こす可能性がある。
124
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
在庫株
“会社”ができた違います。5.I don‘は年末までの年間で、普通株は何も買いません2022年12月31日それは.その会社は全部で購入した85,049そして239,7602021年12月31日と2020年12月31日までの年間で,その普通株は$である561そして$1,538それぞれ,である.2021年12月31日と2020年12月31日までの年間で購入した株の平均価格は6.60そして$6.54それぞれ1株です。すべての買い戻し株式は原価で在庫株に計上される。
注10.(損失)1株当たり収益
1株当たり基本純(損失)収益の計算方法は、普通株株主が純(損失)収益(分子)を当期発行普通株の加重平均(分母)で割るべきである。普通株株主が1株当たりの純純(損失)収入を占めるべき計算方法は、純収入を在庫株式法またはこのような証券性質に基づくIF変換法で調整して普通株等価物希釈の影響を調整している期間内に発行された普通株の加重平均株式数である。継続経営損失が報告されている間、発行された普通株の加重平均は、普通株等価物に格納されることが逆希釈されるので、普通株等価物は含まれない1株当たり純収益の計算2022年12月31日、2021年12月31日、2020年12月31日はそれぞれ以下の通り
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
普通株主は純収入を占めなければならない |
|
|
|
|
|
|
|
|
|
Paragon 28,Inc.の純(損失)収入 |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
|
$ |
3,498 |
|
減算:Bシリーズ転換可能優先株の配当 |
|
|
— |
|
|
|
— |
|
|
|
(812 |
) |
普通株主は純収入を占めなければならない |
|
$ |
(67,326 |
) |
|
$ |
(13,693 |
) |
|
$ |
2,686 |
|
|
|
|
|
|
|
|
|
|
|
加重平均発行された普通株式: |
|
|
|
|
|
|
|
|
|
基本的な情報 |
|
|
76,766,100 |
|
|
|
52,916,711 |
|
|
|
43,510,185 |
|
Aシリーズ転換可能優先株の希釈影響 |
|
|
— |
|
|
|
— |
|
|
|
13,812,500 |
|
未償還株奨励の希釈影響 |
|
|
— |
|
|
|
— |
|
|
|
3,083,495 |
|
薄めにする |
|
|
76,766,100 |
|
|
|
52,916,711 |
|
|
|
60,406,180 |
|
|
|
|
|
|
|
|
|
|
|
(損失)1株当たり収益: |
|
|
|
|
|
|
|
|
|
基本的な情報 |
|
$ |
(0.88 |
) |
|
$ |
(0.26 |
) |
|
$ |
0.06 |
|
薄めにする |
|
$ |
(0.88 |
) |
|
$ |
(0.26 |
) |
|
$ |
0.04 |
|
以下に発行された潜在的希薄化証券は、本報告に記載されている間に反希薄化されるので、普通株主の1株当たりの希薄化(損失)収益の計算から除外される
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
株式オプション |
|
|
6,538,536 |
|
|
|
7,953,018 |
|
|
|
— |
|
制限株式単位 |
|
|
964,054 |
|
|
|
79,886 |
|
|
|
— |
|
Aシリーズ転換優先株 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
Bシリーズ転換可能優先株 |
|
|
— |
|
|
|
— |
|
|
|
6,608,700 |
|
125
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
注11.株ベースの報酬
従業員株購入計画
会社の取締役会は2021年10月8日に“従業員株購入計画”を採択した。2021年に当社株主により2021年10月19日に採択され、当社が提出したS-1表登録声明の発効前日に発効する予定です。ESPPは最初に計画に参加した従業員のために最大購入を提供しました1,329,040当社の普通株の株式価格は85購入権が付与されるか、または行使可能な日(早い者を基準とする)の市価の%である。同社は現在、例年の1月1日から7月1日までの6カ月間の発売を持っており、例年の6月30日と12月31日の購入期間終了時には1つの購入日しかない。ESPPは、2022年1月1日から2031年1月1日まで、毎年1月1日に予約と発行可能な株式数が自動的に小さく増加すると規定している1翌12月31日前日に発行されたすべてのカテゴリの当社普通株式の割合、又は当社取締役会又は委員会が決定したより少ない数の株式。自分から2022年12月31日, 38,968株式はESPPによって発行されています2,054,545株はまだ発行可能である.
条件を満たした従業員は最高で金を支払うことができる15定期賃金控除により、ESPPで購入された毛収入の基本百分率。従業員持株計画によると、従業員1人当たりの株購入限度額は$となる25,000購入権が行使されていない例年ごとに、当社の普通株価値((I)適用購入期間初日の普通株の市価および(Ii)購入日普通株の市価の両者のうち少ないものを決定する)。
2022年12月31日までの年度内会社が発行しました38,968購入権行使時の株式。当社はサービス期間中に補償費用を直線的に確認します。年末までに年度を終える2022年12月31日、会社は$を確認しました213ESPPに関連した報酬支出。いくつありますか違います。発行済みおよび発行済み株式違います。2021年から2020年までの間に,ESPPに関する報酬支出が確認された。
以下に本年度までの仮定を示す2022年12月31日ESPPに基づいて株式の公正価値を決定する場合違います。株が発行されたDは2021年12月31日と2020年12月31日まで年度を終了した。
|
|
|
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
予想変動率 |
|
70.27 |
% |
配当を期待する |
|
— |
|
予想期限(年単位) |
|
0.50 |
|
割引率 |
|
15.0 |
% |
無リスク金利 |
|
2.79 |
% |
2021インセンティブ·プラン
2021年10月8日、会社取締役会は“2021年インセンティブ奨励計画”(“2021年計画”)を採択した。2021年に当社株主により2021年10月19日に採択され、当社が提出したS-1表登録声明の発効前日に発効する予定です。2021年計画認可会社は(I)に相当する普通株式の初期総最高数を発行する7,641,979株式プラス(Ii)2011年計画に基づいて発行可能な株式数に(Iii)2011年計画により制限されて発行可能な任意の株式(満期、没収等)を加える。また(Iv)は2022年1月1日から,毎年この周年日から2031年1月1日までの増加額は,(A)項の比較的小さい者に等しい5当社が前年最終日に発行したすべての種類の普通株式の株式総数、または(B)当社の取締役会または委員会が決定した少ない株式数。2022年12月31日まで、会社は予約しました10,049,847未来に与えられた普通株。
株式オプション
いくつありますか359,054, 3,467,069そして1,723,750この年度までに年度内に付与されたオプションDecember 31, 2022, 2021 and 2020.
会社は現金#ドルを受け取りました5,271, $445そして$1,780株式オプション行使による収益2022年12月31日、2021年12月31日、2020年12月31日。株式オプション行使による税務優遇ここは$1,223, $93そして$409ここ数年で2022年12月31日、2021年12月31日、2020年12月31日。
126
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
2020年以内に、当社は当社のいくつかの従業員及び請負業者に共同で共通することを授与します1,723,750加重平均実行価格$のオプション6.38. 付与されたオプションには,時間に基づくオプションと業績に基づくオプションがあり,これらのオプションは販売業績マイルストーンを実現する際に付与される.
2021年の間、当社は当社のいくつかの従業員、取締役及び請負業者に共同で共通することを授与します3,467,069加重平均実行価格$のオプション14.63. 2021年に付与されたすべてのオプションは、時間ベースのオプションです。
2022年の間、当社は当社のいくつかの従業員、高級者及び請負業者に共同で共通することを授与します359,054加重平均実行価格$のオプション16.08. 2022年に付与されたすべてのオプションは時間に基づくオプションです。
以下、会社の株式オプション計画および2022年12月31日までの2011年と2021年計画の下での活動について概説する
|
|
|
|
|
|
|
|
|
|
|
|
|
株 |
|
|
加重平均行権値 |
|
|
加重平均残契約期間(年) |
|
未返済、2021年12月31日 |
|
7,953,018 |
|
|
$ |
9.02 |
|
|
|
8.16 |
|
授与する |
|
359,054 |
|
|
|
16.08 |
|
|
|
|
行使または釈放 |
|
(1,250,476 |
) |
|
|
4.25 |
|
|
|
|
没収または期限切れ |
|
(523,060 |
) |
|
|
12.89 |
|
|
|
|
未返済、2022年12月31日 |
|
6,538,536 |
|
|
$ |
10.02 |
|
|
|
7.36 |
|
行使可能、2022年12月31日 |
|
3,870,811 |
|
|
$ |
7.18 |
|
|
|
6.46 |
|
すでに帰属しており,2022年12月31日に帰属する予定である |
|
6,538,536 |
|
|
$ |
10.02 |
|
|
|
7.36 |
|
2022年12月31日現在の未償還オプションの総内的価値はい$です59,450それは.2022年12月31日現在,既得と行使可能オプションの内的価値の合計は$である46,196それは.2022年、2021年および2020年12月31日までの年間で、オプションを行使した内的価値の合計は18,764, $3,743そして$1,816それぞれ,である.2022年、2021年、2020年に付与されたオプションの加重平均公正価値は#ドルです9.26, $7.57そして$3.24それぞれ授与の日に。
2022年12月31日まで約一ドルです18,413非既得株式オプション補償スケジュールに関する未確認補償コスト総額は,#年加重平均期間中に確認される予定である2.83何年もです。
以下は使用する終わりの年2022年、2021年、2020年12月31日各オプション報酬の公正価値を決定する際:
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
予想変動率 |
55% - 70% |
|
|
52% - 55% |
|
|
51% - 56% |
|
配当を期待する |
|
— |
|
|
|
— |
|
|
|
— |
|
予想期限(年単位) |
|
6.00 |
|
|
5.75 - 6.25 |
|
|
5.75 - 6.0 |
|
無リスク金利 |
1.69% - 2.79% |
|
|
0.47% - 1.20% |
|
|
0.35% - 1.66% |
|
限定株単位
2021年計画により付与されたRSUは10年契約条項は,通常付与される三つあるいは…4年制期間は、引き続き当社のサービスに依存します。.の間に2022年12月31日と2021年12月31日当社は当社のいくつかの取締役、高級管理者及び従業員に合算を授与します929,090そして79,886それぞれRSUである違います。RSUは2020年に承認された。2022年と2021年に付与されたすべてのRSUは、時間ベースの報酬である“2021年計画”でのRSU活動は以下のとおりである2022年12月31日:
|
|
|
|
|
|
|
|
|
限定株単位 |
|
|
加重平均公平価値 |
|
未返済、2021年12月31日 |
|
79,886 |
|
|
$ |
17.84 |
|
授与する |
|
929,090 |
|
|
|
17.71 |
|
既得 |
|
(36,004 |
) |
|
|
17.36 |
|
没収または期限切れ |
|
(8,918 |
) |
|
|
16.82 |
|
未返済、2022年12月31日 |
|
964,054 |
|
|
$ |
17.74 |
|
すでに帰属しており,2022年12月31日に帰属する予定である |
|
964,054 |
|
|
$ |
17.74 |
|
いくつありますか違います。2021年12月31日と2020年12月31日までの年次内に帰属または没収されたRSU。
127
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
日RSUに付与される公正価値は,付与日普通株の市場価格である。付与日2022年以内に帰属するRSUの総公正価値は#ドルです17.36それは.2021年から2020年までの間に帰属するRSUの公正価値は0.
2022年12月31日まで約一ドルです15,723非既存RSUに関する未確認補償費用総額は,#年の加重平均期間で確認される予定である3.64何年もです。
株に基づく報酬費用
株式ベースの報酬費用は、総合経営報告書と総合(赤字)収益に販売、一般、行政費用を計上する。2022年、2021年、2020年12月31日までの年間で、会社は$を確認しました8,500, $4,863、と$1,808株式オプションに関連する報酬支出をそれぞれ計算する。次の年度までDecember 31, 2022, 2021 and 2020、会社は$を確認しました1,865, $85そして$0RSUに関する補償費用。
注12.従業員福祉計画
当社は満21歳と満3ヶ月サービスの合資格従業員に固定供給計画を提供して、彼らは自発的に資金を供給することができます100彼らは条件を満たした補償の%です。会社は安全港計画を選択し,会社はその計画に貢献しなければならない3条件を満たした報酬の%です。また、会社は計画年度ごとに取締役会の決定と許可の適宜入金を行うことができる。会社は従業員福祉計画に相応の貢献をした$のローカルネットワーク992, $633そして$500ここ数年でDecember 31, 2022, 2021 and 2020それぞれ,である.
注13.所得税
年度までの所得税引当費総額December 31, 2022, 2021 and 2020:
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
税引き前収益 |
|
|
|
|
|
|
|
|
国内では |
$ |
(65,749 |
) |
|
$ |
(17,030 |
) |
|
$ |
5,320 |
|
外国.外国 |
|
(1,641 |
) |
|
|
4,050 |
|
|
|
(295 |
) |
税引き前総収入 |
|
(67,390 |
) |
|
|
(12,980 |
) |
|
|
5,025 |
|
当期税金(福祉): |
|
|
|
|
|
|
|
|
連邦制 |
|
— |
|
|
|
(165 |
) |
|
|
(94 |
) |
状態.状態 |
|
96 |
|
|
|
(36 |
) |
|
|
205 |
|
外国.外国 |
|
315 |
|
|
|
744 |
|
|
|
109 |
|
当期税費合計 |
|
411 |
|
|
|
543 |
|
|
|
220 |
|
繰延税金(福祉): |
|
|
|
|
|
|
|
|
連邦制 |
|
(16,253 |
) |
|
|
(3,506 |
) |
|
|
(4,559 |
) |
状態.状態 |
|
(1,977 |
) |
|
|
(464 |
) |
|
|
(343 |
) |
外国.外国 |
|
(909 |
) |
|
|
170 |
|
|
|
(91 |
) |
評価免除額を変更する |
|
18,664 |
|
|
|
3,970 |
|
|
|
6,300 |
|
繰延税金(福祉)費用総額 |
|
(475 |
) |
|
|
170 |
|
|
|
1,307 |
|
総税金(割引): |
|
|
|
|
|
|
|
|
連邦制 |
|
(16,253 |
) |
|
|
(3,671 |
) |
|
|
(4,653 |
) |
状態.状態 |
|
(1,881 |
) |
|
|
(500 |
) |
|
|
(138 |
) |
外国.外国 |
|
(594 |
) |
|
|
914 |
|
|
|
18 |
|
評価免除額を変更する |
|
18,664 |
|
|
|
3,970 |
|
|
|
6,300 |
|
所得税費用総額 |
$ |
(64 |
) |
|
$ |
713 |
|
|
$ |
1,527 |
|
当社は貸借対照法に基づいて所得税を計算し、財務諸表に含まれている事件の予想される将来の結果の繰延税金資産と負債を確認することを求めている。この方法によれば、繰延税金資産および負債は、資産と負債の財務諸表と税ベースとの差に基づいて決定され、方法は、予想差を使用して戻される年間の現行税率である。
128
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
当社はアメリカ連邦管轄区、各州司法管轄区、適用される外国司法管轄区に所得税申告書を提出し、2018年までにアメリカ連邦や州税務審査を受けなくなりました。2019年のNOL繰り越しのため、2018年は限られた範囲で開放されています。
繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する。以下の期日までに私たちは税金の重要な構成要素を延期します2022年12月31日と2021年12月31日は:
|
|
|
|
|
|
|
|
|
十二月三十一日 |
|
|
2022 |
|
|
2021 |
|
繰延税金資産: |
|
|
|
|
|
応収予備金 |
$ |
356 |
|
|
$ |
213 |
|
費用を計算する |
|
5,351 |
|
|
|
339 |
|
S 263 A資本化可能コスト |
|
461 |
|
|
|
218 |
|
在庫備蓄 |
|
3,436 |
|
|
|
3,957 |
|
研究開発単位 |
|
3,615 |
|
|
|
3,249 |
|
純営業損失 |
|
13,584 |
|
|
|
5,740 |
|
取引コスト |
|
— |
|
|
|
— |
|
利子支出 |
|
1,218 |
|
|
|
387 |
|
株に基づく報酬 |
|
3,324 |
|
|
|
2,208 |
|
リース責任 |
|
384 |
|
|
|
— |
|
研究開発IRC 174(B)資本化コスト |
|
3,433 |
|
|
|
— |
|
他にも |
|
650 |
|
|
|
530 |
|
繰延税金資産総額 |
|
35,812 |
|
|
|
16,841 |
|
推定免税額 |
|
(28,933 |
) |
|
|
(10,270 |
) |
繰延税項目純資産 |
|
6,879 |
|
|
|
6,571 |
|
繰延税金負債: |
|
|
|
|
|
財産と設備 |
|
(5,391 |
) |
|
|
(5,975 |
) |
第四百八十一条調整 |
|
— |
|
|
|
(178 |
) |
特許と商標 |
|
(1,304 |
) |
|
|
(496 |
) |
使用権資産 |
|
(378 |
) |
|
|
— |
|
繰延税金負債総額 |
|
(7,073 |
) |
|
|
(6,649 |
) |
繰延税項純資産(負債)合計 |
$ |
(194 |
) |
|
$ |
(78 |
) |
繰延税項目の純資産の全部または一部が現金化されない場合には、推定準備が確立される。そこで,当社は既存のすべての証拠に基づいて結論を出し,推定手当を#ドルと決定した28,933そして$10,270ある繰延税金資産のためにそれぞれ2022年12月31日と2021年12月31日です。2022年12月31日と2021年12月31日まで同社は連邦純営業損失を#ドルに繰り越している52,349そして$25,119それぞれ1つずつあります無期限繰越期間とドル52,552州別に繰り越した総合州純営業損失は2034それは.また、同社は海外純営業損失#ドルを繰り越した6,788それが始まります2033.
未確認税収割引の期初と期末金額の入金は以下の通り
|
|
|
|
|
|
|
|
|
2022 |
|
|
2021 |
|
税収割引総額の未確認--期初 |
$ |
1,337 |
|
|
$ |
627 |
|
今年度の税収状況に関する増加 |
|
92 |
|
|
|
102 |
|
前年の税収状況に関する増加 |
|
2 |
|
|
|
712 |
|
前年の納税状況に関する減少額 |
|
— |
|
|
|
(104 |
) |
前年度税務頭金決算に関する減少額 |
|
— |
|
|
|
— |
|
税収割引総額の未確認--期末 |
$ |
1,431 |
|
|
$ |
1,337 |
|
未確認税金割引$1,431確認すれば、当社の実際の税率に影響を与えます。会社の会計政策により、未確認の税収利益に関する計算すべき利息及び罰金が税費の構成要素として確認される。自分から2022年12月31日, 違います。未確認の税金優遇に関連した利息や罰金が記録されている。当社は、訴訟時効が満了したり、税収総額が2023年に減少しないと予想しています。
129
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
連邦法定税率で計算される所得税準備金と終了年度実税率の入金December 31, 2022, 2021 and 2020 is:
|
|
|
|
|
|
|
|
|
|
|
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
アメリカの法定連邦税率 |
$ |
(14,152 |
) |
|
$ |
(2,726 |
) |
|
$ |
1,055 |
|
連邦福祉の州税純額を差し引く |
|
(1,901 |
) |
|
|
(492 |
) |
|
|
99 |
|
非アメリカ収入はアメリカの法定税率とは異なる税率で課税されます |
|
(80 |
) |
|
|
(150 |
) |
|
|
80 |
|
外国の収益源、関連外国の税収控除後の純額 |
|
486 |
|
|
|
601 |
|
|
|
306 |
|
税収控除のメリット |
|
(458 |
) |
|
|
(1,569 |
) |
|
|
(670 |
) |
株に基づく報酬 |
|
(2,852 |
) |
|
|
(212 |
) |
|
|
(4,913 |
) |
PPPローン免除 |
|
— |
|
|
|
— |
|
|
|
(861 |
) |
評価免除額を変更する |
|
18,664 |
|
|
|
3,970 |
|
|
|
6,300 |
|
未確認税収割引の変化 |
|
92 |
|
|
|
710 |
|
|
|
10 |
|
他にも |
|
137 |
|
|
|
581 |
|
|
|
121 |
|
所得税引当総額 |
$ |
(64 |
) |
|
$ |
713 |
|
|
$ |
1,527 |
|
2022年12月31日まで私たちの海外業務が持っている現金の総額は$です3,679それは.私たちは私たちの非アメリカ子会社の未分配収益のためにアメリカ繰延税負担や外国源泉徴収税を用意していません。これらの収益は無期限再投資とされています。このような収益を分配するには、いかなるアメリカの繰延税金負債も外国の源泉徴収税もそれほど大きくないだろう。
付記14.約束と約束
賃貸借証書
当社は、一定期間の対価格と引き換えに、確認された資産が存在するか否か、および契約が確認された資産の使用制御権を譲渡するか否かを評価することにより、1つの手配がリースであるか否かを決定する。2つの基準が一致する場合、当社はレンタル開始日とその後(改訂されたように)その使用権(“ROU”)資産及びレンタル負債の初歩的な分類及び計量を決定する。経営リースROU資産および負債は、開始日にレンタル期間内のリース支払いの現在値によって確認されます。
同社はいくつかのオフィススペースと設備をレンタル経営の形でレンタルしている。当社は使用権資産を他の資産、短期賃貸負債を他の流動負債、長期賃貸負債を連結貸借対照表上の他の長期負債に分類する。リース費用は、総合経営報告書と全面(赤字)収益のうち営業(費用)収入の構成要素であることが確認された。2022年1月1日現在、会社はASC 842を採用し、2022年12月31日現在、会社は記録したリース責任共$1,821そしてそれに応じて使用権資産共$1,795その総合貸借対照表にあります。賃貸負債#ドル1,821$からなる447のです短期賃貸負債そして$1,374のです長い間賃貸負債は、他の流動負債と他の長期負債をそれぞれ計上する。当社は2022年12月31日までに賃貸支出$を記録した408合併経営と総合収入表で.
私たちのレンタルの大部分は暗黙的な金利を提供していないので、私たちは開始日に得られる情報に基づく増分借入金利を使用してレンタル支払いの現在値を決定します。逓増借款金利を適用するために、担保金利を有するポートフォリオ方法を採用し、その中で資産は類似した条項と経済環境によってグループ化され、会社はアプリケーションとリース法に実質的な差がないことを合理的に予想している。
ASC 842の採用までの期間に関する開示
賃貸を経営する場合の賃貸料支出総額は#ドルです1,369そして$1,316それぞれ2021年12月31日および2020年12月31日までの年度に,総合経営および全面(赤字)収益報告書に販売,一般および行政費用を計上した。2022年1月、当社は購入する前に通過しました2029それは.2022年12月31日までの年度の賃貸費用には本賃貸に関する費用は含まれていませんが、2021年12月31日と2020年12月31日までの年度の賃貸料は含まれています。
法律訴訟
私たちは様々な訴訟、クレーム、調査、そして他の規制とコンプライアンスに関連しており、その多くは私たちの業務的な一般的な仕事です。いつ損失を招く可能性が高いが,損失の範囲は合理的である
130
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
推定は,その範囲内の最適な推定を累算する.範囲内の最適な推定値が決定できない場合、その範囲のローエンドが計算される。もし私たちのリスク開放が私たちの見積もりと大きく異なる場合、あるいは以前に計上されていなかった債務が発生すれば、これらのクレームの最終的な解決は未来の運営結果に影響を与える可能性がある。潜在的な保険精算は潜在的な負債を相殺しないだろう。
前述したように,2018年3月23日頃,その後Stryker Corp.に買収されたWright Medical Technology,Inc.(総称してWright Medicalと呼ぶ)が米国コロラド州地方裁判所に訴訟を起こし,Paragon 28,Inc.の特許侵害を告発した。また、Wright Medicalは2021年12月23日頃、ある他の特許を侵害していることを告発する米デラウェア州地方裁判所に同社に対する別の訴えを提出した(“デラウェア州訴え”)。
2022年11月28日、会社はStryker Corp.と和解合意に達し、コロラド州の苦情、デラウェア州の苦情、任意の会社の反クレームを終わらせ、総金額は$とした26,000当社はセックに払った金(“和解A”“)をインストールしますまた、同社は#ドルを発生させた1,000和解に関連した法的費用の中で。和解金は(I)$を含む当社が3期に分けて支払うことになる5,000(Ii)2022年12月16日またはその日までに8,0002023年1月1日から2023年1月16日までのいつでもD(Iii)$13,0002023年4月1日から2023年4月17日までのいずれの時間でも。2022年12月31日まで、会社は第1期支払い$を送金します5,000年末後、会社は第2期分割払い#ドルを送金します8,0002023年1月13日。
和解協定は、会社が業務を継続する能力に影響を与えず、会社の既存の製品ラインを何も変える必要もない。和解金額は唯一支払われた対価格であり、同社は将来的にStryker Corp.にいかなる金額も支払う必要はない。
同社が和解協定に署名したのは、完全に訴訟の負担、費用、気晴らし、不確実性を解消するためだ。和解協定はそうではなく、責任や会社がいかなる不法、侵害、または不法活動に従事していることを認めると解釈されてはならない。
付記15.関連者取引
当社は、当社の取締役の一人が所属するエンティティと、いくつかの知的財産権について2017年7月1日の期日を定めたライセンス契約を締結しており、この合意により、当社は4%の支払いが必要です(4知的財産権の許可に関する純収入の%)十五年初回販売日から、年間最低支払額は$250それは.協議の期限は20年自動的に更新します5年制その後の時間帯。本ライセンス契約により,実体に支払われる金の総額は$となる249, $87そして$111ここ数年で2022年12月31日、2021年12月31日、2020年12月31日。2022年12月31日まで及び2021年12月31日までに当該エンティティに支払わなければならない金はい$です164そして$163それぞれ,である.
当社は関連側に専門サービス料計$を支払います405, $542そして$520ここ数年でそれぞれ2022年12月31日,2021年12月31日と2020年12月31日であり,合併経営と全面(赤字)収益表に販売,一般,行政費を計上している。2022年12月31日現在と2021年12月31日までに当該関連先に支払われるべき金額は$0 そして$66それぞれ,である.
注16.市場と地理情報を細分化する
運営分部は、企業の構成要素として定義され、独立した財務情報を得ることができ、経営意思決定者(すなわち、私たちのCEO)によって定期的に評価され、資源をどのように割り当て、業績を評価するかを決定することができる。私たちはASCテーマ280に基づいて、支部報告(“ASC 280”)が1つの運営部門内で私たちのグローバル業務を管理している。細分化市場情報は、管理層が業務を審査し、投資と資源配分の意思決定を行い、運営業績を評価する方式と一致する。
131
連結財務諸表付記
(千単位で1株当たりおよび1株当たりのデータは含まれていない)
1つの国または地域による製品売上には、病院、医師、およびディーラーへの製品売上が含まれる。前記期間のいずれの期間においても、個人顧客が製品総売上高に占める割合は10%以下である違います。現在、お客様は合併売掛金の10%以上を占めています2022年12月31日と2021年12月31日。
下表は地理地域別の顧客所在地による締切年度の総純収入である2022年12月31日、2021年12月31日、2020年12月31日。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
十二月三十一日までの年度 |
|
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
アメリカです |
|
$ |
158,105 |
|
|
$ |
130,112 |
|
|
$ |
100,547 |
|
国際的に |
|
|
23,278 |
|
|
|
17,352 |
|
|
|
10,434 |
|
純収入合計 |
|
$ |
181,383 |
|
|
$ |
147,464 |
|
|
$ |
110,981 |
|
違います。純収入は米国以外の個別国·地域から来ており,この年度までの総合純収入の10%以上を占めているDecember 31, 2022, 2021 and 2020.
下表はこの年度までの地理的地域別の非流動資産総額であり、繰延税項目は含まれていないそれぞれ2022年12月31日と2021年12月31日です。
|
|
|
|
|
|
|
|
|
|
|
2022年12月31日 |
|
|
2021年12月31日 |
|
アメリカです |
|
$ |
79,458 |
|
|
$ |
51,809 |
|
国際的に |
|
|
32,127 |
|
|
|
3,206 |
|
総資産 |
|
$ |
111,585 |
|
|
$ |
55,015 |
|
Disiorの買収により、2022年12月31日現在、米国とフィンランド国内の非流動資産総額は合併総資産の10%を超えている. 違います。以下の日までに,米国以外で総非流動資産を持つ単一国·地域が合併総資産の10%以上を占める2021年12月31日.
注17.後続事件
2023年1月30日、当社は公開発行を完了しました6,500,000普通株で発行価格は$です17.001株当たり、それには3,750,000当社が発行·売却する普通株式(“主要株式”)及び2,750,000証券保有者が売却する普通株(“第二株”)それは.引受契約の条項によると、当社及び売却証券保有者は、引受業者に最大30日間の選択権を付与して、最大購入する562,500株と412,500公開発行価格の普通株式(“オプション株式”)ごとに,全行使の引受割引と手数料を差し引く2023年2月17日。
同社が今回の発行から得た純収益は約#ドルだった68,300引受割引と手数料及び見積会社が支払うべき発売費用を差し引いた後です。売却証券保有者が発売から得た純収益は約#ドル50,700保証割引と手数料を差し引いた後です。当社は証券保有者が普通株を売却して得た収益は何も受け取っていません。
132
情報技術EM 9.会計及び財務開示面の変更と会計士との相違。
ない。
ITEM 9 Aです。制御とプログラムです
情報開示制御とプログラムの評価
我々の経営陣は、最高経営責任者と財務責任者の参加の下で、本年度報告書10-K表がカバーされている期間が終了するまで、取引所法案下の規則13 a-15(E)および15 d-15(E)で定義されているような開示制御および手順の有効性を評価した。この評価に基づき,我々の最高経営責任者と財務責任者は,本年度報告Form 10−Kがカバーする期間が終了するまで,我々の開示制御および手順は合理的な保証レベルで有効であると結論した。
経営陣財務報告内部統制年次報告書
経営者は、取引法第13 a-15(F)及び15 d-15(F)条の規定に従って、財務報告に対する適切な内部統制の確立及び維持を担当する。私たちは財務報告の内部統制に対して財務報告の信頼性を合理的に保証し、公認された会計原則に基づいて外部目的の財務諸表を作成することを目的としている。財政報告書の内部統制には固有の限界がある。このような制限のため、財務報告書の内部統制は重大な誤報をタイムリーに防止したり発見できない可能性がある。しかし、このような固有の制限は財務報告手続きの既知の特徴だ。したがって、(除去ではないにもかかわらず)このリスクを低減するために、この過程で保障措置を設計することが可能である。
最高経営責任者や最高財務責任者を含む経営陣の監督の下、テレデビル委員会後援組織委員会が発表した“内部統制-総合枠組み”(2013)の枠組みに基づいて、2022年12月31日までの財務報告内部統制の有効性を評価した。この評価によると、我々の経営陣は、財務報告書に対する内部統制が2022年12月31日から有効であると結論した。
財務報告の内部統制に存在する重大な欠陥と救済
2021年12月31日と2020年12月31日までの年次財務諸表を作成したところ、経営陣は、我々の財務報告内部統制に重大な弱点があることを発見した。重大な欠陥とは、財務報告の内部統制に欠陥或いは欠陥の組み合わせが存在し、私たちの年度或いは中期財務諸表の重大なミス報告が合理的な可能性があり、適時に防止或いは発見できないようにすることである。監査過程中に発見された重大な弱点は著者らが有効な制御環境を設計或いは維持していないことと関係があり、主な原因は手作り日記帳分録に関連する適切な制御が不足し、及び正式な会計政策、プログラムと制御が不足して複雑な取引を分析、計算と開示することである。
2022年12月31日までの1年間、経営陣は、以下のように大きな弱点を補う措置を講じている
•より多くの合格した技術会計と報告者を招聘し、アメリカ公認会計基準とアメリカ証券取引委員会財務報告要求の面で豊富な知識と経験を持っている
•効果的な役割分担を確保するために制御フレームワークを設計する
•複雑な取引を分析、計算、開示するために、正式な会計政策、プロセスと制御を設計と維持する
•2022年以前に実施した企業資源計画システムの制御を設計と実施し、他を除いて、ある制御を自動化し、職責分業を実行し、日記帳分録の審査を促進する。
経営陣は、会社の統制措置が十分な期間にわたって設計され、有効に運用されていることを確認し、2022年12月31日までに重大な弱点が救済されたと結論した。
財務報告の内部統制の変化
133
上記に加えて、取引法第13 a-15(D)および15 d-15(D)条に要求される評価に関する財務報告内部統制は、2022年12月31日までの四半期内に大きな影響を与えないか、または合理的に財務報告内部統制の変化に影響を与える可能性がある
情報開示制御とプログラムの有効性の制限
我々の開示制御およびプログラムを設計·評価する際に、管理層は、任意の制御およびプログラムは、設計および動作がどんなに良好であっても、予想される制御目標を達成するために合理的な保証を提供することしかできないことを認識している。また、開示制御およびプログラムの設計は、管理層に、そのコストに対する可能な制御およびプログラムの利益を評価する際に判断することが要求されるリソース制限が存在するという事実を反映しなければならない。
情報技術EM 9 B。他の情報。
ない。
情報技術EM 9 Cです。検査を妨害する外国司法管轄区域を開示する。
適用されません。
134
第三部
情報技術EM 10.取締役、行政者、会社管理。
私たちは役員、上級管理職(最高経営責任者、最高財務官、最高会計官を含む)と従業員のために“ビジネス行動基準”と呼ばれる道徳基準を制定した。このコードは私たちのウェブサイトir.capon 28.comのガバナンス部分で公開されることができる。私たちが本規則に任意の非技術的、行政的、または他の非実質的な修正を行う場合、または黙示免除を含む本規則のある条項に任意の免除を付与する場合、修正または免除の性質、発効日および適用対象を私たちのウェブサイト上で開示するか、または米国証券取引委員会に提出された現在の8-K表報告書に修正または免除の内容を開示する。
本年度報告でカバーされるForm 10−Kテーブルに含まれる会計年度終了後120日以内に、第16(A)節“実益所有権報告コンプライアンス”というタイトルのForm 10−Kテーブルにおいて、本エントリ10に関する我々の役員、役員、および会社管理に関する残りの情報を提供する。この情報は、参照によって本プロジェクト10に組み込まれる。
情報技術EM 11.役員報酬。
本年度報告書に含まれる財務年度終了後120日以内に、“役員報酬”と題するForm 10−K表を用いた第11項の役員報酬に関する情報を最終委託書に提供し、その中の他の場所で提供することができる。この情報は、参照によって本プロジェクト11に組み込まれる。
情報技術EM 12.特定の実益所有者の保証所有権および管理層および関連する株主事項。
本年度報告がカバーする10-Kフォームに“いくつかの実益所有者および経営陣および関連株主の証券所有権”と題する10-Kフォームに含まれる会計年度終了後120日以内に、いくつかの実益所有者および管理層および関連株主の証券所有権に関連し、その中の他の場所にも可能性がある最終委託書に第12項に関する情報を提供する。この情報は、参照によって本プロジェクト12に組み込まれる。
情報技術EM 13.何らかの関係や関連取引,および取締役の独立性.
本年度報告がカバーする財政年度終了後120日以内に、“何らかの関係および関連取引”と題する第13項の関連先との取引および取締役独立性に関する情報を提供する。この情報は、参照によって本条項13に組み込まれる。
イットM 14.チーフ会計士費用とサービス料。
本年度報告に含まれる財務年度終了後120日以内に、本プロジェクト14に関する主な会計費用およびサービスの情報を最終委託書に提供し、この年次報告は、Form 10-Kテーブルを採用し、“首席会計士費用およびサービス”というタイトルであり、その中の他の部分も含まれている可能性がある。この情報は、参照によって本プロジェクト14に組み込まれる。
135
第4部
情報技術EM 15.展示品と財務諸表明細書
本報告の第2の部分項目8である財務諸表と補足データを参照されたい。
これらは適用されないか、または必要とされないので、すべての付表は省略される、または要求された情報が連結財務諸表または関連付記に含まれるので、すべての付表は省略される。
以下の展示品は、本明細書に含まれるか、または参照によって本明細書に組み込まれる
|
|
|
|
|
|
|
|
展示品 番号をつける |
|
説明する |
引用で編入する |
|
|
表 |
展示品 |
提出日 |
書類番号 |
同封アーカイブ |
3.1 |
|
Paragon 28,Inc.社登録証明書の改訂と再署名。 |
8-K |
3.1 |
10/19/2021 |
001-40902 |
|
3.2 |
|
付例を改訂および再制定する |
8-K |
3.2 |
10/19/2021 |
001-40902 |
|
4.1 |
|
普通株の書式 |
S-1/A |
4.2 |
10/8/2021 |
333-259789 |
|
4.2 |
|
改正および再署名された“投資家権利協定”は、2020年7月28日にParagon 28,Inc.がその投資家側と署名する |
S-1 |
4.3 |
9/24/2021 |
333-259789 |
|
4.3 |
|
Paragon 28,Inc.は、1934年“証券取引法”第12節に登録された証券に基づいて説明する。 |
|
|
|
|
X |
10.1+ |
|
Paragon 28,Inc.の2021年インセンティブ計画 |
S-8 |
99.2(a) |
10/20/2021 |
333-260367 |
|
10.4+ |
|
総合株式オプションと奨励計画 |
S-1 |
10.4 |
9/24/2021 |
333-259789 |
|
10.4(a)+ |
|
総合株式オプションと奨励計画に基づく報酬プロトコルフォーマット |
S-1 |
10.4(a) |
9/24/2021 |
333-259789 |
|
10.5 |
|
合意の形式を達成する |
S-1/A |
10.5 |
10/12/2021 |
333-259789 |
|
10.6 |
|
産業リース協定は,2018年5月21日にAdmar Grands,LLCとParagon 28,Inc.が締結した。 |
S-1 |
10.6 |
9/24/2021 |
333-259789 |
|
10.7 |
|
信用·セキュリティ協定(定期融資)は,2021年5月6日にMidCap Financial TrustとParagon 28,Inc.が署名した。 |
S-1 |
10.7 |
9/24/2021 |
333-259789 |
|
10.8 |
|
信用·セキュリティ協定(循環融資)は,2021年5月6日にMidCap Financial TrustとParagon 28,Inc.が署名した。 |
S-1 |
10.8 |
9/24/2021 |
333-259789 |
|
10.9+ |
|
非従業員役員報酬政策表 |
S-1/A |
10.9 |
10/8/2021 |
333-259789 |
|
10.11(a)+ |
|
“2021年インセンティブ奨励計画株式オプション付与通知書及び株式オプション協定”フォーマット |
S-1/A |
10.10(a) |
10/8/2021 |
333-259789 |
|
10.11(b)+ |
|
“2021年度インセンティブ奨励計画限定株奨励通知書”と“限定株奨励契約”フォーマット |
S-1/A |
10.10(b) |
10/8/2021 |
333-259789 |
|
10.12+ |
|
雇用協定は,2021年10月8日から発効し,Paragon 28,Inc.とアルバート·ダコスタが署名した |
S-1 |
10.12 |
10/8/2021 |
333-259789 |
|
10.13+ |
|
雇用協定は,2021年10月8日から発効し,Paragon 28,Inc.とStephen M.Deitschによって署名され,両者の間で発効する |
S-1 |
10.13 |
10/8/2021 |
333-259789 |
|
10.14+ |
|
雇用協定は,2021年10月8日から発効し,Paragon 28,Inc.とMatthew Jarboによって署名され,両者の間で発効するe |
S-1 |
10.14 |
10/8/2021 |
333-259789 |
|
10.15+ |
|
2021年従業員株購入計画 |
S-8 |
99.3 |
10/20/2021 |
333-260367 |
|
10.16 |
|
不動産売買契約 |
10-K |
10.16 |
3/8/2022 |
001-40902 |
|
10.17 |
|
商業融資協定は,2022年3月24日に発効し,Zion Bancorporation,N.A.,d/b/a Vectra Bank Colorado,Inc.によって発効した. |
10-Q |
10.1 |
5/9/2022 |
001-40902 |
|
136
|
|
|
|
|
|
|
|
10.18 |
|
信用·セキュリティ協定(循環融資)の第3号改正案は,2022年3月24日から発効し,MidCap Funding IV TrustとParagon 28,Inc.である。 |
10-Q |
10.2 |
5/9/2022 |
001-40902 |
|
10.19 |
|
信用·セキュリティ協定(定期融資)の第2号改正案は,2022年3月24日に発効し,MidCap Financial TrustとParagon 28 Inc.が共同で完成した。 |
10-Q |
10.3 |
5/9/2022 |
001-40902 |
|
10.20 |
|
クレジット·セキュリティ協定(定期融資)の第3修正案は,2022年11月9日,MidCap Financial Trust,貸手MidCap Financial Trust,Paragon 28,Inc.およびParagon Advanced Technologies Inc.である。 |
10-Q |
10.1 |
11/10/2022 |
001-40902 |
|
10.21 |
|
クレジット·セキュリティ協定第4修正案(循環ローン)は、2022年11月9日、MidCap Funding IV Trust、貸手Paragon 28、Inc.およびParagon Advanced Technologies Inc. |
10-Q |
10.2 |
11/10/2022 |
001-40902 |
|
10.22 |
|
商業融資協定第1修正案は,2022年11月10日に発効し,Zion Bancorporation,N.A.dba Vectra Bank ColoradoとParagon 28,Inc.により発効した. |
10-Q |
10.3 |
11/10/2022 |
001-40902 |
|
10.23^ |
|
Wright Medical Technology,Inc.とParagon 28,Inc.の間の和解合意は,2022年11月28日に発効した。 |
|
|
|
|
X |
21.1 |
|
子会社リスト。 |
|
|
|
|
X |
23.1 |
|
独立公認会計士事務所の同意 |
|
|
|
|
X |
24.1 |
|
授権書(当テーブル10-Kの署名ページに含まれる) |
|
|
|
|
X |
31.1 |
|
2002年のサバンズ·オキシリー法第302節で可決された1934年の証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
|
X |
31.2 |
|
2002年サバンズ−オキシリー法第302節で可決された1934年証券取引法第13 a−14(A)及び15 d−14(A)条に基づいて首席財務幹事が認証された。 |
|
|
|
|
X |
32.1 |
|
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条に規定されている最高経営責任者証明書。 |
|
|
|
|
X |
32.2 |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による首席財務官の認証。 |
|
|
|
|
X |
101.INS |
|
連結されたXBRLインスタンス文書−インスタンス文書は、XBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 |
|
|
|
|
|
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
|
|
101.カール |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
|
|
|
101.def |
|
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
|
|
|
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
|
|
101.Pre |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
|
|
|
104 |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
|
|
|
|
|
+管理契約または補償計画を示します。
登録者は既に(I)S−K条例第601(B)(10)項の規定により展示品の部分を編集し、(Ii)S−K条例第601(A)(5)項の規定により付表及び展示品を省略し、及び(Iii)S−K条例第601(A)(6)項の規定により何らかの他の情報を編集した。登録者は、編集されていない完全な展示品のコピーを米国証券取引委員会に追加提供することを要求しなければならない。
?本10-K表年次報告書に添付されている添付ファイル32.1および32.2に添付されている証明は提供されたものとみなされ、米国証券取引委員会に届出されておらず、参照によってParagon 28,Inc.が1933年証券法(改訂本)または1934年証券取引法(改訂本)に従って提出された任意の文書のうち、本10-K表年次報告日の前または後に提出されても、その文書に含まれる任意の一般登録言語にかかわらず。
137
項目16.表格10-Kの概要
ない。
138
サイン性質.性質
改正された1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、正式に許可された以下の署名者が代表して本報告書に署名することを正式に手配している。
|
|
|
|
|
|
Paragon 28,Inc. |
|
|
|
|
日付:2023年3月2日 |
|
差出人: |
/s/アルバート·ダコスタ |
|
|
名前: |
アルバート·ダコスタ |
|
|
タイトル: |
最高経営責任者 |
|
|
|
|
|
|
Paragon 28,Inc. |
|
|
|
|
日付:2023年3月2日 |
|
差出人: |
/s/Stephen M.Deitsch |
|
|
名前: |
スティーブン·M·デッチ |
|
|
タイトル: |
首席財務官 |
139
授権依頼書
これらの陳述を通じて、私はすべての人が、以下に署名したすべての人がアルバート·ダコスタとスティーブン·M·ドッジを彼または彼女の任意およびすべての身分の事実弁護士として構成し、指定し、本10 K表の年次報告書の任意の修正に署名し、それを証拠物およびこれに関連する他の文書と共に米国証券取引委員会に提出し、ここで上述のすべての事実上の弁護士またはその代替者がこれによって行うことができるすべてを承認し、確認することができることを知っている。
本報告書は、改正された1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に署名された。
|
|
|
|
|
名前.名前 |
|
タイトル |
|
日取り |
|
|
|
|
|
/s/アルバート·ダコスタ |
|
会長兼最高経営責任者 |
|
March 2, 2023 |
名前.名前 |
|
(首席行政主任) |
|
|
|
|
|
|
|
/s/Stephen M.Deitsch |
|
首席財務官 |
|
March 2, 2023 |
名前.名前 |
|
(首席財務官) |
|
|
|
|
|
|
|
/s/エリック·ミケルソン |
|
首席財務官兼財務総監 |
|
March 2, 2023 |
名前.名前 |
|
(首席会計主任) |
|
|
|
|
|
|
|
/s/Thomas Schnettler |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
|
|
|
|
|
クエンティン·ブラックフォード |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
|
|
|
|
|
/s/Alfred Grunwald |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
|
|
|
|
|
/s/クリス·ジョンソン |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
|
|
|
|
|
/s/スティーブン·オステル |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
|
|
|
|
|
/s/Meghan Scanlon |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
|
|
|
|
|
/s/クリスティーナ·ライト |
|
役員.取締役 |
|
March 2, 2023 |
名前.名前 |
|
|
|
|
140
























