アメリカです
アメリカ証券取引委員会
ワシントンD.C.,郵便番号:20549
表
(マーク1)
本財政年度末まで
あるいは…。
依頼書類番号:
(登録者の正確な氏名はその定款に記載)
(明またはその他の司法管轄権 |
(税務署の雇用主 |
会社や組織) |
識別番号) |
(主に事務室の住所、郵便番号を含む)
(
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引コード |
|
登録された各取引所の名称 |
|
|
同法第12(G)条により登録された証券:なし。
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい、そうです☐
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、そうです☐
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバ |
☐ |
☒ |
|
非加速ファイルサーバ |
☐ |
規模の小さい報告会社 |
|
|
|
新興成長型会社 |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引法第13(A)節に提供された任意の新しいまたは改正された財務会計基準を遵守する☐
登録者が報告書を提出したか否かを再選択マークで示し、その経営陣が“サバンズ·オキシリー法”第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する(15 USC)。7262(B))は、監査報告書を作成又は発行する公認会計士事務所により提供される。
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです☐違います
登録者の非関連会社が保有する投票権を有する普通株の総時価は約#ドルである
2023年2月15日までの登録者のA類普通株流通株数wAS
引用で編入された書類
本年度報告第3部がForm 10−K形式で提供することを要求するいくつかの情報は、2023年5月1日またはそれまでに米国証券取引委員会に提出された2023年年次総会の最終依頼書(“委託書”)によって提供される。
監査役事務所ID: |
監査役の名前: |
監査役位置: |
有機生成ホールディングス
表格10-Kの年報
2022年12月31日までの財政年度
TABLE内容
|
|
ページ |
第1部 |
|
|
|
|
|
第1項。 |
業務.業務 |
2 |
第1 A項。 |
リスク要因 |
34 |
項目1 B。 |
未解決従業員意見 |
70 |
第二項です。 |
属性 |
70 |
第三項です。 |
法律訴訟 |
70 |
第四項です。 |
炭鉱安全情報開示 |
70 |
|
|
|
第II部 |
|
|
|
|
|
五番目です。 |
登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
71 |
第六項です。 |
保留されている |
72 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
73 |
第七A項。 |
市場リスクの定量的·定性的開示について |
86 |
第八項です。 |
財務諸表と補足データ |
87 |
第九項です。 |
会計と財務情報開示の変更と相違 |
87 |
第9条。 |
制御とプログラム |
87 |
プロジェクト9 B。 |
その他の情報 |
88 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
88 |
|
|
|
第三部 |
|
|
|
|
|
第10項。 |
役員·幹部と会社の管理 |
89 |
第十一項。 |
役員報酬 |
89 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
89 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
89 |
14項です。 |
最高料金とサービス |
89 |
|
|
|
第4部 |
|
|
|
|
|
第十五項。 |
展示品と財務諸表の付表 |
90 |
第十六項。 |
表格10-Kの概要 |
92 |
|
|
|
サイン |
93 |
|
前向き陳述に関する警告説明
このForm 10−K年度報告書には、“業務”、“リスク要因”と“経営陣の財務状況と経営結果の議論と分析”と題する章が含まれており、前向きな陳述が含まれている。これらの陳述は、我々の将来の経営業績への期待、業務戦略および経営、融資計画、潜在的成長機会、潜在的市場機会および競争の影響、および前述に関連する仮定に関連するが、これらに限定されない可能性がある。展望性陳述は固有にリスクと不確定要素の影響を受け、その中のいくつかのリスクと不確定要素は予測できないか定量化されている。これらのリスクおよび他の要因には、限定されるものではないが、“リスク要因”には次のようなリスクが含まれる。場合によっては、前向きな陳述は、“可能”、“そう”、“すべき”、“可能”、“予想”、“計画”、“予想”、“信じ”、“推定”、“予測”、“意図”、“潜在”、“可能”、“将”、“継続”、またはこれらの用語または他の同様の用語の否定によって識別することができる。これらの声明はただ予測に過ぎない。実際の事件や結果は大きく違うかもしれない。
本明細書で使用されるように、文脈が別に説明されていない限り、言及された“私たち”、“会社”、“有機生成”および“オーゴ”は、有機生成ホールディングスおよびそれらの子会社を意味するであろう。
商標とサービスマーク
本明細書に含まれる有機生成のすべての商標、商品名、製品名、図形およびロゴは、米国および/または他の国/地域における有機生成ホールディングスまたはその子会社(適用される場合)の商標または登録商標である。本明細書に含まれるすべての他の当事者商標、商号、製品名、グラフィック、およびロゴは、それぞれの所有者の財産である。他の当事者の商標、商号、製品名、図形またはロゴを使用または表示することは、暗示ではなく、他方との関係を示唆するもの、または他方を承認または賛助するものと解釈されるべきではない。
便宜上、本年度報告で言及された商標、サービスマーク、および商号は使用されていない、(Sm)および(TM)記号が列挙されているが、私たちは、適用法に従って、これらの商標、サービスマーク、および商号に対する当社または適用許可者の権利を最大限に維持する。
1
パ.パRT I
サイトM 1.ビジネス
概要
有機生成会社はリードする再生医学会社であり、高級創傷看護及び外科と運動医学市場の開発、製造と商業化解決方案に集中している。著者らの製品はすでに臨床と科学研究を通じて、ある場合に組織癒合を支持し、加速し、患者の予後を改善できることを証明した。組織工学や細胞治療における多くの突破により,癒合過程の各段階の看護基準を進めている。著者らの解決策は人口高齢化と糖尿病、肥満、心血管と末梢血管疾患及び喫煙などの合併症の増加によって駆動される巨大かつ絶えず増加する市場に対して行われている。病院,創傷看護センター,政府機関,外来サービスセンター(“ASC”)や医師室を含む多くのヘルスケア顧客に差別化された製品や内部顧客支援を提供している。我々の使命は,総合治療ソリューションを提供し,医療結果や患者の生活を大幅に改善するとともに,全体の看護コストを低減することである。
私たちは患者の看護過程全体の需要を満たすために、私たちがサービスする市場で全面的な製品の組み合わせを提供します。著者らはすでに臨床試験、現実世界の結果と健康経済学研究からデータを生成し続け、著者らの製品が提供する臨床治療効果と価値主張を検証するつもりである。我々の製品グループのいくつかの既存および開発中の製品は、米国食品医薬品局(FDA)の発売前申請(PMA)承認または510(K)承認を得ている。臨床試験を行い,FDA承認を得るのに要する多大な時間とコストを考慮すると,我々のデータと規制承認は強力な競争優位性を提供してくれると信じている。私たちの製品開発専門知識と複数の技術プラットフォームは強力な製品ラインを提供しており、未来の成長を推進すると信じています。
高級創傷看護市場では、著者らは先進的な創傷看護製品の開発と商業化に焦点を当て、各種の治療環境における慢性と急性創傷の治療に用いている。著者らは全面的な再生医学製品の組み合わせを持ち、傷口のタイプを考慮することなく、傷口の癒合過程の早期から傷口の閉鎖まで患者を支持することができる。我々の先進的な創傷ケア製品は、静脈性脚潰瘍(“VLU”)および糖尿病性足潰瘍(“DFU”)を治療するためのApligraf;DFU(生産が現在生産を一時停止し、新しい製造工場への移行または第三者製造業者との契約を待つ)を治療するためのDermagraft、様々な創傷タイプのための抗菌バリアPuraPly AM;およびAffity、NovachorおよびNuShield創傷カバーを含む。私たちは訓練された専門的な直接傷口看護販売チームを持っていて、全面的な顧客支援サービスを備えています。
外科や運動医学市場では,慢性や急性手術侵襲や腱や靭帯損傷には,我々の広範な再生医学能力を利用して対処している。私たちの運動医学製品は、外科手術のためのNuShieldと、的確な軟組織修復のためのNuShieldと、外科環境における開放性創傷処置のためのAffity、Novachor、PuraPly MZおよびPuraPly AMを含む。私たちは現在独立機関と私たちの直販チームを通じてこれらの製品を販売している。
2022年12月31日現在、全世界に約1,030人のフルタイム従業員を擁している。2022年12月31日までの1年間に、4億509億ドルの収入を創出し、3.236億ドルの運営費を生み出した。
競争優位
私たちはいくつかの独特な利点があり、これらの利点は私たちの成功に役立ち、私たちの未来の成長のために良い地位を築いていると信じています
2
私たちの業務戦略
私たちは次の戦略が私たちの未来の成長に重要な役割を果たすと信じている
3
業界の概要
治癒しにくい傷や筋骨格損傷に関わる医療条件に重点を置いている。癒合困難は様々な原因によって引き起こされる可能性があり、各種の組織と解剖領域で発生する可能性もある。癒合損傷は通常炎症段階を超えられない癒合と関係があり、慢性傷口或いは損傷、持続的な炎症循環、及び正常な組織癒合を実現できない。生物膜と他の感染条件も傷口の癒合を乱す過程において重要な役割を果たしている。再生医学は天然或いは自然組織にできるだけ近い組織を産生し、損傷組織を置換し、欠陥を充填或いは置換することを目的とした技術の集合である。医師の基本的な傷口癒合過程に対する理解の深まり、及び人口と人口の健康傾向による全身合併症の流行程度の増加に伴い、全身癒合問題を招き、これらの技術に対する需要は増加している。
我々の製品は再生医学技術を用いて、高度創傷看護(慢性創傷)と外科(急性創傷)と運動医学市場で解決策を提供する。業界報告と管理層の推定によると、2021年に私たちの定位可能な高度創傷看護および外科および運動医学市場の総額は約240億ドルであり、その中で高級創傷看護の定位可能市場は100億ドルと推定され、外科および運動医学の定位可能市場は140億ドルと推定される。2021年の高級創傷ケア市場では、治療の49%が高級創傷包帯を使用し、18%が生物学的製剤を使用し、21%が外部創傷治癒装置を使用し、13%がより伝統的な創傷ケア包帯を使用する。バイオ製品中の代用皮膚市場は2021年の11億ドルから2026年には20億ドルに増加すると予想されている。外科と運動医学市場の中で、2015年の手術/急性創傷子市場は91億ドルを占め、慢性炎症と退行性疾病子市場は約38億ドルを占め、腱と靱帯損傷子市場は約10億ドルを占める。
この2つの市場の主な成長原動力は
4
高級創傷ケア市場
創傷は公共衛生に対して巨大かつ日々深刻な負担をもたらし、衛生保健システムの重大な費用でもある。傷口は2つの主要なタイプ、慢性と急性に分けられる。推定によると、全世界で毎年約8000万人の患者は慢性と急性傷口の苦痛を受け、手術切り口を含まない。慢性創傷の複雑さと治療時間の長さにより、慢性創傷は大部分の費用を占めている。
慢性創面
慢性傷口とは包帯などの伝統的な治療方法を用いて周囲を治療した後も適切に癒合していない傷口である。慢性的な傷には
これらの慢性創傷の潜在的病因は異なるが,細胞レベルでは癒合失敗をきたす多くの問題は同じである。これらは制御されていない炎症過程,細胞タイプの不足,細胞分泌の増殖因子を含み,これらは癒合に重要であり,細胞シグナル経路の中断を招く。
傷口の相対流行率
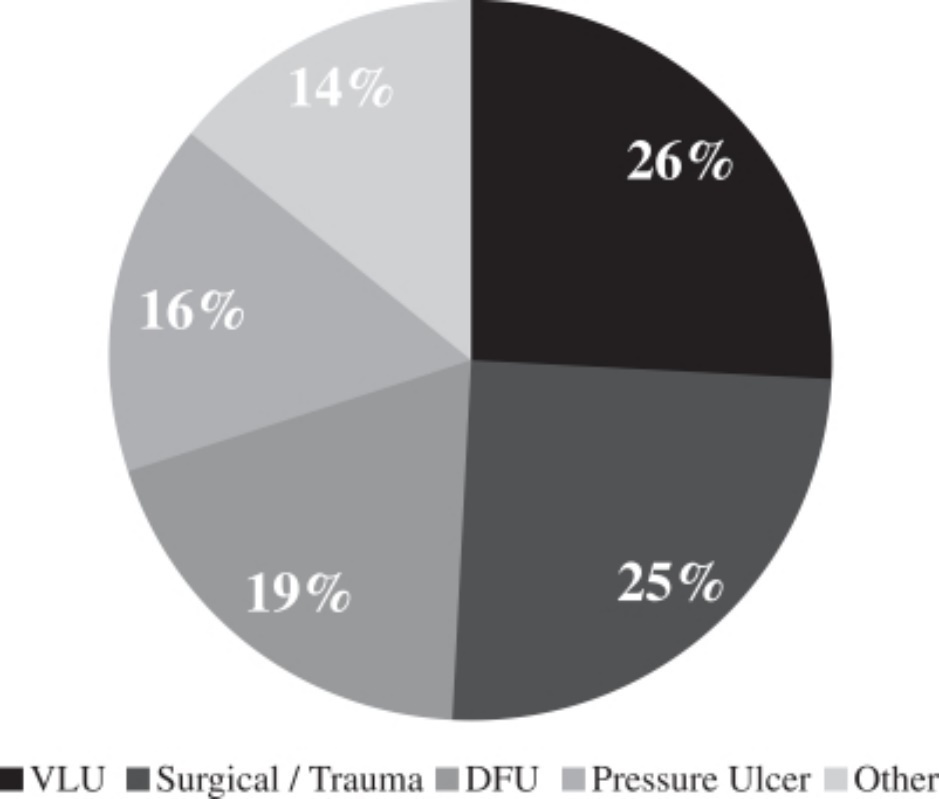
著者らの外来創傷看護機構の顧客は各種のタイプの傷口に直面しており、これらの傷口は異なる解剖位置と潜在的な原因を持っている。2008年6月から2012年6月までの傷口看護センターのデータに対する回顧コホート研究に基づいて、病院外来傷口看護センターの傷口タイプ分布は以下の通りである
傷のタイプの分布*

*2013年9月に発表されたJAMA皮膚病学的遡及性コホート研究に基づきます。
私たちの傷口の看護製品の組み合わせ範囲が広いため、私たちの製品はこれらのすべての傷口タイプの慢性と急性傷口を処理することができます。
5
私たちの解決策は
創傷看護市場は、包帯、ガーゼと軟膏などの伝統的な包帯、および機械設備、先進包帯および生物製剤などの先進的な創傷看護製品を含む。これらの先進的な創傷ケア製品は,伝統療法では十分に解決できない慢性と急性創傷を対象としている。我々の製品は主に代用皮膚に分類され,高度な創傷看護市場の生物製品分類に属する。
Grand View Researchのデータによると、2021年の世界の高級傷口看護市場は約100億ドルと推定され、2028年までに4%の複合年間成長率(CAGR)で増加すると予想されている。この市場はいくつかの製品分類を含み、先進的な創傷包帯、負圧創傷療法或いはNPWTなどの外部創傷癒合設備、皮膚代替品と成長因子などの生物製剤及びその他の伝統的な創傷包帯を含む。これらの製品種別の2021年の大まかな内訳は以下のとおりである。
高級創傷ケア市場
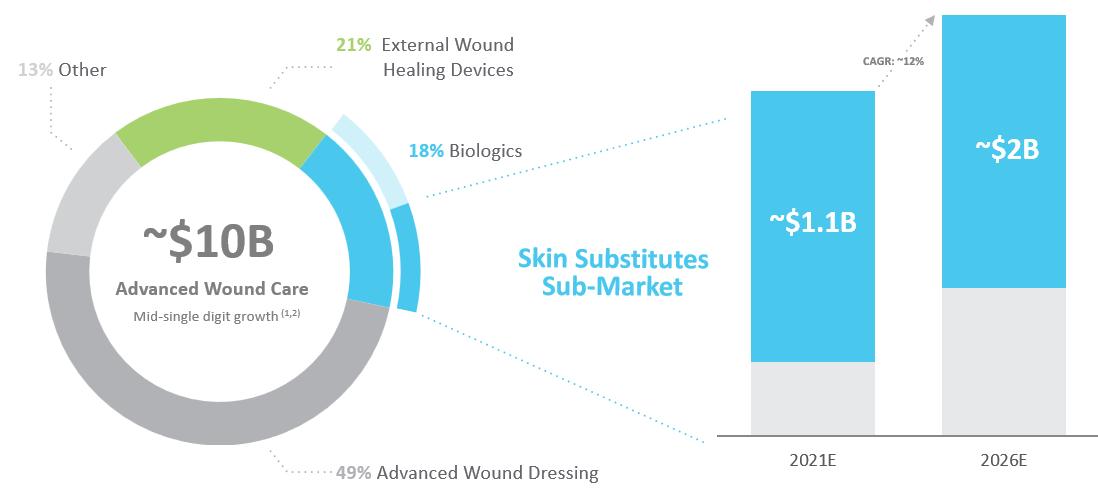
創傷生物製剤は高級創傷看護市場の中で最も小さい細分化市場の一つであるが、増加が最も速く、革新レベルが最も高い。BCC Researchのデータによると、2021年、皮膚代替品と成長因子を含む全世界の創傷生物製品市場は約17億ドルと推定され、その中で皮膚代替品は約62%を占めている。皮膚代替品、即ち皮膚欠陥を覆い、癒合を支持する生物工学或いは生物移植片は、高級創傷看護市場の増加が最も速い分類の一つである。バイオ製品中の代用皮膚市場は2021年の11億ドルから2026年には20億ドルに増加すると予想されている。将来を展望すると,傷の治癒が困難な患者が他の療法から代替品治療に移行するにつれて,代用皮膚市場は引き続き増加することが予想される。
医師たちはこれらの製品の使用を理解し,現在販売されている他の製品と比較してメリットを理解し,支払者は医師により費用対効果のある治療法を使用するよう激励し,患者にはより有効な治療案が求められ,先進的な創傷ケアが米国以外でより一般的になっているため,この市場は急速に増加することが予想される。従来療法に対する代替品のメリットを支持する臨床的エビデンスが増加し続けるにつれて,これらの製品の採用率が増加すると信じられている。皮膚代替品はすでに改善した慢性と急性傷口の癒合率を示し、全体のコストは現在の看護標準より低い。我々が依頼したペアリングコホート研究では,Apligraf治療を受けたDFUの医療保険治療コストは5,253ドルであった(p=0.49)看護基準よりも低く、デマグフィー治療を受けたDFUは、6991ドルであった(p=0.84)看護基準を下回った。ライスらに会います。“生体工学細胞技術による糖尿病足潰瘍治療を受けた医療保険患者の経済結果”。ジェイMed Econ。2015年;18(8):586-95。
私たちの製品は、NPWTや成長因子のような他の代替品や他の先進的な創傷ケア製品と競争している。皮膚代替品としての市場的地位から,生物膜や他の高い感染リスクのある傷の治療に適した抗菌特性を有しており,我々のPuraPly AM製品も抗菌包帯と競合している。抗菌傷製品は歴史的に毎年10億ドルを超える市場を代表している。私たちは抗菌スキンケア代替市場の市場リーダーであり、私たちの全面的なマーケティングと教育活動を通じてこの市場の拡張を支援しています。
6
最後に、代用皮膚市場の浸透率はまだ低い。BioMed GPSのデータによると,世界には790万個を超える傷があり,その中には米国で370万個,医療看護が必要であり,治癒困難な傷に分類されており,伝統的な療法が成功する可能性は低い。人口高齢化および糖尿病、肥満および心血管疾患の増加は市場成長を推進する--これらはすべて悪い血管が慢性的で癒合しにくい傷口の感受性を増加させることと関係がある。皮膚代替品を含む先進的な創傷看護製品の広範な需要と公認されたメリットにもかかわらず、潜在市場全体の規模に対して市場浸透率は依然として低い。私たちの内部見積もりでは、今日完全に潜在的な市場に進出すれば、アメリカだけで代用肌の年収が90億ドルを超える可能性があることを示しています。
私たちは採用率が増加するにつれて、私たちは代替品市場で有利な地位にあると信じている。BioMed GPSによると、私たちはアメリカをリードする代替品会社で、私たちは経験豊富な販売チームを持っており、臨床医、創傷看護センター、病院と深い関係があります。私たちも一連の異なる製品があります。傷口の癒合過程で異なる種類の傷口を処理します。
外科運動薬品市場
推定によると、世界では毎年3.13億例の外科手術がある。医療保険受益者の分析により、外科傷口看護は最も高い傷口看護費用と関係があり、その次はDFUである。熱傷を含む創傷は外科的/急性創傷領域に含まれる。推定によると、全世界で毎年500万人以上が創傷性損傷で死亡している。他の医療分野と比較して運動医学がかなり増加しているのは,運動関連傷害の発生率の上昇や,身体健康に対する認識が増加しているためである。2028年までに、著者らの製品の最近の潜在外科と運動医学市場価値は約140億ドルであり、年間複合成長率は約6%であると推定されている。

外科/急性創傷
外科的および/または急性創傷は皮膚の急速な破裂をきたす創傷であり,下の組織破裂をきたすこともある。急性傷口は創傷性傷口、例えばかすり傷、引き裂き、貫通傷と熱傷であってもよく、外科傷口(移植片、裂開、壊死性軟組織感染)であってもよい。慢性傷口と異なり、慢性傷口は通常癒合するが、生物要素により停滞し、急性傷口は非常に深刻である可能性があり、身体の正常癒合能力を超えている。生物被膜とその他の感染性疾病、特に高い感染リスクを有する急性傷口、例えば開放性骨折は、急性傷口の癒合に対して挑戦を構成する可能性もある。BCC Researchのデータによると,米国だけで15万人以上が侵襲的傷害で死亡し,毎年300万人以上が非致命的傷害で死亡している。毎年18万人が熱傷で死亡し、致命的な熱傷ではなく、発病率の主要な原因であると推定されている。アメリカ熱傷協会のデータによると、毎年約45万人のアメリカ人が深刻なやけどを受け、4万人を超える人は入院と高度な医療看護が必要である。
7
腱と靱帯損傷
腱と靱帯損傷は活発と高齢化人口によく見られる整形外科疾患である。アメリカでは毎年約25万例の肩袖修復手術がある。また,2015年には米国で約4万人の外来患者がアキレス腱修復を行った。再断裂と再手術は依然として非手術治療の重要な問題であり、4.8%のアキレス腱修復症例と25%以上の回転筋カフ修復症例に発生する。糖尿病や肥満および年齢などの併存疾患は癒合失敗や再破裂のリスクが高いことと関連している。再生組織ステントは支持腱、靱帯と他の軟組織の癒合に応用できる。Technavioのデータによると,毎年再生組織ステント市場は10億ドルを超えると推定されている。
運動医学−整形生物学
我々の現在の製品の組み合わせは,高度な創傷ケアや外科的創傷ケア市場における様々な臨床専門や創傷タイプに適用されているが,将来的に再生生物製剤市場への再参入を目指している(BLAによるRENUの承認が得られれば)。整形外科生物製剤は1種の生物物質であり、筋肉骨格系の損傷を治療するために用いられる。整形生物製品は長期的に障害に至る筋肉骨格疾患と損傷した人の治療に用いられる。ほとんどの筋肉骨格損傷は娯楽とスポーツ活動によるものだ。患者は若い人群と専門運動に従事する人群、及び通常退行性疾患と慢性病の治療が必要な老年群を含む。市場では手術量の増加が出現し、一部の原因は合併症と慢性炎症と退行性疾患の発生率が高く、例えば骨関節炎(OA)と筋腱炎である。依然として活発な日々の増加と高齢化を維持するOA患者は引き続き非手術或いは低侵襲代替方案を求める。過去数十年間、米国における膝蓋骨関節炎の罹患率は上昇しており、これは人口高齢化と日々深刻化する肥満流行を反映している。
慢性炎症と変性疾患(将来のチャネル機会)
慢性炎症性と退行性整形外科疾患はますます普遍的になり、一部の原因は人口高齢化と糖尿病と肥満などの共病レベルが比較的に高い。骨性関節炎は関節に最もよく見られる慢性疾患であり,米国では約2700万人が影響を受けている。骨性関節炎は身体の複数の関節に影響を与えることができ、その中で膝関節炎は最もよく見られる治療法である。成人2人に1人は生涯に膝骨性関節炎の症状が出現する。その他の慢性炎症性疾患、例えばアキレス腱と肩袖筋腱病と足底筋膜炎もますますよく見られる。著者らが解決を求めている多くの他の疾病と類似し、慢性炎症と退行性整形外科疾患は通常喫煙、肥満と糖尿病などの要素と関連している。2016年には900万人がステロイドやヒアルロン酸を含むこれらの疾患や他の関連疾患を注射治療したと推定されている。Grand View Researchのデータによると、2020年、全世界の慢性炎症性と退行性整形外科市場(VisCosupplementation Market)は38億ドルを超えた。
私たちの解決策は
私たちの複数の再生技術プラットフォームは、外科と運動医学市場の様々な需要をカバーする広範な製品の組み合わせを構築することができると信じている。短期内に、著者らの重点は臨床医師に傷口カバーと解決方案を提供し、胎盤に基づく開放性急性傷口と腱及び靭帯外科修復プログラムの軟組織癒合解決方案を支持することである。長期的には,我々は我々の注目点を深化させ,慢性炎症と退行性疾患に解決策を提供する予定であり,特に現在Renuに対する第三段階臨床試験で示されている骨性関節炎である。入院病院,ASC,診療所環境における製品の組み合わせで患者のニーズを満たす予定である。2028年までに、私たちの製品の最近の定位外科と運動医学市場はそれぞれ約140億ドルであり、年複合成長率は約6%であると推定した。
外科/急性創傷に対しては,代用皮膚が癒合率の向上と癒合状況の総コストを低下させる上で有効性を示して市場採用を継続しているため,網羅的な技術的組み合わせを持っていると信じている。我々の胎盤に基づく技術(Affacy,Novachor,NuShield)と抗菌特性を有する代用皮膚代替品(MuraPly AM)は組成と臨床応用レベルに大きな差がある。これらの製品属性に加えて、私たちの現在の市場リードと高いレベルの組織能力に加えて、私たちはこの成長していく市場の中で高い割合のシェアを占める能力を持つ自信があります。
腱と靭帯修復において、伝統的な手術方法は機械固定に依存して損傷組織に一時的に接近し、自然癒合過程は永久修復を招くと仮定する。治癒が損なわれた患者は必要な組織構造が生じず,時間の経過とともに受け入れられない失敗率を招く可能性がある。我々は胎盤に基づく技術がより多くの臨床証拠と技術の採用を獲得することに伴い、著者らは現在の製品(NuShieldは手術バリアとして)と著者らの局部コラーゲン手術基質(軟組織強化のためのMuraForce)の面で有利な地位にあると信じている。
骨関節炎とその他の退行性疾患、及び軟組織損傷、例えば腱病と筋膜炎は、現在すべてステロイド或いはHA注射によって治療されている。しかし,ステロイドは限られた時間で痛みを緩和することしかできず,さらに痛みを低下させることが証明されている
8
時間が経つにつれて、いくつかのタイプの組織は潜在的な状況を悪化させるだろう。医管局の治療効果の証拠が疑問視され、かなりの割合の患者が医管局の治療に反応しないことは明らかである。これらの侵襲性の小さい治療失敗の患者の選択は限られており、全関節置換を含む手術干与が必要である可能性がある。
正生物療法は伝統的な治療の有効な代替案であることが証明された。その抗炎症と癒合促進作用のため、それらは機械的干与を超え、損傷組織の癒合過程を支持し、通常もっと速い癒合時間ともっと短い入院時間を招く。DBMと同種異体移植以外に、骨生物学市場は骨形態発生蛋白、HA粘性補充、合成骨移植代替品と幹細胞療法を含む。私たちの現在の製品ラインは胎盤技術(RENU)に基づく運動医学解決方案を含む。ますます多くの臨床と科学的証拠により、これらの製品、特に矯正生物製剤、外科応用における潜在力は、これらの製品がますます多く採用されることを招いた。
私たちの製品
高度な傷ケア
高級創傷看護(慢性傷口)市場において、著者らは広範な細胞と非細胞創傷看護製品の組み合わせの開発と商業化に焦点を当て、癒合損傷の最初の兆候から傷口閉鎖まで患者を治療する。私たちの製品キットはVLU、DFU、褥瘡などの様々な慢性創傷の治療に役立ちます。
著者らの製品の組み合わせの広さと深さは医者が個別の傷口看護患者の需要を満たすために解決方案をオーダーメイドできるようにした。すべてのタイプの傷は通常予測可能な癒合段階を経て,炎症から細胞増殖に進展し,最後に再構築して正常皮膚を形成する。この過程で,創部は様々な原因で停滞する可能性があり,通常は炎症段階である。これらの原因は生物被膜或いは感染、制御されていない炎症過程、細胞タイプと細胞分泌の増殖因子の不足を含み、これらの細胞は癒合と細胞シグナル経路の撹乱に重要である。
生物膜の解決はどの傷も治癒する重要な一歩であることが認識されるようになってきた。生物膜は密に堆積した微生物群落から形成され,これらの微生物群落は創傷表面に付着し,自己産生した細胞外ポリマーやEPS基質に包まれている。生物膜は少なくとも78%の慢性創傷に存在し、すべてのタイプの創傷の癒合を抑制することができる。PUraPly AM製品を用いて癒合障害の最初の兆候が認められた場合に医師に連絡し,広域抗菌剤PHMBにより抗菌バリアとしてバイオフィルムの制御を支援した。バイオフィルムの減少と過剰な炎症反応の制御が治癒をもたらすのに十分であれば,多くの場合のように,MuraPly AMは創傷閉鎖を実現するために必要な唯一の製品である可能性がある。もし潜在的な癒合問題が依然として存在すれば、著者らは一連の生物活性製品と胎盤に基づく創傷カバーを提供し、特に各種の傷口のサイズとタイプのためにオーダーメイドする。
私たちの先進的な創傷看護製品は外来病院の傷口診療所と医師事務室とASCsに応用されている。次の表は私たちの全面的な高級創傷ケア製品シリーズをまとめました
製品(発表年)
|
説明する
|
監督管理
|
臨床応用
|
|
“親和性”(2014)
|
新鮮羊膜創面は、天然組織中の生細胞、増殖因子/サイトカインと細胞外基質蛋白を保存する。 |
361 Hct/P |
慢性と急性創面 |
|
|
|
|
|
|
“ノワジョ”(2021)
|
天然組織中の生細胞、増殖因子/サイトカイン、および細胞外マトリックスタンパク質が保存されている新鮮な絨毛創傷カバー。 |
361 Hct/P |
慢性と急性創面 |
|
|
|
|
|
|
Apligraf(1998年)
|
生物工学生細胞療法は、2種類の生細胞タイプ、角質形成細胞と線維芽細胞を含み、広範なサイトカインと増殖因子を産生することができる |
PMA |
VLU;DFU |
|
|
|
|
|
|
9
製品(発表年)
|
説明する
|
監督管理
|
臨床応用
|
|
|
|
|
デマガフ(2001)*
|
生体工学製品は、生のヒト線維芽細胞を生体吸収性足場に植栽し、ヒトコラーゲン、細胞外基質、タンパク質、サイトカインおよび増殖因子を産生する |
PMA |
DFU |
|
|
|
|
|
|
|
|
“NuShield”(2010)
|
脱水した胎盤組織創面カバーを保存して、羊膜と絨毛膜を含む自然組織のすべての層を保持し、上皮層とスポンジ/中間層を無傷に維持する |
361 Hct/P |
慢性と急性創面 |
|
|
|
|
|
|
|
|
“PuraPly AM”(2016)
|
抗菌バリアは,精製した天然コラーゲン基質と広域ポリヘキサメチレンビグアニジンまたはPHMB抗菌剤からなる。一連の伸長は、追加のコラーゲンマトリックス層およびより高いレベルのPHMBを含むPuraPly XTを含む。製品の追加の開窓(EF)バージョンは、順応性および液体排水を増加させることを可能にする。 |
510(k) |
慢性と急性創面(3つを除く)研究開発度やけど) |
NuTech Medicalが発売され,2017年に有機生成会社に買収された。
*Smith&Neppewによって発売され、2014年に有機生成会社によって買収されました。
親和性とノロ
親和性とNovachorは新鮮であり、羊膜と同種異体絨毛移植創面カバーであり、慢性と急性創面の看護に適している。この2つの製品はいずれも生存羊膜細胞を含む少数の胎盤組織製品の一つであると信じており、それらの独特な点は、製品を新鮮な状態で低温保存し、乾燥あるいは凍結することなく、それらの固有の利点と構造を保持していることである。PHSA第361節の規定によれば、これらの製品は、ヒト細胞、組織、および細胞および組織に基づく製品、またはHCT/Pと呼ばれ、これらの製品は、第361節のHCT/Ps、または単に361 HCT/Psと呼ばれる。親和力は2014年にNuTech Medicalによって発売され、2017年に買収された。Novachorは2021年12月に打ち上げられた。
アプリグラブ
Apligrafは生物工学二層スキン代替品であり、これまでPMAの許可を得た唯一のVLUとDFUの治療のための製品である。Apligrafは1998年に発売され、その組織工学構造を通じてより速い癒合とより完全な傷口閉鎖を推進し、この構造は外層保護性皮膚細胞(ヒト表皮角質形成細胞)と内層細胞(ヒト真皮線維芽細胞)を含み、内層細胞はコラーゲン基質に含まれている。ApligrafはVLUを治療する有力な代用皮膚製品であり,その有効性は広範な臨床歴史に基づいて構築され,出荷量は100万台を超えている。Apligrafも1つ目であり,無作為対照試験(RCT)において患者VLU創部組織の著明な変化を証明する唯一の創部癒合療法であり,不癒合遺伝子マップから癒合パターンへの移行を示していると考えられる。Apligrafは,創傷に生きたヒト皮膚細胞,増殖因子,細胞が産生する他のタンパク質やコラーゲン基質を提供することにより,癒合過程において積極的な役割を果たしている。
デマコフ
ダーマフォードはヒト皮膚線維芽細胞から培養した真皮代替品であり、PMAのDFU治療に承認されている。この製品はSmith&Neppewによって2001年に発売され、2014年に私たちに買収され、損傷した傷口床の修復に役立ち、癒合を促進した。皮下移植中の生細胞は多くの同じタンパク質や増殖因子を産生し,健康皮膚の癒合反応を支持する。FDAがモニタリングしたRCTが癒合の面で伝統的な療法より優れていることを示した以外は
10
実世界の電子健康記録と医療保険データに基づくDFUS研究はすでに競争相手の傷口看護製品と伝統療法と比べ、それは更に高い臨床治療効果と価値を持っていることを証明した。溶解性の一時的なメッシュ布を含み、身体自体の治癒プロセスの一部となるので、週(最大8回)で12週間以内に使用することができ、その間に創傷から除去する必要はない。2021年第4四半期、デマグラフトは生産を停止し、2022年第2四半期、デマグラフトは販売を一時停止し、これはデマグラブ製造を新たな製造施設に移すか、第三者メーカーを招聘する計画の一部であり、大量の長期的なコスト節約をもたらすと予想される。デマグラブが利用できない間、私たちは顧客がデマグラブの代わりにApligrafを使い、デマグラブの販売を一時停止することは私たちの純収入に実質的な影響を与えないと予想している。
ヌシェット
NuShieldは脱水胎盤組織創傷カバーと手術バリアであり、局所或いは手術は標的組織に応用し、自然癒合を支持する。NuShieldは361 HCT/Pとして制御し、中間または海綿層、およびそれらの天然構造と調節蛋白を含む羊膜と絨毛膜の天然構造を保持する我々の独自のLayerLocプロセスを用いて処理した。NuShieldには様々なサイズがあり,創傷カバーとして使用可能であり,多様なサイズの慢性や急性創傷の自然治癒を支援し,室温で保存可能であり,賞味期限は5年である。NuShieldは2010年にNuTech Medicalによって発売され,2017年に買収された。
PuraPly抗菌剤
PuraPly抗菌剤,あるいはMuraPly AMは,創部における生物阻害や過剰炎症による挑戦に対応するために開発された。抗菌バリア皮膚代替品として、PuraPly AMは精製天然ブタI型コラーゲン基質であり、局所広域スペクトル抗菌剤ポリヘキサメチレンビグアニジン(PHMB)が埋め込まれている。MuraPly AMは2016年に発売され、一部と全層創傷、褥瘡、静脈潰瘍、糖尿病潰瘍、慢性血管潰瘍、トンネル/破壊された傷口、手術創傷、創傷創傷、ドレナージ創傷、一度と二度の熱傷を含む多種の創傷タイプを管理するための510(K)の許可を得た。PHMBと天然コラーゲン基質の結合は生物閉塞の管理に役立ち、同時に様々な傷タイプの癒合を支持し、その重症度或いは持続時間にかかわらず。一連の伸長は、追加のコラーゲンマトリックス層およびより高いレベルのPHMBを含むPuraPly XTを含む。製品の追加の開窓(EF)バージョンは、順応性および液体排水を増加させることを可能にする。PHMBを含まないMuraPlyの510(K)除去も開発·獲得し,PuraPly MZを含む“PuraPly”と呼び,抗菌剤を必要としない患者に用いた。
外科運動医学
外科および運動医学市場では、私たちは外科/急性創傷治癒と筋肉骨格損傷(腱修復および慢性変性疾患を含む)の支持に焦点を当てている
11
骨関節炎です。私たちのこの市場の製品は主に入院と外来病院そしてASC環境に使われています。次の表は私たちの外科と運動医学製品シリーズの主要な製品をまとめています
製品(発表年)
|
説明する
|
監督管理
|
臨床応用
|
|
|
|
|
|
|
|
|
|
|
|
|
“新盾”(2010)
|
脱水した胎盤組織バリア膜を保存して自然組織のすべての層を保持し、羊膜と絨毛膜を含み、上皮層とスポンジ/中間層を無傷に維持する |
361 Hct/P |
支持腱,靭帯,その他の軟部組織損傷修復のバリア膜 |
|
|
|
|
“親和性”(2014)
|
新鮮羊膜創面、天然組織中の生細胞、増殖因子/サイトカインと細胞外基質蛋白を保存する |
361 Hct/P |
急性手術創面の創面被覆 |
|
|
|
|
“ノワジョ”(2021)
|
天然組織中の生細胞、増殖因子/サイトカイン、および細胞外マトリックスタンパク質が保存されている新鮮な絨毛創傷カバー。 |
361 Hct/P |
急性手術創面の創面被覆 |
|
|
|
|
“PuraPly AM”(2016)
|
広域PHMB抗菌剤を用いて天然コラーゲン基質を精製した。一連の伸長は、追加のコラーゲンマトリックス層およびより高いレベルのPHMBを含むPuraPly XTを含む。製品の追加の開窓(EF)バージョンは、順応性および液体排水を増加させることを可能にする。 |
510(k) |
外科開放創面処理における抗菌バリア |
|
|
|
|
“フォース”(2019)
|
PuraForceは軟組織強化応用のための生物工学豚コラーゲン外科基質であり、510(K)適応に適用され、体内のすべての腱の増強に用いられる。MuraForceは単位厚さの高い生物力学的強度を持ち,肢体応用の理想的な選択となっている。2019年にこの製品を発売しました |
510(k) |
腱修復手術における縫合や縫合アンカーによる修復に適した軟部組織の補強 |
|
|
|
|
PuraPly MZ(2022)
|
PuraPly MZは粉末またはゲルの形態で深い層およびトンネル状創傷への適用を可能にする微粉化されたPuraPly粒子バージョンである。PuraPly MZは外科手術における開放性創傷の処置に適している。 |
510(k) |
慢性と急性創面(3つを除く)研究開発度やけど) |
12
NuShield、Affity、Novachor、MuraPly AM、MuraForce、PuraPly MZ
私たちは外科と整形外科用のNuShield製品を販売しています。NuShieldは手術バリアとして使用することができ、軟組織修復を支持するために、敷設または被覆バリアとして使用することもできる。バリア膜として使用する場合、このような胎盤組織の天然生物学的特性は、軟組織欠損の癒合、特に癒合が困難な位置または挑戦的な患者集団において役立つ可能性がある。AffacyとNovachor製品を急性手術創の創面カバーとしてマーケティングし,MuraPly AM製品を外科的開放創処置の抗菌バリアとしてマーケティングした。PuraForceは生物工学豚コラーゲン外科基質であり、軟組織補強応用に応用されている。PuraPly MZは粉末またはゲルの形態で外科環境中の開放創傷への適用を可能にする微粉化されたPuraPly粒子バージョンである。
同種異体骨移植製品
我々の同種骨移植製品はFiberOSとOCMPを含む寄付されたヒト体骨から来ている。これらの製品の各々は骨空隙充填剤として使用され、主に脊柱融合および足首融合などの骨融合を必要とする骨融合のために整形外科および神経外科の用途に使用されている。FiberOSは脱鉱皮質線維,鉱化皮質粉と脱鉱皮質粉の混合物であり,OCMPは凍結乾燥した同種異体松質(海綿状あるいはメッシュ)と脱鉱皮質混合物である。
製品ライン
我々は高度な創傷看護と外科および運動医学市場のための強力な製品パイプラインを開発している。私たちが行っている努力は私たちの全面的な製品の組み合わせを深化させ、より多くの臨床応用を満たすことができると信じています。次の表は、私たちのパイプライン製品とそのビジネス発表の潜在的なスケジュールをまとめています
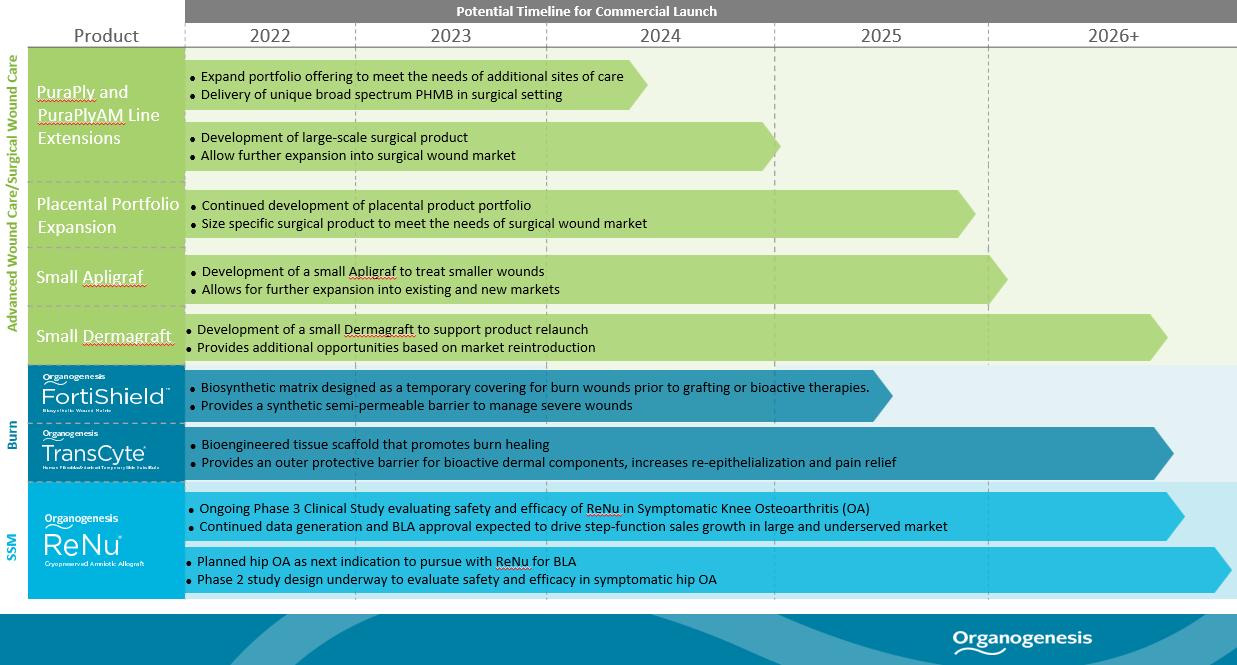
PuraPlyとMuraPlyAM回線の拡張
PuraPly製品の組み合わせは精製された天然コラーゲン基質からなる。PuraPly AMは抗菌バリアであり,精製した天然コラーゲン基質と広域PHMB抗菌剤を利用している。研究開発における生産ライン延長線の設計目標は,我々の知識と専門知識を利用して製品を開発し,より多くの看護地点のニーズを満たすことである。
胎盤ポートフォリオ拡張
13
私たちは胎盤製品が開発中です。設計目標は,手術創市場の需要を満たすために,より大きな室温で貯蔵された賞味期限の長い移植片の開発である。
私たちの研究開発チームは引き続き私たちの胎盤技術プラットフォームからより多くの製品概念を研究し、開発し、私たちの業務開発チームと協力して、より多くの製品のライセンスや買収機会を評価します。
ApligrafとDerMagraftシリーズ延長線
我々は,より多くのサイズのApligrafとDermagraftを開発するための2つの開発プロジェクトを行っている.その目標は、DFUのようなより小さい創傷の臨床使用を最適化するために、少なくとも1つの追加のより小さいサイズの各製品を開発することである。生細胞に基づく製品のこれらのタイプの変更には大量の開発と検証が必要であり,FDA PMA付録がこれらの変更を承認する必要がある。そのため、開発プロジェクトは商業製品を発売するのに数年かかると予想される。デマグ生産ライン延長線の製造は製品の製造と供給能力の完成に依存する。
FortiShield
FortiShieldは、ナイロン生地に接着された半透ケイ素膜とコラーゲンコーティングからなる生合成創傷マトリックスであり、塗布部位に付着し、外部環境へのバリアを提供し、過度な浸出を可能にする柔軟なドレッシングを提供する。FortiShieldは、一時的な創傷カバーとして使用し、止血確立後にきれいな創傷除去創傷に湿潤な創傷治癒環境を提供することを目的としている。この製品の主な適応は二度熱傷の過渡創面基質としてである。より多くの慢性的で急性の傷の応用があります510(K)の出願が提出されており、FDAは、この出願を検討している追加の試験を要求している。この製品が510(K)の承認を得た場合、急性および慢性創傷用途のために商業的に発売する予定である。これはまた製品の製造と供給能力の完了にかかっている。
TransCyte
TransCyteは熱傷癒合を促進する生物工学組織ステントであり、すでにPMAの許可を得て深さ二度と三度熱傷の治療に応用されている。私たちはShireからこの製品を手に入れました。以前はSmith&Neppew社で販売されていました。TransCyteはすべての深刻なやけどの傷の問題を解決するために、私たちの製品の組み合わせを補充した。TransCyteは1種の柔軟で耐久性のある製品であり、熱傷患者に生物活性真皮成分、外部保護バリアを提供し、再上皮化を増加し、痛みを緩和することができる。TransCyteは競争の限られたかなり大きな市場機会を解決すると信じており、現在市場では他の2種類のPMAの許可を得た製品だけがTransCyteと直接競争することができ、しかも1つの競争製品のみが生合成バリアを含んで傷口を保護する。私たちは2022年に熱傷外科医と一緒に臨床体験計画を行い、閉鎖されたLa Jolla施設で生産された製品の供給が限られている。全面的な操業は製造能力の完成にかかっている。
Renu
RENUは凍結保存した懸濁液であり,ヒト羊水組織と細胞から採取し,羊水から調製し,オフィス使用に用いた。それはすでに軟組織の癒合を支持するために応用され、特に退行性疾患、例えば骨関節炎、及び関節と腱損傷、例えば腱病と筋膜炎である。RENUの最初の目標適応は,膝骨性関節炎に関連する症状の治療である。RENUによる膝骨性関節炎治療の臨床研究が発表されており,その安全性の兆候を示している可能性が考えられ,潜在的な治療効果が1年を超えることが示唆されている。2021年5月31日、FDAのいくつかの製品に対する実行猶予期間が終了したため、Renuの商業流通を一時停止しました。これらの製品の以前の市場名は361 HCT/Psでした。われわれは,BLAの膝骨性関節炎に関連する症状の治療の承認を支持し,RENUの臨床研究を行い,股関節OAに関連する症状の治療を支援するためのRENUの臨床研究を継続している。RENUは,より多くの骨関節炎の治療や組織再生応用のための可能性がある可能性があると信じており,このような承認された用途のいずれかの前に,さらなる臨床評価が必要である。Renuは2015年にNuTech Medicalによって発売され、2017年に私たちに買収された。
現在行われている臨床研究
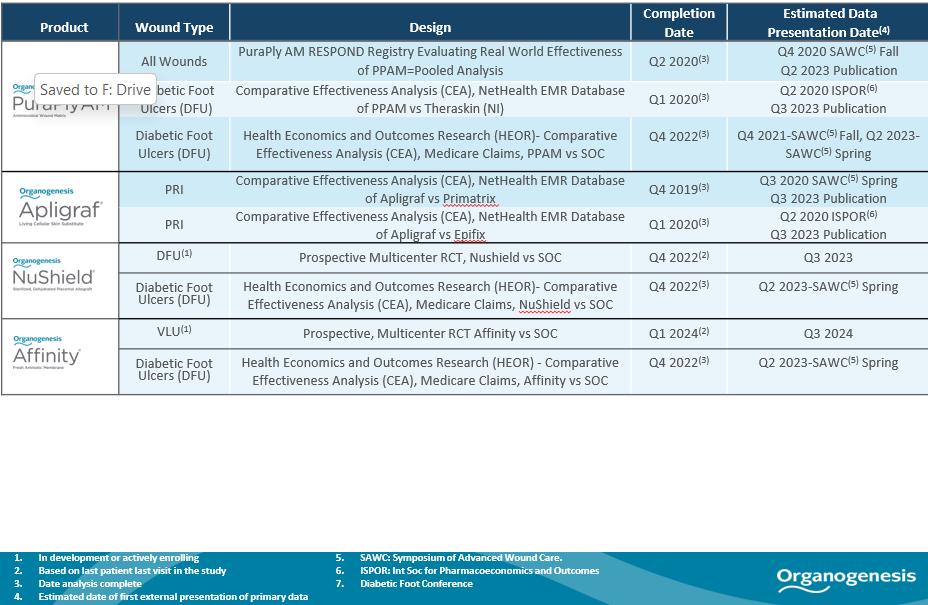
強力で全面的な臨床と現実世界の結果データを収集することは、競争力のある製品の組み合わせを開発し、私たちの競争する市場へのさらなる浸透を推進する重要な構成要素であると信じている。私たちは進行中の三つの展望的試験と6つの比較有効性研究を持っている。私たちは引き続き私たちの高度な創傷看護と外科と運動医学製品のための臨床データを生成することに投資し、時間の経過とともに、これらのデータは医師との販売努力、支払人との精算動態を増強すると信じている。以下の表に我々の高度な創傷看護および外科と運動医学製品の最新の臨床研究状況をまとめた。ここで用いたように,pの値は統計的なメトリクスである.P値が低いほど,臨床試験や研究の結果は実験異常ではなく統計的意義を持つ可能性がある。一般に,統計的意味があると考えられるためには,このような結果はp値を持たなければならない
14
高度な傷ケア
15
運動医学

臨床研究精選を発表しました
PuraPly AM
BuraPly AMを用いた307名の皮膚創傷(急性慢性創傷を含む)に対する前向き、多中心コホート研究では、52、62および73%の創傷はそれぞれ20、26および32週目に治癒し、創傷治癒の中央値は17週間であった。研究した傷口は下腿静脈性潰瘍67例(22%)、糖尿病性足潰瘍62例(20%)、圧力性潰瘍45例(15%)、術後傷口54例(18%)、その他の傷口79例(26%)であった。全307個の傷のうち、ベースライン面積と深さの減少が60%を超える発生率はそれぞれ81%と71%であった。また,ベースライン体積が75%以上減少した創部発生率は85%であった。
MuraPly AM多中心コホート研究から307名の患者の2つのサブグループ分析が発表された。静脈性下腿潰瘍(n=67)列では,8,12,16,24,32週の創部閉鎖率はそれぞれ33%,42%,45%,53%と73%であった。中位閉鎖期間は22週間であった。ベースライン面積と深さ減少が60%を超える発生率はそれぞれ78%と70%であり、その中の87%の体積減少は75%を超えた。
圧力損傷群(n=45)において、4、16、24と32週の傷口閉鎖率はそれぞれ5%、39%、49%と62%であった。すべての傷口癒合の中位時間は32週間であった。ベースライン面積と深さ縮小の60%以上の発生率はそれぞれ78%と64%であり、その中の約82%の傷口の体積縮小は75%を超えた。
親和性
すでに発表された糖尿病足潰瘍のための無作為対照臨床試験において、親和性と看護標準(n=38)と看護標準(n=38)の単独使用を比較し、親和性と看護標準群の60%の傷口は12週間で癒合し、標準看護群の傷口は16週間で癒合した傷口の割合は38%(p=0.04)であり、親和性と看護標準群の傷口は16週間で癒合した傷口の割合は63%であり、標準看護群の傷口の閉鎖率は38%(p=0.04)であった。また,82%の創面面積は標準看護群の58%より60%以上減少し(p=0.02),65%の創面深さは60%以上減少し,標準看護群の39%より39%(p=0.04),81%の創面体積は75%以上減少したが,標準看護群の創面は58%減少した。
16
ヌシェット
NuShieldを用いて50個の創傷(VLU(n=14),DFU(n=24)および他の創傷(n=12))を処置した発表された臨床経験の臨床研究では,45創傷(90%)の創傷閉鎖率は60%~100%であった。すべての創面の完全閉鎖(或いは癒合)の中位時間は102日(14.6週)であり、16週と24週の癒合率はそれぞれ56%と73%であった。NuShield治療を受けたDFUは,中位癒合期間は120日(17.1週),16週と24週の癒合率はそれぞれ43%と59%であった。NuShield治療を受けたVLUは,中位癒合期間は90日(12.9週),16週と24週の癒合率はそれぞれ56%と85%であった。NuShieldを用いて治療した他のすべての創面(褥瘡,不癒合の外科手術,虚血,混合病因および不癒合の切断を含む)の中位癒合時間は48日(6.9週),16週と24週の癒合率はそれぞれ57%と100%であった。
Renu
200名の患者無作為対照の多中心単盲検研究では,RENU(n=68),市販ヒアルロン酸(HA)(n=64),生理食塩水(n=68)を用いた膝蓋骨関節炎症状の治療効果を比較した。HAや生理食塩水を用いた患者と比較して,Renu治療を受けた患者は,HAや生理食塩水を用いた患者よりも12カ月のフォローアップ期間で視覚シミュレーションスコア(VAS)疼痛が有意に減少し,OMERACT−OARSIの方が効率的であったと報告されている。疼痛は膝関節損傷と骨関節炎結果スコア(“Koos”)疼痛スコアを用いて評価され,3カ月と6カ月ではRENUによる疼痛改善幅はいずれもHAより大きかった。
RENU(同種羊膜懸濁物、“ASA”)による症候性膝骨性関節炎(NCT 04636229)の治療効果を評価するために、474名の患者を含む3期展望性、多中心、二重盲検、プラセボ対照研究が行われている。患者は1:1の割合でランダムに分配し、単回関節内注射(IA)2ミリリットルASA(プラス2ミリリットル生理食塩水)或いは4ミリリットル生理食塩水を受ける。主要な治療効果の終点はASAとプラセボ治療を受けた患者の6ケ月時のWOMAC疼痛スコアとベースラインの変化の差として定義されている。現在の第三段階マルチセンター試験の設計と統計方法は200名の患者の研究結果に基づいて通知と最適化を行っている。2023年3月、我々は、膝骨性関節炎に関連する症状を処理するために、我々の第3段階臨床試験に必要な474人の患者の50%からの予め指定された中期分析データの陽性結果を報告し、この試験は、サンプル量の6カ月の主要終点を再推定することに重点を置いている。中期分析によると、独立データモニタリング委員会は試験を修正せず、継続して行い、サンプル量を変更しないことを提案した。DMCはまた,セキュリティデータはRenuの既知のセキュリティプロファイルと一致することを発見した.
17
TransCyte
TransCyteによる部分深度熱傷の安全性と有効性に関する発表された研究では,TransCyte治療を受けた患者の90%以上の創面上皮化の平均期間は11日であったのに対し,スルファジアジン銀クリーム治療を受けた患者は18日(p=0.002)であった。
これまでに発表されたFDA承認製品の臨床研究
われわれはまた大量の臨床証拠を蓄積し,われわれFDAが承認した製品ApligrafとDermagraftの効果を証明した。我々は,他の高度な創傷ケアや外科運動医学製品に投資して類似したデータを生成し続け,時間の経過とともに医師との販売努力や,支払人との精算動態を強化すると信じている。私たちの製品ApligrafはVLUとDFUの治療のためにFDAの承認を同時に得た唯一の製品です。私たちの製品デマゴフもDFUSに対するFDAの承認を得ました。以下に製品ごとの主要データを支援する要約と,現在行われている臨床研究について述べる。ここで用いたように,pの値は統計的なメトリクスである.P値が低いほど,臨床試験や研究の結果は実験異常ではなく統計的意義を持つ可能性がある。一般に,統計的意味があると考えられるためには,このような結果はp値を持たなければならない
アプリグラブ
最初にApligrafに対して2つの重要な研究を行い、この製品の全層と部分層VLUとDLUの治療における安全性と有効性を証明した。その結果,Apligrafはこれらの適応に対するFDAの承認を得た。著者らはすでにいくつかの追加的な研究を行い、この製品の安全性と有効性に更なる臨床証拠を提供し、最近の比較有効性、コスト効果と作用機序の研究を含む。
Pivotal FDA登録試験
DFUの適応に対して,Apligraf治療DFUの多中心前向き無作為対照試験を行った。288人の1型および2型糖尿病患者が入選し、彼らの足底DFUは全層または部分厚であった。慢性傷口は治療前に癒合して30%未満の患者は臨床試験に参加する資格がある。前6週間では,すべての患者の潰瘍は杖や車椅子でアンロードされ,閉鎖後少なくとも4週間以内にカスタマイズされた減圧靴を履いていた。平均潰瘍サイズは2.97 cm22.83 cmです2Apligraf群と対照群。Apligraf群の潰瘍の平均持続期間は12カ月,対照群は11カ月であった。
時間の経過とともに,Apligrafは創部完全閉鎖の発生率において従来療法よりも有意に有効であった。12週間の治療により,Apligrafプラス通常療法(清創,生理食塩水包帯,完全アンロード)で治療したDFUでは,56%(112例中63例)の潰瘍が完全に閉鎖していたのに対し,通常療法のみ(96例中36例)で潰瘍が完全に閉鎖した割合は38%(36例)であったp=.0042)。Apligrafプラス通常治療のDFU傷口の100%癒合の中位時間は65日であり、伝統的な治療を単独で使用した潰瘍の中位癒合期間は90日であった(p=.0026).
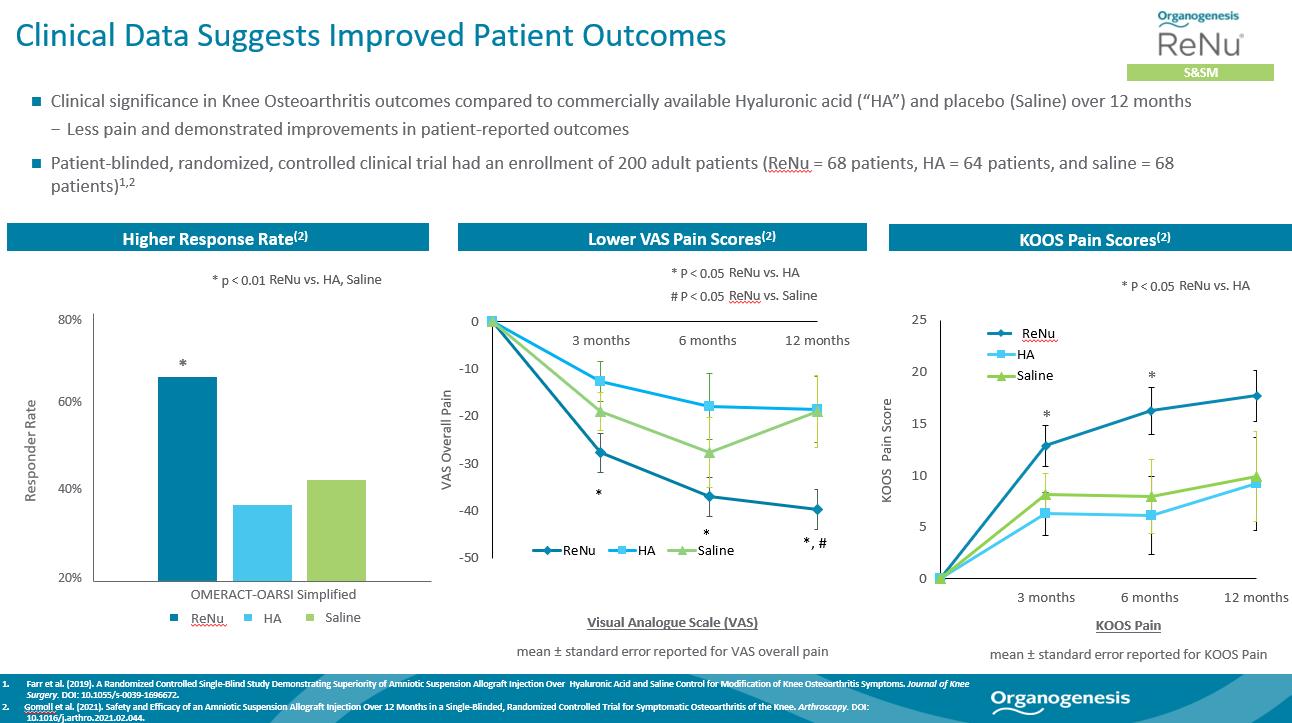
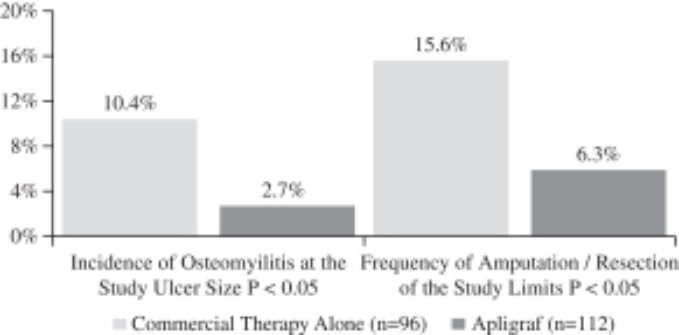
再発は癒合耐久性を測る重要な指標であり,この研究ではApligrafで治療した潰瘍の96%の潰瘍は6カ月以内に閉鎖していたが,対照群の割合は87%であった。この研究の重要な結果の1つは,骨髄炎と切断/切除の有害事象発生率の低下を認めたことである。Apligraf治療を受けた患者は統計学的意義がある(p<.05 lower incidence of osteomyelitis at the study ulcer site vs. compared to patients treated with conventional therapy six months. apligraf-treated required significantly fewer amputations or resections limb>p <.05 compared to patients treated with conventional therapy at six months. the primary results of study are presented in figures below.>
傷の100%閉鎖の発生率 |
傷が100%治癒した中位時間 |
|
|
18
骨髄炎の縮小と切断/切除
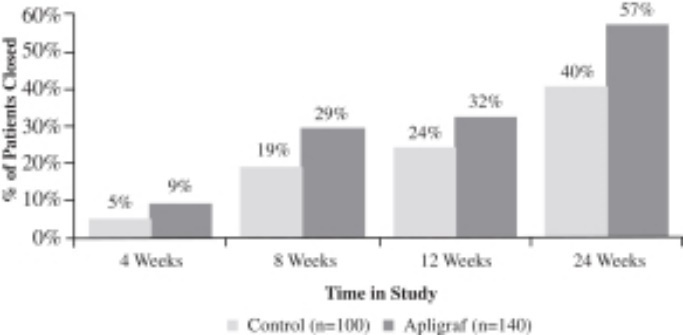
VLUの肝心な試験において、Apligrafの治療効果は展望性、平行群、ランダム、対照、多中心研究で行われ、240名のVLU患者に関連している。Apligraf併用加圧治療を受けた被験者を積極的に治療した被験者と比較し,亜鉛ペーストガーゼと加圧治療を同時に制御した。Apligrafプラス圧迫療法は24週間で創部完全閉鎖に有効であった(57%対40%,p=.022).1年以上持続したVLU患者(n=120)では,Apligrafプラス圧迫療法が24週間前に創部完全閉鎖を達成した有効率は対照群の2倍強(47%比19%であったp=.002)。研究の主な結果を図に示す。
すべての患者は100%閉鎖に達しました
有効性と経済学研究を比較する
我々はNet Healthの創傷専門家が収集したデータに対する独自のアクセス権限を用いて,Apligrafに対して4つの比較有効性研究を行った®電子カルテか電子カルテデータベースです。Net Healthの創傷ケアソフトは全米1000以上の創傷ケアセンターで使用されている。統計専門家や先行臨床医との協力の下で,EpiFix(MiMedx所有),TheraSkin(Bioventus,Inc.所有),OASIS(Smith&Neppew所有),PriMatrix(Integra所有)を含むApligrafと他の代用皮膚の治療結果を分析した。すべての4つの研究により、Apligrafは全体的な治癒率と癒合時間を向上させた。例えば,Apligraf治療を受けた患者の24週間以内の癒合状況は,EpiFix治療を受けた患者より53%相対的に改善した。すべての4つの研究は同業者評議の定期刊行物に発表された。
民間経済コンサルティング会社分析グループは、ApligrafとDermagraftを受けた連邦医療保険患者の経済結果を評価し、伝統的な看護を受けた患者と比較して、実世界の医療サービス利用率と関連コストを評価する研究を行った。一致したApligrafおよび伝統的な看護患者対502対、ならびに222対の一致した皮下移植および伝統的看護患者対のデータを分析した。適合した伝統的な看護患者と比較して,外来サービス利用増加のコストはApligrafとDermagraft患者の低い肢切断率,少ない在院日数と少ない急診科で診療所で相殺された。したがって,18カ月のフォローアップ期間において,DFUを有するApligrafとDermagraft患者の1人当たりの医療費は,それぞれ一致した従来の看護患者(Apligraf 5,253ドル)よりも低かったp=0.49と低い患者1人当たり、デマグは6,991ドル(p=0.84)が低かった).これらの知見は,ApligrafやDermagraftを用いたDFUの治療は,高価な医療サービスの利用を減らすことで,全体的な医療コストを低減することが可能であることを示唆している。
作用機序の臨床研究
Apligrafが慢性VLU癒合を促進する機序を解明するため、マイアミ大学ミラー医学院皮膚科と皮膚外科は無作為対照試験を行い、その中の24名の全快していないVLU患者は標準看護(圧迫療法)或いはApligraf結合標準看護の治療を受けた。組織生検標本を収集する
19
それぞれ治療前と治療後1週間にVLU辺縁を取り,試料に対して遺伝子発現とタンパク質解析を行った。分析により、Apligrafは癒合不能から癒合可能までの組織反応を誘導し、炎症と成長因子シグナルの変調、角質形成細胞の活性化、及び慢性潰瘍損傷状態に関連するシグナル減弱に関連する。これらの方式により,Apligrafアプリケーションは慢性不癒合潰瘍微小環境から急性癒合傷口に類似したユニークな癒合環境への転換を協調した。
デマコフ
大きな重要な臨床試験の結果,デマグはDFUを治療するIII系医療機器として承認された。314人の患者は、通常の治療と組み合わせた皮下移植の安全性および有効性を評価し、通常の治療のみを受けた対照群と比較するための展望性無作為対照試験に参加した。伝統的な治療方法は鋭い創傷除去と潰瘍の洗浄、湿転乾ガーゼの使用、および治療的、減圧靴の使用を含む。踵や前足の足底DFUが1 cm以上であれば,試験スクリーニングを受ける資格がある220 cm以下2それは.スクリーニング訪問中,患者は通常治療を開始した。DFUが次の2週間以内に50%以上縮小せず、患者がすべての他の組み入れおよび排除基準に適合する場合、患者はランダムに2つの治療群のうちの1つに分割される:デマグプラス通常治療または通常治療のみ。デマグ群の患者は週に1回デマゲットの応用を受け、8週間に及ぶ常規治療を受けた。実験の主な終点は,DFUを12週間で完全に閉じた利点である.
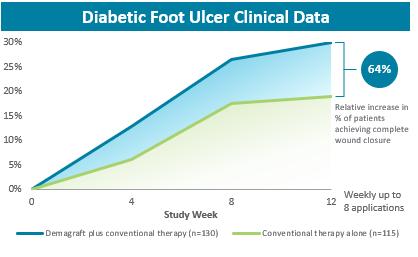
Pivotal FDA登録試験
この重要な臨床試験では,従来療法単独と比較して,デマグと従来療法を週8週間投与したDFUが12週間で100%閉鎖した割合が64%増加した。通常の治療のみを受けている患者と比較して,ダーマフォード群で治療を受けた患者は100%閉鎖している可能性が1.7倍高い。これらの結果は統計的に有意な改善を示した。皮下移植群と対照群の不良イベントの発生率は全体的に一致し、最もよく見られる不良イベントはDFU部位の感染、DFU部位以外の感染、意外傷害と皮膚機能障害/水泡である。しかし、DFU部位で感染が発生した患者は皮下移植治療群で対照群より明らかに低く、それぞれ10.4%と17.9%であった。実験では,デマグ使用に関する不良実験室結果は認められず,不良装置の影響の報告もなかった。また,この試験中やこれまで治療を受けてきた患者では,デルマ移植を受けた患者の免疫学的反応や拒絶反応は報告されていない。試験の主な治癒データを以下の図に示す。
12週間以内に完全に治癒した患者の割合
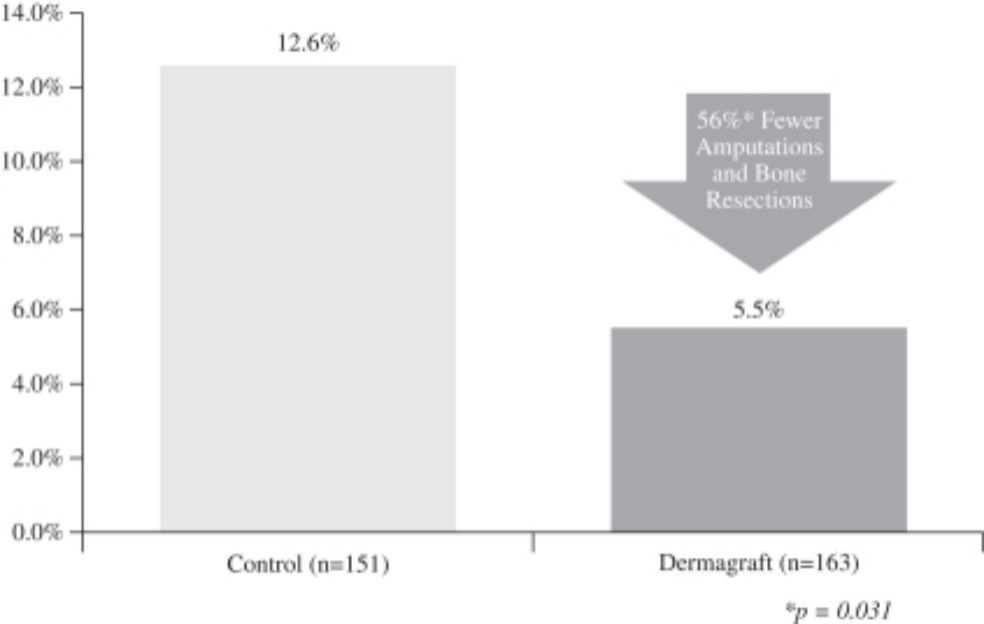
ある専門研究後の分析では、対照群(それぞれ12.6%と5.5%、p=0.031)と比較して、デルマ移植治療を受けた患者の切断或いは骨切りの発生率は有意に低下することが確定された。実験では,デマグ使用に関する不良実験室結果は認められず,不良装置の影響の報告もなかった。また、ありません
20
この試験中あるいはこれまで治療を受けてきた患者では,デルマ移植を受けた患者の免疫反応や拒絶反応が報告されている。切断または骨切除のデータを以下の図に示す。
潰瘍関連切断を経験した患者の頻度や
12週の骨切除
有効性と経済学研究を比較する
EMRデータベースで収集したデータに対する独自のアクセス権限を利用したデマゴフとの3つの比較有効性研究を行った.統計専門家やリーディング臨床医との協力のもと,EpiFix(MiMedx所有),PriMatrix(Integra所有),Grafix(Smith&Neppew所有)を含むダーマグと他の代用皮膚を用いた治療結果を分析した。すべての3つの研究により、デマグは全体的な治癒率と癒合時間を向上させた。ある研究では,デルマ移植治療を受けた患者は24週間でEpiFix治療後52%よりも相対癒合改善を示した。
分析チームが医療保険者の中で行ったデマグリフィー経済学研究は,我々の製品−以前に発表されたFDA承認製品の臨床研究−Apligraf−比較有効性と経済学研究について上記の見出しで述べた。
プラットフォーム技術
著者らが長い間試してきた研究開発能力と成熟した技術プラットフォームは未来の応用に強力と適応性の強い製品ラインを提供した。私たちは経験豊富なプラットフォーム技術を持っています
21
商業インフラ
販売とマーケティング
私たちはアメリカで多面的な販売能力を確立するために多くの資源を投入した。私たちの現在の高級創傷看護製品の組み合わせは経験豊富な直販チームを通じて全米で販売されており、彼らは異なる看護場所の傷口看護に集中している。私たちは直売代表と独立機関の組み合わせを使用して外科と運動薬物市場にサービスする。2022年12月31日現在,我々は約360人の直販代表と約150の独立した代理機関を有しており,我々の目標端末市場で豊富な医療機器販売経験を持っている。これらの販売代表は、販売管理、販売運営および有効性、持続的なトレーニング、分析、およびマーケティングに専念する専門チームによってサポートされています。
私たちは従来、アメリカの市場開発とビジネス活動に集中していましたが、マーケティング登録を受け、商業と流通能力を発展させ、現在アメリカ以外のいくつかの国で製品を販売しています。私たちのApligraf製品 現在、スイスでの私たちの直販チームとサウジアラビアとクウェートの独立販売代理によって販売されています。私たちのNuShield製品はまたスイスの直販チームとクウェートの独立販売代理を通じて流通しています。私たちはメキシコでのデマゴフ製品のマーケティング登録を取得しましたが、私たちは今それを流通していません。さらに、私たちはEUを含む他の主要市場における私たちの製品の規制経路と市場潜在力を評価している。私たちのアメリカの直販チームによる売上はすでに私たちの収入の大部分を占めていて、私たちは引き続き私たちの収入の大部分を占めることが予想されます。
顧客支援サービス
私たちの経験豊富な精算支援チーム、私たちの医療と技術支援チーム、私たちの現場医学連絡チームが提供するサービスを含む内部顧客支援サービスを提供します。これらの基本的な支援サービスを内部で提供することにより、支援サービスと私たちの販売作業とを適切に結合し、顧客の全体的な体験を改善することができるので、競争優位性があると信じています。
研究と開発
我々の研究開発チームは再生医学製品の開発に豊富な経験を持ち,患者の結末を改善し,技術を簡略化し,プログラムを短縮し,入院とリハビリテーション時間を削減し,そのためコストを低減するための製品の設計に取り組んでいる。私たちはマサチューセッツ州カントン、アラバマ州バーミンガムとカリフォルニア州サンディエゴの実験室で研究と開発活動を展開した。私たちは、業界経験と再生医学大学院生プロジェクトを持つリーディングカレッジや大学で研修を受けることで得られた豊富な経験とスキルを持つ従業員を募集·維持している。私たちの内部従業員以外に、私たちは開発実験室、テスト実験室と専門臨床医師からなる外部ネットワークも私たちの研究開発過程で助けを提供します。我々は、FDA規制機関に提出された試験(例えば、BLA)を含む、複数の並行した多中心臨床試験を効率的に実行するために、我々の臨床運営能力を建設し続ける。私たちは私たちが提出した製品承認規制文書を準備して管理することができる強力な規制事務能力を持っている。
私たちのほとんどの製品の組み合わせは、Apligraf、私たちのPuraPly製品シリーズ、私たちのコラーゲン生体材料技術プラットフォーム製品シリーズ、および私たちのすべての胎盤ベースの製品は、私たちの3つの施設の研究開発チームによって開発されました。私たちは広範な規制分類を通じて製品を市場に出すことができて、これはFDAの私たちの製品の承認、あるいはPMAによるIII種類の医療設備の承認、BLAの生物製品の承認、510(K)のII種類の医療設備の承認、また私たちの361種類のHCT/P同種移植製品といくつかの国際登録を受けた製品を証明することができる。
製造業とサプライヤー
私たちは内部で私たちの主要な非胎盤製品を製造し、第三者メーカーを使用して私たちの胎盤製品を生産します。私たちの内部製造施設は著しい拡張能力を持っており、私たちの契約メーカーは有利な地位にあり、将来の拡張を支持できると信じています。
私たちは私たちの製品の高品質と信頼性を維持するために強力な内部コンプライアンスプロセスを持っている。私たちは、年間内部監査と規制機関の外部監査を組み合わせた方法で、私たちの品質管理実践を監視しています。我々はFDAで医療機器製造機関とHCT/P登録機関に登録している。私たちはまた
22
米国組織銀行協会(AATB)は、その組織銀行法規に基づいていくつかの州の許可を得た。私たちのすべての契約メーカーはFDAでHCT/P機関に登録し、AATB認証を受けています。
私たちは第三者原材料サプライヤーを利用して私たちの内部製造プロセスを支援する。私たちは厳格なプロセスを通じて私たちのすべてのサプライヤーを選択して、高品質と信頼性を確保し、拡大していく生産レベルを支援することができます。私たちの製品は承認されたサプライヤーが提供した原材料だけを使用します。品質を確認し、いかなるリスクを識別するために、私たちが認可した供給商会は所定の時間間隔で審査を行う。歴史的に見ると、私たちは私たちの生産要求を満たすために必要なサプライヤーや材料を探し、獲得する上で何の重大な困難にも直面していない。しかし、2019年第1四半期に、私たちのサプライヤーの生産問題のため、私たちは私たちの製品Affacyの生産を一時停止しました。これは私たちの親和性の唯一の供給者なので、これは私たちの生産能力を中断させた。私たちは代替サプライヤーを見つけ、2020年第2四半期に商業規模の生産を再開することができた。その後、追加の容量と供給上の冗長性を提供するために、第2の供給源を追加した。
私たちの製品の生産は十分な数のソース組織の可用性に依存しています。これは私たちの製品の主要な成分です。出所組織には寄付された人体組織、豚組織、牛組織が含まれる。私たちは、機関審査委員会が複数の病院で承認した協定と、私たちまたは私たちの契約メーカーが招聘した組織調達会社を通じて、寄付された人体組織を直接獲得します。私たちは二つの合格した豚組織供給者を持っていて、現在牛組織源がある。我々のこれらの組織に対する処理は,適用されているFDAの現行良好な組織実践やCGTP法規,AATB基準,米国農業部(USDA)の要求に適合しており,我々のサプライヤー源もこれらの要求を遵守することが求められている。
精算する
概要
私たちの顧客は主に病院、傷口看護センター、政府機関、ASCと医者事務室を含み、これらはすべてMedicare、Medicaidと他の第三者支払人の私たちの製品に対する保証と精算に依存しています。連邦医療保険や医療補助のような政府医療計画は、通常、保険基準が公表され定義されており、法律または法規によって確立された医療製品、サービス、プログラムの販売率が公表されている。非政府支払者には自己カバー基準があり,医療製品,サービス,プログラムの支払率について常に交渉されている。多くの保険はまた保険の前提条件として事前に許可されなければならない。また,米国では,管理的医療計画で医療を受ける加入者が増えており,使用状況を監視しており,メンバーが獲得した製品やサービスを得るためには事前に許可する必要がある可能性もある。政府や商業支払者のカバー面や精算が保証されず、変化する可能性がある。
連邦政府が援助した医療保険計画は,高齢者と障害者に医療保険を提供し,米国最大の第三者支払者である。連邦医療保険と医療補助サービスセンター(“CMS”)は連邦医療保険計画を管理し、連邦医療保険行政請負業者(“MAC”)を用いて指定された地理管轄範囲内でクレームを処理し、保険政策の制定と支払いを行う。CMSは代用皮膚に関する全国的な被覆範囲は確定していない。私どもの製品の保証範囲はA/B部分Macの管轄に属しています。私たちの製品の医療保険カバー範囲は、各MACによってその特定の管轄区域に基づいて決定されます。現在、すべてのMac、さらにはローカルカバー範囲決定(“LCD”)が公表されていないMacでさえ、外来病院、医師室、ASC設定での製品をカバーしています。
個人支払者は通常ですがいつも連邦医療保険や他の政府支払者に従って保険や精算決定を行うわけではありません。そのため、良好な医療保険カバー範囲と精算を実現することは時々個人支払者が製品のために有利なカバーと精算を獲得する重要な要素である可能性がある。現在、ほとんどの個人支払者はApligrafとDermagraft、そしていくつかはAffityをカバーしているが、ほとんどの支払人はPuraPly、PuPly AM、NuShieldのような他の多くの製品をカバーしていない。
現在、Medicareは医師室で私たちの製品を使用する場合、平均販売価格に基づいています(“ASP”)いくつかの製品のASPプラス6%を含む方法。外来病院とASC設定では,我々のすべての製品のMedicare支払いは申請プログラムの支払いに縛られている。
23
すべての連邦医療保険支払い金額は、私たちの製品の単独支払いを含めて、自動減額の影響を受けています。2020年、立法は2011年の“予算制御法案”(BCA)に基づいて実施された政府部分の2%の自動減支率を一時停止し、2%の自動減額でASPに基づく製品の最終支払率はASP+4.3%だった。2022年4月1日、1%の金利で再び自動減額が開始された。自動減額率は2022年7月1日から2%に回復した。2010年の法定現収払い法案(“法定現現金払い法案”)によると、国会で可決された法律の多くが赤字中立であることを求める自動減額を命じることもできる。2021年に1.9兆ドルの米国救援計画法案は2021年の国会会期終了時に法定PAYGOを触発する予定だが、国会は法定PAYGO自動減支令を2024年以降に延期する。
2023年の連邦医療保険医料金表(MPFS)の提案更新は、2024年または2025年に私たちのすべての製品を含むすべての代用皮膚代替品の単独支払いを停止するという提案を含む。連邦医療保険は,代用皮膚の費用を単独で支払うのではなく,代替品の支払いと申請手続きの支払いを束ねている。この提案の一部として,連邦医療保険は生物製品ではなくすべての代替品を供給品と見なし,我々を含めてスキンケア代替品を要求するメーカーに,2024年から発効する新たなHCPCSコードを申請する。2022年11月1日に発表された2023年MPFS最終ルールでは、CMSはこのバンドル提案を決定せず、将来的にはより多くのパブリックコメントを考慮するだろうが、彼らは再び同じ政策を提出するか、または将来的に私たちの業務および収入に影響を与える可能性のある他の提案を提示するかもしれない。
病院外来やASC設置で使用されている皮膚代替製品はすべてバンドル販売されている。今のところ皮膚代用品は通っていません。支出法案によると、PuraPly AMとMuraPlyは2018年10月1日から2020年9月30日までの間に直通身分を有し、その際に直通身分が満了する。2020年10月1日から、PuraPlyとMuraPly AMの支払いは、申請手続きの支払い料率にバンドルされる。
傷のケアのための皮膚代替物
我々のすべての高級創傷ケア製品は,医療保険精算目的の“代用皮膚”に分類されている。2014年,CMSは病院外来とASC設置に2段階の支払いシステムを用いて代用皮膚のための“バンドル”支払いを確立した。Medicare支払いシステムは、我々の製品(およびすべての代用皮膚)の支払いを代用代用のアプリケーション支払いにバンドルし、製品の適用および製品自体を含む一次支払いを提供者に支払うことをもたらす。高コスト製品に関するプログラム、すなわちコストがしきい値金額を超えた製品については、支払金額をバンドルすることがあり、敷居を満たしていない低コスト製品に関するプログラムについては、別のバンドル支払い金額がある。バンドル支払い料率は年に1回更新され,地理的位置に応じて調整される。現在、私たちのすべての創傷ケア製品は高コストバンドルに割り当てられているが、これらの製品が高コストバンドルに割り当てられ続けるかどうか、または各バンドルパッケージが支払いのレートを予測することはできない。また、バンドル販売政策の下で、既存の最も安価な製品を用いても、これらの製品がそれほど有効ではないという内在的な動機がある。
バンドル支払いのレートも地理的位置に応じて調整された。このような地域調整は地域間の支払い差が大きい可能性があり,病院支払率60%とASC支払率50%が地域の賃金指数を考慮して地域間で大きく異なる可能性がある。賃金指数調整は、調整されていない支払金額を増加または減少させることができ、1つの地理的領域の代替品製品やサイズを説明するのに十分でない精算費用を他の地理的地域で全額精算する費用を招く可能性がある。
連邦医療保険は、スキンケア代替品に対する二段階バンドル支払い政策を修正する可能性があると表明している。Medicareは2019年の例年に意見を求め、提案したルールはMedicare病院外来期待支払いシステム(OPS)とASC支払いシステム下の提案更新と政策変化と関係がある。連邦医療保険は特に2級バンドル政策を廃止すべきかどうかについて、すべての製品に単一バンドル政策を構築して意見を求める。しかしながら、CMSは、これらのコメントに応答するために、その代用皮膚のレベル2の支払い構造を何も変更していない。2023年の例年の提案規則では、CMSはその2段階の支払い構造の変化について意見を求めなかった。しかし、CMSが最終的にその2レベルの支払い政策のいかなる修正も完了すれば、これらの変更は私たちの製品の精算を減少させる可能性があり、使用率を低下させ、私たちの収入を減少させる可能性がある。さらに、どんな新しい政策も、私たちの競争相手の製品を使用する病院とASCの財務的インセンティブを招き、私たちの市場シェアと収入を減少させる可能性がある。
医師室の設定では、代用皮膚の支払いは製品管理の支払いに縛られていない。代替品は申請プログラムとは別に支払い,すべての生体代用品(我々を含む)の医療保険支払率はASP法1平方センチメートル当たり計算され,製品の総支払率は1平方センチメートル当たりASPの支払率に総cm数を乗じたものである。医師室の設定では,すべてのバイオスキン代替品(我々を含む)の医療保険支払い率はASP法に従って四半期ごとに更新され,地理的な位置では調整されない。すべての連邦医療保険支払い金額は、私たちの製品の単独支払いを含めて、自動減額の影響を受けています。BCAによると、自動減額は連邦部分の医療保険支払い金額を2%減少させた
24
20%の受益者共通保険金額は自動減額の影響を受けない。国会は2022年4月1日まで新冠肺炎突発公衆衛生事件期間中に自動減額を一時停止し,当時の減少幅は1%であった。2022年7月1日から自動減額率は2%に回復した。
ASPによる支払い方法は医師室にのみ適用される。しかし,将来的には,立法や法規により,連邦医療保険は医師室の代用皮膚代替品に対してバンドル支払いを行う可能性がある。実際、2023年のMPFSの提案更新は、2024年または2025年に私たちのすべての製品を含むすべての代替品の個別支払いを停止するという提案を含む。連邦医療保険は,代用皮膚の費用を単独で支払うのではなく,代替品の支払いと申請手続きの支払いを束ねている。2022年11月1日に発表された2023年MPFS最終ルールでは、CMSはこのバンドル提案を決定せず、将来的にはより多くのパブリックコメントを考慮するだろうが、彼らは再び同じ政策を提出するか、または将来的に私たちの業務および収入に影響を与える可能性のある他の提案を提示するかもしれない。
Medicareは2022年までに、医療機器としてFDAによって規制されているので、私たちのいくつかの製品のASPの報告を要求しませんでした。私たちは自発的に大多数の製品のASPデータを報告しました。しかし、2022年4月30日から、2020年総合支出法案に条項が制定されたため、2020年12月27日に法律に署名されたため、すべての製品についてASPを報告することが求められている。CMSには、必ずしも四半期ASPファイルでASPデータが報告されているすべての製品が含まれるとは限りません。現地のA/B部分Macは、そのASPが四半期ASPファイルに出現しなかった医薬品およびバイオ製品のためのローカル支払いを確立した。Macは、サプライヤーが提出したインボイス(卸売調達コスト(WAC)+3%)に基づいてそのような製品の費用を支払う権利があるか、または未公表のASPデータがあるかどうかを決定するためにCMSに連絡することができる。
2021年11月に公布されたインフラ投資·雇用法案90004条は、一定割合を超える使い捨て製品が患者に使用されず、仕入先に廃棄されている(“浪費”)場合、メーカーは連邦政府に返金を支払わなければならないと要求している。傷口の大きさは一致性と一致性が不足しているため、毎回の治療時にいくつかの皮膚代替品を捨てる可能性が高い。仕入先は、製品が個別に支払い(支払料率の一部ではない)を個別に支払う場合にのみ、廃棄された製品の報告を要求される。還付義務は2023年1月1日に施行され,CMSは強積金規則制定において税金還付を実施する方法を提案した。適用されるパーセント要件は、所与のカレンダー四半期に薬剤によって許容される総費用の少なくとも10%である。“特殊な場合”があれば、CMSは廃棄製品の払い戻しの適用割合を高める権利がある。この提案に対する意見を提出し,代用皮膚に関するユニークな状況を指摘し,CMSにより高い割合を適用することを求めた。2022年11月1日に発表された2023年MPFS最終ルールでは、CMSは、提案ルールで使用される水ゲルに例外を除いて、どの製品にもより高い適用率を適用することなく、より高い適用率(10%を超える)を適用するために、特殊な状況を有する可能性のある製品に関するより多くの情報を収集する予定であることを示している。CMSは2020年のデータに基づいて、我々の3つの製品であるApligraf、Dermagraft、PuraPlyの浪費率を推定した。2023年に計算された払い戻し金額がこれらの推定と似ているかどうかはわかりませんが、もしそうなら、私たちはリベートを借りてしまうかもしれません。これは実質的かもしれません, これらの製品には、他の製品もあるかもしれません。廃棄された製品の税金払い戻し責任の総金額はまだ分からない。
例年の2022年のMPFS最終規則の中で、CMSは10つの医療保健汎用プログラムコードシステム(HCPCS)を構築し、合成皮膚代替品のコードを記述し、その後更に多くの合成皮膚代替品コードを構築した。CMSは、代用皮膚のCPTコードの使用を報告する際に、Macにこれらのコードを個別に支払うように指示した。これらの製品の製造業者は、WACを確立したり、ASPを提出する必要がないので(連邦医療保険によって薬品または生物製品とみなされていないので)、MacのA/B部分Macは、領収書に基づいてこれらの製品の費用を支払う可能性が高い。私たちはこれが私たちの業務や収入にどのような影響を与えるのか分からない。
商業保険会社は病院,創傷看護センター,政府施設,ASC,医師事務室などの参加プロバイダと契約を結び,代用品を含む物品やサービスのために合意した支払料率を確立する。通常、これらの料率は料金表の形で存在するが、バンドル支払いの料率がある場合もある。多くの場合、費用スケジュールは、医師室ではなく、病院およびASCにバンドルされた連邦医療保険の支払いレートに基づいている。これらの費用率は保険会社、供給者、地域によって異なるかもしれない。
医療補助のカバー範囲と支払率および我々の製品の使用を許可する提供者(例えば足科医)のタイプの政策は各州の医療補助計画によって決定される。一部の州では、連邦医療保険のように、代替品の医療補助金と申請手続きの支払いを束ね、他の州では単独で支払う可能性がある。医療補助患者を治療するための製品の医療必要性については,州医療補助計画は異なる結論を得る可能性がある。
現在,3つのMac(Novitas,FCSO,CGS)はDFUやVSUの代用皮膚を治療するためのLCDを発行している。各提案されたLCDは、MuraPly製品を非保証製品としている。我々はすでに提案された政策についてコメントし、最終的なLCDでこの局面を打開しようと努力しているが、最終的にLCDにMuraPly製品がカバーされていない場合、このような非カバーは、MuraPly製品の利用率および私たちの収入に悪影響を及ぼす可能性がある。また,これらの提案された政策は,(1)傷に適用可能な代用皮膚の数を制限する,(2)治療中の代用皮膚代替品の交換を禁止する,
25
(3)我々の羊水製品が公衆衛生サービス法361条によって完全に規制されていることを証明するためにFDAの証明を得ることが求められる。これらの液晶ディスプレイは草稿形式で発表されているだけであり,いつ最終的に決定される可能性があるかどうかも分からず,どの最終液晶ディスプレイにどのような政策が含まれるかも分からない.もしその中のいずれかの提案が最終的に決定されたら、私たちの業務と収入は不利な影響を受けるかもしれない。
外科と運動医療製品
病院入院治療の外科および運動医学製品はMedicareによって精算され,Medicare重症度診断関連グループ(“MS−DRG”)に基づくバンドル支払いの一部として退院時にグループに割り当てられた。MS−DRGの分配は患者の予備診断に依存するが,他の二次診断やいくつかの外科手術の規定の影響を受ける可能性もある。いくつかのMS-DRGsは合併症や合併症を引き起こし、精算金額が増加する可能性がある。
MS−DRG支払率は、病院が患者の入院中に提供するすべてのサービスの総合的な予想支払いであり、Medicareクレームデータから計算された平均看護コストに基づく。MS−DRG支払いは、ごく少数の例外を除いて、すべてのサービス、製品、およびリソースを含む。外科手術中に使用される製品は、病院入院患者に提供される際に、通常単独でコードまたは支払いされない。MS−DRG支払いは症例率であり,特定患者のコストが症例率より低い場合には病院が利益を得,コストが症例率より高ければ病院は損失のリスクに直面する。
一部の個人支払者は、MS−DRGベースのシステムを使用して入院サービスの施設を精算する。
競争
私たちは競争の激しい市場で運営されており、これらの市場は急速な技術変革の影響を受けている。これらの市場の成功は主に製品の効果、製品の使いやすさ、製品価格、カバー範囲と十分な第三者精算、技術、臨床と精算支持の顧客支持サービス、及び顧客の製品に対する選好と忠誠度に依存する。
私たちは私たちの製品が証明した臨床治療効果、私たちの製品の組み合わせの広さ、私たち内部の顧客支持サービス、私たちの顧客関係と名声は私たちの競争相手よりもっと優位になると信じています。また,我々は,我々の361個のHCT/Pを除いて,PMA承認と510(K)承認製品を提供する数少ない再生薬物会社の一つであると信じている。
私たちの製品は主に皮膚代替品製品、胎盤に基づく技術製品、整形生物製品、その他の先進的な傷口看護と伝統的な傷口看護製品などと競争している。我々の競争相手はAmniox Medical,Inc.,Artrex,Inc.,Bioventus Inc.,Convatec Group Plc,Integra LifeSciences Holdings Corporation,MiMedx Group,Inc.,Smith&Nephew plc,3 M,Inc.である.
私たちはまた市場で競争し、合格した科学、管理、販売員を募集し、維持し、私たちの製品と相補的または私たちの業務に有利な技術と技術ライセンスを取得します。
私たちはいくつかの会社が私たちの現在と未来の製品分野で競争したり技術を開発していることを知っています。したがって、私たちは競争がまだ激しいと予想している。私たちの競争に成功する能力は、私たちが特許製品を開発する能力に依存し、これらの製品は適時に市場に投入され、十分な保険と補償を得て、費用効果があり、安全で効果的である。
知的財産権
私たちの成功は、私たちの独自技術および知的財産権を保護し、第三者特許および他の独自の権利を侵害することなく運営する能力があることにある程度依存する。私たちは商標、商業秘密、特許、著作権、および他の知的財産権と措置によって、私たちの業務に重要だと思う知的財産権を保護します。私たちはまた独自技術と持続的な技術革新に依存して私たちの競争地位を発展させて維持する。ノワ製薬株式会社がApligraf商標およびドメイン名の権利を付与する許可、およびResorba Medical GmbHまたはResorbaがPHMBを含むコラーゲン創面包帯の米国特許の独占的許可を付与する以外に、他のいかなる技術または知的財産権の材料許可もない。Resorbaの独占ライセンス条項によると、2018年と2019年には毎年少なくとも100万ドルの印税を支払い、2017年にはPuraPly AMの純売上高が続く低桁版税の一部として最低250万ドルの印税を支払うことが義務付けられており、ライセンスの期限は2026年10月に満了する特許の有効期限まで続く。以下のことが発生した場合、Resorbaにライセンス終了を書面で通知することもできます:(I)特許無効または(Ii)特許許可を必要とするすべての活動を停止し、他方に重大な違約が発生した場合、どちらか一方が許可を終了することができますが、通知と救済能力を遵守しなければなりません。また、
26
2018年7月1日に支払われた20万ドルを含む合計60万ドルの前金と維持費を2019年4月1日までの特定時間に支払う義務があります。許可証は譲渡可能だが、これ以上許可することはできない。
2022年12月31日現在、私たちは世界で36件の発行された特許を持っており、そのうち15件は米国特許です。2022年12月31日現在,我々は13件の保留特許出願を有しており,そのうち9件は米国で係属中の特許出願である.必要な維持費、年金、その他の費用を支払う場合、私たちが発行する多くの特許は現在、2027年から2042年の間に満了する予定です。このような特許の満了は私たちの業務に実質的な影響を与えないと予想される。しかも、私たちのApligraf、Dermagraft、NuShield製品を含む私たちの多くの製品は、私たちが発行した特許または出願されている特許のカバー範囲内にありません。我々の特許は、培養組織構造物の製造及び使用方法、多層生組織スタックの製造方法、培養組織構造物を用いた陥凹口腔歯肉の治療方法、胎盤膜を含む骨芽インプラントの製造及び使用方法、羊膜幹細胞液及び胎盤膜を用いた創傷治療方法、胎盤膜製剤を用いた骨格関節への軟骨産生方法、肝細胞増殖因子及びヒアルロン酸を含有する組成物及びこれらの組成物を用いたヒアルロン酸含有胎盤膜製剤の製造方法、ヒト産前幹細胞を採取又は増殖させる方法、低温顆粒胎盤膜保存方法、ヒト羊水を用いた慢性創傷や関節疾患の治療、及び調整可能な創傷掻爬器。我々が出願している特許は、顆粒化羊膜組織および羊膜由来細胞を用いた創傷治療方法、培養された単離された幹細胞および参照細胞源を用いた天然幹細胞集団の評価方法を含む他の分野を含む, 粘性補充剤組成物及びそれを用いた筋骨格炎症処理方法、創傷ケア処理及びその処理を用いたモデルシステム及び方法、抗炎症活性を特徴付けるモデルシステム及び方法、並びに豚コラーゲン組成物及びこれらの組成物を用いた方法。未解決の特許出願は発行された特許を生成しない可能性があり、発行されたか、または将来発行される可能性のある任意の特許が、私たちの現在または未来の製品を保護するか、またはいかなる競争優位性を提供するかを保証することはできません。“”というタイトルの部分を参照リスク要因-私たちの知的財産権に関するリスク“より多くの情報を得るために。
また、2022年12月31日現在、私たちは、10個の米国商標登録および11個の外国商標登録を含む、当社の業務および製品販売で使用される商標または商号を所有または所有する権利を有している。
私たちはまた、サプライヤー、従業員、コンサルタント、および私たちの固有の情報にアクセスする可能性のある他の人とのセキュリティプロトコルおよび独自の情報プロトコルを含む様々な方法で私たちの固有の権利を保護することを求めています。
政府の監督管理
FDAの製品登録、製造、普及に関する規定
我々が米国で販売している医療製品は,発売前にFDAの承認や承認を得ているか,あるいはFDAの発売前審査を必要としない。FDAマーケティング許可を得た上場製品は、クラスII医療機器の510(K)の許可またはIII型医療機器のPMAの承認のうちの1つによって達成された。これらの医療製品はFDAがPHSAやFDCAおよびFDAの実施条例に基づいて規制されている。他の事項に加えて、これらの連邦法規管理は、私たちに代わって、私たちの名義で実行または継続し、私たちの名義で実行され、以下の活動を継続します:生産、研究、開発、テスト、製造、品質管理、包装、ラベル、貯蔵、承認、広告と販売促進、私たちの製品を州間商業、記録保存、サービスと監督、苦情処理、製品修理またはリコール、有害事象報告、およびその他の現場安全是正措置に分配します。
FDA規制審査と承認手続き
適用免除または製品がクラスIデバイスでない限り、私たちが販売する各医療デバイスは、FDAの510(K)許可またはPMA承認を最初に取得しなければならない。さらに、上場装置のいくつかの修正は、PMA補充物510(K)の承認または承認を得る必要がある可能性もある。私たちは豚、牛、人体組織からの製品に対して必要な許可と承認を維持し、これらの製品はFDAによって規制されている。PuraPly、MuraPly AM、MuraPly XT、MuraPly MZ、およびMuraForceは、創傷包帯、口腔内バリア、および外科用メッシュのための510(K)規定に従って発売が許可された医療デバイスである。Apligraf(P 950032)とDermagraft(P 000036)デバイスの医療機器の承認も保持しており,両デバイスともFDAによって慢性創傷治療として承認されている。
27
医療機器と生物製品の製造について,FDAは製品の発売を承認する前に,製品製造とテストに使用する設備,施設,実験室とプロセスを監督·検査する。FDAの承認を得た後、私たちが製造設備、場所、または過程で重大な変更を行う場合、追加の規制審査または検査が必要になる可能性がある。私たちの医療機器製品に対して、私たちの製造プロセスはFDAの品質体系法規あるいはQSRに適合しなければならない。QSRは各設備メーカーに品質システムを構築し、実施することを要求し、このシステムの下で、メーカーは製造過程を監視し、記録を維持し、FDA規定とメーカーが設備に関連する書面規範とプログラムに符合することを表明した。その他の事項を除いて、これらの法規は、製造業者が生産前に性能要件を確立し、設計制御、テスト、記録保存、文書、製造基準、ラベル、苦情処理、管理審査に適した要求に従うことを要求する。
生物製品メーカーは、品質管理と品質保証、記録とファイルの維持を含む、適用されるcGMP法規を遵守しなければならない。製造業者や他のこのような製品の製造と流通に参加する人たちもまたFDAと特定の州機関に彼らの工場を登録しなければならない。国内でも海外の製造企業でも,最初に生産過程に参加する際には,FDAに登録して追加的な情報を提供しなければならない。臨床試験と同時に、会社は通常追加の臨床前研究を完成し、候補生物製品の物理的特徴に関する追加情報を開発し、cGMP要求に基づいて最終的に商業大量生産候補製品を決定するプロセスを決定しなければならない。PHSAは,外来製剤の導入や生物製品の使用による他の有害事象のリスク低減を支援するために,属性が正確に定義できない製品の製造制御の重要性を強調している。製造過程は一貫して高品質の候補製品ロットを生産することができなければならず、他の要求以外に、スポンサーは最終生物製品の特性、強度、品質、効力と純度をテストする方法を開発しなければならない。また,適切な包装を選択·試験し,候補生物製品が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
FDAは定期的に事前発表と事前通知されていないアクセスを行い、我々の設備、施設、実験室、プロセスを再検査し、法規に適合しているかどうかを確認します。このような検査には下請け業者の製造施設が含まれているかもしれない。検査後、FDAは、製造業者が適用法規および/またはプログラムを遵守できなかった場合を列挙し、違反が深刻かつ緊急であることが観察された場合、警告状を発行する483と呼ばれる報告書を発行することができる。製造業者が483または警告状に十分に応答していない場合、FDAは、製造業者に対して法執行行動をとることができ、または他の制裁または結果を適用することができる
しかも、私たちは医療機器報告規則と報告規則を修正して除去しなければならない。医療機器報告法規は、製造業者のデバイスが死亡または重傷を引き起こす可能性があり、または故障が発生した可能性があり、再び故障が発生した場合、死亡または重傷を引き起こす可能性が高い場合、製造業者はFDAに報告しなければならない。報告条例の修正および除去は、機器の健康構成のリスクを低減するため、または健康にリスクを構成する可能性のあるFDCA違反を修復するために、製造業者に現場修正および製品リコールまたは除去をFDAに報告することを要求する。もしこの設備が合理的な可能性があれば、深刻な健康不良の結果や死亡を招く可能性があり、FDAも強制リコールを命令する可能性がある。
あるヒト細胞、組織および細胞と組織に基づく製品、あるいはHCT/Psと呼ばれ、PHSA第361節の規制を受け、“第361節HCT/Ps”と呼ばれ、あるいは単に“361 HCT/Ps”と呼ばれ、他のHCT/PsはFDAの医療機器および/または生物製品に対する規制要求によって制限される。361 HCT/Pと規制された製品は、FDAの事前承認または承認なしに商業流通を行うことができる。21 CFR 1271.10によれば、361 HCT/Pとして規定され、上場前審査を免除するために、HCT/Pは、同種の用途のために最小限に処理されなければならず、他の物品(水、結晶または殺菌、保存または貯蔵剤を除く)と混合して製造することはできない。HCT/Pはまだ必要です
28
全身的影響がなく、生細胞の代謝活動にも依存せず、その主要な機能を発揮するか、または全身性作用を有する場合、自己使用、一次または二次血親のための同種異体使用、または生殖用途のための。親和性とNuShieldは全体的に21 CFR 1271.10での相関基準を満たしていると考えられる。361 Hct/Pガイドによれば、私たちは、AffityおよびNuShieldのラベルおよびマーケティング声明について、創傷カバーとして使用することが意図されていることを明確にし、したがって、361 Hct/P節に適合する。しかしながら、FDAは、私たちの結論に同意しない可能性があり、Affity、NuShield、または私たちが現在所有しているか、または将来市場が所有している可能性のある任意の胎盤ベースのシーツ製品が発売前に承認または承認されることを要求する可能性があり、これは、これらの製品のマーケティングを混乱させ、私たちを規制制裁に直面させ、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性がある。第361節HCT/Pは、cGTP、ドナー資格決定要件、有害事象報告、および広告およびラベル要件を含むFDAの特定の法規によって制限される。CGTP条例は、回収、ドナースクリーニング、ドナー試験、加工、貯蔵、ラベル貼付、包装、および配布のすべてのステップを含むが、これらに限定されないHCT/Pを製造するための方法、施設および制御を管理する。
人体で任意の生物候補製品をテストする前に、候補製品は臨床前テストを経なければならない。臨床前試験は、非臨床研究とも呼ばれ、製品の化学、効力、毒性と調合に対する実験室評価、及び候補製品の潜在的安全性と活性を評価し、治療使用のために理論基礎を確立する体内研究を含む。臨床前試験の進行はGLPを含む連邦法規と要求に適合しなければならない。臨床試験と同時に、会社は通常いくつかの長期の臨床前テスト、例えば生殖不良事件と発ガン性の動物テストを完成しなければならず、また薬物化学と物理特性に関するより多くの情報を開発し、cGMP要求に基づいて最終的に商業大量生産薬物の技術を確定しなければならない。製造過程は一貫して高品質の候補薬物ロットを生産することができなければならず、その中で、メーカーは最終薬物製品の特性、強度、品質と純度をテストする方法を開発しなければならない。
臨床試験スポンサーは臨床前研究の結果、及び生産情報、分析データ、任意の利用可能な臨床データ或いは文献、及び提案された臨床方案をFDAに提出し、新薬申請(IND)の一部としなければならない。FDAは、臨床試験の前または期間のいつでも、安全考慮または規定に適合しない理由で、生物候補製品に対して臨床封印を実施することができる。FDAが臨床一時停止を強制すれば,臨床試験はFDA認可なしに再開されず,その後FDA認可の条件下でのみ再開される可能性がある。したがって,INDの提出によりFDAが臨床試験の開始を許可するか,あるいは開始すると,このような試験を一時停止または終了するという問題はないとは判断できない。
臨床試験は,合格した調査者の監督の下でボランティアや患者に生物候補製品を服用することに関連しており,これらの調査者は通常,試験スポンサーに雇用されたりコントロールされていない医師である。臨床試験は書面の研究案に基づいて行われ、臨床試験の目標、用量手順、被験者の選択と排除基準、および被験者の安全性を監視するためのパラメータは、いくつかの有害事象が発生した場合に臨床試験を停止する停止規則を保証することを含む詳細に説明されている。INDの一部として、各スキームおよびスキームのいくつかの修正はFDAに提出されなければならない。INDの提出はFDAが臨床試験の開始を許可する可能性があり,そうでない可能性もある。臨床試験は,すべての研究対象にインフォームドコンセントを要求することを含むFDAのGCP要求を含む規定に基づいて行われなければならない。また,各臨床試験は,臨床試験を行う各機関の機関審査委員会(“IRB”)によって審査·承認され,あるいはサービスを提供しなければならない。IRBは試験参加者の福祉や権利の保障を担当し,臨床試験に参加する個人のリスクが最低に低下するかどうか,期待利益と比較して合理的かどうかなどの項目を考慮している。IRBはまた、各臨床試験対象またはその法律代表によって署名されなければならないインフォームドコンセントの形式および内容を承認し、試験案を審査および承認し、完成まで臨床試験を監視しなければならない。
29
人体臨床試験は通常3つの連続段階で行われ、これらの段階は重複、合併或いは2つの部分に分けられる可能性がある
承認後の臨床試験は,4期臨床試験と呼ばれることがあり,予備承認後に行うことができる。これらの臨床試験は,治療適応が予想される患者の治療から追加的な経験を得るためのものであり,特に長期安全なフォローアップのためである。時々、製品の承認は発売後の臨床研究の完成にかかっている。
臨床開発のすべての段階において、監督管理機関はすべての臨床活動、臨床データと臨床試験調査人員に対して広範なモニタリングと監査を行うことを要求している。臨床試験結果を詳細に説明する年次進展報告はFDAに提出しなければならない。書面のIND安全報告は、以下の状況を決定するために、迅速にFDA、IRBおよび調査者に提出しなければならない:深刻かつ予期しない疑わしい副作用;他の試験の任意の発見;動物或いは生体実験室試験或いは体外試験の結果は、ヒト被験者に重大なリスクがあることを示す;或いは深刻な疑わしい副作用の発生率は方案或いは研究者マニュアルに記載された発生率よりも臨床的に重要な増加である。スポンサーはできるだけ早くINDセキュリティ報告書を提出しなければならないが、いずれの場合も、スポンサーがその情報有資格報告を確定してから15日後に遅れてはならない。スポンサーはまた、FDAに任意の意外、致命的、あるいは生命に危害を及ぼす疑いのある副作用をできるだけ早く通知しなければならないが、スポンサーが初めて情報を受け取ってからの7つの暦日に遅くはない。
FDA或いはスポンサー或いはそのデータ安全監督委員会はいつでも様々な理由で臨床試験を一時停止することができ、研究対象或いは患者が受け入れられない健康リスクに直面していることを発見することを含む。同様に、臨床試験がIRBの要求に従って行われない場合、または候補生物製品が患者の意外な深刻な傷害に関連している場合、IRBは、その機関の臨床試験の承認を一時停止または終了することができる。
開発と審査計画を加速する
FDAはいくつかの方法でBLASの検討を加速させることを許可された。迅速チャネル計画によれば、候補生物製品のスポンサーは、IND書類を提出すると同時にまたは後に、FDAに特定の適応の製品を迅速チャネル製品として指定することを要求することができる。もし生物製品が深刻或いは生命に危害を及ぼす疾病を治療することを目的とし、そしてこのような疾病が満たされていない医療需要を満たす潜在力を示すならば、迅速なチャンネル指定を受ける資格がある。高速チャネルは,候補製品と研究中の特定の適応に適した組合せを指定する.他の利点に加えて、FDAとより大きな相互作用が可能であれば、FDAは、申請が完了する前に、Fast Track BLA部分のレビューを開始する可能性があり、このプロセスをローリングレビューと呼ぶ。
迅速チャネル計画に従って、画期的な治療指定、再生薬物高度治療指定、優先審査、および承認の加速など、FDAの開発および審査を加速するための他のタイプの計画に参加する資格がある可能性があるFDA発売製品を提出する任意のもの。
30
迅速チャネル指定、画期的な治療指定、RMAT指定、および承認の加速は、承認の基準を変更することはありませんが、開発または承認プロセスを加速する可能性があります。
承認後に要求する
FDAの生物製品に対する監督管理は承認後も継続しており、特にcGMP要求については、品質管理と品質保証及び記録と文書の維持を含む。他の生物製品に適用される承認後の要求は、配布製品の身分、効力、純度と全体的な安全性に影響を与える可能性のあるcGMP偏差、記録保存要求、不良反応の報告、最新の安全と治療効果情報の報告及び電子記録と署名要求の遵守を含む。製品開発プロセス、承認プロセスまたは承認後の任意の時間に適用される米国の要求を遵守できなかった場合、出願人または製造業者は、行政または司法民事または刑事訴訟および負の宣伝に直面する可能性がある。これらの行動は、未解決の出願または補充申請の承認の拒否、承認の撤回、臨床棚上げ、IRBの臨床試験の一時停止または終了、警告または無題の手紙、製品のリコール、製品の差し押さえ、生産または流通の完全または部分的な一時停止、禁止、罰金または他の罰金、政府契約の拒否、強制要求の是正広告、またはヘルスケア提供者とのコミュニケーション、禁止、原状回復、利益の返還、または他の民事または刑事罰を含むことができる。
医療製品のマーケティングと普及
設備や生物製品の広告,マーケティング,販売促進活動もFDAの監督を受けており,FDCAの法定基準とFDAの実施条例を遵守しなければならない。FDAによるマーケティングおよび販売促進活動の監督機関の審査には、消費者向けの広告、ヘルスケア提供者が指導する広告および販売促進、医療専門家とのコミュニケーション、販売促進番組、電子メディアに関連する販売促進活動が含まれるが、これらに限定されない。FDAはまた、販売促進を背景に製品の安全性や有効性について述べた業界賛助の科学的·教育活動を規制している。スポンサーはまた、製品の承認ラベルに記載されていない製品の宣伝または患者集団における製品の普及のための宣伝製品の使用を禁止するようなFDAの広告および販売促進要件を遵守しなければならない(“ラベル外使用”と呼ばれる)。FDAは、承認されていない製品用途またはその広告およびラベル法律に違反する他の企業の法執行行動を推進することができる。法執行行動には、製品差し押さえ、禁止、民事または刑事処罰または監督管理書簡が含まれる可能性があり、これは、医療保健専門家に是正広告または他の是正コミュニケーションを発行する必要があるかもしれない。
31
政府提唱者
私たちは政策立案者とともに公共政策宣伝に参加し,私たちの治療製品が患者や医療にお金を払っている人に価値を提供するために努力し続けている。我々は,政府政策立案者とともに持続可能な医療資金調達に対する長期的な方法を奨励し,革新的な薬物の獲得を確保し,FDAが規制している医療機器や生物製品を予算節約の源としすぎないことを提唱した。衛生保健支出比率が歴史的に下位の市場では,これらの国の政府が投資を増やし,市場改革を行い,その市民が適切な衛生保健の機会を得ることを奨励している。
精算·詐欺·乱用に関する規定
アメリカでは、私たちの製品と私たちの顧客は広範な連邦と州機関によって広く規制されています。これらの機関は、私たちの製品の保険範囲と精算を規制し、医療詐欺や患者や保険計画の乱用を招く可能性のある活動を禁止しています。国際的には,他国の政府もその医療精算計画や医療項目やサービスの交付実施規定を規定している。
アメリカ連邦医療詐欺と法律乱用は一般的に私たちの活動に適用されます。私たちの製品は連邦医療計画、例えば連邦医療保険と医療補助のような連邦医療計画に属しています。私たちおよび私たちの活動に適用される主なアメリカ連邦医療詐欺および乱用法律は、(1)“連邦医療保険計画によって精算可能な業務を生成するために、故意に提供、誘致、支払い、または受け取ることを禁止し、故意に提供、誘致、または受け取ることを禁止する”反リベート法規“と、(3)任意の第三者支払者への虚偽陳述および詐欺的および乱用クレームを禁止する”虚偽精算法“とを含む。
“逆リベート規約”はその広範な適用性のため、特に重要な意義を持っている。具体的には、“逆控除条例”は、他人に個人を推薦または誘導するために、任意の人が直接または間接的に故意に報酬を請求、提供、提供、または提供、手配、または推薦することを禁止し、MedicareおよびMedicaid計画のような連邦医療計画に従って全てまたは一部の費用を支払うことができる商品またはサービスを提供する。場合によっては、医療提供者、患者、または顧客との実質的に任意の財務的相互作用は、反リベート法規に関連する可能性がある。すべての規定の要求が満たされれば、法定例外状況と規制安全港はいくつかの相互作用を保護して起訴されないことができる。しかし、ほとんどの避難港や例外は公正な市価取引を必要とする。政府は保護されていない活動に行動する時に法執行自由裁量権を行使することができる。私たちがよく参加する多くのタイプの相互作用、例えば顧客支援サービスは、反リベート法規に関連する可能性があり、安全港や例外状況によって保護されない可能性があり、構造が不適切であれば、政府の審査と法執行行動のテーマとなってきた。もし政府がこのような活動が虐待だと認定すれば、私たちは法執行行動の影響を受けるかもしれない。傷のケア製品を生産している他の会社は政府の審査と法執行を受けてきた。例えば、2017年初め、Shire PharmPharmticals LLCとShire plcの他の子会社は、連邦と州虚偽請求法案の告発を終わらせるために3億5千万ドルを支払うことに同意し、ShireとShireが2011年に買収した会社Advanced BioHeating, リベートやその他の不正な方法を用いて診療所や医師にその製品Dermagraft(後に製品を買収した)を誘導または過剰使用させた。反リベート法違反の懲罰には,監禁などの刑事罰や罰金などの民事制裁が含まれる可能性があり,連邦医療保険,医療補助,他の連邦医療計画から除外される可能性がある。排除は私たちの製品が連邦医療計画によって精算される資格がないということを意味するだろう。
同様の州虚偽請求,反リベート,保険法があり,国が援助した医療補助や他の医療計画,商業第三者支払者に適用される。保険会社はまた、メーカーに対して個人訴訟を起こし、メーカーのモデルが連邦“詐欺影響と腐敗組織法”(Racketeer Inc.and Corrupt Organities Act、略称RICO)に基づいて虚偽請求をするため、3倍の損害賠償金を支払うことができる。さらに、医師または当事者が別の国の政府関係者である場合、このような配置はその国の法律に違反し、“反海外腐敗法”(Foreign Corrupt Practices Act、略称FCPA)は、米国内の会社が医師または米国国外の他の当事者と合意した手配を起訴するために使用される可能性がある。
審査を受け、反リベート法規によって潜在的な行動理由を提供する以外に、医療機器と薬品メーカーの定価、販売とマーケティング行為も連邦と州の2級の厳格な集中的な監督管理を受けている。例えば,連邦法律·法規は政府医療保険計画のための定価方法を確立し,メーカーの価格計算を支援するために定期的にCMSに販売情報を報告することを要求している。近年、連邦政府とますます多くの州は新しい薬品価格透明性要求を導入し、機関或いは潜在的な買い手に薬品価格の上昇に関する広範な情報を開示することを要求するかもしれない。医療法律および法規は、製造業者と医療提供者との間の財務的相互作用を一般的に制限する;製薬および医療機器会社は、業界協会によって発表された自発的コンプライアンス基準および米国連邦政府によって公布された関連コンプライアンスガイドラインを遵守することを要求し、および/または財務相互作用(いわゆる日光法律)を政府および/または公衆に開示することを要求する。その中の多くの法律法規の要求が曖昧で、あるいは行政指導が必要である。曖昧さがあれば、製造業者は要求を合理的に解釈しなければならないが、これらの解釈は
32
挑戦する。法律とその実施の曖昧性を考慮して、私たちの活動は関連連邦と州法律法規の罰則条項によって制限される可能性がある。
上記の法律や法規を含めて、私たちのヘルスケア法律や法規に適用されることは、絶えず変化する解釈や法執行裁量権の影響を受ける可能性があります。もし政府当局が私たちが適用された法律や法規を遵守していないと判断した場合、私たちおよび私たちの官僚や従業員は、連邦医療保険または医療補助受益者から除外された製品サプライヤーを含む厳しい刑事および民事経済処罰を受ける可能性がある。清算および医療製品およびサービスに関する法律および法規を遵守しないいかなる行為も、私たちの名声、業務、財務状況、キャッシュフローに悪影響を及ぼす可能性がある。医療製品やサービスの提供に関する法律や法規の遵守を確保するために,HHS監察長室の7つの有効なコンプライアンス計画に基づく包括的なコンプライアンス計画を実施した。私たちのコンプライアンス計画にもかかわらず、私たちの運営がすべての適用された医療法律を完全に遵守していることを確実にすることはできない。
私たちの収益性と運営は、立法、規制·精算政策と決定の変化、個人支払者の精算範囲や支払い決定や政策の変化に関するリスクの影響を受けています。清算制度にさらなる立法や行政改革を実施したり、これらのシステムの管理人が引受や精算において私たちの製品に関連する不利な決定を実施することは、清算を著しく減少させたり、引受拒否を招いたりする可能性があり、これは、私たちの製品の受け入れと需要、および私たちの顧客が支払うことを望む価格に影響を与える可能性がある。
季節性
私たちの第四四半期の収入は他の四半期よりもっと強いです。多くの病院は第四四半期に私たちの製品の調達を増加して、アメリカでの予算周期が終わるのに合わせています。1年間で,患者の免責額に対する満足度も今年の遅い時期の収入増加につながる。全体的に言えば、私たちの第1四半期の収入は通常前4四半期を下回り、第2四半期と第3四半期の収入は第1四半期を上回り、第4四半期の収入は今年最高となる。
人的資本資源
2022年12月31日現在、私たちは世界に約1,030人の従業員を持っています。私たちの職員たちの中で誰も集団交渉協定を代表していない。私たちは一度も休業を経験したことがない。私たちは私たちの従業員が仲がいいと信じている。
私たちの業務を管理する際には、従業員を誘致、発展、維持するための一連の措置と目標に重点を置いており、これらの措置と目標は、多様性、コミュニケーション、報酬、任期、専門発展、および健康、福祉、安全を含む私たちの業務に非常に重要だと考えています
33
利用可能な情報
私たちのインターネットサイトはhttp://www.Organenesis.comです。当社のウェブサイトを通じて、Form 10-K年間報告、Form 10-Q四半期報告、Form 8-Kの現在の報告、およびこれらの報告の任意の修正、および依頼書を無料で提供し、これらの材料を米国証券取引委員会または米国証券取引委員会に電子的に提出した後、合理的で実行可能な範囲で時々他の文書を提供します。これらのアメリカ証券取引委員会の記事は私たちのサイトの“投資家”欄で得ることができます。私たちのウェブサイト上の情報は、私たちがアメリカ証券取引委員会に提出した本報告書や他の任意の報告書の一部ではない。
第1 A項リスク要因
リスク要因の概要
以下は,我々のAクラス普通株投資に投機的あるいはリスクを持たせる要因の概要である.この結論は私たちが直面しているすべての危険を解決していない。我々のAクラス普通株に投資決定を行う前に、本リスク要因要約でまとめられたリスクおよび我々が直面している他のリスクのより多くの議論を、以下の“リスク要因”というタイトルで見つけることができ、これらの議論は、本10-K表の他の情報および米国証券取引委員会に提出された他の文書と共に慎重に考慮すべきである。
34
35
リスク要因
以下に説明するリスクおよび不確実性、ならびに本年度報告書10-Kフォームおよび米国証券取引委員会に提出された他の文書に含まれる情報をよく考慮しなければなりません。以下に説明するリスクと不確実性は、私たちが重大なリスクと不確実性として決定したものであるが、私たちが直面している唯一のリスクと不確実性ではない。我々の業務はまた、世界経済の減速、地政学的事件、法律または会計規則の変化、金利および為替レートの変動、テロ、国際紛争、重大な健康問題、自然災害または予想経済および商業状況の他の中断を含む米国および非米国の全体的な経済および業界状況のような、他の多くの会社の一般的なリスクおよび不確実性に影響を与える。私たちは今知らないか、あるいは私たちが現在どうでもいいと思っている他のリスクと不確実性はまた私たちの業務運営と流動性を損なう可能性がある。
臓器発生とその業務に関するリスク
私たちの経営業績は様々な要素によって大幅に変動するかもしれませんが、その多くの要素は私たちがコントロールできません。
私たちは以下の要素の影響を受けて、これらの要素は私たちの経営業績にマイナスの影響を与えるかもしれません
36
私たちの現在と未来の支出水準は主に私たちのいくつかの支出レベルが大きく固定されているにもかかわらず、私たちの投資計画と未来の事件の推定に基づいている。私たちは予期せぬ収入不足を補うために支出をタイムリーに調整できないかもしれない。したがって、私たちの計画支出に対して、収入のいかなる重大な不足も私たちの業務、運営結果、財務状況に直接的な悪影響を及ぼすだろう。さらに、競争環境の変化または法律法規の変化に対する戦略的応答として、私たちは時々、いくつかの価格設定、サービスまたはマーケティング決定(例えば、値下げ)を行うことができ、これらの決定は、私たちの業務、運営結果、および財務状態に実質的な悪影響を及ぼす可能性がある。上記の要因により、我々の収入と経営業績は現在も将来も予測が困難である。
私たちは過去数年間に重大な損失が発生しましたが、2020年度、2021年度、2022年度の純利益を報告しましたが、将来的には赤字になる可能性があります。
これまで、私たちは主に債務と株式融資を通じて私たちの運営に資金を提供してきました。2022年、2021年、2020年12月31日までの会計年度を除いて、私たちが報告した純収益はそれぞれ1,550万ドル、9,420万ドル、1,720万ドルで、設立以来、運営に長年の損失を出しています。2022年12月31日現在、私たちの累計赤字は4530万ドルです。私たちは私たちの製品の販売を支援するために巨大な販売とマーケティングコストが発生すると予想される。私たちのこれまでの損失は、未来のいかなる潜在的な損失に加えて、私たちの業務、経営結果、財務状況に悪影響を及ぼす可能性があります。
私たちは私たちの財務報告の内部統制に大きな弱点があることを発見し、私たちの経営陣は、私たちの開示統制と手続きが無効だと結論した。
“重大な欠陥”とは、我々の財務諸表の重大なミス報告がタイムリーに予防または発見されない可能性があるように、財務報告の内部統制に欠陥または欠陥が存在する組み合わせを意味する。我々は、(I)重要な非従来の取引を適切に識別して評価するための有効な制御を設計し、維持し、(Ii)取引の適切な開始および記録を支援するために、情報技術の一般的な制御および適切な役割分担を設計し、維持し、それにより、これらのデータに依存するトラフィックフロー制御およびアプリケーションへの影響を提供する。
先に報告した重大な欠陥のまとめに含まれるいくつかの内部制御欠陥の解決に成功したが、残りの内部制御欠陥と、この時期に発見された他の内部制御欠陥とを修復しようと努力しており、これらの欠陥をまとめて、2022年12月31日までに存在する財務報告内部制御の重大な欠陥を形成している。しかし、私たちはあなたに未来にもっと多くの重大な欠陥や重大な欠陥が発生しないということを保証できません。もし私たちが財務報告の内部統制や私たちの開示統制や手続きに有効でなければ、私たちの財務結果を正確に報告したり、詐欺を防止することができないかもしれません。これは、投資家が私たちの報告書の財務情報に自信を失い、私たちの株価下落を招く可能性があります.
これらの実質的な弱点の修復に一定の進展があったにもかかわらず、2022年12月31日までに、上記の実質的な弱点が存在すると結論した。我々は、財務報告の内部統制上の欠陥を是正するための措置を講じ、上記のような重大な弱点の根本的な原因を解決するための追加的な手続きと制御措置を実施した。もし私たちが上記の重大な弱点をうまく補うことができない場合、あるいは未来に他の重大な弱点や他の欠陥が発生した場合、私たちは私たちの財務業績を正確に報告できない可能性があり、これは私たちの財務業績に重大な誤報を招く可能性があり、改めて述べる必要がある。
迅速な技術変革は私たちの製品を時代遅れにするかもしれません。研究開発を通じて私たちの製品の供給を向上させなければ、効果的に競争できないかもしれません。
私たちの製品の背後にある技術は迅速で深刻な技術変革の影響を受けている。個々の分野の技術が進歩してより広く知られるようになり,競争も激しくなる.他の人が、私たちが提供したり、開発を求めている製品、サービス、プロセスよりも顕著に優れたサービス、製品、またはプロセスを開発しない保証はありません。このようなどんな事件も、私たちの業務、運営結果、そして財務状況に実質的な悪影響を及ぼす可能性がある。
私たちは変化する顧客のニーズや競争圧力と技術に対応するために、私たちの製品供給を強化し、拡大することを計画していますが、私たちは成功しないかもしれません。すべての新製品の発売や既存製品の強化が成功するかどうかは、私たちが能力があるかどうかを含む多くの要素に依存する
37
私たちが開発し、必要に応じて規制部門の新製品や製品改善の承認または承認を得て市場ニーズを満たしていない場合、またはこれらの製品や改善に対する需要が不足していれば、私たちの運営業績は影響を受けるだろう。新製品、技術、材料、あるいは他の革新の商業可能性を十分に決定できるまで、私たちの研究と開発には大量の時間と資源投入が必要かもしれない。さらに、強化機能または新世代製品の開発に成功したとしても、これらの強化機能または新世代製品は、政府医療保健計画(例えば、Medicareまたは個人健康計画)のカバーまたは精算を受けることができない可能性があり、生じる可能性のある売上は開発コストを超えることはなく、および/または、顧客の選好の変化や競争相手が新しい技術または機能を含む製品を発売することによって、すぐに淘汰される可能性がある。
商業的に成功するためには、私たちは医者を説得しなければなりません。私たちの製品は既存の治療法の安全で有効な代替品であり、私たちの製品は彼らの手術に使用すべきです。
私たちは経験、臨床データと発表した同業者評議の定期刊行物文章によって特定のプログラムで私たちの製品を使用することが伝統的な方法の有利な代替案であることを確定した時にのみ、医者は私たちの製品を採用すると信じている。医師も費用対効果のある製品の使用に興味を持ち,責任看護組織やACOや医療の家などの環境で勤務する可能性があり,これらの環境ではかなりのコストコントロール圧力に直面している。一般的に、医師は彼らの医療実践を変え、私たちの製品を使用するのが遅いかもしれません
私たちの製品に対する市場の受け入れ度は多くの要素に依存し続けるだろう
38
そのほか、著者らは現在著者らのいくつかの製品に対して臨床研究を行っており、これらの製品は361 Hct/psの価格で市場に投入し、各種の臨床応用の治療効果データを産生する。この361項目のHCT/P臨床試験の不利な結果、例えば臨床治療効果の不足或いは治療に関連する深刻な副作用は、医師と病院の使用と著者らの製品の採用に負の影響を与え、それによって私たちの市場受容度に影響を与える可能性がある。
私たちは影響力のある医師が私たちの製品の推薦と支援が市場の受け入れと採用に重要だと信じている。このような支援が得られなければ(例えば、良好な長期臨床データを証明できないので)、医師や病院は私たちの製品を使用しないかもしれません。これは、予想される収入を達成する能力を著しく低下させ、持続的な利益を阻止するでしょう。
業務を展開する過程で、私たちは監督管理の品質要求を遵守し、製品に発生する可能性のある品質問題、および製品に含まれる第三者コンポーネントの欠陥を十分に解決しなければならない。品質問題が生じる可能性のあるリスクを最大限に低減するために内部プロセスを構築しているが,これらのリスクを解消または軽減できない可能性があり,品質問題が生じる可能性があり,その場合には責任を負う。もし私たちの製品の品質が監督機関、医者あるいは患者の期待に合わなければ、私たちは規制制裁を受けるかもしれません。私たちのブランドと名声は影響を受けるかもしれません。私たちの業務、運営結果、財務状況は不利な影響を受けるかもしれません。
私たちは製品責任クレームのリスクに直面していて、十分な製品責任保険を獲得したり維持できないかもしれません。
私たちの業務は私たちを医療機器と人体組織製品の製造、加工、調査とマーケティング過程に固有の製品責任クレームリスクに直面させます。私たちは今、将来的にも潜在的な集団訴訟や大規模侵害クレームを含む製品責任クレームや訴訟を受ける可能性があり、私たちの製品が安全でない条件やダメージを招く可能性があると主張しています。製品責任クレームは、患者とその家族、ヘルスケア提供者、または私たちの製品を販売している他の人によって提出される可能性があります。勝訴するか否かにかかわらず、訴訟を弁護する費用が高く、経営陣の注意を移し、マイナスの宣伝を招く可能性があり、これは私たちの製品の撤回や市場の私たちの製品に対する受け入れ度を低下させる可能性がある。もし私たちが製品責任クレームに成功的に対抗できなければ、私たちは大量の責任とコストを招くかもしれない。さらに、製品責任クレームは、是非曲直や最終結果にかかわらず、以下のようになる可能性がある
私たちは製品責任保険がありますが、十分だと思いますが、この保険は賠償免除額と保険範囲の制限を受けて、この保険を維持できないかもしれません。しかも、請求は私たちの保証範囲を超えたり、私たちの保険証の保証範囲から除外される可能性があります。もし私たちが製品責任保険を許容可能なコストまたは許容可能な条項に維持できず、十分な保証範囲を提供したり、他の方法で潜在的な製品責任クレームから身を保護したり、私たちが必要な保険金額を過小評価したりすると、私たちは重大な責任に直面する可能性があり、これは私たちの業務を損なう可能性があります。1つ以上の製品責任クレームは、私たちの株価を下落させる可能性があり、私たちの責任が私たちの保険範囲を超えた場合、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性があります。
製品供給中断や在庫損失は、私たちの業務、経営結果、財務状況に悪影響を及ぼす可能性があります。
私たちの製品は技術的に複雑なプロセスを使って製造されており、専門的な施設、高度に特定の原材料、その他の生産制限が必要です。これらのプロセスの複雑さや厳格な会社や政府基準は
39
私たちの製品の製造と貯蔵は、私たちを生産リスクに直面させる。持続的な生産リスクに加えて、プロセス偏差または承認されたプロセス変更の予期しない影響は、安定性要件または規範を含む法規要件に適合しない可能性がある。私たちの製品の大部分は規定された温度範囲で貯蔵されて輸送されなければならない。例えば,環境条件がこの範囲からずれると,我々の製品の残賞味期限が損なわれる可能性があり,あるいはその安全性や有効性が悪影響を受け,使用に適さない可能性がある。このような偏差は発見されないかもしれない。実際または疑わしい生産·流通問題の発生は在庫損失を招く可能性があり、場合によってはリコールされ、名声損害と製品責任リスクをもたらす。発見された問題の調査と救済は生産遅延を招き、多くの追加費用を招く可能性がある。例えば、私たちのサプライヤーの生産問題のため、私たちの親和性製品の生産は2019年第1四半期に一時停止します。そのため、私たちは別のサプライヤーを見つけ、2020年第2四半期に商業規模の生産を再開するしかない。その後、追加の容量と供給上の冗長性を提供するために、第2の供給源を追加した。このような供給中断はAffityの収入を減少させる。我々は,他の製品の生産量を増加させることで失われた親和性収入を部分的に相殺することができるが,将来の親和性,デマグ,あるいは我々の他の製品の貯蔵や製造に一時停止や故障が発生した場合には保証できない.将来、私たちの製品のどんな貯蔵や製造故障や供給損失も、私たちの市場シェアを失い、私たちの収入と運営に悪影響を及ぼす可能性があります。
上述したように、デマゴフは2021年第4四半期に生産を停止し、デマグフは2022年第2四半期に販売を停止した。私たちは私たちのデルマ製造を新しい製造施設に移したり、第三者メーカーを招聘することを計画しています。これは大量の長期的なコスト節約をもたらすと予想されています。デマグラブが利用できない間、私たちは顧客がデマグラブの代わりにApligrafを使い、デマグラブの販売を一時停止することは私たちの純収入に実質的な影響を与えないと予想している。しかし、予想される大量の長期コスト節約を実現していない場合、あるいはデマゴフを使用できない間にデマングフの代わりにApligrafを使いたくない場合、これは私たちの純収入や運営業績に悪影響を及ぼす可能性があります。
私たちの製品は限られたサプライヤーとメーカーに依存しているので、私たちのNuShield、Affity、Apligraf、PuraPly抗菌製品を含めて、もし私たちがどんな重要なサプライヤーも失ったら、私たちは巨大な製品開発コストと材料配送遅延を発生する可能性があり、これは私たちの製品販売に大きな影響を与えるかもしれません。
私たちの製品のいくつかの部品は限られたいくつかのサプライヤーから得られました。私たちの成功のために、私たちのサプライヤーは法規の要求に従って、合意された仕様に従って、受け入れ可能なコストで、タイムリーにこれらの部品を提供することができなければなりません。供給の連続性と高品質と信頼性を維持するための私たちの努力は成功しないかもしれない。私たちのサプライヤーが経験した製造中断は私たちのこのような部品の供給を危険にさらすかもしれない。FDAは私たちの製品の製造に厳しい規制と要求を持っているため、私たちはいくつかの構成要素や材料のための追加または代替源を迅速に確立することができないかもしれない。提供される製品が製品性能の構成要素である場合や独自の技術を採用している場合、サプライヤーの交換には多大な努力や大量の投資が必要となる可能性がある。生産の減少または中断(現在、新しい製造施設への移行または第三者製造業者との交渉前にデマグ製造を一時停止していることを含む)、または代替原材料や部品源を得ることができず、私たちの業務、運営結果、および財務状況に実質的な影響を与える可能性がある。さらに、私たちの1つまたは複数のサプライヤーは、私たちの調達またはレンタルデバイス、用品、製品、またはコンポーネントについて私たちにクレジットを提供することを拒否するか、または明らかにあまり割引されていない条項またはより厳しい条件で私たちにクレジットを提供することにのみ同意する可能性があります。これは、必要な設備、用品、製品、コンポーネントを経済的に効率的かつタイムリーな方法で購入またはレンタルする能力を深刻に乱す可能性があり、私たちの業務、運営結果、および財務状況に重大な悪影響を及ぼす可能性があります。いかなる死傷者も自然災害も, 任意の独占サプライヤー運営の他の中断、または任意の既存の独占供給契約の意外な損失は、私たちの業務、運営結果、および財務状況に実質的な悪影響を及ぼす可能性がある。
私たちの製品は人間ドナーの組織供給に依存しており、どんな供給中断も私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性があります。
私たちが生産した多くの製品は私たちが人体組織を得ることを要求している。他の要素を除いて、私たちの業務の成功は人間ドナー組織の獲得性にかかっている。私たちの供給源から組織を得ることができなかった場合は、人体組織を含む製品の需要を効果的に満たす能力を妨害するだろう。我々の製品のために人体組織を加工することは非常に労働集約型であるため,安定した供給流を保つことは困難である。寄付組織の獲得性は、規制の変化、寄付過程に対する公衆の世論、および業界における私たち自身の名声の悪影響を受ける可能性もある。著者らが十分な人体組織の供給を獲得する上で直面する可能性のある挑戦は、獲得性、品質と交付スケジュールの限られた制御を含むいくつかのリスクに関連する。さらに、任意の人体組織成分供給のいかなる中断も、新たな供給源が見つかるまで、我々の製品を製造する能力を実質的に損なう可能性がある(もしあれば)。私たちは合理的な時間内にまたは商業的に合理的な条項で十分な代替供給ルートを見つけることができないかもしれません。これは私たちの業務、運営結果、および財務状況に重大な悪影響を及ぼすでしょう。
40
私たちの製品で使用されている原材料価格の上昇や利用できないことは、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性があります。
私たちの収益力は製品生産に使われる原材料価格の影響を受けています。これらの価格は、需給変化、全体的な経済状況、労働力コスト、燃料に関連する輸送コスト、競争、輸入税、消費税、その他の間接税、通貨為替レート、政府規制など、私たちがコントロールできない要素に基づいて変動する可能性がある。医療業界の高度な競争性と、私たちの顧客と第三者支払者のコスト制御努力により、重要なコンポーネントや原材料のコスト増加をより高い価格で顧客に転嫁することができないかもしれません。肝心な部品や原材料のコストが増加すれば、値上げによってこれらの増加したコストを完全に回収することができない、あるいは他のコスト削減によってこれらの増加したコストを相殺することができなければ、より低い利益率と収益性を経験するかもしれない。インフレやその他の原因により原材料価格が大幅に上昇し、生産性向上、価格上昇、その他の方法で回復できず、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
私たちは大量の資本を投入し続け、私たちの販売やマーケティングインフラを最大限に拡大し、これらの努力が売上の著しい増加を招く保証はない。
私たちは、私たちの販売チームを最適化することによって、2017年にNuTech Medicalおよび2020年にCPN Biosciencesを買収した際に買収した製品のマーケティングと販売をさらに支援することを含む、私たちの内部販売とマーケティング能力を最大限に向上させることに取り組んでいます。そのため、私たちは新しい顧客に接することができ、売上を増加させることができるように、私たちの製品の販売とマーケティング資源に投資し続けます。これらの費用は私たちの経営業績に影響を与え、私たちが引き続き私たちの製品の売上を大幅に増加させることに成功する保証はありません。
私たちが統制していない独立販売機関との関係の減価や終了は、私たちの収入と利益を創出する能力に実質的な悪影響を及ぼす可能性がある。私たちは独立した販売機関ともっと多くの関係を発展させて、私たちのある製品の収入を増加させるつもりです。私たちはそれができなくて、私たちが売上を増加させることを阻止するかもしれません。
私たちの収入の一部は独立販売機関との関係から来ている。どのような理由でも、これらの関係の減少または終了は、私たちの収入および利益を創出する能力に実質的かつ不利な影響を及ぼす可能性がある。独立販売エージェントは通常その範囲内のクライアント関係を制御するため,我々と独立販売エージェントとの関係が終了すると,我々とクライアントの関係が失われる.また,独立販売機関の現場販売エージェントを制御していないため,我々の販売プロセス,コンプライアンス,その他の優先事項が流通業者によって一貫して伝達·実行されることが確保できないリスクがある.私たちが私たちの主要な独立販売エージェントと関係を維持できなかった場合、あるいは私たちの独立販売エージェントが私たちの販売プロセス、法規遵守、その他の優先事項を遵守することを確保できなかった場合、これは私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性があります。私たちは独立販売機関が私たちの製品を販売する時の行為に責任を負うかもしれません。私たちは彼らの活動に対する制御の不足が私たちのこのような違反を予防、検出、または解決する能力を阻害します。
私たちはもっと多くの独立販売機関と関係と手配を発展させて、私たちのいくつかの製品の売上を増加させるつもりです。しかし、私たちはこのような関係を発展させることができないかもしれません。この場合、私たちは売上を増やすことができないかもしれません。私たちの成功は私たちの独立販売機関とその代表がある地域で私たちの製品を維持し、激励できるかどうかにある程度かかっています。彼らは私たちのマーケティング計画を成功的に実施しないかもしれない。私たちのいくつかの独立販売機関は私たちの製品を独占的に販売しないかもしれませんが、他の会社の類似製品を提供するかもしれません。私たちの独立販売機関は私たちとの契約を終了するかもしれません。私たちの製品に十分な販売努力を投入するかもしれません。あるいは彼らの販売努力を彼らにもっと多くの手数料をもたらす他の製品に集中させるかもしれません。これは私たちの業務、経営業績、財務状況に悪影響を及ぼすかもしれません。私たちはまた、これらの製品を商業的に合理的な条項でマーケティングおよび/または流通することに同意する、より多くの独立した販売機関を見つけることができないかもしれない。もし私たちが商業的に受け入れ可能な条項で新しい独立販売エージェント関係を構築したり、既存の販売代理契約を更新したりすることができなければ、私たちの業務、経営結果、財務状況は実質的な悪影響を受ける可能性がある。また、これらの独立販売機関の統制は、私たちの従業員のように厳密ではないため、独立販売機関の不正に関連するリスクを低減する措置をとる可能性がありますが、規制要件や私たちの要求や私たちの政策を遵守しないリスクがあり、これも私たちの業務に悪影響を及ぼす可能性があります。
私たちは私たちの組織を拡大し続ける必要があり、成長を管理することは予想以上に難しいかもしれない。
私たちの成長を管理することは私たちが予想していたより難しいかもしれない。私たちは、私たちの既存と予想される未来の製品の市場に浸透してサービスし、新製品の開発を継続するために、一定の大きな拡張が必要になると予想される。この拡張は管理、業務、そして財政資源に大きな圧力を与えるだろう。私たちの業務の予想成長を管理するためには、既存の運営と財務システム、プログラム、制御を修正し、新しいシステム、プログラム、制御を実施しなければなりません。私たちはまた私たちの財政、行政、そして運営者たちを拡大しなければならない。経営陣はできないかもしれない
41
必要な人員を採用、訓練、維持、激励、管理したり、既存と潜在的な戦略関係と市場機会を識別、管理、開発したりする。
私たちの組織を拡大することに加えて、私たちは私たちの製造能力を拡大しており、これは大量の資本支出を必要とする。もしこのような資本支出が予想以上であれば、私たちの財務状況と資本資源に悪影響を及ぼすかもしれない。また、規制やその他の理由により、私たちの製造施設の拡張が遅れた場合、組織規模の拡大や会社の目標達成能力を制限することができるかもしれません。私たちが計画通りに私たちの製造施設を拡大することができても、私たちは私たちの投資のすべての期待的な利益を達成できないかもしれない。
私たちは買収を通じて私たちの業務を拡大するかもしれません。NuTech MedicalおよびCPN BioScienceに対する私たちの買収、ライセンス、投資、および他の会社や技術への他のビジネススケジュールと同様です。このような買収や商業計画は重大な危険をもたらすかもしれない。
私たちは、ライセンス、流通プロトコル、投資、直接買収によって会社、部門、技術、製品、および権利を買収する戦略的機会を定期的に評価し、例えばNuTech MedicalおよびCPN Biosciencesを買収するなど、私たちの業務を発展させる。1つ以上の取引については
このようなプロジェクトのいずれも私たちの収入、財務状況、そして収益性に実質的な悪影響を及ぼす可能性がある。企業買収は、買収された企業に関連する未知の負債のリスクにも関連しており、実質的である可能性がある。我々のNuTech MedicalとCPN Biosciencesの買収は我々の傷ケア製品の組合せを拡大し,我々のNuTech Medicalの買収は外科と運動薬物市場を含めて潜在市場を拡大した。多くの要素、統合過程の遅延、傷口看護市場への浸透に成功できない羊膜種別或いは必要な監督管理許可を得ることができないため、著者らは短期内或いは根本的に今回の買収による収入、コスト節約と協同効果の増加を実現できないかもしれない。買収に関連する追加責任には、政府法規を遵守しないことが含まれる可能性があり、これらの法規は私たちを調査および民事と刑事制裁を受けることができるかもしれない。例えば、FDAの品質要求に適合していない会社を買収したり、医師に費用や他の形態の報酬を支払ったりして、彼らの製品の使用を引き付けることができるかもしれない。未知の債務を発生させたり、買収を達成できなかった予想収益は、私たちの業務に実質的な悪影響を及ぼす可能性があり、私たちはすべての投資を損失したり、初期投資を回収できなくなる可能性があります。その中には、ライセンスまたは流通権の取得、製品の買収、初期在庫の購入、またはスタートアップ企業に投資するコストが含まれている可能性があります。私たちの投資を回収できない、あるいはこのような投資、関連営業権または資産を任意にログアウトすることは、私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性があります。
新しいビジネスラインや新しい製品とサービスは私たちを追加的なリスクに直面させるかもしれない。
私たちは時々新しいビジネスラインを実施したり、例えばNuTech Medicalを買収する際に買収した外科および運動医学製品、あるいは既存のビジネスライン内で新しい製品およびサービスを提供するかもしれません。これらの努力に関連するリスクと不確実性は、特に市場が十分に発展していない場合や発展している場合である。新しいビジネスラインや新製品やサービスを開発·マーケティングする際には、大量の時間と資源を投入する可能性があります。外部要素、例えば法規遵守性義務、競争的代替方案、市場受容度の不足と市場選好の変化は、新業務或いは新製品の成功実施にも影響を与える可能性がある
42
あるいはサービスです。新業務ラインや新製品やサービスを開発·実施する過程で、これらのリスクをうまく管理できなければ、我々の業務、運営結果、財務状況に重大な悪影響を及ぼす可能性がある。
情報技術システムの深刻な中断や情報セキュリティの破壊は、我々の業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
私たちは先進的な情報技術システムに大きく依存して私たちの業務を運営しています。通常のビジネスプロセスでは、大量の機密情報(個人情報および知的財産権を含むが、これらに限定されない)を収集、格納、および送信する。我々はまた,我々の情報技術インフラの重要な部分を含む当社の業務の重要な部分を第三者に外注しているため,我々は我々の機密情報を入手可能または入手可能な第三者との多くの独立したサプライヤー関係を管理している.我々の情報技術および情報セキュリティシステムの規模および複雑さ、ならびに私たちと契約を締結した第三者プロバイダのシステム(およびその中に存在する大量の機密情報)は、そのようなシステムが、私たちの従業員またはプロバイダの不注意または意図的な行為、または第三者の悪意の攻撃によって、サービス中断またはセキュリティホールの影響を受けやすい可能性がある。このような攻撃の複雑さはますます高くなっており,広範な動機(産業スパイや市場操作に限定されない)や専門知識を持つ団体や個人によって実施されている.データや情報技術の保護には多くの資金が投入されているが,サービス中断やセキュリティホールを防ぐための努力は保証されていない.例えば,2020年8月には,我々の情報技術(“IT”)システムが脅迫ソフトウェア攻撃を受け,あるITシステムが短時間で部分的に損傷している.私たちは法律顧問や他の事件対応専門家とともに事件の調査を終えた。私たちは脅迫ソフトウェア攻撃に関連した大きな損失を受けず、すべてのデータを迅速に回復することができます, 私たちの業務に最小限で一時的な中断だけをもたらすだろう。私たちはデータセキュリティと情報技術システムを保護する措置を取っていますが、これらの措置はこれらの事件を防ぐことができないかもしれません。私たちのネット保険の保険範囲は上記の特定の事件をカバーする可能性がありますが、この保険は賠償免除額と保険範囲の制限を受けて、私たちはこの保険を維持できないかもしれません。しかも、請求は私たちの保証範囲を超えるかもしれない。私たちのシステムのいかなる中断または抜け穴も、私たちの業務運営に悪影響を及ぼす可能性があり、および/または、キーまたは敏感な機密情報または知的財産権の損失をもたらし、財務、法律、商業および名声の損害をもたらす可能性があり、または第三者が私たちの証券を取引するために使用するための重要なインサイダー情報を得ることを可能にします。
HIPAA,HITECH法案,CCPAがカバーする個人データ保護措置に違反すれば,重大な責任を招く可能性がある.
HITECH法案によって改正された1996年の“健康保険携帯性と責任法案”、またはHIPAA、およびこの法案によって発表された条例に基づいて、保護された健康情報のプライバシー、安全、伝送の保護に関連する強制的な契約条項を含むいくつかの義務が規定されている。これらの要件および制限は、サービスを提供するため、または彼らに代わっていくつかの活動を行うために、彼らから保護された健康情報を受信する“保険エンティティ”(医療提供者および保険会社を含む)およびその商業パートナーに適用される。法規及び条例はまた,保護された健康情報のプライバシー又は安全が侵害された場合には,保護された実体及びその業務パートナーに通知義務があることを規定している。私たちの業務過程で、私たちはたまに顧客から保護された健康情報を受け取る。したがって,我々はビジネスパートナーであると考えられるため,このような保護された健康情報を扱う際にHIPAAの要求や制限を受け,ある顧客とビジネスパートナー協定に署名している.
また、カリフォルニア州は2020年1月1日に施行される“カリフォルニア消費者プライバシー法”(CCPA)を公布した。CCPAによると、ある企業は、その個人情報の使用または開示において、カリフォルニア住民に関する開示を強化し、カリフォルニア住民が罰を受けずに彼らの個人情報を使用しないことを選択し、私たちが所有している個人データに関連する他の選択をカリフォルニア人に提供し、16歳以下のカリフォルニア人の個人情報のいくつかの使用に関連する前に選択加入同意を得ることを要求されている。私たちがCCPAを守らなければ、カリフォルニア総検事長は巨額の罰金と禁止救済を求める可能性がある。CCPAはまた、カリフォルニア人があるデータが漏洩した場合に個人訴訟を提起することを許可する。CCPAの様々な側面はまだ不確定であり、私たちは遵守するために私たちの政策や慣行を修正する必要があるかもしれない。カリフォルニア州を除いて、テキサス州と他のいくつかの主要州は現地の医療プライバシーに対して厳格な要求を提出した。
データ保護法の解釈と適用は私たちの接近と一致しないかもしれない。もしそうであれば、これは政府に罰金や命令を科し、やり方を変更することを要求する可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。また,これらのプライバシー規制は国や州によって異なる可能性があり,テストが米国で行われるか現地国で行われるかによって異なる可能性がある.これらの異なる法律や法規を遵守することは、私たちに巨額のコストを発生させたり、私たちの業務に不利な方法で私たちの業務慣行やコンプライアンス手続きを変えることを要求する可能性があります。さらに、データ保護の法律および法規を遵守することは、私たちがデータを収集、使用、開示する能力を制限し、または場合によってはいくつかの司法管轄区域で運営される能力に影響を与える契約でより重い義務を負うことを要求するかもしれない。私たちは私たちがすべての管轄区域の様々なプライバシーと安全要求を遵守しているか、または引き続き遵守することを保証することはできない
43
私たちが商売をしているところ。私たちが適用されるプライバシー保護の法律および法規を遵守できないか、または遵守できないとみなされた場合、このような失敗は、政府が法執行行動を取り、私たちのために責任を負うことを招く可能性があり、これには、重大な民事および/または刑事罰、および私たちの経営業績および業務に悪影響を及ぼす可能性のある個人訴訟および/または負の宣伝が含まれる可能性がある。
私たちは関連側と取引を行い、このような取引は利益衝突がある可能性があり、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性があります。
私たちは関連者たちと多くの取引に到達した。関連側の取引は、我々の管理職と利益の衝突を引き起こす可能性がある
このような紛争は幹部や役員が彼や彼女の経済的利益やある関係者の経済的利益を私たちを凌駕することを求めている可能性がある。逆に、関連先の既存の取引条項と同じ優遇条項で第三者と取引することができない可能性があります。また、関連側取引による利益衝突は、私たちの投資家の信頼を損なう可能性がある。利益相反は私たちの業務、運営結果、そして財務状況に実質的な悪影響を及ぼすかもしれない。
私たちの財務業績は医療改革法における医療機器税条項の悪影響を受ける可能性があります。
“患者保護および平価医療法案”(PPACA)は、米国で販売されている医療機器を製造または輸入する任意のエンティティに2.3%の消費税を徴収する。これらの条項によると、国会研究サービス部は、今後10年間、医療機器業界の総コストは200億ドルに達する可能性があると予測している。国税局は2012年12月に同税を実施する最終規定を発表し、その中で他を除いて2カ月に1回の支払いを要求し、四半期ごとに報告した。2016年“総合支出法案”(Pub.第114-113条)は2015年12月に署名され、医療機器消費税の徴収停止を含む法律となった。2回目の医療機器消費税の徴収停止2年目は2018年1月に法律に署名し、2018年の継続支出法案とした(Pub.L.115-120)は、休止命令を2019年12月31日まで延長する。2019年12月20日、トランプ総裁はPACA下の医療機器税を永久廃止する法案に署名したが、国会が将来改案しない保証はない。私たちの製品のアメリカでの販売にこのような消費税を徴収すれば、私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性があります。
私たちはいくつかのレンタル改善に関連する資産減価費用が発生する可能性があり、これは私たちの業務、運営業績、財務状況に悪影響を及ぼす可能性があります。
2022年12月31日と2021年12月31日まで、私たちの長期資産には、それぞれ1.025億ドルと7920万ドルの不動産、工場、設備が含まれている。イベントや環境変化がある資産の帳簿金額が回収できない可能性があることを示す場合、私たちの長期資産の減値を審査します。1つの資産が減値として決定された場合、資産は公正価値として減記され、公正価値は評価価値に基づいて決定される。どのような減価も、これらの改善されたすべての価値に相当する非現金費用をもたらす可能性がある。2022年、2021年、2020年12月31日までの年間で、私たちの長期資産に関する減価費用は確認されていません。これらの資産予想用途に対する私たちの仮定の変化は、将来の減価費用をもたらす可能性があり、これは、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
もし私たちの営業権と他の償却可能な無形資産や他の投資が損傷したら、私たちは収益に重大な費用を記録する必要があるかもしれない。
公認会計原則に基づいて、吾らは少なくとも毎年商業権の減値をテストし、そして事件或いは情況の変化により帳簿額面が回収できない可能性があることを示した時、著者らの営業権、償却可能無形資産及びM&A活動を通じて取得した他の資産の減価を審査しなければならない。営業権、償却可能無形資産、および買収によって得られた他の資産減価をもたらす可能性のある要因は、ビジネス環境および実際または予想される経営業績の重大な悪影響(会社全体または任意の特定部門に影響を与える)および低下を含む可能性がある
44
わが社の財務状況では。もし私たちの営業権、償却可能無形資産、または他の投資が損傷したら、私たちは未来に追加費用を収益に計上することを要求されるかもしれない。このような費用は私たちの財政的業績に悪影響を及ぼすだろう。
私たちが純営業損失を繰り越す能力を使うことは一定の制限を受けるかもしれません。
2022年12月31日までに、約4440万ドルの連邦純営業損失繰越は、今後数年間の連邦課税収入の減少に使用でき、これらは無期限に繰り越すことができる。改正された1986年の“国内税収法”またはこの規則によると、2022年12月31日までの純営業損失繰越と将来の全純営業損失繰越の控除は課税所得額の80%に制限され、純営業赤字の繰越を制限または一部遅延させる。2022年12月31日までに、約1,430万ドルの州純営業損失が繰越され、2031年12月31日までの1年から2038年に満期になります。適用される州税法がどの程度連邦規則に適合しているかどうかは不明であり,いくつかの州の純営業損失利用が制限されているにもかかわらず。
また,規則382節の規定により,連邦純営業損失繰越能力を利用することが制限される可能性がある。“所有権変更”の場合,第382条は所有権変更後の課税所得額に年次制限を加え,その額は所有権変更前の赤字会社の純営業損失と相殺することができる。第382条の定義によれば、“所有権変更”とは、会社所有権が3年以内に累計50%を超える変更を意味する。2021年12月31日現在、私たちは私たちの連邦純運営損失に制限がないことを確認する研究を行った。現在または未来の私たちの株式所有権の変化は“所有権の変化”を引き起こす可能性があり、その中のいくつかは私たちがコントロールできるものではないかもしれない。したがって,純営業損失繰越を利用して連邦課税収入(あれば)を相殺する能力が382条に制限される可能性があり,将来の納税義務が増加する可能性がある。
私たちは私たちと第三者の製造施設、サプライチェーンと販売チームの正常な運営に依存して、これらはすべて突発的な公共衛生事件の負の影響を受ける可能性があり、新冠肺炎の疫病或いはその他の要素を含み、それによって私たちの業務、財務状況或いは運営結果に実質的な悪影響を与える可能性がある。
胎盤ベースではない製品を生産し、第三者メーカーを使用して胎盤ベースの製品を生産し、第三者原材料サプライヤーを使用して内部製造プロセスをサポートします。もし私たちの製造能力あるいは私たちのサプライヤーの製造能力が公共衛生突発事件によって影響を受け、新冠肺炎の大流行の巻き返しを含めて、私たちは必要なレベルの関連製品を適時に生産できなくなり、甚だしきに至っては生産できないかもしれない。今まで、新冠肺炎疫病はまだ著者らの業務に実質的な不利な影響を与えていないが、未来に突発的な公共衛生事件(新冠肺炎疫病の巻き返しを含む)による私たちのいかなる製造プロセスの減少或いは中断は、すべて私たちの業務、運営業績、財務状況とキャッシュフローに実質的な不利な影響を与える可能性がある。
サプライヤーへの追加制限により、私たちの内部製造プロセスを支援するために必要な原材料を得ることができない可能性もあります。私たちの製品の生産は十分な数のソース組織の可用性に依存しています。これは私たちの製品の主要な成分です。出所組織には寄付された人体組織、豚組織、牛組織が含まれる。私たちは、機関審査委員会が複数の病院で承認した協定と、私たちまたは私たちの契約メーカーが招聘した組織調達会社を通じて、寄付された人体組織を直接獲得します。私たちの源からティッシュを得ることができなかったいかなる、突発的な公共衛生事件に関連する失敗、例えば新冠肺炎の大流行を含めて、すべて私たちの製品の需要を有効に満たす能力を妨害する。供給元組織の供給のいかなる中断も、新しい供給源が見つかるまで、私たちの製品を生産する能力を実質的に損なう可能性がある(もしあれば)。私たちは合理的な時間内にまたは商業的に合理的な条項で十分な代替供給ルートを見つけることができないかもしれません。これは私たちの業務、運営結果、および財務状況に重大な悪影響を及ぼすでしょう。
私たちの現在の高級創傷看護製品の組み合わせは経験豊富な直販チームを通じて全米で販売されており、彼らは異なる看護場所の傷口看護に集中している。私たちは直売代表と独立機関の組み合わせを使用して外科と運動薬物市場にサービスする。これらの販売代表は、販売管理、販売運営および有効性、持続的なトレーニング、分析、およびマーケティングに専念する専門チームによってサポートされています。私たちの直販チームは医師やヘルスケア提供者と対面して私たちの製品を議論することで役割を果たしています。新冠肺炎などの突発的な公共衛生事件は私たちの販売人員が医者と医療関係者と常規の連絡を維持する能力を制限する可能性があり、それによって私たちの製品の需要に負の影響を与える。この場合、私たちの直販代表や独立機関が現在の販売レベルを増加または維持することを保証することはできません。これは私たちの業務、運営結果、財務状況、およびキャッシュフローに大きな悪影響を及ぼす可能性があります。私たちのいくつかの製品の需要はまた予測できない大幅な低下があるかもしれません
45
患者が在宅注文や政府が公衆衛生緊急事態に対応するための他の行動により、いくつかの高度な治療法を得ることができない場合、この製品を使用することができる。
我々が信用協定下の金融契約を遵守し、資金を調達する能力は、新冠肺炎またはその他の要因の実質的な悪影響を受ける可能性がある。
私たちは第三者債務とA類普通株売却の収益を通じて私たちの運営と資本支出に一部の資金を提供した。私たちの2021年信用協定は私たちにある財務契約を遵守することを要求して、総合固定費用カバー率と総合総純レバレッジ率を含めて、四半期ごとにテストします。もし私たちが新冠肺炎の経済的影響や他の理由でこれらの金融契約を履行できない場合、2021年の信用協定下の借金はすぐに満期になって支払う可能性があります。融資者から修正されなければ、循環ローンによるいかなる借金も禁止されます。私たちは私たちの貸主が受け入れ可能な条件でそのような修正に同意するか、または根本的に同意しないという保証はない。そのほか、新冠肺炎の疫病が資本市場に与えるいかなる持続的な妨害も、私たちが株式或いは債券を発行することで資金を調達する能力にマイナス影響を与える可能性がある。
私たちの製品規制や他の政府法規に関連するリスク
私たちの製品は2023年1月1日に施行された“インフラ投資と雇用法案”と返還義務の制約を受けており、私たちのApligraf、Dermagraft、PuraPly製品、および可能な他の製品は返却点が必要かもしれません。これは実質的なものかもしれません。
2021年11月に公布されたインフラ投資·雇用法案90004条は、一定割合を超える使い捨て製品が患者に使用されず、仕入先に廃棄されている(“浪費”)場合、メーカーは連邦政府に返金を支払わなければならないと要求している。傷口の大きさは一致性と一致性が不足しているため、毎回の治療時にいくつかの皮膚代替品を捨てる可能性が高い。還付義務は2023年1月1日に施行され,CMSは強積金規則制定において税金還付を実施する方法を提案した。適用されるパーセント要件は、所与のカレンダー四半期に薬剤によって許容される総費用の少なくとも10%である。“特殊な状況”があれば、CMSは廃棄製品の払い戻しの適用割合を高める権利がある。この提案に対する意見を提出し,代用皮膚に関するユニークな状況を指摘し,CMSにより高い割合を適用することを求めた。2022年11月1日に発表された2023年MPFS最終ルールでは、CMSは、提案ルールで使用される水ゲルに例外を除いて、どの製品にもより高い適用率を適用することなく、より高い適用率(10%を超える)を適用するために、特殊な状況を有する可能性のある製品に関するより多くの情報を収集する予定であることを示している。CMSは2020年のデータに基づいて、我々の3つの製品であるApligraf、Dermagraft、PuraPlyの浪費率を推定した。2023年に計算された払い戻し金額がこれらの推定と似ているかどうかはわかりませんが、もしそうであれば、私たちはこれらの製品と可能な他の製品にリベートを支払うかもしれません。これは実質的かもしれません。廃棄された製品の税金払い戻し責任の総金額はまだ分からない。
私たちの臨床試験では、私たちは実質的な遅延や困難に直面するかもしれない。
規制部門の承認を得て候補製品を販売する前に、候補製品の安全性と有効性を証明するために、広範な臨床試験を行わなければならない。臨床テストは高価で時間がかかり、しかも結果は確定していない。私たちの臨床試験での経験は限られている。もしあれば、どんな臨床試験も計画通りに行われるか、予定通りに完成することは保証できません。1つまたは複数の臨床試験の失敗は、試験の任意の段階で発生する可能性がある。成功を妨げたり、臨床開発をタイムリーに完成させたりする可能性のある事件は、
46
Renuは第3段階の臨床開発中であり,膝骨性関節炎に関連する症状の治療に用いられている。これらの要因により,これらや他の候補臨床試験や研究に対する予想スケジュールは遅延の影響を受ける可能性がある。
臨床前と臨床開発を成功させることができない場合は、私たちの追加コストを招き、あるいは製品販売、監督管理、開発と商業化マイルストーンと特許権使用料から収入を得る能力を弱める可能性がある。また、私たちの候補製品を製造したり、配合を変更したりする場合、修正された候補製品をより早いバージョンに関連付けるために追加的な研究を行う必要があるかもしれません。臨床試験の遅延は、候補製品を商業化する独占的な権利を持つ可能性のある任意の期限を短縮することもできますし、私たちの競争相手が私たちの前に製品を市場に出すことを可能にすることは、候補製品を商業化することに成功する能力を弱める可能性があり、私たちの業務、財務状況、運営結果、将来性を損なう可能性があります。
研究や臨床前研究の成功あるいは早期臨床試験の結果は,以降の試験で得られた結果を代表しない可能性がある。同様に、臨床試験の初期、初期或いは中期データは慎重に考慮すべきであり、最終データは予備、初期或いは中期データと大きく異なる可能性があり、特により多くの患者データを獲得した場合である。
臨床前研究或いは早期臨床試験(実行可能性研究を含む)或いは比較的に早く行った臨床試験の結果は必ずしも未来の臨床試験結果を予測するとは限らず、臨床試験の中期結果も必ずしも最終結果を予測するとは限らない。RENUを含む候補臨床試験は、臨床開発において期待される安全性と有効性を示すことができない可能性があり、臨床前研究において積極的な結果を示すか、または初期またはより早い臨床試験または臨床試験の予備段階を通過することに成功した。私たちは時々予備、予備、または中間データを発表したり報告したりするつもりだ。私たちと私たちのパートナーからの臨床試験の初期、初期または中期データは、試験の最終結果を表すことができない可能性があり、患者登録の継続および/または複数の患者データの出現に伴い、1つまたは複数の臨床結果が重大に変化する可能性があるリスクに直面する可能性がある。この点で、これらのデータは臨床的利益の初歩的な証拠を示す可能性があるが、患者の持続的な追跡およびより多くの患者データの獲得に伴い、任意の治療効果が患者に持続的ではなく、および/または時間の経過とともに減少または完全に停止するリスクが存在する。初期、初期、または中期データもまた監査を受ける必要があります
47
最終データは、このような予備、初期、または一時的なデータと実質的に異なるチェック手順をもたらす可能性がある。したがって、最終データを取得する前に、予備データ、初期データ、または一時データを慎重に考慮すべきである。
私たちのどんな臨床試験も成功する保証はない。また,臨床試験中の薬物,生物製品,細胞療法の失敗率が高かった。製薬と生物技術業界の多くの会社は後期臨床試験で重大な挫折を経験し、臨床前試験と早期臨床試験においても奮い立つ結果を得た。臨床前と臨床活動から得られたデータは異なる解釈を受ける可能性があり、これは監督部門の承認を延期、制限或いは阻止する可能性がある。このようなどんな挫折も、私たちの業務、財務状況、運営結果、および見通しに悪影響を及ぼす可能性がある。
私たちのいくつかの製品のために必要な規制承認や許可を得ることは高価で時間がかかり、私たちの技術を活用する能力を阻害したり、他の業務目標を達成する能力を他の方法で制限したりすることができます。
生物製品や医療機器として,我々が販売している多くの製品は,合法的に商業的に流通するために,FDAや米国以外の同様の規制機関の規制承認や許可を得る必要がある。特に、このような製品は、FDAが公衆衛生サービス法(PHSA)第351条に基づいて生物製品ライセンス申請またはBLASを承認する必要がある場合があり、連邦食品、薬物および化粧品法(FDCA)第515条に基づいて発売前承認またはPMAを提出するか、またはFDCA第510(K)条に従って承認する必要がある場合がある。我々が現在販売している製品は,法律に必要なすべての必要な規制承認や許可を得ていると考えられるが,新たな製品の導入や修正された製品は,新たな承認や許可を得る必要があるかもしれない。また、FDAは、我々が現在販売しているいくつかの製品が、発売前に承認または許可されていない場合には、実際にはそのような承認または許可が必要であると考えることができるかもしれない。承認されたBLAやPMAのプロセスには多大な時間,労力,財政資源がかかり,完成までに数年かかる可能性がある。第510条(K)に従って許可を得る負担はやや軽いが、これは巨大な費用及び資源承諾にも関連している。BLA、PMAまたは510(K)通知を提出する費用、生物製品または医療機器を生産する任意の機関の年間使用料、および各承認製品に適用される製品費用はかなりのものである。
2021年1月,われわれは最初の患者が重要な3期臨床試験に参加したことを発表し,RENUによる膝骨性関節炎関連症状治療の安全性と有効性を評価した。研究計画を策定する前に,承認を支援するための臨床試験を行うコストは高く,これらの費用は必ずしも正確に見積もることができるとは限らない。さらに、臨床活動から得られたデータは、安全性または有効性の欠如を示す可能性があり、または異なる解釈の影響を不確実または受けやすい可能性があり、いずれの解釈も、規制部門の承認を延期、制限、または阻止する可能性がある。失敗や遅延は臨床試験中のいつでも発生する可能性がある。前臨床試験と早期臨床試験の成功は今後の臨床試験も成功することは確保できない。臨床試験後期段階の候補製品であっても、必要な安全性或いは治療効果の終点を示すことができない可能性があり、すでに臨床前研究と初歩的な臨床試験を通じて進展を得たにもかかわらず。製薬と生物技術業界のいくつかの会社は高級臨床試験の中で治療効果或いは不良安全性の不足による重大な挫折を受けたが、比較的に早い試験で良好な結果を得た。私たちは私たちが似たような挫折に直面しないということを確信できない。臨床試験結果が陽性であっても、承認または承認には他の障害が存在する可能性があり、FDAは適時に承認あるいは承認しない可能性があり、甚だしきに至っては全くないかもしれない。FDAが我々の製品を承認または承認したとしても、FDAに提出された臨床データは、支払者に我々の製品をカバーおよび/または十分に補償させるのに十分ではない可能性がある。さらに、FDAは、承認が使用可能かもしれない適応を制限するか、または承認に他の条件を付加することが可能であり、製品の商業的適用を制限する可能性がある。
我々の候補製品の再生医学高度療法やRMAT指定はより速い開発や規制過程をもたらさない可能性があり、このような候補製品が発売承認される可能性も増加しない。
RMATは21世紀の治療法に基づいて導入された新しい名称で、ある再生医学療法の開発と審査に使用されている。RMAT認証を獲得するために、候補再生医学製品は必ず治療、修正、逆転或いは深刻な生命に危害を及ぼす疾病或いは状況を治愈することを目的とし、そして初歩的な臨床証拠を持ち、この薬物は未満足の医療需要を解決する潜在力があることを表明した。RMAT指定は,この薬物が画期的な指定に要求されるように,既存療法に基づいて実質的な改善を提供する可能性があることを示す証拠を必要としない。
RMAT製品候補は、有効な製品開発計画に関する密な指導を受け、高度管理者と経験豊富な従業員が積極的、協力、学際的な審査に参加し、審査をスクロールする。RMAT指定資格に適合する再生医学療法は、迅速チャネル指定、突破的治療指定、加速承認、および優先審査指定を含むFDAの他の迅速計画の資格に適合する可能性もあり、これらがこのような計画の基準を満たしていれば。しかし,RMATを指定することは承認上場を保証するものではなく,承認すれば承認過程が他の場合よりも速くなる.
48
2021年1月、私たちはRMATがRENUに指定され、膝骨性関節炎に関連する症状の治療に使用されることを発表した。しかしながら、RMAT指定を得ることは、膝骨性関節炎に関連する症状の治療のためにRENUを使用すること、または膝骨性関節炎に関連する症状の治療のためにRENUが承認される可能性を増加させるために、より速い開発プロセス、審査または承認をもたらす保証はない。同様に、FDAの通常の手順に従って承認を考慮する薬剤と比較して、任意の将来のRMAT指定または他の加速審査状態(例えば、私たちの任意の他の候補製品のための画期的な治療指定)は、より速い開発プロセス、審査または承認を保証することも、FDAがそのような候補製品の発売を承認する可能性を向上させることもできない。さらに、FDAは任意のRMATまたは他の迅速な検討状態をいつでも撤回することができる。私たちは私たちの他の候補製品のためにRMATまたは画期的な治療指定を求めることができるが、FDAはこのような候補製品のいずれにもこの地位を与えないかもしれない。
私たちは私たちの1つまたは複数の候補製品のためにFDAの迅速なチャネル指定を求めるかもしれませんが、私たちが受け取っても、そのような指定は実際にはより速い開発や規制審査や承認過程を招くことはないかもしれません。
1つの製品が深刻または生命に危険な疾患を治療するために使用され、そのような疾患が満たされていない需要を解決する可能性を示す場合、治療スポンサーはFDA迅速チャネル指定を申請することができる。Fast Track認証を取得しても,Fast Track認証は上場承認または任意の特定の時間範囲で承認されることを保証することはできない.従来のFDAプログラムと比較して、私たちはより速い開発、規制審査、または承認プロセス、および高速チャネルの指定を経験しないかもしれません。また,FDAが我々の臨床開発計画のデータが高速チャネル指定をサポートしなくなったと考えた場合,その指定を撤回する可能性がある。高速チャネル指定だけではFDA優先審査プログラムに適合する資格は保証されない。
FDAが候補製品に指定する画期的な療法は、より速い開発や規制審査や承認過程を招くことはなく、候補製品が発売承認される可能性も増加しない可能性がある。
私たちは1つ以上の候補製品のための画期的な治療指定を求めるかもしれない。画期的な治療法は、製品候補として定義され、その目的は、単独または1つまたは複数の他の薬剤との併用による重篤または生命に危険な疾患または状態を治療することであり、予備臨床証拠は、製品候補が、1つまたは複数の臨床的重要終点において、臨床開発早期に観察される実質的な治療効果のような既存の治療法よりも顕著な改善を示す可能性があることを示す。画期的な治療法として指定された候補製品に対して,FDAと試験スポンサーとの相互作用やコミュニケーションは,臨床開発の最も有効な方法を決定するのに役立つとともに,無効な制御案中の患者数を最小限に抑えることができる。FDAから画期的な治療法の候補品に指定され,新薬申請提出時に臨床データの支持を得ていれば,優先審査を受ける資格もある。
画期的療法に指定されたのはFDAの裁量権である。したがって,我々の候補製品の1つが画期的療法として指定された基準に適合していると考えても,FDAは同意せず,このような指定を行わないことにした可能性がある。いずれの場合も、FDA従来の手順に従って承認を考慮した製品候補と比較して、候補製品に対する画期的な治療指定を受けることは、より速い開発プロセス、審査または承認をもたらすことはなく、FDAの最終承認を保証することもできない可能性がある。さらに、私たちの1つまたは複数の候補製品が画期的な療法の条件に適合していても、FDAは、候補製品がもはや資格条件に適合していないことを後で決定することができ、またはFDAの審査または承認の期間を短縮しないと決定する可能性がある。
私たちは適用される上場後の規制義務を守らなければならないが、その中には新しい規制の承認や許可を得ることが含まれている可能性がある。
承認または承認の後、新たな適応または追加のラベル宣言または製造変更の導入など、承認または承認された製品のいくつかのタイプの変更は、FDAの審査および承認を受けることになり、これは、さらなる非臨床試験または臨床試験を必要とする可能性がある。既存または将来の製品のための新たな規制承認または許可を得ることに関連するコストおよび他の資源負担は、当社の技術を活用するために利用できるリソースを制限したり、他の業務活動を展開する能力を制限したりする可能性があります。変更の性質により、変更は上場前の承認や許可を得ずに行うことができると決定する可能性があります。FDAまたは他の規制機関は、私たちの結論に同意しない可能性があり、このような上場前の承認または承認を要求することは、これらの製品のマーケティングを混乱させ、私たちを規制制裁に直面させ、私たちの業務、財務状況、および運営結果に重大な悪影響を及ぼす可能性がある。
49
FDAは、Affity、Novachor、NuShieldのような、Affity、Novachor、NuShieldのような我々のいくつかのヒト細胞または組織に属する製品のいくつかが、公衆衛生サービス法(PHSA)第361条の単独規制資格に適合していないことを認定し、これらの製品のラベルおよびマーケティング声明の修正を要求するか、またはFDAの承認を得るまで、このような製品の販売を一時停止することを要求することができ、これは私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性がある。
私たちが製造、加工、流通しているいくつかの製品は、ヒト細胞あるいは組織、あるいは羊膜組織を含むヒト細胞または組織に由来する。FDAはヒト細胞、組織及び細胞と組織に基づく製品(HCT/Ps)を具体的に規定している。特に、FDA第21 C.F.R.§1271.10に規定されているいくつかの基準に適合するHCT/Pは、PHSA第361条(いわゆる“第361条Hct/P”)によってのみ規制され、上場前承認または承認要求の制約を受けない。これらは、PHSA第351条および/またはFDCA第505、510または515条に基づいて規制されている製品と比較して、発売後の規制要求もそれほど厳しくない。同社は,我々のいくつかのHct/Psは,羊膜から抽出した製品を含めて,第361条のHct/Psの規定に適合していると考えている。しかし,規制機関はHCT/Pを第361節HCT/Pに分類し,一部は製品の期待用途に依存し,部分的にはHCT/Pの加工に依存する。2017年11月16日、FDAは“ヒト細胞、組織、細胞、および組織ベースの製品の規制考慮:最小限の操作および相同使用”、または361 HCT/Pガイドラインと題する最終指導文書を発表し、その中には、第361条HCT/Pとして既存の規制基準をどのように適用するかに関するFDAの現在の考え方が提供されており、その中には、他の要件に加えて、HCT/Pを最小限に動作させ、それに応じた用途に使用することを要求することも含まれている。全体的に言えば, 最小操作“は、加工によってHCT/Pの元の特性の程度を変化させる基準を意味し、”相同使用“は、ドナーにおいて受信者と同じ基本機能を実行することをHCT/Pに要求することを意味する。FDAは、361 HCT/Pガイドに規定されている原則を、私たちが配布したHCT/Pの任意の行動に適用することは、私たちに不利な結果をもたらす可能性があり、より難しくまたは高価にビジネスを展開することを可能にします。
361 HCT/Pガイドによれば、我々は、Affacy、NuShield、およびNovachor製品を含む胎盤ベースの膜製品のラベルおよびマーケティング声明を明らかにし、361条のHCT/Pの対応する使用要件に適合するために、創傷カバーとして使用することが意図されていることを明らかにする。しかしながら、FDAは私たちの結論に同意しない可能性があり、Affity、NuShield、または私たちが販売している胎盤ベースのシーツ製品が発売前の承認または許可を得ることを要求することは、これらの製品のマーケティングを妨害し、私たちを規制制裁に直面させ、私たちの業務、財務状況、および運営結果に実質的な悪影響を与える可能性がある。さらに,これらの製品は最低限の操作を超えていると考えられる可能性があり,相同用途に使用されていないか,あるいは他の方法では第361条のHCT/Psによって規制されていないため,NuCelおよびRenuのBLAの承認を得る必要があると考えられる。著者らは、FDAが膝骨性関節炎に関連する症状を管理するためにBLAを許可することを支持するために、RENUの臨床研究を継続し、さらなる評価が必要な有利な実行可能性研究によって、RENUは他の膝骨性関節炎の治療と組織再生応用の潜在力があると信じている。NuCelの臨床開発を中止しましたもし私たちがRenuまたはNuCelに対するBLAの承認を得たら、適用された上場後の規制要求を遵守することは大量の時間と大量のコストに関連するだろう。第361条HCT/P規制を受けている製品についても、我々が運営している業界内で規制審査を強化することは、この要求を遵守することが費用がかかる可能性が高いという要求を招く可能性がある。これらの規制結果に関連するコストや他の資源負担は、私たちの技術を活用するために利用できる資源を制限したり、他の業務活動を展開する能力を制限したりする可能性があります。
361 HCT/Pガイドは、HCT/Pの流通業者が任意の規制提案を提出し、ガイドラインを遵守するために必要な任意の発売前承認を得るために、36ヶ月の実行猶予期間を提供することを最初に示した。2020年7月、アメリカ食品薬品監督管理局は、新冠肺炎突発公共衛生事件による挑戦により、執行猶予期間を2021年5月31日まで延長すると発表した。2021年4月21日、FDAは、執行猶予期間が2021年5月31日に終了すると繰り返し、RenuとNuCelの商業流通を停止する。RenuとNuCelの商業化を一時停止することはタイムリーで適切であると考えられるが、FDAおよび他の規制機関は、このような商業化をどのようにまたはいつ行うかに同意しない可能性があり、これは、規制機関の制裁を受け、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
FDAが、ヒト細胞または組織に属するまたは由来するいくつかの製品がPHSA 361条の単独の規制条件に適合していないと認定する可能性がある場合、新しい組織製品の発売はより高価になり、我々の組織製品の拡張は著しく遅延する可能性があり、FDAの承認を得るまで、追加の発売後の規制要求を受けたり、製品販売を一時停止したりする可能性がある。
上述したように、361 HCT/Pガイドラインによれば、FDAは、我々が流通している細胞および組織製品のタイプ、特にヒト皮膚または羊膜組織からなる同種移植製品からの製品は、発売前に承認または承認された要求を受ける可能性がある。FDAがこのような決定を下した場合、このような製品は、私たちが発売を求める将来の製品を含めて、商業化のコストがはるかに高くなるであろう。なぜなら、私たちは動物で臨床前作業を行い、および/または人体で臨床試験を行い、承認を支持しなければならないかもしれないからである。このような臨床前の仕事と臨床試験は高価で時間がかかり、成功を保証できない。さらに、これらの製品は、これらの製品の広告および販売促進のより厳しい制限、およびより広範な有害事象報告を含むが、これらの製品の広告および販売促進に限定されない、現在適用されているものよりも厳しい発売後の規制要求を受ける。将来的には既存のHCT/Pを売り込みたいかもしれません
50
新しい予期される用途のための製品は、第361条HCT/Pの規制資格に適合しないようにし、上場前の承認または承認を必要とし、FDCAおよび/またはPHSAの医療機器または生物製品条項の下で発売後法規を遵守することにつながる可能性がある。これらの要件を遵守することは、大量の時間および大量のコストに関連し、新しい同種移植派生製品を発売する能力を制限することを含む、私たちの技術を活用するために使用できるリソースを制限することができるかもしれない。
著者らは著者らの製品に対して一連の非臨床と臨床試験、比較有効性、経済学とその他の研究を行った。これらの試験または研究または他の人が行った類似の試験または研究の不利な結果は、医師、病院および支払人が私たちの製品を使用または採用することに悪影響を及ぼす可能性があり、これは、これらの製品の市場受容度およびその収益性に悪影響を及ぼす可能性がある。
著者らは著者らの製品に対して各種の非臨床と臨床試験、比較有効性研究及び経済とその他の研究を行い、著者らが行っているRenu臨床試験を含めて、全面的な臨床と現実世界の結果データと費用対効果データを生成し、製品の承認を得て、私たちのサービスの市場への更なる浸透を推進するために努力している。もしこれらの試験と研究または他の人が行った類似の試験および研究が不利な結果をもたらした場合、これらの結果は医師、病院および支払人の使用または私たちの製品の採用に負の影響を与え、それによって市場受容度および収益能力に影響を与える可能性がある。
我々の業務はFDAや他の機関の重大な規制義務の制約を受け続けており,これらの義務を守ることは高価で時間がかかり,我々の技術を活用する能力を阻害したり,他の業務目標を達成する能力を制限したりする可能性がある.
規制の承認や許可を得る義務のほか、私たちのような会社には継続的な規制義務があり、これらの義務を履行するのは高価で時間がかかる。特に、我々の製品の生産と販売はFDAと米国国内外の多くの他の政府機関の広範な規制と審査を受けている。上述したように、私たちが流通しているいくつかの製品は第361条HCT/Pとみなされている。HCT/Psに対するFDAの規制は、製品の登録および発売、ドナーのスクリーニングおよび試験、加工および配布、すなわち“現在の良好な組織実践”またはCGTP、ラベル、保存および不良反応報告の記録、および検査および実行の態様の要件を含む。また,Hct/Psに対するFDAの規制は将来的に変化し続ける可能性が高い。このような新しい規制要件を遵守することは、重大な時間遅延と費用をもたらす可能性があり、これは、私たちの業務、運営結果、および財務状況に実質的な悪影響を及ぼす可能性がある。私たちの他の製品は生物製品や医療機器として規制されており、これらの製品はFDAによってより厳しい規制を受けている。上述したように、これらの製品は、厳格な発売前審査プログラムを経なければならず、承認または承認は、製品の販売適応または販売対象に重大な制限を加える可能性があり、製品の付帯警告を要求するか、または製品の販売および/または使用に他の制限を加える可能性がある。さらに、承認され承認された製品は、FDAのCGTP法規、FDAのQSRおよび/またはFDAの現在の良好な製造仕様またはcGMP法規、有害事象報告を含む他の実質的な法規要件を遵守する義務が継続される, FDAの検査もあります我々の製品の規制承認や許可を維持し、他の方法で私たちの規制義務を履行することに関連するコストや他の資源負担は、私たちの技術を活用するために使用できる資源を制限したり、他の業務活動を展開する能力を制限したりする可能性があります。
いくつかの州では、HCT/Psの製造、貯蔵、または配布には、組織銀行または組織流通業者として経営するための許可証またはライセンスが必要である。HCT/Pの販売に適した必要な州ライセンスやライセンスがあると考えられますが、私たちが知らないまたは守られていない州や地方ライセンスまたはライセンス要件のリスクがあります。もしある管轄区域にこのような規定を満たしていない場合があれば、私たちはその管轄区でHCT/Pを配布することを禁止される可能性があり、罰金や他の処罰を受ける可能性もある。もし私たちにこのような行動を取ったら、私たちの業務および/または財務状況に悪影響を及ぼすかもしれない。
アメリカティッシュ銀行協会(AATB)はティッシュ銀行の操作基準を発表した。このような基準を遵守することは組織銀行になるための要求だ。しかも、いくつかの州は自分の銀行規制を持っている。さらに、移植のためのある人体器官および組織の購入は、皮膚および関連組織を含む価値のある人体器官の譲渡を禁止する“国家臓器移植法”によって制限されているが、人体組織および皮膚の除去、輸送、移植、加工、保存、品質管理および貯蔵に関連する合理的な支払いを可能にしている。私たちは彼らが人体組織を回収、貯蔵、輸送するためのサービスを組織庫、病院、医者に精算した。私たちが支払ったサービス料の合理性を確認するための独立した第三者評価がありますが、価値のある代価で人体組織の売却や譲渡を禁止するNOTAの規定に違反していることが発見された場合、私たち、私たちの役人、または従業員は刑事法執行制裁を受ける可能性があり、これは私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性があります。
51
私たちが製造と加工した多くの製品は人体組織から抽出されたため、疾病を伝播する潜在力がある。
ヒト組織を利用して伝染病を伝播する可能性があり、ヒト免疫不全ウイルスまたはHIV、ウイルス性肝炎、梅毒および他のウイルス、真菌または細菌病原体を含むが、これらに限定されない。私たちは伝染病の伝播を防ぐための連邦と州法規を遵守することを要求された。
私たちは組織の調達と加工に対して厳格な品質管理を維持しているにもかかわらず、これらの品質管理が十分であることを保証できない。また,他社が不適切に処理した寄付組織の疾患伝播に関する負の宣伝は,我々の製品の需要に悪影響を及ぼす可能性がある。もし私たちのすべての製品がいかなる伝染病の伝播に関連していれば、私たちの役人、従業員、そして私たちは政府の制裁を受けるかもしれません。リコールに限定されないが、民事と刑事責任を含み、制裁は連邦政府とのビジネスを禁止することを含む。私たちはまた私たちの製品を使用または受け入れた人が提出した製品責任クレームと、私たちの名声損失に直面するかもしれません。
私たちの製品に関連する欠陥、故障、または品質問題は、製品のリコールや安全警報、不利な規制行動、訴訟(製品責任クレームを含む)および負の宣伝をもたらす可能性があり、これらは私たちの競争優位性と市場シェアを侵食し、私たちの名声、業務、運営結果、および財務状況に重大な悪影響を及ぼす可能性がある。
製品の故障の深刻さとコストの高い結果のため、品質は私たちと私たちの顧客に非常に重要です。私たちのどの製品にも品質と安全問題が発生する可能性があります。私たちの未来の経営結果は私たちが有効な品質管理システムを維持する能力があるかどうかにかかって、私たちの品質システムについて私たちの従業員を効果的に訓練して管理します。我々の製品の開発、製造と制御はFDAと類似の外国機関を含む多くの政府機関の広範かつ厳格な監督管理を受けている。これらの法規要件には,FDAに限定されないQSR,GMP,米国の有害事象/リコール報告要求,世界各地の他の適用法規が含まれており,継続的に審査され,FDAや外国規制機関の定期検査により厳格に監視される。FDAと外国の監督機関はまた、承認された製品の性能を監視するために、発売後のテストと監督を要求する可能性がある。私たちの製造施設や私たちのサプライヤーや独立販売機関の製造施設も定期的な規制検査を受けています。FDAまたは外国当局が、これらの要求のいずれも遵守できないと結論した場合、公開警告状からより厳しい制裁、例えば、製品のリコールまたは差し押さえ、撤回、罰金、法令に同意する、製品の製造または流通を停止する禁止行動、米国以外で製造された製品、輸出制限、制限業務、または他の民事または刑事制裁など、様々な法執行行動をとることができる。私たちの職員たち、職員たち、または私たちに民事または刑事制裁を行うことができる。どんな不利な規制行動も、その規模にかかっている, 私たちの製品を効果的に製造、マーケティング、販売することを制限するかもしれない。
また、将来の立法活動や将来の裁判所判決の結果を予測することはできませんが、これらは規制要求を増加させ、政府の調査を受けたり、予期しない訴訟に直面させたりする可能性があります。いかなる規制行動や訴訟も、是非曲直にかかわらず、巨額のコストを招き、経営陣の他の業務への関心を移し、わが製品の販売や使用に追加的な制限を加える可能性がある。また、品質や安全の問題を含む負の宣伝は、私たちの名声を損なう可能性があり、私たちの製品に対する市場の受容度を低下させ、私たちの顧客を失い、私たちの製品への需要を減らすことができます。実際または感じた品質の問題は、医師が私たちの製品を提案したり、自発的にリコールしたりする可能性もあります。いかなる製品の欠陥や問題、監督管理行動、訴訟、負の宣伝或いはリコールはすべて私たちの業務を混乱させ、私たちの業務、運営結果と財務状況に重大な悪影響を及ぼす可能性がある。
私たちは製品のリコールや自発的な市場撤退を実施するかもしれません。これは私たちのコストを著しく増加させ、私たちの名声を損ない、私たちの業務を混乱させるかもしれません。
私たちの製品の製造、マーケティングと加工には内在的なリスクが存在し、即ち私たちの製品或いは工芸は製造規範、適用法規の要求或いは品質標準に符合しない可能性がある。この場合、私たちは自発的にリコールや市場撤回を実施することができ、あるいは規制機関によってそうすることを要求される可能性がある。私たちの製品をリコールしたり、市場が撤回したりすることは費用が高く、管理資源を移転するだろう。私たちの製品や他のエンティティが加工した類似製品のリコールや撤回は、リコールや撤回の範囲に困惑したり、品質や安全面での私たちの名声が損なわれたりして、私たちの製品の販売に影響を与える可能性もあります。
私たちは私たちの製品のラベル、マーケティング、販売に関する様々な政府法規を遵守します。
製品商業発表の前後に、FDA、連邦貿易委員会が公布した法規、および製品ラベルと広告、流通、販売、マーケティングに関する米国と外国の法規に基づいて、継続的な責任がある。
52
医療機器および生物製品製造業者は、承認または承認された製品ラベルに規定された用途および適応のためにのみ製品を普及させることが許可されている。“ラベル外”用途(すなわち、承認またはクリアされたラベルに記載されていない用途)のための製品の宣伝のための製造業者は、政府医療保健計画に提出された“ラベル外”用途のための製品精算請求が詐欺的であり、“連邦虚偽請求法”または他の連邦および州法規に違反しており、これらのクレームの提出はラベル外販売促進によって引き起こされることを含むいくつかの法執行行動をとっている。“ラベル外”販売促進の禁止を遵守しないことは、巨額の罰金、会社の営業許可証の取り消しまたは一時停止、特定の製品の販売停止、製品リコール、民事または刑事制裁、連邦医療計画から除外される、または他の法執行行動を招く可能性がある。米国では、このような不法行為の告発は、重大な行政義務とコストを課す米国政府との企業誠実な合意を招く可能性もある。
私たちおよび私たちの従業員と請負業者は、虚偽請求法を含む連邦、州、および外国の医療詐欺および法乱用の制約を直接または間接的に受ける。もし私たちがこのような法律を遵守できないか、または完全に遵守できなければ、私たちは巨額の処罰に直面するかもしれない。
私たちの業務は様々な連邦、州、そして外国の詐欺と法律の乱用によって制限されている。これらの法律は私たちのマーケティング、販売、流通製品が通過する財務スケジュールと関係を含む私たちの運営を制限するかもしれません。
私たちの運営能力に影響を与えるアメリカ連邦と州法律は含まれていますがこれらに限定されません
医療業界の活動と配置は、詐欺、浪費、その他の乱用を防止するための広範な法律·法規によって制約されている。これらの法律および法規は、製品の価格設定および割引、顧客報酬の提供、精算支援の提供、他の顧客支援サービス、従業員および独立請負業者への販売手数料または他の報酬の提供、および医療従事者、他の医療提供者、および患者との他の相互作用を含む、製品開発、マーケティングまたは販売促進に関連する様々な活動または他の手配を制限または禁止することができる。
これらの法律の範囲は広いため、法定または規制例外状況と安全港の範囲は狭いため、私たちの商業活動はそのうちの1つ以上の法律の挑戦を受けるかもしれない。医療製品メーカーと医療提供者との関係は、政府が審査を強化する分野である。私たちは医師を養成する講演プロジェクトを展開し、顧客に精算アドバイスと支援を提供するなど、様々な種類の活動に従事しています
53
顧客と患者支援サービスを提供し、これらのサービスはずっと医療機器業界内の政府の審査と法執行行動のテーマである。
政府のコンプライアンスに対する期待と業界ベスト実践は引き続き発展しており、私たちの過去の活動は常に現在の業界ベスト実践と一致しているわけではないかもしれない。また、多くの異なる業界実践がこれらの法律に適合しているかどうかについては、政府の指導が不足しており、政府のこれらの法律に対する解釈が変化し続けており、これらすべてがコンプライアンスの不確実性をもたらしている。規定を遵守しないいかなる行為も、規制制裁、刑事または民事責任を招き、私たちの名声を深刻に損なう可能性がある。従業員やビジネスパートナーが医療専門家や患者との活動や相互作用が適切で道徳的であり、すべての適用される法律、法規、ガイドライン、政策および基準に適合することを確保するための包括的なコンプライアンス計画を持っているが、常に不正行為を識別し、阻止することができるわけではなく、このような行為を発見し、防止するための予防措置は、このような行為を効果的に防止し、リスクを低減し、またはこれらの法律や法規を遵守できないことによる政府の調査や他の行動や訴訟の機会を減少させることができない可能性がある。
もし政府の実体がこれらの法律に違反する可能性のある行為を調査(伝票や民事調査要求を出すことを含む可能性がある)場合、私たちは大量の資源をかけて自分を弁護しなければならない。私たち、私たちの役人、または私たちの従業員がどの法律に違反しているかを告発する人は、私たちの従業員、顧客、競争相手、または他の当事者かもしれませんが、“密告者”と呼ぶことができます。政府の政策は個人が告発者になることを奨励し、連邦裁判所に不当な行為を苦情することだ。政府はこのようなすべての不満を調査し、介入するかどうかを決定するように要求された。もし政府が介入すれば、私たちは政府に資金の返済を要求され、通報者は一定の割合の入金を奨励するだろう。もし政府が介入を拒否すれば、通報者は自分で訴訟を行うことができ、もし彼らが成功すれば、彼らは会社が支払わなければならない任意の判決または和解金額の一定の割合を得ることができる。政府はまた自ら調査を開始する可能性がある。このような行動は、巨額の罰金を科すことや、収益性のある業務を運営する能力を深刻に弱める可能性のある制裁など、私たちの業務に大きな影響を与える可能性がある。特に、私たちの業務が上記のいずれかの法律に違反していることが発見された場合、または私たちがいかなる不正行為も認めずに政府と和解することに同意した場合、または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たち、私たちの官僚および従業員は、民事および刑事罰、損害賠償、罰金、MedicareおよびMedicaidなどの政府医療計画への参加から除外され、監禁される可能性がある, 当社の業務を削減または再編し、当社の誠実な合意を強制的に実施します。いずれも、当社の業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
もし私たちが政府機関に平均販売価格やASPを報告しなければ、あるいは私たちの報告が正確で完全でなければ、私たちは法的リスクに直面するかもしれない。
私たちの製品は医師室でASPプラス六%の料金でMedicareで精算されます。すべての医療保険支払いは,ASP法による支払いを含め,自動減額の制約を受けている。国会はこれまでBCAによる自動減支を停止しており、2022年3月31日まで自動減支はなかった。2022年4月1日には1%の自動減支があり、2022年7月1日から自動減支が2%に回復した。自動減額は政府が支払う部分に適用され、総支払額の80%を占める。また,今後数年では,法定のPAYGOにより最高4%の連邦医療保険の自動減額が命じられる可能性があり,国会で可決された多くの法律で赤字中性が求められている。2022年1月まで、私たちは医療機器としてFDAによって規制されているので、バイオ製品の単独支払い代替品としてすべてのASPの報告を要求されていません。私たちのいくつかの製品を報告するASPを選択しましたが。2022年第1四半期の報告締め切りから、2020年総合支出法案に規定された結果であるバイオ製品として単独で支払われたすべての皮膚代替製品のASPの報告を要求された。2022年1月1日から,生物製品として単独で支払われたすべての皮膚代替製品のASPの報告を開始した。このようなASP報告書は2022年4月30日に最初に発表され、2022年第1四半期に発表された。政府の価格報告書は複雑な要求を要求する。もし私たちがASPを正確に報告しなければならない場合、私たちは前の四半期のASPを再声明しなければならないかもしれないし、私たちは民事罰金を受けるかもしれないし、または違反が知っているか無謀であれば、私たちは虚偽クレーム法案の責任を受けるかもしれない。非常に深刻あるいは繰り返し違反した場合,連邦医療保険計画や他の連邦医療計画との業務往来から除外される可能性がある。
政府の医療改革や他の立法行動のため、私たちはこの業界の大きな不確実性に直面している。
連邦政府、州政府、監督機関、第三者支払人はすでに法律を公布し、医療コストをコントロールし、全体的にアメリカの医療システムを改革する。例えば、2010年の“患者保護·平価医療法案”(PPACA)および2015年の“連邦医療保険アクセスおよびチップ再認可法案”は、政府および民間保険会社が医療を提供し、支援する方法を大きく変えた。これらの変化には,モデル計画や他の価値に基づく調達計画の作成,慢性創傷への低コスト療法を提供することなど,医師や病院にコスト低減の財務的インセンティブを提供することが含まれており,これらの療法が我々の製品よりも有効であっても。最近、PACAの全部または一部を修正または廃止するための幅広い努力が行われている。医療保険のカバー範囲を維持しない個人への税収処罰(いわゆる“個人強制令”)の廃止など、医療保険のカバーや支払いに影響を与える条項を含む税収改革立法が採択された。このような行動や類似した行動
54
私たちの製品の使用に否定的な影響を及ぼすかもしれません。私たちはこのような努力が継続され、連邦と州レベルでより多くの改革提案が提起されるかもしれないと予想する。2019年12月18日、アメリカ第五巡回控訴裁判所は下級裁判所に対してカリフォルニア州はテキサス州を訴えます(本名:テキサス州はアザール事件を訴えた4:18-cv-00167)は、個人権限が違憲であると考え、個人権限が法律の他の規定から分離できないため、PPACA全体が違憲であるかどうかをさらに分析するために、事件を下位裁判所に返送する。米国最高裁判所はこの事件の再審に同意し、2021年6月17日に第5巡回裁判所の決定を覆すことを命じ、この事件を却下した。
また、2022年8月16日、国会は医療保険計画に基づいて薬品とバイオ医薬品の価格を制限する立法を可決した。“インフレ低減法”(IRA)は、衛生·公共サービス部部長に、ある高支出、模倣薬或いは生物類似競争のない医療保険薬物の価格について交渉することを要求する薬品価格交渉計画を構築した。この法律はまた、連邦医療保険B部分のインフレリベートを規定し、2023年第1四半期から発効する。通常、2021年第3四半期から、ASP+6%のB一部の薬物メーカーは連邦医療保険計画にリベートを支払うことを要求される。これらと似たような薬品の価格決定改革は私たちの製品の価格設定圧力を増加させるかもしれない。
一般的な立法行動はまた私たちの業務に影響を及ぼすかもしれない。例えば、2011年の予算統制法案には連邦赤字を減らす条項が含まれている。改正された予算制御法は,2013年4月から医療サービス提供者に支払う医療保険金額を2%減少させ,2032年までの6カ月間有効にする予定である。コロナウイルス援助、救済、経済安全保障(CARE)法案とその後の立法は、2020年5月1日から2022年3月31日までの支払い調整を一時停止した。2022年4月1日から6月30日までに1%の連邦医療保険自動減額があり,2022年7月1日には2%の医療保険自動減支が回復した。また,法定PAYGOにより,2024年の国会会議終了時に4%の連邦医療保険の自動減額を命じることができる。これらや他の類似した政府医療支出削減は、私たちの製品に対する需要の減少や追加の価格設定圧力を招く可能性がある。
現在米国議会に提出されている法案が可決されれば、私たちの業務に影響を与える可能性もある。例えば117年の間にこれは…。国会会議,“治癒2.0法案”,H.R.6000,117回目。(2021)米国衆議院に導入される。同様の形で再導入されれば、私たちの業務に影響を及ぼす可能性のある法律や法規の変化を招く可能性のある条項が含まれている可能性がある。これらの変化は、FDAが特定の日または後に承認または承認する画期的な医療デバイスに新しい支払い経路を提供することを含むことができる。Cures 2.0(または類似立法)の公布もまたFDA指定突破性とRMAT療法のスケジュールを加速し、あるFDA製品を監督する際に患者経験データと実世界証拠を使用する新しい要求を招く可能性がある。もし発効すれば、これらの変化は私たちの競争相手が比較可能またはより先進的な製品を迅速に市場に投入しやすくなり、私たちの製品に対する需要を減らすことができるかもしれない。
私たちの海外市場への販売は私たちを国際販売と運営に関するリスクに直面させます。
私たちは現在海外市場に製品を販売しており、このような販売を拡大する予定です。世界的な組織を管理することは難しく、時間もかかるし、費用も高い。国際事業を展開することで私たちが直面しているリスクは私たちがアメリカで直面しているリスクとは異なるかもしれない。私たちの製品は、国際境界を越えた販売と輸送、および国際源から部品や製品を購入することで、財務省外国資産管理事務室が管理する輸出管理法規や禁輸国に対する貿易制裁、商務部が管理する法律法規を含むが、これらに限定されない幅広い米国と外国政府の貿易、輸出入、税関法規、法律の制約を受けている。これらの規定は、私たちが禁止されている国または個人マーケティング、販売、流通、または他の方法で私たちの製品または技術を譲渡する能力を制限する。
これらの法規および法律を遵守することは費用が高く、適用される法律および法規義務を遵守しないことは、個人の監禁、罰金と処罰、輸出特権の剥奪、貨物の押収、特定の商業活動の制限を含む重大な刑事、民事、行政処罰を含むが、これらに限定されない様々な方法で私たちに悪影響を及ぼす可能性がある。また、適用される法律や法規義務を遵守できなかったことは、私たちの流通や販売活動を中断させる可能性があります。
これらのリスクは、私たちの拡張を制限または破壊し、資金の流れを制限したり、契約権を剥奪したり、公正な補償を与えずに国有化または財産没収によってもたらす可能性がある。国際市場で業務を展開するにはまた大量の管理関心と財政資源が必要だ。
米国の“海外腐敗防止法”違反や同様の世界的な反賄賂法の悪影響を受ける可能性がある。
米国の“反海外腐敗法”(FCPA)、2010年の英国“反賄賂法”および他の司法管轄区の同様の反賄賂法は、会社およびその仲介機関が業務を獲得または保留するための不当な金の支払いを一般的に禁止している。私たちの政策は正確な情報と内部統制を維持することを含むこのような反賄賂法律を遵守することを要求する。私たちは世界の多くの地域で業務を展開しており、これらの地域はある程度政府の腐敗を経験しており、場合によっては反賄賂法律を厳格に遵守することは現地の風習ややり方と衝突する可能性がある。私たちの内部統制政策と手続きが従業員や代理人の行動から私たちを保護するという保証はない。もし私たちが
55
もし私たちが“海外腐敗防止法”や他の違反に責任があることが発見された場合(私たち自身の行為や不注意のためであっても、他人の行為や不注意のためであっても)、契約が取り消されたり、資格を取り消されたり、名声損失を含めて、民事および刑事罰または他の制裁を受ける可能性があり、これらのいずれも、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
私たちの製品の精算に関わるリスク
政府と個人保険が私たちの製品を購入する場合の販売率と保険の範囲が変わる可能性があります。
私たちのほとんどの製品の販売は、政府医療計画(例えばMedicareやMedicaid)や他のグローバル政府機関から製品コスト精算を得る能力に基づいて、私たちの顧客にある程度依存しています。政府医療計画と個人医療計画は医療コストの削減を求め続けている。例えば、2014年、連邦医療保険は、いくつかの臨床環境下で私たちの製品への単独支払いを停止する政策を制定した。この政策は私たちに製品価格を下げることを要求し、これは私たちの収入を大幅に減少させる。
我々の成功は,政府衛生行政部門,個人健康保険会社,他の第三者支払者がこのような製品や関連治療の費用にどの程度保険と十分な補償を提供するかにある程度依存し,このような補償があるかどうかは分からない。例えば,現在の多くの個人支払者は,我々のMuraPly AM,MuraPly,Novachor,NuShield製品に限られた保証範囲を提供しているため,これらの製品は個人支払者が保険を受ける患者への使用に限られている。
政府機関、個人健康計画、その他の医療サービス支払者は、医療コストのコントロールまたは低減に努力し続けており、以下の点に悪影響を及ぼす可能性がある
2023年の例年のMPFSの提案された更新は、2024年または2025年に私たちのすべての製品を含むすべての代用皮膚代替品の個別支払いを停止するという提案を含みます。連邦医療保険は,代用皮膚の費用を単独で支払うのではなく,代替品の支払いと申請手続きの支払いを束ねている。この提案の一部として,連邦医療保険は生物製品ではなくすべての代替品を供給品と見なし,我々を含めてスキンケア代替品を要求するメーカーに,2024年から発効する新たなHCPCSコードを申請する。2022年11月1日に発表された2023年MPFS最終ルールでは、CMSはこのバンドル提案を決定せず、将来的にはより多くのパブリックコメントを考慮するだろうが、彼らは再び同じ政策を提出するか、または将来的に私たちの業務および収入に影響を与える可能性のある他の提案を提示するかもしれない。Medicareが再提案し、最終的に2024年または2025年に代替品の単独支払いを停止する政策を決定した場合、私たちの製品の精算は十分ではないかもしれません。私たちの業務、運営結果、財務状況はマイナスの影響を受ける可能性があります。
支払者は,カバー範囲や精算レベルを制限することで医療コスト,特に一般的な新治療製品,あるいは既存の治療効果が良好と考えられる適応に特化した新治療製品を制御しようとしている。具体的には,2010年に公布された“患者保護と平価医療法案”(Patient Protection and Affordable Care Act,略称PPACA)には,我々の製品を使用することなく,連邦医療保険モデル計画に対する条項が含まれており,これらの計画は財政的インセンティブを創出し,慢性創傷患者を保守的に治療している。また、私たちのすべての製品は外来病院で単独で支払われていません。これは私たちの最大の顧客群です。この支払い政策は人々が私たちの競争相手の製品を使用することを刺激する。したがって,保険や精算を提供しても,保険を得る経路が保険獲得に行政負担を与える場合,および/または我々の製品を使用することは医療提供者にとって行政負担であるか,あるいは利益が代替治療よりも低い場合には,市場の我々の製品に対する受容度はすでに悪影響を受けるであろう。また、連邦医療保険は私たちのほとんどの顧客の主要な収入源であり、私たちのほとんどの製品と私たちの競争相手が病院外来で設定した同じ適応の製品に対して同じ金額を精算します。いくつかの介護場所では、精算金額は私たちが顧客から受け取った製品コストに基づいているのではなく、私たちの競争相手が同じ適応の製品に対して受け取るコストでもないので、私たちの顧客は私たちよりも安い製品を使用して彼らの利益率を増加させることを選択する可能性があり、これは私たちの業務、運営結果、財務状況に実質的な悪影響を与える可能性があります。
立法,法規,政策の変化および予算圧力により,連邦医療保険,医療補助,その他の第三者支払者の精算額は通常毎年調整されている。事実,連邦医療保険は2019年の例年の規則制定で代替案に対する意見を求めた場合,すでにシグナルを発しており,その2段階バンドル政策を停止する可能性がある。政策の変化は2023年に最初に発生する可能性があり、すべての製品のための単一の梱包を構築し、それによって私たちの製品を位置させることが含まれるかもしれません
56
深刻な競争劣勢。これらの変化により、第三者支払者は、保証や精算を減少またはキャンセルしたり、経済的でない新製品の精算を拒否または提供したりする可能性があり、顧客の収入や私たちの製品を購入する能力に影響を与える可能性があります。私たちの顧客の医療サービスに関連する医療規制、支払い、あるいは法執行環境のいかなる変化も、私たちの運営と収入に大きな影響を与える可能性があります。また,連邦医療保険は,連邦医療保険行政請負者(MAC)と呼ばれる地域請負業者を用いてクレームを処理し,保険政策を策定し,指定された地理管轄区域内で支払う。私たちの製品は現在ほとんどのMacコンピュータでカバーされていますが、未来にカバーされるかどうかは確認できません。
我々がCPN Biosciencesから得た製品ラインのような創傷ケア用品は,CMSの定価,データ分析,コード請負者(“PDAC”)のコード検証を受ける必要がある。PDACはすべての創傷看護用品のHCPCS II級DMEPOSコードの検証を担当している。我々は現在CPNで販売されている傷看護用品はすでにPDACのコード検証により検証されており、すべての製品はHCPCS II級コードを持っている。我々が開発または獲得した他の創傷ケア用品もPDACコード検証過程を受ける。私たちはPDACコード検証過程の結果を保証できない。もし私たちが私たちの製品に適したHCPCSコードの検証を受けることに成功しなかったら、私たちの傷の看護用品は精算を受ける資格がないかもしれません。あるいは販売率が私たちの用品の適切な販売率より低いかもしれません。
現在または将来の立法の結果を予測することはできないが,特に最近の医療改革立法への関心を考慮して,政府当局は医療総コストを低減し,わが製品の保証·精算を制限するための取り組みを継続していくことが予想される。もし私たちが第三者支払人から私たちの製品のために十分な補償を受けることに成功できなければ、市場が私たちの製品に対する受け入れ度は不利な影響を受けるかもしれません。不十分な精算水準は私たちの製品に価格下押し圧力を与える可能性もあります。たとえ私たちが私たちの製品のために広範な精算を得ることに成功したとしても、将来の精算政策の変化は私たちの業務、財務状況、運営結果にマイナス影響を与える可能性がある。
政府や個人保険(連邦医療保険行政請負業者を含む)が我々の製品を購入する収益率や保証範囲は不確実性の影響を受けている。
私たちの製品は異なる形式の政府と個人支払人によって精算され、これらの支払い形態の変動は私たちの業務に悪影響を及ぼす可能性があります。たとえば,代用皮膚の支払いがASP法に基づくサービスサイトでは,Medicareが代用皮膚に支払う費用は申請プログラムとは分離される.この場合,すべての代用皮膚(われわれの代用皮膚を含む)の医療保険支払率は1平方センチメートルあたりに計算される。これらのレートはメーカーのASP報告によって四半期ごとに調整され、支払い金額はASPプラス6%、WACプラス3%、または請求書定価である。すべての連邦医療保険の支払い金額は,ASP法での単独支払いを含め,自動減額の制約を受けている。BCAによると,連邦医療保険の2%の自動減額が一時停止され,2022年3月31日まで休止が継続されている。2022年4月1日、自動減支は1%となり、2022年7月1日現在、自動減支は2%に回復した。また,法定PAYGOにより,2024年の国会会議終了時に4%の連邦医療保険の自動減額を命じることができる。2022年1月まで、連邦医療保険法規は、医療機器としてFDAによって規制されているため、製品のASPの報告を要求しない。しかし、2022年第1四半期の報告締め切りから、2020年12月27日に法律に署名した2020年総合支出法案の条項に基づいて我々の製品のASPを報告することが求められている。
CMSが発表した第4四半期のASPファイル(例えば、2021年第4四半期の親和性製品)にASPデータがない場合、A/B部分のMacは、その管轄内で薬品およびバイオ製品の支払いを確立する。これらの場合、Macは通知することなく、四半期のように頻繁に精算方法を更新することができます。Macはまた、すべての代替品製品(私たちの製品を含む)のためのカバー政策を制定する権利があります。したがって,保険や精算を提供しても,保険を受ける経路が行政に負担をかける場合には,我々の製品を使用して行政に負担をかけたり,医療提供者に利益がない,あるいは利益が代替治療よりも低い場合には,市場の我々の製品に対する受容度は悪影響を受けるであろう。
また,連邦医療保険は,代用皮膚に対する2段階バンドル支払い政策を修正する可能性があることを示している。連邦医療保険は2019年の例年の規則制定で意見を求め、これらの規則は連邦医療保険病院外来予想支払いシステム(OPS)と外来手術センター(ASC)支払いシステム下の提案更新と政策変化と関係がある。連邦医療保険は特に2級バンドル政策を廃止すべきかどうかについて、すべての製品に単一バンドル政策を構築して意見を求める。しかし、連邦医療保険はこのような論評に答えるために、その二段階支払い政策に何の変更もしなかった。CMSが提案し、最終的にその2レベルの支払い政策の任意の改訂を決定すれば、これらの変更は私たちの製品の精算を減少させる可能性があり、使用率を下げ、私たちの収入を減少させる可能性がある。さらに、どんな新しい政策も、私たちの競争相手の製品を使用する病院とASCの財務的インセンティブを招き、私たちの市場シェアと収入を減少させる可能性がある。
57
私たちの顧客、調達グループ、第三者支払者、政府組織のコスト制御努力は、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性があります。
私たちの製品の米国における多くの既存および潜在的な顧客は、責任ケア組織または公共調達組織を含むGPOおよび/またはIDNのメンバーであり、私たちの業務はこれらの組織との主要な契約にある程度依存している。私たちの製品は国で入札されたり、より大きな病院GPOと契約を結ぶことができます。GPOとIDNは保健品メーカーと流通業者と定価手配を交渉し、付属病院と他のメンバーに交渉価格を提供する。GPOおよびIDNは、一般に、競合入札プログラムによってカテゴリ毎に契約を付与する。任意の所与の時間において、私たちは、通常、本来満了するプロトコルを含む、入札および交渉および更新GPOおよびIDNプロトコルに応答する異なる段階にいる。入札は、通常、より低い価格を得ることを目的として、複数の製造業者またはサービスプロバイダに募集される。入札プロセスおよび米国GPOとIDN契約プロセスの高度な競争性のため、私たちは私たちの製品の組み合わせにおける主要なGPOおよびIDNとの契約地位を獲得または維持することができないかもしれない。いくつかのこのようなプロトコルに含まれていない場合、私たちの業務、財務状況、および運営結果に大きな悪影響を及ぼす可能性があります。また,GPOやIDNなどの主要調達業者と契約して販売を促進することができるが,これらの製品の販売量は保持できない可能性がある。例えば、GPOおよびIDNは、同じ製品カテゴリの複数のサプライヤーに契約を付与するようになってきている。私たちがある製品カテゴリのGPOまたはIDNの唯一の契約サプライヤーであっても、GPOまたはIDNのメンバーは通常、他のサプライヤーから自由に調達することができる。さらに何かがある, GPOおよびIDN契約は、一般に、60~90日の通知後に無断で終了することができる。医療産業は統合されており,第三者支払者間でより大きな調達グループに統合されることで交渉や購買力が増加する。価格設定割引により、この統合は私たちにより大きな価格設定圧力をもたらす可能性があり、上記のリスクをさらに悪化させる可能性がある。
私たちの知的財産権に関するリスクは
私たちの特許と他の知的財産権は私たちの製品を保護するのに十分ではないかもしれない。
私たちの効果的な競争能力は、私たちの技術と製造プロセスの独自の性質を維持する能力があるかどうかにある程度依存するだろう。私たちは製造と他の技術、特許、商業秘密、商標、許可協定、契約条項に基づいて、私たちの知的財産権を確立し、私たちの製品を保護します。しかし、このような法的手段は限られた保護しか提供できず、私たちの権利を十分に保護できないかもしれない。いかなる理由でも、このような知的財産権を獲得、維持、強制または保護することができなかった場合、第三者がそれと競合する製品を製造することを可能にしたり、商業的に実行可能な基礎の上で私たち自身の製品を開発、製造、販売する能力に影響を与えるか、または私たちの収入、財務状況、または運営結果に実質的な悪影響を与えることはないかもしれない。
特に、私たちは主に商業秘密、ノウハウ、および他の保護が困難な非特許技術に依存している。私たちは、サプライヤー、従業員、コンサルタント、および他の固有情報にアクセスする可能性のある人と秘密保護協定を締結することによって、このような保護を求めることができるが、これらの合意が違反されないことを保証することはできず、いかなる違反にも使用できる十分な修復措置があるか、または私たちの商業秘密、ノウハウ、および他の非特許ノウハウが、私たちの競争相手に知られたり、独立して開発されたりしないことを保証することができる。もし私たちが知的財産権の保護に成功しなければ、私たちの製品の販売は影響を受ける可能性があり、私たちの創造能力は深刻な影響を受ける可能性がある。
私たちは様々な国や地域で私たちの製品に関連する様々な商標の登録を申請しており、特定の製品については、第三者の商標にも依存しています。このような商標は十分な保護を提供できないかもしれない。私たちまたはこれらの第三者はまた、これらの商標の下の権利を実行するための財力がない可能性があり、これは、他の人が商標を使用してその価値を希釈することを可能にするかもしれない。しかも、私たちの商標は第三者の商標と衝突することが発見されるかもしれない。この場合、私たちはこのような商標から何の価値も得られない可能性があり、紛争商標の使用を停止することさえ要求される可能性がある。私たちの商標価値はまた、私たちの商標を許可する際に適切な品質管理を実施できなかったように、私たち自身の行為によって低下する可能性があります。上記のいずれの場合も、私たちの商標の価値や使用能力を損なう可能性があり、私たちの業務に悪影響を及ぼす可能性があります。
私たちの発売製品に関連したほとんどの重要な特許が満期になった。私たちは例えば私たちのApligraf、Dermagraft、またはNuShield製品のような特許保護を持っていない。しかしながら、ビジネス秘密、商標、ノウハウ、および他の非特許技術に加えて、潜在的なビジネス利益をもたらすことができると考えられるので、特許保護を求め続けている。しかし、特許保護を求めるかどうかに対する私たちの評価は間違っているかもしれない。しかも、私たちのいかなる係属中の特許出願も特許を発行してはならない。我々が許可内に発行された特許を取得または取得したとしても、そのような特許権は、任意の第三者が我々の製品または技術と類似したまたは機能的に同じ製品を開発、使用または商業化することを防止するために、十分に広範な有効な特許保護を提供することができず、または他の方法で任意の競争優位性を提供することができる。また、これらの特許権は、第三者の挑戦、撤回、無効、侵害、または回避を受ける可能性がある。このような権利に関連した法律は将来私たちに不利な方法で変更または撤回されるかもしれない。
58
さらに、我々の製品または当社の製品を調製または製造するための技術またはプロセスは、現在または将来的に第三者の特許権を侵害する可能性があります。第三者はまた、当社の製品を開発、製造、または販売するために必要または有用な特許または他の独自の権利を得ることができる。この場合、私たちは他人から知的財産権許可を得ることを必要または選択することができ、私たちは商業的に合理的な条項でこれらの許可を得ることができないかもしれない(もしあれば)。
未解決および未来の知的財産権訴訟は費用が高く破壊的である可能性があり、私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性がある。
私たちの産業は広範囲な知的財産権訴訟を特徴としている。知的財産権訴訟を弁護するのは高価で複雑で、大量の時間がかかり、管理職の注意力を他の商業問題から移し、結果は予測が困難である。私たちは過去に私たちの製品や技術が第三者の知的財産権を侵害したと告発されましたが、将来私たちはこのような告発の影響を受けるかもしれません。任意の未解決または将来の知的財産権訴訟は、場合によっては3倍の損害賠償を含む重大な損害賠償をもたらす可能性があり、影響を受けた製品の製造および販売を阻止する可能性があり、または影響を受けた製品の販売を継続するために、許可および/または巨額の使用料または他の支払いを要求させる可能性がある。このようなライセンスは、もしあれば、商業的に合理的な条項で提供されないかもしれない。私たちは過去と将来、許可を得ることで第三者の知的財産権に関する紛争を解決することを選択するかもしれない。例えば、このようなライセンスまたは他の和解は、プリペイド、年間維持費、および特許使用料に関する可能性がある。任意の所与の時間に、私たちは原告または被告として多くの知的財産権訴訟に巻き込まれる可能性があり、その結果は長い間知ることができないかもしれない。我々の特許又は他の知的財産権侵害又は流用の成功クレームは、我々の業務、運営結果及び財務状況に実質的な悪影響を及ぼす可能性がある。
もし、私たち、私たちの従業員、または私たちの独立請負業者が、競争相手のいわゆる商業秘密、独自または機密情報を誤って使用または開示した場合、または競争相手との競争禁止または入札協定に違反した場合、私たちは損害賠償を受ける可能性がある。
私たちの何人かの従業員たちは以前他の医療設備、製薬、バイオテクノロジー会社に雇われていた。私たちはまた、現在他の医療設備、製薬、あるいはバイオテクノロジー会社に雇われている他の従業員を、私たちの競争相手を含むかもしれない。さらに、私たちは、それと契約することができるコンサルタントまたは他の独立したエージェントが、または私たちの1つまたは複数の競合他社と契約スケジュールを締結した可能性がある。現在未解決のクレームはないにもかかわらず、私たちは、私たち、私たちの従業員、または私たちの独立請負業者が無意識に、または他の方法で、これらの元雇用主または競争相手の商業秘密または他の固有情報を使用または漏洩しているというクレームの影響を受ける可能性がある。さらに、私たちは将来的にクレームを受ける可能性があり、すなわち、私たちは従業員が彼や彼女の競業禁止または競業禁止協定の条項に違反したことを招いた。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。これらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣の注意を分散させる可能性がある。もし私たちがこのようなクレームを弁護しなければ、金銭的損害賠償を支払う以外に、私たちは貴重な知的財産権や人員を失う可能性がある。このような訴訟が起こらないことは保証されず、将来のいかなる訴訟やその脅威も、私たちがより多くの直売代表または他の人員を雇う能力に悪影響を及ぼす可能性がある。キーパーソンや彼らの作業製品の流失は、既存または新製品をマーケティングする能力を阻害または阻止する可能性があり、これは私たちの業務を深刻に損なう可能性があります。
私たちは私たちの特許や他の知的財産権を保護したり強制したりする訴訟に巻き込まれるかもしれないが、これは高価で時間がかかるかもしれないし、最終的には成功しないだろう。
競争相手は私たちが持っているまたは許可している特許や他の知的財産権を侵害または盗用するかもしれない。それに応じて、私たちは権利侵害請求を要求されるかもしれないが、これは高価で時間がかかるかもしれない。私たちは侵害者とされるいかなるクレームに対しても、私たちが彼らの特許を侵害したことを告発するように、これらの当事者たちに反クレームを促す可能性がある。さらに、特許侵害訴訟では、裁判所は、私たちが所有または許可している特許の全部または一部が無効または実行不可能であると判断することができ、その特許の権利請求を狭義に解釈することができ、または侵害がないと結論することができる。任意の訴訟または弁護手続における不利な結果は、私たちの1つまたは複数の特許を無効または狭義に解釈されるリスクに直面させ、私たちの特許出願を発行できないリスクに直面させる可能性がある。
我々が所有または許可している特許または特許出願に関連する発明の優先度を決定するために、第三者によって引き起こされるか、または我々によって提起された干渉手続きが必要である可能性がある。不利な結果は、私たちがこの発明の使用を停止することを要求するか、または勝利者からその権利許可を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条件で私たちにライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。訴訟や介入訴訟に対する私たちの弁護は失敗する可能性があり、成功しても巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性があります。私たちは、特に米国のようにこれらの権利を十分に保護していないかもしれない国では、私たちの知的財産権の盗用を単独でまたは許可者と一緒に防ぐことができないかもしれない。
59
もし私たちが私たちの商業秘密とノウハウの機密性を保護できなければ、私たちの業務と競争地位は損なわれるだろう。
私たちは、従業員、コンサルタント、科学コンサルタント、請負業者と秘密および発明譲渡協定を締結することによって、私たちのノウハウおよびプロセスを保護することを求めています。また、私たちは私たちのビルの実体安全と、私たちの情報科学技術システムの実体と電子安全を維持して、私たちの資料と商業秘密の完全性とセキュリティを維持することに力を入れています。私たちは努力したにもかかわらず、合意は破壊される可能性があり、安全措置は失敗する可能性があり、私たちはいかなる違反や失敗にも対応する十分な救済措置がないかもしれない。さらに、私たちの商業秘密とノウハウは競争相手に知られたり独立して発見されるかもしれない。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。さらに、もし私たちの任意の商業秘密が競争相手によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らが情報を伝達する人がその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちのビジネス秘密が競争相手に漏れたり、競争相手によって独立して開発されたりすれば、私たちの競争地位は損なわれるだろう。
私たちは、私たちが所有または許可している特許および他の知的財産権の発明権または所有権に疑問を提起するクレームに直面する可能性がある。
私たちは、私たちが所有または許可した特許および知的財産権の所有権権益に対する元従業員、協力者、または他の第三者から告発されるかもしれない。私たちの政策は、知的財産権開発に参加する可能性のある私たちの従業員と請負業者が協定に署名することを要求し、そのような知的財産権を私たちに譲渡する義務があることを要求していますが、私たちは実際に私たちが自分の知的財産権を開発しているすべての側とこのような合意を実行できないかもしれません。私たちの許可者は同様の障害に直面している可能性があります。私たちは、例えば、私たちの候補製品の開発に参加したコンサルタントや他の人の義務紛争のため、所有権紛争の影響を受けるかもしれない。訴訟は在庫や所有権に挑戦するいかなるクレームにも対抗するために必要かもしれない。もし私たちがこのようなクレームを弁護できなかった場合、私たちはお金の損害賠償を支払わなければならず、知的財産権の独占所有権や使用権のような貴重な知的財産権を失う可能性があり、これは私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
特許保護の獲得と維持は、政府機関が提出した様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
特許及び特許出願の定期維持費、継続費、年会費及びその他の費用は、特許及び特許出願の有効期間内にいくつかの段階で米国特許商標局及び同様の外国機関に支払われる。私たちは私たちの外部弁護士に依存して外国特許代理機関にこのような費用を支払う。米国特許商標局および各種外国特許機関は、特許出願過程において、いくつかのプログラム、文書、費用支払い、およびその他の規定を遵守することを要求する。私たちは法律事務所と他の専門家を招いて私たちの遵守を助けてくれます。多くの場合、不注意は滞納金を支払うことによって、あるいは規則を適用する他の方法で是正することができます。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効される可能性があり、それにより、関連法ドメインの特許権の一部または全部が失われる可能性がある。この場合、潜在的な競争相手が市場に参入する可能性があり、これは私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性がある。
C米国特許法の抜け穴は特許の全体的な価値を低下させ、製品を保護する能力を弱める可能性がある。
バイオ製薬業界の成功は知的財産権、特に特許に大きく依存している。製薬業界での特許の取得と実施は技術的な複雑さと法律的な複雑さにも関連するため、薬品特許の獲得と実施は高価で時間がかかり、本質的に不確定である。
最近の特許改革立法は、特許出願の起訴および特許の執行と保護の不確実性とコストを増加させる可能性がある。2011年に公布された“ライシー·スミス米国発明法”(Leahy-Smith America Invents Act、略称Leahy-Smith Act)は、特許出願起訴および特許訴訟に影響を与える条項を含む米国特許法を重大に改正した。米国特許商標局は、Leahy-Smith法案の管理を管理するための新しい法規および手続きを制定し、Leahy-Smith法案に関連する特許法の多くの実質的な改正は、2013年3月に施行された最初の提出条項の改正を含む。ライシー·スミス法案の私たちの業務への全面的な影響はまだわかりませんが、コスト増加と特許保護がより限られている可能性があり、いずれも私たちの業務、運営結果、および財務状況に悪影響を及ぼす可能性があります。
60
さらに、米国最高裁判所の最近の裁決は、場合によっては入手可能な特許保護範囲を縮小し、場合によっては特許所有者の権利を弱める。このような事件の結合は、私たちが将来特許を得る能力の不確実性の増加に加えて、私たちが確実に獲得した任意の特許の価値に不確実性をもたらす。米国議会、連邦裁判所、および米国特許商標局の決定によれば、特許を管理する法律および法規は、予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を取得したり、私たちが所有または許可する可能性のある任意の現在または未来の特許を実施する能力を弱める可能性がある。
私たちの負債に関するリスクは
私たちの負債は私たちの業務、運営結果、そして財務状況に実質的な悪影響を及ぼすかもしれない。
2022年12月31日まで、私たちの2021年の信用協定によると、私たちは約7130万ドルの元本未済債務総額を持っています。私たちの負債は、私たちが私たちの債務満期金額を支払うのに十分な現金を生産できない可能性があり、私たちの債務保有者に他の重要な結果をもたらし、私たちの業務に大きな影響を与える可能性があるというリスクを増加させる。例えばこれは
さらに、私たちの高度な保証信用手配を管理する信用協定は、私たちの知的財産を含むすべての個人財産と資産をほぼ担保し、制限的な契約を含み、私たちが長期的に最適な利益に適合する可能性のある活動に従事する能力を制限する。もし私たちがこのような条約を守らなければ、約束違反を招くかもしれないし、違約を治癒したり免除しなければ、私たちのすべての借金の加速を招くかもしれない。
私たちの現在の負債水準にもかかわらず、私たちはもっと多くの借金を招くかもしれない。これは私たちの大量のレバーと関連した危険をさらに悪化させるかもしれない。
私たちは未来に巨大な追加債務を招くかもしれない。私たちの優先担保と付属信用手配を管理する信用協定は私たちと現在と未来の付属会社が追加債務を招く能力を制限しますが、優先担保と付属信用手配の条項は私たちがある場合に重大な追加債務を招くことを許可します。また、私たちの優先保証と二次信用手配を管理する信用協定は、その中で定義された債務を構成しない債務を負担することを禁止しない。私たちが追加債務やこのような他の債務を招く程度では、私たちが債務を返済できない可能性があることを含めて、私たちの上述した巨額債務に関連するリスクが増加するだろう。
私たちは債務を返済するために大量の現金が必要になり、私たちが現金を発生させる能力は私たちがコントロールできない多くの要素に依存し、私たちの債務超過義務を履行できないいかなるものも私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性がある。
私たちが債務を返済し、債務再融資を行う能力、および運営資本需要や計画資本支出に資金を提供する能力は、将来的に現金を発生させる能力に依存する。これは一般経済、金融、競争、商業、立法、規制、その他の私たちがコントロールできない要素の影響をある程度受けている。
もし私たちの業務が運営から十分なキャッシュフローを生じていない場合、あるいは将来私たちの債務を返済するための十分な借金がない場合、あるいは私たちの他の流動資金需要を満たす場合、私たちは債務が満期になる前に、私たちの債務の全部または一部を再融資し、資産を売却し、資本投資を減らしたり、延期したり、追加資本を調達する必要があるかもしれません。これらはいずれも、私たちの業務、運営結果、財務状況に大きな悪影響を及ぼす可能性があります。さらに私たちは
61
必要であれば、商業的に合理的な条項やこのような行動を全く実行できない。私たちが債務を再編または再融資する能力は、当時の資本市場状況と私たちの財務状況に依存するだろう。私たちの債務に対するいかなる再融資もより高い金利で行われる可能性があり、より煩雑な条約の遵守が要求されるかもしれません。これは私たちの業務運営をさらに制限するかもしれません。既存または将来の債務ツールの条項は、私たちの優先的および付属保証信用スケジュールを管理する信用協定を含み、私たちがこのような行動を取ることを制限または阻止する可能性がある。しかも、私たちの未返済債務の利息と元金を予定通りに支払うことができなかったいかなることも、私たちの信用格付けを低下させる可能性があり、これは商業的に合理的な条項で追加債務を発生させる能力を損なう可能性があり、さらには全くない。私たちは私たちの債務超過義務を履行するのに十分なキャッシュフローを作ることができない、あるいは商業的に合理的な条項で私たちの義務を再融資したり、再融資したり、あるいは根本的に不利な影響を与えることができず、これは私たちの業務、経営業績、財務状況、そして私たちの優先的かつ付属保証信用手配および私たちの他の債務を履行する能力に悪影響を及ぼすかもしれない。
私たちは、私たちがコントロールできない事件による違約事件を含む、私たちの未済債務に関する合意を遵守できませんでした。これは、私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼす可能性があります。
私たちの未償還債務に関連するいかなる合意に基づいて違約事件が発生した場合、違約債務の所持者は、その債務に関連するすべての未償還金額を直ちに満期にして支払うことができる。私たちの資産やキャッシュフローが私たちの未返済債務ツール下の借金を返済するのに十分な保証はありません。もし違約事件が発生した時に返済を加速すれば。さらに、私たちが私たちの担保債務に基づいて返済、再融資、または私たちの債務を再構築することができなければ、このような債務の保有者は保証債務の担保に対して訴訟を行うことができる。さらに、1つの債務ツールの下の任意の違約または宣言加速は、私たちの1つまたは複数の他の債務ツールの下での違約イベントをもたらす可能性もある。したがって、私たちのどんな債務不履行も、私たちの業務、運営結果、そして財務状況に実質的な悪影響を及ぼす可能性がある。
私たちの高度な保証信用手配と従属信用手配を管理する信用協定は、私たちの現在と未来の業務、特に私たちが変化に対応したり、いくつかの行動を取る能力を制限します。
私たちの高度な保証信用手配と私たちの二次信用手配を管理する信用協定は、私たちのほとんどの資産(私たちの知的財産を含む)を担保にし、重大な運営と財務制限を加え、特に私たちと他の制限された子会社の能力を制限します
これらの条約と制限のため、私たちは経営業務の面で現在も将来も制限されており、私たちは新たなビジネス機会を効果的に競争したり、利用するために追加の債務や株式融資を集めることができないかもしれない。また、私たちの高度な保証信用手配は、最低総合収入契約(従来の12ヶ月をベースに測定)と最低毎月流動資金比率(毎月最終日で測定)を遵守することを要求しています。高級担保信用手配の経営と財務制限とチノ、そして私たちが未来に締結する可能性のある任意の融資協定は、私たちの業務融資、業務活動に従事し、あるいは私たちの業務戦略を全面的に推進する能力を制限するかもしれない。私たちがこの条約を遵守する能力は私たちがコントロールできない事件の影響を受けるかもしれないし、私たちはこの条約を履行できないかもしれない。例えば、過去、私たちは債務協定で特定の財務協約を遵守していなかったが、この状況は未来に再び起こるかもしれない。私たちは私たちが将来このような条約を守り続けることができるという保証はできないし、もし私たちがそうできなければ、私たちは貸主たちから免除を受けて、そして/またはこの条約を修正することができるだろう。
62
私たちは上記の制限的契約および私たちの未来の債務ツールに時々含まれる他の条項を遵守できず、違約事件を招く可能性があり、違約を治癒または免除しなければ、満期日までにこれらの借金を返済することを要求される可能性がある。もし私たちがこれらの借金をあまり割引しない条件で再融資することを余儀なくされれば、私たちの業務、運営結果、財務状況は不利な影響を受ける可能性があります。
A類普通株に関するリスク
大株主グループは私たちに重大な支配権を行使し、彼らの利益は未来にあなたの利益と衝突するかもしれない。
Alan A.Ades、Albert Erani、Glenn H.Nussdorf、Dennis Erani、Starr Wisdom、Organo PFG LLC、Organo Investors LLC、Dennis Erani 2012 sue Trust、Alan Ades 2014 GRAT受託者、日付は12/29/2012、GN 2016 Family Trust u/a/d 2016年8月12日、GN 2016 Organo GRAT u/a/d 2016年9月30日とRed Holdings、LLCを総称して重要株主グループと呼び、A類普通株が発行された相当数の投票権を統制する。大株主グループは2023年2月15日現在、会社の約45%のA類普通株を共同で実益している。このような投票権制御により、大株主グループは、株主承認を必要とするすべての事項の結果を集団的に効率的に決定することができ、会社役員の選挙及び罷免(当社と重要株主グループとの間の合意条項に基づいて我々4人の取締役を指定する権利を含む)、会社又は管理政策の他の事項(例えば、潜在的な合併又は買収、配当金の支払い、資産売却、並びに会社登録証明書及び会社定款の改正を含む)を含むことができる。このような所有権の集中は、制御権の可能な変化を遅延または阻止し、会社A類普通株の取引市場の流動性を制限する可能性があり、これはそのA類普通株への投資価値を低下させる可能性がある。この投票制御は、潜在売却会社の一部として株主が保有するA類普通株からプレミアムを得る機会を奪う可能性もある。重要株主グループとその関連会社が引き続き当社のかなりの総投票権を持っていれば, 彼らはそれの決定に強く影響したり効果的に制御し続けるかもしれない。大株主グループ及びその関連会社の利益は、会社A類普通株の他の保有者の利益と一致しない可能性がある。
その業務活動の正常な過程において、大株主グループ及びその関連会社は、その利益が我々又は他の株主の利益と衝突する活動に従事する可能性がある。また、大株主グループは、買収、資産剥離、その他の投資を増加させる可能性があると考えている取引に興味を持っている可能性があり、これらの取引があなたにリスクをもたらす可能性がある。
私たちの株価はずっと変動していて、変動し続ける可能性が高い。収入や経営結果の変動は私たちの株価をさらに変動させる可能性があるため、私たちの株主は大きな損失を受ける可能性があります。
私たちの株価はずっと不安定で、様々な要素によって大幅に変動する可能性があり、その多くの要素はコントロールできません。株式市場全体、特に生物技術会社の市場は、極端な変動を経験し、この変動は往々にして特定の会社の経営業績と関係がなく、ある場合、新冠肺炎の疫病はこの変動を悪化させた。私たちのどの財政四半期の収入にも予期せぬ不足が生じており、この四半期の経営業績に悪影響を及ぼす可能性がある。私たちの費用の大部分は相対的に固定されていて、主に人員コストと施設コストを含み、これはこのような不足が私たちの純収入に与える影響を悪化させるかもしれない。このような変動は私たちの株の取引価格に否定的な影響を及ぼすかもしれない。私たちの四半期の経営業績は過去と大きく異なり、未来は大きく変わるかもしれません。
私たちが知っているように、第3項“法律訴訟”で開示されているように、株式取引価格の変動を経験した一部の会社は証券集団訴訟の対象となっている。私たちは一方としてのいかなる訴訟も、正当な理由の有無にかかわらず、不利な判決を招く可能性がある。私たちはまた不利な条件で訴訟を解決することに決定するかもしれない。
このような負の結果は、巨額の損害賠償または罰金の支払い、私たちの名声を損なう、または私たちのビジネス慣行に悪影響を及ぼす可能性があります。訴訟を弁護するためには高価で時間がかかり、私たちの管理職の関心と私たちの資源を分散させるかもしれない。また,訴訟過程では,公聴会,動議や他の一時的な手続きや事態の結果を負の公表にする可能性があり,これは我々A種類の普通株の市場価格に悪影響を与える可能性がある.
63
会社定款は、法律で許容される最大範囲内でデラウェア州衡平裁判所が会社株主のために提起する可能性のある特定のタイプの訴訟及び訴訟の唯一及び独占フォーラムを指定することができ、これは、会社株主が会社又は会社の役員、高級管理者又は従業員との紛争について有利な司法裁判所の能力を得ることを制限し、株主がこのようなクレームを提起することを阻止することができる。
会社の定款によると、会社が書面で代替裁判所を選択しない限り、唯一かつ排他的な裁判所はデラウェア州衡平裁判所である
会社の登録証明書や定款のこれらの条項は、会社またはその役員、高級管理者または他の従業員との間のいくつかの紛争について会社株主が有利な司法裁判を受ける能力を制限する可能性があり、これは、会社およびその役員、高級管理者および従業員に対するこのような訴訟を阻害する可能性がある。あるいは、裁判所が、当社の会社登録証明書または定款におけるこれらの条項が上記の1つまたは複数の訴訟または手続に適用されないと考えている場合、改正された1933年の証券法に基づいて提起された任意の訴訟を含むが、これらに限定されない場合、当社は、他の司法管区におけるこのような問題の解決に関連する追加費用を生じる可能性があり、これは、その業務、財務状況、および経営結果に悪影響を及ぼす可能性がある。また、投資家は連邦証券法とその下の規則や条例を遵守することを放棄できないため、裁判所は改正された“1933年証券法”に基づいて提出された任意の訴訟執行会社の立地条項にも不確実性があるのではないか。
会社規約における条項は、会社への買収を阻止する可能性があり、投資家が将来会社のA類普通株に支払うことを望む可能性のある価格を制限し、経営陣を強固にする可能性がある。
会社の会社登録証明書にはいくつかの条項が含まれており、これらの条項は、株主がその最適な利益に合致すると考えられる能動的な買収提案を阻止する可能性がある。これらの規定には、取締役会が新シリーズの優先株を指定·発行する権利がある条項が含まれており、経営陣の解除の難しさを増加させる可能性があり、自社証券の現行の市場価格よりも高い割増を支払うことに関連する取引を阻害する可能性がある。
一般リスク因子
私たちは現在と将来、証券集団訴訟や他の訴訟の影響を受ける可能性があり、これらの訴訟は、巨額の法的費用を発生させ、経営陣の注意を移し、私たちの業務に損害を与える可能性があります。
私たちは証券集団訴訟と関連した潜在的な責任と名声の危険に直面している。私たちは三番目の“法律訴訟”で開示された証券集団訴訟の当事者です。私たちは、集団訴訟や証券デリバティブ訴訟、および追加の法的費用を発生させ、私たちの株価と名声に悪影響を及ぼす可能性がある追加の訴訟を受けるかもしれない。しかも、私たちは特定の訴訟に参加した特定の個人に賠償と立て替え費用を支払う義務がある。
未解決または将来の訴訟の任意の不利な判決または和解は、巨額の支払い、罰金、および罰金をもたらす可能性があり、これは、私たちの業務、運営結果、財務状況、および名声に重大な悪影響を及ぼす可能性があります。これらの事項に関連するこのような支払い、損害賠償、または和解費用は、私たちの保険範囲を超える可能性があります。これらの訴訟を解決するのに要する時間は予測できないが、私たちに対する訴訟やクレームは、法的根拠のない訴訟やクレームであっても、巨額のコストを発生させる可能性があり、経営陣の日常的な業務運営に対する注意を移し、私たちの名声を深刻に損なう可能性がある。
私たちは激しい競争と持続的な競争に直面しており、これは私たちの業務、運営結果、そして財務状況に悪影響を及ぼすかもしれない。
64
私たちは私たちの業務において持続的で激しい競争に直面しています。その特徴は迅速な技術変革と激しい価格競争です。市場シェアは技術革新や他のビジネス要因によって変化する可能性がある。私たちの顧客は製品を選択する時、製品の信頼性、臨床結果、経済結果、価格とメーカーが提供するサービスを含む多くの要素を考慮します。私たちの競争能力は私たちが顧客と支払者に納得できる臨床と経済的利益を提供し、新製品と技術を開発し、それを商業化し、技術の進歩を予見する能力に大きく依存しています。競争相手の製品紹介や強化は、先進的な技術、より良い機能、またはより低い価格設定を持つ可能性があり、私たちの製品を時代遅れにしたり、競争力を低下させたりする可能性がある。さらに、医療産業の統合は、価格優遇を要求したり、一部のサプライヤーを特定の市場から除外したりすることを招き続けており、これは、私たちの業務、運営結果、または財務状況に悪影響を及ぼす可能性がある。私たちの市場では、このような競争の存在は定価圧力を招く可能性があり、これは私たちの利益のある価格で私たちの製品を販売することを難しくしたり、私たちの製品を販売することができなくなります。そのため、私たちは持続的な努力と財政資源を投入し、私たちが開発している製品を市場に投入し、コスト効果のある臨床結果を提供し、私たちの地域カバー範囲を拡大し、私たちの既存の製品を強化し、先進的な傷口看護と軟組織修復市場のために新製品を開発する必要がある。費用対効果のある製品および/または新製品を開発しても、コストコントロールや支払人からの他の財務的圧力により、これらの製品は保険や精算が得られない可能性がある。
私たちの未来の資本需要は不確定であり、私たちは未来に資金を調達する必要があるかもしれないが、これらの資金は受け入れ可能な条件で提供できないかもしれない、あるいは根本的にはできないかもしれない。
私たちの業務を拡大し続けることは高価であり、私たちは株式発行、既存、または未来の信用手配下の借金、または他の出所から資金を求めるかもしれない。私たちの資本要求は多くの要素に依存します
現在知られていない多くの要素のため、私たちの運営計画は変化する可能性があり、私たちは計画よりも早い追加資金が必要かもしれない。私たちが追加的な資金が必要な時、私たちは私たちが受け入れられる条項でこのような資金を得ることができないかもしれない。さらに、私たちが株式または転換可能な債務証券を発行して資本を調達する場合、あなたは希釈に遭遇する可能性があり、新しい株式または転換可能な債務証券は、株主としての権利に優先する権利、または他の方法であなたの権利に悪影響を与える権利、特典、および特権を有する可能性があります。さらに、私たちが協力、許可、または他の同様の手配を通じて資金を調達する場合、私たちの製品、潜在的製品、またはノウハウに対する貴重な権利を放棄するか、または私たちに不利な条項で許可を付与する必要があるかもしれない。もし私たちが受け入れ可能な条件で資金を調達できなければ、私たちの候補製品を開発し、私たちの既存製品を強化し、私たちの業務計画を実行し、未来の機会を利用したり、競争圧力、サプライヤー関係の変化、あるいは意外な顧客要求に対応することができないかもしれません。これらの事件のいずれも、私たちの開発および商業化目標を達成する能力に悪影響を及ぼす可能性があり、これは、私たちの業務、運営結果、および財務状況に実質的な悪影響を及ぼす可能性がある。
私たちの未来の成功は私たちが肝心な従業員、顧問と顧問を維持する能力、及び合格者を吸引、維持、激励する能力にかかっている。
私たちは私たちの実行幹事に強く依存しており、彼らのサービスを失うことは私たちの目標の実現に悪影響を及ぼすかもしれない。特に、私たちはゲイリー·ギリーニ、私たちの社長兼最高経営責任者に依存している。私たちの業務のために他の合格した従業員、コンサルタント、コンサルタントを募集し、維持し、科学と技術者を含むことも、私たちの成功の鍵となるだろう。現在、私たちの業界にはスキルのある幹部や科学人材が不足しており、このような状況が続く可能性がある。そのため、技能人材に対する競争は非常に激しく、離職率が高い可能性がある。多くの医療機器会社が似たようなスキルを持つ人を争っているため,受け入れ可能な条件で人材を引き付けることはできないかもしれない。役員、重要な従業員、コンサルタント、コンサルタントを募集したり失うことができないサービスは、私たちの研究開発や販売増加目標の進展を阻害する可能性があります。
65
私たちが従業員とコンサルタントを募集し、維持し、激励する能力は、ある程度私たちが魅力的な報酬を提供する能力にかかっている。私たちはまた彼らに支払う現金補償レベルを高める必要があるかもしれません。これは研究開発と販売増加目標を支援するために使用できる資金を減らすことができるかもしれません。私たちは私たちの従業員とコンサルタントに魅力的な報酬を提供するのに十分な現金を持っているという保証はない。
私たちは価値のある従業員を引き留めるために努力しているにもかかわらず、私たちの管理、科学、開発チームのメンバーは彼らの私たちの仕事を終わらせるかもしれない。幹部や他の重要な従業員のサービスを失ったり、適切な代替者を見つけることができなくても、私たちの業務、将来性、財務状況、または運営結果を損なう可能性があります。私たちはこのような個人や私たちの他のどんな従業員のためにも“キーパーソン”保険証書を維持しない。
私たちと人材を競争する多くの会社は私たちよりもはるかに大きい財政や他の資源、そして異なるリスク状況を持っている。彼らはまたより多くの違う機会とより良い職業昇進の機会を提供するかもしれない。その中のいくつかの特徴は私たちが提供できるより高い素質の応募者たちにもっと魅力的かもしれない。もし私たちが引き続き高い素質の人材を誘致し、維持することができなければ、私たちは候補製品の開発、開発と商業化の速度と成功程度が制限されることを発見した。
ビジネスや経済的中断や世界的な健康問題は私たちの業務を深刻に損なうかもしれない。
広範なビジネスや経済的中断は、私たちの業務や製品販売に悪影響を及ぼす可能性があります。例えば,2019年12月,1種の新型コロナウイルス株(新冠肺炎)の爆発は武漢中国に起源し,米国を含む複数の他の国に蔓延している。この疫病は世界各地の特定の企業たちを長い間閉鎖させた。2022年12月31日まで、新冠肺炎疫病は著者らの財務業績と業務運営に実質的な不利な影響を与えなかったが、新冠肺炎は引き続き会社にリスクをもたらし、著者らは疫病が著者らの業務の各方面に与える影響を引き続き密接に注目している。新冠肺炎のような世界的な健康懸念は、しばしば私たちが製品を販売している病院、診療所、医療保健提供者に比例しない影響を与え、これは私たちの業務および私たちの運営結果と財務状況に実質的な悪影響を与える可能性がある。
全体的な経済状況の不確実性と不利な変化は私たちの業務に否定的な影響を及ぼすかもしれない。
もしアメリカの全体的な経済状況が低下した場合、あるいは消費者が経済状況が低下することを心配すれば、私たちの製品の販売は低下する可能性がある。不利な変化は、不利な経済状況、原油価格の変動、サプライチェーン問題、インフレ、政治不安定、消費者自信の低下、新冠肺炎の大流行または別の大流行病の持続または悪化、失業、株式市場変動、信用供給収縮、またはその他の経済状況に影響する要素によって発生する可能性がある。これらの変化は、我々の既存製品の販売または将来の製品の開発に負の影響を与え、コストを増加させ、融資の獲得性を減少させるか、または私たちの製品および潜在的な候補製品の生産および流通に関連するコストを増加させる可能性がある。
会計基準の変化及び管理層が複雑な会計事項に関連する主観的な仮定、推定と判断は私たちの業務、運営結果と財務状況に重大な影響を与える可能性がある。
アメリカ公認会計原則(“GAAP”)と関連会計声明、実施ガイドライン及び私たちの業務に関する広範な事項の解釈は非常に複雑である。これらの事項は、収入確認、レンタル、所得税、営業権、および長期資産の減価、および株式ベースの報酬を含むが、これらに限定されない。これらの規則、ガイドライン、または解釈の変化は、私たちの報告または予想される財務業績または財務状況を著しく変化させる可能性がある。
また、公認会計原則に従って財務諸表を作成し、経営陣に合併財務諸表と付記された報告金額に影響を与える仮定、推定、判断を要求する。我々の見積もりと判断は,歴史的経験と当時の状況で合理的であると考えられる様々な他の仮定に基づいている.これらの見積りの結果は,資産,負債,権益の帳簿価値および他のソースからは見えにくい純収入や費用金額を判断する基礎を構成している。もし私たちの仮定が変化したり、実際の状況が私たちの仮定と異なっていれば、私たちの経営業績は不利な影響を受ける可能性があり、これは私たちの経営業績が証券アナリストや投資家の期待よりも低くなり、私たちの株価を下落させる可能性があります。
私たちが規制義務を守らないことは私たちの業務に否定的な影響を及ぼすかもしれない。
もし私たちまたは私たちのサプライヤーが適用された規制要件を遵守できなかった場合、他の事項を除いて、FDAまたは他の政府機関につながる可能性があります
66
適用される法規要件を遵守しないことは、個人当事者が私たちに民事訴訟(例えば、連邦ラナム法案および/または州不正競争法に基づく)、および他の予期しない負の結果を引き起こす可能性もある。もしこれらの行為のいずれかが発生すれば、私たちの名声を損なう可能性があり、私たちの製品販売が影響を受け、私たちが収入を作ることを阻止するかもしれません。
私たちの管理者、従業員、独立請負業者、主要な調査者、コンサルタント、ビジネスパートナーは、不当な行為や他の法律法規の下で不正な活動に従事する可能性があり、これは私たちに責任をもたらすだろう。
私たちが直面しているリスクは、私たちの官僚、従業員、独立請負業者(契約研究組織またはCROを含む)、首席調査員、コンサルタント、および商業パートナーが詐欺行為または他の不法活動に従事する可能性があり、および/または不正活動を私たちに開示できない可能性があることだ。これらの当事者の不正行為は、故意、無謀、および/または不注意が遵守できなかったことを含むことができるが、これらに限定されないかもしれない
特に、医療製品の生産に参加する会社は、患者のための医療製品が安全かつ有効であることを保証するための法律および法規によって制約されており、特にそれらは偽または汚染されておらず、それらは適切にラベルが貼られており、それらが表す識別、強度、品質、および純度を有する。また、医療製品の研究と開発に参加する会社は広範な法律法規の制約を受けており、これらの法規は研究対象を保護し、臨床試験によるデータと監督審査過程の完全性を確保することを目的としている。上記のいずれの分野でも、私たち自身の従業員であっても、私たちの代理である請負業者、サプライヤー、ビジネスパートナー、コンサルタント、または他のエンティティであっても、規制制裁、刑事または民事責任を招き、私たちの名声を深刻に損なう可能性がある。従業員、CROパートナー、首席調査員、コンサルタント、ビジネスパートナーが医療専門家や患者との活動や相互作用が適切で道徳的であることを確保し、適用されるすべての法律、法規、ガイドライン、政策、基準と一致することを確保するための包括的なコンプライアンス計画を持っているが、常に不適切な行為を識別し、阻止することができるわけではなく、このような行為を発見し、防止するための予防措置は、このような行為を効果的に防止し、リスクを低減し、またはこれらの法律や法規を遵守できないことによる政府の調査や他の行動や訴訟の機会を減少させることができない可能性がある。もし私たちにこのような行動をとると、これらの行動は、巨額の罰金を科すことや、収益性業務を経営する能力を深刻に弱める可能性のある制裁など、私たちの業務に大きな影響を与える可能性がある。
67
もし私たちが環境、健康、安全の法律法規を守らなければ、私たちは罰金や処罰を受けたり、コストを発生したりする可能性があり、これは私たちの業務、運営結果、財務状況に実質的な悪影響を及ぼすかもしれない。
私たちは多くの環境、健康と安全の法律と法規によって制約されていて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理、製造と処理を管理する法律と法規を含む。私たちの行動は化学物質と生物学的材料を含む危険で燃えやすい材料の使用に関するものだ。私たちの業務はまた危険な廃棄物製品を発生させるだろう。私たちは一般的に第三者と契約を結び、このような材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし私たちが危険な材料を使用して汚染や損傷をもたらしたら、私たちはそれによるいかなる損害に責任を負い、いかなる責任も私たちの資源の範囲を超える可能性がある。私たちはまた民事や刑事罰金と処罰に関連した巨額の費用を発生させるかもしれない。
危険材料の使用や他の労災による従業員の負傷により生じる可能性のあるコストや費用を支払うために労働者補償保険を維持しているが、潜在的な責任に対応するために十分な保険を提供できない可能性がある。また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。このような現行または未来の法律法規は私たちの研究、開発、または生産努力を損なうかもしれない。このような法律法規を遵守しないことはまた巨額の罰金、処罰、または他の制裁につながる可能性がある。
実際の税率の意外な変化や会社の収入や他の納税申告書の審査による不利な結果は、会社の財務状況や経営業績に悪影響を及ぼす可能性がある。
同社は米国とスイスで所得税を納付しており、会社の国内納税義務は異なる管轄区域の費用配分の影響を受ける。同社の将来の有効税率は、変動や複数の要因の悪影響を受ける可能性がある
また、会社はアメリカ連邦、州、地方、非アメリカ税務機関による会社の収入、販売、その他の税収の監査を受ける必要があるかもしれない。これらの監査の結果は、会社の財務状況や経営結果に悪影響を及ぼす可能性がある。
当社証券の市場は持続できない可能性があり、これは当社証券の流動性や価格に悪影響を及ぼす。
会社証券の価格は一般市場や経済状況によって大きく変動する可能性がある。活発な会社証券取引市場は永遠に発展しないかもしれないし、発展すれば持続できないかもしれない。また、全体的な経済状況や予測、会社全体の業務状況および会社財務報告の発表により、会社証券の価格が変化する可能性がある。さらに、会社の証券がナスダックに上場されていない場合、または何らかの理由で取得され、場外取引掲示板(非全国的な証券取引所の取引業者間株式証券自動見積システム)で見積が行われている場合、会社証券の流動性および価格は、ナスダックまたは他の国の証券取引所に上場または見積されるよりも限られている可能性がある。市場が確立したり持続できない限り、あなたはあなたの証券を売ることができないかもしれない。
季節性などの影響を受けて、会社の四半期経営業績は大幅に変動する可能性があり、証券アナリストと投資家の予想を下回る可能性があり、その中のいくつかの要素は会社がコントロールできないことであり、会社の株価下落を招く。
同社の四半期経営業績は、いくつかの要因で大きく変動する可能性がある
68
証券または業界アナリストが、会社、その業務または市場に関する研究または報告を発表または停止しない場合、または会社A類普通株に対する推薦が逆に変化した場合、会社A類普通株の価格および取引量が低下する可能性がある。
会社A類普通株の取引市場は、業界または証券アナリストが発表する可能性のあるわが社の業務、会社市場、または会社の競争相手に関する研究と報告の影響を受ける。証券や業界アナリストは、同社に関する研究報告書の発表を中止する可能性がある。同社を追跡しているアナリストが同社の報道を停止したり、同社に関する報告を定期的に発表できなかったりすれば、金融市場での視認性を失う可能性があり、同社の株価や取引量の低下を招く可能性がある。当社のどのアナリストも自社株に対する不利な提案を変更したり、当社のライバルに対してより有利な相対的な提案をしたりすれば、当社A類普通株の価格が下落する可能性がある。
法律、法規または規則の変化、またはいかなる法律、法規または規則を遵守しないことは、会社の業務、投資、および経営結果に悪影響を及ぼす可能性がある。
当社は国、地域、地方政府及びナスダックが制定した法律、法規、規則の制約を受けています。特に、会社は米国証券取引委員会、ナスダック、および他の法律または法規のいくつかの要求を守らなければならない。適用される法律、条例、そして規則を遵守して監視することは難しく、時間がかかり、費用がかかる。このような法律、法規或いは規則及びその解釈及び応用も時々変わる可能性があり、このような変更は当社の業務、投資及び経営業績に重大な不利な影響を与える可能性がある。また、解釈や適用の適用法律、法規又は規則を遵守しないことは、会社の業務や運営結果に重大な悪影響を及ぼす可能性がある。
私たちはナスダックの持続的な上場要求を満たすことができず、私たちの証券がキャンセルされるかもしれません。
もし私たちがナスダックの継続上場の要求、例えば会社の管理要求や最低終値要求を満たしていなければ、ナスダックは私たちの証券を撤退させる措置を取るかもしれない。このような退市は、証券の価格にマイナス影響を与える可能性があり、証券の売却や購入を希望する場合に証券を売却または購入する能力を弱める可能性がある。もし退市事件が発生した場合、私たちが上場要求を遵守するために取ったいかなる行動も、私たちの証券の再上場を許可し、市場価格を安定させたり、私たちの証券の流動性を高めたり、私たちの証券がナスダックの最低購入価格要求以下に下落することを防ぐことを保証することができません。あるいは将来ナスダックの上場要求に合わないことを防止します。また、我々の証券がナスダックに上場していない場合、又は何らかの理由で取得された場合、我々の普通株は、場外取引市場又は非上場証券のために設立された電子掲示板でしか取引できない、例えば場外取引掲示板、国家証券取引所ではなく、取引業者間株式証券自動見積システムであれば、我々の証券の流動性及び価格は、ナスダック又は他の国の証券取引所でオファー又は上場するよりも限られている可能性がある。市場が確立したり持続できない限り、あなたはあなたの証券を売ることができないかもしれない。
69
項目1 B。未解決問題Dスタッフコメント
ない。
プロジェクト2.ニュース運転員
私たちの会社の本社はマサチューセッツ州カントン市の四つの建物の園区にあり、約300,000平方フィートのレンタルと購入空間は製造、運航、運営と研究開発に特化しています。そのうちの三棟はすでに借りています。借約は当初2022年12月31日に満期を予定していたが、その後2027年12月31日に更新され、2021年12月にこれらの借約を5年間継続する選択権を行使した。アラン·A·アデスアルバート·エラニーデニス·エラニグレン·H·ヌスドフが支配する実体から広州の建物を借りています彼らも私たちの株主ですさらに、AdesさんとNussdorfさんは私たちの取締役会のメンバーです。
マサチューセッツ州ノーウッドには、オフィスと実験室用途のための約43,850平方フィートのレンタル施設があります。賃貸契約は2019年3月13日に開始されます。レンタル開始日は2020年2月1日です。初期レンタル期間はレンタル日から10年であり,2021年12月に5年間継続する。レンタル期間終了後16~24ヶ月以内に行使すれば、レンタル期間をさらに10年延長することを選択することができます。
La Jolla施設賃貸契約が2021年12月31日に満了するのに伴い、私たちは2020年8月にカリフォルニア州サンディエゴで約23,000平方フィートの賃貸契約を締結し、オフィスと実験室用途に使用した。賃貸契約は2021年4月1日に開始される。初期レンタル期間はレンタル開始日から10年で、レンタル期間を5年間延長することが選択できます。
カリフォルニア州サンディエゴではLa Jolla工場の製造設備を貯蔵するために約19,000平方フィートの倉庫を借りましたレンタル契約は2024年6月30日に満期になります。
アラバマ州のバーミンガムで、私たちは私たちの羊膜製品を支持するために約25,000平方フィートの施設を借りました。レンタル契約は2022年12月31日に満期になります。私たちはアラバマ州のバーミンガムからマサチューセッツ州のカントン市に業務を移しました。私たちはバーミンガムの小さなレンタル施設で私たちの研究開発事業を維持し続けている。
プロジェクト3.LEGAL訴訟手続き
2021年12月10日、SomogyiがOrgangenation Holdings Inc.らを訴えると題する集団訴訟起訴状。私たちの証券のすべての購入者の1つの仮定カテゴリを代表して、アメリカニューヨーク東区地方裁判所に私たちと私たちの最高経営責任者と最高財務官を起訴します。裁判所はドナルド·マーティンを主な原告に任命した。マーティン·さんは、2022年10月24日に、我々の証券を購入するいわゆるカテゴリーのすべての購入者の請求を2020年8月10日から2022年8月9日までの間に代表する改訂された起訴状を提出し、当社のAffacyおよびMuraPly XT製品に関連する収入、販売の成長、および競争力などに関する連邦証券法違反を告発した。起訴状は、1934年の証券取引法及びその公布された第10 b-5条の規則に違反し、数量化されていない損害賠償及び弁護士費、専門家費及びその他の費用を要求すると主張している。この訴訟はまだ訴訟の初期段階にある。私たちはこれらの言い方に根拠がないと考え、それを有力な抗弁しようとしている。私たちは現在、救済できるクレームを提出できなかったための訴訟を却下するために、私たちの動議を支持するための文書を準備している。
私たちは他のどんな重大な法的手続きの当事者でもない。時々、私たちは通常の業務過程で発生したクレームに関する訴訟や他の法的手続きに巻き込まれる可能性がある。このような事項は知的財産権、雇用、そして他の一般的な請求を含むことができる。私たちの未解決の法律問題について、私たちの現在の理解によると、合理的で可能な損失金額や範囲は、単独でも全体的にも、私たちの業務、総合財務状況、経営結果、あるいはキャッシュフローに実質的な悪影響を与えないと信じています。しかし、このような法的事項の結果は本質的に予測不可能であり、重大な不確実性の影響を受けている。
プロジェクト4.地雷安全管理局安全開示
適用されません。
70
部分第2部:
項目5.登録者普通株権益の市場、関連株KHOLDER Mattersと発行人が株式証券を購入する
市場情報
私たちのA類普通株はナスダック資本市場に看板を掲げて上場し、取引コードはORGOです。2023年2月15日までに、私たちのA類普通株は131,176,200株流通株があり、私たちは583名のA類普通株の登録所有者がいます。この数字には、“有名人代”や“街”名義で株を持っている株主は含まれていない。
配当政策
私たちは私たちの株のどんな現金配当金も発表したり支払ったりしたことがない。私たちは現在、すべての利用可能な資金と将来の収益(あれば)を残し、私たちの業務の成長と発展に資金を提供するつもりです。私たちは予測可能な未来に私たちのA種類の普通株に現金配当金を支払わないと予想している。さらに、私たちの2021年の信用協定の条項は、銀行の同意なしに配当金を支払う能力を制限します。
株式表現グラフ(1)
次の図は、2017年12月29日から2022年12月31日まで、私たちのA類普通株、ナスダック総合指数、ナスダックバイオテクノロジー指数への各100.00ドルの現金投資の累計総リターンを示しています。このような見返りは歴史的結果に基づいており,未来を示唆するための表現ではない.ナスダック総合指数とナスダックバイオテクノロジー指数のデータ仮説配当は再投資された。2017年12月29日から2018年12月10日まで、このグラフは、当社の前身会社Avista Healthcare Public Acquisition Corp.に基づく当社の業務合併終了前のAクラス普通株1株当たり価格の累積総リターンを反映しています。
5年間累計総収益の比較
有機生成ホールディングスではナスダック総合指数は
ナスダックバイオテクノロジー指数は
71
第六項です保留されている
72
プロジェクト7.経営陣の議論Nと財務状況及び業務成果分析
財務状況と経営結果の以下の議論と分析、および当社の連結財務諸表と本年度報告書の他の場所に関する付記(Form 10-K)を読むべきです。本議論および本年度報告Form 10−Kの他の部分は、我々の計画、目標、予想、意図、および予測に関する記述のようなリスクおよび不確実性に関する前向きな陳述を含む。私たちの実際の結果はこのような前向きな陳述で議論された結果と大きく違うかもしれない。このような差異をもたらすか、または促進する可能性のある要因は、本年度報告10−K表の“リスク要因”の部分的に議論された要因を含むが、これらに限定されない。
文意が別に言及されているほか、本節では、用語“私たち”、“私たち”、“当社”、“当社”または“当社”とは、当社とその子会社が現在存在している場合を指す。
概要
有機生成会社はリードする再生医学会社であり、高級創傷看護及び外科と運動医学市場解決方案の開発、製造と商業化に集中している。著者らの製品はすでに臨床と科学研究を通じて、ある場合に組織癒合を支持し、加速し、患者の予後を改善できることを証明した。組織工学や細胞治療における多くの突破により,癒合過程の各段階の看護基準を進めている。著者らの解決策は人口高齢化と糖尿病、肥満、心血管と末梢血管疾患及び喫煙などの合併症の増加によって駆動される巨大かつ絶えず増加する市場に対して行われている。病院,創傷看護センター,政府機関,外来サービスセンター(“ASC”)や医師室を含む多くのヘルスケア顧客に差別化された製品や内部顧客支援を提供している。我々の使命は,総合治療ソリューションを提供し,医療結果や患者の生活を大幅に改善するとともに,全体の看護コストを低減することである。
私たちは患者の看護過程全体の需要を満たすために、私たちがサービスする市場で全面的な製品の組み合わせを提供します。著者らはすでに臨床試験、現実世界の結果と健康経済学研究からデータを生成し続け、著者らの製品が提供する臨床治療効果と価値主張を検証するつもりである。当社のポートフォリオのいくつかの既存および開発中の製品は、FDAの発売前承認(“PMA”)または510(K)によって承認されています。臨床試験を行い,FDA承認を得るのに要する多大な時間とコストを考慮すると,我々のデータと規制承認は強力な競争優位性を提供してくれると信じている。私たちの製品開発専門知識と複数の技術プラットフォームは強力な製品ラインを提供しており、未来の成長を推進すると信じています。
高級創傷看護市場では、著者らは先進的な創傷看護製品の開発と商業化に焦点を当て、各種の治療環境における慢性と急性創傷の治療に用いている。著者らは全面的な再生医学製品の組み合わせを持ち、傷口癒合過程の早期から傷口閉鎖まで、傷口のタイプにかかわらず、患者に支持を提供することができる。我々の高級創傷ケア製品は、静脈性脚潰瘍(“VLU”)および糖尿病性足潰瘍(“DFU”)を治療するためのApligrafと、DFU(生産が現在生産を一時停止し、新しい製造工場への移行または第三者製造業者との契約を待つ)を治療するためのDermagraftと、様々な創傷タイプのための抗菌バリアPuraPly AMと、Affity、NovachorおよびNuShield創傷カバーとを含む。私たちは訓練された専門的な直接傷口看護販売チームを持っていて、全面的な顧客支援サービスを備えています。
外科や運動医学市場では,慢性や急性手術侵襲や腱や靭帯損傷には,我々の広範な再生医学能力を利用して対処している。私たちの運動医学製品は、外科手術のためのNuShieldと、的確な軟組織修復のためのNuShieldと、外科環境における開放性創傷処置のためのAffity、Novachor、PuraPly MZおよびPuraPly AMを含む。私たちは現在独立機関と私たちの直販チームを通じてこれらの製品を販売している。
2022年、2021年、2020年12月31日までの会計年度において、私たちの純収入はそれぞれ4.509億ドル、4.674億ドル、3.383億ドルだった。2022年、2021年、2020年12月31日までの会計年度の純収益は、それぞれ1,550万ドル、9,420万ドル(4,830万ドルの税収推定免税額を含む)、1,720万ドルである。最近3年間の純収益を報告しましたが、設立以来、大きな損失が発生しており、将来的には運営損失が発生する可能性があります。資源がかかるので、私たちが計画している業務拡張を支援するために、組織の発展に努力しています。2022年12月31日現在、私たちの累計赤字は4530万ドルです。これまで、私たちの主な資本源は、私たちの製品の販売、関係者、機関貸手の借金、および私たちA種類の普通株を売却する収益です。私たちは再生医学の一部として機能しています
73
新冠肺炎が大流行する
2023年1月30日、バイデン政府は、2023年5月11日に新冠肺炎に関連する突発的な公衆衛生事件(と国家緊急事態)の申告を終了すると発表した。2022年12月31日まで、新冠肺炎疫病は著者らの財務業績と業務運営に実質的な不利な影響を与えなかったが、新冠肺炎は引き続き会社にリスクをもたらし、著者らは疫病が著者らの業務の各方面に与える影響を引き続き密接に注目している。新冠肺炎(新変種の出現を含む)が将来私たちの財務状況や経営業績にどのような影響を与えるかは予測できない。
CPN買収
2020年9月17日,2020年7月24日の資産購入プロトコルに基づき,CPN Biosciences,LLC(“CPN”)のある資産を買収し,いくつかの債務を負担した.この取引は、ASC主題805による会計の取得方法を用いたトラフィックの組み合わせとして課金される企業合併それは.買収日の総コストは、640万ドルの現金、2,151,438株の公平価値880万ドルの普通株、および当時の公平価値380万ドルまたは有償(“または有償”)を含む1,900万ドルであった。終値時、私たちは580万ドルの現金を支払い、1,947,953株のA類普通株を発行した。残りの140万ドルの対価格は差し押さえられ,2022年4月に会社から60万ドルの現金を支払いCPNの前株式所有者に203,485株のA類普通株を発行して解放された.2022年6月30日までの割増期間が終了した時点で、会社は割増負債を0ドルと計算している。
買収日からCPNの経営結果は我々の総合財務諸表に含まれている.
デマコフ
先に開示したように、デマゴフは2021年第4四半期に生産を停止し、デマグフは2022年第2四半期に販売を停止した。私たちは現在、私たちのデマグ製造を新しい製造施設に移したり、第三者メーカーを招聘することを計画していますが、これは大量の長期コスト節約をもたらすと予想されています。デマグラブが利用できない間、私たちは顧客がデマグラブの代わりにApligrafを使い、デマグラブの販売を一時停止することは私たちの純収入に実質的な影響を与えないと予想している。しかし、予想される大量の長期コスト節約を実現していない場合、あるいはデマゴフを使用できない間にデマングフの代わりにApligrafを使いたくない場合、これは私たちの純収入や運営業績に悪影響を及ぼす可能性があります。
非公認会計基準の管理職の使用
私たちの経営陣はアメリカ公認会計原則あるいはGAAPに適合しない財務指標と、GAAPに符合する財務指標を用いて私たちの経営業績を評価します。これらの非GAAP財務指標は代替ではなく、GAAPによって作成された報告財務結果の補充と考えられるべきである。我々の経営陣は,調整されたEBITDAを用いて我々の経営業績や傾向を評価し,計画決定を行っている。我々の経営陣は,調整後のEBITDAは我々の業務における潜在的な傾向を識別するのに役立つと考えており,そうでなければこれらの傾向は我々が排除した項目の影響によって隠蔽される可能性がある.したがって、調整後のEBITDAは、投資家や他の人が私たちの経営業績を理解し、評価するために有用な情報を提供し、私たちの過去の業績と未来の見通しに対する全体的な理解を強化し、私たちの経営陣が財務と運営決定に使用する重要な財務指標により高い透明性を持たせると考えられる。
EBITDAを減価償却と償却,利息支出,所得税を差し引く前の純収益(赤字)と定義した。調整後のEBITDAをEBITDAと定義し,我々のコア運営実績を反映できないと考えられるいくつかの項目の影響によりさらに調整した。これらのプロジェクトには、非現金持分補償、再編費用、債務清算損失、私たちのプレミアム負債の市価調整、CPN買収に関連する取引コスト、繰延買収対価格の決済収益、関連側からある受取手形の回収、いくつかの未完成建設工事に関連する資本化コストのログアウト、いくつかの合意の終了または特定の建設プロジェクトの一時停止のキャンセル費用、およびいくつかの紛争の和解費用が含まれる。私たちは、私たちの経営陣と取締役会が私たちの経営業績を理解し、評価し、将来の経営計画を策定し、資本分配に関する戦略決定を行うための重要な指標であるため、この10-K表の年次報告書に調整後のEBITDAを示した。特に,調整後のEBITDAを計算する際には何らかの項目を計上せず,我々の業務進行期間と期間の比較に有用な尺度を提供できると考えられる.
我々の調整EBITDAは公認会計原則に基づいて作成されたものではなく、単独で考慮したり、公認会計原則に基づいて作成された措置の代替措置とすべきではない。調整後のEBITDAの使用に関するいくつかの制限
74
純収益(損失)ではなく、後者は公認会計基準に基づいて計算と列報する最も直接比較可能な財務指標である。いくつかの制限は
これらの制限のため,調整後のEBITDAや公認会計基準に基づいて列報された他の経営や財務業績指標も考慮すべきであると考えられる。調整後のEBITDAと純収益(損失)の入金は本報告に含まれており、純収益(損失)は公認会計基準に基づいて計算される最も直接比較可能な財務指標である。
私たちの総合運営結果の構成要素は
私たちの業務の業績を評価する際には、様々な業績と財務指標を考慮しました。以下で議論するプロジェクトは,これらの重要な措置に影響する要因を深く理解するのに役立つと考えられる.
収入.収入
私たちの純収入は私たちの高級創傷看護と外科と運動医学製品の組み合わせから来た。私たちは主に病院、傷口看護センター、政府機関、ASCと医師事務室の販売関係の直売代表を管理と維持することによって、私たちの高級傷口看護製品を販売します。私たちは主に第三者機関を通じて私たちの外科と運動医学製品を販売します。
契約の契約条項によると、顧客が私たちの製品に対するコントロール権を獲得した時、私たちは私たちの高度な創傷看護と外科と運動医学製品の販売収入を確認し、これはある時点で発生し、プログラム日、出荷または交付時に発生する可能性がある。私たちが記録した収入は返品、割引、GPO引戻し準備金を差し引いた純収入であり、これは私たちが確認した収入が直接減少することを意味します。
いくつかの要素は、製品、支払人と地理販売の組み合わせ、運営効率、定価の実現、マーケティングと販売促進努力、注文と出荷の時間、監督管理行動(医療精算プランを含む)、競争と業務買収を含む、私たちのどの時期に報告された収入に影響を与えますか。
売品コストと毛利
販売コストには、人員コスト、製品テストコスト、品質保証コスト、原材料と製品コスト、製造コスト、当社の製造·倉庫施設に関するコストが含まれています。我々の販売コストの変化は販売先の変化と一致しており、製品構造の影響も受けている。
毛利の計算方法は純収入から販売コストを差し引いたものであり,通常収入の増加とともに増加する。私たちの毛利益は製品と地域販売の組み合わせ、製品の実現価格、私たちの製造運営の効率、使用する材料のコストと第三者メーカーが私たちの製品を生産するために受け取る費用の影響を受けます。医療保険精算案を含む監督管理行動は、高価な支出が必要か、あるいは定価圧力を招く可能性があり、私たちの毛利益を減少させるかもしれない。
販売、一般、行政費用
販売、一般および行政費用は、一般に、販売、マーケティング、販売支援、顧客支援、一般および行政者の人員コスト、販売手数料、報酬、保険、専門費用、減価償却、償却、不良債権費用、特許権使用料、情報システムコスト、長期資産を処分する損益、および私たちの行政施設に関連するコストを含む。私たちは一般的に私たちの販売、一般、行政費用が引き続き増加すると予想しています
75
市場開発への投資が増加したことと,収入の持続的な増加に伴い,我々の販売チームが地理的に拡張したため,成長を実現した。
研究開発費
研究開発費には、私たちの研究開発者の人員コスト、私たちの製造技術の改善に関連する費用、私たちの既存製品への改善、そして私たちの製品とプラットフォーム開発パイプへの追加投資が含まれています。私たちの研究開発費には臨床試験費用も含まれている。私たちは発生した費用に応じて研究と開発費用を支払う。我々が新製品と既存製品の臨床試験を継続するにつれて、規制経路(例えば、BLA承認を求める)を通じて、新製品を市場に投入し、私たちの製造プロセスとプログラムを改善し、研究開発費が増加すると予想されている。
その他の費用、純額
利子支出−利息支出には、債務割引および債務発行コストの償却を含み、確認された利息収入が差し引かれる未償還債務の利息が含まれる。
債務返済損失2021年8月、2021年のクレジット協定を締結する際に、元金の未返済、課税利息、最終支払い、前払い費用を含む2019年の信用協定の終了に関連する総額7060万ドルを支払いました。私たちは2021年12月31日までの1年間に190万ドルの融資終了損失を確認した。
繰延買収対価格の収益を決算する−2020年2月,NuTech Medicalの売り手と400万ドルで500万ドルの買収延期対価格紛争を解決し,NuTech Medicalの売り手からNuTech Medicalのレガシー訴訟に関する責任を負い,2020年10月に和解した。この紛争解決とレガシー訴訟では、2020年12月31日までの年間220万ドルの収益を記録した。
所得税
私たちは貸借対照法を使用して所得税を計算する。繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する。繰延税項純資産をより顕在化する可能性のある額に減らす必要があれば、推定免税額を提供する。
繰延税金資産の推定準備が必要かどうかを決定する際に、私たちは繰延税金資産の現金化に関連するプラスと負の証拠を分析し、将来の課税収入、最近の財務業績、および繰延税金資産と負債の将来の輸出の推定を含む。また、税務当局が税務立場の技術的利点に基づいて審査した後、関連する税務立場を維持することが可能かどうかも考えます。上記の要因を考慮して、2021年第4四半期に、私たちの繰延税金資産が将来的に実現する可能性があることを確認し、2021年12月31日現在の米国繰延税項目純資産の推定値を公表し、4830万ドルの所得税収益を生み出した。私たちは2022年12月31日まで、米国の繰延税純資産を評価する必要がないという同じ立場を維持している。
私たちのアメリカでの所得税の支出は課税収入に関連する当期税収支出に関連しており、これらの支出は州の純運営損失によって相殺されることはできない。我々はすでに純営業損失を利用してすべての2022年の連邦課税収入を相殺しているが、すでに純営業損失を使い切っており、ある州では純営業損失の利用制限を受けている。私たちはまた私たちのスイスの完全子会社に関連した所得税外国準備金を記録した。
2段階法を用いて確認すべき税収割引額を決定し、連結財務諸表で確認された所得税の不確実性を計上する。まず、税務機関が外部審査後にこのような状況を維持する可能性を決定するために、税収状況を評価しなければならない。税務状況がより継続する可能性があると考えられる場合、税務状況は、連結財務諸表で確認された利益金額を決定するために評価される。確認可能な利益額は、最終和解時に50%以上の実現可能性がある最大額である。所得税の準備には、それによって生じる税収準備金または未確認の税収割引の影響が適切であると考えられ、関連する純利息および罰金が含まれる。
経営成果
以下の表に示した期間の業務成果を示す
76
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
純収入 |
|
$ |
450,893 |
|
|
$ |
467,359 |
|
|
$ |
338,298 |
|
販売原価 |
|
|
105,019 |
|
|
|
114,199 |
|
|
|
87,319 |
|
毛利 |
|
|
345,874 |
|
|
|
353,160 |
|
|
|
250,979 |
|
運営費用: |
|
|
|
|
|
|
|
|
|
|||
販売、一般、行政 |
|
|
283,808 |
|
|
|
250,200 |
|
|
|
204,193 |
|
研究開発 |
|
|
39,762 |
|
|
|
30,742 |
|
|
|
20,086 |
|
総運営費 |
|
|
323,570 |
|
|
|
280,942 |
|
|
|
224,279 |
|
営業収入 |
|
|
22,304 |
|
|
|
72,218 |
|
|
|
26,700 |
|
その他の費用、純額: |
|
|
|
|
|
|
|
|
|
|||
利子支出 |
|
|
(2,009 |
) |
|
|
(7,236 |
) |
|
|
(11,279 |
) |
繰延買収対価格の収益を決算する |
|
|
- |
|
|
|
- |
|
|
|
2,246 |
|
債務返済損失 |
|
|
- |
|
|
|
(1,883 |
) |
|
|
- |
|
その他の収入(赤字),純額 |
|
|
(13 |
) |
|
|
(13 |
) |
|
|
97 |
|
その他の費用の合計 |
|
|
(2,022 |
) |
|
|
(9,132 |
) |
|
|
(8,936 |
) |
所得税前純収益 |
|
|
20,282 |
|
|
|
63,086 |
|
|
|
17,764 |
|
所得税給付 |
|
|
(4,750 |
) |
|
|
31,116 |
|
|
|
(530 |
) |
純収入 |
|
$ |
15,532 |
|
|
$ |
94,202 |
|
|
$ |
17,234 |
|
EBITDAと調整後のEBITDA
以下の表に、各時期のGAAP純収入と非GAAP EBITDAと非GAAP調整後のEBITDAとの入金を示す
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
|
|
(単位:千) |
|
|||||||||
純収入 |
|
$ |
15,532 |
|
|
$ |
94,202 |
|
|
$ |
17,234 |
|
利子支出 |
|
|
2,009 |
|
|
|
7,236 |
|
|
|
11,279 |
|
所得税支出 |
|
|
4,750 |
|
|
|
(31,116 |
) |
|
|
530 |
|
減価償却 |
|
|
5,845 |
|
|
|
5,781 |
|
|
|
4,438 |
|
償却する |
|
|
4,883 |
|
|
|
4,949 |
|
|
|
3,745 |
|
EBITDA |
|
|
33,019 |
|
|
|
81,052 |
|
|
|
37,226 |
|
株に基づく報酬費用 |
|
|
6,552 |
|
|
|
3,864 |
|
|
|
1,661 |
|
再編成費用(1) |
|
|
2,268 |
|
|
|
4,704 |
|
|
|
618 |
|
決算繰延買収対価格の収益(2) |
|
|
- |
|
|
|
- |
|
|
|
(2,246 |
) |
関連先に何らかの受取手形を取り戻す(3) |
|
|
- |
|
|
|
(179 |
) |
|
|
(1,516 |
) |
手数料の取り消し(4) |
|
|
- |
|
|
|
- |
|
|
|
1,950 |
|
特定資産の核販売(5) |
|
|
4,200 |
|
|
|
1,104 |
|
|
|
- |
|
割増公正価値変動(6) |
|
|
- |
|
|
|
(3,985 |
) |
|
|
203 |
|
和解費(7) |
|
|
2,600 |
|
|
|
700 |
|
|
|
- |
|
債務弁済損失(8) |
|
|
- |
|
|
|
1,883 |
|
|
|
- |
|
施設建設プロジェクト一時停止(9) |
|
|
632 |
|
|
|
- |
|
|
|
- |
|
CPN取引コスト(10) |
|
|
- |
|
|
|
- |
|
|
|
929 |
|
調整後EBITDA |
|
$ |
49,271 |
|
|
$ |
89,143 |
|
|
$ |
38,825 |
|
77
2022年,2021年,2020年12月31日までの年度比較
収入.収入
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
||||||||||||||||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 to 2021 |
|
|
2021 to 2020 |
|
|||||||||||||
|
|
(百分率を除いて千単位) |
|
|||||||||||||||||||||||||
高度な傷ケア |
|
$ |
422,231 |
|
|
$ |
430,237 |
|
|
$ |
294,624 |
|
|
$ |
(8,006 |
) |
|
|
(2 |
%) |
|
$ |
135,613 |
|
|
|
46 |
% |
外科運動医学 |
|
|
28,662 |
|
|
|
37,122 |
|
|
|
43,674 |
|
|
|
(8,460 |
) |
|
|
(23 |
%) |
|
|
(6,552 |
) |
|
|
(15 |
%) |
純収入 |
|
$ |
450,893 |
|
|
$ |
467,359 |
|
|
$ |
338,298 |
|
|
$ |
(16,466 |
) |
|
|
(4 |
%) |
|
$ |
129,061 |
|
|
|
38 |
% |
2022年12月31日までの1年間に、我々の高級創傷ケア製品の純収入は、2021年12月31日までの年度に比べて800万ドル、または2%減少した。高度な傷ケア純収入減少の主な原因はa 2022年12月31日までの1年間に、我々のいくつかの非PuraPly製品の売上高とGPO付き和解費用は収入減少として直接記録されている。
2022年12月31日までの1年間で,われわれの外科·運動医学製品の純収入は,2021年12月31日までの年度に比べて850万ドル,または23%減少した。外科と運動医学の純収入の低下は主に我々のRenuとNuCel製品がFDAの執行猶予が2021年5月31日に満了したため、マーケティングを一時停止した持続的な影響によるものである。
2021年12月31日までの1年間で,われわれの高級創傷ケア製品の純収入は2020年12月31日までの年度より1兆356億ドル増加し,46%増加した。高級創傷看護純収入の増加は主に販売チームを拡大し、既存と新顧客への販売を増加させ、私たちの親和性製品を含む胎盤ベースの製品組み合わせの採用を増加させ、2020年下半期に発売されたMuraPlyシリーズ拡張製品のより多くの採用を増加させた。
2021年12月31日までの1年間で,われわれの外科·運動医学製品の純収入は2020年12月31日までの年度に比べて660万ドル,あるいは15%減少した。外科と運動医学の純収入の低下は主に我々のRenuとNuCel製品がFDAの執行猶予が2021年5月31日に満了したため、マーケティングを一時停止した影響である。
PuraPlyの収入は、2022年12月31日、2021年、2020年12月31日までの年度を含めてそれぞれ2兆427億ドル、1億981億ドル、1億473億ドルだった。PuraPly収入の持続的な増加は,2022年12月31日と2021年12月31日までの年度において,販売チームの拡大,介護場所の拡大,既存顧客や新規顧客のPuraPly製品ライン拡張へのより多くの採用によるものである。
売品コストと毛利
78
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
||||||||||||||||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 to 2021 |
|
|
2021 to 2020 |
|
|||||||||||||
|
|
(百分率を除いて千単位) |
|
|||||||||||||||||||||||||
販売原価 |
|
$ |
105,019 |
|
|
$ |
114,199 |
|
|
$ |
87,319 |
|
|
$ |
(9,180 |
) |
|
|
(8 |
%) |
|
$ |
26,880 |
|
|
|
31 |
% |
毛利 |
|
$ |
345,874 |
|
|
$ |
353,160 |
|
|
$ |
250,979 |
|
|
$ |
(7,286 |
) |
|
|
(2 |
%) |
|
$ |
102,181 |
|
|
|
41 |
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2022年12月31日までの1年間で、商品販売コストは2021年12月31日までの年間920万ドル、または8%減少した。販売コストの低下は主にわれわれの高度な創傷看護と外科及び運動医学製品の販売量の低下によるものである。
毛利は2022年12月31日までの年度、2021年12月31日までの年度より730万ドル、または2%減少した。毛利低下の要因は販売量の低下と製造関連コストの増加であるが,一部は製品組合せから毛金利の高い製品に相殺されている。
2021年12月31日までの1年間で、商品販売コストは2020年12月31日までの年間2690万ドル、または31%増加した。販売コストの増加は主に単位数の増加と製造·品質管理者の増加によるものである。
毛利は2021年12月31日までの年度で、2020年12月31日までの年度より1.022億ドル増加し、41%増となった。毛利の成長は主に私たちの高級傷ケア製品の強力な表現による販売量の増加と製品の組み合わせが私たちのもっと高い毛金利製品に転換することです。
販売、一般、行政費用
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
||||||||||||||||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 to 2021 |
|
|
2021 to 2020 |
|
|||||||||||||
|
|
(百分率を除いて千単位) |
|
|||||||||||||||||||||||||
販売、一般、行政 |
|
$ |
283,808 |
|
|
$ |
250,200 |
|
|
$ |
204,193 |
|
|
$ |
33,608 |
|
|
|
13 |
% |
|
$ |
46,007 |
|
|
|
23 |
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2022年12月31日までの1年間で、販売、一般、行政費は2021年12月31日までの年度に比べて3360万ドル、または13%増加した。販売、一般、行政費用の増加は主に1,220万ドルの従業員数が増加したためであり、主に私たちの直販チームが増加したためであり、新冠肺炎が旅行制限を緩和したため、出張とマーケティング計画は1,000万ドル増加した。私たちの業務の持続的な運営と企業資源計画システムの実施に関する法律、特許使用料、コンサルティングコストは560万ドル増加した。そして,マサチューセッツ州の1つの施設で行われている建設に関するいくつかの設備の処分費用420万ドルと,会社が同一施設の建設プロジェクトの一時停止を決定したことによる60万ドルの解約費用である。また,当社は2021年12月31日までの年度にCPN利得公平価値調整に関する販売,一般,行政費用の400万ドル削減を記録している.2021年にLa Jolla事務所を閉鎖した再編活動と比較して、2022年にバーミンガム事務所を閉鎖する組換え活動の規模は小さいため、雑費用は170万ドル減少し、組換え費用は130万ドル減少し、これらの増加を部分的に相殺した。
2021年12月31日までの年度、販売、一般および行政支出は、2020年12月31日までの年度より4,600万ドル、または23%増加する。販売、一般、行政費用の増加は、主に従業員数(主に私たちの直販者)の増加と販売増加による販売手数料の増加、3,300万ドルの増加、収入増加および私たちの業務継続運営に関する法律、相談費、その他のコスト増加により、各種管理コストが1,090万ドル増加し、新冠肺炎旅行制限の緩和による出張やマーケティング計画の増加に関連して430万ドル増加し、ラホヤ事務所閉鎖に関する再編コストが290万ドル増加した。これまで資本化されていたいくつかの設計や相談費110万ドルのログアウトは,マサチューセッツ州カントン市にある同社の工場の未完成建築工事と関係がある。これらの増加はCPN利得公平価値調整による420万ドルの減少と2020年3月31日までの3カ月間にある製品開発とコンサルティングプロトコルの廃止によるキャンセル費用の200万ドル分削減によって相殺された.
79
研究と開発費
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
||||||||||||||||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 to 2021 |
|
|
2021 to 2020 |
|
|||||||||||||
|
|
(百分率を除いて千単位) |
|
|||||||||||||||||||||||||
研究開発 |
|
$ |
39,762 |
|
|
$ |
30,742 |
|
|
$ |
20,086 |
|
|
$ |
9,020 |
|
|
|
29 |
% |
|
$ |
10,656 |
|
|
|
53 |
% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
2022年12月31日までの1年間で、研究開発費は2021年12月31日までの1年間より900万ドル増加し、29%に増加した。研究開発費用の増加は主に私たちの現有の高級創傷看護と外科と運動医学製品に関連する従業員の数の増加、著者らのパイプライン製品のまだ商業化されていない関連製品のコストの増加、及び私たちのいくつかの製品のために規制承認を求めるために必要な臨床研究と関連コストの増加である。
2021年12月31日までの年度の研究開発費は、2020年12月31日までの年度より1,070万ドル増加し、53%増となった。研究開発費用の増加は主に私たちの現有の高級創傷看護と外科と運動医学製品に関連する従業員の数の増加、著者らのパイプライン製品のまだ商業化されていない関連製品のコストの増加、及び私たちのいくつかの製品のために規制承認を求めるために必要な臨床研究と関連コストの増加である。
その他の費用、純額
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
||||||||||||||||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 to 2021 |
|
|
2021 to 2020 |
|
|||||||||||||
|
|
(百分率を除いて千単位) |
|
|||||||||||||||||||||||||
利子支出 |
|
$ |
(2,009 |
) |
|
$ |
(7,236 |
) |
|
$ |
(11,279 |
) |
|
$ |
5,227 |
|
|
|
(72 |
%) |
|
$ |
4,043 |
|
|
|
(36 |
%) |
繰延買収対価格の収益を決算する |
|
|
- |
|
|
|
- |
|
|
|
2,246 |
|
|
|
- |
|
|
|
0 |
% |
|
|
(2,246 |
) |
|
|
(100 |
%) |
債務返済損失 |
|
|
- |
|
|
|
(1,883 |
) |
|
|
- |
|
|
|
1,883 |
|
|
|
(100 |
%) |
|
|
(1,883 |
) |
|
** |
|
|
その他の収入,純額 |
|
|
(13 |
) |
|
|
(13 |
) |
|
|
97 |
|
|
|
- |
|
|
|
0 |
% |
|
|
(110 |
) |
|
|
(113 |
%) |
その他の費用の合計 |
|
$ |
(2,022 |
) |
|
$ |
(9,132 |
) |
|
$ |
(8,936 |
) |
|
$ |
7,110 |
|
|
|
(78 |
%) |
|
$ |
(196 |
) |
|
|
2 |
% |
**意味がない
2022年12月31日までの1年間で、2021年12月31日までの年度と比較して、他の総支出純額は710万ドル減少し、減少幅は78%だった。2022年の利息支出が減少したのは、2021年の信用協定下の借入金利が低いことによるものだ。2021年の債務弁済損失190万ドルは、2019年8月の返済時に2019年の信用合意返済時に確認された損失と関係がある。
2021年12月31日までの1年間で、2020年12月31日までの年度と比較して、他の総支出純額は20万ドル増加し、2%増となった。利息支出が400万ドル、または36%減少したのは、主に2021年の信用協定下での借入金利の低下によるものだ。2021年の債務弁済損失190万ドルは、2019年8月の返済時に2019年の信用合意返済時に確認された損失と関係がある。二零一零年繰延買収対価の和解収益は二百二十万ドルであり、二零一零年二月にNuTech Medical売り手との繰延買収対価紛争の和解に関連し、二零二零年十月にNuTech Medical売り手と遺留訴訟の和解に関する法定拠出金が減少したが、上記の紛争解決の一部として、吾らはNuTech Medicalのレガシー訴訟を担当した。
所得税給付
|
|
十二月三十一日までの年度 |
|
|
変わる |
|||||||||||||||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 to 2021 |
|
|
2021 to 2020 |
||||||||||||
|
|
(百分率を除いて千単位) |
||||||||||||||||||||||||
所得税給付 |
|
$ |
(4,750 |
) |
|
$ |
31,116 |
|
|
$ |
(530 |
) |
|
$ |
(35,866 |
) |
|
|
(115 |
%) |
|
$ |
31,646 |
|
|
** |
**意味がない
2022年12月31日までの1年間で、所得税支出は280万ドルの当期所得税と200万ドルの繰延所得税が含まれている480万ドル。2022年の実質税率は23.4%で、21%の法定税率から計算される
80
主に州と地方所得税、相殺できない官僚の給与、および繰延税金資産期間中の初期残高のエラーに対する期外調整を調整する。2021年12月31日までの年間で、所得税割引が3,110万ドルとなったのは、2021年12月31日までに記録された米国繰延税純資産に対する全額の推定手当が放出されたためである。本年度報告表格10-Kに掲載されている監査財務諸表の脚注“15.所得税”を参照。
所得税は2021年12月31日までの1年間で3110万ドル割引されたが、2020年12月31日までの1年間で所得税支出は50万ドルだった。この変化は、2021年12月31日までの年間で確認された3,200万ドルの繰延税項目収益によるものであり、主に2021年12月31日までの全額米国繰延税項純資産に基づいて以前に記録された推定値が支給されたためである。本年度報告表格10-Kに掲載されている監査財務諸表の脚注“15.所得税”を参照。
流動性と資本資源
設立以来、私たちは製品販売のキャッシュフロー、付属会社といくつかの付属会社がコントロールする実体の融資、第三者債務、私たちの株を売却する収益を通じて、私たちの運営と資本支出に資金を提供してきた。2022年12月31日までの累計赤字は4530万ドル、運営資金は1.025億ドルの現金と現金等価物を含む1兆476億ドル。私たちは、私たちの循環ローンメカニズムの下で将来の循環借入金に1.25億ドルを使用することができます(本年度報告書Form 10-Kに含まれる監査済み財務諸表の脚注“12.長期債務”を参照)。2022年12月31日までの1年間に,4.509億ドルの純収入,1550万ドルの純収入,2490万ドルの経営活動現金流入を報告した。私たちは、2022年12月31日まで、私たちの手元の現金と運営資本の他の構成要素、2021年の信用協定の下での可用性、製品販売の純現金流量に加えて、本10-K表の年次報告書提出日後少なくとも12ヶ月の運営費用、資本支出要件、債務超過支払いを支払うのに十分であると予想しています。
著者らは引き続き新冠肺炎疫病と関連する持続的な事態の発展に密接に注目しており、これは2023年度或いは以後の商業見通し、現金状況と資本獲得ルートに負の影響を与える可能性がある。私たちは私たちの現金と他の流動性源を評価し続け、もし状況が必要であれば、私たちの運営計画を適切に調整するつもりだ。“第1 A項”を参照してください。本年度報告Form 10−Kにおける“リスク要因”を参照して、リスクについてより多くの議論を行うことができる。
私たちの現金の主な用途は運営資本要求、資本支出、債務超過支払いだ。しかも、私たちは時々資本を買収と他の投資と融資活動に使用するかもしれない。運営資金は主に私たちの人員と私たちの製品の生産に関連する製造コストに使われます。生産量,出荷時間および顧客と支払者の支払周期によって,我々の運営資金要求は時期によって異なる。私たちの資本支出は主に建築改善、製造設備、そしてコンピュータハードウェアとソフトウェアを含む。
私たちが私たちの業務戦略を継続する際には、私たちの長期流動性需要を満たすための追加の資金が必要であり、これらの資金は、追加の株式や債務融資、他の戦略取引、またはこれらの潜在的な資金源の組み合わせによって得られると予想される。私たちは私たちが受け入れられる条件で、タイムリーまたは根本的に追加的な資金を得ることができないという保証がない。
次の表に示す日までの現金と未済債務を示します
|
|
十二月三十一日 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
|
|
(単位:千) |
|
|||||||||
現金と現金等価物 |
|
$ |
102,478 |
|
|
$ |
113,929 |
|
|
$ |
84,394 |
|
|
|
|
|
|
|
|
|
|
|
|||
信用限度額 |
|
$ |
- |
|
|
$ |
- |
|
|
$ |
10,000 |
|
定期融資債務割引と発行コストを差し引いた純額 |
|
|
70,769 |
|
|
|
73,425 |
|
|
|
59,710 |
|
融資リース義務 |
|
|
- |
|
|
|
200 |
|
|
|
15,061 |
|
債務総額 |
|
$ |
70,769 |
|
|
$ |
73,625 |
|
|
$ |
84,771 |
|
信用限度額或いは循環ローンによって、私たちは1.25億ドルに達する資金が未来の循環借款に使用できるが、金融と非金融契約を守らなければならない。
81
キャッシュフロー
次の表は私たちの毎期のキャッシュフローをまとめています
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
|
|
(単位:千) |
|
|||||||||
経営活動が提供する現金純額 |
|
$ |
24,859 |
|
|
$ |
61,978 |
|
|
$ |
5,466 |
|
投資活動のための現金純額 |
|
|
(33,898 |
) |
|
|
(31,220 |
) |
|
|
(23,498 |
) |
融資活動提供の現金純額 |
|
|
(2,199 |
) |
|
|
(1,036 |
) |
|
|
42,468 |
|
現金と制限現金の純増(マイナス)額 |
|
$ |
(11,238 |
) |
|
$ |
29,722 |
|
|
$ |
24,436 |
|
経営活動
2022年12月31日までの年間で,経営活動が提供する現金純額は2,490万ドルであり,このうち純収益は1,550万ドル,非現金費用は4,340万ドルであり,一部は我々の運営資産や負債の変化に関する純現金3,410万ドルで相殺されている。当社の経営資産と負債の変化のための現金純額は、売掛金が880万ドル増加し、在庫·前払い費用が980万ドル増加し、経営リース負債が700万ドル減少し、支出が1190万ドル減少し、これらはすべて売掛金と他の負債増加330万ドルによって部分的に相殺されている。
2021年12月31日までの年間で,経営活動が提供する現金純額は6,200万ドルであり,このうち純収益は9,420万ドル,非現金費用は480万ドルであるが,我々の経営資産や負債の変化に関する純現金3,700万ドルはこの影響を部分的に相殺している。480万ドルの非現金費用には、3680万ドルの標準非現金項目が含まれており、主に減価償却と償却、株式ベースの給与支出と在庫準備金と関係があり、一部は3,200万ドルの繰延税項目の収益によって相殺され、繰延税項目の収益は主に以前に記録された推定手当が放出され、2021年12月31日までの米国繰延税項目の純資産を相殺するためである。営業資産と負債の変化のための現金純額は、売掛金が2,870万ドル増加し、在庫が930万ドル増加し、経営リースおよびその他の負債が1,220万ドル減少し、これらはすべて売掛金、売掛金、その他の流動負債の1,320万ドル増加によって部分的に相殺された。
2020年12月31日までの年間で、経営活動が提供する現金純額は550万ドルで、私たちの1720万ドルの純収入と1600万ドルの非現金費用からですが、私たちの運営資産や負債の変化に関する現金純額2780万ドルはこの影響を部分的に相殺しています。当社の経営資産と負債の変化のための現金純額は、売掛金やその他の流動資産の1790万ドルの増加、在庫の670万ドルの増加、売掛金およびその他の負債の460万ドルの減少を含み、これらはすべて売掛金と他の流動負債の140万ドルの増加によって部分的に相殺されている。
投資活動
2022年12月31日までの1年間に、資本支出のみを含む投資活動に3390万ドルの現金を使用する。
2021年12月31日までの1年間に、資本支出のみを含む投資活動に3120万ドルの現金を使用する。
2020年12月31日までの年間で,1,770万ドルの資本支出とCPN買収に関する580万ドルを含む2,350万ドルの現金を投資活動に使用した.
融資活動
2022年12月31日までの年間で、融資活動のための現金純額は220万ドル。これには主に300万ドルの定期融資と融資リース債務の支払い、CPN繰延買収の対価格に関する60万ドルの支払いが含まれるが、株式奨励活動に関連する純収入140万ドルはこの額を部分的に相殺した。
2021年12月31日までの年間で、融資活動のための現金純額は100万ドル。これには主に、2019年の信用協定下の7,000万ドルの借金の返済、160万ドルの支払いによる返済という債務手配、260万ドルの融資リース債務の支払い、その他の融資活動に関連した220万ドルの支払いが含まれる。
82
融資活動のための現金純額は、主に2021年の信用協定純収益7320万ドルと普通株式オプション行使収益220万ドルで相殺される。
2020年12月31日までの年間で、融資活動が提供する現金純額は4,250万ドル。これには主にA類普通株を発行する純収益5910万ドルとオプションを行使する収益280万ドルが含まれる。融資活動が提供する現金純額は、融資リース債務240万ドルの支払い、NuTech Medical繰延買収の対価格に関する350万ドルの支払い、および2019年のクレジット協定による債務返済純額1350万ドルによって部分的に相殺されます。
負債.負債
2021年信用協定
2021年8月、私たちは私たちの子会社とSVBと他のいくつかの貸手と信用協定を締結し、私たちは2021年の信用協定と呼んでいます。改正された2021年信用協定は、定期融資が7,500万ドル(“定期融資”)と循環信用が1.25億ドルを超えないことを規定している(“循環ローン”)。
2021年の信用協定に基づいて支払われる前払いは、SOFRローンまたはABRローンであってもよく、私たちが選択します。SOFRローンでは,金利は調整期間SOFRに相当する年利に総純レバー率に基づく2.00%から3.25%の間の適用保証金を加えたものである。ABRローンの場合、金利は(1)(A)ウォール·ストリート·ジャーナルの最優遇金利、(B)連邦ファンド金利プラス0.50%と(C)調整後期限SOFR金利プラス1.0%の中で最高者追加する(2)総正味レバー率に基づく1.00%~2.25%の適用保証金。
“2021年信用協定”は、(A)2021年9月30日から2022年6月30日まで(含む)50万ドル、(B)2022年9月30日から2023年6月30日まで(含む)90万ドル、(C)2023年9月30日~2025年6月30日(含む)140万ドル、(D)2025年9月30日から2026年8月6日(定期ローン満期日)までの四半期最終日、190万ドルを連続して四半期分割することを要求している。私たちは定期ローンを事前に支払うことができる。一旦返済すると、定期借款ツールによって借入された金額はこれ以上借り入れてはならない。
2026年8月6日(“循環終了日”)までの四半期毎の初日と、サイクル終了日までの四半期毎の第1日に、利用可能な資金を使用していない費用(“承諾料”)を支払わなければなりません。総正味レバー率に基づいて、承諾料率は0.25%~0.45%である。私たちはいつでもすべての未返済元金および未払い利息を返済して循環融資を減少または終了することを選択することができる。
2021年信用協定によると、私たちは毎シーズンテストの総合固定費用カバー率と総合総純レバレッジ率を含むいくつかの財務契約を守らなければならない。また、私たちはまた、配当支払い、株式買い戻し、債務発生、処分、買収の制限を含む、このような融資協定に慣用されているいくつかの非金融契約を陳述し、保証しなければならない。
2022年12月31日現在、私たちは2021年の信用協定での契約を守っています。私たちの定期ローンツールの下では、私たちは7,130万ドルの未返済借金を持っていますが、私たちの循環ローンツールの下では、未返済の借金はなく、それぞれ1.25億ドルが未来の循環借入金に利用できます。
2019年信用協定
2019年3月に、吾ら、吾等の付属会社及びSVB及びその他の数名の貸手は、改訂された信用協定(“2019年信用協定”)を締結し、4,000,000ドルの定期融資および最高6,000,000ドルの循環信用手配を提供する。この二つの施設は2024年に成熟するだろう。定期ローンの金利は変動年利であり、ウォール·ストリート·ジャーナルの最優遇金利より3.75%と9.25%の両方をプラスしたものに相当する。循環ローン項目の下敷き金利は変動年利であり、ウォール·ストリート·ジャーナルの最優遇金利と5.50%の間の大きな者に相当する。もし私たちが事前にローンを返済したり、ローンを終了したりすることを選択した場合、私たちは元金を返済していない一定の割合を前払い費用として支払う必要があります。最終支払い費用(“最終支払い”)は、定期融資融資の元の元本総額を乗じた6.5%であり、より早く発生した日、すなわち定期融資満期日またはすべての未返済元金の前払を基準とする。
2021年8月に、2021年の信用協定を締結する時、吾らは2019年の信用協定に基づいて満期になった合計7,060万ドルを支払い、元金の未返済、課税利息、最終支払い及び前払い費用を含めて、得られたお金は
83
2021年の信用協定、2019年の信用協定は終了します。2019年の信用合意終了後、当社は2021年12月31日までの年度の融資終了時に190万ドルの赤字を確認した。
重要な会計政策と重大な判断と見積もり
私たちの総合財務諸表は公認会計基準に基づいて作成された。我々の総合財務諸表を作成する際には、財務諸表の日付の資産、負債、開示、および報告期間内に記録された収入および費用に影響を与える推定、仮説、判断を行う必要がある。経営陣は歴史経験とその当時の状況下で合理的と考えられる様々な他の要素に基づいて推定、仮説及び判断を行った。異なる仮説や判断は,我々が統合財務諸表を作成する際に用いる見積りを変更し,逆に我々の結果と報告の結果を実質的に変化させる可能性がある.経営陣はその推定、仮定、そして判断を評価し続けている。歴史的に見ると、私たちの重要な会計見積もりは実際の結果と実質的な差はない。しかし、もし私たちの仮定が変化した場合、私たちの推定を修正したり、他の是正行動を取る必要があるかもしれません。そのいずれかは、私たちの総合運営報告書、流動性、および財務状況に大きな悪影響を及ぼす可能性もあります。
以下の重要な会計政策は、管理層が総合財務諸表を作成する際に判断と推定を適用する重要な分野に関連していると信じている。
収入確認
私たちは高級創傷ケアと外科と運動医学製品を販売することで収入を創出する。私たちのすべての契約の中で義務を履行することは一つしかありません。それは私たちが手配中の具体的な支払いと輸送条項に基づいて私たちの製品を顧客に譲渡することを約束したことです。全体的な取引価格はこの単一の履行義務に割り当てられる。契約条項によると、顧客が私たちの製品に対する制御権を獲得した場合、製品収入が確認され、その製品はある時点で発生し、出荷、プログラム日、または交付時に発生する可能性がある。収入は返品、割引、GPO引戻し準備金を差し引いた純額であり、これは私たちが確認した収入が直接減少することを意味する。これらの減少額は,歴史的経験や具体的な状況から,収入を確認する際に計上すべきである.
売掛金純額
売掛金は領収書価値から予想不良債権を差し引いて列報を用意する。私たちは顧客の支払いを監視し続け、顧客が必要なお金を支払うことができないことによる推定損失保留準備金を提供します。私たちは、歴史経験、信用品質、売掛金残高の年齢、地理に関するリスク、経済状況など、顧客の支払い能力に影響を与える可能性のある要素を考慮した。特定顧客がその財務義務を履行する能力を損なう可能性がある場合には、特定支出は支払額に計上され、確認された売掛金純額を合理的に回収可能と考えられる金額に減少させる。売掛金は回収できないと思われた場合は返金します。以前に査定された売掛金は受け取った時に入金されます。
在庫品
在庫はコスト(先進先出し法で決定)または可現純値の低いもので表示されます。在庫には原材料、製品、生産品が含まれている。それはまた、細胞バンクと規制機関が強制的に行ったテストのコストと、それらを生産するために必要な材料を含む。
我々は定期的に手元の在庫数量を審査し、準備金を記録し、管理層の将来の材料使用量、生産量、古い仮定に基づいて、過剰と古い在庫をその推定された可変現金値に減記し、これらの仮定は未来の需要と市場状況およびある在庫項目の有効寿命の結果である。私たちの過剰と時代遅れ在庫審査プロセスは、販売予測と歴史売上高と手元在庫との対比を分析し、運営部門と協力して、過剰在庫を最大限に回収することを含む。過剰数量の見積もりは主観的であり、主に特定の製品の未来の需要の見積もりにかかっている。実際の販売による将来の需要の見積もりが正確でなければ、当該部品の過剰在庫の減記が増加する可能性がある。
商誉
営業権とは、買収された企業の買収価格が買収された識別可能な資産と負担する負債の公正価値を超えることを指す。営業権は償却されないが、少なくとも毎年(12月31日現在)に減値テストが行われているか、またはイベントまたは状況が帳簿価値がもはや回収可能ではなく、減値損失が発生している可能性があることを示す場合には、減値テストがより頻繁に行われる。減価テストをトリガする可能性がある場合は含まれていますがこれらに限定されません
84
ビジネス環境又は法的要因、規制機関の不利な行動又は評価、又は予期しない競争。私たちは分部経営として唯一の報告単位とされているため、営業権は総合レベルで減値テストを行っている。
ASCテーマ350、無形資産−営業権などに基づいて、まず定性的要因を評価して、数量化営業権減価テストが必要かどうかを決定することができる。全体的なイベントまたは状況を評価した後、私らは、報告単位の公正価値がその額面よりも少ない可能性が高い(すなわち、50%より大きい可能性がある)と判断した場合、量子化テストを行わなければならない。そうでなければ、これ以上のテストは必要ない。あるいは,定性的評価を迂回して直接定量的なテストを行うことができる.数量化商誉減値テストは著者らに報告単位の公正価値とその帳簿価値を推定と比較することを要求した。報告機関の公正価値が純資産の帳簿価値を超える場合、営業権は減損することはない。もし報告単位の公正価値が帳簿価値より低い場合、差額は減値損失に計上され、最高で営業権金額に達することができる。2022年12月31日、私たちは直接定量分析を行うことを選択した。我々は会社の時価を用いて報告単位の公正価値を近似している.公正価値は帳簿価値を超えており、減値記録はない。
営業権減値テストの応用は判断が必要であり、任意の減値指標があるかどうかを決定する定性評価と、報告単位の公正価値を決定することを含む。私たちはその会社の時価を使用して報告単位の公正価値を決定する。会社の時価が減値分析で使用されるレベルから大幅に低下しない保証はない。要因又は状況が変化した場合には、マクロ経済環境及び業界の悪化、会社業績又は将来予測の悪化、又はその報告単位の計画が変化した場合には、営業権減価費用が今後の期間で確認される可能性がある。
2022年、2021年、2020年の期間は営業権減値まで記録されていない。
長期資産減価準備
イベントまたは環境変化が、使用期間が最初よりも短いと推定された場合、または1つの資産または資産グループ別の帳簿金額が回収できない可能性がある場合には、減値について、他の長期資産(識別可能な確認された無形資産を含む)の減値を検討する。このような事実や状況が存在するように,吾らは関連資産やそのグループの資産がその残存寿命内にあることに関連する未割引キャッシュフローをそれぞれの帳票金額と比較し,確認された資産の回収可能度を評価する.減値(ある場合)は、帳簿額面が当該等の資産の公正価値を超えて計算され、減値決定が行われている間に発生する。
2022年、2021年、2020年の間に長期資産の減値は記録されていない。
所得税
私たちは貸借対照法を使用して所得税を計算する。繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する。繰延税項純資産をより顕在化する可能性のある額に減らす必要があれば、推定免税額を提供する。
繰延税金資産の推定準備が必要かどうかを決定する際に、私たちは繰延税金資産の現金化に関連するプラスと負の証拠を分析し、将来の課税収入、最近の財務業績、および繰延税金資産と負債の将来の輸出の推定を含む。また、税務当局が税務立場の技術的利点に基づいて審査した後、関連する税務立場を維持することが可能かどうかも考えます。上記の要因を考慮して、2021年第4四半期に、私たちの繰延税金資産が将来的に実現する可能性があることを確認し、2021年12月31日現在の米国繰延税項目純資産の推定値を公表し、4830万ドルの所得税収益を生み出した。私たちは2022年12月31日まで、米国の繰延税純資産を評価する必要がないという同じ立場を維持している。
2段階法を用いて確認すべき税収割引額を決定し、連結財務諸表で確認された所得税の不確実性を計上する。まず、税務機関が外部審査後にこのような状況を維持する可能性を決定するために、税収状況を評価しなければならない。税務状況がより継続する可能性があると考えられる場合、税務状況は、連結財務諸表で確認された利益金額を決定するために評価される。確認可能な利益金額は、最終的に実現される可能性が50%以上の最大金額です
85
和解する。所得税の準備には、それによって生じる税収準備金または未確認の税収割引の影響が適切であると考えられ、関連する純利息および罰金が含まれる。
価格の推定値があります
CPNの買収については,2020年の買収時に非流動負債,すなわち価格の公正価値(“プレミアム”)があることを確認した.オーバーフロー負債は第3級計量に分類され、その公正価値は観察不可能と全体の公正価値計量に重大な意義がある投入から得られた。このようなプレミアム負債の公正価値は、モンテカルロシミュレーションモデルを使用して推定され、このモデルは、プレミアム期間中の関連財務指標の予測収入および変動性を含む重要な仮定を利用する。私たちは各報告書でプレミアム負債の公正な価値を評価する。負債推定公正価値のいずれの後続変動も、負債が返済されるまで、販売、一般、行政費用に反映される。
株に基づく報酬
我々は、付与日に付与された奨励の公正価値に基づいて付与された株式奨励を測定し、必要なサービス期間(通常は対応する奨励の帰属期間)内の当該奨励金の補償費用を確認する。没収は交付時に見積もりを行い,実際に没収してこれらの見積もりと異なる場合は,その後の期間に必要な改訂を行う。一般に,サービスの付与条件に基づく株式報酬のみを発行し,直線法を用いてこれらの報酬の費用を記録する.私たちは業績帰属条件に基づいた株報酬を発行しなかった。
我々は,最終帰属が予想される報酬の推定授与日公正価値に基づいて,株式に基づく支払いの販売,一般および行政費用のすべての株式ベースの補償費用を総合経営報告書で確認した。
制限株式単位ごとの公正価値は、日当A類普通株に付与された公正市場価値に基づいている。各株式オプション付与の公正価値は、付与された日にBlack-Scholesオプション定価モデルを用いて推定される。私たちは上場会社である時間が短く、公衆流通株は限られており、私たちのA類普通株は会社の特定の歴史と隠れた変動率情報が不足している。そこで、上場同業者の過去の変動率に基づいて予想株価変動率を推定し、自分たちが取引する株価変動性に関する十分な履歴データを持つまでこのようにしていく予定です。私たちの株式オプションの期待期限は、“通常”オプション資格に適合する奨励に適用される“簡略化”方法を用いて決定される。無リスク金利は、奨励付与時に発効した米国債収益率曲線を参考にして決定され、期間は奨励の予想期限にほぼ等しい。予想配当収益率は、私たちがA類普通株に現金配当金を支払ったことがなく、予測可能な未来にいかなる現金配当金も支払うことを期待していないことに基づいている。
表外手配
報告書に記載されている間、私たちは、現在、米国証券取引委員会規則および法規で定義されているいかなる表外手配もない。
最近発表された会計公告
最近発表された会計声明の説明には、採用予定日と予想される合併財務諸表への影響(あれば)が含まれていますが、本年度報告書末のForm 10-Kにおける我々の合併財務諸表への脚注“2.重大会計政策”を参照されたい。
第七A項。定量と定性IVE市場リスクに関する開示
私たちは金利変動と通貨為替変動を含む様々な市場リスクに直面している。私たちは市場のリスクを管理する政策、手続き、そして内部手続きを作った。
金利リスク
2022年12月31日現在、私たちは定期ローンツールの下で7130万ドルの未返済借金があり、循環ローンツールの下で未返済の借金はありません。私たちの2021年の信用協定によると、借金は変動金利で利息を計算します。2022年12月31日までの未返済元本金額によると、金利が直ちに10%の変化が発生することは、我々の財務状況、経営業績またはキャッシュフローに実質的な影響を与えません。
86
外貨と市場リスク
私たちのほとんどの従業員と主要な業務は現在アメリカに位置している。私たちのスイスの外国子会社のビットコインはドルです。通常の業務プロセスでは、請負業者または他のサプライヤーとドル以外の通貨で契約を締結する。これまで、私たちは外貨為替レートが変動するリスクは小さく、取引開始日から計算すると、支払いや支払いを受ける日は一般的に短いからです。したがって、私たちは私たちに重大な外国為替リスクが存在しないと思う。
プロジェクト8.財務諸表Sと補足データ
私たちの総合財務諸表は、独立公認会計士事務所の報告とともに、本年度報告シート10-KのF-1~F-30ページに掲載されています。
第9項.会計事項の変更と不一致会計と財務開示に関するNTANTS
ない。
第9条。制御するプログラムがあります
会社の情報開示制御の評価
会社経営陣は、最高経営責任者と最高財務官の参加の下、2022年12月31日までの開示統制とプログラムの有効性を評価した。1934年に改正された“証券取引法”(以下、“取引法”と略す)第13 a-15(E)及び15 d-15(E)条で定義された“開示制御及び手続”という言葉は、会社が取引法に基づいて提出又は提出された報告において開示を要求する情報を確保し、米国証券取引委員会が公布した規則及び表に規定された時間内に記録、処理、集計及び報告を得ることを目的とした会社の制御及びその他の手続を意味する。開示制御及び手続は、取引所法に基づいて提出又は提出された報告書に開示を要求する情報が蓄積されていることを確保し、その主要幹部及び主要財務官を含む会社管理層に適宜伝達し、開示要求に関する決定を直ちに行うことを目的としているが、制御及び手続に限定されない。経営陣は、どのような制御やプログラムが、どんなに設計や操作が良くても、その目標を実現するために合理的な保証を提供するしかないことを認識しており、管理部門は、可能な制御とプログラムのコスト-利益関係を評価する際にその判断を運用しなければならない。この評価に基づき、我々の経営陣は、CEOやCEOを含め、2022年12月31日現在、財務報告の内部統制が正しく設計されていないため、2022年12月31日まで、財務報告の内部統制が正しく設計されていないため、適切な役割分担を確保すると結論した。
財務報告の内部統制に関する経営陣の報告
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。取引所法案の公布された第13 a-15(F)又は15 d-15(F)条によれば、財務報告の内部統制は、会社の主要行政官及び主要財務官が設計又はその監督の下で、会社の取締役会、管理層及びその他の人員によって実施されるプログラムとして定義され、我々の財務報告の信頼性の合理的な保証を提供し、米国が公認されている会計原則に基づいて外部目的で財務諸表を作成する。
経営陣は、テレデビル委員会後援組織委員会が2013年に発表した“内部統制-総合枠組み”で確立された基準に基づき、社内財務報告の内部統制の有効性を評価した。この評価の結果、経営陣は、2022年12月31日現在、以下に述べる重大な弱点により、財務報告の内部統制を無効としていると結論した。したがって、開示制御および手続きは、取引所法案に基づいて提出または提出された報告書に開示すべき情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、集約および報告され、最高経営者および最高財務官を含む私たちの経営陣に蓄積され、タイムリーに開示決定を下すことを効果的に保証することができない。
我々は、(I)重要な非従来の取引を適切に識別して評価するための有効な制御を設計し、維持し、(Ii)取引の適切な開始および記録を支援するために、情報技術の一般的な制御および適切な役割分担を設計し、維持し、それにより、これらのデータに依存するトラフィックフロー制御およびアプリケーションへの影響を提供する。
経営陣はこれらの重大な弱点の救済に一定の進展を遂げたにもかかわらず、経営陣は2022年12月31日現在、上記のような重大な弱点が残っていると結論した。経営陣は、財務報告の内部統制上の欠陥を是正するために行動し、解決を目指して追加的な手続きと制御を実施している
87
これらの物質が弱い根本的な原因である。経営陣は重大な弱点の最終的な救済を達成するために努力している。経営陣の内部統制救済作業には、
経営陣が財務報告に対する我々の内部統制を評価し、改善しようと努力するにつれて、経営陣は重大な弱点を解決するために追加措置を講じる必要があると決定する可能性がある。しかし、私たちはこのような行動が重要な弱点を効果的に補うことができると信じており、私たちはこのような救済作業に多くの時間と精力を投入し続けるだろう。制御措置が十分に長時間実行され、管理層がテストにより、これらの制御措置が一致して有効に実行される前に、上記のような重大な弱点が存在し続けると結論付けた。
当社の2022年12月31日までの財務報告内部統制の有効性は、独立公認会計士事務所RSM US LLPが監査しており、その認証報告は上記第8項に記載されている。
財務報告の内部統制の変化
2022年12月31日までの四半期内に、財務報告の内部統制に重大な影響を与えていないか、または合理的に我々の財務報告の内部統制に重大な影響を与える可能性のある変化が発生していないが、上記の救済措置に関する変化は除外される。しかし、新たな企業資源計画システムの継続実施と重大な弱点の救済に伴い、私たちのプロセスや手続きを変更し、逆に財務報告に対する内部統制を変化させる可能性があります。これらの変化の発生に伴い、私たちは四半期ごとにこれらの変化が私たちの財務報告の内部統制に実質的な影響を与えるかどうかを評価するつもりだ。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。開示登記検査禁止の外国司法管区
適用されません。
88
部分(三)
プロジェクト10.役員·役員休会ICERSと会社管理
本プロジェクトに要求される資料は,財政年度終了後120日後に米国証券取引委員会に提出される2023年株主総会のために提出された最終依頼書(以下,“依頼書”と呼ぶ)を参考にしたものである。
第11項.実行VE補償
本プロジェクトに要求される情報は,我々の依頼書を参考にする.
プロジェクト12.特定の受益者の保証所有権従業員と経営陣および関連株主について
本プロジェクトに要求される情報は,我々の依頼書を参考にする.
本プロジェクトに要求される情報は,我々の依頼書を参考にする.
第14項:元本口座NTING費用とサービス
本プロジェクトに要求される情報は,我々の依頼書を参考にする.
89
部分IV.IV
プロジェクト15.展示品と国際水泳連盟NCIAL文スケジュール
(A)本報告の一部として提出された書類:
一財務諸表-連結財務諸表インデックスおよび本年度報告書の表10-Kの第8項を参照。
(2)財務諸表添付表明細書は、適用されないか、または必要ではないので、またはこれらの情報が連結財務諸表およびその付記に含まれるので省略される。
(3)展示品インデックス.
展示品索引
証拠品番号: |
|
展示品 |
|
|
|
|
|
|
3.1 |
|
オーゴ社登録証明書(2019年9月16日に米国証券取引委員会に提出されたS-3/Aフォーム登録説明書(書類番号333-233621)添付ファイル3.1参照) |
|
|
|
3.2 |
|
有機生成ホールディングス登録証明書改訂証明書(会社が2022年6月27日に米国証券取引委員会に提出した8-Kフォーム(ファイル番号001-37906)添付ファイル3.1) |
|
|
|
3.3 |
|
“オーゴ定款”(会社が2019年9月16日に米国証券取引委員会に提出したS-3/A表登録説明書(書類番号333-233621)添付ファイル3.2参照) |
|
|
|
4.1 |
|
1934年証券取引法第12節に登録された証券説明書(参考会社が2020年3月9日に米国証券取引委員会に提出した10-K年報(文書番号001-37906)添付ファイル4.1) |
|
|
|
10.1 |
|
2018年12月10日に改訂および再署名されたOrgo、Avista Acquisition Corp.,Avista Capital Partners Fund IV L.P.,Avista Capital Partners Fund IV(Offshore),L.P.といくつかの有機生成普通株式所有者との間の登録権協定(2018年12月11日に米国証券取引委員会に提出された会社現在の8−Kレポート(文書番号001−37906)の添付ファイル10.1を参照して組み込む) |
|
|
|
10.2 |
|
有機生成会社と丹路65号SPE,LLCとの間のレンタル日は2013年1月1日である(2018年12月11日に米国証券取引委員会に提出された会社の現在8-Kレポート(ファイル番号001-37906)の添付ファイル10.4合併を参照することにより) |
|
|
|
10.3 |
|
有機生成会社と85 Dan Road Associates,LLCとの間のレンタル日は2013年1月1日である(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)の添付ファイル10.5合併を参照することにより) |
|
|
|
10.4 |
|
有機生成会社と丹路株式I有限責任会社との間で2013年1月1日に締結されたリース契約(2018年12月11日に米国証券取引委員会に提出された会社の現在8-Kレポート(ファイル番号001-37906)の添付ファイル10.6合併を参照) |
|
|
|
10.5 |
|
スイス有機産業会社とStiftung Regionales Gründerzentum Reinachが締結した2012年6月5日の賃貸契約は、2017年5月9日の第1号補編と2017年5月9日の第2号補編改訂を経て改訂された(添付ファイル10.10を参照して2018年12月11日に米国証券取引委員会に提出された現在の8-Kレポート(第001-37906号文書)) |
|
|
|
10.6 |
|
リース契約は,日付は2014年1月1日であり,Oxmoor Holdings,LLCとPrime Merger Sub,LLC(Nutech Medical,Inc.の利益相続人として)が締結されている.(添付ファイル10.11を参照して会社に組み込まれ、2018年12月11日に米国証券取引委員会に提出された現在の8-Kレポート(ファイル番号001-37906)) |
|
|
|
10.7 |
|
自由工業団地と有機生成会社との間の標準工業/商業マルチテナント賃貸ネットワークは、2011年3月7日、2013年4月19日の第1修正案、2015年4月19日の第2修正案、2017年3月9日の第3改正案改正(添付ファイル10.12を参照して2018年12月11日に米国証券取引委員会に提出された現在の8-K報告書(第001-37906号文書)に組み込まれている) |
|
|
|
10.8 |
|
有機生成会社とゲイリー·ギリシニとの間で2007年2月1日に改訂および再署名されたキー従業員協定(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-K表報告書(ファイル番号001-37906)の添付ファイル10.13を参照して組み込む) |
|
|
|
90
証拠品番号: |
|
展示品 |
10.9 |
|
有機生成会社とパトリック·ビルボとの間で2017年2月14日に署名された従業員書簡協定(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)の添付ファイル10.14を参照して編入) |
|
|
|
10.10 |
|
有機生成会社とアントニオ·モンテカルボとの間で2017年2月14日に署名された従業員書簡協定(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)の添付ファイル10.16を参照して組み込む) |
|
|
|
10.11 |
|
有機生成会社とローリー·フリードマンとの間で2018年1月19日に署名された従業員書簡協定(添付ファイル10.18を参照して2018年12月11日に米国証券取引委員会に提出された現在の8-Kフォーム報告書(ファイル番号001-37906)に組み込まれている) |
|
|
|
10.12 |
|
有機生成会社とBrian Growthとの間で署名された2017年5月9日までの従業員書簡協定(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)の添付ファイル10.19を参照して組み込む) |
|
|
|
10.13 |
|
改訂された2003年株式インセンティブ計画(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(第001-37906号ファイル)添付ファイル10.27を参照して編入) |
|
|
|
10.14 |
|
2003年株式インセンティブ計画下のインセンティブ株式オプションプロトコル表(2018年12月11日に米国証券取引委員会に提出された会社の現在8-Kレポート(ファイル番号001-37906)添付ファイル10.28参照) |
|
|
|
10.15 |
|
2003年株式インセンティブ計画下の非法定株式オプション協定表(2018年12月11日に米国証券取引委員会に提出された会社の現在8-Kレポート(ファイル番号001-37906)添付ファイル10.29参照) |
|
|
|
10.16 |
|
2018年株式インセンティブ計画(改訂後)(会社2022年8月9日に米国証券取引委員会に提出された10-Qシーズン報(ファイル番号001-37906)添付ファイル10.1編入参照) |
|
|
|
10.17 |
|
2018年株式インセンティブ計画下のインセンティブ株式オプションプロトコル表(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)添付ファイル10.31を参照して編入) |
|
|
|
10.18 |
|
2018年株式インセンティブ計画下の非法定株式オプション協定表(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)添付ファイル10.32参照) |
|
|
|
10.19 |
|
取締役および上級管理者賠償プロトコル表(2018年12月11日に米国証券取引委員会に提出された会社現行8-Kレポート(ファイル番号001-37906)添付ファイル10.33を参照して編入) |
|
|
|
10.20 |
|
有機生成会社、Resorba Medical GmbHとAdvanced Medical Solutions Group plcとの間の和解·許可協定が2017年10月25日に発効した(2018年10月9日に米国証券取引委員会に提出されたS−4表登録説明書(文書番号333−227090)の添付ファイル10.5合併を参照して) |
|
|
|
10.21 |
|
2018年12月10日に採択された“オルゴ道徳と行動基準”を改訂し、再改訂する(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)添付ファイル10.35を参照して編入) |
|
|
|
10.22 |
|
オーゴとホールディングスの間で2018年12月10日に署名された持株株主協定(2018年12月11日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)添付ファイル10.36を参照することにより) |
|
|
|
10.23 |
|
有機生成会社はテナントとして、ボブソン·ノーウッド商業有限責任会社を所有者とし、2019年3月13日に締結されたリース契約(2019年3月19日に米国証券取引委員会に提出された会社現在8-Kレポート(ファイル番号001-37906)の添付ファイル10.1統合を参照) |
|
|
|
10.24 |
|
賠償協議表(会社が2016年9月2日に米国証券取引委員会に提出したS-1表登録説明書(第333-213465号文書)添付ファイル10.7を参照して編入) |
|
|
|
10.25 |
|
自由工業団地と有機生成会社との間で2020年2月14日に締結された賃借第4改正案(会社が2020年3月9日に米国証券取引委員会に提出した10-K表年次報告書(文書番号001-37906)の添付ファイル10.41を引用して編入) |
|
|
|
10.26 |
|
2020年2月7日にオクスムールホールディングスと有機生成会社との間で締結された賃貸借契約の第2次改正案(会社が2020年3月9日に米国証券取引委員会に提出した10-K表年次報告書(文書番号001-37906)の添付ファイル10.42を引用して編入)
|
91
証拠品番号: |
|
展示品 |
10.27 |
|
Gillheeney,Sr.(2020年4月29日に米国証券取引委員会に会社が提出したForm 10-K/A(ファイル番号:001-37906)年次報告書の添付ファイル10.43を参照して編入)
|
10.28
|
|
会社とDavid C.Franciscoが2021年1月15日に発行した重要な手紙(合併内容は、会社が現在報告している8-K表添付ファイル10.1(アーカイブ番号:37906)2021年2月16日に米国証券取引委員会に提出)
|
10.29 |
|
有機生成ホールディングスが老ゲイリー·S·ジリヘニと締結した制御権変更保留協定は、2021年5月10日から発効する(合併内容参考会社は2021年5月10日に米国証券取引委員会に提出された10-Q四半期報告(ファイル番号001-37906)の添付ファイル10.2)
|
10.30 |
|
制御権保留プロトコル変更表(非最高経営責任者)(引用会社は2021年5月10日に米国証券取引委員会に提出された10-Q四半期報告書(ファイル番号001-37906)添付ファイル10.3)
|
10.31 |
|
制御権変更保留プロトコル表(独立取締役)(会社が2021年5月10日に米国証券取引委員会に提出した10-Q四半期報告書(ファイル番号001-37906)添付ファイル10.4を参照)
|
10.32 |
|
有機生成持株会社を借り手とし,有機生成会社とPrime Merge Sub,LLCを保証人とし,シリコンバレー銀行を行政代理,先頭手配人,簿記管理人,発行貸金人とSwingline貸金人,およびシリコンバレー銀行と他のいくつかの貸金人が共同で貸手とする(引用会社により2021年8月9日に米国証券取引委員会に提出された現在の8-K報告書(ファイル番号001-37906)の添付ファイル10.1合併貸金人)の間で2021年8月6日に発効した信用協定
|
10.33* |
|
借り手として,借り手であるいくつかの銀行と他の金融機関や実体,および行政代理であるシリコンバレー銀行,および融資者とSwingline貸手である有機生成ホールディングスとの間で2022年12月8日に署名されたクレジット協定第1修正案
|
10.34 |
|
有機生成会社と丹路275 SPE,LLCとの間の2021年8月11日までの売買契約(2021年8月16日に米国証券取引委員会に提出された会社の現在の8-Kレポート(ファイル番号001-37906)の添付ファイル10.1を参照して組み込む)
|
21.1* |
|
有機生成ホールディングスの子会社。 |
|
|
|
23.1* |
|
RSM US LLPの同意 |
|
|
|
31.1* |
|
1934年証券取引法第13 a-14(A)又は15 d-14(A)条による最高経営責任者の証明 |
|
|
|
31.2* |
|
1934年証券取引法第13 a-14条又は15 d-14(A)条に基づいて首席財務官を認証する |
|
|
|
32.1* |
|
2002年サバンズ·オクスリ法案906節で可決された“米国法典”第18編1350条による最高経営責任者と最高財務責任者の証明 |
|
|
|
101* |
|
以下の材料は、XBRL(拡張可能な商業報告言語)として、有機生成ホールディングスが2022年12月31日までの10-K表年次報告を抜粋する:(1)有機生成持株会社の2022年12月31日と2021年12月31日までの合併貸借対照表、(2)有機生成持株会社の2022年12月31日まで、2021年12月31日と2020年12月31日までの合併経営報告書、(3)有機持株会社の2022年12月31日と2020年12月31日までの株主権益連結報告書、(Iv)2022年12月31日と2020年12月31日までの合併現金流動表2022年、2021年、2020年、および(V)有機生成持株会社合併財務諸表を付記する。 |
104 |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
*アーカイブをお送りします。
本展示品の一部の内容に対して秘密待遇を与える.本展示品の秘匿部分は省略されており、星印で表記されている。
?契約や補償計画や手配を管理します。
項目16.表10-Kの概要
ない。
92
登録する解決策
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、本報告が正式に許可された署名者がその署名を代表することを正式に促した。
有機生成ホールディングス |
|
|
|
差出人: |
/s/Gary S.Gillheeney,Sr. |
|
ゲイリー·S·ギリシニ老 社長と最高経営責任者 |
日付: |
March 1, 2023 |
1934年の証券取引法の要求に基づき、本年度報告は、以下の代表会社の人員によって指定された身分及び日付で署名された。
サイン |
|
タイトル |
|
日取り |
|
|
|
|
|
/s/Gary S.Gillheeney,Sr.
ゲイリー·S·ギリシニ老 |
|
社長と役員最高経営責任者(CEO) |
|
March 1, 2023 |
|
|
|
|
|
/S/Davidフランシスコ
デヴィッド·フランシスコ |
|
首席財務官(首席財務·会計幹事) |
|
March 1, 2023 |
|
|
|
|
|
/アラン·A·アデス
アラン·A·アデス |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
/s/Robert Ades
ロバート·アデス |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
マイケル·J·ドリスコール
マイケル·J·ドリスコール |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
/s/Prahyusha DuraiBabu
パトスシャ·デュレバブ |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
/s/David·エラニ
デヴィッド·エラニー |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
/s/ジョイン·ジャコミン
|
|
役員.取締役 |
|
March 1, 2023 |
ジョイン·ジャコミン |
|
|
|
|
|
|
|
|
|
/s/Michele Korfin ミシェル·コルフィン |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
アーサー·S·レボヴィッツ
アーサー·S·レボヴィッツ |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
/s/グレン·H·ヌスドフ
グレン·H·ヌスドフ |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
/s/Gilberto Quintero ギルベルト·クンテロ |
|
役員.取締役 |
|
March 1, 2023 |
|
|
|
|
|
93
有機生成ホールディングス
連結財務諸表索引
|
ページ |
独立公認会計士事務所報告 |
F-2 |
2022年12月31日現在と2020年12月31日現在の連結貸借対照表21 |
F-4 |
2022年12月31日現在、2021年12月31日および2020年12月31日までの総合業務レポート |
F-5 |
2022年12月31日現在、2021年12月31日と2020年12月31日までの株主権益合併報告書 |
F-6 |
2022年12月31日現在、2021年12月31日と2020年12月31日までの連結現金フロー表 |
F-7 |
連結財務諸表付記 |
F-8 |
F-1
“独立公認会計士報告書”アイレード会計士事務所
有機生成ホールディングスの株主と取締役会へ。
財務諸表と財務報告の内部統制に関するいくつかの見方
当社は、有機生成持株会社及びその付属会社(当社)が2022年12月31日及び2021年12月31日までの総合貸借対照表、及び2022年12月31日までの3年度における各年度の関連総合経営報告書、株主権益及びキャッシュフロー、及び関連付記(総称して財務諸表)を監査している。私たちはまた、会社が2022年12月31日までの財務報告の内部統制、根拠を監査しました内部制御--統合フレームワーク2013年にトレデビル委員会が後援した組織委員会が発行された。
上記財務諸表は、すべての重要な点において、当社の2022年12月31日と2021年12月31日までの財務状況、および2022年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、米国公認の会計原則に適合していると考えられる。また,以下のような重大な弱点が制御基準目標の実現に与える影響により,当社は2022年12月31日現在,以下の基準に基づいて財務報告に対して有効な内部統制を維持していないと考えられる内部制御--統合フレームワーク2013年にトレデビル委員会が後援した組織委員会が発行された。
重大な欠陥は財務報告内部制御の欠陥或いは欠陥の組み合わせであり、年度或いは中期財務諸表の重大な誤報が合理的な可能性があり、適時に防止或いは発見できないようにする。以下のような重大な弱点が明らかになり、経営陣の評価に組み込まれている。当社は、(I)取引の適切な開始および記録を支援するために、重要な非通常取引および(Ii)情報技術の一般的な制御および適切な役割分担を正確に識別し、評価するための有効な制御を設計し、維持しておらず、それによって、これらのデータに依存したワークフロー制御およびアプリケーションへの影響を提供する。我々が2022年財務諸表を監査する際に適用する監査テストの性質、時間、範囲を決定する際には、これらの重大な弱点が考慮されており、本報告は、これらの財務諸表に関する2023年3月1日の報告書に影響を与えない。
意見の基礎
当社の経営陣は、これらの財務諸表の作成を担当し、財務報告に対する有効な内部統制を維持し、財務報告の内部統制の有効性を評価する 財務報告書の内部統制に関する経営陣の報告書。私たちの責任は、会社の財務諸表に意見を発表し、私たちの監査に基づいて会社の財務報告内部統制に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうか、エラーによるものであっても詐欺であっても、すべての重大な点で財務報告の有効な内部統制が維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
財務諸表の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。我々の財務報告の内部統制の監査には、財務報告の内部統制を理解すること、重大な弱点があるリスクを評価すること、評価されたリスクテストに基づいて内部統制の設計と運営有効性を評価することが含まれる。私たちの監査はまた、私たちがこのような状況で必要だと思う他の手続きを実行することを含む。私たちは私たちの監査が私たちの意見に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)会社の資産の取引および処分を合理的かつ正確かつ公平に反映した記録を維持することに関連する政策および手順、(2)財務報告を作成するために必要な取引が記録されている合理的な保証、すなわち取引が必要であるという政策および手順が含まれる
F-2
(3)財務諸表に重大な影響を及ぼす可能性のある不正会社資産の買収、使用、または処分を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、次の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
重大な非定例取引を確定する
非通常事務は、定期的にのみ発生する活動を表し、通常は通常の事務流には属さない。当社は、2022年12月31日までに、経営陣に適切な会計処理を決定する際に、財務諸表付記2で述べたグループ調達組織(GPO)と3,300ドルのGPO費用を決済する合意を含むいくつかの非通常取引を締結し、2022年12月31日までの年間収益に計上されている2,600ドルと、財務諸表付記8に記載されているいくつかの設備処分減値指標と、2022年12月31日までの年度停止を含み、当社がOI East資産グループの若干の資産を減価テストすることを求めている。重大な非通常取引が唯一無二であり、会社の日常取引プロセスの一部ではないことを考慮すると、管理層は重大な非通常取引を識別する際に重大な判断を下さなければならない。
経営陣がすべての重大な非定例取引を決定するために講じた行動の結果が十分であるかどうかを判断する上で主観的であるため、経営陣の重大な非定例取引の確認と評価を重要な監査事項としている。
当社の重大な非通常取引に関する監査手続きには、以下のことが含まれています
/s/RSM US LLP
2004年以来、当社の監査役を務めてきました。
ボストン、マサチューセッツ州
March 1, 2023
F-3
有機生成ホールディングス
統合されたインフラスプレー銃のシーツ
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
制限現金 |
|
|
|
|
|
|
||
売掛金純額 |
|
|
|
|
|
|
||
在庫品 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
無形資産、純額 |
|
|
|
|
|
|
||
商誉 |
|
|
|
|
|
|
||
経営的リース使用権資産純額 |
|
|
|
|
|
|
||
繰延税項目純資産 |
|
|
|
|
|
|
||
その他の資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
為替相場の当面の部分を延期する |
|
$ |
- |
|
|
$ |
|
|
定期ローンの当期分 |
|
|
|
|
|
|
||
融資リース債務の当期部分 |
|
|
- |
|
|
|
|
|
賃貸債務の当期分を経営する |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
|
||
費用とその他の流動負債を計算しなければならない |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
定期ローンで当期分を差し引く |
|
|
|
|
|
|
||
経営性賃貸債務、当期分を差し引く |
|
|
|
|
|
|
||
その他負債 |
|
|
|
|
|
|
||
総負債 |
|
|
|
|
|
|
||
(注18) |
|
|
|
|
|
|
||
株主権益: |
|
|
|
|
|
|
||
優先株、$ |
|
|
|
|
|
|
||
普通株、$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこれらの総合財務諸表の構成要素である
F-4
有機生成ホールディングス
合併状態運営部
(単位は千で、1株当たりおよび1株当たりの金額は含まれていない)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
販売原価 |
|
|
|
|
|
|
|
|
|
|||
毛利 |
|
|
|
|
|
|
|
|
|
|||
運営費用: |
|
|
|
|
|
|
|
|
|
|||
販売、一般、行政 |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
|
|
|
|
|
|
|
|||
総運営費 |
|
|
|
|
|
|
|
|
|
|||
営業収入 |
|
|
|
|
|
|
|
|
|
|||
その他の費用、純額: |
|
|
|
|
|
|
|
|
|
|||
利子支出 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
繰延買収対価格の収益を決算する |
|
|
- |
|
|
|
- |
|
|
|
|
|
債務返済損失 |
|
|
- |
|
|
|
( |
) |
|
|
- |
|
その他の収入(赤字),純額 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
その他の費用の合計 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
所得税前純収益 |
|
|
|
|
|
|
|
|
|
|||
所得税給付 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
|
|
|
|
|
|
|
|
|
|
|||
1株当たり純収益: |
|
|
|
|
|
|
|
|
|
|||
基本的な情報 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
薄めにする |
|
$ |
|
|
$ |
|
|
$ |
|
|||
加重平均普通株式発行済み |
|
|
|
|
|
|
|
|
|
|||
基本的な情報 |
|
|
|
|
|
|
|
|
|
|||
薄めにする |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
付記はこれらの総合財務諸表の構成要素である
F-5
有機生成ホールディングス
合併報告書株主権益
(単位は千で、シェアは含まれていない)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
その他の内容 |
|
|
|
|
|
合計する |
|
|||||
|
|
|
|
普通株 |
|
|
支払い済み |
|
|
積算 |
|
|
株主の |
|
||||||||
|
|
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字.赤字 |
|
|
権益 |
|
|||||
2019年12月31日現在の残高 |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
株式オプションの行使 |
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
||||
CPN買収に関する普通株を発行する |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
|||
株に基づく報酬費用 |
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
||
2020年に引受された公開発行で発行された株は、発行コストを差し引く$ |
|
|
|
|
|
|
|
|
|
|
|
|
|
- |
|
|
|
|
||||
純収入 |
|
|
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
||
2020年12月31日の残高 |
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
||||
株式オプションの行使 |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
|||
RSUに帰属し、納税のために提出された株式を差し引く |
|
|
|
|
|
|
|
- |
|
|
|
( |
) |
|
|
- |
|
|
|
( |
) |
|
株に基づく報酬費用 |
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
||
純収入 |
|
|
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
||
2021年12月31日現在の残高(報告書に示す) |
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
||||
GPO費用紛争解決後の調整 |
|
|
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
( |
) |
|
|
( |
) |
2021年12月31日現在の残高(重記) |
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
||||
株式オプションの行使 |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
|||
RSUに帰属し、納税のために提出された株式を差し引く |
|
|
|
|
|
|
|
- |
|
|
|
( |
) |
|
|
- |
|
|
|
( |
) |
|
CPN買収に関する普通株を発行する |
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
|||
株に基づく報酬費用 |
|
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
- |
|
|
|
|
||
純収入 |
|
|
|
|
- |
|
|
|
- |
|
|
|
- |
|
|
|
|
|
|
|
||
2022年12月31日現在の残高 |
|
|
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
付記はこれらの総合財務諸表の構成要素である
F-6
有機生成ホールディングス
合併状態キャッシュフロープロジェクト
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
経営活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
|
|||
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
純収入と経営活動が提供する現金純額を調整する: |
|
|
|
|
|
|
|
|
|
|||
減価償却 |
|
|
|
|
|
|
|
|
|
|||
無形資産の償却 |
|
|
|
|
|
|
|
|
|
|||
経営的リース使用権資産の償却 |
|
|
|
|
|
|
|
|
- |
|
||
非現金利子支出 |
|
|
|
|
|
|
|
|
|
|||
利子支出を繰延する |
|
|
|
|
|
|
|
|
|
|||
賃料を繰延する |
|
|
- |
|
|
|
- |
|
|
|
|
|
繰延買収対価格の収益を決算する |
|
|
- |
|
|
|
- |
|
|
|
( |
) |
繰延税支出 |
|
|
|
|
|
( |
) |
|
|
|
||
財産と設備処分損失 |
|
|
|
|
|
|
|
|
|
|||
不良債権準備をする |
|
|
|
|
|
|
|
|
|
|||
過剰と古い在庫の調整 |
|
|
|
|
|
|
|
|
|
|||
株に基づく報酬 |
|
|
|
|
|
|
|
|
|
|||
債務返済損失 |
|
|
- |
|
|
|
|
|
|
- |
|
|
オーバーフロー負債公正価値変動 |
|
|
- |
|
|
|
( |
) |
|
|
|
|
経営性資産と負債変動状況: |
|
|
|
|
|
|
|
|
|
|||
売掛金 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
在庫品 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
前払い費用と他の流動資産 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
賃貸借契約を経営する |
|
|
( |
) |
|
|
( |
) |
|
|
- |
|
売掛金 |
|
|
|
|
|
|
|
|
( |
) |
||
費用とその他の流動負債を計算しなければならない |
|
|
( |
) |
|
|
|
|
|
|
||
その他負債 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
経営活動が提供する現金純額 |
|
|
|
|
|
|
|
|
|
|||
投資活動によるキャッシュフロー: |
|
|
|
|
|
|
|
|
|
|||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
業務買収のための現金 |
|
|
- |
|
|
|
- |
|
|
|
( |
) |
投資活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
|
|||
2019年のクレジット契約下のクレジット返済限度額 |
|
|
- |
|
|
|
( |
) |
|
|
( |
) |
2019年クレジット協定下の定期ローン借款(返済) |
|
|
- |
|
|
|
( |
) |
|
|
|
|
2021年信用協定の下で定期融資で得られた金は、債務割引と発行コストを差し引く |
|
|
- |
|
|
|
|
|
|
- |
|
|
“2021年信用協定”に規定されている定期ローン返済 |
|
|
( |
) |
|
|
( |
) |
|
|
- |
|
株式融資収益 |
|
|
- |
|
|
|
- |
|
|
|
|
|
持分発行コストを支払う |
|
|
- |
|
|
|
- |
|
|
|
( |
) |
融資リース債務の元金返済 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
株式オプションを行使して得られる収益 |
|
|
|
|
|
|
|
|
|
|||
RSU帰属に関連する源泉徴収税の支払い |
|
|
( |
) |
|
|
( |
) |
|
|
- |
|
繰延買い入れの掛け値を支払う |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
債務の支払いを返済する |
|
|
- |
|
|
|
( |
) |
|
|
- |
|
融資活動提供の現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
現金、現金等価物、および限定現金の変動 |
|
|
( |
) |
|
|
|
|
|
|
||
現金、現金等価物、制限された現金、年明け |
|
|
|
|
|
|
|
|
|
|||
現金、現金等価物、制限現金、年末 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
キャッシュフロー情報の追加開示: |
|
|
|
|
|
|
|
|
|
|||
利子を支払う現金 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
所得税の現金を納める |
|
$ |
|
|
$ |
|
|
$ |
|
|||
非現金投資と融資活動を追加開示します |
|
|
|
|
|
|
|
|
|
|||
精算には前払い料金や他の流動資産に含まれる発売費用が含まれています |
|
$ |
- |
|
|
$ |
- |
|
|
$ |
|
|
企業買収のために発行された株式の公正価値 |
|
$ |
- |
|
|
$ |
- |
|
|
$ |
|
|
企業買収記録の繰延買収対価格と割増負債 |
|
$ |
|
|
$ |
- |
|
|
$ |
|
||
売掛金と売掛金のうち財産·設備購入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
賃貸義務で得られた使用権資産 |
|
$ |
|
|
$ |
|
|
$ |
- |
|
||
付記はこれらの総合財務諸表の構成要素である
F-7
合併後の注釈財務諸表
(千単位で、1株および1株は含まれていない)
1.業務の性質と届出根拠
Orgoホールディングス(“Orgo”あるいは“会社”)は先進的な再生医学会社であり、高度な創傷看護及び外科と運動医学市場の開発、製造と商業化解決策に集中している。同社ポートフォリオのいくつかの既存および開発中の製品は、米国食品医薬品局(FDA)の上場前申請(PMA)の承認または発売前通知510(K)の承認を得ている。同社の顧客には、病院、創傷看護センター、政府施設、非臥床サービスセンター(“ASC”)と医師事務室がある。その会社は所有している
新冠肺炎が大流行する
2023年1月30日、バイデン政府は、2023年5月11日に新型コロナウイルス(新冠肺炎)に関連する突発的な公衆衛生事件(と国家緊急事態)の申告を終了すると発表した。2022年12月31日までの年度内に、新冠肺炎疫病は当社の財務業績及び業務運営に重大な悪影響を与えていないが、新冠肺炎疫病は持続的に当社にリスクを構成し、当社は新冠肺炎疫病が当社の未来の財務状況及び経営業績に与える影響を予測できない。
2.重大な会計政策
以前発表された財務諸表の重記
2022年8月、会社は以前議論されていたGPO費用を$で解決することで、グループ調達組織(“GPO”)と合意した
|
|
|
March 31, 2022 |
|
|
|
2021年12月31日 |
|
||||||||||||||||||
合併貸借対照表 |
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
||||||
費用とその他の流動負債を計算しなければならない |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
||||||
流動負債総額 |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
||||||
総負債 |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
||||||
赤字を累計する |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
株主権益総額 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
2022年3月31日までの3ヶ月間 |
|
|
|
2021年12月31日までの年度 |
|
||||||||||||||||||
連結業務報告書 |
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
||||||
純収入 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
毛利 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
営業収入 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
所得税前純収益 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
純収入 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
F-8
|
|
|
2022年3月31日までの3ヶ月間 |
|
|
|
2021年12月31日までの年度 |
|
||||||||||||||||||
統合現金フロー表 |
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
||||||
純収益/(損失) |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
( |
) |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
経営性資産と負債変動状況: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
費用とその他の流動負債を計算しなければならない |
|
|
$ |
( |
) |
|
$ |
|
|
$ |
( |
) |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
|
|
|
2022年3月31日までの3ヶ月間 |
|
|
|
2021年12月31日までの年度 |
|
||||||||||||||||||
製品別の収入: |
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
||||||
高度な傷ケア |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
外科運動医学 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純収入 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
2022年3月31日までの3ヶ月間 |
|
|
|
2021年12月31日までの年度 |
|
||||||||||||||||||
雑物 |
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
|
|
前に報じたように |
|
|
調整する |
|
|
以上のように |
|
||||||
GPO費用 |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
|
$ |
|
|
$ |
|
|
$ |
|
||||||
購入計画の収入 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
予算の使用
公認会計基準に従って財務諸表を作成することは、報告期間中に報告された資産および負債額、財務諸表を開示する日のまたは資産および負債および報告の業務結果に影響を与えるために、管理層に推定および仮定を要求する。総合財務諸表を作成する際に、管理層が重大かつ最大の不確実性が存在すると考えている推定および仮定は、収入確認、販売差し戻しおよび信用損失、在庫準備金、当期および繰延所得税資産および負債の確認および計量、長期資産の回収可能性の評価、営業権減価の評価、観察不可能な投入を使用する資産および負債の推定値、および株式に基づく補償の推定および確認を含む。実際の結果と結果は,これらの見積りや仮定とは大きく異なる可能性がある.
合併原則
連結財務諸表には、有機生成持株会社及びその全額子会社の勘定及び経営結果が含まれる。すべての会社間の残高と取引はすでに合併中に販売されている。
細分化市場報告
運営部門は企業の構成要素として定義され、これらの情報に関する離散財務情報は、首席運営意思決定者または意思決定グループが、資源の分配と組織業績の評価について決定する際に定期的に評価を行う。会社の最高経営決定者は最高経営責任者です。会社の首席運営決定者は、合併の経営結果を審査し、資源の配分と会社全体の業績評価に関する決定を行う。したがって、同社はそれが単一の経営部門である再生医学を持っていると判断した。
業績評価と経営決定を行うために、同社はその運営を単一の運営部門として管理している。同社の製品組み合わせは、臨床前から後期までに開発された異なる段階の再生医学製品と、商業化された先進創傷看護および外科および運動医学製品を含み、これらの製品は多くの異なるタイプの施設の様々な創傷タイプの癒合を支持する。
現金と現金等価物
同社は主に米国の銀行預金口座に現金を預けており、連邦保険の限度額を超える可能性がある。同社は同社などの口座に損失を出しておらず、現金面で重大な信用リスクに直面しないと信じている。当社はすべての原始期限が三ヶ月以下の高流動性投資を現金等価物と見なしています。
F-9
制限現金
その会社はすでに制限している$
売掛金純額
売掛金は領収書価値から推定された不良債権を差し引いて列報を用意する。同社は顧客の支払いを監視し続け、顧客が必要なお金を支払うことができないことによる推定損失保留準備金を提供している。当社は不良債権準備時に顧客の支払い能力に影響を与える可能性のある歴史的経験、信用品質、売掛金残高の年齢、地理に関するリスクや経済状況などを考慮しています。特定顧客がその財務義務を履行する能力を損なう可能性がある場合には、特定支出は支払額に計上され、確認された売掛金純額を合理的に回収可能と考えられる金額に減少させる。売掛金は回収できないと思われた場合は返金します。以前に査定された売掛金は受け取った時に入金されます。
棚卸しをする
在庫はコスト(先進先出し法で確定)または可現純値の中で低い者が列報する。製品および生産品には材料、人工、および分配された間接費用が含まれる。在庫には、生産条件を満たすように材料のテストを要求する細胞バンクと監督機関が含まれている。
当社は手元の在庫数を定期的に審査し、将来の材料使用量、生産量、陳腐率に対する経営陣の仮定に基づいて、過剰と古い在庫をその推定可変現純値に減記する準備金を記録し、これらの仮定は将来の需要と市場状況およびある在庫項目の有効寿命の結果である。
同社はまた、将来の成長予測を決定するために、その在庫の他の構成要素をテストした。同社はこの成分の平均収益率を決定し、予想収入と比較して適切な保持を確保している。
財産と設備、純額
財産と設備はコストごとに入金され、それぞれの資産の推定耐用年数内で直線的に減価償却される。会社の物件と設備には、2022年12月31日と2021年12月31日まで、賃貸改善、建築、家具、コンピュータ、設備が含まれています。財産と設備の推定使用寿命は以下のとおりである
賃借権改善 |
|
|
家を建てる |
|
|
家具とパソコン |
|
|
装備 |
|
廃棄又は販売時には、資産を処分するコスト及び関連する減価償却は勘定から差し引かれ、それによって生じる収益又は損失はいずれも総合経営報告書に計上される。修理費と維持費は発生時に料金を記入します。関連資産の耐用年数を延長する重大な改善支出は、その残りの推定耐用年数内に資本化し、減価償却する。建設中工事コストは資産投入使用前に発生時に資本化し、その時コストは関連物件と設備に移転し、それぞれの耐用年数内に減価償却する。
商誉
営業権とは、買収された企業の買収価格が買収された識別可能な資産と負担する負債の公正価値を超えることを指す。営業権は償却されないが、少なくとも毎年(12月31日まで)に減値テストを行うか、またはイベントまたは状況が帳簿価値が回収可能でなく、減値損失が発生した可能性があることを示す場合に、より頻繁な減値テストを行う。減値テストを誘発する可能性がある場合には、商業環境または法的要因の重大な不利な変化、規制機関の不利な行動または評価、または意外な競争が含まれるが、これらに限定されない。当社は分部経営として唯一の報告単位とされているため、営業権は総合レベルで減値テストを行っている。
はいASCテーマ350、無形資産-営業権などによると、会社はまず定性的要素を評価して、営業権減価定量化テストを行う必要があるかどうかを決定するかもしれない。全ての事件を評価した後や
F-10
状況は、当社は,報告単位の公正価値がその帳簿価値を下回る可能性が高い(すなわち50%以上の可能性が高い)と考えており,定量化テストが必要である。そうでなければ、これ以上のテストは必要ない。あるいは,会社は定性的評価を迂回して直接定量テストを行うことができる.数量化商誉減値テストは当社に報告単位の公正価値を推定し、それをその帳簿価値と比較することを要求した。報告機関の公正価値が純資産の帳簿価値を超える場合、営業権は減損することはない。もし報告単位の公正価値が帳簿価値より低い場合、差額は減値損失に計上され、最高で営業権金額に達することができる。2022年12月31日、私たちは直接定量分析を行うことを選択した。我々は会社の時価を用いて報告単位の公正価値を近似している.公正価値は帳簿価値を超えています
あったことがある
償却すべき無形資産
無形資産には、当社が所有しているか、当社が許可を持っている知的財産権が含まれています。企業合併で買収された無形資産は、一般的に受け入れられている買収に適していると考えられる無形資産タイプの推定方法を採用し、公正価値で確認する。無形資産は累計償却後の純額と営業権を分けて報告する。限られた寿命を持つ無形資産はその予想寿命内に償却される。無形資産には、開発された技術および特許、商号、商標、顧客関係、商業買収によって得られた競業禁止協定が含まれる
商品名と商標 |
|
|
発達した技術 |
|
|
取引先関係 |
|
|
競業禁止協定 |
|
長期資産減価準備
長期資産は主に財産と設備で構成されている。事件や環境変化が1つの資産や資産グループの帳簿金額が回収できない可能性があることを示すたびに、当社は長期資産の減値を審査する。当社がいつ減値審査を行うかを決定する際に考慮する要因には、業務の予想面での顕著な不振、業界や経済傾向の重大な負の傾向、資産用途の重大な変化や計画における変化が含まれているが、これらに限定されない。このような事件が発生した場合、当社は、割引されていないと予想される将来のキャッシュフロー純額と関連資産グループの帳簿価値を比較することで、減値があるかどうかを決定する。1つの資産が減値として決定された場合、資産は公正価値として減記され、公正価値は現金流量または評価価値に基づいて決定され、特に資産の性質に依存する。当社は2022年12月31日までに長期資産減価を記録していません, 2021, or 2020.
収入確認
製品収入
同社は高級創傷ケアや外科や運動医学製品を販売することで収入を得ている。会社のすべての契約には、会社が手配中の具体的な支払いと出荷条項に基づいて会社の製品を顧客に譲渡することを約束する単一の履行義務がある。全体的な取引価格はこの単一の履行義務に割り当てられる。製品収入は、顧客が契約条項に基づいて会社製品に対する制御権を取得したときに確認され、その製品はある時点で発生し、出荷、プログラム日、または交付時に発生する可能性がある。
可変対価準備金
製品販売収入は、可変対価格準備金を差し引いた純額であり、製品返品、割引、リベート、GPO費用には限定されないが、これらの費用は、会社がその顧客と締結した会社の製品販売に関する契約で提供される。これらの準備金は、顧客が関連販売で稼いだり、請求した金額を、売掛金の減少や負債の確定として記録している。適切な場合、これらの推定は、会社の歴史的経験、現在の契約および法的要件、特定の既知の市場イベントおよび傾向、業界データ、ならびに予測された顧客購入および支払いパターンのような関連要因を確率的に重み付けする一連の可能な結果を考慮する。全体的に、これらの準備金は、契約条項に基づいて取得する権利がある対価格金額の会社の最適な推定を反映しており、純販売価格に含まれており、確認された累積収入が今後一定期間で大きな逆転が生じない可能性が高いことを前提としている。実際の金額
F-11
最終支払いの掛け値は会社の見積もりとは違うかもしれません。実際の結果が会社の推定と異なる場合、会社はこれらの推定値を調整し、製品純収入とこのような違いが既知期間の収益に影響を与える。
製品を返品する
業界慣行と一致して、同社は通常、顧客に製品を購入する限られた返品権利を提供する。当社は顧客が返却可能な製品販売金額を推定し、この推定を関連製品収入確認期間中の収入減少と記録している。同社は現在、その歴史的返品率及びそれが意識しているその予想リターンに顕著に影響する可能性のある要素を使用して、製品のリコール、定価の変化或いは販売率の変化を含む製品返品備蓄を推定している。当社は返品製品の資産を記録していません。その製品は受け取った後に廃棄されるからです。
リベートと手当
会社は、関連製品の収入確認中に添付された総合貸借対照表に含まれる課税費用に含まれる収入の減少をもたらし、負債を確立するために、会社の契約に明示的に規定されたリベートおよび手当を特定の顧客に提供する。
GPO費用
当社はGPOメンバーの製品購入に関する管理サービス費用をGPOに支払います。これらの費用は契約によって決定された会社が売上高のパーセンテージを適用して計算される。同社は取引関係の実質に基づいて、これらのGPO費用を収入減少に分類している。2022年12月31日までの年度2021、2020年、同社が記録したGPO費用は$
他の収入政策
第三者を代表して徴収される販売税、付加価値税、その他の税は収入に含まれていない。
ASC 606-10-32-18の実際の方便を適用して、契約開始時の予想が顧客支払いと顧客への約束された製品の譲渡との間の時間間隔が1年以上である場合、会社は契約に重要な融資部分があるかどうかを評価せず、実質的にすべての顧客がそうである。
ASC 340-40-25-4の実際の方便を適用して、当社が確認すべき資産の償却期間が1年以下である場合、当社は契約発生時に契約を取得した増分コストを支出として確認する。このような費用は販売、一般、そして管理費用に含まれている。
ASC 606-10-25-18 Bにおける実際の便宜を適用して、会社は、顧客契約に関連する輸送および運搬活動を、譲渡関連製品の承諾を履行するコストとする。当社は関連コストを販売コストに計上しています。
収入の分類
次の表は収入を示しているE製品別:
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
高度創傷ケア収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
外科と運動医学収入 |
|
|
|
|
|
|
|
|
|
|||
総収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
列報のすべての期間において、米国以外の地域で発生する純収入は総純収入の1%未満である。
株に基づく報酬
当社は、付与日に付与された株式奨励の公正価値に基づいて付与された株式奨励を計量し、必要なサービス期間(通常は該当奨励の帰属期間)内でこれらの奨励金の補償費用を確認する。没収は付与時に推定され,実際に没収された場合は以下の場合と異なり,必要であればその後の期間で改訂することができる
F-12
これらの見積もり数字です。一般的に、会社が発行する株式報酬はサービス類の帰属条件のみであり、直線法を用いてこれらの報酬の費用を記録する。当社は業績帰属条件に基づく株式奨励金を発行していません。
同社は、最終帰属が予想される奨励の推定に基づいて日公允価値を付与し、総合経営報告書において、株式支払いに基づく販売、一般および行政費用のすべての株式ベースの補償費用を確認する。
制限株式単位ごとに付与された公正価値は、付与された日会社A類普通株の公正市場価値に基づいている。各株式オプション付与の公正価値は、付与された日にBlack-Scholesオプション定価モデルを用いて推定される。この会社の上場時間は比較的に短く、公衆流通株は限られており、そのA類普通株は会社に特定された歴史と隠れた変動率情報が不足している。そこで、上場同業者の履歴変動率に基づいて予想株価変動率を推定し、自身の取引株価変動性に関する十分な履歴データを持つまで継続する予定である。当社の株式オプションの期待期限は、“簡略化”方法で決定され、“通常”オプション資格に適合する株を奨励するために使用されます。無リスク金利は、奨励付与時に発効した米国債収益率曲線を参考にして決定され、期間は奨励の予想期限にほぼ等しい。予想配当収益率は、会社がそのA種類の普通株に対して現金配当金を支払ったことがなく、予測可能な未来にはいかなる現金配当金も支払われないと予想されることに基づく。
広告.広告
広告コストは,発生時に費用を計上し,総合経営報告書における販売,一般および行政費用を計上する。広告費は約$です
研究開発コスト
研究·開発費用には、会社の研究·開発者の人員コスト、製造プロセスの改善に関連する費用、会社の既存製品への改善、製品およびプラットフォーム開発パイプラインへの追加投資が含まれる。研究開発費には臨床試験費用も含まれている。当社は発生した研究と開発費用を負担します。
外貨?外貨
同社の機能通貨は、同社のスイス子会社ORGANGIONIZATION GMBHを含め、ドルである。外貨保有資産と負債及び機能通貨以外の通貨で決済された取引を再計量することにより生じる外貨損益は、連結経営報告書において他の費用純額の構成要素として単独で営業外収入又は費用とする。列報されたすべての期間に記録された外貨の額は取るに足らない。
割増の評価があるかもしれません
CPNの買収については,当社が2020年に買収した際に代償(“プレミアム”)の公正価値について非流動負債を確認した.オーバーフロー負債は第3級計量に分類され、その公正価値は観察不可能と全体の公正価値計量に重大な意義がある投入から得られた。このようなプレミアム負債の公正価値は、モンテカルロシミュレーションモデルを使用して推定され、このモデルは、プレミアム期間中の関連財務指標の予測収入および変動性を含む重要な仮定を利用する。当社は各報告期間にプレミアム負債の公正価値を評価します。負債推定公正価値のいずれの後続変動も、負債が返済されるまで、販売、一般、行政費用に反映される。
所得税
♪the the the会社は貸借対照法を用いて所得税を計算し、この方法は、連結財務諸表または会社納税申告書で確認された事件の将来の税務結果を予想する繰延税金資産および負債を確認することを要求する。繰延税項資産及び負債は、総合財務諸表と資産及び負債の税ベースとの差額に基づいて、予想差額を用いて返送される年度の現行税率を決定する。繰延税金資産と負債の変動を所得税に計上する準備。当社は、その繰延税金資産が将来の課税収入から回収される可能性を四半期ごとに評価し、既存の証拠の重みに基づいて繰延税金資産の全部または一部が現金化できない可能性があると考えている場合には、所得税費用を計上することで推定値を作成する。評価があるかどうかを決定しています
F-13
手当繰延税金資産が必要であることを考慮して、当社は繰延税金項目資産の現金化に関連するプラスと負の証拠を分析し、将来の課税所得額、最近の財務業績及び繰延税金項目資産と負債の将来の償却の推定を含む。また、当社は税務機関が税務状況の技術的価値に基づいて審査を行った後、その税務状況を維持する可能性が高いかどうかも考慮します。これらの要因を考慮して、当社は2021年第4四半期に繰延税金資産が将来的に顕在化する可能性が高いと考え、2021年12月31日までの米国繰延税項純資産の推定準備を公表し、$を発生させた
会社は連結財務諸表で確認された不確定所得税の額を会計処理し、2段階に分けて確認すべき税収割引金額を決定する。まず、税務機関が外部審査後にこのような状況を維持する可能性を決定するために、税収状況を評価しなければならない。税務状況がより継続する可能性があると考えられる場合、税務状況は、連結財務諸表で確認された利益金額を決定するために評価される。確認可能な利益額は、最終和解時に50%以上の実現可能性がある最大額である。所得税の準備には、それによって生じる税収準備金または未確認の税収割引の影響が適切であると考えられ、関連する純利息および罰金が含まれる。
金融商品の公正価値
当社のいくつかの資産及び負債は公認会計原則に基づいて公正価値に基づいて記帳します。公正価値は、計量日市場参加者間の秩序ある取引において、資産または負債が元金または最も有利な市場で負債を移転するために徴収または支払いされる交換価格として定義される。公正価値を計量するための推定技術は,観察可能な投入を最大限に利用し,観察不可能な投入を最大限に減少させなければならない。公正価値別に列挙された金融資産および負債は、公正価値レベルの以下の3つのレベルのうちの1つで分類および開示されなければならず、そのうちの最初の2つのレベルは可視とみなされ、最後のレベルは見えないとみなされる
これらの資産と負債の短期的な性質により、売掛金、在庫、前払い費用およびその他の流動資産、売掛金および売掛金の帳簿価値はその公正価値に近い。オーバーフロー負債の公正価値は、上記公允価値レベル中の第3級投入によって確定された(脚注“4.金融商品公正価値計量”参照)。当社の債務手配項目における未返済借金の帳簿価値(付記“12.長期債務”参照)と根拠割引C灰流モデルは,3段階測定を表す。
1株当たり収益(損益)(EPS)
当社はASCテーマ260における権威ある指導に基づいて、1株当たり収益(損失)を決定した1株当たりの収益それは.1株当たり収益を計算する際には,会社は1種類の普通株(A類普通株)しかないため,基本1株当たり収益を計算する方法は,純収益(損失)を適用期間中に発行された普通株の加重平均で割ったものである。割当1株当たり収益の計算方法は基本的に1株当たり収益と同じであり、株式数の計算方法はすべての潜在的な普通株を考慮した点である。この計算については、発行済み株式オプションと未既得限定株は潜在的な希釈性普通株とみなされている。
新興成長型会社
2021年12月31日までは、2012年のJumpStart Our Business Startups ActまたはJOBS Actの定義に基づく“新興成長型会社”である。雇用法案第107条は、新興成長型会社は、“雇用法案”に規定されている移行期間を延長して新たな又は改正された会計基準を実施することができると規定している。会社は、ASU 2016-02のような新しいまたは改正された会計基準を遵守するために延長された移行期間を使用することを選択した賃貸借証書(テーマ842))今回の選挙により、当社の2021年までの財務諸表は、上場企業の発効日を遵守している会社と比較できない可能性があります。2021年12月31日から、当社は新興成長型会社ではなくなった。
F-14
最近採用された会計公告
FASBは2020年3月、為替レート改革(テーマ848):参考為替レート改革の財務報告への影響を促進するASU第2020-04号を発表した(“ASU 2020-04”)。ASU 2020-04は、予想される市場のロンドン銀行間同業借り換え金利(LIBOR)および他の銀行間同業借り換え金利の代替参考金利への移行に関する財務報告負担を軽減するために、米国公認会計原則の契約改正およびヘッジ会計に関する指導に臨時のオプションオプションおよび例外状況を提供している。FASBは2021年1月、割引移行の影響を受けるデリバティブに適用される主題848の契約修正およびヘッジ会計のいくつかのオプションおよび例外を明らかにするために、金利改革(トピック848):範囲(“ASU 2021-01”)を参照してASU番号2021-01を発表した。ASU 2020-04とASU 2021-01はリリース日から2022年12月31日まで発効します。
同社は2022年12月、LIBORの代わりに隔夜融資金利(SOFR)を保証する債務協定改正案に署名した。同社はこれらのASUで提供された救済を利用している。修正案は、契約キャッシュフローの額やスケジュールに影響を与えず、他の条項の同時修正が参照為替レート改革に関係するため、根拠ASC 848-20-35-8それは.したがって、この改正は当社の総合財務諸表に影響を与えていない。
最近発表された未採用の会計公告
2016年6月、FASBはASU 2016-13を発表した金融商品--信用損失(特別テーマ326): 金融商品信用損失の計量(“ASU 2016-13”)。ASU 2016-13年の発表後、FASBは以下の更新を発表した:ASU 2018-19年、主題326“金融商品−信用損失”の編纂改善, ASU 2019-04, 主題326“金融商品--信用損失”の編纂改善、テーマ815、 派生ツールおよびヘッジ, テーマ825と, 金融商品, ASU 2019-05, 金融商品−信用損失(特別テーマ326)−方向性移行救済− and ASU 2019-11, トピック326の編集改善, 金融商品--信用損失それは.ASU 2016-13年およびすべての関連更新の目標は、報告エンティティが各報告日に保有する信用を拡大するために、財務諸表使用者に、金融商品および他の約束の予期される信用損失に関するより多くの決定有用な情報を提供することである。本ASU中の改訂は現行GAAP中のすでに発生した損失減値方法を代替し、その方法は期待された信用損失を反映し、そして更に広範な合理的かつ支持可能な情報を考慮して、信用損失推定を通知することを要求する。ASU 2016-13と関連更新は財政年度に適用され,公共業務実体(小さな報告会社になる資格がある実体は含まれていない)や財政年度については,2019年12月15日以降から開始されるこれらの年度内の移行期間,およびこれらの年度内の移行期間は,2022年12月15日以降からすべての他のエンティティに対して発効する。早期養子縁組を許可する。本指針の発表時に当社は小さな報告会社であったため、当社は延長された過渡期を利用して、2023年1月1日に留保収益への累積影響調整を確認することにより、本ガイドラインとその関連改善を採用する。当社はASU 2016-13を採用した効果と関連改善の評価を完了し、このような改善が当社の総合財務諸表に重大な影響を与えることを確認した。
3.買収
二零二年九月十七日(“買収日”)に、当社は二零年七月二十四日の資産購入契約に基づいて、CPN Biosciences,LLC(“CPN”)のいくつかの資産の買収及びいくつかの負債を負担する。CPNは、医師室管理ソリューションと先進的な傷ケア製品を提供します。
総掛け値は$です
CPNがプレミアム期間(2021年7月1日から2022年6月30日まで)のレガシー製品収入がCPN 2019年の収入を超えていれば,会社はCPNの前株式所有者にプレミアムを支払う義務がある.割増の金額は等しい
F-15
4.金融商品の公正価値計測
割増負債
2020年9月17日にCPNを買収した会計に関連して、会社はプレミアム負債#ドルを記録した
次の表は、2022年6月30日のオーバーフロー期間が終了するまで、第3レベルの投入を使用して決定された会社のプレミアム負債の公正価値の前転を提供する。
|
|
|
|
割増負債 |
|
|
2019年12月31日現在の残高 |
|
|
|
$ |
|
|
買収期日が価値を公平にする |
|
|
|
|
|
|
価値変動を公平に承諾する |
|
|
|
|
|
|
2020年12月31日の残高 |
|
|
|
|
|
|
価値変動を公平に承諾する |
|
|
|
|
( |
) |
2021年12月31日現在の残高 |
|
|
|
|
|
|
価値変動を公平に承諾する |
|
|
|
|
|
|
2022年6月30日までの残高 |
|
|
|
$ |
|
|
会社は2022年12月31日と2021年12月31日まで、公正価値の非日常的な基礎に基づいて計量した金融資産や負債を何も持っていない。
5.売掛金、純額
売掛金LEは以下のものからなる
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
マイナス--不良債権準備 |
|
|
( |
) |
|
|
( |
) |
|
|
$ |
|
|
$ |
|
||
会社の不良債権準備は以下の条件を満たしていないもの:
2020年12月31日の残高 |
|
$ |
|
|
足し算 |
|
|
|
|
核販売 |
|
|
( |
) |
2021年12月31日現在の残高 |
|
$ |
|
|
足し算 |
|
|
|
|
核販売 |
|
|
( |
) |
2022年12月31日現在の残高 |
|
$ |
|
F-16
6.在庫
在庫、関連準備金の純額を差し引く過剰と時代遅れについては、以下のことが含まれる
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
原料.原料 |
|
$ |
|
|
$ |
|
||
Oracle Work in Process |
|
|
|
|
|
|
||
完成品 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
原材料には会社の製造過程で使用される様々な部品が含まれている。同社の過剰·陳腐在庫審査過程には、販売予測と歴史的売上高と在庫レベルの対比を分析し、運営部門と協力して過剰在庫を最大限に回収することが含まれている。会社は2022年12月31日、2021年12月31日、2020年12月31日までの年間で徴収した
7.前払い料金およびその他の流動資産
前払い費用と他の流動資産会社以下の各項目からなる
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
予約料 |
|
$ |
|
|
$ |
|
||
会議とマーケティング費用 |
|
|
|
|
|
|
||
預金.預金 |
|
|
|
|
|
|
||
保険 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
預金は仕入先が保有する資金であり、12ヶ月以内に放出される予定であるため、流動資産として記録されている。
8.財産と設備、純額
財産と設備が一致する以下の項目のD項目:
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
賃借権改善 |
|
$ |
|
|
$ |
|
||
家を建てる |
|
|
|
|
|
|
||
家具、コンピュータ、設備 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
減価償却累計 |
|
|
( |
) |
|
|
( |
) |
建設中の工事 |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
減価償却費用は$
2022年12月31日までの年間で、当社は#ドルの費用を記録しました
F-17
はいこの決定に関連して、会社は#ドルの費用を記録した
この融資は、同社の2つの資産種別のうちの1つの主要資産の一部である。その他の事項を除いて、当社は設備処分と施工一時停止はASC 360項下のトリガーイベントだと考えている。トリガーイベントは、会社の長期資産が減少する可能性があるということを見せてくれる。当社は2022年にASC 360に基づいて影響を受けた資産グループの回復可能性テストを行った不動産·工場および設備それは.資産グループに直接帰属する推定未割引キャッシュフローは、その資産グループの帳票価値を超えている。したがって,損傷は認められなかった。
9.営業権と無形資産
商誉はい$です
識別可能な無形資産には以下のものが含まれる日付は2022年12月31日
|
|
オリジナル |
|
|
積算 |
|
|
ネットブック |
|
|||
|
|
コスト |
|
|
償却する |
|
|
価値がある |
|
|||
発達した技術 |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
商品名と商標 |
|
|
|
|
|
( |
) |
|
|
|
||
取引先関係 |
|
|
|
|
|
( |
) |
|
|
|
||
独立販売代理ネットワーク |
|
|
|
|
|
( |
) |
|
|
- |
|
|
特許 |
|
|
|
|
|
( |
) |
|
|
- |
|
|
競業禁止協定 |
|
|
|
|
|
( |
) |
|
|
|
||
合計する |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
2021年12月31日現在、識別可能無形資産には、以下が含まれる
|
|
オリジナル |
|
|
積算 |
|
|
ネットブック |
|
|||
|
|
コスト |
|
|
償却する |
|
|
価値がある |
|
|||
発達した技術 |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
商品名と商標 |
|
|
|
|
|
( |
) |
|
|
|
||
取引先関係 |
|
|
|
|
|
( |
) |
|
|
|
||
独立販売代理ネットワーク |
|
|
|
|
|
( |
) |
|
|
- |
|
|
特許 |
|
|
|
|
|
( |
) |
|
|
- |
|
|
競業禁止協定 |
|
|
|
|
|
( |
) |
|
|
|
||
合計する |
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
無形資産の償却は、直線計算或いは加速法を用いて計算し、無形資産の経済効果の消費モードを反映する$
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
その後… |
|
|
|
|
合計する |
|
$ |
|
F-18
10.課税費用およびその他の流動負債
計算すべき費用と他の流動負債には:
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
人員コスト |
|
$ |
|
|
$ |
|
||
印税 |
|
|
|
|
|
|
||
未払い賃貸債務と利子を計算する |
|
|
|
|
|
|
||
応和解料 |
|
|
- |
|
|
|
|
|
課税税 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
|
|
$ |
|
|
$ |
|
||
未払いの賃貸債務とこれらの債務の課税利息はマサチューセッツ州カントン市の建物と関係があります。脚注“17.借約”を参照。脚注を見る2.計算すべき費用を解決する“重大会計政策”。
11.構造調整
会社のコスト構造を低減し,運営効率を向上させるために,異なる場所での製造業務をマサチューセッツ州の施設に統合した。
2020年10月21日、同社はカリフォルニア州ラホアにある工場の労働力と運営を再編する計画を実施することを約束した。関与した再編
3月に2022年9月9日、同社はアラバマ州バーミンガムにある工場の労働力と運営を再編成する計画を実施することを約束した。組換え関連約
再編活動のため、会社が発生した税引前費用は#ドルです
|
|
従業員 |
|
|
他にも |
|
|
合計する |
|
|||
2019年12月31日現在の負債残高 |
|
$ |
- |
|
|
$ |
- |
|
|
$ |
- |
|
費用.費用 |
|
|
|
|
|
- |
|
|
|
|
||
現金分配 |
|
|
- |
|
|
|
- |
|
|
|
- |
|
2020年12月31日現在の負債残高 |
|
|
|
|
|
- |
|
|
|
|
||
費用.費用 |
|
|
|
|
|
|
|
|
|
|||
現金分配 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
2021年12月31日現在の負債残高 |
|
|
|
|
|
|
|
|
|
|||
費用.費用 |
|
|
|
|
|
|
|
|
|
|||
現金分配 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
2022年12月31日現在の負債残高 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
F-19
12.長期債務
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
信用限度額 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
定期ローン |
|
|
|
|
|
|
||
債務割引と債務発行コストを削減する |
|
|
( |
) |
|
|
( |
) |
定期ローン、債務割引と債務発行コストを差し引く |
|
$ |
|
|
$ |
|
||
2021年信用協定
二零二一年八月、当社は借り手として、その付属会社は保証人、シリコンバレー銀行(“SVB”)及びその他の数間貸金人(総称して“貸手”)として改訂された信用協定(“2021信用協定”)を締結し、定期融資手配が$を超えないことを規定した
2021年の信用協定に従って支払われる前払いは、会社が選択するSOFRローンまたはABRローンであってもよい
2021年信用協定は、当社が四半期ごとに同等の分割払いを支払うことを要求している:(A)2021年9月30日から2022年6月30日まで(この日を含む)、$
当社は、2026年8月6日(“循環終了日”)までの四半期毎の第1日とサイクル終了日までの四半期毎の初日に、当社が利用可能な資金を使用していない費用(“承諾料”)を支払わなければなりません。承諾料率は
会社が記録した債務発行コストと関連費用は#ドルです
2022年12月31日と2021年12月31日まで、会社は未返済の借金がありますf $
2022年12月31日まで、2021年の信用協定の将来の支払いは以下の通り12月31日までの電子例年:
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
合計する |
|
$ |
|
F-20
2019年信用協定
2019年3月に、当社、その付属会社及びSVB及びその他の数名の貸手が改訂された信用協定(“2019年信用協定”)を締結し、#元の金額の定期融資を提供します
2021年8月、2021年の信用協定を締結する際、会社は総額#ドルを支払いました
13.株主権益
A類普通株式発行済株式は2022年12月31日現在
A類普通株の1株当たり保有者に権利を持たせる
2022年12月31日及び2021年12月31日に、当社は以下のA類普通株を予約しますKの未来の発行:
|
|
12月 31, |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
発行済みオプションのために予約した株式 |
|
|
|
|
|
|
||
発行された制限株式単位のために発行された株式を保留する |
|
|
|
|
|
|
||
将来付与のために発行された株式を保留する |
|
|
|
|
|
|
||
将来のために保有する法定普通株式総株式 発行する. |
|
|
|
|
|
|
||
2020年に販売を請け負う公開発行
当社は2020年11月に公開発行を完了しました(“2020年貸切公開”)
14.株式ベースの報酬
株式インセンティブ計画--2018年計画
2018年11月28日、会社取締役会が採択され、2018年12月10日に、会社株主は“組織生成2018株式とインセンティブ計画”(“2018計画”)を承認した。“2018年計画”は、会社従業員、高級管理者、取締役及びその他のキーパーソン(コンサルタントを含む)に長期的な激励と奨励を提供し、必要な経験と能力を備えた人員を吸引し、維持し、これらの従業員、高級管理者、取締役及びその他の肝心な人員の利益と会社株主の利益をより緊密に結合させることを目的としている。
F-21
2018年計画“認可会社取締役会または2人以上の独立取締役からなる委員会(いずれの場合も、”管理人“)は、非法定株式オプション、奨励株式オプション、制限株式報酬、制限株式単位、株式付加権、非限定株式報酬、業績株式報酬、および配当等価権のタイプの奨励を付与する。2018年は会社の取締役会が管理する予定です。
2018年計画を採択した際には
株式インセンティブ計画--2003年計画
“2003年度株式インセンティブ計画”(以下、“2003計画”と略す)は、当社は制限株式奨励を発行することができ、または奨励的株式オプションまたは非法定株式オプションを付与することができると規定している。奨励株式オプションは会社員にしか与えられない。制限株式奨励および非法定株式オプションは、会社の従業員、取締役会メンバー、外部コンサルタント、およびコンサルタントに付与することができる。
2018年12月10日から、2003計画に従って追加的な報酬を与えることはできないので、(I)2003計画に従って満了または終了したが、完全に行使されていない株式オプションに関連する任意の株式は、将来の報酬に使用することができない、(Ii)会社によって没収または他の方法で買い戻された限定的な株式に関連する任意の株式は、将来の報酬に使用することができず、(Iii)参加者が報酬を行使するために当社に提出する任意のA類普通株は、将来の報酬に使用することができない。
株に基づく報酬費用
株式インセンティブ計画に基づいて付与された株式オプションが満期になる
当社は、2022年12月31日、2021年12月31日および2020年12月31日までに、株式ベースの報酬支出を記録しました$
制限株式単位(RSU)
2022年12月31日までの年間で、当社は授与します
制限株式単位の活動を以下のように規定する
|
|
|
|
|
重みをつける |
|
||
|
|
|
|
|
平均値 |
|
||
|
|
番号をつける |
|
|
授与日 |
|
||
|
|
の株 |
|
|
公正価値 |
|
||
2021年12月31日に帰属していません |
|
|
|
|
$ |
|
||
授与する |
|
|
|
|
|
|
||
既得 |
|
|
( |
) |
|
|
|
|
取消·没収 |
|
|
( |
) |
|
|
|
|
2022年12月31日に帰属していない |
|
|
|
|
$ |
|
||
2022年12月31日現在、帰属が予想される未帰属制限株式単位に関する未確認補償コスト総額は$である
F-22
株式オプション
2022年12月31日まで及び2021年12月31日までに年度内に授受される株式オプションは
|
|
|
|
|
|
現在までの年度 |
|
|||||
|
|
|
|
|
|
十二月三十一日 |
|
|||||
|
|
|
|
|
|
2022 |
|
|
2021 |
|
||
|
|
|
|
|
|
|
|
|
|
|
||
無リスク金利 |
|
|
|
|
|
|
% |
|
|
% |
||
予想期限(年単位) |
|
|
|
|
|
|
|
|
|
|
||
予想変動率 |
|
|
|
|
|
|
% |
|
|
% |
||
期待配当収益率 |
|
|
|
|
|
|
% |
|
|
% |
||
行権価格 |
|
|
|
|
|
$ |
|
|
$ |
|
||
対象株式価格 |
|
|
|
|
|
$ |
|
|
$ |
|
||
これらの仮定は、2022年12月31日と2021年12月31日までの年間に付与された1株当たりオプションの推定加重平均付与日公正価値を$とする
次の表は、会社の2021年12月31日以来の株式オプション活動をまとめています
|
|
|
|
|
|
|
|
重みをつける |
|
|
|
|
||||
|
|
|
|
|
重みをつける |
|
|
平均値 |
|
|
|
|
||||
|
|
|
|
|
平均値 |
|
|
残り |
|
|
骨材 |
|
||||
|
|
量 |
|
|
トレーニングをする |
|
|
契約書 |
|
|
固有の |
|
||||
|
|
株 |
|
|
値段 |
|
|
用語.用語 |
|
|
価値がある |
|
||||
|
|
|
|
|
|
|
|
(単位:年) |
|
|
|
|
||||
2021年12月31日現在の未返済債務 |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
授与する |
|
|
|
|
|
|
|
|
|
|
|
|
||||
鍛えられた |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
取消·没収 |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|||
2022年12月31日現在の未返済債務 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日までに行使可能なオプション |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2022年12月31日現在の帰属または予想帰属のオプション |
|
|
|
|
$ |
|
|
|
|
|
|
|
||||
行権価格が会社A類普通株公正価値より低い株式オプションについては、株式オプションの総内在価値は、株式オプションの行権価格と会社A類普通株公正価値との差額として計算される。
二零二二年十二月三十一日及び二零二一年十二月三十一日までの年間帰属のオプション総公平価値は
2022年12月31日現在、未確認株式報酬支出総額は$
2010年から2013年までの間に元幹部が数枚の部分請求権手形を手に入れました総額は$です
F-23
15.所得税
2022年12月31日、2021年12月31日、2020年12月31日までの年度における所得税支出(福祉)の構成は以下のとおりである
|
|
十二月三十一日までの年度 |
|
||||||||||||
|
|
2022 |
|
|
|
|
2021 |
|
|
|
2020 |
|
|||
所得税費用(福祉): |
|
|
|
|
|
|
|
|
|
|
|
|
|||
当期税金(福祉) |
|
|
|
|
|
|
|
|
|
|
|
|
|||
連邦制 |
|
$ |
|
|
|
|
$ |
- |
|
|
|
$ |
( |
) |
|
状態.状態 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
外国.外国 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|
||
当期税費総額 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
繰延税支出 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
連邦制 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|
||
状態.状態 |
|
|
( |
) |
|
|
|
|
( |
) |
|
|
|
- |
|
外国.外国 |
|
|
- |
|
|
|
|
|
- |
|
|
|
|
|
|
繰延税金(福祉)合計 |
|
|
|
|
|
|
|
( |
) |
|
|
|
|
||
所得税支出(福祉)合計 |
|
$ |
|
|
|
|
$ |
( |
) |
|
|
$ |
|
||
当社は定期的に繰延税金資産の評価を見直し、正負の証拠をトレードオフして繰延税金資産の回収可能性を評価する。2021年度第4四半期に、当社は推定手当を評価し、2021年12月31日までの3年度の顕著な累積総合収入、収入増加および将来の収益力への期待、および経済環境の負の変化の影響、業務中の重大なリスクと不確実性、および特定の州司法管轄区の税収損失利用の制限を含む負の証拠を考慮した。プラスの証拠とマイナスの証拠を評価した後、当社はその繰延税金資産が将来的に現金になる可能性が高いと考え、2021年12月31日にその繰延税金項目の純資産の推定免税額を公表し、得られた所得税収益は$である
2022年12月31日現在、会社は将来年度の連邦課税所得額、純営業損失繰越額を約$削減するために利用可能です
繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する
|
|
十二月三十一日 |
|
|||||||
|
|
2022 |
|
|
|
|
2021 |
|
||
純営業損失が繰り越す |
|
|
|
|
|
|
|
|
||
連邦制 |
|
$ |
|
|
|
|
$ |
|
||
状態.状態 |
|
|
|
|
|
|
|
|
||
外国.外国 |
|
|
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
|
|
||
資本化R&D |
|
|
|
|
|
|
|
- |
|
|
株に基づく報酬 |
|
|
|
|
|
|
|
|
||
融資リース |
|
|
|
|
|
|
|
|
||
賃貸借契約を経営する |
|
|
|
|
|
|
|
|
||
固定資産 |
|
|
|
|
|
|
|
|
||
減価前繰延税金資産純資産 |
|
|
|
|
|
|
|
|
||
推定免税額 |
|
|
- |
|
|
|
|
|
- |
|
ROU資産 |
|
|
( |
) |
|
|
|
|
( |
) |
無形資産 |
|
|
( |
) |
|
|
|
|
( |
) |
繰延税項目純資産 |
|
$ |
|
|
|
|
$ |
|
||
F-24
同社はスイスの子会社で約#ドルの繰延税金資産を持っている
“国税法”の定義によると、所有権変更は毎年未来の課税収入を相殺するために使用できる純営業損失と研究開発税収の繰越免除金額を制限する可能性がある。その後の所有権変更は今後数年間の制限にさらに影響を及ぼすかもしれない。同社は2021年に分析を完了し、2001年から2021年までの間に所有権変更が発生していないことを決定した。
米国連邦法定所得税税率で計算される期待所得税間の差
|
|
十二月三十一日 |
||||||||||||||
|
|
2022 |
|
|
2021 |
|
2020 |
|
|
|||||||
アメリカ連邦法定所得税率 |
|
|
|
% |
|
|
|
|
% |
|
|
|
% |
|||
連邦評価免税額 |
|
|
- |
|
% |
|
|
|
( |
) |
% |
|
|
( |
) |
% |
国家評価免税額 |
|
|
- |
|
% |
|
|
|
( |
) |
% |
|
|
( |
) |
% |
回復準備と他の調整 |
|
|
( |
) |
% |
|
|
|
- |
|
|
|
|
- |
|
|
前期修正 |
|
|
( |
) |
% |
|
|
|
- |
|
|
|
|
- |
|
|
州と地方所得税 |
|
|
|
% |
|
|
|
|
% |
|
|
|
% |
|||
差し引かれない費用 |
|
|
|
% |
|
|
|
|
% |
|
|
|
% |
|||
役員報酬は162(M)に制限 |
|
|
|
% |
|
|
|
- |
|
|
|
|
- |
|
|
|
外貨利回り |
|
|
|
% |
|
|
|
- |
|
|
|
|
- |
|
|
|
不確定税収準備金 |
|
|
|
% |
|
|
|
|
% |
|
|
|
% |
|||
研究開発単位 |
|
|
|
% |
|
|
|
|
% |
|
|
|
% |
|||
有効所得税率 |
|
|
|
% |
|
|
|
( |
) |
% |
|
|
|
% |
||
当社は税務機関が税務状況の技術的利点に基づいて審査を行った後に税務状況を維持する可能性がある場合にのみ、不確定な税務状況による税務利益を確認します
以下は、同社の所得税が負債の不確定要因を計上している前転表である
|
|
十二月三十一日までの年度 |
|
||||||||||||
|
|
2022 |
|
|
|
|
2021 |
|
|
|
2020 |
|
|||
年初の総残高 |
|
$ |
|
|
|
|
$ |
|
|
|
$ |
|
|||
当期に係る納税状況に基づいて計算される増加額 |
|
|
|
|
|
|
|
|
|
|
|
|
|||
先日の減税状況 |
|
|
( |
) |
|
|
|
|
( |
) |
|
|
|
( |
) |
年末の総括余り |
|
$ |
|
|
|
|
$ |
|
|
|
$ |
|
|||
同社はアメリカ連邦と州司法管轄区およびスイスで所得税申告書を提出した。限られた例外を除いて、会社は2018年12月31日までの数年間、連邦、州、地方、または外国の検査を受けなくなった。しかしながら、2018年12月31日までに生成された繰越属性は、すでにまたは将来の間に使用される場合、州または地方税務機関の審査後に調整することができる。
当社は税務支出の中で利息と罰金に関する費用を確認します。$
16.収入1株当たり損失(EPS)
基本的な1株当たり収益の算出方法は,純収益(損失)をその期間の加重平均流通株数で割ることである。1株当たり利益を希釈する計算方法は,純収益(損失)を加重平均流通株数で割って希釈効果を加えることである
F-25
未確認の補償費用を追加収益として考慮することを含む、在庫株方法を用いた未償還持分奨励。
A類普通株株主の基本と希釈後の純収益(損失)を計算する際に用いる分子と分母の台帳Sは以下のとおりである
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
分子: |
|
|
|
|
|
|
|
|
|
|||
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
分母: |
|
|
|
|
|
|
|
|
|
|||
加重平均発行済み普通株式-基本 |
|
|
|
|
|
|
|
|
|
|||
制限株式単位の希釈効果 |
|
|
|
|
|
|
|
|
|
|||
オプションの希釈効果 |
|
|
|
|
|
|
|
|
|
|||
加重平均発行普通株式-希釈 |
|
|
|
|
|
|
|
|
|
|||
1株当たりの収益-基本 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
希釈して1株当たり収益する |
|
$ |
|
|
$ |
|
|
$ |
|
|||
2022年12月31日、2021年12月31日、2020年12月31日までの年度、株式による未償還奨励
17.賃貸証書
同社のレンタルには主に不動産、設備、車両レンタルが含まれている。
会社はキャンセルできないレンタル契約に基づいて事務、実験室、倉庫と生産空間をレンタルし、レンタル期間は2035年まで、会社によっていくつかのレンタル契約を終了または更新して増加することを選択します至れり尽くせり
同社は経営に基づいてある従業員のために車両をレンタルし、これらの車両のサービスについてチームサービス協定を締結した。新しいレンタカー1台あたりの最低レンタル期間は
当社はレンタル開始時に1つの手配がレンタルかどうかを決定します。当社が選択権を行使すると合理的に判断した場合、賃貸契約の延長または終了の選択権は賃貸条項に含まれます。経営リース総合貸借対照表に計上されている経営リース、使用権資産、経営リース負債。融資リース使用権資産を物件及び設備純額に計上し、関連負債を総合貸借対照表の融資リース負債に計上する。
使用権資産代表会社がリース期間内に対象資産を使用する権利は、リース負債代表会社がリースにより発生したリース金を支払う義務を有する。使用権資産及びリース負債は開始日レンタル期間内に固定リース支払いの現在値を確認します。使用権資産は、有効日または前に発生した任意の初期直接コストおよび支払いされたリース金をさらに含み、リースインセンティブによって減少する。当社は逓増借款金利を割引率とし、いつでも割引率を割り引くことができる借款のリース支払い現在値を特定していない。同社の逓増借款金利とは、類似した経済環境下で、類似した期限及び金額内で、担保に基づいて借金しなければならない金利をいう。当社は、当社の信用格付けに対応した信用リスクプレミアムで無リスク金利を調整し、そのレンタルの逓増借款金利を決定します。
当社はレンタル開始日からレンタル期間終了まで、レンタル経営のレンタル料金を直線法で記録しています。当社は、上記割引率に応じて融資リースコストを使用権資産の減価償却費用と未償還賃貸負債の利息費用との組み合わせに計上している。可変レンタル支払いは主にオフィスとチームレンタルと関連があり、税金、保険、公共エリアのメンテナンス、レンタル車両のメンテナンス計画を含むが、これらに限定されない。可変リース支払いは、発生または使用状況に応じて決定される;したがって、初期使用権資産および負債計算には含まれない。
二零一三年一月一日、当社はDan Road SPE、LLC、85 Dan Road Associates、LLC、Dan Road Equity I、LLC及び275 Dan Road SPE、LLCと融資リース手配を締結し、マサチューセッツ州カントン市にあるオフィスと実験室を借りた。65 Dan Road SPE,LLC,85 Dan Road Associates,LLC,Dan Road Equity I,LLCおよび275 Dan Road SPE,LLCは関連側であり,これらのエンティティの所有者も当社の取締役,元取締役および/または株主であるためである.2021年8月、会社は丹路275号SPE、LLCと賃貸借契約を締結し、同ビル(“丹路275号ビル”)を購入し、価格は1ドルだった
F-26
二零二一年八月に終了し、残りの三部の賃貸契約は二零二年十二月三十一日に終了し、各賃貸契約には五年間の継続選択権があり、家賃は(I)前の年の最後の年の賃貸料或いは(Ii)当時の公平な市価の中で大きい者である。当社は2021年11月に選択権を行使し、レンタル契約をさらに5年間延長します。継続市場賃貸料の最適な推定に基づいて賃貸資産および負債を再計量し、ASC 842-10-25-1に基づいてこれらの賃貸の分類を再評価するレンタル分類そのため、これらのレンタルは融資リースから経営リースに再分類されます. 関連融資リース資産負債は、2021年12月31日現在、合併貸借対照表において経営性賃貸使用権資産と経営性賃貸負債に再分類されている。2022年12月、会社と所有者は最終的にこれらの物件の継続した時価賃貸料を決定し、#ドルを追加増加させた
当社は上記賃貸借契約項の下に計上すべきが未払いの賃貸責任を負っており、詳細は以下のとおりである。2019年4月1日から、当社は2019年の信用協定項で受け取った金利に基づいて計上することに同意しましたが、賃貸債務の利息を払っていません。2021年8月に丹路275号ビルを購入したことについて、会社は支払いました
未払い賃貸債務及び関連利息当算筋萎縮性側索硬化症を以下に示す。
|
|
十二月三十一日 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
延滞賃貸料の主な部分 |
|
$ |
|
|
$ |
|
||
未支払いの運営と公共エリアのメンテナンス費用 |
|
|
- |
|
|
|
|
|
未払い賃貸債務総額 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
未払い賃貸債務の応算利息 |
|
$ |
|
|
$ |
|
||
延滞賃貸料の元本部分は経営賃貸債務の短期部分に計上されているが、丹路275号ビルに関する残高は2022年12月31日と2021年12月31日までの連結貸借対照表の課税費用とその他の流動負債に含まれている。2022年12月31日及び2021年12月31日現在、未支払業務及び公共地域維持費用及び未払いであっても支払われていないリース債務の計上利息は、合併貸借対照表の課税費用及びその他の流動負債に計上される。
レンタルcosの構成要件具体的には以下のとおりである
|
|
分類する |
|
|
現在までの年度 |
|
|
現在までの年度 |
|
||
融資リース |
|
|
|
|
|
|
|
|
|
||
使用権資産の償却 |
|
歯車とSG&A |
|
|
$ |
|
|
$ |
|
||
賃貸負債利息 |
|
利子支出 |
|
|
|
|
|
|
|
||
融資リース総コスト |
|
|
|
|
|
|
|
|
|
||
リースコストを経営する |
|
歯車、研究開発、SG&A |
|
|
|
|
|
|
|
||
短期賃貸コスト |
|
歯車、研究開発、SG&A |
|
|
|
|
|
|
|
||
可変リースコスト |
|
歯車、研究開発、SG&A |
|
|
|
|
|
|
|
||
総賃貸コスト |
|
|
|
|
$ |
|
|
$ |
|
||
補足貸借対照表情報r融資リースの興味は以下の通りである
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
財産と設備、毛額 |
|
$ |
|
|
$ |
|
||
減価償却累計 |
|
|
( |
) |
|
|
( |
) |
|
$ |
- |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
|
$ |
- |
|
|
$ |
|
||
融資リース長期債務 |
|
|
- |
|
|
|
- |
|
融資リース負債総額 |
|
$ |
- |
|
|
$ |
|
|
F-27
関連補足キャッシュフロー情報Dから賃貸借契約までの条項は以下のとおりである
|
|
現在までの年度 |
|
|
現在までの年度 |
|
||
賃貸負債に含まれる金額を計量するために支払う現金: |
|
|
|
|
|
|
||
レンタル経営キャッシュフロー |
|
$ |
|
|
$ |
|
||
融資リースの運営キャッシュフロー |
|
$ |
|
|
$ |
|
||
融資リースのキャッシュフロー融資 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
賃貸義務と引き換えに使用権資産 |
|
|
|
|
|
|
||
賃貸借契約を経営する |
|
$ |
|
|
$ |
|
||
融資リース |
|
$ |
- |
|
|
$ |
- |
|
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
加重平均残余レンタル期間 |
|
|
|
|
|
|
||
融資リース |
|
|
- |
|
|
|
|
|
賃貸借契約を経営する |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
||
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
加重平均割引率 |
|
|
|
|
|
|
||
融資リース |
|
|
- |
|
|
|
% |
|
賃貸借契約を経営する |
|
|
% |
|
|
% |
||
2022年12月31日まで、満期日賃貸負債の割合は以下の通り
|
|
賃貸借契約を経営する |
|
|
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
その後… |
|
|
|
|
賃貸支払総額 |
|
|
|
|
差し引く:利息 |
|
|
( |
) |
リース総負債 |
|
$ |
|
|
18.支払いの引受およびまたは事項
印税
同社はある大学とライセンス契約を締結し、その先進的な傷ケア製品の開発、使用、生産に関連するいくつかの特許権を取得した。この協定によると、同社は製品の純売上高のパーセンテージに基づいて、2006年11月の特許満了前にこれらの特許を使用して特許使用料を生成した。課税総額は#ドルです
2017年10月、当社は第三者とライセンス契約を締結しました。ライセンス契約によると、同社は2017年12月31日以降から2026年10月までの関連特許満了時のライセンス製品の純売上高の一定割合に基づいてライセンス使用料を支払わなければならないが、最低ライセンス使用料支払い条項を遵守しなければならない。同社が記録した特許使用料料金は#ドルです
F-28
NuTech Medical買収の一部として、同社は、特定の製品の一定期間の純売上のパーセンテージに基づいて支払われる継続的なコンサルティングサービスおよび特許使用料のための特定の製品開発およびコンサルティングプロトコルを継承する
法律事務
その活動を行う際には、当社は時々様々なクレームを受け、他社に対するクレームもあります。経営陣は、このようなクレームを最終的に解決することは、会社の財務状況、経営業績、あるいはキャッシュフローに実質的な影響を与えないと考えている。対応金額が可能で推定可能な場合、会社はこれらのクレームに応じています。その会社は$を計算すべきだ
2017年に買収されたNuTech Medicalの購入価格には$が含まれています
19.関連するパーティ取引
連営会社への賃貸義務には、計上されているが未払いの賃貸義務、連合会社との融資リースによる資産購入および連合会社との賃貸借契約の更新が含まれており、付記“17.リース”でさらに説明されている。
2010年、会社取締役会は、会社が3人の役員に融資(“雇用主融資”)を許可し、(I)流動資金(“流動性融資”)を提供し、(Ii)既存株式オプション(“オプション融資”)を行使するための資金を提供する融資計画を承認した。そのうち2人の幹部は2014年に会社を出た。雇用主ローンが満期になり、すべての元金と受取利息は各テーマローンが発行された日から10周年で満期になります。雇用主ローンの金利は違います
20.従業員福祉計画
会社はアメリカ人従業員のために401(K)貯蓄計画(“計画”)を維持した。この計画によれば、条件を満たす従業員は、法定制限の下で、その賃金の百分率で当該計画に資金を供給することができる。当社の出資は取締役会が適宜決定し、直ちに帰属します。会社は2022年12月31日,2021年12月31日,2020年12月31日までの年間で雇用主に$を納付した
二十一後続事件
米国証券取引委員会に本年度報告Form 10−Kを提出したところ,会社は後続事件を評価した。
2023年2月3日、会社はマクロ経済情勢に応じて減員を発表した。リストラで会社の従業員が減少した
F-29
2023年第1四半期にハース
本年度報告書Form 10−Kを提出する際には,会社の製品は2023年1月1日に発効した“インフラ投資·雇用法案”と税還付義務に制約されている。したがって,Apligraf,Dermagraft(市販時),PuraPly製品,および可能な他の製品については,使い捨て製品の一定率以上の製品が患者に使用され提供者に廃棄されていない場合,会社は連邦政府にリベートを支払う可能性がある。
F-30