カタログ表
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1) |
|
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
|
本財政年度末まで |
|
|
|
あるいは…。 |
|
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
|
|
|
そこからの過渡期について |
|
依頼文書番号
(登録者の正確な氏名はその定款に記載)
|
|
|
|
|
|
登録者の電話番号は市外局番を含んでいます(
クラスごとのタイトル |
|
取引コード |
|
登録された各取引所の名称 |
|
|
♪the the the |
ACT第12(G)条により登録された証券:ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい。☐
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速ファイルサーバ,加速ファイルサーバか非加速ファイルサーバかをチェックマークで示す.取引法12 b-2規則における“加速ファイルサーバおよび大型加速ファイルサーバ”の定義を参照してください
|
|
|
|
加速ファイルサーバ☐ |
非加速ファイルサーバ☐ |
規模の小さい報告会社 |
|
|
|
|
新興成長型会社 |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12条(B)に基づいて登録されている場合は,登録者の財務諸表が以前に発表された財務諸表の誤り訂正を反映しているか否かを示すチェックマークを適用する
これらのエラーのより真ん中に登録者の任意のエンタルピーCER幹部が相関回復期間内に§240.10 D−1(B)に基づいて受信したインセンティブベースの補償に基づいて回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです
登録者の非関連会社が保有する投票権と無投票権普通株の総時価は、登録者の普通株2022年6月30日のナスダック世界精選市場での終値に基づいているはい$です
2023年2月14日いくつありますか
引用で編入された書類
登録者最終委託書の特定部分は,登録者2023年株主総会とともに発表され,登録者が2022年12月31日までの財政年度後120日以内に提出される予定である本年度報告第III部に引用して組み込む。引用によって登録者の委託書に明示的に組み込まれていない限り、登録者の委託書は、本10−K年度報告の一部とみなされてはならない。
カタログ表
INNOVIVA,Inc.
2022年Form 10-K年次報告
カタログ表
|
|
ページ |
|
第1部 |
|
第1項。 |
業務.業務 |
4 |
第1 A項。 |
リスク要因 |
33 |
項目1 B。 |
未解決従業員意見 |
69 |
第二項です。 |
属性 |
69 |
第三項です。 |
法律訴訟 |
69 |
第四項です。 |
炭鉱安全情報開示 |
69 |
|
第II部 |
|
五番目です。 |
登録者普通株,関連株主事項及び発行者が株式証券を購入する市場 |
70 |
第六項です。 |
[保留されている] |
71 |
第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
72 |
第七A項。 |
市場リスクの定量的·定性的開示について |
84 |
第八項です。 |
財務諸表と補足データ |
85 |
第九項です。 |
会計と財務情報開示の変更と相違 |
134 |
第9条。 |
制御とプログラム |
134 |
プロジェクト9 B。 |
その他の情報 |
137 |
プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
137 |
|
第三部 |
|
第10項。 |
役員·幹部と会社の管理 |
138 |
第十一項。 |
役員報酬 |
138 |
第十二項。 |
特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
138 |
十三項。 |
特定の関係や関連取引、取締役の独立性 |
138 |
14項です。 |
チーフ会計士費用とサービス |
138 |
|
第4部 |
|
第十五項。 |
展示品と財務諸表の付表 |
139 |
第十六項。 |
表格10-Kの概要 |
139 |
陳列品 |
140 |
|
サイン |
143 |
|
2
カタログ表
前向き陳述に関する特別説明
本年度報告における10-K表は、1933年証券法(改正)第27 A節及び1934年証券取引法(“証券法”)第21 E節の意味に適合する前向き陳述を含む。このような展望的陳述は重大な危険、不確定要素、そして仮定と関連がある。本年度報告では、歴史的事実に関する陳述を除いて、本年度報告におけるすべての陳述は、我々の戦略、将来の運営、将来の財務状況、将来の収入、予想コスト、見通し、計画、意図、期待、目標、および目的に関する陳述を含むが、これらに限定されず、前向きな陳述である可能性がある。“予想”、“信じる”、“可能”、“設計”、“推定”、“予想”、“目標”、“意図”、“可能”、“目標”、“計画”、“プロジェクト”、“追求”、“将”、“将”、および同様の表現(その否定を含む)は、これらの識別語を含む前向き表現を識別することを目的としている。私たちは私たちが展望的陳述で開示した計画、意図、期待、または目標を実際に実現できないかもしれないが、私たちの展望的陳述の背後にある仮説は正しくないことが証明されるかもしれない。したがって、あなたは私たちの展望的な陳述に過度に依存してはいけない。実際の結果またはイベントは、私たちが前向きな陳述で開示した計画、意図、期待、および目標とは大きく異なるかもしれない。私たちまたは私たちを代表する誰のためのすべての書面と口頭前向き声明は、本節で掲載または言及された警告声明によって明確に制限されている。
我々は、GSKと協力した呼吸システム製品の将来の特許使用料収入が予想よりも低い、Relvarの商業化のリスクを含むが、実際の結果または事件が前向き陳述と大きく異なる重要な要素をもたらす可能性があると考えられる®/Breo® エリプタ®Anoro® エリプタ®、GIAPREZA®XERAVAと®これらの製品が承認された司法管轄区域内で、会社の戦略、計画と目標(会社の成長戦略と企業発展の措置を含む)、潜在的な株主への資本返還の時間、方式と金額、臨床研究、データ分析と結果交流の状況とタイミング、候補製品の潜在的な利益と行動メカニズム、開発と商業化による候補製品への期待、規制部門が候補製品を承認する時間、収入、費用およびその他の財務項目の予測、新型コロナウイルス(“新冠肺炎”)の影響;資本導入の時間、方式及び金額は、株主の潜在的資本リターン;会社の成長戦略及びリスクに関連するリスク、第I部“経営層の財務状況及び経営結果の検討及び分析”第I部第1 A項“経営層の財務状況及び経営結果の検討及び分析”で議論されたリスク、及び本10−K年次報告における他の場所で議論されたリスクを含む。本10−K年度報告における展望的記述は、本新聞稿の発表日までの現在の予想に基づいて、法的要件がない限り、新たな情報、未来の事件又はその他の理由で前向き表現を更新する義務を負わない。
当社の10-K年度報告書に含まれる経営陣の財務状況および経営結果の議論と分析、および私たちの総合財務諸表を読むことを奨励します。また、当社の業務に関連するリスクおよび不確実性要因のより包括的な議論を含む“リスク要因”と題する本10-K年度報告書第I部の第1 A項目を読むことを奨励します。上記および本報告第1 A項のリスクに加えて、他の未知または予測不可能な要因も我々の結果に影響を与える可能性がある。したがって、本報告書の情報は、Form 10−QおよびForm 8−Kで提出された報告および文書を含む、米国証券取引委員会(“米国証券取引委員会”)に時々提出された他の報告および文書と共に読まれなければならず、これらのリスク要因を補完、修正、置換、または更新する可能性がある。このような要素のせいで、私たちはこの報告書の展望的な陳述が正確であることが証明されることを保証することができない。しかも、もし私たちの展望的な陳述が不正確であることが証明されたら、この不正確さは実質的である可能性がある。このような展望的陳述の重大な不確実性を考慮して、あなたはこれらの陳述を私たちまたは任意の特定の時間枠内で、または私たちの目標と計画の陳述または保証を完全に達成しないために、私たちまたは他の誰もと見なしてはならない。
3
カタログ表
第1部
プロジェクト1.ビジネス
概要
Innova,Inc.(“Innova”,“会社”,“登録者”または“私たち”などの類似した代名詞)は,特許権使用料と他の医療資産との組み合わせを持つ多様な持株会社である。特許使用料の組み合わせには、Relvarを含むグラクソ·スミスクグループ株式会社(GSK)と協力した呼吸資産が含まれています®/Breo®エリプタ®(フランフルチカゾン/ヴィランテロール、“Ff/VI”)およびAnoro®エリプタ®(臭化ウラン/ヴィランテロ、“UMEC/VI”)。長期的に発効したBeta 2 Agonist(“LABA”)協力協定によると,InnovaはGSKからRelvarを販売する印税を取得する権利がある®/Breo®エリプタ®具体的には,世界の年間純売上高前30億ドルの15%,世界の純売上高が30億ドルを超える全年度純売上高の5%,Anoro販売の特許権使用料®エリプタ®6.5%から10%の範囲で上昇しています最初に我々と締結したプロトコルにより,InnovivaはGSKが支払う特許権使用料の15%を得る権利があり,その後TRELEGYを含むTheravance Respiratory Company,LLC(TRC)に割り当てられる®エリプタ®Relvar以外のTRCに割り当てられる、グラクソ·スミスクラインとのLABA協力プロトコルおよび戦略連盟プロトコル(ここではGSKプロトコルと呼ばれる)に従って、将来発見または開発される可能性のある任意の他の製品または製品の組み合わせに基づいて、これらの製品または製品の組み合わせがRelvar以外のTRCに割り当てられる®/Breo®エリプタ®アーノロと®エリプタ®それは.私たちは2022年7月20日にTRCでの15%の所有権を売却し、TRELEGYの販売によって印税を得る権利がなくなりました®エリプタ®製品です。
我々は,2022年7月11日にentsis Treateutics Holdings Inc.の買収と2022年8月22日にLa Jolla製薬会社(La Jolla)を買収することにより,特許使用料と革新医療資産の組み合わせを拡大した。私たちのビジネスとマーケティング製品にはGIAPREZAが含まれています®(アンジオテンシンII)、米国で承認(“米国”)敗血症や他の分布性ショックを有する成人で血圧を上げ,XERAVAを行う®(エラバサイクリン)成人の複雑な腹内感染の治療のために米国で許可された。我々が開発している薬剤には,我々の主要資産であるシュバタン−ドゥロバタン(“Sul−dur”)のような細菌感染を治療する薬剤が含まれている。
私たちの本社はカリフォルニア州バーリングリム旧湾ショッキング次元金属加工一三五零四号室にあります。郵便番号:九四0零十です。同社は1996年11月にデラウェア州に設立され,名称はAdvanced Medicine,Inc.であり,1997年5月に運営を開始した。その後2002年4月にTheravance,Inc.と改称された。2014年6月、私たちは研究開発業務を剥離した。2016年1月私たちはInnoviva,Inc.と改名しました
私たちの戦略
私たちの会社戦略は現在、GSKと協力している私たちの呼吸資産の潜在的価値を最大化し、私たちの運営を最適化し、資本構成を増加させることを含む株主価値の増加に集中しています。医療業界に有望な会社や資産の日和見買収を積極的に求め、資本収益を向上させることで、特許権使用料管理業務を多様化していきたい。特に、私たちは最近entsisとLa Jollaを買収し、強力な病院と感染症プラットフォームを作りました。
私たちの印税製品の組み合わせ
私たちとグラクソ·スミスクラインとの関係は
LABA連携
2002年11月、著者らはグラクソ·スミスクラインとLABA協力協定を締結し、慢性閉塞性肺疾患(COPD)と喘息を毎日1回治療する製品を開発と商業化した。その協力は3つの組み合わせ製品を開発しており、その中の2つはまだ権利を維持している。この2つの規定は以下のとおりである
4
カタログ表
Relvarの起動と承認のため®/Breo®エリプタ®アーノロと®エリプタ®米国,日本,ヨーロッパでは,LABA協力協定により,2014年12月31日までの1年間にGSKに合計2.2億ドルの記念碑的費用を支払った。グラクソ·スミスクラインに支払われた記念碑的費用は、支払われた資本化費用として確認され、これらの費用は製品商業発売後の推定使用寿命内に償却される。
競争
Relvarを予想しています®/Breo®エリプタ®(FF/VI)とAnoro®エリプタ®(UMEC/VI)喘息および慢性閉塞性肺疾患を治療するために開発されている候補薬剤を含む、いくつかの承認された気管支拡張剤薬剤と単独または組み合わせて競合するであろう。これらの措置には限定されるものではない
5
カタログ表
また,いくつかの会社はAdvair/Seretie(サルメテロール/プロピオン酸フルチカゾン)とSymbiort(フマル酸フォモトロー/ブデソニド)の新製剤を開発しており,グラクソ·スミスクラインやアスリコンの既存製品に対して,それぞれ後発薬やブランド模造薬として発売されている可能性がある。このようなすべての努力は私たちが協力するどの製品にも潜在的な競争だ。FDAがそれぞれ2013年末と2015年にAdvairとSymbiortの完全代替バージョンを承認する指導草案を発表した後、努力が強化された。これらの製品の現在の例は、Teva(後発薬)のDuoResp/BiResp、SandozのAirFluSal Forspiro、ElpensのRolenne、MylanのSirdua(すべての模造バージョンのSeretie)を含み、これらの製品はEUの多くの国で買うことができる。多くの会社はICS/LABA薬Advairの後発薬を市場に出している®ある特許がAdvairをカバーしているため®交付設備は2016年に満期になった。2017年3月、Mylan N.V.は、プロピオン酸フルチカゾン100、250、500マイクログラムおよびサルメテロール50マイクログラム吸入粉末のための簡略化新薬申請(ANDA)に関するFDAの完全な返信を受けた。2017年5月,Hikmaはプロピオン酸フルチカゾンとサルメテロール吸入粉に関するFDAの完全返信を受信したことを発表し,2018年2月,ノバはその後発薬部門Sandozが第3種プロピオン酸フルチカゾンとサルメテロール製品に対するFDAのANDAの完全返信を受信したと発表した。2019年1月、MylanはFDAがAdvair Diskusの最初の疑似製薬WixelaInhu(プロピオン酸フルチカゾンとサメテロール吸入粉、USP)を承認したと発表した®Sandozは後発薬Advairの開発を中止した。TevaはFDAが青少年と成人喘息患者のための2つの製品を承認し,そのうちの1つはAirDuoRespiClickであると発表した®(プロピオン酸フルチカゾンおよびサルメテロール吸入粉)、Advairの非AB代替後発薬®それは.Ciplaは2020年5月にAdvairの模造バージョンの承認をFDAに申請した®それは.Hikmaは2021年4月にAdvair Diskusの汎用バージョンを発売した®2020年1月、アストラ·ジェリコンは米国で模造版をライセンスした試合必佳を発売した。2021年8月ルーピンはLuforbecを発売しました®フォスターのブランド模造薬代替品は、選定されたヨーロッパ市場にある。
一般的に、FDAの2013年9月の指導文書草案によると、これらのメーカーはAdvairと等価であることを証明するために、一連の臨床治療効果、薬物動態学と設備研究を行うことを要求されている。これらの研究は、模倣薬とブランド製品が同じ活性成分、剤形、強度、暴露と臨床治療効果を有することを証明することを目的としている。これらの後発薬はブランド製品と同じ厳格な品質基準に適合しなければならず、それを市場に出すコストは大幅に低下する可能性があり、模造薬を生産する会社は通常より低い価格で製品を提供することができる。したがって、後発薬競争者を導入した後、任意のブランド製品およびそのようなブランド製品と競合する可能性のある製品の売上の大部分は、通常、後発薬製品に流出する。また、FDAは2016年4月、Relvarで使用されている活性成分フランフルチカゾン/ヴィランテロール(FF/VI)をカバーするガイドライン草案を発表した®/Breo®エリプタ®.
6
カタログ表
私たちの総合病院·感染症業務
商業性と市場性製品
次の表は私たちのビジネスと市場製品をまとめています

GIAPREZA®(アンジオテンシンII)
GIAPREZA®(アンジオテンシンII)は、敗血症または他の分布性ショックを有する成人の血圧を増加させるための、米国FDAによって承認された血管収縮薬である。GIAPREZAは、敗血症または他の分布性ショックを有する成人の難治性低血圧を治療するために、欧州委員会(EC)およびイギリス医薬品および保健製品管理局(MHRA)の承認を得ており、これらの成人は、十分な容量回復を行い、カテコラミンおよび他の利用可能な血管加圧薬を適用しているにもかかわらず、低血圧を維持している。GIAPREZAはレニン-アンギオテンシン-アルドステロン系(RAAS)の核心であり、このシステムは逆に血圧を調節するヒト内因性アンギオテンシンIIペプチドをシミュレートする。GIAPREZAはLa Jollaによってアメリカで販売され、Paion Deutschland GmbH(Paionと略称する)によってLa Jollaがヨーロッパとイギリスで販売されている。
アンジオテンシンII治療高拍出量ショック(“Athos−3”)
GIAPREZAは2017年8月に“ニューイングランド医学誌”に発表されたAthos-3結果に基づいて米国FDA、EC、MHRAの承認を得た。ATOS-3は多国籍、ランダム、二重盲検、プラセボ対照研究であり、321名の感染性或いは他の分布性ショックを有する成人は液体と血管加圧薬物治療を受けた後も低血圧を維持し、背景血管加圧薬物治療に基づいて同時にGIAPREZA或いはプラセボ治療を受けた。主な終点は平均動脈圧です
7
カタログ表
(“MAP”)反応は、MAPが75 mm Hg以上であるか、または3時間でベースラインから少なくとも10 mm HgからMAPが上昇すると定義され、背景血管加圧薬の用量を増加させることなく定義されている(Khannaら、2017年“ニューイングランド医学誌”;377:419-430)。
ATOS−3研究設計(1)
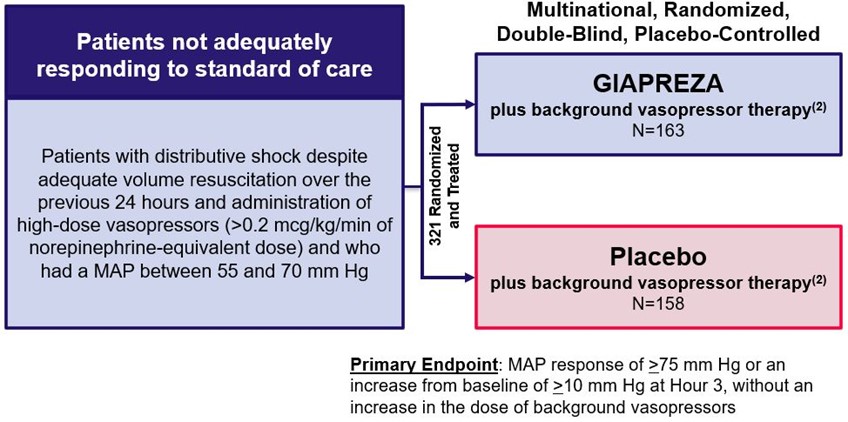
MAP=平均動脈圧
GIAPREZAは血圧反応を有意に改善した。特に,GIAPREZA治療を受けた患者の70%が主な終点に達しているのに対し,プラセボ治療を受けた患者の23%のみが主要終点(P)に達している
主な終点:平均動脈圧反応(1),(2)
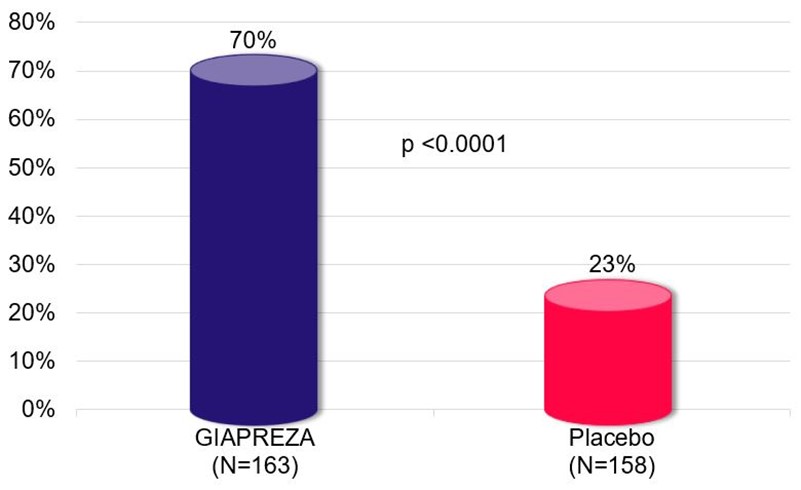
8
カタログ表
GIAPREZAは治療反応を迅速に実現し、調整する能力を提供する。GIAPREZAはMAPを急速に増加させ,MAP反応の中位時間は約5分であった。GIAPREZAの血漿半減期は1分未満であった。
また,積極的な生存傾向が観察された。28日目までのGIAPREZA群の死亡率は46%,プラセボ群では54%(リスク比0.78;95%信頼区間0.57−1.07)であった。
積極的な生存傾向が観察された(N=321)(1),(2)
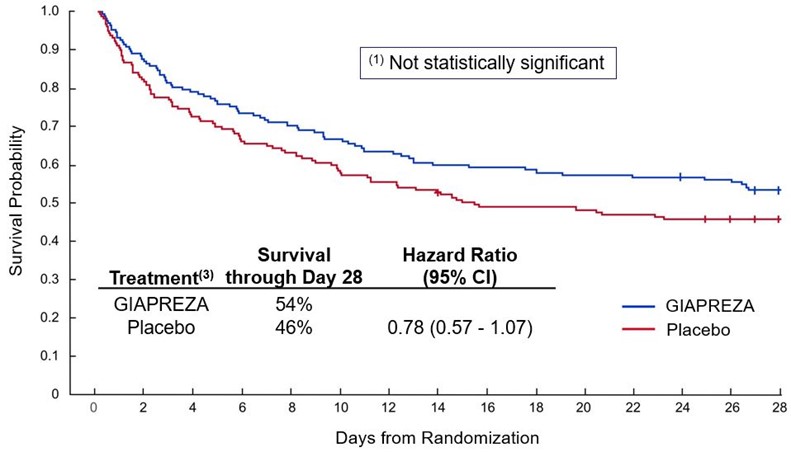
GIAPREZAを服用した患者のうち,10%を超える患者が報告している最もよく見られる副作用は血栓塞栓事象である。
9
カタログ表
≥副作用の発生率は4%でGIAPREZAを用いた患者はプラセボを用いた患者より1.5%高かった(1)
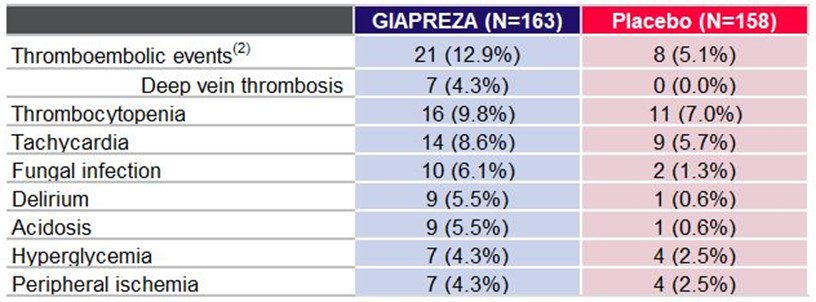
1有害事象、1重篤な有害事象、および有害事象により治療を中止した患者の割合(1)

XERAVA®(エラバサイクリン)
XERAVA®注射用エラワサイクリンはアメリカFDAとシンガポール健康科学管理局(“HSA”)が許可したテトラサイクリン系抗菌薬物であり、18歳以上の患者の敏感微生物によるCIAIの治療に用いられる。XERAVAは欧州委員会,MHRA,香港衛生庁(“DOH”)によって成人CIAIの治療に許可された薬剤である。XERAVAは我々の完全子会社Tetraphase PharmPharmticals,Inc.(“Tetraphase”)が米国で販売され,PaionがTetraphaseを代表してヨーロッパとイギリスで販売され,珠峰医薬有限公司(“Everest”)が中国大陸中国,台湾,香港,マカオ,韓国,シンガポール,マレーシア連邦,タイ王国,インドネシア共和国,ベトナム社会主義共和国,フィリピン共和国で販売されている。2021年3月、エベレストは中国で秘密保持協定を提出し、中国国家医療製品管理局に受け入れられた。
CiaisはICU重症敗血症の第二大よく見られる源である(Brun-Buissonら、JAMA 1995;274(12):968-974)。CIAIは胃腸穿孔による腹膜腔汚染の結果と定義されている(Solomkinら,“臨床感染症”2018年;69(6):921-929)。
エラカサイクリンによるグラム陰性桿菌感染治療の研究
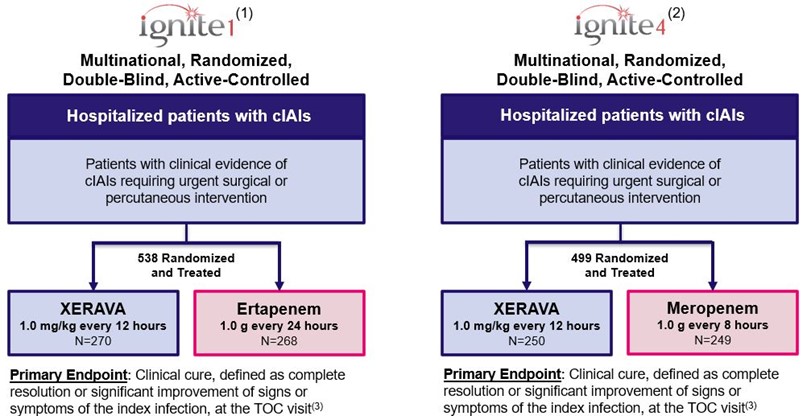
XERAVAは,米国FDA,HSA,EC,MHRAとDOHがIGNITE 1とIGNITE 4に基づく結果に基づいて承認され,それぞれ2017年3月に“米国医学会誌”外科誌に発表され,2018年12月に臨床感染症誌に発表された。
10
カタログ表
IGNITE 1は多国籍、無作為、二重盲検、積極的な対照の研究であり、538名の臨床証拠により頸動脈硬化に緊急手術或いは経皮干与を必要とする患者がXERAVA或いはエルタペナン治療を受けたことを示した。主な終点は臨床治癒であり、治癒(TOC)訪問テストにおいて、指標感染のバイタルサイン或いは病状は完全に消失或いは顕著に改善すると定義されている。TOC訪問は,第一剤研究薬を服用した後25~31日に行った。
IGNITE 4は多国籍、無作為、二重盲検、積極的な対照研究であり、499名の臨床証拠に関連してXERAVA或いはメロペネム緊急手術或いは経皮干与を受ける必要があるCiais患者を示した。主要な終点は臨床治癒であり、指標感染のバイタルサイン或いは症状はTOC受診時に完全に消失或いは顕著に改善すると定義されている。TOC訪問は,第一剤研究薬を服用した後25~31日に行った。
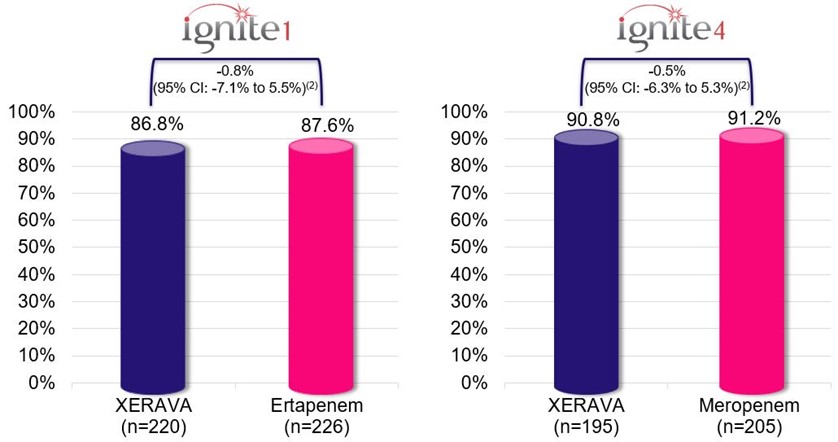
IGNITE 1とIGNITE 4の研究設計
XERAVAは、マイクロITT集団における臨床治癒率において、CiAISを引き起こすベースライン細菌病原体を有し、少なくとも1つの研究薬に対してインビトロ(試験管中)で抗菌活性を有するすべてのランダム対象を含む統計的に非劣勢を示す(N=846)。
11
カタログ表
主な終点:臨床治癒率(1)
以下の表に示すように、グラム陰性、グラム陽性、および嫌気性菌患者の臨床治癒率は、薬剤耐性株を有する患者を含む。
マイクロITT群における一部のベースライン病原体のTOCに対する臨床治癒率(1)
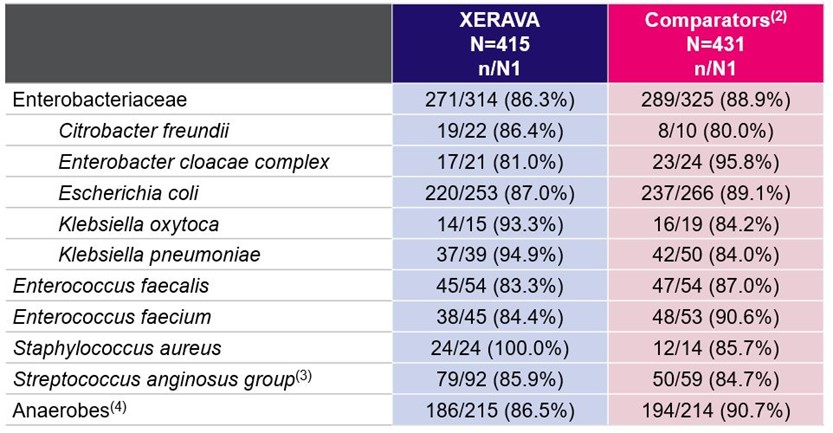
N=マイクロITT集団における対象数;N 1=特定の病原体を有する対象数;n=TOC受診時に臨床治癒した対象数
12
カタログ表
XERAVAは薬剤耐性病原体に対する臨床治癒率が高い(1)
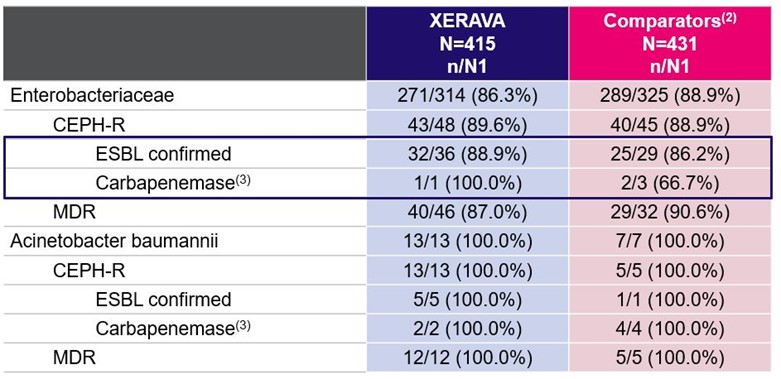
セファロスポリン−R=セファロスポリン耐性;ESBL=超広域スペクトルβ−ラクタマーゼ;
N=マイクロITT集団における対象数;N 1=特定の病原体を有する対象数;n=TOC受診時に臨床治癒した対象数
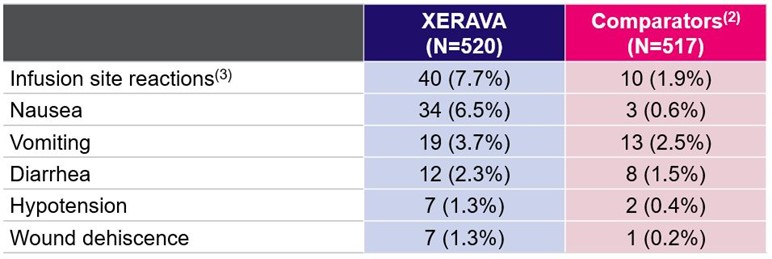
IGNITE 1とIGNITE 4を服用したXERAVA治療患者の中で最もよく見られる副作用は輸液部位反応である。
≥副作用の一部はXERAVA治療を受けた患者の1%が報告されている(1)
販売とマーケティング組織
私たちは経験豊富な販売とマーケティングチームを招聘し、GIAPREZAとXERAVAの商業化に取り組んでいる。同チームは2022年12月31日までに35人の専門家からなり、その中には27人の集中治療専門家が含まれている。
顧客
2022年12月31日までの1年間に,米国では503病院がGIAPREZAを購入し,米国では874病院と他の医療機関がXERAVAを購入した。病院や他の医療機関は通常専門と卸売流通業者のネットワークを介して私たちの製品を購入します。これらの特産品と卸売業者は私たちのものとされています
13
カタログ表
会計目的の取引先です。流通業者の1社を失うことは、販売量が残りの流通業者に吸収されることが予想されるため、私たちの製品の流通能力に大きな影響を与えないと考えられます。GIAPREZAとXERAVAの注文完了に要する納期は比較的短いため,蓄積は我々の業務にとって重要ではない.
競争
カテコラミン(主にノルアドレナリン)は模倣薬であり,安価で,通常分布性ショックの治療に用いられているが,アンギオテンシンを含む加圧素である®(Endo International Plc)や後葉加圧素などの後発薬は、通常二線に用いられる。このランダムな3期研究では,Athos−3,GIAPREZAはカテコラミンやプレシンを含む使用可能なアンギオテンシン反応が不十分な患者に対する臨床的メリットを証明している。GIAPREZAは,使用可能な血管加圧剤に対する反応が不足している患者を治療する主要な競争相手として,これらの同じ血管加圧剤の用量を増加させることである。治療法の変更に成功しなければ,GIAPREZAのビジネスの将来性が制限され,われわれの業務が影響を受ける可能性がある。
XERAVAは、AVYCAZ(セフタジジムとアビバタン、エバービー社によって販売されている);Merrem IVを含む、CIAIおよび他の多剤耐性感染を治療するために現在市場で使用されているいくつかの抗生物質と競合する®(メロペネムアスリーカン販売);Primax®(イミペネムおよびシスタディン、メルク社が販売);RECARBRIO(イミペネム、シスタディンおよびレバタン、メルク社が販売);テガシー®(テギサイクリン、ファイザーによって販売);VABOMERE(メロペネムおよびワボバタン、Melinta治療社が販売);Zerbaxa®(セフェロゾリジンとタゾバクタム、メルク社販売);ZOSYN®(ファイザーによって販売されているピペラシリンおよびタゾバクタム);および現在および将来発売される抗生物質の模倣薬バージョン。治療法の変更に成功しなければ,XERAVAのビジネスの将来性が制限され,われわれの業務が影響を受ける可能性がある。
規制排他性
GIAPREZAとXERAVAは米国FDAによって承認された新しい化学物質(“NCE”)である。米国では、FDAが承認したNCEは、NCEが最初に承認された日から5~7.5年以内にNCEの後発薬バージョンの承認を阻止することができる米国連邦食品、薬物、化粧品法案(FDCA)によって市場独占経営権を獲得する資格がある。具体的には,FDCAはNCEセキュリティ協定の承認を得た申請者に5年間の米国内マーケティング排他期を提供している.FDAが以前に同じ活性部分を含む他の新薬を承認していなければ,薬物はNCEであり,活性部分は薬物物質の作用を担う分子やイオンである。排他期間内に、FDAは、出願人が合法的な参照承認に必要なすべてのデータを所有していない場合、特許出願の別のバージョンのために別の会社によって提出された簡略化された新薬出願(“ANDA”)または505(B)(2)NDAを受け入れない可能性がある。ただし,出願に特許無効又は不侵害の証明が含まれている場合は,国家特許庁がNDAを承認してから4年以内に提出することができる。秘密保持者が認証通知を受けてから45日以内にANDA申請者の訴訟を開始した場合、任意の模倣薬競争の承認は、(I)認証を受けた日から30ヶ月間、または(Ii)裁判所が関連特許特許を無効または未侵害と判断するまで自動的に発効する。裁判所の裁決がない場合、30カ月の猶予期間は、国家経済委員会が秘密保持協定を承認した日から7.5年に要する時間(あれば)を延長する。
2022年2月15日、La JollaはGland Pharma Limited(“Gland”)の第4段落認証通知(“通知書”)を受け取り、GlandがFDAに短い新薬申請(“ANDA”)を提出したことを通知し、米国特許番号:9,220,745;9,572,956;9,867,863;10,028,995;10,335,451;10,493,124;10,500,247;10,548,943;11,096,983;および11,219,662(“GIAPREZA特許”)に記載された有効性を評価することを求めた。通知書は、GIAPREZA特許は、無効であり、強制実行不可能であり、および/またはGlandのANDAに記載された模倣薬の商業的製造、使用、または販売によって侵害されないと主張している。
2022年3月29日、La JollaはGIAPREZA特許がGlandおよびいくつかの関連エンティティの特許を侵害し、GlandのANDA出願に応答するために、米国ニュージャージー州地域裁判所に訴訟を提起した。“ハッジ·ワックスマン法”によると、GIAPREZAは新しい化学物質であるため、La Jollaは通知書を受け取ってから45日以内に特許侵害について訴え、FDAは地域裁判所が訴訟中の特許のすべての主張が無効で、実行不可能であり、および/または侵害されていないことを発見しない限り、GlandのANDAを承認することができない。私たちはGIAPREZAに関連した知的財産権を強力に実行するつもりだ。
FDA安全·革新法案(“FDASIA”)の“直ちに抗生物質奨励”(“Gain”)条項によると、FDAは1つの製品を合格した伝染病製品(“QIDP”)に指定することができる。この称号を得るためには、ヒトが使用する重篤または生命に危険な感染を治療するための抗菌または抗真菌薬になる資格がなければならない。2013年7月、CIAI用XERAVA IV製剤のQIDP称号を取得した。QIDPの出願を承認した後、FDAは、付与された任意の非特許マーケティング専門期間をさらに5年間延長する、例えば、
14
カタログ表
NCEですこの延期はすべての与えられた小児科専門権の延期に対する追加だ。XERAVAはFDASIAによりこの5年間の独占経営権を獲得した。
私たちの候補製品
次の表は,我々の主要候補製品の状態をまとめたものである

スール·デュール
概要
私たちの主要な候補製品Sul-durは新型静脈注射抗生物質である。この製品はβ-ラクタム系抗生物質スルバクタムと我々の新型β-ラクタマーゼ阻害剤(“BLI”)の組み合わせであり、A、C、Dを含む広いスペクトルβ-ラクタマーゼ被覆範囲を有し、カルバペネム耐性による様々な深刻な感染治療のために開発されているアシネトバクターそれは.我々は3つの独立した1期臨床試験を完了しており,そのうちの1つは舒達の肺透過性を評価し,もう1つは腎障害患者で評価している。その後,皮膚疾患患者に対する2期臨床試験を完了した。著者らは2019年に単期3登録試験を開始し、カルバペネム系抗生物質耐性患者の舒達楽を評価したアシネトバクター肺炎および/または血液感染。舒達は多剤耐性患者の予後を改善することができると信じていますアシネトバクター感染し総死亡率を下げます我々は2021年10月に積極的な第3段階データを発表し,われわれの積極的な第3段階データおよびわれわれの臨床前と臨床データの全体に基づいて,2022年9月に新薬申請(NDA)をFDAに提出した。米国FDAはNDAの申請を受けた。舒達は多剤耐性患者の予後を改善することができると信じていますアシネトバクター感染し総死亡率を下げます
アシネトバクター
アシネトバクターグラム陰性、日和見性の人類病原体であり、主に重篤な患者に感染し、通常深刻な肺炎と血液感染を招くが、身体の他の部位にも感染することができる。多くは良性だと思われていましたアシネトバクター現在は医療分野の世界的な脅威と考えられており,一部の原因は,従来他の細菌では見られなかった速度で多剤耐性を得ることができるからである。また、アシネトバクター病原体は乾燥条件下で100日まで生存することができ、空気或いは水滴を介して伝播しやすく、これは集中治療室或いはICUの多くの位置で常にこのような病原体を発見することができ、手すり、枕元、機械呼吸器モニター、静脈輸液ポンプ、ドアハンドル、聴診器と多くの他の位置を含むことができる理由を説明する。注目すべきは98%以上のアシネトバクターICU中の非臨床由来の分離株、例えば欄干とドアハンドルは、多剤耐性と確定された。
薬剤耐性による肺炎と血液感染アシネトバクター死亡率は50%に近いかもしれませんアシネトバクターの現在の標準治療に対する薬剤耐性率は報告の中で最も高い一つであり、アメリカでは30%から50%の間で、ヨーロッパとアジアの一部の地域では90%を超えている。アシネトバクターの−ラクタム系抗生物質に対する耐性は主にD系β−ラクタマーゼの発現によって駆動され,通常A系および/またはC系DNA−ラクタマーゼと組み合わせて使用される。現在、多剤耐性を治療する有効な抗生物質はまだないアシネトバクター感染します。ドゥロネタンは第一臨床段階のBLIであり、A、CとD類β-ラクタマーゼに対して十分な広いスペクトル活性を有し、β-ラクタム系抗生物質の多剤耐性に対する治療効果を回復する可能性があるアシネトバクター.
スルバタンはスッドに使用されているβ−ラクタム系抗生物質であり,優れた微生物効力を有するアシネトバクター以下の要因に基づく他のβ−ラクタム系抗生物質と比較して体外培養そして体内にある分析する。歴史的には医者はシュバタンを使って治療に成功したアシネトバクター広範なβ−ラクタマーゼを介した耐性形成前の感染はスルバタン自体を大きく
15
カタログ表
効果が悪い。我々のデータは,デュロネタンとシュバタンの併用が多剤耐性菌株に対するシュバタンの活性を有効に回復できることを示していると考えられるアシネトバクター.
市場のチャンス
20万人もの人が病院で治療を受けていると思いますアシネトバクターアメリカとヨーロッパの毎年の感染者数は10万人もがカルバペネム系抗生物質に耐性がありますアシネトバクター感染、私たちはこれが私たちがSul-Durに対する最初の目標市場だと思う。また、一部の国の薬剤耐性率が80%を超えていることから、アジア太平洋地域、中南米、ロシア、中東には巨大な市場機会が存在する可能性があると考えられる。承認されれば,Sul−durは既存案が直面している薬剤耐性問題や耐性問題を解決する可能性があると信じており,既存案は現在カルバペネム系抗生物質の使用を制限しており,耐性はミキシンを含むレジメンの懸念される問題である。カルバペネム耐性の治療に用いられる抗生物質は現在のところないアシネトバクター感染します。
臨床発展計画
完成した臨床試験
第3段階登録試験:カルバペネム系薬剤耐性患者の治療のためのSUL−DURの3期登録試験を完了した−攻撃−アシネトバクター感染は,2021年10月に積極的な収益データを公表した。Attackは16カ国·地域の95臨床サイトで207名の患者を募集した。これは2つの部分からなる実験であり,A部分はランダム照合部分(Sul-durとColistin)で記録されているアシネトバクター病院獲得性細菌性肺炎(HABP)、呼吸器関連細菌性肺炎(VAPB)、呼吸器関連肺炎(VP)或いは菌血症、B部分は開放標識部分であり、含まれるアシネトバクターミキシンやポリミキシンBに対する治療が無効または以前に失敗した感染。ベースラインアシネトバクター測定した菌株のカルバペネム系抗生物質に対する耐性は95%より大きかった。
ミキシンと比較して、SUL-DURはA部分CRABCミート群で28日間の全死亡率の主要な治療効果の終点に達した。SUL-DURの死亡率は19.0%(12/63)、ミキシン群は32.3%(20/62)(治療差は-13.2%、95%信頼区間:-30.0、3.5)であった。これまでに評価されたすべての研究群において,28日と14日の全因死亡率はSul−durに有利であり,類似した傾向を示した。臨床治癒率(TOC)において、スーダン群は61.9%、ミキシン群は40.3%であり、統計学的有意差があった(95%信頼区間は2.9-40.3)。B群の28日間の全原因死亡率は17.9%(5/28)であり、A群と一致した。
Sul−dur治療を受けた患者177名の安全性分析では,Sul−durは全体的に耐性が良好であり,ミキシンと比較して良好な安全性を示した。急性腎損傷のRIFLE分類により、Sul-durは主要な安全目標を達成し、腎毒性発生率は統計学的に有意に低下した。スルダールの腎毒性は13.2%(12/91),ミキシン群は37.6%(32/85)(p=0)であった。0002)。安全群における全体的な有害事象(AEs)は2つの治療群の間で類似しており、87.9%(80/91)は南方群で発生し、94.2%(81/86)はA群、89.3%(25/28)はB部分、薬物関連有害事象(AEs)はSul-dur群で12.1%(B部分で10.7%)、ミキシン群では30.2%であった。A群は下痢(16.5%)、アレルギー反応(16.5%)、貧血(13.2%)、低カリウム血症(12.1%)を最もよく見られる非感染性副作用(,10%)、ミキシン陽性反応(AEs)>10%であり、急性腎損傷であった。
2022年11月30日,米国FDAがSul−durの新薬申請(NDA)の優先審査を受けることを発表した。FDAは現在この申請を検討するために諮問委員会会議を開催することを計画している。PDUFAの目標日(または行動日)は2023年5月29日である.
慢性尿路感染患者の第二段階臨床試験:著者らはcUTI患者に対する第二段階の臨床試験を完成し、追加の安全性と薬物動態学(PK)データ及びカルバペネム系薬剤耐性病原体に対する治療効果データを提供した。80人の患者は、6時間に1回の7日間のシューダまたはプラセボ治療をランダムに受けた。両腕患者は背景治療も受けており,現在の看護基準であり,6時間ごとに500ミリグラムイミペネムまたはIMIを静脈内投与している。深刻な有害事象は報告されておらず,Sul−dur plus IMIの有害事象はIMI対照ARMと類似している。第2段階試験で観察されたPKデータは,健常ボランティアの第1段階臨床試験で観察されたPKデータと一致した。
著者らはすでに3つの1期臨床試験を完成し、以下に示すように、そのほかに皮膚病患者に対する2期臨床試験がある。これらすべての臨床試験において,Sul−durは全体的に良好な耐性が認められた。
4つの部分からなる第1段階の初の人体実験です我々の4部1期ヒト臨床試験はオーストラリアで行われ,124名の健康ボランティアが参加した。Sul−durは全体的に耐性が良好であり,用量に関連する全身不良事象や薬物関連の重篤な不良事象は報告されていない。検討した用量範囲でも,SUL−DURの曝露とPKパラメータは線形の用量依存性の増加を示した。
16
カタログ表
1期肺試験:著者らの第一段階肺試験は肺液中の舒達濃度を評価し、これは理解すべき重要な指標であり、発作時に肺炎患者を含み、しかも適切な肺組織貫通の不足は治療効果の低下を招くことを発見した。この試験で達成された肺液中のスルダールのレベルは,以下の原因による肺炎の潜在的治療の潜在的開発として支持されていると考えられるアシネトバクター.
1期腎臓試験:著者らの第一段階腎臓試験は腎障害患者の血清レベルを分析し、著者らが行っている3段階登録試験中の目標患者タイプのための用量調整方案を開発するためのデータを提供した。
我々は2017年6月にSul−durのINDを米国FDAに提出し,FDAは2017年7月にこの計画を継続できることを通知した。FDAは2017年9月にSul-dur Fast TrackとQIDPの称号を授与し、以下の原因による病院獲得性と呼吸器獲得性細菌性肺炎と血液感染の治療に用いられたアシネトバクター.
世界アシネトバクター監視データ
ドゥロネタンはA、CとD類を含む多種のβ-ラクタマーゼに対して広範な活性を有し、現在市場で主にA類とC類β-ラクタマーゼのみをカバーしているBLIとは異なる。Durlobactamは臨床開発の最初のBLIであり,このような広範なものを持っている体外培養活動します。
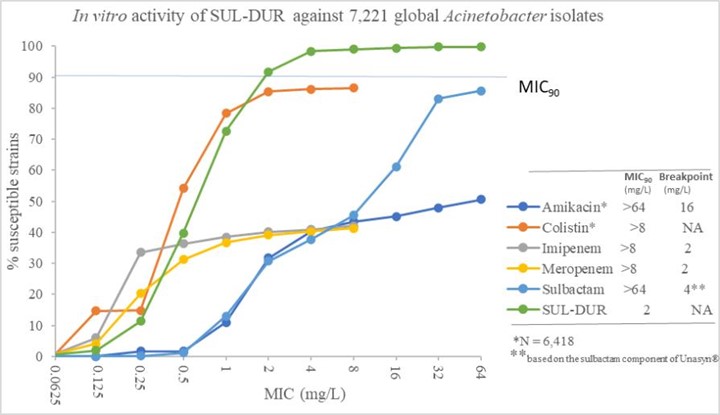
Sul−durも強力な微生物活性を示したアシネトバクター菌株試験管の中にあります以下の図にまとめた一連の研究において、著者らはシューバタン、シュバタン単独と対照薬物の7221株のサルモネラ菌に対する抑制効果を比較したアシネトバクターこれらのデータは2011年から2020年までの間に世界各地の患者から収集された。アミカシンとミキシンは7221株の細菌のうち6418株を試験した。次の図中のグラフは,各試験化合物の濃度を増加させることによりこれらの菌株が抑制された累積パーセンテージを示している。スルバタン及び大多数の他の発売抗生物質のMIC 90値は非常に高く、64 mg/Lに達することは、90%の菌株の成長を抑制するために64 mg/L或いはそれ以上の濃度が必要であることを意味する。対応する断点は臨床と実験室標準研究所(CLSI)によって確立され、各抗生物質の指定濃度として、1種類の菌株が薬剤耐性を有すると考えられるかどうかを定義し、それらのMIC 90値よりはるかに低い。1つの薬剤のMIC 90がそのCLSI臨界点を下回る場合、90%以上の菌株に有効であることが予想される。1つの薬剤のMIC 90がその臨界点より高い場合、薬剤はこれらの菌株に対して広範な治療効果を与えないであろう。この累積分析によると最近の世界の毒株はアシネトバクターミキシン以外のすべての対照抗生物質に耐性があり,有意に低下した臨床効果と一致したアシネトバクター感染します。これに対し,Sul−durの活性は非常に強く,MIC 90は2 mg/Lとはるかに低く,シュバタンのCLSI臨界点4 mg/Lを下回っている(Unasynでは®スバクタムとアンピシリンの組み合わせ)は、私たちが選択した目標曝露レベルのSul−durが世界の多剤耐性の90%以上に有効である可能性を示しているアシネトバクター菌株。テストされた7221菌株のうち、926菌株のサブセットは2016-2018年の間に収集された中国病院から来た。926株の中国分離株の中で、831株(84.6%)がカルバペネム類に耐性があった。逆に、Sul-durはこの亜群に対して強い抗活性を示し、MIC 90は2 mg/L、97.9%の菌株は4 mg/LのSul-durに敏感であった。
17
カタログ表
競争
多剤耐性治療のためのSul−durを初歩的に開発していますアシネトバクター感染します。薬剤耐性率の上昇により多剤耐性患者の標準看護治療アシネトバクター感染症は、一般に、カルバペネム、テトラサイクリン、ポリミキシン、および他の汎用薬剤を含むいくつかの最終治療レジメンの組み合わせを含む。最良の治療法を用いているにもかかわらず,多剤耐性患者の死亡率アシネトバクター感染者数は50%に達すると報告されている。本報告が発表された日まで,多剤耐性の治療に市販されている抗生物質があることは知られていないアシネトバクターしかし私たちは他の潜在的な競争力を持つ製品が体外培養いくつかの菌株に対する活性アシネトバクター。Melinta治療会社は現在ミノサイクリンを販売している。最近皮膚治療に承認されましたがFetrojaは®Shionogi&Co.,Ltd.から、そのタグには、この医薬を用いて治療されたカルバペネム耐性グラム陰性細菌感染患者の全原因死亡率の増加が観察される特定の警告が含まれている。BioVersys AGは2022年5月に彼らの主導計画BV 100が多剤耐性のために開発されたと報告したアシネトバクター感染は,3段階の1期臨床試験を完了した。
商業的方法
アメリカではビジネス戦略はどこへの理解によって推進されていますかアシネトバクター感染は既知で存在する。考えてみるとアシネトバクター感染は免疫機能低下患者に多く発生し、これらの患者の治療環境は通常大型集中治療室(ICU)、移植、癌と熱傷などの専門センター、外来長期急性センター(LTAC)と家庭輸液である。
Sul-durは多剤耐性のために開発されましたアシネトバクターSul−durが満たされていない需要と価値主張は,このような重篤なグラム陰性病原体による感染の治療に用いることを支持すると信じている。この価値主張には
現在のところアシネトバクター治療案はSul−Durの位置を明らかにすることを可能にした。疑似患者アシネトバクター感染は通常広域抗生物質で治療され、通常はカルバペネム類であり、第一線の治療とする。薬剤感受性試験で原因細菌がカルバペネム系抗生物質に対する耐性が確認されればアシネトバクターそして,ミキシンに基づく抗生物質レジメンに切り替えられることが多く,感染の治療に成功しようとしている。しかし,すでに発表されている文献では,ミキシンをベースとしたレジメンの死亡率は50%を超えることが報告されている。
攻撃性第三段階登録試験のデータはより良好な治療効果と安全性を示し,承認されればSul−durはカルバペネム耐性を含む多剤耐性の治療においてミキシンによるレジメンよりも歓迎される可能性が考えられるアシネトバクター感染します。
多剤耐性アシネトバクター中国とより広範なアジア太平洋地域でも、感染は重要な満たされていない医療需要である。著者らは再鼎医薬との協力と許可協定、彼らが攻撃的な第三段階登録臨床試験に参加することを含み、中国とアジア太平洋地域の監督管理の許可と商業化に潜在的な加速経路を提供した。再鼎医薬は中国から約25%の評価可能な発作患者を募集することを支持し、私たちはこれが中国の監督管理意見書を支持すると信じている。著者らが再鼎医薬と達成した合意によると、ある第三段階の登録臨床試験費用を支払う以外に、私たちは前金、マイルストーン費用と特許権使用料を受け取る。私たちは北米とヨーロッパで100%の権利と関連した経済を持っている。米国以外では,多国籍製薬会社と協力し,再鼎医薬との合意がカバーされていない地域でそれらの商業化能力を利用する予定である。2023年1月、再鼎医薬は、中国国家医薬品監督管理局薬物評価センターはすでに国家薬品監督管理局にバウマンアシネトバクター感染の治療を授与し、多剤耐性と抗カルバペネム類(カニ)菌株を含む国家薬品監督管理局に優先審査地位を授与した。
18
カタログ表
ゾリロ星
概要
私たちの第二の末期候補品はゾロシンであり、細菌病原体によって引き起こされる単純な淋病の治療のための潜在的な単回経口療法である淋病ナイザー菌それは.淋病は重大な医療需要がある領域であり、ゾロシンは開発されている唯一の新しい単一用量療法であり、それはセフトリアキソン筋肉注射に薬剤耐性菌株による感染を含む淋病の治療に潜在的な経口単一療法代替を提供する。ゾロシンの目標はフルオロキノロン系抗生物質の有効な作用機序であるが,既存のフルオロキノロン耐性を回避するための新しい方法で行われている。著者らはすでにゾロシンによる単純性淋病患者のいくつかの1期臨床試験と2期臨床試験を完成した。2019年,我々はGARDPと協力して,合併症のない淋病患者におけるゾリロ星の単期3期登録試験を開始した。GARDPはすべての3期臨床試験と薬物開発費用に資金を提供し,その見返りとしてWHOで定義された低収入と選定された中所得国でゾロシンの商業権を獲得する。私たちは北米、ヨーロッパ、アジア太平洋地域の主要市場を含む他のすべての国での商業権利を保持している。
淋病
単純淋病は一種の淋病ナイセ菌(N.)尿路、子宮頚、咽頭或いは直腸の感染は、複雑性淋病よりもっとよく見られ、後者は感染が他の組織と潜在的な血液に拡散することを含む。淋病は骨盤炎、子宮外妊娠と不妊、及びヒト免疫不全ウイルス(HIV)リスクの増加を含む深刻な合併症と関係があるかもしれない。引き続き有効な抗生物質を使用しているにもかかわらず、それは依然として世界で最もよく見られる性伝播細菌感染の一つであり、全世界で毎年8,240万人が感染していると推定されている。まれに症状はなく,女性に多く見られ,持続感染レベルの原因の一つと考えられている。抗生物質は依然として簡単な淋病を治療する主要な手段である それを引き起こす淋病ナイザー菌。
淋病ナイザー菌淋病の病原体であり,他属の染色体DNAを強く摂取する傾向があるナイセリア菌これにより細菌は染色体遺伝子に多くの突然変異を蓄積させ、抗生物質に対する頻繁な耐性を招く。例えばペニシリンが導入されるのは淋病ナイザー菌1943年に感染し、1945年に初めて薬剤耐性を報告した。フルオロキノロン系抗生物質は1949年に初めて淋病の治療に応用され、淋病の治療に最も成功した抗生物質の一つである淋病ナイザー菌しかし、それでも1969年に耐性が発見された。シプロフロキサシンはこのような薬物の一種であり、1980年に導入され、1990年に薬剤耐性が発見された。最近、セファロスポリン系抗生物質、特にセフクシンは、経口投与は良好な治療効果と安全性があるため、淋病の治療に広く応用されているにもかかわらず、淋病ナイザー菌2007年以来報告されてきた。これらの抗生物質の広範な使用により薬剤耐性が出現した淋病ナイザー菌菌株については,治療ガイドラインはその後改訂された。セフトリアキソンは現在CDCが推薦した唯一の淋病治療の選択であり、最近まで、セフトリアキソンは広域抗生物質アジスロマイシンと一緒に使用し、他の性伝播疾病に対するカバーを提供し、これらの疾病はよく淋病と同時に発生する。しかし上昇する抵抗は淋病ナイザー菌アジスロマイシンは最近疾病予防制御センターに現在500 mgセフトリアキソン単一治療を提案している。セフトリアキソンは筋注による投与であり,苦痛になる可能性があり,医療管理者のモニタリングが必要である可能性がある。セフトリアキソンはアメリカの大部分の地域、ハワイ、マサチューセッツ州、中国、日本、ベトナム、韓国、フランス、スペインを含むいくつかの国で有効であるにもかかわらず、淋病ナイザー菌アジスロマイシンとセフトリアキソンに対する薬剤耐性菌株はすでに報告され、これは人々の懸念を引き起こし、即ち薬剤耐性淋病は主要なコミュニティ健康問題になる可能性がある。
市場のチャンス
淋病ナイザー菌差し迫った全世界の公衆衛生の脅威であり、2020年に全世界に8240万例がある(WHO推定)。米国の年間淋病例は160万例に達すると推定されている。WHOによると、全世界に約8240万の新病例があり、その中に15-49歳の感染青少年と成人を含むと推定されている。アメリカ疾病コントロール·予防センターは、2009年以来、アメリカの淋病症例は毎年少なくとも10%増加していると推定している。2021年4月,米国疾病コントロール·予防センターは,米国の性伝播疾患は6年連続で過去最高を記録し,2019年に報告されたクラミジア,淋病,梅毒症例は約260万例であると発表した。
19
カタログ表
マラリア感受性DSまたはR耐性低下が報告された国について2017-2018年に実施した調査結果淋病ナイザー菌既存の抗生物質に対する反応を表に示す。
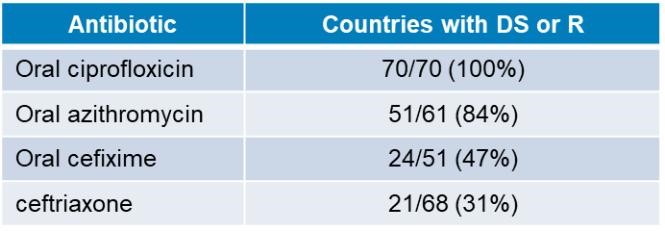
歴史的に薬剤耐性伝播のリスクを減らすために淋病ナイザー菌推奨された一線治療の薬剤耐性率が5%に達した時、疾病管理センターはすでに治療ガイドラインを変更した。2015年以来、CDC淋病ガイドラインの中でただ1種の推薦治療方法がある:250 mgセフトリアキソン筋肉注射プラス1 g経口アジスロマイシン。2020年、疾病管理センターは再びその治療ガイドラインを更新し、現在500 mgのセフトリアキソン筋肉注射による簡単な淋病の治療を提案した。これまで,イギリスの2019年の更新は淋病の経験治療が推奨されており,現在は1 g筋注セフトリアキソン単一療法である。
臨床発展計画
行っている登録試験
第3段階登録試験:2019年、我々はGARDPと協力してグローバルマルチセンター3期登録試験を開始することを発表し、GARDPはすべての3期臨床試験と薬物開発コストを行って援助している。米国、タイ、南アフリカ、オランダ、ベルギーに18カ所もの臨床試験地点を設置する予定だ。著者らの3期登録試験はマルチセンター、開放ラベル、非劣性試験であり、研究対象は約1,000名の淋病を合併していない登録患者であり、彼らは2:1の割合で単剤3.0 gゾリロシン或いは500 mgセフトリアキソンと1グラムアジスロマイシン筋肉注射をランダムに受ける方案である。主な終点は,治療後約6日以内に尿路や子宮頸部部位で微生物治療を受けた患者の割合である。2021年5月、データセキュリティ監視委員会(データセキュリティ監視委員会)は、修正せずにこの研究を継続することを提案した。新冠肺炎疫病による挑戦は依然として続いているにもかかわらず、著者らは最近入学率の上昇を観察し、現在の入学率に基づいて、2023年に試読を完成する予定である。米国食品医薬品局との検討によると,この単段階3登録試験の治療効果データが陽性であれば,われわれの他のゾロシン臨床試験のデータは,米国食品·薬物管理局への機密協定の提出を支援するのに十分であると信じている。
完成した臨床試験
2期臨床概念検証試験:著者らはすでに多中心、ランダム、開放ラベルの2期臨床試験を完成し、2.0 g或いは3.0 gのゾリロシン単回経口投与と500 mg筋肉注射セフトリアキソンによる簡単な淋病治療の治療効果を比較した。この試験では,179名の無作為患者が治療を受け,ゾリロ星の全体的な耐性は良好であり,治療効果はセフトリアキソンに相当した。試験の主要な終点として、単剤ゾリロ星の泌尿生殖系感染に対する微生物根絶と臨床治癒はセフトリアキソンに相当し、方案に符合する人群の中で、3.0 gゾリロシンとセフトリアキソン群の治癒率はすべて100%であった。この臨床試験の結果はニューイングランド医学雑誌 in 2018.
第一段階臨床試験:われわれは2期−1臨床試験でゾロシンを評価し,計72名の健康ボランティアを検討した。第1試験では48名の被験者のPKsと耐性を評価し,18名の被験者の食物効果を評価し,2回目の試験では6名の被験者の吸収,分布,代謝,排泄を評価した。ゾロシンはこれらの試験において全体的な耐性は良好であり,この用量は臨床的に簡単な淋病の治療に用いられることが予想される。高脂肪食の服用はゾロシン血中濃度の増加に関与しており,ゾロシンは食物と一緒に服用でき,食物と一緒に服用しなくてもよいことが示唆された。
臨床前データ
私たちは生物化学微生物と体内にあるゾリロ星のデータですデータにより、ゾロシンはアメリカ、ヨーロッパ、中国、タイと南アフリカの現代臨床分離株に対して強力な活性を有し、これらの菌株はフルオロキノロン類を含む他の抗生物質クラスに耐性があり、その新しい作用機序を考慮することは予想されている。またデータによると
20
カタログ表
淋病の4種類の標準抗生物質の中の2種類に対して顕著な薬剤耐性があり、シプロフロキサシンは1種のフルオロキノロン類薬物であり、アジスロマイシンはマクロライド系抗生物質である。
競争
我々は当初,単一用量経口投与で簡単な淋病を治療する薬剤としてゾロシンを開発していた。淋病は通常500 mgのセフトリアキソン筋肉注射で治療され、セフトリアキソンは汎用的な薬物である。他の非特許セファロスポリンやフルオロキノロン系薬剤も開発されているが,現在の薬剤耐性率を考慮すると,主な治療案としては推奨されていない。グラクソ·スミスクライン社(GlaxoSmithKlineplc)は現在、多種の感染を治療するための格泊達星を開発しており、それは著者らが知っている唯一の末期臨床開発において潜在的な競争力を有する候補製品であり、簡単な泌尿生殖系淋病の治療のために開発されている。グラクソ·スミスクラインは2019年10月に3期臨床試験(Eagle-1)を開始した。以前の1つの2期臨床試験により、単回用量を経口投与した後、2例の泌尿生殖器微生物失敗患者は格ボチジンに対する耐性が出現した。この耐性を克服するために,Eagle−1臨床試験では,格泊達星は研究地点で3000 mg(Mg)を4錠経口投与し,外来で別の1錠3000 mgを経口投与する。
商業的方法
簡単な淋病を治療する抗生物質は通常一次保健医、外来と救急室及び多くのコミュニティサイトを通じて獲得される。また、ゾリロ星を米国疾病コントロール·予防センターに入れるガイドラインは歴史的に人々の認識と受け入れを推進した。私たちはGARDPと協力し、GARDPはあるWHOで定義された低収入と指定された中所得国でゾリロ星の商業化をリードする。
ゾロシンは潜在的な単量治療法(水中の香嚢)であり、自宅での“迅速パートナー療法”を促進することができ、パートナーの重複感染の機会を低下させる可能性がある。快速パートナー療法は、EPTと略称され、クラミジア或いは淋病患者の性パートナーを治療する臨床実践であり、方法は患者に処方或いは薬物を提供し、医療保健提供者ではなく、彼/彼女のパートナーに連れて行かせることであり、まずパートナーに対して検査を行う。米国ではEPTは45州で許可されており、4州では許可されており、1州でのみ禁止されている可能性がある。
製造業
Relvarの製造®/BreoEllipta®(FF/VI)とAnoro®エリプタ®(UMEC/VI)はGSKによって実行される.
私たちは第三者メーカーに依存してGIAPREZAとXERAVAを生産し、予測可能な未来にこのようにして、私たちの発展とビジネスニーズを満たすことが予想されます。私たちのすべての製造協定で、私たちは契約メーカーにFDAの現在の良好な製造規範(“cGMP”)と他のすべての適用された法律法規に従って活性医薬成分(“原料薬”)および薬品を生産することを要求する。私たちは、GIAPREZAおよびXERAVAに関連する独占権を保護するために、潜在的および既存の製造業者と秘密協定を維持します。GIAPREZAとXERAVAの長期ビジネス成功は、著者らの契約メーカーがcGMPに適合する原料薬と薬物製品を間欠的に供給できるかどうかにある程度依存する。
私たちの候補製品について、私たちは現在第三者契約メーカーに依存して、私たちの臨床前研究と臨床試験に必要な原材料、薬物物質と完成品を提供しています。現在の臨床供給需要を満たすためにこれらの第三者と契約を締結していますが、現在、候補製品が承認された後に商業的に供給される製品を生産するために、これらの第三者とは何の契約関係もありません。私たちの製品候補製品が任意の規制機関の潜在的な承認に近づくにつれて、私たちは第三者契約メーカーとこれらの製品の商業生産について合意するつもりです。私たちは現在私たちの製造業者の関係とプロセスを管理するために内部資源を雇用している。
政府の監督管理
その他の事項以外に、アメリカ連邦、州と地方の各レベル及びその他の国の政府当局は私たちの製品の研究、開発、テスト、製造、包装、貯蔵、記録保存、ラベル、広告、販売促進、流通、マーケティング、承認後の監視と報告、製品の輸出入と精算などに対して広範な監督管理を行っている。規制の承認を得て、その後、適用される連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。
アメリカ政府の規制
米国では、規制の承認を得て、その後適切な連邦、州、地方法規、条例を遵守する過程には多くの時間と財政資源が必要だ。守れなかった
21
カタログ表
製品開発プロセス、承認プロセス、または承認後のいずれかの場合、適用される要件は、FDAが係属中の出願の承認拒否、承認撤回、臨床棚上げの実施、警告状および無タイトル手紙の発行、製品リコール、製品差し押さえ、生産または流通禁止の完全または部分的な一時停止、罰金、政府契約の拒否、原状回復、利益の返還または民事または刑事罰のような様々な行政または司法制裁を受ける可能性がある。
審査の流れ
米国では,FDAは連邦食品,薬物と化粧品法案(FDCA),公衆衛生サービス法案(PHSA)と実施条例に基づいて薬品を規制している。規制の承認を得て、その後、適用される連邦、州、地方、外国の法規と条例を遵守する過程には、多くの時間と財政資源が必要だ。製品開発プロセス、承認プロセス、または承認後のいつでも、FDCAおよび他の適用される米国の要求を遵守できなければ、様々な行政または司法制裁を受ける可能性があり、いずれも実質的な悪影響を及ぼす可能性がある。これらの制裁には
FDAが米国で発売される前に必要とされるプログラムは、一般に以下のような態様を含む
開発する候補薬が決定されると,臨床前試験段階に入る。臨床前試験は製品の化学、毒性と調合に対する実験室評価、及び動物研究を含む。INDスポンサーは,臨床前試験の結果を生産情報や分析データとともにINDの一部としてFDAに提出しなければならない。IND提出後であっても,いくつかの臨床前または非臨床試験は継続する可能性がある。臨床前研究の結果に加えて、INDは、臨床試験の目標、安全性を監視するためのパラメータ、および第1の段階が治療効果決定に寄与する場合に評価される有効性基準を詳細に示す1つまたは複数のプロトコルを含むであろう。INDはFDAが30日以内にINDを臨床的放置状態にしない限り、FDA受信後30日以内に自動的に有効になる。この場合,INDスポンサーやFDAは臨床試験開始前に未解決の問題を解決しなければならない。臨床保留はIND中の任意の時間に発生することができ、1つまたは複数の特定の研究またはIND下で行われるすべての研究に影響を与える可能性がある。
CGCPによると,すべての臨床試験は1名以上の合格研究者の監督下で行わなければならない。彼らは実験目標、投与手順、被験者の選択、
22
カタログ表
基準と評価されるべき安全性と有効性基準を排除する。各案およびいずれの修正案もINDの一部としてFDAに提出されなければならず,臨床試験結果を詳細に説明する進捗報告は少なくとも毎年FDAに提出されなければならず,それ以外の場合には深刻な有害事象の発生を含めてより頻繁に提出されなければならない。臨床試験に参加する各機関のIRBは、その機関の臨床試験が開始または継続される前に、プログラムおよび任意の修正案を審査および承認し、臨床試験に関する情報および各試験対象またはその法律代表に提供されなければならないインフォームドコンセントを承認し、研究が完了するまで監視し、他の方法でIRBの規定を遵守しなければならない。いくつかの臨床試験に関する情報は,そのClinicalTrials.govサイト上で公開伝播するために,特定の時間枠で米国国立衛生研究院に提出されなければならない。
人体臨床試験は通常3つの連続段階に分けて行われ、これらの段階は重複或いは合併する可能性がある
第1段階、第2段階、および第3段階試験は、任意の指定された期間内に成功しない可能性がある(あれば)。FDAまたはスポンサーは、研究対象または患者が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で臨床試験を随時一時停止または終了することができる。同様に、1つの臨床試験が委員会の要求に従って行われない場合、または薬剤が患者に予期せぬ深刻な傷害を与えた場合、IRBは、その所在機関の臨床試験の承認を一時停止または終了することができる。
新薬開発期間中、スポンサーは、INDを提出する前、第2段階の終了時、およびNDAの提出前を含むFDAと会う機会がある。他の時間に会議を開催することを要求することもできる。これらの会議は,スポンサーにこれまで収集してきたデータに関する情報を共有する機会を提供し,FDAにアドバイスを提供し,スポンサーとFDAに次の段階の開発について合意することができる。スポンサーは通常、第2段階終了会議を用いて彼らの第2段階臨床結果を検討し、重要な第3段階臨床試験の計画を提出し、あるいは新薬承認の試験を支持すると考えている。
小児科研究公平法案、あるいはPREAは、スポンサーがある薬物と生物製品に対して小児科研究を行うことを要求している。具体的には、PREAは、スポンサーが延期または免除を受けていない限り、新しい活性成分、新しい適応、新しい剤形、新しい投与レジメンまたは新しい投与経路の元のNDA、生物学的許可証申請またはBLASおよびそれらのサプリメントが小児科評価を含むことを必要とする。
臨床試験と同時に,会社は通常追加の動物安全性研究を完了し,薬物化学や物理特性に関する追加情報を開発し,cGMP要求に基づいて製品を生産するプロセスを最終的に決定しなければならない。製造過程は一貫して高品質の候補薬物ロットを生産することができなければならず、メーカーは最終薬物の品質、純度と効力をテストする方法を開発しなければならない。また,適切な包装を選択·試験し,候補薬物が賞味期限内に受け入れられない変質が生じないことを証明するために安定性研究を行わなければならない。
製品開発,臨床前研究および臨床試験の結果,および製造プロセス,薬物化学の分析試験,提案のラベルおよび他の関連情報の記述は,NDAの一部としてFDAに提出され,その製品を1つまたは複数の適応に使用することの承認が要求される。秘密協定の提出には使用料がかかりますが、特定の場合は免除されます。FDAは、それらが届出を受ける前に十分に完全であり、実質的な審査を行うことができることを確実にするために、提出されたすべてのNDAを審査する。それは秘密協定の申請を受け入れるのではなく、より多くの情報を提供することを要求するかもしれない。この場合、秘密協定と追加情報を再提出しなければならない。再提出された申請はFDAが届出を受ける前にも完全性審査を行う。
提出された申請が受け入れられると、FDAは深い検討を始めた。NDAは標準審査または優先審査を受けます。承認された場合、重篤な疾患または状態の治療、予防または診断の安全性または有効性において有意に改善される場合、優先的に審査を受けることができる医薬。優先審査の請求は一般的に提出しなければなりません
23
カタログ表
秘密保持契約を提出する時間。FDAはNDAの審査過程で具体的な業績目標を設定することに同意した。このプロトコルによれば、新しい分子実体またはNMEの承認を求める申請の90%は、FDAがNDAの提出を受けた日から10ヶ月以内に審査され、90%が“優先審査”に指定されたNME申請は、提出日から6ヶ月以内に審査される。非NME薬の承認を求める申請については,10カ月と6カ月の審査期間はFDAが申請を受けた日から開始した。FDAは、最初に申請を提出した後に申請を重大に修正することを考慮するために、審査過程を3ヶ月延長する可能性がある。
FDAは、製品がその予期される用途に対して安全かつ有効であるかどうかを決定し、その製造がcGMP要件に適合するかどうかを決定して、製品の安全性、識別、強度、品質、および純度を保証および維持するためにセキュリティプロトコルを検討する。FDAは、NDAを諮問委員会に提出して、その申請を承認すべきかどうか、どのような条件で承認すべきかを決定するために諮問委員会に提出することができる。FDAは諮問委員会の提案によって制限されていないが、それは一般的にそのような提案に従っている。
セキュリティ協定を承認する前に、FDAは、通常、製品の生産および試験の1つまたは複数の施設を検査する。これらの審査前検査は、薬品成分製造(例えば、活性薬物成分)、薬品完成品製造および制御試験実験室を含むNDAの提出に関連するすべての施設をカバーすることができる。さらに、NDAを承認する前に、FDAは通常、CGCPに適合することを確実にするために、1つまたは複数の臨床場所を検査する。さらに、FDAは、承認の条件として、リスク評価および緩和戦略またはREMS(配布および使用を制限する要件を含む場合がある)、ラベルの強化、特殊なパッケージまたはラベル、特定の有害事象の報告を加速させること、販売促進材料を事前に承認すること、消費者向け広告を制限すること、または承認後に追加的な研究を行うことを要求することができる。
NDAに対するFDAの評価および付随する情報によれば、FDAは、承認状または完全な返信を発行する可能性がある。承認書は、製品の商業マーケティングを許可し、特定の適応に関する具体的な処方情報を提供する。FDAが最終的にNDAが承認基準を満たしていないと決定した場合、FDAは完全な返信状を発行し、この機関が現在の形式のNDAを承認しないことを示す。完全な応答は、一般に、FDAによって決定されたNDA内のすべての特定の欠陥を記述する。完全な返信が発行された場合、出願人は、秘密協定を再提出し、手紙で決定されたすべての不足点を解決するか、または出願を撤回することができる。
審査を速める
FDAには、薬物開発および/または審査のプロセスを加速または簡略化することを目的とした、迅速なチャネルおよび優先審査を含む様々な計画がある。1つの薬剤がこれらの計画のうちの1つまたは複数に適合していても、FDAは、その薬剤がもはや資格条件に適合していないことを後で決定することができ、またはFDAが審査または承認する期間が短縮されない可能性がある。一般に,これらの計画に適合する可能性のある薬剤は,重篤または生命に危険な疾患を治療する薬剤,満たされていない医療ニーズを解決する可能性のある薬剤,既存の治療法よりも意義のある薬剤である。例えば、迅速チャネルは、未満足の医療需要を満たすために、非臨床または臨床データに基づく潜在力のある深刻な疾患を治療するために、臨床開発を促進し、薬物審査を加速することを目的としたプロセスである。優先審査は、重篤な疾患の治療安全性または有効性を著しく改善することを目的とした薬剤は、提出完了後8ヶ月以内(提出後6ヶ月)に迅速な審査を行い、標準新分子実体NDAの標準審査期間は、提出完了後12ヶ月(提出後10ヶ月)である。迅速チャネルおよび優先審査は承認基準に影響を与えないにもかかわらず、FDAは、迅速チャネル指定薬物のスポンサーとの早期かつ頻繁な会議を促進し、優先審査として指定された薬物の申請の審査を加速させるように努力する。
“現在、抗生物質奨励法案を生成する”、または“利得法案”と呼ばれ、新しいQIDPの発展にインセンティブを提供することが意図されている。スポンサーがNDAを提出する前に申請した後にQIDPの新薬に指定され,承認されれば,以前に資格を獲得した任意の排他期以降に5年の排他性を得る資格がある。また、QIDPは優先審査を受け、高速チャネル指定を取得する資格がある。QIDPsは、抗菌または抗真菌耐性病原体またはFDAによって決定される合格した病原体によって引き起こされる感染を含む、深刻または生命に危険な感染を治療することを目的とする抗菌または抗真菌薬として定義される。XERAVAとSul-durはFDAによってQIDPとして指定されている.ゾロシンもFDAから簡単な淋病を治療するQIDPに指定されている。
特許期間回復とデータ排他性
FDAが私たちの薬物使用の時間、期限、および詳細を承認したことによると、私たちのいくつかの米国特許は、1984年の“薬品価格競争および特許期限回復法”(一般にHatch-Waxman修正案と呼ばれる)に従って限られた特許期間の延長を受ける資格がある可能性がある。上述したように、Hatch−Waxman修正案は、製品開発およびFDA規制審査中に失われた特許期間の補償として、製品の単一特許を承認する特許回復期間を最長5年とすることを許可する。しかし、特許期間の回復は、1つの特許の残り期間を合計14に延長することはできない
24
カタログ表
製品が承認された日から数年、承認された医薬製品、使用方法、または製造方法に関する声明のみを延長することができる。承認された薬物に適用される特許は1つのみ延期する資格があり,延期出願は特許が満期になる前に提出されなければならない。米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。我々はXERAVAをカバーする米国特許の特許期間回復を出願しており、将来的には、臨床試験の期待長および関連秘密協定の提出に関連する他の要因に依存して、現在の満期日以降の特許寿命を延長するために、他の現在所有または許可されている特許の特許期間の回復を申請する可能性がある。
FDCA内のデータ排他性条項はまた、いくつかの申請の提出または承認を延期する可能性がある。FDCAは新しい化学実体秘密協定の承認を得た最初の申請者に5年間のアメリカ国内の非特許データ排他期を提供した。FDAが以前に同じ活性部分を含む他の新薬を承認していなければ,薬物は新しい化学実体であり,活性部分は薬物物質の作用を担う分子やイオンである。独占期間内に、FDAは、別の会社によって提出された短い新薬申請またはANDAまたは505(B)(2)NDAを受け入れない可能性があり、同社は、データ独占を得る権利がある薬物を参考上場薬またはRLDとして使用する。しかしながら、出願が特許無効または非侵害の証明を含む場合、4年後に提出することができる。FDAが、出願人が行っているまたは後援する新しい臨床研究(バイオアベイラビリティ研究を除く)が、既存の薬剤の新しい適応、用量または強度のような承認申請に重要であると考えている場合、FDCAはまた、NDA、505(B)(2)NDAまたは既存のNDAの補充に3年間のデータ排他性を提供する。この3年間の専門権は、新しい臨床研究に関連する使用または使用条件のみをカバーしており、FDAが元の活性物質を含む医薬の他の用途または使用条件へのANDAの承認を禁止していない。5年と3年の排他性は完全な秘密協定の提出や承認を延期したり承認したりしないだろう。しかしながら、完全なセキュリティプロトコルを提出する申請者は、その申請を支援するために、または安全かつ有効であることを証明するために必要なすべての臨床前研究および十分かつ制御された臨床試験の参照権を得るために、自己の臨床前および臨床研究を行うことを要求されるであろう。
さらに、上述したように、Gain Actによれば、QIDPとして指定された新薬は、申請が承認された後に取得する資格がある可能性のある他の独占期間、特に5年独占期間、3年独占期間、および孤児独占期間を増加させるために、追加の5年間独占期間を取得する資格がある。
小児科排他性
小児最適医薬品法は、スポンサーがFDAの書面請求又は書面請求に応じて児童臨床試験を行う場合、小児科排他的賞を付与する際に発効する特許及び排他期間以外の追加的な6ヶ月の排他性を追加的に提供することが規定されている。FDAは単独の書面請求で承認の適応を検討することができる。書面申請を出すことは、スポンサーにその研究を要求しない。今まで、私たちは書面の要請を受けていない。
承認後に要求する
承認された場合、規制要求や基準の遵守が維持されていない場合、または製品発売後に問題が発生した場合、FDAは承認を撤回する可能性がある。その後、1つの製品に以前未知の問題が存在し、安全問題を含み、この製品が制限され、甚だしきに至っては完全に市場から撤退する可能性があることを発見した。承認後、承認された製品のいくつかのタイプの変更、例えば、新しい適応の追加、製造変更、および追加のラベル宣言など、FDAのさらなる審査および承認を受ける必要がある。また、FDAは、商業化された承認製品の効果を監視するためにテストおよび監視計画を要求する可能性があり、FDAは、これらの上場後計画の結果に基づいて、製品のさらなる販売を阻止または制限する権利がある。FDAや他の当局はまた、処方薬の販売促進宣伝を行う可能性のある行為を厳しく規制している。FDCAによれば、承認された薬剤は、医師が医学的実践に従ってラベル外で使用される薬剤を処方することができるにもかかわらず、米国のスポンサーにおいて、承認されていないまたはラベル外の使用のための薬剤を宣伝してはならない。もし私たちがラベルの外での使用を普及させることが発見されたら、私たちは制裁、民事と刑事罰金、そして私たちが特定の販売促進行為に従事することを禁止する禁止を含む重大な責任を受けるかもしれない。
さらに、FDAによって生産または流通が許可された任意の医薬品は、FDAによって持続的に規制されており、ここには、以下のようなものが含まれる
25
カタログ表
薬品メーカーと他の生産と流通許可薬品に参与する実体はFDAとある州機関にその機関を登録し、FDAといくつかの州機関の定期的な抜き打ち検査を受けて、cGMP要求と他の法律を遵守する状況を理解しなければならない。
製品開発プロセス、承認プロセス、または承認後のいつでも、FDCAおよび他の適用される米国の要求を遵守できなければ、様々な行政または司法制裁を受ける可能性があり、いずれも実質的な悪影響を及ぼす可能性がある。これらの制裁には
国会は時々草案、提出、立法を通過し、これらの立法はFDA規制製品の承認、製造、マーケティングの法定条項を著しく変える可能性がある。さらに、FDAの法規およびガイドラインは、当機関によって、私たちの業務および製品に大きな影響を与える可能性がある方法で修正または再解釈されることが多い。立法変化が公布されるかどうか,あるいはFDAの法規,ガイドラインや解釈が変わるかどうか,あるいはこれらの変化の影響(あれば)が何になるかは予測できない。
外国監督管理
アメリカの法規のほかに、私たちは各種の外国法規の制約を受けて、これらの法規は私たちの製品の臨床試験及び商業販売と流通を管理しています。我々の製品がFDAの承認を得ているか否かにかかわらず,これらの国や地域で臨床試験や製品の販売を開始するためには,外国や経済地域(例えばEU)の比較可能な規制機関の承認を得なければならない。臨床試験、製品許可、定価と精算を管理する審査手続きと要求は地によって異なり、時間はFDA承認の時間より長い或いは短い可能性がある。
EU規制制度の下で、ある会社は、集中、分散、または相互承認の手続きに基づいて、または純粋な国家承認ルートの下でマーケティング許可申請を提出することができる。生物技術で生産された薬品またはエイズ、癌、神経変性疾患、糖尿病、ウイルス性疾患および孤児薬物などの特定の適応を指定するための新しい活性物質を含む薬品では、集中手順は強制的であり、他の高度に革新的な薬物には選択可能である。集中的な手続きの下で、マーケティング申請は欧州薬品管理局(EMA)に提出され、そこでは関連科学委員会(多くの場合は人用薬品委員会)によって評価され、良い意見は通常、欧州委員会がすべてのEU加盟国に有効な単一マーケティング許可を付与し、さらに(国が措置を実施した後)ノルウェー、アイスランド、リヒテンシュタインにもたらす。一般的に、初期マーケティング許可の有効期間は5年であるが、一旦更新されると、通常有効期限は制限されない。分散プロセスは、2つ以上のEU加盟国で同時にマーケティング許可申請を提出することを可能にし、製品が少なくとも1つの他のEU加盟国で許可されている場合には、相互認識プログラムを使用しなければならない。権限委譲と相互承認手続きは、1つの加盟国(“参照”加盟国と呼ばれる)に対して提出された申請に基づいて、1つまたは複数の“関連”加盟国によって承認されることを規定する。
分散承認手続きによれば、出願人は、参照加盟国及び関連加盟国に申請又はファイル及び関連資料を提出する。会員国たちが有効な申請を受けてから120日以内に評価草案と関連材料草案を作成することを参照する。参考加盟国の評価報告を受けてから90日以内に
26
カタログ表
関連会員国は彼らが公衆衛生に深刻な危険を発見しない限り、評価報告書と関連材料を承認しなければならない。相互承認手続きによると、関連加盟国は加盟国のマーケティング許可を参照するために同じ90日間の期間を持っている。いずれの場合も、公共健康の深刻なリスクに対する懸念は関連するEMA科学委員会によってアップグレードされ、論争の観点は最終的に人が薬品委員会で合意し、欧州委員会に提出される可能性があり、この委員会の決定はすべての会員国に対して拘束力がある。純粋な国家手続きは単一のEU会員国でマーケティング許可を得ることにつながる。
2016年の国民投票結果に続き、英国は2020年1月31日にEUを離脱し、2021年1月1日現在、英国とEUは単独の規制制度を実施している。2020年12月24日、イギリスとEUは、彼らの将来の関係を管理するための貿易·協力協定、すなわちTCAを達成したと発表した。EUが正式に承認される前に、TCAはまだ臨時的だった。TCAは,EUとイギリスの間を貨物が流れ続けることを確保し,製品規制や相互承認に影響を与えるために,薬品や医療機器を含む貨物貿易の新たな手配を規定している。
イギリスのEU離脱により、ある会社がイギリスでその製品を販売することを望むなら、適切な国家マーケティング許可を求めて維持する必要があるだろう。TCAは規制制度の大規模な相互承認を規定していないため,イギリスからEUに輸出される製品はEUの規制要求に適合しなければならない。これは製薬産業の脈絡で多くの影響を及ぼす。2020年1月31日から、英国は集中手続き下での承認決定を含むEU機関とその意思決定に参加しなくなった。また、イギリスからEUに進出した完成品薬品は第3国から輸入されたとみなされている。TCAはロットテストと放流の相互承認を規定していないため,製品はEUで品質管理テストと放行を行わなければならない。しかし、2023年1月までに市場に投入された製品については、イギリスはEUから輸入されたイギリス製品の一括テスト要求を一方的に免除する。これらの発展がどのようにイギリスの候補製品と製品に対する規制要求に影響するかはまだ観察が必要である。
精算する
FDAや他の政府当局が承認した製品のカバー範囲や精算状態には大きな不確実性がある。製品の販売は米国の連邦医療保険(Medicare)と連邦医療補助(Medicaid)などの政府健康計画、商業健康保険会社と管理型医療機関がこのような製品に保険を提供し、十分な精算レベルを確立する程度を含む第三者支払者にある程度依存する。支払者が商品に保険を提供するか否かを判定するプロセスは、保険が承認された後に支払者が製品に支払う価格または販売率を設定するプロセスと分離することができる。第三者支払者は、徴収された価格に挑戦し、医療の必要性を審査し、医療製品およびサービスの費用対効果を審査し、コストを管理するために制御を実施することが増えている。第三者支払者は、承認されたリストまたは処方内の特定の製品に保証範囲を制限することができ、これは、特定の適応のすべての承認された製品を含まない可能性がある。例えば,米国や主要な外国市場の多くでは,GIAPREZAやXERAVAのように病院で管理されている薬剤は病院で購入しなければならず,通常第三者支払者では精算されない。逆に,米国連邦医療保険診断関連グループ(DRG)システムや米国と大多数の主要外国市場が非連邦医療保険患者に対する他の類似システムにより,病院は患者の診断状況に応じて患者症例の精算を行っている。病院で管理されている新薬の採用は通常外来で服用している新薬よりも採用速度が遅く,後者は通常第三者支払者が費用を支払う。
販売が承認される可能性のある任意の製品の保険·精算を確保するためには、企業は、製品の医療必要性および費用効果、およびFDAまたは他の同様の規制承認を得るために必要なコストを証明するために、高価な薬物経済学的研究を行う必要があるかもしれない。それにもかかわらず、候補製品は医学的に必要または費用効果があると考えられないかもしれない。また、支払人が薬品に保険を提供することを決定することは、適切な販売率を承認することを意味するものではない。また、1人の支払人が1つの薬品に保険を提供することを決定し、他の支払者も当該薬品に保険を提供することができない。第三者補償は、製品開発投資の適切なリターンを達成するために、十分に高い価格レベルを維持するのに十分ではない可能性がある。
医療サービス提供者とのインタラクションを管理する医療保健法
FDAの薬品マーケティングに対する制限以外に、他のいくつかの州と連邦法律もいくつかのマーケティング行為を含む私たちの商業活動を制限した。これらの法律には、逆控除法、虚偽申告法、データプライバシーおよびセキュリティ法、および医療提供者への支払いまたは他の価値項目に関する透明性法が含まれるが、これらに限定されない。
連邦反リベート法規は、購入、レンタル、注文または購入、レンタルまたは購入の手配、レンタルまたは手配、Medicare、Medicaidまたは他の連邦医療計画に従って精算可能な任意の医療項目、商品、施設、またはサービスの見返りとして、インフォームドコンセントおよび意図的な場合に提供、支払い、請求、または報酬を受けることを禁止する。“報酬”という言葉
27
カタログ表
価値のあるものを含むと広く解釈されている。この法規は,薬品メーカーと処方者,購入者,処方管理人などの間の手配に適用されると解釈されている。いくつかの法定例外と規制避風港がいくつかの一般的な活動を起訴または他の規制制裁から保護しているにもかかわらず、例外と避風港の範囲は狭く、処方、購入または推薦の報酬を誘導することを目的としていると告発されたやり方に関し、例外または避風港の資格に適合しなければ審査される可能性がある。特定の適用された法定例外や安全港を規制するすべての要求を満たしていないことは、連邦反リベート法規に基づいて、このような行為自体が不法であることを意味するわけではない。代わりに、そのすべての事実と状況の累積審査に基づいて、この手配の合法性を逐案的に評価する。いくつかの裁判所はこの法規の意図要求を、報酬の手配に関連する任意の目的が連邦ヘルスケアカバーの業務への転換を誘導することであれば、連邦反リベート法規は違反されると解釈した。また、2010年の“患者保護·平価医療法案”は、2010年に“保健·教育和解法案”によって改正され、“平価医療法案”(ACA)を総称してより厳しい基準と呼び、個人や実体がこの法令やその法令に違反する具体的な意図を実際に知る必要がなくなり、違反行為を実施できるように、連邦“反リベート法令”に規定された意図基準を改正した。また、, ACAは判例法を編纂し、連邦民事虚偽請求法に基づいて、連邦反リベート法規違反による物品或いはサービスに対する支払いクレームは虚偽或いは詐欺的クレームを構成する。
民事虚偽請求法および民事罰金法を含む連邦虚偽請求法は、任意の個人または実体が故意に連邦政府に虚偽請求を提出することを禁止するか、または故意に虚偽陳述をしたり、クレームを支払うために虚偽陳述を引き起こすことを禁止する。これらの法律によると、製薬会社や他の医療保険会社は起訴されており、価格設定サービス機関に報告された薬品価格をつり上げた疑いがあり、価格設定サービス機関は逆に連邦医療保険や医療補助販売率を設定するために使用されており、顧客に製品を無料で提供する疑いがあり、顧客が製品の連邦計画に料金を請求することが予想される。また、ラベル外販売促進を含むいくつかのマーケティング行為も、虚偽申告法に違反していると告発されている。
1996年の連邦健康保険携帯·責任法案、またはHIPAAは、民間第三者支払人、医療福祉計画を故意かつ故意に流用または窃取し、医療保健違法行為の刑事調査を意図的に妨害し、故意に偽造、隠蔽または隠蔽し、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する重大な虚偽、架空または詐欺的陳述を行うことを含む追加の連邦刑事および民事法規を制定し、故意かつ故意に詐欺の任意の医療福祉計画を実行または実行しようとする計画を禁止している。連邦反リベート法規と同様に、ACAはHIPAA下のある医療詐欺の意図標準を改正し、個人或いは実体が実際に法規或いは法規違反の特定の意図を理解する必要がなく、違反を実施することができる。
また、私たちは連邦政府と私たちが業務を展開している州で公布されたデータプライバシーとセキュリティ法規の制約を受ける可能性があります。HIPAAは“経済と臨床健康情報技術法案”及びその実施条例の改正後、保険実体(即ちある医療保健提供者、健康計画と医療情報交換所)に対して個人が健康情報を識別できるプライバシー、安全と伝送に関連するいくつかの要求を提出した。他に加えて、HITECHは、HIPAAのセキュリティ基準を、カバーエンティティに代わってサービスを提供し、保護された健康情報を受信または取得する商業パートナー、独立請負業者、またはエージェントに直接適用させる。HITECHはまた4つの新しい民事罰金等級を作成し、HIPAAを改訂し、民事と刑事処罰を商業パートナーに直接適用し、州総検察長に新しい権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償または禁止令を要求して連邦HIPAA法を執行し、連邦民事訴訟に関連する弁護士費と費用を求めることができる。
さらに、ACAによって作成された連邦医師支払い陽光法案およびその実施条例に基づいて、いくつかの薬品、デバイス、バイオ製品および医療用品の製造業者は、Medicare、Medicaidまたは児童健康保険計画(いくつかの例外を除く)に従って、そのような法律で定義された医師、教育病院、または医師および教育病院の要求またはその指定された実体または個人を代表し、医師およびその直系親族が所有する特定の所有権および投資利益に関連する情報を含む保険受給者に毎年報告することを要求する。
ほとんどの州にも上記の連邦法律に類似した法規や法規があり、その中には一部の法規の範囲が広く、連邦医療補助や他の州の計画に基づいて精算するプロジェクトやサービス、あるいはいくつかの州では、支払者にかかわらず適用される。いくつかの州の法律は製薬会社に製薬業界の自発的コンプライアンスガイドラインと連邦政府が公布した関連コンプライアンスガイドラインを遵守することを要求している。さらに、いくつかの州の法律は、医薬品製造業者に、臨床医および他の医療保健提供者またはマーケティング支出および薬品定価に支払うことに関する情報を報告することを要求する。しかも、いくつかの州と地方の法律は薬品販売代表が免許を取得することを要求する。州法や外国法は健康情報のプライバシーやセキュリティを管理する場合もあり、多くの法律は互いに大きく異なり、HIPAAに先を越されず、コンプライアンス作業を複雑化させることが多い。
28
カタログ表
最後に,欧州連合“一般データ保護条例(2016/679)”(“GDPR”)には健康情報処理に特化した規定が掲載されている。GDPRは可能な重大な制裁を規定し、非EU会社を規制に組み込むための治外法権措置を含む。GDPRに加えて,ヨーロッパや世界の他の地方の個別国でも類似したデータプライバシー立法が制定されている.この法案は不適切な行為に巨額の罰金を科す可能性があることを含むコンプライアンス義務と規制リスクを増加させる。
医療やその他の改革は
アメリカでは、医療コストを制御するための多くの重要な立法計画が続いているだろう。連邦政府と州政府は、医療コストを低減する取り組みを含む、医療提供または支払いの改革を目的とした立法を継続して提出している。例えば,2010年3月,米国議会はACAを公布し,医療補助の拡大と個人医療保険の実施により医療カバー範囲を拡大し,政府ヘルスケア計画下での薬品のカバー範囲の変更や精算範囲の拡大を含む。トランプ政権政権中、ACAの全部またはいくつかの条項を修正または廃止する努力が行われている。例えば,2017年末に税制改正立法が公布され,ACAによる2019年から強制医療保険カバー範囲を維持しない個人設定に対する税収処罰が廃止された。ACAはまた司法的挑戦を受けた。2018年12月、複数の州総検事長が提起した挑戦の中で、ある連邦地域裁判所はACA全体が違憲と判断した。国会が個人権限条項を廃止すると、国会の税収権力に依存して法律の公布を支持する必要がなくなったからである。2019年12月、連邦控訴裁判所は、ACAの残りの条項も無効であるかどうかを決定するために、個人強制令が違憲である地域裁判所の判断を維持した。この事件はすでに米国最高裁判所に上訴しており、現在も裁決を待っている。
前トランプ政権の下では、医薬品の価格設定に重点を置いた取り組みなど、他にも改革措置があった。例えば、2018年の両党予算法案には、2019年からカバーギャップが50%から70%に向上した間、Medicare Part Dブランド医薬品メーカーがMedicare Part D受益者に割引を提供しなければならないことが含まれている。また、2018年、トランプ総裁と衛生·公衆サービス部長官は、処方薬の価格と自己負担コストを低減する“青写真”を発表した。青写真中のいくつかの提案、及び青写真以来提出された関連薬品の価格設定措置は、製薬業の運営と精算に重大な変化を招く可能性がある。衛生と公衆サービス部はすでにその中のいくつかの措置についてフィードバック意見を求め、同時にその現有の権力に基づいて他の措置を実施した。2020年11月20日、CMSはCMS革新センターを通じて臨時最終規則を発表し、この規則によると、薬品メーカーが一人当たりの国内総生産に比較可能性を有する経済協力と発展組織加盟国で販売されている薬品に対して、調整後、連邦医療保険B部分は“ある高コスト処方薬”の精算が最恵国価格(即ち最低価格)を超えない。2020年12月28日、カリフォルニア州北部の米国地方裁判所は、臨時最終規則の執行を禁止する全国的な予備禁止令を発表した。その中のいくつかの措置やその他の措置は発効するために追加の許可が必要である可能性があるが、国会議員やバイデン新政府は処方薬の価格を下げることが急務であると述べているが、バイデン政府がどのような措置をとるか、あるいはこれらの措置が成功するかどうかは不明である。
最近はまた、薬品コスト問題を解決する州立法努力が展開されており、これらの努力は一般的に薬品コストの透明性の向上或いは薬品価格の制限に重点を置いており、価格或いは患者の精算制限、割引、ある製品への参入の制限及びマーケティングコストの開示と透明性措置を解決し、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。
2019年、国会は新たな立法として2019年の“武装解除法案”を提出し、製薬会社の新しい抗生物質の開発に財政的インセンティブを提供した。この新しい立法はIDSAの意見を指導とし、患者が臨床的に適切な時に新しい抗生物質を獲得できることを確保することに役立ち、病院に抗生物質管理計画を確立し、抗生物質の使用と薬剤耐性を改善する報告を促進し、より迅速に挑戦を確定し、最適な実践を提供することを要求する。最近,この立法は2021年6月に米国衆議院で再提案され,社会保障法第18章を改正し,武装解除抗菌薬の開発と使用,その他の目的への利用を奨励することを目的としている。
一般的な立法コスト制御措置はまた私たちの製品候補製品の精算に影響を及ぼす可能性がある。改正された予算制御法は、医療補助(Medicaid)ではなく、2013年に医療サービス提供者に支払われた連邦医療保険(Medicare)を2%減少させ、国会が追加行動を取らない限り、2029年まで有効となる。大流行期間中に2%の削減が停止された;この一時停止は2021年3月31日に満了する予定だ。Medicare、Medicaid、または実施可能な他の公共援助または補助医療計画に影響を与える重大な支出削減、および/または私たちに徴収される可能性のある任意の重大な税金または費用は、私たちの運営結果に悪影響を及ぼす可能性がある。
29
カタログ表
2020年9月、米上院はHHS管理の購読契約計画を通じて、新抗生物質開発の革新を立て直すための立法を提案した。パスツール法の導入は,FDA承認後に指定された“緊急抗微生物”薬に資金を提供するメカニズムを提供するためである。その見返りに、連邦保険計画でカバーされた患者はこれらの薬を無料で得るだろう。パスド法案によると、これらの契約の価値は7億5千万ドルから30億ドルの間になる可能性がある。パスツール法案や似たようなインセンティブ計画がいつ、または法律になるかどうかは不明だ。2021年10月、PACCARBは衛生·公共サービス部秘書Xavier Becera閣下に手紙を書き、武装解除とパスツールおよび各法案に含まれる抗微生物管理条項を提案した。
連邦や州レベルで新しい立法が採用されれば、販売が承認されれば、私たちの現在または未来の製品の需要や定価に影響を与える可能性がある。しかし、私たちはACAや他の連邦や州改革努力の任意の変化の最終的な内容、時間、または影響を予測することができない。連邦や州医療改革が私たちの将来の業務や財務業績に悪影響を与えないことは保証されない。
その他の法律法規
米国上場企業としては、米国証券取引委員会(“米国証券取引委員会”)の監督活動に関する法律や、我々普通株がその取引をしているナスダック資本市場の法規を含む様々な財務開示や証券取引法規を遵守しなければならない。我々はまた安全作業条件、実験室やり方、動物実験用途に関する各種の法律と法規の制約を受けている。
知的財産権
私たちのビジネス成功は、私たちの候補製品、私たちのコア技術、および他のノウハウの独自または知的財産権保護を獲得し、維持する能力にある程度依存します。これをするためには、私たちは私たちの科学と技術者、そして私たちのコンサルタント、コンサルタント、他の請負業者のスキル、知識、経験に頼っています。私たちが特許を申請できないノウハウを保護するのを助けるために、私たちは商業秘密保護と秘密保護協定に基づいて私たちの利益を保護する。私たちは、従業員、コンサルタント、コンサルタントに秘密協定を締結し、機密情報の開示を禁止し、私たちの業務に重要な考え、発展、発見、および発明を開示し、分配することを要求します。私たちは知的財産権の地位を確立するために、私たちの主要候補製品に対して特許出願を提出した。これらの特許出願は、これらの候補製品に関連する新しい化学物質およびその製造プロセス、中間体、および疾患の治療のための使用を保護することを目的としている。
我々の商業製品、高級候補製品と各種化合物の知的財産権の組み合わせの概要は以下の通りである。
GIAPREZA
2023年2月15日現在、GIAPREZAに関するライセンス知的財産権組合®12件の出願された米国特許,2件の出願中の米国特許,8件の出願されている外国特許,15件の出願中の外国特許を含む。発行された米国特許および係属中の米国特許出願から発行される可能性のある特許は、2029年から2034年までの間に満了し、特許期限の免責声明、延期または調整は行われない。外国特許と審理中の外国特許出願が発行される可能性のある特許は2034年に満了し,免責声明,延長または調整特許はない。
GIAPREZAに関連する知的財産権の組み合わせは、2023年2月15日現在、発行された米国特許3件、係属中の米国特許8件、発行された外国特許7件、係属中の外国特許10件を含む。発行された米国特許および係属中の米国特許出願から発行される可能性のある特許は、2034年から2044年までの間に満了し、特許期限の免責声明、延期または調整は行われない。外国特許、及び未解決の外国特許出願から発行される可能性のある特許は、2034年から2044年の間に満了し、特許期間を延長、延長または調整することは何の免責声明もない。
XERAVA
我々は、2023年2月15日現在、XERAVAに関連する米国特許2件、出願中の米国特許1件、ライセンスされている外国特許17件、出願中の外国特許4件を有している。発行された米国特許と未解決の米国特許出願から発行される可能性のある特許の期限は2029年8月7日であり,免責声明,延期または特許期限調整は何もない。1つの米国特許期間は、508日間の特許期限調整を受けている。外国特許、及び未解決の外国出願から発行される可能性のある特許は、同様に2029年8月7日の満期日を有し、免責声明、延期又は特許期限調整は何もない。
2023年2月15日現在,XERAVAの物質組成と用途をカバーした欧州2323972号特許に基づく補充保護証明書出願も提出された。いくつかの申請は承認され、他の申請は待っている。
30
カタログ表
また、2023年2月15日現在、我々は、結晶形態のイラバサイクリンに関連する2つの承認された米国特許、1つの係属中の米国特許出願、11件の係属中の外国特許出願を有しており、いずれの係属特許出願からの米国特許も2037年に満了し、免責声明、延期、または特許期限の調整を必要としない。同様に、未解決の外国特許出願から発行される可能性のあるいかなる外国特許も2037年に満了する。我々はまた,出願されている米国特許5件,出願中の米国特許1件,出願済み外国特許32件,テトラサイクリン関連他の知的財産権17件の外国特許出願を有している。
|
|
アメリカです |
|
外国.外国 |
||||||||
説明する |
|
発表されました |
|
未定である |
|
満期になる |
|
発表されました |
|
未定である |
|
満期になる |
GIAPREZA |
|
15 |
|
10 |
|
2029 - 2044 |
|
15 |
|
25 |
|
2034 - 2044 |
XERAVA |
|
4 |
|
2 |
|
2029 - 2037 |
|
17 |
|
15 |
|
2029 - 2037 |
他にも |
|
5 |
|
1 |
|
2030 - 2037 |
|
32 |
|
17 |
|
2033 - 2037 |
ドゥロバタン
我々のドゥロバタン計画の知的財産権の組み合わせは、ドゥロバタンおよび他の化学類似体に対する物質組成物の特許出願を含み、合成方法と呼ばれる製造方法、ならびにドゥロバタンを1種以上の抗生物質化合物と組み合わせて使用する使用方法および治療モードを含む。2023年2月15日現在、我々は、発行された4つの米国特許、1つの出願中の仮出願、1つの保留PCT出願、107件の発行された外国特許、および出願中の6つの外国特許を有しており、そのうちの2つは許可されている。承認された外国特許は、オーストラリア、EU、カナダ、中国、香港、イスラエル、インド、日本、マカオ、メキシコ、ニュージーランド、フィリピン、ロシア連邦、シンガポール、南アフリカ、韓国、台湾、イギリスを含む複数の司法管轄区域に分布している。発行された米国と外国特許および出願中の米国と外国特許の満期日はそれぞれ2033年4月と2043年4月となる。
ゾリロ星
我々のゾロシン知的財産権の組み合わせは、ゾロシンおよび他の化学類似体に対する物質組成物の特許出願、ならびに合成方法、使用方法および治療パターンを含む。2023年2月15日現在、私たちは7つの発行された米国特許、74件の発行された外国特許、および出願中の2つの外国特許を持っている。発行された外国特許は、オーストラリア、ブラジル、カナダ、中国、ユーラシア大陸、EU、香港、インド、イスラエル、日本、メキシコ、ニュージーランド、フィリピン、シンガポール、南アフリカ、韓国、台湾、イギリスを含む複数の司法管轄区域に分布している。発行された米国と外国特許および出願中の米国と外国特許の満期日はそれぞれ2029年10月,2034年1月,2035年5月である。
商標、ビジネス秘密、ノウハウ
私たちの商標組合は現在、米国、EU、日本、アルゼンチン、オーストラリア、ブラジル、カナダ、インド、メキシコ、ノルウェー、ロシア連邦、韓国、スイス、台湾、トルコ、イギリス、および他の司法管轄区域で処理される出願を含む複数の司法管轄区域における様々な登録商標およびサービス商標権を含む。私たちの製品とサービスのアメリカと各国際司法管轄区域での発展と向上に伴い、私たちは常に私たちの商標の保護を創造し、適切な場合に商標とサービス商標を追求することでその価値を高めることを求めています。特許と商標保護に加えて、私たちは非特許商業秘密とノウハウ、そして持続的な技術革新に依存して、私たちの競争地位を発展させ、維持しています。私たちは、私たちのビジネスパートナー、協力者、従業員、コンサルタントとの秘密協定、および私たち従業員との発明譲渡協定の一部を使用して、私たちの独自の情報を保護することを求めています。これらのプロトコルは、我々の独自の情報を保護し、発明譲渡プロトコルの場合、第三者との関係によって開発された技術の所有権を付与することを目的としている。このような合意は違反されるかもしれないし、私たちはどんな違反にも対応する十分な救済策がないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。私たちのビジネスパートナー、協力者、従業員、およびコンサルタントが、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利に関する紛争が生じる可能性がある。
私たちはSarissa Capitalとの戦略的パートナーシップ
戦略諮問協定
2020年12月11日、我々はSarissa Capital Management LP(“Sarissa Capital”)と戦略コンサルティング協定(“サービス協定”)を締結し、この合意に基づいて、Sarissa Capitalは様々な戦略サービスを提供してくれ、協力してくれた
31
カタログ表
私たちの買収戦略の策定と実行過程で、私たちは私たちの資産と潜在的な収入源を多様化するために努力してきた。Sarissa CapitalはInnovivaへの投資と私たちの取締役会でのそれの代表であるため、関連者とみなされている。
共同契約
2020年12月11日,我々の完全子会社Innoviva Strategic Partners LLC(“戦略パートナー”)は引受契約および改訂および再予約された有限パートナーシップ(“パートナーシップ合意”)を締結し,これにより,戦略パートナーはISP Fund LP(“パートナーシップ”)の有限パートナーとなる.この共同企業の一般パートナーはSarissa Capitalの付属会社であり、1つの投資管理協定に基づいて、Sarissa Capitalはこの共同企業の投資顧問を担当する。戦略的パートナーはこのパートナーシップに3億ドルの初期寄付を提供した。同組合設立の目的は,医療,製薬,バイオテクノロジー業界の株式証券への投資である。
2021年5月、戦略パートナーは共同企業から1.1億ドルの割り当てを獲得し、GSKが保有する株式を戦略的に買い戻すための資金を提供してくれた。戦略的パートナーシップ、パートナーシップ、Sarissa Capital Fund GP LPが2021年5月20日に締結した書面合意によると、戦略パートナーはパートナーシップに追加の資本金を提供することに同意し、総額は2022年3月31日までの2021年5月に割り当てられた金額に相当する。2022年第1四半期に1億1千万ドルを寄付する。
人力資本
2022年12月31日現在、101人の従業員がフルタイムで働いています。私たちの従業員は労働組合代表もなく、集団交渉合意のカバー範囲もなく、私たちは従業員との関係が良いと思います。私たちはまたコンサルタントを招聘し、必要に応じて第三者と契約を結び、追加資源を提供して私たちの業務活動を支援します。
私たちの主な人的資本管理目標は、私たちの新入社員と既存従業員を識別、採用、統合、維持、激励することだ。私たちは私たちの給与と福祉計画が合格した人材を誘致して維持するために設計されたと信じている。従業員は年間基本給を受け取り、業績ベースの現金ボーナスを得る資格がある。成功した労働環境を創出し維持するために、私たち全員の従業員とその家族の心身の健康と健康、そして柔軟な仕事の手配を支援するために、包括的な包括的な追加福祉を提供します。しかも、私たちは従業員に会社の業績を共有させるために株式奨励を与えた。CEOは定期的に私たちの取締役会や委員会にこれらの人的資本の動向や活動の運営や状況を通報します。
多様性公平性包括性
私たちは、わが社の価値観と行動規範の一貫性を保ちながら、個人の発展を促進する環境を作った。多様性、公平、包摂性に関する外部資源からのシンポジウム、またはDei、ベストプラクティスを提供し、私たちの職場のすべての人の公平な待遇と十分な参加を促進します。
健康、安全、健康
私たちは生命科学業界で市場競争力のある報酬、福祉、その他の従業員サービスを提供し、従業員を誘致し、維持するためのインセンティブメカニズムを創造するように努力している。私たちの給与プランには、市場競争力のある報酬、株式オプション、制限株式単位、ボーナス、従業員の現場奨励、医療·退職福祉、有給休暇、帰省休暇が含まれています。私たちは第三者コンサルタントを利用して私たちの報酬慣行を毎年検討して更新する。従業員の持続的な発展にも取り組み、内部研修や教育計画、第三者オンライン訓練計画を通じて従業員にさらなる発展の機会を提供しています。
私たちの執行官に関する情報は
次の表には、2023年2月28日までの各役員の名前、年齢、ポストを示しています
名前.名前 |
|
年ごろ |
|
務めたポスト |
パヴィル·レフェルト |
|
39 |
|
最高経営責任者 |
マリアンヌ·ジェーン |
|
54 |
|
首席会計官 |
パヴィル·レフェルトCFAは、2020年5月にCEOに任命された。任命される前に、RaifeldさんはSarissa Capital Management LPの投資チームに勤めていた。これまで、スイスの信用証券(米国)有限責任会社医療保健投資銀行チームの上級メンバーだった。以前、Raifeldさんはマッキンゼーとボストンコンサルティング株式会社のコンサルタントを務めており、主にバイオ製薬会社のコンサルタントであります。Raifeldさんはハーバード大学のAB号、コロンビア大学のMBA号を取得しています。
32
カタログ表
マリアンヌ·ジェーン公認会計士、2018年7月に首席会計官に任命された。2014年10月にInnovaに入社する前、甄子丹さんは2012-2014年にSteelwedge Software Inc.の企業財務総監、2011-2012年にIntelmate社の財務総監、2007-2011年にModel N,Inc.社の財務総監を務めた。これまで、甄子丹はCalCPA半島シリコンバレー分会の取締役会メンバーを務めていた。甄子丹はサンフランシスコ州立大学会計学科を卒業し、工商管理学士号を取得した。彼女は米国公認会計士協会(AICPA)とカリフォルニア公認会計士協会(CalCPA)のメンバーだ。
“ビジネス行動規範”
会社はすべての役員、高級管理者、従業員に適用されるInnoviva,Inc.ビジネス行動指針を採択した。2021年3月9日に改訂された“ビジネス行動基準”は、当サイトのコーポレート·ガバナンス部分で取得することができます。URLはWwwv.inva.comそれは.当社が“商業行為準則”をいかなる実質的な改正を行った場合、又は任意の役員又は取締役に当該等の遵守を免除する任意の規定の権利を付与した場合、当社は適用法律の要求に従って修正又は放棄の性質を直ちに開示する。
利用可能な情報
私たちのホームページの住所はWwwv.inva.comそれは.私たちの投資家関係サイトはHttp://investor.inva.comそれは.我々は、我々の投資家関係サイト上の“米国証券取引委員会届出”の項目の下で、Form 10-K年次報告、Form 10-Q四半期報告、Form 8-K現在の報告、当社の役員および上級管理者第16条の報告、および米国証券取引委員会にこのような材料を届出または提供した後、これらの報告の任意の修正を無料で提供する。私たちのウェブサイトの情報は私たちがアメリカ証券取引委員会に提出したこの報告書や他の任意の報告書の一部ではない。InnovivaおよびInnovivaロゴは、Innoviva,Inc.の登録商標である。本報告に登場する他社の商標、商号またはサービスマークは、それぞれの所有者の財産である。
第1 A項。リスク要因
リスク要因の概要
当社は複数のリスクに直面しており、実現すると、その業務、財務状況、経営結果、キャッシュフロー、流動資金獲得に大きな影響を与える可能性があります。当社の業務は、不確定要素とリスクの影響を受けています
33
カタログ表
私たちの業務に関わるリスク
現在、私たちの収入の大部分はグラクソ·スミスクラインから来ており、私たちの最近の成功はグラクソ·スミスクラインと協力した呼吸器プロジェクトの製品の開発と商業化に成功できるかどうかに大きく依存している。
グラクソ·スミスクラインの合意によると、グラクソ·スミスクラインは協力呼吸計画における製品の開発と商業化を担当している。Relvarの特許使用料収入®/Breo®エリプタ®アーノロと®エリプタ®私たちの予測可能な未来のGSK収入の大部分を占めると予想される。このような特許権使用料の収入額や時間は不明であり、非常に不確実である。私たちの最近の成功は、GSKがGSKプロトコルでの商業的義務を履行することと、Relvarの商業的成功に大きく依存している®/Breo®エリプタ® アーノロと®エリプタ®それは.グラクソ·スミスクラインのマーケティングと販売活動を制御することはできません。グラクソ·スミスクラインは成功しないかもしれません。これは私たちの業務を損害し、私たちの証券の価格を下落させます。
私たちの四半期の特許使用料収入は様々な要素によって変動する可能性があります。その多くの要素は私たちがコントロールできるものではありません。私たちが受け取った印税とマイルストーンの支払いは、以下の要素を含む多くの要素に依存するだろう
34
カタログ表
FDAまたは他の適用可能な規制機関がRelvarと競合する模倣薬を承認する場合、Advairの模倣薬を含むが、これらに限定されない®/Breo®エリプタ®Anoroと®エリプタ®あるいはRelvarの一般的な形は®/Breo®エリプタ®GSKプロトコルによって支払われる特許権使用料は予想を下回ることになり、これは逆に私たちの業務を損なうことになり、私たちの証券の価格は下がる可能性があります。
米国国外のNDAまたはマーケティング許可申請が承認されると、カバーされた製品は“上場薬物”となり、さらに米国でのANDAの承認を支持するために潜在的な競争相手に引用されることができる。米国医薬品監督管理局の法規および他の適用される法規および政策は、ANDAまたは他の模倣薬代替品の申請が米国および世界各地のほぼすべての薬品市場で承認されることを促進するために、メーカーが薬物の非侵害修正バージョンを作成することを奨励する。多くの会社がICS/LABA薬Advairの後発薬を市場に出している®ある特許がAdvairをカバーしているため®交付設備は2016年に満期になった。一般的に、FDAの2013年9月の指導文書草案によると、これらのメーカーは一連の臨床治療効果、薬物動態学と設備研究を行い、Advairと等価であることを証明しなければならない。これらの研究は、模倣薬とブランド製品が同じ活性成分、剤形、強度、暴露と臨床治療効果を有することを証明することを目的としている。これらの後発薬はブランド製品と同じ厳格な品質基準に適合しなければならず、それを市場に出すコストは大幅に低下する可能性があり、模造薬を生産する会社は通常より低い価格で製品を提供することができる。したがって、後発薬競争者を導入した後、任意のブランド製品およびそのようなブランド製品と競合する可能性のある製品の売上の大部分は、通常、後発薬製品に流出する。
2019年1月、MylanはFDAがAdvair Diskusの最初の疑似製薬WixelaInhu(プロピオン酸フルチカゾンとサメテロール吸入粉、USP)を承認したと発表した®それは.Tevaは同月、FDAが青少年と成人喘息患者のための2つの製品を承認したと発表し、そのうちの1つはAirDuoRespiClickである®(プロピオン酸フルチカゾンおよびサルメテロール吸入粉)、Advairの非AB代替後発薬®それは.2020年1月、アストラ·ジェリコンはライセンス後発薬Symbiortを発売した。2020年12月、Hikma/VecturaはFDAの承認を発表し、GSKのAdvair Diskus模造バージョンを発売した®.
FDAは2016年4月、Relvarで使用されている有効成分であるフラシリン/ビランテロール(FF/VI)をカバーするガイドライン草案を発表しました®/Breo®エリプタ®それは.RelvarのようなICS/LABA製品と競合する非特許製品を発売する®/Breo®エリプタ®将来の特許使用料収入、収益性、およびキャッシュフローに大きな悪影響を及ぼすことになります。これらの模倣薬と将来承認された後発薬がRelvarの販売にどのような影響を与えるかはまだ確認できません®/Breo®エリプタ®あるいはアーノロ® エリプタ®承認されれば。
政府、支払人または競争または他の医療コスト制御措置(例えば、使用制限)による価格および販売率の低下により、GSKプロトコル下で生じる特許権使用料に悪影響を及ぼす可能性がある。
政府、薬品福祉管理組織(PBM)、保険会社、管理医療組織および他の医療コスト支払者が医療コストをコントロールまたは低減するための持続的な努力は、Relvarの価格、市場参入と総収入に悪影響を与えた®/Breo®エリプタ®Anoroと® エリプタ®そうかもしれません
35
カタログ表
未来に彼らに影響を与える。また、私たちはより多くの競争活動を経験し、引き続き経験することが予想され、これは私たちの製品全体の価格を低くする。
“患者保護及び平価医療法案”(Patient Protection and Affordable Care Act of 2010,PPACAと略称する)や他の医療·保険事務に関する立法又は規制要求又は潜在的な立法又は規制行動、並びに米国管理型医療保健の傾向は、医療製品の購入に悪影響を与え、私たちの協力製品に対する需要と価格を低下させる可能性がある。これはグラクソ·スミスクラインが私たちの協力製品をマーケティングする能力を損なう可能性があり、将来の収入を著しく減少させるかもしれない。例えば、GSKがRelvarを発売した場合®/Breo®エリプタ®2013年10月、グラクソ·スミスクラインはアメリカで慢性閉塞性肺疾患を治療し、いくつかの最大のPBM、医療保険支払者と提供者がカバー範囲を獲得し、予想を下回る全体価格の面で、巨大な挑戦に直面している。特に米国PBMの最近の行動は、呼吸システム製品の割引レベルを高め、私たちが協力した製品は低い純販売定価を実現した。また、ある外国市場では、処方薬の定価は政府によってコントロールされており、精算が得られない場合もある。私たちは価格設定圧力が引き続き存在し、増加するかもしれないと思う。これは、GSKが私たちまたはGSKが受け入れられる価格で私たちの協力製品を販売することを困難にするかもしれませんし、私たちのアナリストや投資家の予想と一致した収入を生み出すことも困難であり、これは私たちの証券の価格を下落させるかもしれません。
最近、大統領政府および米国議会は、PPACAの改正または代替に努力し、医薬品価格設定に関する提案された立法を含む医療システムの他の改革を実施または採択するために行動している。提案可能な任意の潜在的変化と我々の業務への影響(あれば)には不確実性があり,PACA認可の計画に含まれる医療項目やサービスのカバー範囲や精算の影響を含む。しかし,医療改革立法の最終的な内容,時間,効果を予測することもできず,潜在的な立法が我々に与える影響を予測することもできない。
私たちは、より多くの州および連邦医療改革措置を検討し、取ることが可能であると予想され、いずれも、連邦および州政府が医療製品およびサービスのために支払う金額を制限する可能性があり、これは、承認されると、私たちの製品の需要の減少または追加の価格設定圧力を招き、私たちの経営業績に悪影響を及ぼす可能性がある。
私たちの現在の収入の一部はGSK、Relvarと協力して私たちの呼吸製品を販売する特許使用料から来ています®/Breo®エリプタ® アーノロと®エリプタ®それは.私たちの協力製品の適応の治療パターンが変更されることが承認された場合、またはGSKがこれらの製品の販売を維持または増加させるのに十分な資源を投入できないか、または増加し続ける場合、私たちの運営結果は悪影響を受けるであろう。
私たちは現在、グラクソ·スミスクラインと協力した製品の販売印税に部分的に依存しており、私たちの既存の業務を支援しています。慢性閉塞性肺疾患と喘息の治療モードは絶えず変化している。例えば,2018年11月にGOLDガイドラインが改訂され,気管支拡張剤単一療法とLABA/LAMA療法をICS/LABA療法の前に置き,患者がしばしば悪化しない限り,あるいは好酸球数が1立方マイクロリットル300を超えない限りCOPDの治療に用いられた。三連療法(LABA,LAMA,ICS)を必要とする患者でもCOPDにICSを使用することが推奨されている。治療パターンがさらに変化した場合、私たちの協力製品の寵愛が失われるか、またはGSKがRelvarを維持または増加させるのに十分な資源を投入できないか、または継続的に増加させる®/Breo®エリプタ®アーノロと®エリプタ®販売、私たちの運営結果は影響を受けるかもしれません。私たちの証券価格は下がるかもしれません。
Relvarが商業化すれば®/Breo®エリプタ® アーノロと®エリプタ®規制の承認を受けた国/地域でどんな遅延や不利な事態に遭遇したり、遅延や不利な事態の発展を感じたり、あるいは販売や支払者のカバー範囲が投資家、アナリスト、または私たちの予想に合わない場合、私たちの業務は損なわれ、私たちの証券の価格は下落する可能性があります。
パートナーのグラクソ·スミスクラインとの合意によると、グラクソ·スミスクラインはRelvarの商業化を完全に担当している®/Breo®エリプタ® アーノロと®エリプタ®それは.グラクソ·スミスクラインはRelvarを発売した®/Breo®エリプタ® アーノロと®エリプタ®多くの国で、アメリカ、カナダ、日本、イギリス、ドイツなどが含まれています。市場に投入された国での製品の商業化と新国での商業化投入は依然として全体的な定価レベルの変動と支払人のカバー範囲を獲得する不確定な時間枠の影響を受けている。Relvarの商業化に関連する任意の遅延または不利な発展、または感じる追加の遅延または不利な開発®/Breo®エリプタ®アーノロと®エリプタ®販売または支払人のカバー範囲が投資家、アナリスト、または私たちの予想に合わない場合、私たちの業務を深刻に損害し、私たちの証券価格が下落する可能性があることを含む。
36
カタログ表
私たちはグラクソ·スミスクラインに依存して商業化に成功し、グラクソ·スミスクライン協定に基づいて製品を開発した。グラクソ·スミスクラインがこれらの製品の商業化や開発のために十分な資源を投入していない場合、あるいは努力が失敗したり、そのビジネス計画の優先順位を再配置することを選択した場合、私たちの業務は実質的な損害を受けるだろう。
グラクソ·スミスクラインは、Relvarを含むグラクソ·スミスクライン協定に従って開発された製品のすべての臨床および他の製品開発、監督、製造、および商業化活動を担当する®/Breo®エリプタ®アーノロと®エリプタ®それは.多くの重要な要素のため、GSKプロトコル下での私たちの特許使用料収入は私たち、アナリスト、あるいは投資家の期待に達しないかもしれない。グラクソ·スミスクライン協定がカバーしている協力製品のほかに、グラクソ·スミスクラインには大量の呼吸製品の組み合わせがある。グラクソ·スミスクラインは、その製品の組み合わせについて、私たちと協力している呼吸系製品に有害とみなされる可能性のある決定または声明を下すかもしれない。例えば、グラクソ·スミスクラインは、私たちの協力製品の開発と商業化のための努力と資源の面で広範な裁量権を持つことを決定した。また、グラクソ·スミスクラインはその商業化努力を自分の製品に集中させることを決定するかもしれない。例えば2015年1月にグラクソ·スミスクラインはIncruseを発売しました®COPDを治療するラマである(UMEC)。グラクソ·スミスクラインはマーケティングをIncruseに重点を置くことを決定するかもしれません。これはAnoroの潜在的な市場シェアを低下させるかもしれません®エリプタ®私たちが受け取るかもしれないこのような製品の印税を下げますあるいはグラクソ·スミスクラインは市場に参入することを決定し、最終的にRelvarの販売と直接競争する可能性があります®/Breo®エリプタ®それは.グラクソ·スミスクラインが私たちの協力製品を商業化するのに十分な資源を投入しなかった場合、あるいはそのビジネス計画の優先順位を再配置することを選択すれば、私たちの業務、運営、株価はマイナスの影響を受けるだろう。
LABAを使用した喘息治療に関するFDAの政策またはガイドラインのいかなる不利な変化も、私たちの特許使用料収入を深刻に損なう可能性があり、私たちの証券の価格が低下する可能性があります。
2010年2月18日、FDAは、LABAは喘息の治療に単独で使用されるべきではなく、これらの薬剤の製品ラベルにこの警告を含むように製造業者に要求し、これらの薬剤の全体的な使用を減少させる他の措置をとると発表した。FDAが現在LABA薬を要求している製品タグは,LABAの使用は禁忌であり,吸入コルチコステロイドのような喘息コントロール薬を使用していないこと,LABAは喘息コントローラ薬が十分にコントロールできない患者でしか中長期的に使用できないこと,LABAは喘息症状コントロールを実現するのに要する最短時間で使用すべきであり,可能な場合には喘息がコントロールされると使用を中止すべきであることを反映している。また、2010年3月にFDAは、成人、青少年、小児喘息治療においてLABAを用いて重篤な喘息を治療した結果(例えば、入院、呼吸管を使用するプログラム、挿管または死亡と呼ばれる)を評価するために、医学研究研究の設計(“臨床試験設計”と呼ぶ)を検討する諮問委員会を開催した。また,2011年4月,FDAはLABAの安全性をさらに評価するために,現在市販されているLABAのメーカーに追加的な無作為,二重盲検,対照臨床試験を行い,吸入コルチコステロイドにLABAを添加したものと吸入コルチコステロイドのみの臨床試験を比較することを発表した。これらの発売後の研究はすでに完成し、FDAはLABAとICSの連合による喘息の治療はICS単独治療よりもっと深刻な喘息関連副作用を招くことはないと述べた。FDAは、その後、ICS/LABAパッケージ挿入ページからブラックボックス警告を削除した。この懸念は解決されたようであるが,もしあれば何が起こるかは不明である, 将来の懸念は、ICS/LABAの使用およびFF/VIの将来性への潜在的な影響に影響を与える可能性がある。LABAを使用した喘息治療に関するFDAの政策またはガイドラインのいかなる不利な変化も、私たちの業務を深刻に損なう可能性があり、私たちの証券の価格は下落する可能性がある。
RelvarやRelvarの規制の地位に不利な発展は®/Breo®エリプタ®あるいはアーノロ®エリプタ®彼らが規制承認を受けた国/地域では、ラベル制限、安全発見、または任意の他の使用制限を含めて、私たちの業務を損ない、私たちの証券の価格下落を招く可能性がある。
相対的だけど®/Breo®エリプタ® アーノロと®エリプタ®これらの製品はすでに多くの国で承認され、発売されているが、もし新しい安全問題が発見され、治療ガイドラインを変更したり、新しい研究が製品の利益を証明できなかったら、これらの製品の監督管理状態は不利な変化が発生する可能性がある。多くの有名な医薬製品は商業化の過程で不利な発展を経験し、製品が撤回され、承認の用途が制限されたり、新しい警告が増加したりする。もし私たちのどの製品にも不利な規制変化が発生すれば、私たちの業務は損害を受け、私たちの証券価格は下落するかもしれない。
37
カタログ表
COPDのためにFF/VIの喘息またはCOPDのために行われている任意の研究、またはCOPDのためのUMEC/VIの研究、または将来の研究は、我々の業務を深刻に損なうことになり、我々の証券の価格下落に関連する任意の不良発展または結果、承認されていない国/地域の規制機関が喘息またはCOPDのために行われているFF/VI研究または進行中のUMEC/VIのCOPDに対する研究が十分な安全性および有効性を示さないと判断した場合、FF/VIおよび/またはUMEC/VIの持続開発は著しく遅延する可能性があり、それらはこれらの規制機関の承認を得ない可能性がある。承認されても、それらは制限されたラベルによって制限される可能性があり、どのラベルも私たちの業務を損なう可能性があり、私たちの証券の価格は下落する可能性がある。
慢性閉塞性肺疾患や喘息に対するFF/VIの第3段階登録計画が完了したことを発表し,その中のいくつかの主要なデータを報告したが,FF/VIに関するより多くの研究が行われているか,あるいは将来的に開始される可能性がある。これらのプロジェクトの前、現在、または未来のいかなる研究に関連するいかなる不利な発展、または感じる不利な発展は、私たちの業務を深刻に損なう可能性があり、私たちの証券価格は下落する可能性がある。
FDA、欧州医薬品局、日本厚生労働省、カナダ保健省などの司法管轄区域でAnoroが承認されたにもかかわらず®エリプタ®それはまだすべての管轄区域で承認されていない。
提出されるべき他のFF/VI計画またはUMEC/VI計画に関連する他の不利な発展または結果または予想される不利な発展または結果は、私たちの業務を深刻に損なう可能性があり、私たちの証券価格は下落する可能性があります。このような不利な開発の例は、限定されるものではないが、これらに限定されない
相対的に言えば®/Breo®エリプタ®アーノロと®エリプタ®GSKや他の製薬会社が発見、開発、発売、商業化した製品は、ターゲット市場の予期される用途で激しい競争に直面しており、これは、LABA協力協定に従って私たちに支払われる特許使用料が予想を下回る可能性があり、これは、逆に私たちの業務を損なうことになり、私たちの証券価格の下落を招く可能性がある。
グラクソ·スミスクラインは監督部門の許可を得てRelvarを発売し商業化しています®/Breo®エリプタ®Anoroと®エリプタ®世界中のターゲット市場でのそれらの期待された用途。これらの製品は規制部門の承認を得て、米国やいくつかの他のターゲット市場で発売され商業化されているが、これらの製品はグラクソ·スミスクラインや他の競争相手が以前に開発·商業化した既存製品からの激しい競争に直面しており、将来的には同じ製薬会社や他のライバルから発見、開発、商業化された新製品の追加競争に直面する可能性もある。例えば汎用Advairの販売は®グラクソ·スミスクラインによって承認されたCOPDおよび喘息治療薬は、Relvarの販売に悪影響を与え続けている®/Breo®エリプタ®.
呼吸器市場で競争する多くの製薬会社は国際化されており、大量の財務、技術と人員資源を持ち、それらが消費者に競争力のある価格で、高効率と低コストの方式で発見、開発、監督管理の許可を得て、新製品を商業化することができるようにした。また、多くの競争相手は大量の商業インフラを有し、その製品を効率的かつ低コストで商業化し、競争力のある価格で消費者にサービスを提供することに寄与する。時間の経過に伴い、慢性閉塞性肺疾患と喘息を治療するための製品の市場は引き続き重大な革新と製品の発売コストの低下を経験している。Relvarは保証できない®/Breo®エリプタ®アーノロと®エリプタ®消費者にとってより効果的でコストの低い新製品に取って代わられるとは思わないだろう。相対的な能力®/Breo®エリプタ®Anoroと®エリプタ®成功して予想される販売水準に達するためには
38
カタログ表
グラクソ·スミスクラインの商業·開発実績は、目標市場で同じ期待用途を持つ他の製品と比較した競争優位を実現し、維持するためである。
Relvarを販売すれば®/Breo®エリプタ®アーノロと®エリプタ®商業化市場における既存または将来の競争には、より低コストまたはより効果的と考えられる既存および新製品からの競争が含まれているため、私たちが支払う特許権使用料は予想を下回る可能性があり、これは逆に私たちの業務を損ない、私たち証券の価格を下落させることになる。
私たちは私たちが繰り越したすべての純営業損失を利用できないかもしれない。
私たちは純営業損失の繰越や他の重要なアメリカの税務属性を持っていて、アメリカでの他の課税収入を相殺できると信じています。全体の分譲取引の一部として、私たちはTheravance Biophmaにいくつかの資産を譲渡し、Theravance Biophma普通株の流通は1986年の国税法(改正)(以下“規則”と呼ぶ)や財務省条例の適用条文による課税譲渡につながりました。吾らがTheravance Biophmaにいくつかの資産を譲渡して確認した課税収益は,一般に譲渡された資産ごとの公平市価が当該等資産の調整された課税基準の部分を超えていることに等しい。我々はTheravance Biophmaに移行した現金に関するいかなる収益も確認していないが,Theravance Biophmaに移行した他の資産(現金を除く)の公平な市場価値から重大な収益を確認する可能性がある。これらの資産の公平な市場価値の決定は主観的であり,米国国税局(IRS)の調整や将来の挑戦を受ける可能性があり,譲渡により実現された収益額が増加する可能性がある。私たちの資産をTheravance Biophmaに譲渡する際に確認された任意の収益によって生じる米国連邦所得税(その後、譲渡資産のより高い公平な市場価値がもたらす可能性のある任意の増加した米国連邦所得税を含む)は、私たちの純営業損失の繰越から差し引かれるかもしれない。いずれの年度も当社の課税収入の純額を相殺することができる経営損失純額は、規則に基づいて定められたいかなる連続36ヶ月間の所有権変動が50%を超える(“所有権変動”)後に減少する。私たちの普通株の取引は私たちに支配されていない取引であっても, 例えば投資家のテスト期間内の購入または販売は、所有権変更を招く可能性がある。設立以来2022年12月31日までに所有権変更が発生したかどうかを決定する分析を行い、会社はテスト期間内に所有権変更がない可能性が高いと結論した。私たちの株式所有権や売却に対する後続の変化は、将来の純運営損失の効果を制限するかもしれない。上記の所有権変更規定により、何らかの年間使用制限が存在する可能性がある。また、純営業損失には繰越期があるため、満期までに十分な未来課税所得額を持つことができないかもしれない。連邦や州税法の純営業損失繰越に関する将来の変化は、このような純営業損失の制限や制限を要求する可能性もあります。もし繰り越した純営業損失が私たちにとって利用できなくなったり、十分に利用されたりすれば、私たちの将来の課税収入は、いくつかのアメリカ連邦と州税免除なしに連邦と州所得税を免除することができなくなり、そうでなければ、一般企業用途に利用できる資金は減少する。
グラクソ·スミスクラインと協力した任意の呼吸器計画の候補製品が規制機関の承認を得ていない場合、または人体に安全でないか無効と判断された場合、私たちの業務は悪影響を受け、私たちの証券価格は下落する可能性がある。
どの新薬も米国で発売され販売される前にFDAの承認を得なければならない。私たちのパートナーのグラクソ·スミスクラインは、候補製品が商業販売に承認される前に安全かつ有効であることを証明するために、FDAおよび同様の外国の監督管理機関に臨床前および臨床研究データを提供しなければならない。FDAが秘密保持協定を承認する前に、グラクソ·スミスクラインは協力候補製品のこの承認を得ないだろう。FDAから規制承認を得て新製品をマーケティング·販売する過程は複雑であり、数年を要し、大量の資源支出に関連している。海外で薬品を販売するためには、各国で個別の規制承認を受けなければならない。承認手続きは国によって異なり、追加のテストに関連する可能性があり、承認を得るのに要する時間は、FDAの承認を得るのに要する時間とは異なる可能性がある。FDAの承認は他国の規制機関の承認を確保するものではなく、外国規制機関の承認も他国の規制機関またはFDAの承認を確保することができない。代わりに、1つ以上の国で承認を得られなかったことは、他の国で承認を得ることをより困難にする可能性がある。
グラクソ·スミスクラインと協力した候補製品に関する臨床研究では,これらの候補薬剤は無効であり,既存の承認された薬剤よりも劣る,毒性が許容できない,あるいは他の許容できない副作用があることが示唆される可能性がある。そのほか、臨床前研究の結果は必ずしも臨床成功を予測できるとは限らず、より大規模と後期の臨床研究は早期臨床研究と同じ結果を産生しない可能性がある。
一般に、早期臨床前または臨床研究において有望な結果を示す候補製品は、その後、重大な挫折を受け、またはその後の臨床または非臨床研究で失敗する。そのほか、潜在製品の臨床と非臨床研究は往々にして、これらの候補製品の開発を継続することは不可能或いは現実的ではないことを示している。もしこれらの研究が
39
カタログ表
グラクソ·スミスクラインと協力して開発された候補製品に重大な遅延が発生したり、その安全性と有効性を証明できない場合、GSKは規制機関のこのような候補製品の承認を得ることができない可能性があり、私たちの業務と財務状況は実質的な損害を受ける可能性があり、私たちの証券の価格は下落する可能性がある。
過去数年、FDAが発表したいくつかのよく知られている完全な返信及び安全に関連する製品のリコール、一時停止、承認後のラベル改訂は箱の警告と承認適応の変更、及び公衆と政府の安全問題に対する日々の厳格な審査を含み、保守的な監督環境を創造した。新しい法律法規の実施とFDA臨床試験設計ガイドラインの改訂は新薬承認の不確定性を増加させた。また,新薬の承認には新たな化学実体の諮問委員会会議,FDAが適宜決定した本格的なリスク評価と緩和戦略を含む追加的な要求がある。これらの法律、法規、追加の要件、および解釈の変化は、GSKと協力する任意の呼吸器計画における任意の候補製品のFDAの審査および承認作業が承認されないか、またはさらに遅延される可能性がある。
グラクソ·スミスクラインと協力した呼吸器プロジェクトの候補品が規制部門の承認を得ても、Relvarの場合のように®/Breo®エリプタ®アーノロと®エリプタ®したがって、このような製品の商業化は規制行動と監督の不利な影響を受ける可能性がある。
グラクソ·スミスクラインがグラクソ·スミスクラインと協力した任意の呼吸器計画において製品候補の規制承認を得たとしても、この承認は、グラクソ·スミスクラインが薬物を販売することができる患者集団または使用可能な患者集団の指定用途の制限を含むことができ、これは薬物の市場を制限するか、またはグラクソ·スミスクラインを代替療法と比較して競争不利にする可能性がある。このような制限は承認された製品の販売の難しさを増加させる。
例えば,FDAの肺アレルギー薬物諮問委員会と薬物安全·リスク管理諮問委員会BREOのsNDAに関する合同会議で®エリプタ®喘息の治療法として,諮問委員会はBreoに対して大型のLABA安全試験を提案した®エリプタ®成人や12−17歳の児童に求められるべきであり,行っているLABA安全試験と同様に,FDA発売後の要求として,喘息治療薬を含むLABAメーカーごとに行っているLABA安全試験である。FDAはこの提案に同意しない。現在,5−17歳の患者を含む小児科プログラムが行われている。
さらに、承認製品の製造、ラベル、パッケージ、有害事象報告、広告、販売促進、および記録は、依然として広範かつ持続的な規制要件によって制限されている。私たちまたはグラクソ·スミスクラインが、米国または海外または契約製造業者の工場で承認された製品に以前に未知の問題があることを認識した場合、規制機関は、製品の再調製を要求すること、追加の臨床研究を行うこと、製品ラベルを変更すること、製品を市場から撤回すること、または契約製造業者にその施設の変更を要求することを含む、製品、契約製造業者またはGSKに制限を加える可能性がある。グラクソ·スミスクラインはまた、司法省、連邦貿易委員会、米国衛生·公衆サービス部監察長事務室および他の規制機関、およびグラクソ·スミスクラインと協力した任意の呼吸器計画中の任意の候補製品が商業化を許可された外国政府当局を含む地域、国、州、地方機関によって規制されている。“連邦食品、薬品と化粧品法”、“公衆衛生サービス法”及びその他の連邦と州法規と条例は異なる程度で処方薬製品に関連する研究、開発、生産と商業活動を規範化し、非臨床と臨床試験、承認、生産、ラベル、販売、流通、輸入、輸出、発売後の監督、広告、情報伝播と販売促進を含む。規制承認を維持できなかった場合は、GSKがGSKと協力する任意の呼吸器計画における候補製品を商業化する能力を制限することになり、これは私たちの業務および財務状況に実質的な悪影響を与え、私たちの証券の価格下落を招く可能性がある。
私たちがすでにまたは可能な買収や戦略投資は成功しないことが証明されるかもしれない。
私たちの戦略の一部として、株主のために価値を創出すると考えられる買収や投資機会を常に監視·分析しています。
既存または将来の買収および投資は多くのリスクに関連する可能性があり、これらのリスクは、私たちが期待している取引収益を十分に達成することを阻止するかもしれない。これらのリスクには、買収された技術、製品、知的財産権からいかなる商業価値を得ることができなかったか、規制部門の承認を得られなかった場合、または製品が承認された後に貨幣化が実現できなかったこと、および成功結果が保証されていない場合には、製品開発時間が長く、前期開発コストが高いリスクが含まれる。取得された技術および/または知的財産権に関連する特許および他の知的財産権は取得されない可能性があり、取得されても、技術または知的財産権を十分に保護するのに不十分である可能性がある。私たちは事故の訴訟費用を含めて責任を負うかもしれません。これらの費用は私たちが受ける可能性のある賠償保護の範囲内ではありません。私たちが戦略的買収や投資を追求したり完成したりすると、買収や援助された会社の誤った評価を行い、私たちの資産多様性の増加に伴い、私たちの運営の管理に成功しなかった場合、買収や統合の過程で予測できないコストがかかるかもしれません
40
カタログ表
予期せぬ危険や挑戦に直面しています投資が行われると、私たちはそれを正確に推定することができないかもしれません。私たちの連結財務諸表で適切な会計処理を行うか、それを剥離することに成功したり、私たちの最初の投資またはその後に私たちの連結財務諸表に反映される価値を実現したりします。私たちが買収や戦略投資を実施する際に、このようなリスクを効果的に制限できなければ、私たちの業務、財務状況、あるいは運営結果に重大な悪影響を与え、私たちの純収入にマイナスの影響を与え、私たちの証券価格の下落を招く可能性があります。
私たちは私たちの転換可能な二次手形と転換可能な優先手形を含む相当の数の債務を持っていて、それぞれ資本構造とキャッシュフローの面で私たちの普通株主より優先しています。私たちの債務の履行に関連する債務は、私たちの流動性または潜在的に私たちの株主に割り当てられた金額や時間に悪影響を及ぼす可能性がある。
2022年12月31日現在、我々の未償還債務総額は5.497億ドルであり、主に2023年満期の転換可能付属手形(“2023年手形”)項の未償還元金9620万ドル、2025年満期の転換可能優先手形(“2025年手形”)項の未償還元金1.925億ドル、および2028年満期の転換可能手形(“2028年手形”)項の未償還元金2.61億ドル(2023年手形、2025年手形、2028年手形、以下“手形”)を含む。同等の債券は無担保債務であり、2028年債券を除いて、私は満期前に償還できないに等しい。債券保有者に基本的な変動があれば、元本の100%ですべてまたは任意の部分債券を購入し、別途任意の未払い利息を加えることを要求することができます。根本的な変化は、通常、私たちの合併に関連して、私たちが発行した普通株の大部分を買収することと、2023年の債券によって、取締役会の承認なしに私たちの取締役会の多数のメンバーを変更することを含むと定義されています。また,吾らが貨幣化取引を求めたり,会社の構造を変更したりする取引については,そのような取引の構造はチケットの基本的な変更に適合し,手形所持者の権利をトリガする可能性があり,この場合,吾らはそのような取引の一部の純収益を用いて吾などに承諾した任意の手形を買い戻すことを要求される.
この債務の義務を履行することは、私たちの株主に任意の割り当てられた金額や時間に悪影響を及ぼす可能性がある。もし私たちが融資条件が有利だと思うなら、私たちは公共またはプライベート株または債務融資によってこの債務を返済、買い戻し、または再融資することを選択することができる。もしいずれかまたはすべての債券が満期日までに当社の普通株に転換できなかった場合、本行はその時点で発行された債券の全元金総額を所持者に支払わなければならない。上記のいずれの支払いも私たちの現金状況に実質的な悪影響を及ぼす可能性がある。もし私たちがこれらの義務を履行できなければ、債券の違約を招く可能性があり、これは私たちのいくつかの他の債務ツール(あれば)の違約を招く可能性がある。このような違約は私たちの業務を損害し、私たちの証券の価格は下落するかもしれない。
もし私たちが重要な管理者を失った場合、あるいは私たちの肝心な従業員を引き止めることができなければ、私たちの業務を管理する能力が損なわれる可能性があります。
私たちの業績は私たちの管理チームの持続的なサービスと業績に大きく依存しており、彼らは私たちの業務において豊富な経験と専門知識を持っています。私たちの従業員の中で誰も固定された時間帯で働くことを約束していません。すべての人は自由に退職することができます。もし私たちが私たちの合格者を維持できない場合、あるいは彼らが離れる時に彼らを置き換えることができなければ、私たちの業務を管理する能力が損なわれる可能性があり、これは私たちの証券価格の下落を招くかもしれない。
長期的な経済の不透明または衰退、および不安定な市場、信用、金融状況は、私たちの業務に影響を与えるいくつかのリスクを悪化させ、私たちの業務に深刻な悪影響を及ぼす可能性がある。
世界経済の低迷と市場の不安定化は、ビジネス環境をより動揺させ、コストをより高くしている。これらの経済状況およびマクロ経済環境の全体方向の不確定性は私たちのコントロールを超えており、任意の必要な債務や株式融資をより困難にし、コストがより高く、希釈程度をより高くする可能性がある。現在の運営資本や資本支出要件を満たすのに十分な資本資源があると信じていますが、持続的な経済低迷や私たちの支出の大幅な増加は、既存の株主を魅力的でない金利や過剰希釈条項で追加融資する必要があるかもしれません。有利な条件で任意の必要な融資をタイムリーに得ることができなければ、我々の株価に実質的な悪影響を及ぼす可能性があり、臨床開発計画の延期または放棄を要求する可能性がある。
私たちの協力製品の販売は、政府衛生行政部門、個人健康保険会社、流通パートナー、その他の組織の精算に大きく依存する。米国または私たちが業務を展開する可能性のある他の管轄区域全体の経済的負の傾向により、これらの組織はその返済義務を履行できないか、支払いを遅延させる可能性がある。また、連邦や州衛生当局は連邦医療保険や医療補助の精算を減らす可能性があり、民間保険会社はクレームの審査を強化する可能性がある。精算範囲や精算範囲の減少は、私たちまたはパートナーの製品販売や収入に悪影響を及ぼす可能性があります。
しかも、私たちの業務のいくつかの重要な側面は第三者に依存している。挑戦と不確定な経済期には、信用緊縮の市場で、私たちの第三者請負業者、仕入先、
41
カタログ表
パートナーです。もしこのような第三者が私たちに対する彼らの約束を履行できなければ、私たちの業務と経営結果は不利な影響を受けるだろう。
著者らの臨床前研究或いは臨床試験における成功は現在或いは未来の臨床試験の結果を予測できないかもしれない。
我々の前臨床試験と早期臨床試験での成功は、今後の臨床試験が同じ結果を生むことを保証することができず、あるいは候補製品の有効性と安全性を証明するのに十分なデータを提供する。ある候補製品は臨床開発において必要な安全性と有効性を示すことができない可能性があり、臨床前研究で積極的な結果が得られたにもかかわらず、或いはすでに初歩的な臨床試験に成功した。
また,臨床試験の設計はその結果が製品の承認を支持するかどうかを決定することができるが,臨床試験設計における欠陥は臨床試験の進展が良好になるまで明らかにならない可能性がある。著者らは臨床試験を設計する経験が限られており、臨床試験を設計と実行して監督部門の承認を支持できないかもしれない。臨床試験中の薬物や生物製品の失敗率が高かった。製薬と生物技術業界の多くの会社は後期臨床試験で重大な挫折を経験し、臨床前試験と早期臨床試験においても奮い立つ結果を得た。臨床前と臨床活動から得られたデータは異なる解釈を受ける可能性があり、これは監督部門の承認を延期、制限或いは阻止する可能性がある。また、私たちは、私たちの候補製品開発中の規制政策の変化を含む、多くの要因のために規制の遅延や拒否に遭遇する可能性がある。どのような遅延も、私たちの業務、財務状況、運営結果、および見通しに否定的な影響を及ぼす可能性がある。
我々の候補製品の臨床試験がFDA、EMAまたは他の同様の規制機関に満足させる安全性および有効性を証明できなかった場合、または有利な結果が生じなかった場合、候補製品の開発および商業化を完了する過程で追加のコストが生じたり、遅延が生じたり、最終的には達成できない可能性がある。
FDA、EMA、または他の同様の規制機関のマーケティング承認を受けておらず、私たちまたは私たちの潜在的なパートナーは、任意の候補製品を商業化、マーケティング、普及、または販売してはならず、私たちは決してそのような承認を得ないかもしれない。我々の候補製品が制御された良好な臨床試験において患者に対して十分な有効性および/または安全性を示しても、これらの候補製品がいつ監督部門の許可を得るかどうかを予測することはできない。監督部門の許可を得て任意の候補製品を販売する前に、私たちは臨床前開発を完成し、それから広範な臨床試験を行い、私たちの候補製品の人体における安全性と有効性を証明しなければならない。臨床試験は費用が高く,設計と実施が困難であり,完成まで数年かかる可能性があり,結果はまだ確定していない。1つまたは複数の臨床試験の失敗は、試験の任意の段階で発生する可能性がある。そのほか、臨床前と臨床データはよく異なる解釈と分析の影響を受けやすく、多くの会社は彼らの候補製品が臨床前研究と臨床試験で満足できると考えているが、しかし依然としてその製品のマーケティング許可を得られなかった。
臨床試験の前、期間、あるいは臨床試験のため、私たちは多くの予見できない事件に遭遇するかもしれません。これらの事件は、私たちの上場承認を延期したり、私たちの候補製品を商業化することを阻止したりする可能性があります
42
カタログ表
もし私たちが現在予想外の候補製品に対して追加の臨床試験または他の試験を行うことを要求された場合、もし私たちがこれらの候補製品の臨床試験または他の試験を成功させることができない場合、またはこれらの試験または試験の結果が陽性でないか、またはわずかな陽性である場合、または安全問題がある場合、私たちは:
もし私たちがテスト中に遅延に遭遇すれば、私たちの製品開発コストも増加するかもしれません。私たちは臨床試験を完成するために追加の資金が必要かもしれません。われわれのいかなる臨床前研究や臨床試験が計画通りに開始されるかどうか,再構成が必要かどうか,あるいは予定通りに完成するかどうか,あるいは全く知られていない。重大な臨床前研究または臨床試験遅延は、候補製品を商業化する独占的な権利を持つ可能性のある任意の期限を短縮するか、または私たちの競争相手が私たちの前に製品を市場に出し、候補製品を商業化することに成功する能力を弱めることを可能にするかもしれない。さらに、臨床試験の遅延をもたらしたり、招いたりする多くの要素は、最終的に候補製品の規制承認が拒否される可能性がある。
43
カタログ表
もし私たちがより多くの候補製品を発見、開発、商業化することに成功できなければ、戦略目標を拡大して実現する能力は損なわれるだろう。
私たちの多くの仕事は私たちの候補製品の持続的な臨床テストと潜在的な規制承認に集中するが、私たちの戦略の一つの要素は私たちの候補製品を開発し、商業化し、他の治療分野で新しい候補製品を発見し、開発することである。我々は,我々の発見,研究経験,能力を利用して疾患の原因機序に対する活性新しい化合物を設計することを求めている。候補製品を識別·開発する研究には、最終的に任意の候補製品が決定されたか否かにかかわらず、大量の技術、財政と人的資源が必要である。著者らの研究計画は最初に潜在的な候補製品の決定に希望を示す可能性があるが、多くの原因で臨床開発のための候補製品を生成できなかった
もし私たちが他の現在および未来の候補製品から収入を得ることを開発して成功させることができなければ、私たちの将来の見通しは影響を受ける可能性があり、私たちまたは潜在的なパートナーは私たちの現在の候補製品を開発して商業化する際に何か問題に直面する可能性がある。
もし私たちまたは私たちの協力者が臨床試験の患者登録中に遅延や困難に遭遇した場合、必要な規制承認を受けることは延期または阻止される可能性がある。
もし私たちと私たちの協力者がFDA、EMA、または他の同様の規制機関の要求に基づいて、これらの試験に参加するのに十分な数の合格者を見つけることができなければ、私たちは私たちが開発した候補製品の臨床試験を開始、継続、または完成できないかもしれない。われわれが臨床試験で患者を募集した経験は限られており,将来の臨床試験で患者を募集する成功度を予測することはできない。
例えば,われわれの臨床試験に参加した患者は通常病院環境であり,参加の決定は看護師や医師が行うことができる。したがって,家族や/あるいは患者が臨床試験への参加を考慮できない可能性があり,同意を求める提供者/調査者が通常家族や患者と既定の関係がない場合には,患者の参加の同意を求めることが困難になる可能性がある。新冠肺炎の大流行期間中,患者を代表して同意できる友人や家族の面会に病院が制限を加えたため,患者参加の同意を得る挑戦が増加した。新冠肺炎疫病は患者の受診或いは治療後の再診の意志を低下させる可能性がある。また,われわれの競争相手の中には,我々の候補品と同様の適応を治療するための臨床試験を行っており,本来われわれの臨床試験に参加する資格のある患者は,競争相手の臨床試験に移行することができる。もし私たちが患者を1つの臨床試験に参加させることに成功できなかったら、私たちがいつ次の臨床試験を開始できるかに影響する可能性があり、これは私たちの監督部門が私たちの候補製品を承認し、それを商業化する努力の深刻な遅延を招く可能性がある。患者の入選は他の要素の影響を受けている
44
カタログ表
十分な数の患者を募集して臨床試験を行うことはできません。これは深刻な遅延を招き、1つ以上の臨床試験を完全に放棄することを要求するかもしれません。これらの臨床試験の登録遅延は、私たちの候補製品の開発コストを増加させる可能性があり、これは、現在および将来の候補製品を支援するために使用できる資本を減少させ、計画よりも早く追加資本を調達する必要があり、私たちの普通株価値の低下を招き、追加融資を受ける能力を制限する可能性がある。
私たちの候補製品は、不良な副作用や、その規制承認を遅延または阻害する可能性があり、商業潜在力を制限したり、任意の潜在的な上場承認後に重大な負の結果を招く特性を持っている可能性がある。
臨床試験を行っている間、患者は疾患、傷害、および不快感(一般に有害事象と呼ばれる)を含む彼らの健康変化を医師に報告する。私たちはFDAと他の規制機関に不良事件を報告することを要求された。通常,研究されている製品候補がこれらの状況を招いているかどうかは決定できない.規制当局は異なる結論を出すか、またはこれらの観察結果を確認または反論するために追加的なテストを要求するかもしれない。さらに、私たちがより大きく、より長く、より広い臨床計画で私たちの候補製品をテストする場合、またはこれらの候補製品の使用がより広くなるにつれて(規制部門の承認を得た場合)、被験者は、早期試験で観察された疾患、傷害、不快感、および他の有害事象、および以前の試験で発生しなかったか、または検出されなかったことを報告する。多くの場合,研究薬が大規模な3期臨床試験で試験された後,あるいは承認後に商業規模の薬物を患者に提供した後にのみ,副作用が検出される場合がある。より多くの臨床経験が、私たちの現在の任意の候補製品または任意の未来の候補製品に副作用があるか、または深刻なまたは生命を脅かす副作用があることを示す場合、候補製品の開発が失敗または延期される可能性があり、または、候補製品が規制部門の承認を得た場合、承認を取り消す可能性があり、これは、私たちの業務、将来性、経営業績、および財務状況を損なう可能性がある。
さらに、私たちが候補製品の任意の臨床試験を延期、一時停止、または終了することを選択または要求された場合、私たちの候補製品の商業的将来性は損なわれる可能性があり、販売によって収入を発生させる能力は延期またはキャンセルされる可能性がある。このようなどんな状況でも、私たちの業務、財政状況、そして見通しを深刻に損なうかもしれない。
さらに、私たちの任意の候補製品が発売承認された場合、規制機関は、“ブラックボックス”警告または禁忌症のようなラベル宣言の追加を要求するか、またはリスクよりも利益が大きいことを保証するためにREMS計画を採用することができ、その中には、患者への薬物流通のリスクを概説する薬物ガイドラインおよび医療従事者向けのコミュニケーション計画、および/または薬物流通または使用の重大な制限が含まれている可能性がある。さらに、もし私たちまたは他の人が後に私たちの候補製品が不良な副作用をもたらしたことを発見すれば、いくつかの潜在的な重大な負の結果を招く可能性がある
45
カタログ表
これらの事件のいずれも、影響を受けた候補製品に対する市場の受容度を達成または維持することを阻止または維持することができ、または商業化コストおよび費用を大幅に増加させる可能性があり、これは、製品販売からの収入を遅延または阻止し、私たちの業務および運営結果を損なう可能性がある。
著者らが時々発表或いは公表した臨床試験の一時的な“頂線”と初歩的なデータはより多くの患者データの獲得に伴い変化する可能性があり、そして監査と検証プログラムの影響を受け、これは最終データの重大な変化を招く可能性がある。
私たちは時々私たちの臨床試験の一時的なトップラインや初歩的なデータを公表するかもしれない。我々が達成する可能性のある臨床試験の中期データは、患者登録の継続および/またはそれ以上の患者データの獲得に伴い、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクに直面している。初期または最も重要なデータも監査と確認手続きを受けなければならず、これは最終データが以前に公表された予備データと大きく異なる可能性がある。したがって、最終データを得る前に、中期と予備データを慎重に見なければならない。初期または中期データと最終データとの違いは、私たちの業務の将来性を深刻に損なう可能性があり、私たちの普通株の取引価格を大幅に変動させる可能性があります。
もし私たちが環境、健康、安全の法律法規を守らなければ、罰金や処罰を受けたり、私たちの業務を損なう可能性のあるコストが発生するかもしれません。
私たちは多くの環境、健康と安全法律と法規の制約を受けて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理と処理を管理する法律と法規を含む。私たちの行動は化学物質と生物学的材料を含む危険な材料の使用に関するものだ。私たちの業務はまた危険な廃棄物製品を発生させるだろう。私たちは一般的に第三者と契約を結び、このような材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし私たちが危険な材料を使用して汚染や損傷をもたらしたら、私たちはそれによるいかなる損害に責任を負い、いかなる責任も私たちの資源の範囲を超える可能性がある。民事や刑事罰金やこのような法律や法規を遵守しない罰に関する巨額の費用を招く可能性もある。
危険材料の使用による従業員の負傷により生じる可能性のあるコストや支出を支払うために労働者補償保険を維持しているが、潜在的な責任を支払うのに十分ではない可能性がある。私たちは私たちが生物や危険材料を貯蔵したり処分したりすることで、私たちが提起した環境責任や有毒侵害請求に保険を提供することはできません。
私たちの第三者への依存に関するリスク
私たちは第三者に依存して私たちの候補製品の臨床試験を行い、これらの第三者の表現は締め切り前にこのような試験を完了できなかったことや適用された法規制要求を遵守できなかったことを含む満足できない可能性がある。
私たちはすでに契約研究組織(CRO)を招いて、私たちが行っている臨床試験と計画中の臨床試験を行っている。私たちはまた、臨床開発に進展する可能性のある他の任意の候補製品のためにCROを招聘することを望んでいる。これらの臨床試験は,CROや他の第三者,例えば臨床データ管理組織,医療機関,臨床調査者に頼って行われる予定である。このような第三者とのプロトコルは、第三者が履行できなかったことを含む様々な理由で終了する可能性がある。もし私たちが代替計画を達成する必要があれば、私たちの製品開発活動は延期されるだろう。
私たちのこれらの第三者の研究開発活動への依存は、これらの活動に対する私たちの統制を減少させるだろうが、私たちの責任を軽減することはない。例えば,我々のすべての臨床試験が試験の全体的な調査計画や案に沿って行われることを確保していきたい。さらに、FDAは、データと報告の結果が信頼性と正確であることを保証し、試験参加者の権利、完全性および機密性を保護するために、良好な臨床実践またはGCPと呼ばれる臨床試験結果を行い、記録し、報告する監督基準を遵守することを要求する。類似の監督管理要求はアメリカ以外の地域にも適用され、国際人用薬品登録技術要求調整理事会、ICHと略称される。
46
カタログ表
また、指定された時間範囲内で行われているいくつかの臨床試験を登録し、いくつかの完了した臨床試験の結果を、ClinicalTrials.govのような政府が支援する公開アクセス可能なデータベース上で公表することも要求される。私たちまたは第三者がそれをできなかったことは、FDAが臨床データに基づく申請、法執行行動、不利な宣伝、および民事および刑事制裁の承認を拒否する可能性がある。
さらに、これらの第三者は、他のエンティティと関係がある可能性もあり、その中のいくつかは私たちの競争相手である可能性がある。これらの第三者が規制要件や私たちが規定した規程に従って契約責任を成功的に履行し、予想される期限内に私たちの臨床試験を完了または行うことができない場合、私たちは候補製品のマーケティング承認を得ることができないか、遅延する可能性があり、候補製品の商業化に成功する努力を遅らせることができないか、または遅延する可能性がある。
さらに、私たちの臨床試験の首席研究者は時々私たちの科学顧問や顧問を担当し、このようなサービスのために現金または株式補償を得ることができるかもしれない。これらの関係と任意の関連する賠償が知覚または実際の利益の衝突をもたらし、またはFDAが財務関係が試験結果に影響を与える可能性があると結論した場合、適用される臨床試験場所で生成されたデータの完全性が問われる可能性があり、臨床試験自体の効用が脅かされる可能性があり、これは、FDAが私たちが提出した任意のNDAを延期または拒否する可能性がある。そのような遅延や拒否は私たちが候補製品を商業化することを防ぐことができる。
私たちはまた、他の第三者に依存して、私たちの臨床試験の製品供給を保存し、配布したい。私たちの流通業者のどんな業績ミスや規制が合わない場合も、候補製品の臨床開発やマーケティング承認を延期したり、私たちの製品の商業化を延期したりして、追加の損失を招き、潜在的な製品収入を奪う可能性があります。
私たちは第三者との協力に依存して私たちの候補製品を開発し、将来私たちはもっと多くの協力を求めるかもしれない。もしこのような協力が成功しなければ、私たちはこの候補製品の市場潜在力を利用できないかもしれない。
私たちの薬物開発能力は限られており、私たちの製品開発計画と候補製品の商業化には費用を支払うために多くの追加の現金が必要になるだろう。これらの要因により、我々は既存および将来の候補製品の開発に関する協力に依存し続けることが予想される。私たちはすでに複数の製薬会社と潜在的な協力機会について議論し続けるつもりだ。また、私たちは候補製品の開発と商業化のために第三者パートナー、特にアメリカ以外の地域を探すことができるかもしれません。任意の協力手配の協力者には大中型製薬会社、地域と国家製薬会社、生物技術会社が含まれており、私たちは適切な協力者を探す上で激しい競争に直面する可能性がある。もし私たちが合理的な条項や全く協力しないことができなければ、私たちが既存または未来の候補製品を開発する能力は延期される可能性があり、私たちの製品のビジネス潜在力は変わる可能性があり、私たちの開発と商業化コストが増加する可能性がある。もし私たちが任意の第三者と未来の協力計画を達成すれば、私たちの協力者が私たちの候補製品の開発や商業化に投入する資源の数と時間を限られた制御を行う可能性が高い。私たちがこのような計画から収入を創出する能力は、私たちの協力者がこれらの手配の中で彼らに割り当てられた機能を成功的に履行する能力に依存するだろう。
私たちの協力と未来に可能などんな協力も多くのリスクをもたらすかもしれません
47
カタログ表
協調プロトコルは、最も効率的な方法で、または候補製品の開発または商業化を引き起こさない可能性がある。現在または将来の協力者が業務合併に参加すれば、薬物開発または商業化計画の持続的な追求と重視は延期、減少、または終了される可能性がある。
私たちは第三者に依存して私たちの候補製品を生産し、これは私たちが許容可能なコストで十分な数の候補製品や製品、またはそのような数量を得ることができないリスクを増加させ、これは私たちの開発や商業化努力を延期、阻止、または損害する可能性がある。
私たちは私たちが開発または評価している候補製品の臨床的または商業的供給を生産する製造施設を所有したり運営したりしない。私たちは薬物製造経験を持つ人員が限られていて、臨床規模でも商業規模でも、私たちの任意の候補製品を生産する資源と能力が不足している。私たちは現在第三者に私たちの候補製品を供給することに依存しており、私たちの戦略は私たちの候補製品と承認された製品(あれば)のすべての製造を第三者にアウトソーシングすることです。
我々の候補製品の臨床試験を行うためには,既存の法規に適合した方法で我々の化合物を大量に生産できる適切なメーカーを見つける必要がある。私たちの第三者製造業者は、私たちの任意の候補製品の製造能力をタイムリーに、または費用効果的に向上させることに成功できないかもしれません。さらに、拡張活動中および他の任意の時間に品質の問題が発生する可能性がある。もし私たちのメーカーが十分な品質と数量で私たちの候補製品の生産規模を成功的に拡大することができなければ、候補製品の開発、テスト、臨床試験は延期される可能性があり、あるいは実行不可能であり、候補製品の規制承認や商業発表が延期または獲得できない可能性があり、これは私たちの業務を深刻に損なう可能性がある。
たとえ第三者製造業者と手配を確立し、維持することができても、第三者製造業者に依存することはリスクをもたらす
48
カタログ表
第三者メーカーは、米国以外のcGMP法規や同様の規制要件を遵守できない可能性がある。私たちまたは私たちの第三者製造業者が適用された法規に従わないことは、罰金、禁止、民事処罰、遅延、承認の一時停止または撤回、許可証の取り消し、候補製品または製品の差し押さえまたはリコール、運営制限、および刑事起訴を含む制裁を受ける可能性があり、いずれも候補製品の供給に重大な悪影響を及ぼす可能性があります。
私たちの現在と予想されている未来の他の候補製品生産への依存は、私たちの将来の利益率と、私たちが候補製品を開発し、適時かつ競争力のあるマーケティング承認された製品を商業化する能力に悪影響を及ぼすかもしれない。
私たちは政府や非営利団体の契約や贈与を獲得できず、私たちの製品開発活動に資金を提供することができないかもしれない。
歴史的には、政府機関と非営利団体の契約や贈与にある程度依存して資金を提供しており、これは私たちの戦略の一部であり、引き続きそうしています。このような契約や贈与は、資本を提供しているので、株主を希釈することなく、候補製品の持続的な開発に資金を提供する可能性がある。しかし、このような契約や贈与に対する競争はしばしば激しい。契約または贈与を提供するエンティティは、私たちの競争相手が私たちが満足できないいくつかの契約または贈与を満たすことができるように申請または他の方法で資格を得ることを要求する可能性があります。また、これらのエンティティは、契約を提供するか否か、贈与を提供するか否か、付与契約又は贈与の対象、及び各授標者に付与する契約又は贈与の規模について独断的に決定することができる。たとえ私たちが受賞要求を満たすことができても、私たちがどのような契約や贈与を受けるかに選ばれる保証はない。もし私たちが臨床試験にこのような形の資金を提供することに成功できなければ、もしあれば、他の同じ程度の資金が得られない可能性のある方法を探す必要があるだろう。
私たちの政府援助のいくつかのプロジェクトへの依存は、これらのプロジェクトに関連する研究、開発、商業化努力の不確実性を増加させ、これらの政府援助プロジェクトに基づいて開発された候補製品の研究、開発、商業化コストの増加を要求する可能性がある。
私たちのいくつかの開発プロジェクトのいくつかの側面は現在支持されており、一部の資金はNIH、NIAID、CARB-X、国防総省から来ている。政府の実質的な権利および救済措置を反映する条項を含む、NIH、NIAID、CARB-X、および国防総省から付与された契約および贈与を含む米国政府、その機関、およびそのパートナーによって付与された契約および贈与を含み、その多くは、政府以下の権力を含む商業契約では発見されない
私たちはアメリカ政府が私たちが開発したいくつかの技術を使用することを禁止する権利がないかもしれませんし、第三者会社(私たちの競争相手を含む)がこれらの技術を使用することを禁止できないかもしれません
49
カタログ表
アメリカ政府です。米国政府は通常、米国政府の契約に基づいて開発された技術を使用する使用料を免除する権利があるという立場をとっている。
また、政府契約および贈与、およびこれらの契約および贈与を履行する際に付与される下請け契約および下請け契約には、通常、追加の要求が含まれており、これらの要求は、私たちの経営コストを増加させ、私たちの利益を減少させ、これらの条項や条件を遵守できないために責任を負わせる可能性がある。これらの要件には、例えば、
組織として、私たちは政府契約が比較的新しく、このような契約に関連する規制コンプライアンス義務も新しい。もし私たちがこのような義務を守れなかったら、私たちは潜在的な責任を負って契約を終了するかもしれない。
アメリカ政府請負業者として、私たちのコスト及び契約履行状況に対する米国政府の財務監査及びその他の審査、並びにこれらの契約に関連する会計及び一般的な業務慣行を受け入れる。監査結果によると、政府は分配された間接コストを含む契約に関するコストや費用を調整することができる。
私たちの候補製品の商業化に関するリスク
たとえ私たちのすべての候補製品が市場の承認を得ても、これらの候補製品は医師、患者、第三者支払人、医学界の他の人が商業成功に必要な市場受容度を得ることができない可能性がある。
FDA、EMA、または他の同様の規制機関の承認を得て、私たちが開発した候補製品の商業化を開始することができても、その候補製品は医師、患者、病院(薬局主任を含む)および第三者支払者で市場で受け入れられない可能性があり、最終的には商業的に成功できない可能性がある。もし私たちの候補製品が商業販売のために承認されれば、市場の受け入れ度はいくつかの要素に依存する
50
カタログ表
もし私たちのどの候補製品も規制部門の承認を得て市場承認や商業成功を得ることができなければ、私たちの業務の将来性に重大な悪影響を及ぼす可能性がある。
私たちは激しい競争に直面しており、これは他の人たちが私たちよりも早く、あるいは成功的に製品を発見、開発、商業化することにつながるかもしれない。
新薬製品の開発と商業化競争は激しい。私たちの現在と未来の候補製品について、私たちは大型多国籍製薬会社、バイオテクノロジー会社、専門製薬会社、後発薬会社からの競争に直面している。現在,いくつかの大手製薬やバイオテクノロジー会社が製品をマーケティング·販売しているか,薬剤耐性感染を治療するための候補製品を開発している。潜在的な競争相手はまた、学術機関、政府機関、その他の公共および個人研究機関を含む。私たちの競争相手は私たちの候補製品よりも効果的で、より効果的なマーケティングと販売、またはより低コストの技術および医薬製品の開発、獲得、または許可に成功するかもしれません。これは私たちの候補製品を競争力を失って時代遅れにするかもしれません。
もし私たちの競争相手が私たちよりも早くFDA、EMA、または他の同様の規制機関によるその候補製品のマーケティング承認を獲得すれば、私たちの競争相手が市場に入る前に強力な市場地位を確立することができるかもしれない。
私たちの組織と比べ、私たちの多くの競争相手は研究開発、製造、臨床前テスト、臨床試験を行い、監督管理許可とマーケティング許可を得た製品の面でより多くの財務資源と専門知識を持っている。製薬とバイオテクノロジー産業の合併と買収は、私たちの数の少ない競争相手により多くの資源を集中させる可能性がある。規模の小さい会社や他のスタートアップ会社も重要な競争相手になる可能性があり、特に大手や成熟会社との協力で手配されている。これらの第三者は合格した科学と管理者を募集と維持し、臨床試験場と臨床試験の患者登録を確立し、そして私たちの計画と相補的或いは必要な技術を獲得する上で私たちと競争している。
もし私たちの競争相手が私たちが開発する可能性のある任意の候補製品よりも安全で、より効果的で、副作用が少なく、より便利で、より安い製品を開発し、商業化すれば、私たちのビジネス機会は減少または消失するかもしれない。我々の競争相手は、FDA、EMA、または他の同様の規制機関のその候補製品の承認を私たちよりも早く得る可能性があり、これは、競争相手がFDAやEMAから市場独占経営権を獲得すれば、あるいは私たちの競争相手が市場に参入できる前に強力な市場地位を確立した場合、製品の承認を遅延させる可能性がある。また、多くの場合、私たちの競争能力は、後発薬の使用を奨励することを求める保険会社または他の第三者支払者の影響を受ける可能性がある。今後数年、より多くの薬物が模倣薬に基づいて発売されるかもしれない。もし私たちの候補製品が発売承認されたら、私たちはそれらの価格が競争相手の模造薬より著しく高いと予想します。
私たちの現在または未来の候補製品は保険と十分な精算を受けることができないかもしれません。承認されれば、利益を出して販売することが困難になるかもしれません。
私たちまたは私たちのパートナーが商業化した任意の候補製品の市場受容度および販売量は、政府医療保険および医療補助などの政府医療保健計画、政府衛生行政当局、管理医療機関、その他の個人医療保険会社を含む第三者支払者からある程度依存するであろう。第三者支払人は彼らがどのような治療費用を支払い、精算レベルを確立するかを決定する。第三者支払者が自己の保険·精算政策を設定する際には,通常連邦医療保険引受政策と支払制限に依存する。しかし,我々が開発した任意の候補製品のカバー範囲や精算金額に関する決定は支払者ごとに行われる.支払人が薬品に保険を提供することを決定したのは保証できません
51
カタログ表
他の支払者たちもまた薬物に保険と十分な補償を提供するだろう。また、第三者支払者が治療に保険を提供することを決定することは、十分な販売率を承認することを意味するものではない。各支払者は、治療のために製造業者にどの程度の金額を支払うか、その保険薬品リストまたは処方リストのどの層に配置されるかを決定する治療法に保険を提供するかどうかを決定する。支払者の処方上の場合は通常,患者が治療に要する共同費用を得ることが決定され,患者や医師のこのような治療に強い影響を与える可能性がある。自分の病状に応じて処方治療を受けた患者やこのようなサービスを処方した提供者は,通常第三者支払者に依存してすべてまたは一部の関連医療費を精算する。患者が私たちの薬を使用することはあまり不可能であり、提供者も私たちの薬を処方することは不可能で、保険を提供しなければ、私たちの薬物とその管理に十分なコストの大部分を清算することができる。
アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。私たちが商業化したどんな薬も保険と精算を受けることができることを確実にすることはできません。もし精算できるなら、清算レベルはいくらですか。不十分な保険と精算は、私たちが発売許可を得た任意の薬物の需要や価格に影響を及ぼす可能性がある。保険や十分な精算が得られない場合、あるいは限られたレベルに限られていれば、現在および将来開発されている任意の候補製品を商業化することに成功しない可能性がある。
私たちに対する製品責任訴訟は、私たちが重大な責任を負い、私たちが開発する可能性のある任意の製品の商業化を制限する可能性があります。
私たちは人体臨床試験で私たちの候補製品をテストすることに関連する固有製品責任リスクに直面しており、私たちが開発可能な任意の薬物を商業化販売すれば、より大きなリスクに直面する。もし私たちが私たちの候補製品や製品に被害を与えるクレームを自己弁護することに成功できなければ、私たちは大きな責任を招くだろう。是非曲直や最終結果にかかわらず、賠償責任は
私たちが現在持っている製品責任保険の金額は私たちが発生する可能性のあるすべての責任をカバーするのに十分ではないかもしれません。私たちの臨床試験の拡大に伴い、あるいは候補製品を商業化し始めたら、私たちの保険カバー範囲を増やす必要があるかもしれません。保険範囲はますます高くなっています。私たちは可能などんな責任にも対応するために、合理的な費用や十分な金額で保険範囲を維持することができないかもしれない。
私たちの候補製品を国際的にマーケティングするには様々なリスクがあり、これは私たちの業務に影響を与えるかもしれません。
私たちまたは私たちのパートナーは、私たちの候補製品のためにアメリカ以外の規制承認を求めるかもしれませんので、もし私たちが必要な承認を得たら、私たちは外国での運営に関連する追加のリスクに直面することが予想されます
52
カタログ表
私たちの国際業務に関連するこれらのリスクや他のリスクは、私たちが利益を達成したり維持したりする能力を損なう可能性があります。
私たちの業務と成長の管理に関連するリスク
私たちは買収を求めてきて、買収を続けるかもしれない。買収は統合が困難で、キーパーソンの注意を移し、私たちの業務を混乱させ、株主価値を希釈し、私たちの財務業績を損なう可能性がある。
私たちの業務戦略の一部として、補完業務、製品、サービス、または技術の買収を求め続けてきましたが、これらの業務、製品、サービス、または技術は、既存市場での競争能力を加速させたり、新しい市場に参入できるようにしたりすることができると信じています。このような取引のどれもが私たちの財務状況と運営結果に大きな影響を及ぼす可能性がある。買収を正確に評価したり統合したりできなければ、このような買収の予想収益を達成できない可能性があり、予想以上のコストが生じる可能性がある。買収の評価と実行に成功しなかった場合、またはこれらのリスクに他の方法で十分に対応できなければ、私たちの業務や財務業績に実質的な損害を与える可能性がある。
買収はまた、営業権や他の無形資産の記録を招くことも多く、これらの資産は潜在的な減価の影響を受け、私たちの財務業績を損なう可能性がある。したがって、買収や投資を正確に評価できなければ、このような買収の予想収益を達成できない可能性があり、予想以上のコストが生じる可能性があります。買収や投資の評価や実行に成功しなかったか、またはこれらのリスクに他の方法で十分に対応できなかったことは、我々の業務や財務業績に実質的な損害を与える可能性がある。
私たちは私たちの業務をEntasisおよび/またはLa Jollaの業務と私たちが買収する可能性のある他の資産と統合することに成功できないかもしれない。
我々は2022年7月11日にentsisの買収を完了し,これによりentsisはInnovivaの完全子会社となり,2022年8月22日にLa Jollaの買収を完了し,これによりLa JollaはInnovivaの完全子会社となった。私たちはEnTASISとLa Jollaの運営と人員、そして私たちが買収する可能性のある他の資産を統合するには、多くの管理職の時間を含め、追加費用を招く必要があるかもしれません。買収成功に影響する要素は著者らの連合製品ルートの実力、著者らの業務戦略を実行する能力、著者らは研究開発に十分な資金を提供し、肝心な従業員を維持する能力、及び臨床試験の結果、監督部門の許可といかなる承認製品の精算レベルを含む。さらに、私たちが買収したいかなる技術や資産が開発、利益、または維持に成功するかどうかを確認することはできない。
53
カタログ表
私たちがentasisとLa Jollaを買収する期待収益が達成できなければ、私たちの将来の運営と財務運営業績に影響を与えるかもしれない。
ENTASISとLa Jollaを買収する過程で、私たちはすでに研究開発、商業運営、人員を既存のインフラに統合している。これらの買収した業務を統合する際に予期せぬ困難が生じた場合、取引の期待的なメリットは実現できない可能性があり、あるいは期待よりも長い時間を要する可能性がある。買収の予想収益はいくつかの要素によって大幅に減少する可能性があり、以下の要素を含む
このようなすべての事件の発生は、私たちの業務と運営結果に悪影響を及ぼす可能性がある。
もし私たちが将来の買収や戦略協力に従事すれば、これは私たちの資本要求を増加させ、私たちの株主を希釈し、私たちに債務を発生させたり、負債を負担したり、他のリスクに直面させたりする可能性がある。
私たちは、当社の業務計画を実行するために、薬物、知的財産権、技術または業務の許可または買収を含む様々な買収および戦略的協力を時々評価することができます。潜在的な買収や戦略的協力は多くのリスクをもたらす可能性がある
私たちの知的財産権に関するリスクは
もし私たちの技術や候補製品のために特許保護を獲得して維持することができない場合、あるいは獲得した特許保護範囲が十分でなければ、私たちの競争相手は私たちと類似または同じ技術や薬物を開発し、商業化する可能性があり、私たちの技術および候補製品を商業化することに成功した能力は不利な影響を受ける可能性がある。
私たちの成功は私たちがアメリカや他の国で私たちの候補製品の特許保護を獲得して維持する能力に大きくかかっている。我々は,米国や海外に我々の技術や製品候補に関連する特許出願を提出することで,我々の独自の地位を保護することを求めている.もし私たちが私たちの知的財産権を十分に保護しなければ、競争相手は私たちの技術を使用して、私たちが持つ可能性のあるいかなる競争優位性を侵食したり、否定したりするかもしれません。これは私たちの業務を損なうかもしれません
54
カタログ表
収益性を実現することができます私たちの独自の地位を保護するために、私たちはアメリカと海外で私たちの新技術と候補製品に関する特許出願を提出しました。これらの技術と製品は私たちの業務に非常に重要です。
特許出願と起訴過程は高価で時間がかかる。私たち、私たちの現在のライセンシーまたは任意の未来のライセンシーおよびライセンシーは、すべての必要または望ましい特許出願を合理的なコストまたはタイムリーな方法で提出および起訴することができないかもしれない。私たちまたは現在のライセンシー、または任意の未来のライセンシーまたはライセンス者は、特許保護を得る前に、私たちの研究および開発された特許可能な側面を識別することができない可能性がある。
したがって、私たちのこれらと任意の特許と出願は私たちの最大の利益に合った方法で起訴されて強制的に施行されないかもしれない。私たちの特許または特許出願の準備または提出中に形態的な欠陥が存在する可能性があり、または適切な優先権要件、発明権、特許請求の範囲、または特許期限調整のような欠陥が将来的に生じる可能性がある。私たちの現在のライセンシーまたは任意の未来のライセンシーまたはライセンシーが、いかなる特許権の起訴、保守または強制執行においても完全に協力していないか、または私たちの意見に同意しない場合、このような特許権は損害を受ける可能性があり、第三者が競合製品を製造、使用、販売することを阻止することができないかもしれない。我々の特許または特許出願の形態または準備中に重大な欠陥がある場合、そのような特許または出願は無効である可能性があり、および/または強制的に実行できない可能性がある。また,我々の競争相手は同等の知識,方法,ノウハウを自主的に開発することができる.このような結果のいずれも、私たちが第三者からの競争を阻止する能力を弱める可能性がある。
バイオテクノロジーと製薬会社の特許地位は一般的に非常に不確実だ。米国や他の国の特許法や特許法解釈の変化は,我々の特許の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある。しかも、外国の法律はアメリカの法律のように私たちの権利を保護しないかもしれない。これまで、米国または多くの外国司法管轄区域では、バイオテクノロジーおよび製薬特許によって許容される権利要件の広さに関する一致した政策は出現していない。例えば,欧州特許法は,米国法に比べて現在,人体治療法に対する特許性制限が多い。また,薬物化合物や技術に関する特許権の決定は,通常複雑な法律や事実問題に関連しており,近年多くの訴訟のテーマである。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.また,米国特許法の最近の変化は,2011年の“米国発明法”を含めて,我々の特許権の範囲,強度,実行可能性,あるいは我々が提起する可能性のある我々の特許権に関する訴訟の性質に影響を与える可能性がある。
私たちは私たちの現在と未来の候補製品に関連する可能性のあるすべての第三者知的財産権を知らないかもしれない。科学文献で発表された発見は往々にして実際の発見より遅れており、米国と他の司法管轄区の特許出願は通常、申請18ヶ月後に公表され、時には全く公表されないこともある。したがって、私たちは、私たちが私たちの特許または係属中の特許出願で保護を要求した最初の発明であるか、または私たちがそのような発明のために特許保護を申請した最初の人であることを確認することができない。同様に、もし私たちが将来任意の特許または特許出願を持っている場合、私たちは私たちがこれらの特許または特許出願で主張された発明のために特許保護を申請した最初の人であることを確信しないかもしれない。したがって、私たちの特許権の発行、範囲、有効性、商業価値は何の確定的な予測もできません。さらに、我々は、第3の方向の米国特許商標局(USPTO)が以前の技術の発行前に提出したか、またはUSPTOの派生、一方的な再審または当事者間の審査手続きまたは他の場所の同様の手続きに参加して、私たちの特許権または他の人の特許権に挑戦することができる。このような提出、訴訟、または訴訟における不利な裁決は、私たちの特許権の範囲を縮小したり、無効にしたりして、第三者が私たちの技術または候補製品を商業化し、私たちに支払う必要がなく、または第三者特許権を侵害することなく製品を製造または商業化することができなくなることを可能にする可能性があります。もし私たちの特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が私たちと協力し、現在または将来の候補製品を認可、開発、または商業化することを阻止することができる。
私たちの未解決および未来の特許出願は、私たちの技術または候補製品の全部または一部を保護するために、または他社が競争相手の技術および製品を商業化することを効果的に阻止するために、特許の発行を招くことができないかもしれない。私たちの特許出願が特許の形で発表されても、それらの発表形態は、競争製品やプロセスの影響を受けないように、競争相手が私たちと競争することを防止し、または他の方法でいかなる競争優位性を提供するのに十分であるように、私たちの業務目標を達成するのに十分である。私たちの競争相手は、非侵害的に類似または代替技術または製品を開発することによって、私たちの所有または許可された特許を迂回することができるかもしれない。私たちの競争相手は、私たちが持っているまたは許可された特許が無効で、強制的に実行できない、および/または侵害されていないと主張して、承認された製品の任意の模倣薬バージョンの販売を求めるために、短い新薬申請をFDAに提出するかもしれない。あるいは、私たちの競争相手は承認を求め、彼ら自身の製品を販売し、私たちの製品と似ているか、あるいは他の面で私たちの製品と競争するかもしれない。この場合、私たちは訴訟を提起することによって特許侵害を告発することを含む、私たちの特許を擁護および/または主張する必要があるかもしれない。上記のいずれかのタイプの訴訟では、裁判所または他の管轄権を有する機関は、我々の特許が無効であり、および/または強制的に実行できないことを発見することができる。
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、私たちが所有し、許可している特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。このような挑戦は
55
カタログ表
排他的または経営の自由、特許は強制的に執行できない、および/または1つまたは複数の特許主張は、全体的または部分的に縮小、無効、または強制的に実行できないことを主張し、これは、他人が類似または同じ技術および製品を使用することを阻止するか、またはそれを商業化する能力を制限するか、または我々の技術および製品の特許保護期間を制限する可能性がある。
特許条項は候補製品に対する私たちの競争地位を十分に長く保護するのに十分ではないかもしれない。
特許の寿命は限られている。米国では、すべての維持費が直ちに支払われる場合、特許の自然失効時間は、通常、特許要求優先の非一時的出願の最初の提出日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許を取得しても、候補製品の特許有効期限が満了すると、模倣薬を含む競争薬からの競争に直面する可能性がある。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちが持っている特許と許可された特許の組み合わせは、他の会社が私たちと似ているか同じ候補製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
また、新製品候補製品の開発、テスト、規制審査に要する時間を考慮すると、候補製品を保護する特許は、私たちの候補製品の商業化前または直後に満期になる可能性があります。FDAが我々の候補製品の上場承認の時間、持続時間、および条件に基づいて、私たちの1つ以上の米国特許は、1984年の“薬品価格競争および特許期限回復法”(Hatch-Waxman修正案と略称する)とEUの同様の立法(上述したように)に従って限られた特許期間延長を受ける資格がある可能性がある。したがって、私たちは適用された製品からの収入が減少するかもしれない。また、このような状況が発生すれば、私たちの競争相手は私たちの臨床と臨床前データを参考にして、私たちの開発と試験への投資を利用して、他の場合よりも早く彼らの製品を発売し、私たちの競争地位、業務、財務状況、運営結果、将来性は実質的に損害を受ける可能性がある。
第三者から知的財産権の許可を得る必要があるかもしれませんが、このような許可は得られないかもしれませんし、商業的に合理的な条項では得られない可能性もあります。
第三者は、特許権を含む、我々の候補製品開発に非常に重要または必要な知的財産権を有することができる。第三者の特許やノウハウを用いて候補製品を商業化する必要があるかもしれませんが、この場合、これらの第三者から許可を得ることが求められます。このようなライセンスは商業的に合理的な条項では得られないかもしれないし、全く得られないかもしれないし、不利な契約条項を受け入れざるを得ないかもしれない。もし私たちが商業的に合理的な条項でそのようなライセンスを得ることができなければ、私たちの業務は損害を受けるかもしれない。
もし私たちが必要な第三者知的財産権を得ることができない場合、あるいは私たちの既存の知的財産権を維持することができない場合、私たちは私たちの技術、候補製品、またはそれらを製造する方法を再設計するために多くの時間と資源を必要とするかもしれません、または代替技術を開発または許可することは、技術的にも商業的にも不可能かもしれません。もし私たちがそれができなければ、私たちは影響を受けた技術や候補製品を開発したり商業化することができなくなり、これは私たちの業務、財務状況、運営結果、将来性に実質的な損害を与える可能性がある。
私たちは私たちの特許や他の知的財産権を保護したり強制したりする訴訟に巻き込まれるかもしれないが、これは高価で時間がかかり、成功しないかもしれない。
競争相手や他の第三者は、私たちが発表した特許、商標、著作権、または他の知的財産権を侵害する可能性がある。権利侵害や不正使用に対抗するために、費用がかかり、時間がかかる可能性があり、私たちの管理者や科学者の時間と注意力を分散させる権利侵害請求を要求される可能性があります。私たちが認定された侵害者に対するいかなるクレームも、私たちが彼らの特許、商標、著作権、または他の知的財産権を侵害していると主張するように、これらの当事者に反訴を促す可能性がある。さらに、特許侵害訴訟では、裁判所は、私たちの特許が無効であるか、強制的に実行できないか、または1つまたは複数の特許請求の範囲の全部または一部が無効であると判断する可能性があり、私たちは、他方が論争された発明を使用することを阻止する権利がない。主張を実行できない理由は,特許起訴に関連する者が起訴中に米国特許商標局に関連情報を隠蔽したり,誤った声明をしたりしたためかもしれない.もう一つのリスクは、これらの特許の有効性が支持されても、裁判所はその特許の権利要件を狭く解釈するか、または私たちの特許がその発明を含まないことに基づいて、私たちが他方が論争された発明を使用することを阻止する権利がないと判断することである。我々の特許に関連する訴訟または訴訟における不利な結果は、これらの当事者または他の競争相手に対して私たちの特許を主張する能力を制限し、第三者が類似または競合製品を製造および販売する能力を制限または排除する可能性がある。同様に、私たちが商標侵害クレームを主張する場合、裁判所は、私たちが主張する商標が無効または強制執行できないと判断するか、または商標侵害を主張する側が関連商標に対する優先権を有することを主張するかもしれない。この場合には, 私たちは最終的にこのような商標の使用を中止することを余儀なくされるかもしれない。
56
カタログ表
いかなる侵害訴訟でも、私たちが得たいかなる金銭的損害賠償も商業的価値がないかもしれない。さらに、知的財産権訴訟は大量の開示を必要とするため、私たちのいくつかの機密情報は訴訟中に開示によって漏洩される可能性がある。また、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスだと思う場合、私たちの普通株の価格に大きな悪影響を及ぼす可能性がある。しかも、このような侵害クレームを提起し、追及するのに十分な財政的または他の資源があることは保証されず、これらのクレームは通常数年続いて解決される。私たちのいくつかの競争相手は、彼らがより多くの財政資源とより成熟して発展した知的財産権の組み合わせを持っているので、このような訴訟や法的手続きの費用を私たちよりも効率的に負担するかもしれない。私たちが最終的にこのような訴訟で勝訴しても、このような訴訟の金銭的コストと私たちの経営陣と科学者の注意の移転は、私たちが訴訟から得たどんなメリットをも超えるかもしれない。したがって、私たちは努力したにもかかわらず、私たちは第三者の知的財産権の侵害、流用、または成功的な挑戦を防ぐことができないかもしれない。特許訴訟や他の訴訟の開始と継続による不確実性は、市場での競争能力に悪影響を及ぼす可能性がある。
第三者は私たちが彼らの知的財産権を侵害したことを告発する法的訴訟を提起する可能性があり、その結果は不確定であり、私たちの業務を深刻に損なう可能性がある。
バイオテクノロジーおよび製薬業界には大量の知的財産権訴訟があり、私たちは、米国特許商標局への妨害訴訟を含む、私たちの技術または製品候補製品に関連する知的財産権訴訟または他の対抗性訴訟の一方または脅威になる可能性がある。知的財産権紛争は、特許、他の専有権の使用および許可手配の契約条項を含むいくつかの分野で発生する。第三者は既存または未来の知的財産権に基づいて私たちに請求するかもしれない。知的財産権訴訟の結果は不確定要因の影響を受け,これらの不確定要因は事前に十分に定量化できない。
もし私たちが第三者の知的財産権を侵害していることが発見された場合、裁判所の命令を含めて、権利侵害候補製品または製品の開発、製造、または商業化を余儀なくされる可能性がある。代替的に、私たちは、第三者から権利侵害技術を使用する許可を取得し、侵害候補製品の開発、製造、またはマーケティングを継続することを要求される可能性がある。しかし、私たちは商業的に合理的な条項や必要な許可証を得ることができないかもしれない。我々が許可を得ることができても,非排他的である可能性があり,我々の競争相手が我々に許可された同じ技術にアクセスできるようにする.さらに、もし私たちが故意に特許を侵害したことが発見された場合、私たちは3倍の損害賠償と弁護士費を含む金銭損害賠償責任を負われる可能性がある。権利侵害行為の発見は、候補製品を商業化することを阻止したり、一部の業務運営を停止させたりする可能性がある。我々が第三者の機密情報や商業秘密を盗用したと主張することは,我々の業務に類似した負の影響を与える可能性がある.
私たちは世界各地で私たちの知的財産権を保護できないかもしれない。
世界各国で候補製品特許を出願、起訴、擁護する費用は目を引くほど高く、米国以外のいくつかの国での知的財産権は米国ほど広くないかもしれない。場合によっては、私たちはアメリカ以外でいくつかの許可技術の特許保護を得ることができないかもしれない。また、いくつかの外国の法律は知的財産権の保護の程度はアメリカの連邦や州法律に及ばず、私たちが確かに特許保護を求めている司法管轄区でも同様である。したがって、私たちは、米国以外のすべての国または地域で私たちの発明を実施することを阻止することができないかもしれません。私たちが確かに特許保護を求めている司法管轄地域であっても、または私たちの発明を使用して製造された製品をアメリカまたは他の管轄地域で販売したり、輸入したりすることはできません。したがって、私たちは、米国以外のすべての国/地域で第三者が私たちの発明を実施したり、米国または他の管轄区域で私たちの発明を使用して製造された製品を販売または輸入することを阻止することができないかもしれない。
競争相手は私たちが特許保護を申請していない管轄区域で私たちの技術を使用して自分の製品を開発し、さらに他の侵害製品を私たちが特許保護を持っている地域に輸出することができるが、法執行力はアメリカに及ばない。これらの製品は私たちの候補製品や臨床前プロジェクトと競争するかもしれませんが、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法制度、特に特定の発展途上国の法律制度は、特許、商業秘密、および他の知的財産権保護、特にバイオテクノロジー製品に関する保護の強制執行を支持しておらず、これは、私たちの特許侵害を阻止したり、全体的に私たちの独占権を侵害したりして競争製品を販売することを困難にするかもしれない。外国の管轄区域で私たちの特許権を強制的に執行する訴訟手続きは、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移転させる可能性があり、私たちの特許が無効または狭義に解釈されるリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者からのクレームを引き起こす可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。だから私たちの
57
カタログ表
私たちの知的財産権を世界各地で強制的に実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネス的優位性を得るのに十分ではないかもしれません。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう。
私たちの候補製品のために特許や商標保護を求めるほか、特許を取得していないノウハウ、技術、その他の独自の情報を含む商業秘密に依存して、私たちの競争地位を維持しています。私たちは、私たちの従業員、会社の協力者、外部科学協力者、契約メーカー、コンサルタント、コンサルタント、および他の第三者のような秘密にアクセスする権利のある当事者と秘密協定を締結することによって、特定の個人情報の研究または開示を開始する前に、私たちのビジネス秘密を保護することを求めています。私たちはまた私たちの従業員とコンサルタントと秘密と発明または特許譲渡協定を締結します。このような努力にもかかわらず、どちらも合意に違反し、私たちのビジネス秘密を含む私たちの固有の情報を漏洩する可能性がある。これらの努力がなされ、第三者と協力する際に契約条項が採用されたにもかかわらず、私たちは第三者に依存しているため、商業秘密および他の機密情報を共有する必要があり、これは、このような商業秘密が私たちの競争相手に知られ、無意識に他の人の技術に組み込まれたり、開示されたり、またはこれらの合意に違反して使用されるリスクを増加させる。
私たちの知的財産権の無許可使用と開示を規制することは困難であり、私たちは私たちの知的財産権を保護するために私たちが取った手順が有効かどうかも分からない。しかも、私たちはこのような違反のすべてについて十分な救済措置を得ることができないかもしれない。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。
また,我々の競争相手は,我々のビジネス秘密に相当する知識,方法,ノウハウを自主的に開発する可能性がある.競争相手は私たちの製品を購入し、特許保護のない技術を開発する際に得られた競争優位性の一部または全部をコピーすることができる。もし私たちの任意の商業秘密が競争相手によって合法的に取得または独立して開発された場合、私たちは彼らまたは彼らが情報を伝達する人がその技術や情報を使用して私たちと競争することを阻止する権利がないだろう。もし私たちのビジネス秘密が競争相手に漏れたり、競争相手によって独立して開発されたりすれば、私たちの競争地位は損なわれるだろう。
我々の候補製品の規制承認とその他の法的適合性問題に関するリスク
たとえ私たちが必要な臨床前研究と臨床試験を完成しても、監督審査過程は高価で、時間と不確定であり、私たちあるいは任意の未来のパートナーが承認され、私たちの一部あるいはすべての候補製品を商業化することを阻止するかもしれない。したがって、候補製品を商業化するために、私たちまたは任意の未来のパートナーがいつ、どの地域でマーケティング承認を受けるかを予測することはできません。
私たちの候補製品及びその開発と商業化に関連する活動は、それらの設計、研究、テスト、製造、安全、効果、品質管理、記録保存、ラベル、包装、貯蔵、承認、広告、販売促進、販売、流通、輸出入及び安全報告とその他の発売後の情報を含み、すべてFDA、EMAと他の外国監督管理機関の全面的な監督管理を受けている。候補製品のマーケティング承認を得られなかったことは、私たちまたは潜在的な協力者が候補製品を商業化することを阻止するだろう。私たちは市場承認を得るために必要な申請を提出し、支援するために第三者の協力を頼りにします。上場承認を得るためには、広範な臨床前と臨床データ及び各治療適応の支持情報を監督機関に提出し、候補製品の安全性と有効性を確定する必要がある。上場承認を得るためには,製品製造過程に関する情報を規制機関に提出し,規制機関が製造施設を検査する必要がある。私たちの候補製品は効果がないかもしれないし、中程度の効果しかないかもしれないし、あるいは不良または意外な副作用、毒性、または他の特徴があることが証明される可能性があります。これらは私たちの上場承認を阻止するか、または商業用途を阻止または制限するかもしれません。私たちはGMPなどの適用要求に応じて私たちの製品を生産することに成功できないかもしれない。もし私たちの候補製品が市場承認を受けたら、付随するラベルは私たちが予想していたよりも厳格にその承認の用途を制限するかもしれません。これはその製品の販売を制限するかもしれません。
米国でも海外でも、上場承認を得る過程は高価であり、承認されれば何年もかかる可能性があり、関連する候補製品のタイプ、複雑さ、新規性を含む様々な要因によって大きく異なる可能性がある。上場承認を得るためには、広範な臨床前と臨床データ及び各治療適応の支持情報を監督機関に提出し、候補製品の安全性と有効性を確定する必要がある。上場承認を得るためには,製品製造過程に関する情報を規制機関に提出し,規制機関が製造施設を検査する必要がある。FDA、EMAまたは他の規制機関は、私たちの候補製品が安全で有効ではない、中程度のみ有効である、あるいは不良或いは意外な副作用、毒性或いは他の特徴を持っていると認定する可能性があり、私たちは上場許可を得ることができないようにし、或いは商業用途を阻止或いは制限する。どのようなマーケティング承認も
58
カタログ表
私たちが最終的に得た製品は制限されたり、制限されたり、承認された後の約束を受けたりして、承認された製品が商業的に不可能になる可能性がある。
さらに、開発中の市場承認政策の変更、追加法規または法規の変更、または各提出製品申請の規制審査の変更は、申請の承認または拒否の遅延を招く可能性がある。監督管理機関は審査過程中にかなりの自由裁量権を持っており、いかなる申請を受け入れることを拒否することができ、著者らのデータが承認を得るのに十分ではなく、追加の臨床前、臨床或いはその他の研究を行う必要があることを決定することもできる。そのほか、臨床前と臨床試験から得られたデータの異なる解釈は候補製品の上場承認を延期、制限或いは阻止する可能性がある。私たちが最終的に得たどのマーケティング承認も限られているかもしれないし、制限されたり、承認された後の約束は、承認された製品が商業的に実行できないようにすることができる。私たちまたは未来のパートナーが最終的に獲得したいかなるマーケティング承認も制限される可能性があり、または許可された製品が商業的に不可能になるように、制限または承認された約束を受ける可能性がある。
もし私たちが承認を得る上で遅延に遭遇した場合、あるいは私たちの候補製品の承認を得られなかったら、私たちの候補製品のビジネスの見通しが損なわれる可能性があり、私たちの収入を作る能力も損なわれるだろう。
外国の管轄区域でマーケティングの許可を得られなければ、私たちのいくつかの候補製品はこれらの地域で販売できないだろう。私たちの製品候補品がアメリカで得られたいかなる承認も私たちの製品候補品が外国司法管轄区で承認される保証はありません。
EUまたはEUまたは任意の他の管轄地域で私たちの製品をマーケティングして販売するためには、個別のマーケティング承認を得て、多くの異なる規制要件を遵守しなければならない。承認手続きは国によって異なり、追加的なテストが含まれるかもしれない。承認を得るのに要する時間は,FDA承認を得るのに要する時間とは大きく異なる可能性がある。米国以外の規制承認過程には、通常、FDA承認の取得に関するすべてのリスクが含まれる。また、米国以外の多くの国では、製品がその国での販売を許可される前に、精算承認を受けなければならないことが求められている。もしあれば、私たちはアメリカ以外の規制機関から直ちに承認されないかもしれない。FDAの承認は、他国又は管轄区域の規制機関の承認を確保するものではなく、米国以外の1つの規制機関の承認も、他の国又は司法管区の規制機関又はFDAの承認を確保することができない。しかし、一つの管轄区域で承認を拒否することは他の場所で承認される能力に影響を及ぼす可能性がある。私たちはマーケティング承認を申請できないかもしれないし、どの市場でも私たちの製品を商業化するために必要な承認を得ることができないかもしれない。
私たちが私たちの候補製品のためにマーケティング承認を得ても、私たちの製品に対する承認条項と持続的な法規は、私たちまたは私たちの協力者が私たちの製品を製造し、マーケティングする方法を制限するかもしれませんが、これらの要求を遵守することは大量の資源に関連する可能性があり、これは私たちの収益能力を深刻に弱めるかもしれません。
候補製品が上場承認されたとしても、承認された製品及びその製造業者及び営業業者は、REMSの実施又は高価な発売後の研究又は臨床試験及び監督を行って製品の安全性又は有効性を監視する潜在的な要求を含む持続的な審査と広範な規制を受けなければならない。私たちはまた広告と販売促進に関する要求を守らなければなりません。私たちのすべての候補製品のために、私たちは市場の承認を得ました。処方薬に関する販売促進情報は様々な法律や法規によって制限されており,製品が承認されたラベル中の情報と一致しなければならない。したがって、私たちが開発した未承認の適応や用途のための製品を広めることはできません。また、承認された製品の製造業者および製造業者の工場は、品質管理および品質保証に関する要求、およびそれに応じた記録および文書保守および報告要件などを含む、品質管理および製造プロセスがcGMPに適合することを保証することを含むFDAの広範な要求を遵守しなければならない。私たちと私たちの契約メーカーはFDAの定期的な抜き打ち検査を受けて、cGMPに適合することを監督して確保するかもしれません。私たちはまた商業製品不良事件報告書に対するFDAの要求を守らなければならない。
したがって、私たちの1つ以上の候補製品が市場承認を得たと仮定すると、私たちと私たちの契約製造業者は、製造、生産、製品監視、品質管理を含むすべてのコンプライアンス分野に時間、お金、エネルギーをかけ続けるだろう。承認後の規制要件を遵守できなければ、規制機関によって当社製品のマーケティング承認を撤回される可能性があり、将来の製品をマーケティングする能力が制限される可能性があり、利益を達成したり維持したりする能力に悪影響を及ぼす可能性があります。私たちはまた他の民事または刑事処罰を受ける可能性がある。そのため、承認後の法規を遵守するコストは、私たちの経営業績や財務状況に悪影響を及ぼす可能性があります。
59
カタログ表
私たちが上場承認を得た任意の候補製品は、発売後に制限されたり、市場からリコールされたり、撤退したりする可能性があり、もし私たちが規制要求を守っていない場合、あるいは私たちの候補製品が予期せぬ問題に遭遇した場合、その中のどの製品も承認された場合、処罰を受ける可能性がある。
FDAおよび米国司法省を含む他の連邦および州機関は、医薬品マーケティングおよび販売促進に関する要求、承認されたラベル条項の規定、およびcGMP要求に基づいて製品を生産する要求を含む処方薬製品に対するすべての要求に対するコンプライアンスを厳格に規制する。FDAと米国司法省はラベル外使用に関するメーカーのコミュニケーションに厳しい制限を加えており,我々の販売製品の適応が彼らが承認した適応でなければ,ラベル外マーケティングの法執行行動を受ける可能性がある.これらの要求に違反することは、虚偽請求法および他の連邦および州医療詐欺および乱用法律、および州消費者保護法を含む“食品、医薬品および化粧品法”および他の法規に違反することを告発する可能性がある。
私たちはすべての法規の要求を守ることができず、その後、私たちの製品、製造業者、または製造プロセスに以前に未知の不良事件または他の問題が存在することが発見され、様々な結果が生じる可能性があります
もし私たちまたは任意の未来のパートナーが安全モニタリングや薬物警戒に関する法規的要求、および小児科人のための製品の開発に関する要求を守らなければ、重大な経済的処罰を招く可能性もある。同様に、個人情報の保護に関する規制要件を遵守しないこともまた、重大な処罰と制裁を招く可能性がある。
英国やEUの安全モニタリングや薬物警戒に関する要求や,小児科群のための製品開発に関する要求を守らないことは,重大な経済的処罰を招く可能性もある。同様に、個人情報保護に関するイギリスやEUの要求を守らないことは、重大な処罰や制裁につながる可能性もある。
60
カタログ表
私たちの現在と未来のアメリカや他の地域の医療専門家、主要な研究者、コンサルタント、顧客と第三者支払者との関係は、適用される反リベート、詐欺と乱用、虚偽クレーム、医師支払いの透明性、健康情報のプライバシーと安全、および他の医療保健法律法規の制約を直接または間接的に受ける可能性があり、これは私たちを処罰させるかもしれない。
私たちの現在と未来の医療専門家、主要な調査者、コンサルタント、顧客、および第三者支払者との間の配置は、私たちがマーケティングの承認を得た任意の候補製品の業務または財務配置と関係を制限するかもしれないが、連邦反バックル法規および連邦虚偽クレーム法案を含む広範に適用される詐欺と乱用、および他の医療保健法律に直面する可能性があります。また、私たちは連邦政府および私たちが業務を展開している州と外国司法管轄区の医師の支払い透明性法律と患者のプライバシーと安全法規の制約を受ける可能性がある。私たちの運営能力に影響を与える可能性のある連邦、州、外国医療保健法は
61
カタログ表
また,ACAは他にも,連邦反リベート法規と何らかの医療詐欺を管理する刑法の意図要求を改正した。個人や実体はこれ以上法規や法規違反の具体的な意図を理解する必要がない。また、“反リベート法”では、政府は、“虚偽申告法”の規定により、連邦反リベート法規違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると断言することができる。
将来的に第三者の業務配置と適用される医療法律や法規に適合するような努力が巨額のコストに及ぶ可能性があることを確保します。政府当局は、我々の業務実践は、現在または将来、詐欺および乱用または他の医療保健法律の適用に関する法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちの運営が上記の任意の法律または任意の他の私たちに適用される可能性のある政府法規に違反していることが発見された場合、私たちは損害賠償、罰金、返還、Medicare、Medicaidおよび他の連邦医療保健計画への参加から除外される可能性があり、契約損害、名声損害、利益減少および将来の収益減少、当社の誠実な合意または他の合意の制約を受けて、私たちの法律違反に関する疑惑を解決し、私たちの業務を削減または再構成することができ、これらは私たちの業務を運営し、私たちの戦略を実施する能力に悪影響を及ぼす可能性があります。私たちがそれと業務を展開することを期待している任意の医師または他の医療提供者または実体(将来の協力者を含む)が適用法に準拠していないことが発見された場合、彼らは政府の医療計画への参加から除外されることを含む刑事、民事または行政制裁を受ける可能性があり、これはまた私たちの業務に影響を与える可能性がある。
将来の立法および/またはFDA、EMAまたは同様の規制機関によって採用される法規および政策は、現在および将来の候補製品に対する私たちまたは私たちの協力者の臨床試験の実施および完成に要する時間およびコストを増加させる可能性がある。
FDAとEMAはそれぞれ製品開発と承認過程を管理する法規を制定しており,他の外国規制機関も同様である。FDA、EMA、そして他の規制機関の政策が変わるかもしれない。例えば、2016年12月、21世紀治癒法案(21 Century Cure Act)が法律に署名された。その他の事項以外に、“治療法案”は薬品監督を現代化し、革新を奨励することを目的としているが、すべての条項が実行に移されているわけではない。また,2017年8月に最終指導意見を発表し,現在の抗菌薬の開発計画と臨床試験設計の考え方を述べ,満足されていない医療ニーズを有する患者の重篤な細菌性疾患を治療した。Cures ActやFDAや他の規制機関の任意の既存または将来の指導が私たちの候補製品の開発にどのような影響を与えるかを予測することはできません。
最近公布された今後の立法には、“インフレ低減法案”の関連条項が含まれており、私たちと私たちの協力者が私たちの候補製品のマーケティング承認を得て商業化の難しさとコストを増加させ、入手可能な価格に影響を与える可能性がある。
米国や一部の外国司法管轄地域では、医療システムの立法や規制の変化、提案された変化が複数あり、これらの変化は、私たちの候補製品の上場承認を阻止または延期し、承認後の活動を制限または規制し、マーケティングの承認を得た候補製品を収益的に販売する能力に影響を与える可能性がある。
米国や他の地方の政策立案者や支払者の中で,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上および/または参入拡大を既定の目標としている。
アメリカはまた他の連邦医療改革措置を提案して採択した。例えば,2015年の“連邦医療保険アクセスとチップ再認可法案”は臨床医支払い法定式の使用を終了し,品質支払いインセンティブ計画を構築し,品質支払い計画とも呼ばれている。この計画は,高度な代替支払いモード(APM)と功績に基づくインセンティブ決済システム(MIPS)を含む臨床医に2つの参加方式を提供する。2019年11月、CMSは最終ルールを発表し、最終的に品質支払い計画の変化を決定した。支払いを減らす方法はまだわかりません
62
カタログ表
そうでなければ,品質支払い計画の導入は連邦医療保険計画下の医師全体の精算に影響を与える。承認されれば,医療保険の提供者への支払いの変化が,これらのプロバイダの処方や我々の製品を管理する意欲に影響するかどうかも不明である。
また、政府は会社がそのマーケティング製品の価格設定の方式をより厳格に審査した。例えば、最近国会で数回の調査が行われ、薬品定価の透明性の向上、価格設定と患者計画との関係の審査、政府計画の薬品の精算方法の改革を目的とした連邦と州立法が提案され、公布された。特に,最近成立した“インフレ低減法案”には,医療保険が各種処方薬に支払う価格を制限するための条項が含まれている。
ACAや将来講じられる可能性のある他の医療改革措置は,より厳しいカバー基準を招き,我々が受け取った任意の承認製品の価格に追加的な下り圧力をもたらす可能性が予想される。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちまたは私たちの協力者が収入を創出し、利益を達成し、あるいは私たちの薬物を商業化することを阻止するかもしれない。
承認後の要求を拡大し、薬品の販売や販売促進活動を制限するための立法と監督管理提案が提出された。私たちは、より多くの立法変化が公布されるかどうか、あるいはFDAの法規、ガイドライン、解釈が変わるかどうか、あるいはこれらの変化が私たちの候補製品の上場承認にどのような影響を与える可能性があるかどうかを決定することはできない。また、米国議会のFDA承認過程に対するより厳格な審査は上場承認を著しく延期または阻止する可能性があり、より厳格な製品ラベルと上場後のテストとその他の要求の影響を受ける可能性がある。
私たちの候補製品は政府の価格規制を受けるかもしれません。これは私たちの収入に影響を与えるかもしれません。
処方薬や生物製品のコストが上昇していることを考慮すると、米国も海外の政府も薬品定価の審査を強化している。米国では,このような審査が最近の国会調査を招き,製品定価の透明性の向上,価格設定とメーカー患者計画との関係の検討,政府計画の製品精算方法の改革を目的とした連邦立法が提案·公布されている。連邦レベルでは、前トランプ政権の2020年度予算提案には、2020年予算過程または他の将来の立法で公布される可能性があるさらなる薬品価格制御措置が含まれており、例えば、連邦医療保険D部分が連邦医療保険B部分の下のある薬物の価格を交渉することを可能にする措置は、一部の州が医療補助に基づいて薬品価格を交渉することを可能にし、低収入患者の後発薬のコスト分担を廃止することを可能にする。前トランプ政権はまた、医薬品メーカーの競争を増加させ、いくつかの連邦医療保健計画の交渉力を増加させること、製造業者に製品価格を下げるよう激励し、消費者が支払う薬品自己負担コストを低減するための追加提案を含む、薬品価格の引き下げと薬品自己負担コストの低減の“青写真”または計画を発表した。
衛生と公衆サービス部はすでにその中のいくつかの措置についてフィードバック意見を求め、そしてその現有の権力範囲内で他の措置を実施した。例えば,2019年5月,CMSはMedicare Advantage計画が2020年1月1日からB薬剤に対する階段療法の一部を選択することを可能にする最終ルールを発表した。この最終規則はCMSが2019年1月1日に発効する政策変化を編纂した。2020年11月20日、CMSはCMS革新センターを通じて臨時最終規則を発表し、この規則によると、薬品メーカーが一人当たりの国内総生産に比較可能性を有する経済協力と発展組織加盟国で販売されている薬品に対して、調整後、連邦医療保険B部分は“ある高コスト処方薬”の精算が最恵国価格(即ち最低価格)を超えない。2020年12月28日、カリフォルニア州北部の米国地方裁判所は、臨時最終規則の執行を禁止する全国的な予備禁止令を発表した。その中のいくつかの措置および他の措置は発効するために追加の許可を必要とする可能性があるが、国会議員とバイデン新政府は、薬品コストを制御するために新しい立法および/または行政措置を求め続けると表明している。例えば,最近公布された“インフレ率低減法案”には,医療保険が様々な処方薬に支払う価格を制限するための条項が含まれている。州レベルでは、立法機関は、価格または患者の精算制限、割引、特定の製品へのアクセスの制限、およびマーケティングコスト開示および透明性措置を含む、医薬品および生物製品の価格設定を制御するための法規を立法および実施することによって、場合によっては、他の国からの輸入および大量購入を奨励することを目的としている。
米国以外、特にEUでは、処方薬の定価は政府によってコントロールされている。これらの国では、製品の発売許可を受けた後、政府当局との定価交渉にかなりの時間がかかる可能性がある。いくつかの国で保険と精算或いは定価の承認を得るために、私たちは臨床試験を行う必要があるかもしれません。私たちの候補製品の費用効果を他の利用可能な療法と比較します。もし私たちの製品が精算を受けられない場合、あるいは範囲や金額が制限されている場合、あるいは定価レベルが満足できなければ、私たちの業務は損害を受ける可能性があります。
63
カタログ表
私たちがGSKと同盟を結ぶことに関するリスクは
私たちの現在の収入と最近の予想収入の一部は従来、GSKプロトコル下の製品から来ているため、GSKとの紛争は私たちの業務を損害し、私たちの証券の価格を下落させる可能性があります。
歴史的に見ると、私たちの現在と最近のすべての予想収入はGSKプロトコル下の製品から来ている。私たちはこのような製品の印税が未来に私たちの収入の一部を占め続けるかもしれないと予想している。グラクソ·スミスクラインまたは私たちのいかなる行動も、重大な紛争、違約疑惑、訴訟、仲裁、または双方の間の重大な相違を招くこととして、市場または私たちの投資家によって否定的に解釈される可能性があり、私たちの業務を損なう可能性があり、私たちの証券価格の下落を招く可能性がある。このような問題の例は、契約義務の不履行および不履行の疑惑、当社の協力製品および他のGSK呼吸製品に対する相対的なマーケティングおよび販売努力の相違、公開声明に関する論争、および同様の事項を含むが、これらに限定されない。
グラクソ·スミスクラインは戦略的パートナーなので、場合によっては私たちの業務や私たちの株主に実質的なダメージを与える行動をとるかもしれません。
グラクソ·スミスクラインは戦略的パートナーであり、グラクソ·スミスクライン協定によると、その権利と義務は私たちと私たちの株主の利益とは異なる利益をもたらす。特に,グラクソ·スミスクライン協定でカバーされている協力製品のほかに,グラクソ·スミスクラインは大量の呼吸製品の組み合わせを持っている。グラクソ·スミスクラインは、その製品の組み合わせについて、私たちと協力している呼吸系製品に有害とみなされる可能性のある決定または声明を下すかもしれない。例えば、グラクソ·スミスクラインは、その非GSK/Innoviva呼吸システム製品を普及させることができ、またはより低いパーセントの印税を得る権利のある協力製品、GSKプロトコルがカバーする呼吸器プロジェクトの開発または商業化を延期または終了するか、または公開声明を発表するなど、他の行動をとることができ、私たちの株価に負の影響を与える。この点では例としてAdvairの販売は®グラクソ·スミスクラインが承認したCOPDおよび喘息治療薬はRelvarの売上よりも有意に高かった®/Breo®エリプタ®グラクソ·スミスクラインは、Advairを商業化していきたいと公言している®それは.また、GSKは、GSKプロトコルに従って将来支払う可能性のある特許権使用料を支払う義務がある可能性があることを考慮して、GSKは、これらの支払い義務を低減するために、我々の買収を求める可能性がある。GSKが我々を買収する時間を求める可能性があるのは,GSKプロトコルがカバーする薬物計画状況に関する情報を持っている場合には,これらの情報は公開されておらず,知られていない可能性がある。これらの異なる利益のため、グラクソ·スミスクラインはその最適な利益に合致すると考える行動をとるかもしれないが、私たちの最適な利益や私たちの株主の最適な利益に合致しないかもしれない。
グラクソ·スミスクラインはまた、我々が第三者と何らかの特許権使用料の貨幣化取引を行う前に、その同意を得る必要がある可能性があり、これらの取引を行う能力を抑制する可能性があると考えている。
グラクソ·スミスクラインは、GSKがGSKプロトコルに従って私たちに支払った特許使用料の将来の価値を貨幣化することを目的としたいくつかの取引を行う前に、その同意を得る必要があると考えている。グラクソ·スミスクラインは、これらのタイプの取引にはいくつかの契約が含まれている可能性があり、GSKプロトコルのいくつかの条項に違反する可能性があると考えていることを私たちに通知した。GSKの同意なしに、GSKプロトコルの要求に完全に適合するように特許権使用料金銭化取引を手配することができると信じているが、提案された貨幣化取引の第三者は、GSKの取引に対する同意を得ることを要求するか、またはあまり有利でない条項で取引を再構成することを主張するかもしれない。私たちはグラクソ·スミスクラインの同意を得ましたすなわち(I)Relvarでの資本貨幣化に関するいくつかの事前合意された契約を与えることができます®/Breo®エリプタ®Anoro®エリプタ®それは私たちが他の条約に付与した要求に無理に同意することを拒否しないだろう。条件の一つは、すべての場合、これらの条約が開発または商業化されている呼吸器疾患治療製品の製薬会社やバイオテクノロジー会社に有利ではないということだ。あらかじめ合意された条約以外の他の条約の付与にGSK同意を求めると,合理的な条項でGSKの同意を得ることができないか,GSKの同意を得ることができない可能性がある.GSKプロトコルでカバーされていない特許使用料金銭化取引をGSKの同意なしに継続する場合、GSKは、その同意を得ることを要求することができ、またはGSKプロトコルの違反または終了を許可することを理由に、取引に禁止または他の方法で挑戦することを求めることができる。グラクソ·スミスクラインが提起したいかなるクレームが合理的かどうかにかかわらず、私たちはグラクソ·スミスクラインのクレームに抗弁したり、私たち自身のクレームを主張する時に巨大なコストと資源移転が生じ、GSKはその同意を提供するために私たちの譲歩を求めるかもしれない。私たちがいつ、特許使用料の貨幣化取引を行うことができるかどうか、GSKプロトコルに対する実行可能な潜在的影響、またはGSKと協力する呼吸計画の潜在的な特許使用料損失の任意の不確実性は、GSKから大量の特許使用料を受け取る前に、私たちの株主のための資本リターン戦略を追求する能力を弱化させ、私たちの証券の市場価格を大幅に低下させ、私たちの業務に他の実質的な損害をもたらす可能性がある。
64
カタログ表
一般リスク因子
我々の内部コンピュータシステムや私たちと協力している第三者が故障したり、セキュリティホールに遭遇したりする可能性があり、これは私たちの業務を深刻に中断させる可能性があります。
セキュリティ対策が実施されているにもかかわらず、私たちの内部コンピュータシステムおよび私たちと協力する第三者のコンピュータシステム(私たちのパートナーを含む)は、コンピュータウイルス、ソフトウェアエラー、許可されていないアクセス、自然災害、テロ、戦争、ならびに電気通信、デバイス、および電気故障の破壊または破壊を受けやすい。もし私たちまたは彼らがどんな重大なシステム故障、事故、あるいはセキュリティホールに遭遇すれば、私たちの運営中断を招き、私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性があります。特に、マルウェア、不正アクセスデータ、および他の電子セキュリティホールを含むが、これらに限定されないネットワークセキュリティ攻撃が進化しており、これらの脆弱性は、システムの中断、私たちの機密情報の流用、または他の方法で私たちの情報を保護し、データを破損させる可能性があります。
また、カリフォルニア州は最近、米国初のGDPRのような法律と呼ばれる立法を公布した。この法案は“カリフォルニア消費者プライバシー法”(CCPA)と呼ばれ、消費者のための新たなプライバシー権(法律では広く定義されている)を創出し、消費者または家庭の個人データを処理するエンティティにより多くのプライバシーとセキュリティ義務を課す。2020年1月1日の発効以来、CCPAはカバーする会社がカリフォルニアの消費者に新しい開示を提供することを要求し、これらの消費者に新しい方法を提供して、ある個人情報の販売から撤退することを選択し、データ漏洩に対して新しい訴訟理由を取ることを可能にした。CCPAは私たちの業務活動に重大な影響を与える可能性があり、巨額のコンプライアンスコストの支払いを要求し、それによって業務、経営業績、将来性と財務状況に不利な影響を与える。
したがって、私たちのデータがパートナーまたは第三者提供業者で漏洩されたことを含む任意のアクセス、開示、または他の情報損失は、法的クレームまたは訴訟を引き起こす可能性があり、個人情報のプライバシーを保護する法律に基づいて責任を負い、私たちの運営を乱し、私たちの名声を損なう可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。
財務報告書に対して適切かつ効果的な内部統制を維持できない場合、または私たちの財務諸表を作成する際に使用される解釈、見積もり、または判断が正しくないことが証明された場合、私たちの経営業績と私たちの経営業務の能力が損なわれる可能性があります。
サバンズ-オキシリー法案は私たちに財務報告書と開示統制と手続きの効果的な内部統制を確立し、維持することを要求する。米国証券取引委員会の現行規則によると、我々は、サバンズ·オクスリ法案404条の要求に基づいて、経営陣が財務報告内部統制の有効性を報告できるように、我々の財務報告内部統制のシステムおよびプロセス評価およびテストを行わなければならない。私たちの独立公認会計士事務所はまた私たちの財務報告書に対する内部統制を報告することを要求された。私たちのテストと私たちの独立公認会計士事務所のテストは、財務報告内部統制における私たちの欠陥を明らかにするかもしれません。これらの欠陥は実質的な弱点と考えられ、私たちの財務報告内部統制を無効にします。私たちは、引き続き大量の会計·監査費用を発生させ、404条の要件を遵守するために多くの管理時間をかけることを予想している。もし私たちが404条の要求を直ちに遵守できない場合、あるいは私たちまたは私たちの独立公認会計士事務所が私たちの財務報告内部統制において実質的な弱点と考えられる欠陥を発見した場合、私たちの株は下落する可能性があり、私たちは米国証券取引委員会、FINRA、ナスダック世界ベスト市場または他の規制機関の調査または制裁を受ける可能性がある。さらに、発見される可能性のある重大な弱点を是正したり、規制調査や訴訟に対応するためには、多くの管理時間と財政資源が必要になるかもしれません。
私たちはまた複雑な税金法律、法規、会計原則とその解釈に支配されている。財務諸表を作成する際には、会計原則および指針を説明し、財務諸表日の報告された資産および負債額、または有資産および負債の開示、および報告中に生成された報告された収入および発生した費用に影響を与える推定および判断を行う必要がある。私たちの解釈、見積もり、判断は、私たちの歴史的経験と、このような状況では合理的な様々な他の要素に基づいており、これらの要素の結果は、私たちの財務諸表作成の基礎を構成している。アメリカ公認会計原則(以下は“アメリカ公認会計原則”と略称する)の表現は、アメリカ証券取引委員会、財務会計基準委員会、適切な会計原則とガイドラインを解釈し、制定するために設立された各種の他の機関の解釈に依存する。そのうちの1つが私たちの会計確認、計量または開示、または私たちの任意の会計解釈、推定、または仮定に同意しない場合、私たちの報告の結果に大きな影響を与え、前に報告された結果に影響を及ぼす可能性がある。他の潜在的な悪影響を除いて、私たちの財務業績を再記述する必要があることは、私たちの巨額のコストを招く可能性があり、私たちが再記述が完了する前に適時に定期報告を提出する能力に影響を与え、私たちの経営陣と従業員の私たちの業務管理に対する関心を移し、私たちの歴史と未来の財務業績に大きな変化をもたらし、投資家が私たちの経営業績に自信を失って、私たちは証券集団訴訟の影響を受け、私たちの株価を下落させます。
65
カタログ表
当社の従業員または第三者プロバイダ、または私たちポートフォリオ会社の従業員または第三者プロバイダは、規制基準および要件およびインサイダー取引を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります。
私たちは、従業員、第三者プロバイダ、または私たちポートフォリオ会社の従業員または第三者プロバイダの詐欺または他の不適切な行為のリスクに直面しています。我々ポートフォリオ社の従業員、第三者プロバイダまたは従業員、または第三者プロバイダの不適切な行為は、適用法規を故意に遵守しないこと、規制機関に正確な情報を提供すること、連邦および州詐欺および法律法規を遵守すること、財務情報またはデータを正確に報告すること、または許可されていない活動を私たちに開示することを含む可能性がある。特に、衛生保健業界は詐欺、不当行為、リベート、自己取引、その他の乱用行為を防止するための広範な法律と法規の制約を受けている。私たちは、私たちのポートフォリオ会社の従業員、第三者プロバイダ、または第三者プロバイダの不適切な行為を常に識別し、阻止することができるわけではなく、私たちがこのような活動を検出し、防止するための予防措置は、未知または未管理のリスクまたは損失を効果的に制御することができないか、またはこれらの法律または法規を遵守できないことによる政府の調査または他の行動または訴訟から私たちを保護することができないかもしれない。もし私たちにこのような行動を取って、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は巨額の罰金や他の制裁を加えることを含めて、私たちの業務に大きな影響を与えるかもしれない。
私たちは訴訟を招き、追加的な訴訟を招くかもしれない。
私たちは様々な法的手続きの影響を受けてきましたが、将来的には、通常の業務過程や私たちの業務に関連した訴訟、クレーム、法的手続きに直面したり脅威になったりする可能性があります。また、私たちが締結した協定には賠償条項が含まれている場合があり、賠償を受けた第三者にクレームを出すと、費用と損害賠償を負担させる可能性があります。
特定のクレームの是非にかかわらず、訴訟は高価で、時間がかかり、私たちの運営に妨害を与え、経営陣の注意力を分散させる可能性がある。これらの要素を考慮して、私たちは訴訟を解決し、このような紛争を解決するために合意や他の手配に到達するかもしれない。このような合意が受け入れ可能な条件で得られるか,訴訟が発生しない保証はない.このような協定はまた私たちの運営費用を大幅に増加させるかもしれない。
報告期間内に、私等または第三者に対する1つ以上の法的事項が解決された場合、関連する金額が管理層の予想を超える場合、私はその報告期間に等しい総合財務諸表が重大な悪影響を受ける可能性がある。さらに、このような結果は、重大な補償、懲罰的、または3倍の金銭的損害、収入または利益の返還、会社の救済措置、または私たちに対する禁止救済をもたらす可能性があり、これは私たちの財務状況および経営業績に重大な悪影響を及ぼす可能性がある。
私たちはいくつかのタイプのクレームに対して保険範囲を維持していますが、このような保険範囲は、起こりうるすべての損失またはすべてのタイプのクレームをカバーするのに十分ではないかもしれません。
米国の“海外腐敗防止法”や“海外腐敗防止法”や、私たちが業務を展開している国の反賄賂法を守らなければ、私たちは罰やその他の不利な結果を受ける可能性がある。
私たちは一般的に、米国企業が業務を獲得または保留するために外国人官僚への贈賄や外国人官僚への他の禁止された金の支払いを禁止し、正確な帳簿や記録および内部統制を維持することを要求する“海外腐敗防止法”の制約を受けている。しかも、私たちは私たちが業務を展開している他の司法管轄区域の反賄賂法律によって制限されている。私たちの政策や手続きおよび“海外腐敗防止法”や他の反賄賂法によると、私たちの従業員や他の代理人は、私たちが知らずに禁止された行為に従事している可能性があり、私たちはこれに責任を負わなければならないかもしれない。もし私たちの従業員や他の代理人がこのような行為に従事していることが発見された場合、私たちは厳しい処罰および他の結果を受ける可能性があり、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
アメリカ連邦所得税改革は私たちに悪影響を及ぼすかもしれない。
2017年12月22日、米国連邦税立法、通称減税と雇用法案(TCJA)が法律となり、米国国税法の重大な改革が行われた。他の事項以外にも、TCJAは米国連邦税率の変化を含み、利息控除に著しい追加制限を加え、資本支出の支出を許可し、“世界”税制から地域税制への移転を実施し、多くの商業減額と控除を改正または廃止した。
TCJAはアメリカ連邦所得税法の複雑な改正であり、異なる種類の納税者と業界に対して異なる、ある場合は影響を相殺する影響を与え、その後多くの領域で規則を制定と解釈する必要がある。TCJAの全体経済、私たちが経営する業界、私たちのパートナー業務への長期的な影響は信頼できません
66
カタログ表
新しい法律施行の初期段階で予測された。TCJAが我々の経営業績,財務状況,将来の業務運営に悪影響を与えないことは保証されない。TCJAの推定影響は、我々の経営陣が税務コンサルタントに相談した後の現在の知識と仮定に基づいており、確認された影響は、我々の実際の結果および新しい法律のさらなる分析に基づく現在の推定と実質的に異なる可能性がある。TCJAの普通株式保有者への影響は不確定であり,実質的な悪影響である可能性がある。本年度報告書は、このような税金立法または普通株式投資家に影響を与える可能性のある方法については議論しない。投資家はこのような立法と普通株に投資する潜在的な税金結果について彼ら自身の税務顧問に相談しなければならない。
私たちは絶えず変化して複雑な税法に支配されており、これは追加的な負債を招き、私たちの運営結果に影響を及ぼすかもしれない。
私たちはアメリカや他の管轄区域に所得税を納め、私たちの業務過程で、様々な取引や事件の予想される税収処理を判断します。税収法、法規、行政慣行、原則および解釈の変化、および私たちが予想していたのとは異なる事件は、すでに影響を与え、私たちの有効税率、キャッシュフロー、および/または経営業績に悪影響を及ぼす可能性がある。米国が提出した税収提案には現在、2017年の減税や雇用法案のいくつかの改正、例えば研究開発費の資本化を要求する条項の廃止または延期が含まれている。また、米国と我々が業務を行っている他の管轄区の税務機関は、定期的に私たちの納税申告書をチェックし、司法管轄区域間の利益分配の審査を強化しており、私たちの経営業績に悪影響を及ぼす可能性があります。経済協力開発機構や欧州委員会などの協会が税収に関する事項で更なる行動をとることは、我々が業務を展開している国の税法に影響を与える可能性がある。現在のアメリカあるいは国際税収フレームワークの重要な要素に対する修正は私たちの有効税率、経営結果、キャッシュフローに重大な影響を与える可能性がある。
疾病や任意の他の伝染病の広範な爆発、あるいは任意の他の公衆衛生危機は、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。
新型コロナウイルス(新冠肺炎)の発生は世界経済にマイナスの影響を与え、グローバルサプライチェーンを混乱させ、金融市場の大幅な変動と混乱をもたらした。当社は新冠肺炎の流行に関連する事態の発展に注目しており、当社の業務への影響を評価している。新冠肺炎疫病によるグローバルサプライチェーンの延長と経済中断は、私たちの運営結果と財務状況に実質的な影響を与える可能性がある。
Sarissa Capitalと締結されたサービス協定によると、私たちはSarissa Capitalが私たちの戦略投資活動を支援することに依存するかもしれない。
2020年12月11日、私たちはサービス協定を締結し、この協定によると、Sarissa Capitalは私たちの買収戦略の面で実質的な助けを提供してくれた。“サービス協定”の条項に基づいて、その中で規定されている制限を受けて、Sarissa Capitalは他の事項を除いて、(I)Innovivaの全面的な買収と投資プロセスと戦略の制定に協力する;(Ii)市場傾向、市場動態、およびM&A活動についてInnovivaに相談を提供する;(Iii)潜在的な取引目標を決定する;(Iv)取引目標の職務調査および取引の交渉と実行に協力する;(V)投資または買収を行った後、目標会社の成長と運営計画、業績と統合について提案を提供する;取締役やターゲット会社の幹部候補の決定に協力していますこのようなサービスはSarissa Capitalによって提供され、私たちはサービスを提供する方法を制御することができないか、または制御することができない。Sarissa Capitalが必要なサービスを十分に履行できなかったら、私たちの投資活動、運営、そして財務業績は否定的な影響を受けるかもしれない。
私たちの共同企業への投資は私たちを様々なリスクと不確定要素に直面させる可能性があり、いかなるリスクと不確定要素も私たちの投資結果に影響を与える可能性があり、私たちの業務、財務状況、経営業績に重大な悪影響を及ぼす可能性がある。
歴史的に、私たちは現金備蓄を短期投資と有価証券に投資し、主に会社の手形、政府証券、政府機関、商業手形である。2020年12月11日,我々は共同契約を締結し,我々の現金備蓄から3億ドルを投資し,Sarissa Capitalが共同企業の投資管理人として管理した。
私たちは私たちの収入の一部が私たちの特許使用料管理事業から続くと予想しているが、この投資のため、私たちはSarissa Capitalが管理する資産から大きな収入を得るかもしれない。Sarissa Capitalの投資戦略は、公開または非公開取引された証券(債務または株)、派生ツール、および上記のすべてに関連する他の金融商品の“マルチヘッド”ポートフォリオ、特に医療、製薬、およびバイオテクノロジーの分野に集中的に投資されるだろう。この投資戦略に関連するリスクは、従来の固定収益投資戦略や他の低収益戦略のリスクよりもはるかに大きい可能性がある。
67
カタログ表
私たちには限られた権利があり、組合企業の管理やSarissa Capitalの投資活動に参加する権利はありません。私たちはSarissa Capitalが共同企業での私たちの投資を管理することに完全に依存している。私たちはSarissa Capitalが私たちの投資目標を成功的に達成することを保証できない。共同会社証券組合の意外な市場変動や損失は、当社の共同会社への投資に重大なマイナス影響を与える可能性があり、それによって私たちの投資業績、財務状況あるいは経営業績に影響を与える可能性があります。
組合合意は私たちが組合から投資資金を撤回する能力を制限する。
組合契約の条項によると、限られた例外を除いて、“禁売期間”が満了する前に、組合会社に投資した資金を引き下げる権利はありません。ロック期間が終了した後、年間25%のハードル準備金を引き出すことができ、4つの財政四半期に共同企業での全口座を受け取ることができます。したがって,これらの資金の流動資金を獲得する能力は限られており,さらに市場変動の影響を受け,特にパートナーシップポートフォリオの期待集中的な性質を考慮している。
Sarissa Capitalは他の第三者資本を管理し続けるつもりで、組合企業に最小限の時間を投入する必要はない。
管理組合企業以外に、Sarissa Capital、その依頼者及びその関連会社は自分の口座及び/又は第三者口座のために投資と取引活動に従事することができ、組合企業に投資或いは取引活動の排他性或いは優先権を提供する必要がない。Sarissa Capitalの付属会社は管理し、提携企業の目標に似た他の顧客口座を管理し続ける予定だ。パートナーシップ協定は、私たちに時間、努力、または投資機会を割り当てるための具体的な義務または要件を含まず、Sarissa Capitalまたはその関連会社が管理する可能性のあるアカウントの投資性質または時間にいかなる制限も加えない。
私たちの証券の価格はずっと変動していて、変動し続ける可能性があり、私たちの証券を購入した人は大きな損失を受ける可能性があります。
私たちの証券の価格はずっと不安定で、そう続くかもしれない。ナスダック世界ベスト市場で報告されている普通株販売価格の高低は、2022年1月1日から2022年12月31日までの間に、1株10.92ドルから18.97ドルの間である。一般的な株式市場,特にバイオテクノロジーやバイオ製薬会社の市場は極端な変動を経験しており,この変動は往々にして会社の経営業績とは無関係であり,特に過去数年間である。
私たちは株主に資本を返還しないことを選択できないか選択できないかもしれない。
株主への支払いまたは継続支払い資本リターンは、私たちの取締役会が適宜決定し、当社の財務状況、経営結果、資本要求、私たちの戦略計画の実行状況、一般的なビジネス条件、資本リターンの税務処理、私たちの信用協定および他の合意に含まれる潜在的な未来の契約制限、および私たちの取締役会が関連すると考えている他の要因に依存します。他の要因に加えて、将来の資本収益は、将来の買収投資の潜在的資本要求および私たちの運営資本と債務維持要求に対する私たちの見方、法的リスク、株式または債務買い戻し計画、連邦と州所得税の法律または会社法の変化、および私たちのビジネスモデルの変化によって影響を受ける可能性がある。私たちの資本返還計画は時々変わるかもしれないし、私たちは私たちが特定の金額を提供し続けるという保証はない。私たちの将来の資本返還計画の発表は、私たちがどんな具体的なドル債務や株式または普通株の数を買い戻す義務があるということを意味しない。私たちの資本返還計画を減少、一時停止、または変更することは私たちの株価に否定的な影響を及ぼすかもしれない。
私たちの定款と定款およびデラウェア州法律における反買収条項はわが社への支配権変更を阻止または延期する可能性があります。
当社の登録証明書及び定款の規定は、他の場合にプレミアム取引を受ける可能性があることを含む、株主が有利と考える合併または買収を阻害、延期または阻止する可能性があります。これらの規定には
68
カタログ表
さらに、デラウェア州の法律のいくつかの条項はまた、誰かが私たちを買収したり、私たちと合併したりすることを阻止、延期、または阻止するかもしれない。
不利なグローバル経済と政治環境は、私たちの業務、財務状況、または経営結果に悪影響を及ぼす可能性がある。
私たちの経営業績はグローバル経済、グローバル金融市場、グローバル政治状況の悪影響を受ける可能性がある。米国と世界経済は絶えず成長するインフレ、より高い金利、潜在的な景気後退に直面している。われわれの将来の一部の臨床試験は米国以外で行われる可能性があるが,不利な経済条件によりドルが弱くなり,これらの臨床試験の操作コストが高くなる。さらに、現在の新冠肺炎の流行や政治的動揺(ウクライナとロシアとの戦争のような)による衰退や不況を含む深刻または長期的な経済低下は、私たちの候補製品または任意の未来の候補製品に対する需要の低下(承認された場合)、および必要なときに許容可能な条件で追加資本を調達する能力を含む様々なリスクを私たちの業務にもたらす可能性がある。いかなる国際貿易紛争も含めて、疲弊したり衰退したりする経済的または政治的動揺は、私たちの製造業者やサプライヤーに圧力を与え、供給中断を招き、あるいは私たちの顧客に潜在的な製品の支払いを延期させる可能性もあります。上記のいずれも私たちの業務を深刻に損なう可能性があり、私たちは政治的または経済的気候と金融市場の状況が私たちの業務のすべての方法を深刻に損なう可能性があることを予見できない。
提案や将来制定される税務法例は、私たちの財政状況や経営業績にマイナス影響を与える可能性があります。
2022年8月16日、総裁·バイデン氏は“インフレ低減法案”に署名した。アイルランド共和軍には、ある大企業に15%の最低企業所得税を徴収することと、株式買い戻しに行使税を徴収することを含む税金関連条項が含まれており、いずれも2022年12月31日以降の納税年度に発効する。私たちは私たちの財務状況と未来の業務結果にどんな影響があるかを決定するためにアイルランド共和軍を評価している。
項目1 B。未解決従業員意見
ない。
項目2.財産
私たちの本部はカリフォルニア州バーリントンにある2111平方フィートのオフィス空間の賃貸契約を含み、この賃貸契約は2023年12月に満期になります。私たちの他の材料賃貸物件はマサチューセッツ州ウォルザムにあるオフィス空間と実験室施設の組み合わせで、面積は約20,000平方フィートで、2025年12月に満期になります。マサチューセッツ州のウォルザムにも小さいレンタル施設があります。私たちは、これらの施設が私たちの現在の運営ニーズを満たすのに十分であり、必要であれば、私たちの業務の拡張に適応するために、ビジネス合理的な条項で適切な追加空間を提供すると信じています。
項目3.法的手続き
本プロジェクトによって要求される情報は、ここで参照によってプロジェクト8に組み込まれる。“財務諸表及び補足データ”には、13が付記されている。“約束と事項がある”
プロジェクト4.鉱山安全開示
適用されません。
69
カタログ表
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
市場情報
2004年10月5日から2016年1月8日まで、私たちの普通株はナスダックで取引され、取引コードはTHRXである。2016年1月7日、会社名をInnoviva,Inc.に変更し、2016年1月11日から株式コードを“INVA”に変更しました。
所持者
2023年2月14日現在、私たちの普通株式には64人の登録株主がいます。我々の多くの普通株は仲介人や他の機関代表株主が保有しているため,これらの記録保有者が代表する株主総数を見積もることはできない.
発行者が株式証券を購入する
次の表は、2022年12月31日までの3ヶ月間の普通株の株式買い戻し状況を反映しています
期間 |
|
株購入総回数 |
|
|
1株平均支払価格 |
|
|
公開発表された計画または計画の一部として購入した株式総数(1) |
|
|
計画や計画によってはまだ購入していないかもしれない株の約ドルの価値(1) |
|
||||
2022年10月1日から2022年10月31日まで |
|
|
— |
|
|
$ |
— |
|
|
|
— |
|
|
$ |
— |
|
2022年11月1日から2022年11月30日まで |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
2022年12月1日から2022年12月31日まで |
|
|
647,394 |
|
|
|
13.13 |
|
|
|
647,394 |
|
|
|
91,496,562 |
|
合計する |
|
|
647,394 |
|
|
$ |
13.13 |
|
|
|
647,394 |
|
|
$ |
91,496,562 |
|
株式表現グラフ
以下の図は2017年12月31日から2022年12月31日までの間の普通株の累計株主総リターンと同期(I)ナスダック総合指数、(Ii)ナスダック小皿600医薬指数と(Iii)ナスダック生物技術指数の累積総リターンを比較した。このグラフは,2017年12月31日の(1)我々の普通株,(2)ナスダック総合指数,(3)ナスダック小盤株600医薬指数と(4)ナスダックバイオテクノロジー指数各100.00ドルへの投資を仮定し,配当金の再投資を想定している。
次の図に示す比較は履歴データに基づく.我々は,次の図に示す株価表現は,必ずしも我々の普通株の潜在的な未来表現を予測するつもりもないことを示していると警告する.グラフで使用されている情報は,ナスダック,ブルームバーグ,ロイター通信などから信頼できるソースとされているが,我々はこのような情報の誤りや見落としについては何の責任も負わない.
1933年の証券法(改訂本)または1934年の“証券取引法”(改訂本)に基づいて提出された任意の以前または未来の文書には、本10-K表年次報告またはこれらの法規に従って提出された未来の文書を本年度報告に組み込む可能性があるが、本株式表現グラフ部分は、米国証券取引委員会に提出されたものとみなされてはならず、引用によってこれらの法規に従って提出された任意の以前の文書または未来の文書に組み込まれているとみなされてはならない。
70
カタログ表
5年間の累積総リターン比較*
Innoviva,Inc.において、ナスダック総合指数、ナスダック生物技術指数とナスダック小盤株600医薬指数。
*2017年12月31日、配当金の再投資を含む株式または指数に投資された100ドル。
第六項です[保留されている]
71
カタログ表
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
経営陣の議論と分析(“MD&A”)は、我々の業務や運営結果の理解を促進することを目的としています。本議論および分析は、本Form 10-K年度報告書に含まれる連結財務諸表および注釈と共に読まなければならない。本議論および分析に含まれる情報または本Form 10-K年次報告に記載されている他の部分に記載されている情報には、改正された1933年証券法第27 A節および改正された1934年証券取引法第21 E節の展望的な陳述を含む、当社の業務計画および戦略、当社の運営費用、および私たちの協力協定の下での将来の支払いに関する情報が含まれる。このような陳述は危険と不確定要素に関する現在の予想に基づいている。議論が実際の結果が以下の議論および分析に記載された前向きな陳述によって説明または示唆された結果と大きく異なる重要な要素をもたらす可能性がある場合、上記の第1の部分項目1 Aの“リスク要因”と題する節を参照すべきである。より多くの情報は、上記の“前向きな陳述に関する特別な説明”の節を参照されたい。
管理概要
Innova,Inc.(単に“Innova”,“会社”,“登録者”または“私たち”および他の類似した代名詞)は,特許使用料と革新医療資産の組合せを持つ会社である.特許使用料の組み合わせには、Relvarを含むグラクソ·スミスクグループ株式会社(GSK)と協力した呼吸資産が含まれています®/Breo®エリプタ®(フランフルチカゾン/ヴィランテロール、“Ff/VI”)およびAnoro®エリプタ®(臭化ウラン/ヴィランテーロ、“UMEC/VI”)2022年7月まで、トレグリ®エリプタ®(FF/UMEC/VIの組合せ)。私たちは2022年7月20日にTheravance Respiratory Company,LLC(TRC)の15%の所有権を売却し、TRELEGYの販売によって印税を得る権利がなくなりました®エリプタ®製品です。長期的に発効したBeta 2 Agonist(“LABA”)協力協定によると,InnovaはGSKからRelvarを販売する印税を取得する権利がある®/Breo®エリプタ®具体的には,世界の年間純売上高前30億ドルの15%,世界の純売上高が30億ドルを超える全年度純売上高の5%,Anoro販売の特許権使用料®エリプタ®この等級は6.5%~10%の範囲で向上する。
我々は,2022年7月11日にentsis Treateutics Holdings Inc.の買収と2022年8月22日にLa Jolla製薬会社(La Jolla)を買収することにより,特許使用料と革新医療資産の組み合わせを拡大した。買収が完了した後、私たちの商業とマーケティング製品はGIAPREZAを含みます®敗血症または他の分布性ショックを有する成人の血圧を増加させるために許可された(アンジオテンシンII)、およびXERAVA®成人の複雑な腹内感染を治療するためのエラワサイクリンは、細菌感染を治療する薬剤、例えば、我々の主要資産であるシュバタン−ドゥロバタン(“Sul−dur”)を含む細菌感染を治療する薬剤を開発している。そのため、著者らは強力な伝染病と病院運営プラットフォーム及びこれらの治療領域の他の資産、例えばArmata PharmPharmticalsの大量の株式を持っており、Armata PharmPharmticalsはバクテリオファージ開発の先頭者であり、一連の伝染病とその他の深刻な疾病に応用できる可能性がある。私たちは他の医療会社にも経済的利益を持っている。
私たちの会社の構造と組織は私たちの重点活動のために注文したもので、これらの活動は私たちがGSKと協力した呼吸器資産の管理、私たちのマーケティング製品を商業化し、私たちの候補製品を開発し、資本構成を最適化し、上場会社のいくつかの基本的な報告と管理機能を提供することを含む。2022年12月31日まで、私たちは101人の従業員を持っている。
財務のハイライト
Innova株主の純収入は2022年12月31日までの1年間で2兆139億ドルで、2021年12月31日までの年間Innoviva株主の純収入2億659億ドルより5200万ドル減少した。純収入低下の主な原因は、1.532億ドルの未実現損失と、我々の特許使用料収入の減少を含む株式と長期投資の公正価値の減少である。これらの減少は、売却真実と和解委員会が確認した2兆667億ドルの収益部分と相殺された。2022年12月31日現在、現金と現金等価物は合計2.91億ドル、受取特許使用料と製品販売収入は6410万ドル。
企業動態
2022年7月11日、Innovivaがまだ所有していないentsisの発行済みおよび未償還持分証券の購入を4,240万ドルの現金対価格で完了した。EntasisはInnovivaにその主要資産Sul-durを基礎とした伝染病に集中した研究と開発プラットフォームをもたらした。
2022年7月20日、TRCにおける15%の所有権権益を2.82億ドルでRoyalty Pharma Investments 2019 ICAV(“Royalty Pharma”)に売却することを完了しました。TRCの現金残高の一部440万ドルの支払いと、可能な5000万ドルの販売ベースのマイルストーン支払いを含みます。私たちはまたTRCが取引前に所有していた持分と他の投資のすべての所有権を獲得した。
72
カタログ表
2022年8月22日、私たちはLa Jollaの買収を完了し、現金純価格は1億505億ドルだった。La JollaはGIAPREZAを含む成熟した製品の組み合わせをInnovivaにもたらした®感染性または他の分布性ショックおよびXERAVAを有する成人の血圧を増加させるために許可された(アンジオテンシンII)®(エラバサイクリン)成人の複雑な腹内感染の治療のための。
2022年10月31日、我々の取締役会は新しい株式買い戻し計画を承認し、この計画によると、最大1.00億ドルのInnoviva流通株普通株を買い戻すことができる。株式買い戻し計画下の任意の株式買い戻しの時間と金額は、業務資本需要、Innoviva普通株の市場価格、現行株価、一般市場状況、その他の考慮要因の継続的な評価に基づいて、我々の経営陣が適宜決定する。この計画によれば、株式買い戻しは、公開市場購入、私的交渉の取引、大口取引、株式買い戻し取引の加速、取引所取引、またはそれらの任意の組み合わせ、または連邦証券法による他の方法を含むことができる様々な方法によって行うことができる。本計画には終了日がなく、いつでも適宜、一時停止または終了を決定することができ、任意の数の普通株を購入する義務はありません。2022年12月31日現在、公開市場で647,394株を買い戻し、解約しており、総価格は約850万ドルである。2022年12月31日から2023年2月24日まで、公開市場で1,522,947株を買い戻し、総金額は約1,920万ドルだった。すべての買い戻し株は解約された。
臨床最新の状況
グラクソ·スミスクラインとの協力計画は
LABA連携
2002年11月、著者らはグラクソ·スミスクラインとLABA協力協定を締結し、慢性閉塞性肺疾患(“COPD”)と喘息を開発と商業化治療するLABA毎日一次製品(“LABA協力協定”)を開発した。COPDの治療に対して、この協力して3種類の組み合わせ製品を開発した
73
カタログ表
Relvarの起動と承認のため®/Breo®エリプタ®アーノロと®エリプタ®米国,日本,ヨーロッパでは,LABA協力協定により,2014年12月31日までの1年間にGSKに合計2.2億ドルの記念碑的費用を支払った。LABA連携プロトコルにより,我々はGSKに記念碑的な支払い義務をさらに支払っていないにもかかわらず,共同指導委員会への参加を含めてLABA連携プロトコルによる商業化活動を継続し,これらの活動はプロトコル有効期間内に継続されると予想される.グラクソ·スミスクラインに支払われた記念碑的費用は、支払われた資本化費用として確認され、これらの費用は製品商業発売後の推定使用寿命内に償却される。
私たちはGSKからRelvarの印税を販売する権利があります®/Breo®エリプタ®具体的には,上位30億ドルの世界年間純売上高は15%,30億ドルを超える全世界の年間純売上高は5%であった。浅談Anoroの販売®エリプタ®版税は6.5%から10%までアップグレードされています。TRELEGYの販売から印税を受けなくなりました®エリプタ®私たちが私たちの特許使用料権利を売却した後、私たちは2022年7月にTRCでの私たちの所有権を売却した。
Sarissa Capitalと戦略的パートナーシップを構築する
戦略諮問協定
2020年12月11日、Sarissa Capital Management LP(“Sarissa Capital”)と戦略諮問協定(“サービス協定”)を締結し、この合意に基づいて、Sarissa Capitalは私たちの買収戦略の制定と実行を支援するために様々な戦略サービスを提供してくれた。これらのサービスは無料で提供してくれます。Sarissa CapitalはInnovivaの普通株に投資し、私たちの取締役会で代表的なので、関連側と考えられている。
共同契約
2020年12月11日,当社全資付属会社Innoviva Strategic Partners LLC(“Strategic Partners”)は引受契約(“引受プロトコル”)および改訂および再予約された有限責任パートナー(“パートナーシップ協定”)を締結し,これによりStrategic PartnersはISP Fund LP(“パートナーシップ”)の有限責任パートナーとなる.共同企業の一般パートナー(“普通パートナー”)はSarissa Capitalの関連会社であり、1つの投資管理協定に基づいて、Sarissa Capitalはこの共同企業の投資顧問を担当する。戦略的パートナーはこのパートナーシップに3.00億ドルの初期寄付を提供した。同組合設立の目的は,医療,製薬,バイオテクノロジー業界の株式証券への投資である。組合協定は、Sarissa Capitalは組合会社から1%の通常管理費を獲得し、四半期ごとに前払いし、組合会社中の戦略パートナー資本口座の資産純資産値に基づいて計算することを規定している。また、一般パートナーは、組合企業の年間試算期間内の純利益に基づいて、慣例的に10%の年間業績配分を得る権利がある。パートナーシップ協定には36ヶ月の販売禁止期間が含まれており、その後、戦略パートナーは、その販売禁止期間が満了した日から、その後の各周年記念日に組合を脱退する権利があるが、いくつかの制限を受けている。
2021年5月、戦略的パートナーは、GSKが保有するInnova普通株を戦略的に買い戻すために、Innovaに資金を提供するために、このパートナーシップから1.1億ドルの割り当てを獲得した。2022年3月30日、戦略パートナー、パートナー、Sarissa Capital Fund GP LPが2021年5月20日に締結した書面合意に基づき、戦略パートナーはこのパートナーシップに1億1千万ドルを追加出資する。出資は出資日から36カ月の禁売期間がある。
重要な会計政策と試算
私たちの経営陣は私たちの財務状況と経営結果の討論と分析は私たちの財務諸表に基づいています。これらの報告書はアメリカ公認会計基準に基づいて作成されています。これらの財務諸表を作成する際には、財務諸表日までの報告された資産および負債額、または有資産および負債の開示、ならびに報告期間内に報告された収入および発生費用に影響を与える推定および仮定を行う必要がある。我々の見積もりは,我々の歴史的経験と,当時の状況では合理的な様々な他の要因に基づいており,これらの要因の結果は資産や負債の帳簿価値を判断する基礎を構成しているが,これらの資産や負債の帳簿価値は他の源からは明らかではないように見える。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。以下で議論する会計政策は、これらの政策がより重要な分野に関連しているため、経営陣の判断と見積もりに関連しているため、我々の歴史や将来の業績を知るために重要であると考えられる。
74
カタログ表
企業合併
会計基準編集(“ASC”)テーマ805における会計取得方法を用いて、企業合併それは.買収の日から、買収された各会社の経営業績は私たちの合併財務諸表に含まれています。買い取り価格は譲渡対価の公正価値に相当する.買収日には、すでに取得した有形及び識別可能な無形資産、負担された負債及び被買収側の任意の非持株権益を買収日に公正価値に計上する。営業権は、購入価格が買収された資産および負担された負債の公正純価値を超えることを確認した。
資産と負債に割り当てられた金額は公正な価値に基づいている。このような推定値は、特に識別可能な無形資産に関する重大な推定と仮定を要求する。私たちは合理的と思われる仮説と市場参加者の仮説に基づいて公正価値を推定する。重大な推定と仮定は、予想される将来の収入、収益、キャッシュフロー、推定されたいくつかのマイルストーン成果の確率、割引率、資産寿命などの項目に関連する可能性がある。私たちの推定はまた私たちの繰延税金資産と負債に影響を及ぼすかもしれない。予期せぬイベントや状況が発生する可能性があり、このような仮説、推定または実際の結果の正確性および有効性に影響を与える。我々の推定は,入手可能な履歴情報と未来予想に基づいており,推定自体は不確実である.単独で確認可能な無形資産には、一般に上場製品、進行中の研究開発、協力協定が含まれる。
特許使用料収入確認
私たちは特許使用料を稼いでいる間、契約特許権使用料の権利を持つ製品の純売上による特許権使用料収入を確認した。我々のパートナーが提供する純売上高報告は、その推定リターンおよび返金の方法および仮定に基づいて、契約および法的義務、歴史的傾向、過去の経験、および予想される市場状況に基づいて定期的に監視および調整を行う。私たちのパートナーは記録の実際の結果に基づいてその売上を大きく調整する可能性があり、これは私たちの特許使用料収入の変動を招く可能性があります。私たちは定期的に印税審査を行い、パートナーが提供する情報を評価する。特許権使用料は,グラクソ·スミスクラインに支払われた任意の承認とスタートマイルストーン支払いに関する資本化費用を差し引いて確認された純額である。
75
カタログ表
製品販売収入確認
La Jollaを買収したため、私たちは製品販売収入を確認し始めた。我々は、ASCテーマ606の下で、依頼者とエージェントに関する考慮に関する指導を適用した取引先と契約した収入私たちと第三者との間の取引の適切な処理方法を決定するために。我々が手配した取引分類は,手配の性質と契約条項および参加者の業務性質に基づいて決定される.私たちが依頼人とみなされている活動に関するどんな考慮事項も貨物又はサービスが顧客に移転する前に貨物又はサービスを制御する販売者は、製品販売に計上する。
製品販売の任意の収入を確認する前に、契約、履行義務、取引価格を決定し、取引価格を履行義務に分配します。製品販売からの収入は、私たちの顧客が製品制御権を獲得したときに確認し、取引価格によって記録され、記憶容量による使用課金、割引、返品、リベートを含む可変対価格の推定値が差し引かれます。可変対価は期待値金額法を用いて推定され,期待値は一連の可能な対価格金額における確率重み付き金額の総和である.最終的に受け取った実際の対価格金額は私たちの見積もりとは違うかもしれません。もし実際の結果が私たちの推定と実質的に異なる場合、私たちはこれらの見積もりを調整します。これは製品の販売収入と調整期間の収益に影響を与えます。これらのプロジェクトには
私たちがより多くの履歴データを蓄積するにつれて、私たちは可変考慮要素の推定を評価し続け、それに応じてこれらの推定を調整する。
支払資本化費用
事件や環境変化がそのような資産の帳簿価値が回収できない可能性があることを示す場合には,主要地理地域ごとに製品ごとに資本化減価費用を検討する。資本化費用の回収可能性は、資産の帳簿金額と資産予想による予想未割引未来の現金フローを比較することで測定される。回収可能性の決定には、一般に、キャッシュフローを生成する使用年数、その額、および資産の残存価値(あれば)を推定することを含む様々な推定および仮定が必要である。私たちは対応する市場の最近の予測製品販売と長期予測販売から必要なキャッシュフロー推定を得ています。過去、現在、未来の売上と傾向の分析によると、2022年12月31日現在、減値指標はなく、資本化費用に減値費用も記録されていない。
76
カタログ表
可変利子実体
可変利益エンティティ(“VIE”)の主な受益者は、VIEの資産と負債を統合しなければならない。私たちが他のエンティティの可変権益を取得したとき、私たちは関係の開始時およびいくつかの重大なイベントが発生したときに、そのエンティティがVIEであるかどうかを評価することに等しく、もしそうであれば、私たちはVIEの活動を指導する権利があるので、VIEの活動を指導する権利があるので、これらの活動はVIEの経済表現に最も大きな影響を与え、VIEがVIEに重大な影響を与える可能性のある損失またはVIEから利益を得る権利を負担する義務がある。我々の持つ可変利益がVIEに重要な意味を持つ可能性があるかどうかを決定するために,我々のVIE参加の性質,規模,形式に関する定性的,定量的要因を考慮した。
私たちがVIEの活動を指導し、VIEの経済表現に最も大きな影響を与える権利があるかどうかを評価するために、VIEの確立における私たちの役割と、私たちの持続的な権利と責任を含むすべての事実と状況を考慮した。この評価には,VIEの経済表現に最も影響を与える活動を決定することと,どちらが(あれば)これらの活動を制御する権利があるかを決定することがある.一般に、VIE(取締役会管理および代表)に影響を与える最も重要な決定を行い、これらの意思決定者を一方的に罷免する権利を有する当事者は、VIEの活動を指導する権利があるとみなされる。
VIEの損失を吸収する義務があるか、またはVIEからVIEに大きな影響を与える可能性のある利益を得る権利があるかどうかを評価するために、VIEにおいて可変利益とみなされるすべての経済的利益を考慮した。この評価は、これらの利益が全体的にVIEに潜在的な重要性を有すると考えられるかどうかを決定する際に判断することを要求する。
株式と長期投資
私たちはInCarda治療会社(“InCarda”)のCシリーズ優先株と優先株承認証を持っており,プライベート持株の臨床期バイオ製薬会社である。Cシリーズ優先株と引受権証は3級金融商品に分類され、公正価値で記録されているが、資産負債表ごとに再計量しなければならない。我々はBlack-Scholes-Merton定価モデルを用いて、株式承認証の行使価格、米国国債収益率から計算した無リスク金利、残り契約期間を期待期限とし、その上場同業者会社の普通株の履歴変動性から計算した期待株価変動率を仮定の下で推定した。
我々の他の3レベル金融商品には、Gate NeuroSciences Inc.(“Gate”)変換可能なチケットと、これらの証券が公開取引されていないので、ISP Fund LPが保有する私募ヘッドが含まれているので、評価モデルにおけるこれらの証券の評価のための仮定は、上場同行会社の投入を含む重大な観察不可能かつ観察可能な投入に基づいている。著者らはモンテカルロシミュレーションモデルを用いて、一定の合格イベント発生確率とGateの権益価値、無リスク金利、期待株価、同業者会社の波動性と融資時間の仮定の下で、公正価値でGateを計量して本チケットを転換することができる。ISP Fund LPが持つ私募配給ヘッドに適用される推定モデルには、Black-Scholes-Merton定価モデル、モンテカルロシミュレーションモデル、および他の適用可能な推定モデルが含まれる可能性がある。主にBlack-Scholes-Merton定価モデルの入力,モンテカルロシミュレーションモデルに適用されるあるイベントとシーンの確率比率,および適切な割引率について仮定するモンテカルロシミュレーションモデルはまた、証券の株価、期待期限、満期日、無リスク金利および配当収益率、および変動性のような取引詳細に基づく仮定を取り入れている。
比較可能性に影響する要素
以下に説明する要因のために、本報告に記載されている間の歴史的財務状況および経営結果は、異なる時期であっても未来であっても比較可能ではない可能性がある。
ASU 2020−06年度の採用についての詳細は、連結財務諸表付記1“業務説明と主要会計政策概要”を参照されたい。ENTASISおよびLa Jollaの買収およびTRCにおける当社の所有権の売却に関するより多くの情報は、連結財務諸表付記5“合併エンティティおよび買収”を参照されたい。
77
カタログ表
経営成果
純収入
特許権使用料収入
グラクソ·スミスクラインの純収入総額は、数年前と比較して以下の通りである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
印税-Relvar/Breo |
|
$ |
215,034 |
|
|
$ |
234,066 |
|
|
$ |
221,536 |
|
|
$ |
(19,032 |
) |
|
|
(8 |
)% |
|
$ |
12,530 |
|
|
|
6 |
% |
印税-アーノロ |
|
|
38,405 |
|
|
|
44,935 |
|
|
|
45,992 |
|
|
|
(6,530 |
) |
|
|
(15 |
)% |
|
|
(1,057 |
) |
|
|
(2 |
)% |
印税-TRELEGY |
|
|
72,029 |
|
|
|
126,688 |
|
|
|
73,089 |
|
|
|
(54,659 |
) |
|
|
(43 |
)% |
|
|
53,599 |
|
|
|
73 |
% |
総印税 |
|
|
325,468 |
|
|
|
405,689 |
|
|
|
340,617 |
|
|
|
(80,221 |
) |
|
|
(20 |
)% |
|
|
65,072 |
|
|
|
19 |
% |
差し引く:償却資本化 |
|
|
(13,823 |
) |
|
|
(13,823 |
) |
|
|
(13,823 |
) |
|
|
— |
|
|
* |
|
|
|
— |
|
|
* |
|
||
特許権使用料収入 |
|
|
311,645 |
|
|
|
391,866 |
|
|
|
326,794 |
|
|
|
(80,221 |
) |
|
|
(20 |
)% |
|
|
65,072 |
|
|
|
20 |
% |
戦略同盟であるMaba計画 |
|
|
— |
|
|
|
— |
|
|
|
10,000 |
|
|
|
— |
|
|
* |
|
|
|
(10,000 |
) |
|
* |
|
||
印税純収入総額 |
|
$ |
311,645 |
|
|
$ |
391,866 |
|
|
$ |
336,794 |
|
|
$ |
(80,221 |
) |
|
|
(20 |
)% |
|
$ |
55,072 |
|
|
|
16 |
% |
*意味がない
2021年12月31日までの年度と比較して、2022年12月31日までの年間総純収入は3兆116億ドルに低下した。特許権使用料総収入の減少は,主にTRCにおける我々の所有権権益を売却し,TRCの所有権権益がTRELEGYの売却により特許使用料を獲得したためである®エリプタ®それは.Relvarの印税®/Breo®エリプタ®アーノロと®エリプタ® 米国市場の定価圧力と外貨為替レートの変化により低下した。
2020年12月31日までの年度と比較して、2021年12月31日までの年間総純収入は3兆919億ドルに増加した。Relvarの印税®/Breo®エリプタ®有利な調整、患者コンプライアンスの向上及びある市場販売量の持続的な増加により、この数字はある程度増加した。アーノロ®エリプタ®やや低下したのは,主に米国のTRELEGYへの印税圧力が増加しているためである®エリプタ®三聯療法コースの持続的な増加と新市場販売の拡大により,売上高が高かった。
製品純売上高
2022年8月22日のLa Jolla買収から2022年12月31日まで、GIAPREZAの純売上高を含む製品の純売上高が1,970万ドルであることを確認しました®XERAVAと®1420万ドルと550万ドルです同期、私たちの純製品売上高の約96%は米国の顧客、4%は世界の他の地域から来た。
研究と発展
前年同期と比較した研究·開発費用は以下のとおりである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
2021 |
|
||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
$ |
|
|
% |
|
||||||
研究開発 |
|
$ |
41,432 |
|
|
$ |
576 |
|
|
$ |
1,788 |
|
|
$ |
40,856 |
|
|
* |
|
$ |
(1,212 |
) |
|
|
(68 |
)% |
*意味がない
78
カタログ表
研究と開発費用には以下の費用が含まれている
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
2021 |
|
||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
$ |
|
|
% |
|
||||||
対外サービス |
|
$ |
24,666 |
|
|
$ |
576 |
|
|
$ |
1,788 |
|
|
$ |
24,090 |
|
|
* |
|
$ |
(1,212 |
) |
|
|
(68 |
)% |
給与および関連人件費 |
|
|
13,863 |
|
|
|
— |
|
|
|
— |
|
|
|
13,863 |
|
|
* |
|
|
— |
|
|
* |
|
|
関連施設 |
|
|
2,255 |
|
|
|
— |
|
|
|
— |
|
|
|
2,255 |
|
|
* |
|
|
— |
|
|
* |
|
|
他にも |
|
|
648 |
|
|
|
— |
|
|
|
— |
|
|
|
648 |
|
|
* |
|
|
— |
|
|
* |
|
|
研究と開発費用総額 |
|
$ |
41,432 |
|
|
$ |
576 |
|
|
$ |
1,788 |
|
|
$ |
40,856 |
|
|
* |
|
$ |
(1,212 |
) |
|
|
(68 |
)% |
*意味がない
2022年12月31日までの年度の研究と開発費用は,主にentsisが我々の主要候補製品Sul−durのために行った製品開発に起因している。外部サービス費用には、主にコンサルタント、請負業者、契約製造組織に支払われる費用が含まれる。
2021年12月31日と2020年12月31日までの年度の研究·開発費用は,Pulmoquine治療会社の製品開発努力によるものであり,同社は2021年末に解散する。
販売、一般、行政
数年前と比較して、販売、一般、行政費用は以下の通りである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
販売、一般、行政 |
|
$ |
63,538 |
|
|
$ |
16,187 |
|
|
$ |
13,883 |
|
|
$ |
47,351 |
|
|
|
293 |
% |
|
$ |
2,304 |
|
|
|
17 |
% |
2021年12月31日までの年度と比較して,2022年12月31日までの年度の販売·一般·行政費が4740万ドル増加したのは,主に2022年2月17日からEnTASISの運営費を合併することと,2022年8月22日からLa Jollaの運営費を合併するためである。
2021年12月31日までの年間で,販売,一般,行政費用は2020年12月31日までの年度より230万ドル増加しており,これは主に業務発展活動の増加およびTheravance Biophma,当社とTRCとの仲裁による法的費用の増加によるものである。2021年12月31日と2020年12月31日までの年度の法律費はそれぞれ330万ドルと170万ドル。
利子及び配当収入及びその他の費用、純額
数年前と比較して、利息と配当収入およびその他の費用の純額は以下の通りである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
利子と配当収入 |
|
$ |
(6,369 |
) |
|
$ |
(1,839 |
) |
|
$ |
(1,524 |
) |
|
$ |
(4,530 |
) |
|
|
246 |
% |
|
$ |
(315 |
) |
|
|
21 |
% |
その他の費用、純額 |
|
|
3,373 |
|
|
|
3,626 |
|
|
|
348 |
|
|
|
(253 |
) |
|
|
(7 |
)% |
|
|
3,278 |
|
|
* |
|
|
*意味がない
2021年12月31日現在の年度と比較して、2022年12月31日までの年度の利息及び配当収入が増加しているのは、我々の現金等価物、通貨市場基金、その他の利回り投資の金利及び平均残高が増加しているためである。その他の費用(純額)は,主にインターネットサービスプロバイダ基金有限責任会社が発生した費用からなる。
2020年12月31日までの1年と比較して,2021年12月31日までの1年間の利息や配当収入が増加しているのは,ISP Fund LPが管理する投資リターンを含む投資リターンの増加によるものである。
79
カタログ表
利子支出
数年前と比較して、利息支出は以下の通りである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
利子支出 |
|
$ |
15,789 |
|
|
$ |
19,070 |
|
|
$ |
18,331 |
|
|
$ |
(3,281 |
) |
|
|
(17 |
)% |
|
$ |
739 |
|
|
|
4 |
% |
2021年12月31日までの年度と比較して,2022年12月31日までの年度の利息支出が変化したのは,主にASU 2020−06を採用し,転換可能債務ツールの会計処理を簡略化したためである。採択の結果、2025年に満期となる転換可能優先手形(“2025年手形”)の現金決済機能に関する債務割引を2022年1月1日にゼロに調整した。2022年12月31日までの年度の利息支出には、2023年満期の転換可能付属手形(“2023年手形”)、2025年満期の転換可能優先手形および2028年満期の転換可能優先手形(“2028年手形”)の契約利息支出および債務発行償却コストが含まれる。2021年12月31日までの年度の利息支出には、債務割引償却と、我々の2023年債券と2025年債の契約利息支出と債務発行コストの償却が含まれる。ASU 2020-06の採用による利息支出は減少したが、La Jolla買収による高い債務残高と繰延特許使用料債務利息支出部分はこの減少額を相殺した。
2020年12月31日までの1年間と比較して、2021年12月31日までの1年間の利息支出がやや増加しているのは、より多くの債務割引や発行コストが償却により確認されているためである。
債務返済損失
2070万ドルの損失を確認しましたが、これは2040万ドルの総保険料支払いと2022年3月の私たちの2023年債券元金総額1.448億ドルに関する30万ドルの債務発行コストの解約によるものです。
TRCの売却益
TRCにおける我々の所有権権益をRoyalty Pharma(2022年7月20日に完成)に売却したことにより,2.667億ドルの純収益を得たことを確認した。
権益法投資及びその他の株式及び長期投資の公正価値変動
数年前と比べ、権益法投資の公正価値純額及びその他の権益と長期投資の公正価値純額は以下のように変化した
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
権益が価値変動を公平に承諾する |
|
$ |
161,749 |
|
|
$ |
(84,392 |
) |
|
$ |
(49,511 |
) |
|
$ |
246,141 |
|
|
|
(292 |
)% |
|
$ |
(34,881 |
) |
|
|
70 |
% |
その他資産の公正価値変動 |
|
$ |
(8,462 |
) |
|
$ |
(6,638 |
) |
|
$ |
(766 |
) |
|
$ |
(1,824 |
) |
|
|
27 |
% |
|
$ |
(5,872 |
) |
|
|
767 |
% |
権益法投資およびその他の権益と長期投資の公正価値の同比変化は,Armata,InCarda,Gateにおける我々の戦略投資およびISP Fund LPが管理するそれらの投資の実現損益と未実現純損益を反映している.
権益法投資の公正価値変動は主にArmataとentsis投資の公正価値変動によるものである。2022年,2021年,2020年12月31日までの年間で,Armata投資に関する1兆525億ドルの未実現損失,7870万ドルの未達成収益,1900万ドルの未達成収益をそれぞれ記録した。我々のArmataへの投資の未実現収益や損失は,主にその公開取引証券の株価変化によって推進されている.2022年、2021年、2020年12月31日までの年度までに、920万ドルの未実現損失、570万ドルの未実現収益、3050万ドルの未実現収益をそれぞれ記録した。より多くの情報については、連結財務諸表付記6“株式及び長期投資及び公正価値計量”を参照されたい。
80
カタログ表
他の持分と長期投資の公正価値の同比変化は,InCarda,Gateにおける我々の戦略投資およびisp Fund LPによって管理されている投資の実現損益と未実現純損益を反映している。
所得税
数年前と比較して、所得税支出の純額は以下の通りである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
所得税支出,純額 |
|
$ |
66,687 |
|
|
$ |
76,439 |
|
|
$ |
60,431 |
|
|
$ |
(9,752 |
) |
|
|
(13 |
)% |
|
$ |
16,008 |
|
|
|
26 |
% |
2022年12月31日、2021年12月31日、2020年12月31日まで、私たちの連邦所得税の純営業損失はそれぞれ4.115億ドル、9290万ドル、3.615億ドルに転換した。2022年12月31日、2021年12月31日、2020年12月31日までに、約9.553億ドル、6.486億ドル、6.507億ドルの州純運営損失を繰り越し、これらの損失は2029年に満期になる。2022年12月31日、2021年12月31日と2020年12月31日まで、私たちの連邦研究開発税収はそれぞれゼロ、4210万ドル、4360万ドルです。2022年12月31日まで、私たちは3330万ドルの州研究開発税免除を受けた。
2022年,2021年,2020年12月31日までの年度で,6670万ドル,7640万ドル,6040万ドルの所得税支出をそれぞれ確認し,主にこれらの年度による課税所得額に基づいている。
2022年12月31日まで、私たちは全部で1630万ドルの未確認税金割引があります。2021年12月31日と2020年12月31日までの未確認税収割引総額はそれぞれ1,490万ドルと1,520万ドルです。
純営業損失と税収繰越免除の使用は“国税法”や国が定めるようなルールに制約されており、これらのルールは所有権変更に関する年間制限を管理している。私たちは、設立以来所有権変更が発生したかどうかを確認するために、2022年12月31日まで同社を分析した。研究では,同社はテスト期間中に所有権変更が発生していない可能性が高いと結論した。しかし、適用される年間制限にもかかわらず、私たちの純営業損失や信用繰越のどの部分も、連邦と州所得税負債を減らすために使用できる前に満期にならないと予想されます。年次制限は、このような金額の一部または全部が使用される前に満期になった純営業損失と税収控除の繰越につながる可能性がある。もし私たちが別の所有権変更を経験した場合、改正後の1986年“国税法”第382と383節に基づいて、所有権変更前の純営業損失の繰越或いは所有権変更前の税収属性を利用して、例えば税収控除を検討すると、所有権変更後の収入は年間制限を受ける可能性がある。似たような規則は州税法に適用されるかもしれない。
ENTASISを買収したため,ENTASISの所有権変更を検討し,連邦純運営損失のうち1億574億ドルを利用できると予想され,これらの損失は年次制限されている。
La Jollaを買収した結果,その所有権変更を初歩的に分析し,連邦純運営損失2.54億ドルを利用できると予想され,これらの損失は年次制限を受けている
非持株権の純収入に起因することができます
数年前と比較して、非持株権益による純収入は以下の通りである
|
|
|
|
|
|
|
|
|
|
|
変わる |
|
||||||||||||||||
|
|
十二月三十一日までの年度 |
|
|
2022 |
|
|
2021 |
|
|||||||||||||||||||
(単位:千) |
|
2022(1) |
|
|
2021 |
|
|
2020 |
|
|
$ |
|
|
% |
|
|
$ |
|
|
% |
|
|||||||
それは… |
|
$ |
6,341 |
|
|
$ |
102,983 |
|
|
$ |
69,412 |
|
|
$ |
(96,642 |
) |
|
|
(94 |
)% |
|
$ |
33,571 |
|
|
|
48 |
% |
(1)2022年12月31日までの年度とは、2022年2月17日の連結Entsisの初期日から2022年7月11日までEntasisを買収する日、および2022年1月1日から2022年7月20日までTRCでの所有権を売却する日を意味する。
2022年12月31日までの年度まで、非持株権益を占めるべき純収入は630万ドルで、前年同期の1.03億ドルから9660万ドル減少し、主にTRCでの所有権権益の売却による純収入が減少したが、entasisの非持株権益の純損失に相殺された。
81
カタログ表
2021年12月31日と2020年12月31日までの年間で、非持株権益による純収入はTheravance呼吸会社、LLC for Theravance Biophmaの純収入の85%を占める。2020年から2021年までの前年比増加は主にTRELEGYの処方と市場シェアの増加によるものである®エリプタ®.
流動性と資本資源
流動性
設立以来、私たちは主に私募と株式と債務証券の公開、協力手配に応じて受け取った支払いを通じて、私たちの業務に資金を提供してきました。2022年12月31日までの1年間に、3.255億ドルの特許使用料毛収入と1970万ドルの製品販売純収入を創出した。2022年12月31日現在、現金と現金等価物は合計2.91億ドル、GSK売掛金使用料は合計5470万ドル、製品販売に関する売掛金は合計940万ドル。
2022年12月31日現在、2023年手形、2025年手形、2028年手形の3種類の未返済転換手形があり、元金総額は5.497億ドルで、そのうち9620万ドルは2023年1月に満期になり、全額支払いされる。残りの1兆925億ドルと2.61億ドルはそれぞれ2025年8月と2028年3月に満期になる。このような手形に関連した未来の利息支払い総額は4600万ドルだ。
2022年10月31日、我々の取締役会は新しい株式買い戻し計画を承認し、この計画によると、最大1.00億ドルのInnoviva流通株普通株を買い戻すことができる。2022年12月31日現在、我々は公開市場でInnoviva普通株を買い戻し、総価格は約850万ドルである。本計画には終了日がなく、いつでも適宜、一時停止または終了を決定することができ、任意の数の普通株を購入する義務はありません。
2021年5月、戦略的パートナーは、GSKが保有するInnova普通株を戦略的に買い戻すために、Innovaに資金を提供するために、このパートナーシップから1.1億ドルの割り当てを獲得した。2022年3月30日、戦略パートナー、パートナー、Sarissa Capital Fund GP LPが2021年5月20日に締結した書面合意に基づき、戦略パートナーはこのパートナーシップに1億1千万ドルを追加出資する。そして、出資は36ヶ月のロック期間を受け、出資の日から計算される。
将来のニーズを満たすために現金資源が十分であるかどうか
私たちは、現在の運営計画と財務予測によると、私たちの現金と現金等価物は、私たちが予想している債務超過と運営需要を満たすのに十分であり、私たちが行っている株式買い戻し計画は、少なくとも今後12ヶ月以内になると信じている。私たちの長期資本需要は、私たちの特許使用料収入、私たちが現在販売している製品の販売増加、規制機関が私たちの候補製品を承認する時間、そして私たちの買収と戦略投資の結果を含む多くの要素に依存するだろう。もし私たちの現在の運営計画と財務予測が変化すれば、私たちは公共またはプライベート株式発行または債務融資の形でより早く追加資金が必要になるかもしれない。また、有利な融資機会が発生したと考えられる場合、公開または私募株式発行または債務融資の形態で追加資金を提供することを随時求めることができる。しかし、未来の融資は、もしあれば、私たちが受け入れられる金額や条項で提供されないかもしれない。これは私たちが現在の計画通りに私たちの行動に資金を提供するのに十分な財政資源を持たないかもしれない。さらに、私たちは時々私たちの債務を再構成または減少させるかもしれないが、個人的な協議による買い戻し、入札見積もり、償還、修正、または他の方法を含む、これらはすべて私たちの債務協定条項によって許可される。
キャッシュフロー
数年前と比較して、キャッシュフローは以下の通りである
|
|
十二月三十一日までの年度 |
|
|
変わる |
|
||||||||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|
2022 |
|
|
2021 |
|
|||||
経営活動が提供する現金純額 |
|
$ |
201,726 |
|
|
$ |
363,813 |
|
|
$ |
313,113 |
|
|
$ |
(162,087 |
) |
|
$ |
50,700 |
|
投資活動提供の現金純額 |
|
|
(56,634 |
) |
|
|
43,722 |
|
|
|
(314,937 |
) |
|
|
(100,356 |
) |
|
|
358,659 |
|
融資活動のための現金純額 |
|
|
(55,568 |
) |
|
|
(452,497 |
) |
|
|
(29,785 |
) |
|
|
396,929 |
|
|
|
(422,712 |
) |
82
カタログ表
経営活動のキャッシュフロー
2022年12月31日までの年度、経営活動が提供する現金は2.017億ドルで、主に私たちの純収入2.203億ドルおよび運営資産と負債の純変化690万ドルを含むが、純非現金項目2540万ドルによって部分的に相殺される。非現金プロジェクトには、TRCの売却確認の純収益2兆667億ドルが含まれているが、2.413億ドルの非現金費用総額によって部分的に相殺されている。非現金費用は、権益法投資およびその他の権益と長期投資公正価値の純減少1.533億ドル、繰延所得税2500万ドル、資本化費用償却と財産と設備減価償却1390万ドル、無形資産償却560万ドル、債務補償損失2070万ドル、株式補償支出730万ドル、販売製品コストに含まれる在庫公正価値調整1000万ドル、債務割引と発行コスト償却210万ドルを含む。業務資産と負債の変化には、前払い費用が2 140万ドル増加し、協力手配売掛金が1 330万ドル減少し、人事関連の売掛金および他の計上すべき負債および未払い所得税がそれぞれ1 190万ドルおよび1 000万ドル増加した。
2021年12月31日までの年度、経営活動が提供する現金は3.638億ドルで、主に非現金プロジェクト調整後の3.688億ドルの純収入、例えば7640万ドルの繰延所得税、1380万ドルの減価償却と償却、910万ドルの債務割引と発行コスト、200万ドルの株式給与支出を含み、一部は株式方法投資とその他の持分と長期投資の公正価値の純増加8930万ドルおよび協力手配からの売掛金1680万ドルの増加によって相殺される。
2020年12月31日までの年度まで、経営活動が提供する現金は3.131億ドルで、主に非現金プロジェクト調整後の2億938億ドルの純収入、例えば6040万ドルの繰延所得税、1380万ドルの減価償却および償却、840万ドルの債務割引および発行コスト償却、170万ドルの株式給与支出を含むが、権益法投資およびその他の持分および長期投資の公正価値は5030万ドル増加し、協力手配からの売掛金は1450万ドル分相殺される。
投資活動によるキャッシュフロー
2022年12月31日までの1年間に、投資活動のための現金純額は5660万ドルであり、La Jolla買収のために支払われた1.591億ドルの現金(取得した現金を差し引く)、5870万ドルの株式および長期投資購入、6090万ドルのインターネットサービスプロバイダ基金有限公司が管理する株式投資の購入、5000万ドルのインターネットサービスプロバイダ基金有限公司が管理する取引証券の購入、2340万ドルのインターネットサービスプロバイダ基金有限公司が管理する他の投資の純購入と純販売を含む。投資活動のための現金純額は、TRCの所有権権益で得られた純利益2.482億ドル、isp Fund LPによって管理されている株式投資を売却する純収益2430万ドル、および合併entasisによって得られた2310万ドルの現金部分によって相殺される。
2021年12月31日までの1年間に、投資活動が提供する現金純額は4370万ドルであり、これは主に3.01億ドルの販売と1.91億ドルの株式および他の投資の純現金流入により、各種投資ツールを購入した6630万ドルによって相殺され、これらの投資ツールには、普通株、株式承認証、転換可能債務投資、通貨市場基金、その他の証券が含まれるがこれらに限定されない。
2020年12月31日までの年間で,投資活動のための現金純額は3.149億ドルであり,主に株の購入とisp Fund LPが管理する他の投資の3.00億ドルと,普通株の購入,株式承認証,通貨市場基金,その他の証券の1.09億ドルが,有価証券満期日から受け取った8600万ドルの収益によって相殺された。
融資活動によるキャッシュフロー
2022年12月31日までの年間、融資活動のための現金純額は5560万ドルで、そのうちの1.651億ドルは2023年満期の転換可能な二次手形の買い戻しに使用され、6980万ドルは非持株資本に割り当てられ、4390万ドルはENTASIS非持株資本の購入に使用され、2100万ドルは2028年の手形に関連する上限コールオプションの購入に使用され、850万ドルは普通株の買い戻しに使用される。融資活動のための現金純額部分は、私たちが2028年手形を発行した純収益2億525億ドルによって相殺された。
2021年12月31日までの年間で、融資活動のための現金純額は4.525億ドルで、主にグラクソ·スミスクラインから3.941億ドルの普通株と、5950万ドルの非持株権益配分を買い戻したためだ。
2020年12月31日までの年間で、融資活動のための現金純額が2980万ドルだったのは、主に非持株権益に3050万ドルが割り当てられたためだ。
83
カタログ表
契約義務
2022年3月、2028年3月15日に満期となる元金総額2.61億ドルの無担保転換可能優先手形2028年手形の私募を完了した。2028年債券の条項によると、未償還元金の約2.125%の利息を支払う。元金残高2.61億ドルは2028年3月に満期になる。2022年12月31日現在、私たちの支払手形債務には、2023年1月に満期になり、全額支払われた2023年手形に関する9620万ドルと、2025年に満期となる2025年手形に関する1兆925億ドルも含まれています。2025年債券の条項によると、元金を返済していない2.5%の利息を支払う。詳細については、連結財務諸表付記12“債務”を参照されたい。
私たちの短期と長期債務には、私たちの経営賃貸に関連した契約支払いも含まれており、総額は410万ドルに達し、そのうちの約150万ドルは2023年12月31日、2024年と2025年に毎年約130万ドルまで支払われるべきだ。詳細は、連結財務諸表付記13“引受金及び有事項”を参照されたい。
我々のLa Jolla買収の一部として,HCRのLa Jolla印税協定に関する繰延印税義務を確認した。合意条項によると、HCRはGIAPREZAのグローバル純売上高の四半期特許権使用料を獲得する権利がある®2031年1月1日までまたは最高合計特許権使用料を支払う場合(先行発生者を基準)。特許権使用料協定に基づき,HCRに支払われる四半期費用は最高特許権使用料税率で開始され,年間製品純売上高ハードルの実現状況に応じて逓減する。現在の最高特許権使用料は14%だ。2024年1月1日から、合意された累計製品の純売上高のハードルに達していなければ、最高印税税率はさらに4%増加する可能性がある。La Jolla特許使用料協定がHCRに支払う最高特許権使用料の総額は2.25億ドルである。
さらに、様々な許可協定に基づいて、特定のまたは支払い義務があり、特定のマイルストーンの完成と実現に成功したときに特許使用料またはマイルストーン支払いを支払うことを要求します。より多くの情報については、連結財務諸表付記4“ライセンスと連携スケジュール”を参照してください。
著者らはまた、正常な業務過程において、サプライヤーと製造、臨床試験と臨床前研究及び運営目的のための他のサービスと製品について協定を締結した。
第七A項。市場リスクの定量的·定性的開示について
2022年12月31日現在、私たちの債務は固定金利で利されており、私たちは変動金利の未返済債務を持っていない。このような債務に対する私たちのキャッシュフローは金利変化の影響を受けない。
私たちの特定の株式と債務証券投資の公正な価値は変化するかもしれない。投資の基本的な公正価値の変動は重大な損益を招く可能性がある。より多くの情報については、連結財務諸表付記6“株式及び長期投資及び公正価値計量”を参照されたい。
本10−K表年次報告で述べた期間中,インフレ率は上昇し,近い将来上昇し続ける可能性がある。インフレ要因、例えば私たちの原材料、供給コスト、金利と間接コストの増加は、私たちの経営業績に悪影響を及ぼす可能性があります。これまで、インフレが私たちの財務状況や経営結果に実質的な影響を与えているとは考えていませんが、インフレ率が上昇し続けると、近い将来にいくつかの影響を経験するかもしれません。未来のインフレと物価の重大な不利な変化は大きな損失を招くかもしれない。
私たちは国際サプライヤーと締結された原材料調達に関する契約を含むドル以外の通貨建ての取引を達成したため、為替リスクに直面する可能性がある。Relvarの印税収入から来ました®/Breo®エリプタ®アーノロと®エリプタ®グラクソ·スミスクラインはまだアメリカ国外で製品をマーケティングと販売しているため、私たちの大部分の現金と現金等価物、投資及び私たちの大多数のサプライヤー関係はドル建てであるため、間接的に外貨リスクに直面しています。したがって、為替変動が私たちの営業収入に大きな影響を与えるリスクは実質的だとは思いません。
84
カタログ表
項目8.財務諸表と補足データ
|
|
|
ページ |
2022年12月31日現在と2021年12月31日現在の連結貸借対照表 |
86 |
2022年12月31日までの3年度における各年度の連結損益表 |
87 |
2022年12月31日までの3年度の総合総合収益表 |
88 |
2022年12月31日までの3年度の株主権益合併報告書 |
89 |
2022年12月31日までの3年度の連結現金フロー表 |
90 |
連結財務諸表付記 |
92 |
独立公認会計士事務所レポート(PCAOB ID) |
131 |
独立公認会計士事務所レポート(PCAOB ID 248) |
133 |
85
カタログ表
INNOVIVA,Inc.
合併貸借対照表
(単位は千、1株当たりのデータは除く)
|
|
十二月三十一日 |
|
|
十二月三十一日 |
|
||
|
|
2022 |
|
|
2021 |
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
売掛金 |
|
|
|
|
|
|
||
協力して売掛金を手配する |
|
|
|
|
|
|
||
在庫品 |
|
|
|
|
|
|
||
前払い費用 |
|
|
|
|
|
|
||
その他流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
株式と長期投資 |
|
|
|
|
|
|
||
支払済み資本化費用,純額 |
|
|
|
|
|
|
||
使用権資産 |
|
|
|
|
|
|
||
商誉 |
|
|
|
|
|
|
||
無形資産 |
|
|
|
|
|
|
||
税金資産を繰延し,純額 |
|
|
|
|
|
|
||
その他の資産 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
|
|
|
|
|
|
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
人事関連費用を計算しなければならない |
|
|
|
|
|
|
||
支払利息 |
|
|
|
|
|
|
||
収入を繰り越す |
|
|
|
|
|
|
||
2023年に満期になった転換可能な二次手形は、発行コストを差し引く |
|
|
|
|
|
|
||
所得税に対処する |
|
|
|
|
|
|
||
その他負債を計算すべき |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
割引と発行コストを差し引いた長期債務 |
|
|
|
|
|
|
||
その他長期負債 |
|
|
|
|
|
|
||
繰延税金負債,純額 |
|
|
|
|
|
|
||
長期課税所得税 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
株主権益: |
|
|
|
|
|
|
||
優先株:$ |
|
|
|
|
|
|
||
普通株:$ |
|
|
|
|
|
|
||
国庫株:原価で計算する |
|
|
( |
) |
|
|
( |
) |
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
Innoviva株主資本総額 |
|
|
|
|
|
|
||
非制御的権益 |
|
|
|
|
|
|
||
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
連結財務諸表の付記を参照。
86
カタログ表
INNOVIVA,Inc.
合併損益表
(単位は千、1株当たりのデータは除く)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
収入: |
|
|
|
|
|
|
|
|
|
|||
関係者からの特許使用料収入、純額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
協力手配からの収入 |
|
|
|
|
|
|
|
|
|
|||
製品純売上高 |
|
|
|
|
|
|
|
|
|
|||
総収入 |
|
|
|
|
|
|
|
|
|
|||
費用: |
|
|
|
|
|
|
|
|
|
|||
製品販売コスト(含む) |
|
|
|
|
|
|
|
|
|
|||
販売、一般、行政 |
|
|
|
|
|
|
|
|
|
|||
研究開発 |
|
|
|
|
|
|
|
|
|
|||
無形資産の償却を取得した |
|
|
|
|
|
|
|
|
|
|||
Theravance呼吸システムを販売する収益は |
|
|
( |
) |
|
|
|
|
|
|
||
債務返済損失 |
|
|
|
|
|
|
|
|
|
|||
公正価値権益変動法 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
その他権益の公正価値変動と |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
利子と配当収入 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
利子支出 |
|
|
|
|
|
|
|
|
|
|||
その他の費用、純額 |
|
|
|
|
|
|
|
|
|
|||
総費用 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
所得税前収入 |
|
|
|
|
|
|
|
|
|
|||
所得税支出,純額 |
|
|
|
|
|
|
|
|
|
|||
純収入 |
|
|
|
|
|
|
|
|
|
|||
非制御の純収入に起因します |
|
|
|
|
|
|
|
|
|
|||
Innovivaの純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
1株当たりの基本純収入は |
|
$ |
|
|
$ |
|
|
$ |
|
|||
希釈した1株当たりの純収益は |
|
$ |
|
|
$ |
|
|
$ |
|
|||
Innovivaの株を計算するために |
|
|
|
|
|
|
|
|
|
|||
基本データのシェアを計算するために |
|
|
|
|
|
|
|
|
|
|||
希釈した株の計算に使う |
|
|
|
|
|
|
|
|
|
|||
連結財務諸表の付記を参照。
87
カタログ表
INNOVIVA,Inc.
総合総合収益表
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
純収入に再分類する |
|
|
|
|
|
|
|
|
( |
) |
||
総合収益 |
|
|
|
|
|
|
|
|
|
|||
非持株権に帰属できる全面的な収益 |
|
|
|
|
|
|
|
|
|
|||
Innoviva株主の全面的な収益 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
連結財務諸表の付記を参照。
88
カタログ表
INNOVIVA,Inc.
合併株主権益報告書
(単位:千)
|
|
|
|
|
|
|
|
その他の内容 |
|
|
その他を累計する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
合計する |
|
|||||||||
|
|
普通株 |
|
|
支払い済み |
|
|
全面的に |
|
|
積算 |
|
|
在庫株 |
|
|
非制御性 |
|
|
株主の |
|
|||||||||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
収入(損) |
|
|
赤字.赤字 |
|
|
株 |
|
|
金額 |
|
|
利子 |
|
|
権益 |
|
|||||||||
2020年1月1日の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
|
— |
|
|
$ |
|
|
$ |
|
|
|
|
|||||||
非持株権への分配 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|||||
中国·アフリカ持株権の持分活動 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
株式オプションの行使と発行 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
||||||||
株に基づく報酬 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
純収入 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
その他総合収益 |
|
|
— |
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
( |
) |
|||||
2020年12月31日の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
||||||||
非持株権への分配 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|||||
中国·アフリカ持株権の持分活動 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|||||
株式オプションの行使と発行 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
||||||||
普通株買い戻し |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
( |
) |
|
|
|
|
|
( |
) |
|||||
株に基づく報酬 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
純収入 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
2021年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
|
|
|
$ |
( |
) |
|
$ |
|
|
$ |
|
|||||||
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
|
|
|
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|||
非持株権への分配 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|||||
非制御的権益の確認 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
中国·アフリカ持株権の持分活動 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
||||||
非制御的利益の不確認 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
|||||
非制御的利益の不確認 |
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
( |
) |
||||
株式オプションの行使と発行 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
||||||||
両替車に関連する上限コールオプション |
|
|
— |
|
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
( |
) |
|||||
変換可能付属手形の変換 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
普通株買い戻し |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
|
|
— |
|
|
|
( |
) |
||
株に基づく報酬 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
純収入 |
|
|
— |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
— |
|
|
|
|
|
|
|
|
|
|
|||||||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
|
|
|
$ |
( |
) |
|
$ |
|
|
$ |
|
|||||||
連結財務諸表の付記を参照。
89
カタログ表
INNOVIVA,Inc.
統合現金フロー表
(単位:千)
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
経営活動のキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
純収入と経営活動が提供する現金純額を調整する: |
|
|
|
|
|
|
|
|
|
|||
所得税を繰延する |
|
|
|
|
|
|
|
|
|
|||
償却資本化費用と財産·設備減価償却 |
|
|
|
|
|
|
|
|
|
|||
無形資産の償却を取得した |
|
|
|
|
|
|
|
|
|
|||
製品販売コストを計上した公正価値調整 |
|
|
|
|
|
|
|
|
|
|||
株に基づく報酬 |
|
|
|
|
|
|
|
|
|
|||
債務償却割引と発行コスト |
|
|
|
|
|
|
|
|
|
|||
権益法投資公正価値変動純額 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
その他株式及び長期投資の公正価値変動、純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
債務返済損失 |
|
|
|
|
|
|
|
|
|
|||
TRC売却の純収益 |
|
|
( |
) |
|
|
|
|
|
|
||
短期投資は割引して償却する |
|
|
|
|
|
|
|
|
( |
) |
||
リース担保償却 |
|
|
|
|
|
|
|
|
( |
) |
||
他の非現金プロジェクト |
|
|
|
|
|
( |
) |
|
|
|
||
経営性資産と負債変動状況: |
|
|
|
|
|
|
|
|
|
|||
売掛金 |
|
|
( |
) |
|
|
|
|
|
|
||
協力して売掛金を手配する |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
在庫品 |
|
|
|
|
|
|
|
|
|
|||
前払い費用 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
その他の資産 |
|
|
( |
) |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
( |
) |
|
|
|
||
人事関連費用及びその他の負債を計上しなければならない |
|
|
|
|
|
( |
) |
|
|
|
||
支払利息 |
|
|
|
|
|
|
|
|
|
|||
収入を繰り越す |
|
|
( |
) |
|
|
|
|
|
|
||
所得税に対処する |
|
|
|
|
|
|
|
|
|
|||
経営活動が提供する現金純額 |
|
|
|
|
|
|
|
|
|
|||
投資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
有価証券の満期日 |
|
|
|
|
|
|
|
|
|
|||
有価証券を購入する |
|
|
|
|
|
|
|
|
( |
) |
||
株式購入と長期投資 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
インターネットサービスサプライヤー基金が管理する株式投資を購入する |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
Isp Fund LPが管理する取引証券の購入 |
|
|
( |
) |
|
|
|
|
|
|
||
インターネットサービス供給者基金が管理する株式投資を売却する |
|
|
|
|
|
|
|
|
|
|||
インターネットサービスプロバイダ基金が管理する他の投資の購入と販売 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
財産と設備を購入する |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
TRC所有権権益を売却して得られた収益、純額 |
|
|
|
|
|
|
|
|
|
|||
合併して得た現金 |
|
|
|
|
|
|
|
|
|
|||
La Jolla買収のために支払った現金は、買収した現金を差し引く |
|
|
( |
) |
|
|
|
|
|
|
||
投資活動提供の現金純額 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
融資活動によるキャッシュフロー |
|
|
|
|
|
|
|
|
|
|||
非持株権への分配 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
エンタ西アフリカ持株権を購入する |
|
|
( |
) |
|
|
|
|
|
|
||
普通株買い戻し |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
源泉徴収税を満たすために株式を買い戻す |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
普通株式を発行して得た金 |
|
|
|
|
|
|
|
|
|
|||
可変利益実体権益を発行して得られる純収益 |
|
|
|
|
|
|
|
|
|
|||
2023年満期の転換可能な二次手形の買い戻し支払い |
|
|
( |
) |
|
|
|
|
|
|
||
2028年満期の転換可能優先手形の購入に関する上限コールオプション |
|
|
( |
) |
|
|
|
|
|
|
||
2028年満期の転換可能優先手形の収益を発行し、発行コストを差し引く |
|
|
|
|
|
|
|
|
|
|||
融資活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
現金および現金等価物の純増加(減額) |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
期初現金及び現金等価物 |
|
|
|
|
|
|
|
|
|
|||
期末現金および現金等価物 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
90
カタログ表
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
キャッシュフロー情報の追加開示: |
|
|
|
|
|
|
|
|
|
|||
利子を支払う現金 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
所得税の現金を納める |
|
$ |
|
|
$ |
|
|
$ |
|
|||
非現金投資と融資活動を追加開示します |
|
|
|
|
|
|
|
|
|
|||
ASU 2020-06を採用 |
|
$ |
( |
) |
|
$ |
|
|
$ |
|
||
連結財務諸表の付記を参照。
91
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
1.ビジネス説明と重要な会計政策の概要
操作説明
Innova,Inc.(略称“Innova”,“Company”あるいは“we”および他の類似した代名詞)は,特許使用料と革新医療資産の組合せを持つ会社である。特許使用料の組み合わせには、Relvarを含むグラクソ·スミスクグループ株式会社(GSK)と協力した呼吸資産が含まれています®/Breo®エリプタ® (フランフルチカゾン/ヴィランテロール、“Ff/VI”)およびAnoro®エリプタ® (臭化ウラン/ヴィランテーロ、“UMEC/VI”)2022年7月まで、トレグリ®エリプタ® (FF/UMEC/VIの組合せ)。私たちは私たちのを売った
我々は,2022年7月11日にentsis Treateutics Holdings Inc.の買収と2022年8月22日にLa Jolla製薬会社(La Jolla)を買収することにより,特許使用料と革新医療資産の組み合わせを拡大した。私たちのビジネスとマーケティング製品にはGIAPREZAが含まれています® 敗血症または他の分布性ショックを有する成人の血圧を増加させるために許可された(アンジオテンシンII)、およびXERAVA®(エラバサイクリン)成人の複雑な腹内感染の治療のための。我々が開発している薬剤には,我々の主要資産であるシュバタン−ドゥロバタン(“Sul−dur”)のような細菌感染を治療する薬剤が含まれている。そのため、著者らは強力な伝染病と病院運営プラットフォーム、及びこれらの領域の他の資産、例えばArmata PharmPharmticalsの大量の株式を持っており、Armata PharmPharmticalsはバクテリオファージ開発の先頭者であり、一連の伝染病とその他の深刻な疾病に応用される可能性がある。私たちは他の医療会社にも経済的利益を持っている。
合併原則
添付されている連結財務諸表には、Innoviva、当社の完全子会社、および私たちが主な受益者であるいくつかの可変利益エンティティ(VIE)のアカウントが含まれています。すべての会社間の残高と取引はすでに合併中に販売されている。私たちが100%以下の経済的リスクを持っているか、または直面している合併エンティティの場合、私たちは、非制御資本に起因する純収益(損失)を私たちの総合収益表に記録し、それぞれの非制御者がそのエンティティに保持している経済または所有権権益のパーセンテージに相当する。
プレゼンテーションの再分類
当社の前年度財務諸表に報告されている前払い費用及びその他の流動資産、その他の資産及び権益及び長期投資公正価値純額のいくつかの金額は、今年度の列報に適合するように再分類されている。これらの改訂は,先に報告した純収入や純現金流量に純影響を与えなかった。
比較可能性に影響する要素
以下および付記5“総合実体および買収”で議論されている要因により、当社の前記期間における歴史的財務状況および経営業績は、期間間または将来にかかわらず比較可能性がない可能性がある。
経営陣の見積もりを使って
アメリカ公認会計原則(“アメリカ公認会計原則”)に基づいて総合財務諸表を作成する際、管理層は総合財務諸表及び付記所の金額に影響を与える推定と仮定をしなければならない。実際の結果はこのような推定とは大きく異なるかもしれない。経営陣はその重要な会計政策と推定を評価し続けている。私たちの見積もりは歴史的経験と当時の状況で合理的だと思う他の関連仮定に基づいています。資産や負債の帳簿価値が他のソースから見えない場合には,これらの見積りもこれらの価値を判断するための基礎となる.
92
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
信用リスクと重要なサプライヤーとパートナーの集中度
私たちが集中的な信用リスクに直面している金融商品は主に現金と現金等価物、株式と長期投資を含む。私たちは現金を複数の金融機関に預けているにもかかわらず、私たちの預金は連邦保険の限度額を超えるかもしれない。
私たちは第三者メーカーに依存して研究開発と商業プロジェクトに活性医薬成分(“原料薬”)と薬物製品を提供する。これらの計画は原料薬や薬品供給の深刻な中断の悪影響を受ける可能性がある。
現在、私たちの収入の大部分はグラクソ·スミスクラインから来ており、私たちの最近の成功はグラクソ·スミスクラインと協力した呼吸器プロジェクトの製品の開発と商業化に成功できるかどうかに大きく依存している。私たちの最近の成功は、GSKがGSKプロトコルでの商業的義務を履行することと、Relvarの商業的成功に大きく依存している®/Breo®エリプタ®アーノロと®エリプタ®それは.グラクソ·スミスクラインがこれらの製品の商業化や開発のために十分な資源を投入していない場合、あるいは努力が失敗したり、そのビジネス計画の優先順位を再配置することを選択した場合、私たちの業務は実質的な損害を受けるだろう。グラクソ·スミスクラインは、Relvarを含むグラクソ·スミスクライン協定に従って開発された製品のすべての臨床および他の製品開発、監督、製造、および商業化活動を担当する®/Breo®エリプタ®アーノロと®エリプタ®それは.私たちの特許使用料収入は様々な要素によって変動する可能性があり、その中の多くの要素は私たちがコントロールできるものではない。いくつかの重要な要素のため、GSKプロトコル下での私たちの特許使用料収入は私たち、アナリスト、あるいは投資家の期待に達しないかもしれない。
私たちはまた、La Jolla病院や他のヘルスケア組織を買収し、通常専門流通業者ネットワークを介して私たちの製品を購入することによる製品販売収入を確認し始めた。会計目的で、これらのアメリカにある専門流通業者は私たちの顧客とみなされている。そのうちの1つの流通業者を失うことは、私たちの製品を流通する能力に大きな影響を与えないと思います。販売量は新しいまたは既存の流通業者に吸収されることが予想されるからです
細分化市場報告
私たちは単一分野で運営し、すなわち私たちの特許使用料と革新医療資産の組み合わせの潜在的価値を最大化することで、株主に資本リターンを提供する。私たちの最高経営決定者(CODM)は私たちの最高経営責任者だ。CODMは,必要に応じて我々の収入,経営結果,その他のキー財務データに関する情報を用いて,総合的なレベルで資源を割り当て,Innovivaの業績を評価する.私たちの収入は主に私たちの協力計画とイギリスにあるGSKが支払う特許権使用料から来ます。GIAPREZAの純売上高からも収入を得ています®XERAVAと®それは.当社に掲げる期間中の収入に関するより多くの情報を得るために、付記3、“収入確認”を参照してください。私たちの長期資産はアメリカ内にあります。
可変利子実体
可変利益エンティティ(“VIE”)の主な受益者は、VIEの資産と負債を統合しなければならない。私たちが他のエンティティの可変権益を取得したとき、私たちは関係の開始時およびいくつかの重大なイベントが発生したときに、そのエンティティがVIEであるかどうかを評価することに等しく、もしそうであれば、私たちはVIEの活動を指導する権利があるので、VIEの活動を指導する権利があるので、これらの活動はVIEの経済表現に最も大きな影響を与え、VIEがVIEに重大な影響を与える可能性のある損失またはVIEから利益を得る権利を負担する義務がある。
私たちがVIEの活動を指導し、VIEの経済表現に最も大きな影響を与える権利があるかどうかを評価するために、VIEの確立における私たちの役割と、私たちの持続的な権利と責任を含むすべての事実と状況を考慮した。この評価には,VIEの経済表現に最も影響を与える活動を決定することと,どちらが(あれば)これらの活動を制御する権利があるかを決定することがある.一般的に最も重大な決定を下す政党は
93
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
VIE(取締役会における管理職や代表)に影響を与え、これらの意思決定者を一方的に罷免する権利を有する者は、VIEの活動を指導する権利があるとみなされる。
VIEの損失を吸収する義務があるか、またはVIEからVIEに大きな影響を与える可能性のある利益を得る権利があるかどうかを評価するために、VIEにおいて可変利益とみなされるすべての経済的利益を考慮した。この評価は、これらの利益が全体的にVIEに潜在的な重要性を有すると考えられるかどうかを決定する際に判断することを要求する。
業務合併
私たちが企業合併中の実体を買収する時、私たちは買収したすべての資産、負担した負債、および被買収側の任意の非持株権益の公正価値を確認し、買収日を公正価値計量点として決定する。買収日までの営業権、すなわち支払い済みの公正価値が、買収純資産の公正価値が確認された部分を超えていることを確認し、計量した。買収に関連する費用と関連再編コストは発生時に費用を計上する。
獲得された資産および負担された負債の公正価値は、いくつかの推定方法を使用して決定されることができる。無形資産について、私たちは一般的に収益法を使用する。この方法は、まず、各資産のすべての予想される将来の純キャッシュフローを予測する。そして,キャッシュフローに関するリスク要因を反映した適切な割引率を適用することにより,これらのキャッシュフローを現在値に調整する.収益法または他の方法に固有のいくつかのより重要な推定および仮定は、将来のキャッシュフローの額および時間を予測すること、将来のキャッシュフローに固有のリスクを測定するために選択された割引率、および資産ライフサイクルおよび資産に影響を与える競争傾向の評価を含み、任意の進入技術、法律、規制、または経済的障害を考慮することを含む。無形資産の使用寿命を決定することも判断する必要があり、異なるタイプの無形資産は異なる使用寿命を有するので、いくつかの資産は無限の使用寿命を有すると考えられる可能性もある。
現金と現金等価物
購入日満期日が3カ月を超えないすべての高流動性投資は現金等価物であると考えられる。現金等価物はコスト別に計算され、公正価値に近い。
有価証券投資
私たちは短期投資と有価証券に投資して、主に会社の手形、政府証券、政府機関と政府商業手形です。我々は、米国連邦政府が支援するツール以外の投資に対する発行者、業界、または地理的地域のいずれかの信用開放額を制限する。私たちは私たちの有価証券を売却可能な証券に分類し、現金等価物または短期有価証券の公正価値を総合貸借対照表に報告し、関連する未実現損益を株主権益の構成要素として計上する。債務証券の償却コストは、割増償却と満期割引の増加に応じて調整され、総合経営報告書の利息収入に計上される。売却可能な証券の実現損益(あれば)に利子収入を計上する。証券売却のコストは具体的な識別方法によって決定される。売却可能な証券に分類された利息および配当金は、利息および配当収入に含まれる。
私たちは定期的に私たちのすべての投資を検討して、公正な価値が一時的に低下したかどうかを決定する。私たちの審査には、証券発行者の信用、未実現損失状態にある証券の数、未実現損失の深刻さと持続時間、証券売却の意図があるかどうか、証券の余剰コストベースで回収する前に証券を売却することが要求される可能性が高いかどうかなど、減値の原因を考慮することが含まれています。投資の推定公正価値の低下が余剰コストベースよりも低く、この低下が一時的ではないと判断した場合、証券の帳簿価値を減少させ、この低下した金額を他の費用純額に計上する。
売掛金
売掛金は見積もりの即時支払い割引、返金、返金、リベートを差し引いて入金されます。即時支払い割引と記憶容量使用料金の手当は契約条項に基づいている。私たちは既存の契約支払い条項、顧客の実際の支払いモード、個別の顧客の状況に基づいて信用損失支出を推定します。
94
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
在庫品
在庫は先進的な先出の原則に従って、コストまたは推定可現純値の中で低いものを基準とします。以下のことが発生した場合、私たちは定期的に在庫レベルを分析し、在庫を製品販売コストとして減記する:在庫が時代遅れであり、在庫のコストベースがその推定された可変現金値を超えるか、または在庫数量が予想される製品販売を超える。
財産と設備
2022年12月31日と2021年12月31日まで、実験室設備、コンピュータ設備、ソフトウェア、オフィス家具および固定装置、レンタル改善を含む財産および設備はそれぞれ実質的ではない。
財産と設備はコストから減価償却累計を引いて申告する.財産と設備の減価償却は直線減価償却法を採用し、方法は以下の通りである
賃借権改善 |
|
残りのレンタル期間や使用年数が短い |
実験室設備、家具、固定装置 |
|
|
ソフトウェア及びコンピュータ装置 |
|
株式と長期投資
私たちは時々個人や上場企業の株式と債務証券に投資する。もし私たちが投票やVIEモードでこれらの会社に支配権を持っていると判断すれば、私たちはそれらを私たちの連結財務諸表に統合します。もし私たちが投票やVIEモードで私たちがこれらの会社に支配権を持っていないと判断すれば、私たちは投票権権益、取締役会代表、または他の商業関係を通じて大きな影響を与える能力があるかどうかを判断する。
資本会計方法や会計基準編纂(“ASC”)テーマ825下の公正価値オプションを選択することで、私たちが大きな影響を与える投資を説明することができます金融商品それは.公正価値オプションが権益法に従って計上された投資に適用される場合、私たちはそれを私たちの同一エンティティのすべての財務権益(担保を含む株式と債務)に適用し、これらは条件を満たす項目である。価値変動を公平にするすべての損益は,未実現であっても実現したものであっても,連結損益表に権益法投資の公正価値変動純額とその他の権益及び長期投資の公正価値変動純額として示している。
もし私たちが被投資者に大きな影響を与える能力がないと結論すれば、ASCテーマ312下の計量代替案を使用して、確定しやすい公正な価値のない株式投資を計算することを選択することができる投資--株式証券それは.この計量代替案は、同じ発行者または同様の投資の順序取引に見られる価格変化に加えて、同じ発行者または同様の投資の順序取引に見られる価格変化を加えるか、または減算することを可能にする。
ヘルスケア、製薬、バイオテクノロジー業界の通貨市場基金、取引、株式証券を含むISP Fund LPにも投資しています。2020年12月に締結されたパートナーシップ協定によると,吾らは同組合の有限責任パートナーとなり,我々の出資には36カ月のロック期間があり,この制限により出資や関連投資を制御·獲得することができない。これらの投資は総合貸借対照表で長期投資に分類される。
金融商品の公正価値
公正価値を、計量日市場参加者間の秩序ある取引において、資産または負債が元本または最も有利な市場で負債を譲渡するために受信または支払いされた交換価格(脱退価格)と定義する。
95
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
私たちの推定技術は観察可能で観察できない入力に基づいている。観察可能な入力は独立ソースからの入手しやすいデータを反映しており,観察できない入力は我々の市場仮定を反映している.これらの入力を以下の階層構造に分類する
レベル1-同じツールに対する活発な市場でのオファー。
レベル2−市場における同様のツールのオファーをアクティブにすること;市場における同じまたは同様のツールのオファーをアクティブにしないこと;およびその投入が観察可能またはその重要な価値駆動要因によって観察されることができるモデル派生推定値。
レベル3-観察できない投入、および資産の市場活動は少ない(あれば)。
金融商品には、現金等価物、売掛金、協力手配売掛金、売掛金と売掛金、持分投資、転換可能元票が含まれる。これらのツールの相対的な短期的性質のため、現金等価物、協力手配売掛金、売掛金と売掛金の帳簿価値はその推定公正価値に近い。
支払資本化費用
私たちは承認された製品または商業化製品の合意に関連したライセンス側に支払われる費用を利用する。我々は,これらの費用を支払済みの資本化費用(“資本化費用”)に資本化し,製品が規制機関の承認を得た直後に,製品商業発売後の推定使用寿命内にこれらの費用を直線的に償却した。これらの資本化費用の推定耐用年数は、当該製品中の化合物をカバーする最後の特許権がその国で満期または終了する遅い者を基準として、国および製品に基づいて決定される
商誉と無形資産
買収された実体の購入対価格は、企業合併で買収された資産と負担された負債の公正価値を超えることが確認された。耐用年数不定の取り決めや無形資産は償却せず、少なくとも毎年毎年12月1日に減価テストを行うまたは潜在的な減価指標が存在する場合、または発生したイベントまたは状況の変化が、資産の帳簿資産金額が回収できない可能性があることを示す限り、より一般的である。使用年数を決定する無形資産は、それぞれの残りの使用年数で直線的に償却され、潜在的な減値指標が存在する場合、またはイベントまたは状況の変化が資産の帳簿金額が回収できない可能性があることを示す場合にのみ減値テストが行われる。損害指標が発生したかどうかを決定する際には、重大な判断に関連する可能性がある。
賃貸借契約を経営する
使用権資産は、リース開始日前に支払われた任意のリース支払いを含むリース期間内に対象資産を使用する権利を表し、リースインセンティブにより減少する。賃貸負債とは、賃貸期間内の賃貸支払い総額の現在値であり、推定された逓増借入金金利で計算される。レンタル料金は予想レンタル期間内に直線的に確認します。
96
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
収入確認
我々は、ASCテーマ606の下で、依頼者とエージェントに関する考慮に関する指導を適用した取引先と契約した収入私たちと第三者との間の取引の適切な処理方法を決定するために。我々が手配した取引分類は,手配の性質と契約条項および参加者の業務性質に基づいて決定される.私たちが依頼人とみなされている活動に関するどんな考慮事項も貨物又はサービスが顧客に移転する前に貨物又はサービスを制御する販売者は、製品販売に計上する。
私たちの顧客が約束した商品やサービスのコントロール権を獲得すると、収入が確認され、金額はこれらの商品やサービスと交換したい対価格を反映しています。収入は,(1)顧客との契約の決定,(2)契約中の履行義務の決定,(3)契約の取引価格の決定,(4)取引価格を契約に割り当てる履行義務,(5)収入の履行義務の確認の5つのステップで確認される。
特許権使用料収入
私たちは特許使用料を稼いでいる間、契約特許権使用料の権利を持つ製品の純売上による特許権使用料収入を確認した。我々のパートナーが提供する純売上高報告は、その推定リターンおよび返金の方法および仮定に基づいて、契約および法的義務、歴史的傾向、過去の経験、および予想される市場状況に基づいて定期的に監視および調整を行う。私たちのパートナーは記録の実際の結果に基づいてその売上を大きく調整する可能性があり、これは私たちの特許使用料収入の変動を招く可能性があります。私たちは定期的に印税審査を行い、パートナーが提供する情報を評価する。特許権使用料は,グラクソ·スミスクラインに支払われた任意の承認とスタートマイルストーン支払いに関する資本化費用を差し引いて確認された純額である。
製品販売収入
製品販売からの収入は、私たちの顧客が製品制御権を獲得したときに確認し、取引価格によって記録され、記憶容量による使用課金、割引、返品、リベートを含む可変対価格の推定値が差し引かれます。可変対価は期待値金額法を用いて推定され,期待値は一連の可能な対価格金額における確率重み付き金額の総和である.最終的に受け取った実際の対価格金額は私たちの見積もりとは違うかもしれません。もし実際の結果が私たちの推定と実質的に異なる場合、私たちはこれらの見積もりを調整します。これは製品の販売収入と調整期間の収益に影響を与えます。これらのプロジェクトには
私たちがより多くの履歴データを蓄積するにつれて、私たちは可変考慮要素の推定を評価し続け、それに応じてこれらの推定を調整する。
97
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
研究と開発費
研究と開発費用はサービスを提供したり、貨物を受け取っている間に確認します。研究開発費には、第三者研究機関、研究機関、および他の外部サービス提供者によって提供される賃金および福祉、実験室用品、施設および他の間接費用、研究に関連する製造コスト、契約サービス、および臨床に関連するサービスコストが含まれる。将来の研究·開発活動のための商品またはサービスの払戻不可能な前払いは延期され資本化される。これらの金額は、関連貨物が提供されたり、関連サービスが提供された場合に費用として確認されます。また,研究進展と研究製造活動進展の推定に基づいて行われている研究費用の計上項目を重大な判断と推定を用いて記録した。
特許使用料債務利息支出を繰延する
繰延特許権使用料債務に関する利息支出は、繰延特許権使用料債務の予想返済期間内に実際の利息法で確認される。繰延特許使用料債務の予想返済期限を決定する際に使用される仮定は、実質金利に影響を及ぼす可能性のある推定を行うことを要求する。各報告期間内に、GIAPREZAの予測純売上高に基づいて、特許権使用料債務の期待償還期限を延期すると推定されます®それは.実際の金利変動(ある場合)による利息支出変動は、予想基準で入金される。詳しくは付記12、“債務”を参照されたい。
株式報酬奨励の公正価値
私たちはBlack-Scholes-Mertonオプション定価モデルを使用して、私たちの株式インセンティブ計画によって付与されたオプションと、私たちの従業員株式購入計画(“ESPP”)によって付与された株を買収する権利の公正価値を推定する。ブラック·スコイルズ·マートンオプション推定モデルは、期待される付与期限と予想される株価変動を含む仮説を使用する必要がある。私たちは職員会計公告第107号に記載されている“簡略化”方法を採用する株式支払期待されたオプション期間について。私たちは私たちの歴史変動率を用いて予想される株価変動率を推定する。
制限株式単位(“RSU”)および制限株式報酬(“RSA”)は、日標に付与された株の公平な市場価値に基づいて計測される。
株式に基づく補償支出は、最終予想に基づいて付与された奨励金に基づいて計算され、付与時に推定没収を減少させ、実際の没収がその推定と異なる場合には、その後の期間に必要な改訂を行う。株式オプション、RSU、RSAに対する私たちの推定年間罰金率は、私たちの歴史的没収経験に基づいています。
株式オプション、RSU、およびRSAの推定公正価値は、付与された予想期限または帰属の予想期間内に、計算すべき差分テナント値または直線的に計算される。補償支出は、管理層が付与された株式に対して帰属可能であるか否かの最適な推定に基づいて、必要なサービス期間内に入金する。
ESPPによる補償費用は,発売日の普通株の公正価値から計画に規定されている購入割引率を引いて確認した。
所得税
私たちは貸借対照法を用いて所得税を計算する。この方法によれば、繰延税金資産および負債は、財務報告と資産および負債の課税ベースとの差に基づいて決定され、公布された税率および法律を用いて計量され、これらの税率および法律は、差の予想が逆転したときに発効する。繰延税金資産の一部または全部が現金化できない可能性が高い場合には、推定準備を提供する。
税金優遇の確認と測定には重大な判断が必要だ。新しい情報の出現に伴い、私たちの判断は変化するかもしれない。私たちは、各報告期間において、私たちの評価準備を調整する必要があるかどうかを決定するために、私たちの繰延税金資産を評価し続け、私たちの予想と実際の将来の経営業績との差異を含むすべての利用可能なプラスと負の証拠に基づいて、“より可能性が高い”という基準を採用して繰延税金資産を実現する。
98
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
関連税務機関の評価または質疑を受けなければならないすべての課税年度内のすべての重大な不確定倉位を含む、任意の所得税申告表内のすべての重大な倉位を評価します。不確定な税務状況を評価することは、この状況の持続可能性の初歩的な決定から始まり、最終決済時に達成可能な50%を超える最大利益金額で計量される。各貸借対照表の日付まで、未解決の不確定税務状況は再評価しなければならず、持続可能なアサートの背後にある要因が変化したかどうか、確認された税収割引額が依然として適切であるかどうかを判断する。
総合収益
総合収益は純収益と他の総合収益(赤字)からなる。その他の全面収益(損失)には,我々有価証券の未実現と実現済み損益の変化とこれらの変化が税収に及ぼす影響が含まれている。
関連先
2021年5月までにグラクソ·スミスクラインとの取引は関連側と取引されてきたが、当時我々はグラクソ·スミスクラインとの株式買い戻し協議を完了し、Innovivaでのすべての普通株を買い戻した。株の買い戻しが完了した後、グラクソ·スミスクラインは関連先とみなされなくなった。グラクソ·スミスクラインとの取引は、注3“収入確認と協力手配”に記載されている
Sarissa Capital Owネッド
当社が採用している会計公告
2020年8月にFASBはASU 2020-06を発表しました債務--転換可能な債務とその他の代替案(小テーマ 470-20)および派生ツールおよびヘッジ-エンティティ自己資本における契約(小トピック815-40):エンティティ固有資本における変換可能ツールおよび契約の会計処理470~20サブトピックのいくつかの分離モードを削除することによって、変換可能チケットの会計処理を簡略化することが意図されている 両替できる道具です。したがって,他に特徴がない限りデリバティブとして区別して確認する必要がある限り,転換可能債務ツールは償却コストに応じて計測された単一負債として入金される.新基準では,IF変換方法を用いて変換可能ツールの希釈後の1株当たり収益(EPS)の計算も求められている。2022年1月1日から新基準を採用し、改正された遡及方法を採用し、この方法が転換可能な手形を返済していない会計処理に与える影響を評価した。本局が2025年に発行した手形(定義は後述)の採択影響により累積赤字の期初残高が減少#ドル
FASBは2021年10月にASU 2021-08を発表した企業合併 (Topic 805), 契約資産と契約負債の会計処理 顧客との契約から業務合併で得られた契約資産及び契約負債(すなわち繰延収入)を要求する 取得日において、ASCトピック606に従って取得者によって識別および測定される取引先と契約した収入それは.2022年第3四半期には、2022年7月1日から施行されるASU 2021-08を事前に採用することを選択した。この採用は私たちの連結財務諸表に実質的な影響を与えなかった。
2.1株当たり純収益
Innoviva株主の1株当たり基本純収入は,Innoviva株主の純収入を発行済み普通株の加重平均で割ることで計算される。Innoviva株主が1株当たりの純収入を占めるべき計算方法は:Innoviva株主は純収益を普通株と当時発行された希釈潜在普通株等価物を割った加重平均を占めるべきである。希釈性潜在的普通株式等価物には、仮説行使、帰属、および従業員株式報酬の発行、および2023年満期の変換可能付属手形(“2023年手形”)、2025年満期の変換可能優先手形(“2025年手形”)および2028年満期の変換可能優先手形(“2028年手形”)を仮定した場合に発行可能な普通株式が含まれる。
99
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
適用される転換率により、2025年の手形は私たちの選択に応じて現金、普通株式、または両者の組み合わせに変換することができる。われわれの当面の目的は元金を清算することであるE 2025変換時に現金で支払われたチケット。転換プレミアムが1株当たりの純収入に及ぼす影響は、ASU 2020−06年度まで在庫株法で計算されてきたと仮定する。ナスダック世界ベスト市場報告の普通株の1株平均市場価格は初期転換価格を1ドル下回ったためだ
下表に本年度までの1株当たり基本純収益と希釈後の純利益の計算を示すDecember 31, 2022, 2021 and 2020:
|
|
十二月三十一日までの年度 |
|
|||||||||
(1株当たりのデータを除いて、千で) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
分子: |
|
|
|
|
|
|
|
|
|
|||
Innoviva株主は純利益を占めなければなりません |
|
$ |
|
|
$ |
|
|
$ |
|
|||
新設:税収の影響を差し引いた2023年手形の利息支出 |
|
|
|
|
|
|
|
|
|
|||
新設:税収の影響を差し引いた2025年期手形の利息支出 |
|
|
|
|
|
|
|
|
|
|||
新設:税収の影響を差し引いた2028年期手形利息支出 |
|
|
|
|
|
|
|
|
|
|||
Innoviva株主は純収益を占め、希釈した後 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
分母: |
|
|
|
|
|
|
|
|
|
|||
基本純収入の加重平均シェアを計算するために |
|
|
|
|
|
|
|
|
|
|||
2023年紙幣の薄型化効果 |
|
|
|
|
|
|
|
|
|
|||
2025年紙幣の薄型化効果 |
|
|
|
|
|
|
|
|
|
|||
2028年紙幣の薄型化効果 |
|
|
|
|
|
|
|
|
|
|||
持分付与によるオプションと奨励の希釈効果 |
|
|
|
|
|
|
|
|
|
|||
希釈後の純利益の加重平均シェアを計算するために用いられる |
|
|
|
|
|
|
|
|
|
|||
Innoviva株主の1株当たり純収益 |
|
|
|
|
|
|
|
|
|
|||
基本的な情報 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
薄めにする |
|
$ |
|
|
$ |
|
|
$ |
|
|||
逆希釈証券
以下の普通株式等価物は、それらの影響が逆薄化されているので、1株当たりの純利益の計算には含まれない
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
持分インセンティブにより付与された未償還オプションと奨励 |
|
|
|
|
|
|
|
|
|
|||
株式承認証を発行した |
|
|
|
|
|
|
|
|
|
|||
合計する |
|
|
|
|
|
|
|
|
|
|||
3.収入確認
協力手配の純収入
2022年7月13日、Innovivaの完全子会社Innova TRC Holdings,LLC(“ITH”)は、Royalty Pharma Investments 2019 ICAV(“Royalty Pharma”)と株式購入契約(“TRC持分購入契約”)を締結し、TRCにおける私たちの所有権権益を売却した。TRCでの所有権権は2022年7月20日に売却を完了したため、私たちはもう獲得する権利がありません
100
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
我々のGSKプロトコルにより確認された純収入は以下のとおりである
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
印税-Relvar/Breo |
|
$ |
|
|
$ |
|
|
$ |
|
|||
印税-アーノロ |
|
|
|
|
|
|
|
|
|
|||
印税-TRELEGY(1) |
|
|
|
|
|
|
|
|
|
|||
総印税 |
|
|
|
|
|
|
|
|
|
|||
差し引く:償却資本化 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
特許権使用料収入 |
|
|
|
|
|
|
|
|
|
|||
戦略同盟であるMaba計画 |
|
|
|
|
|
|
|
|
|
|||
印税純収入総額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
(1)2022年12月31日までの年度とは、2022年1月1日から2022年7月20日まで、すなわちTRC所有権権益を売却する日を指す。
LABA連携
Relvarの起動と承認のため®/Breo®エリプタ®アーノロと®エリプタ®アメリカ、日本、ヨーロッパではGSKに合計1ドルの記念碑的費用を支払いました
私たちはGSKからRelvarの年間印税を販売する権利があります®/Breo®エリプタ®詳細は以下のとおりである
私たちにも権利がある
2004年戦略同盟
2020年12月31日までの年間で確認しました
製品純売上高
La Jollaを買収した日(2022年8月22日)から2022年12月31日まで、製品の純売上高が$であることを確認しました
101
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
4.ライセンスとコラボレーションのスケジュール
許可を超えて合意する
再鼎医薬
恩塔西と再鼎医薬(上海)有限会社(“再鼎医薬”)は許可と協力協定を締結し、これにより、再鼎医薬はアジア太平洋地区でDurlobactamとSul-dur(“ZAIプロトコル”)を独占的に許可した。ZAI協定の条項によると、再鼎医薬はSul-durの中国での大部分の登録臨床試験費用に資金を提供し、許可製品の第三段階の患者の薬物供給は除外する。中国で許可製品の監督管理許可を受けた後、再鼎医薬は中国以外のアジア太平洋地域で指定された数量の国で開発活動と計画を行い、監督管理の許可を得る。再鼎医薬はまた単独でアジア太平洋地区の特許製品の商業化を担当し、そしてそれが監督管理部門の許可を得た特許製品に対して商業化を行う。著者らは再鼎医薬に臨床開発のための許可製品を提供する義務があり、もし許可製品が承認された場合、著者らは一定の期間内にそれを商業用途に使用する義務があり、再鼎医薬が別途通知しなければならない。再鼎医薬は“ZAI協定”が発効した日から特定の時間内にその商業化活動の製造責任を引き継ぐことができる。
私たちはEは最高総額$を取得する資格があります
GARDP
ENTASISは全世界の抗生物質研究と発展パートナーシップ(GARDP)と協力協定を締結し、ある国で候補製品ゾリロ星(GARDP協力協定)を開発、製造と商業化した。GARDP協力協定の条項によると、GARDPは、ゾロシンを含む単純な淋病治療の候補製品を製造および供給することを含む、商業的に合理的な努力を使用して第3段階登録試験を実行し、全額援助する。私たちはこの合意に基づいてGARDPの精算を研究開発費の減少として記録した。ENTASISを買収した日から2022年12月31日までの関連金額は大きくない。
また、GARDP協力協定によると、GARDPは世界規模で全額支払い、独占、および免版税の許可を得ており、我々のゾリロ星技術を低収入および特定の中所得国でのGARDPの開発、製造、商業化に使用する権利がある。私たちは北米、ヨーロッパ、アジア太平洋地域の主要市場を含む世界のすべての他の国での商業権利を保持している。GARDP協力協定下の義務を履行し,淋病やコミュニティ獲得の適応以外の任意の目的で使用し,ゾロシン技術ライセンスを使用して付与する権利も保持している。ゾロシンの第3段階登録試験結果が上場承認申請を支持すると考える場合、試験完了後6ヶ月以内にFDAに上場承認申請を提出し、商業的に合理的な努力で欧州医薬品局(EMA)に上場承認申請を提出する義務がある。すべての側は商業上の合理的な努力を使用して、候補製品のためにそれぞれの領土でマーケティング許可を得る責任がある。
102
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
パイオン株式会社
Paion AG(“Paion”)ライセンスによると、La JollaはPaionにGIAPREZAを商業化する独占ライセンスを付与する®XERAVAと®ヨーロッパ経済圏では、連合王国とスイス(“パイオン領土”と総称される)。潜在的なビジネスマイルストーンの支払いを受ける権利があります
La JollaはまたPaion商業供給協定(“Paion供給協定”)を締結し、この協定によると、La JollaはPaionに最低数のGIAPREZAを供給する®XERAVAと®2024年7月13日までですPaionプロビジョニング協定は、2027年7月13日以前に、または新しいプロビジョニング協定が実行されるまで自動的に更新されます。供給契約の最初の期限内に、コストで計算された直接および何らかの間接製造コストの補償を得る。La Jollaを買収した日から2022年12月31日まで、本合意により確認された金額は実質的ではない。
珠峰医薬有限公司
珠峰医薬有限公司(“珠峰”)の許可証によると、La Jollaは珠峰に開発と商業化XERAVAの独占許可証を授与した®中国大陸、台湾、香港、マカオ、韓国、シンガポール、マレーシア連邦、タイ王国、インドネシア共和国、ベトナム社会主義共和国、フィリピン共和国(総称して“珠峰地区”と呼ぶ)で複雑な腹内感染とその他の適応を治療する。私たちは追加的な$を得る資格がある
中国国家医療製品管理局にXERAVAの新薬申請を提出した®2021年の中国入院患者の頸動脈閉塞の治療に用いられた。XERAVA®2020年にシンガポールで衛生科学管理局の承認を得た。
La Jollaはまた珠峰商業供給協定(“珠峰供給協定”)を締結し、この協定により、La Jollaは珠峰に最低数のXERAVAを提供する®2023年12月31日に珠峰にいくつかのXERAVAを転移させます®-製造に関連する技術的ノウハウ。直接的で間接的な製造コストの精算を受けることになります
許可内合意
ジョージワシントン大学
ジョージワシントン大学(GW)の許可により,GWはGIAPREZAに関するいくつかの知的財産権をLa Jollaに独占的に許可した®いくつかの発行された特許とGIAPREZAをカバーする特許出願の独占的権利を含む®それは.GWの許可により、ビジネス上の合理的な努力を用いて開発、商業化、マーケティング、GIAPREZAを販売する義務があります®それは.支払う義務があります
103
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
ハーバード大学
ハーバード大学(“ハーバード”)許可書によると、ハーバード大学はLa Jollaにテトラサイクリン系製品に関するいくつかの知的財産権を独占的に許可し、XERAVAを含む®いくつかの発行された特許と、そのような製品をカバーする特許出願の専門権とを含む。ハーバード許可によると、XERAVAを含むビジネス上の合理的な努力を使用して、XERAVAを含むテトラサイクリンベースの製品を開発、商業化、マーケティング、販売する義務がある®それは.ハーバード許可でカバーされているすべての製品に対して、以下のお金を支払う義務があります:(I)最高約$
百達製薬有限公司
Paratek PharmPharmticals,Inc.(“Paratek”)ライセンスによると,ParatekはLa JollaにXERAVAに関連するある知的財産権を非独占的に許可した®いくつかの発行された特許およびXERAVAをカバーする特許出願に対する非排他的権利を含む®それは.百達に支払う義務があります
5.エンティティの統合と買収
実体を合併する
Theravance呼吸会社LLC
2022年7月20日まで、私たちはTRCがVIEであることを決定したので、私たちはVIEモードでTRCを統合した。私たちはTRCが大きな経済的意義を持つ活動を指導し、TRCの損失を吸収する義務があるから、またはVECから利益を得る権利があるから、私たちはそのエンティティの主な受益者である。私たちは開催した
付記3“収入確認”で述べたように、ITHは2022年7月13日にTRC持分購入契約を締結し、私はTRCの所有権権益を売却する。2022年7月20日に取引が完了した時点で$を受け取りました
取引が完了する前に,TRCは合意の一部としてInCarda治療会社,ImaginAbInc.,Gate NeuroSciences,Inc.とNanolive SAでの所有権と投資を割り当て,これらの会社の総帳簿価値は$である
104
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
第1個移転した投資はそれぞれの帳簿価値で入金され,総合損益表には損益は確認されていない。
TRCの財務情報の概要2021年12月31日および2022年までの販売日に関する期間は以下の通り
貸借対照表
(単位:千) |
|
2021年12月31日 |
|
|
資産 |
|
|
|
|
現金と現金等価物 |
|
$ |
|
|
協力手配からの入金 |
|
|
|
|
前払い費用と他の流動資産 |
|
|
|
|
株式と長期投資 |
|
|
|
|
総資産 |
|
$ |
|
|
|
|
|
|
|
負債と有限責任会社のメンバー権益 |
|
|
|
|
流動負債 |
|
$ |
|
|
有限責任会社のメンバー権益 |
|
|
|
|
総負債と有限責任会社のメンバー権益 |
|
$ |
|
|
損益表
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 (1) |
|
|
2021 |
|
|
2020 |
|
|||
特許権使用料収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
協力手配からの収入 |
|
|
|
|
|
|
|
|
|
|||
純収入合計 |
|
|
|
|
|
|
|
|
|
|||
運営費 |
|
|
|
|
|
|
|
|
|
|||
営業収入 |
|
|
|
|
|
|
|
|
|
|||
その他の収入、純額 |
|
|
|
|
|
|
|
|
|
|||
損失を達成した |
|
|
( |
) |
|
|
|
|
|
|
||
所得税支出,純額 |
|
|
|
|
|
|
|
|
|
|||
その他権益と資産の公正価値変動 |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
純収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
(1)2022年12月31日までの年度とは、2022年1月1日から2022年7月20日まで、すなわちTRC所有権権益を売却する日を指す。
インターネットサービスサプライヤー基金LP
2020年12月、私たちの完全子会社Innova Strategic Partners LLC(“戦略パートナー”)が貢献しました$
組合協定は、Sarissa Capitalは組合会社から管理費を受け取り、四半期ごとに前払いし、組合会社の戦略パートナー資本口座の資産純資産値に基づいて計算することを規定している。また、一般パートナーは、共同企業の年間試算期間内の純利益に基づく年間業績費を得る権利がある。
パートナーシップ協定には36ヶ月の販売禁止期間が含まれており、その後、戦略パートナーは、その販売禁止期間が満了した日から、その後の各周年記念日に組合を脱退する権利があるが、いくつかの制限を受けている。
105
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
2021年5月に戦略的パートナーはメッセージを受け取りました
我々はVIEモードでISPFund LPを統合し,ISPFund LPがVIEであることを決定したため,Sarissa Capital Entitiesとの関連先関係によりこのエンティティの主な受益者となった。
2022年12月31日まで私たちは続けて
買収する
エンタス治療ホールディングスです。
私たちは2020年に、特許使用料収入から発生した現金を導入し、異なる生命科学会社に投資することを目的とした資本配置戦略の一部としてentasisへの投資を開始します。ENTASISは先進的で臨床末期の生物製薬会社であり、新型抗菌製品の発見と開発に専念している。2020年第2四半期には
ENTASIS普通株の公正価値は、貸借対照表毎の終値に基づいて計測される。これらの株式承認証の行使価格は$である
2022年2月17日、ISOはENTASISと証券購入協定を締結し、この協定によると、ISOは転換可能なチケットを購入し、総購入価格は#ドルとなった
再測定の結果$であった
106
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
我々は2022年7月11日にentsis余剰非持株権の買収を完了した。その日までのentasisでの保有量を再計算し,1ドルであることを確認した
我々は我々の追加実収資本で買収価格と2022年7月11日に買収した非持株権益の帳簿価値との差額を確認した。
2022年2月17日現在、買収に割り当てられた資産と負担する負債の公正価値は、経営陣の最適な推定と仮定に基づいている。2022年7月に買収を行った後、吾らはentasis及び繰延税金項目負債が提供した製品販売予測に関する新しい資料及び追加資料に基づいて、買収資産及び負債を負担する公正価値に対して初歩的な調整を行った。
2022年12月31日までの年間で,計測期間を$に調整した
当社は初歩的な評価を完了し、できるだけ早く決定する予定ですが、買収日から1年遅れではありません。この取引記録の調達会計はまだ最終的に確定されていない。
次の表は、取引で買収した資産と負担した負債の調整後の公正価値を示します
(単位:千) |
|
2022年2月17日 |
|
|
現金と現金等価物 |
|
$ |
|
|
前払い費用 |
|
|
|
|
その他流動資産 |
|
|
|
|
財産と設備、純額 |
|
|
|
|
使用権資産 |
|
|
|
|
商誉 |
|
|
|
|
無形資産 |
|
|
|
|
その他の資産 |
|
|
|
|
買収した総資産 |
|
$ |
|
|
|
|
|
|
|
売掛金 |
|
$ |
|
|
人事関連費用を計算しなければならない |
|
|
|
|
その他負債を計算すべき |
|
|
|
|
繰延税金負債 |
|
|
|
|
負担総負債 |
|
$ |
|
|
|
|
|
|
|
買収した総資産,純額 |
|
$ |
|
|
ENTASISの買収による名声は,主にENTASISが集結した従業員チームと,我々の業務をより効率的に発展させることに関する価値に起因する。今回の買収による営業権は納税時に控除できないと予想されます。
今回の買収の一部と確認された無形資産についてのより多くの議論については、付記8“商誉及び無形資産”を参照されたい。
当社の2022年12月31日までの年度の総合純収入は、合併日から買収日までの非持株権益を含めて純損失を占めるべきです共$
107
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
ラホア製薬会社は
2022年8月22日、ISOは総対価$でLa Jollaを買収した
買収された資産と負担する負債に割り当てられた公正価値は、2022年8月22日までの経営陣の最適な推定と仮定に基づいている。
2022年12月31日までの年間で,計測期間を$に調整した
我々はすでに初歩的な推定値を完成し、できるだけ早く決定する予定だが、買収日の開始から1年遅れではない。この取引記録の調達会計はまだ最終的に確定されていない。
私たちは約Ly$
次の表は、買収日までに買収資産と負債を負担する公正価値に割り当てられた調整分配状況をまとめた
(単位:千) |
|
2022年8月22日 |
|
|
現金と現金等価物 |
|
$ |
|
|
短期有価証券 |
|
|
|
|
売掛金 |
|
|
|
|
在庫品 |
|
|
|
|
前払い費用 |
|
|
|
|
その他流動資産 |
|
|
|
|
財産と設備、純額 |
|
|
|
|
使用権資産 |
|
|
|
|
商誉 |
|
|
|
|
無形資産 |
|
|
|
|
その他の資産 |
|
|
|
|
買収した総資産 |
|
$ |
|
|
|
|
|
|
|
売掛金 |
|
$ |
|
|
収入を繰り越す |
|
|
|
|
その他負債を計算すべき |
|
|
|
|
その他長期負債 |
|
|
|
|
繰延税金負債 |
|
|
|
|
負担総負債 |
|
$ |
|
|
|
|
|
|
|
買収した総資産,純額 |
|
$ |
|
|
La Jollaを買収して生まれた名声は主にLa Jollaが集結した従業員チーム及び従業員チームを利用して未来に新薬製品を開発と商業化し、私たちの業務をより効果的に発展させることによる価値に起因する。今回の買収による営業権は納税時に控除できないと予想されます。
今回の買収の一部と確認された無形資産についてのより多くの議論については、付記8“商誉及び無形資産”を参照されたい。
108
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
財務情報を備考する
次の表は、EnTASISとLa Jollaの合併が2021年1月1日に発生したように、2022年12月31日と2021年12月31日までの年度のいくつかの未監査の予想財務情報を示している。監査を受けていない備考の財務情報は参考に供するだけであり、買収が2021年1月1日に発生すれば得られる経営結果、あるいは将来出現する可能性のある結果を表明していない。監査されていない予備財務情報はエンタシュとLa Jollaの歴史業績と会社の総合歴史業績を結合し、そしていくつかの調整を含み、エンタシュ普通株と引受権証に対する株式投資の公正価値調整、在庫に対する公正価値調整、無形資産の償却、繰延特許使用料債務の利息支出と買収に関連するコストを含むが、これらに限定されない。
|
|
十二月三十一日までの年度 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
収入.収入 |
|
$ |
|
|
$ |
|
||
純収入 |
|
$ |
|
|
$ |
|
||
Innoviva株主は純収益を占めなければならない |
|
$ |
|
|
$ |
|
||
6.持分および長期投資および公正価値計測
アマタの権益法投資
2020年第1四半期にInnovivaは
2021年第1四半期、ISOはArmataと買収のための証券購入協定を締結した
2022年2月9日、ISOはArmataと証券購入協定を締結し、買収のために
109
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
Armataへの投資はInnovivaやISOがArmataの運営に大きな影響を与えることができるが,Armataの運営を制御することはできない。Armataの業務や事務はその取締役会の指導の下で管理されており,InnovivaやISOは取締役会を制御していない.我々の評価によると,ArmataはVIEであることが確認されたが,InnovivaとISOはVIEの主な受益者ではない。本報告書に記載されている間、私たちは以前の契約で私たちに提供を要求しなかった財務的または他の支援を提供しなかった。私たちの損失に対する最大のリスクは私たちの実体への投資額に等しい。
著者らは公正価値オプションを用いた権益法の下でArmataの普通株と引受権証の計算を行った。Armata普通株の公正価値はその終値に基づいて計算される。2020年,2021年,2022年に購入した権証の発行価格は1ドルである
2013年12月現在2022年9月31日、Armata普通株式と引受権証の公正価値は$と推定されます
私たちの投資日にかかわらず、Armataのまとめた財務情報は、私たちが持っていない部分を含めて、次のように四半期の遅れがあります
貸借対照表情報
|
|
九月三十日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
流動資産 |
|
$ |
|
|
$ |
|
||
非流動資産 |
|
$ |
|
|
$ |
|
||
流動負債 |
|
$ |
|
|
$ |
|
||
非流動負債 |
|
$ |
|
|
$ |
|
||
損益表情報
|
|
12ヶ月まで |
|
|
9か月で終わる |
|
||||||
|
|
九月三十日 |
|
|
九月三十日 |
|
||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
収入.収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
運営損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
110
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
企業投資における権益法の応用
2022年2月にentsisの財務状況と経営業績を合併する前に、entsisを株式方法投資に計上します。詳細は、付記5、“合併実体及び買収”を参照されたい。
私たちの投資日が何であっても、まとめられた財務情報は、私たちが持っていない部分を含めて、1四半期の遅延時間内に以下のように表示されます
貸借対照表情報
(単位:千) |
|
2021年9月30日 |
|
|
流動資産 |
|
$ |
|
|
非流動資産 |
|
$ |
|
|
流動負債 |
|
$ |
|
|
非流動負債 |
|
$ |
|
|
損益表情報
|
|
12ヶ月まで |
|
|
6か月 |
|
||
(単位:千) |
|
2021 |
|
|
2020 |
|
||
運営損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
InCardaの株式投資
2020年第3四半期に真実と和解委員会は
2022年3月9日、TRCはInCardaと手形及び株式証明書購入プロトコル(“InCardaプロトコル”)を締結し、転換可能なチケット(“InCarda転換手形”)及び株式承認証(“InCarda 2022株式証明”)を#ドルで買収した
2022年6月15日、InCarda変換可能手形の元本と課税利息が株式証券に変換された。また,TRCは#ドル投資によりInCardaのDシリーズ優先株融資に参加した
111
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
株は、
2022年と2021年12月31日までに
私たちはInCardaでの私たちの投資を計量代替案に計上した。計量代替案によると、株式投資は最初にその分配コストで入金されるが、帳簿価値は、減値収益または同じ発行者に関連する同じまたは同様の投資の観察可能な価格変化によって調整することができる。InCardaは2022年第2四半期に株式資本再編を行ったため,TRCはオプション定価モデルBacksolve推定方法を用いてInCardaにおける投資価値を再評価した。推定モデルで用いられている主な仮定は,期待保有期間を含む
2022年12月31日までに
112
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
ImaginAbへの株式投資
2021年3月18日、TRCはImaginAb.,Inc.(“ImaginAb.”)と証券購入契約を締結し、購入する
2022年7月20日、TRCは、TRC持分購入契約の条項に基づいて、ImaginAbにおけるTRCのすべての所有権権益および投資をITHに譲渡する。2022年12月31日まで,
ImaginAbへの投資はImaginAbの運営を制御する能力を提供してくれないし,ImaginAbの運営に大きな影響を与えることもない。私たちの評価によると、私たちはImaginAbがVIEだと確信しているが、私たちはVIEの主な受益者ではない。本報告書に記載されている間、私たちは以前の契約で私たちに提供を要求しなかった財務的または他の支援を提供しなかった。私たちの損失に対する最大のリスクは私たちの実体への投資額に等しい。
ImaginABの株式証券は公開取引ではなく,確定しやすい公正価値もないため,ImaginABのC系列優先株や普通株への投資を計量代替案を用いて計算した。計量代替案によると、株式投資は最初にその分配コストで入金されるが、帳簿価値は、減値収益または同じ発行者に関連する同じまたは同様の投資の観察可能な価格変化によって調整することができる。2022年12月31日までand 2021, $
門神経科学における転換可能本票
2021年11月24日、TRCはゲーテ神経科学社(“ゲット”)と転換可能なチケット購入契約を締結し、元金#ドルの変換可能なチケット(“変換可能チケット”)を購入した
113
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
2022年7月20日、TRC持分購入協定の条項に基づき、TRCはGateでの債務投資をITHに譲渡する。著者らはすでにGate変換可能手形を取引証券とし、モンテカルロシミュレーションモデルを用いて、ある合格事件の確率とGateの株式価値、無リスク金利、期待株価、同業者会社の波動性と融資時間の仮定に基づいて、公正価値で計量した。2022年12月31日まで2021年にGate変換可能チケットの公正価値は$と推定されます
Nanoliveへの株式投資
2022年2月18日、TRCはNanolive SA(“Nanolive”)と投資と株主合意を達成し、購入
私たちのNanoliveへの投資はNanoliveの運営を制御する能力を提供することができず、Nanoliveの運営に大きな影響を与えることもできない。私たちの評価によると、私たちはNanoliveがVIEだと確信しているが、私たちはVIEの主な受益者ではない。本報告書に記載されている間、私たちは以前の契約で私たちに提供を要求しなかった財務的または他の支援を提供しなかった。私たちの損失に対する最大のリスクは私たちの実体への投資額に等しい。
Nanoliveの株式証券は公開取引ではなく、確定しやすい公正価値もないため、計量代替案を用いてNanolive Cシリーズ優先株への投資を計算した。2022年12月31日まで, $
販売可能な証券
売却可能な証券の推定公正価値は、これらのまたは同様の投資の見積市場価格に基づいており、これらの市場価格は、商業定価サービスから得られた価格に基づく。販売可能な証券の概要は以下のとおりである
|
|
2022年12月31日 |
|
|||||||||||||
|
|
|
|
|
毛収入 |
|
|
毛収入 |
|
|
|
|
||||
|
|
償却する |
|
|
実現していない |
|
|
実現していない |
|
|
推定数 |
|
||||
(単位:千) |
|
コスト |
|
|
収益.収益 |
|
|
損 |
|
|
公正価値 |
|
||||
貨幣市場基金(1) |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
|
|
2021年12月31日 |
|
|||||||||||||
|
|
|
|
|
毛収入 |
|
|
毛収入 |
|
|
|
|
||||
|
|
償却する |
|
|
実現していない |
|
|
実現していない |
|
|
推定数 |
|
||||
(単位:千) |
|
コスト |
|
|
収益.収益 |
|
|
損 |
|
|
公正価値 |
|
||||
貨幣市場基金(1) |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
2022年12月31日まで、すべての投資は通貨市場基金で、あります
114
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
公正価値計量
私たちの売却可能な証券、株式と長期投資は公正な価値によって日常的に計量し、私たちの債務は償却コストによって計量します。推定された公正価値は以下のとおりである
|
|
2022年12月31日までの見積公正価値計量使用: |
|
|||||||||||||
|
|
オファー |
|
|
意味が重大である |
|
|
意味が重大である |
|
|
|
|
||||
|
|
雷同 |
|
|
観察できるのは |
|
|
見えない |
|
|
|
|
||||
計器タイプ |
|
資産 |
|
|
入力量 |
|
|
入力量 |
|
|
|
|
||||
(単位:千) |
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
資産 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
インターネットサービス供給者基金有限責任会社が持っている投資(1) |
|
|
|
|
|
— |
|
|
|
|
|
|
|
|||
株式投資-Armata普通株 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
株式投資-Armata株式承認証 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式投資-InCarda株式証明書 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
変換可能債券投資−Gate Note |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
見積公正価値に基づいて計量された総資産 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
負債.負債 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
債務 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2023年ノート |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
2025年ノート |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
2028年ノート |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
債務公正価値総額 |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
価値を持つ権利があります |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
見積もり公正価値で計算された負債総額 |
|
$ |
— |
|
|
$ |
|
|
$ |
|
|
$ |
|
|||
|
|
2021年12月31日までの見積公正価値計量使用: |
|
|||||||||||||
|
|
オファー |
|
|
|
|
|
|
|
|
|
|
||||
|
|
活動状態にある |
|
|
意味が重大である |
|
|
|
|
|
|
|
||||
|
|
市場: |
|
|
他にも |
|
|
意味が重大である |
|
|
|
|
||||
|
|
雷同 |
|
|
観察できるのは |
|
|
見えない |
|
|
|
|
||||
計器タイプ |
|
資産 |
|
|
入力量 |
|
|
入力量 |
|
|
|
|
||||
(単位:千) |
|
レベル1 |
|
|
レベル2 |
|
|
レベル3 |
|
|
合計する |
|
||||
資産 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
貨幣市場基金 |
|
$ |
|
|
$ |
— |
|
|
$ |
— |
|
|
$ |
|
||
インターネットサービス供給者基金有限責任会社が持っている投資(1) |
|
|
|
|
|
— |
|
|
|
|
|
|
|
|||
株式投資-Armata普通株 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
株式投資-Armata株式承認証 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式投資−ENTASIS普通株 |
|
|
|
|
|
— |
|
|
|
— |
|
|
|
|
||
株式投資--権利証 |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式投資-InCarda株式証明書 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
変換可能債券投資−Gate Note |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
|
||
見積公正価値に基づいて計量された総資産 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
債務 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
2023年ノート |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
2025年ノート |
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
債務公正価値総額 |
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
|
$ |
|
||
115
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
アンマルタとエンタシーへの株式投資の公正価値は、活発な市場のオファーに基づいており、一級金融商品に分類されている。ARMATAとENTASIS権証の公正価値は2段階に分類され、観察可能な投入に基づいており、その中には基準収益率、報告の取引、ブローカー/取引業者のオファー、発行者の利益差、二国間市場、基準証券、入札、見積、市場研究出版物を含む参考データが含まれる可能性がある。
Cardaの株式証券、Gateの転換可能な手形、isp Fund LPによって保有される私募ヘッド寸および変換可能手形、およびまたは価値のある権利は、公開取引ではないので、評価モデルにおけるこれらの証券の評価のための仮定は、上場同業者の投入を含む重大な観察可能かつ観察可能な投入に基づく。
我々の2023年債券、2025年債券、2028年債券の公正価値は、それぞれのツールの最近の取引価格に基づいて計算される。
7.支払われた資本化費用
グラクソ·スミスクラインに支払われる資本化費用には、グラクソ·スミスクラインへの登録費用と発表に関連するマイルストーン費用が含まれている
|
|
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
償却期限 |
|
2022 |
|
|
2021 |
|
||
アメリカです |
|
2013-2030 |
|
$ |
|
|
$ |
|
||
ヨーロッパ.ヨーロッパ |
|
2013-2029 |
|
|
|
|
|
|
||
日本です |
|
2013-2029 |
|
|
|
|
|
|
||
総帳簿価値 |
|
|
|
|
|
|
|
|
||
累計償却する |
|
|
|
|
( |
) |
|
|
( |
) |
帳簿純価値 |
|
|
|
$ |
|
|
$ |
|
||
これらの記念碑的な費用はその想定される使用寿命内に償却され、製品がそれぞれの地域で商業的に発売されたことから、償却記録は協力手配収入の減少となった。2022年12月31日までの加重平均残余償却期間は
これらのマイルストーン費用に関するより多くの情報は付記3“収入確認”に含まれている。2022年12月31日現在、2021年と2020年12月31日までの年度の償却は$
8.営業権および無形資産
買収の商標権と無形資産は買収日に公正価値で確認される。2022年12月31日現在の売掛金額は$
確定耐用年数を有する無形資産は、その予想耐用年数内に償却される
|
|
使用寿命 |
|
毛収入 |
|
|
積算 |
|
|
純積載運 |
|
|||
(単位:千) |
|
(年) |
|
金額 |
|
|
償却する |
|
|
金額 |
|
|||
発売製品 |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
|||
現在行われている研究と開発 |
|
|
|
|
|
|
|
— |
|
|
|
|
||
協力協定 |
|
|
|
|
|
|
|
— |
|
|
|
|
||
合計する |
|
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||
ENTASIS買収で確認された無形資産は#ドル
116
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
La Jolla買収で確認された無形資産は計#ドル
9.貸借対照表の構成要素
在庫品
在庫には以下の内容が含まれている
(単位:千) |
|
2022年12月31日 |
|
|
原料.原料 |
|
$ |
|
|
製品の中で |
|
|
|
|
完成品 |
|
|
|
|
総在庫 |
|
$ |
|
|
2022年12月31日まで総在庫にはLa Jollaの買収による公正価値調整純額が約#ドル含まれています
その他負債を計算すべき
他の負債には
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
契約製造費用を計算する |
|
$ |
|
|
$ |
|
||
臨床費用を計算すべきである |
|
|
|
|
|
|
||
研究費に応じて計算する |
|
|
|
|
|
|
||
専門サービスに応じる |
|
|
|
|
|
|
||
賃貸負債の流動部分 |
|
|
|
|
|
|
||
繰延特許使用料債務の当面の部分 |
|
|
|
|
|
|
||
ライセンス料と印税を計算する |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
その他の負債総額を計算すべき |
|
$ |
|
|
$ |
|
||
その他長期負債
他の長期負債には
(単位:千) |
|
2022年12月31日 |
|
|
延期特許使用料債務の長期部分 |
|
$ |
|
|
賃貸負債の長期部分 |
|
|
|
|
価値ある権利負債 |
|
|
|
|
その他長期負債総額 |
|
$ |
|
|
いくつありますか
117
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
10.株ベースの報酬
持分激励計画
二零一二年五月、二零一二年株式激励計画(“二零一二計画”)を採択した。2012年計画では、従業員、非従業員取締役、コンサルタントに奨励的株式オプション、非法定株式オプション、RSA、RSU、株式付加価値権を付与することが規定されている。2022年12月31日まで2012年の計画によると残り発行可能な株式の総数は
従業員株購入計画
2004年の従業員の株購入計画(ESPP)によると、私たちの従業員は給料控除で普通株を購入することができて、価格は同じです
2022年12月31日までESPPによる残り発行可能株式の総数は
役員報酬計画
私どもの非従業員取締役は取締役として提供するサービスにより補償を受けています。各非従業員の取締役会メンバーはすべて取締役、取締役会メンバー、独立取締役首席取締役と会長(状況に応じて)を担当するために現金と株式補償を得ることができる。2017年10月には、補償案の現金と株式部分が改正され、直ちに発効しました(“2017年10月改正”)。
2012年に計画実施された計画によると、私たちのすべての独立取締役は定期的に株式奨励を自動的に獲得する。このような贈与は自由に支配できない。二零一二年計画によると、私たちの独立役員やそのような役員の連合会社だけが自動付与を受ける資格があります。この計画によると、初めて非取締役社員となった個人は、取締役会に加入した日に、一度に付与されたRSUを自動的に獲得し、私たちの普通株の数をカバーし、ドルで計算する
毎年、彼や彼女が年次株主総会で取締役会のメンバーに再選された時、各非従業員取締役は自動的にRSUを獲得し、私たちの普通株の数量をカバーして、ドルで計算します
これらのRSUは,役員死亡,制御権が変化した場合に全数付与されるか,あるいは2017年10月改正案後の裁決に対して,取締役サービス終了までに取締役の障害を全数付与する。取締役RSUは、普通株関連株に帰属されていないすべての現金配当金に相当する配当等価権を有する。配当等価物は、帰属を含み、帰属時に現金で支払うことを含む、それに添付された配当単位と同じ条項および条件を遵守しなければならない。
118
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
株に基づく報酬費用
株式で計算された報酬費用の連結損益表の列は以下の通りである
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
販売、一般、行政 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
研究開発 |
|
|
|
|
|
|
|
|
|
|||
合計する |
|
$ |
|
|
$ |
|
|
$ |
|
|||
報酬タイプ別の連結損益表に含まれる株式報酬費用は以下の通りです
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
株式オプション |
|
$ |
|
|
$ |
|
|
$ |
|
|||
RSU |
|
|
|
|
|
|
|
|
|
|||
RSA |
|
|
|
|
|
|
|
|
|
|||
ESPP |
|
|
|
|
|
|
|
|
|
|||
株式に基づく報酬総支出 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
自分から2022年12月31日、未確認株式の補償コストと推定された加重平均償却期間は以下の通り
(単位:千) |
|
未確認補償コスト |
|
|
加重平均償却期間(年) |
|
||
株式オプション |
|
$ |
|
|
|
|
||
RSU |
|
|
|
|
|
|
||
RSA |
|
|
|
|
|
|
||
未確認補償費用総額 |
|
$ |
|
|
|
|
||
報酬奨励
次の表は、2012年計画と以前に計画された株式奨励活動と関連情報をまとめたものである
(単位は千、1株当たりのデータは除く) |
|
未完了オプションの数 |
|
|
未満期オプションの加重平均行権価格 |
|
|
未完成のRSUの数 |
|
|
加重平均-付与時の1株当たり公正価値 |
|
|
未償還特別サービス契約数 |
|
|
加重平均-付与時の1株当たり公正価値 |
|
||||||
2021年12月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||||
授与する |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||||
鍛えられた |
|
|
( |
) |
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|||||
解放されたRSUとRSA |
|
|
|
|
$ |
|
|
|
( |
) |
|
$ |
|
|
|
( |
) |
|
$ |
|
||||
没収される |
|
|
( |
) |
|
$ |
|
|
|
( |
) |
|
$ |
|
|
|
|
|
$ |
|
||||
2022年12月31日現在の残高 |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||||
帰属していると予想されています |
|
|
|
|
$ |
|
|
|
|
|
$ |
|
|
|
|
|
$ |
|
||||||
2022年12月31日まで未償還オプションと行使可能オプションの内的価値の合計は
119
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
行使されたオプションの総内的価値は
2022年12月31日、2021年12月31日、および2020年12月31日、帰属するRSUの推定公正価値総額は、それぞれ230万ドル、110万ドル、130万ドルである。
2022年12月31日,2021年,2020年12月31日までの年間では,帰属するRSAの総推定公正価値は重要ではない。
推定値仮定
当社の株式オプションが付与日の推定価値を計算する際に用いる加重平均は以下のように仮定される
|
|
十二月三十一日までの年度 |
|
|||||||||
|
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
無リスク金利 |
|
|
% |
|
|
% |
|
|
% |
|||
予想期限(年単位) |
|
|
|
|
|
|
|
|
|
|||
波動率 |
|
|
% |
|
|
% |
|
|
% |
|||
配当率 |
|
|
% |
|
|
% |
|
|
% |
|||
株式オプションが付与された加重平均推定公正価値 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
11. 株主権益
2022年10月31日、私たちの取締役会は新しい株式買い戻し計画を承認しました。この計画によると、私たちは最高$を買い戻すことができます
12.債務
私たちの債務は
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
2023年ノート |
|
$ |
|
|
$ |
|
||
2025年ノート |
|
|
|
|
|
|
||
2028年ノート |
|
|
|
|
|
|
||
債務総額 |
|
|
|
|
|
|
||
差し引く:未償却債務割引と発行コスト |
|
|
( |
) |
|
|
( |
) |
総債務,純額 |
|
|
|
|
|
|
||
差し引く:長期債務の現在の部分、純額 |
|
|
|
|
|
|
||
長期債務総額,純額 |
|
$ |
|
|
$ |
|
||
2023年に満了した変換可能な二次手形
2013年1月に公募株式を完成させました
120
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
使用手形の発行。2023年発行の債券の利息は
所有者の選択により、2023年手形は私たちの普通株式の株式に変換することができ、初期転換率は
2023年債の発売については、単一取引相手と2つの私的協議の完封オプション取引を達成した。上限のあるコールオプション取引は総合的なツールであり、私たちが購入した普通株のコールオプションからなり、実行価格は初期転換価格$に等しい
2023年債券の一部の保有者が2014年7月に部分的に転換し、2014年と2015年に配当金を発表·支払いしたため、私たちの2023年債券の転換率総額は
2016年12月31日までの年間で、額面ドルの2023年手形の一部を解約しました
2022年3月7日に$を使用しました
2022年4月18日、ある2023年の手形所有者は彼らの紙幣をドルに両替します
私たちが返済していない2023年の手形残高には以下が含まれています
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
元金 |
|
$ |
|
|
$ |
|
||
債務発行コスト、純額 |
|
|
( |
) |
|
|
( |
) |
帳簿純額 |
|
$ |
|
|
$ |
|
||
次の表にこの年度までの2023年手形に関する確認済み利息支出総額を示すDecember 31, 2022, 2021 and 2020:
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
契約利子支出 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
債務発行原価償却 |
|
|
|
|
|
|
|
|
|
|||
利子と償却費用の総額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
121
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
2023年に発行された債券は2023年1月に満期になった時点で全額支払われている。
2025年満期の転換可能優先手形
2017年8月7日にドルの私募を完了しました
適用される転換率により、2025年の手形は私たちの選択に応じて現金、普通株式、または両者の組み合わせに変換することができる。2025年債券の初期為替レートは
2025年債券保有者は、2025年2月15日の取引終了前に、2025年債券の全部または一部を転換することができます
2025年2月15日以降、2025年債券保有者は、2025年債券満期直前の第2の予定取引日の取引が終了するまで、2025年債券を随時転換することができる。
違約または根本的な変化が発生した場合(上記で定義したように)、2025年手形の所持者は、2025年手形の全部または一部を以下の価格に相当する価格で買い戻すことを要求する可能性がある
2022年1月1日からASU 2020−06改正の遡及方法を採用しており、この方法では、前期報告の財務結果は調整されない。ASU 2020−06の採択は2025年の手形に実質的な影響を与えた。詳細については、付記1、“業務説明および重要会計政策の概要”を参照されたい。
ASU 2020−06年度を採用する前に、2025年手形の転換義務を現金、普通株または現金と普通株の組み合わせで決済する能力があるため、負債部分と埋め込み転換オプション(“株式部分”)との間に収益を分配することで、2025年手形の負債と権益部分を個別に計算した。負債部分の帳票金額は,収益法を用いて交換可能な特徴のない類似負債の公正価値を計測することで計算される.分配方式は似たような債務に対する転換不可能な債務借款金利を反映する。2025年に発行された$債券の株式部分
122
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
コンポーネント.コンポーネント実利法に近似した直線ベースで2025年期手形の利息支出を償却する。権益部分を占めるべき発行コストは追加実収資本の中で権益部分を相殺した。2025年債券負債分の年利率は
2022年1月1日にASU 2020−06を通過した場合,2025年手形の負債と権益部分を統合し,そのツールが成立から通過日まで単一負債として入金されたと仮定する。私たちはまた発行費用の負債と資本部分を統合した。発行コストは2025年債の未償還元本残高から差し引かれ、実質金利法で直線原則で2025年の債券期間内に償却される。2022年1月1日現在、2025年手形の年利率は
私たちが返済していない2025年の手形残高には以下のものが含まれています
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
負債構成部分 |
|
|
|
|
|
|
||
元金 |
|
$ |
|
|
$ |
|
||
債務割引と発行コスト、純額 |
|
|
( |
) |
|
|
( |
) |
帳簿純額 |
|
$ |
|
|
$ |
|
||
純額権益部分 |
|
$ |
|
|
$ |
|
||
次の表には、この年度までの2025年手形に関する確認された利息支出総額を掲載しますDecember 31, 2022, 2021 and 2020:
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
契約利子支出 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
債務発行原価償却 |
|
|
|
|
|
|
|
|
|
|||
債務割引償却 |
|
|
|
|
|
|
|
|
|
|||
利子と償却費用の総額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
2028年満期の転換可能優先チケット
2022年3月に私たちは私募を完了しました
発売総2.61億元の2028年債券元金純額は約
2028年発行の債券の年利率は
適用された転換率により、2028年のチケットは私たちの選択に応じて現金、普通株式、または両者の組み合わせに変換することができる。初期転換率は
2027年9月15日までに、2028年債券は、特定のイベント発生時と、ある時期に所有者によって選択的に変換され、2028年債券満期日直前の第2の予定取引日の取引が終了するまで、2027年9月15日以降の任意の時間に変換可能になる。
123
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
2028年債券保有者は、2027年9月15日の取引終了前に、その全部または一部を2028年債券に変換することができるのは、以下の場合のみである
2027年9月15日またはその後、2028年債券の保有者は、2028年債券の満期直前の翌日の取引が終了するまで、2028年債券を随時転換することができる。
2028年債券は、いつでも、時々、2025年3月20日以降、および満期日直前の75番目の予定取引日または前に、私たちの選択権の全部または一部で償還されますが、私たちの普通株の最後の報告販売価格が指定された時間内に転換価格の130%を超えることを前提としています。償還価格は、償還された2028年期債券の元金に相当し、償還日(ただし償還日を除く)までの課税額及び未償還利息(あればある)を別途加算する。さらに、2028年手形の場合、任意の2028年手形の償還は完全な基本的な変更を構成し(定義は2028年手形の契約を参照)、この場合、2028年手形が償還を要求された後に再両替される場合、2028年手形変換に適用される換算率は場合によっては増加する。
もし私たちが根本的な変化を経験すれば、いくつかの条件を満たした場合、保有者は私たちに2028年の債券の全部または一部を現金で購入することを要求するかもしれない。調達価格の根本的な変化は
2028年債券の発売については、私的交渉の上限コールオプション取引を達成しました。トップされたコール取引の上限価格は最初は$です
2028年発行の債券の年利率は
未返済の2028年手形残高には以下の項目が含まれている
(単位:千) |
|
2022年12月31日 |
|
|
負債構成部分 |
|
|
|
|
元金 |
|
$ |
|
|
債務割引と発行コスト、純額 |
|
|
( |
) |
帳簿純額 |
|
$ |
|
|
124
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
次の表には、2028年期手形発行に関する確認された利息支出総額が記載されています2022年12月31日:
|
|
発行期限 |
|
|
(単位:千) |
|
2022年12月31日 |
|
|
契約利子支出 |
|
$ |
|
|
債務発行原価償却 |
|
|
|
|
利子と償却費用の総額 |
|
$ |
|
|
債務期日
現在、私たちの長期債務の計画総期限は2022年12月31日の状況は以下の通り
(単位:千) |
|
金額 |
|
|
十二月三十一日までの年度 |
|
|
|
|
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
2027 |
|
|
|
|
その後… |
|
|
|
|
合計する |
|
$ |
|
|
印税義務を延期する
La Jollaの買収の一部として,吾らはLa JollaとHealthcare Royalty Partners(“HCR”)のLa Jolla Royalty融資プロトコル(“La Jolla Royaltyプロトコル”)に関する繰延特許義務使用料の公正価値を記録している。La Jolla印税協定の条項によると、HCRはGIAPREZAの世界純売上高から四半期版税を得る権利がある®2031年1月1日までまたは最高合計特許権使用料を支払う場合(先行発生者を基準)。特許権使用料協定に基づき,HCRに支払われる四半期費用は最高特許権使用料税率で開始され,年間製品純売上高ハードルの実現状況に応じて逓減する。現在の最高特許使用料は
La Jollaを買収した日から2022年12月31日まで、利息支出が$であることを確認しました
La Jolla Royalty協定の条項によると、商業的に合理的で勤勉な努力を使用してGIAPREZAを商業化する義務を含むいくつかの義務を履行できない場合®HCRはLa Jolla特許使用料協定を終了し、支払いを要求する権利があります
125
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
La Jolla特許使用料協定でLa Jolla特許使用料協定の満了金額を加速させる可能性があるいくつかの契約条項は、繰延特許権使用料義務と公正価値確認から分離する必要がある組み込みデリバティブとして確認される。我々は、各イベントが発生する可能性を評価し、異なる場合に生じる可能性のある償還金額および償還時間を評価することによって、各派生ツールの公正な価値を決定する。この評価の結果,デリバティブを埋め込む公正価値を決定することは重要ではないため,2022年12月31日までは確認されていない.吾らは、機能故障またはLa Jolla特許権使用料プロトコルが終了するまで、各報告期間における埋め込み誘導ツールの公正価値を推定し、より早い発生者を基準とする。派生ツールに埋め込まれた公正価値の任意の重大な変動は、総合損益表に損益を計上する。
13.支払いの引受およびまたは事項
レンタルを経営する
会社本部、オフィススペース、実験室施設の運営賃貸契約があります。
私たちの運営賃貸契約には施設賃貸が含まれています
2019年、私たちはカリフォルニア州バーリントンにある本社のために運営賃貸契約を締結しました。レンタル料は約
レンタル料金の構成は以下のとおりである
|
|
現在までの年度 |
|
|
(単位:千) |
|
2022年12月31日 |
|
|
直線運営リースコスト |
|
$ |
|
|
可変リースコスト |
|
|
|
|
総賃貸コスト |
|
$ |
|
|
レンタルに関する補足キャッシュフロー情報は以下のとおりである
|
|
現在までの年度 |
|
|
(単位:千) |
|
2022年12月31日 |
|
|
計量に含まれる金額のための現金 |
|
$ |
|
|
経営的リース交換で得られた使用権資産 |
|
|
|
|
買収によって得られた使用権資産 |
|
|
|
|
2022年12月31日まで、私たちの経営賃貸の加重平均残存期間は
126
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
我々は、これらの年度の運営リースが重要ではないため、上記2021年12月31日現在と2020年12月31日までの年度の比較情報を提供していない。
次の表は、合併貸借対照表における経営リースをまとめています
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
資産 |
|
|
|
|
|
|
||
使用権資産 |
|
$ |
|
|
$ |
|
||
負債.負債 |
|
|
|
|
|
|
||
|
$ |
|
|
$ |
|
|||
|
|
|
|
|
|
|||
リース総負債 |
|
$ |
|
|
$ |
|
||
私たちはレンタルの未来最低レンタル支払いを経営しています2022年12月31日の状況は以下の通り
(単位:千) |
|
金額 |
|
|
十二月三十一日までの年度 |
|
|
|
|
2023 |
|
$ |
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
未割引賃貸支払総額 |
|
|
|
|
差し引く:推定利息 |
|
|
( |
) |
リース負債総額を経営する |
|
$ |
|
|
法律訴訟
当社は日常業務運営中に時々法的手続きを扱っています。私たちは現在どのような実質的な法的手続きの当事者でもないが、以下に述べることは除外する。
2022年2月15日、La JollaはGland Pharma Limited(“Gland”)の第4段落認証通知(“通知状”)を受け取り、GlandがFDAに短い新薬申請(“ANDA”)を提出したことを通知し、GIAPREZAの模倣バージョンの生産、使用、または販売の許可を求めた® in the U.S. prior to the expiration of U.S. Patent Nos.: 9,220,745; 9,572,856; 9,867,863; 10,028,995; 10,335,451; 10,493,124; 10,500,247; 10,548,943; 11,096,983; and 11,219,662 (the “GIAPREZA®特許“)は,FDAが承認した治療同等性評価を有する医薬製品(”オレンジマニュアル“)に記載されている。通知状はGIAPREZAが®特許は無効であり、強制的に実行されてはならず、および/またはGlandのANDAに記載されている模倣薬の商業的製造、使用または販売によって侵害されることはない。
2022年3月29日,La JollaはGIAPREZAの特許侵害について訴訟を起こした®Glandおよびいくつかの関連エンティティに対する特許出願は、GlandのANDA出願に応答するために、米国ニュージャージー州地域裁判所で行われている。ハッジ·ワックスマン法によるとGIAPREZAは®1種の新しい化学実体であり、La Jollaは通知書を受け取ってから45日以内に特許侵害苦情を提出し、FDAはGlandのANDAを承認できず、GIAPREZAが許可した7.5年より早い®訴訟における特許のすべての主張が無効であること、強制執行できないこと、および/または侵害されていないと地方裁判所が裁定しない限り。GIAPREZAに関する知的財産権を強力に実行するつもりです®.
このような初期段階を考慮すると、潜在的な将来損失や一連の潜在的未来損失(あれば)を合理的に推定することはできず、2022年12月31日までの負債項目も記録されていない。
賠償やその他の事項
はい通常の業務過程で、私たちはいくつかの事項についてサプライヤー、役員、上級管理者、および他の各方面に異なる範囲と条項の賠償を提供することができます。これらに限定されないが、このような合意違反による損失、私たちが提供するサービス、私たちの不注意または故意の不正行為、違法行為、または
127
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
第三にパーティーです。また、取締役や特定の高級職員や従業員と賠償協定を締結しており、取締役、高級職員、または従業員の身分やサービスとして生じる可能性のある責任について賠償することを要求します。当該等の合意によれば、吾等は賠償を要求されていないため、吾等の知る限り、当社の連結財務諸表に重大な影響を与える可能性のあるクレームは何もない。私たちは取締役と上級職員保険も維持しています。これは私たちが取締役義務を賠償することによるいくつかの責任をカバーしているかもしれません。今まで、私たちはいかなる重大なコストも発生していません。2022年12月31日まで、私たちはこれらの支出のために連結財務諸表に負債を計上していません。
14.所得税
所得税費用は以下の部分からなる
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
現在のところ |
|
|
|
|
|
|
|
|
|
|||
連邦制 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
状態.状態 |
|
|
|
|
|
|
|
|
|
|||
総電流 |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
延期する |
|
|
|
|
|
|
|
|
|
|||
連邦制 |
|
|
|
|
|
|
|
|
|
|||
状態.状態 |
|
|
( |
) |
|
|
|
|
|
|
||
集計を延期する |
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
所得税の総支出,純額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
米国連邦法定所得税間の差が私たちの所得税支出に与える影響は以下の通りであると予想される
|
|
十二月三十一日までの年度 |
|
|||||||||
(単位:千) |
|
2022 |
|
|
2021 |
|
|
2020 |
|
|||
連邦法定税率で徴収される所期税額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
州所得税、連邦福祉を差し引いた純額 |
|
|
( |
) |
|
|
|
|
|
( |
) |
|
連邦と州研究単位 |
|
|
( |
) |
|
|
|
|
|
|
||
非持株権益 |
|
|
|
|
|
( |
) |
|
|
( |
) |
|
子会社合併·解除合併の影響 |
|
|
( |
) |
|
|
|
|
|
|
||
他にも |
|
|
( |
) |
|
|
|
|
|
|
||
評価免除額を変更する |
|
|
|
|
|
|
|
|
( |
) |
||
所得税支出,純額 |
|
$ |
|
|
$ |
|
|
$ |
|
|||
128
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
繰延所得税は、財務報告目的のための資産および負債の帳簿金額と所得税目的のための金額との間の一時的な差異の純税影響を反映する
|
|
十二月三十一日 |
|
|||||
(単位:千) |
|
2022 |
|
|
2021 |
|
||
繰延税金資産 |
|
|
|
|
|
|
||
純営業損失が繰り越す |
|
$ |
|
|
$ |
|
||
研究と開発税収は繰越免除 |
|
|
|
|
|
|
||
投資が未実現損失,純額 |
|
|
|
|
|
|
||
繰延特許使用料債務純額 |
|
|
|
|
|
|
||
他にも |
|
|
|
|
|
|
||
推定控除前の繰延税金資産総額 |
|
|
|
|
|
|
||
推定免税額 |
|
|
( |
) |
|
|
( |
) |
繰延税金資産総額 |
|
|
|
|
|
|
||
繰延税金負債 |
|
|
|
|
|
|
||
減価償却および償却 |
|
|
( |
) |
|
|
( |
) |
投資が収益を達成しておらず,純額 |
|
|
|
|
|
( |
) |
|
在庫公正価値調整 |
|
|
( |
) |
|
|
|
|
他にも |
|
|
( |
) |
|
|
|
|
繰延税項目純資産(負債) |
|
$ |
( |
) |
|
$ |
|
|
繰延税金資産の現金化の可能性が発生しない可能性よりも大きければ、このような資産を入金する。繰延税金資産に対する評価準備が必要かどうかを決定する際には、重大な経営陣の判断が必要である。この決定を下す時、私たちはすべての得られる正と負の証拠、例えば私たちの歴史的経営業績と将来の課税収入の予測可能性を考慮した。今後の課税収入を予測する際には、経営陣の重大な判断も行使しなければならない。具体的には、推定免税額を考慮した場合、以下の基準を評価します
2022年12月31日まで、私たちの連邦純営業損失は約$
国税法や国が定めるような所有権変更制限により、純営業損失や税収控除繰越の使用はかなりの年間制限を受ける可能性がある。年次制限は、このような金額の一部または全部が使用される前に満期になった純営業損失と税収控除の繰越につながる可能性がある。
2022年12月31日までの会社について改正された1986年国内収入法第382節(“第382節”)を分析し、設立以来所有権変更が発生したかどうかを決定した。第382条の研究では、同社はテスト期間中に所有権変更を経験していない可能性が高いと結論している。しかし、適用される年間制限にもかかわらず、私たちの純営業損失や信用繰越は何の部分も満期にならないと予想され、確定された所有権変更によって連邦と州所得税負債を減らすことができます。もし私たちが別の所有権変更を経験した場合、改正後の1986年“国税法”第382と383節に基づいて、所有権変更前の純営業損失の繰越或いは所有権変更前の税収属性を利用して、例えば税収控除を検討すると、所有権変更後の収入は年間制限を受ける可能性がある。似たような規則は州税法に適用されるかもしれない。
129
カタログ表
INNOVIVA,Inc.
連結財務諸表付記
Entsisを買収した結果,entsisの所有権変化を検討し,$を利用できると予想される
La Jollaを買収した結果、その所有権の変化を初歩的に分析し、$を利用できると予想されています
私たちの政策は所得税支出で所得税事項に関連する利息および/または罰金を確認することです。2022年と2021年12月31日までに
不確定税収状況
未確認の税収割引総額の期初残高と期末残高の入金は以下の通り
(単位:千) |
|
金額 |
|
|
2019年12月31日現在の未確認税収割引 |
|
$ |
|
|
2020年税額純減少額 |
|
|
( |
) |
2020年12月31日までの未確認税収割引 |
|
|
|
|
2021年税収部分純減少 |
|
|
( |
) |
2021年12月31日までの未確認税収割引 |
|
|
|
|
2022年税収部分純増加 |
|
|
|
|
2022年12月31日までの未確認税収割引 |
|
$ |
|
|
私たちはアメリカと州の管轄地域で税金を払わなければならない。純営業損失と全体信用繰越のため、2004年から2013年、2015以降の納税年度は連邦と大多数の州税務機関の審査を受けることができる。
15.後続の活動
2023年1月10日、Armataと保証された転換可能な信用協定(“信用協定”)を締結し、この合意に基づいて延長しました
2023年2月2日に、ITHとGateはGate転換手形改訂協定(“手形改訂協定”)を締結し、TRCとGateが2021年11月に締結した転換可能な本チケット購入プロトコルを改訂して、Gate変換可能チケットを買収する(付記6、“株式及び長期投資及び公正価値計量”を参照)。手形改訂協定によると、Gate交換可能手形の元本金額は
130
レイプ独立公認会計士事務所ORT
Innoviva,Inc.株主と取締役会に。
財務諸表のいくつかの見方
Innoviva,Inc.とその子会社(“当社”)の2022年12月31日までの総合貸借対照表,2022年12月31日までの関連総合収益表,全面収益表,株主権益と現金フロー表,および関連付記(総称して“財務諸表”と呼ぶ)を監査した。財務諸表は,すべての重要な面で会社が2022年12月31日までの財務状況と,2022年12月31日までの年度の経営結果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる。
我々はまた、米国上場会社会計監督委員会(PCAOB)の基準に従って、会社が2022年12月31日までの財務報告の内部統制を監査し、根拠を監査した内部統制--統合フレームワーク(2013)テレデビル委員会は、組織委員会が発表した報告書と2023年2月28日の報告書を後援し、会社の財務報告書の内部統制について保留のない意見を表明した。
会計原則の変化
財務諸表付記1で述べたように、会社は2022年1月1日から会計基準更新2020-06を採用している債務-転換可能債務および他のオプション(特別テーマ470-20)および派生ツールおよびヘッジ--エンティティ自己資本契約(特別テーマ815-40):エンティティ自己資本変換可能ツールおよび契約の会計改正されたバックトラック法を採用する。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、財務諸表を当期監査する際に生じる事項であり、監査委員会に伝達または要求され、(1)財務諸表に対して大きな意味を有する勘定または開示に関し、(2)特に挑戦的、主観的、または複雑な判断に関するものである。重要監査事項の伝達は、財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、次の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
合併エンティティおよび株式および長期投資−可変利益エンティティの主な受益者決定−連結財務諸表付記1,5および6を参照−
重要な監査事項の説明
その会社は個人と上場企業の株式と債務証券に投資する。当社は、当該等の権益が可変権益エンティティ(VIE)又は投票権権益エンティティ(VOE)の定義に適合するか否か、及び当社が当該エンティティを合併する必要があるか否かを決定するために、当該等のエンティティにおける権益を評価する。VIEはその主要な受益者によって合併されたものであり、それはVIE経済表現に最も重要な活動を指導する権利があり、可変利益もあり、VIEの損失を吸収したり、VIEに重大な影響を与える可能性のある利益を獲得する権利がある。変数があるかどうかを確認する
131
当社の持つ権益がVIEに重大な影響を与える可能性があることから、当社はVIE参加の性質、規模、形式に関する定性的と定量的な要素を考慮した。一般に、VIE(取締役会管理および代表)に影響を与える最も重要な決定を行い、これらの意思決定者を一方的に罷免する権利を有する当事者は、VIEの活動を指導する権利があるとみなされる。あるタイプのイベントが発生すると、当社はエンティティがVIEであるかどうか、および当社がそのエンティティの主な受益者であるかどうかを再検討する。VIEの主な受益者の決定には重要な管理判断が必要だ。2022年12月31日現在、会社合併VIEの総資産と総負債の帳簿価値はそれぞれ3.206億ドルと160万ドル。また、2022年12月31日現在、合併していないVIEへの会社の投資の帳簿価値は3兆779億ドル。
VIEの主な受益者の決定に関連する会計原則の複雑さと、VIEの確立における経営陣の役割、彼らの持続的な権利および責任、およびどちらがこれらの活動に対する権力を有するかを決定する際に必要な重大な判断のために、当社VIEの主な受益者を重要な監査事項として決定する。これには、監査人がそのVIEの主な受益者であるかどうかを評価するための監査プログラムを実行する際に、合併会計の専門知識を有する専門家を参加させることを含む、監査人の判断力とより大きな努力が必要である。
監査で重要な監査事項をどのように処理するか
VIEの主な受益者の決定に関する監査手続きには、以下のことが含まれています
/s/徳勤法律事務所
カリフォルニア州サンノゼ
2023年2月28日
2022年以来、私たちは会社の監査役を務めてきた。
132
独立公認会計士事務所報告
Innoviva,Inc.の株主と取締役会へ
財務諸表のいくつかの見方
Innoviva,Inc.(デラウェア州の1社)とその子会社(“当社”)2021年12月31日までの連結貸借対照表,2021年12月31日までの2年度に関する総合収益表,全面収益表,株主権益変動表とキャッシュフロー表および関連付記(総称して“財務諸表”と呼ぶ)を監査した。財務諸表はすべての重要な点で会社の財務状況を公平に反映していると考えられます 2021年12月31日までに 運営とそのスマート交通システム 2021年12月31日までの2年度のキャッシュフローは、アメリカ合衆国で一般的に受け入れられている会計原則に適合している。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
/s/均富法律事務所
私たちは2019年から2021年まで当社の監査役を務めています。
カリフォルニア州サンフランシスコ
2022年2月28日
133
項目9.会計·財務開示面の変化と会計士との相違
ない。
第9条。制御とプログラム
情報開示制御と手続きの評価。
2022年12月31日現在、我々は、CEO及び最高会計官を含む経営陣の監督の下で、当社の開示制御プログラム及びプログラムの設計及び操作の有効性を評価し、開示制御プログラム及びプログラムは、米国証券取引委員会規則に基づいて会社の制御プログラム及び他のプログラムとして定義され、1934年の証券取引法(取引法)に基づいて会社が提出した報告書に開示された情報が記録、処理されることを確保するために、会社が1934年に提出した証券取引法(取引法)に基づいて開示された情報の記録、処理、委員会の規則及び表並びに制御及び手続に規定された所定時間内に報告をまとめ、蓄積発行者が“取引法”に基づいて提出又は提出された報告書に開示を要求する情報を確保し、その主要幹部及び主要財務官、又は同様の機能を履行する者を含む発行者管理層に適宜伝達し、必要な開示についてタイムリーな決定を行うことを目的とする。この評価に基づき、我々の最高経営責任者及び最高財務責任者は、その日までに、我々の開示制御及び手続は合理的な保証レベルで有効であると結論した。
財務報告の内部統制に関する経営陣の報告
我々の経営陣は、取引所法案第13 a-15(F)条の規定に従って、財務報告の十分な内部統制を確立·維持する責任がある。財務報告の内部統制には、(1)一般的に受け入れられた会計原則に基づいて財務諸表を作成し、私たちの収入および支出が私たちの管理層および取締役の許可のみに基づいて行われるように、合理的な保証を提供すること、および(3)財務諸表に重大な影響を与える可能性のある不正な買収、使用または処分について、私たちの資産を防止またはタイムリーに発見することができる合理的な保証を提供する、(1)合理的で詳細かつ正確かつ公平に反映された私たちの資産の取引および処分を保存するための政策および手順が含まれる。
経営陣(主要行政官及び財務総監を含む)の監督及び参加の下で、われわれは内部制御--統合フレームワークトレデビル委員会は組織委員会が発行した(2013年の枠組み)を後援した。経営陣の評価には、キー財務報告制御の設計と操作有効性、プロセスファイル、会計政策と私たちの全体制御環境などの要素の評価が含まれている。この評価によると、我々の経営陣は、財務報告書に対する内部統制が2022年12月31日から有効であると結論した。
我々の経営陣による2022年12月31日までの財務報告内部統制の有効性の評価には、La JollaとEntasisの財務報告書内部統制は含まれておらず、2022年12月31日までの年次連結財務諸表のうち、両統制は総資産の約33%と総収入の6%を占めている。我々は2022年8月22日にLa Jollaを買収し、2022年7月11日にentsisを買収し、2022年12月31日現在、買収された企業の内部統制の評価を完了していない。この排除は、証券取引委員会の指導意見、すなわち、買収当時の財務報告に関する経営陣の内部統制に関する報告書は、最近の買収業務の評価を省略する可能性がある。
私たちの独立公認会計士事務所徳勤会計士事務所は2022年12月31日までの財務報告内部統制を監査しました。彼らは私たちの財務報告書の内部統制監査に関する認証報告書を以下のように報告する。
制御措置の有効性に対する制限
私たちの経営陣は、私たちのCEOやCEOを含めて、私たちの開示統制や手続き、あるいは財務報告に対する私たちの内部統制がすべてのミスやすべての詐欺を防ぐことを期待していません。発想や動作がどんなに良くても、絶対的な保証ではなく、合理的な保証しか提供できず、制御システムの目標が実現されることを確保する制御システム。また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.すべての制御系の固有の限界により,どの制御評価もInnoviva内部のすべての制御問題や不正イベント(あれば)が発見されることを絶対的に保証することはできない.また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
134
財務報告の内部統制の変化
2022年12月31日までの年間で、entsisとLa Jollaの買収を完了した。我々は現在、買収した業務やプロセスを我々の内部統制環境に統合し、在庫管理、研究開発活動、製品販売に関する新たな制御の作成を含むが、これらに限定されない当社の財務報告内部統制を必要に変更している。
上記の事項を除いて、2022年12月31日までに、財務報告の内部統制(“外国為替法案”第13 a-15(F)条参照)に対してより多くの重大な変化があり、我々の財務報告の内部統制に重大な影響を与えるか、または合理的に大きな影響を与える可能性がある。
135
独立公認会計士事務所報告
Innoviva,Inc.株主と取締役会に。
財務報告の内部統制については
Innoviva,Inc.とその子会社(“当社”)2022年12月31日までの財務報告内部統制、根拠を監査しました内部統制--統合フレームワーク(2013)テレデビル委員会(COSO)が主催して組織委員会が発表した。2022年12月31日現在、当社はすべての重要な面で財務報告に対する有効な内部統制を維持しており、その根拠は内部統制--統合フレームワーク(2013)COSOから発表されます。
また、米国上場企業会計監督委員会(PCAOB)の基準に従って、当社の2022年12月31日までおよび2022年12月31日までの年度の総合財務諸表および2023年2月28日までの報告を監査し、このような財務諸表に対して保留のない意見を表明した。
経営陣の“財務報告内部統制報告”が述べたように、経営層は、2022年7月11日に買収されたENTASIS治療ホールディングスと、2022年8月22日に買収されたLa Jolla製薬会社の財務報告内部統制を評価中に除外し、その財務諸表は、2022年12月31日現在の総合財務諸表金額のうち、総資産の33%と総収入の6%を占めている。したがって、私たちの監査にはENTASIS治療ホールディングスとLa Jolla製薬会社の財務報告に対する内部統制は含まれていない。
意見の基礎
当社経営陣は、効果的な財務報告内部統制を維持し、添付されている“経営陣財務報告内部統制報告”に含まれる財務報告内部統制の有効性を評価する責任を負う。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/s/
2023年2月28日
136
プロジェクト9 B。その他の情報
ありません
プロジェクト9 Cです。DISCL検査を阻止した外国司法管轄区のOSUREについて。
適用されません。
137
第三部
プロジェクト10.役員、役員、および企業管理
本プロジェクトが要求する情報は,我々の依頼書に引用することにより,我々の2023年株主総会は,2022年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出される.
プロジェクト11.役員報酬
本プロジェクトが要求する情報は,我々の依頼書に引用することにより,我々の2023年株主総会は,2022年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出される.
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
以下では、株式補償計画に基づいて許可されて発行された証券を除き、本プロジェクトの要求情報は、2023年の株主年次総会に提出された委託書に引用することにより、2022年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出される。
株式補償計画に基づいて発行された証券
次の表は、2022年12月31日までに施行されるすべての株式報酬計画に関するいくつかの情報を提供します
計画種別 |
|
まだ行使されていないオプション及び帰属未行使の制限株式単位及び制限株式奨励を行使する際に発行しなければならない証券数 |
|
|
未平倉オプションの加重平均行権価格 |
|
|
株式補償計画に基づいて将来発行可能な証券の数((A)欄に反映されている証券を除く) |
|
|
|||
|
|
(a) |
|
|
(b) |
|
|
(c) |
|
|
|||
証券保有者が承認した持分補償計画 |
|
|
1,465,720 |
|
(1) |
|
15.56 |
|
(2) |
|
3,999,265 |
|
(3) |
項目13.特定の関係および関連取引、および取締役の独立性
本プロジェクトが要求する情報は,我々の依頼書に引用することにより,我々の2023年株主総会は,2022年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出される.
プロジェクト14.主な課金とサービス
本プロジェクトが要求する情報は,我々の依頼書に引用することにより,我々の2023年株主総会は,2022年12月31日までの財政年度終了後120日以内に米国証券取引委員会に提出される.
138
第4部
プロジェクト15.証拠品および財務諸表の添付表
(A)本年報は、以下の書類を表格10-Kの形式で提出します
1.財務諸表:
登録者の次の財務諸表および付表は、本年度報告シートの第10-K第2部第8項“財務諸表および補足データ”に掲載されている
|
|
|
ページ |
2022年と2021年12月31日までの連結貸借対照表 |
86 |
2022年12月31日までの3年度における各年度の連結損益表 |
87 |
2022年12月31日までの3年度の総合総合収益表 |
88 |
2022年12月31日までの3年度の株主権益合併報告書 |
89 |
2022年12月31日までの3年度の連結現金フロー表 |
90 |
連結財務諸表付記 |
92 |
独立公認会計士事務所レポート(PCAOB ID 34) |
131 |
独立公認会計士事務所レポート(PCAOB ID 248) |
133 |
2.財務諸表の添付表:
これらの付表が必要である条件がないため、または必要な資料が財務諸表、財務諸表、または補足財務資料に必要な資料が表示されているため、すべての付表は省略されている。
(B)S-K規則第601項に規定する証拠品:
本プロジェクトに必要な資料は本報告署名ページの後ろの展示品インデックスに掲載されている.
項目16.表格10-Kの概要
ない。
139
陳列品
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
引用で編入する |
|
同封アーカイブ |
||||
展示品 |
|
説明する |
|
表 |
|
展示品 |
|
保存する |
|
|
2.1 |
|
2022年5月23日現在,Innoviva,Inc.,Innoviva Merge Sub,Inc.とentsis Treeutics間の統合プロトコルと計画 |
|
8-K |
|
2.1 |
|
5/24/2022 |
|
|
2.2 |
|
Innoviva,Inc.,Innoviva買収子会社とLa Jolla製薬会社との間の合併協定と計画は,2022年7月10日とした |
|
8-K |
|
2.1 |
|
7/11/2022 |
|
|
3.1 |
|
改訂および再予約された会社登録証明書 |
|
S‑1 |
|
3.3 |
|
7/26/2004 |
|
|
3.2 |
|
再登録証明書の改訂証明書 |
|
10‑Q |
|
3.4 |
|
3/31/2007 |
|
|
3.3 |
|
デラウェア州国務長官に提出された所有権と合併証明書はLABA合併子会社をTheravance,Inc.と合併し,2016年1月7日に発効した |
|
8‑K |
|
3.1 |
|
1/8/2016 |
|
|
3.4 |
|
附則を改訂·再制定し,2017年2月8日から改訂·再記述する |
|
8‑K |
|
3.1 |
|
2/9/2017 |
|
|
4.1 |
|
登録者の普通株式を代表する証明書サンプル |
|
10‑K |
|
4.1 |
|
12/31/2006 |
|
|
4.2 |
|
契約は,日付は2013年1月24日,Theravance,Inc.と受託者であるニューヨーク銀行メロン信託会社との間で締結された |
|
8‑K |
|
4.1 |
|
1/25/2013 |
|
|
4.3 |
|
2023年満期の2.125%変換可能な二次チケットのフォーマット(添付ファイル4.4参照) |
|
|
|
|
|
|
|
|
4.4 |
|
Innovivaと受託者であるニューヨーク·メロン銀行信託会社が2025年に満期となる2.50%の優先手形に変換可能な契約(手形形式を含む)は、2017年8月7日 |
|
8‑K |
|
4.1 |
|
8/7/2017 |
|
|
4.5 |
|
1934年証券取引法第12条に基づく登録者証券説明 |
|
10-K |
|
4.9 |
|
2/19/2020 |
|
|
4.6 |
|
Innoviva,Inc.と受託者であるニューヨークメロン銀行信託会社が2022年3月7日に満期にしたInnoviva 2.125優先手形を変換可能な契約(手形形式を含む) |
|
8-K |
|
4.1 |
|
3/8/2022 |
|
|
10.1 |
|
2010年4月27日に改訂された従業員株購入計画 |
|
10‑Q |
|
10.4 |
|
6/30/2010 |
|
|
10.2 |
|
登録者とグラクソ·スミスクライン集団有限公司との協力協定は,日付は2002年11月14日である |
|
10‑Q |
|
10.1 |
|
6/30/2014 |
|
|
10.3 |
|
登録者とその中に列挙された当事者によって改訂され、再署名された“投資家権利協定”であり、日付は2004年5月11日である |
|
S‑1 |
|
10.13 |
|
6/10/2004 |
|
|
10.4* |
|
登録者とグラクソ·スミスクライン集団有限公司の戦略連合協定は,期日は2004年3月30日である |
|
10‑K |
|
10.13 |
|
12/31/2013 |
|
|
10.5+ |
|
改訂された現金奨励計画の説明 |
|
10‑K |
|
10.22 |
|
12/31/2009 |
|
|
10.6+ |
|
2009年12月16日に施行された規制分流計画改正案 |
|
10‑K |
|
10.47 |
|
12/31/2009 |
|
|
10.7+ |
|
2009年12月16日に採択された2009年支配権変更分離計画 |
|
10‑K |
|
10.48 |
|
12/31/2009 |
|
|
10.8 |
|
登録者、グラクソ·スミスクライン集団有限公司、グラクソ·スミスクラインとグラクソ·スミスクライン有限責任会社の間で改正·再署名された統治協定の第2次改正案は、2010年11月29日となっている |
|
8‑K |
|
10.2 |
|
11/29/2010 |
|
|
10.9 |
|
2011年10月3日“戦略同盟協定”改正案 |
|
10‑K |
|
10.34 |
|
12/31/2011 |
|
|
10.10+ |
|
2012年2月8日に取締役会が承認し、株主が2012年5月16日に承認した2012年株式激励計画及び株式奨励形式 |
|
10‑Q |
|
10.38 |
|
6/30/2012 |
|
|
10.11 |
|
コール取引は基本的に、2013年1月17日までとなっております |
|
8‑K |
|
10.1 |
|
1/23/2013 |
|
|
10.12 |
|
2013年1月18日の他の上限付き通話取引 |
|
8‑K |
|
10.2 |
|
1/23/2013 |
|
|
10.13 |
|
Theravance,Inc.,Theravance Biophma,Inc.とグラクソ·スミスクライン集団有限公司の間の主な合意は2014年3月3日である |
|
8‑K/A |
|
10.1 |
|
3/6/2014 |
|
|
10.14* |
|
Theravance,Inc.とグラクソ·スミスクグループ株式会社との間の協力協定改正案、日付は2014年3月3日 |
|
8‑K/A |
|
10.2 |
|
3/6/2014 |
|
|
10.15* |
|
Theravance,Inc.とグラクソ·スミスクライン集団有限公司との間の戦略連盟合意修正案は、2014年3月3日 |
|
8‑K/A |
|
10.3 |
|
3/6/2014 |
|
|
140
10.16 |
|
TheravanceとTheravance Biophma間の移行サービスプロトコルは,2014年6月2日である |
|
8‑K |
|
10.2 |
|
6/5/2014 |
|
|
10.17 |
|
TheravanceとTheravance Biophmaの間の税務協定は、2014年6月2日です |
|
8‑K |
|
10.3 |
|
6/5/2014 |
|
|
10.18 |
|
TheravanceとTheravance Biophmaの間の従業員事務協定は、2014年6月1日である |
|
8‑K |
|
10.4 |
|
6/5/2014 |
|
|
10.19 |
|
Theravance呼吸会社、有限責任会社TheravanceとTheravance Biophmaの間の合意は、2014年5月31日です |
|
8‑K |
|
10.5 |
|
6/5/2014 |
|
|
10.20 |
|
TheravanceとTheravance Biophma間の移行サービス協定を改訂/明確にし、日付は2015年3月2日 |
|
10‑Q |
|
10.64 |
|
3/31/2015 |
|
|
10.21+ |
|
2009年分流計画変更第1修正案(2009年分流計画と改称) |
|
8‑K |
|
10.2 |
|
7/29/2015 |
|
|
10.22 |
|
2012年度持分インセンティブ計画業績制限株式奨励および制限株式奨励協定通知表(取締役表) |
|
10‑K |
|
10.76 |
|
2/23/2018 |
|
|
10.23+ |
|
2009年分割払い計画第2修正案 |
|
10‑Q |
|
10.81 |
|
7/26/2018 |
|
|
10.24+ |
|
2018年9月7日Marianne Jenとの招聘状 |
|
8‑K |
|
10.1 |
|
9/11/2018 |
|
|
10.25+ |
|
Innoviva,Inc.とPavel Raifeld間の招待状は,日付は2020年5月20日である |
|
8‑K |
|
10.1 |
|
5/26/2020 |
|
|
10.26+ |
|
Innova,Inc.とPavel Raifeld間の招待状は,2022年4月29日となっている |
|
8-K |
|
10.1 |
|
5/2/2022 |
|
|
10.27 |
|
戦略諮問協定は,日付は2020年12月11日であり,Sarissa Capital Management LPとInnoviva,Inc.が署名されている。 |
|
8‑K |
|
10.1 |
|
12/14/2020 |
|
|
10.28 |
|
ISP Fund LP、Sarissa Capital Fund GP LP、Innoviva Strategic Partners LLC、およびその中で言及された他の当事者が改訂および再署名したISP Fund LPの有限パートナーシップ協定は、2020年12月11日となる |
|
8‑K |
|
10.2 |
|
12/14/2020 |
|
|
10.29 |
|
Innoviva,Inc.とグラクソ·スミスクライン集団有限公司との間の株式買い戻し契約は、2021年5月となっている |
|
8-K |
|
10.1 |
|
5/20/2021 |
|
|
10.30 |
|
手紙プロトコルは、2021年5月20日にInnoviva Strategic Partners LLC、isp Fund LP、Sarissa Capital Fung GP LPによって署名された |
|
8-K |
|
10.2 |
|
5/20/2021 |
|
|
10.31 |
|
Innoviva,Inc.,Bank of America,N.A.,Goldman Sachs&Co.LLCとDeutsche Bank AGロンドン支店が2022年3月2日に行った電話確認 |
|
8-K |
|
10.1 |
|
3/8/2022 |
|
|
10.32 |
|
Innoviva,Inc.とENTASIS治療持株会社の間で2022年5月23日に署名された投資家権利協定第1号改正案。 |
|
8-K |
|
10.1 |
|
5/24/2022 |
|
|
10.33 |
|
サポートプロトコルは,2022年7月10日にInnoviva,Inc.,Innova Acquisition Sub,Inc.,Tang Capital Partners,LPとKevin C.Tang Foundationによって署名された |
|
8-K |
|
10.1 |
|
7/11/2022 |
|
|
10.34 |
|
Innoviva,Inc.,Innova TRC Holdings LLCとRoyalty Pharma Investments 2019 ICAV間の持分購入契約は,2022年7月13日である |
|
8-K |
|
10.1 |
|
7/13/2022 |
|
|
10.35 |
|
“協力協定第3修正案”は、2022年7月13日にInnoviva,Inc.,グラクソ·スミスクライン集団有限公司とTheravance呼吸会社の間で署名された。 |
|
8-K |
|
10.2 |
|
7/13/2022 |
|
|
|
|
|
|
|
|
|
|
|
|
|
21.1 |
|
付属会社名簿 |
|
|
|
|
|
|
|
X |
23.1 |
|
独立公認会計士事務所の同意 |
|
|
|
|
|
|
|
X |
23.2 |
|
独立公認会計士事務所の同意 |
|
|
|
|
|
|
|
X |
23.3 |
|
安永法律事務所Armata PharmPharmticals,Inc.独立公認会計士事務所同意** |
|
|
|
|
|
|
|
|
24.1 |
|
授権書(本年度報告の10−K表署名ページ参照) |
|
|
|
|
|
|
|
X |
31.1 |
|
1934年証券取引法第13 a-14条による主要行政官の証明 |
|
|
|
|
|
|
|
X |
31.2 |
|
1934年証券取引法第13 a-14条に基づく首席財務官の証明 |
|
|
|
|
|
|
|
X |
32# |
|
アメリカ法典第18編1350条による証明 |
|
|
|
|
|
|
|
|
141
99.1 |
|
Armata PharmPharmticals,Inc.2022年12月31日までの監査済み連結財務諸表** |
|
|
|
|
|
|
|
|
101.INS |
|
連結されたXBRLインスタンス文書−インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、相互作用データファイルには表示されない。 |
|
|
|
|
|
|
|
X |
101.書院 |
|
イントラネットXBRL分類拡張アーキテクチャ文書 |
|
|
|
|
|
|
|
X |
101.カール |
|
インラインXBRL分類拡張計算リンクライブラリ文書 |
|
|
|
|
|
|
|
X |
101.def |
|
インラインXBRL分類拡張Linkbase文書を定義する |
|
|
|
|
|
|
|
X |
101.介護会 |
|
XBRL分類拡張ラベルLinkbase文書を連結する |
|
|
|
|
|
|
|
X |
101.Pre |
|
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
|
|
|
|
|
|
|
X |
104 |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
|
|
|
|
|
|
|
X |
+テーブル10-K 15(B)項目の要件に従って提出された管理契約または補償計画またはスケジュール。
*証券取引委員会に電子的に提出された証拠品のコピーから漏れた一部には、機密待遇が与えられています。Innoviva社の秘匿処理申請によると,漏れた情報は単独で米国証券取引委員会に提出されている.
**本年次報告書をテーブル10-K改訂形式で提出します。
#メールで提供されます。
142
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、正式に許可された以下の署名者がその代表を代表して本報告に署名することを正式に手配した。
|
INNOVIVA,Inc. |
|
|
|
|
日付:2023年2月28日 |
差出人: |
/s/Pavel RAIFELD パヴィル·レフェルト |
授権依頼書
このような陳述を通じてすべての人を認識し、以下の署名のすべての人は、Pavel Raifeldをその真の合法的な事実受権者と代理人に構成し、委任し、その人の完全な代替と代替の権力を有し、任意およびすべての身分で、彼または彼女の名義、場所、およびその人の代わりに、Form 10-K年報の任意およびすべての改正に署名し、その年報をそのすべての証拠物および他の関連文書と共に証券取引委員会に提出し、上記事実受権者及び代理人に完全な権力及び権限を付与し、当該所内及び周囲で必要及び行わなければならないすべてのことを行い及び実行し、ここで上記事実を承認及び確認する権利及び代理人又はその代理人が合法的に又は手配することができるすべてのことを行うことができる。
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
|
|
|
|
|
サイン |
|
タイトル |
|
日取り |
|
|
|
|
|
/s/Pavel RAIFELD パヴィル·レフェルト |
|
最高経営責任者 |
|
2023年2月28日 |
|
|
|
|
|
/s/マリアンヌ·ジェーン マリアンヌ·ジェーン |
|
首席会計主任(校長 |
|
2023年2月28日 |
|
|
|
|
|
/s/George BickerStaff ジョージ·ビクスタフIII |
|
取締役会議長 |
|
2023年2月28日 |
|
|
|
|
|
/s/オールド海·コスタス メリーランド州オデッシー·コスタス |
|
役員.取締役 |
|
2023年2月28日 |
|
|
|
|
|
/s/Mark DiPaolo マーク·ディポール |
|
役員.取締役 |
|
2023年2月28日 |
|
|
|
|
|
/s/Jules Haimovitz ジュルス·ヘモヴィッツです |
|
役員.取締役 |
|
2023年2月28日 |
|
|
|
|
|
/s/Sarah Schlesinger サラ·シュレシンガー医学博士 |
|
役員.取締役 |
|
2023年2月28日 |
|
|
|
|
|
/s/デボラ·L·バークス デボラ·L·バークス医学博士 |
|
役員.取締役 |
|
2023年2月28日 |
|
|
|
|
|
/s/Sapna Sriastava サプナ·スリワスタワ博士 |
|
役員.取締役 |
|
2023年2月28日 |
143