nvax-20221231虚像2022会計年度0001000694P 1 YP 3 Y20221231#レンタル権使用資産20221231#レンタル権使用資産20221231#レンタル権使用資産20221231#レンタル権使用資産Http://Fasb.org/us-GAAP/2022#その他の負債現在Http://Fasb.org/us-GAAP/2022#その他の負債現在Http://Fasb.org/us-GAAP/2022#その他の負債は現在ではありませんHttp://Fasb.org/us-GAAP/2022#その他の負債は現在ではありません0.080.02.0073411.0089928.05P 1 Y00010006942022-01-012022-12-3100010006942022-06-30ISO 4217:ドル00010006942023-02-21Xbrli:共有0001000694アメリカ-公認会計基準:製品メンバー2022-01-012022-12-310001000694アメリカ-公認会計基準:製品メンバー2021-01-012021-12-310001000694アメリカ-公認会計基準:製品メンバー2020-01-012020-12-310001000694アメリカ-公認会計基準:メンバーに授与2022-01-012022-12-310001000694アメリカ-公認会計基準:メンバーに授与2021-01-012021-12-310001000694アメリカ-公認会計基準:メンバーに授与2020-01-012020-12-310001000694NVAX:皇室メンバーと他のメンバー2022-01-012022-12-310001000694NVAX:皇室メンバーと他のメンバー2021-01-012021-12-310001000694NVAX:皇室メンバーと他のメンバー2020-01-012020-12-3100010006942021-01-012021-12-3100010006942020-01-012020-12-31ISO 4217:ドルXbrli:共有00010006942022-12-3100010006942021-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2019-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2019-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2019-12-310001000694米国-公認会計基準:財務省株式構成員2019-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2019-12-3100010006942019-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2020-01-012020-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2020-01-012020-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310001000694米国-公認会計基準:財務省株式構成員2020-01-012020-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2020-01-012020-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001000694米国-公認会計基準:財務省株式構成員2020-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-3100010006942020-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001000694米国-公認会計基準:財務省株式構成員2021-01-012021-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001000694米国-公認会計基準:財務省株式構成員2021-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001000694米国-公認会計基準:財務省株式構成員2022-01-012022-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310001000694アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2022-12-310001000694アメリカ-公認会計基準:前払いメンバーを保留2022-12-310001000694米国-公認会計基準:財務省株式構成員2022-12-310001000694アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ公認会計基準:非安全債務メンバー2022-12-012022-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバーアメリカ公認会計基準:副次的事件メンバー2023-01-312023-01-310001000694アメリカ-公認会計基準:政府契約メンバーNVAX:アメリカ政府の合意メンバー2022-12-310001000694NVAX:GaviAdvancePurche eAgreement COVAXFacilityMembers2022-12-310001000694SRT:最小メンバ数2022-01-012022-12-310001000694SRT:最大メンバ数2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバーNvax:欧州委員会のメンバー米国-GAAP:SalesRevenueNetMembers2022-01-012022-12-31Xbrli:純0001000694US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーNvax:欧州委員会のメンバー2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバーNVAX:オーストラリア政府のメンバー米国-GAAP:SalesRevenueNetMembers2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバー米国-GAAP:SalesRevenueNetMembersNvax:カナダ政府のメンバー2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーNVAX:イスラエル政府のメンバー2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーNVAX:GaviVaccine連盟メンバー2021-01-012021-12-310001000694US-GAAP:顧客集中度リスクメンバー米国-GAAP:SalesRevenueNetMembersNVAX:アメリカ政府のメンバー2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバー米国-GAAP:SalesRevenueNetMembersNVAX:アメリカ政府のメンバー2021-01-012021-12-310001000694US-GAAP:顧客集中度リスクメンバー米国-GAAP:SalesRevenueNetMembersNVAX:アメリカ政府のメンバー2020-01-012020-12-310001000694US-GAAP:顧客集中度リスクメンバーアメリカ公認会計基準:売掛金メンバーNVAX:アメリカ政府のメンバー2022-01-012022-12-310001000694US-GAAP:顧客集中度リスクメンバーNVAX:EpidemicPreparednessInnovation連盟メンバー米国-GAAP:SalesRevenueNetMembers2021-01-012021-12-310001000694US-GAAP:顧客集中度リスクメンバーNVAX:EpidemicPreparednessInnovation連盟メンバー米国-GAAP:SalesRevenueNetMembers2020-01-012020-12-310001000694US-GAAP:顧客集中度リスクメンバーNVAX:SKBioscienceCoLtd.メンバー米国-GAAP:SalesRevenueNetMembers2021-01-012021-12-310001000694アメリカ-GAAP:BuildingMembers2022-01-012022-12-310001000694SRT:最小メンバ数アメリカ-GAAP:機械とデバイスのメンバー2022-01-012022-12-310001000694アメリカ-GAAP:機械とデバイスのメンバーSRT:最大メンバ数2022-01-012022-12-310001000694US-GAAP:ComputerEquipmentMembers2022-01-012022-12-31NVAX:レポート単位00010006942021-10-012021-10-0100010006942022-10-012022-10-010001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ公認会計基準:非安全債務メンバー2022-01-012022-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2022-01-012022-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ公認会計基準:非安全債務メンバー2022-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2022-12-31NVAX:細分化市場0001000694NVAX:収益メンバー2022-12-310001000694NVAX:連合委員会接種と免疫JCVIメンバー2022-12-3100010006942022-10-012022-12-3100010006942023-01-012022-12-310001000694NVAX:GaviAdvancePurcheプロトコルSIIPLMember2022-12-31NVAX:用量0001000694NVAX:GaviAdvancePurche eAgreement COVAXFacilityMembers2022-11-180001000694NVAX:GaviAdvancePurcheプロトコルSIIPLMember2021-12-310001000694NVAX:GaviAdvancePurcheプロトコルSIIPLMember2022-03-310001000694SRT:北米メンバアメリカ-公認会計基準:製品メンバー2022-01-012022-12-310001000694SRT:ヨーロッパメンバアメリカ-公認会計基準:製品メンバー2022-01-012022-12-310001000694NVAX:RestOfTheWorldMemberアメリカ-公認会計基準:製品メンバー2022-01-012022-12-310001000694SRT:最小メンバ数NVAX:欧州委員会欧州委員会のメンバー2022-12-310001000694NVAX:欧州委員会欧州委員会のメンバーSRT:最大メンバ数2022-12-310001000694NVAX:欧州委員会欧州委員会のメンバー2022-12-310001000694NVAX:欧州委員会欧州委員会のメンバーアメリカ公認会計基準:副次的事件メンバー2023-01-012023-01-3100010006942020-10-220001000694SRT:最小メンバ数NVAX:AmendedAndRestatedUKSupplyAgreementメンバー2022-07-310001000694NVAX:AmendedAndRestatedUKSupplyAgreementメンバーSRT:最大メンバ数2022-07-310001000694NVAX:連合委員会接種と免疫JCVIメンバー2022-07-310001000694NVAX:AmendedAndRestatedUKSupplyAgreementメンバーSRT:最大メンバ数2022-11-300001000694アメリカ-公認会計基準:メンバーに授与NVAX:アメリカ政府の合意メンバー2022-01-012022-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:アメリカ政府の合意メンバー2021-01-012021-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:アメリカ政府の合意メンバー2020-01-012020-12-310001000694NVAX:USDepartmentOfDefenseDoDContractMemberアメリカ-公認会計基準:メンバーに授与2022-01-012022-12-310001000694NVAX:USDepartmentOfDefenseDoDContractMemberアメリカ-公認会計基準:メンバーに授与2021-01-012021-12-310001000694NVAX:USDepartmentOfDefenseDoDContractMemberアメリカ-公認会計基準:メンバーに授与2020-01-012020-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:EPidemicPreparednessInnovationsAwardMember2022-01-012022-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:EPidemicPreparednessInnovationsAwardMember2021-01-012021-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:EPidemicPreparednessInnovationsAwardMember2020-01-012020-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:他の収入付与メンバー2022-01-012022-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:他の収入付与メンバー2021-01-012021-12-310001000694アメリカ-公認会計基準:メンバーに授与NVAX:他の収入付与メンバー2020-01-012020-12-310001000694NVAX:アメリカ政府の合意メンバー2020-07-012020-07-310001000694NVAX:アメリカ政府の合意メンバー2022-07-310001000694アメリカ-公認会計基準:政府契約メンバーNVAX:アメリカ政府の合意メンバー2020-07-012020-07-310001000694NVAX:アメリカ政府の合意メンバー2020-07-310001000694アメリカ-公認会計基準:政府契約メンバーNVAX:アメリカ政府の合意メンバー2022-01-012022-12-310001000694アメリカ-公認会計基準:政府契約メンバーNVAX:DoD契約メンバー2020-06-012020-06-300001000694NVAX:DoD契約メンバー2020-06-012020-06-300001000694NVAX:DoD契約メンバー2022-07-310001000694NVAX:EPidemicPreparednessInnovationsCEPIAgreementメンバに対する連合2020-05-012020-05-310001000694NVAX:CEPIGrantFundingMember2022-01-012022-12-310001000694NVAX:CEPIGrantFundingMember2021-01-012021-12-310001000694NVAX:SalesBasedRoyaltiesMembers2022-01-012022-12-310001000694NVAX:SalesBasedRoyaltiesMembers2021-01-012021-12-310001000694NVAX:TakedaArrangementメンバー2022-01-012022-12-310001000694NVAX:TakedaArrangementメンバー2020-01-012020-12-310001000694NVAX:TakedaArrangementメンバー2021-09-300001000694NVAX:SKBioscienceAgreementメンバー2021-02-280001000694NVAX:設定プロトコルのメンバー2022-12-31Nvax:分割払い0001000694NVAX:設定プロトコルのメンバーアメリカ公認会計基準:負債メンバーを計算すべき2022-12-310001000694NVAX:設定プロトコルのメンバー2022-01-012022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:資産認可証券メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:資産認可証券メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:資産認可証券メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ-公認会計基準:会社債務証券メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:会社債務証券メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ-公認会計基準:会社債務証券メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:機関安全メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:機関安全メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:機関安全メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:機関安全メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:機関安全メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:機関安全メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001000694NVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2022-12-310001000694アメリカ-公認会計基準:公正価値入力レベル1メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値入力レベル2メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2021-12-310001000694アメリカ-公認会計基準:公正価値投入レベル3メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2021-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2021-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001000694NVAX:NovavaxCZFormerlyPrahaVaccinesASMember2020-05-270001000694SRT:最小メンバ数NVAX:NovavaxCZFormerlyPrahaVaccinesASMember2020-05-272020-05-270001000694SRT:最大メンバ数NVAX:NovavaxCZFormerlyPrahaVaccinesASMember2020-05-272020-05-270001000694NVAX:NovavaxCZFormerlyPrahaVaccinesASMember2020-01-012020-12-310001000694NVAX:CMOAndCMDAgreementメンバー2022-01-012022-12-310001000694NVAX:CMOAndCMDAgreementメンバー2021-01-012021-12-310001000694NVAX:A 700 QuinceOrchardRoadAgreementメンバー2020-01-012020-12-31Utr:SQFT0001000694NVAX:A 700 QuinceOrchardRoadAgreementメンバー2020-12-310001000694NVAX:A 700 QuinceOrchardRoadAgreementメンバー2022-12-310001000694NVAX:A 700 QuinceOrchardRoadAgreementメンバー2022-01-012022-12-310001000694NVAX:A 700 QuinceOrchardRoadAgreementメンバー2021-01-012021-12-310001000694NVAX:A 700 QuinceOrchardRoadAgreementメンバーSRT:シーン予測メンバ2023-01-012023-12-310001000694NVAX:FacilityLeaseAgreementメンバSRT:最小メンバ数2022-12-310001000694NVAX:FacilityLeaseAgreementメンバSRT:最大メンバ数2022-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2021-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ公認会計基準:非安全債務メンバー2021-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:債務ツール返済期間のメンバーアメリカ公認会計基準:非安全債務メンバー2022-12-012022-12-31NVAX:神様0001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ公認会計基準:非安全債務メンバーアメリカ公認会計基準:債務ツール返済期間の2人のメンバー2022-12-012022-12-310001000694NVAX:FivePointZeroConvertibleNotesDue 2027メンバーアメリカ-公認会計基準:債務ツール返済期間のメンバーアメリカ公認会計基準:非安全債務メンバー2022-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバーアメリカ公認会計基準:副次的事件メンバー2023-02-012023-02-010001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-01-012016-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-01-250001000694NVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-01-250001000694アメリカ公認会計基準:オプションメンバーを呼ぶNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-01-012016-12-310001000694アメリカ公認会計基準:オプションメンバーを呼ぶNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-01-250001000694NVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバー2016-01-012016-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:FivePointZeroConvertibleNotesDue 2027 MakeWholeFundamentalChangeMemberSRT:最大メンバ数2016-01-012016-12-310001000694アメリカ公認会計基準:非安全債務メンバーNVAX:ThreePointSventyFiveConvertibleNotesDue 2023メンバーSRT:最大メンバ数2016-01-012016-12-310001000694US-GAAP:PrivatePlacementMembers米国-GAAP:シリーズAPReferredStockMembers2020-06-300001000694US-GAAP:PrivatePlacementMembers米国-GAAP:シリーズAPReferredStockMembers2020-12-310001000694US-GAAP:PrivatePlacementMembers2020-12-3100010006942020-06-300001000694アメリカ公認会計基準:優先株メンバーと交換できるUS-GAAP:PrivatePlacementMembers2020-06-012020-06-300001000694アメリカ公認会計基準:優先株メンバーと交換できるUS-GAAP:PrivatePlacementMembers2020-12-310001000694US-GAAP:AdditionalPaidInCapitalMembers2020-10-012020-12-310001000694NVAX:PublicOfferingMember2022-12-012022-12-310001000694NVAX:引受業者メンバー2022-12-012022-12-310001000694NVAX:引受業者メンバー2022-12-310001000694NVAX:2021年6月販売契約メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-06-012021-06-300001000694NVAX:2021年6月販売契約メンバー2022-12-310001000694NVAX:2021年6月販売契約メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310001000694NVAX:2021年6月販売契約メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310001000694NVAX:2021年6月販売契約メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310001000694NVAX:2千15人の株式インセンティブ計画メンバー2022-12-310001000694NVAX:2千15人の株式インセンティブ計画メンバー2022-01-012022-12-310001000694NVAX:2千15人の株式インセンティブ計画メンバー2015-06-012015-06-300001000694NVAX:2千15人の株式インセンティブ計画メンバー2015-06-300001000694SRT:最小メンバ数NVAX:2千15人の株式インセンティブ計画メンバー2015-06-012015-06-300001000694NVAX:2千15人の株式インセンティブ計画メンバーSRT:最大メンバ数2015-06-012015-06-300001000694米国-GAAP:販売コストメンバー2022-01-012022-12-310001000694米国-GAAP:販売コストメンバー2021-01-012021-12-310001000694米国-GAAP:販売コストメンバー2020-01-012020-12-310001000694米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310001000694米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310001000694米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310001000694アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-12-310001000694アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-12-310001000694アメリカ-公認会計基準:一般と行政費用メンバー2020-01-012020-12-310001000694NVAX:2千15人の株式インセンティブ計画メンバー2021-12-310001000694NVAX:2千と5つの株式インセンティブ計画のメンバー2021-12-310001000694NVAX:2千と5つの株式インセンティブ計画のメンバー2022-01-012022-12-310001000694NVAX:2千と5つの株式インセンティブ計画のメンバー2022-12-310001000694米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001000694米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001000694米国-公認会計基準:従業員株式オプションメンバー2020-01-012020-12-310001000694SRT:最小メンバ数米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310001000694米国-公認会計基準:従業員株式オプションメンバーSRT:最大メンバ数2022-01-012022-12-310001000694SRT:最小メンバ数米国-公認会計基準:従業員株式オプションメンバー2021-01-012021-12-310001000694米国-公認会計基準:従業員株式オプションメンバーSRT:最大メンバ数2021-01-012021-12-310001000694SRT:最小メンバ数米国-公認会計基準:従業員株式オプションメンバー2020-01-012020-12-310001000694米国-公認会計基準:従業員株式オプションメンバーSRT:最大メンバ数2020-01-012020-12-310001000694米国-GAAP:制限株式単位RSUメンバー2021-12-310001000694米国-GAAP:制限株式単位RSUメンバー2022-01-012022-12-310001000694米国-GAAP:制限株式単位RSUメンバー2022-12-310001000694アメリカ公認会計基準:従業員ストックメンバー2022-01-012022-12-310001000694アメリカ公認会計基準:従業員ストックメンバー2022-12-310001000694SRT:最小メンバ数アメリカ公認会計基準:従業員ストックメンバー2022-01-012022-12-310001000694SRT:最大メンバ数アメリカ公認会計基準:従業員ストックメンバー2022-01-012022-12-310001000694SRT:最小メンバ数アメリカ公認会計基準:従業員ストックメンバー2021-01-012021-12-310001000694SRT:最大メンバ数アメリカ公認会計基準:従業員ストックメンバー2021-01-012021-12-310001000694SRT:最小メンバ数アメリカ公認会計基準:従業員ストックメンバー2020-01-012020-12-310001000694SRT:最大メンバ数アメリカ公認会計基準:従業員ストックメンバー2020-01-012020-12-310001000694アメリカ公認会計基準:従業員ストックメンバー2021-01-012021-12-310001000694アメリカ公認会計基準:従業員ストックメンバー2020-01-012020-12-310001000694NVAX:参加者の上位3%が遅延メンバー2022-01-012022-12-310001000694NVAX:次の参加者の割合遅延メンバー2022-01-012022-12-310001000694米国-GAAP:外国計画メンバーアメリカ-公認会計基準:年金計画定義の福祉メンバー2022-01-012022-12-310001000694米国-GAAP:外国計画メンバーアメリカ-公認会計基準:年金計画定義の福祉メンバー2021-01-012021-12-310001000694米国-GAAP:外国計画メンバーアメリカ-公認会計基準:年金計画定義の福祉メンバー2020-01-012020-12-310001000694アメリカ-公認会計基準:土地と土地改善メンバー2022-12-310001000694アメリカ-公認会計基準:土地と土地改善メンバー2021-12-310001000694アメリカ-GAAP:機械とデバイスのメンバー2022-12-310001000694アメリカ-GAAP:機械とデバイスのメンバー2021-12-310001000694アメリカ-公認会計基準:リース改善メンバー2022-12-310001000694アメリカ-公認会計基準:リース改善メンバー2021-12-310001000694NVAX:コンピュータソフトウェアとハードウェアメンバ2022-12-310001000694NVAX:コンピュータソフトウェアとハードウェアメンバ2021-12-310001000694アメリカ-アメリカ公認会計基準:建設中のメンバー2022-12-310001000694アメリカ-アメリカ公認会計基準:建設中のメンバー2021-12-310001000694国:CZ2022-12-310001000694国:CZ2021-12-310001000694米国-GAAP:国内/地域メンバー2022-12-310001000694アメリカ-公認会計基準:州と地方法律法規のメンバー2022-12-310001000694アメリカ-公認会計基準:外国人メンバー2022-12-310001000694アメリカ-公認会計基準:州と地方法律法規のメンバーNVAX:SubjectToExpirationMember2022-12-310001000694アメリカ-公認会計基準:州と地方法律法規のメンバーNVAX:未期限メンバー2022-12-310001000694アメリカ-公認会計基準:外国人メンバーNVAX:SubjectToExpirationMember2022-12-310001000694アメリカ-公認会計基準:外国人メンバーNVAX:未期限メンバー2022-12-310001000694アメリカ-公認会計基準:研究メンバー2022-12-3100010006942019-01-012019-12-3100010006942022-12-122022-12-12NVAX:被告00010006942021-08-232021-08-23 アメリカ証券取引委員会
ワシントンD.C.,20549
表10-K
| | | | | |
| ☒ | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2022
あるいは…。
| | | | | |
| ☐ | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
そこからの移行期間について。
依頼文書番号000-26770
Novavax,Inc.
(登録者の正確な氏名はその定款に記載)
| | | | | | | | | | | |
| デラウェア州 | | 22-2816046 |
| (法団として設立された国) | | (国際税務局雇用主身分証明書番号) |
| | |
|
| Firstfield路21号 | | |
| ゲザスバーグ | メリーランド州 | | 20878 |
| (主にオフィスアドレスを実行) | | (郵便番号) |
登録者の電話番号は市外局番を含んでいます(240)268-2000
同法第12条(B)に基づいて登録された証券:
| | | | | | | | |
| クラスごとのタイトル | 取引記号 | 登録された各取引所の名称 |
| 普通株は、1株当たり0.01ドルです | NVAX | ナスダック世界ベスト市場 |
同法第12(G)条により登録された証券:適用されない
登録者が証券法第405条に規定する有名な経験豊富な発行者である場合は、再選択マークで表示してくださいはい、そうです ☒ No ☐
登録者がこの法第13又は15(D)条に従って報告書を提出する必要がないか否かを、再選択マークで示す。はい。☐違います。 ☒
登録者が(1)過去12ヶ月以内(または登録者がそのような報告を提出する必要があるより短い期間)に1934年の証券取引法第13条または15(D)条に提出されたすべての報告書を再選択マークで示すかどうか、および(2)このような提出要求を過去90日以内に遵守してきたはい、そうです ☒ No ☐
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうです ☒ No ☐
S−K条例405項に従って開示された違反者が本明細書に含まれていないかどうかは、再選択マークで表され、登録者によれば、参照によって本明細書に組み込まれた第3の部分または当テーブル10−Kの任意の修正された最終委託書または情報宣言にも含まれない
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。(1つを選択):
| | | | | | | | | | | |
| 大型加速ファイルサーバ | ☒ | ファイルマネージャを加速する | ☐ |
| | | |
| 非加速ファイルサーバ | ☐ | 規模の小さい報告会社 | ☐ |
| | | |
| 新興成長型会社 | ☐ | | |
新興成長型会社である場合は、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13条(A)に規定されている任意の新たな又は改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる☒
証券が取引法第12条(B)に基づいて登録されている場合は、金融機関が金融機関であるか否かをチェックマークで示す
申告書類に含まれる登録者報告書は、以前に発表された財務諸表の誤り訂正を反映している
これらのエラーのより真ん中に登録者の任意の実行者が関連回復中に第240.10 D−1(B)条に従って受信されたインセンティブベースの補償に従って回復分析を行う必要があるかどうかを再選択マークで示す
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです☐ No ☒
登録者非関連会社が保有する投票権と無投票権普通株の総時価(登録者普通株が2022年6月30日にナスダック世界精選市場での最新報告販売価格に基づく)は約$である4,010,000,000.
2023年2月21日までに86,173,245登録者は普通株式の株式を発行した。
参考書類:2022年12月31日までの財政年度終了後120日以内に提出された登録者最終委託書のうち,登録者2023年株主総会に関する部分は,本年度報告のForm 10−K第3部に参考方式で組み込まれている。
Novavax,Inc.
カタログ
| | | | | | | | |
| | ページ |
| 第1部 | |
第1項。 | 商売人 | 4 |
第1 A項。 | リスク要因 | 30 |
項目1 B。 | 未解決従業員意見 | 68 |
第二項です。 | 特性 | 68 |
第三項です。 | 法律手続き | 68 |
第四項です。 | 炭鉱安全情報開示 | 70 |
| | |
| 第II部 | |
五番目です。 | 登録者普通株,関連株主事項及び発行者が株式証券を購入する市場 | 71 |
第六項です。 | 保留されている | 72 |
第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 72 |
第七A項。 | 市場リスクの定量的·定性的開示について | 85 |
第八項です。 | 財務諸表と補足データ | 85 |
第九項です。 | 会計·財務開示面の変化と会計士との相違 | 85 |
第9条。 | 制御とプログラム | 85 |
プロジェクト9 B。 | その他の情報 | 86 |
プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 86 |
| | |
| 第三部 | |
第10項。 | 役員·役員·会社管理 | 87 |
第十一項。 | 役員報酬 | 87 |
第十二項。 | ある実益所有者の担保所有権及び経営陣及び株主に関する事項 | 87 |
十三項。 | 特定の関係や関連取引、取締役の独立性 | 87 |
14項です。 | 主な会計費用とサービス | 87 |
| | |
| 第4部 | |
第十五項。 | 展示品と財務諸表の付表 | 88 |
第十六項。 | 表格10-Kの概要 | 95 |
いくつかの定義は
本年度報告書の“Novavax”、“会社”、“私たち”、“私たち”および“私たち”に対するすべての言及は、Novavax,Inc.およびその完全子会社を指す(文脈が別に説明されていない限り)。
商標に関する説明
Novavax、Nuvaxovid、Matrix−M、Matrix、Prepare、Resolve、およびResVaxは、Novavaxの商標である。本年度報告書に記載されている10−K表の他のいずれの商標も、その所有者の財産である。すべての権利を留保する。私たちは、これらの会社の私たちへの支援または賛助、またはこれらの会社のいずれかとの関係を示唆するために、他の会社の商号や商標を使用したり展示したりするつもりはありません。
前向き情報
このForm 10-K年次報告書はリスクと不確実性に関する前向きな陳述を含む。“リスク要因”の節および本年度報告10−K表の他の部分に記載されている要因のような多くの要因の影響により、我々の実際の結果は、これらの前向き陳述において予想される結果と大きく異なる可能性がある。なお、“経営陣の財務状況及び経営結果の検討及び分析”と題する一部の免責声明を参照されたい
私たちの業務に関するリスクの概要
我々の業務は多くのリスクの影響を受けており,これらのリスクは本10−K表年次報告の“リスク要因”という見出しでより包括的に検討されている。これらのリスクは以下のリスクを含むが、これらに限定されない
•私たちは赤字の歴史があり、未来の収益性も不確実だ。
•私たちは引き続き私たちの現在の運営レベルを維持し、候補ワクチンのさらなる開発に資金を提供するために多くの資金が必要だ。
•私たちのワクチン製品開発は新しい技術と急速に発展する技術に依存しているので、私たちの努力が成功するかどうかは確認できません。
•我々の新冠肺炎候補ワクチンNVX-CoV 2373の監督管理と商業上の成功はまだ確定していない。我々は、複数の司法管轄区域でNVX−CoV 2373の一時登録、条件付きマーケティング許可(CMA)、または緊急使用許可(EUA)を取得しているが、米国で完全な規制承認を得ることができない可能性がある。成功したワクチンをタイムリーに生産することもできます
•SARS-CoV-2ウイルス変種の出現と伝播性、及び二価ワクチンに対する需要は、市場のNVX-CoV 2373に対する受け入れ或いは販売に影響する可能性があり、著者らは新しい冠肺炎ワクチンバージョンを開発してある変種を防ぐ戦略は成功しないかもしれない。
•私たちはバイオテクノロジー会社で、製品の開発、製造、商業化の面で大きなリスクに直面している。
•著者らは第三者に依存していくつかの実験室テストと臨床試験を行って、そして私たちの大量のワクチンの製造と流通のため、私たちは製品の開発と供給の努力の中で遅延或いはいくつかの制御を失う可能性がある。
•私たちはNVX-CoV 2373の商業成功に非常に依存しており、私たちがいくつかの司法管轄区域でNVX-CoV 2373の一時登録、CMA、またはEUAを得ても、私たちの製品が他の市場で許可を得ても、私たちのワクチン製品は最初または永遠に利益を上げないかもしれない。
•新冠肺炎の大流行と関連する政府の公共衛生政策は引き続き変化し、これは新城疫-CoV 2373の商業成功の将来性に予測できない影響を与える可能性がある。
•私たちの多くの競争相手は明らかに多くの資源と経験を持っており、これは私たちと私たちの現在と未来のライセンス保有者のビジネス機会に否定的な影響を及ぼすかもしれない。
•新冠肺炎、インフルエンザと呼吸器合胞体ウイルスに対するワクチンの開発は激しい競争に直面しており、私たちが候補ワクチンに投入した大量の資源は永遠にリターンが見られないかもしれない。
•私たちはアメリカ食品医薬品局(FDA)のすべての許可や私たちの候補ワクチンを販売するために必要な外国の規制承認を得ることに成功できないかもしれない。
•私たちの製品は臨床試験でその主要な終点に到達できない可能性があり、これは私たちが全面的な規制承認に必要な臨床データを支持していないことを意味する。
•NVX-CoV 2373の制御経路は絶えず進化しており、予期せぬ或いは予見できない挑戦を招く可能性がある。
•我々はすでに,将来的に米国以外の地点でいくつかのNVX−CoV 2373の臨床試験を行う予定であり,FDAはこれらの地点での試験データを受け入れない可能性がある。
•その後、製品、製造業者、または施設に以前未知の問題が存在することが発見され、以前にある司法管轄区域で規制されていたワクチンを市場から引き下げることを含む制限を招く可能性がある。
•私たちの成功は私たちが私たちの技術の固有の性質を維持する能力があるかどうかにかかっている。
•もし私たちが私たちの業務開発計画を成功的に実行しなければ、私たちの業務は不利な影響を受けるかもしれない。
•我々の現在の現金状況とキャッシュフロー予測,および2023年の収入,米国政府からの資金,およびGaviの未解決仲裁に関する重大な不確実性を踏まえて,本年度報告書に含まれる財務諸表発表日から1年間経営を継続できるかどうかには大きな疑問がある。
•2027年に満期になった5.00%の転換優先無担保手形(“手形”)の返済には大量の現金が必要ですが、債務を返済するための十分なキャッシュフロー資源がないかもしれません。
•私たちの株価はずっと高度に変動し続けている可能性があるので、私たちの普通株の市場価格は予想以上に低いか不安定かもしれません。
•訴訟は私たちの運営結果と財政状況に実質的な悪影響を及ぼすかもしれない。
•私たちまたは私たちが依存している第三者は、新冠肺炎の大流行のような自然災害や人為的災害または突発的な公共衛生事件の悪影響を受ける可能性がある。
第1部
プロジェクト1.ビジネス
概要
Novavax,Inc.と我々の完全子会社は生物技術会社であり、深刻な伝染病を予防する革新的なワクチンを発見、開発と商業化することによって、全世界的に健康改善を促進する。著者らの独自の組換え技術プラットフォームは遺伝子工学の力と速度を利用して、高免疫原性ナノ粒子ワクチンを効率的に生産し、全世界の緊迫した健康需要を満たすことを目的としている
我々の候補ワクチンは,コンホメーションの正しい組換えタンパク質からなる遺伝子工学ナノ構造であり,自然病原体上のそれらを模倣している。この技術は免疫系が目的蛋白を認識し、広範な保護性抗体を産生することを可能にする。私たちのワクチン技術は差別化免疫反応を誘導する可能性があり、これは自然に発生する免疫や他のワクチン方法よりも有効である可能性があると信じている。私たちの候補ワクチンはまた、免疫反応を増強し、より高いレベルの機能性抗体を刺激し、細胞免疫反応を誘導するために、サポシンベースのMatrix−Mアジュバントを添加する。
我々はすでに開発し、新冠肺炎ワクチンNVX-CoV 2373(“Nuvaxovid”、“Covovax”、“Novavax新冠肺炎ワクチン、補佐”)を商業化し始めており、このワクチンは世界の多くの監督管理機関の承認、臨時承認、一時承認、条件付きマーケティング許可と緊急使用許可を得ており、主要シリーズおよび相同および異種増強適応として、インフルエンザ候補ワクチン、新冠-肺炎組み合わせ(CIC)候補ワクチン、および他の候補ワクチンを開発している。一価または二価製剤を含む新冠肺炎変異株を含む。新冠肺炎と季節性インフルエンザ以外に、私たちが注目している他の領域は呼吸器合胞体ウイルスとマラリアを含む。
私たちは1987年にデラウェア州の法律に基づいて登録された。私たちの主な執行事務所はメリーランド州ゲザスバーグFirstfield路21号にあります。郵便番号:20878、電話番号は(2402682000)。私たちの普通株はナスダック世界の精選市場に発売され、コードは“NVAX”
技術の概要
我々の組換えナノ粒子ワクチン技術は,我々の独自のMATRIX−Mアジュバントに加えて,広範囲な気道や他の新たに出現した感染症に対する候補ワクチンの開発と商業化に非常に適していると信じている。
組換えナノワクチン技術
病原性脅威が決定されると、抗原をコードする遺伝子配列は、その後のワクチン構築物の開発のために選択される。タンパク質の安定性を増強するために、または分解に対する抵抗力を提供するために、遺伝子配列を最適化することができる。この遺伝子構造はバキュロウイルスに挿入される果翅夜蛾(“SF-/BV”)昆虫細胞発現系は、タンパク質の効率的、大規模発現を最適化することを可能にした。SF/BV系は適切なフォールディングと修飾されたタンパク質を産生する--これはワクチン抗原として機能と保護免疫の鍵である可能性がある。タンパク質抗原が精製され、それらの天然提示形態と同様に構成されたポリソルベート系ナノ粒子コアの周りに組織される。これは、マトリックス-Mアジュバントと随時配合することができる高免疫原性ナノ粒子をもたらす。
MATRIX−Mアジュバント
私たちの独自のMATRIX-Mアジュバントは、私たちのプラットフォームにおける重要な差別化要素だった。このアジュバントは抗原提示細胞(APC)を刺激することによって注射部位に入り、局部リンパ節の抗原提示を増強し、強力、耐性が良く、持続的な治療効果を示した。これは逆にAPC,T細胞,B細胞集団,および形質細胞を活性化し,高親和性抗体の産生を促進する免疫増強反応である。この有効な作用機序は,必要な免疫反応を実現するために必要な低用量の抗原を可能にし,ワクチン供給や製造能力の増加に寄与していると考えられる。これらの免疫増強および用量節約能力は、アジュバントの高度に独特な特徴に寄与する。
我々は,我々のMATRIX−Mアジュバントを他の製造業者によって製造されたワクチン抗原と一緒に使用するビジネス機会を評価し続けた。MATRIX−Mアジュバントは、オックスフォード大学ジェンナー研究所によって作成されたマラリアワクチン候補薬R 21の第3段階試験を含む、いくつかのパートナーが率いるマラリアワクチン候補薬と組み合わせて評価されている。オックスフォード大学はすでにインド血清研究所有限会社(SIIPL)と協力してR 21の商業開発を行い、SIIPL R 21の許可証を授与した。我々は、R 21のMATRIX−Mアジュバント成分を製造してSIIPLに供給することを望んでおり、これは、我々のアジュバントにとって重要なビジネス機会であり、可能な許可を待つ。私たちは、主に旅行者と軍用ワクチン市場で、SIIPL製R 21を特定の国で販売·流通する商業権利を持っている。
著者らはまたアメリカ国立衛生研究院チームが指導した2つの第1段階ワクチン試験にMATRIX-Mアジュバントを提供し、重点的にエプスタイン-バルウイルスとマラリア伝播遮断である。
NVX-CoV 2373規制と許可
私たちはNVX-CoV 2373の規制承認を推進する上で実質的な進展を成し遂げた。私たちはすでに世界40以上の国と地域で許可を得ており、18歳以上の成人人口と12歳から17歳の青少年人口のうち、一次シリーズおよび相同および異種増強適応のために使用されている。今まで、私たちは成人と青少年人口の承認、臨時許可、臨時承認、CMAとEUAを得た。私たちは
我々が成人、青少年、幼い子供に異種強化ラベルを使用することを拡大し、支持的な政策提案を実現し、広範な市場参入を実現するために努力している。我々は引き続き各国政府、監督機関、非政府組織と密接に協力し、全世界の公平なわが新冠肺炎ワクチンの獲得を促進することに取り組んでいる。
私たちのワクチンが許可されている地域では、NVX-CoV 2373は、(I)Nuvaxovid(SARS-CoV-2 RS組換え、アジュバント)、(Ii)Covovax(SiIPLによる製造および商業化)、または(Iii)Novavax新冠肺炎ワクチン、アジュバントで販売されている。
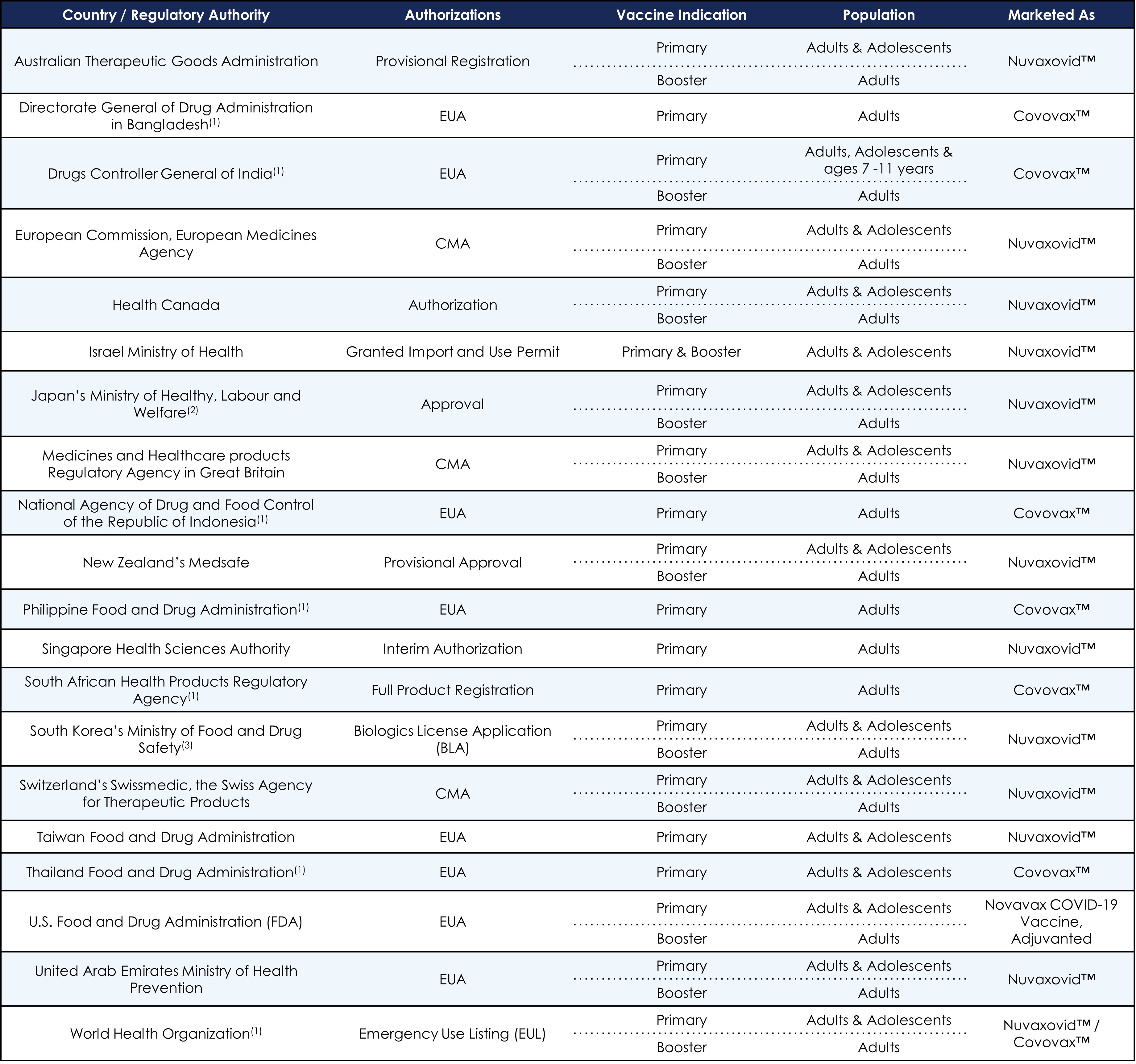
本年度報告書を提出した10-K表までのNVX-CoV 2373の規制権限の概要は以下のとおりである
(1)SIIPLとの連携による規制承認。
(2)パートナーの武田薬品工業株式会社(“武田”)が得た規制製造及びマーケティング承認。
(3)SK Bioscience,Co.(“SK Bioscience”)と協力して規制承認を得る。
以下では、2022年第4四半期および本書類の提出日までに受けた規制権限を重点的に紹介します。
2023年1月、我々のパートナーであるSK Bioscienceは、18歳以上の成人の増強剤のためのNuvaxovidの拡大製造およびマーケティング承認を韓国食品および薬物安全保障(KMFD)から取得した。
2022年12月、カナダ衛生部は12歳から17歳までの青少年の両剤の主要シリーズとして、Nuvaxovidが提出した新薬の補充を許可した。
2022年11月、世界保健機関(“WHO”)は、12歳から17歳の青少年の2剤の一次ワクチンとして、18歳以上の成人の増強剤として、ニューノワソヴィの最新EU Lを発表した。
また,2022年11月,カナダ衛生部はNuvaxovidの認可を拡大し,18歳以上の成人の相同増強剤とした。
同月、イギリスの薬品と保健品監督機関(“U.K”)18歳以上の成人において、拡大したニューカッスル病ウイルスはニューカッスル病ウイルス或いは遺伝子或いはアデノウイルスベクターの主要なシリーズ後の相同と異種強化用量とした。
2022年10月、米国FDAは、許可または承認された新冠肺炎ワクチンを使用して少なくとも6ヶ月間の一次接種を完了した後、獲得できないか、または臨床的に適用可能な18歳以上の成人に第1の強化ワクチンを提供することを許可し、18歳以上のNVX-CoV 2373接種を選択した成人は、そうでなければ、新冠肺炎ワクチンの強化用量を得ることができないからである。
私たちは主要市場で成人と青少年人口に対する初級と適応強化の追加規制提出を完了し、私たちは監督当局とそのいくつかの提出について積極的に検討している。私たちはまだ多くの国と地域で私たちのNVX-CoV 2373タグを拡張することに集中している。
2023年2月、私たちはいくつかの追加的な規制意見書を受け取った。12歳から17歳までの青少年の増強剤としてNVX−CoV 2373のEUAの拡大を求める申請を米国FDAに提出した。拡大EUAの申請は,米国で行われた第3段階予防−19試験小児科部門のデータ支持を得た。CMA拡大申請を欧州医薬品局(EMA)に提出し,12歳から17歳までの青少年を増強剤に入れた。我々は台湾食品薬品監督管理局に18歳以上の成人EUAの申請を提出した。私たちは12歳から17歳の青少年に全面的な血乳酸を提供し、18歳以上の成人に増強適応を提供することを要求する申請をシンガポール健康科学管理局に提出した。
予約プロトコル(“予約プロトコル”)
我々はすでにEUや世界各国と予約契約(“調達協定”を締結しており、本10−K表年次報告では“供給協定”とも呼ばれている)。APAに一般的に含まれる条項には、私たちの製造·流通ネットワークの建設と運営に関連する投資や、私たちのグローバル供給約束を支援する他の費用を支援するための前払いが含まれています。そのような前払いは一般的に私たちがいくつかの発展マイルストーンに到達した時に払い戻しできない。私たちは現在21億ドルの約束行動計画を持っていて、未来に交付される予定だ。
私たちは欧州共同体と“APA”を達成し、EUの各加盟国を代表して最低2000万剤、最大1億剤のNVX-CoV 2373の初期用量を提供し、ヨーロッパ共同体は2023年までに、1回以上に分けて1億剤、最大合計2億剤を追加購入することができる。2022年には、2022年第1四半期と第2四半期に予定されていた約700万剤の以前の約束を取り消し、注文を約6300万剤に削減するとの欧州委員会の通知を受けた。2023年1月には、2022年第1四半期と第2四半期に交付される予定だった改正行政手続法における残り2000万剤の約束線量の交付スケジュールが決定され、2023年に交付される予定である。
2022年7月、イギリス政府を代表する商業、エネルギー、工業戦略大臣(イギリス健康安全保障局に割り当てられた)と改正され、再署名されたSARS-CoV-2ワクチン供給協定(2022年9月26日に改正され、略称“改正と再署名されたイギリス供給協定”)が締結された
大ブリテンおよび北エルラン連合王国(“管理局”)は、双方が2020年10月22日に締結した“SARS-CoV-2ワクチン供給協定”(“元イギリス供給協定”)を改訂し、再記述した。最初のイギリス供給協定によると、管理局は6000万剤のNVX-CoV 2373を購入することに同意し、私たちにお金を前払いした。改訂·再署名されたイギリス供給協定の条項によると、管理局は、最低100万剤と最大1500万剤のNVX−CoV 2373(“条件付用量”)を購入することに同意し、条件付用量の数は、イギリス衛生大臣が承認したワクチン接種と免疫連合委員会(“JCVI”)の支持的提案を適時に完了し、私たちの数に応じて減少させることに依存する。(A)一般成人人口をイギリスSARS-CoV-2ワクチン強化接種活動の一部として使用する場合、または(B)一般青少年人口を連合王国SARS-CoV-2ワクチン強化接種活動の一部として使用する場合、またはSARS-CoV-2一次シリーズワクチン接種として使用する場合については、この提案は、連合王国メンバーが100万人未満の1つまたは複数の人口集団のみに関連するものではない。管理局が条件付用量を購入しない場合、またはそのような条件付き用量の数が1,500万剤NVX-CoV 2373未満に減少した場合、元のイギリス供給協定に従って管理局から受信した2.25億ドルの前払いに関連したお金を返済しなければならない。改訂と再署名されたイギリス供給協定によると、管理局はまた、2024年までに1回または複数回に分けて最大4400万剤を購入することを選択することができる。
JCVIは2022年11月30日現在、NVX−CoV 2373に対して支持的な提案を行っていないため、改正と再署名されたイギリス供給協定の条項によると、(I)条件付用量の数を1500万剤から750万剤に減少させ、条件付用量の減少は、2023年11月30日までにJCVIの支持性提案をタイムリーに実現することにかかっており、この提案は英国衛生大臣から上述したように承認されている。(Ii)吾らは以前に元のイギリス供給協定に基づいて管理局から受け取った前払い1.125億ドルを返済する責任があり、この金は吾等の総合貸借対照表に他の流動負債として反映され、残りの前払い残高1.125億ドルは今期繰延収入に反映される。
当社とGavi、ワクチン連盟(“Gavi”、“Gavi APA”)との間で2021年5月5日に署名されたAPA条項によると、2021年にGaviから3.5億ドルの前金を受け取り、2022年第1四半期に3.5億ドルの追加支払いを受けたのは、世界保健機関によるNVX−CoV 2373に対するEUL(“前払い金額”)が実現したからである。2022年11月18日、GaviがGavi APAの要求に応じて3.5億剤NVX-CoV 2373を調達できなかったため、Gaviに書面通知を出した。2022年11月18日現在,Gavi APAによると,約200万剤の注文しか受けていない。Gaviは2022年12月2日、Gaviがこの合意を否定したため、Gavi APAを深刻に違反したと主張するGavi APAの中止を主張する書面通知を発表した。GAVIはまた、Gavi APAが終了したと主張することに基づいて、Covax融資機構に参加する買い手の拘束力のある注文によってクレジット購入価格をクレジットする任意の金額を差し引く権利があると主張している。2022年12月31日現在、Gaviと余剰プリペイド金額の返金に関する紛争が解決される前に、残りのGavi前払い金額6.974億ドルは、繰延収入から私たちの総合貸借対照表の他の流動負債に再分類されている。2023年1月24日、ガヴィは上記の主張に基づいて国際仲裁裁判所に仲裁請求を提出した。私たちの返事の締め切りは2023年3月2日です。仲裁自体は不確実であり、Gaviから受信した残りの前払い金額を保留する権利があると考えられるが、Gaviの残りの前金金額の全部または一部の返金を要求する可能性もある。
製品ライン
(1)商標がNovavax新冠肺炎ワクチン、アジュバント;Covovax;およびNuvaxovidである選択された地域で許可される。
(2)第3段階菌株変化試験を行っている。
(3)R 21の3期試験を行っており,R 21はマラリア候補であり,オックスフォード大学ジェンナー研究所によって開発され,Matrix-Mアジュバントを用いて調製されている。
(4)第3段階試験により,先に構築された高齢者における臨床開発を行う。
パイプの概要
私たちの臨床パイプラインは、いくつかの治療領域にまたがる候補ワクチンを含み、私たちの新冠肺炎ワクチンNVX-CoV 2373を主導製品とし、このワクチンは承認され、一時的に承認され、一時的に承認され、CMAまたはEUAは、40以上の国と地域の成人および青少年の人々に適用される。著者らは2つの重要な3期臨床試験を通過し、原始新冠肺炎毒株と常用新冠肺炎変種に対する高効率を証明し、同時に良好な安全性を維持した。新冠肺炎に加えて、私たちの臨床製品ラインには季節性インフルエンザとCICワクチンが含まれており、またMATRIX-Mも提供されていますTMマラリア予防の研究に協力しています
我々は,従来NanoFluと呼ばれていた4価ナノインフルエンザワクチン(“qNIV”)候補ワクチンを開発しており,独立インフルエンザワクチンまたは併用ワクチンの有用性を示す2021年9月に発表された成功した第3段階研究により候補ワクチンを進めている。私たちはその後、さらなる開発のために私たちのqNIVを更新した。私たちはNVX-CoV 2373と私たちの更新されたqNIV方法を製剤に組み合わせた独立インフルエンザ候補ワクチンqNIVと私たちのCIC候補ワクチンの第2段階試験で引き続き進展した。2022年10月、著者らはCIC第1/2期臨床試験の陽性結果を発表し、CICワクチンが抗体と多機能CD 4+T細胞(免疫反応の調整を助けるリンパ球)の重症急性呼吸症候群コロナウイルス2(SARS-CoV-2)及び相同と異種インフルエンザ株に対する反応を産生できることを証明した。2022年12月、我々は、さらに独立して更新されたqNIV評価を含む第2段階CIC用量詳細化試験を開始した。
新冠肺炎や季節性インフルエンザに加えて,呼吸器合胞体ウイルス融合(F)タンパク質ナノ粒子候補ワクチンのための呼吸器合胞体ウイルス計画(“RSV Fワクチン”)の開発と,マラリアのためのMATRIX−Mアジュバント協力の継続に興味がある。我々のパートナーであるオックスフォード大学ジェンナー研究所は,候補マラリア患者R 21に対して,我々のMATRIX−Mアジュバントを用いて調製した3期試験を行っている。
世界的な規制許可の後、私たちはまだ免疫と青少年市場を強化して私たちのNVX-CoV 2373ワクチンラベルを拡大することに集中している。私たちは進行中の強化研究を通じてワクチンの有効性を評価し続けます
我々の新冠肺炎変異株は単価あるいは二価製剤の臨床試験と持続開発を含む。われわれはこれらの臨床知見を利用して,進行中の新冠肺炎計画において,われわれの新冠肺炎ワクチンが世界的により多くの監督管理部門の承認を得て,一次,強化と小児科適応に応用することを推進したい。
われわれの新冠肺炎、中国国際投資会社、インフルエンザ独立候補ワクチンは最近の優先順位であるが、パートナーが率いる候補マラリアワクチンは将来の発展に強力な機会を提供している。
かんじょうウイルス
NVX−CoV 2373臨床研究進展
NVX-CoV 2373はすでに多くの臨床試験を通過し、1つの3期一括一致性研究、2項目3期の肝心な治療効果試験、1項目3期オミック戎アシスト試験、1項目2 b期試験、1項目1/2期試験及びその他の多くの試験を含む。私たちは成人、青少年、子供の集団にわたる異種と相同増強を評価するために、私たちの臨床試験を拡大した。われわれの臨床開発計画により,5μgの組換えSpike蛋白と50μgのMatrix−Mアジュバントの投与量を決定した。我々は引き続きデータを収集し,2つの独立した第3段階研究において,安全状況が安心であり,高レベルの治療効果に関連する強力な細胞と体液免疫反応を誘導していることを示した。
ここで、NVX-CoV 2373の臨床試験状況を以下のように総括する
予防-19ステージ3アメリカとメキシコ
予防-19は、米国およびメキシコ119地点のNVX-CoV 2373の18歳以上の年齢の29,949人の参加者における有効性、安全性、および免疫原性を評価するためのランダム、プラセボ対照、観察者盲検法の第3段階試験である。試験では,NVX−CoV 2373の総有効率は90.4%であり,全体的な耐性は良好であり,2回目の接種後に強い抗体反応を引き起こした。2021年12月に試験の全結果が発表されましたニューイングランド医学雑誌それは.2021年12月、私たちはまた予防-19段階3促進研究を開始した。
2022年10月,ヨーロッパで開催された世界ワクチン大会では,18歳または18歳以上の成人および12歳から17歳の青少年の予防−19段階3増強データが公表され,NVX−CoV 2373があらかじめ指定された免疫学的終点に達していることが示された。
2022年10月のIDWeekでは,年齢(18~64歳,65歳)とスケジュールが免疫反応増強に及ぼす影響の評価を含むPrepect−19 Boost研究からの他のデータを示し,全年齢群で有意な増強作用を示した。増強用量は一般的に耐性が良好であり、大部分は軽度から中度の反応であり、持続時間は比較的に短い。
予防−19段階3小児科拡張
予防-19小児科拡張はランダム、プラセボ対照、観察者盲法研究であり、アメリカ73地点の2,247名の12~17歳の青少年におけるNVX-CoV 2373の安全性、有効性(免疫原性)と有効性を評価することを目的とし、重点的に参加者中の人種と民族代表のバランスを確保することである。参加者は候補ワクチンまたはプラセボの2回の注射をランダムに受け、21日間隔で行った。
2022年10月、ヨーロッパで開催された世界ワクチン大会で、著者らは予防-19段階3小児科拡張の相同増強データを公表し、その中で単回増強用量は通常耐性が良好であり、原型毒株およびオミック株BA.1、BA.2およびBA.5サブタイプに対して強力な免疫反応を誘導した。第三剤ワクチンにより、新冠肺炎はオミックなどの現代変異体の予防にメリットがあることを表明した。また,増強用量は一般的に耐性が良好であり,主に軽微から中等度の反応性であり,持続時間は短かった。
2022年4月、青少年試験参加者において予防-19段階3強化研究を開始し、活性ワクチン接種後少なくとも5ヶ月間の投与量を強化することを発表した。
2022年2月、私たちは私たちの第三段階予防-19若年小児科拡張の積極的な結果を発表した。結果:初歩的な治療効果の終点に達し、全体の有効率は80%、臨床有効率は82%であった
デルタ航空の変種に対するものです。すべての研究の変種に対して,青少年の免疫反応は成人の2~3倍である。NVX−CoV 2373耐性は良好であり,安全信号は認められなかった。
2 b/3期ハチドリ試験
2022年8月、著者らは6ケ月から11歳までの幼児における2剤のNVX-CoV 2373の安全性、有効性(免疫原性)と治療効果を評価するために、2 b/3期ハチドリの全世界臨床試験を開始し、シリーズワクチンの初回接種後6ケ月に強化接種を行った。この試験は年齢降格試験であり,乳児(6~23カ月),幼児(2~5歳),小児(6~11歳)のNVX−CoV 2373を評価するために年齢群順に試験される。登録は進行中で、2023年1月に2歳から5歳までのキューに拡大します。この実験はアメリカと他の国で3600人の参加者を募集することを求めている。
第3段階バッチ整合性研究
2022年10月,ヨーロッパで開催された世界ワクチン大会で,一括整合性データを提出した。この研究はその主要な終点に達し、3群のNVX-CoV 2373が18歳から49歳の成人で一致した免疫反応を誘導し、生産の一致性を証明した。NVX−CoV 2373の異種増強反応は、他の米国FDAによって承認された新冠肺炎ワクチンの一次ワクチンを受けた参加者において一致している。
第3段階U.K.
2022年2月、私たちはイギリスの肝心な段階試験からの拡張分析を発表し、6ヶ月の監視期間内にNVX-CoV 2373が高いレベルの治療効果を維持していることを示した。分析により、すべての新冠肺炎感染に対するワクチンの保護率は82.5%であり、有症状と無症状を含むことが分かった。これらのデータは臨床感染症イギリスの第3段階試験の最終分析をもとに発表されましたニューイングランド医学雑誌2021年6月、NVX-CoV 2373の強力な安全性と有効性データを強調し、89.7%のワクチン効力を示した。
南アフリカ2 b期
2022年5月南アフリカの第2段階実験の結果が発表されました柳の葉刀これは、2剤のNVX-CoV 2373のHIVキャリアおよび非HIVキャリアに対する安全性および免疫原性を強調する。南アフリカの2 b期試験はランダム、観察者盲、プラセボ対照の研究であり、4419名の参加者がいた。その結果,ベースラインSARS−CoV 2感染者ではHIV陰性参加者と比較して観察される抗体反応が低いため,接種シリーズで第3剤ワクチンを増加させる可能性がある代替投与法を検討する必要があることが分かった。
第2段階南アフリカ
2022年2月、我々は18~65歳のヒト免疫不全ウイルス(HIV)を携帯した成人におけるNVX-CoV 2373の安全性および免疫原性を評価する南アフリカ第2段階試験を開始した。南アフリカの第二段階試験はランダム、観察者盲、プラセボ対照の研究であり、360人のHIV感染者を募集して異なる用量方案を評価した。免疫障害成人の一次ワクチン接種スケジュールの延長をサポートするために、データが評価されている。
パートナーによるNVX−CoV 2373臨床開発
第2段階/第3段階インド
2023年1月、SIIPLとインド医学研究委員会2/3期試験の免疫原性と安全性結果が発表された柳の葉刀健康科学のプリプリントサーバでMedRxivそれは.このステップ2/3実験は
成人は小児科列のグループを含む。この試験は観察者の盲、ランダム、対照研究であり、920名の2歳から17歳の登録児童が参加し、そして良好な耐性と免疫原性を有することが発見された。
日本1/2期
2022年4月,武田は日本NVX−CoV 2373 1/2期臨床試験の予備データ分析を報告した。このプラセボ対照試験は、20歳以上の年齢200名の参加者において、NVX−CoV 2373の免疫原性と安全性を評価した。初歩的なデータ分析により、安全性の結果は受け入れられ、そして強力な免疫反応を誘導した。
1/2期強化研究−国家アレルギー·感染症研究所が率いる−
2022年3月、我々は、FDA完全承認またはEUAを得た新冠肺炎一次シリーズワクチンを受けた参加者における遅延異種または相同増強レジメンの安全性、反応性および免疫原性を評価するために、国家アレルギーおよび感染症研究所によって支援されている実施中の1/2段階試験への参加を発表した。参加者は、第3剤(12週間以上)のNVX-CoV 2373またはFDAが使用を許可した3つの新冠肺炎ワクチンのうちの1つを得るであろう。すべての結果は2023年に発表される予定だ。
第3段階アラブ首長国連邦
2022年3月、我々は、約1,000人の18歳以上の成人における単剤強化用量ニューカッスル病ウイルスコサッチウイルス2373の安全性および免疫原性を評価するために、アラブ首長国連邦で行われた第3段階研究に参加することを発表し、これらの人々は、国薬ホールディングスの新冠肺炎不活化ワクチンを接種した。この逐一比較のデータは2023年に発表される予定だ。
第2段階Com-COV 3ブースター試験−オックスフォード大学が先頭に立つ
はい。 2022年5月,我々の新冠肺炎ワクチンNVX−CoV 2373は研究中の2種類の新冠肺炎ワクチンの1つであり,12~15歳の青少年約380名のうち第3種の補強剤として研究されているオックスフォード大学のCom−CoV 3ワクチン第2段階試験への参加を発表した。
変異株を含む単価または2価ワクチンの開発
私たちのナノ粒子ワクチン技術は進化する感染症の脅威に迅速に対応するために作られた。新冠肺炎変種の出現に伴い、著者らは自発的にNVX-CoV 2373の変種毒株に対する保護能力を評価し、そして変種特異性単価或いは二価ワクチン構築の潜在需要を評価した。
2023年1月、私たちはアメリカFDAワクチン及び関連生物製品諮問委員会の会議に参加し、会議は一次シリーズの調整と用量ワクチン株の強化からなる投票を一致して採択した。会議では,前方ドリフト変異体に対する免疫反応を含む増強剤としてNVX−CoV 2373が広範な機能的免疫反応を誘導できるデータを共有した。私たちはFDAの菌株変化に関する指導に基づいて最新のワクチンを提供する予定だ。
新冠肺炎三期オミック変異株ワクチン
2022年11月、私たちは私たちの第3段階増強試験の背線結果を発表し、私たちのオミックBA 1候補ワクチンが主要な菌株変化の終点に達したことを示した。第三段階オミック戎アシスト試験の第二グループを進め、私たちの異なる戦略の一部として、秋の準備をしていく予定だ。試験の第2群は,われわれの試験の第1部分に基づいており,我々の単価プロトタイプ株ワクチンと比較して,オミックBA.5ワクチンを単価と2価で評価した。このようなデータは株の変化の規制の承認を支持するだろう。我々はこの研究の第2部を開始して,我々のプロトタイプワクチンとオミックBa.5ワクチン,およびプロトタイプとオミックBA.5ワクチンを含む二価ワクチンの比較を評価する予定である。
アメリカとオーストラリアの第二段階相同強化研究は様々な結果を含みます
2022年8月私たちの第2段階相同ブースター研究の探索的分析結果が発表されました柳葉刀感染症18歳から84歳の健常成人1,282名にNVX−CoV 2373単剤増強剤を使用した場合を評価することを目的としたランダム研究である。全体的には,初回治療後約6カ月の単回補強用量のNVX−CoV 2373
一連のワクチンは原型毒株とすべての評価変異株の体液抗体の著しい増加を誘導し、アルファ、デルタとオミック(BA.1とBA.2)を含む。
さらに、第4剤NVX−CoV 2373相同増強剤からの免疫原性データは、手紙の形態で発表されている“ニューイングランド医学雑誌”2023年1月。第4剤NVX−CoV 2373は反応性を増加させることなく免疫原性を増強することが示唆された。抗原図の作成により、第四剤NVX-CoV 2373ワクチン接種後、現代SARS-CoV-2変種に対して広範な反応があり、これは評価された変種に対してワクチン成分を更新する必要がない可能性があることを示した。より多くのデータが発表される予定だ。
新冠肺炎ワクチン基金
我々は、従来ねじれ速度行動と呼ばれていたパートナー関係から18億ドルを含む米国民衆向けNVX-CoV 2373の開発を支援するために、米国政府から重要な資金を得ている。2020年7月,先進技術国際会社(“ATI”)とプロジェクト協定(“プロジェクト協定”)を締結し,ATIは医療CBRN防衛財団を代表してパートナー関係について行動する財団管理会社である。この協力はアメリカ衛生と公衆サービス部とアメリカ国防省の構成部分の一つであり、新冠肺炎ワクチン、治療法と診断技術の開発、製造と流通を加速することを目的としている。このプロジェクト協定は,我々が2020年6月にATIと締結した基礎協定(“基礎合意”,プロジェクト合意,“米国政府合意”)に関連している。最初のUSGプロトコルは、NVX-CoV 2373の安全性と有効性を決定し、アメリカ政府に1億剤候補ワクチンを製造と交付するために、いくつかの臨床、監督とその他の活動を行うことを要求した。USGプロトコルによると、様々な開発、臨床試験、製造、規制、その他の活動に資金を支払う。USGプロトコルは、資金調達されたプロジェクトがリソース支出に比例しない有益な結果を生じないように米国政府に付与する条項と、米国政府の利益に適合する権利を終了するために基礎プロトコルまたはプロジェクト合意を終了する条項とを含む、米国政府のこのような合意に慣用された条項および条件を含む。もしプロジェクトの合意が完了する前に終了すれば, 私たちは、終了前に完了した仕事と発生した費用または義務の報酬を得る権利があり、“アメリカ政府合意”の条項と一致する。2022年7月、我々はUSG協定を修正し、(I)米国政府に約300万剤のNVX-CoV 2373を初めて交付し、(Ii)最初のUSG合意(最初の約300万剤を含む)に基づいて、米国政府の需要、菌株選択に関するFDAの指導、このような用量の価格について双方が合意した合意および利用可能な資金を規定し、合計1億剤のNVX-CoV 2373を米国政府に追加製造および交付した。最初の300万剤ワクチンは2022年7月に交付された。2023年2月、USGプロトコルを修正し、米国政府に最大150万剤のNVX-CoV 2373を追加交付することを規定したこのような合意の条項を修正した。“プロジェクト協定”に規定されている履行期間は2023年までであり、臨床試験活動を含むが、アメリカ政府の早期終了または双方の同意を経て延長しなければならない。
USG協定によると、私たちは最初にNVX-CoV 2373の開発および候補ワクチンの製造と米国政府への送達に関連するいくつかの活動を支援するために、17.5億ドルまでの資金を得る権利がある。その後の修正では、USGプロトコルが修正され、契約資金および上限を18億ドルに増加させ、USGプロトコルを支援するために18億ドルまでの債務を支出または発生させることができる。
我々が防疫革新連盟(“CEPI”)と達成した融資合意では、CEPIはNVX-CoV 2373の開発を支援するために、3.995億ドルまでの資金を提供することに同意し、その中で2.57億ドルまでのCEPI贈与資金と1.425億ドルに達するCEPIは融資資金を免除することができ、これらの融資は一定の製造活動を前払いするための形式であり、制限または金融契約の制約を受けない。CEPIによって援助された代行組織(“CMO”)ネットワークによって生産されたNVX−CoV 2373が1つまたは複数の第三者に販売され(終了前に我々のGAVI APAによる任意の販売を含むが、これらに限定されない)、そのような販売が、このようなワクチンの製造コストをカバーする場合にのみ、CEPIは、融資基金の下で受信された支払いを免除することができる。今のところローンの返済時間と金額は確定されていません。
以下は我々の歴史上の新冠肺炎融資発展の概要と現状である
| | | | | | | | |
| 資金協力パートナー | 金額 | その他の詳細情報 |
| CEPI | 3億995億ドル | •NVX-CoV 2373の開発を支援するために最高3億995億ドルの資金を得る権利がある •Covax工場によるNVX−CoV 2373の供給 |
| アメリカ国防総省(“国防総省”) | 4,570万ドル | •NVX-CoV 2373の開発を支援するために最高4570万ドルの資金を得る権利がある •1000万人ものNVX-CoV 2373を製造しアメリカ政府に配布しました •契約期間は2022年12月に終了します |
| “アメリカ政府はUSG協定を採択した” | 18億ドル | •NVX-CoV 2373の開発に18億ドルを支出 •NVX-CoV 2373を製造しアメリカ政府に配布しました |
季節性インフルエンザ
インフルエンザ計画(高齢者)
インフルエンザは世界範囲の伝染病であり、深刻な疾病は通常児童と老人などのもっと感じやすい人群に発生するが、普通の人群にも発生する。2022年富商業洞察研究報告によるインフルエンザワクチンの予測によると、季節性インフルエンザワクチンの市場は2022年の約75.4億ドルから2029年の約135.8億ドルに増加すると予想される。
2022年10月にヨーロッパで開催された世界ワクチン大会で,我々は第3段階独立qNIV候補の鍵となる発見を検討し,以前はNanoFluと呼ばれ,その主要な免疫原性終点を満たしていた。これらの結果の最終分析は2021年9月に発表されました柳葉刀感染症それは.その結果、インフルエンザワクチン中の4株のインフルエンザウイルス株と比較して、福来区の四価ワクチンの免疫原性は弱くなく、同時に相同株の野生型凝固抑制抗体反応(22-66%増加)と6株の異種A/H 3 N 2株(34-46%増加)に対しても増強した血液凝固抑制抗体反応を示すことが分かった。また,QNIVはA(H 3 N 2)やB/ビクトリア株に対する多機能抗原特異的T細胞への有効な誘導を示し,福来区四価ワクチンと比較して接種後の各種細胞を介した免疫マーカーが126%−189%増加した。
連合ワクチン
私たちのインフルエンザ計画チームはまだ混合ワクチン候補を推進することに集中している。インフルエンザ計画、NVX-CoV 2373と著者らのRSV計画の発展に伴い、感やすい人々をこれらの疾病から保護するための連合呼吸器ワクチンを開発する十分な理由がある。
コサッチウイルス/インフルエンザ併用ワクチン
新冠肺炎-インフルエンザ連合ワクチン二期臨床試験
2022年12月、私たちは独立して更新されたqNIV候補ワクチンの研究武器を含むCICの第2段階試験を開始した。用量確認試験は2つに分けて行い,オーストラリアとニュージーランドで50歳から80歳までの成人約2300名を募集することを求めた。この試験はランダムであり、観察者は盲目であり、主要かつ副次的な研究目標はCICとインフルエンザ候補ワクチンの各種調合の安全性、耐性と免疫反応を評価することである。2023年1月まで、私たちは1500人の参加者の登録を完了した。初歩的な結果は2023年に、データはインフルエンザ独立試験とCIC候補症例の第二部分試験と未来の臨床開発に情報を提供する予定である。
新冠肺炎-インフルエンザ連合ワクチン1/2期臨床試験
2022年10月,ヨーロッパで開催された世界ワクチン大会では,NVX−CoV 2373と我々の最新のqNIV候補薬を組み合わせた1/2期CIC試験のより多くの積極的な結果が発表された。その結果、CICは抗体と多機能なCD 4+T細胞(免疫の協調を助けるリンパ球を含む免疫反応を産生する能力があることが分かった
反応)変化中のSARS-CoV-2ウイルスおよび相同および異種インフルエンザ株に対する反応。CICワクチンの耐性は良好で、安全性と耐性は試験中の独立NVX-CoV 2373原型ワクチンと四価インフルエンザワクチン候補参考調合と一致した。
呼吸器合胞体ウイルス(RSV)
現在、承認されていないRSVワクチンは全世界で毎年発生する約6400万RSV感染と16万人の死亡に対抗するために使用できる。高齢者(60歳以上)は呼吸器合胞体ウイルス病のリスクが増加し,一部の原因は免疫老化であり,これはヒト免疫系における年齢関連の低下である。呼吸器合胞体ウイルス感染はまた基礎併存疾患の悪化、例えば慢性閉塞性肺疾患、喘息とうっ血性心不全を招く可能性がある。
RSV計画(高齢者)
これまでの二期臨床試験の臨床開発により,高齢者に対するRSV計画にはリン酸アルミニウムや我々独自のMatrix−Mの使用が示唆されたTMアジュバントは、アジュバントのないRSV Fワクチンと比較して、免疫反応の幅、持続時間、および品質を増加させる。高齢者のために更新されたRSVワクチンの臨床前開発機会を評価し続けた。
マラリア
マラリアは生命を脅かす病気で寄生虫によって引き起こされますこの寄生虫は蚊に感染してヒトに伝播しますWHO“2022年世界マラリア報告”によると,2021年には世界で2.47億人のマラリア症例が推定され,61.9万人が死亡した。マラリアはR 21候補ワクチンによって予防される可能性があると信じていますこの候補ワクチンはいくつかのパートナーリーダーの試験によって開発されていますMatrix-M製剤を使ってTMアジュバントです
R 21-マラリアワクチン
R 21はオックスフォード大学ジェンナー研究所が作成したマラリア候補ワクチンであり、Matrix-M製剤を使用しています™アジュバントです。オックスフォード大学はSIIPLにR 21のライセンスを授与した。SIIPLは,許可が得られれば,許可を得た後,毎年少なくとも2億剤R 21を生産することを約束した。また,SIIPLはMatrix-Mを用いる権利がある™疾患が流行している地域ではR 21アジュバントが使用され,ワクチンの市販に応じて特許使用料が支払われる。私たちは、主に旅行者と軍用ワクチン市場で、SIIPL製R 21を特定の国で販売および流通する商業権利を持つだろう。
R 21臨床開発
我々のパートナーであるオックスフォード大学ジェンナー研究所はR 21の第3段階試験を行っており,R 21を評価している。R 21はマラリア候補であり,我々のMATRIX−Mアジュバントを用いて調製されている。2022年9月に行われている1/2 b段階研究の積極的な結果が発表された柳葉刀感染症ブルキナノロでは,5~17歳の小児における強化ワクチン接種後12カ月の安全性,免疫原性,治療効果の結果が報告されている。合計409名の小児が最初の三剤療法後1年にわれわれのMATRIX−Mアジュバントから調製した増強用量のR 21を受け,初回と複数回の臨床マラリアに対して効率を維持し,25μgのMATRIX−Mアジュバントを用いた場合71%の有効率を示し,50μgのMATRIX−Mアジュバントを用いた場合80%の有効率を示した。この試験は引き続き2年間行い、参加者の長期フォローアップ状況を評価し、ワクチン接種の価値を更に強化する。
許可と協力
我々は世界規模で協力し、新冠肺炎の大流行を終わらせるために努力しており、これは上海国際平和研究所との協力に現れ、インドと低所得国と中所得国に新冠ウイルス2373を供給している。日本の武田や韓国のSK Bioscienceとも協力して、私たちの製造と供給能力を拡大しました。
| | | | | | | | |
インド血清研究所個人有限会社 | Covovax™ | •インドは •Covax施設 •フィリピン •インドネシア •南アフリカ •バングラデシュ |
武田薬品株式会社 | ヌワクソヴィ™ | •日本です •韓国 |
SK生物科学有限会社です。 | ヌワクソヴィ™ | •韓国(1) |
(1)SK Bioscienceはタイやベトナムでも非独占的な許可を持っている.
我々の許可と協調プロトコルの概要は以下のとおりである
SIIPL
我々は以前、NVX-CoV 2373の開発、共同処方、充填および整理、登録、商業化のために、供給および許可プロトコルに従ってSIIPLに独占的および非独占的許可を付与した。SIIPLはMatrix-Mを購入することに同意しましたTMまた,SIIPLに非独占ライセンスを付与し,SIIPLの許可領域でNVX−CoV 2373の抗原薬物物質成分の生産を許可し,NVX−CoV 2373の生産にのみ用いた。SIIPLがその許可地域でNVX-CoV 2373を販売する収入を平均的に割り当て,プロトコルコストを差し引いた.我々は、SIIPL(I)の合意期間中のインドにおける独占許可、および(Ii)非独占許可(A)“大流行期間”(世界保健機関が発表した)期間において、世界銀行によって中高所得国または高所得国に指定されているすべての国を除くすべての国に、これらの国に対する権利を保持し、(B)大流行期間後には、世界銀行によって低所得国または中所得国に指定されているのみである。大流行期間の後、私たちはSIIPLに、NVX-CoV 2373をこれらの低所得国および中所得国の第三者に許可する善意の機会があることを通知するかもしれません。SIIPLは、このような第三者条項を一致または改善する機会があり、そうでなければ、SIIPLの許可から1つまたは複数の非排他的国家を除去する権利があります。また、私たちは、ある地域での商業化と販売のためのNVX-CoV 2373を供給し、思愛普楽と契約開発製造契約に基づいて、思愛普楽と私たちが提供した抗原薬物物質とMatrix-Mアジュバントを用いて製造し、完成したワクチン製品を供給するために、思愛普楽と血清生命科学有限会社と供給契約を締結した。2022年5月と8月、私たちはSIIPLとの許可と供給スケジュールを拡大し、SIIPLがオミクヨン亜型を含む新しい冠肺炎変異に対するワクチン、私たちの四価インフルエンザ候補ワクチン、および私たちのCIC候補ワクチンを含む、新しい冠肺炎変異のためのワクチンを生産し、商業化することができるようにした, 4価インフルエンザワクチンとCICワクチンが供給されています2020年3月,我々は我々が提供したMATRIX−Mアジュバントを用いた非独占的許可をSIIPLに付与し,オックスフォード大学ジェンナー研究所が開発したマラリア候補薬R 21の開発,製造,商業化を行った。
武田さん
武田と協力·許可協定があり、この協定に基づき、武田に日本でのNVX−CoV 2373の開発·製造·商業化の独占ライセンスを付与した。協定によれば、武田は用量のNVX-CoV 2373を生産するためにMATRIX-Mアジュバントを購入してくれ、いくつかの開発および商業マイルストーンの実現に従って武田から支払いを受け、NVX-CoV 2373の一部の純利益を販売する権利がある。2021年9月、武田は日本厚生労働省(MHLW)政府と1.5億剤NVX−CoV 2373を購入する合意を決定した。厚生労働省は2023年2月、武田との合意に基づいて残りの線量を廃止した。したがって、現在の協力·許可協定の条項や条件によると、武田の将来の支払いを受けるかどうかは定かではない。
SK生物科学
私たちはSK BioscienceとNVX-CoV 2373を製造し商業化し、韓国、タイ、ベトナム政府に販売するための協力と許可協定に署名した。SK Bioscienceが支払う特許使用料は中2桁以下の範囲内である。また,SK Bioscienceとは,Covax施設で流通された製品を含むNVX−CoV 2373の抗原成分をCovax施設で流通させる製品を含むNVX−CoV 2373の抗原成分をCovax施設で流通させる製品を含むNVX−CoV 2373の抗原成分を製造供給する予定であり,ワクチンを参加国に公平に分配し分配するための施設の構築が行われている
経済です。2022年7月、SK Bioscienceと追加の協定を結び、SK Bioscienceがオミック変異を含む新しい冠肺炎変異に対する医薬物質を生産することができるように、我々の独自の新冠肺炎変異抗原材料を譲渡した。SK生物科学社と合意しましたSK生物科学社は私たちの新冠肺炎ワクチンを予め装着された注射器に装着して提供してくれました
製造と供給
著者らは深刻な伝染病を予防する革新的なワクチンの発見、開発、商業化に取り組んでおり、我々の全世界戦略パートナー関係を直接かつ利用し、CICワクチンを含む多種の候補混合ワクチンを探索している。2021年と2020年には、NVX-CoV 2373の商業化を支援するために、グローバル·サプライチェーンとグローバルパートナー関係を構築しました。2022年には、供給の契約義務およびNVX-CoV 2373に対する予想される需要に適合するように、私たちの製造需要と世界的な製造足跡を修正し、評価し続けます。
私たちの主な製造と供給スケジュールの概要は以下の通りです
行列-MTMアジュバント
我々はスウェーデンウプサラのNovavax AB工場で独自のサポシン系Matrix−Mアジュバントを生産している。AGC Biologicsやポリペプチドグループと契約製造スケジュールを締結し,契約開発と製造サービスを提供し,Matrix−Mアジュバントを大規模に生産するサービスを提供してくれた。
ニューカッスル病ウイルスCoV 2373の抗原成分
我々はチェコ共和国のNovavax CZ工場でNVX−CoV 2373の抗原成分を生産した
著者らはSIIPLとSIIPLの付属会社SLSと供給契約を締結し、NVX-CoV 2373の抗原成分を生産し、そして共同で完成品ワクチン製品を調合、充填と完成した。2022年5月と8月、私たちはSIIPLとの許可と供給スケジュールを拡大し、私たち独自の新冠肺炎候補変種抗原、四価インフルエンザ候補ワクチン、およびCIC候補ワクチンを含み、これによりSIIPLはオミック亜型ワクチン、四価インフルエンザワクチンおよびCICワクチンを含む新冠肺炎変異に対するワクチンを生産し、商業化することができ、このようなワクチンを供給することができる。
また,SK Bioscienceと製造供給スケジュールがあり,この手配によりSK BioscienceはNVX−CoV 2373の抗原成分を全世界の最終薬物製品に供給している。2022年7月、SK Bioscienceと追加の協定を結び、SK Bioscienceがオミック変異を含む新しい冠肺炎変異に対する医薬物質を生産することができるように、我々の独自の新冠肺炎変異抗原材料を譲渡した。
我々はNVX−CoV 2373の長期商業生産プロトコルによりFujifilm DiSynth BioTechnologiesとパートナーシップを構築し,このプロトコルによりFujifilm DiSynth BioTechnologiesはそのイギリスビリンアム工場でNVX−CoV 2373の抗原成分を生産した。
カナダ国家研究委員会(“NRCC”)とNRCCの生物製剤製造センターでNVX−CoV 2373生産の技術移転を行う予定である。この工場は現在工事運転を行っており,完成するとプロセス性能鑑定や大規模GMP生産を開始することができる。
完成したNVX-CoV 2373
セノフェイとセノフィとのワクチン完成品の共同調製、充填、および完成品の供給協定に加え、サイロスと契約開発製造協定を締結し、この協定によると、サイロスは私たちが提供した抗原薬物物質とMATRIX-Mアジュバントを用いて完成したワクチン製品を製造し、供給する。我々は現在,SIIPLとSLSに完全に依存して共同処方,充填,整理NVX−CoV 2373を行っている。SK生物科学社と合意しましたSK生物科学社は私たちの新冠肺炎ワクチンを予め装着された注射器に装着して提供してくれました
新冠肺炎、インフルエンザ、呼吸器合胞体ウイルスの競争
ワクチン市場の競争は激しく、その特徴は技術進歩が迅速であることである。我々の技術は,昆虫細胞中のバキュロウイルス発現系を利用した組換えワクチンの製造に基づいている。われわれのMATRIX−Mアジュバントは,抗原提示細胞を刺激して注射部位に入り,局所リンパ節の抗原提示を増強し,免疫反応を増強することにより,有効かつ耐性良好な効果を示した。我々のMATRIX−Mアジュバントを用いて調製したナノ粒子を用いて調製したバキュロウイルス発現システムは,他の同種の最適なワクチンを創出する技術と比較して,用量節約効果や冷蔵庫温度保存を実現するなど,多くの利点を有しており,新冠肺炎,インフルエンザおよび呼吸器合胞体ウイルスワクチンおよび多様な他の感染症に対するワクチンの開発に非常に適していると信じている。
いくつかのワクチンメーカー、研究機関、その他の組織は新冠肺炎を引き起こすSARS-CoV-2ウイルスに対するワクチンを開発している。現在、核酸(RNA/DNA)、ウイルスベクター、弱毒生ワクチン、タンパク質ベースのワクチンを含む様々な異なるワクチン技術が研究されている。発表されたコロナウイルスワクチンによる追跡によると“ニューヨークタイムズ”2022年8月31日までに更新され、33種類のワクチンが有限或いはすべての使用が許可され、123種類のワクチンが臨床試験中である。ノワックスは米国食品医薬品局のEUAとEU EMAのCMAを獲得した最初のタンパク質基新冠肺炎ワクチンである。2023年2月現在、ノワールはアメリカ食品と薬物管理局EUAの新冠肺炎ワクチンを獲得した4つのメーカーの一つであり、他のメーカーはファイザー、Modernaとジョンソンである。2023年2月までに、ファイザーとModernaの単価新冠肺炎ワクチンはすでにアメリカ食品と薬物管理局のBLAの許可を得て、その二価新冠肺炎ワクチンはすでにアメリカでFDAのEU許可を得た。ノワールとジョンソンの単価ワクチンはすでに米国で米国食品医薬品局のEUAを獲得している。NVX-CoV 2373の原始と変異株に対する高度な有効性及び臨床試験(イギリスとアメリカの2つの重要な3期試験を含む)が示した良好な耐性に基づいて、著者らの候補ワクチンは引き続きこの全世界の公衆衛生危機の解決に重要な役割を果たすと信じている。
一部の会社では、従来の(卵ベース)ワクチン技術と、新しいワクチン技術(細胞ベース)も使用されている季節性インフルエンザワクチンを販売している。現在、多くの季節性インフルエンザワクチンが承認され、販売されており、その大部分はセノフィ、グラクソ·スミスクライン、セチルスなどの大手製薬会社によって販売されている。季節性インフルエンザワクチンの販売競争は非常に激しい。米国の高齢者では,疾患予防コントロールセンターはセノフィ製Fluzone−HDとFlublok,Seqirus製Fluadを優先的に推奨している。そのため、新しい開発と承認された製品は既存のワクチンと区別しなければならず、商業成功を得ることができる。季節性インフルエンザ市場で差別化を示すために、製品は、比較可能または改善可能な耐性プロファイルを依然として示しながら、より効率的および/またはより安価かつ迅速な製造を必要とする可能性がある。我々の多くの競争相手は、新製品および新世代の既存製品を開発しており、その中のいくつかは、製品の免疫原性を増加させるためのアジュバントを添加することによって開発されており、各製品は、現在の市場の製品よりも効率的であることが意図されている。いくつかのライバルは既存の発売ワクチンとは異なる技術を用いて季節性インフルエンザワクチンを開発しており,その中で最も注目されているのはセノフィ,Moderna,ファイザーなどのメッセンジャーリボ核酸である。競争が激しく、技術が進歩しているにもかかわらず、私たちが完成した第3段階と第1/2段階の試験結果に基づいて、私たちのインフルエンザ計画--アジュバント付きナノ季節性インフルエンザ製品は、現在の製品や競争相手が開発している製品と同じように有効で、さらにはより効果的である可能性があると信じている。
また、私たちのプラットフォームはインフルエンザと新冠肺炎のようなワクチンを組み合わせるのに非常に適していると思います。我々の1/2段階試験結果によると,我々は現在,50歳から80歳までの成人における異なる配合の安全性と有効性(免疫原性)を評価するために,我々のCICとインフルエンザ独立候補ワクチンの第2段階試験を行っている。他メーカーで最も有名なのはModernaとファイザーであり,新冠肺炎−インフルエンザ候補薬の1/2期と1期臨床試験が行われている。
現在、世界ではRSVワクチンの販売が許可されていない;しかし、いくつかのワクチンメーカー、学術機関、その他の組織は現在、このようなワクチンを開発する計画をすでにあるいはすでに持っている。これらの組織は、ウイルスベクター、核酸(“RNA/DNA”)、弱毒生キメラ、抗原またはモノクロナル抗体(“Mab”)および競合的組換え技術を含む、様々な技術プラットフォームを用いてRSVによる疾患を予防する製品を開発している。我々の最新のRSV Fワクチン候補ワクチンは、我々の競争相手が開発している他のRSV候補ワクチンや他の製品と同様に有効である可能性がある組換えFタンパク質ナノ粒子であると信じている。このとき,後期臨床試験にある候補ワクチンを持つ複数の会社や他の組織がある。高齢者の中で、グラクソ·スミスクライン、ファイザー、Modernaはすでに彼らの第3段階研究のデータを発表し、グラクソ·スミスクラインとファイザーはアメリカ食品·薬物管理局への監督報告を完了し、処方薬使用料法案は2023年5月に発効し、Moderna計画監督報告書は2023年上半期にアメリカ食品·薬物管理局に提出される。ヤンソンとバイエルン北欧人は現在
第三段階試験。乳児では,ファイザーは第3段階のデータを発表し,母体免疫によりFDAへの候補ワクチンの規制提出を完了し,PDUFA日は2023年8月であった。また,乳児では,アスリコン/セノフィが協力したモノクロナル抗体がヨーロッパで承認され,2023年第3四半期に米国FDAでPDUFAを獲得した日,メルクのモノクロナル抗体は第3段階試験にあった。
全体的に、薬品間の競争はある程度製品の有効性、安全性、信頼性、可用性、価格と特許地位に基づいている。一つの重要な要素は私たちの製品と私たちの競争相手の製品が市場に入る相対的なタイミングだ。そのため、著者らは製品を開発し、臨床試験と審査プロセスを完成し、市場に商業ロット製品を提供する速度は重要な競争要素である。私たちの競争的地位はまた、より効果的かつ/またはより安価で、より速く製造された製品で差別化を示す能力があるかどうかにかかっているかもしれない。私たちの競争地位に影響を与える他の要素は、私たちが合格した人材を誘致し、維持すること、特許保護を得ること、または他の方法で独自製品またはプロセスを開発する能力、および技術構想と商業販売との間の長い期間のために十分な資本資源を得る能力を含む。
特許と独自の権利
私たちは一般的にアメリカと海外で私たちの技術と候補製品のために特許保護を求めている。バイオテクノロジーと製薬会社の特許地位は一般的に高度に不確実であり、複雑な法律と事実の問題に関連している。私たちの成功は私たちができるかどうかにかかっています
•特許を取得して私たち自身の技術と候補品を保護します
•特許によって保護される可能性のある第三者技術の使用許可を得る;
•私たちのビジネスの秘密とノウハウを保護し
•他人の知的財産権と独自の権利を侵害することなく運営される。
特許権
我々は我々のワクチン,製造プロセス,その他の技術に関する知的財産権(特許,ライセンス,技術ノウハウ)を持っている。現在、我々は、ワクチンおよびワクチン関連技術に関連する550件以上の米国および外国特許および特許出願を取得する権利を有しているか、または取得する権利がある。
我々のウイルス様粒子(“VLP”)計画に関連する特許は、現在および未来の季節性および大流行インフルエンザウイルス株を防止するために、インフルエンザ遺伝子配列を使用して多収型に一致するインフルエンザVLPワクチンをカバーする米国特許番号7,763,450を含む。対応する欧州特許、欧州特許1644037号もこの技術をカバーしている。米国特許第8,080,255,8,551,756,8,506,967および8,592,197号は、VLPを生産し、HAおよびNAタンパク質を含むVLPおよび鳥インフルエンザウイルス株A/インドネシア/5/05由来M 1タンパク質を注射することによって、インフルエンザウイルス感染に対する実質的な免疫力を誘導する方法を対象としている。M 1タンパク質がインフルエンザHAタンパク質およびインフルエンザNAタンパク質とは異なるインフルエンザウイルス株に由来する、いくつかの請求項に記載の同様の方法および組成物をさらに含む、請求項1に記載の方法および組成物。欧州関連特許保護は、M 1、HAおよびNAタンパク質を含むVLPを含むワクチン組成物を含む欧州特許2343084号によって提供される。私たちのVLP特許の組み合わせはまた、米国特許番号8,951,537、8,992,939、9,144,607、9,050,290、9,180、9,381,239、9,464,276、9,474,799、および米国以外の複数の司法管轄区域の他の特許を含む多くの他の特許を含む。
私たちはまた私たちのRSVとインフルエンザプロジェクトを含む他の核心プロジェクトに対する特許を取得した。RSV計画の様々な態様に対して発行される特許は、米国特許番号8,715,692、9,675,685、9,731,000、9,717,786、10,022,437、10,426,829および11,253,585を含む。このシリーズの他の特許は、ヨーロッパのEP 237009および世界各地の他の特許を含む。私たちの狂犬病計画に関連する特許は、米国の9,724,405件および10,086,065件、およびヨーロッパのEP 2635257およびEP 3246019件を含む。関連特許は他の世界市場で発行された。私たちのインフルエンザナノ粒子計画が取得した特許は、米国特許番号11,364,294および11,278,612を含む。私たちはワクチン計画に集中しているほか、私たちのMATRIXアジュバント計画のために特許保護を求めている。発行された米国特許番号7,838,019,9,205,147,9,901,634,8,821,881および10,729,764は、我々のMatrix Adjuvant計画に関連する特許例を提供する。
私たちは私たちの新冠肺炎候補ワクチンNVX-CoV 2373の特許を含む、私たちの新冠肺炎ワクチン計画に関連する特許を申請している。発行された米国特許番号10,953,089,11,253,586,11,541,112は、我々の新冠肺炎計画に関連する特許例を提供している。
COVIDプロジェクトに対するPCT出願(PCT/US 2022/020974、PCT/US 2022/080700、PCT/US 2022/082331およびPCT/US 2022/027465)および我々のマラリアプロジェクトに対する2つの未解決PCT出願(PCT/US 2022/078665およびPCT/US 2022/080334)もある。
我々は、我々の呼吸器合胞体ウイルス計画、インフルエンザナノ粒子計画、新冠肺炎計画、およびアジュバント計画を含む広範かつ強力な特許権利保護を提供するために、特許出願を準備、提出、および起訴し続ける。
1986年の“連邦技術移転法”と関連する法律指導は伝播科学と技術革新を奨励した。私たちはアメリカ衛生·公衆サービス部(DHHS)、生物医学高度研究·発展局(Biomedical Advanced Research And Development Authority)との契約が満期になったが、アメリカ政府とのいくつかの他の協力研究に対して、私たちは契約履行中に出現する可能性のある発明の所有権を保留する権利があり、いくつかの商業潜在力を持つ可能性のある開発と結果は機密とみなされるのではなく、製品を商業化するために開発と結果の許可について交渉する必要があるかもしれない。私たちが合理的なコストでこのような許可証を得ることに成功することは保証されず、このような開発と成果が独占的または非独占的な方法で私たちの競争相手に提供されない保証もない。
商業秘密
私たちはまた私たちの利益を保護するために商業秘密保護と秘密保護協定に大きく依存している。私たちの政策は、従業員、コンサルタント、請負業者、製造業者、協力者、および他のコンサルタントに、雇用、相談、または協力関係の構築を開始する際に秘密協定を実行することを要求します。私たちはまた私たちから機密情報を受け取るエンティティの秘密協定が必要だ。従業員、コンサルタント、請負業者に対して、合意は一般的に、個人が私たちにサービスを提供する時にしたすべての発明を私たちの財産として私たちに分配しなければならないと規定されている。
政府規則
Novavaxまたは私たちのパートナーが開発している候補ワクチンを含む生物製品の開発、生産とマーケティングは、米国と他の多くの政府当局の安全性、有効性と品質の面で規制されている。米国とICH基準を満たすことは、通常、業務を展開しようとしている他の国の規制機関の基準を満たすことができると信じているので、米国の規制プロセスおよびFDA、国際調整委員会(“ICH”)および他の機関が実施する基準に重点を置いている。しかし、ある場所、特にEUやイギリス(イギリスに関連する)での期待がある程度異なることに注目し、定期的な書類提出や通信を維持し、他の多くの非米国規制機関との定期会議に参加することでこの違いを解決する積極的な措置をとっている。アメリカでは、人類薬品とワクチンの開発、製造とマーケティングは連邦食品、薬物と化粧品法案の広範な監督管理を受け、生物製品はこの法案と公衆衛生サービス法条項の監督管理を受けている。FDAはこれらの製品の安全性と有効性を評価するだけでなく、これらの製品のテスト、製造、ラベル、保存、記録保存、広告、販売促進などを規制している。新しいワクチンのためのFDA許可を得る過程は高価で時間がかかる。
大多数の国のワクチン臨床開発は薬物と他の生物製品と同じ一般的な制御経路に従っている。FDAの許可を申請して任意の新しい候補ワクチンを発売する前に、著者らはまずFDAに研究用新薬申請(“IND”)を提出し、その中で実験室動物で行われた臨床前毒理学試験の結果、製造方法、放出の品質制御試験、研究製品の安定性、及び著者らが提案した人体試験計画を解釈することを望んでいる。この段階で、FDAは候補ワクチンが合理的に安全かどうかを引き続き人体でテストすることを決定した。そして、私たちは第一段階臨床試験とより大規模な第二段階と第三段階臨床試験を行い、著者らの候補ワクチンの安全性、免疫原性と有効性を証明し、FDAを満足させなければならない。臨床開発に成功したすべての3段階後,BLAをFDAに提出し,ワクチンの安全性と有効性に基づいてワクチン発売許可を申請することができる。似たような道はヨーロッパと他の地域にも存在する。
ワクチンが安全で純粋で有効であることが証明された場合にのみ、FDAはBLAを承認するだろう。FDAがBLAを審査している間,提案された生産施設は承認前の検査を受け,その間,FDAはワクチンの生産·製造施設とワクチンに関する品質文書を詳細に審査する。ワクチンライセンスはまた、衛生保健提供者がその潜在的な利点およびリスクを含むワクチンの正確な使用を理解し、患者および親とコミュニケーションし、ワクチンを安全に公衆に提供するために十分な製品ラベルを提供することを要求する。一般の人々にワクチンを接種するまで、すべての潜在的な有害事象は予見できない。したがって、FDAは通常、許可を得た後にワクチン発売後の臨床試験の第4段階を行い、指定された集団と追加の集団の安全性を収集し続け、時には有効性/治療効果データも含むことが要求される。
衛生部秘書が適切な声明を発表した後、FDA専門家は、十分な、承認され、および利用可能な代替案がない場合に、許可されていない医療製品または承認されていない医療製品を使用して、深刻なまたは生命に危険な疾患または状態を診断、治療または予防することを可能にするEUAを発行することができる。EUAを発行する際には,FDAは許可条件を適用し,EUA所持者はこれらの条件を守らなければならない.このような条件には、ラベルの遵守、正しい使用を確保するための材料の配布、報告義務、および広告および販売促進の制限が含まれるが、これらに限定されない。EUAは国土安全保障省秘書が発表した声明にのみ有効であり,すなわちEUAが適切である.公衆の健康または安全を保護するために、発行基準または他の状況がもはや適切な修正または撤回されない場合、FDAは、EUAをより早期に修正または撤回することもできる。例えば、FDAが潜在的な公共健康脅威がもはや存在しないか、または許可を必要としないと判断した場合、または重大な不良検査結果、EUA製品に関連する有害事象報告、またはEUA製品によって引き起こされる疑いのある有害事象報告、または製品が無効である可能性があることを証明する新たなデータのために、EUAが破棄される可能性がある。EUAは衛生部長が発表した突発公衆衛生事件(“公衆衛生緊急事件”)とは分離しており,これにも依存しない。そのため、バイデン政府はすでに、2020年2月に初めて発表された新冠肺炎PHEが2023年5月11日に満期になると発表したが、この期限はFDA発行のEU薬品監督管理局が発行したEU薬品監督管理局を終了することはない。
持続的な安全性を確保するために,FDAや他の多くの非米国規制機関は,ワクチンや製造プロセスが承認された後もワクチンの生産を監視し続けている。例えば、製造業者がその製品の許可証を持っている限り、定期的な施設検査を含むワクチンおよび生産活動の監視を継続しなければならない。関連する監督管理機関が要求を出した場合、製造業者も各ロットのワクチンに対する自分の効力、安全性、純度のテスト結果を提出することを要求される可能性がある。彼らはまた各ワクチンのサンプルをその機関に提出してテストすることを要求されるかもしれない。
各製品のFDA許可を得る以外に、各国内製造企業はFDAに登録し、FDAの検査を受け、現在の良好な製造規範(GMP)法規を遵守しなければならない。臨床試験を含む米国または米国国外で使用される製品を供給するためには、米国および外国の製造機関、第三者工場を含み、GMP規定を遵守し、FDAまたはその自国の対応する規制機関の定期検査を受けなければならない。
EUとイギリスは同様に承認を得るためのより速い方法を提供し、CMAを提供することで満たされていない医療需要を満たす。CMAは、営業許可が最終的に無条件になるように、収益/リスクを確認するために追加の総合データを取得する条件を付与される。医薬製品の市場での即時発売に関する公衆健康へのメリットは依然としてデータを補充する必要があるという事実に固有のリスクを超えるべきである。
FDAはいくつかの薬物と生物製品の開発と承認を加速することを目的とした計画があり、これらの薬物と生物製品は迅速なチャンネル指定、突破的な治療指定、優先審査指定と加速承認を含む生命に深刻な或いは生命に危害を及ぼす疾患或いは状況の治療を目的としている。まず、FDAは、深刻なまたは生命に危険な疾患または状態を治療するために、1つまたは複数の他の製品と単独でまたは組み合わせて使用することが意図されている場合、そのような疾患または状態の満たされていない医療需要を満たす可能性があることを証明する製品を迅速に検討することができる。Fast Track製品については,スポンサーがFDAとより頻繁にやり取りする可能性があり,FDAは申請完了前にFast Track製品申請部分の審査を開始する可能性がある。FDAは2020年11月にNVX-CoV 2373の快速チャネル称号を許可し、2020年1月に著者らの組換え四価季節性インフルエンザ候補ワクチンNanoFluの迅速チャネル称号を承認した。
第二に、1つの製品が単独で、または1つまたは複数の他の製品と組み合わせて、深刻なまたは生命を脅かす疾患または状態の治療のために使用され、予備臨床証拠が、製品が1つまたは複数の臨床的に重要な終点で既存の療法よりも実質的に改善されている可能性があることを示す場合、製品は突破的療法として指定することができる。FDAは開発過程を通してスポンサーと会議を開催し、適時に
開発と承認に関連する製品スポンサーは、より多くの上級者に審査過程に参加させ、審査チームのために1つの学際的なプロジェクト担当者を指定し、他のステップを採用して効率的な方法で臨床試験を設計する。
第三に、FDAは、重篤な疾患または生命に危険な疾患を治療し、承認された場合、安全性または有効性の点で既存の療法よりも有意に改善される製品を優先的に検討することができる。顕著な改善は,疾患治療の有効性の増加,治療を制限する産物反応の除去あるいは大幅な減少,記録されている患者のコンプライアンスの向上が重篤な結果の改善をもたらす可能性があること,新たな亜群における安全性と有効性の証拠であることが示唆された。優先的に指定された目的は、全体的な関心およびリソースをこのような申請の評価に誘導することであり、医薬品(ワクチンを含む)については、FDAがマーケティング申請に行動する目標を10ヶ月から6ヶ月に短縮することである。
第四に、製品が重篤または生命に危険な疾患を治療し、一般に既存の療法よりも有意な利点を提供する場合、加速的な承認を得る資格がある可能性がある。さらに、それは、臨床利益を合理的に予測する可能性のある代替終点への影響、または不可逆発病率または死亡率(IMM)よりも早く測定できる臨床終点への影響を証明しなければならず、IMMは合理的にIMMまたは他の臨床利益の影響を予測する可能性がある。承認の条件として,FDAは承認を加速させた薬物や生物のスポンサーに十分かつ良好にコントロールされた上場後臨床試験を求め,臨床的意義のある終点を用いた治療効果を確認し,代替終点で観察された承認前の効果を確認することができる。2019年6月、FDAはNanoFluが加速承認パスを使用できることを認めたと発表しました。
米国で規制承認を受けなければならないほか、研究製品は発売しようとしている他の国で規制承認を受けなければならない。一国の規制当局が適切なマーケティング申請を承認するまでは、その国でそのような製品を販売してはならない。FDAの許可は他の規制機関の承認を受けることを保証しない。しかも、多くの国で、政府は製品の価格設定に参加している。この場合、定価審査期間は一般的に市場承認後から始まる。
私たちはまた、私たちスウェーデン工場を管理する国と地方法規を含む、“職業安全と健康法”、“環境保護法”、“有毒物質制御法”、“資源保護と回収法”、その他の既存と潜在的な連邦、州または地方法規の規制を受けている。これらの法律と他の法律は私たちの様々な生物と化学物質の使用、処理、処分、これらの物質と化学物質は私たちの業務、そして私たちの業務から発生する廃棄物を規範化している。私たちの研究と開発は危険材料、化学品、ウイルスの制御された使用に関するものだ。このような材料を処理·処分するセキュリティプログラムは州や連邦法規で規定されている基準に適合していると信じているが,これらの材料による意外な汚染や傷害のリスクは完全には解消できない。もしこのような事故が発生した場合、私たちはそれによるいかなる損害に対しても責任を負う可能性があり、このような責任は私たちの資源範囲を超える可能性がある。また,制御物質を含む製剤については,“薬品施行法”の規定を遵守しなければならない。
国内·海外市場では、規制部門の承認を得て商業販売のための任意の製品の販売は、第三者決済者が精算できるか否かにある程度依存する。第三者支払者には、政府機関またはプロジェクト、個人健康保険会社(管理されている医療計画を含む)、その他の組織が含まれる。これらの第三者決済者はますます価格に挑戦し、医療製品やサービスの費用効果を検討するようになっている。また、新たに承認された保健製品の精算状況には大きな不確実性がある。私たちは私たちの製品の費用効果を証明するために高価な薬物経済学的研究を行う必要があるかもしれない。新たに承認された薬物については,保険獲得や精算に重大な遅延がある可能性があり,保険範囲はこの製品がFDAや米国以外の類似規制機関の承認を得た適応よりも限られている可能性がある。私たちの候補製品はいくつかの価格で費用効果があると思われないかもしれない。一部の市場では十分な第三者精算がない可能性があり、製品開発への投資の適切なリターンを実現するために十分な価格レベルを維持することができる。第三者支払者は、様々な使用管理技術を用いて、当社製品へのアクセスや管理使用を制御することもできます。私たちの候補製品の第三者精算が減少したり、第三者支払者が私たちの候補製品をカバーしないことを決定することは、医師の私たちの製品に対する使用を減少させ、私たちの販売、運営結果、財務状況に実質的な悪影響を及ぼすかもしれません。
米国内では、将来適切な承認を得て任意の候補製品を販売すれば、これらの製品は様々な政府健康福祉計画にカバーされる可能性があり、政府機関によって購入される可能性もある。このような計画に参加するか、またはそのような機関に製品を販売することは規制されている。保険の交換としては、政府医療計画に基づいたり、政府や個人購入者にリベートや割引を提供する義務がある可能性があります。
米国と各州政府は,医療コストの削減を含めた医療提供や支払いの改革を目的とした立法を継続して提案している。例えば、2010年3月、米国議会は、政府医療計画下の薬品のカバー範囲や精算の改正を含む“患者保護·平価医療法案”と“医療·教育協調法案”(“医療改革法案”)を公布した。トランプ政権政権中、“医療改革法案”の条項の全部または一部を改正または廃止する努力が何度かあり、いくつかの改正が実施された。価格制御とコスト制御措置、および既存の統制·措置を講じている司法管轄区域でより厳しい政策をとることで、我々の純収入や業績をさらに制限することができる。
医療改革法案が公布されて以来、米国はまた他の立法改正を提出し、採択した。例えば、2011年の“予算制御法案”によって作成されたプログラムでは、医療保険の提供者への支払い額は自動的に減少し、前期ごとに最高2%削減することができ、2013年4月に施行され、コロナウイルス援助、救済、経済安全法案(通常は“CARE法案”と呼ばれる)に含まれる後続立法改正により、2030年まで有効となる。2020年11月、医療保険·医療補助サービスセンター(CMS)は、あるMedicare B部分の薬物が特定の他の国のこのような薬物の最低価格を超えないように購入することによって、処方薬コストを下げることを目的とした臨時最終規則を発表した(“最恵国ルール”)。この規定により,影響を受けた薬品の低い支払率は2021年から4年以内に徐々に実施される。この規定は多くの理由で産業協会から疑問視されている。2020年12月28日、アメリカカリフォルニア州北区地区裁判所は生物技術革新組織がアザールを訴える事件の中で全国的な初歩的な禁止令を発表し、番号3:20-cv-08603、CMSの最恵国規則の実施を初歩的に禁止した。この初歩的な禁止を考慮して、最恵国規則は2021年1月1日に実施されておらず、これ以上の規則が制定されていなければ実施されない。しかし、私たちの製品を含むように拡大されれば、この暫定最終規則または任意の同様のタイプの参照定価規制は、私たちの業務を潜在的に損なう可能性があります。
最近、アメリカ国民と政府は薬品定価に対してかなりの審査を行い、人々が考えている薬品コストが高すぎることを解決する提案を提出した。最近もいくつかの州立法が薬品コスト問題の解決に努力しており、これらの努力は通常薬品コストの透明性の向上、あるいは薬品価格の制限或いは価格上昇に重点を置いている。連邦や州レベルで新しい立法を採用することは、販売が承認されれば、私たちの候補製品に対する需要や定価に影響を与える可能性がある。政府はまた新冠肺炎の流行に対応するためにもっと多くの行動をとる可能性がある。私たちはどんな連邦と州改革努力の最終的な内容、時間、または効果を予測することができない。連邦や州医療改革が私たちの将来の業務や財務業績に悪影響を与えないことは保証されない。
同様に、米国以外の多くの国では、薬品の価格設定が規制されており、特に医療保健が主に政府の援助や政府の支援を介して保険会社によって提供されている国である。これらの国では、政府組織は通常、まず医薬製品が精算できるかどうかを決定し、次に支払うべき最高価格を確定する。
米国内では、将来規制およびマーケティング承認を得る可能性のある任意の候補製品の販売に関する活動について、リベート法および虚偽申告法を含む医療保健の“詐欺および乱用”に関する様々な連邦および州法の制約を受ける可能性がある。逆バックル法は、一般に、購入、処方、または特定の薬物の使用を含む業務を生成するために、製薬業者が誘致、提供、受け入れ、または支払いを禁止する。これらの法律の具体的な規定はそれぞれ異なるにもかかわらず、それらの範囲は通常広く、特定の業界で実践されている法規、指導、または裁判所判決に法律を適用していない可能性がある。したがって、私たちの接近はこのような反リベート法の挑戦を受けるかもしれない。連邦虚偽請求法案(FCA)を含む虚偽請求法であって、誰もがインフォームドコンセントおよび自発的に第三者支払者(MedicareおよびMedicaidを含む)に提出するか、または任意の虚偽または詐欺的な精算薬またはサービス支払い請求の提出を引き起こすことを禁止する虚偽請求法。これらの法律によると、私たちの製品販売やマーケティングに関する活動が審査される可能性があります。詐欺や法律違反行為は、罰金や民事罰金を含む刑事または民事制裁を受ける可能性があり、連邦医療計画(連邦医療保険や医療補助を含む)から除外される可能性がある。米国では,連邦や州当局は製薬業界でのこれらの法律の実行をますます重視しており,個人はこれらの法律の違法行為を積極的に告発し,政府を代表してFCAによる訴訟を起こしてきた。もし私たちがこのような法律に関する告発を受けたり、これらの法律に違反したと判断されたら、私たちの業務は損害を受けるかもしれない。
2020年11月20日、DHHSは“処方薬に関する計画やPBMのリベートの安全港保護を廃止し、新しい安全港保護を作る”と題する最終規則を発表し、一般に“リベート規則”と呼ばれ、製薬メーカーが計画発起人や薬局福祉に提供する価格優遇(リベートを含む)の保護を廃止することによって、連邦反リベート法規割引安全港を修正した
Medicare Part D計画およびMedicare Advantage計画によると、値下げが法的要求でない限り、彼らと契約を締結するマネージャー。2022年1月1日から、2022年Part D計画年度までに、Part D処方薬計画およびMedicare Advantage処方薬計画に直接(または薬局福祉マネージャーを通じて間接的に)支払われたメーカーに対して、安全港保護を廃止する。リベート規則は2020年12月30日から2つの新たな避難港を構築した。最初の新しい安全港保護製造業者のための処方薬計画(Medicare Advantage組織が提供する処方薬計画を含む)およびMedicaid管理看護組織支払いの値下げは、販売時点で十分に反映されている。二番目の新しい避難港保護メーカーは薬局福祉マネージャーに公平な市価サービス料を支払います。この新しい規定は、第一選択処方位置を得るために、健康計画および薬局福祉マネージャーが製造業者とリベートおよび割引を交渉するインセンティブを変化させる可能性がある。現在、私たちの製品がアメリカで商業化されていれば、これらの変化が私たちの業務や運営にどのような影響を与えるか予測できません。
EUと連合王国では、処方、推薦、裏書き、購入、供給、注文、または医療製品の使用を誘導または奨励するために、医師に福祉または利点を提供することが禁止されている。医師への福祉や利点の提供も、イギリスの“2010年反賄賂法”のようなEU加盟国とイギリスの国家反賄賂法の管轄を受けている。このような法律に違反することは巨額の罰金と監禁につながるかもしれない。
我々はまた、米国の“反海外腐敗法”(FCPA)の制約を受け、いかなる米国の個人または企業が任意の外国人官僚、政党または候補者に直接または間接的に任意の外国人官僚、政党または候補者に支払い、提供、許可支払い、または任意の価値のあるものを提供することを禁止し、外国実体の任意の行為または決定に影響を与え、個人または企業が業務を獲得または保留することを支援することを目的としている。“海外腐敗防止法”はまた、米国に上場する証券会社にある会計条項を遵守することを要求し、これらの条項は、会社(国際子会社を含む)のすべての取引の帳簿と記録を正確かつ公平に反映し、国際業務のために適切な内部会計制御システムを設計し、維持することを要求する。“反海外腐敗法”を遵守することは高価で困難であり、特に腐敗は公認問題である国である。また、海外腐敗防止法は製薬業に特別な挑戦をもたらしており、多くの国では病院が政府によって運営されているため、医師や他の病院従業員は外国人官僚とされている。臨床試験やその他の仕事に関連して病院に支払われた何らかの金は、政府関係者に支払われた不正金と考えられ、“海外腐敗防止法”の法執行行動につながった。様々な法律、法規、および行政命令もまた、米国国外での国家安全目的のための機密情報、および特定の製品およびこれらの製品に関連する技術データを特定の非米国国民と共有することを制限している。アメリカ以外の拡張に伴い、私たちはこれらの法律を守るためにもっと多くの資源を投入する必要があります。これらの法律は私たちがアメリカ以外のところで特定の製品と候補製品を開発、製造、あるいは販売することを阻止するかもしれません, これは私たちの成長潜在力を制限し、私たちの開発コストを増加させるかもしれない。私たちは私たち、私たちの従業員、私たちの顧問、または私たちの第三者請負業者が賄賂と腐敗に関するすべての連邦、州、そして外国法規を遵守しているか、または遵守することを保証することはできない。また、我々の戦略的パートナーや米国以外に位置する第三者請負業者は、十分なコンプライアンス計画がない場合や、彼らが運営する地域の法律や指導を尊重できない可能性がある。国際ビジネス慣行に関する法律を遵守しなければ、重大な民事·刑事罰を受け、政府契約の資格を一時停止または廃止する可能性がある。米国証券取引委員会(“米国証券取引委員会”)は、発行者が“海外腐敗防止法”の会計規定に違反したため、発行者の米国取引所での証券取引を一時停止または禁止する可能性もある。これらの法律に違反していると判断されなくても、政府のこれらの問題の調査には通常、大量の資源がかかり、負の宣伝が必要であり、これは私たちの業務、財務状況、運営結果に悪影響を及ぼす可能性がある。
1996年の“連邦健康保険携行性と責任法案”(HIPAA)は、個人第三者支払者を含む追加の連邦刑事法規を制定し、故意に詐欺の任意の医療福祉計画を実行または実行しようとする計画を知り、故意に実行または実行しようとすることを禁止し、個人第三者支払者;医療福祉計画を故意に流用または盗み取ること;医療保健違法行為の刑事調査を故意に阻害すること;および重大な事実を故意に偽造し、隠蔽または隠蔽すること、または医療福祉、プロジェクトまたはサービスの提供または支払いに関連する任意の重大な虚偽、架空または詐欺的陳述を行うことを禁止する追加の連邦刑事法規を制定した。“健康情報技術促進経済·臨床健康法案”(HITECH)及びその実施条例改正されたHIPAAは、個人が健康情報を識別できる保証実体、又はそれにサービスを提供する保証実体、健康計画及び医療情報交換所及びその業務パートナー、並びに使用、開示又は他の方法で個人識別可能な健康情報を処理する下請け業者に対して、強制的な契約条項を含む個人識別可能な健康情報のプライバシー及び安全に関する要求を適用する。HITECHはまた、カバーする可能性のある実体や商業パートナーに加えられる民事と刑事罰を増加させ、州総検察長に新たな権力を与え、連邦裁判所に民事訴訟を提起し、損害賠償を要求したり、HIPAAの禁止を執行したりすることができる。製薬期間中
バイオテクノロジー会社は通常HIPAAの直接規制を受けていないため,プロバイダ,支払者,他のHIPAAコンプライアンス義務を持つ人とのインタラクションでは,我々の業務は間接的にHIPAAの影響を受ける可能性がある.EU一般データ保護条例(GDPR)や2018年カリフォルニア消費者プライバシー法(CCPA)のような健康や個人情報のプライバシーや安全を管理する州や外国の法律にも支配されています。
最近,連邦や州政府が医師や他の医療保健提供者に支払う費用の規制を強化する傾向が見られた。“医師支払い陽光法案”は、連邦医療保険、医療補助または児童健康保険計画に基づいて支払うことができるいくつかの薬品、設備、生物製品、および医療用品の製造業者に年間報告要件を提出しているが、彼らが医師(医師、歯科医、光線師、足科医および脊椎マッサージ師を含むと定義される)および教育病院に支払うお金、および医師およびその直系親族が所有する所有権および投資権益である特定の例外がある。2022年から適用されるメーカーは,前年に医師アシスタント,看護師勤務者,臨床看護師専門家,登録看護師麻酔科医,登録助産師への支払いや他の価値移転に関する情報を報告することも要求される。
連合とイギリスでは、医師に支払われる費用は公開されなければならない。また,一部の国では,医師との合意は,医師の雇用主,その主管する専門組織,あるいは個別国の監督当局に事前に通知し,承認しなければならない。これらの要件は、EU加盟国に適用される国家法律、業界規則、または専門行為規則に規定されている。このような要求を守らないことは、名声のリスク、公開非難、行政処罰、罰金、または監禁につながる可能性がある。
連邦政府と各州はすでに法律と法規を公布し、製品を販売する薬品メーカーの販売とマーケティングのやり方を規範化した。法律および条例は、一般に、製造業者と医療提供者との間の財務的相互作用を制限し、および/または、このような相互作用を政府および公衆に開示することを要求する。その中の多くの法律法規の要求が曖昧で、あるいは行政指導が必要である。法律およびその実施の曖昧性を考慮して、将来の任意の活動(私たちが連邦医療計画の候補製品の承認および/または補償を得たら)が挑戦される可能性がある。
新冠肺炎疫病の重大な世界的影響を考慮して、1つ以上の政府実体は、1950年に改正された“国防生産法”に基づく米国政府の行動を含む行動をとる可能性があり、これらの行動は、NVX-CoV 2373における私たちのいくつかの権利または機会を直接的または間接的に弱める可能性があり、新冠肺炎ワクチンの私たちに対する経済的価値は限られている可能性がある。また、世界的な衛生危機の間、例えば新冠肺炎の大流行は、疾患の伝播を制御する必要があり、国家境界を閉鎖または厳格に規制することは、私たちの開発と生産活動に挑戦と潜在的な遅延をもたらし、独立した国や国際境界内で私たちの候補ワクチンを開発·生産することは、より大きな費用がかかり、公開配布時間がより長くなる可能性がある戦略をとる必要があるかもしれない。
私たちの候補製品の臨床試験と製品の商業化により、私たちは固有の製品責任リスクに直面している。例えば、私たちが開発したすべての製品が製品テスト、製造、マーケティング、または販売中にダメージを与えたり、不適切なことが発見されたと言われた場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、製品固有の危険について警告、不注意、厳格な責任と保証違反の告発を含む可能性がある。州消費者保護法によると、クレームも主張することができる。もし私たちが製品責任クレームで自分自身を弁護することに成功できなければ、私たちは重大な責任を招いたり、私たちの候補製品の商業化を制限することを要求されるかもしれません。米国では、“公衆準備·緊急事態準備法案”(以下、“準備法案”と略す)が適用された場合には、州または連邦法で規定されている“保険対策”の実施または使用による“損失”クレームを免除する免除権がメーカーに提供されている。しかし、場合によっては、被害者は“故意に失墜した”という罪でメーカーに訴訟を起こすことができる。カバーされた対策“には、安全対策および”合格した大流行または流行病製品“が含まれ、大流行または流行病の診断または治療を目的とした製品、例えば大流行ワクチン、およびそのような製品による状況に対応することが意図された治療が含まれる。これらの免除を適用するために、国土安全保障省長官は“予備法”を引用し、突発的な公衆衛生事件或いは未来の突発公共衛生事件の“信頼できるリスク”が存在することを表明する声明を発表しなければならない。2020年3月17日, 厚労省秘書は“準備法案”に基づいて声明を発表し,それ以来その後の改正案を発表し,行われている新冠肺炎の大流行の何らかの対策に関する活動に責任免除を提供している。現在の申告は更新しない限り2024年10月1日に終了する。私たちは私たちの製品が現在のPrep Act宣言に含まれると信じているが、これは保証されない。
また,衛生·公衆サービス部長官が将来,我々の他の候補製品をカバーする他の声明を行うことは保証されず,米国議会が将来Prep Actでのカバー範囲を減少させたり,それを完全に廃止したりする行動を取らない保証はない。私たちに製品責任訴訟を提起すれば、私たちは多くの責任を負い、候補製品の商業化を制限することを要求されるかもしれません。
人力資本
従業員
2023年2月21日現在、私たちは1,992人の常勤従業員を持っており、その約9%が医学博士号、約21%が他の高級学位を持っている。私たちの従業員総数の中で、約63%の従業員は主に研究開発と製造活動に従事し、約37%の従業員は主に行政、業務開発、商業、財務と会計、法律と行政機能に従事している。スウェーデンにいるある従業員を除いて、彼らは現地の法律に基づいて労働組合と集団協定を締結し、私たちの従業員は労働組合や労働組合代表を持っておらず、私たちの従業員も私たちと集団交渉協定を締結していない。
私たちの職員たちを育成、成長、そして公平に扱うことは私たちの文化の不可分の一部だ。従業員調査に基づく2021年の米国最優秀職場ランキングで認められたことを誇りに思います。私たちはこの賞が私たちの卓越した仕事文化への投資を反映していると信じている。
従業員の安全と福祉
従業員の安全は私たちの最優先順位だ。私たちが2022年の大流行を過ごしている間、私たちは家で働くことができる従業員にそうすることを奨励し続けた。私たちは引き続き新冠肺炎の安全に関する疾病管理センターのすべてのガイドラインに従っている。また、業務ニーズに応じて従業員に持続的な柔軟性を提供するために、従業員が柔軟に遠隔フルタイムで働くか、混合的に動作することを可能にする勤務方式ガイドラインを実施した。我々は内部ネット上の新冠肺炎資源ページを通じて従業員に新冠肺炎上の最新情報を提供する。この資源は従業員に新冠肺炎職場内外の安全情報を提供する。このサイト上の資源には、我々の新冠肺炎プロトコルとガイドライン、マスクと社交距離に関する私たちの政策、感染制御措置リスト、および心理健康支援リソースが含まれている。
私たちはメリーランド州ゲザスバーグにある700クイーンズ果樹園のオフィススペースは2022年に良好なプラチナ認証を獲得した。Wellは世界的に建築物の健康と福祉を促進する先行ツールである。北米35基の認証された建物の一つとして、この建物は材料選択、室内空気の質、音響の面で厳しい基準を達成する。また、私たちの運営と政策は、空気、水、栄養、光、運動、熱快適、音、材料、心、コミュニティの10個のWell概念で高い得点を得るのに役立ちます。
報酬と福祉
私たちの全体的な奨励方案はトップレベルの人材を誘致、吸引、激励、維持することを目的としている。私たちは従業員の様々なニーズを満たすために報酬、福祉、サービスを提供するために努力している。私たちの手厚い総報酬プログラムには、健康を保護し維持する保険を含む競争力のある市場報酬と総合的な福祉、私たちの短期および長期障害計画によって提供される収入保護、養子縁組援助および有給育児休暇計画、後備児童、成人および高齢者介護などの仕事と個人生活のバランスを助けるサービス、毎月財務健康セミナー、一対一財務計画会議、債務および信用管理支援を含む財務健康計画が含まれています。
私たちの健康計画には毎月の時事通信が含まれており、その中で私たちの従業員がより健康で、より幸せな生活を送ることを助けるための組織とパートナー、ツール、資源が重点的に紹介されている。私たちは、私たちの従業員がオンライン登録セラピストに接続することを可能にするいくつかのデジタルアプリケーションを提供し、ストレスおよび不安を減少させ、ポジティブおよび感情の健康を向上させるための活動にアクセスすることができる。私たちは従業員たちが様々な生活事件に対する支持を得るための強力な従業員援助計画を持っている。
従業員の仕事と生活のバランスを助けるために、私たちはコンシェルジュサービスを提供して、従業員が車のサービスを探して予約することを含む各種の個人事務を管理することを助けます。ペットの家政婦と宿泊者を探す;オンラインと自分の指導を検索する;コミュニティ活動を提案する;休暇の考えを提供する;家庭清掃員、水道工、暖房エアコンと
環境美化サービス;ヨガ、個人訓練コースと動き自転車コースを探して予約する;栄養食とレシピを提案する;及びデイサービスセンターの可用性と評価を研究する。
また、私たちは、当社の従業員株式購入計画に株式付与または参加することにより、各従業員に会社の持分を持つメリットを提供しています。私たちは株式報酬がいつもそうであり、私たちの従業員の中で所有権文化を育成し、彼らの利益を私たちの株主の利益と一致させるため、私たちの給与プログラムの重要な構成要素であり続けると信じている。
採用、開発、訓練
従業員の吸引、発展、そして維持は私たちの成功の重要な要素だ。ヘッドハンティング会社との戦略的パートナー関係、ソーシャルメディアチャネルの利用、強力な従業員推薦計画など、様々な求人ツールを利用してトップレベルの人材を探しています。2022年、私たちは初期職業サミットを開催し、150人以上の従業員と大学実習生を誘致、維持、育成した。サミットはこのグループにネットワークを構築し、関係を構築し、Novavax指導者とお互いに学ぶフォーラムを提供した。
従業員の成長と昇進を支援するために、授業料と継続教育精算、および幹部コーチの現場指導や、16,000以上のオンデマンドビデオチュートリアルを含むLinkedIn学習ライブラリを訪問し、ビジネス、リーダーシップ、技術、革新に関するスキル、知識、行動を語る一連の訓練や職業発展の機会を提供します。この12ヶ月間、私たちの従業員は50,000回以上のビデオを見て完成した。また,約200人の従業員が現場指導に参加した。高い潜在力を有する従業員と、指導職の潜在的後継者として決定された従業員に幹部開発計画を提供する。私たちの幹部開発計画には、幹部研修活動とリーダーシップ開発計画が含まれており、私たちの指導部を強化し、私たちのトップ人材を加速し、育成し、将来の発展に備えている。2023年の役員養成プログラムには、34人の従業員からなる多様なグローバルチームが含まれている。専門発展学習シリーズはすべての従業員に向けて、自意識、協力、混合仕事、リーダーシップとビジネスの鋭敏性に重点を置いている。
内部通信
私たちは、役員とのグローバルフォーラム、従業員調査、フォーラムや委員会を介した参加など、様々なツールを使用して公開と直接のコミュニケーションを促進しています。私たちの行政指導者チームは、従業員参加度を増加させることが、一人一人のキャリア成功と私たち全体の成功に重要であることを認識している。
多様性公平性包括性
私たちの多様性、公平、そして包容的な文化(Dei)は、私たちの成長目標を達成するために、私たちの従業員の力を創造、発展させ、利用するのを助ける。著者らは最近、著者らの現在のDei状態に対する根拠に基づく分析を完成し、長年の路線図と戦略を産生し、これは私たちの使命、私たちの人員と私たちの最適な仕事を実現させる。3つの柱の周りに設計されています
•組み込み式Deiは私たちの人員の意思決定と手続きに入った。
•エネルギーを使う私たちの従業員は超新星と呼んで、私たちの価値観を実践して、包容的な文化の中ですくすくと成長しています。
•装備私たちのリーダーと超新星はDeiの理解、能力、教育、ツール、資源を持っている。
私たちは2022年から路線図を施行し、進展を成し遂げている。私たちはDeiと従業員をマネージャーに招聘して、彼は私たちの行動を促進して集中し、包括的な労働力チームを構築することを促進し、助けるだろう。私たちは神に関連した世界的な記念活動を認め始め、包容的な文化を構築し、アイデアや意思決定を生み出す際に異なる視点に触れる指導者を育成するために訓練に投資している。第2回Novavax女性リーダーシップフォーラムを開催し、300人近くのNovavax女性のためにネットワークを構築し、技能を発展させ、声と考えを共有し、積極的な変革の推進者になった。2022年には、行政レベルの代表性の向上にも女性や少数派の向上が進んだ。著者らは3つの人員プロセスの審査、即ち人材獲得、昇進と業績管理を開始し、完成した。私たちはまたDei原則を私たちのNovavaxリーダーシップモデルに統合する意図がある。私たちは私たちの長年のDei戦略と路線図が私たちが絶えず改善して超えられるようにすると信じている。
環境、社会、ガバナンス
上述したDeiや人的資本計画のほかに、環境、社会、ガバナンス(ESG)に関する他のいくつかの計画が行われている。これらのイニシアティブは環境持続可能性、ワクチン獲得と全世界の健康改善の革新、従業員に権力及び管理責任を含む4つの重点領域をめぐって展開されている。私たちがこれらの重点分野を通じて取った様々な利害関係者の方法は、私たちの長期的な成功と私たちの株主の価値を高めるために重要だと信じています。これらの重点分野を支持するイニシアティブの例は、
環境持続可能性
•温室効果ガス排出の資源管理と温室効果ガス(“GHG”)削減戦略の追跡·報告
•持続可能性指標を仕入先評価基準に組み込んだ調達方法
•メリーランド州ゲザスバーグの約17万平方フィートの不動産を借りて、昆斯烏節路700号に位置し、設計時に炭素意識イニシアチブ、例えば純ゼロ駐車構造を採用しました
•多用途レンタルと自社施設を越えた用水節約とエネルギー使用状況のモニタリング
•複数のレンタル施設で油井認証を発行しております
•私たちのパートナーDesert Kingと持続可能なけん素調達を行いますDesert KingはQですUillaja Saponaria私たちのMATRIX-Mアジュバントを生産するためのチリ原産の木
ワクチン接種方法を革新し、世界の健康状態を改善する
•候補R 21マラリアワクチンは,オックスフォード大学ジェンナー研究所が開発し,我々のMATRIX−Mアジュバントを用いて調製した
•コミュニティのパートナーシップを通じてワクチンを獲得し、例えばヒップホップ公衆衛生、国歌、疾病管理センター基金会の代表と協力し、Aspen Ideas:Healthで“最後の1マイル:一堂に集まってワクチンを機能させる”という討論を主宰した
•国家衛生委員会、あなたの家庭へのワクチン接種、全国黒人看護師協会など、Novavaxを代表して公共コメントを提供するために、疾病管理センターに登録された第三者組織からなる局の構築を提唱した
•臨床試験の多様性に重きを置く努力
私たちの従業員の能力を強化する
•Novavaxの慈善寄付を高め、現地のコミュニティ団体(モンゴメリー農村コミュニティ学院、フェルファックス農村技能資源センター)と協力し、現地の非営利組織を支援するための従業員寄付マッチング計画を紹介した
•コミュニティの構築と企業価値観の構築を支援し、潜在力の高い従業員に授業料と教育補償を提供し、専門指導と幹部発展計画を得るための計画を打ち出した
責任をもって治める
•2021年、私たちは全世界の品質保証と品質管理担当者を招聘し、全世界の技術品質、臨床品質、制御システムとコンプライアンス運営の品質管理と機能の構築に専念した
•すべての政府と監督機関の要求と業界標準に符合する政策、良好な実験室規範(GLP)、現在の良好な製造規範(CGMP)と良好な流通規範(GDP)を含む
•首席コンプライアンス官を招聘し、強力な書面基準と商業道徳政策マニュアルである“NovaCode”を出版した
•既定の内部調査協定の遵守状況を報告するためのグローバルホットライン
•戦略的コンプライアンス委員会を設立し、私たちのパートナーがアメリカの法規を遵守するのを助けます
•全社的な商業道徳訓練、指導、原材料審査
•意思決定を指導する標準操作手順を起草する
•より高い政府契約要件を満たす強力なネットワークセキュリティ基準
•異なるワクチンの安全概況をよりよく理解するために、強力な疫学的利益/リスクグループを構築するために首席安全官を招聘した
•更新された安全政策と基準に対して継続的な従業員訓練を行う
情報の可用性
私たちのサイトの住所はwww.novavax.comです。我々は、米国証券取引委員会に米国証券取引委員会を提出または提出した後、合理的で実行可能な範囲内で、当社のForm 10-K年次報告、Form 10-Q四半期報告、Form 8-K現在の報告、および米国証券取引委員会に提出された他の文書、および1934年の証券取引法第13(A)または15(D)節に基づいて提出または提出された任意のこのような報告書を無料で提供する任意の修正案を提供する。米国証券取引委員会には、米国証券取引委員会に電子的に提出された報告書、依頼書、情報声明、その他の発行者に関する情報が含まれたインターネットサイトが設置されており、URLはwww.sec.govである。
我々は、重大な非公開情報を開示する手段として、我々のウェブサイト(www.novavax.com)を使用し、米国証券取引委員会が公布した公平開示規則に基づいて規定されている開示義務を履行する。これらの開示は、私たちのウェブサイト(www.novavax.com)の“投資家”または“ニュース”の部分に含まれています。したがって,投資家は我々のニュース原稿,米国証券取引委員会の届出文書,公開電話会議やネットワーク放送に注目するほか,我々のサイト(www.novavax.com)のこれらの部分にも注目すべきである.
私たちのサイトでは、Novavax社のガバナンスと私たちの取締役会に関する情報も提供されています。私たちは、可能な場合には、適用される米国証券取引委員会およびナスダック規則に基づいて、当社のウェブサイト上で、将来私たちに適用される任意の最高経営責任者、最高財務官、最高会計官および財務総監、および同様の機能を実行する者の本規則の任意の改正または免除を開示するつもりです。
私たちはウェブサイトの投資家関係欄で私たちの財務報告電話会議と私たちが投資界のメンバーと一緒に参加したり主催したりするいくつかの活動をネット中継します。また,我々のサイト投資家関係欄の一部として,ニュースや収益に関するニュース通知や公告も提供している.当サイトの内容は、本10-K表年次報告書の一部でもなく、米国証券取引委員会に提出または提出された他の報告書の一部でもありません。
第1 A項。リスク要因
私たちの業務を評価する時、あなたは次の危険要素を慎重に考慮しなければならない。多くの危険は私たちの実際の結果が展望的な陳述によって示された結果と大きく異なることをもたらすかもしれない。いくつかの危険は主に私たちの業務と私たちが経営している産業と関連がある。他の主に証券市場と私たちの普通株の所有権と関連がある。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今どうでもいいと思っている他のリスクと不確実性がまた私たちに影響を与える重要な要素になる可能性があるということを認識していない。次のリスクのいずれも、当社の業務、財務状況、または運営結果に重大な悪影響を及ぼす可能性があります。本年度報告書に含まれるForm 10-Kと、米国証券取引委員会に提出された他の文書に含まれる他の情報も考慮すべきです。
リスク要因の概要
私たちの業務は多くの危険に直面している。以下は,本節で述べた主なリスク要因の概要である
•私たちは赤字の歴史があり、未来の収益性も不確実だ。
•私たちは引き続き私たちの現在の運営レベルを維持し、候補ワクチンのさらなる開発に資金を提供するために多くの資金が必要だ。
•私たちのワクチン製品開発は急速に発展する新しい技術に依存しているため、私たちの努力は成功しないかもしれない。
•我々の新冠肺炎候補ワクチンNVX-CoV 2373の監督管理と商業上の成功はまだ確定していない。私たちはすでに複数の管轄区域でNVX-CoV 2373の一時登録、条件付き上場許可、または緊急使用許可を得ているが、私たちはアメリカや他の司法管轄区で全面的な規制許可を得ることができないか、あるいは成功したワクチンを適時に生産することができないかもしれない。
•SARS-CoV-2ウイルス変種の出現と伝播性、及び二価ワクチンに対する需要は、市場のNVX-CoV 2373に対する受け入れ或いは販売に影響する可能性があり、著者らは新しい冠肺炎ワクチンバージョンを開発してある変種を防ぐ戦略は成功しないかもしれない。
•私たちはバイオテクノロジー会社で、製品の開発、製造、商業化の面で大きなリスクに直面している。
•著者らは第三者に依存していくつかの実験室テストと臨床試験を行って、そして私たちの大量のワクチンの製造と流通のため、私たちは製品の開発と供給の努力の中で遅延或いはいくつかの制御を失う可能性がある。
•私たちはNVX-CoV 2373の商業成功に強く依存しています。たとえ私たちがいくつかの司法管轄区域でNVX-CoV 2373の一時登録、条件付きマーケティング許可、または緊急使用許可を得ても、私たちの製品が他の市場で許可を得ても、私たちのワクチン製品は最初または永遠に利益を上げないかもしれません。
•新冠肺炎の大流行と関連する政府の公共衛生政策は引き続き変化し、これは新城疫-CoV 2373の商業成功の将来性に予測できない影響を与える可能性がある。
•私たちの多くの競争相手は明らかに多くの資源と経験を持っており、これは私たちと私たちの現在と未来のライセンス保有者のビジネス機会に否定的な影響を及ぼすかもしれない。
•新冠肺炎、インフルエンザと呼吸器合胞体ウイルスワクチンの開発は激しい競争に直面しており、著者らは候補ワクチンに投入された大量の資源は永遠に見返りが見られないかもしれない。
•私たちはFDAの完全な許可や私たちの候補ワクチンを販売するために必要な外国規制承認を得ることに成功できないかもしれない。
•私たちの製品は臨床試験でその主要な終点に到達できない可能性があり、これは私たちが全面的な規制承認に必要な臨床データを支持していないことを意味する。
•NVX-CoV 2373の制御経路は絶えず進化しており、予期せぬ或いは予見できない挑戦を招く可能性がある。
•我々はすでに,将来的に米国以外の地点でいくつかのNVX−CoV 2373の臨床試験を行う予定であり,FDAはこれらの地点での試験データを受け入れない可能性がある。
•その後、製品、製造業者、または施設に以前未知の問題が存在することが発見され、以前にある司法管轄区域で規制されていたワクチンを市場から引き下げることを含む制限を招く可能性がある。
•私たちの成功は私たちが私たちの技術の固有の性質を維持する能力があるかどうかにかかっている。
•もし私たちが私たちの業務開発計画を成功的に実行しなければ、私たちの業務は不利な影響を受けるかもしれない。
•我々の現在の現金状況とキャッシュフロー予測,および2023年の収入,米国政府からの資金,およびGaviの未解決仲裁に関する重大な不確実性を踏まえて,本年度報告書に含まれる財務諸表発表日から1年間経営を継続できるかどうかには大きな疑問がある。
•2027年に満期になった5.00%の転換優先無担保手形の返済には大量の現金が必要で、債務を返済するための十分なキャッシュフロー資源がないかもしれません。
•私たちの株価はずっと高度に変動し続けている可能性があるので、私たちの普通株の市場価格は予想以上に低いか不安定かもしれません。
•訴訟や規制機関の調査は、私たちの運営結果や財務状況に大きな悪影響を及ぼす可能性がある。
•私たちまたは私たちが依存している第三者は、新冠肺炎の大流行のような自然災害や人為的災害または突発的な公共衛生事件の悪影響を受ける可能性がある。
私たちの財務状況と資本要求に関連するリスク
私たちは赤字の歴史があり、未来の収益性も不確実だ。
1987年の設立以来、私たちの支出は収入を超えており、2022年12月31日までの累計赤字は43億ドルだった。私たちの収入と支出は異なる時期に大きく変動する。 私たちの歴史上のほとんどの時間、私たちの支出は私たちの収入を超えており、予測可能な未来には、このような状況はほとんどの時期に起こるかもしれない。我々の過去3会計年度の純損失はそれぞれ2022年の7億ドル、2021年の17億ドル、2020年の4億ドルだった。
歴史的に見ると、私たちの損失は主に私たちの候補ワクチンの研究開発費用、製造関連費用、規制部門の承認獲得に関する費用、私たちの知的財産権の保護に関するコスト、その他の一般と行政運営費用から来ており、その大部分は非現金である。設立以来、私たちの支出は私たちの収入を超えており、私たちは候補ワクチンの規制文書の開発、テスト、製造、提出に努力し、NVX-CoV 2373および必要な規制の承認を得た他の任意の候補製品を商業化するため、私たちの支出は時間の経過とともに変動し、いくつかの年に大幅に増加する可能性があると信じている。
2022年末まで、私たちのNVX-CoV 2373の開発と製造への投資は巨大であり、私たちはこのような投資レベルは2023年の残り時間と後に続くと予想しているが、私たちの総投資の正確な規模は新冠肺炎疫病の持続時間、競争構造、私たちが監督許可を申請した時間と結果、資金の可用性、そして政府、監督機関と医療保健提供者が強化注射方案を推薦するかどうか、どのような方案を推薦するかに依存する。もし私たちが間に合わなければ
もし十分な司法管轄区域で新冠肺炎ワクチンを商業化すれば、私たちは永遠に投資を回収できない可能性が高い。巨額の運営費が引き続き発生すると予想され、時間の経過とともに大きな損失が予想される
•より多くの臨床試験を行い、引き続きNVX-CoV 2373と他の潜在的候補ワクチンの監督部門の承認を求めた
•他の潜在的候補ワクチンの臨床前研究を展開する
•私たちの世界的な製造と流通能力を拡大し、NVX-CoV 2373を商業化する
•私たちの知的財産権の組み合わせを維持し、拡大し、保護する。
そのため、製品販売、許可料、特許権使用料、マイルストーン、契約研究、その他の源が十分な収入を生み出して、私たちの運営を十分に支援するまで、私たちの累積運営損失が増加することを予想しています。私たちは絶対に利益を達成しないかもしれないし、たとえ達成されても、持続的に利益を上げることができないかもしれない。
私たちは引き続き私たちの現在の運営レベルを維持し、候補ワクチンのさらなる開発に資金を提供するために多くの資金が必要だ。
私たちは現在、製品販売、許可料、特許権使用料、マイルストーン、契約研究、または他の源から十分な収入を得て、私たちの運営を十分に支援していません。したがって、私たちは私たちの現金資源を使用し、私たちの運営を維持するために追加の資金が必要であると予想され、私たちの研究開発計画を継続し、臨床前研究と臨床試験を推進し、規制部門の承認を求め、NVX-CoV 2373および任意の他の商業化が許可された候補製品を製造·販売する。
私たちはこれまで、主に株式や債務証券、政府資金や贈与プロトコル、NVX-CoV 2373の供給プロトコル(事前予約プロトコルとも呼ばれることもある)を売却することで運営に資金を提供してきた。購入者の前払いを含むNVX-CoV 2373の供給契約を締結しているにもかかわらず、このような合意から十分な製品収入を生成して私たちの運営を完全に支援することができる前に、追加の公共または私募株式または債務融資、ならびに既存の現金、潜在的な協力、戦略連合およびマーケティング、流通または許可手配、政府および非政府融資エンティティからの資金、および潜在的な他のソースによって私たちの現金需要に融資することが予想される。学術機関、非営利団体、政府実体から契約や支出を申請し続けるかもしれませんが、私たちは成功しないかもしれません。私たちは割引された条件で十分な追加資金を得ないかもしれないし、全くないかもしれない。さらに、臨床試験データに対する負の解読または挫折または感知の挫折は、NVX-CoV 2373または我々の他の候補ワクチンの製造能力および/または生産能力または監督管理申告スケジュールに関連しており、他の新冠肺炎ワクチンからなる競争構造は、有利な条件で追加融資を調達する能力を弱める可能性があり、甚だしきに至っては全くではない。さらに、いくつかの供給プロトコルによれば、関連する司法管轄区域でNVX-CoV 2373の必要な規制マイルストーンをタイムリーに実現することができない場合、政府諮問委員会から支持的な提案を得ることができ、および/または製品の数量または納期義務を達成することができない場合、購入者は、このような合意の終了、彼らの購入約束を減少させ、受信した前払いの全部または一部を返金することを求めることができるかもしれない, このような合意を再交渉することもできますもし私たちが予想される運営に必要な追加資金を集めることができない場合、私たちは、パートナーまたは他のパートナーとのいくつかの技術または候補ワクチンの権利の放棄を要求することを含む、私たちの1つまたは複数の研究または開発計画を大幅に延期、縮小または廃止すること、私たちの組織規模を削減すること、または破産を回避するための代替措置を求めることを要求されるかもしれない。将来的に普通株や他の証券を発行することでより多くの資金を調達すれば、このような発行により、現在の株主の会社における持株比率が希釈されることになり、これはかなり大きい可能性がある。未来の発行はまた私たちの普通株の価格に実質的な悪影響を及ぼすかもしれない。
経済と政治の不確実性は、私たちが資金を得る機会、資金コスト、および予定通りに業務計画を実行する能力に悪影響を及ぼす可能性がある。
全体的に言えば、全世界の経済状況は依然として不確定であり、特に新冠肺炎の疫病、利上げとインフレの影響による。さらに、私たちの行動と業績は、ロシアとウクライナの間の持続的な衝突を含む政治的または内乱または軍事行動の影響を受ける可能性がある。資本市場に参入する方法は
私たちの運営能力に必須的だ。伝統的に、バイオテクノロジー会社は株式市場で資金を調達することで、その研究開発支出に資金を提供する。過去、これらの市場の下落と不確定性は新資本の調達を深刻に制限し、企業が既存の開発、製造、監督管理、商業化努力を拡大し続けるか、あるいはそれに資金を提供する能力に影響を与えた。私たちの現在と予想されている運営には多くの資金が必要だ。米国と世界の全体的な経済·資本市場状況は過去に不安定であり、時々私たちが資本を獲得する機会に悪影響を与え、資本コストを増加させてきた。資本と信用市場は将来の資金調達活動を有利な条件で支持できないかもしれない。経済状況が低下すれば、私たちの将来の株式や債務資本コスト、資本市場に参入する機会は不利な影響を受ける可能性がある。また、有利な条件で資本市場に参入できなければ、想定されたビジネス計画を実行する能力が影響を受けるだろう。また、私たちは臨床研究組織、代行組織、その他の重要なサプライヤーとコンサルタントを含む第三者に依存し、依存するつもりである。世界的な経済状況は、私たちの第三者請負業者とサプライヤーの業績中断や遅延を招く可能性がある。もしこれらの第三者が私たちに対する彼らの契約約束をタイムリーに十分に履行できなければ、私たちの業務は不利な影響を受けるかもしれない。
私たちの既存の援助と供給協定は私たちの候補ワクチンが成功することを保証することができないか、あるいは私たちの候補ワクチンにすべての資金を提供することができるだろう。
我々は米国政府(“USG”)とCEPIとの資金協定で,NVX−CoV 2373の開発と商業化に関する費用の一部をそれぞれ精算した。もしこのような合意の資金約束が私たちがいくつかのマイルストーンまたは条件を満たすことを条件にすれば、私たちは最終的にすべての約束資金を受け取ることができず、私たちのNVX-CoV 2373の開発および商業化活動を支援するための追加資金が必要になる可能性があり、私たちはタイムリーに追加資金を得ることができないかもしれない。例えば、2021年7月には、USGパートナーシップからの資金について、USGは、より多くの米国製造を行う前に、我々の分析方法においてFDAと優先的に一致することを指示し、USGは、このような一致に達するまで、2022年6月までより多くの米国製造に資金を提供しないことを示している。2023年2月、“米国政府協定”改正17の実行について、米国政府は、この裁決を現在の履行期間を超えるまで延長してはならないと表明した。もしUSG協定が私たちが以前に予想していたように修正されなかったら、私たちはUSG協定によって予想されていた残り4.16億ドルの資金を受け取ることができないかもしれない。米国政府協定には、資金援助されたプロジェクトが資源支出に見合った有益な結果を生じないことを決定し、終了することが米国政府の利益に合致することに基づいて、米国政府に終了の権利を与える条項も含まれている。このような決定は、この合意下での資金損失を招き、米国政府の他の行動を招く可能性がある。同時に、CEPIの資金協定は、CEPIがいくつかの合意に違反した場合のいくつかの“進入”権利を規定する。他にも参加しました, そして、私たちのワクチン開発および製造のための資金提供を支援するために、購入者の前払いを含むNVX−CoV 2373の供給プロトコル(場合によっては予約プロトコルとも呼ばれる)を継続して締結することが計画されている。いくつかの供給協定によれば、関連する司法管轄区域でNVX-CoV 2373の必要な規制マイルストーンをタイムリーに実現することができない場合、政府諮問委員会から支持的な提案を得ることができ、および/または製品の数量または納期義務を達成することができない場合、買い手は、このような合意の終了を要求すること、その調達約束を減少させること、受信した事前支払いの全部または一部を返却すること、またはそのような合意を再交渉することを要求することができ、すべてが私たちの財務状況に重大な悪影響を及ぼす可能性がある。例えば、イギリスの規制部門の承認を遅延させた後、2022年7月に、元のイギリス供給協定を改訂および再改訂されたイギリス供給協定を締結し、元のイギリス供給協定と比較して、管理局が購入を承諾したワクチン投与量を減少させる。2022年11月30日現在、イギリスのワクチン接種·免疫合同委員会は、NVX-CoV 2373について支持提案を提出しておらず、改訂と再決定されたイギリスの供給協定の条項に基づいて、管理局が購入を承諾したワクチンの投与量をさらに減少させ、同社が以前に管理局から受け取った1億125億ドルの前払い義務を返済することにつながった。さらに、GaviにGavi APAの終了を通知した後、GaviはGavi APAを終了したと主張し、Gaviから受け取る前にGaviから受け取った6.974億ドルの前払いを返還する義務があると主張した。2023年1月31日, NovavaxはGaviがこの紛争について提起した仲裁要請を受けた。仲裁自体は不確実であり、私たちはGaviから受け取った前払いを保留する権利があると考えているが、Gaviの前払いの全部または一部を返金することを要求する可能性もある。したがって、私たちの既存の資金と供給協定は私たちの候補ワクチンの成功を確保することができず、候補ワクチンの開発と商業化に十分な資金を提供するのに十分ではないかもしれない。
製品開発と商業化に関するリスク
私たちのワクチン製品開発は急速に発展する新しい技術に依存しているため、私たちの努力は成功しないかもしれない。
私たちのワクチン開発は急速に発展する新しい技術と、私たちの製品の即売性と収益性に依存しています。私たちの開発努力と成功すれば、NVX-CoV 2373と私たちの他のワクチンの商業化は様々な理由で失敗するかもしれません
•私たちの組換えナノワクチン技術、そのような技術に基づく任意のまたはすべての製品、または私たちの独自の製造プロセスは、無効または安全ではないことが証明された
•新しい新冠肺炎毒株は絶えず進化し、新城疫CoV 2373はその治療効果が比較的に悪いことが証明された
•私たちまたは私たちの第三者メーカー工場は、合理的なコストと予測された期間で十分な高生産量で生産を繰り返し拡大し、維持することができなかったか、またはそのような生産は、規制部門の承認または商業実行可能性を達成するために必要な純度、効力、品質、安定性、および賞味期限基準を常に満たしていない製品を生産できなかった
•製品は市場と生産に経済的ではない
•私たちまたは私たちの第三者パートナーが生産した製品の一部または全部は、規制当局が規制承認を完了する際に適用される基準に基づいて販売できないと判断される可能性があります
•私たちの内部または第三者製造施設は規制検査を通過していない
•第三者の独自の権利は、私たちまたは私たちの協力者が技術を使用し、製品を製造または販売することを阻止する;または
•第三者競争相手は、より早い承認または優れたマーケティング能力により、より大きな市場シェアを獲得し、維持している。
我々の新冠肺炎候補ワクチンNVX-CoV 2373の監督管理と商業上の成功はまだ確定していない。私たちはすでに複数の管轄区域でNVX-CoV 2373の一時登録、条件付き上場許可、または緊急使用許可を得ているが、私たちはアメリカや他の司法管轄区で全面的な規制許可を得ることができないか、あるいは成功したワクチンを適時に生産することができないかもしれない。
新冠肺炎の発生に対応するために,候補ワクチンNVX−CoV 2373の開発と製造に取り組んでいる。1期、2期、3期の臨床試験の積極的なデータを報告しましたが、私たちとパートナーは、世界保健機関とアメリカ、カナダ、オーストラリア、ニュージーランド、EU、イギリス、インド、インドネシア、フィリピン、シンガポールから一時登録、条件付き上場許可または緊急使用許可、韓国の完全な承認を得ていますが、これらの結果は、加速の有無にかかわらず、スケジュール内の任意の他の関連司法管轄区域の規制提出、許可、承認を支持するのに十分ではないかもしれません。
また、NVX-CoV 2373は、ある司法管轄区域で規制許可を得ており、他の管轄区域でさらなる規制承認を得る可能性があるにもかかわらず、商業化に成功することは、私たち自身および私たちの製造パートナーおよび請負業者の製造能力を効果的に拡大し、維持する能力があるかどうかにかかっている。2020年5月にNovavax CZ(前身はPraha Vaccines,A.S.)を買収したチェコ共和国のBohumilのワクチン製造工場と約150人の従業員を含むが、私たちはまだこの場所で商業ロットを生産したり、規制の承認を得ていない。NVX-CoV 2373抗原成分と独自のMatrix-Mを生産するために第三者と積極的に合意しています™ アジュバント、およびNVX−CoV 2373を配布する。契約の制限と関連する専門知識を持つ第三者メーカーの数が限られているため、商業規模でNVX-CoV 2373とそのコンポーネントを製造するためには、監督管理の承認と施設が必要であり、交換することができる
製造業者たちは高価で時間がかかるかもしれないし、生産中断を招く可能性がある。NVX-CoV 2373及びそのコンポーネントの製造は複雑な過程に関連し、大量の時間と財力を投入して実施する必要があり、私たちの製造能力を確立と維持する努力は時間、規模、再現性、生産量、純度、コスト、効力或いは品質の期待を達成できない可能性がある。原材料と供給品の不足もまた私たちの製造努力に否定的な影響を与えた。我々は、世界的な需要を満たすために、十分な数のNVX-CoV 2373の規制承認をタイムリーに効率的に生産または得ることができない可能性がある。
著者らはワクチン製品の商業化発売における経験が限られており、しかも大流行環境下でこの仕事を展開し、緊迫、肝心な全世界の需要を持っており、これは追加の挑戦をもたらした。私たちの製造能力を拡大するほか、世界各地の第三者とパートナーシップを構築し、より多くの管理、行政、販売、マーケティングを採用、訓練、統合する必要があります。迅速かつ顕著な成長は私たちの行政と運営インフラに圧力を与え、私たちの組織に重大な追加責任をもたらす可能性があり、私たちのこれらの能力の確立と維持の努力は時間、規模、再現性、生産量、純度、コスト、効力或いは品質の方面での期待を達成できないかもしれない。もし私たちが私たちの成長と私たちのますます複雑な運営をうまく管理できなければ、私たちの業務、財務状況、運営結果、見通しは実質的な悪影響を受けるかもしれない。
SARS-CoV-2ウイルス変種の出現と伝播性、及び二価ワクチンに対する需要は、市場のNVX-CoV 2373に対する受け入れ或いは販売に影響する可能性があり、著者らは新しい冠肺炎ワクチンバージョンを開発してある変種を防ぐ戦略は成功しないかもしれない。
我々の新冠肺炎ワクチン原型NVX−CoV 2373は,2019年12月に初めて発見されたSARS−CoV−2ウイルスの遺伝子配列に基づいて開発された一価ワクチンである。SARS-CoV-2ウイルスの継続進化に伴い、新しいウイルス株或いはすでに流通中のウイルス株はこれまでの主要な毒株より伝播性があることが証明され、或いは更に深刻な新冠肺炎疾患を招く可能性がある。例えば、オミックとデルタ航空の変種は以前の変種よりも伝播性や伝染性が観察された。
NVX−CoV 2373は,これらや他の未来変異株の予防にはそれほど有効ではない可能性がある。さらに、NVX-CoV 2373の需要に悪影響を及ぼす可能性があり、特に米国では、米国での緊急使用許可を含む多くの資金が必要となる可能性があるが、NVX-CoV 2373の需要が増加するにつれて、NVX-CoV 2373の需要が増加するにつれて、NVX-CoV 2373は市場承認、一時登録、条件付きマーケティング許可または緊急使用許可を得られないかもしれないが、変種特定または二価ワクチンの需要が増加するにつれて、NVX-CoV 2373は市場承認または大量販売を得ることができない可能性がある。我々はいくつかの変種に対する候補ワクチンが開発されており,オミックの亜変種と,NVX−CoV 2373とともに二価製剤が開発されており,将来的には他のワクチンも開発される可能性がある。しかし、これらの努力が成功しなければ、これらの候補ワクチンは迅速に規制部門の承認を得ておらず、私たちは変種特定のワクチンまたは二価ワクチンを開発する速度が競争相手よりも遅く、これらの候補ワクチンは競争相手のワクチンよりも有効であることが証明されたか、または承認されると、これらの候補ワクチンを製造、流通、またはマーケティングすることに成功できず、これらの欠陥は名声損害、市場シェア損失、および不利な財務結果を招く可能性がある。
私たちの2023年の収入は私たちが開発、製造、流通或いはマーケティングに成功できるかどうかにかかっており、2023年秋の新冠ワクチンシーズンの新冠肺炎候補ワクチンの最新単価或いは二価調合は、それ自体に不確定性があり、規制承認を含む多くのリスクの影響を受けている。2023年初め、著者らはBA.5臨床試験材料の生産に遅延があり、これは2023年秋のCOVIDワクチン季節候補ワクチンに対するFDAの監督管理許可を延期する可能性がある。また、2023年1月、アメリカワクチン及び関連生物製品諮問委員会(VRBPAC)は2023年第2四半期に業界に2023年秋のCOVIDワクチン季節の毒株方案ガイドラインを提供する予定であることを発表した。2023年秋の潜在的需要を満たすために、著者らは菌株方案ガイドラインを提供する前に、更新された新冠肺炎変異菌株製剤の生産を開始する予定である。もし私たちが毒株方案のガイドラインに合わない処方を生産し始めたら、私たちは2023年秋のCOVIDワクチン季節に私たちの顧客に十分な数の適切なワクチンを提供することができなくなり、私たちは販売できない処方に大きなコストを発生させる。
さらに、我々の既存の供給プロトコルのいくつかの取引相手は、NVX-CoV 2373の代わりに特定の変種ワクチンを要求する可能性があり、私たちがいつ特定の変種ワクチンを提供することができるか(あれば)、これらの取引相手は、そのような供給プロトコルのすべての財務的利益を達成する能力に悪影響を及ぼす可能性がある。さらに、NVX-CoV 2373に適応するために多くの資源がかかるかもしれません
あるいはSARS−CoV−2ウイルスの変種を予防するために臨床試験を行うが,このような改装ワクチンの市場は発展しない可能性があり,需要はわれわれの予測やコスト支出と一致しない可能性がある。
私たちはバイオテクノロジー会社で、私たちの製品を開発、製造、商業化する際に大きなリスクに直面しています。
私たちはワクチンの研究開発活動に集中しており、私たちはこの分野で特別な利点と有望そうな技術を持っていると思います。どんな研究開発計画の結果も高度に不確実だ。一部の生物製薬開発計画は最終的に商業製品、甚だしきに至っては候補製品を生成するだけであり、多くの事件は私たちの開発努力を延期し、予想されたスケジュール内に監督書類を提出したり、規制承認、製造、マーケティング、およびNVX-CoV 2373または任意の他のワクチンを販売する能力にマイナス影響を与える可能性がある。最初に有望に見える候補ワクチンは往々にして成功した製品を生産できず、最終的には私たちの候補製品をマーケティングするために規制許可を得たり維持したりするために必要な安全性、効力、純度、安定性、有効性を証明できない可能性がある。多くの場合、臨床前研究または臨床試験は、候補製品が無効であること、またはそれが安全問題を引き起こすこと、または他の副作用が予想を超える利点を有することを示すであろう。臨床前或いは早期臨床試験の成功は大規模臨床試験の成功に転化しない可能性がある。そのほか、臨床試験の成功は往々にして投資増加を招き、累積損失を加速する。臨床試験結果が積極的に見えても,FDAや外国の同業者が結果の解釈に同意しなければ,規制承認を得ることができない可能性があり,生産過程をビジネスレベルに拡大する際には,挑戦に直面する可能性がある。製品が承認され、発売された後であっても、一般用途または発売後の臨床試験では、その製品に安全性または他の以前に未知の問題があることが発見される可能性があり、または製造問題が生じる可能性があり、いずれの場合も、規制承認が一時停止される可能性がある, 承認または撤回の範囲を縮小することに限られ、そうでなければ成功の商業化を阻害する可能性がある。ワクチン産業の激しい競争はまた、私たちが商業的に承認されたどんな製品の商業化に成功するかを制限するかもしれない。
私たちがアメリカ特許商標局の商標登録を取得したかどうかにかかわらず、私たちは私たちの製品に使用しようとしている任意の名前をFDAが承認する必要があります。FDAは、通常、他の製品名と混同される可能性がある可能性を含む、提案された製品名を検討する。FDAが我々が提出した任意の製品名が医療クレームを適切に示唆していないと考えた場合,その名称に反対する可能性がある。FDAが私たちが提案したどんな製品名にも反対すれば、私たちは私たちが提案した製品のために別の名前を採用するように要求されるかもしれない。代替名称を採用する場合、私たちは、その開発候補製品に対する任意の既存の商標出願の利点を失い、適用商標法の資格に適合し、第三者の既存の権利を侵害せず、FDAのために受け入れられる適切な製品名を識別するために、多くの追加資源を要することが要求される可能性がある。私たちは新しい商標のための成功したブランド表示をタイムリーにまたは根本的に確立することができないかもしれないが、承認されれば、製品を商業化する能力を制限するだろう。
著者らは第三者に依存していくつかの実験室テストと臨床試験を行って、そして私たちの大量のワクチンの製造と流通のため、私たちは製品の開発と供給の努力の中で遅延或いはいくつかの制御を失う可能性がある。
著者らは第三者組織に依存していくつかの実験室テストと臨床試験を行い、著者らの大量のワクチン製造活動と流通を行った。もし私たちが受け入れ可能な条件で必要なサービスを得ることができなければ、私たちの製品開発や商業化努力をタイムリーに完成させることができないかもしれない。私たちはこのような活動に対する統制を失ったり、このような政党に依存しすぎたりするかもしれない。これらの第三者は、計画通りにテスト、製造、または流通活動を完了できないか、または法規または商業要件を満たすことができない可能性がある。特に,我々は現在,SIIPLとSLSに完全に依存して共通レシピ,充填,NVX-CoV 2373を整理している.SLSが私たちに十分な共同処方、充填および完了サービスを提供できない場合、規制要件を満たしていない場合、または他の方法で私たちの義務を滞納することができない場合、私たちは、他のプロバイダから代替共同処方、充填および完了サービスをタイムリーまたは根本的に得ることができない可能性があり、これは、顧客注文の交付を阻止または遅延させるか、または他の方法で私たちの業務に負の影響を与える可能性がある。私たちのいくつかの施設も規定された時間枠に従ってUSGやCEPIと契約を締結しており、十分な時間でこれらの施設を使用して十分な供給を提供できないかもしれません
われわれのすべての臨床試験がその全体的な研究計画と案に沿って行われていることを確認する責任がある。また、fdaと外国の監督機関は、データと報告の結果が信頼性と正確であることを保証し、臨床試験の権利、安全性、福祉を確保するために、臨床試験結果を行い、記録し、報告する法規と標準を遵守することを要求している
参加者たちは十分に保護された。FDAと外国規制機関はまた私たちに良い製造実践を遵守することを要求する。私たちの第三者への依存は私たちのこのような責任と要求を免除することができない。このような第三者はその契約義務や規制義務を成功的に履行できないかもしれない。さらに、第三者製造業者が自分または他の会社のために材料または製品を生産する場合、その製造業者は、そのような材料および製品を生産する際に規制リスクに直面する。したがって、これらの材料や製品を生産する法規要求を満たすことができなければ、通常、第三者メーカー工場の法規状態に影響を与え、私たちの材料や製品を生産する能力に影響を与える可能性がある。私たちの任意の第三者サービスプロバイダは交換する必要があるかもしれません。彼らが取得したデータの品質または正確性は影響を受ける可能性があり、私たちに提供されるサービスは遅延する可能性があります。または彼らが生産した製品は、私たちの臨床および製造協定、法規要件、または他の理由に準拠できずに汚染されて使用できないかもしれません。どのような場合でも、私たちの臨床前開発活動または臨床試験は延長、延期、一時停止または終了される可能性があり、私たちは監督部門の承認を得ることができないか、あるいは私たちの候補ワクチンを適時に商業化生産することに成功できないかもしれない。
Prepare試験の結果,ResVaxが試験の主要な終点に到達できなかったことを含め,このワクチンのさらなる開発に挑戦をもたらす可能性があり,その中のいくつかは重大である可能性がある。
準備の結果,RSV候補ワクチンの項目名ResVaxは安全であり,より重篤なRSV疾患症状に有効である可能性が示唆されたが,この試験はその主要な臨床終点には至らなかった。主要な臨床的終点を達成しなかったのは私たちの投資家たちによって否定的だった。試験中に主要な終点に到達できなかったことはワクチン無効の証拠ではないが,これはFDAや欧州医薬品局(EMA)のような規制機関が許可を得る前に追加の臨床試験データが必要である可能性があることを意味する。私たちの潜在的な協力者とパートナーはこの進展に対して否定的な見方をするかもしれないが、これはResVaxと私たちの他のRSV F候補ワクチンの将来の開発をより挑戦的にするかもしれない。
私たちは製品責任があるかもしれません。
ヒトに薬物或いはワクチンを投与することは、臨床試験においても発売承認後であっても、製品責任クレームを招く可能性がある。我々は我々のNVX-CoV 2373試験とNVX-CoV 2373の商業化を含む現在の臨床プロジェクトに製品責任保険を提供する。しかし、私たちは責任による損失から私たちを保護するために、商業的に合理的な条項、合理的なコスト、または十分な金額で追加の保険を獲得したり、保険範囲を維持することができないかもしれない。しかも、このような保険カバー範囲と私たちの資源は、製品責任クレームによって生じるすべての債務を満たすのに十分ではないかもしれない。クレームの成功は、もし本当にあれば、私たちが未来に商業的に適切な条項で十分な製品責任保険を得ることを阻止するかもしれない。クレームが成功しなくても、このようなクレームを弁護するのは時間的で高価であり、市場での私たちの名声を損なう可能性があり、経営陣の注意をそらす可能性がある。
さらに、世界的に大流行した新冠肺炎の発生に対応するためにNVX-CoV 2373を開発しているため、世界保健機関とアメリカ、カナダ、オーストラリア、ニュージーランド、EU、イギリス、インド、インドネシア、フィリピン、シンガポールの一時登録、条件付きマーケティング許可または緊急使用許可、韓国の完全な許可を得ており、研究ワクチンとして広く使用されているワクチンや、他の管轄区域の発売許可を受ける前に一時的または緊急使用が許可されている製品もあります。これらの場合、意外な安全問題は製品責任クレームを招く可能性があり、私たちの既存の保険はこのようなクレームを処理するのに十分ではないかもしれない。
是非曲直や最終結果にかかわらず、賠償責任は
•私たちの製品への需要が減少しました
•規制の権限と承認を撤回する
•私たちの製品を自発的にまたは強制的にリコールします
•追加の非臨床的または臨床的研究、ラベルの変更、または製造プロセス、仕様、および/または施設の変更が必要であるかどうか
•私たちのビジネス的名声とメディアの否定的な関心を損なう
•臨床試験参加者の脱退
•関連訴訟費用
•参加者や他のクレーム者に巨額のお金の報酬を提供し
•収入の損失
•候補ワクチンを商業化することはできません
米国では、“予備法”は適用された場合、州または連邦法による“カバー反措置”の管理または使用による“損失”に対するすべてのクレームを免れるためにメーカーに免除権を提供している。しかし、場合によっては、被害者は“故意に失墜した”という罪でメーカーに訴訟を起こすことができる。カバーされた対策“には、安全対策および”合格した大流行または流行病製品“が含まれ、大流行または流行病の診断または治療を目的とした製品、例えば大流行ワクチン、およびそのような製品による状況を解決するための治療が含まれる。これらの免除を適用するために、国土安全保障省長官は“予備法”を引用し、突発的な公衆衛生事件或いは未来の突発公共衛生事件の“信頼できるリスク”が存在することを表明する声明を発表しなければならない。この“予備法”宣言は,PHEやEUA宣言などの他の宣言とは別に,他の事項に加えて,“予備法”の免除の範囲と期限が規定されている.2020年3月17日、国土安全保障省長官は“準備法案”に基づいて声明を発表し、新たな肺炎の大流行のある対策に関する活動に責任免除を提供するためのその後の改正案を発表した。現在の申告は更新しない限り2024年10月1日に終了する。私たちの製品は現在の予備法声明に含まれていると信じていますが、これは保証されません。さらに、HHS長官は将来、私たちの他の候補製品を含む他の声明を発表しないかもしれませんが、アメリカ議会はPrep Actでのカバー範囲を減らしたり、完全に廃止したりする可能性があります。製品責任訴訟は大量の責任を招く可能性があり、私たちの候補製品の商業化を制限することを要求するかもしれない。
私たちのワクチンを十分な生産量で効率的に生産できない場合、あるいは監督機関の私たちのワクチン製造施設の承認を得ることができなければ、製品開発、臨床試験、監督管理の承認、商業流通の面で遅延や不利な影響を受ける可能性がある。
私たちはNVX-CoV 2373の製造、流通、臨床テストを継続しています。これは私たちの現在唯一の商業製品と製品の収入源です。我々のNVX−CoV 2373および他の候補ワクチンの臨床試験および商業化を達成するためには、NVX−CoV 2373および他の候補ワクチンを十分な生産量および商業規模で効率的に生産するために、施設を獲得または開発する必要がある。私たちは商業販売に必要な数量を支援するためにどんな候補ワクチンを生産するかについて経験が限られている。NVX-CoV 2373の全世界製造能力を向上させたが、製造能力の確立と維持に向けた我々の努力は、タイミング、規模、再現性、生産量、純度、コスト、効力または品質の期待を達成できないかもしれない。例えば、私たちは2023年初めに私たちのBA.5臨床試験材料の生産を遅延させ、これは私たちの2023年秋のCOVIDワクチン季節候補ワクチンに対するFDAの規制承認を延期するかもしれない。私たちは第三者組織が大量のワクチン生産活動を行うことに強く依存している。NVX-CoV 2373の世界的な商業化を支援するための十分な内部製造インフラがなく、NVX-CoV 2373の部品および商業充填加工について第三者協定を締結した。NVX−CoV 2373の抗原成分は現在,インドのSIIPLと韓国のSK Bioscience,Matrix−Mを含むNovavax CZおよび協力製造地点で生産されているTMNVX−CoV 2373のアジュバント成分は現在,ヨーロッパのAGC Biologicsを含むNovavax ABおよび他の協力製造拠点で生産されている。抗原成分またはアジュバントの製造の課題、または後期製造段階の問題は、NVX−CoV 2373の生産に影響を及ぼす可能性があるさらに、我々は現在、SIIPLおよびSLSに完全に依存してNVX-CoV 2373を共同調製、充填、および完了しており、サプライヤーを失うと顧客注文の納品を阻止または延期する可能性がある。
また、十分な在庫供給を確保し、当社の運営を管理するために、予想される製造需要と顧客需要を予測して、在庫需要を予測し、第三者に注文します
製造業者はこのような予測に基づいている。著者らはNVX-CoV 2373需要の能力が著者らの商業戦略を管理する挑戦、一般市場条件或いは監督事項の意外な変化、及び新冠肺炎変種ワクチンに対する市場の需要などを含む多くの要素の負の影響を受ける可能性があることを正確に予測した。もし私たちが私たちの第三者の製造需要を過小評価した場合、私たちは顧客供給協定によって規定された義務をタイムリーに履行できないかもしれない。逆に、私たちが第三者の製造需要を過大評価した場合、最終的には在庫レベルが顧客の需要を超え、一部の在庫が時代遅れや期限切れになってしまう可能性があり、在庫の減記やログアウト、あるいは第三者メーカーが以前に予測した製品ロットをキャンセルする必要がある可能性があり、材料のキャンセル費用につながる可能性があります。例えば、2022年9月に富士と秘密和解協定を締結して釈放し、この合意に基づき、富士に製造活動中止に関する1億85億ドルの賠償を担当しなければならない。また,2022年12月には,2022年の撤廃ロットに関連する約9500万ドルの費用をAGC Biologicsに支払うことに同意した。NVX-CoV 2373の需要と第三者メーカーに必要なサービスを正確に予測できなければ、私たちの運営結果は実質的な損害を受ける可能性があります。
NVX-CoV 2373の生産と他の候補ワクチンの生産は複雑な過程に関連しており、私たちはこの経験が限られている。もし私たちと私たちの第三者製造業者が臨床数量のNVX-CoV 2373と他の候補ワクチンを生産できない場合、あるいは必要に応じて商業数量、十分な生産量、および必要な仕様でNVX-CoV 2373および私たちの他の候補ワクチンを生産できない場合、臨床試験および商業化は延期され、より多くの第三者との供給計画を決定し、達成する必要があるだろう。第三者メーカーはまた、臨床材料や商業製品を生産するために、FDAまたは同等の外国規制機関の承認を得なければならず、遅延を招き、私たちの生産計画を変更する可能性がある。私たちのワクチンは他の製品とこれらの第三者施設に入る機会を競争しており、第三者が他の製品を優先すると、生産が遅延される可能性がある。私たちは許容可能な条項やタイムリーに必要な追加の第三者製造計画を達成することができないかもしれない。また,技術移転協定を締結し,第三者メーカーとノウハウを共有しなければならず,時間がかかり,遅延を招く可能性がある.
契約制限と専門知識を持つ第三者メーカーの数量が限られているため、商業規模で大口ワクチンを生産するために監督管理許可と施設が必要であり、交換メーカーは高価で時間がかかる可能性があり、私たちのワクチン生産中断を招く可能性があり、そして私たちが適時に顧客供給協定下の義務を履行する能力にマイナス影響を与える可能性がある。私たちと私たちの第三者メーカーはまた、以下のような生産課題に直面する可能性があります
•コスト、規模拡大、収益
•原材料や用品が不足しています
•出荷遅延や他のサプライチェーン中断
•品質管理と保証
•汚染、ロット一貫性、効力、純度
•合格者不足と他の能力制限
•製品を販売する可能性のある国ごとに異なる連邦、州、外国法規を厳格に実行し、発展させていく連邦、州、外国法規は、私たちが所有しているおよび第三者製造拠点に適用される国有化または他の地域制限を含む
•資本資金。
遅延または中断は、私たちの業務、財務状況、運営結果、およびキャッシュフローに実質的な悪影響を及ぼす可能性があります。
私たちは私たちの技術を使って開発のためのワクチンを決定し、成功した第三者関係を構築しなければならない。
著者らの候補ワクチンの最近と長期実行可能性はある程度私たちが製薬と生物技術会社、非営利組織と政府機関と新しい戦略協力関係を構築することに成功できるかどうかにかかっている。戦略的協力を確立して政府資金を得ることは難しくて時間がかかる。潜在的な協力者は、私たちの財務、規制、または知的財産権状況の評価に基づいて、または彼らの内部チャネルに基づいて協力を拒否するかもしれない;政府機関は、公共需要、公共利益、私たちの製品がこれらの分野を解決する能力、または私たちの予想または制御を超えた他の理由の評価に基づいて、契約または承認申請を拒否するかもしれない。協力者たちはまた関係を修正したり終わらせたりすることを求めることができる。 過去に製薬やバイオテクノロジー会社、非営利組織、政府機関との戦略協力の構築に成功し、今後新たな関係の構築や既存の関係の下で成功することは保証されていない。もし私たちが受け入れ可能な条件下で十分な数の協力や政府関係を構築できなかった場合、あるいは相手を満足させる協力や関係の下で仕事を展開できなかった場合、私たちの候補ワクチンを商業化することができず、さらなる研究と開発を支援するのに十分な収入を生み出すことができないかもしれない。
私たちが設立または構築可能な協力は、どの候補ワクチンの開発や商業化にもつながらないかもしれない
•私たちは私たちのパートナーの活動をコントロールすることができないかもしれないし、候補ワクチンの許可、開発、商業化を含む、彼らが私たちの義務をタイムリーにまたは根本的に履行しないという保証もないかもしれない
•そのようなパートナーは、私たちの候補ワクチンに十分な資源を投入していないか、または私たちの知的財産権を適切に維持または保護していないかもしれない
•我々のパートナーは、競争力のある製品がより成功する可能性があると考えているか、または私たちよりも経済的に魅力的な条項で商業化できることを前提として、第三者と共に当社の候補ワクチンと直接または間接的に競合する製品を開発または開発することができる
•私たちのパートナーが私たちへの義務を履行または履行できなかったことは、候補ワクチンの開発や商業化の遅延を招き、製品収入を達成する能力に影響を与える可能性があります
•このような協力者が開発した技術との所有権紛争を含む分岐は、訴訟を引き起こす可能性があり、これは時間と費用がかかり、研究開発作業、監督許可、商業化活動を遅延または中止する可能性がある。
もし私たちまたは私たちの協力者が私たちの既存の合意を維持できなかったり、必要に応じて合意を確立できなかった場合、私たちは研究、開発、製造、商業化活動を完全に自費で行うことを要求されるかもしれません。これらの活動は私たちの資本需要を著しく増加させ、私たちは販売、マーケティング、流通能力が不足していることを考慮して、候補ワクチンの商業化を大幅に延期した。
私たちはNVX-CoV 2373の商業成功に強く依存しています。たとえ私たちがいくつかの司法管轄区域でNVX-CoV 2373の一時登録、条件付きマーケティング許可、または緊急使用許可を得ても、私たちの製品が他の市場で許可を得ても、私たちのワクチン製品は最初または永遠に利益を上げないかもしれません。
私たちはNVX-CoV 2373のビジネス成功に強く依存しています。これは私たちの現在唯一の商業製品と製品収入源です。私たちがワクチン製品を販売することから利益を得るかどうかは、私たちがワクチン製品を製造、テスト、発表し、包装し、そのようなワクチン製品を輸送するコストを含む多くの変数に依存する。さらに、CEPI支援協定は、いくつかの中低所得国に一定の用量のNVX-CoV 2373を割り当てることを要求し、ビルとメリンダ·ゲイツ財団との贈与協定は、特定の中低所得国で特定の数のNVX-CoV 2373を販売することを約束することを要求する
私たちが利益を創出する能力に否定的な影響を及ぼす。私たちは私たちが承認したワクチン製品がいつ会社に利益をもたらすか予測できません。最終的に、私たちは私たちの製品から十分な収入を生み出して、利益を達成したり、維持したり、私たちの予想されている運営レベルを維持したりしないかもしれません。
私たちが単独であるいは協力して私たちの任意の候補ワクチンを商業化することに成功しても、私たちは価格設定、第三者清算、医療改革の不確実性に直面しており、これらはすべて変化する可能性があり、私たちの候補ワクチンの任意の商業成功に悪影響を及ぼす可能性がある。
ワクチンの商業販売から収入を得る能力は、当社および任意の現在または潜在的なパートナーまたは顧客が第三者支払先から取得し、このような製品の十分な承認、カバー範囲、および精算レベルを維持する能力に依存する可能性がある
•疾病コントロールと予防センター免疫やり方諮問委員会のような政府衛生行政機関
•民間健康保険会社
•保健組織を管理し
•薬局福祉管理会社
•他の医療関連組織です
第三者支払者は、処方製品がFDAまたは外国同等機関または他の政府規制機関の適切な許可を得ていないと判断した場合、第三者支払者によって決定された費用効果のある治療方法に従って使用されていないか、または試験的、不必要または不適切であると判断した場合、保証を拒否するか、または不十分な補償レベルを提供する可能性がある医療製品の課金に疑問を提起するようになっている。医療製品の使用に影響を及ぼす管理型ヘルスケア組織も価格を下げる可能性がある。
米国や一部の外国司法管轄地域では、すでに多くの立法·規制提言やイニシアティブがあり、ワクチン販売能力に影響を与える可能性のある方法で医療システムを変更することを目的としており、承認されれば、候補ワクチンの価格に悪影響を及ぼす可能性がある。その中のいくつかの提案と実施された改革は薬品定価或いは医療製品の販売率を低下させる可能性があり、私たちは現在商業販売に使用できるワクチンがないが、ある外国司法管轄区では、一時登録、条件付きマーケティング許可或いは緊急使用許可を有する以外に、このような改革の影響は私たちの業務戦略、運営と財務業績に不利な影響を与える可能性がある。例えば、“平価医療法案”(“ACA”)には、例えば、ブランド処方薬の医療補助下の医薬品のリベートを増加させ、医療補助リベートを医療補助管理の医療機関に拡大することと、特定の医療保健提供者に販売される薬品のいわゆる340 B割引定価を延長することとを含む、私たちの将来の収入に悪影響を及ぼす可能性のあるコスト制御措置がいくつか含まれている。医療改革法で将来の収入や利益の見通しに悪影響を及ぼす可能性のある他の条項には、特定の政府計画(連邦医療保険や医療補助を含む)におけるブランド処方薬の売上高の割合に基づいて年会費を評価することが含まれている。ACAはまた連邦医療保険D部分カバーギャップ割引計画を構築し、メーカーは適用ブランド薬品(ワクチンを含む)の交渉価格に基づいて、そのカバーギャップ期間(いわゆる“ドーナツ穴”)が条件を満たす受益者に70%の販売時点割引を提供することに同意しなければならない, メーカーとしての外来薬が連邦医療保険D部の条件に組み込まれており,医療改革の他に,政府の法執行権力の拡大やコンプライアンス関連コストを増加させる可能性のあるより高い基準など,我々の業務に影響を与える可能性もある。
さらに、たまには政治的、立法的、行政的努力があり、ACAの条項の一部または全部を大幅に修正または廃止する不確実性に直面している。例えば、2017年、トランプ政権は低所得加入者にサービスするACA医療保険交換計画に支払う費用分担手当を差し押さえた。減税·雇用法案(TCJA)も2017年末に公布され、医療保険のカバー範囲や支払いに影響を与える条項、例えば2019年から十分な医療保険のカバー範囲を維持していない個人に対する税収処罰(いわゆる“個人強制令”)が廃止された
“2021年米国救援計画法案”により、バイデン政府はACA医療保険取引所で購入した保険への補助金を増加させ、補助金を得る資格をより高い収入水準に拡大した。2018年12月14日,テキサス州北区の米国地方裁判所判事は,個人強制令はACAの鍵と不可分の特徴であるため,TCJAの一部として廃止されたため,ACAの残り条項も無効であると判断した。2019年12月18日、米国第五巡回控訴裁判所は、個人強制令は違憲であると判断したが、ACAの残り条項も無効であるかどうかを決定するために、事件を地域裁判所に返送した。2020年3月2日,米国最高裁はこの事件の審査を求める移審令状の要望書を承認し,2020年11月10日に口頭弁論を聴取した。2021年6月17日、米国最高裁はいくつかの州がACAに対して提出した最新の司法挑戦を却下したが、ACAの合憲性を具体的に裁くことはなかった。また,総裁·バイデンはACA市場による医療保険の獲得を目的とした2021年2月15日から2021年8月15日までの特殊保険期間を開始する行政命令を発表した。行政命令はまた、作業要求を含む医療補助モデル項目および免除計画の再検討、医療補助またはACAによる医療保険カバー範囲の獲得による不必要な障害をもたらす政策の再検討、医療補助またはACAによる医療保険の取得を制限する既存の政策および規則の見直しを指示する。2022年4月5日, バイデン政府は行政命令を出し、“米国人の医療保険取得に関する機関を担当する”“機関の行動を審査し、負担になる医療保険の獲得可能性を拡大し続ける方法を決定する”と指示した。バイデン政府のこれらや他の医療改革措置,あるいはACAに代わる他の挑戦,廃止または代替の努力が我々の業務にどのように影響するかも不明である。
ACAが公布されて以来、他の立法改正も提案され、採択された。これらの変化には、2011年の予算制御法と後続法に基づいて、医療保険提供者の支払総額を2%削減することが含まれており、これらの法律は2013年に始まり、その後の立法改正により、国会が追加行動を取らない限り2030年まで有効になる。2013年1月、“2012年米国納税者救済法”が法律に署名され、病院、画像形成センター、がん治療センターを含むいくつかの提供者への医療保険支払いがさらに減少し、政府が提供者に多額の支払いを取り戻す訴訟時効が3年から5年に延長された。新しい法律は連邦医療保険や他の医療資金のさらなる減少を招く可能性があり、これは顧客が私たちの製品の需要と負担能力、そして私たちの財務運営結果に実質的な悪影響を及ぼす可能性がある。また、近年、製薬業界も薬品定価に関する重大な宣伝対象となっており、宣伝や製薬会社が新製品に対して受け取る価格や、一部の人が高すぎると考えている旧製品の値上げに対する製薬会社の圧力が含まれている。そのため、薬品価格はずっとアメリカ政府の審査強化の重点であり、ある州の総検察長、国会議員、大統領候補者、米司法省を含む。医療業界の改革が潜在的な製品の精算の可能性を下げたら、私たちの潜在製品の市場は減少するだろう, 私たちは潜在的な収入源を失うかもしれない。コスト制御措置の存在や脅威は、私たちの企業パートナーが私たちの候補ワクチンに関する研究や開発計画に従事することをあまり望まない、または従事できない可能性がある。また,政府は新冠肺炎の流行に対応するためにより多くの行動をとる可能性もある。私たちはどんな医療改革立法の最終的な内容、時間、効果を予測することもできず、潜在的な立法が私たちに与える影響も予測できない。
NVX−CoV 2373を含む候補ワクチンの規制承認を得ても,カバー範囲や精算は独自かつ変化する規制政策の影響を受ける可能性がある。例えば、ACA予防保健タスクによれば、個人または団体市場で提供される非祖先団体健康計画および健康保険カバー範囲は、通常少なくとも1年であり、その後、新たに発表された予防保健要件またはガイドラインに第1ドルの保険を提供しなければならない。しかしながら、コロナウイルス援助、救済、経済安全法(“CARE法案”)によれば、個人または団体市場で提供される非祖先団体健康計画および健康保険は、米国予防サービスワーキンググループまたは免疫実践諮問委員会(“ACIP”)が予防的に指定された任意の適格なコロナウイルス予防サービスを15営業日にわたってカバーしなければならない。また、私たちが監督部門の許可を得たら、新冠肺炎ワクチン提供者に対する第三者精算はNVX-CoV 2373に対する市場の受け入れ程度に影響する可能性がある。現在、CARE法案とその実施条例は、(I)米国疾病コントロール·予防センターの新冠肺炎ワクチン接種計画に参加する提供者は、個人の支払い能力や医療保険カバー状況にかかわらず、新冠肺炎免疫接種を行わなければならない、(Ii)提供者は、残高請求書を含む免疫受給者にいかなる精算も求めてはならない;(Iii)第三者、例えば連邦政府が免疫費用を支払っても、費用分担なしに免疫接種管理を行う必要がある。そして(Iv)新冠肺炎突発公衆衛生事件の間、個人健康保険計画は新冠肺炎の免疫接種とその管理をカバーしなければならず、ネットワーク外で提供されても
仕入先。規制部門のNVX-CoV 2373の承認を得ても、2023年5月11日に終了予定のPHEの終了後、すべての支払者が私たちの製品に保険と精算を提供する保証はありませんし、保険を提供しても、十分な投資収益を達成するのに十分な価格を確立したり維持したりするのに十分な金額が保証されません。われわれは新冠肺炎の持続的流行、集団免疫を実現するかどうか(これは将来の新冠肺炎ワクチン接種の必要性に影響する)を予測することができず、新型コロナウイルスがSARS-CoV-2ウイルスの持続突然変異或いは変異に有効であるかどうかを予測することもできない。
新冠肺炎疫病が発生して以来、アメリカ連邦政府はずっと新冠肺炎ワクチンの主要な調達業者であり、全人がワクチン接種を得ることができるようにした。大流行に伴い、危機段階、公共部門会計基準の満期及び市場が第三者精算モードに移行することに伴い、このような全人口範囲の参入は変化する可能性がある。このようなより伝統的な第三者精算モデルへの移行はPHEの終了に関係なく、米国連邦政府が国会からより多くのワクチンを購入し続ける追加資金を獲得していないことを部分的に反映している。連邦政府の新冠肺炎ワクチンに対する援助の減少に伴い、アメリカ政府は商業保険会社と薬局福祉マネージャーを含む異なる医療保健システムルートを通じて、標準的な商業調達に移行し、それによって新冠肺炎ワクチンのコストを保険会社と患者に転嫁する可能性が高い(保険料とネットワーク外コストの形式で)。政府の医療計画や商業保険については,新冠肺炎ワクチンの全面的なカバーがなくなる可能性があり,事前認可協定を策定するなどの精算条件が付加されない場合もある。連邦医療保険(伝統的な連邦医療保険と連邦医療保険の優勢を含む)は引き続きワクチン接種費用を全額支払う;2023年1月1日から、すべての連邦医療保険D部分計画はACIPが推薦したすべての成人ワクチンをカバーしなければならず、費用を分担する必要がなく、たとえ受益者が福祉の控除可能な段階にあっても。ARPAとIRAの条項は、ACIPが推奨するすべてのワクチンをカバーするために、医療補助(特に従来の医療補助に基づいて保険を受ける加入者および特定州のすべての医療に必要な医療補助加入者に対する)およびチップ計画を要求する, 新冠肺炎ワクチン/増強剤を含め,緊急声明が満期になっても,連邦が購入したワクチン供給がなくなり,コストを分担しない。ACAによると、非祖先計画に参加している人(すなわち、個人保険を持っている人のほとんど)は無料で購入し続けます
ACIPが推奨する新冠肺炎ワクチンと関連予約は,加入者がネットワーク内提供者からこの看護を受けていればよい。消費者が私たちの製品を無料で使用することを保証されたり、一定のコストを負担することが保証されていても、私たちの競争相手に比べて十分な数の私たちの製品が利用可能でなければ、あるいは薬局や他のサプライヤーに調達されていなければ、彼らは私たちの製品を訪問する挑戦に直面する可能性がある。
私たちのマーケティング能力は限られています。マーケティングパートナーと協力したり、自分の販売やマーケティング能力を発展させることができなければ、どんな承認された製品を商業化することに成功できないかもしれません。
NVX-CoV 2373の商業化を開始しましたが、現在の専用販売、マーケティング、または流通能力は限られています。したがって,我々はSIIPLとの連携など,流通システムや販売チームを構築した第三者との連携に依存している.私たちが共同販売促進や他の許可手配を達成する限り、私たちの収入は第三者の努力にかかっており、私たちはこれに対してほとんど統制権を持っていないかもしれない。もし私たちが1つ以上の製薬会社や協力者と合意して維持できなければ、私たちは私たちの製品を直接販売することを要求されるかもしれない。マーケティングと販売チームを発展させるのは高価で時間がかかり、製品の発表を延期するかもしれない。私たちは合格した販売員を引きつけて維持したり、他の方法でこの能力を発展させることができないかもしれない。
私たちの候補ワクチンは、たとえ私たちが完全な規制承認を受けたとしても、市場から受け入れられないかもしれない。
私たちの候補ワクチンの商業販売が完全な規制によって承認されても、これらの候補ワクチンの商業的成功は、医師、患者、および第三者支払者(例えば、医療保険会社および医療業界の他のメンバー)がワクチンおよび競合製品の低コスト代替製品としてそれらを受け入れるかどうかに依存する。もし私たちの候補ワクチンが市場で受け入れられなかったら、私たちは私たちの業務を続けるのに十分な収入を得ることができないかもしれない。私たちが開発し商業化する可能性のある任意の製品に対する市場の受け入れの程度と需要は、多くの要素に依存するだろう
•私たちは受け入れ可能な安全性と有効性の証拠を提供する能力(出現している新冠肺炎変種を含む)
•副作用の発生率と重症度
•私たちのワクチンは他のワクチンとは違いますか
•代替療法と競争療法の獲得可能性、相対コストと相対治療効果
•マーケティングと流通戦略の有効性は
•私たちの製品や競合製品や治療法の宣伝;
•私たちは十分な第三者保険カバー範囲や補償を受けることができる。
もし私たちの候補ワクチンが医師、患者、第三者支払人と医学界の他のメンバーおよび免疫接種の手配を担当する関連公衆衛生当局の広範な受け入れを得なければ、私たちの業務、財務状況と運営結果は実質的かつ不利な影響を受ける可能性がある。
私たちは私たちのアジュバント技術の重要な構成要素の十分な供給を保障できないかもしれない。
私たちのアジュバント技術の重要な構成要素はチリで栽培された石鹸樹皮(Quillaja Saponaria)から抽出されているので、私たちは一貫性と十分な高品質のQuillaja抽出物を長期的に得る必要がある。私たちは安全な原材料供給と予備供給者が必要で、そうでなければ、私たちのアジュバント製品は延期される可能性があり、私たちは様々な協力と供給協定に基づいて負担する義務を履行できないかもしれません。
現在または未来の地域関係は、私たちがより大規模な取引を行う能力を阻害するかもしれない。
我々は,世界のある地域で我々の候補ワクチンを開発,製造,配布するための地域協力を行っており,より多くの地域協力への参加が期待されている。SIIPL,武田,SK生物科学社との関係がこれらの地域関係の例である。これらの関係は、一般に、私たちの技術的許可を私たちのパートナーに与えること、または流通協定を締結することに関するものであり、通常は独占的に基づいている。一般的に、排他的プロトコルは特定の地域に限られている。私たちは独占許可と流通協定を締結しているので、大きな会社は私たちと世界的に協力することに興味や能力がないかもしれません。また、このような地域的な関係は私たちを魅力的でない買収目標にするかもしれない。
私たちの候補製品は輸送と貯蔵条件に非常に敏感で、これは私たちの候補ワクチンを紛失や破損のリスクに直面させるかもしれない。
私たちの候補ワクチンは貯蔵と処理条件に敏感だ。製品や製品の中間体の貯蔵や処理が不適切であれば、候補ワクチンの損失を招く可能性がある。私たちの候補ワクチンは使用前に期限切れで失われる可能性がある。もし私たちが私たちの供給物流を効果的に維持していなければ、数量の異常な返品や期限切れ製品に遭遇するかもしれません。もし私たちまたは第三者が私たちの供給物流を効果的に維持できなければ、追加の製造コストを招き、臨床試験または他の方面に必要な数量を供給する能力の遅延を招く可能性がある。
私たちの候補ワクチンは製品リコールの影響を受けるかもしれません。これは私たちの名声、業務、財務業績を損なう可能性があります。
FDAと同様の外国政府当局はいくつかの候補ワクチンのリコールを要求する権利がある。製品に何か重大な欠陥が発見されれば、メーカーは自発的に製品をリコールすることができる。製造ミス、設計またはラベル欠陥、または他の欠陥および問題のため、私たちまたは私たちの戦略パートナーは、政府の強制または自発的なリコールが発生する可能性があります。私たちの任意の候補ワクチンをリコールすることは、管理と財務資源を移転し、私たちの財務状況と運営結果に悪影響を及ぼす。リコール声明はお客様の名声を損なう可能性があり、私たちの販売に悪影響を及ぼす可能性があります(あれば)。
私たちの業界や競争に関するリスクは
私たちの多くの競争相手は明らかに多くの資源と経験を持っており、これは私たちと私たちの現在と未来のライセンス保有者のビジネス機会に否定的な影響を及ぼすかもしれない。
バイオテクノロジーと製薬産業は激しい競争と迅速で重大な技術変革に直面している。私たちは大手製薬会社、専門バイオテクノロジー会社、学術機関、政府機関、民間と公共研究機関を含む多くの潜在的な競争相手を持っている。私たちの多くの競争相手は以下の点で顕著に多くの財務と技術資源、経験、専門知識を持っている
•研究と開発
•臨床前試験
•臨床試験を設計し実施しました
•規制手続きと承認
•生産と製造
•承認された製品の販売とマーケティング
私たちの業界の主な競争要因は
•組織技術の質と広さ
•組織の管理と組織戦略の実行
•組織従業員のスキルと経験と、熟練した経験のある従業員を募集して維持する能力
•組織の知的財産権の組み合わせです
•能力の範囲、目標識別と確認から薬物発見と開発、そして製造とマーケティングまで;
•大量の資本資源を提供し、発見、開発、商業化活動に資金を提供する。
大手老舗会社、例えばメルク会社、グラクソ·スミスクライン、CSL有限会社、セノフィバスド、SA、ファイザー、ジョンソン、アスリーカンとModernaなどはすべてワクチン市場で競争を展開している。特に、これらの会社は政府契約と贈与を獲得して、その研究開発を支援し、テストと臨床試験を行い、監督機関の製品の販売許可を獲得し、このような製品を大規模に製造し、マーケティングが許可された製品を獲得する上で、より多くの経験と専門知識を持っている。
疾患にかかわらず,規模が小さいか早い段階にある会社や研究機関も重要な競争相手であることが証明され,特に大手や老舗製薬会社との協力により手配されている可能性がある。これらの会社が彼らの技術を開発するにつれて、彼らは独自の地位を発展させる可能性があり、これは私たちの製品開発と商業化努力を阻害したり制限したりする可能性がある。私たちはまた、合格した科学と管理者の募集と維持、臨床試験場と臨床試験参加者登録の確立、および私たちの計画と相補的あるいは私たちの業務に潜在的な優位性がある技術と製品の獲得と許可を含むこれらの方面からの競争に直面する。もし私たちの競争相手が私たちよりも早くFDAや他の規制機関のその製品や私たちよりも効果的または安い製品の承認を得ることに成功すれば、私たちのビジネス機会は著しく減少するかもしれない。
効率的な競争のためには、開発、テスト、製造、販売、マーケティングに大量の投資を行わなければならないか、または1つ以上の老舗会社と協力しなければならない。私たちは成功しないかもしれない
どんなワクチンのためにも相当な市場シェアを獲得する。私たちの競争相手はより速く、より低いコストで製品を市場に出すので、私たちの技術とワクチンは時代遅れになったり、競争力が足りないかもしれません。
新冠肺炎、インフルエンザと呼吸器合胞体ウイルスワクチンの開発は激しい競争に直面しており、著者らは候補ワクチンに投入された大量の資源は永遠に見返りが見られないかもしれない。
私たちの新冠肺炎ワクチンはアメリカと他の管轄区域の規制審査と許可手続きを迅速に通過した。新冠肺炎ワクチンと治療薬物の研究開発とテスト速度は非典型的であり、アメリカ食品と薬物管理局或いは他の監督機関の内部計画或いは優先事項の変化或いは変化は、新冠肺炎に対する新しい知識及びこの疾病とウイルスの新変種がどのように人体の変化に影響するかを含み、著者らが新冠肺炎ワクチンのために競争力のある市場シェアを確立する能力に著しく影響する可能性がある。大量のワクチン生産企業、学術機構などの組織はすでに新冠肺炎ワクチンを研究開発し、或いは新冠肺炎ワクチン候補ワクチンを研究開発している。特に、Modernaとファイザー/バイオテクノロジー会社の新冠肺炎ワクチンはすでに監督部門の全面的な許可を得ており、ジョンソンと共に、彼らの新冠肺炎ワクチンはすでにアメリカと他の国で緊急使用許可を得ている。アスリカン、科興生物と国薬持株を含む多くの他の会社は新冠肺炎候補ワクチンのマーケティング許可を開発と獲得する異なる段階にある。これらのすべての会社は、世界保健機関から関連する緊急使用許可証(“EUL”)を取得し、それぞれのワクチンは、関連する国連機関を含む世界保健機関の緊急使用許可証に依存して現地免疫計画をサポートする国または国際連合パートナーに供給される。これまで資金を提供してくれたにもかかわらず、候補ワクチンを求める多くの競争相手は明らかに大きな候補製品開発を持っています, 私たちよりも製造とマーケティング資源が多い。比較的に大きい製薬と生物技術会社はその製品の臨床テストと監督管理の承認を得る方面で豊富な経験を持っており、資源に大量の投資を行い、その候補ワクチンの発見と開発を加速する可能性がある。著者らの新冠肺炎ワクチンの成功はある程度その相対安全性、有効性(新たに出現した変異株を含む)、副作用概況、利便性とコストに依存する。私たちがワクチンを接種する前に承認された新冠肺炎ワクチンは一部の初期ワクチン接種需要を満たしているが、私たちはこの機会を得る機会がなくなった。また、我々のワクチンの前に承認された新冠肺炎ワクチンは、幅広い市場受容度を得る可能性があり、これは私たちが直面している課題である。例えば,米国ではFDAは2021年8月にファイザー/BioNTechワクチンに生物製品許可証申請を発行し,12歳以上の個人新冠肺炎を予防する2剤の一次系ワクチンとして,2022年1月にModernaワクチンを付与し,18歳以上の個人新冠肺炎を予防する2剤の一次系ワクチンとした。アメリカ食品薬品監督管理局は2021年9月22日にファイザー-生物技術緊急使用許可を改訂し、2021年10月20日にModerna緊急使用許可と新冠肺炎緊急使用許可を改訂し、許可は任意のFDA許可或いは許可された新冠肺炎ワクチンの一次接種を完了した後、ある人たちに単剤補強剤を使用する。その後、FDAは2021年11月19日に再びファイザー-生物科学技術緊急使用許可とModerna緊急使用許可を修正した, この単一の増強剤の使用は18歳以上のすべての患者に許可されている。その後,FDAはファイザー−生物科学技術緊急使用認可,5歳以上の個人用単回補強剤の使用を認可し,Moderna緊急使用許可,6歳以上およびModerna初級ワクチンシリーズ接種の6カ月から5歳までの個人用単回補強剤の使用を許可した。FDAはまた、成人と児童群の新冠肺炎治療へのギレドのVeklury(瑞希韋)の使用、および礼来社のオルメット(バリチニ)と遺伝子泰克のActemra(Tocilizumab)のいくつかの入院成人の新冠肺炎の治療に使用することを許可した。さらに、任意の競合他社が新たに出現した変異株を含むより効果的な新しい肺炎ワクチンまたは他の治療方法の生産に成功した場合、または任意の競合他社が任意のそのようなワクチンまたは治療方法をより効率的に生産および流通することができれば、潜在的な政府および他の資金を私たちから他の当事者に移転することができるかもしれない。
我々はNVX-CoV 2373の開発と商業化に大量の財力と人的資源を割り当てており、これは私たちの他の開発計画の遅延や負の影響をもたらす可能性がある。私たちは予測不可能な世界的な健康脅威に対抗するために大量の資源を分配するか、あるいは私たちのワクチンは最終的に成功しないか、または利益がないことが証明される可能性があり、これは私たちの業務に否定的な影響を与えるかもしれない。
現在、多くの季節性インフルエンザワクチンが承認され、市場に投入されている。このような季節性インフルエンザワクチンの販売競争は非常に激しい。そのため、新しい開発と承認された製品は既存のワクチンと区別しなければならず、商業成功を得ることができる。季節性インフルエンザ市場で差別化を示すためには、製品は、特に高齢者において、および/またはより安価またはより迅速に製造される必要があるかもしれない。多くの競争相手が新製品や新世代の既存製品を開発しており、現在販売されている製品よりも効果的であることを目指している。ナノ粒子の季節性インフルエンザワクチン候補ワクチンは現在よりも有効ではないかもしれません
私たちの競争相手が開発している製品や製品です。さらに、私たちの内部または第三者の製造計画は、ビジネス成功に必要な差別化を提供するのに十分な時間またはお金を節約できないかもしれない。
また,複数の会社が異なる開発段階で活発なRSVワクチン計画を持っていることに気づいた。したがって,現在のところRSVワクチンは市場にはないが,これらの活発な計画の成熟に伴い,重大で持続的な競争がある可能性がある。異なるRSVワクチンは異なる集団集団に対してもっと効果が良い可能性があるため、単一のRSVワクチンメーカーは複数の集団に適したワクチンを提供することが困難かもしれない。地理市場にも大きな違いがある可能性があり,単一のRSVワクチンを世界的に販売することが困難になる可能性がある。製造業者がRSVワクチンを許可しても、競争相手は、より効果的かつ/またはより安価である可能性のある新製品に取り組み続ける可能性が高い。我々のRSV候補ワクチンが将来開発され,規制部門の承認を得ても,競争相手が開発している他のより効果的なワクチンが承認されれば,顕著な販売を実現しない可能性がある。
規制やコンプライアンスに関するリスク
私たちはFDAの完全な許可や私たちの候補ワクチンを販売するために必要な外国規制承認を得ることに成功できないかもしれない。
我々の薬品および生物製品の開発、製造およびマーケティングは、EMA、チェコ共和国国家薬物制御研究所(SUKL)(チェコ共和国の私たちの製造工場のため)、スウェーデン医療製品局(L≡kemedelsverket,LV)(スウェーデンで開発されたアジュバント製品のため)、および私たちまたは私たちの下請けメーカーによって活性医薬成分および補助剤を輸入および/または生産する他の国の当局によってFDAおよび他の司法管轄区域規制機関によって規制されている。アメリカと大多数の外国で、私たちは厳格な臨床前テストと広範な臨床試験を完成して、製品の安全性と有効性を証明して、監督部門にこの製品の発売許可を申請することができます。また、私たちの製造施設、プロセス、制御は、安全、純度、効力を確保し、適用される良好な製造実践要件に適合するために、このような製品に対して十分であることを証明しなければならない。NVX-CoV 2373は、NVX-CoV 2373が米国、カナダ、オーストラリア、ニュージーランド、EU、イギリス、インド、インドネシア、フィリピン、シンガポール、韓国で一時登録、条件付きマーケティング許可または緊急使用許可、および世界保健機関のEULを取得したにもかかわらず、私たちの候補ワクチンはまだ米国で完全な規制承認を得ていない。臨床試験や前臨床実験室や動物研究の候補ワクチンもあります
私たちの製品は臨床試験でその主要な終点に到達できない可能性があり、これは私たちが規制承認に必要な臨床データを支持していないことを意味する。
FDAが提案する研究製品が米国で発売される前に、通常必要なステップは、
•臨床前(動物と実験室)試験の表現;
•臨床試験が開始される前に有効でなければならないINDをFDAに提出する
•研究対象者における製品の安全性と有効性を決定するために、十分かつ良好な制御の臨床試験を行った
•一貫性および反復可能な製造プロセスが商業規模で実行され、FDAの検査を通過することができる
•BLAやNDAをFDAに提出し
•FDAは、製品の任意の商業販売または出荷の前に、BLAまたはNDAを承認する。
我々が他国で行っている臨床試験は,類似あるいは同等の手順や要求に従い,ヨーロッパでは,試験自体の許可を得て,現地倫理委員会の同意を得て,試験地点ごとに,試験とその結果に関する具体的な情報を出版する必要がある。端末要求が満たされていない場合、これらの情報は公開され、会社の名声を損なう可能性がある。
これらの過程は非常に高価で、完成するのに数年かかるかもしれないし、私たちは候補ワクチンの安全性、純度、効力と効力を証明できず、規制当局を満足させることができないかもしれない。臨床試験の開始は多くの異なる原因で延期または予想よりも長い時間がかかる可能性があり、その多くの原因は私たちがコントロールできるものではない。安全問題が生じる可能性があり,進行中の臨床試験を延長したり,より多くの臨床試験を行う必要がある可能性がある。早期臨床試験で有望な結果はその後の臨床試験で複製されない可能性がある。規制当局は追加的なテストを要求するかもしれませんが、私たちが提案した製品が既存の治療法よりも良い治療形態を表していることを証明する必要があるかもしれません。さらなる臨床試験を行わなければ、私たちはそれができないかもしれません。さらに、規制当局が製品の規制承認を承認した場合、承認は特定の適応に限定されるか、またはその流通に限定される可能性がある。承認された製品の拡大や増加した適応は承認されない可能性があり、これは私たちの収入を制限するかもしれない。外国の規制機関は似たような制限を適用するかもしれないし、承認を拒否するかもしれない。したがって,臨床前および臨床データが候補ワクチンの規制承認を支持するのに十分であると考えても,FDAや外国規制機関は最終的にはその適用される司法管轄区で商業販売を承認しない可能性があり,あるいは1つ以上の管轄区域での承認をさらに求めることが経済的ではないように規制要求を加える可能性がある。もし私たちの候補ワクチンが承認されなければ、私たちの収益能力は制限され、私たちの業務は不利な影響を受けるだろう。
私たちは規制機関の私たちの製品に対する承認をタイムリーに得ることができないかもしれないし、承認された後に私たちの持続的な規制義務を履行することができないかもしれない。
監督部門の承認を遅らせることは巨大な販売機会を損失し、早期発売のいかなる潜在的なマーケティング優勢を失い、臨床試験コストを増加させる可能性がある。例えば、関連する司法管轄区域のNVX-CoV 2373に対する必要な規制承認をタイムリーに得られなければ、私たちのいくつかのAPAと供給協定は取引相手によって終了される可能性がある。著者らは臨床試験の開始と完成、臨床試験自体と著者らの上場承認申請に必要な臨床前研究の速度はいくつかの要素に依存し、以下の要素を含む
•必要な純度の製品の安定した生産量を繰り返し生産するために、製造能力を拡大し、維持することができる 効果と品質;この拡大は適時に発生する;私たちは必要な臨床前研究と臨床試験のために十分な数の材料を得ることができる
•監督管理機関は提案された臨床試験方案に対して審査と許可を行った
•試験道徳行為を監督する機関審査委員会は臨床試験案とインフォームドコンセントを承認した
•参加者登録および保留率、これは多くの要素の関数であり、参加者群の規模、参加者と臨床場所の接近度、臨床試験の資格基準および方案の性質を含む
•臨床試験参加者が経験した不良試験結果や副作用;
•臨床前と臨床活動から得られたデータを分析し、これらのデータは異なる解釈の影響を受けやすく、どの解釈が遅延、制限、一時停止或いは終了を招く可能性があり、更に臨床研究或いは監督管理の承認を行うことを阻止する
•臨床試験を行い、監視し、適切な監督申請を準備するための熟練かつ経験のあるスタッフを提供する
•製品開発期間中、監督管理部門の薬品或いはワクチンの審査に対する政策が変化した。
著者らは臨床前研究と臨床試験を行う上での経験は限られており、これらの研究と臨床試験は監督管理市場の許可を得るために必要である。私たちは追加的な臨床試験を継続したり開始したりすることが許されないかもしれない。われわれはまた,臨床試験の結果が前研究や類似製品の臨床試験結果と一致しない可能性があるリスク,あるいは臨床試験後期段階の結果が早期段階の結果と一致しない可能性があるリスクに直面している。生物技術と製品開発業界のいくつかの会社は高級臨床試験で重大な挫折を経験し、早期動物と人体試験においても人を奮い立たせる結果を得た。
規制機関は、参加者が受け入れられない健康リスクに直面していることを発見することを含む、様々な理由で私たちまたは私たちの協力者に臨床試験の延期、制限、または停止を要求するかもしれない。さらに、私たちまたは私たちの協力者は、私たちが現在予想している時間範囲内で規制機関に申請を提出できないかもしれない。一旦提出されると、申請は各規制機関の承認を得なければならず、私たちまたは私たちの協力者は、申請に記載された製品を商業化することができる。すべての臨床試験を管理する法規は将来的に変化する可能性があり、これはこのような臨床試験のコストに影響する可能性がある。私たちの臨床試験や規制提出中の任意の予期しないコストや遅延は、私たちの収入を創出する能力を延期し、私たちの財務状況と運営結果を損なうかもしれません。
外国の管轄区域の規制承認を得られなければ、私たちは国際的に私たちの製品を販売することができないだろう。
私たちは候補ワクチンをアメリカ以外の市場に発売しようとしています。これを実現するために、複数の外国政府と供給協定を締結し、商業実体と国際流通協定を締結しました。EU、イギリス、インド、アジア、そして他の多くの非アメリカ司法管轄区域で私たちの製品を販売するためには、私たちは単独の監督管理許可を得て、多くの異なる規制要求を守らなければならない。承認手続きは国によって異なり、追加的なテストとデータ審査が含まれる可能性がある。外国規制機関の承認を得るのに要する時間は、FDA承認を得るのに要する時間とは異なる可能性がある。外国規制機関の承認過程には、FDA承認の取得に関連するすべてのリスクが含まれる可能性がある。また、米国以外の規制機関は、他国で行われた試験データを受け入れない可能性がある。NVX-CoV 2373は、複数の管轄区域で一時登録、条件付きマーケティング許可、または緊急使用許可を取得しているにもかかわらず、他の関連司法管轄区の監督管理許可をタイムリーに得ることができない可能性がある。一つの規制機関の承認は他の管轄区域の規制機関も承認することを保障しない。しかしながら、1つの管轄区域で規制承認を得ることができなかったり、遅延したりすることは、FDAの承認を含む他の管轄区の規制承認過程に悪影響を及ぼす可能性がある。外国の管轄区域で規制の承認を受けることができなかったことは私たちの業務を損なうかもしれない。
NVX-CoV 2373の制御経路は絶えず進化しており、予期せぬ或いは予見できない挑戦を招く可能性がある。
NVX-CoV 2373の規制経路は変化しており、もし私たちがいかなる法律、規則、標準を守らなければ、その中のいくつかはまだ存在しないか、あるいは解釈される可能性があり、変化する可能性があり、処罰、罰金、ワクチン許可の遅延を含む様々な不利な結果を招く可能性がある。変化する法律,条例,基準を遵守する努力は,一般や行政費用の増加や管理時間の移行やコンプライアンス活動への関心を招き続ける可能性がある。たとえば,USGプロトコルを管理するルール,法規,基準は不確実であり,計画の進展とともに変化する可能性がある.これらの規則または基準は、私たちがNVX-CoV 2373を開発する計画に悪影響を及ぼす可能性があり、もし私たちがいかなる法律、規則、または基準に従わなければ、その中のいくつかはまだ存在しないか、または変化する可能性があり、処罰、罰金、または資金を得ることができないなどの一連の不利な結果をもたらす可能性がある。
複数の利害関係者が新冠肺炎の開発、テストと承認ワクチンの速度は非常に異常であり、伝統的なワクチン開発に関連するリスクを増加させる可能性があり、伝統的なワクチン開発には通常8年から10年の時間を要する。この加速されたスケジュールを考慮して、FDA、EMA、イギリスの医薬品、保健製品規制機関(MHRA)のような私たちと規制機関は通常よりも早く決定を下すかもしれない。私たちはそれに許可を申請したい食品と薬物管理局あるいは他の監督機関は新しい冠肺炎に対する新しい知識、疾病がどのように人体に影響を与えるか、ウイルスの新しい変種を含む計画あるいは優先事項を変化あるいは変更しています
NVX-CoV 2373の制御経路。臨床試験の結果は新しい問題を提起する可能性があり、提案された終点を修正すること、または新しい臨床試験場所または被験者の列を増加させることを含む提案された臨床試験を再設計することを要求する。さらに、FDAまたは他の規制機関の臨床データの分析は、私たちの解釈とは異なるかもしれないし、またはワクチンの許可または承認に対する規制機関の要求および予想は時間の経過とともに変化する可能性があり、その結果、FDAまたは他の規制機関は、追加の臨床試験または非臨床研究を要求するかもしれない。変化し続ける制御経路はNVX-CoV 2373の開発、商業化および/または許可を阻害する可能性がある。
また、新冠肺炎に対するいかなるワクチンの許可経路も不明であるため、完全な発売承認を受ける前に、研究ワクチンまたは一時的または緊急使用を許可する製品として、広く使用されているワクチンを特定の国および地域で流通させる可能性がある。これらの場合、意外なセキュリティ問題は、Novavaxと私たちの未来の技術プラットフォームに深刻な名声被害をもたらす可能性があり、その他の問題は、私たちの他の計画の遅延を含み、私たちの臨床試験を再設計する必要があり、大量の追加的な財務資源を必要とする。例えば、私たちは現在、FDAがNVX−CoV 2373に提供する緊急使用許可の下で動作しているが、FDAが潜在的な衛生緊急事態がもはや存在しないか、またはそのような許可が必要であると判断した場合、FDAはそのような許可を破棄する可能性があり、そのような許可がどのくらい続くかを予測することができない。このような撤回は様々な方法で私たちの業務に悪影響を及ぼすかもしれない。
われわれはすでに,米国以外の地点でNVX−CoV 2373の複数の臨床試験を継続し計画しており,FDAはこれらの地点での試験データを受け入れていない可能性がある
米国以外でNVX−CoV 2373のいくつかの臨床試験を行っており,メキシコでの3期試験,イギリスでの3期試験,南アフリカでの2 b期試験,オーストラリアでの1/2期試験,インドでの2/3期試験および日本での1/2期試験を行っている。FDAは米国国外で行われている臨床試験のデータを受ける可能性があるが,これらのデータを受け入れるにはFDAが加える条件の制約を受ける。例えば、臨床試験は入念に設計と進行し、合格した研究者が道徳原則に従って行わなければならない。試験群はまたアメリカ人口を十分に代表しなければならず、データはFDAが臨床的意義があると考えられる方式でアメリカ人口とアメリカの医療実践に適用しなければならない。他の規制機関はそれがある国に対して同じ要求を施行した。また,これらの臨床試験は,データが我々のBLAを支援するために使用される適用された現地法に制限されているが,FDAがデータを受け入れるかどうかは,試験がすべての適用された米国の法律や法規にも適合しているかどうかに依存する。FDAが米国国外で行ったいかなる試験のデータも受け入れなければ、遅延を招く可能性があり、米国で行われた試験の完了を待ったり、追加の試験が必要になったりする可能性があり、これは高価で時間がかかり、NVX-CoV 2373の開発と商業化を延期または永久的に停止する可能性がある。
その後、製品、製造業者、または施設に以前未知の問題が存在することが発見され、以前にいくつかの司法管轄区域で規制許可を得ていたワクチンを市場から引き下げることを含む制限を招く可能性がある。
製品が規制された後であっても、製品および製品の製造業者は、不良事象報告要件および未承認用途への製品の宣伝を禁止することを含む継続的な規制審査を受けるであろう。いかなる承認後の要求も遵守せず、その他を除いて、警告状、製品の差し押さえ、リコール、巨額の罰金、禁止、マーケティング許可または許可証の一時停止または取り消し、経営制限、刑事起訴を招く可能性がある。このような法執行行動、既存の規制要件の任意の意外な変化、または新しい要求の採用、または任意の承認された製品によって発生する任意のセキュリティ問題は、私たちの製品のマーケティングおよび収入を創出する能力に悪影響を与え、それによって、私たちが業務を継続する能力に悪影響を及ぼす可能性がある。
後に製品やその製造に以前未知の問題があることが発見された場合、製品の承認を得た後であっても、製品の販売や製造を制限または禁止される可能性がある。私たちは新しい発見や新開発のセキュリティ問題が規制部門の承認後に発生しないという保証はない。多くの患者がいかなるワクチンを使用することに伴い、時々深刻な不良事件が発生する可能性があり、これらの事件はこの製品の臨床試験に出現しなかったか、あるいは最初はワクチン自体と関係がないようで、後続の情報を収集した後にのみこの製品と因果関係があることを発見した。このようなセキュリティ問題は、私たちが承認した製品の販売を一時停止または停止させる可能性があり、私たちに重大な責任を負わせ、私たちの収益能力や財務状況に悪影響を及ぼす可能性があります。
私たちが成功したワクチンを生産する能力は1つ以上の政府の行動或いは干与によって弱体化される可能性があり、新冠肺炎などの全世界衛生危機の間に、このような状況は更に発生する可能性がある。
新冠肺炎疫病の重大な世界的影響を考慮して、1つ以上の政府実体は、1950年の国防生産法(改正)に基づいて米国政府が取った行動を含む行動をとる可能性があり、NVX-CoV 2373における私たちのいくつかの権利または機会を直接的または間接的に弱める可能性があり、新冠肺炎ワクチンの私たちに対する経済的価値は限られている可能性がある。さらに、世界的な健康危機の間、例えば新冠肺炎の大流行は、疾患の伝播を制御する必要があり、国境を閉鎖または厳格に監督することは、私たちの開発、生産、流通活動に挑戦と遅延をもたらし、独立した国や国際境界内で私たちの候補ワクチンを開発、生産、流通するか、あるいは追加の安全対策や検査を行うことで、より大きな費用がかかり、より長い時間で公開配布される可能性があるかもしれない。
米国食品医薬品局、米国証券取引委員会および他の規制機関の資金不足は、重要な指導部や他の人員を採用して維持する能力を阻害したり、他の方法で私たちの業務運営が依存する可能性のある正常な機能を履行したりする可能性があり、これは、私たちが新製品やサービスを開発したり、商業化したり、資本市場に参入したり、他の方法で私たちの業務を運営する能力に悪影響を及ぼす可能性がある。
FDAとその他の監督管理機関が新製品申請を審査·承認する能力は、政府予算と資金レベル、キーパーソンの雇用と維持及びユーザー費用の支払いを受ける能力、及び法定、監督管理と政策変化を含む様々な要素の影響を受ける。例えば、FDAの平均審査時間は近年変動している。また、政府が米国証券取引委員会や我々の業務に依存する可能性のある他の政府機関に提供する資金は、研究開発活動に資金を提供する機関を含め、政治プロセスの影響を受けており、政治プロセス自体が不安定で予測不可能である。
FDAや他の機関の中断も、新薬が必要な政府機関によって審査·承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼす。例えば、ここ数年間、米国政府は何度か閉鎖されており、食品·医薬品局や米国証券取引委員会のようないくつかの規制機関は、従業員を休暇にし、重要な活動のペースを停止または緩和しなければならない。同様に,EMAのロンドンからオランダへの移転は経験豊富なスタッフの大量流出を招き,イギリスMHRAはEUからの資金を失い,資金損失を招き,スタッフの流出を招いた。政府が長期的に停止したり、関連する規制機関が減速したりすれば、機関が提出した規制文書を適時に審査·処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に重大な悪影響を及ぼす可能性がある。また、当社の上場企業としての運営では、将来的に政府の閉鎖が公開市場に参入し、必要な資本を得る能力に影響を与える可能性があり、適切な資本化と運営を継続することができます。
FDAの高速チャネル指定、EMAまたはMHRAの条件付きマーケティング許可または他の規制加速オプションは、実際には、より速い開発または規制審査または承認プロセスをもたらすことがなく、承認を確保することもできません。
重症または生命に危険な疾患の治療に使用される薬剤であり、このような状況を解決するための満たされていない医療需要の可能性を示す場合、薬物スポンサーは、FDA迅速チャネル指定または同様の迅速チャネル手順を他の規制機関に申請することができる。EUとイギリスでは、条件付きマーケティング許可の付与はスクロール審査手続きに依存する。しかしながら、迅速チャネル指定または条件付き許可は、薬物スポンサーが上場承認されるか、または任意の特定の時間範囲で承認されることを保証しない。FDAは2020年11月にNVX-CoV 2373の快速チャネル称号を許可し、2020年1月に著者らの組換え四価季節性インフルエンザ候補ワクチンNanoFluの迅速チャネル称号を承認した。私たちはまたより多くの他の候補ワクチンのための高速道路指定を求めることができるかもしれない。もし私たちが私たちの他の候補ワクチンのために迅速なチャネル認証を求めるなら、私たちはそれを取得しないかもしれないし、私たちが高速チャネル認証を取得しても、私たちはFDAの従来のプログラムよりも速い開発過程、審査、または承認を経験しないかもしれない。また,FDAが我々の臨床開発プロジェクトのデータが高速チャネルの指定をサポートしなくなったと考えた場合,その指定を撤回する可能性がある。高速チャネル指定だけではFDA優先審査プログラムに適合する資格は保証されない。
高速チャネル認証の取得は製品承認の基準を変更することはないが,開発や承認の流れを加速させる可能性がある.FDAがNVX−CoV 2373およびNanoFluのこのような指定を承認したとしても、それは実際には、より速い臨床開発または規制審査または承認をもたらすことはないかもしれない。また、このような指定は、NVX−CoV 2373やNanoFluが米国で上場承認される可能性を増加させることはない。
私たちは環境、健康、安全法律の制約を受けているので、私たちは最も有利な方法で業務を展開できないかもしれない。
安全な作業条件、実験室と製造実践、動物実験使用、排出と廃水排出、および我々の研究に関連する危険または潜在的危険物質(感染症製剤を含む)の使用と処置の様々な法律と法規を遵守しなければならない。私たちはまた未来のどんな立法や行政行動によって引き起こされる可能性のある規制範囲を正確に予測することができない。このような法律や規制のいずれかは、私たちに追加的な費用を発生させたり、私たちの運営を制限したりする可能性がある。
メリーランド州の施設は安全作業条件、実験室操作、動物実験使用及び危険或いは潜在的危険物質の使用と処分に関連する様々な場所、州と連邦法律法規を遵守しなければならない。米国では,これらの法律には“職業安全と健康法”,“有毒試験物質制御法”,“資源保護·回収法”がある。似たような国と地方法規はスウェーデンとチェコ共和国の私たちの施設を管理している。私たちはこのような材料の意外な汚染、排出、または傷害の危険を除去することができない。連邦、州、地方の法律法規はこれらの材料の使用、製造、貯蔵、運搬と処分を管理する。もし不適切または無許可に放出されたり、個人がこのような危険な材料に暴露された場合、私たちは民事損害賠償を受けるかもしれない。さらに、クレーム者は、私たちが使用したり、第三者がこれらの材料を使用したことによるダメージや汚染について私たちを起訴するかもしれません。私たちの負債は私たちの総資産を超えるかもしれません。環境法律法規を遵守することは費用が高い可能性があり、現在または未来の環境法規は私たちの研究、開発、あるいは生産努力を損なう可能性がある。
一般責任保険がありますが、これらの保険書には化学品汚染によるクレーム、あるいは私たちの運営条件による汚染クレームは含まれていません。私たちの協力者たちは私たちの協力に関連したこのような種類の危険な材料を扱っている。訴訟や調査が発生した場合、私たちまたは私たちの協力者は、いかなる危険物質の接触または放出によって人員や財産に与えるいかなる損傷も、私たちは責任を負わなければならないかもしれない。しかし、私たちは現在、すべての重大に適用される環境と職業健康と安全法規を遵守していると思う。
私たちの候補製品に対して、私たちは追加の医療法律の制約を受けます。私たちがこれらの法律を守らなければ、私たちの運営結果や財務状況に実質的な悪影響を及ぼすかもしれません。
米国内(および海外)では、私たちの任意の候補製品が完全に承認されて商業化され始めた場合、私たちの運営は、第三者支払人や顧客との手配を通じて、追加的な医療規制や連邦や州政府(または外国規制機関または政府)の強制執行を受ける可能性があり、これは、私たちの販売、マーケティング、流通の業務または財務配置と関係を制限する可能性があります。これらの法律および法規は、広範な価格設定、割引、マーケティングおよび販売促進、構造および手数料、特定の顧客インセンティブ計画、および他のビジネススケジュールを制限または禁止する可能性があります。これらの法的拘束を受けた活動は,患者を募集して臨床試験を行う過程で得られた情報の不正使用に関するものである。私たちの運営能力の適用に影響を与える可能性のあるアメリカ連邦および州医療保健法律および法律(外国の既存の外国法律に相当する可能性がある)は、以下のことを含む
•“連邦食品、医薬品および化粧品法”は、他にも、医薬品のマーケティングおよび販売促進を厳格に管理し、未承認の用途のためのメーカーのこのような製品の販売を禁止している
•連邦“反リベート条例”は、他の事項に加えて、任意の人が直接または間接的に故意に報酬を請求、受け取り、または提供することを禁止し、物品やサービスを紹介したり、商品やサービスを購入または注文したりすることを誘導し、これらの報酬は連邦医療保険や医療補助などの連邦保健計画に基づいて支払うことができる
•個人または実体が虚偽または詐欺的な情報の提出または連邦医療保険、医療補助または他の第三者支払者からの支払いのクレームを故意にまたはもたらすことを禁止するFCAを含む連邦虚偽精算法
•FCAによると、メーカーが政府支払人に直接クレームを提出していなくても、虚偽や詐欺的なクレームを“原因”とされていれば、責任を問われる可能性があり、FCAは告発者の個人代表として連邦政府に訴訟を起こし、FCA違反を告発し、任意のお金を共有して取り戻すことも許可されている
•連邦法律は、製薬業者に、特定の計算された製品価格を政府に報告するか、または政府当局または個人実体に、通常、政府医療計画下の精算条件として何らかの割引またはリベートを提供することを要求している
•連邦医師支払陽光法案およびその実施条例は、連邦医療保険、医療補助または児童健康保険計画(いくつかの例外)に基づいて支払うことができる薬品、機器、生物製品および医療用品の製造業者に、医師(医師、歯科医師、光線師および脊椎マッサージ師を含むと定義される)や教育病院への支払いまたは他の価値移転に関する情報、および医師およびその直系親族が所有する所有権および投資権益を毎年国土安全保障省に報告することを要求し、2022年1月1日から、医師アシスタントや勤務看護師などの特定の非医師提供者への価値移転を含む報告義務に拡大した。米国も州レベルで類似した報告要件を制定しており、世界の多くの国が衛生保健専門家との相互作用の開示を要求しているか、または類似した法律を採択しているか、または考慮している
•HIPAAと呼ばれる連邦法は、医療提供者や他のエンティティのプライバシー保護に適用されるほか、任意の医療福祉計画を詐欺する計画や医療事項に関する虚偽陳述を禁止する
•市場活動を広く規制し、消費者の活動を損なう可能性がある連邦消費者保護法と不正競争法
•州法律は、上述した連邦法律に相当し、例えば、任意の第三者支払人(商業保険会社を含む)が精算する物品やサービスに適用可能な反リベートおよび虚偽請求法律、および州プレゼント禁止および透明性法律に相当し、多くの州法律は、連邦法律によって先制されず、コンプライアンス努力を複雑化させることが多い
•州法律は、医療保健提供者と医療保健コミュニティの他のメンバーとの相互作用を制限したり、製薬業者にいくつかのコンプライアンス基準を実施することを要求したりする。
これらの法律の範囲が広く、法定例外状況と選択可能な避難港が限られていることから、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。もし私たちの業務が私たちに適用される任意のこのような法律または任意の他の政府法規に違反していることが発見された場合、私たちは民事および刑事罰、損害賠償、罰金、私たちの業務を削減または再編し、連邦および州医療計画から除外され、さらに監禁される可能性があり、これらのいずれも、私たちの業務運営能力と私たちの財務業績に実質的な悪影響を及ぼす可能性がある。さらに、上述したすべての法律を遵守するために十分なシステム、制御、およびプロセスを実施するコストは巨大である可能性がある。これらの法律に違反するいかなる行為も、正当化に成功しても、巨額の法的費用を招き、会社の業務運営への経営陣の注意をそらす可能性がある。業務を行うことが予想される任意の医師または他の医療提供者またはエンティティが、適用される法律に準拠していないことが発見された場合、その個人またはエンティティは、刑事、民事または行政処罰を受ける可能性がある
政府から援助された医療計画から除外される。今後発売される製品の販売を禁止または制限または撤回することは、不利な方法で業務に大きな影響を与える可能性がある。
従業員の不正行為を常に識別し、阻止できるわけではなく、不正行為を発見し、防止するための予防措置は、未知または未管理のリスクや損失を効果的に制御できない可能性があり、あるいはこのような法律や法規を遵守できないことによる政府の調査や他の行動や訴訟から私たちを保護することができるかもしれない。私たちの業務計画が適用される医療保険法に適合することを確保する努力は巨額のコストに及ぶ可能性がある。政府および法執行当局は、私たちの業務実践が、詐欺および乱用または他の医療保健法律および法規を適用する現在または未来の法規、法規または判例法に適合していない可能性があると結論するかもしれない。もし私たちにこのような訴訟を提起して、私たちが私たち自身を弁護したり、私たちの権利を維持することに成功しなかったら、私たちの業務は損害を受けるかもしれない
我々はまた、“海外腐敗防止法”、イギリスの“反賄賂法”および他の同様の世界的な反賄賂法、および様々な貿易法律や法規(経済制裁、輸出法、税関法を含む)を含む反賄賂や反腐敗法律の制約を受けており、これらの法律を遵守しなければ、私たちの運営結果や財務状況に大きな悪影響を及ぼす可能性がある。
“海外腐敗防止法”及び同様の世界的な反賄賂及び反腐敗法は、企業及びその中間者が業務を獲得又は保留する目的で、腐敗方式で外国政府関係者に任意の報酬又はその他の利益を提供することを禁止している。米国司法省、証券取引委員会、商務省、国務院、財務省、その他の連邦機関や当局は、“海外腐敗防止法”、経済制裁法、輸出規制法および他の連邦法規(外国資産制御弁公室(OFAC)が制定した法律·法規を含む)に違反した会社や個人に広範な民事·刑事罰を加えることを求める可能性がある。また、イギリスの2010年反賄賂法は、国内と国際賄賂、そして民間および公共部門の賄賂を禁止している。組織と関連のある誰もが賄賂を行うことを阻止できなかった組織は、その組織が賄賂を防止するために十分な手続きが実施されていることを証明することができない限り、“収賄法”によって起訴されることができる。
同様に、米国と同様のグローバル貿易法は、経済制裁、輸出法、税関法を含み、私たちがある司法管轄区や取引相手と業務を展開する能力を規範化し、世界各地で製品を輸出入する方法を規範化している。これらの法律によると、異なる政府機関は、輸出許可証を取得することを要求し、制裁された国、実体、および個人での商業活動の停止を要求することを含む商業的慣行を修正することができるかもしれない。これらの法律法規の広範性と動態性はコンプライアンスコストを増加させ、罰金を科すかもしれない。
Novavaxはすでに米国以外の管轄地域で複数の規制承認を得ており、いくつかのリスクの高い司法管轄区域で第三者との協力を含む国際的な場所で商業運営を開始している。また,我々の製造に関する業務の一部は米国以外のハイリスク司法管区で行われている。私たちは未来に私たちの国際活動が増加すると予想する。私たちは適用される反腐敗と貿易法律法規の遵守を促進するために、政策、内部統制、その他の合理的な設計の措置を維持しているが、私たちの従業員や代理人は不当な行為に従事する可能性があり、私たちはこれに責任を負わなければならないかもしれない。このような反腐敗や貿易法律に違反する行為、さらにはそのような違反に対する告発は、調査および/または法執行行動を引き起こす可能性があり、これは、深刻な管理の気晴らしに関連し、法的費用を含む巨額のコストおよび支出をもたらす可能性がある。もし私たちまたは私たちの従業員または私たちを代表する代理人がこれらの法律法規に違反する行為に従事していることが発見された場合、私たちは刑事および民事法執行行動、厳しい罰金と処罰、利益返還、将来の行為禁止、証券訴訟、取引禁止政府業務、証券取引所からの撤退、および私たちの業務、財務状況、経営業績に重大な悪影響を及ぼす可能性のある他の結果を受ける可能性がある。さらに、もし私たちが実際または潜在的な反腐敗や貿易法律法規の違反に関連する負の宣伝の対象になれば、私たちの名声、私たちの収入、または私たちの株価は悪影響を受ける可能性がある。
私たちの知的財産権に関するリスクは
私たちの成功は私たちが私たちの技術の固有の性質を維持する能力があるかどうかにかかっている。
私たちの成功は私たちが私たちの技術と他の商業秘密の固有の性質を維持する能力があるかどうかに大きく依存する。これをするためには、既存特許を起訴して維持し、新しい特許を取得し、商業秘密や他の知的財産権保護を求めなければならない。私たちはまた第三者の所有権を侵害することなく運営しなければならないし、第三者が私たちの権利を侵害することも許さない。私たちは現在、私たちの技術をカバーする560件以上のアメリカと外国特許と特許出願を所有または獲得する権利があります。しかし、薬品と生物製品に関連する特許問題は複雑な法律、科学と事実問題に関連している。これまで、米国特許商標局(USPTO)によって付与されたり、連邦裁判所によって強制的に執行されたバイオテクノロジー特許請求の範囲の広さについては、一貫した政策は現れていない。したがって、私たちは何か特別な特許出願が特許の発行につながるかどうか、あるいは任意の特許の発行が私たちにどんな競争優位性をもたらすのか分からない。私たちはまた私たちがもっと特許を申請できる独自製品を開発するかどうかを確認することができない。また、他の会社が類似技術や製品を独立して開発または複製したり、私たちに発行された特許を回避したりするリスクもある。
私たちの特許出願は成分、製造方法、用途を含む候補ワクチンの様々な特徴をカバーしているにもかかわらず、私たちの特許は競争製品の開発から私たちを完全に保護することはできません。私たちのいくつかの技術的ノウハウと技術は特許を申請できない。特許を出願できない知的財産権および商業秘密に関する私たちの独自の権利を保護するために、従業員、コンサルタント、コンサルタント、および協力者に秘密保護協定を締結することを要求します。これらの合意は、私たちのビジネス秘密、技術的ノウハウ、または他の固有の情報に意味のある保護を提供しないかもしれません。
米国や海外で提案されていない製品名/ブランドの商標登録は、私たちの業務に悪影響を及ぼす可能性があります。
私たちが提案した製品の商標を保護するための商標登録は、アメリカのUSPTOと私たちの主要市場の世界各地の商標局の承認を得る必要があります。米国特許商標局または主要国際司法管轄区の商標局は、様々な潜在的な理由で私たちの任意の商標の登録を拒否する可能性があります。もし私たちの商標が米国または他の重要な国際司法管轄区域に登録されていない場合、私たちはその提案された製品のために別の名前を採用することを要求される可能性がある。代替名称を採用する場合、私たちは、その開発候補製品に対する任意の既存の商標出願の利点を失い、適用商標法の資格に適合し、第三者の既存の権利を侵害せず、FDAおよび他の規制機関のために受け入れられる適切な製品名を識別するために、多くの追加資源を使用することが要求される可能性がある。
第三者は私たちが彼らの知的財産権を侵害したと主張するかもしれない。
これらの活動によって生成された任意の候補ワクチンを含む我々の研究、開発、および商業化活動は、第三者が所有する特許または商標を侵害していることが発見される可能性があり、私たちはこれらの特許または商標のライセンスまたは他の権利を所有していない。提出されたが発表されていない申請を含む私たちが知らない権利があるかもしれないが、これらの申請は発行されると、私たちに不利になるかもしれない。これらの第三者は私たちにクレームをつけるかもしれません。これは私たちに巨額の費用を発生させる可能性があり、勝訴すれば、巨額の損害賠償金を支払うことになるかもしれません。さらに、特許または商標侵害訴訟を起こした場合、訴訟の対象となる製品または生物候補薬物の研究、開発、製造、または販売の停止または延期を余儀なくされる可能性がある。
特許または商標侵害クレームのため、または潜在的クレームを回避するために、第三者に許可を求めることを選択または要求される可能性がある。このようなライセンスは許容可能な条項で提供されないかもしれないし、全く提供されないかもしれない。私たちが許可を得ることができても、許可は私たちに許可料や印税、あるいは両方を支払うことを要求する可能性が高く、私たちに与えられた権利は非排他的である可能性があり、これは私たちの競争相手が同じ知的財産権を得ることをもたらす可能性がある。最終的に、実際または脅威の特許または商標侵害クレームにより、許容可能な条項で許可を得ることができない場合、製品の商業化を阻止されたり、何らかの態様の業務運営を停止させられたりする可能性がある。上記のすべての問題はまた私たちの協力者に影響を及ぼす可能性があり、これはまた協力の成功に影響を与え、私たちに影響を与えるだろう。
製薬やバイオテクノロジー産業では、特許、商標、その他の知的財産権に関する訴訟や他の訴訟が数多く発生している。
私たちは私たちの知的財産権や私たちの協力者が人の知的財産権を擁護したり実行したりするために訴訟に巻き込まれるかもしれないが、これは高価で時間がかかるかもしれない。
競争相手は私たちの特許や私たちの協力者が人かもしれない特許を侵害するかもしれない。したがって、私たちは無許可使用を防ぐために特許侵害訴訟を提起することを要求されるかもしれない。これは高くて時間がかかるかもしれない。さらに、侵害訴訟では、裁判所は、私たちの特許が無効であるか、または強制的に実行できないと判断することができ、または、私たちの特許がその技術をカバーしていないことを理由に、他方の論争技術の使用を阻止することを拒否することができる。任意の訴訟または弁護手続きに対する不利な裁決は、私たちの1つまたは複数の特許を無効または狭義に解釈されるリスクに直面させ、私たちの特許出願を発行できないリスクに直面させる可能性がある。競争相手は私たちの商標や協力者が人かもしれない商標を侵害するかもしれない。したがって、私たちは同じまたは困惑した類似商標の不正使用の侵害に対抗するために訴訟を提起することを要求されるかもしれない。これは高くて時間がかかるかもしれない。
たとえ私たちが成功しても、訴訟は巨額の費用を招き、私たちの経営陣の注意を分散させる可能性がある。幅広い製品の組み合わせを持っていても、私たちは単独であるいは私たちの協力者や許可者と一緒に私たちの独占権が流用されることを防ぐことができないかもしれません。特に法律ではアメリカのようにこのような権利を十分に保護できないかもしれません。
さらに、知的財産権訴訟は大量の開示を必要とするため、このような訴訟の間、私たちのいくつかの機密情報は開示によって漏洩される可能性がある。また,訴訟過程では,公聴会,動議,あるいは他の一時的な手続きや事態の発展の結果が公表される可能性がある.もし投資家たちがこれらの結果が否定的だと思うなら、私たちの普通株の市場価格は深刻な損害を受けるかもしれない。
私たちの特許主張の範囲、有効性、所有権は様々な場面で挑戦される可能性があり、もし私たちが勝たなければ、競争相手を排除する能力が損なわれる可能性があり、商業的に成功する能力を低下させるかもしれない。
私たちは請求の範囲またはその有効性に関する第三者から様々な挑戦を受けるかもしれない。このような疑問は、付与後の再審、一方的な再審、および米国特許商標局で行われる当事者間再審手続きにおいて提出されることができ、または他の法域の同様の対抗手続きで提出することができる。もし私たちがこのような挑戦で成功しなければ、私たちのクレーム範囲は縮小されるかもしれないし、無効と発表されるかもしれない。このような結果は、競争相手をこれらの国の市場から排除する能力を弱める可能性があり、潜在的に私たちのビジネス成功に影響を与える可能性がある。
私たちの特許は、干渉または派生プログラムを含む所有権および発明権に関連する様々な挑戦を受けるかもしれない。第三者は彼らが私たちの特許の発明者であるか、または彼らが特許の所有者だと主張するかもしれない。私たちは私たちの特許に正しい発明者がリストされていることを確実にするために在庫分析を行っているが、管轄権のある裁判所が私たちと同じ結論を出すとは確信できない。もし私たちが所有権または発明権に対抗する挑戦に失敗した場合、裁判所は私たちにより多くの発明者をリストすることを要求するかもしれないし、特許の無効を宣言するかもしれないし、特許の所有権を第三者に譲渡するかもしれない。これらの結果のいずれも競争相手を排除する能力を損なう可能性があり、私たちのビジネス成功に影響を及ぼす可能性がある。さらに、所有権が第三者に譲渡された場合、私たちは、この発明を実践する私たちの独占的な能力を維持するために、これらの権利のライセンスを求める必要があるかもしれない。そのような許可は商業的に合理的な条項で提供されないかもしれないし、全くそうではないかもしれない。もし私たちが許可を得ることができなければ、私たちは特許を巡って設計するために時間、エネルギー、他の資源がかかるかもしれない。いずれの許可も非排他的である可能性があり,競争相手が第三者から許可を得ることができれば,その競争相手を市場から排除する能力が負の影響を受ける可能性がある.
たとえ私たちが最終的に成功しても、このような挑戦に対応することは、私たちに巨額の費用を発生させる可能性があり、本来業務に投入できる大量の財務·管理資源を移転する必要があるかもしれない。
私たちの商標権/登録の範囲、有効性、および所有権は、アメリカや海外の様々な場所で挑戦される可能性があり、もし私たちが勝たなければ、競争相手が困惑した類似商標を使用して登録する能力を排除することができ、商業的に成功する能力を低下させる可能性がある。
私たちは第三者から様々な挑戦を受けるかもしれませんが、これらの挑戦は、アメリカと国際的な商標登録の有効性と関連があります。このような挑戦は、米国特許商標局の商標撤回や異議訴訟において提起することができ、他の管轄区の同様の対抗訴訟で提起することもできる。もし私たちがこのような挑戦に失敗したら、私たちの商標登録は縮小されるかもしれないし、拒否されたりキャンセルされるかもしれない。このような結果は、競争相手が困惑した類似マークを使用する能力を排除し、潜在的に私たちのビジネス成功に影響を与える可能性がある。
私たちの商標登録は、混同の可能性、商業における商標の使用、または米国および国際的な他の理由に関する様々な挑戦を受ける可能性がある。第三者は、私たちの商標が彼らの先行権利を侵害したと主張するかもしれない、または私たちは特定の司法管轄区域で商標登録で識別された商品/サービスに関連する商標を使用していない。私たちは私たちが他人の商標権を侵害していないことを確認するために商標許可検索と分析を行っているが、管轄権のある裁判所が私たちと同じ結論を出すとは確信できない。もし私たちがこのような挑戦に対応できなかった場合、裁判所は私たちの商標登録および/または発行禁止を取り消し、商標の使用を停止することを要求するかもしれない。私たちはまた私たちがどんな商標でも持っている可能性のある一般的な権利に依存できないかもしれない。このような結果の中のどれも私たちのビジネス成功に影響を及ぼすかもしれない
たとえ私たちが最終的に成功しても、このような挑戦に対応することは、私たちに巨額の費用を発生させる可能性があり、本来業務に投入できる大量の財務·管理資源を移転する必要があるかもしれない。
第三者から知的財産権の許可を得る必要があるかもしれませんが、私たちが許可した知的財産権を使用する権利が影響を受けると、候補ワクチンを開発して商業化する能力が損なわれる可能性があります。
私たちは過去にあり、私たちは将来的に第三者から知的財産権の許可を得ることが予想され、これらの許可は私たちの業務に重要になるだろう。私たちはこのようなライセンスベースの特許や特許出願を持っていないし、私たちは特許の起訴や実行を制御しないかもしれない。この場合、私たちはこれらの特許出願を適切に起訴して提出し、これらの特許の侵害を防止するために、私たちの許可者に依存することを余儀なくされるかもしれない。
私たちが権利を持っている多くのライセンスは私たちに特定の分野の権利を提供してくれるが、これらのライセンスおよび他のライセンスの下での私たちの権利範囲は、私たちのライセンシーまたは第三者の議論を受けるかもしれない。さらに、私たちがこれらの技術を使用し、許可特許および特許出願において主張する発明を実践する権利は、それらを終了するのではなく、私たちの許可者がこれらの許可の条項を遵守することに依存する。もし私たちが許可協定の条項や条件に違反した場合、またはいくつかの他の場合、許可者は私たちの任意の許可を終了するかもしれない。
また、ライセンス義務に関するいかなる紛争も、私たちが成功しても、製品を商業化し、収入を創出する能力を遅らせることができる高価で時間のかかる法的行動をとる必要があるかもしれません。さらに、発生した許可問題を解決できなければ、製品の製造、使用、または販売に必要な知的財産権を失う可能性があります。このような損失は、現在または将来の候補製品の開発および商業化努力に影響を与える可能性があり、および/または設計のために追加の作業および費用が必要となる可能性がある。
私たちの候補ワクチンと潜在的な候補ワクチンはいくつかのコンポーネントを必要とし、各コンポーネントは許可プロトコルの主題である可能性がある。これらのコンポーネントの累積許可料や特許権使用料は,これらの候補ワクチンの商業化を不経済にする可能性がある。
特許法や特許法の解釈が変化すれば,我々の競争相手は我々の発見を開発して商業化することができるかもしれない。
米国や米国以外の他の重要な市場、例えばヨーロッパや日本では、バイオ製薬製品や方法の利用可能な特許保護の範囲と範囲は依然として解決されなければならない。また、外国市場は米国特許制度と同レベルの特許保護を提供しない可能性がある。訴訟または行政訴訟は、私たちおよび他の人たちの特定の固有の権利の有効性と範囲を決定するために必要かもしれない。このような訴訟や訴訟は、将来的に大量の資源投入を招く可能性があり、疑問視されている知的財産権を含む任意の製品の販売を停止または使用することは、私たちの収入に悪影響を及ぼす可能性があり、侵害された知的財産権の所有者から許可を得ることができない可能性があり、その許可が全く許可されていなければ、第三者の知的財産権の侵害を回避するために私たちの製品を再設計することは、時間的または不可能である可能性がある。また、米国と他の国の特許法の変化や特許法の異なる解釈は、特許法が他の人が私たちの製品を発見または開発し、商業化することを許可する可能性がある。私たちは私たちが獲得した特許や私たちが持っている非特許技術が私たちに重要な商業保護を提供することを保証できない。欧州では、2023年6月1日に施行される新たな単一特許制度は、新制度導入前に付与された特許を含む欧州特許に大きな影響を与える可能性がある。新しい制度の下で、出願人は特許を承認した後、その特許を単一特許に選択することができ、この単一特許は新しい単一特許裁判所(UPC)によって管轄される。特許
新システム実施前に付与された特許は,UPCの管轄を受けず,UPC国では国家特許として保持することができる。UPC管轄内に残っている特許は、UPCベースの撤回プログラムで挑戦される可能性があり、成功すれば、UPC署名国のすべての国の特許を無効にする可能性がある。また、UPCは新しい裁判所システムであるため、裁判所の法律には前例がなく、どの特許訴訟の結果にもより大きな不確実性が存在する。新しい特許制度が欧州市場で競争相手を排除する能力にどのような影響を与えるか予測できません。特許法の変化に加えて、ロシアのウクライナ侵攻を含む地政学的動向は、特定の司法管轄区域で特許を取得·実行する能力にも影響を与える可能性がある。もし私たちが必要に応じて特定の市場で特許を取得して実施できなければ、私たちがこれらの市場で競争相手を排除する能力は低下する可能性がある。
もし私たちが“ハッジ·ワックスマン法案”に基づいて米国で特許期間延長および/または特許期間調整を取得しなければ、外国で同様の延長を獲得しなければ、競争相手を排除する能力が損なわれる可能性がある。
米国では特許期間は米国最初の非臨時出願日から20年である。場合によっては、特許期間を延長することができる。FDAが私たちの候補製品の発売を承認した時間、期限、条件によると、私たちは1984年の“薬品価格競争と特許期限回復法”(“ハッチ·ウェクスマン修正案”)とEUとイギリスの同様の立法に基づいて、上場製品をカバーする特許の有効期限を延長することができる。
Hatch-Waxman修正案は、製品開発およびFDA規制審査中に損失した有効特許期間の補償として、承認された製品をカバーする特許を最長5年間延長することを可能にする。もし私たちが適用の最終期限内に出願を提出できなかった場合、関連特許の満了前に出願を提出できなかった場合、または適用の要求を満たしていなかった場合、私たちは何の延期も得られないかもしれない。しかも、延期の長さは私たちが要求したものより短いかもしれない。もし私たちが特許期間の延長を得ることができない場合、あるいはこのような延長の期限が私たちが要求したものよりも短い場合、私たちはその製品に対して特許権を行使することができる期限が短縮され、競争相手はより早く承認され、競争製品市場に入るかもしれません。
我々の製品をカバーする特許期間も延長することができ,USPTO起訴特許出願期間にかかる時間を延長することができる。この延期を特許期限調整(“PTA”)と呼ぶ.USPTOがPTAをどのように計算するかについては,法律や法規が変化する可能性があり,法律の変化はこのようなPTAを減少または増加させることができる。しかも、USPTOが承認したPTAは第三者から疑問視されるかもしれない。もし私たちがこのような挑戦の下で勝つことができなければ、PTAは減少またはキャンセルし、特許期間を短縮する可能性があり、これは競争相手を排除する能力にマイナスの影響を与える可能性がある。
従業員事務·管理成長·情報技術に関するリスク
もし私たちが私たちの業務開発計画を成功的に実行しなければ、私たちの業務は不利な影響を受けるかもしれない。
製品、技術、会社の買収、協力、内部許可、または戦略連合や協力への参加を含む内部開発プロジェクトおよび外部機会による成長を期待しています。質の高い機会は限られており、私たちは私たちと私たちの株主が適切だと思う候補者を決定したり、有利な条項で取引を完了したりすることができないかもしれません。このような機会を求めるためには、私たちは大量の追加融資が必要かもしれません。これらの融資は、全くなければ、優遇的な条件で提供されないかもしれません。Novavax CZ(前身はPraha Vaccines)やNovavax ABとの業務統合など、買収を決定·完了することに成功したとしても、戦略取引は、他の業務への経営陣の関心の分散に関するリスク、意外な費用や負債、当社の業務の複雑さの増加を含む多くのリスクに関連しており、買収された施設を有効に利用し、買収した業務や人員の統合に成功したり、期待される相乗効果を十分に実現したりすることができる。
私たちの現在と未来の潜在的な成長を効果的に管理するためには、私たちの運営、財務、管理プロセスを引き続き強化し、従業員基盤を効果的に拡大、訓練、管理する必要がある。私たちの成長計画を支援するには、研究開発、内部製造、第三者メーカーと私たちの業務を通じた他の分野への投資を含む大量の支出と管理資源が必要になります。もし私たちが私たちの成長をうまく管理し、私たちの成長計画を成功的に実行できなかったら、私たちの業務と財務業績は不利な影響を受ける可能性があり、私たちは資産減額や再編費用を発生させる可能性がある。
我々の現在の現金状況とキャッシュフロー予測,および2023年の収入,米国政府からの資金,およびGaviの未解決仲裁に関する重大な不確実性を踏まえて,本年度報告書に含まれる財務諸表発表日から1年間経営を継続できるかどうかには大きな疑問がある。
私たちの経営陣は、いくつかの条件やイベントが存在するかどうかを評価しなければなりません。全体的に見ると、これらの状況や事件は、財務諸表の発表日から1年以内に経営を継続する能力に大きな疑いを抱いています。2022年12月31日現在、私たちは13億ドルの現金と現金等価物および制限現金を持っており、そのうち2.362億ドルが2022年12月に私たちの普通株式の同時売却と発行によって2027年12月15日に満期になる転換可能優先無担保手形(“2027年手形”)によって調達された。当社は2023年1月31日に、当社が2023年2月1日に満期となった転換可能優先無担保手形(“2023年手形”)の未償還元金3.25億ドルに資金を提供します。2022年には6億579億ドルの純損失が発生し,運営活動で使用されている純キャッシュフローは4.159億ドルであった。
我々は現在、1年間の継続経営展望期間のキャッシュフロー予測を推定しており、運営に資金を提供するのに十分な資本があるが、この予測には以下の点を含む大きな不確実性がある
•2023年の収入:私たちの2023年の収入は、2023年秋の新冠肺炎候補ワクチンの単価または二価最新処方を開発、製造、流通、またはマーケティングに成功させる能力にかかっており、それ自体は不確定であり、規制部門の承認を含めて多くのリスクの影響を受けている。2023年初め、著者らはBA.5臨床試験材料の生産に遅延があり、これは2023年秋のCOVIDワクチン季節候補ワクチンに対するFDAの監督管理許可を延期する可能性がある。また、2023年1月、VRBPACは2023年第2四半期に2023年秋のCOVIDワクチン季節に業界に毒株方案指導を提供する予定であることを発表した。2023年秋の潜在的需要を満たすために、著者らは菌株方案ガイドラインを提供する前に、更新された新冠肺炎変異菌株製剤の生産を開始する予定である。もし私たちが毒株方案のガイドラインに合わない処方を生産し始めたら、私たちは2023年秋のCOVIDワクチン季節に私たちの顧客に十分な数の適切なワクチンを提供することができなくなり、私たちは販売できない処方に大きなコストを発生させる。
•アメリカ政府からの資金は:私たちのUSG協定は2023年12月に満了します。私たちは、アメリカ政府が18億ドルのライセンス金額がすべて達成されるまでUSG協定を延長すると予想していた。2023年2月、“米国政府協定”改正17の実行について、米国政府は、この裁決を現在の履行期間を超えるまで延長してはならないと表明した。もしUSG協定が私たちが以前に予想していたように修正されなかったら、私たちはUSG協定によって予想されていた残り4.16億ドルの資金を受け取ることができないかもしれない。
•未解決の仲裁:2023年1月24日、GaviはGavi APAに実質的な違反の疑いがある疑いのある仲裁請求を国際仲裁裁判所に提出した。この仲裁の結果は本質的に不確定であり、残りの6.974億ドルの前金の全部または一部の返還を要求する可能性がある。GAVIアービトレーションに関するより多くの情報は、本年度報告Form 10-Kの第2部第8項“財務諸表および補足データ”の連結財務諸表付記3および付記18を参照されたい。
経営陣は、これらの不確定要因の重要性に鑑み、これらの財務諸表が発表された日から、経営を継続する企業として1年間経営を継続する能力に大きな疑問があると考えている。
私たちが会社運営に資金を提供する能力は、私たちの製品および候補製品のワクチン販売に関連する収入に依存します(これらの候補製品がマーケティング承認を得て商業化に成功した場合)、Gaviとの紛争を解決するかどうか、いつ、およびGaviとの紛争をどのように解決するかを含むいくつかの問題の解決、およびGaviとの紛争の解決を含み、株式および債務融資、協力、戦略連盟、およびマーケティング、流通、または許可によって追加資金を調達することを含む可能性があります。私たちは商業的に受け入れられる条項で新しい融資を得ることができないかもしれないし、根本的にできないかもしれない。さらに、任意の協力、戦略連合、およびマーケティング、流通、または許可配置は、場合によっては、これらの権利がそのような権利のすべての潜在的価値を下回る可能性がある製品または技術の一部または全部の権利を放棄することを要求することができる。さらに、NVX-CoV 2373および私たちの他の候補ワクチンは、インフルエンザ候補ワクチン、CIC候補ワクチン、または単価または二価処方を含む新しい冠肺炎変異株を含み、規制および商業上の成功はまだ確定されていない。もし私たちが
私たちがより多くの資本を得ることができない場合、私たちの資本資源を評価し、業務の一部または全部を延期、縮小または廃止すること、または私たちの組織規模を削減することが要求される可能性があり、いずれも、私たちの業務、財務状況、運営結果、および持続的な経営企業としての運営能力に大きな悪影響を及ぼす可能性がある。
私たちの情報技術システムや私たちが依存しているサプライヤーのセキュリティホールや他の中断は、私たちの情報を危険にさらし、私たちを責任、名声被害、または他のコストに直面させる可能性があります。
私たちの通常のビジネスプロセスでは、私たちは、知的財産権、私たちの独自の業務情報、私たちの臨床参加者、サプライヤーおよびビジネスパートナーに関するデータ、および個人識別情報を含む、現在および将来の多くの戦略的パートナー、サプライヤー、請負業者、およびコンサルタントと敏感なデータを収集して保存します。このような情報の安全維持は私たちの運営と業務戦略に必須的だ。その中のいくつかの情報は、民族国家、組織犯罪集団、“ハッカー活動家”、患者団体、不満を抱く現職または前任社員、その他の人を含む悪意のある第三者の広範な動機と専門知識を持つ犯罪攻撃の魅力的な目標を代表する。我々が行っている業務活動も正常に動作する情報技術システムに依存している.サイバー攻撃はますます複雑化しており,我々がセキュリティ対策を講じているにもかかわらず,我々の情報技術システムやインフラ,我々のサプライヤーやパートナーのシステムやインフラも,このような攻撃や侵入を免れることはできない.2020年、多数の国内外の安全機構は、政府行為者或いは政府付属行為者は専門的に新冠肺炎ワクチンの研究開発に従事する組織であることを発表した。我々のUSGプロトコルでの資金受給者としてのイメージや,我々が開発したNVX-CoV 2373は,より大きなネットワーク攻撃リスクを招く可能性がある.どのような攻撃も、私たちのネットワークに実質的な被害を与える可能性があり、そこに格納されている情報は、アクセス、公開開示、損失、提示、永久的、または一時的にアクセスできない可能性がある。しかも、私たちはシステムの侵入をタイムリーに発見しないかもしれない。私たちの業界の他の会社と同様に、私たちのデータやシステムはマルウェアやコンピュータウイルスを含む攻撃を受けていますが、私たちのシステムや私たちの業務に関連するデータ接続の第三者も攻撃を受けています。また…, 私たちは臨床試験データを保存するウェブサイトと協力しています攻撃は私たちの業務、運営、または財務業績に実質的な影響を及ぼすかもしれない。任意のアクセス、開示、または他の情報損失、私たちまたは私たちのパートナーによって記憶されているか、または私たちの業務中断をもたらす他のネットワーク攻撃、恐喝ソフトウェアを含めて、名声、業務および競争被害を引き起こす可能性があり、私たちのネットワーク防御の修復および強化に関連する巨額のコスト、法的クレームまたは訴訟、政府調査、責任、個人情報のプライバシーを保護する法律、および保険料の増加を含む、これらはすべて私たちの業務に悪影響を及ぼす可能性があります。もし“恐喝ソフトウェア”が私たちのシステムへのアクセスを阻止したり、使用したりすれば、身代金を支払う必要があるかもしれません。もし攻撃者がこのような攻撃過程でいくつかの重要なデータを盗んだ場合、身代金コストに加えて、名声やその他の被害に直面する可能性があります。
グローバルプライバシーやデータセキュリティ要求を遵守することは、追加的なコストと責任をもたらしたり、世界でデータを収集して処理する能力を抑制したりする可能性があり、私たちがデータ保護法律や法規に従わなければ、政府の法執行行動を招く可能性があり、これは私たちの業務や名声を損なうことになる。
プライバシーおよびセキュリティに関する持続的な発展の州、連邦および外国の法律、法規および業界基準は、個人データの収集、使用、保持、保護、開示、転送、およびその他の処理に適用されます。プライバシーやデータ保護法の解釈や適用は国/地域によって異なる可能性があり,不一致や衝突の要求が生じる可能性があり,このような法律を遵守する際に生じるコストを増加させることは巨大である可能性がある.例えば、2018年5月に発効したGDPRは、このようなデータの収集と使用に対する開示要求の向上、企業がこれらの会社が保有する個人データのコピーや削除要求の取得、保持情報の制限、開示重大なデータ漏洩の開示など、個人データの処理に一連の要求を提出している。GDPRは規定を守らないことに対する実質的な処罰を規定しており、罰金額は最高2000万ユーロまたは前財政年度の世界年収の4%に達する自自 1月 1, 2021 the GDPR 保留されています “2018年欧州連合(脱退)法令”第3条はイングランド及びウェルズ,スコットランド及び北アイルランド法律の一部であるため,この法令は“データ保護,私隠及び電子通信(改正等)”により改正されている。(EU離脱)条例2019(SI 2019/419)(“英国GDPR”)、および英国2018年データ保護法我々のGDPR,英国GDPR,その他のプライバシーやデータ保護法を遵守する努力は大きなコストと挑戦をもたらし,時間の経過とともにこれらのコストや挑戦が増加する可能性があり,既存または将来のデータプライバシー法律法規違反に関する巨額の処罰や訴訟に直面している
また、GDPRと英国GDPRは、欧州経済圏やイギリス以外の国への個人データの移転に厳しい制限を加えている。2016年、EUと米国はEUから米国へのデータ移転枠組みに同意し、EU-米国プライバシー盾と呼ばれている。しかし、2020年7月16日、EU裁判所はプライバシー盾の枠組みの無効を宣言して提出する裁決を発表した
欧州委員会の標準契約条項(“SCC”)が国境を越えたデータ伝送に合法的に使用できるかどうかに関する問題。欧州委員会は2021年6月4日、GDPRに基づいて欧州経済圏以外で個人データを送信するための新しいSCCを通過した。この法的メカニズムによると、私たちはこのような国境を越えたデータ転送の影響評価を行い、追加のセキュリティ措置を実施する義務があるかもしれない。私たちが新しいライセンスを私たちの契約スケジュールに組み込む時、私たちは私たちの契約スケジュールを更新し、新しい義務を履行するために大量の資源を使う必要があるかもしれない。国境を越えた個人情報伝送のために有効なコンプライアンスメカニズムを実施できない場合、私たちはより多くの規制行動、巨額の罰金、ヨーロッパから米国への個人情報の処理または送信を禁止する禁止令に直面する可能性がある。個人情報をヨーロッパからアメリカに導入できないことは、ヨーロッパでの臨床試験を行う能力を制限することを含む、私たちの業務運営に重大かつ負の影響を与える可能性があり、契約研究組織、サービスプロバイダ、請負業者、他の制約された会社と協力する能力を制限すること、またはヨーロッパでのデータ処理能力を高いコストで向上させることを要求する。
プライバシー法律法規は米国でも拡大している。2020年1月1日に施行されたCCPAは、カリフォルニアの消費者に新たな情報を開示し、未成年者に関する情報を収集または使用する新しいルールを強制的に実施し、彼らのデータが誰に販売または開示されているかを知る権利、会社に彼らの個人情報を削除する権利、個人情報を売却しないことを選択する権利、消費者がプライバシー権を行使する際に価格やサービスにおいて差別されない権利など、消費者に新たな能力を与える。GDPRと同様に,CCPAも違反行為に潜在的な重大な処罰を設定している。CCPAはまた、あるデータ漏洩行為に個人訴権と法定損害賠償を提供しており、これはデータ漏洩訴訟に関連するリスクを増加させると予想される。2023年に施行されるカリフォルニアプライバシー権法案(CPRA)は、CCPAを拡張し、個人情報を訂正する権利、自動決定において個人情報を使用しないことを選択する権利、以下の行動広告に消費者の個人情報を使用しないことを選択する権利、および地理的位置データを第三者に開示する権利を含む敏感な個人情報の使用および開示を制限する権利を創出する。同様の制限は、CCPAに続く最初の全面的な州プライバシー規制であるバージニア州消費者データ保護法(VCDPA)およびコロラド州プライバシー法(CPA)にも含まれている。CPRA、VCDPA、CPA、その他の米国プライバシー法の遵守を求めるために、我々のプライバシー計画を評価し、更新する必要があり、遵守しようと努力した場合に追加料金が発生することが予想される。
他の州もカリフォルニア州、コロラド州、バージニア州に倣って、より全面的なプライバシー法を制定する可能性がある。このような立法が通過すると、追加の複雑性、要求変化、制限、および潜在的な法的リスクが増加する可能性があり、コンプライアンス計画、影響戦略に追加のリソースを投入し、以前の有用なデータの利用可能性を減少させ、コンプライアンスコストの増加および/またはビジネス実践および政策の変化をもたらす可能性がある。
当社の完全子会社Novavax ABおよびNovavax CZは、SIIPL、武田、SK Bioscience、国際サプライヤーとの協力および契約など、地域パートナーと、米国以外での業務展開に関連する追加リスクに直面しています。
スウェーデンのNovavax ABとチェコ共和国のNovavax CZはNovavax,Inc.の完全子会社です。SIIPLと供給と許可協定を締結し、武田とSK生物科学社とそれぞれ協力と許可協定を締結し、他国の外国政府や会社と他の合意や手配を達成しました。私たちは世界各地の会社、非営利団体、地方政府と協力やパートナーシップを構築していく予定です。米国以外で事業を展開するリスクには、以下のような負の結果が含まれる
•現地市場で製品を開発、製造、販売する能力を管理するための複数の規制要件の遵守に関するコスト
•米国の“海外腐敗防止法”や他の司法管轄区のような反賄賂法のような反賄賂法を遵守できなかった
•関税、禁輸、制裁、輸入制限、および輸出許可要件を含む既存の貿易措置の新しい解釈または変化
•私たちの国際業務を編成し、管理し、運営することの困難さとコスト
•環境、健康、安全法を改正する
•為替レートが変動する
•現在の税法解釈の新しいものや変化の
•政治的不安定さと実際的または予想される軍事的または潜在的な衝突(ロシアとウクライナ間の持続的な衝突、およびより広いヨーロッパまたは世界的な衝突を含むが、これらに限定されない)
•経済の不安定、インフレ、衰退、金利変動
•多くの司法管轄区域では、知的財産権の保護が最小限または減少している
•可能な国有化と収用。
これらのリスクは、単独でも全体的にも、私たちの業務、財務状況、運営結果、およびキャッシュフローに実質的な悪影響を及ぼす可能性がある。
もし私たちが重要な管理職や他の人員を引き付けることができない場合、私たちの業務、経営業績、財務状況は重大な悪影響を受ける可能性があります。
私たちは私たちの高官たちと重要な科学と他の人たちに依存している。これらの人員の流失や私たちが適切な後継計画を実施できなかったことは、私たちの業務を損なう可能性があり、研究、開発、または業務目標の実現を著しく遅延または阻害する可能性がある。重要な管理職の交代により、わが社は管理の連続性と長期的な歴史が不足し、運営と行政効率の低下を招き、コストを増加させる可能性がある。
私たちは私たちが受け入れられる条件で合格した人たちを重要なポストに引き付けることができないかもしれない。製薬と生物技術会社の間の合格従業員に対する競争は非常に激しく、合格従業員の流失、あるいはもっと多くの高技能従業員を吸引、維持と激励することができず、著者らの臨床試験の成功と適切な製品の開発能力を阻害する可能性がある。
私たちはまた時々外部顧問に依存して、彼らは私たちの研究開発と臨床戦略を制定するのを手伝ってくれた。私たちは受け入れ可能な条件でこの人たちを引き付けて維持することができないかもしれないが、これは私たちの発展努力を遅らせるかもしれない。
私たちの転換可能な優先チケットに関するリスク
2027年に満期になった5.00%の転換優先無担保手形の返済には大量の現金が必要で、債務を返済するのに十分なキャッシュフローがないかもしれません。
2022年には元金総額1.753億ドルの債券を発行した。私たちが元金を期日どおりに支払うことができるかどうか、利息を支払うこと、あるいは私たちの債務(債券を含む)のための再融資を行うことができるかどうかは、私たちの未来の表現にかかっており、これらの表現は経済、金融、競争、そして私たちがコントロールできない他の要素の影響を受けるだろう。私たちの業務は、運営から債務を返済し、必要な資本支出を行うのに十分なキャッシュフローを生成することができないため、資産の売却、再編債務、または煩雑または高度に希釈される可能性のある条項で追加の株式資本を得るような1つまたは複数の代替案を採用する必要があるかもしれない。私たちが2027年に満期になった債務を再融資する能力は、事前に転換、償還、または買い戻ししない限り、その時の資本市場と私たちの財務状況に依存する。私たちはこれらの活動のいずれかに従事できないかもしれないし、理想的な条項でこれらの活動に従事することができないかもしれません。これは、私たちの債務不履行を招き、業務の変化の計画と対応における私たちの柔軟性を制限する可能性があります。
私たちには大きな変化が生じたときに必要に応じて債券を買い戻すために必要な資金を調達する能力がないかもしれませんが、将来の債務は私たちの債券を買い戻す能力を制限するかもしれません。
債券保有者は、債券に重大な変動が発生した場合に現金で債券を買い戻すことを当社に要求する権利があり、買い戻し価格は、購入した債券の本金額の100%に等しく、別途加算および未払い利息(あり)に等しい。根本的な変化は、違約や早期返済の事件を構成し、私たちが当時存在していた債務の満期速度を加速させる可能性もある。私たちは十分な財政資源を持っているか、あるいは融資を手配して、基本的に変化した買い戻し価格を現金で支払うことができません。どの債券保有者も基本的に変化した時に買い戻しを提出します。また、当時の既存の信用手配や他の債務(例えば、ある)の制限は、大きな変化が生じたときに債券を買い戻すことはできないかもしれません。我々が必要に応じて債券を買い戻すことができなかったことは,管理債券の契約による違約事件を招き,さらに我々の他の債務(あれば)の条項によって違約を構成することになる.適用される通知または猶予期間の後に関連債務の返済を加速させる場合、債務の返済や債券の買い戻しに十分な資金がない可能性がある。
私たちの普通株式所有権に関連するリスク
私たちの株価はずっと高度に変動し続けている可能性があるので、私たちの普通株の市場価格は予想以上に低いか不安定かもしれません。
私たちの株価はずっと不安定です。2022年1月1日から2022年12月31日まで、私たちの普通株の終値は1株8.86ドルまで低下し、1株当たり142.90ドルに達した。一般的な株式市場、特にバイオテクノロジー会社の市場は極端な変動を経験しており、この変動は往々にしてある会社の経営業績とは無関係である。例えば、新冠肺炎の疫病、インフレと金利の上昇により、生物製薬会社の取引価格は特に大きく変動している。このような広範な市場変動は私たちの普通株の市場価格が予想より低いか不安定になる可能性がある。
また、世界的な新冠肺炎疫病への関心と、新冠肺炎ワクチンの開発への我々の投資を受けて、公共舞台上のこの話題に関する情報は、正確であるか否かにかかわらず、我々の株価に大きな影響を与え続ける可能性がある(積極的であっても消極的であっても)。NVX−CoV 2373における我々の開発,製造,規制,商業化努力に関する情報,あるいは競争相手がその新冠肺炎ワクチンや候補ワクチンについて行っているこのような努力の情報は,我々の株価に大きな影響を与える可能性がある。このような変動のため、初期購入価格あるいは初期購入価格以上で普通株を売ることができないかもしれません。私たちの普通株の市場価格は多くの他の要素の影響を受けるかもしれません
•テスト結果、技術革新、または新しいビジネス製品を含む、私たちまたは私たちの協力者または競争相手の将来に関する公告
•臨床試験の結果
•規制書類の提出の遅れ;
•私たちの現金の備蓄を使い果たし
•株式証券を売却したり債務を増発したり
•我々は重要な戦略的協力パートナーシップ、協力、合弁企業、資本約束または買収を発表した
•政府の規則の変化
•競争相手の成功、特に私たち自身の候補ワクチンと競争する候補ワクチンの開発成功の影響
•私たちとパートナーや援助パートナーとの関係を発展させ
•医療改革や新ワクチンの清算レベルに関する公告や、正確性にかかわらず、私たちの業務や結果に影響を与える他の事項
•私たちまたは既存の株主(内部人や5%の株主を含む)は私たちの株を大量に売却します
•大流行性疾患に関連した発展、伝播、または新しい公告
•訴訟を起こす
•私たちの製品の安全に関心を持っています
•産業や市場全体の大きな挫折や懸念
•食品医薬品局または米国証券取引委員会からのものを含む、規制質問、審査、および可能な行動
•2価ワクチンの需要は
•証券アナリストの提案や利益予想の変化;
•この危険要素の部分に記載されている他の要素。
従来、ある会社の証券市場価格が変動した後、同社に対して証券集団訴訟が提起されるのが一般的であった。私たちにこのような訴訟を提起すれば、私たちがこのようなクレームを弁護するために巨額の費用を支払うことになり、経営陣の注意と資源を移転させる可能性があり、これは私たちの業務、財務状況、運営結果、将来性を深刻に損なう可能性がある。
証券の発行または協力および許可手配による追加資本の調達は、既存の株主に希釈をもたらす可能性があり、または私たちの技術または候補ワクチンの権利を放棄することを要求する可能性がある。
もし私たちが第三者と協力して私たちの1つ以上の候補ワクチンの開発を進めることができなければ、私たちは追加の債務や株式融資を通じて資金を調達する必要があるだろう。私たちが株式証券を発行することで追加資本を調達する程度では、私たちの株主は直ちに希釈を経験することになり、これは深刻かもしれない。また、1986年に改正された“国税法”や同様の国の規定によると、このような株式発行は所有権変更を招く可能性があり、純営業損失の繰越やローンの使用能力を制限している。ある程度、私たちが許可手配やパートナーとの手配によって追加資本を調達すれば、私たちは開発や商業化を求めていた技術や候補ワクチンの権利を放棄することを要求されるかもしれません。条件は私たちに不利かもしれません。また、経済状況は、潜在的な協力者が私たちと取引する意欲や能力にも悪影響を及ぼす可能性がある。彼らはまた研究開発プロジェクトを延期したり廃止したり、全体的な予算を減少させなければならないかもしれない。
当社の改訂及び改訂された会社の登録証明書及び改訂及び再予約された附例及びデラウェア州法律の条文は、当社への買収を遅延又は阻止する可能性があり、たとえ当該等の買収が株主に有利であっても、我々の取締役会の変動を阻害する可能性がある。
私たちの組織文書の条項は、第三者の買収を阻害したり、第三者が会社への支配権を獲得しようとするのを阻止したりする可能性があります。このような取引に参加することを望む株主はそうする機会がないかもしれない。私たちの組織文書はまた、投資家が将来私たちの証券に支払いたい価格を制限し、いつの年も私たちの取締役会の構成を変えることを難しくするかもしれない。例えば私たちの
組織文書は3種類の取締役からなる互い違い取締役会を規定し、3年間の任期を交錯させ、株主の取締役指名と提案の事前通知要求を規定する。
デラウェア州会社として、取締役会または株主の承認を得ない限り、デラウェア州会社法第203条にも保護されています。この条項は、取締役会または株主の承認を得ない限り、私たちの普通株を買収した少なくとも15%の人との商業合併を禁止します。
制御権変更取引や取締役会または経営陣の変動を遅延または阻止するいかなる行為も、潜在的な買収者を阻止したり、私たちの株主がその株の当時の市価よりも高い割増取引の完了を阻止したりすることが可能である。
私たちは私たちの配当金に配当金を支払ったことがなく、私たちは予測可能な未来にもこのような配当金を支払わないと予想している。
私たちは私たちの普通株に現金配当金を支払ったことがない。私たちは現在、すべての収益を業務発展のために維持し、予測可能な未来に現金配当金を支払わないと予想している。したがって、配当金を支払う前に、普通株の資本増価(あれば)が株主の唯一の収益源となる。
一般リスク因子
訴訟や規制機関の調査は、私たちの運営結果や財務状況に大きな悪影響を及ぼす可能性がある。
知的財産権訴訟に加えて、私たちは時々他の訴訟や規制機関の調査を受ける可能性がある。私たちが提起したいかなるクレームの是非にかかわらず、訴訟や規制調査は経営陣の注意力と資源の分流を招く可能性があり、これらのクレームに巨額の費用を支払う必要があるかもしれない。もし私たちが訴訟や規制調査に勝つことができなければ、私たちは重大な責任を招くかもしれない。未解決訴訟に関連する責任を合理的に推定し、発生する可能性が高いと判断できれば、関連責任を記録します。より多くの情報を得るにつれて、私たちは潜在的な責任を評価し、推定を適切に修正するつもりだ。しかし、訴訟に関連した不確実性のため、私たちの推定金額は間違っているかもしれない。
私たちまたは私たちが依存している第三者は、新冠肺炎の大流行のような自然災害や人為的災害または突発的な公共衛生事件の悪影響を受ける可能性がある。
私たちの運営および私たちの臨床研究組織、契約製造組織、必要な材料を製造するサプライヤー、パートナー、流通業者、および私たちが依存している他の第三者の運営は、火災、極端な天気条件、地震、電力不足、電気通信故障、水不足、洪水、ハリケーン、台風、戦争、政治不安、破壊またはテロおよびその他の自然災害または人為的災害の影響、および新冠肺炎疫病のような突発的な公共衛生事件の影響を受ける可能性がある。このような業務中断の発生は、私たちのすべてまたは大部分の施設の使用を阻止する可能性があり、私たちはかなり長い間、いくつかの活動を継続することが難しいか、または不可能かもしれない。深刻な災害や同様の事件が発生した場合、我々の既存の災害復旧および業務連続計画は十分ではないことが証明される可能性があるため、大量の費用や遅延を招く可能性がある。もし私たちの契約製造組織またはサプライヤーの運営が自然災害または人為的災害または公衆衛生緊急事態の影響を受けた場合、私たちは候補製品を製造し、候補製品のために必要な臨床用品を取得する能力が中断される可能性がある。
新冠肺炎の発生は我々の業務や財務業績に実質的な悪影響を及ぼす可能性がある。
新冠肺炎疫病は引き続き全世界の経済と公共衛生に巨大な挑戦をもたらし、著者らの業務、財務状況と運営結果に実質的な不利な影響を与える可能性がある。新冠肺炎への対応として,我々の業務運営の様々な側面が妨害され続けている可能性がある。私たちは、従業員が柔軟に遠隔勤務することを可能にするために、フルタイムでもハイブリッド勤務でも、私たちのワークスタイルガイドを実施しました
従業員に業務需要に基づく持続的な柔軟性を提供する。リモートワークは,我々のネットワークセキュリティリスクを増加させ,データアクセス可能性の問題をもたらし,通信中断の影響を受けやすくなり,いずれも我々の業務運営に悪影響を与える可能性がある.旅行制限や他の政府措置は、私たちの第三者請負業者やサプライヤーの業績中断や遅延を招く可能性もあります。もしこれらの第三者が私たちに対する彼らの契約約束をタイムリーに十分に履行できなければ、私たちの業務は不利な影響を受けるかもしれない。そのほか、いくつかの司法管轄区はすでに異なる程度に商業活動に対する制限を次第に廃止したにもかかわらず、新冠肺炎の復興に加え、新冠肺炎変異株のある地区での潜在的な急増は、制限措置の回復を招く可能性がある。
われわれの臨床試験は,計画中でも進行中であっても,新冠肺炎の大流行の影響を受ける可能性がある。病院または研究機関の政策、連邦、州または地方法規の変化、病院および他の医療資源の優先順位は、新冠肺炎の治療または予防のために使用されるため、研究手順(特に不要とみなされる可能性のある任意のプログラム)、サイト起動、参加者募集と登録、参加者用量計算、候補製品出荷、臨床試験材料の配布、研究モニタリング、サイト検査、およびデータ分析は一時停止または遅延する可能性がある。また、新冠肺炎は、米国食品医薬品局または他の衛生当局の運営に潜在的な影響を与える可能性があり、これは、我々の候補製品の審査および承認を含む審査および承認の遅延を招く可能性がある。このような中断は著者らの臨床試験のいかなる延長或いは優先順位の取り消し或いは監督審査の遅延を招き、すべて私たちの候補製品の開発と研究に重大な影響を与える可能性がある。
新冠肺炎の疫病のため、著者らと他の生物製薬会社の普通株の取引価格の変動は非常に大きく、特に投資家の疫病が世界各国の経済影響に対する懸念と不確定性による。これらの広範な市場や業界の変動、および一般的な経済、政治、市場状況は、私たちの普通株の市場価格にマイナス影響を与える可能性がある。
新型肺炎の疫病は引き続き迅速に変化した.疫病が私たちの業務、臨床前研究と臨床試験に与える影響の程度は未来の事態の発展に依存し、これらの事態の発展は高度に不確定であり、例えば疾病の最終的な地理伝播、変異株の出現、大流行の持続時間、アメリカと他の国の旅行制限と社会距離、企業閉鎖或いは商業中断、およびアメリカと他の国が取った疾病のコントロールと治療行動の有効性を自信を持って予測することができない。
英国のEU離脱は規制や法律の複雑さを増加させる可能性があり、これは私たちがイギリスおよび/またはヨーロッパで業務を展開することをより困難にし、私たちの製品候補製品がイギリスおよび/またはヨーロッパで規制の承認を得ることを確保する上で追加の挑戦をもたらすかもしれない。
イギリスは2020年1月31日にEUを離脱し、移行期間は2020年12月31日までであり、この過渡期は一般的にイギリスの離脱と呼ばれ、これはイギリスとEUでの私たちの運営と候補ワクチンに適用される規制枠組みを含む政治的·経済的不確実性をもたらし、この不確実性は数年続く可能性がある。その他の結果を除いて、イギリスの離脱はイギリスとEU間の商品、サービス、人員の自由な流動を乱す可能性があり、法律と監督管理の複雑さの増加、ヨーロッパでの業務の潜在的なコスト上昇を招く可能性がある。イギリスの離脱の結果の一つとして、EMAはイギリスからオランダに移った。これはEMAスタッフの大幅な減少を招き、これは、臨床試験許可またはマーケティング許可の承認の意見、新薬調合中の活性物質および他の成分の輸出入を混乱させ、臨床試験製品および最終認可製剤のサプライチェーンを乱すなど、その行政手続きの重大な中断および遅延をさらに招く可能性がある。EUは2021年1月1日以降にNVX-CoV 2373の条件付きマーケティング許可を承認したため、イギリスでは先祖ではない。したがって、私たちはイギリスまたは“GB”(イングランド、スコットランド、ウェールズ、EUの条件付きマーケティング許可が北アイルランドに適用され続ける)のために単独のマーケティング許可を得ることを求めなければならず、これは私たちの規制負担を増加させる。NuvaxovidのGB製品ライセンスTMイギリスの薬品と保健製品の監督管理機関がこのワクチンの安全性、品質と有効性を厳格に審査し、イギリスの独立科学諮問機関人類薬品委員会の専門家の意見を得た後、このワクチンは2022年2月3日に承認された。
2022年9月22日、イギリス商業、エネルギー、工業戦略部は、保留されている“2022年EU法(撤回と改革)法案”(“法案”)を公表し、イギリス議会に提出した。この法案は、イギリス21部門に適用される2400件以上の有効な保留EU法律の改正または廃止のための国内法的基盤を提供することを目的としています
経済には、生命科学産業に関連する経済が含まれ、2023年12月31日まで。この法案は薬品規制の将来とイギリスで起こりうる潜在的な監督管理負担にさらなる不確実性を増加させるだろう。
規制枠組みの破壊への累積影響は、欧州連合および/または連合王国における製品のマーケティング許可および商業化の開発準備時間を大幅に増加させる可能性がある。規制の複雑さが増加する可能性があり、これは私たちの臨床試験と規制承認の時間を乱すかもしれない。また、国と国際法律法規の変化と法律上の不確実性は、私たちの臨床と規制戦略に困難をもたらす可能性がある。イギリスの離脱やその他の理由により、いかなるマーケティング承認を得る上でのいかなる遅延も、いかなるマーケティング承認も得ることができず、私たちの候補製品をイギリスおよび/またはEUで商業化することを阻止し、収入を創出し、利益を達成し、維持する能力を制限する。
また、イギリスの離脱により、他の欧州諸国はEUに滞在し続けるかどうかについて国民投票を求める可能性がある。これらの可能性と、私たちが予想していないかもしれない他の可能性と、類似した前例がないことを考慮すると、連合王国のEU離脱がどのような財務、規制、法的影響をもたらすか、このような脱退がどのように私たちに影響を与えるか、そして私たちの業務がどの程度悪影響を受ける可能性があるかは不明である。
私たちはますます大衆監視の目標になり、私たちの業務は不利な宣伝の影響を受けるかもしれない。
新冠肺炎が前例のない緊急な公衆衛生危機を代表していることを考慮して、私たちはNVX-CoV 2373を新冠肺炎候補ワクチンとして開発しており、私たちはすでにアメリカ、外国政府、その他の源からNVX-CoV 2373の開発と潜在的商業化を支持する大量の資金を得ており、私たちはすでに私たちが作成し、行うべきNVX-CoV 2373の開発、テスト、製造、分配、価格決定に関する公衆の高度な関心と審査に直面し続けている可能性がある。もし私たちがこれらのリスクをうまく管理できなければ、私たちは深刻な名声被害に直面する可能性があり、これは私たちの株価にマイナスの影響を与えるかもしれない。メディアの憶測を含めてNVX−CoV 2373の開発に強い関心があり,我々の株価が大幅に変動し,我々が行っている臨床試験のデータや他の情報公開に伴い,この変動は続くと予想される。もし私たちの任意の候補製品の実際または予想の有効性または安全性に懸念があれば、このような懸念は市場がこれらの候補製品の見方に悪影響を与える可能性があり、これは投資家の予想低下を招き、私たちの普通株価格も下落するかもしれない。
ソーシャルメディアプラットフォームの使用はますます多くなり、私たちの業務に新たなリスクと挑戦をもたらした。
ソーシャルメディアは、製薬会社の研究、候補製品、およびこれらの候補製品を交流するためにますます使用されており、どのような疾患を予防するために開発されている。製薬業界のソーシャルメディア実践は発展し続けており,このような使用に関する法規は常に明確ではない。この変化は不確実性と私たちの業務に適用される法規を遵守しないリスクをもたらし、それによって私たちに対する規制行動を招く可能性がある。例えば、被験者は、進行中の盲目的臨床試験における彼らの経験をレビューするためにソーシャルメディアチャネルを使用して、またはいわゆる有害事象を報告することができる。このような事件が発生した場合、適用される有害事象報告義務を監視して遵守できないリスクがあり、あるいはソーシャルメディアによる政治的および市場的圧力の下で、私たちの業務や公衆の合法的な利益を守ることができない可能性があります。これは、私たちの調査製品候補者に対する私たちの発言が制限されているからです。いかなるソーシャルメディアまたはSNSにおいても、敏感な情報または否定的または不正確な投稿またはコメントを不適切に開示するリスクがある。このような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を負い、規制行動に直面したり、私たちの業務に名声やその他の損害を与える可能性があります。
項目1 B。未解決従業員意見
ない。
項目2.財産
2022年12月31日まで、メリーランド州ゲザスバーグで約53,000平方フィートのオフィススペースを当社の本社とし、メリーランド州ゲザスバーグで約170,000平方フィートのオフィススペース(“700 QO”)をレンタルし、現在はオフィススペースとして使用し、製造と研究開発にも利用しようとしています。700 QO賃貸契約の期間は約15年で、賃貸契約を2回連続して5年間継続する権利があります。
2022年12月31日まで、私たちはアメリカで約36.9万平方フィートのオフィスと他の空間をレンタルして、私たちの会社本社と700 QO、異なる海外場所で約24.2万平方フィートのオフィスとその他の空間を含みます。私たちはこの空間を使用して、私たちのサービスと支援、商業、研究開発、製造、管理者にサービスを提供します。私たちの施設は現在のニーズを十分に満たしていると信じていますが、会社経営陣は、必要かもしれない不動産要件を審査·評価して、現在の業務計画を満たしています。
項目3.法的手続き
2021年11月12日、Sosinathan Sinnathuraiは米メリーランド州地方裁判所(以下、メリーランド州裁判所)に証券と言われる集団訴訟を提起し、会社とある上級管理職メンバーを起訴し、タイトルは以下の通りであるSosinathan SinnathuraiはNovavax,Inc.らを訴えた。第8号:21-cv-02910-tdc(“修行行動”)。2022年1月26日、メリーランド州裁判所はSinnathurai訴訟の共同首席原告としてDavid·張、ヌグハリー·バルムクント·ナンデクマール、ジェフリー·ガバートを指定する命令を出した。共同引頭原告は2022年3月11日に改訂された総合起訴書を提出し、被告が会社の商業規模でNVX-CoV 2373を製造し、NVX-CoV 2373の監督管理許可を得た能力についていくつかの虚偽と誤ったと言われる陳述を行ったことを告発した。改正された起訴状は、いわゆるカテゴリを、2021年2月24日から2021年10月19日までの間に同社証券を購入する株主と定義する。2022年4月25日、被告は合併後の改正起訴状の却下を求める動議を提出した。2022年12月12日、メリーランド州裁判所は被告の却下動議の一部同意と一部拒否の裁決を発表した。メリーランド州裁判所は、2人の単独被告に対するすべてのクレームと、合併改訂された起訴状で疑問視されたいくつかの公開声明に基づいて提起されたクレームを却下した。メリーランド州裁判所は残りのクレームと被告を却下する動議を却下し、会社と他の残りの被告に14日以内に回答するように指示した。2022年12月27日、会社は答弁と肯定的な抗弁を提出した。
Sinnathurai訴訟を起こした後、7件の派生商品訴訟を起こした:(I)ロバート·E·マイヤ訴スタンレー·C·エルクらは番号8:21-cv-02996-TDC(“マイヤー行動”)、(Ii)レイ成はスタンレー·C·エルクらの事件を訴えた。第8号:21-cv-03248-貿易局(“揚行動”)、(Iii)ウィリアム·コスターらですスタンレー·C·エククらを訴えた。番号8:22-cv-00024-tdc(“コスター行動”)、(Iv)エイミー·スナイダーはスタンレー·C·エルク事件を訴えた彼らは番号8:22-cv-01415-tdc(“スナイダー行動”),(V)チャールズ·R·ブラックビンらですスタンレー·C·エククらを訴えた。番号1:22-cv-01417-tdc(“ブラック本行動”)、(Vi)Diego J.MesaはStanley C.Erckらの事件を訴えた(“メイサ行動”)と(Vii)ショーン·アコスタはスタンレー·C·エルクらの事件を訴えました(“アコスタ行動”)マイヤー、ヤン、スナイダー、ブラックベンの訴訟はメリーランド州裁判所で提起された。コースト訴訟はメリーランド州モンゴメリー県巡回裁判所で提起され、その後間もなくメリーランド州裁判所に移された。メサとアコスタの訴訟はデラウェア州衡平裁判所(“デラウェア州裁判所”)で提起された。デリバティブ訴訟は、会社の取締役会メンバーとある高級管理者を被告としている。当社は名義上の被告とみなされています。原告はSinnathurai訴訟とほぼ同じいわゆる事実と状況に基づいて派生クレームを提出した。全体的に言えば、派生商品の苦情は受託責任、インサイダー販売、不当な利益、連邦証券法違反、乱用制御、浪費と管理の不備を主張する。原告は宣告性と禁令救済、金銭損害賠償と弁護士費の判決を求めた。
2022年2月7日、メリーランド州裁判所は合併MeyerとYung訴訟の命令(“第一次合併派生訴訟”)を発表した。最初の合併デリバティブ訴訟の原告は2022年4月25日に合併デリバティブ訴訟を起こした。2022年5月10日、メリーランド州裁判所は、Sinnathurai訴訟答弁書を早期に却下または提出する前に、すべての訴訟手続きおよび最終期限を一時停止するという各当事者の請求を承認する命令を発表した。2022年6月10日、スナイダーとブラックベンが提訴した。2022年10月5日、メリーランド州裁判所は、すべてを合併するために、最初の合併派生商品訴訟およびスナイダーとブラック本訴訟における原告の請求を承認する命令を発表した
三宗訴訟、そして連合席引頭原告及び連合席牽引及び連絡弁護士(“第二総合派生訴訟”)を委任した。2件目の合併デリバティブ訴訟の共同けん引原告は2022年11月21日に改訂された合併起訴状を提出した。2023年2月10日、被告は第2次合併派生訴訟の却下を求める動議を提出した。
2022年7月21日、メリーランド州裁判所はコースト行動を州裁判所に返送する覚書意見と命令を発表した。2022年12月6日、コースト訴訟当事者は、原告が2022年12月22日に修正された起訴状を提出することが予想される所定のスケジュールを提出し、(I)当事者は所定のキルスト訴訟を延期するか、または(Ii)被告は2023年1月23日までに事件棚上げの動議を提出する予定である。原告は2022年12月30日に修正された起訴状を提出した。2023年1月23日、被告はカスター事件の延期を求める動議を提出した。2023年2月22日、Kirst訴訟の当事者は、第2次合併派生訴訟で被告が撤回した動議が解決されるのを待つKirst訴訟の規定の承認を裁判所に要求する文書を提出した。2023年2月24日、裁判所は、第2次総合派生訴訟で最終判決が下されるまで、コースト訴訟を見送る命令を発表した。裁判所がKirst訴訟に加入したより広範な執行猶予が各当事者の規定と一致するように修正される可能性があるかどうかについては、当社はいかなる立場も持っていない。
2022年8月30日、“メサ行動”が立案された。2022年10月3日、デラウェア州裁判所は、Sinnathurai訴訟の却下またはSinnathurai訴訟における執行訴えへの回答を却下する前に、メイサ訴訟におけるすべての手続きおよび期限を一時停止する命令を発表した。2023年1月9日、裁判所は、被告が提出しようとしている棚上げ動議についてプレゼンテーションスケジュールを作成するという各当事者の請求を承認する命令を発表した。この命令によると、被告は2023年1月18日に執行を猶予する動議を提出した。原告は2023年2月8日に反対意見を出した。被告は2023年2月22日に答弁書を提出した。2023年2月28日、裁判所は被告が執行を猶予した動議を承認した。
2022年12月7日、アコスタ行動が提出された。2023年2月6日、被告はアコスタ訴訟における起訴状と召喚状の送達を受けた。このクレームと上記で議論されたクレームの財政的影響は計り知れない。
2021年2月26日、トーマス·グルビンスキーという会社の株主が、トーマス·ゴルビンスキー氏がリチャード·H·ダグラスらを訴えたと題する取締役会メンバーと上級管理職メンバーに対するデリバティブ訴訟をデラウェア州裁判所に提出し、番号2021-0172-JRS。当社は名義上の被告とみなされています。ゴルビンスキー氏は、取締役会のメンバーや上級管理職のメンバーが会社の未開示に関する積極的な重大な情報を持っていると言われていることから、2020年4月と2020年6月に行われた株式奨励について疑問を提起した。起訴状は受託責任、浪費、不当な利益違反に対するクレームを主張する。原告はその会社の損害賠償金の判決、2つの判決の撤回、または返還を要求する命令、および訴訟に関連する弁護士費の判決を要求した。2021年5月10日,被告は行動を起こし,すべて訴えを却下した。2021年6月17日、会社の株主投票で2020年4月の奨励と2020年6月の奨励が承認された。承認提案の詳細は、会社が2021年5月3日に提出した最終依頼書に掲載されています。投票結果は、同社が2021年6月24日に提出した8-Kフォームの現在の報告書に開示されている。その後,原告は,2021年6月17日の投票結果により,原告は訴訟や2020年4月と2020年6月の裁決によるいかなるクレームも継続しようとしなくなったと規定している。2021年8月23日,原告は弁護士費と費用の判決を求める動議を提出し,被告はこれに異議を唱えた。2022年10月18日、デラウェア州裁判所は原告の全費用申請を却下した。デラウェア州裁判所の前の命令によると, 原告の費用申請を拒否した後、事件は自動的に却下され、偏見を構成した。2022年11月14日、ゴルビンスキーはデラウェア州最高裁判所に控訴通知書を提出した。原告/控訴者は2022年12月30日に開廷控訴要約を提出した。会社は2023年1月30日に答弁状を提出し、控訴人は2023年2月14日に答弁状を提出した。
PAR滅菌製品有限責任会社(“PAR”)は2022年3月29日、当社が2020年9月にPARと締結したNVX-CoV 2373に充填加工製造サービスを提供する製造·サービス協定(“PAR MSA”)のいくつかの条項に違反したとして、米国仲裁協会に当社に対する仲裁請求を提出した。この問題はまだ初期段階にあるので、潜在的な損失は合理的に見積もることができない。双方は証拠提示を行っており、仲裁は2023年7月に行われる予定だ。当社は平価MSAに違反していないと主張し、この件について積極的に抗弁しようとしているが、この最終解決策が当社に不利であれば、当社の財務状況、経営業績、あるいはキャッシュフローに大きな影響を与える可能性がある。
2022年11月18日、同社はGavi APAをGavi APAの要求に応じて会社から3.5億剤NVX-CoV 2373を購入できなかったため、Gavi APAに書面通知を出した。同社は2022年11月18日現在、Gavi APAのみから約200万剤の注文を受けている。2022年12月2日、GaviはGavi APAを中止すると主張する書面通知を発表した
同社はその合意を否定したため、Gavi APAに深刻な違反をした。GAVIはまた、Gavi APAが終了したと主張することに基づいて、Covax融資機構に参加する買い手の拘束力のある注文によってクレジット購入価格をクレジットする任意の金額を差し引く権利があると主張している。2022年12月31日現在、Gaviと残りのプリペイド金額の返金に関する紛争が解決される前に、Gaviの前払い残高6.974億ドルは繰延収入から会社総合貸借対照表の他の流動負債に再分類されている。2023年1月24日、ガヴィは上記の主張に基づいて国際仲裁裁判所に仲裁請求を提出した。同社の回答締め切りは2023年3月2日。仲裁自体は不確実であり、Gaviから受信した残りの前払い金額を保留する権利があると考えられるが、Gaviの残りの前金金額の全部または一部の返金を要求する可能性もある。
私たちはまた正常な業務過程で生成された様々な法的手続きに参加した。これらの法的訴訟の結果は本質的に予測が困難であるにもかかわらず,経営陣はこれらの法的訴訟の解決が我々の財務状況,経営業績,あるいはキャッシュフローに実質的な悪影響を与えないと予想している。
プロジェクト4.鉱山安全開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
私たちの普通株はナスダック世界の精選市場で取引されています。コードはNVAXです。2023年2月21日現在、私たちの普通株は約137人の登録株主が保有しているその1つはCELDE&Co.であり,預託信託会社(DTC)の著名人であるブローカー、銀行、その他の金融機関が受益者として著名人として持っているすべての普通株はDTCの参加者口座に入金されているため、CEDE&Co.が一株主として保有していると考えられる。私たちは予測可能な未来にどんな現金配当金も発表したり支払わないと予想している。
私たちの株式補償計画に基づいて発行された証券
我々の持分補償計画に関する情報は、株主承認計画及び非株主承認計画を含むものであり、本年度報告の表格10−Kの第3部第12項に含まれる。
[パフォーマンスチャート]
次の図は、Novavax,Inc.の5年間累積普通株株主総収益率を、ナスダック総合指数およびラッセル2000成長バイオテクノロジー指数の累積総収益率と一致させる。このグラフは、2017年12月31日から2022年12月31日までの私たちの普通株式および各指数に100ドルを投資するという表現を追跡している。
5年間の累積収益比較*
Novavax Inc.ではナスダック総合指数は
ラッセル2000はバイオテクノロジー指数を増加させました
*配当再投資を含む株式または指数に100ドルを17/12/31に投資します
12月31日までの会計年度。
2017年12月31日に株式または指数に投資された100ドルの価値は、配当再投資を含め、以下の年度まで
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| 2017 | | 2018 | | 2019 | | 2020 | | 2021 | | 2022 |
| Novavax,Inc. | $ | 100 | | | $ | 148.39 | | | $ | 16.05 | | | $ | 449.64 | | | $ | 576.9 | | | $ | 41.45 | |
| ナスダック複合体 | $ | 100 | | | $ | 97.16 | | | $ | 132.81 | | | $ | 192.47 | | | $ | 235.15 | | | $ | 158.65 | |
| ラッセル2000 Growthバイオテクノロジー | $ | 100 | | | $ | 82.47 | | | $ | 120.36 | | | $ | 187.09 | | | $ | 130.2 | | | $ | 94.86 | |
本グラフは“募集材料”ではなく、米国証券取引委員会“届出”とはみなされず、1933年に証券法(改訂本)や1934年証券法(改訂本)によって提出されたいずれの文書にも引用されておらず、本文書の日付の前または後に作成されたものであっても、このような文書中の一般的な合併言語も考慮されていない。
プロジェクト6.保留
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
本年度報告におけるNovavax,Inc.(“Novavax”およびその完全子会社、“会社”、“私たち”または“私たち”)に関する予想、信念、計画、目標、仮説または未来の事件または業績に関する議論のいずれの陳述も歴史的事実ではなく、前向きな陳述である。このような展望的な陳述は、私たちの能力、目標、将来の収入および支出レベルの予想、および融資活動に関する陳述を含むが、これらに限定されない;Novavaxが2022年12月31日までの監査された財務諸表の日から1年間継続的に経営する能力を含む、私たちの運営計画と見通し、私たちの候補製品に対する潜在的な市場規模と需要、私たちの候補製品の有効性、安全性、および予想される用途、私たちの臨床段階の候補製品と組換えワクチンおよびアジュバント技術の開発、私たちの臨床前の候補製品の開発、私たちは臨床試験への参加の予想;臨床試験と他の臨床前研究の進行、タイミングと潜在結果;規制申告の計画と可能なタイミング;私たちと私たちのパートナーのNVX-CoV 2373の製造能力、タイミング、生産、流通、配送の予想;私たちはNVX-CoV 2373が達成可能な個体数の推定;我々は,NVX−CoV 2373の予想される開発と商業化あるいは許可を行い,新冠肺炎変異株を含む一価または二価製剤を開発しており,NVX−CoV 2373のラベルを増強剤として世界的に拡大し,従来はNanoFluと呼ばれていた季節性4価インフルエンザワクチンを開発している;予想された時間,内容, 本明細書で言及された他の事項は、規制行動の結果と結果、米国政府パートナーシップ(USGプロトコルの前身Warp Fastによる)、米国防総省(“DoD”)およびCEPIの資金、我々のAPAsおよび供給プロトコルの下の資金、このような合意の改正、終了または関連する法的紛争、利用可能な現金資源および使用状況および融資の全体的な利用可能性、協力活動および業務発展計画に関する計画、およびここで言及した他の事項を含む。一般に、前向き記述は、“信じる”、“可能”、“可能”、“将”、“可能”、“可能”、“推定”、“継続”、“進行中”、“考慮する”、“予想する”、“求める”、“計画”、“計画”、“予想”、“予期”、“すべき”、“将”などの言葉またはフレーズを使用することによって識別することができる。これらの用語または他の同様の用語の否定は、すべての前向き表現がこれらの語を含むわけではないが、“目標”または“仮説”である。
前向きな陳述は歴史的事実でもなく、未来の業績の保証でもない。逆に、それらは、現在のビジネスの未来、未来の計画と戦略、予測、予期されたイベント、傾向、経済および他の未来の状況に対する私たちの信念と予想に基づいているだけです。展望性表現は推定、仮説、リスクおよび不確定要素に関連し、実際の結果または結果は任意の前向き表現中の明示または示唆の結果と大きく異なる可能性があるので、あなたはいかなるこのような前向き表現にも高度に依存すべきではない。これらのリスクおよび不確実性は、技術資格および分析検証に関連する要求を含む、単独またはパートナーと共に様々な安全性、有効性および製品特性要件を満たす挑戦を含むが、これらに限定されるものではなく、FDA、世界保健機関、イギリス(“イギリス”)医薬品·保健製品監督機関、欧州医薬品局、韓国食品·薬物安全部または日本保健、労働、福祉部などの関連規制機関に必要な、臨床試験を行う上で予期せぬ挑戦や遅延に遭遇する;希少な原材料および供給を得ることが困難であり、人的資本および製造を含む資源制限を含む
これらのリスクおよび不確実性は、米国証券取引委員会に提出された年次報告書(Form 10-K)に関連する可能性のあるリスクおよび不確実性と、Novavax独自またはパートナーと同時に複数の法域で計画された規制経路を推進する能力の制限と、規制申告書類の交差提出と、潜在的な規制行動とをもたらすことと、複数の商業、政府および他のエンティティとの合意下での契約要件を満たす挑戦と、本10-K年次報告第I部分1 Aの“リスク要因”で識別される他のリスクおよび不確実性とを含み、これらのリスクおよび不確実性は、米国証券取引委員会に時々提出される他の文書において詳細に紹介、修正または更新される可能性があり、これらのリスクおよび不確実性は、www.sech.govおよびwww.go novavov.comで参照することができる。私たちはあなたがこの書類を提出する時にそれらを読むことを奨励する。
私たちは未来の結果、事件、活動レベル、表現、または成果を保障できない。本年度報告書10-K表の任意またはすべての展望的陳述は、実際の結果と正確でないか、または大きな差があることが証明される可能性がある。さらに、いかなる展望的陳述も、作成された日からのみ発表され、法的要件がなければ、新しい情報、未来のイベント、または他の理由によるものであっても、いかなる前向き陳述も更新または修正する義務はない。新しい要素が時々現れて、私たちはどのような要素が発生するのか予測できない。さらに、私たちは、各要素が私たちの業務に与える影響を評価することができません、または任意の要素または要素の組み合わせは、実際の結果が任意の前向き陳述に含まれる結果と大きく異なる程度をもたらす可能性があります。
本年度報告Form 10−Kにおける情報には,米国公認会計原則(“GAAP”)に従って作成されていない財務指標が含まれており,これを調整後販売コストと呼ぶ。私たちはこの非公認会計基準の財務指標を提案して、私たちの業務とその業績を理解するのを助けるためです。調整された販売コストには、規制部門がNVX-CoV 2373を承認する前に開発に使用された標準製造コストの推定が含まれており、そうでなければ、これらのコストは在庫に資本化される。提案されたいかなる非GAAP財務指標はそうでもなく、GAAPが要求する財務指標の代替品と見なすべきでもなく、GAAPが規定する標準化の意味がなく、他社の類似指標の計算と比較できない可能性もある。
概要
私たちは生物技術会社で、革新ワクチンを発見、開発、商業化することによって深刻な伝染病を予防し、全世界で健康改善を促進する。著者らの独自の組換え技術プラットフォームは遺伝子工学の力と速度を利用して、高免疫原性ナノ粒子ワクチンを効率的に生産し、全世界の緊迫した健康需要を満たすことを目的としている。
我々の候補ワクチンは,コンホメーションの正しい組換えタンパク質からなる遺伝子工学ナノ構造であり,自然病原体上のそれらを模倣している。この技術は免疫系が異なる角度から正確な標的蛋白を識別し、保護性抗体を開発できるようにした。私たちのワクチン技術は差別化免疫反応を誘導する可能性があり、これは自然に発生する免疫や他のワクチン方法よりも有効である可能性があると信じている。私たちの候補ワクチンはまた、免疫反応を増強し、より高いレベルの機能性抗体を刺激し、細胞免疫反応を誘導するために、サポシンベースのMatrix−Mアジュバントを添加する。
我々はすでに新冠肺炎ワクチンNVX-CoV 2373(“Nuvaxovid”、“Covovax”、“Novavax新冠肺炎ワクチン、アジュバント”)を開発し、インフルエンザワクチン候補ワクチン、新冠肺炎-インフルエンザ連合ワクチン候補ワクチンおよび他の候補ワクチンを開発しており、単価または二価処方を含む新冠肺炎変異株を含む。NVX-CoV 2373はすでに全世界の複数の監督管理機関の許可、一時許可、一時承認、条件付きマーケティング許可(CMA)と緊急使用許可(EUA)を獲得し、成人と青少年の人々を主要なシリーズとして使用し、相同および異種適応を強化する。新冠肺炎と季節性インフルエンザ以外に、私たちが注目している他の領域は呼吸器合胞体ウイルスとマラリアを含む。
業務のハイライト
2022年第4四半期と最近のハイライト
新冠肺炎ワクチン発注と2023年秋のワクチン接種季節計画
•ノバックスの新型肺炎ワクチンNuvaxovidはこれまでに世界で1億以上の薬を納入しています
•米国政府との改正合意は、2023年に150万剤以上の追加ノワール新冠肺炎ワクチンを交付する
◦この協定はアメリカ国民がノワ新冠肺炎ワクチンを獲得する機会を維持し、より少量のワクチンの開発を支持し、アメリカ食品と薬物管理局の提案に基づいて菌株選択を行い、商業市場に穏やかに移行する
•再確認2023年秋のワクチン接種季節に最新の単価あるいは2価ワクチンを提供する予定で、公衆衛生提案と一致する
•欧州医薬品局(EMA)とFDAがNuvaxovid五剤瓶変異体を承認することを確保し、EMAは同社がチェコ共和国の工場で抗原を生産し、EUにNuvaxovidを供給することを許可した。
新冠肺炎ワクチン臨床開発計画と拡大認可
•米国食品·薬物管理局ワクチン及び関連生物製品諮問委員会に提出されたデータによると、増強剤として使用する場合、ノワールの新冠肺炎ワクチンは現代変種を含む広範な機能性免疫反応を誘導することができる
•第三段階新冠肺炎オミックBA 1候補ワクチンの背線結果を発表し、主要な菌株変化の終点を実現した
◦第2部では,我々のプロトタイプワクチンをオミックオスミウムBA.5ワクチンおよびプロトタイプとオミックBA.5ワクチンを含む二価ワクチンと比較した
•長期ビジネス市場でより広く受け入れられるように、成人ブースターと青少年一次シリーズにNuvaxovidタグを拡張します
新冠肺炎-インフルエンザ連合ワクチン候補臨床研究の進展
•異なる処方のCICとインフルエンザ独立候補ワクチンの50~80歳の成人における安全性と免疫原性を評価するために、第2段階用量確認試験を開始し、2023年に結果が発表される予定である
•CIC第2段階試験は、インフルエンザ代替独立製剤の追加研究分岐を探索することを含む
融資取引
2022年12月には、引受業者に付与された追加株式の選択権を全面的に行使して発行された975,000株の普通株を含む7,475,000株の一般株の公開発売が完了し、1株当たり10.00ドル、純収益は6980万ドルであった。今回の公開発売と同時に,元金総額5.00%の2027年満期の転換可能優先無担保手形(“2027年手形”)を発行し,元金総額は1.753億ドルであり,1933年証券法(改正)第144 A条規則により私募方式で合格機関の買手に追加手形の全面選択権を購入して発行された2530万ドル手形を含む.事前に転換、償還、または買い戻ししない限り、2027年に発行された債券は2027年12月15日に満期になる。初期購入者費用と私たちの発売費用を差し引いた後、2027年債券の発行から1.664億ドルの純収益を得ました。2027年の付記に関するより多くの情報は、本年度報告Form 10-Kの第2部第8項“財務諸表と補足データ”の連結財務諸表付記11を参照されたい。
2021年6月に、吾らは市場発行販売協定(“2021年6月販売協定”)に締結し、当社が最大5億ドルまでの普通株総収益の発行および販売を許可し、当時存在していたat Market発行販売協定を終了した。2022年12月31日現在、2021年6月の販売協定の残高は約3.18億ドル。2022年と2021年12月31日までの年間で,それぞれ220万株と260万株の普通株を売却し,我々の各種市場で発行された販売協定に基づき,それぞれ約1.79億ドルと5.65億ドルの純収益を得た。
重要な会計政策と試算の使用
我々の財務状況と経営結果の検討と分析は、私たちの連結財務諸表を基礎とし、これらの報告書は公認会計基準に基づいて作成された。我々の連結財務諸表を作成する際には、財務諸表日までの資産、負債及び権益に影響を与える報告金額、又は有資産及び負債の開示及び報告期間内に報告された収入及び費用の報告金額の推定、仮説及び判断を行う必要がある。これらの見積もり,特に贈与収入,リース会計,発行前在庫,在庫推定値と研究開発費の会計に関する見積もりは,我々の連結財務諸表に大きな影響を与え,後述する運営結果の分析で詳細に検討した。我々は,歴史的経験と様々な当時の状況では合理的であると考えられる他の仮定から推定し,これらの仮定の結果は資産,負債,資本の帳簿価値を判断する基礎を構成しているが,これらの資産,負債,権益は他の源からは明らかではないように見える.実際の結果と結果は,これらの推定や仮定とは異なる可能性がある.
本年度報告第2部第8項“財務諸表及び補足データ”に添付されている連結財務諸表付記2を参照されたい。我々の各重要会計政策の踏み込んだ議論については、我々の重要会計政策、及びこれらの政策の適用に係る推定及び仮定に関するさらなる情報を含む。
収入確認を付与する
私たちの贈与収入には、主に米国政府契約(USG協定、国防総省契約を含む)に基づいて提供される資金が含まれており、2022年には3兆829億ドルとなる。完成時試算(“EAC”)プロセスを用いて履行義務の履行の進捗状況を測定し,履行義務の履行の進捗状況を審査·監視するためのコストに基づく投入方法である。この過程では,完成進捗,労働力コスト,努力程度,材料と下請けコスト,間接行政コスト,その他の決定されたリスクを含むが,完成進捗,労働力コスト,努力程度,材料と下請けコスト,間接行政コスト,その他の決定されたリスクを含む,これまでに発生してきたコストと,様々な投入や仮定を用いた完成予測を考慮する。契約で定められた義務履行時に許容される総コストは主観的であると推定され,将来の活動やコスト駆動要因を仮定する必要がある。これらの見積もりの変化には様々な原因があるかもしれませんが、大きな変化が発生すれば、私たちの契約中の収入と費用確認の時間に影響を与える可能性があります。我々のコスト精算プラス固定費用契約については,基本履行義務完了時に発生すると予想される契約総コストに占める東アフリカ共同体プログラムによる精算可能契約コストの割合に基づいて固定費用を確認した.東アフリカコミュニティプロセスに関する推定数の変化は,累積追跡に基づいてこのような変化の期間を確認する.私たちは選管会過程での予算変動によって何の大きな違いも現れなかった。
リース会計
我々はCMOおよび契約開発·製造組織(“CDMO”)と生産供給協定を締結し,我々の候補ワクチンを生産した。その中のいくつかの製造供給プロトコルには,我々が制御する指定された製造施設や設備を使用することが含まれており,これらの施設や設備のほとんどの生産を獲得し,埋め込みレンタルの条件を満たしている可能性がある。我々のCMOおよびCDMOプロトコルに埋め込まれたレンタルの評価は非常に複雑であり、契約が資産の使用を決定するために明示的または暗黙的に使用されているかどうか、通常は製造施設の一部の使用であるかどうか、決定された資産の使用を示す権利があるかどうか、決定された資産から実質的にすべての利益を得る権利があるかどうか、レンタル期間、および契約下の固定リース支払いのいずれかを判断する必要がある。レンタル開始日を確定するには判断が必要かもしれません。レンタル開始日が契約の開始日と異なる可能性があります。吾らは、いくつかの予想マイルストーンが吾等のテナント終了の選択権に与える影響に基づいて、埋め込みテナントの取消不能賃貸期間を定めているが、吾らはそのオプションを行使しないことを合理的に確定している。レンタル開始日レンタル期間が12ヶ月を超えるレンタルについては、レンタル期間内に将来の支払いの現在価値を固定してレンタル負債とそれに応じた使用権資産を確認します。私たちはレンタルに隠れている割引率(ある場合)や借金金利を増加させて未来の支払いの現在値を計算します。レンタル期間を決定する際に, 吾等の評価は、吾等が標的資産を使用する期間を合理的に決定する事実及び状況に影響を与える可能性があるとともに、吾等が標的資産を使用する権利がある取消不可能期間及び任意の選択権期間を考慮してリース契約を延長又は終了することができる(吾等が当該選択権を行使することを合理的に決定する)。我々は、ASC 842に基づいて、私たちの賃貸契約および他の合意を評価する際に、契約がレンタルであるかどうか、またはレンタルを含むかどうか、賃貸契約条項および条件の変化が新しいまたは修正されたレンタルを表すかどうかを決定することを含む重大な仮定および判断を使用する
リースとは,経営的あるいは融資的リース,リース義務の現在値を決定するための割引率,および我々の製造供給プロトコルに埋め込まれたリース期限である。2022年12月31日現在、我々の非流動ROU資産総額は1.062億ドル、流動賃貸負債は4410万ドル、非流動賃貸負債は8130万ドルである。
発表前在庫
製品が商業化される可能性があり、その製品に関連する経済的利益を得る権利があると判断した場合、原材料と生産コストを在庫として資本化する。私たちがいつ商業化が可能かの推定は、主に規制部門の類似製品の承認を得る上での経験に基づいている。私たちは2022年から在庫を資本化しており、2022年12月31日現在、約3060万ドルの商業ライブラリが承認前に支出されています。
在庫現金化能力
私たちは定期的に在庫中の超過または時代遅れ在庫を分析し、時代遅れまたは販売できない在庫をその推定された可変純資産値に減記する。我々は、予想される将来の需要と市場状況、現在の販売注文と製品納期の仮定を含む様々な要素に基づいて、過剰または古い在庫と会社の四半期ごとの在庫調達承諾の損失を推定する。予想される将来の需要に対する私たちの仮定は本質的に不確実であり、これらの判断または推定のいずれかを変更すれば、特定の時期に報告された在庫減記金額を大幅に増加または減少させる可能性がある。私たちは2022年から在庫を資本化します。その後,4.476億ドルの在庫減記と1.559億ドルの堅固な調達約束損失を記録し,将来の需要の見積もりではコストを回収できない程度に達した。
研究と開発費の会計計算
私たちは、私たちの研究開発活動に関連する前払いおよび計算費用を推定するためにプロセスを使用して、契約および購入注文の審査、私たちのプロジェクトマネージャーおよびサービスプロバイダとのコミュニケーションを含み、私たちを代表して実行されたサービスを決定し、領収書またはサービスを発行する前に領収書を発行していない場合に、実行されたサービスレベルおよびそのサービスのために生成された関連コストを推定する。この評価の流れは、以下の検討を含む
•臨床試験を行う契約研究機関(“CRO”)と第三者コンサルタントとの合意による費用;
•原材料、実験室用品および設備の調達費用を含む、第三者CMOおよびCDMOプロトコルに基づいてワクチンアセンブリを開発および製造するコスト。
我々は,サービスプロバイダと締結した契約,作業説明書,関連変更書,および内部者や外部サービスプロバイダとサービスの進展とそのようなサービスのために支払う取り決め費用について検討し,提供されるサービスとかかる努力を見積もる.これらの合意の財務条項は、交渉で達成された条項に基づいており、契約によって異なり、時間の経過とともに活動レベルにばらつきを招く可能性がある。場合によっては、私たちのサプライヤーに支払われるお金は、提供されたサービスレベルを超え、事前支払い費用につながる可能性があります。さらに、サードパーティサービス提供者の請求書は、実際に完了した作業と一致しない可能性があり、期末前払いまたは計上されるべきである可能性がある。推定プロセスは、貸借対照表の日までに発生するサービスを決定する際に、前払い残高または計上残高をもたらす可能性がある重大な判断および推定を行うことを要求する。実際の費用の理解に伴い、私たちは私たちの見積もりを調整した。実際に発生した金額と実質的に差がないと予想されているにもかかわらず、提供されるサービスの状態や時間の理解は、関連推定とは異なる可能性があり、特定の時期の金額が高すぎたり、低すぎたりする可能性があります。私たちの前払いおよび計算すべき費用は、CRO、CMO、CDMO、およびサード·パーティ·サービスプロバイダから受信されたタイムリーかつ正確な報告にある程度依存する。見積りプロセスの性質により,見積り費用と実際に発生する費用との間に差がある可能性がある.歴史的に見ると、私たちは以前の時期に何の実質的な違いも経験しなかった。
最近の会計公告
連結財務諸表付記の“付記2--重要会計政策概要”(タイトル下)を参照最近の会計公告”).
2022年と2021年の2財政年度の経営実績
以下は,我々の歴史上の総合財務状況と経営結果の検討であり,本年度報告Form 10−Kに記載されている総合財務諸表とその付記とともに読むべきである。実際の結果と前向き陳述における結果とが大きく異なる要因をもたらす可能性のある他の情報については、本年度報告10−K表第I項第1 A項“リスク要因”を参照されたい。
2021年12月31日までの年度と2020年12月31日までの年度の検討については、項目7をお読みください経営陣の財務状況と経営成果の検討と分析2021年12月31日現在のForm 10−K年次報告にある。
収入.収入
| | | | | | | | | | | | | | | | | |
| 2022 | | 2021 | | 変わる |
| 収入(千単位): | | | | | |
| 製品販売 | $ | 1,554,961 | | | $ | — | | | $ | 1,554,961 | |
| 贈与金 | 382,921 | | | 948,709 | | | (565,788) | |
| 印税その他 | 43,990 | | | 197,581 | | | (153,591) | |
| 総収入 | $ | 1,981,872 | | | $ | 1,146,290 | | | $ | 835,582 | |
製品販売
2022年の製品売上高は16億ドルだったが、2021年には製品売上高はなかった。2022年の製品販売は、2022年に開始されたNVX-CoV 2373の商業販売収入と関係がある。2022年の製品販売の地理的分布は以下の通り
| | | | | |
| 2022 |
北米.北米 | $ | 194,480 | |
| ヨーロッパ.ヨーロッパ | 823,542 | |
世界の他の地域 | 536,939 | |
| 製品総収入 | $ | 1,554,961 | |
贈与金
私たちは贈与収入を以下のように確認した
| | | | | | | | | | | | | | | | | |
| 2022 | | 2021 | | 変わる |
| 贈与収入(単位:千) | | | | | |
アメリカ政府協定 | $ | 380,996 | | | $ | 788,953 | | | $ | (407,957) | |
アメリカ国防総省 | 1,925 | | | 21,683 | | | (19,758) | |
CEPI | — | | | 135,445 | | | (135,445) | |
その他の贈与収入 | — | | | 2,628 | | | (2,628) | |
| 贈与収入総額 | $ | 382,921 | | | $ | 948,709 | | | $ | (565,788) | |
2022年の贈与収入は3兆829億ドルだったが、2021年は9億487億ドルと5兆658億ドル減少した。2022年の贈与収入には、主にUSGプロトコルに従って提供されるサービスの収入が含まれ、2021年の贈与収入には、主にUSGプロトコルおよびCEPI出資プロトコルに従って提供されるサービスの収入が含まれる。収入減少は主にUSGプロトコルと我々とCEPIとの資金合意での開発活動の減少によるものである。
印税その他
2021年の1兆976億ドルと比較すると、2022年の特許使用料やその他の収入は4400万ドルと1兆536億ドル減少した。特許権使用料及びその他の収入は主に我々の許可手配下の特許権使用料に関連しており、収入の低下は、私たちの許可パートナーが販売に基づく特許権使用料が低いためである。
費用:
| | | | | | | | | | | | | | | | | |
| 2022 | | 2021 | | 変わる |
| 費用(千): | | | | | |
| 販売コスト | $ | 902,639 | | | $ | — | | | $ | 902,639 | |
| 研究開発 | 1,235,278 | | | 2,534,508 | | | (1,299,230) | |
| 販売、一般、管理 | 488,691 | | | 298,358 | | | 190,333 | |
| 総費用 | $ | 2,626,608 | | | $ | 2,832,866 | | | $ | (206,258) | |
販売コスト
2022年の販売コストは9.026億ドルで、製品売上高の58%を占め、過剰または古い在庫に関する6.035億ドルの費用および会社の調達承諾の損失が含まれている。規制部門の承認を得る前に、私たちは製造コストを研究開発費として支出する。規制機関の承認を得た後、製品に関連する経済的利益を得る権利があると判断した場合、特定のサプライチェーンの生産コストを資本化します。私たちが生産したワクチン製品とコンポーネントの数を追跡しましたが、承認前の製造コストを追跡していないため、承認前に生産された投入前の在庫の製造コストは合理的に決定できません。しかし,ワクチン製品やコンポーネント在庫の将来の製造コストの予想に基づいて,2022年12月31日までに約3060万ドルの商業ライブラリが承認される前に支出されていると推定される。2023年までに、私たちはコスト削減の大部分の在庫を利用すると予想しています。2022年に販売された在庫および投入前の在庫の予想基準コスト値に、過剰および古い在庫に関する支出およびしっかりとした調達約束の損失を含めると、期間内に調整された販売コストは約10.674億ドル、または製品売上高の69%であり、確認された販売コストより1.648億ドル調整される。私どものお客様の定価の組み合わせや標準コストの変化により、製品の売上に占める販売コストの割合は将来的に変動する可能性があります。
研究と開発費
2021年の25億ドルに比べ、2022年の研究開発費は約12億ドルに低下し、13億ドル減少した。減少の要因は,オミックBA.1候補ワクチンNVX−CoV 2373,二価製剤,CICを含むコロナウイルスワクチンに関する開発活動の減少であり,以下の表で述べる(千単位)
| | | | | | | | | | | |
| 2022 | | 2021 |
| 研究開発費(千単位): | | | |
| コロナウイルスワクチン | $ | 848,042 | | | $ | 2,245,935 | |
| インフルエンザワクチン | 7,163 | | | 7,761 | |
| 他のワクチン開発プロジェクトは | 2,658 | | | 818 | |
| 対外直接研究開発費総額 | 857,863 | | | 2,254,514 | |
| 従業員の支出 | 180,168 | | | 130,576 | |
| 株に基づく報酬費用 | 66,565 | | | 86,928 | |
| 施設費 | 60,428 | | | 26,100 | |
| その他の費用 | 70,254 | | | 36,390 | |
| 研究開発費総額 | $ | 1,235,278 | | | $ | 2,534,508 | |
2022年と2021年のコロナウイルスワクチンの研究·開発費には、富士フイルム和解協定によって得られた9830万ドルの収益(合併財務諸表の付記4、今年度報告第2部、第8項、“財務諸表および補足データ”を含む)が含まれている
支出はそれぞれ2.392億ドルであり,これまで加速されてきたリース製造コストに関連しており,これらのリースにはCMOやCDMOとの複数の製造供給プロトコルが埋め込まれていることが確認された。
ワクチン開発に関する多くの不確実性のため,我々の研究計画を完成させるコストと時間の前向きな推定は提供していない。著者らが臨床前研究と臨床試験からデータを得ることに伴い、著者らは臨床試験を停止或いは延期することを選択し、著者らの資源をより有望な候補ワクチンに集中する可能性がある。臨床試験の完成には数年或いはそれ以上の時間を要するかもしれないが、時間の長さは大きな差がある可能性があり、具体的には臨床試験の段階、規模、主要と副次的な終点及び候補ワクチンの期待用途に依存する。様々な要因の影響により、臨床試験のコストはプロジェクトの全ライフサイクルで大きく異なる可能性がある
•臨床試験に参加した人数
•臨床試験に組み込まれた場所の数
•臨床試験地点が国内でも国際的にも両方あれば
•参加者を募集する時間
•治療コースとフォローアップ状況
•候補ワクチンの安全性と有効性
•規制承認を受ける費用とタイミング、そして規制承認を得る能力。
これらの不確実性のため,我々の研究開発プロジェクトの継続時間と完成コストを決定することはできず,いつ,どの程度我々の研究プロジェクトから将来のキャッシュフローが生じるかを決定することはできない.
2023年、私たちは引き続き私たちの製造需要を評価し、NVX-CoV 2373に対する契約義務と予想需要に基づいて、私たちの世界的な製造足跡を修正し、以前研究開発費として確認されていた追加製造活動が在庫資本化としての基準を満たし始めたので、2022年より研究開発費が低下すると予想されています。2023年に予定されている第2段階臨床試験結果の評価によると,我々はインフルエンザやCIC候補ワクチンに関する潜在的第3段階研究開発費に資金を提供している。
販売、一般、管理費用
販売、一般、管理費用 2021年の2億984億ドルから2022年の4億887億ドルに増加し、1兆903億ドル増加した。販売、一般、行政費の増加は、主に我々の商業販売業務開始に関する費用が1億495億ドル増加したためである。
2023年、私たちが予想する販売、一般、および管理費用レベルは異なるかもしれません。これは、2023年秋の新冠肺炎候補ワクチンの開発、製造、流通、またはマーケティングに成功した能力に依存します。このような不確実性のため、私たちは重要な優先順位に集中するために、私たちの運営支出を減らして制御するつもりだと発表しましたが、時間の経過とともに私たちの投資水準を評価し続けます。
その他の費用、純額:
| | | | | | | | | | | | | | | | | |
| 2022 | | 2021 | | 変わる |
| その他の費用、純額(千): | | | | | |
| 利子支出 | $ | (19,880) | | | $ | (21,127) | | | $ | 1,247 | |
| その他の収入(費用) | 10,969 | | | (6,833) | | | 17,802 | |
| その他の費用の合計 | $ | (8,911) | | | $ | (27,960) | | | $ | 19,049 | |
2022年の私たちの純他支出総額は890万ドルだったが、2021年の純他支出総額は2800万ドルで1900万ドル減少した。2022年から2021年までの間、その他の収入(支出)は主に為替活動と関係がある。
所得税支出:
2022年と2021年12月31日までの年間で,連邦と州所得税および特許使用料の外国源泉徴収税に関する430万ドルと2920万ドルの所得税支出をそれぞれ確認した。
純損失:
| | | | | | | | | | | | | | | | | |
| 2022 | | 2021 | | 変わる |
| 純損失(千元、1株当たり情報を除く): | | | | | |
| 純損失 | $ | (657,939) | | | $ | (1,743,751) | | | $ | 1,085,812 | |
| 1株当たり基本と希釈して純損失 | $ | (8.42) | | | $ | (23.44) | | | $ | 15.02 | |
| 加重平均流通株、基本株、希釈株 | 78,183 | | | 74,400 | | | 3,783 | |
2022年の純損失は7億ドル、あるいは1株8.42ドル、2021年は17億ドル、あるいは1株23.44ドルで11億ドル減少した。純損失の減少は主にNVX−CoV 2373が2022年に商業販売および研究開発費の減少を開始したが,過剰または古い在庫の減記,会社調達承諾の損失,USGプロトコル下での収入の減少により部分的に相殺された。
2022年の加重平均流通株の増加は、主に普通株と私たちのインセンティブ計画に基づいて発行された普通株を売却したためです。
流動性問題と資本資源
私たちの将来の資本需要は、限定されるものではありませんが、これらに限定されない:私たちと戦略パートナーとの間のライセンス契約下での製品販売収入および特許使用料、私たちは贈与協定によって提供される資金と返済、私たちのNVX-CoV 2373および変種候補薬物の開発および商業支援に関連する予想される活動は、様々なCRO、CMOおよびCDMO協定下での重大な約束、臨床前研究および臨床試験の進展、規制承認を得るのに要する時間とコスト、特許主張および他の知的財産権の強制執行コスト、および他の製造、販売および流通コストを含む。私たちは、インフルエンザ候補ワクチンと潜在的な混合ワクチン候補のような他の候補ワクチンおよび製品の開発を継続する予定であり、これらは異なる開発段階にある。
私たちはすでにヨーロッパ共同体と世界各国と供給協定を締結しており、APAと呼ばれることがある。私たちはまた許可と許可協定を持っている。2022年12月31日現在、履行義務の未履行(または一部未履行)に割り当てられた取引価格総額は約30億ドルであり、Gavi APAに関連する金額および改訂および再署名されたイギリス供給協定に関連する線量減少は含まれておらず、ライセンス契約下で販売に基づく特許権使用料に基づく金額は含まれておらず、以下のように定義される。規制のマイルストーンを達成できなかったこと、政府諮問委員会からタイムリーな支持的な提案を得たこと、または当社のAPAによる製品数や交付時間義務を実現することは、私たちがプリペイドの一部を返却したり、将来の支払いを減少させる必要があるかもしれません。これは、私たちが履行していない業績義務の中で収入を実現する能力に悪影響を及ぼす可能性があります。贈与協定に関連する履行義務を履行する時間は,臨床試験や用量交付を含む我々の研究·開発活動の結果に依存する。供給プロトコルに関連する履行義務を履行する時間は、製品製造の時間、追加の適応のマーケティング許可の受信、顧客の需要に応じた送達用量、および顧客が我々のいくつかのAPAに従って原型NVX-CoV 2373ワクチンを変異ワクチンで置換することを要求する能力に依存するであろう。供給協定に含まれる条項には、私たちの製造·流通ネットワークの建設と運営に関連する投資や、私たちの世界的な供給約束を支援するための他の費用を支援するための前払いが含まれています, NVX-CoV 2373交付時の請求書にも適用されます。このような前払いは通常、私たちがいくつかの開発、規制、そして商業マイルストーンを達成した後に返却されない。
また、私たちは引き続き私たちの製造需要を評価し、NVX-CoV 2373への供給と期待需要の契約義務に基づいて私たちの世界的な製造足跡を調整するため、重大なコストが発生する可能性があります。富士フイルム和解協議(本年度報告10-K表第2部第8項“財務諸表と補足データ”の連結財務諸表付記4参照)によると、FDBT製造活動の廃止について1.85億ドルまでの和解金を富士フイルムに支払うことを担当している
富士フイルムCSAによると、このうち4780万ドルは、富士フイルムCSAでの初期予約料を構成し、2022年9月30日の和解金に計上されている。
私たちは欧州共同体と“APA”を達成し、EUの各加盟国を代表して最低2000万剤、最大1億剤のNVX-CoV 2373の初期用量を提供し、ヨーロッパ共同体は2023年までに、1回以上に分けて1億剤、最大合計2億剤を追加購入することができる。2022年には、2022年第1四半期と第2四半期に予定されていた約700万剤の以前の約束を取り消し、注文を約6300万剤に削減するとの欧州委員会の通知を受けた。2023年1月には、2022年第1四半期と第2四半期に交付される予定だった改正行政手続法における残り2000万剤の約束線量の交付スケジュールが決定され、2023年に交付される予定である。
2022年7月、吾らの代表は大ブリテン及び北アイルランド連合王国政府とイギリス商業、エネルギー及び工業戦略大臣(イギリス衛生安全局に委任)と改訂及び再署名されたSARS-CoV-2ワクチン供給協定(2022年9月26日に改訂された“改訂及び再署名されたイギリス供給協定”)を締結し、この協定は双方が2020年10月22日に締結したSARS-CoV-2ワクチン供給協定(“元イギリス供給協定”)を全面的に改訂及び再記述した。最初のイギリス供給協定によると、管理局は6000万剤のNVX-CoV 2373を購入することに同意し、私たちにお金を前払いした。改訂·再署名されたイギリス供給協定の条項によると、管理局は、最低100万剤と最大1500万剤のNVX−CoV 2373(“条件付用量”)を購入することに同意し、条件付用量の数は、イギリス衛生大臣が承認したワクチン接種と免疫連合委員会(“JCVI”)の支持的提案を適時に完了し、私たちの数に応じて減少させることに依存する。(A)一般成人人口をイギリスSARS-CoV-2ワクチン強化接種活動の一部として使用する場合、または(B)一般青少年人口を連合王国SARS-CoV-2ワクチン強化接種活動の一部として使用する場合、またはSARS-CoV-2一次シリーズワクチン接種として使用する場合については、この提案は、連合王国メンバーが100万人未満の1つまたは複数の人口集団のみに関連するものではない。管理局が条件用量またはこのような条件用量の数を1500万剤以下のNVX−CoV 2373に減少させなければ, 元のイギリス供給協定によると、私たちは以前に管理局から受け取った前金に関する2.25億ドルを返済しなければならないだろう。改訂と再署名されたイギリス供給協定によると、管理局はまた、2024年までに1回または複数回に分けて最大4400万剤を購入することを選択することができる。
JCVIは2022年11月30日現在、NVX−CoV 2373に対して支持的な提案を行っていないため、改正と再署名されたイギリス供給協定の条項によると、(I)条件付用量の数を1500万剤から750万剤に減少させ、条件付用量の減少は、2023年11月30日までにJCVIの支持性提案をタイムリーに実現することにかかっており、この提案は英国衛生大臣から上述したように承認されている。(Ii)吾らは以前に元のイギリス供給協定に基づいて管理局から受け取った前払い1.125億ドルを返済する責任があり、この金は吾等の総合貸借対照表に他の流動負債として反映され、残りの前払い残高1.125億ドルは今期繰延収入に反映される。
Gavi APAの条項によると、私たちは2021年にGaviから3.5億ドルの前金を受け取り、2022年第1四半期に3.5億ドルを追加的に支払った。これは、私たちがNVX-CoV 2373に対する世界保健機関のEUL(“前払い金額”)に達したからだ。2022年11月18日、GaviがGavi APAの要求に応じて3.5億剤NVX-CoV 2373を調達できなかったため、Gaviに書面通知を出した。2022年11月18日現在,Gavi APAによると,約200万剤の注文しか受けていない。Gaviは2022年12月2日、Gaviがこの合意を否定したため、Gavi APAを深刻に違反したと主張するGavi APAの中止を主張する書面通知を発表した。GAVIはまた、Gavi APAが終了したと主張することに基づいて、Covax融資機構に参加する買い手の拘束力のある注文によってクレジット購入価格をクレジットする任意の金額を差し引く権利があると主張している。2022年12月31日現在、Gaviと余剰プリペイド金額の返金に関する紛争が解決される前に、残りのGavi前払い金額6.974億ドルは、繰延収入から私たちの総合貸借対照表の他の流動負債に再分類されている。2023年1月24日、ガヴィは上記の主張に基づいて国際仲裁裁判所に仲裁請求を提出した。私たちの返事の締め切りは2023年3月2日です。仲裁自体は不確実であり、Gaviから受信した残りの前払い金額を保留する権利があると考えられるが、Gaviの残りの前金金額の全部または一部の返金を要求する可能性もある。
2022年7月、我々はUSG協定を修正し、(I)米国政府に約300万剤のNVX-CoV 2373を初めて交付し、(Ii)最初のUSG合意(最初の約300万剤を含む)に基づいて、米国政府の需要、菌株選択に関するFDAの指導、このような用量の価格について双方が合意した合意および利用可能な資金を規定し、合計1億剤のNVX-CoV 2373を米国政府に追加製造および交付した。さらに、2022年7月に、我々は国防総省と既存の合意を修正し、FDAのEUAの承認を受けた後、NVX-CoV 2373を初めて交付し、国防総省の需要と利用可能な資金に基づいて、元の合意で想定されていた残り980万剤のNVX-CoV 2373を交付することを規定した。2023年2月、“米国政府協定”改正17の実行について、米国政府は、この裁決を現在の履行期間を超えるまで延長してはならないと表明した。もしUSG協定が私たちが以前に予想していたように修正されなかったら、私たちはUSG協定によって予想されていた残り4.16億ドルの資金を受け取ることができないかもしれない。
我々の融資協定には、現在、CEPIが1つまたは複数の無利子定期融資の形態で提供される資金(“CEPIは融資資金を免除することができる”)が含まれている。CEPIによって支援されたCMOネットワークによって生産されたNVX−CoV 2373が1つまたは複数の第三者に販売され(終了前に我々のGAVI APAに従って行われた任意の販売を含むが、これらに限定されない)、そのような販売が、そのようなワクチンを製造するコストをカバーする場合にのみ、CEPIは、融資基金の下で受信された支払いを免除することができる。今のところローンの返済時間と金額は確定されていません。
2022年12月31日現在、私たちは13億ドルの現金と現金等価物および制限現金を持っていますが、2021年12月31日現在、私たちの現金と現金等価物は15億ドルです。2023年1月31日、2023年2月1日に満期となった2023年債券に3.25億ドルの未償還元金を提供しました。
私たちの2022年の運営資金は、現金と現金等価物、APA項の前払い、製品販売収入、戦略パートナーとのライセンス契約下の特許使用料、普通株販売収入、およびNVX-CoV 2373ワクチン開発活動を支援するUSG協定下の収入から来ている。私たちは私たちの未来の運営資金が主に製品販売収入、私たちのUSG協定下の収入、私たちの現金と現金等価物、および他の潜在的な資金源から来ると予想している。
次の表は、2022年と2021年のキャッシュフローをまとめています
| | | | | | | | | | | | | | | | | |
| 2022 | | 2021 | | 変わる |
| 提供された現金純額(使用): | | | | | |
| 経営活動 | $ | (415,937) | | | $ | 322,946 | | | $ | (738,883) | |
| 投資活動 | (92,985) | | | 100,154 | | | (193,139) | |
| 融資活動 | 324,988 | | | 461,713 | | | (136,725) | |
| 現金、現金等価物および制限現金に及ぼす為替レートの影響 | 4,520 | | | (5,292) | | | 9,812 | |
| 現金、現金等価物、および限定的な現金の純増加 | (179,414) | | | 879,521 | | | (1,058,935) | |
| 年初の現金、現金等価物、制限現金 | 1,528,259 | | | 648,738 | | | 879,521 | |
| 年末現金、現金等価物、制限された現金 | $ | 1,348,845 | | | $ | 1,528,259 | | | $ | (179,414) | |
2022年の経営活動のための現金純額は4.159億ドルだったが、2021年の経営活動で提供された現金は3億229億ドルだった。経営活動からの現金減少は,主に我々のAPAによる前金の減少,サプライヤーへの支払いのスケジュールおよび在庫生産量の増加によるものであるが,我々の純損失の減少分によって相殺されている。
私たちの投資活動は主に資本支出と2021年満期と有価証券の売却収益(購入を差し引く)1兆598億ドルを含む。2022年12月31日と2021年12月31日までの年間資本支出はそれぞれ8910万ドルと5450万ドル。
私たちの融資活動は主に私たちの普通株の売却、2027年手形の発行、融資リース債務の支払い、株式ベースの奨励の行使を含む。2022年、私たちは市場発行販売協定と1株10.00ドルで普通株を公開発行することで、それぞれ約1.79億ドルと7000万ドルの純収益を獲得した。また,我々は2022年に我々の2027年手形を発行することで純収益1.664億ドルを獲得した(添付の総合財務諸表付記11参照).2021年には,市場で販売協定を発行して普通株を売却することにより,約5.65億ドルの純収益を得た。
経営を続ける企業
本年度報告10−K表第II部第8項“財務諸表及び補足データ”の連結財務諸表を作成する際には、財務諸表発表日から1年間経営を継続すると仮定する。2022年12月31日現在、私たちは13億ドルの現金と現金等価物および制限現金を持っています。そのうち2.362億ドルは2022年12月に私たちの普通株式を同時に売却し、2027年手形を発行することで調達されました。2023年1月31日、会社は2023年債の未返済元金3.25億ドルに資金を提供した。2022年には6億579億ドルの純損失が発生し,運営活動で使用されている純キャッシュフローは4.159億ドルであった。
我々は現在、1年間の持続的な経営展望期間のキャッシュフロー予測を推定しており、運営に資金を提供する十分な資本があるが、この予測には2023年の収入、米国政府からの資金、仲裁待ちに関する予測を含む重大な不確定性がある。私たちの2023年の収入は私たちが開発、製造、流通或いはマーケティングに成功できるかどうかにかかっており、2023年秋の新冠ワクチンシーズンの新冠肺炎候補ワクチンの最新単価或いは二価調合は、それ自体に不確定性があり、規制承認を含む多くのリスクの影響を受けている。“リスク要素--製品開発と商業化に関連するリスク--SARS-CoV-2ウイルス変種の出現と伝播性、及び二価ワクチンに対する需要は、市場の新冠-CoV 2373の受け入れ或いは販売に影響を与える可能性があり、著者らは新しい冠肺炎ワクチンバージョンを開発していくつかの変種を防ぐ戦略は成功しないかもしれない”2023年2月、“USG協定”第17号修正案が施行された際、米国政府は、この賞が現在の履行期間を超えない可能性があり、これにより、私たちが以前予想していた残り4.16億ドルのすべての資金を受け取ることができなくなる可能性があると表明した。“リスク要因-私たちの財務状況と資本要求に関連するリスク-私たちの既存の援助と供給協定は、私たちの候補ワクチンが成功することを保証することができないか、または私たちの候補ワクチンにすべての資金を提供することができるだろう”と見ている。2023年1月24日、GaviはGavi APAに実質的な違反の疑いがある疑いのある仲裁請求を国際仲裁裁判所に提出した。その仲裁の結果自体が不確実だ, 私たちはまた残りの6.974億ドルの前金の全部または一部を返却することを要求されるかもしれない。連結財務諸表第2部第8項の付記3と付記18を参照してください
本年度報告の10-K表の“財務諸表および補足データ”は、Gaviアービトレーションに関する他の情報を知るために使用される。経営陣は、これらの不確定要因の重要性に鑑み、これらの財務諸表が発表された日から、経営を継続する企業として1年間経営を継続する能力に大きな疑問があると考えている。
私たちが会社運営に資金を提供する能力は、私たちの製品および候補製品のワクチン販売に関連する収入に依存します(これらの候補製品がマーケティング承認を得て商業化に成功した場合)、Gaviとの紛争を解決するかどうか、いつ、およびGaviとの紛争をどのように解決するかを含むいくつかの問題の解決、およびGaviとの紛争の解決を含み、株式および債務融資、協力、戦略連盟、およびマーケティング、流通、または許可によって追加資金を調達することを含む可能性があります。私たちは商業的に受け入れられる条項で新しい融資を得ることができないかもしれないし、根本的にできないかもしれない。さらに、任意の協力、戦略連合、およびマーケティング、流通、または許可配置は、場合によっては、これらの権利がそのような権利のすべての潜在的価値を下回る可能性がある製品または技術の一部または全部の権利を放棄することを要求することができる。さらに、NVX-CoV 2373および私たちの他の候補ワクチンは、インフルエンザ候補ワクチン、CIC候補ワクチン、または単価または二価処方を含む新しい冠肺炎変異株を含み、規制および商業上の成功はまだ確定されていない。もし私たちが追加資本を得ることができない場合、私たちは私たちの資本資源を評価し、業務の一部または全部を延期、縮小または廃止すること、または私たちの組織規模を削減することを要求される可能性があり、いずれも私たちの業務、財務状況、運営結果、および持続的な経営企業としての運営能力に大きな悪影響を及ぼす可能性がある。
契約義務
次の表は、2022年12月31日までの契約義務(単位:千)をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 契約義務: | | 合計する | | 少ないです
1年 | | 1 – 3
年.年 | | 3 – 5
年.年 | | 超過
5年間 |
| 賃貸借契約を経営する | | $ | 74,853 | | | $ | 18,182 | | | $ | 29,354 | | | $ | 14,791 | | | $ | 12,526 | |
| 融資リース義務 | | 74,837 | | | 29,153 | | | 5,680 | | | 5,968 | | | 34,036 | |
転換可能な手形(1) | | 500,250 | | | 325,000 | | | — | | | 175,250 | | | — | |
2022年12月31日までに確認された契約義務 | | 649,940 | | | 372,335 | | | 35,034 | | | 196,009 | | | 46,562 | |
購入承諾(2) | | 560,638 | | | 560,638 | | | — | | | — | | | — | |
施設賃貸協定(3) | | 56,109 | | | 3,397 | | | 7,050 | | | 7,407 | | | 38,255 | |
| 契約債務総額 | | $ | 1,266,687 | | | $ | 936,370 | | | $ | 42,084 | | | $ | 203,416 | | | $ | 84,817 | |
(1)3.25億ドルの3.75%の転換優先無担保手形が2023年2月1日に満期になり、これらの手形を全額返済した。2022年には、1.753億ドルを発行し、2027年に満期となる5.00%の転換優先無担保手形を発行しました。当社の転換可能な手形の詳細については、当社の連結財務諸表に付記されている“付記11-長期債務”を参照されたい。
(2)この金額とは,主にいくつかのCMO,CDMO,LABプロビジョニングプロトコルによってキャンセル不可能な固定支払義務であり,容易なためにこれらの義務を契約上終了することはできない.いくつかの合意は停止権を規定しているが、停止費を払わなければならない。このような合意によると、私たちはサプライヤーに支払う義務があります。主に回収できないと予想される費用を補償します。2022年12月31日まで、これらの合意は積極的な持続的な計画であり、将来的にこれらの計画から価値を得ることが予想される。このような債務の額は終了の時間と協定に関する条項に依存し、合理的に見積もることができない。私たちの撤回不可能な調達協定の下での現在の債務は私たちの総合貸借対照表に反映されている。
(3)これは、2022年12月31日にまだ開始されていないクイーンズ果樹園700号床面のレンタルに関するものである(総合財務諸表付記10参照)。
上記の義務に加えて、私たちは正常な業務過程で様々な合意と財務的約束を達成します。これらの条項は、一般的に、私たちが貨物を渡したり、サービスを履行する前に、私たちの業務ニーズに応じて、私たちの要求をキャンセル、再配置、または調整することを選択することを可能にします。我々の義務の条件的性質や特定のプロトコルごとに関連する独自の事実や状況により,これらのプロトコルで将来支払い可能な最高額は予測できない.
第七A項。市場リスクの定量的·定性的開示について
私たちはいくつかのリスクの影響を受けます。これらのリスクは私たちの経営業績、キャッシュフロー及び資産と負債の公正価値に影響を与える可能性があります。外貨為替レートの変動と金利の変動を含む。
外貨両替リスク
私たちの本社はアメリカにありますが、私たちの運営結果は、私たちの海外子会社の運営を含めて、外貨為替レート変動の影響を受けています。主にドル対ユーロ、ポンド、スウェーデンクローナ、チェコクローナの為替レート変動です。この為替リスクは、私たちの現金と現金等価物、キャッシュフロー、および経営結果に実質的な影響を与える可能性があり、特に行政手続き法によって生じる収入には、私たちと私たちの取引相手の通貨両替リスクに影響を与える条項が含まれている場合がある。今まで、私たちは未来にそうするかもしれないが、私たちはまだ何の外貨ヘッジ契約も締結していない。
私たちはまた為替リスクの開放に直面しています。これは世界業務の結果をドルに変換し、為替レートが今期初めから変動しているからです。私たちのグローバル業務の財務結果はドルで報告されていますが、私たちの海外子会社の本位貨幣は通常それぞれの現地通貨です。私たちが業務を行っている国の外貨為替レートの変動は私たちの経営業績に影響を与え、通常は予測困難な方法で行われています。我々の海外子会社に関する外国為替レート(主に対ドル)は10%低下し、2022年12月31日現在の株主権益(赤字)を約1820万ドル低下させる。
市場と金利リスク
私たちの投資活動の第一の目標は保証であり、二次目標は収益を最大化することだ。
私たちの金利リスクへの開放は主に私たちのポートフォリオに限られており、これらのポートフォリオは従来から販売可能に分類されてきた。市場金利の変化は、私たちのポートフォリオの現金化可能な価値に大きな影響を与えないと思います。金利の変化は有価証券の満期時に得られた投資収入に影響を与える可能性があり、得られた資金は新たな有価証券に再投資されるため、我々のキャッシュフローや経営業績に影響を与える可能性がある。
利息と配当収入は稼ぎ時に入金され、投資収入に計上される。有価証券の割増と割引(あれば)を償却または満期日に積算し、投資収益を計上する。具体的な識別方法は,自社証券を売却した実現済み損益の計算に用いられる。
私たちの転換可能な優先無担保手形の金利は固定されており、私たちは追加的な重大な債務を持っていない。したがって、私たちは私たちの貸借活動が私たちを重大な金利リスクに直面させるとは思わない。
項目8.財務諸表と補足データ
本プロジェクトに必要な資料はF-1からF-40ページに掲載されている.
項目9.会計·財務開示面の変化と会計士との相違
ない。
第9条。制御とプログラム
情報開示制御とプログラムの評価
“開示制御及び手続”という言葉(米国証券取引委員会規則13 a-15(E)で定義されている)とは、会社が1934年の証券取引法(“取引法”)に従って提出された報告において開示を要求する情報が、米国証券取引委員会の規則および表に指定された期間内に記録、処理、集約および報告されることを保証するための会社の制御および他の手続きを意味する。“開示制御と
手続き“は、取引法に基づいて提出または提出された報告書において企業が開示を要求する情報が蓄積され、会社経営者に伝達されることを確実にすることを目的としているが、その主要幹部および財務官、または同様の機能を適宜履行する者の制御および手順を含むものに限定されず、開示要求に関する決定をタイムリーに行う。
会社経営陣は、CEOおよび最高財務責任者の参加の下、本年度報告書10-K表(“評価日”)までの期間終了時の会社開示制御および手順の有効性を評価した。この評価によると、当社の最高経営責任者と財務責任者は、評価日までに、このような制御およびプログラムが合理的な保証レベルで有効であると結論した。
財務報告の内部統制に関する経営陣の報告
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。“取引法”第13 a-15(F)及び15 d-15(F)条によれば、財務報告の内部統制は、会社の主要幹部及び主要財務官が設計又はその監督の下で、財務報告の信頼性及び公認会計基準に基づいて外部財務諸表を作成する合理的な保証を提供するために、会社の取締役会、管理層及び他の人員によって実施されるプログラムとして定義される。このような内部制御には、以下の条件を満たす政策およびプログラムが含まれる
•会社の資産を合理的、詳細、正確かつ公平に反映した取引および処置の記録の保存に関連している
•公認会計基準に基づいて財務諸表を作成するために取引が必要と記録されていることを保証する合理的な保証を提供し、会社の収支は会社の管理層および取締役の許可のみに基づいて行われる
•財務諸表に重大な影響を及ぼす可能性のある無許可買収、使用または処分会社の資産を防止または適時に発見することについて合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。将来的にどのような有効性評価を行うかの予測には,条件の変化により制御が不十分になる可能性がある,あるいは政策やプログラムを遵守する程度が悪化する可能性があるというリスクがある.
私たちの経営陣は、2022年12月31日までの財務報告書の内部統制に対する我々の有効性を評価した。この評価を行う際には,我々の経営陣は,トレデビル委員会後援組織委員会が発表した2013年の内部統制-総合的な枠組みで規定された基準を用いた.その評価によると、我々の経営陣は、2022年12月31日現在、財務報告書に対する内部統制がこれらの基準に基づいて有効であることを決定している。
安永法律事務所は私たちの財務報告書の内部統制に関する報告書を発表した。本報告は独立公認会計士事務所の報告書第15(A)(1)項に記載されている。
財務報告の内部統制の変化
我々の経営陣は、最高経営責任者及び最高財務責任者を含め、2022年12月31日までの四半期間の財務報告内部統制に発生したいかなる変化も評価し、2022年12月31日までの四半期間には、我々の財務報告の内部統制に重大な影響を与えるか、又は合理的な可能性に大きな影響を与える変化は生じていないと結論した。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
適用されません。
第三部
プロジェクト10.取締役、執行幹事、およびコーポレートガバナンス
本プロジェクトに必要な資料は,当社が2023年6月に開催予定の2023年株主周年総会の最終依頼書(“2023年依頼書”)に参考方式で組み入れた。2022年12月31日までの会計年度終了後120日以内に2023年依頼書を提出する予定です。
プロジェクト11.役員報酬
2023年の依頼書の役員報酬に関するこの項目に要求される情報を参考に本明細書に組み込む。
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
ここでは,本プロジェクトが要求する何らかの実益所有者の保証所有権と管理層および関連株主事項に関する情報を引用し,これらの情報は2023年の依頼書に含まれる.
次の表は、2022年12月31日までの株式報酬計画情報を提供しています。これらの計画によると、私たちの普通株は、私たちの従業員株式購入計画(“ESPP”)の下での株式奨励および購入を行使または付与する際に発行することができる。また、添付されている総合財務諸表付記14における当社の株式報酬およびESPPに関する情報を参照してください。
株式報酬計画情報
| | | | | | | | | | | | | | | | | | | | |
| 計画種別 | | 証券数量
髪を待つ
行使している
未完成の選択肢は
株式証明書と権利を認める
(a) | | 加重平均
行使価格:
卓越した
オプション·株式承認証
権利があります
(b) | | 証券数量
利用可能な時間を保つ
以下の条項により将来発行される
持分補償
図は(含まれない)
反映された証券
(A)欄)
(c) |
証券保有者が承認した持分補償計画(1) | | 6,151,589 | | $47.11 | | 4,501,492 |
| 証券保有者の許可を得ていない持分補償計画 | | 適用されない | | 適用されない | | 適用されない |
(1)私たちの2015年株式インセンティブ計画、2005年株式インセンティブ計画、そしてESPPを含む。(B)の欄の加重平均行重みは、行重みに制限されない制限株式単位を含まない。
項目13.特定の関係および関連取引、および取締役の独立性
ここでは、本条項に組み込まれることによって要求される、2023年の依頼書に含まれるいくつかの関係および関連取引および取締役独立性に関する情報を参照することによって要求される。
プロジェクト14.主な課金とサービス
私たちは、参考のために、2023年の委託書の主要会計士費用およびサービスに関するこの項目によって要求された情報を本明細書に組み込む。
第4部
プロジェクト15.証拠品および財務諸表の添付表
(a)以下の書類は、10-Kフォーム年次報告の一部として提出されます
(1)財務諸表索引
| | | | | |
独立公認会計士事務所レポート(PCAOB ID:42) | F- 2 |
2022年,2021年と2020年12月31日までの総合経営表と全面損失表 | F- 5 |
2022年と2021年12月31日までの連結貸借対照表 | F- 6 |
2022年12月31日現在、2021年12月31日と2020年12月31日までの株主権益(赤字)連結報告書 | F- 7 |
2022年12月31日現在、2021年12月31日と2020年12月31日までの連結現金フロー表 | F- 8 |
連結財務諸表付記 | F- 9 |
(2)財務諸表明細書
財務諸表明細書は省略されており、それらは適用されないので、指示によって要求されたものではないか、または財務諸表または付記に必要なすべての情報が記載されている。
(3)陳列品
単一星番号(*)とラベル付けされた証拠品をアーカイブする.
ダブルプラス番号が表示されている展示品とは、管理契約、補償計画、あるいは手配のことです。
双星号(**)と表示された一部の展示品には秘密待遇を与える。
S-K規則601(B)(10)(Iv)項により,挿入記号(^)とラベル付けされた証拠物に含まれる機密情報は省略されている.
リストされた他のすべての証拠は、米国証券取引委員会に事前に提出され、参照によって本明細書に組み込まれている。
| | | | | | | | |
展示品
番号をつける | | 説明する |
| | |
| 3.1 | | 2回目の改訂·再予約された会社登録証明書(会社が2015年8月10日に提出した2015年6月30日までの10-Q表四半期報告(書類番号000-26770)添付ファイル3.1登録成立参照) |
| | |
| 3.2 | | 改訂された2番目の会社登録証明書(2019年5月9日に会社が提出した現行8-Kレポート添付ファイル3.1(第000-26770号ファイル)参照) |
| | |
| 3.3 | | 定款の改訂及び再発注(会社が2021年6月24日に提出した現行8-Kレポート(アーカイブ番号:000-26770)添付ファイル3.1設立参照) |
| | |
| 3.4 | | 登録者Aシリーズ転換可能優先株指定証明書(会社が2020年6月19日に提出した8-K表(書類番号:000-26770)添付ファイル3.1合併参照) |
| | |
| 4.1 | | 会社普通株サンプル株、1株当たり額面$0.01(会社が2019年12月31日に提出したS-3表登録説明書添付ファイル4.1(書類番号333-235761)) |
| | |
| 4.2 | | 当社とニューヨーク·メロン銀行信託会社が受託者として2022年12月20日に満期となった2027年満期の5.00%転換優先手形の契約(手形形式を含む)(当社が2022年12月21日に提出した現在の8-K表報告(アーカイブ番号000-26770)添付ファイル4.1を参照して法団として設立) |
| | |
| 4.3 | | 会社Aシリーズ変換可能優先株証明書フォーム(当社2020年6月19日提出の8-Kフォーム(ファイル番号:000-26770)添付ファイル4.1を参照) |
| | |
| | | | | | | | |
| 4.4* | | 会社証券説明書 |
| | |
| 10.1†† | | 会社が改訂·改訂された2005年株式インセンティブ計画(2013年3月12日に提出された会社の2012年12月31日までの10-K表年次報告添付ファイル10.2(書類番号000-26770)) |
| | |
| 10.2†† | | 2005年株式インセンティブ計画の改訂と再作成(2014年4月30日に会社が提出した2014年6月12日に開催された年次会議に関する最終依頼書付録1(文書番号000-26770)参照) |
| | |
| 10.3†† | | 当社が改訂·改訂した2005年株式インセンティブ計画に基づいて付与された非法定株式オプション奨励協議書(2015年2月27日に提出された当社2014年12月31日までの10-K表年報添付ファイル10.4(アーカイブ番号000-26770)) |
| | |
| 10.4†† | | 会社が改訂·再策定した2005年株式インセンティブ計画に基づいて付与されたインセンティブ株式オプション奨励協定表(会社が2015年2月27日に提出した2014年12月31日現在の10-K表年次報告添付ファイル10.5(書類番号000-26770)合併参照) |
| | |
| 10.5†† | | Novavax,Inc.2013年従業員株式購入計画の改訂と再作成(合併時参考会社が2022年5月2日に提出した2022年6月16日に開催された年次会議に関する最終依頼書の付録D(文書番号000-26770)) |
| | |
| 10.6†† | | ノワックス社2015年株式インセンティブ計画の改訂と再改訂(2022年5月2日に提出された2022年6月16日に開催された年次会議に関する最終依頼書の付録C(文書番号000-26770参照)) |
| | |
| 10.7†† | | 改訂·再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画によって付与された非法定株式オプション奨励協定のフォーマット(2015年8月10日に会社が提出した2015年6月30日までの四半期報告書Form 10-Q(文書番号:000-26770)添付ファイル10.3合併を参照) |
| | |
| 10.8†† | | 改訂·再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画によって付与されたインセンティブ株式オプション奨励プロトコル表(2015年8月10日に会社が提出した2015年6月30日までの四半期報告Form 10-Q(文書番号:000-26770)添付ファイル10.4合併を参照) |
| | |
| 10.9†† | | 改訂·再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画に付与されたインセンティブ株式オプション奨励プロトコル表(2017年2月27日に会社が提出した2016年12月31日現在のForm 10-K年度報告添付ファイル10.9(文書番号000-26770)を参照して統合) |
| | |
| 10.10†† | | 改訂および再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画によって付与されたインセンティブ株式オプションプロトコル表(業績および時間の帰属に基づく)(2016年11月16日に提出された会社現在報告8-K表の添付ファイル10.1(文書番号000-26770)を合併) |
| | |
| 10.11†† | | 改訂·再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画に付与された制限株式奨励協定表(2015年8月10日に提出された会社に合併して6月30日までのForm 10-Q四半期報告書(文書番号:000-26770)添付ファイル10.5) |
| | |
| 10.12†† | | 改訂·再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画に付与された限定株式単位プロトコル表(2019年3月18日に会社が提出した2019年12月31日までのForm 10-K年度報告添付ファイル10.12(書類番号000-26770)を参照して統合) |
| | |
| 10.13†† | | 改訂·再改訂されたNovavaxによると、Inc.2015年株式インセンティブ計画により付与された株式付加価値権奨励プロトコル表(2019年11月7日に提出された会社に合併して2019年9月30日までの四半期報告Form 10-Q(文書番号:000-26770)添付ファイル10.1) |
| | |
| 10.14†† | | 取締役繰延費用協議表(会社が2016年2月29日に提出した2015年12月31日までの10-K表年次報告(アーカイブ番号000-26770)添付ファイル10.10編入参照) |
| | |
| 10.15†† | | Novavax,Inc.2023年インセンティブ計画(2023年1月9日に統合された会社の現在の報告Form 8-K(文書番号:000-26770)添付ファイル10.1) |
| | |
| 10.16†† | | Novavax,Inc.2023年インセンティブ計画下の非法定株式オプションプロトコルテーブル(当社が2023年1月9日に提出した8-Kフォーム(ファイル番号000-26770)添付ファイル10.2参照) |
| | |
| | | | | | | | |
| 10.17†† | | Novavax,Inc.2023年インセンティブ計画下の制限株式報酬プロトコルテーブル(2023年1月9日に提出された会社の現在の報告8-Kテーブルの添付ファイル10.3(ファイル番号000-26770)に関連して) |
| | |
| 10.18††* | | 会社がジョン·C·ジェイコブスと締結した雇用契約は,2023年1月5日である |
| | |
| 10.19†† | | Stanley C.Erckとの雇用契約は、2011年6月22日(2011年8月9日に提出された会社の2011年6月30日までのForm 10-Q四半期報告書(文書番号:000-26770)添付ファイル10.2合併を参照) |
| | |
| 10.20††* | | 会社がStanley C.Erckと締結したコンサルティング·コンサルティング契約は、2023年1月5日となっています |
| | |
| 10.21†† | | 会社とグレゴリー·M·グレンが2010年7月1日に締結した雇用契約(会社が2010年7月6日に提出した8-K表(アーカイブ番号:000-26770)添付ファイル10.1を参照して会社として設立) |
| | |
| 10.22†† | | 会社とJohn A.Herrmannが2012年4月1日に締結した雇用契約(会社が2016年5月5日に提出したForm 10-Q四半期報告(アーカイブ番号:000-26770)添付ファイル10.2登録により設立) |
| | |
| 10.23†† | | 会社とJohn J.Trizzinoが2014年3月3日に締結した雇用契約(会社が2016年5月5日に提出したForm 10-Q四半期報告書(アーカイブ番号:000-26770)添付ファイル10.3登録により設立) |
| | |
| 10.24†† | | 会社がジェームズ·P·ケリーと2021年7月12日に締結した雇用協定(会社が2021年11月5日に提出した2021年9月30日までのForm 10-Q四半期報告(書類番号000-26770)添付ファイル10.1) |
| | |
| 10.25†† | | 2021年7月12日ジェームズ·P·ケリーへの招待状(当社添付ファイル10.2登録により設立 2021年9月30日までの四半期Form 10-Q四半期報告は、2021年11月5日に提出されます(文書番号000-26770) |
| | |
| 10.26†† | | 会社とStanley C.Erck,Gregory M.Glenn,John J.Trizzino,John A.Herrmann,IIIがそれぞれ2021年6月17日に署名した雇用協定修正案表(2021年8月5日提出の会社2021年6月30日までのForm 10-Q四半期報告(文書番号000-26770)添付ファイル10.2参照) |
| | |
| 10.27†† | | 会社の統制権配当福祉計画の改訂と変更(合併時参考会社が2021年8月5日に提出した2021年6月30日までの四半期報告Form 10-Q(書類番号:000-26770)添付ファイル10.4) |
| | |
| 10.28†† | | 会社がその役員及び上級管理者と締結した賠償協定表(会社が2010年3月16日に提出した2009年12月31日現在の10-K表年次報告添付ファイル10.19(アーカイブ番号000-26770)を参照) |
| | |
| 10.29 | | ARE-20/22/1300 Firstfield Quince Orchard,LLCが会社と締結したFirstfield Road 22号のリース契約は,2011年11月18日(合併時に会社が2012年3月14日に提出したForm 10-K年報第10.25号(文書番号:000-26770)を参照) |
| | |
| 10.30 | | Firstfield Holdco,LLCと会社の間に位置するFirstfield Road 21号の空間リースは,2015年2月4日である(合併は,会社が2015年8月21日に提出した現在の8-Kフォーム報告書の添付ファイル10.1(ファイル番号000-26770)を参照) |
| | |
| 10.31 | | Firstfield Holdco,LLCと会社間のFirstfield Road 21号空間リースの最初の改訂は,2015年8月17日(会社が2015年8月21日に提出した現在の8-Kフォーム報告(ファイル番号000-26770)の添付ファイル10.2合併を参考にすることにより) |
| | |
| 10.32 | | BMR-Firstfield LLC(前身はFirstfield Holdco,LLC)と会社との間のFirstfield Road 21号の空間契約の2回目の改訂は,2017年3月31日(会社が2017年5月8日に提出したForm 10-Q四半期報告(文書番号000-26770)添付ファイル10.2を参照して成立) |
| | |
| | | | | | | | |
| 10.33 | | Are-Marland No.51,LLCと会社の間に位置するQuince Orchard Road 700号の空間契約は,2020年10月22日(参考会社が2021年3月1日に提出したForm 10-K年報添付ファイル10.27を介して会社として設立された(アーカイブ番号000-26770)) |
| | |
| 10.34 | | Are-Marland No.1,LLCと会社の間に位置するQuince Orchard Road 700号の空間を改訂し,日付は2021年6月22日(2022年3月1日提出の会社を参照して2021年12月31日までのForm 10-K年報添付ファイル10.33(文書番号000-26770)を参照して会社として設立された) |
| | |
| 10.35^ | | 供給及び許可協定の改訂及び再締結は、2021年7月1日に、インド血清研究所プライベート株式会社と会社(2021年11月5日に提出された2021年9月30日までの10-Q四半期報告書(書類番号000-26770)添付ファイル10.4を参照して設立される) |
| | |
| 10.36^ | | 会社、インド血清研究所プライベート株式会社と血清生命科学株式会社との間の供給協定は、2021年10月26日に調印された(会社が2022年3月1日に提出した10−K表年次報告書の添付ファイル10.37を参照して設立された(書類番号000-26770) |
| | |
| 10.37^ | | 会社と血清生命科学株式会社が2021年10月21日に締結した契約開発製造協定(2022年8月8日に合併して提出された会社2022年6月30日までのForm 10-Q四半期報告(書類番号000-26770)添付ファイル10.3) |
| | |
| 10.38^ | | 会社と血清生命科学有限会社が2022年4月29日に締結した契約開発製造協定第1号改正案(会社が2022年8月8日に提出した2022年6月30日までの10-Q表四半期報告(書類番号000-26770)添付ファイル10.4合併参照) |
| | |
| 10.39^ | | 会社と血清生命科学有限会社が締結した契約開発製造協定第1号作業説明書は、2022年4月29日から発効する(会社が2022年8月8日に提出した2022年6月30日までの10-Q表四半期報告(書類番号000-26770)添付ファイル10.5合併参照) |
| | |
| 10.40^ | | SK生物科学株式会社との協力と独占ライセンス契約は,2021年2月12日(会社が2021年5月10日に提出した2021年3月31日までのForm 10−Q四半期報告の添付ファイル10.1(文書番号000−26770))である |
| | |
| 10.41^ | | 会社とSK生物科学有限会社の協力と独占許可協定修正案は、2021年12月23日(会社が2022年3月1日に提出した2021年12月31日までのForm 10-K年度報告添付ファイル10.39(書類番号000-26770)) |
| | |
| 10.42^ | | 会社とSK生物科学有限会社の協力と独占ライセンス契約の第1号作業説明書は、日付は2021年12月23日(2022年3月1日提出の会社による2021年12月31日までの10-K表年次報告添付ファイル10.40合併(書類番号000-26770)を参照) |
| | |
| 10.43^ | | 第1号作業説明書を第1号作業説明書に変更し、期日は2022年3月31日の会社とSK生物科学有限会社との協力と独占許可協定(2022年5月9日に合併して提出された会社は2022年3月31日までのForm 10-Q四半期報告の添付ファイル10.2(書類番号000-26770)) |
| | |
| 10.44^ | | 会社と武田薬品株式会社との協力と独占許可協定は,2021年2月24日(会社が2021年5月10日に提出した2021年3月31日までのForm 10−Q四半期報告の添付ファイル10.2(文書番号000−26770))である |
| | |
| 10.45** | | ビルとメリンダ·ゲイツ財団が当社と締結したグローバル参入承諾協定は、2015年9月25日(合併内容は、当社が2015年11月9日に提出したForm 10-Q四半期報告書(文書番号:000-26770)添付ファイル10.2参照) |
| | |
| | | | | | | | |
| 10.46^ | | 会社とParagon Bioservices,Inc.との間の資産購入契約は、2019年6月26日(2019年8月7日に合併して提出された会社が2019年6月30日までのForm 10-Q四半期報告書の添付ファイル10.3(ファイル番号000-26770))である |
| | |
| 10.47^ | | 改訂·再署名されたSARS-CoV-2ワクチン供給協定は、2022年7月1日であり、会社と大ブリテンおよび北エルラン連合王国政府を代表する商業·エネルギー·工業戦略大臣との合意(2022年11月9日に会社が提出した2022年9月30日までの四半期報告Form 10-Qの添付ファイル10.1合併(文書番号000-26770)を参考に) |
| | |
| 10.48^ | | 同社と大ブリテンおよび北アイルランド連合王国政府を代表する商業·エネルギー·工業戦略大臣が2022年9月26日に署名した改訂と再署名されたSARS-CoV-2ワクチン供給協定修正案書(2022年11月9日に合併して提出された会社2022年9月30日までの10-Q表四半期報告添付ファイル10.2(文書番号000-26770)) |
| | |
| 10.49^ | | 会社と厚労省に代表されるオーストラリア連邦との予約契約は、2020年12月31日から発効する(会社が2021年3月1日に提出した10-K表年次報告添付ファイル10.36合併(書類番号000-26770参照)) |
| | |
| 10.50^ | | 当社が厚労省に代表されるオーストラリア連邦と2021年12月23日に締結した“予約契約”改正案(当社が2022年3月1日に提出した“Form 10-K年度報告”添付ファイル10.47(文書番号000-26770)) |
| | |
| 10.51^ | | 会社とカナダ女王陛下との予約契約は、2021年1月19日から発効し、公共工事·政府サービス部長代表(会社が2021年3月1日に提出した会社年次報告Form 10-K(文書番号:000-26770)添付ファイル10.37を参考に合併) |
| | |
| 10.52^ | | 予約契約は,日付は2021年8月16日であり,会社,Novavax CZと欧州委員会が締結している(2021年11月5日に合併して提出された会社が2021年9月30日までのForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.8) |
| | |
| 10.53^ | | 先進技術国際会社と締結された基礎協定は、2020年6月25日(会社2020年9月30日までのForm 10-Q四半期報告添付ファイル10.1(文書番号:000-26770)を参照) |
| | |
| 10.54^ | | 当社が先進技術国際と2022年3月23日に締結した基礎協定改正案第01号(2022年5月9日に合併して提出した当社が2022年3月31日までのForm 10-Q四半期報告(文書番号000-26770)添付ファイル10.1) |
| | |
| 10.55^ | | 当社と先進技術国際会社が2022年8月2日に締結した基礎協定改訂号02(2022年11月9日提出の会社に合併して2022年9月30日までのForm 10-Q四半期報告の添付ファイル10.3(文書番号000-26770)) |
| | |
| 10.56^* | | 当社が先進技術国際会社と締結した基礎協定改訂番号03は,2022年11月30日である |
| | |
| 10.57^ | | 当社と先進技術国際が2020年7月6日に締結した第1号未確定プロジェクト協定(当社の2020年9月30日までの10-Q表四半期報告添付ファイル10.2(文書番号000-26770)合併参照) |
| | |
| 10.58^ | | 当社と先進技術国際会社が2020年7月9日に締結した第1号未確定プロジェクト協定の修正番号01(当社の2020年9月30日までの四半期報告10-Q表の添付ファイル10.3合併(文書番号000-26770参照)) |
| | |
| 10.59^ | | 当社は先進技術国際会社が2020年9月10日に締結した第01号未確定プロジェクト契約の修正番号02(当社が2021年3月1日に提出したForm 10−K年度報告添付ファイル10.41(文書番号:000−26770)を参照) |
| | |
| 10.60^ | | 当社は先進技術国際会社が2020年9月18日に締結した第01号未確定プロジェクト協定の修正番号03(当社が2021年3月1日に提出した10-K表年次報告添付ファイル10.42(文書番号000-26770)を参照) |
| | |
| | | | | | | | |
| 10.61^ | | 当社は先進技術国際会社が2020年12月23日に締結した第01号未確定プロジェクト協定の第04号と改正する(当社が2021年3月1日に提出した10-K表年次報告添付ファイル10.43(文書番号000-26770)合併参照) |
| | |
| 10.62^ | | 当社と先進技術国際会社が2021年1月12日に締結した第01号未確定プロジェクト協定第05号改正案(当社が2021年3月1日に提出した10-K表年次報告添付ファイル10.44(文書番号000-26770)を参照) |
| | |
| 10.63^ | | 当社と先進技術国際会社が2021年1月19日に締結した第01号未確定プロジェクト協定の修正番号06(当社が2021年3月1日に提出した2020年12月31日までのForm 10-K年度報告添付ファイル10.45(文書番号000-26770)合併参照) |
| | |
| 10.64^ | | 当社と先進技術国際会社が2021年4月23日に締結した第01号未確定プロジェクト協定の修正番号07(当社が2021年8月5日に提出した2021年6月30日までのForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.6合併参照) |
| | |
| 10.65^ | | 当社と先進技術国際会社が2021年6月4日に締結した第01号未確定プロジェクト協定の修正番号08(当社が2021年8月5日に提出した2021年6月30日現在のForm 10-Q四半期報告添付ファイル10.7(文書番号:000-26770)合併参照) |
| | |
| 10.66^ | | 当社と先進技術国際会社が2021年7月16日に締結した第01号未確定プロジェクト協定の第09号改正案(当社が2021年11月5日までに提出した2021年9月30日現在のForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.5合併を参照) |
| | |
| 10.67^ | | 当社と先進技術国際会社が2021年8月6日に締結した第01号未確定プロジェクト協定第10号改正案(当社が2021年11月5日に提出した2021年9月30日までのForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.6合併参照) |
| | |
| 10.68^ | | 当社と先進技術国際会社が2021年8月26日に締結した第01号未確定プロジェクト協定の第11号改正案(当社が2021年11月5日に提出した2021年9月30日現在のForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.7合併参照) |
| | |
| 10.69^ | | 当社と先進技術国際会社が2021年12月20日に締結した第01号未確定プロジェクト協定の第12号改正案(当社が2022年3月1日に提出した2021年12月31日現在のForm 10-K年度報告添付ファイル10.64合併(文書番号:000-26770参照) |
| | |
| 10.70^ | | 当社と先進技術国際会社が2022年2月1日に締結した第01号未確定プロジェクト協定の第13号改正案(当社が2022年3月1日に提出した2021年12月31日までのForm 10-K年度報告添付ファイル10.65(文書番号000-26770)合併参照) |
| | |
| 10.71^ | | 当社と先進技術国際会社が2022年7月1日に締結した第01号未確定プロジェクト協定の第14号改正案(当社が2022年11月9日までに提出した2022年9月30日現在のForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.4合併参照) |
| | |
| 10.72^ | | 当社と先進技術国際会社が2022年8月9日に締結した第01号未確定プロジェクト協定の第15号改正案(当社が2022年11月9日までに提出した2022年9月30日までのForm 10-Q四半期報告添付ファイル10.5(文書番号:000-26770)合併参照) |
| | |
| 10.73^ | | 当社と先進技術国際会社が2022年9月9日に締結した第01号未確定プロジェクト協定の第16号改正案(当社が2022年11月9日までに提出した2022年9月30日までのForm 10-Q四半期報告(文書番号:000-26770)添付ファイル10.6合併を参照) |
| | |
| | | | | | | | |
| 10.74^ | | 米国国防総省化学、生物、放射線、核防衛合同プロジェクト実行オフィスと2022年7月29日に締結された契約募集/修正修正第6号(2022年11月9日に合併して提出された会社は2022年9月30日までのForm 10-Q四半期報告添付ファイル10.7(文書番号:000-26770)) |
| | |
| 10.75 | | Aシリーズ変換可能優先引受プロトコルは,日付は2020年6月15日,会社とRA Capital Healthcare Fund,L.P.(2020年6月19日に提出された会社現在報告8-K表の添付ファイル10.1を参照して組み込む(文書番号:000-26770)) |
| | |
| 10.76 | | 資金協定を再記述し、会社と防疫革新連盟が2020年5月11日に締結した(会社が2020年6月30日までに合併した10-Q四半期報告(文書番号000-26770)添付ファイル10.1) |
| | |
| 10.77^ | | 当社と防疫革新連盟が2020年11月2日に締結した“疫病対策資金協定”(ステップ2)IPDPと予算の改正案第1号(2021年3月1日に合併して提出された会社10-K表年次報告添付ファイル10.56(書類番号000-26770)) |
| | |
| 10.78^ | | 2022年9月30日、同社はFujifilm DiSynth BioTechnologies UK Limited、Fujifilm DiSynth BioTechnologies Texas,LLCとFujifilm DiSynth BioTechnologies USA,Inc.との和解合意(2022年11月9日まで提出された会社2022年9月30日までの四半期報告Form 10-Qの添付ファイル10.8(文書番号000-226770)を参照して統合) |
| | |
| 14 | | 行動規則(会社が2022年3月1日に提出した2021年12月31日までのForm 10-K年度報告添付ファイル14(アーカイブ番号000-26770)を参照) |
| | |
| 21* | | 当社の付属会社 |
| | |
| 23.1* | | 独立公認会計士事務所安永法律事務所同意 |
| | |
| 31.1* | | 証券取引法第13 a-14条又は15 d-14(E)条に基づいて行政総裁を認証する |
| | |
| 31.2* | | 証券取引法第13 a-14(A)又は15 d-14(E)条に基づいて首席財務官を証明する |
| | |
| 32.1* | | 2002年にサバンズ·オクスリ法案第906条で可決された“アメリカ法典”第18編1350条によるCEOの証明 |
| | |
| 32.2* | | 2002年サバンズ·オキシリー法第906条で可決された“米国法典”第18編1350条による首席財務官の証明 |
| | |
| 101 | | 以下の財務情報は、当社の2022年12月31日までの年次報告Form 10-Kから、拡張可能な商業報告言語(XBRL)形式である:(I)2022年12月31日および2021年12月31日までの総合貸借対照表、(Ii)2022年12月31日までの3年度の総合経営報告書、(Iii)2022年12月31日までの3年度の総合損益表、(Iv)2022年12月31日までの3年度の総合株主権益(損失)変動表、(五)2022年12月31日までの三年度の連結現金フロー表及び(六)連結財務諸表を付記する。 |
| | |
| 104 | | 表紙対話データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット)。 |
項目16.表格10-Kの概要
適用されません
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、次の署名者が代表して本報告書に署名することを正式に許可した。
| | | | | | | | |
| Novavax,Inc. |
| |
| 差出人: | ジョン·C·ジェイコブス |
| | ジョン·C·ジェイコブス |
| | 社長と最高経営責任者 |
日付:2023年2月28日
1934年の証券取引法の要求によると、本報告は、次の日に登録者として署名された
| | | | | | | | | | | | | | |
| 名前.名前 | | タイトル | | 日取り |
| | | | |
| ジョン·C·ジェイコブス | | 社長と取締役CEO(最高経営責任者) | | 2023年2月28日 |
| ジョン·C·ジェイコブス | | | |
| | | | |
| ジェームズ·P·ケリー | | 常務副総裁、首席財務官、財務主管(首席財務会計官) | | 2023年2月28日 |
| ジェームズ·P·ケリー | | | |
| | | | |
| /s/ジェームズ·F·ヤン | | 取締役会議長 | | 2023年2月28日 |
| ジェームズ·F·ヤン | | | | |
| | | | |
| /s/グレッグ·H·アウトン | | 役員.取締役 | | 2023年2月28日 |
| グレッグ·H·アウトン | | | | |
| | | | |
| /リチャード·H·ダグラス | | 役員.取締役 | | 2023年2月28日 |
| リチャード·H·ダグラス | | | | |
| | | | |
| /s/レイチェル·K·キング | | 役員.取締役 | | 2023年2月28日 |
| レイチェル·K·キング | | | | |
| | | | |
| /s/マーガレット·G·マッグリーン | | 役員.取締役 | | 2023年2月28日 |
| マーガレット·G·マッグリーン | | | | |
| | | | |
| /s/David M.Mott | | 役員.取締役 | | 2023年2月28日 |
| デヴィッド·M·モット | | | | |
| | | | |
| //リチャード·J·ロジャース | | 役員.取締役 | | 2023年2月28日 |
| リチャード·ロジャース | | | | |
| | | | |
連結財務諸表索引
2022年12月31日まで,2021年12月31日と2020年12月31日までの年度
カタログ
| | | | | |
独立公認会計士事務所報告(PCAOB ID:42) | F- 2 |
2022年,2021年と2020年12月31日までの総合経営表と全面損失表 | F- 5 |
2022年と2021年12月31日までの連結貸借対照表 | F- 6 |
2022年12月31日現在、2021年12月31日と2020年12月31日までの株主権益(赤字)総合変動表 | F- 7 |
2022年12月31日現在、2021年12月31日と2020年12月31日までの連結現金フロー表 | F- 8 |
連結財務諸表付記 | F- 9 |
独立公認会計士事務所報告
当社の取締役会と株主へ
Novavax,Inc.
財務諸表のいくつかの見方
Novavax社(当社)の2022年12月31日現在と2021年12月31日までの連結貸借対照表、2022年12月31日までの3年度の関連総合業務表、全面赤字、株主権益(赤字)と現金流量の変化および関連付記(総称して“総合財務諸表”と呼ぶ)を監査しました。総合財務諸表は、すべての重要な面で、2022年12月31日、2022年12月31日、2021年12月31日までの会社の財務状況、および2022年12月31日までの3年度の経営結果とキャッシュフローを公平に反映しており、米国公認会計原則に適合していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に基づき、テレデビル委員会協賛組織委員会が発表した“内部統制-総合枠組み(2013枠組み)”で確立された基準に基づいて、2022年12月31日までの財務報告内部統制を監査し、2023年2月28日に発表した報告書に対して保留意見を発表した。
会社が経営を続ける企業として経営を続ける能力
添付されている総合財務諸表の作成仮説会社は引き続き経営を継続する企業となる。財務諸表付記2で述べたように、当社は経営により経常赤字、運営資金が不足しており、当社の持続経営企業としての持続経営能力が大きく疑われていることを示している。付記2はまた、これらの事項に関する経営陣のイベントや条件の評価、経営陣の計画について説明しています。合併財務諸表には、このような不確実性の結果生じる可能性のある調整は含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、監査委員会に伝達または要求が監査委員会に伝達された当期財務諸表監査によって生じる事項である:(1)財務諸表に対して重大な意義を有する勘定または開示に関するものであり、(2)特に挑戦的で主観的または複雑な判断に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、キー監査事項またはそれに関連する勘定または開示に関する個別的な意見を提供することはない
| | | | | | | | |
| | 在庫過剰と古い備蓄
|
| 関係事項の記述 | | 同社は2022年12月31日現在、3670万ドルの在庫を持っている。付記2に開示されているように、在庫はコストまたは現金化可能値の中の低いものに記載されている。当社は、報告期間毎にその在庫レベルを評価し、販売前に満期リスクがあると予想される在庫、または在庫数が予想される要求を超える在庫を減記する。2022年12月31日までの1年間で、在庫は4億476億ドルに減記され、会社の購入承諾の損失は1兆559億ドルだった。
監査管理層の過剰や古い在庫の見積もりは監査人の主観的判断に関連しており、見積もりは多くの要因に依存しているため、これらの要因は会社統制以外の市場や経済状況の影響を受けている。特に,時代遅れと過剰な在庫計算は,同社製品への期待需要,ワクチンライフサイクルに関する仮定,競合製品の需要への影響,同社の調達承諾を含む重大な仮定に敏感である。
|
| 私たちが監査でどのようにこの問題を解決したのか | | 著者らは会社の超過と時代遅れの在庫備蓄プロセスに対して内部制御を行い、管理層の上述の重大な仮定の審査、及び見積もりを作成するための情報の完全性と正確性の制御を含み、それによって内部制御の操作有効性を理解、評価し、テストした。
他にも、我々の実質的な監査プログラムは、期限切れまたは過剰リスクが存在することが予想される在庫を分析するための方法、仮説、およびデータを評価することを含む。調達承諾や代替用途を評価し,予測需要と歴史的傾向を比較し,実際の在庫レベルと予測需要を比較し,販売予測仮説の記録された在庫備蓄量に対する感受性を評価した。 |
/s/ 安永法律事務所
2014年以来、当社の監査役を務めてきました。
タイソンバージニア州
2023年2月28日
独立公認会計士事務所報告
当社の取締役会と株主へ
Novavax,Inc.
財務報告の内部統制については
我々は,テレデビル委員会後援組織委員会が発表した内部統制-総合枠組み(2013年枠組み)(COSO基準)で確立された基準に基づき,Novavax,Inc.2022年12月31日までの財務報告内部統制を監査した。COSO規格によれば,Novavax,Inc.(当社)は2022年12月31日まですべての重要な面で財務報告を有効に内部統制していると考えられる。
また、米国上場企業会計監督委員会(PCAOB)の基準に従って、会社の2022年12月31日と2021年12月31日までの総合貸借対照表を監査し、2022年12月31日までの年間毎の関連総合経営報告書、全面赤字、株主権益(赤字)の変化とキャッシュフロー、および2023年2月28日までの関連付記と我々の報告書は、持続経営企業としての経営継続能力に関する解釈的段落を含む無保留意見を表明した。
意見の基礎
会社管理層は、財務報告に対する有効な内部統制を維持し、添付文書に記載されている財務報告内部統制の有効性を評価する責任がある財務報告の内部統制に関する経営陣の報告項目9 Aに含まれます。私たちの責任は私たちの監査に基づいて、会社の財務報告書の内部統制に意見を述べることです。私たちはPCAOBに登録されている公共会計士事務所で、アメリカ連邦証券法およびアメリカ証券取引委員会とPCAOBの適用規則と法規に基づいて、私たちは会社と独立しなければなりません。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務報告の有効な内部統制がすべての重要な面で維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の監査には,財務報告の内部統制を理解すること,重大な弱点があるリスクを評価すること,評価されたリスクテストに基づいて内部統制の設計·運用有効性を評価すること,および状況下で必要と考えられる他のプロセスを実行することが含まれる。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制には、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分に関する記録の保存、(2)公認された会計原則に従って財務諸表を作成するために必要な取引が記録されている合理的な保証を提供し、会社の収入および支出は会社の経営陣と取締役の許可のみに基づいて行われる。(三)財務諸表に重大な影響を及ぼす可能性のある不正買収、使用、または処分会社の資産を防止またはタイムリーに発見する合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
/s/ 安永法律事務所
タイソンバージニア州
2023年2月28日
Novavax,Inc.
連結業務報告書
(単位は千、1株当たりの情報は除く)
| | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2022 | | 2021 | | 2020 |
| 収入: | | | | | |
| 製品販売 | $ | 1,554,961 | | | $ | — | | | $ | — | |
| 贈与金 | 382,921 | | | 948,709 | | | 453,210 | |
| 印税その他 | 43,990 | | | 197,581 | | | 22,388 | |
| 総収入 | 1,981,872 | | | 1,146,290 | | | 475,598 | |
| | | | | |
| 費用: | | | | | |
| 販売コスト | 902,639 | | | — | | | — | |
| 研究開発 | 1,235,278 | | | 2,534,508 | | | 747,027 | |
| 販売、一般、管理 | 488,691 | | | 298,358 | | | 145,290 | |
| 総費用 | 2,626,608 | | | 2,832,866 | | | 892,317 | |
| 運営損失 | (644,736) | | | (1,686,576) | | | (416,719) | |
| その他の収入(支出): | | | | | |
| 利子支出 | (19,880) | | | (21,127) | | | (15,145) | |
| その他の収入(費用) | 10,969 | | | (6,833) | | | 13,605 | |
| 所得税費用前損失 | (653,647) | | | (1,714,536) | | | (418,259) | |
| 所得税費用 | 4,292 | | | 29,215 | | | — | |
| 純損失 | $ | (657,939) | | | $ | (1,743,751) | | | $ | (418,259) | |
| | | | | |
| 1株当たり純損失: | | | | | |
| 基本的希釈の | $ | (8.42) | | | $ | (23.44) | | | $ | (7.27) | |
| 発行済み普通株式加重平均: | | | | | |
| 基本的希釈の | 78,183 | | | 74,400 | | | 57,554 | |
総合総合損失表
(単位:千)
| | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2022 | | 2021 | | 2020 |
| 純損失 | $ | (657,939) | | | $ | (1,743,751) | | | $ | (418,259) | |
| その他の全面収益(損失): | | | | | |
| 売却可能な有価証券は再分類後の未実現純収益(損失)を差し引く | — | | | (9) | | | 9 | |
| 外貨換算調整 | (5,024) | | | (8,368) | | | 19,523 | |
| その他全面収益(赤字) | (5,024) | | | (8,377) | | | 19,532 | |
| 総合損失 | $ | (662,963) | | | $ | (1,752,128) | | | $ | (398,727) | |
付記はこれらの財務諸表の不可分の一部だ。
Novavax,Inc.
合併貸借対照表
(千単位で、株や1株当たりの情報は含まれていない)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 資産 |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 1,336,883 | | | $ | 1,515,116 | |
| 制限現金 | 10,303 | | | 11,490 | |
| 売掛金 | 82,375 | | | 454,993 | |
| 在庫品 | 36,683 | | | 8,872 | |
| 前払い費用と他の流動資産 | 237,147 | | | 164,648 | |
| 流動資産総額 | 1,703,391 | | | 2,155,119 | |
| 財産と設備、純額 | 294,247 | | | 225,741 | |
| 使用権資産純額 | 106,241 | | | 40,123 | |
| 商誉 | 126,331 | | | 131,479 | |
| 他の非流動資産 | 28,469 | | | 24,291 | |
| 総資産 | $ | 2,258,679 | | | $ | 2,576,753 | |
| 負債と株主権益(赤字) |
| 流動負債: | | | |
| 売掛金 | $ | 216,517 | | | $ | 127,050 | |
| 費用を計算する | 591,158 | | | 673,731 | |
| 収入を繰り越す | 370,137 | | | 1,422,944 | |
| 融資リース負債の当期分 | 27,196 | | | 130,533 | |
| 転換支払手形 | 324,881 | | | — | |
| その他流動負債 | 930,055 | | | 36,061 | |
| 流動負債総額 | 2,459,944 | | | 2,390,319 | |
| 収入を繰り越す | 179,414 | | | 172,528 | |
| 転換支払手形 | 166,466 | | | 323,458 | |
| 非流動融資リース負債 | 31,238 | | | — | |
| 他の非流動負債 | 55,695 | | | 42,121 | |
| 総負債 | 2,892,757 | | | 2,928,426 | |
| | | |
| 引受金及び又は事項(付記18) | | | |
| | | |
優先株、$0.01額面は2,000,0002022年12月31日と2021年12月31日に認可された株違います。2022年12月31日及び2021年12月31日に発行及び発行された株式 | — | | | — | |
| | | |
| 株主権益(赤字): | | | |
普通株、$0.01額面は600,000,0002022年12月31日及び2021年12月31日に認可された株式;及び86,806,554発行済みおよび発行済み株式86,039,9232022年12月31日発行の株式と76,433,151発行済みおよび発行済み株式75,841,1712021年12月31日に発行された株式 | 868 | | | 764 | |
| 追加実収資本 | 3,737,979 | | | 3,351,967 | |
| 赤字を累計する | (4,275,889) | | | (3,617,950) | |
国庫株766,631株式、2022年12月31日のコストベースと591,980株式、2021年12月31日のコストベース | (90,659) | | | (85,101) | |
| その他の総合損失を累計する | (6,377) | | | (1,353) | |
| 株主権益合計 | (634,078) | | | (351,673) | |
| 総負債と株主権益(赤字) | $ | 2,258,679 | | | $ | 2,576,753 | |
付記はこれらの財務諸表の不可分の一部だ。
Novavax,Inc.
合併株主権益変動表
(千単位で、共有情報を除く)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 普通株 | | その他の内容
支払い済み
資本 | | 積算
赤字.赤字 | | 財務局
在庫品 | | 積算
他にも
全面的に
収入(損) | | 合計する
株主権益 |
| | 株 | | 金額 | | | | | |
| 2019年12月31日の残高 | 32,399,352 | | | $ | 324 | | | $ | 1,260,551 | | | $ | (1,431,801) | | | $ | (2,583) | | | $ | (12,508) | | | $ | (186,017) | |
| 優先株利得変換機能 | — | | | — | | | 24,139 | | | (24,139) | | | — | | | — | | | — | |
| 優先株を転換する | 4,388,850 | | | 44 | | | 199,778 | | | — | | | — | | | — | | | 199,822 | |
| 株に基づく報酬 | — | | | — | | | 128,035 | | | — | | | — | | | — | | | 128,035 | |
| インセンティブ計画に基づいて発行された株 | 2,168,725 | | | 22 | | | 44,447 | | | — | | | (39,223) | | | — | | | 5,246 | |
普通株を発行し、発行コストを差し引いて#ドル11,416 | 32,393,438 | | | 324 | | | 878,526 | | | — | | | — | | | — | | | 878,850 | |
| 有価証券の未実現収益 | — | | | — | | | — | | | — | | | — | | | 9 | | | 9 | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | 19,523 | | | 19,523 | |
| 純損失 | — | | | — | | | — | | | (418,259) | | | — | | | — | | | (418,259) | |
| 2020年12月31日残高 | 71,350,365 | | | 714 | | | 2,535,476 | | | (1,874,199) | | | (41,806) | | | 7,024 | | | 627,209 | |
| 株に基づく報酬 | — | | | — | | | 183,626 | | | — | | | — | | | — | | | 183,626 | |
| インセンティブ計画に基づいて発行された株 | 2,503,819 | | | 24 | | | 68,032 | | | — | | | (43,295) | | | — | | | 24,761 | |
普通株を発行し、発行コストを差し引いて#ドル7,292 | 2,578,967 | | | 26 | | | 564,833 | | | — | | | — | | | — | | | 564,859 | |
| 有価証券の未実現収益 | — | | | — | | | — | | | — | | | — | | | (9) | | | (9) | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | (8,368) | | | (8,368) | |
| 純損失 | — | | | — | | | — | | | (1,743,751) | | | — | | | — | | | (1,743,751) | |
| 2021年12月31日の残高 | 76,433,151 | | | 764 | | | 3,351,967 | | | (3,617,950) | | | (85,101) | | | (1,353) | | | (351,673) | |
| 株に基づく報酬 | — | | | — | | | 131,967 | | | — | | | — | | | — | | | 131,967 | |
| インセンティブ計画に基づいて発行された株 | 701,005 | | | 7 | | | 4,912 | | | — | | | (5,558) | | | — | | | (639) | |
普通株を発行し、発行コストを差し引いて#ドル7,216 | 9,672,398 | | | 97 | | | 249,133 | | | — | | | — | | | — | | | 249,230 | |
| | | | | | | | | | | | | |
| 外貨換算調整 | — | | | — | | | — | | | — | | | — | | | (5,024) | | | (5,024) | |
| 純損失 | — | | | — | | | — | | | (657,939) | | | — | | | — | | | (657,939) | |
| 2022年12月31日の残高 | 86,806,554 | | | $ | 868 | | | $ | 3,737,979 | | | $ | (4,275,889) | | | $ | (90,659) | | | $ | (6,377) | | | $ | (634,078) | |
付記はこれらの財務諸表の不可分の一部だ。
Novavax,Inc.
統合現金フロー表
(単位:千)
| | | | | | | | | | | | | | | | | |
| | 十二月三十一日までの年度 |
| | 2022 | | 2021 | | 2020 |
| 経営活動: | | | | | |
| 純損失 | $ | (657,939) | | | $ | (1,743,751) | | | $ | (418,259) | |
| 純損失と経営活動で使用されている現金純額を掛け合わせる: | | | | | |
| 減価償却および償却 | 29,054 | | | 12,661 | | | 4,885 | |
| 支出された使用権資産から受け取った貸金を差し引く | 18,104 | | | 144,433 | | | 245,861 | |
| 非現金株報酬 | 130,300 | | | 183,626 | | | 128,035 | |
| 超過と古い在庫準備金 | 447,597 | | | — | | | — | |
| その他のプロジェクト、純額 | (21,903) | | | (7,641) | | | (15,080) | |
| 経営性資産と負債変動状況: | | | | | |
| 在庫品 | (477,801) | | | (8,872) | | | — | |
| 売掛金、前払い費用、その他の資産 | 249,166 | | | (183,393) | | | (422,689) | |
| 売掛金、売掛金、その他の負債 | 913,399 | | | 600,326 | | | 163,161 | |
| 収入を繰り越す | (1,045,914) | | | 1,325,557 | | | 271,545 | |
| 経営活動提供の現金純額 | (415,937) | | | 322,946 | | | (42,541) | |
| 投資活動: | | | | | |
| 資本支出 | (89,056) | | | (54,501) | | | (54,473) | |
| 内部使用ソフト | (3,929) | | | (2,985) | | | (149) | |
| Novavax CZを買収し、買収した現金を差し引く | — | | | — | | | (165,516) | |
| 有価証券を購入する | — | | | (2,167) | | | (363,202) | |
| 有価証券満期日収益 | — | | | 159,807 | | | 205,562 | |
| 投資活動提供の現金純額 | (92,985) | | | 100,154 | | | (377,778) | |
| 融資活動: | | | | | |
優先株を売って得た純収益 | — | | | — | | | 199,822 | |
| 普通株を売却して得た純収益 | 249,230 | | | 564,859 | | | 875,623 | |
| 転換手形を発行して得た金 | 175,250 | | | — | | | — | |
| 転換手形の発行に伴う料金をお支払いください | (5,258) | | | — | | | — | |
| 株奨励の純収益を行使する | (639) | | | 24,761 | | | 5,382 | |
| 融資リース払い | (93,595) | | | (127,907) | | | (96,065) | |
| 融資活動が提供する現金純額 | 324,988 | | | 461,713 | | | 984,762 | |
| 現金、現金等価物および制限現金に及ぼす為替レートの影響 | 4,520 | | | (5,292) | | | 2,115 | |
| 現金、現金等価物、および限定的な現金の純増加 | (179,414) | | | 879,521 | | | 566,558 | |
| 年初の現金、現金等価物、制限現金 | 1,528,259 | | | 648,738 | | | 82,180 | |
| 年末現金、現金等価物、制限された現金 | $ | 1,348,845 | | | $ | 1,528,259 | | | $ | 648,738 | |
| 非現金活動の追加開示: | | | | | |
| 販売契約項下の普通株の販売は年末に決済されていません | $ | — | | | $ | — | | | $ | 3,227 | |
| 資本支出は売掛金と売掛金に計上される | $ | 17,665 | | | $ | 10,338 | | | $ | 9,255 | |
新リース契約における使用権資産 | $ | 91,855 | | | $ | 179,210 | | | $ | 247,599 | |
| キャッシュフロー情報の追加開示: | | | | | |
| 現金利息支払い、資本化金額を差し引く | $ | 18,035 | | | $ | 19,428 | | | $ | 13,705 | |
| 所得税の現金を納める | $ | 17,980 | | | $ | 12,606 | | | $ | — | |
付記はこれらの財務諸表の不可分の一部だ。
Novavax,Inc.
連結財務諸表付記
Note 1 – 組織する
Novavax,Inc.(“Novavax”及びその完全子会社“会社”)は生物技術会社であり、深刻な伝染病を予防する革新的なワクチンを発見、開発と商業化することによって、全世界範囲内で健康改善を促進する。同社の新冠肺炎ワクチンNVX-CoV 2373(“Nuvaxovid”、“Covovax”、“Novavax新冠肺炎ワクチン、アジュバント”)、インフルエンザ候補ワクチン、新冠肺炎-インフルエンザ連合ワクチン候補ワクチン及びその他の候補ワクチンは、オミク戎亜型と原型ワクチン(NVX-CoV 2373)を含み、すべてコンホメーションが正確な組換え蛋白からなるナノ構造トランスジェニックワクチンであり、これらの組換え蛋白は疾病の発病機序に重要であり、そして差別化された免疫反応を引き起こす可能性があり、自然免疫或いは他のワクチン方法よりもっと有効である可能性がある。NVX−CoV 2373と他の候補ワクチンは会社独自のMatrix−Mを用いたTMアジュバントは免疫反応を増強し、より高いレベルの機能性抗体を刺激し、細胞免疫反応を誘導することができる。同社は、12歳から17歳までの成人と青少年で新冠コロナウイルス2373を用いた相同増強を支持する予防-19研究のデータを発表している。第3段階の新冠肺炎オミック(研究311)試験の他の発見は、原型ワクチンが異種増強剤として使用され、現代のオミック変種に対して広範な免疫反応を誘導することを示している。
同社は2022年12月31日現在、成人および青少年のNVX-CoV 2373の主要シリーズおよび同種および異種増強剤の適応として、世界の複数の規制機関の承認、一時的な許可、一時的な承認、条件付きマーケティング許可および緊急使用許可(“EUA”)を取得している。
同社は2022年に“Novavax新冠肺炎アジュバントワクチン”と“Nuvaxovid”の名称でニューノワックス−CoV 2373剤の商業輸送を開始した。
Note 2 – 重要会計政策の概要
陳述の基礎
連結財務諸表には、Novavax社およびその完全子会社の勘定が含まれる。合併では、すべての会社間口座と取引がキャンセルされた。
流動資金と持続経営
添付されている総合財務諸表の作成は、当社が財務諸表発表日から1年以内に経営を継続すると仮定しています。2022年12月31日現在、同社は1.310億ドルの現金および現金等価物および限定的な現金236.22022年12月に普通株式と発行会社が2027年12月15日に満期となる転換可能優先無担保手形の同時売却により100万ドルが調達された(付記11と13参照)。2023年1月31日、会社は未返済の元金金額$325.0同社が2023年2月1日に満期にした転換可能優先無担保手形は100万ドル。2022年の間に会社の純損失#ドル657.9百万ドル、純キャッシュフローは業務活動に使用されています#ドル415.9百万ドルです。
会社は現在、1年間の持続的な経営展望期のキャッシュフロー予測には十分な資本が運営に資金を提供すると予想されているが、この予測には2023年の収入、米国政府からの資金、進行中の仲裁に関する予測が含まれている重大な不確実性がある。同社の2023年の収入は、2023年秋の新冠肺炎候補ワクチンの単価あるいは二価最新処方の開発、製造、流通或いは販売に成功する能力に依存し、それ自体に不確実性があり、規制承認を含む多くのリスクの影響を受けている。2023年2月、“米国政府協定”に署名して17(付記3参照)を修正することについて、米国政府は当社に、奨励は現在の履行期間を超えるまで延長できないと表明した。USGプロトコルが会社の経営陣が予想していたように修正されていなければ、会社は残りのドルをすべて受け取ることができないかもしれません416USG協定によると、以前予想されていた資金は100万ドルだった。2023年1月24日、Gavi、ワクチン連盟(“Gavi”)は、会社とGaviの予約契約(“Gavi APA”)に実質的に違反したことを告発する国際仲裁裁判所に仲裁要求を提出した。仲裁の結果自体が不確定であり、会社は残りの前金#ドルの全部または一部の返還を要求される可能性がある697.4百万ドルです
経営陣は、これらの不確定要因の重要性に鑑み、これらの財務諸表発表日から1年以内に、会社が継続経営企業としての継続経営能力に大きな疑問を持っていると考えている。
同社が会社運営に資金を提供する能力は、その製品および候補製品のワクチン販売に関連する収入に依存する(これらの候補製品が上場承認され、商業化に成功した場合)、Gaviとの紛争を解決するかどうか、いつ、およびGaviとの紛争をどのように解決するかを含むいくつかの問題の解決、およびGaviとの紛争の解決を含む管理層の計画であり、株式および債務融資、協力、戦略連盟、およびマーケティング、流通または許可手配の組み合わせによる追加資本の調達を含む可能性がある。商業的に受け入れ可能な条項によると、会社は新しい融資を受けることができないかもしれない、あるいは全くできないかもしれない。さらに、任意の協力、戦略連合、およびマーケティング、流通、または許可配置は、製品または技術の一部または全部の権利を放棄することを会社に要求することができ、場合によっては、これらの権利の潜在的価値は、そのような権利の全ての価値よりも低い可能性がある。さらに、NVX-CoV 2373および同社の他の候補ワクチンは、インフルエンザ候補ワクチン、CIC候補ワクチン、または単価または二価処方を含む新冠肺炎変異株を含み、規制および商業上の成功はまだ確定されていない。当社が追加資本を得ることができない場合、当社はその資本資源を評価し、業務の一部または全部の延期、縮小または廃止、またはその組織規模の削減を要求される可能性があり、いずれも、その業務、財務状況、運営結果、および持続的な経営企業としての運営能力に重大な悪影響を及ぼす可能性がある。
再分類する
以前の期間に報告されたいくつかの金額は、今期の財務諸表に適合する列報方式で再分類された。これらの再分類は,以前に報告された財務状況,キャッシュフローや経営結果に実質的な影響を与えなかった。
予算の使用
アメリカ公認会計原則(“アメリカ公認会計原則”)に基づいて総合財務諸表を作成する際、管理層は総合財務諸表の日付の資産及び負債額、或いは有資産及び負債の開示、及び報告期間内の収入及び支出の報告金額に影響するため、推定及び仮定を行わなければならない。推定は、収入確認、在庫、研究開発費、株式ベースの報酬、長期資産の使用寿命、レンタル、所得税に限定されない。実際の結果はこのような推定とは大きく異なるかもしれない。
収入確認
契約開始時に、会社はその収入スケジュールを分析して、米国公認会計基準に基づく適切な会計処理を決定する。現在、会社の収入スケジュールは会計基準編纂(ASC)テーマ606の範囲内の顧客契約を代表している顧客との契約の収入(主題606)(“ASC 606”)、またはASCトピック958-605によって指導された投稿、非営利団体-収入確認(“ASC 958-605”)。同社は、ASC 606の範囲内に配置された収入を5ステップモードで確認する:(I)顧客との契約を決定するステップと、(Ii)契約における履行義務を決定するステップと、(Iii)取引価格を決定するステップと、(Iv)契約中の履行義務に取引価格を割り当てるステップと、(V)契約義務を履行するときに収入を確認するステップと、を含む。会社は、顧客に譲渡された商品やサービスと引き換えに獲得する権利のある対価格を受け取る可能性がある場合にのみ、5ステップモードで収入を確認する。資金提供者によって課せられた条件が実質的に満たされた場合、会社は、ASC 958-605の範囲内の寄付収入を確認する。寄付金は助成者の課した条件に合った研究や開発活動が展開されるまで繰延収入として入金される。
製品販売
製品販売は,会社が各国政府と締結したNVX−CoV 2373供給契約に関連しており,予約プロトコル(“APA”)と呼ばれることもある。当社は、ASC 606に基づいて計算された1剤当たり製品の取引価格に基づいて製品販売収入を確認し、このような受け入れ条項が適当とみなされない限り、製品販売収入を確認する。APAに条項が含まれていれば、以前に納入された1剤当たりの貨物の価格を下げる可能性があり、会社は価格を制限し、確認された収入が大きく逆転しない可能性が高い。
贈与金
贈与収入には政府契約からの収入もあれば、防疫革新連盟(CEPI)などの組織からの贈与も含まれている。同社は政府の援助、贈与、許可証、臨床開発協定に基づいて研究と開発を行っている。収入は主にNVX-CoV 2373の臨床開発と製造を推進するために、アメリカ政府の契約および他の手配に基づいて提供された資金を含む。
米国政府の契約によると、同社は、NVX-CoV 2373の開発、製造、および米国政府への配信に関連するいくつかの活動を支援するために、償還可能コストまたは償還可能コストに固定費用を加えた上で資金を得る権利がある。同社はこれらの契約を分析し、それらがASC 606の範囲に属することを決定した。個々の契約下の債務は契約範囲内で異なるわけではなく,それらは高度に依存または相互に関連しているため,単一の履行義務とみなされる.これらの手配された取引価格は、会社が予想していた対価格であり、割り当てられた資金の契約金額と未計上資金の可変金額からなり、収入の大きな逆転が生じない可能性が高いことを前提としている。会社が貨物やサービスの支配権を移転して義務を履行することに伴い、会社は時間の経過とともにこれらの契約の収入を確認する。当社は完成時試算(“EAC”)プログラムを用いて履行義務履行の進捗状況を測定し,会社の履行義務履行の進捗状況を審査·監視するためのコストに基づく入力方法である。この過程で、管理層は、完成進捗、労働力コストと努力程度、材料と下請けコスト、間接行政コスト、その他確定されたリスクを含むが、完成の進捗、労働力コストと努力程度、材料と下請けコスト、間接行政コスト、その他の確定されたリスクを含むが、これまでに発生したコストを考慮している。契約で定められた義務履行時に許容される総コストは主観的であると推定され,将来の活動やコスト駆動要因を仮定する会社が必要である。これらの見積り値の変化は様々な原因で発生する可能性があり,顕著であれば, 会社の契約収入や費用確認の時間に影響を与える可能性があります。許可された契約コストは、契約によって生成された直接コストと、料率の形態で直接コストに計上される間接コストとを含む。契約下の進捗課金は、最初に会社が米国政府と合意した一時的間接課金料率に基づく。これらの間接率は毎年検討されている.当社は、間接課金率の変化を決定する間に発生する変化の影響を記録している。これらの変化は、実際に発生した間接コストと、米国政府と合意された一時的間接請求書料率を決定するための推定金額との間の差を反映している。同社は取引価格までの期間中に発生した精算可能な契約コストに基づいて米政府契約の収入を確認している。精算可能費用と固定費用契約については,会社が東アフリカ共同体プログラムに基づいて決定した精算可能契約コストが,基本履行義務完了時に発生する予定の契約総コストに占める割合を占め,固定費用を確認した。当社は累積追跡に基づくEAC過程に関する推定変動を確認した。同社は本見積もりに取引価格を含み、顧客契約の資金有部分と無資金部分を含む。
当社の他の融資協定には、現在、CEPIが融資形式で提供する資金(“CEPI贈与資金”)と、1つまたは複数の無利子定期融資(“CEPIは融資資金を猶予できる”)が含まれています。会社の贈与融資手配によると、CEPI手配を含め、会社は主にNVX-CoV 2373開発関連活動を支援する費用の補償を受ける権利がある。同社は、これらの他の融資計画を分析し、保険加入者に直接的な経済的利益をもたらさないので、ASC 606の範囲内にないことを決定した。助成金供給スケジュールに従って受信された支払いは、ASC 958~605の範囲内の条件付き寄付とみなされ、このような研究および開発活動が資金提供者によって課せられた条件に適合する方法で実際に行われるまで、繰延収入として入金される。CEPIによって援助された契約製造組織(“CMO”)ネットワークで生産されたNVX−CoV 2373が1つまたは複数の第三者(終了前に会社のGAVI APAによる任意の販売を含むがこれらに限定されない)に販売された場合にのみ、CEPIは、融資基金の下で受信された支払いを免除することができ、そのような販売は、CEPIによって援助された製造コストを含まない会社がそのようなワクチンを製造するコストをカバーすることができる。CEPIの財務リスクは依然として存在するため、当社はCEPIプロトコル資金の使用がASCテーマ470の範囲を超えていると判断した債務それは.研究·開発リスクは実質的であると考えられるため,契約開始時に開発に成功することは不可能である。そこで会社はASCテーマ730と結論しました研究と開発(“ASC 730”)は、適用および最適とみなされる。研究開発活動に関する財務リスクはCEPIにあることから,CEPIが提供する任意の資金の償還は将来の経済効果のある研究や開発活動の結果に完全に依存するため,当社はCEPIが融資資金を免除することを他者のための研究·開発の契約義務として入金している。同社は、これらのプロトコルに従って受信された支払いは、研究および開発費用を低減するのではなく、ASC 958~605項目の収入として記録されるべきであると決定した。これは会社がこのような金額を収入として列報する政策と一致する。この決定を達成する際には
当社はすでに多くの要素を考慮しており、この手配が主要な手配であるかどうか、及びこの手配が当社の核心業務及び当社の核心業務の一部に対して重大な意義を持っているかどうかを含む。同社は契約を履行してサービスを研究·開発する際に収入を記録する。
ASC 958−605に従って収入のスケジュールを確認することに関連して予め受信された将来の業績に関連する支払いは延期され、研究および開発活動を行う際に収入として確認される。このような現金支払いは用途に制限され、供給契約で想定される支出が発生する前に制限された現金形式で反映される。
印税その他
会社にも、顧客が会社の知的財産権を機能的許可として使用する権利があり、許可が付与された時点で会社の履行義務を履行することを含む様々な手配がある。これらの許可配置には、販売ベースの印税、特定の開発および商業マイルストーン支払い、および販売専用Matrix-Mが含まれていますTMアジュバントです。発展マイルストーン支払いは、規制承認のようなマイルストーンの実現状況に依存するが、これらのマイルストーンは、会社または許可者の制御範囲内ではないため、マイルストーンが実現される前に、支払いは実現可能であるとは考えられず、取引価格に含まれず、マイルストーンに達したときに、会社が収入を確認する。以前に付与された許可に関連する販売ベースの印税を含む手配については、一定レベルの製品販売を実現することに基づくマイルストーン支払いを含み、許可は印税に関連する唯一または主要な項目とみなされ、会社は関連販売が発生したときに収入を確認する。
当社は相対的に独立した販売価格に基づいて取引価格を契約履行義務ごとに割り当てています。これは、適用される市場条件および関連するエンティティ特定要因(顧客との交渉合意時に考慮される要因を含む)を考慮して、契約義務毎の独立販売価格を決定するために判断すべき仮定を提案する。
販売コスト
販売コストには、当社のこの間の製品販売に関する原材料コスト、生産コスト、製造間接コストが含まれる。販売コストには、過剰、古い、または期限切れ在庫の調整、アイドル生産能力の調整、および将来の需要の見積もりに基づいてコストを回収できないことに基づいて調達承諾の損失を決定することも含まれる。販売コストには、“在庫”というタイトルに記載された規制許可の前に支出された原材料、生産、および製造間接費用に関連するいくつかの費用は含まれていない
研究と開発費
研究開発費には、賃金、株式ベースの報酬、実験室用品、外部契約研究組織(“CRO”)、CMOおよび契約開発および製造組織(“CDMO”)、および会社の臨床開発計画のプロセス開発、製造、臨床、規制および品質保証活動に関連する他の費用が含まれるコンサルタントおよび下請け業者が含まれる。また,関連する間接コストは,福祉や間接費用など,研究開発費にも計上されている
同社は、外部サービスプロバイダと締結された契約に基づいて、その期間に提供されるサービスレベルの推定に基づいて、提供されるサービスに関する研究·開発費用を推定する。研究·開発活動は発生時に費用を計上する。
研究と開発費用を計算すべきである
同社はサービスを提供する際に臨床試験に関する費用を含む研究·開発費用を計算しなければならず、これには発生したが領収書を発行しない費用の見積もりが含まれている可能性がある。会社は、第三者サービスプロバイダが提供する情報およびCRO、CMOおよびCDMO伝票および内部推定を使用して、会社が実行する作業の進捗を決定する。臨床試験案、契約、および参加者登録データに基づく仮定は、これらの計算すべき費用を推定するためにも使用される。
広告費
広告費用は発生時に費用を計上する。同社の広告費は$84.0百万ドルとドル8.92022年12月31日と2021年12月31日までの年間で、それぞれ100万ドル。
株に基づく報酬
当社は、公正価値計算と株式オプション、株式付加価値権(“SARS”)と制限的株式奨励(“RSU”)に関する株式ベース報酬、および“会社員株購入計画”(“ESPP”)による購入を計算しています。当社は、付与日奨励の公正価値に基づいて、株式奨励に必要なサービス期間(一般に帰属期間)内で当該等の奨励に関する補償費用を直線的に確認する。必要なサービス周期は通常1つは至れり尽くせり4年それは.すべての補償の没収は発生したことが確認された。会社は普通新しく発行された株で株式奨励金を決済します。
株式オプションとSARSの公正価値は付与された日にBlack-Scholesオプション定価モデルを用いて計測される.株式オプションおよび重症急性呼吸器症候群の予想期限は、当社の過去の引受権行使経験および帰属後の没収経験に基づいて、帰属日からの過去の予想期限を用いて計算され、特別引出権計画による購入の期待期限は、要約に含まれる購入期間に基づいて計算される。期待変動率は,期待期間に対応するレビュー期間の株価使用履歴変動率に基づいて決定される.無リスク金利は、残り期限が予想期間に等しいゼロ金利米政府債券の収益率に基づいて決定される。当社は配当金を派遣したことがありませんが、当社も予見可能な将来に配当金を派遣するつもりはありませんので、期待配当率はゼロです。
現金と現金等価物
現金および現金等価物には、購入日から満期日が3ヶ月以下の高流動性投資が含まれる。現金等価物はコストごとに入金され,その短期的な性質のため,このコストは公正価値に近い.
公正価値計量
当社はASCテーマ820を適用している公正価値計量と開示金融および非金融資産および負債のための(“ASC 820”)。ASC 820は、市場法(比較可能な市場価格)、収益法(将来の収入またはキャッシュフローの現在値)、およびコスト法(資産サービス能力を置き換えるコストまたはリセットコスト)のような推定方法を検討する。この声明は公正価値階層構造を採用し、公正価値を計量するための評価技術の投入を3つの大きなレベルに分けた。以下にこれら3つのレベルの簡単な説明を示す
•レベル1:活発な市場における同じ資産または負債のオファー(調整されていない)のような観察可能な投入。
•第2級:直接又は間接的に観察可能な資産又は負債の見積以外の投入。これらのオファーには、アクティブ市場における同様の資産または負債の見積もりと、非アクティブ市場における同じまたは同様の資産または負債の見積もりが含まれる。
•第3レベル:報告エンティティ自身の仮定を反映した観察不可能な入力.
制限現金
同社の流動および非流動制限現金には、贈与協定に従って受け取った支払いと、特定の施設賃貸保証金としての信用状の下の現金担保口座が含まれている。贈与契約に応じて受け取った支払いは、会社がこれらの合意に基づいて提供するサービスに料金が発生するため制限されなくなる。制限された現金残高(流動および非流動)は、2022年12月31日および2021年12月31日までに、主にCEPI出資協定に従って支払われる金を含む。
売掛金
会社が無条件に支払い権利を獲得した場合、会社は顧客の売掛金を売掛金として確認する。同社は、経済状況、売掛金の帳簿年齢や顧客特有のリスクを考慮して、未返済売掛金を評価し、受取可能性を評価している。
リスクが集中する
金融商品は会社を集中的な信用リスクに直面させ、主に現金と現金等価物から構成されている。会社の投資政策は、資産支援証券、高級会社債務証券、通貨市場基金を含むいくつかのタイプのツールに投資を制限し、ある業界の満期日と集中度を制限し、会社に一定の流動性レベルを維持することを要求する。時々、同社の金融機関での現金残高は連邦保険の限度額を超える可能性がある。当社はこのような口座に関する損失は何も出ておらず、その現金や現金等価物は重大な信用リスクに直面しないと信じている。
同社の売掛金は、国や地域の顧客との収入手配から来ている。同社の収入は、主に製品販売、政府支援、民間組織からの贈与、およびその協力·許可パートナーからの印税に由来する。以下のお客様は、本報告に掲げる期間中の総収入または売掛金の10%以上を占めています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 収入パーセント
12月31日までの年度 | | 12月31日までの売掛金の割合は |
| 2022 | | 2021 | | 2020 | | 2022 | | 2021 |
| 欧州委員会 | 40 | % | | * | | * | | 10 | % | | * |
| オーストラリア政府は | 21 | % | | * | | * | | * | | * |
| カナダ政府 | 10 | % | | * | | * | | * | | * |
| イスラエル政府は | * | | * | | * | | 21 | % | | * |
| ワクチン連盟 | * | | * | | * | | * | | 77 | % |
アメリカ政府は(1) | 19 | % | | 71 | % | | 46 | % | | 46 | % | | * |
| CEPI | * | | 12 | % | | 47 | % | | * | | * |
| SK生物科学有限会社です。 | * | | 14 | % | | * | | * | | * |
*金額は10%未満
(1)“USG協定”(付記3参照)および国防総省を含む。
同社は現在、1つのサプライヤーによる共同調合、充填とNVX-CoV 2373の完成に完全に依存している。このサプライヤーを失うと、会社が顧客の注文を提出することを阻止または遅延する可能性がある。
在庫品
先進先出し法の下で、在庫はコストまたは可現純値の低い者を基準とし、在庫項目の満期時間を考慮した。当社は移動平均コストを用いて原材料コストを計算し、定期的に調整した標準コスト法を用いて半製品と完成品のコストを計算し、実際のコストと標準コスト推定の偏差を反映している。標準コストは主に商品を製造するコストを含み、直接材料、直接労働力及び第三者サプライヤーのサービスと製品を含む。製造間接費用は予想生産レベルに応じて半製品と生産品に適用される。同社は第三者CMO、CDMO、その他のサプライヤーやサービス組織を利用して、原材料の調達と加工、在庫管理、包装、納入過程をサポートしている。必要があれば、推定された過剰、古い、または期限切れ在庫を販売コストによって調整して、在庫コストをその現金化可能な値に下げることができる。各報告期間内に、当社は、第三者CMOおよびCDMOと締結された供給契約により生じた過剰な会社が撤回できない調達承諾負債が存在するか否かを評価する。将来の製品需要の推定、現在および未来の市場状況、潜在的な製品の古い状況、決定された調達承諾による原材料の期限切れおよび利用、および契約最低限度額など、在庫および会社調達承諾負債の現金化可能な純価値を決定する必要があると判断する必要がある。
その候補製品の予備規制認可を行う前に、当社は発生した期間内に、原材料、生産、製造間接費用に関するコストを研究·開発費用として合併運営報告書に支出する。候補製品に対して初歩的な監督管理許可を行った後、会社が製品に関する経済的利益を得る権利があると判断した場合、会社は特定のサプライチェーンの生産コストを在庫として資本化する。
財産と設備
財産と設備は減価償却累計額を差し引いたコストで申告する。資産の推定耐用年数内に直線減価償却を使用する。修理とメンテナンス費用は発生時に費用を計上します。財産と設備の推定耐用年数は以下のとおりである
| | | | | |
| 使用寿命 |
| 建物.建物 | 25年.年 |
| 機械と設備 | 5 - 7年.年 |
| コンピュータハードウェア | 3年.年 |
| 賃借権改善 | 賃貸契約の耐用年数や残期限が短い |
リース会計
同社はCMOとCDMOと生産供給協定を締結し,その候補ワクチンを生産している。いくつかの製造供給プロトコルには、当社が制御する決定された製造施設および設備を使用することが含まれており、当社はこれらの施設および設備のほとんどの生産を取得し、埋め込み賃貸の条件を満たしている可能性がある。当社は組み込み賃貸を含む製造供給契約を完全な賃貸手配としている。会社CMOおよびCDMOプロトコルに含まれるリースの評価は複雑であり、契約が決定された資産のために明示的または暗黙的に使用されているかどうか、および会社が決定された資産(一般にCMOまたはCDMOの製造施設の一部を使用することを示す権利がある)、レンタル期間、および契約下の固定リース支払いを示す権利があるときに判断する必要がある。契約によっては、レンタル開始日が契約開始日と異なる場合があり、レンタル開始日は、レンタル者がターゲット資産をテナントに提供して使用する日と定義され、会社はその日にレンタル料金を計算する必要がある。当社は、いくつかの予想マイルストーンがテナント選択権を終了することに与える影響(この選択権を行使しないことを合理的に確定すること)に基づいて、テナントに埋め込まれた取消不可能なレンタル期間を特定する。当社は、これらの変化が新たなレンタルまたは既存のレンタルの修正につながるかどうかを決定するために、リース契約条項や条件の変化を評価します。賃貸借契約の修正に用いる, 当社は契約中の残りの対価格を再計量·再分配し、改正発効日にレンタルカテゴリを再評価します。リースは合意された経済的実質によって経営的リースや融資リースに分類される。同社はまた、施設と特定の設備について撤回不可能な賃貸契約を締結した。
レンタル開始日レンタル期間が12ヶ月を超えるレンタルについては、当社はリース負債とそれに応じた使用権資産を確認し、前者は当社がリースによるリース金の支払い義務を表し、後者はリース期間内に対象資産を使用する権利を表し、後者はレンタル期間内に将来の支払いの現在値を固定する。会社はレンタルに隠れている割引率(ある場合)や会社の逓増借款金利を用いて将来の支払いの現在値を計算します。開始日のリース期間が12ヶ月以下のすべての賃貸契約(“短期”借約と呼ばれる)について、会社は、ASCトピック842に適用される実際の便宜策を選択している賃貸借証書(“ASC 842”)は、リース負債またはROU資産を確認するのではなく、レンタル支払いをレンタル期間内の費用として直線的な原則で確認し、指数またはレートに依存しない可変リース支払いは、契約プロトコルに従って業績または使用に応じて可変レンタルコストを生成する間に支出とする。リース期間を決定する際には、当社は、対象資産を使用する期間を合理的に決定する事実や状況に影響を与える可能性があるとともに、対象資産を使用する権利がある取消不可能期間と、選択権の行使を合理的に決定する際にリースを延長または終了する任意の選択期間とを考慮する。当社は改訂された短期賃貸契約を再評価し、当該等の賃貸契約が短期賃貸とみなされる要求に適合しなくなった場合、改訂日がリース開始日であるように、賃貸負債及びROU資産を確認及び計量する。改正され、短期賃貸とみなされる要求に適合し続ける短期賃貸については、当社は改正賃貸項目の下での固定賃貸支払いを再計量し、賃貸支払いを直線原則で改訂レンタル期間の料金と確認した。
経営的リースについては、当社は、レンタル開始日からレンタル期間終了までの固定支払いに関するレンタル料金と、契約契約に応じて業績や使用状況に応じて変動支払いに関するレンタル料金を直線的に確認しています。融資リースについては、当社はROU資産が対象資産のリース期間や使用年数の短い時間で償却されていることを確認した。会社の支出
ASC 730項目の下の研究および開発活動のために取得されたROU資産は、それらが将来的に代替用途がない場合、研究および開発プロジェクトにおいても他の態様でも。
当社は、ASC 842に基づいてそのリース契約および他の合意を評価する際に、契約がリースであるか否かを決定するためのリース期間、リース契約条項および条件の変化が新たなまたは修正されたリースを代表するか否か、リースが経営的リースまたは融資リースを代表するか否か、リース義務の現在値を決定するための割引率、その製造供給契約に含まれるリース期間、および基礎リース資産の推定価値や比較可能会社の財務状況などの推定を用いて決定された会社の逓増借り上げ率を含む重大な仮説および判断を使用する。
長期資産減価準備
イベントまたは環境変化が、資産または資産グループの帳簿金額が、ASCトピック360における長期資産減値または処置の会計基準に基づいて回収できない可能性があることを示す場合、財産および装置、内部使用ソフトウェアおよびROU資産を含む長期資産の減値が検討される不動産、工場、設備。当社は収益法を用いて長期資産または資産グループの推定公正価値を計算します。将来のキャッシュフローの総和が資産または資産グループの帳簿価値よりも小さいことが予想される場合、減値損失を確認する。
商誉
商誉は毎年減値テストを行う必要があり、或いは減値指標が出現した時にもっと頻繁に減値テストを行う必要がある。同社は、その唯一の業務が再編ワクチンの開発であるため、単一の運営部門として運営されていることを決定した1つは報告単位です。当社は主に市場法を採用しており、必要があると考えられれば、収益法を用いて営業権が減値されているかどうかを決定しています。市場法は投資資本の時価に基づいている。当社の株式が公正価値の適切な計量であることを確保するために、当社はその取引量、投資家の多様性、アナリストカバー面などを考慮した。必要があると考えられれば,収益法を用いて市場法の結果を確認することができる.報告単位の帳簿価値がその推定公正価値を超える場合、営業権減値が存在する可能性がある。報告単位の帳票価値がその公正価値を超える場合、減値分析の第2のステップを実行する。分析の第2のステップでは、このような状況が発生した場合、減値損失は、報告単位の営業権に等しい帳簿価値がその暗黙的公正価値を超える部分として記録される。
2022年10月1日と2021年10月1日に、会社の単一報告単位の公正価値がその帳簿価値より大幅に高くなり、違います。2022年10月1日と2021年10月1日までの営業権減額。
所得税
当社はASCテーマ740に基づいて所得税を計算している所得税それは.貸借対照法によれば、繰延所得税は、既存資産及び負債の財務諸表帳簿額面とそのそれぞれの計税基礎及び繰り越しの営業損失との差額による将来の税務結果について確認する。税金資産および負債を繰延して税率計量を策定し,その等の一時的な差額の回収や決済が予想される年度の課税所得額に適用される予定である。税率変動が繰延税金資産や負債に及ぼす影響は、当該等変動公布期間中に収入で確認されている。繰延税項目の純資産を予想変動額に減少させる必要がある場合には、推定支出を設定しなければならない。
2017年の減税·雇用法案における世界無形低税収入(GILTI)条項は、外国企業の有形資産を超えて見返りとされているいくつかの外国収入に米国税を課す。当社は任意の潜在的GILTIを期間コストとすることを選択しました。
不確定納税状況に関連する税収利益は、(1)最も可能性のある確認閾値を満たすこと、(2)交渉または訴訟によって最終的にこの状況を解決すること、または(3)税務機関がその状況を審査および疑問視する訴訟時効が満了したことのうちの1つを満たす期間で確認される。不確定な税収状況に関連した税収割引は、より可能な確認敷居が満たされなくなった時期に逆転される。
同社は従来から大量の連邦、州、外国の税収純営業損失を発生しており、これらの損失は将来的に制限される可能性がある。経営陣は関連する繰延税金資産を全額予約し、評価準備を計算しました
本報告で述べた期間では,関連恩恵が実現されない可能性が高いため,実現できない可能性が高い.同社は現在すべての未納税年度に審査を受けなければならない。
2022年12月31日及び2021年12月31日まで、当社は確認しました4.3百万ドルとドル29.2それぞれ特許使用料の外国源泉徴収税に関する所得税支出に用いられる。2020年12月31日までの年間で、当社は確認します違います。所得税支出。
1株当たり純損失
1株当たりの基本純損失の計算方法は、純損失を当期に発行された普通株の加重平均株式数で割ったものであり、潜在的な希薄化証券の影響は含まれていない。1株当たりの純損失は在庫株方法を用いて計算し、計算方法は純損失を発行された普通株の加重平均で割ったものであり、期間内のいくつかの発行済み証券の希釈効果を考慮した後、主に転換可能な手形、株式オプション、特別引き出し権と非帰属のRSUである。2022年12月31日現在、会社の2027年手形と2023年手形(付記11参照)は約に変換可能になります16.4百万株会社普通株、普通株価格が$以上であると仮定する12.50そして$136.20それぞれ,である.当該等の株式は、手形の利息支出及び未償却譲許及び債務発行コストを計上した後、決済上限が取引を催促する際に自社のいずれの株式にも対応した後、計算範囲に計上しない。IF−転換法により、当該等の株式の影響は逆に薄くなるためである。
外貨?外貨
添付されている連結財務諸表をドルで列記する。会社の国際子会社の本位貨幣は一般的に現地通貨です。国際子会社の財務諸表は、資産と負債総合貸借対照表の日の有効為替レート、権益口座の履歴レートと総合経営報告書の平均レートをドルに換算する。運営キャッシュフローはその期間の有効平均レートに換算し,投資と融資活動のキャッシュフローは取引日に関する有効レートに換算する.折算損益は,添付されている総合貸借対照表において,他の全面収益(損失)を累積する構成要素であることが確認された。他の総合収益(赤字)を計上した外貨換算調整残高は(6.4)百万元と(1.4)は、それぞれ2022年12月31日と2021年12月31日である。取引通貨を機能通貨に変換することによる外貨取引損益総額は(2.5)百万、$(5.3)、および$9.62022年12月31日現在、2021年12月31日現在、2020年12月31日までの年度はそれぞれ100万ドルであり、他の収入(支出)に反映されている。
市場情報を細分化する
当社の業務管理方式は1つは経営分野:組換えワクチンの開発。その会社はその候補ワクチンに対して単独で業務を経営していない。したがって会社にはASCテーマ280で定義された個別に報告可能な部門はありません細分化市場報告.
最近の会計公告
まだ採用されていない
2016年6月、財務会計基準委員会(FASB)は会計基準更新(ASU)2016-13号を発表した金融商品·信用損失(主題326):金融商品信用損失の測定(“ASU 2016-13”)は、2018年、2019年、2020年、2022年にそれぞれ改訂されました。ASUは、会社に歴史経験、現在の条件、および合理的なサポート可能な予測に基づいて、報告日に保有する金融商品のすべての予想信用損失を測定することを要求する“現在の予想信用損失”モデルを提案した。ASU 2016-13は、収入取引からの売掛金を含む公正な価値で計量されない金融商品に適用される。ASUは2023年1月1日から会社に対して発効する。経営陣はこの指針の効果を評価しており、その実施は当社の総合財務諸表に大きな影響を与えません。
通過する
FASBは2020年8月にASU第2020-06号を発表しました債務-転換可能債務およびその他のオプション(主題470-20)と派生ツールおよびヘッジ--エンティティ自身の権益の契約(主題815-40):変換可能資産の会計
実体自身の権益におけるツールと契約(“ASU 2020-06”)は、実体自身の資本のうちのいくつかの変換可能なツールおよび契約を含む、負債および権益の特徴を有するいくつかの金融商品の会計処理を簡略化する。具体的には、新しい基準は、現金変換特徴を有する変換可能債券と、有益な変換特徴を有する変換可能ツールに必要な分離モードとをキャンセルする。それはまた現在の株式契約が派生商品範囲の例外を獲得する資格があるために必要ないくつかの決済条件を取り消し、転換可能なツールの希釈1株当たり収益計算を簡略化した。当社は2022年1月1日にASU 2020-06改正トレーサビリティ法を採用し、当社の連結財務諸表に大きな影響を与えません。
Note 3 – 収入.収入
会社の売掛金には#ドルが含まれている53.8百万ドルとドル419.7顧客に請求した金額に関する百万ドルと28.6百万ドルとドル35.3それぞれ2022年12月31日現在と2021年12月31日現在顧客に課金されていない金額と関係がある2022年12月31日と2021年12月31日までの年間で、会社の売掛金、繰延収入、不良債権準備残高の変化は以下の通り(千計)
| | | | | | | | | | | | | | | | | | | | | | | |
| 期初残高 | | 足し算 | | 控除額 | | 期末残高 |
| 売掛金: | | | | | | | |
2022年12月31日までの年度 | $ | 454,993 | | | $ | 1,768,457 | | | $ | (2,127,240) | | | $ | 96,210 | |
2021年12月31日までの年度 | 262,012 | | | 2,432,268 | | | (2,239,287) | | | 454,993 | |
| 不良債権準備: | | | | | | | |
2022年12月31日までの年度 | — | | | (13,835)(1) | | — | | | (13,835) | |
2021年12月31日までの年度 | — | | | — | | | — | | | — | |
収入を繰り越す(2): | | | | | | | |
2022年12月31日までの年度 | 1,595,472 | | | 46,908 | | | (1,092,829)(3) | | 549,551 | |
2021年12月31日までの年度 | 273,228 | | | 1,598,152 | | | (275,908) | | | 1,595,472 | |
(1)不良債権支出が$13.82022年12月31日までの1年間で違います。2021年12月31日と2020年12月31日までの年間不良債権支出。
(2)金額は$からなる0.4億ドルだ1.4億ドルと0.3現在の繰延収入とドル179.4百万、$172.5百万ドルと違います。2022年、2021年、2020年12月31日までの非当期繰延収入。
(3)繰延収入から差し引かれる金額は以下の通り273.8収入とドルで実現しました819.0$を含む百万ドル697.4Gavi仲裁で議論されている前払い金額(以下に述べる)に関する百万ドルと#ドル112.51,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000ドルの資産は、他の流動負債に再分類されています。2022年第4四半期、同社が確認した収入は41.9可変考慮の制約条件の変化による見積り数の変化に関わる百万ドル.
未清算(または一部未清算)履行債務に割り当てられた取引価格総額は、販売に基づく特許権使用料に関する金額が含まれていない約#ドルである32022年12月31日現在、当社とGavi、ワクチン連盟(“Gavi”)のAPA(“Gavi APA”)に関する金額と、改訂および再署名されたイギリス供給協定(以下の定義)に関連する用量減少は含まれていない。規制マイルストーンを達成できず、政府諮問委員会の支持的な提案をタイムリーに得られなかったり、会社の行政手続法に基づいて製品数や交付時間義務を履行できなかったりすると、会社に一部の前払いの返還を要求したり、将来の支払いを減少させたりする可能性があり、会社が履行していない業績義務で収入を実現する能力に悪影響を及ぼす可能性がある。贈与協定に係る履行義務を履行する時間は、臨床試験や投与量の交付を含む同社の研究·開発活動の結果に依存する。APAに関連する履行義務を履行する時間は、製品製造の時間、追加の適応のマーケティング許可を受けること、顧客の需要に応じて用量を提供すること、および顧客が会社のいくつかのAPAに基づいてプロトタイプNVX-CoV 2373ワクチンを変異ワクチンで置換することを要求する能力に依存する。贈与協定や行政協定に関係のない残りの未履行履行義務は以下の時間内に履行される予定である1年.
Gavi APAの条項とGaviとインド血清研究所(SIIPL)との単独購入契約によると、1.1Covax融資メカニズムに参加する国に10億剤のNVX-CoV 2373を提供する。その会社は製造と流通を予定している350Covax融資メカニズムに基づいて参加した国に100万剤のNVX−CoV 2373を提供した。Gaviとの単独調達プロトコルにより,SIIPLは製造と交付が予想される
収支のバランス1.1Covax融資メカニズムに参加する低所得国と中所得国に10億剤NVX-CoV 2373を提供する。同社は,CEPIとの資金協定で直接援助された施設で生産された抗原およびアジュバントを含む用量を納入する予定であり,供給プロトコルによると,初期用量はSIIPLと血清生命科学有限会社(“SLS”)から供給される。同社は大量の用量を提供することが予想され、Gaviはいくつかの制限の場合、階層的価格設定計画を利用して低所得国、中所得国、および高所得国に割り当てられ、Gaviはより低い価格で低所得国および中所得国にそのような用量を優先的に提供することができる。さらに、SIIPLがCovax施設に予期されるワクチン用量を提供することができない場合、同社は、CEPI援助の製造施設が利用可能な範囲内で追加のNVX-CoV 2373用量を提供することができる。協定によると、その会社は#ドルの前金を受け取った350.02021年にGaviから100万ドルを取得し、追加で$を支払う350.02022年第1四半期、会社はNVX-CoV 2373に対する世界保健機関のEUL(“前払い金額”)を取得した。
2022年11月18日、会社はGaviがGaviを促進できなかったため、Gavi APAの中止を要求する書面通知を出した350Gavi APAの要求に応じて,同社は100万剤NVX−CoV 2373を提供した。同社は2022年11月18日現在、Gavi APAからの注文のみを受けている2百万剤です。Gaviは2022年12月2日、Gaviがこの合意を否定したため、Gavi APAを深刻に違反したと主張するGavi APAの中止を主張する書面通知を発表した。GAVIはまた、Gavi APAが終了したと主張することに基づいて、Covax融資機構に参加する買い手の拘束力のある注文によってクレジット購入価格をクレジットする任意の金額を差し引く権利があると主張している。2022年12月31日現在、残りのGavi前金金額は$697.4この100万ドルの債務は、Gaviと残りの前払い金額の返金に関する紛争が解決される前に、繰延収入から会社総合貸借対照表の他の流動負債に再分類される。2023年1月24日、ガヴィは上記の主張に基づいて国際仲裁裁判所に仲裁請求を提出した。同社の回答締め切りは2023年3月2日。仲裁自体は不確定であり、会社はGaviから受信した残りの前払い金額を保留する権利があると考えているが、Gaviから残りの前金金額の全部または一部を返金する必要がある可能性がある。
製品収入
同社の顧客がいる地理的位置の製品収入は以下の通り(千単位)
| | | | | |
| 現在までの年度
2022年12月31日 |
北米.北米 | $ | 194,480 | |
| ヨーロッパ.ヨーロッパ | 823,542 | |
世界の他の地域 | 536,939 | |
| 製品総収入 | $ | 1,554,961 | |
同社は欧州委員会(“EC”)とAPAを締結し、EUの各加盟国を代表して少なくとも20百万以上100初期用量のNVX-CoV 2373は、ヨーロッパ共同体が追加のものを購入することを選択することができる100百万剤は最高合計で2002023年までに100万薬を1回以上に分けて接種しますAPAの条項によると、同社はEUにある施設でワクチンを生産し、SARS-CoV-2ウイルス変種に対するワクチンの持続的な効力を確保することに同意した。行政手続法の条項によると、会社はいかなる第三者にもNVX-CoV 2373を提供してはならず、このような交付は、会社が“行政手続法”に規定されている欧州委員会への義務の履行を妨げるか、または制限することを前提としているが、会社の“加維手続法”の下での義務は除外される。2022年に欧州委員会は会社に通知しました7行政手続法によると、2022年第1四半期と第2四半期に交付される予定だった以前に約束された100万剤が、注文を約20%に減少させた63百万剤です。2023年1月、当社は残りの部分の改訂交付スケジュールを決定しました20行政手続法により約束された100万剤は、2022年第1四半期と第2四半期に交付される予定で、2023年に交付される予定だ。
2022年7月、当社はイギリスの商業、エネルギー及び工業戦略大臣(イギリス衛生安全局に委任された)代表大ブリテン及び北エルラン連合王国政府(“管理局”)と改訂及び再署名されたSARS-CoV-2ワクチン供給協定(2022年9月26日に改訂された“改訂及び再署名されたイギリス供給協定”)を締結し、双方が2020年10月22日に締結したSARS-CoV-2ワクチン供給協定(“元イギリス供給協定”)を全面的に改訂及び再締結する。最初のイギリス供給協定によると、管理局は購入に同意しました60百万剤NVX-CoV 2373を作製しました
会社に金を前払いする。改訂と再署名されたイギリス供給協定の条項によると,管理局は少なくとも購入に同意した1何百万もの薬と最大の15NVX-CoV 2373の百万剤(“条件用量”)の数は、英国衛生大臣が承認したワクチン接種と免疫連合委員会(“JCVI”)の支持性提案を同社が適時に完了することに依存し、この提案は、(A)イギリスSARS-CoV-2ワクチン強化接種活動の一部としてワクチンを使用する一般成人人口または(B)イギリスSARS-CoV-2ワクチン強化接種活動の一部として一般青少年人口に使用することに関するものである。この提案は連合王国のメンバーが100万人未満の1つ以上の人口集団だけに関する場合は含まれていない。管理局が条件付用量を購入しなければ、またはこのような条件付き用量の数は以下のように減少する15100万剤NVX-CoV 2373、同社は最大$を返済しなければならない225.0以前に元イギリス供給協定に基づいて管理局から受け取った前払いに関する100万ユーロ。改訂と再署名されたイギリス供給協定によると、管理局はまた最も多く購入することができます442024年までに100万薬を1回以上に分けて接種します
JCVIは2022年11月30日現在,NVX−CoV 2373に対して支持的な提案を行っていないため,改訂と再署名されたイギリス供給協定の条項に基づいて,(I)条件付用量の数を15百万剤が届く7.5条件用量の減少は、上述したようにイギリスの衛生大臣の承認を得て、(2)会社が#ドルの償還を義務化することが義務付けられている2023年11月30日までにJCVIの支持的提案をタイムリーに達成することに依存する、百万剤112.5先に“連合王国供給協定”に基づいて管理局から受け取った前払いと関連して、他の流動負債に反映され、前払い残高は#ドルである112.5百万ドルは現在の繰延収入に反映されている。
贈与金
同社が確認した贈与収入は以下の通り(千計)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
アメリカ政府協定 | $ | 380,996 | | | $ | 788,953 | | | $ | 204,727 | |
アメリカ国防総省 | 1,925 | | | 21,683 | | | 12,519 | |
CEPI | — | | | 135,445 | | | 223,158 | |
その他の贈与収入 | — | | | 2,628 | | | 12,806 | |
| 贈与収入総額 | $ | 382,921 | | | $ | 948,709 | | | $ | 453,210 | |
アメリカ政府は
2020年7月,当社は先進技術国際会社(“ATI”)とプロジェクト協定(“プロジェクト合意”)を締結し,ATIは医療CBRN防衛財団を代表する財団管理会社であり,前身の“ねじれ速度行動”のパートナー関係に関係している。反り速度行動はアメリカ衛生と公衆サービス部とアメリカ国防省の各部門間の協力パートナー関係であり、新冠肺炎ワクチン、治療と診断技術の開発、製造と流通の加速に力を入れている。本プロジェクト協定は,当社が2020年6月にATIと締結した基礎協定(“基礎合意”,プロジェクト合意,すなわち“USGプロトコル”)に関するものである。最初のUSGプロトコルは、NVX-CoV 2373の安全性と有効性を決定し、アメリカ政府に製造と交付するための重要な第3段階の臨床試験を含む、同社にいくつかの臨床、監督、および他の活動を要求する100百万剤候補ワクチン。USG協定によると、資金は様々な開発、臨床試験、製造、規制、その他の活動のために会社に支払われる。USGプロトコルは、米国政府に、合理的な決定に基づいて援助されたプロジェクトがリソース支出に見合った有益な結果を生成しないようにすることと、米国政府の利益に適合する権利を終了することに基づいて基礎プロトコルまたはプロジェクト合意を終了するように米国政府に付与する条項とを含む、米国政府のこのような合意の慣用的な条項および条件を含む。プロジェクト合意が完了前に終了した場合、会社は、終了前に完了した仕事および発生した費用または義務の報酬を得る権利があり、米国政府合意の条項に適合する。2022年7月、同社はUSG協定を修正し、同協定の条項を修正し、規定(I)で米国政府に初歩的な契約を交付した3100万剤NVX-CoV 2373および(Ii)米国政府に追加的に製造および納入された製品は、合計で最大100最初のUSGプロトコルで想定された100万剤NVX-CoV 2373(第1弾を含む)
おおむね3百万剤)は、米国政府の需要、菌株選択に関するFDAの指導、このような用量の価格に対する当事者の合意、および利用可能な資金に依存する。♪the the the32022年7月に100万剤の初期用量が交付された。“プロジェクト協定”に規定されている履行期間は2023年までであり、臨床試験活動を含むが、アメリカ政府の早期終了または双方の同意を経て延長しなければならない。
USG協定によると、同社は最初に#ドルまでの資金を得る権利があった1.75NVX−CoV 2373の開発および候補ワクチンの米国政府への生産および送達に関連するいくつかの活動を支援するための。その後の改正で、会社のUSG協定が改正され、契約資金と最高限度額を#ドルに増加させた1.810億ドルで会社は最大10億ドルの債務を支出または生み出すことができます1.8USGプロトコルをサポートするために10億ドル。2022年12月31日現在、会社はドルを確認しました1.4契約開始以来、USG協定に関する収入は10億ドルで、残りは0.410億ドルが消費されます
アメリカ国防総省
2020年6月、当社は米国国防総省化学、生物、放射線、核防衛合同プロジェクト実行事務室(JPEO-CRBND-EB)と、その後2021年1月に改訂(以下、“国防総省契約”と呼ぶ)を行う書簡契約を締結し、この契約に基づいて、JPEO-CRBND-EBは最大#ドルの資金提供に同意した45.7NVX-CoV 2373の製造を支援するために同社に100万ドルを提供した。当社はすべての資金金額を超えない債務を支出または負担する権利があります。
国防総省の契約によると、同社は最初に交付される予定だった10NVX-CoV 2373を国防総省に提供した。♪the the the10FDAが承認した場合、100万剤のNVX-CoV 2373は、2/3期臨床試験またはEUA下で使用することができる。国防総省契約によると、NVX-CoV 2373がFDAの承認を得た後、国防部は5年これは、同様の取引の場合、会社は、国防総省よりも安い価格を米国のいかなる商業顧客にも提供することができないことを意味する。2022年7月、会社は国防総省との既存の合意を修正し、交付した0.2FDAのEUA承認を受けた後,100万剤NVX−CoV 2373を投与し,残りの9.8元の合意は、国防総省の需要および利用可能な資金に基づいて、100万剤NVX−CoV 2373を想定している。国防総省契約の期限は2022年12月に満了する。
防疫革新連盟
2020年5月、当社はCEPIと2020年11月に改訂を行った再融資協定を締結し、この協定によると、CEPIは最大#ドルの資金を提供することに同意した399.5NVX-CoV 2373の開発を支援するために100万ドルを会社に提供する。この協定は5ドルまでの257.0百万ユーロのCEPIは資金を贈与し、最高で142.5CEPIの免除可能な融資資金は100万ドルであり、これらのローンは1つ或いは複数の免除可能な無利子定期ローンであり、目的はある製造活動を事前に返済し、制限性或いは金融契約の制約を受けないことである。2022年12月31日と2021年12月31日までに,CEPIに関する総収入が$であることが確認された358.6100万ドル、未使用金額は主にCEPIの融資免除資金と関係がある。CEPIによって援助されたCMOネットワークによって製造されたNVX−CoV 2373は、CEPIによって援助されたCMOネットワークによって生産されたNVX−CoV 2373が1つまたは複数の第三者に販売される(終了前に会社のGavi APAに従って行われた任意の販売を含むが)場合にのみ償還可能であり、そのような販売は、CEPIによって援助される製造コストを含まない会社がそのようなワクチンを製造するコストをカバーする。今のところローンの返済時間と金額は確定されていません。
印税その他
2022年12月31日及び2021年12月31日まで、当社は確認しました9.0百万ドルとドル178.6販売による特許権使用料に関する収入はそれぞれ100万ドルであり,これは特許使用料や他の収入に反映されている。2022年12月31日及び2020年12月31日まで、当社は確認します20.0日本ではNVX-CoV 2373の百万ドルと20.0それぞれ発展マイルストーンの支払いと関連した百万ドル。
Note 4 – 協力と許可協定
血清研究所
同社はすでにNVX-CoV 2373の開発、共同調製、充填と整理、登録と商業化にSIIPL独占および非独占ライセンスを付与した。SIIPLは同社のMatrix-Mの購入に同意したTM
アジュバントおよび社はSIIPLに非独占ライセンスを付与し、SIIPLの許可領域内でNVX−CoV 2373の抗原医薬物質成分を生産することを許可し、NVX−CoV 2373の製造にのみ使用した。同社とSIIPLはSIIPLがその許可地域でNVX-CoV 2373を販売する収入を平均的に割り当て,プロトコルコストを差し引いた.会社は、SIIPL(I)協定中のインドにおける独占許可および(Ii)非独占許可(A)世界銀行によって中高所得国または高所得国に指定されたすべての国(例えば、世界保健機関が発表した)を付与し、(B)大流行期間後、世界銀行によって低所得国または中所得国に指定された国のみである。大流行期間の終了後、当社は、SIIPLがこれらの低所得国の第三者の任意の善意の機会にNVX-CoV 2373を許可することをSIIPLに通知することができ、SIIPLは、サードパーティ条項と一致または改善する機会があるであろう。そうでなければ、当社は、SIIPLのライセンスから1つまたは複数の非排他的国/地域を除去する権利があるであろう。また、当社も当社と供給契約を締結し、この合意に基づき、当社はいくつかの地域で商業化及び販売を行うためにNVX−CoV 2373を当社に供給し、当社と契約開発製造協定を締結し、この合意に基づき、当社が提供する抗原薬物物質及びMatrix−Mアジュバントを用いて、完成ワクチン製品を製造及び供給する。2022年5月と8月、同社はSIIPLとの許可と供給手配を拡大し、それに特有の新冠肺炎候補変異抗原、四価インフルエンザ候補ワクチン、CIC候補ワクチンを含む, そのため、弊社はオミック亜変異ワクチン、四価インフルエンザワクチンとCICワクチンを含む新冠肺炎変異に対するワクチンを生産と商業化することができ、そしてこれらのワクチンを会社に供給することができる。2020年3月,同社は,オックスフォード大学ジェンナー研究所が開発したマラリア候補薬R 21の開発,製造,商業化のために,上海医科大学が提供したMATRIX−Mアジュバントの非独占許可を付与した。
武田薬品株式会社
同社は武田薬品工業株式会社(“武田”)と提携·許可協定を有しており、同協定に基づき、武田に日本でのNVX−CoV 2373の開発·製造·商業化の独占許可を付与している。協定によれば、武田は、用量のNVX-CoV 2373を生産するために同社からMATRIX-Mアジュバントを購入し、会社は、いくつかの開発および商業マイルストーンの実現に従って武田から支払いを受け、NVX-CoV 2373の純利益の一部を販売する権利がある。2021年9月、武田は日本厚生労働省(MHLW)政府と購入を決定した150百万剤NVX−CoV 2373。厚生労働省は2023年2月、武田との合意に基づいて残りの線量を廃止した。したがって、現在の協力·許可協定の条項や条件によると、会社が武田社の将来の支払いを受けるかどうかは定かではない。2022年12月31日及び2020年12月31日まで、当社は確認します20.0日本ではNVX-CoV 2373の百万ドルと20.0600万ドルは、それぞれ開発および商業マイルストーン支払いに使用され、連結業務報告書の特許使用料および他の収入に含まれます。
SK生物科学有限会社です。
同社はSK Bioscience,Co.,Ltd.(“SK Bioscience”)とNVX-CoV 2373を製造·商業化し,韓国,タイ,ベトナム政府に販売する協力·許可協定を持っている。SK生物科学社は韓国政府とAPAを決定しました402021年から大韓民国に100万剤NVX−CoV 2373を輸出した。SK Bioscienceが支払う特許使用料は中2桁以下の範囲内である。また、同社とSK Bioscienceは、Covax施設で販売される製品を含むNVX−CoV 2373の抗原成分を会社に供給する製造供給計画を有しており、この施設の設立は、参加国および経済体にワクチンを公平に分配および流通させるためのものである。2022年7月、当社はSK Bioscienceと追加協定を締結し、SK Bioscienceがオミック亜変異を含む新冠肺炎変異に対する薬剤を生産することができるように、当社独自の新冠肺炎変異抗原材料を譲渡した。両社はまた、NVX-CoV 2373をプリチャージ注射器の形で製造し、供給する協定に署名した。
他の供給協定
当社、富士フイルムバイオテクノロジー英国株式会社(“FDBK”)、富士フイルムバイオテクノロジーテキサス州有限責任会社(“富士フィルム”)及び富士フィルムバイオテクノロジー米国社(“富士フィルム”は、FDBK及びFDBTとともに、2021年8月20日付の商業供給協定(“富士フィルムCSA”)及びメインサービス協定(“富士フィルムCSA”)により富士フィルムでの製造活動を終了して満期になった富士フィルムに対する契約契約及び配布(“富士フィルム和解合意”)を2022年9月30日に締結した。2020年に会社と富士フイルムとの間の関連作業説明書(“富士フイルムMSA”)。富士フイルムMSA
富士フイルムとCSAは,関連する作業説明書に基づいて,富士フイルムのNVX−CoV 2373に関する製造·供給活動に適した一般条項と条件を決定した。
富士フイルムの和解協議によると、同社は#ドルまでの支払いを担当している185.0富士フイルムCSAによると、FDBT製造活動のキャンセルに関する100万ドル(“和解払い”)を富士フイルムに支払い、そのうち(I)ドル47.8富士フイルムCSAによると、初期予約料である100万ドルは2022年9月30日の和解支払いの貸方に記入されており、(Ii)残り残高は四つ等額の四半期分割払いは$34.32023年3月31日から1人当たり100万ポンド。2022年12月31日現在、残り支払いは$137.2100万ドルは課税費用に反映されています。富士フイルム和解協定によると、富士フイルムは、富士フイルムCSAによるFDBT製造活動の中止による空き製造能力に関する損失を軽減するために、商業的に合理的な努力をしなければならず、最後の2四半期分割払いは、富士フイルムが2023年7月1日から2023年12月31日までに実現した任意の代替収入によって緩和される。和解金は,リース費用が含まれていると確認された金額よりも少なく,富士フイルム和解協議前に富士フイルムCSA項によるFDBT製造活動の研究開発費に反映されているため,2022年12月31日までの年間で利益$を記録している98.3百万は研究·開発費として用いられる(付記10参照)。
双方が合意したいくつかの限られた活動を除いて、富士フイルムMSAは2022年10月21日にFDBUとFDBTのすべての活動を終了し、終了の影響は富士フイルムMSAの規定によって決定された。Fujifilm MSAとFujifilm CSAの条項と条件は、FDBKが行っている活動に対して全面的な効力と役割を維持する。また,会社と富士フイルムが共同で発表したすべてのクレームは,(I)富士フイルムMSAまたは富士フイルムCSAによりFDBTで生産されるロットを廃止し,(Ii)2022年FDBT施設空き時間,(Iii)2021年12月までに富士フィルム生産ロットの製品性能合格試験を完了できなかったこと,(Iv)富士フイルムが富士MSAまたは富士フイルムCSAにより会社の利益のためにFDBTで生産能力や生産ロットを保持することを義務付けていることに関連している。
同社はその製造需要を評価し続け、NVX-CoV 2373を供給する契約義務と予想需要に適合するように世界的な製造足跡を修正しようとしているため、重大なコストが発生する可能性がある。
Note 5 – 現金、現金等価物、制限された現金
以下の表は、統合貸借対照表で報告されている現金、現金等価物、および限定的な現金を照合し、これらの現金と現金等価物の合計は、現金フロー表に示される同じ額の総和(千)である
| | | | | | | | | | | | | | | | | |
| 十二月三十一日 |
| | 2022 | | 2021 | | 2020 |
| 現金と現金等価物 | $ | 1,336,883 | | | $ | 1,515,116 | | | $ | 553,398 | |
| 制限キャッシュフロー | 10,303 | | | 11,490 | | | 93,880 | |
制限非流動現金(1) | 1,659 | | | 1,653 | | | 1,460 | |
| 現金、現金等価物、制限された現金 | $ | 1,348,845 | | | $ | 1,528,259 | | | $ | 648,738 | |
(1)2022年12月31日現在、2021年12月31日現在、その他の非流動資産に分類.
Note 6 – 公正価値計量
次の表は、会社の金融資産と負債の推定公正価値(単位:千):
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年12月31日の公正価値 | | 2021年12月31日の公正価値 |
| レベル1 | | レベル2 | | レベル3 | | レベル1 | | レベル2 | | レベル3 |
| 資産 | | | | | | | | | | | |
貨幣市場基金(1) | $ | 398,834 | | | $ | — | | | $ | — | | $ | 361,822 | | | $ | — | | $ | — |
政府支持証券(1) | — | | 296,000 | | | — | | — | | 266,250 | | | — |
会社債務証券(1) | — | | — | | | — | | — | | 790,672 | | | — |
代理証券(1) | — | | 104,536 | | | — | | — | | — | | | — |
| 現金等価物合計 | $ | 398,834 | | | $ | 400,536 | | | $ | — | | $ | 361,822 | | | $ | 1,056,922 | | | $ | — |
| 負債.負債 | | | | | | | | | | | |
3.752023年に期限が切れた換算チケットの割合 | $ | — | | | $ | 322,111 | | | $ | — | | $ | — | | $ | 447,509 | | | $ | — |
5.002027年に期限切れの換算手形の割合 | — | | | 172,789 | | | — | | — | | — | | | — |
| 支払転換手形総額 | $ | — | | | $ | 494,900 | | | $ | — | | $ | — | | $ | 447,509 | | | $ | — |
(1)すべての投資は、2022年12月31日と2021年12月31日現在、連結貸借対照表において現金および現金等価物に分類される。
第2レベルに分類された固定収益投資は、通常のオファーの間隔およびクレジット利益差で観察可能な金利および収益率曲線、ブローカーまたはトレーダーによって提供される入札、または同様の特徴を有する証券のオファーなどの確認可能な観察可能な市場データを使用して、ホスト銀行において第三者定価プロバイダの推定モデルによって推定される。会社の転換可能な手形の定価は観察可能な投入を使用して推定され、会社の普通株の価格、隠れた変動率、金利と信用利差を含む。
当社には、2022年12月31日および2021年12月31日までの年次内に、いかなる階層間の調達もありません。
短期的な性質のため、会社合併貸借対照表における買掛金と売掛金の金額はその公正価値に近い。
Note 7 – 在庫品
在庫には以下の内容(千計)が含まれている
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 原料.原料 | $ | 13,912 | | | $ | 8,872 | |
| 半製品 | 21,410 | | | — | |
| 完成品 | 1,361 | | | — | |
| 総在庫 | $ | 36,683 | | | $ | 8,872 | |
過剰、陳腐、期限切れ又はその他の原因による在庫減記及び会社調達承諾の損失は、合併経営報告書に販売コストの一構成要素として入金される。2022年12月31日までの年間在庫は#ドルに減記されています447.6百万ドル、会社の購入約束の損失は$155.9百万ドルです。いくつありますか違います。2021年または2020年の間に会社の調達承諾の在庫減記または損失。在庫品
在庫品が廃棄または売却処分によって廃棄された場合、減記準備金は解除される超過と古い在庫備蓄金の活動状況は以下の通り(千で計算)
| | | | | |
| 現在までの年度
2022年12月31日 |
| 2022年1月1日の残高 | $ | — | |
| 減値を含む販売コストを計上する | 447,597 | |
| その他の付加機能 | — | |
| 控除額 | (79,214) | |
| 2022年12月31日の残高 | $ | 368,383 | |
Note 8 – 商誉
商誉帳簿金額の変動状況は以下の通り(千計)
| | | | | | | | | | | |
| |
| 十二月三十一日までの年度 |
| 2022 | | 2021 |
| 期初残高 | $ | 131,479 | | | $ | 135,379 | |
| | | |
| 貨幣換算調整 | (5,148) | | | (3,900) | |
| 期末残高 | $ | 126,331 | | | $ | 131,479 | |
Note 9 – Novavax CZを買収する
二零二年五月二十七日(“買収日”)、当社の完全子会社であるスウェーデン子会社Novavax AB(“買い手”)とde Bilt Holdings B.V.,Poonawalla Science Park B.V.およびBilthven Biologals B.V.が株式購入契約(“契約”)を締結し、Serve International B.V.および当社はそれぞれ保証人である。契約の条項及び条件により、買い手はワクチン製造会社Novavax CZ(前身はPraha Vaccines A.S.)のすべての発行済み及び発行済み株式(“買収事項”)を買収する。買収の一部として、Novavax CZが買収した資産には、チェコ共和国Bohumilに位置する生物製品製造施設と関連資産が含まれており、同社はこれらの資産を利用してその製造能力を拡大する。
買収価格と買収資産と負担する負債の分配
当社は当社を買収者とし、買収会計方法を採用し、買収事項を企業合併として入金しています。買収方法は、会社に公正価値記録に従って買収した資産と負担した負債を要求する。買収価格は純資産公正価値を買収した金額を商誉に計上した。同社は、買収された資産と負担する負債の公正価値を評価するために必要な評価手続きを完了し、買収日までに確認すべき営業権金額を決定する。すべての資産と負債の公正価値の最終確定作業は2020年に完成したので、次の表を参照。
次の表は,購入した資産と負担する負債の公正価値による購入価格の最終分配(単位:千):をまとめたものである
| | | | | |
| May 27, 2020 |
| 前払い費用と他の流動資産 | $ | 326 | |
| 財産と設備 | 96,739 | |
| 商誉 | 70,662 | |
| 売掛金 | (1,193) | |
| 費用を計算する | (205) | |
| 他の非流動負債 | (813) | |
| 購入価格は、購入現金を差し引いた純額です | $ | 165,516 | |
買収された資産と負担する負債の公正価値は、市場とコスト推定方法を用いて決定される。公正価値計測は重大な観察不可能な入力に基づいており,これらの入力は
会社は公開的に入手可能な情報、市場参加者仮説、およびコストと開発仮説を使用する。重大な観察不可能な入力が使用されているため、公正価値計量はASC 820で定義された3段階計量を表す。市場法は、同じまたは比較可能な資産、負債または資産または負債のセットに関する市場取引によって生成された価格および他の関連情報を使用する推定技術である。コスト法は、1つの資産を同等の効用を有する別の資産に置き換える現在のコストを決定することによって価値を推定する。ある特定資産をリセットするコストは、その資産の推定再生産またはリセットコストを反映し、減価償却による価値損失を差し引いて準備する。
コスト法は不動産を含む固定資産を評価するための主な方法である。固定資産はその期待残使用年限内で直線減価償却し、減価償却範囲は4年至れり尽くせり25何年もです。
同社は$を記録した70.7買収に関連する商業権、すなわち買収価格は買収された資産と負担する負債の公正価値よりも高い。今回の買収による営業権は米国連邦所得税から差し引かれることはないと予想される。確認された営業権は、Novavax CZの集合従業員のような、個々の確認資格に適合しない無形資産に起因する。
流動資産と流動負債はその契約または歴史購入額に従って入金され、その公正価値に近い。
2020年12月31日までの年間財務業績への影響
買収の日から、Novavax CZの運営結果は連結財務諸表に含まれている。このため、2020年12月31日までの年間総合財務業績は、Novavax CZの丸12カ月の業績を反映していない。買収日から2020年12月31日まで、Novavax CZは何の収入も確認されず、運営純損失$を記録した11.3百万ドルです。
その会社は約$を生み出した2.72020年12月31日現在の年度買収に関する百万元のコストは、総合経営報告書内の一般および行政支出に含まれている。
補充備考財務資料(監査なし)
以下監査を受けていない財務情報は買収を発効させ、買収が2019年1月1日に発生したようにする。予備試験の財務情報は参考に供するだけであり、必ずしも当時に買収を完了すれば得るべき業務成果を説明するとは限らない監査を受けていない備考財務情報は、同社とNovavax CZの歴史運営結果を結合し、ある試験調整の応用を反映している(千計で、1株当たり金額を除く)
| | | | | |
| 現在までの年度
2020年12月31日 |
| 収入.収入 | $ | 475,598 | |
| 純損失 | (419,896) | |
| 1株当たりの基本と償却純損失 | $ | (7.04) | |
試験準備調整には、買収日に基づいて減価償却支出及びNovavax CZ固定資産の公正価値と余剰使用年数(歴史的減価償却支出を差し引く)を確認し、買収に関連する非日常的なコストを除去することがある。
Note 10 – 賃貸借証書
同社はCMOやCDMOと複数の製造供給契約を締結し,NVX−CoV 2373を生産し,これらの協定に関するリース契約,その研究開発·製造施設,会社本部やオフィス,およびいくつかの設備の運営リースを締結している。
当社は、2022年及び2021年12月31日までの年度までに、先に借り入れ契約を代表すると決定されたCMO及びCDMOプロトコルをいくつか改訂し、その政策に基づいて当該等の契約項目の残りの対価を再計量及び再分配し、改訂発効日までのレンタル種別を再評価する。2022年12月31日までの年度内に、会社は改正された供給契約を再計量する際にROU資産とそれに応じた長期経営賃貸負債を確認した。.の間に
2021年12月31日までの年度は、これまで短期埋め込み賃貸を代表すると決定されていた賃貸については、改正によりレンタル分類が変化することはありません。
2022年から2021年までの間、新規または修正されたレンタルのため、会社は純収益資産(ROU)を確認し、修正された貸金を差し引いて#ドルです18.6百万ドルとドル144.4それぞれCMOとCDMO製造供給プロトコルに埋め込まれた融資リースと長期運営リースである.ROU資産はNVX−CoV 2373を開発する研究や開発活動に関係しているため,会社はROU資産を支出しているが,会社は将来的には代替用途がない。
会社は2022年から2021年までの間に、研究開発施設やオフィススペースに関する各種施設賃貸協定を締結し、延長した。当社は2020年内にメリーランド州ゲザスバーグQuince Orchard Road 700号にある物件について賃貸契約(“700 QO”)を締結した。レンタル期間は約170,000同社は製造、研究開発、オフィス用の空間を平方フィートとしようとしている。レンタル期間は15ROU資産で確認されていない賃貸借契約の年を延長する権利がある。このレンタル契約で規定されている年間基本レンタル料は#ドルです5.8将来の賃料引き上げの影響で、当社は建築物の運営コストを支払う義務があります。当社は2022年12月31日までの年度中に、当該物業界内のいくつかのフロアを直接使用する権利を取得し、当該フロアから実質的な利益を取得し、1つの純収益資産および関連賃貸責任#ドルを確認する73.2会計リースが発生したので、2,000,000,000ドルです。同社は2022年12月31日と2021年12月31日までに発生した49.0百万ドルとドル36.4ROU資産として確認するテナント改善コストに関する百万ドルはそれぞれである.会社は、所有者の出資#ドルを差し引くと、追加のテナント改善費用が発生すると予想している9.82023年までに,建物の残りを期待用途に必要な条件に到達させる。
2022年12月31日までの施設レンタル(700 QOレンタルを除く)の満期日は約三つ至れり尽くせり9年その中には、レンタル期間を延長するオプションが含まれている。同等の施設賃貸借には将来の賃貸料増加の支出が盛り込まれており、当社はビル運営コストを支払わなければならないと規定している。
2022年12月31日と2021年12月31日現在、賃貸に関する補足貸借対照表情報は以下のとおりである(単位:千、加重平均残存賃貸期間および割引率は含まれていない):
| | | | | | | | | | | | | | | | | | | | |
| | | | 十二月三十一日 |
| リース資産と負債 | | 分類する | | 2022 | | 2021 |
| 資産: | | | | | | |
| ROU資産、運営、純額 | | 使用権資産純額 | | $ | 36,384 | | $ | 40,123 |
| 純資産·財務·純資産 | | 使用権資産純額 | | 69,857 | | — |
| 非流動ROU資産総額 | | | | $ | 106,241 | | $ | 40,123 |
| | | | | | |
| 負債: | | | | | | |
| 賃貸負債の当期部分を経営する | | その他流動負債 | | $ | 16,867 | | $ | 30,983 |
| 融資リース負債の当期分 | | 融資リース負債の当期分 | | 27,196 | | 130,533 |
| 流動賃貸負債総額 | | | | $ | 44,063 | | $ | 161,516 |
| | | | | | |
| 賃貸負債の非流動部分を経営する | | 他の非流動負債 | | $ | 50,085 | | $ | 39,116 |
| 融資リース負債の非流動部分 | | 非流動融資リース負債 | | 31,238 | | — |
| 非流動賃貸負債総額 | | | | $ | 81,323 | | $ | 39,116 |
| | | | | | |
| 加重平均残余賃貸年限(年): | | | | | | |
| 賃貸借契約を経営する | | | | 4.6 | | 5.0 |
| 融資リース | | | | 8.3 | | 3.7 |
| | | | | | |
| 加重平均割引率: | | | | | | |
| 賃貸借契約を経営する | | | | 6.4% | | 6.0% |
| 融資リース | | | | 5.4% | | 5.2% |
2022年12月31日まで、2021年、2020年12月31日までの年度の経営賃貸と短期賃貸の賃貸費用は以下の通り(千計)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| レンタル費用を経営する | $ | 6,903 | | | $ | 37,027 | | | $ | 2,462 | |
| 短期レンタル費用 | 94,726 | | | 468,210 | | | 66,805 | |
| 可変レンタル費用 | 6,836 | | | 116,435 | | | 4,854 | |
| 融資リース費用: | | | | | |
| 支出されたROU資産 | $ | 7,759 | | | $ | 112,528 | | | $ | 242,009 | |
| 利子支出 | 1,472 | | | 7,241 | | | 3,097 | |
| 融資リース費用総額 | $ | 9,231 | | | $ | 119,769 | | | $ | 245,106 | |
2022年12月31日、2021年12月31日、2020年12月31日までの年度のレンタルに関する補足キャッシュフロー情報は以下の通り(千計)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 賃貸負債に含まれる金額を計量するために支払う現金: | | | | | |
| 経営的リース使用の経営的キャッシュフロー | $ | 190,158 | | | $ | 203,991 | | | $ | 63,634 | |
| 融資リースのための経営的キャッシュフロー | 1,472 | | | 7,241 | | | 3,097 | |
| 融資リースのための融資キャッシュフロー | 93,595 | | | 127,907 | | | 96,065 | |
| | | | | |
| 賃貸債務と引き換えに純収益資産を経営する | $ | 30,675 | | | $ | 66,682 | | | $ | 5,590 | |
| 融資リース義務と引き換えに得られた純資産 | 73,240 | | | 112,528 | | | 242,009 | |
2022年12月31日現在、賃貸負債の満期日は以下の通り(千計)
| | | | | |
| 年.年 | 金額 |
| 2023 | $ | 47,335 | |
| 2024 | 24,589 | |
| 2025 | 10,446 | |
| 2026 | 10,509 | |
| 2027 | 10,250 | |
| その後… | 46,562 | |
| 最低賃貸支払総額 | 149,691 | |
| 差し引く:推定利息 | (24,305) | |
| リース総負債 | $ | 125,386 | |
Note 11 – 長期債務
同社の長期債務には、以下の内容が含まれている(千計)
| | | | | | | | | | | |
| 十二月三十一日 |
| | 2022 | | 2021 |
| 現在の部分: | | | |
3.752023年に期限が切れた換算チケットの割合 | $ | 325,000 | | | $ | — | |
| 未償却債務発行コスト | (119) | | | — | |
| 当期支払可転換手形総額 | $ | 324,881 | | | $ | — | |
| 現在ではない部分: | | | |
5.002027年に期限切れの換算手形の割合 | $ | 175,250 | | | $ | — | |
3.752023年に期限が切れた換算チケットの割合 | — | | | 325,000 | |
| 未償却債務発行コスト | (8,784) | | | (1,542) | |
| 非流動転換支払手形総額 | $ | 166,466 | | | $ | 323,458 | |
変換可能チケットの支払いに関連する支払利息は、以下のものを含む(千で計算)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| | 2022 | | 2021 | | 2020 |
| 利息.利息 | $ | 12,542 | | | $ | 12,188 | | | $ | 12,188 | |
| 債務発行原価償却 | 1,497 | | | 1,424 | | | 1,424 | |
| 支払転換手形利子支出総額 | $ | 14,039 | | | $ | 13,612 | | | $ | 13,612 | |
2027年変換可能チケット
2022年12月、同社は$を発行した175.32027年12月15日に満期になる転換可能優先無担保手形(“2027年手形”)の元金総額は、以前に転換、償還、または買い戻しがない限り百万ドルとなる。2027年債券は、1933年証券法(改正)下の第144 A条規則及び当社が受託者であるノースカロライナ州ニューヨークメロン銀行信託会社と2022年12月20日に締結した契約(“2027年契約”)に基づいて、合資格機関の買い手に私募方式で発行される。2027年債の発行と同時に、会社はその普通株の公開発行を完了した(付記13参照)。同社は$を受け取りました166.4初期購入者費用と当社の発売費用を差し引くと、2027年債発行の純収益は百万ドルとなる。2027年発行の債券の現金利率は5.00毎年%、2023年6月15日から、毎年6月15日と12月15日に半年ごとに延滞しています。
以下の場合、2027年チケットは、2027年9月15日の直前の営業日の営業終了前の任意の時間に所有者によって選択的に変換することができる:(1)2023年3月31日までのカレンダー四半期以降に開始された任意のカレンダー四半期内(かつ、このカレンダー四半期期間のみ)、会社の普通株の最後の報告販売価格が少なくとも20以下の期間内の取引日(連続の有無にかかわらず)30前のカレンダー四半期の最終取引日が終了し、それを含む連続取引日がそれ以上である1302027年債の適用取引日ごとの交換株価の割合5人いつでも後の営業日の間10個連続取引日期間(“精算期間”)は,算定期間内の取引日ごとに,2027年債券元金あたり$1,000の取引価格(定義は2027年契約参照)を下回っている98(3)当社が償還日直前の予定取引日収市前の任意の時間に当該等2027年の手形を償還するが、償還された(又は償還されたとみなされる)2027年の手形に限定される。及び(4)2027年契約に記載された特定企業事項が発生した場合、当社は、当該取引日前の予定取引日の任意の時間に当該等の2027年の手形を償還することができる。2027年9月15日またはその後、満期日(2027年12月15日)前の営業日の取引が終了するまで、2027年債の保有者は、上記条件にかかわらず、その2027年債の全部または任意の部分を随時転換することができる。転換後、当社は当社の選択に基づき、2027年契約で規定された条項と条件に従って、現金、当社普通株式または現金と当社普通株の組み合わせを支払いまたは交付し、その転換義務を履行することができます。
2027年債券の為替レートは最初は1,000ドル当たり2027年債券元金は80.00株会社普通株を保有しており、初期転換価格$に相当する12.501株当たり普通株。2027年債の予備交換株価は25当社は2022年12月20日に終了するとともに普通株の公開発行価格の%を発行します(付記13参照)。2027年期チケットの換算率は、2027年期契約の条項によって場合によっては調整されます。また、2027年債券満期日前に発生したある企業イベントまたは当社が2027年債券について償還通知を出した後、当社は、その企業イベントについて2027年債券(またはその任意の部分)を転換するか、または関連償還期間(定義2027年契約参照)でその2027年債券(または償還とみなされる)を転換する保有者を選択するために、2027年債券の転換率を向上させる。
会社は2025年12月22日までに2027年に発行された債券を償還しないかもしれない。会社は2025年12月22日以降に、その選択権に基づいて、2027年債券の全部または一部を償還することができ、普通株の最終報告販売価格が少なくとも130当時発効した2027年債券の換算価格のパーセント20任意期間の取引日(連続するか否かにかかわらず)30連続取引日(当該期間の最終取引日を含む)は、自社が償還通知を出した日の直前の取引日まで、償還価格は100償還した2027年期債券元金のパーセンテージを、別途加算及び未償還の利息を、償還日までとする。もし会社が返済していないすべての2027年の手形を償還した場合、最低$50000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,2027年に発行された債券は債務超過基金は設けられていない。
もし会社に根本的な変化があれば(“2027年契約”で定義されているように)、所持者は当社に“2027年契約”の規定のある条件と例外を満たす場合、現金でその全部または一部の2027年手形を買い戻すことを要求することができ、基本的に買い戻し価格を変動させることは等しい100買い戻しされた債券元金の割合を、当算及び未払い利息とともに、基本的に変更された買い戻し日までとする。もし2027年の債券の保有者が完全な根本的な変化に基づいて転換すれば(2027年契約で述べたように)、彼らは換算率を高めることで完全な割増を得る資格があり、最高で1,000ドル当たり2027年の債券元金20.0000株に達する可能性がある(2027年契約で述べた他の調整の制限を受ける)。
2027年手形の発行を計算する際、当社はASC 815-40に規定されている範囲例外を決定した実体自己権益中の契約(“ASC 815-40”)2027年注に組み込まれたすべての変換機能に適していますが、そのうちの1つは除外されています。この残りの変換機能は会社の根本的な変化と関係があり、2022年12月31日に極めて小さな価値を持つことが決定された。
2027年債に関する初回購入者費用と会社発行コストを合わせて$8.81,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,これは1ドルです8.8何百万もの債務発行コストが削減されています5年制2027年に発行された債券の契約期間、実質金利は6.2%.
2023年変換可能チケット
2016年、同社は$を発行した3252023年2月1日に満期となった転換可能優先無担保手形(“2023年手形”)の元金総額は百万元である。2023年の債券は優先無担保債務であり、額面で発行される。会社は未返済の元金#ドルを返済した325百万ドル、期日ごとに計算しますが未払いの利息です。返済資金は2027年債の発行と普通株の同時発行、手元の現金から。
2023年債券は、当社と受託者が二零一六年一月二十九日に締結した契約(“2023年契約”)に基づいて発行されます。同社は$を受け取りました315.0引受料と発行費を差し引いた純収益は百万ドルです。2023年に発行された債券は現金利息があり、利率は3.75%は、毎年2月1日と8月1日に支払います。2023年に発行された手形は満期までに償還できず、会社の普通株式に変換することができます。当社は2019年に20株交換の逆株分割を行ったため、2023年契約第14.04(A)節により、2023年手形は最初に約に両替することができた2,385,8002023年債券元本1,000ドル当たり7.3411株会社普通株の初期転換率から会社普通株を計算する。これは初期変換価格が約$であることを意味する136.20会社の普通株の1株あたりは,約22.5%転換プレミアム、会社普通株の最近の報告に基づく販売価格$111.202016年1月25日1株当たり。また、2023年債の保有者は、2023年債の買い戻しを会社に要求する可能性がある
額面手形には,根本的に変化した応算と未払い利息を加える(2023年契約で述べたように).もし2023年の債券保有者が全体調整事件(2023年契約で述べたような)が完了したときに転換すれば、換算率を1,000ドル当たり2023年の手形元金最大8.9928株(2023年契約で述べた他の調整によって制限されなければならない)まで向上させることによって完全な割増を得る資格があるかもしれない。
2023年手形は米国会計基準470-20条に従って入金され、転換やその他のオプションを持つ債務(“ASC 470-20”)およびASC 815-40。ASC 815-40によれば、株式分類(または非分岐、埋め込み)の資格に適合するためには、ツール(または埋め込み特徴)は、(1)発行者の株式に同時にリンクしなければならない、(2)株式分類ガイドの要求に適合しなければならない。同社の分析によると、2023年の手形には確かにそれ自体の株式にリンクした埋め込み特徴が含まれていることが確定されているが、分岐の要求を満たしていないため、株式構成部分として単独で計算する必要はない。変換特徴を埋め込むことは派生会計の資本範囲の例外状況に符合し、しかも埋め込み変換オプションはASC 470-20項下の資本構成要素として単独で入金する必要がないため、転換可能債券を発行して得られた金は総合貸借対照表に負債として入金される。
2023年債の発行については、同社は$も支払っている38.5費用も含めて、ある金融機関と個人協議を結んだ完納取引(“完封催促取引”)がある。制限されたコール取引は2023年1月27日に満期になった。上限償還取引の条項に基づいて測定される会社普通株1株当たりの市場価格が上限償還取引の実行価格(最初は2023年債券の転換価格に対応)より高く、2023年債券換算率とほぼ同様の逆希釈調整を受けた場合、上限償還取引は通常、2023年債転換時の潜在的希薄化を減少させることが予想される。トップされたコール取引の上限価格は最初は$です194.601株当たりの割増価格は約75会社の普通株式の最近の報告に基づく販売価格$111.202016年1月25日に1株当たり利益を上げ、上限に基づいて取引条項を追加して若干の調整を行わなければならない。しかし、上限催促取引条項で測定した当社の普通株の1株当たりの市価が上限価格を超えると、2023年の債券転換時にはその市価が上限価格を超えるまで赤字が発生する。当社はASC 815-10に基づいて完封取引を評価した派生ツールとヘッジ-全体そして、それらを個別の取引入金として決定し、上限を設定するコールオプション取引を持分ツールに分類する。
その会社は約$を生み出した10.02016年の2023年手形の発行に関する債務発行コストは100万ユーロで、総合貸借対照表に2023年手形の減価を計上した。これは1ドルです10.0100万ドルの債務発行コストが償却され、それ以上であることが確認された7年制2023年手形の契約期間は直線に基づいており、これは実金利法に近似している。同社は$を生み出しています0.91,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000ドルの支出は上限コール取引に関連しており、これらの支出は追加実収資本の減少として記録されている。
Note 12 – 優先株
2020年6月に、当社はAシリーズ転換可能優先株引受協定を締結し、これにより、当社は私募での発行及び販売に同意しました438,885その新たに指定されたA系列転換可能優先株の償還可能株、額面$0.011株(“優先株”)は,買い取り価格は$である455.701株当たり、総収益は$200.0百万ドルです。2020年第4四半期に、発行されたすべての優先株が転換され、会社は発行した4,388,850普通株、額面$0.011株ずつ$に再分類します199.8優先株から追加の実収資本へ。同社は約$で有益な変換機能を確認した24.1優先株発行時に追加投入資本及び累積損失の百万元を記入し、優先株発行としていつでも所持者が償還及び両替を選択することができる。
Note 13 – 株主権益
2022年12月、当社は公募株を完成しました7,475,000普通株式の株式は、975,000引受業者に付与された追加株式の購入オプションをすべて行使した後に発行される普通株は、価格は$10.001株当たりの収益純額、発行コストを差し引く$4.9百万ドル、約百万ドル70百万ドルです。当社は2027年の債券発行と同時に完成して初の公開発売となりました(付記11参照)。
当社は2021年6月に市場発行販売協定(“2021年6月販売協定”)を締結し、最大$を発行·販売できるようにした500その普通株式の総収益は100万ユーロであり、当時存在していた市場別発行販売契約を終了した。2022年12月31日現在,2021年6月の販売契約での残存残高は約$である318百万ドルです。2022年12月31日、2021年、2020年12月31日までの年間で、会社は販売しました2.2百万人2.6百万ドルと32.4普通株式を別々に売却し,純収益は約#ドルである179百万、$565百万ドルと$877その各種at Market発行販売プロトコルにより,それぞれ1,000,000,000ドルである.
Note 14 – 株に基づく報酬
株式計画
改訂された2015年度株式インセンティブ計画(“2015計画”)が2015年6月に会社年度株主総会で採択された。2015年計画によると、株式奨励は、会社および任意の既存または未来の子会社の高級管理者、取締役、従業員、コンサルタント、コンサルタントに付与することができる。
2015年計画で最大の発行を許可14.82015年計画に基づいて付与された配当金は、増加を含む普通株式100万株を奨励する2.4当社の2022年年度株主総会では、2015年計画に基づいて発行を承認した株式は100万株。2015年の計画に基づいて発行されたこのようなすべての株は予約されている。2015年計画は2025年3月4日に満期になる。2022年12月31日までに3.82015年の計画によると、発行可能な株式数は100万株。
改訂及び改訂された2005年株式激励計画(“2005年計画”)は2015年2月に満期になり、この計画に基づいて新たな奨励を行うことはできないが、依然としてその条項に基づいて奨励を継続する。
2015年計画ライセンスおよび2005年計画は、奨励株式オプションを含む株式オプション、制限株式、SARS、およびRSUの付与を可能にする。また、2015年計画によると、非限定的な株、株式単位、業績奨励が付与される可能性がある。株式オプションとSARSは通常最長期限は10年、あるいは与えられたことがあるかもしれません100会社普通株は付与時の公平市場価値の%である。株式オプションの付与は通常以下の期限内に帰属する必要がある1つは至れり尽くせり4年.
会社の合併経営報告書における株式ベースの報酬費用は以下のように記録されている(千計)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 販売コスト | $ | 1,032 | | | $ | — | | | $ | — | |
| 研究開発 | 66,565 | | | 86,928 | | | 55,955 | |
| 販売、一般、管理 | 62,703 | | | 96,698 | | | 72,080 | |
| 株式に基づく報酬総支出 | $ | 130,300 | | | $ | 183,626 | | | $ | 128,035 | |
2022年12月31日現在、資本化して在庫に計上した株式報酬総額は$1.7百万ドルです。あったことがある違います。2021年12月31日現在、在庫の株式報酬を資本化して計上している。
2022年12月31日までに171未帰属株式オプション、SARS、RSU、ESPPに関する未確認報酬支出総額は100万ドルであった。この未確認の非現金補償費用は加重平均期間内に確認される予定です1.1販売コスト,研究開発コストおよび一般と行政費用の間に応じて分配される。この推定には、今後の期間中に行われる可能性のある他の株ベースの報酬の影響は含まれていない。
総内的価値とは、すべての株式オプションおよびSARS保有者が2022年12月31日に彼らの株式オプションおよびSARSを行使した場合、所有者が受信した総内的価値(会社がこの期間の最終取引日の終値と行権価格との差額に現金株式オプションとSARSの数を乗じたもの)である。この額は会社の普通株の終値によって変化する可能性がある。2022年12月31日まで,2021年12月31日と2020年12月31日までの年次の株式オプション,SARS演習とRSU帰属の内的価値の合計は$である21.4百万、$453.8百万ドルと$187.3それぞれ100万ドルです
株式オプションと株式付加価値権
以下は、2022年12月31日までの2015年計画と2005年計画下の株式オプションとSARS活動の概要である
| | | | | | | | | | | | | | | | | | | | | | | |
| | 2015年計画 | | 2005年計画 |
| | 株式オプション | | 重み付けの-
平均値
トレーニングをする
値段 | | 在庫品
オプション | | 重み付けの-
平均値
トレーニングをする
値段 |
| 2022年1月1日に返済されていません | 3,635,837 | | | $ | 42.60 | | | 68,225 | | | $ | 109.52 | |
| 授与する | 633,626 | | | $ | 65.32 | | | — | | | $ | — | |
| 鍛えられた | (134,222) | | | $ | 15.64 | | | (3,000) | | | $ | 31.10 | |
| キャンセルします | (81,951) | | | $ | 90.83 | | | (1,500) | | | $ | 121.00 | |
| 2022年12月31日に返済されていません | 4,053,290 | | | $ | 46.07 | | | 63,725 | | | $ | 112.94 | |
| 2022年12月31日に行使可能な株式 | 2,892,161 | | | $ | 39.58 | | | 63,725 | | | $ | 112.94 | |
2015計画に基づいて付与された株式オプションの公正価値は、付与された日または2015計画が会社の株主によって承認された日に推定され、2020および2019年に付与された特定の株式オプションに適用され、ブラック·スコアーズオプション定価モデルが採用され、以下のように仮定される
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| | 2022 | | 2021 | | 2020 |
株式加重平均ブラック·スコアーズ公正価値
オプションとSARSが承認された | $55.32 | | $158.02 | | $80.48 |
| 無リスク金利 | 1.4%-4.3% | | 0.5%-1.3% | | 0.2%-1.5% |
| 配当率 | —% | | —% | | —% |
| 波動率 | 120.5%-140.1% | | 124.7%-142.0% | | 116.0%-152.2% |
| 予想期限(年単位) | 4.0-6.3 | | 4.1-6.1 | | 3.9-7.6 |
2022年12月31日現在,2015年計画と2005年計画によると未償還株式オプションとSARSの総内的価値と加重平均残存契約期間は約$である3百万ドルと7.1それぞれ数年です。2022年12月31日現在,2015年計画と2005年計画により行使可能な株式オプションとSARSの総内的価値と加重平均残存契約期間は約$である2百万ドルと6.6それぞれ数年です。
限定株単位
以下に2022年12月31日までの年次RSU活動の概要を示す
| | | | | | | | | | | |
| | 量
株 | | 1株当たり
重み付けの-
平均値
公正価値 |
| 2022年1月1日現在の未償還および未帰属資産 | 819,828 | | | $ | 116.70 | |
| 承認された制限株式単位 | 1,882,987 | | | $ | 48.51 | |
| 帰属制限株式単位 | (505,009) | | | $ | 89.77 | |
| 没収された制限株式単位 | (163,232) | | | $ | 99.58 | |
| 2022年12月31日現在の未返済と未帰属 | 2,034,574 | | | $ | 61.65 | |
従業員株購入計画
ESPPは2013年6月に会社年度株主総会で承認された。ESPPの現在の許可の総規模は1.1普通株100万株を購入し、株式総額は引き続き増加します5通過後の各記念日の割合は、最高で2%以下です1.65百万株です。ESPPは従業員が購入日ごとに賃金減額で会社の普通株を購入することを許可し、最高控除額は15彼らの報酬の%は85株式購入時の市場価格またはオプション期間開始日(遅い場合は、オプション期間従業員が初めて参加する資格がある日)の市場価格のうち低い者の割合。2022年12月31日には0.7ESPPにより発行可能な百万株。
ESPPは財務報告書の目的に対する補償と考えられている。したがって、ESPP株の公正価値は、付与された日にブラック·スコルスオプション定価モデルを使用して、以下の仮定の下で推定される
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| | 2022 | | 2021 | | 2020 |
1株当たりの収益のブラック·スコアーズ公許容価値範囲
付与済み株 | $23.59-$79.74 | | $83.47-$238.85 | | $2.57-$92.67 |
| 無リスク金利 | 0.6%-3.3% | | 0.1%-0.2% | | 0.2%-2.6% |
| 配当率 | —% | | —% | | —% |
| 波動率 | 103.0%-142.9% | | 114.9%-159.4% | | 66.6%-189.7% |
| 予想期限(年単位) | 0.5-2.0 | | 0.5-2.0 | | 0.5-2.0 |
Note 15 – 従業員福祉
会社は固定供給401(K)退職計画を維持し、この計画によると、従業員は最大で供給を選択することができる100繰延納税に基づいて、1986年に改正された“国内税法”で許可された最高額に基づいて、その報酬のパーセンテージで計算される。会社がそれにマッチする100最初の割合は3参加者の延期率や50次の枚:%2参加者の延期の割合は最大で4%企業一致です。401(K)計画に対する会社の相応の貢献は直ちに発効する。その401(K)計画によると、同社は#ドルの費用を記録した6.0百万、$3.4百万ドルと$0.92022年、2021年、2020年はそれぞれ100万人。
現地税法や労働法によると、同社の海外子会社には年金計画があり、その計画に貢献する義務がある。この計画に関連した寄付金と他の費用は#ドルだ2.4百万、$1.7百万ドルと$1.02022年、2021年、2020年はそれぞれ100万人。
Note 16 – その他の財務情報
前払い費用と他の流動資産
12月31日現在、前払い料金および他の流動資産には、以下の内容が含まれている(単位:千)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 前払い費用 | $ | 160,773 | | | $ | 120,029 | |
| その他流動資産 | 76,374 | | | 44,619 | |
| 前払い費用と他の流動資産 | $ | 237,147 | | | $ | 164,648 | |
財産と設備、純額
12月31日現在、財産·設備は以下の部分からなる(千計)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 土地と建物 | $ | 101,342 | | | $ | 83,534 | |
| 機械と設備 | 134,809 | | | 119,998 | |
| 賃借権改善 | 18,895 | | | 10,282 | |
| コンピュータハードウェア | 4,927 | | | 2,612 | |
| 建設中の工事 | 81,566 | | | 35,114 | |
| 341,539 | | | 251,540 | |
| 減算:減価償却累計 | (47,292) | | | (25,799) | |
| 財産と設備、純額 | $ | 294,247 | | | $ | 225,741 | |
2022年12月31日と2021年12月31日までの約170.0百万ドルとドル164.0業務で使用されている純資産のうち、それぞれ100万人がチェコ共和国に位置している。減価償却費用は約$29.1百万、$12.5百万ドルと$4.3それぞれ2022年12月31日,2021年12月31日,2020年12月31日である。
費用を計算する
12月31日現在、料金には以下の内容が含まれている(千計)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 従業員福祉と補償 | $ | 52,569 | | | $ | 38,419 | |
| 研究と開発に応じたプロジェクト | 468,214 | | | 577,100 | |
| その他の課税費用 | 70,375 | | | 58,212 | |
| 費用を計算する | $ | 591,158 | | | $ | 673,731 | |
その他流動負債
12月31日現在、他の流動負債には以下の項目(千)が含まれている
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| お客様に返金します | $ | 210,362 | | | $ | — | |
| Gaviに関する他の流動負債(付記3および付記18参照) | 697,384 | | | — | |
| その他流動負債 | 22,309 | | | 36,061 | |
| その他流動負債総額 | $ | 930,055 | | | $ | 36,061 | |
Note 17 – 所得税
12月31日までの年度、会社の所得税引当(収益)控除前の営業収入(赤字)は以下の通り(単位:千)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 国内では | $ | (712,183) | | | $ | (1,633,016) | | | $ | (455,253) | |
| 外国.外国 | 58,536 | | | (81,520) | | | 36,994 | |
| 所得税費用前損失 | $ | (653,647) | | | $ | (1,714,536) | | | $ | (418,259) | |
現行所得税規定(福祉)の重要な構成要素は以下のとおりである(千計)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 国内では | $ | 1,300 | | | $ | — | | | $ | — | |
| 州と地方 | 503 | | | — | | | — | |
| 外国.外国 | 2,489 | | | 29,215 | | | — | |
| 当期所得税支出総額 | $ | 4,292 | | | $ | 29,215 | | | $ | — | |
2022年、2021年、2020年12月31日までの年間で、会社は確認しました4.3百万、$29.2百万ドルと違います。連邦、州、そして外国の当期所得税支出。外国所得税支出は主に特許使用料の外国源泉徴収税と関連がある。当社は上記年度中に全額推定支出による繰延所得税の支出を確認していません。
所得税準備金と米国連邦法定税率を会社の有効税率に適用することで計算された金額の入金は以下のとおりである
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 法定連邦税率 | 21 | % | | 21 | % | | 21 | % |
| 連邦福祉を差し引いた州所得税 | 2 | % | | 6 | % | | 3 | % |
| 研究開発やその他の税金控除 | 1 | % | | 1 | % | | — | % |
差し引かれない費用 | (1) | % | | (2) | % | | (4) | % |
| 非現金株報酬 | (1) | % | | 4 | % | | 7 | % |
| アメリカの海外事業への課税 | (3) | % | | — | % | | — | % |
| 渉外税費支出 | — | % | | (1) | % | | — | % |
| 他にも | 2 | % | | (1) | % | | (1) | % |
| 税率の変化 | (20) | % | | — | % | | 5 | % |
| 評価免除額を変更する | (2) | % | | (30) | % | | (31) | % |
| 所得税支給 | (1) | % | | (2) | % | | — | % |
2022年12月31日現在、同社の連邦、州、外国の純運営損失は2.0億ドルだ0.9億ドルと29.1それぞれの管轄区域の将来の課税所得額の1000万ドルにそれぞれ適用できる。連邦純営業損失は1ドルです2.0年間課税所得額の80%に制限されているにもかかわらず、10億ドルは無期限に繰り越すことができる。州政府の純営業損失はドルです0.42028年から2042年までの間に異なる満期日がある。残りの州の純営業損失は1ドルだった0.510億ドルは無期限に繰り越すことができる。約$15.12024年から2027年にかけて、100万ドルの海外純運営損失が満期になり始める。残りの$14.0百万ドルの海外純営業損失は無期限に繰り越すことができます。同社はまた#ドルの研究税免除を受けている46.02030年から2052年までに100万ドルが満期になります会社の潜在的な所有権変更により、国内純営業損失の繰越と税収控除の使用が年間制限される可能性がある。2022年12月31日現在、会社はこのような制限(あれば)がこれらの国内純営業損失や税収控除の使用に影響を与えないと予想している。
同社はアメリカ連邦司法管区と各州およびスウェーデンやチェコ共和国などの外国司法管轄区で所得税申告書を提出しています。同社は米国連邦と州で純営業損失と信用繰越があり、2002年から2022年まで審査を受けなければならない。スウェーデンの申告書は2016年から2022年まで審査を受け、チェコ共和国の申告書は2019年から2022年まで審査を受ける。
12月31日現在、会社の繰延税金資産と負債の重要な構成要素は以下の通り(千計)
| | | | | | | | | | | |
| 十二月三十一日 |
| 2022 | | 2021 |
| 繰延税金資産: | | | |
| 連邦と州の営業純損失が繰り越す | $ | 479,134 | | | $ | 845,731 | |
| 海外純営業損失が繰り越す | 5,752 | | | 25,625 | |
| 税収控除を検討する | 45,560 | | | 44,618 | |
| リース責任 | 27,625 | | | 52,852 | |
| 収入を繰り越す | 195,049 | | | 20,262 | |
| 在庫備蓄 | 213,076 | | | — | |
| 非現金株報酬 | 27,599 | | | 24,698 | |
| 元引き利息 | — | | | 1,729 | |
| 資本化研究コスト | 49,309 | | | — | |
| 他にも | 13,695 | | | 11,801 | |
| 繰延税項目総資産 | 1,056,799 | | | 1,027,316 | |
| 推定免税額 | (1,020,123) | | | (1,015,333) | |
| 繰延税金資産総額 | $ | 36,676 | | | $ | 11,983 | |
| 繰延税金負債: | | | |
| ROU資産 | (23,330) | | | (10,071) | |
| 固定資産 | (11,587) | | | — | |
| 無形資産 | (1,055) | | | (1,034) | |
| 他にも | (704) | | | (878) | |
| 繰延税金負債総額 | $ | (36,676) | | | $ | (11,983) | |
| 繰延税項目純資産(負債) | $ | — | | | $ | — | |
同社はその繰延税金項目資産の現金化に影響を与えるプラスと負の証拠を評価し、設立以来毎年の重大な損失歴史を含み、そしてアメリカ公認会計原則に基づいて、全額繰延税金項目資産純額を予約した。同社は、2022年12月31日と2021年12月31日現在、繰延税項目の純資産が実現する可能性は低いと結論している。推定免税額は#ドル増加した4.8百万ドルとドル510.52022年12月31日までと2021年12月31日までの年度はそれぞれ100万ドル。
当社は定期的にその繰延所得税資産の評価を再評価し、プラスと負の証拠をトレードオフして回収可能性を評価する。2022年、当社は評価計上を再評価し、2022年12月31日までの3年度の累積損失と、同社の財務諸表発表日から1年間の継続経営能力に対する重大な疑い、NVX-CoV 2373の監督管理許可と商業販売を含む積極的な証拠を考慮した。マイナスとプラスの証拠を評価した後、会社は2022年12月31日まで、会社はその純営業損失、信用とその他の繰延税金資産の評価を維持すべきだと結論した。推定手当の支給及び支給の正確な時間と額は依然として会社の利益レベル、収入の増加、臨床プロジェクトの進展及び未来の収益力に対する期待などの要素の影響を受ける。会社が推定手当に制限されている繰延税項純資産残高総額は#ドル1.110億ドル1.0それぞれ2022年と2021年12月31日までの10億ドル。
当社が所得税状況の影響を確認した場合、技術的な利点により、所得税状況は審査を経て維持される可能性が高い2022年12月31日、2021年12月31日、2020年12月31日までの年度未確認税収割引の期間初めと期末金額を以下のように照合する(千単位)
| | | | | | | | | | | | | | | | | |
| 十二月三十一日までの年度 |
| 2022 | | 2021 | | 2020 |
| 1月1日に確認されなかった税収割引残高 | $ | 11,154 | | | $ | 8,766 | | | $ | — | |
| 本年度は納税額を新設する | 1,260 | | | 4,158 | | | 1,413 | |
| 数年前の納税状況を増やす | 807 | | | — | | | 7,353 | |
| 前年の減税状況 | (8,027) | | | (1,770) | | | — | |
| 数年前の納税状況を決算する | — | | | — | | | — | |
| 12月31日までに確認されていない税収割引残高 | $ | 5,194 | | | $ | 11,154 | | | $ | 8,766 | |
当社の政策は、所得税支出において所得税事項に関する利息と罰金を確認することです。会社は2022年12月31日と2021年12月31日まで、所得税事項に関する利息又は罰金の課税項目を有していない。確認すれば,実際の税率に影響を与える可能性のある未確認税収割引総額は#ドルである5.2百万ドルとドル11.2それぞれ2022年12月31日と2021年12月31日まで。しかし,当社は2022年と2021年12月31日に全額推定準備を維持しており,いずれの未確認税収割引の確認は推定準備の変化によって相殺されるため,損益表に影響を与えない。当社は2022年12月31日現在、今後12カ月間に記録された未確認税収割引準備金残高に大きな変化はないと予想している。未確認の税収割引は、財務諸表において、すべての期間繰延税金資産の減価として列記されている。
Note 18 – 約束や事項があります
法律事務
2021年11月12日、Sosinathan Sinnathuraiは米メリーランド州地方裁判所(以下、メリーランド州裁判所)に証券と言われる集団訴訟を提起し、会社とある上級管理職メンバーを起訴し、タイトルは以下の通りであるSosinathan SinnathuraiはNovavax,Inc.らを訴えた。第8号:21-cv-02910-tdc(“修行行動”)。2022年1月26日、メリーランド州裁判所はSinnathurai訴訟の共同首席原告としてDavid·張、ヌグハリー·バルムクント·ナンデクマール、ジェフリー·ガバートを指定する命令を出した。共同引頭原告は2022年3月11日に改訂された総合起訴書を提出し、被告が会社の商業規模でNVX-CoV 2373を製造し、NVX-CoV 2373の監督管理許可を得た能力についていくつかの虚偽と誤ったと言われる陳述を行ったことを告発した。改正された起訴状は、いわゆるカテゴリを、2021年2月24日から2021年10月19日までの間に同社証券を購入する株主と定義する。2022年4月25日、被告は合併後の改正起訴状の却下を求める動議を提出した。2022年12月12日、メリーランド州裁判所は被告の却下動議の一部同意と一部拒否の裁決を発表した。メリーランド州裁判所はすべての二つ個別被告と特定の公開陳述に基づくクレームは、合併改訂された起訴状で疑問視されている。メリーランド州裁判所は残りのクレームと被告を却下する動議を却下し、会社と他の残りの被告に14日間それは.2022年12月27日、会社は答弁と肯定的な抗弁を提出した。
Sinnathurai訴訟を起こした後、7件の派生商品訴訟を起こした:(I)ロバート·E·マイヤ訴スタンレー·C·エルクらは番号8:21-cv-02996-TDC(“マイヤー行動”)、(Ii)レイ成はスタンレー·C·エルクらの事件を訴えた。第8号:21-cv-03248-貿易局(“揚行動”)、(Iii)ウィリアム·コスターらですスタンレー·C·エククらを訴えた。番号8:22-cv-00024-tdc(“コスター行動”)、(Iv)エイミー·スナイダーはスタンレー·C·エルク事件を訴えた彼らは番号8:22-cv-01415-tdc(“スナイダー行動”),(V)チャールズ·R·ブラックビンらですスタンレー·C·エククらを訴えた。番号1:22-cv-01417-tdc(“ブラック本行動”)、(Vi)Diego J.MesaはStanley C.Erckらの事件を訴えた(“メイサ行動”)と(Vii)ショーン·アコスタはスタンレー·C·エルクらの事件を訴えました(“アコスタ行動”)マイヤー、ヤン、スナイダー、ブラックベンの訴訟はメリーランド州裁判所で提起された。コースト訴訟はメリーランド州モンゴメリー県巡回裁判所で提起され、その後間もなくメリーランド州裁判所に移された。メサとアコスタの訴訟はデラウェア州衡平裁判所(“デラウェア州裁判所”)で提起された。デリバティブ訴訟は、会社の取締役会メンバーとある高級管理者を被告としている。当社は名義上の被告とみなされています。原告はSinnathurai訴訟とほぼ同じいわゆる事実と状況に基づいて派生クレームを提出した。全体的に言えば、派生商品の苦情は受託責任、インサイダー販売、不当な利益、連邦証券法違反、乱用制御、浪費と管理の不備を主張する。原告は宣告性と禁令救済、金銭損害賠償と弁護士費の判決を求めた。
2022年2月7日、メリーランド州裁判所は合併MeyerとYung訴訟の命令(“第一次合併派生訴訟”)を発表した。最初の合併デリバティブ訴訟の原告は2022年4月25日に合併デリバティブ訴訟を起こした。2022年5月10日、メリーランド州裁判所は、Sinnathurai訴訟答弁書を早期に却下または提出する前に、すべての訴訟手続きおよび最終期限を一時停止するという各当事者の請求を承認する命令を発表した。2022年6月10日、スナイダーとブラックベンが提訴した。2022年10月5日、メリーランド州裁判所は、第1の合併派生訴訟およびSnyderとBlackburn訴訟における原告の請求を承認し、3つの訴訟の合併を要求し、共同牽引原告、連合牽引弁護士、連絡弁護士(“第2合併派生訴訟”)を任命する命令を発表した。2件目の合併デリバティブ訴訟の共同けん引原告は2022年11月21日に改訂された合併起訴状を提出した。2023年2月10日、被告は第2次合併派生訴訟の却下を求める動議を提出した。
2022年7月21日、メリーランド州裁判所はコースト行動を州裁判所に返送する覚書意見と命令を発表した。2022年12月6日、コースト訴訟当事者は、原告が2022年12月22日に修正された起訴状を提出することが予想される所定のスケジュールを提出し、(I)当事者は所定のキルスト訴訟を延期するか、または(Ii)被告は2023年1月23日までに事件棚上げの動議を提出する予定である。原告は2022年12月30日に修正された起訴状を提出した。2023年1月23日、被告はカスター事件の延期を求める動議を提出した。2023年2月22日、Kirst訴訟の当事者は、第2次合併派生訴訟で被告が撤回した動議が解決されるのを待つKirst訴訟の規定の承認を裁判所に要求する文書を提出した。2023年2月24日、裁判所は、第2次総合派生訴訟で最終判決が下されるまで、コースト訴訟を見送る命令を発表した。裁判所がKirst訴訟に加入したより広範な執行猶予が各当事者の規定と一致するように修正される可能性があるかどうかについては、当社はいかなる立場も持っていない。
2022年8月30日、“メサ行動”が立案された。2022年10月3日、デラウェア州裁判所は、Sinnathurai訴訟の却下またはSinnathurai訴訟における執行訴えへの回答を却下する前に、メイサ訴訟におけるすべての手続きおよび期限を一時停止する命令を発表した。2023年1月9日、裁判所は、被告が提出しようとしている棚上げ動議についてプレゼンテーションスケジュールを作成するという各当事者の請求を承認する命令を発表した。この命令によると、被告は2023年1月18日に執行を猶予する動議を提出した。原告は2023年2月8日に反対意見を出した。被告は2023年2月22日に答弁書を提出した。2023年2月28日、裁判所は被告が執行を猶予した動議を承認した。
2022年12月7日、アコスタ行動が提出された。2023年2月6日、被告はアコスタ訴訟における起訴状と召喚状の送達を受けた。このクレームと上記で議論されたクレームの財政的影響は計り知れない。
2021年2月26日、トーマス·グルビンスキーという会社の株主が、トーマス·ゴルビンスキー氏がリチャード·H·ダグラスらを訴えたと題する取締役会メンバーと上級管理職メンバーに対するデリバティブ訴訟をデラウェア州裁判所に提出し、番号2021-0172-JRS。当社は名義上の被告とみなされています。ゴルビンスキー氏は、取締役会のメンバーや上級管理職のメンバーが会社の未開示に関する積極的な重大な情報を持っていると言われていることから、2020年4月と2020年6月に行われた株式奨励について疑問を提起した。起訴状は受託責任、浪費、不当な利益違反に対するクレームを主張する。原告はその会社の損害賠償金の判決、2つの判決の撤回、または返還を要求する命令、および訴訟に関連する弁護士費の判決を要求した。2021年5月10日,被告は行動を起こし,すべて訴えを却下した。2021年6月17日、会社の株主投票で2020年4月の奨励と2020年6月の奨励が承認された。承認提案の詳細は、会社が2021年5月3日に提出した最終依頼書に掲載されています。投票結果は、同社が2021年6月24日に提出した8-Kフォームの現在の報告書に開示されている。その後,原告は,2021年6月17日の投票結果により,原告は訴訟や2020年4月と2020年6月の裁決によるいかなるクレームも継続しようとしなくなったと規定している。2021年8月23日、原告は弁護士費と支出#ドルの賠償を求める動議を提出した1.5100万ドル、被告はこれに異議を唱えた。2022年10月18日、デラウェア州裁判所は原告の全費用申請を却下した。デラウェア州裁判所以前の命令により,原告の費用申請を拒否した後,事件は自動的に却下された。2022年11月14日、ゴルビンスキーはデラウェア州最高裁判所に控訴通知書を提出した。原告/控訴者は2022年12月30日に開廷控訴要約を提出した。会社は2023年1月30日に答弁状を提出し、控訴人は2023年2月14日に答弁状を提出した
PAR滅菌製品有限責任会社(“PAR”)は2022年3月29日、当社が2020年9月にPARと締結したNVX-CoV 2373に充填加工製造サービスを提供する製造·サービス協定(“PAR MSA”)のいくつかの条項に違反したとして、米国仲裁協会に当社に対する仲裁請求を提出した。この問題はまだ初期段階にあるので、潜在的な損失は合理的に見積もることができない。双方は証拠提示を行っており、仲裁は2023年7月に行われる予定だ。当社はPAR MSA違反は発生していないと主張し、積極的に弁護しようとしているが、もし
この事項が会社に不利であれば、会社の財務状況、経営業績またはキャッシュフローに重大な影響を与える可能性がある。
2022年11月18日、会社はGaviに書面通知を出し、Gavi APAの中止を要求した。原因はGaviが促進できなかったからである350Gavi APAの要求に応じて,同社は100万剤NVX−CoV 2373を提供した。同社は2022年11月18日現在、Gavi APAからの注文のみを受けている2百万剤です。Gaviは2022年12月2日、Gaviがこの合意を否定したため、Gavi APAを深刻に違反したと主張するGavi APAの中止を主張する書面通知を発表した。GAVIはまた、Gavi APAが終了したと主張することに基づいて、Covax融資機構に参加する買い手の拘束力のある注文によってクレジット購入価格をクレジットする任意の金額を差し引く権利があると主張している。2022年12月31日現在、残りのGavi前金金額は$697.4残りのプリペイド金額の返金に関するGaviとの紛争が解決される前に、600万ユーロが繰延収入から総合貸借対照表内の他の流動負債に再分類された。2023年1月24日、ガヴィは上記の主張に基づいて国際仲裁裁判所に仲裁請求を提出した。同社の回答締め切りは2023年3月2日。仲裁自体は不確定であり、会社はGaviから受信した残りの前払い金額を保留する権利があると考えているが、Gaviから残りの前金金額の全部または一部を返金することを要求する可能性もある。
同社は通常の業務過程で生じる様々な法的手続きにも関与している。これらの法的訴訟の結果は本質的に予測が困難であるにもかかわらず,経営陣はこれらの法的訴訟の解決が会社の財務状況,経営業績,キャッシュフローに大きな悪影響を与えないと予想している。
購入承諾
同社は正常業務過程において,生産能力を会社に提供するCMOとCDMOおよび臨床前研究,臨床試験と他の商品やサービスを提供するサプライヤーと協定を締結した。その中のいくつかの手配はリース会計の範囲に属する(付記10参照)。いくつかの合意は停止権を規定しているが、停止費を払わなければならない。このような合意によると、同社はサプライヤーに支払う義務があり、主に回収できないと予想される費用を補償する。このような債務の正確な金額は終了の時間と協定に関する条項に依存し、合理的に見積もることができない。2022年12月31日現在、これらの合意の多くは積極的な持続的な計画であり、会社は将来的にこれらの手配から価値を得ると予想している。当社は契約終了の義務に関する費用を確認し、このような費用は合理的に評価しなければならない。当社には合理的に評価できない債務はありません。2022年12月31日までに会社は違います。残り期間1年以上の撤回できない購入約束。
Note 19 – 後続事件
2023年1月5日、会社取締役会は、ジョン·C·ジェイコブスを総裁兼最高経営責任者兼取締役会メンバーに任命することを承認し、2023年1月23日から発効した。ジェイコブスさんはStanley C.Erckの後任として、2023年1月5日に取締役会に通知を出し、総裁、最高経営責任者、取締役会のメンバーに退任することを決定し、いずれも2023年1月23日に発効すると表明した。
2023年1月24日、GaviはGavi APAのクレームに基づいて国際仲裁裁判所に仲裁請求を提出した。仲裁自体は不確定であり、会社はGaviから受信した残りの前金金額を保持する権利があると考えているが、残りの前金金額の全部または一部をGaviから返金する必要がある場合がある(付記3および付記18参照)。
2023年1月31日、会社は未返済の元金金額$325.02023年2月1日に満期となった2023年債の1,000,000ポンドが管理されているが,2023年債を管理する契約書はその後,その条項に従って償還·解除された。当社の関連する“最上位取引”は2023年1月27日に満期になりました。