
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表
(マーク1)
1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで
あるいは…。
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
依頼書類番号:
(登録者の正確な氏名はその定款に記載) |
(明またはその他の司法管轄権 | (税務署の雇用主 | |
会社や組織) | 識別コード) |
(主な行政事務室住所) | (郵便番号) |
(登録者の電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
授業ごとのタイトル: |
| 取引記号 |
| 登録された各取引所の名称 |
|
| ♪the the the | ||
|
| ♪the the the |
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。はい。☐
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい。☐
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−Tルール405に従って提出されなければならないと規定されている各対話データファイルを電子的に提出したかどうかを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバ | ☐ | ファイルマネージャを加速する | ☐ |
☒ | 規模の小さい報告会社 | ||
|
| 新興成長型会社 |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われる
証券が同法第12(B)条に基づいて登録されている場合は,登録者の財務諸表が以前に発表された報告書に対する誤り訂正を反映しているか否かを示すチェックマークを適用する
再選択フラグは、これらのエラーのより真ん中に、登録者の任意の実行幹事に対して、関連する回復期間中に受信された報酬ベースの補償に従って回復分析を行う必要があるかどうかを示す
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、そうです
ナスダック資本市場普通株株2022年6月30日の終値によると、登録者の非関連会社が保有する投票権と無投票権普通株の総時価は約1ドルである
2023年2月17日現在、登録者普通株の流通株数は、1株当たり額面0.0001ドル、
引用で編入された書類
ない。
DERMATA治療会社
(DERMATA Treateutics,LLC)
表格10-Kの年報
2022年12月31日までの財政年度
カタログ
|
|
| ページ |
|
第1部 |
| 4 | ||
第1項。 | 業務.業務 |
| 4 |
|
第1 A項。 | リスク要因 |
| 31 |
|
項目1 B。 | 未解決従業員意見 |
| 80 |
|
第二項です。 | 属性 |
| 80 |
|
第三項です。 | 法律訴訟 |
| 80 |
|
第四項です。 | 炭鉱安全情報開示 |
| 80 |
|
|
|
|
|
|
第II部 |
| 81 | ||
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 |
| 81 |
|
第六項です。 | [保留されている] |
| 81 |
|
第七項。 | 経営陣の財務状況と経営成果の検討と分析 |
| 82 |
|
第七A項。 | 市場リスクの定量的·定性的開示について |
| 92 |
|
第八項です。 | 財務諸表と補足データ |
| 92 |
|
第九項です。 | 会計と財務情報開示の変更と相違 |
| 93 |
|
第9条。 | 制御とプログラム |
| 93 |
|
プロジェクト9 B。 | その他の情報 |
| 94 |
|
プロジェクト9 Cです。 | 検査妨害の外国司法管轄権を開示する |
| 94 |
|
|
|
|
|
|
第三部 |
| 95 | ||
第10項。 | 役員·幹部と会社の管理 |
| 95 |
|
第十一項。 | 役員報酬 |
| 100 |
|
第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 |
| 106 |
|
十三項。 | 特定の関係や関連取引、取締役の独立性 |
| 109 |
|
14項です。 | チーフ会計士費用とサービス |
| 110 |
|
|
|
|
|
|
第IV部 |
| 111 | ||
第十五項。 | 展示品と財務諸表の付表 |
| 111 |
|
第十六項。 | 表格10-Kの概要 |
| 114 |
|
サイン |
| 115 | ||
| 2 |
| カタログ表 |
前向き陳述に関する警告説明
この10-K表年次報告書には、1995年の“個人証券訴訟改革法”(改正後の1933年“証券法”第27 A節)と“1934年証券取引法”(改正証券取引法第21 E節)の安全港条項に基づく前向きな陳述が含まれている。展望性表現は私たちの信念、計画、目標、目標、期待、予想、仮説、推定、意図と未来表現に関する表現を含み、既知と未知のリスク、不確定性とその他の要素に関連し、これらのリスク、不確定性とその他の要素は私たちの制御範囲を超える可能性があり、そして私たちの実際の結果、業績或いは成果はこのような前向き表現と明示的或いは暗示的な未来の結果、業績或いは成果とは大きく異なる可能性がある。歴史的事実以外のすべての陳述は前向きな陳述だ。これらの前向き陳述は、“可能”、“予想”、“仮定”、“すべき”、“表明”、“できる”、“信じる”、“考慮”、“予想”、“求める”、“推定”、“継続”、“計画”、“指向”、“プロジェクト”、“予測”、“可能”、“意図”などの言葉を使用することによって識別することができる。“目標”“潜在的”や他の類似した言葉や表現の未来。
多くの重要な要素は実際の結果が私たちが作った任意の展望性声明に表現された結果と大きく異なる可能性がある。これらの要素にはこれらに限定されない
| · | 私たちには運営の歴史が欠けています |
|
|
|
| · | 私たちは予測可能な未来に重大な経営損失が発生し、大量の追加資本が必要になると予想している |
|
|
|
| · | 私たちの現在と未来の資本需要は、候補製品の開発と商業化の努力と、私たちの資本需要を満たす能力を支援しています |
|
|
|
| · | 私たちはまだ臨床前や臨床開発の初期段階にある候補製品に依存しています |
|
|
|
| · | 私たちは薬を作るのに必要な十分な量の原材料を得ることができます |
|
|
|
| · | 私たちまたは第三者メーカーは、臨床前および臨床試験に必要な候補製品cGMPの数を生産する能力と、その後、私たちの候補製品を商業的に量産する能力に基づいています |
|
|
|
| · | 私たちは候補製品のために必要な臨床試験を完成させ、FDAまたは異なる司法管轄区域の他の規制機関の許可を得ることができる |
|
|
|
| · | 私たちは販売とマーケティング組織が不足しています。もし私たちが規制部門の承認を得たら、私たちは私たちの候補製品を商業化することができます |
|
|
|
| · | 私たちは第三者が私たちの候補製品を生産することに依存しています |
|
|
|
| · | 私たちは第三者CROに依存して臨床試験を行い |
|
|
|
| · | 私たちの知的財産権の有効性を維持または保護する能力は |
|
|
|
| · | 私たちは内部で新しい発明と知的財産権の能力を開発しています |
|
|
|
| · | 現在の法律の解釈と未来の法律の段落 |
|
|
|
| · | 投資家はビジネスモデルを受け入れてくれます |
|
|
|
| · | 私たちの費用と資本需要の推定の正確さ |
|
|
|
| · | 私たちは組織と業務成長の能力を十分に支持しています |
|
|
|
| · | 新冠肺炎の持続的伝播とそれによる全世界の大流行及び著者らの臨床前研究と臨床研究への影響。 |
以上は,本稿に含まれる前向き表現がカバーする可能性のある事項の詳細なリストではなく,我々が直面しているリスク要因も列挙されておらず,これらのリスク要因は,我々の実際の結果がこれらの前向き表現で予想される結果と異なる可能性がある.当社の業務および財務パフォーマンスに悪影響を及ぼす可能性のある追加リスクについては、“第I項-第1 A項-リスク要因”を参照されたい。
すべての展望的な陳述はこの警告通知によって明確に制限されている。いかなる前向きな陳述にも過度に依存しないように注意し、これらの陳述は、本報告書までの日付または引用によって本報告書に組み込まれた文書の日付のみを示す。私たちは新しい情報、未来の事件、または他の理由でも、いかなる前向きな陳述も更新、修正、または修正する義務はありません。私たちは何の義務も負わないことを明確に示します。私たちは私たちの期待、信念、そして予測を誠実に表現し、それらが合理的な基礎を持っていると信じている。しかし、私たちは私たちの期待、信念、または計画が達成されるか、達成されるか、または達成されることを保証することはできません。
| 3 |
| カタログ表 |
第1部
プロジェクト1.ビジネス
別の説明または文脈で別の説明がない限り、本報告書で言及されているすべての“デマタ”、“会社”、“私たち”、“私たち”または“私たち”は、デマタ治療会社およびその子会社を意味する。
概要
著者らは臨床段階の医療皮膚病会社であり、識別、開発と商業化革新の候補薬物に集中し、重大な市場チャンスを持つと考えられる医療と美容皮膚状況と疾病の治療に用いられる。
皮膚病、例えばざ瘡、乾癬、多汗症と各種の美容指標は、毎年全世界の数百万人に影響し、これは彼らの生活の質と感情健康に負の影響を与える可能性がある。現在市場には様々な適応に対する治療選択があるが,多くは治療効果の平平,応用案の煩雑さ,各種の負の副作用を含む重大な欠陥が存在すると考えられ,これらはすべて患者のコンプライアンス低下を招くと考えられる。これらの適応の多くはまず局所治療による治療を行うが,多くの患者は患者が満足していないために治療を交換したり,治療を完全に中止したりすることが多い。これは主に緩徐と適度な応答率,比較的早期に出現する負の副作用,毎日の応用計画と長い治療コースによるものである。現在の外用療法の限界から,落胆した患者のニーズを満たす重要な機会があると考えられ,皮膚病や生活様式のニーズを満たす外用製品を探している
私たちの2つの候補製品DMT 310とDMT 410は私たちの独自の多面的なものを融合していますスポンジ.スポンジ様々な皮膚疾患を局所的に治療するための技術。我々のスポンジ.スポンジこの技術は自然に育った淡水スポンジに由来しています湖のスポンジあるいは…。スポンジ.スポンジこれを粉末に加工し,塗布直前に流動化試薬と混合して使いやすいペーストを形成したスポンジ.スポンジ1種の独特な淡水スポンジであり、世界の特定の地区と特定の環境条件下でのみ商業数量で栽培され、これらはすべてその独特な抗微生物、消炎と機械性能を与えている。これらの環境条件、著者らの独占サプライヤーが共同開発した独自の収穫プロトコル及び著者らの収穫後の加工プログラムと結合して、1種の候補製薬製品を生成し、この製品はスポンジの機械成分と化学成分を最適化し、それによって多種の作用機序を有する候補製品を作成し、炎症皮膚状況の治療と美容応用に応用した
私たちが信じているのはスポンジ.スポンジ技術プラットフォームは,様々な皮膚疾患適応に対して化合物を真皮に局所的に輸送することができる単一と組合せ製品を開発·調製することができる。私たちはこの組み合わせはスポンジレストラン機械や化学部品が証明していると信じています体外培養抗微生物や抗炎症特性)が多機能性を増していますスポンジ.スポンジ科学技術プラットフォームは唯一無二の製品として、ざ瘡と乾癬などの多種の医療皮膚病の治療における有効性がある。私たちの機械的性能はスポンジ.スポンジこの技術はボツリヌス毒素、モノクロナル抗体或いは真皮充填物などの各種の巨大分子を、針を必要とすることなく、局部応用を通じて標的治療部位に輸送することを可能にする
私たちの主要候補製品DMT 310は私たちのを利用することを目的としていますスポンジ.スポンジ私たちは週に1回様々な皮膚病を治療する技術を提供していますが、私たちの最初のポイントは普通のざ瘡の治療であり、アメリカでの市場規模は約5000万人です。著者らは2 b期の研究でDMT 310が多種の原因ざ瘡を治療する能力を示し、この研究の中で、著者らは最初に4種類の治療方法を見た後に炎症性皮膚損傷が45%減少し、全体の研究過程において、すべての三つの主要な終点のすべての時点で統計的に著しい改善があった(炎症性皮膚損傷の減少、非炎症性皮膚損傷の減少、及びInvestigatorの全世界評価の改善)。2 b段階のデータによると、2023年下半期に第3段階計画を開始する前に要求を決定するために、FDAとの第2段階会議を終了する準備をしている。また、DMT 310ざ瘡試験の多種の作用機序と抗炎症効果に基づいて、著者らは乾癬の1 b期概念検証試験を完成し、更なる研究に値する鼓舞的な結果を見た
| 4 |
| カタログ表 |
DMT 310は、自然に成長した淡水スポンジから加工された2グラムの粉末からなる湖面のスポンジ。患者は塗布直前に粉末と流動化剤(過酸化水素)を混合し,塗布しやすいペースト状にした。このペーストの応用はスラリーマスクに似ており,皮膚に約10~15分間滞在し,水で洗浄した。DMT 310の機械的成分と化学成分の独特な組み合わせと、著者らの第二段階のざ瘡データに基づいているため、患者はDMT 310を週に1回使用するだけで理想的な治療効果が得られると信じている。機械的な部品ですスポンジ.スポンジ粉末は多くの微小なシリコン質針状針からなり,皮膚にマッサージすると,これらの針状物は角質層(皮膚最外層の保護層)を貫通し,マイクロチャネルを作成して真皮に入り,炎症性サイトカインや細菌が真皮に常駐する。刺突の貫通もマイクロチャネルの開放を招き,酸素が毛皮の脂腺に入り,C.を殺すのに役立つと考えられるにきび嫌気性(無酸素)環境で成長しますにきびシュードモナスざ瘡患者の炎症性病変を引き起こす細菌である)。針刺しは死皮の表層を活性化させ,コラーゲン生成を増加させる。また,新たに作成されたマイクロチャネルは,DMT 310の自然に産生された化合物に導管を提供し,真皮と毛皮脂腺に輸送し,殺すのに役立つと考えられるC. にきび抗炎症がありますそれは.DMT 310は、これらの抗微生物化合物に加えて、抗炎症性化合物、例えば抗炎症性化合物を含むように見えるはい。 体外で実験では,炎症を減少させることで炎症を抑制するにきびカンジダIL−8の産生を刺激し,IL−17 AとIL−17 Fの発現を抑制する。さらにここでははい。 体外でDMT 310有機化合物の研究において、著者らは皮脂細胞脂肪生成の抑制を観察し、これは患者の皮脂(ヒト皮脂腺産生を減少させる油性とワックス質物質)の産生と患者の皮膚の油性に転化する可能性があり、これはいくつかの臨床研究者が著者らの2期ざ瘡研究で観察したものである。これらの生物と機械的効果の結合は,われわれの臨床試験で見られたように,多発性炎症性皮膚疾患を治療する重要な因子である可能性が考えられる。
私たちの2つ目の候補は私たちのスポンジ.スポンジ技術はDMT 410であり,我々の併用治療である。DMT 410は一度に著者らの独自のスポンジ粉末を治療し、その後、ボツリヌス毒素を一度に局部応用して真皮に入ることを含む。現在,ボツリヌス毒素は皮内注射のみで真皮に伝達されることが許可されており,患者にとって苦痛である可能性があり,医師にとっても時間がかかる。しかし、DMT 410がボツリヌス毒素を真皮に局部的に輸送する能力は現有の輸送技術と類似した治療効果レベルを有する可能性があり、耐性問題は更に少なく、応用時間はもっと速く、皮内注射の需要に代わる可能性があると信じている。著者らはまず腋窩多汗症患者の第1段階POC試験でDMT 410をテストし、単回治療4週間後、80%の患者の体重汗量が50%を超えた。現在、多汗症市場の40%近くの患者はボツリヌス毒素の皮内注射の治療を受けており、著者らはDMT 410がこの市場に進出し、皮内にボツリヌス毒素を注射する代わりに大きな機会があると信じている。DMT 410が一期腋窩多汗症試験で観察されたボツリヌス毒素を有効に真皮に輸送する能力に基づいて、毛穴の大きさの縮小、皮脂生成と細紋などを含むDMT 410の一期POC試験を行い、毛穴の大きさの縮小、皮脂生成と細紋などの多種の美容皮膚状況の治療に用いられた。2021年11月には,この実験の主な結果を発表し,有望なデータが見られ,これらのデータはDMT 410をさらに調査する価値があると考えられる。著者らは現在ボツリヌス毒素会社と協力機会を検討しており、DMT 410計画を第二段階研究に移している。
DMT 310のアプリケーション

図1:スポンジ.スポンジ微粉に加工され、6 mlボトル3%Hで2 g袋に包装されています2O2(過酸化水素)。週に1回,粉末と過酸化水素を混合し,混合物を皮膚にマッサージし,10−15分後に水で除去しやすい。
現在の医学や美容皮膚科領域では革新的な治療選択が不足しており,主に再配合や古い分子の組み合わせを導入していると考えられる。私たちはこのような革新の不足は私たちに患者の皮膚状況を治療する方法を変える理想的な機会を提供したと信じている。我々が期待している週1回の治療計画と天然由来の候補品により,ざ瘡,乾癬,多汗症,美容条件下での複数の臨床試験で見られたように,最小の副作用と迅速な治療効果で患者のコンプライアンスを改善することができると信じている。もし私たちが私たちの候補製品の開発に成功し、FDAの承認を得て、皮膚科医の集中処方基礎を構築し、私たちの経営陣の以前の経験を利用することができれば、私たちは商業組織を構築し、皮膚科分野の核心重点分野で治療プログラムを開発し、商業化することができると信じている
| 5 |
| カタログ表 |
私たちの臨床開発パイプラインと候補製品は
著者らの臨床開発プロセスは現在DMT 310とDMT 410を含み、それぞれ開発中であり、多種の皮膚病と条件に用いられている。添付の部分では、各候補製品、その利点、および各候補製品に対する私たちの市場戦略を説明する。次の表と各節に反映される日付は見積り数のみであり,次の表や各節に列挙されたイベントが予想されるスケジュールどおりに完了することや,完了がまったく保証されないことは保証されない
DMT 310
中等度から重度のニキビ2020年6月、著者らはランダム、二重盲検、多中心、プラセボ対照の2 b期臨床試験を完成し、DMT 310は週に1回の中重度ざ瘡治療に応用した。4回のみの局所治療後、DMT 310は、12週目の研究が終了するまで、すべての3つの終点(炎症性病変数、非炎症性病変数、および調査者のグローバル評価)においてプラセボと比較した統計的に有意な改善を示し、12週目の研究が終了するまで統計的にプラセボから分離され続けた。我々は、我々のDMT 310の第3段階計画において、これらの同じ終点を使用して、重度ざ瘡を治療するために提出されたDMT 310を使用して、重度のざ瘡のNDAをサポートする予定である。週に1回適用されるこれらの結果は、DMT 310を市場で治療中から重度のざ瘡までの一流製品にする可能性があると信じている。我々は2023年上半期にFDAとの第2段階会議を終了した後、2023年に第3段階計画を開始する予定だ
軽度から中等度の乾癬2021年10月、著者らはDMT 310の1 b期POC試験を完了し、毎週1回の軽中度乾癬治療に応用した。斑塊型乾癬は慢性炎症性皮膚疾患であり、乾癬市場の約80%を占めている。“富”ビジネス洞察市場研究によると、2019年現在、多くの患者が軽中度疾患を患っており、承認された生物治療を受けることはあまり不可能であり、これらの治療は中等度から重度の疾患の患者にのみ適用されており、第一線の治療として適している。軽中度乾癬を有する患者数が多いことから,より軽微な疾患に対しては有効な局所治療が乏しく,副作用の限られた有効な局所製品への需要が大きいと考えられる。著者らの1 b期POC試験のデータ、DMT 310がIL-17 AとIL-17 Fを低下させた体外データ、及び著者らは2 b期ざ瘡試験で観察された抗炎症作用に基づいて、DMT 310は軽中度乾癬患者の第一線の薬物として使用できると信じており、これらの患者は生物治療に適していない。2021年10月、著者らは著者らのDMT 310 1 b期POC試験の主要な結果を発表し、この試験は30人の軽中度乾癬患者の治療に使用され、これらの患者の皮膚損傷は彼らの身体表面積の2%~30%を覆った。患者はDMT 310治療を受け、毎週1回、治療コースは12週間であった。POC試験で観察された有効性、安全性と耐性に基づいて、より大きな2期プラセボ対照臨床試験に入る前に、著者らは追加の仕事を開始し、著者らの臨床試験設計をよりよく知らせる
中度から重度の酒かす鼻2022年12月5日、我々はDMT 310を週に1回局所応用して治療中に重度の酒かす鼻までの第2段階試験のTOPLINE結果を発表した。データは炎症性皮膚病の治療方法としてDMT 310を支持したが、酒かす鼻研究はその主要な終点に達しなかった。一部の患者の酒かす鼻は確かに有意な変化が発生したが、DMT 310患者の36%は調査者の全世界評価(IGA)採点において応答者の標準に達したが、DMT 310は統計学的にプラセボと分離できず、23%のプラセボ患者は12週目に応答者の基準に達した。治療応答者の定義はIGA等級が“完全”または“ほぼ完全”であり、少なくともベースラインより2段階向上した
以上のことから,我々はDMT 310のこの適応を開発するためにさらなる財源を投入しないことを決定し,DMT 310のこの適応についてはさらなる開発を行わないことにした
| 6 |
| カタログ表 |
DMT 410
私たちは2つ目の候補品を開発していますスポンジ.スポンジDMT 410プラットフォームは、皮膚病と美容疾患の局所治療に用いられ、通常ボツリヌス毒素を複数回注射して治療を行う。現在、ボツリヌス毒素は何度も注射しなければならず、十分なボツリヌス毒素を必要な治療区域に輸送することに成功した。注射は多くの異なる疾病と美容条件に対して有効であるが、それらはボツリヌス毒素の他の場合の使用を制限し、これらの場合、注射、特に皮内注射は、困難、疼痛或いは他の実行不可能である。DMT 410の併用療法は私たちの独特な応用を使用していますスポンジ.スポンジ粉末状,その後ボツリヌス毒素を局所的に使用した。♪the the theスポンジ.スポンジ粉末は流動剤と混合し,治療医から患者の治療領域にマッサージし,針刺しの透過性を増強し,真皮に入るマイクロチャネルを作成した。10分から15分後に医者は取り出しましたスポンジ.スポンジ水でマスクを作る。そして,医師はシリンジからのボツリヌス毒素を患者の皮膚に正確に放出する。ボツリヌス毒素を治療領域にマッサージしてスポンジレストランボツリヌス毒素は角質層を貫通して真皮に入ることができる。このような治療応用は、ボツリヌス毒素を真皮に局所的に輸送することができ、多汗症、ざ瘡およびざ瘡の瘢痕の治療、および皮膚の輝度および輝度を改善し、毛穴の大きさおよび計数、細紋および皮脂産生を減少させるなど、様々な内科疾患を治療することができると信じている。DMT 410のボツリヌス毒素の局所投与は、DMT 410の無針応用、皮内投与を標的とするため、ボツリヌス毒素の美容市場を潜在的に拡大するため、ボツリヌス毒素の市場機会を大幅に増加させることができると信じている。
これまで、著者らはDMT 410による腋窩多汗症治療の開放ラベル1 b段階POC臨床試験、及び多種の美容皮膚条件下での開放ラベル1 b段階POC臨床試験を完成した。腋窩多汗症の1 b期POC試験は10名の患者を含み、各腋窩にDMT 410治療を受けた。DMT 410を用いて1週間治療を行ったところ,汗分泌が減少した。この試験の臨床的終点は、(I)重量測定汗量がベースラインより50%以上減少した患者のパーセンテージ、(Ii)重量汗量が50 mg未満の患者のパーセンテージ、および(Iii)重量汗量変化のパーセンテージを含む。DMT 410を用いた1回の治療4週間後,80%の患者の体重汗量は50%を超え,85%の患者の体重汗量は50 mg未満であり,患者の体重汗量はベースラインより平均75%減少した。これらの結果はDMT 410がボツリヌス毒素を真皮内に局所的に輸送し、ボツリヌス毒素の複数回の皮内注射と類似した治療効果を達成することに役立つ可能性があると考えられる。DMT 410の場合、ボツリヌス毒素は、複数回の注射を必要とすることなく、皮膚を貫通して真皮に入るために局所的に応用できると信じられている。
著者らはまたDMT 410の開放ラベル、10(10)名の患者の1 b期POC試験を完成し、多種の美容皮膚状況(毛穴の大きさ、全体の美容改善、輝度、光度、皮脂発生、眼部細紋、眉間紋、額部紋と外眼角紋)の治療に用いた。われわれのDMT 410 1 b期POC試験では、患者はDMT 410の治療を受け、合計16週間以内に4週間ごとに評価を受け、DMT 410の安全性と耐性、有効性及びその治療効果の持続時間を決定した。2021年11月に主な結果を発表し,そこでは実験の多くのゴールが改善されていることが観察された。8週目には80%の患者のグローバル美容機能が少なくとも25%改善し,60%の患者の毛穴サイズが25%改善した。同様に8週目には90%の患者光度が少なくとも1点改善し,60%の患者輝度が少なくとも1点改善した。これらの医師の分類結果は,Canfield ScienceのVIIAとPrimos視覚分析カメラシステムが提供する客観分析の支援を得た。これらの結果から,ボツリヌス毒素との協力を積極的に求めており,より大規模なプラセボ対照の第2段階試験でDMT 410の開発を継続しており,この試験では,多用量ボツリヌス毒素を顔面全体に適用することを検討することができる。これらの結果は、DMT 410の組み合わせレジメンが、美容皮膚状態および他の皮膚疾患(例えば、多汗症、ざ瘡またはざ瘡瘢痕)の潜在的な適応のためにボツリヌス毒素を大きく拡大することができることを明らかに示す多汗症における我々の結果と組み合わせていると信じている。
DMT 410が上述した任意の適応に対するFDAの承認を得ることは保証されない
| 7 |
| カタログ表 |
私たちの戦略
われわれは許可を得て,差別化された医療や美容皮膚科候補製品を開発し,商業化し,様々な皮膚疾患や疾患の治療に利用する予定であり,これらの製品は市場で大きな未満足需要があると考えられる。この戦略の主な構成要素は以下のとおりである
| ·
| ざ瘡用DMT 310の完全開発と規制承認それは.著者らはDMT 310治療中の重度ざ瘡の2 b期臨床試験を完成した。我々は、2023年上半期にFDAと第2段階会議を開催し、2023年下半期にDMT 310の第3段階計画を開始する予定である。この2つの第3段階試験の結果が積極的であると仮定し,試験完了後約6カ月に新薬申請を提出する予定である。 |
|
|
|
| · | 我々のDMT 410計画は多汗症と美容皮膚条件下での互恵的な協力機会を探索する2021年11月にDMT 410ステージ1 b POC試験の主な結果を発表しましたスポンジ.スポンジOnabotulinumoxinA(ブランド名ボツリヌス菌)の局部応用技術。この試験は,DMT 410がボツリヌス毒素を皮膚状態や疾患の真皮に局所的に輸送する能力があることを証明するさらなる証拠を提供していると信じている。DMT 410の多汗症と美容における研究結果に基づき,我々は現在協力機会を探索し,さらにDMT 410を皮膚病や美容皮膚状態の局所治療に開発している。 |
|
|
|
| · | DMT 310による乾癬治療の第二段階試験を完了した2021年10月、著者らは軽中度乾癬患者で行った1 b期POC試験の主要な結果を発表した。このPOC研究の結果,DMT 310が乾癬治療のためにさらに開発されていることが証明されたと信じている。開発と商業化に成功すれば、DMT 310は乾癬を治療する最初の週に1回の局所製品になると信じられている。乾癬治療のDMT 310計画は現在棚上げされており,追加資金および/または戦略的パートナーを獲得した場合にはさらに進められる。 |
| · | 私たちの製品の組み合わせで他の皮膚科プロジェクトを買収したり、許可して、私たちの現在の候補製品を補充しますそれは.私たちは潜在的な協力機会を絶えず評価し、これらの機会は私たちの現在の候補製品の組み合わせを支持し、私たちの組織に実質的な価値を提供する。早期から中期までの候補製品の開発に専念し,臨床データを生成し,開発の後期段階に入る可能性があり,最終的には商業化に向かう予定である。 |
|
|
|
| · | 私たちの候補製品を効果的にできる地域で商業化し、他の地域と協力することで、私たちの新市場への参入を助け、ポートフォリオの価値を最大限に高めることができるもし私たちの候補製品がFDAの承認を得たら、可能な限りアメリカ市場以外の新しい地域の老舗会社と協力することで、私たちの候補製品の販売エリアを最大限に拡大する予定です。 |
|
|
|
| · | 我々の知的財産権の組合せ,新たな化学実体やNCEへの経路,排他性,原材料供給をさらに強化し,我々の規制申告を推進する私たちは引き続き私たちの知的財産権の組み合わせを強化し、DMT 310のNCE独占経営権を求め、原材料需要に対する私たちの独占供給協定を維持し、私たちの独自の情報を保護し続ける予定です。私たちは私たちの候補製品が規制部門の承認を受けたら、これらの活動が私たちの主な競争優位になると信じている。 |
以上に反映される日付は見積りのみであり,含まれるアクティビティが提出された予想タイムライン内で完了することは保証されない,あるいは完了がまったく保証されていない.さらに、DMT 310またはDMT 410または将来開発可能な任意の他の候補製品の開発に成功する保証はなく、将来開発可能な任意の他の候補製品がFDA承認を得ることも保証されない
| 8 |
| カタログ表 |
皮膚科市場の概要
著者らは現在医学と美容皮膚科市場に集中しており、その中には多種のよく見られ、治療不足の皮膚病と条件、例えばざ瘡、乾癬、多汗症と多種の美容条件が含まれており、その中のいくつかは現在承認されていない製品であり、細紋、毛穴の大きさ、皮脂の発生を減少し、光度と全体の皮膚品質を改善することを含む。著者らは、これらの疾病と状況は患者の生活の質に重大な負の影響を与え、身体と感情創傷及び社会恥を含み、患者に絶えずより良い治療選択を求めさせ、彼らの病状を緩和することを助けると考えている。また,これらの市場は,最近承認された革新的な局所製品は,既存化合物の再配合や組み合わせ以外に他の製品が少ないため,他の市場と同様の発展や進歩を経験していないと考えられる。私たちの候補製品は市場で有利な位置を占め、不足している医療と美容皮膚病市場に革新的な解決策を提供すると信じている
近年、新しい治療選択と更に多くの患者が看護の機会を獲得することに基づいて、アメリカ医療皮膚病市場は著しい増加を経験した。現在の市場データによると、2020年の米国医療皮膚病市場(生物製剤を除く)の処方薬売上高は160億ドルを超えている
米国整形外科学会によると、2016年に米国では1540万例を超える整形手術があり、そのうちの約700万例がボツリヌス毒素を使用していると推定されている。多くの要素は、若年患者の増加、および患者が美容ケアにかかる自由に支配可能な現金を含む、より多くの患者受け入れのような美容皮膚科市場の増加を推進し続けている。また、患者は自腹を切って有効な皮膚治療を行い、彼らが望む個人的な審美外観を実現することを望んでおり、これらの市場の需要と定価をさらに支持していると信じている
以上のことから,皮膚科領域の専門家数が相対的に少ないため,他の多くの処方に基づく専門市場と比較して,皮膚科市場は,美容も医療も低コストな商業化の機会を提供していると考えられる。米国皮膚病学会のデータによると,2020年には米国には約18,000名の皮膚科医がおり,これらの皮膚科医の一部に対して,競合製品の大きな処方者であり,承認された適応を用いて大きな割合の患者を治療する予定である。処方と現金による支払いに基づく製品ラインの組み合わせは、皮膚科市場の多くの側面を組み合わせているため、より大きな医療市場から独立しているため、魅力的なビジネス機会であると信じている
私たちの背景資料はスポンジ.スポンジ技術
湖スポンジの概要
湖のスポンジあるいは、あるいはスポンジ.スポンジ淡水スポンジです海綿亜綱世界の特定の地域で淡水川や湖に大量に生育している科。冬季に休眠し,毎年生息地の生育条件に応じて結殻から指状,分枝まで毎年再生される。北半球の多くの場所で成長しているが、あるところだけが商業製薬製品を支持するのに十分な数量と品質で成長している。その中の一つの場所はロシア中部のボルガ川で、私たちはそこで既知の大きなサプライヤーの一つと独占供給協定に署名しましたスポンジ.スポンジDMT 310の原材料は私たちの供給を保証しますスポンジ.スポンジ素材です。伝統的に地元の人は少量のものを収穫しますスポンジ.スポンジ薬用価値があると考えられ、関節炎を含む様々な炎症を治療するために民間薬として使用されているからである。過去20年間、私たちの独占サプライヤーはその収穫方法と手続きを完備しており、現在は高品質の原材料を提供する能力がある。私たちのサプライヤーは大量のを収集して加工することができますスポンジ.スポンジ毎年です。私たちのサプライヤーは数量と品質に必要な原材料を提供して、私たちの臨床と商業需要を満たすことができると信じています
伝統的な使い方ですスポンジ.スポンジロシアでは多くの安全なデータが提供されている。2003年,ロシア衛生部によると,毎年100万人以上がスポンジを使用しており,安全問題はほとんど報告されていない。2017年には,FDAの植物薬業界開発ガイドラインや植物学ガイドラインを参考に,FDA皮膚病や歯科製品部門に提出された調査新薬(IND)申請にこれらのセキュリティ情報,その他様々な出版物や非臨床研究が提出された。この提出書類はFDAがDMT 310のINDを承認することができ、患者の第二段階の臨床試験に直接入ることができ、一部の原因は歴史上の人類接触である。著者らは依然として多くの必要な非臨床と薬物動態学研究を完成する必要があるが、著者らはこのような仕事を始める前に戦略的に資源を節約し、同時に人類の臨床治療効果と安全性データを収集することができる
| 9 |
| カタログ表 |
スポンジの多重作用機序
独特の属性があります湖のスポンジFDAの植物学的ガイドラインを参考にするだけでなく,毎年十分な原材料供給の持続可能な再生の確保にも寄与している。そして当を受けるスポンジ.スポンジ技術的には,動物王国の一部であり,その生育や行動は植物に類似しており,毎年完全に再生できるため,劣悪な環境条件下でも同様である。毎年スポンジの再成長を招く以外に、スポンジの生存の悪い環境条件は私たちに役立つスポンジ.スポンジ技術の多様な作用機序。20年近くの収穫に基づいて得られた知識はスポンジ.スポンジ私たちのサプライヤーは必要な環境条件とスポンジ.スポンジ最適な原料が得られる特性を備えなければならず,原料に有効な製薬製品に必要な特性が含まれていることを確保する。これらの性能には機械と化学成分が含まれています。これらの成分はスポンジ原材料の中で自然に発生する一部で、私たちに役立ちますスポンジ.スポンジ皮膚病と皮膚病の治療における技術の作用機序
DMT 310の機械的構成要素はスポンジ.スポンジ骨格構造は,有機物質が結合したシリコン質針状体からなり,次の画像2に示す。これらの針状体は滑らかな棒状の形状で両端に1つずつ点がありスポンジ.スポンジいくつかの固有の環境条件下で収穫され、針状体の平均長さは、150~300マイクロメートル、直径約10~15マイクロメートルであってもよい。他のタイプの淡水や海洋スポンジもあるが,それらの多くの針状物はフックやフックで覆われている可能性があり,これらの刺状物が皮膚に刺さったり,両端に不動態化された針状物が含まれており,皮膚が貫通しにくくなっていると考えられる

図2:シリコン質針状体はスポンジ.スポンジ
アメリカで収穫と更なる加工後、私たちの針状体の形式と大きさはそれらを角質層と皮膚バリアを貫通する理想的な機序とし、大きな血管のある皮下組織に貫通することなく、真皮に入るマイクロチャネルを一時的に作成する。これらの新たに作成されたマイクロチャネルは,皮膚のバリアを一時的に開き,大きさの化合物が真皮に的確に輸送されることを可能にする。現在、多くの外用製品は各種の浸透促進剤を含有しており、活性分子が角質層を介して真皮、例えばジメチルスルホキシド(DMSO)に入るのを助ける。しかし、これらの浸透促進剤は小分子浸透しか助けられず、通常局部投与時にボツリヌス毒素などの巨大分子を助けることができない。これらの浸透促進剤は、肌の乾燥やニンニク、例えば味、呼吸、体臭など、望ましくない副作用を引き起こすこともある。私たちが信じているのはスポンジ.スポンジこの技術の違いは,他の局所応用製品と比較して,局所応用により小分子や高分子の伝達が可能であり,刺激性や副作用が少ないことである
皮膚に多くのマイクロチャネルを作る以外に、針状体の貫通は閉じたニキビを開き、酸素が詰まった毛皮脂腺の嫌気環境に入ることができると信じていますC.にきび他の細菌と生存しています最後に,針状物は皮膚内コラーゲンの生成を促進し,皮膚の老化期を加速させ,皮膚の正常な回転周期よりも速やかに新鮮な皮膚を表面にもたらすと考えられる。通常皮膚は表面に新しい層を形成するのに3~4週間かかりますスポンジ.スポンジ技術はこの過程を1週間もたたないうちに終わらせるかもしれない。炎症性皮膚疾患や疾患の治療時間を減少させるとともに,患者の皮膚外観も改善したと考えられる
我々のスポンジ.スポンジ科学技術はまた多種の活性化合物を含み、私たちはこれらの化合物が私たちの候補製品の多種の皮膚病と皮膚病の治療に役立つかもしれないと信じている。私たちは一部がスポンジレストラン自然防御機構は,その生育する水中に存在する天敵を撃退するために有機材料を創出することである。この有機材料はその針状体を結合し,スポンジの骨格構造を形成する。多くの体外研究に基づいて、著者らはスポンジ中の有機化合物は、針葉から分離した時、抗炎症と抗菌特性があると信じている。Cの減少を含む抗炎症活性が観察されましたそれは.にきびIL−8の産生を刺激し,ヒト細胞系IL−17 AとIL−17 Fの産生を低下させる。また,われわれの体外研究では,皮脂細胞の脂肪生成が抑制され,患者の皮膚皮脂生成や油性の減少に変換される可能性が観察された
| 10 |
| カタログ表 |
私たちのすべての機械や化学部品はスポンジ.スポンジ技術は様々な疾患の治療において有益である可能性があり,各機序が結合した場合,その影響は大きく増強する可能性があると信じている。各治療に含まれる大量の針状体は、角質層を介して多くのマイクロチャネルを形成し、化学成分が炎症や細菌に対して十分に浸透して治療領域に輸送されることを可能にする
FDA工業用植物薬開発ガイドライン
現在承認されている多くの局所皮膚病製品はFDAの皮膚病と歯科製品事務室のみで審査され、標準的な承認経路に従っている。しかしながら、我々の主要候補製品DMT 310は天然由来であるため、FDA皮膚科および歯科製品事務室によって審査され、FDA植物審査部は意見を提供するであろう。そして当を受けるスポンジ.スポンジ植物学ではなく,FDAは原材料の品質管理とロット整合性に関する植物学の指導意見を参考にし,開発により商業化に入ることを可能にしている。植物学的ガイドラインを参考にして、植物審査部からDMT 310に関する情報を得ることができ、DMT 310の規制経路が承認される上で重要な利点を提供することができると信じている。これらの利点には,FDAが我々のIND書簡を受け取ったことを確認した後にヒト臨床研究に入ることができ,その後の研究が継続する可能性があり,人類の臨床データを得る大量の財政資源を節約している可能性がある。また,我々のスポンジには多くの活性化合物が含まれていると考えられるが,FDAフィードバックの規制分析や植物ガイドラインによると,品質制御とロット間の整合性を示すためには,識別可能かつ定量可能な活性成分のみを提供すればよいと考えられる。これは、我々の候補製品の各コンポーネントを知ることができず、彼らの製品が組成的に類似していることを証明することができないので、潜在的な競争相手がDMT 310を複製することをより困難にすると考えられる。したがって,類似した製品や候補製品を持つ競争相手は,承認されるためには,我々が達成しなければならないすべての製造,開発,規制手順に従わなければならないと考えられる.しかしながら、DMT 310の開発に成功したことは保証されず、DMT 310がFDAの承認を得ることも保証されない
私たちの候補製品
DMT 310
著者らの主要な候補製品DMT 310は独特で週に1回の自然由来局部製品であり、最初は重度の尋常性ざ瘡或いはざ瘡を治療するために開発された。淡水から抽出したものです湖のスポンジあるいは、あるいはスポンジ.スポンジ特定の環境条件下で北半球全体の特定の場所に生息しています. 我々のスポンジ.スポンジ原材料.原材料 私たちのロシアにおける独占パートナーであり、厳格な合意を遵守し、私たちのサプライヤーの20年間の経験と理想的な薬物製品に関する私たちの専門知識に基づいている。これらの厳密な案の結果,一貫した繰り返し使用可能な化学構造が形成されており,製薬製品に利用可能な材料の製造に重要である。収穫後、スポンジ.スポンジ私たちのアメリカの製造工場に運ばれ、香包に包装する前に、さらに統一された粉末に加工された。治療の前に、患者は粉末を希釈剤(過酸化水素)と混合してペースト状に形成し、その後、患者はそれを治療領域に塗布して、彼らの疾患の複数の態様を治療することができる。DMT 310利用スポンジレストラン機械針刺は、患者の皮膚の再表面を助け、同時に角質層を通るマイクロチャネルを作成し、貫通を可能にするスポンジレストラン天然に産生された有機化合物は様々な皮膚病の治療に役立つ。これらの有機化合物は新たに作成したマイクロチャネルを介して真皮と皮脂腺に入ることができ、炎症性と非炎症性ざ瘡の皮膚損傷はすべてこれらの皮脂腺から起源すると信じている。DMT 310は、ざ瘡の治療の多くの態様に対して、大量の機械的および化学的活性を組み合わせているスポンジ.スポンジ塗りやすい製品になり、週に1回塗るだけです。FDAの許可を得たら、DMT 310の機械と化学特性の結合は現在市場で販売されている他の局部ざ瘡製品より早く効果があり、治療がもっと少なく、副作用がもっと少なく、耐性がもっと良い可能性があると信じている
| 11 |
| カタログ表 |
DMT 310は通常型ざ瘡を治療する
市場のチャンスそれは.ざ瘡の特徴は皮膚が鱗片状赤色を呈し、非炎症性黒頭と白頭、炎症性病変、丘疹と膿疱であり、たまに嚢腫と瘢痕が出現し、顔面、頚部、胸部、背部、肩、上腕に出現する。アメリカでは約5000万人に影響を与えており、約85%の青少年が何らかの形のニキビを経験している。GlobalData Inc.の市場データによると、2016年の米国処方薬市場の処方薬売上高は約26億ドル、2026年には約38億ドルに達すると予想されている
多くの患者は10代で何らかの形のニキビを経験しており,一部の人にとっては時間の経過とともに減少したり,少なくとも25歳までに減少したりする可能性がある。しかし,ニキビが完全に消えるまでどのくらいかかるかは予測できず,30代,40代,さらにはそれ以上になるとニキビになる人もいる。命を脅かすことはありませんが、社会的恥、顔の永久瘢痕の巨大なリスク、自尊心の低下と社交退縮のため、ざ瘡はざ瘡を有する人に重大な傷を与えます。したがって,早期かつ積極的な治療は,有効な週1回の製品を使用することで,この疾患の全体的な長期影響を軽減し,患者の生活の質の向上を招く可能性があると信じている
ざ瘡は患者の生活の質と顔面美容に対するマイナス影響のため、ざ瘡患者はよくざ瘡を治療する強い動機があり、著者らは彼らが自腹を切ってもっと高い価格と高効率な治療方法を買いたいと信じている。使用しやすく有効な局所製品を求める患者は、他の適応の他の処方薬よりも低い販売率を許容し、最終的にざ瘡治療のDMT 310の承認を得て商業化に成功すれば、割引価格を得ることができると信じている。さらに、承認された場合、DMT 310の自然特性は、DMT 310のような天然由来製品の使用を重視する患者を含む潜在的なざ瘡市場を拡大させる可能性があると信じている
ニキビの重症度によって、ニキビ市場は3つに分類できる
| · | 軽度ざ瘡:丘疹或いは膿疱疹を特徴とする;通常非処方薬或いは局部処方療法で治療する |
| · | 中度ざ瘡:多発丘疹と膿疱疹を特徴とし、中等度の炎症を伴う;通常経口と局所処方療法を組み合わせた治療法が用いられる |
| · | 深刻なざ瘡:大量の丘疹と膿疱疹を特徴とし、多くの結節と/或いは嚢腫と深刻な炎症を伴う;現在経口と局部連合治療と光線力学療法を三線治療方案としている |
現行の看護基準の限界それは.現在の治療方案はいくつかの患者に有効である可能性があるが、現在のざ瘡製品は多くの制限と欠陥が存在し、患者のコンプライアンスが比較的に悪い。現在承認されているすべてのざ瘡治療の局所療法は、皮膚内に有効な活性成分を蓄積し、それによってこの疾患を効率的に治療するために、1日1~2回適用されなければならない。このような毎日何度も応用する要求は患者にとって非常に重く、時間がかかり、多くの患者が厳格な応用方案を遵守できなかったことと/或いは複数回の治療をスキップしたことを招く。局部ざ瘡製品に対して、正確な使用と応用スケジュールは特に重要であり、患者の依存性が悪いことは治療効果の低下を招き、そして最終的に無効のため患者の治療を停止する可能性がある。
多くの現在のざ瘡製品、例えば毎日少なくとも1回のレチノイン酸を使用しなければならず、毎回使用後に深刻な痛み、灼熱と脱皮を引き起こす可能性がある。これらの耐性問題は、初回使用後に出現し始める可能性があり、それらによる深刻な不快感は、多くの患者が必要な毎日の応用計画を停止したり、この製品の使用を完全に停止したりする可能性がある。過酸化ベンゾイルやBPOは皮膚乾燥を引き起こすことが知られており,レチノイン酸は初回治療後に紅斑,灼熱と脱皮を含む多くの局所皮膚反応を引き起こす。アダパリン/BPOの共同研究で観察され,20%以上の被験者が中等度または重度の紅斑と刺痛/灼熱を報告している
最後に、多くの外用製品は患者のざ瘡皮膚損傷が明確に改善するまで、6-8週間の潜伏期が避けられない。これは、彼らのざ瘡が改善していること(1日または2回を想定する)を観察するために、30~60回の応用に耐えなければならない可能性があり、同時に、これらの外用製品がもたらす可能性のある灼熱、痛み、および脱皮にも対応しなければならないことを意味する。青少年はにきび市場の最大の部分を構成しており,迅速な感覚の欠如に対する効果が早期に治療を中止することにイライラしていると考えられる。迅速な治療効果の不足、副作用と煩雑な応用スケジュールはすべて患者のコンプライアンス問題を大きく招き、そして最終的に現在の局部治療の治療失敗を招く可能性がある。患者はコストではなく迅速な治療効果と低い副作用に関心を持っていると考えられ,患者はこれらの属性を持つ製品により高い自腹コストを支払いたいと信じている
| 12 |
| カタログ表 |
私たちは重度のざ瘡に対する解決策を持っている承認された場合、DMT 310の週1回のアプリケーションスキームは、患者のコンプライアンスを増加させ、ざ瘡結果を改善する可能性を潜在的に増加させると信じている。私たちの多面性を使って週に1回スポンジ.スポンジ治療技術の面では、DMT 310をすべてのざ瘡患者の第一選択治療方案とし、皮膚科医がざ瘡を治療する方法を変更しようと試みているDMT 310を開発している。著者らはDMT 310を設計してざ瘡を治療する多種の要素を設計し、同時に患者のコンプライアンスを高めることを試みた
もし承認されれば、DMT 310は現在治療中の重度の尋常性ざ瘡の多くの負の特徴を修復する可能性があり、煩雑な治療方案、負の副作用(灼熱、痛み、掻痒或いは乾燥を含み、最初に最初の治療時に発生する可能性があり、その後毎日持続する可能性がある)、及び効果を遅延させる時間(8週間に及ぶ可能性がある)を含むと信じている。DMT 310は、1日1~2回ではなく、週1回のみ適用されるように設計されている。週1回のスケジュールは患者にとってそれほど重くないため,患者のコンプライアンス向上に寄与する可能性が考えられる。そのほか、著者らの2 b期ざ瘡試験において、平均的に、患者はわずか4回の治療後に炎症性ざ瘡皮膚損傷は約45%減少し、12週間後に炎症性皮膚損傷は62%に減少した。また,12週間の試験終了時には,約90%の患者に軽微な耐性問題はなく,重篤な耐性問題を経験していなかった
また,われわれの2 b期試験では,4回の治療のみ後,DMT 310はすべての3つの終点でプラセボと比較した統計的有意差を示すとともに,炎症性および非炎症性障害においても急速な減少が認められた。このような迅速に見える反応は、患者が週1回の応用計画を守り続け、12週目の試験が終了するまで皮膚損傷が減少し続けることを奨励していると考えられる。そのため、患者のコンプライアンスの向上により忠誠心と再使用を招くため、治療効果を感じる時間が速く、耐性の問題が少ない局所製品は、より大きな治療成功を示す機会があると考えられる
DMT 310は軽中度乾癬を治療する
著者らが最近完成した1 b期POC試験で得られた臨床データによると、DMT 310も軽中度乾癬を治療する有効な薬物である可能性があり、しかもDMT 310の体外でのIL-17 AとIL-17 Fの低下作用及び表面積が比較的に小さい軽中度乾癬皮膚損傷に対する使いやすさであると考えられる
乾癬の特徴は“プラーク”であり、即ち皮膚上に隆起した赤色領域であり、銀色或いは白色の死亡皮膚細胞を覆い、“鱗片”と呼ばれる。乾癬のプラークは身体のどの部位にも出現するが,最もよく見られるのは頭皮,膝,肘,体幹,四肢であり,プラークはかゆみが多く,痛みがあることもある。乾癬皮膚損傷の特徴は角質形成細胞の過剰増殖と主にT細胞からなるリンパ細胞に富む浸潤物である。真皮と表皮では,Tリンパ球は抗原提示細胞と相互作用し,Th 1とTh 17サイトカインを分泌する。これらの活性化されたT細胞とその分泌される炎症性サイトカインは乾癬皮膚損傷の原因と考えられている。広範な抗炎症特性以外に、著者らは臨床ざ瘡研究において、DMT 310は体外でIL-17 AとIL-17 Fに対する用量依存性抑制作用を示し、この2種類のサイトカインは乾癬の発病機序と関係があることを観察した。そのため、DMT 310は応用しやすい方案で、直接局部耐性の良好な乾癬皮膚損傷に対して的確な抗炎症治療を行う方法を提供することができる
市場の機会現在,軽度から中等度の疾患の患者は診断不足であるか,治療不足であるか,治療されていない。これは患者に新しい効果的な治療選択を求めさせる。乾癬は慢性炎症性皮膚疾患であり,3.2%に達する世界人口に影響を及ぼすと推定され,2020年には世界売上高は142億ドルであり,2030年には275億ドルに増加すると予想される。斑塊型乾癬は最もよく見られる乾癬であり、80-90%以上の乾癬患者に発生し、その中の約80%の患者は軽度乾癬が出現し、20%の患者は中から重度乾癬が出現する。乾癬の皮膚損傷による毀容以外に、患者は掻痒或いは掻痒を経験する可能性があり、これは患者にとって特によく見られ、悩ましいかもしれない。乾癬は直接的な臨床挑戦をもたらすだけでなく,患者の生活の質も負の影響を受ける。患者は社会的恥辱、拒絶と羞恥感、職場の差別と生産性の低下など、彼らの疾病によって重大な心理影響を受ける可能性がある。これらの患者たちは通常、彼らの病気を治療するために安全で効果的な製品を探している
| 13 |
| カタログ表 |
現行の看護基準の限界多くの利用可能な治療方法は中から重度の疾患に対するものであり、これは軽度患者の治療が不足していることを意味し、5分の1の患者は現在の治療に満足していない。軽度乾癬患者に対する治療は汎用的であることが多いが,患者の疾患をコントロールするには不十分であることが多い。全身暴露の減少により、軽度乾癬患者はまず局部治療を受けた。しかし、患者はよく局部治療は乾癬の負の要素の一つであると考え、一部の原因は利用可能な選択が限られており、例えばコールタール、レチノイン酸、カルモジュリン阻害剤とコルチコステロイドであると考えられる。局所ステロイドは非常によく見られる治療法であるが,短期使用しかできず,視床下部下垂体副腎軸抑制,皮膚萎縮(薄く),紋状(妊娠紋),毛細血管拡張(クモ静脈)などの副作用が関与しているという欠点がある。また,副作用のいくつかは不可逆的であり,治療中止後も存在する。したがって,効果の高い局所ステロイドの長期使用は推奨されず,医師も通常顔面治療のための処方は行われない。また,リバウンドはステロイド治療の既知の挑戦であり,ステロイド中止後の乾癬の回復はステロイド治療を開始する前よりも悪い。
生物療法にはEnbrel,Cosentyx,Humira,Stelaraなどが含まれているが,乾癬の治療には使用が可能であるが,それらの使用は中~重度疾患の患者に高度に限局している。米国では20%未満の患者のみが中から重度の乾癬を有しており,ほとんどの乾癬市場には長期的に有効な治療選択はないと考えられる。より多くのデータは生物製品の吸収を招くが、多種の要素のため、それらは依然として限られており、中から重度の患者にのみ適用され、高いコスト、それに伴う精算と参入制限、頻繁な患者の自己負担、副作用の感知リスク及び患者の注射に対する恐怖を含む。また,ニキビなどの他の炎症性皮膚疾患を治療する他の外用品に比べて,軽度乾癬を治療する外用品には割増の余地があると考えられる。これは、生物療法のコストを比較した場合、軽度乾癬の治療に有効かつ安全な局所製品が市場に大きな影響を与える可能性があるという事実に基づいています。生物療法の年間コストは5万ドルである可能性があります。したがって,医師は生物治療前から乾癬の局所製品を処方していた可能性が高いが,軽度乾癬を有する患者は全身治療ではなく局所製品の使用を好む可能性が考えられる。
乾癬の非生物系治療方案はすでに存在するが、副作用のため、それらの使用も制限されている。アプミラスト(Otezla)は経口PDE 4阻害剤であり,2019年のすべての適応で10億ドルを超える売上が生じたが,中重度患者での使用制限,症状の適度な改善,頻繁な有害事象により,乾癬ではわずかな患者シェアしか得られなかった。軽度から中等度の乾癬を治療する製品を市場に出す必要が極めて大きいと考えられる
現在の局所治療の欠点や,慢性治療による強力な症状改善の選択が乏しいため,特に最近25年間,安全で有効かつ応用しやすい慢性疾患の局所治療が必要であり,副作用のリスクが低く,耐性が良く,すべての解剖領域に容易に応用できると考えられる
軽中度乾癬に対する解決策はそれは.ざ瘡患者の需要と類似しており、乾癬患者は応用しやすく、比較的に少ない応用時間を必要とする治療方案に従う可能性があると信じている。承認された場合、DMT 310は、軽中度乾癬を治療するための第一線の薬剤とすることができる。著者らはDMT 310内の針状物は乾癬皮膚損傷の分解に役立ち、DMT 310の抗炎症成分は皮膚損傷の癒合に役立つと信じている。歴史的に使われていたのでスポンジ.スポンジこれまでわれわれの臨床研究で収集されてきたヒト安全性データから,DMT 310は独自の治療効果と許容可能な安全性と耐性を有するため,慢性乾癬の長期治療に適している可能性が考えられる
DMT 310の機械的作用に加えて,この有機物質の抽出物は体外でIL−17 AおよびIL−17 F分泌を抑制する用量依存的作用を示した。真皮と表皮において、Tリンパ細胞は抗原提示細胞と相互作用し、インターフェロン-γ、インターロイキン2、インターロイキン17、インターロイキン22と腫瘍壊死因子-αを含むTh 1型とTh 17型サイトカインを分泌する。これらの活性化されたT細胞とその分泌される炎症性サイトカインは乾癬患者の皮膚障害の原因と考えられ、疾患免疫経路の根本的な貢献者である。市場にはSuckinumab(Cosentyx,ノワール)やIxekizumab(Taltz,礼来)などの多くの承認されたIL-17 A阻害剤が知られているが、これらはすべて生物製剤であり、系統的な治療を必要とする中から重度乾癬患者にのみ適用される。これらの生物治療候補である限られた患者群は乾癬市場全体のほんの一部しか占めていない。そのため、1種の局所製品は、皮膚中のIL-17経路を抑制し、全身暴露を最大限に減少させることができ、医師と患者の理想的な選択となる
| 14 |
| カタログ表 |
今までに発生したDMT 310の臨床と非臨床データ、及びDMT 310が乾癬皮膚損傷に影響する坊間証拠に基づいて、著者らは2021年10月に軽中度乾癬患者の1 b期開放ラベルPOC研究を完成した。この試験は30名の軽中度乾癬患者に対して12週間の週に1回のDMT 310治療を行い、これらの患者の皮膚損傷は彼らの身体表面積の2%~30%を覆った。この試験の主要な終点は医師の全世界評価であり、これは医者の目標皮膚損傷部位の乾癬重症度を評価する6分量表であり、乾癬面積重症度指数尺度も1つの6点尺度であり、乾癬疾患の重症度を測定し、定性皮膚損傷特徴(紅斑、厚さと鱗屑)と表面積の影響程度を考慮し、掻痒視覚シミュレーション採点は患者の掻痒或いは掻痒に対する測定、及び正常耐性と安全性評価を含む。著者らは2021年10月に主要な結果を公表し、POC試験で見られた有効性、安全性と耐性状況に基づいて、より大きな第二段階プラセボ対照臨床試験に入る前に、追加の仕事を開始し、臨床試験設計に情報を提供した
DMT 310治療中重度の酒かす鼻
2022年12月5日、我々はDMT 310を週に1回局所応用して治療中に重度の酒かす鼻までの第2段階試験のTOPLINE結果を発表した。データは炎症性皮膚病の治療方法としてDMT 310を支持したが、酒かす鼻研究はその主要な終点に達しなかった。一部の患者の酒かす鼻は確かに有意な変化が発生したが、DMT 310患者の36%は調査者の全世界評価(IGA)採点において応答者の標準に達したが、DMT 310は統計学的にプラセボと分離できず、23%のプラセボ患者は12週目に応答者の基準に達した。治療応答者の定義はIGA等級が“完全”または“ほぼ完全”であり、少なくともベースラインより2段階向上した。DMT 310群の23%の中退率がこの研究結果の原因の一つである可能性が考えられる。データをさらに評価した後、DMT 310は酒かす鼻患者に対して耐えられない可能性があり、彼らはしばしばより敏感な皮膚を有すると考えられる。
以上のことから,我々はDMT 310のこの適応を開発するためにさらなる財源を投入しないことを決定し,DM 310のこの適応についてはさらなる開発を行わないことにした。我々はざ瘡を治療するDMT 310計画に資源を集中させ続け、これは2 b期研究で見られた統計学的意義のある結果に基づいている。
大分子の局所送達のためのDMT 400
DMT 400は私たちの共同治療法ですスポンジ.スポンジ注射ではなく局所的に適用することによって、ボツリヌス毒素、モノクロナル抗体、真皮充填物またはワクチンなどの高分子の皮内送達を促進する技術。これらの巨大分子は非常に有効であり,多くの医療や美容皮膚状態や疾患の治療に許可されているが,分子構造が大きすぎて皮膚最外層の防御バリア角質層を貫通できない局所的な使用は許可されていない。そのため,現在皮膚病や疾患に対するすべての巨大分子治療案は注射が必要であり,複数回の注射が必要な場合がある。DMT 400の局所応用レジメンは,従来局所治療では得られなかった製品を使用した医療や美容皮膚疾患に対する局所治療選択を患者に提供することができると信じている
DMT 400の動作原理は,まず我々独自のスポンジ粉をスポンジ機械針状物が皮膚を貫通する治療領域に局所的に応用し,真皮に入るマイクロチャネルを作成することである。真皮ドラムや他のマイクロニードル技術とは異なり,我々独自の針刺は皮膚に1~2日間保持し,真皮ドラムを用いた後のように閉鎖するのではなく,マイクロチャネルを開放している。マイクロチャネルが長時間開いていると,巨大分子は皮膚に局所的に応用でき,真皮に浸透することができる。このような局所的に使用される巨大分子は,新たに作成されたマイクロチャネルにマッサージし,注射を必要とせずにマイクロチャネルを介して真皮への巨大分子の進入を促進すると信じている。このような方向性は体循環への送達ではなく真皮に送達され、これらの巨大分子の全身拡散を減少させ、それによって注射の副作用を潜在的に減少させ、同時に疾病の所在部位への標的応用を増加させる可能性がある
| 15 |
| カタログ表 |
DMT 410は原発性腋窩多汗症の治療
私たちは最初に私たちのDMT 410計画を使用して、私たちのDMT 400治療をテストしました。この計画は、私たちの特許スポンジ粉末の局所使用、次いでボツリヌス毒素を局所的に使用することを含み、これは巨大分子です。DMT 410は最初に1 b期POC試験で行われ、試験対象は10名の原発性腋窩多汗症患者であり、著者らのスポンジ粉がボツリヌス毒素と潜在的な他の巨大分子の皮内投与を促進できるかどうかを確定する。この研究の結果から,原発性腋窩多汗症や潜在的な他の皮膚疾患の治療に活性ボツリヌス毒素を真皮に輸送することに成功したと信じられている
市場のチャンスそれは.多汗症は生活を変える疾患であり,過度の発汗は体温調節要求に比例しない。多くの患者は特定のトリガー因子(例えば情緒ストレス)でこのような過剰な発汗を示す可能性があるが,他の人は自発的に症状を示す可能性がある。通常,多汗症の診断部分は,発汗過多が患者の生活の質にどのように影響するかを測定する主観測定に基づいている。医師も重力により汗量を測定しているが,多汗症の標準閾値は定義されていないにもかかわらず。アメリカだけで1500万人が影響を受けていると推定されている。GlobalData Inc.の市場データによると、2020年にアメリカの処方薬市場の処方薬の売上高は約6,600万ドルであり、2030年には約2.82億ドルに達すると予想され、その40%近くがボツリヌス菌注射によるものである。2016年の米国多汗症罹患率と重症度の最新報告によると、腋窩(腋窩)多汗症はこの疾患の最もよく見られる形式である。しかし、患者も手(手)や足底(足)多汗症のような他の形態の影響を受け、DMT 410は皮内注射管理の悪い研究で見られる副作用を治療および回避できる可能性があると信じている
現行の看護基準の限界それは.多汗症の罹患率は高いが,治療選択は限られており,多くの治療案が有害な副作用をもたらし,患者の受容度を低くしている。典型的な第一線治療は通常塩化アルミニウムをベースとした制汗剤であるが,多くは潜在的な欠点がある。まず、日常応用に時間がかかる可能性があり、患者のコンプライアンスが悪い。次に,多くの制汗剤は皮膚刺激性があり,治療を中止した。最後に,局所的な塩化アルミニウム治療には一時的な持続時間があり,汗コントロールを維持するためには常に繰り返し使用する必要がある。最近,Fresh Track,Inc.やJourney Medical Corporation(以前デミラ社が開発)などが局所抗コリン薬を検討しているが,非ラベルで使用されている全身抗コリン薬と同様の副作用を有することが多いと考えられる。これらの副作用は口乾、目の乾燥、視力不明瞭、頭痛、尿貯留などを含む。このような不人気な副作用は往々にして耐えられず,3分の1もの患者が治療からの撤退を余儀なくされる。もし局部或いは全身治療に失敗すれば、患者はボツリヌス毒素を皮内注射することができ、これはすでに非常に良い治療効果があることが証明されているが、治療は非常に技術によって駆動され、訓練された医師が毒素を真皮の薄層に注射する必要がある。多くの場合、ボツリヌス毒素の治療反応が良くないのは投与量が不正確或いは不足或いは投与が不正確であるためである。患者は注射部位の痛みや不快感を経験する可能性もあり,腫脹や鬱傷を伴う可能性がある。しかし、ボツリヌス毒素の皮内注射による手汗症の治療に対して、もし薬品使用が適当でなければ、最も顕著な不良事件は一過性手無力である。最後の手段として,患者は彼らの多汗症の治療に手術を求めることも可能である, もし侵襲性の小さい治療案が失敗したら。多汗症患者には治療選択があるが,疾患診断に関連する社交的に気まずいため,影響を受けた個人の約半分のみが治療を求めている。これは市場に大きな空白を残し,市場の製品はボツリヌス毒素の有効性と局所治療の安全性と耐性を結合していると考えられる。DMT 410が商業化に成功すれば、このサービス不足を解決する市場機会があると信じている。
| 16 |
| カタログ表 |
私たちは原発性腋窩多汗症に対する解決策だ原発性腋窩多汗症は特発性であるが,その機序は影響領域の分泌腺(汗腺)神経原性過活動と考えられている。ボツリヌス毒素承認のまとめによると,A型ボツリヌス毒素は多汗症に臨床効果があり,多汗症は小汗腺への交感神経刺激を撹乱することにより作用し,4~12カ月の腋窩発汗を有意に減少させることが知られている。ボツリヌス菌の包装インサートによると、ボツリヌス毒素50単位を皮内注射した後、ボツリヌス菌或いはプラセボ治療を受けた患者の中で、それぞれ81%と41%の患者は4週間後に腋窩汗の生産量が50%以上減少した。ボツリヌス毒素の皮内注射は非常に有効であるようであるが,治療は腋窩ごとに複数回注射する必要があり,これは治療医師にとって時間がかかり,真皮の薄い性質のため,投与技術に非常に敏感である。また,標的組織の性質がより敏感であることや,注射が必要な回数を考慮すると,注射部位の痛みがコンプライアンスに乏しい要因と考えられる。したがって,角質層を透過してボツリヌス毒素を真皮に輸送できる局所応用案は,類似した効果を示す可能性があるが,コンプライアンスや採取率が高いと信じられている。DMT 410で腋窩多汗症を治療した1 b期POC研究では,80%の患者で4週目に腋窩下汗量の50%以上の減少が認められた。この結果はボツリヌス毒素の局所応用が私たちの信念を支持していますスポンジ.スポンジ真皮注射技術は皮内注射の実行可能な代替方案であるかもしれない。承認された場合、DMT 410はボツリヌス毒素の皮内注射の必要性を除去することができる。したがって、DMT 410は原発性腋窩多汗症患者を治療する有利な治療選択である可能性があると信じている。さらに、DMT 410は、ボツリヌス毒素を皮内注射するように毒素を筋肉に長距離伝播するリスクがあるのではなく、ボツリヌス毒素を皮内注射するように、DMT 410がボツリヌス毒素を真皮に送達するため、手掌または足底多汗症を治療するのに有効な方法である可能性が信じられている。DMT 410は、手無力および投与疼痛を含む皮内注射の副作用を制限することができる。DMT 410が多汗症に対するFDAの承認を得ることは保証されない
美容疾患を治療するDMT 410DMT 410を用いて多汗症および他の医学的皮膚病、例えばざ瘡を治療する以外に、著者らの最近のDMT 410が多種の美容皮膚病を治療した1 b期POC試験のデータ、例えば毛穴の大きさ、皮脂産生、細紋、輝度と皮膚輝度などに基づいて、DMT 410は多種の美容皮膚病の治療に応用する機会があると信じている。ボツリヌス毒素は各種の美容皮膚状況を治療できることが知られているが、これらの積極的な効果を達成するためには、ボツリヌス毒素は筋肉ではなく真皮に輸送される必要があり、期待される効果を産生する。DMT 410独特の大きさの針状体は角質層を介して真皮に入るマイクロチャネルを作成し,これらのチャネルはボツリヌス毒素を真皮に輸送するのに十分な大きさである。しかしながら、針状体の長さは筋肉層に到達するのに十分ではなく、これは毒素の潜在的な遠隔伝播および潜在的な副作用を制限する。ボツリヌス毒素の作用はアセチルコリンのシナプス間隙への放出を阻止し,そこでコリン受容体に結合し,交感神経機能を抑制することである。このようなコリン伝達を抑制する能力は、皮脂の産生や多汗のような腺体の高分泌の指標を治療するのに適しており、この部分は過度に活発な交感神経によって引き起こされる。美容適応ではボツリヌス毒素が真皮に輸送されなければならないため,皮内注射が通常必要であるが,筋標的注射よりもより大きな表面積を覆ってこれらの美容皮膚状況を治療するためには,皮内注射は複数回投与する必要がある可能性がある。皮内注射も有効に施行することは困難であり,患者を苦痛にさせる可能性がある。これはしばしばこのような治療法が採択されないようにするだろう, これが現在承認されていない美容適応に皮内注射を使用しているためである。また,ボツリヌス毒素の局所製剤が承認されていないのは,分子の大きさや角質層を透過しにくい真皮に到達しているためかもしれない。したがって,美容皮膚条件のためのボツリヌス毒素の皮内注射や局所応用方法は承認されていないため,局所応用によりボツリヌス毒素を真皮への輸送に成功させ,患者の美学的外観を改善する製品には大きな市場機会があると考えられる。承認されれば、私たちはDMT 410がこの市場需要を満たすことができると信じている。
看護基準の限界数年来、筋肉注射ボツリヌス毒素はすでに美容治療に許可され、例えば眉間紋、目尻或いは前頭部しわを減少するが、しかし多くの他の美容皮膚状況、例えば毛穴拡大、皮脂分泌過多、細紋、輝度低下と輝度低下、ボツリヌス毒素はすでに改善作用があることが証明されたが、ボツリヌス毒素製品は皮内注射或いは局部応用を通じても、まだこれらの適応に応用されていない。これは,これらの美容適応は通常,筋ではなく真皮にボツリヌス毒素を輸送する必要があり,真皮の薄い性質により,筋への注入よりも困難である可能性があるためと考えられる。また,皮内注射が必要な顔面領域ははるかに敏感であるため,患者にとってはより苦痛である可能性がある。これらの皮内美容適応症は通常、顔面深層線に必要な筋肉に少量のボツリヌス毒素を注射するのではなく、より広範なボツリヌス毒素を真皮に散布する必要がある。いくつかの皮内研究は顔面に25-30回の皮内注射を行う必要があり、十分な数量のボツリヌス毒素を真皮に輸送することができる。一部の患者は注射を恐れているため、針を使用することを避けることができる治療方法はこれらの人々にとって望ましい。そのほか、ボツリヌス毒素の局部応用はずっと困難であり、分子の大きさによりボツリヌス毒素が角質層を貫通しにくく、多くの局部応用の無効或いは停止を招く。一例はRevanceのRT 001製品であり、魚尾紋治療の3期試験では主要または他の副次的な終点に達していないので、, Revanceは現在この計画を開発し続けるつもりはない。もう一つのボツリヌス毒素会社Allergan(現在はAbbVieの一部)は2016年に局所ボツリヌス毒素計画を開発するために会社を買収した。しかし、Allerganはまだこのプロジェクトについて何の研究もしていない。著者らは、大多数のボツリヌス毒素会社は依然としてボツリヌス毒素を局部注射する方法を開発することに興味があると信じており、この方法は苦痛が比較的に小さく、応用しやすく、更に広い毒素被覆範囲を提供し、そして毒素の潜在的な遠隔伝播を制限するが、まだいかなる製品の開発に成功していない。
| 17 |
| カタログ表 |
私たちの美容皮膚病解決策はDMT 410のような候補製品は、注射よりも大きい顔面真皮にボツリヌス毒素を輸送することに成功し、毛穴の大きさ、皮脂産生と細紋を減少させ、皮膚の輝度と輝度を改善し、筋肉注射による深層細紋の治療のためのボツリヌス毒素の市場を潜在的に拡大するなど、様々な美容皮膚状態に新しい治療選択を提供することができると信じている。DMT 410は、ボツリヌス毒素の注射に一般的に関連する疼痛および不快感が出現することなく、患者に局所治療選択を提供することができると信じている。また,皮膚科医にとっては管理が容易であり,時間が少なく,彼らが提供できる余分な価値駆動の治療選択となると信じている。現在ボツリヌス毒素は顔面筋肉注射に使用されることが許可されており、更に深いしわ、例えば眉間しわ、目尻しわと前頭部しわを治療するが、顔にはまだ多くの他の美容条件があり、ボツリヌス毒素を皮内注射することから、特に局部応用を通じて極めて大きな利益を得ることができる。ある美容指標、例えば細紋、毛穴の大きさと皮脂生成を減少し、そして光度と輝度を高めることは、通常筋肉注射による治療ではないが、ボツリヌス毒素が真皮に輸送されてから適切な効果を産生することができる。DMT 410の独特な大きさの針刺を利用して、著者らはそれが多くの真皮に入るマイクロチャネルを作ることができると信じて、それによってボツリヌス毒素の局部応用に1つの経路を提供した。ボツリヌス毒素は真皮に入ると、皮脂生成を減らす役割を果たし、逆に毛穴の大きさや肌の全体的な油性を減らすことができる。また…, ボツリヌス毒素はすでに顔面ラインの平均体積と深さに有益な影響があることが証明され、皮膚を更に滑らかに見えるようにした。したがって、DMT 410などの製品が必要である可能性があり、真皮におけるボツリヌス毒素の局所応用を促進し、様々な美容皮膚状態を治療することができると考えられる。
承認されれば、DMT 410はボツリヌス毒素の治療市場を多種の他の美容皮膚疾患に拡大する潜在力があると信じている。著者らはDMT 410は1種の有効な製品であり、生物活性ボツリヌス毒素を提供でき、毛穴の大きさ、皮脂生成、細紋、光度、輝度、全体の美観などの治療に局部的に応用できると信じている。著者らは最近DMT 410の1 b期POC試験を完成し、多種の美容皮膚状況の治療に応用し、著者らは一回のDMT 410治療後、毛穴の大きさ、皮脂製品、光度、輝度と全体美容の改善を検査した。このPOC試験で産生されたデータは、DMT 410がボツリヌス毒素を真皮に輸送でき、孔径の縮小、皮脂産生の減少、光度の改善、輝度の改善、そして患者の全体的な美しさを改善できることを示したと信じている。この研究でも有害事象は生じず,治療15分後にのみ軽微な耐性影響が認められた許容可能な耐性データを提供した。これらのデータはこの計画のさらなる発展を証明していると信じ,ボツリヌス毒素を有するパートナーを探しており,ボツリヌス毒素を真皮に輸送する必要がある美容皮膚条件の開発を希望している。DMT 410がFDAに承認されたいかなる美容適応も保証されず,パートナーを見つけて開発できる保証もない
私たちのパイロット候補製品の臨床進展は
DMT 310 2 b期にきび治療の臨床結果
2020年6月、著者らはランダム、二重盲検、プラセボ対照の2 b期臨床試験の結果を受け、この試験は週に1回DMT 310を治療してざ瘡12週間を治療した。私たちはアメリカ14カ所で181人の中から重度のざ瘡患者を募集した。患者の年齢は12歳以上でなければならず、少なくとも20(20)個の非炎症性病変、20(20)個の炎症性病変があり、2(2)個の結節または包嚢を超えず、IGAざ瘡分類中の中度または重度(すなわち3または4)である。IGA尺度は5点から構成され、0-4点、0点は明晰であり、1点は基本的に明晰であり、4点は深刻なざ瘡であり、治療医師による分級を行った。患者はランダムに2群に分けられ、DMT 310或いはプラセボ治療を受けた。患者は、この製品(DMT 310であってもプラセボであっても)を顔面全体に塗布することを要求され、週に1回、12週間持続し、2週間前にオフィスで治療を受け、訓練された研究者によって監視され、その後、患者が自宅で残りの10週間の治療を行う
| 18 |
| カタログ表 |
試験の主要な臨床終点は炎症性病変のベースライン以来の絶対的な減少を含む。2つ目の臨床の終点は:
| · | ベースライン上での非炎症性病変の絶対的な減少; |
|
|
|
| · | 応答者を有するIGAはIGAスケールが2段階変化し、研究終了時に0または1の患者である |
|
|
|
| · | 安全性と耐性です |
我々の2 b期研究のすべての統計分析とデータは,意思治療(ITT)群に関するものであった。ITT集団には、彼らがランダムにグループ化されたすべてのランダム被験者を含み、彼らが研究薬を受けたかどうかにかかわらず、彼らが研究を完了したかどうか。ITT方法は治療群の間で公正な比較を提供した
この試験は2020年6月に完成し、試験のすべての治療効果の終点、すなわち炎症性と非炎症性病変と免疫グロブリン反応者の減少に対して、統計的に顕著で、臨床的意義のある効果があると信じられている。注目すべきは,4回のみの治療後,すべての治療効果終点の治療効果は4週間で統計学的有意であり,プラセボと比較して8週目と12週目に統計学的有意差が続いたことである。4週目では炎症性病変は45%,12週目では62%に減少したが,4週目と12週目ではプラセボの炎症性病変はそれぞれ24%と42%減少した。非炎症性病変に対する治療効果は4週後にも統計学的意義があり,非炎症性病変は4週目に約36%減少した治療効果は12週で58%に達し,プラセボと比較して統計学的に有意な意義があった。また,4週目と12週目では,プラセボと比較して炎症性および非炎症性病変数が減少した割合のP値はいずれも0.001未満であった
免疫グロブリンは早期に統計学的に分離されていることもみられ,DMT 310群では15%の患者が免疫グロブリンA評価をIGA尺度上の応答者,あるいは4回の治療のみを受けた後の免疫グロブリンスコアが0,“はっきり”または1“ほぼ明瞭”であったのに対し,プラセボを服用した患者では2%強であった。この統計分離は試験の残りの部分で継続し,試験終了時,すなわち12週目にDMT 310群の44%の患者がIGA応答者であったのに対し,プラセボ群では17%であった。この差は統計学的に有意であり,P値は0.001未満であった
試験では薬物に関する重篤な副作用は報告されていない。この薬は多くの患者にも耐えられるようであり、92%を超える患者は12週間ではなく、またはやや耐性があり、深刻な乾燥、鱗屑、紅斑、または灼熱/痛みは報告されていない。耐性の問題が確実に報告されている患者では、これらの問題は通常一時的であり、介入することなく迅速に解決できると報告している。これらのデータに基づき,FDAとの面会後も第3段階臨床試験を継続し,同じ臨床終点と同じDMT 310製剤を用いて重度ざ瘡を治療する予定である
以下のグラフは、DMT 310およびプラセボのベースラインから研究終了または12週目までの炎症性および非炎症性病変の絶対的な減少(図3)、およびベースラインから研究終了またはプラセボへの炎症性および非炎症性病変の減少率を示す(図4)。非炎症性病変の減少はこの試験の副次的な終点であるが,FDA承認に必要な3期ざ瘡研究に必要な指標である

図3:DMT 310およびプラセボのベースラインから研究終了または12週目までの炎症性および非炎症性病変の平均減少
| 19 |
| カタログ表 |
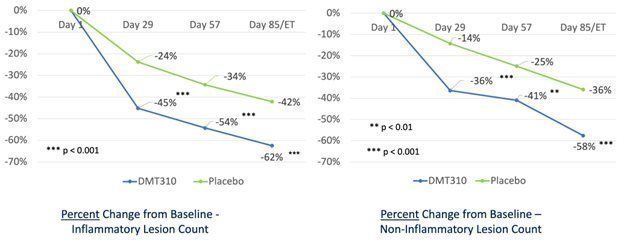
図4.DMT 310およびプラセボの炎症性および非炎症性病変のベースラインから研究終了または12週目までの減少率
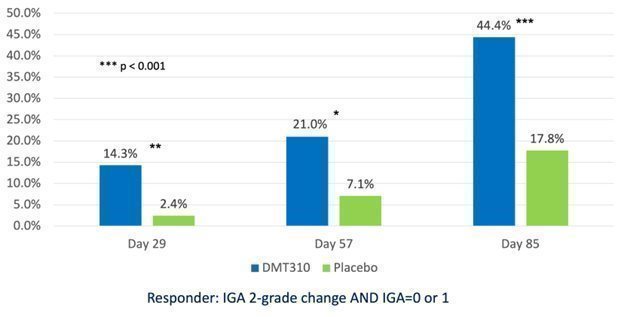
図5.29日目、4週目、57日目、8週目、85日目または12週目における調査員のグローバル評価応答率
(1) | 上の図と表に示すように、“P値”(プラセボに対して)とは、関連患者群とプラセボ群の結果との間に真の差があると断言した場合にエラーする確率を意味する。例えば,P値が0.001未満であることは,治療群の所見がプラセボ群の所見と同様である可能性が万分の1未満であることを示している。P値“が0.05以下であることは、所与の差が統計的に有意であることを意味する |
(2) | “成功”の定義は,IGAの研究完了後に得点が“明瞭”または“ほぼ明瞭”であることである |
さらに、DMT 310の安全性および耐性は受け入れられるようであり、次の図6に示すように、一部の患者が治療緊急有害事象を発生させる。この2 b期試験では,DMT 310の治療を受けた被験者は1人も研究終了時に重篤な局所皮膚反応を認めず,用量調整を受けた患者もいなかった。耐性問題の多くは軽微であり,応用直後に解決され,次の画像7に示すような救急薬は何もない。全体的に言えば、DMT 310は12週間以内に週に1回応用され、全体的に安全であり、患者のDMT 310に対する耐性は良好である
システム臓器の第一選択チームは |
| DMT 310 (N=91) N (%) |
| プラセボ (N=90) N (%) |
全身性障害と投与部位の状況 |
| 5(5.5) |
| 2(2.2) |
応用部位紅斑 |
| 4(4.4) |
| 1(1.1) |
応用部位掻痒 |
| 2(2.2) |
| 2(2.2) |
応用現場乾燥 |
| 1(1.1) |
| 0(0.0) |
応用現場剥離 |
| 1(1.1) |
| 0(0.0) |
図6.突発的な有害事象の治療
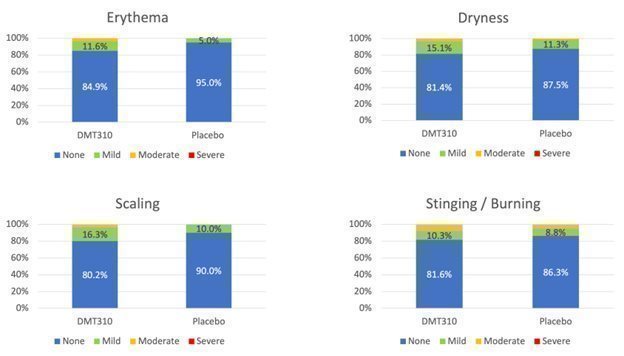
図7.局所許容度
DMT 310 2 a期にきび治療の臨床結果
2018年、著者らはDMT 310の第1回臨床試験を行い、これはランダム、二重盲検、2 x 2因子、プラセボ対照のDMT 310によるざ瘡治療の2 a期臨床試験である。DMT 310と3%H混合の耐性、安全性、有効性を評価するために121名の患者を募集しました2O212週間の局所投与を経て、男性と女性の顔面に重度のざ瘡患者がいた。この研究では,研究製品の成分ごとの貢献を2 x 2外因設計を用いて評価している(すなわち,湖のスポンジ外用粉剤と3%H2O2 USP).以上のように,この2 a期臨床試験は,われわれがざ瘡を治療したDMT 310 2 b期臨床試験と同様の臨床終点を用いた
| 20 |
| カタログ表 |
患者はランダムに4つの治療群に分け、DMT 310+3%H2O2DMT 310+水、プラセボ+3%H2O2プラセボ+水(対照群)。患者は,投与された研究薬を1日目から78日目まで顔面全体に塗布することを要求され,最大12週間(84日)持続した。29日目と57日目の研究センター訪問中、調査者のグローバル評価(IGA)スコアに基づいて、各患者のための研究薬物応用が週1回か低い2週間頻度(2週間に1回)で継続するかを決定した。具体的には、29日目または57日目に免疫グロブリンA>1の患者は、週1回の研究薬物使用を継続し、これらの同じ治療において、免疫グロブリン1の患者は、その後、2週間毎に投与された研究薬を適用するように指示された(以下の画像8を参照して、薬物応用頻度アルゴリズムの研究を紹介する)
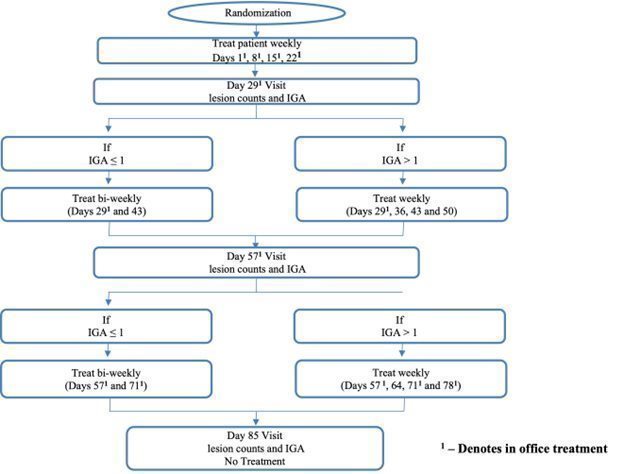
図8.学習によるアクセス頻度アルゴリズムの適用
この2 a期試験により、DMT 310+3%Hと比べ、その終点、炎症性病変の絶対的な減少は統計学的意義と臨床的意義があることを示した2O28週目と12週目または研究終了時にプラセボ+水群(対照群)であった。12週目、DMT 310+3%H2O2 プラセボ+水はベースラインより16病変減少したが、プラセボ+水比基準は11病変減少し、p値は0.05より小さかった。すべての治療群において、15、29、57および85日目に、炎症性および非炎症性病変数はベースラインより平均的に減少(すなわち改善)した。しかし、DMT 310+3%H間の差は統計学的有意差がなかった2O2プラセボ+水(対照群)群と比べ、非炎症性病変計数はベースラインより平均的に変化した
DMT 310+3%H間の統計学的差は認められなかった2O2 両群とプラセボ+水(対照群)群の免疫グロブリンA治療成功(IGA採点は1或いは0、レベル2に変化)或いは任意の受診時にIGAはベースラインよりレベル1或いは2級を改善した患者のパーセンテージ。DMT 310における85日目+3%H2O2DMT 310+水、プラセボ+3%H2O2プラセボ+水群と、それぞれ29.6%、20.0%、27.6%と34.5%の患者はIGA治療反応があった;66.7%、66.7%、65.5%と55.2%の被験者のIGAはベースラインより1級改善した;37.0%、20.0%、27.6%と34.5%の被験者IGAはベースラインより2級改善した
プラセボの分析:試験中の臨床調査者と話した後、非炎症性皮膚損傷のプラセボ反応が正常レベルより高いことを確定した部分はプラセボの粘性による可能性があり、これは患者が顔面を洗浄する必要があり、皮膚剥離と皮脂閉塞(白頭と黒頭)の除去を招き、それによって非炎症性皮膚損傷の数量を減少させる。これによるプラセボ応答率は,他の局所2期ざ瘡試験におけるプラセボ応答率よりもはるかに高いと考えられる。プラセボ不足のため、著者らは2 b期の臨床試験のために新しい独自のプラセボ配合を開発した
週に1回と2週間に1回の治療計画:DMT 310が中から重度のざ瘡患者まで12週間の研究を行ったのは初めてであるため、患者の耐性と安全性を確保し、同時に治療効果を維持しようと試みる保守的な研究設計を選択した。そこで,上述したように,IGA治療応答者(IGAスコア0または1)を2週間または1週間ごとに適用することを許可した。これにより27人の患者のうち3人がDMT 310+3%Hを患っています2O2 プラセボ+水剤群の29名の患者のうち0名の患者の8週目のIGAスコアは1(治療反応者)であり、12週目に2(治療失敗)に回復した。したがって、我々のDMT 310は、重度ざ瘡患者における2 b期の臨床試験には、12週間に1回の毎週適用のみが含まれており、2週間の選択肢はなかった
プラセボ+3%Hの間に統計学的または臨床的差はなかった2O2 プラセボ+水群ではHの3%が2O2 それ自体は治療効果がない
DMT 310ざ瘡治療の次のステップ
著者らは現在必要な非臨床と薬物動態学研究を行っており、完成すれば、2023年上半期にFDAとの第二段階会議を終了し、中重度ざ瘡治療の第三段階計画の方案を検討し、最終的に決定する予定である
| 21 |
| カタログ表 |
FDAとの第2段階会議が終了し、第3段階の継続の承認を得ることができると、重度のざ瘡の治療に使用するために、DMT 310の重要な第3段階計画を開始する予定である。この3期計画は2つの多中心のプラセボ対照試験を含み、それらの臨床終点は著者らが最近成功した治療中の重度ざ瘡のDMT 310 2 b期の臨床試験と同じであると予想される。この2つの3期研究の主な結果を受け取ると,結果が積極的であると仮定し,近いうちに新薬申請やNDAをFDAに提出する予定である。この第3段階計画は、DMT 310治療における重度ざ瘡の安全性および有効性をプラセボと比較して証明することを目的としている。我々が計画している第3段階計画の前または同時に,NDA提出に必要な他の非臨床研究を継続して完成させる予定である。私たちはまた長期的な安全研究を行うつもりだ。DMT 310がざ瘡の治療のために承認された場合、DMT 310は、最終的に非処方薬のスイッチまたは非処方薬の標的への処方の魅力的な処方になることができると信じており、これは、より大きな販売機会を提供する可能性がある。DMT 310がざ瘡の治療のためにFDAの承認を得ることは保証されない
DMT 310 1 a期乾癬治療の臨床結果
著者らはDMT 310による軽~中度乾癬治療の1 a期POC試験を完了した。これは開放型、多中心、12週間の研究であり、研究対象は30名の皮膚損傷が体表面積の2-30%を占める軽中度乾癬患者である。この実験はDMT 310の週1回の治療の耐性、安全性、有効性を評価することを目的としており、DMT 310は2グラムからなるスポンジ.スポンジ3%Hを6 ml混合した粉末2O2それは.軽度または中等度の病変を選択し,病変全体のDMT 310治療を求め,週1回,12週連続,前2週間にオフィスで治療を受け,訓練されたスタッフの監督下で行い,残りの10週間の治療を自宅で行った。
本研究における端末は,以下のとおりである
| · | 医師の疾患の重症度に対する全世界評価(PGA)は,目標病変部位にないあるいは非常に軽微な疾患と定義することに成功し,5点制でそれぞれ0点または1点を得た。 |
|
|
|
| · | 目標皮膚損傷部位の乾癬面積重症指数(PASI)は無或いは軽度と定義され、それぞれ0或いは1であり、満点は6点である。これは、各乾癬患者の鱗屑、紅斑およびプラーク挙上の症状スコアが0または1であることを要求し、被験者が応答者とみなされる。 |
|
|
|
| · | 掻痒視覚シミュレーション採点(VAS)、掻痒(掻痒)患者のベースライン以来の平均変化とパーセンテージ変化を観察した。 |
すべての治療効果分析はAS治療群を用いて行われ、AS治療群は少なくとも1つの研究薬物を受けたすべての登録患者から構成され、Per方案群は研究期間中に重大な違反方案がないすべての登録患者から構成され、これは治療効果分析に影響する。
この試験は2021年8月に完了し,許容可能な安全性と耐性を示し,臨床的意義があると考えられ,軽~中等度乾癬の潜在療法としてDMT 310をさらに検討する価値がある。8週目、DMT 310の目標皮膚損傷に対するPGA採点は0または1に達した割合は29.6%であった。8週目、25.9%の患者の目標皮膚損傷のPASI総得点は0または1であった。注目すべきは、DMT 310の8週目の掻痒(掻痒)症状は治療前より19.6%減少し、ピークは22.5%低下したことである。POC試験のこれらの発見は鼓舞的であり,DMT 310は応用しやすい軽中度乾癬を局所的に治療する方法として,許容可能な安全性と耐性を有すると信じている
試験では薬物関連の重篤な有害事象は報告されておらず,2つの治療緊急有害事象のみが報告されており,いずれも応用部位の掻痒であった。また、この薬も多くの患者に耐えられているように見える。確実に耐性の問題が報告されている患者では,これらの問題は通常一時的であり,介入なしにすぐに解決すると報告している
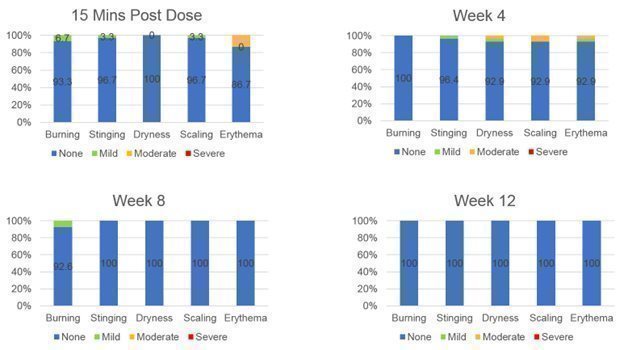
図9:局所許容度
| 22 |
| カタログ表 |
DMT 310乾癬治療の次のステップ
われわれの第1段階POC試験で見られたデータをうれしく思い,特にかゆみの減少が見られたことは,乾癬患者の主な主な主訴の一つであるためである。我々は,DMT 310による乾癬治療の第2段階研究を設計している。第二段階研究はもっと大規模な無作為、二重盲検、プラセボ対照研究であり、DMT 310は乾癬の治療に応用される。1 b段階概念検証研究のデータに基づいて,より多くの武器を増やして週1回の治療を検査し,我々の1 b段階試験における治療効果を潜在的に増強することを考えている。また、乾癬の独特な性質と乾癬プラークの一般的な厚さのため、著者らは応用圧力の増加と応用時間を増加させることも考えられる。皮膚を厚くしていないざ瘡応用レジメンと比較して、厚い乾癬プラークはより密集した治療が必要である可能性が考えられる。DMT 310は乾癬患者の一流の治療選択である可能性があると信じている。乾癬治療のDMT 310計画は現在棚上げされており,追加資金および/または戦略的パートナーを獲得した場合にはさらに進められる。乾癬の治療のためにDMT 310がFDAの承認を得ることは保証されない。
DMT 410ステージ1 b−原発性腋窩多汗症
2019年第1四半期、著者らはDMT 410治療中の重度原発性腋窩汗症の1 b期開放ラベルPOC試験を完成した。この研究では,我々の特許スポンジ粉を1回適用し,各腋窩にボツリヌス毒素を局所的に適用し,各ラベルを1回再構成し,10名の患者を治療した。患者は4週間追跡され,その後汗量を測定し,ベースライン測定と比較した
本実験の端末は,以下のとおりである
| · | 体重測定汗量がベースラインより50%以下減少した患者の割合は |
|
|
|
| · | 体重が50ミリグラム以上の患者の割合と |
|
|
|
| · | 重力汗による百分率変化 |
4週間後、80%の患者の体重汗量は50%を超え、85%の患者の体重汗量は50 mg未満であり、患者の体重汗量はベースラインより75%減少した。これらの臨床データから,ボツリヌス毒素の真皮への局所応用により原発性腋窩多汗症を治療できると信じられている。DMT 410の治療もまた、許容可能な安全性および耐性を有する。著者らはボツリヌス毒素と協力して、DMT 410に対してより大規模な第二段階研究を行い、腋毛症に応用し、手掌(手)或いは足底(足)多汗症に応用する可能性があり、現在まだ承認されていない製品である。DMT 410がFDAの承認を得て多汗症の治療に使用されることは保証されない
DMT 410フェーズ1 b-美学的条件
2020年11月、著者らは著者らの最初の患者を募集してDMT 410の1 b期開放ラベルPOC試験に参加し、上顔面しわ及びその他の多種の真皮毒素伝達の影響を受ける美容皮膚状況、例えば毛穴の大きさ、皮脂生成、輝度、光度、細紋と全世界の美容改善の治療に用いた。ボツリヌス毒素製品を得る権利がないため,FDAはボツリヌス菌の承認適応,上部紋路,この適応の承認用量(64単位ボツリヌス毒素)と承認された投与経路(通常は真皮注射ではなく筋肉注射)を用いてこの試験を行うことが求められている。しかし、著者らの主な興味は筋肉ではなくボツリヌス毒素を真皮に輸送する必要がある美学的皮膚条件に対するDMT 410の臨床効果を研究することである。これは,DMT 410は筋肉ではなくボツリヌス毒素のみを真皮に輸送し,ボツリヌス毒素の効果を真皮に出現する美容条件,例えば細紋,毛穴の大きさ,皮脂産生などに制限すると信じているからである。これらの制限があり,POC試験を開始し,年齢18歳以上の女性患者10名を募集し,各患者は1回のDMT 410治療を受け,我々の特許スポンジ粉の局所使用を含め,一度にボツリヌス菌を局所使用し,ラベルにより組換えし,上面部に行った。患者は、私たちのゴールの達成および効果の持続時間を決定するために、16(16)週間追跡された。安全性と耐性データも収集した。我々は2021年11月にこの研究の主要なデータを受け取り,DM 410が様々な美容皮膚疾患のさらなる研究に使用されていることを証明するのに十分な結果が得られたと考えられる
| 23 |
| カタログ表 |
本実験の終点は,
| · | 顔面しわレベル(FWS)による対外斜角,前額と眉間線の評価が無または軽度の患者の一部であり,この尺度は5点からなり,0点はないことを示し,1点はほとんどないことを示した。応答者と思われるためには,患者も医師も点数について合意しなければならない。 |
|
|
|
| · | グローバル美容改善スコア(GAIS)によると,医師の孔径サイズ改善の評価で改善した患者の部分は,0点が無改善,1点が25%以下の改善,2点が26−50%の改善,3点が51−75%の改善,4点が76−100%の改善であった。 |
|
|
|
| · | 10点視覚シミュレーションスケールの輝度とベースラインの平均値およびパーセント変化に基づく。 |
|
|
|
| · | スケールの輝度とベースラインの平均値およびパーセント変化を10点視覚に基づいてシミュレーションした。 |
|
|
|
| · | 一部の患者は医師の眼底細紋に対するFWS評価で2段階の改善を達成した。 |
治療効果分析はITTと各レジメン(PP)で行われており,これはすべての患者が重大なプラン違反なしに研究を完了したことを意味している。上に示した医師測定の終点に加えて,Canfield Scienceの2次元VISIAと3次元Primosイメージング技術を実施し,多くの美学的終点の客観的な分析を提供した
前頭部線,目尻線,眉間線の評価によると,この研究では反応があると思われる患者はおらず,一部の患者は研究過程全体で少なくとも1つのレベルの変化を確実に実現している。この結果は意外ではなく,ボツリヌス菌はこれらの適応の筋注射のみが許可されているため,真皮外から遠隔地から筋に伝播する潜在的な毒素が見られるとは信じられない。毒素の潜在的な遠隔伝播がないことを見ることは、DMT 410が注射よりも大きな治療領域に適用可能であるが、不必要な顔面影響をもたらす可能性のある真皮外に拡散しないように、重要な安全データを提供するので、私たちにとって鼓舞的である。
DMT 410の真の潜在力は美容終点であり、筋肉ではなくボツリヌス菌を真皮に輸送することによって審美終点に影響を与えることができると信じている。これらの臨床終点は孔径の大きさ、全体の美観改善、輝度、光度と微細線を含む。次の表(図10)は、毛穴サイズの改善または全体的な毛穴サイズの減少を示し、患者の毛穴サイズは少なくとも25%改善され、GAIまたは皮膚品質の全体的な改善を評価するために使用され、患者のGAIは少なくとも25%改善され、輝度または皮膚の色およびテクスチャの総合的な一貫性を評価するために使用され、患者の輝度は少なくとも1点改善され、患者の輝度または顔面反射光領域の強度は少なくとも1点改善される
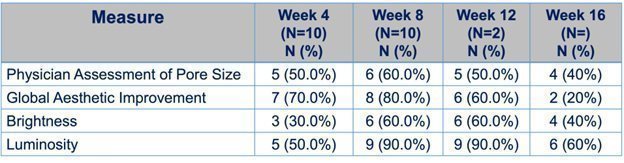
図10:美的終了点
| 24 |
| カタログ表 |
医師が測定した終点に加えて,Canfield Scienceの2次元VISIAと3次元Primosイメージング技術を用いていくつかの重要な終点に関する他の客観的なデータを収集した。VISIAシステムによると、患者は4週間で毛穴数が14.1%、毛穴面積が14.3%減少した。患者は4週間でしわ数が16.5%、しわ面積が11.5%減少した。Primos画像分析を用いて、深い顔線からなる平均線は12.1%減少し、浅層細線からなる平均粗さは6.5%減少した。治療医が見た主観的効果はCanfield撮像システムを用いた客観的測定によりさらに検証されたと信じている。
試験では薬物に関する有害事象は報告されていない。本薬剤に対する耐性は良好であるようであり,治療15分後にのみ軽微な刺痛や紅斑が報告されており,4,8,12あるいは16週目に耐性の問題は報告されていない。
DMT 410美学の次のステップ
DMT 410が多種の美容皮膚疾患を治療するための1 b期POC試験の結果を非常に鼓舞した。これは臨床試験設計制限に基づくDMT 410シグナル検出試験であり、著者らが応用できるボツリヌス菌の数の制限、必要な臨床終点、および治療可能な顔面領域を含む様々な美しい皮膚状態を治療するためのものである。これらの制限があっても,この計画の継続を保証するのに十分な結果が得られていると信じており,依然として承認されていないボツリヌス毒素は,注射でも局所でも治療効果の多くの終点を見ている。多くのゴールが8週目または12週目(12)週に改善され、16週目からベースラインレベルに回復したことは、さらにこの事実を支持していると考えられる。これは、ボツリヌス菌が効果が消退するまで約3(3)カ月継続しているという知識と一致する。多用量のボツリヌス毒素を含むより大規模な第二段階臨床試験を行うことができれば、毛穴の大きさ、皮脂産生、細紋、光度、輝度と全体の美学改善を含む各種の美容皮膚状況を治療する最適な用量を見つけることができると信じている。ボツリヌス毒素はこれらの端末に対する治療効果を示していることが知られているが、最適な用量または投与プログラムに関する研究は少なく、これは、多くのこのような美容皮膚疾患を治療するために、ボツリヌス毒素を十分な大きな治療領域に効率的に送達することができる局所応用が不足しているためである可能性がある。DMT 410はこの需要を満たすことができると信じていますステージ1 bのデータが示すように, そこで,ボツリヌス毒素社とのパートナーシップを積極的に求めており,多様な美容皮膚条件に適したDMT 410計画のさらなる開発を支援することに興味を持っている。ボツリヌス毒素会社との協力パートナーシップの構築に成功することは保証されず、DMT 410がFDAの承認を得て、いかなる美容皮膚疾患の治療に使用されることも保証されない。
製造業
私たちは今のところ何の製造施設も所有したり運営したりしていませんし、近い将来にどんな製造施設を持つつもりもありません。我々は,我々の第三者パートナーに依存して臨床前研究や臨床試験のための製品を生産してきたが,候補薬物が承認されれば,短期的にはこれらのパートナーに依存して我々の薬物物質や医薬製品の商業生産を継続する可能性がある。我々の候補製品の活性医薬成分又は原料薬の製造には、天然由来から抽出された原材料が必要である
私たちはこれまで天然由来のスポンジ.スポンジ原材料はロシアでの私たちの供給者たちから直接来た。2020年2月に私たちはサプライヤーと独占供給協定に署名しましたスポンジ.スポンジ原材料.原材料.私たちのサプライヤーは20年以上スポンジを収集と加工した経験があり、大量のスポンジを収集と加工する能力がありますスポンジ.スポンジ毎年です。私たちのサプライヤーは、候補製品がこれらの原材料の使用を許可されれば、私たちの開発と潜在的なビジネスニーズを満たすために十分な量の原材料を収穫し続けることができると信じています。私たちは二つの荷物を受け取りましたスポンジ.スポンジ2022年度のサプライヤーからの原材料、追加数量が含まれていますスポンジ.スポンジ原材料、私たちはこれが私たちに十分な数のスポンジ.スポンジ中から重度のざ瘡に対する2つの第3段階研究を開始し、完成させ、2つの第3段階研究を成功させた場合、ざ瘡を治療するDMT 310の新薬申請の提出を支持する。しかし、私たちは、私たちが十分な製造能力を得ることができ、費用効果に合った方法で任意の候補製品に対する潜在的な需要を満たすことができるように、他の製造源を模索している“ビジネス-材料協定-デマタ治療有限責任会社とレカ農場有限責任会社との間の供給協定”を参照“私たちの供給情報をもっと知っていますスポンジ.スポンジ.
| 25 |
| カタログ表 |
我々が開発可能な任意の候補薬物の開発や商業数は,FDAと承認を求めている他の管轄区の規制機関の要求に応じて収穫,施設での製造,加工を行う必要がある。私たちは現在私たちの製造請負業者を管理するために内部資源を雇用している。私たちの候補薬物製品の関連メーカーは、彼らが現在の良好な実験室規範またはcGLPとcGMPに適合していることを通知した
私たちは私たちの完全なサプライチェーンに依存して、私たちの第一段階と第二段階の臨床供給需要を支持し、私たちのメーカーは私たちの第三段階の臨床研究と将来のビジネス約束を支援するために、私たちのプロセスを拡張することができると信じています。私たちのサプライヤーと製造業者は、その組織の能力、規制に対する彼らのコンプライアンス、彼らの人員、および彼らの設備のタイプと能力に基づいて具体的に選択されている。生産過程における各段階の試験方法が制定されており,原材料獲得から完成品薬物の生産まで,ヒト使用の臨床材料に関するFDAの適切な規定に満足している。我々の生産運営の各段階(製品発表を含む)に関する分析方法や操作手順は引き続き発展し,我々の第3段階臨床用品·商業生産全体開発計画の一部として検証されるであろう
商業化する
私たちの発展段階を考慮して、私たちは現在、内部販売、マーケティング、流通インフラや能力を持っていない。承認されれば、皮膚科医に集中した専門販売組織を構築することによって、DMT 310または私たちが開発に成功する可能性のある任意の他の候補製品を米国で商業化する予定である。約50−60人の販売代表からなる科学志向の顧客中心のチームが,米国で最も潜在力のあるDMT 310を処方する目標皮膚科医に触れることができると信じている。将来、私たちは独立して、または戦略的パートナーと共に、より多くの地理的地域のためにDMT 310を開発および商業化するかもしれない。DMT 310が承認された場合、私たちはそれを商業化することに成功し、DMT 310は最終的にOTCへの魅力的な処方の変換目標となることができると信じており、これは、より大きなアドレス指定可能な市場およびより大きな販売機会を提供するであろう
競争
我々が計画経営している医療や美容製薬業界は競争が激しく,実践的に変化する可能性がある。私たちは私たち独特の自然技術、知識、経験、資源が私たちに競争優位を提供してくれると信じているが、私たちは多くの異なる源からの競争に直面する可能性があり、私たちの現在のプロジェクトに関連して、あるいは私たちは未来に開発または商業化された任意の他の候補製品を求めることができる。可能な競争相手には、製薬会社、学術·医療機関、政府機関、および公共および個人研究機関が含まれるかもしれない。これらの潜在的な競争相手は、製品の有効性、安全性、価値を実際および潜在的な顧客に伝達することを含む、承認された製品を効果的に商業化、マーケティング、普及させる能力がある
私たちの多くの潜在的な競争相手は私たちよりも多くの製造、財務、研究開発、人員、マーケティング資源を持っている。我々の潜在的な競争相手は、FDAや外国規制機関のマーケティング承認を得る上でも、より多くの経験と専門知識を持っている可能性がある。製品開発、テスト、承認と普及以外に、製薬業の他の競争要素は業界統合、製品品質と価格、製品技術、名声、顧客サービスと技術情報の獲得を含む。したがって、私たちの潜在的な競争相手は、私たちと競争またはより優れた製品を開発し、私たちよりも侵略的に競争し、より長い間その競争優位性を維持することができるかもしれない。競争に直面して、私たちの製品は時代遅れになったり、経済的実行可能性が足りないかもしれない
承認された場合、DMT 310の成功に影響を与える重要な競争要因は、その治療効果、安全性、管理および交付の利便性、価格、および政府および他の第三者支払者から補償を得る可能性である可能性がある。重度ざ瘡の治療に用いられるDMT 310については,承認されれば,主に他の外用製品,口腔製品,オフィスプログラム(例えばレーザー手術),非処方薬,非処方薬,ホメオパシーなどの療法と競合する。軽中度乾癬の治療に用いられるDMT 310については,承認されれば,局所療法,経口療法,全身療法,写真療法,ホメオパシーからの競争に直面する。しかし,われわれの臨床試験によると,DMT 310は現在の治療レジメンに比べて多くの競争優位性を有し,副作用は有意に少ないと考えられる。これらの適応における我々の主な競争は,Vyne治療会社,Sol−Gel技術有限会社,Arcutis BioTreateutics社,Almirall S.A.,Galderma S.A.およびファイザーからの製品である私たちの主な候補製品の業務-臨床進展私たちは完成し、進行中の臨床試験の結果を達成した。DMT 310に類似した潜在的な局所競合製品がざ瘡および乾癬の治療のために使用されていることは知られていないが、このような潜在的な類似競争製品は現在開発中である可能性がある
| 26 |
| カタログ表 |
私たちはまだDMT 410の臨床開発の初期段階にあり、様々な医療および美容皮膚状態および疾患を治療するために使用され、もし私たちが将来マーケティングの承認を得たら、局部製品、口腔製品、オフィスプログラム(例えばボツリヌス毒素注射)、非ラベル薬物、非処方薬、およびホメオパシー、および他の市場に適した新しい参入者のような伝統的な療法と競争する
私たちはまた、適切なパートナーやパートナーを探す努力の中で競争に直面して、私たちの候補製品の組み合わせが私たちの目標商業市場での商業化を助けることを願っています
知的財産権
概要
私たちのビジネスの成功は、DMT 310、DMT 400、DMT 410および私たちの将来の任意の候補製品、医療デバイス、方法学、分析、薬物開発技術、収穫プログラム、技術ノウハウの独自の保護を獲得および維持する能力があるかどうかにある程度依存し、他人の独占権を侵害または他の方法で侵害することなく運営され、他人の侵害を防止するか、または他の方法で私たちの独占権を侵害することを防止する。私たちの戦略は、私たちの候補製品に関連するアメリカと外国特許出願の提出と、私たちの業務の発展と実施に重要な他のノウハウ、発明、および改善によって、私たちの独自の地位を保護することです。また、ビジネス秘密、商標、ノウハウ、持続的な技術革新、排他的プロトコル、秘密および秘密協定、ライセンスプロトコル、発明譲渡、および潜在的なライセンス内機会に依存して、私たちの独自の地位を発展させ、維持しています
特許組合
私たちの特許産業にはライセンス内特許出願と独資特許出願が含まれている。一般に、私たちは最初に米国の臨時特許出願を提出し、その後、直接または特許協力条約(PCT)に基づいて出願を提出する国際特許法条約であり、任意の指定されたメンバー司法管轄区域および国(米国を含む)に発明特許保護の統一的な手続きを求めるために単一の初期特許出願を同時に提出することを規定している。PCT出願は特許として発行されていないが、出願人は後に提出された国家段階出願によって任意の加盟国で保護を求めることを許可している。私たちの現在の特許の組み合わせには複数の特許または特許出願があり、引き続き私たちのすべての候補製品のためにより多くの特許カバー範囲を求めるだろう
DMT 310
我々のDMT 310製品の組み合わせは、2つのシリーズを含み、1つは許可範囲内であり、もう1つはDermataによって所有される。許可された家族は、ヴェラニ社が許可を得た皮膚疾患の治療組成物および方法に関連する特許および特許出願を含む。ライセンス内の組み合わせは、係属中の非一時的米国特許出願、2つの許可された米国特許、およびオーストラリア、ブラジル、カナダ、フランス、ドイツ、アイルランド、イタリア、メキシコ、ロシア、シンガポール、韓国、スペイン、スイス、およびイギリスの許可された外国特許を含む。また、日本で発行された外国特許は無効になり、これ以上有効ではない。これらの特許は、特許期限の調整や延長を行うことなく、2022年から2023年の間に満了または満了することが予想される。FDAによってDMT 310によるざ瘡治療の予想期間が承認される可能性があることによれば、2022年および2023年に満了した特許は、これらの特許が候補製品の保護を提供しないことが予想されるので、私たちの業務に重要ではない。私たちの知的財産権の組み合わせは、DMT 310と私たちの他の候補製品の任意の潜在的なNCE独占経営権によって保護され、原材料需要に対する私たちの独占供給プロトコルを維持し、私たちの独自の情報を保護するために努力していくと予想されます。私たちはまた、DMT 310に関連するDermataファミリーを持っており、アメリカ、オーストラリア、カナダでの申請が行われている。この一連は、DMT 310原料薬および医薬製品の特定の属性と、その提出前に受信されたデータに基づいてざ瘡を治療するための治療関連属性とを意味する。この特許シリーズ中の特許が承認されれば,2039年に満了する予定であり,いかなる特許期限の調整や延長も行われない
| 27 |
| カタログ表 |
DMT 410
私たちのDMT 410ポートフォリオには、デマタが所有する2つの家族が含まれています。第1の家族は、オーストラリア、カナダ、中国、欧州特許庁、日本および韓国からの係属中の米国非臨時特許出願および6つの係属中の外国特許出願を含む。これらの特許出願は、医療および美容皮膚状態および疾患の治療のための、我々固有のスポンジ粉末を使用して複数のボツリヌス毒素と組み合わせて皮膚疾患を治療するための組成物に関する。この特許シリーズ中の特許が承認されれば,2039年に満了する予定であり,いかなる特許期限の調整や延長も行われない.第二の家族は著者らのいくつかの臨床方法と関係があり、海綿粉とボツリヌス毒素と関係がある。第2のシリーズは、米国の非臨時出願とPCT出願からなる。この特許家族における特許は,承認された場合,2041年に満了することが予想され,特許期限の調整や延長はない
DMT 400
私たちのDMT 400ポートフォリオには、デマタが所有する3つの家族が含まれている。第1シリーズには,米国,カナダ,日本で行われている申請が含まれており,我々のスポンジ粉末を多くの承認され開発段階にあるモノクロナル抗体と組み合わせて皮膚病の治療に用いている。この特許シリーズ中の特許が承認されれば,2039年に満了する予定であり,いかなる特許期限の調整や延長も行われない.第2のシリーズは、真皮充填剤と私たち独自のスポンジ粉末との組み合わせによる疾患治療組成物を含む、米国、オーストラリア、日本および韓国で処理される出願を含む。この特許家族内の特許が承認されれば,2040年に満了することが予想され,特許期限の調整や延長はない。第3のファミリーは、疾患を治療するためのワクチンと組み合わせた組成物を含む2023年1月に提出されたPCT出願を含む。
我々の特許の組み合わせは、DMT 310、DMT 410およびDMT 400および他の併用療法に重要な保護を提供すると信じているが、我々の特許が提供する保護は、以前未知の化学構造を要求する特許提供の保護よりもある程度限られている可能性がある。したがって、他の当事者は、例えば、我々の特許請求の範囲を中心に設計された競合的な局所製剤を独立して開発または取得することによって、同じまたは同様の有効成分を含むことができ、または求めることによって、私たちの特許を無効にすることができる
個別特許の期限は、このような特許を取得した国の法律にかかっている。私たちが出願したほとんどの国では,特許期間は非仮特許出願の最優先出願日から20年である。しかし,FDAの要求を遵守したり,米国特許商標局やUSPTOが起訴中に遭遇した遅延による遅延により,米国特許の有効期限を延長することができる。例えば、ハッジ·ワックスマン法は、FDAが承認した薬物が特許満了後に最大5年間の特許期間を延長することを許可する。特許期間の延長の長さは,薬物が規制審査を受ける時間の長さと関係がある。特許延期は、製品承認日から14年を超えることができず、承認された薬物に適用される特許を延長することしかできない。ヨーロッパおよび他の管轄区域にも同様の規定があり、承認された薬物をカバーする特許の期限を延長する。将来、私たちの候補製品がFDAの承認を受けたら、私たちはこれらの候補製品をカバーする特許出願のために特許期間を延長する予定です。私たちは任意の管轄区域で特許期間の延長を求めるつもりで、あれば、私たちも条件を満たす特許がある可能性があります。しかし、米国特許商標局と米国FDAを含む適用当局が、この延長を承認すべきかどうか、この延長の長さを承認すべきかどうかの評価に同意する保証はありません
| 28 |
| カタログ表 |
他の知的財産権
特許保護に加えて、非特許技術のノウハウ、技術革新、技術仕様、分析、および他の独自の情報を含む商業秘密に深刻に依存し、私たちの競争優位性を発展させ、維持しようとしています。私たちは、私たちの非特許技術と商業秘密を保護する能力が、私たちの特許の組み合わせよりも重要でなくても、同様に重要だと信じている。これらの情報は複雑で、期限が切れていないからだ
私たちはアメリカと他のいくつかの管轄区域で商標保護を求めています。もし可能であれば、私たちが適切だと思う時に。私たちは現在アメリカと他の多くの司法管轄区域にDermataを登録している。私たちはアメリカを含む異なる司法管轄区域で私たちの治療薬候補に関連する商標登録を申請するつもりです
材料協定
デマタ治療有限責任会社とヴェラニ社の間の許可協定
2017年3月31日、Villaniは、ライセンス契約(またはライセンス契約)をVillani,Inc.(またはVillani)と締結し、この合意に基づいて、Villaniは、ライセンス特許(例えば、ライセンス契約の定義)に基づいて、以下の内容を含む製品を制定、開発、求め、規制機関の承認、製造、または販売を求めるために、独占的、分割可能な許可、印税のある許可(またはライセンス)を付与した湖のスポンジ特定の許可技術(おそらく製品)を使用して開発されたざ瘡、酒かす鼻、乾癬、アトピー性皮膚炎、脂漏性皮膚炎、光化性角化症および湿疹を含むが、これらに限定されない皮膚疾患、障害および状態を治療するための、単独でまたは他の活性または不活性成分と組み合わせて使用するための方法。我々は研究開発(製造、包装、非臨床研究、臨床試験、監督部門の許可を得ることを含む)と商業化(マーケティング、普及、流通などを含む)を担当する。すべての許可された製品に適用される
許可証の一部として、ヴェラニに対する40万ドルの未返済融資を免除し、将来的にヴィラニに記念碑的な支払いを支払うことに同意した。ライセンス契約に基づいてヴェラニに支払われるべき記念碑的支払いは、私たちが締結した第2の許可修正案(以下の定義)に関する以下の金額に改正されました
ライセンス契約は、(I)いずれか一方が重大な違約について90日間書面で通知することができ、または重大な違約がその通知期間内に訂正されていない場合、30日前に許可協定の終了を通知することができる;(Ii)いずれかの一方が自発的な破産手続を開始し、解散または終了した場合、いずれか一方に書面通知を出した後に直ちに許可協定を終了することができ、(Iii)いずれか一方が非自発的破産手続の制約を受けている場合は、書面通知のいずれか一方が直ちに許可協定を終了し、当該等の手続が90日以内に撤回または保留されていない場合
ライセンス契約には賠償、知的財産権保護、機密性、救済措置と保証などに関連する習慣条項が含まれている。
2019年6月4日、ヴェラニとライセンス修正案と和解協定(または第1ライセンス修正案)を締結した。最初のライセンス修正案によると、Villaniに合計750,000ドルの記念碑的支払いを支払い、交換として、私たちの1 cシリーズ優先株の5,221,156単位をVillaniに発行しました(これらの単位は、私たちがデラウェア州社に変換する過程で私たちの1 cシリーズ優先株の株式に変換され、これは私たちが発行した時の総資本の5%に相当します(完全に希釈した上で)。発行時、これらの単位の価値は730,962ドルであった。その後、第2許可証改正案により、Villaniに発行された1 cシリーズ優先株の株式を以下のように抹消した。第1のライセンス修正案によれば、私たちはまた、以下に述べるように、第2のライセンス修正案に従って修正されたいくつかの記念碑的な支払いをVillaniに支払うことに同意する。これまで、最初のライセンス修正案に関連した75万ドルのマイルストーン支払いは、ライセンスに関連したヴィラニへの支払いの合計金額である
| 29 |
| カタログ表 |
2021年7月30日、私たちは、第1のライセンス修正案によって生成されたいくつかの論争を解決するために、許可と和解協定の第2の修正案(または第2のライセンス修正案)を締結し、ヴェラニが所有する1 Cシリーズ優先株の株式を交換し、ライセンス契約に基づいてヴェラニへのマイルストーン支払いおよび特許権使用料の増加に対処することに同意した。第二許可修正案によって支払われるべき印税料率は、許可製品とHMW組合せ製品(定義ライセンス契約参照)の純売上高の一桁パーセントに等しく、第二許可修正案に規定されているいくつかの調整の影響を受ける。印税は、国·地域及びライセンス製品ごとに支払い、ライセンス契約が発効した日から(I)当該国·地域の最後の有効クレームが満了した日(2023年に満了する)、(Ii)当該ライセンス製品が当該国·地域の法規排他的満期に満了した日から、(Iii)当該ライセンス製品が当該国·地域で初めて商業販売された日から15年以内に支払われる印税。第二の許可修正案によれば、再許可が許可された場合、従属許可収入の10%~30%の再許可費用(ライセンス契約の定義のような)をVillaniに支払う義務がある。将来的にヴェラニに支払われるべきこのようなマイルストーン支払い(ヴェラニの選択により、すべて現金または持分でヴィラニに支払われる)は、開発マイルストーンで合計350万ドルに達し、販売マイルストーンで合計3700万ドルに達する。最初の公募が終わった時、私たちはヴェラニに100万ドルを支払った
会社とReka-Farm LLCとの間の供給協定
2020年2月27日、Reka−Farm、LLC(またはReka−Farm)と独占的な供給契約(または供給協定)を締結し、この合意に基づいてReka−Farmが提供するスポンジ.スポンジ私たちの候補製品を開発するために必要な原材料。“供給協定”は終了しない限り無期限だ。供給契約期間内にReka-Farm供給を禁止するスポンジ.スポンジ化粧品は“供給協定”で定義されているように、ロシア連邦以外の任意の他の製品を開発·販売するために使用される
供給協定によるとReka-Farmに私たちのものを提供しますスポンジ.スポンジ2021年1月1日から,半年ごとにReka−Farmに原材料需要予測(1予測ごと)を提供すべきである。供給協定によるとReka-Farmは必要な量を供給することができることを保証していますスポンジ.スポンジ各予測では、予測の最初の12ヶ月ごとに指定されます。すべての予測は私たちに拘束力がない。もしReka-Farmが私たちに提供できなければスポンジ.スポンジ予測によると使用可能なすべての原材料の数はスポンジ.スポンジReka-Farmはすべてのものまで優先的に提供しなければなりませんスポンジ.スポンジ“予測”で述べたものを提供する
供給契約に基づいて、一キロ当たり事前に合意した価格を支払いますスポンジ.スポンジReka-Farmによって提供され、私たちは、供給契約で定義されているように、私たちが開発した任意の製品の純売上高の1%以下の使用料をReka-Farmに支払う必要がありますスポンジ.スポンジ原材料はレイカ農場から提供されます
本“供給契約”は、(I)いずれか一方が重大な違約により90日以内に書面通知で終了することができ、このような重大な違約がその通知期限内に是正されない場合、および(Ii)当方はReka-Farmに90日間の書面通知を行った後、いかなる理由もなく“供給契約”を終了することができる
供給協定には、賠償、知的財産権保護、セキュリティ、救済措置、保証、およびいくつかの品質要件などに関連する習慣条項が含まれる
人的資本資源
本報告日までに、私たちは8人の常勤従業員がいて、その中の3人の従業員は総合と行政で働き、2人の従業員は非臨床と臨床開発に従事して、2人の従業員は化学、製造と制御部で働き、1人の従業員は監督事務と品質管理部門で働いている
私たちの未来の成功は、私たちが引き続き合格者を引き付け、採用し、維持する能力に部分的にかかっていると思う。特に、私たちは私たちの高度な管理と研究者のスキル、経験、表現に依存している。私たちは他の医療製薬、ヘルスケア会社、大学や非営利研究機関と合格した人材を争っています。
私たちは従業員のニーズを満たすために競争力のある報酬と福祉計画を提供する。これらの計画(国·地域·雇用分類によって異なる)には、賃金以外にも、奨励補償計画、医療·保険福祉、退職投資、有給休暇、帰省休暇などが含まれる。私たちはまた、持分に基づく贈与と帰属条件を的確に使用して、人員の維持、特に私たちの重要な従業員を促進する。
私たちの業務の成功は私たちの人々の福祉と根本的に関連している。したがって、私たちは職員たちの健康と安全に努力している。新冠肺炎疫病に対応するために、私たちは重大な改革を実施し、私たちはこれらの改革は従業員と私たちのコミュニティの最適な利益に符合し、そして政府法規に符合すると考えている
| 30 |
| カタログ表 |
第1 A項。リスク要因
私たちの証券に投資することは高度な危険と関連がある。私たちの証券に投資するかどうかを決定する前に、以下に説明するリスクおよび不確実性、および合併財務諸表、財務諸表付記、および本報告の他の部分の“経営層の財務状況および経営結果の議論および分析”と題する部分を含む、本報告の他のすべての情報を慎重に考慮しなければなりません。以下に説明するリスクと不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは私たちの業務に悪影響を及ぼす重要な要素になる可能性がある、あるいは私たちがどうでもいいと思う他のリスクと不確実性を認識していない。実際に以下のいずれかのリスクが発生すれば、私たちの業務、財務状況、経営結果、将来の見通しは重大な悪影響を受ける可能性がある。この場合、私たちの普通株および/または権利証の市場価格は下落する可能性があり、あなたは投資の一部または全部を損失する可能性があります。
私たちの業務に関するリスクの概要
当社の業務とわが社への投資は、本要約の後に“リスク要因”と題する章で強調されたリスクおよび不確定要因を含む多くのリスクおよび不確定要因の影響を受けています。いくつかのリスクは
| · | 私たちは経営前の会社で、運営の歴史は限られています |
| · | 私たちは私たちの候補製品の開発や商業化に成功したり、タイムリーまたは費用効果に基づいてそうすることができないかもしれない |
| · | 私たちの業務は新冠肺炎の影響を受けるかもしれません |
| · | 私たちは限られた数の候補製品に依存しており、もし私たちの1つ以上の候補キー製品が期待された表現に達しておらず、規制部門の承認を得られなければ、私たちの業務は実質的な悪影響を受ける可能性がある |
| · | 私たちの候補製品は、DMT 310およびDMT 410を含み、市場は私たちが予想していたほど大きくないかもしれない |
| · | 私たちの競争相手や他の第三者は、私たちが彼らの知的財産権を侵害したことを告発し、それによって引き起こされた訴訟に大量の資源を費やすことを強要するかもしれませんが、このような訴訟のいかなる不利な結果も、私たちの業務に実質的な悪影響を及ぼす可能性があります |
| · | 私たちは臨床試験の失敗や遅延に遭遇する可能性があり、これは規制の承認を得て製品販売を開始する能力を危険にさらしたり延期したりする可能性がある |
| · | 私たちはブランドとジェネリック医薬品会社からの激しい競争に直面しています。これは私たちの成長を制限し、私たちの財務業績に悪影響を及ぼすかもしれません |
| · | 私たちは広範な政府の規制を受けており、私たちは私たちが適用法規を遵守しようと努力することに関する重大な不確実性と潜在的な重大なコストに直面している |
| · | 私たちは販売能力を開発したり維持したり、商業化に成功する可能性のある製品を効果的にマーケティングしたり販売することができないかもしれません |
| · | 製造または品質管理問題は、私たちの名声を損なう可能性があり、費用の高い救済活動を必要とするか、または他の方法で私たちの業務に負の影響を与える可能性がある |
| · | 私たちの収益力は第三者支払者の保証と精算にかかっていますが、医療改革や他の将来の立法は引受や精算レベルの減少を招く可能性があります |
| · | 私たちは現在、将来的に第三者からいくつかの知的財産権の許可を得る必要があるかもしれないが、このような許可は得られないかもしれないし、商業的に合理的な条項では得られない可能性がある |
| · | 私たちは関連する第三者特許を識別しないかもしれないし、第三者特許の関連性、範囲、または失効を誤って解釈する可能性があり、これは私たちの製品および候補製品を開発、製造、販売する能力に悪影響を及ぼす可能性がある |
| · | 私たちの候補製品DMT 310とDMT 410の原材料は天然成分から来ており、これらの成分は限られた地域でしか成長せず、毎年収穫する必要がある。予測できない環境条件や状況のため、私たちのサプライヤーは私たちが必要な原料を得ることができないかもしれないし、根本的にできないかもしれません。これは私たちが臨床前研究、臨床試験を行い、最終的に私たちの候補製品を商業化する能力にマイナスの影響を与えるかもしれません |
| · | 我々は現在、DMT 310およびDMT 410に必要な原材料を第三者に提供することに依存しており、許容可能な条件で代替ソースを取得または調達することに困難がある場合、または全くない場合、私たちの業務は影響を受ける可能性がある |
| · | 私たちが現在発表しているDMT 310をカバーする特許は期限が切れているか、2022年から2023年の間に満期になります。これは私たちが予想しているどの市場発売日よりも早いです。我々が現在出願しているDMT 310およびDMT 410を含む特許はまだ発行されておらず、それらが発表されることも保証されていない。私たちは他の製品からの競争によって私たちの市場機会を制限するかもしれない追加の特許カバー範囲を得ることができないかもしれない |
| · | もし私たちがいかなる第三者合意の下での義務を履行できなければ、私たちは私たちの候補製品を開発するために必要な許可権を失うかもしれない |
| · | 私たちの役員、役員、特定の株主(うちの一人は私たちの最高経営責任者の関連会社)は、私たちのかなりの割合の普通株を持っています。もし彼らが共同行動を選択すれば、株主の承認を待つ事項を大きな制御を加えることができます |
| · | 私たちは人員を増やす必要があり、これは私たちの組織の規模と複雑さを増加させ、私たちは成長と会社戦略を実行する上で困難に直面するかもしれない。 |
| 31 |
| カタログ表 |
私たちの財務状況と資金需要に関連するリスク
私たちは臨床段階の製薬会社で、運営の歴史は限られている
私たちは臨床段階の生物製薬会社で、運営の歴史が限られていますので、それに基づいて私たちの業務と将来性を評価することができます。私たちは臨床研究を完成して、監督部門の許可を得て、それから製品の商業販売を始めることができます。私たちの業務計画が成功する可能性は、早期業務の発展と拡大、そして私たちの運営が置かれている規制や競争環境でよく遭遇する問題、巨額の費用、困難、複雑さ、遅延を考慮しなければならない。医薬製品開発は投機性の強い仕事であり、大きなリスクに関連し、資本集約型業務である
したがって、私たちの将来性を考慮して、会社が開発初期段階でよく遭遇するコスト、不確実性、遅延、困難、特に私たちのような早期臨床製薬会社を考慮すべきです。潜在投資家は経営の歴史が限られている会社が直面するリスクと不確実性を慎重に考慮すべきだ。特に、潜在的な投資家は、私たちができることを保証することはできません
| · | 私たちの現在の業務計画を成功的に実施または実行し、私たちの業務計画が健全であることを保証することはできません |
|
|
|
| · | 臨床試験、非臨床試験とその他の必要な要求の完成に成功し、監督機関による著者らの候補薬物DMT 310とDMT 410の発売許可を得た |
|
|
|
| · | 私たちの臨床製品の生産に成功し商業薬品の供給を確立しました |
|
|
|
| · | 私たちの知的財産権を保護し、維持し、必要に応じて守る |
|
|
|
| · | 私たちの候補薬物が市場排他性および/または十分な知的財産権保護を得ることを確実にする |
|
|
|
| · | 経験豊富な管理とコンサルティングチームを引き付けて維持します |
|
|
|
| · | 私たちの候補薬が医学界や第三者支払者や消費者に受け入れられることを確実にします |
|
|
|
| · | 単独販売でも他人と協力しても候補薬の商業販売を開始します |
|
|
|
| · | 上場後の監督管理要求を守る |
|
|
|
| · | 資本市場やその他の面で十分な資金を集めて、私たちの業務計画を達成すること |
|
|
|
| · | 私たちの既存と将来調達可能な資金を利用して、私たちの業務戦略を効果的に実行します。 |
もし私たちが上記のいずれかを成功的に実行できなければ、私たちの業務は失敗する可能性があり、あなたの投資は不利な影響を受けるだろう
| 32 |
| カタログ表 |
私たちは最初から損失を被っていて、予測可能な未来に私たちは引き続き損失を受けると予想される。私たちは現在利益を上げていないし、私たちは絶対に利益を達成したり維持したりしないかもしれない
我々は運営から収入が生じたことはなく,数年以内に収入が生じる可能性はあまりなく,現在運営が赤字状態であり,臨床前開発,候補薬の臨床試験および上場企業運営に関するコストが生じるため,我々の運営コストは大幅に増加することが予想される。規制部門の承認を得て任意の候補薬物の商業化に成功しない限り,対応する収入なしに大量の費用が発生すると予想される。私たちはアメリカや国際的にどんな適応でも規制部門の私たちの候補薬物に対するマーケティング承認を得ることができないかもしれない。私たちの候補薬物を商業化することができても、私たちが相当な収入を生み出したり、利益を達成することを保証することはできない。2014年12月に運営を開始して以来、私たちは毎年赤字を出しています。2022年12月31日と2021年12月31日までの年間で、それぞれ約960万ドルと約790万ドルの純損失が発生した。2022年12月31日までの累計赤字は約4560万ドル。私たちの将来の純損失の規模は、私たちの未来の支出と私たちが収入を作る能力にある程度依存するだろう(もしあれば)。私たちの合意下のマイルストーンや他の支払いが達成または受信できない可能性があるので、私たちの現在と潜在的な未来の協力の収入は不確定だ
2022年12月31日現在、私たちは現金と現金等価物からなる資本資源620万ドルを持っている。私たちは予測可能な未来に引き続き大量の現金資源を投入し、私たちの候補製品の臨床開発、そして私たちが選択可能な任意の他の適応と候補製品の開発に使用する。これらの支出には、研究および開発、臨床前研究および臨床試験、製造および供給、ならびに販売が許可された任意の製品のマーケティングおよび販売に関連するコストが含まれる。特に,候補製品に対する第3段階臨床研究は完成するために多くの資金が必要となる。どの臨床試験の進行と結果も高度に不確定であるため、著者らは現在と未来の候補製品の開発と商業化に必要な実際の金額を合理的に推定することができない
私たちはいつまたは利益を達成したり維持することができるかどうか確信できない。もし私たちが未来に利益を達成すれば、私たちはその後の時期に利益を維持できないかもしれない。利益を上げて利益を維持できなければ、私たちの運営能力を弱化させ、私たちの普通株式または株式証明書の価格と私たちの資金調達能力に悪影響を及ぼすだろう
私たちは私たちの業務に資金を提供するために追加の資金が必要になり、もし私たちが必要な融資を得ることができなければ、私たちは私たちの薬物の開発と商業化を達成できないかもしれない
私たちは、私たちの既存の現金は、その利息とともに、2023年第3四半期まで、私たちの業務に資金を提供するのに十分だと信じています。しかし、私たちのこれらの推定は、間違っていることが証明される可能性があるという仮定に基づいており、私たちは現在予想されているよりも早く利用可能な資本資源を使用するかもしれないし、現在予想されているよりも多くの資本が私たちの運営に資金を提供する必要があるかもしれない。私たちは現在、私たちの候補製品DMT 310とDMT 410を開発するための支出が私たちの既存の現金を超えていると予想しています。私たちは私たちの運営を支援するためにより多くの資金を集め、私たちの計画中の開発と商業化活動を支援し続ける必要があるだろう
| 33 |
| カタログ表 |
私たちが将来必要な支出の額と時間は、多くの要素に依存するだろう
| · | 現在および将来の候補製品の開発、許可または買収の任意の臨床前および臨床試験および他の製品開発活動の時間、進行、およびコスト |
|
|
|
| · | 私たちの候補製品はアメリカや他の国での臨床試験結果です |
|
|
|
| · | FDA承認および任意の外国規制機関が私たちの候補製品を承認する時間と関連するコスト(もしあれば) |
|
|
|
| · | 私たちが開発または買収した任意の他の未来の候補製品の数量と特徴 |
|
|
|
| · | 私たちは、戦略的協力、許可、共同推進、または他の計画の能力、およびそのような計画の条項と時間を確立し、維持する |
|
|
|
| · | 現在または将来の候補製品が販売を許可されている場合、製造、マーケティング、販売、および流通コストを含む商業化活動のコスト |
|
|
|
| · | 承認された製品の市場受容度と受容率 |
|
|
|
| · | 私たちの現在と未来の候補製品と私たちが商業化している任意の製品の第三者の製造と供給計画のコスト |
|
|
|
| · | 私たちが構築する可能性のある追加のアウトソーシング商業製造または供給スケジュールのコストと完了時間 |
| · | 私たちの候補製品に関連する任意の特許主張および他の知的財産権のコストを準備、提出、起訴、維持、弁護、および実行する |
|
|
|
| · | 私たちが巻き込まれているかまたは巻き込まれる可能性のある訴訟に関連する費用と、そのような訴訟のために支払うべき損害賠償を訴えたり弁護したりします |
|
|
|
| · | 発生する可能性のある製品のリコールに関するコスト |
|
|
|
| · | 上場企業の運営コスト |
|
|
|
| · | 代替性および競争的製品または治療の出現、承認、獲得可能性、知覚的利点、相対コスト、相対安全性、および相対的有効性; |
|
|
|
| · | 製品および候補製品、技術またはビジネスの任意の買収に関連することができるかもしれないコスト; |
|
|
|
| · | 人員、施設、設備の要求。 |
私たちは許容可能な条件で追加資金を提供するかどうか、あるいは根本的にできないかどうかを確認することができない。さらに、私たちが参加する将来の債務融資は、私たちの留置権または追加債務の発生を制限すること、配当金の支払い、株式の償還、特定の投資、およびいくつかの合併、合併、または資産売却取引に従事する能力を含む、私たちの業務を制限する契約を適用するかもしれない
もし私たちが必要な時や受け入れ可能な条項で追加資本を調達できない場合、私たちは、私たちの1つまたは複数の候補製品の開発または商業化を大幅に延期、削減、または停止し、私たちの運営を制限したり、魅力的でない条項で合意を締結することによって資金を得ることが要求される可能性があり、これは、少なくとも追加資金を得る前に、私たちの業務、株価、および私たちと業務関係のある第三者との関係に実質的な悪影響を及ぼすかもしれない。もし私たちが運営を続けるのに十分な資金がなければ、私たちは破産保護や他の代替案を求めることが要求される可能性があり、これは私たちの株主が私たちへの投資の一部または全部を失う可能性がある。しかも、私たちが利益を達成したり、競争圧力に対応する能力は深刻に制限されるだろう
| 34 |
| カタログ表 |
追加資本の調達は私たちの株主に希釈し、私たちの運営を制限したり、私たちの技術や候補製品に対する権利を放棄することを要求するかもしれません
これまで、私たちが相当な収入を生み出すことができれば、私たちは株式発行、債務融資、マーケティングと流通手配、他の協力、戦略連合と許可手配、または他のソースの組み合わせによって、私たちの現金需要を満たすことができるかもしれない。私たちは現在約束された外部資金源を持っていない。また、有利な市場条件や戦略的考慮により、現在または将来の運営計画のために十分な資金があると考えても、追加の資本を求めることができる
私たちが株式または転換可能な債務証券を売却することによって追加資本を調達する場合、あなたの所有権資本は希釈され、これらの証券の条項は清算または他の特典を含む可能性があり、普通株主としての権利に悪影響を及ぼす可能性がある。債務融資および優先株融資に関与する可能性のある協定は、追加債務を招く、資本支出を行う、または配当を宣言するなど、私たちが具体的な行動をとる能力を制限または制限する契約を含む。もし私たちが第三者との協力、戦略連合またはマーケティング、流通または許可手配によってより多くの資金を調達する場合、私たちは、私たちの技術、知的財産権、将来の収入流、または候補製品の貴重な権利を放棄するか、または私たちに不利になる可能性のある条項でライセンスを付与することを要求されるかもしれない。もし私たちが必要な時に株式や債務融資で追加資金を調達できない場合、私たちは候補製品開発や将来の商業化努力を延期、制限、減少、または終了する必要があるかもしれない
我々の独立公認会計士事務所は、2022年12月31日現在と2021年12月31日現在の会計年度報告書に、継続的に経営を継続する企業としての能力があるか否かを示す解釈を含んでいる
我々の現在の運営と資本支出能力には不確実性があるため、2022年12月31日と2021年12月31日までの監査年度財務諸表報告書には、継続的な経営企業として継続する能力があるかどうかに関する懸念が含まれている。私たちの持続的な経営能力に対する重大な疑いは、私たちの普通株と引受権証の1株当たり価格に実質的な悪影響を及ぼす可能性があり、私たちは融資を受けることがもっと難しいかもしれない。また、契約義務を履行する能力が懸念されているため、継続的に経営している企業として経営を継続できない可能性があり、追加資金の調達や業務を経営する能力を阻害する可能性があります
税法の変化は私たちの企業の財務状況、経営業績、キャッシュフローに大きな悪影響を及ぼす可能性があります
私たちは私たちが業務を展開している司法管轄区の税収法律、法規、政策の制約を受けて、これらの司法管轄区にはアメリカ連邦、州と地方政府、外国司法管轄区の税務当局が含まれている可能性があります。税法の変化、その他の要因は、私たちの納税義務に変動をもたらし、他の方法で私たちの納税状況および/または私たちの納税義務に悪影響を及ぼす可能性があります。私たちの管轄区域の所得税規則は税務機関と他の政府機関の審査を受け続けている。税法の変化(これらの変化は追跡力を持つ可能性がある)は、私たちまたは私たちの株主に悪影響を及ぼす可能性がある。将来どのような税収提案が提出されるか、あるいはこれらの変化が私たちの業務にどのような影響を与えるかは予測できませんが、これらの変化は、それらが税務立法、法規、政策、あるいは実践に組み込まれていれば、将来私たちが業務を展開する司法管区の財務状況と全体的な有効税率に影響を与え、税務コンプライアンスの複雑さ、負担、コストを増加させる可能性があります
| 35 |
| カタログ表 |
開発·規制·承認·商業化に関するリスク
著者らは新冠肺炎を含む健康流行病と疫病に関連するリスクに直面しており、これは著者らの臨床前研究と臨床試験を厳重に乱す可能性がある。
新冠肺炎疫病による業務中断と関連財務影響の持続時間と地理影響は現在合理的に推定できず、著者らの業務はその影響の不利な影響を受ける可能性がある。新冠肺炎の発生を阻止するために、アメリカは旅行に重大な制限を加えることがあり、多くの企業が閉鎖時間の延長を宣言し、これは私たちの業務に悪影響を与える可能性がある。われわれの臨床試験およびわれわれが計画·進行している臨床前·臨床試験の患者募集は新冠肺炎のため延期される可能性がある。新冠肺炎の大流行がアメリカ食品薬品監督管理局とその他の衛生当局の運営に与える影響は著者らの臨床試験方案の承認を延期する可能性がある。また、私たちは独立した臨床研究者、契約研究組織、および他の第三者サービスプロバイダに依存して、私たちの臨床前研究と臨床試験を管理、監視、その他の方法で実行するのを助けるが、大流行は彼らが私たちの計画に十分な時間と資源を投入する能力に影響を与える可能性がある。また、第三者サプライヤーと契約製造業者に依存して、臨床試験で使用されている薬物製品を生産していますが、大流行は原材料や薬物製品の交付遅延を招く可能性があります。私たちが臨床或いは臨床前試験を行う施設を一時的に閉鎖したり、私たちの試験に参加する従業員、臨床医師或いは患者の旅行能力を制限することは、私たちの運営及び私たちの臨床前と臨床試験を行う能力に不利な影響を与える可能性がある。そのほか、新冠肺炎の大流行は、普通の人のワクチン接種不足と新しい変種の出現を含み、デルタ変種とオミック変種を含む, 私たちの労働力と私たちが依存している第三者の健康と利用可能性に影響を及ぼすかもしれない。新しい、より伝染性や深刻な変種が出現すれば、大流行が私たちの業務に与える影響は持続時間的に増加または延長する可能性がある。
上述の要素のため、著者らの臨床前研究と臨床試験及びいくつかの規制文書の予想データ読み取りの予想スケジュールは負の影響を受ける可能性があり、これは著者らの業務に不利な影響を与える
グローバル経済とサプライチェーンの中断は、私たちの業務、財務状況、運営結果に実質的な悪影響を及ぼす可能性がある。
2020年と2021年のグローバル経済への干渉はグローバルサプライチェーンを阻害し、納期延長を招き、キー部品コストと送料を増加させた。私たちは、サプライヤーや私たちが依存している他の第三者と密接に協力することで、納期中断とコスト増加の影響を最小限に抑える措置を取らなければならないかもしれない。我々は、グローバル経済中断の影響を最小限に抑えるために行動しなければならないかもしれないが、グローバル·サプライチェーンにおける予見不可能な未来の事件が、私たちの業務、財務状況、運営結果に重大な悪影響を与えない保証はない。これまで90日間の小型豚真皮研究所を行うために必要な小型豚の供給を得ることは困難であったため,このような研究の開始を遅らせることを余儀なくされる可能性がある。
また,インフレは臨床試験のコスト,候補製品の研究開発コスト,ビジネスの行政やその他のコストを増加させ,我々に悪影響を与える。私たちは労働力価格と他のビジネスの費用の上昇を経験するかもしれない。インフレの環境下で、コスト増加は私たちの予想を超える可能性があり、私たちは予想よりも早く現金と他の流動資産を使用することになるかもしれない。このような状況が発生した場合、私たちは私たちの運営に資金を提供するために追加の資本を調達する必要があるかもしれません。これらの資金は十分な金額や合理的な条項を得ることができないかもしれません。もしあれば、予想よりも早くなるかもしれません。
経済的不確実性を含む不利な世界環境は、私たちの財務業績に悪影響を及ぼす可能性がある。
世界的な環境、金融市場の混乱、税制改革、あるいは既存の貿易協定や税務慣行の変化が米国にもたらしたいかなる負の金融影響も、私たちの業務に悪影響を及ぼす可能性がある。
また、グローバルマクロ経済環境は、新冠肺炎または他の流行病または流行病、グローバル経済市場の不安定、米国の貿易関税の向上と他国との貿易紛争、グローバル信用市場の不安定、サプライチェーンの弱さ、英国のEU離脱による地政学的環境の不安定、ロシアのウクライナ侵攻や他の政治的緊張、および外国政府債務への懸念を受ける可能性がある。これらの課題はすでに現地経済と世界金融市場で不確実かつ不安定をもたらし続けている可能性がある。
| 36 |
| カタログ表 |
私たちの業務は、私たちの候補製品の成功的な開発、規制承認、商業化、特にDMT 310とDMT 410に依存します
私たちの候補製品の組み合わせは、にきびおよび乾癬の治療のための、週に1回の局所自然由来製品である中期候補製品DMT 310と、多汗症および美容皮膚状態の治療のためのボツリヌス毒素の局所注射に役立つ併用治療レジメンである早期候補製品DMT 410とを含む。私たちの事業の成功は、当社に資金を提供し、将来的に任意の収入を創出する能力を含み、主に候補製品の開発成功、規制承認、商業化、または協力にかかっています。将来的には、私たちはまた、私たちの候補製品、または私たちが許可、買収、または開発する可能性のある任意の未来の候補製品だけに依存するかもしれない。私たちの候補製品の臨床と商業成功は以下の要素を含む多くの要素に依存する
| · | 受け入れ可能な条件で追加資本を調達する能力、あるいは全くできない |
|
|
|
| · | 私たちの臨床試験を迅速に完了することは、現在予想されているよりもはるかに遅いか、またはコストが高く、第三者請負業者の表現に大きく依存するかもしれない |
|
|
|
| · | 米国食品医薬品局、FDA、または同様の外国規制機関が、私たちの候補製品または任意の未来の候補製品の承認と商業化を支援するために、追加の臨床試験を要求するかどうかにかかわらず、 |
|
|
|
| · | FDAと同様の外国規制機関は、私たちの提案適応と私たちの候補製品の提案適応に関する主要な終点評価を受けている |
|
|
|
| · | 私たちはFDAと同様の外国規制機関が私たちの候補製品または任意の未来の候補製品の安全性と有効性を満足的に証明することができる |
|
|
|
| · | 私たちは適切な医薬品放出分析能力を開発しました |
|
|
|
| · | 薬物動態研究で検出可能な活性化合物を識別する能力; |
|
|
|
| · | 私たちの候補製品または将来承認された製品(ある場合)に関連する潜在的副作用の流行率、持続時間、および重症度; |
|
|
|
| · | FDAと同様の外国規制機関の必要な上場承認を適時に受ける |
|
|
|
| · | 実現し、維持し、適用された場合、私たちの第三者請負者が、私たちの契約義務および私たちの候補製品または任意の未来の候補製品または承認された製品(ある場合)に適用されるすべての法規要件を達成し、維持することを保証し、維持する |
|
|
|
| · | 私たちと契約を締結した第三者は、私たちの候補製品または任意の未来の候補製品の臨床試験と商業供給の能力を生産し、監督機関との良好な関係を維持し、現在の良好な製造実践またはcGMPまたは良好な農業と採集業実践またはGACPに適合する商業的に実行可能な製造技術を開発、検証、維持する |
|
|
|
| · | 臨床開発中および私たちの候補製品または任意の未来の候補製品が承認された後、許容可能な安全性を維持し続ける |
|
|
|
| · | 私たちはアメリカと国際で私たちの候補製品または任意の未来の候補製品を商業化することに成功し、単独でも他の会社と協力しても、これらの国と地域でのマーケティング、販売、流通が許可されれば、 |
| 37 |
| カタログ表 |
| · | 医師、患者、および支払人は、代替療法および競合療法に関連するものを含む、私たちの候補製品または任意の将来の候補製品(承認された場合)の利益、安全性および有効性を受け入れる; |
|
|
|
| · | 私たちは多くの承認された規制要件を守ることができる |
|
|
|
| · | 私たちと私たちのパートナーは、私たちの候補製品または任意の未来の候補製品において知的財産権を確立して実施する能力; |
|
|
|
| · | 私たちと私たちのパートナーが第三者特許干渉または知的財産権侵害請求を回避する能力; |
|
|
|
| · | 私たちは、他の候補製品や商業段階製品の開発と商業化に成功できると考えている製品を許可したり、獲得することができる。 |
もし私たちが上記の1つ以上の要素をタイムリーまたは根本的に実現できなければ、その多くは私たちがコントロールできない、私たちは重大な遅延とコスト増加、あるいは規制の承認を得られない、あるいは私たちの候補製品を商業化することができないかもしれない。規制部門の承認を受けても、私たちは決して私たちの候補製品を商業化することに成功できないかもしれない。したがって、私たちは私たちの候補製品または任意の未来の候補製品を販売することによって、運営を継続するために十分な収入を得ることができるということを保証することはできません
FDAのガイドラインによると,FDAとの第二段階会議が終了する前に,90日間の小型豚真皮研究と標準的な皮膚薬物動態研究を完成させる必要がある。小型豚と薬物動態学研究は複雑で、時間がかかり、高価である可能性があり、しかも私たちは必要な研究を成功できない可能性があり、これは第三段階計画及び監督部門の承認と商業化を阻害或いは延期する可能性がある。
局所製品に必要な薬物開発の一部は,FDAとの第二段階会議終了までに90日間の小型豚真皮研究と標準的な真皮薬物動態開発計画を完成させることである。この計画は設計と実施が難しいかもしれないし、その結果も確定していない。皮膚薬物動態学発展計画の一部として、著者らはラット、小型豚とヒト血漿中の分析物を測定する分析方法を開発と検証する必要があり、これは困難、時間と高価である。DMT 310中に存在する分析物は確認されているが,必要なレベルの分析物を検出するのに十分な感度を有する方法は開発されていない。このような方法を遅延または開発できない場合、薬物動態開発計画のための新しいDMT 310分析物を決定する必要があるかもしれない。識別された分析物を検出するための生物分析法の開発に成功したとしても、良好な実験室実践またはGLP条件下でこの生物分析方法を検証しなければならない。私たちがこれを成功的にすることができるという保証はない。このような生物分析方法を検証できない場合、規制部門の承認および商業化を阻止または延期する可能性がある新しい生物分析方法の開発や薬物動態開発計画のための新しい分析物を決定する必要があるかもしれない
FDAとの第二段階会議終了前にGLP条件下で生物分析法を検証した後,90日間の小型ブタ真皮研究とヒトにおける最大使用薬物動態学的研究を行わなければならず,その結果は未知で予測が困難であった。90日間の真皮小型豚研究のための小型豚のグローバルサプライチェーンの遅延と制限により,このような研究の開始を延期させられる可能性がある。また,これらの研究の結果がFDAを満足させることができなければ,薬物動態開発計画全体を再実行する必要がある可能性があり,追加の開発コストや開発スケジュールの遅延を招く可能性があり,この場合,我々の業務は実質的に被害を受ける可能性がある。
| 38 |
| カタログ表 |
私たちの候補製品の臨床薬物開発は非常に高価で、時間と不確定性がある。私たちの臨床試験は私たちの候補製品の安全性と有効性を十分に証明できないかもしれません。これは規制部門の承認と商業化を阻止または延期するかもしれません
我々の候補製品の臨床薬物開発は非常に高価で、時間がかかり、設計と実施が困難であり、その結果自体も確定していない。規制部門による候補製品の商業化販売の承認を得る前に,候補製品が目標適応に使用されることは安全かつ有効であり,予測不可能であることを臨床試験により証明しなければならない。臨床試験を開始した候補製品の多くは規制機関の商業化承認を得たことがない。我々の候補製品は異なる開発段階にあり、試験の任意の段階または試験過程のいつでも、1つ以上の臨床試験失敗が発生する可能性がある。これらの候補製品の臨床試験は数年継続することが予想されるが,達成には予想よりもはるかに長い時間がかかる可能性がある
私たちはまだ私たちの候補製品の承認を得るためにすべての臨床試験を終えていない。私たちはまだFDAと第二段階会議の終了を行っていないし、彼らが私たちにどんなフィードバックを提供するのか分からない。以前のFDAとのコミュニケーションでは、彼らは過酸化水素が私たちのDMT 310製品の有効成分ではないことを証明することを要求した。FDAを説得するのに十分な証拠とデータを提供していなければ、過酸化水素は活性成分ではなく、ただの流動化試薬(過酸化水素)である場合、私たちの臨床計画を変えたり、FDAのフィードバックに基づいて私たちの製品を再作成しなければならないかもしれません。もし私たちが私たちの主導的な製品DMT 310を再調製することを選択したら、私たちは私たちの第二段階の研究を再開することを決定するかもしれません。これは時間と費用がかかり、成功した確実性がありません
進行中と将来の候補製品臨床試験で遅延に遭遇する可能性があり,将来の臨床試験(あれば)が時間どおりに開始されるかどうか,再設計が必要かどうか,時間どおりに十分な数の患者を募集する必要があるかどうか,あるいは予定通りに完了するかどうかが分からない。さらに、私たち、現在または未来に協力する可能性のある任意のパートナー、FDA、IRB、または他の規制機関、州および地方機関、および外国の対応機関を含む、様々な理由でいつでも一時停止、延期、修正または終了を要求する可能性があります
| · | 研究参加者が経験した安全または耐性の問題、例えば、深刻または予期しない毒性または副作用、または他の許容できない健康リスクまたは他の安全問題に曝露することを発見した |
|
|
|
| · | 任意の候補製品は、臨床試験中に有効性が不足しているか、または私たちの候補製品が指定された終点に到達できなかった |
|
|
|
| · | 被験者の募集および登録の速度は予想より遅いか、または同じ適応の候補製品に対する他の会社による臨床試験、または患者が常に治療の適応を求めない臨床試験を含む十分な数の患者を臨床試験に参加することができない |
|
|
|
| · | 新冠肺炎の疫病による隔離或いはその他の制限により、著者らの臨床試験の遅延或いは困難を招く |
|
|
|
| · | すでに臨床試験を開始したが、治療の副作用、治療効果の不足、臨床試験過程に疲労或いは任意の他の原因で随時退出した被験者を維持することは困難である |
|
|
|
| · | 各臨床試験地点で行われた研究はIRBの承認を得ることが困難であった |
|
|
|
| · | 臨床試験に必要な十分な数の材料の製造を遅延させるか、または十分な数の材料を製造または得ることができない |
|
|
|
| · | 私たちのDMT 410のために彼らの製品をテストすることを計画するために、パートナーを見つけることは困難であり、または見つけることができない |
|
|
|
| · | 私たちの製造プロセスまたは製品の配合または配送方法の不足または変更; |
| 39 |
| カタログ表 |
| · | 適用される法律、法規、規制政策の変化 |
|
|
|
| · | 遅延または予期されるCRO、臨床試験場所、および他の第三者請負業者と、臨床試験契約またはレジメンで許容可能な条項について合意することができなかった |
|
|
|
| · | 十分な数の臨床試験サイトを増やすことはできません |
|
|
|
| · | 適切な処方と投与量の不確実性について |
|
|
|
| · | 私たち、私たちの従業員、私たちのCROまたは彼らの従業員、または他の第三者請負業者は、契約および適用可能な法規要件を遵守できなかったか、またはタイムリーまたは許容可能な方法でそのサービスを履行することができませんでした |
|
|
|
| · | 私たち、私たちの従業員、私たちのCROまたは彼らの従業員、または私たちが協力する可能性のある任意のパートナー、または彼らの従業員は、臨床試験または薬物および生物製品の処理、貯蔵、安全および記録保存に関する適用されたFDAまたは他の法規要件を遵守できなかった |
|
|
|
| · | 参加する臨床医や臨床機関のスケジュールと衝突しています |
|
|
|
| · | 適切な臨床試験案を設計できなかった |
|
|
|
| · | データが不足していて、規制部門の承認を支持できない |
|
|
|
| · | 医学研究者は私たちの臨床計画に従うことができないか、または |
|
|
|
| · | 治療中または治療後に対象との連絡を維持することは困難であり、これはデータが不完全である可能性がある。 |
我々の局所候補製品については,所望の治療効果を達成するために,皮膚バリアを介して十分な濃度の活性医薬成分やAPIを標的皮膚組織に送達することが求められている。したがって,安全性と有効性を決定することは困難である可能性がある.局所投与経路は新しい調合と剤形に関連する可能性があり、これは開発と製造が困難である可能性があり、新しい監督管理問題を引き起こし、開発或いは審査遅延を招く可能性がある。例えば、DMT 310の原料薬は粉砕スポンジ粉であり、以前FDAが処方薬としてスポンジを承認したことは知られていなかった
私たちまたは私たちが協力する可能性のある任意のパートナーは、製薬やバイオテクノロジー業界の他のいくつかの会社の経験のように、早期の試験でもエキサイティングな結果を得たように、私たちの臨床試験で大きな挫折を経験する可能性がある。もし私たちまたは私たちの潜在的なパートナーが私たちの候補製品に関連する臨床開発を放棄または遅延させると、私たちは私たちの業務計画を効果的に実行できないかもしれません。私たちの業務、財務状況、経営業績、見通しは損なわれます
候補製品の製造または処方を変更する方法は、追加のコストや遅延を招く可能性がある
候補製品が臨床前研究から後期臨床試験まで、潜在的な承認と商業化を得るために、製造方法や調合などの開発計画の様々な方面に伴い、この過程で変更を行い、過程と結果の最適化に努力することはよく見られる。このような変化はこのような期待された目標を達成できない可能性がある。これらの変化のいずれも、我々の候補製品の表現が異なり、計画中の臨床試験または変更された材料を用いた他の将来の臨床試験の結果に影響を与える可能性がある。このような変化はまた、追加のテスト、FDA通知、またはFDA承認を必要とする可能性がある。これは臨床試験の完成を遅らせる可能性があり、接続臨床試験或いは1つ以上の臨床試験を繰り返す必要がある
| 40 |
| カタログ表 |
私たちは、適用された規制要件下のDMT 310または私たちの初期候補製品の規制承認を得ることができないかもしれない。FDAと外国の監督管理機関は承認過程において大きな裁量権を持っており、承認候補製品の延期、制限、または拒否を含む。どんな規制承認の遅延、制限、または拒否は、商業化、私たちの創出潜在力、私たちの業務、そして私たちの経営業績に悪影響を及ぼすだろう
私たちは現在販売が許可されていない製品で、私たちは規制部門の許可を得ず、私たちの現在または未来の任意の候補製品を商業化するかもしれない。著者らの薬品に関連する研究、テスト、生産、安全監督、治療効果、品質管理、記録保存、ラベル、包装、貯蔵、承認、販売、マーケティング、流通、輸出入及び安全とその他の発売後の情報の報告はすべてアメリカと外国FDAと他の監督機関の広範な監督管理を受けており、これらの監督管理は国によって異なる。新薬申請やNDAの承認やFDAが提出した他の適用可能な規制文書を得るまで、私たちは現在の候補製品を米国で販売することは許可されていません。私たちまたは私たちのパートナーが外国関連規制機関の必要な承認を得るまで、私たちはいかなる外国でも私たちの現在の候補品を販売することを許可されません
DMT 310或いはDMT 410などの新薬の発売を許可するためには、FDAと/或いは外国の監督管理機関は必ず臨床前と臨床データを受け取り、薬品の安全性、純度、効力、有効性とコンプライアンス生産がNDA或いはその他の適用監督管理文書中の申請の予想適応に符合することを十分に証明しなければならない。天然由来から抽出された製品と新薬製品の開発と承認は長い、高価かつ不確定な過程に関連し、どの段階でも遅延または失敗が発生する可能性がある。製薬と生物製薬業界のいくつかの会社は非臨床開発、臨床試験(第三段階の臨床開発を含む)において重大な挫折を経験し、早期の臨床前研究或いは臨床試験でも良好な結果を得た。その他を除いて,これらの挫折は,これまで報告されていなかった有害事象を含めた臨床試験期間中の発見や臨床試験における安全性や有効性観察によるものである。臨床試験の成功は今後の臨床試験の成功,あるいは非臨床研究も成功する保証はない。他側の臨床試験結果は,われわれやわれわれのパートナーが行う可能性のある試験の結果を代表しない可能性がある。例えば,DMT 310では,我々の2 a期と2 b期の臨床試験の結果は,より多くの患者の3期臨床試験の結果を正確に予測できない可能性がある。われわれの2 a期と2 b期の臨床試験から収集したヒト安全性データからも,われわれの薬物動態計画の結果は予測できなかった
FDAと外国の監督管理機関は薬品の審査過程においてかなりの自由裁量権を持っており、多種の原因で承認候補製品を延期、制限、或いは拒否する権利がある。FDAまたは適用される外国の規制機関は、
| · | 1つまたは複数の臨床試験の設計または実施に同意しない |
|
|
|
| · | 候補製品の安全性は、その提案の適応によって有効であると考えられないか、または候補製品の安全性または他の知覚的リスクがその臨床的または他の利益を超えると考えられる可能性がある |
|
|
|
| · | 臨床前研究および臨床試験のデータは承認を支持するのに十分であるとは思わない、あるいは臨床試験の結果はFDA或いは適用された外国の監督管理機関が承認を要求する統計或いは臨床意義レベルに適合していない可能性がある |
|
|
|
| · | 私たちまたは第三者による臨床前研究または臨床試験データの解釈、または私たちと協力する可能性のある任意のパートナーの解釈に同意しません |
|
|
|
| · | 臨床試験から収集されたデータを決定することは、秘密協定または他の適用可能な規制申請の提出をサポートするのに十分ではない可能性がある |
|
|
|
| · | 追加的な前臨床研究や臨床試験が必要です |
| 41 |
| カタログ表 |
| · | 配合、品質管理、ラベルまたは仕様における現在または未来の候補製品の欠陥を識別すること |
|
|
|
| · | 薬物により敏感な集団の薬物動態または安全性を決定するために、小児科患者において臨床試験を行うことが要求される |
|
|
|
| · | 承認は高価な追加承認後の臨床試験の表現に依存する |
|
|
|
| · | 私たちが最初に要求したよりも限られた適応または狭い患者集団、または市場適合性に影響を与える可能性のある強い警告を有するように、私たちの現在または任意の未来の候補製品を承認する |
|
|
|
| · | 承認しないことは私たちの候補製品の商業化に必要または望ましいラベルだと思います |
|
|
|
| · | 当社と契約した第三者製造業者または試験実験室の製造プロセス、制御、または施設は認められません |
|
|
|
| · | 私たちの製品は異なる承認手続きと生産需要を必要とする薬剤ではなく、設備であると考えられています |
|
|
|
| · | 私たちの製品の一つは、追加の臨床試験や各研究が患者の数を増加させる単一の薬を必要とするのではなく、組み合わせ製品であることを考慮する |
|
|
|
| · | その承認政策を変更したり、新しい法規を採用したりして、私たちの臨床データ或いは監督文書が承認を得るのに十分ではないようにする。 |
植物学的指導の下で,2種類の製品のみがFDAの承認を得た。これらの製品の有効成分はすべて植物抽出物から抽出された。また,両製品とも尋常ざ瘡の適応として承認されていない。淡水スポンジはスポンジ.スポンジ技術的には動物であり,DMT 310薬物製品にスポンジ全体を使用しているため,FDAは薬物製品製造に関連する原材料品質管理の植物学的ガイドラインを参考にすることを可能にしている。私たちは他の規制機関がDMT 310の承認過程をどのように扱うのか分からない。さらに、FDAまたは他の規制機関は、彼らの政策を変更し、追加の法規を発表したり、既存の法規を修正したり、他の行動を取ったりする可能性があり、これは、私たちが将来開発している製品の承認をタイムリーに阻止または延期する可能性がある。このような政策や規制の変化は、私たちに追加的な要求を加えるかもしれません。承認された能力を延期したり、コンプライアンスコストを増加させたり、私たちが獲得した可能性のある任意のマーケティング許可を維持する能力を制限したりするかもしれません
私たちの任意の候補製品に対するいかなる適用規制承認のいかなる遅延、制限、または拒否は、私たちの候補製品の商業化に不利な影響を与え、私たちの業務、財務状況、経営業績、将来性を損なうだろう
われわれは第1段階3期臨床試験を行う準備をしているが,それや将来の臨床試験は成功できないかもしれない
3期臨床試験の進行は複雑な過程である。われわれの管理チームメンバーは過去に他社勤務時に3期臨床試験を行ったことがあるにもかかわらず,会社としてはこれまで3期臨床試験を行ったことがないため,予想以上の時間とより大きなコストが必要である可能性がある。正確な治療方案、完成或いは遅延を含むことができず、私たちの第三段階の臨床試験を阻止或いは遅延することは、未来のDMT 310臨床試験を開始し、監督部門の私たちの候補製品に対する承認を得て商業化することを阻止或いは延期する可能性があり、これは私たちの財務業績に不利な影響を与える。また,我々の競争相手の一部は現在DMT 310と同様の適応を治療する候補製品の臨床試験を行っており,本来われわれの臨床試験に参加する資格のある患者は競争相手の候補製品の臨床試験に参加することができる
| 42 |
| カタログ表 |
患者の入選は他の要素の影響を受けている
| · | 調査中の病気の重症度は |
|
|
|
| · | 研究に関する資格基準 |
|
|
|
| · | 研究された製品候補製品のリスクと収益を感知する |
|
|
|
| · | 臨床試験に参加するための努力を促進し |
|
|
|
| · | 医者の患者の回診のやり方 |
|
|
|
| · | 治療中および治療後に患者の能力を十分に監視する; |
|
|
|
| · | 潜在的患者のための臨床試験場所の距離および利用可能性を提供する |
|
|
|
| · | 私たちは、対象、主要な研究者、またはスタッフの潜在的な大流行、または臨床サイトの利用可能性(例えば、新冠肺炎の発生)を制限する可能性があるなど、制御できない要因である可能性がある。 |
現在の候補製品や将来の候補製品が規制部門の承認を得ても,医師や患者の広範な採用や商業成功に必要なことを実現できない可能性がある
私たちの現在または未来の任意の候補製品の商業成功は、承認されれば、商業的に成功しないかもしれないが、医師、患者、および適応を承認する支払人の結果製品の広範な採用と使用に大きく依存するだろう。承認された場合、私たちの現在または未来の候補製品の採用程度および採用率は、複数の要素に依存する
| · | この製品が承認された臨床適応およびこれらの適応の治療に対する患者の承認製品の需要 |
|
|
|
| · | 他の治療法と比較して私たちの製品の有効性は |
|
|
|
| · | 私たちが承認される可能性のある任意の候補製品について、保健計画および他の医療支払者を管理することは、保険と十分な補償を提供する |
|
|
|
| · | 代替療法に関する私たちの候補製品の治療コストと、患者は製品に支払うことを望んでいます(承認されれば) |
|
|
|
| · | 医師、診療所の主要な経営者と患者はこの製品を安全かつ有効な治療方法である |
|
|
|
| · | 医師および患者は、承認された適応を治療するための他の利用可能な治療法ではなく、スポンジ製品DMT 310を含む新しい治療法を採用することを望んでいる |
|
|
|
| · | 患者は淡水スポンジから抽出した製品は医療サービスを提供できると考えている |
|
|
|
| · | 承認された適応治療に対する医師または患者の可能性のある特定の療法に対する任意の偏見を克服する; |
| 43 |
| カタログ表 |
| · | 医師や医療関係者が製品候補者の適切な訓練と管理を行う |
|
|
|
| · | 私たちの候補製品の結果と管理および全体的な治療体験に対する患者の満足度 |
|
|
|
| · | 他の非必需品と比較して、患者は特に経済的に困難な時期に、私たちのいくつかの候補製品のためにお金を支払うことを望んでいる |
|
|
|
| · | 代替療法と比較して、私たちの候補製品は医師に収入と収益を提供するかもしれない |
|
|
|
| · | 私たちの候補製品の副作用の流行率と深刻さは |
|
|
|
| · | FDAによって承認された候補製品ラベルに含まれる制限または警告; |
|
|
|
| · | FDAは、リスク評価および緩和戦略またはREMSの任意の要件を実施することを要求する |
|
|
|
| · | 私たちの販売、マーケティング、流通努力の有効性 |
|
|
|
| · | 需要に対応するのに十分な供給量を維持することができます |
|
|
|
| · | 私たちの候補製品に対する否定的な宣伝または競争製品に対する肯定的な宣伝;および |
|
|
|
| · | 潜在的な製品責任クレーム。 |
現在または将来の任意の候補製品の使用が許可されているが、ビジネス成功に必要な医師や患者の広範な採用が実現できなければ、私たちの経営業績や財務状況は悪影響を受け、収入を創出し、業務を継続する能力を遅延、阻止、または制限する可能性がある
DMT 310と将来の候補製品にNCE独占経営権を求める予定であるが、このような独占経営権を得ることができない可能性がある
我々の業務戦略の一部として,DMT 310や将来の候補製品のために新たな化学実体やNCEの独占経営権を求める予定である。米国では、製薬業者はNDAがNCEを承認してから5年間の非特許専有権を得ることができ、NCEはFDAが任意の他のNDAで承認されていない活性部分を含む医薬である。活性部分“は、医薬物質の生理的または薬理作用を担う分子またはイオンとして定義される。5年間の排他期間内に、FDAは、薬剤の模倣薬バージョンの承認を求めるいかなるANDAまたは505(B)(2)NDAの申請を受け入れることができず、これは、FDAによる薬物の調査結果に依存するが、後続の申請者が第4段落の認証を行った場合、FDAは4年後の申請を受け入れることができる。製品が小児科独占特許の要求に適合するように、FDAがいくつかの小児科研究を行うことを要求する書面請求を受け、書面請求を受けた後にFDAにこのような研究報告を提出することと、書面請求で指定された条件を満たすこととを含む場合、この排他期間をさらに6ヶ月延長することができる。DMT 310はNCEを構成しており,NCE独占経営権を取得する資格があるべきであると考えられる。しかし、私たちはこのような独占的な許可を得ることができないかもしれません。もし私たちのいかなる競争相手も私たちの前にFDAの類似薬物製品に対するNDAの承認を得たら、彼らは私たちではなくNCEの独占許可を得る資格があるかもしれません。DMT 310のNCE独占経営権を取得していない場合、または競合他社がDMT 310のセキュリティ協定の承認を提出して取得する前に同様の製品のNCE独占経営権を取得した場合、販売および収入を創出する能力は悪影響を受ける
| 44 |
| カタログ表 |
私たちの候補製品が承認されれば、激しい競争に直面し、効果的な競争ができなければ、重大な市場浸透を達成することを阻止するかもしれない
製薬業の特徴は技術が急速に進歩し,競争が激しく,特許療法の開発を高度に重視していることである。多くの製薬会社,後発薬会社,バイオテクノロジー会社,化粧品会社,学術·研究機関が我々が開発している製品と競合する保健製品の開発,特許,製造,マーケティングに従事しており,これらの会社にはVyne Treeutics,Cassiopea,Sol−Gel,Arcutis BioTreatetics,Arena PharmPharmticals,Amgen,AbbVie,Bristol Meyers Squib,Lilly,Nestle,Pfizerなどがある。私たちの多くの競争相手は私たちよりも多くの財務資源、マーケティング能力、販売力、製造能力、研究開発能力、臨床試験専門知識、知的財産権の組み合わせ、特許と製品候補の監督管理承認を得る上での経験及びその他の資源を持っている。競合製品を提供する会社の中には、幅広い他の製品、膨大な直販チーム、そして私たちのターゲット医師との長期顧客関係を持っており、市場浸透努力を阻害する可能性があります。また、もし私たちのいくつかの候補製品が承認されれば、非処方薬治療を含む他の皮膚科製品と競争する可能性があり、いくつかの患者の自由支配可能な予算シェアを争い、臨床実践において医師の注意を引く
私たちの候補製品が規制部門の承認を得たら、私たちは他の承認された療法からの激しい競争に直面すると予想される。承認されれば、私たちの候補製品はまた、規制されていない、承認されていない、ラベル外、および非処方薬と競争する可能性がある。私たちのいくつかの候補製品が承認されれば、承認された適応に新しい治療法を提供し、既存の治療法と競争せざるを得なくなり、その中のいくつかの治療法は医師および患者によって広く理解され、受け入れられている。この市場で競争に成功するためには,我々が承認した製品の相対コスト,安全性,有効性(あれば)が既存および他の新しい療法の魅力的な代替案を提供していることを証明しなければならない。このような競争は私たちの候補製品の市場シェアを減少させ、私たちの候補製品の定価に下振れ圧力を与える可能性があり、これは私たちの業務、財務状況、経営業績と将来性を損なう可能性があります。私たちが直面している競争に関するより多くの情報は、“ビジネス競争”を参照されたい
ある外国国家の監督管理要求はそんなに厳しくないため、これらの国際市場で使用できる皮膚病製品とプログラムはアメリカが使用を許可したのよりずっと多い。ある国際市場では、私たちの競争相手がその製品の有効性やマーケティング方式について主張することも少なく制限されている。したがって、私たちはこのような市場がアメリカよりも多くの競争に直面すると予想する
私たちの候補製品は汎用または同様のタイプの製品競争に直面することが予想され、これは私たちの業務、財務状況、経営業績、将来性に悪影響を及ぼす可能性があります
私たちの任意の候補製品の特許保護が満期になったり、任意の特許保護が失われたり、または私たちの任意の候補製品の特許保護が満了または失われた場合、私たちの任意の候補製品の模倣薬競争相手は、模倣薬またはその等価物に対して未解決の特許侵害訴訟を提起したにもかかわらず、その製品は承認され、その販売価格は私たちが承認した候補製品よりもはるかに低い可能性があり、私たちはその製品の大部分の売上を短時間で損失する可能性があり、これは私たちの業務、財務状況、経営業績、および見通しに悪影響を及ぼすだろう
FDAまたは任意の規制機関が、植物学的ガイドラインの原則に関連する天然材料から派生したので、DMT 310の試み模倣バージョンをどのように見るかは不明である。現在市場では承認されていない天然製品後発薬,FDAにも天然製品後発薬承認プログラムに関するガイドラインはない。そのため、天然製品の模造薬がアメリカで商業販売許可を得ることの難しさがどれだけ大きいかは不明である。FDAがそうなるかどうかは不明です湖のスポンジ代替的に、DMT 310原料とは異なる場所から収穫された類似スポンジ種は、DMT 310原料と同じとみなされるので、汎用経路に従って承認されることができる
| 45 |
| カタログ表 |
私たちが商業化している任意の候補製品、または私たちが協力する可能性のある任意のパートナーが商業化された任意の製品は、持続的な規制審査を受けるだろう
私たちまたは私たちのパートナーがアメリカの規制機関の候補製品の承認を得ても(あれば)、私たちまたは私たちのパートナーは持続的な規制審査とコンプライアンス義務の制約を受けるだろう。例えば、我々の候補製品について、FDAは、製品が発売される可能性のある承認の指示用途または承認条件に重大な制限を加える可能性がある。候補製品の承認には、製品の安全性および有効性を監視するための第4段階臨床試験またはREMSを含む可能性の高い承認後の研究および監視の要件が含まれる可能性がある。私たちはまた、FDAの持続的な義務と持続的な規制審査を受け、私たちの候補製品の製造、加工、ラベル、包装、流通、有害事象報告、貯蔵、広告、販売促進、記録などに関連する。これらの要件は、安全および他の発売後の情報および報告の提出、登録、およびcGMP要件、FDAの良好な臨床実践(GCP)、良好な農業および採集規範(GACP)、要求および良好な実験室規範(GLP)の継続を含み、これらの要件は、FDAが臨床および臨床前開発および著者らが行った任意の臨床試験においてすべての候補製品に対して実行される法規およびガイドラインである。ある候補製品が他の国/地域での販売が許可された場合、私たちはこれらの国/地域の法律と政府規制機関によって加えられた同様の制限と要求を受ける可能性がある
もし私たち、私たちのパートナー、私たちの候補製品、あるいは私たちの候補製品の製造施設が適用される規制要求を遵守できなければ、規制機関は:
| · | 製品の販売、製造を制限し、製品の承認または取り消しに必要な許可証を一時停止または撤回する |
|
|
|
| · | 宣伝材料を強制的に修正したり、医療従事者に訂正情報を提供するように要求したりします |
|
|
|
| · | 様々な罰金の適用、検査費用の精算、具体的な行動に必要な満期日、規定を遵守しないことに対する処罰を含むことができる、私たちまたはパートナーに同意法令を締結することを要求します |
|
|
|
| · | 開示されている可能性がある警告状の発行、原因通知の説明、または呼ばれる違反を説明する無見出しの手紙 |
|
|
|
| · | 刑事捜査と起訴を展開する |
|
|
|
| · | 禁止、一時停止、または必要な承認またはその他の許可を実施する |
|
|
|
| · | 他の民事や刑事罰を与える者は |
|
|
|
| · | 進行中の臨床試験を一時停止します |
|
|
|
| · | 私たちまたは私たちの潜在的パートナーが提出した係属中の出願または承認された出願を承認することを遅延または拒否する追加出願; |
|
|
|
| · | 米国からの麻薬または易製毒化学品の輸入または輸出の許可を拒否する |
|
|
|
| · | 費用の高い新しい製造要件を含む、一時停止またはサービスに制限を加えること;または |
|
|
|
| · | 製品を差し押さえたり差し押さえたりしたり、私たちまたは私たちのパートナーに製品のリコールを開始することを要求します。 |
FDAおよび他の適用される政府機関の法規、政策または指導は変化する可能性があり、私たちの候補製品に対する規制承認を阻止または延期するため、または承認後の活動をさらに制限または規範化するために、新しいまたは追加の法規または政府法規が公布される可能性がある。米国や海外の将来の立法や行政行動によって生じる可能性のある不利な政府規制の可能性、性質、程度を予測することはできない。もし私たちが規制コンプライアンスを達成して維持することができなければ、私たちは私たちの候補製品のマーケティングを許可されないかもしれません。これは、私たちが収入を創出し、収益性を達成したり、維持したりする能力に悪影響を与えます
| 46 |
| カタログ表 |
我々は将来,米国以外で候補製品の臨床試験を行う可能性があり,FDAや適用される外国規制機関はこのような試験からのデータを受け入れない可能性がある
私たちは将来、カナダ、ヨーロッパ、南米を含むアメリカ以外の場所で1つ以上の臨床試験を行うことを選択するかもしれない。FDAまたは適用される外国規制機関は、米国または適用司法管轄区域外で行われた臨床試験からのデータを受け入れることができるが、FDAまたは適用される外国規制機関は、このような研究データをいくつかの条件によって制限される可能性がある。外国の臨床試験のデータを米国の上場承認の基礎として利用しようとする場合、FDAは、これらのデータが米国の人口および米国の医療実践に適用されない限り、外国のデータのみに基づいて申請を承認することはなく、研究は公認能力のある臨床研究者によって行われ、データは有効であると考えられ、FDAによる現場検査を必要としない、またはFDAがこのような検査を行う必要があると考えられる場合、FDAは現場検査または他の適切な方法でデータを検証することができる。多くの外国の規制機関も似たような要求を持っている。また、このような外国研究は、研究を行う外国司法管轄区に適用される現地法律に規定される。FDAや適用された外国規制機関が米国や適用司法管轄区域以外で行われた試験データを受け入れることは保証されない。FDAや適用される外国の規制機関がこれらのデータを受け入れなければ、追加的な試験が必要になる可能性が高く、高価で時間がかかり、私たちの業務計画の様々な側面を遅らせることになるだろう
私たちの候補製品は、不良な副作用や他の予期しない特性をもたらす可能性があり、その規制承認を延期または阻止し、承認ラベルの商業イメージを制限したり、承認後の規制行動を招いたりする可能性がある
私たちのどの候補製品も、臨床開発中または(承認された場合)承認された製品が発売された後に予見できない副作用が生じる可能性がある。候補製品によって引き起こされる副作用は、私たち、私たちが協力する可能性のある任意のパートナーまたは規制機関が臨床試験を中断、修正、延期、または停止させる可能性があり、より厳しいラベルやFDA、または同様の外国機関が規制承認を遅延または拒否する可能性があります。臨床試験の結果は深刻で受け入れられない副作用を明らかにする可能性がある。この場合、試験は一時停止または終了される可能性があり、FDAまたは同様の外国規制機関は、任意またはすべての目標適応の候補製品のさらなる開発を停止するか、または承認を拒否するように我々または潜在的パートナーに命令することができる。薬物に関連する副作用は、患者の募集や患者の試験完了能力に影響したり、製品責任クレームを招いたりする可能性がある。これらの状況のいずれも、私たちの業務、財務状況、経営業績、および見通しを損なう可能性があります
さらに、私たちまたは他の人が、私たちの候補製品が、アメリカまたは外国の規制部門の承認を得た後、または同じまたは関連する活性成分を有する他の製品に起因する副作用または他の以前に未知の問題を発見した場合、多くの潜在的な負の結果をもたらす可能性がある
| · | 規制部門は製品の承認を撤回することができる |
|
|
|
| · | 規制当局は製品のリコールを要求するかもしれないし、私たちまたは私たちの潜在的なパートナーは自発的に製品をリコールするかもしれない |
|
|
|
| · | 規制部門は、製品ラベルに警告や禁忌症を増加させ、製品ラベルの適応範囲を縮小したり、医師や薬局に現場警報を出したりすることができる |
|
|
|
| · | 私たちは、患者に配布するために、またはREMSを確立するために、そのような副作用のリスクを要約するための薬物ガイドラインの作成を要求されるかもしれない |
|
|
|
| · | 私たちは製品をどのように普及させるかについて制限されるかもしれない |
|
|
|
| · | 私たちは製品の投与方法を変更したり、他の方法で製品を修正することを要求されるかもしれません;FDAまたは適用される外国の規制機関は、製品の安全性または有効性を監視するために、追加の臨床試験または高価な発売後試験および監視を要求する可能性があります |
|
|
|
| · | FDAまたは適用される外国の規制機関は、製品の安全性または有効性を監視するために、追加の臨床試験または高価な上場後試験および監視を要求する可能性がある |
|
|
|
| · | この製品の販売台数は大幅に減少する可能性がある |
|
|
|
| · | 私たちは起訴され、患者への傷害に責任を負うかもしれない |
|
|
|
| · | 私たちのブランドと名声は影響を受けるかもしれない。 |
| 47 |
| カタログ表 |
不良副作用または他の以前に未知の問題に起因する上記のいずれのイベントも、影響を受ける候補製品に対する市場の受容度を達成または維持することを阻止することができ、候補製品の商業化コストを大幅に増加させる可能性がある
私たちは製品責任のリスクに直面するかもしれません。もし私たちに成功したクレームを提出すれば、もし私たちがこれらのクレームに対する保険カバー範囲が十分でなければ、私たちは重大な責任を招くかもしれません
私たちの候補製品の臨床テストのため、私たちは固有の製品責任リスクに直面しています。もし私たちがどんな製品を商業化すれば、私たちはもっと大きなリスクに直面します。1つの製品がFDAによって商業販売のために承認され、FDAまたは適用される外国規制機関の許可および規制された施設で生産されても、このようなリスクは依然として存在する。私たちの製品と候補製品は重要な身体機能と過程に影響を与えることを目的としている。私たちの候補製品に関連するどんな副作用、製造欠陥、誤用、または乱用は、患者の負傷や死亡を招く可能性がある。私たちは私たちが未来に製品責任訴訟に直面しないことを保証することもできませんし、私たちの保険カバー範囲がこのような状況での私たちの責任をカバーするのに十分であることを保証することもできません
また、私たちの候補製品がただダメージを与えているように見えても、私たちに責任を請求する可能性があります。消費者、ヘルスケア提供者、製薬会社、または他の販売または他の方法で私たちの候補製品に接触した人は、私たちに製品責任クレームを提起するかもしれません。もし私たちが製品責任クレームで自分を弁護することに成功できなければ、私たちは重大な責任と名声の損害を招くだろう。さらに、製品責任クレームは、是非曲直や最終結果にかかわらず、以下のようになる可能性がある
| · | 臨床試験参加者の脱退 |
|
|
|
| · | 臨床試験場所や試験項目全体を中止し |
|
|
|
| · | 私たちの候補製品に対する規制部門の承認を得ることができない |
|
|
|
| · | 私たちの候補品を商業化することはできません |
|
|
|
| · | 私たちの候補製品への需要は減少しました |
|
|
|
| · | 私たちのビジネス的名声を損なうことは |
|
|
|
| · | 製品のリコール、または市場からの撤回、またはラベル、マーケティング、または販売促進制限 |
|
|
|
| · | 関連した訴訟や同様の紛争の巨額の費用 |
|
|
|
| · | 経営陣の関心と他の資源を私たちの主な業務から分離します |
|
|
|
| · | 私たちの患者または他のクレーム者に保険範囲内にない可能性のある巨額の金銭賠償を支払う;または |
|
|
|
| · | 収入損失。 |
| 48 |
| カタログ表 |
私たちは現在製品責任保険を維持しています。これは私たちのすべての製品責任に関連する費用や損失をカバーするのに十分ではないかもしれませんし、私たちが受ける可能性のあるいかなる費用や損失も含まれていないかもしれません。さらに、保険範囲はますます高価になっており、将来、私たちは製品責任による損失から私たちを保護するために、合理的なコスト、十分な金額、あるいは十分な条項で保険範囲を維持できないかもしれない。もし私たちの候補製品が規制部門の承認を得たら、私たちは私たちの製品責任保険を増加させる必要があり、これは費用が高く、私たちは商業的に合理的な条項で増加した製品責任保険を得ることができないかもしれないし、全く得られないかもしれない。成功した製品責任クレームあるいは一連の私たちに対するクレームは私たちの株価を下落させる可能性があり、もし私たちの保険範囲を超えたと判断すれば、私たちの現金を減少させ、私たちの業務、財務状況、経営業績、将来性を損なう可能性があります
もし私たちの候補製品が発売を許可され、私たちがラベル外用途を不正に普及させたことが発見された場合、あるいは医者が私たちの製品を乱用したり、ラベルの外で私たちの製品を使用したりすれば、私たちは製品販売やマーケティングの禁止、製品責任クレームと巨額の罰金、処罰、制裁を受ける可能性があり、私たちのブランドと名声は損なわれる可能性がある
FDAとその他の監督管理機関は薬品と生物製品に関するマーケティングと販売促進声明を厳格に監督する。特に,製品はFDAや他の規制機関によって承認されていない用途や適応に使用されてはならず,これらの用途や適応は製品の承認ラベルに反映されており,直接比較臨床データがなければ,相対的安全性や有効性声明を提示することはできない。もし私たちが任意の候補製品のラベル外使用を推進することが発見されたら、私たちは警告または命名されていない手紙を受け取り、重大な責任を負うことができ、これは私たちの業務に実質的な損害を与えるだろう。連邦政府も州政府も不正販売促進の疑いのある会社に巨額の民事と刑事罰金を科し、いくつかの会社がラベル外販売促進に従事することを禁止している。もし私たちが私たちのマーケティングや販売促進慣行に基づくこのような調査や起訴の目標になれば、私たちは同様の制裁に直面する可能性があり、これは私たちの業務に実質的な損害を与えるだろう。また、経営陣の注意は私たちの業務運営から移行する可能性があり、巨額の法的費用が生じる可能性があり、私たちのブランドや名声が損なわれる可能性があります。FDAはまた、企業に同意法令または永久禁止を締結し、これらの法令または永久禁止に基づいて、特定の販売促進行為を変更または制限することを要求する。もし私たちがFDAが私たちの製品のラベル外使用の販売促進活動に参加していると思われた場合、私たちは無見出しの手紙、警告状、禁止、差し押さえ、民事罰金、刑事罰を含むFDA規制または法執行行動の影響を受ける可能性がある。もし他の連邦、州、あるいは外国の法執行機関が私たちの商業活動が非ラベル使用を普及させることを構成していると思っていれば、また行動する可能性があり、これは刑事罰を含む重大な処罰を招く可能性がある, 民事または行政処罰、損害賠償、罰金、返還、政府医療計画から除外され、我々の業務を削減または再編する。
しかし、私たちは医師が彼や彼女が適切だと思う場合、これらの適応以外に私たちの候補製品を使用することを防ぐことはできない。医師はまた、私たちの候補製品を乱用したり、不適切な技術を使用したりする可能性があり、不良結果、副作用、または傷害を招く可能性があり、これは製品責任クレームを招く可能性がある。もし私たちの候補製品が誤用されたり、不適切な技術と一緒に使用されたりすれば、私たちは医者や彼らの患者から高価な訴訟を受けるかもしれない。さらに、FDAによって承認された適応以外に私たちの候補製品を使用することは、このような疾患を有効に治療できない可能性があり、これは、医師および患者における私たちの名声を損なう可能性がある
私たちは、開発中または承認後のいつでも、私たちの任意の候補製品を開発または商業化しないことを選択することができ、これは、これらの候補製品に対する私たちの潜在的な投資リターンを減少または除去するだろう
いつでも、私たちは様々な理由で私たちの任意の候補製品の開発を停止することを決定することができますか、または私たちが承認した1つまたは複数の候補製品を商業化し続けることなく、私たちの製品を時代遅れにする新しい技術、競争相手製品からの競争、または適用される規制要件に変更または適合しないことを含むことができます。もし私たちが大量の資源を投入した計画を中止すれば、私たちは私たちの投資から何の見返りも得られず、私たちはこれらの資源を潜在的により効果的な用途に割り当てる予想された機会を逃すだろう
| 49 |
| カタログ表 |
例えば、2022年12月5日、私たちはDMT 310治療中に重度の酒かす鼻まで週に1回局所応用された我々の第2段階試験のTOPLINE結果を発表した。データは炎症性皮膚病の治療法としてDMT 310を支持しているが、酒かす鼻研究はその主要な終点に達していない。以上のことから,我々はDMT 310のこの適応を開発するためにさらなる財源を投入しないことを決定し,DMT 310のこの適応についてはさらなる開発を行わないことにした
私たちまたは私たちの現在と未来のパートナーは将来的に製品リコールの影響を受ける可能性があり、これは私たちのブランドと名声を損なう可能性があり、私たちの業務に負の影響を与える可能性があります
もし私たちの候補製品が上場を許可され、規格に適合していない場合、または傷害や病気を引き起こすと考えられている場合、または製造、ラベル、販売促進、販売または流通に関する法規を含む政府法規に違反していると告発された場合、私たちまたは私たちの現在と未来のパートナーは、製品のリコール、撤回、または差し押さえの影響を受ける可能性がある。将来のどんなリコール、撤回、または差し押さえも、消費者が私たちのブランドの自信に実質的な悪影響を与え、私たちが承認した製品への需要を減少させる可能性がある。また、私たちが承認したどの製品もリコール、撤回、または差し押さえには管理職の高い関心が必要であり、巨額と思わぬ支出を招き、私たちの業務、財務状況、経営業績を損なう可能性があります
私たちまたは私たちが協力する可能性のある任意のパートナーが、規制の承認を得られる可能性のある任意の候補製品、または商業化を求める可能性のある任意の未来の製品が達成され、カバー範囲と十分な精算レベルを維持することができなければ、それらの商業的成功は深刻に阻害される可能性がある
処方によってしか得られない候補製品について、私たちまたは私たちが協力する可能性のある任意のパートナーの成功的な販売は、保証範囲の利用可能性と第三者支払者の十分な精算に依存する。自分の病状を治療するために処方された患者は、通常、その処方薬に関する費用の全部または一部を精算するために第三者支払者に依存する。政府医療計画(MedicareおよびMedicaidなど)および個人第三者支払者が提供する保険範囲と十分な補償は、新製品の受容度に重要である。カバー範囲の決定は臨床と経済標準に依存する可能性があり、より成熟或いはより低コストの治療代替物がすでに利用可能であるか、あるいはその後利用可能な場合、これらの標準は新薬製品に不利である。もし私たちの候補製品が魅力的な治療プロファイルを示さなければ、彼らは保険と精算を受ける資格がないかもしれない。特定の製品の保険を受けても,それによる精算支払率が十分に高くない可能性があり,あるいは患者が受け入れられないほど高く受け入れられないほど高い共同支払いが必要である可能性がある。患者は保険を提供しなければ、私たちの製品を使用することはあまりできません。私たちの製品の大きなコストを支払うのに十分な費用を精算するのに十分です
また,我々の候補製品の市場は,第三者支払者の薬物処方を獲得できるかどうか,あるいは第三者支払者が保険や精算の薬剤リストを提供するかどうかに大きく依存する。このような処方に組み込まれた業界競争は往々にして製薬会社に下振れ価格圧力をもたらす。さらに、価格の低い後発薬または他の代替品がある場合、第三者支払者は、その処方に特定のブランド薬を含むことを拒否するか、または他の方法で患者がブランド薬を得ることを制限する可能性がある
また,第三者決済者は,外国でも国内でも,政府のも商業的にも,ますます複雑な方法を開発して医療コストを抑えている。また,米国では,個人第三者支払者は連邦医療保険に従う傾向にあるにもかかわらず,第三者支払者間には統一された薬品保険や精算政策がない。そのため、薬品の保証範囲と精算範囲は支払人によって異なる。そのため、保証範囲の決定過程は通常時間がかかり、高価な過程であり、私たちの候補製品を使用するためにそれぞれ各支払人に科学と臨床支持を提供する必要があり、保証と十分な補償を得ることができない
また、将来の保険·精算は米国や国際市場でより多くの制限を受ける可能性があると考えられる。私たちが規制部門の承認を得る可能性のある任意の候補製品の第三者保険と精算は、アメリカや国際市場で十分な補償を受けることができないかもしれません。これは、私たちの業務、財務状況、経営業績、将来性を損なう可能性があります
| 50 |
| カタログ表 |
医療立法や規制改革措置は、政府の定価や精算の制限を含め、私たちの業務や運営結果にマイナスの影響を与える可能性がある
アメリカと一部の外国司法管轄区では、医療保健システムに関するいくつかの立法と法規の変化と提案された変化が継続され、これらの変化は候補製品の上場承認を阻止或いは延期し、承認後の活動を制限或いは規範化し、上場承認を獲得した任意の候補製品を収益的に販売する能力に影響を与える可能性がある
米国や他の地方の政策立案者や支払者の中で,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上および/または参入拡大を既定の目標としている。米国では、製薬業はこれらの努力の重点であり、重大な立法計画の大きな影響を受けてきた。例えば,米国では,2010年の“患者保護と平価医療法案”(Patient Protection and Affordable Care Act,略称ACA)は政府や民間保険会社が医療保健に資金を提供する方式を大きく変え,製薬業に大きな影響を与えている。ACAの多くの条項は生物製薬業界に影響を与え、生物製薬製品がMedicare Part BとMedicaid計画に従って連邦補償を獲得するため、あるいはアメリカ政府機関に直接販売するために、メーカーは公衆衛生サービス法(PHS)に基づいて薬品定価計画に参加する資格のある実体に割引を提供しなければならない。公布以来、ACAのいくつかの側面に対して司法と国会の質疑と修正案が提出された。ACAの実行には、ACAをさらに修正する可能性と、ACAの法的挑戦またはACAの廃止への努力とを含む不確実性が依然として存在する
また、処方薬や生物製品価格の上昇を受けて、米国政府は薬品定価のやり方の審査を強化した。2021年9月9日、バイデン政府は範囲の広い政策提案リストを発表し、その大部分は薬品価格と薬品支払いを低減するために国会が実行する必要がある。米国衛生·公衆サービス部(HHS)の計画には、他の改革措置のほか、連邦医療保険交渉価格の許可と価格上昇の抑制、およびサプライチェーンの強化、生体模倣薬と模倣薬の普及、価格の透明性を高める市場改革を含む処方薬価格の低下の提案が含まれている。これらの取り組みは最近ピークに達し、2022年8月に“インフレ低減法案”(IRA)が公布され、その中でHHSがある薬品と生物製品の販売価格について交渉することが許可され、これらの薬品と生物製品は連邦医療保険と医療補助サービスセンター(CMS)が連邦医療保険B部分とD部分によって精算され、CMSは少なくとも7年(生物製品は11年)の高支出単一由来薬物しか承認されていないにもかかわらず、交渉価格は選択年度後2年以内に発効する。交渉価格は2026年に初めて発効し,2023年10月から法定最高価格を上限とし,インフレ率よりも高い速度で連邦医療保険B部分とD部分の薬物価格を向上させる製薬業者を懲罰する。アイルランド共和軍は衛生·公衆サービス部長官が最初の数年に規制ではなく指導によってその多くの規定を実施することを許可した。IRAを守らないメーカーは様々な処罰を受ける可能性があります, 民事罰金も含まれている。アイルランド共和軍はまた、ACA市場で医療保険を購入した個人に2025年まで強化された補助金を提供する。このような規定は法的挑戦を受ける可能性があるにもかかわらず、2023年から段階的に施行されるだろう。
他の提案変化の例としては,承認後の要求を拡大し,“孤児薬品法”を変更すること,薬品の販売や販売促進活動を制限することに限らない
私たちは、より多くの立法変化が公布されるかどうか、あるいは政府の法規、ガイドライン、解釈が変わるかどうか、あるいはこれらの変化が私たちの候補薬物や製品の発売承認、販売、定価、または精算にどのような影響を与えるかを決定することはできません。これらの措置や将来講じられる可能性のある他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受けた任意の承認された薬物の価格に追加的な下振れ圧力をもたらす可能性があると予想される。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの薬物の商業化を阻止するかもしれない
| 51 |
| カタログ表 |
さらに、FDAは、我々の業務および製品に大きな影響を与える可能性がある方法で、FDAの法規およびガイドラインを修正または再解釈する可能性がある。任意の新しい法規またはガイドライン、または既存の法規またはガイドラインの修正または再解釈は、DMT 310または任意の将来の候補製品に追加のコストを適用するか、またはFDAの審査時間を延長することができる。規制、法規、政策、解釈の変化がいつ、発表され、実施され、採用された場合、私たちの将来の業務にどのように影響するかを決定することはできません。他の事項に加えて、このような変化は必要かもしれない
| · | 承認される前により多くの臨床試験を行わなければならない |
|
|
|
| · | 製造方法を変え |
|
|
|
| · | 1つ以上の製品のリコール、交換、または生産停止; |
|
|
|
| · | 追加的な記録保存。 |
このような変更は、多くの時間を必要とし、大きなコストをもたらす可能性があり、またはDMT 310または他の候補製品の潜在的な商業価値を低下させる可能性がある。さらに、他の製品の規制承認または承認を遅延させることは、私たちの業務、財務状況、および運営結果を損なうことになります
私たちはまた、医療法律、法規、法執行の制約を受ける可能性があり、私たちがこれらの法律を守らなければ、私たちの業務、運営、財務状況に悪影響を及ぼすかもしれない
詐欺と乱用と患者の権利に関連するいくつかの連邦と州医療保健法律法規は現在も将来も私たちの業務に適用されている。私たちは連邦政府と私たちまたは私たちのパートナーが業務を展開する州によって規制されている。私たちの経営能力に影響を与える可能性のある法律法規には
| · | 他の事項に加えて、任意の個人または実体が直接または間接的に、現金または実物の形態で直接または間接的に現金または実物の形態で直接または間接的に提供され、開示または隠蔽的に提供され、請求され、受信され、または任意の報酬(任意のリベート、賄賂またはリベートを含む)を提供することが禁止され、個人の紹介を誘導するため、または任意の商品、施設またはサービスを購入、レンタルまたは注文する見返りとして、これらの報酬は、連邦医療保険および医療補助計画などの連邦医療計画に従って全部または部分的に支払うことができる |
|
|
|
| · | 連邦民事および刑事虚偽申告法および民事金銭罰法は、例えば、個人または実体に刑事および民事処罰を適用し、民事通報者または刑事訴訟を含む連邦民事虚偽申告法を含む。これらの個人または実体は、他に加えて、虚偽または詐欺的な支払い請求の提出または虚偽または詐欺的な支払いクレームの提出または提出を意図的に連邦政府(連邦医療保険および医療補助計画を含む)に提出するか、または虚偽の陳述によって連邦政府への資金支払い義務を回避、減少、または隠蔽することを含む |
|
|
|
| · | 1996年の連邦“健康保険携帯性と責任法案”、またはHIPAAと呼ばれ、詐欺の任意の医療福祉計画を故意かつ故意に実行または実行しようとする計画を故意かつ故意に実行または実行しようとすることを禁止し、あるいは虚偽または詐欺的な言い訳、陳述または約束によって、任意の医療福祉計画が所有または保管または制御する任意の金銭または財産を得ることを禁止し、支払者(例えば、公共または個人)にかかわらず、医療福祉計画を故意に流用または故意に盗み、医療保険違法行為の刑事調査を故意に阻害する。医療事項の提供または支払いに関連する医療福祉、プロジェクトまたはサービスに関連する重要な事実を任意のトリックまたは手段で隠蔽または隠蔽するか、または任意の重大な虚偽陳述を行うこと |
| 52 |
| カタログ表 |
| · | HIPAAは、“衛生情報技術促進経済·臨床健康法”及びその実施条例改正を経て、個人が識別可能な健康情報のプライバシー、安全及び伝送を保護する上で、ヘルスケア提供者、健康計画及び医療情報交換所を含むカバーされたエンティティ及びそれぞれの業務パートナーが、カバーエンティティ又はそれを代表して個人が識別可能な健康情報を作成、受信、維持、又は送信する義務があることを規定している |
|
|
|
| · | “平価医療法案”の連邦医師陽光要求では、医薬品、設備、生物製品および医療用品のメーカーが、医師および教育病院への支払いおよび他の価値移転に関する情報、ならびに医師およびその直系親族が所有する所有権および投資権益を毎年医療保険および医療補助サービスセンターに報告することを要求する |
|
|
|
| · | 州法律は、任意の第三者支払人(商業保険会社を含む)が精算する物品またはサービスに適用可能な反リベートおよび虚偽クレーム法律のような上記の各連邦法律に相当し、州法律は、製薬会社が製薬業界の自発的コンプライアンスガイドラインおよび連邦政府が公布した適用コンプライアンスガイドラインを遵守することを要求するか、または医療保健提供者および他の潜在的な転換源への支払いを他の方法で制限することを要求し、州法律は、医薬品メーカーに医療提供者またはマーケティング支出への支払いおよび他の価値移転に関する情報を報告することを要求する。また,健康情報のプライバシーやセキュリティを管理する州法もあり,その多くの法律は互いに大きく異なり,同様の効果が生じず,遵守努力を複雑化させる可能性がある。 |
これらの法律の範囲が広く、法定例外状況と選択可能な避難港が限られていることから、私たちのいくつかの商業活動は1つ以上のこのような法律の挑戦を受けるかもしれない。しかも、最近の医療改革法案はこのような法律を強化した。例えば、最近公布された“平価医療法案”は、他に加えて、連邦反リベート法規と特定の医療詐欺刑事法規の意図要件を改正した。個人や実体はこれ以上法規や法規違反の具体的な意図を理解する必要がない。また、“平価医療法”では、政府は、連邦民事虚偽申告法の規定により、連邦“反リベート条例”違反による物品やサービスを含むクレームが虚偽または詐欺的クレームを構成していると主張することができる
このような法律の遵守を達成して維持することは費用が高いことが証明されるかもしれない。また、私たちがこれらの法律に違反した行為は、たとえ私たちが弁護に成功しても、巨額の法的費用を招く可能性があり、私たちの経営陣の業務運営への注意をそらすことができます。私たちの業務が上記の任意の法律または私たちに適用される任意の他の政府の法律または法規に違反していることが発見された場合、私たちは、行政、民事および刑事罰、損害賠償、罰金、返還、連邦および州医療計画から除外され、個人監禁または削減または再編を含む罰を受ける可能性があり、これらは、私たちの業務運営能力および私たちの財務業績に悪影響を及ぼす可能性があります
私たちの業務は危険材料の使用に関連しており、私たちと私たちの第三者サプライヤーと製造業者は環境法律と法規を守らなければなりません。これは高価かもしれませんし、私たちの業務方法を制限しています
私たちの第三者サプライヤーと製造業者の製造活動は、私たちが持っている危険材料の制御された貯蔵、使用、および処置に関し、私たちの候補製品のコンポーネントと他の危険化合物を含む。私たちと私たちの製造業者とサプライヤーはこれらの危険材料の使用、製造、貯蔵、運搬と処分に関する法律法規を守らなければならない。場合によっては、これらの危険材料および使用中に発生する様々な廃棄物は、私たちのサプライヤーまたは製造業者の施設に貯蔵され、使用および処理を待っている。私たちと私たちのサプライヤーと製造業者は汚染リスクを完全に除去することができません。これは私たちの商業化努力、研究開発努力、業務運営中断を招き、私たちのサービスプロバイダや他の人に被害を与え、環境破壊をもたらし、高価な清掃作業を招き、これらの材料と指定廃棄物製品の使用、貯蔵、処理、処理を管理する適用法律と法規に基づいて責任を負うことができます。我々の第三者サプライヤーや製造業者がこれらの材料を処理·処分する際に使用するセキュリティプログラムは、全体的にこれらの法律法規に規定された基準に適合していると信じているが、状況が確かにそうであることは保証されず、これらの材料の意外な汚染や傷害のリスクを除去することもできない。この場合、私たちはそれによって生じるいかなる損害にも責任を負わなければならず、このような責任は私たちの資源範囲を超える可能性がある。私たちは現在生物や危険廃棄物保険を受けていない
| 53 |
| カタログ表 |
当社の従業員、独立請負業者、主要調査者、コンサルタント、サプライヤー、CRO、および私たちが協力する可能性のある任意のパートナーは、法規基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります
私たちが直面しているリスクは、私たちの従業員、独立請負業者、主要な調査者、コンサルタント、サプライヤー、CRO、私たちが協力する可能性のある任意のパートナーが詐欺的または他の不法活動に従事する可能性があるということだ。このような人員の不正行為は、FDAまたは外国規制機関に真、完全かつ正確な情報を報告することを要求する法律、製造基準、連邦、州および外国医療詐欺および法律およびデータプライバシーの乱用、または財務情報またはデータを真に、完全かつ正確に報告することを要求する法律を含む、故意、無謀または不注意な行為、または以下の法律または法規に違反する不正な活動を含む可能性がある。特に、医療業界の販売、マーケティング、その他のビジネス配置は、詐欺、リベート、自己取引、その他の乱用を防止するための広範な法的制約を受けている。これらの法律は、研究、製造、流通、定価、割引、マーケティングおよび販売手数料、販売手数料、顧客インセンティブ計画、および他の商業計画を含む広範な商業活動を制限または禁止する可能性がある。これらの法律の制約を受けた活動はまた、臨床試験中に得られた情報の不適切な使用、あるいは薬品の不法流用に関連し、これは規制制裁或いは他の行動或いは訴訟を招き、それによってこのような法律或いは法規を遵守できず、私たちの名声を深刻に損なう可能性がある。また、連邦調達法は政府契約に関連する不当行為に実質的な罰を加え、ある請負業者に商業道徳と行為準則を維持することを要求した。もし私たちにこのような訴訟を提起し、私たちが自分の権利を弁護したり、維持することに成功しなかったら、これらの行動は民事訴訟の強制執行を含む私たちの業務に大きな影響を与えるかもしれない, 刑事·行政処罰、損害賠償、罰金、連邦医療保険、医療補助、その他の連邦医療保険計画から除外される可能性があり、契約損害、名声損害、利益および将来の収益の減少、および私たちの業務の削減は、私たちの業務運営能力と私たちの経営業績に悪影響を及ぼす可能性があります。
私たちの将来の成長は外国市場に進出する能力にある程度依存しており、そこでは追加の規制負担や他のリスクや不確定要素の影響を受けるだろう
私たちの将来の収益性は、私たちの候補製品を海外市場で商業化する能力があるかどうかにある程度依存し、これらの市場で第三者との協力に依存するつもりです。DMT 310または他の候補製品を海外市場で商業化すれば、追加のリスクと不確定要素に直面するだろう
| · | 私たちの顧客は市場参入を獲得し、私たちの製品候補製品の海外市場で適切な補償を得ることができます |
|
|
|
| · | 私たちは第三者に依存しているので、ビジネス活動を直接統制することはできません |
|
|
|
| · | 複雑で変化の多い外国の監督管理、税収、会計、法律要求の負担を遵守する |
|
|
|
| · | 外国の異なる医療実践と風習が市場受容度に与える影響 |
|
|
|
| · | 輸入または輸出許可証の要件; |
|
|
|
| · | 売掛金入金時間が長い |
|
|
|
| · | 輸送納期がもっと長い |
|
|
|
| · | 技術訓練の言語障害 |
|
|
|
| · | 一部の国では知的財産権の保護力が小さい |
|
|
|
| · | 外貨為替レートの変動 |
|
|
|
| · | 契約紛争が発生した場合、外国の法律によって管轄される契約条項の解釈。 |
| 54 |
| カタログ表 |
私たちの候補製品の海外販売は、政府規制、政治的、経済的不安定、貿易制限、関税変化の悪影響を受ける可能性もあり、いずれも私たちの運営結果に悪影響を及ぼす可能性があります
製品中の複雑な成分混合物のため、DMT 310テスト方法の開発は独特な挑戦に直面している。放出と品質管理評価のために適切な分析方法を決定するためには、成功と不確定まで大量の開発時間とコストを必要とする可能性がある
DMT 310は無機と有機成分からなり,多くの製薬製品と異なり,単一の活性成分が分析開発目的に利用できるものはない。薬物製品の放出と安定性を測定するために、様々な皮膚疾患の発症機序に作用することが知られている炎症性サイトカインに対するDMT 310の抑制作用を評価するために、細胞ベースのバイオアッセイ方法を開発する予定である。この方法は活性を示す可能性があるが、DMT 310の品質制御放出効力試験としては適していない可能性がある。さらに、この技術は、安定性表示および製品の微小な変化または劣化を検出するのに十分な感度を有していない可能性がある。この方法を利用して適切な効力分析を開発することができなければ、代替生物分析プラットフォームまたは補助方法を決定し、開発しなければならない可能性があり、これらの方法は、私たちのテスト要求を満たすために追加の直交方法を必要とする可能性がある。これは高価で時間がかかる可能性があり、成功するかどうかはまだ確定されておらず、秘密保護プロトコルの提出遅延を招く
私たちの第三者への依存に関するリスク
私たちは、DMT 310およびDMT 410を製造するための原材料を提供するサプライヤーに依存している。契約の終了は製品開発の中断を招き、私たちの業務は損害を受けるだろう
私たちは現在、合格したDMT 310とDMT 410で使用されている原材料の供給源しかありません。私たちは私たちのサプライヤーと独占的な供給契約を持っていますが、私たちのサプライヤーは私たちの合意の条項を遵守せず、第三者に供給する可能性があります。DMT 310およびDMT 410は、ロシア政府実体の一部によって保護されたロシアボルガ川デルタ地域に生育する野生淡水スポンジを含む。ロシア政府実体は一定の数量の淡水スポンジを分配し、各収穫季節に収穫することができ、任意の年に特定の年にスポンジやスポンジの数が数年未満であることを決定することができ、これはDMT 310とDMT 410の原材料を製造し、供給する能力に影響を与える可能性がある。十分な原材料備蓄がなければ、あるいは原材料を備蓄していても、私たちの非臨床·臨床研究を行う数量的な需要を満たすのに十分な原材料があるか、承認された場合に市場に製品を供給することはできません
ある環境条件によって、DMT 310とDMT 410に含まれる淡水スポンジは毎年1回しか収穫できない。収穫季節にこれらの環境条件がなければ、私たちのサプライヤーは必要な原材料を収穫できない可能性があり、これはDMT 310およびDMT 410を製造および供給する能力に影響を与える可能性がある。私たちのサプライヤーがスポンジを収穫する能力も悪天候の影響を受ける可能性があり、彼らが収穫できる時間の長さを制限することができ、これは収穫できる原材料の数量を制限する可能性があり、これは私たちがDMT 310とDMT 410を製造して供給する能力に影響を与えるかもしれない。ボルガ川デルタスポンジが成長した部分も汚染物の汚染を受ける可能性があり、これは私たちのサプライヤーが収穫しようとしているスポンジを汚染し、人類に使用できないようにし、私たちのDMT 310とDMT 410を製造と供給する能力に影響を与えるかもしれない
| 55 |
| カタログ表 |
私たちが供給を得ることができても、私たちと私たちのサプライヤーは多くの環境と地政学的リスクに直面しています
| · | ボルガ川に汚染を導入して汚染する可能性があります湖のスポンジ人口は私たちがコントロールできない環境要因によって、新たな不純物や原材料の供給を減少させる可能性がある |
|
|
|
| · | 損湖のスポンジ生息地や他の類似した環境リスクがスポンジ個体群に及ぼすリスクは,気候変動,過剰開発,その他の原因によるものである |
|
|
|
| · | 病気のリスクは湖のスポンジ収穫された地理的地域 |
|
|
|
| · | 米ロ貿易問題のリスク |
|
|
|
| · | アメリカとロシアの間の特定のプロジェクトの貿易を制限します |
|
|
|
| · | ロシアの実体との支払い手段を制限する; |
|
|
|
| · | 他の予見できない地政学的要素は私たちが原材料供給を得る能力を制限する。 |
原材料の収穫に制限を加えることができる。このようなイベントは、DMT 310およびDMT 410および予想される製造ライン拡張のコストおよび能力に大きな影響を与える可能性がある。原材料を入手した国は、天然製品の輸出に関する法律や条例を変更したり、そのような製品の輸出業者が支払うべき税金や関税を徴収したり増加させたりすることができる。また、我々の既存のサプライヤーが直面しているいかなるビジネス、世界的または経済的課題も、正常な業務プロセスにおいても、非正常な業務プロセスにおいても、私たちの原材料需要を供給する能力を弱める可能性がある。したがって、私たちの原材料供給は、私たちの天然由来製品の供給と生産に影響を与えるいかなる問題によって、著しく遅延したり、利用できなくなる可能性があるかもしれない。さらに、私たちが新しいまたはより多くのサプライヤーが必要な場合、私たちが臨床前に必要な品質と数量で私たちに必要な原材料を供給できる他の任意のサプライヤーを探すのに多くの時間と財力が必要かもしれません。私たちは商業的に合理的な条項で代替または新しいサプライヤーと新しい合意を交渉することができないかもしれませんが、私たちがこのような合意に到達できなかったことは、私たちの財務状況、業務、臨床試験、将来性を損なう可能性があります
私たちの業務はロシアに対する新しい制裁と輸出規制、ロシアのウクライナ侵攻に対する他の反応の影響を受けるかもしれない。
ロシアのウクライナ侵攻により、米国、イギリス、EUなどの政府は、ロシア個人と実体に対する一括調整制裁と輸出規制措置を制定した。私たちは現在独占的な供給協定の一方ですスポンジ.スポンジDMT 310およびDMT 410のための原料。この供給協定の相手側はロシアの実体だ。今まで、このような制裁や輸出規制は私たちが供給協定を履行する能力に影響を与えなかった。しかしながら、米国、イギリス、および/またはEUは、ロシアおよびロシアエンティティとの取引に対して強化された輸出制御および経済制裁を実施し、本既存の契約または私たちが締結する可能性のある任意の将来の契約に基づいて、サプライヤーから購入した原材料の支払いを履行または送金することを阻止するかもしれない。私たちは二つの荷物を受け取りましたスポンジ.スポンジ2022年度のサプライヤーからの原材料、追加数量が含まれていますスポンジ.スポンジこれらの原材料は私たちに十分な数のスポンジ.スポンジ中から重度のざ瘡に対する2つの第3段階研究を開始し、完成させ、2つの第3段階研究に成功した場合、ざ瘡を治療するDMT 310の新薬申請の提出を支持する。ロシアに対して実施される可能性のある新しい制裁または輸出規制の程度および広さによると、そうでなければ、またはウクライナ戦争の影響により、私たちの業務、運営結果、および財務状況は実質的で不利な影響を受ける可能性がある。
| 56 |
| カタログ表 |
私たちは過去に依存してきて、引き続き第三者CROと他の第三者に依存して、私たちの臨床試験と製品開発の他の方面を行って監督することが予想されている。もしこれらの第三者が私たちの要求に適合していない場合、あるいは要求に応じて実験を行うことができない場合、私たちは私たちの契約義務を履行できないか、あるいは規制部門の私たちの候補製品の承認を得ることができないか、あるいはそれを商業化することができないかもしれない
我々は従来,第三者CROに依存して臨床試験や製品開発の他の側面を行って監督していくことが予想されてきた。著者らはまた異なる医療機関、臨床研究者と契約実験室に依存して、著者らの臨床規程とすべての適用された法規要求に基づいて試験を行い、FDAの法規とGCPを含み、これは患者の権利と健康を保護するための国際標準であり、そして臨床試験発起人、管理者と監督者の役割、及び薬品と生物製品の処理、貯蔵、安全と記録保存を管理する州法規を定義した。これらのCROと他の第三者はこれらの試験を行い、その後臨床試験からデータを収集と分析する上で重要な役割を果たしている。著者らの臨床試験と臨床前研究の実行はこれらの方面に深刻に依存し、彼らの活動のいくつかの方面のみを制御している。我々および我々のCROおよび他の第三者請負者は、FDAおよび同様の外国規制機関が臨床開発製品に対して実行する法規およびガイドラインであるGCP、GLP、およびGACP要件を遵守しなければならない。監督管理機関は定期的に試験スポンサー、主要な調査者、試験地点を検査することによって、これらのGCP、GLPとGACP要求を実行する。私たちまたはこれらの第三者のいずれかが適用されるGCP、GLP、およびGACP要件を遵守できない場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDAまたは他の規制機関は、私たちまたはパートナーのマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。特定の規制機関で検査した後、保証することはできません, このような規制機関は、我々の任意の臨床または前臨床試験が適用されるGCPおよびGLP要件に適合することを決定するであろう。また,われわれの臨床試験は通常cGMP法規下で生産された製品を用いて行われなければならない。私たちがこれらの法規と政策を遵守しないことは、私たちが臨床試験を繰り返す必要があるかもしれないが、これは規制承認過程を遅らせるだろう。
私たちのCROは私たちの従業員ではなく、私たちは彼らが私たちの臨床試験に十分な時間と資源を投入しているかどうかをコントロールすることができない。私たちのCROはまた、私たちの競争相手を含む他の商業実体と関係があるかもしれません。彼らはまだこれらの実体のための臨床試験または他の薬物開発活動を行っているかもしれません。これは私たちの競争地位を損なうかもしれません。私たちはCROが私たちの知的財産権を不正に開示または流用する可能性があるというリスクに直面しており、これは私たちのビジネス秘密保護を低下させ、私たちの潜在的な競争相手が私たちのノウハウを訪問して利用することを可能にするかもしれない。もし私たちのCROがその契約の義務または義務を成功裏に履行できず、予想された期限内に達成できなかった場合、または彼らが得た臨床データの品質または正確性が私たちの臨床方案や法規の要求または任意の他の理由を遵守できなかった場合、私たちの臨床試験は延長、延期、または終了される可能性があり、私たちは規制部門の私たちが開発した任意の候補製品の承認を得ることができないか、または商業化に成功できないかもしれない。したがって、私たちの財務業績と私たちが開発したどの候補製品のビジネス見通しも損なわれ、私たちのコストが増加する可能性があり、私たちの収入を創出する能力が遅れる可能性がある
もし私たちのいかなるCRO或いは臨床試験サイトがいかなる原因で私たちの臨床試験に参加することを中止すれば、私たちはCRO或いは臨床試験サイトの代替と手配を達成できないかもしれない、あるいは商業的に合理的な条項でそうする。また,臨床試験サイトとの関係が終了すると,われわれが行っている臨床試験に登録されている患者の後続情報が失われる可能性があり,これらの患者の看護を別の適格な臨床試験サイトに移すことができない限りである。さらに、私たちの臨床試験の首席研究者は時々私たちの科学顧問や顧問を務めることができ、このようなサービスに関連する現金または持分補償を得ることができる。これらの関係と任意の関連する賠償が知覚的または実際の利益の衝突をもたらす場合、FDAは、適用される臨床試験地点で生成されたデータの完全性を疑問視する可能性がある
私たちは第三者請負業者が私たちの候補製品の供給、製造、流通の臨床薬物供給に完全に依存しており、いくつかの独占的なサプライヤーとメーカーを含み、もし私たちの任意の候補製品が監督管理の承認を得たら、私たちは第三者に依存して商業供給、製造、流通を行うつもりで、私たちは未来の任意の候補製品の臨床前、臨床と商業供給の供給、製造、流通は第三者に依存すると予想している
私たちは今のところありませんし、臨床前、臨床または商業数量の薬物物質または製品を供給、製造または流通するインフラや能力を得るつもりもありません。私たちは候補製品を開発する能力と、私たちが製品を商業的に供給する能力は、私たちが第三者から私たちの候補製品で使用されている原材料と原料薬、その他の物質と材料を獲得することに成功できるかどうかにある程度依存し、法規の要求に基づいて第三者から完成品を製造し、臨床前と臨床試験と商業化に十分な数量の製品を持っている。もし私たちがこれらの第三者との供給関係を発展させ、維持することができなければ、私たちは私たちの候補製品を開発し続けたり、商業化することができないかもしれない
| 57 |
| カタログ表 |
私たちは彼らが提供する材料または彼らが製造した完成品の唯一の供給源としていくつかの第三者に依存し続けていくだろう。私たちの既存のどんなサプライヤーや製造業者でもいいです
| · | 施設や設備の意外な損傷や損傷、または他の理由で、タイムリーまたは要求された数量で製品を提供することができません |
|
|
|
| · | 製造能力をタイムリーにあるいは費用効果的に増加させ、より多くの数量とより高い生産量で薬品と成分を生産することができなかったか、あるいは私たちの商業需要を十分に満たすことができなかった |
|
|
|
| · | 独占サプライヤーとメーカーの関連問題に依存して、私たちの生産需要を満たすことができません |
|
|
|
| · | 規制要件を満たしていない製品を提供してくれます |
|
|
|
| · | 事業中断や財務が借金を返済できないために得られません |
|
|
|
| · | 承認された源としての規制の地位を失う |
|
|
|
| · | 既存の供給契約がタイムリーに満了し、条項が許容可能または完全に満了したときに、そのような合意を継続することを望まないか、または継続することはできないか、または |
|
|
|
| · | 必要な医薬物質や製品の生産を中止したり製造したりする。 |
上記のいずれかの場合、私たちがサプライヤーまたは製造業者を代替していない場合、プロセスを識別、同定し、代替サプライヤーまたは製造業者に転送するために、多くの管理時間および費用がかかるであろう。技術を他の場所に移転するには、追加のプロセス、技術、および検証研究が必要となる可能性があり、これらのプロセス、技術および検証研究はコストが高く、かなりの時間を要する可能性があり、成功しない可能性があり、多くの場合、FDAの審査および承認が必要となる。新しいサプライヤーやメーカーの需要を探して鑑定するいかなるものも、私たちの候補製品の生産を大幅に延期し、私たちのマーケティング候補製品の能力に悪影響を与え、私たちの業務に悪影響を及ぼす可能性がある。私たちはタイムリーに、受け入れ可能な条項を押したり、交換を受けることができないかもしれない。しかも、私たちと私たちの製造業者は現在大量の薬物物質と他の材料の在庫を持っていない。薬物または他の材料の供給または私たちの候補製品の製造のいかなる中断も、私たちの業務、財務状況、経営業績、および将来性に重大な悪影響を及ぼす可能性がある
私たちは私たちの契約サプライヤーとメーカーが品質管理、品質保証、合格者を含む十分な能力を維持する能力があるかどうかを直接制御することができません。私たちは最終的にcGMPやGACPなどの法規要件の遵守を確保する責任がありますが、私たちの契約サプライヤーとメーカーは原材料、原料薬、完成品を生産する際に毎日cGMPやGACPを遵守することに依存しています。我々の契約サプライヤー及び製造業者は、商業販売のための原料薬及び他の物質及び材料又は完成品を製造するための施設は、検査を通過し、FDA及び他の関連規制機関の承認を得なければならない。我々の契約サプライヤーとメーカーは,FDAがその施設検査計画と提出された技術情報を審査することにより実行されるcGMPとGACP要求を遵守しなければならない。任意の製品または候補製品またはコンポーネントのセキュリティが適用法または他の理由に準拠していないことによって損害を受けた場合、影響を受けた製品または候補製品を商業化したり、規制部門の承認を得ることに成功しない可能性があり、それによるダメージに責任を負う可能性がある。これらの要因のいずれも、候補製品の臨床前研究、臨床試験または規制提出または承認の遅延または終了をもたらす可能性があり、より高いコストをもたらすか、または承認された製品をタイムリーかつ効率的に商業化することができない、または根本的に不可能になる可能性がある
| 58 |
| カタログ表 |
また、これらの契約メーカーは、他の会社と協力して、これらの会社のために材料や製品を供給し、製造することで、私たちのサプライヤーや製造業者がこのような材料や製品を生産する際に規制リスクに直面することにもなる。そのため、これらの材料や製品を生産する監督管理要求を満たしていないことは、契約サプライヤーやメーカー施設の監督管理承認にも影響を与える可能性がある。FDAや同様の外国規制機関が、これらの施設が私たちの候補製品を供給または製造するために承認されていない場合、または将来承認を撤回すれば、代替的な供給または製造施設を探す必要があるかもしれません。これは、規制機関の承認を得たり、私たちの候補製品を販売したりする能力に悪影響を与えます
契約製造業者およびサプライヤーへの私たちの依存は、彼らまたはその施設にアクセスする権利のある第三者が、私たちのビジネス秘密または他の固有の情報を取得し、流用する可能性をさらに暴露します
また、私たちのサプライヤーを含むいくつかのサプライヤーの製造施設湖のスポンジアメリカ以外のところにあります。これは、規制機関の承認要件または輸入検査、不完全または不正確な輸入文書、または欠陥包装などを含む、規制機関の承認要件または輸入検査、不完全または不正確な輸入文書または欠陥包装などを含む、我々の製品または候補製品またはその構成要素を米国または他の国/地域に輸入する困難をもたらす可能性がある
もし私たちが協力を構築して維持できなければ、私たちは私たちの開発と商業化計画を変えなければならないかもしれない
私たちの候補製品の開発と潜在的な商業化は費用を支払うために多くの追加現金が必要になるだろう。我々の候補製品をさらに開発するためには,製薬やバイオテクノロジー会社と協力し,これらの候補製品を開発し,潜在的な商業化を行う可能性がある。私たちは適切なパートナーを探すことで激しい競争に直面している。私たちが協力について最終的な合意に到達するかどうかは、パートナーの資源と経験の評価、提案された協力の条項と条件、提案されたパートナーの多くの要素の評価に依存するだろう。これらの要因は、臨床試験の設計または結果、FDAまたは他の規制機関によって承認された可能性、候補研究製品の潜在的市場、そのような候補製品の製造および患者への配送のコストおよび複雑さ、競争製品の潜在性、私たちの知的財産権の所有権に関連する任意の不確実性、および一般的な業界および市場状態を含むことができる。パートナーはまた、協力可能な同様の指示を得るために、候補製品または技術を代替することを考慮することができ、そのような連携が、私たちと協力する連携よりも私たちの候補製品に魅力的であるかどうかを考慮することができる。将来のライセンス契約によると、私たちはまた、潜在的なパートナーと特定の条項で合意を締結することができないように制限される可能性があります。協力の交渉と記録は複雑で時間がかかる。また,最近では大手製薬会社間の業務合併数が大きく,将来の潜在的パートナー数の減少を招いている
私たちが未来に可能な協力は次のような危険を伴うかもしれない
| · | 協力者は彼らがこれらの協力の努力と資源に適用することを決定する上で大きな裁量権があるかもしれない |
|
|
|
| · | 協力者は期待通りに義務を履行していないかもしれない |
|
|
|
| · | 協力者の戦略的重点や利用可能な資金の変化、または買収などの外部要素は、資源を移転したり、相互競争の優先順位を生成したりする可能性がある |
|
|
|
| · | 協力者は発見と臨床前開発を延期することができ、私たちが選択した目標の製品開発に十分な資金を提供し、候補製品の発見と臨床前開発を停止または放棄し、候補製品の新しい発見と臨床前開発を繰り返しまたは行うことができる |
| 59 |
| カタログ表 |
| · | 協力者は、協力者が競争力のある製品が我々の製品よりも成功する可能性があると考えていることを前提として、第三者開発と直接または間接的に我々の製品または候補製品と競合する製品を独立して開発または間接的に開発することができる |
|
|
|
| · | 私たちと協力して発見された候補製品は、私たちの協力者によって彼ら自身の候補製品や製品と競争するとみなされるかもしれません。これは、協力者が資源を投入して私たちの候補製品を開発することを停止する可能性があります |
|
|
|
| · | 特許権、契約解釈、または第一選択開発プロセスにおける相違を含む協力者との相違は、候補製品の発見、臨床前開発または商業化の遅延または終了をもたらす可能性があり、候補製品に対して追加の責任を負うこと、または訴訟または仲裁を引き起こす可能性があり、いずれも時間がかかり高価になる可能性がある |
|
|
|
| · | 協力者は、私たちの知的財産権または私たちに許可された知的財産権を正確に維持したり、保護することができないかもしれないし、私たちの固有の情報を何らかの方法で使用して、私たちの知的財産権または固有の情報を危険にさらしたり、私たちを潜在的な訴訟に直面させたりするために訴訟を招く可能性がある |
|
|
|
| · | 協力者は第三者の知的財産権を侵害する可能性があり、これは私たちを訴訟と潜在的な責任に直面させるかもしれない |
|
|
|
| · | 協力者の便宜のために、協力を終了するかもしれませんが、終了すれば、適用可能な候補製品をさらに開発または商業化するために追加の資金を集める必要があるかもしれません。 |
協力は一般的にすべての当事者に詳細な義務を課すだろう。もし私たちが私たちの義務に違反すれば、私たちは協力を終了する可能性があることを含む重大な結果に直面するかもしれないし、パートナーの製品候補製品に多くの時間とお金を投入する権利は失われるだろう
私たちはタイムリーに基づいて、受け入れ可能な条項や全く協力を交渉することができないかもしれない。それができなければ、候補製品の開発を削減し、その開発計画や私たちの1つ以上の他の開発計画を減少または延期し、潜在的な商業化を延期したり、私たちの支出を増加させたり、自費で開発や商業化活動を行わなければならないかもしれない。もし私たちが私たちの支出を増やし、私たち自身の開発や商業化活動に資金を提供することを選択すれば、私たちは追加の資本を得る必要があるかもしれないし、これらの資本は受け入れ可能な条件で私たちに提供できないかもしれないし、全く得られないかもしれない。もし私たちが十分な資金がなければ、私たちは私たちの候補製品をさらに開発したり、それらを市場に出して製品収入を作ることができないかもしれない
私たちの成長、従業員、運営に関するリスクを管理する
私たちは未来に組織の規模と複雑さをさらに増加させる必要があり、私たちは成長戦略を実行し、どんな成長を管理するかについて困難に直面するかもしれない
私たちの既存の管理、人員、システム、そして施設は、私たちの業務計画と最近の未来の成長を支援するのに十分ではない。私たちは、私たちの計画の研究、開発、商業化活動を支援するために、私たちの化学と製造チーム、臨床チーム、管理、運営、財務、その他の資源をさらに拡大する必要があるだろう
| 60 |
| カタログ表 |
私たちの運営や成長や様々なプロジェクトを効果的に管理するためには
| · | 私たちの業務、財務、管理、規制コンプライアンス制御と報告システムと手続きを引き続き改善します |
|
|
|
| · | 十分な数の優秀な従業員を引きつけて維持します |
|
|
|
| · | マーケティング、販売、流通能力を発展させる |
|
|
|
| · | 候補製品のビジネス化活動を経済的に効率的に管理しています |
|
|
|
| · | 開発と商業化のパートナー関係の構築と維持 |
|
|
|
| · | 私たちの臨床前と臨床試験を効果的に管理しています |
|
|
|
| · | 現在の候補製品の生産能力をビジネスレベルまで向上させるとともに、効率的に第三者供給と製造業務を経済的かつ効率的に管理する |
|
|
|
| · | 私たちの開発作業を効率的に管理しながら、パートナーや他の第三者に対する契約義務を履行します。 |
また,歴史的には,前臨床試験や臨床試験に関する課題を含め,アルバイト外部コンサルタントのサービスを利用して多くのタスクを遂行していく予定である。私たちの成長戦略はまた、このような任務と未来の他の任務を実行するために、コンサルタントへの私たちの使用を拡大する必要があるかもしれない。私たちの業務のいくつかの機能はコンサルタントに依存しており、これらのコンサルタントを効率的に管理し、彼らが契約義務を成功的に履行し、予想される期限内に任務を達成することを保証する必要がある。私たちは、既存のコンサルタントを管理したり、必要があれば、経済的に合理的な条件で、あるいは全くない他の適任な外部コンサルタントを見つけることができるという保証はありません。新入社員の募集やコンサルタントの拡大で私たちの組織を効率的に管理し、拡大することができなければ、私たちが計画した研究、開発、商業化活動を効果的に実行するために必要な任務を効率的に実行することができない可能性があり、私たちの研究、開発、商業化の目標を達成できないかもしれません
経営陣や他のキーパーソンを引き付けることができなければ、私たちの候補製品の開発や商業化に成功したり、他の方法で私たちの業務計画を実施したりすることができないかもしれません
競争の激しい製薬業で競争する能力は私たちが高い素質の管理、科学、医療、販売とマーケティング及びその他の人員を誘致し、維持する能力にかかっている。私たちは最高経営責任者社長と取締役CEOジェラルド·T·プロール、規制事務と品質保証上級副社長、マリア·ベドア·トロ·ムネラ博士、工商管理修士など、私たちの管理と科学者に強く依存しています。そして、私たちの上級副総裁開発部、Christopher J.Nardo、M.P.H.,Ph.D.これらの個人がサービスを失うことは、私たちの製品ラインの成功開発を阻害、遅延あるいは阻止する可能性があり、私たちが計画した臨床試験の完成、私たちの候補製品の商業化、許可或いは新しい資産の買収は、私たちが業務計画を成功的に実施する能力に負の影響を与える可能性がある。もし私たちがその中の誰かのサービスを失ったら、私たちは適切な代替者をタイムリーに見つけることができず、適切な代替者を見つけることさえできないかもしれません。したがって、私たちの業務は損害を受けるかもしれません。私たちはこのような個人や私たちの他のどんな従業員のためにも“キーパーソン”保険証書を維持しない。わが社の価値のある従業員を引き留めるために、給料と現金奨励のほか、時間の経過とともに付与された株式オプションを提供します。時間が経つにつれて、従業員に対する株式オプションの価値は私たちの株価変動の大きな影響を受けます。これらの変動は私たちの制御範囲を超えており、いつでも他社の見積もりを相殺するのに十分ではないかもしれません
バイオテクノロジー、製薬、その他の業界の合格人材に対する激しい競争のため、特に私たちの本部があるサンディエゴ地区では、私たちは未来に合格した管理職と他の重要な人員を引き付けることができないかもしれない。私たちは経験者を私たちの会社に引き付けることが難しいかもしれませんし、私たちの従業員を募集して維持するために多くの財政資源が必要かもしれません。私たちと適格な人材を競争している多くの他の製薬会社は、私たちよりも多くの財務や他の資源、異なるリスク状況、そしてより長い業界の歴史を持っている。それらはまた職業発展にもっと多様な機会とより良い機会を提供するかもしれない。必要な人員を引き付けて維持することができなければ、業務目標を達成するための制限が生じる可能性があり、業務戦略を実施し、業務目標を実現する能力を損なうことになります
| 61 |
| カタログ表 |
また、私たちは科学と臨床コンサルタントを持っていて、私たちの発展と臨床戦略の制定を助けてくれます。これらのコンサルタントは私たちの従業員ではなく、他の実体と約束、相談、または相談契約を持っているかもしれません。これは彼らの私たちに対する利用可能性を制限するかもしれません。また、私たちのコンサルタントは他社と合意し、これらの会社が私たちと競争する可能性のある製品や技術を開発するのを助けるかもしれません
私たちが最近公布された性別と多様性割当量を含む新しい州法律の影響を受ける可能性がある適格取締役会のメンバーを引き付けて維持する能力
2018年9月、カリフォルニア州は、カリフォルニアに本社を置く上場企業が取締役会で少なくとも1人の女性代表を維持することを要求するSB 826を公布した。具体的には、2019年末までに取締役会の少なくとも1人の女性が、2020年末までに、5人のメンバーの上場企業取締役会が少なくとも2人の女性取締役を要求され、6人以上のメンバーの上場企業取締役会が少なくとも3人の女性取締役を要求される。2020年9月、カリフォルニア州はAB 979を公布し、カリフォルニアに本部を置く上場企業が取締役会の中で少なくとも1人の代表的な不足コミュニティからのメンバーの代表性を維持することを要求した:2021年末までに、少なくとも1人の取締役メンバーが代表的な不足コミュニティからの出身であることを要求し、2022年末までに、メンバーが4人を超えるが9人未満の上場企業取締役会は、少なくとも2人の取締役が代表的不足コミュニティからの出身であることを要求され、9人以上のメンバーを有する上場企業取締役会は、少なくとも3人の取締役が代表的不足コミュニティからの出身であることを要求される。指定された最低レベルに到達できなかったことは、これらの会社を経済的処罰と名声の損害に直面させるだろう。私たちが合格した取締役会のメンバーを募集、吸引、および/または維持し、カリフォルニアの法律によって上記の割当量を達成できることは保証できません。これは私たちを罰および/または名声の損害に直面させる可能性があります
私たちの現在のマーケティング能力は限られており、販売組織もありません。もし私たちが自分や第三者を通じて販売とマーケティング能力を確立できなければ、私たちの候補製品を商業化することに成功できなくなり、承認されれば、製品収入を生み出すこともできないだろう
私たちの現在のマーケティング能力は限られており、販売組織もありません。もし私たちの候補製品がアメリカ、カナダ、EU、そして私たちが進出を求めている他の司法管轄区域で承認され、それを商業化するためには、私たちのマーケティング、販売、流通、管理、その他の非技術的能力を確立しなければなりません。あるいは第三者とこれらのサービスを提供するように手配しなければなりません。私たちは成功しないかもしれません。著者らの管理チームは医薬製品のマーケティング、販売と流通方面の経験を持っているが、1つの会社として、私たちは以前医薬製品のマーケティング、販売と流通の方面の経験がなく、販売組織の構築と管理は重大なリスクに関連し、私たちは合格者を雇用、維持と激励し、十分な販売手がかりを生成し、販売とマーケティング人員に十分な訓練を提供し、異なる地理的な位置に分散した販売とマーケティングチームの能力を有効に管理する。私たちの内部販売、マーケティング、流通能力の発展のいかなる失敗や遅延も、これらの製品の商業化に悪影響を及ぼすだろう。直接販売チームや流通システムを構築する他の第三者と協力して、自分たちの販売チームや流通システムを強化したり、自分たちの販売チームや流通システムの代わりにしたりすることを選択することができます。もし私たちが受け入れ可能な条項やそのような計画を根本的に達成できなければ、私たちは私たちの候補製品を商業化することに成功できないかもしれない。もし私たちが私たちの候補製品を商業化することに成功できなければ、私たち自身も1つ以上の第三者と協力することで、私たちの業務、財務状況、経営業績、見通しが影響を受けるだろう
もし私たちが他の候補製品や承認された製品を許可、買収、開発、マーケティングすることに成功できなければ、私たちの業務を発展させる能力を弱めるだろう
私たちは他の製品や候補製品を許可、買収、開発、マーケティングするつもりで、ビジネス段階の製品を許可したり、買収したり、他の戦略取引に従事したりするかもしれません。私たちの内部研究開発能力が限られているため、私たちは製薬会社、学術科学者と他の研究者に依存して、可能な製品や技術を販売してくれるかもしれません。この戦略の成功は、将来性のある候補薬品および製品を識別し、選択し、その既存の所有者と許可または買収協定を交渉し、これらの手配に資金を提供する能力にある程度依存する
候補製品を提案、交渉し、実施するか、製品の許可や買収を承認する過程は長くて複雑だ。他の会社は、より多くの財務、マーケティング、販売、および他の資源を有する会社を含み、候補製品および承認された製品の許可または買収を競合する可能性がある。私たちの資源は限られており、第三者製品、業務、技術の買収や許可を識別して実行し、現在のインフラに統合することはできません。また、未完成の潜在的買収に資源を投入することができるかもしれないし、このような努力の予想される利点を実現できないかもしれない。私たちは私たちが受け入れられると思う条項で他の候補製品の権利を得ることができないかもしれないし、全く得られないかもしれない
| 62 |
| カタログ表 |
さらに、我々が得た任意の候補製品は、商業販売の前に、臨床前または臨床試験を含み、FDAおよび適用される外国規制機関の承認を得ることを含む追加の開発作業が必要となる可能性がある。すべての候補製品は典型的な薬品開発失敗リスクが出現しやすく、候補製品は十分な安全と有効が証明されない可能性があり、監督管理機関の許可を得られない可能性がある。また、私たちが買収した任意の承認された製品が利益のある方法で製造または販売されるか、または市場の承認を得ることは保証されない
私たちが考慮する可能性のある他の潜在的な取引には、剥離、戦略パートナー関係、合弁企業、再編、資産剥離、業務合併と投資を含む様々な異なる商業計画が含まれる。このような取引は、非日常的または他の費用を発生させる必要がある可能性があり、短期的および長期的な支出を増加させ、重大な統合課題をもたらしたり、私たちの管理や業務を混乱させたりする可能性があり、これは私たちの運営や財務業績に悪影響を及ぼす可能性があります。例えば、これらの取引は、多くの潜在的なビジネスおよび財務リスクに関連する
| · | 未知の借金への開放 |
|
|
|
| · | 私たちの業務を中断し、買収した製品、候補製品、または技術を開発するために、私たちの経営陣の時間と注意を移す |
|
|
|
| · | 買収を支払うために発生する大量の債務または持分証券の希釈発行; |
|
|
|
| · | 買収と統合の巨額のコスト |
|
|
|
| · | 資産または減価費用の減価 |
|
|
|
| · | 償却費が増える |
|
|
|
| · | 買収された企業の業務および人員を私たちの業務および人員と合併する困難およびコスト |
|
|
|
| · | 管理職および所有権の変化により、買収された企業の主要なサプライヤー、パートナーまたは顧客との関係が減少した |
|
|
|
| · | 私たちの重要な従業員や買収された企業のどんな従業員も引き止めることができない。 |
したがって、私たちが上記の性質のいかなる取引を行うか、あるいは成功することは保証されません。私たちが完成したいかなる取引も、私たちの業務、財務状況、経営業績、将来性を損なう可能性があります
| 63 |
| カタログ表 |
私たちの候補製品で使用される原料薬と他の物質と材料の製造と供給は複雑な任務であり、技術的に挑戦的であり、製造、テスト、品質保証と流通サプライチェーンの多くの環節に故障の可能性があり、製品製造と流通後に潜在的な欠陥が存在する可能性がある
原料薬、その他の物質と材料及び薬品完成品の製造と供給は技術的に挑戦的である。私たちの直接制御範囲を超えた変化は私たちの候補製品の品質、数量、価格と成功裏の配送に影響を与える可能性があり、私たちの候補製品の開発と商業化を阻害、遅延、制限、あるいは阻止する可能性がある。ミスと処理が不適切であることは珍しくなく、成功した生産と供給に影響を与える可能性がある。いくつかのリスクは
| · | 私たちの製造業者は、生産または輸送準備中にcGMPまたはGACP要求に準拠していない、または製品の処理が不適切である |
|
|
|
| · | 私たちの契約サプライヤーと製造業者は、高生産量とロットの品質、一貫性、安定性を効果的かつ経済的に増加し、維持することができません |
|
|
|
| · | FDAが承認した生体検査法を開発して未来の製品を発表することはできません |
|
|
|
| · | 最適な薬物送達物質および技術、生産および貯蔵方法、ならびに包装および輸送プログラムを決定することは困難である |
|
|
|
| · | 輸送と輸出入のリスク、特に私たちのサプライチェーンのグローバル性を考慮して |
|
|
|
| · | 分析結果の遅延や分析技術の失敗は、私たちの未来の製品の品質管理と発表に依存している |
|
|
|
| · | 自然災害、流行病、労使紛争、財務困難、原材料供給の不足、施設および設備の問題、または私たちの契約製造業者およびサプライヤーの業務運営に対する他の形態の妨害; |
|
|
|
| · | 潜在的な欠陥は、製品発表後に明らかになる可能性があり、製品のリコールや廃棄を招く可能性がある。 |
これらの要因のいずれも、私たちの臨床試験、規制提出、必要な承認、または私たちの候補製品の商業化に関連する遅延またはそれ以上のコストをもたらす可能性があり、これは、私たちの業務、財務状況、運営結果、および将来性を損なう可能性があります
| 64 |
| カタログ表 |
私たちの経営業績は大幅に変動する可能性があり、これは私たちの将来の経営業績を予測しにくくし、私たちの経営業績を予想を下回ってしまう可能性があります
これまで、私たちの業務は主に私たちの候補製品の研究と開発に限られ、私たちの候補製品に対して臨床前研究と臨床試験を行ってきた。私たちのどんな候補製品も規制部門の承認を受けていない。したがって、私たちの未来の成功や生存能力に対するあなたのどんな予測も、私たちがより長い運営歴史や市場で承認された製品を持っているほど正確ではないかもしれません。また、私たちの経営業績は様々な他の要素によって変動する可能性があり、その中の多くの要素は私たちがコントロールできないもので、以下の要素を含む予測が困難かもしれません
| · |
| 私たちの候補製品の開始、登録、および臨床試験の時間を遅延させる |
| · |
| 私たちの候補製品または競争候補製品の臨床試験のタイミングおよび成功または失敗、または私たちの競争相手またはパートナー間の統合を含む業界競争構造における任意の他の変化; |
| · |
| 臨床開発における候補製品の規制審査と承認に関するいかなる遅延もない |
| · |
| 私たちの候補製品に関する研究や開発活動の時間、コスト、投資レベルは時々変化する可能性がある |
| · |
| 我々の候補製品を製造するコストは、FDAのガイドラインや要求、生産数量によって異なる可能性がある |
| · |
| 私たちは候補品を開発するための追加資金を得ることができます |
| · |
| 他の候補製品や技術を取得または開発するための支出を獲得または生成することができます |
| · |
| 私たちの候補製品に対する需要レベルは、彼らが承認されれば、これは大きな違いがあるかもしれない |
| · |
| 私たちの候補製品の潜在的な副作用は、商業化を延期または阻止し、または承認された薬物の市場からの撤退を招く可能性がある |
| · |
| 承認された場合、患者または医療提供者は、候補製品のカバー範囲または十分な補償能力を得ることができる |
| · |
| 私たちは第三者製造業者が私たちの候補製品を供給したり製造したりすることに依存しています |
| · |
| 効果的な販売、マーケティング、流通インフラをタイムリーに構築することができます |
| · |
| もし私たちの候補製品が承認されれば、市場の受容度と、これらの候補製品の需要を予測する能力 |
| · |
| 私たちは承認を得て候補品をアメリカ以外の場所で商業化することができます |
| · |
| 私たちは協力、許可、または他の手配の能力を確立し、維持する |
| · |
| 知的財産権を保護する能力と第三者の能力 |
| · |
| 潜在的な訴訟または他の紛争に関連する費用と結果; |
| · |
| 私たちは未来の成長能力を十分に支持しています |
| · |
| 私たちは私たちの業務を効率的に管理するために、重要な人員を引き付けて維持することができる |
| · |
| 危険物質に関わる潜在的な責任 |
| · |
| 私たちには十分な保険証書を維持することができます |
| · |
| 未来の会計宣言や私たちの会計政策の変化 |
| 65 |
| カタログ表 |
私たちの経営業績と流動性需要は市場変動や経済低迷の負の影響を受ける可能性があります
私たちの経営業績と流動性はアメリカや世界の他の地域の一般的な経済状況の負の影響を受けるかもしれません。非必須医療製品やプログラムの市場は特に不利な経済状況の影響を受けやすい可能性がある。一部の患者は私たちのいくつかの候補製品は自由に支配可能であると思うかもしれないが、もしこのような製品が全額精算できなければ、これらの製品に対する需要は著者らの目標患者群の自由支配可能な支出レベルとリンクするかもしれない。国内·国際経済状況と懸念により、国内·国際株式·債務市場は急激な変動と動揺を経験し続けている可能性がある。これらの経済状況や懸念が持続的または悪化し、市場が変動し続けると、私たちの経営業績と流動性は、私たちのいくつかの製品に対する需要が弱まって、必要に応じて資金を調達することが難しくなり、私たちの株価が下落する可能性があるなど、多くの面でこれらの要素の悪影響を受ける可能性がある。また、私たちは主にアメリカで私たちの製品を販売する予定ですが、私たちのパートナーは広範なグローバル業務を持っており、これは間接的に私たちをリスクに直面させています
もし私たちの内部コンピュータシステムに故障が発生したら、私たちの業務と運営は影響を受けるだろう
セキュリティ対策が取られているにもかかわらず、私たちの内部コンピュータシステム、および私たちの現在の未来のパートナー、請負業者、およびコンサルタントのコンピュータシステムは、コンピュータウイルス、許可されていないアクセス、自然災害、テロ、戦争、および電気通信および電気故障の破壊を受けやすい。これまで,このような重大なシステム故障,事故,セキュリティホールを経験したことはないが,このような事件が発生して我々の運営が中断されると,我々の製造活動,開発計画,業務運営に大きな中断を招く可能性がある.例えば、完成または将来の臨床試験の生産記録または臨床試験データの損失は、我々の規制承認作業を遅延させる可能性があり、データを回復または複製するコストを著しく増加させる可能性がある。任意の中断またはセキュリティホールが、私たちのデータやアプリケーションを紛失したり、破損したり、機密または独自の情報を適切に開示しない場合、私たちは責任を招く可能性があり、私たちの製品および候補製品のさらなる商業化および開発が延期される可能性があります
私たちはますます情報技術に依存しており、私たちのシステムとインフラはネットワークセキュリティとデータ漏洩リスクを含む一定のリスクに直面している
我々の情報技術システムは深刻な破壊や情報セキュリティの破壊を受けており,我々の業務に悪影響を与える可能性がある.通常の業務プロセスでは,大量の機密情報を収集,保存,転送することは,このような機密情報の機密性と完全性を維持するために安全な方法で行わなければならないことが重要である.我々の情報技術システムおよび我々と契約を締結した第三者プロバイダのシステムの規模および複雑さは、これらのシステムが、当社の従業員、パートナーまたはサプライヤーの不注意または故意の行為、悪意のある第三者の攻撃、または私たちまたは第三者が維持するシステムインフラの意図的または意外な物理的損傷である可能性があるため、サービス中断およびセキュリティホールの影響を受けやすいようにする。このような機密、独自、または商業秘密情報を秘密にすることは、私たちの競争業務の地位に非常に重要だ。私たちは、このような情報を保護し、情報技術に投資する措置を取っていますが、私たちの努力は、私たちのシステムにおけるサービス中断またはセキュリティホールを防止し、または私たちの業務運営に悪影響を及ぼす可能性があり、または重要なまたは敏感な情報の損失、伝播、または誤用をもたらす不正または意図しないエラーの使用または機密情報の開示を防止することを保証することはできません。盗難、ハッカー攻撃、詐欺、詐欺、または他の形態の詐欺、または任意の他の理由によって、他社が競合製品を生産すること、当社の独自技術または情報を使用すること、または私たちの業務または財務状態に悪影響を及ぼす可能性がある、当社のセキュリティ対策または意外な紛失、意図しない開示、未承認の伝播、商業秘密、独自情報、または他の機密情報の流用または乱用に違反します。さらにこのような中断やセキュリティホールは, 機密情報を紛失または漏洩した場合、私たちに財務、法律、商業、名声の損害をもたらし、私たちの業務、財務状況、運営結果、またはキャッシュフローに重大な悪影響を及ぼす可能性があります。
私たちの知的財産権に関するリスクは
私たちは、私たちの候補製品をカバーする特許権や他の知的財産権を獲得または実行することができず、第三者が私たちと競争することを防止するのに十分な広さを持つ技術を持っているかもしれません
候補製品や技術での私たちの成功は、アメリカや他の国で特許保護を獲得し、維持し、私たちのビジネス秘密を保護し、第三者が私たちの独占権を侵害することを防止する能力にある程度依存するだろう。私たちが第三者の無許可または侵害によって使用されない候補製品を保護する能力は、効果的かつ実行可能な特許を取得して維持する能力、または秘密保護契約を実行する能力に大きく依存する
| 66 |
| カタログ表 |
私たちの特許にはアメリカと外国の管轄区での特許と特許出願が含まれており、私たちの製品はこれらの管轄区で市場機会があると思います。カバーされた技術とカバー範囲は国によって異なる。私たちが特許を付与していない国について、私たちは私たちの技術の無許可使用を阻止する能力がないかもしれない。私たちが獲得可能などの特許の範囲も狭いかもしれないので、競争相手に迂回されやすい。さらに、私たちが特許を付与していない国では、第三者は、私たちの候補製品と同じまたは実質的に類似した製品を製造、使用、または販売することができるかもしれない
特許出願手続きは、特許起訴とも呼ばれ、高価で時間がかかり、私たちと私たちの現在または未来の許可者および被許可者は、必要または望ましいすべての特許出願を合理的なコストまたはタイムリーに準備、提出、起訴することができないかもしれない。私たちまたは現在のライセンシー、または任意の未来のライセンシーまたはライセンシーは、特許保護を受ける前に、開発および商業化活動中に行われた発明の出願可能な特許の態様を識別することができない可能性がある。したがって、私たちの業務の最高の利益に合った方法でこれらと私たちの任意の特許と出願を起訴して強制してはいけません。私たちの特許または特許出願の準備または提出中に形態的な欠陥が存在する可能性があり、または適切な優先権要件、発明権、特許請求の範囲、または特許期限調整のような欠陥が将来的に生じる可能性がある。私たちの現在のライセンサーまたは任意の未来のライセンシーまたはライセンシーが、任意の特許権を起訴、維持または実行する上で、私たちと完全に協力しないか、または同意しない場合、このような特許権は損害を受ける可能性があり、第三者が競合製品を製造、使用、販売することを阻止できないかもしれません。私たちの特許または特許出願の形態または準備中に重大な欠陥がある場合、そのような特許または出願は無効であり、強制的に実行できない可能性がある。また,我々の競争相手は同等の知識,方法,ノウハウを自主的に開発することができる.これらの結果のいずれも、第三者からの競争を阻止する能力を弱める可能性があり、これは、私たちの業務、財務状況、および経営業績に悪影響を及ぼす可能性があります
薬物発明に関連する特許の特許性、有効性、実行可能性、および請求項の範囲に関する法律基準のため、私たちが特許を取得、維持、および実行する能力は不確実であり、複雑な法律および事実の問題に関連する。したがって、既存の特許または私たちが取得または許可する可能性のある任意の特許下の権利は、私たちの候補製品をカバーしないかもしれないし、または私たちの候補製品に十分な保護を提供することができず、ブランドおよび模倣薬会社の競合製品またはプロセスを含む競合製品またはプロセスの競争において商業的優位性を得ることができるようにすることができる。さらに、私たちは私たちが私たちに持っていたり、許可してくれた任意の未解決または未来の特許出願がいかなる特許を発行するかを保証することはできない。特許がすでに発行されたり、発表されるであろうとしても、私たちは、これらの特許の主張が裁判所によって有効または強制的に実行可能であると認定されるか、または競合製品のための任意の重大な保護を提供するか、または私たちに商業的価値を有することを保証することはできません
皮膚病治療分野の競争相手はすでに科学出版物、特許、特許出願を含む大量の既存技術を創造した。私たちが有効かつ強制的に実行可能な特許を取得して維持する能力があるかどうかは、私たちの技術と従来技術との差が、私たちの技術が従来技術よりも特許を得ることを可能にするかどうかに依存する。私たちの技術はいくつかの唯一無二の発明を含み、いかなる既存技術も複製できないと信じているが、私たちは私たちの技術のすべての最新の発展の未完成の発行された特許をカバーしておらず、私たちは私たちが成功する特許保護(あれば)も確定していない。特許が確実に発表されても、第三者は、そのような発行された特許または私たちが所有または許可している他の任意の発行された特許の有効性、実行可能性、または範囲を迂回または疑問視する可能性があり、これは、そのような特許が縮小され、無効にされ、または実行できない可能性がある。もし私たちが持っているまたは追求している特許が私たちの候補製品に提供する保護の広さや強度に挑戦すれば、会社が私たちと協力して私たちの候補製品を開発することを阻止したり、候補製品を商業化する能力を脅かすかもしれません
一部の外国司法管轄区の法律はアメリカと同程度の知的財産権を提供しておらず、多くの会社は外国の管轄区域の保護とこのような権利を保護する上で重大な困難に直面している。もし私たちが知的財産権を保護する上でこのような困難に遭遇したり、他の管轄区域で私たちの知的財産権を効果的に保護できなければ、私たちのビジネスの将来性は深刻な損害を受ける可能性がある。製薬と生物技術会社の特許地位は非常に不確定である可能性があり、複雑な法律と事実問題に関連し、重要な法律原則はまだ解決されていない。米国や他国の特許法または特許法解釈の変化は,我々の知的財産権の価値を低下させる可能性がある。したがって、私たちは、私たちの特許または第三者特許において許容または実行される可能性のある特許請求の範囲の広さを予測することができない
| 67 |
| カタログ表 |
未来の私たちの所有権に対する保護の程度は不確実だ。場合によっては、特許保護は入手できないか、または深刻に制限される可能性があり、私たちの権利を十分に保護することができないか、または私たちの競争優位性を獲得または維持することを可能にするかもしれない。例えば:
| · |
| 私たちは、私たちのすべての未解決特許出願および発行特許がカバーされた発明を最初にまたは最初に提出した会社ではないかもしれない |
| · |
| 他の会社は類似または代替技術を独立して開発したり、私たちの任意の技術をコピーしたりすることができる |
| · |
| 他人の特許は私たちの業務に悪影響を及ぼすかもしれない |
| · |
| 私たちが取得した特許または私たちのライセンシーが発行した特許は、商業的に実行可能な製品を含まないかもしれないし、競争優位性を提供してくれないかもしれないし、第三者の挑戦を受ける可能性がある |
| · |
| 私たちの許可内に発行された特許から得られた任意の特許は、無効または強制的に実行できない可能性がある |
| · |
| 私たちは特許を申請できる他の独自技術を開発しないかもしれない |
特許の寿命は限られている。米国では、特許の自然失効期間は、通常、その最初の非一時的優先権出願が提出された日から20年である。様々な延期があるかもしれない;しかし、特許の有効期限とその提供される保護は限られている。もし私たちの候補製品に特許保護がなければ、私たちは私たちの候補製品からの模造バージョンの競争に直面するかもしれない。また、候補製品の特許出願と規制承認との間の長い時間は、特許保護下で候補製品を販売する時間を制限しており、これは、早期候補製品の収益性に特に影響を与える可能性がある。DMT 310に関連する発行された米国特許は、2022年から2023年の間に満了または満了し、特許が満了した後に承認された場合、これらの特許は特許期間を延長する資格がない。
独自の商業秘密と非特許のノウハウはまた私たちの業務に非常に重要だ。第三者とセキュリティ協定を締結し、特定の従業員、コンサルタント、コンサルタントと知的財産権保護協定を締結することによって、私たちの商業秘密および非特許ノウハウを保護する措置をとっているにもかかわらず、第三者はこれらの情報を得ることができ、あるいは私たちの権利を保護できないかもしれない。私たちのサプライヤー、製造業者、他の第三者が使用するビジネス秘密の保護にも限られた統制があります。私たちは拘束力のある合意に違反しない保証はなく、私たちが合意違反行為に対して十分な救済措置を持っている保証はなく、私たちの商業秘密と非特許技術が私たちの競争相手に知られたり、独立して発見されないことを保証することはできない。もし商業秘密が独立して発見されたら、私たちはそれらの使用を防ぐことができないだろう。第三者が私たちの商業秘密または非特許ノウハウを不正に取得して使用することを強制することは高価で時間がかかり、結果は予測できない。しかも、アメリカ以外の裁判所は商業秘密情報を保護することをあまり望んでいないかもしれない
最近の特許改革立法は、私たちの特許出願をめぐる起訴や将来の特許の実行または保護をめぐる不確実性とコストを増加させる可能性がある
これまで、いくつかの法律原則が解決されておらず、米国特許で許容される権利要件の広さまたは解釈に一貫した政策がなく、関連する法律、科学的、および事実的問題の複雑さのために、特許請求項を支援および解釈するために必要な特許および特許出願の具体的な内容が非常に不確実であるため、私たちが特許を取得する能力は非常に不確定である。米国や他の国の特許法や特許法解釈の変化は,我々の知的財産権の価値を低下させたり,我々の特許保護の範囲を縮小したりする可能性がある
| 68 |
| カタログ表 |
例えば、2011年9月16日、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を及ぼす可能性もある。米国特許商標局(USPTO)は、“ライシー·スミス法案”の全面的な実施を規範化するために、新たな未検査法規や手続きを制定し、“ライシー·スミス法案”に関連する特許法の多くの実質的な改正、特に最初の提出条項の改正は、2013年3月に発効した。Leahy-Smith法案はまた、第三者が発行された特許に挑戦しやすく、特許出願の起訴に介入するためのいくつかの手続きを導入した。最後に、“ライシー·スミス法案”には新しい法定条項が含まれており、米国特許商標局がその実施のために新しい法規を発表することを要求し、裁判所は新しい法規の条項を解釈するのに数年かかるかもしれない。Leahy-Smith法案が私たちの業務運営と私たちの知的財産権の保護と実行にどのような影響を与えるかを判断するのは時期尚早だ。しかし、Leahy-Smith法案とその実施は、私たちの特許出願をめぐる起訴と、私たちの将来の特許の実行または保護の不確実性とコストを増加させるかもしれない。さらに、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下し、場合によっては利用可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかを決定している。このような事件の結合は,我々の将来の特許取得能力に関する不確実性の増加に加えて,特許価値に関する不確実性をもたらしている, 一度手に入れたら。米国議会、連邦裁判所、および米国特許商標局の行動によれば、特許を管理する法律および法規は、予測不可能な方法で変化する可能性があり、それにより、私たちが新しい特許を取得したり、私たちが所有または許可または将来獲得可能な特許を実施する能力を弱める可能性がある。私たちのノウハウをカバーしている特許を取得し、実行し、保護できないことは、私たちのビジネスの見通しと財務状況に実質的な悪影響を及ぼすだろう。
同様に、他の国または管轄区域の特許法律および法規の変化、またはそれらを実行する政府機関の変化、または関連政府当局が特許法律または法規を実行する方法の変化は、新たな特許を取得したり、将来入手可能な特許を実行する能力を弱める可能性がある。また、一部の外国の法律の専有権に対する保護程度や方式は米国の法律とは異なる。したがって、私たちはアメリカでも海外でも、私たちの知的財産権を保護して守ることで大きな問題に直面するかもしれない。例えば、他の国で同じ発明をカバーする特許が発行されているのではなく、特定の国で発明をカバーする特許が発行されている場合、または、ある国で発行された特許の有効性、実行可能性または範囲、または1つの国で発行された特許の書面記述または許可のいずれかの司法解釈が、他の国によって発行された対応する特許の解釈と異なる場合、私たちがこれらの国で私たちの知的財産権を保護する能力は制限される可能性がある。米国や他の国の特許法や特許法解釈の変化は,我々の知的財産権の価値を大きく低下させたり,我々の特許保護の範囲を縮小したりする可能性がある
私たちは世界各地で私たちの知的財産権を保護できないかもしれない
世界のすべての国で私たちの候補製品申請、起訴、そして特許保護の費用は目を引くほど高いだろう。特定の国、特に発展途上国では、特許可能性に対する要求が異なる可能性がある。しかも、いくつかの国の法律は知的財産権の保護の程度はアメリカの法律に及ばない。したがって、私たちは第三者がアメリカ以外のすべての国で私たちの発明を実施することを防ぐことができないかもしれない。競争者は私たちが特許保護を受けていない司法管轄区域で私たちの技術を使用して自分の製品を開発することができ、また、私たちが特許保護を持っている地域に侵害製品を輸出することもできるが、侵害活動に対する法執行力は十分ではない。これらの製品は私たちの製品と競争するかもしれませんが、私たちの特許や他の知的財産権は彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。特定の国の法律制度、特に特定の発展途上国の法律制度は、特許や他の知的財産権保護、特に薬品に関連する特許保護の強制執行に賛成しておらず、これにより、私たちの特許の侵害を阻止したり、私たちの専有権を侵害する方法で競争製品を販売することを困難にする可能性があります。外国の管轄区域で私たちの特許権を強制的に執行する訴訟手続きは、巨額のコストを招き、私たちの努力と注意を私たちの業務の他の側面から移転させる可能性があり、私たちの特許が無効または狭義に解釈されるリスクに直面する可能性があり、私たちの特許出願を発表できないリスクに直面させ、第三者からのクレームを引き起こす可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。また,ヨーロッパのある国やある発展途上国には強制許可法があり,これらの法律により特許権者は第三者に許可を強制的に付与される可能性がある。これらの国では、もし私たちの特許が侵害された場合、あるいは私たちの特許を第三者にライセンスすることを余儀なくされた場合、私たちは限られた救済措置を得ることができ、これはこれらの特許の価値を大幅に低下させる可能性がある。これは私たちの潜在的な収入機会を制限するかもしれない。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが所有したり許可したりする知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。最後に、私たちが知的財産権を保護して実行する能力は、外国の知的財産法の意外な変化の悪影響を受ける可能性がある
| 69 |
| カタログ表 |
私たちの特許保護の獲得と維持は、政府特許機関によって提出された様々なプログラム、書類提出、費用支払い、および他の要求を遵守することに依存し、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある
発行された特許の定期維持費および年会費は、特許有効期間内にいくつかの段階に分けて米国特許商標局および外国特許代理機関に支払われなければならない。米国特許商標局および各種外国政府特許機関は、特許出願過程において、いくつかのプログラム、文書、費用支払い、およびその他の同様の規定を遵守することを要求する。多くの場合、適用規則に従って滞納金を支払うか、または他の方法で不注意を是正することによって失効を是正することができるが、場合によっては、規定を遵守しないことは、特許または特許出願が放棄または失効され、関連法ドメインの特許権の一部または全部の喪失をもたらす可能性がある。特許または特許出願が放棄または失効される可能性のある規定を遵守しないイベントは、規定された期限内に公式行動に応答することができなかったこと、費用を支払わなかったこと、および適切に合法化されず、正式な文書を提出することを含む。もし私たちまたは私たちの許可者が私たちの候補製品をカバーする特許や特許出願を維持できなければ、私たちの競争相手は市場に入ることができるかもしれません。これは私たちの業務に悪影響を及ぼすでしょう
もし私たちが知的財産権許可協定の義務を履行できなかったら、私たちは私たちの業務に重要な許可権を失うかもしれない
私たちは特定の許可協定の当事者であり、これらの協定は様々な職務調査、マイルストーン、特許権使用料、保険、その他の義務を私たちに強要する。もし私たちがこれらの義務を守らなければ、対応する許可者は許可を終了する権利があるかもしれません。この場合、影響を受けた候補製品を開発したり販売したりすることができない可能性があります。これらの権利を失うことは、私たちの業務、財務状況、経営業績、および見通しに重大な悪影響を及ぼすかもしれない。これらのライセンススケジュールに関するより多くの情報は、“ビジネス-連携およびライセンスプロトコル”を参照されたい
もし私たちが第三者の知的財産権侵害を起訴されたら、これは高価で時間がかかり、訴訟の不利な結果は私たちの業務に実質的な悪影響を及ぼすかもしれない
私たちのビジネス成功は、第三者の固有の権利を侵害することなく、私たちの候補製品を開発、製造、マーケティング、販売し、当社の独自技術を使用する能力に依存します。私たちは、そのような候補製品をマーケティングして販売し、そのような技術を使用して既存または将来の特許を侵害しないことを保証することはできない。我々の候補製品に関連する分野には,米国や外国から発行された特許や第三者が所有する未解決特許出願が数多く存在する.バイオテクノロジーや製薬業界の拡張や特許の発行に伴い、他社は我々の候補製品、技術または交付または使用方法が彼らの特許権を侵害していると主張する可能性があり、そのリスクが高まっている。さらに、私たちを含む業界参加者は、どの特許が様々な薬剤、生物学的製品、薬物送達システム、またはそれらの使用方法をカバーしているか、およびこれらの特許のうちどれが有効かつ強制的に実行可能である可能性があるかを常に明確にしているわけではない。したがって,我々の分野で発行される特許や提出された特許出願数が多いため,第三者は我々の候補製品,技術または方法を含む特許権を持っていると主張する可能性がある
さらに、私たちの候補製品またはノウハウは、侵害されたか、または侵害されたと告発された第三者に特許を発行するかもしれない。米国におけるいくつかの特許出願は、特許発行前に秘密にされている可能性があるので、米国および多くの外国司法管轄区域の特許出願は、通常提出後18ヶ月後に発行され、科学文献中の出版物は、実際の発見よりも遅れていることが多いため、他の人が、私たち自身の許可内に発行された特許または私たちが審理している出願に含まれている技術について特許出願を提出していないとは判断できない。私たちの競争相手は特許出願を提出したかもしれませんし、将来的に提出されるかもしれません。私たちの候補製品または私たちの技術と類似しています。このような任意の特許出願は、私たち自身および認可内の特許出願または特許よりも優先される可能性があり、これは、そのような技術をカバーする発行された特許を取得する権利をさらに要求することができる。他方が私たちが所有または許可してくれた発明と同様の発明について米国特許出願を提出した場合、私たちまたは技術を許可する場合、許可者は、発明の優先権を決定するために、米国で干渉プログラムに参加しなければならない可能性がある
| 70 |
| カタログ表 |
私たちは、特許または他の知的財産権を有する第三者の将来の訴訟に直面したり、脅かされたりする可能性があり、これらの第三者は、“ハッジ·ワックスマン法”第4項に基づいて提起された訴訟を含む、我々の候補製品またはノウハウがこれらの第三者の知的財産権を侵害していると主張する。これらの訴訟は、このような薬物の既存特許権が存在すると主張する可能性があり、このような種類の訴訟は、費用が高く、私たちの経営業績に悪影響を及ぼす可能性があり、私たちがこのような特許を侵害していなくても、または私たちが主張する特許に対して最終的に無効と決定された場合がある。裁判所は私たちが第三者の特許を侵害したと判断し、特許が含まれている活動を停止するように命令する可能性がある。また,裁判所は相手の特許侵害のために相手に損害賠償金を支払うよう命令する可能性がある
特許侵害請求のため、または潜在的なクレームを回避するために、第三者に許可を求めることを選択または要求される可能性がある。このようなライセンスは商業的に受け入れられる条項で提供されていないかもしれないし、全くそうではないかもしれない。たとえ私たちが許可を得ることができても、許可は私たちに許可料や印税を支払うことを要求する可能性が高く、あるいは両方を持って、私たちに与えられた権利は非排他的である可能性があり、これは私たちの競争相手が同じ知的財産権を得ることをもたらすかもしれない、あるいはそのような権利は制限的であり、私たちの現在と未来の活動を制限するかもしれない。最終的に、実際または脅威の特許侵害クレームにより、私たちまたは許可者が許容可能な条項で許可を得ることができない場合、私たちまたは許可者は、製品の商業化を阻止されたり、特定の態様の業務運営を停止させられたりする可能性がある
私たちに提起される可能性のある侵害クレームに加えて、妨害、派生、再審査、またはUSPTOが発表または承認した他のライセンス後訴訟、および私たちの現在または他の製品知的財産権に関する外国の類似訴訟を含む他の特許訴訟および他の訴訟の当事者になる可能性がある
バイオテクノロジーと製薬産業では、一般的に特許と他の知的財産権に関する多くの訴訟がある。今まで、誰も私たちに侵害訴訟を提起したことがない。もし第三者が私たちが知的財産権を侵害していると主張すれば、私たちはいくつかの問題に直面するかもしれない
| · |
| 権利侵害と他の知的財産権のクレームは、事件の状況にかかわらず、訴訟を提起するのは高価で時間がかかる可能性があり、そして私たちの管理層の核心業務に対する注意力を移す可能性がある |
| · |
| 権利侵害の実質的な損害賠償は、もし裁判所が紛争製品または技術侵害または第三者の権利を侵害すると判断した場合、私たちは支払わなければならないかもしれない。もし裁判所が侵害が故意であることを発見した場合、私たちは3倍の損害賠償金と特許権者の弁護士費の支払いを命じられる可能性がある |
| · |
| 裁判所は、第三者が知的財産権を許可してくれなければ、第三者がそうする必要はない限り、可能な製品や技術を販売することを禁止している |
| · |
| 第三者から許可を得ることができる場合、私たちは、私たちの製品または技術に大量の使用料または前払い費用を支払うか、または知的財産権交差許可を付与する必要があるかもしれない |
| · |
| 私たちの製品やプロセスを再設計して、権利を侵害しないようにすることは不可能かもしれません。あるいは大量のお金の支出と時間が必要かもしれません |
私たちのいくつかの競争相手は、彼らがより多くの資源を持っているので、私たちよりも複雑な特許訴訟の費用を効果的に受けるかもしれない。さらに、いかなる訴訟の開始および継続によって生じるいかなる不確実性も、追加資金を調達する能力を損なう可能性があり、または他の方法で私たちの業務、財務状況、経営業績、および見通しに悪影響を及ぼす可能性がある
| 71 |
| カタログ表 |
私たちはある第三者の許可者とパートナーに依存しており、将来的には引き続きそうしなければならないので、もし私たちの許可者またはパートナーのうちの1つが第三者の知的財産権侵害で起訴されれば、私たちの業務、財務状況、経営業績、および見通しは私たちが直接起訴されたように影響を受けるかもしれない。訴訟リスクに直面していることに加えて、私たちは、告発された侵害行為が私たちの独自技術によって引き起こされたかどうかにかかわらず、これらの第三者に対して提起された特許訴訟の一部の費用の支払いを要求する可能性があるいくつかの許可者およびパートナーとコスト分担協定を締結しているか、または、これらの第三者に対して提起された特許訴訟の一部の費用を支払うことを要求することに同意する。場合によっては、これらのコスト分担協定はまた、私たちの技術だけに基づいて負担するよりも大きな侵害損害賠償責任を負うことを要求するかもしれない
上記のいずれの状況の発生も、我々の業務、財務状況又は経営業績に悪影響を及ぼす可能性がある
私たちは私たちの特許や他の知的財産権、または私たちの許可者の特許を保護または強制する訴訟に巻き込まれるかもしれません。これは高価で時間がかかるかもしれません
競争相手は私たちの特許や私たちの許可側の特許を含めて私たちの知的財産権を侵害するかもしれない。したがって、私たちは第三者の権利侵害または不正な使用を阻止するために権利侵害請求を要求されるかもしれない。これは高価で時間がかかるかもしれないが、特に私たちのような規模の会社には。さらに、侵害訴訟では、裁判所は、私たちの特許が無効または強制執行できないと判断することができ、または、私たちの特許主張がその技術を含まないか、または侵害者への禁止を付与するために必要な要素を満たしていないことを理由に、他方の関連技術の使用を阻止することを拒否することができる。任意の訴訟または他の手続きに対する不利な裁決は、私たちの1つまたは複数の特許が無効、狭義の解釈または修正されるリスクに直面し、私たちの候補製品をカバーしないようにするかもしれない。さらに、このような不利な裁決は、私たちの特許出願が発表されないリスクに直面するか、または発表された範囲が限られており、私たちの候補製品をカバーしたり、他社の類似製品の販売を阻止するのに十分ではないかもしれません
米国特許商標局において提起された干渉、派生、または他のプログラムは、我々の特許出願または我々のライセンシーまたは潜在的パートナーの特許出願に関連する発明の優先権または特許性を決定するために必要である可能性がある。私たちが提起した訴訟やUSPTO訴訟は失敗するかもしれないし、第三者に引用されるかもしれない。私たちが勝訴しても、国内または海外の訴訟や米国特許商標局または外国特許庁の訴訟は、巨額のコストを招き、私たちの経営陣の注意を分散させる可能性がある。私たちは単独で、または私たちのライセンシーや潜在的なパートナーと一緒に、私たちの独占権が流用されることを防ぐことができないかもしれません。特に法律ではアメリカのようにそのような権利を十分に保護していないかもしれません
さらに、知的財産権訴訟または他の訴訟手続きが大量の開示を必要とするため、私たちのいくつかの機密情報は、そのような訴訟または他の訴訟手続きにおいて開示によって漏洩される可能性がある。さらに、このような訴訟または訴訟中に、聴聞結果、動議または他の一時的手続きまたは事態の発展を開示するか、または関連文書を公開的に閲覧することができる。もし投資家がこれらの結果がマイナスだと思うなら、私たちの普通株式または株式証明書の市場価格は深刻な損害を受ける可能性がある
私たちの第三者への依存は、私たちのビジネス秘密を共有することを要求し、これは、私たちのビジネス秘密が流用または漏洩する可能性を増加させ、従業員や第三者との秘密保護協定は、ビジネス秘密の漏洩を十分に防止し、他の固有情報を保護することができない可能性がある
私たちは、独自の商業秘密または機密ノウハウおよび非特許ノウハウが、私たちのビジネスに非常に重要であると考えている。私たちは、特に特許保護の価値が限られていると思う場合、商業秘密または機密技術によって私たちの技術を保護するかもしれない
このような情報を競争相手から開示または盗み取らないようにするために、私たちの政策は、当社の従業員、コンサルタント、協力者、請負業者、およびコンサルタントが、独自の情報の研究または開示を開始する前に、秘密協定および材料譲渡協定、コンサルティング協定、または他の同様の合意(適用される場合)を締結することを要求することである。これらの協定は、一般に、私たちの商業秘密を含む、第三者が私たちの機密情報を使用または開示する権利を制限する。しかしながら、現職または元従業員、コンサルタント、協力者、請負業者、およびコンサルタントは、競争相手に私たちの機密情報を意図的にまたは意図的に開示することができず、秘密協定は、機密情報を無許可に開示することができない場合に十分な救済措置を提供できない可能性がある。商業秘密および他の機密情報を共有する必要は、そのような商業秘密が私たちの競争相手に知られ、意図せずに他の人の技術に組み込まれるか、または開示されるか、またはこれらの合意に違反して使用されるリスクを増加させる。私たちの独自の地位が私たちのノウハウおよびビジネス秘密にある程度基づいていることを考慮すると、競争相手は、私たちのビジネス秘密または他の許可されていない使用または開示が私たちの競争地位を損なうことを発見し、私たちの業務および運営結果に悪影響を及ぼす可能性があります。第三者が商業秘密または機密技術を不法に入手して使用することを強制することは高価で、時間がかかり、予測できない。秘密保持プロトコルの実行可能性は管轄地域によって異なる
| 72 |
| カタログ表 |
さらに、これらの合意は、一般に、私たちの合意がいくつかの限られた発行権を含む可能性があるにもかかわらず、私たちの従業員、コンサルタント、協力者、請負業者、およびコンサルタントが、私たちのビジネス秘密に関連する可能性のあるデータを発行する能力を制限します。私たちは私たちのビジネス秘密を保護しようと努力しているにもかかわらず、私たちの競争相手は、私たちと第三者との合意、独立開発、または私たちの任意の第三者協力者が情報を発表することによって、私たちのビジネス秘密を発見するかもしれない。競争相手は私たちのビジネス秘密が私たちの競争地位を損なうことを発見し、私たちの業務に悪影響を及ぼすだろう
私たちは以下の告発の影響を受けるかもしれない:私たちの従業員、コンサルタント、または独立請負業者が間違って使用したり、彼らの前の雇用主または彼らの以前または現在の顧客のいわゆる商業秘密を開示してくれた
バイオテクノロジーや製薬業界でよく見られるように、私たちの一部の従業員は以前、私たちの競争相手や潜在的な競争相手を含む他のバイオテクノロジーや製薬会社に雇われていた。さらに、私たちはコンサルタントを招いて、私たちの製品や候補製品の開発を手伝ってくれました。彼らの多くは以前に雇われていたか、または他のバイオテクノロジーや製薬会社にコンサルティングサービスを提供していました。私たちは、これらの従業員とコンサルタント、または私たちが無意識に、または他の方法で彼らの前の雇用主または彼らの前または現在の顧客の商業秘密または他の固有の情報を使用または漏洩したと非難されるかもしれない。これまで,このような請求例があることは知られていなかったが,このような請求例が出現した場合には,どのような請求例にも対抗するために訴訟を行う必要がある可能性がある.たとえ私たちがこのようなクレームに対抗することに成功したとしても、どのような訴訟も長引く可能性があり、費用が高く、私たちの管理チームの注意を分散させ、投資家や他の第三者に有望視されず、不利な結果を招く可能性がある
もし私たちの特許期間が私たちの製品が承認される前または直後に満期になったら、あるいは模倣薬や生物類似薬の製造業者が私たちの特許に挑戦することに成功した場合、私たちの業務は実質的な損害を受ける可能性があります
特許の有効期限は限られています。米国では、すべての維持費が適時に支払われる場合、特許の自然失効時間は、通常、米国で最初の非臨時出願日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品、その製造、または用途の特許が取得されても、特許有効期限が満了すると、模倣薬または生物類似薬を含む競争薬からの競争に直面する可能性がある
FDAが私たちの候補製品の発売を承認した時間、期限、条件によると、私たちの1つ以上の米国特許は、1984年の“薬品価格競争と特許期限回復法”(Hatch-Waxman Actと略称する)とEUの同様の立法に従って限られた特許期間の延長を受ける資格がある可能性がある。ハッジ·ワックスマン法は、製品開発およびFDA規制審査中に失われた有効特許期間の補償として、承認された製品の特許を最大5年間延長することを可能にする。特許期間の延長は,製品が承認された日から14年間の余剰特許期間を超えてはならず,承認された薬物に適用される特許を延長することしかできない。しかし、適用の最終期限内に出願を提出できなかった場合、関連特許の満了前に出願を提出できなかった場合、または適用の要求を満たしていなかった場合、延期されない可能性がある。しかも、延期の長さは私たちが要求したものより短いかもしれない。もし私たちが特許期間の延長を得ることができない場合、あるいはこのような延長の期限が私たちが要求したものよりも短い場合、私たちはその製品に対して特許権を行使することができる期限が短縮され、私たちの競争相手は私たちが予想していたよりも早く発売競争製品の承認を得ることができるかもしれない。さらに、我々が任意の特許期間延長期間内に排除する権利の範囲は限られている可能性があり、競争相手の製品または製品使用を含まない可能性もある。したがって、私たちは適用製品からの収入が減少する可能性があり、大幅に減少するかもしれない
| 73 |
| カタログ表 |
新薬候補薬の開発、試験、規制審査に要する時間を考慮すると、これらの候補薬物を保護する特許は、これらの候補薬物の商業化前または直後に満了する可能性がある。したがって、私たちの特許と特許出願は、他の人が私たちと似ているか同じ製品を商業化することを排除するために、私たちに十分な権利を提供していないかもしれない。上記のいずれも、我々の競争地位、業務、財務状況、経営結果、および見通しに重大な悪影響を及ぼす可能性がある
模倣薬または生物類似薬の製造業者は、法廷または特許庁において、私たちの特許の範囲、有効性、または実行可能性に挑戦する可能性があり、私たちはこれらの知的財産権を成功的に実行または保護することができない可能性があり、したがって、関連製品を独占的に開発またはマーケティングすることができない可能性があり、これは、製品の任意の潜在的販売に重大な悪影響を及ぼすであろう。私たちが発行した特許または私たちの未解決特許出願で発行される可能性のある特許が満了した後、潜在的な競争相手にこのような特許権を主張することができなくなり、私たちの業務および運営結果は不利な影響を受ける可能性があります
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません
我々の未登録商標または商号は、挑戦、侵害、回避、または汎用商標として発表されるか、または他の商標が侵害されたと認定される可能性がある。私たちはこれらの商標と商品名に対する私たちの権利を保護できないかもしれません。私たちは私たちが関心のある市場における潜在的な協力者や顧客の中で知名度を確立するために必要です。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または商標の所有者は、我々の未登録商標または商号の変異体を含む商号または商標侵害クレームを提起することができる。長期的には、私たちが商標や商号を成功的に登録し、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。商標、商業秘密、ドメイン名、著作権または他の知的財産権に関連する専有権を実行または保護する努力は無効である可能性があり、大量のコストおよび資源移転を招き、私たちの財務状況または運営結果に悪影響を及ぼす可能性があります
私たちの固有の情報は失われるかもしれないし、私たちはセキュリティホールに遭遇するかもしれない
私たちの正常な業務過程で、私たちは知的財産権、臨床試験データ、独自の業務情報、個人データ、および臨床試験被験者と従業員の個人識別情報を含む敏感なデータを私たちのデータセンターとネットワークに収集して保存する。このような情報の安全な処理、維持、そして伝達は私たちの行動に必須的だ。私たちはセキュリティ措置を取っているにもかかわらず、私たちの情報技術とインフラはハッカーの攻撃を受けやすいか、あるいは従業員のミス、汚職、その他の中断によって破られる可能性があります。私たちが知っている限り、私たちは今までこのような重大なセキュリティホールを経験していませんが、どのような脆弱性も、私たちのネットワークを危険にさらす可能性があり、そこに格納されている情報がアクセス、公開、開示、紛失、または盗まれる可能性があります。任意のこのような情報のアクセス、開示、あるいは他の損失は、法律クレームや訴訟、個人情報のプライバシーを保護する法的責任、重大な監督管理処罰、私たちの運営を妨害し、私たちの名声を損害し、人々が私たちと私たちの臨床試験を行う能力に自信を失うことを招き、これは私たちの名声に不利な影響を与え、私たちの候補製品の臨床開発を延期する可能性がある
証券市場に関するリスク及び普通株及び引受権証の所有権
私たちの普通株と引受権証の市場価格はずっと不安定で、大幅に変動する可能性があり、これは私たちの証券の保有者に大きな損失をもたらす可能性があります。
私たちの普通株の市場価格の変動は大きく、2021年8月に初めて公募株を公開して以来、私たちの普通株の市場価格は1株0.162ドルから6.95ドルまで様々です。私たちの普通株と株式認定証の市場価格は変動が大きい可能性があり、以下の要素の影響を受ける可能性がある
| · |
| 当社の四半期または年度の経営業績の実際または予想変動 |
| 74 |
| カタログ表 |
| · |
| 競争相手と比較して、わが社の業績や成長率の実際または予想変化 |
| · |
| 投資界や私たちが大衆に提供している財務的推定および予測を達成できなかったか、またはそれを超えることができなかった |
| · |
| 証券アナリストは新しいまたは最新の研究報告書または報告書を発表する |
| · |
| 普通株式または株式承認証の取引量レベルが一致しない株価と出来高変動に起因することができる |
| · |
| 重要な管理者や他の人員の増減 |
| · |
| 特許、訴訟事項、および私たちの技術のための特許保護を得る能力を含む、特許権に関連する紛争または他の発展; |
| · |
| 追加的な債務または株式融資が発表されるか、または予想される |
| · |
| 私たち、私たちの内部人または他の株主は私たちの普通株式を売却したり、株式証明書を発行したりします |
| · |
| 米国や他の地方の一般経済、市場または政治状況(新冠肺炎の大流行による状況を含むがこれらに限定されない) |
特に,我々のような臨床段階では会社の市場価格は非常に不安定であったが,これらに限定されない
| · |
| 私たちの候補製品の臨床試験の遅延または失敗、またはFDAおよび他の規制機関の承認を得た |
| · |
| 私たちの製品候補製品の知的財産権の発展や論争について |
| · |
| 私たちや競争相手の技術革新は |
| · |
| 投資家は会社の評価の変動は私たちと互角だと思っています |
| · |
| 私たちまたは私たちの競争相手は、重大な契約、買収、戦略的パートナーシップ、合弁企業、資本約束、新技術または特許を発表します |
| · |
| 重要な取引を完了できなかったか、またはサプライヤーと協力して私たちの製品を生産することができなかった; |
| · |
| 立法は医療治療の価格に制限を加えることを提案する |
これらおよび他の市場および業界要素は、私たちの普通株と株式承認証の市場価格と需要を大幅に変動させる可能性があり、私たちの実際の経営業績にかかわらず、投資家がその普通株や株式証明書の株式を売却することを制限または阻止する可能性があり、そうでなければ、私たちの普通株と株式証明書の流動性にマイナスの影響を与える可能性がある。また、株式市場全体、特にナスダック資本市場と新興成長型会社は、極端な価格と出来高変動を経験しており、これらの変動は往々にしてこれらの会社の経営業績に関係なく、あるいは比例しない。従来、ある証券の市場価格が変動した場合、その証券の保有者は、当該証券を発行した会社に対して証券集団訴訟を提起する。もし私たちのすべての株主が私たちを提訴すれば、私たちは巨額の訴訟弁護費用を生むかもしれない。そのような訴訟はまた私たちの経営陣の時間と注意を移すかもしれない
| 75 |
| カタログ表 |
私たちの株式承認証は何の価値もないかもしれない
私たちの普通株の市場価格が私たちが発行した株式承認証の発行された株式価格に永遠に等しいか、またはそれを超える保証はありません。株式承認証が行使可能な期間中、私たちの普通株価格が引受権証の行使価格を超えていなければ、株式承認証には何の価値もないかもしれない
株式承認証は、持株者が承認株式証を行使して我々の普通株式を購入するまで、持株者に普通株主としてのいかなる権利も与えない
株式承認証を行使する際に私たちの普通株式の株式を取得しない限り、あなたの株式承認証は普通株主としてのいかなる権利も提供しません。あなたの株式引受証を行使する際には、行使日以降の事項について普通株主の権利を行使する権利を記録する権利のみがあります
私たちは“新興成長型会社”であり、“新興成長型会社”に適用される開示要求を低減することができるようになり、私たちの普通株や引受権証の投資家への魅力を低下させる可能性があります
私たちはJOBS法案で定義されている“新興成長型企業”であり、“新興成長型企業”であり続ける限り、他の上場企業に適用されるが“新興成長型企業”には適用されない様々な報告要件のいくつかの免除を利用したいと考えているが、これに限定されないが、サバンズ-オキシリー法案第404条の監査師認証要求を遵守する必要はなく、定期報告や依頼書における役員報酬に関する開示義務の削減や、役員報酬の非拘束性相談投票の要求の免除、株主承認までに承認されていないゴールドパラシュート支払いの要求を免除する。私たちは5年間に及ぶ“新興成長型企業”とすることができ、または(I)私たちの年間総収入が12.35億ドルを超える最初の会計年度の最終日まで、(Ii)取引法第12 b-2条に規定されている“大型加速申告会社”になった日まで、最近完成した第2四半期の最終営業日までに、非関連会社が保有する私たちの普通株の時価が7億ドルを超えると、このような状況が発生する。または(Iii)我々が前3年間に10億ドルを超える転換不能債券を発行した日
私たちは、私たちがもはや“新興成長型会社”ではなくなるまで、上記の報告書を利用して免除するつもりだ。雇用法案によると、“新興成長型企業”は、これらの基準が民間企業に適用されるまで、新たなまたは改正された会計基準の採用を延期することもできる。我々は、新規または改訂された会計基準の免除を使用しないことを撤回できないことを選択したため、他の“新興成長型企業”ではない上場企業と同様の新たまたは改正された会計基準の制約を受ける
もし私たちがこれらの免除に依存することを選択すれば、投資家は私たちの普通株式や株式承認証の吸引力が低下することを発見するかどうか予測できない。もし一部の投資家が私たちの普通株式または株式承認証が未来の開示の選択を減らすことによって魅力が低下していることを発見した場合、私たちの普通株と引受権証の取引市場はそんなに活発ではない可能性があり、私たちの普通株と株式承認証の価格はもっと不安定である可能性がある
私たちの内部統制の有効性は制限される可能性があり、もし私たちの制御システムがエラーや詐欺を防止できなければ、私たちの会社に実質的な損害を与える可能性があります。もし私たちが重大な弱点を是正できなかった場合、あるいは私たちが未来に大きな弱点に遭遇した場合、あるいは将来的に有効な内部統制システムを維持できなかった場合、私たちの財務状況や経営結果を正確かつタイムリーに報告することができない可能性があり、これは投資家の自信に悪影響を与え、私たちの普通株式や株式証明書の価値に影響を与える可能性がある
私たちが2021年8月に初公開募集を完了するまで、私たちは民間会社であり、会計人員が限られており、財務報告の内部統制を解決するための私たちの会計手続きを十分に実行できなかった規制資源も限られていた。新上場企業として、私たちはアメリカ証券取引委員会の規則の下で、上場会社の要求に応じて制御環境を設計した。
| 76 |
| カタログ表 |
財務会計と開示制御及びプログラムに対する適切な内部統制は上場企業の運営に重要である。このようなシステムを効率的に構築することはできないかもしれませんが、特に公開報告会社として運営される予定です。これにより、当社に関する財務情報を確実に吸収して編集することができず、エラー防止や詐欺発見能力を著しく弱めることになり、これらは様々な角度から当社に悪影響を与えることになります
さらに、財務報告書の開示統制や内部統制が確立されても、すべてのミスやすべての詐欺を防ぐことはできないと予想される。設計および動作がどんなに良好であっても、絶対的な保証ではなく、合理的な保証しか提供できず、保証制御システムの目標が実現される制御システム。また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.すべての制御システムの固有の限界により,どの制御評価もすべての制御問題や不正イベントが発見されたことを絶対に保証することはできない.私たちの統制システムはミスや詐欺を防ぐことができず、私たちに実質的な悪影響を及ぼすかもしれない
証券や業界アナリストが我々の業務に関する研究報告を発表しない場合、あるいは不正確または不利な研究報告を発表しなければ、私たちの株価や取引量は低下する可能性がある
私たちの普通株式と権利証の取引市場は、証券または業界アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存する。私たちは現在持っていないし、証券や業界アナリストの研究報告を決して得られないかもしれない。もし証券や業界アナリストが私たちの会社を報道し始めなければ、私たちの証券の取引価格はマイナスの影響を受けるだろう。もし私たちが証券や業界アナリストの報告を得た場合、1人以上の追跡アナリストが私たちの証券格付けを引き下げたり、私たちの業務の不正確または不利に関する研究報告を発表したりすれば、私たちの株価と株式証明書価格が下落する可能性がある。これらのアナリストのうちの1人以上が私たちへの報告を停止したり、私たちに関する報告書を定期的に発表できなかったりすれば、私たちの証券に対する需要が減少する可能性があり、これは私たちの証券の価格と取引量を低下させる可能性がある
将来私たちの普通株の売却、株式承認証、あるいは私たちの普通株に転換できる証券は私たちの株価を押し下げるかもしれません
私たちの普通株、株式承認証、または私たちの普通株に変換できる証券はいつでも公開市場で販売される可能性があります。これらの売却、あるいは市場で大量の株式保有者が株を売却しようとしているとの見方は、我々の普通株や引受権証の市場価格を低下させる可能性がある。2023年2月14日まで、私たちは12,321,848株の普通株流通株を持っています。私たちの普通株、株式承認証、または私たちの普通株に変換可能な証券の大量株が売却資格に適合した後に公開市場で販売されれば、売却は私たちの普通株と引受権証の取引価格を低下させ、将来の資本を調達する能力を阻害する可能性がある
もし私たちがナスダックの持続的な上場要求を守り続けることができなければ、私たちの普通株式および/または株式承認証が清算される可能性があります
2022年6月17日、我々はナスダック株式市場上場資格スタッフから手紙(“ナスダック”)を受け取り、我々の普通株の30営業日連続の終値計算によると、ナスダック上場規則第5550(A)(2)条に規定されているナスダック資本市場への上場継続は1株1.00ドルの最低購入価格を維持しなければならないという要求を遵守していないと指摘している(以下“通知”という)。ナスダック上場規則第5810(C)(3)(A)条によると、我々は、通知日から180暦の契約期間を提供するか、または2022年12月14日まで、最低成約見積要求を再遵守することを得る。2022年12月15日には、最低締切入札要求を再遵守するために、2023年6月12日までの180暦の追加契約期間を取得しました
私たちは引き続き私たちの普通株の終値を監視し、割り当てられたコンプライアンス期間内にすべての適用可能なナスダック要求を再遵守することを求め、最低終値要件を再遵守するために普通株式の逆分割を実施することを含む適切な場合に利用可能な選択を考慮する可能性がある。もし私たちがナスダックに上場し続けるために逆株式分割の実施を求める場合、このような逆株式分割を発表または実施することは、私たちの普通株および/または株式承認証の価格に悪影響を及ぼす可能性がある。もし私たちが割り当てられたコンプライアンス期間内にナスダックが承認する可能性のあるいかなる延期も含めてコンプライアンスを再獲得できなかった場合、ナスダックは私たちの普通株式と株式承認証が取得されるという通知を出すだろう。そして、私たちはこの判決についてナスダック公聴会グループに控訴する権利があるだろう。180日間の契約期間内に最低入札価格要求を再遵守する保証はありませんし、ナスダックの他の上場要求を守り続ける保証もありません。退市は私たちの普通株式と引受権証の取引を大幅に減少させる可能性があり、ナスダックに関連する市場効率の喪失と連邦政府の州証券法に対する優先購入権を失うことにより、私たちの普通株と引受権証の市場流動性に悪影響を与え、受け入れ可能な条項で融資を得る能力に悪影響を与え、もしあれば、投資家、サプライヤー、顧客、従業員の潜在的な自信を失い、業務発展の機会が減少する可能性がある。また、私たち普通株および/または株式承認証の市場価格はさらに下落する可能性があり、株主は一部または全部の投資を損失する可能性がある。
| 77 |
| カタログ表 |
私たちの役員、役員、主要株主は私たちに大きな支配権を持っていて、会社の統制権の変更を延期または阻止する可能性があります
2023年2月14日現在,我々の役員,役員,5%を超える普通株式保有者とその関連会社実益は,我々が発行した普通株の合計約36.4%を有している.したがって、これらの株主は力を合わせて、取締役選挙および私たちの所有またはほとんどの資産の任意の合併、合併、または売却を含む、我々株主に提出された承認事項の結果に著しく影響を与えることができる。また、これらの株主は共同で行動し、わが社の管理や事務を制御する能力がある。したがって、このような所有権集中は、以下のように私たちの普通株式と引受権証の市場価格を損なう可能性があります
| · |
| 私たちの統制権の変更を延期したり、延期したり、阻止したりする |
| · |
| 私たちの合併、合併、接収、またはその他の業務統合を妨げる;または |
| · |
| 潜在的な買収者が買収要約を提出することを阻止したり、他の方法で私たちを統制しようとしたりする |
我々の役員、取締役、私たちの普通株の5%以上を保有する株主、およびそれらの関連会社の私たちが発行した株の所有権についてのより多くの情報は、以下の“主要株主”を参照されたい
わが社の登録証明書や定款に含まれる反買収条項、およびデラウェア州法律の条項は、買収の試みを損なう可能性があります
当社の会社登録証明書、定款、およびデラウェア州法律に含まれる条項を改正し、再記述することは、取締役会が望ましくないと思う買収をより困難にし、遅延したり、阻止したりする可能性があります。当社のコーポレート·ガバナンス文書には、以下の条項が含まれています
| · |
| 私たちの取締役会を3つに分類します |
| · |
| “空白小切手”優先株を発行することは、株主の承認を必要とせず、投票権、清算、配当金、および私たちの普通株より優れた他の権利を含む可能性がある |
| · |
| 役員と上級管理者の責任を制限し、賠償を提供する |
| · |
| 私たちの株主が特別会議の前に業務を招集して展開する能力を制限する |
| · |
| 私たちの株主会議で株主の業務提案を事前に通知し、取締役会に入った候補者を指名することを要求します |
| · |
| 取締役会と株主会議の開催と手配を制御するプログラム; |
| · |
| 私たちの取締役会に明確な権力を提供し、以前に手配された年間会議を延期し、以前に手配された特別会議をキャンセルすることができます |
これらの条項は単独でまたは一緒に敵意の買収、統制権の変更、または私たちの経営陣の変動を延期または阻止する可能性がある
デラウェア州会社として、私たちはまた、デラウェア州会社法第203条を含むデラウェア州の法律の条項を遵守しなければならない。この条項は、私たちが発行した普通株式の15%を超える株主が、私たちのほとんどの発行された普通株式所有者の許可を得ずにいくつかの商業合併を行うことを禁止している
私たちが改正して再記述した会社登録証明書、定款またはデラウェア州法律の遅延または抑止権変更の条項は、私たちの株主が彼らの普通株式または株式承認証から割増の機会を得ることを制限する可能性があり、また一部の投資家が私たちの普通株式と引受権証のために支払う価格に影響を与える可能性がある
| 78 |
| カタログ表 |
私たちが純営業損失を繰り越す能力は限られているかもしれません
2022年12月31日現在、我々の純営業損失繰越(NOL)は連邦所得税で約920万ドル、州所得税で約500万ドルである。これらのNOLの使用は、私たちの未来の収入を含む多くの要素に依存しており、これは保証できない。これらのNOLは期限が切れた時に使用されない可能性があり、私たちの未来の所得税債務を相殺することもできない。また、改正された1986年の国内税法第382条又は同法規及び州法律の該当条項によれば、ある会社が1回の価値でその持分を計算して3年以内に5%の株主の持分から50%を超える変化を経験した場合、その変動前のNOLと他の変動前の税収属性とを用いて変動後の収入を相殺する能力は限られている可能性がある。私たちは将来株式所有権の変化のために所有権の変化を経験するかもしれないが、その中のいくつかは私たちがコントロールできるものではないかもしれない。私たちの歴史NOLの所有権の変化を実質的に制限することは、私たちの未来のアメリカ連邦所得税とアメリカ州所得税の義務を効果的に増加させ、私たちの将来の経営業績を損なうかもしれません。また、2017年の減税と雇用法案、2020年のコロナウイルス援助、救済、経済安全法案またはCARE法案の改正により、2018年と今後数年間に発生する連邦NOLは無期限に繰り越す可能性があるが、2020年12月31日以降に開始される納税年度使用であれば、これらの年に発生する連邦NOLの控除額は課税収入の80%以内に制限される。2018年1月1日までの数年間に発生した連邦純営業損失は、20年間繰り越すことができますが、課税収入の80%に限られていません。
私たちは私たちの配当金に配当金を支払ったことがなく、私たちは予測可能な未来にも現金配当金を支払わないと予想している
私たちは私たちの株の現金配当金を発表したり支払ったりしたことがない。私たちは現在、将来のどんな収益も残して、私たちの業務の運営と拡張に資金を提供するつもりで、私たちは予測可能な未来にいかなる配当金も発表したり支払うことはないと予想しています。したがって、株主は、将来の収益に投資する唯一の方法として、価格上昇後に彼らの普通株と引受権証を売却することに依存しなければならない
私たちが改訂し、再記述した会社登録証明書は、デラウェア州衡平裁判所が私たちの株主のために提起する可能性のある特定のタイプの訴訟および訴訟の唯一および独占フォーラムを指定し、これは、私たちまたは私たちの役員、上級管理者、または他の従業員との紛争において有利な司法フォーラムを得ることを制限することができる
私たちが書面で代替裁判所を選択することに同意しない限り、私たちは会社の登録証明書の要求を修正し、再記載しなければ、デラウェア州衡平裁判所は法律で許容される最大範囲内で、次の各項目の唯一かつ独占裁判所となるだろう
| · |
| 私たちが提起した任意の派生訴訟や法的手続きを代表する |
| · |
| いかなる訴訟も、私たちの取締役、役員、または他の従業員が会社または私たちの株主に対する任意の受託責任に違反することを主張します |
| · |
| 吾等又は吾等のいずれかの取締役又は吾等の上級職員に対して提起された訴訟、又は吾等又は吾等の任意の役員又は高級社員に対して当社、吾等の会社登録証明書又は附例のいずれかの条文の解釈又は適用について提出された申立 |
| · |
| 内政原則に支配されているクレームを主張するいかなる訴訟も |
しかし、デラウェア州衡平裁判所が商標管轄権の欠如によって上述の任意の訴訟を却下した場合にのみ、デラウェア州の別の州裁判所にこのような訴訟を提起することができる
専属裁判所条項は法律の許容範囲に限られ、改正された1934年の“証券取引法”または“取引法”に基づいて提起されたクレームには適用されず、排他的連邦管轄権が規定されている他のいかなる連邦証券法にも適用されない
| 79 |
| カタログ表 |
また、証券法第22条は、連邦裁判所と州裁判所は、このようなすべての“証券法”訴訟に対して同時に管轄権を持っていると規定している。したがって、州裁判所と連邦裁判所はこのようなクレームを受理する管轄権を持っている。複数の司法管轄区で訴訟を提起せざるを得ないことや、異なる裁判所が不一致または逆の裁決を行わなければならない脅威、およびその他の考慮要因を回避するために、我々が改正して再記載した会社登録証明書は、アメリカ合衆国連邦地域裁判所が証券法に基づいて提起された任意の訴因を解決するための独占的なフォーラムとなる。デラウェア州裁判所はこのような選択の裁判所条項が事実上有効であることを決定したが、株主は米国連邦地域裁判所以外の場所で証券法に基づいて、私たち、私たちの役員、高級管理者、または他の従業員にこのようなクレームを提出することを求めることができる。このような状況の中で、私たちは、私たちが改訂して再記載した会社登録証明書の独占フォーラム条項の有効性と実行可能性を強く主張する予定です
私たちはこの条項が私たちに有利であると信じているが、それはデラウェア州法律の適用された訴訟タイプにおける適用一貫性を向上させるためであるが、この条項は、私たちまたは私たちの役員、幹部、または他の従業員との紛争に有利であると考えられる株主の司法フォーラムでのクレームを制限または阻害する可能性があり、これは、私たちと私たちの役員、役員、および他の従業員に対するこのような訴訟を阻止し、投資家のクレームのコスト増加を招く可能性がある。あるいは、裁判所が、私たちが改訂および再記載した会社登録証明書に含まれる裁判所条項の選択が訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の司法管轄区域でそのような訴訟の解決に関連する追加費用を発生させる可能性があり、これは、私たちの業務および財務状況に悪影響を及ぼす可能性がある
裁判所がこの条項を実行するかどうかには不確実性があり、投資家は連邦証券法とその下の規則や法規の遵守を放棄することはできないことに注目している。この条項は、デラウェア州法律の適用された訴訟タイプへの適用をより一致させるため、私たちに有利であると信じているにもかかわらず、この条項は、私たちの役員や上級管理者に対する訴訟を阻止する効果があるかもしれない
項目1 B。未解決従業員意見
ない。
項目2.財産
私たちの郵送先はカリフォルニア州サンディエゴデルマ高地路3525 Del Mar Heights路322号、郵便番号92130です。新型肺炎のせいで、私たちのすべての従業員たちは遠隔で働いている。以前、私たちはカリフォルニア州サンディエゴでオフィススペースを借りたが、私たちは2019年にレンタル契約を更新しないことを選択した。私たちの仮想作業オフィスは、新たなレンタルや追加または代替の運営空間の評価を交渉することを求める可能性があるにもかかわらず、現在のニーズを満たすのに十分だと信じています。私たちは商業的に合理的な条件下で、いつでも適切な代替空間を得ることができると信じている。
項目3.法的手続き
正常な業務過程で、私たちは時々クレームに関連するかもしれない。訴訟やクレームの結果は正確には予測できませんが、私たちが当事者であることや私たちの財産が実質的な影響を受けていると考えられる未解決訴訟は現在何もありません。結果にかかわらず、訴訟は費用が高く時間がかかる可能性があり、経営陣の重要な業務事項や計画に対する注意力を分散させ、私たちの全体運営にマイナスの影響を与える可能性がある。
プロジェクト4.鉱山安全開示
このプロジェクトは適用されません。
| 80 |
| カタログ表 |
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
市場情報
2021年8月12日から、我々の普通株式と引受権証は、ナスダック資本市場でそれぞれDRMAとDRMAWのコードで取引されている。その前に、私たちの普通株式または株式承認証は市場を公開しなかった。
所持者
2022年12月31日現在、私たちの普通株には約71人の登録株主がいます。この数値には、その株式が街の名義で保有されている利益所有者は含まれていない。我々普通株の実際の保有者数は、実益所有者である株主を含むこの記録保有者の数を超えているが、その株式はブローカーが街頭名義で保有しているか、または他の指定者が保有している。
配当をする
私たちは普通株の現金配当金を発表したり支払ったりしたことがない。予測可能な未来には、普通株の現金配当金を発表または支払うつもりはありませんが、現在は任意の将来の収益を残し、私たちの業務の発展と成長に資金を提供するつもりです。普通株への現金配当金の支払い(あれば)は完全に私たちの取締役会が適宜決定し、私たちの収益、資本要求、財務状況、その他の関連要素に依存します。
第六項です[保留されている]
| 81 |
| カタログ表 |
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
本年度報告書(Form 10-K)の他の部分の私たちの財務状況と経営結果の議論と分析、および私たちの財務諸表および関連付記を読まなければなりません。本議論および分析に含まれるまたは本報告の他の部分に記載された情報は、リスクおよび不確定要因に関する前向きな陳述を含む、我々の業務計画および戦略に関連する情報を含む。本報告の“リスク要因”の一部に列挙された要素を含む多くの要因のため、我々の実際の結果は、以下の議論および分析における前向き陳述に記載されているか、または示唆された結果とは大きく異なる可能性がある。以下の議論で述べた“私たち”,“デマタ”または“会社”とは,デマタ治療会社を指し,従来はデマタ治療有限責任会社と呼ばれていた
概要
著者らは臨床段階の医療皮膚病会社であり、識別、開発と商業化革新の候補薬物に集中し、重大な市場チャンスを持つと考えられる医療と美容皮膚状況と疾病の治療に用いられる。
皮膚病、例えばざ瘡、乾癬、多汗症と各種の美容指標は、毎年全世界の数百万人に影響し、これは彼らの生活の質と感情健康に負の影響を与える可能性がある。現在市場には様々な適応に対する治療選択があるが,多くは治療効果の平平,応用案の煩雑さ,各種の負の副作用を含む重大な欠陥が存在すると考えられ,これらはすべて患者のコンプライアンス低下を招くと考えられる。これらの適応の多くはまず局所治療による治療を行うが,患者の不満により,多くの患者が治療を交換したり,治療を完全に停止したりすることが多い。これは主に緩徐と適度な応答率,比較的早期に出現する負の副作用,毎日の応用計画と長い治療コースによるものである。現在の外用療法の限界から,落胆した患者のニーズを満たす重要な機会があると考えられ,皮膚病や生活様式のニーズを満たす外用製品を探している
私たちの2つの候補製品DMT 310とDMT 410は私たちの独自の多面的なものを融合していますスポンジ.スポンジ様々な皮膚疾患を局所的に治療するための技術。我々のスポンジ.スポンジこの技術は自然に育った淡水スポンジに由来しています湖のスポンジあるいは…。スポンジ.スポンジこれを粉末に加工し,塗布直前に流動化試薬と混合して使いやすいペーストを形成したスポンジ.スポンジ1種の独特な淡水スポンジであり、世界の特定の地区と特定の環境条件下でのみ商業数量で栽培され、これらはすべてその独特な抗微生物、消炎と機械性能を与えている。これらの環境条件、著者らの独占サプライヤーが共同開発した独自の収穫プロトコル及び著者らの収穫後の加工プログラムと結合して、1種の候補製薬製品を生成し、この製品はスポンジの機械成分と化学成分を最適化し、それによって多種の作用機序を有する候補製品を作成し、炎症皮膚状況の治療と美容応用に応用した
私たちが信じているのはスポンジ.スポンジ技術プラットフォームは,様々な皮膚疾患適応に対して化合物を真皮に局所的に輸送することができる単一と組合せ製品を開発·調製することができる。私たちはこの組み合わせはスポンジレストラン機械や化学部品が証明していると信じています体外培養抗微生物や抗炎症特性)が多機能性を増していますスポンジ.スポンジ科学技術プラットフォームは唯一無二の製品として、ざ瘡と乾癬などの多種の医療皮膚病の治療における有効性がある。私たちの機械的性能はスポンジ.スポンジこの技術はボツリヌス毒素、モノクロナル抗体或いは真皮充填物などの各種の巨大分子を、針を必要とすることなく、局部応用を通じて標的治療部位に輸送することを可能にする
私たちの主要候補製品DMT 310は私たちのを利用することを目的としていますスポンジ.スポンジ私たちは週に1回様々な皮膚病を治療する技術を提供していますが、私たちの最初のポイントは普通のざ瘡の治療であり、アメリカでの市場規模は約5000万人です。著者らは2 b期の研究でDMT 310が多種の原因ざ瘡を治療する能力を示し、この研究の中で、著者らは最初に4種類の治療方法を見た後に炎症性皮膚損傷が45%減少し、全体の研究過程において、すべての三つの主要な終点のすべての時点で統計的に著しい改善があった(炎症性皮膚損傷の減少、非炎症性皮膚損傷の減少、及びInvestigatorの全世界評価の改善)。2 b段階のデータによると、2023年下半期に第3段階計画を開始する前に要求を決定するために、FDAとの第2段階会議を終了する準備をしている。また、DMT 310ざ瘡試験の多種の作用機序と抗炎症効果に基づいて、著者らは乾癬の1 b期概念検証試験を完成し、更なる研究に値する鼓舞的な結果を見た
| 82 |
| カタログ表 |
DMT 310は、自然に成長した淡水スポンジから加工された2グラムの粉末からなる湖面のスポンジ。患者は塗布直前に粉末と流動化剤(過酸化水素)を混合し,塗布しやすいペースト状にした。このペーストの応用はスラリーマスクに似ており,皮膚に約10~15分間滞在し,水で洗浄した。DMT 310の機械的成分と化学成分の独特な組み合わせと、著者らの第二段階のざ瘡データに基づいているため、患者はDMT 310を週に1回使用するだけで理想的な治療効果が得られると信じている。機械的な部品ですスポンジ.スポンジ粉末は多くの微小なシリコン質針状針からなり,皮膚にマッサージすると,これらの針状物は角質層(皮膚最外層の保護層)を貫通し,マイクロチャネルを作成して真皮に入り,炎症性サイトカインや細菌が真皮に常駐する。刺突の貫通もマイクロチャネルの開放を招き,酸素が毛皮の脂腺に入り,C.を殺すのに役立つと考えられるにきび嫌気性(無酸素)環境で成長しますにきびシュードモナスざ瘡患者の炎症性病変を引き起こす細菌である)。針刺しは死皮の表層を活性化させ,コラーゲン生成を増加させる。また,新たに作成されたマイクロチャネルは,DMT 310の自然に産生された化合物に導管を提供し,真皮と毛皮脂腺に輸送し,殺すのに役立つと考えられるC. にきび抗炎症がありますそれは.DMT 310は、これらの抗微生物化合物に加えて、抗炎症性化合物、例えば抗炎症性化合物を含むように見えるはい。 体外で実験では,炎症を減少させることで炎症を抑制するにきびカンジダIL−8の産生を刺激し,IL−17 AとIL−17 Fの発現を抑制する。さらにここでははい。 体外でDMT 310有機化合物の研究において、著者らは皮脂細胞脂肪生成の抑制を観察し、これは患者の皮脂(ヒト皮脂腺産生を減少させる油性とワックス質物質)の産生と患者の皮膚の油性に転化する可能性があり、これはいくつかの臨床研究者が著者らの2期ざ瘡研究で観察したものである。これらの生物と機械的効果の結合は,われわれの臨床試験で見られたように,多発性炎症性皮膚疾患を治療する重要な因子である可能性が考えられる。
私たちの2つ目の候補は私たちのスポンジ.スポンジ技術はDMT 410であり,我々の併用治療である。DMT 410は一度に著者らの独自のスポンジ粉末を治療し、その後、ボツリヌス毒素を一度に局部応用して真皮に入ることを含む。現在,ボツリヌス毒素は皮内注射のみで真皮に伝達されることが許可されており,患者にとって苦痛である可能性があり,医師にとっても時間がかかる。しかし、DMT 410がボツリヌス毒素を真皮に局部的に輸送する能力は現有の輸送技術と類似した治療効果レベルを有する可能性があり、耐性問題は更に少なく、応用時間はもっと速く、皮内注射の需要に代わる可能性があると信じている。著者らはまず腋窩多汗症患者の第1段階POC試験でDMT 410をテストし、単回治療4週間後、80%の患者の体重汗量が50%を超えた。現在、多汗症市場の40%近くの患者はボツリヌス毒素の皮内注射の治療を受けており、著者らはDMT 410がこの市場に進出し、皮内にボツリヌス毒素を注射する代わりに大きな機会があると信じている。DMT 410が一期腋窩多汗症試験で観察されたボツリヌス毒素を有効に真皮に輸送する能力に基づいて、毛穴の大きさの縮小、皮脂生成と細紋などを含むDMT 410の一期POC試験を行い、毛穴の大きさの縮小、皮脂生成と細紋などの多種の美容皮膚状況の治療に用いられた。2021年11月には,この実験の主な結果を発表し,有望なデータが見られ,これらのデータはDMT 410をさらに調査する価値があると考えられる。著者らは現在ボツリヌス毒素会社と協力機会を検討しており、DMT 410計画を第二段階研究に移している。
新冠肺炎疫病は引き続きアメリカと世界各地で重大な影響を与えている。ワクチンの獲得性は未来に希望をもたらし、ウイルスの新しい変種とワクチン免疫力の潜在的な減弱は未来にこの大流行の影響を受け続ける可能性があり、これは私たちの業務に不利な影響を与える可能性がある。これまで,同社は計画や進行中の臨床前や臨床試験,製造あるいは輸送中に処理遅延や中断を行っており,大きな影響を与えていない。私たちの業務に対する潜在的な影響は、患者登録、独立した臨床研究者、契約研究組織および他の第三者サービスプロバイダによって提供される時間およびリソースの中断、当施設の一時閉鎖、従業員旅行能力の中断または制限、ならびに原料薬および薬品の第三者サプライヤーおよび契約製造業者の製造および/または出荷遅延を含む計画および進行中の臨床前および臨床試験の遅延を含む。
| 83 |
| カタログ表 |
私たちの運営の歴史は限られている。設立以来、私たちの業務はDMT 310とDMT 410の開発に集中してきて、私たちの会社を組織して配置して、資金を集めて、私たちのサプライチェーンと製造技術を確立して、更に私たちの多重行動メカニズムを表現していますスポンジ.スポンジ技術、知的財産権の組み合わせを確立し、非臨床と臨床試験を行う。私たちは候補製品が発売されることを許可されていないし、製品販売から何の収入も得られていない。私たちは主に株式証券と債務証券を売却することで私たちの業務に資金を提供します。設立以来、初公募株で売却された証券を含む合計約5190万ドルの総収益を債務と株式証券の売却で調達した。
今まで、私たちは何の収入も生じず、重大な運営損失を出した。2022年12月31日と2021年12月31日までの純損失はそれぞれ960万ドルと790万ドルで、2022年12月31日までの累計赤字は4560万ドルだった。私たちは予測可能な未来に巨額の費用と運営損失が続くと予想している。私たちは持続的な活動に関連する費用が大幅に増加すると予想しています
| · | 非臨床研究および3期臨床試験を含むざ瘡治療のためのDMT 310を完全に開発した |
|
|
|
| · | 重度のざ瘡治療のためのDMT 310の規制承認を準備し、提出する |
|
|
|
| · | 第2段階臨床試験および第3段階臨床試験を含む乾癬治療のためのDMT 310の開発を継続し、追加の資金または戦略的パートナーを待つ |
| · | 美容および医療皮膚病の治療のためのDMT 410型ボツリヌス毒素パートナーの決定 |
|
|
|
| · | 承認されれば、販売やマーケティング担当者の雇用など、DMT 310の商業化に備えている |
|
|
|
| · | 第二段階と第三段階の試験と商業販売のために私たちの候補製品を生産し始めました |
|
|
|
| · | より多くの研究開発と販売、一般、行政人員を募集する |
|
|
|
| · | 私たちの知的財産権の維持、拡張、保護の組み合わせと |
|
|
|
| · | 上場企業の運営に関連した追加コストが発生する。 |
私たちは私たちの運営を支援するための追加の資金が必要になるだろう。私たちは公共またはプライベート·エクイティまたは債務融資または他のソースを通じて私たちの業務に資金を提供することを求めることができる。私たちは受け入れ可能な条項で十分な追加融資を受けることができないかもしれないし、根本的にできないかもしれない。私たちが必要な時や有利な条件で資金を調達できなかったことは、私たちの財務状況や私たちの業務戦略を実施する能力にマイナス影響を与えるだろう。私たちは利益を達成するために相当な収入を作る必要があるだろうが、私たちは決してそれをしないかもしれない。
経営成果の構成部分
収入.収入
私たちは設立以来何の収入も生じておらず,規制部門の承認を得て候補製品を商業化するまで,近い将来製品販売から何の収入も生じないと予想している。
| 84 |
| カタログ表 |
運営費
研究と開発費
研究開発活動は私たちのビジネスモデルの核心だ。臨床開発後期段階にある候補製品は通常,臨床開発早期段階の候補品よりも高い開発コストを有しており,これは主に後期臨床試験の規模と持続時間が増加しているためである。予測可能な未来には,我々の候補製品ラインがさらに臨床試験段階に入るにつれて,研究·開発コストが大幅に増加することが予想される。しかし,多くの要因に基づいてプロジェクトに関連する総支出を正確に予測して商業化を実現することは不可能であると考えられる。また、持続的な規制要件を含む、私たちの候補製品の商業化に関連する未知の費用も多く、その多くは現在正確に決定できていない。
研究と開発費用には私たちの候補製品開発に関する費用が含まれています。私たちは発生した費用に基づいて開発費用を計上します。これらの費用には
| · | CROおよびわれわれの臨床試験と臨床前研究を行う研究サイトとコンサルタントとの合意による費用 |
|
|
|
| · | 製造及び供給拡大費用、製造検証ロット及び製造前臨床試験供給及び商業供給の取得及び製造のコスト |
|
|
|
| · | ライセンス料の支払いおよびマイルストーンの支払いを含む、当社の研究開発活動を支援するための材料および用品を含むアウトソーシング実験室サービス。 |
私たちの候補製品が開発に成功するかどうかは大きな不確実性を持っている。現在,余剰開発を完了するために必要な努力の性質,タイミング,コスト,あるいは我々の候補製品がいつ大量の現金純流入を開始する可能性があるかを合理的に見積もることや知ることはできない。この不確実性は臨床試験の持続時間とコストに関連する多くのリスクと不確定要素であり、多くの要素のため、これらのリスクと不確定要素はプロジェクトの全ライフサイクルで大きく異なる
| · | 臨床試験に組み込まれた臨床サイト数 |
|
|
|
| · | 適切な患者の登録に要する時間の長さ |
|
|
|
| · | 臨床試験に参加した患者群の規模は |
|
|
|
| · | 患者はオスミウムの投与量を受ける |
|
|
|
| · | 患者のフォローアップの持続時間 |
|
|
|
| · | オスミウムと候補製品の発展状況 |
|
|
|
| · | 候補製品の治療効果と安全性。 |
私たちの支出は、規制承認の条項と時間、および任意の特許主張または他の知的財産権を提出、起訴、弁護、実行する費用を含む他の不確実性の影響を受ける。私たちは私たちの候補製品が規制部門の承認を得ることに絶対に成功しないかもしれない。私たちの臨床試験は思わぬ結果を得るかもしれない。私たちは私たちの候補製品の臨床試験を停止、延期、または修正することを選択することができる。候補製品の開発のために、これらの変数のいずれかの結果の変化は、候補製品の開発に関連するコストおよび時間の大きな変化を意味する可能性がある。例えば、FDAや他の規制機関が現在予想以上の臨床試験を要求した場合、あるいは任意の臨床試験の登録に重大な遅延があった場合、私たちは臨床開発を達成するために多くの追加の財政資源と時間を費やす必要があるかもしれない。製品の商業化には数年と数百万ドルの開発コストがかかるだろう。
| 85 |
| カタログ表 |
一般と行政費用
一般と行政費用は主に行政と行政機能者の給料と関連費用、出張費と招聘費用を含む。その他の一般的および行政的費用には、株式に基づく報酬費用、法律、会計、税務関連サービスの専門費用、保険料、コンサルタントに支払う費用が含まれる。私たちは発生した費用によってすべての一般的で行政的な費用を支払う。
賃金総額の増加,インフラの拡大,証券取引所上場や米国証券取引委員会の要求遵守に関する相談,法律や税務関連サービスの増加,会計と投資家関係コストおよび上場企業に関連する役員や上級管理者保険料の維持により,我々の一般的かつ行政費用が増加すると予想される
利子支出
利息支出には、主に、私たちが以前返済していなかった転換可能な債務とシリコンバレー銀行ローンの利息支出、債務割引コストの償却、および許可証改訂と和解協定によって支払われたマイルストーン支払いの利息が含まれています。
利子収入
利子収入には、計利子預金口座から得られた現金等価物の利息収入が含まれる
所得税
設立から2021年3月24日まで有限責任会社の形で運営し、共同企業として納税します。したがって、その日前のどんな所得税の責任や利益は私たちの会員たちに計上されなければならない。2021年3月24日以来、私たちはC社として運営し、貸借対照法に基づいて所得税を計算してきた。この方法は、財務諸表に組み込まれた事件の予想される将来の税収結果のために繰延税金資産と負債を確認することを要求している。この方法によると、繰延税項資産及び負債は、財務諸表と資産及び負債の税ベースとの差額に基づいて、予想差額を用いて返送される年度の現行税率を決定する。税率変動が繰延税金資産や負債に及ぼす影響は、公布日を含む期間の収入で確認されている
繰延税項純資産の程度は,これらの資産がより顕在化する可能性があると考えられることを確認した。このような決定を下す際には,既存の課税仮差異の将来逆転,予想される将来課税所得額,税務計画戦略,最近の経営結果を含む利用可能なすべての積極的かつ消極的な証拠を考慮した。もし私たちが未来に私たちの繰延税金資産が私たちが記録した純額を超えることができると判断すれば、私たちは繰延税金資産の推定値を調整し、これは所得税の支出を減らすだろう
我々は、(1)管理職が税務倉庫位の技術的優位性に基づいて税務倉位を維持する可能性が高いかどうかを2段階で行う手順に基づいて不確定な税務倉位を記録すること、および(2)確認のハードルに達する可能性の高い税務倉位について、管理層は、最終的に関連税務機関と和解する際に実現可能な50%以上の最大税収割引額を確認する。所得税支出のうち税優遇が確認されていない利息と罰金(ある場合)を確認します。どんな課税利息と罰金も関連された納税義務に含まれている
重要な会計政策と重大な判断と見積もり
私たちの経営陣は財務状況と経営結果の検討と分析は私たちの財務諸表に基づいており、これらの報告書はアメリカで公認されている会計原則に基づいて作成されています。これらの財務諸表を作成する際には、財務諸表の日に報告された資産および負債額、または有資産および負債の開示および報告期間内に報告された収入および支出に影響を与える推定を行う必要がある。持続的な基礎の上で、著者らは臨床開発費用及び単位と普通株の公正価値に関する推定と判断を含む著者らの推定と判断を評価した。私たちの推定は歴史的経験と私たちがこのような状況で適切な様々な他の要素に基づいていると思う。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。
| 86 |
| カタログ表 |
我々の重要な会計政策は、本年度報告書10-K表の他の場所の監査財務諸表付記2により包括的に記述されているが、以下の会計政策は、財務諸表を作成する際に重大な判断や推定を行う過程に重要であると考えられる
研究と開発費
財務諸表作成過程の一部として、実際の研究開発費を記録し、研究開発費、流動資産、その他の流動負債を見積もる必要がある。このプロセスは、未締結契約および約束を検討することと、提供されたサービスを決定するために私たちの担当者とコミュニケーションすることと、請求書を受信していない場合、または他の方法で実際のコストを通知することとを含む場合に、実行されるサービスレベルおよびサービスによって生じる関連コストを推定することを含む。私たちのほとんどのサービスプロバイダは毎月私たちが提供してくれるサービスや契約マイルストーンに達した時に私たちに借金の領収書を発行してくれます。私たちは、当時知られていた事実と状況に基づいて、私たちの財務諸表において、各貸借対照表の日付までの計算された研究開発費、流動資産、および他の流動負債を推定する。予想される研究開発費,前払い資産,その他の流動負債の例としては,契約メーカーに支払う臨床試験材料の生産に関する費用と,契約研究機関に支払う我々を代表する臨床試験に関する費用がある。
私たちは、これらのサービスを提供する実体を代表する契約との契約による提供サービスの推定に基づいて、臨床製造および臨床試験に関連する費用を計算する。これらの合意の財務条項は交渉が必要であり、契約によって異なり、支払いの不均衡を招く可能性がある。このような契約によって支払われたお金は薬品生産と臨床試験に関連する多くの単独任務の成功に大きく依存する。臨床試験の場合,見積りコストの一部は通常,試験中の治療患者の予想コストに関係しており,このコストは試験に参加した患者数によって確認されている。その他の間接費用は,一般に研究見積り期間中に直線的に確認される.実際のコストが私たちに知られているにつれて、私たちは計算すべき項目を調整した。今まで、私たちの推定は実際に発生した費用と大きな差はなかった。しかし、その後の推定の変化は、私たちの計算すべき項目に大きな変化をもたらす可能性があり、これは、私たちの貸借対照表や運営結果に大きな影響を与える可能性もあります。
著者らは臨床研究機関(“CRO”)と臨床試験サイトと達成した合意に基づいて、単一の臨床試験期間中に完成した仕事割合と患者加入率の推定に基づいて、第三者による臨床試験活動を計上と支出した。私たちは契約、サプライヤー契約と調達注文を審査し、内部臨床者と外部サービスプロバイダと試験或いはサービスの進度或いは完成段階及びこのようなサービスのために支払う取り決め費用について討論することによって、見積もり数を決定する。しかし,臨床試験の実際のコストや時間は高度に不確実であり,リスクの影響を受け,われわれの臨床開発計画を含む多くの要因によって変化する可能性がある
私たちは、当時私たちが知っている事実と状況に基づいて、財務諸表において、各貸借対照表の日付までの課税費用を推定します。実際にサービスを提供する時間や努力の程度が見積りと異なる場合には,対応する項目を調整する.将来の研究および開発活動で使用されるプロセス開発または製造および臨床用品の分配費用を含み、関連商品またはサービスが消費またはサービス提供されている間に費用として確認されることを含む、払戻不可能な商品およびサービスの前払い。
| 87 |
| カタログ表 |
普通株式公正価値と持分補償
株式に基づく補償コストは、付与日に付与された公正価値に基づいて計量され、通常は帰属期間である必要なサービス期間内の費用であることが確認される。同社の政策は、非従業員に付与された株式奨励の推定値を付与した日に公正な価値で計量することを許可している。
株式ベースの報酬の適切な公正価値を決定するためには、私たちの普通株の最初の公募株前に奨励された公正価値、およびオプション、オプションに対する期待寿命および期待株価変動を含む主観的仮定を使用する必要がある。私たちはブラック-スコアーズオプション価格モデルを使用して私たちのオプション報酬を評価する。株式に基づく報酬の公正価値を計算する際に用いる仮定は,我々の最適な推定を表し,固有の不確実性と判断の応用に関わる.したがって、要因が変化すれば、経営陣は異なる仮定を使用し、株式に基づく報酬支出は将来の報酬に対して実質的に異なる可能性がある。
2021年8月に初めて公募される前に、株式オプションを発行し、その推定された株式ベースの報酬支出を計算する際に、普通株の公正価値を定期的に推定することが求められています。普通株の公正価値は、経営陣が独立第三者評価会社の協力を得て定期的に決定している。これらの推定値に基づく仮定は、固有の不確実性と管理判断の重要レベルの応用に関連する管理職の最適な推定を代表する。
公正価値を確定するために、他の事項を除いて、私たちの普通株を関係のない第三者に売却する同期取引、私たちの普通株の市場性の欠如、上場会社と比較可能な市場表現を考慮した。
共同単位の公正価値
我々の共通単位は,初公募まで取引市場を公開していないため,授権日ごとに,単位付与の基礎となる共通単位の公平価値を推定した.吾らは、第三者との公正取引推定共通単位の公正価値を参考にして、推定日又は推定日に近い共同単位を含む。
2019年12月31日までの年間で、従業員、上級管理職、取締役に161,142のB類共通単位を配布しました。2020年12月31日までの年度中に,コンサルタントにB類一般単位2,926個,従業員1名にB類一般単位2,643個を配布した。2019年と2020年に発行されたすべてのクラスB共通単位は、収入プログラム93-27,1993-2 C.B.343に定義されており、収入プログラム2001-43,2001-2 C.B.191によって明らかにされている。業績ベースのご褒美については、予定の業績基準を達成する可能性があれば、費用を確認します。今まで、単位ベースの給与費用はまだ重要ではなかった。単位ベースの報酬の公正価値を計算する際に使用される仮定は、経営陣の最適な推定を代表し、内在的な不確実性と経営陣判断の応用に関連している。したがって、要因が変化すれば、経営陣は異なる仮定を使用し、単位に基づく報酬支出は将来の報酬で実質的に異なる可能性がある。これらすべての証券は、2021年3月に有限責任会社から1社に転換した際に、私たちの資本単位の株を交換した。
2022年12月31日までと2021年12月31日までの年次比較
次の表は、2022年12月31日と2021年12月31日までの年間経営実績をまとめたものです
|
| 十二月三十一日までの年度 |
| |||||||||
|
| 2022 |
|
| 2021 |
|
| 差別化する |
| |||
運営費用: |
|
|
|
|
|
|
|
|
| |||
研究開発 |
| $ | 5,651,041 |
|
| $ | 3,459,340 |
|
| $ | 2,191,701 |
|
一般と行政 |
|
| 4,023,445 |
|
|
| 4,397,524 |
|
|
| (374,079 | ) |
総運営費 |
|
| 9,674,486 |
|
|
| 7,856,864 |
|
|
| 1,817,622 |
|
運営損失 |
|
| (9,674,486 | ) |
|
| (7,856,864 | ) |
|
| (1,817,622 | ) |
他の収入や支出: |
|
|
|
|
|
|
|
|
|
|
|
|
利息純額 |
|
| (63,573 | ) |
|
| 45,613 |
|
|
| (109,186 | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
純損失 |
| $ | (9,610,913 | ) |
| $ | (7,902,477 | ) |
| $ | (1,708,436 | ) |
| 88 |
| カタログ表 |
研究と開発費
研究·開発費は2021年12月31日までの年度の350万ドルから2022年12月31日までの年度の570万ドルに増加し、約220万ドル増加した。研究·開発費の増加は,臨床試験費用が110万ドル増加し,非臨床費用が70万ドル増加し,CMC費用が30万ドル増加し,従業員·人員費が20万ドル増加したが,株による報酬支出が10万ドル減少したことで相殺された
一般と行政費用
一般·行政費は40万ドル減少し、2021年12月31日までの年度の440万ドルから2022年12月31日までの年度の400万ドルに減少した。一般·行政費の減少は、株による補償費用が80万ドル減少し、法律費が20万ドル減少し、従業員や人件費が10万ドル減少したが、増加した50万ドルの保険料と20万ドルの上場企業費用の増加で相殺されたためである。
他の収入と支出
2021年12月31日までの年度では,他の収入·支出は109,186ドル増加したが,2022年12月31日現在の年度の利息純額は63,573ドルであったが,2021年12月31日現在の年度の純利息支出は45,613ドルであった。同社は2022年第3四半期に現金清掃口座を開設し、隔夜預金による利息収入の取得を開始している。前年の利息支出は債務償却と関係があり、割引と以前の未返済債務の利息支出。2021年12月31日と2022年12月31日まで、会社は何の未済債務も持っていない
キャッシュフロー
次の表は、私たちの経営と融資活動のキャッシュフローをまとめています
|
| 現在までの年度 十二月三十一日 |
| |||||
|
| 2022 |
|
| 2021 |
| ||
キャッシュフローデータレポート: |
|
|
|
|
|
| ||
提供された純現金総額(使用): |
|
|
|
|
|
| ||
経営活動 |
| $ | (8,834,164 | ) |
| $ | (5,693,392 | ) |
融資活動 |
| $ | 4,276,652 |
|
| $ | 15,961,798 |
|
現金と現金等価物を増やす(減らす) |
| $ | (4,557,512 | ) |
| $ | 10,268,406 |
|
経営活動
2022年12月31日までの年間で、運営に使用されている現金は880万ドルで、純損失960万ドル、支払·売掛金およびその他の流動負債が30万ドル減少したが、90万ドルの非現金株報酬および20万ドルの前払い費用と他の流動資産の減少によって相殺された
2021年12月31日までの1年間で,運営に使用された現金は570万ドルであり,純損失790万ドルおよび前払い費用や他の流動資産が70万ドル増加した結果であったが,190万ドルの非現金株報酬および100万ドルの支払·売掛金と他の流動負債の増加によって相殺された
| 89 |
| カタログ表 |
融資活動
融資活動が提供する現金は2022年12月31日までの1年間で430万ドルであり、2022年4月に非公開配給会社証券で普通株と引受権証を発行して得られた純収益の結果である
2021年12月31日までの1年間に、融資活動が提供した現金は1,600万ドルで、私たちが初めて公募株の純収益1,540万ドル、転換可能付属本票160万ドル、1 Dシリーズ優先株発行60万ドルを発行し、1 Cシリーズ優先株5,221,156株の100万ドルおよび60万ドルの債務元金と末期支払いによって相殺された。
流動性と資本資源
設立以来、私たちは何の収入も生まれていないし、どんな製品も商業化していない。2022年12月31日現在、私たちの現金と現金等価物は合計620万ドル、累計赤字は4560万ドルです。2022年と2021年12月31日までの1年間、運営にそれぞれ880万ドルと570万ドルの現金を使用した。
歴史的に見ると、私たちの主な現金源には、普通株と優先株の発行収益、債券発行の収益が含まれている。私たちの現金の主な用途は、運営に使用される現金(私たちの候補製品の臨床開発および一般および管理費用を含む)および許可権支払いを含む。将来の現金の主な用途は、持続的な運営、研究開発資金、一般運営資金の需要であると予想される。研究開発費の持続的な増加に伴い、運営や研究開発活動を維持するためにより多くの資金を集める必要があると予想される。
将来の資本需要
著者らは近いうちにDMT 310の開発、監督管理の許可と潜在的な商業化に重点を置き、ざ瘡と乾癬の治療に用いる予定である。ざ瘡や乾癬治療のためのDMT 310の臨床開発や,美容や医療用皮膚疾患の治療のためのDMT 410の継続的な研究開発に伴い,今後数年で純損失が生じると予想される。また,より多くの候補薬剤を識別,買収,許可,開発する機会を探し,潜在的にビジネス能力を構築し,当社のインフラを拡大する予定である。もし私たちの臨床試験が成功しなかったり、FDAが現在の臨床試験で産生された候補薬を承認しなければ、私たちはこれらの計画の開発と商業化を達成できないかもしれませんが、これは私たちが期待している、あるいは全く承認されていません。
私たちの資本の主な用途は、給与と関連費用、臨床コスト、外部研究開発サービス、法律、その他の規制費用、行政と管理費用であると予想されています。私たちの将来の資金需要は、私たちの候補薬物開発を支援するために必要な資源に大きく依存するだろう。
上場企業としては、大量の法律、会計、その他の費用が発生しますが、私たちは個人会社としてそうする必要はありません。また,2002年のサバンズ-オキシリー法案と,米国証券取引委員会とナスダックが採択した規則は,上場企業に特定のコーポレートガバナンスを実施することを要求しているが,これらは民間会社としては適用されていない.私たちはこのような規則と規制が私たちの法律と財務コンプライアンスコストを増加させ、いくつかの活動をもっと時間的で高価にするだろうと予想する。
私たちは、私たちの既存の現金と現金等価物が、2023年第3四半期までの運営費用と資本支出需要を支払うのに十分になると信じている。私たちの現金滑走路のこの推定は間違っていることが証明される可能性があるという仮定に基づいていて、私たちは予想よりも早く私たちが利用できる資本資源を利用することができます。私たちは、DMT 310によるざ瘡治療の第3段階研究を行うために追加の資金を必要とし、他の候補薬剤の許可または買収を求める。
追加の資金はタイムリーで、優遇的な条件では得られないかもしれませんし、これらの資金が調達されれば、私たちの長期業務戦略を継続させるのに十分ではないかもしれません。もし私たちが十分な追加資本を集めることができなければ、私たちは私たちが計画した業務と私たちの成長戦略の追求を大幅に削減する必要があるかもしれない。
| 90 |
| カタログ表 |
私たちは株式または転換可能な債務証券を売却することで追加資本を調達することができる。この場合、これらの証券の条項は、清算または他の特典を含むことができ、私たち普通株式所有者の権利に悪影響を及ぼす可能性がある。
薬品研究,開発,商業化に関連する多くのリスクと不確実性のため,我々の運営資金需要の正確な金額を見積もることはできない。私たちの未来の支出需要は多くの要素に依存するだろう
| · | 私たちが求めている候補薬の数と特徴は |
|
|
|
| · | 我々の候補薬物の研究と開発および臨床前研究と臨床試験を行う範囲、進捗、結果とコスト |
|
|
|
| · | 私たちの候補薬物の規制承認を受ける時間と関連するコスト |
|
|
|
| · | 私たちの候補薬や商業化に成功した薬の製造コストは |
|
|
|
| · | 私たちは、戦略的協力、許可または他の手配の能力、およびこのような合意の財務条項を確立し、維持します |
|
|
|
| · | 訴訟コストおよびそのような訴訟の結果およびそのような訴訟の結果を含む、特許請求の範囲の準備、提出、起訴、維持、弁護および執行に関連するコスト |
|
|
|
| · | 私たちの現在または未来の候補薬剤(ある場合)の時間、領収書および販売金額、またはそれに関連するマイルストーン支払いまたは特許使用料。 |
我々の業務を比較的長期的に発展させるために,研究開発,候補製品の臨床試験,その他の運営と潜在的な製品買収および許可を大量の資源を投入して行う予定である。我々は、我々の内部開発チャネルを強化するために、より多くの製品や候補製品を買収または許可し、開発する計画の一部として、一連の広範な戦略取引を評価し続ける予定である。私たちが求める可能性のある戦略的取引機会は、私たちの流動性と資本資源に大きな影響を与える可能性があり、追加の債務を発生させたり、株式を求めたり、あるいはその両方を要求することができるかもしれない。さらに、新たなまたは既存の治療分野で開発、買収、承認または開発が得られるかもしれない製品を求めたり、既存の業務を拡大し続けたりすることができるかもしれない。したがって、私たちは、私たちの業務を拡大したり、一般企業用途に使用したりするために、より多くの製品、候補製品、または会社を許可または買収するために、日和見主義的に追加資本を得る機会を求め続ける予定だ。戦略的取引は、1つまたは複数の公共債務または個人債務または株式融資によって追加資本を調達する必要があるか、または協力または協力手配の形態で構築することができるかもしれない。私たちは現在、買収、許可、または同様の戦略的商業取引を行うための手配、合意、または了解を持っていない。
もし私たちが株式証券を発行することで追加資金を調達すれば、私たちの株主は希釈されるだろう。債務融資が可能であれば、固定支払義務の増加を招き、追加債務を招く、資本支出を行う、または配当を宣言するなど、特定の行動をとる能力を制限または制限する契約を含む可能性がある。私たちが調達した任意の債務融資または追加株式には、清算や他の特典など、私たちまたは私たちの株主に不利な条項が含まれている可能性があります。もし私たちが第三者との協力および許可手配を通じてより多くの資金を調達する場合、私たちの技術、将来の収入流、または候補製品の貴重な権利を放棄するか、または私たちに不利になる可能性のある条項で許可を与える必要があるかもしれない。
| 91 |
| カタログ表 |
経営を続ける企業
設立以来、資金調達や研究開発活動など、組織活動に従事してきた。私たちはまだ収入が生まれておらず、利益運営が実現されておらず、運営から正のキャッシュフローが生じたこともない。利益のある運営が実現すれば、継続できる保証はない。いずれの臨床前段階の製薬会社にも関連するリスクに直面しており,これらの会社は研究開発に多くの資金を投入している。我々の研究·開発プロジェクトが成功することは保証されず、開発された製品が必要な規制承認を得ることは保証されず、いかなる承認された製品も商業的に実行可能である保証はない。また,我々は技術が急速に変化する環境で運営しており,従業員やコンサルタントのサービスに大きく依存している.しかも、私たちの未来の運営は会社が追加資本を調達する努力が成功するかどうかにかかっている。これらの不確実性は、財務諸表の発表日後に経営を続ける企業として12カ月間経営を続ける能力を大きく疑わせている。添付された財務諸表は持続的な経営に基づいて作成される。財務諸表には、会社が経営を継続できない可能性があるために資産の回収可能性及び分類又は負債の金額及び分類による可能性のある将来の影響を反映するための調整は含まれておらず、持続的な経営の目的は、正常な業務過程において経営、現金化資産及び負債を清算することである。2022年12月31日と2021年12月31日までの純損失はそれぞれ960万ドルと790万ドルで、12月31日までの累計赤字は4560万ドルです, 2022年私たちは現在開発中の候補製品から相当な収入を得ることができるまで、より多くの損失が予想される。私たちの主な資金源はいつも債務と株式証券を発行することだ。
最近発表された会計基準
最近の会計声明の検討については、本年度報告書の他の一部の財務諸表に付記されている重要な会計政策の概要を参照されたい。
“雇用法案”
2012年4月5日、JumpStart Our Business Startups Act of 2012またはJOBS Actが法律に署名した。雇用法案には、“新興成長型企業”に対するいくつかの報告要件の低減を含むいくつかの条項が含まれている。“新興成長型会社”として、JOBS法案が提供する移行期間を延長して新たな会計基準または改正会計基準を実施することを選択したため、非新興成長型会社に新たな会計基準または改正会計基準を採用することを要求する関連日にこのような基準を遵守する。雇用法案第107条では,延長された過渡期を利用しない決定は撤回できないと規定されている。
JOBS法案に規定されているいくつかの条件を満たす場合には、“新興成長型企業”として、他の事項を除いて、(I)第404条に基づいて、財務報告内部制御システムについて監査人証明報告を提供する必要はなく、(Ii)ドッド·フランクウォールストリート改革および消費者保護法案による非新興成長型上場企業に要求される可能性のあるすべての報酬開示を提供する。(Iii)上場企業会計監督委員会が採択する可能性のある強制監査会社のローテーションに関する任意の要件を遵守するか、または監査および財務諸表に関する追加資料を提供する監査師報告(監査役議論および分析)を追加し、(Iv)役員報酬と業績との間の関連性、および行政総裁報酬と従業員報酬中央値との比較など、いくつかの役員報酬に関連する項目を開示する。これらの免除は、私たちの初公募株式完成5周年まで適用されるか、または以前に発生したものに準ずる“新興成長型会社”としての要求を満たさなくなるまで適用される。
第七A項。市場リスクの定量的·定性的開示について
適用されません。
項目8.財務諸表と補足データ
本プロジェクトで要求される情報は、本年度報告におけるF−1ページから始まるタブ10−Kの単独章に掲載され、参照されて本明細書に組み込まれる。
| 92 |
| カタログ表 |
項目9.会計·財務開示面の変化と会計士との相違
ない
第9条。制御とプログラム
情報開示制御とプログラムの評価
私たちの経営陣は、最高経営責任者と財務責任者の参加の下、2022年12月31日までの開示統制と手続きの有効性を評価しました。取引法規則13 a-15(E)および15 d-15(E)に定義されている用語“開示制御および手順”は、取引法に従って提出または提出された報告において開示を要求する会社の情報が米国証券取引委員会規則および表によって指定された期間にわたって記録、処理、集約および報告されることを保証するための会社の制御および他のプログラムを意味する。開示制御及び手続は、取引所法に基づいて提出又は提出された報告書に開示を要求する情報が蓄積されていることを確保し、その主要幹部及び主要財務官を含む会社管理層に適宜伝達し、開示要求に関する決定を直ちに行うことを目的としているが、制御及び手続に限定されない。経営陣は、どのような制御やプログラムが、どんなに設計や操作が良くても、その目標を実現するために合理的な保証を提供するしかないことを認識しており、管理部門は、可能な制御とプログラムのコスト-利益関係を評価する際にその判断を運用しなければならない。我々の2022年12月31日までの開示制御及び手続の評価によると、我々の最高経営責任者及び最高財務官は、その日までに、我々の開示制御及び手続が合理的な保証レベルで有効であると結論した。
経営陣財務報告内部統制年次報告書
米国証券取引委員会規則は新規上場企業のための過渡期を設けているため、本年度報告には財務報告の内部統制に対する管理層の評価報告も含まれておらず、我々独立公認会計士事務所の認証報告も含まれていない。
財務報告の内部統制の変化
2022年12月31日までの年度中、経営陣が“取引所法案”第13 a-15(D)および15 d-15(D)条に基づいて行った評価では、財務報告の内部統制に大きな影響を与えたり、合理的に財務報告の内部統制に大きな影響を与える可能性があることが分かった。
| 93 |
| カタログ表 |
制御措置の有効性の固有の制限
私たちの経営陣は、私たちの最高経営責任者とCEOを含み、財務報告の開示制御と手続きおよび内部統制は、その目標を達成するための合理的な保証を提供し、合理的な保証レベルで有効であると信じています。しかし、私たちの経営陣は私たちの開示統制と手続き、あるいは財務報告に対する私たちの内部統制がすべてのミスとすべての詐欺を防ぐことを期待していない。発想や動作がどんなに良くても、絶対的な保証ではなく、合理的な保証しか提供できず、制御システムの目標が実現されることを確保する制御システム。また,制御システムの設計は,資源制約が存在し,そのコストに対する制御の利点を考慮しなければならないという事実を反映しなければならない.すべての制御システムの固有の限界により,どの制御評価もすべての制御問題や不正イベントが発見されたことを絶対に保証することはできない.これらの固有の限界は、意思決定過程における判断が誤っている可能性があり、簡単なエラーまたはエラーによって故障が発生する可能性があるという現実を含む。また、ある人の個人的な行動、2人以上の結託、または制御の管理によって、制御を回避することができる。任意の制御システムの設計も、将来のイベント可能性のいくつかの仮定に部分的に基づいており、任意の設計がすべての潜在的な将来の条件でその目標を成功的に達成する保証はなく、時間の経過とともに、制御が条件の変化によって不十分になる可能性があり、またはポリシーまたはプログラムを遵守する程度が悪化する可能性がある。費用対効果を有する制御システムの固有の制限により、エラーまたは詐欺によるエラー陳述が発生し、発見されない可能性がある。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
ない。
| 94 |
| カタログ表 |
第三部
プロジェクト10.役員、役員、および企業管理
行政員および役員
次の表は、今年度の報告日までの私たちの役員と役員に関する情報を提供します
名前.名前 |
| 年ごろ |
| ポスト |
行政員 |
|
| ||
ジェラルド·T·プロール |
| 63 |
| 最高経営責任者兼社長 |
ケリー·K·ヴァン·フォース |
| 44 |
| 最高財務官上級副社長 |
クリストファー·J·ナウド博士 |
| 58 |
| 首席開発官上級副総裁 |
マリア·ベドア·トロ·ムネラ博士 |
| 71 |
| 上級副総裁、規制事務と品質保証 |
役員.取締役 |
|
| ||
David·ヘア(2)(3) |
| 74 |
| 役員をリードする |
Wendell Wierenga博士(2) |
| 75 |
| 役員.取締役 |
キャサリン·スコット(1) |
| 54 |
| 役員.取締役 |
スティーヴン·J·マントー博士(3) |
| 71 |
| 役員.取締役 |
メアリー·フィッシャー(1) |
| 61 |
| 役員.取締役 |
アンドリュー·サンドラー医学博士(2)(3) |
| 58 |
| 役員.取締役 |
ブルターニュ·ブラドリック(1) |
| 53 |
| 役員.取締役 |
(1) | 監査委員会委員 |
(2) | 報酬委員会のメンバー |
(3) | 委員会のメンバーを指名して管理する |
管理する
2014年12月、ジェラルド·T·プロールは取締役の一員となり、総裁は私たちのCEOを務め、2021年4月に私たちの会長になりました。プロルさんは製薬業界で30年以上の経験を持つ。2002年1月から2014年1月まで,プロイルはサンタルス社の最高執行長兼最高経営責任者を務め,リーダーはサンタルス社を26億ドルでSalix製薬会社に売却した。Proehlさんは、Santarus社に入社する前に14年間Hoechst Marion Roussel社で働いていましたが、そこではグローバルマーケティング副社長を含めて様々な職務を担当していました。Hoechstの仕事中、彼は心臓病学、アレルギー/呼吸器、免疫学と神経学を含む複数の治療領域の製品マーケティングを担当した。プロールさんは、ニューヨーク州立大学コトランド校で教育学士、ウィック森林大学の運動生理学の修士号、ロクヘスト大学の工商管理修士号を取得している。プロルさんは現在、上場企業Tenax治療会社(ニューヨーク証券取引所コード:TENX)の取締役会長である。プロルさんが取締役会の役員に選ばれたのは、他社の経営経験と、製薬専門の製薬会社の創設·経営の歴史を持っていたからである
ケリー·K·ヴァン·フォースは2021年9月に私たちの上級副総裁兼首席財務官になりました。Van Hooseさんは、生命科学業界で15年以上の会計と金融経験を含む20年以上の経験を持つ経験豊富な協力金融·会計専門家である。デマタに加入する前に、Van Hooseさんは2020年9月から2021年4月まで民間バイオテクノロジー会社TEGA治療会社の首席財務官を務めた。TEGAに加入する前に、Van Hooseさんは2019年11月から2020年4月までCurzion PharmPharmticals,Inc.の財務担当者を務め、2020年4月までHorizon Treeutics plcによって買収された個人的に珍しい疾患会社である。Van Hooseさんは2017年12月から2019年7月まで臨床段階バイオテクノロジー会社Avelas Biosciences,Inc.に勤務していた。2005年9月から2016年2月まで、Van HooseさんはAcadia PharmPharmticals,Inc.で取締役財務と企業総監高級主管を含む職責の日々増加した指導職を務めた。Van Hooseさんのキャリアは徳勤から始まり、現在は公認会計士(カリフォルニア非公認会計士)である。ヴァン·フェスさんは南カリフォルニア大学で会計学士号を取得し、カリフォルニア大学オーウェン校で金融修士号を取得した。
| 95 |
| カタログ表 |
クリストファー·J·ナウド博士は2022年7月に私たちの上級副総裁兼首席開発官となった。Nardo博士は製薬業界で15年以上の経験を持っている。2010年9月から2015年5月まで、Nardo博士はAllergan PLCでますます多くの責任職を務め、第三段階から製品の承認と発売まで、最初に過活動膀胱治療のためのボツリヌス菌の臨床開発を指導し、最終的に皮膚科治療領域内の美容部門の臨床開発を指導し、そしてAllergan/Medytox協力の全世界開発チームの責任者を務め、AGN/MTX共同開発委員会の議長を務めることを含む。2006年から2010年まで、Nardo博士はナスダック(SIPI)で総裁副主任を務め、臨床運営と生物統計学を担当した。これまで、Nardo博士はCancerVax会社、免疫反応会社とP&G会社(ニューヨーク証券取引所コード:PG)で各種の臨床開発指導職を務めたことがある。ナウド博士はノースカロライナ大学教会山校ギリングス公共衛生学院で疫学博士号を取得し、サンディエゴ州立大学公衆衛生学院で疫学と生物統計学修士号を取得し、ロヨラ·マリモンテ大学で生物学学士号を取得した
マリア·ベドア·トロ·ムネラ博士は2016年1月に私たちの上級副総裁となり、規制事務と品質保証を担当した。Bedoya Toro Munera博士は製薬業の法規遵守性、品質管理と品質保証の面で30年以上の経験を持っている。2014年から2015年までCelgeneに販売され、Bedoya Toro Munera博士はReceptos Inc.で法規事務と品質保証部上級副社長を務めていた。Receptos,Inc.以前、Bedoya Toro Munera博士は2007年6月から2014年1月までSantarus,Inc.法規事務および品質保証部上級副社長を務めていた。2006年11月から2007年5月まで、彼女は衛材医学研究会社で取締役の高級監督管理事務を務め、Ligandが2006年11月にその腫瘍学製品を衛材に剥離した時、彼女はLigand PharmPharmticals,Inc.から衛材に転任した。2003年から2006年まで、ベドヤ·トロ·ムネラ博士はリガンで取締役グローバル規制事務とコンプライアンス部高官を務めた。2000年から2003年まで、彼女はバクスターハイランド免疫会社で取締役の全世界監督管理事務を務めた。1998年から2000年まで、Bedoya Toro Munera博士はバスフ生物研究会社で取締役監督事務/品質主管を務め、1996年から1998年まで、彼女は膵淀素製薬会社で取締役品質保証と監督管理コンプライアンス部の主管を務めた。1988年から1996年まで、Bedoya Toro Munera博士はローナ-プレンツバレ社で働き、法規コンプライアンス、品質保証、品質管理とコンプライアンスの面でますます多くの責任を負うポストを務めた。Bedoya Toro Munera博士はシカゴ大学の工商管理修士号とオハイオ大学の生物分析化学博士号を持っている。また、彼女は西ミシガン大学の生物分析化学修士号と化学学士号を取得した
非従業員取締役
David·ヘアは私たちの共同創業者で、2014年12月から取締役会のメンバーを務め、2021年4月から取締役のCEOを務めています。ヘアさんは、Hale BioPharma Ventures社の会長兼CEOであり、Hale BioPharma Venturesは、バイオテクノロジー、専門的な製薬、診断、医療機器会社の形成と開発に専念している民間企業です。ヘアさんは連続創業者であり、彼は多くの成功したバイオ医薬品会社の形成と開発に参加しました。2004年から専門バイオ製薬会社Santarus,Inc.の会長を務め、2000年からSantarus取締役会のメンバーを務め、Salix PharmPharmticals,Ltd.が2014年にSantarus,Inc.を買収する前にSkinMedica,Inc.の会長を務め、SkinMedica,Inc.が2012年にAllerganに売却される前、Micromet,Inc.が2012年にAmgen Inc.に販売される前に、Somaxon PharmPharmticals,Inc.,Inc.が2013年にPernix治療ホールディングスに売却される前に、Crisi Medical Systems,Inc.,Inc.は2015年にBickton&Dinson&Company,Company,Inc.に販売された。Agility Clinic,Inc.は,2017年にPrecision Medicine Inc.に販売される前に販売されている.ヘアさんは連合創業者で、2013年から腫瘍治療会社(ナスダック·コード:ONCT)の会長を務めています。ヘルさんは、プライベート企業Neurelis,Inc.の共同創業者であり、現在は取締役会社であり、Zerigo Health,Inc.,Cadence,Inc.,Evoke Pharma,Inc.,Elevation Pharma,Inc.およびZgenix,Inc.の共同創業者でもある。ヘルさんは、バイオテクノロジー産業組織(BIO)およびバイオテクノロジー研究所の取締役会メンバーであるBIOCOM and Connectの共同創業者である。彼は1986年からずっとラディ児童病院の取締役会メンバーを務めており、2011年から2015年までの取締役会主席を含み、ラディ児童ゲノム医学研究所の創始者と主席である。彼はカリフォルニア大学サンディエゴ校レイディ管理学院院長諮問委員会のメンバーです, サンディエゴ大学取締役会のメンバー、サンディエゴ経済発展会社の元役員メンバー。ブラックが取締役に選ばれたのは、豊富な業界と幹部のビジネス経験を持っているからだ。
| 96 |
| カタログ表 |
2016年9月、ウェンデル·ヴィレンガ博士が取締役の一員となった。2011年6月から2014年1月まで、ヴィレンガ博士はSantarus,Inc.で研究開発実行副総裁を務め、Santarus,Inc.は上場生物製薬会社であり、2014年1月にSalix製薬会社に買収された。2004年7月から2011年5月まで、Wierenga博士はアンビット生物科学会社とNeurocrine生物科学会社(ナスダック株式コード:NBIX)で研究開発実行副総裁を務めた。Neurocrineに入社する前に,1999年8月から2004年6月までSyrx,Inc.の最高経営責任者を務め,2005年に武田薬業有限公司に買収された初期段階のバイオテクノロジー会社を設立した。1990年から2000年にかけて、何博士はParke Davis/Warner Lambert研究上級副総裁も務め、当時同社はファイザー社に買収された。それまで、何博士は1974-1990年にUpjohn製薬会社で複数の研究職を務めていた。ウィレンガ博士はスタンフォード大学で化学博士号を取得し、ミシガン州ホープ市のホープ学院で学士号を取得した。彼は現在Crinetics社(ナスダックコード:CRNX)の取締役会長であり、細胞動力学会社(ナスダックコード:CYTK)の取締役会メンバーでもある。最近はAnacor製薬会社とXenoPort社の取締役会メンバーであり,その後それぞれファイザー社とArbor製薬会社に売却されている。Wierenga博士はその業界と幹部のビジネス経験から取締役に選ばれた
キャサリン·スコットは2021年8月に初公募株が発効して取締役の一員となった。スコットさんは現在発売バイオテクノロジー会社ARS製薬会社(ナスダックコード:SPRY)の首席財務官である。ARS製薬に入社する前、Scottさんは2017年1月から2022年3月までNeurana PharmPharmticalsの首席財務官、2014年8月から2021年4月までRecros Medica最高財務官、2016年2月から2021年3月までAdigica Healthの首席財務官、2014年8月から2016年12月までClarity Medicalの首席財務官、2016年3月から2016年5月までOncent Treeuticsの首席財務官、2014年8月から2016年8月までReMDunaの首席財務官を務め、2010年3月から2014年11月までBioSurplusの首席財務官を務めた。BioSurplusに加入する前、ScottさんはRA Capital Advisorsのパートナーであり、RA Capital Advisorsはサンディエゴの個人投資銀行であり、金融コンサルティングサービスを提供していた。1994年12月から2010年7月まで、ScottさんはRA Capital Advisorsで15年間働き、一連の企業顧客のために数十億ドルの合併、買収、資産剥離と再編を完成した。スコットのキャリアは、安達信サンディエゴ事務室の監査役から始まり、公共と個人顧客に集中している。スコットさんはサンディエゴ県キリスト教青年会の前議長と現役員議長で、公認会計士とCFA免許所持者でもある。Scottさんはカリフォルニア大学ロサンゼルス校を優秀な成績で卒業し、経済学/商学学士号を取得した。豊富な業界と金融経験を持っているため、スコットは取締役のパートナーに選ばれた
2021年8月、初公募が発効した後、スティーブン·J·マントー博士が取締役のパートナーとなった。2005年7月以来、ドア博士はコナトゥス製薬会社の取締役会の取締役メンバーを務め、2005年7月から2012年12月までの間、ドア博士はコナトゥス製薬会社の取締役会議長を務めた。モントー博士はコンネス社の共同創業者の一人で、2005年7月から同社の総裁兼最高経営責任者を務め、同社が2020年5月に組織遺伝子会社(ナスダック株コード:HSTO)と合併するまで務めている。モントー博士はバイオテクノロジーと製薬業界で30年以上の総合的な経験を持っている。1997年から2005年まで、門戸博士はイートン製薬会社の最高経営責任者兼取締役会の総裁を務めた。門戸博士はイートン製薬を発見に専念した組織から、人体臨床試験でまたは臨床試験に近い複数の製品を持つ薬物開発会社に転換するよう指導した。2005年4月、イートンはファイザーに売却された。これまで、門戸博士は1995年から1997年まで奇龍偉業会社(後の奇龍技術遺伝子治療センター)の総裁を務め、1995年から1997年まで奇隆社の副総裁を務めていた。1992年から1995年まで、孟托博士はバイアグラ社研究開発部総裁副主任を務めた。バイアグラに加入する前に,モントー博士は1982年から1992年まで米国シアノアミン社で複数の職を務め,米国シアノアミン社の業務部門Lederle−Praxis Biologalsを含めてウイルスワクチン研究開発部門の取締役を務めていた。現在、ゲートル博士はホーヘガン社、BIOCOMカリフォルニア社、各種学術·慈善組織の取締役会に勤務している。彼は以前、バイオテクノロジー革新組織、生物新興会社部門管理委員会、生物健康部門管理委員会、Sangamo生物科学会社取締役会に勤務していた。モントー博士はロゲス大学微生物学博士と修士号を持っている, ローグス大学の微生物学学士号を取得しましたモントー博士が取締役に選ばれたのは、いくつかの製薬会社での幹部指導経験を含むバイオテクノロジーや製薬業界での経験からだ。
| 97 |
| カタログ表 |
私たちが2021年8月に初公募株が発効した後、メアリー·フィッシャーは取締役の一員になった。フィッシャーは現在、科学ベースのスキンケア用品会社Colocience Inc.で最高執行長、会長、取締役顧問を務めている。彼女はSkinMedica社の子会社だった。SkinMedica在任中、フィッシャーは2008年4月から2012年12月までCEOを務め、その間に会社を率いて3億5千万ドルでエルビル社への売却に成功した。SkinMedicaに加入する前に、2000年6月から2007年7月まで、FisherさんはAcorda治療会社(ナスダックコード:ACOR)の首席運営官を務めた。彼女は1994年3月から1999年3月までCephalon社で管理と指導職を務め、1990年11月から1994年3月まで免疫会社で管理と指導職を務め、1981年から1990年までベーリンガー-インゲルハイム社で管理と指導職を務めた。2012年9月から2017年4月までZeltiq Aesthetics,Inc.で取締役会メンバーを務め、2013年6月から2018年8月までOvarcienceで取締役会メンバーを務めていた。フィッシャーは2019年1月からSientraの取締役会メンバーを務めてきた。フィッシャーさんはその幅広いビジネスと専門経験で役員のメンバーに選ばれました
アンドリュー·サンドラー医学博士は2021年8月に初公募株が発効して取締役の一員となった。Dr.Sandlerは2017年9月以来、Kiadis Pharma N.V.の首席医療官を務めている。Kiadisに加入する前、Dr.Sandlerは2016年1月から2017年6月までMedivation(ファイザーに買収された)医療事務上級副総裁を務めている。2010年10月から2015年4月まで、Dr.SandlerはDendreon PharmPharmticalsで首席医療官とシアトル現場担当者を含む複数の追加職務を担当した。Dendreonに加入する前に,Dr.Sandlerは2008年9月から2010年4月までスペクトル製薬の首席医療官を務め,2008年2月から2010年2月までバイエル医療保健製薬グローバル医療事務腫瘍部副主管総裁を務めた。Dr.Sandlerは2003年10月から2008年8月までバーレックス腫瘍学/先霊社,1999年10月から2003年6月までレーガン社で様々な職務を担当していた。1994年7月から1996年6月まで、Dr.Sandlerはカリフォルニア大学サンフランシスコ校血液学/内科腫瘍学研究員である。彼はいる1990年7月から1994年6月までニューヨークシネ病院で診察を受けた。Dr.Sandlerは西奈山医学院を卒業し,医学博士号を取得した。シナイ半島)1986年7月から1990年6月まで。また1986年にロチェスター大学を卒業し神経科学の学士号を取得しましたDr.Sandlerが取締役に選ばれたのは,バイオテクノロジーや製薬業界での経験と彼の指導経験からである
ブルターニュ·ブラドリックは2022年1月に取締役ユーザーになった。ブラドリックさんは2022年9月からNeurelis社の首席運営官兼首席財務官を務め、2021年10月から首席財務官を務めてきた。Neurelisに加入する前に、Bradrickさんは2020年6月から2021年9月までの間にViaCyte社の首席運営官と首席財務官を務めた。Viacyteに加入する前に、Bradrickさんは2016年から2020年までInsulet Corporationで戦略と企業発展副総裁を務め、アボット(ニューヨーク証券取引所株式コード:ABT)で取締役業務発展と連合管理職を務めた。これらのポストを担当する前に、Bradrickさんは1997年から2007年までの間にPiper Jaffray、Credit SuisseとChase Securitiesで生命科学業界の投資銀行家を務めた。ブラドリックのキャリアは連邦準備銀行審査員から始まった。ブラドリックさんはコーネル大学ジョンソン管理大学院の工商管理修士号とミズーリ大学の工商管理学士号を持っています。豊富な業界と金融経験を持っているため、ブラドリックは取締役のパートナーに選ばれた。
家族関係
どの役員や行政員の間にも家族関係はない
取締役会各委員会
私たちの取締役会は監査委員会、報酬委員会、指名、そして会社管理委員会を設立した。私たちの取締役会は私たちの業務管理を容易にするために他の委員会を設置するかもしれない。各委員会の構成と機能は以下のとおりである。会員たちは彼らが辞任するまで、または私たちの取締役会が別の決定を持つまで、この委員会に勤めている。これらの委員会のすべては私たちの取締役会が承認した定款に従って運営されており、これらの規定は私たちのウェブサイトで見つけることができる
監査委員会。私たちの監査委員会はキャサリン·スコット、メアリー·フィッシャー、ブルターニュ·ブラドリックで構成され、スコットさんは監査委員会の議長を務めている。我々の取締役会は、現在我々の監査委員会に勤務している3人の取締役が独立しており、ナスダック市場規則および取引所法案規則10 A-3の意味に適合していることを確認している。また、我々の取締役会は、キャサリン·スコットが米国証券取引委員会規則とナスダック商城規則が指す監査委員会金融専門家になる資格があることを決定した
| 98 |
| カタログ表 |
監査委員会は、我々の財務報告手続及び内部統制制度を監督·監督し、我々の公認会計士による監査を審査·評価し、監査過程で発見された任意の実質的な問題を取締役会に報告する。監査委員会は私たちの公認会計士の任命、報酬、そして監督を直接担当している。監査委員会は関連者とのすべての取引を検討して承認する
補償委員会です。私たちの報酬委員会はウェンデル·ヴィレンガ、David·ヘア、アンドリュー·サンドラーで構成され、ウィレンガ博士は報酬委員会の議長を務めている。当社取締役会は、現在当社報酬委員会に勤務している3人の取締役が上場基準に基づいて独立しており、取引所法案が公布した第16 b-3条の規則に基づいて定義された“非従業員取締役”と、改正された1986年国内税法第162(M)節に基づいて定義された“外部取締役”であることを決定した
報酬委員会は、従業員の報酬、福祉計画、役員報酬などの分野について取締役会に意見と提案を提供する。給与委員会はまた、当社のCEO総裁や他の上級管理職の報酬に関する会社の目標や目標を審査·承認し、これについて取締役会全体に提案します
会社管理委員会を指名しています。私たちの指名とコーポレートガバナンス委員会は、David·ヘア、スティーヴン·メントとアンドリュー·サンドラーで構成されており、ヘアさんはノミネートとコーポレートガバナンス委員会の議長を務めています。私たちの株主選挙で取締役会に入った個人を指名とコーポレートガバナンス委員会が指名します。指名及びコーポレートガバナンス委員会は、株主の提案を考慮し、我々の定款に規定された手順に従って速やかに提出すれば、考慮されたすべての者に同じ基準を適用する。指名と企業管理委員会の全メンバーはすべてナスダック上場基準で定義された独立取締役である
取締役会構成
私たちの取締役会は7人のメンバーで構成されている。私たちの役員は、彼らの後継者が選挙されて資格を得るまで、または彼らが辞任したり、免職されたより早い者まで在任する
私たちが再記述した会社登録証明書と定款の条項によると、私たちの取締役会は三種類に分けられ、第一類、第二類と第三類に分けられ、各種類は三年間交互に勤めています。1種類の取締役の任期が満了した場合、この種類の取締役は任期満了の当年の年次株主総会で新たな3年間の任期に当選する資格がある。私たちの取締役は以下の3つに分類されます
| · |
| 最初の役員はアンドリュー·サンドラーとメアリー·フィッシャーです。彼らの任期は2025年の年次株主総会で満期になります |
| · |
| 二番目の役員はDavid·ヘアとスティーブン·J·メントであり、彼らの任期は2023年の年間株主総会で満了するだろう |
| · |
| 第三種取締役はジェラルド·T·プロール、ウェンデル·ヴィレンガ、キャサリン·スコットであり、彼らの任期は2024年の年次株主総会で満期になる |
取締役数の増加により増加した任意の取締役職は、各カテゴリが可能な限り3分の1の取締役で構成されるように、この3つのカテゴリに割り当てられると予想される。私たちの取締役会は3つのレベルに分かれており、3年間の任期を交錯させることで、私たちの経営陣の交代や統制権の変更を延期または阻止する可能性があります
当社の会社登録証明書の改訂及び改訂及び再記載の定款規定は、我々の取締役会決議によりのみ、認可された取締役数を変更することができる。私たちの改正·再記述された会社登録証明書および改正·再記述の定款は、私たちの取締役が原因がある場合にのみ免職されることができ、取締役会の拡大による空席を含めて、当時在任していた取締役の多数の投票でしか埋めることができないことを規定しています
| 99 |
| カタログ表 |
私たちは理事会の多様性に関する公式的な政策を持っていない。取締役会のメンバーを選ぶ際、私たちの第一の任務は、どのメンバーがその既定の専門成果、取締役会メンバー間の協力文化に積極的に貢献する能力、私たちの業務に対する理解及び競争構造の理解を通じて、私たちの株主の利益を促進するかを決定することである
ビジネス行為と道徳的基準
私たちは私たちの従業員、上級管理職、役員に適用される書面商業行為と道徳基準を採択しました。最新のコードコピーは、www.dermatarx.comにある弊社のコーポレート·ガバナンス部分に公開されています。私たちは、私たちのウェブサイト上で、または米国証券取引委員会に提出された文書において、将来の私たちの商業行為および道徳基準のいくつかの条項の改正を開示するか、または任意の主要幹部、主要財務官、主要会計官または統制者、または同様の機能を実行する人および私たちの取締役のこのような条項の免除に適用する予定です
延滞金第16条報告
取引法第16条(A)条は,我々の役員,上級管理者,及び10%を超える登録種別株式証券を有する個人が,米国証券取引委員会に所有権報告及び所有権変更報告書を提出することを要求する。2022年7月7日、クリストファー·ナウドは1日遅れて株式贈与を受けたと報告する表4を提出した。私たちが10%以上の普通株を持っている役員および取締役が電子的にアメリカ証券取引委員会に提出した表3、4および5(およびその修正案)の審査、および私たちが役員および取締役から受け取った任意の書面陳述(上記を除く)に基づいて、私たちの知る限り、他のすべての第16(A)条の届出要求は2022年度に直ちに満たされたと信じています
プロジェクト11.役員報酬
次の表および添付の記述性開示は、私たちが任命した役員が2022年12月31日および2021年12月31日までの年間で稼いだ報酬情報を示しています。私たちが任命した役員は私たちの最高経営責任者であり、2022年12月31日までに役員を務める最高報酬の2人の役員(私たちの最高経営責任者を除く)でもある
| · |
| ジェラルド·T·プロール社長CEO |
|
|
|
|
| · |
| ケリー·ヴァン·フス上級副社長兼最高財務責任者 |
|
|
|
|
| · |
| クリストファー·J·ナウド博士私たちの上級副総裁兼首席開発官です |
報酬総額表
次の表には、2022年12月31日と2021年12月31日までの年間に任命された役員の給与情報を示します
名称と主要ポスト |
| 年.年 |
| 賃金.賃金 |
|
| ボーナス(1) |
|
| 株式オプション 賞(2) |
|
| 合計する |
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
ジェラルド·T·プロール |
| 2022 |
| $ | 317,917 |
|
| $ | - |
|
| $ | 152,620 |
|
| $ | 470,537 |
|
社長と最高経営責任者 |
| 2021 |
|
| 135,907 |
|
|
| - |
|
|
| 1,162,306 |
|
|
| 1,298,213 |
|
ケリー·K·ヴァン·フォース |
| 2022 |
|
| 298,750 |
|
|
| - |
|
|
| 49,440 |
|
|
| 348,190 |
|
最高財務官上級副社長 (3) |
| 2021 |
|
| 78,750 |
|
|
| 28,800 |
|
|
| 354,900 |
|
|
| 462,450 |
|
クリストファー·J·ナウド博士 |
| 2022 |
|
| 297,917 |
|
|
| - |
|
|
| 63,390 |
|
|
| 361,307 |
|
首席開発官上級副総裁 |
| 2021 |
|
| 270,000 |
|
|
| 86,400 |
|
|
| 322,504 |
|
|
| 678,904 |
|
(1) | プロール2021年のボーナスは完全に付与された株式オプションで支払われる。すべての株式オプションは私たちの2021計画に基づいて付与された。ヴァン·フォースとナウド博士の2021年のボーナスは現金で支払われた。2022年には何のボーナスも支払われなかった。 |
(2) | 米国証券取引委員会規則によると、この欄には、2021年期間に付与された株式オプション奨励の付与日公正価値合計が反映されている。これらの金額はFASB ASCトピック718によって計算される.本文書の他の部分の財務諸表付記7は,この金額を計算する際に用いる仮定を紹介した。この額は,役員が株式オプションを付与し,株式オプションを行使したり,株式オプションの対象となる普通株を売却したりする際に実現する実際の経済価値を反映していない. |
(3) | ヴァン·フェスさんは2021年9月にデマタに加入した。 |
| 100 |
| カタログ表 |
私たちが指定した行政員の採用手配と
私たちは以下に掲げる指定幹部ごとに雇用協定を締結する側です。これらの指名された執行官は、現在、私たちと締結されている常習秘密と知的財産権譲渡協定の一方である
ジェラルド·T·プロール
2021年12月6日,我々はプロールさんと雇用契約を締結した。Proehl契約の条項によると、Proehlさんは社長兼CEOを務め、毎年350,000ドルの基本給を受け取る。また、プロールは年間ボーナスを得る資格があり、目標金額はプロール基本給の50%に相当する。各年間ボーナスの実際の金額は、当社およびProehlさんが事業年度ボーナスに関連するカレンダー年度に定めた会社の目標およびProehlさん個人目標の達成度に応じて定められます。一年以内の会社目標とProehlさん個人の業績目標の達成度は、合理的な情状酌量に基づいて決定される。さらに、Proehlさんは、当社の既存の持分インセンティブ計画または将来採用する可能性のある任意の他の持分インセンティブ計画に応じて時々配当金を獲得する資格を有しており、そのようなインセンティブの条項および条件は、当社の取締役会または報酬委員会により適宜決定されます。Proehlさんはまた、当社が採用する任意の役員福祉プログラムまたは計画に参加する資格があります。
われわれはProehl契約で定められているさんの雇用を、いつでも前週前に書面でProehlさんに通知した後、いつでも終止符を打つことができる。Proehlさんは、その雇用関係を十分な理由で(Proehlプロトコルで定義されている)十分な理由で60日以内に書面で終了することができる。
(I)Proehlさんの雇用が理由なく又は十分な理由で終了された場合、(I)Proehlさんは(I)自らの持分補償計画に基づいて得られた既得額又は福祉を取得する権利があり、(Ii)Proehlプロトコルによりその雇用の最後の日又はそれ以前に発生した精算可能な費用、(Ii)Proehlさんが我々の任意の持分補償計画に基づいて取得した既得額又は福利厚生(第I)~(Ii)第4条、総称して義務となる。)(Iv)さんProehlが解任されてから60日以内に次の通常支給日に1度に支払われるProehlさんの基本給12ヶ月間に相当する、(V)取締役会が支払うべき年次ボーナスの比例的支払額に相当し、(Vi)が当選した場合、我々はProehlさんに12ヶ月間のCOBRA健康福祉用具を償還することになる。
それにもかかわらず、Proehlさんの雇用が理由なく終了した場合、またはコントロール権の変更の前の3ヶ月以内またはそれ以降の年(“2021年計画”に規定されるように)に十分な理由が辞任した場合、Proehlさんは(1)計算すべき債務、(2)Proehlさんの基本給の18ヶ月以内の解散費(Proehlさんが解雇されてから60日以内に次の通常の給与日に一度に支払われることになる)、(3)取締役会がProehlさんに支払うべき目標年次ボーナス金額、(4)取締役会が決定したProehlさんに支払われるべき年間ボーナス額、(4)当選すれば、我々はProehlさんの18ヶ月間の特定のメガネ蛇の健康福祉を償還し、(V)Proehlさんは彼が解雇された日には完全に彼に帰属する未償還持分報酬とみなされることになる。
| 101 |
| カタログ表 |
もしProehlさんの雇用関係が何らかの理由または正当な理由なく終了した場合、彼は(I)雇用契約に従って支払われたが支払われなかった基本給を雇用の最終日またはそれ以前に雇用契約に従って支払われなければならず、(I)その雇用契約に従ってその雇用の最後の日またはそれ以前に発生した精算可能な費用、ならびに(Ii)Proehlさんが我々の任意の持分補償計画に基づいて取得した既得額または福利厚生を取得する権利を有する。
専hlさんを書面で通達した後、いつでもProehlさんの雇用を終了することができる。Proehlさんは4週間前に書面で通知を出すことができ,十分な理由がない場合はいつでも自発的にその雇用関係を打ち切ることができる。
ケリー·K·ヴァン·フォース
2021年11月19日、私たちはヴァン·フェスさんと雇用協定を締結し、その後、2022年1月1日に改正(改正ファンフェス協定)を行った。ファンフス協定の条項によると、彼女は上級副総裁兼首席財務官を務め、毎年300,000ドルの基本給を得ている。また、ファンフェスには年間ボーナスを得る資格があり、目標金額はファンフス基本給の40%(40%)に相当する。各年間ボーナスの実際の金額は、私たちの会社の目標とVan Hooseさんの個人目標の達成度に基づいており、それぞれの場合、私たちとVan Hooseさんが年間ボーナスに関連するカレンダー年度のために決定します。会社の目標とVan Hooseさんの1年間の個人業績目標の達成度は私たちが合理的な情動権に基づいて決定します。さらに、雇用協定の条項によると、Van Hooseさんは、私たちの既存の持分インセンティブ計画の下で株式奨励を時々得る資格があり、または私たちが将来採用する可能性のある任意の他の持分インセンティブ計画を持っており、そのような奨励の条項と条件(ある場合)は、私たちの取締役会または報酬委員会によって適宜決定されるだろう。Van Hooseさんはまた私たちが採用したどんな幹部福祉計画や計画に参加する資格がある。
私たちはVan Hooseさんに2週間前に書面で通知した場合、Van Hooseさんの雇用をいつでも理由なく終わらせることができる(この用語はVan Hooseさんの雇用協定に定義されている)。Van Hooseさんは60日以内に私たちに書面通知を出した後、正当な理由でその雇用関係を終了することができます。通知を出した後、私たちはVan Hooseさんが十分な理由の条件があると思っているが、その雇用協定に規定されているいくつかの条件を守らなければなりません。
Van Hooseさんが理由もなく採用を中止された場合、Van Hooseさんは(I)債務を受け取る権利があり、(Iv)Van Hooseさんの基本給9ヶ月に相当する解散料(Van Hooseさんが解雇されてから60日以内の次の定期支給日に一度に支払う)、(V)取締役会が決定したVan Hooseさんの目標年間花紅金額、および(Vi)が選ばれた場合、当社はVan HooseさんにいくつかのCOBRA健康福祉を9ヶ月返済する。
それにもかかわらず、Van Hooseさんの雇用が理由なく終了した場合、または彼女が支配権変更前の3ヶ月以内またはその後の1年間(“2021年計画”で定義されているように)辞任する十分な理由があれば、Van Hooseさんは(1)債務を計算し、(2)Van Hooseさんの基本給12ヶ月に相当する解散料(Van Hooseさんが解雇されてから60日以内の次の通常支給日に一度に支払う)、(3)取締役会が決定したVan Hooseさんに支払うべき目標年間ボーナス金額、(4)当選すれば、当社はVan Hooseさんに12ヶ月間のCOBRAのある健康福祉を精算し、(V)Van Hooseさんは彼女が契約を終了した日に完全に帰属したすべての未返済持分奨励金とみなされる
もしVan Hooseさんの雇用関係がどんな理由でも正当な理由がなくて終了した場合、彼女は(I)彼女が雇われた最後の日に稼いだが支払われていない基本給を得る権利があり、(Ii)彼女が雇われた最後の日または前に雇用協定によって精算可能な費用、および(Iii)Van Hooseさんが私たちの任意の持分補償計画に従って得られる既得額または福祉を得る権利がある。
ヴァン·フェスさんに書面で通知した後、私たちはいつでもヴァン·フェスさんの雇用を中止することができます。Van Hooseさんは十分な理由なしに、2週間前に書面で私たちに通知した場合、いつでも自発的に雇用関係を終了することができます。
| 102 |
| カタログ表 |
クリストファー·J·ナウド博士
2021年8月17日、Nardo博士と雇用協定を締結し、その後、2021年12月6日、2022年1月1日、2022年7月1日に改正された(改正された協定はNardo協定)。Nardo博士は首席開発官の上級副総裁を務め、年間基本給は32万ドル。また、Nardo博士は年間ボーナスを得る資格があり、目標金額はNardo博士の基本給の40%(40%)に相当する。各年間ボーナスの実際の金額は、わが社の目標とNardo博士の個人目標の達成度に基づいており、いずれの場合も、年間ボーナスに関連するカレンダー年度のために、私たちとNardo博士によって決定される。一年以内に会社の目標とNardo博士の個人業績目標の実現程度は著者らが合理的な情動権によって決定する。また、雇用協定の条項によると、Nardo博士は、私たちの既存の持分インセンティブ計画または私たちが将来採用する可能性のある任意の他の持分インセンティブ計画に基づいて時々持分奨励を受ける資格があり、このような奨励の条項と条件(ある場合)は、私たちの取締役会または報酬委員会によって適宜決定される。Nardo博士はまた私たちが採用したどんな幹部福祉計画や計画に参加する資格がある
私たちはNardo博士の雇用を2週間前に書面で通知した場合、Nardo博士の雇用をいつでも中止することができる(この用語はNardo博士の雇用協定に定義されている)。Nardo博士は60日以内に書面で通知した後,正当な理由(Nardo博士の雇用合意に定義されている)で雇用関係を終了し,通知後,Nardo博士が十分な理由があると考えている病態を治癒する30日があるが,その雇用合意に規定されているいくつかの条件を遵守しなければならない
Nardo博士の雇用が理由なくまたは十分な理由で終了した場合、Nardo博士は(I)課税債務、(Iv)Nardo博士の基本給9ヶ月に相当する解散費(Nardo博士が解雇されてから60日以内の次の正常支給日に一度に支払う)、(V)取締役会はNardo博士に支払うべき目標年間ボーナス額を決定し、(Vi)当選すれば、会社はNardo博士に9ヶ月のあるコブラ健康福祉を返済する。
それにもかかわらず、Nardo博士の雇用が理由なく終了された場合、または支配権変更直前の3ヶ月以内に、または支配権変更後1年以内に(“2021年計画”で定義されているように)辞任する十分な理由があれば、Nardo博士は(I)計算すべき債務を獲得し、(Ii)Nardo博士の基本給12ヶ月に相当する解散料(Nardo博士退職後60日以内の次の通常支給日に一度に支払う)、(Iii)取締役会が決定したNardo博士に支払うべき目標年間ボーナス額、(Iv)が当選すれば、(Iv)当選すれば、会社はNardo博士の12ヶ月のいくつかのCOBRA健康福祉を清算し、(V)Nardo博士はその退職の日にそのすべての未返済に完全に帰属する株式奨励とみなされる
Nardo博士の雇用関係が任意の理由または正当な理由なしで終了された場合、彼は、(I)その雇用の最後の日または前に雇用協定に従って精算可能な費用を得る権利があり、(Iii)Nardo博士が私たちの任意の持分補償計画に従って得る権利がある既得額または福祉の任意の金額または福祉を得る権利がある
Nardo博士に書面で通知した後、私たちはNardo博士の雇用関係をいつでも終わらせることができる。Nardo博士は,十分な理由がなく,2週間前に書面で通知された場合には,随時自発的にその雇用関係を終了することができる
| 103 |
| カタログ表 |
財政年度終了時の優秀株奨励
次の表は、2022年12月31日現在、任命された役員1人当たりの普通株関連流通株オプションの株式数をまとめています
|
| オプションの対象となる証券の数 |
|
| 選択権 トレーニングをする |
|
| 選択権 満期になる |
| 帰属.帰属 |
| |||||||
名前.名前 |
| 練習可能である |
|
| 行使できない |
|
| 値段 |
|
| 日取り |
| スケジュール |
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
ジェラルド·T·プロール |
|
| 7,181 |
|
|
| 3,746 |
|
| $ | 6.31 |
|
| 3/31/26 |
|
| (1 | ) |
|
|
| 23,373 |
|
|
| 25,407 |
|
|
| 6.31 |
|
| 3/31/26 |
|
| (2 | ) |
|
|
| 9,756 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (3 | ) |
|
|
| 9,756 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (4 | ) |
|
|
| 28,389 |
|
|
| 9,463 |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (5 | ) |
|
|
| 49,462 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (6 | ) |
|
|
| 4,517 |
|
|
| - |
|
|
| 2.07 |
|
| 1/2/27 |
|
| (9 | ) |
|
|
| 197,610 |
|
|
| - |
|
|
| 1.88 |
|
| 1/2/32 |
|
| (10 | ) |
|
|
|
|
|
|
| 42,141 |
|
|
| 2.07 |
|
| 1/2/27 |
|
| (10 | ) |
|
|
|
|
|
|
| 57,859 |
|
|
| 1.88 |
|
| 1/2/32 |
|
| (10 | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ケリー·K·ヴァン·フォース |
|
| 23,437 |
|
|
| 51,563 |
|
|
| 5.39 |
|
| 8/31/31 |
|
| (7 | ) |
|
|
| - |
|
|
| 30,000 |
|
|
| 1.88 |
|
| 1/2/32 |
|
| (10 | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
クリストファー·J·ナウド博士 |
|
| 2,439 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (8 | ) |
|
|
| 6,097 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (3 | ) |
|
|
| 6,097 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (4 | ) |
|
|
| 18,292 |
|
|
| 6,098 |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (5 | ) |
|
|
| 1,585 |
|
|
| - |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (6 | ) |
|
|
| 11,686 |
|
|
| 12,704 |
|
|
| 5.74 |
|
| 3/31/31 |
|
| (2 | ) |
|
|
| - |
|
|
| 30,000 |
|
|
| 1.88 |
|
| 1/2/32 |
|
| (10 | ) |
|
|
| - |
|
|
| 30,000 |
|
|
| 0.51 |
|
| 6/30/32 |
|
| (11 | ) |
_____________
(1) | この株式オプション賞は2021年3月31日に授与される。株式オプションは2021年1月11日から35等分の毎月分割払いになります。 |
(2) | この株式オプション賞は2021年3月31日に授与される。株式オプションは2021年1月1日から48ヶ月に分けて全額分割払いとなります。 |
(3) | この株式オプション賞は2021年3月31日に授与される。2018年1月1日から、株式オプションは48回に分けて月額分割払いとなります。 |
(4) | この株式オプション賞は2021年3月31日に授与される。株式オプションは2018年12月19日から48ヶ月に分けて全額分割払いとなります。 |
(5) | この株式オプション賞は2021年3月31日に授与される。2019年12月11日から、株式オプションは月額分割払いで48回 |
(6) | この株式オプションは2021年3月31日に付与され、発行時に完全に付与される。 |
(7) | この株式オプション賞は2021年9月1日に授与される。株式オプションは2021年9月1日から48ヶ月に分けて全額分割払いとなります。 |
(8) | この株式オプション奨励は2021年3月31日に付与され、完全に付与された。株式オプションは2017年9月1日から48ヶ月に分けて全額分割払いとなります。 |
(9) | この株式オプション奨励は2022年1月3日に付与され、発行時に完全に付与される。 |
(10) | この株式オプションは2022年1月3日に付与された。株式オプションは、株式オプションが付与された最初の周年日に40%に帰属し、残りの60%は残り36ヶ月に帰属し、総帰属期間は48ヶ月である |
(11) | この株式オプション賞は2022年7月1日に授与される。株式オプションは株式オプション付与1周年の日から25%が付与され、残りは2022年7月1日から月額分割払い36回 |
2022年12月31日までの1年間、私たちは、私たちが任命したいかなる役員の未償還オプション報酬に対しても、再定価や他の修正またはキャンセルを行っていません。
| 104 |
| カタログ表 |
役員報酬
次の表は、2022年12月31日までの財政年度の会社の全非従業員役員の報酬に関するいくつかの情報を示しています
名前.名前 |
| 稼いだ費用を現金で支払う(1) |
|
| 株式大賞(2) |
|
| 株式オプション賞 |
|
| 合計する |
| ||||
デヴィッド·ヘア |
| $ | 18,125 |
|
| $ | 54,750 |
|
| $ | 7,540 | (3) |
| $ | 80,415 |
|
ウェンデル·ヴィレンガ博士です |
|
| 12,500 |
|
|
| 37,500 |
|
|
| 7,540 | (3) |
|
| 57,540 |
|
キャサリン·スコット |
|
| 34,375 |
|
|
| 20,625 |
|
|
| 7,540 | (3) |
|
| 62,540 |
|
スティーブン·J·メンター博士です |
|
| 45,813 |
|
|
| - |
|
|
| 7,540 | (3) |
|
| 53,353 |
|
メアリー·フィッシャー |
|
| 29,688 |
|
|
| 17,812 |
|
|
| 7,540 | (3) |
|
| 55,040 |
|
アンドリュー·サンドラー医学博士です |
|
| 30,563 |
|
|
| 18,375 |
|
|
| 7,540 | (3) |
|
| 56,478 |
|
ブルターニュ·ブラドリック |
|
| 17,813 |
|
|
| 17,812 |
|
|
| 12,040 | (3) |
|
| 47,665 |
|
____________________________
(1) | 取締役会が現金で稼いだり支払ったりした費用は2022年の例年の費用で、私たち取締役を代表して稼いだ費用です。 |
(2) | この欄の金額は,我々非従業員取締役に付与されたRSUの付与日公正価値を反映している.これらの金額はFASB ASCトピック718によって計算される.上記RSU奨励付与日公報価値を決定するための推定値仮定の検討については、本年度報告Form 10−Kに含まれる2022年12月31日までの監査総合財務諸表付記1を参照されたい。 |
(3) | 米国証券取引委員会規則によると、この欄には、2022年期間に付与された株式オプション奨励の付与日公正価値合計が反映されている。これらの金額はFASB ASCトピック718によって計算される.この額を計算する際に用いる仮定は,本文書の他の部分に含まれる我々の財務諸表の付記に説明した.この金額は、取締役が株式購入に帰属し、購入権を行使したり、当該等の株式購入に関連する普通株を売却する際に現金化される実際の経済価値を反映していない。 |
(4) | これらの株式オプション奨励は2022年1月12日に授与され、授与スケジュールは1/12ですこれは…。月に1回の帰属。 |
我々の報酬政策によると、取締役会メンバーは年間40,000ドル(取締役最高経営責任者60,000ドル)、監査委員会メンバー1人当たり年間7,500ドル(議長15,000ドル)、報酬委員会メンバー1人当たり年間5,000ドル(議長10,000ドル)、指名およびコーポレートガバナンス委員会メンバー1人当たり年間4,000ドル(議長8,000ドル)を得ることができる。この政策によって支払われた任意の補償は、前の例年に行われなければならない現金または制限株式単位を各取締役会メンバーの選挙で支払うことができる。取締役非従業員報酬政策の一部として、我々の取締役は、(I)100%を制限株式単位で計算するか、(Ii)50%を現金および50%を制限株式単位で計算するか、または(Iii)100%現金で計算することを選択することができる。本政策は2022年1月1日から始まる財政年度に適用される。
私たちはまた、取締役会に加入した後、取締役会メンバーが私たちの普通株を10,000株購入する株式オプションを自動的に獲得し、毎年1月1日に、当時取締役に勤めていた非従業員1人当たり5,000株を購入するために株式オプションを自動的に獲得する持分補償政策も採用している。これらの株式オプションの期限は10年であり、行使価格は付与された日の普通株式公正時価の100%に相当する。この政策によって付与されたすべてのオプションは私たちの2021年計画に基づいて付与されるだろう。
| 105 |
| カタログ表 |
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
株式補償計画に基づいて発行された証券
2021年3月24日、我々の取締役会および株主は、奨励的株式オプションおよび非制限株式オプションを付与して、我々普通株の株式および他のタイプの奨励を購入することを規定する2021計画を採択した。2021年6月29日、我々の取締役会と株主は、2021年計画に対する修正案を承認し、2021年計画で付与されたオプションおよび他の奨励に関する発行可能普通株式総数を増加させた
2021年計画の全体的な目的は、条件に合った従業員、高級管理者、非従業員取締役、その他の個人サービス提供者が自主感を発展させ、自ら私たちの発展と財務成功に参加し、彼らが私たちの業務に最善を尽くすことを奨励し、それによって私たちの利益と私たちの株主の利益を促進する手段を提供することである。2021年計画を通じて、私たちはこの等合資格者のサービスを保留し、その人たちが私たちの成功と私たちの子会社の成功のために最善を尽くすことを奨励します。
次の表は、私たちの給与計画に関する情報を提供し、この計画によると、株式報酬は2022年12月31日に認可された
|
| 証券数量 未償還オプション、株式承認証、権利の行使時に発行されます |
|
| 未償還オプション、権証および権利の加重平均行権価格 |
|
| 持分補償計画に基づいて将来発行可能な証券数(a欄に反映された証券を除く) |
| |||
計画種別 |
| (a) |
|
| (b) |
|
| (c)(2) |
| |||
証券保有者が承認した持分補償計画(1) |
|
| 8,050,139 |
|
| $ | 4.04 |
|
|
| 455,539 |
|
証券保有者の許可を得ていない持分補償計画 |
|
| - |
|
|
| - |
|
|
| - |
|
合計する |
|
|
|
|
|
|
|
|
|
|
|
|
(1) | この行が示す金額には2021年計画下の証券が含まれている |
(2) | “2021年計画”中の“常青樹”条項によると、2023年初日に123,218株を自動増発し、2022年12月31日の流通株数の1%に相当する;これらの株は今回の計算の列ではない。 |
特定の実益所有者と経営陣の保証所有権
次の表は、2023年2月14日までの私たちの普通株の利益所有権情報を示しています。具体的には以下の通りです
| · |
| 私たちが知っている実益は私たちの普通株式の5%以上のすべての人またはグループの関係者を持っています |
| · |
| 私たち役員は誰もが |
| · |
| 私たちの任命されたすべての行政者は |
| · |
| 私たちのすべての現職幹部と役員はチームです |
| 106 |
| カタログ表 |
私たちはアメリカ証券取引委員会の規則に従って実益権を決定した。これらの規則によれば、利益所有権は、個人またはエンティティが投票権または投資権を個別にまたは共有する任意の普通株式を含む。適用される所有権率は、2023年2月14日現在の12,321,848株の発行された普通株に基づく。個人または実体実益が所有する株式の数およびその人の所有権パーセンテージを計算する際に、その人が現在行使可能である、または2023年2月14日から60日以内に行使されるオプションによって制限される普通株は、他の他の人の所有権パーセンテージを計算する際に、これらの株式は発行済み株式とみなされないにもかかわらず、発行済み株式とみなされる
別の説明がない限り、上場する各株主は、株主実益が所有する株式に対して唯一の投票権及び投資権を有し、適用されるコミュニティ財産法の制約を受ける
実益所有者の氏名又は名称及び住所(1) |
| 株式数 実益所有者(2) |
| パーセント 株 有益な 持っている |
| |||
5%以上の株主 |
|
|
|
|
| |||
Proehl投資リスク投資有限責任会社 |
|
| 2,933,531 | (3)(4) |
| 23.8 | % | |
任命された行政員と役員 |
|
|
|
|
|
|
| |
ジェラルド·T·プロール |
|
| 3,724,819 | (3)(4)(5) |
| 28.9 | % | |
クリストファー·J·ナウド博士 |
|
| 91,322 | (6) |
| * |
| |
ケリー·K·ヴァン·フォース |
|
| 43,187 | (7) |
| * |
| |
デヴィッド·ヘア |
|
| 717,388 | (8)(9)(10) |
| 5.8 | % | |
ウェンデル·ヴィレンガ博士です |
|
| 84,470 | (11) |
| * |
| |
キャサリン·スコット |
|
| 44,584 | (12) |
| * |
| |
スティーブン·J·マントー博士です |
|
| 15,000 | (13) |
| * |
| |
メアリー·フィッシャー |
|
| 38,443 | (14) |
| * |
| |
アンドリュー·サンドラー医学博士です |
|
| 39,184 | (15) |
| * |
| |
ブルターニュ·ブラドリック |
|
| 33,443 | (16) |
| * |
| |
行政者全員と役員全体として(11人) |
|
| 4,831,840 |
|
| 36.4 | % | |
* | 1%未満です |
(1) | 別の説明がない限り、すべての上場株主の住所はカリフォルニア州サンディエゴデルマ高地路3525 Del Mar Heights路、郵便番号:92130です。別の説明がない限り、各上場株主は、株主実益が所有する株式に対して唯一の投票権及び投資権を有し、適用される共同体財産法の制約を受ける。 |
|
|
(2) | 我々は、1934年に改正された証券取引法第13 d-3条の規則に基づいて、通常、証券の投票権および/または処分権によって決定される実益所有権を決定した。上記普通株式は、別の説明のほか、2023年2月14日に所有し、実益所有者に指定された個人が登録所有し、その個人がそれぞれ所有する普通株式に対して唯一の投票権と処分権を有する。 |
|
|
(3) | 私どもの会長兼最高経営責任者Gerald T.ProehlはProehl Investment Ventures LLCの会長兼CEOです。ProehlさんはProehl Investment Ventures LLCの所有権を持っているので、Proehl Investment Ventures LLCが保有する私たちの普通株式の株式に対して唯一の投票権と処分制御権を持っているとみなされる可能性があります。したがって、ProehlさんはProehl Investment Ventures LLCが保有する我々の普通株式の実益とみなされる可能性があります。 |
|
|
(4) | (I)Proehl Investment Ventures LLCが保有する2,905,544株の普通株,(Ii)27,987株がProehl Investment Ventures LLCが保有する引受権証を行使した後に発行可能な普通株を含み,これらの株式承認証は2023年2月14日から60日以内に行使可能である。 |
| 107 |
| カタログ表 |
(5) | (I)Proehlさん保有59,512株式、(Ii)Proehlさん保有による2023年2月14日から60日以内に行使可能な普通株式購入希望者に対して発行する385,510普通株式、(Ii)Proehlさん2020取下げ不能信託の受託者として保有する8,928株式普通株式、(Iv)Proehlさん氏がAllison Taylor Proehl 2020不可信託所有者として保有する17,857株の普通株式、(V)Proehlさん氏はSean Michl Prohl専利信託受託者として保有する35,767株の普通株式を含む。および(Vi)142,857株の普通株式および引受権証により、Proehl家族信託受託者としてProehlさんが保有する最大142,857株の普通株式を購入する。Proehlさんの保有株式オプション行使後に発行可能な85,150株の普通株式を含まず、これらの株式は2023年2月14日から60日以内に行使できない。 |
(6) | (I)Nardo博士が保有する25,121株の普通株、(Ii)Nardo博士が保有する2023年2月14日から60日以内に行使可能な株式オプション発行可能な63,762株の普通株、および(Iii)Nardo博士が2001年10月3日にNardo家族信託の共同受託者として保有した2,439株の普通株を含む。Nardo博士が保有する株式オプション行使後に発行可能な161,236株の普通株は含まれておらず、これらの株は2023年2月14日から60日間行使できない。 |
(7) | 43,187株の普通株を含め、Van Hooseさんが持っている株式オプションを行使した後に発行することができ、2023年2月14日から60日以内に行使することができる。Van Hooseさんが持っている株式オプションが2023年2月14日以降60日以内に行使できないため発行可能な161,813株の普通株は含まれていない。 |
(8) | 取締役最高経営責任者David·ハイアールはハイアール生物製薬ベンチャー有限公司の会長兼最高経営責任者だ。ヘアさんがHale BioPharma Ventures LLCを制御しているため、彼はHale BioPharma Ventures LLCが保有する私たちの普通株式の株式に対して唯一の投票権と絶対制御権を持っていると考えられているかもしれません。したがって、ヘアさんは、Hale BioPharma Ventures LLCが保有する私たちの普通株式を所有している実益とみなされるかもしれません。 |
(9) | (I)Hale BioPharma Ventures LLCが保有する532,925株の普通株と,(Ii)Hale BioPharma Ventures LLCが保有する3,048株の普通株を含み,2023年2月14日から60日以内に引受権証を発行することができる。 |
|
|
(10) | (I)Haleさんが保有する75,720株の普通株式、(Ii)Haleさんが保有する2023年2月14日から60日以内に発行可能な購入株式に対して発行可能な22,072株の普通株式、(Iii)Haleさん氏が、普通株式に対して投票権および処分制御権を有する有限責任組合企業に対して保有する12,195株の普通株式、および(Iv)35,714株の普通株式および引受権証を含めて、HaleさんをHale家族信託受託者として購入する場合に最も多い35,714株の普通株とする |
(11) | (I)Wierenga博士が保有する62,398株の普通株と(Ii)22,072株を含み、2023年2月14日から60日間以内にWierenga博士が保有する株式オプションを行使した後に発行できる普通株を含む。 |
(12) | (I)スコットさんが2008年3月28日にスコット2008信託受託者として保有した2,439株の普通株、(Ii)スコットさんが保有した27,145株の普通株、および(3)スコットさんが2023年2月14日から60日間行使可能な株式オプションで発行可能な15,000株の普通株を含む |
|
|
(13) | 15,000株の普通株を含め、門戸博士が保有する株式オプションを行使した後に発行することができ、2023年2月14日から60日以内に行使することができる |
|
|
(14) | (I)23,443株のFisherさんが保有する普通株と、(Ii)15,000株がFisherさんが保有する2023年2月14日から60日以内に行使可能な株式オプションを行使する際に発行可能な普通株を含む |
|
|
(15) | (I)Dr.Sandlerが保有する24,184株の普通株および(Ii)15,000株のDr.Sandlerが保有する2023年2月14日から60日以内に行使可能な普通株を含む |
|
|
(16) | (I)ブラドリックさんが保有する23,443株の普通株と、(Ii)ブラドリックさんが保有する2023年2月14日から60日以内に行使可能な株式オプションを含む15,000株の普通株 |
| 108 |
| カタログ表 |
項目13.特定の関係および関連取引、および取締役の独立性
以下は、2022年1月1日以来、私たちが関与している取引の説明であり、関連する金額は120,000ドルを超えるが、これらの取引のうち、任意の取締役、役員、または5%以上の投票権を有する証券の所有者またはそれらの任意の直系親族が、直接的または間接的な重大な利益を有することになるが、これらの配置は、“役員報酬”に記載されている
ショーン·プロール
ショーン·プロールは取締役最高経営責任者のジェラルド·T·プロールの息子で、現在アリペイ高級法律と業務発展部に雇われている。ショーン·プロールの年収は16.8万ドル。さらに、Sean Proehlさんは、当社の既存の持分インセンティブ計画または将来採用する可能性のある任意の他の持分インセンティブ計画に基づいて時々配当金を獲得する資格を有しており、そのようなインセンティブの条項および条件は、当社の取締役会または報酬委員会によって適宜決定されます。
関係者取引の政策と手順
我々の取締役会は、関係者取引の審査及び承認又は承認のための政策及び手続を規定する書面による関係者取引政策を採択した。本政策は、任意の取引、手配または関係、または任意の同様の取引、手配または関係をカバーしており、関連する金額は120,000ドルを超え、または2022年12月31日および2021年12月31日までの私たちの総資産平均値の1%を超え、関係者は、直接または間接的な重大な利益を有しているが、証券法下のS-K法規第404項に規定されているいくつかの例外は除外される。関連者またはエンティティが関連者から商品やサービスを購入または購入し,関連者がその関連者またはエンティティにおいて重大な権益,負債,債務保証,および吾などの雇用関係者を持つ.このような取引を承認する際に、我々の監査委員会は、(I)取引条項が、関係者と公平な取引を行う際に得られる条項に相当するか否か、(Ii)取引における関係者の権益の程度、(Iii)会社へのメリット、(Iv)関連者が取締役、取締役の直系家族または取締役がパートナーである実体であれば、取締役の独立性への影響を含むすべての関連する事実および状況を考慮する責任があるが、これらに限定されない, 株主または実行者、(V)製品またはサービスと比較可能な他のソース、(Vi)取引条項、および(Vii)第三者が利用可能な条項とは無関係である。すべての関係者取引は、我々の監査委員会が政策規定のガイドラインに基づいて承認または承認した場合にのみ完了することができる。審査中の取引に関連する任意の監査委員会のメンバーは、その取引の承認または承認に関する審議または投票に参加してはならない。しかし、この取引を審査する監査委員会会議では、定足数を決定する際にも、このような取締役が計算される可能性がある。
役員は自主独立している
ナスダックの規則によると、取締役会が取締役の取締役会がその人の関係が取締役が職責を履行する際に独立判断を行使することを妨害しないと考えている場合にのみ、その会社は“独立した取締役”となる資格がある。上場企業監査委員会のメンバーは、監査委員会、取締役会または任意の他の取締役会委員会のメンバーの身分を除いて、上場企業またはその任意の付属会社の任意の相談、相談またはその他の補償費を直接または間接的に受け入れてはならない、または他の方法で上場会社またはその任意の付属会社の関連者となってはならない。
| 109 |
| カタログ表 |
当社取締役会は、David·ヘア、ウェンデル·ヴィレンガ博士、アンドリュー·サンドラー医学博士、メアリー·フィッシャー、スティーブン·J·門トー、ブルターニュ·ブラドリック、キャサリン·スコットをナスダック商城規則第5605(A)(2)条で定義された“独立取締役”とすることを決定した。私たちは監査委員会、報酬委員会、そして指名と会社管理委員会を設立した。我々の取締役会は、キャサリン·スコットを“監査委員会財務専門家”と決定しており、その定義は、米国証券取引委員会の適用規則を参照し、監査委員会のすべてのメンバーは“独立”であり、適用されるナスダック上場基準と1934年証券取引法規則10 A-3の独立性基準に適合している。監査委員会のメンバーはすべてアメリカ証券取引委員会とナスダック株式市場適用規則と法規の金融知識に対する要求に符合している。
プロジェクト14.チーフ会計士費用とサービス
独立公認会計士事務所に支払う費用
次の表は、過去2会計年度にMayer Hoffman McCann,P.C.または我々の独立公認会計士事務所MHMが提供する専門サービスに毎年支払う費用をまとめたものである
十二月三十一日までの年度 |
| 2022 |
|
| 2021 |
| ||
課金(1) |
| $ | 423,928 |
|
| $ | 436,064 |
|
監査関連費用 |
|
| - |
|
|
| - |
|
税金.税金 |
|
| 25,522 |
|
|
| 78,812 |
|
他のすべての費用 |
|
| - |
|
|
| - |
|
合計する |
| $ | 449,450 |
|
| $ | 514,876 |
|
(1) | 監査費用には、当社の年次財務諸表の監査、四半期財務諸表の審査、米国証券取引委員会に提出された登録報告書の提出に協力して生じる専門的なサービス費用、および通常、当社の独立公認会計士事務所が提供する規制申告または参加に関するサービスが含まれています。基本的には,MHM株主の制御下で働くMHMの全員がCBIZ社の完全子会社の従業員であり,CBIZ社は別の実践構造でMHMに人員や様々なサービスを提供している |
監査役の独立性
2022年12月31日までの財政年度中には、Mayer Hoffman McCann,P.C.によって提供される他の専門サービスはなく、Mayer Hoffman McCann,P.C.の独立性を維持することとの互換性を考慮する必要がある。
監査委員会独立公認会計士事務所監査及び許可された非監査サービスの事前承認に関する政策
私たちの監査委員会は、独立公認会計士事務所を使用するサービスを規範化する政策を制定しました。この政策によれば、我々の監査委員会は、このようなサービスを提供することが会計士の独立性を損なわないように、私たちの独立した公認会計士事務所が提供するすべての監査および非監査サービスを事前に承認しなければならない。2022年12月31日までの財政年度において、Mayer Hoffman McCann,P.C.に支払われるすべての費用は、私たちの取締役会および/または監査委員会によって予め承認されています。
| 110 |
| カタログ表 |
第4部
プロジェクト15.証拠品および財務諸表の添付表
(a)(1) | 財務諸表 |
財務諸表および関連付記は、Mayer Hoffman McCann,P.C.の報告とともに、本リスト10-K“第2部分--第8項--財務諸表および補足データ”の要求に従って、F-1~F-26ページに記載されている。
(a)(2) | 財務諸表明細書 |
その中に記載されている資料が財務諸表または付記に適用または記載されていないことが要求されるので、すべての付表は省略される
(a)(3) | 陳列品 |
以下の証拠は,本年度報告の10−K表の一部として提出されるか,または引用により本年度報告に組み込まれる。
証拠品番号: | 書類説明 | |
3.1 | 改訂·再発行されたデマタ治療会社登録証明書(会社が2021年8月6日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル3.2を参照して合併)。 | |
3.2 |
| 2022年7月11日にデラウェア州州務卿に提出された改訂および再発行されたデマタ治療会社登録証明書第1号修正案(2022年7月11日に米国証券取引委員会に提出された会社の現在の8-K表報告書の添付ファイル3.1を参照して組み込まれる)。 |
|
|
|
3.3 | デマータ治療会社の定款を改訂·再改訂した(会社が2021年8月6日に米国証券取引委員会に提出したS−1表登録説明書添付ファイル3.4を参照して合併)。 | |
| ||
3.4 |
| 改正·再改訂されたデモタ治療会社規約の第1号改正案(2022年9月23日に米国証券取引委員会に提出された最新8−K表報告書の添付ファイル3.1を引用して編入)。 |
|
|
|
4.1 | デマータ治療会社の普通株式を代表する証明書サンプル(会社が2021年8月6日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル4.1を参照して合併)。 | |
| ||
4.2 | 普通株式引受権証表(当社が2021年8月6日に米国証券取引委員会に提出したS−1表登録説明書添付ファイル4.3を参照して合併)。 | |
| ||
4.3 | 当社が初めて公募で発行した普通株引受権証表(当社が2021年8月6日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル4.4参照) | |
|
| |
4.4 | 当社初公開発売時に発行された引受業者承認株式証表(当社が2021年8月6日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル4.2を参照して登録成立)。 |
| 111 |
| カタログ表 |
4.5 | デマータ治療会社とDirect Transfer有限責任会社は、会社の初公開(会社が2021年8月6日に米国証券取引委員会に提出したS-1表S-1の登録説明書添付ファイル4.5を参照して設立された)と締結された引受権証代理プロトコルのフォーマットである。 | |
|
|
|
4.6 |
| 登録直接発売方式で発行された普通株式承認株式証(合併内容は、当社が2022年4月25日に米国証券取引委員会に提出した8-K表添付ファイル4.1参照)。 |
|
| |
4.7 |
| 登録直接発売方式で発行された予融資権証表(合併内容は、当社が2022年4月25日に米国証券取引委員会に提出した8-K表添付ファイル4.2参照)。 |
|
|
|
4.8 |
| 証券説明。* |
10.1 | デマータ治療会社とその上級管理者と取締役が締結した賠償協定表(会社が2021年8月6日に米国証券取引委員会に提出したS−1表登録説明書添付ファイル10.1を参照して合併した)。 | |
| ||
10.2 | ピマタ治療会社2021年株式インセンティブ計画(引用会社が2021年8月6日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル10.2を合併して作成) | |
| ||
10.3 | ピマタ治療会社2021年株式インセンティブ計画の改正案第1号(同社が2021年8月6日に米国証券取引委員会に提出したS-1表登録説明書添付ファイル10.15を合併したものを引用することにより) | |
|
| |
10.4 | 2021年株式インセンティブ計画非限定株式オプション奨励表(合併内容参考会社2021年8月6日に米国証券取引委員会のS-1表登録説明書添付ファイル10.3)に提出する |
10.5 | 2021年株式インセンティブ計画下のインセンティブ株式オプション奨励表(2021年8月6日に米国証券取引委員会に提出されたS-1表登録説明書添付ファイル10.4を参照して編入される) | |
| ||
10.6 | デマタ治療会社とジェラルド·T·プロール社との間で2021年12月6日に締結された雇用協定(合併内容は、同社が2021年12月10日に米国証券取引委員会に提出した8−K表の添付ファイル10.1参照) | |
|
|
|
10.7 | Demata Treateutics,Inc.とChristopher J.Nardo,M.P.H.,Ph.との間で2021年8月17日に署名された雇用協定表(2021年8月6日に米国証券取引委員会に提出されたS-1表登録声明添付ファイル10.6を引用して統合された) | |
| ||
10.8 |
| Demata Treateutics,Inc.とChristopher J.Nardoとの間の雇用協定の2021年12月6日第1号改正案(2021年12月10日に米国証券取引委員会に提出された会社の現在の8−Kレポートの添付ファイル10.4を参照して編入される)。ガンギエイ |
|
|
|
10.9 | デマタ治療会社とクリストファー·J·ナルドとの間の雇用協定2022年1月1日第2号改正案(同社が2022年3月8日に米国証券取引委員会に提出した10−K表年次報告書の添付ファイル10.9を引用して編入) | |
|
| |
10.10 |
| Demata Treateutics,Inc.とChristopher Nardoとの間の雇用協定改正案は,期日は2022年7月1日の改正案第3号である(合併内容は2022年8月15日に米国証券取引委員会に提出された会社10-Q表四半期報告書の添付ファイル10.4参照)。ガンギエイ |
| 112 |
| カタログ表 |
10.11 | デマタ治療会社とマリア·ベドア·トロ·ムネラ博士,MBAとの間で2021年12月6日に締結された雇用協定(同社が2021年12月10日に米国証券取引委員会に提出した8−K表の添付ファイル10.3を引用して合併した) | |
|
|
|
10.12 |
| Demata Treateutics,Inc.とMaria Bedoya Toro Munera,Ph.との間の雇用協定修正案は、2022年1月1日(合併内容は2022年3月8日に米国証券取引委員会に提出された会社10-K表年次報告添付ファイル10.11を参照)* |
| ||
10.13 |
| デマタ治療会社とケリー·K·ヴァン·フスとの間で2021年12月6日に締結された雇用協定(合併内容は、同社が2021年12月10日に米国証券取引委員会に提出した8−K表現在報告書の添付ファイル10.2参照) |
|
|
|
10.14 |
| Demata Treateutics,Inc.とKyri K.Van Hooseとの間の雇用協定の改正案2022年1月1日第1号改正案(2022年3月8日に米国証券取引委員会に提出された会社Form 10−K年次報告書の添付ファイル10.13を参照して編入)。ガンギエイ |
|
|
|
10.15 | Demata Treateutics LLCとReka-Farm LLCとの間の供給協定は、2020年2月27日である(同社が2021年8月6日に米国証券取引委員会に提出したS-1表登録声明の添付ファイル10.8を参照して合併する) | |
| ||
10.16 | Demata Treateutics LLCとVillani,Inc.が2017年3月31日に締結したライセンス契約(会社が2021年8月6日に米国証券取引委員会に提出したS-1表登録声明の添付ファイル10.9を参照して統合された)# | |
| ||
10.17 | 2017年3月31日までのDermata Treateutics LLCとVillani,Inc.との間のライセンス契約添付ファイルAが改訂および再起動された(2021年8月6日に米国証券取引委員会に提出された会社S-1表登録声明を参照した添付ファイル10.10合併) | |
| ||
10.18 | 2019年6月4日現在、デマータ治療有限責任会社とベラニ社との間のライセンス改訂および和解協定(同社が2021年8月6日に米国証券取引委員会に提出したS-1表登録声明の添付ファイル10.11を参照して合併した) | |
| ||
10.19 | デマータ治療会社とヴェラニ社が2021年7月30日に締結したライセンス改正および和解協定修正案(合併内容は、2021年8月6日に米国証券取引委員会に提出されたS-1表登録説明書添付ファイル10.12を参照) | |
|
|
|
10.20 |
| Demata Treateutics,Inc.と買い手が2022年4月20日に署名した証券購入契約表(合併内容は、当社が2022年4月25日に米国証券取引委員会に提出した8-K表添付ファイル10.1を参照)。 |
|
|
|
10.21 |
| Demata Treateutics,Inc.と買い手が2022年4月20日に締結した登録権協議表(合併内容は、当社が2022年4月25日に米国証券取引委員会に提出した8-K表添付ファイル10.2を参照)。 |
|
|
|
10.22 |
| 登録者とMaxim Group LLCが2022年4月20日に締結した配給代理契約表(合併内容は、当社が2022年4月25日に米国証券取引委員会に提出した8-K表添付ファイル10.3を参照)。 |
| 113 |
| カタログ表 |
23.1 |
| Mayer Hoffman McCann、P.C.同意* |
|
|
|
31.1 |
| ルール13 a~14(A)またはルール15 d−14(A)による首席実行幹事の証明 |
|
|
|
31.2 |
| 細則13 a~14(A)または細則15 d-14(A)に従って首席財務幹事を確認する |
|
|
|
32.1 |
| ルール13 a-14(B)またはルール15 d-14(B)に従ってCEOおよび最高財務責任者を認証します。** |
|
|
|
101.INS* |
| XBRLインスタンス文書-インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルには表示されない |
101.SCH* |
| イントラネットXBRL分類拡張アーキテクチャ文書 |
101.CAL* |
| インラインXBRL分類拡張計算リンクライブラリ文書 |
101.DEF* |
| インラインXBRL分類拡張Linkbase文書を定義する |
101.LAB* |
| XBRL分類拡張ラベルLinkbase文書を連結する |
104 |
| 表紙相互データファイル(添付ファイル101に含まれるイントラネットXBRLのフォーマット) |
# | 米国証券取引委員会規則によると、本展示品(星番号で示す)の部分は省略されている。 |
* | 本局に提出します。 |
** | 家具付きで、保存されていません。 |
† | 契約または補償計画、契約または手配を管理することを指す。 |
項目16.表格10-Kの概要
ない。
| 114 |
| カタログ表 |
DERMATA治療会社
財務諸表索引
2022年12月31日と2021年12月31日までに
2022年12月31日と2021年12月31日までの年度
独立公認会計士事務所レポート(PCAOB ID) | F-2 |
財務諸表: |
|
貸借対照表 | F-3 |
運営説明書 | F-4 |
株主権益表 | F-5 |
現金フロー表 | F-6 |
財務諸表付記 | F-7 |
| F-1 |
| カタログ表 |
独立公認会計士事務所報告
取締役会に提出し
デマタ治療会社の株主:
財務諸表のいくつかの見方
我々は,Demata Treateutics,Inc.(前身はDermata Treateutics,LLC)(“会社”)2022年12月31日と2021年12月31日までの貸借対照表,および2022年12月31日までの2年間の毎年の関連経営報告書,株主権益(損失)と現金流量,および関連付記(総称して“財務諸表”と呼ぶ)を監査した。財務諸表は,すべての重要な面で,会社の2022年12月31日と2021年12月31日までの財務状況と,2022年12月31日までの2年度の経営結果とキャッシュフローを公平に反映しており,米国公認の会計原則に適合していると考えられる
持続的経営の不確実性
添付財務諸表の作成は、同社が引き続き経営を継続する企業であると仮定している。財務諸表付記1で述べたように、当社は運営により経常赤字および負キャッシュフローが発生し、追加融資に依存して運営資金を提供している。これらのことは、経営を続ける企業として存続する能力が大きく疑われている。付記1は、これらの事項に関する経営陣の計画も説明しています。財務諸表には、このような不確実性の結果による可能性のあるいかなる調整も含まれていません。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても不正であっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性について意見を述べるためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
2016年以来、当社の監査役を務めてきました。
/s/
2023年2月21日
| F-2 |
| カタログ表 |
DERMATA治療会社
(DERMATA Treateutics,LLC)
貸借対照表
|
| 十二月三十一日 |
| |||||
|
| 2022 |
|
| 2021 |
| ||
資産: |
|
|
|
|
|
| ||
現金と現金等価物 |
| $ |
|
| $ |
| ||
前払い費用と他の流動資産 |
|
|
|
|
|
| ||
総資産 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
負債と株主資本: |
|
|
|
|
|
|
|
|
負債: |
|
|
|
|
|
|
|
|
売掛金 |
| $ |
|
| $ |
| ||
負債その他流動負債を計上しなければならない |
|
|
|
|
|
| ||
総負債 |
|
|
|
|
|
| ||
引受金及び又は有事項(付記10参照) |
|
|
|
|
|
|
|
|
株主権益: |
|
|
|
|
|
|
|
|
普通株、額面$ |
|
|
|
|
|
| ||
追加実収資本 |
|
|
|
|
|
| ||
赤字を累計する |
|
| ( | ) |
|
| ( | ) |
株主権益総額 |
|
|
|
|
|
| ||
総負債と株主権益 |
| $ |
|
| $ |
| ||
付記はこれらの財務諸表の不可分の一部だ。
| F-3 |
| カタログ表 |
DERMATA治療会社
(DERMATA Treateutics,LLC)
運営説明書
|
| この年度までに 十二月三十一日 |
| |||||
|
| 2022 |
|
| 2021 |
| ||
運営費用: |
|
|
|
|
|
| ||
研究開発 |
| $ |
|
| $ |
| ||
一般と行政 |
|
|
|
|
|
| ||
総運営費 |
|
|
|
|
|
| ||
運営損失 |
|
| ( | ) |
|
| ( | ) |
他の収入や支出: |
|
|
|
|
|
|
|
|
利息純額 |
|
| ( | ) |
|
|
| |
純損失 |
| $ | ( | ) |
| $ | ( | ) |
5,221,156株1 Cシリーズ優先株を償還して配当とする(付記6参照) |
| $ |
|
| $ |
| ||
1 Dシリーズの転換可能な優先株式条項が改訂された場合は配当とみなされます(付記6参照) |
| $ |
|
| $ |
| ||
普通株主は純損失を占めなければならない |
| $ | ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
普通株は基本的に1株当たり純損失と希釈して1株当たり純損失 |
| $ | ( | ) |
| $ | ( | ) |
加重平均基本と希釈普通株式単位/株 |
|
|
|
|
|
| ||
付記はこれらの財務諸表の不可分の一部だ。
| F-4 |
| カタログ表 |
DERMATA治療会社
(DERMATA Treateutics,LLC)
株主権益表
|
| A類によく見られる |
|
| クラスBによく見られる |
|
| 第一選択シリーズ1 |
|
| 第一選択シリーズ1 a |
|
| 1 aシリーズ株式承認証 |
|
| 第一選択シリーズ1 b |
|
| 第一選択1 cシリーズ |
|
| 第一選択1 Dシリーズ |
|
| 優先株 |
|
| 優先株式証 |
|
| 普通株 |
|
| その他の内容 |
|
|
|
|
|
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 職場.職場 |
|
| 金額 |
|
| 株 |
|
| 額面.額面 |
|
| 株 |
|
| 額面.額面 |
|
| 株 |
|
| 額面.額面 |
|
| 支払い済み 資本 |
|
| 積算 赤字.赤字 |
|
| 合計する |
| |||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||||||||||||||||||
2020年12月31日残高 |
|
|
|
| $ |
|
|
|
|
| $ |
|
|
|
|
| $ |
|
|
|
|
| $ |
|
|
|
|
| $ |
|
|
|
|
| $ |
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ | ( | ) |
| $ | ( | ) | |||||||||||||||||||||||
1 Dシリーズ優先株発行済み |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
| ||||||||||
B類共通単位は没収された |
|
|
|
|
|
|
|
|
|
| ( | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
普通単位を普通株に変換する |
|
| ( | ) |
| $ | ( | ) |
|
| ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
| ||||||||
優先株を優先株に転換する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ( | ) |
| $ | ( | ) |
|
| ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
| ( | ) |
| $ | ( | ) |
|
| ( | ) |
| $ | ( | ) |
|
| ( | ) |
| $ | ( | ) |
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| - |
| |||||
株式証明書単位を優先株に転換する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
1 Cシリーズ優先株を償還する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ( | ) |
|
|
|
|
| $ | ( | ) |
優先株の普通株への転換 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
| ||||
優先株式証を普通株式承認証に転換する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| - |
| |
転換債券を普通株に転換する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
| $ |
| ||||
普通株式と権利証の発行、純発行コスト |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
| $ |
| ||||
株に基づく報酬 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ | 1,586,722 |
| |
純損失 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ | ( | ) |
| $ | ( | ) |
2021年12月31日の残高 |
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
|
|
| $ |
|
|
|
|
| $ | ( | ) |
| $ |
| ||||
普通株式と引受権証の発行は,発行コストを差し引く |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
|
|
|
|
|
|
|
|
| ||||
事前資本権証を行使する際に普通株式を発行する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
| - |
|
|
|
|
|
|
|
| |||
制限株式単位賞を授与する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
制限株式単位の転換時に普通株を発行する |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ |
|
|
| ( | ) |
|
|
|
|
|
| - |
| ||
株に基づく報酬 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
純損失 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| $ | ( | ) |
|
| ( | ) |
2022年12月31日の残高 |
|
| - |
|
| $ |
|
|
| - |
|
| $ |
|
|
| - |
|
| $ |
|
|
| - |
|
| $ |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ | - |
|
|
| - |
|
| $ |
|
|
| - |
|
| $ |
|
|
|
|
| $ |
|
|
|
|
| $ | ( | ) |
| $ |
| ||||||||||
付記はこれらの財務諸表の不可分の一部だ
| F-5 |
| カタログ表 |
DERMATA治療会社
(DERMATA Treateutics,LLC)
現金フロー表
|
| この年度までに 十二月三十一日 |
| |||||
|
| 2022 |
|
| 2021 |
| ||
経営活動のキャッシュフロー: |
|
|
|
|
|
| ||
純損失 |
| $ | ( | ) |
| $ | ( | ) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
|
|
株に基づく報酬 |
|
|
|
|
|
| ||
債務割引コストの償却 |
|
|
|
|
|
| ||
以下の点の変化により現金が増加/(減少) |
|
|
|
|
|
|
|
|
前払い費用と他の流動資産 |
|
|
|
|
| ( | ) | |
売掛金 |
|
| ( | ) |
|
|
| |
負債その他流動負債を計上しなければならない |
|
| ( | ) |
|
|
| |
経営活動で使用されている現金純額: |
|
| ( | ) |
|
| ( | ) |
資金調達活動のキャッシュフロー: |
|
|
|
|
|
|
|
|
普通株式と引受権証を発行して得られた金は,発行コストを差し引く |
|
|
|
|
|
| ||
前払い資金株式承認証を行使する際に普通株を発行して得られる収益 |
|
|
|
|
|
| ||
1 Cシリーズ優先株を償還する |
|
|
|
|
| ( | ) | |
債務を返済する |
|
|
|
|
| ( | ) | |
転換付属本券の純収益を発行する |
|
|
|
|
|
| ||
1 Dシリーズ優先株発行で得られたお金 |
|
|
|
|
|
| ||
融資活動が提供する現金純額: |
|
|
|
|
|
| ||
現金および現金等価物の純増加(減額) |
|
| ( | ) |
|
|
| |
期初現金及び現金等価物 |
|
|
|
|
|
| ||
期末現金および現金等価物 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
補足開示: |
|
|
|
|
|
|
|
|
利子を支払う現金 |
| $ |
|
| $ |
| ||
税金の現金を納める |
| $ |
|
| $ |
| ||
非現金融資活動: |
|
|
|
|
|
|
|
|
普通株と優先株及び株式承認証を普通株及び優先株及び株式承認証に変換する |
| $ |
|
| $ |
| ||
変換可能付属チケットを1 Dシリーズ優先単位に変換 |
| $ |
|
| $ |
| ||
1 Dシリーズの転換可能な優先株式条項の改訂後は配当とみなされます |
| $ |
|
| $ |
| ||
初回公開時に変換可能付属本券および受取利息を普通株に変換します |
| $ |
|
| $ |
| ||
初公開時に優先株を普通株に転換する |
| $ |
|
| $ |
| ||
付記はこれらの財務諸表の不可分の一部だ
| F-6 |
| カタログ表 |
DERMATA治療会社
(DERMATA Treateutics,LLC)
財務諸表付記
1.述べた組織と根拠
デマタ治療会社(以下、“会社”)は2014年12月に設立され、デラウェア州の有限責任会社(“有限責任会社”)で、名称はデマタ。2021年3月24日、同社は有限責任会社からデラウェア州のC社に変更され、デマータ治療会社と改称された。本財務諸表付記では、株式証券に言及するいずれかの“単位”は、転換前の持分証券を意味し、本財務諸表付記で言及されている“株式”または“株式”は、転換後の株式証券を意味する。同社は臨床段階のバイオテクノロジー会社で、医学や美容皮膚状況や疾患の治療に専念している。
初公募株
2021年8月17日、同社は初公募株式(IPO)を完了した
2021年8月の初公募の完了に関する状況は以下の通り
| - | 売り出す |
|
|
|
| - | 変換しました |
|
|
|
| - | ドルの換算 |
|
|
|
| - | 変換しました |
初めて公募した各購入者は1株の普通株と1部の引受権証を獲得し、普通株を購入し、合併発行価格は1ドルである
会社の普通株と引受権証はそれぞれナスダック株式市場に上場し、コードはそれぞれ“DRMA”と“DRMAW”であり、2021年8月に取引を開始する。
IPO後、優先株または優先株権証流通株はありません。最初の公募前に会社は
株を逆分割する
2021年7月1日、会社取締役会と株主が承認した会社登録証明書改正案に基づき、会社は20.5株1株の割合で会社普通株を逆分割した。逆分割のため,額面は調整されていない.財務諸表に含まれるすべての発行済み株式と発行済み普通株および1株当たりの金額は遡及調整されており、すべての列報期間のこのような逆株式分割を反映して、会社が発行した優先株の株式交換比率も調整されている。詳細については、付記6-持分証券を参照されたい。
| F-7 |
| カタログ表 |
流動性と持続的経営の不確実性
設立以来、同社はそのほとんどの資源を研究·開発活動に投入し、何の収入も生じず、いかなる候補製品も商業化していない。2022年12月31日現在、現金と現金等価物の合計は#ドル
歴史的にみると、同社の主要な現金源には、普通株と優先株の発行収益、債券発行の収益が含まれている。同社の現金の主な用途には、運営に使用される現金と支払い許可権が含まれる。同社は,将来の現金の主な用途は,持続的な運営,研究·開発への資金提供,臨床前研究と臨床試験および一般運営資金需要であると予想している。同社は、研究開発費の持続的な増加に伴い、運営と研究開発を維持するためにより多くの資金を調達する必要があると予想している。添付財務諸表の作成は、同社が引き続き経営を継続する企業であると仮定している。財務諸表には、当社が経営を継続できない可能性があることによる資産の回収可能性および分類または負債の金額および分類による将来の影響を反映するための調整は含まれていない。
経営陣は継続して経営を続ける企業として
経営を継続するためには、同社は追加の資本資源を調達する必要があるだろう。会社が経営から大量の現金を生成することができる前に、管理層が会社のためにそのような資源を得る計画は、会社の株式証券または債務の収益の発行、または製品開発、技術許可または協力に関する取引の収益を含む。経営陣は、十分な額の融資または協力協定の出所があれば、優遇条項で会社に提供することを保証することはできない。また、新冠肺炎の流行は引き続き発展しており、世界の金融市場を混乱させている。同社の追加資本調達能力は、世界経済状況の潜在的な悪化や最近の米国と世界各地の信用·金融市場の疫病による中断と変動の悪影響を受ける可能性がある。中断が続いたり深まったりすれば、会社は追加資本を得ることができないかもしれない
会社は普通株と引受権証の初公開で追加資本を調達したが、経営陣の現在の計画は、会社が経営を継続できるかどうかに対する多くの疑いを緩和していない。
陳述の基礎
添付財務諸表は、米国公認会計原則(“公認会計原則”)に基づいて作成される。公認会計基準に従って財務諸表を作成することは、財務諸表と付記中の報告の額に影響を与えるために、管理層に推定と仮定を要求する。実際の結果はこのような推定とは大きく異なるかもしれない。
2.主な会計政策の概要
予算の使用
同社の財務諸表は公認会計基準に基づいて作成されている。会社の財務諸表の作成は、管理層が資産、負債および費用報告金額に影響を与える推定および仮定を行い、財務諸表および付記に開示または資産および負債を有することを要求する。管理層は、計算すべき研究開発費用、株式に基づく報酬および権益ツールの推定公正価値に関する推定と判断を含むこれらの推定と判断を継続的に評価する。経営陣はその見積もり数を評価し続けている。当社はその当時の状況で合理的と考えられる様々な仮定に基づいて見積もりを出しています。異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある。
| F-8 |
| カタログ表 |
市場情報を細分化する
経営部門は企業の構成要素として定義され、その独立した離散情報は、首席経営意思決定者あるいは意思決定グループが資源をどのように分配するかを決定し、業績を評価する際に評価することができる。同社と同社の首席運営決定者は、1つの運営部門において会社の運営を見直してその業務を管理しており、この部門は医薬品の開発·商業化業務である。その会社は一つの細分化市場でしか運営されていない。
繰延融資コスト
同社は、このような融資が完了するまで、進行中の株式融資のいくつかの法律、会計、その他の費用とコストを資本化し、繰延発売コストとする。株式融資が完了すると、これらのコストは関連発行の追加実収資本の減少額として入金される。2021年8月に初公募を完了した後、約
現金と現金等価物
当社は連邦預金保険会社(“FDIC”)が保証している信用の良い金融機関に現金を預けています。この現金は小切手、現金掃除、そして通貨市場口座に存在する。時々、保有預金はFDICが提供する保険金額を超える可能性がある。同社は保険付き現金清算口座を維持しており、この口座では、主に小切手口座の現金を一夜明けて高流動性の短期投資に投資している。当社は購入日満期日が90日以下のすべての高流動性投資を現金等価物と見なしている。当社の現金及び現金等価物は何の損失も出ておらず、重大な信用リスクはないと信じています。
公正価値計量
当社は三級公正価値階層構造を採用し、当社の公正価値計量に使用する投入を優先順位付けした。これらのレベルは、アクティブ市場における同じ資産のオファーのような観察可能な入力として定義されるレベル1と、直接または間接的に観察可能なアクティブ市場のオファー以外の入力として定義されるレベル2と、市場データが少ないかないか、したがって、エンティティが自分の仮定を作成する必要がある観察不可能な入力として定義されるレベル3とを含む。同社の現金清掃口座は、見積もりが活発で観察可能な市場で利用可能であるため、一級とされている。当社は,これらの金融商品の短期満期日により,現金と現金等価物,売掛金,売掛金の帳簿価値がその推定公正価値に近いと考えている。
特許費用
米国や他の国で特許保護を取得·維持することに関する特許コストは,発生時に費用を計上する。特許費用は一般費用と行政費用に分かれています
研究と開発
研究·開発コストには,会社の候補製品開発に関する費用が含まれている。この等の支出には,契約研究機関との合意による支出,製造及び供給規模拡大支出,臨床前及び臨床試験供給品の購入及び製造のコスト,アウトソーシング実験室サービス(当社の研究開発活動を支援するための材料及び用品を含む),商業価値が証明されていない許可費及びマイルストーンのための金が含まれている。このような費用は費用が発生した期間内に費用を計上する。ライセンス技術の事前支払いおよびマイルストーン支払いは、発生したとき、またはマイルストーンが達成可能であるか、または達成可能であることが決定されたときに研究および開発支出として使用される。将来的に受信される研究および開発活動のための貨物またはサービスの前払いは、前払い費用として記録され、関連する貨物またはサービスを受信したときに支出される
| F-9 |
| カタログ表 |
所得税
設立から2021年3月24日まで、会社は有限責任会社の形で運営され、共同企業として納税する。したがって、その日までの任意の所得税債務または利益は会社のメンバーに計上されなければならない。2021年3月24日以来、同社はC社として運営されており、貸借対照法に基づいて所得税を計算しており、この方法は、財務諸表に含まれる事件の予想される将来の税収結果の繰延税金資産および負債を確認することを要求している。この方法によると、繰延税項資産及び負債は、財務諸表と資産及び負債の税ベースとの差額に基づいて、予想差額を用いて返送される年度の現行税率を決定する。税率変動が繰延税金資産や負債に及ぼす影響は、公布日を含む期間の収入で確認されている。
会社が繰延税項目純資産の範囲を確認したのは、会社はこれらの資産がより現金化する可能性があると考えていることだ。このような決定を下す際には、管理層は、既存の課税の一時的な差の将来逆転、将来の課税収入の予想、税務計画戦略、最近の経営の結果を含む、利用可能なすべてのプラスおよび負の証拠を考慮する。経営陣が当社が将来その記録純額を超える繰延税金資産を実現できると判断した場合、管理層は繰延税金資産の推定値を調整し、所得税の支出を減らすことになる。
当社は、(1)経営陣が税務倉庫位の技術的優位性に基づいて、より税務倉位を維持する可能性があるかどうかを決定すること、および(2)確認のハードルに達する可能性の高い税務倉位について、管理層は、関連税務機関と最終的に和解を達成する際に実現可能な最大税収割引額の50%以上を確認する、2ステップに分けた手続きに基づいて不確定な税務倉位を記録する。同社は所得税支出で未確認の税収割引に関する利息と罰金を確認した。どんな課税利息と罰金も関連された納税義務に含まれている。
株に基づく報酬
2021年3月、会社取締役会と株主は“2021年総合持分インセンティブ計画”(“2021年計画”)を採択した。2021年計画に基づいて付与された株式オプションについて、会社は、必要なサービス期間内に直線法を用いて確認された推定公正価値に基づいて、従業員、取締役、非従業員に支給されるすべての株式に基づく報酬の補償費用を計量·確認する。従業員に付与された普通株式オプション購入の公正価値は,授与日にBlack−Scholes推定モデルを用いて推定した。株式報酬費用を計算する際には、会社はブラック·スコアモデルで使用されている変数に対して、株式報酬の期待期限、標的普通株の予想変動率、配当率、および無リスク金利を含むいくつかの仮定と判断を行う必要がある。没収は発生期間に計上して没収する.2021年計画により付与された制限株式単位(“RSU”)は、付与日に普通株の公正価値を計量し、それに応じた補償費用を必要なサービス期間内に比例して確認する。追加的な議論のために付記7-持分インセンティブ計画を参照してください
総合損失
総合損失には,計上期間の純損失とその他の総合収益(損失)が含まれる。当社は損益などの他の総合収益(赤字)プロジェクトを実現していないため、2022年12月31日および2021年12月31日までの年度で、総合損失は純損失に等しい。
| F-10 |
| カタログ表 |
1株当たり普通株/株純損失
2021年3月24日、同社は有限責任会社からC社に転換した。転換時には、発行された普通株と優先株ごとに1株の普通株と優先株に変換する。普通株式は転換時に発行された普通株と類似した権利と特徴を持つ。1株当たり純損失を計算する際には、当社は転換前に発行された普通株数に転換の影響を遡及的に適用する。シー社に転換する前の一株当たりの純損失とは普通株あたりの純損失のことです。
単位/株式あたりの基本純損失の計算方法は、普通株式保有者または株主が純損失を期間中の既発行単位または株式の加重平均で割るべきであること、関連する普通株を交付する条件として将来サービスを必要としないこと、または発行可能制限株式単位があること、およびその行使は交付株式(総称して“基本株式”と総称する)に対して名目対価格を行う必要があるため、普通株または株式等価物の事前資本権を考慮する必要がない。単位または1株当たりの純損失は、当期発行済み普通株または発行済み株式等価物の希釈効果から発行済み基本株式を調整することにより算出される。償却単位または株式純損失の計算については、優先単位または株式、利益権益および購入優先単位または株式の引受権証は普通株または株式等価物とみなされるが、その影響が逆償却であれば、1株当たりの普通株または株式を計算する希薄純損失には含まれない
会社は本報告期間の純損失を報告しているため、希釈後の1株当たり普通株または普通株純損失は、本報告期間の1株当たり普通株または普通株の基本純損失と同じである
|
| 十二月三十一日までの年度 |
| |||||
|
| 2022 |
|
| 2021 |
| ||
|
|
|
|
|
|
| ||
純損失 |
| $ | ( | ) |
| $ | ( | ) |
5,221,156株1 cシリーズを優先株に転換可能な場合の配当金とする |
| $ |
|
| $ |
| ||
1 Dシリーズの転換可能な優先株式条項の改訂後は配当とみなされます |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
普通株主は純損失を占めなければならない |
| $ | ( | ) |
| $ | ( | ) |
|
|
|
|
|
|
|
|
|
1株当たりの普通株の基本と償却純損失 |
| $ | ( | ) |
| $ | ( | ) |
加重平均基本と希釈普通株式単位/株 |
|
|
|
|
|
| ||
普通株式または普通株等価物は、1株当たりの普通株または普通株の償却純損失を計算するには含まれていないが、将来的に1株当たりの基本収益を希釈する可能性があるのは以下のとおりである
|
| 12月31日まで |
| |||||
|
| 2022 |
|
| 2021 |
| ||
|
|
|
|
|
|
| ||
普通株式オプション |
|
|
|
|
|
| ||
普通株式引受証 |
|
|
|
|
|
| ||
潜在的希薄化証券総額 |
|
|
|
|
|
| ||
最近採用された会計公告
2022年12月31日までの年度内に、会社は最新の会計基準を審査しており、将来的に最近発表された会計声明を採用することは会社の財務状況や経営業績に大きな影響を与えないと予想される
| F-11 |
| カタログ表 |
3.資産負債の表示が細かい
以下は、いくつかの貸借対照表の詳細を提供する
|
| 12月31日まで |
| |||||
|
| 2022 |
|
| 2021 |
| ||
|
|
|
|
|
|
| ||
前払い費用と他の流動資産 |
|
|
|
|
|
| ||
前払い保険 |
| $ |
|
| $ |
| ||
研究開発費を前払いする |
|
|
|
|
|
| ||
前払いその他 |
|
|
|
|
|
|
| |
受取利息 |
|
|
|
|
|
|
| |
繰延発売コスト |
|
|
|
|
|
| ||
前払い費用とその他の流動資産総額 |
| $ |
|
| $ |
| ||
|
|
|
|
|
|
|
|
|
負債その他流動負債を計上しなければならない |
|
|
|
|
|
|
|
|
研究と開発コストを計算すべきである |
| $ |
|
| $ |
| ||
報酬と福祉に計上すべきである |
|
|
|
|
|
| ||
その他の措置を講じる |
|
|
|
|
|
|
| |
負債およびその他の流動負債総額を計算しなければならない |
| $ |
|
| $ |
| ||
4.付属変換可能チケット
同社は2020年7月と10月に$を発行した
2021年1月27日、当社は手形条項を改訂し、発行された転換可能な本チケットの最高金額を
2021年3月に、当社は債券条項をさらに改訂し、債券を1 Dシリーズ優先株購入者と同じ価格で1 Dシリーズ優先株に転換することを許可した。2021年3月15日までにドル
当社は上記2021年3月に付記に対する改訂を重大な改正と考えており、会計基準編纂(“ASC”)470-50-40-10に基づいて会計処理を終了する必要がある。手形再買付価格の独立推定値によると、再買付価格と改訂直前の手形帳簿純値との差額は財務諸表に大きな影響を与えない。
| F-12 |
| カタログ表 |
当社の2021年8月の初公募については,債券の未償還元金および応算利息を合わせて$とした
同社は2022年12月31日と2021年12月31日現在、未返済の本票を持っていない
5.長期債務
二零一七年二月、当社は珪谷銀行(“SVB”)と融資及び保証協定を締結したが、SVBは2ロットに分けて当社に定期融資を提供することに同意した。最初の$
融資·担保協定については、SVBは2017年2月9日以降と2027年2月9日までのいつでも購入した引受証単位を受け取っている
2019年6月に、当社はSVBと融資及び担保協定第一修正案を締結し、この等の改正により、当社が2019年12月1日までにいくつかの資本マイルストーンに達しなかった場合、定期ローン元金支払いは2019年12月21日から2020年5月1日に延期され、繰延元金支払いは月平均分期で支払うことになり、また、当社は2020年6月1日に定期融資満期日2021年2月9日まで元金の支払いを開始する予定である。また、これらの元金が6ヶ月延期された場合、払い戻しできない修正費は#ドルとなる
払い戻しできない改修費$
2021年1月と2月、会社は最後の元金#ドルを支払った
同社には2022年12月31日と2021年12月31日までの長期未返済債務がない。
6.持分証券
普通株と優先株
2021年3月24日、会社はデラウェア州の法律に基づいて有限責任会社をデラウェア州のC社に変換する転換計画(“転換”)を制定した。転換過程で、有限責任会社の全額支払いされた優先株と普通株は同数の会社優先株と普通株に変換され、1株当たりの額面価値は0.0001ドルであった。発行された株式は、変換前単位が享受すべき同じ権利、特典、および特権を有する。本財務諸表付記における権益証券を“単位”と呼ぶ任意の提案法は、転換前の権益証券を意味するが、本財務諸表付記における“株式”または“株”への任意の言及は、転換後の権益証券を意味する。
| F-13 |
| カタログ表 |
2021年7月1日、会社取締役会と株主が承認した会社登録証明書改正案に基づき、会社は20.5株1株の割合で会社普通株を逆分割した。逆分割のため,額面は調整されていない.財務諸表に含まれるすべての発行済みおよび発行された普通株式および1株当たりの金額は、すべての列報期間の逆分割を反映するように遡及的に調整されている。
2021年8月17日、会社は初公募株を完成し、その中で
2021年8月の初公募の完了に関する状況は以下の通り
| - | 売り出す |
|
|
|
| - | 変換しました |
|
|
|
| - | ドルの換算 |
|
|
|
| - | 変換しました |
IPO後、優先株または優先株権証流通株はありません。最初の公募前に会社は
2022年4月25日、同社は私募(“パイプ”)を終了し、同私募で販売した
その会社の発行済み株式と発行済み普通株式の総数は
シリーズ1第一選択ユニット
会社は2014年12月8日に設立されて2016年まで発行された
| F-14 |
| カタログ表 |
シリーズ1 a第一選択コンポーネント
2016年、当社は発行しました
1 bシリーズ第1選択コンポーネント
2018年、当社は発行しました
1 cシリーズ第一選択コンポーネント
2019年6月14日、会社はドルへの参加を終了した
2019年6月、
会社の1 cシリーズ優先株は2021年第1四半期に優先株に転換した。また、2021年8月、同社はすべての優先株を普通株に転換した。シリーズ1 c第一選択ユニットが完成していないのは、2022年12月31日と2021年12月31日までである。
シリーズ1 D第1選択コンポーネント
2021年3月、当社は発表
A類公共単位
2014年から2015年の間に会社は
B類公共単位
その会社は所有している
| F-15 |
| カタログ表 |
清算優先権
当社が2021年8月に初公募するまで、当社の優先株は本書類に記載されている清算特典に制限されなければなりません。流動資金事件が発生した場合にA系列優先株が償還されていない限り、任意の流動資金活動収益は、まず、1 D系列優先株が清算中に1 C系列優先株の2倍の優先株を有し、その後、1 C系列優先株が満たされた後、1 c、1 b、1 a系列優先株とともに参加するように割り当てられる。第2に、1 cシリーズ優先株保有者に支払う収益は、その1 cシリーズ投資の2倍をカバーするのに十分であり、第3に、1 cシリーズ、1 aシリーズ、1 bシリーズ、1 cシリーズおよび1 dシリーズ優先株保有者に支払う収益は、利息を支払うのに十分であり、金利は
転換権
当社が2021年8月に初公募するまで、当社の優先株は本協定に記載されている株式交換権利の規制を受けなければなりません。会社がAシリーズの優先株を初めて発行したとき各シリーズ1の好ましいユニットおよび各シリーズ1 aの好ましいユニット、各シリーズ1 bの好ましいユニット、各シリーズ1 cの好ましいユニット、および各シリーズ1 dの好ましいユニットは、変換日にシリーズ1の好ましいユニット、シリーズ1 aの好ましいユニット、シリーズ1 bの好ましいユニット、シリーズ1 cの好ましいユニットまたはシリーズ1 dの好ましいユニットの単位値の合計を0.80で割った積に、変換日に発行されたシリーズ1の好ましいユニット、シリーズ1 aの好ましいユニット、シリーズ1 bの好ましいユニット、シリーズ1 cの好ましいユニット、またはシリーズ1 Dの好ましいユニットの単位値を乗じたものに等しい。1系列優先株及び1 a系列優先株及び1 b系列優先株、1 c系列優先株及び1 d系列優先株を転換した後、第1シリーズ優先株及び1 a系列優先株及び1 b系列優先株及び1 c系列優先株及び1 d系列優先株に発行されるAシリーズ優先株、1 bシリーズ優先株及び1 cシリーズ優先株及び1 Dシリーズ優先株は、自社が転換日に発行した他のAシリーズ優先株と同様の権利、特権及び優先権を有することになる。当社は優先株の分類を考慮し,各優先株が制御権変更時に受け取った同じ形式の対価に関与しているため,株式構成要素に適切に計上されていると結論した。2022年12月31日と2021年12月31日現在、未償還の優先株または株はない。
| F-16 |
| カタログ表 |
株主合意
2021年3月24日,Demata Treateuticsについて,LLCはデラウェア州の会社に変更され,同社はProehl Investment Ventures,LLCとHale Biophma Ventures,LLCを含むすべての当時の株主と株主合意(改訂後の株主合意)を締結した。株主合意(当社の株式譲渡について若干の制限を含む)は、株主側が保有する自社株株式について、どのように当社の買収について議決または入札締結合意および了解を行い、取締役選挙のいくつかの投票権について規定する。また、株主合意に基づいて、当社1 a系列優先株の保有者は、2026年3月14日までの任意の時間に自社1 a系列優先株の株式数を購入する権利があり、当該1 a系列優先株株主は、1 a系列優先株の株式総数が、当該1 a系列株主が当時保有していた1 a系列優先株(又は1 a系列優先株式証)の株式総数の25%の積を超えないことを要求しなければならない。いずれの1 a系列優先株式証により購入された1 a系列優先株の株1株当たりの買い取り価格は$である
2021年6月29日、会社取締役会は、2021年7月1日から会社登録証明書を改訂し、会社が発行した1 Dシリーズ優先株の転換価格とある転換メカニズムを調整し、これにより、1 Dシリーズ優先株の1株当たり株を普通株数に変換し、(I)(A)1 Dシリーズ優先株の元発行価格に(B)1.2を乗じ、最も近い整数分、(Ii)IPOで初めて公開発行された1株発行価格の80%を四捨五入する。シリーズ1 D変換は、任意の株式分割によってさらに調整されてはならない。
2021年6月29日、会社取締役会は2021年7月1日から、2021年計画に対する修正案を承認し、発行可能な普通株式数を
2021年6月29日会社取締役会は
2021年7月12日、会社取締役会は会社登録証明書を修正し、会社が発行·発行した1 Dシリーズ優先株の転換価格といくつかの転換メカニズムをさらに調整した。1 Dシリーズ優先株転換条項の2つの改正は、改訂を計算するために統合された。この等の改訂が1 Dシリーズ優先株の改訂或いは終了を招くかどうかを確定するために、当社は関連する権威の指針に基づいて、独立第三者評価会社を招聘して、転換条項の変更前及び転換条項の変更直後の1 Dシリーズ優先株の公正価値を決定することに協力した。これにより公正価値が大幅に増加したため、当社は改正により会計清算を招いたと認定した。したがって、会社は、適切な計量および列記を決定するために、ASC 260(1株当たり収益)およびASC 470(債務)を適用して類推する
当社は2021年7月30日に、ライセンス及び和解協議の第2回改訂(又は第2次ライセンス改訂)を締結し、これにより、ライセンス契約下で生じるいくつかの論争を解決するために、Villani,Inc.(“Villani”)が保有する1 Cシリーズ優先株株式を交換し、ライセンス契約に基づいてVillaniに支払われるべきマイルストーン支払い及び特許権使用料の増加と引き換えに交換することに同意した。2021年7月30日、ヴェラニは降伏した
| F-17 |
| カタログ表 |
2021年8月14日、会社取締役会は会社登録証明書の改正案を可決し、普通株を許可する株式数を9000万株に増加させた。
2022年7月11日、会社は、会社の普通株式の法定株式数を増加させるために、会社が改訂·再登録した登録証明書(“登録証明書”)の改訂証明書(“改訂証明書”)をデラウェア州州務卿に提出した
株式承認証
IPO時に発行された引受権証
2021年8月17日、会社は初公募株を完成し、その中で
当社は,初公開発売時に発行された引受権証の条項を評価し,ASC 480(負債と権益を区別する)およびASC 815(デリバティブツールおよびヘッジ)が提供する会計指針に基づいて,この等持分証を権益ツールに分類することを決定した。当社は株式証明書が持分分類に属することを確定したため、当社は初公募で得られた金(発行コストを差し引いた)を普通株に記入し、得られた金額の残高を追加実収資本に記入する。株式承認証1部当たり2021年8月17日の公正価値は$
2022年12月31日現在、未償還株式証は行使可能
2022年12月31日までに会社は
引受業者IPO株式承認証
2021年8月に当社初の公募が完了した後、当社は引受業者に引受権証を発行します
2022年12月31日までに会社は
B類一般単位と一緒に発行された引受権証
2021年3月、会社はB類一般単位利益権益をある元従業員とコンサルタントに付与した。有限責任会社からC-Corporationに転換する過程で、同社は転換した
| F-18 |
| カタログ表 |
2022年12月31日までに会社は
1 a系列優先株発行に伴う引受権証
2016年11月に発行された5,000,000台1 aシリーズ優先株については、1 a系列優先メンバーが2016年11月15日以降と2021年11月15日までのいずれかの時期に会社から引受単位を取得し、1 a系列優先株メンバーが要求すべき1 a系列優先株数を取得し、
融資·担保協定については、SVBは2017年2月9日以降と2027年2月9日までのいつでも購入した引受証単位を受け取っている
2021年7月、会社は20.5株1株の割合で会社普通株株式の逆分割を行い、優先株の株式交換比率も調整した。2021年8月、会社初公募に関連して、未発行の1 aシリーズ優先証を転換
2022年12月31日までに会社は
PIPEとともに発行された一般権証と事前出資株式証
2022年4月、同社はパイプを完成させ、その中で販売した
2022年6月30日までの四半期で、87.5万件の事前出資の引受権証を行使した。2022年9月30日までの四半期内に
2022年12月31日までに会社は
| F-19 |
| カタログ表 |
7.持分インセンティブ計画
会社の“2021年総合株式激励計画”(“2021年計画”)によると、会社は会社の従業員、取締役、コンサルタントに普通株の購入、制限的な株式奨励、業績株奨励、インセンティブ配当奨励、その他の現金奨励或いは直接普通株を発行するオプションを付与することができる
2022年1月1日から、会社の2021年計画に含まれる常青樹条項は、2021年計画によって発行可能な普通株式総数を増加させ、金額は会社が2021年12月31日までに発行した普通株の1%に相当する。この常緑樹条項は追加的な
2022年12月31日までに追加のものがあります
公正価値計量
同社は、株式の報酬に基づく公正な価値を決定するために、高度な主観的仮定を使用することを要求するブラック·スコアーズオプション推定モデルを使用している。各従業員の株式オプションの公正価値は、付与日に公正価値法に基づいてBlack-Scholesモデルを用いて推定される。その後、各株式オプションの推定公正価値は、通常、帰属期間である必要なサービス期間内に支出される。同社がブラック·スコアズモデルで使用した仮説と推定は以下のとおりである
| ·
| 普通株は価値を公平にする。会社株式オプション計画の基礎となる普通株の推定公正価値は、以下に述べるように、管理職が様々な要因を考慮して決定される。会社普通株を購入するすべてのオプションは、付与日のこれらのオプションに関連する会社普通株の公正価値を下回らない1株当たり価格で行使することができる。会社普通株が公開取引市場を有していない場合には、初公開前に、授与日毎に、会社が付与日に知っている情報に基づいて、最近発生した任意の事件及び普通株1株当たりの公正価値の潜在的影響及び一部の独立第三者評価会社からの投入を審査した上で、その普通株の公正価値を推定する。会社が株式を初公開した後、普通株の公正価値は、会社普通株の付与日の終値で計量される。 |
|
|
|
| · | 無リスク金利です。同社がBlack-Scholes推定モデルで使用している無リスク金利は、米国債ゼロ金利債券の暗黙的収益率に基づいており、その期限はオプションの予想期限と同じである |
|
|
|
| · | 期限を見込む。予想期間は、会社が株式に基づく奨励予想未償還期間を代表する。非上場企業として当社の普通株を売却または譲渡する制限により、当社の従来の行使モデルは、上場企業として経験するモデルを代表していないと考えられています。同社は、上場企業として十分な取引履歴を持つまで、SAB 110簡略化方法を使用し続ける予定である |
| · | 波動性。その普通株価格の取引履歴が限られているため、当社は業界同業者の歴史波動性に基づいて価格変動性を決定した。業界の同業者は生物技術業界のいくつかの上場会社から構成され、これらの会社は類似した特徴を持っており、臨床試験の進展と治療適応を含む |
|
|
|
| · | 配当収益率。期待配当金の仮定は、会社が現在その期待配当政策に対する期待に基づいている。これまで、会社は普通株主に何の配当も発表していなかったため、会社が使用した期待配当率はゼロだった。 |
| F-20 |
| カタログ表 |
次の表に、株式オプション付与のための加重平均仮定を示す
|
| 十二月三十一日までの年度 |
| |||||
|
| 2022 |
|
| 2021 |
| ||
付与日公正価値 |
| $ |
|
| $ |
| ||
無リスク金利 |
|
| % |
|
| % | ||
配当率 |
|
| % |
|
| % | ||
所期寿命 |
|
|
|
|
|
| ||
予想変動率 |
|
| % |
|
| % | ||
株に基づく報酬費用
一般に、株式報酬は、株式報酬を得た従業員、取締役、コンサルタントに支払われる現金給与の分類に基づいて、研究開発費または一般および行政費用に割り当てられる
2021年3月24日、有限責任会社からC-Corporationへの転換の過程で、同社は
2021年12月、会社取締役会は、現金ボーナスの代わりに、会長兼最高経営責任者に株式オプションを付与することを許可した。株式オプション付与に関連する40万ドルの株式報酬支出は2021年12月31日現在の会計年度に計上されているが、追加実収資本への影響は2022年第1四半期の株式オプション付与時まで計上されていない
次の表は、会社の経営報告書に含まれる株式オプションとRSUに関する株式報酬支出総額をまとめたものである
|
| 12月31日まで |
| |||||
|
| 2022 |
|
| 2021 |
| ||
研究開発 |
| $ |
|
| $ |
| ||
一般と行政 |
|
|
|
|
|
| ||
|
| $ |
|
| $ |
| ||
2022年12月31日現在、株式オプションに関する未確認報酬コスト総額は約1億ドル
| F-21 |
| カタログ表 |
株式奨励活動
会社株計画株式オプション活動の概要は以下のとおりである
|
| 未完了オプション数 |
|
| 加重平均行権値 |
|
| 加重平均残契約期間(年) |
| |||
2021年12月31日の残高 |
|
|
|
| $ |
|
|
|
| |||
付与したオプション |
|
|
|
|
|
|
|
|
| |||
行使のオプション |
|
| - |
|
|
|
|
|
| - |
| |
オプションはキャンセルされました |
|
| - |
|
|
|
|
|
| - |
| |
2022年12月31日の残高 |
|
|
|
| $ |
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
2022年12月31日に行使可能なオプション |
|
|
|
| $ |
|
|
|
| |||
2022年12月31日までに行使可能なオプションの内的価値合計は、対象オプションの行権価格とその日の会社普通株終値との差額、すなわちドルを計算する
2022年12月31日現在、株式オプションに関する未確認報酬コスト総額は約
制限株式単位奨励活動
同社の持分計画制限株式単位(RSU)奨励活動の概要は以下の通りである
|
| 量 RSUの素晴らしさは |
| |
2021年12月31日の残高 |
|
| - |
|
承認済みRSU |
|
|
| |
決済済みRSU |
|
|
| |
RSUをキャンセルしました |
|
| - |
|
2022年12月31日の残高 |
|
| - |
|
当社は2022年12月31日までに年度中に発送します
8. 401(k) Plan
同社は条件を満たすすべての従業員に401(K)貯蓄計画を提供している。会社は従業員の延期と補償に基づいて従業員口座に割り当てられた計画に対して適宜のマッチング支払いを行うことができる。今まで、会社は貯蓄計画に相応の貢献をしていなかった。
| F-22 |
| カタログ表 |
9.ライセンス契約
二零一七年三月三十一日、当社はVillani,Inc.と改訂されたライセンス契約(“ライセンス契約”)を締結し、これにより、Villaniはライセンス特許(定義ライセンス契約)に基づいて、以下の成分を含む製品の制定、開発、求め、規制機関の承認、製造、販売を求めるために、当社に独占的、再許可及び使用料を徴収する許可(“許可”)を付与した湖のスポンジ(単独でまたは他の活性または不活性成分と組み合わせて使用する)ざ瘡、酒かす鼻、乾癬、アトピー性皮膚炎、脂漏性皮膚炎、光化性角化症および湿疹を含むが、許可された特定の技術(“許可された製品”)を使用して開発された疾患、障害および皮膚状態を治療するためのものである。同社は開発(製造、包装、非臨床研究、臨床試験を含み、監督部門の承認と商業化(マーケティング、普及、流通などを含む))を担当している。すべての許可された製品に適用される。ライセンスの一部対価格として、会社は以前ヴィラニに提供した未返済ローン#ドルを免除した
最初のライセンス契約は2019年に改正され、いくつかのノウハウや特許を受けたことを考慮して、会社はVillaniに発行した
2021年7月30日、会社はさらに“許可·決済協定第2改正案”(以下、“第2改正案”)における許可協定を改正した。第2の修正案を考慮してヴェラニは交換しました
10.支払いの引受およびまたは事項
コロナウイルスが大流行している
2020年3月11日、世界保健機関は新型コロナウイルス(新冠肺炎)の大流行を発表した。緊急声明、運営不能、従業員不足、業務中断保険クレームなどにより、業務閉鎖や政府が活動停止を命じた重大な不確実性が生じる可能性があります。これらの事項のいずれも、会社の将来の業績に大きな影響を与える可能性があります。
仕入先協定
ロシアのウクライナ侵攻により、米国、イギリス、EUなどの政府は、ロシア個人と実体に対する一括調整制裁と輸出規制措置を制定した。その会社は現在独占的な供給協定の一方であり,その協定は供給されているスポンジ.スポンジDMT 310およびDMT 410のための原料。この供給協定の相手側はロシアの実体だ。米国、イギリスおよび/またはEUは、ロシアおよびロシア実体との取引に対して強化された輸出規制および経済制裁を実施し、当社が既存の契約または締結可能な任意の将来の契約を履行することを阻止するか、または当社のサプライヤーから購入した原材料の送金を阻止する可能性がある。同社は2022年度にサプライヤーから2ロットの原材料を受け取り、その中に追加数量を含むスポンジ.スポンジ当社は十分な原材料を提供すると信じていますスポンジ.スポンジ中から重度のざ瘡に対する2つの第3段階研究の開始と完了を支持し、2つの第3段階研究の成功後にざ瘡を治療するDMT 310に対する新薬申請を提出することを支持する。ロシアに対して実施される可能性のある新しい制裁または輸出規制の程度と広さによると、そうでなければ、あるいはウクライナ戦争の影響で、同社は追加供給を受けるスポンジ.スポンジDMT 310およびDMT 410によって使用される原材料は、負の影響を受ける可能性があり、これは、そのトラフィック、運営結果、および財務状態に悪影響を及ぼす可能性がある。
| F-23 |
| カタログ表 |
法律訴訟
通常業務の過程で、当社は法的訴訟に巻き込まれたり、法的訴訟の脅威にさらされたりする可能性があります。当社は、いかなる法的手続きにも関与していないし、その財務状況、経営業績、流動資金に重大な悪影響を及ぼすことが予想される法的手続きの脅威には関与していません
11.関連先
会社が2021年3月に有限責任会社からC社に転換する前に、会社には2人の管理メンバーがいた。当社の初公募終了時には、管理メンバーの一人が依然として当社の大株主であり、当社の最高経営責任者兼取締役会長を務めています。もう一人の管理メンバーは、当社の初公募終了時も実益所有者であり、当社取締役会の先頭取締役を務めている。以下,この2人の管理メンバとその関連会社をIPO完了後に総称して主要株主と呼ぶ
2020年以内に、管理メンバーおよびその他の関係者が当社に$を貸します
2021年第3四半期、当社は6-持分証券に付記されているように、1 Dシリーズ優先株の転換条項を改訂した。1 Dシリーズ優先株改訂の結果として、同社は約#ドルの配当金を提案した
12.所得税
歴史的に、同社は連邦および州所得税目的のために組合企業の形で所得税申告書を提出する直通実体によって運営されている。したがって、当社はアメリカ連邦や州所得税を支払う必要がありません。関連税金の結果はメンバーによって報告されています。2021年3月、会社は有限責任会社から会社に変更されたため、米国連邦や州税収の目的のために、会社は実体レベルで課税した
所得税の計上と米国連邦法定会社の税率を用いて計算された所得税との間の入金は以下の通りである
|
| 締切り年数 十二月三十一日 |
| |||||
(単位:千) |
| 2022 |
|
| 2021 |
| ||
アメリカ連邦法定所得税率 |
| $ | ( | ) |
| $ | ( | ) |
恒久的な違いや他の違いは |
|
|
|
|
|
| ||
株に基づく報酬費用 |
|
|
|
|
|
| ||
研究開発単位 |
|
| ( | ) |
|
| ( | ) |
推定免税額 |
|
|
|
|
|
| ||
総税額を支出する |
|
|
|
|
|
| ||
会社の繰延税金純資産の重要な構成要素は以下の通りである
|
| 12月31日まで |
| |||||
(単位:千) |
| 2022 |
|
| 2021 |
| ||
純営業損失が繰り越す |
| $ |
|
| $ |
| ||
研究開発が盛んになっている |
|
|
|
|
|
| ||
資本化研究と開発 |
|
|
|
|
|
| ||
株に基づく報酬費用 |
|
|
|
|
|
| ||
無形資産 |
|
|
|
|
|
| ||
その他、純額 |
|
|
|
|
|
| ||
繰延税項目総資産 |
|
|
|
|
|
| ||
減算:推定免税額 |
|
| ( | ) |
|
| ( | ) |
繰延税金資産総額 |
| $ |
|
| $ |
| ||
| F-24 |
| カタログ表 |
会社はすでにその繰延税金資産のために全額推定準備金を構築しており、不確定要素が会社がこのような資産を現金化するのに十分な課税収入を生成する可能性が高いためである。経営陣は、既存の繰延税金資産を利用するために、将来十分な将来課税収入が生じるかどうかを推定するために、既存のプラスおよび負の証拠を評価する。評価の重要な客観的否定的証拠は成立以来発生した累積損失だ
これらの客観的証拠は、例えば会社の将来成長の予測など、他の主観的証拠を考慮する能力を制限する。この評価によると、2022年12月31日現在、手当は#ドルとなっている
2022年12月31日現在、同社の連邦純営業損失繰越またはNOL利用可能額は1ドルとなっている
2022年12月31日まで、同社は連邦と州の研究開発税の繰越免除を持っており、利用可能な金額は$です
規則第382節の要求により、累積所有権変更が発生または将来発生すれば、会社NOLと研究開発信用繰越の使用は重大な年度制限を受ける可能性がある。一般的に、“基準”の定義によると、所有権変更は、3年以内の一回または一連の取引のため、ある株主または公衆団体が会社が発行した普通株式の所有権変更が50%を超えることになる。このような所有権変更は、毎年それぞれ未来の課税収入と税収を相殺するために使用できる純資産と研究開発信用繰越金額を制限する可能性がある。当社は守則第382条に基づいて当該等所有権変更分析を完了していないため、当該等繰延税金資産の現金化が最高敷居要求に達していないことについて全額評価準備を設けている。所有権が変化した場合、または将来的に変化した場合、将来の課税所得額および所得税費用を相殺するために使用されることができる残りの税金属性繰越金額は、制限またはキャンセルされる可能性がある。相殺されれば、関連資産は繰延税金資産から除外され、推定免税額はそれに応じて減少する。推定免税額の存在により、将来の所有権変更による制限は当社の実際の税率に影響を与えません
当社は税務機関の審査後に不確定な税務状況を維持する可能性が高い場合には、その不確定税務状況からの税務利益を確認します。当社が予想していた未確認の税務割引は今後12ヶ月以内に大きな変化はありません。また、推定免税額の存在により、法人が税収割引の将来の変化を確認していないことは実際の税率に影響を与えない
| F-25 |
| カタログ表 |
以下の表は、会社が税優遇総額に関する活動を確認していないことをまとめており、これらの活動は、記載期間の期間初めと期末にまとめられている
|
| 締切り年数 十二月三十一日 |
| |||||
(単位:千) |
| 2022 |
|
| 2021 |
| ||
未確認税利期初め残高 |
| $ |
|
| $ |
| ||
本年度に関連する納税状況に基づいて計算される増加額 |
|
|
|
|
|
| ||
数年前の納税状況を増やす |
|
|
|
|
|
| ||
先日の減税状況 |
|
|
|
|
|
| ||
税収割引期間末残高は確認されていません |
| $ |
|
| $ |
| ||
未確認の税収割引額は、会社繰延税金資産の決定に反映される。これらすべての金額は、繰延税金資産推定値準備の同等の調整によって相殺されるため、当社の実際の税率に影響を与えないことが確認された。同社は税収割引を確定していない負債は今後12カ月以内に大きな変化はないと予想している
当社の政策は、所得税支出において所得税事項に関する利息及び/又は罰金を確認することです。2022年12月31日又は2021年12月31日現在、会社の貸借対照表には利息又は罰金の課税項目がなく、2022年12月31日及び2021年12月31日までの年間運営報告書で利息及び/又は罰金が確認されていない。
その会社はアメリカと各州で税金を払わなければなりません。当社は設立日から当該等の管轄区税務機関の審査を受けなければならない
| F-26 |
| カタログ表 |
サイン
1934年の証券取引法第13節と第15節(D)節の要求に基づいて、登録者は、本報告が正式に許可された署名者がその署名を代表することを正式に促した。
| DERMATA治療会社 |
|
| (登録者) |
|
|
|
|
日付:2023年2月21日 | /s/Gerald T.Proehl |
|
| ジェラルド·T·プロール |
|
| 最高経営責任者 |
|
| (首席行政主任) |
|
|
|
|
日付:2023年2月21日 | /s/Kyri K.Van Hoose |
|
| ケリー·K·ヴァン·フォース |
|
| 首席財務官 |
|
| (首席財務会計官) |
|
改正された1934年の証券取引法の要求に基づき、本表格10-Kの年次報告は、以下の者代表登録者によって指定された身分及び日付で署名された。
サイン | タイトル | 日取り | ||
/s/Gerald T.Proehl | 社長、CEO、会長(CEO) | 2023年2月21日 | ||
ジェラルド·T·プロール |
|
|
|
|
/s/Kyri K.Van Hoose | 首席財務官(首席財務·会計幹事) | 2023年2月21日 | ||
ケリー·K·ヴァン·フォース |
|
|
|
|
/s/Davidヘア | 役員をリードする | 2023年2月21日 | ||
デヴィッド·ヘア |
|
|
|
|
/s/ウェンデル·ヴィレンガ博士 | 役員.取締役 | 2023年2月21日 | ||
Wendell Wierenga博士 |
|
|
|
|
|
|
|
|
|
/s/Mary Fisher |
| 役員.取締役 |
| 2023年2月21日 |
メアリー·フィッシャー |
|
|
|
|
|
|
|
|
|
アンドリュー·サンドラー医学博士 |
| 役員.取締役 |
| 2023年2月21日 |
アンドリュー·サンドラー医学博士 |
|
|
|
|
|
|
|
|
|
/s/Steven J.Mento、博士 |
| 役員.取締役 |
| 2023年2月21日 |
スティーブン·J·マントー博士です |
|
|
|
|
|
|
|
|
|
キャサリン·スコット |
| 役員.取締役 |
| 2023年2月21日 |
キャサリン·スコット |
|
| ||
|
|
|
|
|
/s/ブルターニュ·ブラドリック |
| 役員.取締役 |
| 2023年2月21日 |
ブルターニュ·ブラドリック |
|
| ||
115 |