biib-2022123100008750452022会計年度誤りP 3 Y20221231#M&A資産の減価償却と担保428Http://Fasb.org/us-GAAP/2022#運用リース権使用資産Http://Fasb.org/us-GAAP/2022#運用リース権使用資産Http://Fasb.org/us-GAAP/2022#その他の負債現在Http://Fasb.org/us-GAAP/2022#その他の負債現在Http://Fasb.org/us-GAAP/2022#OperatingLeaseLiablityNonCurrentHttp://Fasb.org/us-GAAP/2022#OperatingLeaseLiablityNonCurrentP 3 YP 3 Y00008750452022-01-012022-12-3100008750452022-06-30ISO 4217:ドル00008750452023-02-14Xbrli:共有0000875045アメリカ-公認会計基準:製品メンバー2022-01-012022-12-310000875045アメリカ-公認会計基準:製品メンバー2021-01-012021-12-310000875045アメリカ-公認会計基準:製品メンバー2020-01-012020-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー2022-01-012022-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー2021-01-012021-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー2020-01-012020-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMember2022-01-012022-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMember2021-01-012021-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMember2020-01-012020-12-3100008750452021-01-012021-12-3100008750452020-01-012020-12-31ISO 4217:ドルXbrli:共有00008750452022-12-3100008750452021-12-310000875045BIIB:Sangamo治療会社のメンバー2022-01-012022-12-310000875045BIIB:Sangamo治療会社のメンバー2021-01-012021-12-310000875045BIIB:Sangamo治療会社のメンバー2020-01-012020-12-310000875045BIIB:IncMemberの治療拒否2022-01-012022-12-310000875045BIIB:IncMemberの治療拒否2021-01-012021-12-310000875045BIIB:IncMemberの治療拒否2020-01-012020-12-310000875045BIIB:Sage TreateuticsIncMember2022-01-012022-12-310000875045BIIB:Sage TreateuticsIncMember2021-01-012021-12-310000875045BIIB:Sage TreateuticsIncMember2020-01-012020-12-3100008750452020-12-3100008750452019-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2021-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2021-12-310000875045米国-公認会計基準:財務省株式構成員2021-12-310000875045米国-GAAP:親会社のメンバー2021-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2021-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310000875045米国-GAAP:親会社のメンバー2022-01-012022-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2022-01-012022-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-12-310000875045BIIB:共有買い戻し計画5メンバー米国-公認会計基準:財務省株式構成員2022-01-012022-12-310000875045BIIB:共有買い戻し計画5メンバー米国-GAAP:親会社のメンバー2022-01-012022-12-310000875045BIIB:共有買い戻し計画5メンバー2022-01-012022-12-310000875045BIIB:共有買い戻し計画5メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310000875045US-GAAP:AdditionalPaidInCapitalMembersBIIB:共有買い戻し計画5メンバー2022-01-012022-12-310000875045BIIB:共有買い戻し計画5メンバーアメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2022-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2022-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2022-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2022-12-310000875045米国-公認会計基準:財務省株式構成員2022-12-310000875045米国-GAAP:親会社のメンバー2022-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2022-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2020-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2020-12-310000875045米国-公認会計基準:財務省株式構成員2020-12-310000875045米国-GAAP:親会社のメンバー2020-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2020-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310000875045米国-GAAP:親会社のメンバー2021-01-012021-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2021-01-012021-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-12-310000875045BIIB:共有買い戻し計画5メンバー米国-公認会計基準:財務省株式構成員2021-01-012021-12-310000875045BIIB:共有買い戻し計画5メンバー米国-GAAP:親会社のメンバー2021-01-012021-12-310000875045BIIB:共有買い戻し計画5メンバー2021-01-012021-12-310000875045BIIB:共有買い戻し計画5メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310000875045US-GAAP:AdditionalPaidInCapitalMembersBIIB:共有買い戻し計画5メンバー2021-01-012021-12-310000875045BIIB:共有買い戻し計画5メンバーアメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2019-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2019-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2019-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2019-12-310000875045米国-公認会計基準:財務省株式構成員2019-12-310000875045米国-GAAP:親会社のメンバー2019-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2019-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留2020-01-012020-12-310000875045米国-GAAP:親会社のメンバー2020-01-012020-12-310000875045アメリカ公認会計基準:非制御的利益メンバー2020-01-012020-12-310000875045アメリカ公認会計原則:他の総合収入メンバーを累計2020-01-012020-12-310000875045BIIB:共有買い戻し計画5メンバー米国-公認会計基準:財務省株式構成員2020-01-012020-12-310000875045BIIB:共有買い戻し計画5メンバー米国-GAAP:親会社のメンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画5メンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画5メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310000875045US-GAAP:AdditionalPaidInCapitalMembersBIIB:共有買い戻し計画5メンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画5メンバーアメリカ-公認会計基準:前払いメンバーを保留2020-01-012020-12-310000875045BIIB:共有買い戻し計画4メンバー米国-公認会計基準:財務省株式構成員2020-01-012020-12-310000875045米国-GAAP:親会社のメンバーBIIB:共有買い戻し計画4メンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画4メンバー2020-01-012020-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバーBIIB:共有買い戻し計画4メンバー2020-01-012020-12-310000875045US-GAAP:AdditionalPaidInCapitalMembersBIIB:共有買い戻し計画4メンバー2020-01-012020-12-310000875045アメリカ-公認会計基準:前払いメンバーを保留BIIB:共有買い戻し計画4メンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画3メンバー米国-公認会計基準:財務省株式構成員2020-01-012020-12-310000875045BIIB:共有買い戻し計画3メンバー米国-GAAP:親会社のメンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画3メンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画3メンバーアメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310000875045BIIB:共有買い戻し計画3メンバーUS-GAAP:AdditionalPaidInCapitalMembers2020-01-012020-12-310000875045BIIB:共有買い戻し計画3メンバーアメリカ-公認会計基準:前払いメンバーを保留2020-01-012020-12-310000875045アメリカ-アメリカ公認会計基準:普通株式メンバー2020-01-012020-12-310000875045US-GAAP:AdditionalPaidInCapitalMembers2020-01-012020-12-31Xbrli:純0000875045SRT:最小メンバ数2022-01-012022-12-310000875045SRT:最大メンバ数2022-01-012022-12-310000875045BIIB:サムスン生物類似協定メンバー2022-03-310000875045BIIB:サムスン生物類似協定メンバー2022-04-300000875045BIIB:サムスン生物類似協定メンバーBIIB:PaymentDueAtFirst周年記念メンバー2022-04-300000875045BIIB:サムスン生物類似協定メンバーBIIB:PaymentDueAtSecond周年記念メンバー2022-04-300000875045米国-GAAP:ソフトウェアとソフトウェア開発コストメンバーSRT:最小メンバ数2022-01-012022-12-310000875045米国-GAAP:ソフトウェアとソフトウェア開発コストメンバーSRT:最大メンバ数2022-01-012022-12-310000875045アメリカ-GAAP:BuildingMembersSRT:最小メンバ数2022-01-012022-12-310000875045アメリカ-GAAP:BuildingMembersSRT:最大メンバ数2022-01-012022-12-310000875045アメリカ-GAAP:家具と固定機器のメンバーSRT:最小メンバ数2022-01-012022-12-310000875045アメリカ-GAAP:家具と固定機器のメンバーSRT:最大メンバ数2022-01-012022-12-310000875045アメリカ-GAAP:機械とデバイスのメンバーSRT:最小メンバ数2022-01-012022-12-310000875045アメリカ-GAAP:機械とデバイスのメンバーSRT:最大メンバ数2022-01-012022-12-31BIIB:細分化市場0000875045BIIB:BIIB 118メンバー2020-03-012020-03-310000875045BIIB:サムスン生物類似協定メンバー2022-04-012022-04-300000875045BIIB:サムスン生物類似協定メンバー2022-03-31ISO 4217:KRW0000875045BIIB:サムスン生物類似協定メンバー2022-01-012022-12-310000875045BIIB:サムスン生物類似協定メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:投入割引率を測るメンバーBIIB:PaymentDueAtFirst周年記念メンバー2022-12-310000875045BIIB:サムスン生物類似協定メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:投入割引率を測るメンバーBIIB:PaymentDueAtSecond周年記念メンバー2022-12-310000875045BIIB:サムスン生物類似協定メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-12-310000875045BIIB:サムスン生物類似協定メンバーBIIB:PaymentDueAtFirst周年記念メンバー2022-01-012022-12-310000875045BIIB:サムスン生物類似協定メンバーBIIB:PaymentDueAtSecond周年記念メンバー2022-01-012022-12-3100008750452022-09-012022-09-300000875045BIIB:従業員数の減少2021-12-310000875045BIIB:従業員数の減少2022-01-012022-12-310000875045BIIB:従業員数の減少2022-12-310000875045国:アメリカAIIB:TECFIDERAMEメンバー2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーAIIB:TECFIDERAMEメンバー2022-01-012022-12-310000875045AIIB:TECFIDERAMEメンバー2022-01-012022-12-310000875045国:アメリカAIIB:TECFIDERAMEメンバー2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーAIIB:TECFIDERAMEメンバー2021-01-012021-12-310000875045AIIB:TECFIDERAMEメンバー2021-01-012021-12-310000875045国:アメリカAIIB:TECFIDERAMEメンバー2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーAIIB:TECFIDERAMEメンバー2020-01-012020-12-310000875045AIIB:TECFIDERAMEメンバー2020-01-012020-12-310000875045国:アメリカBIIB:VUMERITYメンバー2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:VUMERITYメンバー2022-01-012022-12-310000875045BIIB:VUMERITYメンバー2022-01-012022-12-310000875045国:アメリカBIIB:VUMERITYメンバー2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:VUMERITYメンバー2021-01-012021-12-310000875045BIIB:VUMERITYメンバー2021-01-012021-12-310000875045国:アメリカBIIB:VUMERITYメンバー2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:VUMERITYメンバー2020-01-012020-12-310000875045BIIB:VUMERITYメンバー2020-01-012020-12-310000875045AIIB:フルマラソンのメンバー国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーAIIB:フルマラソンのメンバー2022-01-012022-12-310000875045AIIB:フルマラソンのメンバー2022-01-012022-12-310000875045AIIB:フルマラソンのメンバー国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーAIIB:フルマラソンのメンバー2021-01-012021-12-310000875045AIIB:フルマラソンのメンバー2021-01-012021-12-310000875045AIIB:フルマラソンのメンバー国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーAIIB:フルマラソンのメンバー2020-01-012020-12-310000875045AIIB:フルマラソンのメンバー2020-01-012020-12-310000875045BIIB:AVONEXMembers国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:AVONEXMembers2022-01-012022-12-310000875045BIIB:AVONEXMembers2022-01-012022-12-310000875045BIIB:AVONEXMembers国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:AVONEXMembers2021-01-012021-12-310000875045BIIB:AVONEXMembers2021-01-012021-12-310000875045BIIB:AVONEXMembers国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:AVONEXMembers2020-01-012020-12-310000875045BIIB:AVONEXMembers2020-01-012020-12-310000875045BIIB:PLEGRIDYメンバー国:アメリカ2022-01-012022-12-310000875045BIIB:PLEGRIDYメンバーアメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310000875045BIIB:PLEGRIDYメンバー2022-01-012022-12-310000875045BIIB:PLEGRIDYメンバー国:アメリカ2021-01-012021-12-310000875045BIIB:PLEGRIDYメンバーアメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310000875045BIIB:PLEGRIDYメンバー2021-01-012021-12-310000875045BIIB:PLEGRIDYメンバー国:アメリカ2020-01-012020-12-310000875045BIIB:PLEGRIDYメンバーアメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-310000875045BIIB:PLEGRIDYメンバー2020-01-012020-12-310000875045BIIB:妨害メンバー国:アメリカ2022-01-012022-12-310000875045BIIB:妨害メンバーアメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310000875045BIIB:妨害メンバー2022-01-012022-12-310000875045BIIB:妨害メンバー国:アメリカ2021-01-012021-12-310000875045BIIB:妨害メンバーアメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310000875045BIIB:妨害メンバー2021-01-012021-12-310000875045BIIB:妨害メンバー国:アメリカ2020-01-012020-12-310000875045BIIB:妨害メンバーアメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-310000875045BIIB:妨害メンバー2020-01-012020-12-310000875045BIIB:TysabriProductMember国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:TysabriProductMember2022-01-012022-12-310000875045BIIB:TysabriProductMember2022-01-012022-12-310000875045BIIB:TysabriProductMember国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:TysabriProductMember2021-01-012021-12-310000875045BIIB:TysabriProductMember2021-01-012021-12-310000875045BIIB:TysabriProductMember国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:TysabriProductMember2020-01-012020-12-310000875045BIIB:TysabriProductMember2020-01-012020-12-310000875045BIIB:FAMPYRAMERメンバー国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:FAMPYRAMERメンバー2022-01-012022-12-310000875045BIIB:FAMPYRAMERメンバー2022-01-012022-12-310000875045BIIB:FAMPYRAMERメンバー国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:FAMPYRAMERメンバー2021-01-012021-12-310000875045BIIB:FAMPYRAMERメンバー2021-01-012021-12-310000875045BIIB:FAMPYRAMERメンバー国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:FAMPYRAMERメンバー2020-01-012020-12-310000875045BIIB:FAMPYRAMERメンバー2020-01-012020-12-310000875045BIIB:マイクロソフト製品収入メンバー国:アメリカ2022-01-012022-12-310000875045BIIB:マイクロソフト製品収入メンバーアメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310000875045BIIB:マイクロソフト製品収入メンバー2022-01-012022-12-310000875045BIIB:マイクロソフト製品収入メンバー国:アメリカ2021-01-012021-12-310000875045BIIB:マイクロソフト製品収入メンバーアメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310000875045BIIB:マイクロソフト製品収入メンバー2021-01-012021-12-310000875045BIIB:マイクロソフト製品収入メンバー国:アメリカ2020-01-012020-12-310000875045BIIB:マイクロソフト製品収入メンバーアメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-310000875045BIIB:マイクロソフト製品収入メンバー2020-01-012020-12-310000875045国:アメリカBIIB:SPINRAZAMEメンバー2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:SPINRAZAMEメンバー2022-01-012022-12-310000875045BIIB:SPINRAZAMEメンバー2022-01-012022-12-310000875045国:アメリカBIIB:SPINRAZAMEメンバー2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:SPINRAZAMEメンバー2021-01-012021-12-310000875045BIIB:SPINRAZAMEメンバー2021-01-012021-12-310000875045国:アメリカBIIB:SPINRAZAMEメンバー2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:SPINRAZAMEメンバー2020-01-012020-12-310000875045BIIB:SPINRAZAMEメンバー2020-01-012020-12-310000875045国:アメリカBIIB:BENEPALIMEメンバー2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:BENEPALIMEメンバー2022-01-012022-12-310000875045BIIB:BENEPALIMEメンバー2022-01-012022-12-310000875045国:アメリカBIIB:BENEPALIMEメンバー2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:BENEPALIMEメンバー2021-01-012021-12-310000875045BIIB:BENEPALIMEメンバー2021-01-012021-12-310000875045国:アメリカBIIB:BENEPALIMEメンバー2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:BENEPALIMEメンバー2020-01-012020-12-310000875045BIIB:BENEPALIMEメンバー2020-01-012020-12-310000875045AIIB:重要なメンバー国:アメリカ2022-01-012022-12-310000875045AIIB:重要なメンバーアメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310000875045AIIB:重要なメンバー2022-01-012022-12-310000875045AIIB:重要なメンバー国:アメリカ2021-01-012021-12-310000875045AIIB:重要なメンバーアメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310000875045AIIB:重要なメンバー2021-01-012021-12-310000875045AIIB:重要なメンバー国:アメリカ2020-01-012020-12-310000875045AIIB:重要なメンバーアメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-310000875045AIIB:重要なメンバー2020-01-012020-12-310000875045BIIB:FlIXABIMembers国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:FlIXABIMembers2022-01-012022-12-310000875045BIIB:FlIXABIMembers2022-01-012022-12-310000875045BIIB:FlIXABIMembers国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:FlIXABIMembers2021-01-012021-12-310000875045BIIB:FlIXABIMembers2021-01-012021-12-310000875045BIIB:FlIXABIMembers国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:FlIXABIMembers2020-01-012020-12-310000875045BIIB:FlIXABIMembers2020-01-012020-12-310000875045国:アメリカBIIB:BYOOVIZメンバー2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:BYOOVIZメンバー2022-01-012022-12-310000875045BIIB:BYOOVIZメンバー2022-01-012022-12-310000875045国:アメリカBIIB:BYOOVIZメンバー2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:BYOOVIZメンバー2021-01-012021-12-310000875045BIIB:BYOOVIZメンバー2021-01-012021-12-310000875045国:アメリカBIIB:BYOOVIZメンバー2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:BYOOVIZメンバー2020-01-012020-12-310000875045BIIB:BYOOVIZメンバー2020-01-012020-12-310000875045BIIB:生体模倣薬メンバー国:アメリカ2022-01-012022-12-310000875045BIIB:生体模倣薬メンバーアメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310000875045BIIB:生体模倣薬メンバー2022-01-012022-12-310000875045BIIB:生体模倣薬メンバー国:アメリカ2021-01-012021-12-310000875045BIIB:生体模倣薬メンバーアメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310000875045BIIB:生体模倣薬メンバー2021-01-012021-12-310000875045BIIB:生体模倣薬メンバー国:アメリカ2020-01-012020-12-310000875045BIIB:生体模倣薬メンバーアメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-310000875045BIIB:生体模倣薬メンバー2020-01-012020-12-310000875045BIIB:FUMADERMメンバー国:アメリカ2022-01-012022-12-310000875045BIIB:FUMADERMメンバーアメリカ-GAAP:非アメリカのメンバー2022-01-012022-12-310000875045BIIB:FUMADERMメンバー2022-01-012022-12-310000875045BIIB:FUMADERMメンバー国:アメリカ2021-01-012021-12-310000875045BIIB:FUMADERMメンバーアメリカ-GAAP:非アメリカのメンバー2021-01-012021-12-310000875045BIIB:FUMADERMメンバー2021-01-012021-12-310000875045BIIB:FUMADERMメンバー国:アメリカ2020-01-012020-12-310000875045BIIB:FUMADERMメンバーアメリカ-GAAP:非アメリカのメンバー2020-01-012020-12-310000875045BIIB:FUMADERMメンバー2020-01-012020-12-310000875045国:アメリカBIIB:ADUHELLメンバー2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:ADUHELLメンバー2022-01-012022-12-310000875045BIIB:ADUHELLメンバー2022-01-012022-12-310000875045国:アメリカBIIB:ADUHELLメンバー2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:ADUHELLメンバー2021-01-012021-12-310000875045BIIB:ADUHELLメンバー2021-01-012021-12-310000875045国:アメリカBIIB:ADUHELLメンバー2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーBIIB:ADUHELLメンバー2020-01-012020-12-310000875045BIIB:ADUHELLメンバー2020-01-012020-12-310000875045アメリカ-公認会計基準:製品メンバー国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:非アメリカのメンバーアメリカ-公認会計基準:製品メンバー2022-01-012022-12-310000875045アメリカ-公認会計基準:製品メンバー国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:非アメリカのメンバーアメリカ-公認会計基準:製品メンバー2021-01-012021-12-310000875045アメリカ-公認会計基準:製品メンバー国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:非アメリカのメンバーアメリカ-公認会計基準:製品メンバー2020-01-012020-12-31BIIB:卸0000875045BIIB:総代理店メンバー1人2022-01-012022-12-310000875045BIIB:総代理店メンバー2名2022-01-012022-12-310000875045BIIB:総代理店メンバー1人2021-01-012021-12-310000875045BIIB:総代理店メンバー2名2021-01-012021-12-310000875045BIIB:総代理店メンバー1人2020-01-012020-12-310000875045BIIB:総代理店メンバー2名2020-01-012020-12-310000875045BIIB:総代理店メンバー1人2022-12-310000875045BIIB:総代理店メンバー2名2022-12-310000875045BIIB:総代理店メンバー1人2021-12-310000875045BIIB:総代理店メンバー2名2021-12-310000875045BIIB:現金割引メンバーを予約する2021-12-310000875045BIIB:契約調整メンバー2021-12-310000875045米国-GAAP:返品·許可メンバーの販売2021-12-310000875045BIIB:現金割引メンバーを予約する2022-01-012022-12-310000875045BIIB:契約調整メンバー2022-01-012022-12-310000875045米国-GAAP:返品·許可メンバーの販売2022-01-012022-12-310000875045BIIB:現金割引メンバーを予約する2022-12-310000875045BIIB:契約調整メンバー2022-12-310000875045米国-GAAP:返品·許可メンバーの販売2022-12-310000875045BIIB:現金割引メンバーを予約する2020-12-310000875045BIIB:契約調整メンバー2020-12-310000875045米国-GAAP:返品·許可メンバーの販売2020-12-310000875045BIIB:現金割引メンバーを予約する2021-01-012021-12-310000875045BIIB:契約調整メンバー2021-01-012021-12-310000875045米国-GAAP:返品·許可メンバーの販売2021-01-012021-12-310000875045BIIB:現金割引メンバーを予約する2019-12-310000875045BIIB:契約調整メンバー2019-12-310000875045米国-GAAP:返品·許可メンバーの販売2019-12-310000875045BIIB:現金割引メンバーを予約する2020-01-012020-12-310000875045BIIB:契約調整メンバー2020-01-012020-12-310000875045米国-GAAP:返品·許可メンバーの販売2020-01-012020-12-310000875045アメリカ公認会計基準:売掛金メンバー2022-12-310000875045アメリカ公認会計基準:売掛金メンバー2021-12-310000875045米国-公認会計基準:その他現在の負債メンバー2022-12-310000875045米国-公認会計基準:その他現在の負債メンバー2021-12-310000875045BIIB:RoyaltyAttributedToOCREVUSメンバー2022-01-012022-12-310000875045BIIB:RoyaltyAttributedToOCREVUSメンバー2021-01-012021-12-310000875045BIIB:RoyaltyAttributedToOCREVUSメンバー2020-01-012020-12-310000875045BIIB:RocheGroupGenentechMember2022-01-012022-12-310000875045BIIB:RocheGroupGenentechMember2021-01-012021-12-310000875045BIIB:RocheGroupGenentechMember2020-01-012020-12-310000875045BIIB:契約製造およびその他の収入メンバー2022-01-012022-12-310000875045BIIB:契約製造およびその他の収入メンバー2021-01-012021-12-310000875045BIIB:契約製造およびその他の収入メンバー2020-01-012020-12-310000875045US-GAAP:RoyaltyMember2022-01-012022-12-310000875045US-GAAP:RoyaltyMember2021-01-012021-12-310000875045US-GAAP:RoyaltyMember2020-01-012020-12-310000875045BIIB:契約製造およびその他の収入メンバー2020-06-300000875045BIIB:契約製造およびその他の収入メンバーBIIB:契約メーカー顧客メンバー2020-01-012020-12-310000875045BIIB:契約製造およびその他の収入メンバー2020-12-310000875045BIIB:LEOEMBIMERメンバー2022-12-310000875045BIIB:ADUHELLメンバー2022-01-012022-03-310000875045アジアインフラ投資銀行:衛材会員BIIB:医療保険センターと医療保険サービスメンバーBIIB:ADUHELLメンバー2022-01-012022-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:一里塚報酬メンバー2022-01-012022-12-310000875045BIIB:ADUHELLメンバー2021-10-012021-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:ADUHELLメンバー2021-01-012021-12-310000875045BIIB:ADUHELLメンバー2021-12-310000875045SRT:最小メンバ数BIIB:ライセンスされていない特許メンバー2022-01-012022-12-310000875045SRT:最大メンバ数BIIB:ライセンスされていない特許メンバー2022-01-012022-12-310000875045BIIB:ライセンスされていない特許メンバー2022-12-310000875045BIIB:ライセンスされていない特許メンバー2021-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembers2022-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembers2021-12-310000875045米国-公認会計原則:商標と貿易名メンバー2022-12-310000875045米国-公認会計原則:商標と貿易名メンバー2021-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:TGNMembers2022-10-012022-12-310000875045BIIB:夜星メンバーBIIB:BIIB 111メンバー2021-01-012021-12-310000875045BIIB:夜星メンバーBIIB:BIIB 112メンバー2021-01-012021-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:TGNMembers2021-01-012021-03-310000875045BIIB:BIIB 111メンバー2020-01-012020-12-310000875045BIIB:BIIB 054メンバー2020-01-012020-12-310000875045BIIB:他のメンバーの研究·開発を行っている2020-01-012020-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:TGNMembersAIIB:融合製薬メンバー2022-01-012022-12-310000875045BIIB:TGNMembers2022-01-012022-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:夜星メンバーBIIB:BIIB 111メンバー2022-01-012022-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:夜星メンバーBIIB:BIIB 112メンバー2022-01-012022-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:夜星メンバーBIIB:BIIB 111メンバー2020-10-012020-12-310000875045BIIB:BIIB 111メンバー2021-01-012021-12-310000875045BIIB:BIIB 112メンバー2021-07-012021-09-300000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:BIIB 111メンバー2021-09-300000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:BIIB 112メンバー2021-09-300000875045BIIB:BIIB 111とBIIB 112メンバー2021-07-012021-09-300000875045米国-GAAP:InProcessResearchAndDevelopmentMembers生物遺伝国際神経科学有限会社のメンバーBIIB:BIIB 054メンバー2022-01-012022-12-310000875045BIIB:夜星メンバーBIIB:BIIB 054メンバー2020-10-012020-12-310000875045BIIB:夜星メンバーBIIB:BIIB 054メンバー2020-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ政府メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ政府メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ-公認会計基準:アメリカ政府メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:資産認可証券メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:資産認可証券メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:資産認可証券メンバー2022-12-310000875045BIIB:サムスン生物類似協定メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2022-12-310000875045BIIB:サムスン生物類似協定メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-12-310000875045BIIB:サムスン生物類似協定メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル1メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:会社債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ政府メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ-公認会計基準:アメリカ政府メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ-公認会計基準:アメリカ政府メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル1メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310000875045米国-公認会計基準:投入割引率を測るメンバー2021-12-310000875045米国-公認会計基準:投入割引率を測るメンバーSRT:重み平均メンバ2022-12-310000875045米国-公認会計基準:投入割引率を測るメンバーSRT:重み平均メンバ2021-12-310000875045アメリカ-GAAP:公正価値は再帰的メンバーを測定する2020-12-310000875045米国-公認会計基準:その他の非現在の責任メンバー2021-12-310000875045BIIB:BIIB 054メンバー2022-01-012022-12-310000875045AIIB:融合製薬メンバー2015-02-012015-02-280000875045AIIB:融合製薬メンバー2021-12-310000875045AIIB:融合製薬メンバー2022-12-310000875045BIIB:生物遺伝国際神経科学メンバー2010-12-012010-12-310000875045BIIB:生物遺伝国際神経科学メンバー2020-01-012020-12-310000875045BIIB:生物遺伝国際神経科学メンバー2020-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:BIIB 111メンバー2022-12-310000875045米国-GAAP:InProcessResearchAndDevelopmentMembersBIIB:BIIB 112メンバー2022-12-310000875045AIIB:高齢者ノード3点6個2つ5パーセント2人2人のメンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045AIIB:高齢者ノード3点6個2つ5パーセント2人2人のメンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045BIIB:高齢者ノード4分0 5パーセント20 20 5メンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045BIIB:高齢者ノード4分0 5パーセント20 20 5メンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045BIIB:A 225プレミアムNoteesDue 5月12030メンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045BIIB:A 225プレミアムNoteesDue 5月12030メンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045BIIB:高齢者ノード5点2パーセントDuewenty 45メンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045BIIB:高齢者ノード5点2パーセントDuewenty 45メンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045BIIB:A 315プレミアムNoteesDue 5月12050メンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045BIIB:A 315プレミアムNoteesDue 5月12050メンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045AIIB:3つのポイント2つ5パーセント高齢者またはノード2月21人50人のメンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045AIIB:3つのポイント2つ5パーセント高齢者またはノード2月21人50人のメンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045アメリカ-GAAP:高齢者の注意事項メンバー2022-12-310000875045アメリカ-GAAP:高齢者の注意事項メンバー2021-12-310000875045米国-GAAP:ビジネス紙のメンバー2022-12-310000875045米国-GAAP:ビジネス紙のメンバー2021-12-310000875045米国-公認会計基準:買い戻し協議メンバー2022-12-310000875045米国-公認会計基準:買い戻し協議メンバー2021-12-310000875045アメリカ公認会計基準:MoneyMarketFundsMembers2022-12-310000875045アメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310000875045アメリカ公認会計基準:債務証券メンバー2022-12-310000875045アメリカ公認会計基準:債務証券メンバー2021-12-310000875045BIIB:Corporation DebtSecurities CurrentMembers2022-12-310000875045BIIB:Corporation DebtSecuritiesNonCurrentMember2022-12-310000875045BIIB:政府のセキュリティ現在のメンバー2022-12-310000875045BIIB:政府安全保障は現在のメンバーではありません2022-12-310000875045BIIB:担保融資とその他の資産保証証券現在のメンバー2022-12-310000875045BIIB:担保融資やその他の資産保証証券は現在のメンバーではない2022-12-310000875045BIIB:株式証券現在のメンバー2022-12-310000875045BIIB:Corporation DebtSecurities CurrentMembers2021-12-310000875045BIIB:Corporation DebtSecuritiesNonCurrentMember2021-12-310000875045BIIB:政府のセキュリティ現在のメンバー2021-12-310000875045BIIB:政府安全保障は現在のメンバーではありません2021-12-310000875045BIIB:担保融資とその他の資産保証証券現在のメンバー2021-12-310000875045BIIB:担保融資やその他の資産保証証券は現在のメンバーではない2021-12-310000875045BIIB:株式証券現在のメンバー2021-12-310000875045BIIB:株式証券非現在のメンバー2021-12-310000875045AIIB:戦略投資メンバー2022-12-310000875045AIIB:戦略投資メンバー2021-12-310000875045SRT:最小メンバ数2021-01-012021-12-310000875045SRT:最大メンバ数2021-01-012021-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMember通貨:ユーロ2022-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMember通貨:ユーロ2021-12-310000875045通貨:ポンドUS-GAAP:DesignatedAsHedgingInstrumentMember2022-12-310000875045通貨:ポンドUS-GAAP:DesignatedAsHedgingInstrumentMember2021-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMember貨幣:円2022-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMember貨幣:円2021-12-310000875045金種:カナダドルUS-GAAP:DesignatedAsHedgingInstrumentMember2022-12-310000875045金種:カナダドルUS-GAAP:DesignatedAsHedgingInstrumentMember2021-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMember2022-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMember2021-12-310000875045アメリカ-公認会計基準:外国為替長期メンバー2022-01-012022-12-310000875045アメリカ-公認会計基準:外国為替長期メンバー2021-01-012021-12-310000875045アメリカ-公認会計基準:外国為替長期メンバー2020-01-012020-12-310000875045アメリカ-アメリカ公認会計基準:販売メンバー米国-米国公認会計基準:外国為替契約メンバー2022-01-012022-12-310000875045アメリカ-アメリカ公認会計基準:販売メンバー米国-米国公認会計基準:外国為替契約メンバー2021-01-012021-12-310000875045アメリカ-アメリカ公認会計基準:販売メンバー米国-米国公認会計基準:外国為替契約メンバー2020-01-012020-12-310000875045アメリカ-アメリカ公認会計基準:販売メンバーBIIB:キャッシュフロー収入メンバー米国-米国公認会計基準:外国為替契約メンバー2022-01-012022-12-310000875045アメリカ-アメリカ公認会計基準:販売メンバーBIIB:キャッシュフロー収入メンバー米国-米国公認会計基準:外国為替契約メンバー2021-01-012021-12-310000875045アメリカ-アメリカ公認会計基準:販売メンバーBIIB:キャッシュフロー収入メンバー米国-米国公認会計基準:外国為替契約メンバー2020-01-012020-12-310000875045米国-米国公認会計基準:外国為替契約メンバーアメリカ公認会計基準:運営費用メンバー2022-01-012022-12-310000875045米国-米国公認会計基準:外国為替契約メンバーアメリカ公認会計基準:運営費用メンバー2021-01-012021-12-310000875045米国-米国公認会計基準:外国為替契約メンバーアメリカ公認会計基準:運営費用メンバー2020-01-012020-12-310000875045BIIB:キャッシュフロー運営費メンバー米国-米国公認会計基準:外国為替契約メンバーアメリカ公認会計基準:運営費用メンバー2022-01-012022-12-310000875045BIIB:キャッシュフロー運営費メンバー米国-米国公認会計基準:外国為替契約メンバーアメリカ公認会計基準:運営費用メンバー2021-01-012021-12-310000875045BIIB:キャッシュフロー運営費メンバー米国-米国公認会計基準:外国為替契約メンバーアメリカ公認会計基準:運営費用メンバー2020-01-012020-12-310000875045BIIB:高齢者ノード2点9パーセントDuewentyTwentyMembersアメリカ-GAAP:高齢者の注意事項メンバー2020-05-310000875045US-GAAP:InterestRateSwapMemberUS-GAAP:DesignatedAsHedgingInstrumentMember2022-12-310000875045US-GAAP:InterestRateSwapMemberアメリカ公認会計基準:利息支出メンバー2020-05-012020-05-310000875045BIIB:サムスン生物類似協定メンバー2018-05-310000875045BIIB:サムスン生物類似協定メンバー2018-11-012018-11-300000875045アメリカ公認会計基準:NetInvestmentHedgingMembersアメリカ-公認会計基準:外国為替長期メンバー2021-01-012021-12-310000875045アメリカ公認会計基準:NetInvestmentHedgingMembers2021-12-310000875045アメリカ公認会計基準:NetInvestmentHedgingMembers2022-01-012022-12-310000875045アメリカ公認会計基準:NetInvestmentHedgingMembers2021-01-012021-12-310000875045アメリカ公認会計基準:NetInvestmentHedgingMembers2020-01-012020-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバーアメリカ公認会計基準:NetInvestmentHedgingMembers2022-01-012022-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバーアメリカ公認会計基準:NetInvestmentHedgingMembers2021-01-012021-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバーアメリカ公認会計基準:NetInvestmentHedgingMembers2020-01-012020-12-310000875045米国-公認会計基準:非指定メンバー2022-12-310000875045米国-公認会計基準:非指定メンバー2021-12-310000875045米国-公認会計基準:その他の現在の資産メンバーUS-GAAP:DesignatedAsHedgingInstrumentMember2022-12-310000875045米国-公認会計基準:その他の現在の資産メンバーUS-GAAP:DesignatedAsHedgingInstrumentMember2021-12-310000875045米国-GAAP:他の非現在の資産メンバUS-GAAP:DesignatedAsHedgingInstrumentMember2022-12-310000875045米国-GAAP:他の非現在の資産メンバUS-GAAP:DesignatedAsHedgingInstrumentMember2021-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMemberアメリカ公認会計基準:負債メンバーを計算すべき2022-12-310000875045US-GAAP:DesignatedAsHedgingInstrumentMemberアメリカ公認会計基準:負債メンバーを計算すべき2021-12-310000875045米国-公認会計基準:その他の現在の資産メンバーアメリカ公認会計基準:NetInvestmentHedgingMembers米国-米国公認会計基準:外国為替契約メンバー2022-12-310000875045米国-公認会計基準:その他の現在の資産メンバーアメリカ公認会計基準:NetInvestmentHedgingMembers米国-米国公認会計基準:外国為替契約メンバー2021-12-310000875045米国-公認会計基準:その他の現在の資産メンバー米国-公認会計基準:非指定メンバー2022-12-310000875045米国-公認会計基準:その他の現在の資産メンバー米国-公認会計基準:非指定メンバー2021-12-310000875045米国-公認会計基準:非指定メンバーアメリカ公認会計基準:負債メンバーを計算すべき2022-12-310000875045米国-公認会計基準:非指定メンバーアメリカ公認会計基準:負債メンバーを計算すべき2021-12-310000875045BIIB:バイオ製品製造業のメンバーAIIB:スイス·ソローザンヌメンバー2022-01-012022-12-31Utr:SQFT0000875045BIIB:倉庫ユーティリティとサポートスペースメンバーAIIB:スイス·ソローザンヌメンバー2022-01-012022-12-310000875045BIIB:管理空間のメンバーAIIB:スイス·ソローザンヌメンバー2022-01-012022-12-310000875045AIIB:スイス·ソローザンヌメンバー2022-12-310000875045AIIB:スイス·ソローザンヌメンバー2021-12-310000875045AIIB:スイス·ソローザンヌメンバー2021-06-300000875045AIIB:A 125ブロードウェーメンバー2022-09-012022-09-300000875045AIIB:A 125ブロードウェーメンバー2022-09-300000875045アメリカ-GAAP:BuildingMembersAIIB:A 125ブロードウェーメンバー2022-09-300000875045アメリカ-公認会計基準:本土メンバーAIIB:A 125ブロードウェーメンバー2022-09-300000875045アメリカ-GAAP:機械とデバイスのメンバーAIIB:A 125ブロードウェーメンバー2022-09-300000875045SRT:最小メンバ数2022-12-310000875045SRT:最大メンバ数2022-12-310000875045SRT:最小メンバ数BIIB:サブメンバー2022-12-310000875045SRT:最大メンバ数BIIB:サブメンバー2022-12-310000875045米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310000875045米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310000875045米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310000875045アメリカ-公認会計基準:販売一般と管理費用メンバー2022-01-012022-12-310000875045アメリカ-公認会計基準:販売一般と管理費用メンバー2021-01-012021-12-310000875045アメリカ-公認会計基準:販売一般と管理費用メンバー2020-01-012020-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー2022-01-012022-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー2021-01-012021-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー2020-01-012020-12-310000875045アメリカ-GAAP:BuildingMembers2022-12-310000875045BIIB:高齢者ノード5点2パーセントDuewenty 45メンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-02-280000875045AIIB:3つのポイント2つ5パーセント高齢者またはノード2月21人50人のメンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-02-280000875045BIIB:高齢者ノード5点2パーセントDuewenty 45メンバーアメリカ-GAAP:高齢者の注意事項メンバー2021-02-012021-02-280000875045アメリカ-GAAP:高齢者の注意事項メンバーBIIB:高齢者ノード5点2パーセントDuewenty 45メンバー2021-02-012021-02-280000875045BIIB:A 2020高齢者注意:メンバーアメリカ-GAAP:高齢者の注意事項メンバー2020-04-300000875045BIIB:A 225プレミアムNoteesDue 5月12030メンバーアメリカ-GAAP:高齢者の注意事項メンバー2020-04-300000875045BIIB:A 315プレミアムNoteesDue 5月12050メンバーアメリカ-GAAP:高齢者の注意事項メンバー2020-04-300000875045BIIB:A 2020高齢者注意:メンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-01-012022-12-310000875045AIIB:A 2015高度な注意事項メンバーアメリカ-GAAP:高齢者の注意事項メンバー2022-01-012022-12-310000875045AIIB:A 2015高度な注意事項メンバー2022-01-012022-12-310000875045BIIB:高齢者ノード2点9パーセントDuewentyTwentyMembersアメリカ-GAAP:高齢者の注意事項メンバー2015-09-150000875045アメリカ公認会計基準:利息支出メンバーBIIB:高齢者ノード2点9パーセントDuewentyTwentyMembersアメリカ-GAAP:高齢者の注意事項メンバー2020-05-012020-05-310000875045BIIB:高齢者ノード2点9パーセントDuewentyTwentyMembersアメリカ-GAAP:高齢者の注意事項メンバー2020-01-012020-12-310000875045US-GAAP:InterestRateSwapMemberアメリカ公認会計基準:利息支出メンバーアメリカ-GAAP:高齢者の注意事項メンバー2020-01-012020-12-3100008750452015-09-1500008750452022-09-1500008750452022-07-012022-07-310000875045アメリカ公認会計基準:RevolvingCreditFacilityMembers2020-01-310000875045アメリカ公認会計基準:RevolvingCreditFacilityMembers2020-01-012020-01-310000875045アメリカ公認会計基準:RevolvingCreditFacilityMembers2022-12-310000875045米国-GAAP:シリーズAPReferredStockMembers2022-12-310000875045BIIB:SeriesXPferredStockMember2022-12-310000875045BIIB:第一選択株メンバーを指定していない2022-12-310000875045BIIB:共有買い戻し計画5メンバー2020-10-310000875045BIIB:共有買い戻し計画5メンバー2022-12-310000875045BIIB:共有買い戻し計画4メンバー2019-12-310000875045BIIB:共有買い戻し計画3メンバー2019-03-310000875045米国-GAAP:累計純未現金投資GainLossMembers2021-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2021-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2021-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2021-12-310000875045米国-GAAP:累積換算調整メンバー2021-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers2022-01-012022-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2022-01-012022-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2022-01-012022-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2022-01-012022-12-310000875045米国-GAAP:累積換算調整メンバー2022-01-012022-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers2022-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2022-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2022-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2022-12-310000875045米国-GAAP:累積換算調整メンバー2022-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers2020-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2020-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2020-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2020-12-310000875045米国-GAAP:累積換算調整メンバー2020-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers2021-01-012021-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2021-01-012021-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2021-01-012021-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2021-01-012021-12-310000875045米国-GAAP:累積換算調整メンバー2021-01-012021-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers2019-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2019-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2019-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2019-12-310000875045米国-GAAP:累積換算調整メンバー2019-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers2020-01-012020-12-310000875045アメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2020-01-012020-12-310000875045米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2020-01-012020-12-310000875045米国-GAAP:累積定義された福祉計画調整メンバー2020-01-012020-12-310000875045米国-GAAP:累積換算調整メンバー2020-01-012020-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2022-01-012022-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2021-01-012021-12-310000875045米国-GAAP:累計純未現金投資GainLossMembers米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2020-01-012020-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類するアメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2022-01-012022-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類するアメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2021-01-012021-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類するアメリカ-GAAP:累積GainLossNetCashFlowHedgeParentMember2020-01-012020-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2022-01-012022-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2021-01-012021-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する米国-GAAP:HedgeExcludedComponentIncludingPortionAttributeTO非制御利益メンバーとして他の総合収入損失派生資格を累積2020-01-012020-12-310000875045US-GAAP:累積外貨通貨調整は、ポート属性テーブルを含む非制御利息メンバー米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2022-01-012022-12-310000875045US-GAAP:累積外貨通貨調整は、ポート属性テーブルを含む非制御利息メンバー米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2021-01-012021-12-310000875045US-GAAP:累積外貨通貨調整は、ポート属性テーブルを含む非制御利息メンバー米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2020-01-012020-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2022-01-012022-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2021-01-012021-12-310000875045米国-米国公認会計原則:他の総合収入を累積メンバーに再分類する2020-01-012020-12-310000875045BIIB:時間値制限株式単位メンバー2022-01-012022-12-310000875045BIIB:時間値制限株式単位メンバー2021-01-012021-12-310000875045BIIB:時間値制限株式単位メンバー2020-01-012020-12-310000875045BIIB:市場株式単位メンバー2022-01-012022-12-310000875045BIIB:市場株式単位メンバー2021-01-012021-12-310000875045BIIB:市場株式単位メンバー2020-01-012020-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2022-01-012022-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2021-01-012021-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2020-01-012020-12-310000875045米国-GAAP:親会社のメンバー2022-01-012022-12-310000875045米国-GAAP:親会社のメンバー2021-01-012021-12-310000875045米国-GAAP:親会社のメンバー2020-01-012020-12-310000875045BIIB:市場株式単位メンバー2022-01-012022-12-310000875045BIIB:市場株式単位メンバー2021-01-012021-12-310000875045BIIB:市場株式単位メンバー2020-01-012020-12-310000875045BIIB:時間値制限株式単位メンバー2022-01-012022-12-310000875045BIIB:時間値制限株式単位メンバー2021-01-012021-12-310000875045BIIB:時間値制限株式単位メンバー2020-01-012020-12-310000875045BIIB:CashSettledPerformanceSharesMember2022-01-012022-12-310000875045BIIB:CashSettledPerformanceSharesMember2021-01-012021-12-310000875045BIIB:CashSettledPerformanceSharesMember2020-01-012020-12-310000875045BIIB:パフォーマンス単位メンバー2022-01-012022-12-310000875045BIIB:パフォーマンス単位メンバー2021-01-012021-12-310000875045BIIB:パフォーマンス単位メンバー2020-01-012020-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2022-01-012022-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2021-01-012021-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2020-01-012020-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2022-01-012022-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2021-01-012021-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2020-01-012020-12-310000875045BIIB:EmployeStockPurche ePlanMember2022-01-012022-12-310000875045BIIB:EmployeStockPurche ePlanMember2021-01-012021-12-310000875045BIIB:EmployeStockPurche ePlanMember2020-01-012020-12-310000875045BIIB:株式オプションメンバー2022-01-012022-12-310000875045BIIB:株式オプションメンバー2021-01-012021-12-310000875045BIIB:株式オプションメンバー2020-01-012020-12-31AIIB:計画0000875045BIIB:取締役計画メンバー2006-05-012006-05-310000875045BIIB:A 2017 Omnibus EquityPlanMembers2017-06-300000875045BIIB:A 2017 Omnibus EquityPlanMembers2017-06-012017-06-300000875045SRT:CEO実行官メンバBIIB:A 2017 Omnibus EquityPlanMembers2022-01-012022-12-310000875045SRT:CEO実行官メンバBIIB:A 2017 Omnibus EquityPlanMembers2022-12-310000875045米国-公認会計基準:従業員株式オプションメンバー2022-01-012022-12-310000875045BIIB:市場株式単位メンバー2013-01-012013-12-31BIIB:増量0000875045BIIB:市場株式単位メンバー2022-01-012022-12-310000875045BIIB:市場株式単位メンバー2021-12-310000875045BIIB:市場株式単位メンバー2022-12-310000875045アメリカ公認会計基準:パフォーマンス共有メンバー2022-01-012022-12-310000875045BIIB:市場株式単位メンバー2021-01-012021-12-310000875045BIIB:市場株式単位メンバー2020-01-012020-12-310000875045BIIB:市場株式単位メンバーSRT:最小メンバ数2021-01-012021-12-310000875045SRT:最大メンバ数BIIB:市場株式単位メンバー2021-01-012021-12-310000875045BIIB:市場株式単位メンバーSRT:最小メンバ数2020-01-012020-12-310000875045SRT:最大メンバ数BIIB:市場株式単位メンバー2020-01-012020-12-310000875045BIIB:CashSettledPerformanceSharesMember2022-01-012022-12-310000875045BIIB:CashSettledPerformanceSharesMember2020-01-012020-12-310000875045アメリカ公認会計基準:パフォーマンス共有メンバー2020-01-012020-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2018-01-012018-03-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2022-01-012022-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2021-12-310000875045BIIB:PerformanceStockUnitsSettledinStockMember2022-12-310000875045アメリカ公認会計基準:パフォーマンス共有メンバーSRT:最小メンバ数2022-01-012022-12-310000875045アメリカ公認会計基準:パフォーマンス共有メンバーSRT:最大メンバ数2022-01-012022-12-310000875045アメリカ公認会計基準:パフォーマンス共有メンバー2021-01-012021-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2018-01-012018-03-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2022-01-012022-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2021-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2022-12-310000875045BIIB:PerformanceStockUnitsSettledinCashMember2021-01-012021-12-310000875045BIIB:時間値制限株式単位メンバー2022-01-012022-12-310000875045BIIB:時間値制限株式単位メンバー2021-12-310000875045BIIB:時間値制限株式単位メンバー2022-12-310000875045BIIB:時間値制限株式単位メンバーSRT:役員メンバー2022-01-012022-12-310000875045BIIB:時間値制限株式単位メンバー2021-01-012021-12-310000875045BIIB:時間値制限株式単位メンバー2020-01-012020-12-3100008750452015-06-012015-06-300000875045AIIB:A 2015 ESPPMメンバー2022-01-012022-12-310000875045AIIB:A 2015 ESPPMメンバー2021-01-012021-12-310000875045AIIB:A 2015 ESPPMメンバー2020-01-012020-12-310000875045BIIB:現金と現金等価物の形で近い外国人メンバーBIIB:米国の2017年の税収行動メンバー2017-12-310000875045BIIB:他の外国のイヤホンメンバーBIIB:米国の2017年の税収行動メンバー2017-12-310000875045BIIB:米国の2017年の税収行動メンバー2022-12-310000875045BIIB:米国の2017年の税収行動メンバー2021-12-310000875045AIIB:TECFIDERAMEメンバー2020-12-3100008750452022-03-310000875045米国-GAAP:国内/地域メンバーアメリカ-公認会計基準:一般商業メンバー2022-12-310000875045アメリカ-公認会計基準:州と地方法律法規のメンバーアメリカ-公認会計基準:研究メンバー2022-12-310000875045米国-GAAP:国内/地域メンバー2022-12-310000875045アメリカ-公認会計基準:外国人メンバーアメリカ-公認会計基準:一般商業メンバー2022-12-310000875045アメリカ-公認会計基準:外国人メンバー2021-01-012021-12-310000875045アメリカ-公認会計基準:外国人メンバー2022-01-012022-12-3100008750452022-04-012022-06-300000875045BIIB:DenaliIonisSageAndSangamoメンバー2022-01-012022-12-310000875045BIIB:DenaliIonisSageAndSangamoメンバー2021-01-012021-12-310000875045BIIB:OCREVUMメンバーSRT:最小メンバ数2017-03-012017-03-310000875045BIIB:OCREVUMメンバーSRT:最大メンバ数2017-03-012017-03-310000875045BIIB:OCREVUMメンバー2017-03-012017-03-310000875045BIIB:OCREVUMメンバーアメリカ-公認会計基準:外国人メンバー2017-03-012017-03-310000875045BIIB:MosunetuzumabMembers2022-01-012022-01-310000875045BIIB:MosunetuzumabMembers2021-01-012021-12-310000875045BIIB:MosunetuzumabMembers2022-01-012022-12-310000875045BIIB:Rituxanメンバー2022-12-310000875045BIIB:GAZYVAMER2022-12-310000875045BIIB:GAZYVAMER2022-01-012022-12-310000875045BIIB:NewAntiCD 20メンバー2020-01-012020-12-310000875045BIIB:NewAntiCD 20メンバー2022-01-012022-12-310000875045BIIB:NewAntiCD 20メンバー2021-01-012021-12-310000875045BIIB:GAZYVAMER2020-12-310000875045BIIB:GAZYVAMER2021-12-310000875045BIIB:Ionis製薬会社のメンバーSRT:最小メンバ数BIIB:SPINRAZAMEメンバー2022-01-012022-12-310000875045BIIB:Ionis製薬会社のメンバーSRT:最大メンバ数BIIB:SPINRAZAMEメンバー2022-01-012022-12-310000875045BIIB:Ionis製薬会社のメンバーBIIB:SPINRAZAMEメンバー2022-01-012022-12-310000875045BIIB:Ionis製薬会社のメンバーBIIB:SPINRAZAMEメンバー2021-01-012021-12-310000875045BIIB:Ionis製薬会社のメンバーBIIB:SPINRAZAMEメンバー2020-01-012020-12-310000875045BIIB:Ionis製薬会社のメンバー2018-06-012018-06-300000875045BIIB:Ionis製薬会社のメンバー2018-06-300000875045BIIB:Ionis製薬会社のメンバーSRT:最小メンバ数2018-06-300000875045BIIB:Ionis製薬会社のメンバーSRT:最大メンバ数2018-06-300000875045BIIB:Ionis製薬会社のメンバー2022-01-012022-12-310000875045BIIB:Ionis製薬会社のメンバー2021-01-012021-12-310000875045BIIB:Ionis製薬会社のメンバー2020-01-012020-12-310000875045BIIB:Ionis製薬会社のメンバー2017-12-012017-12-310000875045BIIB:Ionis製薬会社のメンバー2017-12-310000875045BIIB:Ionis製薬会社のメンバーBIIB:BIIB 115メンバー2021-12-310000875045BIIB:Ionis製薬会社のメンバー2013-09-012013-09-300000875045BIIB:Ionis製薬会社のメンバー2013-09-300000875045BIIB:SOD 1メンバーBIIB:Ionis製薬会社のメンバー2018-12-310000875045BIIB:SOD 1メンバーBIIB:Ionis製薬会社のメンバー2022-01-012022-12-310000875045BIIB:SOD 1メンバーBIIB:Ionis製薬会社のメンバー2021-01-012021-12-310000875045BIIB:SOD 1メンバーBIIB:Ionis製薬会社のメンバー2020-01-012020-12-310000875045BIIB:Ionis製薬会社のメンバー2012-12-012012-12-310000875045BIIB:Ionis製薬会社のメンバー2012-12-310000875045BIIB:Ionis製薬会社のメンバー2019-12-012019-12-310000875045BIIB:BIIB 080メンバーBIIB:Ionis製薬会社のメンバー2019-12-012019-12-310000875045アジアインフラ投資銀行:衛材会員2022-01-012022-12-310000875045アジアインフラ投資銀行:衛材会員2021-01-012021-12-310000875045アジアインフラ投資銀行:衛材会員2020-01-012020-12-310000875045アジアインフラ投資銀行:衛材会員アメリカ-公認会計基準:販売一般と管理費用メンバーBIIB:E 2609とBAN 2401メンバー2022-01-012022-12-310000875045アジアインフラ投資銀行:衛材会員アメリカ-公認会計基準:販売一般と管理費用メンバーBIIB:E 2609とBAN 2401メンバー2021-01-012021-12-310000875045アジアインフラ投資銀行:衛材会員アメリカ-公認会計基準:販売一般と管理費用メンバーBIIB:E 2609とBAN 2401メンバー2020-01-012020-12-310000875045BIIB:AducanumabMemberアジアインフラ投資銀行:衛材会員米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310000875045BIIB:AducanumabMemberアジアインフラ投資銀行:衛材会員米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310000875045BIIB:AducanumabMemberアジアインフラ投資銀行:衛材会員米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310000875045BIIB:AducanumabMemberアジアインフラ投資銀行:衛材会員アメリカ-公認会計基準:販売一般と管理費用メンバー2022-01-012022-12-310000875045BIIB:AducanumabMemberアジアインフラ投資銀行:衛材会員アメリカ-公認会計基準:販売一般と管理費用メンバー2021-01-012021-12-310000875045BIIB:AducanumabMemberアジアインフラ投資銀行:衛材会員アメリカ-公認会計基準:販売一般と管理費用メンバー2020-01-012020-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:協調利益共有メンバー2022-01-012022-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:協調利益共有メンバー2021-01-012021-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:一里塚報酬メンバーBIIB:ADUHELLメンバー2021-01-012021-12-310000875045BIIB:神経免疫メンバーBIIB:規制のマイルストーンメンバー2021-01-012021-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:一里塚報酬メンバーBIIB:ADUHELLメンバー2020-01-012020-12-310000875045BIIB:神経免疫メンバーBIIB:規制のマイルストーンメンバー2020-01-012020-12-310000875045BIIB:ADUHELLメンバー2022-10-012022-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:在庫遊休能力費用と契約委員会メンバーBIIB:ADUHELLメンバー2022-01-012022-12-310000875045アジアインフラ投資銀行:衛材会員BIIB:在庫遊休能力費用と契約委員会メンバーBIIB:ADUHELLメンバー2021-01-012021-12-310000875045アジアインフラ投資銀行:衛材会員2022-12-310000875045アジアインフラ投資銀行:衛材会員2021-12-310000875045BIIB:UCBPharmaSAMMembers米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310000875045BIIB:UCBPharmaSAMMembers米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310000875045BIIB:UCBPharmaSAMMembers米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310000875045BIIB:VUMERITYメンバーBIIB:AlkerMesMembers2022-01-012022-12-310000875045BIIB:VUMERITYメンバーBIIB:AlkerMesMembers2019-10-012019-10-310000875045BIIB:VUMERITYメンバーBIIB:AlkerMesMembers2021-01-012021-12-310000875045BIIB:VUMERITYメンバーBIIB:AlkerMesMembers2020-01-012020-12-310000875045BIIB:Acordaメンバー2020-09-300000875045BIIB:Acordaメンバー2020-07-012020-09-300000875045BIIB:Acordaメンバー2022-01-012022-12-310000875045BIIB:Acordaメンバー2021-01-012021-12-310000875045BIIB:Acordaメンバー2020-01-012020-12-310000875045BIIB:Sage TreateuticsIncMember2020-12-012020-12-310000875045BIIB:Sage TreateuticsIncMemberSRT:シーン予測メンバ2023-12-310000875045BIIB:Sage TreateuticsIncMember米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310000875045BIIB:Sage TreateuticsIncMember米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310000875045BIIB:Sage TreateuticsIncMember米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310000875045BIIB:Sage TreateuticsIncMemberアメリカ-公認会計基準:販売一般と管理費用メンバー2022-01-012022-12-310000875045BIIB:Sage TreateuticsIncMemberアメリカ-公認会計基準:販売一般と管理費用メンバー2021-01-012021-12-310000875045BIIB:Sage TreateuticsIncMemberアメリカ-公認会計基準:販売一般と管理費用メンバー2020-01-012020-12-310000875045BIIB:IncMemberの治療拒否2020-09-012020-09-300000875045BIIB:IncMemberの治療拒否米国-公認会計基準:研究·開発費メンバー2022-01-012022-12-310000875045BIIB:IncMemberの治療拒否米国-公認会計基準:研究·開発費メンバー2021-01-012021-12-310000875045BIIB:IncMemberの治療拒否米国-公認会計基準:研究·開発費メンバー2020-01-012020-12-310000875045BIIB:Sangamo治療会社のメンバー2020-02-012020-02-290000875045BIIB:Sangamo治療会社のメンバー2020-04-012020-04-300000875045米国-公認会計基準:研究·開発費メンバーBIIB:Sangamo治療会社のメンバー2022-01-012022-12-310000875045米国-公認会計基準:研究·開発費メンバーBIIB:Sangamo治療会社のメンバー2021-01-012021-12-310000875045米国-公認会計基準:研究·開発費メンバーBIIB:Sangamo治療会社のメンバー2020-01-012020-12-310000875045BIIB:InnoCarePharmaLimitedInnoCareAgreementメンバー2021-08-012021-08-310000875045BIIB:他の研究と発見メンバー2022-01-012022-12-310000875045BIIB:他の研究と発見メンバー2021-01-012021-12-310000875045BIIB:他の研究と発見メンバー2020-01-012020-12-310000875045BIIB:サムスン生物類似協定メンバー2012-02-290000875045BIIB:サムスン生物類似協定メンバー2012-02-012012-02-290000875045BIIB:サムスン生物類似協定メンバー2022-04-300000875045BIIB:サムスン生物類似協定メンバーアメリカ公認会計基準:在庫メンバー2022-04-012022-04-300000875045BIIB:サムスン生物類似協定メンバー米国-GAAP:技術的権利の発達したメンバー2022-04-012022-04-300000875045BIIB:サムスン生物類似協定メンバー2022-01-012022-12-310000875045BIIB:サムスン生物類似協定メンバー2021-01-012021-12-310000875045BIIB:サムスン生物類似協定メンバー2021-12-3100008750452019-01-012019-12-31BIIB:製品0000875045BIIB:サムスン生物類似協定メンバー2019-12-012019-12-310000875045BIIB:サムスン生物類似協定メンバー2020-01-012020-01-310000875045BIIB:サムスン生物類似協定メンバー2019-01-012019-12-310000875045BIIB:サムスン生物類似協定メンバー2019-12-310000875045AIIB:発展の里程標メンバーBIIB:サムスン生物類似協定メンバー2021-07-012021-09-300000875045BIIB:サムスン生物類似協定メンバー2021-07-012021-09-300000875045BIIB:サムスン生物類似協定メンバー2022-12-310000875045BIIB:サムスン生物類似協定メンバー2013-12-012013-12-310000875045BIIB:サムスン生物類似協定メンバー2013-12-012013-12-310000875045BIIB:サムスン生物類似協定メンバー2017-08-012017-08-310000875045BIIB:サムスン生物類似協定メンバー2016-01-012016-01-310000875045BIIB:サムスン生物類似協定メンバー2016-05-012016-05-310000875045BIIB:サムスン生物類似協定メンバー2021-01-012021-12-310000875045BIIB:サムスン生物類似協定メンバー2020-01-012020-12-310000875045BIIB:サムスン生物類似協定メンバー2021-12-310000875045BIIB:神経免疫メンバー2022-01-012022-12-310000875045BIIB:神経免疫メンバーBIIB:規制のマイルストーンメンバー2020-06-300000875045アジアインフラ投資銀行:衛材会員2020-04-012020-06-300000875045アジアインフラ投資銀行:衛材会員BIIB:神経免疫メンバーBIIB:規制のマイルストーンメンバーBIIB:ADUHELLメンバー2021-06-300000875045アジアインフラ投資銀行:衛材会員BIIB:ADUHELLメンバー2021-04-012021-06-3000008750452019-11-012019-12-310000875045BIIB:TysabriProductMember2013-12-310000875045BIIB:Ionis製薬会社のメンバーSRT:最小メンバ数BIIB:SPINRAZAMEメンバー2016-01-012016-12-310000875045BIIB:Ionis製薬会社のメンバーSRT:最大メンバ数BIIB:SPINRAZAMEメンバー2016-01-012016-12-310000875045AIIB:発展の里程標メンバー2022-12-310000875045BIIB:規制のマイルストーンメンバー2022-12-310000875045AIIB:ビジネスマイルストーンのメンバー2022-12-310000875045BIIB:AducanumabMemberSRT:シーン予測メンバ2023-12-310000875045国:アメリカ2022-01-012022-12-310000875045国:アメリカ2021-01-012021-12-310000875045国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:他の事後福祉計画で定義された福祉メンバー2022-12-310000875045アメリカ-GAAP:他の事後福祉計画で定義された福祉メンバー2021-12-310000875045国:中国2022-01-012022-12-310000875045国:中国2021-01-012021-12-310000875045国:中国2020-01-012020-12-310000875045国:中国2022-12-310000875045国:中国2021-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー国:中国2022-01-012022-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー国:中国2021-01-012021-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー国:中国2020-01-012020-12-310000875045国:徳2022-12-310000875045国:徳2021-12-310000875045国:徳2022-01-012022-12-310000875045国:徳2021-01-012021-12-310000875045国:徳2020-01-012020-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー国:徳2022-01-012022-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー国:徳2021-01-012021-12-310000875045アメリカ-公認会計基準:その他の非運営収入支出メンバー国:徳2020-01-012020-12-310000875045アメリカ-公認会計基準:製品メンバーBIIB:ヨーロッパにはドイツのメンバーは含まれていない2022-01-012022-12-310000875045国:徳アメリカ-公認会計基準:製品メンバー2022-01-012022-12-310000875045SRT:アジアメンバアメリカ-公認会計基準:製品メンバー2022-01-012022-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバアメリカ-公認会計基準:製品メンバー2022-01-012022-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー国:アメリカ2022-01-012022-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーBIIB:ヨーロッパにはドイツのメンバーは含まれていない2022-01-012022-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー国:徳2022-01-012022-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーSRT:アジアメンバ2022-01-012022-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーBIIB:細分化地域グループカウント配列その他のメンバ2022-01-012022-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMember国:アメリカ2022-01-012022-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMemberBIIB:ヨーロッパにはドイツのメンバーは含まれていない2022-01-012022-12-310000875045国:徳アメリカ-GAAP:ProductAndServiceOtherMember2022-01-012022-12-310000875045SRT:アジアメンバアメリカ-GAAP:ProductAndServiceOtherMember2022-01-012022-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバアメリカ-GAAP:ProductAndServiceOtherMember2022-01-012022-12-310000875045国:アメリカ2022-12-310000875045BIIB:ヨーロッパにはドイツのメンバーは含まれていない2022-12-310000875045国:徳2022-12-310000875045SRT:アジアメンバ2022-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバ2022-12-310000875045アメリカ-公認会計基準:製品メンバーBIIB:ヨーロッパにはドイツのメンバーは含まれていない2021-01-012021-12-310000875045国:徳アメリカ-公認会計基準:製品メンバー2021-01-012021-12-310000875045SRT:アジアメンバアメリカ-公認会計基準:製品メンバー2021-01-012021-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバアメリカ-公認会計基準:製品メンバー2021-01-012021-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー国:アメリカ2021-01-012021-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーBIIB:ヨーロッパにはドイツのメンバーは含まれていない2021-01-012021-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー国:徳2021-01-012021-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーSRT:アジアメンバ2021-01-012021-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーBIIB:細分化地域グループカウント配列その他のメンバ2021-01-012021-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMember国:アメリカ2021-01-012021-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMemberBIIB:ヨーロッパにはドイツのメンバーは含まれていない2021-01-012021-12-310000875045国:徳アメリカ-GAAP:ProductAndServiceOtherMember2021-01-012021-12-310000875045SRT:アジアメンバアメリカ-GAAP:ProductAndServiceOtherMember2021-01-012021-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバアメリカ-GAAP:ProductAndServiceOtherMember2021-01-012021-12-310000875045国:アメリカ2021-12-310000875045BIIB:ヨーロッパにはドイツのメンバーは含まれていない2021-12-310000875045国:徳2021-12-310000875045SRT:アジアメンバ2021-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバ2021-12-310000875045アメリカ-公認会計基準:製品メンバーBIIB:ヨーロッパにはドイツのメンバーは含まれていない2020-01-012020-12-310000875045国:徳アメリカ-公認会計基準:製品メンバー2020-01-012020-12-310000875045SRT:アジアメンバアメリカ-公認会計基準:製品メンバー2020-01-012020-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバアメリカ-公認会計基準:製品メンバー2020-01-012020-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー国:アメリカ2020-01-012020-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーBIIB:ヨーロッパにはドイツのメンバーは含まれていない2020-01-012020-12-310000875045BIIB:20の治療プロジェクトからの収入メンバー国:徳2020-01-012020-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーSRT:アジアメンバ2020-01-012020-12-310000875045BIIB:20の治療プロジェクトからの収入メンバーBIIB:細分化地域グループカウント配列その他のメンバ2020-01-012020-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMember国:アメリカ2020-01-012020-12-310000875045アメリカ-GAAP:ProductAndServiceOtherMemberBIIB:ヨーロッパにはドイツのメンバーは含まれていない2020-01-012020-12-310000875045国:徳アメリカ-GAAP:ProductAndServiceOtherMember2020-01-012020-12-310000875045SRT:アジアメンバアメリカ-GAAP:ProductAndServiceOtherMember2020-01-012020-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバアメリカ-GAAP:ProductAndServiceOtherMember2020-01-012020-12-310000875045国:アメリカ2020-12-310000875045BIIB:ヨーロッパにはドイツのメンバーは含まれていない2020-12-310000875045国:徳2020-12-310000875045SRT:アジアメンバ2020-12-310000875045BIIB:細分化地域グループカウント配列その他のメンバ2020-12-310000875045AIIB:スイス·ソローザンヌメンバー2022-12-310000875045AIIB:スイス·ソローザンヌメンバー2021-12-310000875045AIIB:スイス·ソローザンヌメンバー2020-12-31 アメリカ証券取引委員会
ワシントンD.C.,20549
表10-K
| | | | | |
| ☒ | 1934年証券取引法第13条又は15条に基づいて提出された年次報告 |
本財政年度末まで十二月三十一日, 2022
あるいは…。
| | | | | |
| ☐ | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
依頼書類番号:0-19311
生物遺伝会社
(登録者の正確な氏名はその定款に記載)
| | | | | | | | |
| デラウェア州 | | 33-0112644 |
| (登録設立又は組織の国又はその他の管轄区域) | | (国際税務局雇用主身分証明書番号) |
ビンニー街225番地, ケンブリッジ大学, 体積量02142
(617) 679-2000
(登録者は主に事務室の住所を実行し、郵便番号と電話番号、市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| | | | | | | | | | | | | | | | | |
| クラスごとのタイトル | | 取引コード | | 登録された各取引所の名称 |
| 普通株、額面0.0005ドル | | BIIB | | ♪the the the | ナスダック世界ベスト市場 |
同法第12条(G)に基づいて登録された証券:ありません
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してくださいはい、そうです x No o
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。はい、そうですo 違います。 x
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示すはい、そうです x No o
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうです x No o
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたいx
| | | | | | | | | | | | | | |
| 大型加速ファイルサーバ | x | | ファイルマネージャを加速する | ☐ |
| 非加速ファイルサーバ | ☐ | | 規模の小さい報告会社 | ☐ |
| | | 新興成長型会社 | ☐ |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する☐
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オクスリ法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいてその財務報告の内部統制の有効性を評価したことを証明する。この評価は、その監査報告書を作成または発行する公認会計士事務所によって行われるx
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、そうです☐ No x
登録者の非関連会社が保有する登録者普通株の総時価(その株がこの計算に含まれていない誰も関連会社であることは認めない)は,登録者が最近終了した第2四半期最後の営業日の普通株の最終売却価格から計算され,総時価は$である29,397,964,818.
2023年2月14日現在登録者は144,485,646普通株、額面0.0005ドル、発行されました。
引用で編入された書類
我々は、2023年株主総会の最終委託書の内容の一部を参考にして本報告の第3部に組み込む。
カタログ表
生物遺伝会社
表格10-Kの年報
2022年12月31日までの年度
カタログ
| | | | | | | | |
| | | ページ |
第1部 |
第1項。 | 業務.業務 | 1 |
第1 A項。 | リスク要因 | 28 |
項目1 B。 | 未解決従業員意見 | 42 |
第二項です。 | 属性 | 42 |
第三項です。 | 法律訴訟 | 43 |
第四項です。 | 炭鉱安全情報開示 | 43 |
|
第II部 |
五番目です。 | 登録者普通株市場、関連株主事項及び発行者による株式証券の購入 | 44 |
第六項です。 | 保留されている | 45 |
第七項。 | 経営陣の財務状況と経営成果の検討と分析 | 46 |
第七A項。 | 市場リスクの定量的·定性的開示について | 79 |
第八項です。 | 財務諸表と補足データ | 81 |
第九項です。 | 会計と財務情報開示の変更と相違 | 81 |
第9条。 | 制御とプログラム | 81 |
プロジェクト9 B。 | その他の情報 | 82 |
プロジェクト9 Cです。 | 検査妨害に関する外国司法管区の開示 | 82 |
|
第三部 |
第10項。 | 役員·幹部と会社の管理 | 83 |
第十一項。 | 役員報酬 | 83 |
第十二項。 | 特定の実益所有者の担保所有権及び経営陣及び関連株主の事項 | 83 |
十三項。 | 特定の関係や関連取引、取締役の独立性 | 83 |
14項です。 | チーフ会計士費用とサービス | 83 |
|
第4部 |
第十五項。 | 展示品と財務諸表の付表 | 84 |
第十六項。 | 表格10-Kの概要 | 84 |
| |
サイン | 88 |
連結財務諸表 | F- 1 |
前向き陳述に関する説明
本報告書には,1995年の私証券訴訟改革法(同法案)の規定による前向きな陳述が含まれており,この法案の“安全港”条項から利益を得ることを目的としている。これらの前向きな陳述は、“目標”、“予想”、“信じ”、“可能”、“推定”、“予想”、“予測”、“目標”、“意図”、“可能”、“計画”、“潜在”、“可能”、“将”、“将”などの類似した意味の語および用語を伴う可能性がある。特に、以下の側面に関する前向きな陳述を言及した
•収入の予想額、スケジュールおよび計算;または有、マイルストーン、特許権使用料と許可、協力、購入または剥離プロトコル項目の下の他の支払い、税務状況およびまたは事項、入金の収集可能性、承認前の在庫、販売コスト、研究および開発費用、報酬およびその他の販売、一般および行政費用、無形資産の償却、外貨両替リスク、資産および負債の推定公正価値、および減価評価;
•販売、価格設定、成長、清算、当社の市場とパイプライン製品の発売に関する期待、計画、見通し
•既存製品からの新しいオリジナル療法、模倣薬、プロドラッグおよび生物模倣薬の競争激化、および我々の製品または競合製品の模倣薬または生物類似バージョンを含む、簡略化された規制経路の下で許可された製品を含む、我々の競争市場における製品競争激化の潜在的影響
•特許条項、特許期間延長、特許庁の行動、および予想される獲得可能性および規制排他期間
•私たちのポートフォリオでの計画と投資、わが社の戦略の実施
•業務成長の駆動力には、発見、研究開発計画、および業務発展機会に関連する資源を投入する計画および意図、およびいくつかの業務発展取引およびコスト削減措置の潜在的なメリットおよび結果、および達成されることが期待されるいくつかの業務発展取引およびコスト削減措置が含まれる
•潜在的な臨床試験、申請および承認のコストと時間、第三者との協力、および私たちと私たちのパートナーパイプライン製品の開発および商業化の潜在的な治療範囲を含む、私たちの製品、候補薬物およびパイプライン計画の予想、開発計画、および予想スケジュール
•私たちの特許および他の独自および知的財産権、税務監査、評価および和解、定価、販売および販売促進慣行、製品責任およびその他の事項に関連する行政、法規、法律および他の手続きの時間、結果、および影響
•私たちは私たちの業務や業務活動に資金を提供し、これらの活動のために資金を得ることができる
•不良セキュリティ事件は、私たちの発売製品、私たちの発売製品の模造薬または生物類似バージョン、または私たちの製品と同じカテゴリーに属する任意の他の製品に関するものです
•販売、費用、備蓄と手当、サプライチェーン、製造、ネットワーク攻撃または他のプライバシーまたはデータセキュリティ事件、研究開発コスト、臨床試験と従業員を含む、新冠肺炎疫病とその他の全世界衛生疫病の私たちの業務と運営に対する直接と間接的な影響
•ウクライナ紛争の現在と潜在的な影響は、私たちの運営と販売への影響と、影響を受けた地域での私たちの臨床試験活動の計画が中断または遅延する可能性がある
•米国(米国)の医療改革の潜在的な影響には、2022年の“インフレ低減法案”(IRA)と、価格設定行動と私たちの製品精算の影響を減らすことを含む、医療コストの削減と政府支出全体のレベルを制限するための措置が世界的に取られている
•我々の製造能力、第三者契約製造組織の使用、私たちの製造能力の変化に関する計画と時間、新しいまたは既存の製造施設の活動、およびSolothurn製造施設の残りの部分が製品または候補製品の製造を開始し、ノースカロライナ州研究三角園区(RTP)に位置する遺伝子治療製造施設の運営開始の予想スケジュール;
•一部の国の信用や経済状況は不確定であり、私たちがこれらの国で売掛金を受け取る影響は続いている
•賃貸約束、購入義務、および他の契約義務のスケジュールおよび履行状況
•新しい法律(税収を含む)、規制要件、司法判断、会計基準の影響。
これらの展望的陳述はリスクと不確定要素に関連しており、第1 A項。リスク要因本報告や本報告書の他の部分に掲載されているように,実際の結果はこのような声明に反映された結果とは大きく異なる可能性がある。あなたはこの陳述に過度に依存してはいけない。展望的な陳述はただこの報告日までの状況を代表する。法律の要求がない限り、私たちは新しい情報、未来の発展、または他の理由でも、いかなる前向きな陳述を公開更新する義務も負いません。
会社と製品参考に関する説明
本報告では次のように述べた
•“生物遺伝”、“会社”、“私たち”、“私たち”とは、生物遺伝研究会社とその合併子会社を意味する
•Rituxan“とは、Rituxan(リツキシマブの米国、カナダ、日本における商標名)およびMabThera(リツキシマブの米国、カナダ、日本以外の商標名)を意味する。
商標に関する説明
アドゥヘラム®、Avonex®プレグリディ®Rituxan®、Rituxan HYCELA®SPINRAZA®Tecfidera®Tysabri®VUMERITY® 生物遺伝会社の登録商標です
ベネッパーリ™BYOOVIZ™FlIXabi™、FUMADERM™、IMRALDI™ 健康な気候、健康な生活™生物遺伝会社の商標です。
アクトムラ®CIMZIA®ENBREL®,EYLEA®FAMPYRA™、Gazyva®、HUMIRA®LEQEMBI™Lucentis®、LUNSUMIO™、OCREVUS®レクシェード® 本報告書で言及されている他の商標は、それぞれの所有者の財産である。
第1部
プロジェクト1.ビジネス
概要
生物遺伝会社は世界規模の生物製薬会社であり、世界各地の深刻かつ複雑な疾病を有する患者の発見、開発と革新療法の提供に専念している。われわれは多発性硬化症(MS)を治療する広範な薬物の組み合わせを持ち、初めて承認された脊髄性筋萎縮症(SMA)の治療法を発売し、アルツハイマー病の決定的な病理を解決するために2つの治療法を共同開発した。私たちは神経学、神経精神医学、専門免疫学、稀な疾患のルートを推進することに集中している。私たちは内部研究開発計画と外部協力を通じて私たちの薬物発見と開発を支援している。
我々が販売している製品は,MSを治療するTecfidera,VUMERITY,Avonex,Pregridy,TysabriおよびFAMPYRA;SMA治療SPINRAZA;アルツハイマー病治療ADUHELM;および重篤な斑塊型乾癬を治療するFUMADERMを含む。衛材株式会社(Eisai)と協力してアルツハイマー病治療のためのLEQEMBIを商業化し,2023年1月に米国食品医薬品局(FDA)の加速承認を得た。我々は、非ホジキンリンパ腫、慢性リンパ球性白血病(CLL)および他の疾患の治療のためのRituxan HYCELA、非ホジキンリンパ腫およびCLLの治療のためのRituxan HYCELA、CLLおよび濾胞性リンパ腫の治療のためのGazyva、原発進行性多発性硬化症(PPMS)および再発性多発性硬化症(RMS)の治療のためのOCREVUS、LUNSUMIO(Mosunetuzumab)であり、2022年第4四半期に米国で加速承認され、再発または難治性濾胞性リンパ腫の治療のための;Glofitamab、潜在的非特異的ホジキンリンパ腫の治療のための潜在的に特異的な抗体を治療するための商業的および財務的権利を有する。我々と羅氏集団の全メンバー遺伝子テーク社(Genentech)との協力により,他の潜在的な抗CD 20療法を増加させることも選択できる。
MSとSMAへの新たな潜在的革新に引き続き投資するほか、重度抑うつ障害(MDD)および出産後うつ病(PPD)のズランノロンの治療、アルツハイマー病の治療のBIIB 080、筋萎縮性側索硬化症(ALS)のtofersenの治療、およびある形態の狼瘡を治療するlitifilimabおよびdapirolizumab pegolを含む中末期計画を進めている。
我々はまた、Benepali、ENBRELを参照するエナジー生物類似体、IMRALDI、HUMIRAを参照するアダリモモノクロナル生物類似体、FLIXABI、インフリキシマブ生物類似体、Remicade、およびBYOOVIZ、Lucentisを参照するranibizumab生物類似体、米国で提案されたBIIB 800、提案されたtocilizumab生物類似参考Actemra、およびSB 15を含む潜在的生物類似製品を開発し続けている、ヨーロッパのある国で先進生物製剤の生物模倣薬を商業化している。
私たちの連携スケジュールに関する他の情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
主要業務発展
以下は,2022年初めから我々の業務に影響を与える重要な事態の概要である
以下で議論する連携関係や他の関係に関する他の情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
重要な協力関係の発展
防衛協力協定
LEQEMBI(Lecanemab)連携プロトコル
2023年1月、著者らと衛材はFDAがLEQEMBIの承認を加速することを発表し、アルツハイマー病の治療のための抗アミロイド様抗体である。さらに、2023年1月、私たちと衛材は、LEQEMBIの伝統的な承認を得るために、補完生物製品ライセンス申請(BLA)のFDAへの提出を完了したと発表した。
2023年1月、欧州医薬品局(EMA)はlecanemabの上場許可申請(MAA)の審査を受けた。
衛材は2023年1月に日本医薬品·医療機器庁(PMDA)に提出されたMAAを完成させ,lecanemabを行い,日本厚生労働省の優先審査を得た。
2022年12月、衛材は中国指導者の国家薬品監督管理局にBLAをスクロールして提出し、lecanemabを承認し始めた。
2022年3月に衛材とのLEQEMBI関連供給協定を延長し,LEQEMBI薬物物質の生産に5年から10年に延長した。
ADUHELM連携プロトコル
2022年3月14日,衛材とのADUHELM連携協定を修正した。改正日より,我々は世界でADUHELMの唯一の決定権と商業化権利を持ち,2023年1月1日から衛材はADUHELM純売上高による分級特許権使用料のみを受け取り,ADUHELMのグローバル損益の共有には参加しなくなった。衛材は2022年1月1日から2022年12月31日までの間の開発、商業化、製造費シェアを3.35億ドルに制限し、2022年12月31日までにこの目標を達成した。この限度額に達すると,ADUHELMに関するすべてのコストを負担する.
衛材との協力手配に関する他の情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
Zuranolone(BIIB 125)
2022年6月、私たちと私たちのパートナーであるSage Treateutics,Inc.(SAGE)は、MDDおよびPPDの潜在的治療Zuranoloneに対するSkylark 3期研究が主要かつすべての重要な副次的終点に達したと発表した。
2022年12月、我々およびSageは、MDDおよびPPDの潜在的治療のためのズランノドンを承認するために、FDAへのローテーション出願(NDA)を完了した。今回の提出は2022年早い時期に開始された機密協定申請を完了した。
FDAは2023年2月にNDAを受け,ズランノドンの優先審査を承認し,処方薬使用料法案(PDUFA)の行動日は2023年8月5日であった。
Sageとのご協力に関するより多くの情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
遺伝子テーク
LUNSUMIO(Mosunetuzumab)
2022年1月、我々は遺伝子テークとの選択権を行使し、再発または難治性濾胞性リンパ腫を治療する二重特異性抗体であるLUNSUMIO(Mosunetuzumab)の共同開発と商業化に関与した。これに関連して,2021年12月に遺伝子テークに3,000万ドルのオプション権料を支払った。
2022年12月、遺伝子テイクはFDAがLUNSUMIOの加速承認を承認したことを発表し、欧州委員会(EC)も2022年6月にLUNSUMIOを承認した。
Glofitamab
2022年12月、私たちはGenentechとGlofitamabの商業化と経済学的共有について合意し、GlofitamabはCD 20とCD 3に対する二重特異性抗体を結合し、潜在的なB細胞非ホジキンリンパ腫の治療に使用する研究中のT細胞である。
遺伝子テークとの協力に関するもっと多くの情報をお読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
他の協力関係
エルセロン治療会社は
2022年12月、我々はAlcyone Treateutics(Alcyone)と許可および協力協定を締結し、患者の治療体験を改善し、脊髄腫瘍および筋萎縮性側索硬化症のような神経疾患を有する患者の許容性を改善することを目的とした埋め込み型医療デバイスであるThecaFlex DRxシステムを共同開発した。今回の協力の条項によると、エルコンとシステムを共同開発し、エルコンは独自にこのシステムの製造と商業化を担当する。この取引で、私たちはAlcyoneに1000万ドルを前払いした。
会社の事務
サムスンBioepis-Biogenとサムスン生物の合弁企業
2022年4月、Samsung Bioepisにおける49.9%の株式をサムスン生物株式会社(Samsung Biologics)に売却することを完了しました。この取引の条項によると、私たちは取引完了時に約10億ドルの現金を受け取り、2つの支払いで約13億ドルの支払いを延期する予定で、この2つの支払いはそれぞれ取引完了1周年で満期になった約8.125億ドルと、取引完了後2周年に満了した約4億375億ドルになる見通しだ。
この取引の一部として、私たちはいくつかの商業マイルストーンを達成した後に5000万ドルの追加収入を得る資格がある私たちのこのような性質または支払いに対する政策は、支払いが現金化可能な間に支払いを確認することであり、これは通常、支払いを受ける期間と同じである。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置、私たちの連結財務諸表はこの報告書に含まれている。
2022年コスト削減計画
2021年12月と2022年5月には,一連のコスト削減措置を実施する計画を発表し,完成後に約10億ドルの費用を節約する予定である。これらの節約は、リストラ、商業ADUHELMインフラの大幅な廃止、ある不動産場所の統合、私たちの販売、一般と行政、研究開発機能の運営効率の向上など、一連の措置によって実現されている。
これらの取り組みにより,合計約1.31億ドルの再編費用が発生すると予想され,主に解散費に関係している。この金額は2022年の間に大きな部分が発生した。自分から2022年12月31日おおむね3590万ドル私たちの再編成備蓄に残っていて、2026年まで支払われる予定だ。
2022年コスト節約計画に関するより多くの情報は、お読みください付記4、再編成私たちの連結財務諸表は本報告書に含まれている。
125ブロードウェイのアフターレンタル取引
2022年9月、マサチューセッツ州ケンブリッジ市ブロードウェイ125号(ブロードウェイ125号)に位置する建物とブロックの販売を完了し、総売上高は約6.03億ドルで、1080万ドルのテナント手当が含まれている。同時に、この取引の完了に伴い、私たちはビルを借りて、レンタル期間は約5.5年です。
ブロードウェイ125号の販売とレンタル取引に関するもっと多くの情報は、お読みください付記11,財産·工場·設備そして別注12,賃貸借契約私たちの連結財務諸表は本報告書に含まれている。
経営陣の変動
•2022年11月、クリストファー·A·ヴァイバッハを総裁兼最高経営責任者に任命することを発表しました。
•2022年2月、私たちはニコール·マーフィーを執行副総裁に任命し、製薬運営と技術を担当することを発表した。
•2023年1月、我々はプリリア·シンハルを常務副主任総裁に任命し、発展を担当することを発表した。
取締役会の最新情報
•2022年6月、ナンシー·ライミンとブライアン·ボスナは私たちの取締役会を退職した。
•2022年11月、Christopher A.Viebbacherが私たちの取締役会に参加した。
私たちの幹事の実行に関する情報をもっと知りたいのですが、本報告の“幹事の実行に関する情報”と題する小節を読んでください。
製品とパイプライン開発
多発性硬化症と神経免疫学
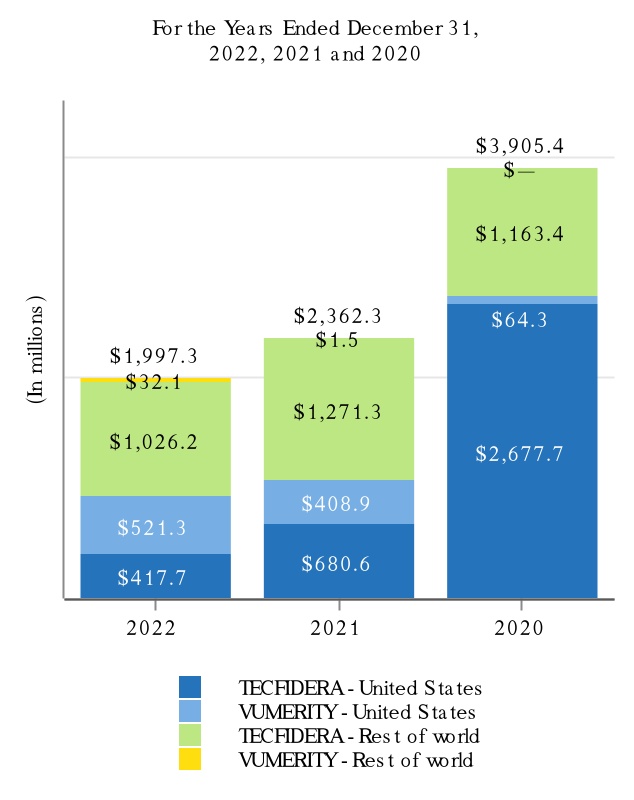
Tecfidera(フマル酸ジメチル)
•2022年6月、欧州特許庁(EPO)は、2028年2月に満了するTecfideraに関連する特許を付与した。
•2022年10月、欧州連合裁判所(CJEU)の総検事長は、Tecfideraの規制データ保護についてBiogenに有利な拘束力のない諮問意見を発表した。この意見は,CJEUが欧州一般裁判所の以前の裁決を棚上げし,欧州医薬品局が後発薬Tecfideraの販売申請を発効させない決定を無効にすることを提案した。
アルツハイマー病と認知症
LEQEMBI(Lecanemab)
•2023年1月、著者らと衛材はFDAがLEQEMBIの承認を加速することを発表し、アルツハイマー病の治療のための抗アミロイド様抗体である。また,2023年1月,我々と衛材はLEQEMBIの従来の承認を得るためにFDAへの補完BLAの提出が完了したことを発表した。
•2022年9月,われわれと衛材はLEQEMBIの確証段階3明瞭性アルツハイマー病研究の陽性背線結果を発表した。LEQEMBIは主端点とすべての重要な二次端点を満たし、結果は非常に顕著な統計学的意義を持っている。
•2022年11月、衛材は2022年アルツハイマー病臨床試験会議でLEQEMBIの実証段階3解像度アルツハイマー病研究の完全な結果を示した。
•2022年11月ニューイングランド医学雑誌LEQEMBIの実証段階3解像度アルツハイマー病研究の完全な結果を発表した。
アドゥヘム(アドゥカヌズマブ)
•2022年3月、我々が発表した新しいデータは、100 mg/mL ADUHELMの静脈内投与から2年半近く(128週間)後、3期試験の長期拡張段階にある患者のアルツハイマー病の2つの重要な病理疾患であるアミロイドβプラークと血漿p-tau 181の発病率は引き続き有意に低下したことを示した。
•2022年3月アルツハイマー病予防雑誌同業者評議の原稿を発表し、肝心な段階3に出現し、ADUHELM 100 mg/mL静脈注射による早期アルツハイマー病治療の研究に参与したことを詳しく紹介した。この出版物は、試験における主な、第2および第3の終点の結果、ならびに安全データおよびバイオマーカーサブ研究を含む。
•2022年3月,ADUHELMの検証性第4段階enVision研究の最終研究案をFDAに提出し,その審査と承認に供した。
•2022年4月、医療保険·医療補助サービスセンター(CMS)は、ADUHELMを含むアルツハイマー病抗アミロイド治療薬の最終NCDを発表した。最終的なNCDはエビデンス開発のカバー範囲を確認しており,このカバー範囲では,連邦医療保険を持つ患者は承認された臨床試験の一部である場合にのみ治療を受けることができる。この決定により,実際にはすべての医療保険受益者がADUHELMを得ることができなくなった。
•2022年4月,CMSの決定により,現在ADUHELM治療を受けている米国患者に連続的な看護計画を提供する計画を発表した。
神経精神医学
Zuranolone(BIIB 125)
•2022年2月,われわれとSageはMDD患者に対するズラノドンの3期サンゴ研究が試験目標を達成したことを発表し,3日目と2週間の治療期間中に抑うつ症状が迅速かつ統計的に有意に減少し,主要かつ重要な副次的ゴールを達成したことを示した。
•2022年6月、私たちとSageは、産後うつを有する女性に対するSkylark 3期Zuranone研究が、主要かつすべての重要な副次的ゴールに達したと発表した。
•2022年10月、私たちとSageは、産後うつを患っている女性におけるZuranoneの3期Skylark研究における追加データを発表しました。このデータはヨーロッパ神経精神薬理学アカデミー(ECNP)大会で発表された。
•2022年12月、私たちおよびSageは、MDDおよびPPDの潜在的治療のためのZuranoloneの承認のためにFDAにスクロール提出されたNDAを完了した。今回の提出は2022年早い時期に開始された機密協定申請を完了した。
•FDAは2023年2月にNDAを受け,ズランノドンの優先審査を承認し,PDUFAの行動日は2023年8月5日であった。
神経筋疾患
スペンサー(Nusinesen)
•2022年3月、我々は、臨床結果を評価し、遅発型SMAを有する児童、青少年および成人における比較的大量のSPINRAZAの安全性を評価するための第1の患者を全世界3 b期Ascend研究で治療したことを発表し、これらの児童、青少年および成人は以前Evrysdi治療を使用していた。
BIIB 115
•2022年10月、BIIB 115の第1段階研究の第1の患者は用量治療を受けた。BIIB 115はSMAのために開発されている研究ASOである。
トフィソン(BIIB 067)
•2022年6月,tofersenの新たな12カ月データを公表し,開始遅延(開放ラベル延長研究では6カ月後)よりも早くtofersenの使用を開始することで,臨床機能,呼吸機能,筋力,生活の質の低下を遅らせることができることを示した。
•FDAは2022年7月にNDAを受け,tofersenの優先審査を承認し,tofersenはスーパーオキシドジスムターゼ1(SOD 1)ALS患者に対するアンチセンス研究薬として評価されており,現在PDUFAの作用日は2023年4月25日である。
•2022年9月ニューイングランド医学雑誌Tofersenの3期Valor研究の詳細な結果を発表し,3期Valor研究とtofersen潜在治療SOD 1 ALSの開放ラベル延長研究の総合的な分析を評価した。
•2022年12月、EMAはトファーソンのMAA審査を受けた。
運動障害
BIIB 122(DNL 151)
•2022年5月、BIIB 122に対する2 b期LUMA研究において投与が開始され、BIIB 122はロイシンリピート2(LRRK 2)に富む小分子阻害剤であり、約640人の早期パーキンソン病患者においてBIIB 122およびプラセボの治療効果および安全性を評価した。
•2022年10月私たちは協力パートナーと デナリー治療会社(デナリー)はパーキンソン病患者においてBIIB 122の第3段階灯台研究を開始することを発表し,LRRK 2遺伝子の原因変異を確認した。
ALO 1811
•2022年6月、著者らはAlectos Treateutics Inc.(Alectos)と協力と許可協定を締結し、新型臨床前選択性GBA 2阻害剤ALO 1811を開発し、それを商業化し、パーキンソン病患者の潜在的口腔疾患修飾治療に応用した。
免疫学
Litifiimab(BIIB 059)
•2022年7月ニューイングランド医学雑誌2部からなる第2段階丁香研究(B部)では,皮膚エリテマトーデス(CLE)部分が積極的な結果を示しており,狼瘡治療の研究薬であるlitifilimabを評価している。この研究は主な終点に達しており,プラセボに比べてススタルモノクロナル抗体の方が皮膚病活動を減少させる効果が強いことが証明されているからである。
•2022年9月ニューイングランド医学雑誌第2稿を発表し,2部からなる第2段階丁香研究(A部分)がlitifilimabの全身性エリテマトーデス(SLE)部分を評価した積極的な結果を詳細に紹介した。この研究はその主要な終点に達しており,プラセボと比較してスタタ非モノクロナル抗体が活動関節総数の統計的有意な減少に関与していることが証明されているからである。
•2022年10月、第1の患者はlistFilimabの2/3期紫晶研究において用量治療を受け、litifilimabはプラセボと比較した慢性肺水腫患者における治療効果と安全性を評価した。
生体模倣薬
BIIB 801(CIMZIA参照)
•2022年2月、CIMZIAを参考に提案されたcertolizumab pegol生物類似体であるBIIB 801を開発、製造、商業化するために、Xbrane Biophma AB(Xbrane)と商業化および許可協定を締結した。
BYOOVIZ(Lucentis参照)
•2022年6月、私たちとサムスンBioepisはBYOOVIZを発表し、Lucentisのranibizumab生物類似体を参考にしてアメリカで発売した。
BIIB 800(Actemra参照)
•2022年6月、我々のパートナーであるBio-Thera Solutions,Ltd.(Bio-Thera)はBIIB 800の第3段階研究の陽性結果を発表し、BIIB 800は1種の提案されたtocilizumab生物類似体であり、重篤な活動期および進行性関節リウマチの治療に抗インターロイキン6受容体のモノクロナル抗体Actemraを参考にした。これらのデータは2022年欧州リウマチ年次総会で発表された。
•2022年9月、EMAはBIIB 800のMAA審査を受けた。
•FDAは2022年12月にBIIB 800の略称BLAの審査を受けた。
生産停止計画
•2022年3月,われわれとIonis製薬会社(IONIS)は,BIIB 078のALSにおける第一段階研究はいかなる二次治療効果の終点にも達しておらず,臨床的利益も示されていないと発表した。これらの結果に基づき,BIIB 078の開発を中止した.
•2022年6月、我々は、特定の神経および神経変性疾患の潜在的治療のためにBIIB 100のさらなる開発を中止し、主にALSにおいて、経営陣がその戦略審査過程の一部として行った決定に基づいている。
•2022年7月、我々は、統合失調症関連認知障害の第2段階スコア研究において、BIIB 104がその主要または副次的な治療効果の終点に達していないことを発表した。認知·機能の主要·副次的測定で観察された一貫した有効性が乏しいことを考慮して,BIIB 104計画を中止することにした。
•2022年には,様々な精神·神経疾患の行動や神経症状を潜在的に治療するためのBIIB 118(CK 1阻害剤)のさらなる開発を中止し,その戦略審査過程の一部として管理層による決定を行った。
•2022年12月、三叉神経痛(TGN)および糖尿病性疼痛性神経病変(DPN)の潜在的治療のためのビソトリアジン(BIIB 074)のさらなる開発を中止した規制、開発、そして商業化の挑戦に基づく。
•2023年2月に私たちはInnoCare Pharma Limited(InnoCare) Orelabrutinibの場合、MSの治療のための小分子Bruton‘sチロシンキナーゼ阻害剤の経口投与。
発売製品
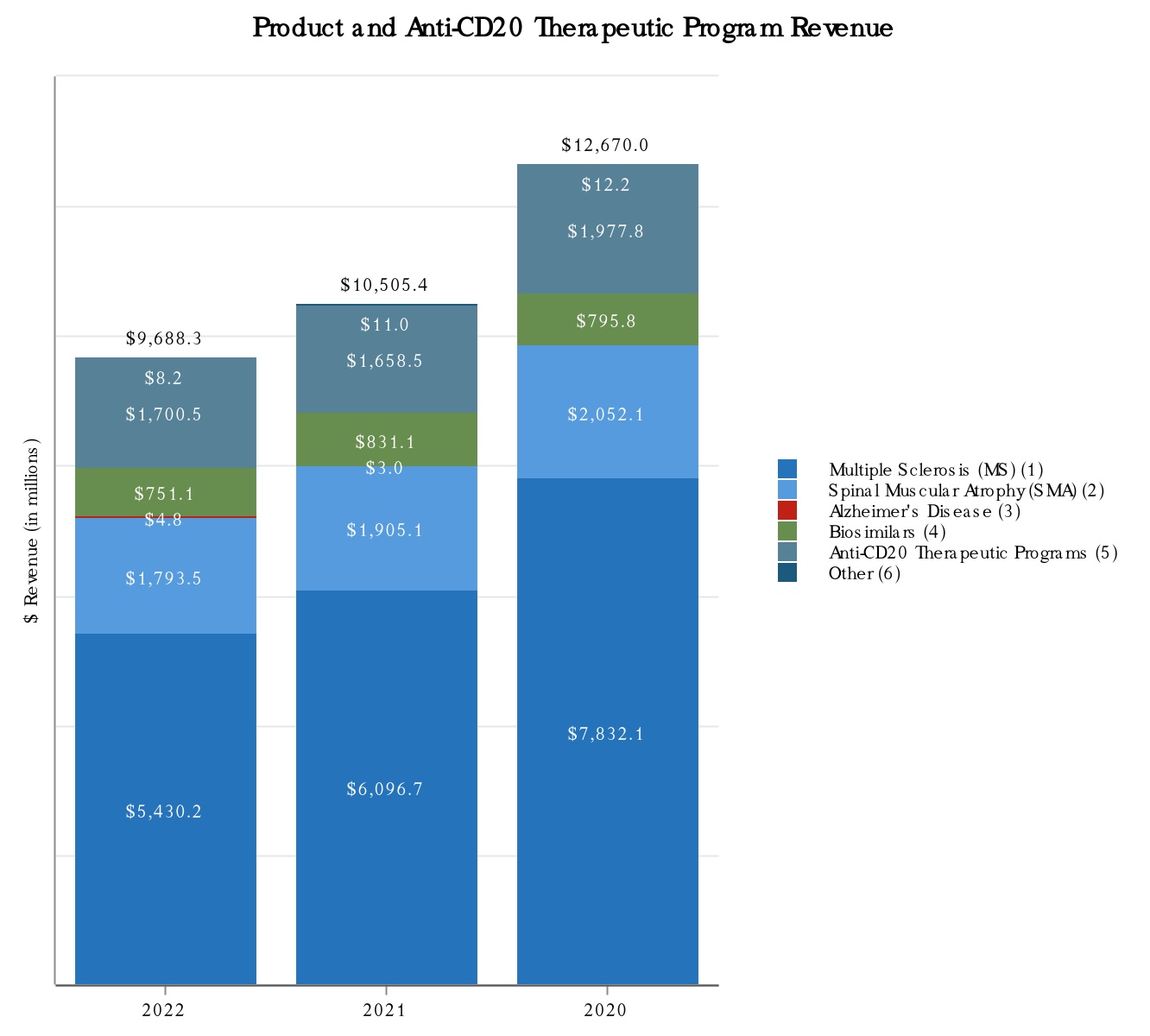
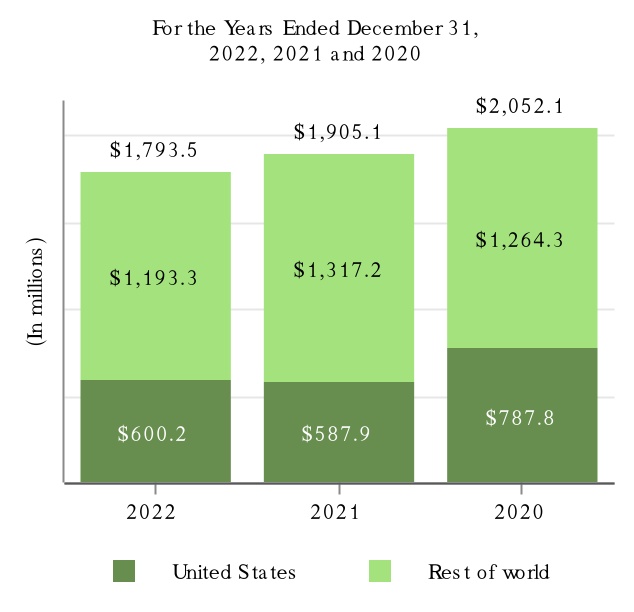
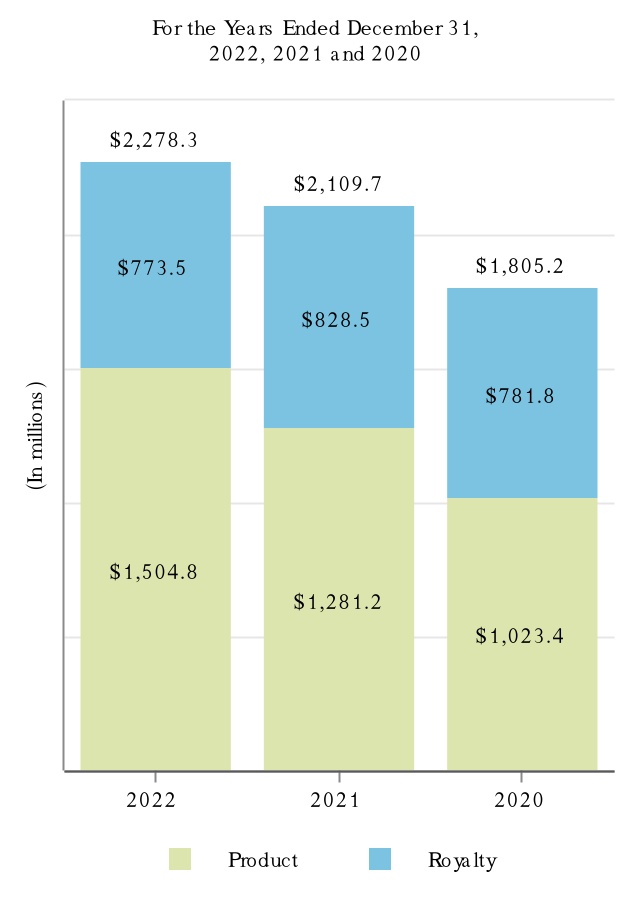
次の図に2022年,2022年,2021年,2020年12月31日までの年度における製品別収入と抗CD 20治療計画の収入を示す。
(1) MSはTecfidera,VUMERITY,Avonex,Plegridy,Tysabri,FAMPYRAを含む。VUMERITYは2021年第4四半期にEUで商業使用を開始した。
(2)SMAにはSPINRAZAが含まれる。
(3)アルツハイマー病にはADUHELMが含まれている。
(4)生体模倣薬にはBenepali,IMRALDI,FLIXABI,BYOOVIZがある。BYOOVIZは2022年6月に米国で発売され、2022年第3四半期に商業使用を開始した。
(5)抗CD 20治療案にはRituxan,Rituxan HYCELA,Gazyva,OCREVUSがある。
(6)他にもFUMADERMがある.
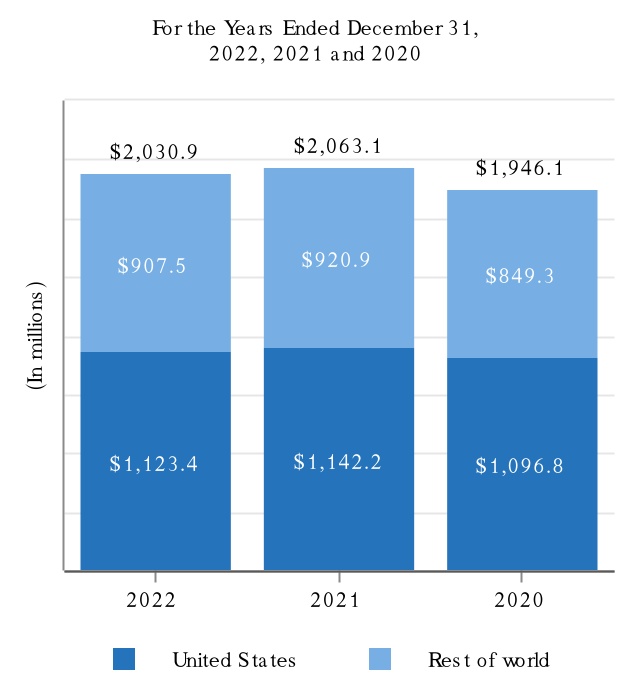
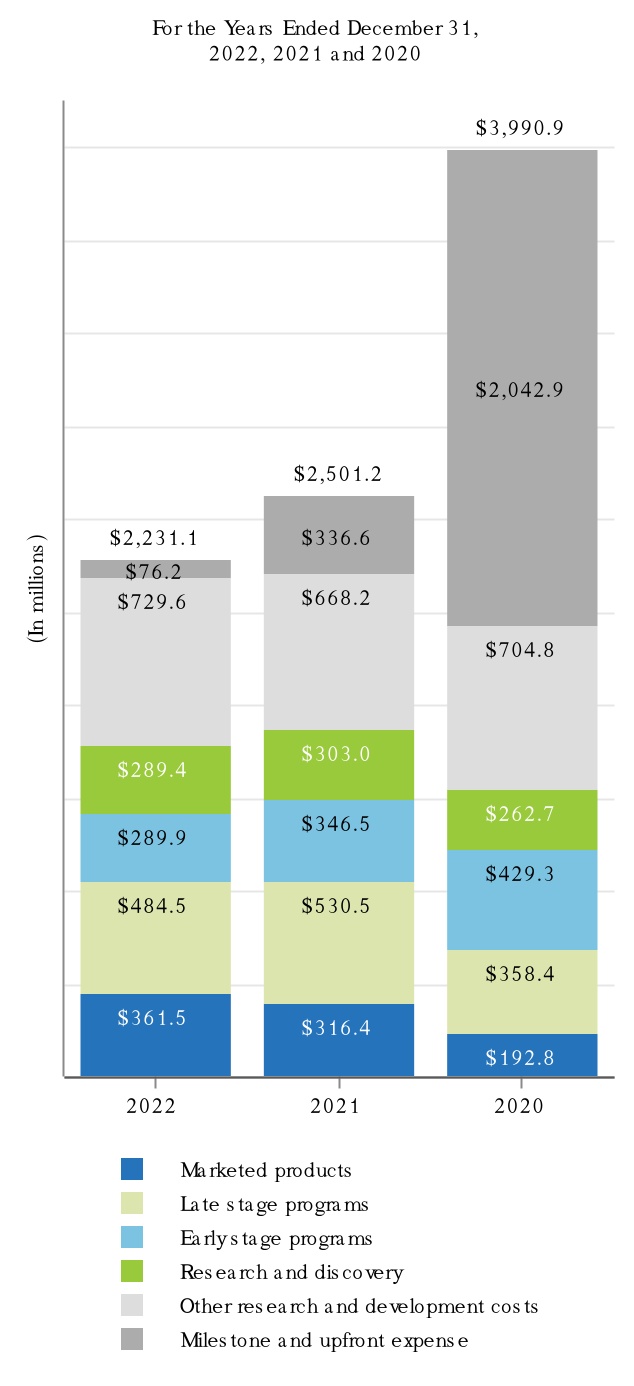
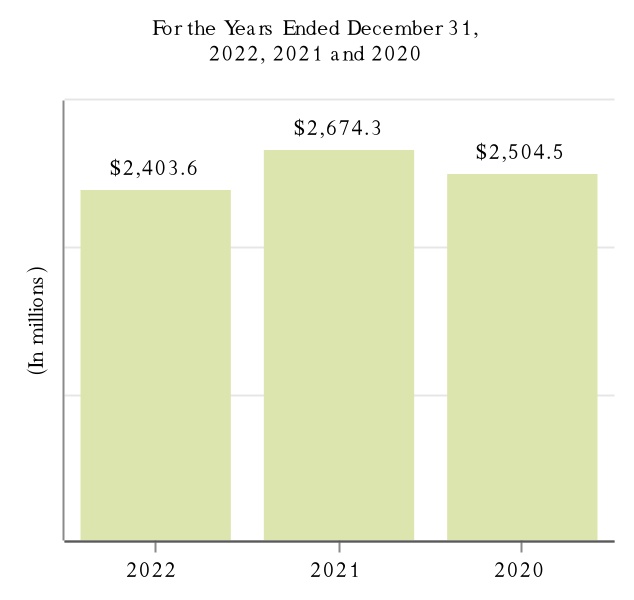
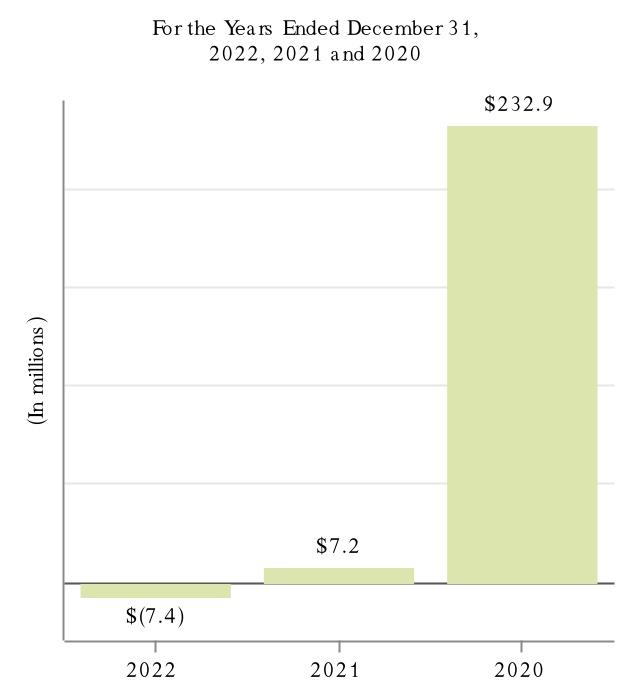
2022年,2021年,2020年12月31日までの会計年度において,Tecfidera,Tysabri,SPINRAZAの製品売上高はそれぞれ我々の総収入の10.0%以上を占めている。私たちの製品と私たちが運営している他の収入と地理区域に関するもっと多くの財務情報を読んでください付記5、収入そして25細分化された情報私たちの連結財務諸表は本報告書とプロジェクト7.経営陣の財務状況と経営成果の検討と分析本報告に含まれます。私たちの業務に伴うリスクに関する議論は第1 A項。リスク要因本報告に含まれます
多発性硬化症
我々はMS患者を治療するための多くの製品を開発、製造、販売している。MSは進行性疾患であり、体は神経細胞に沿って情報を伝達する能力を失い、筋肉の制御を失い、麻痺し、場合によっては死亡する。活動性RMS患者は不均一な疾患進展パターンを経験し、その特徴は安定期が疾病の突発によって中断され、その後患者は比較的に低い機能ベースラインに回復する可能性があることである。
私たちが販売しているMS製品と私たちの主な市場は以下の通りです
| | | | | | | | | | | | | | | | | | | | |
| 製品 | | 指示する | | 協力者 | | 主要市場 |
| | | | | | |
| | RMSはアメリカで
EU再発多発性硬化症(RRMS) | | ありません | | アメリカです。
フランス
ドイツ
イタリア
日本です
スペイン.スペイン
イギリス.イギリス |
| | | | | | |
| | RMSはアメリカで
EUのRRMSです | | Alkermes Pharmaアイルランド株式会社、Alkermes plc(Alkermes)の子会社 | | アメリカです。
ドイツ
イスラエル
スイス
イギリス.イギリス |
| | | | | | |
| | 均角根 | | ありません | | アメリカです。
フランス
ドイツ
イタリア
日本です
スペイン.スペイン
|
| | | | | | |
| | RMSはアメリカで
EUのRRMSです | | ありません | | アメリカです。
フランス
ドイツ
イタリア
スペイン.スペイン
イギリス.イギリス
|
| | | | | | |
| | 均角根
EUのRRMSです
クローン病はアメリカで | | ありません | | アメリカです。
フランス
ドイツ
イタリア
スペイン.スペイン
イギリス.イギリス |
| | | | | | |
| | 多発性硬化症患者の歩行能力の研究 | | アコダ治療会社(Acorda) | | フランス
ドイツ |
AlkermesとAcordaとの協力に関するより多くの情報をお読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
神経筋疾患
SMAの特徴は,脊髄と低位脳幹運動ニューロンの喪失であり,重篤な進行性筋萎縮や虚弱をきたすことである。最終的に,最も深刻なSMAを有する人は麻痺する可能性があり,呼吸や嚥下などの生命の基本的な機能を実行することは困難である。SMN 1遺伝子の欠損或いは突然変異により、SMA患者は十分な生存運動ニューロン(SMN)蛋白を産生できず、これは筋肉の神経細胞の生存を制御するために重要である。SMAの重症度はSMN蛋白の含有量と関係がある。1型SMAを有する人は,最も生命を脅かす形であり,産生されるSMN蛋白は非常に少なく,かつ
支持なしに座ることができ,通常呼吸支持や栄養介入なしに2歳以上まで生きることはできない。2型および3型SMAを有する人は、より多くのSMNタンパク質を産生し、それほど深刻ではないが、生活を変えることができるSMA形態を有する
私たちのSMA製品と主要市場は以下の通りです
| | | | | | | | | | | | | | | | | | | | |
| 製品 | | 指示する | | 協力者 | | 主要市場 |
| | | | | | |
| | SMA | | アイオニス | | アメリカです。
ブラジル
カナダ
中国
フランス
ドイツ
イタリア
日本です
スペイン.スペイン
トルコ |
Ionisとの協力に関するより多くの情報をお読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
アルツハイマー病
アルツハイマー病の特徴は脳に2つの異常があることである:アミロイドプラークと神経原線維交絡。神経細胞間の組織に認められるアミロイドプラークは,βアミロイドと呼ばれる異常なタンパク質塊と,ニューロンや他の細胞の変性断片である。
私たちのアルツハイマー病製品と主な市場は以下の通りです
| | | | | | | | | | | | | | | | | | | | |
| 製品 | | 指示する | | 協力者 | | 主要市場 |
| | | | | | |
| | アルツハイマー病 | | 衛材 | | アメリカです。 |
| | | | | | |
| | アルツハイマー病 | | 衛材 | | アメリカです。 |
衛材との協力手配に関する他の情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
生体模倣薬
生体模倣薬は1組の生物薬であり,現在利用可能な生物療法と高度に類似しており,これらの生物療法は“発起人”と呼ばれる会社によって開発されている。著者らがSamsung Bioepisと達成した合意によると、著者らはヨーロッパのある国と地域で3種類の抗腫瘍壊死因子生物模倣薬を販売する:Benepali、ENBRELを参照するエナジー生物模倣薬、IMRALDI、HUMIRAを参照するアダリミズマブ生物模倣薬、およびFLIXABI、Remicadeを参照するインフリキシマブ生物模倣薬。Lucentisを参照したranibizumab生物類似体であり,米国,EU,イギリスで承認されたBYOOVIZを商業化する独占的権利も得た。2021年第3四半期に。BYOOVIZは2022年6月に米国で発売され、2022年第3四半期に商業使用を開始した。
私たちの現在の生物類似製品と主要市場は以下の通りです
| | | | | | | | | | | | | | |
| 製品 | | 指示する | | 主要市場 |
| | | | |
| | 関節リウマチ
若年性特発性関節炎
乾癬性関節炎
軸性脊椎炎
斑塊型乾癬
小児斑塊型乾癬 | | フランス
ドイツ
イタリア
スペイン.スペイン
イギリス.イギリス |
| | | | |
| | 関節リウマチ
若年性特発性関節炎
軸性脊椎炎
乾癬性関節炎
乾癬
小児斑塊型乾癬
化膿性汗腺炎
思春期化膿性汗腺炎
クローン病だ
小児科クローン病
潰瘍性大腸炎
ぶどう膜炎
小児科ぶどう膜炎 | | フランス
ドイツ
スウェーデン
イギリス.イギリス |
| | | | |
| | 関節リウマチ
クローン病だ
小児科クローン病
潰瘍性大腸炎
小児潰瘍性大腸炎
強直性脊椎炎
乾癬性関節炎
乾癬 | | フランス
ドイツ
イタリア |
| | | | |
| | 新生血管性(湿性)老年性黄斑変性
網膜静脈閉塞後黄斑浮腫
近視性脈絡膜新生血管 | | アメリカです。 |
サムスンBioepisとの協力手配に関するもっと多くの情報を読んでください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
遺伝子テーク関係
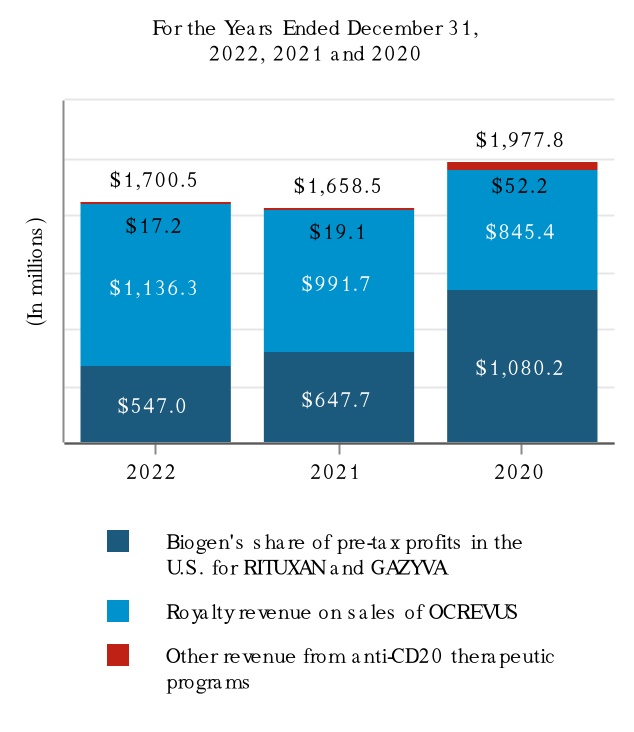
遺伝子テークと合意し,Rituxan,Rituxan HYCELA,Gazyva,OCREVUS,2022年第4四半期に米国で加速承認を得たLUNSUMIO,GLOFITAモノクロナル抗体および他の潜在的抗CD 20療法の添加に関するいくつかの商業的および財務的権利を得る権利があることを合意した。
著者らの現在の抗CD 20治療方案と主要な市場は以下の通りである
| | | | | | | | | | | | | | |
| 製品 | | 指示する | | 主要市場 |
| | | | |
| | 非ホジキンリンパ腫
CLL
関節リウマチ
2つの形態のANCA関連小血管炎
尋常型天疱瘡 | | アメリカです。
カナダ |
| | | | |
| | 非ホジキンリンパ腫
CLL | | アメリカです。 |
| | | | |
| | 未治療の慢性リンパ球性白血病のクロロアミノブチルベンゼンの併用
濾胞性リンパ腫
化学療法併用後は未治療の濾胞性リンパ腫をGazyvaのみで治療した | | アメリカです。 |
| | | | |
| | 均角根
PPM | | アメリカです。 |
| | | | |
| | 再発または難治性濾胞性リンパ腫 | | アメリカです。 |
遺伝子テークとの協力に関するもっと多くの情報をお読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
他にも
| | | | | | | | | | | | | | | | | | | | |
| 製品 | | 指示する | | 協力者 | | 主要市場 |
| | | | | | |
| | 中から重度の斑塊型乾癬 | | ありません | | ドイツ |
患者支援と訪問
著者らは患者、提唱組織と医療保健協会と交流し、満足されていない需要を深く理解する。これらの活動から得られた洞察力は,患者がより良い生活を送ることを支援するためのサービス,計画,アプリケーションを患者に提供するのに役立つ。他の以外に、病気や製品特定サイト、保険研究サービス、財務援助計画など、私たちの製品に顧客サービスとその他の関連計画を提供します
私たちの市場製品の調達を促進します
私たちは患者が私たちの治療法を得るのを助けるために努力している。私たちの患者代表は財政援助ツールを使用することができる。これらのツールにより,患者が彼らの保険範囲を理解し,必要に応じて保険オプションと計画を比較するのを助ける。米国では,特定の資格基準に基づいて,条件に適合した未加入または加入不足の患者に自己援助または無料製品を提供する計画を立てている。私たちは慈善資金も提供しています
独立した慈善団体は、患者が治療に関連した自己負担費用を支払うのを助ける。
すべてのヘルスケア利害関係者には共通の責任があり,患者が新たな革新的な薬物を平等に獲得することを確保していると信じている。私たちは定期的に私たちの価格設定戦略を検討し、患者が私たちの治療を受けるように優先的に配置する。私たちは私たちの治療価格を私たちの治療が患者に提供する価値と一致させるための価値に基づく契約計画を持っている。著者らはまた監督機構、臨床研究者、倫理学者、医師と患者が組織とコミュニティを提唱するなどと協力し、どのように著者らの患者を中心とする価値観に符合し、監督標準と合意に符合する方式で、どのように著者らの研究治療を獲得する要求を処理するかを確定した。適切な場合、患者は、早期訪問計画、単一の患者訪問、または人道主義的または同情的理由に基づいて緊急使用することによって、研究治療を得ることができる。
マーケティングと流通
販売チームとマーケティング
私たちは主に私たち自身の販売チームとマーケティングチームを通じて、アメリカ、ヨーロッパ、日本を含む世界各地で私たちのマーケティング製品を普及させます。いくつかの国、特に私たちが新しい地理的地域に拡張し続けている地域では、私たちは第三者と協力している
Rituxan,Rituxan HYCELA,Gazyva,OCREVUS,LUNSUMIOは羅氏グループとそのライセンス保有者によって販売されている。
ヨーロッパのある国でのサムスンBioepisとの合意および米国におけるBYOOVIZの合意に基づき、Benepali、IMRALDI、FLIXABIを商業化した。
私たちは個人勤務や大型医療センターの専門医の販売やマーケティングに集中しています。私たちは伝統的な業界慣例を使って私たちの製品をマーケティングし、医者を訓練する。これには,我々の販売代表が個別医療提供者(対面と仮想),広告,専門シンポジウム,ダイレクトメール,デジタルマーケティング,ケアポイントマーケティング,公共関係,その他の方法を訪問することが含まれる.私たちは個人診療所と主要医療センターの医療提供者の販売とマーケティングに集中しています。
流通手配
私たちは主に薬品卸売と専門流通業者と専門薬局、通販専門流通業者あるいは輸送サービス提供者を通じてアメリカで私たちの製品を流通します。他の国では私たちの製品は
製品は国によって異なり、薬品卸売業者と大部分のマーケティングと流通活動を担当する第三者流通パートナーを含む。
衛材はインドと他のアジア太平洋市場で雅芳、Tysabri、Tecfidera、Pregridyを流通しており、中国は含まれていない。
Rituxan,Rituxan HYCELA,Gazyva,OCREVUS,LUNSUMIOは羅氏集団とそのライセンス所持者によって流通されている。
私たちはヨーロッパのある国でBenepali、IMRALDI、FLIXABIを販売し、これらの製品の中国およびBYOOVIZのアメリカでの独占販売権を獲得する権利があります。
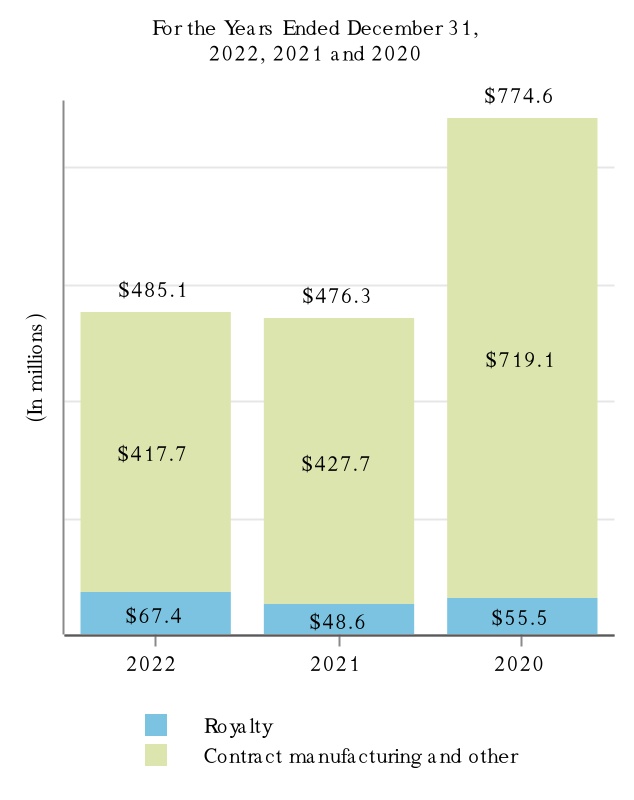
2022年、2021年、2020年12月31日までの年間で、両卸の製品売上高はそれぞれ私たちの総収入の10.0%以上を占め、合計すると、それぞれ私たちの総製品収入の37.9%、38.9%、45.8%を占めています。もっと情報を知りたいのですが、お読みください付記5、収入私たちの連結財務諸表は本報告書に含まれている。
特許その他の独自の権利
特許は私たちの製品と候補製品の独占権を獲得して保護するために非常に重要だ。私たちはしばしばアメリカやアメリカ以外の選定国で私たちの研究開発努力から来た発明と私たちが許可または買収した発明のために特許保護を求めています。さらに、私たちは様々な特許と特許出願の権利を許可する
米国特許と多くの外国特許は一般に最初の出願日から20年以内に有効であるが,1995年6月8日までに出願された米国特許の有効期限は発行日から17年までであり,20年遅れであれば可能である。場合によっては、特許期間は、監督審査によって要求される治療方法の間に失われた期限の一部を再取得するために延長されてもよく、または米国では、米国特許商標局(USPTO)の起訴出願における遅延があるので、延長されてもよい。具体的には、米国では、FDAが承認した薬物をカバーする特許有資格延長(最長5年であるが、製品承認日から合計14年を超えることはできない)に基づいて、FDA規制審査中に失われた特許期間の補償として、1984年の“薬品価格競争と特許期限回復法”(通常はハッジ·ワックスマン法と呼ばれる)に基づいている。現地の法律によると、外国特許の期限と展示期間はそれぞれ異なる。例えば私たちの製品の追加保護証明書(SPC)は
いくつかのヨーロッパ諸国で承認され、上場承認を得る上での遅延を部分的に補償した。
規制排他性は規制データ保護と市場保護を含む可能性があり、私たちの製品に意味のある保護を提供することもできる。規制データ保護は、薬物または生物学的上場許可の保持者に、一定期間内にそれを独占的に使用して、高いコストで作成し、関連する監督管理機関に提出して、その製品の承認を得るための独自の臨床前および臨床データを提供する。排他的使用期間の後、第三者が短い承認申請においてこれらのデータを参照し、その模倣薬および生物模倣薬(任意の適用可能な市場保護によって制限されている)を販売することを可能にする。市場保護は、その間に同じ活性成分を含む別の製品の商業化を防止するために、薬物またはバイオマーケティング許可の保持者に、一定期間にわたってその製品を商業化する独占権を提供する。世界貿易機関が貿易に関連する知的財産権協定(TRIPS)について署名国に革新薬品の規制排他性を提供することを要求しているにもかかわらず、各国の実施と実行状況は大きく異なる。
私たちはまた競争力を維持するために他の形態の非特許機密情報に依存する。私たちは主に私たちの従業員、コンサルタント、外部科学協力者、私たちがその研究を支援している科学者、他のコンサルタントと公開および秘密協定を締結することを避けることで、このような情報を保護します。私たちの従業員の場合、関連法律によると、これらの協定はまた、これらの従業員が雇用されている間に構想した発明および他の知的財産が私たちの独自財産であることを規定している。
私たちの商標は私たちにとって重要であり、通常、米国特許商標局および他の国/地域の特許または商標局の商標出願または登録によってカバーされる。私たちはまた、例えばAcordaから許可された商標FAMPYRAなど、第三者から許可された商標を使用します。商標保護は現地の法律によって異なり,一部の国では商標がまだ使用されている限り,他の国では商標が登録されていれば商標保護は継続される。商標登録は一般的に固定されているが継続可能な条項を対象としている。
私たちの特許組合は
次の表は、私たちが現在私たちの発売製品に重要だと考えているアメリカとヨーロッパのいくつかの特許、地域、特許番号、一般的なテーマ、および予想される満期日を示しています。別に説明がない限り,満期日を予想する
付与された特許期間の延長及び発行されたSPCを含む。場合によっては、特定の形態または成分、製造方法、または特定の疾患または条件を治療する際に医薬を使用するための、我々の製品に関連する追加の遅延満了特許がある。私たちはまた、米国や他の地域でより多くの特許と特許期間の延長を求め続け、私たちの製品の様々な側面をカバーし、発表すれば、表に記載された特許が満期になった後まで特許権を独占的に延長する可能性がある。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| 製品 | | 領土.領土 | | 特許番号. | | 一般題材 | | 特許 満期になる(1) |
| T@@ ec@@ f@@ id@@ er@@ a | | ヨーロッパ.ヨーロッパ | | 1,131,065 | | フマル酸ジアルキルエステルの合成及び自己免疫疾患の治療におけるその使用 | | 2024(3) |
| | ヨーロッパ.ヨーロッパ | | 2,653,873 | | 使い方 | | 2028 |
| プレグリディ | | アメリカです。 | | 8,524,660 | | 治療法 | | 2023 |
| | アメリカです。 | | 8,017,733 | | インターフェロンβ−1 aのポリマー結合体 | | 2027 |
| | ヨーロッパ.ヨーロッパ | | 1,656,952 | | インターフェロン−β−1 aのポリマー結合体及びその用途 | | 2024(4) |
| | ヨーロッパ.ヨーロッパ | | 1,476,181 | | インターフェロン−β−1 aのポリマー結合体及びその用途 | | 2023(5) |
| T@@ ys@@ ab@@ ri | | アメリカです。 | | 8,124,350 | | 治療法 | | 2027 |
| | アメリカです。 | | 8,349,321 | | 製剤 | | 2024 |
| | アメリカです。 | | 8,815,236 | | 製剤 | | 2024 |
| | アメリカです。 | | 8,871,449 | | 治療法 | | 2026 |
| | アメリカです。 | | 8,900,577 | | 製剤 | | 2024 |
| | アメリカです。 | | 9,316,641 | | 安全関連検査 | | 2032 |
| | アメリカです。 | | 9,493,567 | | 治療法 | | 2027 |
| | アメリカです。 | | 9,709,575 | | 治療法 | | 2026 |
| | アメリカです。 | | 10,119,976 | | 患者のリスクを評価する方法 | | 2034 |
| | アメリカです。 | | 10,233,245 | | 治療法 | | 2027 |
| | アメリカです。 | | 10,444,234 | | 安全関連検査 | | 2031 |
| | アメリカです。 | | 10,677,803 | | 治療法 | | 2034 |
| | アメリカです。 | | 10,705,095 | | 治療法 | | 2026 |
| | アメリカです。 | | 11,280,794 | | 治療法 | | 2034 |
| | アメリカです。 | | 11,287,423 | | 安全関連検査 | | 2031 |
| | アメリカです。 | | 11,292,845 | | 治療法 | | 2027 |
| | ヨーロッパ.ヨーロッパ | | 1,485,127 | | 使い方 | | 2023(2) |
| | ヨーロッパ.ヨーロッパ | | 2,170,390 | | 製剤 | | 2028 |
| | ヨーロッパ.ヨーロッパ | | 2,236,154 | | 製剤 | | 2024 |
| | ヨーロッパ.ヨーロッパ | | 2,676,967 | | 使い方 | | 2027 |
| | ヨーロッパ.ヨーロッパ | | 3,339,865 | | 安全関連検査 | | 2031 |
| | ヨーロッパ.ヨーロッパ | | 3,417,875 | | 製剤 | | 2024 |
| | ヨーロッパ.ヨーロッパ | | 3,575,792 | | 安全関連検査 | | 2032 |
| スズメの花 | | ヨーロッパ.ヨーロッパ | | 1,732,548 | | アミノピリジン徐放錠によるMS患者の歩行速度向上に関する研究 | | 2025(6) |
| | ヨーロッパ.ヨーロッパ | | 2,377,536 | | 多発性硬化症治療用アミノピリジン徐放性組成物 | | 2025(7) |
| 虚栄心 | | アメリカです。 | | 8,669,281 | | 化合物及び医薬組成物 | | 2033 |
| | アメリカです。 | | 9,090,558 | | 治療法 | | 2033 |
| | アメリカです。 | | 10,080,733 | | 結晶形態、医薬組成物及び治療方法 | | 2033 |
| | ヨーロッパ.ヨーロッパ | | 2,970,101 | | 結晶形態、医薬組成物及び治療方法
フマル酸エステルプロドラッグおよび様々な疾患治療におけるそれらの使用 | | 2034 |
| SPINRAZA | | アメリカです。 | | 7,101,993 | | 2‘−O−修飾プリンを含むオリゴヌクレオチド | | 2023 |
| | アメリカです。 | | 7,838,657 | | SMAに対するSMAの標的SMN 2スプライス部位抑制配列治療 | | 2027 |
| | アメリカです。 | | 8,110,560 | | SMAに対するSMAの標的SMN 2スプライス部位抑制配列治療 | | 2025 |
| | アメリカです。 | | 8,361,977 | | SMN 2スプライシングの調製用組成物及び方法 | | 2030 |
| | アメリカです。 | | 8,980,853 | | SMN 2スプライシングの調製用組成物及び方法 | | 2030 |
| | アメリカです。 | | 9,717,750 | | SMN 2スプライシングの調製用組成物及び方法 | | 2030 |
| | アメリカです。 | | 9,926,559 | | SMN 2スプライシングの調製用組成物及び方法 | | 2034 |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | アメリカです。 | | 10,266,822 | | SMAに対するSMAの標的SMN 2スプライス部位抑制配列治療 | | 2025 |
| | アメリカです。 | | 10,436,802 | | 脊髄性筋萎縮症の治療法 | | 2035 |
| | ヨーロッパ.ヨーロッパ | | 1,910,395 | | SMN 2スプライシングの調製用組成物及び方法 | | 2026(8) |
| | ヨーロッパ.ヨーロッパ | | 2,548,560 | | SMN 2スプライシングの調製用組成物及び方法 | | 2026(9) |
| | ヨーロッパ.ヨーロッパ | | 3,305,302 | | SMN 2スプライシングの調製用組成物及び方法 | | 2030 |
| | ヨーロッパ.ヨーロッパ | | 3,308,788 | | SMN 2スプライシングの調製用組成物及び方法 | | 2026 |
| | ヨーロッパ.ヨーロッパ | | 3,449,926 | | SMN 2スプライシングの調製用組成物及び方法 | | 2030 |
| アドゥヘラム | | アメリカです。 | | 8,906,367 | | 疾患特異的結合分子及び標的を提供する方法 | | 2032(10) |
| | アメリカです。 | | 10,131,708 | | アルツハイマー病の治療法 | | 2028 |
| 楽奇美 | | アメリカです。 | | 8,025,878 | | フィブリノーゲン選択性抗体及びその用途 | | 2027(1)(10) |
次のページに脚注があります。
(1)I特許保護を除いて、私たちのいくつかの製品はアメリカとEUで規制排他性を得る権利があり、予想締め切りは以下の通りです
| | | | | | | | | | | | | | |
| 製品 | | 領土.領土 | | 予想期限が切れる |
| T@@ ec@@ f@@ id@@ er@@ a | | EUです。 | | 上訴することができる |
| プレグリディ | | アメリカです。 | | 2026 |
| | EUです。 | | 2024 |
| SPINRAZA | | アメリカです。 | | 2023 |
| | EUです。 | | 2029 |
| アドゥヘラム | | アメリカです。 | | 2033 |
| 楽奇美 | | アメリカです。 | | 2035 |
(2)本特許の有効期限に関する詳細は、お読みください注21、訴訟私たちの連結財務諸表は本報告書に含まれている。
(3)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2024年に延長している。
(4)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2024年に延長している。
(5)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2028年に延長している。
(6)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2026年まで延長している。
(7)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2026年まで延長している。
(8)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2031年に延長している。
(9)この特許はあるヨーロッパ諸国が付与したSPCの制約を受けており,これらの国は特許期間を2031年に延長している。
(10)この主題を持つ特許は,米国で特許期間を延長する権利がある可能性がある
特許の存在は、私たちが特許技術を実践したり、特許製品を商業化する権利を保証しない。製薬、生物製薬およびバイオテクノロジー製品、化合物およびプロセスに関連する特許、例えば、私たちの既存製品、化合物およびプロセスをカバーする特許、および私たちが将来出願する可能性のある特許は、常に完全または十分な保護を提供するわけではない。訴訟干渉反対各方面間審査、行政挑戦、または他の同様のタイプの訴訟は、場合によっては必要であり、過去には、将来的にも必要である可能性があり、私たちのいくつかの特許、法規排他性または他の固有権の有効性および範囲を決定し、他の場合、第三者が私たちの製品の製造、使用または販売に関連するいくつかの特許権の有効性、範囲、または非侵害を主張することを決定する。私たちはまた、後発薬、生物模倣薬、前薬物製造業者、および規制経路の簡略化によって承認された製品のような、我々の製品の特許、規制排他性、または他の独占権に対する第三者の挑戦に直面している。私たちの特許地位、規制排他性、または他の独占権に影響を与える可能性のあるリスクと不確実性に関する議論が掲載されている第1 A項。リスク要因本報告に含まれる、上記のいくつかの特許に関連する法的手続きの議論は、注21訴訟私たちの連結財務諸表はこの報告書に含まれている。
競争
バイオ製薬産業と私たちが経営している市場の競争は非常に激しい。バイオテクノロジーや製薬会社を含む多くの会社が,我々が承認してくれた製品の治療への適応や我々の研究·開発活動に向けた治療分野の製品開発に取り組んでいる。私たちのいくつかの競争相手は私たちよりも多くの財務、マーケティング、研究開発、そして他の資源を持っているかもしれない。
業界の競争とリードは、管理と技術の卓越と革新に基づいており、研究開発による特許やその他の独自の地位を確立していると信じている。指導的地位を得ることはまた、私たちの候補製品を最大限に承認、受け入れ、使用する能力、および施設、設備、人員、臨床テスト、製造、マーケティングに資金を提供する十分な財政資源があるかどうかに大きく依存する。業界で競争力を維持するもう一つの重要な側面は、有力な科学者や技術者を募集し、維持して、ビジネス専門知識を持って私たちの製品を効果的にマーケティングすることを含む、私たちの研究活動を展開し、私たちの開発計画を推進することである。
承認販売された製品間の競争は、特許地位、製品効果、安全性、患者の利便性、送達デバイス、信頼性、可用性、精算および価格などに基づく可能性がある。そのほか、1種の新しい薬品が早期に市場に入ることは製品の受容度と市場シェアを獲得する上で重要な優勢を持っているかもしれない。そのため、我々が製品を開発し、テストと承認プロセスを完成し、商業ロット製品を提供する相対速度は、私たちの競争地位に大きな影響を与えるだろう。
新製品または技術の発売には、競争相手が新しい技術や技術を開発すること、または既存の製品または技術に関する新しい情報が含まれ、我々の市場製品に対する競争が激化し、わが市場製品の価格設定圧力がもたらされる。我々の製品によって治療される疾患のために、新しいまたは改善された治療レジメンまたは看護または治療基準を開発し、私たちの製品の使用を低減またはキャンセルすることができ、または進行中の臨床試験の候補製品に対する実用性および使用を制限することができる。
また、私たち自身が承認したいくつかの製品、私たちのパートナーの製品、および候補パイプライン製品の商業化は、私たちの既存製品の将来の販売に悪影響を及ぼすかもしれません。
私たちの製品と収入流は、既存製品の模倣薬、プロドラッグおよび生物模倣薬の発売、および簡略化された規制経路によって許可された製品のため、多くの市場で日々激しい競争に直面し続けている。このような製品の販売価格はブランド製品よりずっと低いかもしれません。そのため、このような製品と他の価格の低い競争製品を発売することは私たちの製品の価格と私たちの製品の販売量を著しく下げるかもしれません。これは私たちの収入にマイナスの影響を与えます。また、ある市場では、私たちの製品の模造や生物類似バージョンが商業化されると、私たちの製品を自動的に代替し、短時間で私たちの収入を大幅に減少させる可能性がある
私たちの長期的な競争地位は、満たされていない医療需要を満たす革新、費用対効果の高い製品の発見と開発に成功できるかどうか、そして競争の激しい環境の中で製品を効率的に製造し、製品を効率的に発売·販売する能力にかかっていると信じている。
我々の市場製品が直面している競争に関するより多くの情報は以下のとおりである第1 A項。リスク要因本報告に含まれます。
多発性硬化症
Tecfidera、Avonex、Plegridy、TysabriおよびVUMERITYは、それぞれ、以下の1つまたは複数のブランド製品およびこれらの製品の模倣および生物類似バージョンと競合する:
| | | | | | | | |
| 競合製品 | | 競争相手 |
| オバジオ(テフロン) | | セノフィGenzyme |
| β−インターフェロン/β−β−1 bインターフェロン | | バイエル集団 |
| プルミヴィ(ublituximab-ximy) | | TG治療会社 |
コパゾン
(酢酸ゲロチラメエステル) | | Teva製薬工業有限公司 |
Extavia
(インターフェロン−β−1 b) | | ノワ製薬 |
| ギレンア(Fingolimod) | | ノワ製薬 |
| グラトパ(酢酸ゲラテラメエステル) | | サンドーズはノワ製薬の部門です |
| Lemtrada(Alemtuzumab) | | セノフィGenzyme |
| MAVENCLAD(クラトラビン) | | EMD Serono |
| マイゼート(西波リモット) | | ノワ製薬 |
| OCREVUS(オリジュズマブ) | | 遺伝子テーク |
| PONVORY(Ponesimod) | | ジョンソンが生前の楊森製薬会社 |
Rebif
(インターフェロン−β−1) | | EMD Serono |
| ZEPOSIA(オゾン) | | BMS |
| バフェタン(フマル酸モノメチル) | | バンナ生命科学 |
| KESIMPTA(Ofatumab) | | ノワ製薬 |
多くのTecfideraの模倣薬は今北米、ブラジルとあるEUの国に入って、以下の国と比べて、それらの価格は大きな割引があります
テフェデラです。Tecfideraに対する後発薬競争は我々のTecfidera収入を大幅に減少させ,Tecfideraの収入は将来的に低下し続けることが予想される。
EUでは、2022年6月に付与されたTecfideraに関連する特許の強制執行を求めており、この特許は2028年に満了する。また、Tecfideraが少なくとも2024年2月までに規制データと市場保護を受ける権利があることを確認するために訴訟を起こしている。我々の会社、欧州薬品管理局、欧州委員会はそれぞれ、欧州医薬品局がTecfideraの模倣薬申請を許可しない決定を廃止した欧州一般裁判所2021年5月の裁決を上訴した。その理由は、欧州医薬品局と欧州委員会がTecfideraが規制データとマーケティング保護を受ける権利があると判断した際に誤った評価を行ったからである。当社,環境管理協会,欧州委員会はいずれも一般裁判所の誤った裁決について上訴しており,控訴は審理中である。2022年10月6日、CJEU総検事長はBiogenに有利な拘束力のない諮問意見を発表した。この意見はCJEUが欧州一般裁判所の判決を撤回することを提案した。私たちはCJEUの決定を待っている。
FAMPYRAは、歩行障害を有する成人MS患者の歩行能力を改善する治療法とされており、この満たされていない医療ニーズを解決する最初の治療法であり、すべてのタイプのMS患者において有効性が証明されている。現在、FAMPYRAはMS患者の歩行能力を改善するために唯一承認されている治療法である
マイクロソフト市場の競争は非常に激しい。我々とともに,多くの会社が多発性硬化症を治療する追加療法の開発に努めており,将来的にはわれわれの多発性硬化症製品と競合する可能性がある。2017年と2018年にEUで承認されたこのような製品の一つは、遺伝子テークによって開発されたRMSおよびPPMSを治療する薬剤であるOCREVUSである。私たちはOCREVUSに経済的利益がありますが、OCREVUSが引き続き市場シェアを獲得している場合、あるいは私たちまたはライバルが開発している他のMS製品が商業化されていれば、私たちのMS製品の将来の販売は悪影響を受ける可能性があります。
脊髄性筋萎縮
私たちは遺伝子治療製品と経口製品からの競争に直面している。今後、私たちはより多くの司法管轄区域でこの2つの製品からの競争に遭遇し、これは私たちのSPINRAZA販売に悪影響を及ぼす可能性があると予想している。
また,現在開発中の他の製品が発売されれば,SPINRAZAと競合する可能性もあることが分かった。SPINRAZAの将来の販売は競合製品の商業化に悪影響を受ける可能性がある。
乾癬
FUMADERMはドイツの乾癬市場において、メトトレキサートとシクロスポリンなどの経口系療法を含むいくつかの異なるタイプの療法と競争している。
生体模倣薬
Samsung Bioepisとの合意によると、著者らは現在ヨーロッパのある国で商業化されている3種類の生物類似製品Benepali、IMRALDIとFLIXABIは、それぞれそれらの参考製品ENBREL、HUMIRAとRemicade及びこれらの参考製品の他の生物模倣薬と競争している
また,Samsung Bioepisとの合意により,我々は現在米国で商業化されている生物類似製品BYOOVIZとその参考製品Lucentisおよびその参照製品の他の生体模倣薬と競争している。
他の適応における遺伝子技術の関係
腫瘍におけるRituxan,Rituxan HYCELAおよびGazyvaの応用
Rituxan、Rituxan HYCELAとGazyvaはTREANDA(塩酸ベンダムスチン)、Arzerra(Ofatumab)、IMBRUVICA(Ibrutinib)とZydelg(Idelalisib)を含む腫瘍学市場で多くの療法と競争している
時間の経過とともにRituxan,HYCELA,Gazyvaは腫瘍学市場でRituxanとますます激しい競争を展開することも予想される。また,生物学的に類似した製品を含む他にもいくつかの抗CD 20分子が承認され,Rituxan,Rituxan HYCELA,Gazyvaと腫瘍学や他の市場で競合していることが知られている。クラスBiRituxanを参考にした類似製品はすでに米国で発売され、より低い価格で提供されている。この競争は、前の時期に比べてRituxanの売上が大幅に低下したため、遺伝子テックと協力して手配した税引前利益に大きな悪影響を与えた。これらの製品がより多くの市場シェアを獲得するにつれて、生物類似製品の競争が引き続き激化し、今後数年間の米国での共同普及利益に大きな悪影響を及ぼすことが予想される。
リツキシマブによる関節リウマチの治療
Rituxanは関節リウマチ市場でいくつかの異なるタイプの治療法と競争しており、その中には伝統的な修正疾患の抗リウマチ薬、例えばステロイド、メトトレキサートとシクロスポリン、腫瘍壊死因子阻害剤、Orencia(Abatacept)、Actemra(Tocilizumab)とXeljanz(Tofacitinib)が含まれている。
生物模倣薬を含む他の製品が開発されており、承認されれば、可能であることも知られています
Rituxanと関節リウマチ市場で競争しています
研究と開発計画
研究に対する約束は私たちの使命に必須的だ。我々の研究努力は,疾患の潜在生物学をよりよく理解することに集中しており,高度に満たされていない医療ニーズを真に変えることが可能な患者の生活を発見し,提供することができる。生物製品に関する私たちの専門知識と、小分子、アンチセンス、遺伝子治療、遺伝子編集、その他の技術の面で日々増加している能力を応用することによって、私たちは新しいあるいはより良い治療法が必要と考えられる特定の医療需要に対して。
我々は引き続き大量の資源を投入して的確な研究と開発を行う予定である
大量の満足されていない需要と候補薬物は高度な差別化の潜在力を持つ機会がある。我々が行っている研究開発の一部として,我々は大量の資源を投入して臨床研究を行い,新薬物製品や技術の開発を推進し,我々の既存製品が治療ラベルで現在承認されている疾患以外の疾患への有用性を探る。
私どもの総合損益表に含まれる研究開発費に関するより多くの情報は、お読みくださいプロジェクト7.経営陣の財務状況と経営成果の検討と分析本報告に含まれます。
以下の表に,われわれが現在行っている臨床試験の研究と開発計画およびこのような計画の現在の段階を重点的に紹介する。薬物開発は高度なリスクと投資に関連しており,我々の開発計画の地位,タイミング,範囲が変化する可能性がある。私たちの薬物開発に悪影響を及ぼす可能性のある重要な要素は第1 A項。リスク要因本報告に含まれます。
| | | | | | | | | | | | | | | | | | | | | | | |
アルツハイマー病と
認知症 | | Lecanemab(Aβモノクロナル)*-アルツハイマー病 | | アメリカ、EU、日本で申請します |
| | | | | | |
| Lecanemab(Aβモノクロナル)*−臨床前アルツハイマー病 | | 第3段階 |
| | | | | | |
| アデュカヌマブ(Aβマブ)**アルツハイマー病 | | 日本や他の市場で申請する |
| | | | | | |
| BIIB 080(Tau ASO)*アルツハイマー病 | | 第二段階 | |
| | | | | | |
| BIIB 113(OGA阻害剤)−アルツハイマー | | ステップ1 | | | |
| | | | | | | |
| 神経精神医学 | | ズランノドン(GABA)APAM)*-MDD | | アメリカで提出された申請 |
| | | | | | |
| ズランノドン(GABA)APAM)*-PPD | | アメリカで提出された申請 |
| | | | | | | |
| 専門免疫学 | | Dapirolizumab pegol(抗CD 40 L)*−SLE | | 第3段階 |
| | | | | | |
| Litifiimab(抗BDCA 2)-SLE | | 第3段階 |
| | | | | | |
| Litifiimab(抗BDCA 2)-CLE | | ステップ2/3 |
| | | | | | | |
| 神経筋疾患 | | トフィソン(SOD 1 ASO)*-SOD 1 ALS | | アメリカとEUで提出された申請です。 |
| | | | | | |
| BIIB 105(ataxin-2 ASO)#-筋萎縮性側索硬化 | | ステップ1/2 | |
| | | | | | |
| BIIB 115(SMN ASO)*-SMA | | ステップ1 | | | |
| | | | | | | |
パーキンソン病と
運動障害 | | BIIB 122(DNL 151)*-LRRK 2パーキンソン病 | | 第3段階 |
| | | | | | |
| BIIB 122(DNL 151)*-パーキンソン病 | | 第二段階 | |
| | | | | | |
| BIIB 124(SAGE-324)*-基本振戦 | | 第二段階 | |
| | | | | | |
| BIIB 094(ION 859)#-パーキンソン病 | | ステップ1 | | | |
| | | | | | |
| BIIB 101(ION 464)#-マルチシステム萎縮 | | ステップ1 | | | |
| | | | | | |
| BIIB 132(ATXN-3 ASO)#-SCAR 3 | | ステップ1 | | | |
| | | | | | | |
| 多発性硬化症 | | BIIB 091(末梢BTK阻害剤)−MS | | ステップ1 | | | |
| | | | | | |
| BIIB 107(抗VLA 4)−MS | | ステップ1 | | | |
| | | | | | | |
| 神経血管 | | グリベンクラミドIV(SUR 1−TRPM 4阻害剤)−LHI脳卒中 | | 第3段階 |
| | | | | | |
| グリベンクラミドIV(SUR 1−TRPM 4阻害剤)−脳挫傷 | | 第二段階 | |
| | | | | | |
| BIIB 131(TMS-007)−急性虚血性脳卒中 | | 第二段階 | |
| | | | | | | |
| 遺伝性神経発達障害 | | BIIB 121(UBE 3 A ASO)#-アンジェマン症候群 | | ステップ1 | | | |
| | | | | |
| | | | |
| | | | | | |
| | | |
*協調計画
*2021年6月に米国でADUHELMブランドで加速的に承認されました。
*米国では2023年1月にLEQEMBIブランドで承認が加速され、米国、EU、日本で従来の承認が申請されました。
#オプションプロトコル
大脳半球梗塞(LHI)
協力者や他の第三者とのいくつかの合意に関する情報は、タイトルを読んでください業務関係下と別注2、買収, 付記19、連携関係その他の関係そして付記20可変利益実体への投資私たちの連結財務諸表はこの報告書に含まれている。
業務関係
私たちの業務戦略の一部として、私たちは他の会社、大学、医学研究機関とライセンス、合弁企業と協力手配を構築して、私たちのいくつかの製品と候補製品の臨床開発および/または商業化を支援し、私たちの研究計画を支援することを含む業務関係を構築します。また、他の会社、大学、医学研究機関から私たちの業務に相補的な製品または製品および技術の権利を得る機会を評価します。
以下は、いくつかの業務関係および連携の簡単な説明であり、これらの業務関係および連携は、私たちのチャネルを拡張し、既存および潜在的な新製品および技術のいくつかの権利を提供してくれる。いくつかの関係に関するもっと多くの情報、それらが私たちの業務の持続的な財務と会計に与える影響を含めて、読んでください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
衛材株式会社
著者らは衛材と協力協定を達成し、LEQEMBI(Lecanemab)を共同開発し、商業化し、アルツハイマー病の治療に用いられる抗アミロイド様抗体である。衛材は全世界のLEQEMBI開発と監督管理提出の責任者であり、両社は共同で商業化と共同でこの製品を普及させ、衛材は最終決定権を持っている。すべてのコストは、研究開発、販売とマーケティング費用を含めて、すべて私たちと衛材が折半します。LEQEMBIの発売が承認された後、著者らは衛材と共同でLEQEMBIを普及させ、損益を二等分する。著者らは現在LEQEMBI薬剤と薬品を生産し、2022年3月、著者らは衛材とのLEQEMBI関連供給協定を延長し、5年から10年に延長し、LEQEMBI薬剤の生産に応用した。
我々はまた衛材とADUHELMについて協力することで合意した。我々の最初のADUHELM連携プロトコルにより,ADUHELMの持続的な発展をリードし,衛材と地域ベースの利益分配を共同でADUHELMを促進する.2022年3月14日,衛材とのADUHELM連携協定を修正した。改正日より,我々は世界でADUHELMの唯一の決定権と商業化権利を持ち,2023年1月1日から衛材はADUHELM純売上高による分級特許権使用料のみを受け取り,ADUHELMのグローバル損益の共有には参加しなくなった。衛材の1月からの開発、商業化、製造費に占めるシェアは3.35億ドルに制限されている
2022年1日から2022年12月31日まで、2022年12月31日までに実現される。この限度額に達すると,ADUHELMに関するすべてのコストを負担する.
また、私たちと衛材は場合によっては日本でAvonex、TysabriとTecfideraを共同で普及させ、衛材はインドと他のアジア太平洋地域市場(中国を含まない)でAvonex、Tysabri、Tecfidera、Plegridyを流通している。
Sage治療会社
我々はSageと世界的な協力と許可協定を締結し,MDDやPPDを治療するズランノドン,てんかんなどの他の神経系疾患の特発性振戦を潜在的に治療するBIIB 124(SAGE−324)を共同開発·商業化した。この協力により、両社は同等の開発責任とコスト、米国での商業化利益と損失を分担する。米国以外では、日本、台湾、韓国を含まず、ズランノロンの開発と商業化を担当し、10代から20歳以下のSageの潜在的な分級使用料を支払うことが可能だ。
エオニス製薬会社.
著者らはIonisと独自の全世界的なオプションと協力協定を持っており、最大3つの遺伝子標的のアンチセンス療法の開発と商業化に関連している。Ionisとの単独協力とライセンス契約により,我々は独占的なグローバルライセンスを持ち,SMAを開発·商業化するSPINRAZAを開発·商業化することができる。著者らはIonisと10年間の独占協力協定を締結し、広範な神経疾患のために新型ASO候補薬物を開発した。
また、Ionisと研究協力協定を締結し、協定によると、両社とも発見レベルの研究を行い、新しいASO候補薬を開発し、商業化し、SMAの潜在的治療、および潜在的な神経疾患治療のための追加のアンチセンスまたは他の治療方法を開発し、商業化する。
遺伝子テーク社(羅氏グループ)
遺伝子テークと合意し,Rituxan,Rituxan HYCELA,Gazyva,OCREVUS,2022年第4四半期に米国で加速承認を得たLUNSUMIO,GLOFITAモノクロナル抗体および他の潜在的抗CD 20療法の添加に関するいくつかの商業的および財務的権利を得る権利があることを合意した。
デナリー治療会社です。
われわれはデナリーと協力·許可協定を締結し,デナリーによるパーキンソン病治療のLRRK 2小分子阻害剤の共同開発と共同商業化を行った。このような協力の下、両社は特定の割合に応じて世界発展の責任とコスト、および米国と中国で商業化された損益を分担している。アメリカと中国以外では、私たちは商業化を担当し、Denaliの潜在的な階層的特許権使用料を支払うことができる。
LRRK 2計画に加えて,その抗体輸送車両(ATV):ATVが有効化した抗アミロイドβ計画と,その輸送車両技術を利用した2つの2つの臨床前プロジェクトの独占的許可をテナリーの輸送車両プラットフォームから得る計画を持っている。また,デナリーがこのようなプロジェクトのための協力を求めることを決定すれば,特定の神経変性疾患の適応の他の2つのATVイネーブル療法について優先的に交渉する権利がある。
サムスン生物科技有限公司
2012年2月、私たちはサムスン生物会社と合弁協定を締結し、Samsung Bioepisという実体を設立し、生物類似製品を開発、製造、販売した。著者らはまたSamsung Bioepisと合意し、10年以内に3種類の抗腫瘍壊死因子生物類似候補製品をヨーロッパのある国と日本のBenepaliで商業化した。このプロトコルによれば、私たちは、ヨーロッパのある国で商業化されるBenepali、ENBRELを参照するエナジー生物類似体、IMRALDI、HUMIRAを参照するadalimumab生物類似体、およびFlIXABI、インフリキシマブ抗生物類似体、Remicadeを参照する。
2019年12月、私たちはSamsung Bioepisとの取引を完了し、Samsung Bioepisとヨーロッパのある国/地域でBenepali、IMRALDI、FLIXABIを購入するための既存のビジネス合意を延長する選択権を得た。Lucentisを参照したranibizumab生物類似体であり,2021年第3四半期に米国,EU,イギリスで承認されたBYOOVIZを商業化する独占的権利も得た。BYOOVIZは2022年6月に米国で発売され、2022年第3四半期に商業使用を開始した。私たちとSamsung Bioepisとの商業化協定以外に、私たちは私たちのいくつかの独自技術をSamsung Bioepisに許可し、サムスンBioepisの開発、製造、商業化のためにその生物類似製品を使用した。
2022年4月、私たちはSamsung Bioepisにおける49.9%の株式をSamsung Biologicsに売却する取引を完了した。この取引の条項によると、私たちは取引完了時に約10億ドルの現金を受け取り、約10億ドルを得る予定です
13億ドルの現金は2回の支払いで支払いを延期し、そのうちの約8.125億ドルが取引1周年で満期になり、約4.375億ドルが取引完了2周年で満期になる。
この取引の一部として、私たちはいくつかの商業マイルストーンを達成した後に5000万ドルの追加収入を得る資格がある私たちのこのような性質または支払いに対する政策は、支払いが現金化可能な間に支払いを確認することであり、これは通常、支払いを受ける期間と同じである。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置、私たちの連結財務諸表はこの報告書に含まれている。
連合信用銀行
われわれはUCBと共同で,SLEと他の将来合意した適応の潜在的治療に用いられる抗CD 40 Lペグ化Fab Dapirolizumab pegolを開発·商業化した。両社は研究、開発、販売、マーケティング費用を含む適応の費用を平均的に分担する。上場が承認されれば、両社はdapirolizumab pegolを共同で普及させ、利益と損失を折半する。
Sangamo治療会社
我々は、Sangamo治療会社(Sangamo)と、アルツハイマー病を含むtauopathyのためのST-501を開発および商業化するための協力および許可プロトコルを有している;ST-502は、パーキンソン病を含む結合核病のためのST-502;第3の神経筋疾患標的;および5年以内に決定および選択された9つの追加の神経疾患標的を含む。この2社は,Sangamoの独自の亜鉛指蛋白技術を用いて,腺関連ウイルスにより神経疾患に関連する重要な遺伝子の発現を調節している。この協力により、協力によって開発された任意の製品の潜在的純売上高の高いビット数から10代以下のパーセントの階層印税をSangamoに支払うことができる。
監督管理
私たちが現在と考えている活動とこれらの活動から生まれた製品、技術、工芸は政府によって厳格に規制されている。
薬品の監督管理
アメリカの製品審査と承認後の法規
審査の流れ
新しい薬品が米国で販売できる前に,製品の臨床前研究と臨床試験を行い,結果をFDA承認に提出しなければならない。限られた例外を除いて、FDAは会社に承認前と承認後の臨床試験を登録し、公共データベースに臨床試験結果を開示することを要求する。所定の時間内に試験を登録したり、研究結果を開示したりすることができなかったことは、民事罰金を含めて処罰につながる可能性がある。臨床試験計画は必ず治療効果を確定し、適切な投与量と投与量方案を確定し、そして安全使用の条件を確定しなければならない。これはリスクの高い過程であり,漸進的な臨床研究が必要であり,これらの研究では候補製品が予定のゴールに成功しなければならない。そして,製品の臨床前と臨床試験結果はBLAまたはNDAの形でFDAに提出される。BLAまたはNDAに対する応答として、FDAは、追加情報の提供を要求する上場を許可することができ、または申請が十分な承認ベースを提供できないと判断した場合、出願を拒否することができる。
製品の開発と監督管理の承認を得るのに数年かかり、大量の資源支出に関連し、そして多数の要素に依存し、関連疾病の重症度、適切な代替治療方法があるかどうか、臨床前或いは臨床試験で観察された潜在的安全信号、及び臨床試験で証明された製品のリスクとメリットを含む。FDAは製品承認過程においてかなりの裁量権を有しており,FDAがいつ承認されるかどうかを確実に予測することは不可能である.機関は、BLAまたはNDAのスポンサーに追加の臨床研究を要求するか、または製品に関する他の科学的または技術的情報を提供することを要求する可能性があり、これらの追加の要求は、予期しない遅延または費用をもたらす可能性がある。さらに、製品が承認されても、承認は、既存の臨床前および/または臨床データに対するFDAの解釈に基づいて制限される可能性がある
FDAは4つの異なる方法を制定しており、特にこれらの薬剤が第1の薬剤である場合、治療意義のある重要な薬剤の開発と加速を促進することを目的としている
既存の治療方法または既存の治療方法と比較して優位性がある:承認の加速、迅速なチャネル、突破的な治療、および優先的な審査。
•承認を加速する:FDAは深刻または生命に危害を及ぼす疾患を治療することを許可し、既存の治療方法よりも意義を持って患者に治療利益を提供する製品を提供するかもしれない。この経路によれば、FDAは、生存率または不可逆的な発症率に基づくのではなく、代替終点または臨床終点に基づいて製品を承認することができる。承認が生存率または発症率ではなく代替終点または臨床終点に基づく場合、スポンサーは、臨床的利益を検証および説明するために、承認後にFDAに検証データを提供することを要求されるであろう。FDAの加速承認規定によると、FDAが結論を出した場合、有効であることが証明された薬物は、流通または使用が制限された場合にのみ安全に使用することができ、安全な使用を確保するために、いくつかの発売後の制限が必要となる可能性がある。さらに、加速承認の下で承認された製品の場合、スポンサーは、広告を含むその宣伝材料のすべてのコピーを、最初の伝播の少なくとも30日前にFDAに提出することを要求される可能性がある。例えば,発売後の研究で臨床的利益が確認されなかった場合,製品流通の制限が安全な使用を確保するのに不十分であることや,スポンサーが承認を加速する条件を遵守できなかった場合,FDAが承認を撤回する可能性があることは明らかである。
•快速通路:FDAは深刻な疾病を治療し、満足されていない医療需要或いは合格伝染病製品に指定された薬物を解決する潜在力があることを証明するデータがあるかもしれない。
•画期的な治療:FDAは単独或いは他の1つ以上の薬物と連合して深刻或いは生命に危害を及ぼす疾病或いは状況を治療することを目的とした薬物を“突破的治療”の地位を授与することができ、初歩的な臨床証拠は、臨床の顕著な終点に基づく現有の治療方法が実質的に改善されていることを表明した。画期的な治療状態はスポンサーにもっと早く、もっと頻繁にFDAと非臨床と臨床データの開発について会議を開催する権利があり、そしてFDAが製品開発或いは監督管理提案を提供することを許可し、製品承認の時間を短縮する。画期的な治療状態は製品が優先審査を受ける資格があることを保証しておらず,FDA承認も確保できない。
•優先審査:優先審査“は、重篤な疾患を治療する薬剤の出願(元または治療効果補充)にのみ適用され、承認された場合、重篤な疾患の治療、診断または予防の安全性または有効性が著しく改善される。小児科研究に対するFDAの書面請求によって達成された研究、合格感染症製品に指定された薬剤の申請、または優先審査証明書と共に提出された薬物の任意の申請または補充のためにラベル変更を提出する任意のサプリメントについても、優先審査を得ることができる。
FDAは2016年12月、SPINRAZA承認に関連するまれな小児科疾患優先審査証明書を発表した
発売後研究
どのような承認経路を採用しても、FDAはスポンサーに追加的な上場後研究を要求する可能性があり、承認の条件として、安全性と有効性に関するデータを提供する。スポンサーが必要な研究を行うことができなければ、FDAはその承認を撤回するかもしれない。また,FDAが有効であることが証明された薬物は,流通や使用が制限された場合にのみ安全に使用可能であり,安全使用を確保するために発売後の制限を強制的に実施することができると結論した。この場合、スポンサーは、安全条件下での製品の使用を確保するために、厳格な制度の確立を要求される可能性がある。これらのシステムは一般にリスク評価および緩和策(REMS)と呼ばれる。FDAは、REMSを含むいくつかの上場後の約束を守らなかった行為に経済的処罰を科すことができる。さらに、承認されたREMSの任意の変更は、実施前にFDAの審査および承認を受けなければならない。
不良事件報告
著者らは臨床研究期間中と上場承認後に報告された副作用と有害事象の情報をモニタリングし、監督管理機関にこのような情報と事件を報告する。FDAの安全報告書の要求を守らないことは民事または刑事罰を招く可能性がある。臨床試験期間中に報告された副作用或いは不良事件は上場承認を延期、阻害或いは阻止する可能性がある。承認後に出現する新しいセキュリティ情報に基づいて、FDAは、製品ラベルの変更を強制的に要求することができ、新しいREMSを強制的に実施するか、または既存のREMSに要素を添加し、新しい発売後の研究(追加の臨床試験を含む)を要求するか、または製品の承認を一時停止または撤回することができる。これらの要求は私たちが製品の市場承認を維持する能力に影響を与えるか、あるいは私たちに要求するかもしれません
このような承認を得たり維持したりするために巨費を投入する。
承認された製品の変更を許可する
承認された製品のいくつかのタイプの変更を求める場合、例えば、新しい適応を追加し、いくつかの生産変更を行うか、または特定の成分または構成要素を変更する製造業者または供給者の場合、FDAは、そのような変更を事前に検討および承認する必要があるであろう。新しい適応については,製品が最初に承認された用途に対して安全かつ有効であることを追加的な臨床データを用いて証明する必要がある。FDAの規制審査は、計画の変更を拒否または修正したり、追加のテストまたは評価を要求したりする可能性があり、これは計画変更のコストを大幅に延期または増加させる可能性がある。
製品広告と販売促進の規制
FDAは、その管轄内の製品の承認前と承認後のすべての広告および販売促進活動および通信を規制する。FDAの指導によると、会社は製品ラベルに、または製品ラベルと一致して安全性および有効性宣言を提出することができる。しかしながら、医師は、薬物ラベルに記載されていない使用のための、合法的に得られた薬物を処方するかもしれない。このラベル外の処方は医学専門科でよく見られ,通常医師の信念,すなわちラベル外の使用が患者に対する最良の治療であることを反映している。FDAは医師が治療を選択する行為を規範化していないが,FDAの規定は確かにメーカーの非ラベル使用に関するコミュニケーションに厳しい制限を加えている。適用されるFDAの要求を守らなければ、会社は否定的な宣伝、FDAの法執行行動、広告の是正、政府が取ることができる様々な民事·刑事罰を受ける可能性がある。
組合せ製品に対する監督管理
FDAは、組合せ製品を、2つ以上の規制された成分を含む製品(例えば、生物学的および器具)として定義する。生物製品と設備はすべて自分の規制要求があり、組み合わせ製品には追加の要求があるかもしれない。私たちのいくつかの上場製品はこの定義に適合し、この枠組みとアメリカ以外の類似した法規によって規制されており、私たちのいくつかの候補パイプライン製品もこの枠組みの下で規制承認を受ける可能性があると予想される
2017年5月、医療機器(MDR)と体外診断医療機器(IVDR)に関する新法規がEUで施行された。MDR規制は2021年5月に施行された
IVDR条例は2022年5月から適用される。過渡期の終わりに、このような規制が含まれているすべての製品はこのような規制を遵守することを要求されるだろう。これらの条例は新しい要求を導入し、ある分類の医療機器に対して臨床調査を行い、監督審査の強化、上場後の監督と警戒の要求を強化し、更に高い透明性を規定することを要求した。これらの規定は,全体の薬物−機器組合せ製品の医療機器部品の評価要求を変更し,医療機器や医療製品規制制度の下で機器部品の評価が求められている。
アメリカ国外の製品の審査と承認後の法規
私たちはアメリカ以外の多くの司法管轄区で私たちの製品を販売しています。これらの司法管轄区域の大多数は原則的にアメリカの製品承認と承認後の監督管理の流れに似ています。例えば、ヨーロッパでは、私たちの大部分の前にアメリカはそこに集中していて、いくつかのマーケティング承認経路があります。具体的には承認を求める製品の種類に依存しています。集中手続きの下で、ある会社は環境管理協会に申請を提出した。上場許可申請はアメリカのNDA或いはBLAに類似し、EMAがヒト薬物を担当する専門家科学委員会CHMPによって評価される。CHMPがMAAが品質、安全性、有効性の要求を満たし、この薬物が正の利益リスクバランスを持っていると判断した場合、それは積極的な意見を取り、欧州委員会が発売を許可することを提案する。CHMPの意見は拘束力がないが、通常ヨーロッパ共同体に採択されている。欧州共同体によって承認されたMAAはEUのすべての加盟国で有効である。すべての生物製品、孤児薬物製品、および神経変性疾患の新しい治療法は集中的なプログラムを必要とし、いくつかの他の製品も使用することができ、重大な治療、科学または技術革新を構成する製品を含む。
集中手続きに加えて、欧州規制枠組みには、EU加盟国で監督審査と承認を行う次の選択肢が含まれている
•最初の申請はEU加盟国の主管当局にのみ提出される全国的な手続きである
•申請者がいくつかのEU加盟国に同じ申請を提出し、薬物がどのEU加盟国でも許可されていない場合、同時に承認される分散手続きと、
•相互承認手続きは、EU加盟国で許可された薬品を有する申請者が、他のEU加盟国でこの許可を相互承認することを申請することができる
アメリカと同様に、EUも優先薬物評価計画(Prime)、加速評価と条件付き上場許可を含む重要な薬物を治療する監督管理経路を最適化する異なる方法を持っている。Primeの目的は,開発過程全体で薬物開発者に追加的な支援を提供することである。満たされていない医療ニーズを満たす製品の加速評価により,EUの規制審査スケジュールが短縮される可能性がある。また、公衆健康の利益のために、製品に条件付きマーケティングライセンスを付与することができ、この場合、直ちに利用可能な利点は、通常の要件よりも不完全なデータを有するリスクを超える。条件付きマーケティング許可の有効期限は1年で、毎年更新することができます。マーケティング許可保持者は、収益リスク残高が正であることを確認するために、包括的なデータを提供するために、特定の義務(進行中または新しい研究、場合によっては追加の活動も含む)を達成する必要がある。製品に関する全面的なデータを取得すると、マーケティング許可を標準マーケティング許可に変換することができる。
米国やEUに加えて、他の地域の一部の国では、国家規制当局が特定の医療ニーズを満たす製品の審査スケジュールを短縮することを約束する“加速”審査を受ける可能性もある。
EUでは,薬物警戒に関する詳細な立法と良好な薬物警戒慣行に関する広範な指導がある。EU薬物警戒義務を守らないと上場許可所持者に重大な経済的処罰を与える可能性がある。
どのような審査プロセスを採用しても、各方面は審査後の不良事件に対して監視、検査と評価を行う責任があり、国家主管部門、ヨーロッパ薬品監督管理局、欧州委員会と上場許可所持者を含む。EMAの薬物警戒リスク評価委員会は人類薬物の安全性を評価とモニタリングし、製品安全問題について提案を提出した。販売許可保持者は、医薬製品の利益とリスク評価に影響を与える可能性のあるいかなる新しい情報を監督管理機関に通報する義務がある
米国,EU,その他の管轄地域では,FDAを含む規制機関がNDA,BLA,上場許可保持者を定期的に検査し,薬物警戒義務を遵守していることを評価している。
良好な製造規範
監督管理機関は製品を承認する前に、薬品と生物製品の製造とテストに使用する設備、施設、プロセスに対して監督と検査を行う。もしある会社が規制機関の承認を得た後、製造設備、場所、あるいはプロセスを重大に変更した場合、追加の監督審査と承認が必要になる可能性がある。また、現行の良好な製造規範(CGMP)と規制機関が製品承認後に実行する特定の製品法規を遵守しなければならない。FDA、EMA、その他の規制機関も定期的に訪問し、製品が初歩的な承認を得た後、設備、施設、技術を再検査する。これらの検査結果が、私たちの設備、施設、またはプロセスが適用される法規および製品承認条件に適合していないと判断した場合、規制機関は、重大な経済的処罰と製造業務の一時停止を含む、私たちの民事、刑事または行政制裁または救済措置を求めることができます。
良好な臨床実践
FDA、EMAとその他の監督機関はデータと結果の正確性を確保し、試験参加者の権利と福祉が十分に保護されていることを確保するために、設計、進行、監視、監査と臨床試験結果を報告する法規と標準を公布した(通常現在の良好な臨床実践(CGCP)と呼ばれる)。監督管理機関は定期的に試験スポンサー、主要な調査者と試験場所、契約研究組織(CRO)と機関審査委員会を検査することによってCGCPを実行する。もし私たちの研究が適用されたCGCPガイドラインに適合していなければ、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、関連する規制機関はマーケティング申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。規定を守らないことはまた民事や刑事制裁を招く可能性がある。われわれはCROを含む第三者に依存して多くの臨床試験関連活動を展開している。これらの第三者がCGCPを遵守しなければ,同様にわれわれの臨床試験データが拒否されたり,他の制裁を受けたりすることになる。
2014年4月、ヨーロッパ共同体は2014年6月に施行された新しい臨床試験条例を採択したが、2022年1月まで施行されなかった。申請日にも行われている臨床試験には,過渡的な規定がある。臨床試験申請も引き続き根拠を得ることができる
臨床試験指令(既存の規制枠組み)は2023年1月までである。すべての臨床試験は2025年1月までに臨床試験条例に完全に適合しなければならない。この規定はEU全体の臨床試験の評価と管理手続きを調整し、EUで行われた各臨床試験の許可、進行と結果の情報の公開を要求する。
生体模倣薬の承認
米国では,患者保護·平価医療法案(PPACA)が公衆衛生サービス法(PHSA)を改正し,FDAが生物模倣薬または後続生物製品と呼ばれる生物製品を承認することを許可しており,これらの生物製品は,以前に承認された潜在的略語パケットに基づく生物製品と“高度に類似している”ことが証明されている。生物類似製品はそれが参考製品と安全性と有効性の面で臨床的に意義のある差異がないことを証明しなければならず、しかも生物類似製品の中で臨床不活性成分のわずかな差異しか許されない。しかし、生物模倣薬の承認経路は確かに生物製品メーカーにその生物製品が承認された日から12年の排出期を与え、それから生物類似競争を導入することができる。しかし,生体模倣薬の承認枠組みは当初PACAの一部として公布されていたため,不確実性があった。連邦立法および行政部門は、PACAの条項の一部または全部を廃止、大幅に修正、または廃止するために努力し続けている可能性がある。PACAが廃止され,大幅に改正または失効されれば,このような行動が生物類似法規にどのような影響を与えるかは不明である。
2003年以来、EUは生物模倣薬の承認手続きを実行してきた。EMAは、モノクロナル抗体を含む生物模倣薬の要求を承認することを含む、いくつかの科学的および製品固有の生物類似ガイドラインを発表した。連合では、生物模倣薬は一般的に集中的な手続きで承認される。許可経路は生物類似製品の発起人が監督部門の許可を求め、獲得することを許可し、これはある程度革新製品の臨床試験データへの依存に基づいているが、全面的な比較可能性研究を通じて、この生物類似製品はすでにこの製品と“似ている”ことが証明された。多くの場合,生物模倣薬は新薬に通常必要なすべての臨床試験を行わずに市場に出すことができる。
“孤児薬物法案”
米国の“孤児薬物法案”によると、FDAは、まれな疾患や状態を治療するための薬物または生物製品に孤児薬を指定することができる。米国では、このような疾患または状態は、通常、20万人に影響を与えない疾患または状態である。製品であれば
孤児の薬物名を有する製品は、その後、孤児の排他性を得る権利があるFDAのこのような名称を有する適応に対する最初の承認を得る権利があり、すなわちFDAは、発売承認後7年以内に、後の製品が臨床的に孤児製品よりも優れていることが証明されるように、いくつかの非常に限られた場合を除いて、同じ適応について同一の薬物を販売する他の任意の出願を許可することができない。他の国も米国の“孤児薬物法”のような立法を公布し、稀な疾患の治療、予防或いは診断を奨励する薬物の研究、開発とマーケティングを奨励した。EUでは、孤児の称号を獲得し、維持した薬品は、承認、方案援助、集中的な上場許可手続きに入った後、10年間の市場排他性を獲得する権利がある。SPINRAZAは米国、EU、そして日本で孤児薬物の称号を与えられた。
定価と精算に関する規定
国内外の市場では、私たちの製品の販売は政府、個人健康計画、その他の組織の獲得可能性と精算金額を含む第三者支払者に大きく依存している。私たちの製品の定価と精算には大きな不確実性があり、薬品価格は引き続き厳格に審査されている。政府は私たちの製品のカバー範囲、精算と定価を規制して、コストをコントロールしたり、私たちの製品の使用に影響を与えたりするかもしれません。政府も個人的な利害関係者も、私たちの価格設定戦略に対する挑戦は、私たちの業務を損なう可能性がある。米国と外国政府は、医療保険のカバー面やコストに影響を与える追加改革措置を公布し、定期的に考慮している。個人保健計画もカバー範囲や精算制限を実施することでコストや利用を管理することができる。他の支払者は、管理型医療保健組織、健康保険会社、薬局福祉マネージャー、政府健康管理機関、および個人健康保険会社を含み、私たちの製品をその処方に置くことに関連する価格割引またはリベートを求め、場合によっては、知覚価値に応じて特定の薬物の取得、カバー、または定価に制限を加える可能性がある。
アメリカ国内にあります。
•医療補助:医療補助は連邦と州の共同計画であり、各州が管理し、低収入と障害受益者に向けている。医療補助薬品還付計画によると、私たちは州医療補助計画で精算された単位製品ごとに税金の払い戻しを支払わなければならない。還付額は法律により決定され、平均メーカー価格(AMP)の上昇幅がインフレ(消費者価格指数−Urbanで測定)を超えた場合、還付額は上方調整される
返却金額は,我々がCMSに提出した現在のAMPと製品ごとの最適価格の報告に基づいて四半期ごとに計算される。AMPと最適価格を計算する要求は複雑である.私たちは、以前に報告されたAMPまたは最適価格の任意の修正を一定期間報告することを要求されており、これらの修正は、私たちの前の数四半期の返却責任に影響を与える可能性がある。また,情報提供が間に合わなかったり,故意に政府に虚偽情報を提出したりしたことが発見された場合には,医療補助薬品税還付計画を管理する法規が民事罰金を規定している。
•医療保険: 連邦医療保険は連邦政府が管理する連邦計画だ。その計画は65歳以上の個人と特定の障害者たちを扱っている。連邦医療保険B部分は、一般に、医師または他の医療従事者によって管理されなければならない薬剤、ある耐久性医療機器に関連する薬剤、またはある経口抗癌薬およびいくつかの経口免疫抑制薬をカバーする。連邦医療保険B部は薬物の平均販売価格(ASP)に応じてこのような薬物の費用を支払う。製造業者は、私たちを含めて、四半期ごとにCMSにASP情報を提供することを要求されている。メーカーが提出した情報はMedicare支払率を計算するために使用される。メーカーがASPの報告書に虚偽の陳述をしたことが発見された場合、管理法規は民事罰金を規定する。
連邦医療保険D部は,登録された連邦医療保険患者に自己管理薬(すなわち医師が管理する薬剤ではない)の保険を提供する。連邦医療保険D部分は米国政府が承認した個人処方薬計画によって管理されている。各薬物計画は処方薬の保証範囲と定価のために独自のMedicare Part D処方を確立し、薬物計画は時々これらの処方を修正する可能性がある。処方薬計画は、メーカーや薬局と価格交渉を行い、メーカー割引の可用性を条件に処方を手配することが可能である。また,我々を含むメーカーが連邦医療保険Dの一部の受益者が使用しているブランド処方薬がその薬品福祉のカバーギャップに達した場合には,CMSに70.0%と高い割引を提供することが求められている。
2022年8月16日、総裁·バイデンは、(1)政府が選定した高コスト医療保険D部分薬(2026年から)とB部分薬(2028年から)について価格交渉を行うことができると規定した“アイルランド共和法”に署名した。(2)価格上昇速度がインフレを超えた場合、メーカーは連邦医療保険B部分とD部分薬に税金還付を支払うことができる
2022年から,D部とB部はそれぞれ2022年と2023年から,および(Iii)連邦医療保険D部分の再設計は,現在のカバーギャップ条項の代わりに,2025年から連邦医療保険受益者に2,000ドルの自己負担費用上限を設定し,メーカーは最高2,000ドル上限の10.0%のコストを負担し,上限に達すると20.0%となる
製造業者(我々を含む)にとって、これらの変化の結果は、i)私たちの医薬品収入に重大な悪影響を及ぼす可能性があり、これらの薬剤は、“交渉”を必要とする、ii)インフレ条項に拘束された薬剤の新しい税金還付責任、およびiii)D部分再設計に関連する潜在的な重大な追加コストを含む可能性がある。しかし、この立法が私たちの業務に与える影響の程度は、規制当局がこれから取るいくつかの実行行動に依存するため、アイルランド共和軍の私たちの販売と逆に私たちの業務に与える影響の全面的な程度はまだ不明である。
•連邦機関割引定価:もし連邦機関が連邦供給スケジュール(FSS)を通じて私たちの製品を購入すれば、私たちの製品は割引価格の影響を受けるだろう。我々の製品は退役軍人管理局(VA)、国防部、沿岸警備隊、公衆衛生サービス(PHS)のカバーと精算を受けるためにFSSに参加する必要がある。Medicaid,Medicare,PHS薬品定価計画のカバー範囲もFSSの参加に依存する。FSS定価の目的は私たちが最も安い非連邦顧客に受け取った製品価格を超えないことです。また,退役軍人管理局,国防省(軍人と家族がTricare小売薬局で計画して購入した薬品を含む),沿岸警備隊,PHSで購入した薬品の価格上限は非連邦メーカー平均価格(Non−FAMP)の76.0%であった。非FAMPの増加がインフレ(消費者物価指数−Urbanによって測定される)を超える場合、追加の割引が適用される。また、情報提供が間に合わなかった場合、あるいは故意に政府に虚偽の情報を提出したことが発見された場合、管理法規は民事罰金を規定する。
•3400億ドルの割引価格:我々の製品の医療補助薬品リベート計画と連邦医療保険B部分でのカバー範囲を維持するためには,PHS薬品定価計画第340 B条により製品を購入した特定の保険実体に大幅な割引を提供しなければならない。割引を受ける資格のある購入者には、経済的に必要な患者に比例しないサービスを提供する病院、コミュニティ衛生診療所、PHSAに従って何らかのタイプの贈与を得る他の実体が含まれる。すべての上の
私たちの製品に対して、これらの保険実体に外来薬を販売する時、法規で規定されている金額(“最高価格”)を超えない価格を受け取ることに同意しなければなりません。さらに、我々は、340 B上限価格よりも低い価格をこれらの保証エンティティに提供することができるが、必要ではない。340 B割引式はAMPに基づいており,医療補助薬品返却計画により計算された返却点レベルとほぼ類似している
アメリカ以外の国
アメリカ以外では、私たちの製品は異なる支払人によって支払い、政府は主な支払い元です。政府は製品の精算を決定したり影響したりすることができ、価格を設定したり、他の方法で定価を規制したりすることもできる。政府当局との価格交渉は私たちの製品の商業化を延期するかもしれない。各国政府は、値下げ、強制リベート、価値に基づく定価、および基準価格(すなわち、他国の価格を参照し、これらの基準価格を使用して価格を制定する)を含む様々なコスト制御措置を使用して製品コストを制御することができる。多くの国の予算圧力は引き続き各国政府に各種の費用制御措置を考慮或いは実施させ、例えば価格の凍結、値下げとリベートの増加、模造薬の代替と患者の費用分担の拡大を促す
販売とマーケティングに関する規定
私たちは、リベート法や虚偽申告法を含む、ヘルスケアの“詐欺と乱用”に関する様々な連邦や州法に支配されている。逆引き落とし法は、一般に、特定の薬物の購入または処方を含む業務を生成するために、処方薬メーカーが特定の薬物の処方を誘致、提供、受信、または支払うことを禁止する。これらの法律の具体的な規定はそれぞれ異なるにもかかわらず、それらの範囲は通常広く、これらの法律が特定の業界実践にどのように適用されるかを明らかにするための法規、指導意見、または裁判所判決はないかもしれない。したがって、私たちの接近は逆リベートや似たような法律の挑戦を受けるかもしれない。虚偽請求法は、関係者および自発的な場合に、第三者支払者(連邦医療保険および医療補助を含む)に提出するか、または虚偽または詐欺的な精算薬品またはサービスクレーム、クレームに従って提供されていない物品またはサービスのクレームまたは医療不必要な物品またはサービスのクレームを提出することを禁止する。これらの法律によると、私たちの製品販売やマーケティングに関する活動が審査される可能性があります。詐欺や法律違反行為は、罰金や民事罰金を含む刑事または民事制裁を受ける可能性があり、連邦医療計画(連邦医療保険や医療補助を含む)から除外される可能性がある。アメリカでは連邦と州当局がこれらの法律の施行を強化しています
製薬業界では、個人と個人が連邦民事虚偽請求法に基づいて違法行為を積極的に告発し、政府を代表して訴訟を起こしてきた。もし私たちがこのような法律に関する告発を受けたり、これらの法律に違反したと判断されたら、私たちの業務は損害を受けるかもしれない。
連邦政府と各州はすでに法律と法規を公布し、薬品メーカーの販売とマーケティングのやり方を規範化した。法律法規は、一般に、製造業者と医療提供者との間の財務的相互作用を制限するか、または政府および公衆にそのような相互作用を開示することを要求する。このような法律には連邦日光条項が含まれている。陽光条項は、ある政府計画に基づいて製品を精算する薬品製造業者に適用され、これらのメーカーは、医師およびいくつかの他の保健従事者または教育病院に支払われるいくつかの金を連邦政府に毎年開示(再開示)するように要求する。州法はまた薬品価格情報とマーケティング支出の開示を要求するかもしれない。このような法律には曖昧な要求が多く含まれている。法律とその実施の不明確性を考慮して、私たちの通報行為は関連連邦と州法律法規の処罰条項の制約を受ける可能性がある。米国以外では,他の国では医療提供者との財務的インタラクションを開示する要求が実施されており,より多くの国ではこのような法律が考慮または施行される可能性がある。
その他の規則
渉外反腐敗
私たちは様々な連邦と外国の法律によって制約されており、これらの法律は私たちが政府関係者に報酬を支払う上での国際的なビジネス慣行を規範化している。これらの法律には、米国企業およびその代表が任意の外国政府職員、政府職員、政党または政治候補に支払うことを禁止する米国“反海外腐敗法”(FCPA)が含まれており、業務の獲得または保留、または他の方法で優遇待遇を得ること、または公的身分で働く人に影響を与えることを目的として、支払いを提出し、支払いを承諾し、または許可している。多くの国では、私たちがよく接する医療専門家は、“海外腐敗防止法”の外国政府関係者の定義に適合しているかもしれない。“海外反腐敗法”はまた、上場企業にその取引を正確かつ公平に反映した帳簿と記録を作成·保存し、適切な内部会計制御制度を設計·維持することを要求している。
私たちが支配している法律には、公共の場での収賄や賄賂の収賄を禁止するイギリスの“2010年収賄法”(“収賄法”)も含まれている
民間部門は、外国の公職者に賄賂を与え、従業員や他の代理人の贈賄を防止するのに十分な手続きがない。英国で事業を展開している米国の会社は一般的に“収賄法”の制約を受ける。反収賄法に規定されている懲罰措置には、会社に巨額の罰金を科すことと、場合によっては会社幹部に刑事制裁を科すことが含まれる。
アメリカ国立衛生研究院のガイドライン
我々の米国施設では,現在の米国国立衛生研究院の組換えDNA分子に関する研究ガイドライン(NIHガイドライン)に沿った研究を求めている。現地法規によると,他の事項に加えて,ノースカロライナ州RTPにおける我々の施設に関するNIHのガイドラインを遵守し,何らかの許可に基づいて運営しなければならない。
その他の法律
私たちは今と未来の業務がずっと続いていて、様々な他の法律と規制によって制限され続けるだろう。我々の研究で使用されているデータプライバシーおよび保護、安全な作業条件、実験室アプローチ、動物の実験使用および購入、貯蔵、移動、輸入、輸出、および危険または潜在的な危険物質(放射性化合物および感染症製剤を含む)の使用および処置に関連する様々な法律、法規および提案は、私たちの活動に適用されるか、または適用可能である。私たちが締結した独占許可権に関するいくつかの協定は、国や国際反独占規制を受ける可能性があり、その影響は予測できない。未来の立法や行政行動は政府の規制の程度を正確に予測できない可能性がある。
2016年、欧州議会とEU理事会は、現在のEUデータ保護指令および関連国別立法の代わりに、包括的な一般データプライバシー規制(GDPR)を採択した。GDPRは2018年5月に発効し、EU内の個人データの収集と使用を規制しています。GDPRは範囲が広く、個人データに関する個人の同意、個人に提供する情報、個人データのセキュリティと秘密、データ漏洩通知、個人データの処理に第三者プロセッサを使用することがいくつか要求されています。GDPRはまた、個人データをEUから米国に移すことに対して厳格な規定を実施し、法執行機関を提供し、金額が大きい者を基準に、最高2,000万ユーロまたは侵害者の世界年収4.0%の罰金が科される可能性があることを含む、規定を遵守しない行為に巨額の処罰を加えた。
製造業
私たちは世界中の患者に絶え間なく薬品を供給することを確保することを求めている。これのために、私たちは私たちの製造能力、能力、技術、そして施設を検討し続けている。私たちは、私たちの製造施設、私たちがアウトソーシングした第三者契約製造組織に加えて、現在私たちの製品と私たちの生物類似製品を開発、製造、販売しているパートナーSamsung Bioepisおよび他の戦略契約製造パートナーに十分な能力を提供していると信じている。
2021年3月、我々は、複数の治療領域にわたる遺伝子治療パイプラインを支援するために、ノースカロライナ州のRTPに新しい遺伝子治療製造工場を設立する計画を発表した。新たな製造施設は約19.7万平方フィートで、2023年末に運営を開始する予定で、総投資は約1.95億ドルと予想されている。この新施設の建設は2021年第4四半期に始まった。
製造施設
私たちの薬製造施設には
| | | | | | | | |
| 施設 | | 作られた薬物物質は |
| ノースカロライナ州RTP | | Avonex
プレグリディ
T@@ ys@@ ab@@ ri
その他* |
| スイスソロトゥン | | アドゥヘラム
楽奇美 |
*他には、契約製造パートナーのために製造された製品が含まれます。
私たちの薬物製造施設に加えて、ノースカロライナ州RTPには、非腸外施設と経口固体用量製品製造施設を含む医薬製品製造施設とセットインフラがあります
非腸外施設は、生物製品をバイアルに充填する能力と容量を増加させ、候補製品の充填に使用する。経口固体用量製品工場は私たちがアウトソーシングした小分子製造能力を補充することができる。
ノースカロライナ州のRTPにオリゴヌクレオチド合成製造工場を持っていますこの施設は現在臨床パイプライン中のASO候補薬を生産できるようにしている。
私たちの将来の成長と薬物開発パイプラインを支援するために、私たちはスイスのソローザンヌに大規模な生物製品製造施設を建設している。2021年第2四半期、同工場の一部はスイス機関から発行された良好な製造規範(GMP)多製品ライセンスを取得した
治療製品(スイス医療グループ)。SolothurnはADUHELMおよびLEQEMBIの製造にFDAによって許可されている。Solothurn工場の第2の製造キットは2023年末に運営されると予想される。
遺伝子テークはバルクRituxan,Rituxan HYCELA,Gazyvaの世界的なすべての製造活動を担当し,あるバルクRituxan,Rituxan HYCELAとGazyvaの製造を第三者にアウトソーシングする。IONISはSPINRAZAに活性医薬成分(原料薬)を提供する。Alkermesは単独のプロビジョニングプロトコルに基づいて現在VUMERITYとFAMPYRAを提供している。2019年10月、私たちは新しいプロビジョニング協定を締結し、AlkermesとのVUMERITY許可と協力協定を修正しました。私たちは技術移転を開始し、過渡期後にVUMERITYを製造するか、または私たちが従事する第三者によるVUMERITYを製造し、私たちまたは私たちが指定した人が製造したVUMERITYの将来の世界の商業純売上の任意の部分と交換してAlkermeにより高い特許権使用料を支払うことを選択した。2022年10月、私たちはAlkermesと新しいFAMPYRA供給協定を締結した。Acordaは以前Alkermesとの再許可プロトコルによりFAMPYRAを提供していたが,AcordaとAlkermes間の調停結果により,2022年10月に終了した.
第三者仕入先とメーカー
私たちは主に第三者を使用して、私たちの小分子製品と候補製品(TecfideraとFUMADERMを含む)の原料薬と最終製品、そして私たちの高分子製品の最終薬物製品、次いで候補製品を生産する
私たちの製品の大部分の充填層とすべての最終製品の組み立てと保存操作、そして私たちの大部分のラベルと包装操作を集中的な第三者契約製造組織にアウトソーシングします。私たちの製品と候補製品を生産するために必要な原材料、輸送設備、例えば注射器と自動注射器、その他の用品は、様々な第三者サプライヤーとメーカーから調達され、数量は私たちの需要を満たすのに十分です。在庫管理と適宜二重調達により,このような原材料,設備,用品の持続的な供給を確保した。当社の第三者サービス提供者、サプライヤー、および製造業者は、FDAまたは他の管轄地域同様の機関の従来のcGMP検査を受け、品質管理チームの評価および認証を受ける可能性があります。
ESGと気候に関する事項
序言:序言
私たちの環境、社会、ガバナンス(ESG)は、気候、健康、公平を優先し、弱者、および持続可能性、ガバナンス、透明性、開示における持続的なリーダーシップに重点を置くように努力している。
私たちは依然として有害排出を除去し、私たちの製品を製造するための資源を最大限に減らすことで、私たちの環境足跡を減らすことに取り組んでいます。2014年以来、私たちは100%の電力使用量を再生可能エネルギー、信用と補償と一致させることで、内部で効果的な措置を推進し、サプライヤーと協力して、気候変動への影響に責任を負う。グリーンケミストリーはわが社全体で歓迎され,絶えず新しい方法を探索し,我々の薬物開発過程をより安全,より効率的,より持続可能にするとともに,資源を節約している。
統治する
ESG監督は、我々のESG戦略および短期および長期目標の年次審査を含む、我々取締役会のガバナンス原則に正式に組み込まれている。私たちは定期的に私たちの業務パフォーマンス、コスト上昇、およびサプライチェーン挑戦に基づいて私たちの環境約束を検討します。私たちは依然として従業員やサプライヤーを参加させ、有名機関と協力し、健康結果を改善する科学的かつ行動を推進することに取り組んでいる。
このような優先順位に対する私たちのより広い約束の一部として、私たちは引き続き従業員と役員報酬の一部を私たちのESG努力を推進することにリンクさせていきます。
私たちはすべての実質的な側面で環境の適用に関する法律と法規を遵守するために努力している。環境コンプライアンスや潜在的救済活動に関する将来コストを正確に予測することはできないが,環境法遵守は大量の資本支出を必要とせず,我々の運営や競争地位に実質的な悪影響を与えることもないと予想される。我々の実行委員会は、気候変動の業務への影響を評価し、環境への悪影響を制限するための会社の行動を監督する責任がある。
私たちの企業リスク管理(ERM)枠組みは、気候に関するリスクと機会を確保し、私たちの全体的な業務戦略に溶け込むことを目指しています。我々のERMチームは業務の各方面の気候に関する戦略リスクを監視し,気候シナリオをその一つとしている
評価する。ERMチームは毎年会社全体のリーダーを参加させることで、気候に関連する有形リスクと過渡的リスクを含む確定されたリスクを評価する。企業リスク管理チームは毎年、私たちの実行委員会や取締役会に彼らの調査結果や活動の最新状況を提供しています。
リスク管理
ESG問題を解決することは、私たちの長期的なグローバル戦略の一部であり、私たちの未来への投資でもあり、利害関係者や投資家が私たちのESG実践にますます興味を持っているのが見られます。我々は引き続きESG努力を進めているが、投資家、監督機関、第三者ランキング会社、顧客、および社会全体が急速に変化するという予想を満たすことに成功するかどうかは、ESG問題を管理することができるかどうかは不明である。私たちは予想通りにESGトランザクションを管理することができず、私たちの名声やサービスに悪影響を及ぼす可能性があります。
気候リスク管理
我々は気候リスクを気候変動による損失リスクと定義し,実物リスクと過渡リスクを含む。実物リスクは、気候変動の実物影響(例えば、嵐、干ばつ、火災、洪水増加)がどのように実物資産を直接損傷するか、あるいは他の方法でその価値や生産性に影響を与えるかを考慮する。転換のリスクは政策がどのように変化するかを考慮している。気候変化に対応する法規、文化、技術、商業やり方と市場選好(例えば、炭素定価政策、発電が化石燃料から再生可能エネルギーへ)は資産と企業価値の変化を招く可能性がある。サプライチェーンの中断、顧客の生物類似市場予想の変化、規制環境の潜在的な変化は化石燃料の使用に不利であり、これらは業務義務の履行を困難にしたり、巨額の費用を発生させたりする可能性がある。
決定された重大なリスクと機会は、私たちの実行委員会と取締役会に報告されるERMチームに報告されるだろう。私たちは、財務的に大きな意味を持ち、私たちのビジネスモデルに影響を与える可能性のあるリスクや機会、およびすでに到着しているか、または必要な緩和措置を考慮して処理します。
私たちの環境関連リスクに関するより多くの情報は、お読みください第1 A項。リスク要因本報告に含まれます
人力資本
2022年12月31日現在、私たちは世界に約8,725人の従業員を持っています。約4970人の従業員が米国で雇用され、約3755人の従業員が外国で雇用された
多様性公平性包括性
生物遺伝研究所では、偏見、人種差別、そして不寛容は受け入れられない。私たちは、採用、採用、昇進、保留、実践の発展を含む、組織のすべての面で多様性、公平性、包摂性(DE&I)を実現することに取り組んでいます。2022年12月31日現在、生物遺伝研究会社の30.4%のマネージャー級および以上の職は米国の少数民族が担当している。私たちの政策ややり方は世界的だが、アメリカ以外の多くの国の法律は従業員の人種や人種データを収集することを許可していない。2022年12月31日現在,世界的に生物遺伝研究会社役員および以上のレベルの職の47.4%が女性が担当している
私たちのDE&I戦略は、堅固な基礎の上で業務全体に対する私たちの約束を深化させるための実行可能なステップを概説します。この計画には,我々の人材の構築と,我々のリーダーシップを強化する戦略,我々が治療している疾患地域で十分にサービスされていないコミュニティの健康結果を改善し,従業員や患者に影響を与えるコミュニティに貢献することが含まれている。私たちはリーダーシップ、責任、透明性を通じて私たちの組織で意識と能力を向上させる計画だ。この戦略を確立し推進するために、私たちは従業員で構成された企業間管理機関、すなわち多元化、公平、包容戦略理事会に依存している。
私たちは第一選択雇用主として認められて光栄です。私たちは5年連続で障害者:Inの障害者平等指数で100%の点数を獲得し、この指数は私たちの障害統合に関する政策とやり方を測定した。また、私たちはノースカロライナ州の障害者に3年連続で受賞された:付属機関と国家レベルで障害を支援し、投資することを表彰するためにDI-NC雇用主賞を授与した。私たちは9年連続で人権運動によってLGBTQ+Equityの最適な勤務先に評価され、彼らの会社平等指数で100%の点数を獲得した。
私たちの世界競争力を強化する
私たちは従業員のDE&I意識と能力を強化するために努力している。私たちは私たちの職員たちが私たちの戦略に貢献するために必要な資源と学習を持っていることを確実にすることに集中してきた。私たちの人事マネージャーは包括的な採用と求人の訓練を受け、私たちの全世界の従業員もDE&Iコースの訓練を受けた。
2022年には、異文化連携を強化し、文化の敏捷性を向上させ、私たちのグローバルチームをさらに接続するためのツールであるGlobeSmartを発売しました。私たちの従業員リーダーはGlobeSmartを使用して、より良い異文化協力とチームワークを実現するために、世界各地に存在する異なる仕事スタイル、視点、方法を探索し、操作可能な個人化提案を得ることができます
チームが信頼を築き,連携を強化し,多様性を利用する新しい方法を探索する.
報酬公平に関する哲学
私たちは私たちの職員たちが同じ賃金を保障することを確実にするために努力している。私たちは市場と基準データに基づいて報酬の構成要素と範囲を決定する。この場合、すべての従業員の報酬を合理的な範囲で公平に支払うように努力し、役割、市場データ、内部公平、勤務先、関連経験、個人、業務単位、会社表現などの要因を考慮する。また,多様なグローバル従業員に様々なニーズを満たす報酬機会を持たせ,患者や株主のために毎日最善を尽くすように激励するために,柔軟な福祉を提供することに取り組んでいる。
私たちは定期的に私たちの給与実践を検討し、給与決定の公平性を分析し、個別従業員と従業員チーム全体を対象としている。2022年には、世界的な性別報酬評価の結果を共有し、役員、管理、その他の専門レベルの報酬を分析した。
私たちは、採用、業績管理、報酬決定における偏見を識別、介入、防止するためのコミュニケーションや訓練などの措置を策定し、資源を提供し、さらにマネージャーやリーダーを育成し、報酬問題で公平な決定を下すことを支援している。
人材と発展
従業員の成功と幸福に影響を与える要素が多い。私たちは従業員が私たちの共通の使命を果たすことができるように職場を作り、同時に彼らの挑戦を軽減するのを助けた。職業発展から健康へ、労働環境まで、従業員のニーズを満たす機会が多く、人々が学ぶことができ、成長し、価値のある職業を築くことができる職場を築くことができる。私たちは職員たちが一連の専門的な開発資源を活用することを奨励する。マネージャーたちは従業員の表現を訓練し、従業員の発展討論に参加して、成長と学習を支持する。
持続的な学習の機会は従業員に関する尊敬度と成功に役立つ。Biogenでは、発展は在職学習、挑戦的な新しい任務、正式な訓練、オンライン学習、指導などの方式で行われる。多くの従業員が在宅勤務を続けるにつれて、仮想学習は重要な役割を果たしている。仮想学習は生物遺伝大学とLinkedIn学習によって獲得できる.生物遺伝大学を通じて,教師ベースの授業を1200件以上提供しており,そのうち約300件がインターネットで提供されている.LinkedInの学習を通じて私たちは従業員に
2万人以上に増えました 英語、ドイツ語、フランス語、スペイン語、日本語、ポルトガル語、イタリア語、オランダ語、ポーランド語、トルコ語、標準語の11言語のオンデマンド学習モジュールを提供する
私たちがサービスする患者のように多様で包容的な職場を創造し維持するために、私たちは、私たちの人材パイプと既存のリーダーに投資する計画を提供します
•アクティブ化、反映、共同作成:厳しい幹部職に適応するためにトップレベルの人材に準備をさせる。
•女性リーダーシップコース: 女性指導者が直面している独特な挑戦に対応して、影響力と影響力を高める。
•幹部リーダーシップ撤退:リーダーを文化を形作り粘り強さを養うためのテーマに浸るようにしましょう
•The Partnership,Inc.の生物多様性研究者プログラム: 私たちの人材パイプを支援し続けるために、多様なリーダーグループを持ち、高い潜在力、キャリア中期、代表性の不足している少数派が私たちが作るのを助けるプロジェクトに参加しています。
•台頭している女性:中層女性指導者が直面している独特な挑戦を解決し、影響力と影響力を高める。
•新興指導者:高い潜在力のある個人貢献者たちに第一級の指導者のための準備をさせる。
•BetterUp:組織における彼らの影響力を高めるための個人的な努力を支援するためのコーチ計画を提供する。
私たちの従業員資源ネットワーク(ERN)は従業員が知識を共有し、連絡を確立するために貴重な機会を提供した。私たちの現在の従業員再訓練ネットワークは
•育児ネットワークグループ:Biogenの最新ERNは在職親と介護者に支持、ネットワークと発展機会を提供し、従業員が仕事と生活バランスの挑戦に対応するのを助ける。
•点火式:職業初期の専門家たちと彼らの提唱者たちが集まった。
•アクセス可能性:障害者たちと障害者たちの世話をする従業員たちを支援する。
•生物遺伝退役軍人ネットワーク:退役軍人と退役軍人の同盟国が相互に連絡して支持することを奨励する。
•モザイク:異なる文化背景に対する認識と鑑賞を育成し、メンバー間の関係と発展機会を促進する。
•リード·アウト: LGBTQ+従業員に一流の労働環境を提供し、すべてのLGBTQ+従業員とその盟友を抱きしめることをサポートします。
•女性革新ネットワーク:世界中の女性や同盟国のためにネットワーク、指導、学習機会を作る。
•私たちの影響: 労働環境、健康、公平を促進し、従業員の個人生活を改善し、私たちの生活と仕事のコミュニティを改善する。
私たちは私たちの従業員の健康と健康需要を満たすために、私たちの計画を引き続き発展させて、これが最高の素質の従業員を誘致し、維持する鍵だと信じています。私たちは柔軟な仕事手配政策を更新して、従業員が労働時間内にもっと大きな柔軟性を持つことを可能にして、従業員の仕事と家庭生活の需要のバランスを助けて、私たちの多くの現場の健康サービスを仮想環境に移して、仮想行為の健康、栄養、フィットネスと全体の健康課程と相談を含み、全世界で無料でHeadspace瞑想アプリケーションを発売して、セミナーとプログラミングを提供して、従業員のストレス対応、隔離と靭性の育成を支援し、財務計画セミナーとコンサルティング会議は、従業員の日々増加する需要を満たし、充電、投票とボランティアサービスに追加の休暇と時間を提供する。
従業員調査
我々は,従業員調査計画を利用して従業員に電子メールやモバイルアプリケーションを送信し,コメント機会を提供し,問題へのフィードバックを促進する.この調査は、彼らの建設文化、業績、敬業従業員の実践に関する匿名情報をマネージャーとリーダーに提供し、彼らが計画を立て、持続的な改善の有効性を測定できるようにすることを目的としている。私たちは従業員のフィードバックに非常に関心を持っており、従業員の意見の収集と分析をより厳格で複雑にするために、人的資源部門全体に分析コミュニティを構築している。私たちは彼らの観点を利用して私たちに行動を指導し、参加度と支援を高め、すべての従業員のために働く良い場所としての私たちの名声を維持するのを助ける。このような行動の一例は私たちの2022年健康週間で、1週間の間に停止することだ
後任計画
私たちは毎年私たちのグローバル企業で人材評価を行い、その中には私たちの多くのポストの後継計画の評価などの重要な議題が含まれています。業務の長期的な連続性を確保するために、私たちは人材の発展を積極的に管理して、対を埋める
わが社の継続的な成功。しかも、私たちの取締役会は毎年私たちの幹部の後継計画を検討するだろう。
職場の健康と安全
私たちの従業員の福祉は第一であり、私たちはすべての従業員が安全で健康な職場を作る上で役割を果たしていると信じている。私たちの従業員は違う役割と機能を持っています。それが私たちが彼らに安全な労働環境を促進することを許可して、仕事が実験室でもオフィスでも製造工場で行われている理由です。私たちの政策とやり方は私たちの従業員を保護するためだけでなく、私たちが運営している周りのコミュニティを保護するためでもある。
2022年、私たちは人間の表現を私たちの環境、健康、安全計画に取り入れていく上で大きな進展を遂げ続けている。私たちは安全問題について、労働者たちが解決策の一部だと信じている。著者らは従業員が開放報告、仕事観察とリスク対話などの実践を通じて協力して自主的に問題解決に参与することを奨励する。さらに、我々の物理安全計画は、重要なタスクの詳細な評価に重点を置いており、制御措置がない場合、または使用されていなければ、これらのタスクは従業員を深刻なダメージや死亡に直面させる可能性がある。これらの評価により,我々の行動はこれらの基本的な活動に関連するリスクを低減し,我々の運営システムが従業員にとってより安全で柔軟であることを確保している.私たちはまたプロジェクトが完了した後に“行動後回顧”を使用するつもりだ。これらの審査は,改善すべき分野に集中できるだけでなく,良好な進展の面から良好なやり方を学習·応用することができるようにした。私たちは、このような計画を通じて私たちの従業員を参加させ、彼らに権力を与えることで、業界全体の安全パフォーマンスとリスク管理を処理する方法を変えることができると信じています。
我々幹部に関する情報(2023年2月15日現在)
| | | | | | | | | | | | | | | | | | | | |
| 将校.将校 | | 現在の位置 | | 年ごろ | | 年に生物遺伝研究所に加入する |
| クリストファー·A·ウィバッハ | | CEO社長 | | 62 | | 2022 |
| スーザン·H·アレクサンダー | | 常務副首席法務官兼秘書総裁 | | 66 | | 2006 |
| マイケル·R·マクドナ | | 常務副総裁兼首席財務官 | | 59 | | 2020 |
| ニコール·マーフィー | | 医薬運営技術部常務副総裁 | | 50 | | 2015 |
| Ginger Gregory博士 | | 常務副総裁兼首席人的資源官 | | 55 | | 2017 |
| ラシッド·イザール | | 総裁常務副総裁、グローバル製品戦略と商業化 | | 48 | | 2019 |
| Priya Singhal M.D.,M.P.H. | | 常務副局長総裁、開発部部長 | | 55 | | 2020 |
| ロビン·C·クライマー | | 首席会計官上級副社長 | | 57 | | 2018 |
| | | | | |
| クリストファー·A·ウィバッハ |
| 経験 |
| 魏バッハさんは、2022年11月以来、当社の総裁兼CEO兼取締役会のメンバーを務めています。Biogenに加入する前に、Viebacherさんは2015から2022年の間にボストン投資基金Gurnet Point Capitalの管理パートナーを務めました。以前、Viebacherさんは、セノフィ·グローバル·CEOを2008年から2014年までの間に務めていました。セノフィに加入する前に、Viebacherさんはドイツ、カナダ、フランスのグラクソ·スミスクラインで20年以上働いており、その後米国で北米製薬部門の社長を務めている。ウェバッハのキャリアは普華永道会計士事務所から始まり、特許会計士資格を取得した。Viebacherさんは以前、Brands,Inc.とCrossover Health社の会長を務めていたウェタンタ生物科学社の取締役会長を務めていました。東北大学の理事やスタンフォード医学院研究員委員会のメンバーでもあります |
| 上場企業取締役会 |
| l | PureTech Health Plc. |
| 教育 |
| l | カナダオンタリオ州キングストンの女王大学、学士。 |
| | | | | |
| スーザン·H·アレクサンダー |
| 経験 |
| アレクサンダーさんは2018年4月から執行副総裁、最高法務官兼秘書を務めてきました。これに先立ち、アレクサンダーさんは2017年3月から2018年3月まで当社の執行副総裁兼首席法律、企業サービス兼秘書を務め、2011年12月から2017年3月まで当社執行副総裁兼首席法務官兼秘書を務め、2006年から2011年12月まで当社執行副総裁、総法律顧問兼会社秘書を務めた。生物製薬に加入する前に、Alexanderさんは2003年から2006年1月まで生物製薬サービス会社PAREXEL International Corporationで総法律顧問兼会社秘書高級副総裁を務めた。2001年から2003年まで、Alexanderさんはソフトウェア会社IONA Technologiesの総法律顧問を務めた。1995年から2001年まで、Alexanderさんはカボット社で法律顧問を務めており、これは特殊化学品と高性能材料会社だ。これまで、Alexanderさんはヒンクリー法律事務所、Allen&Snyder法律事務所、Fine&Ambrogne法律事務所のパートナーだった |
|
| |
| 教育 |
| l | ガールス理学部学士。 |
| l | ボストン大学法学部、J.D. |
| | | | | |
| マイケル·R·マクドナ |
| 経験 |
マックドナさんは、2020年8月以来、執行副社長兼チーフ財務責任者として務めてきました。生物遺伝研究会社に入社する前に、McDonnellさんは、2015年12月から2020年7月まで、IQVIA Holdings Inc.執行副社長兼最高財務責任者(CEO)を務め、IQVIA Holdings Inc.生命科学分野で先進的な分析、テクニカルソリューション、契約研究サービスを提供する世界的な大手プロバイダーです。これに先立ち、McDonnellさんは、2008年11月から2015年12月まで、世界をリードする衛星サービスプロバイダー国際通信衛星機関執行副社長兼チーフ財務官、2004年9月から2008年10月までの間に上場商業金融会社MCG Capital Corporation執行副総裁兼チーフ財務官を務め、2006年8月から2008年10月までMCG Capital Corporationの首席財務官を務めた。McDonnellさんは、MCG Capital Corporationに加入する前に、2004年7月から2004年8月まで、衛星直轄事業者EchoStar Communications Corporation(f/k/a DISH Network Corporation)の副総裁兼チーフ財務官を務め、2000年8月から2004年7月までの間に上級副総裁兼首席財務官を務めていた。McDonnellさんは、4年間のパートナーを含む、普華永道会計士事務所に14年間勤務しています。McDonnellさんは公認会計士です。 |
| 上場企業取締役会 |
| l | 利点医療システム会社です。 |
| 教育 |
| l | ジョージシティ大学会計学学士 |
| | | | | |
| ニコール·マーフィー |
| 経験 |
| 2022年2月以来、マーフィーさんは私たちの執行副総裁を務め、製薬運営と技術を担当してきた。これまで、Murphyさんは、2019年6月から2022年1月まで、最近担当した私たちのグローバル製造·技術運営担当上級副社長を含むBiogenで高級管理職を務めていた。2017年、マーフィーさんはBiogen血友病特許経営権の剥離に成功する過程で重要な役割を果たし、Bioverativ副総裁と技術運営主管を務め、臨床と商業開発、品質、監督管理、製造と調達を担当した。剥離前、Murphyさんは2015年5月から2016年12月までBiogenの社長兼ケンブリッジ現場運営担当を務めていた。生物遺伝研究会社に入社する前、マーフィーさんは生物製薬会社の安進で取締役サプライチェーンの主管を務めており、彼女の役割は商業製造と技術運営を指導することを含む。2001年から2015年までの間に、マーフィーさんは安進で多くの技術と運営職を担当し、各種施設のスタートアップ企業、業務開発統合、戦略転換と新製品の発売に重要な貢献をした。安進に加入する前に、マーフィーさんは免疫製薬会社とモンサント社で様々な技術開発と工学職を務めていた。 |
| 教育 |
| l | マサチューセッツ大学アーマースター校工学学士 |
| l | レンスラー工科大学工学修士と工商管理修士 |
| | | | | |
| Ginger Gregory博士 |
| 経験 |
| グレゴリー博士は2017年7月以来、私たちの執行副総裁と首席人的資源官を務めてきました。生物遺伝研究会社に入社する前、グレゴリー博士は2014年2月から2017年4月まで世界の専門バイオ製薬会社シャルル社で執行副総裁兼首席人的資源官を務めた。これまで、Gregory博士は異なる業界の多くの多国籍企業で幹部人力資源職を担当し、飲食持株会社Dunkin‘Brands Group Inc.が首席人力資源官を務め、ノワ製薬会社はノワワクチンと診断会社の人力資源部の主管を務め、ノワール消費者健康とノワール生物医学研究所人力資源部の主管を務め、ノワノルド製薬会社は高級副総裁を務め、同社のデンマークコペンハーゲンにある本社の企業人員と組織責任者を務めた。彼女のキャリアの初期、グレゴリー博士は製薬会社BMSで様々な人材通才や専門家の職を務め、情報技術コンサルティング会社ボスエレンとハミルトンで組織変革と有効性の分野のコンサルタントを務めていた。 |
| 教育 |
| l | マサチューセッツ大学心理学学士 |
| l | ジョージワシントン大学心理学博士 |
| | | | | |
| ラシッド·イザール |
| 経験 |
イザールさんは2021年7月から当社の執行副社長を務めており、世界的な製品戦略や商業化を担っています。これまで、イザールさんはラテンアメリカ、オーストラリア、アジア、日本、中東、アフリカ、トルコ、ロシアを含む大陸間地域の社長を務め、全世界の生物模倣薬事業部の総裁を務めていた。生物遺伝研究会社に入社する前に、イザールさんは、ビジネスおよび製造ビジネスをリードすることを含むフランスの社長であるアスリカンのさん社長を務めています。アスリコン在任中、彼は心血管専門部グローバル副総裁を含む多くのポストを務め、北米子会社及びヨーロッパと中国におけるこの専門権の発展に重要な貢献をした。これまでに、さん総裁の戦略転換副総裁を務め、上海駐在中国さんのCEOも務め、さん総裁は商業国際副総裁を務め、中国、オーストラリア、ブラジル、ロシア、米州、ラテンアメリカ、アジア、トルコ、中東、アフリカで事業を担当している |
| 教育 |
| l | シェブルック大学工商管理修士 |
| l | ハーバードビジネススクール企業幹部のモデルチェンジプロジェクト |
| |
| |
| | | | | |
| Priya Singhal M.D.,M.P.H. |
| 経験 |
シンハル博士は2023年1月以来、私たちの執行副総裁と発展部の責任者を務めてきました。これまで、Singhal博士は2021年以来ずっと私たちの臨時研究開発主管を務め、2020年にBiogenに再加入して以来、中国と日本の研究開発主管を含む全世界の安全と監督科学主管を務めたことがある。Singhal博士は最初に2012年から2018年まで生物遺伝研究会社に勤め、相次いで総裁臨床試験福祉リスク管理副総裁、安全と福祉リスク管理全世界主管及び全世界発展臨時連合席主管と高級副総裁などのポストを務めた。2020年に生物遺伝会社に復帰する前に、Singhal博士は2019年から2020年までの間にZafgen Inc.の研究開発と製造主管を務めた。2008年から2012年まで、シンゲル博士は頂点製薬会社に勤め、その中に医療事務副主任総裁が含まれていた。Singhal博士は2005年にMillennium PharmPharmticals,Inc.で彼女の薬物開発生涯を開始し、VELCADEと他の化合物の利益リスク管理を指導した。 |
| 教育 |
| l | ハーバード大学公衆衛生学院国際衛生修士 |
| l | ムンバイ大学医学博士(M.D.) |
| |
| |
| | | | | |
| ロビン·C·クライマー |
| 経験 |
| クライマーさんは2020年12月から私たちの首席会計官上級副総裁を務めてきた。これに先立ち、クライマーさんは2018年11月から2020年12月まで私たちの副財務長総裁を務めました。生物遺伝に加入する前に、クライマーさんは2014年5月から2018年11月までレンタカー会社ヘルツグローバルホールディングス有限公司の上級副総裁兼首席会計官を務めた。これまで、Kramerさんは2007年から2014年までの間にドイツ勤務全国事務室会計基準とコミュニケーショングループに勤務することを含む専門サービス会社徳勤会計士事務所(Deloitte&Touche LLP)の監査パートナーを務めていた。2005年から2007年まで、クライマーさんはフィッシャー科学国際会社の首席会計官を務め、同社は実験室供給とバイオテクノロジー会社である。2004年から2005年まで、クライマーさんはパーソナルケア会社ギレ社の取締役外部報告、会計、制御部門を務めた。クライマーさんは安永会計士事務所と安達信会計士事務所でパートナーを務めていた。クライマーはマサチューセッツ州の公認会計士です。彼女はマサチューセッツ州公認会計士協会とアメリカ公認会計士協会のメンバーです。クライマーさんは現在女性と企業センターの取締役会に勤めている。Kramerさんは2011年9月から2015年12月までマサチューセッツ州会計委員会の取締役会メンバーを務め、2016年から2018年までProbus保険会社のヨーロッパDAC取締役会のメンバーを務めた。 |
| 上場企業取締役会 |
| l | Armata製薬会社はバイオテクノロジー会社です |
| 教育 |
| l | セレム州立大学会計学学士 |
利用可能な情報
私たちの主な実行事務室はマサチューセッツ州カンブリッジ市ビンニー街225番地にあり、郵便番号:02142、電話番号は(6176792000)。私たちのサイトの住所はwww.bigen.comです。私たちは投資家これらの材料が米国証券取引委員会に電子的に提出された後、私たちのサイトの年間報告書Form 10-K、Form 10-Q四半期報告、Form 8-K現在の報告、およびこれらの報告書のすべての修正は合理的で実行可能な状況でできるだけ早く発表されるだろう。我々は本報告に我々のサイトアドレスを含み,非アクティブなテキストとして参照するだけであり,我々のサイトへのアクティブなリンクとするつもりはない.私たちのウェブサイトの内容はこの報告書に含まれていない。
第1 A項。リスク要因
私たちの業務に関わるリスク
私たちは製品の収入に大きく依存している
私たちの収入は私たちの製品の持続的な販売と抗CD 20治療計画で持っている財務的権利に依存します。私たちの収入の大部分は競争が激しくなっている市場に集中して私たちの製品を販売しています。私たちの任意の製品または任意の抗CD 20治療計画に関連する以下の任意の負の事態の発展は、私たちの収入および運営結果に悪影響を及ぼす可能性があり、または私たちの株価を下落させる可能性があります
•既存製品の新しいオリジナル療法、模倣薬、プロドラッグおよび生体模倣薬、および規制経路の簡略化下で承認された製品を含む、競合製品を導入、より大きく受け入れ、またはより割引して精算する;
•安全性や有効性の問題
•政府または規制要件によって引き起こされる制限および追加圧力を含む製品の価格設定または価格上昇に関する制限および追加圧力、私たちの製品の模倣薬または生物学的に類似したバージョンを含む競争激化、または支払人および他の第三者精算政策およびやり方の変化または実施;
•不利な法律、行政、法規、または立法発展
•私たちは患者、医療提供者、他の人たちの中で良い名声を維持する能力を持っていて、これは私たちの定価と精算決定の影響を受けるかもしれません
•患者は著者らの製品の診断、処方或いは投与を受けることができない或いは受け入れたくない、或いは競争的療法を処方と実施することを決定し、これは新冠肺炎疫病の直接或いは間接的な結果である。
LEQEMBIは、米国では商業発売の初期段階にある。新製品発表に関連するリスクやこれらのリスク要因に記載されている他の要因に加えて、BiogenおよびEisaiがLEQEMBIを商業化することに成功した能力が悪影響を受ける可能性がある
•LEQEMBI精算に十分な能力を獲得し維持しています
•衛材と生物遺伝会社マーケティングLEQEMBIのビジネス戦略の有効性;
•衛材とBiogenは患者、医療保健提供者とアルツハイマー病コミュニティの他の人の中で積極的な名声を維持する能力は、衛材が制定したLEQEMBIに関する定価と精算決定の影響を受ける可能性がある。
衛材や生物遺伝が承認を加速する条件を守れなければ,FDAは承認を撤回する可能性がある。
私たちの長期的な成功は新製品の成功と既存製品の他の適応にかかっています。
私たちの長期的な成功は、私たちの研究開発活動または私たちのライセンス、あるいは第三者から買収された新製品の成功開発、および私たちの既存製品の他の指標に依存するだろう。
製品開発は非常に高価で、高度な不確実性と危険に関連しており、成功しないかもしれない。少数の研究と開発プロジェクトだけが製品を商業化することができる。疾患治療の新しい方法の成功や製品開発の時間やコストを予測することは困難である。アンチセンスオリゴヌクレオチドプラットフォームと遺伝子療法に基づく新しい方法の開発を含む新しい疾患治療法の開発は、このような治療法の開発において経験の限られた規制当局の承認を得ることを含む、より多くの挑戦とリスクをもたらす可能性がある
臨床試験データは異なる解釈を受け、データが研究療法の安全性、有効性、および/または承認を支持するのに十分であると考えても、規制機関は同意しない可能性があり、追加のデータを要求し、承認の範囲を制限したり、承認を完全に拒否したりする可能性がある。また、規制当局が製品候補を承認することは、他の規制機関もその製品候補を承認することを意味するわけではない。
臨床前仕事或いは早期臨床試験の成功は後期或いはそれ以上の規模の臨床試験が成功することを確保しない。臨床試験により、著者らの候補製品は治療効果が不足し、有害な副作用があり、意外な不良事件を招く或いは他の懸念を引き起こす可能性があり、それによって監督管理部門の許可を得る可能性を著しく下げる可能性がある。これは、計画を終了すること、承認されたラベル上で使用および安全警告を重大に制限すること、治療例において不利な位置を配置すること、または候補製品の商業的潜在力を著しく低減することをもたらす可能性がある。
新製品や適応の開発に成功したとしても,候補製品や適応の開発を中止する戦略的決定を行うことが可能であり,例えば,介護基準よりも商業化が困難であると考えられる場合,あるいは我々のパイプラインで他の機会を求めたいと考えている
新製品または他の適応のある製品の販売は投資家の予想に合わない可能性がある。
もし私たちが効果的に競争できなければ、私たちの業務と市場地位は影響を受けるだろう。
バイオ製薬産業と私たちが経営している市場競争は激しい。我々は製品のマーケティングと販売、新製品と新技術の開発、ビジネス潜在力のある新製品を獲得する権利、人員の募集と維持の面で競争を展開している。私たちはバイオテクノロジーや製薬会社と競争していますこれらの会社は市場や製品ラインでより多くの製品、より多くの財務、マーケティング、研究開発、その他の資源、その他の技術や競争優位性を持っています
私たちの製品は引き続き新しい創始療法、模倣薬、プロドラッグ、および既存製品の生体模倣薬、および簡略化された規制経路の下で承認された製品の日々の激しい競争に直面している。その中のいくつかの製品の販売価格は私たちのブランド製品より大幅に低いかもしれない。このような製品や他の価格の低い競争製品の発売は減少しており、将来的に製品に受け取る価格と私たちの製品の販売量を大幅に下げることができるかもしれません。これは私たちの収入にマイナスの影響を与えます。例えば,2020年には複数のTecfideraが模倣薬を米国市場に進出させているため,Tecfideraへの需要と価格が大幅に低下している。また、ある市場では、私たちの製品の模造や生物類似バージョンが商業化されると、私たちの製品を自動的に代替し、短時間で私たちの収入を大幅に減少させる可能性がある。
私たちの競争、維持、そして業務を発展させる能力もまた、様々な要素の悪影響を受ける可能性がある
•私たちの製品と私たちの協力者の製品を含む、私たちの製品のより効果的で、より安全で、より安い、またはより便利な代替品である可能性のある製品を含む他の製品を発売します
•医師がラベル外で使用する治療法は、患者を治療する他の場合に適している
•患者集団の大きさと、新しい患者および既存の患者が私たちの治療法を使用する能力を識別、吸引、維持することを含む患者動態
•医者は処方箋を発行したくなく、患者は私たちの製品を使用したくなくて、このような製品の有効性と安全性に関する追加データはありません
•医師および患者は、私たちの製品、私たちの製品の模倣薬、または私たちの製品と同レベルの任意の他の製品に対する信頼が損なわれたり、ラベルの変更、定価と精算決定、または私たちの製品または模倣薬または生体模倣薬を使用して治療した患者が発生する可能性のある不良な経験または事件によって、私たちの販売と名声を損なう;
•主要な国際市場の競争相手と比較して、私たちの製品は適切な価格設定と十分な補償を得ることができません
•私たちは私たちの製品の特許、データ、または市場独占性を獲得して維持することができる。
もし私たちが私たちの戦略と成長計画の期待的な利益を実行または達成できなければ、私たちの業務は不利な影響を受けるかもしれない。
我々の戦略および成長計画の成功的な実施は、製品、技術および会社の買収および内部許可、または戦略連合と協力に参加することができる内部開発プロジェクト、商業計画、および外部機会に依存する可能性がある
私たちは多くの有望なプロジェクトが準備されていると信じていますが、内部開発プロジェクトの失敗や遅延、あるいは私たちのビジネス計画を実行する上での困難は、私たちの現在と未来の成長に影響を与え、外部開発機会への追加的な依存を招く可能性があります
私たちの既存製品と準備中の潜在的な新製品のさらなる開発を支援するには、当社の業務の研究開発、販売、マーケティング、製造能力、および他の分野への投資を含む大量の資本支出と管理資源が必要となります。規制当局の承認前に、潜在的な新製品の重大な運営や資本支出を継続している可能性があるが、このような投資が回収される保証はなく、私たちの財務状況、業務、運営に悪影響を及ぼす可能性がある。
高品質でかなり価値のある外部製品開発の可獲得性は限られており,これらの製品を獲得する機会は強い競争性を持っている。したがって、適切な買収者を見つけることができるかどうか、あるいは合意できるかどうかを確認することはできません。
私たちは、規制または他の承認を得ることができなかったこと、紛争や訴訟を含む、多くの理由で取引を開始または完了できなかったかもしれない。さらに、私たちは取引から予想されるすべての戦略と財務的収益を得ることができないかもしれないし、収益が延期されたり、根本的に起こらないかもしれない。私たちはまた、完了した取引において追加のコストまたは負債に直面する可能性があり、これらのコストまたは負債は完了前に考慮されていない。
取引の実行、資産の買収、または業務の統合、または予想される相乗効果を達成する任意の失敗は、成長減速、コストが予想よりも高いこと、資産減価費用を記録すること、および私たちの業務、財務状態、および運営結果に悪影響を及ぼす可能性のある他の行動をもたらす可能性がある。
私たちの製品の販売は第三者支払者の十分なカバー範囲、定価、補償に大きく依存しており、これらの支払者は政治、社会、競争、その他の源からますます大きな圧力に直面している。私たちは十分な保険を得て維持したり、定価を下げたり、精算したりすることができず、私たちの業務、名声、収入、運営結果に悪影響を及ぼす可能性があります。
私たちの製品の販売は十分な保証範囲、定価と第三者支払者の精算に大きく依存しています。新しい医薬製品が承認された場合、製品の政府および個人補償の利用可能性は不確定である可能性があり、製品の定価および補償金額も不確定である
私たちの製品の定価と精算は様々な要素の悪影響を受ける可能性があります
•連邦、州、または外国政府法規または個人第三者支払人補償政策の変更と実施
•雇用主は個人健康保険計画に圧力をかけ、コストを削減することを要求する
•支払者が価格割引またはリベートを求める能動性を強化し、向上させ、場合によっては、特定の薬剤の取得またはカバー、または知覚価値に基づいて決定される定価に制限を加えるために、私たちの製品を彼らの処方に置く
•私たちの製品が補償を受ける能力、または競争製品に相当する補償を得る能力;
•私たちの価値に基づく契約計画は、この計画に基づいて、私たちの製品の価格をその臨床的価値にリンクさせることを目標としています。方法は、患者の結果に基づいて価格を調整するか、あるいは任意の原因(治療効果や耐性の問題を含む)で治療を停止した患者のために価格を調整することです。
私たちが製品に価格を設定する能力は国によって違いますので、私たちの製品の価格もそうです。各国政府は、値下げ、強制リベート、価値に基づく定価、および基準価格(すなわち、他国の価格を参照し、これらの基準価格を使用して価格を制定する)を含む様々なコスト制御措置を使用して製品コストを制御することができる。私たちの製品を処方する市場では、薬品価格は厳格に審査されている;例えば、アイルランド共和軍には薬品の価格に関するいくつかの規定がある。私たちは世界的に薬品の価格設定や他の医療コストが巨大な政治的、社会的圧力を受け続けると予想している。一部の国の価格は私たちの製品が販売している他の国の価格を参照して制定されています。特定の国で十分な価格を獲得して維持することができないことは、我が国製品の同国での収入を制限するだけでなく、既存および潜在的な新市場で許容可能な価格を得る能力に悪影響を及ぼす可能性があり、市場成長を制限する可能性がある。これは、第三者の国境を越えた貿易のための機会を創出したり、製品を販売または販売しない決定に影響を与えたりして、私たちの地理的拡張計画や収入に悪影響を及ぼす可能性がある。そのほか、一部は新冠肺炎疫病の影響により、ある司法管轄区で、政府衛生機関は遡及と/或いは前向きに著者らの製品の販売率を調整する可能性がある。
現在と未来の競争相手からの競争は、私たちが定価と市場シェアを維持する能力に悪影響を及ぼすかもしれない。私たちの競争相手が販売した新製品は潜在的な価格で私たちの収入が減少するかもしれません
販売量を減らして削減する。また、私たちの製品の模造薬あるいは生物類似バージョン、後続製品、プロドラッグ、あるいは簡略化された規制経路によって許可された製品を発売することは、私たちが製品に受け取る価格と私たちの製品の販売量を著しく下げるかもしれません。
多くの支払者は、より限られた福祉計画設計、より高い患者自己負担または共同保険義務、および商業製造業者自己支払い援助計画を使用する患者に対する制限(自己アキュムレータによる調整または最大化計画を含む)を含む、より大きな処方コストを患者に転嫁する福祉計画改革を継続的に採用する。健康保険業界の重大な統合はいくつかの大手保険会社と薬局福祉マネージャーが薬品メーカーとの定価と使用交渉に更に大きな圧力をかけ、メーカーに必要な割引とリベートを大幅に増加させ、患者の接触と使用を制限した。保険会社、薬局福祉マネージャーと他の支払人とのさらなる統合は、これらの実体の私たちと他の製薬業者との交渉チップを増加させるだろう。上述した追加割引、リベート、カバー範囲、または計画変更、制限、または排除は、影響を受けた製品の販売に重大な悪影響を及ぼす可能性があります。
もし私たちの製品が十分な保証範囲、定価あるいは精算を得られなかった場合、私たちの業務、名声、収入と運営結果に悪影響を及ぼす可能性があります。
私たちは協力者や他の第三者との関係に依存して収入を得ることや、私たちのいくつかの製品や候補製品の開発、規制承認、商業化、マーケティングなどは私たちが完全に制御可能ではありません。
私たちは多くの協力関係と他の第三者関係に依存して収入を得て、私たちのいくつかの製品と候補製品の開発、規制承認、商業化、マーケティングを獲得します。また、私たちの製品と候補製品に関連する規制事務と臨床開発のいくつかの側面を第三者にアウトソーシングします。第三者への依存は私たちを多くのリスクに直面させます
•私たちの協力者や第三者が私たちの計画、製品、または候補製品に投入される資源を制御できないかもしれない
•契約の下では、マイルストーンの実現および支払い、開発または商業費用の支払い、開発技術の所有権、および基本的な合意が私たちに重大な保護を提供できない可能性があり、または協力者または第三者が義務を履行していない場合には効果的に実行できない可能性があるという議論が生じる可能性がある
•私たちの協力者または第三者の利益は常に私たちの利益と一致しているわけではなく、これらの当事者は、私たちの収入に悪影響を及ぼす可能性があり、または私たちの業務、運営結果、または財務状況に悪影響を及ぼす可能性のある税収戦略を取ることができ、規制の承認や私たちと同じ方法または程度で製品をマーケティングすることを求めないかもしれない
•第三者関係は各方面の協力を必要とし、有効な協力ができない場合、製品販売または共同制御下の候補製品の臨床開発または規制承認に悪影響を及ぼす可能性があり、候補製品の研究、開発または商業化の終了を招く可能性があり、または訴訟または仲裁を招く可能性がある
•私たちの協力者または第三者は、税法、法規要件および/または適用される契約義務を含む適用法律を遵守できなかったか、または私たちの製品の基礎となる任意の知的財産権を保護および実行できなかったいかなる責任も、私たちの収入に悪影響を与え、可能な法的訴訟に巻き込まれる可能性があります
•私たちの協力者または第三者のいかなる不当な行為や行為も、民事または刑事調査および金銭および禁止処罰を受け、私たちの財務報告の正確性とタイミングに影響を与え、および/または私たちの業務を展開する能力、私たちの経営業績、および私たちの名声に悪影響を及ぼす可能性があります。
このような危険を考慮して、私たちの現在と未来の協力努力が成功するかどうかにはかなりの不確実性がある。これらの努力が失敗すれば、私たちの製品開発や新製品の商業化が延期される可能性があり、製品収入が低下する可能性があり、および/または、これらの計画の予想される利点を達成できない可能性がある。
私たちの運営結果は現在と未来の潜在的な医療改革の悪影響を受けるかもしれない。
米国では,連邦と州立法機関,衛生機関,第三者支払者は医療コストの抑制に重点を置き続けている。立法と規制提案、医療保険計画(アイルランド共和軍に含まれる計画を含む)を改革する法令、および社会的源からのますます大きな圧力が顕著になる可能性がある
私たちの製品の処方、購入、精算方法に影響を与える。例えば、“患者保護と平価医療法案”(PPACA)の条項は、Medicaid薬品リベート計画の下でメーカーのリベートを増加させ、あるブランドの処方薬メーカーの年会費と税収を増加させ、メーカーにMedicare Part Dに基づいてある外来薬の割引計画に参加することを要求し、公衆衛生サービス法340 B条に基づいて割引を受ける資格のある病院数を拡大することを含む、政府および民間保険会社の医療費の支払い方法を変化させる。このような変化はすでに行われ、私たちの業務に大きな影響を及ぼすことが予想される
私たちはPACAの条項の一部または全部の廃止、大幅な修正、または廃止に努力するために不確実性に直面するかもしれない。現在公布または将来改訂されたPACAが私たちの業務や財務業績に悪影響を与えないことは保証されず、将来の医療改革に関連する連邦や州立法や行政変化が私たちの業務にどのように影響するかを予測することもできません。
処方薬のコストに対する大衆の関心はますます増えており、私たちは世界的に薬品の定価と他の医療コストが引き続き大きな政治的、社会的圧力を受けると予想している。たとえば,米国衆議院の2つの委員会はこれまでADUHELMの承認と価格を調査してきた.また、すでに(アイルランド共和軍の内容を含む)処方薬の価格設定問題を解決する立法提案が続くと予想されている。その中のいくつかの提案は著者らの業務に重大な影響を与える可能性があり、2020年9月に発表された行政命令を含み、この命令はB部分とD部分の薬品に対して“最恵国”モードをテストし、販売率を国際薬品定価指標とリンクさせる。これらの行動及びPPACAと医療保険法の将来に対する不確定性は薬品定価に下振れ圧力をもたらし、著者らの監督管理負担と運営コストを増加させる可能性がある
州予算も巨大な経済圧力に直面しており、新冠肺炎疫病の結果を含み、これは各州が薬品のカバー範囲を制限する或いは支払いのメカニズムを制限することで予算を節約することをますます求めている可能性がある。近年、いくつかの州は薬品価格を制御する立法と投票措置を考慮し、アメリカ以外のコストの低い司法管轄区からの薬品の輸入を許可する法律と、州薬品調達に対して価格制御を実施するための法律を含む。州医療補助計画はますますメーカーに補充リベートの支払いを要求し、補充リベートを支払わない薬物を使用して事前に州計画の許可を得ることを要求している。政府の医療補助費削減努力は,医療補助計画が管理型医療機関への使用を増加させる可能性がある。これは,管理型医療組織がより大部分の人口の処方決定に影響を与え,我々の製品の価格や精算に応じて制限される可能性がある
EUと他のいくつかの国際市場では、政府は低コストで消費者に医療サービスを提供し、薬品価格、患者の資格或いは精算レベルを監督し、政府が援助する医療システムのコストを制御する。多くの国が措置を発表または実施しており、政府支出の全体的なレベルを制限するために、医療コストを低減するために、将来的に新たなまたは追加の措置を実施する可能性がある。これらの措置は国によって異なり、他のほかに、患者の面会の制限、値上げの一時停止、予想と可能なトレーサビリティの値下げとその他の補償、強制的な割引またはリベートの増加、過去の値上げの回復、およびより多くの低コスト国からの薬品の輸入を含む可能性がある。これらの措置は私たちの収入に否定的な影響を与え、私たちの将来の収入と運営結果に悪影響を与え続ける可能性がある。
生物模倣薬の商業化における著者らの成功は生物模倣薬の開発、製造と商業化に固有のリスクと不確定性を受けた。もし私たちがこのような活動で成功しなければ、私たちの業務は不利な影響を受けるかもしれない。
生物類似製品の開発、製造と商業化には専門知識が必要であり、コストは非常に高く、しかも複雑な監督管理を受けなければならない。生物模倣薬の商業化の成功はいくつかのリスクの影響を受けています
•第三者への依存。私たちはパートナーや他の第三者の努力にある程度依存しており、私たちは生物模倣薬製品の開発と製造において、これらのパートナーと第三者の制御が限られているか、あるいはコントロール権がない。これらの第三者が成功的に実行できなかった場合、私たちの生物類似製品開発または生物類似製品の商業化は延期される可能性があり、生物類似製品の収入が低下する可能性があり、および/または、これらの配置の予想される利点を達成できない可能性がある
•規制適合性。生物模倣薬製品のある法域における監督管理と商業経路が絶えず変化と不確定であるため、生物類似製品は監督管理障害或いは遅延に直面する可能性がある
•十分な供給を提供する能力がある。生物模倣薬を生産するのは複雑だ。もし私たちが製造やサプライチェーンの問題に直面したら、私たちは需要を満たすことができないかもしれない。私たちは第三者に依存して生物学的に似た製品を生産しています
費用対効果に適合した方法で、または適用される法規を遵守し、私たちの既存または未来の生物学的類似製品の需要に見合った生産能力を増加させることができないか、または増加したくないかもしれない
•知的財産権と規制の挑戦。生物学的類似製品は、広範な特許許可、特許侵害訴訟、禁止または規制の挑戦に直面する可能性があり、これは、製品の商業発売を阻止したり、それを長年延期したり、金銭的損害、処罰または他の民事制裁を実施し、私たちの名声を損なう可能性がある
•市場と辛抱強い受け入れを得ることができなかった。患者、医師、および/または支払人が生物類似製品を安全かつ有効な製品として受け入れない場合、既存の療法よりも競争力のある価格または他の利点を提供する場合、生物類似製品の市場成功は悪影響を受けるであろう
•競争に挑戦する。バイオ類似製品は、革新者製品と他社から提供される生物類似製品との競争を含む激しい競争に直面しており、これらの製品は、より高い受容度またはより優遇された精算を得る可能性がある。現地の入札手続きは、生物類似製品のある司法管轄区での販売と販売を制限する可能性がある。1つの管轄区域の競争相手の数、承認の時間、およびタイムリーかつ費用効果のある方法で生物類似製品の販売に成功する能力は、このビジネス分野での成功に影響を与える他の要素である可能性がある。
知的財産権に関するリスク
もし私たちが私たちのデータ、知的財産権、そして他の固有の権利の十分な保護を得て維持できなければ、私たちの業務は損なわれるかもしれない
私たちの成功は、私たちの長期生存と成長を含み、私たちの製品および候補製品の商業化に重要ないくつかの規制形態の排他性を含む、特許および他の知的財産権を取得して守る能力にある程度依存する。米国および他の重要市場の特許保護および/または規制排他性は依然として不確定であり、一部はこれらの国の特許庁、裁判所、行政機関、立法者の決定に依存する。私たちは、特定の規制形態の排他性を含む特許や他の知的財産権を取得または保護することができないかもしれないし、または私たちが獲得した保護は、私たちが業務を展開しているすべての国/地域のビジネス利益を保護するのに十分な広さと程度がないかもしれません。これは、私たちに財務、商業または名声の損害をもたらし、あるいは私たちの株価の下落や変動を招く可能性があります。また、このような訴訟の和解は、専営期間や他の保護期間を短縮し、影響を受ける製品の収入を減少させることが多い。
米国を含む多くの市場では,メーカーはイノベーター製品の安全性や有効性データに依存することが許される可能性があり,特許や規制排他性がなくなった後,競合バージョンの製品を販売する前に臨床試験を行う必要はない。この場合、メーカーの要価は大幅に低下することが多く、会社収入の大部分は短時間で減少する可能性がある。さらに、模倣薬および生体模倣薬の製造業者は、私たちの特許または他の知的財産権保護が満了する前に、彼らの製品を発売するか、または発売しようと試みることを選択することができる。
さらに、私たちの製品は第三者が持っている特許や他の知的財産権を侵害していると認定される可能性があります。法的手続き、行政的課題、または他のタイプの手続きは、第三者が主張する我々の製品の製造、使用または販売に関連するいくつかの特許権の有効性、範囲、または未侵害行為を決定するために必要であり、将来的にも必要である可能性がある。法的手続きはまた、第三者と締結された知的財産権許可協定の満了期間および後に要求される権利、義務、および支払いを決定するために必要である可能性がある。そのような手続きは予測できず、しばしば長引くことが多く、費用が高い。このような訴訟の負の結果は、私たちの製品の製造と販売を阻害または阻止し、侵害製品または技術の許可を求めること、または私たちに対する重大な金銭的損失を評価することを要求する可能性があり、これらの損失は、私たちの財務諸表の計算すべき金額を超える可能性がある(ある場合)。権利侵害製品や技術の必要な許可を得られなかったことは私たちの製品の製造や販売を阻止するかもしれません。また、私たちが取得できる任意のライセンスによる支払いは、対象とする製品やサービスから得られる利益を減少させる可能性があります。これらの状況のいずれも、私たちに財務的、商業的、または名声的損害をもたらす可能性があり、または私たちの株価の下落または変動を招く可能性がある。
私たちの製品と候補製品の開発、臨床テスト、規制に関するリスク
成功した臨床前仕事或いは早期臨床試験は後期試験の成功、監督管理部門の承認或いは製品の商業実行可能性を確保できない。
臨床試験における陽性結果は後続や確認性試験で重複しない可能性がある。そのほか、臨床前仕事或いは早期臨床試験の成功は後期或いはそれ以上の規模の臨床試験が成功することを確保しておらず、監督部門の許可を得ることも確保できない。後期臨床試験が成功しても
規制機関は私たちの候補製品の承認を延期または拒否するかもしれない。規制当局は私たちのデータに対する見方に同意しないかもしれないし、追加的な研究を要求し、私たちの試験設計や終点に同意しない、あるいは十分な精算を許可しないかもしれない。規制当局はまた、候補製品を製造するための施設またはプロセス、私たちの用量または送達方法、またはキットを承認しない可能性がある。監督管理当局は予想よりもっと厳しい上場承認を許可する可能性があり、適応を制限して患者群を縮小し、安全モニタリング、教育要求、検証性試験及びリスク評価と緩和戦略を強制的に実施することを含む。このような事件の発生は、巨大なコストおよび支出を招き、私たちの業務、財務状況、および運営結果に悪影響を与え、および/または私たちの株価を下落させたり、一定の変動を経験させたりする可能性がある。
臨床試験と生物製薬製品の開発は長くて複雑な過程である。もし私たちの臨床活動を十分に管理できなければ、私たちの臨床試験や潜在的な規制承認は延期または拒否されるかもしれない。
臨床試験を行うことは複雑で、時間がかかり、高価な過程である。著者らは適時に臨床試験を完成する能力は多くの重要な要素に依存し、方案の設計、監督と機構審査委員会の承認、患者加入率及び現在の良好な臨床実践に対するコンプライアンスを含む。もし私たちまたは私たちの第三者臨床試験プロバイダまたは第三者CROがこれらの臨床活動を成功的に実行できなかった場合、私たちの臨床試験または潜在的な候補製品の規制承認は延期または拒否される可能性がある。
私たちはすでに臨床試験サイトを開設し、私たちの経験の限られた国で患者を募集しています。多くの場合,第三者のサービスを用いてわれわれの臨床試験に関する活動を行い,これらの方に依存して正確に結果を報告する。我々の第三者への依存は,臨床試験の時間,進行,費用,品質を制御する能力に影響する可能性がある。CROは私たちの臨床試験に関連する大部分の活動と報告を担当し、このような試験に関連する費用に悪影響を与え、このようなCROが不良であれば、私たちの多くの試験が影響を受ける可能性がある。私たちは私たちのCROを交換する必要があるかもしれませんが、これは影響を受ける試験遅延や他の方法で規制の承認を得て、私たちの候補製品を商業化する努力に悪影響を及ぼす可能性があります。
不利なセキュリティ事件や私たちの製品の使用と安全警告の制限は、私たちの業務、製品販売、株価に悪影響を及ぼす可能性があります。
私たちの発売製品、私たちの発売製品に関する模造薬あるいは生物類似バージョン、あるいは私たちの製品と同じ種類に属する製品の不良安全事件は私たちの業務にマイナスの影響を与える可能性があります。我々の製品の安全問題が製品責任を招く可能性があることを発見し、追加のラベルまたは安全監視を要求し、市場から製品を撤回し、および/または罰金または刑事罰を科す追加の規制審査および要求を引き起こす可能性がある。不良安全事件はまた、私たちの製品および名声に対する医師、患者、および/または投資家の信頼を損なう可能性がある。その中のどれも私たちの運営結果に悪影響を及ぼすかもしれない
監督機関は定期的な安全更新報告、患者登録、その他の報告要求を通じて、公衆により多くの独立した安全情報を直接提供している。私たちの製品や私たちと似たような製品に関連する不良安全事件と、このような事件に関する公開的な噂は、私たちへのクレームを増加させる可能性があり、また、私たちの製品の販売低下や私たちの株価が一定期間変動する可能性があります。
使用または安全警告の制限は、我々の製品のラベルに含まれる必要がある可能性があり、これは、これらの製品の予想される収入を著しく減少させ、大量の費用および管理時間を必要とする可能性がある。
私たちの運営に関わるリスクは
私たちの技術システムが故障したり破壊されたりすると、私たちに責任を負わせたり、私たちの業務運営を中断させたりする可能性があります。
私たちは私たちの業務を運営するために技術システムとデータにますます依存している。新冠肺炎の流行はすでに私たちが業務のやり方を変えて、それによってこのような依存を悪化させて、アメリカと他の主要市場での私たちの大多数のオフィス従業員のオフィスでの仕事の要求を変えて、私たちの一部の従業員は今混合あるいは全遠隔職場で働いています。したがって、私たちはますます私たちの技術システムに依存して私たちの業務を運営しています。私たちが業務を効率的に管理する能力は、ソフトウェアすなわちサービス(SaaS)、プラットフォームであるサービス(PaaS)、インフラであるサービス(IaaS)を含むクラウド技術を使用することを含む、当社の技術システムおよびデータの安全性、信頼性、十分性に依存しています。当社の技術システムまたは当社のビジネスパートナーの技術システム(当社のクラウド技術を含む)の障害、侵入、腐敗、破壊および/または破壊、および/または私たちのデータおよび情報への不正アクセスは、私たちの業務運営に負の影響を与え、および/または技術の交換および/または身代金の支払いを要求する責任を私たちに負わせる可能性があります。我々の技術システムは,我々のクラウド技術を含め,数や複雑さを増加させ続け,故障,悪意の侵入,ランダム攻撃が発生した場合に我々の脆弱性を増加させる.データ.データ
プライバシーまたはセキュリティホールはまた、私たち、患者、顧客、または他のビジネスパートナーに属する知的財産権、商業秘密、または個人情報を含む敏感なデータをもたらす可能性があり、許可されていない人または公衆に暴露される可能性がある。
ネットワーク攻撃がサプライヤー、顧客、または会社に影響を与える場合、サプライヤー、サプライヤー、およびサプライチェーンの他の会社を含む、ネットワーク攻撃の頻度、複雑さ、強度が増加しており、発見されにくくなっている。それらはしばしば動機、資源が十分で、熟練と忍耐強い行為者によって実施され、民族国家、組織犯罪集団、“ハッカー活動家”および不注意または悪意のある行動を行う従業員または請負業者を含む。ロシアのウクライナ侵攻に関する不安定さを含む地政学的不安定は、サイバー攻撃を増加させる可能性がある。ネットワーク攻撃は、有害なマルウェアおよびキーレコーダの配備、恐喝ソフトウェア、サービス拒否攻撃、悪意のあるウェブサイト、社会工学および他の手段を使用して、私たちの技術システムおよびデータのセキュリティ、完全性、および利用可能性に影響を与えることを含む。ネットワーク攻撃はまた、製造業、ハードウェア、またはソフトウェアサプライチェーン攻撃を含み、これらの攻撃は、製品または代行製品の製造遅延をもたらす可能性があり、またはデータプライバシーまたはセキュリティホールをもたらす可能性がある。私たちの主要業務パートナーは似たようなリスクに直面しており、彼らのシステムのいかなるセキュリティホールも私たちのセキュリティ態勢に悪影響を及ぼす可能性がある。さらに、クラウド技術をますます使用することは、これらおよび他の運営リスクを増加させ、クラウドまたは他の技術サービスプロバイダが、そのシステムを十分に保護することができず、ネットワーク攻撃を防止することができず、私たちの運営を混乱させ、流用、腐敗、または機密または適切な情報の損失を招く可能性がある。
私たちは、私たちの業務連続性計画を含む当社のシステムおよびインフラを建設し、改善し続けていますが、私たちの努力が私たちのシステムに故障や脆弱性を防ぐ保証はありません。これらの故障や脆弱性は、私たちの業務および運営に悪影響を及ぼす可能性があり、および/またはキーまたは敏感な情報の損失を招き、これは私たちに財務、法律、運営または名声の損害をもたらし、競争優位性や消費者の信頼を失う可能性があります。私たちの責任保険は、セキュリティホール、サイバー攻撃、および他の関連違反に対する私たちのクレームをカバーするのに十分ではないかもしれません。
規制当局は新しいサイバーセキュリティ規制を制定することを考慮している。例えば、米国証券取引委員会は、上場企業のネットワークセキュリティリスク管理、戦略、管理、およびイベント報告に関する開示規則を修正することを提案している。このような提案された規制は私たちの運営方式に影響を及ぼすかもしれない。
規制当局は、プライバシー侵害に対して新たな、より高い罰金を科すことを含む、新たなデータプライバシーとセキュリティ要件を実施している。例えば、EUの“一般データ保護条例”は、個人データ処理に関する規定を確立し、法執行機関を提供し、規定を遵守しない行為に厳しい処罰を加えている。カリフォルニア消費者プライバシー法(CCPA)や他の通過可能な法律のような米国の新しいデータプライバシーおよびセキュリティ法は、同様に個人情報を要求しており、CCPAを遵守しないことは、個人訴訟(特定のデータ漏洩の場合には法律で定義された損害賠償)および法執行の責任を引き起こす可能性がある。これらの現在および将来の法律、政策、業界基準または法的義務を遵守しない、または不正アクセス、個人情報の取得、配布、または移転を招くいかなるセキュリティ事件も、政府の法執行行動、訴訟、罰金、処罰または否定的な宣伝を招く可能性があり、私たちの顧客が私たちへの信頼を失う可能性があり、これは私たちの業務および運営結果に大きな悪影響を及ぼす可能性がある。
製造問題は私たちのコストを大幅に増加させ、私たちの製品の供給を制限し、または私たちの収入を減少させるかもしれない。
私たちの製品の製造過程は複雑で、監督管理が厳しく、多くのリスクに直面しています
•第三者と単一ソース提供者たちの依存リスク。私たちの製品と候補製品の製造プロセスの多くの側面は、VUMERITYを含む第三者サプライヤーと製造業者に依存している。場合によっては、私たちの製品の独特な製造方法のため、私たちは原材料と製造用品の単一供給者に依存します。これらの第三者は独立した実体であり、それ自体の独自の運営や財務リスクの影響を受けており、これらのリスクは私たちのコントロール下にない。これらの第三者は、タイムリーで経済的に効率的な方法で、または適用される法規を遵守してその義務を履行することができない可能性があり、彼らは、私たちの既存または未来の製品の需要に見合った生産能力を増加させることができないか、または増加したくないかもしれない。サービスの専門性およびサプライヤーや製造方法のいかなる重大な変更も規制部門の承認を得る必要があるため、代替サプライヤーを探すには多くの時間がかかり、多くの費用がかかる可能性がある。私たちは代替サプライヤーと合意できるかどうかを確認することもできませんし、FDAや他の規制機関が私たちがこのような代替製品の使用を許可するかどうかも確認できません。そのほか、新冠肺炎の疫病、天気事件、労働力或いは原材料不足などのサプライチェーンの中断などの要素は私たちの製品製造の困難と遅延を招く可能性があり、これは私たちの運営業績に不利な影響を与えたり、製品不足を招く可能性がある。
•世界の大口商品供給リスク私たちの巨大分子製品と候補製品は私たちの製造施設に依存して薬物物質を生産する。私たちのこれらの製品と候補製品の全世界的な大量供給は、これらの施設の絶え間ないかつ効率的な運行に依存しており、これらの施設は設備故障、労働力或いは原材料不足、公衆衛生流行病、自然災害、電力故障、ネットワーク攻撃、および多くの他の要素の悪影響を受ける可能性がある。
•現行のGMP(CGMP)の遵守に関するリスク。私たちと私たちの第三者サプライヤーは、通常、cGMPおよび他の厳格な要求を遵守し、FDAおよび他の規制機関の検査を受けて、コンプライアンスを確認することを要求されます。私たちの施設や業務または第三者が規制機関の承認を得られなかったため、または任意の規制機関の検査によって、私たちの製品の製造、充填、包装、または保存中に発生した任意の遅延、中断、または他の問題は、私たちの製品開発および商業化能力を深刻に損なう可能性があります。規定を深刻に遵守しないことはまた、罰金や他の民事または刑事制裁の適用を招き、私たちの名声を損なう可能性がある。
•製品損失リスク。汚染、酸化、設備故障或いは設備の設置或いは操作が不適切、サプライヤー或いはオペレータのミスのため、私たちの製品の製造過程は製品損失の影響を受けやすい。正常製造プロセスとの微小な偏差でも生産量の低下、製品欠陥、その他の供給中断を招く可能性がある。もし私たちの製品や製造施設で微生物、ウイルス、あるいは他の汚染物質が発見されたら、汚染物質を調査して修復するために、私たちの製造施設を長時間閉鎖する必要があるかもしれない。
私たちの製造業務または第三者サプライヤーおよび製造業者の運営に影響を与える不利な発展は、出荷遅延、在庫不足、ロット故障、製品撤回またはリコール、または当社製品の商業供給の他の中断をもたらす可能性があります。また、在庫を解約し、規格に適合しない製品のために他の費用や支出を招き、コストの高い救済努力を行ったり、より高価な製造代替案を求めたりしなければならない可能性もある。このような発展は私たちの製造コストを増加させ、患者と医師が競争の治療法に転換し、私たちの収益力を低下させたり、私たちの名声を損なったりするため、収入や市場シェアを失う可能性がある
また,製造中断や遅延の可能性を低減し,破壊的なイベントの深刻性を低下させるための業務連続性計画があるにもかかわらず,これらの計画が十分である保証はなく,我々の業務や運営に悪影響を与える可能性がある.
経営陣や他の人事異動は私たちの運営を乱す可能性があり、経営陣や他の会社を離れる可能性のある人員のために速やかに人員を引き留めたり、合格した後継者を引き付けたりすることは困難かもしれません。
経営陣、他の人員、および私たちの全体的な留職率の変化は、私たちの業務を混乱させる可能性があり、どのような混乱も、私たちの運営、計画、成長、財務状況、または運営結果に悪影響を及ぼす可能性があります。新しい経営陣メンバーは、私たちの業務の計画や機会について異なる見方を持つかもしれませんが、これは、私たちが新しい機会に集中したり、既存の計画を減らしたり、変更したりすることにつながる可能性があります。
私たちの成功は私たちが競争の激しい環境の中で合格した経営陣や他の人員を引きつけて維持できるかどうかにかかっている。合格した人材の需要量は非常に大きく、私たちは巨大なコストを発生させて彼らを引きつけたり維持したりするかもしれない。私たちは人材を誘致と維持する困難に直面する可能性があり、原因は非常に多く、管理層の変動、1つ以上のマーケティング或いは後期プロジェクトの表現が良くない或いは生産停止、競争相手の採用或いは全体の労働市場の変化を含む。また、私たちの組織構造や弾力的な仕事の手配の変化は、従業員の生産力と士気、そして私たちが従業員を吸引、維持、激励する能力に影響する可能性がある。私たちは私たちの業務に必要な人員を雇用または保留できることを保証することができず、いかなる人員の流失が私たちの財務状況や業務結果に実質的な影響を与えないことを保証することはできない。
医療業界に影響を与える広範な法律や規制要件を遵守しなければ、より高いコスト、罰金、業務損失に直面する可能性がある。
私たちの活動および私たちの協力者、流通業者、および他の第三者プロバイダの活動は、米国および他の司法管轄区域で広範な政府規制および監督を受けており、変化および変化する解釈の影響を受ける可能性があり、これは、コンプライアンスに関連する巨額のコストを発生させるか、または私たちの1つまたは複数のビジネス実践を変更することを要求するかもしれない。FDAと類似の外国機関は著者らの多くの最も重要な業務活動を直接監督し、臨床前と臨床研究、製品製造、広告と販売促進、製品流通、不良事件報告、製品リスク管理及び良好な実践品質ガイドラインと法規の遵守を含む。私たちは医師や他の健康人との交流を
製品の販売や使用における詐欺や乱用を防止し、ヘルスケア会社のマーケティング実践に大きな制限を加えることを目的とした、わが製品を開発または購入した介護提供者も政府の規制を受けている。ヘルスケア会社は、医療提供者との関係のより厳しい審査に直面しており、不正確な価格設定情報の提出、許可されていない薬品ラベル外販売促進、医療業務の推奨に影響を与えるための支払い、虚偽の政府精算申請の提出、独占禁止規定の違反、または環境問題に関する違反を含む、政府の規制違反を告発する訴訟と調査の目標となってきている。また、保険料や共同支払援助計画、このような援助を提供する第三者慈善団体への寄付など、会社が後援する患者援助計画の審査を強化した。アメリカ政府は患者の助けを提供する第三者慈善団体へのいくつかの寄付に疑問を提起した。もし私たちまたは私たちのサプライヤーや寄付受給者がこれらのプロジェクトの運営中に関連する法律、法規、または政府の指導を遵守していないことが発見された場合、私たちは巨額の罰金や処罰を受けるかもしれない。私たちが引き続き私たちのグローバル業務を拡大し、異なる患者集団を有する新しい治療分野に入るにつれて、法律法規の遵守に関連するリスクが増加する可能性があり、これらの分野の製品流通方法、マーケティング計画、または患者援助計画は、私たちが現在使用しているか、あるいは支持しているのとは異なる可能性がある
保健業界を管理する条件と条例は変化する可能性があり、追跡力がある可能性がある
•新しい法律、条例または司法裁決、または既存の法律、条例または司法裁決の新しい解釈、衛生保健の獲得可能性、定価またはマーケティング慣行の遵守、雇用慣行の遵守、交付方法、保健製品とサービスの支払い、衛生情報とデータプライバシーおよび安全法律法規の遵守、医師および教育病院に支払われたお金およびその他の価値の追跡と報告、広範な反賄賂および反腐敗禁止、製品シリーズ化とラベル要求、および中古製品回収要求;
•FDAと外国の監督管理承認の流れや視点の変化は、新製品の承認を延期または阻止し、市場機会を失う可能性がある
•政府の閉鎖または移転は、新薬候補薬の審査および/または承認に要する時間を遅らせるために、審査および承認過程の遅延を招く可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある
•EMAの臨床透明性政策のような臨床試験結果および品質データの透明性を向上させる要求を規定することは、承認申請に含まれる商業秘密および競争敏感な情報を保護する能力に影響を与える可能性があり、または私たちの業務を損なうために名声損害、誤解、または法的行動をもたらす可能性があると誤解される可能性がある
•FDAおよび外国法規の変化は、追加のセキュリティ監視、ラベルの変化、製品の流通または使用の制限、または当社の製品が発売された後の他の措置を必要とする可能性があり、これは、私たちの業務コストを増加させ、承認された製品の将来の許可用途に悪影響を及ぼすか、または他の方法で私たちの製品の市場に悪影響を及ぼす可能性があります。
政府の規定に違反した行為は、罰金や民事罰金、連邦医療保険や医療補助などの政府計画から除外され、我々の業務を担当する幹部を罰するなど、刑事や民事制裁を受ける可能性がある。もし私たちが政府に提出した価格情報を誤って計算したことが発見された場合、私たちはまた政府支払人から受け取った金額の返済、あるいは追加のリベートと利息の支払いを要求されるかもしれない。また,法的手続きや調査は本質的に予測不可能であり,多額の判決や和解が生じる場合がある.私たちは私たちが運営している司法管轄区域の法律または法規を遵守するための適切なコンプライアンス制御、政策、手続きがあると信じているが、私たちの従業員、代理店、流通業者、協力者、または第三者プロバイダの行動はこのような法律や法規に違反するかもしれない。私たちが法律を遵守しているかどうかにかかわらず、告発された不正行為に関する調査や訴訟は、私たちの費用を増加させ、私たちの名声を損ない、管理時間と注意を移し、私たちの業務に悪影響を及ぼす可能性がある。
私たちの販売と経営は国際業務リスクの影響を受けています。
私たちは国際市場での私たちの影響力を増加させており、これは私たちの業務や収入に悪影響を及ぼす可能性がある多くのリスクに直面している。国際市場での私たちの販売拡大の努力と戦略が必ず成功する保証はありません。新興市場国は特に世界と現地の政治、法律、監督管理と金融不安定時期の影響を受けやすい可能性があり、腐敗と詐欺性商業行為の発生率は更に高い可能性がある。全世界の臨床試験以外に、ある国は現地の臨床試験データを薬物登録過程の一部とする必要があるかもしれないが、これは全体の薬物開発と登録のスケジュールを増加させる可能性がある。私たちも要求されるかもしれません
第三者代理または流通業者への依存を増加させ、新興市場で協力または買収した会社が以前使用していた不慣れな運営や手配を増加させる。
私たちの販売と運営は国際業務リスクの影響を受けています
•公衆衛生流行病、例えば新冠肺炎が大流行し、全世界経済と医療保健に与える影響
•あまり有利ではない知的財産権や他の適用法;
•必要な外国の規制機関の製品に対する承認をタイムリーに得ることができない
•私たちは、政府または規制要件による値上げを含む、製品の価格設定、精算または値上げを受ける能力の制限と追加的な圧力を獲得し、維持している
•インフレやサプライチェーンの中断などにより、商品コストが増加した
•国際製造の追加的な複雑さ
•ロシアのウクライナ侵攻に関連する地政学的不安定な臨床試験の遅延
•私たちの経験の限られた国では後続や確認臨床試験を成功させることはできません
•支払いと返済周期が長いこと、売掛金が回収できるかどうかの不確実性
•私たちの収入、純収入、いくつかの投資価値に悪影響を及ぼす可能性のある外貨為替レートの変動
•政府の規制を実施する
•多様なデータプライバシーと保護要件
•外国の法律法規を遵守する基準はますます複雑になり、これらの基準は国によって異なり、相応するアメリカの法律法規と衝突する可能性がある
•イギリスの“2010年反賄賂法”や他の場所、これらの法律による調査と起訴を含む、イギリスの影響の深い反賄賂と反腐敗立法
•複雑な輸出入規制法を遵守する
•税法を改正する
•関税や禁輸と他の貿易制限を徴収する。
しかも、私たちの国際業務はアメリカの法律によって規制されている。例えば、米国反海外腐敗法(FCPA)は、業務を取得または保留すること、または他の方法で優遇待遇を得ること、または公的身分で働く人に影響を与えることを目的として、米国企業およびその代表が、任意の外国政府職員、政府職員、政党または政治候補者に支払いを提出し、支払いを承諾し、支払いまたは許可して任意の価値のあるものを支払うことを禁止する。多くの国では、私たちがよく接する医療専門家は、“海外腐敗防止法”の外国政府関係者の定義に適合しているかもしれない。国内または海外の法律を遵守しないことは、承認製品の承認を遅延または拒否する可能性があり、リコール、差し押さえまたは市場から承認を撤回する可能性のある製品、製品の供給を中断すること、または輸出または輸入特権を一時停止すること、民事または刑事制裁を実施すること、私たちの国際業務を担当する幹部を起訴すること、および私たちの名声を損なうことを含む様々な不利な結果をもたらす可能性がある。私たちがアメリカ以外で製品を販売する能力はどんな重大な損害を受けても、私たちの業務と財務業績に悪影響を及ぼす可能性があります。また,適切なコンプライアンス制御,政策,プログラムが“海外腐敗防止法”を遵守していると考えられるが,我々の従業員,代理店,流通業者,協力者や第三者プロバイダの行為は“反海外腐敗法”に違反するリスクがあり,責任を問われる可能性がある。もし私たちの従業員、代理店、流通業者、協力者、あるいは第三者サプライヤーがこのような行為に従事していることが発見された場合、私たちは厳しい罰を受け、他の責任を負う可能性があり、これは私たちの業務、経営業績、財務状況にマイナスの影響を与える可能性がある。
私たちは大規模なバイオ製品製造施設を建設しており、これは大量の投資を招くが、これらの投資が回収される保証はない。
私たちの将来の成長と薬物開発パイプラインを支援するために、スイスのソローザンヌに大型生物製剤製造施設を設立することで、私たちの巨大分子生産能力を拡大していますが、追加の生産能力やこの投資が回収されるかどうかは保証できません。
もし私たちが私たちの製造施設を十分に利用できなければ、私たちの業務は損害を受けるかもしれない。生産能力過剰による費用は引き続き発生する可能性があり、私たちの財務状況や運営業績にマイナス影響を与えるだろう。
Solothurn工場はFDAによってADUHELMやLEQEMBIの使用が許可されているにもかかわらず,規制機関がSolothurn工場を他の製品の製造に承認する保証はない。
持続的な新冠肺炎疫病とその他の全世界衛生疫病は直接或いは間接的に著者らの業務、運営結果と財務状況に不利な影響を与える可能性がある。
私たちの業務はすでに持続的な新冠肺炎の大流行と他の全世界の衛生疫病の悪影響を受け続ける可能性がある。
私たちは引き続き私たちの業務と適用された政府提案を監視し、新しい冠肺炎の疫病と他の世界的な衛生疫病のために、旅行の制限と柔軟な仕事の手配を含む私たちの正常な業務を調整しました。新冠肺炎の大流行と他の全世界衛生疫病の爆発により、医療保健環境中の顧客向けの専門家の相互作用は変化した。これは私たちの製品マーケティングや教育医の能力を制限し、これは逆に製品マーケティングや販売における私たちの競争能力に悪影響を及ぼす可能性がある。
フレックスタイムスケジュールの変化は従業員の留任、従業員の生産力と士気に影響を与え、私たちの技術資源に圧力を与え、運営リスクをもたらす可能性がある。さらに、遠隔作業環境に移行することが増えているため、遠隔作業環境はそれほど安全ではない可能性があり、ハッカー攻撃を受けやすいため、ネットワーク攻撃や他のプライバシーやデータセキュリティイベントのリスクが増加する可能性がある。
新冠肺炎の大流行と他の全世界の衛生疫病は私たちと私たちが依存している第三者労働力の健康と可用性に影響を与えるかもしれない。また、我々の協力者あるいは他の第三者が新冠肺炎の大流行と他の全世界の衛生疫病によって経験した遅延と中断はこのような各方面の義務を履行する能力に不利な影響を与える可能性があり、これは製品販売或いは連合制御下の候補製品の臨床開発或いは監督許可に影響を与える可能性がある。
著者らは現有の臨床試験を継続し、或いは新しい臨床試験を開始する能力はすでにすでに新冠肺炎の大流行とその他の全世界の衛生暴発の不利な影響を受け続ける可能性がある。臨床材料の旅行と/或いは輸送の制限及び病院スタッフと資源が新冠肺炎感染患者に移転されることは試験運行と募集を混乱させる可能性があり、登録の減速及び/或いは偏差或いは臨床試験場所のモニタリングなどの重要な臨床試験活動を中断する可能性がある。このような挑戦は議定書によって規定された手続きを満たすことが困難になる可能性がある。著者らは臨床試験の操作に対していくつかの調整を行い、新冠肺炎の大流行と他の全世界衛生疫病期間中の試験データの完全性が直面するリスクを最小限に下げるために努力する必要があるかもしれない。また、新冠肺炎の大流行とその他の全世界衛生疫病がアメリカ食品と薬物管理局と他の衛生当局の業務に与える影響は私たちの候補製品の潜在的な承認を延期する可能性がある。
過去に州と連邦医療改革措置が取られ、将来的にも採用される可能性があり、いずれも連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの製品に対する需要の減少や追加の価格設定圧力を招き、私たちの業務に予測できない財務的影響を与える可能性がある。
現在、新冠肺炎の大流行とその他の全世界衛生疫病が引き続き著者らの業務に与える全体的な影響を推定することはまだ不可能であるが、大流行がすべての業務活動に与える広範な影響は私たちの業務、サプライチェーンと流通システム、運営業績と財務状況に実質的な不利な影響を与える可能性がある。
第三者が偽または不適切なバージョンの私たちの製品または盗まれた製品を不法に流通および販売することは、私たちの名声および業務に悪影響を及ぼす可能性がある。
第三者は、私たちの厳格な製造、流通、テスト基準に適合していない偽物を不法に流通し、販売しているか、または私たちの製品のバージョンに適していない可能性があります。偽または不適切な薬物を受け入れた患者は一連の危険な健康結果に直面する可能性がある。私たちの名声と業務は私たちのブランドで販売されている偽物や不適切な薬品によって損害を受けるかもしれません。倉庫、工場、あるいは輸送の途中で盗まれた在庫は、その後不適切に貯蔵され、許可されていないルートで販売され、患者の安全、私たちの名声、そして私たちの業務に悪影響を及ぼす可能性がある。
ソーシャルメディアプラットフォームの使用はますます多くなり、新たなリスクと挑戦をもたらしている。
ソーシャルメディアは私たちの製品と私たちの治療法が治療を目的とした病気を交流するためにますます使用されている。生物製薬業界のソーシャルメディア実践は発展し続けており、このような使用に関連する法規は常に明確ではなく、不確実性と法規不遵守のリスクをもたらしている
私たちの業務に適用されます。例えば、患者は、ソーシャルメディアチャネルを使用して、製品の有効性をレビューしたり、いわゆる有害事象を報告したりすることができる。このような開示が発生した場合、適用される有害事象報告義務を監視し、遵守できないリスクがあり、あるいは製品に対する私たちの発言が制限されているため、ソーシャルメディアによる政治的および市場的圧力に直面して、私たちは会社や公衆の合法的な利益を守ることができないかもしれない。さらに、敏感な情報を不適切に開示したり、ソーシャルメディア上で私たちの否定的または不正確な投稿またはコメントを投稿したりするリスクもある。私たちはまた、私たちの会社、経営陣、候補製品、または製品に関する批判にソーシャルメディアで出会うかもしれない。ソーシャルメディアの直接的さは、事実でも観点でも、ソーシャルメディアを介して投稿された私たちに関する投稿をリアルタイムで制御することができない。否定的な宣伝やソーシャルメディアプラットフォームや同様のメディアで私たちに関する不良情報を投稿することは私たちの名声を損なう可能性があり、私たちはこれらの情報を逆転できないかもしれない。もしこのような事件が発生したり、私たちが適用された法規を遵守できなかった場合、私たちは責任を招き、制限的な規制行動に直面したり、私たちの業務に他の損害を与える可能性があります。
私たちの普通株保有に関わるリスクは
私たちの経営業績は大きな変動の影響を受けます。
私たちの四半期収入、費用、純収益(赤字)は過去に変動してきましたが、これらのリスクに記載されているリスクにより、将来は大幅に変動する可能性がありますリスク要因私たちが負担するかもしれない費用と費用の時間。記録されているか記録する必要があるかもしれない費用は
•私たちの業務を再編または他の簡素化し、資源を再分配する計画のコスト
•進行中の研究開発(IPR&D)および他の無形資産を含む投資、固定資産、および長期資産の減価;
•品質規格不合格の在庫減記、過剰または時代遅れの在庫の経常費用および製品の一時停止、期限切れまたはリコールに関する在庫減記費用;
•価格や株式投資の公正な価値変動がある
•不良債権支出と増加した不良債権準備金
•訴訟およびその他の法律または行政訴訟、規制事項および税務事項の結果
•許可および協力協定に基づいて、買収、資産剥離およびその他の業務発展活動に関連する金を支払う
•いくつかの契約を履行できなかった
•新冠肺炎などの公衆衛生流行病が従業員、全世界経済と医療保健に与える影響。
私たちの業務の世界的なため、私たちの収入やいくつかの資産と負債も外貨為替レートの変動の影響を受けます。為替レート変動の影響を緩和するための私たちの努力は成功しないかもしれない。したがって、私たちの報告通貨、ドルと私たちが業務を展開している他の通貨との間の通貨変動は予測できない方法で私たちの経営業績に影響を与えるだろう。私たちの純収入も私たちが要求される可能性のある外貨ヘッジ取引費用の影響で変動する可能性があります。特に、対沖関係を早期に終了することにより、予想以上の費用が発生する可能性がある。
私たちのどの時期の経営業績も必ずしも未来の予想結果を示すとは限りません。
私たちの不動産への投資は完全に現れていないかもしれない。
私たちは不動産を所有したり賃貸したりして、主に研究実験室、オフィス空間、製造業務を含む建物から構成されています。私たちは、私たちの業務運営のいくつかの側面を合併または合併することを決定するか、または私たちの1つ以上の物件を処分することができます。その中のいくつかは、空き家率が高く、物件価値が低下している市場に位置する可能性があります。もし私たちが所有しているすべての物件の公正価値がその帳簿価値よりも低いと判断した場合、これらの物件へのすべての投資を実現できず、ある資産の期待使用寿命が予想施設閉鎖によって短縮された場合に重大な減価費用または追加減価償却が生じる可能性があります。もし私たちがすべて或いは一部の物件を空けることを決定すれば、施設閉鎖コスト、従業員の離職と保留費用、賃貸停止費、転貸収入を超える賃貸料支出、賃貸改善減価と資産加速減価償却などの重大なコストが発生する可能性があります。このような事件のいずれも私たちの運営結果に悪影響を及ぼす可能性がある。
私たちのポートフォリオは市場、利息、信用リスクの影響を受け、これらのリスクはその価値を低下させる可能性がある。
私たちは、私たちの現金に投資するための有価証券ポートフォリオと、いくつかのバイオテクノロジー会社に投資する株式証券を持っています。私たちのポートフォリオ価値の変化は
私たちの収入に影響を与える。私たちの投資価値は、金利上昇、私たちのポートフォリオにおける債券と他の証券格付けの引き下げ、特定の会社のマイナス情報、バイオテクノロジー市場の感情、世界金融市場の不安定さが、私たちのポートフォリオにおける証券の流動性を低下させ、私たちのポートフォリオにおける証券の担保価値の低下、その他の要因を含む、私たちの投資価値が低下する可能性がある。これらのすべての事件は、私たちのポートフォリオの帳簿価値を下げるために、あるいは私たちの買収コストよりも低い価格で投資を売却するために、私たちの記録費用を招く可能性がある。投資を分散させ、ポートフォリオ全体のリスク状況を継続的に監視することでこれらのリスクを低減しようとしているにもかかわらず、私たちの投資価値は低下する可能性がある。
私たちが株を買い続ける保証もないし、お得な価格で株を買い戻す保証もありません。
私たちの取締役会は時々株式買い戻し計画を承認する。株式買い戻しの金額と時間は資本供給状況に依存し、株式買い戻しが私たちの株主の最適な利益に合致し、すべての関連法律と私たちが適用する合意に適合していることを決定します。他の要素を除いて、私たちの株を買い戻す能力は、私たちの現金残高と戦略取引の潜在的な未来の資本需要、私たちの経営業績、私たちの財務状況、私たちが関連すると思う他の私たちのコントロール範囲を超えている要素に依存するだろう。また、最近公布されたアイルランド共和法には株式買い戻しに消費税を課すことが含まれており、株式買い戻しのコストを増加させる。私たちの株式買い戻し計画によると買い戻しを減らしたり買い戻しを完了したりすることは私たちの株価にマイナス影響を与える可能性があります。もし本当に買い戻したら、私たちが割引価格で株を買い戻す保証はありません。
私たちは私たちに有利な条項で資本と信用市場に入ることができないかもしれない。
私たちは、運営資本、資本支出、債務超過要求、その他の業務活動のために、私たちの既存の資金と運営によって生成された現金を補充するために、資本と信用市場への参入を求めることができるかもしれない。資本と信用市場は経験しており、過去にも極端な変動と破壊を経験しており、これは借り手と投資家に不確実性と流動性の問題をもたらしている。不利な市場条件の下で、私たちは有利な条件で資本や信用市場融資を得ることができないかもしれない。国が認可した信用格付け機関が発表した信用格付けの変化は、我々の融資コストや我々証券の市場価格にも悪影響を及ぼす可能性がある。
私たちの負債は私たちの業務に悪影響を及ぼす可能性があり、私たちが計画したり、業務変化に対応する能力を制限する可能性があります
私たちの債務は、マイルストーンと特許権使用料支払い義務を含む、私たちの重大または負債とともに、私たちの業務に重要な影響を与えるかもしれません。例えば、このような債務は、
•一般的に不利な経済的で工業的な条件下での私たちの脆弱性を増加させる
•私たちの資本市場への参入を制限し、未来により多くの債務を招く能力
•私たちは、業務発展、研究開発、およびM&Aを含む他の目的で利用可能なキャッシュフローを減少させるために、キャッシュフローの大部分を債務返済に使用することを要求している
•業務や私たちの業界の変化を計画したり対応したりする上での柔軟性を制限し、負債の少ない競争相手に比べて不利になるようにします。
私たちのいくつかの協力協定には統制権変更条項が含まれており、第三者が私たちを買収しようとするのを阻止するかもしれない。
私たちのいくつかの協力協定には、買収者が支払いたい潜在的な買収価格を下げるか、株主に有利とみなされる可能性のある買収の試みを阻止する制御権条項の変更が含まれている。制御権が変化すると、いくつかの条項は、私たちに支払われるマイルストーン、利益または特許権使用料の減少をもたらすか、または私たちの協力パートナーに、私たちの協調プロトコルを終了させ、運営制御権を獲得するか、または連携テーマとしての計画を強制的に購入または販売する権利を有する可能性があります。
一般リスク因子
私たちの有効税率は変動していて、私たちが税務管轄区で発生した債務は計算された金額を超えるかもしれない。
世界のバイオ製薬会社として、私たちは多くの国、州、他の司法管轄区で税金を払わなければならない。したがって、私たちの有効税率は、私たちが経営している異なる地域の適用税率(源泉徴収税を含む)の組み合わせから得られます。私たちの財務諸表を作成する際には、このような場所ごとに税金を支払う必要があると予想されます。多くの要素のため、私たちの実際の税率は過去の経験あるいは現在の予想とは違うかもしれません。私たちのを含む
各国の収益性、私たちの税務申告に対する審査·監査結果(2017年の“減税·雇用法案”の影響に関するものを含む)、我々の不確定な税収頭寸価値の調整、税務機関または他の管轄権のある機関の解釈、税務案件の結果、所得税会計の変化、税収法律·法規の変化(アイルランド共和軍に関連する法律·法規を含む)
税務機関との受け入れ可能な手配や、税法の将来の変化などを確保したり維持することができず、納税義務が財務諸表に計上された金額を超えてしまう可能性があります。
経済協力開発機構の“税ベース侵食および利益移転”(BEPS)プロジェクトで提案されるか、またはこれから提案される提案の一部または全部が、我が国の税務当局および経済グループによって実施されれば、実際の税率に悪影響を及ぼす可能性がある。これらの取り組みは、グローバル企業の利益と最低グローバル税率への課税の共通国際原則に重点を置いている。
私たちの業務はコンプライアンスコストと汚染や傷害リスクを含む環境リスクに関するものだ。
私たちの業務と私たちのいくつかの戦略的パートナーの業務は、危険材料、化学品、生物製品、放射性化合物の制御された使用に関する。私たちがこのような材料を処理し、処理するセキュリティプログラムは州、連邦、外国の基準に符合すると信じているが、意外な汚染や傷害のリスクは常に存在する。もし私たちが事故に責任を負うなら、あるいはもし私たちが工場の長時間閉鎖を受けたら、私たちは巨額のコスト、損害、罰金を招くかもしれません。これは私たちの業務を損なうかもしれません。私たちの製品と候補製品の製造はまた政府機関の給水と廃水排出許可を得る必要がある。十分な量の水や廃水の許可を得ることを含めて適切な許可を得ていなければ、多大なコストや生産量の制限を招く可能性があり、これは私たちの業務を損なう可能性がある。しかも、規制機関は新しい環境情報開示規則を制定することを検討している。例えば、米国証券取引委員会は、気候関連開示要求に関する開示規則を修正することを提案する。このような提案された規制は私たちの運営方式に影響を及ぼすかもしれない。
項目1 B。未解決従業員意見
ない。
項目2.財産
以下は、2022年12月31日現在の自社および賃貸物件の概要です。
アメリカです。
マサチューセッツ州
マサチューセッツ州カンブリッジでは、研究実験室と火力発電所を収容した建物を含む約263,000平方フィートの不動産空間を持っています。
さらにマサチューセッツ州で約1,429,000平方フィートをレンタルしました
•マサチューセッツ州ケンブリッジ市に位置する1,072,000平方フィートは、企業本部オフィスおよび他の行政および開発機能および実験室からなり、そのうち289,000平方フィートは、一般的なオフィス空間、実験室および製造施設のために複数の会社によって転貸されている
•マサチューセッツ州ウェストンには三五七,000平方フィートのオフィススペースがあります。その中で174,000平方フィートは私たちのレンタル契約の残り期間内に転貸します。
私たちのマサチューセッツ州賃貸協定は2028年まで異なる日に満了されるだろう。
125ブロードウェイビルの販売後レンタルします
2022年9月、私たちはブロードウェイ125号にある建物とブロックの販売を完成しました。今回の売却では,ビルを同時にレンタルし,レンタル期間は約5.5年であり,2022年12月31日現在我々の総合貸借対照表に記録されている約1.682億ドルの新規賃貸負債と使用権資産を確認した。このビルの売却と即時借戻しは売却·借り戻し処理の資格を持ち、経営的賃貸に分類される。より多くの情報については、アクセスしてください
ブロードウェイ125号の販売とレンタル取引については、お読みください付記11、不動産、建屋及び設備及び付記12、借款私たちの連結財務諸表は本報告書に含まれている。
ビンリー街300番地の借款変更
2022年9月、私たちはマサチューセッツ州ケンブリッジ市ビンニー街300号(ビンニー街300号)にある部分レンタルを部分的に中止し、残りの空間の大部分のレンタル期間を短縮することで合意しました。この協定は、2022年に不動産地を統合することでコストを低減するための私たちの努力によって推進された。ビンリー街300番地のテナント変更に関する情報は、お読みください別注12,賃貸借契約私たちの連結財務諸表は本報告書に含まれている。
ノースカロライナ州
ノースカロライナ州のRTPでは約1040,000平方フィートの不動産面積を持っています
•357,000平方フィートの研究室とオフィススペース
•ASO製造キットおよび行政空間を含む20.6万平方フィートの多機能施設
•17.5万平方フィートの大型バイオ製品生産施設に関連しています
•105,000平方フィートの小型バイオ製品製造工場と関係があります
•8.4万平方フィートの倉庫空間と公共施設
•非腸管充填剤施設に関連する70,000平方フィート;
•43,000平方フィート関連の大型浄化施設。
また、ノースカロライナ州ダラムで約65,000平方フィートの倉庫空間を借りました。私たちのノースカロライナ州賃貸協定は2025年までの違う日に満期になるだろう。
2021年3月、我々は、複数の治療領域にわたる遺伝子治療パイプラインを支援するために、ノースカロライナ州のRTPに新しい遺伝子治療製造工場を設立する計画を発表した。新たな製造施設は約19.7万平方フィートで、2023年末に運営を開始する予定で、総投資は約1.95億ドルと予想されている。この新施設の建設は2021年第4四半期に始まった。
国際的に
スイス
私たちの将来の成長と薬物開発パイプラインを支援するために、私たちはスイスのソローザンヌに大規模な生物製品製造施設を建設している。完成後、この施設は大型バイオ製品製造施設に関連する393,000平方フィート、29万平方フィートの倉庫、公共施設、および支持空間、および51,000平方フィートの行政空間を含むことになる。2021年第2四半期、同工場の一部はスイス医療グループが発行したGMP多製品許可証を取得した。SolothurnはADUHELMおよびLEQEMBIの製造にFDAによって許可されている。Solothurn工場の第2の製造キットは2023年末に運営されると予想される。
他の国際組織
私たちはスイスバー、私たちの国際本部、イギリス、ドイツ、フランス、日本、カナダと他の多くの国でオフィススペースを借りています。私たちの国際賃貸協定は2031年まで異なる日に満了されるだろう。
項目3.法的手続き
2022年12月31日までの法律問題に関する議論は、お読みください注21訴訟我々の連結財務諸表は、本報告書に含まれており、参考として本プロジェクトに組み込まれている。
プロジェクト4.鉱山安全開示
適用されません。
第II部
項目5.登録者普通株式市場、関連株主事項、発行者による株式証券の購入
市場と株主情報
我々の普通株はナスダック世界の精選市場で取引され、コードは“BIIB”である。2023年2月14日現在、私たちの普通株には約448人の登録株主がいます。
配当をする
設立以来、私たちは現金配当金を送ったことがない。私たちはこれまで現金配当金を支払う意図もなく、現在も現金配当金を支払う意図はありませんが、現金配当金の支払い、株式買い戻し、買収など、私たちの資本配置戦略を検討し続けています。
発行人が株式証券を購入する
次の表は、2022年第4四半期の普通株式買い戻し活動をまとめています
| | | | | | | | | | | | | | | | | | | | | | | |
| 期間 | 総人数
購入株
(#) | | 平均価格
株で支払う
($) | | 総人数
購入株
公開活動の一部として
発表された計画
(#) | | ドルに近似する値
まだ来ていないかもしれない株
以下の条件で購入する
私たちの番組
(百万ドル) |
| 2022年10月 | — | | | $ | — | | | — | | | $ | 2,050.0 | |
| 2022年11月 | — | | | $ | — | | | — | | | $ | 2,050.0 | |
| 2022年12月 | — | | | $ | — | | | — | | | $ | 2,050.0 | |
合計する(1) | — | | | $ | — | | | | | |
(1) 2022年第4四半期に株の買い戻しはなかった。
2020年10月、我々の取締役会は、50億ドルまでの普通株(2020株買い戻し計画)を買い戻す計画を承認した。私たちの2020年の株式買い戻し計画は満期日がありません。2020年の株式買い戻し計画に基づいて行われるすべての株買い戻しHASE計画は中止される予定だ。2020年の株式買い戻し計画によると、私たちは約2億ドルを買い戻して撤退しました360万、600万株と160万株の普通株で、コストは約7億5千万ドル2022年12月31日と2021年12月31日までの年間はそれぞれ18億ドルと4.0億ドルである2020それぞれ,である.大ざっぱに21億ドル2020年の株式買い戻し計画によると2022年12月31日。
2019年12月、我々の取締役会は、2020年9月30日に完了する50億ドルまでの普通株(2019年12月の株式買い戻し計画)を買い戻す計画を承認した。私たちの2019年12月の株式買い戻し計画によると、買い戻したすべての株が解約されました。我々の2019年12月の株式買い戻し計画によると、2020年12月31日までの年間で、約1670万株の普通株を買い戻し、解約し、コストは約50億ドルとなっている。
2019年3月、我々の取締役会は、2020年3月31日に完成する予定の最大50億ドルの私たちの普通株(2019年3月の株式買い戻し計画)を買い戻す計画を承認した。私たちの2019年3月の株式買い戻し計画によると、買い戻したすべての株が解約されました。我々の2019年3月の株式買い戻し計画によると、2020年12月31日までの年間で、約410万株の普通株を買い戻し、解約し、コストは約13億ドルとなっている。
2022年8月、アイルランド共和軍は法律に署名した。その他を除いて、アイルランド共和軍は2022年12月31日以降の株の純買い戻しに消費税を1.0%徴収している。歴史的に、私たちは自由に選択可能な株の買い戻しを行ったことがある。
[パフォーマンスチャート]
以下の業績グラフは私たちの普通株、ナスダック製薬指数、標準プール500指数とナスダック生物技術指数の5年間の累計株主総リターンを比較した。以下の業績グラフは、2017年12月31日に私たちの普通株式と3つの指数にそれぞれ100.00ドル、配当金を再投資したと仮定しています。
次の図の株価表現は必ずしも未来の株価表現を暗示しているとは限らない.
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2017 | | 2018 | | 2019 | | 2020 | | 2021 | | 2022 |
| 生物遺伝会社 | | $100.00 | | $94.46 | | $93.14 | | $76.86 | | $75.31 | | $86.92 |
| ナスダック医薬指数 | | $100.00 | | $107.95 | | $123.62 | | $136.62 | | $169.94 | | $189.23 |
| 標準プール500指数 | | $100.00 | | $95.62 | | $125.72 | | $148.85 | | $191.58 | | $156.88 |
| ナスダックバイオテクノロジー指数 | | $100.00 | | $91.14 | | $114.02 | | $144.15 | | $144.18 | | $129.59 |
タイトルの下に含まれる情報[パフォーマンスチャート]証券取引法第18条の規定に基づいて、又は同条に規定する責任を他の方法で負うことも、第14 A条の規定に適合する“募集材料”とみなされてはならず、また、1933年“証券法”又は1934年に“証券取引法”に基づいて提出されたいずれの文書における引用内容ともみなされてはならない。
プロジェクト6.保留
プロジェクト7.経営陣の財務状況と経営成果の検討と分析
以下の議論は、本報告F−1ページからの連結財務諸表と付記とともに読まなければならない
2021年12月31日までの年度と2020年12月31日までの年度についての検討については、お読みください第七項。 経営陣の財務状況と経営成果の検討と分析2021年12月31日までの年次報告Form 10−Kに位置している。
実行要約
序言:序言
生物遺伝会社は世界規模の生物製薬会社であり、世界各地の深刻かつ複雑な疾病を有する患者の発見、開発と革新療法の提供に専念している。多発性硬化症を治療する広範な薬剤の組み合わせを有し,最初に承認されたSMA治療法が発売され,アルツハイマー病の決定的な病態を解決するための2つの治療法が共同開発された。私たちは神経学、神経精神医学、専門免疫学、稀な疾患のルートを推進することに集中している。私たちは内部研究開発計画と外部協力を通じて私たちの薬物発見と開発を支援している。
我々が販売している製品は,MSを治療するTecfidera,VUMERITY,Avonex,Pregridy,TysabriおよびFAMPYRA;SMA治療SPINRAZA;アルツハイマー病治療ADUHELM;および重篤な斑塊型乾癬を治療するFUMADERMを含む。我々はまた衛材と協力してアルツハイマー病治療のためのLEQEMBIを商業化し,2023年1月にFDAの加速承認を得た。私たちはいくつかの商業的および財務的権利を持っている:非ホジキンリンパ腫、CLLおよび他の疾患の治療のためのRituxan;非ホジキンリンパ腫およびCLLの治療のためのRituxan HYCELA;CLLおよび濾胞性リンパ腫の治療のためのGazyva;PPMSおよびRMSのためのOCREVUS;LUNSUMIO(Mosunetuzumab)は、2022年第4四半期に米国で加速承認され、再発または難治性濾胞性リンパ腫の治療のための;非ホジキンリンパ腫の潜在的治療のための研究的二重特異性抗体である。我々と羅氏集団の全メンバー遺伝子テークとの協力により,他の潜在的な抗CD 20療法を追加することも選択できる。
MSおよびSMAへの新たな潜在的革新に引き続き投資することに加えて、MDDおよびPPDのためのZuranolone、アルツハイマー病のためのBIIB 080、ALSのためのtofersen、およびいくつかの形態の狼瘡のためのlitifiimabおよびdapirolizumab pegolを含む私たちの中末期計画を進めている。
我々はまた、Benepali、ENBRELを参照するエナジー生物類似体、IMRALDI、HUMIRAを参照するアダリモモノクロナル生物類似体、FLIXABI、インフリキシマブ生物類似体、Remicade、およびBYOOVIZ、Lucentisを参照するranibizumab生物類似体、米国で提案されたBIIB 800、提案されたtocilizumab生物類似参考Actemra、およびSB 15を含む潜在的生物類似製品を開発し続けている、ヨーロッパのある国で先進生物製剤の生物模倣薬を商業化している。2023年2月、私たちは私たちの生物模倣薬業務のための戦略的選択を探索していることを発表した。
私たちの連携スケジュールに関する他の情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
私たちは世界中の患者に絶え間なく薬品を供給することを確保することを求めている。これのために、私たちは私たちの製造能力、能力、技術、そして施設を検討し続けている。私たちの将来の成長と薬物開発パイプラインを支援するために、私たちはスイスのソルスーンに大規模な生物製品製造施設を設立することで、私たちの巨大分子生産能力を拡大している。2021年第2四半期、同工場の一部はスイス医療グループが発行したGMP多製品許可証を取得した。SolothurnはADUHELMおよびLEQEMBIの製造にFDAによって許可されている。Solothurn工場の第2の製造キットは2023年末に運営されると予想される。私たちはSolothurn工場が生物資産製造に対する私たちの期待される最近の需要を支持すると信じている。もし私たちの製造施設を十分に利用できなければ、私たちの製品に対する需要が予想を下回ったため、過剰な生産能力費用が発生し、これは私たちの財務状況と経営業績に負の影響を与えるだろう。
私たちの収入は、私たちの製品の持続的な販売と、私たちが抗CD 20治療計画に持っている財務的権利に依存して、私たちが新製品および技術を開発、獲得する権利、および/またはそれを商業化しない限り、私たちは私たちの製品の販売および私たちの抗CD 20治療計画の財務的権利に大きく依存するだろう。
長期的に言えば、私たちの収入増加は臨床開発の成功、監督管理機関の承認と新商業製品の発売に依存するだろう
これらの要因には,我々の製品および既存製品の他の指示,我々が販売している製品に関連する特許および他の権利を獲得し維持する能力,我々の研究開発努力からの資産および/または外部業務発展機会を成功させる能力が含まれている.
事業環境
当社のビジネス環境の詳細については、ご参照くださいプロジェクト1.業務、本報告に含まれます。製品販売に悪影響を及ぼす可能性のある競争や定価リスクに関するより多くの情報は、お読みください第1 A項。リスク要因は本報告に含まれます。
アドゥヘム(アドゥカヌズマブ)
アメリカです。
FDAは2021年6月にADUHELMの加速承認を承認し,2022年3月までADUHELMを用いて治療した患者に観察されたアミロイドβプラークの減少に基づいて衛材と協力してきた。加速承認の一部として、アルツハイマー病患者におけるADUHELMの臨床的利益を検証するための検証的試験が必要である。検証性試験がADUHELMの臨床的利益を検証できなかった場合,ADUHELMの利益リスクが正でないか,あるいは加速承認の条件を遵守できなかった場合,FDAは承認を撤回する可能性がある。
2022年4月,CMSはADUHELMを含むアルツハイマー病抗アミロイド治療薬の最終NCDを発表した。最終的なNCDはエビデンス開発のカバー範囲を確認しており,このカバー範囲では,連邦医療保険を持つ患者は承認された臨床試験の一部である場合にのみ治療を受けることができる。この決定により,実際にはすべての医療保険受益者がADUHELMを得ることができなくなった。この決定は,将来のADUHELMへの需要を最小限に抑えることが予想される.
2022年第1四半期には,最終的なNCDにより,在庫抹消や調達承諾に関する費用約2.75億ドルを記録し,ADUHELMに関する予測需要を超えた。また,2022年12月31日までの1年間にADUHELMに関する総アイドル容量費用約1.11億ドルを記録した。これらの費用は2022年12月31日までの年度総合損益表に販売コストを計上している。
私たちは約1.97億ドルを確認しました。衛材の45.0%の在庫シェア、遊休生産能力費用と協力利益(損失)共有の契約約束と関係があります
2022年12月31日までの年間総合収益表にあります。
また,最終的なNCDにより,ADUHELMを支援するビジネスインフラを大幅に廃止し,現在米国で治療を受けている患者に無料薬物計画を提供し続けることを含む患者参入計画を管理するための最も少ない資源を保持している。
乗船再調剤研究や第4段階上場後の需要研究enVisionの継続など,ADUHELMの何らかの規制や研究開発活動に資金を提供し続ける予定である。ADUHELMに関する他の行動は,公表されるこのような抗体のデータやFDAやCMSとのさらなる接触から分かる可能性がある。
2022年3月14日,衛材とのADUHELM連携協定を修正した。改正日より,我々は世界でADUHELMの唯一の決定権と商業化権利を持ち,2023年1月1日から衛材はADUHELM純売上高による分級特許権使用料のみを受け取り,ADUHELMのグローバル損益の共有には参加しなくなった。衛材は2022年1月1日から2022年12月31日までの間の開発、商業化、製造費シェアを3.35億ドルに制限し、2022年12月31日までにこの目標を達成した。この限度額に達すると,ADUHELMに関するすべてのコストを負担する.
世界の他の地域
EMAは2020年10月にアドゥカヌマブのMAA審査を受け,2020年12月に厚生労働省(MHLW)が日本のデュカヌマブのNDA審査を受けた。
2021年12月、EMAのCHMPは、ヨーロッパのデュカヌモノ抗MAAに対する否定的な意見を採択した。私たちはCHMPにこの意見を再検討することを要求する。2022年4月、私たちはヨーロッパでアドゥカヌモノクロナルに対する私たちのMAAを撤回することを決定したと発表した。
T@@ ec@@ f@@ id@@ er@@ a
多くのTecfideraの模造薬は今北米、ブラジルとあるEU国家に入って、Tecfideraと比べて、それらの価格は大きな割引があります。Tecfideraに対する後発薬競争は我々のTecfidera収入を大幅に減少させ,Tecfideraの収入は将来的に低下し続けることが予想される。
EUでは、2022年6月に付与されたTecfideraに関連する特許の強制執行を求めており、この特許は2028年に満了する。また、Tecfideraが規制データを得る権利があることを確認するために訴訟を起こしています
市場保護は少なくとも2024年2月まで続く。我々の会社、欧州薬品管理局、欧州委員会はそれぞれ、欧州医薬品局がTecfideraの模倣薬申請を許可しない決定を廃止した欧州一般裁判所2021年5月の裁決を上訴した。その理由は、欧州医薬品局と欧州委員会がTecfideraが規制データとマーケティング保護を受ける権利があると判断した際に誤った評価を行ったからである。当社,環境管理協会,欧州委員会はいずれも一般裁判所の誤った裁決について上訴しており,控訴は審理中である。2022年10月6日、CJEU総検事長はBiogenに有利な拘束力のない諮問意見を発表した。この意見はCJEUが欧州一般裁判所の判決を撤回することを提案した。私たちはCJEUの決定を待っている。
もっと情報を知りたいのですが、お読みください注21、訴訟我々の連結財務諸表は、本報告書と議論の下に含まれています運営実績−製品収入−多発性硬化症(MS)−フマル酸下です。
新冠肺炎とその他の中断した商業更新について
新冠肺炎
新冠肺炎の大流行は引き続き世界各地の公衆衛生と経済に巨大な挑戦をもたらした。新冠肺炎疫病は直接或いは間接的に著者らの業務、運営結果と財務状況(販売、費用、備蓄と手当、サプライチェーン、製造、臨床試験、研究開発コストと従業員関連コストを含む)の持続時間と全面程度は未来の発展に依存し、これらの発展は高度な不確定性、不確定性と不確定性を持っており、しかも予測が困難であり、出現する可能性のある新冠肺炎に関する新しい情報、新冠肺炎の抑制或いは治療のための行動、及び現地、地域、国家と国際顧客と市場への経済影響を含む。
私たちは私たちの製品に対する需要を監視しています。病院が私たちのいくつかの製品を管理して新冠肺炎患者を看護するために必要な資源を移転したことによって、新しい患者が製品の使用を開始する遅延の持続時間と程度を見ることができるかもしれません。例えば、医師室や病院環境で管理されている製品、例えばチサプリドや思普楽を含みます。新冠肺炎の大流行期間中には,免疫抑制療法への需要減少もみられる可能性がある。
現在、世界各地で行われている臨床試験を継続していますが、新冠肺炎の予防措置は、いくつかの臨床試験のスケジュールに影響を与えています
直接または間接的に、未来のタイミングにさらなる影響を与える。
地政学的緊張情勢
ロシアのウクライナ侵攻に関連した持続的な地政学的緊張は、ロシア政府や企業への制裁やその他の制限を含む世界的な商業中断と経済変動を招いた。私たちはロシアでもウクライナにも支店や従業員がいませんが、私たちは確かに流通業者を通じてロシアの患者に様々な療法を提供しており、現在ウクライナとロシアの臨床試験に参加しています。このような裁判の時間と費用は衝突によって影響を受けるかもしれない。また、ロシアへの特定の製造材料の輸出に対する政府の新たな制裁は、新製品の承認を得る能力を延期または制限する可能性がある。
紛争が私たちの業務や財務業績に与える影響は依然として不確定であり、紛争の深刻さと持続時間、地域や世界の経済状況への影響、紛争が蔓延しているかどうか、あるいはウクライナやロシア以外の国に影響を与えるかどうかを含む将来の事態の発展に依存するだろう。2022年12月31日と2021年12月31日までの年度では、これらの地域の販売収入は製品総収入の2.0%未満である。
私たちは、ロシアとウクライナの間の持続的な衝突を引き続き監視し、私たちの業務、サプライチェーン、パートナー、または顧客への任意の潜在的な影響、および私たちの運営結果に悪影響を及ぼす可能性のある任意の要素を評価します。
新冠肺炎疫病とその他の全世界衛生疫病、不利な天気事件、地政学事件、労働力或いは原材料不足とその他のサプライチェーンの中断などの要素は製品不足或いはその他の困難、及び製品製造の遅延或いはコスト増加を招く可能性がある。
新冠肺炎の大流行とウクライナ衝突で構成される様々なリスクに関するより多くの情報をお読みください第1 A項。 リスク要因は本報告に含まれます。
“2022年インフレ率削減法案”
2022年8月、アイルランド共和軍は米国で法律に署名した。アイルランド共和軍は、最低税の15.0%と消費税の1.0%の株式買い戻しを含む新たな税収条項を導入した。アイルランド共和軍の規定は2022年12月31日以降の期間内に有効になるだろう。2022年12月31日現在、アイルランド共和軍の公布は、私たちの所得税の支出や繰延税純資産の重大な調整をもたらしていない。私たちは今後、より多くの指導や法規を発表し、さらなる情報を得た後も、私たちの業務や運営結果への潜在的な影響を評価し続ける予定です。
IRAはまた、CMSがいくつかの高価な単一源Medicare薬物の最高公平価格を交渉することを可能にし、受益者の自己処方薬コストを低減するためにMedicare Part Dを再設計することを含む、米国製薬業に重大な影響を与える可能性のある重大な薬品定価改革を含み、これは計画および製造業者がより高い費用を支払うことをもたらす可能性がある。アイルランド共和軍はまた、メーカーが医療保険で覆われた単一由来薬物と生物製品の価格をインフレ調整後を超える比率に引き上げることを罰するために、薬品インフレ税還付要求を確立した。また,生物類似の発展を奨励するために,アイルランド共和軍は条件に適合した生物類似製品に8.0%の連邦医療保険B部分追加支払いを5年間提供した。
アイルランド共和軍が私たちの業務、運営結果、財務状況に及ぼす全体的な影響と、製薬業全体への影響はまだ不明だ。追加的な資料があれば、私たちは評価を続けるつもりだ。
財務のハイライト
2022年、生物遺伝会社の希釈後の1株当たり収益は20.87ドルで、2021年同期の10.40ドルより100.7%増加した。
以下に述べる経営成果2021年12月31日までの年度と比較して、2022年12月31日までの年度は、私たちの純収益と生物遺伝会社が1株当たりの希薄収益を占めるべきであることを以下のように反映している
収入.収入
•2022年の総収入は101億734億ドルで、2021年の109.817億ドルに比べて8.083億ドル低下し、減少幅は7.4%だった。
•2022年の製品収入純額は79.78億ドルで、2021年の88.469億ドルに比べて8.591億ドル低下し、減少幅は9.7%だった。この減少は主にマイクロソフト製品が6.665億ドル、あるいは10.9%減少したためです
収入、SPINRAZA製品の収入は1.116億ドル低下し、減少幅は5.9%、生物類似業務収入は800万ドル低下し、下げ幅は9.6%であった。
◦MS製品の収入は2021年の60.967億ドルから2022年の54.302億ドルに低下し、6.665億ドル減少し、減少幅は10.9%であり、これは主に北米、ブラジルとあるEU諸国の多数のTecfidera模倣薬進入者によるTecfidera需要の減少、及び患者のより高い治療効果と経口MS療法への移行に伴い、インターフェロン需要は競争によって減少した。
◦SPINRAZAの収入は2021年の19.051億ドルから2022年の17.935億ドルに低下し、1兆116億ドル減少し、減少幅は5.9%であり、これは主に国家構造、外貨両替の悪影響と出荷時間によるものであるが、販売量の増加分によって相殺されている。売上高の伸びはあるアジア市場の成長を反映しているが、一部はある成熟市場(特にドイツと日本)の競争激化による売上高低下によって相殺されている。
◦生物類似業務からの収入は2021年の8.311億ドルから2022年の7.511億ドルに低下し、減少幅は8.0億ドル、減少幅は9.6%であり、これは主に不利な定価と外貨両替の悪影響によるものであるが、販売量の増加分はこの影響を相殺している。
•2022年の抗CD 20治療プロジェクトの収入は合計17.05億ドルであり,2021年の16.585億ドルと比較して4200万ドル増加し,2.5%に増加した。この増加は主にOCREVUSの販売特許使用料収入が1兆446億ドル,あるいは14.6%増加したが,Rituxan収入の1.034億ドル減少,あるいは18.0%部分で相殺されたためである。Rituxanの販売は生物類似競争の悪影響を受けている。
•2022年のその他の収入は合計4.851億ドルで、2021年の4.763億ドルより880万ドル増加し、1.8%増加した。
費用.費用
•2022年の総コストと支出は65.816億ドルで、2021年の92.365億ドルに比べて26.549億ドル減少し、減少幅は28.7%だった。
◦研究開発支出は2021年の25.012億ドルから2022年の22.311億ドルに低下し、減少幅は2.701億ドル、減少幅は10.8%で、主に2021年の前金増加によるものだ。2021年には、InnoCare、Ionis、Bio-Thera、Genentech、Capsigen Inc.,Ginkgo Bioworksとの協力に関連した約2.85億ドルの前金を記録し、2022年の前払いは2850万ドルである。また,2021年にはBIIB 111(チミフェプリストンemparvovec)とBIIB 112(補酵素遺伝子toliparvovec)に関する3910万ドルの推定臨床試験終了コストと製造承諾を記録した。
◦無形資産を買収する償却と減価は2021年の8.813億ドルから2022年の3.659億ドルに減少し、5.154億ドルあるいは58.5%減少し、主に2021年に記録された減価費用の増加によるものである。2021年には6億293億ドルの減価費用を記録したが、2022年の減価費用は1.196億ドルだった。
◦コストと支出の減少も、2022年に確認された私たちの建物1棟の売却に関する5.037億ドルの税引前収益によるものだ。
◦その他(収入)支出、2022年純額反映税前収益は15億ドルSamsung Bioepisにおける49.9%の株式売却に関連しているが、一部は9.00億ドルの税引前費用および和解費用および費用によって相殺され、これは2015年前の行動に関連したQui-tam訴訟を解決するための訴訟和解合意に関連している
以下に述べる財務状況、流動性、資本源:
•2022年、私たちは運営から13.843億ドルの純キャッシュフローを生み出した。
•2022年12月31日現在、現金、現金等価物、有価証券の総額は約55兆985億ドル。
•2020年の株式買い戻し計画によると、2022年に約360万株の普通株を買い戻し、解約し、コストは約7億5千万ドル。2022年12月31日現在、私たちの2020年の株式買い戻し計画によると、まだ約21億ドルが利用可能です。
重要な協力関係の発展
以下で議論する連携関係や他の関係に関する他の情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
防衛協力協定
LEQEMBI(Lecanemab)連携プロトコル
2023年1月、著者らと衛材はFDAがLEQEMBIの承認を加速することを発表し、アルツハイマー病の治療のための抗アミロイド様抗体である。また,2023年1月,我々と衛材はLEQEMBIの従来の承認を得るためにFDAへの補完BLAの提出が完了したことを発表した。
2023年1月、EMAはlecanemabのMAA審査を受けた。
衛材は2023年1月に日本PMDAに提出されたMAAを完成させてlecanemabを行い,日本厚生労働省の優先審査を受けた。
2022年12月、衛材はLecanemabの承認のために中国の国家薬品監督管理局にBLAをスクロール提出した。
2022年3月に衛材とのLEQEMBI関連供給協定を延長し,LEQEMBI薬物物質の生産に5年から10年に延長した。
ADUHELM連携プロトコル
2022年3月14日,衛材とのADUHELM連携協定を修正した。改正日より,我々は世界でADUHELMの唯一の決定権と商業化権利を持ち,2023年1月1日から衛材はADUHELM純売上高による分級特許権使用料のみを受け取り,ADUHELMのグローバル損益の共有には参加しなくなった。衛材は2022年1月1日から2022年12月31日までの間の開発、商業化、製造費シェアを3.35億ドルに制限し、2022年12月31日までにこの目標を達成した。この限度額に達すると,ADUHELMに関するすべてのコストを負担する.
衛材との協力手配に関する他の情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
Zuranolone(BIIB 125)
2022年6月、私たちとパートナーのSageは、MDDおよびPPDの潜在的治療Zuranoloneに対するSkylark 3期研究が主要かつすべての重要な副次的終点に達したと発表した。
2022年12月、私たちおよびSageは、MDDおよびPPDの潜在的治療のためのZuranoloneの承認のためにFDAにスクロール提出されたNDAを完了した。今回の提出は2022年早い時期に開始された機密協定申請を完了した。
FDAは2023年2月にNDAを受け,ズランノドンの優先審査を承認し,PDUFAの行動日は2023年8月5日であった。
Sageとのご協力に関するより多くの情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
遺伝子テーク
LUNSUMIO(Mosunetuzumab)
2022年1月、我々は遺伝子テークとの選択権を行使し、再発または難治性濾胞性リンパ腫を治療する二重特異性抗体であるLUNSUMIO(Mosunetuzumab)の共同開発と商業化に関与した。これに関連して,2021年12月に遺伝子テークに3,000万ドルのオプション権料を支払った。
2022年12月、遺伝子テイクはFDAがLUNSUMIOの加速承認を承認し、欧州委員会も2022年6月にLUNSUMIOを承認したと発表した。
Glofitamab
2022年12月、私たちはGenentechとGlofitamabの商業化と経済学的共有について合意し、GlofitamabはCD 20とCD 3に対する二重特異性抗体を結合し、潜在的なB細胞非ホジキンリンパ腫の治療に使用する研究中のT細胞である。
遺伝子テークとの協力に関するもっと多くの情報をお読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
他の協力関係
エルセロン治療会社は
2022年12月、Alcyoneと許可および協力協定を締結し、患者の治療体験を改善し、筋萎縮性側索硬化症および筋萎縮性側索硬化症のような神経疾患を有する患者の可視性を改善することを目的として、ASO治療を皮下に提供することを目的としたThecaFlex DRxシステムを共同開発した。今回の協力条項によると、私たちは
AlcyoneはThecaFlex DRxシステムを共同開発し,Alcyoneは単独でその製造と商業化を担当する。この取引で、私たちはAlcyoneに1000万ドルを前払いした。
他の主な発展
トフィソン(BIIB 067)
2022年7月,FDAがNDAを受け入れ,tofersenの優先審査を承認したことを発表し,tofersenはSOD 1 ALS患者のための評価中のアンチセンス薬であり,現在のPDUFAの行動日は2023年4月25日である。2022年12月、EMAはトファーソンのMAA審査を受けた。
BIIB 800(Actemra参照)
2022年9月、私たちとパートナーのBio-Theraは、EMAがBIIB 800のMAAの審査を受け、BIIB 800は重症、活動性、および進行性関節リウマチの治療のために提案されたtocilizumab生体類似体であり、抗インターロイキン6受容体モノクロナル抗体Actemraを参照することを発表した。FDAは2022年12月にBIIB 800の略称BLAの審査を受けた。
BIIB 122(DNL 151)
2022年10月私たちは協力パートナーと デナリーはパーキンソン病の潜在的治療のためのBIIB 122の第3段階灯台研究の開始を発表した。
デナリーとの協力に関するより多くの情報をお読みください付記19、連携関係その他の関係本報告に含まれる総合財務諸表まで.
会社の事務
サムスンBioepis-Biogenとサムスン生物の合弁企業
2022年4月、私たちはSamsung Bioepisにおける49.9%の株式をSamsung Biologicsに売却する取引を完了した。この取引の条項によると、私たちは取引完了時に約10億ドルの現金を受け取り、2つの支払いで約13億ドルの支払いを延期する予定で、この2つの支払いはそれぞれ取引完了1周年で満期になった約8.125億ドルと、取引完了後2周年に満了した約4億375億ドルになる見通しだ。
この取引の一部として、私たちはいくつかの商業マイルストーンを達成した後に5000万ドルの追加収入を得る資格がある私たちのこのような性質または支払いに対する政策は、支払いが現金化可能な間に支払いを確認することであり、これは通常、支払いを受ける期間と同じである。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置、私たちの連結財務諸表はこの報告書に含まれている。
2022年コスト削減計画
2021年12月と2022年5月には,一連のコスト削減措置を実施する計画を発表し,完成後に約10億ドルの費用を節約する予定である。これらの節約は、リストラ、商業ADUHELMインフラの大幅な廃止、ある不動産場所の統合、私たちの販売、一般と行政、研究開発機能の運営効率の向上など、一連の措置によって実現されている。
これらの取り組みにより,合計約1.31億ドルの再編費用が発生すると予想され,主に解散費に関係している。この金額は2022年の間に大きな部分が発生した。自分から2022年12月31日おおむね3590万ドル私たちの再編成備蓄に残っていて、2026年まで支払われる予定だ。
2022年コスト節約計画に関するより多くの情報は、お読みください付記4、再編成私たちの連結財務諸表は本報告書に含まれている。
高級手形の償還
2022年7月、金利3.625の優先債券を償還し、元金総額は10億ドルで、2022年9月15日に満期になった。
高級債券の償還に関するその他の資料は、ご参照ください付記13、負債私たちの連結財務諸表は本報告書に含まれている。
125ブロードウェイのアフターレンタル取引
2022年9月、ブロードウェイ125号館とブロックの販売を完了し、販売総価格は約6.03億ドルで、その中には1080万ドルのテナント手当が含まれている。同時に、この取引の完了に伴い、私たちはビルを借りて、レンタル期間は約5.5年です。
ブロードウェイ125号の販売とレンタル取引に関するもっと多くの情報は、お読みください付記11,財産·工場·設備そして別注12,賃貸借契約私たちの連結財務諸表は本報告書に含まれている。
行動の結果
収入.収入
収入の概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 | | 変更率 | | $Change |
| | | 2022
V.v.
2021 | | 2021
V.v.
2020 | | 2022
V.v.
2021 | | 2021
V.v.
2020 |
| (単位:百万、百分率を除く) | | 2022 | | 2021 | | 2020 | | | |
| 製品収入純額: | | | | | | | | | | | | | | |
| アメリカです | | $ | 3,469.3 | | | $ | 3,805.7 | | | $ | 5,900.1 | | | (8.8) | % | | (35.5) | % | | $ | (336.4) | | | $ | (2,094.4) | |
| 世界の他の地域 | | 4,518.5 | | | 5,041.2 | | | 4,792.1 | | | (10.4) | | | 5.2 | | | (522.7) | | | 249.1 | |
| 製品総収入,純額 | | 7,987.8 | | | 8,846.9 | | | 10,692.2 | | | (9.7) | | | (17.3) | | | (859.1) | | | (1,845.3) | |
| 抗CD 20治療プロジェクトの収入 | | 1,700.5 | | | 1,658.5 | | | 1,977.8 | | | 2.5 | | | (16.1) | | | 42.0 | | | (319.3) | |
| その他の収入 | | 485.1 | | | 476.3 | | | 774.6 | | | 1.8 | | | (38.5) | | | 8.8 | | | (298.3) | |
| 総収入 | | $ | 10,173.4 | | | $ | 10,981.7 | | | $ | 13,444.6 | | | (7.4) | % | | (18.3) | % | | $ | (808.3) | | | $ | (2,462.9) | |
製品収入
製品収入の概要は以下の通りである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 | | 変更率 | | $Change |
| | | 2022
V.v.
2021 | | 2021
V.v.
2020 | | 2022
V.v.
2021 | | 2021
V.v.
2020 |
| (単位:百万、百分率を除く) | | 2022 | | 2021 | | 2020 | | | |
| 多発性硬化症(MS): | | | | | | | | | | | | | | |
| T@@ ec@@ f@@ id@@ er@@ a | | $ | 1,443.9 | | | $ | 1,951.9 | | | $ | 3,841.1 | | | (26.0) | % | | (49.2) | % | | $ | (508.0) | | | $ | (1,889.2) | |
虚栄心(1) | | 553.4 | | | 410.4 | | | 64.3 | | | 34.8 | | | 538.3 | | | 143.0 | | | 346.1 | |
| フマル酸総量 | | 1,997.3 | | | 2,362.3 | | | 3,905.4 | | | (15.5) | | | (39.5) | | | (365.0) | | | (1,543.1) | |
| Avonex | | 973.5 | | | 1,208.7 | | | 1,491.9 | | | (19.5) | | | (19.0) | | | (235.2) | | | (283.2) | |
| プレグリディ | | 331.9 | | | 357.4 | | | 385.6 | | | (7.1) | | | (7.3) | | | (25.5) | | | (28.2) | |
| 総インターフェロン | | 1,305.4 | | | 1,566.1 | | | 1,877.5 | | | (16.6) | | | (16.6) | | | (260.7) | | | (311.4) | |
| T@@ ys@@ ab@@ ri | | 2,030.9 | | | 2,063.1 | | | 1,946.1 | | | (1.6) | | | 6.0 | | | (32.2) | | | 117.0 | |
| スズメの花 | | 96.6 | | | 105.2 | | | 103.1 | | | (8.2) | | | 2.0 | | | (8.6) | | | 2.1 | |
| 小計:ミリ秒 | | 5,430.2 | | | 6,096.7 | | | 7,832.1 | | | (10.9) | | | (22.2) | | | (666.5) | | | (1,735.4) | |
| | | | | | | | | | | | | | |
| 脊髄性筋萎縮: | | | | | | | | | | | | | | |
| SPINRAZA | | 1,793.5 | | | 1,905.1 | | | 2,052.1 | | | (5.9) | | | (7.2) | | | (111.6) | | | (147.0) | |
| | | | | | | | | | | | | | |
| 生体模倣薬: | | | | | | | | | | | | | | |
| ベネッパーリ | | 441.0 | | | 498.3 | | | 481.6 | | | (11.5) | | | 3.5 | | | (57.3) | | | 16.7 | |
| IM@@ RA@@ LD@@ I | | 224.5 | | | 233.4 | | | 216.3 | | | (3.8) | | | 7.9 | | | (8.9) | | | 17.1 | |
| FlIXABI | | 81.3 | | | 99.4 | | | 97.9 | | | (18.2) | | | 1.5 | | | (18.1) | | | 1.5 | |
BYOVIZ(2) | | 4.3 | | | — | | | — | | | NM | | — | | | 4.3 | | | — | |
| 小計:生体模倣薬 | | 751.1 | | | 831.1 | | | 795.8 | | | (9.6) | | | 4.4 | | | (80.0) | | | 35.3 | |
| | | | | | | | | | | | | | |
| その他: | | | | | | | | | | | | | | |
| FUMAD | | 8.2 | | | 11.0 | | | 12.2 | | | (25.5) | | | (9.8) | | | (2.8) | | | (1.2) | |
| アドゥヘラム | | 4.8 | | | 3.0 | | | — | | | 60.0 | | | NM | | 1.8 | | | 3.0 | |
| 製品総収入,純額 | | $ | 7,987.8 | | | $ | 8,846.9 | | | $ | 10,692.2 | | | (9.7) | % | | (17.3) | % | | $ | (859.1) | | | $ | (1,845.3) | |
(1) VUMERITYは2021年第4四半期にEUで商業使用を開始した。 (2)BYOOVIZは2022年6月に米国で発売され、2022年第3四半期に商業使用を開始した。
NM意味がない
多発性硬化症(MS)
フマル酸
フマル酸の収入にはTecfideraとVUMERITYからの販売が含まれている。VUMERITYは2021年第4四半期、EU、スイス、およびイギリスでRRMSの治療のために承認された。
2021年と比べ、2022年にアメリカのフマル酸収入が13.8%低下したのは、主にアメリカ市場に複数のTecfideraの模造薬が入る者がTecfideraの需要を低下させたためであるが、薬局のリベート、管理看護リベートと共同支払い援助の減少及びVUMERITY販売量の増加により、Tecfideraの純価格上昇部分はこの低下を相殺した。
2022年、2021年と比較して、フマル酸の世界の他の地域での収入が16.9%低下したのは、主にTecfideraの定価の低下と、複数のTecfideraの模造薬のドイツやカナダなどの市場への進出に伴い、Tecfideraの需要が低下したためである。為替両替の悪影響もこの低下を後押ししているが、VUMERITY販売量の増加分はこの影響を相殺している。
EUでは、2022年6月に付与されたTecfideraに関連する特許の強制執行を求めており、この特許は2028年に満了する。また、Tecfideraが少なくとも2024年2月までに規制データと市場保護を受ける権利があることを確認するために訴訟を起こしている。わが社、欧州市場管理局、欧州委員会はそれぞれ欧州一般裁判所の2021年5月の裁決を上訴しており、この裁決は欧州市場管理局の不確定を宣言している
EMAおよびECに基づいて、Tecfideraが法規データおよびマーケティング保護を得る権利を決定する際に誤った評価を行い、Tecfideraの模倣薬の承認申請を検証した。当社,環境管理協会,欧州委員会はいずれも一般裁判所の誤った裁決について上訴しており,控訴は審理中である。2022年10月6日、CJEU総検事長はBiogenに有利な拘束力のない諮問意見を発表した。この意見はCJEUが欧州一般裁判所の判決を撤回することを提案した。私たちはCJEUの決定を待っている。
もっと情報を知りたいのですが、お読みください注21訴訟私たちの連結財務諸表はこの報告書に含まれている。
2022年と比較して、2023年のTecfideraの収入は引き続き低下すると予想され、これは北米、ラテンアメリカ、一部のEU諸国の後発薬競争の結果である。
2023年のVUMERITYの販売量は2022年より増加すると予想されていますが、これは主に米国と一部の欧州市場の需要が増加しているためです。私たちは私たちが以前に報告した契約製造業者の製造問題を解決したと信じている。しかも、私たちは規制部門の二番目の供給源に対する承認を得るために努力している。私たちは2023年に供給不足が発生しないと予想して、現在十分な在庫の再建に集中しています.
インターフェロン
2022年は2021年と比較して米国のインターフェロン収入が18.9%低下し,主にインターフェロン販売量が15.5%低下したためである。販売量の純低下は,患者のより高い治療効果と経口多発性硬化症治療への移行に伴い,インターフェロン市場が持続的に低下していることを反映している。
2022年、2021年と比較して、世界の他の地域のインターフェロン収入は12.9%低下し、主な原因はインターフェロン販売量が6.0%低下したことであり、患者がより高い治療効果と経口多発性硬化症治療への転換に伴い、インターフェロン市場の持続的な低下、及び外貨両替の不利な影響が原因である。
2022年と比較して,2023年には米国や世界の他市場におけるインターフェロンの収入が低下し続けることが予想され,他のMS製品からの競争が激しくなっているためである。
T@@ ys@@ ab@@ ri
2021年と比較して、2022年の米国Tysabriの収入は相対的に横ばいであり、販売量はやや低下しているが、より高い割引と手当を差し引くと、定価の増加を部分的に相殺している。
2021年と比較して、2022年のTysabriの世界の他の地域での収入は相対的に横ばいであり、定価はやや低下し、外貨両替の悪影響は販売量の増加分によって相殺された。
2022年と比較して、2023年のTysabriの世界での収入は相対的に横ばいになると予想される。女性に対する追加治療の競争が激しくなっているにもかかわらず、いくつかのヨーロッパ市場では、Tysabriは引き続き値下げに直面すると予想される。Tysabriの潜在的な生物類似進入者は、早ければ2023年にアメリカとヨーロッパ市場に進出する可能性があることも分かった。
脊髄性筋萎縮
SPINRAZA
2021年と比較して、2022年の米国SPINRAZAの収入は相対的に横ばいであり、販売量が3.7%と小幅に増加しているのは、出荷時間の原因であるが、部分的にはより高い割引と補助金によって相殺されている。
2022年は2021年と比較して、SPINRAZAの世界の他の収入が9.4%低下し、主に国の組合せ、外貨両替の悪影響と出荷時間によるものであるが、販売量の増加分はこの低下を相殺した。売上高の伸びはあるアジア市場の成長を反映しているが、一部はある成熟市場(特にドイツと日本)の競争激化による売上高低下によって相殺されている。
遺伝子治療製品と経口製品からの競争にもかかわらず、2023年のSPINRAZAの収入は2022年と横ばいになると予想される。米国の緩やかな成長および新興市場の持続的な参入拡大は,競争激化と負荷量動態の影響を相殺することが予想される。
Ionisとの協力に関するより多くの情報をお読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
生体模倣薬
Benepali、IMRALDI、FLIXABI、BYOOVIZ
2021年第3四半期、Lucentisを参考にしたレニビズマブBYOOVIZは米国、EU、イギリスで承認された。BYOOVIZは2022年6月に米国で発売され、2022年7月に米国の主要流通業者を通じて商業販売に投入された。
2021年と比較して、2022年の生物類似製品の収入が9.6%低下したのは、主に不利な定価と外貨両替の悪影響によるものであるが、販売量の増加分はこの影響を相殺した。
2022年と比較して,2023年には我々の生体模倣薬業務の収入が緩やかに増加することが予想されるが,これはBYOOVIZが米国や世界の他の地域で継続的に発売され,ある市場の持続的な値下げを部分的に相殺したためである。
我々は現在、2つの充填地点の施設規制検査欠陥を解決するためにIMRALDIの契約メーカーと協力しており、解決しなければ、これらの欠陥は供給に影響を与え、2023年のIMRALDI販売に悪影響を及ぼす可能性がある。Benepaliの製造にも1つの施設が使用されているため,2023年のBenepaliの販売に悪影響を及ぼす可能性がある。私たちはもっと多くの生産能力を確保するためにベネパリ既存の二次供給者と協力している。
サムスンBioepisとの協力手配に関するもっと多くの情報を読んでください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
抗CD 20治療プロジェクトの収入
遺伝子テーク(羅氏集団)
Rituxanにおける我々のシェアは,Rituxan HYCELAとGazyva Collaborationの米国での運営利益,OCREVUSで販売されている特許使用料収入と他の抗CD 20治療計画の収入を含めて以下の表にまとめられている。議論を容易にするために,RituxanとRituxan HYCELAを総称してRituxanと呼ぶ.
アメリカのRituxanとGazyvaにおける生物遺伝研究会社の税引前利益シェア
次の表は、米国におけるRituxanとGazyvaの税引前利益シェアをまとめています
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 製品収入、純額 | | $ | 1,729.2 | | | $ | 2,032.0 | | | $ | 3,334.1 | |
| コストと費用 | | 253.6 | | | 291.8 | | | 433.0 | |
| アメリカの税引前利益。 | | $ | 1,475.6 | | | $ | 1,740.2 | | | $ | 2,901.1 | |
| Biogenの税引前利益におけるシェア | | $ | 547.0 | | | $ | 647.7 | | | $ | 1,080.2 | |
2022年と2021年に比べて米国製品の純収入が低下した要因は、リツキシマブの米国での販売量が減少したことである#年
28.4%は、主に様々な生物学的類似製品からの競争によるものである。
2022年は2021年と比較して少量を減らす協力コストと支出の主な原因はより低い販売コスト、販売およびマーケティング費用、流通コスト、およびリツキシマブに関連する他のコストおよび費用。
生物類似製品を含む他のいくつかの抗CD 20分子が承認され,RituxanやGazyvaと腫瘍学や他の市場で競合していることが知られている。クラスBiRituxanを参考にした類似製品はすでに米国で発売され、より低い価格で提供されている。この競争は、前の時期に比べてRituxanの売上が大幅に低下したため、遺伝子テックと協力して手配した税引前利益に大きな悪影響を与えた。これらの製品がより多くの市場シェアを獲得するにつれて、生物類似製品の競争が引き続き激化し、今後数年間の米国での共同普及利益に大きな悪影響を及ぼすことが予想される。
OCREVUSの販売特許使用料収入
2022年と2021年に比べてOCREVUSの販売特許権使用料収入が増加したのは,主に米国におけるOCREVUSの販売増加によるものである。
OCREVUS特許使用料収入は,第三者に対する我々の見積りとOCREVUSの同期販売に対する市場研究データに基づいている。実際の特許使用料収入と推定特許権使用料収入との差は既知の期間に調整され、通常は次の四半期と予想される。
抗CD 20治療プロジェクトの他の収入
抗CD 20治療計画の他の収入は、私たちがカナダRituxanの税引き前に共同で利益シェアを普及させることを含む。
FDAは2022年12月、再発または難治性濾胞性リンパ腫の治療のための二重特異性抗体であるLUNSUMIOを承認した。私たちのLUNSUMIOにおける税前損益シェアは、抗CD 20治療計画収入の構成要素として私たちの総合損益表に計上される。2022年12月31日までの1年間、LUNSUMIOの収入はわずかだった。
遺伝子テークとの協力に関するより多くの情報、税引前利益共有式とCD 20治療計画の将来の収入への影響を含む情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
その他の収入
その他の収入には、特許権使用料収入と契約製造およびその他の収入が含まれており、要約は以下の通りである
特許使用料収入及び契約製造その他の収入
代役やその他の収入
私たちは契約製造と他の収入を記録し、主に契約製造協定の下での収入から来ている。
2021年と比較して、2022年の契約製造やその他の収入の減少は、主にバッチ発表の時間に関する契約製造収入の低下によるものである。
特許権使用料収入
私たちは私たちの特許関連製品の純販売から印税を獲得し、サムスンBioepisとの協力手配から生物類似製品の印税収入を得た。
サムスンBioepisとの協力手配に関するもっと多くの情報を読んでください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
割引と手当準備金
製品販売収入記録は控除適用割引と
私たちが業務を展開しているいくつかの国際市場で価格設定行動を実施することに関する手当を含む手当。
これらの準備金は、関連販売によって稼いだ金額または請求される金額の推定に基づいており、売掛金の減少(その金額が私たちの顧客に支払われるべきである場合)または負債(その金額が私たちの顧客以外の方に支払われるべきである場合)に分類される。これらの推定は、我々の歴史的経験、現在の契約および法的要件、特定の既知の市場イベントおよび傾向、業界データ、および予測された顧客購入および支払いパターンを反映する。実際の金額は最終的に私たちの見積もりとは違うかもしれない。実際の結果が異なれば,これらの見積りを調整し,調整期間内の報酬に影響を与える可能性がある
GDP削減の割引、契約調整、返品準備金の概要は以下の通り
2022年、2021年、2020年12月31日までの年度、割引と手当準備金の総生産に占める割合はそれぞれ30.1%、28.6%、27.1%だった。
割引
割引には貿易期限割引と卸割引が含まれています
2021年と比較して2022年割引が減少した要因は総売上高の低下であり,これはTecfideraの売上が低下したが,Tysabriの購入割引増加がこの影響を相殺したためである。
契約調整
契約調整は主にアメリカの医療補助と管理式医療リベート、薬局リベート、共同支払い(COPAY)援助、退役軍人管理局、340 B割引、専門薬局計画費用とその他の政府リベート或いは適用手当に関連する
2021年に比べて2022年の契約調整数が減少した要因は
Tecfideraのアメリカでの販売は、薬局リベート、医療補助バックルと管理看護リベートの減少、及びVUMERITY推定の有利な変化によるアメリカ医療補助リベートの減少を招いた。
返品
製品返品準備金は卸の返品のために設立されました。契約条項によると、卸は製品の破損や期限切れなどの理由で返品することができます。卸の大部分の返品は製品の期限が切れたためです。製品返品準備は関連収入確認期間中に確認され、製品販売が減少した
2022年は2021年と比較して、リターン準備金が相対的に一致している
私たちの収入備蓄の他の資料については、ご参照ください付記5、収入、私たちの連結財務諸表はこの報告書に含まれている。
コストと費用
総コストと費用の概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 | | 変更率 | | $Change |
| | | 2022
V.v.
2021 | | 2021
V.v.
2020 | | 2022
V.v.
2021 | | 2021
V.v.
2020 |
| (単位:百万、百分率を除く) | | 2022 | | 2021 | | 2020 | | |
| 販売コストは,購入した無形資産の償却や減価は含まれていない | | $ | 2,278.3 | | | $ | 2,109.7 | | | $ | 1,805.2 | | | 8.0 | % | | 16.9 | % | | $ | 168.6 | | | $ | 304.5 | |
| 研究開発 | | 2,231.1 | | | 2,501.2 | | | 3,990.9 | | | (10.8) | | | (37.3) | | | (270.1) | | | (1,489.7) | |
| 販売、一般、行政 | | 2,403.6 | | | 2,674.3 | | | 2,504.5 | | | (10.1) | | | 6.8 | | | (270.7) | | | 169.8 | |
| すでに購入した無形資産の償却と減価 | | 365.9 | | | 881.3 | | | 464.8 | | | (58.5) | | | 89.6 | | | (515.4) | | | 416.5 | |
| 協業利益を分担する | | (7.4) | | | 7.2 | | | 232.9 | | | (202.8) | | | (96.9) | | | (14.6) | | | (225.7) | |
| デンマークヒレード製造事業の損失を剥離する | | — | | | — | | | (92.5) | | | — | | | NM | | — | | | 92.5 | |
| (収益)再計量または公定価値損失 | | (209.1) | | | (50.7) | | | (86.3) | | | 312.4 | | | (41.3) | | | (158.4) | | | 35.6 | |
| 現在行われている研究と開発を買収する | | — | | | 18.0 | | | 75.0 | | | (100.0) | | | (76.0) | | | (18.0) | | | (57.0) | |
| 再編成費用 | | 131.1 | | | — | | | — | | | NM | | — | | | 131.1 | | | — | |
| 建物を売却して得た収益 | | (503.7) | | | — | | | — | | | NM | | — | | | (503.7) | | | — | |
| その他の費用,純額 | | (108.2) | | | 1,095.5 | | | (497.4) | | | (109.9) | | | (320.2) | | | (1,203.7) | | | 1,592.9 | |
| 総コストと費用 | | $ | 6,581.6 | | | $ | 9,236.5 | | | $ | 8,397.1 | | | (28.7) | % | | 10.0 | % | | $ | (2,654.9) | | | $ | 839.4 | |
NM意味がない
販売コストは,購入した無形資産の償却や減価は含まれていない
2022年12月31日、2021年、2020年12月31日までの年度、総収入に占める販売コストの割合はそれぞれ22.4%、19.2%、13.4%だった。
製品販売コスト
2021年と比較して,2022年の製品販売コストの増加は,主に2022年のADUHELM過剰在庫や調達承諾のログアウトに関する費用の増加,我々の製造施設に関するアイドル生産能力総費用の増加,製品組合せによる製品販売コストの増加によるものである。
2022年,2021年,2020年12月31日までの年度において,過剰,陳腐あるいは滞納により減記された在庫額はそれぞれ3.362億ドル,1.676億ドル,2660万ドルであった。
2022年と2021年12月31日までの年度では,予想需要を超えるADUHELM在庫抹消と調達承諾に関する費用約2.86億ドルと1.7億ドルをそれぞれ記録した。
2022年と2021年12月31日までに,それぞれ約1億19億ドルと4800万ドルの総遊休容量費用を記録した。
衛材の45.0%の在庫,遊休生産能力費用,契約承諾に関する約1億97億ドルと9900万ドルを確認し,それぞれ2022年12月31日と2021年12月31日までの年間総合収益表における協力利益(赤字)分担に記録した。
衛材との協力手配に関する他の情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
販売使用料コスト
2021年と比較して,2022年の販売特許使用料コストの低下は,主にSPINRAZA,Tysabri,Avonexの売上高低下により支払うべき特許使用料が減少したが,VUMERITY販売増加が支払うべき特許権使用料部分はこの低下を相殺した。
研究と開発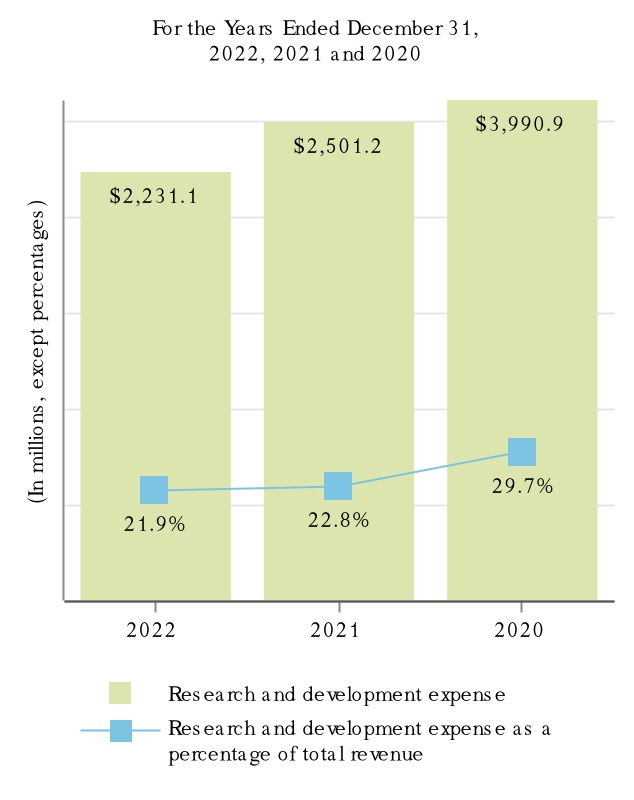
私たちは発見、研究、開発計画、商業発展機会に大量の資源を投入することを約束することで、私たちの薬物発見と開発を支援した。
我々の研究開発コストの大部分は,全体の研究開発活動や不特定プロジェクトを支援するための間接コストであり,管理コスト,減価償却,情報技術,施設ベースの費用など,複数のプロジェクトに有利な活動を含む。これらのコストは,上表の他の研究や開発コストと考えられ,特定の計画や段階に割り当てられない.
我々の上場製品を支援するための研究·開発費用には,製品ライフサイクル管理活動に関するコストがあり,適用すれば,既存製品のための新適応の開発に関するコストも含まれている。後期計画とは,第3段階の開発または登録段階にある計画である。初期計画は第1段階または第2段階の開発段階にある計画である。研究と発見とは,我々の発見研究や翻訳科学の努力を支援するためのコストである.コストは発生時に計画状態に応じて開発段階に反映される.したがって、同じプログラムは同じ年の異なる発展段階で表現されることができる。私たちのいくつかのプロジェクトについて、研究開発活動は私たちの協力関係と他の関係の一部です。私たちの費用は総費用に占める私たちのシェアを反映する。
2021年と比較して,2022年の研究開発費の低下は主に2021年のマイルストーン支払いの増加によるものであるが,SLEやCLEの潜在的治療のためのBIIB 059(抗BDCA 2)の進展,再発や難治性濾胞性リンパ腫の治療のための二重特異性抗体LUNSUMIOの開発,特発性振戦の潜在的治療のためのBIIB 124(SAGE−324)の開発,Denaliと協力してパーキンソン病の潜在的治療のためのBIIB 122(DNL 151),およびBIIB 800の開発,BIIB 800は提案されている類似生物参照Actemraである。
前金は含まれていません。私たちは2023年に私たちのコア研究開発支出が小幅に増加すると予想しています。私たちは引き続き私たちのパイプに投資するからです。著者らは引き続き大量の資源を投入し、重大な満足されていない需要と候補薬物が高度な差別化の潜在力がある場合、的確に研究と開発機会を提供するつもりである。
マイルストーンと前期費用
2022年の研究開発費には、
•IONISに記念碑的支払いの研究開発費を支払うための3700万ドル
•2022年第2四半期のAlectosとの協力に関連した前金に関する研究開発費1500万ドル
•1,000万ドル
私たちは2022年第4四半期にAlcyoneと協力した。
2021年の研究開発費には
•2021年第3四半期のInnoCareとの連携に関連する前金関連研究開発費1.25億ドル
•Ionisとの協力協定に従って選択権を行使し、開発中の調査ASOであるSMAのためにBIIB 115を開発および商業化するための6,000万ドル
•遺伝子テーク共同開発LUNSUMIOに支払い、それを商業化するオプション使用料に関する研究および開発費用を支払うための3,000万ドル
•Bio-Theraとの開発、製造および商業化のためのBIIB 800の商業化および許可協定に関連する前払いに関する研究および開発費用のために3,000万ドルが使用される。
これらの連携に関連する前金は、支払日までに、それらに関連する計画が規制部門の承認を得ていないため、研究開発費に分類される。
これらの連携スケジュールに関する他の情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
初期プロジェクト
2021年と比較して、2022年の私たちの早期プロジェクトに関する支出が減少したのは、主に以下に関連するコストが低下したためである
•パーキンソン病患者はCinpanemab(BIIB 054)を中止した
•アルツハイマー病の治療を中止した
•X-連鎖網膜色素変性患者補酵素遺伝子toliparvovec(BIIB 112)の中断;
•末期全身性エリテマトーデスに対する利フェリズマブ(BIIB 059)の潜在的治療進展
•パーキンソン病治療におけるBIIB 122の応用の進展
•TGNおよびDPNでは、ビソトリアジン(BIIB 074)の使用を停止した
•アルツハイマー病の潜在的治療薬としてBIIB 078の使用を中止した。
以下の費用の増加分は減少額を相殺した
•特発性振戦の潜在的治療のためのBIIB 124の開発支出が増加した
•慢性肺胞炎の潜在的治療のための訴訟モノクロナル抗体(BIIB 059)の開発費用を増加させる
•アルツハイマー病の潜在的治療のためのBIIB 113の開発支出を増加させる
•急性虚血性脳卒中を潜在的に治療するためのBIIB 131の開発支出を増加させる
•BIIB 121の開発支出を増加させ、アンジェマン症候群の潜在的治療に用いる。
後期計画
2022年と2021年と比較して、我々の後期計画に関連する支出が減少した要因は、以下の点に関連するコスト低減である
•米国でADUHELMの承認が加速された後、ADUHELMは後期段階から市場に進出する
•脈絡膜血症におけるBIIB 111の中止
以下の費用の増加分は減少額を相殺した
•末期全身性エリテマトーデスに対する利フェリズマブ(BIIB 059)の潜在的治療進展
•パーキンソン病の潜在的治療におけるBIIB 122の進展;および
•Actemraのtocilizumab生物類似体BIIB 800を参考にして末期段階に入ることを提案する。
市場化した番組
2022年と2021年を比較して、私たちのマーケティング計画に関連する支出が増加したのは、主に以下の点に関連するコストが増加したためです
•米国でADUHELMの承認が加速された後、ADUHELMは後期段階から市場に進出する
•アメリカでLUNSUMIOの承認が加速された後、LUNSUMIOは後期段階から市場に入ります。
他の研究と開発
2019年3月、衛材は早期アルツハイマー病患者に対してLEQEMBIを開発する全世界3期試験を開始した。我々の協力手配によると、衛材は全世界でLEQEMBI開発と監督管理を指導して提出し、2社は共同でこの製品を商業化と共同で普及させ、衛材は最終決定権を持っている。すべてのコストは、研究開発、販売とマーケティング費用を含めて、すべて私たちと衛材が折半します。FDAは2023年1月にLEQEMBIの加速承認を承認した。さらに、衛材は、LEQEMBIの従来の経路で承認されるために、2023年1月にBLAを補完する作業をFDAに提出することを完了した。
2022年12月31日まで、約8980万ドルのLEQEMBI関連の製品在庫があります。
衛材との協力手配に関する他の情報は、お読みください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
販売、一般、行政
2022年に2021年と比較して,販売,一般,行政費用が減少した要因は,2022年の間にコスト低減措置を講じたことである。
最終的なNCDの結果として,ADUHELMを支援するビジネスインフラを基本的に廃止し,現在米国で治療を受けている患者のための無料薬物計画を継続することを含む患者参入計画を管理するための最も少ない資源を保持した。
2021年第2四半期から衛材はアメリカで返済されます
ADUHELM販売,一般と行政費用は我々の総合損益表における連携利益(損失)分担で確認した.
2022年にコスト節約計画を実施したため,ADUHELMを支援する商業インフラの大幅な廃止やその他のコスト低減策を含めた販売,一般,行政コストは2023年に低下し続けると予想される。
すでに購入した無形資産の償却と減価
私たちの償却費用は無形資産の経済的消費と減価に基づいている。私たちの最も重要な償却可能無形資産は、私たちが業務合併によって得たTysabri、Avonex、SPINRAZA、VUMERITY、Tecfidera(世界の他の地域)製品と他の計画と関連がある。
2021年と比較して、2022年の無形資産償却·減価の減少は、主に2021年の減価費用の増加により、約6億293億ドルであるのに対し、2022年の減価費用は約1.196億ドルである。
2022年12月31日までに、すでに購入した無形資産の償却·減価反映1億196億ドルヴィソタ命に関する減価費用NEはDPNの潜在的治療法である。
2021年12月31日現在,買収済み無形資産の償却および減価は,BIIB 111に関する3.65億ドルの減価費用,BIIB 112に関連する2.200億ドルの減値費用,およびVxotrigineに関する4430万ドルの減価費用の影響を反映しており,TGNの潜在的治療に用いられている。
2022年、2021年、2020年12月31日までの年度まで、減価費用を計算しない買収無形資産の償却総額はそれぞれ2.463億ドル、2.52億ドル、2.551億ドルだった。
私たちは製品の性能に関するイベントと予想を監視する。もし新しい情報が私たちの最新の分析に基づいた仮定が私たちの現在の推定で使用されている仮定と大きく異なることを示すならば、私たちの分析は更新され、関連製品の予想生涯収入に大きな変化をもたらす可能性がある。前の時期や現在の予想と比較して、不良事件の発生は、私たちが買収した無形資産に関する償却費用を大幅に増加させる可能性があり、将来の運営業績に大きなマイナス影響を与える可能性があります。
企業合併に関する知的財産権の研究開発
知的財産権の研究開発は著者らが業務合併の一部として買収した、買収の日にまだ技術実行可能性に達していない研究開発資産の公正な価値である。十月三十一日、事件や環境変化が資産の帳簿価値が回収できない可能性があることを示すたびに、私たちは毎年知的財産権研究と発展を買収する減価として資本化された金額を審査しています。
全体的に、私たちが買収した知的財産権研究開発資産の価値はいくつかの変数に依存し、未来の収入と競争影響の推定を含み、著者らは競争市場において十分な価格設定能力を確保し、著者らは臨床試験と監督フィードバックデータに基づいて安全性と有効性を確認する能力、開発コストのレベルを期待し、特定の研究プロジェクトを1つの臨床試験段階から次の段階に推進する可能性とタイミングに成功した。私たちは、私たちのライフサイクル管理戦略、研究開発優先事項と開発リスク、計画とポートフォリオ経済の変化、外貨為替レートと経済傾向に関する影響を含む、これらと他の変数の推定を絶えず再評価し、臨床研究と開発過程の生産性に関する業界と会社データを評価している。私たちが推定した変化は私たちの知的財産権研究開発資産の推定値に大きな変化をもたらす可能性がある。
ビソトリアジン
ビソトリアジンを買収してからしばらくTGNに対する潜在的な治療と潜在的なtはDPN、もう一つの形態の神経病理性疼痛を治療する。我々は,糖尿病の治療に利用可能なビソトリアジンの潜在的な3期研究の設計についてfdaと接触したTGNとDPN2022年に完成したビソトリアジンの追加臨床試験を行った。
この追加臨床試験の表現は,TGNを治療可能な維索三純第3段階研究の開始を延期したため,2021年第1四半期にTGN治療可能な維索トリアジンに関連する4,430万ドルの減価費用を確認した。
2022年第4四半期規制,開発,商業化への挑戦に基づき,ビソトリアジンのさらなる開発を中止したこの年度までに 2022年12月31日、私たちが確認した減価費用は約1億196億ドル関連コンテンツVxotrigineはDPNの潜在的治療に用いられ,このIPR&D無形資産の余剰帳簿価値をゼロに低下させるこの資産に関連する対価格債務の価値を調整しました税引前収益の約2.091億ドルは、我々の総合損益表内で再計量または対価格の公正価値損失(収益)で確認されます。
BIIB 111とBIIB 112
2021年第2四半期に、私たちはBIIB 111の第3段階STAR研究とBIIB 112の第2段階/第3段階XIRius研究がそれらの主要な終点に達していないことを発表した。2021年第3四半期には、経営陣の決定により、これらのプロジェクトのさらなる開発を停止しましたが、これはその戦略審査過程の一部です。2021年12月31日現在、減価費用を確認しておりますBIIB 111に関連する減価費用3.65億ドルとBIIB 112に関連する減価費用22,000,000ドルは、これらの知的財産権研究開発無形資産の余剰帳簿価値をゼロに低下させる。
また、私たちはBIIB 111とBIIB 112のさらなる開発を一時停止することを決定したため、2021年第3四半期に約3910万ドルの費用を記録し、私たちの製造計画とこれらのプロジェクトの一時停止による他のコストに関連している。これらの費用は2021年12月31日までの年度総合損益表で研究開発費であることが確認された。
私たちが買収した無形資産の償却と減価に関するより多くの情報は、お読みください付記7、無形資産及び商業権私たちの連結財務諸表は本報告書に含まれている。
協業利益を分担する
協力利益(赤字)分担は主に、2013年のSamsung Bioepisの生体模倣薬ビジネス協定に関連する利益または損失におけるサムスンBioepisの50.0%シェアと、2021年第2四半期から、米国とADUHELMとの協力協定に関連する収入および支出における衛材の45.0%シェアを含む。衛材は2023年1月1日からADUHELM純売上高による分級特許権使用料のみを徴収し,世界的な損益を共有しなくなった。
ここ数年で2022年12月31日および 2021, 純利益共有費用は2.174億元とそれぞれ2.854億ドルであり、サムスンBioepisが協力純利益の50.0%を共有することを反映している。
2022年と2021年12月31日までの年度において,純減少した運営費はそれぞれ約2兆247億ドルと2.332億ドルであり,米国の純協力赤字に占める衛材のシェアの45.0%を反映していることが確認された。
2021年12月31日までの1年間に,衛材が2021年第2四半期に神経免疫に支払ったADUHELMが米国で発売した1.0億ドルのマイルストーン支払いの45.0%を反映するために4500万ドルの運営費を純減少させたことも確認された。
サムスンBioepisと衛材との協力に関するもっと多くの情報を読んでください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
(収益)再計量または公定価値損失
2022年12月31日までの年度私たちまたは対価債務の公正な価値変化は、主にビソトリアジンに関連するさらなる開発作業を停止して、TGNおよびDPNを治療することができ、私たちまたは対価債務が約減少したためであるy 1.954億ドル、および対価格負債を再評価または保有するための金利の変化。
2021年12月31日までの1年間、私たちのまたは対価格債務の公正な価値変化は、主に技術と規制の成功の可能性の低下と、私たちのVxotrigine計画に関連するいくつかの残りの発展マイルストーンの予想達成時間の遅延によるものである。
私たちの知的財産権研究開発無形資産に関するより多くの情報は、お読みください付記7、無形資産及び商業権私たちの連結財務諸表は本報告書に含まれている。
再編成費用
2022年コスト削減計画
2021年12月と2022年5月には,一連のコスト削減措置を実施する計画を発表し,完成後に約10億ドルの費用を節約する予定である。これらの節約は、リストラ、商業ADUHELMインフラの大幅な廃止、ある不動産場所の統合、私たちの販売、一般と行政、研究開発機能の運営効率の向上など、一連の措置によって実現されている。
これらの取り組みにより,合計約1.31億ドルの再編費用が発生すると予想され,主に解散費に関係している。この金額は2022年の間に大きな部分が発生した。自分から2022年12月31日おおむね3590万ドル私たちの再編成備蓄に残っていて、2026年まで支払われる予定だ。
2022年12月31日までの1年間に、2022年コスト節約計画に関連する税前再編費用純額約1兆311億ドルを確認し、そのうち約1.126億ドルに従業員解散費が含まれている。私たちの再編準備金は計上すべき費用、その他は私たちの総合貸借対照表に計上されます。
2022年9月、私たちはビンニー街300号に位置する部分賃貸契約を部分的に終了し、残りの空間の大部分のレンタル期間を短縮する合意に達した。これは約530万ドルの収益をもたらし,この収益は今年度までの総合損益表の再編費用に入金される2022年12月31日それは.ビンリー街300番地のテナント変更に関する情報は、お読みください
別注12,賃貸借契約この報告書に記載されているこれらの連結財務諸表について。
現在の容量需要を評価した後,2022年3月にノースカロライナ州ダラムにある患者サービスオフィスの使用を中止した。私たちがこの施設を使用することを停止する決定は、その施設のいくつかのレンタル改善と他の資産に直ちに費用を発生させる。そこで,約1,040万ドルの加速減価償却費用を確認し,これらの費用は今年度までの総合損益表の再編費用に計上されている2022年12月31日それは.2022年5月、私たちは賃貸譲渡契約を締結し、この協定に基づき、残りのレンタル義務を外部第三者に譲渡しました。賃貸譲渡の結果として、2022年第2四半期に関連経営賃貸義務と使用権資産の確認を取り消しました。
2022年12月31日までの1年間に、我々の総合収益表における再構成費用に記録されている約1320万ドルの他の再構成コストが確認された。その他の再構成コストには,施設閉鎖コスト,従業員非解散費,資産抹消,その他のコストなどの項目がある。
次の表は2022年までの年度のリストラに関する費用と支出をまとめたものである2022年12月31日:
| | | | | | | | |
| (単位:百万) | | 合計する |
| 再編準備金、2021年12月31日 | | $ | — | |
| 費用.費用 | | 112.6 | |
| 支払い | | (78.0) | |
| 外貨とその他の調整 | | 1.3 | |
| 再編準備金、2022年12月31日 | | $ | 35.9 | |
建物を売却して得た収益
2022年9月、ブロードウェイ125号館とブロックの販売を完了し、販売総価格は約6.03億ドルで、その中には1080万ドルのテナント手当が含まれている。2022年12月31日までの1年間で、この売却は約5.037億ドルの販売税前収益をもたらし、取引コストを差し引いた。
同時に、この取引の完了に伴い、ビルをレンタルし、レンタル期間は約5.5年であり、2022年12月31日現在の総合貸借対照表に約1.682億ドルの新規賃貸負債と使用権資産が記録されていることにつながった。このビルの売却と即時借戻しは売却·借り戻し処理の資格を持ち、経営的賃貸に分類される。
ブロードウェイ125号の販売とレンタル取引に関するもっと多くの情報は、お読みください付記11,財産·工場·設備そして別注12,賃貸借契約私たちの連結財務諸表は本報告書に含まれている。
その他の費用,純額
2021年と比較して、2022年の他の支出純額の変化は、主に2022年にSamsung Bioepisでの49.9%の株式売却に関する約15億ドルの税前収益を反映しており、一部は9.00億ドルの税前費用および和解費用と支出によって相殺され、これらの費用は2015年前の行為に関連した和解訴訟和解合意と関連している。
2022年12月31日までの1年間で、我々が保有する株式証券の未実現純損失と達成済み損失はそれぞれ約2兆647億ドルとゼロであったが、2021年の未実現純損失と達成済み収益はそれぞれ8.314億ドルと1030万ドルであった。
2022年12月31日までの1年間に確認された未実現純損失は,DenaliとSangamo普通株投資における公正価値総額が約2.78億ドル減少したことを主に反映している。
2021年12月31日までの1年間に確認された未実現純損失は,主にDenali,Sage,Sangamo,Ionis普通株への投資の公正価値総額が約8.196億ドル減少したことを反映している。
2022年12月31日までの1年間の純利息支出は1兆573億ドルだったが、2021年は2兆426億ドルだった。この低下は、主に2022年の投資利息収入が2021年より増加したことと、2022年9月15日に満期となる3.625%優先債券の償還により、元金総額が10億ドル、2022年の利息支出が減少したためである。
2023年の純利息支出は、2023年の平均債務残高が低いため、2022年に比べて減少すると予想される
私たちの現金と有価証券の金利上昇による利息収入。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置私たちの連結財務諸表は本報告書に含まれている。
高級債券の償還に関するその他の資料は、ご参照ください付記13、負債私たちの連結財務諸表は本報告書に含まれている。
訴訟和解協定に関するその他の情報は、お読みください付記18、その他の連結財務諸表明細私たちの連結財務諸表は本報告書に含まれている。
所得税支給
私たちの業務の世界的なせいで、私たちの有効税率は毎年変動する。私たちの実際の税率に最も影響を与える要素は、税法の変化、私たちの課税収入の複数の管轄区域間の分配の違い、私たちの研究開発費の額と特徴、
特定の控除と信用、買収、そして許可取引。
2022年12月31日までの1年間、2021年と比較して、神経免疫繰延税純資産の影響は含まれておらず、以下に述べるように、訴訟和解協定やブロードウェイ125号に位置するビルを売却する税金の影響を含む。これらの成長は,今年度の国際再編に関する税収割引の影響,Samsung Bioepisにおける我々の株式売却の影響,およびVxotrigineの開発中止を決定した影響によって部分的に相殺された。さらに、2021年に、私たちの有効税率は、BIIB 111とBIIB 112の減価費用の税収影響と、私たちの持分ツール価値が変化する非現金税収の影響のおかげだ。
訴訟和解協定に関するその他の情報は、お読みください付記18、その他の連結財務諸表明細私たちの連結財務諸表は本報告書に含まれている。
神経免疫繰延税金資産
2021年には、ADUHELMの将来の販売状況に応じて、スイスで約1.00億ドルの繰延税純資産を記録した
2022年第1四半期、ADUHELMに関連する最終NCDを発行する際に、この繰延税金資産の純価値をゼロにするために、約8,500万ドルの推定値を記録した。
我々の繰延税項純資産に対するこれらの調整は,非持株権益に起因する純収入(損失)に割り当てられた等額と相殺金額とともに我々の総合損益表に記録されているため,生物遺伝会社の純収入への純影響はゼロである。
神経免疫との連携に関するより多くの情報をお読みください付記20は、可変利子実体への投資私たちの連結財務諸表は本報告書に含まれている。
“インフレ低減法案”
2022年8月、アイルランド共和軍は米国で法律に署名した。アイルランド共和軍は、最低税の15.0%と消費税の1.0%の株式買い戻しを含む新たな税収条項を導入した。アイルランド共和軍の規定は2022年12月31日以降の期間内に有効になるだろう。金利協定の制定は私たちの収入に実質的な調整をもたらしていない
2022年12月31日までの税収支出または繰延税項目純資産。
私たちの所得税、不確定税位、所得税の税率調節に関するもっと多くの情報は、お読みください付記17,所得税私たちの連結財務諸表は本報告書に含まれている。
被投資者の権益(収入)損失,税引き後純額
2012年2月、私たちはサムスン生物会社と合弁協定を締結し、Samsung Bioepisという実体を設立し、生物類似製品を開発、製造、販売した。
2022年4月、私たちはSamsung Bioepisにおける49.9%の株式をSamsung Biologicsに売却する取引を完了したSamsung Bioepisを売却した後,Samsung Bioepisの運営結果や基差に関する償却に関する収益や損失は確認されなくなった。
今回の売却に先立ち,実体業績が利用可能な場合に延滞金の4分の1を計算し,我々の総合収益表に被投資者(収入)損失における権益,減税後の純額を反映したSamsung Bioepisへの投資に関する運営結果シェアを権益法により確認した。私たちはまた2018年11月に投資によって生じたいくつかの基礎差額の償却を確認した
2022年12月31日までの1年間に、260万ドルの投資純収益が確認され、サムスンBioepisの営業利益におけるシェアを反映し、税引き後純額は合計1700万ドルで、合計1440万ドルの赤字償却で相殺された。この金額は私たちが
決算によると、サムスンが以前にBioepisを売却した業績は4分の1滞納と確認された。
この年度までに2021年12月31日、私たちは3,490万ドルの投資純収益を確認し、サムスンBioepisの営業利益における私たちのシェアを反映し、税引き後純額は合計6,460万ドルで、合計2,970万ドルの赤字償却によって相殺された。
2021年12月31日までの1年間、我々の投資純収益は、サムスンBioepisに関連する繰延税金資産推定手当の放出による3120万ドルの収益を反映している。推定手当は、プラスとマイナスの証拠(サムスンBioepisの歴史的収益を含む)を考慮して2021年第2四半期に発表された。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置私たちの連結財務諸表は本報告書に含まれている。
サムスンBioepisとの協力手配に関するもっと多くの情報を読んでください付記19、連携関係その他の関係私たちの連結財務諸表はこの報告書に含まれている。
非制御性権益、税引後純額
私たちの連結財務諸表は、私たちが主な受益者であることを確認するため、可変利息実体神経免疫の財務結果を含む。
2021年と比較して、2022年に非持株権益による税引後純収益(損失)の変化は主に2021年に記録された繰延税収割引とマイルストーン支払いによるものであり、以下に述べる。
2021年には、ADUHELMの将来の販売状況に応じて、スイスで約1.00億ドルの繰延税純資産を記録した。
2022年第1四半期、ADUHELMに関連する最終NCDを発行する際に、この繰延税金資産の純価値をゼロにするために、約8,500万ドルの推定値を記録した
我々の繰延税項純資産に対するこれらの調整は,非持株権益に起因する純収入(損失)に割り当てられた等額と相殺金額とともに我々の総合損益表に記録されているため,生物遺伝会社の純収入への純影響はゼロである。
2021年、非ホールディングス資本による純収益(損失)の変化も、2021年の間にADUHELMが米国で発売したことに関連する神経免疫会社に支払われた1.00億ドルのマイルストーン支払いによるものである。
神経免疫との連携協定に関するより多くの情報をお読みください付記20可変利益実体への投資私たちの連結財務諸表はこの報告書に含まれている。
所得税に関するもっと多くの情報は、お読みください付記17,所得税私たちの連結財務諸表は本報告書に含まれている。
財務状況、流動資金、資金源
私たちの財務状況の概要は以下の通りです
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 12月31日まで | | | | |
| (単位:百万、百分率を除く) | | 2022 | | 2021 | | 変更率 | | $Change |
| 金融資産: | | | | | | | | |
| 現金と現金等価物 | | $ | 3,419.3 | | | $ | 2,261.4 | | | 51.2 | % | | $ | 1,157.9 | |
| 現在の有価証券は | | 1,473.5 | | | 1,541.1 | | | (4.4) | | | (67.6) | |
| 有価証券--非流動証券 | | 705.7 | | | 892.0 | | | (20.9) | | | (186.3) | |
| 現金、現金等価物、有価証券総額 | | $ | 5,598.5 | | | $ | 4,694.5 | | | 19.3 | % | | $ | 904.0 | |
| 借金: | | | | | | | | |
| 支払手形の当期分 | | $ | — | | | $ | 999.1 | | | NM | | $ | (999.1) | |
| 支払手形 | | 6,281.0 | | | 6,274.0 | | | 0.1 | | | 7.0 | |
| 借入総額 | | $ | 6,281.0 | | | $ | 7,273.1 | | | (13.6) | % | | $ | (992.1) | |
| 運営資金: | | | | | | | | |
| 流動資産 | | $ | 9,791.2 | | | $ | 7,856.5 | | | 24.6 | % | | $ | 1,934.7 | |
| 流動負債 | | (3,272.8) | | | (4,298.2) | | | (23.9) | | | 1,025.4 | |
| 総運営資金 | | $ | 6,518.4 | | | $ | 3,558.3 | | | 83.2 | % | | $ | 2,960.1 | |
NM意味がない
概要
私たちはこれまで主に運営によって稼いできたキャッシュフローと私たちの既存の現金資源を通じて私たちの運営と資本支出に資金を提供し、引き続き資金を提供する予定です。私たちは、Tecfideraの模倣薬競争および生物類似競争がRituxan販売量に及ぼす米国と他の主要市場の影響は、2023年に引き続き私たちの運営キャッシュフローを減少させ、私たちの将来の運営キャッシュフローに重大な悪影響を及ぼすと信じている。
2022年12月31日までの1年間、いくつかの重要なキャッシュフローは以下の通りである
•経営活動が提供するキャッシュフローの純額は13.843億ドル
•Samsung Bioepisで得られた9億903億ドルの純利益を売却しました
•私たちのビルを売却した純利益は5兆826億ドルでした
•2022年9月15日に満期となった3.625分の優先債券を償還し、10億ドルを支払った
•訴訟和解協議は総額9.17億ドルと和解費用と支出を支払った
•所得税支払純額総額は9.329億ドル
•株式買い戻しのための7億5千万ドル
•不動産、工場、設備の購入に2億403億ドル。
2021年12月31日までの1年間、いくつかの重要なキャッシュフローは以下の通りである
•経営活動が提供するキャッシュフローの純額は36.399億ドル
•株式買い戻しに18億ドル
•私たちの個人要約交換(交換要約)に関する1.7億ドル入札した2045年9月15日満期の5.200分の優先債券(2045年優先債券)2051年2月15日満期の新シリーズ3.250%優先債券(2051年優先債券)と現金の購入、入札した2045年優先債券を現金で購入する要約、
•不動産、工場、設備を購入するための2億581億ドル
•所得税支払純額は2兆479億ドル
•神経免疫会社に1億ドルの記念碑的支払いを支払います
私たちの既存の資金は、運営によって生成された現金と結合されており、必要であれば、予測可能な未来における私たちの運営、運営資本、戦略連合、マイルストーン支払い、資本支出、および債務超過需要を満たすのに十分な追加の融資資源を得ることができると信じている。また、株主に日和見的にキャッシュバックを行い、買収やライセンス活動を含めた他の業務取り組みを行うことが可能です。私たちはまた時々新しい協力協定、戦略連合、および追加の株式と債務融資を通じて、または他の側面から追加の資金を求めることができる
出所:重要な新しい機会を特定すべきかどうか.
訴訟和解協定に関するその他の情報は、お読みください付記18、その他の連結財務諸表明細私たちの連結財務諸表は本報告書に含まれている。
私たちの財務状況や将来の経営業績に悪影響を及ぼす可能性のあるリスクに関するより多くの情報をお読みください第1 A項。 RISK要因そして第七A項。市場リスクの定量的·定性的開示について本報告に含まれます。
現金、現金等価物、有価証券
私たちの業務が他の用途に使用される前に、私たちは通常、私たちの投資政策に基づいて、私たちの現金備蓄を銀行預金、預金証書、商業手形、会社手形、アメリカと外国政府ツール、一夜逆買い戻し協定、および他の利息のある取引可能な債務ツールに投資します。私たちの政策は多様なポートフォリオを維持することで、私たちの現金備蓄と有価証券の信用リスクを下げ、機関、期限、投資タイプのリスクを制限することです
2022年12月31日現在、私たちの現金、現金等価物、有価証券の総額は約56億ドルですが、2021年12月31日現在の現金、現金等価物、有価証券の総額は約47億ドルです。2022年12月31日までの現金、現金等価物、および有価証券の2021年12月31日比の変化は、主に、訴訟和解協定および和解費用および支出のための純支払総額9.17億ドル、Samsung Bioepisの株式で受け取った9.903億ドルの純利益の売却、および私たちの建物1棟で販売された5.826億ドルの純収益を含み、2022年9月15日に満期となった3.625%優先債券の償還に使用された10億ドルの現金と株式買い戻しのための7.5億ドルが相殺された。
次の表は、私たちの重要な普通株投資の公正価値をまとめています
| | | | | | | | | | | | | | |
| | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| デナリー | | $ | 370.2 | | | $ | 550.7 | |
| セージ | | 238.0 | | | 231.9 | |
| サンガモ | | 74.3 | | | 173.7 | |
| アイオニス | | 108.6 | | | 87.5 | |
| | $ | 791.1 | | | $ | 1,043.8 | |
契約保有期間はデナリーやサイキーに制限されていますが
SangamoとIonisが満期になったので、私たちがこれらの投資を清算する能力は、私たちの資本規模、市場関連活動の数、私たちが集中している所有権レベル、および私たちが協力者として生じる潜在的な制限によって制限されるかもしれない。したがって、私たちが得た収益はこのような投資の現在の価値よりはるかに低いかもしれない
私たちの連携スケジュールに関する他の情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
投資やその他の資産
2021年12月31日現在、私たちの総合貸借対照表の投資および他の資産には、Samsung Bioepisにおける私たちの投資の帳簿価値5.999億ドルが含まれている。2022年4月、私たちはSamsung Bioepisにおける49.9%の株式をSamsung Biologicsに売却する取引を完了した。この取引の条項によると、私たちは取引完了時に約10億ドルの現金を受け取り、2つの支払いで約13億ドルの支払いを延期する予定で、この2つの支払いはそれぞれ取引完了1周年で満期になった約8.125億ドルと、取引完了後2周年に満了した約4億375億ドルになる見通しだ。
この取引の一部として、私たちはいくつかの商業マイルストーンを達成した後に5000万ドルの追加収入を得る資格がある。今回の取引が完了して2周年後も私たちに支払われていないお金があれば、現金の代わりに残りの満期金額を支払うために、5.0%の割引でサムスン生物普通株の株を得ることができます。現在、サムスン生物が満期金をタイムリーに支払うことができなかった可能性はわずかだと考えられている。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置私たちの連結財務諸表は本報告書に含まれている。
資本支出
2021年3月、我々は、複数の治療領域にわたる遺伝子治療パイプラインを支援するために、ノースカロライナ州のRTPに新しい遺伝子治療製造工場を設立する計画を発表した。新たな製造施設は約19.7万平方フィートで、2023年末に運営を開始する予定で、総投資は約1.95億ドルと予想されている。この新施設の建設は2021年第4四半期に始まった。
借金をする
2021年2月、私たちは次のような交換見積もりを完了しました
•2045年優先債券の元金総額は6.246億ドル、2051年優先債券の元本総額7.07億ドルと現金支払い総額約1兆518億ドルに両替された
•私たちは2045年の優先手形の元金総額は890万ドルで、約1210万ドルの現金支払い総額を償還し、課税利息や未払い利息は含まれていない。
以下に,現在返済されていない2020年に発行された優先無担保手形(2020優先手形)の概要を示す
•元金総額15億元、金利2.25分の優先債券は、2030年5月1日に満期となる
•元金総額15億元、金利3.15%の優先債券は、2050年5月1日に満期となる。
以下は、2015年に発行された現在返済されていない優先無担保手形(2015高級手形)の概要です
•元金総額17.5億元、金利4.05分の優先債券は、2025年9月15日に満期となる
•元金総額11.2億元の優先債券は、元金5.20%で、2045年9月15日に満期となる。
私たちの2020年の高級債券と2015年の高級債券は割引価格で発行され、これらの債券は発行から満期までの間に追加の利息支出として償却される。
2022年7月、2022年9月15日に満期となった3.625分の優先債券を償還し、元金総額は10億ドルとなった。
私たちの高級ノートに関する他の情報は、お読みください付記13、負債私たちの連結財務諸表は本報告書に含まれている。
2022年12月31日と2021年12月31日までの未返済借入金の公正価値概要については、お読みください付記8、公正価値計量、私たちの連結財務諸表はこの報告書に含まれている。
信用手配
2020年1月、私たちは10億ドル、5年間の優先無担保循環信用手配を締結し、この計画によると、運営資金と一般企業用途のための資金を抽出することが許可された。循環信用手配の条項には金融ローンが含まれています
私たちが最高の総合レバレッジ率を超えないことを要求する協約。
2022年12月31日と2021年12月31日現在、未返済の借金はなく、この手配されたすべての契約を守っています。
運営資金
運営資本の定義は流動資産から流動負債を差し引くことである。2022年と2021年12月31日現在、運営資本はそれぞれ65億ドルと36億ドル。運転資本の変化は流動資産総額が約19億ドル増加し、流動負債総額が約10億ドル減少したことを反映している
流動資産
流動資産総額が増加した要因は以下のとおりである
•現金、現金等価物、有価証券は純増加し、経営活動により提供される純現金流量は約13.843億ドル
•Samsung Bioepisで販売されている株から約9億903億ドルの現金(費用控除)を得た
•サムスンバイオ社の約7億988億ドルの売掛金を記録し、サムスンバイオ社における当社の株式の一部を売却した
•約5.826億ドルの現金収入は私たちの建物の売却と関係がある。
この成長は、2022年9月15日に満期となった3.625%優先債券の現金、7.5億ドルの株式買い戻し、9.17億ドルの訴訟和解合意および和解費用と支出の一部相殺に使われている。
流動負債
流動負債総額が減少した要因は以下のとおりである
•2022年9月15日に満期となり、金利3.625の優先債券を償還し、約10億ドルを償還し、2021年の流動負債に分類する
•私たちは勘定の減少を払わなければならない。
共有買い戻し計画
2020年10月、我々の取締役会は、50億ドルに達する普通株を買い戻す計画である2020年の株式買い戻し計画を承認した。私たちの2020年の株式買い戻し計画は満期日がありません。2020年の株式買い戻し計画に基づいて行われるすべての株買い戻しハース
計画は引退するだろう。2020年の株式買い戻し計画によると、私たちは約2億ドルを買い戻して撤退しました360万、600万株と160万株の普通株で、コストは約7億5千万ドル2022年12月31日と2021年12月31日までの年間はそれぞれ18億ドルと4.0億ドルである2020それぞれ,である.大ざっぱに21億ドル2020年の株式買い戻し計画によると2022年12月31日。
2019年12月、我々の取締役会は、2020年9月30日に完了する50億ドルに達する普通株を買い戻す2019年12月の株式買い戻し計画を承認した。私たちの2019年12月の株式買い戻し計画によると、買い戻したすべての株が解約されました。2019年12月の株式買い戻し計画によると、私たちは約1670万株の普通株を買い戻し、解約しました。コストは
2020年12月31日までの年間で約50億ドル。
2019年3月、我々の取締役会は、2020年3月31日に完了する50億ドルまでの普通株を買い戻す予定の2019年3月の株式買い戻し計画を承認しました。私たちの2019年3月の株式買い戻し計画によると、買い戻したすべての株が解約されました。我々の2019年3月の株式買い戻し計画によると、2020年12月31日までの年間で、約410万株の普通株を買い戻し、解約し、コストは約13億ドルとなっている。
2022年8月、アイルランド共和軍は法律に署名した。その他を除いて、アイルランド共和軍は2022年12月31日以降の株の純買い戻しに消費税を1.0%徴収している。歴史的に、私たちは自由に選択可能な株の買い戻しを行ったことがある。
キャッシュフロー
次の表は私たちのキャッシュフロー活動をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 | | 変更率 |
| | | 2022
V.v.
2021 | | 2021
V.v.
2020 |
| (単位:百万、百分率を除く) | | 2022 | | 2021 | | 2020 | |
| 経営活動提供のキャッシュフロー純額 | | $ | 1,384.3 | | | $ | 3,639.9 | | | $ | 4,229.8 | | | (62.0) | % | | (13.9) | % |
| 投資活動が提供するキャッシュフロー純額 | | 1,576.6 | | | (563.7) | | | (608.6) | | | 379.7 | | | (7.4) | |
| 融資活動が提供する現金流量純額 | | (1,747.3) | | | (2,086.2) | | | (5,272.7) | | | (16.2) | | | (60.4) | |
経営活動
経営活動のキャッシュフローとは,投資や融資活動以外のすべての活動に関する現金収入と支出のことである。私たちは、経営活動が提供する現金が、予測可能な未来に運営需要と資本支出に資金を提供する主要な源であると予想している。
運営キャッシュフローは、以下の各項目の純収入を調整することで得られる
•減価償却と償却、減価費用、戦略投資が収益(損失)、買収した知的財産権の研究開発と株式に基づく報酬などの非現金経営プロジェクト
•経営性資産と負債の変化は、取引に関する現金の受取と業務結果で確認された時間差を反映している
•私たちの買収業務に関連する、または支払いと連携に関連する支払いの公正価値の変化があります。
2022年は2021年に比べて業務活動が提供するキャッシュフロー純額が減少した
主な原因は,2022年の収入低下,訴訟和解協議による純支払い9.17億ドルおよび和解費用と支出,支払期間および2022年の所得税純支払いの増加である。高い納税分は,研究開発のための支払いの減税限度額が変化したためである。
投資活動
2022年に2021年と比較して、投資活動が提供する純現金フローが増加したのは、主にSamsung Bioepisの49.9%の株式を2022年第2四半期に売却して得られた9.903億ドルの費用純額と、2022年第3四半期に私たちの建物を売却して得られた5億826億ドルの純収益によるものだ。
融資活動
2021年と比較して、2022年の融資活動のための純キャッシュフローが減少した要因は、2022年の株式買い戻しが11億ドル減少したが、2022年の債務返済は8.322億ドル増加し、この影響を部分的に相殺したことだ。
契約義務と表外手配
契約義務
次の表は、以下に述べるように、不確定な税金状況、資金承諾、または発展、規制および商業マイルストーン支払い、または支払いがあるか、または対価格に関する金額は含まれていない2022年12月31日までの契約義務をまとめている。 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 期限どおりの支払い |
| (単位:百万) | | 合計する | | 少ないです
1年 | | 1 to 3
年.年 | | 3 to 5
年.年 | | その後…
5年間 |
取消不能な経営賃貸借契約(1)(2)(3) | | $ | 364.2 | | | $ | 82.7 | | | $ | 140.8 | | | $ | 110.3 | | | $ | 30.4 | |
長期債務債務(4) | | 10,262.4 | | | 232.7 | | | 2,197.7 | | | 323.7 | | | 7,508.3 | |
購入やその他の債務(5) | | 917.2 | | | 306.7 | | | 600.6 | | | 1.7 | | | 8.2 | |
| 固定収益義務 | | 90.8 | | | — | | | — | | | — | | | 90.8 | |
| 契約債務総額 | | $ | 11,634.6 | | | $ | 622.1 | | | $ | 2,939.1 | | | $ | 435.7 | | | $ | 7,637.7 | |
(1)私たちは私たちの業務に不動産と設備をレンタルします。上の表に示した額は、12月31日までの各列報期間中に経営賃貸項目を解約できない将来の最低賃貸料承諾額を詳細に説明している。最低賃貸料約束以外に、これらのレンタル契約は追加の税金、保険、メンテナンス、その他の運営費用を支払う必要があるかもしれません
(2)債務はマサチューセッツ州ウェストンの施設と世界各地の他の施設の空き部分を差し引くと予想される転貸収入を差し引いた純額です。
(3)2022年9月、私たちはブロードウェイ125号にある建物とブロックの販売を完成しました。同時に、この取引の完了に伴い、私たちはビルを借りて、レンタル期間は約5.5年です。ブロードウェイ125号の販売とレンタル取引に関するもっと多くの情報は、お読みください付記11,財産·工場·設備そして別注12,賃貸借契約私たちの連結財務諸表は本報告書に含まれている。
(4)長期債務義務は、我々が2015年の優先債券、2020年の優先債券、私たちの2021年に交換して提供する優先債券に関連しており、元金と利息支払いを含む。
(5)買収及びその他の債務には、5.58億ドルと累計外国子会社が以前に納税していなかった海外収益の一度に送金税(過渡的通行料税)とみなされる余剰支払いと、デリバティブ契約負債純額公正価値に関する2,600万ドルが含まれている。
特許権使用料支払い
T@@ ys@@ ab@@ ri
Tysabriの年間20億ドルの全世界の純売上高に18.0%または支払いが義務付けられ、20億ドルを超えるTysabriの全世界の年間純売上高に25.0%または支払いが義務付けられている。特許使用料の支払いは私どもの総合損益表で販売コストであることが確認されました。
SPINRAZA
我々は,11.0%から15.0%の階層的特許権使用料税率を用いてSPINRAZAの年間グローバル純売上高に特許使用料を支払い,これらの特許権使用料は我々の総合損益表で販売コストであることを確認した.
虚栄心
Alkermes plc(Alkermes)の子会社Alkermes Pharmaアイルランド株式会社にVUMERITYグローバル純売上高の特許権使用料を支払い、使用料税率は15.0%であり、我々の総合損益表で販売コストであることを確認した。
2019年10月、私たちは新しいプロビジョニング協定を締結し、AlkermesとのVUMERITY許可と協力協定を修正しました。技術移転を開始することにしました
過渡期の後、VUMERITYまたは第三者によるVUMERITYを製造するために、私たちまたは私たちが指定した人によって製造されたVUMERITYの将来のグローバル商業純売上高の任意の部分のより高い印税をAlkermesに支払いました。
Alkermesと協力して手配したもっと多くの情報について、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
開発、規制、商業マイルストーンの支払いがあります
私たちの2022年12月31日までの開発計画によると、私たちの様々な協力の一部として、私たちの様々な協力の一部として、約20億ドルの開発マイルストーン、約5億ドルの規制マイルストーン、約68億ドルのビジネスマイルストーンを含む約93億ドルの潜在的マイルストーン支払いを将来的に第三者に支払うことを触発する可能性があります。これらのプロトコルの下での支払いは、一般に、いくつかの開発、管理、またはビジネスマイルストーンに達したときに満了し、支払われる。これらのマイルストーンの実現は可能だとは考えられていないからです
2022年12月31日現在、私たちの財務諸表にはこのような事項や事項が記録されていません。いくつかの開発、規制、または商業マイルストーンの成功達成に依存するので、マイルストーン支払いに関連する金額は契約債務とみなされない
いくつかの臨床とビジネスのマイルストーンに達したら、私たちの現在の合意によると、2023年に3.562億ドルまでのマイルストーン費用を支払うかもしれません。これは、SageがMDDおよびPPDの潜在的治療のために米国で初めて商業販売されたZuranoloneの合計2.25億ドルのマイルストーンを含む。
他の出資約束
2022年12月31日現在,われわれは異なる臨床試験段階でいくつかの臨床研究を行っている。私たちの最も重要な臨床試験支出はCROだ。CROとの契約は通常、私たちの選択の下でキャンセルし、別途通知することができます。2022年12月31日現在、連結貸借対照表ではCROで発生した支出のために約2040万ドルの支出を記録している。2022年12月31日までの既存のCRO契約によると、将来の約束をキャンセルできる約9.29億ドルがあります。
税収に関する義務
私たちはそれぞれの税務機関との現金決済期間を確実に見積もることができないので、不確定税務状況に関する負債を私たちの契約債務要約から除外します。2022年12月31日現在、不確定な税収状況に関する負債は約1兆546億ドルである。
2022年12月31日と2021年12月31日現在、過渡的通行税項下での課税所得税負債はそれぞれ約5.58億ドルと6.33億ドルである。2022年12月31日までの課税額のうち、1年以内に約1兆378億ドルが支払われる見通しだ。過渡的通行税は2018年から8年以内に分期納付され、利息は発生しない。
その他の表外手配
我々は,表外手配を促進するために設けられた構造的融資や特殊な目的実体と呼ばれるエンティティとは何の関係もない.したがって、私たちがこのような関係に参加すれば、私たちはいかなる融資、流動性、市場、または信用リスクにも直面しないだろう。もし私たちが主な受益者なら、私たちは可変利益実体を統合するだろう。
新会計基準
新しい会計基準に関する議論は、お読みください付記1、重要会計政策の概要、私たちの連結財務諸表はこの報告書に含まれている。
法律事務
2022年12月31日までの法律問題に関する議論は、お読みください注21訴訟私たちの連結財務諸表はこの報告書に含まれている。
重要な会計政策と試算
我々の総合財務諸表は米国公認会計原則(米国公認会計原則)に基づいて作成され、資産、負債、権益、収入および費用に影響を与える可能性のある報告金額、あるいは資産と負債の関連開示の推定、判断、仮定を行うことが求められている。持続的な基礎の上で、私たちは私たちの推定、判断、そして仮定を評価する。我々は過去の経験や我々が合理と考えている他の様々な仮定から推定しているが,これらの仮定の結果は資産,負債および権益の帳簿価値および収入および支出金額を判断する基礎となっている.実際の結果はこれらの推定とは異なる可能性がある。他の重要な会計政策の概要は付記1、主要会計政策の概要私たちの連結財務諸表は本報告書に含まれている
収入確認
私たちの顧客が約束された商品やサービスのコントロール権を獲得した時、私たちは収入を確認し、その金額は私たちが予想していたこれらの商品やサービスと交換した対価格を反映しています。財務会計基準委員会(FASB)会計基準編纂606に規定されている5段階モデルに従って収入を確認した取引先と契約した収入:(I)顧客との契約を決定すること、(Ii)契約中の履行義務を決定すること、(Iii)取引価格を決定すること、(Iv)契約に取引価格を割り当てる履行義務、および(V)契約義務を履行する際に収入を確認すること。
製品収入
アメリカでは、私たちは主に卸売と専門ディーラーと専門薬局に私たちの製品を販売します。他の国では、私たちは主に卸売業者、病院、薬局、その他の第三者流通パートナーに私たちの製品を販売します。これらのお客様はその後、私たちの製品を転売します
衛生保健提供者と患者ですまた,医療提供者や支払者と合意し,我々の製品に関連する政府が強制的または私的に協議する割引や手当を規定している。
製品収入は,顧客が我々の製品に対する制御権を獲得したときに確認され,これはある時点で発生し,通常は顧客に渡す際である.もし私たちが確認すべき資産の予想償却期間が1年以上かそれ以下の金額であれば、契約が発生したときに契約を得るための増額コストを支出する。
割引と手当準備金
製品収入は、当社が業務を展開しているいくつかの国際市場で定価行動を実施することに関する割引や手当を含む、私たちの顧客、医療提供者、または支払者との契約に提供される割引および手当を差し引いた準備金です。私たちはこれらの可変対価格部分のために設立された準備金の過程は私たちの歴史的なやり方と実質的な差はないと推測する。
製品収入準備金は製品収入の減少に分類され、通常は以下のように表現される:割引、契約調整、リターン。
これらの準備金は、関連販売によって稼いだ金額または請求される金額の推定に基づいており、売掛金の減少(その金額が私たちの顧客に支払われるべきである場合)または負債(その金額が私たちの顧客以外の方に支払われるべきである場合)に分類される。我々は可変対価格準備の準備金の見積りを我々の手法の一致適用によって計算し,期待値法を採用した.これらの推定は、我々の歴史的経験、現在の契約および法的要件、特定の既知の市場イベントおよび傾向、業界データ、および予測された顧客購入および支払いパターンを反映する。取引価格は、割引や割引の影響を反映した可変対価格が含まれており、制限される可能性があり、確認された累積収入金額が今後の期間に大きな逆転が生じない可能性が高い場合にのみ、販売純価格を計上する。実際の金額は最終的に私たちの見積もりとは違うかもしれない。実際の結果が異なれば,これらの見積りを調整し,調整期間内の報酬に影響を与える可能性がある.
2022年12月31日まで、割引、契約調整と準備金は10.0%変化しました
私たちの税引前収益の約3兆386億ドルの減少につながるだろう。
割引、リベートと製品の返品以外に、流通ルートの流通業者と他の顧客と一定の顧客サービス契約を維持して、在庫管理、データと流通サービスを提供してくれます。これは通常収入の減少に反映されます。これらのサービスの分離可能な収益と公正な価値を証明できる範囲で、私たちは私たちの総合損益表でこれらの支払いを販売、一般、行政費用に分類します。
私たちの収入に関するもっと多くの情報は、お読みください付記5、収入私たちの連結財務諸表は本報告書に含まれている。
在庫品
各報告期間において、在庫が過剰または時代遅れであるかどうかを検討し、古いまたは他の方法では販売できない在庫をその推定された可変現純値に減記する。時代遅れまたは過剰な在庫を決定するためには、管理層は、私たちの製品の将来の需要、製品の満期日、推定された将来の売上高、および私たちの全体的な未来計画の仮定に基づいて見積もる必要があります。もし顧客の需要がその後私たちの予測と違う場合、私たちは追加の在庫費用を記録する必要があるかもしれない。
在庫減記を推定するための仮定は合理的であると考えられるが,これらの仮定の将来の重大な変化や将来のイベントや市場状況の変化が異なる見積りをもたらす可能性は保証されない.
2021年にはADUHELMに関する予測需要を超えて約1.2億ドルの在庫を解約した.2022年第1四半期、CMSの最終決定により、約2.75億ドルを解約しました。
2022年12月31日現在、我々ADUHELM在庫の帳簿価値は取るに足らない。2021年12月31日現在、約2.23億ドルのADUHELM在庫を保有しています。
知的財産権の研究開発を含む買収された無形資産
私たちが1つの企業を買収する時、買収した知的財産権の研究開発は公正な価値で計量し、無形資産として資本化し、そして少なくとも毎年減値テストを行い、10月31日まで、商業化まで、その後、知的財産権の研究開発はその推定使用寿命内に償却する。私たちが買収した1つまたは1組の資産が適用会計基準の下での業務定義に適合していない場合、買収された知的財産の研究開発はその買収日に支出される。これらの資産を開発する将来のコストを記入する
発生した研究と開発費用。
私たちはバイオテクノロジー会社を買収したり、可変利益実体を合併することで無形資産を獲得しており、これらの資産を引き続き獲得する予定です。これらの無形資産は主に人類治療製品と候補知的財産権研究開発製品に関連する技術を含む。重要な識別可能な無形資産が買収された場合、私たちは通常、独立した第三者評価会社を招いて、これらの資産の買収日までの公正な価値の決定に協力する。経営陣は買収されたあまり重要ではない識別可能な無形資産の公正価値を決定するだろう。割引キャッシュフローモデルは、一般に、これらの推定値のために使用され、これらのモデルは、これらに限定されるものを含むが、重要な推定および仮定を使用する必要がある
•建設中のプロジェクトの完了時間と予想コストを見積もる
•規制の承認を計画する
•製品および進行中のプロジェクトによって生成された製品販売の将来のキャッシュフローを推定すること;
•項目に応じて適切な割引率と確率率を作成した。
私らは、買収された無形資産に分配された公正な価値は、買収日の既存の事実と状況下の合理的な推定と仮定に基づいていると信じている。
これらのプロジェクトが成功しなければ、会社の販売や収益力は将来的に悪影響を受ける可能性がある。しかも、買収された無形資産の価値は減価されるかもしれない。予想されるプロジェクトの売上、開発コストまたは収益性、またはそのようなプロジェクトに関連するイベントを推定するための基本的な仮定は、推定されたように発生する保証はない。
長期資産の減価と償却
保有及び使用すべき長期資産には、財産、工場及び設備、並びに知的財産権研究開発及び商標を含む無形資産が含まれる。事件や状況の変化が資産の額面が回収できない可能性があることを示す場合、物件、工場、設備は減値の有無を検査される。私たちは十月三十一日から毎年私たちの無形資産の減価を審査して、事件や状況の変化がある資産の帳簿価値を示す限り回収できないかもしれません。
減価評価を行う際には,上記と同様の方法で公平価値を計算するあさって
知的財産権の研究開発を含む無形資産それは.もし私たちが買収した知的財産権研究開発の帳簿価値がその公正価値を超える場合、無形資産はその公正価値に減記される。私たちが買収した知的財産権研究開発の公正な価値を決定する際に使用される推定と仮定の変化は減値を招く可能性がある。減値は総合損益表で買収された無形資産の償却と減価に計上されている。
我々の最新の減価評価によると、私たちは2022年12月31日と2021年12月31日までの年度にそれぞれ約1.196億ドルと6.293億ドルの減価費用を発生し、主に知的財産権研究開発計画の中断と関係がある。私たちの損傷に関するより多くの情報は付記7、無形資産及び商業権私たちの連結財務諸表は本報告書に含まれている。
私たちの最も重要な無形資産は私たちが獲得して許可した権利と特許だ。取得され許可された権利および特許は、主に私たちがTysabriを買収するすべての残りの権利と関連がある。我々は,関連無形資産関連製品による収入に基づく経済消費法を用いて,我々が販売している製品に関連する無形資産を償却する。私たちの長期計画期間内で、そして事件や環境変化が関連製品の期待寿命収入に重大な影響を与えるたびに、私たちは毎年私たちのマーケティング製品の期待寿命収入を分析します。
2022年、2021年、2020年私たちの長期資産に関する減価費用に関するより多くの情報をお読みください付記7、無形資産と商業権、私たちの連結財務諸表はこの報告書に含まれている。
値段が合うかもしれない
私たちは買収日の公正価値によって企業合併によって発生したか、または価格を記録します。その後の報告期間ごとに、余剰債務を再評価し、対価格費用の調整として、私たちの総合損益表にその公正価値の増減を記録します。私たちまたは対価格債務の公正な価値の変化は、販売および開発マイルストーンに基づく任意の累積販売および開発マイルストーンの割引率および実現時間の調整、またはいくつかの臨床イベントの確率の変化、および規制承認に関連する仮説確率の変化を含む1つまたは複数の投入の変化による可能性がある。これらの公正価値計量は第三級計量に属し、それらは市場では観察できない重大な投入に基づいているからである。
これらの仮定の妥当性を決定する際には,買収日以降の各時期までの重大な判断を採用した.したがって、上記の仮定の変化は、任意の所与の期間に記録された、または価格費用に大きな影響を与える可能性がある。
所得税
私たちは私たちの各管轄区域の税金法律法規の解釈に基づいて所得税申告書を準備して提出します。私たちの総合財務諸表を作成する際には、私たちの実際の当期税費支出を推定し、税収と財務報告目的によるプロジェクトの処理によって生じる一時的な差異を評価することで、私たちが経営している各司法管轄区の所得税負債を推定します。これらの違いは、私たちの総合貸借対照表に含まれる繰延税金資産と負債をもたらす。2018年第4四半期に世界無形低税収入(GILTI)繰延税額を記録するために選ばれた場合、GILTI税に関する金額を一時的な差額に計上しました。
私たちの繰延税金資産の現金化能力を評価する際には、重大な経営陣の判断力が必要だ。この評価を行う際には、繰延税金資産の一部または全部が現金化できない可能性が高いかどうかを考慮します。繰延税金資産の最終的な現金化は、これらの一時的差額控除可能期間中に生成された将来の課税所得額に依存する。この決定を下す際には、適用される財務会計基準に基づいて、繰延税金負債の予定引抜き、将来の課税所得額、および税務計画戦略の影響を考慮することが許可される。もし実際の結果が私たちの見積もりと違っていれば、今後の間に私たちの推定を調整し、推定手当を確立する必要があるかもしれません。これは私たちの総合的な財務状況と運営結果に大きな影響を与えるかもしれません。
不確定な税収状況を確認·解決するために“より可能性の高い”敷居を用いて、不確定な税収状況を計算する。我々は四半期ごとに不確定な税務状況を評価し、税法の変化、納税申告書に採用されているまたは予想される税収状況の測定、監査すべき事項の効果的な解決、監査活動の過程で得られた情報、および税収状況に関連する事実または状況の変化を含むが、様々な要素を考慮する。私たちは不確定な頭寸をめぐる関連事実の任意の後続の変化を反映するために負債レベルを調整する。税務状況を確定しない責任は法律上削除または事項がある場合にのみ免除され、通過することができます
税務機関への支払いにおいても,訴訟時効が満了した場合でも,そのポストに関する利益の確認は“該当しない可能性が高い”というハードルに達したり,審査手続きにより債務を効率的に解決したりしている。著者らは、税務機関がそのすべての規定または予想される審査手続きを完了すると、すべての控訴および行政覆核を含むと考えており、私たちは税務状況のいかなる方面についても控訴したり、訴訟を提起する計画はないが、税務当局は関連する税務状況を審査または再審査する可能性が高いと信じている。私たちはまた、所得税支出で確認されていない税金優遇に関する潜在的な利息と罰金を計算しなければならない。
第七A項。市場リスクの定量的·定性的開示について
私たちはいくつかのリスクの影響を受けます。これらのリスクは私たちの経営業績、キャッシュフロー、資産と負債の公正な価値、外貨為替レートの変動、金利変動と株価開放、そして新冠肺炎の疫病とウクライナの衝突による私たちの業務を展開する市場の経済状況の変化を含むかもしれません。我々は各種金融ツールを通じて外貨為替レートと金利の影響を管理しており、外貨長期契約、金利ロック契約、金利スワップ契約などの派生ツールを含む。私たちは取引や投機を目的として金融商品を注文しない。これらの契約の取引相手はいずれも主要な金融機関であり、いずれの取引相手とのリスクも明らかに集中していない。
外貨両替リスク
私たちの業務の世界的なため、私たちの業務結果は外貨為替レートの変動の影響を受けます。そのため、私たちの総合財務状況、経営業績とキャッシュフローは外貨為替市場の変動の影響を受ける可能性があり、主にユーロ、ポンド、カナダドル、スイスフランと円に対する為替レートの変動です。
私たちのグローバル業務の財務結果はドルで報告されていますが、私たちの大多数の海外子会社のビットコインはそれぞれの現地通貨です。私たちが業務を行っている国の外貨為替レートの変動は私たちの経営業績に影響を与え、通常は予測困難な方法で行われています。特に、ドルが他の通貨に強くなるにつれて、ドルで報告すると、非米国収入の価値が低下する。ドルが強くなることが純利益に与える影響は
非米国支出の価値は緩和され、ドルで報告されると、非米国支出も減少するだろう。ドルが他の通貨に弱くなるにつれて、ドルで報告すると、非米国の収入と支出の価値が増加するだろう。
我々はすでに収入と運営費用のヘッジと貸借対照表のリスク管理計画を構築し、未来の外貨キャッシュフローの変動と外貨為替レートの変動による公正な価値変化を防止する。
2018年第2四半期、監査品質センター国際実践ワーキンググループはアルゼンチンを3年間の累計インフレ率が100.0%を超えると予想される国に分類し、アルゼンチン経済が高度なインフレ状態にあることを示した。この分類は私たちの2022年12月31日までの運営業績や財務状況に実質的な影響を与えず、将来的にも私たちの運営業績や財務状況に実質的な影響を与えないと予想される。
収入と運営費ヘッジ計画
我々の外国為替ヘッジ計画は、時間の経過とともに、為替変動が収入や運営費用に与える部分的な影響を緩和することを目的としている。私たちは外貨長期契約と外貨オプションを使用して外貨リスクを管理します。私たちの大部分の長期契約は今後12ヶ月の外貨建てのある予測収入と運営費用取引に使われます。私たちは通貨投機に参加しない。私どもの収入と運営費ヘッジプランの詳細については、お読みください10派生ツール私たちの連結財務諸表はこの報告書に含まれている
外貨為替レート変動が収入や純収入に与える影響を軽減する能力が弱まっており、外貨為替レートの大幅な変動が長く続いているためである。特に、外貨レートの切り下げや大幅な悪化は緩和しにくく、収益にマイナス影響を与える可能性がある。これらの契約のキャッシュフローは私たちの総合キャッシュフロー表で経営活動として報告されています。
貸借対照表リスク管理対沖計画
私たちはまた長期契約を使用して、ある貸借対照表プロジェクトに関連する外貨開放を減少させる。私たち貸借対照表リスク管理計画の主な目標は外国の付属会社の外貨建ての純資産と負債の開放を減らすことです。このような場合、私たちは主に長期通貨を使用する
契約します。私たちは貸借対照表に関連した項目についてヘッジ会計を選択しなかった。これらの契約のキャッシュフローは私たちの総合キャッシュフロー表で経営活動として報告されています。
以下の定量化情報には、レート変動が、私たちの収入、運営費用、および貸借対照表が沖計画で使用される長期契約に与える影響を含む。2022年12月31日と2021年12月31日までに、すべての期限の外貨為替レートのドルに対する不利な変動を10.0%と仮定すると、長期契約の公正価値がそれぞれ約2.937億ドルと3.331億ドル減少する。公正価値変動を推定するのは、仮定為替変動が未平倉長期契約に与える影響を測定することによって決定される。我々はこのようなツールの市場リスクが仮説の影響を受けることを定量化する手法を用いており,実際の影響は大きく異なる可能性がある.すべての外貨操作取引を考慮していないため、市場リスクに関する数量化情報は限られている。
金利リスク
私たちのポートフォリオは現金等価物と短期投資を含む。市場金利の潜在的な変化により、私たちの有価証券の公正価値は変化する可能性がある。金利感応型ツールの公正価値の潜在的変化は,想定した100ベーシスポイントの全期限の逆変動に基づいて評価された。2022年12月31日と2021年12月31日までに、この仮定の100ベーシスポイントの逆変動は、我々の金利感受性ツールの公正価値仮定損失をそれぞれ約1170万ドル、1430万ドルにもたらすと予想される。私たちが投資する公正な価値は、第三者定価サービスまたは他の観察可能な市場データを使用して決定される。
信用リスク
私たちが集中的な信用リスクに直面させる可能性のある金融商品には、現金と現金等価物、投資、派生商品、売掛金が含まれる。私たちは、広く多様な金融商品に投資することで、現金や現金等価物や投資に関連するリスクを最小限に抑えることを試みている。我々は,元本残高の保障と流動性の維持を目的とした信用格付けと満期日に関するガイドラインを策定した。私たちのポートフォリオは私たちの投資政策に基づいて維持されており、この政策は許可された投資を定義し、信用品質基準を規定し、任意の単一発行者の信用開放を制限している。我々は取引相手として格付けの高い金融機関のみを選択し、デリバティブによる信用リスクを最小限に抑える。
私たちはいくつかの国で業務を展開していますが、これらの国では、経済状況は疲弊しており、新冠肺炎疫病とウクライナ衝突の影響を含め、受取期間の延長を招く可能性があります。私たちは、国際経済や関連金融市場に関連する変動を含めて、これらの状況を引き続き監視し、私たちの業務に及ぼす可能性のある影響を評価します。今まで、私たちは売掛金の回収について何の重大な損失もありませんでした。
私たちは2022年12月31日と2021年12月31日まで、私たちの不良債権準備が十分だと信じている。
持分価格リスク
私たちの戦略的ポートフォリオはいくつかのバイオテクノロジー会社の株式証券への投資を含む。私たちがこのような証券を持っている時、私たちは株式価格リスクの影響を受けます。これは株式投資の公正価値が変化したので、将来の収益の変動性を増加させるかもしれません。私たちは私たちの業務に基づいて、私たちの価格リスクを制限することが含まれている可能性があるこのような株式証券の売却を考慮するかもしれない。
これらの権益証券の公正価値変動は株式市場の変動や一般経済状況の変化などの要素の影響を受ける。株価敏感ツールの公正価値の潜在的変化を想定した10.0%の不利な変動で評価された。2022年12月31日と2021年12月31日現在、仮定した10.0%の不利な変動は、公正価値をそれぞれ約7910万ドルおよび1.048億ドル減少させると仮定している。
項目8.財務諸表と補足データ
本プロジェクト8に必要な資料は、本報告のF−1~F−79ページに記載されており、ここに組み込まれて参考となる。
項目9.会計·財務開示面の変化と会計士との相違
ない。
第9条。制御とプログラム
財務報告書の開示統制と手続きと内部統制
制御とプログラム
私たちは、経営陣、最高経営責任者、財務責任者を含む監督と参加の下で、以下の項目の有効性を評価した
2022年12月31日現在、当社の開示制御及びプログラムの設計及び運用(1934年証券取引法改正規則13 a−15(E)又は15 d−15(E)で定義されている)。この評価によると、本報告で述べた期間が終了するまで、我々の開示制御および手順は、効率的に確保されていると結論した
(A)証券取引法に基づいて提出または提出された報告書において開示を要求する情報が、米国証券取引委員会の規則および表に規定された時間内に記録、処理、集約および報告されているかどうか、および
(B)これらの資料は蓄積され、適切な場合には、必要な開示に関する決定をタイムリーに行うために、私たちの主要行政官および主要財務官を含む私たちの経営陣に伝達される
我々の開示制御およびプログラムを設計·評価する際には、任意の制御およびプログラムは、設計および動作がどんなに良好であっても、予想される制御目標を達成するために合理的な保証を提供することしかできず、我々の管理層は、可能な制御とプログラムの費用対効果関係を評価する際にその判断を適用しなければならないことを認識している。
財務報告の内部統制の変化
2022年12月31日までの四半期内に、財務報告の内部統制には何の変化もなく、これらの変化は、私たちの財務報告の内部統制に大きな影響を与えたり、合理的になったりする可能性がある。
経営陣財務報告内部統制年次報告書
私たちの経営陣は私たちの財務報告書に対する十分な内部統制を確立して維持する責任がある。財務報告の内部統制は、証券取引法規則13 a-15(F)および15 d-15(F)において、会社の主要幹部と主要財務官が設計またはその監督の下で、米国公認会計原則に基づいて財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供するために、会社の取締役会、管理層、その他の人員によって実施されるプログラムとして定義されている。私たちの財務報告書に対する内部統制は以下の政策と手続きを含む
•私たちの資産に対する私たちの取引と処置を合理的で詳細かつ正確に反映した記録を保存することと関連がある
•アメリカ公認会計原則に基づいて財務諸表を作成するために取引が必要と記録されていることを保証し、私たちの収支は私たちの経営陣と取締役の許可のみに基づいて行われることを保証します
•当社の財務諸表に重大な影響を及ぼす可能性のある不正な取得、使用、または処理を防止またはタイムリーに発見することができる合理的な保証を提供します。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。将来的にどのような有効性評価を行うかの予測には,条件の変化により制御が不十分になる可能性がある,あるいは政策やプログラムを遵守する程度が悪化する可能性があるというリスクがある.
私たちの経営陣は、2022年12月31日までの財務報告書の内部統制に対する我々の有効性を評価した。この評価を行う際には,管理層は,トレデビル委員会後援組織委員会が2013年の内部統制−総合枠組みで提案した基準を用いた。
我々の評価によると、我々の経営陣は、2022年12月31日現在、財務報告に対する内部統制がこれらの基準に基づいて有効であると結論している。
2022年12月31日現在、財務報告の内部統制の有効性は、その認証報告に記載されているように、独立公認会計士事務所の普華永道会計士事務所によって監査されており、この報告は本明細書に含まれている。
プロジェクト9 B。その他の情報
ない。
プロジェクト9 Cです。検査妨害に関する外国司法管区の開示
適用されません。
第三部
プロジェクト10.役員、役員、および企業管理
私たちの実行幹事に関する情報はタイトルの下にリストされています私たちの執行官に関する情報は本報告項目1である。私たちのビジネス行動規則は、私たちの主要行政者、主要財務者、主要会計担当者、または財務総監、および類似の機能を実行する人に適用される道徳的規則を含み、私たちのウェブサイトwww.bigen.comに掲示されています“会社の管理“小節”投資家“サイトの一部です私たちは私たちのウェブサイトの同じ位置で私たちの商業行動基準条項の任意の修正または免除に対して必要なすべての開示を行うつもりです
本プロジェクトの残りの部分に対する回答は引用的に題に組み込まれている“提言1-取締役の選出、“バイオ遺伝子会社の会社管理”そして“その他--株主提案“2023年度株主総会の依頼書に含まれています。
プロジェクト11.役員報酬
本プロジェクトに対する回答は,回答の議論を引用して“と題する行政職の報酬について” and “生物遺伝会社のコーポレートガバナンス”2023年度株主総会の依頼書に含まれています。
プロジェクト12.特定の実益所有者の保証所有権及び管理職及び株主に関する事項
本プロジェクトに対する回答は引用でまとめたものである“株式制”そして“株式報酬計画情報”2023年度株主総会の依頼書に含まれています。
項目13.特定の関係および関連取引、および取締役の独立性
本プロジェクトに対する回答は,回答の議論を引用して“と題する関係者と取引しています” and 生物遺伝研究会社のコーポレートガバナンス“2023年度株主総会の依頼書に含まれています。
プロジェクト14.チーフ会計士費用とサービス
本プロジェクトに対する回答は引用的に“”と題する節に組み込まれている2-我が国の独立公認会計士事務所の選抜を承認することを提案する“2023年度株主総会の依頼書に含まれています。
第4部
プロジェクト15.証拠品および財務諸表の添付表
A.(1)連結財務諸表:
以下の財務諸表を本報告の一部として提出します
| | | | | | | | |
| 財務諸表 | | ページ番号 |
| 合併損益表 | | F-2 |
| 総合総合収益表 | | F-3 |
| 合併貸借対照表 | | F-4 |
| 統合現金フロー表 | | F-5 |
| 合併権益表 | | F-6 |
| 連結財務諸表付記 | | F-9 |
独立公認会計士事務所レポート(PCAOB ID)238) | F-78 |
四捨五入の理由で,ある合計は総和ではない可能性がある.
(2)展示品
85ページから始まる“証拠インデックス”に列挙された証拠は、本報告の一部として提出または提供されるか、または参照によって本報告に組み込まれ、本明細書で参照される。
(3)財務諸表添付表
これらの添付表は、適用されないか、または不要であるか、または連結財務諸表およびその付記に含まれているため、省略される。
項目16.表格10-Kの概要
適用されません。
展示品索引
| | | | | | | | |
| 証拠品番号: | | 説明する |
| 2.1† | | Biogen Idec International Holding Ltd.,Elan Pharma International LimitedとElan PharmPharmticals,Inc.の間の資産購入契約は,2013年2月5日であった。2013年2月12日に提出されたForm 8-K/A現在の報告書の添付ファイル2.1として。 |
| 2.2 | | Biogen Inc.とBioverativ Inc.の間の分離プロトコルは,2017年1月31日である.2017年2月2日に我々が提出したForm 8-K現在の報告書の添付ファイル2.1として。 |
| 3.1 | | 改訂および再予約された会社登録証明書。2012年6月30日までの四半期報告書10-Q表の添付ファイル3.1として提出します。 |
| 3.2 | | 会社登録証明書改訂証明書。2015年3月27日に我々が提出したForm 8-K現在の報告書の添付ファイル3.1として。 |
| 3.3 | | 生物遺伝会社が改訂·再登録した証明書は、改訂されました。2021年6月8日に提出され、現在報告されている8-K表の添付ファイル3.1として提出されます。 |
| 3.4 | | 四番目に、添付例が改正されて再制定される。2017年6月9日に提出したForm 8-K現在の報告書の添付ファイル3.1として。 |
| 4.1 | | Biogen Inc.および米国銀行全国協会が2020年4月30日に署名した第2の補足契約は、それぞれ添付ファイルAおよび添付ファイルBに添付されたグローバルチケットの形態を含む。2020年4月30日に我々が提出したForm 8-K現在の報告書の添付ファイル4.2として。 |
| 4.2 | | Aシリーズ優先株とXシリーズ初級参加優先株の権利、優先、特権の説明については、添付ファイル3.1を参照されたい。 |
| 4.3 | | Biogen Inc.と米国銀行全国協会との契約は,2015年9月15日である。2015年9月16日に提出したForm 8-K現在の報告書の添付ファイル4.1として。 |
| 4.4 | | Biogen Inc.と米国銀行全国協会との間の最初の補充契約は、2015年9月15日である。2015年9月16日に我々が提出したForm 8-K現在の報告書の添付ファイル4.2として。 |
| 4.5 | | 第三補充契約は,期日は2021年2月16日であり,Biogen Inc.と米国銀行全国協会が署名した。2021年2月16日に我々が提出したForm 8-K現在の報告書の添付ファイル4.2として。 |
| 4.6 | | 2051年に満期となった3.250%優先手形の形は、私募伝説を持つ世界的な手形の形である。2021年2月16日に我々が提出したForm 8-K現在の報告の添付ファイル4.3として。 |
| 4.7 | | 2051年に満了した3.250%優先チケットの形式は、Sルール図の例を持つグローバルチケットの形態である。2021年2月16日に我々が提出したForm 8-K現在の報告書の添付ファイル4.4として。 |
| 4.8+ | | 証券説明。 |
| 4.9 | | 2021年2月16日、生物遺伝会社、ドイツ銀行証券会社、シティグローバル市場会社は、2051年満期の3.250%優先債券の登録権協定に関する合意を締結した。2021年2月16日に我々が提出したForm 8-K現在の報告書の添付ファイル4.5として。 |
| 10.1 | | 生物遺伝会社、アメリカ銀行、ゴールドマン·サックスアメリカ銀行と他の貸手との間の信用協定は、2015年8月28日である。2015年9月1日に我々が提出したForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.2 | | 信用協定は,期日は2020年1月28日であり,行政エージェント,揺動限度額貸手と信用証発行者である生物遺伝会社,米国銀行と信用証発行者および他の融資先によって達成される。2020年2月3日に我々が提出したForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.3+ | | 信用協定修正案は,期日は2023年2月7日であり,行政代理,揺動限度額貸金人と信用証発行者である生物遺伝会社,米国銀行,ノースカロライナ州および他の貸手との間で署名されている。 |
| 10.4† | | 2回目の改正と再署名は,2010年10月18日にBiogen IDEC Inc.とGenentech,Inc.の間の協力協定に調印された。2010年12月31日現在の10-K表年次報告書に添付ファイル10.5として提出されている。 |
| 10.5† | | Biogen Idec Inc.とGenentech,Inc.の間のGA 101財務条項に関する書面合意は,2010年10月18日であった。2010年12月31日現在の10-K表年次報告書に添付ファイル10.6として提出されている。 |
| 10.6 | | 和解と許可協定は、日付は2017年1月17日で、生物遺伝スイス製造有限会社、生物遺伝国際控股有限公司、Forward Pharma A/Sとその他の各方面が達成した。2017年2月1日に我々が提出したForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.7* | | 生物遺伝会社2017年総合株式計画。我々が2017年4月26日に提出した付表14 Aに関する最終依頼書の付録Bとして提出した。 |
| 10.8* | | Biogen Inc.2017総合持分計画の下で制限株式単位奨励協定の形式。2017年6月30日までの四半期報告書10-Q表の添付ファイル10.2として提出します。 |
| 10.9* | | Biogen Inc.2017総合株式計画の下で市場株式単位奨励協定の形式。2017年6月30日までの四半期報告書10-Q表の添付ファイル10.3として提出します。 |
| 10.10* | | Biogen Inc.2017総合持分計画の下で業績単位奨励プロトコルのフォーマット。2017年6月30日までの四半期報告書10-Q表の添付ファイル10.4として提出します。 |
| | | | | | | | |
| 証拠品番号: | | 説明する |
| 10.11* | | Biogen Inc.2017総合持分計画によると、現金決済の業績単位で合意の形式を奨励する。2017年6月30日までの四半期報告書10-Q表の添付ファイル10.5として提出します。 |
| 10.12* | | Biogen Inc.2017総合株式計画によると、業績株式単位奨励協定の形式(現金決済)。2017年12月31日までのForm 10-K年度報告書の添付ファイル10.10として提出します。 |
| 10.13* | | バイオ遺伝会社2017年総合株式計画下で業績株単位奨励協定の形式。2017年12月31日までのForm 10-K年度報告書の添付ファイル10.11として提出します。 |
| 10.14* | | バイオ遺伝会社2017年総合株式計画下で業績株単位奨励協定の形式。2018年3月31日現在の四半期報告10-Q表の添付ファイル10.1として提出します。 |
| 10.15* | | バイオ遺伝会社の2017年総合株式計画下の業績株単位奨励協定(現金決済)の形。2018年3月31日までの四半期報告書10-Q表の添付ファイル10.2として提出します。 |
| 10.16* | | 生物遺伝会社2017年総合持分計画下の制限株式単位奨励協定(2018年一括移行贈与)の形。2018年3月31日までの四半期報告書10-Q表の添付ファイル10.3として提出します。 |
| 10.17* | | Biogen Inc.2017年総合株式計画下の市場株式単位奨励協定形式(2019年7月からの贈与に適用)。2019年6月30日までの四半期10-Qフォームに、当社の四半期レポートの添付ファイル10.1として提出します。 |
| 10.18* | | バイオ遺伝会社2017年総合持分計画下で業績株単位奨励協定の形式(2019年7月からの贈与に用いられます)。2019年6月30日までの四半期10-Q表に、当社の四半期報告書の添付ファイル10.2として提出します。 |
| 10.19* | | バイオ遺伝会社2017年総合持分計画下の業績株式単位奨励協定(現金決済)の形式(2019年7月からの贈与に用いる)。2019年6月30日までの四半期報告書10-Q表の添付ファイル10.3として提出します。 |
| 10.20+ | | Biogen Inc.2017統合持分計画の下で非限定株式オプション奨励プロトコルの形態。 |
| 10.21* | | Biogen IDEC Inc.2008年に総合持分計画が改正され再スタートされた。2014年3月31日現在の四半期10-Q表には、我々の四半期報告書の添付ファイル10.1として提出されています。 |
| 10.22* | | Biogen IDEC Inc.2008年総合持分計画の下で業績単位奨励協定の形式。2014年3月31日現在の10-Q表四半期報告書に添付ファイル10.2として提出した。 |
| 10.23* | | 生物遺伝研究IDEC会社の2008年総合株式計画下の市場株式単位奨励協定の形式。2014年3月31日現在の10-Q表四半期報告書に添付ファイル10.3として提出した。 |
| 10.24* | | 生物遺伝IDEC会社の2008年総合持分計画下で制限株式単位奨励協定の形式である。2008年8月1日に提出されたForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.25* | | 生物遺伝研究IDEC社の2008年総合株式計画下の非制限株式オプション奨励協定。2008年8月1日に提出されたForm 8-K現在の報告書の添付ファイル10.2として。 |
| 10.26* | | 生物遺伝研究会社の2008年総合株式計画によると、現金決済業績株式奨励協定の形式である。2010年3月31日現在の四半期報告10-Q表の添付ファイル10.1として提出します。 |
| 10.27* | | 生物遺伝会社は2006年に非従業員取締役持分計画を改訂した。2022年3月31日までの四半期報告書10-Q表の添付ファイル10.2として提出します。 |
| 10.28* | | 生物遺伝会社。2015年従業員株購入計画。我々が2015年4月30日に提出した付表14 Aに関する最終依頼書の付録Aとして提出した。 |
| 10.29* | | 生物遺伝IDEC社の2008年業績管理激励計画。私たちが2008年5月8日に提出した付表14 Aに関する最終依頼書の付録Bとして。 |
| 10.30* | | 生物遺伝会社の2019年業績管理激励計画形式は、改訂された。2021年6月30日までの四半期報告10-Q表の添付ファイル10.1として提出します。 |
| 10.31* | | Biogen IDEC Inc.は補充貯蓄計画を自発的に実行し,2004年1月1日から改訂·再記述した。2003年12月31日までの10−K表年次報告書に添付ファイル10.13として提出した。 |
| 10.32* | | Biogen IDEC Inc.補充貯蓄計画は改訂された。2015年12月31日までの10−K表年次報告書に添付ファイル10.23として提出した。 |
| 10.33* | | Biogen IDEC Inc.自発的な取締役会貯蓄計画は、修正された。2015年12月31日現在の10−Kフォーム年次報告書に添付ファイル10.24として提出されている。 |
| 10.34* | | 生物遺伝会社幹部離職政策である米国執行副総裁は、2019年6月19日から改訂された。2019年6月30日までの四半期報告書10-Q表の添付ファイル10.4として提出します。 |
| 10.35* | | 生物遺伝会社幹部離職政策である米国常務副総裁は、2020年7月13日に改訂が発効した。2020年9月30日までの四半期報告10-Q表の添付ファイル10.1として提出します。 |
| 10.36* | | 取締役会の年間招聘概要(2020年1月1日から発効)。2019年9月30日までの四半期報告10-Q表の添付ファイル10.1として提出します。 |
| | | | | | | | |
| 証拠品番号: | | 説明する |
| 10.37* | | 役員と上級管理者の賠償協議フォーマット。2011年6月7日に提出されたForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.38* | | Biogen Inc.とMichel Vounatsosが2016年12月18日に署名した雇用協定は、2017年1月6日から発効した。2016年12月19日に我々が提出したForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.39* | | 2022年5月2日Michel Vounatsos雇用手配に関する手紙。2022年5月3日に我々が提出したForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.40* | | Biogen Inc.とChristopher A.Viebacherとの雇用契約は,2022年11月10日である。2022年11月10日に我々が提出したForm 8-K現在の報告書の添付ファイル10.1として。 |
| 10.41* | | Michael McDonnellの雇用手配に関する手紙は、2020年7月16日に日付されている。2020年9月30日までの四半期報告書10-Q表の添付ファイル10.2として提出します。 |
| 10.42* | | 2005年12月13日スーザン·アレクサンダー雇用計画に関する手紙。2009年12月31日現在の10-Kフォーム年次報告書に添付ファイル10.58として提出されている。 |
| 10.43* | | 2017年10月12日Chirfi Guindo雇用手配に関する手紙。2020年12月31日までの10−K表年次報告書に添付ファイル10.41として提出した |
| 10.44 | | 合弁協定は2011年12月6日サムスン生物製薬有限会社とBiogen Treateutics Inc.(F/k/a Biogen IDEC Treateutics Inc.)との間の合意は、2012年2月28日、2014年9月29日、2019年2月20日に改訂された。2021年3月31日までの四半期報告10-Q表の添付ファイル10.1として提出します。 |
| 10.45+ | | 2017年10月22日のBiogen MA Inc.と衛材株式会社との協力協定を改訂·再署名した。 |
| 10.46+ | | 2022年3月13日にBiogen MA Inc.とEisai Co.,Ltd.との間で改訂および再署名された協力協定の第1の修正案。 |
| 21+ | | 子会社です。 |
| 23+ | | 独立公認会計士事務所の普華永道会計士事務所の同意を得た。 |
| 31.1+ | | 2002年のサバンズ-オキシリー法第302条に基づいて最高経営責任者証明書が発行された。 |
| 31.2+ | | 2002年サバンズ-オキシリー法第302条に基づいて首席財務官を認証する。 |
| 32.1++ | | 2002年のサバンズ·オキシリー法第906条によると、最高経営責任者と最高財務責任者を認証する。 |
| 101++ | | 生物遺伝会社2022年12月31日までの10−K表年次報告には,iXBRL(イントラネット拡張可能商業報告言語)フォーマット:(I)総合収益表,(Ii)総合包括収益表,(Iii)総合貸借対照表,(Iv)総合キャッシュフロー表,(V)総合権益表と(Vi)総合財務諸表が付記されている。 |
| | | | | |
| † | 本展示品の内容の一部を秘匿処理することに同意または要求された. |
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、次の署名者が代表して本報告書に署名することを正式に許可した。
| | | | | |
| 生物遺伝会社 |
| |
| 差出人: | /S/ CHRISTOPHERA.VIEHBACHER |
| クリストファー·A·ウィバッハ |
| 最高経営責任者 |
日付:2023年2月15日
本報告は、1934年の証券取引法の要求に基づき、以下の者によって登録者として指定日に署名された。
| | | | | | | | | | | | | | |
| 名前.名前 | | 容量 | | 日取り |
| | | | |
/S/ CHRISTOPHERA.VIEHBACHER | | 役員と最高経営責任者(CEO) | | 2023年2月15日 |
| クリストファー·A·ウィバッハ | | |
| | | | |
/S/ M氷河.氷河R.MCDONNELL | | 常務副総裁兼首席財務官(首席財務官) | | 2023年2月15日 |
| マイケル·R·マクドナ | | |
| | | | |
/S/ RオビンC.Kラメル | | 上級副総裁、首席会計官(首席会計官) | | 2023年2月15日 |
| ロビン·C·クライマー | | |
| | | | |
/S/ Sテリオス Pアパドボロス | | 取締役と取締役会長 | | 2023年2月15日 |
| ストラオス·パパゾプロス | | |
| | | | |
/S/ AレクサンダーJ. Dエンナー | | 役員.取締役 | | 2023年2月15日 |
| アレクサンダー·J·ダナー | | |
| | | | |
/S/ CアロリンD.D.Dオサ | | 役員.取締役 | | 2023年2月15日 |
| キャロライン·D·ドーサ | | |
| | | | |
/S/ MアリアC.FREIRE | | 役員.取締役 | | 2023年2月15日 |
| マリア·C·フレレ | | |
| | | | |
/S/ WイリアムA·HAWKINS | | 役員.取締役 | | 2023年2月15日 |
| ウィリアム·A·ホギンズ | | |
| | | | |
/S/ WイリアムD.J幾つか | | 役員.取締役 | | 2023年2月15日 |
| ウィリアム·D·ジョーンズ | | |
| | | | |
/S/ JESUB.Mアンタス | | 役員.取締役 | | 2023年2月15日 |
| イエス·B·マンタス | | |
| | | | |
/S/ R冷たいのC. MULLIGAN | | 役員.取締役 | | 2023年2月15日 |
| リチャード·C·ムリガン | | |
| | | | |
/S/ E米K.ROWINSKY | | 役員.取締役 | | 2023年2月15日 |
| エリック·K·ロヴェンスキー | | |
| | | | |
/S/ S泰豊答え:Sヘヴィン | | 役員.取締役 | | 2023年2月15日 |
| スティーヴン·A·シェウィン | | |
生物遺伝会社そして付属会社
連結財務諸表
| | | | | | | | |
| | | ページ番号 |
| 合併損益表 | | F-2 |
| 総合総合収益表 | | F-3 |
| 合併貸借対照表 | | F-4 |
| 統合現金フロー表 | | F-5 |
| 合併権益表 | | F-6 |
| 連結財務諸表付記 | | F-9 |
| 独立公認会計士事務所報告(PCAOB ID 238) | F-78 |
生物遺伝会社そして付属会社
合併損益表
(単位:百万、1株を除く)
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| | 2022 | | 2021 | | 2020 |
| 収入: | | | | | | |
| 製品、ネットワーク | | $ | 7,987.8 | | | $ | 8,846.9 | | | $ | 10,692.2 | |
| 抗CD 20治療プロジェクトの収入 | | 1,700.5 | | | 1,658.5 | | | 1,977.8 | |
| 他にも | | 485.1 | | | 476.3 | | | 774.6 | |
| 総収入 | | 10,173.4 | | | 10,981.7 | | | 13,444.6 | |
| コストと費用: | | | | | | |
| 販売コストは,購入した無形資産の償却や減価は含まれていない | | 2,278.3 | | | 2,109.7 | | | 1,805.2 | |
| 研究開発 | | 2,231.1 | | | 2,501.2 | | | 3,990.9 | |
| 販売、一般、行政 | | 2,403.6 | | | 2,674.3 | | | 2,504.5 | |
| すでに購入した無形資産の償却と減価 | | 365.9 | | | 881.3 | | | 464.8 | |
| 協業利益を分担する | | (7.4) | | | 7.2 | | | 232.9 | |
| デンマークヒレード製造事業の損失を剥離する | | — | | | — | | | (92.5) | |
| (収益)再計量または公定価値損失 | | (209.1) | | | (50.7) | | | (86.3) | |
| 現在行われている研究と開発を買収する | | — | | | 18.0 | | | 75.0 | |
| 再編成費用 | | 131.1 | | | — | | | — | |
| 建物を売却して得た収益 | | (503.7) | | | — | | | — | |
| その他の費用,純額 | | (108.2) | | | 1,095.5 | | | (497.4) | |
| 総コストと費用 | | 6,581.6 | | | 9,236.5 | | | 8,397.1 | |
| 投資者の税引き前収入から税引後費用と権益損失を差し引かれる | | 3,591.8 | | | 1,745.2 | | | 5,047.5 | |
| 所得税(福祉)費用 | | 632.8 | | | 52.5 | | | 992.3 | |
| 被投資者の権益(収入)損失,税引き後純額 | | (2.6) | | | (34.9) | | | (5.3) | |
| 純収入 | | 2,961.6 | | | 1,727.6 | | | 4,060.5 | |
| 非持株権益の税引き後純収益(損失)に帰することができる | | (85.3) | | | 171.5 | | | 59.9 | |
| 生物遺伝会社の純収入。 | | $ | 3,046.9 | | | $ | 1,556.1 | | | $ | 4,000.6 | |
| | | | | | |
| 1株当たり純収益: | | | | | | |
| 生物遺伝会社の1株当たりの基本的な収益に起因することができる。 | | $ | 20.96 | | | $ | 10.44 | | | $ | 24.86 | |
| 生物遺伝会社の希釈後の1株当たりの収益に起因することができる。 | | $ | 20.87 | | | $ | 10.40 | | | $ | 24.80 | |
| | | | | | |
| 計算に使用される加重平均シェア: | | | | | | |
| 生物遺伝会社の1株当たりの基本的な収益に起因することができる。 | | 145.3 | | | 149.1 | | | 160.9 | |
| 生物遺伝会社の希釈後の1株当たりの収益に起因することができる。 | | 146.0 | | | 149.6 | | | 161.3 | |
これらの連結財務諸表の付記を参照してください。
生物遺伝会社そして付属会社
総合総合収益表
(単位:百万)
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| | | 2022 | | 2021 | | 2020 |
| 生物遺伝会社の純収入。 | | $ | 3,046.9 | | | $ | 1,556.1 | | | $ | 4,000.6 | |
| 他の全面的な収入: | | | | | | |
| 売却可能な証券の未実現収益(赤字),税引き後純額 | | (13.5) | | | (3.6) | | | (2.8) | |
| 現金流動保証期間は収益(損失)を実現せず,税引き後純額 | | (38.7) | | | 232.8 | | | (186.8) | |
| 純投資ヘッジ収益(赤字),税引き後純額 | | (25.5) | | | 34.0 | | | (33.6) | |
| 年金福祉債務の未実現収益(赤字)、税引き後純額 | | 43.7 | | | 21.5 | | | (33.5) | |
| 貨幣換算調整 | | (24.2) | | | (92.4) | | | 92.9 | |
| 税引き後のその他の総合収益(赤字)合計 | | (58.2) | | | 192.3 | | | (163.8) | |
| 生物遺伝会社の全面収益(赤字)。 | | 2,988.7 | | | 1,748.4 | | | 3,836.8 | |
| 非持株権益の総合収益(損失)、税引き後純額に起因することができる | | (85.3) | | | 172.1 | | | 60.9 | |
| 総合収益(赤字) | | $ | 2,903.4 | | | $ | 1,920.5 | | | $ | 3,897.7 | |
これらの連結財務諸表の付記を参照してください。
生物遺伝会社そして付属会社
合併貸借対照表
(単位:百万、1株を除く)
| | | | | | | | | | | |
| 12月31日まで |
| 2022 | | 2021 |
| 資産 |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 3,419.3 | | | $ | 2,261.4 | |
| 有価証券 | 1,473.5 | | | 1,541.1 | |
| 売掛金純額 | 1,705.0 | | | 1,549.4 | |
| 抗CD 20治療法によるものです | 431.4 | | | 412.3 | |
| 在庫品 | 1,344.4 | | | 1,351.5 | |
| その他流動資産 | 1,417.6 | | | 740.8 | |
| 流動資産総額 | 9,791.2 | | | 7,856.5 | |
| 有価証券 | 705.7 | | | 892.0 | |
| 財産·工場·設備·純価値 | 3,298.6 | | | 3,416.4 | |
| 経営的リース資産 | 403.9 | | | 375.4 | |
| 無形資産、純額 | 1,850.1 | | | 2,221.3 | |
| 商誉 | 5,749.0 | | | 5,761.1 | |
| 繰延税金資産 | 1,226.4 | | | 1,415.1 | |
| 投資やその他の資産 | 1,529.2 | | | 1,939.5 | |
| 総資産 | $ | 24,554.1 | | | $ | 23,877.3 | |
| 負債と権益 |
| 流動負債: | | | |
| 支払手形の当期分 | $ | — | | | $ | 999.1 | |
| 課税税金を納める | 259.9 | | | 174.7 | |
| 売掛金 | 491.5 | | | 589.2 | |
| 費用とその他を計算すべきである | 2,521.4 | | | 2,535.2 | |
| 流動負債総額 | 3,272.8 | | | 4,298.2 | |
| 支払手形 | 6,281.0 | | | 6,274.0 | |
| 繰延税金負債 | 334.7 | | | 694.5 | |
| 長期経営賃貸負債 | 333.0 | | | 330.4 | |
| その他長期負債 | 944.2 | | | 1,320.5 | |
| 総負債 | 11,165.7 | | | 12,917.6 | |
| 引受、又は事項及び担保(付記22及び23) | | | |
| 株本: | | | |
| 生物遺伝研究会社の株主権益 | | | |
優先株、額面$0.0011株当たり | — | | | — | |
普通株、額面$0.00051株当たり | 0.1 | | | 0.1 | |
| 追加実収資本 | 73.3 | | | 68.2 | |
| その他の総合損失を累計する | (164.9) | | | (106.7) | |
| 利益を残す | 16,466.5 | | | 13,911.7 | |
在庫株は、コストで計算する23.8百万ドルと23.8百万株を区別する | (2,977.1) | | | (2,977.1) | |
| ダール生物遺伝会社の株主権益 | 13,397.9 | | | 10,896.2 | |
| 非制御的権益 | (9.5) | | | 63.5 | |
| 総株 | 13,388.4 | | | 10,959.7 | |
| 負債と権益総額 | $ | 24,554.1 | | | $ | 23,877.3 | |
これらの連結財務諸表の付記を参照してください。
生物遺伝会社そして付属会社
統合現金フロー表
(単位:百万)
| | | | | | | | | | | | | | | | | |
| 12月31日までの年度 |
| | 2022 | | 2021 | | 2020 |
| 経営活動のキャッシュフロー: | | | | | |
| 純収入 | $ | 2,961.6 | | | $ | 1,727.6 | | | $ | 4,060.5 | |
| 純収入と経営活動のキャッシュフロー純額を調整する: | | | | | |
| 減価償却および償却 | 518.4 | | | 487.7 | | | 457.2 | |
| 無形資産減価準備 | 119.6 | | | 629.3 | | | 209.7 | |
| 在庫に関する超過と陳腐な費用 | 336.2 | | | 167.6 | | | 26.6 | |
| 現在行われている研究と開発を買収する | — | | | 18.0 | | | 75.0 | |
| 株式ベースの報酬 | 254.1 | | | 238.6 | | | 198.3 | |
| 値段が合うかもしれない | (209.1) | | | (50.7) | | | (86.3) | |
| デンマークヒレロッド製造事業の剥離(収益)/損失 | — | | | — | | | (92.5) | |
| 所得税を繰延する | (168.6) | | | (426.8) | | | 149.0 | |
| 戦略投資損 | 265.9 | | | 826.8 | | | (681.8) | |
| 権益法投資損失 | (2.6) | | | (34.9) | | | (3.3) | |
| サムスンBioepis株を売却する収益 | (1,505.4) | | | — | | | — | |
| 建物を売却して得た収益 | (503.7) | | | — | | | — | |
| 他にも | 208.2 | | | 202.2 | | | 104.6 | |
| 営業資産と負債の変動、純額: | | | | | |
| 売掛金 | (203.4) | | | 324.8 | | | 2.8 | |
| 抗CD 20治療法によるものです | (19.0) | | | 1.2 | | | 176.7 | |
| 在庫品 | (320.2) | | | (462.4) | | | (316.3) | |
| 費用とその他の流動負債を計算しなければならない | (113.4) | | | (95.4) | | | 154.2 | |
| 所得税資産負債 | (142.3) | | | 230.8 | | | (67.5) | |
| 経営性資産と負債のその他の変動、純額 | (92.0) | | | (144.5) | | | (137.1) | |
| 経営活動提供のキャッシュフロー純額 | 1,384.3 | | | 3,639.9 | | | 4,229.8 | |
| 投資活動によるキャッシュフロー: | | | | | |
| 家屋·工場·設備を購入する | (240.3) | | | (258.1) | | | (424.8) | |
| 有価証券の販売収益と満期日 | 3,671.0 | | | 3,405.4 | | | 7,299.4 | |
| 有価証券を購入する | (3,448.5) | | | (3,808.7) | | | (6,397.7) | |
| サムスンBioepis株を売却して得られた収益 | 990.3 | | | — | | | — | |
| 建物を売却して得た金 | 582.6 | | | — | | | — | |
| Sangamo治療会社の株を買収する | — | | | — | | | (141.8) | |
| デナリー治療会社の株を買います | — | | | — | | | (423.7) | |
| Sage Treateutics,Inc.株を買収する | — | | | — | | | (441.0) | |
| デンマークのヒレロッド製造事業の収益を剥離する | — | | | 28.1 | | | — | |
| 現在行われている研究と開発を買収する | — | | | (18.0) | | | (75.0) | |
| 無形資産の買収 | (2.9) | | | (18.8) | | | (52.0) | |
| | | | | |
| 売却戦略投資の収益 | — | | | 93.5 | | | 74.9 | |
| 他にも | 24.4 | | | 12.9 | | | (26.9) | |
| 投資活動が提供するキャッシュフロー純額 | 1,576.6 | | | (563.7) | | | (608.6) | |
| 資金調達活動のキャッシュフロー: | | | | | |
| 在庫株を購入する | (750.0) | | | (1,800.0) | | | (6,679.1) | |
| 株式ベースの給与手配の株式発行に関する支払、純額 | (1.9) | | | (0.7) | | | (4.6) | |
| 債務返済と債務交換時に支払う保険料 | (1,002.2) | | | (170.0) | | | — | |
| 借入金収益 | — | | | — | | | 2,967.4 | |
| 借金を返済する | — | | | — | | | (1,500.0) | |
| 非持株権益に対する純貢献 | 12.4 | | | (94.4) | | | (71.0) | |
| | | | | |
| 他にも | (5.6) | | | (21.1) | | | 14.6 | |
| 融資活動が提供する現金流量純額 | (1,747.3) | | | (2,086.2) | | | (5,272.7) | |
| 現金および現金等価物の純増加(減額) | 1,213.6 | | | 990.0 | | | (1,651.5) | |
| 現金および現金等価物に及ぼす為替レート変動の影響 | (55.7) | | | (59.8) | | | 69.0 | |
| 現金と現金等価物、年明け | 2,261.4 | | | 1,331.2 | | | 2,913.7 | |
| 現金と現金等価物、年末 | $ | 3,419.3 | | | $ | 2,261.4 | | | $ | 1,331.2 | |
これらの連結財務諸表の付記を参照してください。
生物遺伝会社そして付属会社
合併権益表
(単位:百万)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 優先株 | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
損 | | 保留する
収益.収益 | | 在庫株 | | 合計する
生物遺伝会社
株主の
株権 | | 非制御性
利益. | | 合計する
株権 |
| | 株 | | 金額 | | 株 | | 金額 | | | | | 株 | | 金額 | | | |
| バランス、2021年12月31日 | — | | | $ | — | | | 170.8 | | | $ | 0.1 | | | $ | 68.2 | | | $ | (106.7) | | | $ | 13,911.7 | | | (23.8) | | | $ | (2,977.1) | | | $ | 10,896.2 | | | $ | 63.5 | | | $ | 10,959.7 | |
| 純収入 | — | | | — | | | — | | | — | | | — | | | — | | | 3,046.9 | | | — | | | — | | | 3,046.9 | | | (85.3) | | | 2,961.6 | |
| その他総合収益(損失)、税引き後純額 | — | | | — | | | — | | | — | | | — | | | (58.2) | | | — | | | — | | | — | | | (58.2) | | | — | | | (58.2) | |
| 非持株権に分配する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | |
| 非持株権益出資 | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | 12.3 | | | 12.3 | |
| 2020年株式買い戻し計画に基づいて普通株を買い戻し、コストで計算する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (3.6) | | | (750.0) | | | (750.0) | | | — | | | (750.0) | |
| 普通株は2020年の株式買い戻し計画に基づいて退役し、コストで計算します | — | | | — | | | (3.6) | | | — | | | (257.9) | | | — | | | (492.1) | | | 3.6 | | | 750.0 | | | — | | | — | | | — | |
| | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | |
| 株式オプションと株式購入計画に基づいて普通株を発行する | — | | | — | | | 0.2 | | | — | | | 44.2 | | | — | | | — | | | — | | | — | | | 44.2 | | | — | | | 44.2 | |
| 株式奨励計画による普通株の発行 | — | | | — | | | 0.5 | | | — | | | (46.0) | | | — | | | — | | | — | | | — | | | (46.0) | | | — | | | (46.0) | |
| 株式支払いに関する報酬費用 | — | | | — | | | — | | | — | | | 263.5 | | | — | | | — | | | — | | | — | | | 263.5 | | | — | | | 263.5 | |
| 他にも | — | | | — | | | — | | | — | | | 1.3 | | | — | | | — | | | — | | | — | | | 1.3 | | | — | | | 1.3 | |
| バランス、2022年12月31日 | — | | | $ | — | | | 167.9 | | | $ | 0.1 | | | $ | 73.3 | | | $ | (164.9) | | | $ | 16,466.5 | | | (23.8) | | | $ | (2,977.1) | | | $ | 13,397.9 | | | $ | (9.5) | | | $ | 13,388.4 | |
これらの連結財務諸表の付記を参照してください。
生物遺伝会社そして付属会社
合併権益報告書−(続)
(単位:百万)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 優先株 | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
損 | | 保留する
収益.収益 | | 在庫株 | | 合計する
生物遺伝会社
株主の
株権 | | 非制御性
利益. | | 合計する
株権 |
| 株 | | 金額 | | 株 | | 金額 | | | | | 株 | | 金額 | | | |
| バランス、2020年12月31日 | — | | | $ | — | | | 176.2 | | | $ | 0.1 | | | $ | — | | | $ | (299.0) | | | $ | 13,976.3 | | | (23.8) | | | $ | (2,977.1) | | | $ | 10,700.3 | | | $ | (14.2) | | | $ | 10,686.1 | |
| 純収入 | — | | | — | | | — | | | — | | | — | | | — | | | 1,556.1 | | | — | | | — | | | 1,556.1 | | | 171.5 | | | 1,727.6 | |
| その他総合収益(損失)、税引き後純額 | — | | | — | | | — | | | — | | | — | | | 192.3 | | | — | | | — | | | — | | | 192.3 | | | 0.6 | | | 192.9 | |
| 非持株権に分配する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (100.0) | | | (100.0) | |
| 非持株権益出資 | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | 5.6 | | | 5.6 | |
| 2020年株式買い戻し計画に基づいて普通株を買い戻し、コストで計算する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (6.0) | | | (1,800.0) | | | (1,800.0) | | | — | | | (1,800.0) | |
| 普通株は2020年の株式買い戻し計画に基づいて退役し、コストで計算します | — | | | — | | | (6.0) | | | — | | | (231.9) | | | — | | | (1,568.1) | | | 6.0 | | | 1,800.0 | | | — | | | — | | | — | |
| 株式オプションと株式購入計画に基づいて普通株を発行する | — | | | — | | | 0.2 | | | — | | | 54.4 | | | — | | | — | | | — | | | — | | | 54.4 | | | — | | | 54.4 | |
| 株式奨励計画による普通株の発行 | — | | | — | | | 0.4 | | | — | | | (2.4) | | | — | | | (52.6) | | | — | | | — | | | (55.0) | | | — | | | (55.0) | |
| 株式支払いに関する報酬費用 | — | | | — | | | — | | | — | | | 246.6 | | | — | | | — | | | — | | | — | | | 246.6 | | | — | | | 246.6 | |
| 他にも | — | | | — | | | — | | | — | | | 1.5 | | | — | | | — | | | — | | | — | | | 1.5 | | | — | | | 1.5 | |
| バランス、2021年12月31日 | — | | | $ | — | | | 170.8 | | | $ | 0.1 | | | $ | 68.2 | | | $ | (106.7) | | | $ | 13,911.7 | | | (23.8) | | | $ | (2,977.1) | | | $ | 10,896.2 | | | $ | 63.5 | | | $ | 10,959.7 | |
これらの連結財務諸表の付記を参照してください。
生物遺伝会社そして付属会社
合併権益報告書−(続)
(単位:百万)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 優先株 | | 普通株 | | その他の内容
支払い済み
資本 | | 積算
他にも
全面的に
損 | | 保留する
収益.収益 | | 在庫株 | | 合計する
生物遺伝会社
株主の
株権 | | 非制御性
利益. | | 合計する
株権 |
| 株 | | 金額 | | 株 | | 金額 | | | | | 株 | | 金額 | | | |
| バランス、2019年12月31日 | — | | | $ | — | | | 198.0 | | | $ | 0.1 | | | $ | — | | | $ | (135.2) | | | $ | 16,455.4 | | | (23.8) | | | $ | (2,977.1) | | | $ | 13,343.2 | | | $ | (4.1) | | | $ | 13,339.1 | |
| 純収入 | — | | | — | | | — | | | — | | | — | | | — | | | 4,000.6 | | | — | | | — | | | 4,000.6 | | | 59.9 | | | 4,060.5 | |
| その他総合収益(損失)、税引き後純額 | — | | | — | | | — | | | — | | | — | | | (163.8) | | | — | | | — | | | — | | | (163.8) | | | 1.0 | | | (162.8) | |
| 非持株権に分配する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (75.0) | | | (75.0) | |
| 非持株権益出資 | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | — | | | 4.0 | | | 4.0 | |
| 2020年株式買い戻し計画に基づいて普通株を買い戻し、コストで計算する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (1.6) | | | (400.0) | | | (400.0) | | | — | | | (400.0) | |
| 普通株は2020年の株式買い戻し計画に基づいて退役し、コストで計算します | — | | | — | | | (1.6) | | | — | | | (60.8) | | | — | | | (339.2) | | | 1.6 | | | 400.0 | | | — | | | — | | | — | |
| 2019年12月の株式買い戻し計画に基づいて普通株を買い戻し、コストで計算する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (16.7) | | | (5,000.0) | | | (5,000.0) | | | — | | | (5,000.0) | |
| 普通株は2019年12月の株式買い戻し計画により退役し、コストで計算されます | — | | | — | | | (16.7) | | | — | | | (121.3) | | | — | | | (4,878.7) | | | 16.7 | | | 5,000.0 | | | — | | | — | | | — | |
| 2019年3月の株式買い戻し計画に基づいて普通株を買い戻し、コストで計算する | — | | | — | | | — | | | — | | | — | | | — | | | — | | | (4.1) | | | (1,279.1) | | | (1,279.1) | | | — | | | (1,279.1) | |
| 普通株は2019年3月の株式買い戻し計画により退役し、コストで計算される | — | | | — | | | (4.1) | | | — | | | (71.0) | | | — | | | (1,208.1) | | | 4.1 | | | 1,279.1 | | | — | | | — | | | — | |
| 株式オプションと株式購入計画に基づいて普通株を発行する | — | | | — | | | 0.2 | | | — | | | 49.3 | | | — | | | — | | | — | | | — | | | 49.3 | | | — | | | 49.3 | |
| 株式奨励計画による普通株の発行 | — | | | — | | | 0.4 | | | — | | | — | | | — | | | (53.7) | | | — | | | — | | | (53.7) | | | — | | | (53.7) | |
| 株式支払いに関する報酬費用 | — | | | — | | | — | | | — | | | 204.5 | | | — | | | — | | | — | | | — | | | 204.5 | | | — | | | 204.5 | |
| 他にも | — | | | — | | | — | | | — | | | (0.7) | | | — | | | — | | | — | | | — | | | (0.7) | | | — | | | (0.7) | |
| バランス、2020年12月31日 | — | | | $ | — | | | 176.2 | | | $ | 0.1 | | | $ | — | | | $ | (299.0) | | | $ | 13,976.3 | | | (23.8) | | | $ | (2,977.1) | | | $ | 10,700.3 | | | $ | (14.2) | | | $ | 10,686.1 | |
これらの連結財務諸表の付記を参照してください。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記
これらの説明で言及されている“Biogen”、“会社”、“私たち”とは、生物遺伝会社とその合併した子会社を指す。
業務の概要
生物遺伝会社は世界規模の生物製薬会社であり、世界各地の深刻かつ複雑な疾病を有する患者の発見、開発と革新療法の提供に専念している。我々は多発性硬化症(MS)を広く治療する薬剤の組み合わせを持ち、最初に承認された脊髄性筋萎縮症(SMA)を治療する方法を発売し、アルツハイマー病を治療する2つの方法を共同開発した。私たちは神経学、神経精神医学、専門免疫学、およびまれな疾患のルートの推進に注力している。私たちは内部研究開発計画と外部協力を通じて私たちの薬物発見と開発を支援している。
我々が販売している製品は,MSを治療するTecfidera,VUMERITY,Avonex,Pregridy,TysabriおよびFAMPYRA;SMA治療SPINRAZA;アルツハイマー病治療ADUHELM;および重篤な斑塊型乾癬を治療するFUMADERMを含む。衛材株式会社(Eisai)と協力してアルツハイマー病治療のためのLEQEMBIを商業化し,2023年1月に米国食品医薬品局(FDA)の加速承認を得た。我々は、非ホジキンリンパ腫、慢性リンパ球性白血病(CLL)および他の疾患の治療のためのRituxan HYCELA、非ホジキンリンパ腫およびCLLの治療のためのRituxan HYCELA、CLLおよび濾胞性リンパ腫の治療のためのGazyva、原発進行性多発性硬化症(PPMS)および再発性多発性硬化症(RMS)の治療のためのOCREVUS、LUNSUMIO(Mosunetuzumab)であり、2022年第4四半期に米国で加速承認され、再発または難治性濾胞性リンパ腫の治療のための;Glofitamab、潜在的非特異的ホジキンリンパ腫の治療のための潜在的に特異的な抗体を治療するための商業的および財務的権利を有する。我々と羅氏集団の全メンバー遺伝子テーク社(Genentech)との協力により,他の潜在的な抗CD 20療法を増加させることも選択できる。
MSとSMAへの新たな潜在的革新に引き続き投資するほか、重度抑うつ障害(MDD)および出産後うつ病(PPD)のズランノロンの治療、アルツハイマー病の治療のBIIB 080、筋萎縮性側索硬化症(ALS)のtofersenの治療、およびある形態の狼瘡を治療するlitifilimabおよびdapirolizumab pegolを含む中末期計画を進めている。
我々はまた、Benepali、ENBRELを参照するエナジー生物類似体、IMRALDI、HUMIRAを参照するアダリモモノクロナル生物類似体、FLIXABI、インフリキシマブ生物類似体、Remicade、およびBYOOVIZ、Lucentisを参照するranibizumab生物類似体、米国で提案されたBIIB 800、提案されたtocilizumab生物類似参考Actemra、およびSB 15を含む潜在的生物類似製品を開発し続けている、ヨーロッパのある国で先進生物製剤の生物模倣薬を商業化している。
私たちの連携スケジュールに関する他の情報は、お読みください備考19:連携関係とその他の関係私たちの連結財務諸表は本報告書に含まれている。
整固する
私たちの連結財務諸表は、私たちの財務諸表と、私たちが主な受益者である完全子会社と可変利息実体の財務諸表を反映します。私たちが以下のリスクに直面しているまたは直面している統合エンティティには100.0税を除いた純追加は、当社の総合収益表に記録されている非制御権益の純収益(損失)に起因し、各非制御側が当該等の実体が保持している経済権益又は所有権権益のパーセンテージに相当する。会社間残高と取引は合併で流された
私たちが可変利益エンティティの主要な受益者であるかどうかを決定する際に、我々は、(1)そのエンティティの重大な経済活動を指導する権力と、(2)そのエンティティの損失を負担するか、またはそのエンティティからそのエンティティに重大な意味を有する可能性のある利益を得る権利を同時に有するかどうかを決定するために定性的な方法を採用する。既存の関係や将来の取引の変化が、私たちの1つまたは複数の協力者またはパートナーを合併またはキャンセルする可能性があるので、私たちが可変利益エンティティの主要な受益者であるかどうかを評価し続けています。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
予算の使用
総合財務諸表を作成する際には、資産、負債、権益、収入および費用の報告金額、または資産および負債に関する開示に影響を及ぼす可能性がある推定、判断、および仮定を行う必要がある。持続的な基礎の上で、私たちは私たちの推定、判断、そして仮定を評価する。我々は過去の経験や我々が合理と考えている他の様々な仮定から推定しているが,これらの仮定の結果は資産,負債および権益の帳簿価値および収入および支出金額を判断する基礎となっている.実際の結果はこれらの推定とは異なる可能性がある。
新冠肺炎疫病は直接或いは間接的に著者らの業務、運営結果と財務状況(販売、費用、備蓄と手当、サプライチェーン、製造、臨床試験、研究開発コストと従業員関連コストを含む)の持続時間と全面程度は未来の発展に依存し、これらの発展は高度な不確定性、不確定性と不確定性を持っており、しかも予測が困難であり、出現する可能性のある新冠肺炎に関する新しい情報、新冠肺炎の抑制或いは治療のための行動、及び現地、地域、国家と国際顧客と市場への経済影響を含む。また、ウクライナ紛争に関連した持続的な地政学的緊張、および関連する制裁やその他の懲罰措置は、世界経済に大きな不確実性をもたらしている。紛争、制裁、そしてそれに伴う市場混乱の程度と持続時間は非常に予測できない。我々は合併財務諸表で新冠肺炎の流行とウクライナの持続的な地政学的衝突の影響を推定し、将来これらの推定は変化する可能性がある。
収入確認
私たちの顧客が約束された商品やサービスのコントロール権を獲得した時、私たちは収入を確認し、その金額は私たちが予想していたこれらの商品やサービスと交換した対価格を反映しています。財務会計基準委員会(FASB)会計基準編纂(ASC)606に規定されている5段階モデルに従って収入を確認した取引先と契約した収入:(I)顧客との契約を決定すること、(Ii)契約中の履行義務を決定すること、(Iii)取引価格を決定すること、(Iv)契約に取引価格を割り当てる履行義務、および(V)契約義務を履行する際に収入を確認すること。
製品収入
アメリカでは、私たちは主に卸売と専門ディーラーと専門薬局に私たちの製品を販売します。他の国では、私たちは主に卸売業者、病院、薬局、その他の第三者流通パートナーに私たちの製品を販売します。これらの顧客はその後、私たちの製品を医療提供者と患者に転売する。また,医療提供者や支払者と合意し,我々の製品に関連する政府が強制的または私的に協議する割引や手当を規定している。
製品収入は,顧客が我々の製品に対する制御権を獲得したときに確認され,これはある時点で発生し,通常は顧客に渡す際である.もし私たちが確認すべき資産の予想償却期間が1年以上かそれ以下の金額であれば、契約が発生したときに契約を得るための増額コストを支出する。
割引と手当準備金
製品収入は、当社が業務を展開しているいくつかの国際市場で定価行動を実施することに関する割引や手当を含む、私たちの顧客、医療提供者、または支払者との契約に提供される割引および手当を差し引いた準備金です
製品収入準備金は製品収入の減少に分類され、通常は以下のように表現される:割引、契約調整、リターン。
これらの準備金は、関連販売によって稼いだ金額または請求される金額の推定に基づいており、売掛金の減少(その金額が私たちの顧客に支払われるべきである場合)または負債(その金額が私たちの顧客以外の方に支払われるべきである場合)に分類される。我々は可変対価格準備の準備金の見積りを我々の手法の一致適用によって計算し,期待値法を採用した.これらの推定は、我々の歴史的経験、現在の契約および法的要件、特定の既知の市場イベントおよび傾向、業界データ、および予測された顧客購入および支払いパターンを反映する。取引価格は、割引や割引の影響を反映した可変対価格が含まれており、制限される可能性があり、確認された累積収入金額が今後の期間に大きな逆転が生じない可能性が高い場合にのみ、販売純価格を計上する。実際の金額は最終的には
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
見積もりです。実際の結果が異なれば,これらの見積りを調整し,調整期間内の報酬に影響を与える可能性がある.
割引には貿易期限割引と卸割引が含まれています。貿易条件割引と卸奨励は,主に卸が既定の奨励期間内に送金することによる信用の推定義務と,卸が契約に規定する各種在庫管理を遵守することによる信用の推定義務に関連する。私たちは顧客が支払う時間を含めて、私たちの歴史的経験に基づいてこれらの準備金を決定します。
契約調整は主にアメリカの医療補助と管理医療リベート、薬局リベート、共同支払い(COPAY)援助、退役軍人管理局(VA)と公衆衛生サービス(PHS)割引、専門薬局計画費用とその他の政府のリベート或いは適用手当に関連する。
•医療補助リベート:私たちが決められた返済計画に基づいて各州に負担する推定義務に関するものだ。リベート項目は、関連収入が確認された同期間内に入金され、製品収入が減少して負債を形成し、総合貸借対照表における課税費用及び他の流動負債を計上する。医療補助金に対する私たちの責任には、1つの州が本四半期に提出するクレームの推定、推定された請求書を受け取っていない前の四半期のクレーム、前の四半期に支払われていないクレームに対する受信された領収書、および期末流通ルートに存在する在庫に対して提出される潜在的なクレームの推定が含まれる。
•政府は戻ってきましたVAおよびPHS割引を含む返金は、私たちがこれらの製品を提供する卸売業者に請求された価格よりも低い価格で合格医療提供者に製品を販売することを契約によって約束したことによって生じる推定義務を表す。卸売業者は私たちに製品のために卸売業者が支払った費用と合格医療提供者の最終販売価格との差額を受け取ってくれた。リベートと返金準備金は関連収入を確認しながら設立され、製品収入が減少し、売掛金の純額が減少する。返金金額は通常、卸売業者が合格した医療提供者に転売する時に確定し、私たちは通常卸売業者から転売を通知されてから数週間以内にこのような金額にポイントを支給します。VA,PHS,その他の記憶容量使用課金の準備金には,卸の既存の在庫金額が含まれており,これらの在庫は合格した医療提供者に販売されることが予想され,卸はクレジット額を発行していないと主張する記憶容量別課金を行う.
•管理型医療サービスバックポイント:私たちの第三者を代表して、主に薬局福祉マネージャーの推定義務です。リベート項目は、関連収入が確認された同期間内に入金され、製品収入が減少して負債を形成し、総合貸借対照表における課税費用及び他の流動負債を計上する。これらのリベートは、業績に基づく目標、規定された立場、値上げ制限手当(価格保護)から来ている。これらのリベートの課税費用の計算は,カバー範囲パターンの推定と,それによる同期内で稼いだ適用契約リベート比率に基づいている.
•CoPay助けて:条件を満たした患者への経済援助を代表し,保険要求の処方薬の共同支払いを支援する。Copay課税料金の計算は、クレームの推定に基づいており、期末に受信された流通チャネルに存在する在庫に関する各クレームのコストに基づいている。
•薬局の返却:私たちが特定の薬局に製品を販売する契約約束による見積もり義務を代表します。リベート項目は、関連収入が確認された同期間内に入金され、製品収入が減少して負債を形成し、総合貸借対照表における課税費用及び他の流動負債を計上する。これらのリベートは、購入された製品または配布された製品からの契約割引です。これらのリベートの課税費用を計算するのは,薬局への購入や調剤パターンの推定と,それによって生じる契約同期内に稼いだ適用契約リベート比率である。
•他の政府はリベートしました非米国薬品税又は適用される手当は主に国際市場の強制的なリベートと割引に関連しており、国際市場において、政府が支援する医療システムは医療の主な支払者である。
製品返品準備金は卸の返品のために作成され、関連収入を確認する際に記録され、製品収入が減少する。契約条項によると、卸は製品の破損や期限切れなどの理由で返品することができます。ほとんどの人は
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
卸が返品したのは製品の期限が切れたためです。期限切れ製品返品備蓄は,履歴返品データを生産ロットに基づく関連販売と比較することで推定される。履歴収益率は、各製品のために決定され、市場における各製品に固有の既知または予想変化に基づいて調整される。
割引、リベートと製品の返品以外に、流通ルートの流通業者と他の顧客と一定の顧客サービス契約を維持して、在庫管理、データと流通サービスを提供してくれます。これは通常収入の減少に反映されます。これらのサービスの分離可能な収益と公正な価値を証明できる範囲で、私たちは私たちの総合損益表でこれらの支払いを販売、一般、行政費用に分類します。
抗CD 20治療プロジェクトの収入
遺伝子テークとの協力はASC 808の範囲内にあります協力協定その中で、協力計画の提案と開示について指導が提供された。本脚注では,RituxanとRituxan HYCELAを総称してRituxanと呼ぶ.
RituxanとGazyvaの税引前共同販売促進利益およびOCREVUS売却の特許使用料収入におけるシェアは交換ライセンスからです。我々は許可や連携プロトコルの下で将来の業績義務がないため,収入は発生した基本販売であることが確認された.
抗CD 20治療プロジェクトの収入は
(I)米国におけるRituxanおよびGazyvaの税引前利益および損失シェア
(2)OCREVUS販売の特許使用料収入;および
(Ii)私たちがカナダRituxanの税引前共同で利益シェアを普及させることを含む、抗CD 20治療計画の他の収入
RituxanとGazyvaの税引前共同販売促進利益は遺伝子泰克と羅氏集団が計算して私たちに支払ってくれます。税引前共同販売促進利益には、第三者顧客の純売上高から製造に適したコスト、第三者特許権使用料、流通、販売およびマーケティング費用、および遺伝子テックとローグループで発生した共同開発費用が含まれる。我々がRituxanとGazyvaの税引前利益に占めるシェアには,遺伝子テークと羅氏集団から得られた情報に基づく推定が含まれている。これらの予想は変化する可能性があり,実際の結果は異なる可能性がある
OCREVUS同期販売に対する第三者の見積もりと市場研究データからOCREVUS販売の特許権使用料収入を確認した。実際の特許使用料収入と推定特許権使用料収入との差は既知の期間に調整され、通常は次の四半期と予想される。
2022年1月、私たちは遺伝子テークと共にLUNSUMIOの共同開発と商業化に参加する選択権を行使し、このプロジェクトは後に2022年12月にFDAの承認を得た。私たちと遺伝子テークの協力により、私たちは共同でLUNSUMIOの米国での運営損益を促進する権利がある。
規制機関が承認する前に、抗CD 20製品の開発による費用シェアを研究開発費に計上し、商業化前のコストを販売、一般と行政費用に計上し、総合損益表に計上する。抗CD 20製品が承認された後、この製品に関連する開発、販売、およびマーケティング費用のシェアを、抗CD 20治療プロジェクト収入における税前利益シェアの減少として記録する
そこで,生物遺伝会社はLUNSUMIOの開発に関連する費用のシェアを研究·開発費に記録し,販売,一般,行政費用における商業化前コストシェアを2022年12月,すなわちFDA承認時に記録した。2023年1月から、米国におけるLUNSUMIOの任意の税前損益シェアは、我々の合併損益表において抗CD 20治療計画収入の構成要素として反映される。
遺伝子テークとの関係についてより多くの情報をお読みください付記19、連携関係その他の関係これらの連結財務諸表
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
その他の収入
代役やその他の収入
私たちは契約製造と他の収入を記録し、主に契約製造協定の下での収入から来ている。契約製造契約項の下の収入は、顧客が製品制御権を取得する際に確認され、これはある時点で発生する可能性があり、一定期間内に発生する可能性もあり、具体的には合意の条項および条件に依存する。
特許権使用料収入
特許使用料収入は、私たちが許可を超えた特許に関連する製品の純販売から得た特許使用料と、サムスンBioepis Co.,Ltd.(Samsung Bioepis)と協力して手配した生物類似製品の特許使用料収入を反映している。これらの取り決めは,許可を交換し,販売と使用に基づく特許権使用料例外を利用することに起因する.このため、受信した特許権使用料が確認されたことに基づいて販売が発生する。
協力関係と他の関係
私たちはまた、収入と私たちのいくつかの製品と候補製品の開発、規制承認、商業化とマーケティングの面で多くの重要な協力関係と他の第三者関係を構築した。もし私たちが第三者との販売取引の元本であれば、総合損益表の該当項目で収入、販売コスト、運営費用を毛数で確認します。もし私たちが第三者との販売取引の元本でなければ、私たちの収入、販売コスト、運営費用シェアは私たちの総合損益表に他の収入の構成要素として記録されています。
私たちは遺伝子テーク、衛材、サムスンBioepisの開発と商業化手配と協力手配を代表して、それぞれが1つ以上の共同運営活動の積極的な参加者であり、これらの手配の重大なリスクとリターンに直面しているからである。これらの手配は,許可を交換し,必要に応じて販売と使用に基づく特許権使用料例外を利用することに起因する.したがって、特許権使用料または利益共有金額に関する収入は、発生した基本販売として確認される。
遺伝子テーク、衛材、サムスンBioepisとの協力に関するもっと多くの情報を読んでください備考19:連携関係とその他の関係これらの連結財務諸表まで。
公正価値計量
私たちは公正価値で記録された金融資産と負債がいくつかあり、公正価値計量会計基準に記載されている公正価値等級の中で第1、2または3級に分類されている。
•レベル1·公正価値は、アクティブ市場で我々が取得することができる同じ資産または負債の見積もり(未調整)を使用して決定される
•レベル2公正価値は、金利、収益率曲線、外貨スポットレート、およびオプション価格推定モデルのようなアクティブ市場における同じまたは同様の資産および負債のオファーまたは他の市場で観察可能な情報を利用することによって決定される
•レベル3−価格または推定値は、公正な価値計量に重大な意味を有し、観察されない投入を必要とする。
私たちの金融資産の大部分は二次に分類されています。私たちの金融資産(通常、私たちの現金等価物、売却可能な債務証券、およびいくつかの売却可能な株式証券、デリバティブ契約、繰延補償計画資産を含む)は、取引価格で初期推定され、その後、各報告期間の終了時に第三者定価サービスまたはオプション価格推定モデルを用いて推定されます。定価サービスは業界標準推定モデルを利用して、収入と市場に基づく方法及び観察可能な市場投入に基づいて価値を決定することを含む。これらの観察可能な市場入力は、報告可能な取引、基準収益率、信用利回り、取引業者/取引業者のオファー、入札、見積もり、現在のスポットレート、および他の業界および経済イベントを含む。
私たちは使用するモデルを理解し、他の価格源から市場価値を取得し、場合によっては価格設定データを分析することによって、私たちの第三者価格サービスが提供する価格を検証します。オプション定価モデルは,期限,株価変動性,定常満期日無リスク金利,配当収益率を含むモデルにおける仮定を用いた。私たちの検証手続きを完了した後、2022年12月31日と2021年12月31日まで、私たちの価格設定サービスが提供するいかなる公正な価値計量も調整またはカバーしていません。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
その他の資産と負債
当社の合併貸借対照表に反映されている抗CD 20治療計画未収の売掛金,その他の流動資産,売掛金と売掛金,その他の短期満期日による近似公正価値である。
現金と現金等価物
流動性が高く、いつでも現金に変換でき、購入日から3ヶ月以内に満期になった投資のみを現金等価物としています。現金等価物には、2022年12月31日と2021年12月31日まで、通貨市場基金、商業手形、隔夜逆買い戻し協定、その他の購入日から3ヶ月以内に満期となる債務証券が含まれる。
売掛金
私たちの大部分の売掛金は製品販売から来て、主に私たちの卸売業者と他の第三者流通業者、公立病院、薬局と他の政府実体の売掛金で、そして標準的な支払い条項があり、通常要求されています30至れり尽くせり90何日ですか。
販売後1年以内に売掛金を回収することを望む場合、契約開始時に重大な融資部分の影響に応じて売掛金を調整することはありません。
お客様が支払うことができないことによる可能性のある見積もり損失に売掛金準備金を提供します。回収できないと判断された金額は準備金から差し引かれたりログアウトしたりします。
サムスン生物会社は帳簿を受け取るべきです
2022年4月に私たちは49.9%Samsung Bioepisの持分をSamsung Biologics Co.,Ltd.(Samsung Biologics)に譲渡し,売掛金を約$とした1.310億ドルの現金は2回の支払いで延期され、金額は約$です812.5100万ドル満期1年で約100万ドルです437.5百万ドルは、この取引が完了して二周年に満期になります。サムスン生物会社が私たちに借りているお金はリスク調整割引率を使用することで公正価値記録を推定していますSamsung Bioepisにおける私たちの株式とこれらの売掛金の会計処理に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
信用リスクが集中する
私たちが集中的な信用リスクに直面させる可能性のある金融商品には、現金と現金等価物、投資、派生商品、売掛金が含まれる。私たちは、私たちが以前に定義した広範で多様な金融商品に投資することで、現金や現金等価物や投資に関連するリスクを最小限にしようとしている。我々は,元本残高の保障と流動性の維持を目的とした信用格付けと満期日に関するガイドラインを策定した。私たちのポートフォリオは私たちの投資政策に基づいて維持されており、この政策は許可された投資を定義し、信用品質基準を規定し、任意の単一発行者の信用開放を制限している。我々は取引相手として格付けの高い金融機関のみを選択し、デリバティブによる信用リスクを最小限に抑える。
私たちの製品を使用する顧客と市場の種類が多く、それらは多くの異なる地理地域に分散しているため、売掛金に関する信用リスクの集中度は緩和され、売掛金は通常無担保である。顧客の財務パフォーマンスと信頼性を監視し、彼らの信用状況の変化を適切に評価し、対応できるようにします。私たちはこのような状況を監視し続け、それらが私たちの業務に及ぼす可能性のある影響を評価する。
有価証券その他の投資
取引可能債務証券
売却可能な売却可能な債務証券は公平な市価で入金され、損益計上累計を実現していない他の全面的な権益収益(損失)は、関連税項の影響を差し引いた後、当該証券に信用損失が生じない限り、吾等は当該証券を売却する意向を決定したか、又は吾等は、証券が予想回収前に当該証券を売却する可能性が高いことを確認している。実現した損益は特定確認に基づく他(収入)費用純額で報告する。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
有価証券とベンチャーファンド
我々の有価証券は公正市場価値記録,未実現収益と損失を他(収入)費用に計上し,純額は我々の総合損益表に計上している。私たちの有価証券は公開取引された有価証券への投資を代表し、私たちの総合貸借対照表に投資と他の資産を計上します
我々のリスク投資基金への投資は公正価値に近い資産純資産を計上し,収益や損失を他の費用に計上することは実現せず,純額は我々の総合損益表に計上した。私たちが投資するベンチャー投資基金の基本的な投資は、あるバイオテクノロジー会社に投資する株式証券であり、私たちの総合貸借対照表の投資や他の資産に含まれています。
非流通株証券
私たちは会社の株式証券にも投資していますが、これらの会社の証券は公開取引ではなく、公正価値も容易に得られません。このような投資は権益会計方法あるいは可視価格変動調整のコストから減値を引いて計上され、私たちの持株比率及びその他私たちの重大な影響力を示す要素に依存する。私たちは最近の会社融資の暗黙的な価値、比較可能な会社の公開市場価格、一般市場状況に基づいてこれらの投資を監視し、その価値がいかなる増加や低下が生じているかどうかを評価する。このような投資は私たちの総合貸借対照表の投資と他の資産に含まれている。
取引可能債務証券の非一時的減価評価
我々は,非一時的減値の意味に基づいて定期的な審査を行い,個々の損失を実現していない投資があることを識別·評価した。単一証券の現在の公正価値がその償却コスト基礎より小さい場合、未実現損失が存在する。一時的かつ信用損失とは無関係に債務証券を売却可能な未実現損失が確定し,税額を差し引いて他の総合収益(損失)を計上する。
赤字を達成していない売却可能な債務証券について、経営陣は、売却しようとしているかどうかを評価するか、または予想される償却コストに基づいて回収する前に証券を売却することを要求される可能性が高いかどうかを評価する。私たちが証券を売却しようとしている場合、あるいは証券の売却が要求される可能性があり、証券の公正価値の低下は非一時的とみなされ、赤字を実現していないすべての金額が減価損失として収益に反映される。
私たちが証券を売却する意図にかかわらず、私たちはその証券の信用に関連する損失を評価するために、実現されていないすべての損失を追加的に分析します。信用損失は、証券の余剰コスト基盤を回収するために十分なキャッシュフローを受けないことが確認された。
権益会計法
私たちが投資する会社の経営や財務政策に大きな影響を与える能力がある場合には、権益会計方法を用いて投資活動を記録する。私たちが大きな影響力を持っているかどうかを評価する際には、私たちの投資の性質と規模、私たちが持っている投票権と保護権、他の会社のガバナンスに参加するかどうか、協力や他のビジネス関係があるかどうかなど、他の関連要素を考慮します。権益会計法では、他社の収入や損失に占める当社のシェアを合併収益表に記録しています。もし私たちの損失シェアが私たちの投資の帳簿価値を超えた場合、私たちは追加的な資金を提供することを約束しない限り、追加的な損失の確認を一時停止し、そうし続けるつもりだ。
在庫品
在庫はコストまたは可変現純値の中で低いものを基準にして、先進先出法でコストを計算します。在庫コストを長期コストに分類し、通常運用期間外で在庫を使用したい場合には、これらのコストを投資·合併貸借対照表の他の資産に含める。臨床または商業製品生産に利用可能な在庫は,臨床生産活動のために決定する際に,研究·開発コストとして支出される。
在庫原価資本化
私たちは規制承認前に私たちの製品に関する在庫コストを資本化し、経営陣の判断によると、将来の商業化は可能であると考えられ、将来の経済効果は
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
実現を期待しています。ある特定の製品の製造コストを資産資本化すべきかどうかを評価する際には,多くの属性が考えられる.我々は、既知のセキュリティまたは有効性の問題、潜在的なラベル制限、および他の承認障害を含む、規制承認プロセスおよびこの承認プロセスにおける特定製品の地位を評価します。私たちは私たちが期待している製品に関する研究開発計画と制限、そしてそれが使用される適応を評価する。私たちは承認や商業化を阻害する可能性のある物流制限を決定する際に、私たちのサプライチェーンを含む私たちの製造環境を考慮します。製品の賞味期限と予想承認時間との関係を考慮し,商業化を阻害または延期する可能性のある特許関連や契約問題を考慮する。私たちの判断はまた商業化の実行可能性、市場傾向、市場受け入れ基準に基づいている。最後に,この製品に関する優位性のある精算戦略を考え,実現可能な経済効果を評価する。(他の潜在的要因を除く)必要な規制機関が承認を拒否したり、重大な遅延承認を拒否したりするため、このような判断が変化した場合には、承認前在庫に関する先行資本化コストを計上する。
古くなった在庫と売れ残りの在庫
各報告期間において、在庫が過剰または時代遅れであるかどうかを検討し、古いまたは他の方法では販売できない在庫をその推定された可変現純値に減記する。実際の現金化可能な純価値が私たちの推定された純価値よりも低い場合、または需要推定に基づいて在庫利用率がさらに減少すると判断された場合、追加の在庫減記が必要となる可能性がある。しかも、私たちの製品は製造過程全体にわたって厳格な品質管理と監視を受けています。もしあるロットあるいは単位の製品が品質規格に適合しなくなった場合、私たちは販売コストに費用を計上し、いかなる滞売在庫をその推定した可変現金値に減記する。すべての場合、製品在庫は、コストまたはその推定可能な現在算入値のうちのより低いものを基準とする。在庫滞納により減記された金額は私どもの総合損益表に販売コストを計上しております。
不動産·工場および設備
物件、工場及び設備はコストで入金され、事件や環境変化により資産の帳簿額面が回収できない可能性がある場合は、減価について審査を行う必要がある。物件、工場や設備に関する正常、日常的または定期的な修理と保守活動のコストは、発生時に費用を計上する。修理が将来の経済効果をもたらす場合、計画された主要な修理活動のコストは、関連する資産購入や建設を含めて資本化される。
主要資本プロジェクト建設期間中に発生する利息コストは資本化され、基礎資産準備が整ってから予想される使用が可能となり、このとき利息コストは基礎資産寿命内の減価償却費用として償却される。また、規制機関が商業的に承認された薬物を生産する新しい製造設備に許可証を発行するために必要な検証作業に関連するいくつかの直接的かつ増分的なコストを利用する。これらのコストは主に直接人工および材料を含み、その予期される用途のために装置を準備する際に発生する。検証コストは,関連設備の使用寿命内に償却するか,検証過程で生産された製品を販売する際に販売コストとして支出する。
また,ある内部で使用されている計算機ソフトウェア開発コストを資本化している.ソフトウェアが生産資産の構成要素である場合、これらのコストは機械および装置に含まれ、関連するソフトウェアの推定使用寿命内に直線的に償却され、使用寿命は通常、推定される三つ至れり尽くせり5年.
私たちは一般的に直線減価償却あるいは私たちの財産、工場と設備のコストを償却して、それぞれの資産の推定使用年数に応じて減価償却や償却を行い、以下のように概説します
| | | | | |
| 資産種別 | 有用な寿命 |
| 土地 | 未減価償却 |
| 建物.建物 | 15至れり尽くせり40年.年 |
| 賃借権改善 | 賃貸借に関する耐用年数または年期が短い |
| 家具と固定装置 | 5至れり尽くせり7年.年 |
| 機械と設備 | 5至れり尽くせり20年.年 |
| コンピュータソフトウェアとハードウェア | 3至れり尽くせり5年.年 |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
私たちが財産、工場、設備を処分する時、関連コストと減価償却を私たちの総合貸借対照表の関連口座から除外し、それによって発生した任意の収益または損失を私たちの総合収益表に計上します。
賃貸借証書
私たちは契約の開始時に一つの手配がレンタルかどうかを確認します。経営リース資産は私たちがレンタル期間内に対象資産を使用する権利を表し、経営リース負債は私たちがレンタルによって発生した賃貸金の支払い義務を代表する。経営リース資産および負債はリース開始日にリース期間内にリース支払いの現在値を確認する。レンタル期間を決定する際には、テナントが行使されると合理的に判断した場合に、テナントを延長または終了するオプションが含まれています。
暗黙的金利が随時決定可能な場合には、暗黙的金利を使用し、暗黙的金利が開始日に取得可能な情報に基づいて随時決定できない場合には、増加借入金金利を使用してリース支払いの現在値を決定する。私たちの逓増借款金利は、関連賃貸と同じ通貨と期限の保証借入金金利を用いて決定されます。
私たちの経営リース資産を決定するための賃貸支払いには、賃貸報酬、宣言された賃貸料の増加、インフレ率に関連するアップグレード条項(確定できれば)が含まれており、私たちの総合貸借対照表で私たちの経営賃貸資産を確認することができます。私たちのレンタル契約はレンタルと非レンタル構成要素を同時に含むことができます。支払いが固定されている時、私たちはそれを単一のレンタル構成要素として会計処理を行います。レンタルプロトコルに含まれる可変支払いは、発生時に料金を計上します。車両のようないくつかの設備のレンタルについては、組み合わせ方法を適用して、経営リース資産と負債を効率的に計算します。
私どもの経営リースは、経営リース資産、計上費用その他、総合貸借対照表における長期経営賃貸負債に反映されています。最低レンタル料金のレンタル料金はレンタル期間内に直線的に確認します。
私たちはまた第三者に転貸する不動産賃貸協定を持っている。私たちは分譲人の経営リースとして私たちの総合貸借対照表に計上すべき費用とその他その他の長期負債を計上します。私たちは総合損益表で借入期間内の転貸収入を直線法で確認した。
レンタルに関するもっと多くの情報は、お読みください別注12,賃貸借契約これらの連結財務諸表まで。
無形資産
我々の無形資産には、完成した技術(取得および認可内の権利および特許、開発された技術、認可外の特許を含む)、2009年1月1日以降に買収された研究開発(IPR&D)、商標、および商号が含まれる。私たちの無形資産は買収時に公正な価値で記録され、私たちの総合貸借対照表に累積償却と減価を差し引いて報告されます(適用すれば)。
将来の収入が合理的に推定できることを期待すれば、すでに取得及び許可された権利及び特許、開発された技術及び許可された特許に関連する無形資産は、合理的に推定できれば、その推定使用年数によって経済消費法に従って償却することができる。収入が合理的に見積もることができない場合は、直線法を用いる。償却は、総合損益表で買収された無形資産の償却と減価に計上されている。
我々は,関連無形資産関連製品による収入に基づく経済消費法を用いて,我々が販売している製品に関連する無形資産を償却する。私たちの長期計画期間内で、そして事件や環境変化が関連製品の期待寿命収入に重大な影響を与えるたびに、私たちは毎年私たちのマーケティング製品の期待寿命収入を分析します。
商業化前に商標、商号、知的財産権の研究開発に関連した無形資産は償却されない。無期限の寿命があるため、しかし、減値審査を受ける必要がある。私たちは十月三十一日から毎年私たちの無形資産の減価を審査して、事件や状況の変化がある資産の帳簿価値を示す限り回収できないかもしれません。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
買収の進行中の研究開発(IPR&D)
買収した知的財産権の研究開発とは、まだ技術実行可能性に達していない研究開発資産に割り当てられた公正な価値である。買収に割り当てられた知的財産権研究開発の価値は,買収した技術を商業的に実行可能な製品に開発するコストを見積もり,プロジェクトによる収入を見積もり,純現金流量を現在値に割引することで決定される。買収を評価するための知的財産権研究開発の収入とコスト予測は、新薬開発の成功確率に基づいて、適宜減少する。また、これらの予測は、関連する市場規模と成長要因、技術の予想傾向、および私たちと競争相手が新製品を発売する性質と予想時間を考慮している。純現金流量を現在値に換算するための比率は、プロジェクトの発展段階および予測に使用される経済推定における不確実性に比例する。IPR&Dを買収した後、私たちは私たちの買収が単一資産または一組の資産の購入を構成するかどうかの評価を完了する。我々は,今回の評価では,買収された技術の性質,単独のキャッシュフローが存在するかどうか,開発過程と完了段階,数量的意義,および我々が取引を達成した理由を含む複数の要因を考慮した.
もし私たちが適用会計基準の定義に従って事業を買収すれば、買収された知的財産権の研究開発は無形資産に資本化される。会計基準の下で適用されない業務定義に適合しない資産の1つまたは組を買収した場合、買収された知的財産の研究開発はその買収日に支出される。これらの資産を開発する将来のコストは,発生時に我々の総合収益表に研究と開発費用を計上する
減値評価を行う際には,上記と同様の方法で公平価値を計算する.もし私たちが買収した知的財産権研究開発の帳簿価値がその公正価値を超える場合、無形資産はその公正価値に減記される。私たちが買収した知的財産権研究開発の公正な価値を決定する際に使用される推定と仮定の変化は減値を招く可能性がある。減値は総合損益表で買収された無形資産の償却と減価に計上されている。
商誉
営業権とは、確認可能な有形と無形純資産の購入価格と公正価値との差額であり、購入会計方法によって計算される。営業権は償却しませんが、十月三十一日から毎年減値を審査し、いかなる事件や状況の変化が営業権の帳簿価値が回収できない可能性があることを示す時に行います。
私たちは報告機関の公正価値をその帳簿価値と比較する。報告単位に割り当てられた純資産の帳簿価値が我々の報告単位の公正価値を超えていれば,差額に等しい減価損失を記録する.中で述べたとおり25細分化された情報これらの連結財務諸表について私たちの運営方法は1つは運営部門、これが私たちの唯一の報告機関だ。
長期資産減価準備
保有·使用すべき長期資産には,物件,工場や設備,および存続が確定した無形資産が含まれており,事件や状況変化が資産や資産グループに関する帳簿金額が回収できない可能性があることが示された場合には,減値について審査を行う。
回収可能性の決定は、資産使用およびその最終処分によって生成された未割引将来のキャッシュフローの推定に基づく。このようなキャッシュフローが資産の帳簿額面を回収するのに不十分であることが予想される場合、その等資産はその公正価値に減記される。処分すべき長期資産は公正価値から売却コストを差し引いて帳簿にする。
値段が合うかもしれない
私たちが買収した対価格は通常、1つ以上の特定の事件の発生に依存する未来の支払いを含む。私たちは買収日に公正な価値でその等または支払いのある債務を記録した。我々は推定モデルを通じて価格債務に対する公正価値を推定し、これらの推定モデルはマイルストーンの実現に関する確率調整仮説を格納し、関連支払いの可能性を推定した。私たちは各報告書期間に私たちのまたは対価格債務を再評価する。私たちのまたは対価格債務の公正な価値変化は私たちの総合損益表で確認されています。または、割引率の調整、製品開発に関連する予想支出額または時間の変動、製品に関する現金流量および準備金額または時間の変動を含む、対価格債務公正価値の変動は、1つまたは複数の投入の変動によって生じることができる
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
商業化、販売および開発の累積マイルストーンに基づく任意の仮説達成または時間の変化、いくつかの臨床イベントの確率の変化、および規制承認に関連する仮説確率の変化
我々の推定モデルにおける割引率は,債務返済に関する信用リスクの尺度を代表している.私たちの割引または債務の期限は、候補製品の現在の開発段階、その候補製品に対する特定の開発計画が開発手順を完了する確率、およびトリガまたは支払いの時間に基づいて調整されます。成功確率を見積もる際には,業界研究や我々自身の経験を含むいくつかのソースからの類似マイルストーン事件に関するデータを利用した.このような公正な価値計量は市場では観察できない重大な投入に基づいている。これらの仮定の妥当性を決定する際には,買収日以降の各時期までの重大な判断を採用した.
派生ツールとヘッジ活動
キャッシュフローと公正価値派生ツール
私たちは総合貸借対照表で公正な価値ですべての派生ツールが資産または負債であることを確認した。派生ツールの公正価値は、当期収益または累積他の全面収益(損失)確認に変動し、派生ツールがヘッジ取引の一部として指定されているかどうか、およびそうであれば、ヘッジ取引のタイプに依存する。これらのツールのキャッシュフローは,ヘッジ項目のキャッシュフローと同じクラスに分類される.私たちは取引や投機目的のために派生道具を持ったり発行したりしないつもりだ。
我々は,ヘッジ取引で使用されるデリバティブがヘッジプロジェクトのキャッシュフローや公正価値の変動を効果的に相殺できるかどうかを開始時および継続的に評価した.我々は,裁定取引に用いたデリバティブの長期点数部分を有効性テストから除外し,その部分に関する公正価値損益を我々の総合損益表において関連裁定項目と同一行に記録した.予測された取引が二度と発生しないと判断した場合、ヘッジツールが影響を受ける部分のヘッジ会計を停止し、契約上の任意の関連未達成収益または損失は現在の収益で確認される。
純投資デリバティブ
徳西さん純投資ヘッジは我々の総合貸借対照表で公正価値で資産または負債であることが確認された。我々は,累積した他の包括収益(損失)における現金為替レートの変化をヘッジし,長期レートの変化を排除し,契約期間内の総合収益表純額に他(収入)費用における長期点数を償却した。これらのツールのキャッシュフローは,ヘッジ項目のキャッシュフローと同じクラスに分類される.
2022年第2四半期から、私たちは純投資ヘッジファンドを持っていません。それらは私たちが売るにつれて49.92022年4月にサムスンBioepisで%の株式を所有する。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
デリバティブやヘッジ活動についての情報は、お読みください付記10、派生ツールこれらの連結財務諸表まで。
外貨の換算
私たちのほとんどの海外子会社のビットコインは現地通貨です。我々がドル以外の機能通貨で取引している非米国子会社については、資産と負債は資産負債表の日の現在の為替レートで換算されている。収入と支出項目はその期間の平均外貨為替レートに換算する。海外業務の財務諸表をドルに変換することによる調整は純収益の決定に計上するのではなく、権益の単独構成要素として他の全面収益(損失)の累計に記録されている。資産と負債の本位貨幣が現地通貨と異なる子会社については、非貨幣性資産と負債は資産を買収した日の有効為替レートで換算し、貨幣性資産と負債は資産負債表日の現行為替レートで換算する。収入と支出項目はこの期間の平均外貨為替レートで換算される。これらの子会社の換算調整は他(収入)費用に計上し、純額は我々の総合損益表に計上する。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
販売使用料コスト
私たちは、知的財産権の取得に関連する許可または購入契約に基づいて、複数の第三者に使用料を支払います。これらの特許使用料は、通常、特定の年におけるわが製品の売上の割合(特許使用料料率)で計算される。特許権使用料は一定に保つことができ、年間期間の総売上高に応じて毎年増加または減少することができる。四半期ごとに通年の総印税義務を見積もり、実際の四半期売上高が通年推定売上高に占める割合に基づいて、割合額を販売コストとして確認する。例えば、いずれの例年の純売上水準が当該年内の特許権使用料を増加させた場合、推定された混合特許権使用料料率に基づいて、年間の販売コストを平均比率で記録する。
株式ベースの給与会計
我々の株式ベース報酬計画付与の奨励には、株式オプション、株式表現に応じて付与される制限株式単位(MSU)、現金決済の業績既得性制限株式単位(CSPU)、時間既得性制限株式単位(RSU)、我々の取締役会の報酬·管理発展委員会が現金または普通株(PU)で決済する業績既得制限株式単位(PU)、株式または現金で決済する業績既得性株式単位(PSU)、および我々の従業員による株式購入計画(ESPP)に基づいて発行される株を自ら決定することがある。補償支出は付与日奨励の推定公正価値に基づいて確認される。必要なサービス期間(通常は帰属期間)内で賠償金の見積もり数を没収することを考慮した後,期待される賠償額の補償費用を確認する。報酬が非実質的な帰属期間(例えば、一部の奨励が退職資格に適合する場合に付与される)を有する場合、私たちは、付与日から従業員が退職資格に適合する日までの期間に基づいて費用を推定および確認する。
我々の株式オプション付与の公正価値は,Black-Scholesオプション推定モデルを用いて付与日に推定した.その後、株式オプションの推定公正価値は、オプションの帰属中に支出される。
我々のMSUの公正価値はモンテカルロシミュレーションを持つ格子モデルを用いて推定される.我々は,我々MSUのサービス期間に適用されるシェアベースの補償費用を加速帰因方法を適用して確認した.実際に株式を稼ぐことが予想される可能性は日割りで考えられているため、実際の稼ぎを反映した単位に支出は調整されない。
私たちのRSUの公正価値は付与された日の私たちの株の市場価値に基づいている。RSUの補償費用は,適用されるサービス期限内に直線的に確認される.
現金決済のCSPU、PU、PSUの会計計算を行う際には、加速帰属法を用いて株式による報酬支出を確認し、予想決済により各報告期間終了時に負債の公正価値を再計測する。現金決済のCSPU,PU,PSUに関する補償費用は,株価と,ある業績基準に達する可能性と,期待される業績基準に関する目標支払いレベルを評価した後に得られる単位数に基づいている.四半期ごとに累積調整を記録し、株価の変化や業績に関する条件の推定結果を反映して、結果が確定·解決される日まで記録する。業績基準が達成されていない場合、または達成されないと予想される場合、以前に確認された報酬に関連する任意の報酬支出が打ち切られる。
株式決済におけるPSUの公正価値は付与日の株価に基づいている。ある業績基準を達成する確率と達成された業績基準に関する目標支出レベルを評価した後、予想される単位数で報酬費用を確認する。四半期ごとに累積調整数を記録し、結果確定·決算日まで業績に関する条件の見積もり結果を反映させる。業績基準が達成されていない場合、または達成されないと予想される場合、以前に確認された報酬に関連する任意の報酬支出が打ち切られる。
研究開発費
研究開発費用には、報酬および福祉、施設および管理費用、臨床試験費用および契約研究機関(CRO)に支払われる費用、臨床供給および製造費用、予想された製品発表によって資本化され、もはや現金化されていないと判断された在庫の解約、および第三者協力者に支払われる他の外部費用および前払い費用およびマイルストーンが含まれる研究開発活動で発生する費用が含まれる。研究開発
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
料金は発生時に料金を計上します。第三者協力者に支払われる前金とマイルストーン支払いは、規制部門の承認を得る前に発生した費用として計上される。規制機関の承認後に支払われた一里塚支払いは、関連製品の残存使用寿命内に資本化·償却される。私たちはサービスを提供する前に研究開発サービスのために支払ったお金を私たちの総合貸借対照表に前払い資産として記録し、サービスを提供する際に費用を計上します。終了または終了した計画に関連して行われている臨床試験のコストも計算すべきであるが,その計画の終了または終了の決定を行う際には,これらの計画は将来的な経済効果を持たない。
私たちは時々開発協定を締結し、パートナーと費用を分担する。私たちは、私たちの協力パートナーから受け取った彼らが分担した開発コストに関する支払い記録を研究開発費の減少に記録します付記19、連携関係その他の関係これらの連結財務諸表。GenentechがRituxan,Gazyva,その他の予備適応が承認された製品の持続開発で発生した費用は研究開発費として記録されるのではなく,抗CD 20治療計画収入の構成要素である利益における我々のシェアを減少させた。
事業化製品との連携については、私どもが担当者であれば、連結損益表に収入とそれに応じた運営コストをそれぞれの項目に記録します。もし私たちが元金でなければ、私たちは運営費用を収入の減少として記録するだろう。
販売、一般、管理費用
販売、一般及び行政支出は主に販売及び市場、財務、人力資源、法律、情報科学技術及びその他の行政人員に関連する報酬及び福祉、外部市場普及、広告及び法律支出及びその他の一般及び行政コストを含む。
広告費用は発生時に費用を計上する。2022年、2021年、2020年12月31日までの年間における広告コストは合計$54.1百万、$98.7百万ドルとドル111.8それぞれ100万ドルです
所得税
所得税規定には連邦税、州税、地方税、外国税が含まれる。所得税は貸借対照法で計算される。繰延税金資産と負債は、財務諸表の帳簿額面とそのそれぞれの税額との間の一時的な差異による将来の税務結果を推定することについて確認した。繰延税項資産および負債は制定税率計量を採用し,回収または一時的な差額の決済が予想される年度の課税所得額に適用される予定である。私たちは私たちの繰延税金資産の現金化能力を評価し、繰延税金資産のすべてまたは一部が現金化できない可能性が高い場合に推定準備を確立する。私たちは私たちの世界無形低税収入(GILTI)税金計算に関する繰延税金を確認した。
在庫が第三者に売却された場合、我々の合併グループ内の実体内の在庫移転による所得税の結果は、当期でも繰延でも、前払い税金または繰延費用として記録され、我々の合併収益表で確認される。在庫以外の資産の実体内移転及び繰延税項に関する変化による所得税結果を移転発生時に確認する。
不確定な税収状況を確認·解決するために“より可能性の高い”敷居を用いて、不確定な税収状況を計算する。我々は四半期ごとに不確定な税務状況を評価し、税法の変化、納税申告書に採用されているまたは予想される税収状況の測定、監査すべき事項の効果的な解決、監査活動の過程で得られた情報、および税収状況に関連する事実または状況の変化を含むが、様々な要素を考慮する。私たちはまた、所得税(福祉)費用に確認されていない税金優遇に関する潜在的な利息と罰金を総合収益表に計上します。
事件があったり
私たちは現在様々なクレームと法的訴訟を行っている。任意のクレーム、断言された、または断言されていない、または法的訴訟の潜在的損失が可能であると考えられ、金額を合理的に推定することができ、または損失範囲を決定することができる場合、損失準備金は計上されるべきか、または損失準備金が計上されるべきである。これらの計算すべきプロジェクトは経営陣の可能性のある損失の最適な推定値を代表する。合理的に損失が発生する可能性がある場合、または合理的に損失可能な金額が記録の準備を超える場合には、開示も規定される。私たちは四半期ごとに各重要事項の状況を検討し、その潜在的な財務リスクを評価する。重要な判断は
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
確率と暴露が合理的に推定されるかどうかを決定する時に必要だ。これらの事項に関する不確実性のため,計算すべき項目はその時点で得られる最適な情報のみをもとにしている.より多くの情報を得るにつれて、未解決クレームや訴訟に関連する潜在的な責任を再評価し、私たちの推定を変更する可能性があります。法律手続きに関連する法律費用は発生時に費用を計上する。
1株当たりの収益
1株あたりの基本収益の計算方法は,生物遺伝会社の未分配純収入をその期間に発行された普通株の加重平均で割る。希釈1株当たり収益は国庫法により計算され,計算方法は純収入で除した期間内に発行された普通株の加重平均に希釈可能な発行済み普通株同値株を加える。
新会計公告
指定された発効日から、財務会計基準委員会または我々が採用している他の基準策定機関は、時々新しい会計公告を発表する。以下で他の議論がない限り、吾らは、最近発表された基準を採用することが、吾等の総合財務諸表または開示に重大な影響を与える可能性があると信じていない。
公正価値計量
FASBは2022年6月、会計基準更新(ASU)第2022-03号を発表した公正価値計量 (Topic 820): 契約販売制限下における持分証券の公正価値計量それは.この基準は、持分証券を売却する契約制限は、持分証券会計単位の一部とはみなされないため、公正価値を計量する際には考慮されないことを明らかにしている。この基準は2024年1月1日から私たちに施行される。私たちは2022年第3四半期にこの基準を事前に採用することを選択した。採用された後,Sage治療会社(SAGE)のある株の公正価値計測から余剰契約販売制限の影響が除去されたため,合併損益表に非実質的な他(収入)費用を記録した。
所得税
2019年12月、FASBはASU第2019-12号を発表した所得税 (Topic 740): 所得税の会計計算を簡素化するそれは.本基準は、第740の主題における一般原則のいくつかの例外を削除し、所得税会計のいくつかの他の態様を簡略化する。この基準は2021年1月1日に施行され、私たちの連結財務諸表や関連開示に実質的な影響を与えていません。
BIIB 118買収
2020年3月、著者らはファイザー社(ファイザー社)からBIIB 118(CK 1阻害剤)を獲得し、各種の精神と神経疾患の行為と神経症状患者を潜在的に治療する。今回の買収について、私たちは#ドルを前払いしました75.02020年12月31日までの年間総合収益表では、この金が資産買収として入金され、買収された知的財産権研究開発として記録されている2022年には、その戦略審査過程の一部として、経営陣の決定によりBIIB 118のさらなる開発を中止しました。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
サムスンBioepisの合弁企業株を売却する
2022年4月に私たちは49.9%サムスン生物の株式はサムスン生物会社が保有している。この取引の条項によると、約$を受け取りました1.0取引完了時に10億ドルの現金を獲得し、約10億ドルを獲得する予定です1.310億ドルの現金は2回の支払いで延期され、金額は約$です812.5100万ドル満期1年で約100万ドルです437.5百万ドルは、この取引が完了して二周年に満期になります
販売する前に、帳簿価値サムスンBioepisへの投資総額は$です581.6百万ドルです上には年.年2022年12月31日までに確認された税引き前収益は約1.5この取引に関連した10億ドルは、他の費用を計上し、我々の総合損益表で純額とする。この税引前収益にはその他の総合収益を累計する純収益は約$である58.9累計翻訳損失は100万ドルで、部分的に約1,500ドルを相殺します57.0私たちの純投資ヘッジで発生した百万ドルの収益を終わらせる。
私たちの結論は、剥離Samsung Bioepisは、この業務を剥離する決定が、私たちの業務および財務業績に大きな影響を与える戦略的転換を意味しないので、私たちの合併財務諸表で非持続的な業務として報告される基準に適合していない。
私たちは公正な価値オプションを選択し、公正な価値でサムスン生物会社が私たちに支払うべき金額を計算した。2022年12月31日現在、1回目と2回目の支払いの見積公正価値使用リスク調整割引率5.7%そして5.9%それぞれ,約$798.8百万そして$405.4百万それぞれ,である.これらの支払いは、3段階計量に分類され、我々の総合貸借対照表における他の流動資産および投資および他の資産にそれぞれ反映される。
2022年12月31日までの年間で約$10.7百万損失は約$1.4百万私たちの1回目と2回目の支払いにそれぞれ関連した公正な価値変化を反映する。これらの変化は他の(収入)費用に記録されており,我々の合併損益表では純額である.
この取引の一部として、私たちには最高$を得る資格があります50.0いくつかのビジネスマイルストーンを達成した上で、100万ドルの収入を得た。私たちのこのような性質または支払いに対する政策は、支払いが現金化可能な間に支払いを確認することであり、これは通常、支払いを受ける期間と同じである。
今回の取引完了2周年後も当社の未払い金があれば、当社は選択することができます5.0残りの満期金額は%割引で現金の代わりに支払います。現在、サムスン生物が満期金をタイムリーに支払うことができなかった可能性はわずかだと考えられている。
なお,本年度まで2022年12月31日私たちは約$の離散税金支出を記録した257.9この取引に関連した100,000,000ドルは,我々の総合収益表の所得税(福祉)費用に反映される。
2022年コスト削減計画
2021年12月と2022年5月に、2022年に一連のコスト削減措置を実施する計画を発表した。これらの節約は、リストラ、商業ADUHELMインフラの大幅な廃止、ある不動産場所の統合、私たちの販売、一般と行政、研究開発機能の運営効率の向上など、一連の措置によって実現されている。
これらの措置の下で、総再編成費用は約$と推定されます131.0100万ドルは主に解散費と関連がある。この金額は2022年の間に大きな部分が発生した。2022年12月31日までに35.9私たちの再編成準備金にはまだ100万ドルがあり、2026年までに支払われる予定だ。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2022年12月31日までの年間で約131.1私たちの2022年コスト節約計画に関する税引前再編費用の純額は100万ドルで、その約112.6従業員の解散費を含む百万ドルです。これらのコストは我々の総合損益表に再構成費用を計上している。私たちの再編準備金は計上すべき費用、その他は私たちの総合貸借対照表に計上されます。
2022年9月、私たちはマサチューセッツ州ケンブリッジ市ビンニー街300号(ビンニー街300号)にある部分レンタルを部分的に中止し、残りの空間の大部分のレンタル期間を短縮することで合意しました。これは約$の収益をもたらした5.3百万ドルは,2022年12月31日までの年間総合収益表に再編費用を計上した。ビンリー街300番地のテナント変更に関する情報は、お読みください別注12,賃貸借契約これらの連結財務諸表まで。
現在の容量需要を評価した後,2022年3月にノースカロライナ州ダラムにある患者サービスオフィスの使用を中止した。私たちがこの施設を使用することを停止する決定は、その施設のいくつかのレンタル改善と他の資産に直ちに費用を発生させる。そこで私たちは約$10.4加速減価償却費用百万ドルは、2022年12月31日までの年度総合損益表に再編費用を計上する。2022年5月、私たちは賃貸譲渡契約を締結し、この協定に基づき、残りのレンタル義務を外部第三者に譲渡しました。賃貸譲渡の結果として、2022年第2四半期に関連経営賃貸義務と使用権資産の確認を取り消しました。
2022年12月31日までに,他の組換えコストが約$であることを確認した13.2100万ドルは私たちの総合損益表の再構成費用に記録されています。その他の再構成コストには,施設閉鎖コスト,従業員非解散費,資産抹消,その他のコストなどの項目がある。
次の表は2022年までの年度のリストラに関する費用と支出をまとめたものである2022年12月31日:
| | | | | | | | | | | | |
| (単位:百万) | | 合計する | | | | |
| 再編準備金、2021年12月31日 | | $ | — | | | | | |
| 費用.費用 | | 112.6 | | | | | |
| 支払い | | (78.0) | | | | | |
| 外貨とその他の調整 | | 1.3 | | | | | |
| 再編準備金、2022年12月31日 | | $ | 35.9 | | | | | |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
製品収入
製品別収入の概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| | | 2022 | | 2021 | | 2020 |
| (単位:百万) | | ユナイテッド航空
州政府 | | 残りの部分
世界 | | 合計する | | ユナイテッド航空
州政府 | | 残りの部分
世界 | | 合計する | | ユナイテッド航空
州政府 | | 残りの部分
世界 | | 合計する |
| 多発性硬化症(MS): | | | | | | | | | | | | | | | | | | |
| T@@ ec@@ f@@ id@@ er@@ a | | $ | 417.7 | | | $ | 1,026.2 | | | $ | 1,443.9 | | | $ | 680.6 | | | $ | 1,271.3 | | | $ | 1,951.9 | | | $ | 2,677.7 | | | $ | 1,163.4 | | | $ | 3,841.1 | |
虚栄心(1) | | 521.3 | | | 32.1 | | | 553.4 | | | 408.9 | | | 1.5 | | | 410.4 | | | 64.3 | | | — | | | 64.3 | |
| フマル酸総量 | | 939.0 | | | 1,058.3 | | | 1,997.3 | | | 1,089.5 | | | 1,272.8 | | | 2,362.3 | | | 2,742.0 | | | 1,163.4 | | | 3,905.4 | |
| Avonex | | 649.2 | | | 324.3 | | | 973.5 | | | 830.2 | | | 378.5 | | | 1,208.7 | | | 1,083.4 | | | 408.5 | | | 1,491.9 | |
| プレグリディ | | 148.4 | | | 183.5 | | | 331.9 | | | 152.9 | | | 204.5 | | | 357.4 | | | 190.1 | | | 195.5 | | | 385.6 | |
| 総インターフェロン | | 797.6 | | | 507.8 | | | 1,305.4 | | | 983.1 | | | 583.0 | | | 1,566.1 | | | 1,273.5 | | | 604.0 | | | 1,877.5 | |
| T@@ ys@@ ab@@ ri | | 1,123.4 | | | 907.5 | | | 2,030.9 | | | 1,142.2 | | | 920.9 | | | 2,063.1 | | | 1,096.8 | | | 849.3 | | | 1,946.1 | |
| スズメの花 | | — | | | 96.6 | | | 96.6 | | | — | | | 105.2 | | | 105.2 | | | — | | | 103.1 | | | 103.1 | |
| 小計:ミリ秒 | | 2,860.0 | | | 2,570.2 | | | 5,430.2 | | | 3,214.8 | | | 2,881.9 | | | 6,096.7 | | | 5,112.3 | | | 2,719.8 | | | 7,832.1 | |
| | | | | | | | | | | | | | | | | | |
| 脊髄性筋萎縮: | | | | | | | | | | | | | | | | | | |
| SPINRAZA | | 600.2 | | | 1,193.3 | | | 1,793.5 | | | 587.9 | | | 1,317.2 | | | 1,905.1 | | | 787.8 | | | 1,264.3 | | | 2,052.1 | |
| | | | | | | | | | | | | | | | | | |
| 生体模倣薬: | | | | | | | | | | | | | | | | | | |
| ベネッパーリ | | — | | | 441.0 | | | 441.0 | | | — | | | 498.3 | | | 498.3 | | | — | | | 481.6 | | | 481.6 | |
| IM@@ RA@@ LD@@ I | | — | | | 224.5 | | | 224.5 | | | — | | | 233.4 | | | 233.4 | | | — | | | 216.3 | | | 216.3 | |
| FlIXABI | | — | | | 81.3 | | | 81.3 | | | — | | | 99.4 | | | 99.4 | | | — | | | 97.9 | | | 97.9 | |
BYOVIZ(2) | | 4.3 | | | — | | | 4.3 | | | — | | | — | | | — | | | — | | | — | | | — | |
| 小計:生体模倣薬 | | 4.3 | | | 746.8 | | | 751.1 | | | — | | | 831.1 | | | 831.1 | | | — | | | 795.8 | | | 795.8 | |
| | | | | | | | | | | | | | | | | | |
| その他: | | | | | | | | | | | | | | | | | | |
| FUMAD | | — | | | 8.2 | | | 8.2 | | | — | | | 11.0 | | | 11.0 | | | — | | | 12.2 | | | 12.2 | |
| アドゥヘラム | | 4.8 | | | — | | | 4.8 | | | 3.0 | | | — | | | 3.0 | | | — | | | — | | | — | |
| 製品総収入 | | $ | 3,469.3 | | | $ | 4,518.5 | | | $ | 7,987.8 | | | $ | 3,805.7 | | | $ | 5,041.2 | | | $ | 8,846.9 | | | $ | 5,900.1 | | | $ | 4,792.1 | | | $ | 10,692.2 | |
(1) VUMERITYは2021年第4四半期にEUで商業使用を開始した。
(2)BYOOVIZは2022年6月に米国で発売され、2022年第3四半期に商業使用を開始した。
私たちが確認した収入は二つ卸占26.8%和11.12022年のGDPの%を占めています28.8%和10.12021年のGDPに占める割合と30.5%和15.32020年の国内総生産の1%を占めています
2022年12月31日までに二つ卸個人約占め22.7%和10.9製品販売に関する売掛金の純額の割合と21.9%和10.2それぞれ2021年12月31日までの割合。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
割引と手当準備金の変化の分析概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日 |
| (単位:百万) | | 割引 | | 契約書
調整する | | 返品 | | 合計する |
| 期初残高 | | $ | 137.7 | | | $ | 759.6 | | | $ | 38.0 | | | $ | 935.3 | |
| 今年度の販売に関する現行の準備 | | 666.6 | | | 2,715.5 | | | 12.3 | | | 3,394.4 | |
| 数年前の調整に関する | | (2.8) | | | 1.4 | | | (7.2) | | | (8.6) | |
| 本年度の販売に関する支払·貸金 | | (514.9) | | | (2,060.7) | | | (1.2) | | | (2,576.8) | |
| 数年前の販売に関する支払·貸金 | | (132.8) | | | (558.1) | | | (18.4) | | | (709.3) | |
| 期末残高 | | $ | 153.8 | | | $ | 857.7 | | | $ | 23.5 | | | $ | 1,035.0 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2021年12月31日 |
| (単位:百万) | | 割引 | | 契約書
調整する | | 返品 | | 合計する |
| 期初残高 | | $ | 141.4 | | | $ | 1,093.0 | | | $ | 41.6 | | | $ | 1,276.0 | |
| 今年度の販売に関する現行の準備 | | 736.7 | | | 2,948.7 | | | 15.2 | | | 3,700.6 | |
| 数年前の調整に関する | | (4.0) | | | (96.1) | | | (3.3) | | | (103.4) | |
| 本年度の販売に関する支払·貸金 | | (599.3) | | | (2,283.1) | | | (0.4) | | | (2,882.8) | |
| 数年前の販売に関する支払·貸金 | | (137.1) | | | (902.9) | | | (15.1) | | | (1,055.1) | |
| 期末残高 | | $ | 137.7 | | | $ | 759.6 | | | $ | 38.0 | | | $ | 935.3 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2020年12月31日 |
| (単位:百万) | | 割引 | | 契約書
調整する | | 返品 | | 合計する |
| 期初残高 | | $ | 131.1 | | | $ | 1,027.3 | | | $ | 40.5 | | | $ | 1,198.9 | |
| 今年度の販売に関する現行の準備 | | 774.7 | | | 3,308.8 | | | 19.0 | | | 4,102.5 | |
| 数年前の調整に関する | | (1.0) | | | (54.0) | | | 1.3 | | | (53.7) | |
| 本年度の販売に関する支払·貸金 | | (635.1) | | | (2,426.1) | | | — | | | (3,061.2) | |
| 数年前の販売に関する支払·貸金 | | (128.3) | | | (763.0) | | | (19.2) | | | (910.5) | |
| 期末残高 | | $ | 141.4 | | | $ | 1,093.0 | | | $ | 41.6 | | | $ | 1,276.0 | |
我々の総合貸借対照表に含まれる上記準備金総額の概要は以下のとおりである
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 売掛金の減少 | | $ | 143.4 | | | $ | 133.2 | |
| 計算すべき費用とその他の費用の構成要素 | | 891.6 | | | 802.1 | |
| 収入に関する準備金総額 | | $ | 1,035.0 | | | $ | 935.3 | |
抗CD 20治療プロジェクトの収入
表に抗CD 20治療項目の収入をまとめた。本脚注では,RituxanとRituxan HYCELAを総称してRituxanと呼ぶ.
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| OCREVUSの販売特許使用料収入 | | $ | 1,136.3 | | | $ | 991.7 | | | $ | 845.4 | |
| アメリカのRituxanとGazyvaにおける生物遺伝研究会社の税引前利益シェア | | 547.0 | | | 647.7 | | | 1,080.2 | |
| 抗CD 20治療プロジェクトの他の収入 | | 17.2 | | | 19.1 | | | 52.2 | |
| 抗CD 20治療プロジェクトの総収入 | | $ | 1,700.5 | | | $ | 1,658.5 | | | $ | 1,977.8 | |
大ざっぱに16.7%, 15.1%和14.72022年、2021年、2020年、私たちの総収入の10%はそれぞれ遺伝子テークとの協力から来ています。私たちの協力に関するより多くの情報を知っています
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
遺伝子テークとの手配、どうぞお読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
その他の収入
その他の収入には、特許権使用料収入と契約製造およびその他の収入が含まれており、要約は以下の通りである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| 代役やその他の収入 | | $ | 417.7 | | | $ | 427.7 | | | $ | 719.1 | |
| 特許権使用料収入 | | 67.4 | | | 48.6 | | | 55.5 | |
| その他収入合計 | | $ | 485.1 | | | $ | 476.3 | | | $ | 774.6 | |
代役やその他の収入
代工その他の収入は主に私たちの戦略顧客と代行契約を結んで稼いだ金額を反映しています。
2019年第3四半期に、契約製造顧客との合意を修正し、この合意に基づいて、製造に関連する特定の知的財産権を顧客に許可しました。2020年第2四半期に、顧客の製品は、製造に関連するいくつかの知的財産権を用いて製造された規制部門の承認を得た。私たちは$を得る権利があります500.0一連の三回払いの百万ドルです。最初の支払いは規制部門がこのような製品を承認した後に満期になり、2020年第2四半期に受信される。第2の金は監督管理部門の承認1周年に期限が切れ、2021年第2四半期に受領される。第3の金は監督管理部門の承認2周年に期限が切れ、2022年第2四半期に受領される。
2020年12月31日までの年間契約製造その他の収入は346.2上述したように、修正されたプロトコルに基づいて、製造に関連するいくつかの知的財産権の許可を顧客に渡し、そのような顧客に製造製品供給サービスを提供する。残りの$を割り当てました153.8百万ドル500.0百万の取引価格が製品を製造して顧客にサービスを提供することに対する表現は、2026年まで続くと予想される。製造サービスに割り当てられる価値は、供給に対する予想される需要および比較可能な製造および発展サービスの公正な価値に基づく。
特許権使用料収入
特許使用料収入は、私たちが許可を超えた特許関連製品の純販売から得た特許使用料と、サムスンBioepisと協力して手配したバイオ類似製品の特許使用料収入を反映しています。
サムスンBioepisとの協力手配に関するもっと多くの情報を読んでください備考19:連携関係とその他の関係これらの連結財務諸表まで。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
在庫の構成部分の概要は以下のとおりである
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 原料.原料 | | $ | 413.2 | | | $ | 349.6 | |
Oracle Work in Process(1) | | 751.9 | | | 814.0 | |
| 完成品 | | 200.4 | | | 187.9 | |
| 総在庫 | | $ | 1,365.5 | | | $ | 1,351.5 | |
| | | | |
| 貸借対照表分類: | | | | |
| 在庫品 | | $ | 1,344.4 | | | $ | 1,351.5 | |
| 投資やその他の資産 | | 21.1 | | | — | |
| 総在庫 | | $ | 1,365.5 | | | $ | 1,351.5 | |
(1) 2022年12月31日までの製品在庫は、約$を含む89.8LEQEMBIに関する百万ドルです。
長期在庫は私たちの総合貸借対照表の投資と他の資産に含まれています。
過剰、古い、または滞納により減記された在庫金額は販売コストに計上され、総額は#ドルとなる336.2百万、$167.6百万ドルとドル26.62022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。
在庫査定
2022年4月,医療保険·医療補助サービスセンター(CMS)はADUHELMを含むアルツハイマー病抗アミロイド治療種別の最終全国被覆決定(NCD)を発表した。最終的なNCDはエビデンス開発のカバー範囲を確認しており,このカバー範囲では,連邦医療保険を持つ患者は承認された臨床試験の一部である場合にのみ治療を受けることができる。この決定は,将来のADUHELMへの需要を最小限に抑えることが予想される.2022年第1四半期に約#ドルを無効にしました275.0CMSのこの決定により,ADUHELMに関する在庫は100万ドルに達しており,この決定は2022年12月31日までの年度総合損益表の販売コストで確認された。約$を確認しました136.0衛材に関する百万ドル45.0これらの費用の共同利益(損失)共有におけるこれらの費用の割合は、2022年12月31日までの年度総合損益表である。
2021年第4四半期に約#ドルを無効にしました120.0予測需要を超える百万在庫がADUHELMに関連していることは,2021年12月31日までの年度総合損益表の販売コストで確認した。約$を確認しました59.0衛材に関する百万ドル45.02021年12月31日までの年間総合収益表では、これらの費用の協力利益(赤字)共有におけるシェアがある。
2022年12月31日現在、我々ADUHELM在庫の帳簿価値は取るに足らない。2021年12月31日までに223.0百万のADUHELM在庫があります。より多くの情報については、お読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
無形資産
累計償却、減価費用、調整後の無形資産を差し引くと以下のようにまとめられる
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 2022年12月31日まで | | 2021年12月31日まで |
| (単位:百万) | 予想寿命 | | コスト | | 積算
償却する | | ネットワークがあります | | コスト | | 積算
償却する | | ネットワークがあります |
| プラント技術 | 4-28年.年 | | $ | 7,415.3 | | | $ | (5,629.2) | | | $ | 1,786.1 | | | $ | 7,413.1 | | | $ | (5,388.5) | | | $ | 2,024.6 | |
| 現在行われている研究と開発 | 商業化までは定かではありません | | — | | | — | | | — | | | 132.7 | | | — | | | 132.7 | |
| 商標と商品名 | 不定である | | 64.0 | | | — | | | 64.0 | | | 64.0 | | | — | | | 64.0 | |
| 無形資産総額 | | | $ | 7,479.3 | | | $ | (5,629.2) | | | $ | 1,850.1 | | | $ | 7,609.8 | | | $ | (5,388.5) | | | $ | 2,221.3 | |
償却と減価
購入した無形資産の償却と減価総額は#ドル365.9百万、$881.3百万ドルとドル464.82022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。
減価費用は含まれておらず、総額は#ドルである無形資産の償却を買収した246.3百万、$252.0百万ドルとドル255.12022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。T.T彼は減った3年以内の無形資産の償却(減価費用を除く)の買収は主にEが取得した無形資産の償却比率は低い。
2022年12月31日までに、すでに購入した無形資産の償却·減価反映$119.6百万ヴィソタ命に関する減価費用NE(BIIB 074)は糖尿病性疼痛性神経病変(DPN)の潜在的治療に用いられる。
2021年12月31日までの年間で、買収された無形資産の償却と減価が反映されている365.0BIIB 111(Timrepicene Emparvovec)に関する百万ドルの減価費用、a#220.0BIIB 112(Cotoretgene Toliparvovec)に関する百万ドルの減価費用と#ドル44.3三叉神経痛(TGN)を治療する可能性のあるビソトリアジンに関連する百万ドルの欠陥費用。
2020年12月31日までに、購入済み無形資産の償却·減価が反映されている115.0BIIB 111に関連した100万ドルの減価費用は75.4BIIB 054(Cinpanemab)に関連する百万ドルの減価費用と19.3私たちのもう一つの知的財産権研究開発無形資産に関する減価費用は100万ユーロだ
完成した技術
完成した技術は主に私たちが資産買収、許可証、業務合併によって獲得した他の市場製品と計画と関係がある
企業合併に関する知的財産権の研究開発
知的財産権の研究開発は著者らが業務合併の一部として買収した、買収の日にまだ技術実行可能性に達していない研究開発資産の公正な価値である。知的財産権研究と開発残高には外貨為替レートの変動に関する調整が含まれている。十月三十一日、事件や環境変化が資産の帳簿価値が回収できない可能性があることを示すたびに、私たちは毎年知的財産権研究と発展を買収する減価として資本化された金額を審査しています。2021年12月31日まで、著者らの知的財産権研究開発資産に関する帳簿価値は、著者らがConverise PharmPharmticals Holdings Ltd.(Converging)を買収した時に買収した知的財産権研究開発プロジェクトと関係がある。2022年12月31日現在、Vxotrigineの開発中止を決定したため、余剰帳簿価値を減少させる減価費用を確認しましたゼロ.
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
ビソトリアジン
Conversionに対する私たちの買収について、$を確認しました424.6買収した知的財産権研究開発無形資産のうち百万ドルはビソトリアジンに使用されている。ビソトリアジンを買収してからしばらくTGNに対する潜在的な治療と潜在的なtはDPN、もう一つの形態の神経病理性疼痛を治療する。われわれはFDAとビソトリアジンによるTGNとDPN治療の潜在3期研究の設計に接触し,2022年に完成したもう1つのビソトリシンの臨床試験を行った。
この追加臨床試験は,ビソトリアジンの潜在的治療TGNの3期研究の開始を延期したことから,1ドルの欠陥費用を確認した44.32021年第1四半期、TGNの治療が可能なビソトリアジンに関連する100万人。
2022年第4四半期規制,開発,商業化への挑戦に基づき,ビソトリアジンのさらなる開発を中止した。2022年12月31日までに,減価費用が約$であることを確認した119.6百万ドルは以下の関連がありますVxotrigineはDPNの潜在的治療に用いられ,このIPR&D無形資産の余剰帳簿価値をゼロに低下させるまた、この資産に関連する対価格債務の価値を調整し、税引前収益を約#ドルとした209.1百万これは,我々の総合損益表内で再計測または代償のある公正価値損失(収益)で確認されている.
BIIB 111とBIIB 112
夜星治療会社の買収について、$を確認しました480.0百万ドルとドル220.0買収した知的財産権研究開発無形資産はそれぞれBIIB 111とBIIB 112である。2020年第4四半期に減価費用を確認しました115.0第三者製造遅延がスケジュールに影響を与え、BIIB 111の第3段階開発の推進に関するコストが増加したため、BIIB 111に関連する100万ドルを招いた。
2021年第2四半期に、私たちはBIIB 111の第3段階STAR研究とBIIB 112の第2段階/第3段階XIRius研究がそれらの主要な終点に達していないことを発表した。2021年第3四半期には、経営陣の決定により、これらのプロジェクトのさらなる開発を停止しましたが、これはその戦略審査過程の一部です。2021年12月31日までの年間で確認します減価費用共$365.0BIIB 111に関連する100万ドルと減価費用#220.0BIIB 112に関連する100万ドルは、これらの知的財産権研究開発無形資産の余剰帳簿価値をゼロ.
また,我々はBIIB 111とBIIB 112のさらなる開発を一時停止することにしたため,約$を記録した39.12021年第3四半期、私たちの製造計画とこれらの計画の一時停止による他のコストに関するコストは100万ドルと予想されています。これらの費用は2021年12月31日までの年度総合損益表で研究開発費であることが確認された。
BIIB 054
生物遺伝国際神経科学株式会社(BIN)を買収する過程で、私たちは$を確認しました110.9知的財産権を買収して無形資産100万元を研究開発する2021年2月、私たちの第2段階Spark研究がその主要または副次的な終点に達していないので、パーキンソン病の潜在的治療薬としてBIIB 054の開発を中止することを発表した。2021年2月にこの決定を下しましたが、これは2020年12月31日までに存在する条件に基づいています。そこで,約1ドルの減価費用を確認した75.42020年第4期に関連知的財産権研究開発無形資産の公正価値を削減 ゼロ.
知的財産権研究開発減値費用はすでに買収した無形資産の償却と減値に計上し、再計量或いは対価格債務による収益は総合損益表に再計量或いは対価格の公正価値損失(収益)を計上する。無形資産及び或いは代償負債の公正価値は、第3級公正価値の計量及び投入(推定収入、コスト及び成功確率を含む)の確率に基づいて割引現金流量計算を調整することによって決定される。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
無形資産は将来的に償却される予定だ
今後5年間の有限寿命無形資産の償却状況は以下の通りと予想される
| | | | | | | | |
| (単位:百万) | | 2022年12月31日まで |
| 2023 | | $ | 215.0 | |
| 2024 | | 195.0 | |
| 2025 | | 190.0 | |
| 2026 | | 175.0 | |
| 2027 | | 165.0 | |
商誉
次の表は私たちの営業権残高の変化の前触れを提供します
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 商誉、年初 | | $ | 5,761.1 | | | $ | 5,762.1 | |
| | | | |
| | | | |
| 他にも | | (12.1) | | | (1.0) | |
| 商誉,年末 | | $ | 5,749.0 | | | $ | 5,761.1 | |
2022年12月31日までに違います。営業権に関する累積減価損失。他には外貨為替レートの変動に関する調整が含まれている。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
次の表は、定期的に公正価値の計量と台帳に基づいて、公正価値を決定するための評価技術の公正価値レベルのレベルを示す私たちの資産と負債に関する情報を提供します
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日まで |
| (単位:百万) | | 合計する | | 見積もりはありますか
活発な市場
(レベル1) | | 大切な他の人
観測可能入力
(レベル2) | | 意味が重大である
見えない
入力量
(レベル3) |
| 資産: | | | | | | | | |
| 現金等価物 | | $ | 2,847.6 | | | $ | — | | | $ | 2,847.6 | | | $ | — | |
| 売却可能な債務証券: | | | | | | | | |
| 会社債務証券 | | 1,231.6 | | | — | | | 1,231.6 | | | — | |
| 政府証券 | | 810.3 | | | — | | | 810.3 | | | — | |
| 担保ローンやその他の資産支援証券 | | 137.3 | | | — | | | 137.3 | | | — | |
| 有価証券 | | 791.1 | | | 791.1 | | | — | | | — | |
| その他の流動資産: | | | | | | | | |
サムスンバイオ社の売掛金(1) | | 798.8 | | | — | | | — | | | 798.8 | |
| その他の資産: | | | | | | | | |
| 派生ツール契約 | | 63.0 | | | — | | | 63.0 | | | — | |
| 繰延補償計画資産 | | 32.8 | | | — | | | 32.8 | | | — | |
サムスンバイオ社の売掛金(1) | | 405.4 | | | — | | | — | | | 405.4 | |
| 合計する | | $ | 7,117.9 | | | $ | 791.1 | | | $ | 5,122.6 | | | $ | 1,204.2 | |
| 負債: | | | | | | | | |
| 派生ツール契約 | | $ | 26.0 | | | $ | — | | | $ | 26.0 | | | $ | — | |
| | | | | | | | |
| 合計する | | $ | 26.0 | | | $ | — | | | $ | 26.0 | | | $ | — | |
(1)サムスン生物は私たちの49.92022年第2四半期に、私たちは公正価値オプションを選択した。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2021年12月31日まで |
| (単位:百万) | | 合計する | | オファー
活発な市場で
(レベル1) | | 意味が重大である
他にも観察されるのは
入力量
(レベル2) | | 意味が重大である
見えない
入力量
(レベル3) |
| 資産: | | | | | | | | |
| 現金等価物 | | $ | 1,632.2 | | | $ | — | | | $ | 1,632.2 | | | $ | — | |
| 売却可能な債務証券: | | | | | | | | |
| 会社債務証券 | | 1,108.2 | | | — | | | 1,108.2 | | | — | |
| 政府証券 | | 1,192.7 | | | — | | | 1,192.7 | | | — | |
| 担保ローンやその他の資産支援証券 | | 132.2 | | | — | | | 132.2 | | | — | |
| 有価証券 | | 1,048.5 | | | 181.7 | | | 866.8 | | | — | |
| 派生ツール契約 | | 80.9 | | | — | | | 80.9 | | | — | |
| 繰延補償計画資産 | | 33.4 | | | — | | | 33.4 | | | — | |
| 合計する | | $ | 5,228.1 | | | $ | 181.7 | | | $ | 5,046.4 | | | $ | — | |
| 負債: | | | | | | | | |
| 派生ツール契約 | | $ | 10.8 | | | $ | — | | | $ | 10.8 | | | $ | — | |
| 対価格債務があります | | 209.1 | | | — | | | — | | | 209.1 | |
| 合計する | | $ | 219.9 | | | $ | — | | | $ | 10.8 | | | $ | 209.1 | |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
現金等価物および売却可能債務証券に分類される二次ツールの公正価値は、第三者定価サービスによって決定される。2022年第3四半期に、私たちは予想に基づいてASU 2022-03を事前に採用することを選択し、これにより、契約販売制限の影響は、いくつかの保有期間によって制限された残りのSage普通株の公正価値計量から除去される。2022年12月31日現在、Sage普通株への全投資は一次評価基準に分類されている。本基準を採用する前に、株式証券を売却可能な第2レベルツールに分類された公正価値は、Sage普通株への投資の一部を代表し、オプション定価推定モデルを用いて推定される。
Sangamo治療会社(Sangamo)とDenali治療会社(Denali)の普通株への投資は2022年満期の保有期間制限がある。2022年12月31日現在、SangamoとDenali普通株投資の公正価値は1級計量に分類されている。このような保有期間制限が満了する前に、これらの投資は二次計量に分類される。
Denali、Sage、Sangamoでの私たちの投資の契約保有期間制限が満了したにもかかわらず、私たちがこれらの投資を清算する能力は、私たちの資本規模、市場関連活動の数、私たちの集中所有権レベル、および私たちの協力者としての地位によって生じる潜在的な制限によって制限されるかもしれない。したがって、私たちが得た収益はこのような投資の現在の価値よりはるかに低いかもしれない。
Denali、Sangamo、Sage普通株への投資に関するより多くの情報は、お読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
あったことがある違います。2022年12月31日と2021年12月31日まで、私たちの資産の重大な減価は公正価値に基づいて計量と勘定されています。また,2022年12月31日と2021年12月31日までの推定技術に変化はなかった。
第三者定価サービスが提供する価格に関する検証プログラムと私たちのオプション価格評価モデルについての説明は、お読みください公正価値計量部はい付記1、重要会計政策の概要、これらの連結財務諸表。
公正価値に応じて保有する第3級資産と負債
以下の表は、公正な価値で恒常的に計量された我々のレベル3の金融資産と負債の推定に使用される推定技術と重大な観察不可能な投入を示す日付までの定量化情報を提供する
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 第3レベル公正価値計測に関する定量化情報 |
| | 公正価値 | | | | 意味が重大である
観察できない入力 | | 射程距離 | | 加重平均 |
| (単位:百万) | | 2022(1) | | 2021 | | 技術を評価する | | | 2021 | | 2022(1) | | 2021 |
|
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| 負債: | | | | | | | | | | | | | | |
| 対価格債務があります | | $ | — | | | $ | 209.1 | | | 現金流を割引する | | 割引率 | | 1.30% | | — | % | | 1.30 | % |
| | | | | | 発展の一里塚を実現する時期を期待する | | 2023 to 2027 | | — | | | — | |
| | | | | | | | | | | | | | |
| | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | | | |
| | | | | | | | | | | | |
(1)2022年12月31日までの年間でVxotrigineの開発を中止したため、対価格債務の公正価値をゼロに調整した。
加重平均割引率は,我々のあるいは対価格債務の相対公正価値から計算される.また、私たちは様々な技術と規制が成功する確率を推定モデルに適用して、私たちの対価格債務の公正な価値を推定し、範囲から10.92021年12月31日までの一定確率は%である。
2022年12月31日と2021年12月31日まで、資産や負債の転入または流出のレベル3はない。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
対価格債務があります
私たちのConversionとゴミ箱私たちは特定のマイルストーン事件の成果に基づいて追加的な支払いをすることに同意する次の表は、第3レベルの計量に分類される対価格債務の公正価値の前転を提供します
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 公正価値、年初 | | $ | 209.1 | | | $ | 259.8 | |
| 価値変動を公平に承諾する | | (209.1) | | | (50.7) | |
| | | | |
| 価値を公平にし,年末になる | | $ | — | | | $ | 209.1 | |
2021年12月31日までの約209.1私たちのまたは対価格債務総額の公正価値のうち100万ドルが他の長期負債の構成要素として私たちの総合貸借対照表に反映されています。私たちは対価格債務の公正価値変動が私たちの総合損益表に計算されたり、価格に対する公正価値が再計量された損失(収益)が計上されたりします。
2022年12月31日まで、私たちのまたは代償債務の公正価値変動は、主にVxotrigineに関連するさらなる開発作業を停止し、TGNおよびDPNを治療することが可能であり、私たちまたは代償義務が約減少したためであるy $195.4対価格負債の金利を再評価するための変化もあります
2021年12月31日までの1年間、私たちのまたは対価格債務の公正な価値変化は、主に技術と規制の成功の可能性の低下と、私たちのVxotrigine計画に関連するいくつかの残りの発展マイルストーンの予想達成時間の遅延によるものである。
または対価負債のある公正価値は、第3級公正価値を用いて計量および投入される確率調整割引現金流量に基づいて計算される。我々の金融資産·負債の評価に採用されている評価技術及び投入に関する情報は、参照されたい付記1、重要会計政策の概要、これらの連結財務諸表。
合流医薬持ち株有限公司
2015年2月にConversionを買収した時、私たちは対価格債務#ドルを記録しました274.5百万ドルです。2021年12月31日現在、このまたは対価格債務の公正価値は$である209.1百万ドルです。2022年第4四半期規制,開発,商業化への挑戦に基づき,ビソトリアジンのさらなる開発を中止した。したがって、収束に関連するまたは対価格債務の公正価値はゼロに調整され、税引き前収益は約#ドルとなる209.12022年12月31日までの1年間でこの税引き前収益は総合損益表に再計量あるいは対価格の公正価値損失(収益)を計上する。
生物遺伝国際神経科学有限公司
2010年12月にBINを買収する過程で、私たちは対価格債務#ドルを記録しました81.2百万ドルです。BIIB 054の第2段階研究結果によると,パーキンソン病の潜在的治療へのBIIB 054のさらなる開発を中止した。また、2020年第3四半期と第4四半期には、BINの買収に関連する他のプロジェクトを停止し、これらのプロジェクトに対して非実質的または対価格義務を負っています。BINの買収に関連した代償債務の公正な価値はゼロ$を得ることができます101.52020年12月31日までの1年間でこの税引き前収益は総合損益表に再計量あるいは対価格の公正価値損失(収益)を計上する。
非日常的公正価値計測
2022年12月31日までに減額費用を$と記録しました119.6ビソトリアジンに関する百万ドルです。そのため,これらの計画に関する余剰帳簿価値は零点です2021年12月31日までに減額費用を$と記録しました365.0BIIB 111と$220.0BIIB 112に関連する100万人。そのため,これらの計画に関する余剰帳簿価値はゼロ.
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
無形資産減価に関するより多くの情報は、お読みください付記7、無形資産及び商業権これらの連結財務諸表まで。
公正価値台帳に記載されていない金融商品
他の金融商品
ある金融商品の短期的な性質のため、私たちの総合貸借対照表に反映されている売掛金の帳簿価値は公正価値に近く、これらの売掛金は抗CD 20治療計画、他の流動資産、売掛金と売掛金、その他から来ている。
債務道具
私たちの債務ツールは二級負債に属し、その公正価値の概要は以下の通りである
| | | | | | | | | | | | | | |
| | | 公正価値
12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
3.6252022年9月15日満期の優先債券率(1) | | $ | — | | | $ | 1,020.0 | |
4.0502025年9月15日に満期となる優先債券の割合 | | 1,699.9 | | | 1,895.2 | |
2.2502030年5月1日に満期となる優先債券の割合 | | 1,219.0 | | | 1,475.9 | |
5.2002045年9月15日満期の優先債券率 | | 1,033.2 | | | 1,463.0 | |
3.1502050年5月1日に満期となる優先債券の割合 | | 989.0 | | | 1,457.7 | |
3.2502051年2月15日満期の優先債券率 | | 469.1 | | | 692.9 | |
| 合計する | | $ | 5,410.2 | | | $ | 8,004.7 | |
(1)2022年7月私たちは私たちの3.6252022年9月15日に満期となる優先債券の割合。両替の他の資料については、ご参照ください付記13、負債これらの連結財務諸表まで。
私たちの一連の高級債券の公正な価値は市場、観察可能、そして実証された供給源によって決定された。2021年と比較して、2022年12月31日現在のわれわれの高級債券の公正価値は変化しており、これは主に2021年12月31日以来、我々の高級債券を評価するための米国債利回りの増加と関連している。私たちの高級ノートに関する他の情報は、お読みください付記13、負債これらの連結財務諸表まで。
次の表は、購入日から3ヶ月以内に満期になった金融資産をまとめており、当社の総合貸借対照表に含まれる現金と現金等価物:
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 商業手形 | | $ | 177.2 | | | $ | 247.6 | |
| 隔夜逆買い戻し協議 | | 59.0 | | | 200.0 | |
| 貨幣市場基金 | | 2,581.5 | | | 901.6 | |
| 短期債務証券 | | 29.9 | | | 283.0 | |
| 合計する | | $ | 2,847.6 | | | $ | 1,632.2 | |
私たちの商業手形は、課税利息、隔夜逆買い戻し協定、通貨市場基金と短期債務証券を含み、その短期満期日のため、その帳簿価値は公正価値に近い
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
我々の有価証券収益(損失)はその他(収益)費用に計上し,純額は我々の総合損益表に計上する次の表は、販売可能な債務と株式証券をまとめ、販売可能に分類されています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日まで |
| (単位:百万) | | 償却する
コスト | | 毛収入
実現していない
収益.収益 | | 毛収入
実現していない
損 | | 公平である
価値がある |
| 売却可能な債務証券: | | | | | | | | |
| 会社債務証券: | | | | | | | | |
| 現在のところ | | $ | 936.2 | | | $ | — | | | $ | (4.9) | | | $ | 931.3 | |
| 当面ではない | | 305.3 | | | 0.1 | | | (5.1) | | | 300.3 | |
| 政府証券: | | | | | | | | |
| 現在のところ | | 547.1 | | | 0.1 | | | (5.0) | | | 542.2 | |
| 当面ではない | | 271.4 | | | — | | | (3.3) | | | 268.1 | |
| 担保ローンや他の資産支援証券: | | | | | | | | |
| 現在のところ | | — | | | — | | | — | | | — | |
| 当面ではない | | 139.1 | | | 0.1 | | | (1.9) | | | 137.3 | |
| 取引可能債務証券総額 | | $ | 2,199.1 | | | $ | 0.3 | | | $ | (20.2) | | | $ | 2,179.2 | |
| | | | | | | | |
| 有価証券: | | | | | | | | |
| 有価証券、現品 | | $ | 1,133.8 | | | $ | — | | | $ | (342.7) | | | $ | 791.1 | |
| | | | | | | | |
| 流通可能株式証券総額 | | $ | 1,133.8 | | | $ | — | | | $ | (342.7) | | | $ | 791.1 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2021年12月31日まで |
| (単位:百万) | | 償却する
コスト | | 毛収入
実現していない
収益.収益 | | 毛収入
実現していない
損 | | 公平である
価値がある |
| 売却可能な債務証券: | | | | | | | | |
| 会社債務証券: | | | | | | | | |
| 現在のところ | | $ | 723.6 | | | $ | 0.1 | | | $ | (0.3) | | | $ | 723.4 | |
| 当面ではない | | 385.4 | | | 0.2 | | | (0.8) | | | 384.8 | |
| 政府証券: | | | | | | | | |
| 現在のところ | | 817.0 | | | — | | | (0.4) | | | 816.6 | |
| 当面ではない | | 377.0 | | | 0.1 | | | (1.0) | | | 376.1 | |
| 担保ローンや他の資産支援証券: | | | | | | | | |
| 現在のところ | | 1.1 | | | — | | | — | | | 1.1 | |
| 当面ではない | | 131.8 | | | — | | | (0.7) | | | 131.1 | |
| 取引可能債務証券総額 | | $ | 2,435.9 | | | $ | 0.4 | | | $ | (3.2) | | | $ | 2,433.1 | |
| | | | | | | | |
| 有価証券: | | | | | | | | |
| 有価証券、現品 | | $ | 33.9 | | | $ | 9.9 | | | $ | — | | | $ | 43.8 | |
| 有価証券、非流動資産 | | 1,133.1 | | | 151.0 | | | (279.4) | | | 1,004.7 | |
| 流通可能株式証券総額 | | $ | 1,167.0 | | | $ | 160.9 | | | $ | (279.4) | | | $ | 1,048.5 | |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
契約満期日の概要:債務証券の売却が可能
契約満期日に販売可能な販売可能な債務証券に分類される推定公正価値と償却コストの概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 12月31日まで |
| | | 2022 | | 2021 |
| (単位:百万) | | 推定数
公正価値 | | 償却する
コスト | | 推定数
公正価値 | | 償却する
コスト |
| 1年以下の期間で満期になる | | $ | 1,473.5 | | | $ | 1,483.3 | | | $ | 1,541.1 | | | $ | 1,541.7 | |
| 1年から5年後に期限が切れなければならない | | 694.4 | | | 703.7 | | | 868.2 | | | 870.2 | |
| 5年後に期限が切れる | | 11.3 | | | 12.1 | | | 23.8 | | | 24.0 | |
| 取引可能債務証券総額 | | $ | 2,179.2 | | | $ | 2,199.1 | | | $ | 2,433.1 | | | $ | 2,435.9 | |
2022年12月31日と2021年12月31日まで、販売可能な販売可能債務証券に分類される平均満期日は約8月和10それぞれ数ヶ月です。
取引可能債務証券収益
有価証券の満期と売却所得およびそれによる実現損益は以下のようにまとめられる
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 満期と売却で得られた収益 | | $ | 3,671.0 | | | $ | 3,405.4 | | | $ | 7,299.4 | |
| すでに収益を実現している | | — | | | 0.2 | | | 17.7 | |
| 損失を達成した | | 12.6 | | | 4.0 | | | 26.0 | |
2022年12月31日現在、2021年と2020年12月31日までの年度は赤字を達成しており、主に社債、機関担保融資支援証券、その他の資産支援証券の販売に関連している。
戦略投資
2022年12月31日まで、私たちの戦略ポートフォリオは合計を含んでいます846.0百万ドルは、私たちの総合貸借対照表の投資と他の資産に含まれている。2021年12月31日まで、私たちの戦略ポートフォリオは合計を含んでいます1,110.3100万ドルは、私たちの総合貸借対照表の他の流動資産と投資およびその他の資産に計上されます。
私たちの戦略ポートフォリオは、あるバイオテクノロジー会社の株式証券への投資を含み、これらの投資は、私たちの開示に反映されています付記8、公正価値計量これらの連結財務諸表のうち、基礎投資は、あるバイオテクノロジー会社の株式証券と非上場株式証券のリスク投資基金である。
2022年12月31日までの1年間、私たちの戦略ポートフォリオが減少したのは、主にDenaliとSangamo普通株投資に対する公正価値の低下によるものである。
Denali、Sangamo、Sage、Ionis普通株への投資に関するより多くの情報は、お読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
外貨長期契約-ヘッジツール
私たちの業務の世界的なため、私たちの収入と運営費用の一部はドル以外の通貨で記録されています。このため、ドルで計量された収入や営業費用の価値は外貨為替レートの変化の影響を受ける。私たちは金融機関と外貨長期契約と外貨オプションを締結し、主な目的は外貨為替レートの変動が私たちの国際収入と運営費用に与える影響を軽減することです。
2022年12月31日までと2021年12月31日までに発効する外貨長期契約と外貨オプションの期限は1至れり尽くせり12月和1至れり尽くせり15それぞれ数ヶ月です。これらの契約は現金に指定されました
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
これらの外貨長期契約と外貨オプションに有効性テストに含まれる部分の流量ヘッジと未実現損益は,他の全面収益(損失)(以下表ではAOCIと呼ぶ)で累計報告されている.このような契約の実現損益は,ヘッジ通貨で販売されている製品が確認された場合には収入に計上され,ヘッジ通貨で計上された費用には営業費用が計上される。すべてのキャッシュフローのヘッジ再分類は,他の全面収益(損失)の累積と公正価値変動の一部が我々の総合損益表に含まれていないことから,ヘッジ項目の影響を受けていることを確認した.
予想収入と業務費用をヘッジするために締結した外貨長期契約と外貨オプション名義金額の概要は以下の通り
| | | | | | | | | | | | | | |
| | | 名目金額
12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| ユーロ.ユーロ | | $ | 1,495.5 | | | $ | 1,828.0 | |
| ポンド | | 162.8 | | | 166.2 | |
| | | | |
| 円?円 | | — | | | 72.7 | |
| カナダドル | | 57.2 | | | 59.9 | |
| 外貨長期契約総額 | | $ | 1,715.5 | | | $ | 2,126.8 | |
これらの外貨長期契約と外貨オプションの公正価値は、他の全面収益(損失)の累積に含まれる税前部分を以下のようにまとめる
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 未実現収益 | | $ | 29.9 | | | $ | 60.8 | | | $ | — | |
| 未実現(赤字) | | (21.3) | | | (7.0) | | | (212.5) | |
| 純収益を実現しない | | $ | 8.6 | | | $ | 53.8 | | | $ | (212.5) | |
私たちは達成されていない純収益は約#ドルと予想される8.6百万ドルは次の年に解決されます12その他の総合収益(損失)のいずれかの累積金額は,収入や運営費用の調整として報告する。私たちと私たちの取引相手の信用リスクが契約公正価値に与える影響と、双方が契約義務を履行する能力を考えます。2022年12月31日と2021年12月31日まで、信用リスクは私たちの外貨長期契約の公正価値を実質的に変えていない。
次の表は、我々の総合損益表においてヘッジツールとして指定されている外貨長期契約の影響をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 12月31日までの年度 |
純収益/(損失) AOCIから営業収入に変更する (単位:百万) | | 純収益/(損失)
営業収入で確認する(百万ドル) |
| 位置 | | 2022 | | 2021 | | 2020 | | 位置 | | 2022 | | 2021 | | 2020 |
| 収入.収入 | | $ | 201.6 | | | $ | (60.0) | | | $ | 18.3 | | | 収入.収入 | | $ | (8.6) | | | $ | (8.4) | | | $ | (9.9) | |
| 運営費 | | (5.5) | | | (0.8) | | | 3.3 | | | 運営費 | | — | | | — | | | — | |
金利契約--ヘッジツール
私たちはいくつかの貸借取引について金利ロック契約または金利スワップ契約を締結して、金利変動に対するリスクを管理し、私たちの全体の貸借コストを下げました
金利交換契約
私たちの発行について2.902020年9月15日に満期になった優先債券は、金利スワップ協定を締結し、名目金額の合計は$です675.02020年9月15日に満期になる予定だった100万ドル。金利交換契約は、価値変動を公平にするヘッジとして指定されている2.90金利変動の優先手形の割合に起因することができる。2020年5月、私たちは金利スワップ契約を決済して、同時に事前に私たちのを償還しました2.90%高度手形、収益は約$3.3百万ドルは、2020年12月31日までの年度内に、利息支出の構成要素として我々の総合損益表に記録されている。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
純投資ヘッジ--ヘッジツール
2012年2月、私たちはサムスン生物会社と合弁協定を締結し、Samsung Bioepisという実体を設立し、生物類似製品を開発、製造、販売した。2018年6月、私たちは合弁協定に従って私たちの選択権を行使し、Samsung Bioepisにおける私たちの持株比率を約5.0%から約49.9%です。株式購入取引は2018年11月に完了し、取引が完了した後、私たちは支払いました759.510億ウォン(1ドル)676.6サムスンバイオ製薬を買収しましたこの取引に関連したサムスンBioepis株式への投資はウォンレート変動の影響を受けている
ドルとウォンの為替変動を緩和するために、外貨長期契約を締結しました。これらの契約は純投資ヘッジに指定されている。2022年4月に私たちは49.9サムスン生物の%持分をサムスン生物に譲渡し、これらの外貨長期契約を完了した。今回の売却を完了した後,われわれの純投資ヘッジの累計収益$57.0百万ドルは累積された他の全面収益(損失)から再分類され,販売確認された税前収益総額に反映され,その収益は他(収益)支出に計上され,我々の総合損益表で純額となる。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
私たちのを売っている49.9%の株式は、累積他の総合収益(損失)において、これらの外貨長期契約スポットレートの変化を確認します。これらの外貨長期契約公正価値の税引き前部分は累計他の全面収益(損失)を計上し、純収益は#ドルであることを反映している10.62021年12月31日まで。我々は,長期レートに関する公正価値変化を我々のヘッジ関係から除外し,契約期間内の総合収益表で他(収入)費用中の長期点数を純額で償却した。他の全面収益(損失)を累積した長期点公正価値を計上した税引き前部分は純損失#ドルを反映している3.62021年12月31日まで。
次の表は、私たちの連結財務諸表における純投資ヘッジの影響をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 12月31日までの年度 |
純収益/(損失)
他の全面収入で確認(有効部分)(単位:百万) | | 純収益/(損失)
その他の全面収入で確認(有効性テストの金額は含まれていない)(百万単位) | | 純収益/(損失)
純収入で確認する
(有効性テストに含まれていない金額)(単位:百万) |
| 位置 | | 2022 | | 2021 | | 2020 | | 位置 | | 2022 | | 2021 | | 2020 | | 位置 | | 2022 | | 2021 | | 2020 |
純投資ヘッジ収益(1) | | $ | 20.4 | | | $ | 46.0 | | | $ | (35.1) | | | 純投資ヘッジ収益(1) | | $ | (3.2) | | | $ | (3.2) | | | $ | 4.5 | | | その他の支出(1) | | $ | (4.6) | | | $ | (0.6) | | | $ | 2.9 | |
(1) 2022年第2四半期から、私たちは純投資ヘッジファンドを持っていません。それらは私たちが売るにつれて49.92022年4月にサムスンBioepisで%の株式を所有する。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
サムスンBioepisとの協力手配に関するもっと多くの情報を読んでください備考19:連携関係とその他の関係これらの連結財務諸表まで。
外貨長期契約--その他の派生ツール
私たちはまた、ある貸借対照表の頭寸に関連する外貨リスクを緩和するために、他の外貨長期契約を締結します。通常期限は1ヶ月以下です。私たちはこのような取引のためにヘッジ会計を選択しなかった。
これらの未返済外貨長期契約の名目総額は#元である1,238.8百万ドルとドル1,268.0それぞれ2022年12月31日と2021年12月31日まで。純損失#ドル34.7百万ドル純損失$43.3百万ドルの純収益は$です30.1これらの契約に関連する100万ドルは他(収入)支出の構成要素として記録されており,それぞれ2022年,2021年,2020年12月31日までの年間純額である。
派生ツールの概要
私たちのいくつかの派生ツールは取引相手と純額決済スケジュールを締結しなければなりませんが、私たちは総合貸借対照表で派生ツールの資産と負債を相殺しません。デリバティブ資産と負債が相殺された場合、次の表の金額に実質的な差はないだろう
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
次の表は、ヘッジツールとして指定されている派生ツールを含む、私たちの未償還デリバティブの公正価値と統合貸借対照表における列報をまとめています
| | | | | | | | | | | | | | | | | | | | |
| | | | 12月31日まで |
| (単位:百万) | | 貸借対照表位置 | | 2022 | | 2021 |
| キャッシュフローヘッジツール: | | | | | | |
| 資産誘導ツール | | その他流動資産 | | $ | 37.9 | | | $ | 66.2 | |
| | 投資やその他の資産 | | — | | | 5.5 | |
| 負債誘導ツール | | 費用とその他を計算すべきである | | 18.4 | | | 6.6 | |
| | | | | | |
| | | | | | |
ヘッジツールに投資しています(1) | | | | | | |
| 資産誘導ツール | | その他流動資産 | | — | | | 4.1 | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| | | | | | |
| 他の派生ツール: | | | | | | |
| 資産誘導ツール | | その他流動資産 | | 25.1 | | | 5.1 | |
| 負債誘導ツール | | 費用とその他を計算すべきである | | 7.6 | | | 4.2 | |
(1) 2022年第2四半期から、私たちは純投資ヘッジファンドを持っていません。それらは私たちが売るにつれて49.92022年4月にサムスンBioepisで%の株式を所有する。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
財産·工場と設備は歴史的コスト,減価償却累計純額で入金される財産、工場と設備、純価値の構成は以下の通りである
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 土地 | | $ | 202.4 | | | $ | 207.5 | |
| 建物.建物 | | 1,592.9 | | | 1,699.7 | |
| 賃借権改善 | | 107.7 | | | 121.0 | |
| 機械と設備 | | 1,611.5 | | | 1,585.5 | |
| コンピュータソフトウェアとハードウェア | | 999.9 | | | 971.6 | |
| 家具と固定装置 | | 61.1 | | | 67.4 | |
| 建設中の工事 | | 888.8 | | | 770.3 | |
| 総コスト | | 5,464.3 | | | 5,423.0 | |
| 減算:減価償却累計 | | (2,165.7) | | | (2,006.6) | |
| 財産·工場と設備を合計して純額 | | $ | 3,298.6 | | | $ | 3,416.4 | |
減価償却費用総額は$272.4百万、$235.3百万ドルとドル201.92022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。
2022年12月31日,2021年12月31日,2020年12月31日までに,建設中工事に関する利息コストを資本化し,総額は約$とした17.1百万、$36.3百万ドルとドル65.2それぞれ100万ドルです
スイスソロトゥン製造工場
私たちの将来の成長と薬物開発パイプラインを支援するために、私たちはスイスのソローザンヌに大規模な生物製品製造施設を建設している。完成すればこの施設は393,000大型バイオ製品製造施設に関連した平方フィートは290,0002平方フィートの倉庫や公共施設やサポートスペース51,0001平方フィートの行政空間です2022年12月31日と2021年12月31日までに711.1百万ドルとドル677.0百万ドルは,それぞれその施設に関連する建設中工事に資本化される。2021年第2四半期、この施設の一部はスイスの治療製品機関が発行した良好な製造規範多製品許可証を取得し、収入は約$だった1.22021年第2四半期に投入された固定資産は10億ドルに達した。SolothurnはADUHELMの生産と
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
FDAが承認したLEQEMBI。Solothurn工場の第2の製造キットは2023年末に運営されると予想される。
125ブロードウェイビルで販売しています
2022年9月、ブロードウェイ125号館とブロックの販売を完了しました。総販売価格は約$です603.0百万ドルで1ドルも含まれています10.8百万借主手当。この取引がもたらす税引前収益は約$だ503.7百万ドルは,取引コストを差し引いて,2022年12月31日までの年度総合損益表に建築販売収益に反映される。この取引は約$を含んでいます79.2財産、工場、設備の純額は100万ドルで、約#ドルです72.6百万ドルは建築に使われ、約百万ドルです1.6百万ドルの土地と約$5.0百万ドルを機械と設備に使います。
私たちは実験室とオフィススペース、そしていくつかの設備を含む不動産をレンタルします
私たちのレンタル契約の残りのレンタル期間はありません1年至れり尽くせり8年それは.あるレンタル契約には1つ以上のオプションが含まれていて、更新するために私たちが自分で決定して、更新条項はレンタル期間を延長することができます1年至れり尽くせり6年.
しかも、私たちは特定の不動産を第三者に又貸しする。私たちの転貸グループはレンタルを経営しています。残りのレンタル条項の範囲は2年.至れり尽くせり6年それは.私たちの分譲賃貸契約には継続のオプションが含まれていません。それらは私たちの経営賃貸契約と同時に終了しますから。
私たちのすべてのレンタルはレンタルを経営する条件を満たしています。次の表は、私たちがレンタルを経営している総合貸借対照表の列報状況をまとめました
| | | | | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | 貸借対照表位置 | | 2022 | | 2021 |
| 資産: | | | | | |
| 経営的リース資産 | 経営的リース資産 | | $ | 403.9 | | | $ | 375.4 | |
| | | | | |
| 負債.負債 | | | | | |
| 流動経営賃貸負債 | 費用とその他を計算すべきである | | $ | 97.2 | | | $ | 89.1 | |
| 非流動経営賃貸負債 | 長期経営賃貸負債 | | 333.0 | | | 330.4 | |
| リース負債総額を経営する | | | $ | 430.2 | | | $ | 419.5 | |
以下の表は,我々の総合損益表におけるレンタルコストの影響をまとめたものである
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| | | | 12月31日までの年度 |
| (単位:百万) | | 損益表位置 | | 2022 | | 2021 | | 2020 |
| リースコストを経営する | | 研究開発 | | $ | 2.0 | | | $ | 3.4 | | | $ | 5.2 | |
| | 販売、一般、行政 | | 95.9 | | | 95.9 | | | 93.1 | |
| 可変リースコスト | | 研究開発 | | 0.4 | | | 0.8 | | | 1.1 | |
| | 販売、一般、行政 | | 25.4 | | | 25.7 | | | 21.1 | |
| 転貸収入 | | 販売、一般、行政 | | (24.0) | | | (23.9) | | | (24.2) | |
| | その他の費用,純額 | | (4.1) | | | (4.0) | | | (3.9) | |
| 純賃貸コスト | | | | $ | 95.6 | | | $ | 97.9 | | | $ | 92.4 | |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
可変レンタルコストは主に私たちの経営リースに関する経営費用、税収、保険と関係があります。これらのコストの性質は通常可変であるため,経営リース資産や関連リース負債の計量は計上されていない。
今後5年以降を予想する最低レンタル料は以下の通り
| | | | | | | | |
(単位:百万) | | 2022年12月31日まで |
| 2023 | | $ | 111.0 | |
| 2024 | | 107.0 | |
| 2025 | | 80.5 | |
| 2026 | | 65.7 | |
| 2027 | | 69.5 | |
| その後… | | 36.6 | |
| 賃貸支払総額 | | $ | 470.3 | |
| 差し引く:利息 | | 40.1 | |
| リース負債現在価値を経営する | | $ | 430.2 | |
賃貸の加重平均残存期間と加重平均割引率は以下の通りである
| | | | | | | | | | | | | | | | |
| | 12月31日まで |
| | 2022 | | 2021 | | |
| 加重平均残存賃貸年限(年) | | 4.64 | | 5.43 | | |
| 加重平均割引率 | | 3.7 | % | | 2.9 | % | | |
我々の総合キャッシュフロー表では、経営活動が提供するキャッシュフローに含まれる当社の経営リースに関するキャッシュフロー情報の補足開示は以下の通りである
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 賃貸負債の金額を計上するための現金 | | $ | 107.4 | | | $ | 105.8 | | | $ | 100.2 | |
| リース義務と引き換えに経営的リース資産 | | 108.3 | | | 18.1 | | | 59.0 | |
125ブロードウェイビルの売買とレンタル取引
ブロードウェイ125号にあるビルを売ることについて、私たちは同時にこのビルを借りました。レンタル期間は約5.5年には約#ドルが確認されました168.22022年12月31日現在、私たちの合併貸借対照表に記録されている新賃貸負債と使用権資産は100万ドルです。このビルの売却と即時借戻しは売却·借り戻し処理の資格を持ち、経営的賃貸に分類される。私どものビルの販売に関する情報をもっと知りたいのですが、お読みください付記11,財産·工場·設備これらの連結財務諸表まで。
ビンリー街300番地の借款変更
2022年9月、私たちはマサチューセッツ州ケンブリッジビンニ街300号に位置する部分賃貸契約を部分的に中止し、残りの空間の大部分のレンタル期間を短縮することに合意した。この協定は、2022年に不動産地を統合することでコストを低減するための私たちの努力によって推進された。この取引は、発効日に賃貸借契約改定とみなされ、約#ドルの使用権資産の確認解除につながる47.4100万ドル賃貸負債は約$です52.7100万ドルで約$の収益が得られます5.3百万ドルは,2022年12月31日までの年間総合収益表に再編費用を計上した。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
私たちの債務の概要は以下の通りです
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 現在の部分: | | | | |
3.6252022年9月15日満期の優先債券率(1) | | $ | — | | | $ | 999.1 | |
| 支払手形の当期分 | | $ | — | | | $ | 999.1 | |
| 現在ではない部分: | | | | |
4.0502025年9月15日に満期となる優先債券の割合 | | $ | 1,744.7 | | | $ | 1,742.9 | |
2.2502030年5月1日に満期となる優先債券の割合 | | 1,492.9 | | | 1,492.0 | |
5.2002045年9月15日満期の優先債券率 | | 1,100.3 | | | 1,099.9 | |
3.1502050年5月1日に満期となる優先債券の割合 | | 1,473.8 | | | 1,473.2 | |
3.2502051年2月15日満期の優先債券率 | | 469.3 | | | 466.0 | |
| 支払手形の非流動部分 | | $ | 6,281.0 | | | $ | 6,274.0 | |
(1)我々の3.6252022年9月15日に満期となった優先債券は2022年7月にすべて償還された。
見積もりを交換する
2021年2月、私たちの個人要約交換(交換要約)私たちの入札を完了しました5.200新シリーズ優先債券は2045年9月15日に満期(2045年優先債券)の割合3.2502051年2月15日に満期となった優先債券(2051年優先債券)と現金、および我々が入札した2045年優先債券を現金で購入する要約。
元金総額は約$である624.6私たちの2045年の高級チケットのうち100万枚が交換され、元金総額は約$です700.72051年の優先手形と現金支払い総額は約151.8百万ドルです。私たちの交換要約は債務修正に計上されています。そのため、現金部分は追加の債務割引に反映されており、2051年の優先手形期間内の利息支出の調整償却となっています。
また私たちが償還した元金の総額は約$です8.92045年の高級手形のうち100万枚、現金支払い総額は約$12.1百万ドルで、課税利息と未払い利息は含まれていません。償還は債務清算として入金されました。そこで、#ドルの税引前費用を確認しました3.2この2045年の優先手形が終了した時、債券額面は100万ポンドだった。この費用は,2021年12月31日までの年間総合収益表で利息支出とその他の支出純額が確認されており,早期償還割増の支払いと,このような2045年優先手形に関する余剰未償却元債務発行コストと割引残高の解約を反映している。
和解の際、私たちは合計約#ドルの現金も支払った13.8前回利息支払日から交換又は償還された2045年優先手形のすべての当算及び未払い利息を支払う。約$を生み出しました6.12021年12月31日までの年度総合収益表では,我々の交換見積に関するコスト(利息支出で確認)が他(収入)支出で純額であることが確認された。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2020年高級債券
2020年4月30日、我々は高級無担保手形を発行しました。元金総額は$です3.0億元(2020年高級手形)には、以下が含まれている
•$1.510億ドルの元金総額2.252030年5月1日に満期になった優先債券の割合は99.973額面の割合
•$1.510億ドルの元金総額3.152050年5月1日に満期になった優先債券の割合は99.174額面の%です。
私たちの2020年の優先債券は優先無担保債券で、いつでも以下のサイトで償還できます100.0元金の%に利子を加算し、満期前の段落指定期間内に、指定された補完金額を算出する。私たちの2020年優先債券には支配権変更条項が含まれており、場合によっては、以下の価格で2020年優先債券を購入することが要求される場合があります101.0元金の%に買い戻し日までの応算と未払い利息を加える。
約$を生み出しました24.4今回の発行に関する百万ドルコストは、我々の総合貸借対照表における債務帳簿金額の減少に計上されている。この等コストは、実際の金利法で発行されて満期までの間に追加利息支出に償却される。割引は実金利法で発行から満期日までの間に追加利息支出に償却されます。私たちの2020年高級債券の利息は2020年11月1日から、毎年5月1日と11月1日に支払われます。
2015年高級手形
以下は、2015年に発行された現在返済されていない優先無担保手形(2015年優先手形)の概要である
•$1.7510億ドルの元金総額4.052025年9月15日に満期になった優先債券の価値は99.764額面の割合
•$1.1210億ドルの元金総額5.202045年9月15日満期の優先債券、価値は99.294額面の%です。
今回の発行に関するオリジナルコストは約$である47.5我々の総合貸借対照表には、債務帳簿金額の減少として100万ユーロが記録されている。これらのコストは割引とともに発行されてから期限が切れるまでの間、実金利法で追加利息として償却される
2015年の優先手形は優先無担保債務で、いつでも以下の住所で償還することができます100.0元金の%に計上すべき利息と特定の補完金額を加える。2015年の高級債券には支配権変更条項が含まれています。この条項は私たちに相当するように要求するかもしれません101.0場合によっては、元金の%に購入した日の利息と未払い利息を加算する。
2015年9月15日にドルを発行しました1.510億ドルの元金総額2.90優先債券は2020年9月15日に満期となり、金利:99.792額面の%です。我々の2.90優先手形は優先的な無担保債務の割合だ。について2.90%高級債券、金利交換契約を締結し、固定金利を受け取り、可変金利を支払いました。2020年5月には2020年優先債券を売る純収益で償還しました2.90%満期前のプレミアムチケット、純税前費用が$であることを確認します9.4この紙幣が消滅した後、100万ドル。この費用は2020年12月31日までの年間総合収益表で利息支出とその他(収入)支出純額で確認され、#ドルの支払いを反映している12.7100万早期償還割増および残りの未償却未償却元債務の発行コストと割引残高は、#ドル部分で相殺されます3.3決済関連金利スワップ契約に関する百万元の収益。金利契約の他の資料については、ご参照ください10派生ツールこれらの連結財務諸表。
3.625分の優先債券は、2022年9月15日に満期になります
2015年9月15日にドルを発行しました1.0私たちの元金総額は10億ドルです3.625優先債券は2022年9月15日に満期となり、金利:99.920額面の%です。我々の3.625優先手形は優先的な無担保債務の割合だ。2022年7月私たちは私たちの3.625%満期前の高級手形、税引前純費用が約$であることを確認2.4この等優先手形が終了した場合、主に支払いの早期割増および余剰の未償却未償却元債務の発行コストおよび割引残高を反映する
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
これらの費用は,2022年12月31日までの年度総合収益表で利息支出とその他(収入)支出純額で確認されている。
2020年信用手配
2020年1月に私たちは1.010億ドルです5年制無担保循環信用手配を優先して、運営資金と一般会社用途のための資金を抽出することができます。循環信用手配の条項には金融契約が含まれており、私たちは最高総合レバレッジ率を超えてはならないことを要求する。この循環信用計画は私たちが2015年8月に達成した循環信用計画を代替する。2022年12月31日までに違います。借金を返済せず、このローンの下のすべてのチェーノを守る。
債務期限
私たちの債務スケジュールによると、支払うべき金額の総額は以下の通りです
| | | | | | | | |
| (単位:百万) | | 2022年12月31日まで |
| 2023 | | $ | — | |
| 2024 | | — | |
| 2025 | | 1,750.0 | |
| 2026 | | — | |
| 2027 | | — | |
| 2028年以降 | | 4,817.3 | |
| 債務総額 | | $ | 6,567.3 | |
| 減算:債務割引と発行費 | | (286.3) | |
| 長期債務総額 | | $ | 6,281.0 | |
私たちの債務の公正な価値は付記8、公正価値計量、これらの連結財務諸表。
優先株
私たちは8.0100万株の優先株があります1.75百万株はAシリーズとして許可されています1.0100万株がXシリーズの初級参加と5.25100万株未指定。株式は、株主投票または行動なしに時々カテゴリまたはシリーズごとに発行され、各カテゴリまたはシリーズの株式の指定、権力、特典、相対、参加、選択、または他の特別な権利、ならびにこれらの株式を管理する文書に記載されている任意の資格、制限または制限が添付されていてもよい。このような優先株は、配当権、清算優先権、または両方の両方の点で普通株の前に並ぶことができ、すべてまたは限られた投票権を有することができ、普通株に変換することができる違います。優先株は2022年、2021年、2020年の間に発行·発行される。
普通株
次の表は、2022年12月31日、2021年12月31日、2020年12月31日までの普通株式の認可、発行、流通株数を示しています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日まで | | 2021年12月31日まで | | 2020年12月31日まで |
| (単位:百万) | 授権 | | 発表されました | | 卓越した | | 授権 | | 発表されました | | 卓越した | | 授権 | | 発表されました | | 卓越した |
| 普通株 | 1,000.0 | | | 167.9 | | | 144.0 | | | 1,000.0 | | | 170.8 | | | 147.0 | | | 1,000.0 | | | 176.2 | | | 152.4 | |
株式買い戻し
2020年10月に取締役会は買い戻し計画を承認しました5.0私たちの普通株の10億ドル(2020年株買い戻し計画)。私たちの2020年の株式買い戻し計画は満期日がありません。2020年の株式買い戻し計画に基づいて行われるすべての株買い戻しHASE計画は中止される予定だ。2020年の株式買い戻し計画によると、私たちは約2億ドルを買い戻して撤退しました3.6百万人6.0百万ドルと1.6100万株の普通株でコストは約$750.0百万人$1.810億ドル400.0昨年12月末現在の年度の百万元
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
31, 2022, 2021 and 2020それぞれ,である.大ざっぱに$2.110億2020年の株式買い戻し計画によると2022年12月31日。
2019年12月、私たちの取締役会は買い戻し計画を承認しました。最高買い戻し金額は5.0私たちの普通株の10億ドル(2019年12月株買い戻し計画)は、2020年9月30日までに完了します。私たちの2019年12月の株式買い戻し計画によると、買い戻したすべての株が解約されました。2019年12月の株式買い戻し計画によると、私たちは約40%を買い戻して撤退しました16.7100万株の普通株でコストは約$です5.02020年12月31日までの年間で
2019年3月、私たちの取締役会は買い戻し計画を承認しました。最高買い戻し金額は5.0私たちの普通株の10億ドル(2019年3月株買い戻し計画)は、2020年3月31日までに完了します。私たちの2019年3月の株式買い戻し計画によると、買い戻したすべての株が解約されました。2019年3月の株式買い戻し計画によると、私たちは約40%を買い戻して撤退しました4.1100万株の普通株でコストは約$です1.32020年12月31日までの年間で
2022年8月、“2022年インフレ削減法案”(アイルランド共和軍)が法律に署名した。その他を除いて、アイルランド共和軍は2022年12月31日以降の株の純買い戻しに消費税を1.0%徴収している。歴史的に、私たちは自由に選択可能な株の買い戻しを行ったことがある。
額面以上の株式を買い戻して支払う金額は、追加の実収資本と留保収益の間に分配され、私たちの追加実収資本残高を超えた金額は留保収益の減少に計上されます。
その他の総合収益を累計する
下表は,構成要素別の累積その他の総合収益(損失)純額の変化をまとめた
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日 |
| (単位:百万) | | 証券売却可能な未実現収益(赤字),税引き後純額 | | キャッシュフローヘッジの未実現収益(赤字),税引き後純額 | | 純投資ヘッジ収益税引後純額(1) | | 年金福祉債務の未実現収益(赤字)、税引き後純額 | | 貨幣換算調整 | | 合計する |
| バランス、2021年12月31日 | | $ | (2.2) | | | $ | 53.8 | | | $ | 25.5 | | | $ | (44.8) | | | $ | (139.0) | | | $ | (106.7) | |
| 再分類前の他の総合収益(損失) | | (23.5) | | | 137.3 | | | 12.6 | | | 43.7 | | | (83.1) | | | 87.0 | |
| 他の全面収益(損失)の累計から再分類された金額 | | 10.0 | | | (176.0) | | | (38.1) | | | — | | | 58.9 | | | (145.2) | |
| 当期純その他総合収益(赤字) | | (13.5) | | | (38.7) | | | (25.5) | | | 43.7 | | | (24.2) | | | (58.2) | |
| バランス、2022年12月31日 | | $ | (15.7) | | | $ | 15.1 | | | $ | — | | | $ | (1.1) | | | $ | (163.2) | | | $ | (164.9) | |
(1) 2022年第2四半期から、私たちは純投資ヘッジファンドを持っていません。それらは私たちが売るにつれて49.92022年4月にサムスンBioepisで%の株式を所有する。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2021年12月31日 |
| (単位:百万) | | 証券売却可能な未実現収益(赤字),税引き後純額 | | キャッシュフローヘッジの未実現収益(赤字),税引き後純額 | | 純投資ヘッジ収益税引後純額 | | 年金福祉債務の未実現収益(赤字)、税引き後純額 | | 貨幣換算調整 | | 合計する |
| バランス、2020年12月31日 | | $ | 1.4 | | | $ | (179.0) | | | $ | (8.5) | | | $ | (66.3) | | | $ | (46.6) | | | $ | (299.0) | |
| 再分類前の他の総合収益(損失) | | (6.6) | | | 178.2 | | | 33.4 | | | 21.5 | | | (92.4) | | | 134.1 | |
| 他の全面収益(損失)の累計から再分類された金額 | | 3.0 | | | 54.6 | | | 0.6 | | | — | | | — | | | 58.2 | |
| 当期純その他総合収益(赤字) | | (3.6) | | | 232.8 | | | 34.0 | | | 21.5 | | | (92.4) | | | 192.3 | |
| バランス、2021年12月31日 | | $ | (2.2) | | | $ | 53.8 | | | $ | 25.5 | | | $ | (44.8) | | | $ | (139.0) | | | $ | (106.7) | |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2020年12月31日 |
| (単位:百万) | | 証券売却可能な未実現収益(赤字),税引き後純額 | | キャッシュフローヘッジの未実現収益(赤字),税引き後純額 | | 純投資ヘッジ収益税引後純額 | | 年金福祉債務の未実現収益(赤字)、税引き後純額 | | 貨幣換算調整 | | 合計する |
| バランス、2019年12月31日 | | $ | 4.2 | | | $ | 7.8 | | | $ | 25.1 | | | $ | (32.8) | | | $ | (139.5) | | | $ | (135.2) | |
| 再分類前の他の総合収益(損失) | | (9.3) | | | (165.0) | | | (30.7) | | | (33.5) | | | 92.9 | | | (145.6) | |
| 他の全面収益(損失)の累計から再分類された金額 | | 6.5 | | | (21.8) | | | (2.9) | | | — | | | — | | | (18.2) | |
| 当期純その他総合収益(赤字) | | (2.8) | | | (186.8) | | | (33.6) | | | (33.5) | | | 92.9 | | | (163.8) | |
| バランス、2020年12月31日 | | $ | 1.4 | | | $ | (179.0) | | | $ | (8.5) | | | $ | (66.3) | | | $ | (46.6) | | | $ | (299.0) | |
次の表は、累積他の全面収益(損失)から再分類された金額をまとめています
| | | | | | | | | | | | | | | | | | | | | | | | | | |
| (単位:百万) | | 再分類された金額は
その他の総合収益を累計する | | 損益表位置 |
| 12月31日までの年度 | |
| 2022 | | 2021 | | 2020 | |
| 証券売却可能な収益 | | $ | (12.6) | | | $ | (3.8) | | | $ | (8.2) | | | その他の支出 |
| | 2.6 | | | 0.8 | | | 1.7 | | | 所得税(福祉)費用 |
| | | | | | | | |
| 現金流動保証収益(赤字) | | 201.6 | | | (60.0) | | | 18.3 | | | 収入.収入 |
| | (5.5) | | | (0.8) | | | 3.3 | | | 運営費 |
| | (0.3) | | | 0.2 | | | 0.3 | | | その他の支出 |
| | (19.8) | | | 6.0 | | | (0.1) | | | 所得税(福祉)費用 |
| | | | | | | | |
純投資裁定収益(1) | | 38.1 | | | (0.6) | | | 2.9 | | | その他の支出 |
| | | | | | | | |
| 貨幣換算調整 | | (58.9) | | | — | | | — | | | その他の支出 |
| | | | | | | | |
| 総額を再分類して税額を差し引く | | $ | 145.2 | | | $ | (58.2) | | | $ | 18.2 | | | |
(1)2022年第2四半期から、私たちは純投資ヘッジファンドを持っていません。それらは私たちが売るにつれて49.92022年4月にサムスンBioepisで%の株式を所有する。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
1株当たり収益を計算する際に使用する基本と希釈後の流通株は以下のように計算される
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 分子: | | | | | | |
| 生物遺伝会社の純収入。 | | $ | 3,046.9 | | | $ | 1,556.1 | | | $ | 4,000.6 | |
| 分母: | | | | | | |
| 発行済み普通株式加重平均 | | 145.3 | | | 149.1 | | | 160.9 | |
| 希釈性証券の影響: | | | | | | |
| | | | | | |
| 時間付与制限株式単位 | | 0.5 | | | 0.3 | | | 0.2 | |
| 市場ストック単位 | | 0.1 | | | 0.1 | | | 0.1 | |
| スポット決済実績ストック単位 | | 0.1 | | | 0.1 | | | 0.1 | |
| 希釈性潜在普通株 | | 0.7 | | | 0.5 | | | 0.4 | |
| 希釈した1株当たりの収益を計算するための株 | | 146.0 | | | 149.6 | | | 161.3 | |
1株当たりの純利益の金額は計上されておらず、それらの影響は逆に減額されているからだ。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2022年12月31日現在、2021年と2020年12月31日までの年度の1株当たり収益は、約3割を反映している3.6百万株6.0百万株と22.4私たちの株式買い戻し計画によると、私たちの普通株の100万株をそれぞれ持っています。私たちの株買い戻し計画に関するもっと多くの情報は、お読みください付記14、公平これらの連結財務諸表まで。
株式ベースの給与費用
以下の表は、合併損益表に含まれる株式ベースの給与費用をまとめたものです
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 研究開発 | | $ | 98.5 | | | $ | 89.3 | | | $ | 80.0 | |
| 販売、一般、行政 | | 175.1 | | | 169.5 | | | 131.3 | |
| 小計 | | 273.6 | | | 258.8 | | | 211.3 | |
| 資本化株式報酬コスト | | (9.3) | | | (8.0) | | | (6.2) | |
| 株式に基づく報酬費用は総コストと費用に計上される | | 264.3 | | | 250.8 | | | 205.1 | |
| 所得税効果 | | (49.2) | | | (46.7) | | | (33.5) | |
| 株式ベースの報酬支出は、生物遺伝会社による純収入に含まれている。 | | $ | 215.1 | | | $ | 204.1 | | | $ | 171.6 | |
以下の表は、株式ベースの各給与プランに関連する株式ベースの給与料金をまとめたものである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 市場ストック単位 | | $ | 13.2 | | | $ | 45.6 | | | $ | 40.5 | |
| 時間付与制限株式単位 | | 202.3 | | | 159.8 | | | 142.6 | |
| 現金決済実績単位 | | — | | | — | | | (1.7) | |
| 業績単位 | | — | | | — | | | (0.1) | |
| スポット決済実績ストック単位 | | 35.0 | | | 23.9 | | | 7.9 | |
| 現金で決済した業績株単位 | | 10.1 | | | 12.2 | | | 8.6 | |
| 従業員株購入計画 | | 12.7 | | | 17.3 | | | 13.5 | |
| 株式オプション | | 0.3 | | | — | | | — | |
| 小計 | | 273.6 | | | 258.8 | | | 211.3 | |
| 資本化株式報酬コスト | | (9.3) | | | (8.0) | | | (6.2) | |
| 株式に基づく報酬費用は総コストと費用に計上される | | $ | 264.3 | | | $ | 250.8 | | | $ | 205.1 | |
2022年12月31日現在、未帰属株式に基づく報酬に関する未確認報酬コストは約$である290.5百万ドル、推定された没収金額を差し引く。加重平均期間内にこれらの帰属されていない報酬のコストを確認する予定です2.0何年もです。
株式ベースの報酬計画
私たちは三つ(I)生物遺伝株式有限会社2006年非従業員取締役株式計画(2006年取締役計画)、(Ii)生物遺伝株式有限公司2017年総合株式計画(2017総合株式計画);及び(Iii)生物遺伝株式有限会社2015年従業員株式購入計画(2015 ESPP)
役員計画
2006年5月、私たちの株主は2006年の取締役計画を承認し、株をもとに取締役を奨励した。2006年取締役計画によって付与された奨励には、株式オプション、制限株、RSU、株式付加価値権およびその他の奨励が含まれることができ、報酬の金額および条項および条件は、
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2006年の取締役計画の規定によると、私たちの取締役会の委員会です。全部予約しました1.61,000,000株の普通株式は、2006年の取締役計画に従って発行される。2006年取締役計画では、株式オプション及び株式付加価値権以外の奨励は、計画下に保留された株式総数に計上されることが規定されている1.5--1対1。2015年6月、株主は2006年の取締役計画の期限を2025年6月まで延長する改正案を承認した。
総合計画
2017年6月、私たちの株主は2017年の総合株式計画を承認し、私たちの従業員に株式ベースの奨励を提供しました。2017総合持分計画によって付与される奨励には、株式オプション、制限株、RSU、履行株式、株式付加価値権、その他の奨励が含まれる場合があり、奨励の金額および条項および条件は私たちの取締役会委員会によって決定されますが、2017総合持分計画の規定によって制限されなければなりません。2017年の総合株式計画によると付与可能な普通株式は8.0この目的のために保持されている100万株の普通株式に、2017年6月7日現在もBiogen IDEC Inc.2008総合株式計画(2008総合株式計画)によって付与されることができる普通株、または2017年6月7日現在の2008年総合株式計画下の未完了奨励が全部または部分的にキャンセルされ、提出または終了された場合、再び付与可能な普通株式が可能である。2017年総合持分計画では、株式オプションと株式付加価値権以外の奨励は、この計画の下で利用可能な株式総数に計上されることが規定されている1.5--1対1。
私たちの株主が2017年の総合株式計画を承認して以来、私たちは2008年の総合株式計画に基づいて何の奨励も行っていません。未来も2008総合株式計画に基づいて何の奨励を行うつもりはありませんが、2008総合株式計画の下の未使用株式は2017総合株式計画に転用されました。
株式オプション
2022年12月31日までの年間で約81,0002017年総合計画に基づき我々の最高経営責任者(CEO)(2022年CEO Grant)に株式オプションを付与し、付与日の公正価値を$とする139.10選択肢ごとに合計約$となる11.2百万ドルです。我々の株式オプション付与の公正価値は,Black-Scholesオプション推定モデルを用いて付与日に推定した.その後、株式オプションの推定公正価値は、オプションの帰属中に支出される。2022年CEO Grantは1年以内に年単位で分割払いする資格があります3年制付与された日から一定期間は、CEOの継続雇用を条件とする。未償還株式オプションは一つあります10年間授出日関連普通株公平市価を下回らない1株当たり価格で行使することができる
二零一零年に付与され二零二年に行使された残りの株式購入権の内的価値総額は$です2.9百万ドルです。
次の表は、株式オプション実現の税収割引額と、2010年以前に付与された余剰株式オプションの行使により受け取った現金をまとめています
| | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2020 |
| 株式オプションによる税収割引 | | $ | 2.9 | |
| 株式オプション行使で受け取った現金 | | 0.7 | |
市場ストック単位(MSU)
2014年前に従業員に与えられたMSUは四つ等額の年次増加は、贈与の日の1周年から算出する。参加者は最終的にゼロそして150.0実際の株式表現に基づいて付与された目標単位数のパーセンテージを算出する
2014年に従業員にMSUを授与し、その後三つ等額の年次増加は授与日の1周年から始まり、参加者は最終的にゼロそして200.0実際の株式表現に基づいて付与された目標単位数のパーセンテージを算出する
このような奨励金の付与は関連職員たちの継続雇用状況にかかっている。付与されたMSU数は,我々の株価に係るいくつかの市場ベースの基準を達成することに基づいて資格を取得する目標単位数を表す.稼いだMSU数は,付与された日からの年次周年日ごとにそれぞれの帰属期間で計算され,複数の履行期間が生じる
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
したがって、最終的に獲得された報酬数を決定した後、追加のMSUを発行することができ、または現在完了していないMSUをキャンセルすることができる。
2022年からは、長期インセンティブ計画の一部としてMSUを付与せず、代わりにRSUを業績付与する。
次の表は私たちのMSU活動をまとめています
| | | | | | | | | | | |
| 2022年12月31日 |
| 株 | | 加重平均
付与日公正価値 |
| 2021年12月31日に帰属していません | 257,000 | | | $ | 372.08 | |
| 授与する | — | | | — | |
| 既得 | (87,000) | | | 369.22 | |
| 没収される | (57,000) | | | 371.24 | |
| 2022年12月31日に帰属していない | 113,000 | | | $ | 366.52 | |
我々は格子モデルとモンテカルロシミュレーションを用いてMSUの贈与を評価した.この推定方法はいくつかの重要な仮定を利用しています30MSUライセンス日のカレンダー日平均終値、我々の株価の予想変動率、無リスク収益率、期待配当率
我々が推定に用いた仮定の要約は以下のとおりである
| | | | | | | | | | | | | | | | |
| | | | 12月31日までの年度 |
| | | | | 2021 | | 2020 |
| 期待配当収益率 | | | | —% | | —% |
| 予想株価変動範囲 | | | | 54.8% - 61.6% | | 37.8% - 44.1% |
| 無リスク金利区間 | | | | 0.06% - 0.21% | | 1.41% - 1.48% |
| 授権日30日平均株価 | | | | $262.23 - $360.31 | | $257.83 - $325.40 |
| 加重平均1株当たり日公正価値を付与する | | | | $358.77 | | $398.61 |
2022年、2021年、2020年に付与されたMSUの公正価値の合計は18.8百万、$22.5百万ドルとドル26.9それぞれ100万ドルです
現金決済実績単位(CSPU)
従業員に与えられたCSPU三つ等額の年次増加は、贈与の日の1周年から算出する。このような報酬の付与は関連従業員の継続雇用状況に依存し、これらの奨励金は現金で決済される。配布されるCSPU数は,毎年12月31日に終了する実行期間開始時に決定される何らかの業績評価基準の達成状況に基づいて,資格獲得目標数である.参加者は最終的にゼロそして200.0実績指標実現度に応じて付与された目標ユニット数のパーセンテージを算出する。したがって、得られた単位数を最終的に決定した後、追加のCSPUを発行するか、または現在清算されていないCSPUをキャンセルすることができる。CSPUは責任報酬に分類され、以下の条件により現金で決済されます30帰属日ごとのカレンダー日平均終値は、実際の帰属と稼いだ単位数が分かればよい。株式を発行しないので、これらの奨励は株式を希釈しないだろう。2020年12月31日現在、すべての残りのCSPUは完全に帰属している。
2020年にCSPUを清算するために支払われた現金総額は#ドル3.8百万ドルです
業績既得性制限株式単位(PU)
PUはRSUの形式である従業員を授与し、私たちの取締役会の報酬と管理発展委員会が自ら決定し、現金或いは普通株の株式で決済することができる。これらの賞の構造と計算方法はCSPUと同じであり三つ等額の年次増加は、贈与の日の1周年から算出する。支給される業績ユニット数は,毎年12月31日に終了した実績期間開始時に決定された何らかの業績尺度に基づいて,資格獲得の目標ユニット数である。参加者は最終的にゼロそして200.0実績指標実現度に応じて付与された目標ユニット数のパーセンテージを算出する。したがって、得られたユニット数を最終的に決定した後、追加のPUを発行することができ、または現在完了していないPUをキャンセルすることができる。PUが現金で決済した根拠は30暦法
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
実際に獲得および獲得された単位数が知られると、各帰属日までの日平均終値。2020年12月31日現在,すべての残りの膿液は完全に帰属している。
すべての2020年に帰属するPUは現金で決済され、総額は$です3.4百万ドルです。
業績在庫単位(PSU)
在庫決済のPSU
2018年第1四半期に、在庫で決済した業績にRSU奨励を授与し始めました。従業員に与えられたPSUは3年制公演期間と贈与日3周年のベスト。このような奨励金の付与は関連職員たちの継続雇用状況にかかっている。付与されたPSU数は、累積実績に基づいて資格を取得する目標数を表します3年制成績期間開始時に決定された業績測定基準は、試験期間3年目の12月31日まで
参加者は最終的にゼロそして200.0適用実績指標の実現度に応じて付与された目標PSU数のパーセンテージ。したがって,最終的に得られたユニット数を決定した後,追加のPSUを発行したり,現在完了していないPSUをキャンセルしたりすることができる.
2022年から長期インセンティブ計画の一部としてMSUを付与せず,代わりにPSUに3年間累計相対株主総リターン(RTSR)指標に基づく業績指標を付与する。PSUは授与日の3周年に付与され,この累積RTSR指標からPSU数が得られる。
次の表は、在庫決済活動のPSUをまとめました
| | | | | | | | | | | |
| 2022年12月31日 |
| 株 | | 加重平均
付与日公正価値 |
| 2021年12月31日に帰属していません | 196,000 | | | $ | 289.94 | |
授与する(1) | 270,000 | | | 294.43 | |
| 既得 | (44,000) | | | 316.83 | |
| 没収される | (86,000) | | | 279.09 | |
| 2022年12月31日に帰属していない | 336,000 | | | $ | 292.95 | |
(1)株式決済のPSUは20222月に授与された年間賞とともに授与される賞も含まれています2022従業員を雇用しながら付与されたPSU。これらの付与は、付与時に資格を獲得する目標株式数を反映している。
モンテカルロシミュレーション付き格子モデルを用いてPSUの付与を評価した.この推定方法はいくつかの重要な仮定を利用しています30引受先付与日のカレンダー日平均終値、我々の株価の予想変動率、無リスク収益率、期待配当率
我々が推定に用いた仮定の要約は以下のとおりである
| | | | | | | | | | | | |
| | |
| | | 2022年12月31日 | | | | |
| 期待配当収益率 | | —% | | | | |
| 予想株価変動範囲 | | 44.0% - 45.9% | | | | |
| 無リスク金利区間 | | 1.8% - 3.9% | | | | |
| 授権日30日平均株価 | | $231.31 - $294.86 | | | | |
| 加重平均1株当たり日公正価値を付与する | | $294.43 | | | | |
2022年と2021年に株式で決済されたPSUの公正価値は合計#ドルである9.5百万ドルとドル15.5それぞれ百万ドルです
現金で決済するPSU
2018年第1四半期には、現金決済の業績に限定的な株式単位を付与するための奨励を開始しました。従業員に与えられたPSUは三つ出演期間と贈与日3周年のベスト。このような奨励金の付与は関連職員たちの継続雇用状況にかかっている。付与されたPSU数は,以下の条件に基づいて資格取得の目標数を表す
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
得られた成果三つ業績目標を決定する際に年度業績測定基準を決定し、この年度業績測定基準は毎年年初に開始され、その年の12月31日まで終了する
参加者は最終的にゼロそして200.0適用実績指標の実現度に応じて付与された目標PSU数のパーセンテージ。したがって,最終的に得られたユニット数を決定した後,追加のPSUを発行したり,現在完了していないPSUをキャンセルしたりすることができる.PSUは責任報酬に分類され、以下の条件で現金で決済されます30PSUの実際の帰属および獲得数が決定されると、ホーム日までのカレンダー日平均終値。株式を発行しないので、これらの奨励は株式を希釈しないだろう。
2022年からは,我々の長期インセンティブ計画の一部として,このようなPSUを付与せず,代わりに時間制限のあるRSUを付与する。
次の表は、現金イベントで決済したPSUをまとめています
| | | | | |
| 2022年12月31日 |
| 株 |
| 2021年12月31日に帰属していません | 134,000 | |
授与する(1) | 24,000 | |
| 既得 | (49,000) | |
| 没収される | (26,000) | |
| 2022年12月31日に帰属していない | 83,000 | |
(1)現金で決済するPSUは20222月に授与された年間賞とともに授与される賞も含まれています2022従業員を雇用しながら付与されたPSU。これらの付与は、付与時に資格を獲得する目標株式数を反映している。
2022年と2021年に現金で決済されたPSUの公正価値は合計#ドル11.0百万ドルとドル9.9それぞれ100万ドルです
時間既得性制限株式単位(RSU)
従業員に与えられるRSUは通常毎年3分の1以下です3年付与された日の記念日,又は授与の日の3周年には,当該従業員が引き続き我々に雇用されない限り,その計画に別段の規定がない限り。私たちの普通株式の株式は帰属時に従業員に交付されますが、適用される源泉徴収税を払わなければなりません。我々の取締役会に在任している取締役に付与されたRSUは、授与日の1周年に授与され、いずれの場合も、取締役は授与日まで引き続き我々の取締役会に在任することを前提としている。私たちの普通株は帰属時に取締役に交付され、源泉徴収税は何も徴収されません
次の表に私たちのRSU活動をまとめます
| | | | | | | | | | | |
| 株 | | 加重平均
付与日公正価値 |
| 2021年12月31日に帰属していません | 1,202,000 | | | $ | 291.54 | |
授与する(1) | 1,751,000 | | | 221.28 | |
| 既得 | (539,000) | | | 297.72 | |
| 没収される | (468,000) | | | 244.03 | |
| 2022年12月31日に帰属していない | 1,946,000 | | | $ | 237.90 | |
(1)与えられたRSU2022主に2月に授与された年間賞とともに授与されたRSUを代表します2022新しい従業員を雇うことと一緒に賞を授与します与えられたRSU2022約10%も含めて15,000私たちの取締役会にRSUを授与します。
2021年および2020年に付与されたRSUの加重平均付与日は#ドルである276.90そして$318.87それぞれ,である.
2022年、2021年、2020年に帰属するRSUの公正価値は合計1ドルである116.3百万、$132.2百万ドルとドル140.5それぞれ100万ドルです
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
従業員株購入計画(ESPP)
2015年6月、私たちの株主は2015年のESPPを承認した。2015年にESPPが購入できる普通株の最大総株式数は6.2百万ドルです
次の表に私たちのESPP活動をまとめます
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万、株式を除く) | | 2022 | | 2021 | | 2020 |
| 2015年のESPP発行株によると | | 241,000 | | | 248,000 | | | 212,000 | |
| 2015年にESPPが受け取った現金によると | | $ | 44.2 | | | $ | 54.4 | | | $ | 48.6 | |
所得税費用
未計上所得税費用と所得税費用の構成は以下のとおりである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 所得税(福祉)支出前収入: | | | | | | |
| 国内では | | $ | 1,842.0 | | | $ | 448.3 | | | $ | 3,290.0 | |
| 外国.外国 | | 1,749.8 | | | 1,296.9 | | | 1,757.5 | |
| 所得税支出前総収入 | | $ | 3,591.8 | | | $ | 1,745.2 | | | $ | 5,047.5 | |
| 所得税(福祉)費用: | | | | | | |
| 現在: | | | | | | |
| 連邦制 | | $ | 694.5 | | | $ | 319.1 | | | $ | 647.0 | |
| 状態.状態 | | 39.0 | | | 23.1 | | | 41.2 | |
| 外国.外国 | | 67.9 | | | 137.1 | | | 155.1 | |
| 総電流 | | 801.4 | | | 479.3 | | | 843.3 | |
| 延期: | | | | | | |
| 連邦制 | | (328.3) | | | (242.5) | | | (1,749.9) | |
| 状態.状態 | | 2.5 | | | (11.9) | | | (6.8) | |
| 外国.外国 | | 157.2 | | | (172.4) | | | 1,905.7 | |
| 集計を延期する | | (168.6) | | | (426.8) | | | 149.0 | |
| 所得税費用総額 | | $ | 632.8 | | | $ | 52.5 | | | $ | 992.3 | |
過渡通行料税
2017年の減税と雇用法案は、外国子会社がこれまで納税していなかった海外収益に一度に送金税(過渡的通行料税)を徴収することで、米国の歴史的に送金されていない収益に対する所得税の延期を解消した。過渡的通行料税は、外国会社が蓄積した海外収益のうち私たちが占めるシェアに基づいて評価されており、これらの収入は以前課税されていなかった。現金と現金等価物形式の収入は以下の税率で課税される15.5%、他のすべての収入は以下の税率で課税されます8.0%.
2022年12月31日と2021年12月31日まで、私たちの課税負債は$です558.0百万ドルとドル633.0過渡的通行料税によると、それぞれ100万ドルです。2022年12月31日までの課税額のうち、約$137.81年以内に100万ドルを支払う予定です。過渡的通行税は2018年から8年以内に分期納付され、利息は発生しない。
未送金収益
2022年12月31日現在、私たちの収益は米国以外の地域に永久的に再投資されることはないと考えられ、収益を国内に送金する予定の源泉徴収総額推定に関する繰延税金負債が記録されている。利益を除いて、永久再投資帳簿/税ベース差額を約$とします1.52022年12月31日まで、主に
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
仕入会計。これらの恒久的再投資ベース差は、外国子会社の売却や様々な他の事件によって逆転する可能性があるが、2022年12月31日現在、これらの事件は可能とは考えられない。もしこのような違いが逆転すれば、アメリカの残りの納税義務はドルの間にあるだろう300.0百万ドルとドル400.02022年12月31日まで。
T@@ ec@@ f@@ id@@ er@@ a
多くのTecfideraの模造薬は今北米、ブラジルとあるEU国家に入って、Tecfideraと比べて、それらの価格は大きな割引があります。Tecfideraに対する後発薬競争は我々のTecfidera収入を大幅に減少させ,Tecfideraの収入は将来的に低下し続けることが予想される。
2020年12月31日現在、米国におけるTecfideraの将来予想売上に依存する繰延税金資産の現金化能力を評価し、いくつかの繰延税金資産の純資産を約$減少させた1.710億ドル、GILTIおよび税金相殺に関連する繰延税金負債算入を約#ドル削減1.6十億ドルです。2020年12月31日までの1年間で、これらの減税に関する所得税支出は約90.3百万ドルです。私たちはこのような繰延税金資産の現金化能力を評価し続ける。2022年12月31日と2021年12月31日までに、これらの繰延税金資産が約$増加することを記録しました17.4百万ドルとドル108.5100万ドルと繰延税金負債は約#ドル増加しました16.7百万ドルとドル103.9それぞれ100万ドルです
繰延税金資産と負債
私たちの繰延税金資産と負債の重要な構成要素の概要は以下の通りです
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| 繰延税金資産: | | | | |
| 税金控除 | | $ | 112.6 | | | $ | 121.0 | |
| 在庫、その他準備金、課税項目 | | 202.8 | | | 199.4 | |
| 無形資産、純資産 | | 1,370.3 | | | 1,477.5 | |
| 神経免疫会社のADUHELMの税金ベースは | | 470.3 | | | 475.8 | |
| IRC第174条研究·開発資本化 | | 271.8 | | | — | |
| 純営業損失 | | 1,845.9 | | | 1,973.0 | |
| 株式ベースの報酬 | | 37.2 | | | 31.7 | |
| 他にも | | 280.7 | | | 208.8 | |
| 推定免税額 | | (2,003.3) | | | (1,961.3) | |
| 繰延税金資産総額 | | $ | 2,588.3 | | | $ | 2,525.9 | |
| 繰延税金負債: | | | | |
| 購入無形資産 | | $ | (76.1) | | | $ | (256.6) | |
| サムスンBioepis投資分割払い | | (138.0) | | | — | |
| GILTI | | (1,002.0) | | | (1,037.6) | |
| 税金控除 | | (228.7) | | | (260.2) | |
| 減価償却、償却その他 | | (251.8) | | | (250.9) | |
| 繰延税金負債総額 | | $ | (1,696.6) | | | $ | (1,805.3) | |
2022年12月31日から2021年12月31日までの間の推定手当の変化は、主に、ADUHELMにおいてNeurity SubOne AG(神経免疫)税ベースに関連する繰延税金資産の推定準備金を確立することと、上述したようないくつかの繰延税金資産の推定調整に関連しており、これらの資産の実現は、Tecfideraの将来の米国での販売状況に依存する。
繰延税金資産と負債のほかに、実体内の在庫販売に関する繰延費用を記録した。2022年12月31日と2021年12月31日までの繰延費用総額は$56.6百万ドルとドル39.6それぞれ100万ドルです
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
“インフレ低減法案”
2022年8月、アイルランド共和軍は米国で法律に署名した。アイルランド共和軍は、最低税の15.0%と消費税の1.0%の株式買い戻しを含む新たな税収条項を導入した。アイルランド共和軍の規定は2022年12月31日以降の期間内に有効になるだろう。2022年12月31日現在、アイルランド共和軍の公布は、私たちの所得税の支出や繰延税純資産の重大な調整をもたらしていない。
税率.税率
米国連邦法定税率と私たちの有効税率との間の帳簿概要は以下の通りである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| | | 2022 | | 2021 | | 2020 |
| 法定料率 | | 21.0 | % | | 21.0 | % | | 21.0 | % |
| 州税 | | 1.1 | | | 0.8 | | | 0.7 | |
| 外国の収入に課税する | | (4.9) | | | (10.5) | | | (3.3) | |
| 税金控除 | | (1.7) | | | (3.8) | | | (1.2) | |
| 購入無形資産 | | 0.3 | | | (1.6) | | | 0.7 | |
| Tecfidera被害 | | — | | | — | | | 1.8 | |
| GILTI | | 0.7 | | | 1.3 | | | 1.3 | |
| サムスンBioepisの販売 | | (1.6) | | | — | | | — | |
| 訴訟和解協定 | | 2.6 | | | — | | | — | |
| | | | | | |
| 神経免疫税影響 | | 2.3 | | | (5.3) | | | (0.1) | |
| 内部再編成 | | (1.4) | | | — | | | — | |
| 他にも | | (0.8) | | | 1.1 | | | (1.2) | |
| 実際の税率 | | 17.6 | % | | 3.0 | % | | 19.7 | % |
税率の変動
2022年12月31日までの1年間、2021年と比較して、神経免疫繰延税純資産の影響は含まれておらず、以下に述べるように、訴訟和解協定やブロードウェイ125号に位置するビルを売却する税金の影響を含む。これらの成長は,今年度の国際再編に関する税収割引の影響,Samsung Bioepisにおける我々の株式売却の影響,およびVxotrigineの開発中止を決定した影響によって部分的に相殺された。さらに、2021年に、私たちの有効税率は、BIIB 111とBIIB 112の減価費用の税収影響と、私たちの持分ツール価値が変化する非現金税収の影響のおかげだ。
2021年12月31日までの1年間、2020年と比較して、神経免疫繰延税金資産の影響は含まれていないが、以下に述べるように、主にTecfideraの非特許競争に対する米国市場の悪影響、BIIB 111およびBIIB 112減値費用の税収影響、および私たちの株式投資価値が変化する非現金税収の影響を含む収益力地域の組み合わせの変化によるものであり、2021年には純損失が達成されず、2020年には純利益が達成されていない。私たちの2020年の有効税率はまた、Tecfideraの将来の米国での販売に依存するいくつかの繰延税金資産に対する評価準備に関する所得税支出を反映している。
訴訟和解協定に関するその他の情報は、お読みください付記18、その他の連結財務諸表明細これらの連結財務諸表まで。
神経免疫繰延税金資産
2021年の間、私たちはスイスで約#ドルの繰延税金純資産を記録した100.0神経免疫社はADUHELMの納税ベースで100万ユーロであり,その実現はADUHELM社の将来の販売状況に依存する
2022年第1四半期にADUHELMに関する最後のNCDを発行したところ,我々が記録した推定手当は約#ドル増加した85.0100万ドルでこの繰延税金資産の純価値をゼロにします。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
我々の繰延税項純資産に対するこれらの調整は,非持株権益に起因する純収入(損失)に割り当てられた等額と相殺金額とともに我々の総合損益表に記録されているため,生物遺伝会社の純収入への純影響はゼロである
神経免疫との連携に関するより多くの情報をお読みください付記20は、可変利子実体への投資これらの連結財務諸表まで。
税制属性
2022年12月31日現在、私たちがアメリカ連邦所得税目的のために行った一般商業信用繰越約は$です8.1100万人が2027年に満期になりますアメリカの所得税の目的で、私たちは約$の研究と投資の繰越を免除します132.72023年に満期を迎えた100万ドルの純運営損失は約24.82036年には100万台が満期になる。外国所得税の目的で私たちは$を持っています15.52027年から満期を迎えた連邦純営業損失は10億ドルに繰り越し15.42027年から満期を迎えたスイス州の純営業損失は10億ドルに膨らむ。
繰延税金資産の現金化能力を評価する際には、繰延税金資産の一部または全部が現金化できない可能性が高いかどうかを考慮した。繰延税金資産の最終的な現金化は、これらの一時的差額控除可能期間中に生成された将来の課税所得額に依存する。この決定を下す際には、適用される財務報告基準に基づいて、繰延税金負債の予定沖販売、将来の課税所得額、および税務計画戦略を考慮することが許可される。過去の課税所得額と所得税負債レベルおよび繰延税金資産利用可能期間の将来の課税所得額の予測に基づいて、記録された推定値準備後の完全子会社繰延税金資産を差し引いた純収益を実現することが可能であると考えられる。もし実際の結果が私たちの推定と違ったり、将来の間に私たちの推定を調整したりすれば、推定手当を調整したり確立したりする必要があるかもしれません。これは、私たちの総合財務状況や運営結果に大きな影響を与えるかもしれません。
所得税における不確実性会計
未確認の税収割引の期初と期末金額の入金概要は以下の通りです
| | | | | | | | | | | | | | | | | | | | |
| | |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 期初残高 | | $ | 563.4 | | | $ | 75.7 | | | $ | 129.9 | |
| 当期に係る納税状況に基づいて計算される増加額 | | 36.3 | | | 4.2 | | | 1.5 | |
| 前期税額への補充 | | 23.4 | | | 509.9 | | | 51.7 | |
| 前期税額減少額 | | (14.9) | | | (18.8) | | | (63.6) | |
| 法規が満了する | | (1.6) | | | (3.2) | | | (7.9) | |
| 返金を決済する | | (0.2) | | | (4.4) | | | (35.9) | |
| 期末残高 | | $ | 606.4 | | | $ | 563.4 | | | $ | 75.7 | |
2021年12月31日までの1年間に、未確認の税収総額を約ドル増加させました455.0百万ドルは,スイスの税収目的の繰延税金資産に関連しており,神経免疫会社のADUHELMにおける納税基盤に用いられている。この確認されていない税収割引は、繰延税金項目総資産の減少として記録されており、上述した繰延税金項目純資産は、我々の総合貸借対照表上の単独負債としてではない。2022年12月31日現在,神経免疫に関する未確認税収割引は約$である450.0100万ドルこれは為替レートの変化の結果です
私たちの2020年の活動は特定の税務問題を効果的に解決する影響を反映する。私たちと私たちの子会社は定期的に様々な税務機関の検査を受けています。私たちはアメリカ各州とアメリカ連邦と他の外国司法管轄区で所得税申告書を提出します。ごく少数の例外を除いて、私たちは2017年前にアメリカ連邦税務審査を受けなくなったか、2013年までに州、地方、または非アメリカ所得税審査を受け入れなくなった。
米国国税局と他の国家税務機関は、知的財産権関連取引に関する私たちの会社間移転定価を定期的に検査し、彼らはこのような推定値に対する私たちの1つ以上の立場に同意しないかもしれない。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2022年、2021年、2020年12月31日までの未確認税収割引残高は134.0百万、$87.5百万ドルとドル68.8未確認の税収割引(州問題上の連邦福祉を差し引く)をそれぞれ控除し、確認すれば、今後の期間の実際の所得税率に影響を与える。
所得税支出で確認されていない税金優遇に関する潜在的利息と処罰を確認します。2022年,2021年および2020年12月31日までの年間で,総利息および罰金支出が$であることを確認した0.7百万、$2.7百万ドルとドル1.0それぞれ100万ドルです私たちは$を蓄積しました25.2百万ドルとドル24.82022年12月31日と2021年12月31日まで、支払利息と罰金はそれぞれ100万ドル。
私たちが他の税務機関からより多くの情報を受け取ると、私たちはこれらの機関との和解を含む、いくつかの譲渡価格、協力事項、および他の問題に関連する不確定な税金の価値を調整するかもしれない。
私たちの未確認税金優遇総額(利息を含まない)は最大約$減少する可能性があると思います500.0約$を含めて百万ドルです450.0上述したように、今後12ヶ月以内に、様々な監査閉鎖、和解、訴訟時効が満了するため、ADUHELMとNeurityの税収基盤に関する未確認税収割引は100万ドル増加する。ADUHELMにおける神経免疫会社の納税基盤に関する未確認税収総額のどの変化も生物遺伝会社の純収入にゼロ影響を与え,関連する繰延税金資産について全額推定準備金を記録しているからである。
キャッシュフロー情報を補完する
2022年12月31日、2021年、2020年12月31日までの年間キャッシュフロー情報の補足開示は以下の通り
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 年内に支払う現金: | | | | | | |
| 利子 | | $ | 262.5 | | | $ | 280.8 | | | $ | 272.7 | |
| 所得税 | | 932.9 | | | 247.9 | | | 906.7 | |
その他の費用,純額
その他の費用純額の構成は以下のとおりである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
サムスンBioepis株を売却する収益(1) | | $ | (1,505.4) | | | $ | — | | | $ | — | |
| 訴訟和解合意と和解費用 | | 917.0 | | | — | | | — | |
| 利子収入 | | (89.3) | | | (11.0) | | | (42.0) | |
| 利子支出 | | 246.6 | | | 253.6 | | | 222.5 | |
| 投資損失,純額 | | 277.3 | | | 824.9 | | | (685.7) | |
| 外貨(収益)損失,純額 | | 35.5 | | | 22.4 | | | 10.7 | |
| その他、純額 | | 10.1 | | | 5.6 | | | (2.9) | |
| その他の費用を合計して純額 | | $ | (108.2) | | | $ | 1,095.5 | | | $ | (497.4) | |
(1)税引き前の収益を反映して、取引コストを差し引いて、私たちのを売ることから49.92022年4月、サムスンバイオ社はサムスンバイオ社の%持分をサムスンバイオ社に譲渡した。Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
上の表に示すように、投資(収益)損失純額は債務証券、ある生物技術会社の株式証券、基礎投資がある生物技術会社の株式証券のリスク投資基金と非流通持分証券に関連する。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2022年第2四半期に記録された税引前費用は900.0100万ドル、和解費用と支出を加えて、2015年前の行為に関するQui Tam訴訟の訴訟和解合意を解決するために使用される。この費用は、2022年12月31日までの年間総合収益表の他の費用純額に含まれています。
下表は、2022年、2022年、2021年、2020年12月31日までの私たちが保有する株式証券に関する投資(収益)損失をまとめています
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| 権益証券確認の純損失 | | $ | 264.7 | | | $ | 821.1 | | | $ | (693.9) | |
| 差し引く:権益証券による純損失 | | — | | | (10.3) | | | (12.1) | |
| 権益証券確認の未実現損失 | | $ | 264.7 | | | $ | 831.4 | | | $ | (681.8) | |
2022年12月31日までの年間で確認された未実現純損失は,主にDenaliとSangamo普通株投資における公正価値総額が約$減少したことを反映している278.0百万ドルです。2021年12月31日までの年間で確認された未実現純損失は,主にDenali,Sage,Sangamo,Ionis普通株への投資の公正価値総額が約$減少したことを反映している819.6百万ドルです。
費用とその他を計算すべきである
計算すべき費用およびその他の費用には、以下のものが含まれる
| | | | | | | | | | | | | | |
| | | 12月31日まで |
| (単位:百万) | | 2022 | | 2021 |
| | | | |
| 収入に関する割引と手当準備金 | | $ | 891.6 | | | $ | 802.1 | |
| 従業員補償と福祉 | | 395.6 | | | 345.1 | |
| 協力費用 | | 277.9 | | | 324.7 | |
| 特許使用料と許可料 | | 209.4 | | | 234.7 | |
| | | | |
| | | | |
| | | | |
| 他にも | | 746.9 | | | 828.6 | |
| 費用とその他の費用総額を計算しなければならない | | $ | 2,521.4 | | | $ | 2,535.2 | |
他の長期負債は#ドルです944.2百万ドルとドル1,320.52022年12月31日と2021年12月31日まで、それぞれ100万ドルで、課税所得税の総額を含めて#ドルです541.7百万ドルとドル664.5それぞれ100万ドルです
私たちの業務戦略では、パートナーが持っている特定のノウハウ、技術、特許権を使用して製品を開発、生産、販売する権利があるように、様々な協力協定を締結しました。様々な協力協定の条項は、ある製品開発目標を達成する際に記念碑的な支払いを支払い、協力によって生じた商業製品の将来販売(あれば)について印税を支払うことを要求する可能性がある。
連携スケジュールにより,連携内のコスト分担機構や活動の性質に応じて,連携相手との応受や対応資金残高を記録することが可能である.私たちの重要な協力計画は以下の通りだ。
遺伝子テーク社(羅氏グループ)
私たちはいくつかの商業的および財務的権利を持っている:非ホジキンリンパ腫、CLLおよび他の疾患の治療のためのRituxan;非ホジキンリンパ腫およびCLLの治療のためのRituxan HYCELA;CLLおよび濾胞性リンパ腫の治療のためのGazyva;PPMSおよびRMSのためのOCREVUS;LUNSUMIO(Mosunetuzumab)は、2022年第4四半期に米国で加速承認され、再発または難治性濾胞性リンパ腫の治療のための;非ホジキンリンパ腫の潜在的治療のための研究的二重特異性抗体である。我々と羅氏集団の全メンバー遺伝子テークとの協力により,他の潜在的な抗CD 20療法を追加することも選択できる。本脚注では,RituxanとRituxan HYCELAを総称してRituxanと呼ぶ.
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
我々が連携プロトコルの規定に従って制御権を変更する場合,遺伝子テイクはRituxanを購入する権利を提示する権利があり,遺伝子テークの要約を受け取るか,そのカプセルと同じ条項に従って遺伝子テークを購入する権利を持たなければならない.遺伝子テークはまた、以下の条項に従って私たちが協力中に残りの製品を購入する権利を同時に購入したとみなされる。
私たちの遺伝子テックとの協力は、合弁企業や他の法的実体によってではなく、契約手配によって設立された。
Ritxan
遺伝子テックとその付属会社はRituxanのグローバル製造および以下のすべての開発と商業化活動を担当している
•アメリカ: 私たちはアメリカでRituxanを開発、商業化、そしてマーケティングする権利を共同で独占的に許可した。
•カナダ: 私たちはカナダでRituxanを開発、商業化、そしてマーケティングする権利を共同で独占的に許可した。
同前の瓦
羅氏グループとそのサブライセンス所持者は、依然として米国におけるGazyvaの開発、製造、商業化に全責任を負う。Gazyvaの米国での総売上高は、以下の表で述べたように、RituxanとLUNSUMIOの共同販売促進利益における当社のパーセンテージに影響を与える可能性がある。
OCREVUS
遺伝子テックとの協力協定条項によると、以下の会社からアメリカの純売上高の等級別特許権使用料を獲得します13.5%に増加し、最大で24.0年間純売上高が$を超える900.0百万ドルです。1つになります50.0米国がOCREVUSに類似した生体薬を承認した場合,これらの特許権使用料は%減少する
さらに私たちは毛の収入を受け取ります3.0OCREVUSの米国以外での純売上高の印税パーセントは,印税期限は11OCREVUSが初めて国単位で商業販売を行ってから数年。
OCREVUSの商業化は、RituxanやGazyvaから得られた共同販売促進利益の割合に影響を与えません。遺伝子テークはOCREVUSの開発と商業化を独自に担当し,将来のコストに資金を提供している。遺伝子テークは慢性リンパ球性白血病、非ホジキンリンパ腫或いは関節リウマチにおいてOCREVUSを発展させることができない。
OCREVUS特許使用料収入は,同期OCREVUS販売の第三者と市場研究データの見積もりに基づいている。実際の特許使用料収入と推定特許権使用料収入との差は既知の期間に調整され、通常は次の四半期と予想される。
もし私たちが協力協定の定義に従って制御権を変更すれば、遺伝子テイクは、米国でのみ現在の純売上高の印税を支払い続けることと引き換えに、OCREVUSを購入する権利とみなされるだろう(私たちの協力協定で定義され、上記でまとめられるように)11OCREVUSがアメリカで初の商業販売1周年
LUNSUMIO(Mosunetuzumab)
2022年1月には,遺伝子テークとの選択権を行使し,LUNSUMIOの共同開発と商業化に参加した。今回の演習では1ドルを記録しました30.02021年12月に遺伝子テークに支払われた百万ユーロオプション行権料は,2021年12月31日までの年度総合損益表の研究開発費で確認された。私たちはまた約#ドルの費用を記録した20.0遺伝子テークの補償に百万ドルです30.02021年にこの候補製品を開発することによるコストの%シェアは,2021年12月31日までの年度の総合損益表で研究開発費として確認された。2022年12月31日までに約$を記録しました28.4100万ドルの研究開発費と約13.0我々がこの連携に関する合併損益表では,販売とマーケティング費用は百万ドルに達している.
私たちは遺伝子テークとの協力の下で30.0FDAが承認する前に,LUNSUMIOの開発コストの%を,米国の共同販売促進運営損益で階層的に共有する権利があることを以下の表に示す.また、LUNSUMIOの米国国外での販売から1桁の印税を取得しました。2022年12月、LUNSUMIOはFDAによって再発や難治性濾胞性リンパ腫の治療に加速されました。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
もし私たちが協力プロトコルの定義に従って制御権を変更すれば、GenentechはLUNSUMIOを購入する権利を購入したとみなされます30.0LUNSUMIOが米国初の商業販売11周年を前に、米国の共同販売促進運営利益や損失の割合。
Glofitamab
2022年12月,GLOFITAMABの商業化と経済学的共有に関連するGenentechと合意し,GLOFITAMABは末期二重特異性抗体であり,B細胞非ホジキンリンパ腫や他の血液癌のために開発されている。この協定の条項によると、私たちは支払い義務がなく、GLOFITAMABの米国での潜在的な純売上高に基づいて等級版税を獲得する。遺伝子テークはGLOFITAMABが米国内で商業化する唯一の決定権を持ち、承認されれば、GLOFITAMABの米国での潜在的純売上高の中央値から1桁までの階層的特許権使用料を得る資格がある。
もし私たちが協力協定の定義に従って制御権を変更すれば、遺伝子テイクは、米国での純売上高(私たちの協力協定に基づいて定義されている)の1桁の特許権使用料と引き換えに、Glofitamabを購入する権利とみなされ、製品が米国で初めて商業販売されて11周年になるまで。
利益共有式
RituxanとLUNSUMIOの利益シェア
私たちは現在アメリカでRituxanとLUNSUMIOの税引前共同販売促進利益共有式を提供しています30.0最初の$のシェア率は50.0毎年毎年獲得している共同販売促進運営利益は合計数百万ドルですFDAがLUNSUMIOを承認したため、RituxanとLUNSUMIOが合併した年間共同販売促進利益におけるシェアは$を超えています50.0以下の表に示すように、百万ドルは次の事件によって異なる
| | | | | |
| |
| |
| LUNSUMIOの承認後から最初の閾値日まで | 37.5 | % |
| 第1の閾値日の後から第2の閾値日まで | 35.0 | % |
| 2つ目の閾値日の後 | 30.0 | % |
最初の敷居日(I)いかなる12ヶ月連続の期間においても、Gazyvaの米国における総売上高が$に達することを指す500.0百万ドルまたは(Ii)毎年のアメリカLUNSUMIOの総売上がドルに達する最初の日150.0百万ドルです。
第2の閾値日(I)米国LUNSUMIO総売上高が$に達した任意の例年の総売上高の最初の日を指し、遅い日を基準とする350.0(2)最初の開始日が出現したカレンダー年以降の暦1月1日。
アメリカのRituxan税引前利益シェアは$を超えています50.02022年12月31日、2021年、2020年12月31日までの年度37.5%.
Gazyva利益シェア
現在Gazyvaの税引前利益共有式を提供しています35.0最初の$のシェア率は50.0毎年毎年稼いでいる営業利益の百万ドル年間共同販売促進利益における私たちのシェアは$を超えています50.0以下の表に示すように、百万ドルは次の事件によって異なる
| | | | | |
| |
| 2つ目のGazyva閾値日まで | 37.5 | % |
| 2番目のGazyva閾値日の後 | 35.0 | % |
| |
2番目のGazyva閾値日付12ヶ月連続で、Gazyvaの米国での総売上高が$に達したことを指す500.0百万ドルです。Gazyvaが非CLL適応で承認されたか否かにかかわらず、第2のGazyva閾値日は実現可能である。
Gazyvaでの税引前利益シェアは$を超えています50.02022年12月31日、2021年、2020年12月31日までの年度37.5%.
もし私たちが協力協定の規定に従って統制権を変更すれば、GenentechはGazyvaが米国で初めて商業販売されて11周年になるまで、協力計画(上述した)に従ってGazyvaの賠償金を支払い続けることと引き換えに、Gazyvaの権利を購入したとみなされる。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
抗CD 20治療プロジェクトの収入
抗CD 20治療項目の収入の概要は以下の通りである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| OCREVUSの販売特許使用料収入 | | $ | 1,136.3 | | | $ | 991.7 | | | $ | 845.4 | |
| アメリカのRituxanとGazyvaにおける生物遺伝研究会社の税引前利益シェア | | 547.0 | | | 647.7 | | | 1,080.2 | |
| 抗CD 20治療プロジェクトの他の収入 | | 17.2 | | | 19.1 | | | 52.2 | |
| 抗CD 20治療プロジェクトの総収入 | | $ | 1,700.5 | | | $ | 1,658.5 | | | $ | 1,977.8 | |
規制機関の承認に先立ち,抗CD 20製品の開発による費用を研究開発費と商業化前コストの販売費用,一般費用,行政費用に計上し,総合損益表に計上した。抗CD 20製品が承認された後、この製品に関連する開発、販売、およびマーケティング費用のシェアを、抗CD 20治療プロジェクト収入における税前利益シェアの減少として記録する
エオニス製薬会社
SPINRAZA
2012年1月、Ionis製薬会社(IONIS)と協力·許可協定を締結し、この協定に基づき、SMAを治療するSPINRAZAを開発し、商業化することができる独占的な世界的許可を得た。
Ionisとの合意によると、SPINRAZAの世界的な年間純売上高に基づいてIonisに特許使用料を支払い、使用料率は11.0%和15.0%は、当社の総合損益表の販売コストで確認します。2022年,2021年,2020年12月31日までの年間,SPINRAZAの販売に関する特許使用料コストの合計は約ドルである243.1百万、$267.1百万ドルとドル286.6それぞれ100万ドルです
2018 Ionisプロトコル
2018年6月に私たちは10年間Ionisと独占的な協力協定を達成し、一連の神経系疾患のために新型アンチセンスオリゴヌクレオチド(ASO)候補薬物を開発し、総金額は5ドルである1.0前金も含めて億ドルです375.0100万ドルを購入しました11.5100万株のIonis普通株、コストは$625.0百万ドルです。
契約が成立した時私たちは$を記録した50.9百万ドル375.0私たちの総合貸借対照表では前払いサービスとして100万ドルを前払いし、残りのドルを確認しました324.1我々の総合損益表では,研究·開発費は100万ドルである。前払いサービスとして記録された金額は、合意期間内に研究および発見サービスのスケジュールを提供するために約束された従業員リソースの価値を表す。
本プロトコルによる治療法を認可し,このような治療法の開発と商業化を担当する権利がある。$までの開発マイルストーンをIONISに支払う可能性があります125.0百万か$270.0適応に年間許可料,および潜在商業純売上高の特許権使用料を加えると,1項目あたりの使用料は100万ドルであった。
2022年、2021年、2020年12月31日までの年間で実現しました10.0百万、$22.5百万ドルとドル11.3本プロトコルで決定した神経学的目標の進展に関する100万ドルは,我々の総合損益表に研究と開発費用として記録した。
2017年SMA連携協定
2017年12月、我々はIONISと協力協定を締結し、SMAの潜在的治療のための新しいASO候補薬を決定した。この合意により,我々はこのような協力による療法を認可し,これらの療法の開発と商業化を担当する権利がある。
この協定を締結すると,われわれは1ドルもうけた25.0Ionisに100万ドル前払いしてIonisに最高$を支払うかもしれません260.0新薬候補薬が発売承認されれば、数百万ドルの追加開発と規制マイルストーン支払いを受けることになる。ビジネス化後にはIonisに最高$を支払うこともできます800.0このような療法の潜在的純売上高に応じて,業績に基づくマイルストーン支払いと分級特許権使用料が別途支払われる。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2021年12月には、Ionisとともに選択権を行使し、BIIB 115を開発して商業化するためのグローバル独占許可を得ており、BIIB 115はSMAが開発している調査的ASOである。このオプション行使について、私たちは#ドルの選択加入支払いを支払った60.02021年12月31日までの年間総合収益表では、この費用は研究開発費と記されている。
2013年長期戦略研究協定
2013年9月に私たちは6年制Ionisとの研究協力協定は、この合意に基づいて、両社が協力して発見レベルの研究を行い、その後、アンチセンス或いは他の療法の開発と商業化活動を行い、神経系疾患を潜在的に治療する。このプロトコルにより,Ionisはプロトコルで決定された一連の神経学的目標を検討している
IONISは,この協力により開発されたすべての候補製品のマイルストーン支払い,許可料,印税支払いを取得する資格があり,具体的な金額は合意条項に基づいて提案した候補製品の形態に依存する
非ALSアンチセンス製品候補製品に対して、IONISは第二段階試験を完成することによる全世界開発を担当し、著者らは臨床試験設計と監督策略方面の提案を提供する。ALSアンチセンス製品の候補製品に対して、著者らは全世界の開発、臨床試験設計と監督策略を担当する。私たちは第2段階試験が終わる前に候補製品を許可する権利がある。もし私たちが選択権を行使すれば、私たちはIonisに高い$を支払うだろう70.0百万の許可料を負担し、世界的な開発、規制、そして商業化の責任を負う。ある規制のマイルストーンを実現した後、IONISは追加のマイルストーン支払いを受ける可能性があり、金額は最高$に達する130.0100万ドル,IONISが協力して行った臨床試験に関する追加金額と,選択肢行使後に候補製品の開発に成功すれば,将来販売される特許権使用料が追加される
2018年12月,Ionisに対して選択権を行使し,スーパーオキシドジスムターゼ1(SOD 1)変異を有するALSを治療する研究薬であるtofersen(BIIB 067)の開発·商業化のための世界的独占特許使用料許可を得た。潜在的な許可後のマイルストーン支払いには最大$が含まれる可能性があります55.0ミリオンと印税は世界の潜在年間純売上高の中低調率を占めている。オプション行使後、私たちはtofersenの開発、製造、商業化に関するコストと費用を単独で責任を負う。
2022年12月31日、2021年、2020年12月31日までの年間で実現しました17.0百万、$10.0百万ドルとドル28.0百万ドルは,それぞれ本プロトコルでのプロジェクトの推進に関連しており,我々の総合損益表には研究と開発費用として記録されている.
2012 Ionisプロトコル
2012年12月、私たちはIonisと最大3つの遺伝子標的を開発し、それを商業化する合意に達した
この協定によると、Ionisは任意の候補製品のグローバル開発を担当している 第二段階の試験を完成することを通じて、著者らは臨床試験の設計と監督策略について提案を提供する。許可候補製品を選ぶことができます 第2段階の実験が終わるまで。もし私たちが選択権を行使すれば、私たちは$までの許可料を支払うだろう70.0100万ドルで、世界的な開発、規制、商業化の責任を負う。Ionisは最高$を得る資格がある130.0特定の規制のマイルストーンを実現する際に、追加のマイルストーン支払いと、将来の販売の特許権使用料を取得します もし私たちが選択権を行使した後に候補製品を開発することに成功したら。
2019年12月、私たちはIonisに対して選択権を行使し、現在アルツハイマー病の潜在的治療の第二段階にあるBIIB 080(Tau ASO)の開発と商業化のための世界的な独占特許使用料許可を得た。オプションの行使について、私たちは#ドルを支払った45.0私たちの総合損益表では、この費用は研究開発費として記録されています。将来の支払いには$までの追加マイルストーン支払いが含まれるかもしれません155.0もし私たちがオプション行使後に候補製品の開発に成功すれば、将来販売される特許権使用料は1000万ドルから15万ドルの間になるだろう。
2022年12月31日までの年間で記念碑的な支払い$が生まれました10.0百万ドルは,本プロトコルによるBIIB 080の推進に関連しており,この費用は我々の総合損益表の研究と開発費用に記録されている。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
衛材株式会社
LEQEMBI(Lecanemab)連携
著者らは衛材と協力協定を達成し、LEQEMBI(Lecanemab)を共同開発と商業化し、これはアルツハイマー病の潜在的治療のための抗アミロイド様抗体(LEQEMBI協力)である。
衛材は全世界のLEQEMBI開発と監督管理提出の責任者であり、両社は共同で商業化と共同でこの製品を普及させ、衛材は最終決定権を持っている。すべてのコストは、研究開発、販売とマーケティング費用を含めて、すべて私たちと衛材が折半します。LEQEMBIの発売が承認された後、著者らは衛材と共同でLEQEMBIを普及させ、損益を二等分する。著者らは現在LEQEMBI薬剤と薬品を生産し、2022年3月、著者らは衛材とのLEQEMBI関連供給協定を延長し、5年から10年に延長し、LEQEMBI薬剤の生産に応用した。
LEQEMBIの協力は、衛材の共同開発と商業化ADUHELM(Aducanumab)のオプション(ADUHELMオプション)と、私たちの抗tauモノマブ(anti-Tauオプション)を共同開発と商業化するオプションを提供した。2017年10月、衛材はADUHELMオプションを行使し、ADUHELM(Aducanumab)(ADUHELM連携協定)を共同開発·商業化する新たな協力協定に署名した。
2022年3月14日,衛材とのADUHELM連携協定を修正した。改正日より,我々は世界でADUHELMの唯一の決定権と商業化権利を持ち,2023年1月1日から衛材はADUHELM純売上高による分級特許権使用料のみを受け取り,ADUHELMのグローバル損益の共有には参加しなくなった。2022年3月には衛材とのLEQEMBI連携協定も修正し、逆Tauオプションを廃止した。
いずれの会社も制御権変更が発生すれば,我々のLEQEMBI連携プロトコルで定義されているように,買収されていない方はLEQEMBI連携プロトコルにおける定義に従って運営分離を開始することを選択することができる.業務が分離した場合、衛材と協力し、LEQEMBIに関する任意の開発、製造、あるいは商業責任を直ちに私たちから衛材に移管します。この場合,制御権変更後6カ月以内にLEQEMBIに関する費用分担に対する継続責任は相当に減少する80.0運営が分離される前に私たちが借りなければならない債務の%は、他のすべての経済的権利は変わらないだろう。
また,いずれかの会社が支配権変更,すなわち買収側がLEQEMBI連携プロトコルの定義に従って競合製品の商業化に従事していれば,非被買収側も被買収側に競合製品の商業化を停止することを要求することができる.買収側が競合製品を商業化し続けることを選択すれば、非被買収側はLEQEMBI協力協定を終了することができる。また,我々が買収側でなければ,LEQEMBIでの権益を衛材に売却するか,LEQEMBIにおける衛材の権益を購入するかを選択することができるが,LEQEMBI連携プロトコルで規定されているパラメータを遵守する必要がある.
LEQEMBI連携に関する開発,販売,マーケティング費用の概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | |
| | | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| LEQEMBI推進に関する連携による総開発費用 | | $ | 347.2 | | | $ | 323.0 | | | $ | 219.3 | |
| LEQEMBI連携開発費におけるBiogenのシェアは,我々の総合損益表における研究開発費に反映されている | | 173.6 | | | 161.5 | | | 109.6 | |
| LEQEMBI連携による総販売とマーケティング費用 | | 104.6 | | | 27.2 | | | 9.8 | |
| LEQEMBI共同販売とマーケティング費用におけるBiogenのシェアは、当社の総合損益表における販売、一般、行政費用に反映されています | | 52.3 | | | 13.6 | | | 4.9 | |
ADUHELM連携プロトコル
我々の最初のADUHELM連携プロトコルにより,ADUHELMの持続的な発展をリードし,衛材と地域ベースの利益分配を共同でADUHELMを促進する.2019年から、衛材は私たちに精算してくれます45.0ADUHELMによる開発,販売,マーケティング費用の%を連携して推進する.
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2022年3月14日,衛材とのADUHELM連携協定を修正した。改正日より,我々は世界でADUHELMの唯一の決定権と商業化権利を持ち,2023年1月1日から衛材はADUHELM純売上高による分級特許権使用料のみを受け取り,ADUHELMのグローバル損益の共有には参加しなくなった。衛材の開発、商業化、製造費におけるシェアは1ドル以下に制限されている335.02022年1月1日から2022年12月31日までの期間は100万ドルで、2022年12月31日までに実現される。この限度額に達すると,ADUHELMに関するすべてのコストを負担する.
ADUHELM連携プロトコルに関する開発費用、販売とマーケティング費用、およびマイルストーン支払いの概要は以下の通りです
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| ADUHELM開発費用総額 | | $ | 149.4 | | | $ | 183.7 | | | $ | 152.0 | |
| ADUHELM共同開発費における生物遺伝会社のシェアは,我々の総合損益表における研究開発費に反映されている | | 82.2 | | | 101.1 | | | 83.6 | |
| ADUHELM連携プロトコルによるADUHELM販売とマーケティング費用総額 | | 134.2 | | | 562.3 | | | 353.0 | |
| バイオ遺伝会社のADUHELM連携販売とマーケティング費用におけるシェアは,我々の総合損益表における販売,一般と行政費用および連携利益(損失)シェアに反映されている | | 71.5 | | | 301.4 | | | 193.7 | |
| ADUHELM連携第三者マイルストーンの総数 | | — | | | 100.0 | | | 75.0 | |
| バイオ遺伝会社が衛材から得たADUHELMマイルストーン支払い精算シェアは,我々の総合損益表における連携利益(損失)分担に反映されている | | — | | | 45.0 | | | 33.8 | |
ADUHELM共同販売促進損益
米国では,ADUHELMが第三者に販売した収入を製品収入の構成要素と確認し,我々の総合損益表では純額である.また、これらのコストが発生したため、収入および販売とマーケティング費用に関するコストを私たちの総合損益表に記録しました。衛材に支払われた金と衛材から受け取った金45.0米国における共同販売促進利益または損失の%シェアは我々の総合損益表で連携利益(損失)分担であることが確認された。2022年12月31日と2021年12月31日までの年度で,純減少の運営費は約10%であることを確認した224.7百万ドルとドル233.2百万ドルはそれぞれ衛材の45.0アメリカの協力純損失の%を占めています
2021年12月31日までに,運営費の純減少を1ドル確認した45.0百万反映衛材の45.0$のパーセントシェア100.0米国におけるADUHELMの発売に関するNeurImmuneへの百万ドルのマイルストーン支払いは,我々の総合損益表に連携利益(損失)共有に記録されている。
2020年12月31日現在,運営費の純減少を1ドル確認した33.8百万反映衛材の45.0$のパーセントシェア75.0バイオ製品ライセンス申請(BLA)をFDAに提出してADUHELMを承認することに関連するNeurImmuneへの百万マイルストーン支払いは,我々の総合損益表に連携利益(損失)分担に記録されている。
2021年第4四半期には164.0ADUHELMに関する予測需要を超える在庫と調達承諾額のログアウトに関する費用は数百万ドルである.2022年第1四半期に最後の非感染性疾患で約#ドルを記録しました275.0ADUHELMに関する予測需要を超える在庫と調達承諾額のログアウトに関する費用は数百万ドルである.また,2022年12月31日と2021年12月31日までに約$を記録した111.0百万ドルとドル30.0それぞれADUHELMに関する総アイドル容量費用である.これらの費用は,2022年12月31日と2021年12月31日までの年度総合損益表に販売コストを計上している。
約$を確認しました197.0百万ドルとドル99.0衛材に関する百万ドル45.02022年および2021年12月31日までの年度の総合損益表内の在庫、遊休生産能力の有料および協力利益(赤字)分担における契約承諾の占める割合をそれぞれ算出した。
上記の合意に関連した衛材の受取金はわれわれがRe約$88.0百万 aND$285.4それぞれ2022年12月31日と2021年12月31日まで。衛材に支払わなければならない上記の合意に係る金Re約$81.2百万 aND$46.5それぞれ2022年12月31日と2021年12月31日まで。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
また、私たちと衛材は場合によっては日本でAvonex、TysabriとTecfideraを共同で普及させ、衛材はインドと他のアジア太平洋地域市場(中国を含まない)でAvonex、Tysabri、Tecfidera、Plegridyを流通している。
連合信用銀行
2003年11月,われわれはUCBと協力協定を締結し,全身性エリテマトーデスや他の将来合意した適応の治療に用いられる抗CD 40 Lペグ化Fab Dapirolizumab pegolを共同開発·商業化した。我々やUCBは,他の適応におけるDapirolizumab pegolの開発を提案することができる.双方が1つの適応を合意した適応として連携に加えることに同意しなければ,我々やUCBは適用側が自ら費用を負担した場合にこのような適応排除の開発を求めることができるが,非追跡側の臨床活動証明後の選択権に制限される。
合意された適応によって生じるすべてのコストは、研究、開発、販売、マーケティング費用を含み、私たちと連合信用銀行が平均的に分担する。上場が承認されれば、両社はdapirolizumab pegolを共同で普及させ、利益と損失を折半する。
UCB連携プロトコルに関する開発費用の概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| UCB連携開発総費用 | | $ | 68.0 | | | $ | 84.2 | | | $ | 58.3 | |
| UCB共同開発費における生物遺伝会社のシェアは我々の総合損益表の研究開発費に反映されている | | 34.0 | | | 42.1 | | | 29.2 | |
アルクメス
2017年11月、我々はAlkermes plc(Alkermes)の子会社Alkermes Pharmaアイルランド株式会社とRMSを治療する新しいフマル酸塩VUMERITYについて独占許可と協力協定を締結した。2019年10月、FDAはRMSの治療のために米国でVUMERITYを承認した。VUMERITYは2021年第4四半期、EU、スイス、およびイギリスで再発多発性硬化症(RRMS)の治療のために承認された。
この協定によると、私たちはVUMERITYの開発と商業化の独占的なグローバル許可を得て、Alkermesに支払いました15.0VUMERITYグローバル商業純売上高の%は、我々の総合損益表の販売コストで確認します。場合によっては、VUMERITYの商業販売純額に対して支払われるべき特許権使用料は、一定期間内に等級別の最低年次支払い要件を遵守しなければならない5年FDAの承認後に。2022年,2021年,2020年12月31日までの年度,VUMERITY販売に関する特許権使用料コストの合計は約ドルである83.0百万、$61.6百万ドルとドル12.9それぞれ100万ドルです
Alkermesは,Alkermesの独占許可により開発されたVUMERITY以外の新候補製品の開発と商業化に成功した後,年間商業純売上高の1桁から10代以下の2桁の印税を得る資格がある。
Alkermesは単独のプロビジョニングプロトコルに基づいて現在VUMERITYとFAMPYRAを提供している。2019年10月、私たちは新しいプロビジョニング協定を締結し、AlkermesとのVUMERITY許可と協力協定を修正しました。私たちは技術移転を開始し、過渡期後にVUMERITYを製造するか、または私たちが従事する第三者によるVUMERITYを製造し、私たちまたは私たちが指定した人が製造したVUMERITYの将来の世界の商業純売上の任意の部分と交換してAlkermeにより高い特許権使用料を支払うことを選択した。2022年10月、私たちはAlkermesと新しいFAMPYRA供給協定を締結した。Acordaは以前Alkermesとの再許可プロトコルによりFAMPYRAを提供していたが,AcordaとAlkermes間の調停結果により,2022年10月に終了した.
Acorda治療会社
2009年6月、私たちはAcorda Treateutics,Inc.(Acorda)と協力と許可協定を締結し、米国以外の市場でFAMPYRAなどのファブリジンを含む製品を開発し、商業化しました。私たちはこれらの市場のすべての規制活動と関連製品の将来の臨床開発を担当しています
この協定によると、米国以外の純売上高レベルに基づいて等級別特許権使用料を支払い、いくつかの規制と商業マイルストーンの実現に成功したことに基づいて潜在的なマイルストーン支払いを実現する可能性があり、これらのマイルストーンはマイルストーンを実現する際に無形資産資本化し、経済消費モデルを利用して償却することになる。2020年第3四半期にマイルストーンを認識しました15.0百万ドルが満期になりました
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
アメリカ抜きの純売上高は1ドルに達した100.04四半期連続で、私たちの純資産は100万ユーロで、無形資産に資本化され、純額は私たちの総合貸借対照表に計上された
協力·許可協定については,AcordaとFAMPYRAのビジネス供給についてもプロビジョニング協定を締結した。このプロトコルはAcordaとAlkermes Inc.の間の既存プロトコルのサブライセンス手配であり,Alkermes Inc.はElan Drug Technologiesを買収し,後者はAcordaライセンスのオリジナルである.2022年10月、AcordaとAlkermesは許可と供給特許権使用料紛争を解決できないため、Acordaは2020年7月に米国仲裁協会に仲裁を提起し、AcordaはFAMPYRA許可と供給の純売上高のいかなる特許権使用料もAlkermesに支払う必要がなく、Acordaは現在代替源を自由に使用してFAMPYRAを供給することができることを知った。Acordaは,AlkermesからFAMPYRAを取得しないため,FAMPYRAを直接獲得するためにAlkermesとプロビジョニングプロトコルを締結する必要があることを通知している.
2022年12月31日,2021年12月31日,2020年12月31日までの年度まで,FAMPYRA特許使用料と商業供給に関する販売総コストは,我々の総合損益表に反映されて約#ドルである46.1百万、$46.6百万ドルとドル44.5それぞれ100万ドルです
Sage治療会社
2020年11月、我々はSageとグローバル協力と許可協定を締結し、Zuranolone(BIIB 125)とBIIB 124(SAGE-324)、Zuranolone(BIIB 125)をMDDとPPDの潜在的治療に使用し、BIIB 124(SAGE-324)はてんかんなどの他の神経系疾患の特発性振戦の潜在的治療に使用した。
2020年12月にこの取引を完了するために$を購入しました650.0100万株のSage普通株、または約6.2百万株、価格は約$です104.141株当たり、これらの株は最初に譲渡制限を受けた。我々は、買収されたSage普通株の初期公正価値および約$を反映するために、合併貸借対照表に投資資産および他の資産を記録した209.0我々の総合損益表では,Sage普通株支払いのプレミアムに反映されるように研究·開発費は1,000,000,000ドルである.私たちは$を前払いした875.02020年12月31日までの年度総合損益表には研究開発費の100万ドルと記されている。
Sageに開発と商業マイルストーンの支払いも可能で、総額は約$に達するかもしれません1.6この協力に規定されたすべてのマイルストーンが実現されれば、10億ドルに達するだろう。両社は同等の開発責任とコスト、米国での商業化利益と損失を分担する。米国以外では、日本、台湾、韓国を含まず、ズランノロンの開発と商業化を担当し、Sageの潜在的な分級使用料を10代から20歳以下に支払う可能性がある。Sageマイルストーンに合計$を支払うかもしれません225.0米国で初めてMDDとPPDの治療のためのズランノドンを商業的に販売し、100万ドルの価値がある。
この連携に関する開発,販売,マーケティング費用の概要は以下のとおりである
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| Sage連携開発総費用 | | $ | 173.3 | | | $ | 167.7 | | | $ | — | |
| バイオ遺伝会社のSage連携開発費におけるシェアは,我々の合併損益表における研究開発費に反映されている | | 86.7 | | | 83.8 | | | — | |
| コラボレーションによるSage販売とマーケティング費用総額 | | 109.9 | | | 36.4 | | | — | |
| バイオ遺伝会社のSage Collaboration販売とマーケティング費用におけるシェアは、我々の総合損益表における販売、一般、行政費用に反映されています | | 55.0 | | | 18.2 | | | — | |
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
デナリー治療会社です。
2020年8月、私たちはデナリーと協力と許可協定を締結し、デナリーがパーキンソン病を治療するロイシンリピート2(LRRK 2)に富む小分子阻害剤を共同開発し、商業化したLRRK 2計画に加えて、私たちはDenaliの輸送車両プラットフォームからその抗体輸送車両(ATV)を含む2つの臨床前プロジェクトの独占的な許可オプションを持っているATV活性化抗アミロイドベータその輸送車両技術を計画して利用する二番目の計画。また,デナリーがこのようなプロジェクトのための協力を求めることを決定すれば,特定の神経変性疾患の適応の他の2つのATVイネーブル療法について優先的に交渉する権利がある。
この協力の一部として$を購入しました465.0百万2020年9月にDenali普通株を購入する、あるいは約13百万株、価格は約$です34.941株当たり、これらの株は最初に譲渡制限を受けた。私たちは合併貸借対照表に投資資産と他の資産を記録して、買収したデナリ普通株の初期公正価値と約#ドルの費用を反映した41.3我々の総合損益表では,デナリ普通株支払いのプレミアムに反映するために研究·開発費を100万ユーロ計上している。私たちは$を前払いした560.02020年12月31日までの年度総合損益表には研究開発費の100万ドルと記されている。
デナリー開発とビジネスマイルストーンにも支払うことができます総額は約$に達するかもしれません1.1LRRK 2計画に関連するマイルストーンが実現されれば10億ドルですこのような協力の下、両社は特定の割合に応じて世界発展の責任とコスト、および米国と中国で商業化された損益を分担している。アメリカと中国以外では、私たちは商業化を担当し、Denaliの潜在的な等級版税を支払うことができる。
2022年10月、私たちとデナリーは、潜在的なパーキンソン病治療のためのLRRK 2の小分子阻害剤であるBIIB 122(DNL 151)の第3段階灯台研究を開始することを発表した。
この連携に関する開発費用をまとめると以下のようになる
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| デナリー共同開発総費用 | | $ | 75.1 | | | $ | 42.5 | | | $ | 14.6 | |
| デナリー共同開発費における生物遺伝会社のシェアは我々の総合損益表の研究開発費に反映されている | | 43.8 | | | 25.5 | | | 8.8 | |
Sangamo治療会社
2020年2月、我々はSangamoと、アルツハイマー病を含むtauopathy;パーキンソン病を含む突発性核病のためのST-501の開発と商業化のための協力と許可協定を締結した;第3の神経筋疾患標的;および最大9つの追加の神経疾患標的は、5年制ピリオド。この2社は,Sangamoの独自の亜鉛指蛋白技術を用いて,腺関連ウイルスにより神経疾患に関連する重要な遺伝子の発現を調節している。
2020年4月にこの取引を完了するために$を購入しました225.0百万Sangamo普通株式、あるいは約24百万株、価格は約$です9.211株当たり、これらの株は最初に譲渡制限を受けた。我々は、買収したSangamo普通株の初期公正価値と約#ドルの費用を反映するために、合併貸借対照表に投資資産と他の資産を記録した83.0我々の総合損益表では,Sangamo普通株支払いのプレミアムに反映するために研究·開発費が100万ドル増加した。私たちは$を前払いした125.02020年12月31日までの年度総合損益表には研究開発費の100万ドルと記されている。
私たちはまたSangamoに研究、開発、監督、商業マイルストーンの支払いを支払うことができます。総額は約$に達するかもしれません2.4この協力の下で許容されるすべての目標を選択し、この協力で規定されたすべてのマイルストーンを達成すれば、10億ドルを達成することができる。この金額の中で最高$に達します80.0目標を選択するために100万ドル1.9特定の研究、臨床開発、規制、および初の商業販売マイルストーンの成果と#ドルのための億ドル380.0特許製品の世界的な年間純売上高が特定の水準に達すると、百万ドルとは特定の販売に基づくマイルストーンを実現することを意味する。また,この協力により開発された任意の製品の潜在的純売上高に応じてSangamoに桁数から10代以下の割合で等級別印税を支払うことが可能である.
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
この連携に関する開発費用をまとめると以下のようになる
| | | | | | | | | | | | | | | | | | | | |
| | 12月31日までの年度 |
| (単位:百万) | | 2022 | | 2021 | | 2020 |
| Sangamo共同開発総費用 | | $ | 19.1 | | | $ | 22.7 | | | $ | 10.1 | |
| Sangamo連携開発費におけるBiogenのシェアは,我々の合併損益表の研究開発費に反映されている | | 12.1 | | | 14.6 | | | 6.4 | |
Innocare Pharma Limited
2021年7月、私たちはInnoCare Pharma Limited(InnoCare)とOrelabrutinibの協力および許可協定を締結し、OrelabrutinibはOrelabrutinibさんの潜在的治療のための経口小分子Brutonチロシナーゼ阻害剤であり、現在、複数の国、プラセボ対照のRRMS第2段階試験研究が行われている。今回の協力条項によると、我々は世界(香港、マカオ、台湾を含む)以外の地域(香港、マカオ、台湾を含む)で多発性硬化症およびある自己免疫疾患領域を治療するorelabrutinibの独占的権利を有し、InnoCareは中国(香港、マカオ、台湾地区を含む)の腫瘍学およびある自己免疫疾患領域においてorelabrutinibの世界的独占的権利を保持している。
この取引は2021年8月に完了したため、私たちは#ドルを前払いした125.02021年12月31日までの年度総合損益表には研究開発費の100万ドルと記されている。InnoCareに最高約$を支払う可能性もあります812.5このような協力が特定の開発、ビジネスマイルストーン、販売ハードルを実現すれば、潜在的な開発マイルストーンと潜在的な商業支払いは100万ドルに達するだろう。また、この協力の下で開発された任意の製品の潜在的な純売上高に基づいてInnoCare等級版税を支払い、低いから高いまでの青少年パーセントを支払うことができるかもしれない。
2023年2月に私たちはMSの潜在的治療のためのオレラブチニブのInnocare。
他の研究や発見の手配は
これらの計画には、いくつかの臨床および商業開発の成果に基づいて今後数年以内に支払う記念碑的支払いが含まれる可能性がある。
他にも
2022年12月31日まで,2021年と2020年12月31日までに約 $39.2百万, $89.1百万ドルとドル92.1私たちの統合報告書の研究と開発費として百万ドルです他の研究と発見に関連した計画に関する収入
サムスン生物科技有限公司
合弁企業協定
2012年2月、私たちはサムスン生物会社と合弁協定を締結し、Samsung Bioepisという実体を設立し、生物類似製品を開発、製造、販売した。サムスンバイオ製薬会社の貢献280.510億ウォン(約1ドル)250.0百万ドル)85.0サムスンBioepisの%株を持っていて、私たちは貢献しました49.510億ウォン(約1ドル)45.0100万ドルの残りは15.0%の所有権です。2018年6月、私たちは合弁協定に従って私たちの選択権を行使し、Samsung Bioepisにおける私たちの持株比率を約5.0これは以前参加していなかった株式融資の影響を反映しています49.9%です。株式購入取引は2018年11月に完了し、取引が完了した後、私たちは支払いました759.510億ウォン(1ドル)676.6サムスンバイオ製薬を買収しました
2022年4月に私たちは49.9Samsung Bioepisにおける持分はSamsung Biologicsである。この取引の条項によると、約$を受け取りました1.0取引完了時に10億ドルの現金を獲得し、約10億ドルを獲得する予定です1.310億ドルの現金は2回の支払いで延期され、金額は約$です812.5100万ドル満期1年で約100万ドルです437.5百万ドルは、この取引が完了して二周年に満期になります。
この取引の一部として、私たちには最高$を得る資格があります50.0いくつかのビジネスマイルストーンを達成した上で、100万ドルの収入を得た私たちのこのような性質または支払いに対する政策は、支払いが現金化可能な間に支払いを確認することであり、これは通常、支払いを受ける期間と同じである。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
今回の売却に先立ち,実体業績が利用可能な場合に延滞金の4分の1を計算し,我々の総合収益表に被投資者(収入)損失における権益,減税後の純額を反映したSamsung Bioepisへの投資に関する運営結果シェアを権益法により確認した。
2018年11月の投資では、資本会計方法は、投資の公正価値と被投資者基礎純資産における当社の資本の帳簿価値との差額を識別して分配することを要求しています。上述したように、これらの基差は、2022年4月に販売が完了するまで、その経済寿命内に償却される。総ベース差は約#ドル675.0600万ドルは、在庫、開発された技術、知的財産権の研究開発、繰延税金残高と関係がある。在庫に関する基礎差はその推定耐用年数内に税額を差し引いて償却します1.5年、市場製品の既開発技術と知的財産権の研究開発に関する基礎差額はその推定使用年限内に税項を差し引いて償却する15何年もです。
2022年12月31日までの年間で、私たちの投資純収益は2.6百万ドルは、サムスンBioepisの営業利益における私たちのシェアを反映しています。税収を差し引いて、合計$です17.0100万ドルは償却されたドルの合計#ドルで相殺された14.4百万ドルです。この金額は、業績が4分の1滞納であることが確認されたため、Samsung Bioepisを販売する前の業績シェアを反映している。Samsung Bioepisを売却した後,Samsung Bioepisの運営結果や基差に関する償却に関する収益や損失は確認されなくなった。
2021年12月31日までの年間で、私たちの投資純収益は34.9百万ドルは、サムスンBioepisの営業利益における私たちのシェアを反映しています。税収を差し引いて、合計$です64.6100万ドルは償却されたドルの合計#ドルで相殺された29.7百万ドルです。
2021年12月31日までの1年間の投資純収益は31.2サムスンBioepisに関連する繰延税金資産の推定手当に関する100万福祉の放出。推定手当は、プラスとマイナスの証拠(サムスンBioepisの歴史的収益を含む)を考慮して2021年第2四半期に発表された。
2021年12月31日まで、サムスンBioepisにおける投資帳簿価値の合計713.310億ウォン(1ドル)599.9百万ドル)、それは私たちの総合貸借対照表における投資と他の資産の構成要素に分類される。サムスンBioepisの売却と関連して、私たちが投資した帳簿価値はゼロに低下した。
Samsung Bioepisでの株式売却に関するもっと多くの情報を読んでください付記3、処置これらの連結財務諸表まで。
2019年開発と商業化協定
2019年12月、サムスンBioepisとの取引を完了し、商業化の独占的権利を獲得しました二つ潜在的な眼科生物類似製品、BYOOVIZ(ranibizumab-Nina)、Lucentisを参照したranibizumab生物類似製品、およびSB 15、提案された自由cept生物類似製品、EYLEAを参照して、世界の主要な市場で、アメリカ、カナダ、ヨーロッパ、日本とオーストラリアを含む。サムスン生物は開発を担当して、あらかじめ指定された毛利率でこの2種類の製品を提供してくれます45.0%.
この取引について、私たちは#ドルを前払いしました100.02020年1月にサムスンBioepisに100万ドルを支払いました63.0100万ドルは2019年の総合損益表に研究開発費と37.0100万ドルは無形資産として記録され、2019年には純額が私たちの連結貸借対照表に計上された
2020年第3四半期にサムスンBioepisに1ドルを支払いました15.0百万ドルの発展マイルストーンは、私たちの総合損益表に研究開発費を計上した。2021年第3四半期には15.0米国、EU、イギリスのBYOOVIZ承認に関する記念碑的支払い100万ドルは、無形資産に資本化され、我々の総合貸借対照表に純計上されている。サムスンBioepisに約$を支払う可能性もあります180.0追加的な開発、規制、そして販売ベースのマイルストーンのために百万ドルが使用される。
2013年のBenepali、IMRALDI、FLIXABIビジネス協定の期間をさらに延長するオプションを獲得しました5年しかし、オプション使用料$を支払う必要があります60.0100万ドルで、中国でこれらの製品を商業化する独占権利の選択権を獲得した
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
2013年ビジネス協定
2013年12月にサムスンBioepisと合意しました10年間ヨーロッパと日本のBenepaliの場合,3つの抗腫瘍壊死因子(TNF)生物類似候補品である。以上のように,我々は本プロトコルをもう一度延長する権利がある5年それは.この合意によると、私たちは合計1ドルの臨床開発マイルストーンを前払いしました46.0100万ドル、これは私たちの総合損益表に研究開発費として記載されています。関連するプロジェクトは規制部門の承認を得ていないからです。追加の記念碑的支払いにも同意しました25.0EU監督部門が3種類の抗腫瘍壊死因子生物類似候補製品を許可した後、各製品は100万ユーロに達する。IMRALDI、HUMIRAを参照するadalimumab生物類似体、FLIXABI、Remicadeを参照するインフリキシマブ生物類似体、およびBenepali、ENBRELを参照するetanercept生物類似体、それぞれ2017年8月、2016年5月と2016年1月にEUの監督管理許可を得て、著者らは関連するマイルストーン支払い総額を合計$に資本化する75.0百万ドルは無形資産として、純額は私たちの総合貸借対照表に計上されている。
Benepali,IMRALDI,FLIXABIが第三者に販売する収入を我々の総合収益表の製品収入純額に反映させ,これらのコストが発生した場合に収益および販売とマーケティング費用に関するコストを我々の総合収益表に記録する.エバーヴィ社に支払う特許権使用料はIMRALDI社を販売する際に我々の総合損益表の販売コストで確認します。
私たちは共有します50.0我々のSamsung Bioepisのビジネスプロトコルに関する利益または損失の%は,我々の総合損益表における連携利益(損失)分担で確認された.2022年,2021年および2020年12月31日までに,純利益を支出に分けることを確認したf $217.4百万, $285.4百万ドルとドル266.5サムスンBioepisを反映した100万ドルです50.0共同純利益の%を共有します
その他のサービス
Samsung Bioepisを設立すると同時に、私たちはSamsung Bioepisと許可協定を締結した
ライセンス契約によると、我々はSamsung Bioepisに独占許可を与え、その使用、開発、製造、商業化を許可し、サムスンBioepisはBiogen製品に固有の技術を使用して作られた生物類似製品を使用することを許可した。交換として,サムスンBioepisが開発·商業化した生物類似製品から1桁の印税を得た。
2022年、2021年、2020年12月31日までの年間で、私たちはエド$20.6百万、$20.7百万ドルとドル20.9許可された印税収入はそれぞれ百万ドルです合意は、私たちの総合損益表の他の収入の構成要素だ
議論された合意に関連したサムスン生物科学技術の受取金イヴは$2.0百万aND$4.1それぞれ2022年12月31日と2021年12月31日まで。Samsung Bioepisに支払われた上記の合意に関する金額Re$40.5百万ドルとd $148.7それぞれ2022年12月31日と2021年12月31日まで。
合併可変利子実体
私たちの連結財務諸表は可変利息実体の財務結果を含み、私たちはこれらの実体の主な受益者です。以下は私たちの重要な可変利益実体だ。
神経免疫SubOne社は
我々は,アルツハイマー病の潜在的治療のための抗体を開発し,ADUHELM(改訂された神経免疫プロトコル)を含む神経免疫会社と協力·許可協定を締結した。私たちはすべての協力製品の開発、製造、そして商業化を担当している。神経免疫プロトコルは、許可製品に関連するいくつかの特許の長い期間内に有効であるか、または12ライセンス製品の最初の商業販売から数年
私たちは神経免疫の主要な受益者であることを確認したので、私たちは協力を通じて実体経済表現に最も影響を与える活動を指導する能力があり、私たちは100.0連携を支援するための研究開発コストの%である.私たちの特許使用料は
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
神経免疫プロトコルは,ADUHELM市販の印税を含め,高い1桁から10代以下である。
神経免疫プロトコルの条項によると、神経免疫に記念碑的な支払いを払わなければなりません#75.0ADUHELMの承認を得るためにFDAに規制文書を提出した後、2020年第2四半期に神経免疫会社に支払いました75.0ADUHELMの承認のためのBLAのFDAへの提出が完了した後,ADUHELMは非制御的権益による純利益(損失)の費用が確認され,我々の総合損益表から税を差し引いた。また、2020年第2四半期には、純利益共有収入が#ドルであることを確認した33.8百万反映衛材の45.0$のパーセントシェア75.0百万ドルのマイルストーン支払いは、私たちの総合損益表における協力利益(赤字)分担で確認されました。
2021年6月、ADUHELMはFDAの加速承認を得た。神経免疫プロトコルの条項によると、神経免疫に記念碑的な支払いを払わなければなりません#100.0アメリカでのADUHELMの発売に関連した100万ドルです2021年第2四半期に儲けました100.0当社の総合損益表から税額を差し引いたところ、非持株権益が純収益(損失)に占めるべき支出は百万ユーロであることが確認された。また、2021年第2四半期には、純利益共有収入が#ドルであることを確認した45.0百万反映衛材の45.0$のパーセントシェア100.0百万ドルのマイルストーン支払いは、私たちの総合損益表における協力利益(赤字)分担で確認されました。
2021年の間、私たちはスイスで約#ドルの繰延税金純資産を記録した100.0神経免疫社はADUHELMの納税ベースで100万ユーロであり,その実現はADUHELM社の将来の販売状況に依存する。2022年第1四半期にADUHELMに関する最後のNCDを発行したところ,我々が記録した推定手当は約#ドル増加した85.0100万ドルでこの繰延税金資産の純価値をゼロにします。我々の繰延税項純資産に対するこれらの調整は,非持株権益に起因する純収入(損失)に割り当てられた等額と相殺金額とともに我々の総合損益表に記録されているため,生物遺伝会社の純収入への純影響はゼロである。
神経免疫繰延税金資産の影響を除去し、神経免疫の資産と負債は著者らの総合財務状況或いは運営結果に重要ではない。契約が要求した金額を除いて、私たちは神経免疫会社に何の資金も提供していない。
我々が神経免疫会社に精算した研究と開発コストは,我々の総合損益表における研究と開発費用に反映されている。返済の金額は、2022年、2022年、2021年、2020年12月31日までの年間ではどうでもいい。
衛材との協力手配に関する他の情報は、お読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
未合併可変利子実体
私たちは様々な利益実体と関係がありますが、私たちはこれらの実体の経済的成功に大きな影響を与える活動を指導する権限がないので、これらの関係を強化していません。このような関係は特定のバイオテクノロジー会社への投資と研究協力協定を含む
2022年12月31日と2021年12月31日までに、潜在的に可変利益実体を合併していないいくつかのバイオテクノロジー会社の投資を代表する帳簿価値の合計は$である27.8百万ドルとドル24.6それぞれ100万ドルです我々のこれらの可変利益実体に関する損失の最大の開口は,我々が投資する帳簿価値に限られている.
私たちはまた、いくつかの可変利益実体と研究協力協定を締結し、いくつかの開発活動に資金を提供することを要求した。これらの開発活動は発生時に我々の総合収益表における研究と開発費用を計上している。以前の契約で要求された金額を除いて、私たちはこれらの可変利息実体に何の融資も提供していません。
私たちは現在、以下に述べる事項を含む様々なクレームと法的手続きに参加している。請求及び法的手続きに関連する会計政策については、推定及び又は事項の使用を含むものについては、参照付記1、主要会計政策の概要これらの連結財務諸表まで。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
いくつかのまたは損失については、管理層がさらなる情報を把握する前に、可能な損失または損失の範囲を推定することができず、これらの情報には、(1)どのようなクレームが(あれば)処分動議実践の中で生き残っていくか、(2)証拠提示によって得られた情報、(3)当事者の損害賠償要求および証拠に関する情報、(4)当事者の法的理論、(5)当事者の和解立場が含まれる。このとき、可能な損失または損失範囲が推定されることができる場合、以下の潜在的または損失記述に含まれる。
私たちが参加するクレームおよび法的手続きはまた、私たちの製品、パイプまたはプロセスに関連する特許の範囲、有効性または実行可能な挑戦、および他の人が保有する特許の範囲、有効性、または実行可能な挑戦を含む。その中には第三者が私たちが彼らの特許を侵害したと主張することが含まれている。これらの訴訟のいずれの不利な結果も、(I)特許保護を失うこと、(Ii)特定の活動を継続することができないこと、および(Iii)重大な損害賠償、使用料、罰金、および/または許可料を第三者に支払うことのうちの1つまたは複数をもたらす可能性がある。
あるいは損失がある
ADUHELM証券訴訟
株主が2020年11月(2020年11月の証券訴訟)と2022年2月(2022年2月の証券訴訟)に提起した訴訟では、我々および一部の現職·前任幹部が被告とされ、米国マサチューセッツ州地方裁判所で議決された。これらの訴訟は,米国連邦法典第15編78 j(B)節と78 t(A)節および第17 C.F.R.第240.10 b-5節に規定されている連邦証券法に違反しており,これらの訴訟を集団訴訟と金銭救済として宣言することを求めている.2022年9月、裁判所は2020年11月の証券訴訟を却下し、原告は米国第一巡回控訴裁判所に上訴した。2022年2月の証券訴訟を却下する動議について私たちは審理中だ。
株主派生訴訟
私たちと取締役会のメンバーは、2022年2月9日と7月21日に米マサチューセッツ州地方裁判所で提起されたデリバティブ訴訟の被告に株主に指定された。訴訟は、米国法第15編第78 n(A)節及び第17編連邦証券法第240節第14.A-9節に規定された連邦証券法違反、受託責任及び会社資産の浪費を告発し、宣言性と禁止救済、生物遺伝会社への金銭救済及び原告への弁護士費及び費用を求める。裁判所はこの2つの事件を棚上げにした.
IMRALDI特許訴訟
2018年9月、Fresenius Kabi Deutschland GmbH(Fresenius Kabi)は、パリ高裁でBiogen France SASに対する損害賠償および禁止救済訴訟を提起し、デュッセルドルフ地方裁判所でBiogen GmbHに対する訴訟を提起した。2022年6月、Fresenius Kabiは、欧州特許3 145 488(EP‘510特許)の国同業者を侵害したとして、Fresenius Kabiがこの2つの訴訟を修正した。2022年6月、Fresenius Kabiは、欧州特許3 145 488(EP’488特許)による特許請求権要件を主張するためにこの2つの訴訟を修正した。
2022年6月、欧州特許庁(EPO)技術控訴委員会(TBA)は、EP‘510特許の下ですべての未解決の侵害請求を解決するEP’510特許の撤回を確認した。欧州特許庁は2022年10月にEP‘488特許の有効性を維持した。
2020年6月、フェゼンユス·カービーはデンマーク海事·商業高等裁判所で予備禁止手続きを開始し、IMRALDIがEP‘488特許を侵害したデンマーク対応製品と対応するデンマーク実用新案DK 2020 00038 Y 3を主張した。2021年9月、裁判所はフェゼンユス·カービーの予備禁止請求を却下し、フェゼンユス·カービーは控訴を撤回した。
2019年7月、Gedeon Richter Nyrtはデュッセルドルフ地域裁判所でBiogen GmbHに対して損害賠償と禁止救済訴訟を提起し、2035年10月に満了した欧州特許番号3 212 667(EP‘667特許)のドイツ対応特許を侵害したことを告発した。この事件は保留され、Gedeon RichterがTBAに控訴するのを待っている。TBAは2023年7月に公聴会が開催された。
2020年11月、Gedeon Richter Nyrtはデュッセルドルフ地区裁判所でBiogen GmbHに対して訴訟を提起し、EP‘667規格に適合するドイツの実用新案を侵害したと告発した。この訴訟は保留され、Biogenがドイツ特許商標局に実用新案の取り消しを提出するのを待って、公聴会は2023年3月に開催される予定である。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
元株主とのトラブル
2015年、BiogenはイギリスのConveriseを買収した。2019年11月と12月、株主代表サービス有限責任会社はConveriseの前株主を代表して#ドルのクレームを主張する手紙を送ってくれました200.0私たちのConversion買収契約違反の疑いで100万ドルの罰金を科された。私たちはこのような言い方に異議を提起する。
ERISA集団訴訟
2020年9月、米国マサチューセッツ州地方裁判所は生物遺伝401(K)貯蓄計画参加者が2020年7月と8月に私たちに提起した2つの事件を合併し、ERISA規定の受託責任に違反したことを告発した。原告は訴訟を集団訴訟や金銭その他の救済として宣言することを求めた。
人間的な患者が訴訟に協力する
2021年9月、Humana Inc.(Humana)は米国マサチューセッツ州地方裁判所で、多発性硬化症患者に無料の薬物を提供し、多発性硬化症患者を支援する非営利団体への慈善寄付による損害を告発する訴訟を起こした。Humanaは連邦RICO法案と州法に違反したと告発し、法定の3倍の損害賠償、弁護士費、費用を要求した。私たちはまだ審理中の却下動議を提出した。
総代理店の件
2022年12月、私たちは中東および北アフリカの多くの国の生物遺伝製品流通業者との流通協定を終了した。この前のディーラーは契約違反だと主張した。今のところ誰も訴訟を提起していない。
その他の事項
政府調査
同社は米国証券取引委員会(Securities And Exchange Commission)から伝票を受け取り,医療サイトやADUHELMの承認を含むADUHELMに関する情報の提供を求めている。2021年,米国衆議院監督·改革委員会,エネルギー委員会(House Committee),監察長室(OIG)はそれぞれADUHELMに関する調査を発表した。2022年12月、衆議院委員会は調査報告書を発表した。
Tysabri特許について
2022年9月、我々は“生物製品価格競争と革新法”(“米国法典”第42編262節)に基づいて米国デラウェア州地域裁判所に訴訟を提起し、Sandoz Inc.とPolPharma Biologics S.A.を起訴し、特許侵害に対する宣言的判決を求めた。裁判日はまだ確定していない。
2022年12月、TBAは、Natalizumab(Tysabri)を使用する患者の治療前試験をカバーするために、我々の欧州特許2 676 967(EP‘967特許)が撤回されたことを確認した。
2021年9月、PolPharma Biologics S.A.,Sandoz AG、Sandoz Limited、およびSandoz GmbHはEP‘967特許のイギリス対応特許の撤回を要求するためにイギリス高裁に訴訟を起こした。裁判日はまだ確定していない。
欧州連合総裁判所Tecfideraの廃止手続きについて
製薬会社PolPharma SA(PolPharma)とMylanアイルランド有限会社(Mylanアイルランド)はそれぞれEU総裁判所(PolPharmaが2018年10月とMylanアイルランドで2020年11月に)に訴訟を提起し、Tecfideraが規制データ保護から利益を得ているため、欧州医薬品局(EMA)がその模倣薬Tecfideraの販売申請の決定を検証しないことを要求した。2021年5月5日、欧州一般裁判所は、PolPharmaに関する欧州医薬品局の不検証決定を無効と発表した。欧州裁判所は2023年3月16日に私たちのこの決定に対する控訴決定を発表するだろう。ミロン·アイルランドが提起した事件は保留された。
製品責任とその他の法的手続き
私たちはまた製品責任クレームと他の法律手続きに参加しています。これらの手続きは通常私たちの正常な業務活動に付随しています。いずれの訴訟の結果も正確には予測できないが,我々は考えない
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
このような既存の問題の最終的な解決は私たちの業務や財務状況に大きな悪影響を及ぼすだろう。
特許権使用料支払い
T@@ ys@@ ab@@ ri
2013年、私たちはElanからTysabriが所有または制御していない残りの権利のすべての所有権を取得した。買収協定によると,Elan ofに支払う義務がある18.0毎年世界の商業純売上高は最高です2.010億ドルです25.0世界の商業年間純売上高はドルの%を超えています2.0十億ドルです。Elanと他の第三者に支払われた特許権使用料は,我々の総合損益表で販売コストであることを確認した.Elanは2013年12月にPerrigo Company plc(Perrigo)に買収され、Perrigoはその後、これらの権利を第三者に売却し、2017年1月から発効した。
SPINRAZA
2016年には、IONISからSPINRAZAを開発し、商業化する選択権を行使した。Ionisとの合意に基づき、SPINRAZA年度のグローバル商業純売上高の特許権使用料をIonisに支払い、使用料率は11.0%和15.0%は、当社の総合損益表に販売コストと記載されています。Ionisとの協力に関するより多くの情報をお読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
虚栄心
Alkermesとの合意によると、VUMERITYのグローバル商業純売上高に基づいてAlkermesに特許使用料を支払い、使用料率は15.0%は、当社の総合損益表に販売コストと記載されています。場合によっては、VUMERITYの商業販売純額に対して支払われるべき特許権使用料は、一定期間内に等級別の最低年次支払い要件を遵守しなければならない5年FDAの承認後に。Alkermesと協力して手配したもっと多くの情報について、お読みください備考19:連携関係とその他の関係これらの連結財務諸表まで。
監督管理と商業マイルストーン支払い
2022年12月31日までの発展計画によると、将来的に約ドルまでの潜在的なマイルストーン支払いを第三者に支払うことをトリガするかもしれません9.3約10億ドルを含みます2.010億ドルの発展の一里塚で約10億ドルです0.510億ドルの規制マイルストーンと約6.8数十億ドルのビジネスマイルストーンは、私たちの様々な協力の一部として、許可と開発計画を含む。これらのプロトコルの下での支払いは、一般に、いくつかの開発、管理、またはビジネスマイルストーンに達したときに満了し、支払われる。2022年12月31日現在、これらのマイルストーンの実現は不可能と考えられているため、私たちの財務諸表にはこのような事項や事項は記録されていません。いくつかの開発、規制、または商業マイルストーンの成功達成に依存するので、マイルストーン支払いに関連する金額は契約債務とみなされない
いくつかの臨床とビジネスのマイルストーンに達すると、私たちは高い$を支払うかもしれません356.2私たちの現在の合意によると、2023年には100万個のマイルストーンに達するだろう。これには総額#ドルのマイルストーンが含まれている225.0MDDとPPDの治療のためのZuranoloneを米国で初めて商業販売したところ、Sageは100万ドルを獲得した。
2020年第2四半期に神経免疫会社に支払いました75.0ADUHELMの承認のためのBLAのFDAへの提出が完了した後,ADUHELMは非制御的権益による純利益(損失)の費用が確認され,我々の総合損益表から税を差し引いた。
2021年6月、ADUHELMはFDAの加速承認を得た。神経免疫プロトコルの条項によると、神経免疫に記念碑的な支払いを払わなければなりません#100.0アメリカでのADUHELMの発売に関連した100万ドルです2021年第2四半期に儲けました100.0当社の総合損益表から税額を差し引いたところ、非持株権益が純収益(損失)に占めるべき支出は百万ユーロであることが確認された。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
他の出資約束
2022年12月31日現在,われわれは異なる臨床試験段階でいくつかの臨床研究を行っている。私たちの最も重要な臨床試験支出はCROだ。CROとの契約は通常、私たちの選択の下でキャンセルし、別途通知することができます。私たちは約$の課税費用を記録した20.42022年12月31日現在、私たちの合併貸借対照表のうち100万ドルがCROの支出に使われています。私たちは約$を持っている929.02022年12月31日現在、既存のCRO契約に基づくキャンセル可能な将来の約束は100万ドルに達している。
税収に関する義務
私たちはそれぞれの税務機関との現金決済期間を確実に見積もることができないので、不確定税務状況に関する負債を私たちの契約債務要約から除外します。2022年12月31日までに154.6不確実な税金状況に関連した負債は数百万ドルに達する。
2022年12月31日と2021年12月31日現在、私たちの所得税負債は約$です558.0百万ドルとドル633.0過渡的通行料税によると、それぞれ100万ドルです。2022年12月31日までの課税額のうち、約$137.81年以内に100万ドルを支払う予定です。過渡的通行税は2018年から8年以内に分期納付され、利息は発生しない。過渡的使用費税のその他の資料については、ご参照ください付記17,所得税これらの連結財務諸表まで。
2022年12月31日と2021年12月31日まで、私たちは大きな保証負債記録を持っていません。
私たちは正常な業務過程で他社との合意に基づいて賠償条項を締結し、通常は業務パートナー、請負業者、臨床サイトと顧客とです。これらの規定により、私たちは一般的に補償を受けた側が私たちの活動によって被ったり招いた損失について、補償を受けた側に賠償し、損害を受けないようにします。このような補償条項は一般的に基礎協定の終了後も有効だ。このような補償条項によると、私たちが未来に支払わなければならない最大の潜在的な金額は無限だ。しかし、これまで、私たちは訴訟を弁護したり、これらの賠償条項に関連したクレームを解決するための物質的コストは発生していません。したがって、このような合意の推定された公正な価値はわずかだ。したがって、私たちは2022年12月31日と2021年12月31日まで、このような合意の負債を記録していない。
私たちは様々な退職と年金計画を支援する。私たちは、計画資産の予想収益率と将来の福祉を割引するための金利を含む、これらの計画の負債と費用の推定にいくつかの仮定を入れた。
401(K)貯蓄計画
アメリカのほとんどの年齢が30歳を超える正社員に適用される401(K)貯蓄計画を維持しています21それは.参加者は自発的に寄付することができる。我々は401(K)貯蓄計画のマッチング式に基づいて入金を行った。一致したすべての寄付金と参加者の寄付は直ちに授与される。401(K)貯蓄計画はまた、以前生物遺伝会社退職計画に参加していた参加者を代表して、いくつかの移行入金を持っている。私たちの401(K)貯蓄計画に関連する費用は主に私たちの相応の支払いで構成されています。
我々の401(K)貯蓄計画に関する費用の合計は約$である56.0百万、$58.4百万ドルとドル44.32022年12月31日まで、2021年、2020年12月31日までの年度はそれぞれ100万ドル。
給与繰延計画
私たちは、米国で選択された管理従業員たちの一部の給与の支払いを延期することを可能にする、いわゆる補充貯蓄計画(SSP)の制限されない繰延給与計画を維持している。SSPはまた、会社が支払った高給のアメリカ人従業員に何らかのポイントを提供している。これらのポイントは復元試合と呼ばれる。繰延給与金額は稼ぐときに計算しなければならない。SSPのルールにより,この繰延賠償金は現金形式で割り当てることができる.2022年12月31日と2021年12月31日までの繰延補償金額は合計約#ドルとなる131.9百万ドルとドル131.4百万ドル、私たちの総合貸借対照表の他の長期負債に計上されます。SSPは以前Biogen,Inc.退職に参加した参加者を代表していくつかの移行寄付金を持っています
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
計画してみます。復興試合と参加者の寄付はすぐに受賞するだろう。参加者への割り当ては一度に支払うこともできますし、参加者が年分割払いを選択することもできます。
年金計画
私たちの退職福祉計画には、スイスやドイツの付属会社の従業員のための固定福祉計画と、私たちが存在する他の国/地域の他の些細な固定福祉計画を維持運営していることが含まれています。
私たちのスイス計画は政府が規定した退職基金で、従業員に最低投資収益を提供する。最低投資収益はスイス政府によって毎年決定されています2.00% in 2022 and 1.002021年と2020年の両方とも2%だ。スイスの計画によると、私たちと私たちの従業員のいくつかの年収は、政府が確定した金額を超えて、独立投資受託者が管理する基金に入金しなければならない。雇用主が支払う金額は少なくとも従業員の支払いに等しくなければならない。従業員の最低支払いはそれぞれの従業員の年齢、給料、性別に基づいている。スイスで計画されている無資金純年金義務は、2022年12月31日と2021年12月31日までに1ドルである49.9百万ドルとドル64.1それぞれ100万ドルと計画資産総額は193.7百万ドルとドル200.1それぞれ100万ドルです2022年、2021年、2020年に、純支出総額は20.0百万、$21.5百万ドルとドル15.5それぞれ100万ドルですスイスの計画と関係があります5.3百万、$3.5百万ドルとドル2.6100万ドルはそれぞれその他の支出に計上されており,我々の総合損益表では純額である。
ドイツで計画された債務は資金がなく、総額は#ドルだ40.9百万ドルとドル68.4それぞれ2022年12月31日と2021年12月31日まで。ドイツ計画に関連する定期純年金コストの合計は#ドルである5.9百万、$7.6百万ドルとドル6.22022年12月31日、2021年12月31日、2020年12月31日終了年度はそれぞれ百万ドルである1.8百万、$2.1百万ドルとドル2.0100万ドルはそれぞれその他の支出に計上されており,我々の総合損益表では純額である。
私たちの運営方法は1つは運営部門は、深刻な神経と神経変性疾患を有する患者及び関連治療近隣患者の発見、開発と世界的な革新療法の提供に集中している。私たちのCEOは経営意思決定者として、会社全体に基づいて会社の運営に資源を管理·分配しています。我々の研究開発機関は新たな候補製品の研究と発見を担当し、将来の潜在製品の開発と登録を支援する。私たちの製薬、運営と技術組織は製造プロセス、臨床試験供給、商業製品供給、流通、建築と施設の開発を管理しています。私たちの商業機関はアメリカと国際での私たちの商業製品の開発を担当しています。同社はまた、会社の従業員の機能の支援を受けている。会社全体の基礎の上で資源を管理と分配し、私たちの最高経営責任者が利用可能な資源の全体レベルを評価することができ、そしてどのようにわが社の長期戦略目標に符合する機能、治療領域と研究開発プロジェクトにこれらの資源を最適に配置することができる。この決定過程と一致して、私たちの最高経営責任者は合併した単一部門の財務情報を使用して業績を評価し、将来の財務結果を予測し、資源を分配し、激励目標を設定する。
地理的地域別に記載された製品収入、その他の収入、および長期資産の企業範囲は以下のように開示される。収入は主に顧客または被許可者の位置に応じて各国/地域に分配される。
カタログ表
生物遺伝会社そして付属会社
連結財務諸表付記−(続)
地理情報
次の表には、地理的地域別のいくつかの財務情報が含まれています
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| | 2022年12月31日 |
| (単位:百万) | | アメリカです。 | | ヨーロッパ.ヨーロッパ(1) | | ドイツ | | アジア | | 他にも | | 合計する |
| 外部顧客からの製品収入 | | $ | 3,469.3 | | | $ | 2,401.3 | | | $ | 926.2 | | | $ | 672.1 | | | $ | 518.9 | | | $ | 7,987.8 | |
| 抗CD 20治療プロジェクトの収入 | | 1,636.4 | | | 0.1 | | | — | | | — | | | 64.0 | | | 1,700.5 | |
| 外部顧客からの他の収入 | | 425.8 | | | 11.7 | | | — | | | 47.6 | | | — | | | 485.1 | |
| 長寿資産 | | 1,369.4 | | | 2,275.8 | | | 21.0 | | | 13.7 | | | 22.6 | | | 3,702.5 | |
| | | | | | | | | | | | |
| | 2021年12月31日 |
| (単位:百万) | | アメリカです。 | | ヨーロッパ.ヨーロッパ(1) | | ドイツ | | アジア | | 他にも | | 合計する |
| 外部顧客からの製品収入 | | $ | 3,805.7 | | | $ | 2,626.0 | | | $ | 1,162.4 | | | $ | 688.0 | | | $ | 564.8 | | | $ | 8,846.9 | |
| 抗CD 20治療プロジェクトの収入 | | 1,596.7 | | | — | | | — | | | — | | | 61.8 | | | 1,658.5 | |
| 外部顧客からの他の収入 | | 429.9 | | | 9.7 | | | — | | | 36.7 | | | — | | | 476.3 | |
| 長寿資産 | | 1,390.5 | | | 2,337.8 | | | 25.4 | | | 16.4 | | | 21.7 | | | 3,791.8 | |
| | | | | | | | | | | | |
| | 2020年12月31日 |
| (単位:百万) | | アメリカです。 | | ヨーロッパ.ヨーロッパ(1) | | ドイツ | | アジア | | 他にも | | 合計する |
| 外部顧客からの製品収入 | | $ | 5,900.1 | | | $ | 2,495.3 | | | $ | 1,161.1 | | | $ | 596.7 | | | $ | 539.0 | | | $ | 10,692.2 | |
| 抗CD 20治療プロジェクトの収入 | | 1,897.4 | | | 0.1 | | | — | | | — | | | 80.3 | | | 1,977.8 | |
| 外部顧客からの他の収入 | | 733.6 | | | 8.0 | | | 0.1 | | | 32.9 | | | — | | | 774.6 | |
| 長寿資産 | | 1,496.3 | | | 2,290.2 | | | 31.2 | | | 16.2 | | | 10.9 | | | 3,844.8 | |
(1)ヨーロッパに関連した金額からドイツに起因する金額を引くことを表す。
長寿資産
2022年12月31日2021年2020年までに2,198.5百万、$2,237.0百万ドルとドル2,180.6私たちの長期資産のうち、それぞれ100万ドルはスイスのソローザンヌの大型生物製品製造工場の建設と関係がある。
Solothurnメーカーについてもっと情報を読んでください11、財産、工場、設備、これらの連結財務諸表。
独立公認会計士事務所報告
Biogen Inc.取締役会と株主へ
財務諸表と財務報告の内部統制に関するいくつかの見方
Biogen Inc.とその子会社(“貴社”)の2022年12月31日と2021年12月31日までの総合貸借対照表、および2022年12月31日現在の3年度に関する総合収益表、全面収益表、権益表、キャッシュフロー表(総称して“総合財務諸表”と呼ぶ)を監査した。テレデビル委員会(COSO)協賛組織委員会が発表した“内部統制-総合枠組み(2013)”で確立された基準に基づき、2022年12月31日までの財務報告内部統制を監査した。
上記の総合財務諸表は、米国公認の会計原則に従って、当社の2022年12月31日および2021年12月31日までの財務状況、および2022年12月31日までの3年度の経営実績およびキャッシュフローを各重大な面で公平に反映していると考えられる。また、COSOが発表した“内部統制-総合枠組み(2013)”で確立された基準によると、2022年12月31日現在、会社はすべての実質的な面で財務報告に対して有効な内部統制を維持していると考えられる。
意見の基礎
当社経営陣は、このような総合財務諸表の作成、有効な財務報告内部統制の維持、財務報告内部統制の有効性の評価を担当しており、9 A項の経営陣の財務報告内部統制年次報告書に含まれている。私たちの責任は、私たちの監査に基づいて、会社の合併財務諸表と会社が財務報告の内部統制に対して意見を述べることです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、連結財務諸表に重大なミスがないかどうか、エラーによるものであっても詐欺であっても、すべての重大な点で財務報告に対する有効な内部統制が維持されているかどうかを決定するために、合理的な保証を得るために監査を計画し、実行することを要求する。
我々の連結財務諸表の監査には、連結財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであっても詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれる。これらの手続きは、連結財務諸表中の金額および開示に関する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、合併財務諸表の全体列報の評価も含まれています。我々の財務報告の内部統制の監査には、財務報告の内部統制を理解すること、重大な弱点があるリスクを評価すること、評価されたリスクテストに基づいて内部統制の設計と運営有効性を評価することが含まれる。私たちの監査はまた、私たちがこのような状況で必要だと思う他の手続きを実行することを含む。私たちは私たちの監査が私たちの意見に合理的な基礎を提供すると信じている。
財務報告の内部統制の定義と限界
会社の財務報告に対する内部統制は、公認された会計原則に基づいて、財務報告の信頼性と外部目的の財務諸表の作成に合理的な保証を提供することを目的としたプログラムである。会社の財務報告に対する内部統制は、(1)合理的で詳細かつ正確かつ公平に会社の資産を反映した取引および処分の記録を維持することに関連している、(2)公認された会計原則に従って財務諸表を作成するために取引が必要とされている合理的な保証を提供し、会社の収入および支出は会社の経営陣および取締役の許可のみに基づいて行われる、という政策と手続きを含む。および(Iii)財務諸表に重大な影響を与える可能性のある不正買収、使用または処分会社の資産を防止またはタイムリーに発見することについて合理的な保証を提供する。
その固有の限界のため、財務報告書の内部統制は誤った陳述を防止したり発見できない可能性がある。また,将来的にどのような有効性評価を行うかの予測は,条件の変化により制御不足のリスクが生じる可能性があり,あるいは政策やプログラムの遵守度が悪化する可能性がある.
重要な監査事項
以下に述べる重要な監査事項は、監査委員会に監査委員会に伝達または要求を伝達することを指し、(I)総合財務諸表に対して重大な意義を有する勘定または開示に関連し、(Ii)私たちが特に挑戦的、主観的または複雑な判断を有する当期総合財務諸表監査によって生じる事項に関するものである。重要監査事項の伝達は、総合財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、以下の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
医療補助と管理型医療リベート準備金
連結財務諸表付記1及び付記5に記載されているように、同社は、医療補助及び管理保健リベートを含む準備金控除後の製品販売収入を確認している。課税費用やその他の費用のうち、2022年12月31日現在の契約調整総額は8.681億ドル。この残高の一部には米国の医療補助と医療税還付管理の支出が含まれている。医療補助リベートは,会社が既定の精算手配による各州への推定義務と関係がある。同社の医療補助金に対する払い戻しの負債には、1つの州が本四半期に提出するクレームの推定、推定された請求書を受け取っていない前の四半期のクレーム、前の四半期に支払われていないクレームに対する受信した領収書、および期末流通ルートに存在する在庫に対して提出される潜在的なクレームの推定が含まれる。管理式看護リベートは会社の第三者(主に薬局福祉マネージャー)に対する推定債務を代表する。これらのリベートは、業績に基づく目標、規定された立場、値上げ制限手当(価格保護)から来ている。これらのリベートの課税費用の計算は,カバー範囲パターンの推定と,それによる同期内で稼いだ適用契約リベート比率に基づいている.医療補助·管理式医療のリベート項目は,関連収入を確認しながら計上し,製品収入の減少を招き,計上すべき費用や他の流動負債の負債を作成した。医療補助と管理保健評価は、歴史的経験、現在の契約と法律要求、特定の既知の市場イベントと傾向、業界データ、および予測された顧客購入と支払いモードを反映する。
医療補助準備金と介護リベートの管理に関連する手続きを実行することは重要な監査事項の主要な考慮要素であることを確定し、これらの準備金の開発は重大な計量不確定性に関連しているため、管理層は重大な判断を下した。準備金は歴史経験、現在の契約要求、特定の既知の市場事件と支払いモードに基づいて制定された仮定に基づいているため、これは逆に監査人がアプリケーションとこれらの仮定に関連する監査証拠を評価する上で高度な判断、主観的、努力を招いた。
この問題を処理することは、統合財務諸表に対する私たちの全体的な意見を形成するための実行手順および評価監査証拠に関するものである。これらのプログラムには,医療補助や医療リベート準備金の管理に関する制御措置の有効性をテストすることが含まれており,これらの医療補助を推定し,医療リベート準備金を管理するための仮定を制御することも含まれている。これらのプログラムは、(I)製品需要に関する第三者データ、価格変化に関するデータ、具体的な返却計画の条項、実際の返却点クレームの歴史的傾向、および契約要求変化および市場イベントの考慮を利用して、医療補助および管理看護返却準備金を独立的に推定するステップと、(Ii)独立推定を管理層の推定と比較するステップと、(Iii)会社の返却合意の契約条項との整合性を評価することを含む会社の支払いの戻り点クレームをテストするステップと、をさらに含む。
/s/普華永道会計士事務所
ボストン、マサチューセッツ州
2023年2月15日
2003年以来、当社の監査役を務めてきました。