カタログ表
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
表格10-Q
x 1934年“証券取引法”第13又は15(D)節に規定された四半期報告
2022年11月30日までの四半期報告
あるいは…。
o1934年“証券取引法”第13又は15(D)節に提出された移行報告書
_から_への過渡期.
委員会ファイル番号:000-52403
CNBX製薬 Inc.
(登録者の正確な氏名はその定款に記載)
|
(明またはその他の司法管轄権 会社や組織) |
(税務署雇用主身分証明書番号) | |
|
#3ベセスタ地下鉄センター ベセスタ |
||
| (主にオフィスアドレスを実行) | (郵便番号) |
(877)
(登録者の電話番号、 市外局番を含む)
同法第12条(B)に基づいて登録された証券:
| クラスごとのタイトル | 取引記号 | 登録された各取引所の名称 | ||
| 適用されない | 適用されない | 適用されない |
第12条(G)に基づいて登録された証券:
普通株、額面0.0001ドル
(クラス名)
再選択マークは、登録者が、(1)過去12ヶ月以内(または登録者がそのような報告を提出する必要があるより短い期間)に、1934年の証券取引法第13または15(D)節に提出されたすべての報告書を提出したかどうか、および(2) が過去90日以内にそのような提出要件に適合しているかどうかを示す。はい、そうですxない o
再選択マークは、登録者が過去12ヶ月以内に(または登録者がそのような文書の提出を要求されたより短い時間以内に)S−T法規(本章232.405節)規則405に従って提出を要求した各対話データファイルを電子的に提出したかどうかを示す。はい、そうですxない o
登録者 は、大型加速申告会社、加速申告会社、非加速申告会社、小さい申告会社または新興成長型会社であることを再選択マークで表す。 は、“取引法”12 b-2条のルールにおける“大型加速申告会社”、“加速申告会社”、“小さい申告会社”、“br}および”新興成長型会社“の定義を参照してください
| 大型加速ファイルサーバo | ファイルマネージャを加速するo |
| 規模の小さい報告会社 | |
| 新興成長型会社 |
もしbrが新興成長型会社である場合、登録者が延長された移行期間を使用しないことを選択したかどうかを再選択マークで示して、取引法第13(A)節に従って提供された任意の新しいまたは改正された財務会計基準を遵守してくださいo
登録者が空殻会社であるかどうかをチェックマークで表す(“取引法”第12 b-2条で定義されている)。はい、そうですo Nox
2023年1月14日まで、登録者は1,257,927株の普通株を持ち、額面は0.0001ドル。
本四半期報告で使用される用語“CNBX製薬有限会社”、“当社”、“私たち”、“私たち”はCNBX製薬有限会社とその完全子会社G.R.I.N Ultra Ltd.を指す。
CNBX製薬会社です。
表格10-Q
2022年11月30日
索引.索引
| 前向き陳述に関する注意事項 | 3 | |
| 第1部-財務情報 | 4 | |
| 第1項。 | 連結財務諸表 | 4 |
| 2022年11月30日まで(監査なし)及び2022年8月31日までの連結貸借対照表 | 4 | |
| 2022年11月30日と2022年11月30日までの3ヶ月間の総合経営報告書と全面赤字(未監査) | 5 | |
| 2022年11月30日と2022年11月30日までの3ヶ月間の株主権益(赤字)連結報告書(未監査) | 6 | |
| 2022年11月30日と2022年11月30日までの3ヶ月間合併現金フロー表(監査なし) | 7 | |
| 連結財務諸表付記(監査なし) | 8 | |
| 第二項です。 | 経営陣の財務状況と経営成果の検討と分析 | 11 |
| 第3項 | 市場リスクの定量的·定性的開示について | 31 |
| 第四項です。 | 制御とプログラム | 31 |
| 第2部-その他の情報 | 33 | |
| 第1項。 | 法律訴訟 | 33 |
| 第1 A項。 | リスク要因 | 33 |
| 第二項です。 | 最近未登録証券を売却する | 33 |
| 第六項です。 | 陳列品 | 33 |
| サイン | 34 | |
| 2 |
前向き陳述に関する警告説明
本四半期報告の表格10-Q中のいくつかの情報は、項目2“経営層の財務状況および経営結果の議論と分析”および本文の他の部分を含み、将来の事件および予想に関連するか、または関連する可能性があり、したがって、“1995年個人証券訴訟改革法案”が指す“前向きな陳述”を構成する。非歴史的陳述は、未来の業績、業績、流動性、財務状況、見通しと機会に対する私たちの現在の予想と予測を反映し、未来の事件に対する多くの仮定を含む、私たちと私たちの経営陣が現在把握している情報と、私たちの業務に影響を与える重大な要素に対する彼らの解釈に基づいている。このような前向き 陳述は、以下に関する陳述を含む:
| · | 私たちの製品の潜在市場の規模と成長、これらの市場にサービスを提供する能力 | |
| · | 私たちの支出と収入、現金資源の十分性、そして追加的な融資需要に対する私たちの期待 | |
| · | 私たちの製品が市場に受け入れられる速度と程度は | |
| · | 私たちの競争への期待は | |
| · | 私たちが期待している成長戦略は | |
| · | 私たちはキーパーソンの能力を引き付けたり維持したりします | |
| · | 私たちはパートナーシップを構築し維持する能力です | |
| · | 米国や他の国の管理動態、特に大麻法の変化と実行に関連したもの | |
| · | 私たちの製品のために知的財産権保護を獲得し維持する能力; | |
| · | 私たちの業務と私たちが経営している市場の予想された傾向と挑戦。 |
前向きな陳述は、私たちの未来の計画、戦略、および予期を仮定して説明することに関し、一般に、“可能”、“すべき”、“将”、“可能”、“予定”、“予想”、“予想”、“推定”、“信じる”、“意図する”、“求める”または“プロジェクト”、またはこれらの語の否定またはこれらの語または同様の用語の他の変形を使用することによって識別することができる。各種のリスク、不確定性とその他の要素のため、運営、見通しと機会の実際の結果、業績、流動性、財務状況と結果はこれらの 展望性陳述中の表現或いは暗示の内容と重大な違いが存在する可能性があり、甚だしきに至っては大きな差が存在する可能性がある。これらの陳述は、2022年8月31日現在のForm 10−K年次報告(2022年11月29日提出)と題する“リスク要因”と題する第br節および我々の他の公開申告文書で見つけることができる。
これらのリスクと不確実性に鑑み,特に我々の業務の草創的性質を考慮すると,本稿に含まれる前向き陳述 が確実に発生する保証はない.読者はどんな前向きな陳述にも過度に依存してはいけない。連邦証券法が明確に要求しない限り、私たちは、新しい情報、未来のイベント、状況の変化、またはどんな他の理由でも、いかなる前向きな陳述を公開更新または修正する義務を負わない。
| 3 |
第1部-財務情報
項目1.財務諸表
CNBX製薬会社です。
合併貸借対照表
| 十一月三十日 | 八月三十一日 | |||||||
| 2022 | 2022 | |||||||
| 監査を受けていない | 審査されました | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金と現金等価物 | $ | $ | ||||||
| 前払い料金とその他の売掛金 | ||||||||
| 流動資産総額 | ||||||||
| 売却可能な投資 | ||||||||
| 装置、ネットワーク | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 流動負債: | ||||||||
| 売掛金と売掛金 | $ | $ | ||||||
| 転換可能なローン | ||||||||
| 関係者の都合で | ||||||||
| 流動負債総額 | ||||||||
| 株主権益(赤字): | ||||||||
| 優先株、$額面は株式を許可して発行済みおよび発行済み株式 | ||||||||
| 普通株、$額面はライセンス株、 2022年11月30日に発行及び流通株、2022年8月31日に発行及び流通株 | ||||||||
| 追加実収資本 | ||||||||
| 株式承認証を発行する | ||||||||
| その他総合損失 | ( | ) | ( | ) | ||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益合計 | ( | ) | ( | ) | ||||
| 総負債と株主権益 | $ | $ | ||||||
連結財務諸表の付記 を参照してください。
| 4 |
CNBX製薬会社です。
合併経営報告書と全面損失
(未監査)
| 次の3か月まで | ||||||||
| 十一月三十日 | 十一月三十日 | |||||||
| 2022 | 2021 | |||||||
| 監査を受けていない | ||||||||
| 運営費用: | ||||||||
| 研究開発費 | $ | $ | ||||||
| 一般と行政費用 | ||||||||
| 総運営費 | ||||||||
| 運営損失 | ( | ) | ( | ) | ||||
| その他の収入 | ||||||||
| 財務(損失) | ( | ) | ( | ) | ||||
| 純損失 | ( | ) | ( | ) | ||||
| 売却可能資産の損失 | ( | ) | ( | ) | ||||
| 全面損失総額 | $ | ( | ) | $ | ( | ) | ||
| 1株当たりの純損失-基本と希釈後: | $ | ) | $ | ) | ||||
| 加重平均流通株数−基本と希釈− | * | |||||||
連結財務諸表の付記 を参照してください。
*2022年5月12日、同社は普通株式を1:120の割合で逆分割した。
| 5 |
CNBX製薬会社です。
株主権益合併報告書(損失)
監査を受けていない
| 普通株 株 | その他支払い済み | その他の総合 | 積算 | 株主権益合計 | ||||||||||||||||||||||||
| 株 | 金額 | 資本 | 株式承認証 | 利得 | 赤字.赤字 | (赤字) | ||||||||||||||||||||||
| 残高、 2022年8月31日 | $ | $ | $ | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||||||||||||||
| 株式ベースの支払い | – | |||||||||||||||||||||||||||
| その他総合損失 | – | ( | ) | ( | ) | |||||||||||||||||||||||
| 純損失 | – | ( | ) | ( | ) | |||||||||||||||||||||||
| 残高、 2022年11月30日 | $ | $ | $ | $ | ( | ) | $ | ( | ) | $ | ( | ) | ||||||||||||||||
| 普通株 株 | その他支払い済み | その他の総合 | 積算 | 株主権益合計 | ||||||||||||||||||||||||
| 株 | 金額 | 資本 | 株式承認証 | 利得 | 赤字.赤字 | (赤字) | ||||||||||||||||||||||
| 残高、 2021年8月31日 | * | $ | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||||
| 発行サービス普通株 | – | |||||||||||||||||||||||||||
| その他総合損失 | – | ( | ) | ( | ) | |||||||||||||||||||||||
| 純損失 | – | ( | ) | ( | ) | |||||||||||||||||||||||
| 残高、 2021年11月30日 | * | $ | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||||||
付記は財務諸表の構成要素である。
*2022年5月12日、会社は1:120の割合で普通株式を逆分割した。
| 6 |
CNBX製薬会社です。
統合現金フロー表
(未監査)
| 次の3か月まで | ||||||||
| 十一月三十日 | 十一月三十日 | |||||||
| 2022 | 2021 | |||||||
| 監査を受けていない | ||||||||
| 経営活動のキャッシュフロー: | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 純損失と経営活動で使用されている現金純額を照合するための調整: | ||||||||
| 減価償却 | ||||||||
| 転換可能な融資推定値 | ||||||||
| 株式ベースの支払い | ||||||||
| 経営性資産と負債変動状況: | ||||||||
| 売掛金と前払い費用を減らす | ||||||||
| 売掛金と売掛金を増やす(減らす) | ||||||||
| 経営活動のための現金純額 | ( | ) | ( | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 現金純増(マイナス) | ( | ) | ( | ) | ||||
| 期初の現金と現金等価物 | ||||||||
| 期末現金と現金等価物 | $ | $ | ||||||
連結財務諸表の付記 を参照してください。
| 7 |
CNBX製薬会社です。
連結財務諸表付記
(未監査)
注1-業務の性質、陳述、継続経営
組織する
CNBX製薬会社(“当社”), は2004年9月15日にネバダ州に登録設立され,名称は推力エネルギー会社である。
2010年9月30日、法定資本を9億株普通株(額面0.0001ドル)と1億株優先株(額面0.0001ドル)に増加させ、発行された普通株と発行された普通株を1対20の逆分割を行った。逆分割により,我々の発行済み普通株 は13,604,000株から680,200株および5,000,000株優先株に減少した。
2014年4月25日、会社の統制権が変化しました Cannabics,Inc.(“Cannabics”)は株式購入プロトコル によって会社の大部分の発行済みと発行済み普通株を買収した。締め切り、すなわち2014年4月25日、株式購入契約の条項によると、Cannabicsは198,000ドルで41,000,000株当社が発行した制限的普通株を購入し、51%を占めた。
2014年5月21日、会社はネバダ州で合併によりCNBX製薬会社に改称した。会社の主要事務所はメリーランド州ベセスタにある。同社はワークフローを実験室研究と開発に変更した。
2014年6月19日、FINRAは最終的に会社名と株式コードをアメリカ鉱業会社からCNBX製薬会社に変更し、新しい株式コード を“CNBX”に変更することを許可した。承認の前提はCNBX製薬会社が2014年5月21日にネバダ州国務長官に米国鉱業会社との合併条項を提出したことである。ネバダ州の法律によると、CNBX製薬会社は登録者と合併して登録者に組み込まれ、登録者は生き残った実体である。合併は,改正されたネバダ州改正法規第92 A.180節に基づいて行われるため,登録者やCNBX製薬会社の株主承認は必要ない。
2014年8月25日、当社はイスラエル社G.R.I.N.(“GRIN”)を完全子会社化した。GRINは同社のイスラエルでの製品の研究と開発活動を提供する。
同社は2017年7月24日、ヒトゲノム、腫瘍遺伝学、および特定の大麻化合物に基づく診断ツールを開発するための遺伝学実験室の設立を発表した。
八月二十日これは…。2020年、同社はその抗腫瘍候補薬物RCC-33のために新しい部門を設立し、結腸直腸癌の治療に用いることを発表した。これは会社がクリニカルパスに注目した結果です体内にある実験では,主要医療センターとの連携, および製品アーカイブの準備,会社は米国FDAとIND前会議を予定している。
十月十八日これは…。2022年、会社は癌治療の組成物と方法について2つの新しい臨時特許出願を提出し、結腸直腸癌と結腸直腸癌患者の早期介入治療を含む。
陳述の基礎
添付されていない未監査財務諸表 は、アメリカ公認会計原則(“アメリカ公認会計原則”)に基づいて作成され、中期財務諸表列報に用いられ、Form 10-Qに適合する。したがって、それらは年次財務諸表に要求されるすべての情報と脚注を含まない。経営陣は、監査されていない財務諸表には、財務状況、経営成果、現金流量を公平に報告するために必要な調整(通常の経常的な計上項目のみからなる)が含まれていると考えている。提案された業務結果 は、必ずしも他の中期または年間の予想結果を表すとは限らない。
これらの監査されていない財務諸表は、11月29日に米国証券取引委員会(“米国証券取引委員会”)に提出されたForm 10-Kに含まれる2022年8月31日の年次財務諸表とともに読まなければならないこれは…。, 2022.
| 8 |
合併原則
連結財務諸表には当社とGRINの勘定が含まれています。すべての重大な会社間残高と取引は合併で販売された。
経営を続ける企業
添付されていない審査財務諸表
は持続経営原則に従って作成し、正常業務過程中の資産現金化と負債返済状況を考慮した。2022年11月30日までの3カ月間、会社の純損失は357,669ドル、設立以来累計357,669ドルの赤字となった
会社が継続的に経営できるかどうかは,その創設能力,投資資本を継続的に調達する能力,業務計画を策定·実施する能力に依存する。その会社がこのような努力で成功するという保証はない。
研究開発コスト
当社は会計基準アセンブリ730“研究と開発”(“ASC 730”)に基づいて研究と開発コストを計算した。ASC 730は、開発コストが発生した場合に費用を計上することを要求する。費用から差し引いた研究と開発コストはそれぞれ62,888ドルと1ドルである
再分類する
前期財務諸表のいくつかの金額は、今期の報告書に適合するように再分類された。これらの再分類は,以前に報告された損失,総資産または株主権益に影響を与えない.
付記2--関連先取引
2022年11月30日までの3カ月間、会社は2人の役員に113,870ドルの賃金支出を支払い、社会福祉を含め、支払われた現金は#ドルだった
2022年11月30日までに、会社には5人の従業員がいて、そのうちの2人は私たちの取締役Gabriel YarivとEYAL Baradで、彼らは私たちの法律顧問とCFOと共に月給を獲得しました。弁護士を除いて、すべての職員たちはイスラエルに住んでいる。
会社は2022年11月30日と2021年11月30日にそれぞれCannabics,Inc.に223,645ドルの未返済残高を支払いました。この前払いは要求に応じて支払い、利息を計算しません。
2022年11月30日までの3ヶ月間、会社は75,557ドルの非現金支出を記録し、株式ベースの支出として取締役会長、取締役会メンバー、コンサルタントに支払われた。
2022年11月30日現在、会社は売掛金と売掛金の下で、2人の取締役Gabriel YarivとEYAL Baradの未返済残高 の計310,557ドルを対応している。
付記3--株主権益(損失)
授権株
同社は最大900,000,000株の普通株を発行する権利があり、額面は$一株ずつです。普通株の1株当たり流通株は、株主に株主投票投票を提出するすべての事項で1株1票の投票権を有する権利がある。すべての普通株は評価不可能で累積されておらず、優先引受権はない。
| 9 |
付記4--支払引受及び又は事項
私たちはイスラエルのレホバートにある実験室を借りました毎月のレンタル料は6,500ドルです私たちの現在の賃貸契約は2024年2月末に終了しますが、私たちには2つの1年間の選択権があり、管理職はそれまでに実行する予定です。
注5--その後の活動
2022年11月8日、TaGeza生物製薬有限公司の持株権を買収したことが発表された。TaGeza研究チームは引き続き会社に取り組み、共同創業者のベンジャミン·デッカー教授(医学博士)は引き続き会社の首席科学者を務め、Gabriel YarivはTaGeza生物製薬会社の最高経営責任者(Br)を務める。
報告日まで、両社はこれまで最終合意に達していないにもかかわらず、協力を続けている。
十二月九日これは…。2022年には24,200ドルでSativusinの株式を売却しました
十二月二十七日これは…。2022年、会社 は表S-1登録声明を撤回しました。
十二月二十九日これは…。2022年、会社は8-K文書を提出し、取締役会メンバーの辞任を発表した。
2023年1月4日、会社は投資家に32,236株の普通株 を発行し、これは総額50,000ドルの転換可能な融資の結果である。
当社は、財務諸表が発行され、米国証券取引委員会に提出された日付を介して後続イベントを評価し、財務諸表における開示または確認が必要な他のようなイベントがないことを確認した。
| 10 |
項目2.経営陣の検討及び財務状況及び経営結果分析。
私たちの業務:
著者らは臨床前段階のプラットフォーム技術生物製薬会社であり、すでに腫瘍学中にまだ満足していない重大な医療需要領域で独自の革新薬物を開発し、現在結腸直腸癌(“CRC”)に集中している。われわれが開発している大腸癌候補薬はRCC−33であり,これは一流のbr療法であり,主に結腸癌患者の腫瘍細胞活性を低下させ,新たな補助治療としての独立薬や結腸鏡検査後の癌分期前の“機会の窓”と,結腸鏡検査後の難治性br患者に対する治療と手術補助治療の2つの場合に開発されている。当社は人類第一2023年にI/II期臨床試験を行った。新補助治療は手術治療前に治療を行って患者の予後を改善するものであり,われわれの業務戦略は臨床研究(パートナーとの協力を含む)によりわれわれの計画を推進し,買収,協力あるいは内部開発により高度に満たされていない医療需要分野で日和見的に計画を増やすことである。
CNBX製薬会社は臨床段階の製薬会社であり、主にカンナビノイドに基づく新型製品と癌治療のための革新技術の開発に取り組んでいる。
同社は現在、進行癌と癌嫌気性悪液質症候群(CACs)の治療に用いられる患者および結腸直腸癌を治療するためのRCC-33を評価するために、2023年にI/II(A)期の臨床研究を開始しようとしている。会社の活動はイスラエルのレホバートにある会社の生物実験室施設を中心に、私たちの科学チームはそこで会社の研究と開発をリードしています。
わが社の中核業務には、以下のようなものがある
| · | 薬物発見:新しい分子製剤と候補薬の開発 | |
| · | 知的財産権:私たちの製品を保護するために対応する知的財産権を申請する;そして | |
| · | 規制:私たちが開発したプロセスのすべての候補薬物のために規制方法を開始します |
著者らの現在の業務モードはIND(新薬研究)分類下の各新薬候補のために FDA監督管理経路を行い、そして I/II(A)段階の臨床研究(人体毒性と概念検証)に成功した。この一里塚を達成する過程で、同社は、より大きな製薬会社とのビジネス合意を含む、各候補製品を利用したいくつかのビジネス機会を得る。そのため、わが社はいかなる製品の製造、流通、販売にも従事しておらず、近い将来そうすることも予想できません。
2.パイプの開発:
2.1.Cannabicsによる癌拒食−悪液質症候群の治療
概要
CACsを治療する候補製品としてCannabics SRを開発している。Cannabics SRは徐放経口カプセルであり、その中に標準化されたカンナビノイド化合物 を含み、イスラエル海法腫瘍科Rambam病院医療保健園区のGil Bar-Sela博士が行った同業者評議の試験研究において、この研究はCACS患者の体重が明らかに増加することを示した。特許出願中の技術は、1日1回または2回の便利な投与を提供し、効果が迅速で、治療効果が安定し、6~8時間持続する。
癌拒食症−悪液質症候群
CACSは癌に関連するよく見られる合併症であり、発病率と死亡率はすべて非常に高い。これは複雑な代謝症候群であり、持続的に上昇する基礎代謝率は十分なカロリーや蛋白質を摂取することで補うことができず、非自発性と進行性の体重減少を招き、癌患者の機能障害の増加、特に疾病の末期にある。確立されると、現在、既存の薬理或いは栄養支持技術を用いてCACsを逆転することはできない。
| 11 |
飢餓とは異なり,CACS患者の体重減少は主に筋質の喪失によるものであり,骨格筋分解代謝の増加とタンパク質合成の減少が特徴である。このような体重減少は重要な臨床結果と関係があり、例えば発病率の増加、化学療法効果の低下、筋肉萎縮、炎症、疲労と生存期待の低下である。しかし,CACSが患者に与える影響はダイエット効果に限定されない。生活の質、機能能力、症状、心理結果と社交面はすべてCACsの影響を受ける。
国家癌研究所のデータによると、癌死亡の3分の1近くはCACsに関連する深刻な体重減少と“代謝突然変異”に起因し、50%を超える癌患者は悪液質で死亡する。現在、CACの全体罹患率は癌確定診断時に40%、末期は70%~80%と推定されている出典“腫瘍学/血液学レビュー”、2013;88(3):625-636)は、癌患者の生命の最後の1~2週間以内に体重減少の全体的な発生率が86%に達する可能性がある(出典“痛みと症状管理雑誌”2007;34:94-104).
CACsの病因とその後の発展は依然としてあまり知られていないが、炎症、合成ホルモン分泌減少と代謝反応変化を含むいくつかの要素と生物経路に関連することが知られている。過去10年間に、CACsの研究は重要な進展を得て、その機序に対する理解及び有望な薬理学と支持性看護干与措置の発展を含むが、現在まだ有効な薬物治療CACsがない。
現在、CACsに対する治療は一般的に栄養支持とCACsの病理生理調節薬物に基づいており、最もよく見られるのはプロゲステロン、メチルプロゲステロンとメチルヒドロキシプロゲステロン及びコルチコステロイドである。プロゲステロンは脂肪組織を増加させることで食欲を刺激し体重を改善するようであるが,痩せ体重を増加させることは確認されていない。メチルプロゲステロンは死亡率や血栓塞栓症のリスクも増加している。それにもかかわらず、メチルプロゲステロンはFDAが承認したCACsを治療する唯一の薬剤であり、これまで有効性や耐性の面で優れている薬剤は何もない。コルチコステロイドも食欲刺激や疲労減少に有効であると考えられているが、インスリン抵抗性、液体滞留、ステロイド筋症、皮膚脆弱、副腎機能不全、睡眠や認知障害などの長期使用の副作用により、短期的にのみ使用すべきである。他の薬は調査中か開発中だ。承認された治療法の不足を考慮すると,CACsは依然として重要な満たされていない医療ニーズ分野であると考えられる。
慢性前立腺癌のカンナビノイド治療
長い間、大麻は耐性が良く、安全で、有効な選択であると考えられ、患者の癌関連症状への対応を助けることができ、現在制吐、鎮痛剤などとして使用されている多くの処方薬の重篤な副作用よりも少ない。そのため,大麻系化合物は癌患者の嘔気や嘔吐の軽減,癌の痛みの軽減,食欲の刺激,生活の質の向上のための緩和ケアに応用されている。ドロノビノール(Marinol)とナベキソン(Cesamet)は合成大麻を基礎とする2種類の薬物であり、すでにアメリカ食品と薬物管理局によって伝統的な制吐治療が無効な患者の化学療法関連性吐き気の治療に許可されている。別の薬剤、ナビキシノール(Sativex)、特定の大麻抽出物は、末期癌患者の疼痛症状を緩和するためにカナダおよびイギリスで承認されている。
カンナビノイドに基づく治療法は癌治療法として興味があるにもかかわらず,その使用は大麻の法的地位以外の障害によって制限されている。最大の障害は,その有効性を証明する臨床研究に乏しいことである。カンナビノイドは癌患者の食欲,体重,体脂肪レベル,カロリー摂取量,情緒と生活の質を改善する証拠があるが,これらの影響に関する少数の研究結果は一喜一憂しており,定説はない。また,いくつかの研究はアプローチ学的に制限されており,確定的な結論は得られない.
大麻系薬物の治療用途も従来の投与経路によって制限されており,これらの制限は有効性を低下させている。喫煙と大麻吸引は標準化や再使用可能な配合が乏しいため,効力が大きく異なる。他の投与経路と比較して,調製されていない大麻の摂取も吸収差やバイオアベイラビリティの低さに関係しており,より高い用量とより大きな負の副作用リスクが必要である。また,カンナビノイド菌株に関する既存の情報が乏しいため,医療提供者が用量比率を決定することは困難である。しかし,われわれの経験では,患者の医療用大麻の主な懸念は,迷走方向やめまいのような副作用であり,これは,投与直後の活性大麻血濃度ピークの有意な変化によるものである。さらに,これらの副作用は即時放出法によく見られ,患者が推奨治療案を遵守できなかった重要な要素であり,彼らの健康や福祉に一般的な脅威となっていると考えられる。
| 12 |
Cannabics SR
Cannabics SRは、脂質br}エマルジョン中に懸濁された特許出願中のカンナビノイド抽出物配合物を含むヒドロキシプロピルメチルセルロース(HPMC)カプセル の形態の経口組成物である。その効果は比較的速く、通常30~40分以内であり、その後、活性カンナビノイドは徐々におよび持続的に放出され、各カプセルの有益な効果の安定レベルは6~8時間に達する。Cannabics SR は一致した予測可能なカンナビノイド濃度,および有効成分の吸収プロファイルとバイオアベイラビリティ を提供しており,他の経口カンナビノイド投与よりも優れていると考えられる。Cannabics SR中の活性薬物成分の多因子メリットはCACsに対して安全かつ有効な治療が満たされていない医療需要を満たし、それによって患者のコンプライアンスとより良い健康結果を高めたと信じている。
Cannabics SRカプセルは食品レベルのbr材料のみを含み、いかなる人工添加剤も含まない。各カプセルの有効成分は、成分、配合、および用量で標準化されており、選択された医療用大麻系統から抽出された活性カンナビノイドの純天然抽出物のみからなる。すべての補助材料はFDAが公認している安全補助材料である。
CACs治療の潜在力としてCannabics SRに加えて,我々のSR技術は他のbr適応を有する患者の独自の需要を満たすことができると信じており,これらの患者にとってカンナビノイド製剤の持続放出は有益である可能性がある。
臨床発展
2016年、大麻SRカプセルのCACへの影響、特に進行癌患者の体重減少を評価するための2年間の試験研究を開始した。この研究はGil Bar-Sela教授が指導し、彼はランバム衛生保健キャンパス腫瘍科取締役副主任、緩解期と支持性腫瘍科責任者及び黒色腫と肉腫患者のサービス担当を務めたことがある。
患者は大麻徐放剤2×10 mgを服用し,24時間に1回,治療コースは6カ月であった。研究期間中、いくつかの患者がいくつかの精神薬の副作用を報告した後、各カプセルの用量は5 mgに減少した。5 mgの用量で副作用の報告はほとんどなかった。参加者は診察を受けるたびに秤量された。この研究の主な目標は体重がベースラインより10%増加することだ。この研究への参加に同意した24名の患者のうち,17名が大麻徐放治療を開始したが,11名のみが2週間以上のカプセル治療を受けていた。研究を終えた6名のうち,3名が主な終点に達していた。残りの3名は体重が安定していた。生活の質アンケートでは,br患者は大麻緩解剤治療後に食欲減退が軽減したと報告している(p=0.05)。患者の自己報告によると,食欲や情緒が改善し,痛みや疲労も軽減した。
様々な制限があるにもかかわらず,初歩的な研究では,1日5 mg×1または5 mg×2カプセルを服用した17名中3名(17.6%)で体重が10%増加し,br}に有意な副作用はなかった。残りの患者の体重は安定していた。また,研究に少なくとも4.5カ月滞在したすべての患者は食欲増加を報告し,検討を終えた患者の83%も同様であった。研究を終えた50%の患者では,疼痛軽減と睡眠改善が報告されている。その他の結果では,研究を終えた83%の患者で食欲不振の苦情が有意に減少した。(ご参照くださいBar-Sela,Gilら。用量制御された大麻カプセルが末期癌患者の癌関連性悪液質と拒食症候群に与える影響:初歩的な研究。癌総合治療第18巻(2019年):153473541981498。DOI:10.1177/153473541981498.)
| 13 |
図1:ヨーロッパ癌研究と治療組織生活の質アンケート(EORTC QLC-C 30)の報告によると、Cannabics SR治療を完成した6名の患者の食欲低下)
商業化する
私たちが計画した試験的な研究結果は、私たちがイスラエル保健省の許可の下でイスラエルでCannabics SRを商業化することを可能にするかもしれない。もし私たちがこのような許可を得たら、私たちはイスラエルのGMPメーカーを招いて大麻SRカプセルを生産し、全国流通のためにするつもりだ。
2020年5月13日、イスラエル経済省は自由パスワードに署名し、イスラエルからGMP認証された医療用大麻製品の輸出を許可した。私たちは現在、私たちのすべての利用可能な国際市場でのCannabics SRの輸出機会と最適な商業化経路、特にEU、カナダ、オーストラリア市場を評価している
癌と癌拒食性悪液質症候群(CACS) 市場分析
癌悪液質市場の動態は今後数年で変化することが予想され、臨床開発の早期段階にある肝心な参加者は開発段階のいくつかの稀な候補薬物で積極的な結果を得たため、重大な積極的な転換が生じる可能性がある。新興療法は予測期間内に発売される予定である。また,この疾患は有効な治療法が不足しており,癌悪液質市場の競争が少ないため,製薬会社に新薬を創出するために大きな機会を提供している。また、人々の癌悪液質に対する認識の向上も癌悪液質市場の増加に積極的な影響を与えた。
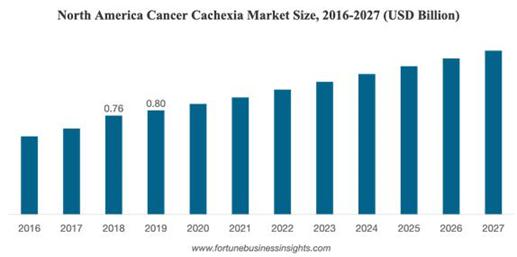
全世界の癌悪液質市場規模は2027年までに29.3億ドルに達すると予想され、予測期間内の複合年間成長率は4.8%である[2020-2027].

| 14 |
“フォーチュン”ビジネス情報サイト:癌-悪液質-市場-103262
北米地域は世界の癌拒食症−悪液質症候群薬物市場で最大のシェアを占めており,癌症例の増加により,北米は全世界の癌拒食−悪液質症候群薬物市場で大きな市場シェアを占めることが予想される。国際癌研究機関(IARC)は世界の新規癌症例1300万例を主張している。“世界癌報告”では,2020年に新規癌症例が50%増加し,1500万例に達することが規定されている。高度に発達したヘルスケアシステムの存在,医師の新製品に対する高度な受け入れ ,先進技術ツールの全面的な利用可能,FDAの新薬承認,および多くの会社が腫瘍製品 (https://www.datamIntelligence ence.com/Research−report/癌−anoreia−cachexia−syndrome−Drug−market)を開発している
2.2 RCC-33:結腸直腸癌治療の候補薬:
我々が開発している抗腫瘍フラッグシップ製品RCC−33は結腸直腸癌治療の抗癌候補薬であり,3である研究開発確定診断者数は2人までです発送する全癌の中で最も致命的であり,世界では毎年約200万人の新たな確定診断例があり,現在の市場価値は120億ドルと推定され,2027年には170億ドルに達すると予想されている。
RCC-33特許処方は1種の特定の合成カンナビノイド分子成分からなり、繰り返し行われた体内研究において、この成分は結腸直腸癌腫瘍体積を30%以上減少させる可能性が証明された。
概要
癌とカンナビノイド
癌は、100種類以上の関連疾患のセットを説明するための汎用用語であり、異常な細胞の制御されていない成長および拡散が、一般に腫瘍と呼ばれる腫瘍の進行をもたらし、その後、周囲組織に侵入し、その後、身体の他の部位に拡散または転移することを特徴とする。新たな治療法の研究と導入に大きな資金が投入されているにもかかわらず、癌はまだ満たされていない医療需要の重要な分野である。世界保健機関のデータによると、癌は世界2位の死亡原因であり、2021年には1000万人近くが死亡すると推定されている。2019年1月1日現在、米国では1690万人以上が癌を患っており、2022年には190万人の新症例と609,360人が癌で死亡すると予想されている(資料源:アメリカ癌協会。癌事実(br}&図2022)。
過去10年間、人々は大麻類化合物の腫瘍学における治療価値にますます興味を持ってきた。長い間、大麻は耐性が良好で、安全かつ有効な選択であると考えられており、吐き気と嘔吐を減少させ、癌の痛みを軽減し、食欲を刺激し、生活の質を高めることによって、患者の癌関連症状への対応を助けることができる。しかし、痛みを緩和するメリット以外に、カンナビノイド類化合物もその抗癌潜在力によってますます注目されており、いつか癌治療に革命的な変化をもたらす可能性があると信じている。
カンナビノイドは大麻植物に天然に存在する化合物であり、薬理的に人体が産生するカンナビノイドと類似しており、内因性カンナビノイドと呼ばれる。内因性カンナビノイドはヒト内因性カンナビノイド系(ECS)の一部であり、複雑な生物ネットワークであり、カンナビノイド受容体とカンナビノイドの形成、輸送と分解に参与する酵素も含む。ECSは重要な内因性システムであると考えられ、最も重要な生物過程の調節に参与して体内のバランスを維持し、身体が外部あるいは環境が変動した場合に安定とバランスを維持することを助ける(資料源:“現代薬物設計”、2016;22(12):1756-1766).
カンナビノイド受容体或いは酵素の発現と機能或いは内因性カンナビノイド濃度の変化によるECS失調は癌を含むいくつかの疾患と関係がある(癌を含む)出典“国際分子科学誌”、2020;21(3):747)である。実際、ECSとその制御過程の調節に参与する機序はほとんど癌生物学のすべての重要な経路を含む。健康組織と比較して、様々なタイプの腫瘍におけるECSの発現は変化しており、この異常発現は癌の予後と疾病の結果と関係があり、具体的には癌の源に依存する(出典イギリス薬理学雑誌、2018;175(13):2566-2580). 最近の研究により、内因性カンナビノイドは細胞増殖のバランスを維持するのに役立ち、標的ECSは癌の成長に影響を与える可能性があることが示唆されている(出典カナダ泌尿外科学会誌、2017;11(3-4):E 138-E 142).
| 15 |
カンナビノイドはECS中のカンナビノイド受容体と相互作用することができ、時々親和性は内因性カンナビノイドより高い。そのため、内因性カンナビノイド制御のすべての過程はカンナビノイドの妨害を受けやすい。カンナビノイドを用いてECSを調節する能力はいくつかの魅力的な薬物治療標的を含み、全身抗癌治療に応用し、そして大量の研究を引き起こし、カンナビノイドの癌細胞に対する作用を検討した(出典: 薬理学的レビュー,2006;58(3):389−462).
臨床前研究において、カンナビノイド類化合物は選択的な抗腫瘍特性を示し、腫瘍タイプと特定の環境によって、抗増殖、アポトーシス促進、抗血管新生、抗転移と抗炎症作用を発揮する(出典:がん医学、2018:7(3):765-775)である。これらの影響は、単独ではなくカンナビノイドを一緒に使用する場合には、より顕著に見えるようであり、このメカニズムは、環境効果したがって,カンナビノイドの組み合わせは癌管理に改善された抗増殖戦略をもたらす可能性が考えられる。
潜在的な抗癌薬として以外に、カンナビノイドはいくつかの伝統的な抗腫瘍薬と相乗作用が観察され、例えば化学療法薬、brはそれらの治療効果を高めた(出典癌医学、2018;7(3)765-775)である。これは連合治療の可能性を増加させることができ、患者が利用できる化学療法の選択範囲を増加させることができ、そして異なるレベルで腫瘍の進展を標的とすることができ、同時に治療効果に影響を与えることなく細胞毒薬物の投与量を大幅に減少させることができる。
図2大麻抽出物と化学療法薬の同一抽出物と3種類の異なる化学療法の組み合わせ治療後の癌生検に対する協同作用
本稿提出日までに,抗癌治療のためのマリファナ薬が承認されていることは知られていない。
私たちの主な候補製品はRCC-33であり、私たちはCRCを治療するために開発しています。RCC-33は、ヒト結腸癌細胞株の生存能力を低下させる上での相乗的効果を示す独自の大麻化合物配合物を含む経口カプセルである。
結腸直腸癌
結腸直腸癌は全世界で比較的によく見られる癌の一つであり、全世界の医療体系に対する重大な挑戦である。世界保健機関のデータによると、結腸直腸癌は世界で3番目に確定診断された癌であり、癌関連死亡の第二の原因でもある。米国では2019年に約1,369,005人が結腸直腸癌を患っている(資料源:アメリカ国立癌研究所。“癌統計事実:結腸直腸癌”)。 2022年、アメリカでは151,030例の結腸癌と44,850例の直腸癌が診断され、合計52,580人がこれらの癌で死亡すると予想されています(資料源:アメリカ癌協会。“がんの事実と数字2022”).
多くの大腸癌開始時にbrと呼ばれる非癌性成長,すなわち結腸や直腸の内層に進展するポリープである。最も一般的なポリープは腺腫性ポリープや腺腫と呼ばれています。アメリカ癌協会のデータによると、3分の1から半分の人は最終的に1つ以上の腺腫に発展すると推定されています。すべての腺腫は癌化能力を持っていますが、10%未満の人だけが浸潤性癌に進展すると推定されています。腺腫が癌に変化する可能性は、腺腫が大きくなったり、何らかの組織病理学的特徴が得られるにつれて増加します。br癌化した腺腫は、腺癌と呼ばれ、すべての癌を占めています(資料源:アメリカ癌協会。“2020年から2022年までの結腸直腸癌の事実と数字”)である。腺癌は血管やリンパ管に成長し,他の解剖部位に移行する機会を増加させる可能性がある。
| 16 |
CRCは一般的に発展が遅く、10年から20年かかる。腺癌の発生、発展と拡散過程中に発生する一連の複雑な事件は遺伝と環境要素による突然変異の生涯蓄積の結果である可能性が高く、腺腫から癌への配列と呼ばれる。br}具体的なCRC症例の具体的な原因は通常不明であるが、半分以上の症例と死亡は喫煙、不健康な飲食、高飲酒、スポーツトレーニングの不足と過体重などのbrの生活様式と環境要素に起因することができる資料源:アメリカ癌協会。“がんの事実と数字2020”).
結腸直腸癌は通常疾患が進展するまで症状が出現するため,スクリーニングにより腺腫を早期に発見することは重要である。治療や切除を行わなければ,腺腫は潜在的に生命を脅かす癌となる可能性がある。
現在の看護基準
結腸直腸癌患者の治療選択はいくつかの要素に依存し、癌のタイプと段階、可能な副作用、患者の好みと全体健康を含む。手術による腫瘍切除は最もよく見られる治療形式であり、特に悪性腫瘍の早期段階である。末期結腸直腸癌患者は補助化学療法を与えて手術後に残留した癌細胞を殺すことができ、標準化学療法は深刻な副作用と関連しているが、大多数の患者にとってはわずかなメリットである。放射線治療は通常直腸癌の治療に使用されるが、疾患の末期でなければ、結腸癌患者の放射線治療の使用は通常提案されていない(資料源:アメリカ癌学会。“結腸直腸癌の治療”).
結腸直腸癌は異質性疾患であり、独特な臨床、分子と病理生理特徴を有する。したがって,同じ臨床段階で診断されても,患者によって治療に対する反応は異なる。この異質性は依然として各個体が治療を最適化する障害である。研究者は免疫治療と標的治療のような新しい治療選択を研究し続けており、特定の腫瘍の遺伝子、タンパク質、その他の要素に重点を置いている(資料源:アメリカ癌協会。“大腸研究の進展”).
免疫療法はヒト自身の免疫系を用いて癌細胞を殺す。アメリカ食品と薬物管理局はすでにいくつかの結腸直腸癌を治療する免疫療法、例えばペブロリズマブ(Keytruda)、ニボズマブ(Opdivo)とイブリズマブ(Yervoy)を許可した。他のタイプの癌の治療に有望な免疫療法の多くもCRCテストを受けている。免疫治療はいくつかの鼓舞的な結果を得たが、依然として重大な制限が存在する。その治療効果は通常予測不可能であり,治療は身体抵抗力を引き起こすか,あるいは身体免疫系が健康組織を攻撃する非標的毒性を引き起こす可能性がある。免疫療法は他のプログラムよりも時間がかかるかもしれませんし、従来の治療法よりもはるかに高いかもしれません(出典薬学と治療学、2017;42(8):514-521).
標的治療は、癌細胞内またはその表面の特定の分子を標的とする薬剤を使用して、癌の成長を減速させ、癌細胞を破壊し、癌症状を緩和する。異なるタイプの標的治療薬があり,薬物の標的分子によって薬物の作用様式が異なる。患者の腫瘍細胞に発現する分子タイプに応じて治療法を選択することで,医師が一人一人に癌治療をカスタマイズすることが可能となる。いくつかの標的治療薬、例えばベバシズマブ(アバシン)とセツキシマブ(ルビタール)は、すでに末期結腸直腸癌の治療に応用されている。臨床の将来性を示すにもかかわらず、標的治療は依然として挑戦に直面しており、例えば腫瘍の異質性、非標的毒性と獲得性薬剤耐性(出典:医学研究雑誌、2019;4(2):99-105)である。高い応答確率を有する患者を識別するためのバイオマーカーの欠乏も特に重要な障害である。免疫療法と同様に,標的療法のコストは従来療法よりも大きく高い。
癌を治癒する“万能薬” がなく,個人化された癌治療の組み合わせが症例ごとに長期生存のメリットを得る最適な方法である可能性が考えられる。そのためには,より多くの予防戦略と新たな製剤を開発することが重要となる。
カンナビノイドと結腸直腸癌
結腸直腸癌の治療にますます興味を持つ分野の一つは大麻類薬物の開発と使用である。ECSは胃腸の重要な調節システムと考えられ、運動、分泌、感覚、炎症と発ガンなどの多くの重要な機能に参与する。最近の 研究では,ECSはCRCの発展に重要な役割を果たしていると考えられているため,CRCを抑制する適切な目標 と見なすべきである出典“薬理学の最前線”、2016;7:361)である。結腸直腸癌におけるECS成分の発現増加は、比較的に悪い予後と疾病の末期と関係がある(資料源:大麻とカンナビノイド研究,2018,3(1):272-281例えば、カンナビノイド受容体が結腸腫瘍細胞に過剰発現していることが発見されており、この上昇は癌予後の指標と考えられている(出典イギリス薬理学雑誌、2018;175(13):2566-2580).
| 17 |
結腸直腸癌に対する大麻系化合物の影響に関する研究では,結腸直腸癌細胞系の生存率を低下させることが示唆されている体外培養 (出典:がん医学、2018;7(3):765-775)、 は、カンナビノイドが異なる動物モデル結腸癌の発癌作用を予防または減少させることができるという納得できる科学的証拠もあるが(br})出典:“胃腸病と肝疾患”専門家コメント、11:10,871-873).
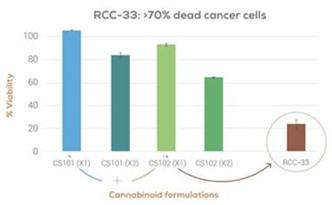
カンナビノイドは大腸癌を治療する有望な薬剤であると考えられている。私たちは何度か行ってきました体外培養我々のバイオインフォマティクスプラットフォームを用いた未発表の研究では,カンナビノイドが結腸癌細胞の壊死を引き起こすことが明らかにされている。多くのカンナビノイドは癌細胞に対してある程度の毒性を示すが、いくつかのカンナビノイド抽出物と組み合わせは他の単独あるいは組み合わせのカンナビノイドと比較してより高い毒性レベルを示すことが分かった。これらの発見はRCC−33の開発を刺激し,これは我々がCRCを治療する候補製品である。
図3:結腸癌細胞株の活力に対する異なるカンナビノイドの組み合わせの協同作用.
RCC-33
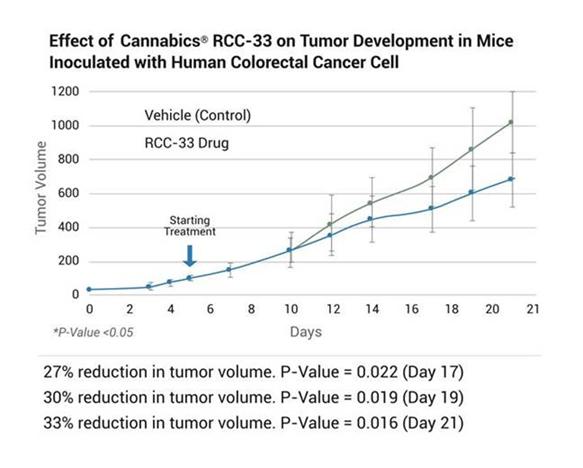
われわれはRCC−33経口カプセルや高濃度大麻類CBDVとCBGAを含む新しい調製溶液を開発しており,結腸腺癌の治療に有効である可能性が信じられている。RCC−33中のカンナビノイドはbr}の組み合わせで複雑な協同抗腫瘍作用を示し,精神活性はなかった。私たちの臨床前段階では体外培養ヒト結腸癌細胞系(RKO,HCT 116)に対する15種類の異なるカンナビノイドの影響を評価し,RCC−33を単独と併用した研究では,他のカンナビノイド組み合わせと比較して,RCC−33は結腸癌細胞活力の低下に明らかな効果があることが示された。重要なことは,ヒト結腸直腸癌細胞を接種したマウスの腫瘍進展を有意に抑制することが検出されたことである。
| 18 |
発展計画
同社は現在、進行癌と癌嫌気性悪液質症候群(CACs)の治療に用いられる患者および結腸直腸癌を治療するためのRCC-33を評価するために、2023年にI/II(A)期の臨床研究を開始しようとしている。著者らは更なる臨床前研究を行い、安全性と有効性を確定し、それから初の人類臨床試験を行う予定である。
臨床前研究
著者らは良好な実験室規範(GLP)に従って非臨床安全性研究を行い、絶えず投与量を増加させるRCC-33の全身と局部毒性を評価し、用量パラメータを確立する予定である。2023年に行われる予定のこれらの臨床前研究の結果,我々が計画したI/II(A)期臨床試験を指導する。開発計画を支援する非臨床要求はIND前会議でFDAと検証される。このような研究は重複用量毒性研究、男性と女性の生育能力研究、胚胎発育研究、動物虐待関連研究、薬物動態学研究、薬物-薬物相互作用研究などを含む可能性がある。
臨床試験
著者らは2023年第1四半期に開始したI/II(A)期(A)漸増用量臨床試験においてCannabis SRとRCC-33の安全性、耐性と薬物動態学特性を評価する予定である。この臨床試験は多用量のRCC-33の結腸直腸癌患者に対する耐性、薬物動態学、薬効学と治療効果を検査する。我々は現在,第1段階/第2段階(A)ヒト概念検証研究を行うための潜在的な契約研究組織と臨床試験センターを探しており,6,500,000ドルがかかる予定である。しかし、本出願日までに、会社は第1段階/第2段階(A)研究を完了するのに十分な資金を有していない。
著者らの第一段階試験の結果によると、著者らはRCC-33のINDをFDAに提出し、第二段階二重盲検プラセボ対照臨床試験の臨床方案(br}は異なる用量レベルの結腸直腸癌患者とプラセボ対照のRCC-33を評価する予定である。計画中の第二段階人体検証概念試験の結果は著者らのRCC-33臨床開発の更なるステップに意思決定根拠を提供する。
私たちのルート:
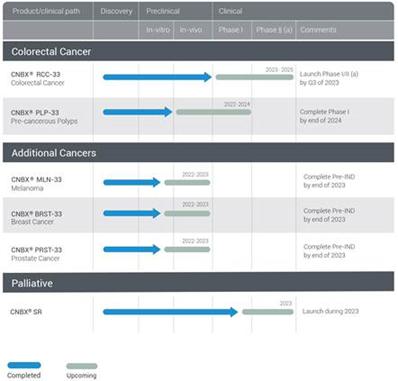
当社は、大腸癌候補治療薬RCC−33に加えて、結腸鏡検査中の側方播種性大腸ポリープの局所治療のためのPLP−33、乳癌治療用BRST−33、黒色腫治療用MLN−33、前立腺癌治療用PRST−33を含む他のいくつかの候補薬を開発している。これらの追加候補薬は開発の初期段階にあり,同社は2023年末までに各製品の体内研究を完了する予定である。(図4参照).
| 19 |
図4
2.3現在積極的に開発されていない製品 シリーズ:
同社にはいくつかの製品ラインが現在積極的に開発されていないが,会社はその資源と注意を上記FDA経路候補薬とSRカプセルの開発 に集中させることにしたからである。積極的に開発されていない製品ラインには
Cannabics CDX(評価する)薬剤感受性試験
Cannabics CDXは、医療提供者に臨床決定支援データを提供することを目的とした開発中のインビトロ薬物感受性試験であり、これらのデータに基づいて、大麻系薬物治療を受けている特定の癌患者に対して、どの大麻系化合物または大麻系化合物の組み合わせが最も有益な抗癌効果を有する可能性があり、どの大麻系化合物が禁忌である可能性があるか。
会社は起動後の後の段階でこの決定を見直すかもしれません 人類第一その結腸直腸癌治療薬物候補RCC-33の臨床研究検証。
| 20 |
3.癌治療薬候補薬の市場機会:
3.1. 新しい補助療法:
国立がん研究所によると,新補助治療は“主な治療の前に,腫瘍縮小の第一歩として投与される治療は,通常手術である”という。
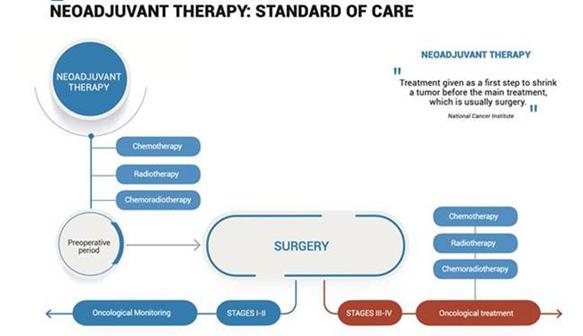
制限:
| · | 軽微から重篤な副作用 | |
| · | 抑制された免疫系 | |
| · | 術後化学療法に対する腫瘍残留物の潜在的耐性 |
*“nCRTはITGHを増加させ、残留腫瘍における薬剤耐性腫瘍細胞集団の拡張をもたらす可能性がある”。
腫瘍学の最前線。2019年
局部進行期直腸癌における新補助化学療法の作用--腫瘍内異質性の影響。
| 21 |
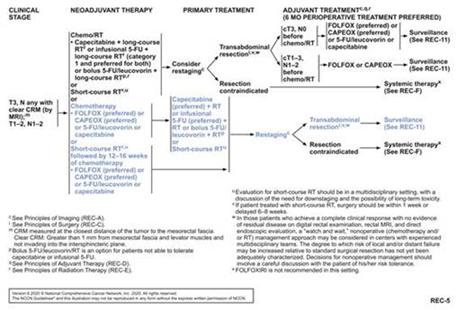
3.1.1直腸癌の新しい補助治療
新しい補助放射線化学療法はすでに局部末期直腸癌の標準治療方法になっている。新補助放射線化学療法は腫瘍の大きさを縮小し,再発を減少させるだけでなく,腫瘍切除率や肛門温存率を向上させることができ,副作用が少ない。術前化学療法と比べ、術前放射線化学療法は局部再発率を更に低下させ、分期を低下させることができる。高位直腸癌と比べ、中低位直腸癌は新しい補助放射線化学療法からもっと多くの利益を得ることができる。
3.1.2乳癌の新しい補助治療
早期乳癌において、手術は根治治療の主要な手段である。腫瘍の臨床病理特徴により、局所放射線治療と全身補助内分泌治療或いは化学療法を補助する目的は再発のリスクを減少させることである。しかし,術前に新たな補助環境下でこれらの療法を施行する可能性はいくつかの利点を提供している
| · | 腫瘍の大きさを小さくして切除可能性を高め | |
| · | 保存手術の比率を高め美容効果を改善しました | |
| · | 腋窩手術の範囲を減らし | |
| · | 微小転移疾患の早期治療 |
| 22 |
図5である.ASCO乳癌新補助治療ガイドライン

ASCOのガイドラインによると,多くの患者が新たな補助化学療法を受ける資格があり,BRST−33の最終消費者であるが,現在の治療法では重篤な副作用 は否定されている。
看護基準の副作用とリスク:
| · | 吐き気や嘔吐 | |
| · | 抜け毛 | |
| · | 爪や肌の変化 | |
| · | 食欲が減退する | |
| · | 重みの変化 | |
| · | 下痢や便秘 | |
| · | 口瘡 | |
| · | 疲れている |
| 23 |
3.2.カンナビノイド新補助治療
FDAは古くからカンナビノイドの臨床研究を推進してきたが,大麻や大麻で発見された化合物を含む薬剤の開発に興味を示す関係者が増えてきたからである。最近の立法変化も医療用大麻臨床研究に新たな機会を開いた。この研究機関の進歩と発展に伴い,FDAはこの新興科学分野の薬物開発を支援しようと努力している。
RCC−33及びBRST−33−直腸癌及び乳癌の新たな補助治療基準を改善するための潜在的安全薬
看護基準に対するRCC−33およびBRST−33の期待 の利点:
| · | 非抑制性免疫系 | |
| · | 潜在的な低毒性は、患者がより少ない副作用を受けるため、新しい補助治療においてより重要である。この2つの候補薬剤は大麻工場で発見された2種類の天然分子(カンナビノイド)に基づいているため,分子の短期的かつ長期的な安全性が低い可能性がある。毒性が予測できない新薬の実体にあるようには見えない。 | |
| · | 術後化学療法に対する腫瘍残留物の潜在的耐性を克服する |
3.3.癌免疫治療:
我々の業務戦略は,パートナーと臨床研究を行うことで我々の計画を推進し,買収,連携あるいは内部開発により高度に満たされていない医療需要分野で機会を選んで計画を増やすことである。腫瘍学は重大な進展を得たが、固形腫瘍患者の治療にはまだ大量の満足されていない需要があり、特に現有の薬物に対して無効或いは無効な末期疾患患者がある。CNBX PharmPharmticalsとTageza PharmPharmticalsの業務と臨床協同作用は独特な治療方法に向かって進んでおり、そして それらの組み合わせを最適化し、癌患者の腫瘍治療選択を拡大する。チームワークは経験豊富な科学者、医師と傑出した医療保健研究専門家からなる独特な協力である。パートナー関係の中で、CNBX製薬会社はその先端インフラプラットフォームを利用して薬物開発の各段階でTagezaに支持を提供し、標的検証、化合物検証及び臨床前と臨床試験の最適化を含む。Tageza製薬パートナーでは,最大の腫瘍学センターの一つからの臨床経験,治療期間中に大量の患者から得られたデータと知見が検証され,新規大麻系治療から最も利益を得る可能性のある患者を決定することができる。これまで最終合意に達していなかったにもかかわらず、両社は協力を続けている。
現在、多くの既存の治療を受けている患者は腫瘍の大きさの縮小から利益を得ているが、よく再発し、より侵襲性のある疾患に発展する。残りの化学療法耐性腫瘍細胞群は腫瘍起始細胞(TIC)(以前は癌幹細胞(CSC)と呼ばれていた)が豊富であった。TaGeza技術は、TIC/CSCに対して、小分子の使用を再調整し、標的免疫治療ADC(抗体薬物結合体)のための特定の抗体を生成する。
CSCsは結腸直腸癌に最も早く発見された。その異質性、薬剤耐性などの特徴のため、伝統的な治療方法はCSCsを完全に除去することは困難である。残りの腫瘍幹細胞は腫瘍の再発と浸潤を招き、最終的に患者の死亡を招くことができる。そこで,腫瘍幹細胞を効率的に標的とする治療法を開発することは,胃腸癌の治療を大きく促進する(孫勇,Li,B.,曹,Q.など)。Brポリマーナノ粒子を用いて腫瘍幹細胞を標的とし胃腸癌を治療した。幹細胞研究報告13,489(2022)。Http://doi.org/10.1186/s 13287-022-03180-9
抗体薬物結合ADC
抗体-薬物結合体(ADC)は1種類の新興の高効率薬物であり、化学療法と免疫治療の完璧な結合である。抗体-薬物結合体(ADC)は、一般に、モノクロナル抗体(MAbs)によって化学リンカーを介して細胞傷害性薬物に共有結合される。それは標的能力が強いと殺傷力が強い利点を結合し、癌細胞に対する正確かつ高効率な殺滅を実現し、すでに抗癌薬物の研究開発の焦点の一つになっている。2000年に最初のADC Mylotarg(健択ozogamicin)がアメリカ食品と薬物管理局(FDA)の許可を得て以来、現在までに、全世界で14個のADCが市場許可を獲得した。そのほか、現在すでに100名以上のADC候補患者が臨床段階の研究を行った。この“バイオミサイル”と呼ばれる新しい抗がん剤が腫瘍標的治療の新時代をリードしている。腫瘍細胞に発現する標的抗原はADC薬物が腫瘍細胞のナビゲーション方向を識別することであり、細胞毒ペイロードを癌細胞に輸送する機序(例えばエンドサイトーシス作用)も決定した。したがって、適切な標的抗原を選択することは、ADCを指定する最も重要な考慮要素である。標的外毒性を減少させるために、標的抗原はまず腫瘍細胞に特異的または主要に発現すべきであるが、正常組織では非常に少ないか低い。22この抗原は理想的には表面(または細胞外)抗原(Fu,Z.,Li,S.,han, S.など)である。抗体薬物結合体:腫瘍標的治療の“バイオミサイル”。振込先 から7,93(2022)に署名します。00947-7)ADC市場指標
| 24 |
現在市販されているADCの世界売上高は2026年に164億ドルを超えると予想されている。ADCの市場は2026年後にさらに増加し、新しい薬物はいくつかの腫瘍学適応の臨床実践に入るからである。Https://www.nature.com/ods/d 41573-021-
4. GMP生産およびビジネス運営アウトソーシング:
4.1。 GMP生産アウトソーシング
我々の現在の立場は,我々の候補薬物承認過程に必要なすべての化学 製造と制御(CMC)がアウトソーシングされることである。RCC−33製剤 および我々が開発している他のすべての候補薬は,天然分子からインスピレーションを得ているが,化学合成分子や原料薬(活性医薬成分)からなる製剤のみからなる。当社は植物学や植物学製品の開発には一切従事していません。また、IND前会議要請をFDAに提出することを踏まえて、臨床段階製品に適したGMP(良好な製造規範) 級原料薬のメーカーとサプライヤーとの合意が必要となります。いくつかの歴史ある大手米国会社がFDAとの協力について長期的な記録を持っている。したがって、製造業者はまた、IND届出全体にわたってCNBXをサポートする必要があり、CMCに関するすべての必要および関連情報をFDAに提出された包括的な技術パッケージの形態で提供することを含む。上記のプロトコルにより提供された原料薬は,2023年に発売予定のI/II(A)段階臨床研究に同社が用いられる。
4.2. 商業運営
私たちはまだ販売、マーケティング、または製品流通インフラを確立していません。強力なマーケティング能力と流通ネットワークを持つ製薬業界の老舗会社brと,許可手配と戦略的パートナー関係 により我々が開発した任意の薬物を商業化する予定である。私たちは通常、任意の許可または協力条項を交渉する前に、それらの臨床 および商業的潜在力を決定するために、私たちの候補薬剤の第1段階および第2段階の臨床試験を適切に推進することを意図している。私たちはこの方法が私たちが短期的に開発する可能性のある任意の薬物または他の製品の最も十分なマーケティングと流通潜在力を達成すると信じている。
5.コア活動:
5.1.薬物発見
内部最先端の実験室施設ですべてのスクリーニングと臨床前研究を行う{br
私たちの研究と開発は
これらの問題を解決し、臨床結果を改善するために、CNBX製薬会社は癌の進展をモニタリングする診断方法とカンナビノイド-癌感受性テストの開発に集中し、全身でカンナビノイド薬物を用いて癌を治療することをカスタマイズした。新しい高スループットスクリーニング(HTS)方法を用いて、癌細胞系と大麻薬物患者からの循環腫瘍細胞(CTC)を研究した。
われわれの目標は,治療範囲の広い癌であり,主要な治療法としても伝統的な化学療法の補完としてもある。既存療法に無効あるいはこれらの治療法に副作用を生じる患者にとっては,新たな薬物へのニーズは依然として大きいと考えられる。我々は,これらの活性化合物の相乗作用の潜在的治療応用を認識し,活性化合物がその抗腫瘍活性に関連する特定の比率を解読する方法およびプログラムを確立した。
著者らの政府許可実験室は独特な、カスタマイズ設計と建設された研究開発実験室を運営しており、この実験室は高スループットスクリーニング(HTS)機能とbr}最先端のデータツールを結合し、各種の生物分析の小型化と自動化を実現することができる。自動化システム は以下のコンポーネントからなる:
| 1. | 定量顕微鏡のために設計された自動化された細胞イメージングと分析プラットフォームである高含有量スクリーニング(HCS)プラットフォーム。 |
| 2. | フローサイトメトリーは、多パラメータ単細胞分析を実現できる。 |
| 3. | 正確かつ反復可能な液体および化合物体積を分配するための液体処理のための自動化ワークステーション。 |
| 4. | マルチモードマイクロボードリーダーは、多種の生物反応/過程を迅速に測定するために設計されている。 |
| 25 |
これらの機器の統合はロボットアームによって実現され,これはすべての機器の連続プロセスを使用することを可能にする.
これらの機器が生成した読み取りは,増殖抑制,アポトーシス誘導,血管新生防止,癌細胞毒性などのパラメータへのわれわれのカンナビノイドバンクの影響についての知見を提供している。
これらの実験は,細胞画像,細胞特定マーカー,生物反応の範囲/シグナルからなる多重データを生成する。異なる濃度のカンナビノイドおよびその組み合わせを用いて生物学的反応を測定し、特定の癌タイプに対する最も有効なカンナビノイド治療法を決定する。
体外研究−薬物スクリーニング
我々は、大麻比率、用量と抗腫瘍活性との間の相関を検出するための独自の高スループットスクリーニング(HTS)および高含有量スクリーニング(HCS)プログラムを有し、増加しているヒト癌細胞系ライブラリーを使用して、より多くの種類の大麻系化合物を作成する。これらの化合物の異なる組織系統の腫瘍細胞系における生物活性を測定し、非常に価値のある治療データを作成した。最も有効なカンナビノイド/天然抽出物をスクリーニングした。著者らの体外研究における目標は偽と天然カンナビノイド抽出物のライブラリーを構築し、癌細胞系ライブラリーに対する生物学的影響を明らかにすることである。HTS技術は私たちがより速い方法でこのデータベースを獲得し、癌遺伝学に関連するより多くの作用機序を掲示することを可能にした。我々 は現在,治療や結果に関する有意義な知見の発見を支援するために,我々のデータを複雑なデータマイニングと組み合わせている。
著者らの核心技術は絶えず発展している生物情報学プラットフォームであり、このプラットフォームは高スループットスクリーニング技術、先進的なデータ分析と独自の方法を利用して多種の大麻類化合物の腫瘍細胞に対する生理影響を迅速に測定する。この技術は数千種類のカンナビノイドの組み合わせをスクリーニングし、異なるカンナビノイドの配合と割合の抗腫瘍特性に関する複数のデータセットを生成することができる。我々は我々のバイオインフォマティクスプラットフォームを通じてカンナビノイドに対して広範な臨床前研究を行い、これは私たちの製品候補薬物の開発に情報を提供した。
 |
 |
| 26 |
著者らは発展しつつある臨床前バイオインフォマティクスプラットフォームを開発し、多種の大麻類化合物の各種癌細胞に対する生理影響を評価と分類できるようにした。最先端の高スループットスクリーニングとフローサイトメトリーを利用して、著者らのプラットフォームは毎週数千種類の化合物を測定することができ、著者らはそれらと絶えず増加するヒト癌細胞株と生検組織バンクとの相互作用を迅速かつ有効に検査することができる。我々のプラットフォームから発生した大量のデータにより,われわれはカンナビノイドの様々な治療作用やカンナビノイド比率モデルに関する深い知識を蓄積しており,これらのモデルは癌に意義のある生理的影響を証明している。
私たちのバイオインフォマティクスプラットフォームには次のようなものがあります
| Ø | 高スループットスクリーニング、高含有量スクリーニング、フローサイトメトリー、機械学習、ロボット学と独自の方法; |
| Ø | ヒト癌細胞のデータベースと数千種類の異なるカンナビノイド化合物の組み合わせと割合 |
| Ø | 生物反応データデータベースが増加しています |
| Ø | 内部抽出、加工方法と分析技術は、良好な特性と標準化を持つ抽出液を産生する |
| Ø | 規制された大麻生産者と協力して、私たちの大麻化合物庫を拡大し、未来の独自品種の道を提供してくれるかもしれない |
| Ø | 完全に統合された内部研究と開発 |
| Ø | 規制の専門知識。 |
特定の癌タイプに対して一連の潜在的活性を有するカンナビノイド が決定されると、私たちは体外培養そして体外でそれらの潜在的活性を決定するために 研究を評価する。この過程を通じて、私たちはそれらの治療可能性を評価することができる。著者らの臨床前実験の結果は著者らの臨床開発計画に起点を提供した
5.2.知的財産権
事業発展に必須的な技術、発明、そして商業機密を拡大して保護する。
知的財産権
私たちの成功は、以下に説明する私たちの一時特許を含む、私たちの製品の将来性、技術および独自の知識の固有の特性、他人の固有の権利を侵害することなく運営する能力、および他人の挑戦を防御し、私たちの固有の権利を侵害することを防止する能力に大きく依存する。
私たちは引き続きアメリカと他の国で私たちの独自技術のための特許保護を求める予定だ。これまで、私たちの知的財産権の組み合わせは、米国特許商標局に提出された私たちの業務に関連する3つの臨時特許(医薬製剤、薬物送達、大麻および他の大麻化合物の治療用途および個人化された大麻類診断)、ならびに技術的ノウハウおよび商業秘密を含む。
科学顧問委員会:
著者らの候補薬物の開発は著者らの臨床顧問チームの密接な指導と支持の下で行われ、このチームは世界的に有名な専門家から構成され、その中には癌研究、癌治療、腫瘍学、血液学、黒色腫、胃腸病学、人工知能とFDA監督領域に特定の専門知識を有する医師と科学者が含まれている。著者らの専門家チームは世界各地で非常に資格があり、尊敬されており、一部のメンバーは彼らの尊敬される名前で多くの出版物を発表し、“新イングランド医学と自然雑誌”のような高権威同業者評議の出版物に含まれ、数例だけを挙げた。
| 27 |
キャロライン·ロバート教授
Caroline Robert教授、医学博士、世界的に有名な黒色腫の専門家、フランスパリGustave Roussy研究所皮膚科主任。彼女はINSERM 981パリ南大学黒色腫研究部役員のパートナーでもある。Robert教授はヨーロッパ癌研究と治療組織(EORTC)黒色腫グループの前主席であり、現在ヨーロッパ腫瘍皮膚病協会(EADO)、ヨーロッパ医学腫瘍学会(ESMO)、ヨーロッパ皮膚性病学協会(EADV)、フランス皮膚病と性病学学会(SFD)、アメリカ腫瘍学会(ASCO)とアメリカ臨床研究協会(AACR)の取締役会メンバーである。
Amos Toren教授(医学博士)
Amos Toren教授は2001年からSheba医学センター小児科血液腫瘍科と骨髄移植科取締役主任、テルアビブ大学ザックラー医学院血液科教授を務めた。トルン教授は小児科学、普通血液学と小児科血液腫瘍学の専門家である。彼は遺伝学博士号を持ち、テルアビブ大学Recannati商学院衛生管理修士(MHA)の資格を取得した。br}Toren教授は大量の臨床研究を主宰し、研究者が発起し、会社が発起し、単センターと多センターを設立した。Amos Toren教授は2001年からシェバ医学センター児童血液腫瘍科と骨髄移植科の取締役主任を務め、テルアビブ大学ザックラー医学院血液科の教授でもある。
Zamir Halpern教授(医学博士)
Halpern教授はイスラエルテルアビブSourasky医療センター胃腸病研究所の高級内科医であり、イスラエル衛生部国家胃腸栄養と肝疾患委員会の現議長でもある。彼はイスラエル肝臓研究協会の議長、イスラエル胃腸病学会の議長、国家食糧·農業委員会の議長も務めた。Halpern教授,イスラエルテルアビブSourasky医療センター胃腸病研究所の上級医 である。
Noam Shomron教授(博士)
Noam Shomron教授は基礎科学を使ってより良い医療を推進することに熱中している。Shomron教授はテルアビブ大学医学院機能ゲノムチームの責任者で、マサチューセッツ工科大学で訓練を受けた。Shomron博士は多学科の科学者チームを指導し、このチームは人工知能を用いて生物医学領域のビッグデータを解析する計算方法を開発した。Shomronは30件以上の特許を有し,医学,農業,商業を含む複数のゲノム領域で同業者評議の200編近くの出版物を発表した。
Sigal Tavor博士(医学博士)
Tavor博士は現在イスラエルテルアビブAssuta医学センター血液腫瘍研究所で高級内科医を務めている。Tavor博士は現在イスラエルのヴァイツマン研究所で遺伝子治療研究に従事している。Tavor博士はテルアビブSourasky医療センター血液学と骨髄移植部門白血病部門の前代理責任者である。Tavor博士は2つのポストドクター奨学金を持ち、それぞれカリフォルニア大学ロサンゼルス校の血液と腫瘍系とイスラエル魏ズマン研究所免疫学系である。Tavor博士は同業者評議の定期刊行物に大量の白血病に関する文章を発表し、イスラエル血液学と輸血学会、ヨーロッパ血液学協会(EHA)、アメリカ血液学学会(ASH)とヨーロッパ白血病ネットワーク(ELN)のメンバーである。
Yonina Tova博士(医学博士)
Yonina Tova博士(MD)は国際的に公認されている放射腫瘍学者であり、アメリカ放射線学委員会(ABR)の認証を受け、現在イスラエルZIV病院放射線治療研究所に勤めている。Tova博士は1986年にシカゴイリノイ大学医学院で医学学位を取得し、放射線治療癌に専門的に従事し、放射線療法を用いて多種の癌を治療した。
| 28 |
エリズ·スカパ博士(医学博士)
スカパ博士は2000年にイスラエル海法理工学部で優秀な成績で医学博士号を取得した。彼はその後マサチューセッツ州ボストンのハーバード大学ブリグラムと婦人病院で肝疾患研究奨学金を獲得し,日本東京のNTT医療センターで内視鏡粘膜下剥離術研究員奨学金を得た。彼は侵襲性内視鏡検査の専門家で、結腸鏡検査と胃カメラ検査で豊富な経験を持っている。診断性と侵襲性内視鏡超音波に精通しており,2019年以来テルアビブSourasky医療センター内視鏡粘膜下解剖計画の担当者を務めてきた。Scapa博士はイスラエルテルアビブSourasky医学センター胃腸病研究所の高級内科医で、ハーバード大学ブリグラム女性病院で肝病学研究奨学金を受けたことがある。
アラン·ホフマン博士研究開発副社長
Hochman博士はテルアビブ大学ザックラー医学院癌免疫学博士号を持っている。Hochman博士は革新生物技術とスタートアップ会社の中で20年以上の多才な研究開発指導経験と管理職を持っている。
Lior Eshdat博士副社長
Eshdat博士は有機化学博士号 を持ち,14年を超える知的財産権実践経験を有している。イスラエル特許検事になる前,Eshdat博士はボルダー大学でポストドクター研究奨学金を持ち,動的有機光の高級化学者であり,同社はコロラド州でOLED表示技術を開発した。
ダナ·ベン·Ami Shor博士(医学博士)
Ben-Ami Shor博士はイスラエルテルアビブSourasky医療センターで公認されている侵襲性内視鏡と胃腸病学の専門家である。Ben-Ami Shor博士は2009年にテルアビブ大学サックラー医学院を優秀な成績で卒業し、医学博士号を取得した。彼女はイスラエルのSheba医療センターで内科と胃腸病学を専攻している。フロリダ州AdventHealth介入内視鏡センターの高度内視鏡(ASGE)認証奨学金の完成にも成功した。また,Ben−Ami Shor博士は診断と治療において内視鏡超音波(EUS)や内視鏡逆行性膵胆管造影術(ERCP)に精通している。Ben-Ami Shor博士はイスラエルテルアビブSourasky医療センターで公認されている侵襲性内視鏡と胃腸病学の専門家である。
Sigalit Arieli Portnoy博士(博士)
規制、検証、そして品質分野の上級顧問。Sigalit Ariely−Portnoy博士は製薬業界で17年以上の経験を有している。この間,太郎薬業有限会社で運営グループ副総裁を務め,Teva製薬 実業有限会社でカファサバOSD工場マネージャーを務め,製薬·化学工場を管理していた。Ariely−Portnoy博士はTevaの世界最大の工場(年間90億枚 ,収入20億ドルを超える)を管理している。彼女のキャリアの中で、彼女はアメリカFDA、EMEA、イスラエル保健省、他の機関の50回以上の検査をリードした。Ariely-Portnoy博士は率先して200,000平方フィートの製薬工場、いくつかの化学工場と生物倉庫を建設し、半固体、液体と経口固体製剤メーカーのために多くの重大な工場拡張を行った。2003年から2006年までの間に、エリ·ポートノイ博士はPDA(腸外薬物協会)イスラエル分会の総裁である。過去5年間に、Ariely-Portnoy博士はGSAPを管理しており、これはいくつかの主要な領域で製薬、医療設備と生物技術会社にコンサルティングを提供する会社であり、革新製品開発、監督管理、品質システムの構築と検証サービスを含む。Ariely-Portnoy博士はイスラエル海法理工学部化学工学と生物医学工学専攻の学士、修士、博士号を取得した。Sigalit Ariely−Portnoy博士は製薬業界で豊富な経験を持ち,太郎製薬 工業株式会社で運営グループ副総裁を務め,Teva製薬工業有限会社でOSD工場マネージャーを務め,製薬·化学工場を管理していた
ベンジャミン·デッカー教授(医学博士)
Dekel教授(医学博士)はイスラエル幹細胞学会の責任者であり,Sheba医学センター小児科腎臓病学部と小児科幹細胞研究所の責任者でもある。彼もテルアビブ大学の臨床研究革新と発展副院長、再生医学センターの腎臓病学と取締役主席でもある。
| 29 |
経営成果
2022年11月30日と2022年11月30日までの3ヶ月
運営費
2022年11月30日までの3ヶ月間の総運営費用は346,790ドルで、2021年11月30日までの3ヶ月の1,110,349ドルに比べて、私たちの総運営費用は763,559ドル減少しました。減少の原因は、一般行政費用が386,403ドル減少したことであり、主に取締役会シェアに基づく費用と研究開発費が377,156ドル減少したためである。
2022年11月30日までの3ヶ月間、10,879ドルの財務損失が発生しましたが、2021年11月30日までの3ヶ月の財務収入は212,670ドルでした。財務支出の減少は主に4,542ドルの転換可能な融資をリスコアリングしたためであるが、2021年11月30日までの3カ月は196,768ドルであった。そのため、2022年11月30日までの3カ月の純損失は357,699ドルだったが、2021年11月30日までの3カ月の純損失は1,323,020ドルとなった。
純損失
2022年11月30日までの3カ月間の純損失は965,321ドルから357,699ドル減少したが、2021年11月30日までの3カ月間の純損失は1,323,020ドルだった。
流動性と資本資源
概要
2022年11月30日まで、私たちの現金は21,600ドル ですが、2021年11月30日までは786,414ドルです。今後12ヶ月間の運営で少なくとも1,000,000ドルの費用が発生することが予想されます。 これらの費用には、管理費用、法律、会計費用、研究と開発費用、外部医療センターへの臨床研究の費用など、主に一般費用が含まれると予想されます。
2022年11月30日までの3ヶ月間の流動性と資本資源と2021年11月30日までの3ヶ月間の比較
2022年11月30日までの3カ月間、運営に使用した現金は95,915ドルだったが、2021年11月30日までの3カ月間の運営で使用された現金は599,545ドルだった。2022年11月30日までの3ヶ月間の経営活動のキャッシュフローがマイナスであり、主な原因は会社の純損失357,699ドル、売掛金と負債が2,687ドル増加し、売掛金と前払い費用が135,784ドル減少し、減価償却43,185ドル、転換可能なローン推定値4,542ドル、株式ベースの支払い75,557ドルである
2022年11月30日までの3ヶ月間、投資活動からのキャッシュフロー がないのに対し、2021年11月30日までの3ヶ月間の投資活動からのキャッシュフローは513ドルである。
私たちは私たちの費用を支払うために資金を集めなければなりません。私たちは株主にお金を借りたり、株式を発行したり、第三者と戦略的手配を達成しなければならないかもしれません。私たちが追加資金を得ることを保証することはできない。私たちは現在、銀行ローン、信用限度額、または他の資金源を通じて資金を得るための手配や了解に誰とも合意していない。私たちは今のところこのような計画や計画がないので、私たちの運営のために資金を集めることができません。これは私たちの会社の生存能力を維持することに深刻なマイナス影響を与えます。
経営を続ける企業
我々の現在の運営と資本支出能力には不確実性があるため、私たちの独立監査人は、2022年8月31日までの年度監査財務諸表に関する報告書に説明を加え、継続的に経営していく企業としての能力があるかどうかを説明している。私たちの財務報告書は、私たちの独立監査人がこの情報を開示することをもたらす追加の付記開示を含む。
| 30 |
私たちが審査していない財務諸表は持続的な経営を基礎として作成され、正常な業務過程で資産と負債を清算すると仮定している。私たちの持続経営企業としての経営継続能力は、私たちが将来利益運営を創出し、および/または必要な融資を得る能力にかかっており、私たちの義務を履行し、満期時に正常な業務運営による債務を返済することができます。 現在これらの事項を確定できない結果、私たちが持続的な経営企業として継続できるかどうかに対する深刻な疑いを引き起こしています。私たちが監査していない財務諸表には、資産や負債の金額や分類の調整は含まれていません。もし私たちが経営を続けることができなければ、これらの調整を行う必要があるかもしれません。
私たちの業務が利益を上げる保証はありません。私たちの持続的な生存と未来の成長計画は、収入を創出するか、追加の債務や株式を発行するか、運営に必要な追加資本を得ることができるかどうかにかかっている。
表外手配
私たちは現在、私たちの財務状況、財務状況の変化、収入または支出、運営結果、流動性、資本支出または資本資源に現在または未来に重大な影響を与える表外手配を持っていない。
肝心な会計政策
米国公認の会計原則に従って財務諸表を作成することは、財務諸表の日付の資産および負債の報告金額およびまたは資産および負債の開示に影響を及ぼすいくつかの推定および仮定を作成することを要求する。これらの推定数および仮定は、報告された期間の報告の収入および支出額に影響を与えると仮定する。私たちは歴史的経験と様々な私たちがこのような状況で合理的だと思う他の仮定に基づいて私たちの推定を行っている。異なる仮定や条件では,実際の 結果はこれらの推定値と大きく異なる可能性がある.私たちは財務諸表を作成する間に作成された重大な推定値を監視し続ける。私たちは歴史的経験と様々な他の要素と状況に基づいて、推定と仮定を継続的に評価します。私たちの推定と仮定はこのような場合には合理的だと信じている: しかし、異なる未来の条件では、実際の結果はこれらの推定とは異なる可能性がある。
我々が2022年11月29日に提出したForm 10−K年度報告書の項目7“経営陣の検討及び財務状況及び経営成果の分析”及び付記2“2022年8月31日現在の監査総合財務諸表における重要会計政策概要” を参照して、我々の重要な会計政策及び推定を検討する。
第3項市場リスクの定量的·定性的開示について
この項の下で要求される開示は、S-K条例第503(E)項によって定義されるので、より小さい報告会社によって報告されることを要求しない。
項目4.制御とプログラム
| (a) | 情報開示制御とプログラムの評価 |
当社は、取引所法案に基づいて提出または提出された報告書において当社が開示すべき情報が米国証券取引委員会規則および表で指定されたbr期限内に記録、処理、まとめおよび報告され、最高経営者および最高財務責任者(状況に応じて)を含む会社の管理層に蓄積および伝達するために、開示制御(Br)および手順(取引所法案第13 a-15(E)および15 d-15(E)条で定義されるような)のセットを維持し、必要な開示について適時に決定することを目的としている。証券取引法第13 a-15条(B)によると、本四半期報告書10-Q表がカバーされている期間が終了するまで、会社管理層(CEO、財務官、監査委員会を含む)は、監督·参加の下でその開示制御及び手続の有効性を評価している。監査委員会は、当社の開示制御および手順を評価、審査し、決定することが、本四半期の申告書類に有効である。この評価に基づき,取締役会は監査委員会の調査結果,すなわち11月30日までの会社の開示制御及び手続を受け入れて承認したこれは…。2022年までに、本四半期報告書10-Q表がカバーする期間が終了すると、合理的な保証を提供するために有効になり、取引法に基づいて提出または提出された報告で開示を要求される情報が、米国証券取引委員会規則および表で指定された期間内に記録、処理、まとめ、報告され、最高経営者、最高財務官、br}監査委員会(状況に応じて)を含む会社管理層に蓄積され、適切に決定されるように保証される。
| 31 |
| (b) | 財務報告の内部統制の変化 |
自分たちが前の報告書を提出して以来、会社は監査委員会を維持して、私たちの内部財務報告をよりよく検討してきた。11月30日までの間、財務報告における内部統制には他の変動はありませんこれは…。2022年には、我々の財務報告の内部統制に重大な影響を与えたり、合理的に重大な影響を与える可能性が高い。
| (c) | 内部統制の有効性の限界について |
読者に注意してください。私たちの経営陣は、私たちの開示統制と手続き、あるいは財務報告に対する私たちの内部統制がすべての詐欺や重大なミスを防止することを望んでいません。内部制御システムは,その発想や動作がどんなに良くても,絶対的な保証ではなく,制御システムの目標を実現するために合理的な保証を提供するしかない.すべての制御システムの固有の限界のため、いかなる制御評価 も、我々の制御範囲内のすべての制御問題および詐欺事例が検出されたことを絶対的に保証することはできない。 任意の制御システムの設計も、将来のイベント可能性のいくつかの仮定に部分的に基づいており、任意の制御設計がすべての潜在的な未来条件でその所定の目標を達成することに成功することを保証することはできない。時間の経過とともに制御 は条件の変化により不十分になったり,政策やプログラムへの遵守度が悪化したりする可能性がある.
| 32 |
第2部-その他の資料
項目1.法的訴訟
ない。
第1 A項。リスク要因
我々は取引法ルール12 b-2で定義されている小さな報告会社であり,本プロジェクトに要求される情報を提供する必要はない.
項目2.未登録証券の近いうちの販売
ない。
項目6.展示品
| 添付ファイル31.1* | 登録者首席執行幹事は,2002年の“サバンズ·オキシリー法”第302条(規則13 a−14(A)または規則15 d−14(A))に基づいて行われた認証。 |
| 添付ファイル31.2* | 登録者首席財務官は,2002年“サバンズ−オキシリー法”第302条(規則13 a−14(A)又は規則15 d−14(A))に基づいて発行された証明。 |
| 添付ファイル32.1** | 2002年サバンズ-オキシリー法案第906節で可決された“米国法典”第18編第1350条に規定する首席執行幹事の証明による。 |
| 添付ファイル32.2** | 2002年“サバンズ·オックススリー法案”第906節で可決された“米国法典”第18編第1350条に規定する首席財務幹事の証明。 |
| 101.INS*** | XBRLインスタンスドキュメントを連結する |
| 101.SCH*** | イントラネットXBRL分類拡張アーキテクチャ文書 |
| 101.CAL*** | インラインXBRL分類拡張計算リンクライブラリ文書 |
| 101.DEF*** | インラインXBRL分類拡張Linkbase文書を定義する |
| 101.LAB*** | XBRL分類拡張ラベルLinkbase文書を連結する |
| 101.PRE*** | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
| 104 | 表紙対話データファイル(添付ファイル101に含まれるiXBRLのフォーマット)。 |
______________________________
| * | 本局に提出します。 |
| ** | 手紙で提供する。 |
| *** | XBRL(拡張可能な商業報告言語)情報は、1933年の証券法(改正)第11条または12条の目的のために提供され、提出されていない、または登録声明または募集説明書の一部は、1934年の証券取引法(改正)第18条の目的に基づいて提出されていないとみなされ、そうでなければ、これらの条項の下での責任を負わない。 |
| 33 |
サイン
1934年“証券取引法”第13節又は第15(D)節の要求に基づいて、登録者は正式に正式に許可を委託した署名者がその代表を代表して本報告に署名する。
| CNBX製薬会社です。 | ||
| 日付:2023年1月13日 | 差出人: | /s/EYAL BARAD |
| エアル·バーラッド | ||
| タイトル: |
最高経営責任者 (首席行政主任) | |
| 日付:2023年1月13日 | 差出人: | /s/URIベンまたは |
| ウリー·ベンや | ||
| タイトル: |
首席財務官 (首席財務官) | |
| 34 |