
第424条(B)第5条に基づいて提出する
登録番号333-261073
目論見書副刊
(2021年11月24日現在の目論見書)

ATHIRA製薬会社
Up to $75,000,000
普通株
我々はすでに2023年1月6日にCantor Fitzgerald&Co.あるいはCantor FitzgeraldまたはCantor FitzgeraldおよびBTIG,LLCまたはBTIGと制御された持株権要約SM販売プロトコルを締結し、本入札説明書の付録および添付の入札説明書が提供する普通株式に関連し、1株当たり額面0.0001ドルである。コント·フィッツジェラルドとBTIGをエージェントと呼ぶ.販売契約の条項によると、本募集説明書補足書類及び添付の目論見書によれば、吾等は、総発行価格が75,000,000ドルに達する普通株式を、1人又は複数の代理人(各代理人は代理人又は依頼者)に時々透過又は販売することができる
我々の普通株はナスダック世界の精選市場に上場し、コードは“ATSA”である。私たちの普通株のナスダック世界ベスト市場での最後の販売価格は2023年1月5日、1株当たり3.41ドルです
本募集説明書付録及び添付の目論見書によれば、我々普通株の販売(あれば)は、改正された1933年“証券法”又は“証券法”公布の第415(A)(4)条に規定されている“市場発行”とみなされる販売中に行われる。エージェントは、具体的な数量または金額の証券を販売する必要はないが、代理店と私たちが共同で合意した条項に従って、その正常な取引および販売慣行に適合した商業的に合理的な努力を販売エージェントとする。いかなる代理管理、信託、または同様の手配で資金を受け取る予定は存在しない
販売契約によれば、各エージェントは、そのエージェントによって売却された普通株式販売総価格3.0%に相当する手数料を得る権利がある。私たちを代表して普通株を売るという点では、各代理人は証券法の意味での“引受業者”とみなされ、代理人の補償は引受手数料または割引とみなされる。私たちはまた、証券法または1934年に改正された証券取引法または取引法に規定された債務を含む、いくつかの責任について代理人に賠償と貢献を提供することに同意する。代理人補償に関するより多くの情報は、本募集説明書補編S-67ページから始まる“流通計画”というタイトルの部分を参照してください
私たちの普通株に投資することは危険と関連がある。私たちの普通株に投資する前に、本募集説明書増刊S-10ページから始まる“リスク要因”のタイトルと、本募集説明書の付録および添付の入札説明書に引用的に本明細書に組み込まれた他の文書に類似したタイトル下の情報をよく読んでください。
米国証券取引委員会およびどの州証券委員会もこれらの証券を承認または承認しておらず、本募集説明書の付録または添付の目論見書の十分性または正確性に基づいて判断されていない。どんな反対の陳述も刑事犯罪だ。
|
|
本募集説明書の増刊日は2023年1月6日です。
カタログ
目論見書副刊 |
|
ページ |
本目論見書の副刊について |
|
S-1 |
前向き陳述に関する注意事項 |
|
S-2 |
募集説明書補足要約 |
|
S-5 |
供物 |
|
S-9 |
リスク要因 |
|
S-10 |
収益の使用 |
|
S-65 |
配当政策 |
|
S-66 |
配送計画 |
|
S-67 |
法律事務 |
|
S-68 |
専門家 |
|
S-69 |
そこでもっと多くの情報を見つけることができます |
|
S-70 |
引用で法団として成立する |
|
S-71 |
目論見書 |
|
ページ |
本募集説明書について |
|
1 |
募集説明書の概要 |
|
2 |
リスク要因 |
|
5 |
前向きに陳述する |
|
5 |
収益の使用 |
|
5 |
株本説明 |
|
6 |
債務証券説明 |
|
7 |
預託株説明 |
|
13 |
手令の説明 |
|
15 |
引受権説明 |
|
16 |
仕入契約説明 |
|
17 |
単位説明 |
|
18 |
配送計画 |
|
18 |
法律事務 |
|
20 |
専門家 |
|
20 |
そこでもっと多くの情報を見つけることができます |
|
20 |
引用で法団として成立する |
|
20 |
S-I
本目論見書の副刊について
本募集説明書の付録及び添付の目論見書は、我々が米国証券取引委員会又は米国証券取引委員会に提出したS-3表登録説明書の一部であり、この登録説明書は“保留”登録手続を採用する。この保留登録手続きによれば、私たちは、添付の入札説明書に記載されている任意の証券の組み合わせを1つまたは複数の製品に時々提供および販売することができる。
添付の株式募集説明書は、発行可能な証券の一般的な説明を提供します。添付の株式募集説明書を使用して証券を発行するたびに、この発行条項に関する具体的な情報が含まれる1つ以上の目論見書補足資料を提供します。募集説明書の副刊はまた、添付の株式募集説明書中の情報を追加、更新、あるいは変更することができる
本募集説明書副刊、添付の入札説明書、および参照によって本明細書またはその中に組み込まれた文書は、私たちに関する重要な情報、私たちの普通株式、および投資前に理解すべき他の情報を含みます。本募集説明書付録は、価格、発行された普通株数、および我々の普通株に投資するリスクを含む今回の発行の具体的な詳細について述べている。添付の目論見書は我々に関する一般的な情報を提供しており、その中のいくつかは今回の発行に適用されない可能性があります
本募集説明書の付録のいずれかの陳述が添付の目論見書の記載と一致しない場合、本募集説明書の付録の記載は、添付の株式募集説明書の記載を修正または置換するものとみなされる。本募集説明書の付録および添付の目論見書、およびタイトル“どこでより多くの情報を見つけることができるか”に記載されている他の情報を同時に読まなければなりません
吾らまたは代理人は、本募集説明書の副刊および添付入札説明書に記載されているか、または参考方法で本募集説明書に組み込まれた資料を閣下に提供することを許可していない。他の人があなたに提供するかもしれない他の情報については、私たちは何の責任も負いませんし、その信頼性を保証することもできません。本募集説明書の付録、参照によって組み込まれた文書、および添付の入札説明書または無料で書かれた目論見書中の情報は、それぞれの日付においてのみ正確であると仮定しなければならない。これらの日付以来、私たちの業務、財務状況、運営結果、見通しに大きな変化が生じている可能性があります。
いずれの場合も、本募集説明書付録は、本募集明細書付録に記載されている証券以外の任意の証券の売却または購入の要約を募集することを構成しないか、またはそのような証券を購入する要約を売却または求めることを構成しない
文脈が別に説明されていない限り、本明細書の付録、添付の目論見、および参照によって本明細書および本明細書に組み込まれる情報において、“私たち”、“Athera”および“会社”は、Athera Pharma,Inc.およびそれらの完全子会社を意味する。
S-1
前向き陳述に関する注意事項
本募集説明書の付録、添付の入札説明書、および参照によって本明細書およびその中に組み込まれた文書は、我々の経営陣の信念および仮定、ならびに私たちの管理職が当時得ることができる情報に基づく前向きな陳述を含む。本募集説明書の付録、添付の入札説明書、および本明細書および参照によって組み込まれた文書に含まれる非純粋な歴史的陳述は、前向き陳述に属し、証券法第27 A節および取引法第21 E節の意味に適合する。
場合によっては、“予想”、“信じ”、“継続”、“可能”、“推定”、“予想”、“可能”、“進行中”、“計画”、“潜在”、“予測”、“プロジェクト”、“すべき”、“目標”、“将”、“将”、またはこれらの用語、または他の同様の用語の否定によって、前向きな陳述を識別することができる。すべての展望的声明書がこのような単語を含んでいるわけではないにもかかわらず。未来の予想を議論し、将来の運営結果や財務状況の予測を含む、または他の“前向き”情報を述べているので、これらの声明をよく読むべきだ。これらの陳述は、私たちの未来の計画、目標、期待、意図、および財政的表現、およびこれらの陳述が根拠とする仮定と関連がある。これらの前向きな陳述は、以下の態様に関する陳述を含むが、これらに限定されない
S-2
これらの展望性陳述はいくつかのリスクと不確定性の影響を受け、これらのリスクと不確定性は実際の結果と展望性陳述で予想されるものと大きく異なることを招く可能性がある。このような違いを引き起こす可能性のある要因には,本募集説明書付録の“リスク要因”の節で,我々の最近のForm 10−K年次報告と,我々の最近のForm 10−K年次報告後の最新のForm 10−Q四半期報告で議論された要因が含まれるが,これらに限定されない。これらの陳述は、本募集説明書の付録、添付の入札説明書、および参照によって本明細書および文書に組み込まれたすべての陳述と同様に、その日付までのみ記載されており、法的要件がない限り、将来の発展に応じてこれらの陳述を更新または修正する義務はない。我々のリスク要因は、本募集説明書の付録、添付の目論見書、または本明細書またはその中に組み込まれた情報を参照する日にそのような条件が存在しないことを保証するものではなく、そのようなリスクまたは条件が完全または部分的に達成されていない肯定的な宣言として解釈されてはならない。
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。これらの陳述は、本募集説明書の付録、添付された入札説明書、および参照によって本明細書およびその中に組み込まれた文書から得られた情報に基づいており、これらの情報は、このような陳述の合理的な基礎を構成していると考えられるが、このような情報は、限られたまたは不完全である可能性があり、私たちの陳述は、入手可能なすべての関連情報を徹底的に調査または検討したことを示すように解釈されてはならない。このような陳述は本質的に不確実であり、あなたにこのような陳述に過度に依存しないように想起させる。
本入札説明書の付録、添付の入札説明書、および参照によって本明細書に組み込まれた文書は、AThria、AThria Pharma、AThriaロゴ、およびAThriaの他の商標またはサービスマークを含む当社の商標および登録商標を含む。本募集説明書の付録、添付の入札説明書、および参照によって本明細書およびその中に組み込まれた文書に出現する他の各商標、商号、またはサービスマークは、その所有者に属する。
S-3
本募集説明書増刊において、“私たち”、“Athera”、“会社”とは、Athera Pharma,Inc.及びその完全子会社を意味する。
S-4
募集説明書補足要約
本要約は、本募集説明書の付録および添付の入札説明書において、より詳細に紹介されているか、または引用によって本明細書に組み込まれた精選情報を重点的に紹介している。それはあなたとあなたの投資決定に重要かもしれないすべての情報を含まない。私たちの普通株式に投資する前に、本募集説明書の副刊“リスク要因”の部分に記載されている事項を含む、株式募集説明書全体、添付された目論見説明書、および参照によって本明細書およびその中に組み込まれた情報をよく読み、当社のForm 10-K年間報告およびForm 10-Q報告を含む、組み込まれた財務諸表および関連する注釈および他の情報を参照する必要があります。文脈が別に説明されていない限り、本募集説明書の付録に記載されている“Athera Pharma,Inc.”、“We”、“Our”および“Us”は、総称してAthera Pharma,Inc.(デラウェア州の会社)およびその完全子会社と呼ばれる。
会社の概要
著者らは臨床末期の生物製薬会社であり、小分子の開発に集中して神経細胞の健康を回復し、神経退化を緩和する。我々の方法は,自然産生の保護および神経ネットワーク修復の機序である肝細胞増殖因子(HGF)/MET系,またはHGF/METを増強することを目的としている。HGF/METシグナルを増強することは,ニューラルネットワークを障害から保護·修復し,炎症を減少させ,再生を促進し,タンパク質病態を減少させ,疾患を変化させる可能性があると信じている。これらすべての特徴はニューロンの健康を改善し、臨床的利益に転化する可能性が予想される。我々の製品ラインは、(1)中枢神経系または中枢神経系に対して、血液脳関門または血液脳関門を横断することによって、および/または(2)末梢神経系を目的とした一連の小分子からなる我々の特許薬物発見プラットフォームまたはATHプラットフォーム上に確立されている
われわれの主要な候補薬であるFosgonimetonあるいはATH−1017は皮下注射,血液脳関門貫通,小分子HGF/MET系の正性調節剤である。フォトリメドンの主要な標的アルツハイマー病(AD)の治療効果は多くの臨床試験で評価されている
*ACT-AD試験は国家衛生研究院国家老齢研究所の贈与支援を受け、入賞番号はR 01 AG 06268であった。提供される情報は完全にAtheraが担当しており,必ずしも国家衛生研究院の公式的な観点を代表するとは限らない。
2021年7月,我々はLIFT−ADとACT−AD臨床試験のために26週間のオープンタグ拡張研究に患者を募集しており,フォゴニメゾンを用いた1年間の安全性データを収集できることを発表した。2022年5月,われわれのLIFT−ADとACT−AD臨床試験の26週間の開放ラベル延長研究をさらに12カ月延長し,いずれかの試験を完了し,進行中の開放ラベル延長に参加した合格者を選択し,現在18カ月にわたるフォソニー·メゾン開放ラベル治療を受けることができることを発表した。
S-5
次図に我々のATH化合物および発見と開発計画の現在の開発段階を説明した。また,われわれのATHプラットフォームを中枢神経系や末梢神経系の他の適応に拡張し,多様な疾患のニューロン健康を改善している。著者らの薬物発見はATH技術の潜在力を探索することに集中し、この技術はHGF/MET活性の各種臨床応用における応用を促進することを目的としている。
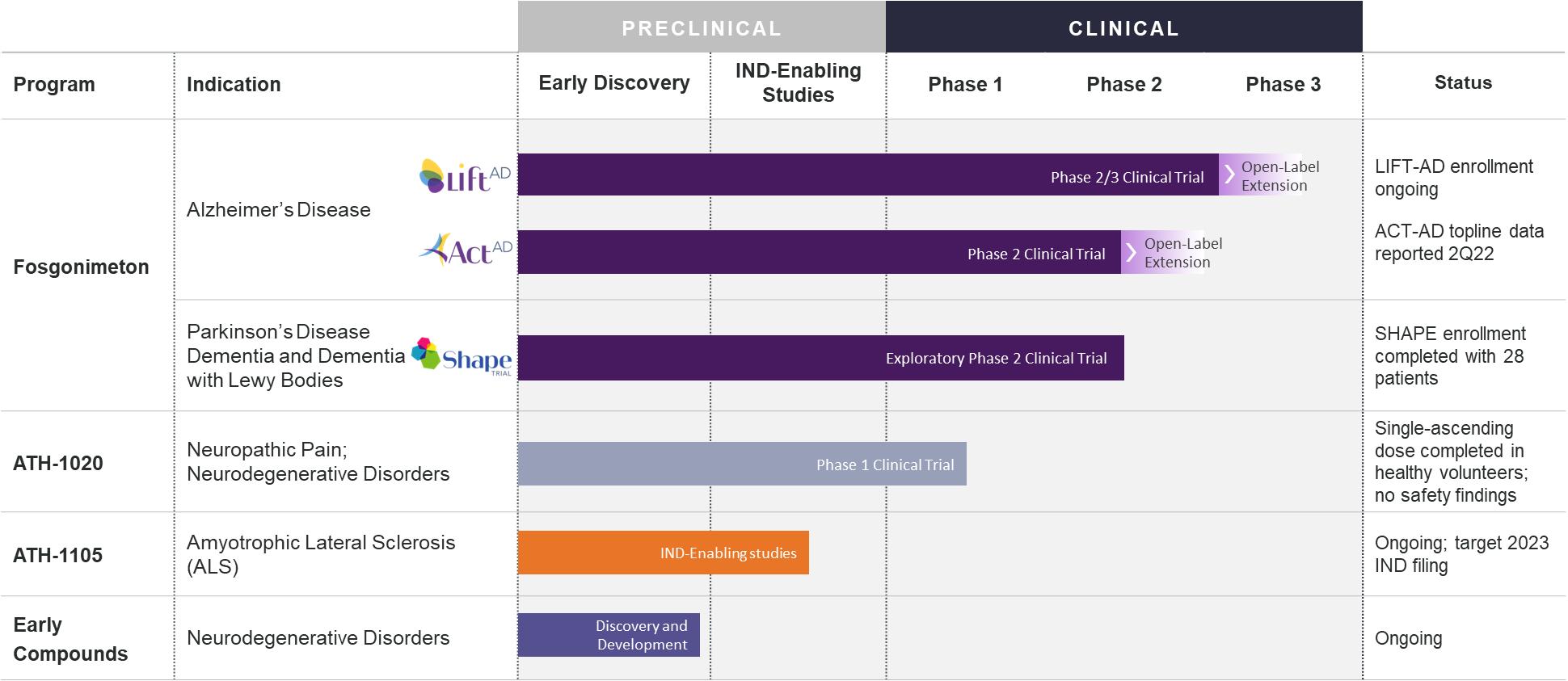
私たちは内部発見を通じて私たちの製品の組み合わせを拡大し、最適化し、私たちの革新的な内部研究開発能力を通じてより多くの外部業務開発活動を計画するように努力しています。
ある初歩的な財務状況情報
私たちは2022年12月31日までの年度連結財務諸表は公表されていません。本募集説明書増刊に掲載されている初歩的な財務データは管理職が作成し、管理層が担当する。私たちの独立公認会計士事務所安永会計士事務所は初歩的な財務データを監査、審査、作成、あるいは適用する取り決めの手続きを行っていません。したがって、安永法律事務所はこれについて意見を述べたり、他の形態の保証を提供したりしない。私たちや安永法律事務所は、以下の財務情報を調整する必要がある項目を確認するかもしれません。本募集説明書の付録公表日以降に、2022年12月31日までの監査された総合財務諸表を完成させる予定です。したがって、この初歩的な推定数に過度に依存してはならない。
2022年12月31日現在、私たちは約2.452億ドルの現金、現金等価物、投資を持っている。
リスク要因の概要
私たちの業務は本募集説明書の付録“リスク要素”の部分的に強調されたリスクと不確定要素を含む多くのリスクと不確定要素の影響を受ける。以下は私たちが直面している主なリスクの概要です
S-6
S-7
企業情報
私たちは2011年3月にワシントンでM 3 Biotech,Inc.の会社として設立されました。2015年10月、私たちはデラウェア州の会社に変わり、その後“Athera Pharma,Inc.”と改名しました。私たちの主な行政事務室は18706 North Creek Parkway、Suite 104、Bothell、Washington 98011にあります。私たちの電話番号は(425)620-8501です。私たちのサイトはwww.athira.comです。当社のウェブサイトに掲載されている或いは当社のウェブサイトを通じて取得できる資料は本募集定款増刊の一部ではなく、本募集定款増刊にも組み入れられないが、本募集定款増刊に掲載されている当社のウェブサイトの住所は非能動テキスト参考に過ぎない。
S-8
供物
普通株式を提供しています |
私たちの普通株の総発行価格は75,000,000ドルに達します。 |
発売後に発行される普通株: |
最大59,811,859株の私たちの普通株は、2022年9月30日までに発行された37,817,724株の普通株に基づいて、今回の発行では1株3.41ドルの発行価格で21,994,135株の私たちの普通株が売却されたと仮定し、これは2023年1月5日に私たちの普通株のナスダック全世界精選市場での最終報告販売価格である。実際に発行される株式数は今回発行された販売価格によって異なります。 |
配送計画: |
もしあれば、ナスダック世界ベスト市場で代理店を通じて時々行われるかもしれません。本募集説明書を参照してS-67ページから始まる“流通計画”を補編する。 |
収益の使用: |
今回の発行の主な目的は,研究開発活動や,運営資本や他の一般会社用途を含めた我々の運営を支援するための追加資本の獲得である。本募集説明書を参照して第S-64ページからの“収益の使用”を補編する。 |
リスク要因: |
私たちの普通株に投資することは危険と関連がある。本募集説明書の増刊S-10ページおよび添付の募集説明書の5ページ目からの“リスク要因”、および引用方式で本明細書およびその中に組み込まれた文書から識別されたリスクと不確定要素を参照してください。私たちの最新の10-K表年次報告および10-K表年次報告に続く最新の10-Q表四半期報告を含めて、投資決定を行う前によく考慮すべきリスクを検討してください。 |
ナスダック世界ベスト市場のマーク: |
“アザ” |
今回の発行後の我々普通株の流通株数は、2022年9月30日現在の37,817,724株流通株をベースとしており、含まれていない
なお,本入札明細書付録のすべての情報は,上記の未償還オプションを行使しないと仮定している.
S-9
リスク要因
私たちの普通株に対するどんな投資にも高い危険がある。本入札明細書の付録および添付の入札説明書に含まれているまたは引用的に組み込まれている他の情報に加えて、当社の普通株式に投資する前に、参照によって本明細書に組み込まれた我々の最新のForm 10−K年次報告およびForm 10−K年度報告後の最新のForm 10−Q四半期報告に記載された重要な要素を慎重に考慮しなければならない。より詳細な情報については、本募集説明書付録に“どこでより多くの情報を見つけることができるか”と“引用により会社に登録されている”と題する章を参照してください。
以下に言及する任意のリスク要因は、我々の業務、経営結果、または財務状況に重大な負の影響を与える可能性があり、それにより、私たちの普通株の取引価格を低下させる可能性がある。このような危険は唯一存在する可能性のある危険ではない。私たちが今知らないことや私たちがどうでもいいと思う他のリスクはまた私たちの業務運営を損なうかもしれない。あなたは投資の全部または一部を失うかもしれない。我々のリスク要因は,本募集説明書の付録までにこのような条件が存在しないことは保証されておらず,このようなリスクや条件がすべてまたは部分的に実現されていない肯定的な声明と解釈されるべきではない。
我々の業務と候補製品の開発に関するリスク
私たちは臨床末期の生物製薬会社で、運営の歴史は限られている。
著者らは臨床末期の生物製薬会社であり、小分子の開発に集中して神経細胞の健康を回復し、神経退化を緩和する。私たちの限られた経営の歴史は私たちの業務の成功を評価することを難しくするかもしれない。薬物開発は高度に不確実な仕事であり、大きなリスクに関連している。これまで、潜在的な重要な臨床試験を完成させておらず、候補製品のマーケティング承認を得ておらず、商業規模の候補製品を製造しておらず、第三者代表を配置していないし、成功した候補製品の商業化に必要な販売やマーケティング活動も行っていない。私たちの会社としての歴史は私たちの未来の成功と生存能力のどの評価も重大な不確実性の影響を受けます。私たちは臨床段階の生物製薬会社が急速に発展している分野でよく遭遇するリスクと困難に直面するが、私たちはまだこれらのリスクと困難を克服する能力を示していない。もし私たちがこのような危険と困難に成功的に対応できなければ、私たちの業務は影響を受けるだろう
Fosgonimetonまたは他の任意の候補製品の発売承認を支援するために、臨床試験を設計し、実行することができないか、または実行できないかもしれません。私たちは現在或いは計画中の臨床試験或いは任意の他の未来の臨床試験が時間通りに完成或いは成功するかどうかを確定することができない。米国食品医薬品局、FDA、または外国の規制機関が私たちの研究設計、案や案の修正や統計計画に同意するか、あるいは彼らが私たちのように臨床試験結果を説明し、私たちの候補製品の承認を求める申請を提出することができる前に、より多くの臨床試験を行う必要があるかもしれない。もし臨床試験の結果がFDAあるいは外国の監督管理機関を満足させてマーケティング申請を支持することができない場合、私たちは私たちの候補製品の潜在的な承認を支持するために、獲得できない可能性のある大量の資源をかけて追加の臨床試験を行う必要があるかもしれない。たとえ私たちの候補製品が規制部門の承認を得ても、このような承認の条項は私たちの候補製品の範囲と用途を制限する可能性があり、これはその商業的潜在力を制限する可能性がある。
私たちが収入を創出し利益を達成する能力は私たちが一連の目標を達成する能力に大きく依存する
私たちの業務は私たちの候補製品の成功的な発見、開発、商業化に完全に依存している。私たちは商業販売を許可されていない製品は、今後数年は製品販売から何の収入も得られないと予想されます。もしあれば。私たちが製品収入を作る能力は、Fosgonimetonと私たちの将来の1つ以上の他の候補製品の成功した臨床開発と最終商業化に大きく依存するだろう。私たちが収入を創出し利益を達成する能力は一連の目標を達成する能力に大きく依存しています
S-10
私たちは私たちの目標を達成することに決して成功しないかもしれないし、たとえ私たちが成功しても、利益を達成するのに十分な大きさや十分な収入が生まれないかもしれない。もし私たちが確実に利益を達成したら、私たちは四半期や年度の収益性を維持したり向上させることができないかもしれない。私たちが達成できず利益を維持していることは、会社の価値を低下させる可能性があり、私たちが研究開発努力を維持し、追加的に必要な資本を調達し、業務を発展させ、運営を継続する能力を弱める可能性がある。
私たちはまた、持続可能で反復可能で拡張可能な製造プロセスの開発、またはビジネスパートナーへのプロセスの移転において遅延に遭遇する可能性があり、これは、私たちの臨床試験を完了することを阻止するか、またはタイムリーに、または利益を得て、私たちの候補製品を商業化することを阻止するかもしれない。実施前に、生産プロセスまたは施設の変更は、FDAのさらなる比較可能な分析および承認を必要とし、これは、一貫性および持続的な安全性および有効性を証明するために、我々の臨床試験および候補製品の開発を延期する可能性があり、移行研究を含むより多くの臨床試験を必要とする可能性がある。
私たちは以前FDAに新薬申請やNDAを提出したこともなく、類似した外国規制機関に任意の候補製品の類似承認文書を提出したこともない。NDAまたは他の関連する規制申告文書は、候補製品が各必要な適応に対して安全かつ有効であることを決定するために、大量の非臨床データおよび臨床データおよび支援情報を含まなければならない。セキュリティプロトコルまたは他の関連する規制文書はまた、製品の化学、製造、および制御に関する重要な情報を含まなければならない。私たちは私たちの現在または未来の候補製品が臨床試験で成功するかどうかを確認できない。また、彼らが臨床試験で成功しても、私たちの候補製品や任意の未来の候補製品は規制部門の承認を得られない可能性がある。もし私たちが現在または未来の候補製品が規制部門の承認を得られなければ、私たちは運営を続けることができないかもしれない。私たちが規制部門の承認を得て候補製品を販売することに成功したとしても、私たちの収入は、規制部門の承認を得て商業権を持つ地域の市場規模と、製品の可用性を競争し、十分な第三者精算や医師の採用があるかどうかにある程度依存するだろう。
S-11
私たちが開発したフォソニーメドンは決して適切な製品が生まれないかもしれません
私たちはニューロンの健康を回復するための小分子としてフォゴニドンを開発している。私たちはまだ規制部門からフォソニーメドンの承認を得ておらず、私たちの方法が単独あるいは他の治療法と組み合わせて承認可能または販売可能な製品の開発につながることも確認できない。シナリオ分析はACT-AD試験の主要な終点に達していない。LIFT−AD研究を継続した場合,われわれのLIFT−AD試験や他の臨床試験でフォソニーメタゾンの安全性と有効性を証明することに成功しない可能性がある。
ニューロンの健康を回復するための小分子として、フォゴンメドンを発展させることは、私たちに大きな挑戦をもたらしました
私たちの見通しはフォシノンの成功的な開発に大きくかかっている。Lift-AD試験においてフォソニー·メゾンの安全性と有効性を証明していなければ、株主価値を最大化するための戦略代替案を探索する可能性があり、これには、可能な合併、業務合併、投資、購入、許可または他の資産買収、または株主への資本返還の可能性が含まれるかもしれないが、これらに限定されない。
我々が小分子を用いて脳増殖因子を標的とする方法は,新たな治療法に基づいており,予見できないリスクに直面している。これまで,われわれの1 a/1 b期と2期臨床試験のデータは限られており,将来の試験が候補製品の安全性,有効性,耐性を支援するデータが生じるかどうかは決定できなかった
我々はすでに小さな分子候補製品プラットフォームを発見し、開発しており、私たちはこのプラットフォームの中から私たちの主要な候補製品Fosgonimetonを選択し、AD、パーキンソン病痴呆(PDD)、ルイ体痴呆(DLB)の治療のために開発中である。我々の候補製品は内因性脳成長因子を対象としており,ニューラルネットワークの保護と修復が期待され,最終的に臨床結果や疾患関連バイオマーカーの改善を招く可能性があると信じている。神経変性疾患における脳成長因子の治療将来性は早期の治療において阻害され、有効かつ非侵襲的な脳送達が乏しいためである。我々の小分子候補製品は血液脳関門を貫通し、脳成長因子の活性を増強することを目的としているが、私たちの候補製品の適用患者における安全性と有効性を確定することはできず、私たちの臨床試験が私たちの設計方法が期待した治療効果を産生したことを証明するのに十分な証拠を提供することはできない
著者らの今までの非臨床と臨床研究結果によると、フォソニー·メコンは迅速に認知、機能を改善し、AD患者の生活を回復する潜在力があると信じている。しかし,これらの考え方やこの方法は新規であり,現在1 a/b期と2期臨床試験に基づくデータは限られている
プロトコル分析により,われわれの第二段階ACT−AD臨床試験の主な終点は達成されなかった。その後、背景治療を受けていないフォソニーメタゾン或いはAChEIs患者の予め指定された亜群のデータを事後分析したところ、プラセボと比較して、26週時のERP P 300潜伏期と認知能力は有意に改善したが、統計学的に有意な意義はなかった。後期分析は治療効果を確定することができないが、これらの分析は現在と未来の臨床研究の設計を指導するのに役立つことができる。1つの非盲目の中期治療効果と無効性分析の後、1つの独立したデータ監視委員会は軽中度AD患者の中でフォゴニミドンのLIFT-AD研究を継続することを提案した。委員会はまた,150名未満の患者の追加登録や,総登録300名未満の背景治療(AChEIs)のない患者に伴い,観察された初歩的な効果の大きさを考慮して,主な終点に良好な原動力を提供することを確認した。我々のACT−AD試験や我々の中期分析結果から我々が行っているLIFT−AD試験の修正が最終的に実験成功を招く保証はない。例えば,我々のバイオマーカーデータは統計的に有意な臨床的利益に変換されない可能性があり,FDAは我々の統計計画や分析に同意しない可能性があり,あるいは試験には我々の終点測定を行うのに十分な動力がない可能性がある。
これまで,われわれの1 a/1 b期と2期の臨床試験のデータは比較的少ない被験者からであり,将来的により多くの被験者や臨床地点に関連する試験が候補製品の安全性,有効性,耐性を支持するデータが生じるかどうかは決定できなかった。最終的にはフォゴニドンや他のどの小分子も治療効果に必要ないくつかの特性を持っていないことが分かるかもしれません我々の製品プラットフォームでは,フォソニドンや他の小分子の有効性,安全性,耐性に関する証拠は限られている。私たちはこのような候補製品を開発しようとする多くの資金を使うかもしれないが、決して成功しないだろう。
S-12
著者らは研究開発努力を中枢神経系と末梢退行性疾患の治療に集中し、これは製品開発の面で非常に限られた成功を収めた領域である
著者らの研究と開発努力は中枢神経系(CNS)と末梢退行性疾患の解決に集中している。全体的に言えば、製薬会社の中枢神経系と末梢退行性疾患領域における努力は製品開発の方面での成功は非常に限られている。中枢神経系療法の開発は独特な挑戦に直面しており、生物学に対する理解が不完全であり、血液脳関門或いは血液脳関門の存在が薬物の脳への流動を制限する可能性があり、臨床前研究結果はその後の臨床試験と投与量の選択においてよく翻訳性が不足し、及び候補製品の効果が小さすぎて臨床試験中に選択した結果指標を使用できない可能性があり、或いは測定した結果が統計学的意義に達していない。ADと他の中枢神経系或いは末梢疾患の患者に対して、有効な治療選択は少ない。著者らの未来の成功は著者らの中枢神経系と末梢疾患を治療する技術と候補製品の成功開発に高度に依存している。中枢神経系および末梢疾患を治療するための候補製品を開発し、承認された後に商業化することは、私たちが最適な用量を選択したことを確保し、適切な臨床試験を実行して有効性をテストすることと、FDAと他の監督管理機関の監督許可を得ることを含む多くの挑戦に直面するであろう。
私たちの取締役会の独立特別委員会は、私たちの元最高経営責任者と彼女がワシントン州立大学で博士研究を行っている共同で書いた論文を審査しました。特別委員会の調査結果は、(I)私たちの元最高経営責任者が2011年の博士論文で画像を改ざんしたことと、ワシントン州立大学の大学院生の時に人と共著し、2011年から2014年までに発表した少なくとも4つの研究論文、(Ii)いくつかの通信やアプリケーションで疑問視された研究論文を引用し、(Iii)WSUの独占ライセンスが私たちに与えた二六六特許には、いくつかの変更された画像が含まれている。ワシントン州立大学は、私たちの元最高経営責任者がワシントン州立大学で博士研究を行った潜在的な研究不正行為に関する疑惑を審査しました。WSUの調査がいつ完了するかは予測できず,WSUがどのような結論に達するかも予測できない
私たちの取締役会の独立特別委員会は、Kais博士が彼女の博士研究に関連した研究でKais博士が使用した画像の改ざん疑惑を含む、私たちの元最高経営責任者Leen Kais博士と西テキサス州立大学で博士研究を行っている共著者が共著者と共同で書いた論文の審査に参加した
独立特別委員会の主な発見は、2011年の博士論文と少なくとも4つの研究論文で私たちの元最高経営責任者がイメージを改ざんしたことであり、これらの論文はウィスコンシン州立大学で大学院生の時に人と共著し、2011年から2014年まで発表された。告発された行為は、私たちの現在の任意の候補製品または行われている臨床研究とは無関係であるが、この発見は、私たちの名声、私たちのライセンス内の特許、および係属中の特許出願、許可およびライセンスに実質的な悪影響を及ぼす可能性があり、FDAを含む政府機関のさらなる調査をもたらす可能性があり、いずれも私たちの業務および将来性に重大な悪影響を及ぼす可能性がある。“私たちのどんなキーパーソンの流失も、私たちの業務、運営結果、競争地位を深刻に損なう可能性がある”というように、2021年10月18日、Kais博士は辞表を提出し、総裁兼最高経営責任者と取締役会のメンバーを辞任し、2021年10月18日から発効した。ケヴァス博士が辞任すると同時に、私たちの取締役会はマーク·リトン博士兼工商管理修士を総裁兼最高経営責任者と取締役会メンバーに任命した。
本募集説明書の付録に開示されているように、“リスク要因”の節で“私たちと私たちのいくつかの役員と幹部は、巨額のコストを招き、経営陣の注意をそらす訴訟の被告とされている”と題され、最新の四半期報告10-Q表の“第2部、第1項-法律訴訟”では、引用によって本明細書に組み込まれ、Kawas博士や他の関係者が告発された不正行為に関する虚偽や誤解に関する訴訟を提起しており、Kawas博士や他の関連者が告発された虚偽や誤解に関する訴訟を起こしている。これらの告発と、私たちと私たちのいくつかの役員や上級管理職に対する持続的な訴訟および関連事項のため、私たちは否定的な宣伝の対象となってきた。このような否定的な宣伝は、現在および未来の投資家、政府規制機関、特許庁、裁判所、現在および未来の従業員、重要なオピニオンリーダー、潜在的な協力者、提唱団体、私たちの臨床試験に参加する現在および未来の患者、医師および潜在的な患者とサプライヤーとの信頼、名声、および関係を損なう可能性がある。例えば、このような負の宣伝は、私たちが才能のある従業員を募集し、採用し、CRO、臨床試験場所、その他の各方面との既存の業務関係を維持し、新しい業務関係を確立し、患者を私たちの臨床試験に参加させ、将来実行可能な業務を維持する能力に悪影響を及ぼす可能性がある。また、負の宣伝と私たちの職場環境への影響は、私たちの従業員の雇用関係を終了させる可能性があり、彼らが引き続き私たちに雇用されていれば、士気低下を招き、私たちの業務に実質的な悪影響を及ぼす可能性がある。また、, 否定的な宣伝は私たちの株価に悪影響を与え続ける可能性があります
S-13
したがって、従業員たちと潜在的な従業員たちは私たちのところで働くことを求めたり続けたりする傾向があまりないかもしれない。したがって、私たちの業務、財務状況、運営結果、キャッシュフローは重大な悪影響を受ける可能性があります。
ワシントン州立大学は、私たちの元最高経営責任者がワシントン州立大学で博士研究を行った潜在的な研究不正行為に関する疑惑を審査しました
先に述べた取締役会独立特別委員会の調査に加え、西豪州立大学は、カヴァス博士が西豪州立大学博士の学習中に行った潜在的な不正行為を検討した疑いを審査したと発表した。私たちはこの審査が進行中であることを知っており、調査が最終的に私たちの業務や名声にどのような影響を与えるかを予測することはできない。私たちはまたWSUの調査がいつ完了するのか正確に予測できない。WSUが行っている調査は、我々の取締役会独立特別委員会の調査とは異なる結論を得ることができるか、または他のまたは異なる情報を発見する可能性があり、我々の取締役会の独立特別委員会は、“-私たちの取締役会の独立特別委員会が、ワシントン州立大学で博士研究を行っている彼女と共同で執筆した論文の審査に参加する”でこの調査の結論を検討する。特別委員会の調査結果は、(I)私たちの元最高経営責任者が2011年の博士論文で画像を改ざんしたことと、ワシントン州立大学の大学院生の時に人と共著し、2011年から2014年までに発表した少なくとも4つの研究論文、(Ii)いくつかの通信やアプリケーションで疑問視された研究論文を引用し、(Iii)WSUの独占ライセンスが私たちに与えた二六六特許には、いくつかの変更された画像が含まれている。ワシントン州立大学は、私たちの元最高経営責任者がワシントン州立大学で博士研究を行った潜在的な研究不正行為に関する疑惑を審査しました。WSUの調査がいつ完了するかは予測できず,WSUがどのような結論に達するかも予測できない。WSUの調査結論は我々の業務に実質的な悪影響を及ぼす可能性がある, これには、私たちの名声、科学的信頼性、および私たちのライセンス内特許と承認されるべき特許出願、現在のライセンスおよび承認されるべき出願、およびWSUとの関係が含まれており、私たちはWSUから特許および特許出願許可を取得しており、これらの特許および特許出願は私たちのいくつかの候補製品の基礎となっている。
私たちは将来的にクレーム、訴訟、仲裁手続き、政府調査、その他の法律、規制、行政手続きの影響を受け、潜在的な責任と関連費用に直面する可能性があり、これは私たちの業務、経営業績、財務状況に重大な悪影響を及ぼす可能性がある。
私たちは将来的にクレーム、訴訟、仲裁手続き、政府調査、その他の法律、規制、行政手続きの影響を受ける可能性がある。2022年11月、私たちは司法省民事司の民事調査訴求、あるいは訴求を受けた。この需要は、私たちがWSUとの関係に関する文書や情報を求め、2016年と2019年に米国国立衛生研究院(NIH)に提出したいくつかの支出申請と、2020年に私たちが受けたNIH支出です。私たちは法務省とこの要求について協力している。このまたは任意の他の調査、クレーム、または訴訟の結果は、どの程度の確実性予測もあってはならない。正常な業務過程において、私たちは、将来も様々な法律クレームの対象になる可能性があります。私たちに対するクレーム、調査、または訴訟は、正当な理由があるか否かにかかわらず、時間がかかり、高価な訴訟を招き、私たちの名声を損なう可能性があり、管理層の高度な関心を必要とし、大量の資源を移転する必要があり、そのようなクレーム、調査または訴訟の解決は、重大な損害賠償、和解費用、罰金または罰金をもたらす可能性があり、これらは、私たちの業務、財務状況、または経営結果に悪影響を与え、あるいは私たちの名声やブランドが損害を受け、制裁、同意法令、禁止、または他の業務慣行を変更する必要がある救済措置をもたらす可能性がある。
さらに、場合によっては、投資家、取締役、上級職員、顧客、サプライヤー、または他の第三者賠償を代表し、法的費用を招く契約または他の法的義務がある可能性があります。例えば、私たちは、私たちの役員と上級管理者を最大限に補償し、私たちの従業員、代理人、他の人たちに賠償する可能性があるという規定を改正して再説明します。取締役や役人と賠償協定も締結しており、これらの職務を担当することで生じる可能性のあるクレームを賠償することを求めています。これらの賠償協定はまた、このようなクレームを調査または抗弁する際に合理的かつ実際に発生した費用を立て替えることを要求しており、もし事実がその人が賠償を受ける資格がないことを証明すれば、いかなる立て替え費用を回収することが難しいか、または回収することができないかもしれない。もし私たちが私たちの任意の投資家、役員、上級管理者、従業員、顧客、サプライヤー、または他の第三者に弁護または賠償を提供すること、または彼らに費用を前借りすることを要求または同意された場合、私たちは私たちの業務、運営結果、または財務状況に悪影響を及ぼすかもしれない重大なコストと支出を生じるかもしれない。
臨床開発は1つの長く高価な過程と不確定な結果に関連し、早期、比較的に小規模な臨床前研究と臨床試験の結果は複数の臨床試験場所にまたがる大規模な肝心な臨床試験の最終安全性或いは有効性を予測できないかもしれない。われわれは臨床試験において重大な遅延に遭遇する可能性があり,あるいは予想されるスケジュール内で臨床試験を行うことや完成できない可能性があり,まったくなければ
S-14
私たちの主要な候補製品であるフォソニーメドンはAD、PDDとDLBを潜在的に治療するために臨床開発を行っている。われわれの他の早期候補は,筋萎縮性側索硬化症のためのATH−1105を含めて非臨床開発が行われており,ATH−1105については2023年のIND申告に準備されている。私たちの候補製品がいつ、あるいは人体で効果的で安全であることが証明されるか、あるいは規制部門の承認を受けるかどうかを予測することはできない
私たちの候補製品の商業化販売が規制される前に、私たちは長い、複雑で高価な非臨床研究と臨床試験を通じて、私たちの候補製品が各目標適応に対して安全かつ有効であることを証明しなければならない。非臨床や臨床試験は費用が高く,完成までに数年かかる可能性があり,その結果自体は不確定である。非臨床研究と臨床試験過程でいつでも失敗が発生する可能性があり、しかも私たちの候補製品は開発の初期段階にあるため、失敗のリスクが高く、私たちは決して適切な製品の開発に成功しないかもしれない。著者らの候補製品の非臨床研究と早期臨床試験の結果は後期臨床試験の結果を予測できないかもしれない。候補製品は非臨床研究および早期臨床試験において有望な結果を示す可能性があるが、その後の臨床試験では安全でないか有効であることが証明される可能性がある。例えば,動物で実験を行う条件は人間で実験を行う条件とは異なるため,動物研究の結果,人間における安全性や有効性を正確に予測できない可能性がある。非臨床研究や臨床試験による候補製品の失敗は,通常極めて高い流出率を招く。非臨床研究と初歩的な臨床試験で進展を得たが、臨床試験後期段階の候補製品は必要な安全性と有効性を示すことができないかもしれない。例えば,我々の1 a/b期臨床試験は88名の患者を募集し,そのうち11名のみが軽中度AD患者であり,そのうち7名の患者がフォゴニドン治療を受け,残りの4名の患者はランダムに対照群に割り当てられ,脳機能への潜在的な積極的な影響を含む大脳ネットワーク活動の改善が示唆された。しかし、, 著者らの第二段階ACT-AD臨床試験は更に大きな患者群を含み、その中の約60%は標準看護AChEIsを受けたが、全研究群のERP P 300潜伏期変化の主要な終点に達しなかった。予め指定されたサブグループにおけるACT-AD結果の事後分析によると、背景アセチルコリンエステラーゼ阻害剤(AChEIs)がない場合、フォゴニメドン単独投与患者の認知、機能、および神経変性指標は積極的な効果があることを示しているが、将来の試験からのデータが早期の発見を支持するか、またはフォゴニミドン治療ADの安全性および有効性がFDAを満足させることを証明し、監督部門の承認を支援することはできない。同様に、早期の比較的小規模な研究、バイオマーカー分析、単一或いは比較的に少ない臨床試験地点を有する臨床試験は、複数の臨床試験地点にまたがる大規模な重要な臨床試験の最終安全性と有効性を予測できない可能性がある。重要な臨床試験からのデータが積極的であっても、規制機関は、このようなデータが承認されるのに十分でない可能性があり、追加の臨床試験を要求する可能性があり、これは、予想される開発スケジュールを大幅に遅らせる可能性があり、このような追加の臨床試験に追加的な資金を提供し、私たちの業務に悪影響を及ぼす可能性がある。ADの性質により,Fosgonimeton規制の承認を得る能力はさらに複雑化しており,これは歴史的に薬物開発の挑戦的な適応であった。生物製薬業界のいくつかの会社は高級臨床試験で重大な挫折を受け、早期の試験で良好な結果を得たが、治療効果の不足或いは受け入れられない安全性の問題が存在する。非臨床研究や臨床試験を開始した候補製品の多くは製品として承認されなかった。
ある場合、多種の要素のため、同一候補製品の異なる非臨床研究と臨床試験の安全性或いは有効性結果は著しい差が存在する可能性があり、方案中に規定された臨床試験プログラムの変化、患者群の大きさとタイプの差異、臨床試験方案の変化と臨床試験方案に対する遵守及び臨床試験参加者の退学率を含む。例えば,われわれの第二段階ACT−AD臨床試験のTOPLINE結果は,われわれの1 a/b相臨床試験の治療データとは異なる可能性があり,少なくとも一部の原因は,患者群,治療持続時間,データ分析の違い,背景AChEI治療の潜在的影響であると考えられる。もし将来の実験がフォゴニミドンと付加標準看護AChEIsとの併用の効果が弱まっていることを示すならば、私たちはより狭い適応を求める必要があるかもしれないし、私たちの目標集団をフォゴニドンがより大きな効果を示す人たちに制限することは、私たちの業務と将来性に実質的な悪影響を及ぼすかもしれない。
2021年7月6日,LIFT-ADとACT-AD試験を開始したオープンタグ延期を発表し,2022年5月にオープンタグ延期をさらに12カ月延長することを発表した.LIFT−ADあるいはACT−AD試験期間中に26週間の治療期間を完了した後,開放ラベル延長治療を継続し,Fosgonimetonの18カ月にわたる追加治療を受けることができる。最初の試験では,研究者と患者は治療群の分配を盲目的に維持した。このような開放ラベル拡張研究は,我々が将来行っているいくつかの臨床試験は,限られた数の臨床サイトで限られた数の患者に対する研究設計における開放ラベルである可能性がある。オープンタグ“臨床試験”とは、患者および研究者の両方が、患者が研究製品候補を受け入れているかどうかを知っているかどうか、または既存の承認薬またはプラセボを意味する。最も典型的には,オープンラベル臨床試験は候補の研究製品のみをテストし,異なる用量レベルで試験を行う可能性がある。開放ラベル臨床試験は様々な制限を受けており,これらの制限は任意の治療効果を誇張する可能性があり,開放ラベル臨床試験中の患者が治療を受ける際に知られているからである。オープンラベル臨床試験は“患者偏見”の影響を受ける可能性があり,すなわち患者が症状が改善したと考えているのは,実験的治療を受けていることを意識しているだけである。また,オープンラベル臨床試験は,“調査者偏見”の影響を受ける可能性があり,すなわち臨床試験の生理結果を評価·審査する人は,どの患者が治療を受けているかを知り,その知識を知っている場合に治療群の情報をより有利に解釈することが可能である。
S-15
もし臨床試験が著者ら、臨床試験を行う機関審査委員会やIRBs、臨床試験のデータ安全監視委員会あるいはFDAなどの外国の監督機関によって一時停止または終了された場合、私たちも遅延に遭遇する可能性がある。臨床試験は様々な原因で遅延或いは終了する可能性があり、以下の項目に関連する遅延或いは失敗を含む
また,海外で臨床試験を行うことは,候補製品のためにしようとしているように,追加のリスクをもたらし,臨床試験の完成を遅らせる可能性がある。これらのリスクには,外国に登録された患者が医療サービスや文化的慣習の違いにより臨床案を遵守できなかったこと,外国規制計画に関する追加行政負担を管理すること,およびこのような外国に関連する政治的·経済的リスクがある。
また,われわれの臨床試験の首席研究員は時々私たちの科学コンサルタントやコンサルタントを務め,このようなサービスに関する報酬を得る可能性がある。場合によっては、私たちはFDAまたは同様の外国規制機関にいくつかの関係を報告することを要求されるかもしれない。FDAや同様の外国の規制機関は結論を出す可能性があり、私たちと主要な研究者との財務関係は利益の衝突をもたらしたり、他の方法でこの研究の解釈に影響を与えたりする。したがって,FDAや同様の外国の規制機関は,適用された臨床試験地点で発生するデータの完全性を疑問視する可能性があり,臨床試験自体の効用が脅かされる可能性がある。これは、FDAまたは同様の外国規制機関が私たちの上場申請の承認を遅延または拒否することを招き、最終的に私たちの1つ以上の候補製品が上場承認を拒否することにつながる可能性がある。もし私たちが任意の候補製品の臨床試験の完了を遅延または終了すれば、私たちの候補製品のビジネスの将来性は損なわれ、これらの候補製品から製品収入を得る能力は延期されるだろう。また、臨床試験を完成するいかなる遅延も私たちのコストを増加させ、私たちの候補製品の開発と承認過程を緩和し、そして私たちの製品販売と収入を創造する能力を危険にさらす。
もし私たちの現在と未来の臨床試験結果が私たちの候補製品に対する治療効果が定説がなければ、もし私たちが統計と臨床的意義のある臨床終点に達していなければ、もし私たちの候補製品に安全問題があれば、私たちは:
S-16
著者らが時々発表或いは公表した臨床試験中の任意の“背線”、中期、初期或いは初歩データはより多くの患者データの出現に従って変化する可能性があり、そして監査と検証プログラムの制限を受け、これは最終データの重大な変化を招く可能性がある
著者らは時々著者らの非臨床研究と臨床試験の初歩的或いは主要なデータを公開開示する可能性があり、これらのデータは当時使用可能なデータの初歩的な分析に基づいて、特定の研究或いは臨床試験に関連するデータに対してより全面的な審査を行った後、結果及び関連する発見と結論は変化する可能性がある。私たちはまた、私たちのデータ分析の一部として、すべてのデータを全面的かつ詳細に評価する機会がないか、または受け取る機会がないかもしれないという仮説、推定、計算、および結論を出した。したがって、私たちの報告の裏線または予備結果は、同じ研究の将来の結果と異なる可能性があり、またはより多くのデータを受信して十分に評価されると、異なる結論または考慮要因がこれらの結果を合格させる可能性がある。バックラインデータはまだ監査と確認手続きを受ける必要があり、これは最終データが私たちが以前に発表した予備データと大きく異なる可能性がある。したがって、最終データが利用可能になる前に、バックラインデータは慎重に表示されなければならない。
時々,我々の非臨床研究や臨床試験の中期データを開示することも可能である。例えば、私たちは2022年10月に、1つの独立したデータ監視委員会がすでに私たちの2/3期Lift-AD臨床試験に対して盲目でない中期治療効果と無効性分析を行ったと発表した。私たちが完成する可能性のある臨床試験の中期データは、患者登録の継続とより多くの患者データの獲得に伴い、あるいは私たちの臨床試験の患者が彼らの疾患の他の治療を継続するにつれて、1つまたは複数の臨床結果が実質的に変化する可能性があるというリスクを受ける可能性がある。初期または中期データと最終データとの間の不利な違いは、私たちのビジネスの将来性を深刻に損なう可能性があります。しかも、私たちまたは私たちの競争相手が中間データを開示することは私たちの普通株の価格変動を招くかもしれない。
そのほか、著者らは臨床試験から受け取ったデータに基づいて、初歩的であっても最終的であっても、将来の臨床試験に意思決定根拠を提供し、試験設計、試験規模及びより多くの臨床試験を起動するかどうかを含む。例えば,2020年11月にACT−ADを開始し,フォゴニドンの作業記憶処理速度や認知測定に対する全体的な影響をより良く知るための探索的な第2段階臨床試験である。ACT−ADのバックライン結果は2022年6月に公表された。我々は,これらのデータを用いてLIFT−ADに関する戦略決定を支援し,これらのデータを用いて,現在の臨床試験や我々が開始可能な任意の他の試験に関する将来の戦略決定を支援することを期待している。TOPLINE結果は当時利用可能なデータの初歩的な分析に基づいており、データをより全面的かつ十分に審査することは異なる結論を得る可能性があり、これはフォソニー·メゾンに関する任意の追加試験の決定に負の影響を与える可能性がある。我々のACT−AD試験結果やLift−AD試験の中期分析による我々が行っているLift−AD試験の修正が最終的に実験成功を招く保証はない。例えば,我々のバイオマーカーデータは統計的に有意な臨床的利益に変換されない可能性があり,FDAは我々の統計計画や分析に同意しない可能性があり,あるいは試験には我々の終点測定を行うのに十分な動力がない可能性がある。
さらに、規制機関を含む他の人は、私たちの仮定、推定、計算、結論または分析を受け入れないか、またはデータの重要性を異なる方法で解釈またはトレードオフする可能性があり、これは、特定の計画の価値、特定の候補製品または製品の承認または商業化、およびわが社の全体的な状況に影響を与える可能性がある。さらに、開示された特定の研究または臨床試験に関する情報を選択することは、通常、広範な情報に基づいており、あなたまたは他の人は、私たちが決定した重要な情報または他の適切な情報が私たちの開示に含まれることに同意しない可能性がある。もし私たちの報告書の中期、裏線、または予備データが実際の結果と異なる場合、または他の人が、規制機関を含め、結論を出すことに同意しない場合、私たちが承認を得る能力、および
S-17
商業化は、私たちの候補製品が損害を受ける可能性があり、これは私たちの業務、経営業績、将来性、あるいは財務状況を損なう可能性がある。
もし私たちが臨床試験の患者登録および/または保留において遅延または困難に遭遇した場合、私たちの規制提出または必要な上場承認は延期または阻止される可能性がある
もし私たちが十分な数の合格患者を募集し、募集することができなければ、FDAまたは他の類似の外国監督機関が要求した臨床試験を完成させることによって、これらの臨床試験に参加することができなければ、私たちの候補製品の臨床試験を開始または継続することができないかもしれない。患者の入選は臨床試験時間の重要な要素である。私たちが条件に合った患者を募集する能力は限られているかもしれないし、予想以上に遅い募集につながる可能性があります。われわれの競争相手が我々の候補品と同じ適応で開発中の計画のための臨床試験を行っており,本来われわれの臨床試験に参加する資格のある患者が競争相手計画の臨床試験に参加すれば,患者登録も影響を受ける可能性がある。また,われわれが完成した臨床試験の公開報告結果は,われわれが行っている試験の登録に影響する可能性がある。十分な数のこのような患者が見つからなければ、私たちの臨床試験と開発計画は延期されるかもしれない
われわれの試験に必要な数の被験者を遅延または不成功に募集すれば,われわれが以前行った試験の結果,競争的臨床試験,厳しすぎる資格要件やその他の要因によりも,われわれの臨床試験結果は延期される可能性があり,われわれの臨床試験のコストは大幅に増加する可能性があり,フォソニドンの全体的な開発スケジュールは負の影響を受ける可能性がある。例えば,新冠肺炎の大流行の影響により,われわれのある臨床試験地点があるオーストラリアで実施されている政府制限を含めて,われわれが行っている臨床試験の登録者数は鈍化している。われわれのACT−AD臨床試験では,募集速度が遅くなり,2022年6月に発表された第2段階ACT−AD臨床試験のTOPLINE結果の時間が変化した。私たちは似たような登録問題が未来に再び起こらないことを確実にすることができない。たとえ我々の試験で目標被験者数を登録することに成功したとしても、FDAおよび他の規制機関は、任意の規制承認条件として、より多くの被験者に追加の臨床試験を要求する可能性がある
私たちは十分な数の患者を私たちの臨床試験に参加することができません。これは重大な遅延を招きます。あるいは1つ以上の臨床試験を完全に放棄する必要があるかもしれません。さらに、私たちの任意の臨床試験サイトが承認された研究案、良好な臨床実践、またはFDA規定に適合していない場合、私たちは、そのようなサイト、参加者、そのようなサイトが登録されている可能性のあるデータ、およびそのようなサイトによって収集されたデータを排除することを要求される可能性がある。これらのイベントのいずれかが発生した場合、または任意の理由で任意のデータの排除を要求された場合、私たちは、私たちが最初に想像していたよりも多くのサイトまたはより多くの参加者を募集することを要求される可能性がある。私たちの臨床試験における登録遅延あるいは他の遅延は私たちの候補製品の開発コストを増加させ、候補製品を販売するマーケティング許可を得る能力を脅かす可能性があります。また,われわれの臨床試験に十分な数の患者を募集できても,治療や任意のフォローアップ期間内に臨床試験への参加を維持することは困難である可能性がある。
私たちは激しい競争に直面しています。もし私たちの競争相手が私たちよりも早く技術や製品を開発したり、あるいは私たちが開発した候補製品よりも効果的で、安全で、安い場合、私たちのビジネス機会は否定的な影響を受けるでしょう
バイオテクノロジーと製薬業界は急速に発展する技術を利用して、激しい競争の特徴を持っている。私たちの科学知識、プラットフォーム技術と開発専門長は私たちに競争優位を提供してくれると信じていますが、私たちは大小の製薬会社、新興生物技術会社、学術、政府と個人研究機関からの競争圧力に直面しています。私たちの多くの競争相手は私たちよりも多くの財務資源、市場占有率、開発、臨床前と臨床テスト、製造、商業化、監督審査手続きおよび/またはマーケティングと販売に関する専門知識を持っています。私たちの競争相手は患者募集、臨床研究組織、運営資源の面で私たちと競争するかもしれない。したがって、私たちの競争相手は私たちよりも早く、または成功的に製品を発見、開発、許可、または商業化することができるかもしれない。
我々が開発·商業化に成功する可能性のある候補製品は,既存療法や将来出現する可能性のある新しい療法と競争するであろう。例えば、FDAは最近、Biogen Inc.とEisai Co.,Ltd.によって開発された薬物lecanemabの承認を加速し、礼来社もアルツハイマー病治療の候補製品を開発している。私たちが他の療法と効果的に競争する能力に影響を与える重要な製品機能には、私たちの製品の有効性、安全性、利便性があります。私たちの競争相手は特許保護や他の知的財産権を獲得する可能性があり、これは私たちの候補製品を開発または商業化する能力を制限する。政府や他の第三者支払者の精算も我々の製品の定価と競争力に大きな影響を与えるだろう。私たちの競争相手も私たちよりも早くFDAや他の規制機関のその製品の承認を得ることができ、これは私たちの競争相手が私たちが市場に入る前に強力な市場地位を確立することをもたらすかもしれない。適用することができます
S-18
私たちの競争に関するより多くの情報は、参照によって本明細書に組み込まれた我々の最新のForm 10-K年間報告書の“Part I,Item 1-Business-競合”というタイトルの部分を参照してください
私たちは、より利益的または成功可能性の高い候補製品または適応を利用することなく、特定の候補製品または適応を追求するために限られたリソースを費やす可能性がある
私たちの財務と管理資源が限られているので、私たちは私たちが決定した特定の適応の研究計画、治療プラットフォーム、候補製品に集中しています。したがって、私たちは、他の治療プラットフォームまたは候補製品を求める機会を放棄または延期するか、または後に、より大きな商業的潜在力またはより大きな成功可能性を有することが証明される他の適応を求めることができる。私たちの資源配分決定は私たちが実行可能な商業製品や利益のある市場機会を利用できないかもしれない。現在と未来の研究開発計画、治療プラットフォームと特定の適応候補製品への支出はいかなる商業的に実行可能な製品も発生しないかもしれない。もし私たちが特定の候補製品の商業的潜在力や目標市場を正確に評価していなければ、独占開発と商業化の権利を保持することが私たちにより有利な場合、私たちは協力、許可、または他の特許権使用料手配を通じてその候補製品に価値のある権利を放棄するかもしれない。
私たちは他の療法と組み合わせた候補製品を開発するかもしれないが、これは私たちを追加的なリスクに直面させるだろう
私たちは、1つまたは複数の他の承認されたまたは承認されていない療法と組み合わせた候補製品を開発することができる。他の既存療法と組み合わせて使用するために開発された任意の候補製品が市販承認または商業化されていても、FDAまたは米国以外の同様の外国規制機関が、我々の製品と組み合わせて使用される治療法の承認を取り消す可能性があるか、またはこれらの既存療法のいずれかが安全性、有効性、製造、または供給の問題になる可能性があるというリスクに直面するであろう。候補製品と組み合わせて使用する療法が、任意の候補製品のために選択された適応の看護基準に置き換えられれば、FDAまたは同様の外国の規制機関は、追加の臨床試験を要求するかもしれない。このようなリスクの発生は、私たち自身の製品を招く可能性があり、承認されれば、市場から撤退されたり、商業的にあまり成功しないだろう。
私たちはまた、FDAまたは同様の外国の規制機関が発売されていない1つまたは複数の療法を組み合わせて候補製品を評価することを選択することができる。承認されていない療法が最終的に単独または私たちの製品と組み合わせてマーケティング承認を得なければ、私たちが開発した未承認の併用適応治療と組み合わせた任意の候補製品をマーケティングして販売することができないだろう。また,未承認療法は,重篤な副作用の可能性,臨床試験遅延,FDA承認の欠如など,現在開発·臨床試験中の候補製品と同様のリスクに直面している。FDAまたは同様の外国の規制機関がこれらの他の薬剤を承認しない場合、または私たちが開発した候補製品に関連して評価する薬剤を選択した場合、安全性、有効性、品質、製造または供給の問題が生じた場合、このような併用療法の承認または販売を得ることができない可能性がある。
私たちの長期的な見通しはある程度発見、開発と商業化のより多くの候補製品に依存し、これらの製品は開発中に失敗したり、遅延を受けたりし、それによってその商業生存能力に不利な影響を与える可能性がある
私たちの未来の経営業績は私たちが現在臨床と非臨床開発で持っている製品ではなく、監督部門の候補製品の承認を得て商業化する能力に依存している。候補製品は非臨床と臨床開発のどの段階でも意外に失敗する可能性がある。安全性,有効性,臨床実行,変化する医療看護基準や他の予測不可能な変数に関するリスクにより,候補製品の歴史的失敗率が高い。候補製品の非臨床試験または早期臨床試験の結果は、候補製品の後期臨床試験で得られる結果を予測できない可能性がある。
私たちが将来開発する可能性のある他の候補製品の成功は、以下の要素を含む多くの要素に依存するだろう
S-19
たとえ私たちが任意の他の未来の候補製品を臨床開発に推進することに成功しても、それらの成功は本“リスク因子”の節で他の場所で説明されたすべての臨床、監督、および商業リスクの影響を受ける。したがって、私たちはあなたに保証することはできません。私たちはあなたに発見、開発、規制部門の承認を得て、私たちの未来の他の候補製品を商業化したり、相当な収入を発生させることができます。
私たちはオーストラリアの完全子会社を通じていくつかの研究開発業務を行っています。もし私たちがオーストラリアで運営する能力を失った場合、あるいは私たちの子会社がオーストラリア法規によって許可された研究開発税の免除を受けることができなければ、私たちの業務と運営結果は影響を受ける可能性がある。
2020年7月、私たちはオーストラリアに完全子会社を設立し、オーストラリアでの製品開発候補者のために様々な臨床前と臨床活動を展開した。地理的距離が遠いため、現在オーストラリアでは従業員が不足していることと、私たちはオーストラリアで運営経験が不足しているため、私たちはオーストラリアで私たちのトップ製品をモニタリング、開発し、臨床試験を含めて商業化することができないかもしれない。また、私たちがオーストラリアで私たちの候補製品のために行った任意の臨床試験の結果がFDAや外国の規制機関によって受け入れられ、開発と商業化承認を行うことは保証されない。
また、オーストラリアの現行の税収法規では、払い戻し可能な研究開発税収は合格支出の43.5%に相当すると規定されている。もし私たちがオーストラリアで子会社を運営する能力を失った場合、あるいは私たちが研究開発税の免除を受ける資格がない場合、あるいはオーストラリア政府が税収控除を大幅に減少または廃止すれば、私たちの業務と運営結果は不利な影響を受ける可能性がある。
私たちのどんな重要な人員の流出も、私たちの業務、運営結果、そして競争地位を深刻に損なう可能性がある。
競争のために、私たちは幹部たちと他の重要な職員たちを引き付け、維持し、激励しなければならない。合格した幹部、科学者、技術、法律、会計人員を募集し、維持することは私たちの業務に重要であり、私たちの業界では経験のある従業員に対する競争が激しい可能性がある。1人以上のキースタッフを失ったり、必要なときにより多くのキーパーソンを募集することができなくなり、私たちの業務や将来性に実質的な悪影響を及ぼす可能性があります。
2021年6月、私たちの取締役会は、当時の最高経営責任者Leen Kawas博士を一時休暇にし、Kais博士とウィスコンシン州立大学での博士研究などを共著した論文の審査を待っていた。我々の取締役会の独立特別委員会は,独立法律顧問の協力のもと,カヴァス博士が西豪州立大学在学中に提出した博士研究に関する告発及び関連事項を調査した。この特別委員会の初歩的な発見は、カヴァス博士が2011年の博士論文と少なくとも4つの研究論文で画像を改ざんしたことであり、これらの論文はウィスコンシン州立大学で大学院生の時に人と共著し、2011年から2014年まで発表された
2021年10月18日、カバ博士は辞表を提出し、総裁、最高経営責任者、取締役会のメンバーを辞任し、2021年10月18日から発効した。ケヴァス博士が辞任すると同時に、私たちの取締役会はマーク·リトン博士兼工商管理修士を総裁兼最高経営責任者と取締役会メンバーに任命した。私たちのどの重要な従業員の後継と移行過程も、私たちの業務、運営結果、採用と維持努力及び競争地位に直接或いは間接的な不利な影響を与える可能性がある。
新冠肺炎やその他の衛生流行病に関連するリスク
新型コロナウイルス病或いは新冠肺炎、大流行とその他の疾病の爆発の持続と潜在的な影響は著者らの非臨床研究と臨床試験を含む著者らの業務に不利な影響を与える可能性がある。
新冠肺炎の疫病と政府が取った対応措置は企業と商業に直接と間接的な重大な影響を与え、労働力不足、サプライチェーンの中断、施設と生産の一時停止及び医療サービスと用品のようなある商品とサービスに対する需要の変動を含む。新冠肺炎の蔓延に対応するため、私たちは行政事務室を一時閉鎖し、研究開発実験室の従業員数を制限した。現在、私たちのオフィスと実験室はすべて再開放されていますが、新冠肺炎症例や他の疾病の発生は再出現する可能性があり、これは私たちが再び施設を閉鎖したり、他の措置を取ったりする可能性があります
S-20
返事をする。特に,新たな感染性の高い新冠肺炎変種が出現し,米国のある地域や他の場所に急速に伝播する可能性があり,この復興がいつ,どの程度我々の業務に影響を与えるかは不明である。また,われわれのいくつかの臨床試験地点は過去に受けており,将来的にも新冠肺炎に関する制限を受け,その運営に悪影響を及ぼす可能性がある。著者らの多くの臨床試験地点はすでに新冠肺炎と関連する制限を緩和したが、未来に新しい制限を加える可能性があり、新しい新冠肺炎変異体の爆発に対応するためにも、いかなる類似疫病の発生にも。新冠肺炎疫病の著者らの業務と財務業績に対する持続的な影響程度はまだ確定していないが、新冠肺炎病例或いは疾病の急増は著者らの業務、財務状況と経営業績に実質的な負の影響を与える可能性がある
著者らは未来に新冠肺炎の大流行或いはその他の疾病の爆発による著者らの業務、非臨床研究と臨床試験の中断に深刻な影響を与える可能性がある。このような割込みには、以下のことが含まれる可能性がある
新冠肺炎が再燃したり、新たな疾患が発生したりした場合、被験者をこのような疾患から保護することを目的とした追加の臨床試験政策およびプログラムの制定と実施が要求される可能性がある。例えば、2020年3月、アメリカ食品と薬物管理局は疫病期間中の臨床試験に関する指導意見を発表し、この指導意見はその後更新を行い、その中に疫病の影響を受けた臨床試験スポンサーのいくつかの考慮要素を記述し、臨床試験報告に臨床試験を管理するための応急措置と、新冠肺炎の大流行による臨床試験の中断を含むことを要求し、唯一の被験者識別子と研究場所に従って新冠肺炎大流行関連研究中断の影響を受けるすべての被験者リストをリストし、個人参加状況がどのように変化したかを説明した。実施された緊急措置(例えば、参加者が製品および/または研究を停止し、重要な安全性および/または有効性データを収集するための代替プログラム)の報告された臨床試験の安全性および有効性結果への影響の分析および対応する議論とを含む。2020年6月、アメリカ食品薬品監督管理局はまた薬品生産従業員の新冠肺炎感染に対応する良好な製造規範注意事項ガイドラインを発表し、薬品汚染を防止する生産制御提案を含む。
S-21
新冠肺炎の大流行や他の疾患の発生により、生物製薬会社株の取引価格は過去に不安定であり、未来も非常に不安定である可能性があり、私たちの普通株の取引価格も高い変動を経験する可能性がある。もし新冠肺炎が再燃したり、新たな病気が発生したりすれば、普通株を売却することで資金を調達することが困難に直面する可能性があり、あるいはそのような売却は不利な条項で行われる可能性がある。さらに、新冠肺炎の伝播による不況、不況、または他の持続的な不利な市場事件は、私たちの業務および私たちの普通株価値に実質的な悪影響を及ぼす可能性がある。
新冠肺炎の灰再発或いはその他の疾病の発生は著者らの業務運営の最終的な影響に対して非常に高い不確定性があり、変化が発生する可能性があり、そして未来の発展に依存し、これらの発展は正確に予測できない。さらに、私たちまたは第三者サプライヤーの他の業務中断は、私たちの業務に深刻な影響を与え、私たちの将来の潜在的な収入や財務状況を深刻に損害し、私たちのコストや支出を増加させる可能性があります。我々の業務および我々のCRO、商業製造組織またはCMOおよび他の請負業者、コンサルタントおよび第三者の業務は、他の世界的な大流行、地震、電力不足、電気通信故障、水不足、洪水、ハリケーン、台風、火災、極端な天気条件、医療流行病および他の自然または人為的災害または業務中断の影響を受ける可能性があり、私たちは主にこれらの状況に自己保険を提供する。このような業務中断の発生は、私たちの運営と財務状況を深刻に損害し、私たちのコストと支出を増加させる可能性がある。私たちは私たちの候補製品を生産して加工するために第三者メーカーに依存する。これらのサプライヤーの運営が人為的または自然災害または他の業務中断の影響を受ける場合、候補製品の臨床供給を得る能力が妨害される可能性がある。
私たちの財務状況と資本需要に関連するリスク
設立以来、私たちは大きな被害を受けており、予測可能な未来には、引き続き大きな被害を受けると予想されています。
私たちは製品販売から何の収入も得ていません。候補製品は私たちに任意の収入を提供するために大量の追加投資が必要になります。2022年9月30日と2021年9月30日までの9カ月間、それぞれ6550万ドルと3850万ドルの純損失を計上し、2022年9月30日までの累計赤字は1兆614億ドルだった。
私たちは大部分の財務資源を研究と開発に投入し、私たちの臨床と非臨床開発活動を含む。これまで、私たちの運営資金は主に普通株の売却と発行、転換可能な優先株、普通株式承認証、転換可能手形の収益から来ており、その次は収入の付与と株式オプションの行使である。
私たちは予測可能な未来に巨額の費用が発生し、運営損失が増加すると予想している
S-22
様々な理由で、私たちの費用は予想を超える可能性があり、FDA、ヨーロッパ薬品管理局或いはEMA或いは国内或いは国外の他の監督管理機関を含む、現在予想されている基礎の上で臨床とその他の研究を行うことを要求している。私たちの以前の損失は、予想された未来の損失に加えて、すでに私たちの株主権益に悪影響を与え続けるだろう。
私たちは私たちの運営を支援し、Fosgonimetonの開発と商業化を完成させ、他や将来の候補製品を開発して商業化するために多くの追加資金が必要になるだろう。もし私たちが必要な時にこの資金を集めることができなければ、私たちは私たちの製品開発計画や他の業務を延期、減少またはキャンセルさせることを余儀なくされるかもしれない
私たちの設立以来、私たちは大量の現金を使って私たちの運営に資金を提供しており、予測可能な将来、私たちが行っている活動に関連する費用は大幅に増加することが予想され、特に私たちが研究と開発を続け、臨床試験を開始し、Fosgonimetonの上場承認を求める場合。フォゴニドンを開発し,AD,PDD,DLB,われわれが将来追求する可能性のある任意の他の適応を治療する臨床試験には大量の資金が必要となる。また、Fosgonimetonや将来の候補製品の発売承認を得た場合、販売、マーケティング、製造、流通に関する巨額の商業化費用が発生すると予想されています。また、上場企業の運営に関連した追加コストが引き続き発生すると予想される
したがって、私たちは私たちの持続的な業務と関連した多くの追加資金を得る必要があるだろう。2022年9月30日現在、私たちは2億6千万ドルの現金、現金等価物、投資を持っている。私たちの現在の運営計画によると、私たちの既存の現金、現金等価物、および投資は、少なくとも本募集説明書の補充日以降の今後12ヶ月以内に、私たちの運営費用および資本支出需要を支払うのに十分であると予想される。しかし、持続的に変化する環境は、私たちの支出増加の速度が私たちの現在の予想よりもはるかに速く、私たちがコントロールできない状況のため、私たちは現在予想されているよりも多くのお金が必要かもしれない。もし私たちが現在の予想よりも速い速度で拡張することを選択すれば、私たちは予想よりも早く追加資金を調達する必要があるかもしれない
私たちの将来の資金需要の額と時間は多くの要素に依存し、その中のいくつかの要素は私たちがコントロールできるものではありません。これらに限定されません
S-23
私たちは受け入れ可能な条項や追加的な資金を得ることができないかもしれない。このような資金はいずれも、株主への希釈、債務契約や償還義務の強制実施、または我々の業務の他の制限に影響を及ぼす可能性がある。もし私たちがタイムリーに資金を得ることができなければ、私たちは私たちの1つ以上の研究や開発計画を大幅に削減または放棄することを要求されるかもしれない。私たちはまた、いくつかの技術または候補製品の権利を放棄すること、または他の方法で私たちに不利な条項に同意することを要求することを要求されるかもしれないパートナーとの手配または他の方法で資金を求めることができる
私たちは純営業損失を利用して将来の課税収入を相殺する能力が制限されるかもしれません
2021年12月31日現在、今後約950万ドルの課税収入と約290万ドルの連邦税収控除を相殺するための連邦純営業損失繰越(NOL)がある。2017年度以降に発生した合計8070万ドルの連邦NOLは無期限に繰り越しますが、他のすべてのNOLは、使用しなければ2025年に開始される異なる年に満期になります。未来の課税収入の不足は私たちがこのようなNOLを利用する能力に悪影響を及ぼすだろう。また、改正された1986年の国内税法第382条又は同法典によると、会社が“所有権変更”を行う際には、そのNOLを利用して将来の課税所得額を相殺する能力が制限される。私たちは1回または複数回の所有権変更を経験したかもしれない。将来私たちのNOLと税金控除を使用する時間によって、私たちはこれまでの所有権変更によって毎年使用できる金額を制限するかもしれません。しかし、私たちはこのような制限が使用されずに私たちのNOLと税金の繰越満期をもたらすとは思わない。さらに、将来的に私たちの株式所有権の変化と、私たちがコントロールできないかもしれない他の変化は、規則382条による追加所有権の変化につながる可能性があります。我々のNOLは、州法の類似条項によって損害を受けたり、コロナウイルス援助、救済、経済安全法案によって改正された“減税·雇用法案改正案”の条項によって制限される可能性もある。これらの資産の将来収益の不確実性を最終的に実現するため、我々のNOLや他の繰延税金資産に関する全額推定準備金を記録した。
税法の変化は私たちの業務、キャッシュフロー、運営結果、あるいは財務状況に実質的な悪影響を及ぼす可能性があります。
私たちは複数の課税管区の税金法律、法規、そして政策に支配されている。税法の変化、その他の要因は、私たちの納税義務と有効税率に変動をもたらし、他の方法で私たちの納税状況および/または納税義務に悪影響を及ぼす可能性があります。例えば、多くの国や地方司法管轄区および経済協力開発組織などの組織は、賃金や従業員への付加税の徴収を含む新しい税法や既存の税法の改正を提出または実施している。税法のいかなる新しいまたは変化も、私たちの有効な税率、経営業績、税収控除またはインセンティブまたは納税に悪影響を及ぼす可能性があり、これは私たちの業務、キャッシュフロー、経営業績、または財務状況に重大な悪影響を及ぼす可能性がある。
規制承認およびその他の法律コンプライアンス事項に関するリスク
FDAと他の外国監督管理機関のような監督管理審査過程は冗長で、時間がかかり、しかも本質的に予測不可能である。もし私たちの候補製品のために必要な規制承認を得ることができない場合、あるいは必要な規制承認を遅延させると、私たちの候補製品を商業化することができない、あるいは私たちの候補製品の商業化を遅らせることになり、私たちの収益能力は深刻な損害を受けるだろう
私たちの候補製品とその開発と商業化に関連する活動は、設計、テスト、製造、安全、効果、記録保存、ラベル、貯蔵、承認、広告、販売促進、販売、流通、輸出入などを含み、すべてアメリカFDAと他の監督管理機関の全面的な監督管理を受け、そして受けている
S-24
比較可能な外国の規制機関。私たちがどんな候補製品を商業化することができる前に、私たちは市場の承認を受けなければならない
FDAと他の類似外国監督管理機関の承認を得ることは予測不可能であり、通常は臨床試験開始後数年後に承認される必要があり、これは関連する候補製品のタイプ、複雑性、新規性を含む多くの要素に依存する。さらに、候補製品の臨床開発過程において、承認政策、法規、または承認を得るために必要な臨床データのタイプおよび数が変化する可能性があり、司法管轄区域によって異なる可能性があり、承認の遅延または承認申請の不承認の決定を招く可能性がある。また,監督管理の承認を得るためには,薬品製造過程に関する情報を関係監督当局に提出し,生産施設を検査する必要がある。監督管理機関は承認過程においてかなりの自由裁量権を持っており、いかなる申請も拒否することができ、私たちのデータが承認を得るのに十分ではなく、追加の非臨床、臨床、あるいは他のデータが必要であることを決定することもできる。私たちが最終的に臨床試験を完了し、私たちの候補製品の承認を得たとしても、FDAおよび他の同様の外国規制機関は、それらの適応や患者数が私たちが最初に要求したものよりも限られているかもしれないので、あるいは他の処方制限や警告を適用して、その製品の商業的潜在力を制限する可能性があるからです。私たちはまだどの候補製品のために提出したり、規制部門の許可を得ていません。私たちのどの製品候補も規制部門の承認を得られないかもしれません。また、私たちの候補製品の開発および/または規制承認は、私たちがコントロールできない理由で延期される可能性があります。
私たちの候補製品の申請は多くの理由で規制部門の承認を得ることができないかもしれません
この長い承認過程と、臨床試験結果の予測不可能性は、規制部門の承認を得ることができず、私たちのどの候補製品も市場に出すことができず、私たちの業務、運営結果、将来性を深刻に損なう可能性がある。さらに、私たちが私たちの候補製品の承認を得ても、規制機関は私たちの任意の候補製品を承認するかもしれません。その適応は私たちが要求するものよりも少ないか、あるいは限られています。狭い適応、警告、またはリスク評価、および緩和策、またはREMSの形で大きな制限を加えるかもしれません。規制当局は、私たちが開発する可能性のある製品に請求しようとしている価格を承認しないかもしれないし、高価な発売後の臨床試験の表現によって承認されるかもしれないし、候補製品のラベルには、候補製品の商業化に必要または必要なラベル宣言が含まれていないことが承認されるかもしれない。上記のいずれの状況も私たちの業務を深刻に損なう可能性がある。
大量に開発されている薬物のうち、一部のみがFDAなどの外国規制承認手続きに成功し、商業化されている。長い承認過程と将来の臨床試験結果の予測不可能性は、私たちの業務、運営結果、将来性を深刻に損なう規制部門の承認を得られず、私たちの候補製品を販売する可能性があります。
S-25
私たちが現在或いは未来の候補製品を単独で使用したり、他の承認された製品或いは研究している新薬と共同使用する場合、深刻な不良事件、毒性或いはその他の不良副作用を招く可能性があり、安全状況を招く可能性があり、監督管理部門の承認を阻害し、市場の受け入れを阻止し、その商業潜在力を制限し、或いは重大なマイナス結果を招く可能性がある
薬品の一般的な状況のように、私たちの候補製品の使用に関連する副作用や有害事象がある可能性が高い。われわれの臨床試験結果は副作用や予期せぬ特徴の重症度と流行度を示す可能性がある。私たちの候補製品による副作用は、私たちまたは規制機関の臨床試験の中断、延期、または停止を招く可能性があり、より厳しいラベル、またはFDAまたは同様の外国の規制機関が規制承認を延期または拒否する可能性がある。薬物に関連する副作用は、患者の募集或いは患者の臨床試験を完成する能力に影響し、或いは潜在的な製品責任クレームを招く可能性がある。このようなどんな状況でも、私たちの業務、財政状況、そして見通しに大きな被害を及ぼす可能性がある
我々の候補製品が単独で使用されるか、または他の承認された製品または試験新薬と併用される場合、非臨床研究または臨床試験において予期しない特徴がある場合、私たちは、それらの開発を中断、延期または放棄するか、または開発をより狭い用途またはサブ集団に制限する必要がある可能性があり、これらのサブ集団において、副作用または他の特徴は、リスク効果の観点からそれほど一般的ではなく、それほど深刻ではなく、または容易に受け入れられる。治療に関連する副作用は、患者募集または被験者が臨床試験を完了する能力に影響を与える可能性があり、または潜在的な製品責任クレームを引き起こす可能性がある。これらの状況のいずれも、影響を受けた候補製品に対する市場の受容度を達成または維持することを阻止し、私たちの業務、財務状況、および将来性を深刻に損なう可能性がある。
われわれの臨床試験では,患者は将来われわれの非臨床研究あるいは以前の臨床試験では観察されなかった重大な有害事象やその他の副作用を受ける可能性がある。私たちの候補製品のいくつかは慢性療法として使用されるかもしれないし、安全問題のために規制機関によって特別に審査される可能性がある人々のために使用されるかもしれない。また,我々の候補製品を他の療法と組み合わせて使用すれば,我々の候補品はこの療法に関連する有害事象を悪化させる可能性がある。私たちの候補製品を使用して治療された患者も単独の治療を受けている可能性があり、これらの治療は、私たちの候補製品とは無関係な副作用または有害事象をもたらす可能性があるが、私たちの臨床試験の成功、例えば、私たちの候補製品の効果を妨害する可能性がある。われわれのACT−AD臨床試験では,患者に対してあらかじめ指定されたグループ分け分析を行い,標準看護(AChEIS)とフォソニー·メゾンの併用が治療効果を低下させる可能性があることが分かった。フォソニー·メゾンの安全性と有効性を決定するためにもっと多くの臨床研究が必要であるが、治療標準AChEIsがフォゴンニドンの治療効果に影響し、そして大部分の患者がAChEIs治療を受けていれば、潜在的な標的患者集団あるいは私たちが求めているフォソニー·メノンの適応は私たちが予想していたよりはるかに小さい可能性があり、これは私たちの業務と将来性に実質的な損害を与える可能性がある
老年患者を著者らの臨床試験に組み込むことは、これらの患者が使用する可能性のある他の治療法或いは薬物によって死亡或いは他の不良医療事件を招く可能性がある。私たちの現在または未来の任意の臨床試験において重大な有害事象または他の副作用が観察された場合、私たちは患者を臨床試験に参加することが困難になる可能性があり、患者は私たちの臨床試験から撤退するかもしれない、あるいは私たちは臨床試験を完全に放棄すること、またはその候補製品の開発努力を完全に放棄することを要求されるかもしれない。我々、FDA、または他の同様の規制機関またはIRBは、そのような臨床試験における対象が許容できない健康リスクまたは副作用に曝露されていると考えることを含む、様々な理由で候補製品の臨床試験を随時一時停止することができる。生物技術業界で開発されたいくつかの潜在療法は最初に早期臨床試験で治療の将来性を示したが、その後副作用が発生することが発見され、それらの更なる発展を阻害した。副作用が候補品の発売承認を阻止したり保持したりしなくても,他の療法と比較した耐性により,副作用が市場受け入れを抑制する可能性がある。このような事態のどのような発展も、私たちの業務、財務状況、そして見通しに実質的な損害を与える可能性がある。
また、もし私たちの任意の候補製品が発売承認された場合、これらの候補製品に関連する臨床試験に見られない毒性も承認された後に発展する可能性があり、追加の臨床安全試験の要求、薬品ラベルに追加の禁忌症、警告と予防措置の添加、製品の使用を重大な制限を行うか、あるいは製品を市場からリコールすることを招く可能性がある。私たちの候補製品が人体に毒性を与えるかどうかを予測できず、それによって非臨床研究或いは早期臨床試験に基づく監督管理許可が撤回されることを排除或いは招くことができない。
一つの管轄区域で私たちの候補製品に対する規制承認を獲得し、維持することは、私たちが他の管轄区域で私たちの候補製品の規制承認を得ることに成功するという意味ではない
一つの管轄区域で私たちの候補製品に対する規制承認を獲得し、維持することは、私たちが他の任意の管轄区域で規制承認を得ることができるか、または維持することができるという保証はない。例えば、FDAが候補製品の発売を承認しても、外国司法管轄区の比較可能な監督管理機関は、候補製品のこれらの国での製造、マーケティング、販売促進、精算を承認しなければならない。しかし、1つの管轄区域で規制承認を得ることができなかったり、遅延したりすることは、他の管轄区域の監督管理承認過程にマイナス影響を与える可能性がある。承認する
S-26
手続きは司法管轄区域によって異なり、1つの管轄区で行われる臨床試験は他の管轄区の監督機関によって受け入れられない可能性があるため、米国とは異なる要求と行政審査期限に関連する可能性がある。米国以外の多くの管轄区では、候補製品は先に精算許可を得てから、その管轄区で販売を許可することができる。場合によっては、私たちが私たちの製品のために受け取る価格もまた承認されなければならない。
私たちはまた他の国でマーケティング申請を提出することができる。米国以外の管轄区域の監督管理機関は候補製品の承認に要求があり、私たちはこれらの管轄区が発売される前にこれらの要求を守らなければならない。外国の監督管理の承認を獲得し、外国の監督管理要求の遵守を確立し、維持することは、私たちに重大な遅延、困難、コストをもたらす可能性があり、私たちの製品がある国/地域で発売されることを延期または阻止する可能性がある。もし私たちまたは未来のパートナーが国際市場の規制要求を遵守できなかったり、適用されたマーケティング承認を得られなかったりすれば、私たちの目標市場は減少し、潜在的な製品候補製品のすべての市場潜在力を達成する能力は損なわれるだろう。
私たちの候補製品が規制機関の承認を得ても、私たちは持続的な規制義務と持続的な規制審査の制約を受けることになり、これは多くの追加費用を招く可能性があり、もし私たちが規制要求を遵守していない場合、あるいは私たちの候補製品に予期せぬ問題が発生した場合、私たちは処罰を受けるかもしれない
私たちは候補製品のために得られたどんな規制承認も監視して、候補製品の安全性と有効性を監視することを要求します。FDAはまた、私たちの候補製品を承認するためにREMSを必要とする可能性があり、これは、制限された分配方法、患者登録、および他のリスク最小化ツールのような薬物ガイドライン、医師コミュニケーション計画、または安全使用を確保する他の要素を必要とする可能性がある。さらに、FDAまたは同様の外国規制機関が私たちの候補製品を承認した場合、私たちの候補製品の製造プロセス、ラベル、包装、流通、有害事象報告、貯蔵、広告、販売促進、輸入、輸出、記録保存は広範で持続的な規制要求を受けるだろう。これらの要件は、安全および他の上場後の情報および報告、登録の提出、および私たちが承認後に行った任意の臨床試験について、現在の良好な生産規範またはcGMP法規、良好な実験室規範またはGLP、法規および良好な臨床実践またはGCP法規を継続的に遵守することを含む。その後、私たちの候補製品には、予想されていない深刻さや頻度の不良事象、または私たちの第三者製造業者または製造プロセスを含む、以前に未知の問題が存在することが発見され、または規制要件を遵守できなかったことは、他の事項を引き起こす可能性がある
FDAや他の規制機関の政策は変わる可能性があり、私たちの候補製品に対する規制承認を阻止、制限、または延期するための追加の政府法規が公布されるかもしれない。もし私たちが既存の要求の変化に適応できない場合、あるいは新しい要求や政策を採用することができない場合、あるいは規制適合性を維持できない場合、私たちは私たちが得る可能性のあるマーケティング承認を失う可能性があり、私たちは利益を達成したり維持することができないかもしれない。米国や海外の将来の立法や行政や行政行動によって生じる可能性のある政府規制の可能性、性質、程度も予測できない。現在および将来の立法、行政行動、および訴訟(行政命令を含む)がどのように実施されるか、およびそれらが我々の業務、私たちの臨床開発、ならびにFDAを含むFDAおよび他の機関がその規制権力を行使する能力にどの程度影響を与えるかを予測することは困難である
S-27
FDAに提出された任意の規制文書または申請に対して承認前検査とタイムリーな審査を行います。任意の行政行動がFDAが正常な過程で活動を監督·実行する能力に制限を与える場合、私たちの業務は負の影響を受ける可能性がある。
また、FDAは薬品の販売促進の可能性のある声明に対して厳格な監督管理を行った。特に、製品は、当該製品が承認されたラベルに反映されるように、FDA承認されていない用途に使用されてはならない。FDAや他の機関はラベル外用途の普及を禁止する法律法規を積極的に実行しており,ラベル外用途の普及が不適切であることが発見された会社は重大な民事,刑事,行政処罰を受ける可能性がある。上記のいずれかの事件や処罰が発生すると、候補製品を商業化し、収入を創出する能力を抑制する可能性があり、対応するために多くの時間と資源が必要となり、負の宣伝が生じる可能性がある
資金不足や世界的な健康懸念によるFDA、証券取引委員会、その他の政府機関の中断は、重要な指導部や他の人員の能力を雇用·保持することを阻害する可能性があり、または新たなまたは修正された製品がタイムリーまたは完全に商業化され、承認または商業化されることを阻止するか、またはこれらの機関が私たちの業務運営に依存する可能性のある正常な業務機能を履行することを他の方法で阻止することは、私たちの業務に負の影響を与える可能性がある
FDAが新製品を審査·承認する能力は、政府予算と資金レベル、キーパーソンの雇用と維持、ユーザー費用の支払いを受け入れる能力、法律、法規と政策の変化、およびFDAの通常の機能を履行する能力に影響を与える可能性のある他の事件を含む様々な要素の影響を受ける可能性がある。したがって、その機関の平均検討時間は近年変動している。また、政府が米国証券取引委員会(Securities and Exchange Commission、単に米国証券取引委員会と略す)や、我々の業務が依存する可能性のある他の政府機関に提供する資金は、研究開発活動に資金を提供する機関を含め、政治過程の影響を受け、政治過程自体が不安定で予測不可能である。
FDAや他の機関の中断も、新薬が必要な政府機関によって審査および/または承認されるのに要する時間を遅らせる可能性があり、これは私たちの業務に悪影響を及ぼすだろう。例えば、近年、2018年や2019年を含め、米国政府は何度も閉店しており、米国食品·医薬品局や米国証券取引委員会などのある規制機関は、キー従業員を休暇させ、キー活動を停止せざるを得ない。また、新冠肺炎突発公共衛生事件に対応するため、2020年3月に国内外の検査機関が基本的に一時停止して以来、FDAはルーチンのモニタリング、生物研究モニタリングと審査前検査を優先的に回復するように努力してきた。FDAは、いつどこで優先国内検査が行われるかを決定するのを助ける格付けシステムを開発している。2020年と2021年に、一部の会社はFDAがその申請の必要な検査を完了できなかったため、完全な返信を受け取ったと発表した。2022年2月、FDAは国内の定例モニタリング検査を再開することを発表した。FDAはまた、国家許可を得て、疾病管理センターの一級または二級新冠肺炎旅行提案範囲内で以前計画された外国監視検査を継続することを発表した;そうでなければ、検査は再配置され、2022年4月に外国優先検査を再開することが期待される。FDAは国内の承認前検査に大きく追いついているが、滞っている外国検査の処理を続けている。しかし,FDAは現在の検査速度を継続できない可能性があり,審査スケジュールが延長される可能性があり,承認前検査や臨床場所の検査が必要な場合や,行われている新冠肺炎の大流行,旅行制限や人員不足などが含まれている, FDAはこのような必要な検査を審査期間内に終わらせることができない。アメリカ以外の監督管理機関は類似の制限或いは他の政策措置を取って新冠肺炎疫病に対応する可能性があり、監督活動の中で遅延に遭遇する可能性がある。政府が長期的に停止したり、他の中断が発生したりした場合、または世界的な健康または他の懸念がFDAまたは他の規制機関の定期検査、審査または他の規制活動を適時に阻害し続ける場合、FDAが私たちの規制提出を適時に審査し、処理する能力に深刻な影響を与える可能性があり、これは私たちの業務に重大な悪影響を及ぼす可能性がある。また、将来的に政府の停止や遅延は、資本を適切に利用して事業を継続するために、公開市場に参入し、必要な資本を得る能力に影響を与える可能性がある。
私たちは、承認を加速するルートを使用することで、FDAや同様の外国規制機関の承認を得ることを試みるかもしれない。もし私たちがそのような承認を得ることができなければ、私たちは私たちの予想を超える追加の非臨床研究や臨床試験を要求される可能性があり、これは必要な市場承認を得る費用を増加させ、必要な市場承認を受けることを延期するかもしれない。FDAの加速承認を得ても,我々の検証的試験が臨床的利益を証明していない場合,あるいは厳格な上場後の要求を守らなければ,FDAは加速承認の撤回を求める可能性がある
私たちは未来に私たちの1つ以上の候補製品の承認を加速させることを求めるかもしれない。加速承認計画によれば、FDAは、代替終点または中間臨床終点に対して臨床的利益を合理的に予測することができる候補製品を決定する場合に、既存の治療法よりも意義のある治療利益を提供する、深刻または生命に危険な疾患の治療のための候補製品の承認を加速することができる。FDAは臨床利益は特定の疾病の背景下で臨床意義のある積極的な治療効果であり、例えば不可逆的な発病率或いは死亡率であると考えている。承認を加速するために,エージェントの終端ノードはタグである
S-28
実験室測定或いはその他は臨床利益を予測できると考えられているが、それ自体は臨床利益の計量ではない。中間臨床終点は不可逆的発病率或いは死亡率への影響の前に測定できる臨床終点であり、それは不可逆的な発病率或いは死亡率或いは他の臨床利益に対する影響を合理的に予測する可能性がある。加速承認経路は既存療法に対する新薬の優位性は直接の治療優位ではないかもしれないが、患者と公衆衛生の観点から見ると臨床上重要な改善状況である。承認された場合、承認を加速することは、一般に、薬物の臨床的利益を検証および説明するために、勤勉な方法で追加的な承認後の検証的研究を行うことにスポンサーが同意することに依存する。このような承認後の研究が薬剤の臨床的利益を確認できなかった場合、FDAは薬剤の承認を撤回する可能性がある。
私たちの任意の候補製品の加速承認を求める前に、FDAのフィードバックを求めるつもりです。そうでなければ、私たちが承認を求めて加速させる能力を評価します。フィードバックや他の要因を評価した後、加速的な承認または任意の他の形態の加速開発、審査、または承認を得るために機密協定を求めたり提出したりすることは保証されません。同様に、FDAのその後のフィードバックの後、私たちが最初にそうすることを決定しても、加速承認または任意の他の形態の加速開発、審査または承認を求めたり申請したりすることは保証されない。さらに、私たちの候補製品のための加速承認申請を提出するか、または迅速な規制指定(例えば、画期的な治療指定)を得ることを決定した場合、そのような提出または申請が受け入れられるか、または開発加速、審査または承認がタイムリーに承認されるか、または完全に保証されることは保証されない。FDAまたは他の同様の外国規制機関も、私たちの申請を考慮したり、任意の種類の申請を承認する前にさらなる検討を要求することができる。我々の候補製品が加速承認または任意の他の形態の加速開発、審査または承認を得ることができない場合、候補製品の商業化の時間がより長くなり、候補製品の開発コストが増加し、市場での競争地位を損なう可能性がある。
さらに、FDAが承認計画またはそのような計画の内部審査手続きの加速に関する政策または規制要件を大幅に変更した場合、我々の臨床開発計画およびそのような計画下での規制承認は実質的な影響を受けたり、延期されたりする可能性がある。FDAが加速承認経路でBiogenを承認したAduhelmに関する最近の議論を受けて,FDAはFDAのAduhelmに対する審査の調査を監察長事務室に要求し,2022年12月29日に承認され,食品·薬物総合改革法案(FDORA)を含む2023年の総合支出法案が法律に署名された。FDORAはFDAの当局とその規制枠組みに対していくつかの改革を行い、その中には承認経路の改革を加速し、例えばFDAに承認後の研究要求の条件を具体的に説明することを要求し、FDAが承認後の要求を満たしていないために迅速に製品をリコールするプログラムを規定している。現在、これらの提案、未来の政策変化及びFDA法規の変化がアルツハイマー病治療と著者らの臨床開発計画中の新薬応用にどのように影響するかはまだ不明である。
私たちは現在の規制と未来の立法の変化がもたらす困難に直面するかもしれない。医療コストを低減するための医療立法措置は,我々の業務や運営結果に実質的な悪影響を及ぼす可能性がある
米国および多くの外国司法管轄区域は、医療システムに影響を与える立法および規制の変化を制定または提案しており、これらの変化は、私たちの候補製品や任意の将来の候補製品の発売承認を阻止または延期し、承認後の活動を制限または規制し、マーケティング承認を得た製品を収益的に販売する能力に影響を与える可能性がある。規制、規制の変化、または既存の規制の解釈は、例えば、私たちの将来のビジネスに影響を与える可能性があります
アメリカでは、医療費用を統制するための多くの立法計画が続いているだろう。例えば,2010年3月,2010年に医療·教育調整法案(あるいは総称してACA)が改正された“患者保護·平価医療法案”(Patient Protection And Affordable Care Act)が可決され,政府や民間保険会社が医療保険に融資する方式を大きく変更し,米国製薬業に大きな影響を与えた。ACAに含まれる条項は,医療補助計画で精算された薬品のリベートを増やし,医療補助リベートを医療補助管理保健計画に拡大し,ある連邦医療保険Dの一部の受益者に強制的な割引を提供し,製薬会社の連邦ヘルスケア計画における販売シェアに応じて年会費を徴収することで薬品の収益性を低下させる可能性がある。医療補助薬品還付計画は製薬業者に以下の会社と締結し,国の還付協定を発効させることを要求している
S-29
米国衛生·公衆サービス部部長、あるいはHHS部長は、各州が連邦マッチング資金を獲得する条件として、メーカーが医療補助患者に提供する外来薬に用いられる。ACAは医療補助薬品リベート計画の下でメーカーが支払うべき最低医療補助リベートを増加させ,リベート計画を医療補助管理の看護組織に登録されている個人に拡大することを含む医療補助薬品リベート計画をいくつか修正した。ACAはまた、あるブランドの処方薬のメーカーに対して年間費用と税収を確立し、新しいMedicare Part D保証ギャップ割引計画を作成し、この計画によると、メーカーは保証不足期間中に条件を満たす受益者に適用ブランド薬品交渉価格の70%(2018年両党予算法により増加し、2019年から発効)の販売時点割引を提供することに同意しなければならず、メーカーの外来薬としてMedicare Part Dの条件に組み込まれている。2020年12月、米国連邦医療保険と医療補助サービスセンター(CMS)は最終規則を発表し、Medicaid薬品バックオフ計画下のメーカー価格報告の重大な変化を実施した。薬局福祉マネージャーアキュムレータ計画に影響を与える製造業者が支援する患者支援計画の法規と、いくつかの価値ベースの調達計画に関連する最適な価格報告とを含む。2021年1月1日に施行される“2021年米国救援計画法案”によると、メーカーが州医療補助計画に支払う医療補助薬品還付計画還付の法定上限が撤廃される。この上限を廃止することは、販売製品よりも多くのリベートの支払いを製薬業者に要求する可能性があり、これは私たちの業務に実質的な影響を与える可能性がある。
上述したように、ACAのいくつかの態様は、公布以来、司法と国会の挑戦を受けてきた。2021年1月28日、バイデン総裁は、ACA市場を介して医療保険を取得することを目的とした特別な保険加入期間を開始する行政命令を発表し、特定の政府機関に医療保健の獲得を制限する既存の政策および規則を検討し、再検討するよう指示した。2021年6月、米最高裁はテキサス州と他の挑戦者がACAの法的地位に挑戦していないと判断し、この事件を却下したが、ACAの合憲性を具体的に裁くことはなかった。また、2022年8月16日、総裁·バイデンは2022年インフレ削減法案に署名し、個人がACA市場で医療保険を購入する強化補助金を2025年に延長した。2025年からアイルランド共和軍は新たに設立されたメーカー割引計画により、受益者の最大自己負担コストを著しく低減し、連邦医療保険D部分計画下の“ドーナツの抜け穴”を解消した。ACAは未来に司法や国会で挑戦される可能性がある。バイデン政府の追加的な挑戦と医療改革措置がACAにどのように影響するかは不明である。私たちの業務に実質的な悪影響を与えるために、どんな新しい法律と法規の要求を遵守することも時間的で高価な可能性がある。
2018年には両党予算法もACAを改訂し、2019年1月1日から発効し、連邦医療保険D部分に加入する製薬業者が不足している販売時点割引を追加し、多くの連邦医療保険薬物計画のカバーギャップを縮小し、通常は“ドーナツ穴”と呼ばれている。CMSは、ACAリスク調整計画に従って、CMSがこのリスク調整を決定するための方法に関する連邦地域裁判所の訴訟結果に応答するために、いくつかのACAに合格した健康計画および健康保険発行者にさらにお金を受け取ることを可能にする最終規則を発表した。また,CMSは2020年から個人や小団体市場の保険会社に基準を設定する上で,各州により大きな柔軟性を与える最終規則を公表しており,このような市場で販売されている保険計画に要求される基本的な健康福祉をACAが緩和する可能性がある。2012年の“米国納税者救済法”(American納税者救済法,ATRA)は,病院を含むいくつかの医療サービス提供者に支払う医療保険費用を減少させ,政府が医療サービス提供者に多額の金を取り戻す訴訟時効を3年から5年に延長した。その他の立法変化には、2011年の“予算制御法案”に基づいて、医療保険提供者の医療保険支払総額を前期当たり最大2%削減することが含まれており、2013年に始まり、2031年まで有効となるが、国会が追加行動を行わない限り、様々な新冠肺炎救済立法に基づいて2020年5月1日から2022年3月31日まで支払いを停止する。現在の立法によると、医療保険支出の実際の減少幅は2022年の1%から本自動減額の最終年度の4%まで様々になる。
アメリカでは、特殊薬品の価格設定に関する立法と法執行の関心が増加している。具体的には,米国議会は最近いくつかの調査を行い,薬品定価の透明性の向上,連邦医療保険下の処方薬のコスト低減,定価とメーカー患者計画との関係の審査,政府計画の薬品精算方法の改革を目的とした連邦と州立法を提案した。例えば、2021年7月、バイデン政府は“米国経済における競争を促進する”という行政命令を発表し、その中には処方薬の競争を増加させるための複数の条項がある。2022年8月、国会はIRAを採択し、その中には製薬業と連邦医療保険受益者に重大な影響を与える処方薬条項を含み、連邦政府がある高価な単一源連邦医療保険薬物の最高公平価格について交渉することを許可し、薬品価格交渉要求を遵守しないメーカーに罰と消費税を適用し、すべての連邦医療保険B部分とD部分の薬物がインフレリベートを獲得することを要求し、もしその薬品価格の増加がインフレより速い場合、それに限られた例外を提供し、連邦医療保険D部分を再設計して受益者の自己処方薬コスト、その他の変化を下げることを含む。また、バイデン政府は2022年10月14日に追加の行政命令を発表し、アメリカ衛生·公衆サービス部(HHS)に90(90)日以内に報告書を提出するように指示し、医療保険と医療補助革新センター(Center For Medicare And Medicaid Innovation)をさらに利用して薬物価格を下げる新しいモデルをテストすることを説明した
S-30
医療保険と医療補助受益者の費用。これらの立法、行政と行政行動、バイデン政府が将来実施する任意の医療措置と機関規則が私たちと製薬業全体に与える影響はまだ不明である。コスト抑制措置や他の医療改革を実施することは、収入を創出し、利益を達成すること、または候補製品を商業化することを阻止するかもしれない(承認されれば)。
2022年4月、CMSは、アルドゥカヌモノクロナル抗体またはAduhelm、ならびにFDAによって承認された任意の将来のアミロイドに対するモノクロナル抗体、ならびにアルツハイマー病の治療のための適応をカバーする最終的な国家政策を発表した。2つの部分からなる国家保険決定計画(NCD)によれば、連邦医療保険は、アルツハイマー病の治療のためのアミロイド(またはプラーク)に対するモノクロナル抗体をカバーし、証拠開発保険項目の下で指定されたカバー基準に従って提供されるとき、これらの抗体はFDAの伝統的な承認を得るであろう。CMSはまた、通常の臨床実践または登録によってデータを収集するような、CMSによって承認された研究に参加する医療保険患者により良い機会およびカバー範囲を提供するであろう。また,FDAが臨床的利益を示すか加速的な承認を得ているかが決定されていない薬物では,連邦医療保険はFDAや米国国立衛生研究院が承認した臨床試験で保険を提供する。CMSがFDAによって承認されたアルツハイマー病の他のカテゴリーを治療する薬剤に対して同様のカバー制限をとる場合、私たちの候補製品を含む、候補製品を商業化する能力は負の影響を受ける可能性があり、承認されれば、収入および利益を達成する可能性がある。将来のCMSカバー決定と政策がどのように我々の業務に影響を与えるかはまだ不明である。
州レベルでは、各州はますます積極的に、価格または患者の精算制限、割引、ある製品への参入の制限、マーケティングコストの開示および透明性措置を含む薬品および生物製品の価格設定を制御するための法規を立法と実施し、場合によっては、他の国からの輸入と大量購入を奨励することを目的としている。また、地域衛生保健当局や個別病院は、どの薬品やサプライヤーが彼らの処方薬や他の医療計画に含まれるかを決定するために入札プログラムを使用することが増えている。これらの措置が承認されると、私たちの製品に対する最終的な需要を下げたり、私たちの製品の価格設定に圧力をかけるかもしれません。多くの州では、州薬品価格透明性と報告法が検討されているか、最近公布されており、これは私たちのコンプライアンス負担を大幅に増加させ、規制部門の承認を得て商業化を開始した後、このような州法律に基づいてより大きな責任を負わせる可能性がある。私たちは将来、より多くの州と連邦医療改革措置を取ることが予想され、そのいずれも連邦と州政府が医療製品やサービスのために支払う金額を制限する可能性があり、これは私たちの候補製品に対する需要の減少または追加の価格設定圧力を招く可能性がある。
私たちの収入の見通しはアメリカと海外の医療支出と政策の変化の影響を受けるかもしれない。私たちは、高度に規制された業界で運営されており、医療可用性、医療製品およびサービスの交付または支払い方法に関連する新しい法律、法規または司法判断、または既存の法律、法規または決定に対する新しい解釈は、私たちの業務、運営、および財務状況に悪影響を及ぼす可能性がある。
外国、連邦と州の各レベルはすでに立法と監督管理提案を引き続き提出することが可能であり、医療保健の獲得性を拡大し、医療保健コストをコントロール或いは低減することを目的としている。ACAの廃止、代替、または重大な修正を含む将来的に取られる可能性のある措置を予測することはできない。政府、保険会社、医療組織、その他の医療サービスを管理する支払人は、医療コストの抑制または低減、および/または価格規制の実施に努力し続けており、悪影響を及ぼす可能性がある
連邦医療保険や他の政府計画精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性があり、これは私たちの将来の収益性に悪影響を及ぼす可能性がある。
将来的に採用される可能性のある他の医療改革措置は、より厳しいカバー基準をもたらす可能性があり、私たちが受け取った任意の承認された製品の価格に追加の下振れ圧力をもたらす可能性があると予想される。また,政府は新冠肺炎の大流行に対応するためにより多くの行動をとる可能性がある。連邦医療保険や他の政府が計画している精算のいかなる減少も、個人支払者の支払いの同様の減少を招く可能性がある。コスト抑制措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは候補製品の商業化を阻止するかもしれない。承認後の規制を拡大するための立法と規制の提案が提出された
S-31
バイオテクノロジー製品の販売と販売促進活動を要求して制限する。連邦と州政府がこれらの立法と規制提案をどの程度実施するか、より多くの立法変化が公布されるかどうか、FDAの法規、指導あるいは解釈が変わるかどうか、あるいはこれらの変化が私たちの候補製品の上場承認にどのような影響を与えるかを決定することはできない(もしあれば)。また、FDA承認過程に対する国会のより厳格な審査は、上場承認を著しく延期または阻止し、より厳しい製品ラベルと上場後のテストとその他の要求の制約を受ける可能性がある。
私たちは医療専門家、臨床研究者、CRO、第三者支払者との関係は、私たちの現在と未来の業務活動と関係があり、私たちが連邦医療保健計画に参加し、連邦支出(例えば国家衛生研究院からの資金)を受けることは、連邦と州医療詐欺と乱用法律、虚偽クレーム法律、透明性法律、政府価格報告、医療情報プライバシーと安全法律の制約を受ける可能性があり、これは私たちを刑事制裁、民事処罰、契約損害、政府医療計画から除外され、名声損害、行政負担、利益と将来の収益の減少などの問題に直面させる可能性がある
医療提供者と第三者支払者は,我々が市場の承認を得た任意の候補製品を推薦·処方する上で主な役割を果たしている。私たちの現在と未来の医療専門家、臨床研究者、CRO、第三者支払者、顧客との手配は、私たちがマーケティング許可を得た製品の業務または財務配置と関係を制限するかもしれない広範に適用される詐欺と乱用、その他の医療法律と法規に直面する可能性があります。同様に、私たちが連邦医療計画に参加し、NIHの連邦支出を受けることは、連邦虚偽申告法、民事処罰と評価、刑事起訴、その他の行政、民事、刑事救済措置の制約を受けるかもしれない。
私たちの運営能力に影響を与える可能性のある法律は含まれているが、これらに限定されない
S-32
これらの法律の広範性と利用可能な法定例外と規制安全港の狭さのため、私たちのいくつかの業務活動は、医師の顧問委員会との手配(一部の医師が提供されたサービスの補償として株や株式オプションを獲得した)、候補製品が米国で発売された後の任意の販売およびマーケティング活動を承認し、法的挑戦および法執行行動を受ける可能性がある。私たちの運営が上記の任意の連邦および州法律または私たちに適用される任意の他の政府法規に違反していることが発見された場合、私たちは、損害賠償、罰金、返却、監禁、政府医療計画から除外され、追加の報告義務および監督(これらの法律を遵守しない疑いを解決するために会社の誠実な合意または他の合意の制約を受けている場合)、およびこれらの法律に準拠していない疑いを解決するために、私たちの業務の縮小または再編を含むかもしれません。いずれも、私たちの業務運営能力および私たちの運営結果に悪影響を及ぼす可能性があります。
当社の従業員、独立請負業者、コンサルタント、ビジネス協力者、首席調査員、CRO、サプライヤー、およびサプライヤーは、法規基準および要件を遵守しないことを含む、不適切な行為または他の不適切な活動に従事する可能性があります
上記の独立特別委員会の調査結果に関連するリスクに加えて、私たちの従業員、独立請負業者、コンサルタント、商業協力者、主要な調査者、CRO、サプライヤー、サプライヤーが不当な行為または他の不適切な活動に従事する可能性があるリスクに直面しています。これらの当事者の不正行為は、FDA法規を遵守できなかったこと、FDAに正確な情報を提供すること、連邦および州医療詐欺および法律法規を遵守すること、財務情報またはデータを正確に報告すること、または不正な活動を開示することを含むことができる。はい
S-33
特に、衛生保健業界の販売、マーケティングと商業手配は詐欺、不当行為、リベート、自己取引とその他の乱用行為を防止するための広範な法律と法規の制約を受けている。これらの法律法規は、広範な価格設定、割引、マーケティングおよび販売促進、販売手数料、顧客インセンティブ計画、および他のビジネス計画を制限または禁止する可能性があります。これらの方面の不正行為はまた、臨床試験過程で得られた情報を不当に使用する可能性があり、これは規制制裁と著者らの名声に深刻な損害を与える可能性がある。私たちは常にこれらの当事者の不適切な行為を識別し、阻止することができるわけではなく、私たちがこのような活動を発見し、防止するための予防措置は、未知または未管理のリスクや損失を効果的にコントロールできないかもしれないし、これらの法律や法規を遵守できないことによる政府の調査や他の行動や訴訟から私たちを保護することができないかもしれない。もし私たちにこのような訴訟を提起し、私たちが私たちの権利を弁護または維持することに成功しなかった場合、これらの訴訟は、民事、刑事および行政処罰、損害賠償、罰金、返還、監禁、MedicareおよびMedicaidなどの政府援助から除外された医療計画の参加から、誠実な監督と報告義務、契約損害、名声損害、利益減少および将来の収益、ならびに私たちの業務の削減または再編を含む、私たちの業務に重大な影響を与えるかもしれません。
もし私たちが環境、健康、安全の法律法規を守らなければ、私たちは罰金や罰金を科されたり、コストを発生したりする可能性があり、これは私たちの業務の成功に実質的な悪影響を及ぼすかもしれない
私たちは多くの環境、健康と安全法律と法規の制約を受けて、それらの研究室の手続きと危険材料と廃棄物の処理、使用、貯蔵、処理と処理を管理する法律と法規を含む。私たちの行動は化学物質、生物学的、そして放射性物質を含む危険で燃えやすい材料の使用に関するものだ。私たちの業務はまた危険な廃棄物製品を発生させるだろう。私たちは一般的に第三者と契約を結び、このような材料と廃棄物を処理する。私たちはこのような材料が汚染や傷害をもたらす危険を除去することができない。もし私たちが危険な材料を使用して汚染や損傷をもたらしたら、私たちはそれによるいかなる損害に責任を負い、いかなる責任も私たちの資源の範囲を超える可能性がある。私たちはまた民事や刑事罰金と処罰に関連した巨額の費用を発生させるかもしれない。危険材料の使用による従業員の負傷により生じる可能性のあるコストや支出を支払うために労働者補償保険を維持しているが、潜在的な責任を支払うのに十分ではない可能性がある。私たちは私たちが生物、危険または放射性物質を貯蔵したり処分したりすることによって、私たちが提起した環境責任や有毒侵害に対して保険を維持することはできません。
また、現在または未来の環境、健康、安全法律法規を遵守するためには、巨額のコストが生じる可能性がある。このような現行または未来の法律法規は私たちの研究、開発、または商業化努力を損なうかもしれない。このような法律法規を遵守しないことはまた巨額の罰金、処罰、または他の制裁につながる可能性がある。
私たちはアメリカと外国のいくつかの反腐敗、反マネーロンダリング、輸出規制、制裁、その他の貿易法律と法規の制約を受けている。私たちは違反によって深刻な結果に直面するかもしれない
その他の事項を除いて、米国および外国の反腐敗、反マネーロンダリング、輸出規制、制裁およびその他の貿易法律法規は、総称して貿易法と呼ばれ、会社およびその従業員、代理人、臨床研究組織、法律顧問、会計士、コンサルタント、請負業者および他のパートナーの許可、約束、提供、提供、誘致、直接または間接的に公共または民間部門の受取人の腐敗または不当な支払い、または任意の他の価値のあるものを受け入れることを禁止する。貿易法違反は、巨額の刑事罰金と民事処罰、監禁、貿易特権の喪失、資格取り消し、税収の再評価、契約違反と詐欺訴訟、名誉損害、その他の結果を招くことができる。私たちは政府機関や政府付属病院、大学、その他の組織の役人や従業員と直接または間接的な相互作用を持っている。私たちはまた、アメリカ以外での私たちの活動がタイムリーに増加すると予想している。我々は、第三者を招いて臨床試験および/または必要な許可、許可、特許登録、および他の規制承認を得ることを計画しており、私たちは、このような活動を明確に許可していなくても、事前にそのような活動を知っていても、私たちの人員、代理またはパートナーの腐敗または他の不正活動に責任を負わなければならないかもしれない。
私たちの第三者への依存に関するリスクは
私たちは第三者に依存して私たちの非臨床研究と臨床試験を行う。これらの第三者がその契約責任を正確かつ成功的に履行することができない場合、または予想される最終期限までに完了することができなければ、規制部門から私たちの候補製品の承認を得たり、商業化することができない可能性がある
我々は,医療機関,CRO,CMO,戦略パートナーなどの独立した研究者や協力者に利用し,我々との合意に基づいて我々の非臨床研究や臨床試験を行って支援している
CRO,臨床試験地点,CMOと予算や契約を交渉せざるを得ないことが予想されるが,有利な条件ではできない可能性があり,開発スケジュールの遅延とコストの増加を招く可能性がある。私たちは大きく依存しています
S-34
これらの第三者は私たちの非臨床研究と臨床試験の過程で、私たちは彼らの活動のいくつかの側面だけを制御している。したがって,我々自身に完全に依存している従業員と比較して,これらの非臨床研究や臨床試験の進行,時間と完成および非臨床研究や臨床試験により開発されたデータの管理の直接制御は減少する。しかし、私たちは私たちのすべての研究が適用された合意、法律と法規の要求、そして科学的な基準に従って行われ、私たちの第三者への依存が私たちの規制責任を免除しないことを確実にする責任がある。我々とこれらの第三者はGCPを遵守しなければならないが,これはFDAや同様の外国規制機関が臨床開発において候補製品に対して実行する法規やガイドラインである。監督管理機関は定期的に臨床試験スポンサー、主要な研究者と臨床試験地点を検査することによって、これらのGCPを実行する。もし私たちまたはこれらの第三者のいずれかが適用されたGCP法規を遵守できなかった場合、私たちの臨床試験で生成された臨床データは信頼できないと考えられる可能性があり、FDAまたは同様の外国の規制機関は、私たちの上場申請を承認する前に追加の臨床試験を行うことを要求するかもしれない。検査後、これらの監督機関は私たちのいかなる臨床試験がGCP規定に適合しているかどうかを確認することを保証することはできません。また,われわれの臨床試験はcGMP規定により生産された薬剤を用いて行わなければならず,大量の試験患者が必要となる。これらの第三者がこれらの規定を遵守できなかったか、あるいは十分な数の患者を募集できなかったかは、臨床試験を繰り返す必要があるかもしれない, これは規制部門の承認過程を延期するだろう。さらに、その中のいずれかの第三者が連邦または州詐欺および乱用または虚偽クレーム法律法規または医療プライバシー·セキュリティ法に違反した場合、私たちの業務は巻き込まれる可能性がある。
われわれの臨床試験を行ういかなる第三者もわれわれの従業員でもなく,また,当等の第三者と合意して提供した救済措置を除いて,われわれが行っている臨床候補製品に十分な時間と資源を投入しているかどうかを制御することはできない。これらの第三者はまた、私たちの競争相手を含む他の商業実体と関係があるかもしれません。彼らはまた、これらの実体のための臨床試験や他の薬物開発活動を行っているかもしれません。これは、彼らが私たちを代表する表現に影響を与えるかもしれません。これらの第三者がその契約の義務または義務を成功裏に履行できなかった場合、または予想された期限内に完了した場合、交換が必要である場合、または彼らが得た臨床データの品質または正確性が、私たちの臨床方案または規制要件または他の理由を遵守できなかった場合、私たちの臨床試験は延長、延期または終了される可能性があり、私たちは候補製品の開発を完了し、規制部門の承認を得たり、商業化に成功したりすることができないかもしれない。したがって、私たちの財務業績と候補製品のビジネス見通しが損なわれ、私たちのコストが増加する可能性があり、私たちの収入を創出する能力が延期される可能性がある。
第三者を交換或いは増加して著者らの非臨床研究と臨床試験を行うことは大量のコストに関連し、大量の管理時間と重点が必要である。しかも、新しい第三者が仕事を始める時、自然な過渡期がある。したがって,遅延が生じ,期待される臨床開発スケジュールを満たす能力に実質的な影響を与える可能性がある。
我々は第三者と契約を結び,我々の非臨床研究や臨床試験の候補製品を生産し,より多くの臨床試験を行い,最終的に商業化する予定である。このような第三者への依存は、許容可能なコストで十分な数の候補製品または薬物またはそのような数を得ることができないリスクを増加させ、これは、私たちの開発または商業化努力を延期、阻止、または損害する可能性がある。
私たちは現在、開発と商業化のために私たちの候補製品を生産するためのインフラや内部能力を持っていない。我々の組織メンバーの指導の下で,第三者メーカーに依存して非臨床研究や臨床試験のための候補製品の生産に依存し続ける予定である。私たちは長期的な供給協定を持っていない。また,我々の候補製品の原材料は,単一ソースのサプライヤーからの場合もあり,発注から材料を受け取るまでに長い納期が必要となる場合がある.もし私たちの任意の候補製品または任意の未来の候補製品が任意の理由(製造、供給または貯蔵問題、または他の理由にかかわらず)によって意外に供給を失った場合、私たちは、未解決または行われている臨床試験の遅延、中断、一時停止または終了、または再起動または反復が要求される可能性がある。私たちは引き続き第三者メーカーに依存して市場の承認を得た任意の候補製品に商業的な供給を提供したい。私たちは第三者製造業者と必要な合意を維持または確立することができないかもしれないし、受け入れ可能な条項でそうすることができないかもしれない。たとえ第三者製造業者と合意できても、第三者メーカーに依存することは、追加的なリスクをもたらす
S-35
活性薬物物質や完成品を生産するcGMP規制については,生産過程のすべてを完全に制御することはできず,我々の契約製造パートナーに依存してcGMP規定を遵守している。第三者メーカーは、cGMP法規や米国以外の類似した法規要件を遵守できない可能性がある。もし私たちの契約製造業者が私たちの規格やFDAまたは他の機関の厳格な規制要件に適合した材料を生産することに成功しなければ、彼らはその製造施設の上場承認を確保および/または維持することができないだろう。しかも、私たちの契約製造業者が十分な品質管理、品質保証、合格者の能力を維持することを制御することはできません。FDAや同様の外国規制機関が私たちの候補製品を生産するためにこれらの施設を承認しない場合、または将来的にそのような承認を撤回すれば、代替製造施設を探す必要があるかもしれません。これは、私たちの候補製品を開発、獲得、またはマーケティングする能力に深刻な影響を与えます(承認されれば)。私たちまたは私たちの第三者製造業者が適用された法規を遵守できなかったことは、罰金、禁止、民事処罰、遅延、許可の一時停止または撤回、許可証の取り消し、候補製品または薬物の差し押さえまたはリコール、運営制限、刑事起訴を含む制裁を受ける可能性があります, いずれも私たちの候補製品や薬物の供給に重大で不利な影響を与え、私たちの業務と運営結果を損なう可能性がある。私たちは現在、将来的に他人が私たちの候補製品や薬物を生産することへの依存が、私たちの将来の利益率と、私たちが適時かつ競争力のある上場で承認された候補製品の商業化能力に悪影響を及ぼす可能性があると予想している。
私たちの製造プロセスはこのようなプロセスの品質と信頼性に関するFDAの規定を守る必要があります。関連法規を遵守しないいかなる行為も、私たちの臨床計画の遅延または終了、およびいかなる規制承認の一時停止または撤回を招く可能性がある
私たち自身の工場や第三者の工場で私たちの製品を商業的に生産するためには、FDAのcGMP法規とガイドラインを守る必要があります。私たちは品質管理と品質保証を実現する上で困難に直面する可能性があり、人材不足が発生する可能性がある。FDAと同様の外国規制機関の検査を受け、適用される規制要件に適合しているかどうかを確認する。CGMPまたは他の規制要件を遵守できなかった場合、または私たちの施設または第三者の施設または運営が規制要件を遵守できなかった場合、または任意の規制機関の検査によって、私たちの正確な薬物の製造、充填、包装または貯蔵中に発生した遅延、中断、または他の問題により、私たちの臨床試験の正確な薬物供給の重大な遅延、または臨床試験の終了または一時停止、または候補製品のマーケティング申請の提出または承認の遅延または阻止を含む、我々の候補製品を開発および商業化する能力を著しく低下させる可能性がある。深刻な不遵守はまた、警告または無タイトル手紙、罰金、禁止、民事処罰、規制機関が私たちの候補製品に上場承認、遅延、一時停止または承認撤回、許可証の取り消し、押収またはリコール、製品の運営制限、刑事起訴を与えることができなかった制裁の適用を招く可能性があり、これらはいずれも私たちの名声と業務を損なう可能性がある。
もし私たちの第三者メーカーが傷害や適用法違反の方法で危険材料を使用すれば、損害賠償責任を負わなければならないかもしれません。
我々の研究開発活動は,我々の第三者メーカーによる潜在的危険物質(化学材料を含む)の制御使用に関するものである。私たちのメーカーはアメリカ連邦、州と地方の法律法規の制約を受けて、医療と危険材料の使用、製造、貯蔵、運搬と処分を管理している。メーカーがこれらの材料を使用,処理,貯蔵,処分する手順は法律で規定されている基準に適合していると信じているが,医療や危険材料による汚染や傷害のリスクを完全に除去することはできない。このような汚染や傷害のため、私たちは責任を負うかもしれないし、地方、都市、州、または連邦当局はこれらの材料の使用を制限し、私たちの業務運営を中断するかもしれない。事故が発生すると、私たちは損害賠償責任や罰金を要求されるかもしれません。責任は私たちの資源範囲を超えるかもしれません。私たちは医療や危険材料による責任に保険をかけない。適用される環境法律と法規を遵守することは費用が高く、現在
S-36
あるいは将来の環境規制は、私たちの研究、開発、生産努力を損なう可能性があり、これは、私たちの業務、将来性、財務状況、または運営結果を損なう可能性があります。
私たちは戦略的協力、許可手配、またはパートナー関係を使用して、私たちの計画の発展を加速させ、その商業的潜在力を最大限に発揮するかもしれないが、私たちはこのような協力、手配、またはパートナー関係のメリットを意識していないかもしれない。
私たちは世界でFosgonimetonと私たちの小分子候補薬物パイプラインの権利を持っている。適切な状況では、私たちは戦略的協力、許可手配、またはパートナー関係を使用して、私たちの計画の開発を加速させ、私たちの計画のビジネス潜在力を最大限に発揮するかもしれない。これらの関係のいずれも、非日常的な費用と他の費用を発生させ、私たちの短期的かつ長期的な支出を増加させ、私たちの既存の株主を希釈したり、私たちの管理と業務を混乱させたりする証券を発行することを要求することができるかもしれない。
私たちは適切な戦略パートナーを探す上で激しい競争に直面しており、交渉過程は時間がかかり複雑だ。また、私たちの候補製品のための戦略的パートナーシップや他の代替手配を構築する努力は成功しないかもしれません。なぜなら、協力努力の開発段階が早すぎると考えられる可能性があるので、第三者は、私たちの候補製品が安全性と有効性を示し、市場の承認を得るために必要な潜在力を持っているとは思わないかもしれません。また、“--我々の取締役会の独立特別委員会は、ワシントン州立大学での博士研究と共同で書かれた論文の審査に参加し、私たちの業務と名声への影響を検討した。特別委員会の調査結果は、(I)私たちの元最高経営責任者が2011年の博士論文で画像を改ざんしたことと、ワシントン州立大学の大学院生の時に人と共著し、2011年から2014年までに発表した少なくとも4つの研究論文、(Ii)いくつかの通信やアプリケーションで疑問視された研究論文を引用し、(Iii)WSUの独占ライセンスが私たちに与えた二六六特許には、いくつかの変更された画像が含まれている。ワシントン州立大学は、私たちの元最高経営責任者がワシントン州立大学で博士研究を行った潜在的な研究不正行為に関する疑惑を審査しました。WSUの調査がいつ完了するか、WSUがどのような結論を出すかは予測できないが、“潜在的な取引相手が私たちとの関係を阻害する可能性がある。
もし私たちが協力を求めるなら、私たちはタイムリーで受け入れ可能な条件で協力を交渉することができず、交渉することさえできないかもしれない。もし私たちがそれができなければ、候補製品の開発を減らし、その開発計画や私たちの1つ以上の他の開発計画を減らしたり、その潜在的な商業化を延期したり、販売やマーケティング活動の範囲を縮小したり、私たちの支出を増加させ、自費で開発または商業化活動を行わなければならないかもしれない。もし私たちが私たちの支出を増やし、私たち自身の開発や商業化活動に資金を提供することを選択すれば、私たちは追加の資本を得る必要があるかもしれないし、これらの資本は受け入れ可能な条件で私たちに提供できないかもしれないし、全く得られないかもしれない。もし私たちが十分な資金がなければ、私たちは私たちの候補製品をさらに開発したり、それらを市場に出して製品収入を作ることができないかもしれない。
私たちが候補製品と協力することに成功しても、これらの関係は多くのリスクの影響を受け、その中には以下のリスクが含まれているかもしれない
S-37
したがって、もし私たちが追加の戦略的協力、許可手配、またはパートナー関係に加入すれば、私たちがこれらの取引を私たちの既存の業務と会社文化と組み合わせることに成功できなければ、私たちはこのような取引の利点を達成できないかもしれません。これは、私たちのスケジュールを延期したり、他の方法で私たちの業務に悪影響を与えるかもしれません。私たちはまた、戦略的協力、許可手配、またはパートナー関係の後に、この取引が合理的な収入または特定の純収入を証明することを達成するかどうかを確定することはできない。私たちの候補製品に関連する任意の新しい戦略的協力、許可手配、またはパートナー関係のいかなる遅延も、私たちの候補製品のいくつかの地域での開発および商業化を延期する可能性があり、これは私たちの業務の将来性、財務状況、および運営結果を損なうことになる。
もし私たちが将来の買収や戦略協力に従事すれば、これは私たちの資本要求を増加させ、私たちの株主を希釈し、私たちに債務を発生させたり、負債を負担したり、他のリスクに直面させたりする可能性がある。
我々は、相補製品、知的財産権、技術または業務の許可または買収を含む、様々な買収機会および戦略的取引およびパートナー関係を時々評価する。潜在的な買収や戦略的パートナーシップは、多くのリスクをもたらす可能性がある
また、将来的に買収や協力を求めると、希釈証券を発行し、債務を負担したり、発生したりして、巨額の使い捨て費用を発生させ、将来の償却費用の重大な無形資産を買収する可能性がある。
S-38
私たちの製品の商業化能力に関するリスクは
承認されても,我々の候補製品は医師,患者,医療支払者,医学界の他のビジネス成功に必要な人に十分な市場受容度を得ることができない可能性がある
私たちの候補製品が監督部門の許可を得ても、それらは医者、患者、医療支払者、医学界の他の人の中で十分な市場受容度を得ることができないかもしれない。私たちが承認した任意の候補製品の市場受容度や精算の程度は、多くの要素に依存するだろう
もし私たちのすべての候補製品が承認されたが、医師、病院、医療支払者、および患者の十分な程度の受け入れを得られなければ、私たちはこれらの候補製品から十分な収入を得ることができないかもしれず、私たちの財務業績は否定的な影響を受けるかもしれない。
私たちはこれまで候補製品を商業化したことがなく、必要な専門知識、人員、資源が不足している可能性があり、単独で、または適切なパートナーと共に任意の製品の商業化に成功している
私たちは候補製品を商業化したことがない。私たちは私たちの候補製品のいくつかの権利を協力者に許可するかもしれないが、もしそうなら、私たちはこの協力者たちの助けと指導に依存するだろう。私たちが商業化権利とマーケティング承認を保持している候補製品については、自分の販売、マーケティング、供給組織を構築したり、これらの活動を第三者にアウトソーシングしなければなりません。
承認された場合、私たちの候補製品の自己商業化に影響を与える可能性のある要素は、十分な数の有効な販売およびマーケティング担当者の募集と保持、十分な教育およびマーケティング計画を作成して、私たちが承認した候補製品に対する公衆の受容度を向上させること、私たちの会社、従業員、および第三者が適用される医療保健法を遵守することを確保すること、および独立した販売およびマーケティング組織を作成することに関連する他の予見できないコストを含む。販売·マーケティング組織を構築することは高価で時間がかかり、承認された後の私たちの候補製品の発表を延期する可能性がある。私たちは効果的な販売とマーケティング組織を作ることができないかもしれない。もし私たちが自分の流通やマーケティング能力を確立できない場合、あるいは適切なパートナーを見つけて私たちの候補製品を商業化することができなければ、私たちはこれらの製品から収入を得ることができず、利益を達成したり維持することもできないかもしれない。
S-39
もし私たちが開発したすべての候補製品の市場機会が私たちが思っているより小さいなら、私たちの収入は不利な影響を受けるかもしれません。私たちの業務は影響を受けるかもしれません。
我々は最初に我々の製品候補開発を様々な中枢神経系や末梢疾患適応の治療に重点を置く予定である。承認されれば、私たちの候補製品治療から利益を得る可能性のあるアドレス可能な患者集団は、私たちの推定に基づいている。これらの推定は様々な源から来ており、科学文献、診療所調査、患者基金会と市場研究を含み、正しくないことが証明されている可能性がある。そのほか、新しい研究はこれらの中枢神経系と末梢疾患の推定発病率或いは流行率を変化させる可能性がある。私たちの候補製品に対するいかなる規制承認も、私たちの臨床試験で検査され、FDAによって決定された治療適応に限定され、これは、私たちの製品がFDAによって明確に承認されていない他の治療適応を販売することを許可しないだろう。さらに、私たちの候補製品の潜在的にアドレス指定可能な患者集団は、最終的に私たちの候補製品の治療を受けることができないかもしれない。例えば,我々のACT−AD臨床試験のTOPLINEデータによるあらかじめ指定されたサブグループ分析から,標準ケア(AChEIS)とフォソニーメタゾンの組み合わせが奏効率を低下させる可能性があることが分かった。この仮説がより多くの研究によって支持されていれば,AChEIsを受け入れた患者はフォゴニドンのアドレス可能な患者集団から除外される可能性がある。私たちの候補製品が規制部門の承認を得ても、この承認はラベル制限を条件にしている可能性があり、これらの制限はアドレス指定可能な患者集団を実質的に制限している。私たちの市場機会はまた未来に市場に参入する競争相手の治療によって制限されるかもしれない。もし私たちの任意の推定が不正確であることが証明された場合、私たちまたは私たちの戦略パートナーが開発した任意の候補製品の市場機会は著しく減少し、私たちの業務に実質的な影響を与える可能性がある。
私たちに製品責任訴訟を提起すれば、私たちは多くの責任を負い、候補製品の商業化を制限することを要求されるかもしれません
私たちの候補製品は計画的な臨床テストを行うため、私たちは固有の製品責任リスクに直面しています。もし私たちがどんな製品を商業化すれば、私たちはもっと大きなリスクに直面します。例えば、私たちの候補製品が臨床試験、製造、マーケティング、または販売中に傷害をもたらすと思われるか、または他の態様では不適切であることが発見された場合、私たちは起訴されるかもしれない。このような製品責任クレームは、製造欠陥、設計欠陥、製品固有の危険について警告、不注意、厳格な責任、または保証違反の告発を含む可能性がある。州消費者保護法によると、クレームも主張することができる。もし私たちが製品責任クレームで自分自身を弁護することに成功できなければ、私たちは重大な責任を招いたり、私たちの候補製品の商業化を制限することを要求されるかもしれません。成功的な防御であっても、多くの財政的で管理的な資源が必要だ。事件がどうであっても最終的な結果がどうであろうと、賠償責任は次のようになるかもしれない
潜在的な製品責任クレームを防止するために、許容可能なコストで十分な製品責任保険を獲得または保持することができず、私たち単独または会社パートナーと開発した製品の商業化を阻止または阻害する可能性がある。臨床試験保険がありますが、私たちの保険書も各種の排除があります。私たちは製品責任クレームの影響を受けるかもしれませんが、私たちは保険範囲を受けていません。私たちは私たちの保険範囲の制限を超えたり、私たちの保険カバー範囲内でない裁判所の裁決または和解合意で達成された任意の金額を支払う必要があるかもしれません。私たちはこれらの金額を支払うために十分な資本を持っていないか、または得ることができません。私たちが未来の会社のパートナーと合意しても、私たちは損害賠償を受ける権利があります。何かクレームがあれば、この賠償は利用できないか十分かもしれません
S-40
新ロット製品の保険カバー範囲と精算状況はまだ確定していない。私たちの候補製品は不利な価格設定法規、第三者保険、清算やり方、あるいは医療改革措置の影響を受ける可能性があり、これは私たちの業務を損なうことになります。新製品や既存製品のために十分な保険や精算を得ることができない場合、これらの製品をマーケティングする能力を制限し、収入を創出する能力を低下させる可能性があります
新薬の発売審査、定価、カバー範囲と精算を管理する規定は国によって異なる。米国では、最近公布された立法が承認要求を大幅に変更する可能性があり、これは追加のコストに関連し、承認の遅延を招く可能性がある。一部の国は薬品の販売価格が承認されてから発売されることを要求している。多くの国で、定価審査期間はマーケティングまたは製品許可を承認した後から始まる。一部の外国市場では、処方薬の定価は初歩的な承認を得た後も、政府の持続的なコントロールを受けている。したがって、特定の国/地域での製品のマーケティング承認を得ることができるかもしれませんが、その後、価格法規の制約を受けて、これらの法規は私たちの製品の商業発表を延期し、長い時間遅延し、その国/地域で製品を販売することによって生じる収入に悪影響を与える可能性があります。不利な価格設定制限は、私たちが開発可能な任意の候補製品が市場承認を得ても、1つ以上の候補製品への投資を回収する能力を阻害する可能性がある。
米国や他の国の市場では,患者は通常第三者支払者によって治療に関連する費用の全部または一部を精算する。政府医療保健計画(例えば連邦医療保険や医療補助)や商業支払者の十分なカバーと精算は新製品の受容度に重要である。私たちが私たちの候補製品を商業化することに成功できるかどうかは、政府衛生行政部門、個人健康保険会社、その他の組織がこれらの製品と関連治療に提供する保険範囲と十分な補償にある程度依存する。政府当局と第三者支払者、例えば個人健康保険会社や健康維持組織は、どのような薬剤を支払うかを決定し、精算レベルを確立する。政府や個人支払者が提供する保険範囲や精算範囲は,多くの患者が遺伝子治療製品などの治療を負担できるために重要である。私たちが決定するかもしれないこれらまたは他の将来の候補製品の販売は、私たちの製品候補のコストがどの程度健康維持、管理医療、薬局福祉および同様の医療管理組織によって支払われるか、または政府衛生行政当局、個人健康保険会社、および他の第三者支払人によってどの程度精算されるかに大きく依存する。保険や十分な精算が得られない場合、あるいは限られたレベルに限られていれば、候補製品を商業化することに成功できないかもしれません。保険を提供しても、承認された精算金額が十分に高くない可能性があり、十分な投資リターンを実現するために十分な価格設定を確立したり維持したりするのに十分ではないかもしれません。第三者支払人の精算はいくつかの要素にかかっているかもしれません, しかしこれに限らず、第三者決済者は製品の使用を決定した
アメリカの医療業界と他の地域の主な傾向の一つはコストコントロールだ。政府当局と第三者支払者は,特定の薬物のカバー範囲や精算金額を制限することでコストを抑制しようとしている。多くの国では、国家衛生システムの一部として、医療製品の価格は異なる価格制御メカニズムの制約を受けている。一般的に、この制度での薬品価格はアメリカよりずっと低い。他の国は会社が自分の薬品価格を固定することを許可しているが、会社の利益を監視する。追加の外国価格規制や定価規制の他の変化は、私たちの候補製品に受け取ることができる費用を制限するかもしれません。そのため、米国以外の市場では、米国に比べて製品の精算が減少する可能性があり、商業的に合理的な収入や利益を生み出すには不十分である可能性がある。
新たに承認された製品の保険カバー範囲や精算に関する不確実性も大きく,カバー範囲はFDAや同様の外国規制機関が薬物を承認する目的よりも限られている可能性がある。アメリカでは、新薬精算に関する主な決定は通常衛生と公衆サービス部に属するCMS機構によって行われる。CMSは新薬がどの程度連邦医療保険の下でカバーと精算されるかを決定し、個人支払者はよくCMSに大きく従う。第三者支払者の間には統一された製品保証と精算政策がなく、製品の保証と精算レベルは支払人によって異なる。そのため、保証範囲の確定過程は通常時間がかかって高価な過程であり、私たちの製品を使用するために単独で各支払人に科学と臨床支持を提供する必要があるかもしれないが、保証範囲と十分なものを保証することができない
S-41
精算は一貫して申請されるか、あるいは最初に得られるだろう。CMSが私たちのような根本的な新製品の精算にどのような決定を下すのか予測することは難しい。ヨーロッパの清算機関はCMSよりもっと保守的かもしれない。さらに、精算を受ける資格があるということは、いかなる薬物もすべての場合に支払われることを意味するわけではなく、または支払いの費用率は、研究、開発、製造、販売、流通を含む私たちのコストをカバーする。もし適用されれば、新薬の一時精算レベルも私たちのコストを支払うのに十分ではないかもしれないし、永久的にならないかもしれない。販売率は薬物の使用や臨床環境によって異なる可能性があり,すでに低コスト薬物のために設定された精算レベルに基づいている可能性があり,他のサービスの既存支払いにも組み込まれている可能性がある。私たちは政府援助や個人支払者から、私たちが開発する可能性のある任意の承認された製品の保証範囲と利益の支払率を迅速に得ることができません。これは、私たちの経営業績、候補製品を商業化するために必要な資金を調達する能力、および私たちの全体的な財務状況に実質的な悪影響を及ぼすかもしれません。
医薬品の正味価格は、政府医療計画または個人支払者が要求する強制的な割引またはリベート、および将来、米国価格よりも低い価格で販売される可能性のある国から医薬品を輸入することを制限する法律の緩和によって低下する可能性がある。私たちが開発したすべての承認された製品のために保証範囲と利益の収益率を迅速に得ることはできません。これは私たちの経営業績、製品の商業化に必要な資金を調達する能力、および私たちの全体的な財務状況に実質的な悪影響を及ぼす可能性があります。
ますます多くの第三者支払人は製薬会社に価格に基づいて所定の割引を提供し、医療製品の定価に挑戦することを要求している。私たちは私たちが商業化されたどの候補製品も精算できることを確実にすることはできない。もし精算できるなら、精算のレベルもそうだ。精算は私たちが市場で承認された任意の候補製品の需要や価格に影響を及ぼすかもしれない。精算を得るためには,医師は標準看護薬よりも患者が我々の製品を使用することが,価格の低い標準看護薬の後発薬を含むより良い治療結果を有することを証明する必要があるかもしれない。私たちは、管理型ヘルスケアの傾向、ヘルスケア組織のますます増加する影響力、および追加的な立法変化により、私たちの任意の候補製品の販売に関連する価格設定圧力に直面すると予想される。全体的に,医療コストの下振れ圧力は非常に大きくなり,特に処方薬,外科手術,その他の治療が行われている。そのため、新製品の参入にはますます高い壁が設けられている。
私たちの候補製品を国際的にマーケティングすることに関連する様々なリスクは私たちの業務に実質的な悪影響を及ぼす可能性があります
私たちは最終的にアメリカ以外の規制機関が私たちの候補製品を承認することを求める予定ですので、もし私たちが必要な承認を得たら、私たちは外国での運営に関する追加のリスクに直面すると予想しています
S-42
これらのリスクや国際業務に関連する他のリスクは、収益性ビジネスの能力を実現または維持することに大きな悪影響を及ぼす可能性があります。
私たちの知的財産権に関するリスクは
私たちの成功は私たちの知的財産権とノウハウを保護する能力にかかっている
私たちのビジネス成功は、私たちの候補製品、ノウハウ、およびその用途のために特許保護および商業秘密保護を取得および維持する能力、および他人の固有の権利を侵害することなく運営する私たちの能力にある程度依存する。私たちは一般に、私たちの候補製品、ノウハウ、およびその用途に関連する特許出願を米国および海外に提出することによって、私たちの固有の地位を保護しています。これらの特許は、私たちの業務に非常に重要です。私たちの固有の地位を保護するために、私たちは、発行された特許または処理されるべき出願を第三者から取得または許可することができる。
係属中の特許出願は、そのような出願において要求される技術を実施する第三者に対して強制的に実行することはできず、そのような出願が特許を発行するまで、かつ、発行された特許請求の範囲が技術をカバーする範囲に限定される。我々の特許出願または現在または未来のライセンシーの特許出願が追加の特許発行をもたらすことを保証することはできないし、または発行された特許は、同様の技術を有する競争相手に対して十分な保護を提供することになり、発行された特許が第三者によって侵害されないこと、設計されたこと、発見されたことが強制的に実行または無効にされないことを保証することはできない。
発行された特許が後に無効または強制執行できないと認定される可能性があり、または第三者または特許所有者が各特許庁または裁判所に提起した訴訟において修正または撤回される可能性がある。したがって、私たちと現在または未来のライセンシーの固有の権利に対する未来の保護の程度は不確定だ。限られた保護だけを提供するかもしれないし、私たちの権利を十分に保護できないかもしれないし、私たちがどんな競争優位性を獲得したり維持したりすることを可能にするかもしれない。これらの不確実性および/または制限は、私たちの財務状況および運営結果に重大な悪影響を及ぼす可能性があり、私たちの候補製品に関連する知的財産権を適切に保護することができる。
2022年9月30日現在、我々の特許組み合わせは、発行された米国特許1件、係属中の米国特許出願10件、米国以外の管轄区における発行済み特許2件、米国以外の管轄区における未解決特許9件、および特許協力条約に基づいて提出された4つの未解決国際特許出願を含む。私たちが持っている特許と特許出願は、物質の成分として私たちの製品候補であるフォソニーメタゾンの治療法、その他の小分子療法に対するものです。この米国特許は2037年6月に満期となり、規制遅延により特許期限が延長されることはない。カヴァス博士はこれらの会社が持っている特許の発明者です。私たちの特許組合せは、発行された8つの米国特許と、約13件の発行された特許と、WSUによって独占的に許可された米国以外の司法管轄区域で審査される1つの特許出願とをさらに含む。付与された特許の組み合わせは、物質組成物または医薬製剤としてのフォゴニメドンを直接カバーするのではなく、フルソニーミドンの活性代謝産物、すなわちヘキサン酸-チロシン-イソロイシン-(6)-アミノヘキサン酸アミドまたはジヘキシルアミン、およびジヘキシルアミンをカバーする発行された米国特許を含む、使用。カヴァス博士はそのうちの5つが許可されたアメリカ特許の発明者だ。
私たちは、私たちの係属中の特許出願中の特許請求または現在または将来の許可者の権利要件が、米国特許商標局またはUSPTO米国裁判所または外国特許庁および裁判所によって出願可能特許とみなされるか、または私たちが所有または許可している特許における権利要件が挑戦されたときに無効または実行不可能と認定されないと判断することはできない。
S-43
特許出願プロセスは多くのリスクと不確実性の影響を受けており、私たちまたは私たちの潜在的な未来のパートナーが特許を取得して保護することによって、私たちの候補製品を成功的に保護することを保証することはできない。これらのリスクと不確実性には
特許訴訟プロセスも高価で時間がかかり、私たちは、現在または未来の許可者と、合理的なコストまたはタイムリー、または商業的利点を持つ可能性のあるすべての司法管轄区域を保護するために必要または望ましいすべての特許出願を提出し、起訴することができないかもしれない。私たちまたは任意の既存または未来の許可者も、特許保護を受けるのが遅くなる前に、私たちの研究開発成果の特許可能な側面を識別できない可能性がある。
さらに、私たちは、私たちの従業員、外部科学協力者、CRO、第三者メーカー、コンサルタント、コンサルタント、および他の第三者などと、私たちの研究開発成果を得る権利のある特許に関する当事者と秘密保持および秘密協定を締結したにもかかわらず、いずれもこのような合意に違反し、特許出願を提出する前にそのような成果を開示し、特許保護を求める能力を危険にさらす可能性がある。
新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちの知的財産権は他の人たちが私たちと似ているか同じ製品を商業化することを排除するために十分な権利を提供してくれないかもしれない。
もし私たちが獲得した任意の特許保護の範囲が十分に広くない場合、あるいは私たちがいかなる特許保護を失った場合、競争相手が類似または同じ候補製品を商業化する能力が悪影響を受けることを阻止する
生物製薬会社の特許地位は通常高度に不確定であり、複雑な法律と事実問題に関連しており、近年多くの訴訟のテーマとなっている。したがって,我々の特許権の発行,範囲,有効性,実行可能性,商業的価値は高い不確実性を持っている.私たちの未解決および将来の特許出願および現在または将来の許可者の特許出願は、私たちを保護する候補製品の発行、または他の候補競合製品の商業化を効果的に阻止する特許の発行につながる可能性があります。
また,特許出願に要求されるカバー範囲は特許発行前に大幅に縮小することができ,その範囲は特許発行後に再解釈することができる.私たちが現在または将来所有しているまたは許可中の特許出願が特許の形態で発表されても、それらは、私たちに任意の意味のある保護を提供し、競争相手または他の第三者が私たちと競争することを阻止するか、または他の方法で私たちに任意の競争優位性を提供する形で発表されることはない。私たちが所有または許可している任意の特許は、第三者の挑戦または回避される可能性があり、または第三者の挑戦のために縮小、失効、または強制的に実行されない可能性がある。したがって、私たちは私たちの候補製品が保護可能なのか、まだ効果的で実行可能な特許によって保護されているのか分からない。我々の競争相手または他の第三者は、同様のまたは代替技術または製品を非侵害的に開発することによって、私たちの特許または任意の現在または将来の許可者の特許を回避することができ、これは、私たちの業務、財務状況、運営結果、および見通しに重大な悪影響を及ぼす可能性がある。
S-44
特許の発行は、その発明性、範囲、有効性、または実行可能性に対して決定的ではなく、我々の特許または任意の現在または将来のライセンシーの特許は、米国および海外の裁判所または特許庁で挑戦される可能性がある。私たちは、第3の方向の米国特許商標局が提出した既存技術の発行前提出、または反対、派生、撤回、再審査、付与後審査またはPGR、当事者間審査またはIPR、または私たちの特許権に挑戦する他の同様の手続きに参加する可能性がある。このような提出、訴訟、または訴訟における不利な裁決は、私たちの特許権の範囲を縮小したり、第三者が私たちの候補製品を商業化し、私たちと直接競争することを可能にしたり、第三者の特許権を侵害することなく製品を製造または商業化することができなくなる可能性があります
さらに、我々の特許または任意の現在または将来のライセンス者の特許は、外国特許庁の反対、現在または将来のライセンス者の発明優先権または他の特許的特徴に対する私たちの特許および特許出願の主張に挑戦する可能性がある。
例えば、本募集説明書の付録の他の場所で開示された訴訟を考慮すると、“リスク要因”の一部のタイトルの下で“-私たちおよび私たちのいくつかの役員および役員が、巨額のコストをもたらし、経営陣の注意をそらす可能性のある訴訟の被告とされている”と、私たちの最新のForm 10-Q四半期報告書の“第2の部分、第1の-法的訴訟”(参照して本明細書に組み込むことによって)を含む訴訟を考慮すると、第三者は、私たちが許可した特許および特許出願の有効性または実行可能性を疑問視することができる。法的に無効と実行不可能と断言された後の結果は予測できない。このような挑戦は、特許権の喪失、排他性の喪失、または特許主張の縮小、無効、または実行不能をもたらす可能性があり、これは、我々が発行した特許に含まれないジヘキサノンの他の修正のような、同様の技術および製品の使用を阻止すること、または商業化する能力を制限する可能性がある。最終的な結果が私たちに有利であっても、このような手続きは大量のコストを招く可能性があり、私たちの科学者と経営陣に多くの時間がかかる必要がある。さらに、私たちが許可した特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、結果にかかわらず、会社が私たちと協力し、現在または将来の候補製品を認可、開発、または商業化することを阻止することができる。さらに、これらの訴訟手続きは、私たちの業務、運営結果、および財務状況に実質的な悪影響を及ぼす可能性がある。
私たちはFosgonimetonをカバーする特許と特許出願を持っているにもかかわらず、私たちの特許と私たちが獲得した未来の特許は、他の人が私たちの候補製品と類似した製品を開発したり商業化したりすることを効果的に阻止できないかもしれない。Fosgonimeton特許家族は西豪州立大学が発行したDihea特許とは異なり、同じ特許家族の一部でもないため、Kais博士が博士研究で画像を改ざんした疑いとは無関係であるが、第三者はこれらの疑惑を利用して、私たちが持っている特許や特許出願の有効性と実行可能性を疑問視する可能性がある。このような事件は大量のコストを招く可能性があり、私たちの科学者や経営陣が多くの時間を費やし、最終的な結果が私たちに有利であっても、会社が私たちと協力して許可し、現在または未来の候補製品を開発したり、商業化したりすることを阻止するかもしれない。
私たちおよび/またはWSUは、Kais博士が博士の学習中に画像を改ざんしたという疑惑があるので、Kais博士が博士の学習中に画像を改ざんしたとして、これらの特許(ジヘキサノンに関連する任意の特許を含む)の実行可能性および有効性を再検討するために、いくつかの追加審査の請求をUSPTOに提出する可能性がある。どんな補完的な検査手続きの結果も予測できない。実質的な新たな特許性問題が発見された場合、米国特許商標局取締役は、その特許の一方的な再審査を命令する。このような手続きで不利な裁決を下すことは,影響を受ける特許権の範囲を縮小したり,無効にしたり,実行できなくする可能性がある.当方に有利な補充審査プログラムは、審査された特許の有効性および実行可能性の推定を支持するが、第三者は、訴訟または他の法的手続きにおいて特許および特許出願に疑問を提起することができる。
知的財産権は必ずしも私たちの競争優位に対するすべての潜在的な脅威を解決できるとは限らない
私たちの知的財産権が提供する未来の保護の程度は不確定であり、知的財産権には限界があるため、私たちの業務を十分に保護できないか、あるいは競争優位性を維持することができるかもしれない。例えば:
S-45
このような事件が発生した場合、私たちの業務、運営結果、そして将来性を深刻に損なう可能性がある。
私たちのビジネスの成功は、第三者の特許や他の固有の権利を侵害することなく運営する私たちの能力に大きく依存する。第三者は私たちが彼らの専有権を侵害し、損害賠償責任を招いたり、私たちの開発と商業化努力を阻害したり延期したりする可能性があると主張している。
私たちの商業的成功は第三者の特許と固有の権利の侵害を避けることにある程度依存する。しかし、私たちの研究、開発、および商業化活動は、第三者が所有または制御している特許または他の知的財産権を侵害または他の方法で侵害される可能性がある。他のエンティティは、特許または独自の権利を有しているか、または取得することができ、これは、私たちの候補製品および将来承認される可能性のある製品を製造、使用、販売、提供、または輸入する能力を制限し、または私たちの競争的地位を損なう可能性がある。アメリカ国内外で、生物製薬業界は特許と他の知的財産権に関連する訴訟を大量に持っており、特許侵害訴訟、異議、再審、知的財産権訴訟、アメリカ特許商標局および/または対応する外国特許庁に提起されたPGR訴訟を含む。我々が候補製品を開発している分野には,第三者米国や外国から発行された特許や係属中の特許出願が多く存在する.我々の候補製品の使用または製造に関連する第三者特許または材料、配合、製造方法または治療方法の請求項に記載の特許出願が存在する可能性がある。
バイオ製薬業界の拡張や特許の発行に伴い、我々の候補品が第三者特許権侵害の告発を受けるリスクが高まる可能性がある。特許出願は一定期間秘密であるため、関連出願が公表される前に、任意の候補製品の商業化が第三者特許を侵害する可能性があることを知らない可能性があり、製品候補又は技術に関連する特許出願を初めて提出した会社であることも確認できない。さらに、特許出願が発表されるまでに数年かかる可能性があるため、現在処理されている特許出願がある可能性があり、後で私たちの候補製品が発行された特許を侵害する可能性がある。さらに、特許検索は、特許間の用語の違い、データベースの不完全さ、および特許請求の意味を評価することが困難であるため、我々の技術に関連する可能性のある第三者特許権を識別することは困難である。私たちが知っていない保証もありませんが、私たちの業務とは関係のない既存技術だと思いますが、それにもかかわらず、最終的には、これらの技術が私たちの製造、使用、販売、販売、提供、または将来承認される可能性のある候補製品を輸入する能力を制限したり、私たちの競争的地位を損なったりすることが発見されるかもしれません。さらに、第三者は将来的に特許を取得し、私たちの技術を使ってこれらの特許を侵害したと主張するかもしれない。第三者が主張するいかなる特許侵害請求も非常に時間がかかり、可能性がある
S-46
本募集説明書の付録の日まで、第三者が私たちの特許を侵害したと主張していないにもかかわらず、他の人は独自の権利を持っている可能性があり、私たちの候補製品の発売を阻止する可能性があります。私たちの特許関連法律訴訟に対して損害賠償を要求し、私たちの候補製品、治療適応、またはプロセスに関連する商業活動を禁止しようと努力しても、故意に侵害されたと判断された場合、3倍賠償し、私たちの候補製品を製造またはマーケティングする許可証を取得することを含む重大な損害賠償責任を負うことができます。これらのクレームの弁護は、その是非にかかわらず、巨額の訴訟費用がかかり、当社の業務における従業員資源を大量に移転することになる。私たちがこのような訴訟に勝つかどうかは予測できませんし、これらの特許に必要ないかなる許可が商業的に受け入れられる条項で提供されるかどうかも予測できません。また,我々や将来の戦略的パートナーが許可を得ることができても,これらの権利は非排他的である可能性があり,これは我々の競争相手が同じ知的財産権を獲得する可能性がある.さらに、必要であれば、権利侵害を避けるために、私たちの候補製品、私たちの治療適応、または過程を再設計できるかどうかを決定することはできない。したがって、司法や行政訴訟で不利な裁決を下したり、必要なライセンスを取得できなかったりすることで、私たちの候補製品の開発と商業化を阻止することができ、これは私たちの業務、財務状況、経営業績を損なう可能性があります。また、知的財産権訴訟は、その結果にかかわらず、負の宣伝をもたらす可能性があり、私たちの候補製品や技術をマーケティングまたは他の方法で商業化することを禁止する可能性があります。
私たちにクレームを出した当事者は、彼らがより多くの資源を持っているので、私たちよりも複雑な特許訴訟の費用を効果的に維持することができるかもしれない。さらに、知的財産権訴訟や行政訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報が開示によって漏洩される可能性がある。さらに、任意の訴訟の開始および継続によって生じる任意の不確実性は、追加資金を調達する能力に重大な悪影響を及ぼすか、または私たちの業務、運営結果、財務状況、および将来性に重大な悪影響を及ぼす可能性がある。
私たちは買収と許可を通じて私たちの候補製品に必要な権利を獲得したり維持することができないかもしれない
私たちの開発計画は将来的に第三者が持つ独占権を使用する必要があるかもしれないので、私たちの業務の成長は、これらの第三者の独占権を取得、許可、または使用する能力にある程度依存するかもしれません。私たちは、私たちの候補製品にとって必要と考えられる任意の成分、使用方法、プロセス、または他の第三者知的財産権を第三者から得ることができないかもしれません。第三者知的財産権の許可·買収は競争分野であり、一部のより成熟した企業は、魅力的または必要と考えられる第三者知的財産権許可または買収戦略をとる可能性がある。これらの老舗会社はその規模、資本資源及び更に強い臨床開発と商業化能力のため、私たちより競争優位を持っているかもしれない。しかも、私たちを競争相手と思っている会社は私たちに権利を譲渡したり許可したりしたくないかもしれない。私たちはまた私たちの投資を適切なリターンを得るための条項で許可したり、第三者の知的財産権を取得することができないかもしれないし、全くできないかもしれない。もし私たちが必要な第三者知的財産権を得ることに成功しなかった場合、あるいは既存の知的財産権を維持できない場合、関連計画や候補製品の開発を放棄しなければならない可能性があり、これは私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。
私たちは、私たちの特許または現在または未来の許可者の特許を保護または強制する訴訟に巻き込まれる可能性があり、これは高価で、時間がかかり、成功しないかもしれない。さらに、法廷で疑問視された場合、私たちが発行した特許または現在または未来のライセンシーの特許は、無効または強制的に実行できないと認定される可能性がある
競争相手は私たちの知的財産権を侵害するかもしれない。権利侵害や不正使用を防ぐために、私たちは権利侵害請求を要求されるかもしれません。これは高価で時間がかかるかもしれません。さらに、特許侵害訴訟では、裁判所は、私たちが所有しているまたは許可中の特許が無効であること、強制執行できないこと、および/または侵害されていないと判断することができる。もし私たちまたは未来の任意の潜在的協力者が第三者に対して法的訴訟を提起して、私たちの候補製品に対する特許を強制的に執行する場合、被告は私たちの特許または任意の既存または未来のライセンシーの特許を無効にし、および/またはすべてまたは一部を強制的に執行することができない。米国の特許訴訟では,被告が無効および/または実行不可能と主張する反訴が一般的である。有効性を疑問視する理由には、新規性の欠如、明らかな、十分な書面記述の欠如、有効化されていないこと、またはいくつかの法定要件のいずれかを満たすことができなかったと言われている
S-47
実用型二重特許。主張を実行できない理由は、特許訴訟に関連する人が誤って陳述したり、米国特許商標局に関連情報を誤って隠蔽したり、起訴中に誤った陳述をしたりすることを含む可能性がある。
第三者は、訴訟の範囲外であっても、米国特許商標局または海外特許庁に類似した無効クレームを提出することができる。このようなメカニズムは、再審、PGR、知的財産権、派生手続き、および外国司法管轄区域の同等の手続き(例えば、反対手続き)を含む。このような訴訟は、私たちの技術またはプラットフォーム、または私たちが開発する可能性のある任意の候補製品をカバーしないように、私たちの特許または現在または未来のライセンシーの特許を撤回、キャンセルまたは修正する可能性がある。法的に無効と実行不可能と断言された後の結果は予測できない。例えば、有効性の問題については、私たちは無効な以前の技術がないとは確信できないが、私たちと特許審査員は起訴中にこれを知らない。もし第三者が無効または強制不可能な法的主張に勝った場合、私たちは少なくとも部分的、さらにはすべて、私たちの技術またはプラットフォーム、または私たちが開発する可能性のある任意の候補製品の特許保護を失うだろう。このような特許保護の喪失は、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすだろう。
法律が無効であると断言し、および/または強制的に実行できない結果は予測不可能であり、従来技術は、我々の特許または任意の現在または将来の許可者の特許を無効にする可能性がある。我々の特許および特許出願または任意の現在または未来のライセンシーの特許および特許出願に関連するすべての潜在的に関連する以前の技術が発見されたことは保証されない。私たちが知っていることがないことも保証されないが、私たちの特許および特許出願または任意の既存または将来のライセンシーの特許および特許出願におけるクレームの有効性または実行可能な以前の技術に影響を与えないと考えられるが、それにもかかわらず、最終的には、クレームの有効性または実行可能性に影響を与えることが発見される可能性がある。さらに、発行された特許請求が十分な書面説明が不足しているか、または有効でないことが発見された場合、私たちの特許または現在または未来のライセンシーの特許を無効にする可能性がある。
被告が無効および/または強制執行できない法的主張に勝った場合、私たちは候補製品の少なくとも一部またはすべての特許保護を失う可能性がある。さらに、我々の特許および特許出願または任意の現在または将来の許可者の特許および特許出願によって提供される保護の広さまたは強度が脅かされている場合、会社が現在または将来の候補製品を許可、開発、または商業化することを阻止する可能性がある。このような特許保護の喪失は私たちの業務に実質的な悪影響を及ぼすだろう。
解決策が私たちに有利であっても、私たちの知的財産権に関する訴訟や他の法的手続きは、私たちに巨額の費用を発生させ、私たちの技術や管理者の正常な責任を分散させる可能性があります。また、公聴会、動議、または他の一時的な手続きまたは事態の発展の結果が公表される可能性があり、証券アナリストや投資家がこれらの結果がマイナスだと思う場合、私たちの普通株の価格に大きな悪影響を及ぼす可能性がある。このような訴訟または訴訟は、私たちの運営損失を大幅に増加させ、開発活動または任意の将来の販売、マーケティング、または流通活動に使用することができるリソースを減少させる可能性がある。私たちはそのような訴訟や訴訟手続きを適切に行うのに十分な財政的または他の資源がないかもしれない。私たちのいくつかの競争相手は、彼らがより多くの財政資源を持っているので、私たちよりもこのような訴訟や訴訟の費用を効率的に負担するかもしれない。特許訴訟や他の訴訟の開始と継続による不確実性は、市場での私たちの競争能力を損なう可能性がある。
さらに、知的財産権訴訟または私たちの知的財産権に関連する他の法的手続きが大量の開示を必要とするため、私たちのいくつかの機密情報は、そのような訴訟または他の手続きで開示によって漏洩される可能性がある。聴聞、動議、または他の一時的手続き、または事態発展の結果を公開することもできる。もし証券アナリストや投資家がこれらの結果がマイナスだと思っていれば、私たちの普通株の価格に実質的な悪影響を及ぼす可能性がある。
しかも、特許の発行は私たちに特許発明を実践する権利を与えない。第三者は私たち自身の特許製品の販売を阻止し、私たち自身の特許技術を実践する特許を持っているかもしれない。
知的財産権訴訟や法的手続きは不利な宣伝を招き、私たちの名声を損なう可能性があり、私たちの普通株の市場価格の下落を招く可能性がある。
任意の知的財産権訴訟または法律手続の過程において、訴訟または法律手続の開始および聴聞結果、裁決の発議および他の臨時手続の公告がある可能性がある。もし証券アナリストや投資家がこれらの声明が否定的だと思うなら、私たちの既存の候補製品、計画、または知的財産権の知覚価値は低下する可能性がある。したがって、私たちの普通株の市場価格は下がるかもしれない。このような声明はまた私たちの名声や私たちの未来の製品の市場を損なう可能性があり、これは私たちの業務に実質的な悪影響を及ぼすかもしれない。
S-48
発明の優先度を決定するためには、派生プログラムが必要である可能性があり、不利な結果は、関連技術の使用を停止すること、または勝利者から権利許可を得ようと試みることを要求することができる
第三者によって開始されるか、または我々によって提起されるか、または米国特許商標局によって発表される派生プログラムは、我々の特許または特許出願、または任意の既存または将来の許可者の発明に関する優先度を決定するために必要である可能性がある。不利な結果は、私たちが関連技術の使用を停止することを要求するか、または勝利者から許可を得ようとすることを要求するかもしれない。もし勝利者が商業的に合理的な条件で私たちにライセンスを提供しなければ、私たちの業務は損害を受ける可能性があります。派生訴訟の弁護は失敗する可能性があり、成功しても巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。さらに、このようなプログラムに関連する不確実性は、私たちの臨床試験を継続するために資金を調達し、私たちの研究計画を継続し、第三者から必要な技術的許可を得たり、パートナー関係を開発または製造する能力に実質的な悪影響を及ぼす可能性があり、これらの資金は、候補製品を市場に出すのを助けるだろう。
特許改革立法は、我々が発行した特許または任意の現在または将来の許可者をめぐる特許出願を増加させ、我々が発行した特許または任意の現在または将来の許可者の特許を実行または保護する不確実性およびコストを増加させる可能性がある
2011年9月16日、“ライシー·スミス米国発明法”または“ライシー·スミス法案”が法律に署名された。“ライシー·スミス法案”は米国特許法を多くの重大な改正を行った。このような条項は特許出願起訴方式に影響を与える条項を含み、特許訴訟に影響を及ぼす可能性もある。特に、“ライシー·スミス法案”によれば、米国は2013年3月に“最初に特許出願を提出した発明者”制度に移行し、この制度の下で、他の特許性要件を満たすと仮定して、最初に特許出願を提出した発明者は、要求された発明が第三者が最初に発明したものであるか否かにかかわらず、特許を取得する権利がある。したがって、2013年3月以降であるが、我々が以前に米国特許商標局に特許出願を提出した第三者は、たとえ第三者が発明を行う前に本発明を作成したとしても、我々の発明をカバーする特許を付与することができる。これは私たちが発明から特許出願までの提出時間を認識することを要求するだろう。さらに、有効かつ強制的に実行可能な特許を取得して維持する能力は、我々の技術と従来技術との差が、我々の技術が従来技術よりも特許を取得することを可能にするか否かに依存する。米国およびほとんどの他の国/地域の特許出願は、提出後または発行前の期間は秘密であるため、私たちまたは任意の現在または未来の許可者が、(1)私たちの候補製品に関連する特許出願または(2)発明特許または特許出願に要求される任意の発明を提出する最初の会社であることを決定しない可能性がある。
Leahy-Smith法案はまたいくつかの大きな変化を含み、これらの変化は特許出願の起訴方法に影響を与え、特許訴訟に影響を与える可能性もある。これらの措置は、特許訴訟中に米国特許商標局が印刷出版物を第3の方向に提出することを可能にすることと、PGR、IPRおよび派生プログラムを含む米国特許商標局によって管理された許可後訴訟手続き(PGR、IPRおよび派生プログラムを含む)によって特許の有効性または実行可能性を攻撃する追加の手続きとを含む。このような提出または手続きにおける不利な裁決は、私たちの特許権の範囲を縮小したり、実行可能にしたり、無効にしたりして、私たちの競争的地位に悪影響を及ぼす可能性があります。
USPTO手続きの証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続において、USPTOが権利請求を無効にするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって,第三者は米国特許商標局の手続きを用いて我々の特許主張の無効を宣言しようとする可能性があり,第三者が地域裁判所訴訟で最初に被告として疑問を提起すれば,我々の特許主張は無効ではない.したがって、“ライシー·スミス法案”およびその実施は、私たちを起訴する特許出願または任意の既存または将来のライセンシーをめぐる特許出願を増加させ、私たちが発行した特許または任意の既存または未来のライセンシーの特許を実行または保護する不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。
米国特許法や他の国の法律の変化は、特許の全体的な価値を低下させ、候補製品を保護する能力を弱める可能性がある
他の生物製薬会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存している。生物製薬産業で特許を取得して実施することは高度な技術と法律の複雑さに関連している。したがって、生物製薬特許を取得して実行することは高価で、時間と固有の不確実性だ。米国及び他の国の特許法又は特許法解釈の変化は、我々の知的財産権の価値を低下させる可能性があり、特許出願をめぐる起訴及び特許出願の実行又は保護の不確実性及びコストを増加させる可能性がある。私たちは、私たちの特許または第三者特許で許容または実行される可能性のある特許請求の範囲の広さを予測することができない。しかも、国会や他の外国立法機関は私たちに不利な特許改革立法を通過するかもしれない。
S-49
例えば、米国最高裁判所は近年、いくつかの特許事件に対して裁決を下しているが、場合によっては利用可能な特許保護範囲を縮小するか、場合によっては特許所有者の権利を弱めるかである。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.米国議会、米国連邦裁判所、米国特許商標局または外国司法管轄区の類似機関の決定によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それによって、私たちが新しい特許を獲得したり、私たちの既存の特許と私たちが将来獲得または許可する可能性のある特許を実施する能力を弱める可能性がある。例えば、特許が付与されると、欧州特許出願はすぐに単一特許に選択することができ、これは単一特許裁判所(UPC)によって管轄されるであろう。単一特許を選択することは欧州特許実践の大きな変化になるだろう。UPCは新しい裁判所制度であるため、裁判所には前例がなく、UPCにおける任意の訴訟の不確実性が増加している。
私たちは私たちの特許と他の知的財産権の発明権または所有権のクレームに疑問を受けるかもしれない
私たちはまた、元従業員や他の第三者が私たちの特許や他の知的財産権の所有権を持っているというクレームを受ける可能性がある。訴訟は、これらと他の挑戦在庫または所有権のクレームに対抗するために必要かもしれない。もし私たちがこのようなクレームを弁護することができなければ、お金の損害賠償を支払う以外に、私たちは貴重な知的財産権を失う可能性がある。このような結果は私たちの業務に実質的な悪影響を及ぼすかもしれない。私たちがこのようなクレームを弁護することに成功しても、訴訟は巨額のコストを招き、経営陣や他の従業員の注意を分散させる可能性がある。
特許条項は候補製品に対する私たちの競争地位を十分に長く保護するのに十分ではないかもしれない
特許の寿命は限られている。米国では、すべての維持費が適時に支払われる場合、特許の自然失効時間は、通常、米国で最初の非臨時出願日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許を取得しても、特許有効期限が切れたら、競争製品からの競争を受け入れるかもしれません。新製品候補製品の開発、テスト、および規制審査に要する時間を考慮すると、これらの候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちの特許の組み合わせは、他社が私たちと似ているか同じ製品を商業化することを排除するために、私たちに十分な権利を提供していないかもしれない。
もし私たちが私たちの候補製品のために特許期間を延長しなければ、私たちの業務は実質的な損害を受けるかもしれない
FDAが我々の候補製品が発売される時間、期限および詳細を承認することによれば、私たちの1つまたは複数の米国特許または任意の既存または将来の許可者の特許は、1984年の“薬品価格競争および特許期限回復法”または“ハッジ·ワックスマン修正案”に従って限られた特許期間を回復する資格がある可能性がある。ハッジ·ワックスマン改正案は、製品開発およびFDA規制審査中に失われた特許期間の補償として、特許回復期間を最長5年とすることを許可している。各FDAが承認した製品は、FDA規制審査中に失われた特許期間の補償として最大1つの特許を延長することができる。特許期間の延長は、製品承認日から計14年の期間を超えてはならず、当該承認された薬品、その使用方法又はその製造方法に関連する請求項のみが延長することができる。私たちの候補製品が規制部門の承認を得られれば、特定の国/地域でも特許期間を延長することができる。しかし,適用の最終期限内に出願を提出できなかったこと,関連特許の満了前に出願を提出できなかったことや適用の要求を満たしていなかったことなどにより延期が得られなかった可能性がある.しかも、特許保護の適用期間や範囲は私たちが要求しているものよりも短いかもしれない。もし私たちが特許期間の延長や回復を得ることができない場合、あるいはどのような延長の期限が私たちが要求したよりも短い場合、私たちの競争相手は私たちの特許が満期になった後に競争製品の承認を得ることができ、私たちの収入は減少する可能性があり、実質的である可能性がある。また、このような状況が発生すれば、私たちの競争相手は私たちの開発と臨床試験への投資を利用して、私たちの臨床と非臨床データを参考にして、他の場合よりも早く彼らの製品を発売するかもしれない。
私たちは世界各地で私たちの知的財産権を保護することができないだろう
私たちはアメリカとアメリカ以外の管轄区域で発行された許可内の特許と被審査特許出願を持っています。しかし、世界各国で特許を申請、起訴、保護する費用は目を引くほど高く、米国以外のいくつかの国での知的財産権は米国ほど広くないかもしれない。また、いくつかの外国の法律は知的財産権の保護の程度はアメリカの連邦や州法律に及ばない。したがって、第三者がアメリカ以外のすべての国で私たちの発明を実施したり、国内外で私たちの発明を使用して製造した製品を販売したり輸入したりすることを阻止することはできません
S-50
アメリカや他の管轄区域です競争者は私たちが特許保護を受けていない司法管轄区域で私たちの発明を使用して自分の製品を開発することができ、また、他の侵害製品を私たちが特許保護を持っている地域に輸出することもできるが、法執行力はアメリカに及ばない。これらの製品は私たちの候補製品と競争するかもしれませんが、私たちの特許、現在または未来の許可者の特許、または他の知的財産権は、彼らの競争を効果的にまたは阻止するのに十分ではないかもしれません。
多くの会社は外国の管轄区域の知的財産権の保護と保護に重大な問題に直面している。多くの国の法制度は、特許および他の知的財産権保護の強制執行を支持しておらず、これは、私たちの特許または現在または未来のライセンシーの特許を侵害することを阻止したり、私たちの専有権を侵害する方法で競争製品を販売することを阻止することを困難にするかもしれない。外国の管轄区域で私たちの特許権を強制的に執行する訴訟は、大きなコストを招く可能性があり、私たちの努力と注意を私たちの業務の他の側面から移すことは、私たちの特許または任意の既存または未来のライセンシーの特許が無効または狭義に解釈されるリスクに直面する可能性があり、私たちの特許出願または任意の現在または未来のライセンシーの特許出願は発行されないリスクに直面し、第三者が私たちにクレームを提起する可能性がある。私たちは私たちが起こしたどんな訴訟でも勝てないかもしれないし、判決された損害賠償や他の救済措置(もしあれば)は商業的な意味がないかもしれない。したがって、私たちが世界各地で私たちの知的財産権を実行する努力は、私たちが開発または許可した知的財産権から顕著なビジネスメリットを得るのに十分ではないかもしれません。
多くの国に強制許可法があり,これらの法律により特許権者は第三者に強制的に許可を付与される可能性がある。また、多くの国は政府機関や政府請負業者に対する特許の実行可能性を制限している。これらの国では,特許権者の救済措置は限られている可能性があり,このような特許の価値を大幅に低下させる可能性がある。もし私たちが第三者に私たちの業務に関連する任意の特許の許可を与えることを余儀なくされた場合、私たちの競争地位は損なわれる可能性があり、私たちの業務、財務状況、運営結果、および将来性は不利な影響を受ける可能性がある。
地政学的行動は、私たちの特許出願または任意の既存または将来のライセンシーの特許出願をめぐる起訴またはメンテナンス、ならびに私たちが発行した特許または任意の既存または未来のライセンシーの特許の維持、強制執行または弁護の不確実性およびコストを増加させる可能性がある。例えば、ロシアのウクライナ侵攻に関連する米国と外国政府の行動は、ロシアでの特許出願の提出、起訴、維持を制限または阻止する可能性がある。政府の行動はまたロシアで発行された特許を維持することを阻止するかもしれない。これらの行動は、ロシアにおける特許権の一部または全部の喪失を招く可能性がある私たちの特許または特許出願を放棄または失効させる可能性がある。このような事件が発生すれば、私たちの業務に実質的な悪影響を及ぼす可能性がある。また、ロシア政府は、2022年3月に、米国や他のロシアが友好的でないと考えている国·地域でロシアの会社や個人が、同意または補償なしに、特許権者が所有している発明を利用して、米国および他のロシアが友好的でないと考えている国で公民権または国籍を有し、米国や他の国に登録しているか、またはこれらの国に主要な商業または利益活動場所を有することを許可する法令を採択した。したがって、私たちは、第三者がロシアで私たちの発明を実践したり、私たちの発明を使用して製造された製品をロシア国内で販売したり輸入したりすることを防ぐことができないだろう。したがって、私たちの競争地位は損なわれる可能性があり、私たちの業務、財務状況、経営業績、見通しは不利な影響を受ける可能性があります。
私たちの特許保護の獲得と維持は、法規および政府特許機関によって提出された様々な手続き、文書、費用支払い、および他の要求に依存しており、これらの要求に適合しなければ、私たちの特許保護は減少またはキャンセルされる可能性がある。
我々の特許および/または出願および任意の既存または将来のライセンシーの特許および/または出願の生命期間内に、定期維持費、継続費、年会費および様々な他の政府費用は、我々の特許および/または出願、ならびに任意の既存または将来のライセンシーの特許および/または出願の生命期間内の異なる時間に、米国特許商標局および各外国特許庁に支払われる。私たちはシステムが私たちにこれらの費用を支払うことを注意して、私たちは私たちの外部特許年金サービスが満期になった時にこれらの費用を支払うことに依存します。また、米国特許商標局および各外国特許庁は、特許出願過程において、いくつかのプログラム、文書、費用支払い、および他の同様の条項を遵守することを要求する。私たちは名声の良い法律事務所や他の専門家を招いて私たちの遵守を助け、多くの場合、不注意は滞納金を支払うことによって、あるいは特定の管轄区域に適用される規則に従って他の方法で是正することができる。しかしながら、場合によっては、規定を遵守しないことは、特許または特許出願の放棄または失効をもたらす可能性があり、それにより、関連する管轄区域の特許権の一部または全部が失われる可能性がある。このような事件が発生すれば、私たちの業務に実質的な悪影響を及ぼす可能性がある。
もし私たちの商標と商号が十分に保護されていなければ、私たちは興味のある市場で知名度を作ることができないかもしれません。私たちの業務は悪影響を受けるかもしれません
私たちは登録または未登録の商標または商号を使用して、私たち自身と私たちの製品をブランドしてマーケティングするつもりです。私たちの商標または商号は、挑戦、侵害、回避、または汎用商標として発表されるか、または他の商標を侵害していると判断される可能性がある。私たちはこれらの商標や商品名に対する私たちの権利を保護できないかもしれません。これらの商標と商品名は、私たちが関心のある市場で潜在的なパートナーや顧客の知名度を確立する必要があり、登録は困難かもしれませんし、コストも高いです
S-51
米国国内外の司法管轄区域では、これらの商標および商号に対する私たちの権利を維持および/または保護する。時々、競争相手は私たちと似たような商品名や商標を採用して、ブランド表示を確立する能力を阻害し、市場の混乱を招く可能性があります。さらに、他の登録商標または商標の所有者は、我々の登録または未登録商標または商号の変異体を含む商号または商標侵害クレームを提出することができる。長期的には、私たちの商標や商号に基づいて名称を確立することができなければ、効果的に競争できない可能性があり、私たちの業務は悪影響を受ける可能性があります。商標、商業秘密、ドメイン名、著作権または他の知的財産権に関連する専有権を実行または保護する努力は無効である可能性があり、大量のコストおよび資源移転を招き、私たちの財務状況または運営結果に悪影響を及ぼす可能性があります。
もし私たちが私たちの商業秘密の機密性を保護できなければ、私たちの商業と競争の地位は損なわれるだろう
さらに、私たちは、非特許技術的ノウハウ、技術、および他の独自の情報を含む、私たちのビジネス秘密を保護することによって、私たちの競争地位を維持します。第三者との秘密協定の締結や、従業員、コンサルタント、コンサルタントとの秘密情報および発明協定の締結など、当社のビジネス秘密および非特許ノウハウを保護する措置を講じていますが、そのようなすべての合意が正式に実行されている保証はありません。いずれも契約に違反し、私たちのビジネス秘密を含めて独自の情報を漏洩する可能性があり、このような違反について十分な救済措置を得ることができない可能性があります。強制執行側が商業秘密を不正に開示したり流用したりする主張は困難であり、高価で時間がかかり、結果は予測できない。しかも、米国国内外のいくつかの裁判所は商業秘密をあまり望んでいないか、または保護したくない。
さらに、第三者は、この情報を取得する可能性があり、またはこの情報または同様の情報を独立して取得する可能性があり、私たちは、彼らが技術または情報を使用して私たちと競合することを阻止する権利がない。もしこのような事件が発生した場合、あるいは私たちが他の方法で私たちの商業秘密の保護を失った場合、これらの情報の価値は大幅に低下し、私たちの競争的地位は損なわれるかもしれない。もし私たちが特許発表前に特許保護を申請しない場合、または私たちの独自技術および他の機密情報を他の方法で秘密にすることができない場合、私たちが特許保護または私たちの商業秘密情報を保護する能力が脅かされる可能性がある。
私たちは私たちまたは私たちの職員たちがいわゆる機密情報や商業秘密を誤って使用または漏洩したと告発されるかもしれない
我々は、外部科学協力者、CRO、第三者製造業者、コンサルタント、コンサルタント、潜在的パートナー、多会社の財産を共有するテナント、および他の第三者のような第三者の独自の地位を保護するために、将来的にセキュリティおよびセキュリティ協定を締結することが可能である。第三者が私たちまたは私たちの従業員が無意識にまたは他の方法で合意に違反し、第三者の独自の商業秘密または他の情報を使用または開示したと主張した場合、私たちは訴訟を受ける可能性がある。このような問題の弁護は、その是非曲直にかかわらず、巨額の訴訟費用がかかり、私たちの業務から従業員資源を大量に移転する可能性がある。私たちは私たちがこのようなどんな行動でも勝つかどうか予測できない。また、知的財産権訴訟は、その結果にかかわらず、負の宣伝を招く可能性があり、私たちの候補製品をマーケティングまたは他の方法で商業化することを禁止する可能性があります。このようなクレームに抗弁しなければ、重大な金銭的損失責任を負わせたり、開発や商業化努力を阻害したり、延期したりする可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。私たちがこれらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの管理チームや他の従業員の注意を分散させる可能性がある。
私たちにクレームをつけた当事者は、彼らがより多くの資源を持っているので、私たちよりも複雑な知的財産訴訟の費用を効率的に負担することができるかもしれない。さらに、知的財産権訴訟に関連する大量の開示要求により、私たちのいくつかの機密情報が開示によって漏洩する可能性がある。さらに、任意の訴訟の開始および継続によって生じる任意の不確実性は、追加資金を調達する能力に重大な悪影響を及ぼすか、または私たちの業務、経営業績、財務状況、および見通しに重大な悪影響を及ぼす可能性があります。
私たちは競争相手から従業員を誤って雇用したか、または私たちまたは私たちの従業員が彼らの前の雇用主の機密情報や商業秘密を間違って使用または開示したという非難を受けるかもしれない
バイオ製薬業界では、私たちの従業員のほかに、コンサルタントを招いて候補製品の開発を手伝ってくれていますが、これはバイオ製薬業界ではよく見られます。これらのコンサルタントの多くと、私たちの多くの従業員は、以前、他の生物製薬会社のためにコンサルティングサービスを提供していたか、または現在、他の生物製薬会社のためにコンサルティングサービスを提供していたか、または現在、他の生物製薬会社にコンサルティングサービスを提供していたか、または可能性があります
S-52
私たちの競争相手や潜在的な競争相手を含む会社です。私たちは、私たち、私たちの従業員またはコンサルタントが無意識に、またはその前の雇用主またはその前の顧客または現在の顧客の商業秘密または他の固有の情報を使用または漏洩したという疑惑の影響を受けるかもしれない。このような疑いに対抗するために訴訟を提起する必要があるかもしれない。もし私たちがこのようなクレームを弁護することができなければ、金銭損害賠償の支払いに加えて、貴重な知的財産権や人員を失う可能性があり、これは私たちの業務に悪影響を及ぼす可能性がある。私たちがこれらのクレームを弁護することに成功しても、訴訟は巨額のコストを招き、私たちの管理チームや他の従業員の注意を分散させる可能性がある。
私たちが私たちの候補製品を開発して商業化する権利は、他人が私たちに付与する許可証の条項と条件にある程度制限されるかもしれない
私たちは第三者とライセンス契約を締結しており、将来的には他社と追加のライセンス契約を締結して、私たちの研究開発や候補製品の商業化を進めることができるかもしれません。これらの許可および他の許可は、すべての関連使用分野および将来的に私たちの候補製品を開発すること、またはそれを商業化するすべての地域でそのような知的財産権および他の権利を使用することを望む独占的権利を提供しない可能性がある。
さらに、このような許可協定のいずれかの条項によれば、私たちは、第三者から許可を得た候補製品をカバーする特許および特許出願の準備、提出、起訴、維持、強制執行および弁護を制御する権利がないかもしれない。この場合、私たちはこれらの特許および特許出願が私たちの業務の最適な利益に合った方法で準備、提出、起訴、維持、実行、および弁護されるかどうかを決定することができない。もし私たちの現在または未来の任意の許可者がこれらの特許を起訴、維持、強制実行および保護できなかった場合、またはこれらの特許または特許出願の権利を失う場合、私たちが許可を得た権利は減少またはキャンセルされる可能性があり、そのような許可権利によって制限された候補製品の任意の権利は不利な影響を受ける可能性がある。
私たちのライセンシーおよび任意の未来のライセンス者は、第三者コンサルタントまたは協力者または第三者からの資金に依存する可能性があり、したがって、私たちのライセンス者は、私たちが許可する特許の唯一および独占所有者ではありません。もし他の第三者が私たちが許可した特許の所有権を持っている場合、彼らはこれらの特許を私たちの競争相手に許可するかもしれないが、私たちの競争相手は私たちの候補製品と似ているか同じ製品を販売することができる。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
私たちは合理的な費用や合理的な条項で追加的なライセンスを得ることができないかもしれない。たとえ我々が許可を得ることができても,我々の競争相手が我々に許可された同じ権利にアクセスできるように非排他的である可能性がある.この場合、私たちは、私たちの候補製品を再設計するために多くの時間と資源をかけて、またはそれらの方法を製造するか、または代替技術を開発または許可する必要があるかもしれません。これらは、技術的にも商業的にも不可能かもしれません。もし私たちがそれができなければ、影響を受けた候補製品を開発したり商業化することができないかもしれません。これは、私たちの業務、財務状況、運営結果、将来性を深刻に損なう可能性があります。私たちは、第三者特許が存在しないことを保証することはできません。これらの特許は、私たちの現在の製造方法、候補製品、または未来の方法または候補製品に対して強制的に実行される可能性があり、それによって、私たちの製造または将来の販売を禁止したり、私たちの将来の販売について、第三者に印税および/または他の形態の賠償を支払う義務があります。これは重大かもしれません。
もし私たちが合意における私たちの義務を履行できなかった場合、私たちはこれらの合意に従って第三者から知的財産権や他の権利を許可したり、許可側との業務関係が妨害されたりして、私たちの業務に非常に重要な許可権を失う可能性があります
私たちと現在または未来のライセンシーとの間で、知的財産権およびライセンス契約に拘束されている他の権利に関する論争が発生する可能性があります
S-53
さらに、第三者知的財産権または他の権利を許可するプロトコルは複雑であり、そのようなプロトコルのいくつかの条項は様々な解釈の影響を受ける可能性がある。生じる可能性のある契約解釈の相違の解決は、関連知的財産権または他の権利に対する私たちの権利と考えられる範囲を縮小するか、または関連協定の下での私たちの財務または他の義務を増加させる可能性があり、いずれの場合も、私たちの業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼす可能性がある。さらに、我々が許可している知的財産権や他の権利をめぐる紛争が、商業的に許容可能な条項で現在の許可スケジュールを維持する能力を阻害したり、弱体化したりすれば、影響を受ける候補製品の開発および商業化に成功できない可能性があり、これは、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。
私たちが最善を尽くしたにもかかわらず、私たちの許可側は、許可協定に深刻に違反している可能性があるので、許可協定を終了し、これらの許可協定がカバーする候補製品を開発し、商業化することができないかもしれません。これらの許可内で終了された場合、または基礎特許が予想される排他性を提供できなかった場合、競争相手は、規制部門の承認を求め、私たちと同じ製品を販売する権利がある。これは私たちの競争地位、業務、財務状況、運営結果、および見通しに実質的な悪影響を及ぼすかもしれない。
私たちのいくつかの候補製品の特許保護と特許起訴は第三者にかかっているかもしれない
私たちは通常、特許出願および候補製品に関連する特許の起訴、保守および実行を制御する権利を得ることを求めているが、時々特許出願および私たちの候補製品に関連する特許の提出および起訴活動は、ライセンシーまたはパートナーによって制御される可能性がある。もし許可者またはパートナーが私たちの業務の最適な利益に合った方法でこのような特許および特許出願を起訴、維持、実行できなかった場合、適用可能なすべての特許出願費用の支払いと、私たちの候補製品をカバーする特許を含む場合、私たちは知的財産権の権利やこれらの権利に対する私たちの排他性を失う可能性があり、これらの候補製品を開発し、商業化する能力は悪影響を受ける可能性があり、私たちは競争相手が私たちの候補製品と似ているか、または同じ製品を製造、使用、販売することを阻止できないかもしれない。さらに、私たちが第三者に付与した特許および特許出願の特許起訴を制御する権利があっても、私たちは、特許起訴の日までの私たちの許可者、私たちの許可者、およびその弁護士の行動または不作為の悪影響または損害を受ける可能性があります。
政府が援助したプロジェクトによって発見された知的財産権は、“進行権”、いくつかの報告要件、および米国会社の選好のような連邦法規の制約を受ける可能性がある。これらの規定を遵守することは、私たちの独占権を制限し、非アメリカメーカーと契約を締結する能力を制限するかもしれない
米国政府の資金を用いて産生されたフォゴニメドンを用いてアルツハイマー病を治療する方法を要求する特許出願を有しており、将来的に米国政府資金または贈与によって生じる知的財産権を開発、買収することができるかもしれない。1980年の“ベハ·ドール法案”によると、米国政府は政府が援助して開発した発明に対して何らかの権利を持っている。米国政府のこれらの権利は、任意の政府の目的のために発明を使用する非排他的、譲渡不可能、撤回不可能な世界的許可を含む。さらに、ある限られた場合、米国政府は、(1)発明を商業化するのに十分なステップが取られていない場合、(2)政府は、公衆衛生または安全需要を満たすために行動しなければならない、または(3)政府は、公共使用に対する連邦法規の要求を満たすために行動しなければならない、または(3)政府は、公共使用に対する連邦法規の要求を満たすように行動しなければならない、という権利を第三者に付与する権利がある。このような“入場”権利は、以前に存在した主題または政府支出または助成とは無関係な基金によって生成されたテーマまで延長することなく、そのような政府支出または補助金の使用によって生成された新しいテーマに適用される。もしアメリカ政府がアメリカ政府の資金や贈与を使用することによって生じる知的財産権の進行権を行使する場合、私たちは私たちが開発した知的財産権を許可または再許可することを余儀なくされるかもしれません。あるいは私たちに不利な条項で許可する知的財産権です, 私たちがこのような権利を行使するためにアメリカ政府の補償を受けるという保証もない。付与者が政府に発明を開示していない場合、又は所定の期限内に知的財産権登録申請を提出していない場合、米国政府もこれらの発明の所有権を取得する権利がある。政府援助の計画の下で生成された知的財産権もいくつかの報告要求によって制約されており、この要求を守るには大量の資源が必要かもしれない。さらに、米国政府は、これらの発明を含む任意の製品、またはこれらの発明を使用することによって製造された製品のいずれも、実質的に米国で製造されなければならないことを要求する。もし知的財産権所有者または譲受人が合理的ではあるが成功しない努力をしたことを証明し、同様の条項で米国で大量生産される可能性のある潜在的な許可者に許可を与えることができれば、資金を提供する連邦機関は、米国工業のこのような選好を放棄する可能性がある
S-54
この場合、国内製造は商業的に実行可能ではない。このような米国工業への偏愛は、このような知的財産権がカバーする製品について非米国製品メーカーと契約する能力を制限するかもしれない。
ネットワークセキュリティに関するリスク
私たちはネットワーク、インフラ、およびデータに依存しており、これは、私たちのシステムまたは私たちのCROまたは他の請負者またはコンサルタントが使用するシステムのセキュリティ障害または脆弱性を含むデータセキュリティリスクに直面させます。私たちはモバイル技術を含めて私たち自身または第三者の情報技術システム、インフラ、データに依存して、私たちの業務を運営しています。私たちのコンピュータシステムの多様性と複雑さは故障したり、セキュリティホールを受けたりする可能性があります
セキュリティ対策が実施されているにもかかわらず、我々の内部コンピュータシステムおよび我々のCROおよび他の請負者およびコンサルタントのコンピュータシステムは、コンピュータウイルスおよび不正アクセスの破壊を受けやすい可能性がある。同様に、データプライバシーまたはセキュリティイベントまたは従業員または他の人の違反は、私たちの知的財産権、商業秘密、または私たちの従業員、患者、顧客、または他のビジネスパートナーの個人情報を含む敏感なデータを引き起こす可能性があり、許可されていない人または公衆に暴露される可能性があり、または乱用される可能性がある。ネットワーク攻撃、インターネットベースの悪意のある活動、オンラインおよびオフライン詐欺、および他の同様の活動は、私たちの個人、敏感、機密または独自の情報および情報技術システム、ならびに私たちが依存する第三者のセキュリティ、完全性、および利用可能性を脅かす。このような脅威は一般的であり、検出がますます困難になっており、従来のコンピュータ“ハッカー”、脅威参加者、“ハッカー活動家”、組織的犯罪脅威参加者、人員(例えば、窃盗または乱用によって)、複雑な民族国家、および民族国家によって支持される参加者を含む様々なソースから来ている。一部の行為者は現在、地政学的な理由で軍事衝突と防御活動を組み合わせた民族国家行為者を含むサイバー攻撃に従事し、継続することが予想される。戦争と他の重大な衝突の間、私たちは私たちが依存する第三者として、報復的なネットワーク攻撃を含むこれらの攻撃のリスクが増加しやすいかもしれません。これらの攻撃は、私たちのシステムと運営、サプライチェーン、および私たちの商品やサービスを生産、販売、流通する能力を実質的に混乱させる可能性があります。
私たちおよび私たちが依存する第三者は、社会工学攻撃(ネットワーク釣りによる攻撃を含む)、悪意のコード(例えば、ウイルスおよびワーム)、マルウェア(高度な持続的な脅威侵入を含む)、サービス拒否攻撃(例えば、充填証明書)、証拠窃取、人員不正行為またはエラー、恐喝ソフトウェア攻撃、サプライチェーン攻撃、ソフトウェア脆弱性、サーバ障害、ソフトウェアまたはハードウェア故障、データまたは他の情報技術資産損失、広告ソフトウェア、電気通信障害、地震、火災、洪水、および他の同様の脅威を含むが、様々な変化する脅威を受ける可能性がある。遠隔作業の増加は、私たち従業員の仕事や私たちのシステムにアクセスする方法に影響を与え、これは、不良行為者がネットワーク攻撃を発動する機会がより多く、あるいは従業員が無意識にセキュリティリスクやイベントを発生させ、任意のセキュリティホールやイベントの影響を増幅させる可能性がある。将来的または過去のビジネス取引(例えば、買収または統合)は、我々のシステムが、買収または統合エンティティのシステムおよび技術に存在する脆弱性の負の影響を受ける可能性があるので、より多くのネットワークセキュリティリスクおよび脆弱性に直面する可能性がある。
様々な環境で敏感な情報や他社データを処理するために、第三者サービスプロバイダおよび技術に依存して重要なビジネスシステムを実行する可能性があります。私たちはまた、第三者サービスプロバイダにいくつかの製品やサービスを提供したり、他の方法で私たちの業務を運営したりすることに依存する可能性があります。これらの第三者の情報セキュリティアプローチを監視する能力は限られており、これらの第三者には十分な情報セキュリティ対策がない可能性がある。もし私たちの第三者サービス提供者がセキュリティ事件や他の中断に遭遇したら、私たちは悪い結果に直面するかもしれない。第三者サービス提供者がプライバシーや安全に関する義務を履行できなかった場合、損害賠償を受ける権利があるかもしれませんが、どの賠償も私たちの損害を補うのに十分ではないかもしれません。あるいはそのような賠償を取り戻すことができないかもしれません。また、サプライチェーン攻撃の頻度と深刻さが増加しており、私たちのサプライチェーンにおける第三者のインフラや私たちの第三者パートナーのサプライチェーンが損なわれていないという保証はありません。
私たちのビジネスパートナーは、同様のリスクに直面しており、いかなるセキュリティホールやそのシステムに影響を与えるセキュリティイベント、または彼らが受けている他の状況も、私たちのセキュリティ状態に悪影響を及ぼす可能性があります。セキュリティホール、事件、またはプライバシー侵害は、商業秘密、会社資源、個人、敏感、機密または独自の情報(保護された健康情報または他の患者情報を含む)の損失または不正な使用、開示または修正またはアクセスを招き、または患者情報へのアクセスを阻止し、前述の任意の状況で発生した見方は、私たちの名声を損なう可能性があり、連邦および/または州違反通知法律および外国法律等価物に遵守させ、強制的に是正行動を受けさせ、そのような違反または違反行為に応答する他の通知を提供するか、または他のステップをとる可能性がある。データベースの内容の正確性を確認することが要求されます。そうでなければ、私たちは訴訟、クレーム、調査、処罰、または法律法規によって規定された他の責任に直面します。いずれも、私たちの業務を混乱させ、および/またはコスト増加または収入または会社資源の損失をもたらす可能性があります。また,機密情報にアクセスするモバイルデバイスの一般的な使用は,セキュリティホールや事故のリスクを増加させる.
このような脅威のための安全障壁を設定しようと努力しているにもかかわらず、私たちはこのような危険を完全に軽減することはできない。これまで、私たちは、ネットワーク攻撃または他の情報セキュリティ事件(例えば、ネットワーク釣り、社会工学、恐喝ソフトウェアまたはマルウェア攻撃)が、私たちの業務、財務状態、または運営に及ぼす実質的な影響を経験したことがありません
S-55
しかしながら、攻撃技術の頻繁な変化、およびそのような攻撃の数および複雑さの増加により、私たちの業務、財務状態、または運営は将来的に悪影響を受ける可能性がある。私たちは、通常、イベントが発生した後に検出されるように、しばしば変化するので、許可されていないアクセスを得るため、または私たちのシステムに危害を及ぼすための技術を予測または阻止することができないかもしれない。漏洩や他のセキュリティホールやイベントが発生し、当社の運営中のデータの損失や破損や中断を招く場合、私たちの開発計画や業務運営の実質的な中断を招く可能性があります。例えば、完了した、行われている、または将来の臨床試験における臨床試験データの損失は、我々の規制承認作業を遅延させる可能性があり、データを回復または複製するコストを著しく増加させる可能性がある。任意の中断またはセキュリティホールまたはイベントが、私たちのデータまたはシステムを紛失または破損させ、または個人、敏感、機密または独自の情報を適切に使用、開示または修正しない場合、私たちは責任を招く可能性があり、私たちの候補製品のさらなる開発および商業化は延期される可能性がある。私たちはデータおよび情報技術インフラを保護するために投資し続けていますが、私たちの努力がサービス中断を防止すること、または私たちの業務および運営に悪影響を及ぼす可能性があることを防止または識別すること、および/またはキーまたは敏感な情報または会社リソースの脆弱性またはセキュリティホールまたはイベントを紛失または不適切なアクセスを引き起こすことを引き起こす保証はありません。このような中断、違反またはイベント、または発生した任意の知覚は、私たちの財務、法律、商業、または名声の損害をもたらす可能性がある。また、, 私たちの責任保険は、セキュリティホール、ネットワーク攻撃、および他のプライバシーおよびセキュリティホールまたはイベントに関連するクレームをカバーするのに十分ではない場合があります。
私たちの契約には責任制限が含まれていないかもしれませんが、あっても、私たちの契約における責任制限は、私たちのデータプライバシーとセキュリティ義務に関連する責任、損害、またはクレームから私たちを保護するのに十分である保証はありません。私たちの保険範囲が私たちのプライバシーと安全慣行によって生じる責任から私たちを保護または軽減するのに十分か、または私たちを保護するのに十分かどうかは確認できません。私たちはこのような保険が商業的に合理的な条項や根本的に存在しない、あるいはそのような保険が未来のクレームを支払うと判断することはできません。
データ収集は,個人情報の使用,処理,国境を越えた移行に関する限定的に規定されている
臨床試験を行い、患者を現在と未来の臨床試験に参加し続ける場合、プライバシー、データ保護、データ安全に関する追加制限を受ける可能性がある。欧州経済地域(EEA)個人に関する個人データは、EU一般データ保護条例(GDPR)によって制限される個人健康データを含む、収集、使用、記憶、開示、移転、または他の方法で処理される。GDPRの範囲は広く,個人データを処理する会社に対して多くの要求がなされており,健康や他の敏感なデータの処理,個人データに関する個人の同意の取得,個人へのデータ処理活動に関する情報の提供,個人データの安全と機密性の保護のための保障措置の実施,データ漏洩に関する通知の提供,第三者処理者の採用時に何らかの措置をとるなどの要求がある。GDPRはまた、米国を含む欧州経済圏以外の国への個人データの移転に厳しいルールを実施し、データ保護当局が2000万ユーロや世界の年収の4%に達する可能性のある罰金を含む、GDPR違反行為に巨額の罰金を科すことを許可している。GDPRはまた、データ主体と消費者協会に個人訴訟権利を与え、監督当局に苦情を提出し、司法救済を求め、GDPR違反による損害について賠償を受けることができる。さらに、GDPRは、国境を越えたデータ転送の制限を含む。GDPRで規定されている国境を越えたデータ転送のいくつかの側面には、欧州連合またはEUの法的手続きの結果を含む不確実性がある。例えば, EU裁判所の2020年7月の裁決は、EU-米国のプライバシー盾の無効を宣言し、欧州委員会が承認した標準契約条項の使用に追加的な義務を課した。国境を越えたデータ転送におけるこれらや他の事態の発展は、国境を越えた個人データの複雑さを増加させる可能性があり、国境を越えたデータ転送に関連するメカニズムを検討·修正する必要があるかもしれない。
また、イギリスのEU離脱、つまりイギリスの離脱は、イギリスのデータ保護規制に不確実性をもたらした。英国はEUを離脱し、最大1750万ポンドまたは世界売上4%の罰金を科すことが規定されているGDPRのような立法を実施しており、金額は大きい者を基準としている。GDPRおよびイギリスGDPRは、これらの制度の下で処理される個人データに対する私たちの責任と責任を増加させ、個別の国およびイギリスによって実施される政策および措置を含むGDPRの遵守を保証するために、政策および措置の制定または修正を要求される可能性があり、それぞれが私たちの政策やプログラムを修正し、追加の契約交渉に参加することを要求する可能性があり、これは、負債、費用、コスト、および運営損失をもたらす可能性があります。GDPRとイギリスGDPRを遵守することは、厳格で時間のかかるプロセスとなり、私たちの業務コストを増加させたり、努力したにもかかわらず、ヨーロッパ経済地域とイギリスでの活動によって罰金、処罰、訴訟、名声損害のリスクに直面する可能性があります
S-56
さらに、米国では、連邦、州、地方政府は、データ漏洩通知法、個人データプライバシー法、消費者保護法(例えば、連邦貿易委員会法案第5条)および他の同様の法律(例えば、盗聴法)を含む多くのデータプライバシーおよびセキュリティ法律を公布している。カリフォルニアは“カリフォルニア消費者プライバシー法”(California Consumer Privacy Act,略称CCPA)を公布し、カリフォルニアの消費者のために新しいプライバシー権(法律で定義されているような)を創造し、消費者または家庭の個人データを処理する実体に対してより多くのプライバシーと安全義務を規定した。CCPAは、カバーする会社が、そのような会社がデータを収集、使用、および共有する方法に関する新しい開示を消費者に提供し、これらの消費者に、特定の販売からの撤退または個人情報の移転を選択する新しい方法を提供し、消費者に追加の訴訟理由を提供することを要求する。2020年カリフォルニア州プライバシー権法案(CPRA)が2023年1月1日に施行され、ビジネス代表や従業員に適した個人情報を含むCCPAの要求が拡大され、この法律を実施·施行するための新たな規制機関が設立された。CCPAはいくつかの臨床試験で処理されたデータを免除しているにもかかわらず、CCPAはコンプライアンスコストを増加させ、私たちが維持しているカリフォルニア住民の他の個人データに関する潜在的な責任を増加させる可能性がある。また、バージニア州、ユタ州、コネチカット州、コロラド州のような他の州では、CCPAと同様の義務が課せられているプライバシーやセキュリティに関する法律が提出または公布されている。CCPA,CPRA,その他進化する州プライバシー立法は,我々の業務活動に影響を与える可能性があり,個人データや保護された健康情報に関する変化する規制環境における我々の業務の脆弱性を示している.
データプライバシーやセキュリティに関する契約義務の制約を受ける可能性もあり,このような義務を守る努力は成功しない可能性がある.例えば、GDPRおよびCCPA/CPRAのようないくつかのプライバシー法は、私たちのサービスプロバイダに特定の契約制限を適用することを要求し、私たちはまた、臨床試験情報を共有するプロバイダとの契約において使用および開示制限を受ける可能性がある。さらに、データプライバシーおよびセキュリティに関連するいくつかの認証または自律原則を遵守するなど、プライバシーポリシー、マーケティング材料、および他の声明を発表することができます。もしこのような政策、材料、または声明が私たちの接近に欠陥があることが発見された場合、透明性の欠如、詐欺性、不公平または不実であれば、私たちは規制機関の調査、法執行行動、または他の不利な結果を受けるかもしれない。
データプライバシーやセキュリティに関する義務は急速に変化しており,ますます厳しくなり,規制の不確実性をもたらしている。さらに、これらの義務は、法ドメイン間で不一致または衝突する可能性がある異なる適用および解釈される可能性がある。このような義務を準備して履行するには私たちが多くの資源を投入する必要がある。これらの義務は、私たちのビジネスモデル、情報技術、システム、および実践、ならびに個人データを処理する任意の第三者を代表するビジネスモデル、情報技術、システム、および実践を変更する必要があるかもしれません。私たちは、私たちのデータプライバシーやセキュリティ義務を守る努力に失敗することがある(または失敗したと考えられる)。また、私たちが努力しているにもかかわらず、私たちが依存している人や第三者がこのような義務を履行できない可能性があり、これは私たちの業務運営に悪影響を及ぼす可能性があります。
米国と国際データ保護法律法規を遵守することは、私たちがデータを収集、使用、開示する能力を制限し、または場合によってはいくつかの司法管轄区域で運営する能力に影響を与える契約でより重い義務を負うことを要求するかもしれない。プライバシー、データ保護、およびデータセキュリティに関連する米国または国際法律および法規に準拠できないと実際にまたは報告されているいかなる行為も、政府の調査、訴訟、および法執行行動(民事または刑事罰を含む可能性がある)、個人訴訟または負の宣伝を招き、私たちの名声を損なう可能性があり、私たちの経営業績および業務に負の影響を与える可能性がある。さらに、私たちまたは潜在的な協力者が情報を取得する臨床試験対象者、およびこの情報を共有する提供者は、契約上、私たちの情報の使用および開示能力を制限したり、私たちの使用、保留および他の情報処理に他の義務または制限を加えたりする可能性があり、そうでなければ、私たちは、私たちの使用、保持、および他の処理情報に適用される契約制限に直面する可能性があります。私たちがプライバシー権を侵害していると主張し、データ保護法を遵守できなかったり、私たちの契約義務に違反したりして、私たちが責任を負わなくても、弁護の費用が高く、時間がかかり、否定的な宣伝を招き、私たちの業務を損なう可能性があります。
私たちの普通株式所有権に関連するリスク
私たちと私たちの一部の役員や幹部は訴訟の被告にされており、これらの訴訟は巨額の費用を招き、経営陣の注意をそらす可能性がある
私たちの最新のForm 10-Q四半期報告“Part II,Item 1-Legal Procestions”に記載されているように、私たちと私たちのいくつかの役員および取締役は、一般的に、私たちおよびいくつかの役員および取締役が取引所法案第10(B)および/または20(A)条およびこの法案に基づいて公布された規則10 b-5に違反していることを告発し、虚偽および/または誤ったと言われる陳述を行い、会社の業務に関する重大な不利な事実を見落としている。これらの訴えは、明示されていない補償性および懲罰的損害賠償、および弁護士費を含む合理的な費用および支出を要求する。本募集説明書の増刊日まで、これらの事項の結果を予測することはできません。私たちは保険を持っているにもかかわらず、それはかなりの責任保留を規定し、制限されており、私たちが所属する集団訴訟または他の訴訟に関連する費用または責任の大部分または任意の費用または責任を招いたり、受けたりする可能性があることは含まれていないかもしれない。さらにこれらの結論のどのような結論も
S-57
吾等に不利かつ吾等が役員及び上級職員責任保険所が保証しない重大なコスト又は損害を招くことは、吾等の財務状況及び業務に重大な悪影響を及ぼす。また、訴訟は、当社の経営陣や取締役会が訴訟に時間と注意を移し、私たちの名声に悪影響を及ぼす可能性があり、さらに、業務の発展や製品候補製品の能力向上に非常に重要な業務計画や戦略を実行することを含む、経営陣および取締役会の他の優先順位に対する関心や資源をさらに移行させ、いずれも私たちの業務に実質的な悪影響を及ぼす可能性がある。また、追加的な訴訟を提起する可能性がありますが、訴訟の結論は私たちに不利ですが、それにより取締役や上級職員責任保険に含まれていない巨額の費用や損害賠償を招くことは、私たちの財務状況や業務に大きな悪影響を与えます
維権株主の行動は過去には破壊的であり,未来も破壊的である可能性があり,我々の業務の戦略方向に不確実性をもたらす可能性がある.
私たちの業務は株主急進主義によって負の影響を受ける可能性があり、これは破壊的であり、私たちの業務の戦略方向の不確実性を招く可能性がある。例えば、2022年2月、ある過激な株主は、2022年年度株主総会で自分ともう1人の候補者を私たちの取締役会に指名するつもりだと発表した。この代理権競争は成功しなかったが、株主急進主義が再び発生し、私たちの業務、運営結果、財務状況に悪影響を及ぼす可能性がある。例えば、本募集説明書の付録の日付まで、私たちの時価は私たちの現金、現金等価物、および投資の合計より低いです。他の類似した立場にあるバイオテクノロジー会社も、株主維権者からの清算と投資家への資本返還の提案を受けている
私たちは、株主と建設的なコミュニケーションを維持し、すべての株主の価値を高めるために、彼らの意見や意見を歓迎する努力をしています。しかし、エージェント権競争や他の急進的な行動は私たちに悪影響を及ぼすかもしれない
代理権競争や他の権利維持者の努力が成功しなくても、私たちが負担するコストの増加や、取締役会や上級管理職の気晴らしは、このような負の影響の程度を特定できないにもかかわらず、私たちの業務に悪影響を及ぼす可能性があります。
私たちは私たちの普通株の活発な市場が続くかどうか分からないので、あなたが持っている私たちの普通株の株式を売ることは難しいかもしれません
もし私たちの普通株の活発な市場が持続できなければ、あなたはあなたの普通株を魅力的な価格で売ることができないかもしれません。私たちは私たちの普通株の取引価格を予測できない。今後の1つまたは複数の時期に、私たちの運営結果や私たちの製品ラインの進展が公開市場アナリストや投資家の予想に合わない可能性があるため、これらや他の要因により、私たちの普通株価格が低下する可能性がある
S-58
私たちの普通株の市場価格は変動する可能性があり、これは投資家に大きな損失をもたらすかもしれない
私たちの普通株の市場価格は変動するかもしれない。したがって、普通株を買ったか、あるいはそれ以上の価格で普通株を売ることができないかもしれません。普通株市場の価格変動を引き起こす可能性があるいくつかの要素は
近年、株式市場全体、特に製薬やバイオテクノロジー会社の市場は、重大な価格や出来高変動を経験しており、これらの変動は、その株式がこれらの価格や出来高変動を経験した会社の経営業績の変化に関係なく、あるいは比例しないことが多い。私たちの実際の経営業績にかかわらず、広範な市場と業界要素は私たちの普通株の市場価格に深刻な影響を与える可能性がある。会社の証券市場価格にこのような変動が生じた時期以降、証券集団訴訟はしばしば
S-59
その会社を提訴した。私たちの株価の潜在的な変動性のため、私たちは未来に証券訴訟の目標になるかもしれない。証券訴訟は巨額のコストを招き、経営陣の注意と資源を私たちの業務から移す可能性がある
私たちの総流通株の大部分は近い将来に市場に売却される可能性があります。これは私たちの普通株の市場価格を大幅に低下させる可能性があります。たとえ私たちの業務が良好であっても
公開市場で私たちの大量の普通株を売ることはいつでも起こる可能性がある。これらの売却、あるいは市場で大量の普通株を持っていると思っている人が株を売却しようとしているという見方は、私たちの普通株の市場価格を下げる可能性があります。また、我々の株式インセンティブ計画又はこれらの計画に基づいて付与された将来の奨励に基づいて未償還株式オプションを行使する際に発行される株式は、適用されるホームスケジュール、任意の適用される市場行き詰まり及びロック協定の規定、並びに改正された1933年証券法又は証券法の下の第144条及び第701条の許容される範囲内で、公開市場で販売される
また、2022年9月30日現在、約510万株の我々普通株の保有者は、いくつかの権利を行使する資格があり、様々な条件や制限の下で、彼らの株式に関する登録声明を提出したり、彼らの株式を自分または他の株主のために提出する可能性のある登録声明に含めたりすることを要求している。私たちはまた普通株を登録して、私たちの株式補償計画に基づいて、私たちは普通株を発行するかもしれません。これらの株を登録すると、発行時に公開市場で自由に販売することができ、付与されると、付属会社に適用される数量制限を受けることができる。これらの追加株のいずれかが公開市場で販売されている場合、またはそれらが売却されると考えられている場合、私たちの普通株の市場価格は低下する可能性がある
我々の役員、役員、大株主はかなりの割合の普通株を持っていますが、これは制御権の変更を含めて、重要な取引結果に影響を与える能力を制限する可能性があります。
2022年9月30日現在、私たちの役員、役員、私たちが発行した普通株の主要所有者と、それぞれの関連会社実益は、私たちが発行した普通株の大量の株式を持っています。したがって、これらの株主が一緒に行動すれば、取締役選挙や重大な会社取引の承認を含む株主の承認を必要とするすべての事項に影響を与えることができる。このような所有権集中はわが社の支配権の変更を遅延または阻止し、私たちの普通株の市場価格に影響を与える可能性があります
私たちは“新興成長型会社”であり、新興成長型会社に適用される開示要求を下げることは、私たちの普通株の投資家への魅力を低下させる可能性があります
私たちは2012年のJumpStart Our Business Startups ActやJOBS Actで定義されているように“新興成長型会社”です。私たちがまだ新興成長型企業である限り、私たちは他の非新興成長型企業に適用される上場企業の特定の開示要求の免除に依存することを許可され、計画されている。これらの免除には、SOX第404条の監査人認証要件を遵守する必要がなく、上場企業会計監督委員会が採用する可能性のある強制監査会社のローテーションまたは監査および財務諸表に関する補足情報を提供する監査師報告に関するいかなる要求も遵守する必要がなく、役員報酬に関する開示義務を低減し、役員報酬について拘束力のない諮問投票を行うことや、株主が以前承認されていない金パラシュート支払いを承認する要求を免除することが含まれる。したがって、我々が株主に提供する情報は、他の上場企業が提供する情報とは異なることになる。私たちはもし私たちがこのような免除に依存すれば、投資家が私たちの普通株の吸引力の低下を発見するかどうか予測できない。したがって、一部の投資家が私たちの普通株の吸引力が低下していることを発見すれば、私たちの普通株はそれほど活発ではない取引市場が出現する可能性があり、私たちの株価はもっと変動するかもしれない
我々の金融インフラを構築し、我々の会計システムや制御を改善することができなければ、上場企業の財務報告や内部統制要求を遵守する能力を弱める可能性がある
上場企業として、私たちはますます厳格な規制環境で運営されており、これは、2002年のサバンズ-オクスリ法案、またはサバンズ-オクスリー法案、ナスダック世界精選市場の規制、アメリカ証券取引委員会の規則と規定、開示要求の拡大、報告要求の加速とより複雑な会計規則の遵守を要求している。サバンズ-オキシリー法が要求する会社責任には、財務報告および開示制御および手続きに対する会社の監督と適切な内部統制の確立が含まれている。効果的な内部統制は信頼できる財務報告書を作成するために必要であり、財務不正防止を助けるためにも重要である。経営陣が報告できるように、財務報告の内部統制に対してシステムとプロセス評価とテストを行わなければならない
S-60
サバンズ·オクスリー法404条の要求によると、財務報告書の内部統制に対する私たちの有効性は。私たちは未来にこのような報告書の要求を満たすことで困難に直面するかもしれない。
私たちの会計と財務機能、インフラを建設する過程はすでに完了し、多くの追加の専門費用、内部コスト、管理努力が必要になり続けるだろう。このようなシステムを実装または使用する任意の中断または困難は、私たちの制御に悪影響を与え、私たちの業務を損なう可能性があります。さらに、このような妨害や困難は、予期せぬコストと経営陣の注意をそらすことをもたらす可能性がある。また、私たちの内部財務·会計制御システムや手続きにおける弱点が発見される可能性があり、私たちの財務諸表に重大なミスが発生する可能性があります。私たちの財政報告書に対する内部統制はすべてのミスと詐欺を阻止したり発見したりしないだろう。設計および動作がどんなに良好であっても、絶対的な保証ではなく、合理的な保証しか提供できず、保証制御システムの目標が実現される制御システム。すべての制御システムの固有の限界により,どの制御評価も誤りや不正による誤り陳述が発生しないことは絶対に保証されず,すべての制御問題や不正が発見されることは絶対に保証されない.
もし私たちがサバンズ-オキシリー法案404条の要求を適時に守ることができなければ、あるいは適切で効果的な内部統制を維持できなければ、私たちはタイムリーで正確な財務諸表を作成できないかもしれない。信頼できる財務報告を提供したり、詐欺を防止することができなければ、私たちの業務や運営結果が損なわれる可能性があり、投資家は私たちが報告した財務情報に自信を失う可能性があり、私たちはナスダック、米国証券取引委員会、または他の規制機関の制裁や調査を受けるかもしれない。
私たちの定款やデラウェア州やワシントン州の法律での反買収条項は、私たちの買収を困難にし、私たちの株主が現在の経営陣を交換または更迭する試みを制限し、私たちの株価を制限するかもしれません
当社の改訂及び再記載された会社登録証明書及び改訂及び重述された付例の条文は、株主がその株式によって割増を得る可能性のある取引、又は当社株主がその最適な利益に適合すると考えられる取引を含む、当社の制御権又は管理層の実際又は潜在的な変更に関する取引を遅延又は阻止する可能性がある。したがって、このような規定は私たちの普通株の価格に悪影響を及ぼすかもしれない。その他の事項を除いて、改訂及び再記載された会社登録証明書及び改訂及び再記載された定款:
また,我々はデラウェア州に登録設立されているため,デラウェア州会社法第203条の規定により,デラウェア州会社が株主が“利害関係のある”株主になった日から3年以内に任意の“利害関係のある”株主と広範な業務統合を行うことを一般的に禁止している。同様に、私たちの主な執行事務室はワシントンにあるので、ワシントン商業会社法の反買収条項は現在または未来のいくつかの場合に私たちに適用されるかもしれない。これらは
S-61
条項は、株主が“買収者”となった日から5年間、“購入者”を構成するいかなる株主とも広範な業務統合を行うことを禁止している
私たちの定款の改正と再記述は、デラウェア州衡平裁判所とアメリカ連邦地域裁判所は、私たちと私たちの株主とのほとんどの紛争の独占的なフォーラムであり、これは、私たちの株主が有利な司法フォーラムを得ることを制限し、私たちまたは私たちの役員、上級管理者、または従業員との紛争を処理することを制限するかもしれない
デラウェア州衡平裁判所は、私たちが提起した任意の派生訴訟または訴訟を代表する独占裁判所、受託責任違反を主張する任意の訴訟、デラウェア州一般会社法、私たちの会社登録証明書、または私たちの改正と再記載された会社定款に基づいて私たちにクレームを提起する任意の訴訟、任意の解釈、適用、強制執行、または私たちの会社登録証明書または私たちの改正および再記載された会社定款の有効性を決定する訴訟、および私たちが内部事務原則によって管轄されているクレームを提起する任意の訴訟である。この規定は、取引法で規定されている義務や責任を執行するための訴訟にも適用されず、米国連邦裁判所が排他的管轄権を有する他のクレームにも適用されない。
私たちが改正して再記述した付例は、米国連邦地域裁判所が証券法に基づいて提出された任意の訴因を解決するための独占的なフォーラムになるとさらに規定している。他社の組織文書に類似した排他的連邦フォーラム条項の実行可能性は法的訴訟で挑戦されており,デラウェア州最高裁判所は,デラウェア州法律によると,このようなタイプの排他的連邦フォーラム条項は表面的に有効であるが,他の裁判所がこのような条項を実行するかどうかには不確実性があり,投資家は連邦証券法とその下の規則や法規の遵守を放棄することはできない.
これらの排他的フォーラム条項は、司法フォーラムにおいて、私たちまたは私たちの役員、役員、または他の従業員とのトラブルに有利であると考える株主のクレームを提起する能力を制限する可能性があり、これは、私たちと私たちの役員、役員、および他の従業員に対するこのような訴訟を阻止することができるかもしれない。あるいは、もし裁判所が、私たちが改正して再説明した定款のいずれかの独占的な法廷条項が訴訟で適用されないか、または実行できないことを発見した場合、私たちは、他の司法管轄区域でこのような訴訟を解決することによって、さらなる重大な追加費用が生じる可能性があり、これらすべては、私たちの業務、財務状況、および運営結果に実質的な悪影響を及ぼす可能性がある。
一般リスク因子
私たちのコンサルタントとコンサルタントは独立請負業者に分類され、彼らが独立請負業者に誤って分類されていると判断されれば、私たちは結果に直面する可能性がある。
労働者分類法の適用には不確実性がしばしばあるため、私たちの独立請負業者は、適用法によって誤分類されたとみなされる可能性があるというリスクに直面している。管理サービスプロバイダが独立請負業者であるか従業員であるかのテストは、通常、事実に非常に敏感であり、管轄法律によって異なる可能性がある。独立請負者の地位や誤分類を管理する法律や条例も、異なる当局によって解釈され、不確実性と予測不可能性をもたらす可能性がある。誤分類の決定または告発は、税金の源泉徴収および免除、未払い賃金および賃金および工数法律および要求(例えば、最低賃金および残業に関する法律および要求)によって生じる金銭的リスク、従業員福祉、社会保障、労働者補償および失業のクレーム、民権法による差別、嫌がらせおよび報復のクレーム、労働組合、集団交渉および他の協調活動に関する法律に基づいて提出されるクレーム、雇用主および従業員の法律および法規に適用される他のクレーム、告発または他の訴訟に基づいて、雇用主および従業員の法律および法規に適用される他のクレーム、告発または他の訴訟を含む潜在的なリスクをもたらす。このようなクレームは、金銭的損害(賃金ベースの損害賠償または原状回復、補償性損害賠償、違約性損害賠償および懲罰的損害賠償を含むが、これらに限定されないが含まれるが含まれるが、これらに限定されない)、利息、罰金、罰金、費用、費用(弁護士費を含むが、これらに限定されない)、刑事および他の責任、評価または和解をもたらす可能性がある。このような告発、クレーム、不利な裁決は、私たちにサービスを提供するコンサルタントやコンサルタントを含むが、私たちのブランドや名声を損なう可能性もあり、これは私たちの業務に悪影響を及ぼす可能性がある。
もし証券アナリストが私たちの業務に関する研究や報告を発表しなければ、あるいは彼らが私たちの株に対するマイナス評価を発表したら、私たちの株価は下落するかもしれません
私たちの普通株の取引市場は、業界や金融アナリストが発表した私たちまたは私たちの業務に関する研究と報告にある程度依存するだろう。もしアナリストがいないか少ないアナリストが私たちを報道し始めたら、私たちの株の取引価格は下がるかもしれない。私たちがアナリストの報告を得たとしても、もし私たちの業務を追跡しているアナリストが1人以上のアナリストが私たちに対する彼らの
S-62
株、私たちの株価は下落するかもしれない。もしこのようなアナリストの一人以上が私たちの株を追跡しなければ、私たちは市場での私たちの株の可視性を失うかもしれないし、これは逆に私たちの株価を下落させるかもしれない
上場企業として、私たちの運営コストは引き続き増加し、私たちの経営陣は、新しいコンプライアンス措置やコーポレートガバナンス実践を実施するために多くの時間を投入する必要があるだろう
上場企業として、特に私たちが新興成長型企業ではなくなった後、大量の法律、会計、その他の費用が発生します。これらの費用は私たちが民間会社として発生していません。2002年のサバンズ-オキシリー法案、ドッド-フランクウォール街改革と消費者保護法、ナスダック世界精選市場の上場要求及びその他の適用された証券規則と法規は上場企業に対して有効な開示、財務制御と会社管理やり方の確立と維持を含む様々な要求を提出した。上場企業の要求に応えるためには、より多くの会計、財務、その他の人員を招聘しており、これらの人員を引き続き招聘する予定であり、私たちの経営陣や他の人員はこれらの要求の遵守を維持するために多くの時間を投入する必要がある。このような要求は私たちの法律と財政的コンプライアンス費用を増加させ、いくつかの活動をもっと時間的で高価にするだろう。例えば、上場企業としての私たちの規制に適用されることで、取締役や上級管理職責任保険を獲得することがより難しくなり、高価になる可能性があり、合格した取締役会のメンバーを引き付けることが難しくなる可能性があります。私たちは現在、私たちが発生する可能性のある追加コスト金額やそのようなコストの時間を予測または推定することができないこれらの規則と規則を評価している。これらの規則と条例はよく異なる解釈を受けます。多くの場合、特殊性が不足しているので、, 規制や理事機関が新たな指導を提供するにつれて、それらの実践への応用は時間の経過とともに変化する可能性がある。これは遵守事項に関する持続的な不確実性と、開示と統治慣行を絶えず修正するために必要なより高いコストをもたらす可能性がある。
もし私たちが効果的な内部統制を維持できなければ、私たちの業務、財務状況、そして経営結果は不利な影響を受けるかもしれない
上場企業としては、改正された1934年証券取引法又は取引法に基づいて、SOX第404条の要求を含めて、報告その他の義務を履行しなければならず、これらの要求は、経営陣が我々の財務報告内部統制の有効性を年間評価することを要求する
管理管理層が財務報告内部統制が有効であるかどうかを確定するために達成しなければならない基準の規則は複雑であり、規則下の詳細な基準を達成するためには大量の文書、テスト、可能な救済措置が必要である。テスト過程で、私たちの経営陣は重大な弱点や欠陥を発見する可能性があり、これらの欠陥や欠陥は適時に修復できない可能性があり、2002年の“サバンズ-オックススリー法案”で規定された期限内に完成できない可能性がある。これらの報告とその他の義務は、会計資源を含む我々の管理、行政と業務資源に対して、極めて大きな要求を提出した
私たちの経営陣は財務報告書の十分な内部統制を確立して維持する責任がある。我々の財務報告に対する内部統制は、米国が公認している会計原則に基づいて財務報告の信頼性と外部目的の財務諸表作成に合理的な保証を提供することを目的としたプログラムである。有効な内部統制を維持できなかった場合は、私たちの業務、財務状況、および経営結果に悪影響を及ぼす可能性があります
今回の発行に関連するリスク
今回の発行で販売されている普通株を購入すれば、あなたの株の有形帳簿純価値はすぐに大幅に希釈される可能性があります。
今回発売された普通株1株当たりの価格は、今回の発売前に発行した普通株1株当たりの有形帳簿純価値よりも高い可能性がある。この場合、今回発行された新投資家は直ちにその株式価値の希釈を招くだろう。
私たちは今回発行された純収益の使用に対して幅広い裁量権を持つことになる。
私たちは幅広い裁量権を持ち、今回の発行で株式を売却する純収益を使用することができ、私たち普通株の投資家は、これらの収益の適用に対する我々の取締役会と経営陣の判断に依存するであろう。今回発行した純収益を研究開発活動や運営資金や他の一般会社用途を含めて我々の運営支援に利用しようとしているが,これらの純収益分配を特定の目的には用いていない。投資決定の一部として、投資家は収益があるかどうかを評価する機会がないだろう
S-63
適切に利用されています私たちが得た資金を使うことは私たちの経営業績を改善しないかもしれませんし、ここで発行する証券の価値を増加させることもありません。
S-64
収益の使用
今回の発行の主な目的は,研究開発活動や,運営資本や他の一般会社用途を含めた我々の運営を支援するための追加資本の獲得である。今回発行された純収益額は、売却された普通株数と売却時の市場価格に依存する。販売契約に基づいて任意の普通株を売却したり、販売契約を融資源として活用できる保証はありません
私たちは私たちが特定の分野で支出する正確な金額やこのような支出の時間を具体的に決定していない。本募集説明書付録で提供した我々の普通株売却収益の金額と時間,我々の臨床試験と非臨床研究の進展,その他の製品開発活動を含む,目的ごとの実際の支出金額は多くの要因によって大きく異なる可能性がある。しかも、支出は他の資金調達と他の要素があるかどうかにかかっているかもしれない。これらの用途の前に、今回発行された純収益を米国政府の短期·中期有利子債務、投資レベル手形、預金または直接または保証債務に投資する予定だ。
私たちは、候補製品の臨床開発に引き続き資金を提供するために、大量の追加資本を調達することを要求されると予想される。私たちは株式を発行することでより多くの資本を調達するために、追加の公共資金や個人融資を求める予定だ。
S-65
配当政策
私たちは私たちの配当金のいかなる現金配当金も発表したり支払ったりしたことがなく、現在私たちは予測可能な未来にどんな現金配当金も支払うつもりはない。私たちは現在、運営を支援し、私たちの業務の成長と発展に資金を提供するために、すべての利用可能な資金と未来の任意の収益を維持するつもりです。将来配当金を派遣するかどうかは私たちの取締役会が適用される法律に基づいて適宜決定し、私たちの経営結果、財務状況、契約制限、資本要求などの要素に依存する。私たちが未来に現金配当金を支払う能力は未来の債務ツールや優先証券によって制限されるかもしれない。
S-66
配送計画
吾らはCantor FitzgeraldおよびBTIGと制御持分を締結してSM販売プロトコルまたは販売プロトコルを発売しており、このプロトコルによれば、吾らは時々透過的にまたは代理人(各エージェントは代理人または依頼者)に普通株を発行および売却することができる。この目論見書の付録と添付の目論見書によると、私たちの普通株の株を売ることができます。総販売価格は最高7500万ドルに達します。販売協定は、同日、現在の報告の証拠として8−K表の形で提出され、引用により本願明細書の付録に添付される。
配給通知を出した後、販売契約の条項及び条件を満たしている場合には、代理人は、証券法第415条(A)(4)条の規定に従って、法律で許可されている、“市場発売”とみなされる任意の方法で我々の普通株を売却することができる。時々指定された価格や私たちが指定した価格より高い価格で販売できなければ、代理店に普通株を売らないように指示することができます。私たちまたは代理人は通知を受けた後に普通株の発行を一時停止し、他の条件によって制限されることができる。
私たちは彼らが代理として私たちの普通株を売却して提供したサービスを補償するために、現金形式で代理店に手数料を支払います。販売契約によると、各エージェントは1株当たり販売総価格の3.0%の固定手数料率で補償を受ける権利がある。今回の発行完了条件として最低発行金額の要求がないため,現在のところ我々の実際の公開発行金額,手数料,収益総額(あれば)を決定することはできない.私たちはまた、その法律顧問の費用と支出を含む代理人の特定の費用を返済することに同意し、金額は75,000ドルおよびいくつかの持続的な費用を超えない。今回発売された総費用(販売契約条項によって代理店に支払うべき補償や補償は含まれていません)は約395,000ドルと見積もられています。
普通株販売の決済は、任意の販売日以降の第2の営業日に行われるか、吾らが特定の取引について代理人と合意した他の日に行い、吾等への純収益の支払いと引き換えに行われる。本募集説明書付録で想定する我々の普通株の販売は、預託信託会社の施設または私たちが代理人と合意する可能性のある他の方法で決済します。代理管理、信託、または同様の手配で資金を受ける予定は存在しない。
各エージェントは、販売協定に規定されている条項と条件に基づいて、その販売と取引慣行に基づいて、その商業的に合理的な努力を尽くして、普通株を購入するオファーを募集する。私たちを代表して普通株を売るという点では、各代理人は証券法の意味での“引受業者”とみなされ、代理人の補償は引受手数料または割引とみなされる。私たちは特定の民事責任(証券法下の責任を含む)について代理人に賠償と貢献を提供することに同意した。
販売契約により当社普通株の発売は販売契約終了時に終了いたします。販売契約の条項によると、私たちと各エージェントはいつでも販売契約を終了することができます。
各代理店とその共同経営会社は私たちとその共同経営会社に各種の投資銀行、商業銀行、その他の金融サービスを提供することができます。彼らは将来これらのサービスで通常の費用を受け取るかもしれません。Mルール要求の範囲内では,エージェントは本入札説明書付録項の下でMルールに違反して発行している間,我々の普通株に関する市販活動に従事してはならない.
本募集説明書副刊及び添付の入札説明書は代理人が維持するウェブサイト上で電子形式で提供することができ、代理人は本募集説明書副刊及び付属の入札説明書を電子的に配信することができる。
S-67
法律事務
ここで提供された普通株式の有効性はワシントン州シアトル専門会社のWilson Sonsini Goodrich&Rosatiによって伝達されるだろう。Cantor Fitzgerald&Co.とBTIG,LLCはニューヨークCooley LLP代表が今回の発行に参加した。Wilson Sonsini Goodrich&Rosati,P.C.のあるメンバーおよびそのメンバーと関係者からなる投資パートナーシップ企業が保有する普通株は1%未満である。
S-68
専門家
独立公認会計士事務所安永会計士事務所は、2021年12月31日現在のForm 10-K年度報告書に含まれている当社の総合財務諸表を監査しており、この報告書は、本募集説明書および登録説明書の他の部分に引用されている。我々の連結財務諸表は、安永会計士事務所が会計·監査専門家の権威ある報告書として引用したものである。
S-69
そこでもっと多くの情報を見つけることができます
私たちはアメリカ証券取引委員会に年度、四半期と現在の報告、依頼書、その他の情報を提出します。私たちのアメリカ証券取引委員会の届出書類はインターネットを介してアメリカ証券取引委員会のウェブサイトwww.sec.govで調べることができます。我々のForm 10-K年間報告、Form 10-Q四半期報告、およびForm 8-K現在の報告は、これらの報告の任意の改正を含み、取引法第13(A)または15(D)節に従って米国証券取引委員会に提出または提供された他の情報も、インターネットを介して無料でアクセスすることができる。これらの資料を電子的にアメリカ証券取引委員会に提出したり、それを提供したりした後、これらの届出書類は合理的で実行可能な場合にできるだけ早く提供されるだろう。私たちがアメリカ証券取引委員会に提出したいくつかの情報のコピーは、http://www.athira.com/である私たちのサイトでも入手できます。当社のウェブサイト上または当社のサイトで得られた情報は、本募集説明書の付録、添付の入札説明書、または引用によって本明細書またはその中に組み込まれた情報の一部ではありません。
S-70
引用で法団として成立する
アメリカ証券取引委員会は、私たちが米国証券取引委員会に提出した多くの情報を参照によって組み込むことを可能にしており、これは、公開された入手可能な文書を推薦することによって、重要な情報を開示することができることを意味します。我々が本募集説明書付録に引用した情報は、本募集説明書補足材料の一部とみなされる。将来の文書は、参照によって米国証券取引委員会に組み込まれているので、本入札説明書の補編は絶えず更新され、これらの将来の文書は、参照によって組み込まれたまたは組み込まれた情報の一部を修正または置換する可能性がある。これは、本入札明細書の付録または以前に参照によって組み込まれた任意の文書中の任意の陳述が修正または置換されたかどうかを決定するために、私たちが参照によって組み込まれたすべての米国証券取引委員会の届出文書を確認しなければならないことを意味する。本明細書の付録または本明細書の添付の任意の他の後で提出された文書に含まれる陳述が修正または置換されている限り、本募集説明書の付録または添付の入札説明書の文書に組み込まれた任意の陳述は、引用によって修正または置換されているとみなされるであろう。修正または置換された説明は、修正または置換されない限り、本募集説明書の付録または添付の目論見書の一部とはみなされないであろう
本入札明細書の補編は、引用的に以下の文書に組み込まれ、取引法第13(A)、13(C)、14または15(D)節に従って米国証券取引委員会に提出された任意の未来の届出文書(それぞれの場合、8-K表のいずれかの現在報告第2.02または7.01項に提供されている文書または文書の一部を除き、この表に提出されたこのような情報に関連する証拠物は除く)、登録説明書に従って提出された証券要約が終了または完了するまで:
本明細書の付録または添付の入札説明書には、または本明細書の付録または添付の入札説明書において参照によって組み込まれた任意の文書中の、本明細書またはその中で言及された任意の契約または他の文書の内容に関する記述は必ずしも完全ではなく、それぞれの場合、参照によって組み込まれた文書の証拠物としてアーカイブされた契約または他の文書のコピーが言及され、各説明は、すべての重要な態様において参照文書によって定義される。
手紙を書くか、以下の住所に電話することで、これらのファイルのコピーを無料で請求することができます
ATHIRA製薬会社
北渓公園大通り18706号、スイートルーム104
ボゼルワシントン州98011
注意:投資家関係
(425) 620-8501
S-71
目論見書

ATHIRA製薬会社
$300,000,000
普通株
優先株
債務証券
預託株
株式承認証
引受権
仕入契約
職場.職場
私たちは時々発行時に決定された金額、価格、条項で、1回または複数回の発行で証券を発行することができる。本募集説明書は、これらの証券の一般条項及びこれらの証券を発行する一般的な方法について述べている。これらの証券の具体的な条項は、本募集説明書の付録に提供され、これらの証券の具体的な発行方法も説明され、本募集説明書に含まれる情報を追加、更新、または修正することが可能である。あなたが投資する前に、あなたは本募集説明書とどんな適用可能な目論見書の付録を読まなければなりません。私たちが本募集説明書に基づいて販売している証券の総発行価格は300,000,000ドル以下です。
これらの証券は代理店や引受業者と取引業者を介して直接あなたに売ることができます。もし代理人、引受業者、または取引業者が証券を販売するために使用された場合、私たちは株式募集説明書の付録に彼らの報酬を指名して説明する。これらの証券を公衆に売却する価格と、今回の売却から得られる純収益も目論見書付録に示す予定である。
我々の普通株はナスダック世界の精選市場に上場し、コードは“ATSA”である。各目論見書の副刊は、その発行された証券がどの証券取引所に上場するかどうかを明記する。
連邦証券法の定義によると、我々は“新興成長型会社”であるため、今回と将来申告書類のいくつかの低下した上場企業の報告要求を遵守することを選択することができる。普通株以外の任意の証券が任意の証券取引所に上場することに関する情報を、任意の適用される目論見書付録に提供する。
このような証券への投資はリスクと関連がある。私たちの証券に投資する前に、本募集説明書の5ページ目からの“リスク要因”のタイトル下の情報と、本募集説明書の10-Kまたは10-Q表の最新報告書の“項目1 A-リスク要因”を参照してお読みください。
米国証券取引委員会およびどの州証券委員会もこれらの証券を承認または承認しておらず、本募集説明書の十分性または正確性に基づいて意見を発表していない。どんな反対の陳述も刑事犯罪だ。
本募集書の日付は2021年11月24日である。
本募集説明書について
この目論見書は、米国証券取引委員会(SEC)または米国証券取引委員会に提出された登録声明の一部であり、“棚上げ”登録手続きを採用している。この保留登録手続きによれば、当社は、本入札明細書に記載されている任意の証券組み合わせを時々1つまたは複数の製品で販売することができる。
本募集説明書は、発行可能な証券の一般的な説明を提供します。私たちが証券を販売するたびに、発行条項に関する具体的な情報が含まれる一つ以上の目論見書補足資料を提供します。募集説明書の副刊はまた、本募集説明書に含まれる情報を追加、更新、または変更することができる。あなたは、本募集説明書および任意の適用可能な目論見補足資料、およびタイトル“どこでより多くの情報を見つけることができるか”に記載されている他の情報を読まなければならない
私たちは、本入札説明書、任意の適用可能な入札説明書付録、または任意の無料で書かれた入札説明書に含まれるか、または参照によって組み込まれた情報とは異なる情報を提供することを誰にも許可していません。他の人があなたに提供するかもしれない他の情報については、私たちは何の責任も負いませんし、その信頼性を保証することもできません。本募集説明書および任意の適用可能な入札説明書または任意の関連する無料で書かれた入札説明書は、いずれの場合も、適用募集説明書付録に記載されている証券以外の任意の証券の売却または招待購入の要約を構成しないか、またはそのような証券の売却または招待購入を構成する要約を構成しない。本募集説明書、任意の募集説明書の付録、参照によって組み込まれた文書、および任意の関連する自由作成目論見書中の情報は、それぞれの日付においてのみ正確であると仮定しなければならない。これらの日付以来、私たちの業務、財務状況、運営結果、見通しに大きな変化が生じている可能性があります。
1
募集説明書の概要
本要約は、本明細書においてより詳細に紹介されるか、または参照によって組み込まれた精選された情報を重点的に紹介する。それはあなたとあなたの投資決定に重要かもしれないすべての情報を含まない。私たちの証券に投資する前に、当社の株式募集説明書のタイトルが“リスク要因”の節で述べた事項、および当社のForm 10-K年次報告およびForm 10-Q四半期報告を含む、本明細書で引用された財務諸表、関連説明、および他の情報をよく読まなければなりません。文脈が別に説明されていない限り、本入札明細書で言及されている“ATHIRA Pharma,Inc.”、“We”、“Our”および“Us”は、総称してATHIRA製薬会社、デラウェア州の会社およびその子会社と呼ばれる。
会社の概要
著者らは臨床末期の生物製薬会社であり、小分子の開発に集中して神経細胞の健康を回復し、神経退化を阻止する。私たちの候補製品に対して、私たちの目標は迅速な認知改善を提供し、私たちの新しい作用機序を用いて神経疾患の進行を変えることである。我々の方法は、肝細胞増殖因子/MET、またはHGF/MET、自然に産生される再生系によって神経増殖因子シグナルを増強することを目的としている。HGF/METシグナルを増強することは,既存のニューロンを損傷から保護し,炎症を減少させ,再生を促進し,脳活動を積極的に調節する可能性があると信じている。これらすべての特徴はニューロンの健康を改善し、臨床的利益に転化する可能性が予想される。我々のチャンネルは著者らの特許薬物発見プラットフォーム或いはATHプラットフォーム上に構築され、一連の小分子からなり、(1)中枢神経系或いは中枢神経系を標的とし、血液脳関門或いは血液脳関門を越えることによって、或いは(2)末梢神経系を標的とすることを目的としている
われわれの主要候補薬物ATH−1017は皮下注射,血液脳関門を貫通する小分子HGF/MET正性調節剤である。われわれの1 a/1 b期臨床試験では,ATH−1017はアルツハイマー病(AD)の治療に用いられる耐性は良好であり,重篤な副作用はなかった。この臨床試験は、11名の軽中度AD患者を含む88名の被験者を募集し、彼らは治療群および対照群に割り当てられた。非臨床研究とATH-1017の第一段階臨床試験により、ATH-1017は大脳ネットワーク活動において改善され、脳機能に潜在的な積極的な影響があることが示唆された。AD被験者ではATH−1017の複数回投与でP 300潜伏期が有意に改善した。P 300潜伏期は認知高度に関連する機能測定であるが、これらのP 300潜伏期結果と認知改善との間の関連は確立されていない。2020年9月にLIFT−ADの現場起動と患者スクリーニングを開始したが,これはATH−1017に対する2/3期臨床試験であり,軽中度ADの登録と治療を支援するために重要なデータを提供する可能性があり,2022年末にTOPLINE結果が予想される。2020年11月、著者らはまたP 300第二段階臨床試験ACT-ADを開始し、軽中度ADを治療し、ATH-1017が仕事記憶処理速度と認知測定に対する全体的な影響をよりよく理解し、2022年上半期にTOPLINE結果があると予想した。2021年7月,我々はLIFT−ADおよびACT−AD臨床試験のために患者を募集していることを発表し,ATH−1017の1年間にわたる安全性と有効性データを収集することができるようになった。2021年10月,ACT−AD臨床試験の患者登録が完了したことを発表した。ADに加えて,ATH−1017はより広範な認知症患者集団を解決する可能性があると信じている
2
以下図に我々ATH化合物の現在の開発段階および発見と開発計画を説明した。また,われわれのATHプラットフォームを中枢神経系や末梢神経系の他の適応に拡張し,多様な疾患のニューロン健康を改善している。著者らの薬物発見はATH技術の潜在力を探索することに集中し、この技術はHGF/MET活性の各種臨床応用における応用を促進することを目的としている。
私たちは内部発見を通じて私たちの製品の組み合わせを拡大し、最適化し、私たちの革新的な内部研究開発能力を通じてより多くの外部業務開発活動を計画するように努力しています。
企業情報
私たちは2011年3月にワシントンでM 3 Biotech,Inc.の会社として設立されました。2015年10月、私たちはデラウェア州の会社に変わり、その後“Athera Pharma,Inc.”と改名しました。私たちの主な行政事務室は18706 North Creek Parkway、Suite 104、Bothell、Washington 98011にあります。私たちの電話番号は221-8115です。私たちのサイトはwww.athira.comです。本募集規約に含まれているか、または本サイトを介してアクセス可能な情報は、本募集説明書の一部ではなく、本募集説明書にも含まれておらず、本募集説明書に本募集説明書に含まれている我々のサイトアドレスは、非活動的なテキストとしてのみ参照されている。
発行可能証券
私たちは、1つまたは複数の発行において、普通株、優先株、預託株式、債務証券、引受権証、引受権、購入契約、および単位を任意の組み合わせで提供または販売することができる。私たちが本募集説明書に基づいて販売している証券の総発行価格は300,000,000ドル以下です。本募集説明書と一緒に証券を発売するたびに、募集説明書補足資料を提供し、発売された証券の具体的な金額、価格、条項、および今回の売却から得られる予定の純収益を説明します。
これらの証券は、引受業者、取引業者または代理人によって販売されてもよく、または購入者に直接販売されてもよく、または“流通計画”というタイトルで本明細書に記載されている部分に販売されてもよい。各募集説明書増刊は、証券販売に関与する任意の引受業者、取引業者、代理人または他のエンティティの名称、および彼らと達成した任意の適用可能な費用、手数料、または割引スケジュールを記載する。
普通株
私たちは普通株を発行することができて、1株当たり0.0001ドルの価値があり、単独で発行することもできますし、私たちの普通株に変換できる他の登録証券を発行することもできます。私たち普通株の保有者は、合法的に配当金を支払うために使用できる資金から私たちの取締役会が発表した配当を得る権利がありますが、優先株株主の権利(あれば)は制限されています。私たちは過去に配当を持っていなかったし、現在配当の計画もない。普通株のすべての所有者は一株一票の権利を持っている。普通株保有者は優先購入権を持っていない。
3
優先株
デラウェア州の法律で規定されている制限の下で、私たちの取締役会は1つ以上のシリーズの優先株を発行する権利があり、各シリーズに含まれる株式の数を時々決定し、各シリーズの株式の指定、権力、優先と権利およびそれらの任意の資格、制限または制限を決定する権利があり、すべての場合、私たちの株主はさらなる投票や行動を取る必要はない。私たちが提供する一連の優先株は、償還条項、私たちの清算、解散または清算時の権利、投票権、および普通株式に変換する権利を含む、本入札明細書に添付されている特定の目論見説明書の補足資料により全面的に説明されるだろう。
預託株
私たちは預託株式と預託証明書に代表される部分優先株を発行することができる。
私たちが提供する各一連の預託株式または預託証明書は、償還条項、私たちの清算、解散または清算時の権利、投票権、および普通株式に変換する権利を含む、本募集説明書に添付されている特定の入札説明書補足資料により完全に説明されるであろう。
債務証券
私たちは1つまたは複数の優先債務または二次債務の形態で保証または無担保債務を提供することができる。優先債務証券および二次債務証券は、本明細書では総称して“債務証券”と呼ばれる。二次債務証券は一般的に私たちの優先債務の支払い後にのみ支払いを受ける権利がある。優先債務項目には、一般に吾等の借入金のすべての債務が含まれるが、当該等債務項目条項を管理する文書では、二次債務証券よりも優先しないこと、または支払権において二次債務証券と同じか、または二次債務証券よりも明示的に優先する債務は除外される。私たちは普通株に転換できる債務証券を発行することができる。
債務証券は私たちと受託者との契約に基づいて発行され、この契約は添付の目論見書付録に明記されます。吾らは、本募集規約内で契約管限を受ける債務証券の一般的な特徴について概説したが、契約形式はすでに登録説明書の証拠物としてアーカイブされており、本目論見書はその一部である。私たちはあなたに契約書を読むことを奨励します。
株式承認証
私たちは普通株、優先株、債務証券、または預託株式の購入に株式承認証を提供することができる。私たちは単独で権利証を発行することができ、他の証券と一緒に発行することもできる。
引受権
私たちは私たちの普通株、優先株、債務証券、預託株式、株式承認証、またはこれらの証券の一部または全部からなる単位を購入するための引受権を提供することができる。これらの引受権は単独で発売することもできるし、ここで発売された任意の他の証券と一緒に発売することもでき、譲渡することもでき、譲渡しなくてもよい。
仕入契約
所有者または将来のある日または複数の日に特定の数量または可変数の証券を相手に購入する義務がある契約を含む購入契約を提供することができます。
職場.職場
本明細書に記載された1つまたは複数の他の証券カテゴリからなる単位の任意の組み合わせを提供することができる。各ユニットの発行は,そのユニットの所持者もそのユニットに含まれる各証券の所持者とする.
4
リスク要因
私たちの証券に投資することは高度な危険と関連がある。当証券の毎回発行に適用される目論見書付録には、我々の証券投資への適用リスクの検討が含まれています。私たちの証券への投資を決定する前に、適用される目論見書副刊“リスク要因”の節で議論される具体的な要素、および株式募集説明書副刊に含まれるまたは引用的に組み込まれたすべての他の情報、または本入札明細書に引用または組み込まれた他のすべての情報を慎重に考慮しなければならない。あなたはまた、米国証券取引委員会に提出された最新の年次報告書の“第I部分-第1 A項-リスク要因”と、米国証券取引委員会に提出された最新の四半期報告書の“第II部分-第1 A項目-リスク要因”で議論されているリスク、不確定要素および仮定を考慮しなければならず、これらのリスク、不確定要素および仮説は、将来、米国証券取引委員会に提出される他の報告によって時々修正、補充、または代替される可能性がある。私たちが説明した危険と不確実性は私たちが直面している唯一の危険と不確実性ではない。私たちは今知らないか、あるいは私たちが現在どうでもいいと思う他の危険と不確実性はまた私たちの運営に影響を及ぼすかもしれない。
前向きに陳述する
本募集説明書、各目論見書付録及び引用により本募集説明書及び各募集説明書付録に格納された情報は、いくつかの“前向き陳述”を含み、これらの陳述は、改正後の1933年“証券法”第27 A節又は改正後の“証券法”、及び改正された1934年証券取引法第21 E節又は取引法の意味に適合する。“信じる”、“可能”、“将”、“推定”、“継続”、“予想”、“意図”、“予想”、“可能”、“将”、“プロジェクト”、“計画”、“可能”、および同様の表現およびそれらの変形は、前向き陳述を識別することを意図しているが、そのような陳述を識別する唯一の手段ではない。これらの陳述は、本募集説明書、任意の付随する目論見説明書の副刊、および本明細書およびその中で引用された文書の中に現れ、特に“リスク要因”および“経営層の財務状況および経営結果に対する議論および分析”と題する章には、我々の管理職の意図、信念、または現在予想されている陳述が含まれており、これらの陳述は既知および未知のリスク、不確定要素および仮定の影響を受ける。このような展望性陳述は未来の業績の保証ではなく、リスクと不確定要素に関連し、各種の要素のため、実際の結果は展望性陳述中の予測結果と大きく異なる可能性があることに注意してください。
展望性陳述自体はリスクと不確実性の影響を受けるため、その中のいくつかのリスクと不確定性は予測または定量化できないので、未来のイベントの予測として展望性陳述に依存してはならない。展望性陳述に反映された事件と状況は実現できない或いは発生する可能性があり、実際の結果は展望性陳述中の予測結果と大きく異なる可能性がある。法律(米国証券法および米国証券取引委員会の規則および法規を含む)の要件が適用されない限り、私たちは、任意の新しい情報、未来の事件、または他の理由でも、本明細書に含まれる任意の前向きな陳述を公開または修正することを意図していない。
また、“私たちが信じている”という声明と類似した声明は、関連テーマに対する私たちの信念と意見を反映している。これらの陳述は,募集説明書の発表日までに我々が把握した情報に基づいており,これらの情報がこのような陳述の合理的な基礎を構成していると考えられるが,これらの情報は限られているか不完全である可能性があり,我々の陳述は,我々が入手可能なすべての関連情報を徹底的に調査または検討していることを示していると解釈されてはならない.これらの陳述は本質的に不確実であり、投資家にこのような陳述に過度に依存しないように注意する。
本募集説明書および引用して本募集説明書に入る文書には、業界源から得られた市場データが含まれている可能性がある。このようなソースは情報の正確性や完全性を保証しない。私たちは私たちの産業情報源が信頼できると信じているにもかかわらず、私たちは独立してこのような情報を確認しない。市場データは、複数の他の予測に基づく予測を含むことができる。本募集説明書の発表日までには,これらの仮定は合理的で合理的であると考えられるが,実際の結果は予測とは異なる可能性がある。
収益の使用
幅広い裁量権を保持し、本目論見書に基づいて我々の証券を売却して得られた純収益の使用を行う。適用される目論見書付録に別途規定されていない限り、今回の発行から得られた純収益は、運営資金や他の一般会社用途に利用される予定である。私たちはまた、補完的な製品、技術、または事業に買収、許可、または投資するために純収益の一部を使用することができるが、私たちは現在、そのような取引の合意または約束を完了していない。我々の現在の計画と業務状況によると,今回発行された純収益の期待用途は我々の現在の意図を代表している.今回の発行終了時に受信する純利益のすべての特定用途を正確に説明することはできない.これらの用途の前に、今回発行された純収益を米国政府の短期·中期有利子債務、投資レベル手形、預金または直接または保証債務に投資する予定だ
5
株本説明
私たちの株式の記述は、添付ファイル4.3を参照して、2021年3月25日に米国証券取引委員会に提出された2020年12月31日までの10-Kフォーム年次報告書に組み込まれています。
6
債務証券説明
以下の説明は、任意の適用可能な目論見明細書の付録に含まれる追加の情報と共に、本入札明細書の下で提供される可能性のある債務証券のいくつかの一般的な条項および条項を概説する。特定一連の債務証券の売却を提案する際には、本募集説明書の付録にこのシリーズの具体的な条項を説明する。また、本入札明細書に記載されている一般条項及び規定が特定の一連の債務証券にどの程度適用されるかを付録に説明する
私たちは、債務証券を単独で発行したり、本明細書に記載された他の証券と共に発行したり、他の証券を転換、行使、または交換する際に発行することができる。債務証券は、本募集明細書の付録に別途規定されていない限り、私たちの優先的、優先的二次債務とすることができ、債務証券は、私たちの直接無担保債務となり、1つまたは複数のシリーズに分けて発行される可能性がある
債務証券は私たちと受託者との契約に基づいて発行され、この契約は添付の目論見書付録に明記されます。私たちは以下の契約の精選部分をまとめました。要約が不完全である。契約の形式はすでに登録説明書の証拠物として提出されており、本募集説明書はその一部であり、契約中にあなたに重要になる可能性のある条項を読まなければなりません。以下の要約には、これらの条項を容易に見つけることができるように、契約章番号への参照が含まれています。要約で用いられていない本稿で定義していない大文字用語は,契約で指定された意味を持つ.
一般情報
各一連の債務証券の条項は、当社の取締役会決議または当社の取締役会決議に基づいて設立され、当社の取締役会決議、高級管理者証明書、または補充契約に規定されている方法で述べたり確定したりする。各一連の債務証券の特定の条項は、このシリーズに関連する目論見説明書の付録に記載される(任意の定価付録または条項説明書を含む)。
私たちは債券に応じて無限数の債務証券を発行することができ、これらの債券は1つまたは複数のシリーズであってもよく、期限は同じであっても異なっていてもよく、額面、割増、または割引によって発行される。株式募集説明書付録(任意の定価付録または条項説明書を含む)に、任意の一連の債務証券に関連する元本総額および債務証券の以下の条項を列挙する(適用される場合)
7
契約条項に基づいて加速満期を宣言したときに、満期及び支払うべき金額がその元金を下回ることを規定する債務証券を発行することができる。適用される目論見書付録に、これらの債務証券のいずれかに適用される連邦所得税考慮要因及びその他の特別な考慮要因の情報を提供します。
もし吾等が1つまたは複数の外貨または1つまたは複数の外貨単位で任意の債務証券の購入価格を計算する場合、または任意の一連の債務証券の元金および任意のプレミアムおよび利息が1つまたは複数の外貨または1つまたは複数の外貨単位で支払われる場合、吾等は適用される目論見書補充資料の中で、そのような債務証券の発行に関する制限、選挙、一般税務考慮、特定条項およびその他の資料を閣下に提供する。
譲渡と交換
適用目論見書付録に記載されているように、各債務証券は、取引法に基づいて登録された決済機関(我々は、信託機関と呼ぶ)の名義で登録された1つ以上のグローバル証券または信託機関の著名人(グローバル債務証券で表される任意の債務証券を“簿記債務証券”と呼ぶ)、または最終登録形態で発行された証明書(認証された証券で表される任意の債務証券を“認証された債務証券”と呼ぶ)に代表される。以下のタイトル“グローバル債務証券および課金システム”に加えて、課金債務証券は、証明書形式で発行することができない。
証書債務証券
契約条項に基づいて、私たちがこの目的のために設立した任意の事務所で証明的債務証券を譲渡または交換することができます。いかなる証拠式債務証券の譲渡や交換はサービス料を取りませんが、私たちはできます
8
譲渡または交換に関連する任意の税金または他の政府の料金を支払うのに十分な金額を支払うことが要求される。
閣下は当該等の証明書債務証券を代表する証明書を提出し、吾等又は証明書の受託者が証明書を新規所有者に再発行することができ、又は吾等又は受託者が新規所有者に新しい証明書を発行することができ、証明書債務証券及び証明書証券の元金、プレミアム及び利息を取得する権利を譲渡することができる
グローバル債務証券·課金システム
代表記帳債務証券の各グローバル債務保証は、保管人または代表保管人に預けられ、保管人または保管人の名義で登録される。
聖約
私たちは適用される入札説明書の付録に任意の債務証券発行に適用される任意の制限的なチェーノを列挙するつもりだ。
制御権変更時には何の保護も提供しません
吾等が適用される目論見書付録に別途説明されていない限り、債務証券は、吾等の支配権変更や高レバレッジ取引(当該等の取引が支配権変更を招くか否かにかかわらず)が債務証券保有者に悪影響を及ぼす可能性がある場合に債務証券保有者に証券保障を提供する条文は含まれない。
資産の合併·合併·売却
私たちは、誰とも合併したり、合併したり、私たちのすべてまたは実質的にすべての財産と資産を譲渡、譲渡、またはレンタルして、私たちを相続人と呼ぶ誰にもレンタルしてはいけません
上記の規定にもかかわらず、私たちのどの子会社も私たちと合併、合併、またはその全または一部の財産を私たちに譲渡することができます。
違約事件
“違約事件”とは、任意の一連の債務証券について、次のいずれかである
特定一連の債務証券の違約事件(破産、資本不担保又は再編のある事件を除く)は、必ずしも任意の他の一連の債務証券の違約事件を構成するとは限らない。♪the the the
9
当社または当社付属会社が時々返済していないいくつかの債務の場合、ある違約事件や契約下の加速が違約事件となる可能性があります。
吾らは、当該等の失責又は失責事件が発生してから30日以内に、当該失責又は失責事件の状況を合理的に詳細に説明し、これについてどのような行動をとるか、どのような行動をとるかを合理的に詳細に説明する書面通知を受託者に通知する。
未償還時に任意の一連の債務証券に違約事件が発生して継続している場合、受託者又は当該一連の未償還債務証券元本の25%以上の保有者は、吾等に書面通知(当該一連の債務証券が割引証券に属する場合は、直ちに受託者に通知しなければならない)、当該一連のすべての債務証券の元金(又は当該一連の債務証券が割引証券である場合は、当該一連の条項に示される元金部分)及び当該一連のすべての債務証券の課税利息及び未払い利息(あれば)を宣言することができる。いくつかの破産、債務返済不能または再編事件に起因する違約事件では、すべての未償還債務証券の元本(またはその特定の額)およびすべての未償還債務証券の計上および未払い利息(ある場合)は、受託者または未償還債務証券の任意の所有者がいかなる声明または他の行動を行うことなく、即時満期支払いとなるであろう。任意の一連の債務証券について加速弁済の発表後のいつでも、受託者が弁済満期金の判決または判決を取得する前に、一連の債務証券について発生したすべての無責任事件(あれば)について、当該一連の債務証券の支払い加速元金および利息についてのすべての無責任事件が契約書の規定に従って救済または猶予されていなければ、一連の未償還債務証券の過半数の元本所有者は弁済を撤回し、加速することができる。われわれは、いかなる一連の債務証券に関連する目論見書補足資料を参照して、違約事件が発生した場合に当該等割引証券の一部元本の償還を加速することに関する特別規定を理解してください。
契約規定は、受託者がその責任を履行するか、またはその権利または権力を行使する場合に、受託者がその責任を履行するか、または権利または権力を行使する際に招く可能性のある任意の費用、法的責任または支出が、受託者を満足させる代償を得ない限り、その契約下の任意の責任の履行を拒否することができる、またはその契約下の任意の権利または権力を行使することを拒否することができる。受託者のある権利には別の規定があるほか、任意の一連の未償還債務証券元本の過半数を持つ所有者は、受託者が獲得可能な任意の救済を求めるために、任意の法律手続きの時間、方法および場所を指示する権利があり、または一連の債務証券について受託者が付与された任意の信託または権力を行使する権利がある。
一連の債務保証の所有者は、その契約について任意の司法または他の法的手続きを提起する権利がないか、またはその契約について管理者または受託者に委任するか、またはその契約下の任意の救済措置について任意の法的手続きを提起する権利がない
契約には任意の他の規定があるにもかかわらず、任意の債務保証の所有者は、その債務保証が記載された期限または後に当該債務保証の元金、保険料、および任意の利息の支払いを受信し、支払いの強制執行について訴訟を提起する権利を有するであろう。
契約は、財政年度終了後120日以内に受託者に契約遵守に関する声明を提出することを要求します。任意の一連の証券について、失責または失責事件が発生し、継続しているが、受託者の担当者がこのことを知った場合、受託者は、失責または失責事件の発生後90日以内に、または受託者の担当者が当該失責または失責事件を知ってから90日以内に、当該一連の証券の各証券所有者に通知を送付しなければならない。この契約は、受託者が誠実に確定し、抑留通知が債務証券保有者の利益に適合している場合、受託者は債務証券所持者に当該一連の債務証券のいかなる違約又は違約事件に関する通知を出さなくてもよい(当該一連の債務証券の支払いを除く)。
改正と免除
吾等及び受託者は、いかなる債務証券所有者の同意なしに、任意の一連の契約又は債務証券を修正、改訂、又は補充することができる
10
改正または改訂の影響を受けた各系列の未償還債務証券の少なくとも多数の元本保有者の同意を得た場合には、契約を修正して修正することもできる。その時点で返済されていないすべての影響を受けた債務証券の所有者の同意を得ていない場合、修正または修正を行うことはできません
いくつかの特定の規定を除いて、任意の一連の未償還債務証券元本の少なくとも過半数の所有者は、当該シリーズのすべての債務証券の所有者を代表して、当該契約の規定の遵守を放棄することができる。任意の一連の未償還債務証券の過半数元金所有者は、このシリーズのすべての債務証券の所有者を代表して、一連の債券の過去のいかなる違約及びその結果を免除することができるが、このシリーズの債務証券の元金、プレミアム或いは利息の支払い違約は除外する;しかし、任意の一連の未償還債務証券の過半数の元金所有者は加速及びその結果を撤回することができ、加速によるいかなる関連支払い違約を含むことができる。
債務証券といくつかのチノは場合によっては失効する
法律上の失敗
契約規定は、適用される一連の債務証券の条項が別途規定されていない限り、任意の一連の債務証券に関連する任意の義務およびすべての義務(特定の例外を除く)を解除することができる。もし私たちが信託の形で受託者に撤回できない資金および/またはアメリカ政府債務を渡したり、この場合、私たちは責任を解除されるだろう
11
ドル以外の単一通貨で建てられた債務証券については、当該通貨の発行又は発行に至る政府義務は、その条項に従って利息及び元金を支払うことにより、国家公認の独立公共会計士事務所又は投資銀行が契約条項及び当該債務証券の条項に基づいて、当該一連の債務証券の規定の期限までに当該一連の債務証券の毎期元金、プレミアム及び利息及び任意の強制弁済基金を支払うのに十分な資金又は米国政府義務を提供する。
私たちが米国国税局から裁決を受けたことを示す弁護士の意見を受託者に提出した場合、または米国国税局が裁決を発表したか、または契約が成立した日から、適用された米国連邦所得税法が変化した場合にのみ、この意見は、一連の債務証券の所有者が預金の結果であることを確認しないことを確認すべきであり、一連の債務証券の所有者は、米国連邦所得税目的の収入、収益または損失を確認しないであろう。預金、失敗及び解除の状況が発生していない場合は、同じ額、同じ方法及び同じ時間に米国連邦所得税を納付する。
一部のキノの無効
この契約規定は、適用される一連の債務証券の条項が別途規定されていない限り、ある条件を遵守する場合には、
私たちはこれを聖約の失敗と呼ぶ。これらの条件には
役員、上級職員、従業員、または株主は個人の責任を負う必要はありません
私たちの過去、現在、または将来の役員、上級管理者、従業員または株主は、債務証券または契約下での私たちのいかなる義務も、またはそのような義務またはそれによって生じる任意のクレームに基づいていかなる責任も負わないだろう。債務保証を受けることで、すべての保有者たちはこのようなすべての責任を放棄して免除した。この免除と免除は債務証券を発行する部分的な相対価格だ。しかし、このような免除および免除は、米国連邦証券法で規定されている責任を効果的に免除することができない可能性があり、米国証券取引委員会は、このような免除は公共政策に違反していると考えている。
12
治国理政法
当該契約および債務証券は、当該契約または当該証券によって引き起こされるか、またはそのような契約または証券に関連する任意の申立または論争を含み、ニューヨーク州の法律によって管轄される。
契約は、私たち、受託者、および債務証券保有者(彼らによって債務証券を受け取る)が、法律の適用によって許容される最大範囲内で、契約、債務証券またはしようとする取引によって引き起こされる、またはそれに関連する任意の法律手続きにおいて陪審員によって裁判される任意およびすべての権利を撤回することができないことを規定する。
契約は、契約または行われる取引によって引き起こされる、または基づく法的訴訟、訴訟または法律手続きは、ニューヨーク市に位置するアメリカ合衆国連邦裁判所またはニューヨーク市に位置するニューヨーク州裁判所で提起することができ、吾らは受託者および債務証券保有者として(彼らによって債務証券を受け取る)任意のこれらの訴訟、訴訟または法律手続きにおいて、これらの裁判所の非排他的司法管轄権に撤回することができないと規定する。この契約は、任意の法律手続文書、伝票、通知又は文書を郵送(任意の適用される法規又は裁判所規則が許容される範囲内)で契約の当事者の住所に送達することは、任意のこのような裁判所に提起された任意の訴訟、訴訟又は他の手続の有効な法的手続文書の送達であることをさらに規定する。この契約は、吾ら、受託者及び債務証券保有者(彼らを通じて債務証券を受け取る)が撤回できず、無条件に任意の反対を放棄し、上記指定裁判所で任意の訴訟、訴訟又は他の法律手続の意見を提出することをさらに規定し、撤回及び無条件放棄及び無条件に抗弁しないことに同意すること、又は当該等の訴訟、訴訟又は他の法律手続が不便な裁判所で提起されたことに同意することができる。
一般情報
私たちは自分の選択に応じて、すべての優先株ではなく、発行部分優先株または預託株式を選択することができる。もし私たちがそうすれば、私たちは預金株式の預託証明書を公衆に発行し、各預託証明書は特定の系列優先株の一部を代表し、適用される株式募集説明書の補編に記載される。株式募集説明書の補編に別段の規定がない限り、預託株式の各保有者は、当該預託株式に代表される優先株のすべての権利及び割引権を適用された割合で享受する権利を有する。このような権利は配当金、投票権、償還権、転換権、および清算権を含む。
預託株式の基礎となる優先株株は、私たちと預託証明書所持者と預託証明書所持者との間の預託合意に基づいて、吾等が選定した銀行又は信託会社に入金して預託者とする。保管人は株式を預託する譲渡代理,登録員,配当金支払いエージェントとなる.
預託株式は預託プロトコルにより発行された預託証明書によって証明される。預託証明書の所有者は、居住証明書の提出および特定の費用の支払いなど、所有者に特定の行動を要求する預金協定の制約を受けることに同意する。
本募集説明書に記載されている預託株式条項の要約は完全ではない。米国証券取引委員会に登録されている預託プロトコルフォーマット、当社の登録証明書、および適用系列優先株の指定証明書を参考にしなければなりません。
配当金とその他の分配
受託者は、預託株式関連優先株が受け取ったすべての現金配当金又は他の現金に基づいて、預託株式保有者が関連記録日に所有する預託株式数の割合に応じて、預託株式の記録所有者に分配する。預託株式に関する記録日は、対象優先株の記録日と同じとなる。
現金以外の分配がある場合は,信託機関は,信託機関が分配不可能であると判断しない限り,その受信した財産(証券を含む)を預託株式の記録保持者に割り当てる.このような状況が発生した場合、私の行の許可を得て、保管人は、財産を売却し、売却した純額を所有者に分配することを含む別の分配方法をとることができる。
13
清算優先権
預託株式に関連する一連の優先株が清算優先権を有している場合、吾等の自発的又は非自発的清算、解散又は清算の場合、預託株式保有者は、適用目論見書付録に規定されている適用優先株系列の1株当たりの清算優先権の一部を獲得する権利がある。
株の引き揚げ
関連する預託株式が以前に償還を要求された場合を除き、預託証明書が預託者事務所に提出されたとき、預託株式保有者は、預託者事務所で彼又は彼女の命令に優先株の全株式数及び預託株式に代表される任意の金銭又はその他の財産を交付する権利がある。もし所有者が交付した預託証明書が預金持分数が抽出しようとしているすべての優先株に相当する預託持分数を超えたことを証明した場合、その預託証明書は同時に所有者に新しい預託持分を渡し、預託持分数がその数を超えていることを証明する。いずれの場合も、預託証明書を提出する際には、預託機関は優先株の断片的な株式を交付しない。その後、引き揚げられた優先株保有者は、預託契約に基づいてこれらの株式を入金してはならず、預託株式を証明する預託証明書を受け取ってはならない。
預託株の償還
受託者が保有する優先株株式を償還するたびに、受託者は、そのように償還された優先株株式に相当する預け入れ株数を同じ償還日に償還する。償還対象優先株の償還価格に、指定された償還日までの優先株に相当する累積および未払い配当に相当する金額を全額支払う限り。1株当たり受託株式の償還価格は、優先株の償還価格とその他の1株当たりの支払金額に、1株預託株式代表の優先株分の点数を乗じたものに等しい。償還する預託株式が全預託株式より少ない場合、償還が必要な預託株式は、一括または比例または預託者によって決定される任意の他の公平な方法で選択される。
指定された償還日後、償還を要求する預託株式は、未償還とみなされなくなり、預託株式保有者のすべての権利は終了するが、償還時に支払うべき金を受け取る権利及び預託株式保有者が預託株式を証明する預託証明書を預託者に提出する際に取得する権利があるいかなる金銭又は他の財産を除く。
優先株投票権
保管人は、優先株保有者が参加する権利のある任意の会議の通知を受けた後、会議通知に記載されている情報を当該優先株に関する預託証明書の記録保持者に郵送する。優先株に関する預託証明書の記録日は、優先株の記録日と同じとなる。記録日には、預託株式の記録保持者毎に、その預託株式に代表される優先株株数に関する投票権の行使を保存者に指示する権利がある。受託者は、これらの指示に基づいて、実際に実行可能な場合には、受託株に代表される優先株の数を可能な限り投票し、管財人がそうできるように、必要と思われる可能性のあるすべての行動をとることに同意する。保管者は、預託株式保有者から具体的な指示を受けない限り、優先株株に相当する数の優先株株に投票しない。
人の押記を保管する
私たちは預託手配の存在だけで発生したすべての移転と他の税金と政府費用を支払うつもりだ。私たちは受託者に優先株の初期入金と任意の優先株償還に関する費用を支払います。預託証明書保持者は、譲渡税、所得税およびその他の税、ならびに政府課金および他の費用(配当金の徴収および分配、権利の売却または行使、優先株の撤回、および譲渡、分割または組合せ預託証明書に関連する費用を含む)を支払わなければならず、これらの費用は、預託プロトコルによって明文化的に規定されている。預託証明書所持者がこれらの費用を支払っていない場合、預託機関は預託株式の譲渡を拒否し、配当金と分配を抑留し、預託証明書が証明した預託株式を売却することができる。
14
“預金契約”の修正と終了
預託株式を証明する預託証明書の形式および預託契約の任意の規定は、当行と預託者との間の合意によって修正することができる。しかしながら、預託株式保有者の権利を実質的かつ不利に変更する修正案は、発行された預託株式の大多数の保有者の承認を得ない限り、発効しない。以下の場合にのみ、管理者または私たちは預金契約を終了することができます
保管人の退職と更迭を依頼された
保管人はいつでも私たちにその選択退職の通知を提出することで退職することができます。いつでもこの保管人を移動することができます。保管人の任意の辞任または更迭は、私たちが後任の保管人を任命し、その任命を受けた後に発効します。後任受託者は、辞任又は免職通知を提出してから60日以内に指定しなければならず、主要事務所が米国に設置され、適用協定に規定されている必要な資本及び黒字を有する銀行又は信託会社でなければならない。
通達
受託者は、預託証明書所持者に転送して受託者に交付し、当社から受け取った依頼書募集資料を含めて、優先株保有者に提供するすべての通知、報告、その他の通信を要求します。また、受託者は、受託者の主要事務所及びそれが適切であると考えられる他の場所で、預託証明書所持者が閲覧するために、私たちが受託者に渡した任意の報告及び通信を優先株式所有者である受託者に提供する。
法的責任の制限
いずれか一方がその義務を履行する際に法律またはそれが制御できない任意の状況によって阻止または遅延された場合、私たちも保管者も責任を負わない。私たちの義務と保管人の義務は、私たちの義務とそれに応じて負う義務を誠実に履行することに限られます。満足できる賠償を提供しない限り、吾らおよび受託者は、受託株式または優先株についていかなる法的手続きを提起したり、それを正当化する義務がないだろう。私たちおよび保管人は、弁護士または会計士の書面意見、優先株供託を提出する人、預託証明書保持者またはそのような情報を提供する能力があると考えられる他の者が提供する情報、および真実であると考えられ、適切な当事者または複数の者によって署名または提出された文書に依存することができる。
手令の説明
私たちは株式承認証を発行して債務証券、優先株、預託株式または普通株を購入することができる。適用される目論見明細書の付録に記載されているように、私たちは、1つまたは複数の追加の引受権証、債務証券、優先株、預託株式または普通株、またはこれらの証券の任意の組み合わせと共に単独でまたはそれらの任意の組み合わせで発売することができる。もし私たちが株式承認証を1つの単位の一部として発行すれば、適用される目論見書副刊は、これらの権利証が権利証満期日までに当該単位の他の証券と分離できるかどうかを規定する。適用される株式募集説明書付録には、任意の引受権証の以下の条項が記載されている
15
引受権説明
私たちは私たちの普通株、優先株、債務証券、預託株式、株式承認証、あるいはこれらの証券の一部または全部からなる単位を購入するために引受権を発行することができる。これらの引受権は単独で発売することもできるし、ここで発売された任意の他の証券と一緒に発売することもでき、譲渡することもでき、譲渡しなくてもよい。任意の引受権の発売については、吾等は、1人以上の引受業者又は他の購入者と予備手配を締結することができ、この手配によれば、引受業者又は他の購入者は、当該等の発売後も引受されていない任意の証券の購入を要求される可能性がある。
私たちが提供する任意の引受権に関する募集説明書補足資料は、適用される範囲内に、以下の部分または全部を含む発行に関する具体的な条項を含む
16
本募集説明書及び任意の募集説明書付録における引受権の記述は、引受権合意を適用する重大な条項の概要である。これらの説明は、これらの承認権プロトコルを完全に繰り返しているわけではなく、有用な情報を発見する可能性があるすべての情報も含まれていない可能性があります。私たちは、要約ではなく、適用された引受権プロトコルを読むことを促します。なぜなら、購入権所有者としてのあなたの権利を定義しています。より多くの情報を知るためには、引受権発行直後に米国証券取引委員会に提出される関連引受権契約の表を参照し、本募集説明書のタイトルを“どこでより多くの情報を見つけることができるか”という節で述べたようにする
仕入契約説明
以下の説明は、本入札明細書の下で提供可能な購入契約の一般的な特徴をまとめたものである。以下に要約する特徴は、一般に、本募集説明書の下で提供可能な任意の将来の購入契約に適用されるが、我々が提供する可能性のある任意の購入契約の特定の条項を、適用される入札説明書の付録により詳細に説明する。任意の調達契約の具体的な条項は、これらの調達契約の発行について第三者と交渉した結果、他の理由で、以下に述べるものと異なる可能性がある。私たちが募集説明書の付録の下で提供する任意の購入契約の条項は、以下に説明する条項とは異なる可能性があるので、この要約が本募集説明書の要約と異なる場合、適用される募集説明書の付録の情報のみに依存しなければなりません。
関連購入契約を売却する前に、本募集説明書に従って提供可能な任意の購入契約の形態を、登録説明書の一部である登録説明書に参照して格納する。私たちは、提供された特定の購入契約に関連する任意の適用可能な目論見補足資料と、これらの購入契約によって制限された証券条項を含む完全なツールとを読むことを促します。いくつかの手形またはこれらの手形の形態は、証拠物として登録説明書に提出されており、本入札説明書は、その一部であり、これらの文書または表の補足部分は、参照によって登録説明書に組み込むことができ、本入札説明書は、米国証券取引委員会に提出された報告からの報告書の一部である。
私たちは、所有者に私たちに購入する義務があることを要求することと、将来の1つまたは複数の日に特定の数量または可変数の私たちの証券を保有者に販売することを含む購入契約を発表するかもしれません。あるいは、購入契約は、私たちが保有者に購入することを要求し、保有者に特定の数量または異なる数量の証券を販売することを要求することができる。
任意の購入契約を提供する場合、一連の購入契約のいくつかの条項は、以下を含むが、以下を含むが、適用される入札説明書の付録に記載される
17
単位説明
私たちは、本明細書に記載された2つ以上の証券からなる任意の組み合わせの単位を発行することができる。例えば、私たちは債務証券と引受権証からなる単位を発行して普通株を購入することができる。以下に、本入札明細書に従って提供可能な単位のいくつかの一般的な条項および規定について説明する。単位に関する特定条項、及び一般条項及び条文は、このように提供される単位の範囲(あればある)に適用可能であり、適用される目論見補編内で説明する。
各ユニットの発行は,そのユニットの所持者もそのユニットに含まれる各証券の所持者とする.したがって、その単位は、含まれるすべての保証された保持者の権利と義務を持つだろう。単位は、単位合意の条項に従って発行され、当該協定は、単位に含まれる証券を、任意の時間または指定された日前の任意の時間に単独で保有または譲渡してはならないと規定することができる。私たちが機関を発行するたびに、私たちはアメリカ証券取引委員会に任意の特定の単位発行に関連する単位プロトコル表と単位証明書のコピーを提出します。これらの書類を読んで、あなたに重要な条項を理解すべきです。単位プロトコルテーブルのコピーと関連単位証明書のより多くの情報をどのように取得するかについては、本募集説明書のタイトル“どこでより多くの情報を見つけることができるか”という部分を参照してください
任意の特定の単位発行に関する目論見補編は、これらの単位の条項を説明し、適用範囲には以下が含まれる
配送計画
私たちは証券を売るかもしれません
また、証券を配当として発行したり、引受権の形で既存の証券所有者に発行したりすることができる。
証券購入の要約を直接求めることもできますし、代理人を指定してこのような要約を求めることもできます。このような発行に関連する募集説明書の付録に、証券法により引受業者と見なすことができる任意の代理の名前を記載し、支払わなければならない任意の手数料を記載する。このような代理人は、その委任期間内に最善を尽くして行動するか、または適用された目論見付録に示された場合に、堅固な約束に基づいて行動するであろう。本株式募集説明書は、上述した任意の方法または適用可能な入札説明書付録に記載された他の方法によって、我々の証券を発売するために使用することができる。
証券の流通は時々1つまたは複数の取引で行われるかもしれない
各株式募集説明書の副刊は証券の流通方法と任意の適用の制限を記述する。
18
特定系列証券の目論見書補編については、証券発行の条項が記載されており、以下を含む
任意の引受業者または代理人が、本募集説明書に関連する証券を売却するために使用される場合、吾等は、証券を売却する際に、それと請負契約または他の合意を締結し、引受業者または代理人の名前または名称、およびそれと達成された関連合意の条項を募集説明書の付録に記載する。
取引業者が目論見書に関連する証券の売却に使用された場合、元本として取引業者にその証券を売却する。そして、取引業者は、これらの証券を異なる価格で公衆に転売することができ、価格は、取引業者が転売時に決定することができる。
もし私たちが引受権の形で既存の証券所有者に証券を提供すれば、取引業者と予備引受契約を締結し、予備引受業者として機能する可能性がある。私たちは予備引受業者が購入を約束した証券のために予備引受業者に承諾料を支払うかもしれない。もし吾らが予備引受手配を締結していなければ、吾らは取引業者マネージャーを吾などのために引受権発売を管理することを保留することができる。
代理店、引受業者、取引業者、その他の人々は、彼らが私たちと締結する可能性のある合意に基づいて、ある民事責任(証券法下の責任を含む)について私たちに賠償する権利があるかもしれない。
適用される目論見書付録にこの説明があれば,吾らは引受業者や吾などの代理人である他の者に何らかの機関の要約を求め,遅延交付契約に基づいて吾等に証券を購入し,遅延交付契約は目論見書付録に記載されている期日支払いと交付を規定する。各契約の金額は、入札説明書の付録に記載された金額以上であり、当該契約に従って販売される証券の総額は、入札説明書の付録に記載された金額よりも少ないか、またはそれ以上であってはならない。許可された契約を締結することができる機関は、商業銀行、貯蓄銀行、保険会社、年金基金、投資会社、教育および慈善機関、および他の機関を含むが、いずれの場合も私たちの承認を得なければならない。遅延納品契約はいかなる条件にも制限されませんが、以下の条件は除外します
引受業者及び他の代理人は、遅延納品契約の効力又は履行に対して何の責任も負わない。
いくつかの代理店、引受業者、および取引業者およびその共同会社は、通常の業務中に、私たちまたはそれぞれの1つまたは複数の連属会社の顧客、私たちと借金関係があり、他の取引に従事し、および/または投資銀行サービスを含むサービスを提供してくれるかもしれません。
有価証券の発行を容易にするために、引受業者は、有価証券または任意の他の有価証券の価格に影響を与える取引を安定的、維持または他の方法で行うことができ、これらの有価証券の価格は、そのような有価証券の支払いを決定するために使用される可能性がある。具体的には、どの引受業者も今回の発行に関連した場合に超過配給し、自分の口座のために空手形を作ることができる。さらに、超過配給または安定化された証券または任意の他の証券の価格を補うために、引受業者は、公開市場でその証券または任意の他の証券を競合購入することができる。最後に、引受業者からなる銀団が証券を発行する際に、引受業者又は取引業者が取引中に以前に発行した証券を買い戻し、シンジケートの空頭寸、安定取引又は他の取引を補充する場合、引受業者又は取引業者が発行中に証券を流通させることを許可する売却特許権を回収することができる。これらの活動のいずれも、証券の市場価格を独立した市場レベルよりも安定または維持することができる。このような引受業者は、これらの活動に従事する必要はなく、いつでもそのような活動を終了することができる。
19
取引法第15 c 6-1条によると、二級市場の取引は、そのような取引の当事者が別途明確な約束をしない限り、2営業日以内に決済することが一般的である。適用される目論見書は付録に規定することができ、あなたの証券の原発行日は、あなたの証券取引日の後の二つの予定営業日以上である可能性がある。したがって、この場合、あなたの証券の元の発行日前の第3営業日前のいずれかの日に証券取引を行うことを希望する場合、あなたの証券は最初にあなたの証券取引日後の3所定の営業日以内に決済される予定であるため、決済できないことを防止するための代替決済スケジュールを要求されることになる。
証券は新たに発行された証券であってもよいし、既定の取引市場がなくてもよい。証券は国家証券取引所に上場してもよいし、国家証券取引所に上場しなくてもよい。私たちはどんな証券の流動性や取引市場の存在も保障できない。
法律事務
ここで提供される証券の有効性はワシントン州シアトル専門会社のWilson Sonsini Goodrich&Rosatiによって伝達されるだろう。他の法的問題は、私たちに渡されるか、または任意の引受業者、取引業者、または代理人に渡される可能性があります。私たちは、適用される募集説明書の付録に指定された弁護士を添付します。Wilson Sonsini Goodrich&Rosati,P.C.のあるメンバーおよびそのメンバーと関係者からなる投資パートナーシップ企業が保有する普通株は1%未満である。
専門家
安永会計士事務所は独立公認会計士事務所であり、2020年12月31日現在の10-K表年次報告書に記載されている財務諸表を監査しており、この報告書は、本募集説明書及び登録説明書の他の部分を引用して記入している。我々の連結財務諸表は、安永会計士事務所が会計·監査専門家の権威ある報告書として引用したものである
そこでもっと多くの情報を見つけることができます
私たちはアメリカ証券取引委員会に年度、四半期と現在の報告、依頼書、その他の情報を提出します。私たちのアメリカ証券取引委員会の届出書類はインターネットを介してアメリカ証券取引委員会のウェブサイトwww.sec.govで調べることができます。私たちがアメリカ証券取引委員会に提出したいくつかの情報のコピーは、http://www.athira.com/である私たちのサイトでも入手できます。私たちのサイトや私たちのサイトで得られる情報は、本募集説明書の一部ではありません。
本募集説明書及び任意の目論見書補編は、米国証券取引委員会に提出された登録説明書の一部であり、登録説明書中のすべての情報は含まれていない。登録声明の情報と証拠品を確認して、私たちと私たちの合併子会社と私たちが提供する証券に関するさらなる情報を理解しなければなりません。発売された証券の条項を確立する任意の契約書または他の書類の表は、証拠品として登録説明書に提出され、本募集説明書は、登録説明書の一部であるか、または表8−Kの現行報告の表紙の下に提出され、引用的に本募集説明書に組み込まれる。本募集説明書または任意の目論見書付録における当該などの文書に関する陳述はすべて要約であり、各陳述は各方面でその指摘された文書によって制限される。あなたは関連事項のより完全な説明を得るために実際の文書を読まなければならない。
引用で法団として成立する
アメリカ証券取引委員会は、私たちが米国証券取引委員会に提出した多くの情報を参照によって組み込むことを可能にしており、これは、公開された入手可能な文書を推薦することによって、重要な情報を開示することができることを意味します。私たちが本募集説明書で引用した情報は、本募集説明書の一部とみなされる。私たちは、参照によって将来の文書を米国証券取引委員会に組み込んでいるので、本入札説明書は、参照によって含まれるまたは組み込まれた情報の一部を修正または置換する可能性がある将来の文書を更新し続けるであろう。これは、本契約書または以前に参照によって組み込まれた任意の文書中の任意の陳述が修正または置換されたかどうかを決定するために、私たちが参照によって組み込まれたすべての米国証券取引委員会が文書を記録したことを確認しなければならないことを意味する。本募集説明書は、以下に掲げる書類を参照し、取引法第13(A)、13(C)、14又は15(D)条に従って米国証券取引委員会に提出された任意の将来の届出文書(各場合、8−K表のいずれかに基づいて現在報告第2.02又は7.01項に提供されている文書又は文書の一部を除き、この表に提出されたこのような情報に関連する証拠物を除く)は、コスト募集説明書下の証券要約を終了又は完了するまでを参照する
20
手紙を書くか、以下の住所に電話することで、これらのファイルのコピーを無料で請求することができます
ATHIRA製薬会社
北渓公園大通り18706号、スイートルーム104
ボゼルワシントン州98011
注意:投資家関係
(425) 620-8501
21

Up to $75,000,000
普通株
目論見書副刊
|
|
2023年1月6日