| 非アルコール性脂肪肝患者に対して24週間(12週間延長)のペビドアミン試験br}アルコール性脂肪性肝疾患 ナスダック:ALT ステファン·ハリソン医学博士、首席研究員br}2022年12月20日 |
| 前向き宣言 - 前向き宣言 安全 - 港 この プレゼンテーション は Altimmune, Inc が用意されています (“私たち、” “私たち、” “私たち、“ ”Altimmune“ または ”会社“) と は 1995年の プライベート 証券 訴訟 改革 法案 内のある を含む 展望 - 展望 宣言” 意味 , は 未来 財務 または業務 業績, 条件, 計画, 見通し, 傾向, または 戦略 と その他の 財務 と 業務 事項に関する 報告書を含み, は 制限のない を含む 我々の 臨床 資産の キー マイルストーン の 計時 データ データ 読み取り NAFLD 試験の 段階 2肥満 臨床 試験 試験 と 潜在的顧客 規制部門 承認, 商業化 または 販売 任意の 製品 または 候補薬物 を添加し、 のとき または が 本ニュース原稿 ニュース原稿を使用すれば、 字 “が可能であり、” が可能であり、“ ”はず、“ ”期待、“ ”信じ、“ ”推定、“ ”期待、“ ”予定、“ ”計画、“ ”予測“ と に類似した 式 と それらの 変異体、 彼ら は と 社 を 前向き - 展望性 展望性 陳述 を識別するからです 会社 は これらの 前向き - 前向き 陳述 は 多くの 仮説, リスク, と 不確実性の影響を受けます, どの が 時間 を変更したか 重要な 要素 は 実際の 結果 と が大きく異なる が で議論された 結果 前向き 陳述 あるいは 歴史 経験 に リスク と 不確実性を含む可能性がある は に関する リスクを含む: 潜在的な 影響 ウクライナで行われている 衝突 と COVID - 19大流行, 規制審査中の 遅延 , 製造 とサプライチェーン 中断, アクセス 臨床 サイト, 登録, が ヘルスケア システム および グローバル 経済 に与える悪影響 ; 肝臓 脂肪 含有量 と 人口統計データ が 段階 1 b NAFLD 研究 未来 試験 成功 の影響を研究する 研究の 結果 の信頼性 は と人間 の安全 と の可能な悪影響 による 結果 社の製品 製品 候補製品 ; 社 は 予想時間内に 臨床試験 材料 を生産する能力 ; と 未来 製品 進歩の 成功 未来 臨床試験 試験の 成功 を含む 要因 と リスクに関する さらなる情報 は 会社の業務の に影響を与える可能性がある 財務条件 と 運営の結果 は 会社が U に提出した ファイルに 証券 と取引所 手数料に含まれる, を 社の 年次報告 表 10- K 中の タイトル “リスク 要因” の下に まで 年12月31日まで 2021と 我々の その他 アメリカ証券取引委員会の 届出書類を含み, どの が www . アメリカ証券取引委員会 . gov に に がある |
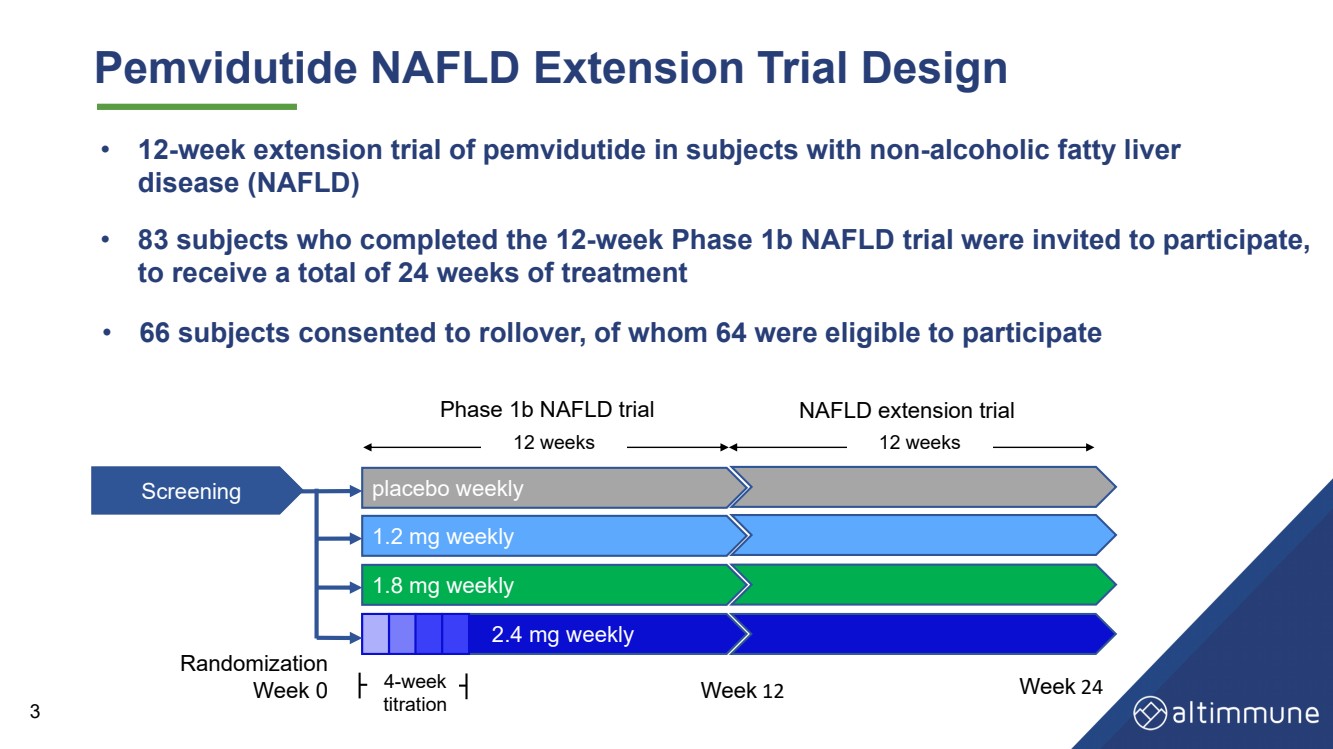
| Pemviduide NAFLD延長試験設計 · 83名12週1 b期NAFLD試験を完了した被験者が参加し、br}は24週間の非アルコール性脂肪肝(NAFLD)患者の24週間の培美度徳延長試験 · 12− 被験者 疾患(NAFLD) 3· 66名の被験者が転期に同意し、その中の64人はスクリーニング プラセボ毎週 1.8 mg週 2.4 mg毎週 1.2 mg毎週 4- 週 滴定 ランダム化 週0期1 b NAFLD試験 NAFLD延長試験 12週 24に参加する資格がある |
| 研究者群 − の肝心な資格基準 被験者は12週間の1 b期非アルコール性脂肪肝試験で投与量を完成する必要があり、保護者試験に入る時に以下の基準を満たした: · 男性と女性、年齢18-65歳 · 体重指数28 kg/m 2· 非アルコール性脂肪肝、磁気共鳴検査により肝臓脂肪含有量(LFC) − 10% · は明らかな線維化がなく、繊維硬化 LSMと定義された |
| 研究終点 有効性 · 主要終点: · 0週と比較して、24週MRI − PDFFが肝臓脂肪含有量(LFC)· 肝心な副次的終点: · 血清アラニンアミノトランスフェラーゼ(ALT)レベルと補正T 1(CT 1)イメージングの肝臓炎症を24週で0週に比べて 体重減少率(%)0週に比べて安全 · 不良事象(AES) · 重篤な副作用 · による薬中止の副作用 · 胃腸耐性 · バイタルサイン · 血糖コントロール(空腹血糖、HbA 1 c) 5 |
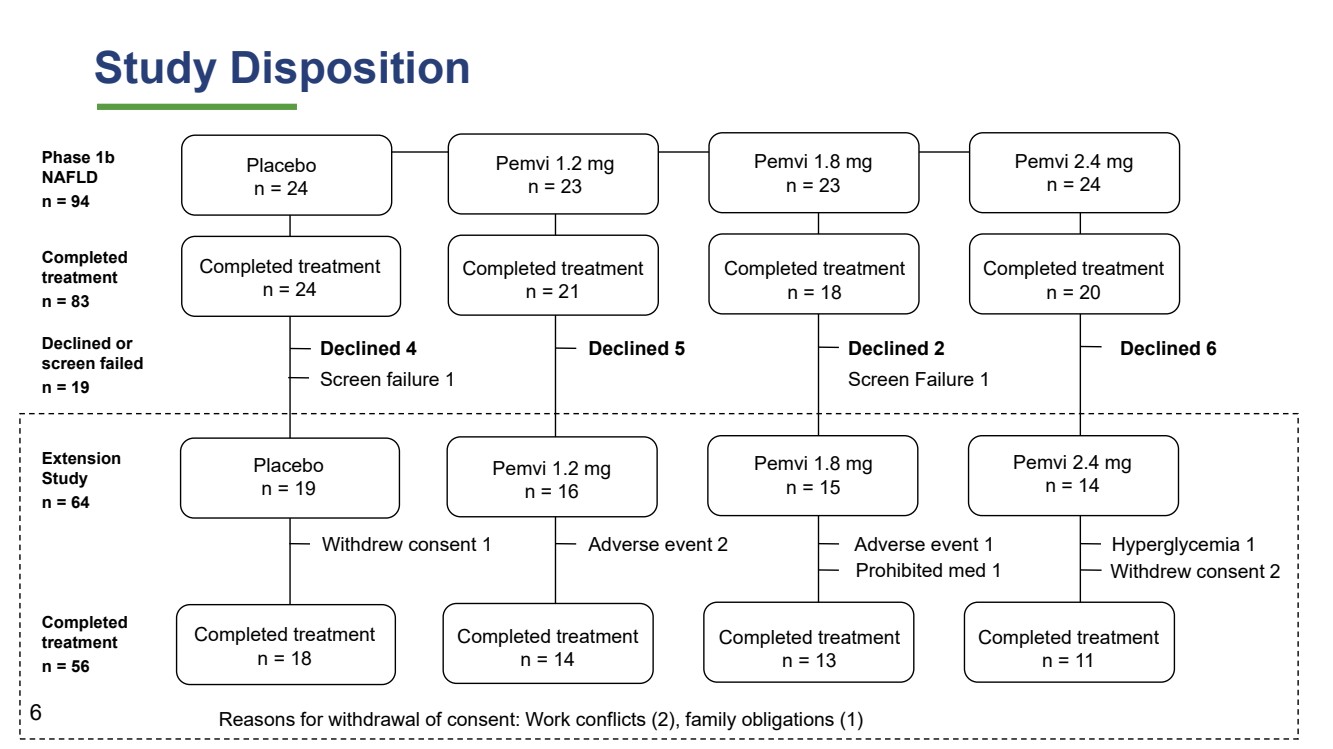
| 検討処置 プラセボ n=24個のPemvi 1.2 mg n=23個のPemvi 1.8 mg n=23個のPemvi 2.4 mg n=24個の完了治療 n=24個の完了治療 n=21個の完了治療 n=20個の完了治療 n=18個のPemvi 1.2 mg n=19個のPemvi 1.2 mg n=16個のPemvi 2.4 mg n=14個のPe m 1.8 mg n=15個の治療拒否6完了治療 n=18治療完了 n=14治療完了 n=11治療完了 n=13同意1有害事象の撤回2有害事象1同意撤回2段階1 b NAFLD n=94延期 研究 n=64 6禁薬1高血糖1低下4スクリーニング失敗1低下2スクリーニング失敗1承認撤回の原因:仕事衝突(2),家庭義務(1) は完了しました 治療 n=83 治療を完了しました n=56拒否されましたまたは スクリーニングが n=19に合格しませんでした |
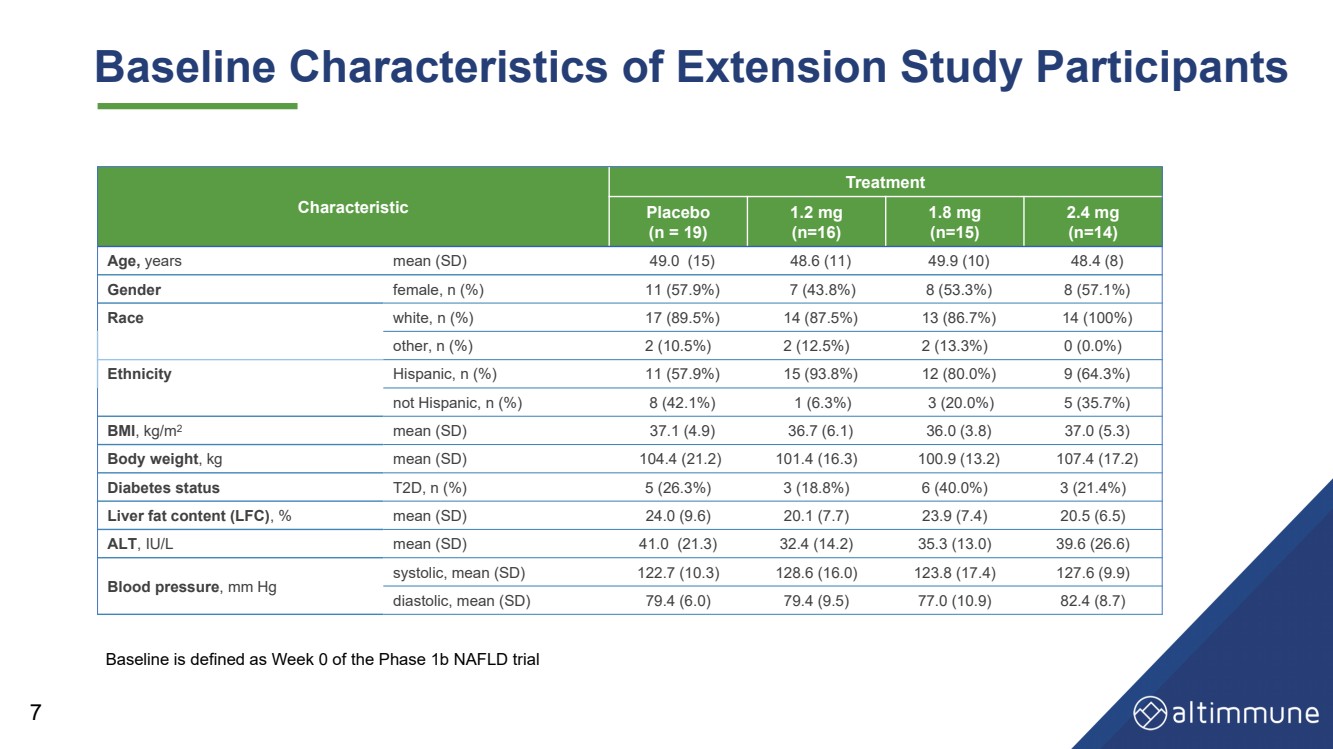
| Baseline Characteristics of Extension Study Participants Characteristic Treatment Placebo (n = 19) 1.2 mg (n=16) 1.8 mg (n=15) 2.4 mg (n=14) Age, years mean (SD) 49.0 (15) 48.6 (11) 49.9 (10) 48.4 (8) Gender female, n (%) 11 (57.9%) 7 (43.8%) 8 (53.3%) 8 (57.1%) Race white, n (%) 17 (89.5%) 14 (87.5%) 13 (86.7%) 14 (100%) other, n (%) 2 (10.5%) 2 (12.5%) 2 (13.3%) 0 (0.0%) Ethnicity Hispanic, n (%) 11 (57.9%) 15 (93.8%) 12 (80.0%) 9 (64.3%) not Hispanic, n (%) 8 (42.1%) 1 (6.3%) 3 (20.0%) 5 (35.7%) BMI , kg/m 2 mean (SD) 37.1 (4.9) 36.7 (6.1) 36.0 (3.8) 37.0 (5.3) Body weight , kg mean (SD) 104.4 (21.2) 101.4 (16.3) 100.9 (13.2) 107.4 (17.2) Diabetes status T2D, n (%) 5 (26.3%) 3 (18.8%) 6 (40.0%) 3 (21.4%) Liver fat content (LFC) , % mean (SD) 24.0 (9.6) 20.1 (7.7) 23.9 (7.4) 20.5 (6.5) ALT , IU/L mean (SD) 41.0 (21.3) 32.4 (14.2) 35.3 (13.0) 39.6 (26.6) Blood pressure , mm Hg systolic, mean (SD) 122.7 (10.3) 128.6 (16.0) 123.8 (17.4) 127.6 (9.9) diastolic, mean (SD) 79.4 (6.0) 79.4 (9.5) 77.0 (10.9) 82.4 (8.7) 7 Baseline is defined as Week 0 of the Phase 1b NAFLD trial |
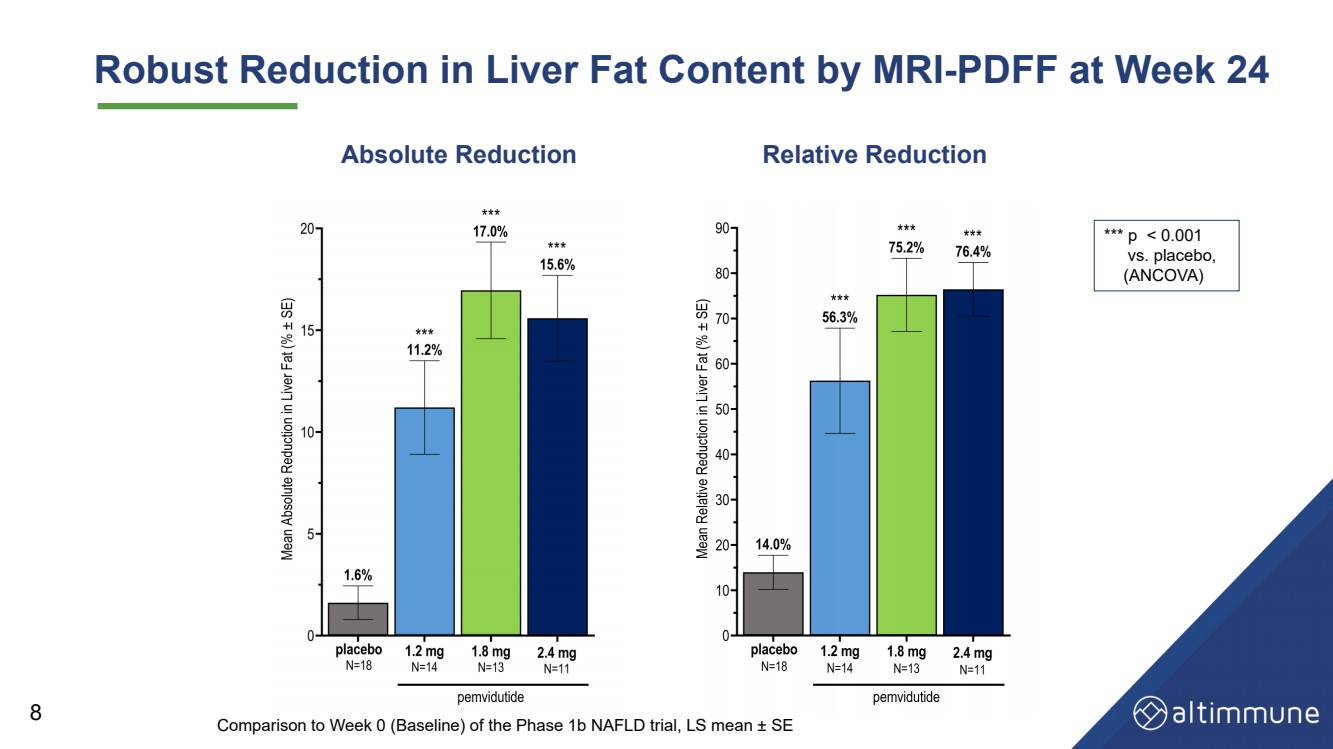
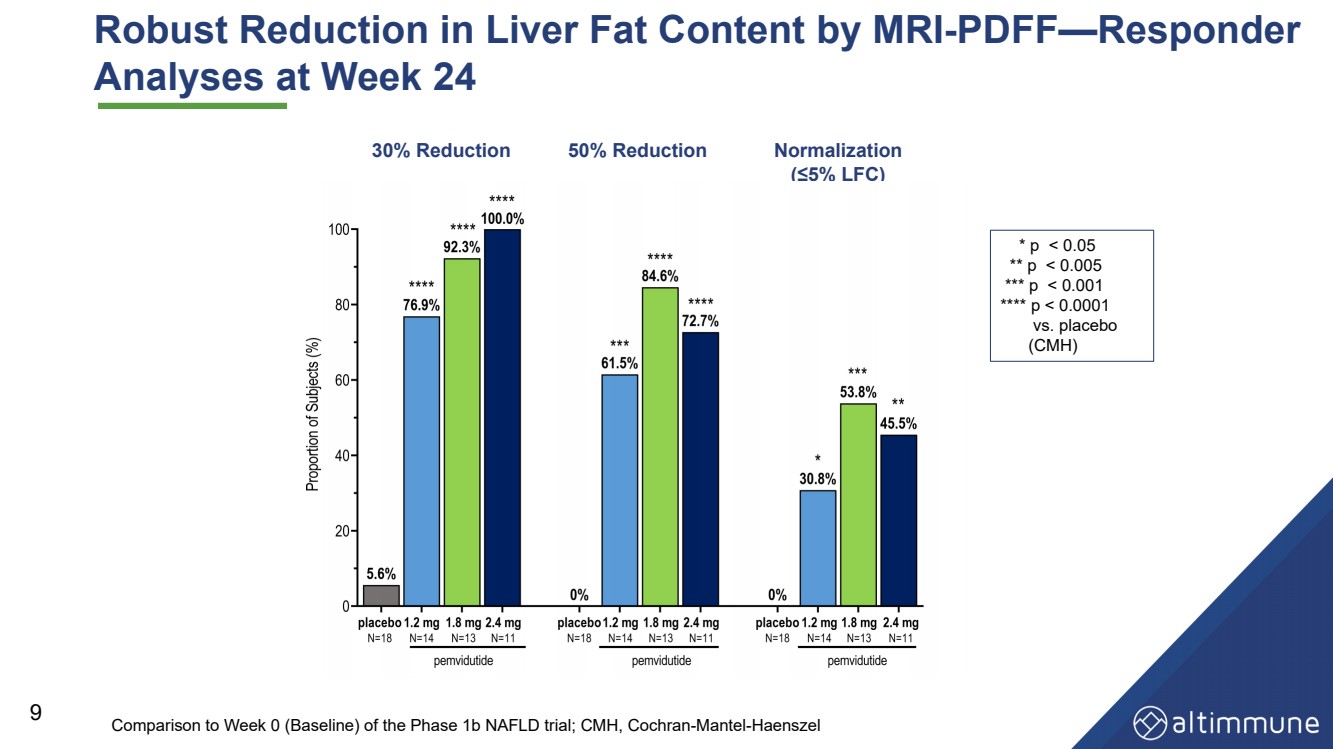
| 24週時のMRI検査では、肝臓脂肪含量の有意な低下 - PDFF 8絶対値減少 相対値減少 *p を示した |
| 9 1 b期非アルコール性脂肪肝試験の0週目(ベースライン)と比較して、24週目の核磁気共鳴検査では肝臓脂肪含有量が有意に低下した − pdff − 応答者 は0週目(ベースライン)と比較した;コクレン大学のcmh − mantel − Haenszel は30%減少 は50%減少 正常化 −(5%LFC) *p |
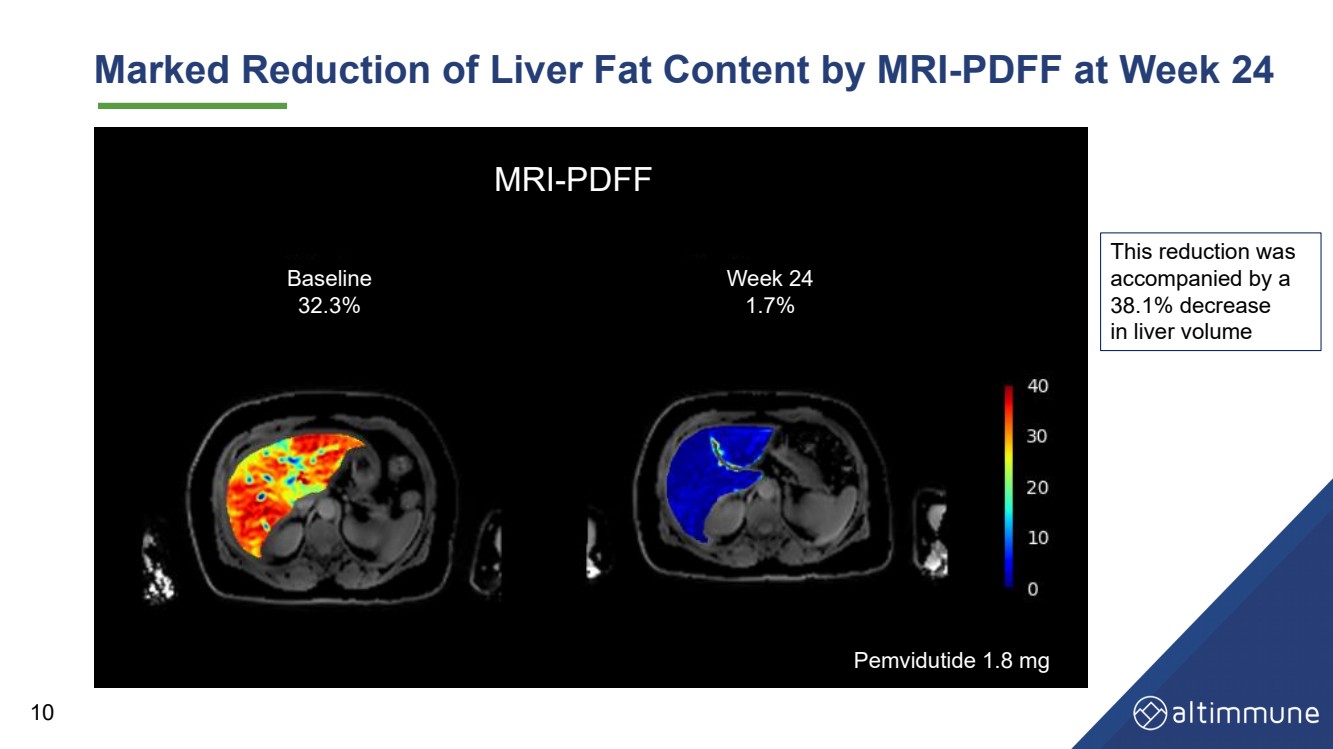
| 10核磁気共鳴検査により、肝臓脂肪含有量は24週間で有意に減少した - pemvidutie 1.8 mg 核磁気共鳴検査 - pdff ベースライン 32.3% 24週1.7% この減少は肝臓体積の減少に伴い38.1% の減少を示した |
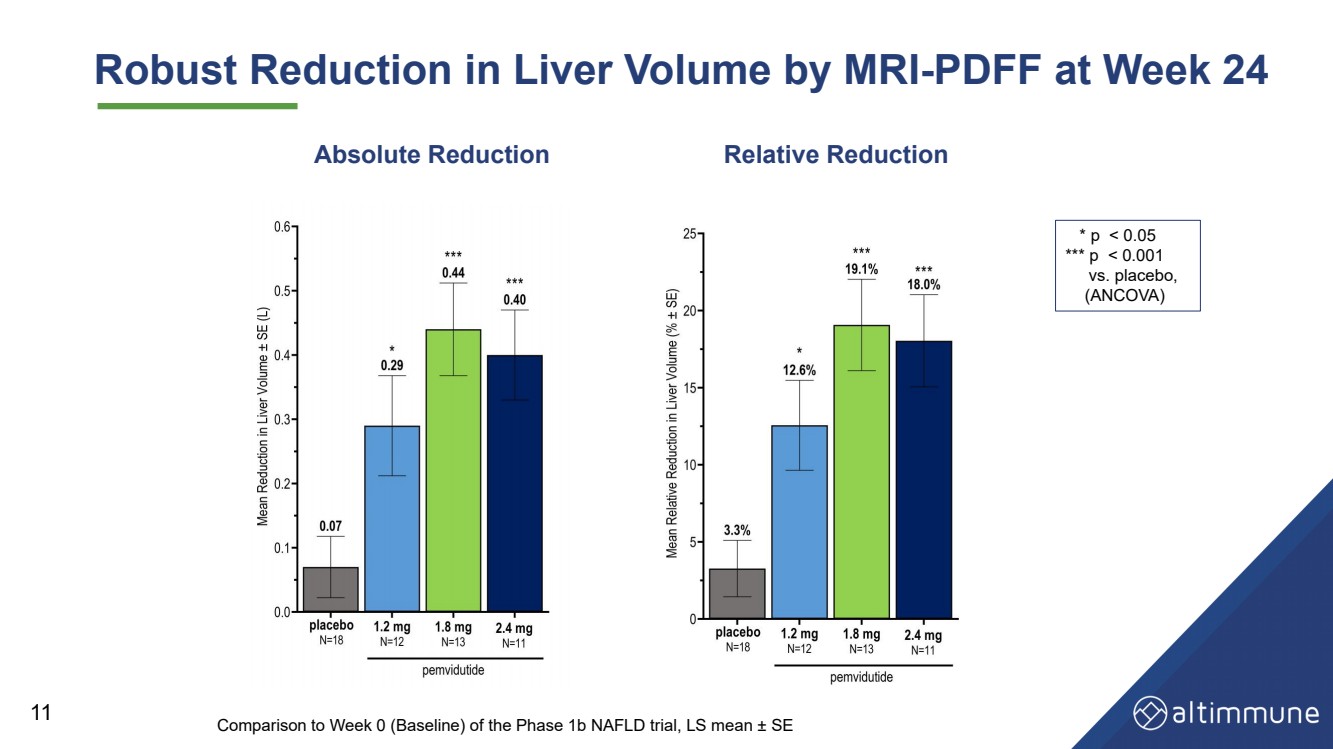
| 24週時MRIにより肝臓体積は明らかに縮小 - PDFF 11*pを示した |
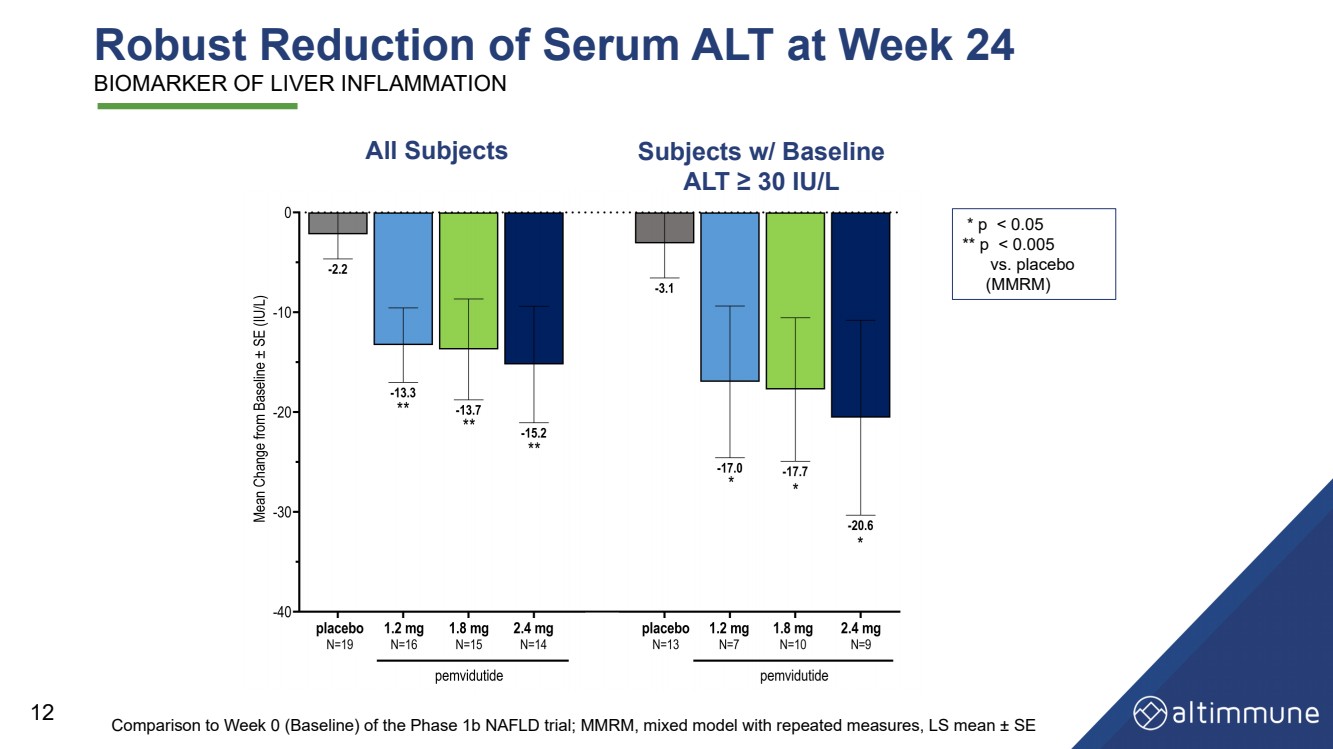
| 1 b期非アルコール性脂肪肝試験の0週目(ベースライン)と比較して、24週目の血清ALTは ALT が0週目(ベースライン)と比較した;MMRMは繰り返し測定した混合モデルであり、LS平均値 ± SE 全被験者 被験者 ALT 30 IU/L *p |
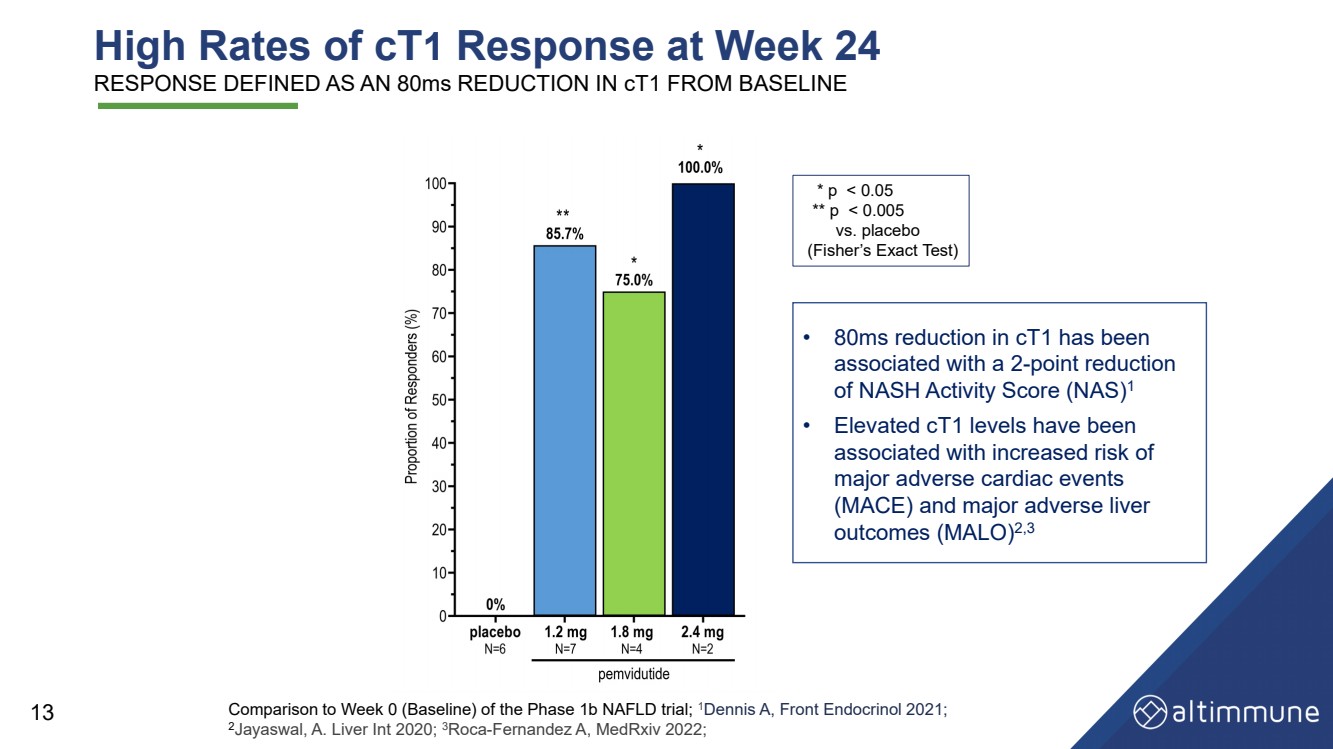
| 24週の高ct 1応答 は、1 b期NAFLD試験の0週目(ベースライン)と比較して、 c t 1がベースラインより80 ms 13減少し、 1 Dennis A,Front Endocrinol 2021; 2 Jayaswal,A.liver Int 2020; 3 Roca - Fernandez A,MedRxiv 2022; *pと定義されている |
| 14 ** p |
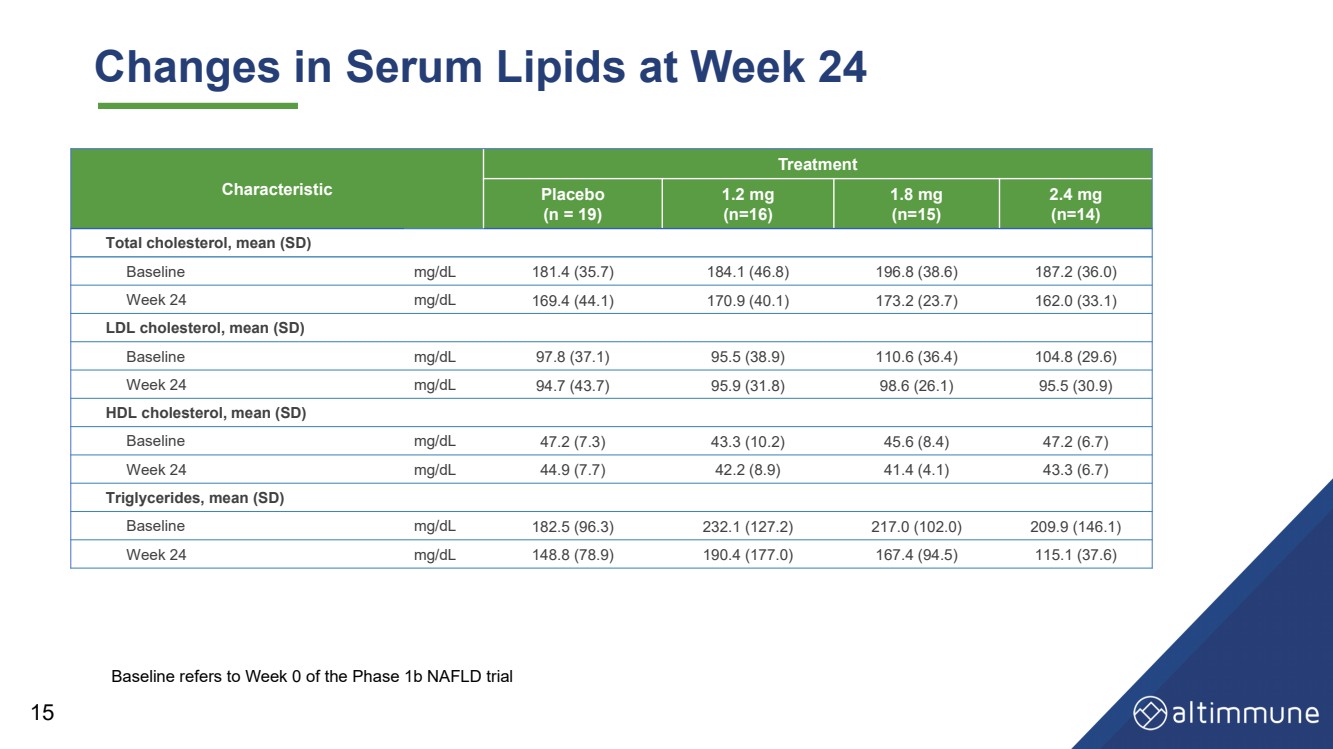
| 15 Changes in Serum Lipids at Week 24 Characteristic Treatment Placebo (n = 19) 1.2 mg (n=16) 1.8 mg (n=15) 2.4 mg (n=14) Total cholesterol, mean (SD) Baseline mg/dL 181.4 (35.7) 184.1 (46.8) 196.8 (38.6) 187.2 (36.0) Week 24 mg/dL 169.4 (44.1) 170.9 (40.1) 173.2 (23.7) 162.0 (33.1) LDL cholesterol, mean (SD) Baseline mg/dL 97.8 (37.1) 95.5 (38.9) 110.6 (36.4) 104.8 (29.6) Week 24 mg/dL 94.7 (43.7) 95.9 (31.8) 98.6 (26.1) 95.5 (30.9) HDL cholesterol, mean (SD) Baseline mg/dL 47.2 (7.3) 43.3 (10.2) 45.6 (8.4) 47.2 (6.7) Week 24 mg/dL 44.9 (7.7) 42.2 (8.9) 41.4 (4.1) 43.3 (6.7) Triglycerides, mean (SD) Baseline mg/dL 182.5 (96.3) 232.1 (127.2) 217.0 (102.0) 209.9 (146.1) Week 24 mg/dL 148.8 (78.9) 190.4 (177.0) 167.4 (94.5) 115.1 (37.6) Baseline refers to Week 0 of the Phase 1b NAFLD trial |
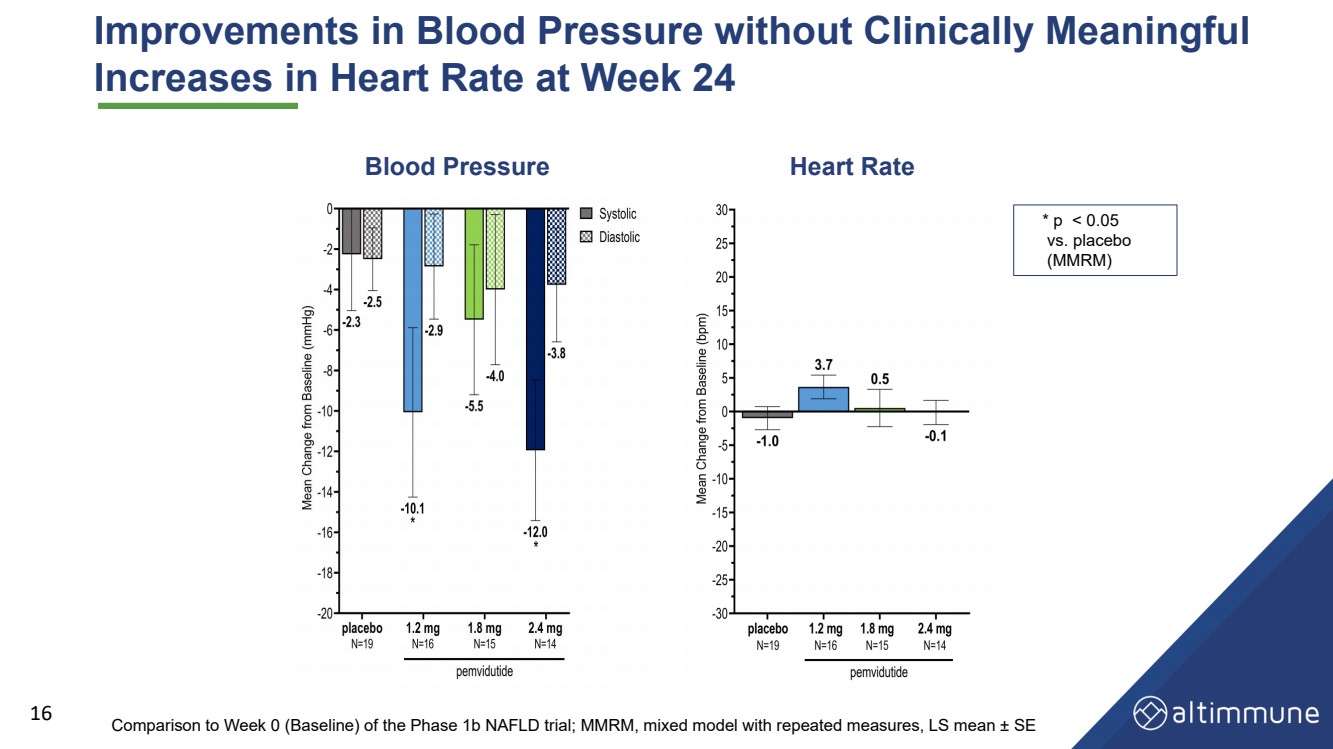
| 血圧が改善し臨床的意義がない 24週目に心拍数が16心拍数 血圧 が1 b期NAFLD試験の0週目(ベースライン)と比較した;MMRM,繰り返し測定した混合モデル,LS平均値 ± SE *p |
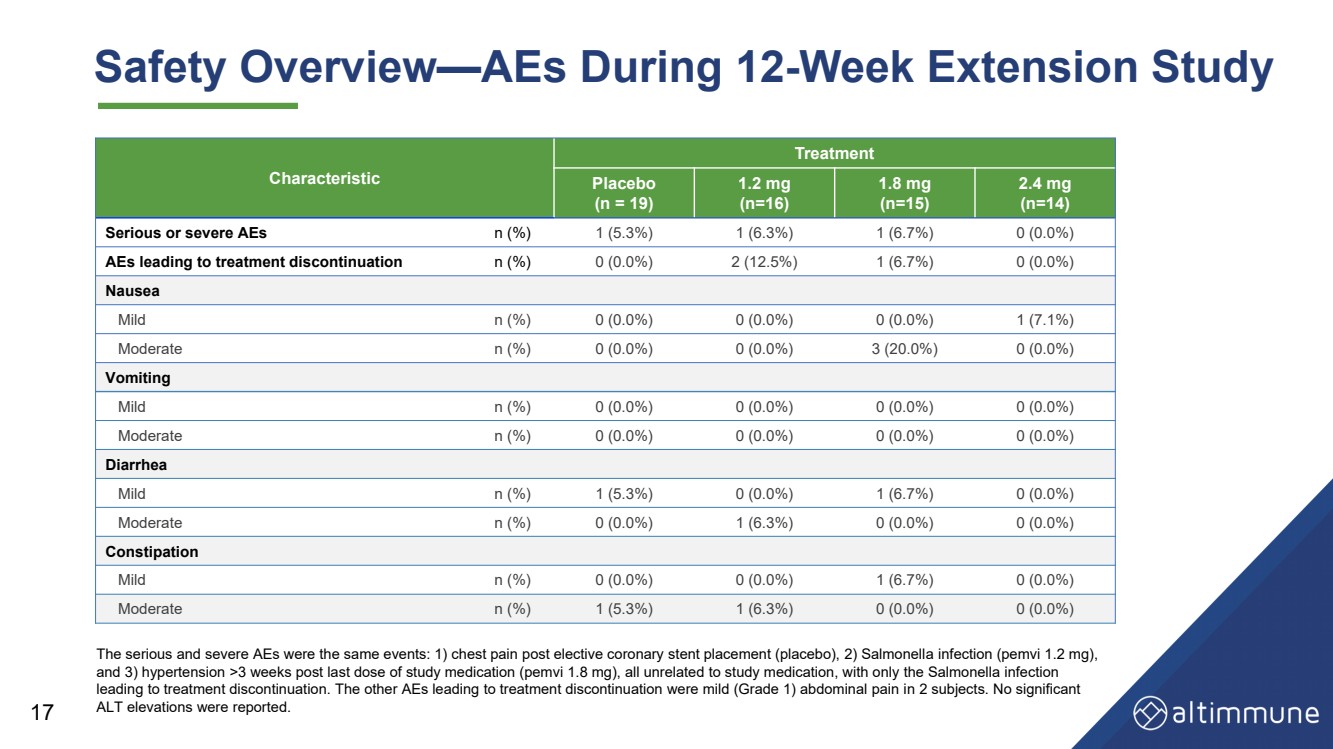
| Characteristic Treatment Placebo (n = 19) 1.2 mg (n=16) 1.8 mg (n=15) 2.4 mg (n=14) Serious or severe AEs n (%) 1 (5.3%) 1 (6.3%) 1 (6.7%) 0 (0.0%) AEs leading to treatment discontinuation n (%) 0 (0.0%) 2 (12.5%) 1 (6.7%) 0 (0.0%) Nausea Mild n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (7.1%) Moderate n (%) 0 (0.0%) 0 (0.0%) 3 (20.0%) 0 (0.0%) Vomiting Mild n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) Moderate n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) Diarrhea Mild n (%) 1 (5.3%) 0 (0.0%) 1 (6.7%) 0 (0.0%) Moderate n (%) 0 (0.0%) 1 (6.3%) 0 (0.0%) 0 (0.0%) Constipation Mild n (%) 0 (0.0%) 0 (0.0%) 1 (6.7%) 0 (0.0%) Moderate n (%) 1 (5.3%) 1 (6.3%) 0 (0.0%) 0 (0.0%) 17 Safety Overview — AEs During 12 - Week Extension Study The serious and severe AEs were the same events: 1) chest pain post elective coronary stent placement (placebo), 2) Salmonell a i nfection (pemvi 1.2 mg), and 3) hypertension >3 weeks post last dose of study medication (pemvi 1.8 mg), all unrelated to study medication, with only the Salmonella infection leading to treatment discontinuation. The other AEs leading to treatment discontinuation were mild (Grade 1) abdominal pain i n 2 subjects. No significant ALT elevations were reported. |
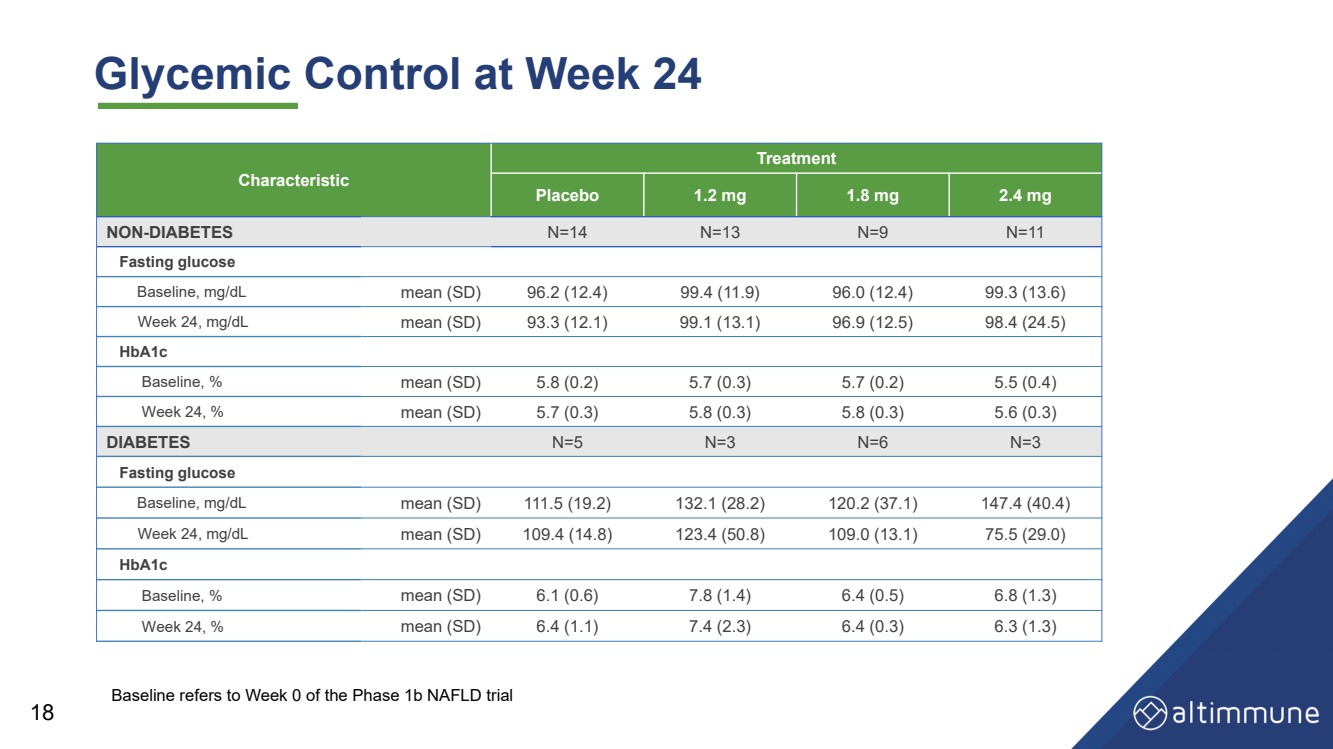
| Glycemic Control at Week 24 18 Characteristic Treatment Placebo 1.2 mg 1.8 mg 2.4 mg NON - DIABETES N=14 N=13 N=9 N=11 Fasting glucose Baseline, mg/dL mean (SD) 96.2 (12.4) 99.4 (11.9) 96.0 (12.4) 99.3 (13.6) Week 24, mg/dL mean (SD) 93.3 (12.1) 99.1 (13.1) 96.9 (12.5) 98.4 (24.5) HbA1c Baseline, % mean (SD) 5.8 (0.2) 5.7 (0.3) 5.7 (0.2) 5.5 (0.4) Week 24, % mean (SD) 5.7 (0.3) 5.8 (0.3) 5.8 (0.3) 5.6 (0.3) DIABETES N=5 N=3 N=6 N=3 Fasting glucose Baseline, mg/dL mean (SD) 111.5 (19.2) 132.1 (28.2) 120.2 (37.1) 147.4 (40.4) Week 24, mg/dL mean (SD) 109.4 (14.8) 123.4 (50.8) 109.0 (13.1) 75.5 (29.0) HbA1c Baseline, % mean (SD) 6.1 (0.6) 7.8 (1.4) 6.4 (0.5) 6.8 (1.3) Week 24, % mean (SD) 6.4 (1.1) 7.4 (2.3) 6.4 (0.3) 6.3 (1.3) Baseline refers to Week 0 of the Phase 1b NAFLD trial |
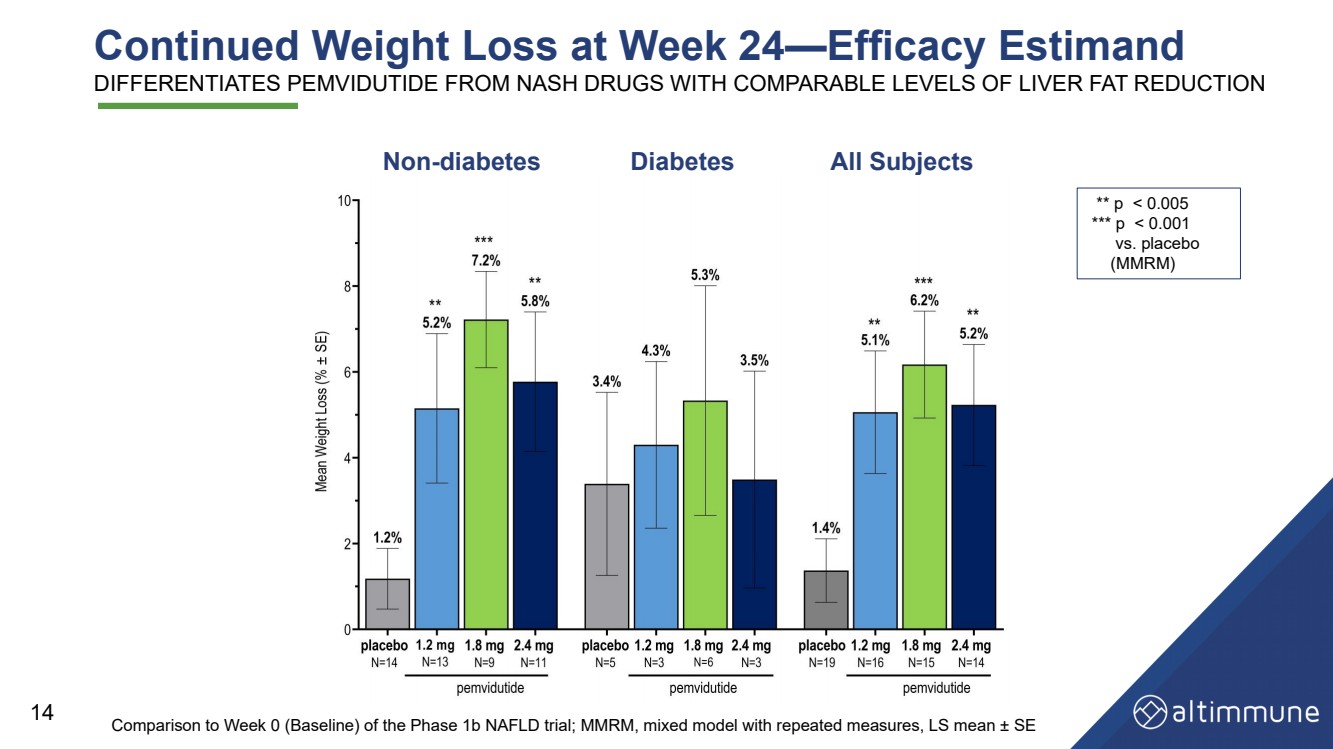
| Summary and Conclusions • Greater than 75% relative liver fat reduction at 24 weeks, better than or equal to the effects of other leading NASH candidates • Significant reductions and normalization in serum ALT and improvement in cT1 point to potent effects in NASH clinical trials • Non - diabetes — continued weight loss, achieving 7.2% at pemvidutide 1.8 mg at Week 24 • Diabetes — achieved 5.3% weight loss at pemvidutide 1.8 mg at Week 24 Liver fat reduction Weight loss • Low rates of AEs leading to treatment discontinuation, no serious/severe AEs related to pemvidutide • Cardioprotective reductions in blood pressure without increases in heart rate • Glycemic control maintained with trends toward improvements in fasting glucose and HbA1c in subjects with diabetes • No clinically significant ALT elevations Safety and tolerability 19 |
| NASDAQ: ALT Questions pertaining to this presentation: Rich Eisenstadt, CFO reisenstadt@altimmune.com |