カタログ表
私たちの候補製品は交付と製造、臨床前研究と早期臨床試験を含む。私たちは候補製品の販売が許可されていないし、製品販売から何の収入も生じていません。私たちは現在すべての候補製品が発見と臨床前開発段階にあります
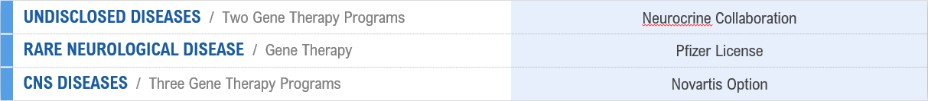
私たちは主に、私たちの以前のセノフィGenzyme Corporationとの協力、またはセノフィGenzymeとの協力(2015年2月から開始し、2019年6月に終了)を含む、償還可能な転換可能な優先株の私募、私たちの普通株の公開、および私たちの戦略協力に関する費用、マイルストーン支払い、コスト補償によって、私たちは以前Abbie Biotech Ltd.との協力(タウ関連疾患に集中)、またはAbbVie Tau協力(2018年2月から開始し、2020年8月に終了)、私たちは以前AbbVieアイルランド無限会社との協力、α-シヌクレインの病理種、またはAbbie-AlAlAlAlAlAlpha協力核タンパク質、α-シナプスタンパク質の病理種、またはAbbie-AlAlAlAlAlAlpha協力に焦点を当てた。Neurocrineとの私たちの協力は2019年2月に始まり、2020年8月に終了し、Neurocrineとの持続的な協力は2019年3月に始まり、私たちとファイザーとのオプションと許可協定は2021年10月に始まり、私たちとノワールとのオプションと許可協定は2022年3月に始まった。私たちはNeurocrineとの協力協定をNeurocrine協力協定と呼ぶ。我々とファイザーの選択権と許可プロトコルをグロープロトコル,我々とノワールのオプションと許可プロトコルをノワールプロトコルと呼ぶ.
私たちはまだ私たちの他の計画を推進し、発見と臨床前開発段階で他の候補製品を求めて、ハンチントン病を治療する第二世代計画、脊髄性筋萎縮症(SMA)を治療する計画、そしてヒト表皮増殖因子受容体陽性(HER 2+)脳転移を治療する計画を含む。我々は,パートナー関係を通じてこのようにする機会を評価しており,われわれの第二世代ハンチントン病治療計画とわれわれのHER 2+脳転移治療計画の臨床前研究を継続していく。SMA治療の第二世代計画の早期臨床前研究を継続する予定であり,この計画のためのパートナーを探している。
私たちはNeurocrineと協力してFriedreich運動失調を含む疾患の治療を続けた。私たちは現在すべての候補製品が開発の初期段階にある。我々はまた,AAV遺伝子療法や我々固有抗体を用いて治療可能な他の疾患を評価し,我々固有のトレーサーシェルを利用することができる他の可能な治療法を積極的に探索し続けている。
著者らの優先遺伝子治療と他の生物治療計画はすべて臨床前開発段階にあり、以下に総括を行う

*早期研究計画は、転移性乳癌脳転移に対するvHER 2ベクトル化抗体およびハンチントン病に対するHTT遺伝子治療を含む。
*第1段階の終了後、Voyagerは、米国における共同開発/共同商業化FA計画、コスト/利益の40%をVoyager、60%をNeurocrineに割り当てるか、またはNeurocrineのグローバル商業権を付与することを選択することができる。
31