sgmo-20220930誤り2022Q30001001233--12-310030,00000010012332022-01-012022-09-3000010012332022-10-31Xbrli:共有00010012332022-09-30ISO 4217:ドル00010012332021-12-3100010012332022-07-012022-09-3000010012332021-07-012021-09-3000010012332021-01-012021-09-30ISO 4217:ドルXbrli:共有0001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2022-06-300001001233US-GAAP:AdditionalPaidInCapitalMembers2022-06-300001001233アメリカ-公認会計基準:前払いメンバーを保留2022-06-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2022-06-3000010012332022-06-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2022-07-012022-09-300001001233US-GAAP:AdditionalPaidInCapitalMembers2022-07-012022-09-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2022-07-012022-09-300001001233アメリカ-公認会計基準:前払いメンバーを保留2022-07-012022-09-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2022-09-300001001233US-GAAP:AdditionalPaidInCapitalMembers2022-09-300001001233アメリカ-公認会計基準:前払いメンバーを保留2022-09-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2022-09-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2021-12-310001001233US-GAAP:AdditionalPaidInCapitalMembers2021-12-310001001233アメリカ-公認会計基準:前払いメンバーを保留2021-12-310001001233アメリカ公認会計原則:他の総合収入メンバーを累計2021-12-310001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2022-01-012022-09-300001001233US-GAAP:AdditionalPaidInCapitalMembers2022-01-012022-09-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2022-01-012022-09-300001001233アメリカ-公認会計基準:前払いメンバーを保留2022-01-012022-09-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2021-06-300001001233US-GAAP:AdditionalPaidInCapitalMembers2021-06-300001001233アメリカ-公認会計基準:前払いメンバーを保留2021-06-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2021-06-300001001233アメリカ公認会計基準:非制御的利益メンバー2021-06-3000010012332021-06-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2021-07-012021-09-300001001233US-GAAP:AdditionalPaidInCapitalMembers2021-07-012021-09-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2021-07-012021-09-300001001233アメリカ-公認会計基準:前払いメンバーを保留2021-07-012021-09-300001001233アメリカ公認会計基準:非制御的利益メンバー2021-07-012021-09-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2021-09-300001001233US-GAAP:AdditionalPaidInCapitalMembers2021-09-300001001233アメリカ-公認会計基準:前払いメンバーを保留2021-09-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2021-09-300001001233アメリカ公認会計基準:非制御的利益メンバー2021-09-3000010012332021-09-300001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2020-12-310001001233US-GAAP:AdditionalPaidInCapitalMembers2020-12-310001001233アメリカ-公認会計基準:前払いメンバーを保留2020-12-310001001233アメリカ公認会計原則:他の総合収入メンバーを累計2020-12-310001001233アメリカ公認会計基準:非制御的利益メンバー2020-12-3100010012332020-12-310001001233アメリカ-アメリカ公認会計基準:普通株式メンバー2021-01-012021-09-300001001233US-GAAP:AdditionalPaidInCapitalMembers2021-01-012021-09-300001001233アメリカ公認会計基準:非制御的利益メンバー2021-01-012021-09-300001001233アメリカ公認会計原則:他の総合収入メンバーを累計2021-01-012021-09-300001001233アメリカ-公認会計基準:前払いメンバーを保留2021-01-012021-09-300001001233SGMO:AtTheMarketOfferingMembers2022-01-012022-09-300001001233SGMO:AtTheMarketOfferingMembers2021-01-012021-09-300001001233アメリカ公認会計基準:従業員ストックメンバー2022-01-012022-09-300001001233アメリカ公認会計基準:従業員ストックメンバー2021-01-012021-09-300001001233SGMO:SanofiembersメンバーSGMO:ChangeInCollaborationAgreementスコープメンバアメリカ-公認会計基準:連携性手配メンバー2021-07-012021-09-300001001233SGMO:SanofiembersメンバーSGMO:ChangeInCollaborationAgreementスコープメンバアメリカ-公認会計基準:連携性手配メンバー2021-01-012021-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバSGMO:ノワール生物医学研究所IncMember米国-GAAP:顧客と契約した収入2022-07-012022-09-30Xbrli:純0001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバSGMO:ノワール生物医学研究所IncMember米国-GAAP:顧客と契約した収入2021-07-012021-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバSGMO:ノワール生物医学研究所IncMember米国-GAAP:顧客と契約した収入2022-01-012022-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバSGMO:ノワール生物医学研究所IncMember米国-GAAP:顧客と契約した収入2021-01-012021-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入SGMO:BigenMAIncMembers2022-07-012022-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入SGMO:BigenMAIncMembers2021-07-012021-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入SGMO:BigenMAIncMembers2022-01-012022-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入SGMO:BigenMAIncMembers2021-01-012021-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ国家薬品監督管理局:KtePharmaIncMember米国-GAAP:顧客と契約した収入2022-07-012022-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ国家薬品監督管理局:KtePharmaIncMember米国-GAAP:顧客と契約した収入2021-07-012021-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ国家薬品監督管理局:KtePharmaIncMember米国-GAAP:顧客と契約した収入2022-01-012022-09-300001001233SGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ国家薬品監督管理局:KtePharmaIncMember米国-GAAP:顧客と契約した収入2021-01-012021-09-300001001233SGMO:SanofiembersメンバーSGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入2022-07-012022-09-300001001233SGMO:SanofiembersメンバーSGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入2021-07-012021-09-300001001233SGMO:SanofiembersメンバーSGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入2022-01-012022-09-300001001233SGMO:SanofiembersメンバーSGMO:協調プロトコルからの収入付与と許可集中度リスクメンバ米国-GAAP:顧客と契約した収入2021-01-012021-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバー2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-GAAP:ビジネス紙のメンバー2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-GAAP:ビジネス紙のメンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-GAAP:ビジネス紙のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー米国-GAAP:ビジネス紙のメンバー2022-09-300001001233アメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバー2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:資産認可証券メンバー2022-09-300001001233アメリカ-公認会計基準:アメリカ証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:アメリカ証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-公認会計基準:アメリカ証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ-公認会計基準:アメリカ証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-09-300001001233アメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定する2022-09-300001001233アメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2022-09-300001001233アメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2022-09-300001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバーアメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバー2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバーアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-GAAP:ビジネス紙のメンバー2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-GAAP:ビジネス紙のメンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-GAAP:ビジネス紙のメンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー米国-GAAP:ビジネス紙のメンバー2021-12-310001001233アメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310001001233アメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001001233アメリカ-公認会計基準:会社債務証券メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバー2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定する米国-公認会計基準:資産認可証券メンバーアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001001233アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー米国-公認会計基準:資産認可証券メンバー2021-12-310001001233アメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310001001233アメリカ-公認会計基準:公正価値入力レベル1メンバーアメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定する2021-12-310001001233アメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値入力レベル2メンバー2021-12-310001001233アメリカ公認会計基準:預金メンバー資格認証アメリカ-GAAP:公正価値は再帰的メンバーを測定するアメリカ-公認会計基準:公正価値投入レベル3メンバー2021-12-310001001233アメリカ公認会計基準:MoneyMarketFundsMembers2022-09-300001001233アメリカ公認会計基準:現金等価物メンバー2022-09-300001001233アメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバー2022-09-300001001233米国-GAAP:ビジネス紙のメンバー2022-09-300001001233アメリカ-公認会計基準:会社債務証券メンバー2022-09-300001001233米国-公認会計基準:資産認可証券メンバー2022-09-300001001233アメリカ-公認会計基準:アメリカ証券メンバー2022-09-300001001233アメリカ公認会計基準:預金メンバー資格認証2022-09-300001001233アメリカ公認会計基準:MoneyMarketFundsMembers2021-12-310001001233アメリカ公認会計基準:現金等価物メンバー2021-12-310001001233アメリカ-公認会計基準:アメリカ政府スポンジ企業債務証券メンバー2021-12-310001001233米国-GAAP:ビジネス紙のメンバー2021-12-310001001233アメリカ-公認会計基準:会社債務証券メンバー2021-12-310001001233米国-公認会計基準:資産認可証券メンバー2021-12-310001001233アメリカ公認会計基準:預金メンバー資格認証2021-12-310001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2020-08-012020-08-310001001233SGMO:指定された臨床前開発と最初の商業販売マイルストーンのメンバーSGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2020-07-272020-07-270001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバSGMO:ビジネスマイルストーンのメンバー2020-07-272020-07-270001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2020-07-272020-07-270001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2022-09-300001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2021-12-310001001233SGMO:ノワール生物医学研究所IncMember2022-01-012022-09-300001001233SGMO:ノワール生物医学研究所IncMemberUS-GAAP:ライセンスとサービスメンバー2022-07-012022-09-300001001233SGMO:ノワール生物医学研究所IncMemberUS-GAAP:ライセンスとサービスメンバー2021-07-012021-09-300001001233SGMO:ノワール生物医学研究所IncMemberUS-GAAP:ライセンスとサービスメンバー2022-01-012022-09-300001001233SGMO:ノワール生物医学研究所IncMemberUS-GAAP:ライセンスとサービスメンバー2021-01-012021-09-300001001233国家気象局:研究サービスメンバーSGMO:ノワール生物医学研究所IncMember2022-07-012022-09-300001001233国家気象局:研究サービスメンバーSGMO:ノワール生物医学研究所IncMember2021-07-012021-09-300001001233国家気象局:研究サービスメンバーSGMO:ノワール生物医学研究所IncMember2022-01-012022-09-300001001233国家気象局:研究サービスメンバーSGMO:ノワール生物医学研究所IncMember2021-01-012021-09-300001001233SGMO:ノワール生物医学研究所IncMember2022-07-012022-09-300001001233SGMO:ノワール生物医学研究所IncMember2021-07-012021-09-300001001233SGMO:ノワール生物医学研究所IncMember2021-01-012021-09-300001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2021-01-012021-06-300001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2020-01-012020-12-310001001233SGMO:ノワール生物医学研究所IncMember2020-08-310001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2022-07-012022-09-300001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2022-01-012022-09-300001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2021-07-012021-09-300001001233SGMO:ノワール生物医学研究所IncMemberSGMO:連携と許可プロトコルメンバ2021-01-012021-09-300001001233SGMO:株式購入プロトコルメンバーSGMO:BigenMAIncMembers2020-04-012020-04-300001001233SGMO:株式購入プロトコルメンバーSGMO:BigenMAIncMembers2020-04-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2020-05-012020-05-310001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2020-04-300001001233SGMO:PreApprovalMilestoneMemberSGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2020-04-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembersSGMO:販売ベースのマイルストーンメンバー2020-04-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2020-04-012020-04-30SGMO:製品_目標0001001233SGMO:株式購入プロトコルメンバーSGMO:BigenMAIncMembers2022-09-300001001233SGMO:株式購入プロトコルメンバーSGMO:BigenMAIncMembers2021-12-310001001233SGMO:BigenMAIncMembers2022-01-012022-09-300001001233SGMO:BigenMAIncMembersUS-GAAP:ライセンスとサービスメンバー2022-07-012022-09-300001001233SGMO:BigenMAIncMembersUS-GAAP:ライセンスとサービスメンバー2021-07-012021-09-300001001233SGMO:BigenMAIncMembersUS-GAAP:ライセンスとサービスメンバー2022-01-012022-09-300001001233SGMO:BigenMAIncMembersUS-GAAP:ライセンスとサービスメンバー2021-01-012021-09-300001001233国家気象局:研究サービスメンバーSGMO:BigenMAIncMembers2022-07-012022-09-300001001233国家気象局:研究サービスメンバーSGMO:BigenMAIncMembers2021-07-012021-09-300001001233国家気象局:研究サービスメンバーSGMO:BigenMAIncMembers2022-01-012022-09-300001001233国家気象局:研究サービスメンバーSGMO:BigenMAIncMembers2021-01-012021-09-300001001233SGMO:BigenMAIncMembers2022-07-012022-09-300001001233SGMO:BigenMAIncMembers2021-07-012021-09-300001001233SGMO:BigenMAIncMembers2021-01-012021-09-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2020-01-012020-12-310001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2022-09-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2022-07-012022-09-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2022-01-012022-09-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2021-07-012021-09-300001001233SGMO:連携と許可プロトコルメンバSGMO:BigenMAIncMembers2021-01-012021-09-300001001233SGMO:株式購入プロトコルメンバーSGMO:BigenMAIncMembers2020-01-012020-12-310001001233SGMO:連携と許可プロトコルメンバ国家薬品監督管理局:KtePharmaIncMember2018-04-012018-04-300001001233国家薬品監督管理局:得られた成果指定の研究臨床開発監督と第一商業販売マイルストーンのメンバーSGMO:連携と許可プロトコルメンバ国家薬品監督管理局:KtePharmaIncMember2018-04-012018-04-300001001233SGMO:連携と許可プロトコルメンバ国家薬品監督管理局:KtePharmaIncMemberSGMO:完了数指定売上高マイルストーンに基づいて世界的に純売上高許可数製品が指定レベルのメンバーに達する場合2018-04-012018-04-30SGMO:マイルストーンSGMO:オプション0001001233SGMO:連携と許可プロトコルメンバ国家薬品監督管理局:KtePharmaIncMember2019-09-012019-09-300001001233SGMO:連携と許可プロトコルメンバ国家薬品監督管理局:KtePharmaIncMember2022-09-300001001233SGMO:連携と許可プロトコルメンバ国家薬品監督管理局:KtePharmaIncMember2021-12-310001001233国家薬品監督管理局:KtePharmaIncMember2022-01-012022-09-300001001233国家薬品監督管理局:KtePharmaIncMemberUS-GAAP:ライセンスとサービスメンバー2022-07-012022-09-300001001233国家薬品監督管理局:KtePharmaIncMemberUS-GAAP:ライセンスとサービスメンバー2021-07-012021-09-300001001233国家薬品監督管理局:KtePharmaIncMemberUS-GAAP:ライセンスとサービスメンバー2022-01-012022-09-300001001233国家薬品監督管理局:KtePharmaIncMemberUS-GAAP:ライセンスとサービスメンバー2021-01-012021-09-300001001233国家気象局:研究サービスメンバー国家薬品監督管理局:KtePharmaIncMember2022-07-012022-09-300001001233国家気象局:研究サービスメンバー国家薬品監督管理局:KtePharmaIncMember2021-07-012021-09-300001001233国家気象局:研究サービスメンバー国家薬品監督管理局:KtePharmaIncMember2022-01-012022-09-300001001233国家気象局:研究サービスメンバー国家薬品監督管理局:KtePharmaIncMember2021-01-012021-09-300001001233国家薬品監督管理局:KtePharmaIncMember2022-07-012022-09-300001001233国家薬品監督管理局:KtePharmaIncMember2021-07-012021-09-300001001233国家薬品監督管理局:KtePharmaIncMember2021-01-012021-09-300001001233SGMO:Sanofiembersメンバー2014-01-012014-01-31SGMO:計画0001001233SGMO:Sanofiembersメンバー2014-01-012022-06-280001001233SGMO:Sanofiembersメンバー2022-01-012022-09-30SGMO:製品0001001233SGMO:SanofiembersメンバーSGMO:連携と許可プロトコルメンバ2022-01-012022-09-300001001233SGMO:Sanofiembersメンバー2022-09-062022-09-060001001233SGMO:SanofiembersメンバーSGMO:連携と許可プロトコルメンバ2014-01-012022-06-280001001233SGMO:Sanofiembersメンバー国家気象局:マイルストーン3メンバーSGMO:連携と許可プロトコルメンバ2022-06-280001001233SGMO:SanofiembersメンバーSGMO:連携と許可プロトコルメンバ2022-09-300001001233SGMO:SanofiembersメンバーSGMO:連携と許可プロトコルメンバ2021-12-310001001233SGMO:SanofiembersメンバーUS-GAAP:ライセンスとサービスメンバー2022-07-012022-09-300001001233SGMO:SanofiembersメンバーUS-GAAP:ライセンスとサービスメンバー2021-07-012021-09-300001001233SGMO:SanofiembersメンバーUS-GAAP:ライセンスとサービスメンバー2022-01-012022-09-300001001233SGMO:SanofiembersメンバーUS-GAAP:ライセンスとサービスメンバー2021-01-012021-09-300001001233SGMO:Sanofiembersメンバー国家気象局:研究サービスメンバー2022-07-012022-09-300001001233SGMO:Sanofiembersメンバー国家気象局:研究サービスメンバー2021-07-012021-09-300001001233SGMO:Sanofiembersメンバー国家気象局:研究サービスメンバー2022-01-012022-09-300001001233SGMO:Sanofiembersメンバー国家気象局:研究サービスメンバー2021-01-012021-09-300001001233SGMO:SanofiembersメンバーSGMO:記念碑的業績メンバー2022-07-012022-09-300001001233SGMO:SanofiembersメンバーSGMO:記念碑的業績メンバー2021-07-012021-09-300001001233SGMO:SanofiembersメンバーSGMO:記念碑的業績メンバー2022-01-012022-09-300001001233SGMO:SanofiembersメンバーSGMO:記念碑的業績メンバー2021-01-012021-09-300001001233SGMO:Sanofiembersメンバー2022-07-012022-09-300001001233SGMO:Sanofiembersメンバー2021-07-012021-09-300001001233SGMO:Sanofiembersメンバー2021-01-012021-09-300001001233SGMO:PfizerMember2017-05-012017-05-310001001233SGMO:PfizerMemberSGMO:SBFiveTwoFiveAndOtherProductsMember2017-05-012017-05-310001001233SGMO:成果指定臨床開発知的財産権と規制マイルストーンのメンバーSGMO:PfizerMemberSGMO:SBFiveTwoFiveAndOtherProductsMember2017-05-012017-05-310001001233SGMO:PfizerMemberSGMO:最初の商業販売マイルストーンの成果メンバーSGMO:SBFiveTwoFiveAndOtherProductsMember2017-05-012017-05-310001001233SGMO:PfizerMemberSGMO:SBFiveTwoFiveAndOtherProductsMember2017-05-310001001233SGMO:その他の製品メンバーSGMO:PfizerMember2017-05-310001001233SGMO:ファイザーSB 525メンバーSGMO:SBFiveTwoFiveAndOtherProductsMember2017-05-012022-09-300001001233SGMO:ファイザーSB 525メンバーSGMO:SBFiveTwoFiveAndOtherProductsMember2017-12-012022-03-310001001233SGMO:ファイザーSB 525メンバー2017-05-012017-05-310001001233SGMO:ファイザーSB 525メンバー2017-05-012022-09-300001001233SGMO:ファイザーSB 525メンバー2021-01-012021-09-300001001233SGMO:ファイザーSB 525メンバー2021-07-012021-09-300001001233SGMO:ファイザーSB 525メンバー2022-07-012022-09-300001001233SGMO:ファイザーSB 525メンバー2022-01-012022-09-300001001233SGMO:PfizerC 9 ORF 72メンバー2017-12-012017-12-310001001233SGMO:PfizerC 9 ORF 72メンバーSGMO:指定された臨床前開発と最初の商業販売マイルストーンのメンバーSRT:最大メンバ数SGMO:CNINOまたはRFSINGの2人のメンバー2017-12-012017-12-310001001233SGMO:PfizerC 9 ORF 72メンバーSRT:最大メンバ数SGMO:ビジネスマイルストーンのメンバーSGMO:CNINOまたはRFSINGの2人のメンバー2017-12-012017-12-310001001233SGMO:PfizerC 9 ORF 72メンバー2017-12-012022-03-310001001233SGMO:PfizerMemberSGMO:CNINOまたはRFSINGの2人のメンバー2017-12-012017-12-310001001233SGMO:PfizerC 9 ORF 72メンバーSGMO:CNINOまたはRFSINGの2人のメンバー2017-12-012017-12-310001001233SGMO:PfizerMemberSGMO:CNINOまたはRFSINGの2人のメンバー2020-09-012020-09-300001001233SGMO:PfizerMemberSGMO:CNINOまたはRFSINGの2人のメンバー2020-01-012020-12-310001001233SGMO:PfizerC 9 ORF 72メンバーSGMO:CNINOまたはRFSINGの2人のメンバー2022-07-012022-09-300001001233SGMO:PfizerC 9 ORF 72メンバーSGMO:CNINOまたはRFSINGの2人のメンバー2021-07-012021-09-300001001233SGMO:PfizerC 9 ORF 72メンバーSGMO:CNINOまたはRFSINGの2人のメンバー2021-01-012021-09-300001001233SGMO:PfizerC 9 ORF 72メンバーSGMO:CNINOまたはRFSINGの2人のメンバー2022-01-012022-09-300001001233米国-公認会計基準:研究·開発費メンバー2022-07-012022-09-300001001233米国-公認会計基準:研究·開発費メンバー2021-07-012021-09-300001001233米国-公認会計基準:研究·開発費メンバー2022-01-012022-09-300001001233米国-公認会計基準:研究·開発費メンバー2021-01-012021-09-300001001233アメリカ-公認会計基準:一般と行政費用メンバー2022-07-012022-09-300001001233アメリカ-公認会計基準:一般と行政費用メンバー2021-07-012021-09-300001001233アメリカ-公認会計基準:一般と行政費用メンバー2022-01-012022-09-300001001233アメリカ-公認会計基準:一般と行政費用メンバー2021-01-012021-09-300001001233SGMO:JefferiesLLCMメンバーSGMO:AtTheMarketOfferingAgreementメンバー2020-08-012020-08-310001001233SGMO:JefferiesLLCMメンバーSGMO:AtTheMarketOfferingAgreementメンバー2022-07-012022-09-300001001233SGMO:JefferiesLLCMメンバーSGMO:AtTheMarketOfferingAgreementメンバー2022-01-012022-09-300001001233SGMO:JefferiesLLCMメンバーSGMO:AtTheMarketOfferingAgreementメンバーアメリカ公認会計基準:副次的事件メンバー2022-10-012022-10-310001001233SGMO:JefferiesLLCMメンバーSGMO:AtTheMarketOfferingAgreementメンバー2021-07-012021-09-300001001233SGMO:JefferiesLLCMメンバーSGMO:AtTheMarketOfferingAgreementメンバー2021-01-012021-09-30 アメリカです
アメリカ証券取引委員会
ワシントンD.C.,20549
________________________________________________
表10-Q
________________________________________________
(マーク1) | | | | | |
| ☒ | 1934年証券取引法第13条又は15(D)条に規定する四半期報告 |
本四半期末まで2022年9月30日
あるいは…。 | | | | | |
| ☐ | 1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
移行期になります 至れり尽くせり
手数料書類番号000-30171
________________________________________________
Sangamo治療会社
(登録者の正確な氏名はその定款に記載)
________________________________________________ | | | | | | | | | | | | | | |
| デラウェア州 | | | | 68-0359556 |
(明またはその他の司法管轄権
会社や組織) | | | | (税務署の雇用主
識別番号) |
| | | | | |
マリナ通り7000番地です。, ブリスベン, カリフォルニア州, 94005 |
| (主な行政事務室住所)(郵便番号) |
(510) 970-6000
(登録者の電話番号、市外局番を含む)
________________________________________________________________________________________________
同法第12条(B)に基づいて登録された証券: | | | | | | | | | | | | | | |
| クラスごとのタイトル | | 取引コード | | 登録された各取引所の名称 |
| 普通株は、1株当たり0.01ドルです | | SGMO | | ナスダック世界ベスト市場 |
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示すはい、そうです ☒ No ☐
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示すはい、そうです ☒ No ☐
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
| | | | | | | | | | | | | | |
| 大型加速ファイルサーバ | ☒ | | ファイルマネージャを加速する | ☐ |
| 非加速ファイルサーバ | ☐ | | 規模の小さい報告会社 | ☐ |
| | | 新興成長型会社 | ☐ |
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する。ガンギエイ
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、違います☒
2022年10月31日までに163,880,007発行者の普通株は1株当たり0.01ドルで、発行された。
索引.索引
Sangamo治療会社 | | | | | | | | |
第1部財務情報 | |
| | |
第1項。 | 財務諸表 | 6 |
| 2022年9月30日と2021年12月31日までの簡明総合貸借対照表 | 6 |
| 2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月の簡明総合業務レポート | 7 |
| 2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月の簡明総合全面赤字報告書 | 8 |
| 2022年と2021年9月30日までの3ヶ月と9ヶ月の株主権益簡明合併報告書 | 9 |
| 2022年と2021年9月30日まで9ヶ月キャッシュフロー表簡明総合レポート | 11 |
| 簡明合併財務諸表付記 | 12 |
第二項です。 | 経営陣の財務状況と経営成果の検討と分析 | 27 |
第三項です。 | 市場リスクの定量的·定性的開示について | 37 |
第四項です。 | 制御とプログラム | 38 |
| | |
第2部:その他の情報 | |
| | |
第1項。 | 法律訴訟 | 39 |
第1 A項. | リスク要因 | 39 |
第二項です。 | 未登録株式証券販売と収益の使用 | 40 |
第三項です。 | 高級証券違約 | 40 |
第四項です。 | 炭鉱安全情報開示 | 40 |
五番目です。 | その他の情報 | 41 |
第六項です。 | 陳列品 | 42 |
| | |
サイン | 43 |
別の説明または文脈で別の説明がない限り、本四半期報告書で言及されている“Sangamo”、“会社”、“私たち”、“私たち”および“私たち”は、Sangamo治療フランス会社およびSangamo治療イギリス株式会社を含むSangamo治療会社およびその子会社を意味する。
本四半期の報告に登場する任意の第三者商標名、商標、サービスマークは、それぞれの所有者の財産である。
前向き陳述に関する特別説明
本報告に含まれるいくつかの陳述は、“1933年証券法”(改正された)第27 A節又は“証券法”及び“1934年証券取引法”(改正された)第21 E節又は“取引法”が指す“前向き陳述”に属する。これらの陳述は私たちの未来の事件と関係があり、私たちが予想している運営、研究、開発、製造と商業化活動、臨床試験、経営結果と財務状況を含む。これらの展望性陳述は既知と未知のリスク、不確定要素とその他の要素に関連し、私たちの実際の結果、表現或いは成果と展望性陳述の明示或いは暗示の任意の未来の結果、表現或いは成果とは大きく異なる可能性がある。前向きな陳述は、以下の態様に関する陳述を含むことができるが、これらに限定されない
•私たちの戦略は
•候補製品の予期される研究および開発、およびそれによって生成される任意の承認された製品の潜在的商業化;
•私たちの協力者または戦略パートナーとの臨床前研究と臨床試験の開始、範囲、進展速度、登録、用量、予想結果と時間
•治療効果の持続性を含む候補製品の治療と商業的潜在力
•我々の遺伝子治療および細胞治療技術、亜鉛指蛋白(ZFP)、技術プラットフォーム、亜鉛指ヌクレアーゼ(ZFN)および亜鉛指蛋白転写因子(ZFP-TF)を含む候補製品に使用される技術の治療と商業的潜在力
•私たちは、BIVV 003(以前SAR 445136と呼ばれていた)計画のための潜在的な新しいパートナーを見つける能力を含む、協力および戦略的パートナーシップを確立し、維持し、そのような計画の予想される収益を達成することができる
•既存と新しい協力の期待収入とその時間;
•私たちの業務と運営、そして私たちの協力者の業務と運営(臨床試験と製造を含む)に対する私たちの発展している新冠肺炎の大流行の影響と、このような影響を管理する能力の推定
•私たちの研究開発や他の費用は
•私たちは既存で潜在的な新しいサプライヤーと製造業者から、あるいは私たち自身の内部製造施設から十分な臨床前および臨床候補製品供給を得ることができます
•Sangamoと私たちのパートナーおよび戦略パートナーは、候補製品の規制承認を獲得し、維持する能力と、規制承認を得ることに関連する時間およびコスト;
•私たちが法規の要求、義務、制限を遵守する能力と私たちの業務と運営に与える影響
•私たちは、他人の知的財産権を侵害することなく、私たちの知的財産権を保護し、私たちの業務を運営する能力、私たちの候補製品を開発し、商業化するために必要な技術の権利を獲得し、維持する能力を含む
•競合製品と候補製品が私たちの競争地位に与える影響と、競争製品と候補製品の競争に対応する能力を含む競争発展
•私たちは現金資源と支出、資本需要、追加融資需要の推定、そして私たちが追加融資を得る能力
•私たちはビジネスの成長を管理しています
•私たちが予想している経営と財務業績は
•私たちの運営と法的リスクは
•私たちの計画、目標、期待、そして意図、そして他の非歴史的事実の陳述。
場合によっては、“目標”、“予想”、“仮定”、“信じ”、“継続”、“可能”、“推定”、“予想”、“予測”、“目標”、“指導”、“意図”、“可能”、“可能”、“進行中”、“計画”、“プロジェクト”という用語を使用することによって、前向きな陳述を識別することができる。“求める”、“すべき”、“目標”、“将”、および前向き陳述を識別するための類似表現。これらの表現は未来の事件に対する著者らの現在の見方を反映し、仮説に基づいており、既知と未知のリスク、不確定要素とその他の要素に関連し、私たちの実際の結果、業績或いは成果は展望性表現に明示或いは暗示された任意の未来の結果、業績或いは業績と大きく異なることを招く可能性がある。これらのリスクと不確実性は含まれているが、これらに限定されない
•私たちは臨床段階のバイオテクノロジー会社で、承認された製品や製品の収入を得ていない。著者らの成功は臨床試験結果に大きく依存し、この結果は著者らの候補製品の安全性と有効性を証明し、監督管理機関を満足させた。積極的な臨床試験結果と監督管理の承認を得ることは高価で、長く、挑戦性と予測不可能であり、いかなる候補製品に対しても永遠に発生しない可能性がある。
·私たちの多くの候補製品は、承認された商業的に実行可能な治療製品を生成していない新しいZFP技術に基づいています。
·設立以来、深刻な運営赤字が発生しており、将来的には赤字が続くと予想されている。私たちは永遠に利益を上げないかもしれない。
·私たちは、私たちの運営に資金を提供し、実行可能なビジネスとして運営を継続するために多くの追加資本が必要です。この追加的な資本は割引された条件で私たちに提供されないかもしれないし、全くそうではないかもしれない。
·私たちは、大手バイオ製薬会社との協力に大きく依存して収入を創出し、多くの候補製品の開発、規制部門の承認を得て商業化しています。もし私たちの協力者と衝突した場合、あるいは協力が何らかの理由で終了すれば、私たちの収入と製品開発はマイナスの影響を受けるだろう。
·バイオテクノロジーと遺伝子医薬は競争の激しい業界。私たちの競争相手は私たちの競争相手よりも優れた技術と製品を開発したり、私たちの候補技術や製品よりも早く商業化するかもしれません。
·遺伝子薬の製造は複雑で、高価で、高度に規制され、リスクがある。私たちは現在第三者メーカーに深刻に依存しており、自分で製品を製造する経験は限られている。製造挑戦は予期せぬコスト、供給中断、そして私たちの製品開発作業への損害と遅延を招く可能性があります。
·私たちの候補製品が規制部門の承認を得ても、私たちが承認した製品は医師や患者の市場承認を得られない可能性があり、第三者支払者から十分な保険や補償を受けることができず、商業的可能性を証明できない可能性もあります。
·私たちは、すべての所望の司法管轄区域で、私たちの技術および候補製品のために必要かつ理想的な知的財産保護を獲得、維持、実行することができない可能性があり、これは、私たちの技術および製品開発努力の価値に悪影響を及ぼす可能性があり、高価で冗長で注意を分散させる訴訟のリスクを増加させ、予測不可能な結果をもたらす可能性がある。
·第三者は競争相手でもないかもしれませんが、特許または他の独占権を侵害、流用、または無許可で行使していると告発される可能性があります。このような告発は、侵害訴訟、他の公金流用訴訟、または脅威がこのような行動をとる可能性があり、これらすべては、高価で冗長で注意を分散させる訴訟のリスクを増加させ、予測不可能な結果をもたらす可能性がある。
·私たちの成功は、より多くの素質の高い熟練従業員を雇用、統合、維持し、現在の重要な幹部や従業員を引き留めることにかかっており、これらの人に対する競争が非常に激しいことを考慮すると、米国各地の従業員流出率が“大辞職”によって増加することは挑戦的かもしれない
·持続的かつ持続的に変化する新冠肺炎の流行は、私たちの業務および運営、ならびに私たちの協力者、製造業者、および他のビジネスパートナーの業務および運営に悪影響を与え続ける可能性がある。もしこれらの影響が実質的になれば、私たちの収入と製品開発努力は否定的な影響を受けるかもしれない。
·私たち普通株の市場価格はずっと変動していて、変動し続ける可能性が高く、私たちの普通株への投資の全部または一部を損失する可能性があります。
上記のリスク、不確定要因、その他の要因に関する他の議論、および我々の業務に対する他の重大なリスクおよび不確定要因は、2022年2月24日に米国証券取引委員会に提出された2021年12月31日までの年次報告Form 10−Kの第I部1 A項の“リスク要因”項の下で見つけることができ、本四半期報告第II部第1 A項に記載されているリスク項目の下でのリスク補充については、この追加的な議論を参考にすることを奨励する。このような危険、不確実性、そして他の要素を考慮して、あなたはこのような前向きな陳述に過度に依存してはいけない。また、これらの前向きな陳述は、文書を提出した日までの私たちの計画、目標、推定、期待、および意図のみを代表する。あなたはこの報告書を完全に読んで、私たちの実際の未来の結果と事件の時間が私たちが予想していたのとは大きく違うかもしれないということを理解しなければなりません。私たちは他の方法でいかなる展望的声明も達成されることを保証することはできません。私たちはここでこのような警告声明を通じて私たちのすべての展望的声明を限定する。
法的要件がない限り、私たちは、未来に新しい情報があっても、これらの前向き陳述で予想される結果と大きく異なる理由で、任意の前向き陳述を更新または追加する義務がない、または実際の結果を更新または補足する義務がない。しかし、あなたは関連したテーマについて私たちがした何かを追加的に開示することを提案します
この報告書は様々な候補製品に関連するいくつかの臨床研究と試験の討論を含む。これらの研究は通常,これらの候補薬物に関連するより大きな臨床データの一部であり,ここでの議論はより大きなデータを背景に考慮すべきである。さらに、臨床データは異なる解釈を受けることができ、データが候補製品の安全性および/または有効性を支持するのに十分であると考えても、規制機関は私たちの観点に同意しない可能性があり、追加のデータを必要とする可能性があり、承認を完全に拒否する可能性もある。
第1部財務情報
項目1.財務諸表
Sangamo治療会社
簡明合併貸借対照表
(監査を受けていない
| | | | | | | | | | | |
| 九月三十日
2022 | | 十二月三十一日
2021 |
| 資産 | | | |
| 流動資産: | | | |
| 現金と現金等価物 | $ | 94,570 | | | $ | 178,872 | |
| 有価証券 | 218,998 | | | 197,676 | |
| 受取利息 | 524 | | | 349 | |
| 売掛金 | 4,522 | | | 6,013 | |
| 前払い費用と他の流動資産 | 18,007 | | | 15,859 | |
| 流動資産総額 | 336,621 | | | 398,769 | |
| 非流通有価証券 | 36,700 | | | 88,169 | |
| 財産と設備、純額 | 55,986 | | | 51,523 | |
| 無形資産 | 46,439 | | | 53,760 | |
| 商誉 | 34,511 | | | 39,702 | |
| 経営的リース使用権資産 | 64,956 | | | 73,181 | |
| 他の非流動資産 | 17,200 | | | 15,319 | |
| 制限現金 | 1,500 | | | 1,500 | |
| 総資産 | $ | 593,913 | | | $ | 721,923 | |
| 負債と株主権益 | | | |
| 流動負債: | | | |
| 売掛金 | $ | 17,380 | | | $ | 9,759 | |
| 報酬と従業員の福祉に計上しなければならない | 19,045 | | | 20,840 | |
| その他負債を計算すべき | 14,046 | | | 11,577 | |
| 収入を繰り越す | 71,890 | | | 85,711 | |
| 流動負債総額 | 122,361 | | | 127,887 | |
| 繰延収入、非流動収入 | 115,641 | | | 166,776 | |
| 賃貸負債の長期部分 | 39,705 | | | 44,055 | |
| 所得税を繰延する | 5,740 | | | 6,645 | |
| 他の非流動負債 | 1,312 | | | 1,217 | |
| 総負債 | 284,759 | | | 346,580 | |
| 引受金とその他の事項 | | | |
| 株主権益: | | | |
| 優先株 | — | | | — | |
| 普通株 | 1,619 | | | 1,459 | |
| 追加実収資本 | 1,423,105 | | | 1,334,138 | |
| 赤字を累計する | (1,096,572) | | | (956,267) | |
| その他の総合損失を累計する | (18,998) | | | (3,987) | |
| 株主権益総額 | 309,154 | | | 375,343 | |
| | | |
| | | |
| 総負債と株主権益 | $ | 593,913 | | | $ | 721,923 | |
簡明な連結財務諸表付記を参照してください。
Sangamo治療会社
業務報告書を簡明に合併する
(監査を受けていない。千にして、一株当たりの金額を除く)
| | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| 収入.収入 | $ | 26,460 | | | $ | 28,563 | | | $ | 84,069 | | | $ | 82,715 | |
| 運営費用: | | | | | | | |
| 研究開発 | 65,116 | | | 62,498 | | | 183,719 | | | 179,018 | |
| 一般と行政 | 16,238 | | | 14,501 | | | 46,239 | | | 47,135 | |
| 総運営費 | 81,354 | | | 76,999 | | | 229,958 | | | 226,153 | |
| 運営損失 | (54,894) | | | (48,436) | | | (145,889) | | | (143,438) | |
| 利息とその他の収入,純額 | 1,769 | | | 834 | | | 5,754 | | | 3,010 | |
| 所得税前損失 | (53,125) | | | (47,602) | | | (140,135) | | | (140,428) | |
| 所得税費用 | 30 | | | 86 | | | 170 | | | 373 | |
| 純損失 | (53,155) | | | (47,688) | | | (140,305) | | | (140,801) | |
| 非持株権益は純損失を占めなければならない | — | | | — | | | — | | | (11) | |
| Sangamo治療会社の株主は純損失を占めるべきです | $ | (53,155) | | | $ | (47,688) | | | $ | (140,305) | | | $ | (140,790) | |
| Sangamo治療会社の株主の1株当たり基本と希釈後の純損失 | $ | (0.34) | | | $ | (0.33) | | | $ | (0.93) | | | $ | (0.98) | |
| Sangamo治療会社の株主の1株当たりの基本的かつ希釈後の純損失の株式を計算するための | 158,042 | | | 145,399 | | | 150,850 | | | 144,173 | |
簡明な連結財務諸表付記を参照してください。
Sangamo治療会社
簡明総合総合損失表
(監査を受けていない
| | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| 純損失 | $ | (53,155) | | | $ | (47,688) | | | $ | (140,305) | | | $ | (140,801) | |
| 外貨換算調整 | (6,028) | | | (2,565) | | | (14,040) | | | (6,006) | |
| 年金純収益 | 55 | | | — | | | 130 | | | — | |
| 取引可能証券の未実現収益(赤字),税引き後純額 | 135 | | | (45) | | | (1,101) | | | (36) | |
| | | | | | | |
| 総合損失 | (58,993) | | | (50,298) | | | (155,316) | | | (146,843) | |
| 非持株権益は総合損失を占めなければならない | — | | | — | | | — | | | (11) | |
| Sangamo治療会社の全面的な損失。 | $ | (58,993) | | | $ | (50,298) | | | $ | (155,316) | | | $ | (146,832) | |
簡明な連結財務諸表付記を参照してください。
Sangamo治療会社
株主権益報告書を簡明に合併する
(監査を受けていない;千単位で、株式金額を除く)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年9月30日までの3ヶ月 | | |
| 普通株 | | その他の内容
支払い済み
資本 | | 積算
赤字.赤字 | | 積算
他にも
全面的に
収入を損ねる | | 合計する 株主の 権益 | | |
| 株 | | 金額 | | |
| 2022年6月30日の残高 | 153,352,502 | | | $ | 1,534 | | | $ | 1,373,324 | | | $ | (1,043,417) | | | $ | (13,160) | | | $ | 318,281 | | | |
| 市場発行に関する普通株を発行し、発行費用を差し引いた純額 | 8,483,104 | | | 85 | | | 42,089 | | | — | | | — | | | 42,174 | | | |
| 株式オプションを行使して制限株式単位に関連する場合に普通株を発行し,税金を差し引く | 82,617 | | | — | | | (101) | | | — | | | — | | | (101) | | | |
| | | | | | | | | | | | | |
| 株に基づく報酬 | — | | | — | | | 7,793 | | | — | | | — | | | 7,793 | | | |
| | | | | | | | | | | | | |
外貨換算調整 | — | | | — | | | — | | | — | | | (6,028) | | | (6,028) | | | |
| 年金純収益 | — | | | — | | | — | | | — | | | 55 | | | 55 | | | |
| 有価証券は収益純額,税引き後純額を実現していない | — | | | — | | | — | | | — | | | 135 | | | 135 | | | |
| | | | | | | | | | | | | |
| 純損失 | — | | | — | | | — | | | (53,155) | | | — | | | (53,155) | | | |
| 2022年9月30日の残高 | 161,918,223 | | | $ | 1,619 | | | $ | 1,423,105 | | | $ | (1,096,572) | | | $ | (18,998) | | | $ | 309,154 | | | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年9月30日までの9ヶ月間 |
| 普通株 | | その他の内容
支払い済み
資本 | | 積算
赤字.赤字 | | 積算
他にも
全面的に
収入を損ねる | | 合計する 株主の 権益 |
| 株 | | 金額 |
| 2021年12月31日の残高 | 145,921,530 | | | $ | 1,459 | | | $ | 1,334,138 | | | $ | (956,267) | | | $ | (3,987) | | | $ | 375,343 | |
| 市場発行に関する普通株を発行し、発行費用を差し引いた純額 | 14,711,770 | | | 147 | | | 66,301 | | | — | | | — | | | 66,448 | |
| 株式オプションを行使して制限株式単位に関連する場合に普通株を発行し,税金を差し引く | 925,455 | | | 9 | | | (1,847) | | | — | | | — | | | (1,838) | |
| 従業員株購入計画による普通株の発行 | 359,468 | | | 4 | | | 1,111 | | | — | | | — | | | 1,115 | |
| 株に基づく報酬 | — | | | — | | | 23,402 | | | — | | | — | | | 23,402 | |
| | | | | | | | | | | |
外貨換算調整 | — | | | — | | | — | | | — | | | (14,040) | | | (14,040) | |
| 年金純収益 | — | | | — | | | — | | | — | | | 130 | | | 130 | |
| 有価証券は純損失を実現せず,税引き後の純額 | — | | | — | | | — | | | — | | | (1,101) | | | (1,101) | |
| | | | | | | | | | | |
| 純損失 | — | | | — | | | — | | | (140,305) | | | — | | | (140,305) | |
| 2022年9月30日の残高 | 161,918,223 | | | $ | 1,619 | | | $ | 1,423,105 | | | $ | (1,096,572) | | | $ | (18,998) | | | $ | 309,154 | |
Sangamo治療会社
株主権益報告書を簡明に合併する
(監査を受けていない;千単位で、株式金額を除く)
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2021年9月30日までの3ヶ月 |
| 普通株 | | その他の内容
支払い済み
資本 | | 積算
赤字.赤字 | | 積算
他にも
全面的に
収入(損) | | -ではない
制御管
利子 | | 合計する 株主の 権益 |
| 株 | | 金額 |
| 2021年6月30日の残高 | 145,106,901 | | | $ | 1,451 | | | $ | 1,313,102 | | | $ | (871,083) | | | $ | 1,987 | | | $ | — | | | $ | 445,457 | |
| 市場発行に関する普通株を発行し、発行費用を差し引いた純額 | 202,705 | | | 2 | | | 2,365 | | | — | | | — | | | — | | | 2,367 | |
| 株式オプションを行使して制限株式単位に関連する場合に普通株を発行し,税金を差し引く | 206,970 | | | 2 | | | 615 | | | — | | | — | | | — | | | 617 | |
| 従業員株購入計画による普通株の発行 | — | | | — | | | — | | | — | | | — | | | — | | | — | |
| 株に基づく報酬 | — | | | — | | | 7,873 | | | — | | | — | | | — | | | 7,873 | |
| | | | | | | | | | | | | |
外貨換算調整 | — | | | — | | | — | | | — | | | (2,565) | | | — | | | (2,565) | |
| 有価証券は純損失を実現せず,税引き後の純額 | — | | | — | | | — | | | — | | | (45) | | | — | | | (45) | |
| | | | | | | | | | | | | |
| 純損失 | — | | | — | | | — | | | (47,688) | | | — | | | — | | | (47,688) | |
| 2021年9月30日の残高 | 145,516,576 | | | $ | 1,455 | | | $ | 1,323,955 | | | $ | (918,771) | | | $ | (623) | | | $ | — | | | $ | 406,016 | |
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 2021年9月30日までの9ヶ月間 |
| 普通株 | | その他の内容
支払い済み
資本 | | 積算
赤字.赤字 | | 積算
他にも
全面的に
収入(損) | | -ではない
制御管
利子 | | 合計する 株主の 権益 |
| 株 | | 金額 |
| 2020年12月31日の残高 | 142,063,203 | | | $ | 1,421 | | | $ | 1,269,375 | | | $ | (777,981) | | | $ | 5,419 | | | $ | (868) | | | $ | 497,366 | |
| 市場発行に関する普通株を発行し、発行費用を差し引いた純額 | 2,007,932 | | | 20 | | | 27,079 | | | — | | | — | | | — | | | 27,099 | |
| 株式オプションを行使して制限株式単位に関連する場合に普通株を発行し,税金を差し引く | 1,200,871 | | | 12 | | | 1,582 | | | — | | | — | | | — | | | 1,594 | |
| 従業員株購入計画による普通株の発行 | 244,570 | | | 2 | | | 2,052 | | | — | | | — | | | — | | | 2,054 | |
| 株に基づく報酬 | — | | | — | | | 24,880 | | | — | | | — | | | — | | | 24,880 | |
| フランスのSangamo社の追加株式を買収する | — | | | — | | | (70) | | | — | | | — | | | (64) | | | (134) | |
外貨換算調整 | — | | | — | | | — | | | — | | | (6,006) | | | — | | | (6,006) | |
| | | | | | | | | | | | | |
| 有価証券は純損失を実現せず,税引き後の純額 | — | | | — | | | — | | | — | | | (36) | | | — | | | (36) | |
| 買断非持株権益 | | | | | (943) | | | | | | | 943 | | | — | |
| 純損失 | — | | | — | | | — | | | (140,790) | | | — | | | (11) | | | (140,801) | |
| 2021年9月30日の残高 | 145,516,576 | | | $ | 1,455 | | | $ | 1,323,955 | | | $ | (918,771) | | | $ | (623) | | | $ | — | | | $ | 406,016 | |
簡明な連結財務諸表付記を参照してください。
Sangamo治療会社
簡明合併現金フロー表
(監査を受けていない
| | | | | | | | | | | |
| 9か月で終わる
九月三十日 |
| 2022 | | 2021 |
| 経営活動: | | | |
| 純損失 | $ | (140,305) | | | $ | (140,801) | |
| 純損失と経営活動で使用される現金純額の調整: | | | |
| 減価償却および償却 | 8,765 | | | 6,675 | |
| 有価証券(割引)を割増償却する | (324) | | | 2,394 | |
| 経営的リース使用権資産の償却その他の変動 | 6,357 | | | 6,104 | |
| 無料株収益 | — | | | (18) | |
| 株に基づく報酬 | 23,402 | | | 24,880 | |
| 財産と設備の収益を処分する | — | | | (30) | |
| 営業資産と負債の純変化: | | | |
| 受取利息 | (175) | | | 415 | |
| 売掛金 | 1,491 | | | (2,743) | |
| 前払い費用と他の資産 | (5,848) | | | (6,467) | |
| 支払すべき帳簿その他の負債 | 9,443 | | | (4,699) | |
| | | |
| 報酬と従業員の福祉に計上しなければならない | (1,225) | | | (1,932) | |
| | | |
| 収入を繰り越す | (64,956) | | | (62,292) | |
| 賃貸負債 | (3,298) | | | (3,227) | |
| 他の非流動負債 | 95 | | | 1,204 | |
| 経営活動のための現金純額 | (166,578) | | | (180,537) | |
| 投資活動: | | | |
| 有価証券を購入する | (225,621) | | | (300,387) | |
| 有価証券の満期日 | 254,990 | | | 509,620 | |
| 有価証券の販売 | — | | | 6,870 | |
| 財産と設備を購入する | (12,697) | | | (20,420) | |
| Sangamoフランス株を追加購入します | — | | | (119) | |
| | | |
| 投資活動が提供する現金純額 | 16,672 | | | 195,564 | |
| 融資活動: | | | |
| 市場で発行された収益は,発行費用を差し引く | 65,848 | | | 27,099 | |
| | | |
| 配当金の株式純額決済に関する支払済み税 | (1,962) | | | (2,988) | |
| 株式オプションを行使して得られる収益 | 124 | | | 4,582 | |
| 従業員の株式購入計画に基づいて普通株を発行して得た金 | 1,115 | | | 2,053 | |
| 融資活動が提供する現金純額 | 65,125 | | | 30,746 | |
| 現金、現金等価物および限定現金に及ぼす為替レート変動の影響 | 479 | | | (148) | |
| 現金、現金等価物、および制限的現金純増加 | (84,302) | | | 45,625 | |
| 期初現金、現金等価物、および限定現金 | 180,372 | | | 132,829 | |
| 現金、現金等価物、制限された現金、期末 | $ | 96,070 | | | $ | 178,454 | |
| 補足キャッシュフロー開示: | | | |
| 未払い負債に計上する財産と設備 | $ | 3,927 | | | $ | 650 | |
| 賃貸義務と引き換えに使用権資産 | $ | — | | | $ | 1,349 | |
| テナント改善手当は反賃貸負債に含まれています | $ | 1,531 | | | $ | — | |
| 買断非持株権益 | $ | — | | | $ | 943 | |
簡明な連結財務諸表付記を参照してください。
Sangamo治療会社
簡明合併財務諸表付記
(未監査)
注1-重大会計政策の組織·列報根拠とまとめ
業務の組織と記述
Sangamo治療会社(“Sangamo”または“当社”)は1995年6月にデラウェア州に登録設立され、2017年1月にSangamo生物科学会社から改名された。Sangamoは臨床段階のゲノム薬物会社であり、画期的な科学を深刻な疾病患者の生活を変える薬物に転化することに力を入れている。
陳述の基礎
添付されていない監査を経ない簡明総合財務諸表はアメリカ中期財務資料公認会計原則(“アメリカ公認会計原則”)及びアメリカ証券取引委員会(“アメリカ証券取引委員会”)の規則及び規定に基づいて作成されたものである。したがって、それらは、米国公認会計基準によって要求される完全な財務諸表のすべての情報および脚注を含まない。経営陣は、公正新聞に記載されている間の財務諸表に必要な調整(正常な経常的調整のみを含む)が含まれていると考えている。2022年9月30日までの3カ月と9カ月の経営業績は、2022年12月31日までの年度の予想業績を必ずしも代表するとは限らない。2021年12月31日現在の簡明総合貸借対照表データは、Sangamoが2022年2月24日に米国証券取引委員会に提出した2021年12月31日までの10-K表年次報告(“2021年年報”と略す)に含まれる監査された総合財務諸表に由来する。
添付されている簡明総合財務諸表には、当社及びその付属会社の勘定が含まれている。すべての会社間残高と取引は簡明な連結財務諸表から抹消されました。当社が100%以下の経済リスクを有しているか、または直面している合併実体については、当社はその総合経営報告書に非持株権益を純損失を占めるべきであり、それぞれの非制御者が当該等の実体に保持している経済又は所有権権益のパーセンテージに相当する
添付されている簡明総合財務諸表及び関連財務資料は“2021年年報”に含まれている2021年12月31日までの監査された総合財務諸表及び脚注と一緒に読まなければならない。
流動性と管理計画
Sangamoは現在,実験技術に関するいくつかの長期開発プロジェクトを行っている.このようなプロジェクトは達成するために数年と多くの支出がかかるかもしれないし、最終的には成功しないかもしれない。同社は利用可能な現金資源、協力と戦略パートナーシップ基金、研究贈与および株式または債務証券の発行で業務に資金を提供する計画だ。Sangamoは、2022年9月30日までの利用可能な現金、現金等価物および有価証券、ならびに予想される将来のマイルストーンおよび協力、戦略的パートナーシップおよび研究贈与からの研究サービス収入は、これらの連結財務諸表の発表日から少なくとも今後12ヶ月以内に現在計画されている業務に資金を提供するのに十分であるとしている。Sangamoはその候補製品の開発と商業化を達成するために多くの追加的な財政資源を必要とするだろう。追加資本は、もしあれば、会社が受け入れられる条項では得られないかもしれない。十分な資金がない場合、又は潜在的な資金源の条項が不利である場合、会社の業務及びその技術及び治療製品を開発する能力が損なわれる。さらに、任意の追加持分証券の売却は、会社株主の持分希釈を招く可能性があり、どの債務融資にも、会社業務を制限する契約が含まれている可能性がある。
重要会計政策の概要
予算の使用
アメリカ公認会計原則に基づいて簡明総合財務諸表を作成することは管理層に推定と仮定を要求し、簡明総合財務諸表及び付記中の報告の金額に影響を与える。管理層は、重要な会計政策または収入確認、臨床試験課税項目、所得税、資産および負債の公正価値(買収所得を含む)および株式報酬に関する推定を含む、その推定値を継続的に評価する。過去の経験と当社が関係状況に関する部下が合理的であると考えている様々な他の特定市場その他に関する仮定に基づいて作成した結果構成であると思われる
資産や負債の帳簿価値を判断するが、これらの資産や負債の帳簿価値は他の出所では明らかではない。実際の結果はこれらの推定とは異なる可能性がある。
2021年9月、ベータ地中海貧血計画のプロジェクトコストの増加、及び鎌状細胞病計画のプロジェクト範囲と相応のコストの増加により、セノフィ社(“セノフィ”)との協力協定の推定値が変化し、同社は収入調整を記録し、この2つの要素はいずれも比例累積業績測定基準の低下を招いた。
この調整は収入を1ドル減少させた2.5百万ドル純損失増加$2.5100万ドルで会社の1株当たり基本的に希釈して純損失を増加させました0.022021年9月30日までの3ヶ月と9ヶ月。
収入確認
当社は会計基準編纂(“ASC”)テーマ606の規定に基づいてその収入を会計処理している取引先と契約した収入(“ASCトピック606”)。同社の契約収入は、許可手配や研究活動の贈与を含む協力協定から来ている。研究および許可協定には、通常、事前署名または許可料、研究サービスのコスト補償、最低再許可料、マイルストーン支払い、および将来のライセンシー製品販売の印税が含まれる。その会社は固定と可変対価協定を持っている。払い戻し不可能な前期費用と研究開発活動の資金は固定されていると考えられ、マイルストーン支払いは通常可変対価格として決定される。Sangamoの研究贈与は通常、複数年契約であり、贈与協定条項で定義された合格した研究と開発費用の償還を規定している。研究助成協定の下での収入は,一般に関連する合格研究費が発生した場合に確認される。繰延収入とは主に受け取ったが稼いでいない研究が支払い可能かもしれない部分を指す。
会社がその合意に規定された義務を履行する際に確認すべき適切な収入額を決定する場合、会社は、(1)契約で約束された貨物またはサービスを決定するステップと、(2)契約で異なるか否かを含む約束された貨物またはサービスが履行義務であるかどうかを決定するステップと、(3)可変対価格の制限を含む取引価格を測定するステップと、(4)推定販売価格に基づいて取引価格を履行義務に割り当てるステップと、(5)会社が各履行義務を履行する場合(または義務を履行するとき)に収入を確認するステップとを実行する。
履行義務は、契約において独自の商品またはサービスを顧客に譲渡する承諾であり、ASCテーマ606における計算単位である。同社の履行義務には,許可権,開発サービス,規制提出や承認手続きに関するサービスがある。連携プロトコルによって稼いだ研究サービス収入は,一般に関連サービスを提供する際に収入として確認される.払戻不可能な前払い費用の収入は、投入方法(すなわち、推定総コストに対する累積実コスト)を用いて、関連する履行義務の履行の進捗状況を測定することによって、または予期される履行義務が一定期間平均的に履行された場合(またはエンティティが既製の履行義務を有する場合)によって直線的に確認される。1つの手配に必要な努力程度及び当社がこの手配の下での責任履行を達成することを期待する期間を決定する際には、発生する内部人員コスト及び外部コスト総額、場合によっては随時待機可能な責任期間を含む可能性がある重大な管理職判断を行う必要がある。これらの見積もりの変化は確認された収入に実質的な影響を及ぼす可能性がある。会社が義務履行がいつ完了したか、どうでもいいと合理的に見積もることができない場合、会社が合理的にその等の推定を行うことができるまで収入確認が延期される。同社は制限されない推定可変対価金額を取引価格に計上している。取引価格に含まれる金額は,確認された累積収入が大きく逆転しない可能性の高い金額に制限される.その後の各報告期間の終了時に, 当社は,取引価格に含まれる推定変動コストおよび任意の関連制限を再評価し,必要に応じて全体の取引価格の推定を調整する。そして累積追跡法を用いて残りの見積り実績期間中に収入を確認する.人員や製造コストなどの業績期間やプロジェクトコストを見積もり、四半期ごとに審査し、必要に応じて調整し、会社の現在の交付時間の仮定を反映させる。
これらの手配に対する会計処理の一部として、会社は仮説を立てなければならず、これらの仮定は、契約で決定された個々の履行義務の独立販売価格を決定するために判断する必要がある。同社は重要な仮定を用いて独立販売価格を決定し、その中には予測収入、開発スケジュール、人員コスト販売率、割引率、および技術と監督管理が成功する確率が含まれている可能性がある。これらのスケジューリングに関するコストと支出は従来から確認されている収入に近い.
主な協力協定と研究活動の贈与の収入が総収入に占める割合は以下の通りである
| | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| ノワール生物医学研究所です | 36 | % | | 40 | % | | 35 | % | | 35 | % |
| 生物遺伝研究会社 | 36 | % | | 38 | % | | 36 | % | | 39 | % |
| 凧製薬会社 | 26 | % | | 22 | % | | 23 | % | | 23 | % |
| セノフィ社 | — | % | | (3) | % | | 4 | % | | 2 | % |
| | | | | | | |
会社のパートナーから受け取った資金は一般に返却されず,会社がその履行義務を履行する際に収入と記すことは,時間の経過(すなわち随時待機の義務)や投入方法(すなわち総見積もりコストに対する累積実コスト)を用いることで満たされている。会社がパートナーから精算できる合格研究開発コストが発生し、このようなコストが精算されることが合理的に保証された場合、収入も確認される。関連履行義務が完了する前にパートナーから受け取ったいかなる支払いも繰延収入と表記する。
現金、現金等価物、制限された現金
Sangamoは、購入日に購入された元の満期日が3ヶ月以下であるすべての高流動性投資を現金等価物とみなす。現金および現金等価物は、現金、普通通貨市場口座内の預金、および米国政府がサポートする実体債務証券を含む。制限された現金は#ドルの信用状で構成されている1.5百万ドルで、カリフォルニア州ブリスベン社の本社を借りる保証金に相当します。
簡明統合貸借対照表に報告されている現金、現金等価物、および限定的な現金と付随する簡明現金フロー表で報告されている金額の入金状況は以下のとおりである(千計) | | | | | | | | | | | | | | | | | | | | | | | |
| 九月三十日
2022 | | 十二月三十一日
2021 | | 九月三十日
2021 | | 十二月三十一日
2020 |
| 現金と現金等価物 | $ | 94,570 | | | $ | 178,872 | | | $ | 176,954 | | | $ | 131,329 | |
| 非流動制限現金 | 1,500 | | | 1,500 | | | 1,500 | | | 1,500 | |
| 現金、現金等価物、および限定現金は、添付の簡明現金フロー表で報告されています | $ | 96,070 | | | $ | 180,372 | | | $ | 178,454 | | | $ | 132,829 | |
最近採用された会計公告
ない。
注2-公正価値計量
当社は公正価値によって一定の基礎に基づいてある金融資産と負債を計量し、現金等価物、有価証券、自由株資産を含む。公正価値は公正価値計量と開示の権威指導の下で三級階層構造によって確定され、公正価値計量に使用される投入優先順位は以下の通りである
レベル1:同じ、制限されていない資産または負債が計量日に得られるアクティブ市場の調整されていないオファー;
第2レベル:資産または負債の全期間にわたって、非アクティブな市場オファーまたは直接または間接的に観察可能な投入;および
第3級:価格や推定技術は公正な価値計量に重要な意義があるが観察できない投入(すなわち、市場活動の支持が少ないかないか)が必要である。
同社の現金等価物および有価証券の公正価値計量は、公正価値システム内の以下のレベルで決定される(千で計算) | | | | | | | | | | | | | | | | | | | | | | | |
| 2022年9月30日 |
| 公正価値計量 |
| 合計する | | レベル1 | | レベル2 | | レベル3 |
| 資産: | | | | | | | |
| 現金等価物: | | | | | | | |
| 貨幣市場基金 | $ | 44,911 | | | $ | 44,911 | | | $ | — | | | $ | — | |
| | | | | | | |
| | | | | | | |
| 合計する | 44,911 | | | 44,911 | | | — | | | — | |
| 有価証券: | | | | | | | |
| アメリカ政府が支援する実体債務証券 | 23,392 | | | — | | | 23,392 | | | — | |
| 商業手形証券 | 120,386 | | | — | | | 120,386 | | | — | |
| 会社債務証券 | 14,888 | | | — | | | 14,888 | | | — | |
| 資産支援証券 | 37,773 | | | — | | | 37,773 | | | — | |
| アメリカ国庫券 | 16,922 | | | — | | | 16,922 | | | — | |
| 預金証書 | 42,337 | | | — | | | 42,337 | | | — | |
| 合計する | 255,698 | | | — | | | 255,698 | | | — | |
| 現金等価物と有価証券総額 | $ | 300,609 | | | $ | 44,911 | | | $ | 255,698 | | | $ | — | |
| | | | | | | |
| | | | | | | |
| | | | | | | | | | | | | | | | | | | | | | | |
| 2021年12月31日 |
| 公正価値計量 |
| 合計する | | レベル1 | | レベル2 | | レベル3 |
| 資産: | | | | | | | |
| 現金等価物: | | | | | | | |
| 貨幣市場基金 | $ | 119,919 | | | $ | 119,919 | | | $ | — | | | $ | — | |
| 合計する | 119,919 | | | 119,919 | | | — | | | — | |
| 有価証券: | | | | | | | |
| アメリカ政府が支援する実体債務証券 | 30,614 | | | — | | | 30,614 | | | — | |
| 商業手形証券 | 105,757 | | | — | | | 105,757 | | | — | |
| 会社債務証券 | 33,682 | | | — | | | 33,682 | | | — | |
| 資産支援証券 | 70,701 | | | — | | | 70,701 | | | — | |
| 預金証書 | 45,091 | | | — | | | 45,091 | | | — | |
| 合計する | 285,845 | | | — | | | 285,845 | | | — | |
| 現金等価物と有価証券総額 | $ | 405,764 | | | $ | 119,919 | | | $ | 285,845 | | | $ | — | |
| | | | | | | |
| | | | | | | |
| | | | | | | |
現金等価物と有価証券
当社では一般に有価証券を2段階に分類しています。あまり活発でない市場で取引されている同じ証券の観察可能な市場価格を使用する場合、ツールは2段階に分類されます。同じ証券の観察可能な市場価格が得られない場合、このようなツールは、基準曲線、同種の証券の基準、業界グループ、行列定価、および推定モデルを用いて価格設定を行う。これらの評価モデルは、価格設定プロバイダまたはブローカー固有であり、基準収益率、報告の取引、ブローカー/取引業者見積、発行者価格差、二国間市場、基準証券、入札、見積、および市場研究出版物を含む参照データを含む多くの情報を含む。いくつかのセキュリティタイプでは、他の入力が使用される場合があり、またはいくつかの標準入力は適用されない場合があります。評価者は、市場状況に応じて任意の日に任意の証券の投入を異なる優先順位付けすることができ、列挙されたすべての投入が任意の日の各証券評価の評価プロセスに使用できるわけではない。
注3-現金等価物と有価証券
次の表は、同社の現金等価物と有価証券(単位:千)をまとめた | | | | | | | | | | | | | | | | | | | | | | | |
| 償却する
コスト | | 毛収入
実現していない
収益.収益 | | 毛収入
実現していない
損 | | 推定数
公正価値 |
| 2022年9月30日 | | | | | | | |
| 資産 | | | | | | | |
| 現金等価物: | | | | | | | |
| 貨幣市場基金 | $ | 44,911 | | | $ | — | | | $ | — | | | $ | 44,911 | |
| | | | | | | |
| | | | | | | |
| 合計する | 44,911 | | | — | | | — | | | 44,911 | |
| 有価証券: | | | | | | | |
| アメリカ政府が支援する実体債務証券 | 23,832 | | | — | | | (440) | | | 23,392 | |
| 商業手形証券 | 120,750 | | | 11 | | | (375) | | | 120,386 | |
| 会社債務証券 | 15,050 | | | — | | | (162) | | | 14,888 | |
| 資産支援証券 | 38,039 | | | 2 | | | (268) | | | 37,773 | |
| アメリカ国庫券 | 16,943 | | | — | | | (21) | | | 16,922 | |
| 預金証書 | 42,478 | | | 5 | | | (146) | | | 42,337 | |
| 合計する | 257,092 | | | 18 | | | (1,412) | | | 255,698 | |
| 現金等価物と有価証券総額 | $ | 302,003 | | | $ | 18 | | | $ | (1,412) | | | $ | 300,609 | |
| | | | | | | |
| 2021年12月31日 | | | | | | | |
| 資産 | | | | | | | |
| 現金等価物: | | | | | | | |
| 貨幣市場基金 | $ | 119,919 | | | $ | — | | | $ | — | | | $ | 119,919 | |
| 合計する | 119,919 | | | — | | | — | | | 119,919 | |
| 有価証券: | | | | | | | |
| アメリカ政府が支援する実体債務証券 | 30,700 | | | 1 | | | (87) | | | 30,614 | |
| 商業手形証券 | 105,792 | | | 7 | | | (42) | | | 105,757 | |
| 会社債務証券 | 33,723 | | | 1 | | | (42) | | | 33,682 | |
| 資産支援証券 | 70,807 | | | 1 | | | (107) | | | 70,701 | |
| 預金証書 | 45,116 | | | 1 | | | (26) | | | 45,091 | |
| 合計する | 286,138 | | | 11 | | | (304) | | | 285,845 | |
| 現金等価物と有価証券総額 | $ | 406,057 | | | $ | 11 | | | $ | (304) | | | $ | 405,764 | |
契約満期日に計算される有価証券の公正価値は以下のとおりである(千で計算) | | | | | | | | | | | |
| 九月三十日
2022 | | 十二月三十一日
2021 |
| 1年以下の期間で満期になる | $ | 218,998 | | | $ | 197,676 | |
| 1年から5年後に期限が切れる | 36,700 | | | 88,169 | |
| 合計する | $ | 255,698 | | | $ | 285,845 | |
いくつありますか違います。2022年9月30日までの3ヶ月と9ヶ月以内に実現した投資販売損益。2021年9月30日までの3ヶ月と9ヶ月以内に、投資販売の達成損益はわずかである。
同社はその投資政策によりそのポートフォリオに関する信用リスクを管理し,購入を高品質の発行者に制限し,そのポートフォリオが単一発行者に投資できる金額を制限している。“会社”ができた違います。T記録は、2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月の有価証券に関連する信用損失または他の減価費用を準備している。
同社は2022年9月30日と2021年9月30日までの3カ月と9カ月で、その有価証券関連の未実現損失を計上している。その会社は重大な未実現損失はなく,単独でも全体的にも販売することができる
2022年9月30日と2021年12月31日まで12カ月連続で赤字を達成していない証券。その投資予定期限に基づき、当社はこれらの投資を一定期間保有する可能性が高く、その償却コスト基盤を回収するのに十分であると判断した。2022年9月30日までの3カ月と9カ月では、証券の未実現収益総額や累積された他の全面収益純収益は重要ではない。未実現損失は信用リスクによるものではなく、市場状況の変化と関係がある。同社は定期的に有価証券を審査し、信用損失の兆候を探している。当社が考慮している要因には,持続時間,価値低下の幅や原因,潜在的な回収期間,証券発行者の信用とその売却意向などがある。有価証券については、委員会も、(I)当社がその償却コスト基準を回収する前に債務証券を売却する必要があるかどうか、および(Ii)信用損失により余剰コスト基準を回収できない可能性があるかどうかを考慮する。当社の保有証券の発行者の信用に重大な悪化があることを示す重大な事実や状況はありません。当社は、当社の当該等証券の審査に基づいて、未実現損失の持続時間と深刻度の評価、及び当社が当該等の投資を満期まで保有する能力及び意図を含めて、当社が決定する違います。有価証券関連の信用損失準備金は2022年9月30日または2021年12月31日に要求される。
注4-1株当たりの基本と償却純損失
Sangamo治療会社の株主が1株当たりの基本純損失を占めるべき計算方法は:Sangamo治療会社株主は純損失をこの期間に発行された普通株の加重平均で割るべきである。Sangamo治療会社の株主が1株当たりの希釈純損失を占めるべき計算方法は、Sangamo治療会社の株主は純損失をこの期間に発行された普通株の加重平均で割るべきであり、それらの影響は逆希釈であるため、潜在的な希釈証券は何も考慮しない。
Sangamo治療会社株主の希釈1株当たり純損失を計算する際には、株式オプションや制限株式単位(“RSU”)に制約された既発行株式総数および発行のために保留された従業員株式購入計画(“ESPP”)株は含まれておらず、これらは逆希釈されている。2022年9月30日と2021年9月30日までに、発行済み株式オプションとRSUおよび発行用に予約されたESPP株の合計18,524,016そして15,838,002それぞれ,である.
注5-大顧客、パートナー関係、戦略同盟
ノワール生物医学研究所です
2020年7月27日、同社はノワール生物医学研究所(“ノワール”)と遺伝子制御療法の研究、開発と商業化について協力と許可協定を達成し、3種類の神経発育障害を治療する。この協定(署名の日から発効)によると、同社は、ノファ社の関連特許および技術に基づいて、特定の亜鉛フィンガータンパク質(“ZFP”)転写因子(“ZFP-TF”)を開発、製造および商業化するために、特定の神経発達障害(自閉症スペクトラム障害および知的障害を含む)に関連する3つの未開示遺伝子について、ノファ社に独占的、特許権使用料および世界的許可を付与する。同社は協力中に遺伝子標的ごとに早期研究活動を行い,このような研究所に必要なZFP−TFを生産し,その費用はノファ社から資金を提供している。ノワール社は他の研究活動を担当し、新薬応用(“IND”)を可能にする研究、臨床開発、監督管理許可、臨床前、臨床と承認製品の製造、及び全世界の商業化を許可した。協定に規定されているいくつかの例外を除いて、同社は、協力対象となる3つの遺伝子のいずれかに対する任意の治療製品を開発、製造または商業化してはならない。ノワール社はまた、同社の特定のアデノ関連ウイルス(“AAV”)を許可することを選択することができ、その唯一の目的は、協力して生成された許可製品を開発、製造、商業化することである
協定によると、ノファ社は同社に$を支払った75.02020年8月の前払い許可料は100万ドルである。この費用と早期研究活動の費用補償のほかに、同社にはノバ社から最高#ドルの収入を得る資格がある420.0百万ドルの発展の一里塚で、最高で300.0百万ドルのビジネスマイルストーンです。同社にはノファ社から協力によるライセンス製品の潜在的な商業純売上高からノファ社等級の高い桁数から10代以下の2桁の印税を稼ぐ資格がある。特許の満了、市場独占性の喪失、および第三者知的財産権のいくつかのライセンスに基づいて支払われる費用により、これらの特許権使用料支払いは減少するだろう。この協定は、適用される特許使用料の期限が満了するまで、個々の製品および国ごとに継続される。ノワール社は、規定された通知期間の後、任意の理由で完全または一つずつ合意を終了する権利がある。双方はもう一方の破産や重大な、未治癒の違約によって合意を中止する権利がある。
本プロトコルにより受け取ったすべての支払いは、稼いだ後、返却できないと貸記できません。成約価格は1ドルです95.1前払い許可料が含まれています75.0100万ドルで研究コストは$と推定されます20.1推定された研究期間内に100万ドルが提供されるだろう。すべての臨床または規制のマイルストーン金額は開始時に完全に制限されていると考えられている
この合意です。制限の評価の一部として、会社は現在のマイルストーンの実現が不確定であり、可変対価格に関する不確実性が解決された後の将来の時期に依存する多くの要因を考慮している。各報告期間内に、不確定イベントが解決された場合、または他の状況が変化した場合、当社は、取引価格に含まれる推定可変対価格およびすべての制限された金額を含む取引価格を再評価する。
同社はASCテーマ606に基づいてノファ社との合意を評価し、ノファ社が顧客であると結論した。同社はこの手配の中で、技術と持続的な研究サービスの許可として単一の履行義務を決定した。同社の結論は、ライセンスは離散的ではなく、合意に基づいて行われる研究サービスを除いて、ノファ社に対して独立した価値がないからである。そこで,会社は継続研究サービスの予想研究期間内の比例表現に基づいて前金の収入を確認した。履行義務やプロジェクトコストの進捗の見積もりは四半期ごとに審査し,必要に応じて調整し,履行義務履行時間に対する会社の現在の仮定を反映させる。2022年9月30日と2021年12月31日までの会社の売掛金は$2.0百万ドルとドル1.9100万ドルと繰延収入は1ドルです17.7百万ドルとドル40.9百万ドルは、それぞれこの合意と関連がある。
プロトコルにより確認された収入は以下のとおりである(千計) | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| ノワール協定に関連した収入: | | | | | | | |
| 前払い許可証料を確認する | $ | 7,582 | | | $ | 9,093 | | | $ | 23,222 | | | $ | 22,852 | |
| 研究サービス | 2,028 | | | 2,421 | | | 6,211 | | | 6,104 | |
| 合計する | $ | 9,610 | | | $ | 11,514 | | | $ | 29,433 | | | $ | 28,956 | |
その会社は$を支払った1.52020年12月31日までの年間財務顧問費は百万ドルで、2% of $75.0ノワール社の協力とライセンス契約に関する前払い許可料は100万ドルを得た。同社は$を確認した1.5契約資産として百万ドルは、このような金額が合意を得るコストを表すからだ。この残高は、ASC主題340によるノワールへのサービス転送に一致するシステムに基づいて償却され、一般的および管理費用に含まれるその他の資産と繰延コスト(“ASCトピック340”)。その会社は$を償却した0.2百万ドルとドル0.52022年9月30日までの3ヶ月と9ヶ月でそれぞれ0.2百万ドルとドル0.52021年9月30日までの3カ月と9カ月でそれぞれ100万ドル。
生物遺伝研究会社
2020年2月、会社はBiogen MA、Inc.(“BIMA”)とBiogen International GmbH(BIMAと共に、“Biogen”)と協力と許可協定を締結し、神経系疾患を治療するための遺伝子制御療法を研究、開発し、商業化した。両社は同社がAAVが提供する独自のZFP技術を利用して神経疾患に関与するキー遺伝子の発現を調節する計画である。提携契約を実行するとともに、当社はBIMAと株式購入プロトコルを締結し、これによりBIMAは購入に同意します24,420,157会社普通株(“生物遺伝株”)、1株当たり価格は$9.2137購入総価格は約$です225.0百万ドルです。
協力協定は、改正された1976年の“ハート-スコット-ロディノ反トラスト改良法”に基づいて待機期間を終了した後、2020年4月に発効し、#ドルの支払いを含む他の慣例成約条件を満たした225.0100万ドルは生物遺伝会社の株式を購入するために使われています
協力協定に基づき,生物遺伝会社は同社に#ドルのライセンス料を前払いした125.02020年5月までに、この数字は100万だ。その会社には研究、開発、監督と商業マイルストーンの支払いを得る資格があり、総額は約ドルに達する可能性があります2.410億ドル、Biogenがプロトコルによって許可されたすべての目標を選択し、合意に規定されたすべての指定されたマイルストーンを達成した場合、最高可達$を含む925.0百万ドルの承認前のマイルストーン支払いとガンダム1.5最初の商業販売と他の販売ベースのマイルストーン支払いは10億ドルだった。また、同社は協力によるライセンス製品の潜在的な商業純売上高から1桁から10代以下の等級別高額印税を得る資格がある。特許の満了、生物類似製品の市場進出、およびいくつかの第三者知的財産権ライセンスに基づいて支払われる費用により、これらの特許権使用料は減少する可能性がある。
協力協定によれば、同社は、生物遺伝会社によって選択された特定の神経疾患遺伝子標的のためのいくつかのZFPおよび/またはAAV製品を開発、製造および商業化するために、その関連する特許および技術に基づいて、生物遺伝会社に独占的、特許使用料および世界的許可を付与する。生物遺伝会社は、筋萎縮性側索硬化症の治療のためのST-501、パーキンソン病を含む同型核病の治療のためのST-501、DM 1に対する第3の候補製品、神経筋疾患、および第4の不開示神経疾患遺伝子標的のうちの4つを選択している。生物遺伝会社は最も多く指名する権利があります
7人残りの時間内の追加目標5年協力協定の発効日から始まります。生物遺伝会社が選択した各遺伝子目標について、同社は早期研究活動を行い、費用は両社が分担し、独自の中枢神経系送達ベクターと治療関連遺伝子に対するZFP-TF(または潜在的他のZFP製品)との組み合わせを開発することを目的としている。生物遺伝会社はIND使能研究、臨床開発、関連する監督管理相互作用と全世界商業化の責任とコストを担っている。同社は初の臨床試験の製造活動を担当している三つ同社は引き続き協力製品を開発し、現在開発中の内部製造能力を適宜利用する予定だ。生物遺伝研究会社は初回臨床試験以外の生産活動を担当している三つ製品です。会社のいかなる目標に対する研究活動も一定期間以内に行われるだろう7年になる協定が発効した日から(すなわち2027年4月まで)。協力協定に規定されているいくつかの例外を除いて、同社は、生物遺伝会社が選択した目標のための任意の治療製品の開発、製造、または商業化を禁止されている。
協力協定は,適用されるすべての印税条項が満了するまで製品や国/地域で継続して行われる.生物遺伝は、規定された通知期間の後、任意の理由で全部または一つずつ協力プロトコルを終了し、置換する権利がある10個目標です。いずれにしても、他方の破産または重大な違約行為によって本合意を終了する権利がある。また,生物遺伝会社が当社が生物遺伝研究会社に付与した任意の特許に異議を唱えた場合,同社は協力協定を終了することができる。
株式購入契約の条項によると、生物遺伝は、当社の事前書面による同意を得ていない場合及び特定の条件及び例外を満たす場合には、当社が発行した普通株の株式を直接又は間接的に買収すること、要約買収又は交換要約又は双方間の合併を求めるか、任意の事項について依頼書又は同意を求めるか、又は当社の追加株式を潜在的に買収することに関連する他の指定行動を行うことに同意している。このようなポーズ制限は,次の日付の早い時間に満了する3年制協力協定発効記念日とBiogen実益は5会社普通株の%を占めています。
同社はASCテーマ606に基づいて生物遺伝会社との協力協定を評価し,生物遺伝会社が顧客であると結論した。成約価格は1ドルです204.6前払い許可料が含まれています125.0100万ドルと株式購入による追加対価格$79.6百万ドルはドルと225.0生物遺伝株を購入した100万ドルと145.4発行された株式の推定公正価値は百万ドルである。生物遺伝会社に発行される株式はオプション定価モデルを用いて推定され、ある保有期間制限を反映する。これらのすべての金額が完全に制限されているので、すべての目標選択費用と臨床または規制マイルストーンは取引価格に含まれていない。制限の評価の一部として、当社は、現在追加目標の指名やマイルストーンの実現が不確定であり、可変対価格に関する不確実性が解決されている将来の時期に依存する多くの要因を考慮している。不確定事件が解決された場合や状況が他に変化した場合、会社は取引価格を再評価する。
同社は生物遺伝研究会社の協力協定の中で単一の履行義務を決定し,一連の異なる研究サービス日を含む随時利用可能な義務であり,その間,生物遺伝研究会社は会社のライセンスと研究資源を取得した。前払い許可料の収入は,許可取得および会社がBiogen選択の目標に対応した研究サービスを随時準備することが義務付けられている。契約期間内に要求時に研究サービスを提供する義務があるため,前払い許可料と株式購入の追加対価格は一定期間直線的に確認され,研究サービス提供予定資源と一致し,2027年4月,すなわち予定義務期間となる。予定されている履行期間は四半期ごとに審査され、必要に応じて調整され、会社の現在の交付時間の仮定を反映する。生物遺伝会社によるSangamoによる早期研究活動の分担費用の精算収入は研究サービスを行うことが確認された。2022年9月30日と2021年12月31日までの会社の売掛金は$1.7百万ドルとドル2.8100万ドルと繰延収入は1ドルです132.1百万ドルとドル154.0百万ドルは、それぞれこの合意と関連がある。
プロトコルにより確認された収入は以下のとおりである(千計)
| | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| Biogen協定に関連した収入: | | | | | | | |
| 認可免許と予備費 | $ | 7,306 | | | $ | 7,306 | | | $ | 21,918 | | | $ | 21,918 | |
| 研究サービス | 2,107 | | | 3,661 | | | 8,740 | | | 10,266 | |
| 合計する | $ | 9,413 | | | $ | 10,967 | | | $ | 30,658 | | | $ | 32,184 | |
その会社は$を支払った7.02020年12月31日までの年間財務顧問費は百万ドルで、2% of $225.0株式を売却して得た百万元と2% of $125.0前払い費用は100万ポンドです。発生する費用は以下の点と関係がある
バイオ遺伝会社との協力協定と株式売却の株式購入協定。当社は、相対的に公正な価値で2つの合意の間に費用を分配することが合理的だと考えている。同社は$を確認した4.1百万というのは2出来高のパーセントは$です204.6契約資産として百万ドルです。この残高はASCテーマ340の規定に従い,生物遺伝研究会社にサービスを移行する場合に応じて,システムに基づいて償却して一般と行政費用を計上する。その会社は$を償却した0.1百万ドルとドル0.42022年9月30日までの3ヶ月と9ヶ月でそれぞれ0.1百万ドルとドル0.42021年9月30日までの3カ月と9カ月でそれぞれ100万ドル。同社は$を確認した2.9百万ドルというのは2ドルのパーセント145.41,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,000,
凧製薬会社
2018年2月、同社はギリッド科学社の子会社Kite Pharma,Inc.(“Kite”)と2018年4月5日(“発効日”)に発効し、潜在的な癌工学細胞療法を研究·開発し、商業化するための2019年9月に改訂·再記述したグローバル協力および許可協定を締結した。今回の協力で、SangamoはKiteと協力して研究計画を展開しており、この計画によると、両社はキメラ抗原受容体(CARS)、T細胞受容体(TCR)とNK細胞受容体(NKRs)をコードする遺伝子を挿入して挿入することを含む、T細胞およびナチュラルキラー細胞(NK細胞)のいくつかの遺伝子を妨害して挿入するために、亜鉛指ヌクレアーゼ(ZFN)とウイルスベクターを設計している。Kiteはすべての臨床開発、製造、そして任意の最終製品の商業化を担当している。
本協定の条項によれば、当社は、当社の関連特許及びノウハウに基づいて、癌の治療のための特定の細胞治療製品の開発、製造、商業化のための独占的、印税付き、世界的に再許可可能なライセンスをKiteに付与し、これらの製品は、研究計画および工学設計の特定の細胞治療製品からの可能性がある離体する候補標的に対するCAR,TCRまたはNKRは,選定されたZFNとこの研究計画に従って開発されたウイルスベクターを用いて発現された。
研究計画期間内に、ある例外を除いて、当社は癌治療目的でいかなる細胞治療製品を研究、開発、製造、商業化してはならず、その結果、離体するヒト癌細胞上またはその中に発現する標的に対するCAR、TCRまたはNKRを発現するゲノム編集。研究計画期間が終了した後、会社はいくつかの例外を除いて、癌治療の目的のために以下のような理由で産生される細胞治療製品の開発、製造、商業化を禁止される離体するゲノム編集は,候補標的に対するCAR,TCRまたはNKRを発現する。
発効日後、当社は1ドルを受け取りました150.0Kiteは百万ドル前払いした。また,Kiteは会社が共同研究プロジェクトを展開している直接費用を精算している。Sangamoには開発や販売に基づくマイルストーン支払いを受ける資格があり、総額は$に達する可能性があります3.0この協定で規定されたすべての具体的なマイルストーンが達成されれば10億ドル。このお金のうち約$は1.3特定の研究、臨床開発、規制、および初の商業販売マイルストーンのための10億ドル、および約ドル1.8特許製品の世界的な年間純売上高が特定の水準に達すると、10億ドルは特定の販売に基づくマイルストーンの実現につながる。各開発·販売に基づくマイルストーン支払い(I)は、当該ライセンス製品が関連するマイルストーンイベントを達成した回数にかかわらず、許可製品毎に1回のみ支払われ、(Ii)は1回目のみである10このようなマイルストーンイベントを実現することが可能なライセンス製品の数を考慮することなく、関連マイルストーンイベントの回数を実現する。また、同社は将来のライセンス製品の世界的な年間純売上高に応じて、桁数の割合で段階的に増加する特許使用料を得る権利がある。特許の満了、生物類似製品の市場進出、およびいくつかの第三者知的財産権ライセンスに基づいて支払われる費用により、これらの特許権使用料は減少する可能性がある。
合意における初期研究条項は6年発効日からです。Kiteは研究期間を延長する権利がある二つその他の内容1年制期間中は別途前払い料金をいただきます10.0年間百万ドルです。本プロトコル項の下のすべてまたは支払いがあり、稼いだ後、返却および貸記できません。2019年9月の協定の改正と再記述について、会社はKiteと新たな研究計画を締結し、精算可能なサービス費用は約#ドルと見積もられている3.4総出来高に含まれる百万ドルです。同社の本契約による取引の総価格は$である189.3前払い許可料を含めて百万ドルです150.0百万ドルとドル39.3推定実行期間内に,決定された研究プロジェクトの推定返済可能サービス料は100万ドルである。また,同社は,研究期間延長オプションの行使を推定する推定費用とすべてのマイルストーン金額が完全に制限されていると結論している。制限の評価の一部として、会社は現在のマイルストーンの実現が不確定であり、現在の不確定な未来のイベントに依存することを含む多くの要因を考慮している。各報告期間内に、不確定イベントが解決された場合、または他の状況が変化した場合、会社は、取引価格に含まれる推定可変対価格およびすべての制限された金額を含む取引価格を再評価する。開発と販売に基づくすべてのマイルストーン支払いは取引価格に含まれていない。
会社はASCテーマ606に基づいてKiteとのプロトコルを評価し、Kiteが顧客であると結論した。Kiteは、指定された通知期間の後、本プロトコルのすべての内容または各ライセンス製品または各候補ターゲットを任意の理由で終了する権利がある。いずれにしても、他方の破産または重大な違約行為によって本合意を終了する権利がある。
同社は,Kiteプロトコルにおける主な履行義務は,(1)技術ライセンスおよび研究サービスを随時準備する義務と,(2)継続的な研究サービスであることを決定している。前期ライセンス料の収入は,Kiteがより多くの目標を選択しているため,許可取得や会社が随時このような研究サービスを実行する義務があることに関係している。契約期間内に要求に応じて研究サービスを提供することが義務付けられているため,ライセンスと待機義務の費用は時間の経過とともに直線的に確認され,2024年4月,すなわち待機義務の推定期限までとなる。総合サービス提供可能に関する償還可能費用の収入は,研究サービスを提供する際に確認した。これらのスケジューリングに関するコストと支出は従来から確認されている収入に近い.予想される業績期間とプロジェクトコストは四半期ごとに審査され、必要に応じて調整され、企業の現在の成果交付時間の仮定を反映する。2022年9月30日と2021年12月31日までの会社の売掛金は$0.6百万ドルとドル0.1100万ドルと繰延収入は1ドルです37.8百万ドルとドル56.5百万ドルは、それぞれこの合意と関連がある。
プロトコルにより確認された収入は以下のとおりである(千計) | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| 凧協定に関連した収入: | | | | | | | |
| 認可免許と予備費 | $ | 6,296 | | | $ | 6,296 | | | $ | 18,682 | | | $ | 18,682 | |
| 研究サービス | 619 | | | 113 | | | 875 | | | 339 | |
| 合計する | $ | 6,915 | | | $ | 6,409 | | | $ | 19,557 | | | $ | 19,021 | |
セノフィ社
同社は2014年1月、ベータ地中海貧血と鎌状細胞病(“SCD”)に対する治療法を開発するための独占的なグローバル協力と許可協定(“2014協力協定”)を締結した。2014年の協力協定は最初にBIMAと署名され、BIMAはその後Bioverativ Inc.に譲渡され、後者はその後サイノフィによって買収された。2014年の協力協定によると,同社は最初に共同で行った二つ研究計画:2021年第3四半期に停止したベータ地中海貧血計画と,SAR 445136(現在BIVV 003)の開発につながるSCD計画であり,SCD治療のためのZFN遺伝子編集細胞治療製品候補であり,現在も行われている。セノフィは2021年12月、便宜上2014年の提携契約の終了を当社に通知し、2022年6月28日(“終了日”)から発効します。双方は2022年9月6日に終了と移行協定(“終結と移行協定”)に署名した。
SCD計画では,同社とセノフィはIND申請前に共同で研究·開発活動を担当しているが,セノフィはその後プロトコルに従って開発された特許製品の世界的な臨床開発,製造,商業化を担当している。協定条項に適合した場合、会社はセノフィに独占的で特許使用料を徴収する権利を付与し、会社が制御するいくつかのZFPおよび他の技術を使用して、合意に基づいて開発された特許製品を研究、開発、製造し、商業化する権利がある。同社はまた、セノフィの世界規模での非独占的、免版税の全額許可を付与し、同社が同協定に基づいて開発したいくつかの他の知的財産権の権益に基づいて再許可を付与する権利がある。契約期間内に、契約を除いて、会社は、許可製品に関連する遺伝子に対するいくつかの遺伝子治療製品を研究、開発、製造、または商業化してはならない。
協定によると、会社は前払い許可料#ドルを受け取った20.0指定された臨床開発,規制,販売マイルストーンに達した場合には,追加支払いを受ける資格があり,特許製品ごとの純売上高に応じて支払う特許権使用料を得る資格がある。セノフィはまた,SangamoがSangamoと行った研究や開発活動に関する合意費用を返済する。終了日まで、合計$13.5臨床開発マイルストーンの成果によると、すでに100万件を受け取った違います。製品が承認されたので違います。2014年の協力協定によると、すでに印税費用を稼いでいるか、または徴収される。
サイノフェイは同社への終了通知で,その終了はサイノフェイの戦略方向の変更に関連しており,自己個人化細胞療法ではなく同種異体汎用ゲノム薬物法に重点を置いていると述べている。終了日から2014年の協力協定はすべて終了し、終了日から、当社はセノフィから記念碑的な支払いや特許使用料を得る権利がない。終了日まで、セノフィは2014年の協力協定に基づいて開発や開発を援助する義務はありません
2014年の協力協定の下での協力研究計画。2014年の協力協定によりセノフィに付与されたライセンスは終了し、ライセンス権は会社に回復された。
終了および移行協定の一部として、セノフィは、独占的、世界的に全額支払い、印税免除、永久的、取消不可能な許可を同社に付与し、SCD計画下で開発、製造、使用、販売、および他の方法でBIVV 003を商業化する権利がある。同社は,行われている臨床試験や関連する長期後続研究の完成を含めて,BIVV 003に関連するすべての臨床試験の責任を負うことに同意した。同社はまたBIVV 003に関するすべての規制責任を担っている。セノフィは同社にガンダムを提供することに同意しました90BIVV 003のすべてのファイル、材料、第三者と締結された契約、およびセノフィが所有するBIVV 003関連デバイスの使用権。
セノフィは,行っているBIVV 003臨床試験の費用および2023年12月31日までの長期後続研究の費用を同社に補償することにも同意し,最高で#ドルに達する7.0百万ドルです。また,会社が2023年12月31日以降にBIVV 003の開発を継続しないことを選択した場合,セノフィは2023年後に発生した長期後続研究費を会社に返済する義務があり,最高で$に達する5.3百万ドルです。サイノフェイの清算義務は、BIVV 003との第三者との協力、協力、販売、許可または剥離について締結された契約を含む、いくつかのトリガイベントが発生したときに終了するか、またはFDAが臨床試験および/または長期後続研究の早期閉鎖を許可する場合を含む。
同社はASCテーマ606に基づいて2014年のセノフィとの協力協定を評価し、この合意によると、セノフィは顧客であると結論した。同社はこの手配における履行義務を,継続的な研究サービス活動と組み合わせた技術許可として決定している。同社の結論は、ライセンスは明らかではありません。研究サービスがなければ、セノフィに価値がないからです。そこで,会社は進行中の研究サービスの業績進展に基づいて前金とマイルストーンの収入を確認した。履行義務やプロジェクトコストの履行における進捗推定は、四半期ごとに審査され、必要に応じて調整され、会社の当時の交付時間に関する仮定を反映する。これらのスケジューリングに関するコストと支出は従来から確認されている収入に近い.セノフィ2021年12月に発行された2014年の協力協定の終了通知は、会社が予想するサービス範囲を縮小し、取引価格を推定し、残りの履行スケジュールを短縮する改正である。この変更と一致したのは,2014年の連携協定でのすべてのサービスが2022年6月28日までに完了し,最終的に取引価格に含まれるすべての金額がその日までに確認されたことである.最終成約価格は$96.3前払い許可料が含まれています20.0百万、二つの記念碑的な支払い、合計金額は$です13.5100万ドルで研究費を精算します62.8百万ドルです。2022年9月30日と2021年12月31日までの会社の売掛金はゼロそして$0.62014年の協力協定にそれぞれ関連した100万ドル。2014年の協力協定に関する繰延収入はゼロそして$1.1それぞれ2022年9月30日と2021年12月31日まで。
当社の結論は,終了と移行プロトコルにより,セノフィは顧客ではなく,セノフィが得られなくても進行中の臨床試験や長期後続研究の結果を用いることができないためである。この関係はASCトピック808の範囲内の連携でもない協力手配それは.同社の結論は、セノフィから買収された資産は事業を代表するものではなく、これらの資産のほとんどの価値が取得または再取得された知的財産権許可に集中しているからである。同社にはセノフィが行っている臨床試験や長期後続研究費の返済義務はない。そこで,同社はセノフィの補償をその研究開発費の減少として確認した。2022年9月30日までの3ヶ月と9ヶ月で、会社は研究開発費ドルを削減した0.9会社の2022年9月30日現在の簡明総合貸借対照表上の前払い費用およびその他の流動資産に含まれる100万ドル
2014年の協力協定に基づいて確認された収入は以下の通り(千計) | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| セノフィ協定に関連した収入: | | | | | | | |
| 前払い料金を確認する | $ | — | | | $ | (1,125) | | | $ | 677 | | | $ | (692) | |
| 研究サービス | — | | | 1,125 | | | 2,126 | | | 2,417 | |
| 記念碑的業績 | — | | | (759) | | | 457 | | | (467) | |
| 合計する | $ | — | | | $ | (759) | | | $ | 3,260 | | | $ | 1,258 | |
2021年9月、セノフィとの協力協定の見積もりが変化したため、同社は収入調整を記録した。この調整は,ベータ地中海貧血レジメンのプロジェクト費用の増加と,SCDレジメンのプロジェクト範囲とそれに応じた費用の増加により,両者とも減少したためである
比例累積業績の測定では。この調整は収入を1ドル減少させた2.5百万ドル純損失増加$2.5100万ドルで会社の1株当たり基本的に希釈して純損失を増加させました0.022021年9月30日までの3ヶ月と9ヶ月。
ファイザー。
Giroctocogene Fitelparvovecグローバル連携とライセンスプロトコル
2017年5月、当社はファイザー(“ファイザー”)と独占的なグローバル協力及び許可協定を締結し、これにより、当社は血友病Aを治療する遺伝子治療製品Fitelparvovec及びその密接に関連する製品の研究、開発及び商業化について協力関係を構築した。
この協定によると、同社は1/2期臨床試験とある癌原遺伝子fitelparvovecの製造活動を担当し、ファイザー社はその後全世界範囲で原癌遺伝子fitelparvovecの開発、製造、マーケティングと商業化を担当している。Sangamoはまた、他のAAVに基づく血友病A遺伝子治療製品を協力して研究開発することも可能である。
協定条項によると、会社はファイザーに独占的なグローバル特許使用料許可を付与し、会社が制御するいくつかの技術を使用してgirococogene fitelparvovecおよびその関連製品を開発、製造、商業化する権利がある。ファイザーは同社に非独占的で世界的に、印税免除、全額支払いの許可を付与し、プロトコルに基づいて開発されファイザーによって制御されたいくつかの製造技術を用いてAAV交付システムを使用した会社製品を生産する権利がある。特定の時期に、同社とファイザー社は協力以外の臨床でいくつかのAAVに基づく血友病A遺伝子治療製品を開発或いは商業化してはならない。
以前に終了しない限り、本協定の期限は、各製品及び各国を基礎として、(I)一国で製品をカバーする特許権が満了するまで、(Ii)一国における製品の規制排他性が満了するまで、及び(Iii)15年ある国の製品が初めて商業販売された後。ファイザーは、理由なしに合意全体を終了するか、製品または国/地域で合意を終了する権利がある。合意は、他方が治癒していない実質的な違約または他方の破産に基づいていずれか一方によって終了することもできる。いかなる理由でも終了すると、当社がファイザー社にgiroctocogene fitelparvovecおよび関連製品の開発、製造、商業化を付与するライセンスは自動的に終了します。会社が任意の1つまたは複数の国または地域で原因またはファイザー会社の契約を終了するとき、ファイザー社は、終了された1つまたは複数の国/地域でgiroctocogene fitelparvovecを開発、製造、および商業化するために、ファイザー社が制御するいくつかの技術に従って自動的に会社に独占的、印税付きの許可を付与する。
契約を実行する際、会社は前払い費用#ドルを受け取る70.0100万ドルで最高$を得る資格があります208.5特定の臨床開発、知的財産権、規制マイルストーンの実現に基づいて百万ドルを支払い、最高で$に達する266.5Giroctocogene fitelparvovecと可能な他の製品の最初の商業販売マイルストーンに100万ドルを支払います。契約に規定されているすべてのマイルストーンを実現すると仮定して、潜在的な臨床開発、知的財産権、規制、および最初の商業販売マイルストーンの支払い総額は最大で$に達することができます475.0100万ドルに達しています300.0Giroctocogene fitelparvovecに100万ドルを提供し、最高$に達する175.0協定によって開発可能な他の製品の費用は100万ドルであるが、第三者知的財産権のいくつかのライセンスによって支払われる費用は減少する。さらに、ファイザーは、特許満了、生物類似製品の市場進出、およびいくつかの第三者知的財産権ライセンスに基づいて支払われる費用が減少する可能性があるため、合意に基づいて開発された各潜在的許可製品のために会社に印税を支払うことに同意した。今までのところ二つマイルストーン:$55.0しかし合計100万ドルを支払いました違います。製品が承認されたので違います。合意に基づいて、特許使用料を稼いだ。
同社はASC主題606に基づいてファイザーとの合意を評価し、ファイザーは顧客であると結論した。本契約項の下の取引総価格は$である134.0百万ドル、その中に前払い費用と研究サービス料が含まれています#ドル79.0百万元と以下に関連する費用二つ取得したマイルストーンの総金額は#ドル55.0百万ドルです。Sangamoは内部と外部の研究費用を担当し、前払い費用の一部として、ある条件を満たしていれば、Sangamoはファイザー社に追加精算を要求する権利がある。取引価格には制限された臨床的または規制的なマイルストーンはない。規制の評価の一部として、会社は当時のマイルストーンの実現が不確定であり、可変対価格に関する不確実性が解決された将来の期間に依存するなど、多くの要因を考慮している。各報告期間内に、不確定イベントが解決された場合、または他の状況が変化した場合、会社は、取引価格に含まれる推定可変対価格およびすべての制限された金額を含む取引価格を再評価する。
同社は協定における履行義務を技術と持続的な研究サービスのライセンスとして決定している。同社は、契約に基づいて会社が実行する研究サービスを除いて、ファイザー社に対して独立した価値がないため、ライセンスは離散的ではないと結論している。会社は認識しています
継続研究サービスの割合で支払われた前金の収入に基づいて、2020年まで、会社は研究サービスを提供しています。その履行義務やプロジェクトコストの進捗状況の見積りを四半期ごとに審査し,必要に応じて企業の成果交付時間の仮定を反映するように調整した。
2020年12月、会社は手配内の成果の交付と研究サービスの責任を果たした。そこで、会社は2020年12月に前払いの余剰繰延収入を確認し、違います。収入は2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月以内に確認された。
C 9 ORF 72研究連携とライセンスプロトコル
2017年12月、当社はファイザーと潜在遺伝子治療製品の開発と商業化について単独の独占的なグローバル協力と許可プロトコルを締結し、これらの製品はZFP-TFSを用いて筋萎縮性側索硬化症と遺伝子変異に関連する前頭側頭葉変性を治療したC 9 ORF 72ジーン。この合意によると、同社は、変異形態のZFP-TFの発現を決定、表現、および臨床前開発に結合し、特に減少させるために、ファイザー社と協力して研究計画に同意するC 9 ORF 72ジーン。
本協定の条項によると、会社は、予め合意された基準に適合したZFP−TFの遺伝子治療製品の開発、製造、商業化のために、会社の関連特許及びノウハウに基づいてファイザーに独自の印税負担のあるグローバルライセンスを付与している。特定の期間内に、当社とファイザーはいずれも協力以外に研究、開発、製造、または商業化のいずれもしてはならないC 9 ORF 72ジーン。
以前に終了しない限り、本協定の期限は、(I)国/地域におけるライセンス製品をカバーする特許請求の期限が満了するまで、(I)国/地域におけるライセンス製品の排他的規制が満了するまで、(Ii)ライセンス製品の国/地域における排他的規制が満了するまでである15ライセンス製品が主要市場国で初めて商業販売された数年後。ファイザーはまた、理由なしに合意全体を終了するか、製品または国/地域で合意を終了する権利がある。合意は、他方が治癒していない実質的な違約または他方の破産に基づいていずれか一方によって終了することもできる。特定の期間内に任意の主要候補者を決定して開発を行うことができない場合、またはファイザー社が特定の期間内にリード候補を特定の開発マイルストーンを超えて引き上げないことを選択した場合、合意も終了する。いかなる理由でも終了すると、当社が合意に基づいてファイザー社に開発、製造、商業化許可製品を付与するライセンスは自動的に終了します。任意の特許製品または特許製品によっていずれか1つまたは複数の国または地域が会社または輝瑞によって無断で終了された場合、会社は、終了された1つまたは複数の国/地域で製品を開発、製造、および商業化するために、ファイザーによって制御される特定の技術下の非独占的で印税の許可を得る権利があるであろう。
ファイザーが重大な違約で会社に中止された後、ファイザーは研究、開発、製造、或いは商業化専門に許可されないC 9 ORF 72遺伝子にはしばらく時間がありますファイザーが会社の重大な違約によって終了した後、会社は研究、開発、製造或いは商業化の専門とすることを許可されないC 9 ORF 72遺伝子にはしばらく時間があります
その会社は1ドルを受け取った12.0ファイザーから100万ドルの前金を得て最高$を得る資格があります60.0ファイザー社は特定の臨床前開発、臨床開発と最初の商業販売マイルストーンの実現状況に基づいて100万ドルの開発マイルストーン支払いを支払い、最高で90.0ライセンス製品の世界的な年間純売上高が指定水準に達した場合、百万ドルの商業マイルストーン支払いを受けることができる。また、ファイザーはライセンス製品の世界の年間純売上高の増加、中から高い桁までの割合に応じて会社に特許使用料を支払う。特許の満了、生物類似製品の市場進出、およびいくつかの第三者知的財産権ライセンスに基づいて支払われる費用により、これらの特許権使用料は減少する可能性がある。すべての当事者たちはそれが研究計画を実行する費用に責任があるだろう。ファイザー社はライセンス製品の後続開発、製造、商業化の運営と財務責任を担当する。これまでのマイルストーンは$5.0しかし100万ドルを達成して支払いました違います。製品が承認されたので違います。特許使用料はC 9 ORF 72ファイザーの合意。
同社はASC主題606に基づいてファイザーとの合意を評価し、ファイザーは顧客であると結論した。同社は,本契約での取引総価格は$であると結論した17.0百万ドルは前払い費用に相当します12.0百万ドルとマイルストーンの実現に関連した費用は$です5.0百万ドルです。取引価格には制限された臨床的または規制的なマイルストーンはない。規制の評価の一部として、会社は当時のマイルストーンの実現が不確定であり、可変対価格に関する不確実性が解決された将来の期間に依存するなど、多くの要因を考慮している。当社は、各報告期間内に、不確定イベントが解決された場合、または他の状況が変化した場合に、取引価格に含まれる推定可変対価格およびすべての制限された金額を含む取引価格を評価する。
同社は本協定における履行義務を技術と継続研究サービスのライセンスとして決定している。同社は、契約に基づいて会社が提供するサービスを除いて、ファイザー社に対して独立した価値がないため、ライセンスは離散的ではないと結論した。そこで,会社は継続研究サービスの割合に基づいて前金の収入を確認し,2020年まで,すなわち会社が研究サービスを提供するまでの期間を示した。
同社は2020年9月に手配中の成果と研究サービスの責任を果たしたため、1ドルを稼いだ5.0百万マイルストーンは、会社が2020年12月31日までの年間累計でこの数字を確認している。また、当社は2020年9月に前払いの残り繰延収入を確認し、違います。収入は2022年9月30日と2021年9月30日までの3ヶ月と9ヶ月以内に確認された。
注6-株に基づく報酬
次の表に統合作業報告書に含まれる在庫に基づく報酬費用総額(千単位)を示す: | | | | | | | | | | | | | | | | | | | | | | | |
| 3か月まで
九月三十日 | | 9か月で終わる
九月三十日 |
| 2022 | | 2021 | | 2022 | | 2021 |
| 研究開発 | $ | 4,395 | | | $ | 4,935 | | | $ | 13,656 | | | $ | 14,645 | |
| 一般と行政 | 3,398 | | | 2,938 | | | 9,746 | | | 10,235 | |
| 株式に基づく報酬総支出 | $ | 7,793 | | | $ | 7,873 | | | $ | 23,402 | | | $ | 24,880 | |
注7-株主権益
市場で協定を発売する
二零二年八月、当社はJefferies LLC(“Jefferies”)と市場発売計画について公開市場販売協定を締結し、この計画により、当社は時々適宜、発行価格が$に達する当社の普通株式を一任することができる150.0ジェフリーを通じて会社の販売代理や依頼人とします。売却契約によると、当社はいかなる株式も売却する義務はありません。2022年9月30日までの3ヶ月と9ヶ月以内に会社が販売しました8,483,104そして14,711,770普通株で、純収益は約$です42.2百万ドルとドル66.4それぞれ100万ドルですそのうちの約4割は0.62022年10月に100万ドルを受け取り、2022年9月30日現在の会社簡明総合貸借対照表の前払い費用および他の流動資産に記録されている。2021年9月30日までの3ヶ月と9ヶ月以内に会社が販売しました202,705そして2,007,932普通株で、純収益は約$です2.4百万ドルと$27.1それぞれ100万ドルです
注8-所得税
当社の中期所得税引当金は、その年間有効税率の推定に基づいて決定され、その期間に出現する独立項目(ある場合)を調整した。当社は四半期ごとに年間有効税率の見積もりを更新し、推定された年間有効税率が変化すれば、当社はその間に累積調整を行う。2022年9月30日までの3ヶ月と9ヶ月以内に、会社が記録した所得税支出は10万ドルと0.2それぞれ100万ドルです2021年9月30日までの3ヶ月と9ヶ月以内に、会社が記録した所得税支出は0.1百万ドルとドル0.4それぞれ100万ドルです
同社は米国連邦と州繰延税項目の純資産およびSangamo France繰延税項目の純額に対して全額推定手当を維持し続けており、同社はこれらのメリットが実現できないと考えているからだ。2022年9月30日までの3ヶ月と9ヶ月の税収支出は主に外国所得税支出によるものである。
2020年3月27日に公布された“コロナウイルス援助、救済と経済安全法案”は従業員の留任控除を提供し、これは払戻可能な賃金税の免除であり、企業が新冠肺炎流行中に従業員を保留することを奨励する。条件を満たした雇用主は、2020年3月12日以降から2021年1月1日までに支払われたいくつかの賃金に基づいて、従業員1人当たり最高5000ドルのクレジットを取得し、2021年9月30日まで延長することができる。この経費に対する会社の評価や大流行病に関する業務が受ける重大な影響に基づいて,会社は認識しているゼロそして$3.02022年9月30日までの3ヶ月と9ヶ月のERCはそれぞれ利息とその他の収入であり、2022年1月と4月に返金を申請する際に簡明総合経営報告書で純額となる違います。2022年9月30日までの3ヶ月および9ヶ月の間に返金を受けており、金額は2022年9月30日までの当社簡明総合貸借対照表の前払い支出及びその他の流動資産に記入されている。
2022年8月16日、2022年に“インフレ低減法案”が署名されて法律となり、税収条項は主に世界調整後の財務諸表収入に対して15%の最低税率を実施し、株式買い戻しに1%の消費税を課すことに集中している。2022年の“インフレ率低減法案”は2023年から発効する。最近の声明を受けて、2022年のインフレ低減法案が会社の税率や財務業績にどのような影響を与えるかは不明である(あれば)。現在、当社は総合監査財務諸表が実質的な影響を受けることはなく、さらなる情報を得た後もその影響を評価し続けると予想されています。
項目2.経営陣の財務状況と経営成果の検討と分析
“経営陣の財務状況と経営結果の討論と分析”の討論には傾向分析、推定、その他の前向きな陳述が含まれており、改正後の1933年証券法第27 A節と改正後の1934年取引法第21 E節の意味に合致している。これらの前向き陳述は、“予想”、“信じる”、“継続”、“可能”、“推定”、“予想”、“意図”、“可能”、“計画”、“求める”、“すべき”、“会する”などの語彙を含む表現、およびこれらの語彙または表現の他の類似した意味または否定的な意味を含むが、これらに限定されない。このような展望的陳述は、既知および未知のリスク、不確実性、推定および他の要素の影響を受けることができ、これらのリスク、不確実性、推定および他の要素は、私たちの実際の結果、表現または成果または業界結果をもたらす可能性があり、そのような前向き陳述が明示的または暗示する任意の未来の結果、表現または成果とは大きく異なる。実際の結果は、第1部1 A項に記載された“リスク要因”と、2022年2月24日に米国証券取引委員会に提出された2021年12月31日現在のForm 10−K年次報告または2021年年次報告に記載されている“リスク要因”と、本四半期報告第II部第1 A項に記載されたリスクとが異なるため、前向き陳述で述べられた結果と大きく異なる可能性がある。また、以下の議論および分析、および本報告に含まれる簡明な総合財務諸表および付記、ならびに2021年年報に含まれる総合財務諸表およびその付記を読む必要があります。
概要
我々は臨床段階の遺伝子薬物会社であり,画期的な科学を薬物に変換し,重篤な疾患を有する患者と家庭の生活を変えることに取り組んでいる。私たちは私たちの新しい科学と私たちの内部製造能力を利用して、私たちの臨床と臨床前候補製品を開発することでこの使命を実現する予定です。
臨床計画更新:
•ファブリック病:Isaralgagene Ciparvovecは,ST−920とも呼ばれ,我々が所有するFabry病治療の候補遺伝子治療製品であり,現在我々の1/2期STAAR臨床研究で評価されている。Sangamoは最近3回の医学会議でSTAAR研究の最新の初歩的なデータを公表した。2022年2月14日までの締め切りまで、データは8月に代謝先天性誤り研究学会(SSIEM)年次総会で発表された。2022年7月21日までの最新の初歩データは10月に開催された第29回ヨーロッパ遺伝子と細胞治療学会大会(ESGCT)と国家稀な疾患組織(NORD)会議で発表された。最新の初歩的なデータにより、投与量のアップグレード段階のすべての9名の患者は服用後23ケ月に達した時間に、最後の測定日まで、α-GalA活性は持続的に上昇し、平均正常レベルの2倍から30倍まで様々であった。4名の患者は酵素代替療法を中止し、投与中止後28週間以内にα-GalA活性は依然として有意に上昇した。2022年7月21日の締め切り以来、第5位もERT研究を開始した最後の用量増加段階の患者はERTを脱退した。すべての退出した患者は救急心臓蘇生術を受けなかった。1/2期STAAR研究は拡張段階に移行し、最初の5人の拡張患者の用量は、最初の2人の女性患者を含む5 e 13 Vg/kg用量レベルであった。私たちは男性と女性候補者を含めて複数の患者たちをスクリーニングしている。著者らは引き続き潜在的な肝心な3期試験を積極的に計画し、衛生当局、患者権益提唱団体と調査人員と接触している。
•鎌状細胞病:BIVV 003、以前はSAR 445136であり、我々の亜鉛指ヌクレアーゼまたはZFNであり、鎌状細胞病(SCD)の遺伝子編集のための自己細胞療法候補製品であり、現在、我々の1/2期PRECIZN-1臨床研究で評価されている。2022年10月、私たちは、最終製品の中長期前駆細胞の数を増加させるために、改良方法を用いて生産された候補製品を受けた研究中の2人目の患者である1/2期研究の6人目の患者に投与した。FDAは2022年8月、SangamoのBIVV 003再生医学高度療法またはRMATの申請を承認した。RMATは深刻な疾病を治療、修正、逆転或いは治愈するための再生医学療法を授与され、初歩的な臨床証拠により、この薬物は未満足の医療需要を解決する潜在力があることを表明した。2022年12月10−13日にルイジアナ州ニューオーリンズで開催される第64回米国血液学会(ASH)年次総会と博覧会でのポスタープレゼンテーションで最新のデータを展示する予定であり,その中で受け入れられた要約は下にあり,1/2期PRECIZN−1研究からのポスタープレゼンテーションである。第三段階は引き続き研究設計、支援活動、生産準備状況を行う。
•腎移植拒絶反応:TX 200は我々が所有するキメラ抗原受容体(CAR)、工学制御性T細胞(CAR)、細胞治療製品CAR-Tregであり、生体ドナーからのHLA-A 2不適合腎移植を予防するための免疫媒介拒絶反応であり、現在われわれの1/2期堅固な臨床研究で評価されている。2022年9月,1/2期研究中の2人目の患者に投与した。候補製品は引き続き
両患者とも耐性が良好であった。2022年10月,1/2期STEST研究中の2名目の患者は十二指腸腸閉塞の重篤な有害事象あるいはSAEを経験した。患者もCOVID陽性に注目された。TX 200研究の首席調査員と安全モニタリング委員会評価SAEはTX 200治療に関係なく,患者はそれ以来完全に回復した。患者3のための準備では,臨床活動は引き続き進展している。腎移植が手配され,可能な投与日が確定した後,3人目の患者の投与時間を指導する予定である
•血友病AGiroctocogene fitelparvovecはSB−525とも呼ばれ,重症血友病Aを治療する候補遺伝子治療製品であり,我々の1/2期ALTA研究と登録された3期アフィン臨床試験の対象である。我々は我々の協力者ファイザー(またはファイザー)とともにgiroctocogene fitelparvovecを開発している。我々とファイザー社は,2022年12月10-13日にASHのポスタープレゼンテーションで1/2期ALTA研究の更新データを展示する予定であり,その中で受け入れられた要約は次のように位置する.2022年9月、私たちはファイザーと共同で、自発的な一時停止とその後の臨床休止の後、第3段階のアフィン試験が募集を再開したと発表した。試験サイトは9月に登録を再開し,まもなく投与を再開する予定である。すべての試験点は2022年末に使用される予定で、肝心な読み取り値は2024年上半期に発表される予定だ。
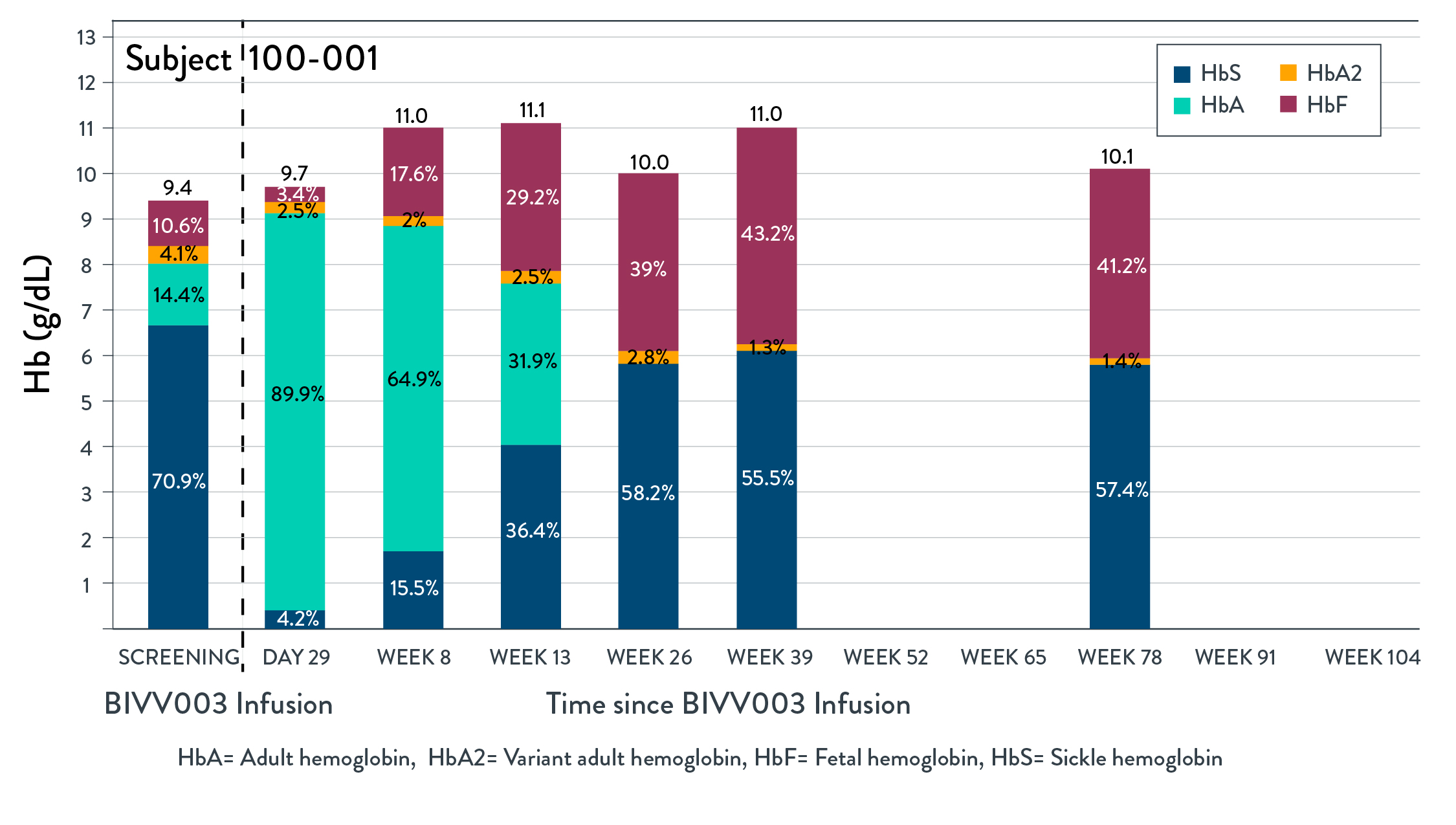
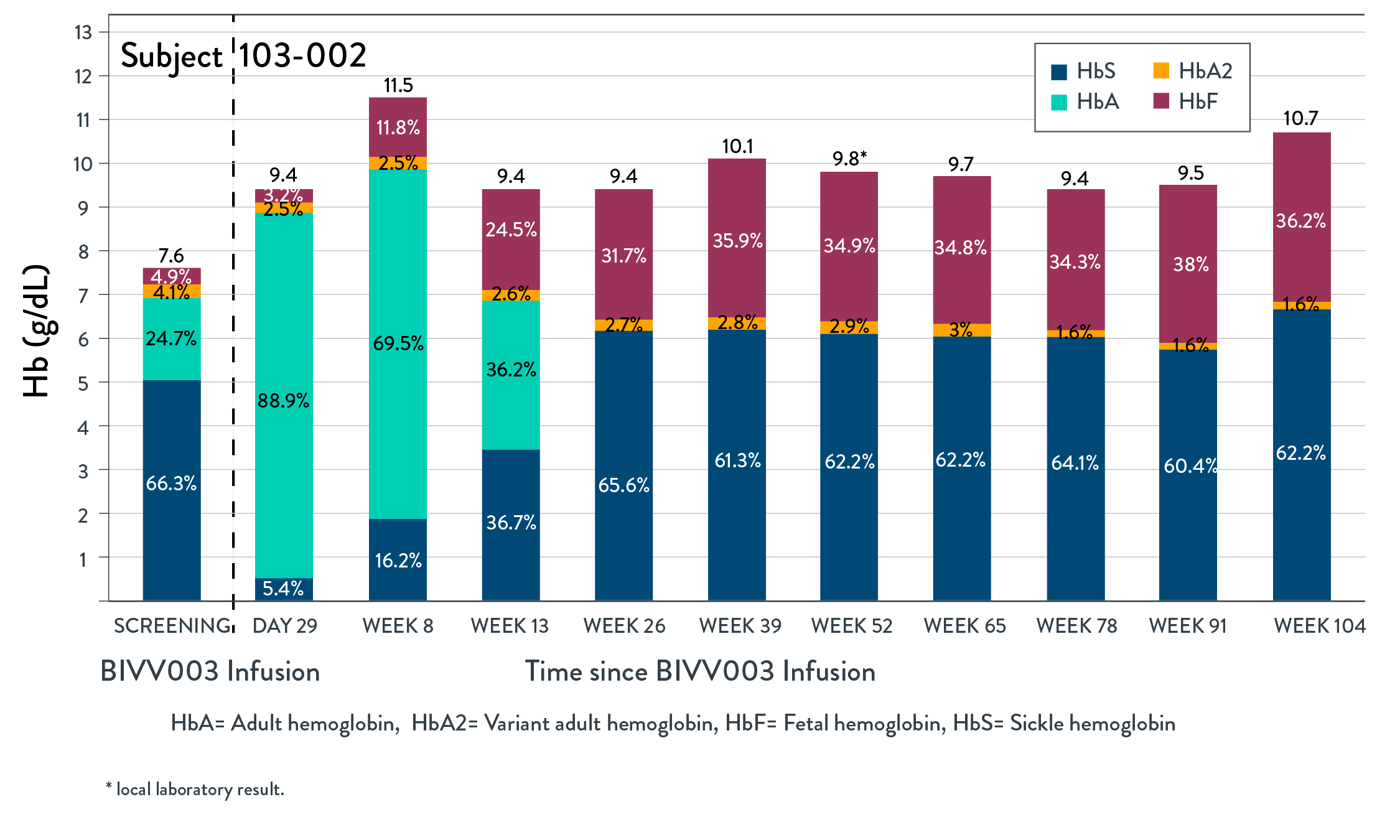
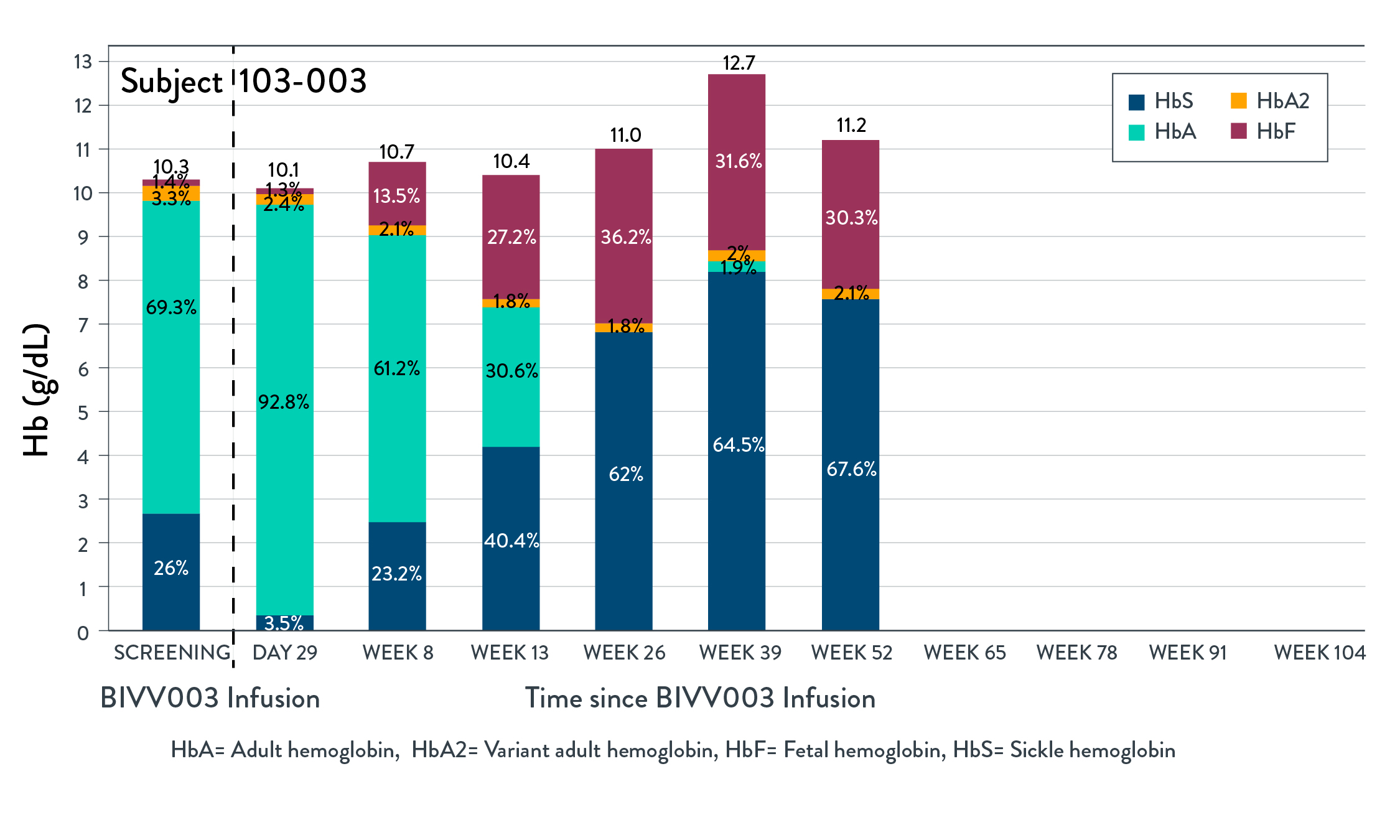
BIVV 003 1/2期PRECIZN-1研究の初歩的な安全性と有効性結果の概要
•BIVV 003は、自己CD 34造血幹細胞(HSPC)を含み、BCL 11 A遺伝子赤系特異的エンハンサー(ESE)を標的とするZFNSによってインビトロ修飾され、赤血球内因性胎児ヘモグロビン(HBF)の産生を増加させる新しい候補治療製品である。
•PRECIZN-1は、米国6地点の重症SCD患者(n=8;年齢18~40歳)におけるBIVV 003の安全性および耐性を評価するために行われている最初のヒト、開放ラベル、単一アーム、多地点研究である。
•条件を満たした患者はプリシャ福の動員と分離を受けた。ZFNメッセンジャーを用いてリボ核酸を自己HSPCにインビトロでトランスフェクトし,BIVV 003を作製した。ブチルチオダンプレコンディショニング後少なくとも72時間に単回静脈注入を行った。
•患者の幹細胞移植および造血回復、有害事象、臨床および実験室溶血マーカー、総ヘモグロビンおよびHbF、HbFを含む赤血球パーセンテージ、およびSCDに関連する事象を監視する。
•2022年5月3日までに4名の患者がBIVV 003注入を受け,治療期間が最も長い患者に125週間にわたるフォローアップを行った
•5人目の患者は2022年5月4日にBIVV 003注射を受け、移植された。この患者は、候補製品中のZFN修飾長期前駆細胞の数を増加させるために、内部試験において示された改良されたプロセスを使用して生産されたBIVV 003を受け入れた。
•締め切りまでにBIVV 003を服用した4名のうち,3名の患者は締め切りにBIVV 003を投与して以来臨床症状が改善した。これら3人の患者の場合、BIVV 003注射後26週間、HBFレベルのパーセンテージは30%以上で安定しており、治療期間が最も長い患者(2年)のHBFレベルは104週間まで持続している(以下図1参照)。F細胞(HBFを含む赤血球)のパーセンテージは、104週間まで90%以上に維持されている。総ヘモグロビンレベルは9.4−12.7 g/dLの間に維持された。そのうちの1名のHbFレベルは20%以下で安定しており,HbFレベルは細胞あたり10 pg以上に維持されておらず,注入後9カ月と16カ月に重篤なVOCsが2回出現した。
図1:総HbとHbの経時的階層
2022年5月3日までBIVV 003は全体的に耐性が良好であり,輸液に関する反応はなかった。アスピリンは動員と白花丹清髄調節においてプリーシャと一致することが報告されている。BIVV 003に関連する副作用やSAEと評価された報告はない。
巨細胞癌遺伝子Fitelparvovec 1/2期ALTA研究の最新の初歩的な結果の概要
計11名の男性患者がこの研究に参加し,そのうち5名は3 E 13−VG/kg最高用量群に属していた。2022年5月20日までに、患者は147~247週間追跡されており、そのうちの2人は3年(156週)を完成していない。
•2022年5月20日現在、最高用量(3 e 13−Vg/kg)の列の中で、最もよく見られる治療関連副作用は、肝酵素上昇と輸液関連反応:アラニントランスアミナーゼ上昇(ALT 3/5)(60.0%)、アスパラギン酸トランスアミナーゼ(AST 2/5)上昇(40.0%)、発熱3/5(60.0%)、頻脈2/5(40.0%)である。
•最高用量のコホートでは,原癌遺伝子fitelparvovec注入後約6時間で低血圧と発熱が出現した患者が報告されており,これらの事件は治療により完全に軽快し,翌日の注入後の退院は延期されていない。2022年5月20日までの最高用量群の5名の患者のうち,4名の患者のALT上昇は7日を超えるコルチコステロイド治療を要し,ALTの上昇はコルチコステロイド治療コース(中央値56日;範囲:7−135日)を徐々に減少させることでコントロールされ,臨床的意義のある第VIII因子レベルやFVIII活性を維持しながら,コルチコステロイド治療前後に出血事象やその後最も少ない出血事象がないことが証明された。
•2022年5月20日現在,FVIIIの阻害剤は開発されておらず,血栓事象や肝臓腫瘤も検出されていない。
•3 E 13−VG/kgキューでは,156週にデータが利用可能な3名の患者のFVIII平均活動は軽度から正常範囲に維持されており,以下の表に示すとおりである。残りの2人の患者の既存のデータでは、1人の患者は130週間の間にFVIII活動レベルを軽度の範囲に維持し、もう1人の患者のFVIII活動レベルはより低い定量化レベルを下回った(
•3 E 13−VG/kgキューでは,年間化出血率,すなわち候補製品注射後3週間からの全出血回数を年単位の観察期間で割ったところ,注射後1年目はゼロであり,フォローアップ期間全体で0.9であった。このキューでは,2名の患者は合計12回の出血イベント(6回の侵襲的出血,4回の自発性出血,2回の原因不明出血)を経験しており,外因性FVIII治療が必要である。2022年5月20日までに,このキューには患者が予防を回復していない。
テーブルです。Fitelparvovec 3 e 13−vg/kg遺伝子Fitelparvovec 3 e 13−vg/kg群凝固因子VIII活性の一段階法と発色法測定
| | | | | | | | | | | | | | | | | | | | | | | |
| | |
第8因子活性は
正常率、中央値(最小、最大) | 学習週間 |
| 化学分析をする | 12週目 | 24週目 | 52週目 | 78週目 | 104週目 | 130週目 | 156週目 |
| 一期凝固 | 93.7
(82.7, 167.7)
| 104.8
(30.5, 212.6)
| 31.1
(12.0, 191.3)
| 57.5
(3.8, 144.2)
| 27.5
(4.1, 99.1)
| 23.3
(5.4, 164.5) | 22.9
(22.6, 129.0) |
| 生色 | 62.1
(51.8, 109.5)
| 70.1
(20.4, 123.8)
| 20.1
(7.8, 122.3)
| 40.1
(0.9, 114.7)
| 16.3
(0.9, 71.6)
| 12.3
(0.9, 113.2) | 12.5
(11.8, 91.1) |
| 患者、n | 5 | 5 | 4a | 4a | 5 | 4a | 3b |
(a)52週,78週,130週ではそれぞれ1名の患者が面会に参加できなかった。 | | |
(b)データ削減時には,2名の患者が156週目に達していなかった。 | | |
| 最小、最大=最小、最大 | | |
| | | | | | | |
臨床前計画
われわれの臨床前開発は2つの革新の優先分野に集中している:(I)自己免疫疾患用CAR−Treg細胞療法と(Ii)神経疾患用ゲノム工学。著者らの臨床前プロジェクトの適応は神経発達障害、癌、炎症性腸疾患、神経病変と神経変性疾患、例えば筋萎縮性側索硬化症、多発性硬化症とハンチントン病を含み、その中のいくつかは著者らがパートナーのBiogen MA、Inc.とBiogen International GmbHと共同開発したものであり、私たちは総称してBiogen、ノ華生物医学研究所、あるいはノワール、ファイザーと武田製薬有限会社と呼ばれる。
協力する
私たちは生物製薬会社との何度もの協力は私たちに重要な財務と戦略的利益をもたらし、私たちの研究開発努力と私たちのZFP技術プラットフォームの潜在力を強化した。彼らは私たちの協力者の治療と臨床専門知識とビジネス資源を利用して、私たちの薬をより早く持っていくことを目標としています
病人です。私たちはこれらの協力が私たちのZFP技術プラットフォームの価値を反映し、私たちの候補製品の潜在的な市場を潜在的に拡大すると信じている。私たちはこれまでに約8.15億ドルの前払い許可料、マイルストーン支払い、パートナーへの普通株売却の収益を受けており、潜在的な製品印税を除いて、将来的に私たちの協力から67億ドルまでのマイルストーン支払いを稼ぐ権利がある。
内部製造
私たちは私たちの内部製造能力が私たちに競争優位を提供すると信じている。我々は現在カリフォルニア州ブリスベンの本社に腺関連ウイルス(AAV)製造工場を設置し,カリフォルニア州ブリスベンとフランスバル州に細胞療法メーカーを設置している。私たちの製造戦略は、私たちの候補製品により大きな柔軟性、品質と制御を提供することであり、方法は、私たちの内部製造、契約製造組織またはCMOとパートナー関係を通じてバランスと必要な能力を確立することであり、製造技術と分析に投資し、強力なサプライチェーンを発展させることである。
私どもの業務の詳細については、2021年年報第1項第1項の“業務”を参照されたい。
持続的新冠肺炎の大流行の影響
私たちは持続的な新冠肺炎の大流行が私たちの業務と運営に与える影響を経験し続け、大流行のアメリカ、フランス、イギリスと私たちの臨床研究と試験場所(例えばカナダ、イタリア、オーストラリアの新しい場所)での変化に伴い、私たちはこれらのあるいはもっと深刻な影響を経験し続けるかもしれない。例えば,現場スタッフや臨床試験患者の新冠肺炎陽性例を処理する際には,我々の現場運営は周期的な短期中断を経験しており,われわれの現場スタッフや臨床試験患者に深刻な新冠肺炎が発生すれば,我々の運営は今後より長期的な中断を経験する可能性がある。また、私たちは時々私たちの資源を再構成と優先順位付けして、旅行制限、密度制限と供給制限が新冠肺炎に与える適度な影響を緩和することを要求された。私たちの計画が長期的に中断されれば、私たちの協力協定で想定されている私たちのバイオ製薬パートナーを支援する能力に影響を与え、スケジュールを調整することにつながる可能性があります。
また,isaralgagene Citizparvovecの1/2期STAAR臨床研究はすでにそのスケジュールの遅延を経験し続けており,一部の原因は新冠肺炎の影響や医療資源が大流行に抵抗するために転用されていることを評価した。例えば、私たちはこの研究のための募集、募集、投与に遅延があり、一部の原因は患者が流行の大流行中に飛行機で車で距離以外の試験地点に行きたくないことと医療機関に入ることであり、一部の原因は試験地点が新冠肺炎臨床看護の優先順位をSTAAR研究のような研究活動の上に置くためである。ある患者が登録或いは薬を飲む前に新冠肺炎ワクチンの接種或いは新冠肺炎の検査が陽性であることを決定した時、及びある患者の候補患者が新冠肺炎ワクチンを接種しないことを決定した時、この研究も遅延し、これは彼らが研究に参加する資格を取り消した。そのほか、新冠肺炎の影響により、著者らはSTAAR研究に必要な原材料を提供する方面でいくつかの短期遅延に遭遇し、臨床試験材料の輸送においてもいくつかの短期遅延に遭遇した。これらの課題は私たちの最初のSTAAR研究スケジュールを約3~6ヶ月後退させたと推定される。もし新冠肺炎がワクチン接種遅延、新たな新冠肺炎変異或いは意外事件により著者らの募集、スクリーニング、登録と投与及び本研究の原材料源に与える影響が激化すれば、本研究の臨床スケジュールは再改訂される可能性がある。
また,われわれはわれわれの全資本が有する腎移植拒絶反応を治療するCAR−Treg細胞療法候補品であり,われわれCMOの製造や技術移転挑戦に関連する新冠肺炎の影響,患者とドナーの新冠肺炎検出が陽性であったため,そのスケジュールが延期されているTX 200を確固として評価した。もし新冠肺炎の影響で追加的な遅延があれば、私たちがこの研究を行うスケジュールは調整されるかもしれない。
我々の協力プロジェクトについて、これらの研究および実験がSTAARおよびSTESTRATE研究において経験し、経験し続ける類似の課題を経験した場合、我々の協力者によって管理される研究および実験のスケジュールも将来的に遅延される可能性がある。
未来を展望して、著者らは引き続き新冠肺炎が著者らの運営、研究承諾と臨床試験及び著者らの協力者、臨床試験地点とCMOに与える影響に注目する。これらの影響の重症度はある程度新冠肺炎疫病及び関連政府命令と制限措置の持続時間と重症度、及び疫病がどのように私たちと私たちの商業パートナーが正常に業務を運営する能力を制限するかに依存する。これらの操作の中断、および将来的には、私たちが運営する場所や業界に一般的に適用される制限、あるいは特に私たちと私たちの施設に適用される制限によって生じる可能性のあるより深刻な中断は、私たちのタイムリーな研究能力を阻害し、協力者に対する研究義務を履行し、私たちの治療計画の発展を推進することができるかもしれない。このような遅延と中断は、私たちの業務、運営業績、財務状況に実質的な影響を及ぼす可能性がある。
私たちは、新冠肺炎の疫病が私たちの2022年の財務状況に実質的なマイナス影響を与えないと予想している。私たちは短期的に、私たちは財政的に有利な地位にあり、私たちの完全な所有と協力の研究を実行できると信じています
臨床プロジェクトをしています2022年9月30日現在、私たちは3.503億ドルの現金、現金等価物、有価証券を持っている。私たちは現在資本が十分であると考えているにもかかわらず、疫病の変化(ウクライナ戦争、インフレ、気候変動、金利上昇、その他の経済的不確実性とボラティリティの影響)は、世界金融市場のさらなる混乱を招き、私たちの資本獲得能力を弱める可能性があり、これは私たちの未来の流動性にマイナスの影響を与えるかもしれない。私たちは現在、新冠肺炎の疫病は私たちの貸借対照表上の金融資産あるいは商業権の評価にいかなる実質的な損害を与えないと予想している。私たちは、オフィス従業員のために実施された遠隔職場配置が、私たちの財務報告や制御システムに影響を与えているとは思いません。
新冠肺炎疫病がどの程度直接或いは間接的に著者らの業務、運営と財務状況に影響するかは、現在まだ高度で不確定な未来の事態の発展に依存する。これらの動態は、疫病の最終持続時間と重症度、新しい新冠肺炎変異体の影響、旅行制限、アメリカ、フランス、イギリスおよび他の国の新しい公衆衛生制限、企業閉鎖または商業中断、ならびにアメリカ、フランス、イギリスおよび他の国が疾病を制御および治療するために取った行動の有効性と適時性を含み、ワクチン接種計画の有効性とタイミングを含む。このウイルスの新しい変種の急増は,最近のオミック変種とその亜変種を含めており,将来的には以前の命令や制限を回復したり,新たな制限を加えたりする可能性がある。私たちの事件に対する理解が絶えず発展し、更に多くの情報を得ることに伴い、著者らは著者らの収入、費用と製造、臨床試験と研究開発スケジュールに関連する指導を大幅に変えるかもしれない。
進化しつつある新冠肺炎の大流行に関するリスクと不確実性に関するより多くの情報は,2021年年次報告第1部1 A項で“リスク要因”と題する節を参照されたい。
経営成果の一部は
私たちの収入は主に前払い許可料、研究サービス精算、マイルストーン成果と研究支出援助の収入を含む。我々は収入が異なる時期に変動し続けることを予想しており,新たなパートナーやパートナー精算がその初期条項の後に継続することは保証されず,これらの合意に規定されたマイルストーンを達成できる保証もない.
設立以来,我々は純損失を出しており,少なくとも今後数年以内には,我々の研究·開発活動を継続するにつれて,損失が予想される。これまで、私たちは主に株式証券の発行や協力と助成金の収入を研究することで、私たちの業務に資金を提供してきました。
今後も研究開発に大量の資源を投入することが予想され,我々の候補製品を研究段階から臨床試験に進めることに成功すれば,今後数年間の研究開発費が増加することが予想される。Biogen、Kite Pharma、Inc.またはKiteおよびノワール社との合意条項によると、研究や開発活動に関連するいくつかの費用は私たちに精算されます。Biogen,Kite,Novartisから受け取った精算資金は収入として確認され,関連コストが発生しており,入金が合理的に保証されているためである。
一般及び行政支出は主に行政人員、財務及び行政人員の給与及び人事関連支出、株式給与支出、専門費用、分配済み施設支出、特許訴訟支出及びその他の一般会社支出を含む。私たちの候補製品を診療所に普及させ、診療所を通過することに伴い、私たちの業務の成長には一般的な費用と管理費用が増加することが予想される。
重要な会計政策と試算
添付されている経営陣の私たちの財務状況と経営結果の討論と分析は、私たちの簡明な総合財務諸表と関連開示に基づいており、これらの報告書と関連開示はアメリカで公認されている会計原則に基づいて作成されている。これらの簡明な総合財務諸表を作成する際には、私たちの簡明な総合財務諸表とその付記に報告された金額に影響を与える推定、仮説、判断を行う必要がある。我々は過去の経験や当時の状況では合理的な様々な他の仮定を推定していると考えられるが,これらの仮定の結果は資産や負債の帳簿価値を判断する基礎となっており,そのような資産や負債の帳簿価値は他の出所から容易に見られるわけではない.異なる仮定または条件では、実際の結果は、これらの推定値とは異なる可能性がある
私たちは、収入確認と長期資産(営業権や無形資産を含む)の推定に関する重要な会計政策と推定は、私たちの簡明な総合財務諸表を作成する際に使用される最も重要な推定と仮定であると信じている。
2022年9月30日までの3ヶ月と9ヶ月の間、我々のキー会計政策及び見積もりは、2021年年報第2部第7項“経営陣の財務状況及び経営結果の検討及び分析”で開示されたキー会計政策及び見積もりと比較して大きな変化はない。
2022年と2021年9月30日までの3ヶ月と9ヶ月の経営実績
収入.収入 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 9月30日までの3ヶ月間 | | 9月30日までの9ヶ月間 |
| (単位は千、100%比は除く) | | (単位は千、100%比は除く) |
| 2022 | | 2021 | | 変わる | | % | | 2022 | | 2021 | | 変わる | | % |
| 収入.収入 | $ | 26,460 | | | $ | 28,563 | | | $ | (2,103) | | | (7%) | | $ | 84,069 | | | $ | 82,715 | | | $ | 1,354 | | | 2% |
総収入は主に協力協定からの収入を含む。私たちは今後数年間の収入が主にBiogen、ノワール、Kite、ファイザーとの協力協定から来ると予想しています。時間が経つにつれて、このような合意に基づいて受け取った前金とマイルストーン支払いを確認し続けます。
2021年同期と比較して,2022年9月30日までの3カ月間の収入が210万ドル減少したのは,主にノワール社との協力協定に関する収入が190万ドル減少し,生物遺伝会社との協力協定に関する収入が160万ドル減少したためである。2021年の間にセノフィ協力協定に関連する190万ドルの収入調整部分がこれらの減少を相殺したのは、主にプロジェクトコスト推定の変化により合意下の収入の調整が生じたが、セノフィ協力協定の終了により減少した収入110万ドルおよびKite協力協定に関連する収入が50万ドル増加したためである。
2021年同期と比較して、2022年9月30日までの9ヶ月間の収入が140万ドル増加したのは、主に2021年の間にセノフィ協力協定に関する収入が190万ドル調整され、主にプロジェクトコスト推定の変化により、合意下での収入の調整が行われたが、セノフィ協力協定の終了による収入は10万ドル減少し、Kite協力協定に関連する収入が50万ドル増加したことと、ノバ協力合意に関連する収入が50万ドル増加したことによって相殺されるためである。これらの増加は生物遺伝会社との協力協定に関連した150万ドルの収入の減少分によって相殺された。
運営費 | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |
| 9月30日までの3ヶ月間 | | 9月30日までの9ヶ月間 |
| (単位は千、100%比は除く) | | (単位は千、100%比は除く) |
| 2022 | | 2021 | | 変わる | | % | | 2022 | | 2021 | | 変わる | | % |
| 運営費用: | | | | | | | | | | | | | | | |
| 研究開発 | $ | 65,116 | | | $ | 62,498 | | | $ | 2,618 | | | 4% | | $ | 183,719 | | | $ | 179,018 | | | $ | 4,701 | | | 3% |
| 一般と行政 | 16,238 | | | 14,501 | | | 1,737 | | | 12% | | 46,239 | | | 47,135 | | | (896) | | | (2%) |
| 総運営費 | $ | 81,354 | | | $ | 76,999 | | | $ | 4,355 | | | 6% | | $ | 229,958 | | | $ | 226,153 | | | $ | 3,805 | | | 2% |
研究と開発費
研究開発支出は主に給与関連支出を含み、株式給与、実験室用品、臨床前と臨床研究費用、臨床用品製造コスト、契約研究及び施設と情報技術費用を含む。
2021年同期と比較して、2022年9月30日までの3ヶ月間の研究開発費が260万ドル増加したのは、施設や情報技術コストが270万ドル増加したことが主な原因であり、これは、全体的なコスト増加とプロジェクトの進展により、私たちの研究開発部門がより多くの空間を再分配し、私たちの計画を支持する従業員数が増加したため、給与や他の人員コストが80万ドル増加し、出張や娯楽費用が50万ドル増加したためである。ある研究開発活動の時間スケジュールのため、臨床前、臨床と実験室の供給費用は40万ドル減少し、セノフィは90万ドルのある研究開発費用を返済し、一部はこれらの増加を相殺した。2022年と2021年9月30日までの3ヶ月間、研究開発費に含まれる株式報酬支出はそれぞれ440万ドルと490万ドルだった。
2021年同期と比較して、2022年9月30日までの9ヶ月間の研究開発費は470万ドル増加し、主な原因は施設と情報技術コストが780万ドル増加したためであり、全体的なコスト増加とプロジェクトの進展により、私たちの研究開発部門は追加の空間を再分配し、出張と娯楽費用は90万ドル増加し、給与と他の人員コストは80万ドル増加し、私たちの計画を支持した。ある研究開発活動の時間スケジュールのため、臨床前、臨床と実験室の供給費用は370万ドル減少し、セノフィは90万ドルのある研究開発費用を返済し、一部はこれらの増加を相殺した。株を基礎とする
2022年と2021年9月30日までの9ヶ月間、研究開発費に含まれる給与支出はそれぞれ1370万ドルと1460万ドルだった。
今後も研究·開発に多くの資源を投入し続ける予定であり,われわれの臨床計画を進めることに成功すれば,われわれの早期候補製品を臨床試験に入れることができれば,今後数年間の研究·開発費が増加することが予想される。
我々の開発計画の完成に要する時間の長さとこれらの計画の開発コストは,我々の候補製品が臨床試験に参加する範囲と時間,他の治療分野での開発計画の決定,パートナーや協力者とともに我々の候補製品を独自に開発するか,の影響を受ける可能性がある。例えば,我々の候補製品は複数の治療領域が開発されており,その中のいくつの治療領域を追求し続けるかは不明である。また、各追求された治療分野の規制承認を得るために必要な臨床試験の範囲および数は、適用規制機関の意見に依存しており、我々が展開する可能性のあるすべての潜在的治療分野についてこのような意見を求めていないが、このような意見を提供した後であっても、適用される規制機関は、当社または他社によって生成された新しいデータに基づいて、または私たちが制御できない他の理由で規制を承認する前に、追加の臨床研究を要求する可能性がある。いかなる監督管理許可の条件として、私たちはまた上場後の開発承諾の制約を受ける可能性があり、追加の臨床試験要求を含む。以上で議論した不確実性のため,我々の開発計画に関する継続時間や完了コストを決定することはできない.
私たちの潜在的な治療製品は長く不確実な規制過程の影響を受けており、これは私たちが必要な規制承認を得ることにつながらないかもしれない。必要な規制承認が得られなければ、私たちは影響を受けた候補製品を商業化することができないだろう。また,我々の候補製品の臨床試験は安全性と有効性を証明できない可能性があり,規制部門の承認を阻止または著しく遅らせる可能性がある。私たちの研究開発活動に関するリスクと不確実性の議論は、私たちの候補製品の開発完了と、私たちの業務、財務状況、成長見通しへの影響を含めて、2021年年報第I部1 A項の“リスク要因”で見つけることができ、本四半期報告における第II部第1 A項に記載されているリスクの中で補完することができる。
一般と行政費用
一般及び行政支出は主に給与に関連する支出を含み、行政、法律、財務及び行政人員の株式給与、専門費用、施設及び情報科学技術支出、及びその他の一般会社の支出を含む。
2021年同期と比較して、2022年9月30日までの3ヶ月間の一般·行政費は170万ドル増加し、主に給与やその他の人員費用が210万ドル増加したことと、法律·専門費が100万ドル増加したためである。プロジェクトの進展によりより多くの空間が我々の研究·開発部門に再分配され,分配費用は160万ドル減少し,これらの増加を部分的に相殺した。2022年と2021年9月30日までの3ヶ月間、一般および行政費用に含まれる株式ベースの報酬支出はそれぞれ340万ドル、290万ドルだった。
2021年同期と比較して、2022年9月30日までの9ヶ月の一般·行政費用は90万ドル減少し、主にプロジェクトの進展によりより多くの空間を我々の研究開発部門に再分配し、分配コストが430万ドル減少した。給与とその他の人員費用、法律と専門費用、旅行と娯楽費用は340万ドル増加し、この減少額を部分的に相殺した。2022年と2021年9月30日までの9ヶ月間、一般および行政費用に含まれる株式ベースの報酬支出はそれぞれ970万ドル、1020万ドルだった。
私たちが引き続き私たちの製品の組み合わせを拡大し、私たちの候補製品を臨床に投入することに伴い、私たちはより高い一般的かつ管理費用が業務の成長をサポートすることが予想される。
利息とその他の収入,純額
2022年9月30日までの3カ月間で,利息と他の収入純額が2021年同期比90万ドル増加したのは,主に市場金利上昇を反映した利息収入が120万ドル増加したことと,カリフォルニア再生医学研究所が2021年のST−400計画停止に関する贈与の償還義務を解除したことにより20万ドル減少したためである。これらの増加は外貨為替レート変動に関する50万ドル減少額によって部分的に相殺される。
2021年同期と比較して、2022年9月30日までの9ヶ月間の純利息およびその他の収入が270万ドル増加したのは、コロナウイルス援助、救済、経済安全法に規定されている300万ドルの従業員保留信用の恩恵を受け、市場金利上昇を反映した利息収入が140万ドル増加したためである
利息支出60万ドルは,カリフォルニア再生医学研究所が2021年のST−400計画停止に関する贈与の償還義務解除に関与している。これらの増加は外貨為替レートの変動に関する240万ドルの減少によって部分的に相殺される。
流動性と資本資源
流動性
設立以来、私たちは大きな純損失が発生し、私たちは主に株式証券、会社協力者、戦略パートナーの支払い、研究支出を発行することで私たちの運営に資金を提供しています。
2022年9月30日現在、私たちの現金、現金等価物、有価証券の総額は3.503億ドルですが、2021年12月31日までの現金、現金等価物、有価証券の総額は4億647億ドルです。私たちの最も重要な資本使用は従業員の給与と外部研究開発費用に使用され、製造、臨床試験と著者らの治療計画に関連する臨床前活動を含む。私たちの現金と投資残高は、米国政府が支援する実体債務証券、商業手形証券、通貨市場基金、会社債務証券、資産支援証券、預金を含む様々な利息ツールの形で保有されている。即時需要を超えた現金は、資本保証と流動性を実現するために、私たちの投資政策に基づいて投資されるだろう。
2020年8月、私たちはJefferies LLCと公開市場販売協定または販売協定を締結し、既存の棚登録声明に基づいて、1.5億ドルまでの普通株を時々“市場”製品の形で売ることを規定した。2022年9月30日までの9ヶ月間に、販売契約に基づいて14,711,770株の普通株を売却し、純収益は約6640万ドルであり、そのうち約60万ドルは2022年10月に受け取り、2022年9月30日までの総合貸借対照表の前払い費用と他の流動資産に記録されている。その後10月には販売契約に基づいて1,921,594株の普通株を売却し、純収益は約870万ドルだった。
私たちは将来的に現金使用率が増加することを予想していますが、特に私たちの製品開発を支援するために、私たちの利用可能な現金、現金等価物および有価証券、ならびに協力および戦略パートナー関係からの期待収入は、少なくとも今後12ヶ月以内に現在計画されている運営に資金を提供するのに十分であり、私たちの簡明な連結財務諸表が発表された日から計算されると信じています。私たちは、今後12ヶ月後の需要を満たすために、より多くの協力協定および/またはより多くの株式または債務融資を売却することで、より多くの資金を調達したい。この不確実で変動している時期に、私たちは私たちの流動性を監視し続けるつもりだ。
キャッシュフロー
経営活動
2022年9月30日までの9ヶ月間、経営活動で使用された純現金は1兆666億ドルで、主に私たちの純損失が1.403億ドル、繰延収入が6500万ドル減少し、前払い費用とその他の資産が580万ドル増加し、レンタル負債が330万ドル減少したことを反映している。株式補償、減価償却、償却、有価証券の割増償却、リース使用権資産の償却経営に関する非現金支出3820万ドルおよび売掛金やその他の計上すべき負債が940万ドル増加し、この減少額を部分的に相殺した。
2021年9月30日までの9ヶ月間、経営活動で使用された現金純額は1.805億ドルで、主に私たちの純損失1.408億ドル、繰延収入6230万ドルの減少、前払い費用とその他の資産の650万ドルの増加、売掛金とその他の計上負債の470万ドルの減少、賃貸負債の長期部分の320万ドルの減少、売掛金270万ドルの増加、および売掛金と従業員福祉の190万ドルの減少を反映している。これらの減少は、株式ベースの給与、減価償却および償却、有価証券割増(割引)償却、および賃貸使用権資産を経営する償却とその他の変化に関連する4010万ドルの非現金支出部分によって相殺される。
投資活動
2022年9月30日までの9カ月間、投資活動が提供した純現金は1670万ドルで、2.55億ドルの有価証券満期日と関係があるが、一部は2.256億ドルの有価証券購入と1270万ドルの不動産·設備購入によって相殺された。
2021年9月30日までの9カ月間、投資活動が提供する現金純額は1兆956億ドルで、主に5.096億ドルの有価証券の満期と690万ドルの有価証券の売却に関係しているが、一部は3.004億ドルの有価証券の購入と2040万ドルの不動産や設備の購入によって相殺されている。
融資活動
2022年9月30日までの9カ月間、融資活動が提供した現金純額は6510万ドルで、主に6750万ドルの市場発行収益、170万ドルの発行費用、および従業員の株式購入計画に基づいて普通株を購入する収益110万ドルを差し引くと、株式の純決済に関する税金200万ドルが部分的に相殺された。
2021年9月30日までの9カ月間、融資活動が提供した現金純額は3070万ドルで、主に2790万ドルの市場発行収益、80万ドルの発売費用を差し引いて、株式オプションの行使と従業員の株式購入計画による株購入の収益660万ドルに関連し、一部は株式決済純額300万ドルの株式奨励に関する税金で相殺された。
運営資本および資本支出要求
私たちは少なくとも今後数年以内に営業赤字が続くと予想しています。私たちは現在資本が十分であると考えているが、持続的な新冠肺炎の大流行、ウクライナ戦争、インフレ、金利上昇、その他の経済不確定性とボラティリティの影響は、世界金融市場の深刻な混乱を招き、私たちの資本獲得能力を弱める可能性があり、これは未来に私たちの流動性にマイナスの影響を与える可能性がある。今後12ヶ月後の将来の資本需要は巨大になり、私たちは追加的な協力協定および/または株式または債務融資を通じて、私たちの候補製品の開発、製造、潜在的な商業化に資金を提供する大量の追加資本を調達する必要があるだろう。また、私たちが独自の人間療法に重点を置く場合、私たちは各製品のコストが数億ドルを超えるかもしれないFDAの候補製品の承認を求める必要があるだろう。定期的に資金集めの機会を考え、市場状況や私たちの運営計画を含め、様々な要因に基づいて、資金集めを増やすかどうかを時々決めていくかもしれません。私たちが受け入れられる条項の下で、追加的な資本を得ることができないかもしれないし、根本的にできないかもしれない。利用可能な十分な資金がない場合、または潜在的な資金源の条項が不利であれば、私たちの業務と私たちの候補製品パイプラインを推進する能力は損なわれるだろう。さらに、私たちの市場発売計画に基づく追加売却を含む任意の追加株式証券の売却は、私たちの株主持分を希釈する可能性があり、どの債務融資も私たちの業務を制限する契約を含む可能性があります。
私たちの未来の資本需要は多くの展望的な要素に依存するだろう
•私たちの候補製品および潜在的候補製品の臨床試験の開始、進展、スケジュール、および完了
•規制承認の結果、時間、コスト
•私たちの協力協定の成功は
•規制要件の変化がもたらす可能性のある遅延;
•私たちが求めている候補製品の数は
•特許出願の提出及び起訴、並びに特許請求の執行及び弁護に係る費用;
•将来の許可内と許可外取引の時間と条項
•販売、マーケティング、製造、流通能力のコストとタイミングを確立する
•私たちの候補製品の臨床と商業用品を調達するコストは
•私たちは、このような買収および投資に関連するコストを含む企業、製品または技術に買収または投資する程度である
•潜在的な紛争と訴訟の費用。
契約義務
我々の2021年12月31日までの将来最低契約義務は2021年年次報告書に報告される。2022年9月30日までの9ヶ月間、私たちがこれまで2021年年報で開示していた契約義務と比較して、私たちの正常業務過程以外に大きな変化はありません。
プロジェクト3.市場リスクに関する定量的·定性的開示
私たちの市場リスクの開放は私たちの現金、現金等価物、有価証券と関係があります。私たちの投資政策の目標は、元本を保証し、流動性需要を満たすことと、私たちの投資政策パラメータと市場状況に基づいて市場収益率を得ることです。私たちは以下の範囲でできるだけ利息収入を増加させる投資を選択します
ガイドラインです。我々の目標を達成するために、期待される現金需要を満たすために、高い信用品質と異なる満期日を有する現金等価物と証券ポートフォリオとを維持している。
私たちのポートフォリオの証券はレバレッジ化されておらず、販売可能に分類されている。これらの売却可能な証券の多くは短期証券であり、金利リスクはわずかである。私たちの投資には現在、米国政府がサポートしている実体債務証券、商業手形証券、会社債務証券、資産保証証券、預金証書が含まれている。私たちの投資政策は取締役会によって承認され、任意の種類の投資発行者に投資できる金額を制限し、信用リスク集中度を低下させます。すべての投資は市価で計算され、市価はコストに近い。私たちはポートフォリオで派生金融商品を使用しない。我々の2022年9月30日の市場リスクは、2021年年報第7 A項で議論されているリスクと実質的に変化していない。
外貨両替リスク
私たちはアメリカとヨーロッパで業務をしています。各外資系子会社の本位貨幣は本貨幣である.私たちは外貨リスクに直面しています。主にヨーロッパの子会社の業務を通じて、これらの子会社は主にユーロで業務を展開しています。子会社の財務諸表をドルに換算したため、株主権益に収益と損失を記録した。私たちの2022年9月30日の外貨両替リスクは、2021年年報第7 A項で議論したリスクと実質的な変化はありません。
項目4.制御とプログラム
情報開示制御とプログラムの評価
我々は、我々の取引所法案報告において開示が必要な情報が、米国証券取引委員会規則および表で指定された期間内に記録、処理、集約および報告されることを確実にするための合理的な保証を提供し、これらの情報が、必要な開示に関する決定をタイムリーに行うために、我々の経営陣に蓄積されて伝達されることを目的とする開示制御および手続きを維持する。
我々の最高経営責任者と最高財務責任者の監督の下で、2022年9月30日までの開示制御および手順(取引所法案規則13 a-15(E)および15 d-15(E)で定義されるような)の有効性を評価した。この評価に基づき、2022年9月30日現在、我々の最高経営責任者および最高財務官は、我々の開示統制および手続きが合理的な保証レベルで有効であると結論した。
制御やプログラムへの固有の制限
私たちの経営陣は、CEOやCEOを含め、私たちの開示統制や手続き、および財務報告に対する私たちの内部統制がすべてのミスやすべての詐欺を防ぐことを期待していません。制御システムの設計や動作がどんなに良くても,合理的な保証を提供し,制御システムの目標を実現することしかできない.制御システムの設計は資源の制限を反映しており,制御の利点はそのコストに対して考慮しなければならない.すべての制御システムには固有の限界があるため、どの制御評価もわが社のすべての制御問題や不正事件がすでにまたは検出されることを絶対に保証することはできません。これらの固有の制限は、開示および財務報告手続きの既知の特徴であるため、これらのリスクを除去するのではないにもかかわらず、保障措置を設計することが可能である。これらの固有の限界には,意思決定における判断が誤りである可能性があり,故障発生は簡単な誤りや誤りによる現実がある.制御はまた、ある人の個人的な行動、2人以上の結託、または制御の管理優先によって回避することができる。いずれの制御システムの設計も,将来のイベントの可能性に対する何らかの仮定にある程度基づいている.私たちの開示制御と手続き、および財務報告に対する私たちの内部統制は、その目標を達成するための合理的な保証を提供することを目的としているが、どの設計もすべての未来の条件でその目標を達成することに成功する保証はない。時間の経過とともに,条件の変化や政策やプログラムに対する遵守度の悪化により,制御が不十分になる可能性がある.費用対効果のある制御システムの固有の限界から, ミスや詐欺による誤った陳述は発生する可能性があり、発見されないだろう。
財務報告の内部統制の変化
2022年9月30日までの四半期内に、財務報告の内部統制には何の変化もなく、これらの変化は、私たちの財務報告の内部統制に大きな影響を与えたり、合理的になったりする可能性があります。
第2部:その他の情報
項目1.法的手続き
私たちはどんな重大な保留法的手続きの当事者でもない。時々、私たちは正常な業務過程で発生した法的訴訟に巻き込まれるかもしれない。
第1 A項。リスク要因
以下では、2021年年次報告第1部1 A項で先に開示された変化とは異なる、我々のリスク要因の変化を補完的な形で提供する。2021年年報第I部第1 A項に開示されたリスク要因は、これらの補完リスクに関する追加的な議論を提供しており、2021年年報第I部第1 A項に開示されたリスク要因を読んでよく考慮して、私たちの業務に重要なリスクおよび不確実性要因をより全面的に理解することを奨励します。
私たちの臨床試験のために十分な患者を識別、鑑定、募集することができないかもしれないし、適時に私たちの臨床試験を完成できないかもしれません。これは私たちの候補製品の開発を延期または阻止するかもしれません。
患者を識別、鑑定と募集して著者らの候補製品の臨床試験に参加し、そしてこれらの臨床試験を完成することは、著者らの成功のキーポイントである。患者登録と試験完了に影響する要素は以下のとおりである
•患者集団の規模と患者を識別するプログラム
•実験案の設計
•資格と排除基準
•研究を受けた製品候補製品のリスクと収益を感知する
•ゲノム治療法のリスクと利点を認識しています
•競争療法と臨床試験の有用性
•絶えず変化する新冠肺炎の全世界の大流行と移転医療資源が大流行に抵抗することと関係のある潜在的な追加遅延は、ある患者が新冠肺炎ワクチンを接種することを決定し、ある患者は登録或いは投与前に新冠肺炎の検査·測定が陽性を呈し、及びある患者の候補患者は新冠肺炎ワクチンを接種したくないため、研究に参加する資格を取り消された
•以前に自発的に募集を一時停止し、より多くの患者にgiroctocogene fitelparvovecを投与する3期アフィン試験のような、私たちまたは私たちの協力者の臨床試験の自発的一時停止に関連する遅延または中断、および試験サイトの活性化;
•規制当局は、giroctocogene fitelparvovecの3期模倣試験に適用された以前の臨床一時停止のような、著者らの臨床試験または著者らの協力者の臨床試験に臨床休止を適用し、この一時停止はその後キャンセルされ、Sangamoと私たちの協力者は、監督機関によって適用された臨床一時停止をタイムリーまたは許容可能な条件で解除できないかもしれない、または根本的に解除できない可能性がある
•私たちの1/2期PRECIZN-1研究では、私たちはSangamoへの移行を完了したので、私たちは以前の協力協定に基づいて、セノフィの権利と義務を達成したので、より多くの患者を募集し、投与する際に遅延や困難に遭遇する可能性があります
•調査中の病気の重症度は
•潜在的な患者に対する遺伝子検査の利用可能性;
•潜在患者に臨床試験場所の近似性と可用性を提供する
•患者の必要と希望の特徴;
•患者の同意を得て維持する能力
•試験に参加した患者が試験終了前に退出するリスク;
•医師の患者への転職方法と
•治療期間と治療後に患者を十分にモニタリングする能力がある。
われわれの臨床試験の時間は,患者の参加を募集する能力と完成に必要なフォローアップ期間に依存する。私たちの競争相手も他の候補製品を開発しています。彼らは同じ限られた患者集団のために競争しています。必要な数の患者を速やかに募集できなければ、私たちはできないかもしれません
これは私たちの候補製品の競争的地位と商業的可能性に否定的な影響を与えるかもしれないし、候補製品から利益を得ることを期待している製品収入、マイルストーン支払い、または特許使用料を遅延または減少させるかもしれない。例えば,新冠肺炎の大流行に関する挑戦,新冠肺炎検出陽性の患者,この研究への参加の見直しやスクリーニングサイト数が限られていることなどから,STAAR 1/2期臨床研究(我々の全資本が持つFabry病治療の遺伝子治療製品候補薬isaralgene cinparvovecを評価する)を募集,スクリーニング,募集,投与する患者において遅延や挑戦に遭遇している。TX 200の1/2期堅固な臨床研究も同様の遅延と挑戦を経験したことを評価した。また、著者らとファイザーは、原癌遺伝子fitelparvovecの第三段階アフィン試験で治療を受けた一部の患者は治療後にFVIII活性が150%を超え、ファイザーは今回の試験中の追加患者のスクリーニングと投与量を自発的に一時停止することを決定し、提案された方案修正案を実施し、FVIIIレベルの上昇した臨床管理にガイドラインを提供することを目的とした。自発的休止後,FDAはこの試験を臨床放置し,2022年3月にFDAは臨床放置を解除した。2022年9月には、ファイザー社による自発的な一時停止がキャンセルされ、試験が再開され、登録が再開され、用量はすぐに回復すると予想されていますが、試験中のすべての残りの患者の投与量が回復または適時に完了することを保証することはできませんか、または全く保証されていないか、またはこのような試験のデータを適時に発表することができます(もしあれば), すべての試験点がすぐに起動されるか、全くできません。
第3段階生体模倣試験の持続的な遅延または追加的な一時停止は、試験の実施と完了、および規制機関のgiroctocogene fitelparvovecの承認を求める予想スケジュールに悪影響を及ぼす可能性があり、これは逆に、giroctocogene fitelparvovecの競争地位と商業可能性、ならびに私たちの業務、将来性、および私たちの普通株の市場価格に大きな悪影響を及ぼす可能性がある。
また,遺伝子薬物に関連する有害事象の負の宣伝,患者群のような競争的臨床試験やその他の理由でわれわれの臨床試験に参加したい患者が少ない場合には,われわれの候補製品に対する臨床試験や臨床データの提出時間が遅れる可能性がある。これらの遅延は,コスト増加,臨床試験の制限や終了,製品開発スケジュールの遅延を招く可能性がある。もし私たちがこのような挑戦に対応するためにより多くの司法管轄区域に拡大することを強要すれば、追加的な費用、遅延、そして危険をもたらすかもしれない。もし私たちが計画通りに臨床試験を成功できなければ、私たちの業務、財務状況、運営結果、将来性と私たちの普通株の市場価格に不利な影響を与えるだろう。
ロシアがウクライナでとっている軍事行動を含む不利な世界経済状況は、私たちの業務にマイナスの影響を与える可能性があり、これは私たちの業務、財務状況、運営結果、見通し、私たちの普通株の市場価格に実質的な悪影響を及ぼす可能性がある。
2022年2月24日、ロシア軍はウクライナに対して重大な軍事行動を発動し、この地域で持続的な衝突と破壊が発生する可能性がある。ウクライナへの影響及び他の国が講じた行動は、カナダ、連合王国、欧州連合、米国が実施した新たなより厳しい制裁を含む。ロシアとウクライナの官僚、個人、地域、業界の他の国と会社と組織、およびロシアがこのような制裁に対する行動、および国家と政治機関のこのような制裁、緊張、軍事行動に対する反応、および起こりうるより広い衝突は、サプライチェーンの中断を招き、インフレ、金融市場の変動、資本市場の中断の激化を招き、激化する可能性があり、世界経済と金融市場への影響は、私たちの業務、運営、経営業績、財務状況、および私たちの普通株の価格と私たちが必要な時に受け入れ可能な条件でより多くの資本を調達する能力に影響する可能性がある。さらに、これらのすべての影響は、私たちと私たちの協力者のサプライチェーンを乱す可能性があり、私たちと私たちの協力者が私たちの候補製品が進行しており、将来の臨床試験の能力に悪影響を及ぼす可能性がある。軍事行動、制裁、それによる経済、市場、その他の混乱の程度や持続時間は予測できないが、巨大かもしれない。このような中断のいずれも、2021年年報に記載されている他のリスクの影響を拡大する可能性がある。
第二項株式証券の未登録販売及び収益の使用
ない。
項目3.高級証券違約
適用されません。
プロジェクト4.鉱山安全開示
適用されません。
項目5.その他の情報
ない。
項目6.展示品
| | | | | | | | | | | |
| 展示品番号 | | | 書類説明 |
| 3.1 | | | 改訂および改訂された7つ目の会社登録証明書は、改訂された(当社が2017年8月9日に提出した10-Q表四半期報告の添付ファイル3.1を参照して編入)。 |
| | | |
| 3.2 | | | 7回目の改訂後の会社登録証明書の第4回改訂証明書(当社が2020年5月22日に提出した8−K表の現在報告書の添付ファイル3.1を参照して編入)。 |
| | | |
| 3.3 | | | 第4次改正及び再改訂の定款(2020年12月15日に当社が提出した現在の8−K表報告書の添付ファイル3.1を引用して編入)。 |
| | | |
| 5.1+ | | | Cooley LLPの意見。 |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| | | |
| 10.1#+ | | | 会社とナタリア·デュブワ-スターリングフェローとの間の手紙の合意は、2022年9月28日となっている。 |
| | | |
| 23.1+ | | | Cooley LLPの同意は,本四半期報告の10-Qテーブルの添付ファイル5.1に含まれる. |
| | | |
| 31.1+ | | | 第13 a-14(A)条特等に対して幹事の認証を行う。 |
| | | |
| 31.2+ | | | 細則13 a-14(A)首席財務幹事の証明。 |
| | | |
| 32.1+ | * | | “米国法典”第18編第1350条による認証。 |
| | | |
| 101.INS | | | XBRLインスタンス文書−インスタンス文書は、そのXBRLタグがイントラネットXBRL文書に埋め込まれているので、対話データファイルには表示されない。 |
| | | |
| 101.衛生署署長 | | | イントラネットXBRL分類拡張アーキテクチャ文書 |
| | | |
| 101.CAL | | | インラインXBRL分類拡張計算リンクライブラリ文書 |
| | | |
| 101.DEF | | | インラインXBRL分類拡張Linkbase文書を定義する |
| | | |
| 101.LAB | | | XBRL分類拡張ラベルLinkbase文書を連結する |
| | | |
| 101.価格 | | | インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント |
| | | |
| 104 | | | Sangamo社の2022年9月30日までの3ヶ月間のForm 10-Q四半期報告の表紙は、内蔵XBRL形式で、添付ファイル101に含まれています |
_____________________________
*米国法第18編第1350節(2002年“サバンズ-オキシリー法案”第906節に基づく)によれば、添付ファイル32.1に添付されている“Form 10-Q”四半期報告に添付されている証明書は、改正された“1934年証券取引法”第18節の規定に基づいて登録者が提出されたとみなされてはならない。
# 契約または補償計画または手配を管理することを指す。
+同封のアーカイブ。
サイン
1934年の証券取引法の要求によると、登録者はすでに正式に本報告を正式に許可した署名者がそれを代表して署名することを促した。
日付:2022年11月3日 | | | | | |
| Sangamo治療会社 |
| |
| /s/Alexander D.Macrae |
| アレクサンダー·D·マクレレ |
| 社長と最高経営責任者 |
| (首席行政主任) |
| |
| /s/PRATHYUSHA DURAIBABU |
| パトスシャ·デュレバブ |
| 上級副社長と首席財務官 |
| (首席財務会計官) |