
アメリカです
アメリカ証券取引委員会
ワシントンD.C.,郵便番号:20549
表
(マーク1)
1934年証券取引法第13条又は15(D)条に規定する四半期報告 |
本四半期末まで
あるいは…。
1934年証券取引法第13条又は15条に基づいて提出された移行報告 |
そこからの過渡期について
依頼書類番号:
(登録者の正確な氏名はその定款に記載)
|
||
(明またはその他の司法管轄権 会社や組織) |
|
(税務署の雇用主 |
|
|
|
(主にオフィスアドレスを実行) |
|
(郵便番号) |
登録者の電話番号、市外局番を含む:(
同法第12条(B)に基づいて登録された証券:
クラスごとのタイトル |
|
取引 記号 |
|
登録された各取引所の名称 |
|
|
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の規則における“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
|
☒ |
|
ファイルマネージャを加速する |
|
☐ |
|
|
|
|
|
|||
非加速ファイルサーバ |
|
☐ |
|
規模の小さい報告会社 |
|
|
|
|
|
|
|
|
|
新興成長型会社 |
|
|
|
|
|
|
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する。ガンギエイ
登録者が空殻会社であるか否かをチェックマークで示す(取引法第12 b-2条で定義されている)。はい、そうです
2022年8月5日現在登録者は
Arcturus治療ホールディングス。その子会社は
カタログ
|
|
ページ |
第1部: |
財務情報 |
1 |
第1項。 |
財務諸表(監査なし) |
1 |
|
2022年6月30日と2021年12月31日までの簡明総合貸借対照表 |
1 |
|
2022年と2021年6月30日までの3ヶ月と6ヶ月の簡明総合経営報告書と全面赤字 |
2 |
|
2022年と2021年6月30日までの3ヶ月と6ヶ月の株主権益変動簡明総合レポート |
3 |
|
2022年6月30日と2021年6月30日までの6ヶ月間簡明合併現金フロー表 |
4 |
|
簡明合併財務諸表付記 |
5 |
第二項です。 |
経営陣の財務状況と経営成果の検討と分析 |
17 |
第三項です。 |
市場リスクの定量的·定性的開示について |
26 |
第四項です。 |
制御とプログラム |
26 |
第二部です。 |
その他の情報 |
27 |
第1項。 |
法律訴訟 |
27 |
第1 A項。 |
リスク要因 |
27 |
第二項です。 |
未登録株式証券販売と収益の使用 |
27 |
第三項です。 |
高級証券違約 |
27 |
第四項です。 |
炭鉱安全情報開示 |
27 |
五番目です。 |
その他の情報 |
28 |
第六項です。 |
陳列品 |
29 |
サイン |
32 |
|
i
前向き陳述に関する特別説明
本10-Q表四半期報告または本四半期報告は、“経営層の財務状況および経営結果の議論および分析”と題する部分を含み、本明細書で引用された文書は、連邦証券法、1933年証券法(改正)第27 A条、1934年証券取引法(改正)第21 E条に示された明示的または暗示的な“前向き陳述”を含む可能性があり、1995年の個人証券訴訟改革法の安全港条項に基づいて行われている。様々な要素の影響により、私たちの実際の結果はこれらの展望性陳述で予想された結果と大きく異なる可能性があり、その中には本四半期報告第2部1 A項“リスク要因”に列挙された要素が含まれている。法律の要求がない限り、私たちは新しい情報、未来の事件、または他の理由でも、これらの前向きな陳述を更新する義務を負わない。これらの表現は、すべての前向き表現がこれらの識別可能な語を必ず含むわけではないが、“可能”、“将”、“予想”、“予想”、“計画”、“計画”、“信じ”、“推定”または未来の結果を表す他の言葉を含む可能性がある様々な未来のイベントに対する私たちの現在の予想または信念を表す。本四半期報告書の展望的な陳述は、以下の説明を含むが、これらに限定されない
II
これらおよび他の展望的陳述は現在の予測に過ぎず、既知および未知のリスク、不確実性および他の要素の影響を受けることができ、これらのリスク、不確実性および他の要素は、私たちまたは私たちの業界の実際の結果、活動レベル、業績、または業績を展望性陳述が予想しているものと大きく異なることをもたらすかもしれない。そのほか、科学研究、臨床前と臨床試験の歴史結果は未来の研究或いは試験が同じ結論を得ることを保証せず、本文が指す歴史結果が他の研究、臨床前と臨床試験結果或いはその他の原因によって同じ方式で解釈されることも保証しない。本四半期報告書に含まれる前向き陳述は、米国証券取引委員会に提出された他の文書で議論されているリスクおよび不確実性を含むリスクおよび不確実性の影響を受ける。これらの前向きな陳述に過度に依存しないように読者に警告し、他に説明がない限り、これらの前向きな陳述は、本プレスリリースの日にのみ発表される。私たちは展望性陳述に反映された予想は合理的だと考えているが、私たちは未来の結果、活動レベル、業績或いは成果を保証することができない。
三、三、
最初の部分は資金調達ですAL情報
プロジェクト1.融資すべての報告書。
Arcturus治療ホールディングス。その子会社は
濃縮Consolidaテッド貸借対照表
(単位は千、額面情報は除く)
|
|
六月三十日 |
|
|
十二月三十一日 |
|
||
|
|
(未監査) |
|
|
|
|
||
資産 |
|
|
|
|
|
|
||
流動資産: |
|
|
|
|
|
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
売掛金 |
|
|
|
|
|
|
||
前払い費用と他の流動資産 |
|
|
|
|
|
|
||
流動資産総額 |
|
|
|
|
|
|
||
財産と設備、純額 |
|
|
|
|
|
|
||
経営的リース使用権資産純額 |
|
|
|
|
|
|
||
権益法投資 |
|
|
— |
|
|
|
|
|
非流動制限現金 |
|
|
|
|
|
|
||
総資産 |
|
$ |
|
|
$ |
|
||
負債と株主権益 |
|
|
|
|
|
|
||
流動負債: |
|
|
|
|
|
|
||
売掛金 |
|
$ |
|
|
$ |
|
||
負債を計算すべきである |
|
|
|
|
|
|
||
長期債務の当期部分 |
|
|
|
|
|
|
||
収入を繰り越す |
|
|
|
|
|
|
||
流動負債総額 |
|
|
|
|
|
|
||
繰延収入,当期分を差し引く |
|
|
|
|
|
|
||
長期債務,当期分を差し引く |
|
|
|
|
|
|
||
賃貸負債を経営し,当期分を差し引く |
|
|
|
|
|
|
||
総負債 |
|
$ |
|
|
$ |
|
||
株主権益 |
|
|
|
|
|
|
||
普通株:$ |
|
|
|
|
|
|
||
追加実収資本 |
|
|
|
|
|
|
||
赤字を累計する |
|
|
( |
) |
|
|
( |
) |
株主権益総額 |
|
|
|
|
|
|
||
総負債と株主権益 |
|
$ |
|
|
$ |
|
||
付記はこのような簡明な総合財務諸表の構成要素である。
1
Arcturus治療ホールディングス。その子会社は
業務実体簡明合併報告書配給と総合損失
(未監査)
(1株当たりのデータを除いて、千で)
|
|
3か月まで |
|
|
6か月まで |
|
|
||||||||||
|
|
六月三十日 |
|
|
六月三十日 |
|
|
||||||||||
|
|
2022 |
|
|
2021 |
|
|
2022 |
|
|
2021 |
|
|
||||
収入.収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
|
||||
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
研究と開発、ネットワーク |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
一般と行政 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
総運営費 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
運営損失 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
権益法投資の収益 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
|
|
|
外貨収益(損失) |
|
|
|
|
|
( |
) |
|
|
|
|
|
|
|
|||
財務費用、純額 |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
|
( |
) |
|
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
1株当たり基本と希釈して純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
加重平均流通株、基本株、希釈株 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
総合的な損失: |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
総合損失 |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
$ |
( |
) |
|
付記はこのような簡明な総合財務諸表の構成要素である。
2
Arcturus治療ホールディングス。その子会社は
濃縮固形化株主権益分担額
(未監査)
千の計で
2022年6月30日までの3ヶ月 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
その他の内容 |
|
|
|
|
|
合計する |
|
|||||
|
|
普通株 |
|
|
支払い済み |
|
|
積算 |
|
|
株主の |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字.赤字 |
|
|
権益 |
|
|||||
残高-2022年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式オプション行使時に普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
残高-2022年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
2021年6月30日までの3ヶ月 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
その他の内容 |
|
|
|
|
|
合計する |
|
|||||
|
|
普通株 |
|
|
支払い済み |
|
|
積算 |
|
|
株主の |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字.赤字 |
|
|
権益 |
|
|||||
残高-2021年3月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式オプション行使時に普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
残高-2021年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
2022年6月30日までの6ヶ月間 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
その他の内容 |
|
|
|
|
|
合計する |
|
|||||
|
|
普通株 |
|
|
支払い済み |
|
|
積算 |
|
|
株主の |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字.赤字 |
|
|
権益 |
|
|||||
残高-2021年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
株式オプション行使時に普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
残高-2022年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
2021年6月30日までの6ヶ月間 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
その他の内容 |
|
|
|
|
|
合計する |
|
|||||
|
|
普通株 |
|
|
支払い済み |
|
|
積算 |
|
|
株主の |
|
||||||||
|
|
株 |
|
|
金額 |
|
|
資本 |
|
|
赤字.赤字 |
|
|
権益 |
|
|||||
残高-2020年12月31日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
純損失 |
|
|
— |
|
|
|
— |
|
|
|
— |
|
|
|
( |
) |
|
|
( |
) |
買収している研究開発に関する普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
株式オプション行使時に普通株を発行する |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
|||
株式ベースの給与費用 |
|
|
— |
|
|
|
— |
|
|
|
|
|
|
— |
|
|
|
|
||
残高-2021年6月30日 |
|
|
|
|
$ |
|
|
$ |
|
|
$ |
( |
) |
|
$ |
|
||||
3
Arcturus治療ホールディングス。その子会社は
合併状態を簡素化するキャッシュフロープロジェクト
(未監査)
千の計で
|
|
6月30日までの6ヶ月間 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
経営活動: |
|
|
|
|
|
|
||
純損失 |
|
$ |
( |
) |
|
$ |
( |
) |
純損失と経営活動で使用される現金純額の調整: |
|
|
|
|
|
|
||
減価償却および償却 |
|
|
|
|
|
|
||
株式ベースの給与費用 |
|
|
|
|
|
|
||
製品の研究開発費で得られた |
|
|
— |
|
|
|
|
|
権益法投資の損失 |
|
|
|
|
|
( |
) |
|
外貨取引収益 |
|
|
( |
) |
|
|
( |
) |
その他の非現金費用 |
|
|
|
|
|
|
||
経営性資産と負債の変動 |
|
|
|
|
|
|
||
売掛金 |
|
|
|
|
|
( |
) |
|
前払い費用と他の資産 |
|
|
( |
) |
|
|
|
|
売掛金 |
|
|
( |
) |
|
|
( |
) |
負債を計算すべきである |
|
|
|
|
|
|
||
収入を繰り越す |
|
|
( |
) |
|
|
( |
) |
経営活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
投資活動: |
|
|
|
|
|
|
||
財産と設備を購入する |
|
|
( |
) |
|
|
( |
) |
投資活動のための現金純額 |
|
|
( |
) |
|
|
( |
) |
融資活動: |
|
|
|
|
|
|
||
債務収益 |
|
|
— |
|
|
|
|
|
株式オプションを行使して得られる収益 |
|
|
|
|
|
|
||
融資活動が提供する現金純額 |
|
|
|
|
|
|
||
現金、現金等価物、および制限的現金純増加 |
|
|
( |
) |
|
|
( |
) |
期初現金、現金等価物、および限定現金 |
|
|
|
|
|
|
||
期末現金、現金等価物、および制限現金 |
|
$ |
|
|
$ |
|
||
|
|
6月30日までの6ヶ月間 |
|
|||||
|
|
2022 |
|
|
2021 |
|
||
キャッシュフロー情報を補足開示する |
|
|
|
|
|
|
||
利子を支払う現金 |
|
$ |
|
|
$ |
|
||
非現金投資活動 |
|
|
|
|
|
|
||
賃貸負債と引き換えに使用権資産 |
|
$ |
|
|
$ |
|
||
普通株発行による買収で進められている研究と開発 |
|
$ |
— |
|
|
$ |
|
|
売掛金と売掛金のうち財産·設備購入 |
|
$ |
|
|
$ |
|
||
付記はこのような簡明な総合財務諸表の構成要素である。
4
Arcturus治療ホールディングス。その子会社は
濃縮合併に関する注記財務諸表
(未監査)
注1.主要会計政策の業務説明、列報根拠と概要
業務説明
Arcturus治療持株会社(“会社”或いは“Arcturus”)は後期段階にある全世界の臨床メッセンジャーRNA薬物会社であり、伝染病ワクチンの開発と肝臓と呼吸器稀な疾患の重大なチャンスに集中している。同社は2020年に臨床段階会社になり、当時同社はオルニチントランスアミナーゼ(OTC)欠陥に対する研究新薬(IND)申請と候補LUNAR-COV 19に対する臨床試験申請(CTA)がすでに関連衛生当局の許可を得たことを発表した。
陳述の基礎
添付されている簡明総合財務諸表はArcturus治療持株会社及びその子会社の勘定を含み、監査を受けていない。合併では、すべての会社間口座と取引がキャンセルされた。これらの簡明な総合財務諸表は、米国中期財務情報公認会計原則(“GAAP”)に基づいて作成された。したがって、それらは、会計基準によって要求される完全な財務諸表に必要なすべての情報および脚注を含まない。経営陣は、付随する簡明な連結財務諸表は、正常な経常的な調整を含めてすべての調整を反映しており、公正列報に掲げる中期業績に必要とされていると考えている。
中期財務業績は必ずしも年間の予想業績を代表するとは限らない。これらの簡明な総合財務諸表は、監査された総合財務諸表と、会社が2021年12月31日までの年次報告Form 10-Kに含まれる脚注と組み合わせて読まなければならない。
この等の簡明総合財務諸表は公認会計原則に基づいて作成され、管理層は債務ツールの推定値、権益法投資、株式に基づく給与支出、負債計上項目、所得税、収入及び繰延収入、リース及びその他の資産及び負債報告金額に影響する事項について推定及び仮定を行い、財務諸表の期日の或いは資産及び負債及び報告期間内の収入及び支出報告金額を開示することを要求する。これらの推定は、現在の事件や会社が将来取る可能性のある行動に対する経営陣の理解に基づいているが、実際の結果は最終的にはこれらの推定や仮定とは異なる可能性がある。
合弁企業·権益法投資と可変利益実体
当社はそれに重大な影響を与えますが支配権を持たない投資は権益法で入金されます。権益法投資活動と
2021年4月、Arcturusと日本の法律に基づいて設立された会社Axelead,Inc.はArcalis,Inc.(“合弁実体”)という合弁実体を設立し、日本の法律に基づいて会社として運営した。Axeleadは日本の製薬業界に向けた総合的な薬物発見解決策提供者である。2017年7月1日,Axeleadは武田薬品工業株式会社薬物発見研究部門の一部後継者となった。合弁会社は、メッセンジャー製造に専念する契約開発·製造組織となり、会社や第三者に製造サービスを提供することを目標としている。この合弁企業は、Arcturusのいくつかの承認権を含む合弁実体の初期資金と合弁実体株主の権利を規定する株主合意を含む。合弁企業の一部として、当社は合営実体と許可と技術移転協定を締結し、この協定に基づいて、Arcturusは合営実体にある知的財産権の非独占許可を付与し、合営実体の施設使用に供し、Arcturusにある技術移転活動を行うことを命じた。
当社は合併により、当社が当該等の実体業務の主な受益者である可変権益実体(“VIE”)を決定した。経営陣は、権力は大角星とアクレアードの間で共有され、関連しない側としている。すべての当事者の同意は実質的であり、合弁実体の重大な活動について決定するために必要である。管理層はArcturusが共同経営実体の活動を指導する権利があると信じていないが、これらの活動は共同経営実体の経済表現に最も重大な影響を与えている。したがって,当社はVIEモデルで合弁エンティティを統合する必要はないと結論した。
5
当社が保有している株式は超えないため
流動性
設立以来、同社は重大な経営赤字を発生させた。2022年6月30日と2021年12月31日までの会社の累計赤字はドル
同社の設立以来の活動には,主に研究·開発活動,一般·行政活動,資金調達がある。同社の活動は、会社が持続可能な収入と運営利益を達成するまで追加資金を得られなかったことを含む、重大なリスクと不確定要素の影響を受けている。会社設立から2022年6月30日まで同社の運営資金は、主に株式売却の収益、協力協定で得られた収入、長期債務収益に由来している。2021年度には、同社は#ドルの定期融資を受けた
経営陣は、その手元に十分な運営資金を持っており、少なくともこれらの簡明な連結財務諸表が発表された日から今後12ヶ月以内に運営に資金を提供することができると信じている。会社が追加資金を得ることに成功することは保証されず、将来の運営資金需要に対する会社の予測が正確であることが証明されるか、または任意の追加資金が今後数年間運営を継続するのに十分であることが保証されない。
市場情報を細分化する
資源配分と業績評価に関する決定を行う際に、首席運営決定者は経営部門を企業の構成要素として決定し、評価のために個別の離散財務情報を提供することができる。会社及びその主な経営意思決定者は、会社の運営状況を確認し、会社の業務を管理する
収入確認
会社は、主題606の範囲内に配置された収入確認、(I)契約の決定、(Ii)契約における履行義務の決定、(Iii)取引価格の決定、(Iv)契約の履行義務に取引価格を割り当てること、および(V)会社が契約義務を履行したとき、または義務を履行したときに収入を確認する5つのステップを実行することによって決定される。
同社の収入協定の条項には、許可料、前払い、マイルストーン支払い、研究·開発活動の精算、オプション行使費用、薬物譲渡、相談および関連技術移転費用、商業化製品販売の特許権使用料が含まれる。前金を含む予定は、受領または満了時に繰延収入として記録され、会社がこれらの手配の義務を履行するまで、収入確認を将来の期間に延期することを要求する可能性がある。イベントに基づくマイルストーン支払いは可変対価格を表し、会社は会社がマイルストーン支払いを受け取るか、受け取ることができないので、最も可能な金額方法を使用して、このような可変対価格を推定する。これは、潜在的なマイルストーン支払いを2値イベントにするからである。最も可能な金額法は会社にマイルストーンの支払いを稼ぐ可能性を決定することを要求する。これらのマイルストーンの実現には高い不確実性があることから、会社が決定したマイルストーン金額は完全に制限されており、これらの支払いに関する不確実性が解決されるまで、収入は確認されない。販売が発生した場合、同社は販売の特許権使用料に基づいて支払われた収入を確認する。不確定事件の解決やその他の状況の変化に伴い、会社は各報告期間内に取引価格を再評価する。
履行義務は、契約において独自の商品またはサービスを連携相手に譲渡する承諾であり、主題606における計算単位である。契約の取引価格は、相対的に独立した販売価格に応じてそれぞれ異なる履行義務に割り当てられ、履行義務を履行する際に収入として確認される。
参照してください“注2、協働収入”会社の連携手配の具体的な詳細については、参照のこと。
6
賃貸借証書
参照してください“付記9、支払引受及び又は事項”当社の賃貸契約の具体的な詳細については、ご参照ください。
研究と開発、ネットワーク
すべての研究と開発費用は発生した費用に計上されている。研究と開発コストは、主に賃金、株式ベースの給与、従業員福祉、臨床前研究および臨床試験に関連するコスト(臨床研究機関および他の専門サービスに支払う金額を含む)、過程中の研究と開発費用と許可契約費用、任意の贈与、および発売前在庫を差し引く。すでに支払い済みの金
研究·開発のための貨物またはサービスを受け取る前に、貨物またはサービスを受けるまで資本化しなければならない。
同社は、第三者請負業者、実験室、臨床試験場所およびその他の方面の作業支払いを含む、推定された研究と開発コストの計算すべきプロジェクトを記録した。その中のいくつかの請負者は、実際に提供されるサービスに基づいて月ごとに課金され、他のいくつかの請負者は、いくつかの契約マイルストーンを実装することに基づいて定期的に課金される。後者については、会社が貨物やサービスを利用または提供する際には費用を計上しなければならない。患者登録に関する臨床試験地点コストは,患者が試験に入り,試験中に進展するにつれて蓄積される。
発表前在庫
予備監督機関による研究候補製品の承認を得る前に、当社は発生した期間内に、生産在庫に関するコストを研究開発費としてその簡明総合運営報告書に支出し、全面的な損失を計上した。会社が規制機関の承認を得てその後候補製品を商業化する可能性があると考え、候補製品の販売が将来の経済的利益を実現することも予想される場合、会社は生産コストを在庫として資本化する。
現金フロー表
次の表は、簡明統合貸借対照表内に報告されている現金および現金等価物および限定的な現金と簡明統合現金フロー表に記載されている同じ額の総額とを照合する
(単位:千) |
|
June 30, 2022 |
|
|
June 30, 2021 |
|
||
現金と現金等価物 |
|
$ |
|
|
$ |
|
||
非流動制限現金 |
|
|
|
|
|
|
||
現金、現金等価物、および限定的な現金総額 |
|
$ |
|
|
$ |
|
||
1株当たり純損失
1株あたりの基本純損失の計算方法は,純損失を当期発行済み普通株の加重平均株式数で割ったものであり,普通株等価物は考慮しない。1株当たり純損失の計算方法は、純損失を在庫株方法で決定した期間に発行された普通株と希釈普通株等価物の加重平均株式数で割る。
新しい会計声明は、財務会計基準委員会または他の基準策定機関によって時々発表され、会社が発効日を指定してから採用される。別の議論がない限り、当社は、最近発表されたまだ発効していない基準の影響は、私たちの簡明な総合財務諸表および開示に実質的な影響を与えないと信じています。
注2.収入
同社はすでに製薬とバイオテクノロジー会社とライセンス契約と協力研究開発手配、コンサルティング、関連技術移転、薬物譲渡と製品収入協定を締結している。これらの手配によると、会社は許可料、相談費、製品費、技術譲渡費、前払い、特定の研究·開発マイルストーンまたは技術譲渡マイルストーンに達した場合のマイルストーン支払い、承認された製品販売の特許権使用料および研究開発の補償を得る権利がある
7
活動します。同社がこれらのサービスを提供するコストは研究·開発費用に含まれている。同社の記念碑的支払いは通常、ある臨床前、臨床、商業成功基準を達成することを基準としている。臨床前のマイルストーンは疾病動物モデルの体内概念検証、主要な候補対象の識別、及びINDを有効にする毒理学研究を完成する可能性がある。例えば、臨床マイルストーンは、第1の患者が第1の段階、第2の段階、および第3の段階の臨床試験を成功的に登録または完了することを含むことができ、商業マイルストーンは、通常、純売上高または総売上高に基づいて分類される。核酸薬物療法やワクチンの開発に必要な臨床前と臨床活動に関するリスクにより,同社ではこれらのマイルストーンの実現は保証されていない。
次の表に示した2022年6月30日までの6ヶ月間の契約資産残高には、パートナー、コンサルティング、関連技術移転パートナーからの売掛金、および繰延収入を含む契約負債が含まれており、会社年報に開示されている場合と比較してもよい。
(単位:千) |
|
契約資産 |
|
|
残高-2021年12月31日 |
|
$ |
|
|
請求書から確認した収入の増加 |
|
|
|
|
現金受取控除額 |
|
|
( |
) |
残高-2022年6月30日 |
|
$ |
|
|
|
|
|
|
|
(単位:千) |
|
契約責任 |
|
|
残高-2021年12月31日 |
|
$ |
|
|
高度な請求書の付加内容 |
|
|
|
|
当期承諾提供サービスの控除 |
|
|
( |
) |
残高-2022年6月30日 |
|
$ |
|
|
下表は、会社の上記期間の収入(千単位)をまとめたものである。
|
|
この3か月 |
|
|
6か月来た |
|
||||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
2022 |
|
|
2021 |
|
||||
Vinbiocare |
|
$ |
|
|
$ |
— |
|
|
$ |
|
|
$ |
— |
|
||
ジェイソン |
|
|
|
|
|
|
|
|
|
|
|
|
||||
超大型遺伝子 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
流動資金 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
イスラエル保健省は |
|
|
|
|
|
— |
|
|
|
|
|
|
— |
|
||
他にも |
|
|
|
|
|
|
|
|
|
|
|
|
||||
総収入 |
|
$ |
|
|
$ |
|
|
$ |
|
|
$ |
|
||||
以下の段落では、当社の最も重要な協力スケジュールの性質と目的に関する情報を提供します。
Vinbiocare
当社は2021年6月11日から2021年8月2日まで,Vingroup株式会社のメンバーであるVinbiocare(総称して“Vinbiocare協定”と呼ぶ)と一連の合意を締結し,これにより,当社はVinbiocareに技術専門長と支援サービスを提供し,ベトナムにおけるメッセンジャーリボ核酸薬物製品製造施設の構築に協力する。このような専門知識には,会社員や検証施設の構築に必要な薬物物質に触れることができる特定のレベルが含まれるべきである。合意条項によると、同社はまた、Vinbiocareがベトナムで第3段階の臨床研究を行うために、特定の用量のARCT-154を提供する。会社は前金を受け取り、合計#ドルになりました
ASC主題606に基づいてVinbiocareプロトコルを評価すると、同社は、Vinbiocareが顧客であると結論した。当社はVinbiocareプロトコルで約束されたすべての商品/サービスを決定し,ある約束された商品/サービスを統合した場合,当社は4つの異なる履行義務があると結論した。それは..
8
フルタイム第3段階臨床試験の支援、製造施設の拡張、技術移転のためのコンサルティングサービスの同値(“FTE”)料率。
2022年6月30日現在、取引価格には、製造施設の建設と技術移転を支援するために、受信された前払い価格と予算の精算自己コストが含まれている。当社は契約履行義務の独立販売価格、すなわち独立販売価格に対する割合に応じて、取引価格を義務履行に割り当てています。薬品と薬品の履行義務は貨物移転の時点で確認される。コンサルティング実績義務は,提供されたサービスの割合に基づいて一定期間確認されており,これは,実際に発生したコストを業績義務を履行するために予算の総コストに組み込むことを意味する.販売に基づく特許権使用料に関連するいかなる対価格も、制限されているので、薬品生産時に確認されるだろう。2022年に確認された収入は,薬物物質の交付,製造施設拡張支援の相談,第3段階臨床試験を支援する技術移転と相談に関連する。
2022年6月30日と2021年12月31日までの繰延収入総額Vinbiocareプロトコルの費用は$
ヤンソン製薬、Ultragenyx製薬、クレVac社
Janssen製薬会社(“Janssen”)、Ultragenyx製薬会社(“Ultragenyx”)とCureVac AG(“CureVac”)については,ASCテーマ606に基づいてそれぞれの合意を評価した。当社の結論は、契約相手側が顧客であることである。同社は、各合意で約束されたすべての商品/サービスを決定し、約束された商品/サービスが異なるはずがないため、独立したベースでは何の価値もないと結論した。したがって、各合意で約束された貨物/サービスは単一の履行義務として決定される。最後に、同社は、追加的な協力目標や選定目標を許可するオプションを選択するには割引価格で価格を設定しているわけではないため、取引価格を割り当てる履行義務を代表しないと結論した。
ジェイソン
2017年10月、当社はJanssenと研究協力及び許可協定(“2017プロトコル”)を締結し、RNA療法によるB型肝炎治療の候補薬物の開発に協力した。2017年の合意は、会社とヤンソンの間に関連知的財産権の発見、開発、資金義務、所有権を割り当てた。
2022年6月30日まで残りの取引価格は、受信された前払い価格、予算の自己支払い可能料金、および臨床前マイルストーン支払い#ドルを含む
2022年6月30日と2021年12月31日までの繰延収入総額Ssenは$
超大型遺伝子
二零一五年十月に,当社はUltragenyxと研究協力および許可プロトコル(改訂,“Ultragenyxプロトコル”)を締結し,これにより,ArcturusはUltragenyxにいくつかのArcturus技術の共同独占許可を付与し,この許可は以下の各段落で述べた備蓄目標独占期間内にのみ有効であった。この協力協定は2017年、2018年、2019年第2四半期に改訂された。協力の初期段階で、同社はいくつかの稀な疾病目標に対する治療方法を設計し、最適化する。Ultragenyxプロトコルによると,Ultragenyxは協力開発期間中により多くのまれな疾患標的を増加させる権利がある。また,共同開発期間中,同社はUltragenyxとともに共同指導委員会に参加する。
2022年6月30日までの既存開発目標の現在の潜在的開発、規制、ビジネスマイルストーン支払いはい$です
9
2022年6月30日まで取引価格には、受信された前払い費用、オプション支払い、独占延期支払い、およびUltragenyxプロトコル修正案3(“修正案3”)によって受信された追加料金が含まれる
修正案3は、契約の改正とされ、最初のUltragenyx協定の一部とされている。取引価格は直線に基づいて入力法を用いて収入が確認されている
流動資金
はい
2022年6月30日まで取引価格には、受信した前払い価格が含まれています
ドルの前払い価格
その他の合意
2022年1月、同社は最大#ドルの資金提供に同意した製薬会社と協定を締結した
イスラエル保健省は
2020年8月17日、同社はイスラエル衛生部(“衛生部”)と、イスラエルに同社の新冠肺炎候補ワクチン(“イスラエル供給協定”)を供給することで合意したが、適用された規制承認を含むいくつかの条件を遵守しなければならない。2020年10月、“イスラエル供給協定”によると、会社は払戻できない金#ドルを受け取った
10
付記3.公正価値計量
当社は、計量日に市場参加者間の秩序ある取引において資産を売却するか、または移転負債を支払うことによって受信された価格で、その資産および負債の公正価値を決定する。当社は公正価値を計量するための投入に基づいて公正価値階層構造を構築した。
公正価値レベルの3つの階層は以下のとおりである
第1レベル:同じ資産または負債の活発な市場でのオファー。
第2段階:活発な市場からのオファーを除いて、直接または間接的に観察可能な投入。
レベル3:観察することが困難な投入は、市場データが少ないか、または全くないので、市場参加者が使用する推定および仮定を反映する会社によって作成された推定および仮定に基づいて決定される。
現金、制限的現金、売掛金、シンガポールローンの満期日が相対的に短いため、その帳簿価値はそれぞれの公正価値に近い。金利変動により、現在の市場金利を反映しているため、当社の債務融資で抽出された長期債務の帳簿価値は公正価値に近い。
2022年6月30日と2021年12月31日まで公正な価値に応じて恒常的に計量されるすべての資産は、現金等価物および通貨市場基金を含み、公正価値階層構造の第1レベルに分類される。このような金融商品の公正な価値は見積もりに基づいて計量される。
付記4.資産負債の表示が細かい
財産と設備の純残高には、
(単位:千) |
|
June 30, 2022 |
|
|
2021年12月31日 |
|
||
研究設備 |
|
$ |
|
|
$ |
|
||
コンピュータとソフトウェア |
|
|
|
|
|
|
||
事務設備と家具 |
|
|
|
|
|
|
||
賃借権改善 |
|
|
|
|
|
|
||
建設中の工事 |
|
|
|
|
|
|
||
合計する |
|
|
|
|
|
|
||
減価償却累計と償却を差し引く |
|
|
( |
) |
|
|
( |
) |
財産と設備、純額 |
|
$ |
|
|
$ |
|
||
減価償却と償却費用は#ドルです
計算すべき負債には以下の内容が含まれる
(単位:千) |
|
June 30, 2022 |
|
|
2021年12月31日 |
|
||
補償すべきである |
|
$ |
|
|
$ |
|
||
嚢胞性線維症財団責任(注9) |
|
|
|
|
|
|
||
賃貸負債の当期部分を経営する |
|
|
|
|
|
|
||
|
|
|
|
|
|
|||
製造生産能力費 |
|
|
|
|
|
|
||
その他は研究·開発費を計算すべきである |
|
|
|
|
|
|
||
合計する |
|
$ |
|
|
$ |
|
||
注5.債務
製造業供給協定
2020年11月7日、同社の完全子会社Arcturus Treeutics,Inc.はシンガポール共和国経済発展局(“EDB”)と製造支援協定(“支援協定”)を締結した。支援協定によると、シンガポール開発銀行はシンガポールドルの定期融資(“シンガポール融資”)を提供することに同意した
11
AS2022年6月30日まで、会社はシンガポール融資の一部を流動融資と報告し、潜在元金の約新元の返済を反映している
シンガポールのローンは最初に長期債務として記録され、金額は#ドルだった
西聯銀行との長期債務
2018年10月12日、Arcturus Treateutics,Inc.は西部連盟銀行(“銀行”)と融資を締結し、#ドルを獲得した
2019年10月30日、Arcturus Treateutics,Inc.は世銀とこの融資(改正された“融資協定”)について第3の修正案(“第3修正案”)を締結した。
改正案によると、世銀は2019年10月30日にArcturus治療会社に#ドルの定期融資を提供することに同意した
Arcturus治療会社は#ドルの融資開始費を支払った
定期ローンはいつでも全額前払いできますが、以下の費用を前払いしなければなりません
満期または前払い時(前述した)には,Arcturus Treeutics,Inc.が支払いを要求される
重大な悪影響が発生したことを含む違約事件が発生した場合、当社は融資協定項下のすべての債務を直ちに返済する責任がある可能性がある。当社は2022年6月30日現在、融資協定下のすべての契約を遵守しています。
2022年6月30日現在、長期債務の元本支払い状況は以下の通り
|
|
|
|
|
2022 |
|
$ |
|
|
2023 |
|
|
|
|
合計する |
|
$ |
|
|
同社はその長期債務に関する利息支出#ドルを確認した
12
付記6.株主権益
Alexion製薬許可協定
2021年2月17日、当社とAlexion PharmPharmticals,Inc.(“アレクシオン)これにより、Alexionは、特定のAlexion特許出願を使用することを許可する独占的なグローバル許可を同社に付与する。ライセンス契約の条項に基づいて、ライセンスの交換として、会社が発表した
1株当たり純損失
2022年6月30日までの3ヶ月と6ヶ月の1株当たりの純損失計算に計上されていない希薄証券逆希釈されているからです
注7.株式ベースの報酬
2022年6月、会社の2022年株主総会において、会社株主は、2019年計画下で奨励資格者を奨励するための株式総数を増加させ、2019年計画下で奨励資格者のための株式総数を増加させる会社2019年総合持分インセンティブ計画の改正案(改正案として、すなわち“2019年計画”)を承認した
2021年10月、会社は最高到達可能性をカバーした2021年インセンティブ株式インセンティブ計画を採択した
株式オプション
当社の3か月及び6か月までの簡明総合経営報告書及び全面損失における株式補償支出2022年6月30日と2021年6月30日の状況は以下の通り
|
|
この3か月 |
|
|
|
6か月来た |
|
||||||||||||
(単位:千) |
|
2022 |
|
|
|
2021 |
|
|
|
2022 |
|
|
|
2021 |
|
||||
研究開発 |
|
$ |
|
|
|
$ |
|
|
|
$ |
|
|
|
$ |
|
||||
一般と行政 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
合計する |
|
$ |
|
|
|
$ |
|
|
|
$ |
|
|
|
$ |
|
||||
13
注8.所得税
その会社はアメリカと各州で税金を払わなければなりません。同社は予測された年間有効税率を用いて四半期所得税を算出し、本四半期に発生する任意の離散項目を調整している。有効税率と連邦法定税率との主な違いは、会社の純営業損失の推定免税額と関係がある。
2022年6月30日までの3ヶ月と6ヶ月2021年には会社記録が
付記9.支払いの引受やその他の事項
新冠肺炎ワクチンの発展動向
同社は2020年3月4日、シンガポール経済発展局から、デューク-シンガポール国立大学医学院との共同開発潜在的な新冠肺炎ワクチンの開発を支援するための贈与(“贈与1”)を得た。賞助金は最高で新元を達成できる
同社は2020年10月2日、潜在的な新冠肺炎ワクチン(ARCT-021)の臨床開発を支援するために、シンガポール経済発展局から別の贈与(“贈与2”)を獲得した。この贈与金は最高新元に達する
嚢胞性線維症財団協定
2019年8月1日、会社は嚢胞性線維化基金会(CFF)と2017年5月16日から2018年7月13日まで改訂された開発計画書簡協定を改訂した。この改正案によると、(1)林業基金は月-林業を立て替えた額を#ドルに増加させる
14
賃貸借証書
2017年10月、当社は先に入居した本社付近のオフィススペースについて撤回不可能な経営賃貸協定を締結した。レンタルは2018年3月から始まり、レンタル期間は約
2020年2月、当社は既存本社付近のオフィススペースについて2つ目の撤回不可能な経営賃貸契約を締結した。レンタル期間を延長する
同社は2021年2月、既存の本社付近のオフィススペースについて3つ目の撤回不可能な運営賃貸契約を締結した。レンタルは開始日から12ヶ月継続し、毎月の基本レンタル料は約$です
2021年9月、同社は現在の本社付近のオフィス、研究開発、工事、実験室空間について4つ目の撤回不能賃貸契約を締結した。レンタルの初期期限が延長されます
貸借対照表上の経営リース、使用権、資産、および負債は、残りのリース期間内の余剰賃貸支払いの現在値を表す。同社は賃貸支払いを非レンタル構成要素に割り当てていない;したがって、公共地域維持および行政サービスの支払いは、レンタル使用権資産および負債に含まれていない。賃貸契約中の暗黙的な金利は確定しにくいため、会社はその増加借入金金利を使用して賃貸支払いの現在値を計算する。
自分から2022年6月30日、経営リース負債の残り支払いは以下の通り
(単位:千) |
|
余剰賃貸払い |
|
|
2022 |
|
$ |
|
|
2023 |
|
|
|
|
2024 |
|
|
|
|
2025 |
|
|
|
|
2026 |
|
|
|
|
その後… |
|
|
|
|
余剰賃貸支払総額 |
|
|
|
|
差し引く:推定利息 |
|
|
( |
) |
リース負債総額を経営する |
|
$ |
|
|
加重平均残余レンタル期間 |
|
|
||
加重平均割引率 |
|
|
% |
|
経営リースコストには、経営リース負債に計上された固定賃貸支払いが含まれ、レンタル期間内に直線法で入金される。運営リースコストは$
15
付記10.関連者取引
権益法投資
2018年6月、会社はAdair技術に関する無形資産の売却を完了した。Adairの資産購入契約によると、会社は1部を受け取りました
参照してください付記1、合弁企業、権益法投資及び可変権益実体同社とAxelead社が合弁エンティティArcalis,Inc.を設立するプロトコルの具体的な詳細について。
16
プロジェクト2.経営陣の議論と分析財務状況と経営実績。
以下にArcturus治療ホールディングスが2022年6月30日までの3カ月と6カ月間の財務状況と運営結果について検討した。本合意に別段の規定がない限り、“会社”、“Arcturus”、“私たち”とは、Arcturus治療持株会社及びその合併子会社を意味する。以下の議論と分析、および中期簡明総合財務諸表と本文の他の部分に含まれる付記を読むべきです。我々の経営陣の財務状況や経営結果の検討·分析に関するより多くの情報は、2022年3月1日に米国証券取引委員会(“委員会”)に提出された2021年12月31日現在の10-K表年次報告(“2021年年次報告”)を参照されたい。本報告書が別に規定されていない限り、本報告で使用される大文字とフレーズは、2021年の年次報告書でそれらに与えられた同じ意味を持つべきである。
本報告には,我々が合理的と考えている仮説に基づいているにもかかわらず,リスクや不確実性の影響を受ける前向き表現が含まれており,これらのリスクや不確実性は,実際のイベントや状況が,このような前向き表現の現在の期待や明示または示唆の状況とは大きく異なる可能性がある。
あなたはこの報告書と私たちがこの報告書で引用した文書を読むべきで、これらの文書は証拠としてこの報告書に完全に提出されており、私たちの未来の実際の結果は私たちが予想していたものと大きく異なるかもしれないということを認識しなければならない。あなたはまた、私たちがこの報告書の日付の後に時々委員会に提出または提出される報告書に記載された要素とリスクを検討しなければならない。
概要
Arcturusは全世界末期臨床メッセンジャーRNA薬物会社であり、伝染病ワクチンの開発と肝臓と呼吸器稀な疾患の重大なチャンスに集中している。私たちのメッセンジャーRNA(メッセンジャーRNA)プラットフォームに加えて、私たち固有の脂質ナノ粒子送達システムLUNAR®複数の核酸薬剤を可能にすることが可能であるが、我々独自の自己増幅RNA技術(自己転写および複製RNAまたはStarr®技術)は、より低い用量レベルでより持続的なRNAおよび持続的なタンパク質発現を提供することが可能である。
我々は,月や我々の核酸技術に関連する独自のプラットフォームを利用して,重大な医療ニーズを満たしていないまれな遺伝疾患の予防や治療のためのmRNAベースのワクチンや治療パイプラインを開発·推進している。私たちは革新的な交付解決策を通じてこのプラットフォームを拡張し続け、私たちの発見努力を拡大することができるようにします。我々の独自月技術は、RNA治療薬を疾患に関連する標的組織に効果的かつ安全に送達すること、およびRNAワクチンにとって凍結乾燥によってコールドチェーン貯蔵および流通に関連する挑戦を緩和することなど、RNA薬物開発における主要な障害を解決することを目的としている。我々のプラットフォームは,多様な組織の多機能性,各種核酸療法との互換性,および拡張可能な製造プロセスの専門知識の開発により,次世代核酸薬を提供できると信じている。
次のグラフは私たちの現在のチャネルを表しています

17
新冠肺炎ワクチン計画の主な更新は
アメリカとシンガポールで行われた第1/2段階研究
2022年1月,米国とシンガポールで行われた1/2段階研究参加者の免疫原性データを公表した。参加者は、2剤Comirnatyを接種して少なくとも5カ月後に、増強剤として5マイクログラムのARCT-154を再接種した結果、D 614 Gおよびいくつかの関心変異体(VOCs)および関心変異体(VOI)に対する中和抗体活性レベルが鼓舞的に増加することが示された。2022年5月、91日目に中和抗体反応の持続性を示す追加の中和抗体活性データを提供した。D 614 G変異体の仮性ウイルス微中和(MNT)検証の結果,強化用量後15日目と29日目に幾何平均倍数上昇(GMFR)はそれぞれ用量前レベルの28倍と40倍であった。91日目に抗体レベルは強化前レベルの30倍に維持され,中和抗体反応の持続性が示唆された。Beta変異体に対する検証MNT試験で得られた免疫原性データも共有し,中和抗体反応の持続性はGMFRとそれぞれ15,29および91日目に26,31および−24の増加と類似していることを示した。
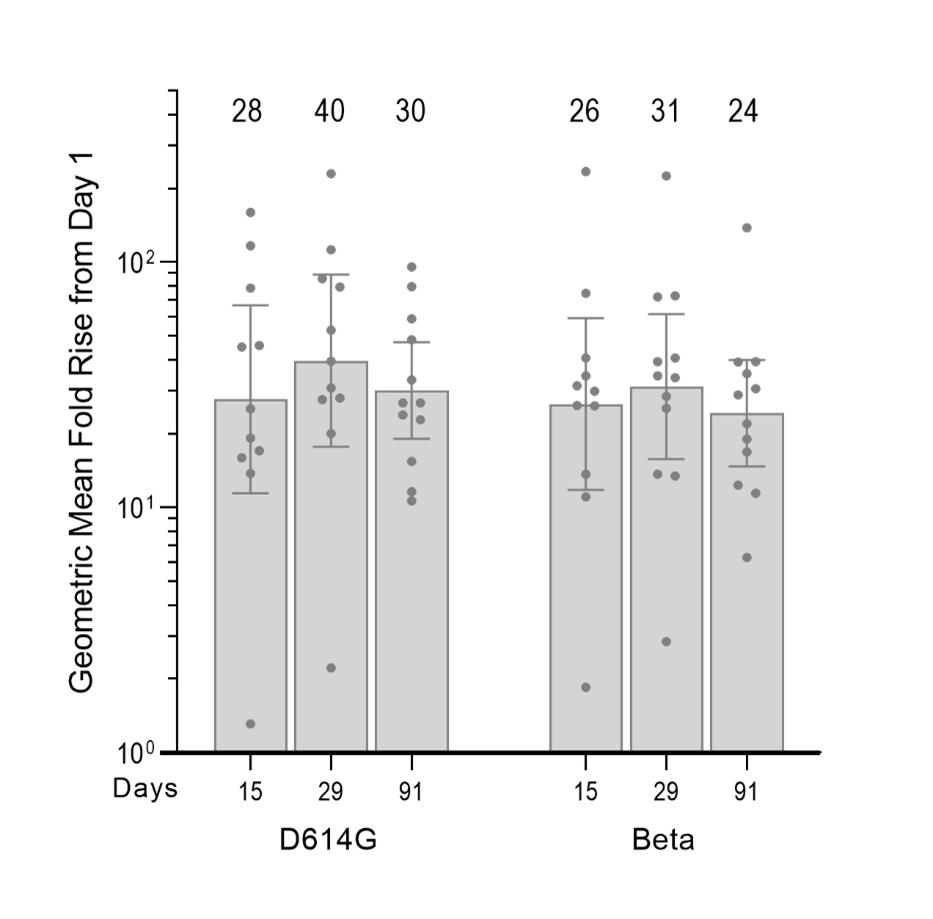
図:検証された擬似ウイルス微中和(MNT)分析結果(左:D 614 G;右:Beta)は、参加者によって得られた幾何平均濃度(95%信頼区間)から、1日目の中和抗体応答のGMFRレベル(ARCT−154を使用する前のベースラインレベル)(D 614 G:n=12/12、15日目、91日および11/12日、Beta:n=12/12、1日目、29日、91日および11/12日、15日目)について示した
18
2022年5月、ARCT-154 BoostがARMSを注射した後、91日目の代替ウイルス中和(SVNT)試験において、VOCs株(BetaおよびDeltaを含む)およびVOIS SARS-CoV-2株に対しても強力かつ持続的な中和抗体反応を示すことを発表した。
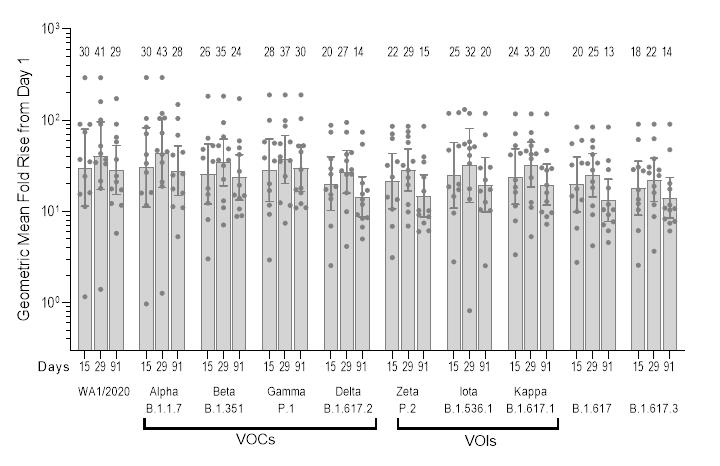
図:SARS-CoV-2変種のエージェントウイルス中和実験(SVNT)の結果.このグループは,1日目のGMFRはそれぞれ15日目,29日目,91日目(増強前ベースラインレベル;1,29,91日目n=12;15日目n=11/12)であることを示している.VOCs=注目の変形;VOIS=興味のある変異体
同一段階の1/2試験では,ARCT−154を増強剤として受けた参加者のうち,SARS−CoV−2オミック変異株BA.1とBA.2の中和抗体に対する免疫応答を示すデータ(探索的MNT試験;南アフリカ国立感染症研究所とウィトウォーターズランド大学のモル実験室)も報告されている。オミック特異的偽ウイルスMNT測定の結果,ARCT−154 ARM(n=12)の増強後29日目には,中和抗体力価はそれぞれベースラインの54倍(BA.1)と46倍(BA.2)であった。
2022年8月,追加データ(探索的MNT試験;南アフリカ国立感染症研究所とウィトウォーターズランド大学のモル実験室)の1/2段階試験からの追加データを報告し,ARCT−154 ARCT−154 ARM(n=12)増強後91日目のSARS−CoV−2オミック変異株BA.1とBA.2に対する持続中和抗体免疫応答を示した。オミック特異性偽ウイルスMNT測定の結果、免疫強化後91日目、中和抗体力価はそれぞれ44倍(BA.1)と39倍(BA.2)であった。BA.5を含むオミック変異体の6カ月間のデータが収集されており,2022年第3四半期に共有される予定である。
19
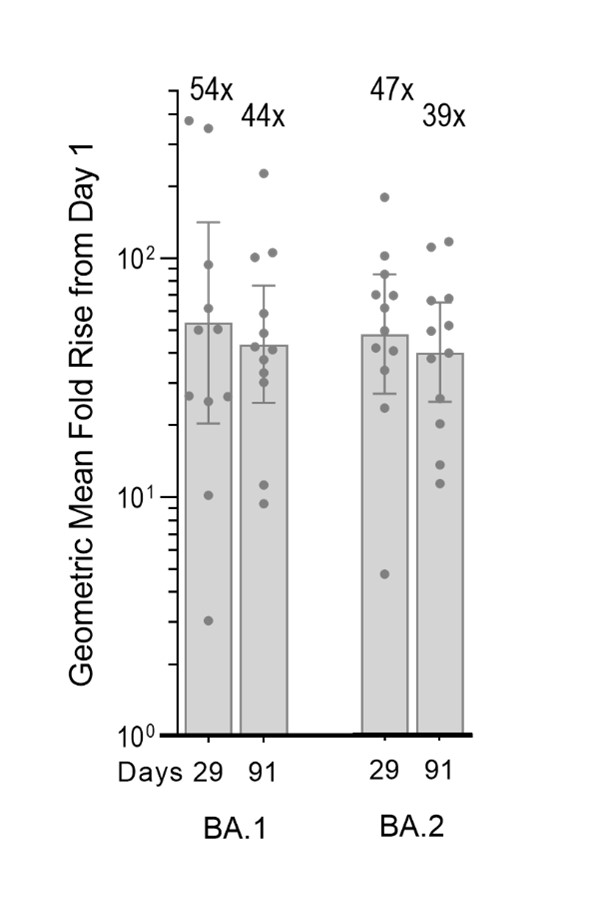
図:探索的仮性ウイルス微中和(MNT)分析結果(左:BA.1,右:BA.2)は,1日目に抗体応答を中和したGMFRレベル(ARCT−154を用いて補強する前のベースラインレベル)を示し,参加者(BA.1とBA.2:N=12/12,91日目)から得られたウイルス中和濃度(95%信頼区間)から計算した。
ベトナムの1/2/3段階研究
2021年には,Vingroup連合株式会社(Vingroup)グループ会社のメンバー会社Vinbiocare Biotech Joint Stock Company(Vinbiocare)と重要な協力を達成し,Vinbiocareに技術専門知識と支援サービスを提供し,ベトナムにおける製造工場の設立を支援した。Vinbiocareと共に、著者らは新冠肺炎に対する研究を次世代自己増幅mrnaワクチンARCT-154をベトナムの1/2/3段階研究に推進し、この研究はVinbiocareによって援助と賛助された。この試験はランダム、観察者盲法、プラセボと積極的な対照であり、ARCT-154の安全性、免疫原性と有効性を評価することを目的としている。第1/2/3段階研究の第3段階ARMは2021年9月に開始された。この研究はベトナムで19,000人以上の成人被験者を募集し,その中には新冠肺炎の重篤な合併症を有するリスクの高い個人が含まれている。本研究の第3段階プラセボ対照治療効果部分は16,000人を超える参加者を募集した。
2022年2月、私たちのパートナーVinbiocareは、研究中のプラセボ対照の1/2/3 a段階の安全性および免疫原性データを含む、約1,000人の参加者を含むベトナム保健省に提出されたARCT-154緊急使用許可(EUA)申請を完了した。Vinbiocareは2022年4月、検討中のARCT-154潜在EUAパケットを補完するために、3 b期の一部研究のワクチン安全性と有効性分析結果をベトナム衛生部に提出した。この研究のプラセボ対照段階3 b部分はワクチンの主要な治療効果の終点に達した。データ分析により、28日間隔で2剤を接種した5-MCGARCT-154の新冠肺炎に対する全体的な保護率は55.0%(95%CI;46.9%-61.9%)であり、重症と致死性新冠肺炎に対する保護率は95.3%(95%CI;80.4%-98.9%)であった。プラセボ群では9例の新冠肺炎関連死亡が報告されており,ARCT−154ワクチン群では1例であった。ARCT-154ワクチン接種グループの単一死亡は1人の年齢の大きい参加者の中で発生し、この参加者も深刻な新冠肺炎のより高いリスクに直面している。研究で新冠肺炎症例が発見された間、ベトナム新冠肺炎感染に関連する流行SARS-CoV-2株はDeltaとオミックであった(Https://coariants.org/国ごと/地域; Https://covid 19.wh.int/Region/wpro/Country/vn; HTTPS://OurWorldInData.orgニュー冠肺炎データブラウザ-ベトナム通).
Vinbiocareは,ARCT−154の2回目の服用後1カ月間に,17,000名を超えるプラセボ対照の1/2/3段階参加者のセキュリティデータを検討した。ワクチン接種群とプラセボ群のインシデント発生率は類似しており,これまで心筋炎や心膜炎の報告はなかった。請願事件の分析は,多くの事件の重症度が軽微または中等度であることを示している。データ安全監視委員会の独立した審査提案はこの研究を継続し、何の修正もしない。
20
Vinbiocareが共有している他のデータも免疫原性の主要な終点に達しており,第二剤ARCT−154接種28日後に代替ウイルス神経化試験(SVNT)により測定したところ,祖先(武漢)株の血清転換率は98.4%であった。この分析は第1/2/3 a段階研究に登録された第1陣約1000名の参加者の中で行われ,Vinbiocareが早い時期にEUA申告文書の一部としてベトナム衛生部に提供された。この研究のより包括的な免疫原性、有効性、および安全性データは後で発表される。
重要なブースター研究
ARCT−154の登録ブースター研究は2022年第4四半期に開始されると予想される。最近の衛生当局の指導によると、ArcturusはARCT-154の世界登録を支援するために、2つの試験からなる更新設計を考えている。我々は,最初に我々と協力してARCT−021を開発するグローバル実体が継続しないことを選択したため,我々の第1世代ARCT−021新冠肺炎ワクチンのすべての開発活動を一時停止した。
ワクチンプラットフォームの安定性データ
著者らの凍結乾燥新冠肺炎ワクチンの製品形式、安定性と冷鎖特性に関する新しいデータは現有の新冠肺炎ワクチンの安定性要求と比較して有利である。凍結乾燥粉の室温安定性は4日間(25℃;相対湿度60%),冷蔵庫安定性は6カ月(2~8℃),長期安定性は18カ月(−25℃~−15℃)であった。ワクチンは摂氏2~8度で輸送されることが許可されており、温度循環の下で安定していることに注意されたい。
私たちの他の候補開発プロジェクトのキー更新は
私たちの研究とプラットフォーム活動の鍵となる更新について
経営成果
以下、我々の財務状況及び経営結果の検討及び分析は、本報告の他の部分の簡明総合財務諸表及び関連付記、並びに2021年12月31日現在の年度監査された財務諸表及び関連付記とともに読まなければならない。私たちの過去の経営業績とその後の私たちの経営業績の年間比較は必ずしも将来の業績を暗示しているとは限りません。
収入.収入
私たちは、前払い、研究開発計画の許可料、研究開発資金、マイルストーン支払い、オプション行使および排他的費用、将来販売の特許使用料、相談費、および技術移転支払いを含む可能性がある製薬およびバイオテクノロジーパートナーおよび政府機関と合意しました。表に示す期間の総収入(千単位)をまとめた
|
|
6月30日までの3ヶ月間 |
|
|
2021 to 2022 |
|||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|||
収入.収入 |
|
$ |
27,093 |
|
|
$ |
2,001 |
|
|
$ |
25,092 |
|
|
* |
21
|
|
6月30日までの6ヶ月間 |
|
|
2021 to 2022 |
|||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|||
収入.収入 |
|
$ |
32,337 |
|
|
$ |
4,128 |
|
|
$ |
28,209 |
|
|
* |
*100%以上
2021年6月30日までの3カ月と比較して、2022年6月30日までの3カ月間の月収は2510万ドル増加した。収入の増加は,主にVinbiocareとの合意が1,270万ドル増加したことと,イスラエル保健省の予約費が1,250万ドル増加したことを確認したためである。
2021年6月30日までの6カ月間と比較して、2022年6月30日までの6カ月間の月収は2820万ドル増加した。収入の増加は,主にVinbiocareとの合意が1,560万ドル増加したことと,イスラエル保健省の予約費が1,250万ドル増加したことを確認したためである。
私たちの運営費用には研究開発費と一般と行政費用が含まれています。
|
|
6月30日までの3ヶ月間 |
|
|
2021 to 2022 |
|
|
6月30日までの6ヶ月間 |
|
|
2021 to 2022 |
|
||||||||||||||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
||||||||
運営費用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
研究と開発、ネットワーク |
|
$ |
38,189 |
|
|
$ |
45,679 |
|
|
$ |
(7,490 |
) |
|
|
-16.4 |
% |
|
$ |
83,082 |
|
|
$ |
95,729 |
|
|
$ |
(12,647 |
) |
|
|
-13.2 |
% |
一般と行政 |
|
|
10,993 |
|
|
|
10,042 |
|
|
|
951 |
|
|
|
9.5 |
% |
|
|
21,723 |
|
|
|
19,785 |
|
|
|
1,938 |
|
|
|
9.8 |
% |
合計する |
|
$ |
49,182 |
|
|
$ |
55,721 |
|
|
$ |
(6,539 |
) |
|
|
-11.7 |
% |
|
$ |
104,805 |
|
|
$ |
115,514 |
|
|
$ |
(10,709 |
) |
|
|
-9.3 |
% |
研究と開発費、純額
次の表に私たちの総研究開発費をカテゴリ別に示します
|
|
6月30日までの3ヶ月間 |
|
|
2021 to 2022 |
|
|
6月30日までの6ヶ月間 |
|
|
2021 to 2022 |
|
||||||||||||||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
||||||||
外部配管開発費用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
月-COVID、ネットワーク |
|
$ |
16,939 |
|
|
$ |
27,085 |
|
|
$ |
(10,146 |
) |
|
|
-37.5 |
% |
|
$ |
44,755 |
|
|
$ |
56,397 |
|
|
$ |
(11,642 |
) |
|
|
-20.6 |
% |
初期プロジェクト |
|
|
5,087 |
|
|
|
3,074 |
|
|
|
2,013 |
|
|
|
65.5 |
% |
|
|
8,638 |
|
|
|
8,027 |
|
|
|
611 |
|
|
|
7.6 |
% |
技術を発見する |
|
|
3,242 |
|
|
|
5,706 |
|
|
|
(2,464 |
) |
|
|
-43.2 |
% |
|
|
4,607 |
|
|
|
13,551 |
|
|
|
(8,944 |
) |
|
|
-66.0 |
% |
外部プラットフォーム開発費用: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
人事関連費用 |
|
$ |
10,533 |
|
|
$ |
8,563 |
|
|
$ |
1,970 |
|
|
|
23.0 |
% |
|
$ |
20,850 |
|
|
$ |
15,472 |
|
|
$ |
5,378 |
|
|
|
34.8 |
% |
施設と設備費用 |
|
|
2,388 |
|
|
|
1,251 |
|
|
|
1,137 |
|
|
|
90.9 |
% |
|
|
4,232 |
|
|
|
2,282 |
|
|
|
1,950 |
|
|
|
85.5 |
% |
研究開発費総額(純額) |
|
$ |
38,189 |
|
|
$ |
45,679 |
|
|
$ |
(7,490 |
) |
|
|
-16.4 |
% |
|
$ |
83,082 |
|
|
$ |
95,729 |
|
|
$ |
(12,647 |
) |
|
|
-13.2 |
% |
著者らの研究開発費用は主に研究開発活動の展開に関連する外部製造コスト、契約研究機関による体内研究と臨床試験、臨床と監督顧問、人員関連費用、施設関連費用と実験室用品を含む。2022年6月30日までの3ヶ月間、研究と開発費用はそれぞれ3820万ドルであったが、昨年同期は4570万ドルであり、これは主に臨床コストが1340万ドル減少したが、契約製造と実験室コストは330万ドル増加し、施設費用は110万ドル増加し、人員と相談費用は200万ドル増加したからである。2022年6月30日までの6ヶ月間の研究と開発支出はそれぞれ8310万ドルであったが、前年同期は9570万ドルであり、主な原因は臨床コストが1190万ドル減少し、許可費が490万ドル減少し、契約製造と実験室コストが330万ドル減少したが、人員コストの540万ドル増加と施設コストの増加によって相殺された。私たちは、私たちのパイプラインの進展に伴い、私たちの研究開発努力と関連コストが増加し、今後数年間も相当なレベルを維持し続けると予想している。
早期計画は、臨床前段階または第1段階の臨床段階にある計画を表し、協力的である可能性があり、CFおよびOTC計画を含む非協力的である可能性もある。Discovery Technologiesは製品ラインを拡張する我々の努力を代表しており,主にあらかじめ協力した研究と新能力評価に関連している。私たちのいくつかのプロジェクトに対して、これらの活動は私たちの協力関係と他の関係の一部であり、費用は会社に与えられた資金部分で相殺されるかもしれません。
22
費用は主に外部製造コスト、実験室用品、設備、コンサルティングと専門費用を含む。今後数年間、早期プロジェクトと発見技術の支出は着実に増加すると予想される。
関係者の支出には、主に従業員の給料と福祉、株式ベースの給与とコンサルタントが含まれており、近い将来も増加し続けると予想されている。私たちは引き続き従業員数を増やして、私たちの外部ルート、プラットフォーム、臨床試験の需要を満たすためである。
私たちの拡張に伴い、施設と設備費用は引き続き増加している。2022年6月30日までの3ヶ月間には、増加した賃貸料と、2022年4月に接収した新施設に関するコストが含まれています。我々の新施設に関するレンタル料が増加するため,施設や設備費用は短期的に増加することが予想される。
一般と行政費用
一般及び行政支出は主に行政、行政、法律及び会計機能の賃金及び関連福祉、及び法律及び会計サービスの専門サービス料、及びその他の一般及び行政支出を含む。2022年6月30日までの3ヶ月と6ヶ月、一般と行政費用はそれぞれ1100万ドルと2170万ドルだが、前年同期はそれぞれ1000万ドルと1980万ドルだった。増加の主な原因は,従業員数の増加による人員費用と新施設に関する賃貸料の増加である。
財務(費用)収入,純額
|
|
6月30日までの3ヶ月間 |
|
|
2021 to 2022 |
|
|
6月30日までの6ヶ月間 |
|
|
2021 to 2022 |
|
||||||||||||||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
||||||||
利子収入 |
|
$ |
168 |
|
|
$ |
190 |
|
|
$ |
(22 |
) |
|
|
-11.6 |
% |
|
$ |
322 |
|
|
$ |
378 |
|
|
$ |
(56 |
) |
|
|
-14.8 |
% |
利子支出 |
|
|
(728 |
) |
|
|
(710 |
) |
|
|
(18 |
) |
|
|
2.5 |
% |
|
|
(1,446 |
) |
|
|
(1,256 |
) |
|
|
(190 |
) |
|
|
15.1 |
% |
合計する |
|
$ |
(560 |
) |
|
$ |
(520 |
) |
|
$ |
(40 |
) |
|
|
7.7 |
% |
|
$ |
(1,124 |
) |
|
$ |
(878 |
) |
|
$ |
(246 |
) |
|
|
28.0 |
% |
利息収入は現金と現金等価物の形で生じる。前年同期と比較して、2022年6月30日までの3カ月と6カ月の利息収入が減少したのは、現金と現金等価物残高の減少によるものだ。利息支出は私たちが西聯銀行の融資と保証契約、シンガポールローンと関係があります。前年同期と比較して、2022年6月30日までの3ヶ月と6ヶ月の利息支出が増加したのは、主に2021年1月に資金を提供するシンガポールローンに関する計上すべき利息支出の増加によるものである。
他の収入と支出
|
|
6月30日までの3ヶ月間 |
|
|
2021 to 2022 |
|
|
6月30日までの6ヶ月間 |
|
|
2021 to 2022 |
|
||||||||||||||||||||
(千ドル) |
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
|
2022 |
|
|
2021 |
|
|
$Change |
|
|
変更率 |
|
||||||||
権益法投資の収益 |
|
$ |
(131 |
) |
|
$ |
(328 |
) |
|
$ |
197 |
|
|
|
-60.1 |
% |
|
$ |
(516 |
) |
|
$ |
920 |
|
|
$ |
(1,436 |
) |
|
* |
|
|
外貨収益(損失) |
|
|
1,217 |
|
|
|
(13 |
) |
|
|
1,230 |
|
|
* |
|
|
|
1,376 |
|
|
|
417 |
|
|
|
959 |
|
|
* |
|
||
合計する |
|
$ |
1,086 |
|
|
$ |
(341 |
) |
|
$ |
1,427 |
|
|
* |
|
|
$ |
860 |
|
|
$ |
1,337 |
|
|
$ |
(477 |
) |
|
|
-35.7 |
% |
|
*100%以上
その他の収入と支出項目は外貨取引と権益法投資の損益に関連する。2022年6月30日までの3ヶ月と6ヶ月で、それぞれ120万ドルと140万ドルの外貨収益を記録しましたが、前年同期にはそれぞれ2000万ドルの赤字と40万ドルの収益を記録しました。これは主にシンガポールのローンによるものです。
2022年6月30日までの3ヶ月と6ヶ月で、それぞれ10万ドルと50万ドルの損失を記録したが、昨年同期、バロン製薬会社への株式投資は30万ドルの損失と90万ドルの収益を出した。
23
表外手配
2022年6月30日現在、私たちは、表外手配または他の契約の狭いまたは限られた目的を促進することを目的とした、構造的融資または特別な目的エンティティと呼ばれるエンティティのような、統合されていないエンティティまたは金融協力と何の関係も確立していない。
流動性と資本資源
会社設立から2022年6月30日までの四半期まで、会社の運営資金は主に株式売却、長期債務、協力協定で得られた収入に由来している。2022年6月30日には 2.835億ドルの無制限現金および現金同等物。
融資と保証協定
2018年10月12日、西聯銀行と“融資と担保協定”(“融資協定”)を締結しました。第3の修正案によると、世銀は2019年10月30日に融資協定を1,500万ドルに増やすことに同意した。融資協定は最優遇金利に1.25%から2.75%の変動金利を加算して利上げする。改正案はさらに、融資協定の満期日を2023年10月30日と規定している。支払期間は2022年8月1日に終了し、私たちは元金残高への支払いを開始します。
製造業支援協定
2020年11月7日、EDBと“製造業支援協定”(略称“支援協定”)を締結した。支援協定によると、EDBは、LUNAR-COV 19候補ワクチン(ARCT-021)の生産を支援するために、通常の交付要件を満たすことを条件に、6,210万新元の定期融資(“シンガポール融資”)を提供することに同意した。シンガポールのローンは年利4.5%で、日ごとに計算されます。私たちは2021年1月29日に支援協定に基づいて6,210万新元(4,660万ドル)を全額借金することを選択した。EDBは、帳簿期間を2022年3月31日に延長し、監査完了後30日以内にその日までの未使用資金をEDBに返還することに同意した。監査は2022年第3四半期に完了する予定だ。双方はシンガポールの融資条項の修正について交渉を続けている。2022年6月30日現在、ARCT−021の製造に使用されていない金額に基づいて2022年度に返済可能な元金約2090万シンガポールドル(1540万ドル)を反映した流動融資の一部を報告しており、2022年度にこの一部の融資を返金する予定である。支援協定によると、シンガポール融資の残り部分は約3,120万ドルであり、最終支払日までに規制部門の承認を得ず、純売上高が1億ドル未満であれば免除することができる。我々は現在、ARCT-021の規制承認を継続しないと予想しており、2022年度にシンガポール融資の残り部分の免除についてEDBと検討を開始する予定である。
シンガポールの融資は最初に4660万ドルの長期債務として記録され、これは私たちが資金を受け取った時の現金収益だった。2022年第1四半期、“支援協定”の規定に基づき、元本債務残高に2021年に関連する計算すべき利息190万ドルを増加させ、現在の為替レートを反映して債務残高を4780万ドルに増加させるように残高を調整した。2022年6月30日までの6ヶ月間、純外貨取引収益140万ドルを記録しましたが、2021年6月30日までの6ヶ月間、純外貨取引収益40万ドルを記録しました。2022年6月30日までの3ヶ月と6ヶ月間、私たちが記録した利息支出と相応の負債はそれぞれ50万ドルと110万ドルですが、2021年6月30日までの3ヶ月と6ヶ月の利息支出と相応の負債はそれぞれ50万ドルと90万ドルです。同社は2022年6月30日現在、シンガポールの融資と関連約束でのすべての契約を守っている。
Vinbiocareプロトコル
2021年8月2日,我々はVingroup株式会社のメンバーVinbiocareと,ベトナムに我々の研究用新冠肺炎ワクチン計画を生産し,ベトナム国内で販売·使用するための製造工場を設立することで合意したことを発表した。また,Vinbiocareはベトナムで1/2/3期研究を行うことにも同意した。
合意条項によると,Vinbiocareはベトナムに製造工場を設立しており,我々はVinbiocareに我々の研究用新冠肺炎候補ワクチンを生産するノウハウとプロセスを提供している。私たちはまたベトナムでのワクチン生産の独占ライセンスをVinbiocareに提供し、この施設はベトナムでしか流通されていない。許可と技術移転は薬品製造に適しているが,メッセンジャーリボ核酸生薬の製造には適していない。Vinbiocareは4000万ドルを前払いし,技術移転に関する費用を担当している。Vinbiocareはまた,我々が提供したメッセンジャーリボ核酸医薬物質と製造施設で生産されたワクチンの特許使用料を支払う。
一般財務資源
我々が現在制限していない現金および現金等価物残高2.835億ドルの大部分は、(I)COVID Booster試験の一部に2022年度に使用されることが予想され、(Ii)インフルエンザワクチン計画のさらなる進展、(Iii)
24
私たちの月-OTC候補ARCT-810の第2段階試験を継続し、(Iv)2022年後半にCTAを提出し、(V)私たちのプラットフォームおよび他の一般的な管理活動を拡大し続けるために、私たちの月-CF計画を推進する。
私たちの未来の資本需要は予測が難しく、私たちがコントロールできない多くの要素にかかっているだろう。もし私たちが十分な財政資源を維持できなければ、私たちの業務、財務状況、そして経営業績は重大で不利な影響を受けるだろう。私たちが受け入れ可能な条件やもっと多くの必要な資金を得ることができるという保証はない。しかも、株式や債務融資は私たちの既存株主の持株に希釈効果をもたらす可能性がある。
私たちは予測可能な未来により多くの損失を被ることが予想され、私たちは発展のために資金を提供するために、より多くの債務や株式融資、またはより多くのパートナーシップを構築する必要があるだろう。わが社の収益性への移行能力は識別と開発に成功した候補メッセンジャーリボ核酸薬に依存します。もし私たちが計画のマイルストーンを実現できず、発生したコストが私たちの予測を超えたり、私たちの債務の契約要求を満たすことができなければ、私たちは自由に支配可能な支出を減らし、一部またはすべての製品の開発を停止する必要があり、これは私たちの一部の開発計画を遅らせることになり、これらは私たちの予想される業務目標を達成する能力に実質的な悪影響を与えるだろう。
資金需要
予測可能な未来には、引き続き損失が発生し、私たちが引き続き私たちの候補製品を開発し、規制部門の承認を求め、私たちの製品を商業化し始めるにつれて、損失が増加すると予想される。したがって、私たちは私たちの長期計画を支持するために追加的な資本が必要になるだろう。私たちの現在の現金状況は、重大な予測不可能な費用がないこと、パートナーが予想されるレベルで資金を提供し続けること、および私たちの支払い義務が、付記5で言及した長期信用計画の下で現在の満期日に従うのに十分であると信じています。私たちは、株式および/または債務融資、パートナーとの協力、または他の融資源を通じて追加資本を求めるつもりです。もし私たちが外部から追加的な資金を求めるなら、私たちは私たちが受け入れられる条件でこのような資金を調達できないかもしれないし、このような資金を集めることができないかもしれない。もし私たちが必要な時や受け入れ可能な条件で追加資本を調達できない場合、私たちは候補製品の削減または停止、リストラ、清算資産、破産申請、再編、他のエンティティとの合併または運営停止を要求されるかもしれない。
私たちの将来の資金需要は予測が難しく、多くの要素に依存しています
重要な会計政策と試算
私たちは公認会計基準に従って簡明な連結財務諸表を作成する。そこで,我々が把握している情報に基づいて,合理的と考えられる何らかの推定,判断,仮説を作成する.これらの判断は本質的に不確実な事項への影響を見積もることに関連しており,これらの事項は我々が報告した運営結果や財務状況に大きな影響を与える可能性がある。私たちは、2021年12月31日までの総合財務諸表付記2に、私たちの重要な会計政策をより全面的に説明しました。
25
2021年年次報告における経営陣の財務状況や経営結果の検討·分析項目7で提供される情報と比較して、我々のキー会計政策や見積もりには実質的な変化はない。
プロジェクト3.数量と品質市場リスクの開示について。
私たちの市場リスクに対する主な開口は利息収入と支出感度そして為替レートです。利息収入と支出の敏感性はアメリカの金利総水準の変化の影響を受けている。外国為替市場リスクはシンガポール経済発展局の贈与や融資と関係があり、これは本四半期報告で検討される“簡明合併財務諸表付記、1.業務説明”に付記する 適切であれば、デリバティブ金融商品を使用することで、外国為替市場リスクの開放を管理することができる。私たちはこのような派生金融商品をヘッジやリスク管理目的に使用することができる。D.D私たちの現金と現金等価物の性質と外貨為替レートに対する潜在的な影響の評価を考慮して、私たちは今のところ重大な市場リスクの開放の影響を受けていないと思います。
項目4.制御プログラムがあります
情報開示制御とプログラムの評価
取引所法案規則13 a-15(B)および規則15 d-15(B)の要求に基づいて、我々の経営陣は、当社の最高経営責任者、私たちの主要財務官、および私たちの最高会計官を含み、本四半期報告に含まれる期間の終了時に、当社の開示制御およびプログラムの設計および動作の有効性を評価した。この評価に基づき、経営陣は、2022年6月30日現在、会社の開示制御と手続きは合理的な保証レベルで有効であると結論し、2022年6月30日までの10-Q表に含まれる簡明な総合財務諸表は、すべての重要な面で、私たちの財務状況、経営業績、全面赤字、株主権益報告書、現金流量と一致し、米国公認会計原則に適合していると考えられる。
財務報告の内部統制の変化
取引所法案規則13 a-15(D)および規則15 d-15(D)の要求に基づいて、当社の経営陣は、当社のCEO、私たちの主要財務官、および私たちの主要会計官を含めて、本Form 10-Q四半期報告がカバーする期間内に、当社の財務報告の内部統制に重大な影響を与えるか、または合理的に大きな影響を与える可能性のある他の変化が発生したかどうかを決定するために、財務報告の内部統制を評価している。この評価に基づき、我々の最高経営責任者、最高財務責任者、および最高会計官は、本Form 10-Q四半期報告がカバーしている間、財務報告の内部統制に大きな影響を与えていないか、または合理的に財務報告の内部統制に大きな影響を与える可能性が高いと結論した。
26
第2部-その他R情報
項目1.法律規定法律手続き。
私たちは時々様々な法律手続きに巻き込まれ、政府の調査、知的財産権、ビジネス関係に関するクレームを含む正常な業務過程で発生するクレームの影響を受ける可能性がある。このような法的手続きやクレームの主題は、突出した複雑で重大な不確定要素の影響を受けるだろう。このような訴訟やクレームの結果は、事件にかかわらず、本質的に不確実である;したがって、損失の可能性と任意の推定された損害賠償を評価することは困難であり、かなりの判断が必要である。
第1 A項。RISK因子です。
我々の業務は、2021年12月31日までの財政年度Form 10−K年次報告第1 A項に記載されているリスクを含む様々なリスクに直面しており、これらのリスクを検討することを強くお勧めします。以下に述べる以外に,2022年3月1日に委員会に提出した2021年12月31日までのForm 10−K年次報告で述べたリスク要因に大きな変動はなかった。
我々は最初の新冠肺炎候補ワクチンARCT−021の開発を終了した。私たちの後継者である新冠肺炎候補ARCT-154のさらなる研究には多くの追加の資源と資金が必要であり、研究を完了する資金が決定されない限り、私たちはこの計画を継続できないかもしれない。
われわれの最初の新冠肺炎候補ワクチンARCT−021は選ばれており,全世界の実体と計画されている新冠肺炎に対する多国籍第三段階ワクチン試験は行われておらず,行われていない。私たちはARCT-021の追加開発研究を支援するつもりはない。私たちの次世代候補を推進するために、ARCT-154は多くの時間と資源を費やしてきた。そのほか、他のいくつかの種類はすでに承認され、全世界で広く採用されている新冠肺炎ワクチンの存在により、著者らはいずれかの新冠肺炎候補ワクチンに対して臨床試験を行い、発売許可(緊急使用許可を含む)を獲得する難度は大幅に増加した。私たちの現在の現金残高の大部分は、このような開発活動を支援する製造活動と、規制機関に書類を提出しようとする対応する製造活動と資源を含む、2022年に私たちのパイプラインのために継続している臨床前および臨床開発活動を支援するために使用される予定です。私たちのLUNAR-COV 19候補ワクチンの任意の追加の第3段階試験は、もしあれば、主にまたは私たちの現金備蓄を通じて資金を提供する必要があるかもしれない。私たちは株式取引、追加債務、または潜在的な顧客の前払い、協力取引などで追加資金を調達し、LUNAR-COV 19の商業化に資金を提供する必要があるだろう。もし私たちがそのような機会を発見できなければ、私たちは新しい冠肺炎計画を終わらせる決定を下すかもしれない。このような機会に関連するいかなる条項も、ARCT-154の最終的な商業化が私たちに与える価値を低下させるかもしれない。
我々がベトナムで行っているARCT-154 1/2/3期臨床試験のデータは、ベトナムの監督管理機関、米国FDA、または他の司法管轄区の規制機関に十分な証拠を提供できない可能性があり、それが十分に安全かつ有効であり、任意の上場承認(任意の緊急使用許可を含む)、または合理的な臨床経路が承認されることができることを証明している。
最近暴露された新冠肺炎検出キットスキャンダルにより,これらの臨床試験がベトナムで完了し,ベトナム規制機関が審査する時間が大幅に遅れる可能性がある。このスキャンダルは衛生部高官と14省の疾病コントロールセンター長と衛生官僚を追放した。臨床試験結果は本質的に不確定であり、著者らの潜在的な成功と業務の将来性は現在著者らの新冠肺炎ワクチン計画に大きく依存している。十分な安全性と有効性を証明し、これらの臨床試験を適時に完成させることができなければ、私たちは新冠肺炎ワクチンの巨大な市場機会への期待を逃す可能性が高く、私たちはこのプロジェクトのために多くの努力と財政資源を払っている。
項目2.未登録資産販売TY証券とその収益の使用。
ない。
プロジェクト3.デフォルトUPON高級証券です。
ない。
4つ目:地雷の安全TYが披露する。
適用されません。
27
項目5.その他情報です。
ない。
28
プロジェクト6.展示品。
展示品索引
展示品番号 |
|
説明する |
|
|
|
3.1 |
|
会社登録証明書。二零一九年三月十八日に提出された代表委任声明/目論見書(番号333-230353)の登録説明書添付ファイルBは、登録説明書の一部である。 |
|
|
|
3.2 |
|
証明書を改訂し、日付は2020年11月25日です。添付ファイル3.1を参照して2020年11月25日に提出されたForm 8-K(ファイル番号:001-38942)を組み込む。 |
|
|
|
3.3 |
|
Arcturus治療ホールディングスの規約。会社が2020年5月8日に米国証券取引委員会に提出したS-3表登録声明(ファイル番号333-238139)の添付ファイル3.2統合を参考にします。 |
|
|
|
4.1 |
|
登録者証券説明。添付ファイル4.1を参照して2022年2月28日に提出された2021年12月31日現在のForm 10-K年次報告(ファイル番号001-38942)に組み込む。 |
|
|
|
10.1 |
|
賠償協議形式。当社が2020年3月16日に提出した2019年12月31日現在のForm 10-K年次報告(ファイル番号001-38942)に添付ファイル10.1を参照して組み込む。 |
|
|
|
10.2 |
|
2019年の総合持分インセンティブ計画が改正され、再策定された。添付ファイル4.3を参照により2020年8月5日に提出された表S-8の登録声明(ファイル番号333-240397)に組み込む。 |
|
|
|
10.3** |
|
融資·保証契約は、2018年10月12日に、西聯銀行とArcturus Treateutics,Inc.によって締結され、添付ファイル10.1を参照して2018年10月15日に提出された外国プライベート発行者からForm 6-K(文書番号001-35932)に編入される。 |
|
|
|
10.4** |
|
AureVac AGおよびArcturus Treateutics Inc.によって改訂および再署名された開発およびオプション協定修正案は、2018年9月28日である。添付ファイル99.2を参照することにより、同社が2018年10月1日に提出した外国プライベート発行者報告テーブル6-K(文書番号001-35932)に組み込まれる。 |
|
|
|
10.5** |
|
Arcturus治療会社とJanssen製薬会社との間の研究協力と許可協定は、2017年10月18日となっている。2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)は、添付ファイル4.7を参照して組み込まれる。 |
|
|
|
10.6** |
|
Arcturus治療会社と合成ゲノム会社との間の研究と独占ライセンス契約が、2017年10月24日に発効した。添付ファイル4.8を参照して、2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)を組み込む。 |
|
|
|
10.7** |
|
Arcturus治療会社と武田製薬有限会社の完全子会社ミレニアム製薬会社との研究協定は、2016年12月6日から発効し、2017年12月21日に改訂された。添付ファイル4.9を参照して、2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)を組み込む。 |
|
|
|
10.8** |
|
Arcturus治療会社とUltragenyx製薬会社との研究協力と許可協定は2015年10月26日に締結され,2017年10月17日と2018年4月20日に改訂された。添付ファイル4.10を参照して、2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)を組み込む。 |
|
|
|
10.9** |
|
Arcturus治療会社とUltragenyx製薬会社との研究協力と許可協定第3改正案が、2019年6月18日に施行された。添付ファイル10.2を参照して、2019年6月20日に提出されたForm 8-K(ファイル番号001-38942)を組み込む。 |
|
|
|
10.10** |
|
Arcturus治療会社と嚢胞性線維化財団との間の手紙協定は,2017年5月16日であった。添付ファイル4.11を参照して、2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)を組み込む。 |
|
|
|
10.11** |
|
Arcturus治療会社と嚢胞性線維化財団の間で2019年8月1日に署名された書簡協定第2号改正案。添付ファイル10.16を参照して、2019年8月14日に提出された10-Qフォームを統合します。 |
|
|
|
10.12** |
|
Arcturus治療会社とAureVac AG間の開発とオプションプロトコルは,2018年1月1日,2018年5月3日に改訂された。添付ファイル4.12を参照して、2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)を組み込む。 |
|
|
|
10.13** |
|
Arcturus治療会社とAureVac AG間の開発·選択プロトコル第3改正案は、2019年7月26日。添付ファイル10.20を参照して、2019年8月14日に提出されたForm 10-Q(ファイル番号001-38942)を組み込む。 |
29
|
|
|
10.14** |
|
Arcturus治療会社とProtiva BioTreateutics Inc.が締結したライセンス契約は,2012年11月28日にMarina Biotech,Inc.とProtiva BioTreateutics Inc.の利益相続人として行われた。添付ファイル4.14を参照して、2018年7月10日に提出されたForm 20-F/A(ファイル番号001-35932)を組み込む。 |
|
|
|
10.15** |
|
Arcturus治療会社とMarina Biotech社との間の特許譲渡と許可協定は,2013年8月9日である。添付ファイル4.15を参照して、2018年5月14日に提出されたForm 20−F(ファイル番号001−35932)を組み込む。 |
|
|
|
10.16 |
|
Arcturus Treateutics Ltd.とArcturus Treateutics Holdings Inc.の間で2019年2月11日に締結された株式交換協定。当社が2019年3月18日に提出した2018年12月31日までのForm 10-K年次報告(文書番号001-35932)には、添付ファイル10.13を参照して組み込まれている。 |
|
|
|
10.17** |
|
改訂·再署名された合弁企業、研究協力、許可協定は、2018年7月14日、Arcturus治療会社とプロヴィデンズ治療会社との間の合弁企業、研究協力、許可協定である。会社が2019年4月10日に提出した2018年12月31日までの10-K表年次報告第1号修正案(文書番号001-35932)の10.14号添付ファイルを引用して合併する。 |
|
|
|
10.18** |
|
研究協力協定は、2019年3月8日にArcturus治療会社と武田製薬有限公司の完全子会社ミレニアム製薬会社が署名した。添付ファイル10.15を参照して、2019年3月18日に提出された2018年12月31日までのForm 10-K年次報告書(ファイル番号001-35932)を統合します。 |
|
|
|
10.19 |
|
Arcturus治療会社とARE-SD地域第44号有限責任会社との賃貸契約は、2017年10月4日。添付ファイル4.6を参照して、2018年5月14日に提出されたForm 20-F(ファイル番号001-35932)に組み込まれます。 |
|
|
|
10.20 |
|
Arcturus Treateutics Holdings Inc.とARE-SD Region No 44,LLCの間のリース協定第1修正案は、2020年2月1日となっている。当社が2020年3月16日に提出した2019年12月31日現在のForm 10-K年次報告(ファイル番号001-38942)に添付ファイル10.23を参照して組み込む。 |
|
|
|
10.21** |
|
Arcturus治療ホールディングスとシンガポール経済発展局との間の受信日は2020年3月4日である。当社が2020年3月16日に提出した2019年12月31日現在のForm 10-K年次報告(ファイル番号001-38942)に添付ファイル10.24を参照して組み込む。 |
|
|
|
10.22** |
|
Arcturus治療会社とイスラエル保健省の間の供給協定は、日付は2020年8月17日である。2020年11月9日に提出されたForm 10-Q四半期報告書(ファイル番号001-38942)は、添付ファイル10.32を参照して組み込まれる。 |
|
|
|
10.23** |
|
製造支援協定は、Arcturus治療持株会社とシンガポール経済発展局が署名し、期日は2020年11月7日である。2020年11月9日に提出されたForm 10-Q四半期報告書(ファイル番号001-38942)は、添付ファイル10.33を参照して組み込まれる。 |
|
|
|
10.24 |
|
Arcturus治療会社と西部連盟銀行の間で2020年12月1日に署名された融資·担保協定第4改正案。添付ファイル10.1を参照して2020年12月7日に提出されたForm 8−K(ファイル番号:001−38942)に組み込まれる。 |
|
|
|
10.25 |
|
2020年従業員株購入計画。添付ファイル4.3を参照して組み込むことにより、2020年8月5日に提出されたS−8(ファイル番号333−240392)を形成する。 |
|
|
|
10.26 |
|
Arcturus治療会社とARE-SD地域第44号有限責任会社との間でレンタルされる第2改正案は、2020年11月13日となっている。当社が2020年3月1日に提出した2020年12月31日までのForm 10-K年次報告(文書番号001-38942)は添付ファイル10.29を参照して当社に組み込まれています。 |
|
|
|
10.27 |
|
Arcturus治療会社とARE-SD地域番号44,LLC間のレンタル第3改正案は,2021年2月25日である。当社が2020年3月1日に提出した2020年12月31日までのForm 10-K年次報告(文書番号001-38942)は添付ファイル10.30を参照して当社に組み込まれています。 |
|
|
|
10.28 |
|
Arcturus治療ホールディングス。役員離職政策。添付ファイル10.1を参照することによって、2021年4月26日に提出されたタブ8−Kの現在の報告書(ファイル番号001−38942)を組み込む。 |
|
|
|
10.29 |
|
技術許可と技術支援協定は、Arcturus治療会社とVinbiocare研究と製造株式会社によって署名され、2021年7月29日に署名され、2021年7月30日に発効した。添付ファイル10.32を参照して、2021年8月10日に提出されたForm 10-Q四半期報告書(ファイル番号001-38942)に組み込まれる。 |
|
|
|
30
10.30 |
|
フレームワーク薬物供給協定は、2021年7月29日に署名され、2021年7月30日に発効し、Arcturus治療会社とVinbiocare研究と製造株式会社によって署名された。添付ファイル10.33を参照して、2021年8月10日に提出されたForm 10-Q四半期報告書(ファイル番号001-38942)に組み込まれる。 |
|
|
|
10.31 |
|
Arcturus治療会社と西部連盟銀行の間で2021年10月27日に署名された融資·担保協定第5修正案。添付ファイル10.34を参照して、2021年11月9日に提出されたForm 10−Q(ファイル番号001−38942)に組み込まれる。 |
|
|
|
10.32 |
|
Arcturus治療会社とTPSC IX,LLCとの間のリースは,2021年9月29日である。添付ファイル10.35を参照して、2021年11月9日に提出されたForm 10-Q(ファイル番号001−38942)に組み込まれる。 |
|
|
|
10.33 |
|
Arcturus治療ホールディングス。2021年に株式インセンティブ計画を誘導します。添付ファイル4.1を参照して、2021年10月20日に提出された表S−8の登録声明(文書番号333−260391)に組み込まれる。 |
|
|
|
10.34* |
|
Arcturus治療会社と西部連盟銀行の間で2022年4月19日に署名された融資·担保協定第6修正案。添付ファイル10.36を参照して、2022年5月8日に提出されたForm 10-Q(ファイル番号001−38942)に組み込まれる。 |
|
|
|
10.35 |
|
改正された2019年総合持分インセンティブ計画が改訂され、再策定された。2022年6月30日に提出された表S-8登録声明の添付ファイル4.3を参照して組み込まれます。 |
|
|
|
31.1* |
|
1934年改正証券取引法第13 a-14(A)又は15 d-14(A)条に基づいて発行された首席執行幹事証明書。 |
|
|
|
31.2* |
|
首席財務官は、1934年の証券取引法第13 a-14条または第15 d-14(A)条に基づいて発行された証明に基づいている。 |
|
|
|
32.1* |
|
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条に規定されている最高経営責任者証明書。 |
|
|
|
32.2* |
|
2002年の“サバンズ-オックススリー法案”906節で採択された“米国法典”第18編1350条による首席財務官の認証。 |
|
|
|
101* |
|
以下は、登録者が2022年6月30日までの財政四半期のForm 10-Q四半期報告において、インライン拡張可能ビジネス報告言語(Inline XBRL)形式で作成した財務諸表と脚注である |
|
|
101.INSイントラネットXBRLインスタンスドキュメント-インスタンスドキュメントは、そのXBRLタグがイントラネットXBRLドキュメントに埋め込まれているので、対話データファイルには表示されません |
|
|
101.SCHイントラネットXBRL分類拡張アーキテクチャ |
|
|
101.CALイントラネットXBRL分類拡張計算リンクライブラリ |
|
|
101.DEFイントラネットXBRL分類拡張定義リンクライブラリ |
|
|
101.LABインライン接続XBRL分類拡張ラベルLinkbase |
|
|
101.PREイントラネットXBRL分類拡張プレゼンテーションリンクライブラリ |
104 |
|
表紙インタラクションデータファイル(イントラネットXBRL文書に埋め込む) |
|
|
|
*アーカイブをお送りします。
**本展示品のいくつかの機密部分は、(I)が実質的ではないので、公開された文書から削除されており、(Ii)は、開示された内容に競合ダメージを与える。
経営陣の補償計画、契約、または手配。
31
標札本当だよ
1934年の証券取引法の要求によると、登録者はすでに正式に本報告を正式に許可した署名者がそれを代表して署名することを促した。
|
Arcturus治療ホールディングス。 |
|
|
|
|
日付:2022年8月9日 |
差出人: |
/s/アンディSassine |
|
|
アンディ·サシン |
|
|
首席財務官 |
32