| 12- 週,1 b期研究:過体重と肥満の非アルコール性脂肪性肝疾患患者に対する除草剤研究 − アルコール性脂肪性肝疾患患者 − TOPLINE ナスダック:ALT ステファン·ハリソン医学博士,首席研究員 2022年9月14日 |
| 前向き宣言 - 前向き宣言 安全 - 港 この プレゼンテーション は Altimmune , Inc によって用意されている. (“私たち, ”私たち,“ ”私たち,“ ” Altimmune “ The ”会社“”) と は が プライベート証券 訴訟 改革 法案 の 内のある を含む前向き - 声明“ を含み, は 臨床 開発に関する タイミング と私たちの 臨床 資産 の良好な に資金 マイルストーン を提供する 報告書 および 未来 財務 または業務 業績、 条件、 計画、 前景、 傾向、 報告書を含む。 または 戦略 と その他の 財務 と ビジネス トランザクション, を商業化 または 任意の 製品 または 候補薬 の将来性 を販売しています 添加, または もし がこのプレゼンテーションで を使用している場合, 単語 “可能”,“br}”は可能であり,“ ”は“ ”期待,“ ”は信じ,“ ”推定,“ ”期待,“ ”意図,“ ”計画,“ ”は“ と が類似した 式 と それらの 変異体を予測する. 彼ら は と 社 可能 を 展望性 - 前向き 陳述 を識別するからです 会社 警告 これらの 前向き - 前向き陳述 は 多くの 仮説、リスク、 と 不確実性に制限されています。 どの が 時間内に を変更しましたか。 重要な 要素 は 実際の 結果 と が実質的に異なる が で議論された 結果 前向き 陳述 あるいは 履歴 経験 に リスク と 不確実性を含む可能性があります, は に関する リスクを含む: COVID − 19大流行 による潜在的 影響 ,例えば 規制 審査における 遅延 、 製造 と供給 サプライチェーン 中断、 ウクライナで持続的な 衝突 不利な 影響 ヘルスケアシステム と グローバル経済の 中断 , 時間 と 信頼性 結果 研究 と 人間の安全 と が生じる可能性のある 悪影響 社の 製品 製品の 管理 による 結果 結果 と, 解釈 我々の 臨床試験 の 結果 社の 製品の 行為 候補 が から までどのように それらの 製品 候補 は 未来の 研究 で を実行することができます Br} 要因 と リスクに関する情報 が 社の 業務に影響を与える可能性がある, 財務条件 と 運営の結果 は 会社が U に提出した ファイルに含まれています。 証券 と 取引所 委員会、 社の 年度 報告 表 K と 四半期報告 表 表 Q 中の タイトル “リスク 要因” 下に 表 Q 提出を含む 表 米国証券取引委員会, どの が www . アメリカ証券取引委員会 . gov に がここで発表された 声明 が 日付が のときにのみ ここで を説明することができる , と 任意の 前向き - 本稿に含まれる 陳述 は 仮説 会社 に基づいて から ここで 日付 は合理的な と考えています 会社 は何の義務も負いません 更新 これらの 文 は 結果 として新しい 情報 または 未来の イベント . 2 |
| VVVVVVVVV VVVVVVVVV グルカゴン特異的 GLP - 1特異的 螺旋安定剤 増強効力 Euport DOMAIN 週用量、 改善したPK はGI耐性 修飾残基 プロテアーゼ安定性 COOH 3 P 卵白素 1バランス(1:1)GLP − 1:グルカゴン二受容体アゴニスト 摂食量 インスリン分泌 グルカゴン分泌 − 細胞質量/機能 グルコース,β21,胆汁酸産生 トリグリセリド重合,脂肪酸,酸化脂肪酸を改善した。Br}ケトン生成 肝臓 最初からbr}脂肪生成 低密度リポ蛋白受容体活性(血漿低密度リポ蛋白 - C) エネルギー消費 GLP − 1グルカゴン 胃排出遅延 3 1提案ホテル |
| Pemviduide 1 b期非アルコール性脂肪肝試験設計94名の被験者を1:1:1:1の割合でランダムに投与し、2型糖尿病(T 2 D)の有無で4つの治療群のうち1つに分け、ランダムに、過体重/肥満と非アルコール性脂肪性肝疾患(NAFLD)を有する被験者に対するペメドペプチド対照研究 過体重/肥満と非アルコール性脂肪性肝疾患(NAFLD) 4· 無カロリー制限或いはライフスタイル介入br}毎週スクリーニングbr}プラセボ 毎週プラセボ1.8 mgを服用し、計12週間 週2.4 mg、計8週間 週1.2 mg、計12週間 1.8 0.6 1.8 4- 週滴定 |
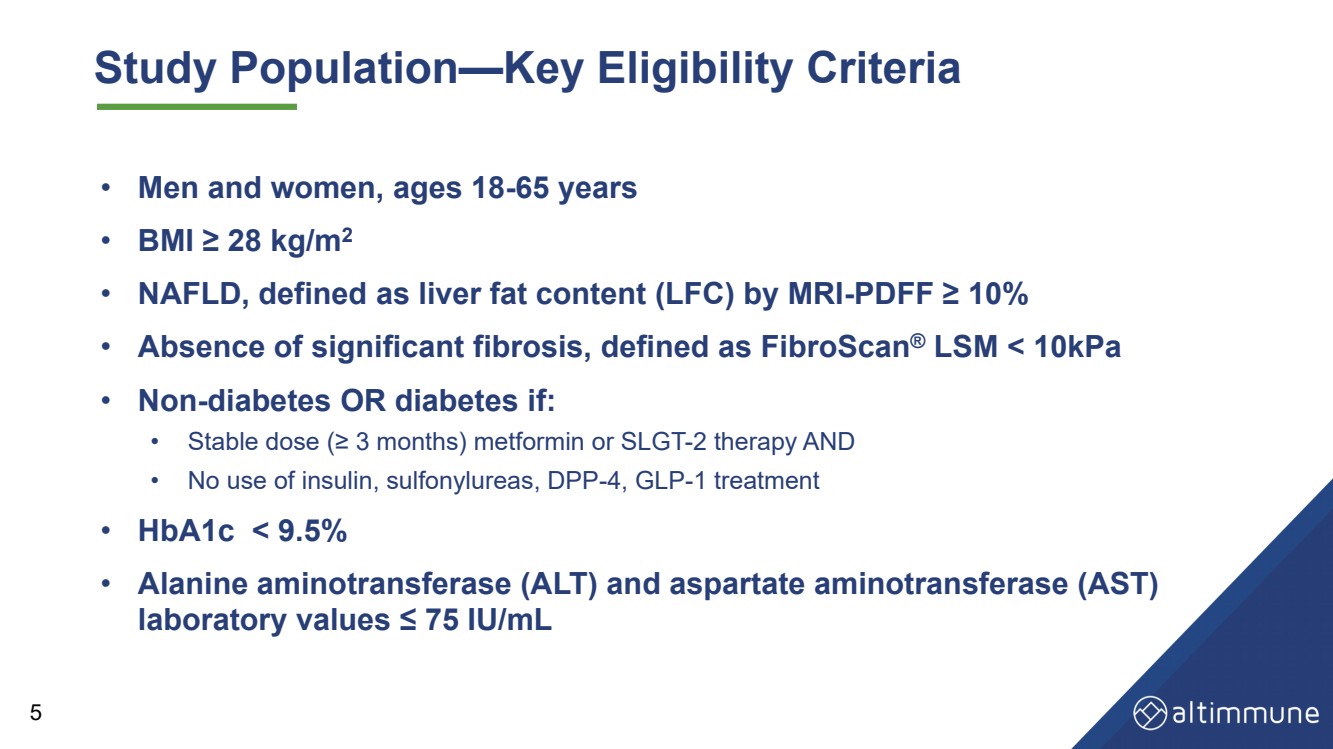
| 研究群 − の主な合格基準 · 男性と女性、年齢18-65歳 · 体重指数28 kg/m 2· 非アルコール性脂肪肝、核磁気共鳴検査により肝臓脂肪含有量(LFC) - 10% · は明らかな繊維化がなく、繊維スキャン LSMと定義した |
| 研究終点 治療効果 主な終点:MRIによる肝臓脂肪含有量 − pdff · 肝心な副次的終点:体重減少パーセンテージ(%) 安全性 有害事象(AEs) · 重症と重篤なAEs · による薬中止を招くAEs · 胃腸耐性 · ALT上昇 · バイタルサイン 血糖コントロール(空腹血糖、糖化ヘモグロビン) 6 |
| Characteristics of Study Participants Characteristic Treatment Placebo (n = 24) 1.2 mg (n=23) 1.8 mg (n=23) 2.4 mg (n=24) Age, years mean (SD) 47.9 (14) 48.6 (11) 50.3 (9) 48.8 (8) Gender female, n (%) 14 (58.3%) 9 (39.1%) 12 (52.2%) 15 ( 62.5%) Race white, n (%) 21 (87.5%) 21 (91.3%) 20 (87.0%) 24 (100%) other, n (%) 3 (12.5%) 2 (8.7%) 3 (13.0%) 0 (0.0%) Ethnicity Hispanic, n (%) 14 (58.3%) 20 (87.0%) 19 (82.6%) 18 (75.0%) not Hispanic, n (%) 10 (41.7%) 3 (13.0%) 4 (17.4%) 6 (25.0%) BMI , kg/m 2 mean (SD) 36.9 (4.7) 36.3 (5.6) 35.4 (3.9) 35.3 (5.0) Body weight , kg mean (SD) 105.1 (20.8) 102.4 (14.6) 98.9 (19.7) 98.2 (18.9) Diabetes status T2D, n (%) 6 (25.0%) 7 (30.4%) 7 (30.4%) 7 (33.3%) Liver fat content (LFC) , % mean (SD) 23.8 (9.2) 21.6 (7.3) 21.8 (8.0) 20.2 (7.0) ALT , IU/L mean (SD) 39.5 (21.4) 32.4 (13.8) 36.4 (15.6) 37.8 (24.4) Blood pressure , mm Hg systolic, mean (SD) 122.8 (11.4) 129.0 (14.1) 123.2 (15.9) 125.9 (12.3) diastolic, mean (SD) 79.6 (6.0) 79.3 (9.1) 77.8 (9.7) 80.1 (8.6) Total cholesterol , mg/dL mean (SD) 181.4 (39.0) 186.9 (44.8) 200.0 (35.2) 182.2 (39.7) LDL cholesterol , mg/dL mean (SD) 100.0 (38.2) 100.2 (34.3) 116.6 (33.6) 101.3 (33.0) Triglycerides , mg/dL mean (SD) 169.3 (90.1) 224.9 (119.1) 192.2 (114.9) 220.0 (169.3) HDL cholesterol , mg/dL mean (SD) 47.5 (6.8) 42.6 (9.1) 47.0 (9.9) 45.3 (7.3) 7 |
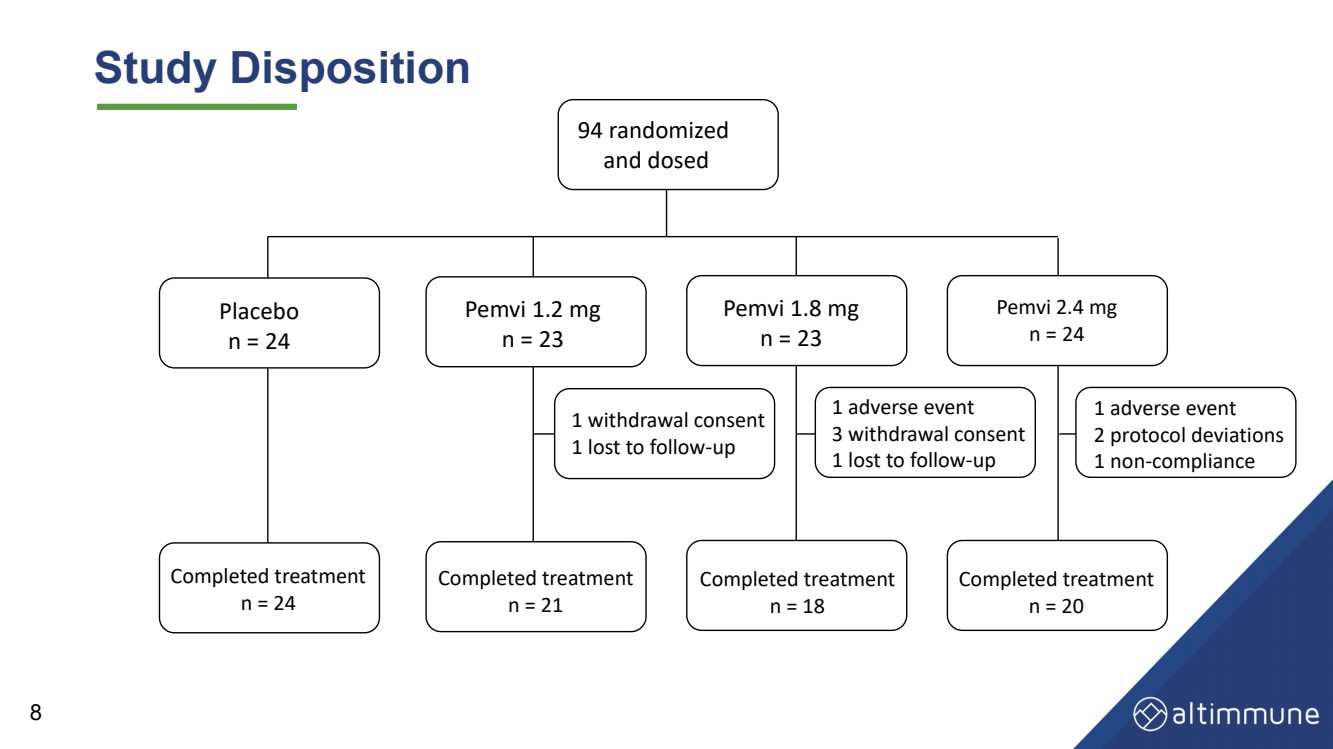
| 8研究処理 94ランダム および用量 プラセボ n=24個のPemvi 1.2 mg n=23個のPemvi 1.8 mg n=23個のPemvi 2.4 mg n=24個の完了治療 n=24個の完了治療 n=21個の完了治療 n=20 1つの中止同意 1つの訪問失敗 - 治療 1つの不良イベント 3つの中止同意br}Br}1回の訪問失敗 - 上 1回の不良イベント 2次プラン偏差 1回は - コンプライアンス に適合していない 2次プラン偏差 n=18 |
| 12週にMRI検査により肝臓脂肪含有量 - pdff 9絶対値減少 相対減少 *p を低下させる |
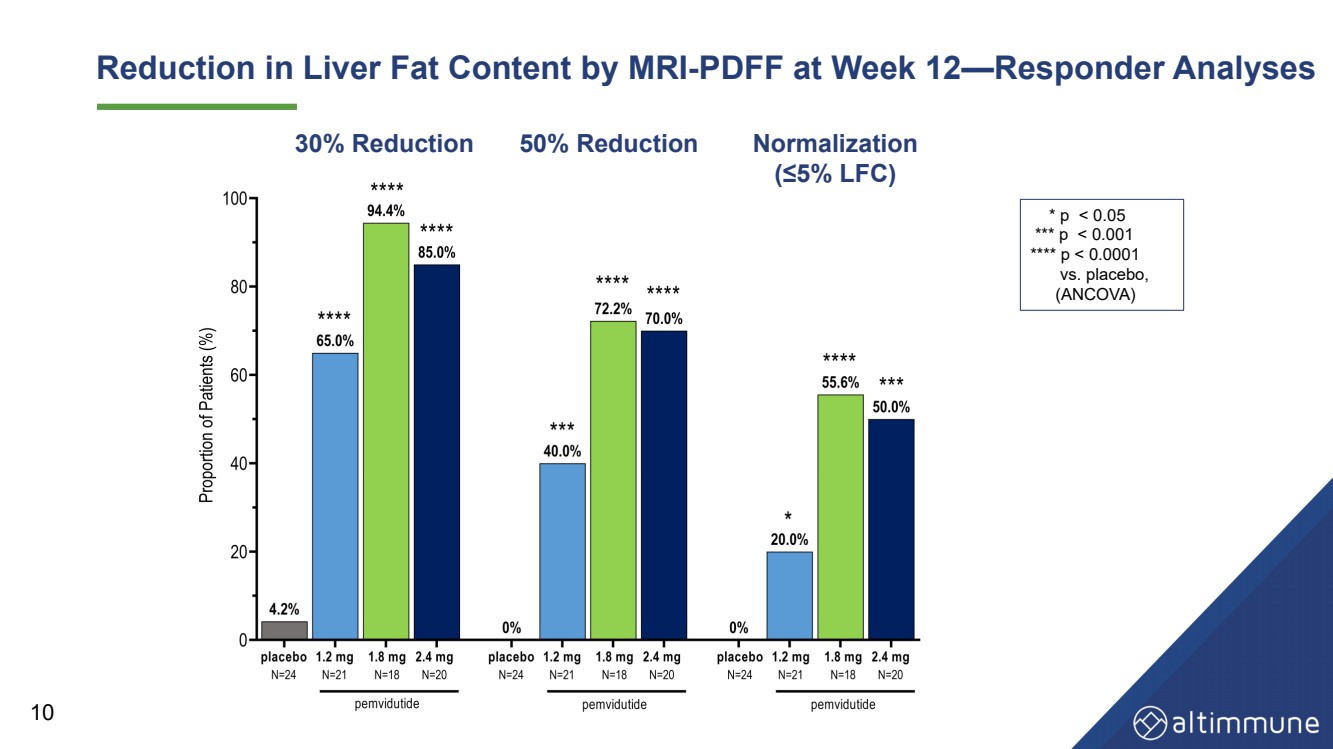
| 10 12週目にMRI - PDFFによる肝臓脂肪含有量の低下- 応答者分析 *p |
| 12週目ALT低下11全被験者 被験者はベースライン ALT 30 IU/L *p |
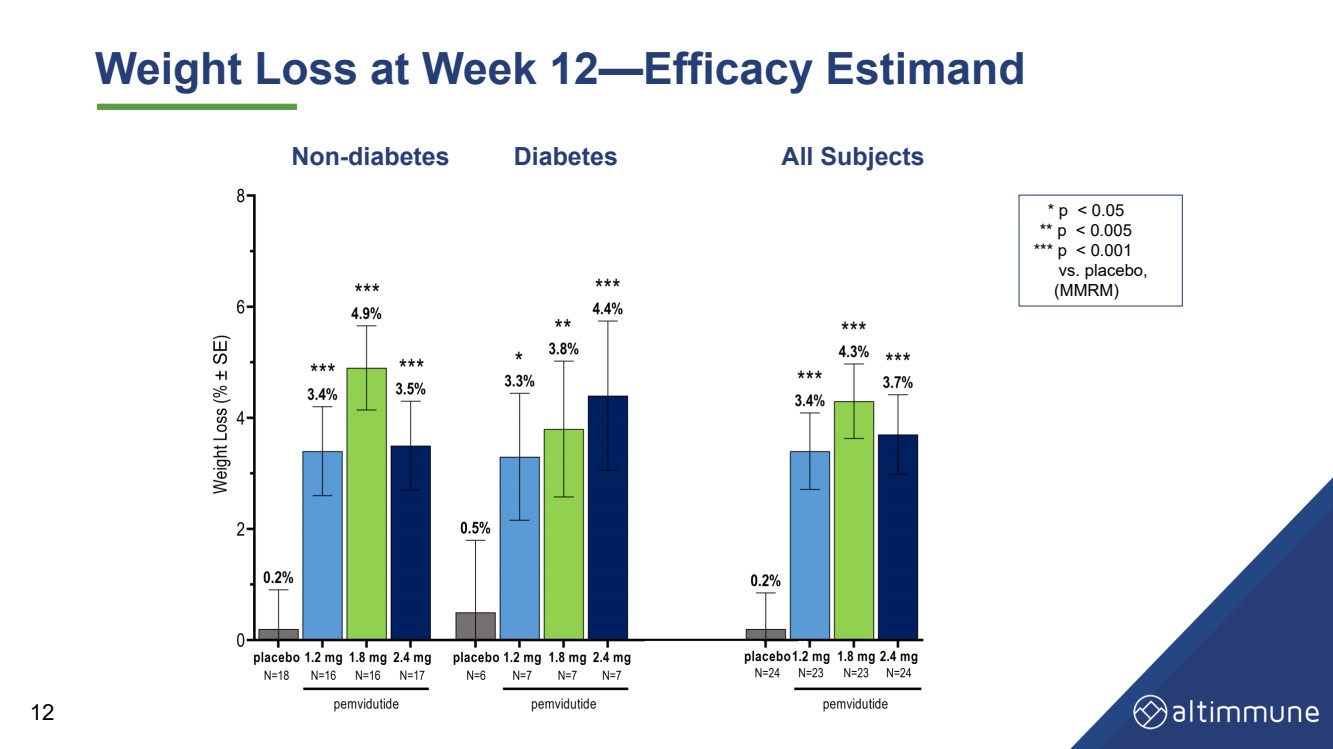
| 12週間体重減少- 治療効果 評価 12非 - 糖尿病 糖尿病 すべての被験者 *p |
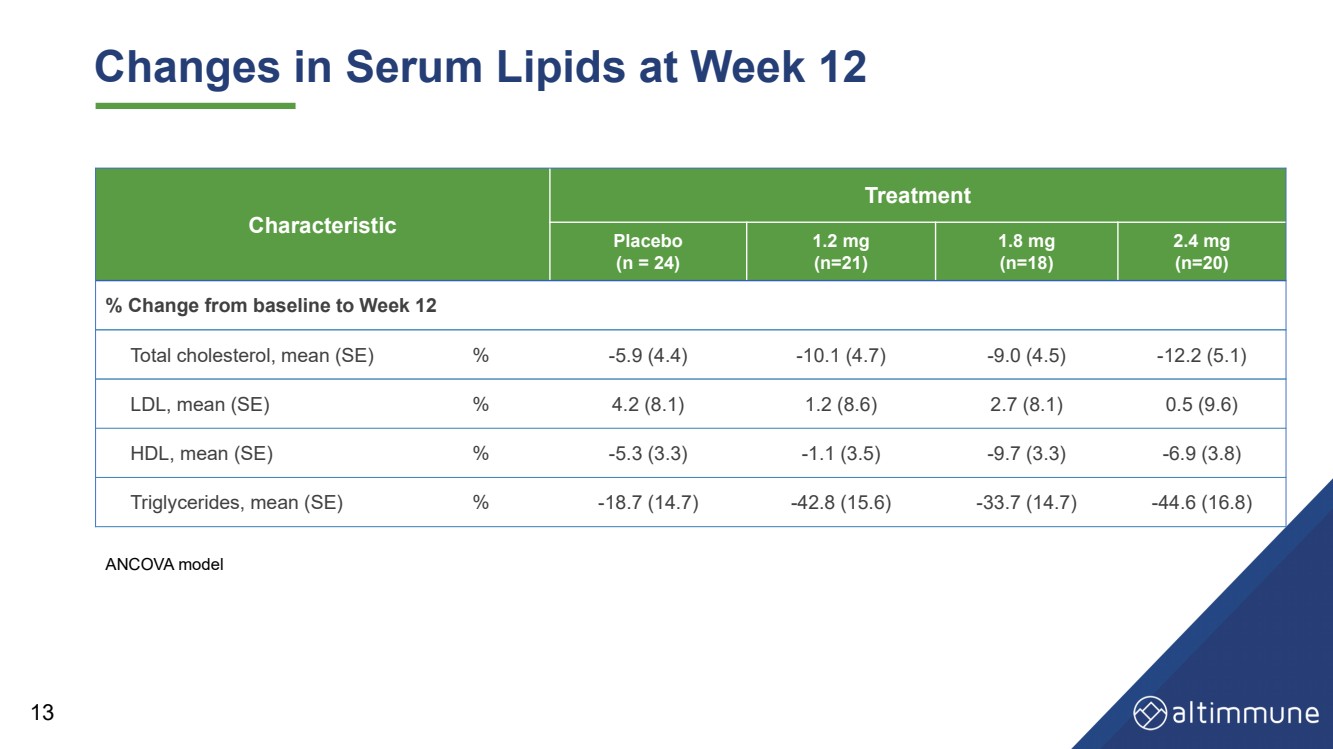
| 13治療12週時の血中脂質変化 治療 プラセボ (n=24) 1.2 mg (n=21) 1.8 mg (n=18) 2.4 mg (n=20) ベースラインから12週目までの総コレステロール変化。平均値(SE) % − 5.9(4.4) − 10.1(4.7) − 9.0(4.5) − 12.2(5.1) 低密度リポ蛋白,平均値 (SE) % 4.2(8.1) 1.2(8.6) 2.7(8.1) 0.5(9.6) 高密度リポ蛋白,平均値 (SE) % − 5.3(3.3) − 1.1(3.5) − 9.7(3.3) − 6.9(3.8) トリグリセリド ,平均値 (SE) - 18.7(14.7) - 42.8(15.6) - 33.7(14.7) - 44.6(16.8) ANCOVAモデル |
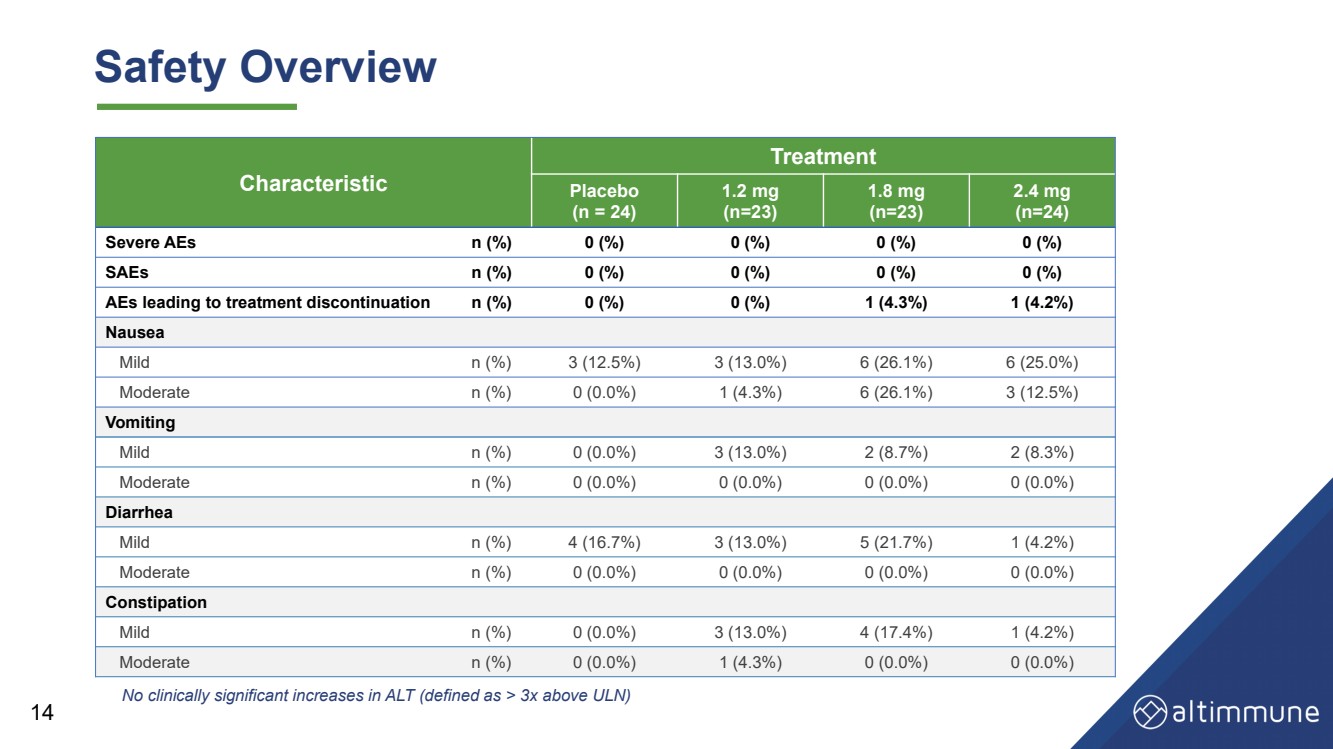
| Characteristic Treatment Placebo (n = 24) 1.2 mg (n=23) 1.8 mg (n=23) 2.4 mg (n=24) Severe AEs n (%) 0 (%) 0 (%) 0 (%) 0 (%) SAEs n (%) 0 (%) 0 (%) 0 (%) 0 (%) AEs leading to treatment discontinuation n (%) 0 (%) 0 (%) 1 (4.3%) 1 (4.2%) Nausea Mild n (%) 3 (12.5%) 3 (13.0%) 6 (26.1%) 6 (25.0%) Moderate n (%) 0 (0.0%) 1 (4.3%) 6 (26.1%) 3 (12.5%) Vomiting Mild n (%) 0 (0.0%) 3 (13.0%) 2 (8.7%) 2 (8.3%) Moderate n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) Diarrhea Mild n (%) 4 (16.7%) 3 (13.0%) 5 (21.7%) 1 (4.2%) Moderate n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) Constipation Mild n (%) 0 (0.0%) 3 (13.0%) 4 (17.4%) 1 (4.2%) Moderate n (%) 0 (0.0%) 1 (4.3%) 0 (0.0%) 0 (0.0%) 14 Safety Overview No clinically significant increases in ALT (defined as > 3x above ULN) |
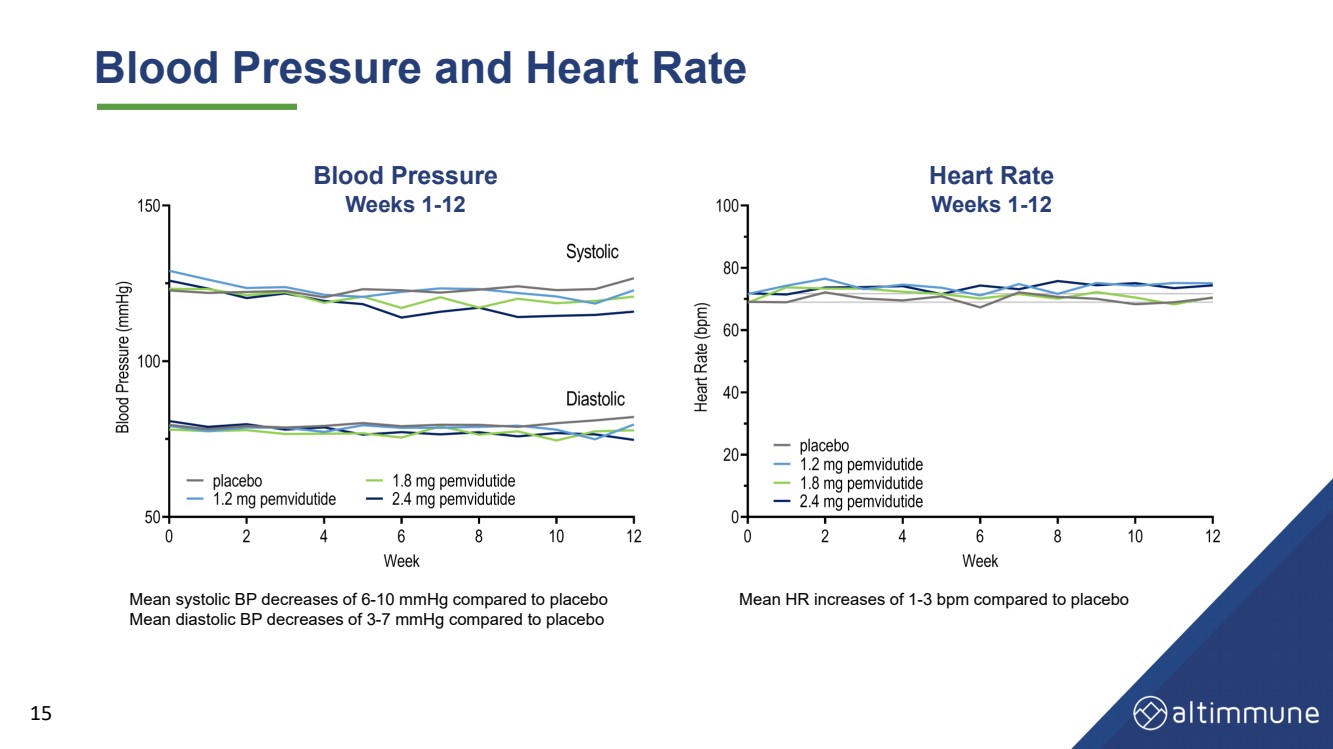
| Blood Pressure and Heart Rate 15 Mean HR increases of 1 - 3 bpm compared to placebo Blood Pressure Weeks 1 - 12 Heart Rate Weeks 1 - 12 Mean systolic BP decreases of 6 - 10 mmHg compared to placebo Mean diastolic BP decreases of 3 - 7 mmHg compared to placebo |
| Glycemic Variables ─ Non - diabetes and Diabetes 16 Characteristic Treatment Placebo 1.2 mg 1.8 mg 2.4 mg NON - DIABETES N=18 N=16 N=16 N=17 Fasting glucose Baseline, mg/dL mean (SD) 99.9 (13.6) 99.4 (12.4) 95.1 (10.3) 97.9 (13.6) Week 12, mg/dL mean (SD) 101.6 (16.7) 99.5 (12.5) 96.0 (10.8) 100.1 (11.0) HbA1c Baseline, % mean (SD) 5.8 (0.2) 5.7 (0.3) 5.7 (0.3) 5.6 (0.4) Week 12, % mean (SD) 5.8 (0.2) 5.9 (0.4) 5.6 (0.4) 5.8 (0.3) DIABETES N=6 N=7 N=7 N=7 Fasting glucose Baseline, mg/dL mean (SD) 114.0 (18.1) 124.4 (26.1) 117.3 (34.7) 166.1 (49.6) Week 12, mg/dL mean (SD) 128.5 (33.9) 118.4 (36.8) 135.9 (65.5) 129.9 (52.6) HbA1c Baseline, % mean (SD) 6.2 (0.6) 6.6 (1.4) 6.4 (0.5) 7.5 (1.3) Week 12, % mean (SD) 6.3 (0.8) 6.4 (1.6) 6.9 (1.5) 7.7 (1.2) |
| Summary and Conclusions • Robust (>68%) relative liver fat reductions at 12 weeks, better than or equal to the effects of other leading NASH candidates • Significant reductions in serum ALT point to potent effects in NASH clinical trials • Non - diabetes — placebo - adjusted weight loss (4.7%) at Week 12 • Diabetes — placebo - adjusted weight loss (3.9%) at Week 12 Liver fat reduction Weight loss • No severe or serious AEs and low rates of AEs leading to treatment discontinuations • Well - tolerated without the need for dose titration, consistent with prior experience • No clinically significant ALT elevations • Glycemic control maintained Safety and tolerability 17 |
| NASDAQ: ALT Questions pertaining to this presentation: Rich Eisenstadt, CFO reisenstadt@altimmune.com |