アメリカ証券取引委員会
ワシントンD.C.,20549
表
本財政年度末まで
依頼文書番号
GeoVax研究所,Inc.
(登録者の正確な氏名はその定款に記載)
| (明またはその他の司法管轄権 会社や組織)
(主にオフィスアドレスを実行) | アメリカ国税局の雇用主は 識別コード)
(郵便番号) |
(
登録者’市外局番が含まれています
同法第12条(B)に基づいて登録された証券:
| クラスごとのタイトル | 取引記号 | 登録された各取引所の名称 |
| | | それは.. |
| | | それは.. |
同法第12条(G)により登録された証券:なし
登録者が証券法規則405で定義されている経験豊富な発行者である場合は、再選択マークで示してください。そうだな
登録者がこの法第13節または第15節(D)節に基づいて報告を提出する必要がないかどうかを再選択マークで示す。そうだな
再選択マークは、登録者が(1)過去12ヶ月以内(または登録者がそのような報告の提出を要求されたより短い期間)に、1934年の証券取引法第13条または第15(D)節に提出されたすべての報告書を提出したかどうか、および(2)過去90日以内にそのような提出要件に適合しているかどうかを示す
再選択マークは、登録者が過去12ヶ月以内(または登録者がそのような文書の提出を要求されたより短い時間以内)に、S−T規則405条(本章232.405節)に従って提出を要求した各相互作用データファイルを電子的に提出したか否かを示す
登録者が大型加速申告会社,加速申告会社,非加速申告会社,小さな報告会社,あるいは新興成長型会社であることを再選択マークで示す。取引法第12 b-2条の“大型加速申告会社”、“加速申告会社”、“小申告会社”、“新興成長型会社”の定義を参照されたい。
大型加速ファイルサーバおよび加速ファイルサーバ
新興成長型企業であれば、登録者が延長された移行期間を使用しないことを選択したか否かを再選択マークで示し、取引所法第13(A)節に提供された任意の新たまたは改正された財務会計基準を遵守する。ガンギエイ
登録者が報告書を提出したかどうかを再選択マークで示し、その経営陣が“サバンズ-オキシリー法案”(“米国連邦法典”第15編、第7262(B)節)第404(B)条に基づいて財務報告書の内部統制の有効性を評価したことを証明し、その評価は、その監査報告を作成した公認会計士事務所によって行われた
登録者が空殻会社であるか否かをチェックマークで示す(同法第12 b-2条で定義される)。はい、そうです
登録者の非関連会社が2021年6月30日に保有する普通株の総時価は,その日の終値に基づいて$となる
2022年3月9日現在の発行済み普通株式数:
引用で編入された書類
登録者は、その2022年年次総会の最終委託書に関する提出された内容の一部を参照して本文書の第3部に組み込む。
カタログ表
| 第1部 |
1 |
|
| 第1項。 |
商売人 |
1 |
| 第1 A項。 |
リスク要因 |
15 |
| 項目1 B。 |
未解決従業員意見 |
27 |
| 第二項です。 |
特性 |
27 |
| 第三項です。 |
法律手続き |
27 |
| 第四項です。 |
炭鉱安全情報開示 |
27 |
| 第II部 |
28 |
|
| 五番目です。 |
登録者普通株市場、関連株主事項、発行者による株式証券の購入 |
28 |
| 第六項です。 |
保留されている |
28 |
| 第七項。 |
経営陣の財務状況と経営成果の検討と分析 |
28 |
| 第七A項。 |
市場リスクの定量的·定性的開示について |
34 |
| 第八項です。 |
財務諸表と補足データ |
34 |
| 第九項です。 |
会計·財務開示面の変化と会計士との相違 |
35 |
| 第9条。 |
制御とプログラム |
35 |
| プロジェクト9 B。 |
その他の情報 |
35 |
| プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
35 |
| 第三部 |
36 |
|
| 第10項。 |
役員、行政、会社の管理 |
36 |
| 第十一項。 |
役員報酬 |
36 |
| 第十二項。 |
ある実益所有者の担保所有権及び経営陣及び株主に関する事項 |
37 |
| 十三項。 |
特定の関係や関係者の取引、取締役の独立性 |
37 |
| 14項です。 |
主な会計費用とサービス |
37 |
| 第4部 |
38 |
|
| 第十五項。 |
展示品と財務諸表の付表 |
38 |
| 第十六項。 |
表格10-Kの概要 |
40 |
| サイン |
41 |
本年度報告(以下の管理に関する章を含む)’財務状況と経営結果の討論と分析)は、私たちの業務、財務状況、経営結果と将来性に関する前向きな陳述を含む。このような言葉は“期待して” “期待しています” “意向は、” “計画は、” “信じています” “探しています” “推定数”このような語の同様の表現または変異体は、前向き陳述を識別することを意図しているが、本年度報告において前向き陳述を識別する唯一の手段ではない。また、将来の事項に関する陳述は、当社の業務、当社の財務状況、当社製品の研究·開発に関する陳述、および非歴史的事項に関する他の陳述を含み、前向きな陳述である。
本年度報告書の前向きな陳述は、我々の経営陣の善意の判断を反映しているにもかかわらず、このような陳述は、私たちが現在知っている事実と要素にしか基づいていない。そのため、展望性陳述は固有にリスクと不確定要素の影響を受け、実際の結果と結果は展望性陳述中の討論或いは期待の結果と大きく異なる可能性がある。このような結果および結果の違いをもたらすか、または促進する可能性のある要因は、タイトルの下で議論される要因を含むが、これらに限定されない“リスク要因”以下,本年度報告で他の場所で検討した場合とする。読者はこれらの前向き陳述に過度に依存しないでください。これらの前向き陳述は本年度報告発表の日にのみ発表されます。私たちは、本年度の報告日後に起こりうる任意のイベントや状況を反映するために、いかなる前向きな陳述を修正または更新する義務はありません。著者らは読者に本年報で開示された各資料を慎重に検討し、これらの資料は興味のある人に意見を提供し、当社の業務、財務状況、経営業績及び将来性に影響する可能性のあるリスクと要素を説明することを目的としている。
第1部
| 第1項。 |
商売人 |
概要
GeoVax Labs,Inc.(“GeoVax”または“当社”)は臨床段階のバイオテクノロジー会社であり,新しい特許プラットフォームを用いて感染症や癌に対するヒトワクチンと免疫療法を開発している。GeoVaxの製品ラインには,進行中の新冠肺炎と頭頸部癌のヒト臨床試験がある。その他の研究開発プロジェクトはジカウイルス、出血熱ウイルス(エボラ出血熱ウイルス、スーダン、マルブルクとラサ)とマラリアに対する予防的ワクチン、および多発性固形腫瘍に対する免疫療法を含む。同社の完全所有、共同所有、許可内の知的財産権の組み合わせは70件以上の付与または未解決の特許出願があり、20個の特許シリーズに分布しており、これらの特許は“私たちの知的財産権”の節でより詳細に議論されている。
私たちの製品開発ルートは
我々は現在,感染症や癌の予防や治療のためのワクチンや免疫療法を開発している。以下の表に我々の製品開発計画の状態をまとめ,以下のページでより詳細な議論を行う.
| 指示する |
候補製品 |
現状 |
| コロナウイルスワクチン |
||
| 新冠肺炎(免疫低下患者の一次ワクチン) |
GEO-CM 04 S 1 |
臨床-第2段階 |
| 新冠肺炎(遺伝子転写のブースター) |
GEO-CM 04 S 1 |
臨床-第2段階 |
| パンコロナウイルス |
GEO-CM 02 |
臨床前/INDサポート |
| がん免疫治療 |
||
| 固形腫瘍(末期頭頸部癌)* |
Geeptin |
臨床−第1/2期 |
| 固形腫瘍(MUC 1) |
MVA-VLP-MUC 1 |
臨床前/INDサポート |
| 他の感染症ワクチン |
||
| ジカウイルス** |
GEO-ZM 02 |
臨床前/INDサポート |
| エボラウイルス、スーダンマルブルク** |
Geo-EM 01 |
臨床前/INDサポート |
| ラシャ熱** |
GEO-LM 01 |
探索性の |
| マラリア** |
GEO-MM 02 |
探索性の |
*孤児薬の地位が付与されています、詳細は参照“我々の知的財産権は”一節です。
**FDAはクーポン計画の指示を優先的に検討します
私たちのコロナウイルスワクチン計画は
SARS-CoV-2ウイルスによる新冠肺炎が急速に全世界を席巻した。世界保健機関は新冠肺炎を国際的に注目されている突発的な公共衛生事件と発表し、2022年3月初めまでに、全世界で4.25億例以上の病例が報告され、600万人近くが死亡した。
現在24種類のワクチンが世界の1つまたは複数の国で使用されており、その中には米国の3つが含まれている。これらのワクチンは主にSARS-CoV-2 S蛋白に対する抗体を誘導するためであるが、組換え蛋白、完全不活化ウイルス、欠陥アデノウイルスベクター(3つの異なるタイプ)或いはmRNAを含むS抗原の異なる発現機序に依存する。抗ウィルス薬物とモノクロナル抗体の現在の可獲得性と有効性は限られている。アメリカ疾病コントロールと予防センターのデータによると、ここ数ケ月以来、新冠肺炎遺伝子ワクチンの有効性に対する推定はある程度低下し、原因はワクチン誘導の免疫力が時間の経過とともに弱まり、SARS-CoV-2変異株が増加する可能性のある免疫脱出、或いはこれらの要素と他の要素との総合作用である。
SARS-CoV-2は嚢膜一本鎖陽性RNAウイルスであり、SARS-CoV-2ファミリーに属する冠状鳥科ベタコロナウイルスに属しますSARS-CoV-2のゲノムは1つの大きなS蛋白をコードし、ウイルスが宿主受容体に付着し、宿主細胞に入る過程において重要な役割を果たしている。S蛋白はSARS-CoV-2を含むヒトコロナウイルスワクチンの主要な標的である。S蛋白受容体結合ドメイン(“RBD”)サブユニットに対する中和抗体はウイルスの宿主細胞への結合を阻止する。感染後に産生されたすべての中和抗体のうち,90%以上がRBDサブユニット,およびRBDに治療活性標的位を示すモノクロナル抗体であった。
免疫障害患者のGEO-CM 04 S 1-CDCに対して免疫障害患者をSARS-CoV-2疾患の高リスク患者とし、血液系悪性腫瘍の治療プログラムを受けた患者を含む。SARS-CoV-2感染は自己と異体造血細胞移植(HCT)、およびキメラ抗原受容体(CAR)-T細胞療法の受容者を含むこの脆弱な血液病患者集団において非常に深刻であることが予想される。この脆弱な患者群における他の呼吸器ウイルスの深刻な影響を考慮して、血液学細胞治療の受容者は深刻な臨床疾病に罹患する可能性があり、治療結果、例えば発病率と生存率に深刻な影響を与える可能性がある。著者らは血液病患者におけるSARS-CoV-2の疫学と臨床表現に対する理解は非常に限られており、しかも多数の重要な差が存在し、まだ承認されていないワクチンの臨床試験は免疫機能が低下した患者に集中しているからである。そのため、異なる免疫障害患者群におけるSARS-CoV-2ワクチンの有効性と安全性はまだ確定されておらず、候補SARS-CoV-2ワクチンのこれらの患者に対する有効性と安全性は異なる可能性がある。
著者らの候補ワクチンGEO-CM 04 S 1(以前はCOH 04 S 1と呼ばれていた)は人工合成した弱毒改良型アンカラワクシニアウイルス(SMVA)ベクターに基づいて、SARS-CoV-2ウイルスの刺突(S)と核カプシド(N)抗原を同時に発現し、最初は希望の城(COH)で免疫損傷患者のために開発された。COHが健常成人に対して行ったプラセボ対照の第1段階臨床試験では,GEO−CM 04 S 1は安全かつ免疫原性であることが証明された。2021年11月、GeoVaxはCOHと許可協定を締結し、GeoVaxにワクチンのさらなる開発と商業化の世界的な独占権利を付与した。
Geo−CM 04 S 1は,その安全性と免疫原性を評価するための第二段階臨床試験(NCT 04977024)を行っており,ファイザー/BioNTech mRNAによるワクチンと比較して,従来異遺伝子造血細胞移植,自家造血細胞移植あるいはキメラ抗原受容体(CAR)T細胞治療を受けていた患者で比較した。Geo-CM 04 S 1はS蛋白とN蛋白を同時に含む唯一のSARS-CoV-2ワクチンであり、癌患者の第二段階試験に入った。MVA担体に基づくワクチンはしばしば14日未満の時間で迅速に免疫反応を産生し、副作用は軽微である。この試験も,検討中の多抗原SARS−CoV−2ワクチンを,現在食品·医薬品局(FDA)が承認しているファイザー/BioNTechのmRNAワクチンと免疫障害者で初めて比較したものである。これらの患者は現在利用可能な新冠肺炎ワクチンを接種した後、よく弱い抗体反応を示す。
GEO-CM 04 S 1は、強化ワクチン-2021年12月、GEO-CM 0461の1/2段階試験(NCT 04639466)の第2段階として患者登録を開始し、現在FDAによって承認されているファイザー/バイオテクノロジーおよびModernaの2針rnaワクチンの代わりに汎用強化ワクチンとしての使用を評価する。この“COH 04 S 1の安全性と生物学的有効用量を評価する第1/2段階用量アップグレード研究”という臨床試験がCOH病院で行われている。COH 04 S 1はMVAに基づく合成SARS-CoV-2ワクチンであり、1種または2種類の注射または健康成人ボランティアの推進剤として使用されている。
GEO-CM 04 S 1はSARS-CoV-2に対するSとNタンパク質の強力な体液と細胞免疫反応を誘発することを目的としているため、GeoVaxは増強剤としての使用が免疫系に追加の抗原標的を提供し、それによってより広範な免疫反応を産生すると信じている。GEO−CM 0461ワクチンのMVA主幹は免疫誘導にも有効である可能性があり,MVAは免疫抑制を背景にもT細胞反応を強く誘導することが知られているからである。また,GEO−CM 04 S 1は,S抗原で観察された有意な配列変異に対してより良い保護を提供し,免疫持続性を提供することができ,MVAに確立されている。
試験の第一段階は年齢が18歳から55歳までの間、以前SARS-CoV-2に感染したことのない健康個人に対して用量逓増安全性研究を行うことを目的とした。主な目的は健康ボランティアにおけるGEO-CM 04 S 1ワクチンの安全性、耐性と免疫原性を評価することであり、これらのボランティアは筋肉注射によって3種類の異なる用量のワクチンを注射することである。免疫反応の持続時間をより良く評価するために,ボランティアの後続研究が継続されている。第一段階試験結果の科学的紹介と出版は2022年初めに行われる予定である。
ワクチン接種が行われている第2段階の後押し研究は、ファイザー/バイオテクノロジーまたはModernaによって生産されるFDAによって承認されたSARS-CoV-2 mRNAワクチンのうちの1つの2剤レジメンを以前に接種した18歳以上の健常者60名を含む。この研究は用量増加試験として設計され、COH 04 S 1を増強剤としての安全性と免疫原性を専門的に評価した。全研究過程で測定された免疫学的反応には,SARS−CoV−2懸念される変種(VOC)に対するSARS−CoV−2中和抗体レベル,オミックVOC,および特定のT細胞反応が含まれる。
Geo-CM 02は汎コロナウイルスワクチン-第一世代SARS-CoV-2ワクチンとして迅速に発展し、人類群において高い有効性を有することが証明された。これらの第一世代ワクチンの多くはSARS−CoV−2ウイルスをコードするSタンパク質のために設計されており,高レベルの中和抗体を誘導することを目的としている。しかし,狭い注目S蛋白の潜在的限界が明らかになりつつあり,新たに出現した変異体は,オミック変異体に見られるように,ワクチン誘導抗体の中和から部分的に逃避することができる。したがって,これらのワクチンの新たなSARS−CoV−2変種や将来のコロナウイルスオーバフロー事件に対する有効性は依然として非常に懸念されている。
その新規修飾を利用したウイルスアンカラウイルス様粒子(GV−MVA−VLP)TM)プラットフォーム上で、GeoVaxは、標的病原体からの複数の遺伝的保存的構造および非構造タンパク質を含むことによって、より広範な免疫を誘導することが期待できるワクチンの設計戦略を開発した。GV−MVA−VLPTMプラットフォームは多種の免疫原をコードする平衡抗体と細胞(T細胞)に対する反応を誘導し、新たに出現した変異体の免疫脱出を潜在的に制限することが知られている。MVAはSARS-CoV-2刺突(S)、膜(M)と被膜(E)蛋白支持を発現する体内にあるウイルス様粒子(VLP)の形成は,抗体とT細胞反応を誘導する。他の配列の保守的な構造と非構造蛋白を添加することはT細胞反応に標的を提供し、ワクチン誘導免疫反応の広さと機能を増加させる。この戦略は増強の潜在力を持つ汎用ワクチンの開発に基礎を提供し、伝播するコロナウイルスによる疾病負担を軽減する。GeoVax候補ワクチンは、承認または開発されている他のワクチンと比較して唯一無二であるため、より広く持続的なSARS−CoV−2に対する保護免疫レベルを提供するように設計されており、これは、ワクチンの実用的および受容を制限する可能性のある潜在的な副作用を回避しながら、新たに出現する変種の影響から保護することができるはずである。
GeoVaxの主要な候補ワクチン(GEO-CM 02)はS蛋白を抗体標的としてコードし、MとE蛋白はT細胞標的をコードする。S、MおよびEタンパク質の組み合わせ発現支持体内にあるVLPの形成と最適免疫原性。小動物研究では、同社は単剤後の機能性免疫反応を測定し、これらの反応は感染と発病に対する保護を媒介し、より毒性の強いBeta変種の保護を含む
2021年1月,米国国家衛生研究院(NIH)に属する国家アレルギー·感染症研究所(NIAID)はGeoVaxに小規模企業革新研究(SBIR)を付与し,同社のワクチン開発を支援した。第1段階の支出は新冠ウイルスGV−MVA−VLPワクチンの臨床前研究進展我々の候補ワクチン評価の持続的な設計、建設と臨床前テストを支持し、人体臨床試験の準備をしている。2021年には,複数の国際ワクチン会議で実験結果の科学的報告や出版物が発表され,2022年に発表される予定である。
私たちの癌免疫治療計画は
地理情報システム®Geeptinは、遺伝子ガイド酵素プロドラッグ療法(GDEPT)と呼ばれる遺伝子治療戦略によって固形腫瘍を治療するための新しい特許製品/技術である。2021年9月、GeoVaxはPNP治療会社(“PNP”)と譲渡と許可協定を締結し、GeoVaxがGeeptinを独占的に開発および商業化する権利を付与した。Geeptin技術は国立癌研究所(NCI)の資金支援の下で開発され,NCIはNIHの一部である。GeoVaxがGeeptinに発行するライセンスは、Geeptinの使用をすべてのヒト疾患および/または状態に拡大する権利を含むが、他の癌に限定されない。
GDEPTでは、非ヒト遺伝子を有する腫瘍細胞を選択的に形質導入するためにベクターが使用され、この遺伝子は、無毒プロドラッグを猛毒抗腫瘍化合物に変換することができる酵素を発現するその場でそれは.地質学的循環治療には2日間に3回の腫瘍内にゲジピンを投与し,プロドラッグリン酸フルダラビンを1日1回,3日間連続投与した。1つの第一段階の用量範囲の研究は、単周期Geeptin療法の安全性を評価し、この治療法の耐性は良好であり、固形腫瘍患者の腫瘍サイズが縮小していることを証明した。
再発性頭頸部扁平上皮癌(HNSCC)患者におけるGeeptin反復周期療法の安全性と有効性を評価することを目的としたスタンフォード大学とエマレー大学との協力により、再発性頭頸部扁平上皮癌(HNSCC)患者における安全性および有効性を評価するための1/2期試験(NCT 03754933)が現在行われており、治癒可能な治療法がない。試験設計には,反復投与があり,Geeptinを使用し,その後全身フルダラビンを使用し,より大規模な患者試験に拡大する前により多くの情報を得る方法とした。この研究の初期段階はFDAがその孤児製品臨床試験贈与計画に基づいて資金を提供した。FDAはGeeptinを承認しました孤児薬物状態は,唇癌,舌癌,歯周癌,口腔癌,唾液腺癌,その他の口腔癌を含む腫瘍内治療解剖に有用な口腔および咽頭癌に用いられる。2022年1月、著者らは全世界の臨床研究解決方案提供者CATO SMSを招聘して、行っている1/2期試験を管理し、そして臨床サイトの拡大に協力し、患者の登録と評価を加速する。
MUC 1による免疫治療−腫瘍は通常、抑制因子を産生することによってヒトの自然免疫系を抑制することができ、免疫抵抗機序、特に腫瘍抗原に対する特異的なT細胞として癌細胞を死滅させることができる。免疫検査点阻害剤(ICIS)の発見と商業化の発売に伴い、免疫腫瘍学領域は新しい動力を獲得し、ICISは1種のモノクロナル抗体(MAb)である。ICISは自然発生と腫瘍誘導の免疫チェックポイントを遮断し、機能性T細胞をより十分に細胞増殖、サイトカインの産生と腫瘍細胞に対する殺傷を回復させる。
伝統的な治療法(例えば放射線治療、化学療法、抗体など)と異なり、腫瘍ワクチンを治療することは誘導応答の潜在力があり、腫瘍を制御或いは除去できるだけでなく、免疫記憶を確立し、腫瘍の再発を抑制と防止することができる。腫瘍ワクチンの利便性、安全性と低毒性はそれらを将来ICISと結合して腫瘍を治療する免疫治療方法中の貴重なツールになった。現在,少数の担体癌ワクチンのみがICISと結合してテストされており,これらのワクチンはすべて早期臨床段階にある。
我々は、癌患者の治療的抗腫瘍抗体およびT細胞反応を向上させることを目的として、細胞表面関連MUC 1タンパク質の異常グリコシル化形態に基づいて、乳癌、結腸癌、卵巣癌、前立腺癌、膵臓癌および肺癌を含む複数の癌において発現するGV-MVA-VLPワクチンプラットフォームを開発している。
| ● |
MVA−VLP−MUC 1候補ワクチンを作製し,VLPの産生をMUC 1免疫金染色法で電子顕微鏡下で証明し,VLPがヒト細胞系で低グリコシル化形態のMUC 1を発現することを示した。 |
| ● |
私たちはピッツバーグ大学癌免疫療法のトップ専門家であるオリベイラ·フェンーン博士と協力し、多くの腫瘍が免疫系によって外来の異常形態と識別されたMUC 1を発現することを最初に示した人の一人である。ファーン博士との協力により、MVA-VLP-MUC 1候補ワクチンとMUC 1合成ペプチドの組み合わせは、トランスジェニックマウスにおいてヒトMUC 1に対する耐性を打破し、リンパ腫腫瘍モデルにおいて挑戦に有効な免疫反応を誘導することができることを示した。 |
| ● |
2022年、私たちはノースカロライナ大学シャーロット校のPinku Mukherjee博士と共にIND Enabling動物研究を開始し、最適なワクチン接種過程とスケジュールを決定して、第1段階の臨床試験で評価できる方案を定義した。 |
我々は以前、ViaMune,Inc.と協力して、後者は、広範な抗腫瘍抗体およびT細胞反応を産生することができるMUC 1ベースのワクチンを開発することを目標とした完全に合成されたMUC 1候補ワクチン(MTI)を開発した。したがって、生成されたMUC 1ワクチンは、進行MUC 1+腫瘍の癌患者のための新しいワクチン接種戦略としてICISと組み合わせることができる。Pinku Mukherjee博士によるMTIとMVA-VLP-MUC 1連合ワクチンに対する臨床前研究により、著者らのワクチンはMTIとICIの併用により、結腸直腸癌マウスモデルの腫瘍負担を著しく低下させた。
MUC 1に基づく癌免疫治療は、新しい技術と製品の組み合わせを含む多くの努力である。GeoVaxは,我々の方法は将来拡大する癌治療選択の一部になると信じている。
エボラ出血熱ワクチン(エボラ、スーダン、マルブルク、ラサ)
エボラウイルス(EBOV、以前はザイールエボラウイルス)、スーダン(SUDV)、マルブルクウイルス(MARV)は糸状ウイルス科出血熱疾患を引き起こす家庭では,ヒトでの死亡率は90%に達している。ラシャ熱ウイルス(LASV)は一種のArenaviridaeエボラウイルスと重なる地域では,このウイルスは重篤で致命的な出血性疾患を引き起こすこともある。FDAは2019年12月、ザイールウイルスによるエボラ疾患を予防する初の組換えエボラ生ワクチンを承認した。このrVSV-ZEBOVは第一段階試験で安全問題を示し、複製能力があるため、最近エボラ疫病が始まった西アフリカに生息するHIV感染者のような免疫障害の個人に脅威になる可能性がある。
将来の出血熱爆発に対応できる製品の未満足の需要を満たすために,我々のGV−MVA−VLPプラットフォームを用いてワクチンを開発している。MVA担体自体は安全とされており,最初は免疫障害者のために開発され,天然痘ワクチンとして使用されていた。我々のワクチンは,ハイリスク個体をEBOV,SUDV,MARVおよびLASVから保護するだけでなく,抗原交差反応やT細胞のより保守的な基質タンパク質(例えばVP 40やZ)への誘導,および我々や他のメーカーが使用している標準GPタンパク質のような他の再出現病原体の重症度を低下または変化させる可能性が予想される。そのため、GeoVax GV-MVA-VLP方法は独特な優勢な組み合わせを提供し、汎FILOワクチンの広汎性と安全性を実現することができる。アフリカの人々を保護するほか、疾病の米国への伝播を防止し、テロリストが生物的脅威のある病原体を放出することを防ぐための準備をすることを目的としている。
著者らのMVA-VLP-EBOV候補ワクチンはげっ歯動物と非ヒト霊長類動物における初歩的な臨床前研究により、単回免疫後、致死量のEBOVに対して100%の保護作用があることを表明した。最近の致死攻撃モルモットモデルにおける研究では,GeoVaxワクチンMVA−VLP−SUDVとMVA−VLP−MARVが死亡に対して100%の保護作用を有することが明らかにされている。これらのワクチンはその後、厳しいカニクイザル感染挑戦モデルで評価された。ワクチン接種は非ヒト霊長類動物をウイルス血症、体重減少、死亡から保護し、これらのウイルスはワクチンを接種していない動物において致命的なスーダンやマルブルクウイルス攻撃後に産生される。ワクチン接種後の免疫反応評価は,中和抗体と機能性T細胞の存在が,最適な保護に結合する反応の広さを示している。同様に、著者らのLASV候補ワクチンのげっ歯動物における初歩的な臨床前研究により、直接脳に入る複数の毒株からなる致命的な用量のLASV攻撃に対して、100%の単剤保護作用があることを表明した。非ヒト霊長類の研究はNIAIDや国防総省と協力して行われており,臨床開発計画は治験データと潜在的危険爆発発生時の世界的優先事項に基づいて定義される。
他の感染症プロジェクト
Geo-ZM 02はジカウイルスの略称であり、ジカウイルス(ZIKV)による新しい出現伝染病であり、乳児小頭奇形と成人グリーン-バレー症候群(神経変性疾患)の増加と関係がある。ZIKVはその組織のメンバーです黄ウイルス科その中にはデング熱,黄熱病,日本脳炎,森林脳炎,西ナイルウイルスなどの医学的に重要な病原体が含まれている。公衆衛生当局者はZIKVへの接触を避け、妊娠を延期し、感染後に基本的な支持性看護(液体、休憩とアセトアミノフェン)を行うことを提案した。
ZIKVワクチンの未満足のニーズを解決するために,我々のGV−MVA−VLPプラットフォームを用いて構築した新しい候補ワクチンを開発している。MVAは優れた安全記録を有しており,出産適齢女性や新生児をワクチン接種者に含める必要があることを考慮すると特に重要である。我々のジカワクチンはNS 1遺伝子製品に基づいて設計されており、抗体依存増強(ADE)のリスクを除去するために設計されており、ADEは深刻な副作用であり、ワクチンを接種した個体が完全な保護性の免疫反応がない場合、感染すれば、実際にはより致命的な反応を引き起こす。
著者らは著者らのGEO-ZM 02候補ワクチンを用いてげっ歯動物に対する初歩的な臨床前研究により、直接脳に入る致死量のZIKVに対して100%の単剤保護作用を有することを表明した。アカゲザルでは,GEO−ZM 02ワクチンの接種は,ZIKV中和抗体を誘導するために設計されていないにもかかわらず,ウイルス複製を制御するのに有効な免疫反応を誘導することができる。GEO-ZM 02のさらなる開発は、パートナーのサポートに依存する。
Geo−MM 02はマラリアに用いられている−世界的には,マラリアは毎年2.28億人の感染と40.5万人の死亡を招いている。数十年のワクチン研究が行われているにもかかわらず、候補ワクチンは実質的な保護作用(例えば>50%)を産生できなかった。これらのワクチンの多くはマラリア寄生虫のライフサイクルの一段階に対してのみ免疫反応を誘導する単独のタンパク質に基づいている。GeoVaxのMVA−VLPマラリア候補ワクチンは,寄生虫ライフサイクルの複数段階からの抗原を融合し,持続的な機能性抗体およびCD 4+とCD 8+T細胞反応による免疫反応の誘導を目指しており,これらは理想的なワクチンが免疫反応を誘導する特徴である。
我々はオーストラリアをリードする感染症研究機関バーネット研究所と協力し,マラリア感染予防ワクチンを開発した。このプロジェクトには,GeoVaxのGV−MVA−VLPを用いてマラリアに結合したマラリアワクチンプラットフォームの設計,構築,特徴づけが含まれている悪性マラリア原虫そして間日マラリア原虫バーネット研究所が同定した配列。ワクチンの設計,構築と特徴づけはGeoVaxで行われ,Burnet Instituteではその独自の機能解析を用いて動物モデルにおいて免疫原性と挑戦的な研究が行われている。GEO-MM 02のさらなる開発は、連邦贈与または他のソースによって提供される追加資金サポートに依存する。
HIV−わが社はSARS−CoV−2と癌免疫治療計画の開発に重点を置いているため,我々のHIVワクチン開発は持続的な政府支援に乏しいため,最近これらの計画の積極的な開発を中止することにした。私たちのこの分野での技術と知的財産権は外部許可や協力に提供され続けるだろうが、私たちはこれらの計画にいかなる会社資源も投入しない。
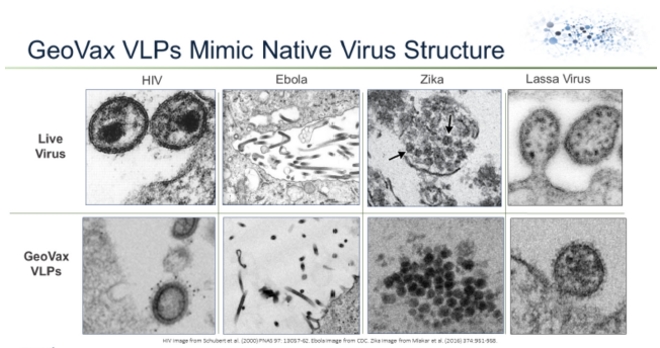
我々のGV-MVA-VLP™ホーム.ホーム
GeoVaxのGV−MVA−VLPワクチンプラットフォームは,改良されたアンカラワクシニアウイルス(MVA)を利用して,複数のワクチン抗原を持つことができる大型ウイルスであり,発現したタンパク質がワクチンを接種したヒト体内でウイルス様粒子(VLP)免疫原に組み立てられている。ワクチンを接種した人に産生されたVLPは、自然感染中に発生したウイルス産生を模倣することができ、免疫系の体液や細胞腕を刺激して標的感染を識別、予防·制御することができる。MVA-VLP由来ワクチンは宿主において持続的な免疫反応を引き起こすことができ、弱毒生ウイルスに類似し、同時に複製欠陥ベクターの安全特性を提供する。
ワクチンは通常、病原性微生物に類似した製剤(抗原)を含む。従来のワクチンは通常、弱体化または致死のウイルス形態またはその表面蛋白から作られる。いくつかのより新しいワクチンは、組換えDNA(デオキシリボ核酸)技術を使用して、標的病原体DNA配列の特定の部分から細菌または培養細胞においてワクチン抗原を産生する。次に産生された抗原を精製してワクチンを調製した。これらの精製抗原の中で最も成功しているのは,B型肝炎ワクチン(メルクのRecombivaxオスミウムやグラクソ·スミスクラインのEngerix)や乳頭腫ウイルス(グラクソ·スミスクラインのCervarxオスミウムやメルクのGardasil)などの非感染性病原性顆粒(VLP)であると考えられる。我々の方法は,組換えDNAおよび/または組換えMVAを用いてワクチンを接種したヒトにVLPを産生し,製造の複雑さとコストを低減した。われわれのHIVワクチンのヒト臨床試験では,われわれのVLPがワクチンを接種したヒトの細胞内に発現し,安全であるが,強い持続的な体液や細胞免疫反応を引き起こすことが証明されていると信じている。
VLPは形式的に真のウイルスを模倣するが、伝染性或いは複製能力を持たず、そして人体免疫システムに標的ウイルスを識別し、殺して感染を防止することができる。VLPはまた、感染を制御し、疾病の長さと重症度を減少させるために、免疫システムを訓練してウイルス感染細胞を識別し、殺すことができる。VLPに基づくワクチンの最大の課題の1つは,VLPが真のウイルスのように免疫系に認識されるようにワクチンの方式を設計することである。私たちが設計したワクチンはHIVやエボラやマルブルクやラシャ熱などのエンベロープウイルスに対するVLPが発生すると体内にあるタンパク質抗原だけでなく、接種者細胞からの膜からなるエンベロープも含む(受容者の細胞において)。この場合,自然感染期間中に人体内で産生されるウイルスと高度に類似している。生産VLP体外培養対照的に、封筒がないか、またはそれらを製造するための培養細胞(通常はハムスターまたは昆虫細胞)からの封筒である。したがって,我々の技術は我々が生産したVLPが真のウイルスに近いため,明らかな利点を提供していると信じている.私たちの免疫原のこの特性は人体の免疫系をウイルスを認識しやすくすると信じている。VLPを生産することで体内にある私たちは潜在的な浄化問題も避けていると信じています体外培養VLPの生産。
次に図1にGeoVax MVA−VLPワクチンにより発現された実際のウイルスとこれらのウイルスのVLPのシート電子顕微鏡例を示す。

図1.MVA-VLPとローカルウイルス構造の比較
MVA−VLPプラットフォームでは,MVAの巨大なコード能を利用して複数のタンパク質をコードする遺伝子を挿入し,これらの遺伝子の結合はMVA感染細胞のVLP産生を支持するのに十分である。MVAがコードするウイルス基質蛋白と糖タンパク質がVLPに組み込まれた複数の候補ワクチンの実用性が証明された。MVAは当初,より安全な天然痘ワクチンとして開発され,免疫障害者に用いられていた。ニワトリ胚やニワトリ胚線維芽細胞に継代(500世代以上)して標準天然痘ワクチンを弱毒化することにより開発され,ヒト細胞ではウイルスの複製能力が限られている(したがって安全である)が,鳥類細胞では高い複製能力を有している(そのため製造コスト効果が高い)。これらの欠失は免疫逃避遺伝子の喪失を招き,これらの遺伝子は野生型天然痘感染の伝播に寄与し,ヒト免疫反応が存在する場合でも同様である。
我々はNIH/NIAIDのBernard Moss博士の実験室と協力し,15年を超える協力の中で,VLPに組み立てられたワクチン蛋白を効率的に発現させるために4世代の異なるMVAベクターを検討した。これらの努力は、ワクチン標的タンパク質をコードする外因性遺伝子を、各製品の生産安定性を最適化する方法でMVAに導入するために、異なるシャトル担体の開発および複数の挿入部位の決定をもたらす。各MVA-VLPワクチンは、最大2つの発現カセットを有し、各発現カセットは、関心病原体から選択される1つ以上の抗原をコードする。各ワクチンは、VLPを形成するために必要な2つの抗原を少なくとも発現し、例えば、HIVおよび出血熱ワクチンの場合、ウイルス基質タンパク質およびエンベロープ糖タンパク質を発現する。我々は,合成された早期,晩プロモーターを用いて,高レベルではあるが致命的ではない挿入発現を提供し,ワクチンを接種した個体の細胞感染直後に起動した。
GV-MVA-VLPワクチンプラットフォームは他の利点を持っています
| ● |
安全:一般に,ヨーロッパではMVAの安全性は12万人以上の被験者で証明されており,MVAの最初の発展過程や最近ではより安全な天然痘ワクチンとしてのMVAの開発に伴い免疫障害者が含まれている。我々のHIVワクチンは多くのヒト臨床試験において優れた安全性を示した。 |
| ● |
耐久性:私たちの技術は持続的なワクチン反応を向上させました持続ワクチン反応の励起はMVAの母体ワクチン反応のB細胞から付与され,天然痘に対する高度な持続反応が向上したと仮定した。 |
| ● |
病薬に対する限られた免疫力:1980年に天然痘を根絶した後、天然痘ワクチン接種はその後終了し、1980年前に生まれた人と選択された人々(例えば、ワクチンを接種した実験室スタッフと第一反応者)を除いて、すべての人はワクチンを接種しておらず、MVA由来ワクチンに対する事前に存在する免疫力もなかった。従来のワクチン接種で使用される親ウイルス(例えば、麻疹)に関連する媒介、またはすべての年齢層のヒトに感染する一般的なウイルス(例えば、サイトメガロウイルス)を構成する媒体の場合、予め存在する免疫による媒介への潜在的干渉がより問題となる可能性がある。 |
| ● |
異なるワクチンの順序使用のための再使用プラットフォーム. マウス実験では2つのワクチン(例えばGV-MVA-VLP-ジカおよびGV-MVA-VLP-エボラ)は4週間間隔で、その免疫原性に負の影響はなかった(媒介免疫の欠如)。 |
| ● |
アジュバントは必要ありませんMVAは通常強い先天性免疫反応を刺激し,アジュバントを使用する必要はない。 |
| ● |
熱安定性:MVAは液体でも凍結乾燥形態でも安定している(>6年の貯蔵)。 |
| ● |
遺伝的安定性と製造可能性:設計が適切であれば,MVAは遺伝子的に安定であり,確立されたニワトリ胚線維芽細胞基質中で確実に製造することができ,スケーラビリティおよびより高いプロセス整合性と効率を支持する新しい連続細胞系でも製造可能である。 |
アメリカ政府からの支援
贈与と契約
私たちは私たちのワクチン開発計画を支持する複数の連邦支出と契約の受給者だった。私たちの最新賞は以下の通りです
ラサ国防総省グラント。2018年9月、米国国防総省(DoD)は、LASVワクチン開発プロジェクトをサポートするために2442,307ドルの協力協定を授与しました。この贈与は,米国陸軍医学研究調達活動が同業者審査医学研究計画(PRMRP)によって付与されたものであり,国会が指導する医学研究計画(CDMRP)の一部である。GeoVaxへの直接の贈与資金のほか、国防総省は別の奨励の下で米陸軍科学者に援助して私たちのワクチンのテストを行った。この賞のタイトルはLassa Fev新型MVA−VLPワクチンGEO−LM 01主種子ウイルスの臨床前研究進展ER“,我々の候補ワクチンのげっ歯類および非ヒト霊長類モデルにおける免疫原性および効力データの生成,およびワクチン種子バンクの製造プロセスの開発とcGMP生産を支持した。
新冠肺炎SBIR助成金。2021年1月、NIAIDは、SARS-CoV-2ウイルスに対するワクチンの開発を支援するために、299,927ドルのSBIR第1段階贈与を与え、SARS-CoV-2は新冠肺炎を引き起こすウイルスである。この贈与のタイトルは“新冠ウイルスGV−MVA−VLPワクチンの臨床前研究進展私たちの候補ワクチンの進行中の設計、建設、そして臨床前テストを支持する。
他の連邦支持者は
CDCと我々のジカワクチン計画,NIAIDのロッキー山実験室施設による出血熱ウイルスワクチン計画および米国陸軍感染症医学研究所(USAMRIID)のための出血熱ウイルスワクチン計画の協力と内部手配により,追加の連邦実物支持を得た。このような支援は一般的に私たちを代表して前臨床動物研究を行ったり支持したりするためのものだ。
政府の監督管理
米国や他の国の政府当局の規制は、私たちが行っている研究開発活動や製品製造における重要な要素の一つだ。このような規定を遵守するにはかなりの専門知識、時間、そして費用が必要だ。
アメリカでは、薬品と生物製品は連邦と州によって厳格に規制されている。私たちの製品は“連邦食品、薬品と化粧品法案”(FD&C法案)、“公衆衛生サービス法案”、これらの法規に基づいて公布された法規及びその他の連邦と州法規の規制を受けている。その他の事項以外にも,これらの法律は薬品や医療機器のテスト,製造,安全,効能,ラベル,貯蔵,記録保存,承認,広告と普及などの面を管理している。この規制の枠組み内での製品開発や承認は予測が困難であり,数年を要し,多大な費用がかかる。ヒトワクチンがアメリカで発売される前に必要なステップは
| ● |
臨床前実験室試験、体内臨床前研究と調合研究; |
| ● |
現行の良好な製造規範(CGMP)の規定を厳格に遵守した場合に製品を製造し、試験する |
| ● |
ヒト臨床試験の研究性新薬申請をFDAに提出し、この申請は人体臨床試験が開始される前に発効しなければならない |
| ● |
この製品の安全性と有効性を決定するために、十分かつ良好に制御された人体臨床試験 |
| ● |
バイオ製品ライセンス申請、および必要な使用料をFDAに提出すること |
| ● |
FDAは製品の任意の商業販売または出荷前にBLAを承認する |
米国で任意の人間が使用する薬物や生物製剤を販売する前に、製品スポンサーはFDAの承認を得なければならない。また,いずれの新薬や生物製剤を商業流通に導入する前にも,各生産企業はFDAに登録しなければならず,承認前の検査を通過しなければならない。
FDAへの緊急使用許可(EUA)許可は、FDAが公衆衛生緊急時に必要な医療対策の獲得と使用を促進することによって、国家のある脅威に対する公衆衛生保護の強化を助けることを可能にする。FD&C法案第564条によれば、FDA専門家は、脅威剤によって引き起こされる深刻または生命に危険な疾患または状況を診断、治療または予防するために、未承認医療製品または未承認医療製品を緊急時に使用することを可能にすることができ、十分な、承認され、利用可能な代替案を有さない。これは私たちの新冠肺炎や他の伝染病候補ワクチンにもっと速い発売経路を提供するかもしれない。これはファイザー−バイオテクノロジーとModernaがそれぞれの新冠肺炎ワクチンに従う承認プログラムである。
GeoVaxは私たち自身の工場で人のためのワクチンを生産していないため、私たちは自分たちの運営とアウトソーシング製造運営において要求に適合することを確保しなければならない。FDAによって規制されているすべての製造企業(米国に製品を輸出する国内企業や外国企業を含む)はFDAの検査を受け、製品、薬品、設備に関するFDAのcGMP規定を遵守しなければならない。
FDAは、文書審査、調査、検査によって、適用される法規や法規に適合しているかどうかを決定する。FDAはいくつかの実行機構を使用して、簡単に軽微な欠陥の是正を要求してから施設の強制リコール、閉鎖まで、さらには最も深刻な違反に対して刑事告発を行うことができる。
FDAの規制許可を得ても、発売された製品は継続的な審査を受け、その後、以前未知の問題や適用された規制要求を遵守できなかったことは、製品のマーケティングを制限したり、その製品を市場からリコールしたりし、民事または刑事制裁を受ける可能性があることが分かった。
FDAがこの薬を承認したか否かにかかわらず、製品はこれらの国が商業販売を開始する前に外国の規制機関の承認を得なければならない。臨床試験と薬物承認を管理する要求は国によって異なり、承認に要する時間はFDA承認の時間より長いか短い可能性がある。
私たちはまた、安全作業条件、実験室と製造実践、動物の実験使用、および私たちの研究に関連する危険または潜在的危険物質の使用と処置に関する様々な連邦、州と地方の法律、法規、提案を守らなければならない。未来のいかなる立法や行政行動によって引き起こされる可能性のある政府の規制の程度は正確に予測できない。
FDA熱帯病優先審査券計画
FD&C法案第524条認可FDAは,特定の基準に適合する承認された熱帯病製品適用のスポンサーを優先審査証明書(PRV)に付与する。PRVの資格を得るためには、スポンサーの出願は、“熱帯疾患”の予防または治療のための医薬または生物製品でなければならず、優先審査を受ける資格がなければならず、FD&C法案第505(B)(1)条または公衆衛生サービス法第351条によって承認された任意の他の出願で承認された活性成分(有効成分の塩またはエステルを含む)を含んではならない。優先審査はFDAの目標が6ヶ月以内に決定されることを意味する。
PRVは販売されるかもしれない。例えば、小さな会社は、無視された疾患に対する薬物開発のためのクーポン券を獲得し、商業疾患の治療のために大企業に販売する可能性がある。クーポン券の価格は需給状況に依存する。クーポンの価値は、より早い販売移転、より早く進出したより長い有効特許寿命、および競争相手よりも早く進出した競争優位性の3つの要因からなる。最も売れている治療法は毎年数十億ドルの売上を生み出すことができるため,数ヶ月前に承認されて数億ドルのクーポン券が得られる可能性がある。2014年に初めてクーポン券が発売されて以来、クーポン券の価格は6800万ドルから3.5億ドルまで様々だ。
GeoVaxは,エボラ,スーダン,マルブルク,ラシャ熱,マラリア,ジカウイルスのワクチン計画にはそれぞれPRVを取得する資格がある可能性があり,適切な時期にPRVを申請する予定であるとしている。しかし、私たちは私たちが資格を持っているか、PRVとして承認されることを保証できない。
製造業
成功するために、私たちの製品は法規の要求に従って受け入れ可能なコストで商業的に量産しなければなりません。今まで、私たちは何の製品も商業化していませんし、法規の要求に基づいて私たちの候補製品の商業ロットを生産できることも証明されていません。もし私たち自身があるいは第三者との契約を通じて規制基準に従って適切な数量の製品を生産できない場合、このような製品の臨床試験、監督管理許可とマーケティングが遅れる可能性があります。このような遅延は私たちの競争的地位と利益を達成する機会に悪影響を及ぼすかもしれない。私たちは私たち自身でも第三者との契約を結んでも、商業的に実行可能なコストや数量でこのような製品を生産できることを確実にすることはできません。
私たちは現在私たちのいかなる製品のいかなる臨床あるいは商業用品を生産するための施設や内部の専門知識を持っていません。逆に,我々の戦略は第三者契約メーカーが研究や臨床試験に必要なワクチンを生産することに依存している。我々は第三者メーカーとDNAとMVAワクチンの供給計画を達成し,我々が計画した臨床試験に用いた。これらのサプライヤーはFDAの“良好な製造規範”と(ヨーロッパメーカーにとって)ヨーロッパ薬品管理局の類似規定に従って運営されている。これらの供給者は、現在計画されている臨床試験を完成させるために十分なワクチン供給を提供することができると予想している。米国とヨーロッパでは一般に異なる請負者が臨床試験評価のためのワクチンを生産しているが,ある生産や試験活動では既存の請負者に代わることは困難である可能性があり,他の請負者に変更すると契約サービスのコストが大幅に増加する可能性がある。また,潜在的な新冠肺炎ワクチンの需要により,現在ワクチン製造能力が不足しており,候補ワクチンを生産する能力に影響を与える可能性がある。
我々のワクチンのMVA成分は現在胚卵培養細胞で製造されている。我々は,より商業規模生産に適したバイオリアクタで増殖できる連続細胞系でMVAを培養する方法を模索している。
私たちのワクチンの生産過程で使用される原材料と他の用品、そして私たちが研究活動で使用している原材料と他の用品は通常いくつかの商業サプライヤーから得ることができ、私たちはこのような材料と用品を十分な数を得ることができ、すべての予測可能な臨床研究に使用することができると信じている。
競争
私たちの候補製品は大手製薬会社、専門製薬とバイオテクノロジー会社、学術·研究機関からの激しい競争に直面し、引き続き直面する。私たちは迅速な技術変革、絶えず発展する業界標準、新興競争と新製品の発売を特徴とする業界で競争している。競争相手は、我々の候補パイプラインおよび技術と競合する既存の製品および技術を有し、私たちの候補パイプおよび技術と競合する他の製品および技術を開発および商業化することが可能である。競争する会社や機関は私たちよりも多くの財力を持っている可能性があるので、彼らはより広範なサービスと製品ラインを提供することができ、研究と開発により大きな投資を行うことができるかもしれない。競争相手も私たちより強い開発能力を持っている可能性があり、製品の非臨床と臨床テストを負担し、監督管理の許可を得、薬品の製造とマーケティングの面でもっと多くの経験を持っている。彼らはまたより高い知名度とより良い顧客接触機会を持っているかもしれない。
私たちはワクチン開発分野のいくつかのサブ分野の全面的な市場競争に直面しており、その中にはセノフィ、グラクソ、メルク、楊森、三菱田部、武田とファイザーなどの大型多国籍製薬会社、中型製薬会社と新興バイオテクノロジー会社、Dyavax、Novavax Inc.,Moderna、BioNtechとHookipa、およびアメリカ国立衛生研究院を含む学術と非営利ワクチン研究者と開発業者が含まれている。競争が激しいにもかかわらず、この業界の特徴は広範な協力、許可、M&A活動だ。
現在、20種類以上の新冠肺炎ワクチンが世界の1つ以上の国で使用されることが許可されており、その中にはアメリカの3カ国(ファイザー/バイオテクノロジー、Moderna、ヤンソン)が含まれている。これらのワクチンはすべてSARS-CoV-2ウイルスに基づくS蛋白であるが、S抗原の異なる提示或いは発現機序に依存し、完全な、不活化ウイルス、欠陥のあるアデノウイルスベクター(3種類の異なるタイプ)或いはmRNAを含む。末期臨床または承認前の候補ワクチンを有する主要な会社は,ノワックス社,アスリーカン社,CureVac N.V.,Medicago社,グラクソ·スミスクライン社,セノフィ社,ダイナワックス社,Valneva SE社である。
多くの会社は癌を治療するために各種の治療性ワクチン或いは他の免疫療法を開発しており、Advaxis、免疫設計、Oncohyreon、バイエルン北欧、羅氏製薬、メルク会社、百時美施貴宝とアスリコンを含む。
現在、世界市場にFDA許可と商業化されたジカワクチンや出血熱ウイルスワクチン(エボラ出血熱を除く)はない。大手製薬やバイオテクノロジー会社を含むいくつかの発展段階にある老舗企業が,これらの分野のワクチン研究や開発に積極的に参加していることが知られている。出血熱ウイルスの場合、これらの会社はNewLink Geneticsとメルク、ジョンソン、Novavax、Innovio、グラクソ·スミスクラインを含む。ジカウイルスについては,NewLink Genetics,Inovio,Merck,Butantan Institute,NIH(NIAID)がある。FDAは2019年12月に最初のワクチン(ERVEBO)を承認しました®)を予防するためのエボラウイルスは、メルク社によって開発された。
マラリア感染を予防する商業的なワクチンはまだない。第一世代感染を遮断したマラリアワクチンRTS,Sは規制審査を受けている。それは4剤を必要とし、すでにWHOに試験的な研究実施のために推薦された。このワクチンは単一抗原を基礎としており,効力が大きくない(30−40%,被験者の年齢に依存する)ため,WHOは次世代マラリアワクチンの開発と許可のためのロードマップを作成している。これらのワクチンには,マラリアの感染や伝播を阻止するための複数の抗原が含まれており,少なくとも75%の有効率が予想される。
我々の知的財産権は
私たちのビジネス成功は、アンカラウイルス様粒子(MVA-VLP)の改良に基づくワクチン、私たちが許可を得た合成MVA新冠肺炎候補ワクチン、および許可されたGeeptin遺伝子ガイド酵素プロドラッグ療法、およびこれらを用いた治療方法を含む、私たちの能力および私たちの許可された候補臨床製品のための特許保護の能力にある程度依存する。
我々は、我々の許可内資産の許可者と協力して、私たちの各製品及び開発候補製品のための特許保護を求め、適用された場合には、他の治療及び/又は抗原剤との組み合わせ及び用量計画の特許保護を求める。私たちの成功はまた、他人の財産権を侵害することなく運営する能力と、他人が私たちの財産権を侵害することを防止する能力にかかっている。私たちの政策は、米国特許出願を提出し、適切な場合に外国特許出願を提出することによって、私たちの独自の地位を保護することであり、これらは、私たちのノウハウ、発明、および改善をカバーしており、これらは、私たちの業務の発展および実施に非常に重要である。私たちは、私たちの許可者と協力して、アメリカ特許出願の提出を確実にし、適切な場合には、私たちの業務の発展と実施に重要な私たちの許可内の技術、発明、改善をカバーする外国特許出願を提出します。私たちはまた、ビジネス秘密、技術ノウハウ、持続的な技術革新、潜在的な許可内の機会に依存して、私たちの独自の地位を発展させ、維持しています。また、適切な場合には、規制当局が私たちの臨床候補製品を承認するのに要する時間を補うために、規制機関が私たちの臨床候補製品を承認するのに要する時間を補うために、米国、ヨーロッパ、他の国の法的枠組みから利益を得ることが予想される。
私たちは新技術と候補製品を開発すると同時に、私たちの知的財産権戦略を評価し、改善していく。私たちは、私たちの基本技術の改善、競争に適応したり、ビジネス機会を改善したりする分野を含む、適切な時期に私たちの知的財産戦略に基づいてより多くの特許出願を提出する予定です。また、私たちが開発した新しい技術を保護するために、私たちが適切だと思う場合に特許出願を提出する予定です。我々の特許出願戦略は、通常、米国で特許保護を求めることを含み、適切な場合には、このような保護が有用である可能性があると考えられる他の国/地域で特許保護を求めることを含む。
2021年12月31日現在、私たちが世界で所有、共同所有、許可されている特許は、ライセンスされた米国特許19件、許可された米国特許3件、係属中の米国特許出願10件、許可された外国特許56件、係属中の外国特許20件、特許協力条約(PCT)4出願、および25個の特許シリーズに関連する米国仮出願4つを含む。個別特許の期限は、このような特許を取得した国の法律にかかっている。我々が現在出願を提出している国では,特許期間は優先権出願である非仮特許出願の最初の提出日から20年である。さらに、米国および他の管轄地域に適用される場合には、特許期限の調整、回復、および/または特許期間の延長を求める予定である。例えば、FDAが我々のワクチン製品の時間、期限、および詳細を承認することによれば、私たちのいくつかの米国特許は、1984年の“薬品価格競争および特許期限回復法”(一般に“Hatch-Waxman修正案”と呼ばれる)に従って特許期間を延長し、“米国法”第35編156節に符号化する資格がある可能性がある。“米国法典”第35編第156節は、製品開発及びFDA規制審査の過程で失われた特許期間の補償として、最長5年間の特許期間の回復を許可する。しかし,特許期限の回復は特許の残存期間を延長することはできず,製品承認日から合計14年を超えることはできない。特許期間回復期間は、一般にIND発効日と生物製品ライセンス出願(BLA)提出日との間の時間の半分であり、BLA提出日とその出願が承認された日との間の時間を加える, しかし,出願人が職務調査を行っていないいつでも,審査期間は短縮されるであろう.承認されたワクチン製品に適用される特許はこのような延期を受ける資格があり,延期出願は特許が満了する前に提出されなければならない。米国特許商標局はFDAと協議し,任意の特許期間の延長または回復の出願を審査·承認する。補完保護証明書と呼ばれる類似の特許延期は、ヨーロッパにもある。特定の他の管轄区域でも、特許の有効期間を延長するための法的枠組みがある。私たちは現在、私たちが合格特許を持っていて、延長期間を得ることができる任意の司法管轄区域内で、私たちまたは私たちの独占許可のために発行された任意の特許に特許期間の延長を求めるつもりです;しかし、米国のFDAを含む適用可能な規制機関は、このような延長を承認すべきかどうか、そのような延長の期間を承認すべきかどうかの評価に同意することに同意します。さらに、私たちの特許が延長されても、その特許は、特許の延長部分を含めて、米国または外国の最終管轄権裁判所によって無効または強制執行不可能と判断される可能性がある。
私たちの現在の特許組み合わせは、DNAおよびMVAに基づくHIVワクチンの様々な態様に関連する5つの特許シリーズを含み、それらの遺伝子挿入発現複数のHIVタンパク質成分、成分、構造、複数のサブタイプのHIVに対する免疫主張、投与経路、安全性および他の関連要因、およびそれらの治療および予防使用方法は、投与制度を含む。私たちはエマレー大学とアメリカ国立衛生研究院(NIH)からHIVワクチン計画に関するライセンス特許を取得しましたこれらの特許は2022年から2028年の間に満期になり、いかなる特許期間の調整や延長も含まれない。我々は、特定のワクチン投与方法に対する付与された米国特許(US 11,098,086)を含む特許シリーズを完全に有しており、これらの方法が発行され、有効かつ実行可能である場合、特許期間の調整または延長は含まれない2037年に満了される。
我々は,エボラウイルス予防ワクチンに対する許可米国特許出願と,マルブルクウイルスおよびその用途に対する係属中の米国特許出願を完全に持っている。これらの出願は、発行、有効、および実行可能な場合、特許期間の調整または延長を含まず、2036年に満了する。
私たちはジカウイルス予防ワクチンとその用途に対する米国特許出願を完全に持っている。本出願が発表され、有効かつ強制的に実行可能であれば、特許期間の調整または延長は含まれない2037年に満了する。
私たちはジョージア州立大学と共同で、ライセンスされた米国特許(US 11,052,148)を含むB型肝炎ウイルス(B型肝炎)予防ワクチンの特許シリーズおよびその使用を有している。これらの出願は、発行され、有効かつ実行可能な場合、特許期間の調整または延長を含まず、2037年に満了される。
私たちはマラリア予防ワクチンとその使用に関する許可された米国特許出願を完全に持っている。本出願は、発行、有効及び実行可能な場合には、特許期間の調整又は延長を含まず、2038年に満了する。
我々は、我々の免疫腫瘍ワクチン組成物およびその使用方法に関する許可された米国特許出願および承認された外国出願(AU 2017206102)を含む3つの特許シリーズを完全に有する。これらのファミリーの特許出願は、発行され、有効かつ実行可能である場合、特許期間の調整または延長を含まず、2037~2040年の間に満了する。
我々は,SARS CoV−2を治療する様々なMVAベースのワクチンに関する出願中の2つの特許ファミリーを完全に有している。これらの一連の特許出願は、発行され、有効かつ実行可能である場合、特許期間の調整または延長を含まず、2041~2042年の間に満了する。我々は、SARS-CoV 2ワクチンのためのMVAウイルス主幹のいくつかの態様について、特許期間の調整または延長を含まず、2023年から2032年までの2023年から2032年に満了する米国国立衛生研究院(NIH)からの非独占的な内部許可の3つの特許シリーズを有している。NIH 2特許ファミリーから我々のMVA SARS−CoV 2候補ワクチンに関連するコロナウイルススパイク蛋白成分の非独占的許可を得た。これらの一連の特許出願は、発行され、有効かつ実行可能である場合、特許期間の調整または延長を含まず、2037年から2041年の間に満了される。
私たちは完全にMVAに基づくワクチンによるジカウイルス治療の米国の申請を待っている。特許出願が発行され、有効かつ実行可能である場合、特許期間の調整または延長は含まれない2037年に満了される。
我々は,ワクチン接種中にT細胞起動を増強するためのウイルス構築物に対する特許系列をLeidos,Inc.と共有している。本特許シリーズにおける特許出願は、発行され、有効かつ実行可能である場合、特許期限の調整または延長は含まれない2042年に満了される。
私たちはいくつかの特許と特許出願のグローバル独占許可取得者であり、私たちはEmory Technologyと呼ばれ、Emory大学が最初に2002年8月23日に締結され、2004年6月23日に再記載された許可協定(“Emory許可”)に基づいてHIVまたは天然痘ワクチンを所有、許可、または他の方法で制御する。エマレー大学が許可した特許は2022年から2028年の間に満期になり、いかなる特許期間の延長も含まれない。エマレー許可により,我々はまた米国国立衛生研究院が発行した4つの米国特許の非独占許可を得ており,これらの特許は我々のMVA担体ワクチンをベクターとしてHIVウイルス抗原を伝達し,ヒト体内で免疫反応を誘導する能力に関与している。これらの許可を得たNIH特許は2023年に満期となり,特許期間の延長は含まれていない。
我々がワクチンに使用したMVA主幹は,NIAIDウイルス疾患実験室(LVD)のBernard Moss博士の実験室から提供された。私たちはアメリカとアメリカ国立衛生研究院のNIAIDを代表して、MOSS実験室と提供された材料を使用して生成されたいくつかの特許と特許出願を含むNIH MVAバックボーンの非独占的商業許可を取得した。私たちはまたMVA主幹を他の候補ワクチンに使用することができる非独占研究開発許可証を持っている。もし私たちが後に研究開発許可証下の候補ワクチンを商業化することを決定したら、適切な商業化許可証について交渉する必要があるだろう。これらの許可されたNIH特許及び特許出願は、どこで発行され、有効かつ実行可能であれば、2023年から2032年の間に満了し、特許期限の調整または延長は含まれない。
2021年11月9日に署名された独占許可協定によれば、我々は、新冠肺炎の予防、減少、改善または治療のためのワクチン製品に関する希望城の3つの特許ファミリーを独占的に許可している。許可されている特許ファミリーが、1つ以上のSARS-CoV-2抗原をコードする合成MVAワクチンおよびその製造および使用方法を含む合成MVAベクターに対して、COH 04 S 1を含み、現在第2段階のヒト臨床試験が行われている多抗原SARS-CoV-2ワクチン。これらの許可を得た希望の城特許シリーズは、発行、有効、および実行可能であれば、いかなる特許期限の調整または延長も含まず、2041年に満了する。
2021年9月28日にPNP治療会社と締結された譲渡·許可協定に基づき、アラバマ大学と南方研究所の2つの特許ファミリーを独占的に許可した。この2つの特許シリーズは,尾部変異プリンヌクレオシドリン酸化酵素とフルダラビンによる癌治療の使用に対して,我々のGeeptin臨床候補製品の使用面をカバーしている。これらのライセンス内の特許シリーズは、発行され、有効かつ実行可能である場合、特許期間の調整または延長を含まず、2029年から2032年の間に満了する。
私たちは、私たちがすでに許可した、または許可された現在未解決の特許出願、または私たちが提出または許可する可能性のある任意の新しい特許出願が、米国または任意の他の国/地域で発表されることを決定することはできない。これらの特許が発行されても、他の人が私たちの製品やプロセスを使用することを防ぐために、これらの特許が十分に広くなることは保証されない。さらに、私たちの特許、および私たちが許可または将来可能に許可された特許は、裁判所によって無効または強制執行不可能と判断されるかもしれないし、第三者は許可またはそれを中心に設計された特許を得ることができ、私たちはそれをすることができないかもしれない。現在および将来の競争相手は、特許出願を許可または提出したか、または特許を取得した可能性があり、我々が競合する製品またはプロセスに関連する追加の特許または独占権を得ることができる。さらに、第三者の専有権侵害またはより早い発明日に関する任意のクレームは、正当な理由がなくても、費用の高い訴訟、冗長な政府訴訟、管理職の注意および資源の移転を招き、私たちに不利な使用料を締結することができるかもしれない協定を締結することを要求する可能性がある。
私たちはまた、適切な状況で米国、ヨーロッパ、他の国の法的枠組みから利益を得ることを望んでおり、これらの枠組みは、私たちの臨床製品が規制承認を受けることを保証するのに要する時間とコストを補償するための規制排他期間を提供する。例えば、2010年、米国は“生物製品価格競争と革新法”(BPCIA)を公布した。BPCIAによると、バイオ製品のイノベーターメーカーは、このような製品のバイオ類似バージョンが米国で発売されることが許可される前に、12年の独占使用期限を付与される可能性がある。これは、FDAが製品のバイオ類似バージョンの申請を承認しない可能性があり、製品の販売が承認された日から12年(いくつかの小児科研究が行われ、FDAが受け入れた結果を得る場合、6ヶ月の排他性を延長する可能性がある)ことを意味する。また,“BPCIA”は潜在的な関連特許を共有するプログラムを確立し,承認前に特許訴訟を行うことができる.BPCIAはまたFDAが許可した最初の生物類似製品に一定期間の排出期間を提供することによって、生物類似申請者に激励措置を提供する。BPCIAの12年間のデータ独占条項は、競争相手が自分の原始生物製品ライセンス申請(BLA)を提出することによって、私たちの製品または類似製品の発売承認を求めることを阻止しない。
私たちは適用された場合、異なる管轄区域から珍しい病気の治療を奨励する追加市場排他的条項から利益を得るつもりだ。例えば、米国では、1983年の“孤児薬品法”によれば、FDAは、通常、米国で20万人未満または米国で20万人を超える影響を与える疾患または状態であり、このようなタイプの疾患または状態の製品を米国で開発および提供するコストは、製品の販売から回収されるという、まれな疾患または状態の予防または治療を目的としたワクチン製品に孤児の称号を与える可能性がある。BLAを提出する前に、孤児としての指定を要請しなければならない。FDAが孤児の称号を付与した後、FDAは、治療剤の識別およびその潜在的な孤児の使用を開示する。孤児として指定された製品がその後、このような指定された疾患または状況を有するFDAの最初の承認を得た場合、この製品は、孤児薬物の排他性を得る権利があり、これは、FDAが承認日から7年以内に、限定された場合、例えば、より効率的、より安全、または患者ケアに大きな貢献をすることによって、孤児に対して排他的な製品に対する臨床的利点を示すか、または薬品供給問題の場合でなければ、同じ適応に対して同じ薬物を販売する任意の他の出願を承認することができないことを意味する。しかしながら、競争相手は、同じ適応に対する異なる製品または異なる適応に対する同じ製品の承認を得る可能性があり、後者の場合、医療専門家はラベル外用途のための製品を自由に発行することができるので、私たちは孤児が排他的であるにもかかわらず、競争相手の製品は孤立適応に使用することができる。
私たちは私たちの特許地位に関連したいかなる訴訟、反対、介入、または他の潜在的な不利な手続きに参加しない。しかし、もし私たちが訴訟、妨害訴訟、反対または他の知的財産権訴訟に巻き込まれた場合、例えば、告発された侵害または第三者がより早い発明日を主張したため、私たちは多くのお金と時間をかけなければならない可能性があり、不利な判決が発生した場合、私たちは損害賠償責任、私たちの知的財産権の無効、および技術や開発製品の使用を阻止することができる禁止救済に直面する可能性があり、いずれも私たちの業務、財務状況、または運営結果に大きな悪影響を及ぼす可能性がある。また、第三者の専有権の侵害やより早い発明日に関するいかなるクレームも、正当な理由がなくても、コストの高い訴訟、冗長な政府手続き、管理職の注意や資源の分散を招き、全く優位性のない使用料を締結することができるかもしれないという合意を要求する可能性がある。
特許に加えて、私たちはまた、非特許、独自の商業秘密およびノウハウ、および持続的な技術革新に依存して、私たちの競争地位を発展させ、維持している。私たちは、私たちのビジネスパートナー、協力者、従業員、コンサルタントとの秘密協定、および私たち従業員との発明譲渡協定の一部を使用して、私たちの独自の情報を保護することを求めています。これらのプロトコルは、我々の独自の情報を保護し、発明譲渡プロトコルの場合、第三者との関係によって開発された技術の所有権を付与することを目的としている。このような合意は違反されるかもしれないし、私たちはどんな違反にも対応する十分な救済策がないかもしれない。しかも、私たちのビジネス秘密は競争相手に知られたり独立して発見されるかもしれない。私たちのビジネスパートナー、協力者、従業員、およびコンサルタントが、私たちのために働いているときに他人が所有している知的財産権を使用する場合、関連するまたはそれによって生じるノウハウおよび発明の権利に関する紛争が生じる可能性がある。
許可協定
希望の城許可-2021年11月9日、著者らはカリフォルニアの非営利公益会社希望の城(COH)と独占許可協定(COH許可)を締結し、この協定に基づいて、同社はCOH 04 S 1をさらに開発と商業化する全世界の独占権利を獲得し、COH 04 S 1は1種の多抗原SARS-CoV-2ワクチンであり、現在第2段階の人体臨床試験を行っている。COH許可証はGeoVaxが新冠肺炎に対抗するための重要な特許、技術ノウハウ、監督文書と臨床材料に対する独占権利を付与する。COHライセンスの条項には、COHライセンスの発効日から30日以内にCOHに5,000,000ドルの頭金を支払うことと、COHライセンスの発効日の最初の記念日および第2の記念日にそれぞれ3,000,000ドルおよび2,000,000ドルを追加的に支払うことを含む前払い費用が含まれる。これらの条項には、選択された開発、規制、販売活動が完了した後に支払われるマイルストーン支払いも含まれている。同社はまた、COHライセンス特許がカバーする製品の純売上高の特許使用料をCOHに毎年支払い、国/地域とライセンス製品に基づいて行うが、指定された減額で支払わなければならない。
Geeptin許可-2021年9月28日、私たちはPNP治療会社(“PNP”)と譲渡と許可協定(“Geeptin許可”)を締結し、この協定によると、会社はGedestin特許、技術ノウハウ、監督管理記録書類、臨床材料と商標を含む重要な知的財産権の全世界独占権利を獲得した。Gedestinの特許組合せは,最初にPNPによってアラバマ大学バーミンガム校(UAB)と南方研究所(SRI)から許可された。Gedestinライセンスの条項によると、UAB、SRIとPNPの間の独占ライセンスプロトコルによると、同社はPNPの後継者であり、固形腫瘍の治療の新しい特許製品Gedestinの開発と商業化の独占的権利を獲得している。
Geeptinライセンスの条項は、(I)取引が完了したときの前払い、(Ii)特定の開発および規制イベントの完了時に支払われるべきマイルストーン支払い、および(Iii)より短い3年以内に、または同社がGeeptinを使用してヒト頭頸部癌を治療するバイオ製品ライセンス申請を承認することをFDAに申請する際の四半期サポート支払いを含む。同社はまた、国/地域と製品の規定に基づいて、国/地域と製品の規定に基づいて、純売上高(Geeptinライセンスでの定義)にミドルクラスの年間印税を支払う。同社はPNPにも引受権証を発行し、2022年3月28日以降と2026年9月28日までのいつでも行使でき、最大10万株の会社普通株を承認し、行使価格は1株13.00ドルとなる。FDAが模倣薬または生物学的類似製品を承認した後、Geeptinライセンスは、最初の期間内に有効に維持され、その後、慣例的な停止権に基づいて、5年間の追加期限が自動的に更新される。
NIHライセンス−2020年11月25日,同社はNIAIDに代表される米国衛生·公衆サービス部(HHS)と内部研究用途のための特許と生体材料許可協定(“研究許可”)を締結し,多種類の病原体に対するワクチンの非臨床開発を支援している。研究許可証はGeoVaxがこれらの材料とHHS機関が所有する特許権を使用することを許可し、同社の独自技術を結合し、アンカラウイルス様粒子(MVA-VLP)ワクチンを予防及び/又は治療的に改良し、エボラウイルス、エボラ-スーダンウイルス、ラサウイルス、マルブルクウイルス、ジカウイルスとマラリアに対抗するために開発及び/又は治療的に改良した。このプロトコルはまた、同社のある腫瘍学領域における研究と開発にも拡張されている。このプロトコルはGeoVaxにHHS特許および材料非臨床開発とその候補ワクチンおよび免疫療法を使用した非独占的権利を提供する。
同社は2020年10月22日,NIAIDに代表されるHHSと特許と生体材料許可協定(“COVID許可”)を締結し,新冠肺炎を引き起こすSARS−CoV−2ウイルスに対するワクチンの開発を支援した。COVID許可証はGeoVaxがこれらの材料と衛生部の各機関が持つ特許権と同社の独自技術を結合し、新型肺炎に対する予防的な改良アンカラウイルス様粒子(MVA-VLP)ワクチンを作成することを可能にする。COVIDライセンスは、GeoVaxに新冠肺炎ワクチンの開発、製造、商業化の非独占的権利を提供し、NIAIDの安定したスパイクタンパク質の特許権を取得することを含む。安定したスパイクタンパク質は、SARS-CoV-2ウイルスがヒト組織に入るために使用されるタンパク質である。
科学顧問
私たちは私たちの科学顧問委員会に意見を求め、この委員会は複数のトップレベルの科学者からなり、科学と医療事務について意見を提供する。私たち科学顧問委員会の現在のメンバーは
| 名前.名前 | 職位·機関所属関係 | |
| ハリエット·L·ロビンソン博士 | GeoVax首席科学官栄休 | |
| スタンレー·A·プロトキン医学博士 | ペンシルバニア大学名誉退職教授ジョンホプキンス大学のアルバイト教授 | |
| バーニー·S·グレアム医学博士 | NIAIDワクチン研究センター上級研究員 | |
| スコット·C·ウィーバー博士 | 取締役、テキサス大学医学分院ヒト感染と免疫科学研究所、ガルヴィストン国立研究所 | |
| オリベイラ·J·フィン博士 | ピッツバーグ大学免疫学と外科特任教授 |
人的資本資源
私たちは現在11人のフルタイム従業員がいる。私たちは一人の職員たちが集団交渉協定によって保護されておらず、私たちは私たちの職員たちが良い関係を持っていると信じている。また、コンサルタントおよび独立請負業者を招いて、重要な役割を果たし、および/または持続的かつ短期的な専門家サービスを提供する。
私たちの未来の成功は、私たちが高技能従業員を引きつけ、維持し続ける能力に大きくかかっていると信じている。私たちは私たちの従業員に競争力のある報酬、株式機会、そして穏健な雇用プランを提供し、医療、退職計画、有給休暇を含む彼らの生活のあらゆる面の健康を促進する。
企業背景
わが親会社の前身であるGeoVax Labs,Inc.(報告実体)は,1988年6月にイリノイ州の法律によりDauphin Technology,Inc.(“Dauphin”)として最初に登録された。2006年9月、DauphinはGeoVax,Inc.との合併を完了した。合併の結果、GeoVax,Inc.はDauphinの完全子会社となり、DauphinはGeoVax Labs,Inc.と改称された。2008年6月、デラウェア州の法律により会社が再登録された。GeoVax,Inc.はヒト疾患を治療または予防する新製品を開発する業務を除いて,現在は何の業務も行っていない。私たちの主な事務所はジョージア州のスマイナに設置されていて、アトランタの大部分にあります。
利用可能な情報
私たちのサイトの住所はwww.geovax.comです。我々は、依頼書、10-Kフォーム年次報告、10-Qフォーム四半期報告、8-Kフォームの現在の報告、およびこれらの報告の修正を本サイト“投資家-アメリカ証券取引委員会報告”の項目の下で無料で提供した後、合理的で実行可能な範囲内でこれらの材料をできるだけ早く電子的にアーカイブまたは米国証券取引委員会に提供する。私たちはまた、当サイトで“投資家-コーポレートガバナンス”というタイトルでビジネス行動基準を提供しています。当社のサイトに掲載されている資料は本年度報告には含まれていません。
| 第1 A項。 |
リスク要因 |
私たちの証券の所有権は高度な危険と関連がある。あなたが私たちの証券を持っているかどうかを決定する前に、あなたは以下に説明するリスク、不確実性、および他の要素を慎重に検討して考慮しなければならない。これらの要素のいずれも、私たちの業務、財務状況、経営結果、および見通しに実質的な悪影響を及ぼす可能性があり、私たちの普通株の市場価格に悪影響を及ぼす可能性があり、あなたは投資の一部または全部を損失する可能性があります。以下に説明するリスクと不確実性は、わが社が直面している唯一のリスクと不確実性ではない。私たちは私たちが現在どうでもいいと思っている他のリスクと不確実性もまた私たちの業務運営を損なう可能性があるということを認識していない。また、当社の財務諸表および関連付記を含む本10-K表に含まれる他の情報を参照しなければなりません。
リスク要因の概要
私たちの業務は多くのリスクと不確実性の影響を受けており、次節でこの点をより詳細に議論します。他にも、これらのリスクには以下の主なリスクが含まれている
私たちの業務と資本要求に関連するリスク
| ● |
私たちは運営赤字の歴史があり、私たちは予測可能な未来にも損失が続くと予想している。 |
| ● |
私たちの業務は持続的な資金が必要になるだろう。もし私たちが十分な資金を得られなければ、私たちは私たちの行動を続けることができないかもしれない。 |
| ● |
情報技術システムの深刻な中断や情報セキュリティシステムの破壊は,我々の業務に悪影響を与える可能性がある. |
| ● |
私たちの業務は広範囲な公衆衛生流行病や他の私たちがコントロールできない悲劇的な事件の悪影響を受けるかもしれない。 |
候補製品の開発と商業化および第三者への依存に関するリスク
| ● |
私たちの製品はまだ開発中で、検証されていません。これらの製品は成功しないかもしれません。 |
| ● |
私たちは重要な人たちに依存して、彼らはいつでも私たちとの雇用関係を終わらせることができる。もし私たちが誰かのサービスを失ったら、私たちの業務と運営は不利な影響を受けるかもしれない。 |
| ● |
規制と法的不確実性は巨額の費用や他の方法で私たちの業務を損なう可能性がある。 |
| ● |
私たちは激しい競争と迅速な技術変革に直面しており、これは私たちが商業化や開発する製品よりも良い製品をもたらすかもしれない。 |
| ● |
私たちの候補製品は新しい医療技術に基づいているので、固有のリスクです。私たちの製品の安全性と有効性に対する懸念は私たちの未来の成功を制限するかもしれない。 |
| ● |
私たちは臨床試験で遅延に遭遇する可能性があり、これは私たちの財務業績とビジネスの将来性に不利な影響を与えるかもしれない。 |
| ● |
我々の製品のビジネス潜在力を開発するために必要な規制承認をタイムリーに得ることができなければ、将来の開発コストを増加させたり、将来の販売を損なう可能性があります。 |
| ● |
州薬品マーケティングコンプライアンスと報告要求は、私たちを州政府または他の政府当局の監督管理と法律行動に直面させる可能性がある。 |
| ● |
医療法や施行条例の変化、医療政策の変化は、現在予測できない方法で私たちの業務に影響を与える可能性があり、私たちの業務や運営結果に大きな悪影響を及ぼす可能性があります。 |
| ● |
私たちは私たちが商業化を求める候補製品の協力関係を構築することに成功できないかもしれないが、これは私たちが製品を発見、開発、商業化する能力に悪影響を及ぼすかもしれない。 |
| ● |
私たちは製造、販売、マーケティングの経験がありません。 |
| ● |
私たちが開発している製品は市場の承認を得られないかもしれません。 |
| ● |
私たちは訴訟の弁護や製品責任クレームのための損害賠償金を支払うように要求されるかもしれない。 |
| ● |
第三者支払者の支払決定は定価や市場受入度に悪影響を及ぼす可能性がある。もし私たちの製品が十分に精算されなければ、それらが広く使用される可能性は低くなるだろう。 |
私たちの知的財産権に関するリスクは
| ● |
私たちの成功は私たちの知的財産権とノウハウを獲得し、維持し、保護し、実行する能力にかかっている。 |
| ● |
もし私たちが許可者に対する契約義務を履行しなければ、私たちは私たちの重要な知的財産権の許可権を失うかもしれない。 |
| ● |
他の側は私たちが彼らの知的財産権や独占権を侵害していると主張するかもしれませんが、これは私たちが巨額の費用を発生させたり、私たちの製品の販売を阻止したりする可能性があります。 |
| ● |
私たちまたは私たちの許可者のアメリカと外国での知的財産権を保護できないいかなる行為も、他人が私たちの製品を製造または販売することを阻止する能力を制限する可能性があります。 |
| ● |
米国特許法の変化は特許の全体的な価値を低下させ、私たちの候補製品を保護する能力を弱める可能性がある。 |
| ● |
私たちの候補製品の特許保護と特許起訴は第三者にある程度依存している。 |
私たちの普通株に関するリスクは
| ● |
私たち普通株の市場価格は大きく変動しています。 |
| ● |
私たちの普通株または他の株式証券の追加株式を売却または発行することは、私たちの株主の追加的な希釈をもたらす可能性がある。 |
| ● |
わが社の登録証明書に優先株株式の発行を許可するいくつかの条項は、第三者の制御権の変更を困難にする可能性があります。 |
| ● |
私たちは配当金を支払ったこともないし、そうする計画もない |
| ● |
上場企業のコンプライアンスは私たちを役員や役員を引き付けたり引き留めたりするのが難しくなるかもしれません。 |
| ● |
私たちの会社の登録証明書と定款は私たちの大多数の株主が賛成票を投じて修正することができる。 |
| ● |
もし私たちが細価格株とされているため、細価格株規則の制約を受けて、ブローカーが普通株の株式取引を阻止される可能性がある。 |
私たちの業務と資本要求に関連するリスク
私たちは運営赤字の歴史があり、私たちは予測可能な未来にも損失が続くと予想している。
研究開発に専念している会社としては、これまで製品収入がなく、政府支出や他の協力からの収入も運営費を支払うのに十分なキャッシュフローが生じていなかった。我々の設立以来,研究開発活動に関するコストや我々の運営に関する一般的かつ行政費用により,毎年運営損失が発生している。2021年12月31日までの1年間に、18,570,317ドルの純損失が発生した。われわれの研究開発,臨床前,臨床,製造努力の拡大に伴い,より多くの運営損失を招き,累積損失が増加することが予想される。私たちが収入を創出し、利益を達成する能力は、候補製品の開発を成功させ、臨床前テストと臨床試験を行い、必要な監督管理の承認を得て、私たちの製品を製造し、マーケティングし、あるいはそれを商業化する能力に依存する。私たちがこのような挑戦に成功しない限り、私たちは利益を得ることができず、経営を続けることができないかもしれない。
私たちの業務は持続的な資金が必要になるだろう。もし私たちが十分な資金を得られなければ、私たちは私たちの行動を続けることができないかもしれない。
これまで、私たちは主に私たちの株式証券の売却と政府の贈与と臨床試験支援を通じて、私たちの業務に資金を提供してきました。私たちは、臨床試験、運営費用、知的財産権保護と法執行、規制承認の求め、製造、マーケティング、販売機能の確立またはアウトソーシングを含む、異なる時間間隔で私たちの運営に多くの追加資金を提供する必要があります。私たちはこのような追加的な資金が私たちが受け入れられる条件で提供されるか、または根本的にできないということを保証できない。もし私たちの業務を現在のレベルまたは将来必要とされる可能性のあるレベルに維持するために必要な大量の資金を得ることができない場合、私たちは臨床研究や臨床試験を延期し、運営を減らし、あるいは協力手配によって資金を得ることを要求されるかもしれません。これは、いくつかの製品または潜在的な市場の権利を放棄することを要求するかもしれません。
私たちは連邦政府が私たちのワクチンや免疫療法開発プロジェクトに対する追加的な支援を求めるかもしれないが、私たちが開発活動の後期段階に入るにつれて、政府の財政支援はもっと得られないかもしれない、あるいは全く得られないかもしれない。したがって、私たちは私たちの開発活動を支援するために他の資金源を探す必要があるだろう。
私たちの現在の運営資金は、2023年第2四半期まで、私たちの計画された運営レベルを支持するのに十分であると予想される。私たちは私たちのワクチン開発計画を著しく推進し、私たちの運営を継続するために追加の資金を調達する必要があるだろう。我々の運営キャッシュフロー需要を満たすために,政府贈与計画と臨床試験支援により非希釈資本の源を求める予定である。私たちはまた私たちの株式証券、債務、または転換可能な債務ツールを追加的に発行することを計画するかもしれない。もし私たちが必要な時に運営資金の需要を維持するために必要な融資を得ることができない場合、あるいは融資コストが目を引くほど高く、その結果は私たちの業務、経営業績、財務状況、見通しに実質的な悪影響を与える可能性がある。
情報技術システムの深刻な中断や情報セキュリティシステムの破壊は,我々の業務に悪影響を与える可能性がある
我々は,情報技術システムと従来の記録保存を組み合わせて我々の業務を運営している.通常のビジネスプロセスでは、機密情報(個人情報および知的財産権を含むがこれらに限定されない)を収集、格納、および送信する。我々はまた,我々の情報技術システムの要素を含む我々の業務要素を第三者にアウトソーシングするため,我々の機密情報を入手可能または可能な第三者との多くの独立したベンダ関係を管理している.我々の情報技術および情報セキュリティシステムおよび記録は、従業員またはサプライヤーの不注意や故意の行為によるセキュリティホール、サービス中断、またはデータ損失の影響を受けやすい可能性がある。我々の情報技術や情報セキュリティシステムや記録も第三者の悪意のある攻撃を受けやすい可能性がある.このような攻撃は、広範な専門知識および動機(金融犯罪、産業スパイ、および市場操作を含むがこれらに限定されない)を有する団体および個人によって開始されるように複雑化している。
私たちは限られた資金の一部を私たちの情報技術と情報セキュリティシステムに投資し続けていますが、セキュリティホール、サービス中断、またはデータ損失を防ぐための私たちの努力は保証されません。任意のセキュリティホール、サービス中断、またはデータ損失は、私たちのビジネス運営に悪影響を及ぼす可能性があり、および/または、キーまたは敏感な機密情報または知的財産権の損失をもたらし、財務、法律、商業および名声の損害をもたらす可能性があり、または第三者が私たちの証券を取引するために使用される可能性のある重要なインサイダー情報を取得することを可能にします。
私たちの業務は広範囲な公衆衛生流行病や他の私たちがコントロールできない悲劇的な事件の悪影響を受けるかもしれない。
私たち自身の従業員や施設に依存するほか、私たちの協力者、実験室、他の施設に依存して、私たちの業務を継続して運営しています。私たちはいかなる予防措置を取っているにもかかわらず、新冠肺炎などの公衆衛生流行病あるいはその他の壊滅的な事件、例えば自然災害、テロ、ハリケーン、火災、洪水と氷雪嵐は、私たちの業務を中断させる可能性がある。
我々の実験室内部と私たちの協力者の必要な仕事はずっと続いており、新冠肺炎疫病の重大な中断を受けていないにもかかわらず、私たちは状況を監視し続け、より多くの情報と指導を得ることに伴い、私たちの現行政策を調整し、旅行の一時停止と自ら業務を展開する制限はすでに私たちの業務発展努力にマイナスの影響を与え続け、運営または他の挑戦をもたらす可能性があり、これらの挑戦はすべて私たちの業務、財務状況、運営結果を損なう可能性がある。
また、新冠肺炎の疫病は私たちの運営を乱すかもしれません。私たちの従業員は限られているので、感染したり病気になった管理職のメンバーや他の従業員は仕事をサボる可能性があります。新冠肺炎関連疾患も我々の取締役会メンバーに影響を与え、取締役会や取締役会会議の欠席を招き、わが事務所を管理するために必要な取締役会やその委員会の定足数を開催することをより困難にしている可能性がある。
候補製品の開発と商業化および第三者への依存に関するリスク
私たちの製品はまだ開発中で、検証されていません。これらの製品は成功しないかもしれません。
利益を得るために、私たちは私たちの製品を販売することで収入を作らなければならない。しかし、私たちの製品は違う開発とテスト段階にある。我々の製品はまだ人体臨床試験で検証されておらず、いかなる政府機関の販売許可も得られていない。もし私たちが私たちの製品や工芸を開発して証明することができなければ、あるいは他の収入源を開発しなければ、私たちは利益を得ることができなくなり、さらにある時、私たちは運営を停止します。
私たちは重要な人たちに依存して、彼らはいつでも私たちとの雇用関係を終わらせることができる。もし私たちが誰かのサービスを失ったら、私たちの業務と運営は不利な影響を受けるかもしれない。
私たちの業務戦略の成功は重要な管理、技術と科学者の持続的なサービス、及び私たちがより多くの合格者と管理者を引き付ける能力に大きく依存する。会社、学術機関、他の組織との間の人材競争は非常に激しい。人材を誘致して維持する能力は私たちの財政的挑戦の不利な影響を受ける。もし私たちがキーパーソンとコンサルタントを引き付けることができなければ、私たちの成功した開発、テスト、商業化と私たちの製品と候補製品をマーケティングする能力にマイナスの影響を与えるかもしれない。
規制と法的不確実性は巨額の費用や他の方法で私たちの業務を損なう可能性がある。
私たちの製品を製造して販売するためには、私たちは広範な国内と国際法規を守らなければならない。米国で我々の製品を販売するためには,米国食品医薬品局(FDA)の承認を得る必要がある。FDAの要求を含む規制要件を満たすには、通常何年も必要であり、承認されれば、これは製品のタイプ、複雑性、および新規性に依存し、大量の資源が必要となる。私たちは私たちの製品がFDAの承認を受けるかどうか予測できない。たとえそれらが承認されても、私たちは承認された時間枠を予測することができない。異なる司法管轄区の外国の監督管理要求は異なり、場合によってはFDAの要求よりも厳しいか、あるいは満足しにくい可能性がある。FDAと同じように、私たちはいつこのような規制の承認を受けることができるか予測できない。私たちの製品が長期にわたって多くの患者集団で安全かつ成功的に使用できることを証明できなければ、私たちの製品はFDAや外国政府の規制機関によって承認を拒否される可能性が高い。
私たちは激しい競争と迅速な技術変革に直面しており、これは私たちが商業化や開発する製品よりも良い製品をもたらすかもしれない。
人類伝染病の予防或いは治療のワクチン市場競争は激しく、迅速と重大な技術変革の影響を受けている。私たちはアメリカと海外にたくさんの競争相手がいて、その中には私たちよりずっと資源の多い大会社が含まれています。もし私たちの競争相手が開発した製品の有効性や安全性が私たちの製品より明らかに優れていれば、私たちの製品を商業化できないかもしれません。私たちのいかなる商業化製品の販売も損なわれる可能性があります。私たちのいくつかの競争相手と潜在的な競争相手は私たちよりも多くの製品開発能力と財務、科学、マーケティング、人材を持っています。競争相手はより早く製品を開発し、FDAの承認をより早く得るか、あるいは私たちが開発している製品よりも効率的な製品を開発するかもしれない。私たちは競争力を維持するために私たちの技術能力を拡大することを求めます;しかし、他の人の研究と開発は、私たちの技術や製品を時代遅れにしたり、競争力を欠いたり、治療や治療法が私たちよりも優れている可能性があります。
私たちの候補製品は新しい医療技術に基づいているので、固有のリスクです。私たちの製品の安全性と有効性に対する懸念は私たちの未来の成功を制限するかもしれない。
新医療技術に基づく候補製品を開発する際には,固有の失敗リスクに直面している。これらのリスクには、私たちが作った製品が有効でない可能性があり、候補製品が安全でないか、必要な規制承認が得られないことと、私たちの候補製品が大規模な生産が困難になることや市場に割に合わないことが含まれています。
多くの薬品は多種の潜在的な合併症と副作用を招き、すべてのものが正確に予測できるわけではなく、しかも多くの副作用は患者によって異なる可能性がある。長期的な追跡データは、私たちの製品に関連する以前に確定されていない合併症を明らかにするかもしれない。潜在医師や他の人の合併症に関する情報に対する反応は,市場がわが製品の受容度に実質的に悪影響を及ぼす可能性があり,逆に我々の業務に実質的な被害を与える可能性がある。
私たちは臨床試験で遅延に遭遇する可能性があり、これは私たちの財務業績とビジネスの将来性に不利な影響を与えるかもしれない。
計画中の臨床前と臨床試験が時間どおりに開始されるかどうかは分からないし,予定通りに何の試験も完了するかどうかもわからない。もし私たちがテストや承認に遅延があれば、あるいは計画よりも多くの臨床試験を行う必要があれば、製品開発コストが増加するだろう。重大な遅延は私たちの財務業績と私たちの製品のビジネス見通しに悪影響を与え、私たちの収益力を遅らせるかもしれません。
著者らは独立した臨床研究者、ワクチンメーカーと他の第三者サービスプロバイダに深刻に依存して、著者らの臨床試験を成功的に実行したが、彼らの活動の多くの方面を制御することができなかった。私たちは私たちのすべての臨床試験が試験の全体的な研究計画と方案に従って行われることを保証する責任がある。さらに、FDAは、データおよび報告の結果が信頼性および正確であることを保証し、試験参加者の権利、完全性およびセキュリティを保護するために、臨床試験結果を行い、記録し、報告する基準を遵守することを要求し、一般に良好な臨床実践と呼ばれる。私たちが統制できない第三者への依存は私たちのこのような責任と要求を免除することができない。第三者は計画通りに活動を達成できない可能性があり,あるいは法規の要求やわれわれが規定した案に基づいてわれわれの臨床試験を行っていない可能性がある。もしこれらの第三者がその義務を履行できなかった場合、私たちの候補製品の開発、承認、商業化を延期または阻止する可能性がある。
我々の製品のビジネス潜在力を開発するために必要な規制承認をタイムリーに得ることができなければ、将来の開発コストを増加させたり、将来の販売を損なう可能性があります。
私たちのワクチンはFDAによって米国での販売が許可されておらず、他の規制機関の許可も得られず海外で販売されている。我々の技術のビジネス潜在力を発掘するために,より多くの臨床前研究と臨床試験を行って計画している。この過程は非常に高価で、多くの時間が必要かもしれない。失敗は結果が有利であってもテストのどの段階で起こる可能性がある。臨床試験で安全性と有効性を十分に証明できず、監督部門の承認を延期或いは排除し、技術或いは製品を商業化する能力を制限する可能性がある。そのようなどんな失敗も私たちの業務を深刻に損なう可能性がある。さらに、私たちが得た任意の承認は、承認を求めるすべての臨床適応を含まない場合があり、または使用条件に関する狭い適応、警告、予防または禁忌症の形態、または煩雑なリスク管理計画、分配制限または承認後の研究要件を含むことができる。
州薬品マーケティングコンプライアンスと報告要求は、私たちを州政府または他の政府当局の監督管理と法律行動に直面させる可能性がある。
いくつかの州はすでに立法を制定し、製薬会社にマーケティングコンプライアンス計画を構築し、販売、マーケティング、定価とその他の活動に関する報告を定期的に提出することを要求している。他の州も似たような立法を考慮している。その中の多くの要求事項は新しくて不確実であり、利用可能な指針は限られている。私たちがこのような法律を完全に遵守しない限り、私たちは法執行行動、罰金、その他の処罰に直面し、否定的な宣伝を受ける可能性があり、これらはすべて私たちの業務を損なう可能性がある。
医療法や施行条例の変化、医療政策の変化は、現在予測できない方法で私たちの業務に影響を与える可能性があり、私たちの業務や運営結果に大きな悪影響を及ぼす可能性があります
米国や他の管轄地域では、医療システムに関するいくつかの立法·規制改革および提案された改革が継続されており、これらの改革は、候補製品の上場承認を阻止または延期し、承認後の活動を制限または規範化し、マーケティングの承認を得た候補製品を収益的に販売する能力に影響を与える可能性がある。米国やEUを含む他の地方の政策立案者や支払者の中で,医療システムの改革を推進することに大きな興味があり,医療コストの抑制,質の向上,および/または参入拡大を既定の目標としている。米国では、製薬業はこれらの努力の重点であり、重大な立法計画の大きな影響を受けてきた。
“患者保護と平価医療法案”は2010年の“医療·教育調整法案”(“平価医療法案”と総称する)の改正により、政府と民間保険会社が医療保健に融資する方式を大きく変え、米国製薬業に重大な影響を与えた。“平価医療法案”には、処方薬価格および医療製品への政府の支出に関する条項を含む医療コストを低減するためのいくつかの条項が含まれている。
公布以来、“平価医療法案”のいくつかの側面も司法や国会の挑戦を受けており、前トランプ政権もこの法規のいくつかの側面を廃止または代替しようと努力している。私たちは引き続き“平価医療法案”とその後の法規改正が私たちの業務に与える影響を評価し続ける。このような変化が私たちの業務や財務状況にどの程度影響を及ぼす可能性があるかはまだ確定されていない。
最近,政府は薬品メーカーがその上場製品に価格を設定する方式についても審査を強化している。すでに何度か国会調査·提出された法案や,州政府の努力は,製品定価の透明性の向上,価格設定とメーカー患者計画との関係の審査,薬品に対する政府の計画補償方法の改革を目指している。FDAは2017年6月、既存製品との模造薬競争を奨励することで処方薬価格を低下させる薬品競争行動計画を発表した。FDAは2018年7月、生物模倣薬からの処方生物製品の競争を同様に促進するための生物類似行動計画を発表した。
アメリカの個別州は立法と実施を通じて薬品と生物製品の定価を制御するための法規の面でもますます積極的になってきており、これらの法規は価格或いは患者の精算制限、割引、ある製品への参入の制限とマーケティングコストの開示及び透明性措置を含む。例えば、2017年9月、カリフォルニア州議会は、製薬会社にその製品の価格が2年以内に16%を超える場合に、少なくとも60日前に健康保険会社および政府健康計画を通知し、さらに製薬会社に値上げの原因を説明するように要求するSB 17を承認した。2016年からバーモント州では、州政府が認定したあるメーカーに値上げに理由を提供することを求める法律が成立した。
これらの措置や将来講じられる可能性のある他の医療改革措置は,より厳しいカバー基準とより低い精算を招き,我々が受け取った任意の承認製品の価格に下振れ圧力を与える可能性が予想される。連邦医療保険や他の政府援助計画のいかなる精算減少も、個人支払者の支払いの同様の減少を招く可能性がある。上場承認を得ると、コスト制御措置や他の医療改革を実施することは、私たちの収入の創出、利益の実現、あるいは私たちの薬物の商業化を阻止するかもしれない。
私たちは私たちが商業化を求める候補製品の協力関係を構築することに成功できないかもしれないが、これは私たちが製品を発見、開発、商業化する能力に悪影響を及ぼすかもしれない。
私たちは未来に候補製品の開発と商業化のために協力を求めたい。任意の協力の時間と条項は、潜在的協力者の臨床試験結果の評価、および製品の安全性と有効性の概要の他の側面に依存する。もし私たちがどの候補製品についても適切な協力者と合意できなければ、私たちはこれらの候補製品の開発と商業化全体に資金を提供することを余儀なくされ、私たちはそうする資源がないかもしれない。資源制限が製品候補開発の早期に協力協定を締結することを要求すれば、製品が最終的に生じる可能性のある任意の収入のより限られたシェアを受け入れることを余儀なくされる可能性がある。私たちは適切な協力者を探すことで激しい競争に直面している。しかも、このような協力計画の交渉と記録は複雑で時間がかかる。私たちがどんな候補製品のための協力や他の代替計画を作る努力は成功しないかもしれない。私たちが協力に成功したとしても、私たちは協力者が彼らの義務や私たちの期待を履行することを確実にすることができないかもしれない。
私たちは製造、販売、マーケティングの経験がありません。
私たちは製造、販売、あるいはマーケティングの経験がない。私たちの製品を製造、マーケティング、販売するために必要な専門知識を得るためには、私たち自身の商業インフラおよび/または協力のビジネス配置とパートナーシップを発展させなければならない。私たちが現在の運営計画を実行する能力は、私たちが契約する可能性のある第三者協力者の表現を含む多くの要素に依存する。
私たちが開発している製品は市場の承認を得られないかもしれません。
私たちの製品は医師、患者、医療支払者、医療界の市場に受け入れられないかもしれません。私たちが競争に成功するかどうかを決める重要な要素は
| ● |
私たちの製品の有効性と安全性 |
| ● |
承認の時間と範囲を規制する |
| ● |
保険会社や他の人の精算範囲 |
| ● |
私たちの製品の価格と費用効果、特にどんな競争製品と比較しても |
| ● |
特許保護を維持する能力 |
| ● |
市場需要は簡単にはわかりません。 |
私たちは訴訟の弁護や製品責任クレームのための損害賠償金を支払うように要求されるかもしれない。
製品責任はバイオテクノロジーと医薬製品テストとマーケティングの大きなリスクだ。私たちは人体臨床試験中と監督管理の承認後に販売された製品は巨大な製品責任の開放に直面しているかもしれません。私たちは製品責任保険を受けて、私たちはこのような保険証書を引き続き保険したいです。しかし、製品責任クレームは、その是非にかかわらず、保険制限を超え、経営陣の注意をそらし、私たちの名声と私たちの製品の需要に悪影響を及ぼす可能性がある。
第三者支払者の支払決定は定価や市場受入度に悪影響を及ぼす可能性がある。もし私たちの製品が十分に精算されなければ、それらが広く使用される可能性は低くなるだろう。
我々が開発した製品に対する市場の受容度は,承認されれば精算政策に依存し,将来の医療改革措置などの影響を受ける可能性がある。政府当局と第三者支払者、例えば個人健康保険会社や健康維持組織は、彼らがどの薬剤を保険し、支払いレベルを確立するかを決定する。私たちは私たちが開発する可能性のあるどんな製品も精算できると確信できない。また、精算政策が私たちの製品への需要を減らしたり、私たちの製品に支払う価格を減らしたりしないことは確認できません。精算が得られない場合や限られた基礎の上で精算が得られなければ、私たちが開発した製品の商業化に成功できないかもしれません。
私たちの知的財産権に関するリスクは
私たちの成功は私たちの知的財産権と独自の権利を獲得し、維持し、保護し、実行する能力にかかっている 技術
全体的に、私たちのビジネスの成功は、私たちの候補製品、独自技術およびその用途に対する特許保護および商業秘密保護、ならびに他人の知的財産権を侵害、流用、または他の方法で侵害することなく運営する能力を含む、私たちおよび私たちの許可者が、私たちの知的財産権およびノウハウを取得、維持、保護、および実行する能力にある程度依存するであろう。もし私たちまたは私たちの許可者が私たちの知的財産権を獲得、維持、保護または実行できない場合、または私たちの知的財産権が私たちの技術または私たちの候補製品を満たすのに十分でなければ、私たちの競争地位が損なわれる可能性があり、これは私たちの業務、運営結果、財務状況、および見通しに実質的な悪影響を及ぼす可能性がある。私たちの特許出願が特許が発行されることを保証することはできないし、またはすでに発行された特許は、類似の技術を持つ競争相手からの攻撃から十分な保護を提供することができず、特許が発行されると、第三者に侵害、流用、侵害、設計または無効にされない保証はない。発行された特許が後に無効であると認定されたとしても、強制的に執行されないか、または第3の方向の各特許庁または裁判所が提起した訴訟において修正または撤回される可能性がある。未来の私たちの知的財産権の保護の程度は不確実だ。限られた保護しかないかもしれないし、私たちの権利を十分に獲得し、維持し、保護し、実行することができないかもしれないし、私たちがどんな競争優位性を獲得または維持することを可能にすることができる。私たちは、私たちの候補製品に関連する知的財産権を適切に取得、維持、保護、実行する能力にこれらの不確実性および/または制限が存在し、私たちの財務状況および運営結果に大きな悪影響を及ぼす可能性がある。
私たちは、米国特許商標局(USPTO)または米国または外国の特許庁および裁判所が、私たちが許可されていない係属中の特許出願中の権利要件が特許を出願可能であると考えるかどうか、また、最終的に私たちの特許出願から提出される可能性がある権利要件が挑戦されたときに無効または実行不可能であることが発見されないかどうかを決定することはできない。もし私たちまたは私たちの許可者が私たちの候補製品に対する特許保護を獲得または維持できない場合、私たちの業務、財務状況、運営結果、および見通しは実質的な損害を受ける可能性があります。
もし私たちが許可者に対する契約義務を履行しなければ、私たちは私たちの重要な知的財産権の許可権を失うかもしれない。
私たちが製品で使用する技術の重要な部分に対する私たちの権利は第三者から許可を得て、私たちがライセンシーに対する契約義務を履行しなければ、私たちの権利は終了します。私たちの任意の許可協定によって知的財産権を終了することは、私たちが製品を生産または保護する能力に悪影響を及ぼす可能性があります。私たちのライセンス契約によると、私たちの義務は、臨床開発と規制承認マイルストーンを実現する際に、記念碑的なお金、商業製品を販売する際の印税、特許出願とメンテナンス費用の精算を許可者側に支払うことを要求することです。もし私たちが破産したり、他の方法で契約義務を履行できなければ、私たちの許可者は私たちが依存している重要な技術に対する私たちの権利を終わらせることができる。
他の側は私たちが彼らの知的財産権や独占権を侵害していると主張するかもしれません。これは私たちに巨額の費用を発生させたり、私たちの製品の販売を阻止したりする可能性があります
私たちの成功は、第三者の特許および独自の権利を侵害することなく運営する私たちの能力にある程度依存するだろう。バイオ製薬業界では,生物製品の製造,使用,販売は大量の特許訴訟の影響を受けてきた。このような訴訟は、しばしば第三者特許または他の専有権の有効性または侵害性に関連する。製薬会社、バイオテクノロジー会社、大学、研究機関、または他の第三者が特許出願を提出した可能性があるか、または我々の製品が可能な方の製品、候補製品、または他の技術的側面をカバーする特許が付与されている可能性がある。
第三者に発行される将来または既存の特許は、我々の製品またはその使用または製造をカバーする特許主張を含むことができる。特に、新冠肺炎ワクチン分野の特許構造は混雑しており、2020年1月以降、多くの実体が、Moderna、ヤンソン製薬会社、セメンティス社、VaxBio社、オックスフォード大学、BioNTech社、西奈山イカン医学院、ディオールワックス株式会社、エバータ大学、トニー製薬会社からのいくつかのSARS-CoV-2抗原と抗原の組み合わせを使用することを含む多くの特許出願を提出している。私たちは通常の業務過程で時々侵害クレームを受けることが予想され、第三者は将来私たちの現在の製品あるいは私たちが開発または許可する可能性のある製品について私たちに権利侵害を請求するかもしれない。訴訟や介入手続きは私たちを強制するかもしれません
| ● |
疑われる知的財産権を含む製品の販売、製造、または使用の停止または延期; |
| ● |
損害賠償金を支払う |
| ● |
受け入れ可能な条項で提供できない可能性のある許可や印税協定(あれば)を締結する。 |
いかなる訴訟や介入手続きも、その結果にかかわらず、規制承認過程が遅延する可能性があり、コストが高く、私たちの主要経営陣と技術者が多くの時間と労力を投入する必要がある。
私たちや私たちのライセンシーを守る力のない行動は’アメリカと他の国の知的財産権は、私たちが他人が私たちの製品を製造または販売することを阻止する能力を制限するかもしれない。
私たちは、ビジネス秘密、特許を取得していないノウハウ、持続的な技術革新、および場合によっては特許保護に依存して、私たちの競争地位を維持するつもりだ。私たちの特許および許可の特許権は、挑戦、無効、侵害、または回避される可能性があり、これらの特許に付与された権利は、独自の保護または競争優位性を提供してくれない可能性がある。私たちと私たちの許可者たちは受け入れ可能な特許保護を持つ特許製品を開発できないかもしれない。特許主張が許可されても、特許請求は発行されないかもしれないし、発行された場合には、私たちが与えられるかもしれない技術を保護するのに十分ではないかもしれない。競争的または互いに衝突する権利要件を含む特許が第三者に発行される場合、私たちは、そのような特許によってカバーされる製品の商業化を阻止されるか、または代替技術の取得または開発が要求される可能性がある。さらに、他の当事者たちは、類似または代替技術を複製、包囲、または独立して開発することができる。
私たちのいくつかの特許シリーズおよび私たちのライセンス特許シリーズは、起訴の初期段階にあり、そのような出願において要求される技術を実践する第三者に対して、そのような出願が特許を取得するまで、またはそのような出願が特許を取得するまで、その後、発行された特許要件が第三者技術をカバーする範囲内でのみ強制的に実行されることはできない。私たちの特許出願が特許が発行されることをもたらすか、または発行された特許は、類似の技術を持つ競争相手からの攻撃から十分な保護を提供することを保証することはできない。特許が一旦発行されると,第三者に侵害,流用,侵害,設計または無効にされることは保証されない.発行された特許が後に無効であると認定されたとしても、強制的に執行されないか、または第3の方向の各特許庁または裁判所が提起した訴訟において修正または撤回される可能性がある。未来の私たちの知的財産権の保護の程度は不確実だ。限られた保護しかないかもしれないし、私たちの権利を十分に獲得し、維持し、保護し、実行することができないかもしれないし、私たちがどんな競争優位性を獲得または維持することを可能にすることができる。私たちは、私たちの候補製品に関連する知的財産権を適切に取得、維持、保護、実行する能力にこれらの不確実性および/または制限が存在し、私たちの財務状況および運営結果に大きな悪影響を及ぼす可能性がある。
私たちは第三者が私たちの知的財産権を侵害したり、使用したりすることを阻止できないかもしれません。私たちはそれから知的財産権の許可を得た当事者も、第三者が許可された知的財産権を侵害したり、使用したりすることを阻止できないかもしれません。私たちは一般的に私たちの製品文書と他の固有の情報へのアクセスと配布を制御して制限しようと努力している。このような固有の情報を保護しようと努力しているにもかかわらず、許可されていない当事者たちは、私たちが固有と考えている情報を取得して使用するかもしれない。他の締約国は、同様の独自技術を独立して開発することができ、これらの技術を得ることもできる。
一部の外国の法律は独自情報の保護程度は米国の法律に及ばず、多くの会社はこれらの国で独自の情報を保護する際に重大な問題とコストに直面している。
さらに、私たちまたは私たちのライセンシーの特許出願が承認されても、特許期間は、候補製品における私たちの競争地位を十分に長く保護するのに十分ではないかもしれません。特許の寿命は限られている。米国では、すべての維持費が適時に支払われれば、特許の自然失効時間は、通常、その最初の米国非臨時出願日から20年である。様々な延期があるかもしれないが、特許の有効期限とその提供される保護は限られている。私たちの候補製品をカバーする特許が取得されたか、または獲得されたとしても、特許有効期限が満了すると、競争製品からの競争を受け入れることができるかもしれない。候補製品の開発、テスト、規制審査に要する時間を考慮すると、候補製品を保護する特許は、これらの候補製品の商業化前または直後に満了する可能性がある。したがって、私たちの特許の組み合わせは、他の会社が私たちと似ているか同じ候補製品を商業化することを排除するために、私たちに十分な権利を提供していないかもしれない。
米国特許法の変化は特許の全体的な価値を低下させ、私たちの候補製品を保護する能力を弱める可能性がある。
他のバイオテクノロジー会社と同様に、私たちの成功は知的財産権、特に特許に大きく依存する。バイオテクノロジー特許を取得して施行することは高価で時間がかかり、本質的に不確実だ。米国及び他の国の特許法又は特許法解釈の変化は、我々の知的財産権の価値を低下させる可能性があり、特許出願をめぐる起訴及び特許出願の実行又は保護の不確実性及びコストを増加させる可能性がある。私たちは、私たちの特許または第三者特許で許容または実行される可能性のある特許請求の範囲の広さを予測することができない。しかも、国会や他の外国立法機関は私たちに不利な特許改革立法を通過するかもしれない。
例えば、2011年9月16日に法律となった“ライシー·スミス米国発明法”や“ライシー·スミス法案”に署名して米国特許法をいくつかの重大な改正を行った。これらの条項は、特許出願起訴方式に影響を与える条項を含み、既存技術を再定義し、競争相手に特許の有効性に挑戦するために、より効果的かつ費用効果的な方法を提供する。これらの措置には、第三者が特許訴訟中に米国特許商標局に以前の技術を提出することを可能にすることと、特許の有効性を攻撃するために、ライセンス後審査を含む米国特許商標局によって管理される認可後手続きとが含まれる各方面間審査と派生手続き。また、これらのUSPTO付与後訴訟における証拠基準は、米国連邦裁判所が特許請求の無効を宣言するために必要な証拠基準よりも低いため、第三者は、USPTO手続において、USPTOが権利請求を無効にするのに十分な証拠を提供する可能性があり、同じ証拠が最初に地域裁判所訴訟で提出された場合には、権利請求を無効にするのに十分ではない。したがって,第三者は米国特許商標局の手続きを用いて我々の特許主張の無効を宣言しようとする可能性があり,第三者が地域裁判所訴訟で最初に被告として疑問を提起すれば,我々の特許主張は無効ではない.したがって、Leahy-Smith法案およびその実施は、私たちの特許出願をめぐる起訴および私たちが発行された特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに大きな悪影響を及ぼす可能性がある。2013年3月以降、“ライシー·スミス法案”によれば、米国は第1の発明者から出願制に移行し、このような制度の下で、他の法定要件が満たされていると仮定すると、第1の特許出願を提出した発明者は、第三者が第1の発明によって要求された発明であるか否かにかかわらず、発明の特許を取得する権利がある。したがって、2013年3月以降であるが、同じ発明を含む出願を提出する前に米国特許商標局に特許出願を提出した第三者は、当該第三者が発明を行う前にこの発明を作成したとしても、我々の発明をカバーする特許を付与することができる。これは私たちが発明から特許出願までの提出時間を認識することを要求するだろう。アメリカと他のほとんどの国の特許出願は提出後または発表前の一定期間秘密にされているため, 私たちまたは私たちのライセンス者が最初に(I)私たちの候補製品および私たちが開発可能な他のノウハウに関連する任意の特許出願を提出するか、または(Ii)私たちまたは私たちのライセンシーの特許または特許出願で主張される任意の発明を発明するかどうかを決定することはできません。私たちが効果的かつ強制的に実行可能な特許を持っている場合であっても、他方が私たちの出願日前にその発明を商業に使用していることを証明することができる場合、または他方が強制許可から利益を得ることができる場合、私たちは、他の人が要求された発明を実践することを排除することができない。しかし、Leahy-Smith法案およびその実施は、私たちの特許出願をめぐる起訴および私たちが発行した特許の実行または保護の不確実性およびコストを増加させる可能性があり、これらのすべては、私たちの業務、財務状況、運営結果、および見通しに重大な悪影響を及ぼす可能性がある。
また,生物製品や薬品の開発や商業化における会社の特許地位は特に不確定である。米国最高裁判所と連邦巡回裁判所の最近の裁決は、場合によっては特許保護の範囲を縮小し、場合によっては特許権者の権利を弱める。例えば最近の連邦巡回裁判所はAriad Pharms,Inc.訴状来社., 598 F.3d 1336, 1340 (Fed. Cir. 2010) (en banc), 恵氏とコーディス社はアボット研究室に訴えました, 720 F.3d 1380 (Fed. Cir. 2013), Enzo Life SCIS,Inc.はロ氏分子システム会社を訴えています 928 F.3d 1340 (Fed. Cir. 2019), and アドニックス製薬会社です。LLCはGIlead SCIS事件を訴えた。INC., 941 F.3d 1149 (Fed. Cir. 2019), and アンはセノフィを訴えた“連邦判例編纂”第3話987巻、第1080ページ(FED.CIR.2021年)は薬品と生物製品の広範なクレームを得る基準を大幅に向上させた。
より高い特許性要件に加えて、最高裁判所および連邦巡回裁判所は、最近、BPCIAによって審理された生物類似製品の承認に関連する案件に基づいて、生物類似製品を承認する前に任意の特許侵害問題を解決することが意図されている“特許舞踊”条項が自由に支配可能であると考えており、生物類似製品スポンサーへのその出願および製造情報のコピーの提供を拒否することによって脱退を選択することができる(参照)サンダース社はアン捜査に訴えました137 S.Ct1664(2017)。FDAが承認を発表して初めて生物学的に似た応用が分かったかもしれません免疫会社はサムスンBioepsis事件を訴えました2:19-cv-117555-ccc-mf(D.N.J.2019年4月30日)。我々の将来の特許取得能力に関する不確実性の増加に加えて,このようなイベントの結合は,いったん特許を取得する価値に関する不確実性をもたらしている.議会、米国連邦裁判所、米国特許商標局、または外国司法管轄区の類似機関の決定によると、特許を管理する法律および法規は予測不可能な方法で変化する可能性があり、それによって、私たちが新しい特許を獲得したり、私たちの既存特許と将来獲得可能な特許を実施する能力を弱めることができる。
私たちの候補製品の特許保護と特許起訴は第三者にある程度依存している。
私たちまたは私たちの許可者は、開発および商業化活動の過程で作られた発明の特許可能な側面を識別できないかもしれません。そうでなければ、遅すぎて、特許保護を受けることができません。したがって、私たちは私たちの特許地位を強化する予想された潜在的な機会を逃すかもしれない。私たちの特許または特許出願の準備または提出中に形態的な欠陥が存在する可能性があり、または将来的には、適切な優先権請求、在庫、特許請求の範囲、または特許期限調整要求に関して、これらの欠陥が生じる可能性がある。もし私たちまたは私たちの許可者がそのような特許および他の知的財産権を確立、維持、または保護できなかった場合、そのような権利は減少またはキャンセルされる可能性がある。もし私たちの許可者がいかなる特許権を起訴、維持、または実行する上で完全に協力しないか、または私たちの意見に同意しない場合、これらの特許権は損害を受ける可能性があります。私たちの特許または特許出願が形態、準備、起訴または実行において重大な欠陥がある場合、そのような特許は無効および/または強制的に実行できない可能性があり、そのような出願は有効で強制的に実行可能な特許を決して生成しない可能性がある。これらの結果のいずれも、第三者の競争を阻止する能力を弱める可能性があり、第三者競争は私たちの業務に悪影響を及ぼす可能性がある。
私たちは第三者に依存して特許出願を提出し、起訴し、私たちのいくつかの許可協定に基づいて特許を維持し、他の方法で許可された知的財産権を保護する。私たちは持っていないし、私たちの特許や特許出願や他の知的財産権のこのような活動に対して主要な統制権を持っていない。私たちは、第三者のこのような活動が適用された法律および法規に準拠しているか、または効果的かつ強制的に実行可能な特許または他の知的財産権をもたらすだろうと判断できない。私たちのいくつかのライセンシーと締結されたライセンス契約の条項によると、ライセンス者は、私たちのライセンス特許の実行を制御したり、これらの特許が無効であると主張する任意のクレームを抗弁する権利がある可能性があり、たとえ私たちがこのような強制執行または抗弁を許可されても、私たちライセンシーの協力が必要となるであろう。私たちは、私たちの許可者が十分な資源を割り当てているかどうか、またはそのような特許の実行またはこのような主張の弁護を優先して、許可特許における私たちの利益を保護するかどうかを決定することはできません。たとえ私たちがこれらの法的行動の一方でなくても、不利な結果は私たちの業務を運営するために必要かもしれない知的財産権を許可し続けることを阻止するかもしれないので、私たちの業務を損なう可能性がある。もし私たちのいかなる許可者も私たちの候補製品をカバーする特許保護を適切に起訴し、維持することができなければ、私たちがこれらの候補製品を開発し、商業化する能力は不利な影響を受ける可能性があり、競争相手が競合製品を製造、使用、販売することを阻止できないかもしれない。
さらに、私たちが第三者から取得または許可された特許および特許出願に対する特許起訴を制御する権利があっても、私たちの先輩は、私たちが特許起訴を制御する前の人およびその弁護士の行動または不作為の悪影響または損害を受ける可能性がある。
私たちが様々な第三者から取得したり許可したりする技術は保留権利の制約を受けるかもしれない。私たちの先輩は、基礎技術を非商業学術および研究用途に使用する権利、その技術に関連する研究の一般的な科学的発見を発表する権利、および技術に関連する科学および学術情報を慣例的に開示する権利を含む、彼らと私たちとの合意に基づいていくつかの権利を保持することができるかもしれない。私たちの先輩を監視することは難しいかもしれませんが、彼らの技術の使用をこれらの用途に制限しているかどうか、悪用すると、許可技術の権利を強制的に執行するために多くの費用が発生する可能性があります。
また、私たちのいくつかのライセンス特許権と技術をもたらす研究部分はアメリカ政府によって援助されています。したがって,政府はこれらの特許権や技術に対して一定の権利,あるいは進行権を持つ可能性がある.政府資金で新しい技術を開発する場合、政府は、政府が非商業目的のために発明を使用することを許可する非排他的許可を含む、生成された任意の特許のいくつかの権利を得ることができる。これらの権利は、政府が第三者に私たちの機密情報を開示し、第三者が私たちが許可した技術を使用または許可する先行権を行使することを可能にするかもしれない。適用される許可者が政府に発明を開示していない場合、又は所定の期限内に知的財産権登録申請を提出していない場合は、米国政府もこれらの発明の所有権を取得する権利がある。政府が政府援助の技術の実用化を実現できなかったため、健康や安全需要を緩和し、連邦法規の要求を満たすために行動する必要があると考えている場合、あるいは米国工業を優先しなければならないため、政府はそのデモ権利を行使することができる。さらに、このような発明に対する私たちの権利は、そのような発明を含む製品を米国で製造するいくつかの要件によって制約される可能性がある。政府のこのような権利のいかなる行使も、私たちの競争地位、業務、財務状況、経営結果、および将来性を損なう可能性がある。
私たちの普通株に関するリスクは
私たち普通株の市場価格は大きく変動しています。
私たちの普通株の市場価格は非常に不安定で、引き続きそうなると予想される。いくつかの要因は、私たちまたは他の会社が発表した新しい発展、規制事項、新しいまたは既存の薬品または手続き、私たちの財務状況に対する懸念、経営結果、訴訟、政府規制、合意、特許または独自の権利に関連する事態の発展または紛争を含み、私たちの株式の市場価格に大きな影響を与える可能性がある。また、私たちが将来的に普通株を売却することと、私たちのオプションと引受権証所持者がその後普通株を売却する潜在的な希薄化効果は、私たちの株式の市場価格に悪影響を及ぼす可能性がある。
また、証券市場は特定の会社の経営業績とは無関係な重大な価格や出来高変動を時々経験する。このような市場変動はまた私たちの普通株の市場価格に実質的な悪影響を及ぼす可能性がある。
私たちの普通株または他の株式証券の追加株式を売却または発行することは、私たちの株主の追加的な希釈をもたらす可能性がある。
私たちの運営キャッシュフローの需要を満たすために、私たちは私たちの株式証券、債務、あるいは転換可能な債務ツールを追加発行する計画があるかもしれない。より多くの株式証券を販売することは、私たちの株主が著しい追加的な希釈を得ることをもたらすかもしれない。債務の発生は債務返済義務や運営と融資契約を招く可能性があり、これは私たちの運営を制限する。私たちは投資家たちに私たちが受け入れられる金額や条項で融資を受けることを保証することはできない(もしあれば)。
株式証保有者が行使を選択した場合、私たちは私たちの流通権証に関連する追加普通株を発行する義務があります。2,360,000株の発行された事前資金権証は名義で行使することができ、他の発行された株式承認証は1株3.26ドルから13.00ドルまでの行使価格で5,884,115株を行使することができる。これらの株式承認証の行使は私たちの普通株の増発を招き、私たちの株主の持株比率を希釈するだろう。
わが社の登録証明書に優先株株式の発行を許可するいくつかの条項は、第三者の制御権の変更を困難にする可能性があります。
私たちの会社の証明書は私たちの取締役会が最大10,000,000株の優先株を発行することを許可しました。優先株は1つまたは複数の系列に分けて発行することができ、発行条項は当社取締役会が発行時に決定することができ、株主がさらなる行動をとる必要はない。これらの条項は、特定事項に対する一連の投票権、配当金および清算の優先権、転換権、償還権、および債務超過基金条項を含む投票権を含むことができる。新たに発行された優先株を発行することは、私たちの普通株式保有者の権利を弱める可能性があるため、私たちの普通株の価値を低下させる可能性がある。さらに、将来の優先株保有者に付与される特定の権利は、第三者との合併または第三者への資産売却能力を制限するために使用される可能性がある。わが取締役会が優先株を発行する能力は、支配権変更の買収や実現をより困難にし、遅延、阻害、阻止、またはコストをより高くする可能性があり、これは逆に株主が有利な要約延長の下で収益を確認することを阻止し、私たちの普通株の市場価格に実質的かつ負の影響を与える可能性がある。
私たちは配当金を支払ったこともないし、そうする計画もない。
当社の普通株の保有者は当社の取締役会が発表した配当金を得る権利があります。今まで、私たちは私たちの普通株に現金配当金を支払っていません。私たちは予測可能な未来にも私たちの普通株に現金配当金を支払わないと予想されています。私たちは将来の収益を保留するつもりで、もしあれば、私たちの業務運営に資金を提供します。したがって、投資家が私たちの普通株で得られる可能性のある任意の潜在的なリターンは、その普通株の時価増価の形で現れるだろう。
上場企業のコンプライアンスは私たちを役員や役員を引き付けたり引き留めたりするのが難しくなるかもしれません。
サバンズ-オクスリー法案、テレス-フランク法案、雇用法案、FAST法案、その後アメリカ証券取引委員会が実施したルールは、上場企業のコーポレートガバナンスのやり方を変更することを要求した。上場企業として、私たちはこれらの規則と法規とその修正案が私たちのコンプライアンスコストを増加させ、いくつかの活動をより時間的で高価にすると予想している。上場企業としては、これらの規制により、取締役や上級管理者責任保険の取得が困難になる可能性も予想され、同じまたは類似した保険を得るために、低減された保険限度額や保険範囲の受け入れが要求される可能性があります。したがって、私たちは資格のある人を引き付けたり維持したりすることが難しいかもしれません。
私たちの会社の登録証明書と定款は私たちの大多数の株主が賛成票を投じて修正することができる
デラウェア州一般会社法によると、会社の会社登録証明書は、会社定款がより大きな割合の株式投票を要求しない限り、投票権のある大部分の流通株と、1つのカテゴリとして投票する権利のある各カテゴリの多数の流通株の保有者が賛成票を投じて修正することができる。わが社の登録証明書は改訂された後、大きな割合の株式投票を必要としません。“デラウェア州会社法”が許可された場合、私たちの定款は私たちの取締役会に私たちの定款を通過、修正、または廃止する権限を与えます。私たちは投票する権利のある株主たちが同時に私たちの規定を通過、修正、または廃止する権利がある。
もし私たちが細価格株とされているため、細価格株規則の制約を受けて、ブローカーが普通株の株式取引を阻止される可能性がある。
米国証券取引委員会は、“細価格株”を規範化する一連の規則を採択しており、すなわち細価格株とみなされる株の取引を制限している。これらのルールは、“取引法”におけるルール3 a 51−1、15 g−1、15 g−2、15 g−3、15 g−4、15 g−5、15 g−6、15 g−7、および15 g−9を含む。このような規定は細価格株の流動性を低下させるかもしれない。“細価格株”とは、一般に、1株当たり価格が5ドル未満の株式証券を意味する(特定の国の証券取引所に登録されている証券またはナスダック上でオファーされた証券を含まず、取引所またはシステムがそのような証券取引に関する現在の価格および出来高情報を提供する場合)。もし私たちがナスダックから退市すれば、私たちの証券は過去に構成されており、未来もルールの意味での“細価格株”を再構成する可能性がある。米国のブローカー-トレーダーに適用される追加販売慣行および開示要求は、ブローカーの普通株の取引を阻害する可能性があり、これは、このような株式の市場流動性を深刻に制限し、二次市場での販売を阻害する可能性がある。
米国のブローカーは、既存の顧客または“認可投資家”(一般に純資産が1,000,000ドルを超える(個人の住所を含まない)または年収が200,000ドルを超える、またはその配偶者と合わせて300,000ドルを超える個人を指す)以外の誰にも細価格株を販売し、購入者のために特別な適合性判定を行わなければならず、販売前に購入者の書面同意を得なければならない。また、“細価株”条例は、米国のブローカーが“細価株”に関連する取引を行う前に、当該ブローカーまたはこの取引が免除されない限り、米国証券取引委員会の“細価株”市場基準に基づいて作成された開示スケジュールを提出しなければならないことを要求している。米国ブローカーはまた、米国ブローカーおよび登録代表に支払われる手数料および証券の現在のオファーを開示しなければならない。最後に、米国の仲買業者は毎月報告書を提出し、顧客口座の“細価格株”の最新価格情報、および“細価格株”有限市場の情報を開示しなければならない。
米証券取引委員会によると、株主は、近年、“細価格株”市場が詐欺や乱用モデルの影響を受けていることを認識すべきだという。これらのモデルは、(I)1つまたは複数のブローカーが証券市場を制御することを含み、これらの市場はしばしば発起人または発行者と関係がある;(Ii)事前に手配された売買ペアおよび虚偽と誤ったニュース原稿を通じて価格を操作する;(Iii)経験のない販売者は高圧販売策略および非現実的な価格予測の“ボイラー室”手法を採用する;(Iv)売買ブローカーが過度および不開示の売買差額および値上げを招く;および(V)価格が必要なレベルに操作された後、発起人およびブローカー取引業者は同じ証券を大量に投げ売りし、投資家の損失を招く。私たちの経営陣は歴史的に細価格株市場で発生した乱用を認識している。市場や市場に参加するブローカーの行動を決定することは期待されていないが、経営陣は、実際の制限の範囲内で、私たちの証券に対して記述されたモデルを構築することを防止するために努力する。
| 項目1 B。 |
未解決従業員意見 |
ありません
| 第二項です。 |
特性 |
私たちの主な実行オフィスはジョージア州スマイナにあり、私たちはそこで約8,400平方フィートのオフィスと実験室空間を借りました。私たちのこの不動産に対する賃貸契約は現在2022年12月31日に満期になる予定です。私たちは今どの不動産も持っていません。私たちは、私たちの現在の施設が私たちの切実な需要を満たすのに十分であり、私たちの運営に悪影響を与えることなく、契約を更新できると信じている。しかも、私たちは私たちがもっと多くの場所が必要なら、私たちは商業的に合理的な条件でより多くの施設を得ることができると信じている。
| 第三項です。 |
法律手続き |
私たちは現在どんな実質的な法的手続きの当事者でもない。私たちは通常の業務過程で発生する法律手続きのような様々な法的手続きに時々巻き込まれるかもしれない。
| 第四項です。 |
炭鉱安全情報開示 |
適用されません。
第II部
| 五番目です。 |
登録者の市場’普通株、関連株主事項、発行者による株式証券の購入 |
市場情報
私たちの普通株は現在ナスダック資本市場で取引されています。コードはGOVXです。
所持者
2022年3月9日、私たちの普通株式の保有者は12人です。我々の普通株式の大部分は仲介人や他の機関代表株主が保有しており,これらの記録保有者が代表する株主総数を見積もることはできない.
配当をする
私たちは普通株の現金配当金を発表したり支払ったりしたことがなく、予測可能な未来にも私たちの普通株に何の配当金も支払わないだろう。私たちは将来の収益を維持したいです。もしあれば、私たちの業務に再投資するために使用します。私たちは発行可能ないかなる優先株のすべての配当金が全額支払われない限り、普通株式の配当金の支払いを許可されないだろう。私たちは現在優先株を増発する計画を持っていない。私たちが締結する可能性のあるどんな信用協定もまた私たちが配当金を支払う能力を制限するかもしれない。将来の配当金支払いは私たちの取締役会の適宜決定権に依存し、私たちの財務状況、経営結果、現金需要、将来の見通し、および私たちの取締役会が関連すると思う他の任意の要素に依存します。
最近売られている未登録証券
本報告に関連する期間において、現在の8-Kレポートまたは10-Q四半期レポートで以前に報告されていなかった未登録証券の販売は販売されていない。
発行人が株式証券を購入する
2021年第4四半期に、私たちは何の株式証券も買い戻していない。
| 第六項です。 |
保留されている |
適用されません。
| 第七項。 |
管理する’財務状況と経営成果の検討と分析 |
以下、当社の財務状況と経営結果の検討·分析は、“財務データ精選”と、当社の連結財務諸表およびF−1ページからの関連付記とともに読まなければなりません。本議論は、現在の予想に基づいて、未来のイベントおよび私たちの未来の財務パフォーマンスに関連するので、リスクおよび不確実性に関する前向きな陳述を含む。多くの重要な要素の影響により、私たちの実際の結果は、これらの展望性陳述で予想された結果と大きく異なる可能性があり、“リスク要素”と本年度報告の他の部分に列挙された要素を含む。
概要と最新の発展
GeoVaxは臨床段階の生物技術会社であり、新型担体ワクチンプラットフォームを用いて伝染病と癌に対する免疫療法とワクチンを開発している。GeoVaxの製品ラインには,進行中の新冠肺炎と頭頸部癌のヒト臨床試験がある。その他の研究開発プロジェクトはジカウイルス、出血熱ウイルス(エボラ出血熱ウイルス、スーダン、マルブルクとラサ)とマラリアに対する予防的ワクチン、及び固形腫瘍に対する免疫療法を含む。私たちのいくつかのワクチン開発活動はずっとアメリカ政府の財政的支援を受け続けるだろう。この支援には,我々に直接付与された研究補助金と契約も含まれており,臨床前動物研究やヒト臨床試験への間接的な支援も含まれている。
GEO-CM 04 S 1ライセンス2021年11月、GeoVaxは希望の城とライセンス契約(“COH許可”)を締結し、GeoVaxにGEO-CM 04 S 1(前身はCOH 04 S 1)のさらなる開発および商業化の独占権利を付与した。Geo-CM 04 S 1は合成され、弱毒化された改良アンカラワクシニアウイルス(SMVA)ベクターであり、SARS-CoV-2ウイルスの刺突と核カプシド抗原を発現し、最初はCOHで免疫低下患者のために開発された。
Geo−CM 04 S 1が行っている第二段階臨床試験では,その安全性と免疫原性を評価し,ファイザーmRNAに基づくワクチンと比較して,これらの患者は以前に異遺伝子造血細胞移植,自家造血細胞移植あるいはキメラ抗原受容体(CAR)T細胞治療を受けていた。Geo-CM 04 S 1はSARS-CoV-2スパイク蛋白と核カプシドタンパク質を同時に含む唯一の新冠肺炎ワクチンであり、癌患者の第二段階試験に入る。このようなワクチンも14日未満で迅速に免疫反応が生じ,副作用が少ないことが多い。この試験も,研究中の多抗原性新冠肺炎ワクチンを,現在食品·薬物管理局が承認しているファイザー/バイオテクノロジー社の遺伝子ワクチンを免疫機能が低下している人と初めて比較したものである。これらの患者は現在利用可能な新冠肺炎ワクチンを接種した後、よく弱い抗体反応を示す。
2021年12月、GEO-CM 04 S 1の1/2期試験の2期部分は、現在FDAによって承認されているワクチンとしての汎用強化ワクチンとしての使用を検討するための患者募集を開始した。GeoVaxは、GEO-CM 04 S 1ワクチンが異種増強剤として使用される場合、Modernaまたはファイザー社から開発されたSARS-CoV-2 Spikeタンパク質のみに対するmRNAワクチンの相同増強ではなく、免疫系に追加の識別要素を提供すると信じている。COH 04 S 1ワクチンのMVA骨格は新冠肺炎免疫誘導に有効である可能性があり,MVAは免疫抑制を背景にもT細胞反応を強く誘導するためである。また,Spikeと核カプシド抗原を標的としたGEO−CM 04 S 1はSpike抗原で観察された顕著な配列変異をより大きな保護を提供する可能性がある。
地理情報システム®許可証2021年9月、GeoVaxはPNP Treateutics,Inc.と譲渡と許可協定(“Geeptinライセンス”)を締結し、この協定によると、GeoVaxはGeeptinオスミウムの独占的権利を買収することによって、その免疫腫瘍学導管を拡大し、新しい技術プラットフォームを追加した。Geeptin GDEPTはGDEPT(遺伝子ガイド酵素前駆体薬物療法)と呼ばれる遺伝子治療策略による固形腫瘍の治療のための新しい特許製品である。GDEPTでは、非ヒト遺伝子を有する腫瘍細胞を選択的に形質導入するためにベクターが使用され、非毒性プロドラッグを有効な抗腫瘍化合物に変換することができる酵素を発現する。現在,再発性頭頸部扁平上皮癌(HNSCC)患者における繰り返し周期のGeeptin療法の安全性と有効性を評価するための1/2期臨床試験が行われており,これらの患者の腫瘍は注射可能であり,治癒可能な治療法はない。FDAはすでにGeeptinがHNSCCを治療する孤児の薬物地位を授与し、行っている臨床試験の初期段階はFDAがその孤児製品の臨床試験贈与計画に基づいて資金を提供している。GeoVaxのGeeptinライセンスは、癌を含むが、これらに限定されないすべてのヒト疾患および/または条件に使用する権利を含む。
わが社の戦略は,我々の差別化されたワクチン/免疫療法技術を推進,保護,利用し,感染症や各種癌に対する予防的·治療的ワクチンや免疫療法の開発に成功している。我々の目標は,製品を人体臨床試験に推進し,規制承認と商業化を実現するためのパートナーや許可手配を求めることである。著者らはまた、複数の政府、学術と企業実体と協力と協力を通じて、第三者資源を利用して臨床前と臨床試験を行った。
私たちは私たちが開発している製品の販売から何の収入も得ていません。少なくとも今後数年以内にこのような収入は発生しないと予想しています。私たちの候補製品は広範な臨床前と臨床テストを含む大量の追加の研究と開発仕事が必要になるだろう。臨床試験まで進められたすべての候補製品は,商業使用前に規制部門の承認を得る必要があり,大量の商業化コストが必要となる。私たちの研究開発努力は成功しないかもしれません。私たちは決して十分な製品収入を生み出して利益を上げないかもしれません。
経営成果
次の表は、2021年12月31日現在と2020年12月31日までの年度の経営成果をまとめたものである
| 2021 |
2020 |
変わる |
||||||||||
| 贈与と協力収入 |
$ | 385,501 | $ | 1,823,658 | $ | (1,438,157 | ) | |||||
| 運営費用: |
||||||||||||
| 研究開発 |
15,554,171 | 2,444,459 | 13,109,712 | |||||||||
| 一般と行政 |
3,577,153 | 2,196,014 | 1,381,139 | |||||||||
| 総運営費 |
19,131,324 | 4,640,473 | 14,490,851 | |||||||||
| 運営損失 |
(18,745,823 | ) | (2,816,815 | ) | (15,929,008 | ) | ||||||
| その他収入合計 |
175,506 | (141,253 | ) | 316,759 | ||||||||
| 純損失 |
$ | (18,570,317 | ) | $ | (2,958,068 | ) | $ | (15,612,249 | ) | |||
贈与と協力収入
私たちの贈与と協力収入は、私たちのワクチン開発活動を支援するために、アメリカ政府機関からの贈与と契約、および他の第三者との協力計画に関連しています。私たちは関連するコストと費用が発生したため、これらの贈与に関連した収入を記録した。次の表は、2021年12月31日と2020年12月31日までの贈与と協力収入をまとめています
| 2021 |
2020 |
変わる |
||||||||||
| Lassa fever-アメリカ陸軍支出 |
$ | 85,574 | $ | 1,438,465 | $ | (1,352,891 | ) | |||||
| 新冠肺炎−米国国立衛生研究院SBIR補助金 |
299,927 | - | 299,927 | |||||||||
| マラリア-協力収入は |
- | 385,193 | (385,193 | ) | ||||||||
| 合計する |
$ | 385,501 | $ | 1,823,658 | $ | (1,438,157 | ) | |||||
2021年12月30日までの1年間で,贈与と連携収入が2020年より1,438,157ドル(79%)減少したのは,上表に示した積極的な贈与と連携の異なる組み合わせと,このような贈与や連携に関する支出時間によるものである。2021年12月31日現在、81,526ドルの査定贈与資金が2022年の間に使用できる。
研究と開発費
私たちの研究開発費は異なる時期にかなり変動するかもしれませんが、これは私たちの政府支出や他の研究プロジェクトに関連する支出時間とその他の要素に依存します。私たちの従業員の時間は複数のプロジェクトに分布しているので、私たちの研究開発費用はプロジェクトごとに開示されません。私たちの実験室施設は複数の候補製品に使用されています。政府支出収入に関する研究·開発費の直接コストを追跡し、方法は、従業員が各支出にかかる時間の割合と、各支出に関連する他の直接コストを分配することである。贈与に関する間接費用は単独で追跡するのではなく,贈与機関と合意した契約管理費に基づいて計算される。したがって,政府の贈与に関する記録収入は発生したコストとほぼ同じである。
2021年12月31日までの年間研究開発費は15,554,171ドルで、2020年の2,444,459ドルより13,109,712ドル(536%)増加した。この増加のうち、10,000,000ドルは、COH許可による前払い許可料(2021年に支払われる5,000,000ドルおよび今後数年間に支払われるべき5,000,000ドル)、1,864,300ドルは、COH許可による臨床試験費用および特許コストの精算に関するものであり、459,825ドルは、Gedestin許可に関連する前払い許可料(209,825ドルの株式費用を含む)に関する。2021年および2020年の研究開発支出には、従業員の株式オプションに関連する株式ベースの報酬支出96,814ドルおよび7,156ドルがそれぞれ含まれ、89,658ドル増加した(以下、“株式ベースの報酬支出”の下での議論を参照)。2020年から2021年までに研究開発費が695,929ドル増加したのは,主に我々の新冠肺炎ワクチン計画,製造プロセス開発および全体活動レベルの高い支出に関連しているが,我々の政府支出に関連する外部支出の減少部分がこの増加を相殺したためである。
一般と行政費用
2021年12月31日までの年度の一般および行政支出は3,577,153ドルであり,2020年の2,196,014ドルより1,381,139ドル(63%)増加した。これらの期間の一般的および行政的費用には、それぞれ、株式ベースの報酬支出273173ドルおよび57307ドルが含まれる(以下の“株式ベースの報酬支出”以下の議論を参照)。株式ベースの報酬支出は含まれておらず、2021年と2020年の一般および行政費用はそれぞれ3,303,979ドル、2,138,707ドルで、1,165,272ドル(54%)増加した。この増加のうち,約36万ドルはデラウェア州特許経営税の増加(今後数年は20万ドルを超えないと予想される)によるものであり,残りは主に法律,会計,特許コスト,保険コスト,相談費,投資家関係コストの増加によるものである。
株に基づく報酬費用
次の表は、2021年12月31日と2020年12月31日までの年間株式ベース給与支出の構成要素を示している。一般に、株式報酬費用は、株式報酬取得者に支払われる従業員、コンサルタントまたは取締役の現金給与に応じて分類され、研究開発費または一般および行政費用に割り当てられる。
| 2021 |
2020 |
|||||||
| 株式オプション費用 |
$ | 269,427 | $ | 18,730 | ||||
| 非従業員サービスに発行された株 |
100,560 | 45,733 | ||||||
| 株式に基づく報酬総支出 |
$ | 369,987 | $ | 64,463 | ||||
2019年4月と2020年1月に実施された逆株式分割のため、2020年1月の残高が無視できるように、すべての未返済株式オプションを調整し、さかのぼって説明しました。したがって、私たちは2020年のほとんどの時間に私たちの株式オプション計画に関連した株式ベースの報酬支出を記録していない。私たちは2020年12月に従業員株式オプション付与を再起動し、2020年12月31日までの1年間に比例支出額を記録した。
2021年12月31日と2020年12月31日までの株式給与支出の配分は以下の通り
| 2021 |
2020 |
|||||||
| 一般と行政費用 |
$ | 273,173 | $ | 57,307 | ||||
| 研究開発費 |
96,814 | 7,156 | ||||||
| 株式に基づく報酬総支出 |
$ | 369,987 | $ | 64,463 | ||||
その他の収入(費用)
2021年12月31日と2020年12月31日までの年間の利息収入はそれぞれ4736ドルと2271ドル。年間の違いは主に投資可能な現金と金利変動によるものだ。
2021年12月31日と2020年12月31日までの年間の利息支出はそれぞれ1,286ドル、143,524ドル。2021年の利息支出はGRA手形と購買力平価ローンに関連し、2020年の利息支出は2020年に解約したGRA手形、購買力平価ローン、保険料に関する融資コスト、転換可能な債券に関連する。
2021年の間に,購買力平価融資元金と受取利息の免除に関する債務弁済収益172,056ドルを記録した。
重要な会計政策と試算
私たちの財務状況と経営結果の検討と分析は私たちの総合財務諸表に基づいており、これらの報告書はアメリカで公認されている会計原則に基づいて作成されている。これらの財務諸表を作成するには、資産、負債、収入および費用の報告金額および関連または資産および負債の開示に影響を与えるために、管理層が推定および判断する必要がある。継続的な上で、経営陣はその見積もり数を評価し、必要に応じて調整する。我々は過去の経験や他の様々な当時の状況では部下が合理的と考えられる仮説に基づいて推定しているが,これらの仮定の結果は資産や負債の帳簿価値を判断する基礎となっており,そのような資産や負債の帳簿価値は他の出所から容易に見られるわけではない.異なる仮定または条件では、実際の結果は、これらの推定値と大きく異なる可能性がある。
2021年12月31日現在の年度総合財務諸表付記2は、本10−K表に含まれる我々の重要会計政策について概説している。以下の重要な会計政策は、連結財務諸表を作成する際に使用されるより重要な判断と推定に影響を与えると考えられる
収入確認
FASB会計基準に基づいて2014-09を更新して収入を確認しました取引先と契約した収入(ASU 2014-09)、会計基準編纂特別テーマ606の新しいテーマが設けられている。この基準は、原則に基づいており、収入がいつ、どのように確認されるかを決定するための5段階モデルを提供する。核心原則は、1つのエンティティが約束された貨物またはサービスを顧客に譲渡する場合、収入を確認すべきであり、その額は、そのエンティティがこれらの貨物またはサービスと交換する権利があると予想される対価格を反映しなければならないことである。
奨学金収入-私たちは、私たちのワクチン開発計画を支援するために、政府エンティティによって支払われた払い戻し不可能な贈与を受け入れます。返済可能な費用が発生し、私たちが贈与資金を受けるためのすべての要件を遵守した場合、これらの贈与に関する収入を記録します。
研究協力−我々は、特定のワクチン開発方法および/または疾患適応について時々協力研究および開発プロトコルを締結する可能性があり、これらのプロトコルのいくつかの手配に基づいて、臨床前研究のための第三者資金を得る。各プロトコルは、ASU 2014-09年度に決定された手順に従って評価され、それに応じて収入が確認される。
株に基づく報酬
私たちは株式に基づく取引を計上し、これらの取引では、会社は、付与日に付与された公正な価値に基づく持分ツールと交換するために、従業員、取締役または他の人のサービスを受ける。普通株奨励の株式による補償コストは、発行日標の普通株の価格から推定される。株式オプションまたは株式承認証の株式補償コストは、付与日に各ツールの公正価値に基づいて推定され、この公正価値は、ブラック-スコアーズオプション定価モデルに基づいて計算される。株式ベースの報酬コストは、報酬に必要なサービス期間内に比例して直線的に計算される費用であることを確認した。株式給与に関するより多くの情報は、弊社財務諸表の付記7を参照されたい。
流動性と資本資源
成立から2021年12月31日までの累計純損失は約6440万ドルであり、将来的には運営損失と運営によるマイナスキャッシュフローが予想される。これまで、私たちの運営資金は主に私たちの株式証券の売却と政府支出と臨床試験援助から来ています。
次の表は、2021年12月31日と2020年12月31日までの私たちの流動性と資本資源、およびここ数年の終了時のキャッシュフローをまとめています
| 12月31日まで |
||||||||
| 流動性と資本資源 |
2021 |
2020 |
||||||
| 現金と現金等価物 |
$ | 11,423,870 | $ | 9,883,796 | ||||
| 運営資本 |
6,193,756 | 9,424,839 | ||||||
| 十二月三十一日までの年度 |
||||||||
| キャッシュフローデータ |
2021 |
2020 |
||||||
| 提供された現金純額(使用): |
||||||||
| 経営活動 |
$ | (11,196,420 | ) | $ | (2,750,570 | ) | ||
| 投資活動 |
(47,718 | ) | (156,791 | ) | ||||
| 融資活動 |
12,784,212 | 12,507,816 | ||||||
| 現金と現金等価物の純増加 |
$ | 1,540,074 | $ | 9,600,455 | ||||
経営活動-2021年に経営活動で使用された現金純額は11,196,420ドルであり、主に私たちの純損失18,570,317ドル、減価償却費用、株式ベースの報酬費用、および私たちのPPPローン返済時に確認された収益などの非現金項目、および私たちの運営資金口座の変化によって相殺されます。2020年に経営活動で使用された現金純額は2,750,570ドルであり,これは主に純損失2,958,068ドルであり,減価償却や株式による報酬支出などの非現金費用および私たちの運営資金口座の変化によって相殺されている。
投資活動-投資活動のための2021年および2020年の現金純額は、財産および設備の購入のためにそれぞれ47,718ドルおよび156,791ドルです。
融資活動2021年の融資活動によって提供される現金純額は、(1)我々の普通株を公開発行するための純収益9,408,920ドル、(2)引受権証を行使する純収益3,404,156ドル、(3)発行された転換可能な優先株を買い戻すための1,000ドル、および(4)ジョージア研究連盟社に支払われた手形(“GRA手形”)の元金返済27,864ドルを含む12,784,212ドルであり、GRA手形は2021年に全額返済される。また、2021年5月には、貸手は170,200ドルのPPPローンと、1,856ドルの課税利息を免除しました。
2020年の融資活動で提供される現金純額は12,507,816ドルであり,(1)我々の普通株と引受権証を公開発売した純収益11,158,496ドル,(2)転換可能な優先株を売却した純収益300,000ドル,(3)購買力平価融資収益170,200ドル,(4)支払手形発行の純収益888,500ドル,(5)株式証行使の収益2,500ドル,および(6)GRA手形への元金返済11,880ドルを含む。
資金需要と資金源
私たちの資本の主な用途は人員の給料と関連費用、臨床試験を行うコスト、臨床前と臨床材料の製造コスト、第三者研究サービス、実験室と関連用品、法律とその他の監督管理費用及び一般管理費用である。私たちは近い将来、このような費用が依然として主要な運営資本要求になると予想している。
我々が様々なプロジェクトの開発を継続し,開発の後期に入るにつれて,我々の研究や開発コストは増加し,特に臨床試験では増加することが予想される。我々は,City of Hope,PNP Treateutics,Inc.,Alabama University at Birmingham,Southern Research Institute,Emory University,および米国国家アレルギー·感染症研究所(NIAID)に代表される米国衛生·公衆サービス部(HHS)と我々の製品開発活動に関する様々な技術や特許権のライセンス契約を締結している。これらの合意には、プリペイド、特定の開発および規制活動が完了したときに支払われるべきマイルストーン費用、最低年間特許権使用料または他の費用、および将来の純売上高に基づく特許権使用料が含まれる可能性がある。これらの合意に記録されていない将来最低支払総額(将来起こりうる事件によるマイルストーンや特許権使用料は含まれておらず,双方とも合意を終了しないと仮定する)は2022年には約174,000ドル,2023年には約128 000ドル,2024年には約128 000ドル,2025年には約28 000ドル,2026年には約28,000ドルとなる.
GeeptinとCOH 04 S 1臨床計画により、2022年以降の研究と開発支出は大幅に増加する。バイオテクノロジー研究や開発に関する多くの不確実性のため,我々の研究計画を完成させるコストや時間の前向きな推定は提供していない。これらの不確実性のため、私たちの将来の支出は今後しばらく高度に不安定になる可能性があり、これは実験と研究の結果に依存する。私たちが臨床前研究と臨床試験からデータを得る時、私たちはいくつかの開発計画を停止或いは延期して、私たちの資源をより将来性のある候補製品に集中することを選択するかもしれない。臨床前研究と人体臨床試験を完成するには数年或いはそれ以上の時間を要するかもしれないが、時間の長さはいくつかの要素によって大きく異なる可能性がある。将来の臨床試験の持続時間とコストがプロジェクトの全ライフサイクルで大きく異なる可能性があるのは,適切な患者被験者の募集に要する時間長,最終的に臨床試験に参加した患者数,患者フォローアップの持続時間および臨床試験に含まれる臨床地点の数を含むヒト臨床試験プログラムの開発期間中の差があるためである。
2022年以降には,研究開発活動や他の一般企業活動の拡大を支援するために,我々の一般的かつ行政コストが増加することが予想される。
私たちは現在、このような資金を得る保証はないにもかかわらず、追加の政府と半政府支出計画および臨床試験支援を通じて資金源を求めている。Geeptinは1/2期試験を行っており,スタンフォード大学とエマレー大学が協力して行われており,研究の第1段階(10名の患者)はFDAがその孤児製品臨床試験贈与計画に基づいて資金を提供している。
2022年1月、私たちは普通株式と引受権証の私募を完了し、純収益は約920万ドルだった。
私たちは私たちの既存の現金と現金等価物が2023年第2四半期までの予想される現金需要を満たすのに十分になると信じている。しかし、私たちの財務資源がどのくらいの間私たちの業務を支援するのに十分な予測は、リスクと不確実性要素に関連し、間違っていることが証明される可能性のある仮定に基づいている前向きな陳述であり、実際の結果は大きく異なるかもしれない。私たちは計画よりも早く追加資金を得るか、あるいは私たちが現在予想しているよりも多くの資金を得る必要があるかもしれない。私たちが運営しなければならない実際の資金の金額は多くの要素によって影響され、その中のいくつかの要素は私たちがコントロールできない。これらの要因には,我々の研究活動の進展;私たちの研究計画の数と範囲;私たちの臨床前および臨床開発活動の進展と成功;私たちとの研究開発協定を締結した当事者との開発努力の進展;私たちの候補製品の製造コスト、および私たちが商業製造協定を締結する可能性のある当事者との努力の進展;私たちは既存の研究開発計画を維持し、新しい研究開発と許可手配を確立する能力;特許権利要件および他の知的財産権に関連するコストの起訴と実行;協力、許可および他の同様の計画の条項と時間の確立と維持;リスク要因は、任意の自然災害または公衆衛生危機(例えば、新冠肺炎疫病)の影響、私たちが入手または獲得可能な任意の製品または技術に関連するコスト、および承認を規制するコストおよび時間を含む。
私たちは、私たちの開発計画の進展、商業化準備、その他の運営コストを含む、私たちの将来の運営活動を支援するために追加の資金を調達し続ける必要があります。私たちがとりうる融資戦略は、政府資金、協力、戦略連合、または第三者との許可手配など、株式公開または非公開売却、債務融資、または政府資金、協力、戦略連合、または第三者との許可手配など、他の資本源からの資金を含むが、これらに限定されない。より多くの資金を得ることを確保するための追加的な資本があることは保証されないし、もしあれば、これらの資金が優遇条件で私たちの需要を満たすのに十分な保証もない。もし私たちが受け入れられる条件や十分な金額で追加資本を調達できなければ、私たちは私たちの1つ以上の候補製品の開発を大幅に延期、削減、または停止しなければならないかもしれない。
純営業損失が繰り越す
2021年12月31日現在、私たちが所得税目的で繰り越した総合純営業損失は7520万ドルで、うち約4890万ドルは2022年から2037年に満期になります。私たちには約160万ドルの研究開発税控除があります(あれば)、使用しなければ、これらの税金は2022年から2041年に満期になります。国税法第382節に含まれる条項は、所有権権益が過去の期間中に発生または将来発生する可能性のある重大な変化によるものであるため、任意の所与の年度における純営業損失の使用および研究税収控除を制限する可能性がある。
表外手配
オフィスと実験室の運営リース以外に、私たちは私たちの財務状況或いは経営結果に重大な影響を与える可能性がある表外手配は何もありません。
| 第七A項。 |
市場リスクの定量的·定性的開示について |
私たちの市場リスクへの開放は主に金利収入感受性に限られていますが、これはアメリカ金利の全体的な水準の変化の影響を受けています。特に私たちのかなりの投資は機関通貨市場基金にあるからです。私たちの投資活動の主な目標は、元本を維持しながら、リスクを著しく増加させることなく、受け取った収入を最大化することです。私たちの短期投資の性質のため、私たちは私たちが重大な市場リスクの影響を受けないと信じている。私たちはどんな派生金融商品や外貨道具も持っていない。
| 第八項です。 |
財務諸表と補足データ |
我々は,2021年12月31日まで,2020年12月31日までおよび2021年12月31日までの2年間の合併財務諸表と補足付表とその付記,および独立公認会計士事務所に関する報告を,本年度報告のF−1からF−17ページのForm 10−Kに掲載した。
| 第九項です。 |
会計·財務開示面の変化と会計士との相違 |
会計又は財務開示事項又は本項目9項の下で開示を要求する他の報告すべき事項については、我々の会計士と食い違いがない。
| ITEM 9 Aです。 |
制御とプログラム |
情報開示制御とプログラムの評価
私たちは、1934年の証券取引法(改正取引法)に基づいて提出または提出された報告書で開示を要求した財務情報が、所定の期間にわたって記録、処理、集計、報告され、タイムリーに開示決定を行うために、私たちの経営陣に蓄積され、伝達されることを確保するために、開示制御および手続きを維持する。
我々は,我々の経営陣の監督と参加の下で,本テーブル10-Kまでの期間終了時の開示制御とプログラムの設計と動作の有効性を評価した.この評価に基づき、我々の最高経営責任者および最高財務官は、2021年12月31日まで、我々の開示制御および手続きが有効であり、取引所法案に基づいて提出または提出された報告書で開示を要求する情報が、米国証券取引委員会規則および表に指定された期間内に記録、処理、まとめ、報告されることを合理的に保証することができると結論した。
財務報告の内部統制に関する経営陣の報告
経営陣は、取引法規則13 a-15(F)によって定義されたように、財務報告の十分な内部統制の確立と維持を担当する。経営陣は、財務報告書の内部統制に対する2021年12月31日までの有効性を評価した“内部統制-統合フレームワーク(2013)”、テレデビル委員会(COSO)が主催して組織委員会が発表した。この評価の結果、経営陣は、会社の非通常取引に対する解釈に重大な欠陥があるため、会社の財務報告に対する内部統制や手続きが無効であると結論した。会社の非通常的な取引に対する制御はいくつかの項目を十分に正確に識別するのに不利だ。経営陣は、非通常の取引のより包括的な検討を含む、より効率的な内部統制を設計し、実施するステップを取っている。
財務報告の内部統制の変化
最近の財政四半期内に、財務報告の内部統制に大きな影響を与えていないか、または合理的に財務報告の内部統制に大きな影響を与える可能性のある変化が発生していません。前項で述べた社内財務報告の内部統制の変化は、2022年3月31日までの四半期内に実施される。
コントロールに対する制限
経営陣は私たちの開示統制と手続き、または財務報告に対する私たちの内部統制がすべてのミスや詐欺を防止または発見することを期待していない。いかなる規制制度も,その設計や運営がどのように整備されても,何らかの仮定に基づいて,絶対的な保証ではなく,その目標が達成できることを確保するために合理的な保証しか提供できない。また,どの制御評価も,誤りや不正による誤り陳述が発生しないことや,社内のすべての制御問題や不正事件(あれば)が発見されていることを絶対に保証することはできない.
| プロジェクト9 B。 |
その他の情報 |
ない。
| プロジェクト9 Cです。 |
検査妨害に関する外国司法管区の開示 |
適用されません。
第三部
| 第10項。 |
役員、行政、会社の管理 |
本プロジェクトに要求される情報は、米国証券取引委員会に提出された2022年年度株主総会の最終委託書に含まれ、タイトルは“取締役及び役員”及び“コーポレート·ガバナンス”であり、引用により本明細書に組み込まれる。
ビジネス行為と道徳的基準
私たちの取締役会は、私たちのサイトで見つけることができる書面の商業行為と道徳基準を採択しました Wwwww.geovax.comそれは.当社は誰の要求に応じて“道徳規則”を無料で提供します。このような依頼は,会社秘書の管理下で通常メールで送信することができる.私たちは、すべての役人、役員、従業員が仕事で遭遇した法律と道徳的問題を処理する際に、この規則を遵守することを要求します。この規則は従業員が利益の衝突を避け、すべての法律と他の法律の要求を遵守し、誠実で道徳的な方法で業務を展開し、正直で私たちの最良の利益に合致する方法で行動することを要求する。従業員たちは彼らが実際的または明らかに違反した任意の行動だと心から思うことを報告するように要求された。2002年の“サバンズ-オキシリー法案”は、ある会社に、会計、内部会計制御または監査事項に関する苦情を受け取り、保留し、処理し、従業員に不審会計または監査事項に関する苦情を秘密および匿名で提出することを可能にする手続きを制定することを要求する。私たちはこのような手続きを持っている。
同社はウェブサイトで発表しますWwwww.geovax.comまたは、米国証券取引委員会に提出されたForm 8-Kにおいて、最高経営者または最高財務官または同様の機能を実行する者に適した道徳的規則条項の任意の修正または免除が開示され、(I)個人と職業関係との間の実際または表面的利益衝突を道徳的に処理することを含む誠実かつ道徳的な行為と関連し、(Ii)会社が米国証券取引委員会または米国証券取引委員会に提出された報告および文書および会社による他の公開宣伝において包括的、公平、正確、タイムリーかつ理解可能な開示を行うこと;(Iii)適用される政府の法律、規則、および条例を遵守すること、(Iv)規則に示された適切な人に“道徳的規則”に違反する内部状況を直ちに報告すること、または(V)“道徳的規則”の遵守に責任を負う。役員または取締役に付与された任意の免除は、取締役会によってのみ承認され、米国証券取引委員会に提出された8-K表に開示されることとその理由である。2021年にはそのような免除が承認されなかった。
| 第十一項。 |
役員報酬 |
本プロジェクトに要求される情報は、米国証券取引委員会に提出された2022年年度株主総会の最終委託書に含まれ、“コーポレート·ガバナンス”および“役員報酬”と題され、参照によって本明細書に組み込まれる。
| 第十二項。 |
ある実益所有者の担保所有権及び経営陣及び株主に関する事項 |
本プロジェクトに要求される情報は、米国証券取引委員会に提出された2022年年度株主総会の最終委託書に含まれ、“主要株主、取締役、幹部の証券所有権”と題され、この引用により本明細書に組み込まれる。
株式補償計画に基づいて発行された証券
次の表は、2021年12月31日現在、当社の株式証券の発行が許可されている補償計画に関するいくつかの情報を示しています。
| 計画種別 |
発行する証券の数 運動中に支給する 未完成の選択肢では 株式承認証及び権利(A) |
加重平均 行権価格 未完成の選択肢は 株式証書及び権利を承認する |
余剰証券数 将来以下の条件で発行することができる 持分補償計画 ((A)欄に反映された証券を除く) |
| 株主承認持分補償計画 |
962,300 | $3.18 | 506,700 |
| 株主の承認を得ない持分補償計画 |
272,997 | $5.00 | -0- |
私たちの持分補償計画の記述は、2021年の連結財務諸表の脚注7で見つけることができ、これは本書類の添付ファイルとして提出されました。
| 十三項。 |
特定の関係や関係者の取引、取締役の独立性 |
本プロジェクトに要求される情報は、米国証券取引委員会に提出された2022年年度株主総会の最終委託書に含まれ、“コーポレート·ガバナンス”および“いくつかの関係および関連者取引”と題され、参照によって本明細書に組み込まれる。
| 14項です。 |
主な会計費用とサービス |
本プロジェクトに要求される情報は、米国証券取引委員会に提出された2022年年度株主総会の最終委託書に含まれ、“独立公認会計士事務所の任命承認”と題され、この引用により本明細書に組み込まれる。
第4部
| 第十五項。 |
展示品と財務諸表の付表 |
| (a) | 本報告の一部として提出された書類: | |
| (1) | 財務諸表 |
ページ |
| 独立公認会計士事務所報告 |
F-2 |
|
| 2021年12月31日現在と2020年12月31日現在の連結貸借対照表 |
F-3 |
|
| 2021年12月31日までと2020年12月31日までの総合業務報告書 |
F-4 |
|
| 2021年12月31日現在と2020年12月31日現在の株主権益(損失額)連結報告書 |
F-5 |
|
| 2021年12月31日と2020年12月31日までの統合現金フロー表 |
F-6 |
|
| 連結財務諸表付記 |
F-8 |
|
| (2) | 財務諸表明細書 |
|
| 以下の財務諸表付表本年度報告書に掲載されているF-17ページForm 10-K:付表2--2021年12月31日現在と2020年12月31日までの年間推定値と適合資格勘定 |
||
| 別表2−2021年と2020年12月31日終了年度の推定値と合格口座 |
||
| これらの情報は、これらの情報が連結財務諸表または付記の他の場所に含まれるので、適用または不要であるので、他のすべての財務諸表の添付表は省略される。 |
||
| (3) | S-K規則601項に要求される証拠品 |
| 展示品 |
||
| 番号をつける |
説明する |
|
| 3.1 |
会社登録証明書(3) |
|
| 3.1.1 |
2010年4月13日に提出されたGeoVax Labs,Inc.社登録証明書修正証明書(5) |
|
| 3.1.2 |
2010年4月27日に提出されたGeoVax Labs,Inc.社登録証明書修正証明書(6) |
|
| 3.1.3 |
2013年8月2日に提出されたGeoVax Labs,Inc.社登録証明書修正証明書(7) |
|
| 3.1.4 |
2015年5月13日に提出されたGeoVax Labs,Inc.社登録証明書修正書(8) |
|
| 3.1.5 |
2016年6月14日に提出されたGeoVax Labs,Inc.登録証明書修正証明書(10) |
|
| 3.1.6 |
2017年8月4日に提出されたGeoVax Labs,Inc.登録証明書修正証明書(11) |
|
| 3.1.7 |
2019年4月30日に提出されたGeoVax Labs,Inc.登録証明書修正証明書(14) |
|
| 3.1.8 |
2020年1月21日に提出されたGeoVax Labs,Inc.登録証明書修正証明書(16) |
|
| 3.1.9 |
2020年9月24日に提出されたGeoVax Labs,Inc.登録証明書修正書(23) |
|
| 3.2 |
附例(3) |
|
| 4.1 |
会社普通株を代表する株式フォーマット、1株当たり額面$0.001(20) |
|
| 4.1.1 |
普通株引受権証表(22) |
|
| 4.1.2 |
代表授権書プロトコルフォーマット(21) |
|
| 4.1.3 |
授権証代理プロトコルフォーマット(21) |
|
| 4.1.4 |
複数の管理債権者に交付する令状表(21) |
|
| 4.1.5 |
普通株式引受権証表、期日は2020年6月26日(19) |
|
| 4.1.6 |
期日は2021年2月11日の引受業者株式証明書協議表(26) |
|
| 4.1.7 |
普通株式引受権証表、期日は2021年9月28日(28) |
|
| 4.1.8 |
前払い資金株式証明書協議フォーマット(30) |
|
| 4.1.9 |
普通株式証明書表(30) |
|
| 10.1 ** |
GeoVax Labs,Inc.とDavid A.Doddとの雇用プロトコル(12) |
|
| 10.2 ** |
GeoVax,Inc.マーク·W·レイノルズとの雇用協定(4) |
|
| 10.2.1 ** |
GeoVax Labs,Inc.マーク·W·レイノルズとの雇用協定改正案第1号(8) |
|
| 10.2.2 *’** |
GeoVax,Inc.とMark J.Newman,PhDの間の雇用協定は,改正され再決定され,2022年3月9日に決定された |
|
| 10.2.3 *’** |
GeoVax,Inc.とKelly T.McKee,MDとの間の諮問協定は,2021年12月22日である |
|
| 10.5 ** |
GeoVax Labs,Inc.2020年株式インセンティブ計画、2021年8月11日(18)の改訂と再記述 |
|
| 10.5.1 ** |
非限定株式オプションプロトコルフォーマット(27) |
|
| 10.6 |
GeoVax,Inc.とエマレー大学との間のライセンス契約(改訂および再記述)(2) |
|
| 10.7 |
米国国立アレルギー·感染症研究所と署名した特許と生体材料許可協定は,期日は2020年10月22日(24)である |
| 10.8 |
米国国立アレルギー·感染症研究所と署名した内部研究使用に関する特許と生体材料許可協定は,期日は2020年11月25日(25)である |
|
| 10.9 |
UCB,Inc.とGeoVax,Inc.の間のオフィスおよびラボレンタル(17) |
|
| 10.10 * |
GeoVax Labs,Inc.取締役報酬計画の概要 |
|
| 10.11 |
GeoVax社とPNP治療会社との間の譲渡·許可契約日は2021年9月28日(28) |
|
| 10.12 |
GeoVax,Inc.と希望の城との間の独占許可協定は,2021年11月9日(29)である |
|
| 10.13 |
証券購入協定、期日は2022年1月14日(30) |
|
| 10.14 |
登録権協定、期日は2022年1月14日(30) |
|
| 14.1 |
道徳的規則(13) |
|
| 21.1 |
登録者の子会社(15社) |
|
| 23.1 * |
Wipfli LLP同意(米国PCAOB監査役事務所ID |
|
| 31.1 * |
1934年証券取引法第13 a-14(A)又は15 d-14(A)条による認証 |
|
| 31.2 * |
1934年証券取引法第13 a-14(A)又は15 d-14(A)条による認証 |
|
| 32.1 * |
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条による認証 |
|
| 32.2 * |
2002年にサバンズ·オクスリ法案第906条で可決された“米国法典”第18編1350条による認証 |
|
| 101.INS |
(1)XBRLタグが連結されたXBRLドキュメントと共に埋め込まれているので、相互作用データファイルには存在しない相互接続XBRLインスタンス文書(このインスタンス文書は相互作用データファイルには現れない)(1) |
|
| 101.衛生署署長 |
イントラネットXBRL分類拡張アーキテクチャ文書(1) |
|
| 101.CAL |
イントラネットXBRL分類拡張計算リンクベース文書(1) |
|
| 101.DEF |
インラインXBRL分類拡張Linkbase文書(1)を定義する |
|
| 101.LAB |
XBRL分類拡張タグLinkbase文書(1)を連結する |
|
| 101.価格 |
インラインXBRL分類拡張プレゼンテーションLinkbaseドキュメント(1) |
|
| 104 |
表格10-Kの本年度報告書表紙のイントラネットXBRLは、添付ファイル101に内蔵されたXBRL文書セット(1)に含まれる |
| * |
本局に提出します。 |
|
| ** |
契約または補償計画または手配を管理することを指す。 |
|
| (1) |
1933年に改正された証券法第11条または12条または1934年に改正された“証券取引法”第18条については、これらの相互データファイルは、提出されたまたは登録された声明または募集説明書の一部とみなされてはならず、他の方法でこれらの条項の下の責任を負うべきでもない。 |
|
| (2) |
登録者が2006年10月4日に提出した現在の8−K表報告書を参照して組み込む。 |
|
| (3) |
登録者が2008年6月23日に提出した8−Kフォームの現在の報告書から引用される。 |
|
| (4) |
登録者が2010年3月8日に提出したForm 10−K年次報告書から引用される。 |
|
| (5) |
登録者が現在提出している2010年4月14日に提出された8-K表報告書から引用される。 |
|
| (6) |
登録者が2010年4月28日に提出した8−Kフォームの現在の報告書から引用される。 |
|
| (7) |
登録者が2013年8月2日に提出した8−Kフォームの現在の報告書を参照して組み込む。 |
|
| (8) |
登録者が2013年10月23日に提出した8−Kフォームの現在の報告書を参照して組み込む。 |
|
| (9) |
登録者に組み込まれた2015年5月14日に提出された8−Kフォームの現在の報告書を参照することによって。 |
|
| (10) |
登録者が2016年6月16日に提出した現在の8−K表報告書に関連して参照する。 |
|
| (11) |
登録者が2017年8月4日に提出した8−Kフォームの現在の報告書を参照して組み込む。 |
|
| (12) |
2018年9月7日に登録者によって提出された現在のタブ8−K報告書に結合された報告書を参照する。 |
|
| (13) |
登録者が2019年3月26日に提出したForm 10-K年次報告書から引用します。 |
|
| (14) |
登録者が現在提出している2019年4月30日のForm 8-K報告書から引用 |
|
| (15) |
登録者が2019年11月7日に提出したForm 10-Q四半期報告書から引用します。 |
|
| (16) |
参照によって登録者が2020年1月21日に提出した現在の8−K表報告書。 |
|
| (17) |
登録者が2020年3月24日に提出したForm 10−K年度報告書から引用した。 |
|
| (18) |
登録者が2021年11月12日に提出したForm 10-Q四半期報告書から引用される。 |
|
| (19) |
2020年6月26日に登録者によって提出された8−Kフォームの現在の報告書を参照して組み込む。 |
|
| (20) |
2020年8月26日に提出された登録者S−1表登録声明(文書番号333−239958)に引用された修正案第2号を引用する。 |
|
| (21) |
2020年9月8日提出の登録者S−1表登録説明書(書類番号333−239958)を引用して組み込む改正案第3号 |
|
| (22) |
改正案は、2020年9月23日に提出された登録者S−1表登録声明(書類番号333−239958)の第4号を引用して編入される。 |
|
| (23) |
引用によって登録者が2020年9月25日に提出した現在の8-K表報告書。 |
|
| (24) |
2020年10月26日に出願された8−Kフォームの現在の報告書を参照して登録者に組み込む。 |
| (25) |
2020年11月30日に出願された8−Kフォームの現在の報告書を参照して登録者に組み込む。S-K法規第601(B)(10)項によれば、当社は、(I)漏れた情報が重要ではないと判断しているため、(Ii)漏れた情報が開示されている場合、会社に競争損害を与える可能性があるため、本文書のいくつかの秘匿部分は漏れている。 |
|
| (26) |
参照によって登録者に組み込まれた2021年2月11日に提出された8−Kフォームの現在の報告書。 |
|
| (27) |
登録者が2021年3月23日に提出したForm 10−K年度報告書から引用する。 |
|
| (28) |
参照によって登録者に組み込まれた2021年9月29日に提出された8−Kフォームの現在の報告書。S-K法規第601(B)(10)項によれば、本添付ファイルのいくつかの秘密部分は、(I)当社が見落とした情報が重要ではないと判断したため、(Ii)当社は通常、漏れた情報を個人または機密と見なしているからである。 |
|
| (29) |
参照によって登録者に組み込まれた2021年11月10日に提出された8−Kフォームの現在の報告書。S-K法399 601(B)(10)条によれば、本文書のいくつかの秘密部分は、(I)当社が見落とした情報が重要ではないと判断したため、(Ii)当社は通常、漏れた情報を個人または機密と見なしているからである。 |
|
| (30) |
参照によって登録者に組み込まれた2022年1月20日に提出された8−Kフォームの現在の報告書。 |
| 第十六項。 |
表格10-Kの概要 |
ない。
サイン
1934年“証券取引法”第13又は15(D)節の要求に基づいて、登録者は、次の署名者が代表して本報告書に署名することを正式に許可した。
|
|
GeoVax研究所,Inc. |
|
|
|
|
|
|
|
|
|
差出人: |
/s/ デビッド·A·テレス |
|
|
|
デビッド·A·テレス |
|
|
|
|
社長と最高経営責任者 |
|
|
| (首席行政主任) | |||
| 日付:2022年3月9日 | |||
本報告は、1934年の証券取引法の要求に基づき、以下の登録者によって登録者として指定日に正式に署名された。
| 署名/名称 | タイトル | 日取り | |
| /s/デビッド·A·テレス | 役員.取締役 | March 9, 2022 | |
| デビッド·A·テレス | 総裁と行政長官室9 | ||
| (首席行政主任) | |||
| /s/マーク·W·ルノー | 首席財務官 | March 9, 2022 | |
| マーク·W·レイノルズ | (首席財務会計官) | ||
| /s/ランデル·D·チェイス | 役員.取締役 | March 9, 2022 | |
| ランデル·D·チェイス | |||
| /s/デビッド·A·テレス | 役員.取締役 | March 9, 2022 | |
| デビッド·A·テレス | |||
| /s/Dean G.Kollintzas | 役員.取締役 | March 9, 2022 | |
| コリザス院長 | |||
| ロバート·T·マクナリー | 役員.取締役 | March 9, 2022 | |
| ロバート·T·マクナリー | |||
| /s/小ジョン·N·スペンサー | 役員.取締役 | March 9, 2022 | |
| ジョン·N·スペンサー |
GeoVax研究所,Inc.
2021年連結財務諸表インデックス
| 独立公認会計士事務所報告 |
F-2 |
| 2021年12月31日現在と2020年12月31日現在の連結貸借対照表 |
F-4 |
| 2021年12月31日までと2020年12月31日までの総合業務報告書 |
F-5 |
| 2021年12月31日現在と2020年12月31日現在の株主権益(損失額)連結報告書 |
F-6 |
| 2021年12月31日と2020年12月31日までの統合現金フロー表 |
F-7 |
| 連結財務諸表付記 |
F-8 |
| 財務諸表明細書: |
|
| 別表2−2021年と2020年12月31日終了年度の推定値と合格口座 |
F-17 |
 |
桃樹街東北235号スイートルーム1800 アトランタ、GA 30303 |
404 588 4200 Wipflii.com |
独立公認会計士事務所報告
GeoVax Labs,Inc.株主と取締役会へ。
連結財務諸表に対するいくつかの見方
当社は添付GeoVax Labs,Inc.及びその付属会社(“貴社”)の二零二年十二月三十一日及び二零二年十二月三十一日の総合貸借対照表、当該日までの年度に関する総合運営報告書、株主権益(損失)及びキャッシュフロー、及び総合財務諸表及び付表に関する付記(総称して“財務諸表”と呼ぶ)を審査した。財務諸表は,当社の2021年12月31日と2020年12月31日までの財務状況,およびそれまでの年度までの経営結果とキャッシュフローをすべての重要な面で公平に反映しており,米国公認の会計原則に適合していると考えられる。
意見の基礎
これらの財務諸表は会社の経営陣が責任を負う。私たちの責任は私たちの監査に基づいて会社の財務諸表に意見を発表することです。私たちは米国上場企業会計監督委員会(PCAOB)に登録されている公共会計士事務所であり、米国連邦証券法および米国証券取引委員会とPCAOBの適用規則と法規に基づいて、会社と独立しなければならない。
私たちはPCAOBの基準に従って監査を行っている。これらの基準は、財務諸表に重大な誤報がないかどうかに関する合理的な保証を得るために、エラーによるものであっても詐欺によるものであっても、監査を計画し、実行することを要求する。当社はその財務報告の内部統制を監査することを求められておらず、私たちも招聘されて監査を行っていません。私たちの監査の一部として、財務報告の内部統制を理解することが求められていますが、社内財務報告の内部統制の有効性に対する意見を表明するためではありません。したがって、私たちはそのような意見を表現しない。
我々の監査には、財務諸表の重大な誤報リスクを評価するプログラム、エラーによるものであれ詐欺であっても、これらのリスクに対応するプログラムを実行することが含まれています。これらの手続きは、財務諸表中の金額および開示に関連する証拠をテストに基づいて検討することを含む。我々の監査には、経営陣が使用する会計原則の評価と重大な見積もり、財務諸表の全体列報を評価することも含まれています。私たちは私たちの監査が私たちの観点に合理的な基礎を提供すると信じている。
重要な監査事項
以下に述べる重要な監査事項とは、(1)財務諸表に対して重大な意味を有する勘定又は開示に関し、(2)特に挑戦的、主観的、又は複雑な判断に係る財務諸表を監査して生じた事項である。重要監査事項の伝達は、財務諸表に対する私たちの全体的な意見をいかなる方法でも変えることはなく、次の重要な監査事項を伝達することによって、重要な監査事項又はそれに関連する勘定又は開示について個別の意見を提供することもない。
株式取引
財務諸表付記7で述べたように、当社は株式承認証及び株式オプションを含む多種の複雑度及び数量の異なる権益ツールを有している。
私たちは会社の株式構造の複雑さが重要な監査問題の主要な考慮要素であるべきであると考え、普通株式、普通株発行活動、株式証活動への転換を含む株式取引量に基づいて、すべての株式取引を十分に開示することを確保することは挑戦的である。これらの見積もり数や活動を監査するには、これらの取引の数や複雑さ、および必要な監査手続を実行し、これらの手続の結果を評価する際に、監査員の高度な判断が必要である。
この重要な監査問題を解決するために私たちが実行している主な監査手続きは以下の通りです
| ● |
会社の株式取引会計と記録プロセスの制御に対する設計有効性を評価した |
| ● |
我々は、Black-Scholesモデル計算において、付与された株式オプションおよび引受権証の価値を推定するための仮説をテストし、その中には、株式オプションおよび引受権証の推定寿命および会社株価の変動性などのいくつかの重要な仮定が含まれている |
/s/
2005年以来、当社の監査役を務めてきました。
March 9, 2022
| GeoVax研究所,Inc. |
|||||||
| 合併貸借対照表 |
| 十二月三十一日 | ||||||||
| 2021 | 2020 | |||||||
| 資産 | ||||||||
| 流動資産: | ||||||||
| 現金と現金等価物 | $ | $ | ||||||
| 贈与資金その他売掛金 | ||||||||
| 前払い費用と他の流動資産 | ||||||||
| 流動資産総額 | ||||||||
| 財産と設備、純額 | ||||||||
| 預金.預金 | ||||||||
| 総資産 | $ | $ | ||||||
| 負債と株主権益 | ||||||||
| 流動負債: | ||||||||
| 売掛金 | $ | $ | ||||||
| 費用を計算する | ||||||||
| 支払手形の当期分 | ||||||||
| 流動負債総額 | ||||||||
| 費用を計算しなければなりません | ||||||||
| 支払手形,当期分を差し引く | ||||||||
| 総負債 | ||||||||
| 承諾(付記6) | ||||||||
| 株主権益: | ||||||||
| 優先株、$額面:ライセンス株式-Bシリーズ転換可能優先株、$その価値は-そして..2021年12月31日および2020年12月31日に発行および発行された株式 | ||||||||
| 普通株、$額面:ライセンス株式-発行済み株式と発行済み株式そして2021年12月31日と2020年12月31日にそれぞれ | ||||||||
| 追加実収資本 | ||||||||
| 赤字を累計する | ( | ) | ( | ) | ||||
| 株主権益総額 | ||||||||
| 総負債と株主権益 | $ | $ | ||||||
連結財務諸表の付記を参照。
GeoVax研究所です会社
連結業務報告書
| 十二月三十一日までの年度 | ||||||||
| 2021 | 2020 | |||||||
| 贈与と協力収入 | $ | $ | ||||||
| 運営費用: | ||||||||
| 研究開発 | ||||||||
| 一般と行政 | ||||||||
| 総運営費 | ||||||||
| 運営損失 | ( | ) | ( | ) | ||||
| その他の収入(支出): | ||||||||
| 利子収入 | ||||||||
| 利子支出 | ( | ) | ( | ) | ||||
| 債務返済収益 | ||||||||
| その他収入合計 | ( | ) | ||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 基本的で希釈されています | ||||||||
| 普通株1株当たり純損失 | $ | ( | ) | $ | ( | ) | ||
| 加重平均流通株 | ||||||||
連結財務諸表の付記を参照。
GeoVax研究所,Inc.
合併株主権益報告書(欠員)
| 合計する | ||||||||||||||||||||||||||||
| 優先株 | 普通株 | その他の内容 | 積算 | 株主の 権益 | ||||||||||||||||||||||||
| 株 | 金額 | 株 | 金額 | 実収資本 | 赤字.赤字 | (足りないところを) | ||||||||||||||||||||||
| 2019年12月31日の残高 | $ | $ | $ | $ | ( | ) | $ | ( | ) | |||||||||||||||||||
| 現金と交換するために転換可能な優先株を売る | ||||||||||||||||||||||||||||
| 優先株を普通株に転換する | ( | ) | ( | ) | ||||||||||||||||||||||||
| 過渡的融資で発行された権利証 | - | - | ||||||||||||||||||||||||||
| 株式承認証の行使時に普通株式を発行する | ||||||||||||||||||||||||||||
| 債券転換時に普通株を発行する | ||||||||||||||||||||||||||||
| 課税補償取り消し時に普通株式を発行する | ||||||||||||||||||||||||||||
| 現金と引き換えに普通株を売る | ||||||||||||||||||||||||||||
| サービス普通株を発行する | ||||||||||||||||||||||||||||
| 株式オプション費用 | - | - | - | - | - | |||||||||||||||||||||||
| 逆株式分割後の株式総合記事 | ( | ) | ||||||||||||||||||||||||||
| 2020年12月31日までの年度純損失 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 2020年12月31日残高 | ( | ) | ||||||||||||||||||||||||||
| 現金と引き換えに普通株を売る | ||||||||||||||||||||||||||||
| 株式承認証の行使時に普通株式を発行する | ||||||||||||||||||||||||||||
| サービス普通株を発行する | ||||||||||||||||||||||||||||
| 技術許可証を発行する令状 | - | - | ||||||||||||||||||||||||||
| 優先株買い戻し | ( | ) | ( | ) | ( | ) | ||||||||||||||||||||||
| 株式オプション費用 | - | - | ||||||||||||||||||||||||||
| 2021年12月31日までの年度純損失 | - | - | ( | ) | ( | ) | ||||||||||||||||||||||
| 2021年12月31日の残高 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||||||||
連結財務諸表の付記を参照。
GeoVax研究所です会社
統合現金フロー表
| 十二月三十一日までの年度 | ||||||||
| 2021 | 2020 | |||||||
| 経営活動のキャッシュフロー: | ||||||||
| 純損失 | $ | ( | ) | $ | ( | ) | ||
| 純損失と経営活動で使用される現金純額の調整: | ||||||||
| 減価償却および償却 | ||||||||
| 債務割引償却 | ||||||||
| 株に基づく報酬費用 | ||||||||
| 技術許可費のために令状を発行する | ||||||||
| 債務返済収益 | ( | ) | ||||||
| 資産と負債の変動状況: | ||||||||
| 贈与資金その他売掛金 | ( | ) | ||||||
| 前払い費用と他の流動資産 | ( | ) | ( | ) | ||||
| 売掛金と売掛金 | ||||||||
| 総額を調整する | ||||||||
| 経営活動のための現金純額 | ( | ) | ( | ) | ||||
| 投資活動によるキャッシュフロー: | ||||||||
| 財産と設備を購入する | ( | ) | ( | ) | ||||
| 投資活動のための現金純額 | ( | ) | ( | ) | ||||
| 資金調達活動のキャッシュフロー: | ||||||||
| 普通株式売却および株式承認証で得られた純額 | ||||||||
| 株式承認証を行使して得られた金の純額 | ||||||||
| 優先株を売って得た純収益 | ||||||||
| 支払手形の純収益を発行する | ||||||||
| 過渡的融資の純収益 | ||||||||
| 優先株買い戻し | ( | ) | ||||||
| 支払手形元金償還 | ( | ) | ( | ) | ||||
| 融資活動が提供する現金純額 | ||||||||
| 現金と現金等価物の純増加 | ||||||||
| 期初現金及び現金等価物 | ||||||||
| 期末現金および現金等価物 | $ | $ | ||||||
非現金融資活動の追加開示:
2021年12月31日までの年間:
| ● |
無現金行使引受証で149,705株の普通株が発行された |
| ● |
支払手形に関する172,056ドル元本と受取利息はローン免除後にキャンセルされました |
2020年12月31日までの年間で:
| ● |
転換可能優先株転換時に716,790株普通株が発行された |
| ● |
現金なしで株式承認証を行使した場合,36,902株の普通株が発行された |
| ● |
現在と前任社員と取締役の1,500,000ドルを免除するために、300,001株の普通株と300,001株の株式承認証を発行した |
| ● |
1,200,000ドル変換可能債券と14,667ドル関連利子転換後、177,626株普通株、126,042件の事前資金引受権証、303,668件の株式承認証が発行された |
連結財務諸表の付記を参照。
GeoVax研究所,Inc
連結財務諸表付記
2021年12月31日と2020年12月31日までの年度
| 1. | 業務記述と最新の発展 |
GeoVax Labs,Inc.(“GeoVax”あるいは“会社”)は臨床段階の生物技術会社であり、新型担体ワクチンプラットフォームを利用して伝染病と癌に対する免疫療法とワクチンを開発する。GeoVaxの製品ラインにはCOVIDヒト臨床試験が含まれています19頭頸部癌もあります。その他の研究開発プロジェクトはジカウイルス、出血熱ウイルス(エボラ出血熱ウイルス、スーダン、マルブルクとラサ)とマラリアに対する予防的ワクチン、及び固形腫瘍に対する免疫療法を含む。私たちのいくつかのワクチン開発活動はずっとアメリカ政府の財政的支援を受け続けるだろう。この支援には,我々に直接付与された研究補助金と契約も含まれており,臨床前動物研究やヒト臨床試験への間接的な支援も含まれている。
地理的に-CM 04 S 1許可証 -- In 2021年11月GeoVaxは希望の城とライセンス契約(“COHライセンス”)を締結し,GeoVaxにGEOのさらなる開発と商業化の独占的権利を付与した-CM 04 S 1(以前に呼ばれた)COH 04 S 1)である。地理的に-CM 04 S 1SARSコロナウイルス刺突と核カプシド抗原を発現する人工合成弱毒化修飾アンカラワクシニアウイルスベクター2ウイルスは,最初はCOHで免疫低下患者のために開発された。
地理的に-CM 04 S 1研究段階を進めている2これまでに異遺伝子造血細胞移植,自家造血細胞移植あるいはキメラ抗原受容体(CAR)T細胞治療を受けた患者において,その安全性と免疫原性を評価する臨床試験は,ファイザーmRNAによるワクチンと比較した。地理的に-CM 04 S 1唯一のCOVIDです19ワクチンにはSARS-CoVもあります2スパイクとカプシドタンパク質は一つの段階に入ります2癌患者で実験を行いますこのワクチンは急速に免疫反応を起こす傾向があります14数日--わずかな副作用しかなかった。この裁判も1つ目は研究中の多抗原コサッキーウイルスを比較してみましょう19現在、アメリカ食品と薬物管理局(FDA)が許可したPfizer/BioNTechは免疫不全群にmRNAワクチンを提供している。このような患者は現在利用可能なCOVIDを受けると弱い抗体反応を示すことが多い19ワクチンです。
はい2021年12月この段階の患者登録が始まります2段階の一部1/2土木工事を試行するところ-CM 04 S 1現在FDAで承認されているワクチンとしての汎用強化ワクチンとしての使用を検討した。GeoVaxは地球観測組織を信じていますCM 04 S 1ワクチンを異種増強剤として接種する場合、Modernaまたはグローから開発されたSARS-CoVのみに対するmRNAワクチンの相同増強ではなく、免疫系に追加の認識要素を提供する2スペックタンパク質です。それは..COH 04 S 1ワクチンのMVAバックボーン5月.コロナウイルス感染をより効果的に誘発します19免疫は,MVAが免疫抑制を背景にしてもT細胞反応を強く誘導するためである。また土力工学ではCM 04 S 1刺突と核カプシド抗原を標的としています5月.SPEKE抗原で観察された顕著な配列変化に対してより大きな保護を提供する。
地理情報システム®許可証 -- In 2021年9月GeoVaxはPNP Treateutics,Inc.と譲渡と許可協定(“PNP許可証”)を締結し、この協定によると、GeoVaxはGeeptin≡の独占権利を買収することによって、その免疫腫瘍学パイプラインを拡張し、新しい技術プラットフォームを増加した。Geeptin GDEPTは新型特許製品であり、GDEPT(遺伝子ガイド酵素前駆体薬物療法)と呼ばれる遺伝子治療策略を通じて固形腫瘍を治療する。GDEPTでは、非ヒト遺伝子を有する腫瘍細胞を選択的に形質導入するためにベクターが使用され、非毒性プロドラッグを有効な抗腫瘍化合物に変換することができる酵素を発現する。A段階1/2現在,繰り返し周期のジジピン治療再発性頭頸部扁平上皮癌(HNSCC)の安全性と有効性を評価する臨床試験が行われており,これらの患者の腫瘍は注射可能である違います。治癒可能な治療法ですFDAはすでにGeeptinがHNSCCを治療する孤児の薬物地位を授与し、行っている臨床試験の初期段階はFDAがその孤児製品の臨床試験贈与計画に基づいて資金を提供している。GeoVaxがGeeptinに付与するライセンスは、すべてのヒト疾患および/または疾患に適用する権利を含む注釈癌に限られています
GeoVaxはデラウェア州の法律登録によって設立されました。私たちの主要な事務所はジョージア州アトランタ市地区にあります。
| 2. | 重要会計政策の概要 |
合併原則
添付されている連結財務諸表には、GeoVax Labs,Inc.と、当社の完全子会社GeoVax,Inc.の口座が含まれています。すべての会社間取引は合併で解約されました。
陳述の基礎
開ける January 21, 2020, 私たちは一つのことを達成しました1-そのために-
添付されている総合財務諸表の作成仮説は、継続して経営している企業として、正常な業務過程で資産の現金化と負債の返済を考えています12個-これらの連結財務諸表が印刷された日から1ヶ月後。我々の現在のすべての努力は,基本的に我々のワクチンや免疫療法候補薬を研究·開発している。私たちは将来純損失が予想され、私たちの研究開発活動を続ける際には大量の資金が必要だ。私たちの利益への移行は私たちの候補製品の成功的な開発と商業化などにかかっているだろう。私たちは5月.私たちがこれをしない限り、私たちは追加資金を集め続ける必要があるはずだ。
これまで、私たちの活動資金は、私たちの株式証券の売却、政府支出と臨床試験援助、企業と学術協力から来ています。私たちは既存の現金が計画された業務を続けるのに十分だと信じています二番目1/42023.私たちは、より多くの個人および/または債務または株式証券を公開することで、将来の業務に資金を提供する予定です。さらに私たちは5月.戦略的パートナーとの手配を通じて、あるいは他のソースからより多くの資金を求める。あるかもしれない違います。私たちがより多くの資金を集めたり、利益や運営の正のキャッシュフローを達成したり維持することができることを確実にする
予算の使用
公認会計原則(GAAP)に適合して財務諸表を作成するためには、財務諸表日の資産および負債額、または有資産および負債の開示および報告期間内の収入および費用の報告金額に影響を与える推定および仮定を行う必要がある。実際の効果5月.これらの見積もりとは違います。
現金と現金等価物
すべての満期日は三つ現金等価物として購入された場合、6ヶ月以下である。私たちの現金と現金等価物は主に銀行預金と通貨市場口座で構成されている。納期が短いため、記録の価値は公正市場価値に近い。
金融商品公正価値と信用リスク集中
集中的な信用リスクに直面させる金融商品には、主に現金と現金等価物が含まれており、それらは高信用品質の金融機関によって維持されている。貸借対照表に報告されている現金と現金等価物の帳簿価値は公正価値に近い。
財産と設備
財産と設備はコストから減価償却累計と償却を差し引く。維持·整備支出は発生時に運営費を記入し,増加·改善費用は資本化に記入する。直線方法を用いて資産の推定耐用年数内の減価償却を計算します。減価償却範囲は至れり尽くせり何年もです。私たちは直線法を使って関連レンタル期間内にレンタル改善を償却します。
財務会計基準委員会(FASB)会計基準更新(ASU)に基づいてリースを確認します違います。 2016-02, 賃貸借証書(ASU)2016-02)を要求し、テナントは、以下の原則に従ってリースを融資リースまたは経営的リースに分類する注釈レンタルは実際にはテナントの融資購入です。この分類は、レンタル料金が有効利息法で確認されるか、レンタル期間内の直線法で確認されるかを決定します。テナントはすべてのレンタル期間を記録することを要求されました12数ヶ月間、彼らの分類にかかわらず。私たちの施設賃貸契約の場合、有効期限は以下です12数ヶ月前私たちは会計政策を選択しました注釈賃貸資産と負債を確認し、レンタル期間内のレンタル費用を直線法で記録する。
長期資産減価準備
イベントや環境変化が資産の帳簿価値を示す場合、長期資産の減価を検討します5月.注釈取り戻すことができます。保有·使用する資産の回収可能性は,資産の帳簿価値とそのような資産が予想される将来の純現金流量とを比較することで測定した。このような資産は減値されていると考えられるように,確認すべき減値は,当該等資産の額面が予想を超える将来のキャッシュフロー純額の額に基づいて計測される.
費用を計算する
財務諸表作成過程の一部として、発生したと思いますが実際に発生した費用注釈しかし私たちの第三に-パーティーサプライヤー。このプロセスは、これらのプロバイダが私たちに代わって提供するサービスおよび活動を識別し、各貸借対照表の日付までにこれらのサービスが達成されたレベルおよび生成された関連コストを推定することを含む。
1株当たり純損失
普通株1株あたりの基本損失と希薄損失は、発行された普通株の加重平均から計算される。普通株等価物には,変換可能優先株の変換および株式オプションと株式引受権証の行使時に発行可能な普通株が含まれる.すべての普通株等価物は1株当たりの希薄損失の計算に計上されておらず、その影響は逆薄になるからである。1株当たりの希薄損失時に含まれない普通株等価物の加重平均を計算し,在庫株方法で計算すると,合計は以下のようになる
収入確認
FASB会計基準に基づいて収入を確認します2014-09, 取引先と契約した収入(ASU)2014-09)これは新しいテーマを作り会計基準はテーマを編纂します606.この基準は原則に基づいており、提供されている5人−収入がいつ決定されるか、およびどのように確認されるかのステップモデル。核心原則は、1つのエンティティが約束された貨物またはサービスを顧客に譲渡する場合、収入を確認すべきであり、その額は、そのエンティティがこれらの貨物またはサービスと交換する権利があると予想される対価格を反映しなければならないことである。
奨学金収入-私たちは、私たちのワクチン開発計画を支援するために、政府エンティティによって支払われた払い戻し不可能な贈与を受け入れます。返済可能な費用が発生し、私たちが贈与資金を受けるためのすべての要件を遵守した場合、これらの贈与に関する収入を記録します。
研究協力私たちは時々5月.特定のワクチン開発方法および/または疾患適応について協力研究と開発協定を締結することにより,我々は獲得した第三に−いくつかの構成に基づいて、臨床前研究のための締約金を提供するステップと。各プロトコルはASUで定義された流れに従って評価を行う2014-09収入を確認しています
研究開発費
研究開発(R&D)費用は主に私たちの候補製品の発見、開発、テストと製造によるコストを含む。これらの費用には,(1)人員の賃金,福祉,株式報酬,(2)開発を行う実験室用品と施設に関する費用,(3)給付第三に·第三者サービスプロバイダは、当社の前臨床研究および臨床試験に関連するデータ、(Iv)スポンサー研究プロトコルに関連するコスト、および(V)臨床試験に使用される材料を調達および製造するコストを実行、監視および蓄積する。これらのコストは発生時に費用を計上する。.の間に2021,私たちは$も記録した
特許費用
私たちは、特許の取得と保護に関する支出が発生した場合に費用を計上し、一般的かつ行政的費用に含まれる。
期間間比較
予見可能な未来に、私たちの経営業績は変動することが予想される。したがって期間間の比較は注釈将来の時期の結果の予測と考えられている。
所得税
私たちは負債法で所得税を計算する。この方法によれば、繰延税金資産および負債は、既存の資産および負債の帳簿金額とそれぞれの税ベースとの間の差額に起因する財務諸表の帳簿金額との間の差額に起因する推定将来の税金結果で確認される。繰延税金資産及び負債は、一時的な差額の回収又は決済が期待される年度の現行税率で計量される。繰延税金資産は、管理職がそれがもっと超える可能性があると思わない限り、推定手当を差し引く注釈繰延税金資産の一部または全部が現金化されるだろう。
株に基づく報酬
私たちは株式に基づく取引を計上し、これらの取引では、会社は、付与日に付与された公正な価値に基づく持分ツールと交換するために、従業員、取締役または他の人のサービスを受ける。普通株奨励の株式による補償コストは、発行日標の普通株の価格から推定される。株式オプションまたは株式承認証の株式補償コストは、付与日にブラック·スコアーズオプション定価モデルから計算された各ツールの公正価値に基づいて推定される。株式ベースの報酬コストは、報酬に必要なサービス期間内に比例して直線的に計算される費用であることを確認した。備考をご参照ください7株式ベースの報酬情報をより多く取得する。
最近その他の会計公告
上述したように、すでに違います。最近の会計声明や会計声明の変化は、私たちの財務諸表に実質的な影響を与えると予想されています。私たちは最近発表されたいかなるものも信じません注釈しかし、現在有効な会計基準が採用されていれば、私たちの財務諸表に実質的な影響を与えるだろう。
| 3. | 財産と設備 |
附合併貸借対照表に示される財産及び設備は、以下の各項目からなる2021年12月31日そして2020:
| 2021 | 2020 | |||||||
| 設備と家具 | $ | $ | ||||||
| 賃借権改善 | ||||||||
| 総資産と設備 | ||||||||
| 減価償却累計と償却 | ( | ) | ( | ) | ||||
| 財産と設備、純額 | $ | $ | ||||||
減価償却費用は$
| 4. | 費用を計算する |
総合貸借対照表に示される課税費用は、以下の項目からなる2021年12月31日そして2020:
| 2021 | 2020 | |||||||
| 当期許可料を計上する | $ | $ | ||||||
| 当期ではない許可料を計上する | ||||||||
| 賃金総額を計算すべきである | ||||||||
| その他の課税費用 | ||||||||
| 費用総額を計算する | $ | $ | ||||||
| 5. | 債務 |
GRA注釈 – On 2018年2月28日ジョージア州研究連合(GRA)と高級手形購入協定を締結しましたこの合意に基づいて発表しました-#ドルと交換するためにGRAに1年間のプレミアム約束手形(“GRA手形”)を支払う
CARE法案Paycheck保護計画ローン– 開ける April 17, 2020, 1ドル受け取りました
転換可能債券 – On June 26 2020, 私たちは元金総額#ドルの転換可能債券を発行した
年度入金までの利子支出2021年12月31日そして2019具体的には以下のとおりである
| 2021 | 2020 | |||||||
| GRA注釈 | $ | $ | ||||||
| 購買力平価ローン | ||||||||
| 保険料融資コスト | ||||||||
| 転換可能債券(124,185ドル債務割引償却を含む) | ||||||||
| 利子支出総額 | $ | $ | ||||||
| 6. | 支払いを引き受ける |
レンタルを経営する
約レンタルしました
許可協定
我々は,City of Hope,PNP Treateutics,Inc.,Alabama University at Birmingham,Southern Research Institute,Emory University,および米国国家アレルギー·感染症研究所(NIAID)に代表される米国衛生·公衆サービス部(HHS)と我々の製品開発活動に関する様々な技術や特許権のライセンス契約を締結している。これらの合意は5月.前金、選定された開発および規制活動の完了時に支払われるべきマイルストーン費用、最低年間特許権使用料またはその他の費用、および将来の純売上高に基づく特許権使用料が含まれています。これらのプロトコルに記録されていない将来の最低支払総額(将来またはイベントによって支払われるべきマイルストーンおよび特許使用料は含まれておらず、双方とも合意を終了していないと仮定する)は約$である
他の約束
正常な業務過程において、私たちは私たちのワクチンの生産とテスト、研究とその他の活動について各種の確定的な調達約束を達成します。自分から2021年12月31日約一ドルです
| 7. | 株主権益 |
優先株
はい June 2021, 残りの株式を買い戻しました
普通株
2020公開発行する– 開ける2020年9月29日私たちは販売を引き受けた公募株を完成させた“2020提供“)合計の
自自2016通り抜ける2020年8月会社の現金資源を節約するのを助けるために、私たちの幹部と非従業員取締役はそれぞれの現金報酬の全部または一部を受け取ることを延期することに同意した。完成している2020割引、$
完成している2020全部で発行しました
2021公開発行する– 開ける2021年2月11日私たちは引受の公募株を完成した
捜査令状演習-期間2021,
その他普通株取引-期間2021そして2020私たちは発表しました
株式オプション計画
株式に基づくインセンティブ計画があります“2020“計画”によると私たちの取締役会は5月.私たちの従業員に株式オプションを付与します。合計する
私たちはブラック·スコアモデルを用いて株式オプション付与の付与日と公正価値を決定した。このモデルは、無リスク証券の金利のようないくつかの情報を利用し、その期限は、通常、推定されたオプションの期待寿命に等しく、付与された株式オプションの公正価値を計算するために、オプションの行使または満了前の予想未償還時間のようないくつかの他の仮定を要求する。我々が公正価値計算に用いる重要な仮定は以下のとおりである
| 2021 | 2020 | |||||||
| 加重平均無リスク金利 | % | % | ||||||
| 期待配当収益率 | % | % | ||||||
| オプションの期待寿命 | ||||||||
| 予想変動率 | % | % | ||||||
下株式オプション活動概要2020計画締め切り2021年12月31日および本年度までの変動状況を以下に示す。
| 番号をつける の株 | 重み付けの- 平均値 トレーニングをする 値段 | 重み付けの- 平均値 残り 契約書 期限(年) | 骨材 固有の 価値がある | |||||||||||||
| 2020年12月31日現在返済していません | $ | |||||||||||||||
| 授与する | ||||||||||||||||
| 鍛えられた | ||||||||||||||||
| 没収または期限切れ | ||||||||||||||||
| 2021年12月31日現在の未返済債務 | $ | $ | ||||||||||||||
| 2021年12月31日に行使できます | $ | $ | ||||||||||||||
期間に付与されたオプションの加重平均付与日公正価値2021そして2020はい$です
株式引受権証
未完済株式証明書の概要-次の表は、未償還引受権証の要約情報を提供します2021年12月31日株式承認証に関するその他の情報を以下の表に示す.
| 捜査令状説明 | 番号をつける の株 | トレーニングをする 値段 | 満期になる | ||||||
| 2020年株式承認証 | Jun 2025 | ||||||||
| 2020単位株式証明書 | Sep 2025 | ||||||||
| 2020年衆院議員権限 | Mar 2024 | ||||||||
| 2021年代表権限 | Aug 2024 | ||||||||
| 2021年株式承認証 | Sep 2026 | ||||||||
| 2021年12月31日現在の未償還株式証総数 | |||||||||
| 加重平均行権値 | $ | ||||||||
| 加重平均残存寿命(年) | |||||||||
2020株式承認証 – In June 2020, 転換債券の発行において、私たちは株式承認証を発行した
2020単位株式証 – In 2020年9月について2020私たちは公開しました
2020代表権証 – In 2020年9月私たちは発表しました
2021代表権証 – In 2021年2月私たちは発表しました
2021株式承認証 – In 2021年9月技術許可協定について発表しました
株式に基づく割増報酬
株式ベースの報酬支出を除いて2020計画(参照)株式オプション上の図)では2021年12月31日そして2020,私たちは$を認めた
| 8. | 退職計画 |
私たちは多雇用主固定借款退職計画に参加しました“401k“計画”は1名第三に-サービス提供者、当社は401kマッチングの公式に基づいてその従業員を代表して計画を行う.次の年度まで2021年12月31日そして2020世界銀行への貢献は401k計画は$
| 9. | 所得税 |
はい2021年12月31日合併した連邦純営業損失(“NOL”)繰越契約$があります
繰延所得税は、財務報告目的のための資産および負債の帳簿価値と所得税目的のための額との間の一時的な差異の純影響を反映する。繰延税金資産と負債の重要な構成要素は2021年12月31日そして2020:
| 2021 | 2020 | |||||||
| 繰延税金資産: | ||||||||
| 純営業損失が繰り越す | $ | $ | ||||||
| 研究開発税収は繰越免除 | ||||||||
| 株に基づく報酬費用 | ||||||||
| 賃金を計算すべき | ||||||||
| 繰延税金資産総額 | ||||||||
| 繰延税金負債 | ||||||||
| 減価償却 | ||||||||
| 繰延税項目純資産 | ||||||||
| 推定免税額 | ( | ) | ( | ) | ||||
| 減価準備後の繰延税項純資産 | $ | - | $ | - | ||||
私たちは将来、これらの資産を実現するために十分な課税収入を生み出す能力に不確実性があるため、繰延税項目の純資産金額に相当する全額推定準備を確立しました。米国連邦法定税率で計算された赤字所得税優遇と報告された所得税支出の入金は以下の通りである
| 2021 | 2020 | |||||||
| 税引前損失のアメリカ連邦法定税率に適用されます | $ | ( | ) | $ | ( | ) | ||
| 恒久的差異 | ||||||||
| 研究開発単位 | ( | ) | ( | ) | ||||
| 人民元建て手当の変動、期限切れ項目の控除その他の調整 | ||||||||
| 所得税費用を申告する | $ | - | $ | - | ||||
| 10. | 贈与と協力収入 |
私たちは国家アレルギー·感染症研究所(NIAID)とアメリカ国防総省から政府実体の贈与を受けて、私たちのワクチン研究開発を支援しています。私たちは精算可能な費用が発生したので、政府支出に関する収入を記録した。.の間に2021そして2020,記録しました$
| 11. | 後続事件 |
開ける January 19, 2022, 私たちは私募を完成しました
GeoVax研究所,Inc.
別表二-推定及び合資格勘定
ここ数年で2021年12月31日そして2020
| (減少を)増やす | ||||||||||||||||||||
| 説明する | 残高は 初めから 周期の | 料金は… コストと 費用.費用 | 料金は… 他にも 勘定.勘定 | 控除額 | 残高は 端部 周期の | |||||||||||||||
| 貸借対照表で適用される資産から差し引かれる準備金: | ||||||||||||||||||||
| 繰延税金資産準備 | ||||||||||||||||||||
| 2021年12月31日までの年度 | $ | $ | $ | - | $ | - | $ | |||||||||||||
| 2020年12月31日までの年度 | $ | $ | ( | ) | $ | - | $ | - | $ | |||||||||||