

2024 年 8 月公司演讲 展品 99.2

免责声明以下演示文稿, 包括这些幻灯片的任何印刷或电子副本、演讲者的演讲、任何演示和问答环节中传达的信息,以及在现场或场内分发的任何文件或材料 与演示文稿(统称为 “演示文稿”)的关联由 Cabaletta Bio, Inc.(“我们”、“我们的”、“Cabaletta” 或 “公司”)编写,用于 仅供参考。本演示文稿无意成为招股说明书,不完整或包含您可能想要的所有信息。除非另有说明,否则此处包含的声明均自本演示文稿之日起作出, 并且本演示文稿在任何情况下均不得暗示此处包含的信息在该日期之后的任何时候都是正确的,或者该信息将进行更新或修订以反映随后的信息 在本协议发布之日之后可用或发生更改。 诸如(但不限于)“期待”、“相信”、“期待”、“预测” 等词语 “估计”、“打算”、“计划”、“将”、“应该” 和 “可以” 以及类似的表述或词语可识别前瞻性陈述。各种风险、不确定性和假设 可能导致实际业绩与我们的前瞻性陈述中的预期或暗示结果存在重大差异。此类风险和不确定性包括但不限于与我们产品的成功、成本和时机相关的风险 候选药物开发活动、临床前研究和临床试验,与我们在临床前研究和临床试验中证明足够的安全性、有效性和耐受性证据的能力相关的风险;以及 CABA-201 Musk-CAART,在设计相似的结构中观察到的风险,包括但不限于给药方案,并不能表明我们希望通过 CABA-201 取得的结果,即生物活动迹象的风险 或者持续性可能无法为长期结果提供信息,在有效的 CD19-CAR t 肿瘤学研究中观察到的持续性与淋巴消耗相结合的风险并不表示也不适用于 mPV 患者的临床反应、风险 与低于预期的临床试验场所激活率或入组率有关,我们有能力在其 CABA-201 的临床前研究和临床试验中证明足够的安全性、有效性和耐受性证据;风险 对试验设计或方法的修改可能没有预期的好处,可能需要进一步修改试验设计;我们保护和维护知识产权地位的能力,与我们的关系相关的风险 第三方、与监管机构评估监管文件以及与我们的候选产品相关的其他信息相关的不确定性、我们保留和认可任何孤儿药提供的预期激励措施的能力 指定和快速通道指定、与监管申报和潜在许可相关的风险、我们的任何一个或多个候选产品无法成功开发和商业化的风险、结果的风险 临床前研究或临床研究无法预测与未来研究相关的未来结果,也无法预测与动荡的市场和经济状况以及公共卫生危机相关的风险。新的风险和不确定性可能由此产生 不时地,不可能预测所有的风险和不确定性。除非适用法律要求,否则我们不打算公开更新或修改此处包含的任何前瞻性陈述,无论是由于任何新的前瞻性陈述 信息、未来事件、情况变化或其他方面。尽管我们认为此类前瞻性陈述中反映的预期是合理的,但我们无法保证此类预期会被证明是正确的。因此, 提醒你不要过分依赖这些前瞻性陈述。对于任何此类前瞻性陈述的准确性,不作任何陈述或保证(明示或暗示)。有关这些风险和其他风险的讨论 以及不确定性和其他重要因素,其中任何一个都可能导致我们的实际业绩与前瞻性陈述中包含的业绩存在重大差异,请参阅我们最新的年度报告表中标题为 “风险因素” 的部分 10-k,以及我们在其他和随后向美国证券交易委员会提交的文件中对潜在风险、不确定性和其他重要因素的讨论。本演示文稿中包含的某些信息涉及或基于 从第三方来源获得的研究、出版物、调查和其他数据,以及公司自己的内部估计和研究。尽管该公司认为截至本演示文稿发布之日这些第三方来源是可靠的,但它 未独立核实,也未对从第三方来源获得的任何信息的充分性、公平性、准确性或完整性做出任何陈述。公司是各种商标、商品名称和服务商标的所有者。 本演示文稿中出现的某些其他商标、商品名称和服务标志是第三方的财产。仅为方便起见,本演示文稿中提及的商标和商品名称不带® 和 Tm 符号, 但不应将此类提法解释为表明其各自所有者不会根据适用法律最大限度地主张其相关权利.
开发并推出第一种疗法 针对自身免疫性疾病患者的靶向细胞疗法
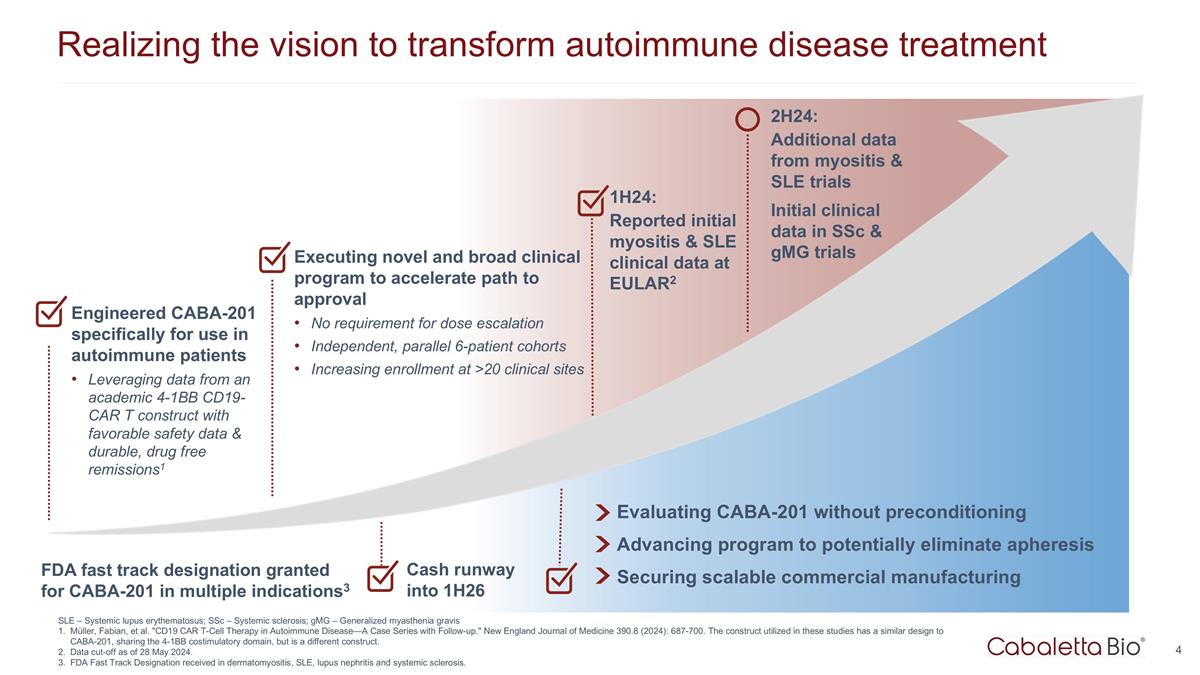
实现变革愿景 自身免疫性疾病治疗 1H24:在 EULAR2 上报告的初步肌炎和系统性红斑狼疮临床数据在没有预处理的情况下评估 CABA-201 推进可能消除血液分离的计划确保可扩展的商业制造 Cash Runway 进入 1H26 专为自身免疫患者设计的 CABA-201 利用来自学术界 4-1Bb CD19-CAR t 结构的数据,具有良好的安全数据和耐用的无药物缓解措施1 执行新颖而广泛的临床计划,以 加快获得批准的路径无需增加剂量独立的、平行的 6 名患者群组 2H24 年增加 >20 个临床场所的入学人数:来自肌炎和系统性红斑狼疮试验的更多数据 ssC 和 GmG 试验的初始临床数据 美国食品药品管理局批准了多种适应症的 CABA-201 快速通道认证3 SLE — 系统性红斑狼疮;ssC — 系统性硬化症;gmG — 全身性重症肌无力 Müller、Fabian 等“CD19 CAR T 细胞疗法 自身免疫性疾病——随访病例系列。”新英格兰医学杂志 390.8(2024):687-700。这些研究中使用的结构与 CABA-201 的设计相似,共享 4-1Bb 共刺激域,但有所不同 构造。截止日期为 2024 年 5 月 28 日。在皮肌炎、系统性红斑狼疮、狼疮肾炎和系统性硬化症方面获得了 FDA 快速通道认证。
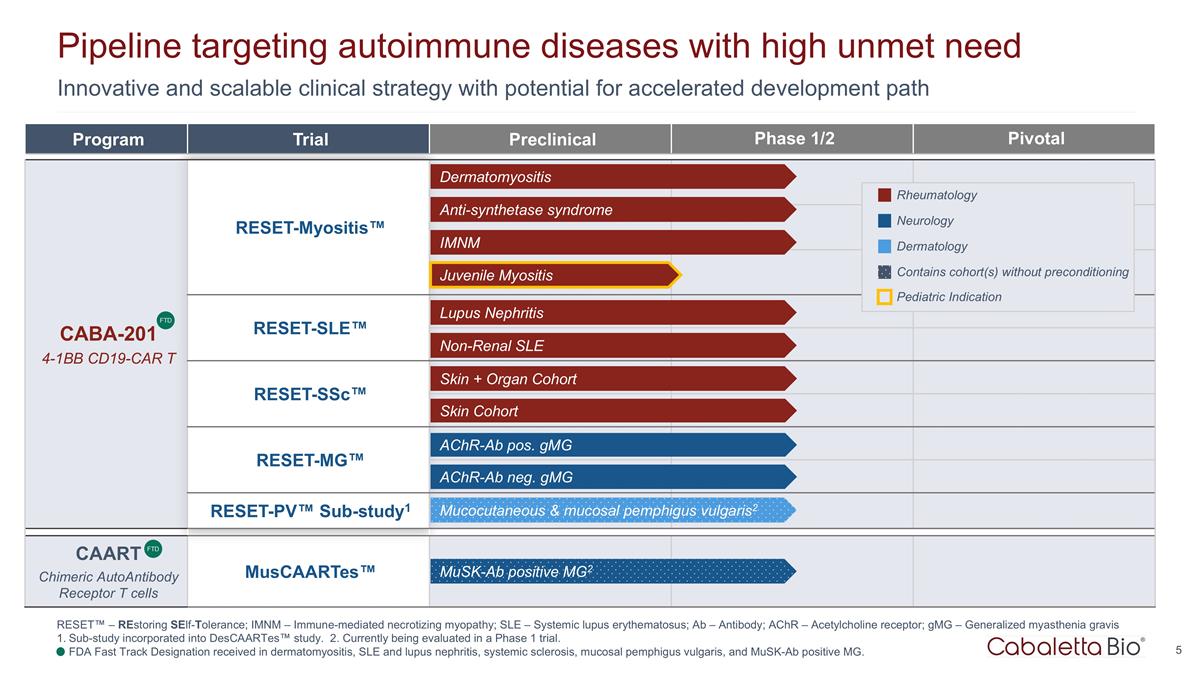
创新且可扩展的临床 有可能加快开发路径的策略研发管道针对需求量高的自身免疫性疾病项目试验 1/2 期临床前 Pivotal CABA-201 4-1Bb CD19-CAR t reset-Myositis™ CARTA 嵌合抗原受体 T 细胞 用于自身免疫 reset-SLE™ reset-SSC™ reset-MG™ reset-PV™ sub-study1 caART 嵌合自身抗体受体 t 细胞 Muscaartes™ 皮肌炎抗合成酶综合征 imnM 狼疮肾炎非肾性 SLE 皮肤 + 器官 队列 achr-ab neg. gmG achr-ab pos. gmG 皮肤队列风湿病学神经病学皮肤科 FTD 皮肤粘膜和粘膜寻常型天疱疮2 包含未预处理的队列幼年肌炎儿科适应症 musk-ab 阳性 MG2 FTD RESET™ — 恢复自我耐受;imNM — 免疫介导的坏死性肌病;SLE — 系统性红斑狼疮;Ab — 抗体;AchR — 乙酰胆碱受体;gmG — 全身性重症肌无力子研究 已纳入 Descaartes™ 研究。2.目前正在 1 期试验中进行评估。在皮肌炎、系统性红斑狼疮和狼疮肾炎、系统性硬化、寻常型粘膜天疱疮和Musk-AB阳性MG方面获得美国食品药品管理局快速通道认证。

嵌合抗原受体 t 细胞 自身免疫 CABA-201

Cabaletta 的 CD19 活页夹带有 体外和体内活性与FMC631,2(学术报告中使用的粘合剂3)相似 CABA-201:CD19-CAR t 专为自身免疫物联网设计——研究者发起的试验;Flu/Cy — Fludarabine/环磷酰胺 Peng,Binghao J, 等人。“CABA-201 是一种针对耐药性自身免疫性疾病的 CD19 CAR t 的全人类 4-1Bb 疗法,具有临床前特异性和活性。”海报发表于:美国基因与细胞疗法学会第26届年会; 2023 年 5 月 19 日;加利福尼亚州洛杉矶。戴振宇等“用于T细胞疗法的新型全人源抗CD19嵌合抗原受体的开发和功能表征。”细胞生理学杂志 236.8(2021):5832-5847。 穆勒、法比安等“自身免疫性疾病中的CD19 CAR T细胞疗法——随访案例系列。”新英格兰医学杂志 390.8(2024):687-700。作为 CT120 的一部分进行了评估,该产品是双 CD19xCD22 CAR t 候选产品 由南京艾索生物医药有限公司(IASO Bio)开发。CABA-201 中的跨膜结构域是 CD8α 与学术结构中使用的 TNFRSF19(特洛伊)的对比。这两个跨膜结构域尚未被证明具有显著的 临床前研究中功能或IFN-γ产生的差异。tisagenlecleucel 中使用了 CD8α 跨膜结构域。CABA-201 IASO 报告的肿瘤学中使用经许可的 CD19 粘合剂的临床数据4 经过全面人体粘合剂评估 作为具有标准 Flu/Cy 预处理的 CD22 粘合剂联合使用迄今为止中国物联网中约有 20 名患者报告了数据安全数据支持自身免疫发育全人类抗 CD19 粘合剂相似结合 与 FMC63 的亲和力和生物活性,与相同的表位结合1,2 4-1Bb 共刺激结构域与学术研究中使用的 costim. 结构域相同 CD3-Zeta 信号域 CABA-2015

目前正在进行系统性红斑狼疮和肌炎试验 正在报名,扩大产品组合,以实现 CABA-201 恢复自我耐受 (RESET™) 1/2 期试验的潜力,这些试验推进了 SLE — 系统性红斑狼疮;Dm — 皮肌炎;SSC — 系统性硬化;gMG — 全身性重症肌无力;ESRD — 终末期肾脏疾病 CABA-201 也将在寻常型天疱疮子研究 CABA-201 ssC gmG 2024 ~8.8万 ~5.5万 100万以上中年发病较为常见 伴有肺、心脏、肾损害的进行性皮肤和器官纤维化双模式发病年龄平均存活期 12 岁 Rheum Neuro Undiscl 出现肌无力危象的风险,呼吸衰竭 1/2 期试验 Rheum Neuro Undiscl。 美国患病率临床前自身免疫性疾病,其中 b 细胞起关键作用 SLE ~16-32万,影响年轻女性和有色人种约 40% 患有狼疮性肾炎,其在 10 年内死亡或 ESRD 的风险约为 25% > > > 肌炎 ~68k 典型的中年发病只有经美国食品药品管理局批准的治疗才是 Dm 中的 IvIG 由于肺部和心脏受累导致的高死亡率 >
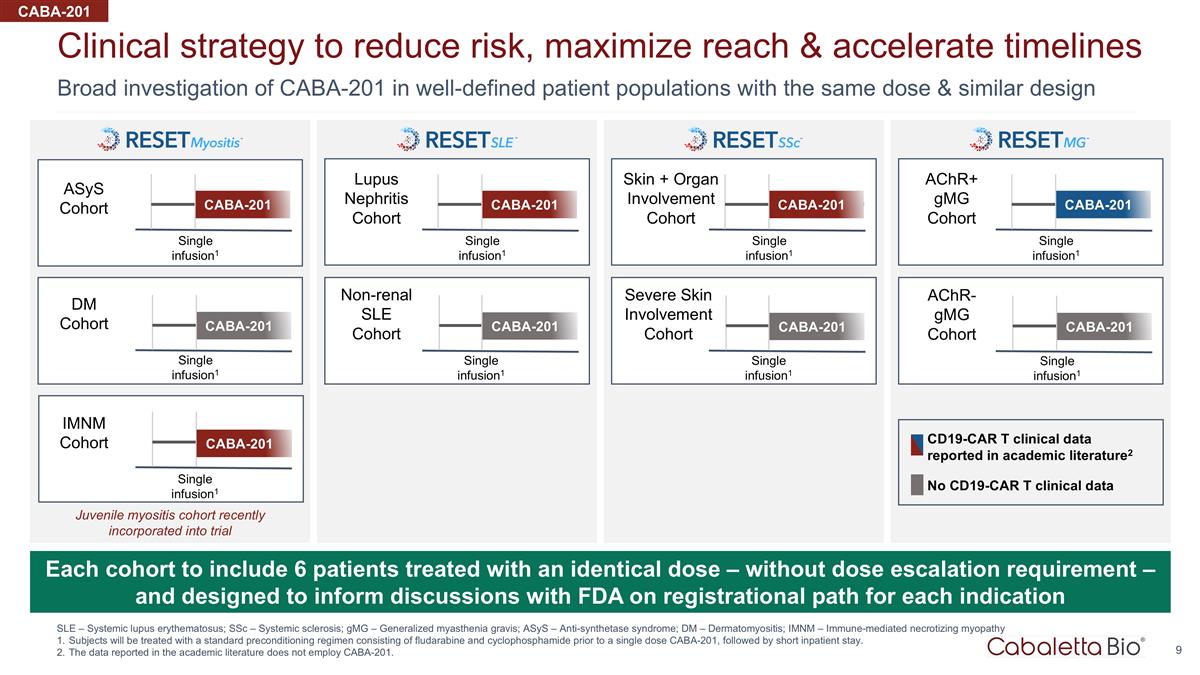
对 CABA-201 的广泛调查 定义明确的患者群体、相同剂量和相似设计的临床策略,以降低风险、最大限度地扩大覆盖范围并加快进度 SLE — 系统性红斑狼疮;ssC — 系统性硬化;gmG — 广义 重症肌无力;ASYs — 抗合成酶综合征;Dm — 皮肌炎;imNM — 免疫介导的坏死性肌病受试者将接受由氟达拉滨和环磷酰胺组成的标准预处理方案进行治疗 在单剂量 CABA-201 之前,随后是短暂的住院时间。学术文献中报告的数据不使用 CABA-201。每个队列将包括6名接受相同剂量治疗的患者——无剂量递增要求 — 旨在为与美国食品和药物管理局就每种适应症的注册路径进行的讨论提供信息 CABA-201 ASYs 队列单次输液1 CABA-201 imnM 队列单次输液1 Dm 队列 CABA-201 皮肤 + 器官受累队列 CABA-201 achr+ gMG 队列 CABA-201 狼疮肾炎队列 CABA-201 非肾性系统性红斑狼疮队列严重皮肤受累队列 achr-gmG 队列 CABA-201 CABA-201 CABA-201 无 CD19-CAR t 临床数据 CD19-CAR t 学术文献中报告的临床数据 t 临床数据2 单次输液1 单次输液 infusion1 单次输液1 单次输液1 单次输液1 单次输液1 单次输液1 CABA-201 青少年肌炎队列最近纳入试验
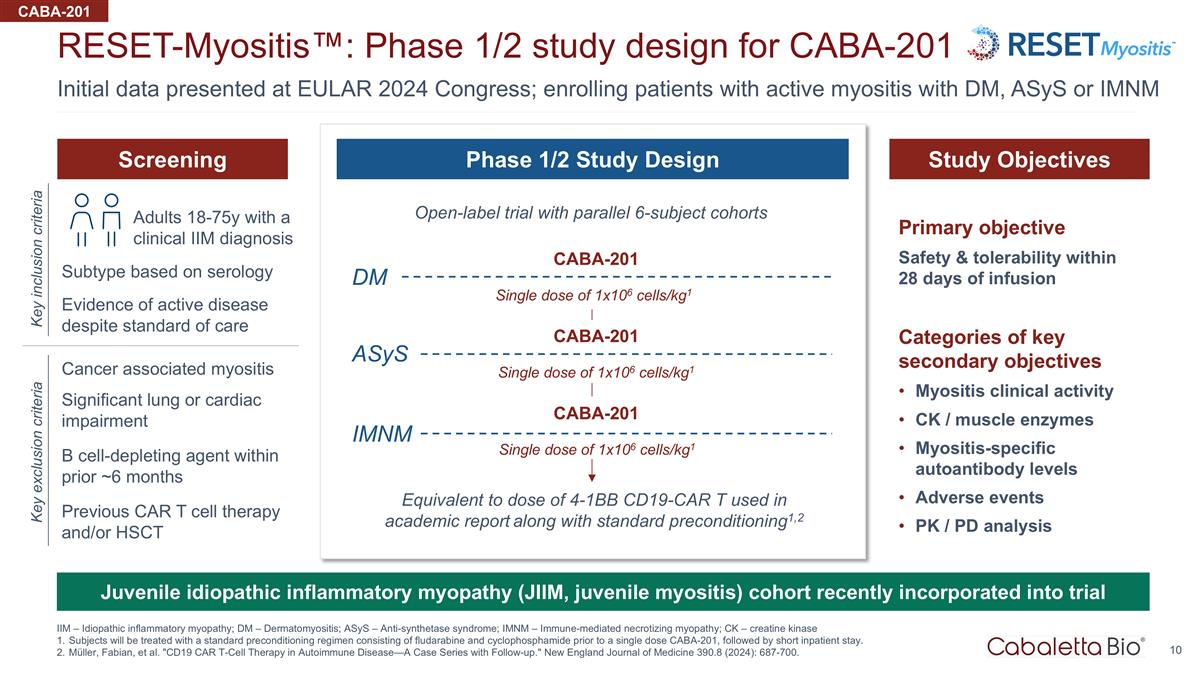
在 EULAR 上提供的初始数据 2024 年国会;招收患有 Dm、ASYs 或 imNM reset-Myositis™ 的活动性肌炎患者:CABA-201 IIM — 特发性炎性肌病;Dm — 皮肌炎;ASYS — 抗合成酶综合征的1/2期研究设计; imNM — 免疫介导的坏死性肌病;Ck — 肌酸激酶受试者将在单剂量 CABA-201 之前接受由氟达拉滨和环磷酰胺组成的标准预处理方案进行治疗,然后是短剂量 住院。穆勒、法比安等“自身免疫性疾病中的CD19 CAR T细胞疗法——随访案例系列。”新英格兰医学杂志 390.8(2024):687-700。CABA-201 在过去约 6 个月内被视为细胞消耗剂 主要目标输液后 28 天内的安全性和耐受性关键次要目标类别肌炎临床活性 Ck/肌肉酶肌炎特异性自身抗体水平不良事件 Pk/PD 分析开放标签试验 平行 6 名受试者队列相当于学术报告中使用的 4-1Bb CD19-CAR t 剂量以及标准预先条件1,2 筛查研究目标 1/2 阶段研究设计尽管有标准护理但仍存在活动性疾病的证据关键包括 标准癌症相关性肌炎关键排除标准严重的肺部或心脏损伤经临床诊断的 18-75 岁成年人单剂量 1x106 个细胞/kg1 CABA-201 单剂量 1x106 个细胞/kg1 单剂量 1x106 个细胞/kg1 CABA-201 单剂量 1x106 cells/kg1 CABA-201 Dm imNM 先前基于血清学的 CAR t 细胞疗法和/或 hSCT 亚型幼年特发性炎症性肌病(JiiM,幼年肌炎)队列最近纳入试验
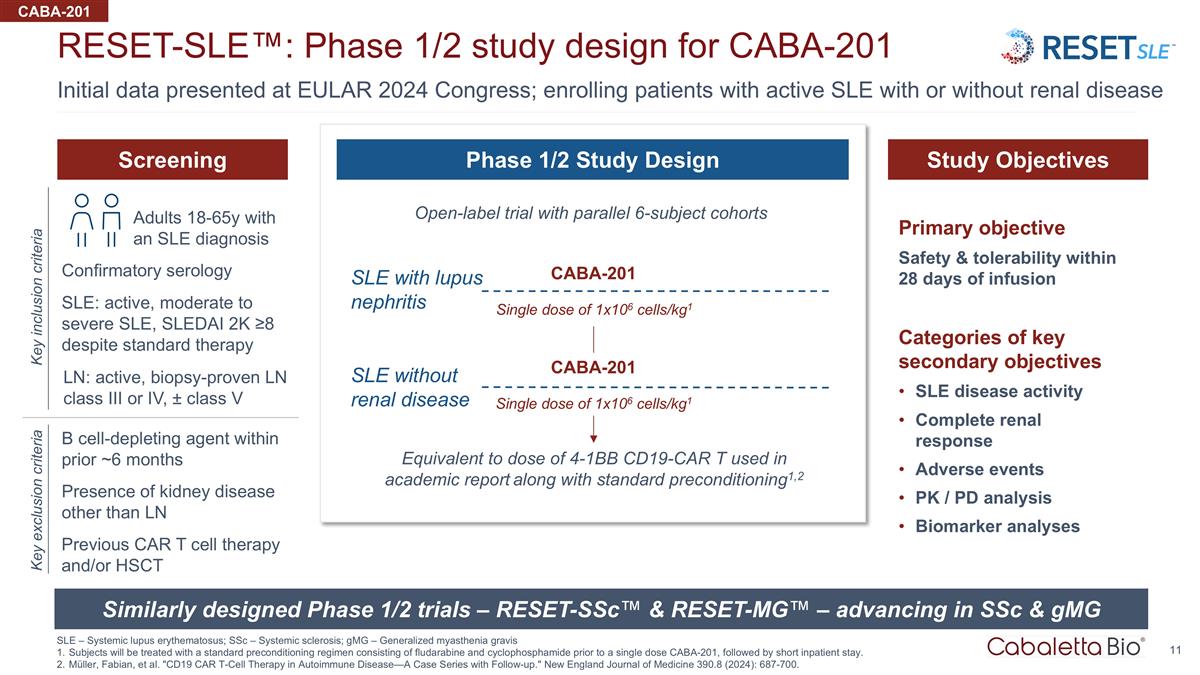
在 EULAR 上提供的初始数据 2024 年国会;招收伴或不伴有肾脏疾病的活动性系统性红斑狼疮患者 reset-SLE™:CABA-201 SLE — 系统性红斑狼疮 1/2 期研究设计;ssC — 系统性硬化;gmG — 全身性重症肌无力 在单剂量 CABA-201 之前,受试者将接受由氟达拉滨和环磷酰胺组成的标准预处理方案进行治疗,然后是短期住院。穆勒、法比安等“CD19 CAR T 细胞疗法在自身免疫中的应用 疾病——随访病例系列。”新英格兰医学杂志 390.8(2024):687-700。CABA-201 SLE 伴狼疮肾炎无肾脏疾病的 SLE 与 6 位受试者平行队列的开放标签试验相当于 4-1Bb CD19-CAR T 的剂量 与标准前提条件一起用于学术报告1,2 筛选研究目标 1/2 期研究设计类似设计的 1/2 期试验 — reset-SSC™ 和 reset-MG™ — 在 ssC 和 gMG 确认方面取得进展 血清学 b 细胞消耗剂在过去 6 个月内 SLE:活动性、中度至重度 SLE,尽管采用标准疗法,SLEDAI 0.2万 ≥8 关键纳入标准 LN 以外的肾脏疾病的存在关键排除标准单剂量 1x106 cells/kg1 CABA-201 单剂量 1x106 个细胞/kg1 CABA-201 诊断为 SLE 的 18-65 岁成人主要目标输液后 28 天内的安全性和耐受性关键次要目标类别系统性红斑狼疮疾病活动完全肾脏反应 不良事件 Pk/PD 分析生物标记物分析 LN:活性、经活检验证的 LN III 级或 IV 级,± V 级以前的 CAR t 细胞疗法和/或 HSCT
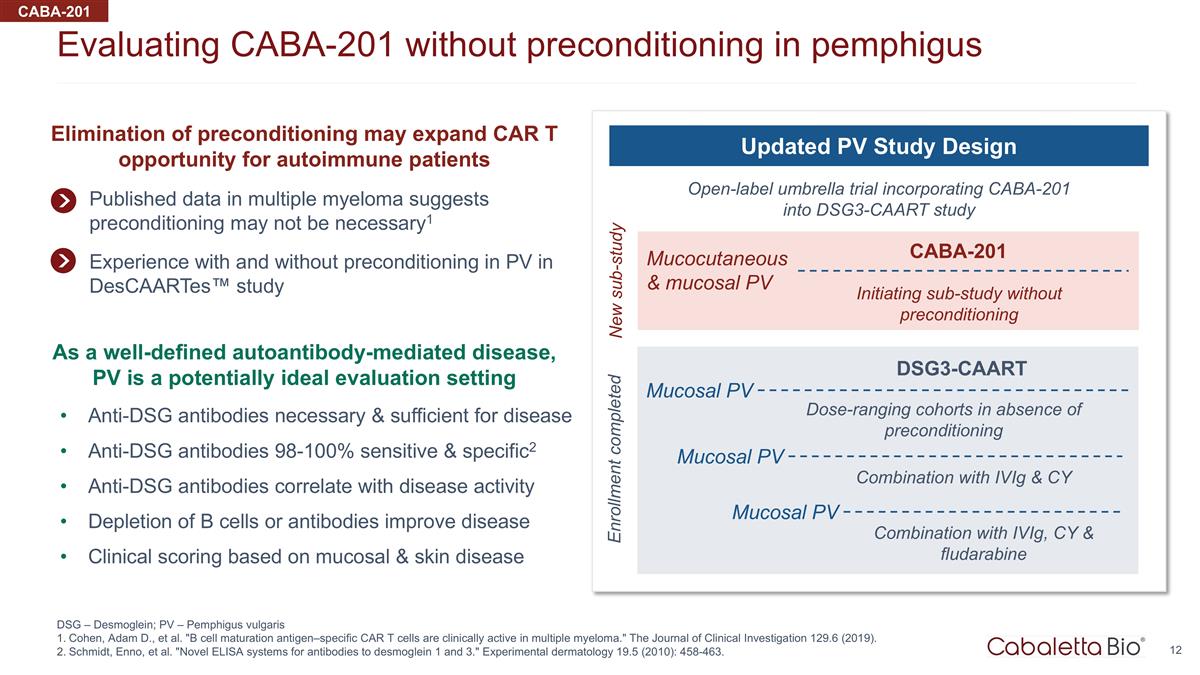
在不使用 CABA-201 的情况下评估 天疱疮预处理 DSG — Desmoglein; PV — 寻常型天疱疮 Cohen、Adam D. 等“b 细胞成熟抗原特异性 CAR t 细胞在多发性骨髓瘤中具有临床活性。”临床杂志 调查 129.6 (2019)。施密特、恩诺等“用于桥粒细胞 1 和 3 抗体的新型 ELISA 系统。”实验皮肤病学 19.5(2010):458-463。CABA-201 公布的多发性骨髓瘤数据表明预处理可能不是 必要1 在 Descaartes™ 研究中对光伏进行预处理和未进行预处理的经验将 CABA-201 纳入 DSG3-CAART 研究的开放标签伞式试验更新的 PV 研究设计皮肤粘膜和粘膜 PV 在没有皮肤和粘膜 PV 的情况下启动子研究 预处理 CABA-201 新子研究作为一种定义明确的自身抗体介导疾病,PV 是一种潜在的理想评估设定了疾病抗 DSG 抗体所必需且足够的 98-100% 敏感性和特异性2 抗 DSG 抗体与疾病活性相关性 b 细胞或抗体消耗可改善疾病基于粘膜和皮肤病的临床评分取消预处理可能会扩大自身免疫患者的 CAR t 机会 在没有预处理的情况下,剂量范围的队列 dsg3-CAART 粘膜 PV 组合与 iViG 和 CY 粘膜 PV 组合以及 iViG、CY 和氟达拉滨粘膜 PV 注册已完成
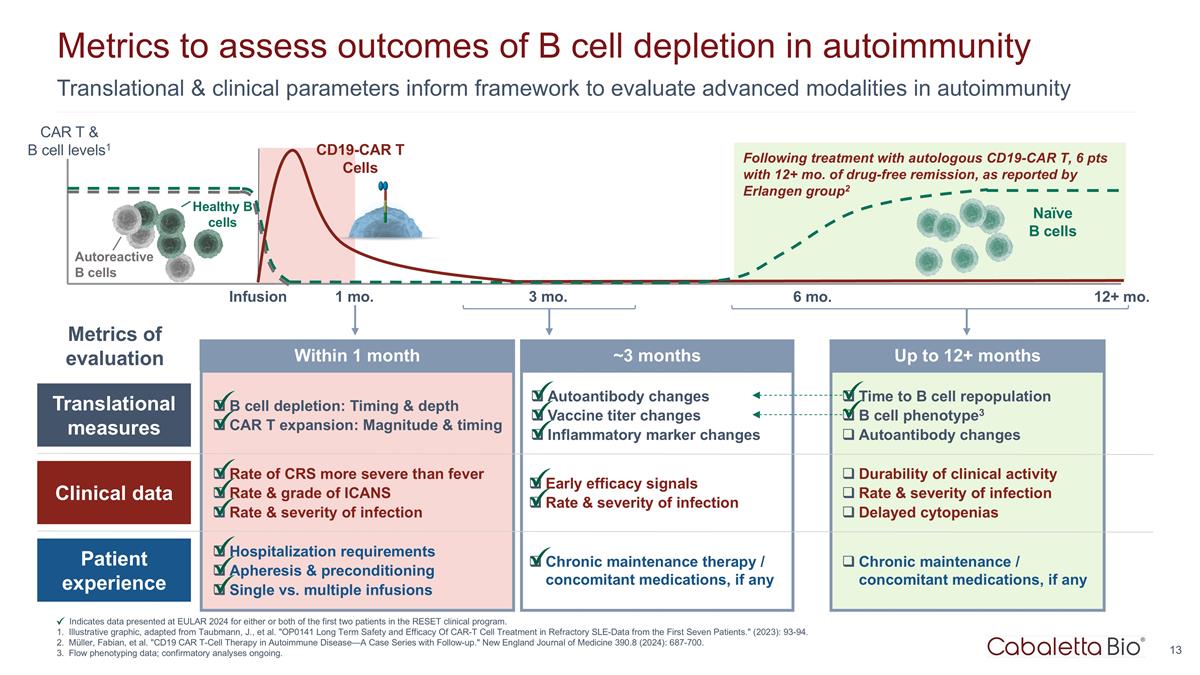
是 b 细胞重组的时候了 b 细胞 phenotype3 自身抗体变化临床活性的耐久性感染率和严重程度延迟性血细胞减少慢性维持/伴随用药物(如果有)长达 12 个月以上的转化与临床参数为框架 评估自身免疫指标中的先进模式以评估自身免疫中b细胞消耗的结果表明在EULAR 2024上提供的有关reSET临床项目中前两名患者中任一或两名患者的数据。说明性图形, 改编自 Taubmann, J. 等人。“OP0141 在前七名患者的难治性 SLE-数据中CAR-T细胞治疗的长期安全性和有效性。”(2023年):93-94。穆勒、法比安等“CD19 CAR T 细胞疗法在自身免疫性疾病中的应用—— 附有后续行动的案例系列。”新英格兰医学杂志 390.8(2024):687-700。流量表型数据;确认性分析正在进行中。据报道,在使用自体 CD19-CAR t 治疗后,6 分,无药物缓解期超过 12 个月 Erlangen group2 输液 1 个月 3 个月 12+ 第 6 个月CD19-CAR t Cells Naíve b 细胞健康 b 细胞自反应 b 细胞 CAR t 和 b 细胞水平1 转化测量临床数据 b细胞消耗患者体验:时间和深度 CAR T 扩展:CRS 的幅度和时机比发烧更严重的比率和 ICANS 的等级感染率和严重程度住院要求血液分离和预处理单次输液与多次输液自身抗体变化疫苗 滴度变化炎症标志物变化早期疗效信号感染率和严重程度慢性维持治疗/伴随药物(如果有)在 1 个月内~3 个月内评估指标
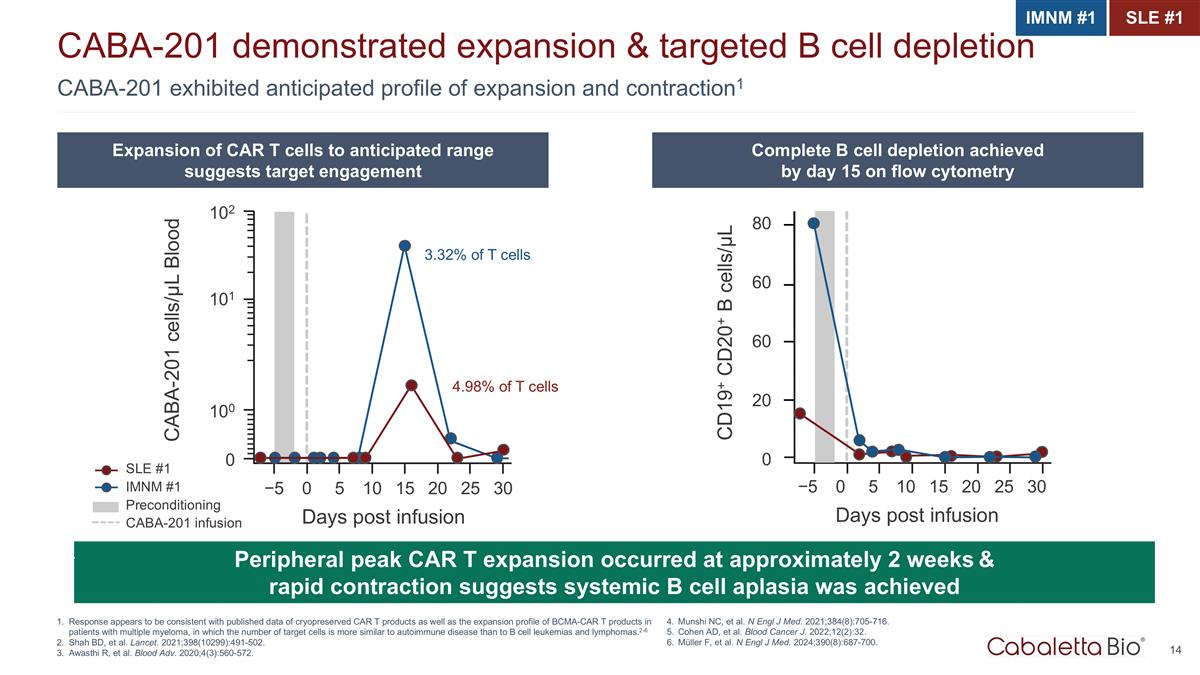
CABA-201 预计展出 膨胀和收缩概况1 CABA-201 显示了膨胀和靶向 B 细胞耗尽反应似乎与冷冻保存的 CAR T 产品的已发布数据以及 BCMA-CAR T 产品的膨胀概况一致 多发性骨髓瘤患者,其中靶细胞的数量与自身免疫性疾病的数量比 B 细胞白血病和淋巴瘤更相似。2-6 Shah BD 等人。《柳叶刀》,2021;398(10299):491-502。Awasthi R 等人。Blood Adv.2020; 4 (3): 560-572。 IMNM #1 SLE #1 CAR T 细胞扩展到预期范围表明靶向参与流式细胞术在第 15 天完成了 B 细胞耗竭外周峰值 CAR T 扩张发生在大约 2 周且快速收缩表明 全身 B 细胞再生障碍实现了 4.98% 的 T 细胞 3.32% CABA-201 细胞/µL 血液 102 101 100 0 −5 0 5 10 15 20 25 30 天输液后 SLE #1 IMNM #1 预处理 CABA-201 输液 CD19+ CD20+ B 细胞/µL 60 80 60 20 0 −5 0 5 10 15 20 25 30 天输液后 Munshi NC 等人N Engl J Med. 2021; 384 (8): 705-716。Cohen AD 等人《血液癌》杂志,2022年;12(2):32。Müller F 等人。N Engl J Med. 2024; 390 (8): 687-700。
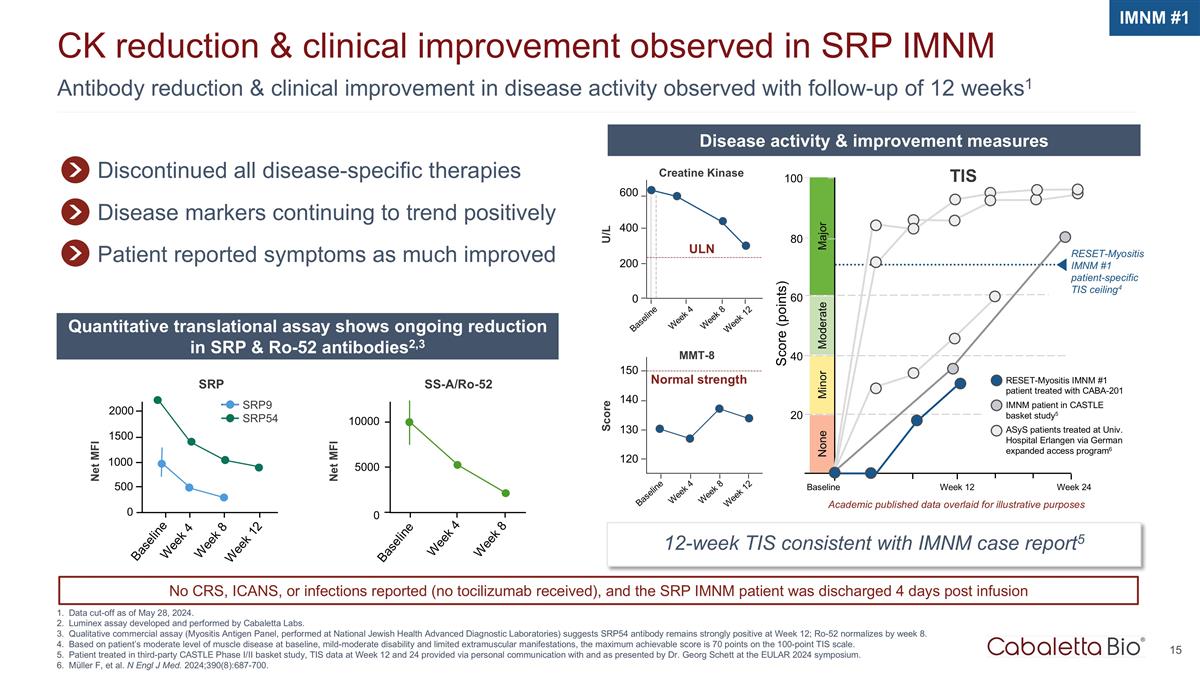
抗体还原和临床 截至2024年5月28日,在SRP iMNM数据截止日期中观察到的12周随访1Ck减少和临床改善,观察到疾病活动有所改善。Luminex 检测由 Cabaletta Labs 开发和执行。定性商业试验 (在国家犹太人健康高级诊断实验室进行的肌炎抗原小组)显示,SRP54 抗体在第 12 周保持强劲阳性;Ro-52 到第 8 周恢复正常。基于患者中等程度的肌肉疾病 基线、轻度至中度残疾和有限的肌外表现,根据TIS的100分量表,最高可达到的分数为70分。在第三方 CASTLE I/II 期篮子研究中接受治疗的患者,第 12 周和第 24 周的 TIS 数据通过 与 Georg Schett 博士在 EULAR 2024 年研讨会上的个人沟通,并由他主持。Müller F 等人N Engl J Med. 2024; 390 (8): 687-700。iMNM #1 已停止所有疾病特异性疗法疾病标志物继续呈正向趋势 患者报告的症状大大改善了疾病活性和改善措施定量转化分析显示 SRP 和 Ro-52 抗体持续减少2,3 12 周 TIS 与 iMNM 病例报告一致 5 基线周 4 ULN U/L 600 400 0 第 8 周 12 周肌酸激酶正常强度 mmt-8 150 140 130 120 基线周 4 周第 8 周 12 分主要分数(分数)100 80 轻度中度 60 40 20 周基线周 12 无重置肌炎 imnM #1 患者特异性 TIS ceiling4 TIS reset-myositis imnM #1 患者在 CASTLE basket 研究中与 CABA-201 imNM 患者一起接受治疗 5 ASYs 患者在大学接受治疗埃尔兰根医院通过德国扩大准入计划6 学术界发布的数据叠加用于说明目的 SRP9 SRP54 SS-a/RO-52 第 8 周第 4 周基线 10000 5000 0 第 8 周基线 1500 500 2000 周 12 1000 0 Net MFI Net MFI SRP 未报告 CRS、ICANS 或感染情况(未收到托珠单抗),SRP iMNM 患者在 4 天后出院 输液
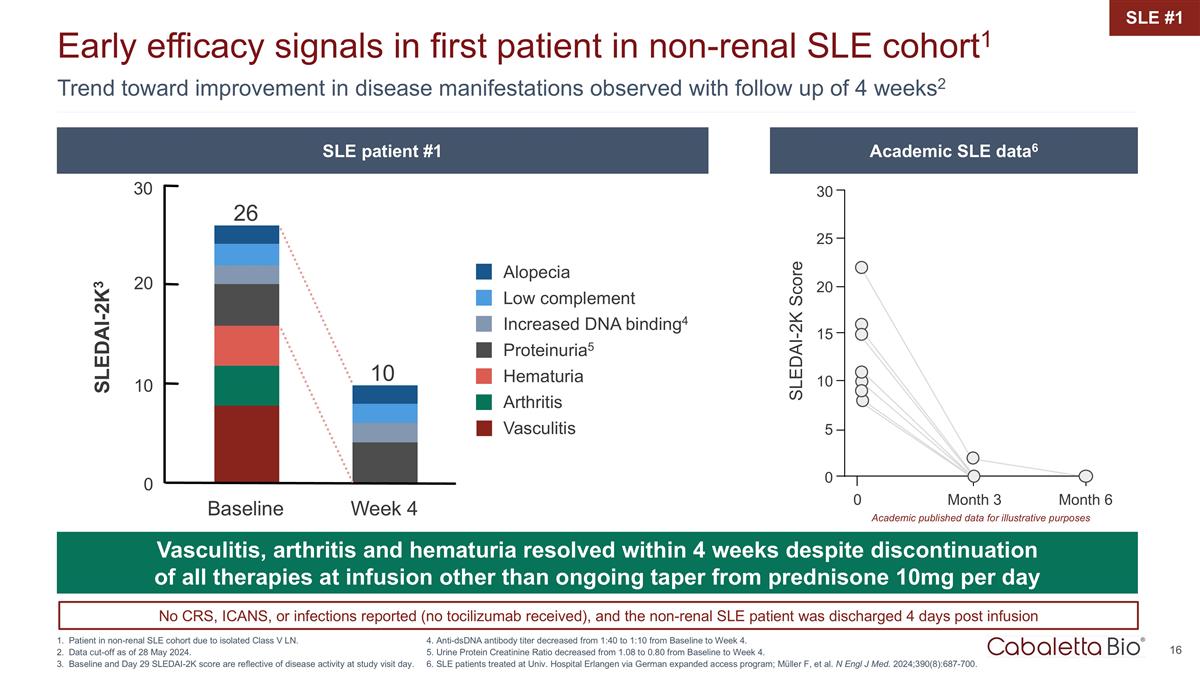
0 0 个月 3 个月 6 个 SLEDAI-0.2万分数 25 20 30 10 5 15 学术界发布的数据用于说明目的 4 周随访观察到的疾病表现有改善的趋势2 非肾性系统性红斑狼疮队列中首位患者的早期疗效信号 1 非肾性系统性红斑狼疮患者 由于孤立的 V 类 LN 而导致的队列。截止日期为 2024 年 5 月 28 日。基线和第29天的SLEDAI-0.2万分数反映了研究访问当天的疾病活动。SLE #1 尽管停药,但血管炎、关节炎和血尿在 4 周内得到缓解 在所有输液疗法中,除了持续逐渐减少泼尼松 10 毫克每天 10 毫克脱发低补体增加了 DNA 结合4 proteinuria5 血尿关节炎血管炎 26 10 20 SLEDAI-2K3 10 0 基线周 4 30 SLE 患者 #1 Academic SLE 患者 Academic SLE data6 4.从基线到第 4 周,抗 dsDNA 抗体滴度从 1:40 降至 1:10。5.从基线到第4周,尿蛋白肌酐比率从1.08降至0.80。6.在大学接受治疗的系统性红斑狼疮患者通过德国扩建的埃尔兰根医院 访问程序;Müller F 等N Engl J Med. 2024; 390 (8): 687-700。未报告CRS、ICANS或感染(未接受托珠单抗),非肾性系统性红斑狼疮患者在输液 4 天后出院
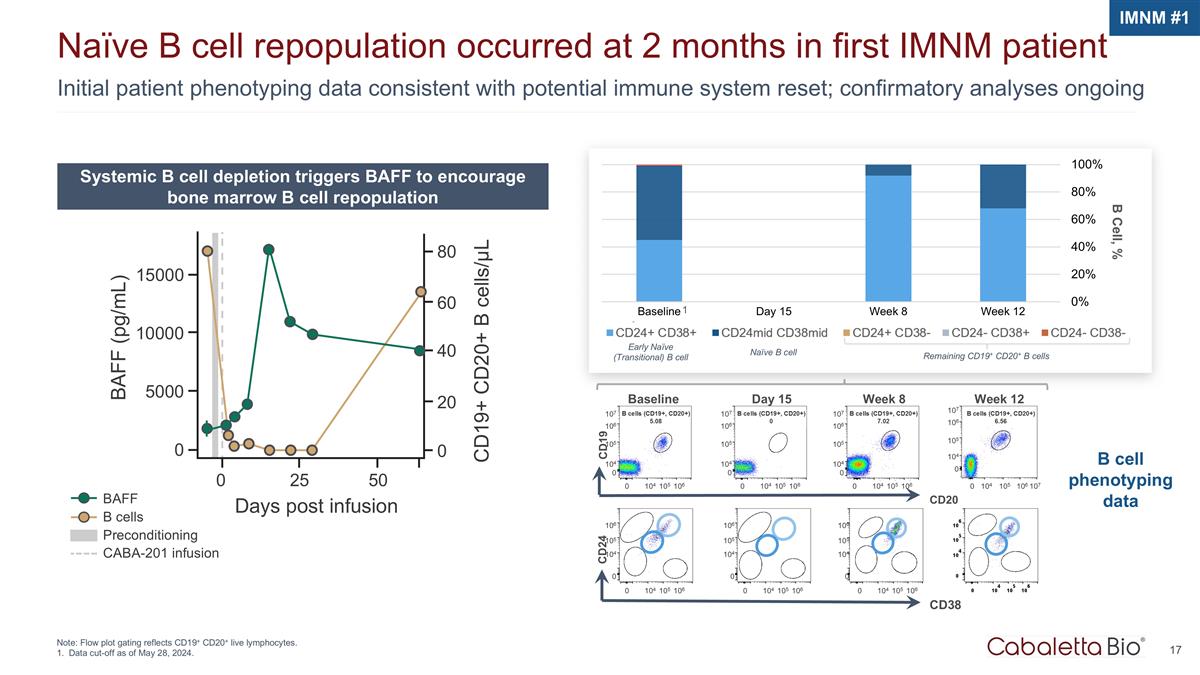
BAFF b 细胞预处理 CABA-201 输液初始患者表型数据与潜在的免疫系统重置一致;确认性分析仍在进行中 Naíve b 细胞重组发生在首位 imNM 患者 2 个月时注意:流程图门控反映 CD19+ CD20+ 活淋巴细胞。截止日期为2024年5月28日。系统性 b 细胞消耗触发 BAFF 促进骨髓 b 细胞重组 imnM #1 15000 10000 5000 0 0 25 50 天输液后 CD19+ CD20+ b 细胞/µL BAFF (pg/mL) 80 60 40 20 0 B 细胞,% CD20 基线 CD19 107 106 105 104 0 0 0 104 106 1050细胞(CD19+、CD20+)5.08 周 12 107 106 104 0 0 104 0 104 0 104 104 0 104 104 0 104 104 0 104 0 第 8 周 107 106 105 104 0 0 周 8 107 106 104 0 0 104 106 1050细胞(CD19+,CD20+)7.02 CD38 CD24 106 106 104 0 0 0 104 106 106 105 105 105 105 104 0 0 104 0 104 0 0 0 0 104 0 0 104 0 0 104 104 0 0 104 104 104 106 1050细胞表型数据 1 早期天真(过渡)b 细胞天真 b 细胞剩余 CD19+ CD20+ b 细胞

分阶段的方法允许 有效配置资本,同时利用经验丰富的合作伙伴制造战略后期和商业化:扩大规模和商业化数据门控、分阶段投资早期阶段:宾夕法尼亚大学、CDMO和CABA流程正在进行宾夕法尼亚大学有 多年来可靠地提供及时的产品扩大了载体和细胞产品供应方面的商用CDMO合作伙伴关系工艺开发工作步入关键研究的商业化就绪流程评估实现商业化就绪的路径 制造:扩大CDMO关系自动化制造的机会卡巴莱塔运营的工厂战略合作伙伴关系持续关注创新以解决规模问题内部计划Cellares技术评估计划 先进的
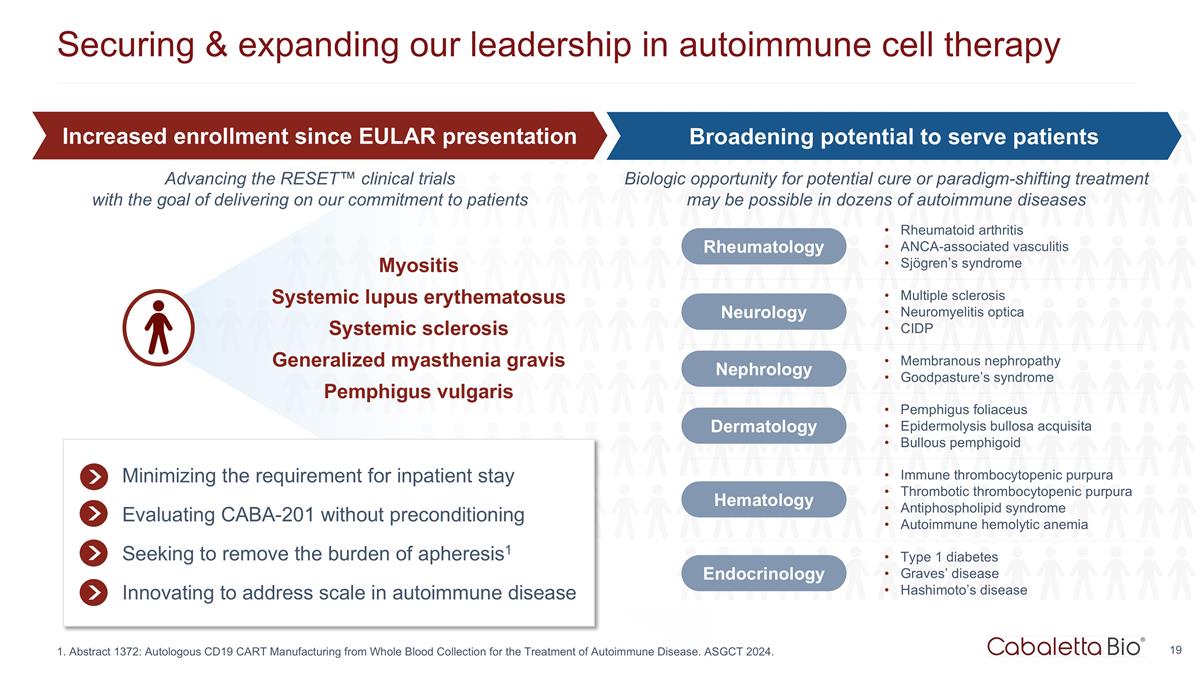
保护和扩展我们的 自身免疫细胞疗法的领导地位肌炎系统性红斑狼疮系统性硬化症全身性肌无力重症寻常型天疱疮尽量减少住院要求无需预处理即可评估 CABA-201 消除血管失调的负担1 创新解决自身免疫性疾病的规模问题免疫性血小板减少性紫癜血栓性血小板减少性紫癜抗磷脂综合征自身免疫性溶血性贫血血液学 1 型糖尿病 Graves' 疾病桥本氏病内分泌学风湿病学类风湿关节炎 ANCA 相关血管炎 Sjögren 综合征神经病学多发性硬化视神经脊髓炎 CIDP 肾脏病膜性肾病 Goodpasture's 综合征皮肤科叶型天疱疮 Epidermolysis bullosa acquisita bullosa acquisita 大疱性类天疱疮自 EULAR 出现以来入学人数增加扩大为患者服务的潜力扩大潜在治愈或改变模式的治疗的生物学机会 可能用于数十种自身免疫性疾病推进RESET™ 临床试验,目标是兑现我们对患者的承诺 1.摘要 1372:通过采集全血来制造自体 CD19 cART 进行治疗 自身免疫性疾病。ASGCT 2024。

企业摘要

运营成功记录 评估自身免疫领域的新型细胞疗法候选药物 Cabaletta Bio 领导团队 Anup Marda 首席财务官 Arun Daswand.D. 首席商务官 David J. Changwan.D.D.万.P.H.,FACR 首席医学官玛莎·奥康纳 首席人力资源官迈克尔·杰拉德总法律顾问史蒂芬·尼希特伯格万德总裁、首席执行官兼董事长希瑟·哈特-霍尔首席合规官萨米克·巴苏万德首席科学官格温多琳·宾德博士科学与技术总裁 科学顾问委员会 Aimee Paynewand.D.,博士,联合创始人兼联席主席 Michael C. Milonewand.D.,博士联合创始人兼联席主席 Carl Junewand.D. Jay Siegelwand.D. Brian Danielswand.D.,Drew Weissmanwand.D.,博士。Iain McInnes,博士,FRCP,FRSE, FMedSci Georg Schettwand.D. 董事会 Steven Nichtbergerwand.D. Richard Henriques Scott Brunwand.D. Mark Simon Catherine Bollardwand.D.《财富》杂志的肖恩·托马塞洛。©2023 财富媒体知识产权有限公司。版权所有。经许可使用。 Sarah Yuan 首席技术官
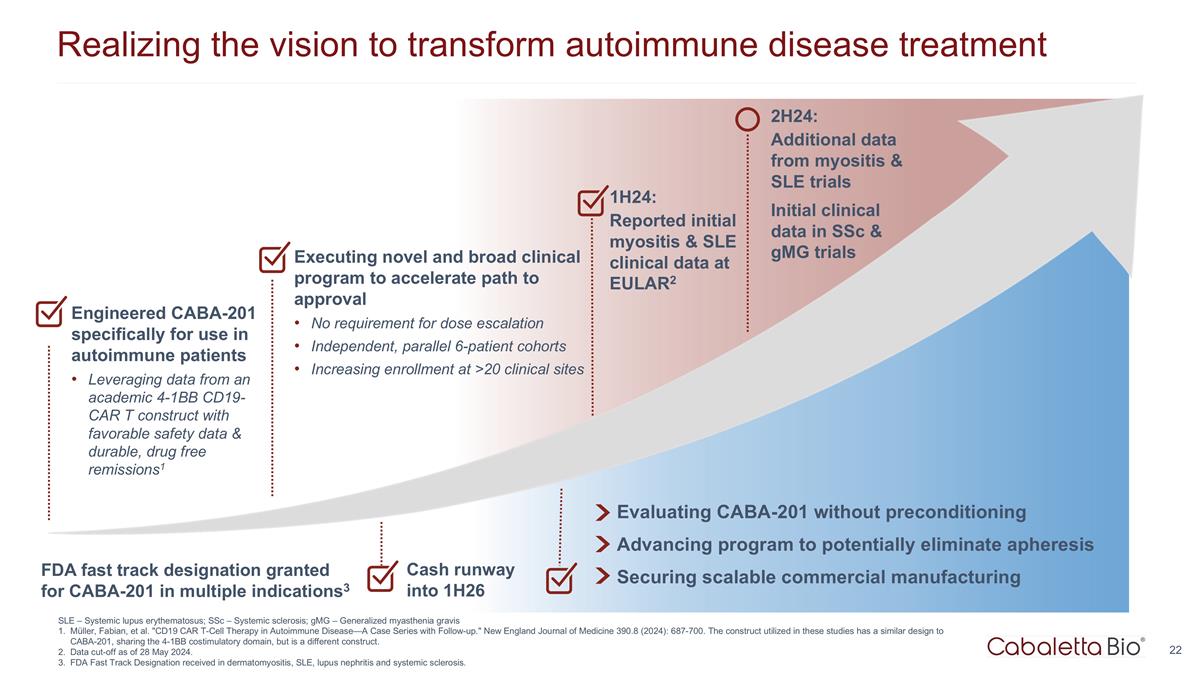
实现变革愿景 自身免疫性疾病治疗 1H24:在 EULAR2 上报告的初步肌炎和系统性红斑狼疮临床数据在没有预处理的情况下评估 CABA-201 推进可能消除血液分离的计划确保可扩展的商业制造 Cash Runway 进入 1H26 专为自身免疫患者设计的 CABA-201 利用来自学术界 4-1Bb CD19-CAR t 结构的数据,具有良好的安全数据和耐用的无药物缓解措施1 执行新颖而广泛的临床计划,以 加快获得批准的路径无需增加剂量独立的、平行的 6 名患者群组 2H24 年增加 >20 个临床场所的入学人数:来自肌炎和系统性红斑狼疮试验的更多数据 ssC 和 GmG 试验的初始临床数据 美国食品药品管理局批准了多种适应症的 CABA-201 快速通道认证3 SLE — 系统性红斑狼疮;ssC — 系统性硬化症;gmG — 全身性重症肌无力 Müller、Fabian 等“CD19 CAR T 细胞疗法 自身免疫性疾病——随访病例系列。”新英格兰医学杂志 390.8(2024):687-700。这些研究中使用的结构与 CABA-201 的设计相似,共享 4-1Bb 共刺激域,但有所不同 构造。截止日期为 2024 年 5 月 28 日。在皮肌炎、系统性红斑狼疮、狼疮肾炎和系统性硬化症方面获得了 FDA 快速通道认证。

八月企业演讲 2024