

2023 年 12 月 PRECISION1 三分之一 中期分析 NAB-sirolimus 的 PRECISION1 试验显示 TSC1 或 TSC2 失活改变对多种实体瘤具有抗肿瘤活性,表现出 99.2

前瞻性陈述肯定 本演示文稿中包含的关于非历史事实事项的陈述,是经修订的1934年《证券交易法》第21E条和私人证券诉讼所指的前瞻性陈述 1995 年法案,被称为 PSLRA。其中包括有关管理层意图、计划、信念、预期或未来预测的声明,因此,提醒您不要过分依赖它们。前瞻性 声明可能包括但不限于以下方面的声明:Aadi Bioscience, Inc.(“Aadi”)临床试验的预计开始、注册、数据发布和完成时间,包括预期的全面临床试验 在 2024 年春季之前注册 PRECISION 1 试验,预计 PRECISION 1 在 2024 年第三季度进行三分之二的中期分析,PRECISION1 研究预计在 2024 年底之前完成,最终的 PRECISION1 数据预计将在年初公布 2025 年;管理层认为公司有望在 PRECISION 1 研究中提供更多临床证据,并推进nab-sirolimus的注册进程;监管机构申报和批准的时间和可能性 新适应症的FYARRO;基于Aadi临床试验数据的潜在催化剂的预期时机;Aadi的预期现金流;Aadi成为领先精准肿瘤公司的潜力;以及预测 伴有TSC1和TSC2改变的癌症的年发病率及相关的市场机会。任何前瞻性陈述都无法保证,实际结果可能与预期有重大差异。Aadi 使用诸如此类的词语 “预期”、“相信”、“计划”、“期望”、“项目”、“打算”、“可能”、“将”、“应该”、“可能”、“估计” “预测”、“潜力”、“继续” 和类似表述来识别PSLRA安全港条款所涵盖的这些前瞻性陈述。此类前瞻性陈述 基于我们的预期,涉及风险和不确定性;因此,由于多种因素,包括但不限于不确定性,实际结果可能与声明中表达或暗示的结果存在重大差异 与FYARRO的临床开发和监管批准有关,包括临床试验开始、注册和完成方面的潜在延迟;与发布中期、头条和初步数据相关的风险 临床试验;Aadi开发和商业化FYARRO®(nab-sirolimus,ABI-009)的计划;Aadi的商业化、营销和制造能力和战略;临床效用、潜在优势和市场 对FYARRO的接受;与Aadi现金余额足以为运营提供资金相关的风险;Aadi研究、开发和商业化其当前和未来候选产品的计划;Aadi识别其他候选产品的能力 具有巨大商业潜力的产品或候选产品;与市场规模、Aadi的竞争对手及其行业相关的发展和预测;政府法律法规的影响;Aadi保护其的能力 知识产权状况;以及Aadi对未来收入、支出、资本要求和额外融资需求的估计。Aadi的 “风险因素” 标题下详细描述了这些风险 截至2023年9月30日的季度10-Q表季度报告于2023年11月8日提交给美国证券交易委员会(“SEC”),以及不时向美国证券交易委员会提交的其他文件。前瞻性 本演示文稿中包含的陈述基于Aadi截至本演示之日获得的信息。除非法律要求,否则Aadi没有义务修改或更新任何前瞻性陈述,无论结果如何 新信息、未来事件或其他信息。
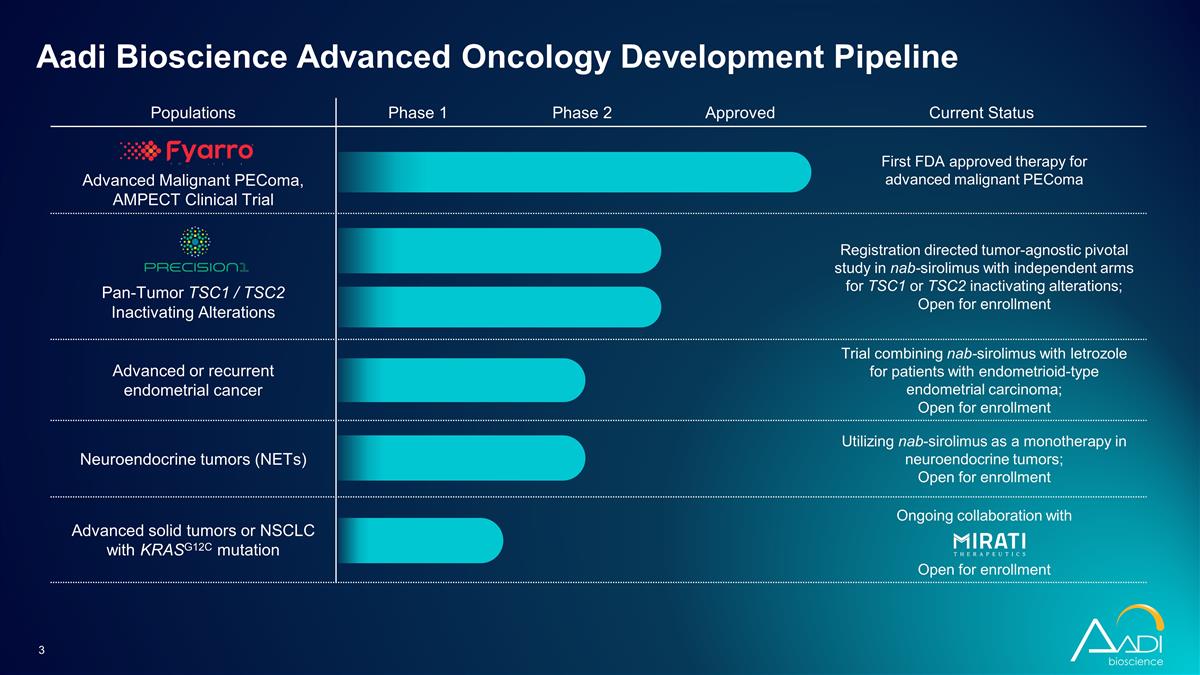
人群第 1 阶段第 2 阶段已获批准 当前状态晚期恶性 pecoMA,AMPect 临床试验首个 FDA 批准的晚期恶性 peeComa 泛肿瘤疗法 TSC1/TSC2 灭活改变注册指导肿瘤的与肿瘤无关的关键性研究 nab-sirolimus 针对 TSC1 或 TSC2 失活变异的独立分组;开放报名泛肿瘤 TSC2 失活改变针对子宫内膜样型患者的晚期或复发性子宫内膜癌试验 nab-sirolimus 和来曲唑联合使用 nab-sirolimus 和 letrozole 子宫内膜癌;开放注册神经内分泌肿瘤 (NET) 利用 nab-sirolimus 作为神经内分泌肿瘤的单一疗法;开放注册带有 KRASG12C 突变的晚期实体瘤或 NSCLC 正在与 Open 合作 供注册 Aadi Bioscience 高级肿瘤学开发管线

TSC1 和 TSC2 变更:密钥 mTOR 途径中的致癌驱动因素 mTOR 信号通路 mTOR S0.6万 4EBP1 Rheb Raptor PDK1 ampK Akt TSC1/ TSC2 LKB1 (STK11) eRk Mek Raf Ras 在 TSC1 和 TSC2 中的失活突变驱动 mTOR 通路激活和肿瘤生长 TSC1 和 TSC2 是 PI3K/AKT/mTOR 途径中 mTOR 活性的上游调节剂 TSC1 和 TSC2 突变在癌症中发生的速度约为 2%,每年约为 16,000 例新发病例。没有批准针对 TSC1 和 TSC2 突变患者的疗法,但有大量的病例报告 对 mTOR 抑制的持久反应经过 CLIA 认证的 NGS 试剂盒已经捕获了 TSC1 和 TSC2 突变,经常在癌症和/或经过验证的靶标中发生突变
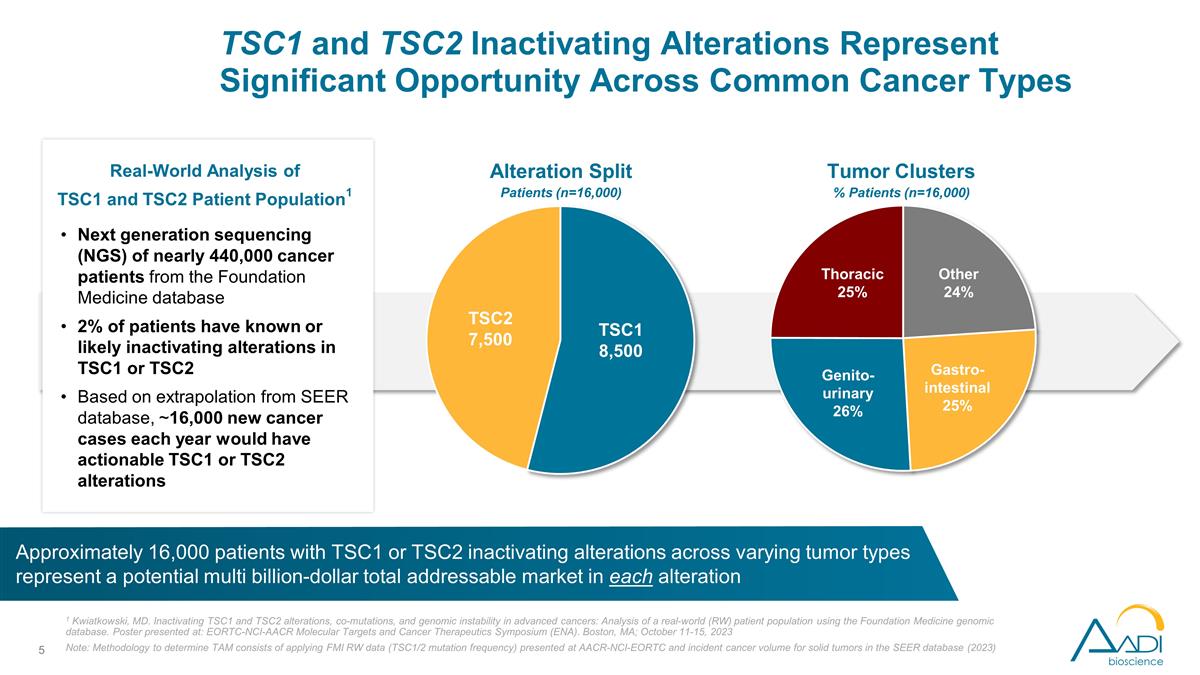
的下一代测序(NGS) 来自基金会医学数据库的近44万名癌症患者2%的患者已知或可能出现TSC1或TSC2的失活变化。根据SEER数据库的推断,每年约有16,000例新的癌症病例可以采取行动 TSC1 或 TSC2 改动 1 马里兰州夸特科夫斯基使晚期癌症的TSC1和TSC2改变、共同突变和基因组不稳定性失活:使用基础医学基因组数据库分析现实世界(RW)患者群体。海报 发表于:EORTC-NCI-AACR分子靶标和癌症治疗研讨会(ENA)。马萨诸塞州波士顿;2023 年 10 月 11 日至 15 日注意:确定 tAM 的方法包括应用在 AACR-NCI-EORTC 上提供的 FMI RW 数据(TSC1/2 突变频率)以及 SEER 数据库中实体瘤的癌症发病量 (2023) TSC1 和 TSC2 患者群体的真实世界分析1 大约有 16,000 名不同肿瘤类型的 TSC1 或 TSC2 失活改变的患者有潜力 每种变异的潜在市场总额为数十亿美元肿瘤集群百分比患者(n = 16,000)TSC1 和 TSC2 失活改变代表了常见癌症类型改变的重大机遇分裂患者(n=16,000)TSC1 8,500
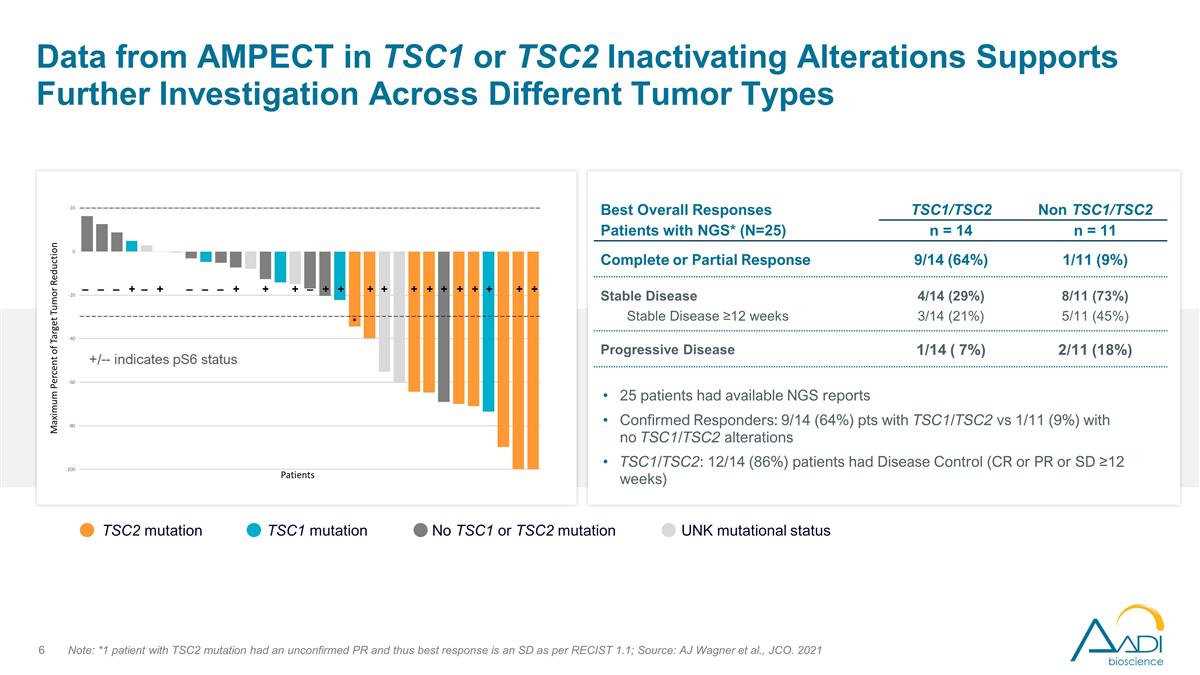
来自 Ampect 在 TSC1 或 TSC2 中的数据 失活改变支持对不同肿瘤类型的进一步研究注意:*1 名 TSC2 突变患者的 PR 未经证实,因此根据 reCist 1.1,最佳反应是 SD;来源:AJ Wagner 等人,JCO。2021 年 TSC2 突变 TSC1 突变没有 TSC1 或 TSC2 突变 unK 突变状态 25 名患者有 NGS 报告已确诊的应答者:9/14 (64%) pts 有 TSC1/TSC2 与没有 TSC1/TSC2 改变的 1/11 (9%) pts TSC1/TSC2:12/14 (86%) 患者患有疾病控制 (CR 或 PR 或 SD ≥12 周)最佳总体反应患者 NGS* (N=25) TSC1/TSC2 非 TSC1/TSC2 n = 14 n = 11 完全或部分反应 9/14 (64%) 1/11 (9%) 稳定疾病 4/14 (29%) 8/11 (73%) ≥12 周 3/14 (21%) 5/11 (45%) 进行性疾病 1/14 (7%) 2/11 (18%)

PRECISION1:直接注册 nab-sirolimus 在 TSC1 或 TSC2 失活改变(N = ~60)(N = ~60)中的肿瘤无关试验 A 组:TSC1 组 B:TSC2 关键资格标准转移性或局部晚期疾病没有资格接受手术 mTOR 抑制剂治疗 通过 NGS 发现的致病性 TSC1 或 TSC2 失活变异必须接受过该疾病的标准疗法,或者研究人员认为不太可能受益 PRECISION1 试验二项可独立评估的组,TSC1 和 TSC2 各一个 主要终点:通过盲目独立放射学审查进行的 ORR 根据当地 NGS 结果计算的患者累积量第一位患者于 2022 年 3 月给药,预计入组期为 24 个月
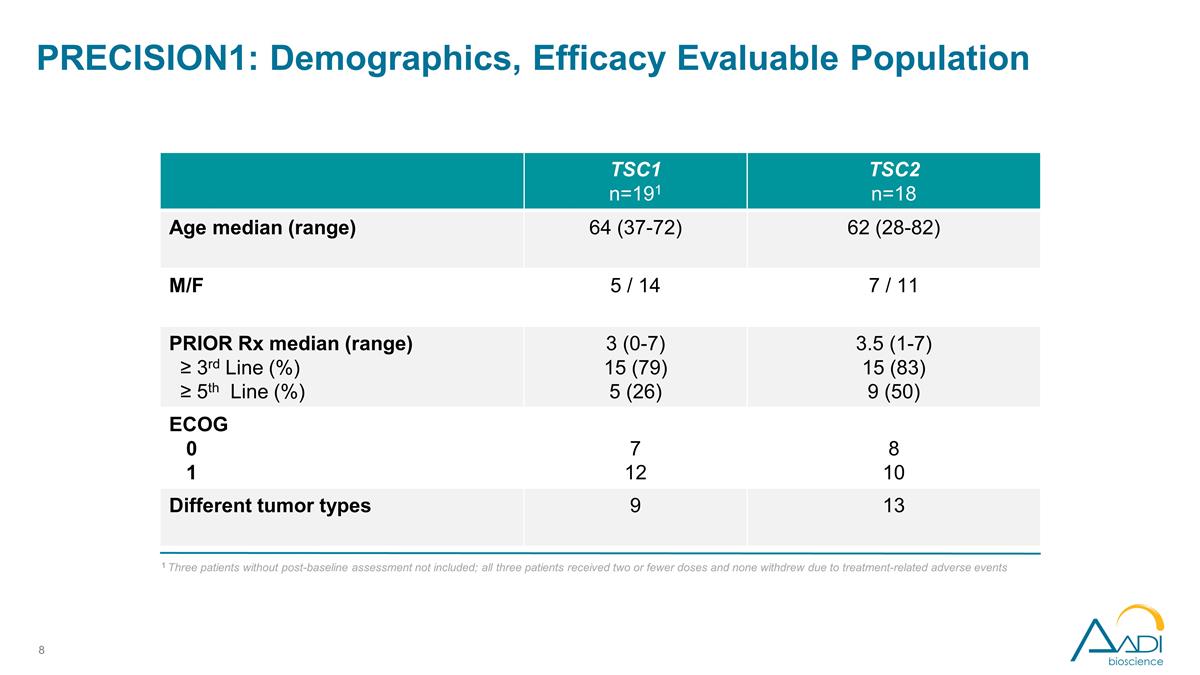
PRECISION1:人口统计、功效 可评估人群 1 不包括三名未进行基线后评估的患者;所有三名患者均接受了两剂或更少的剂量,没有人因治疗相关的不良事件而退出 TSC1 n=191 TSC2 n=18 年龄中位数(范围)64 (37-72) 62 (28-82) M/F 5/14 7/11 PRIOR Rx 中位数(范围)≥ 第 3 线 (%) ≥ 第 5 线 (%) 3 (0-7) 15 (79) 5 (26) 3.5 (1-7) 15 (83) 9 (50) ECOG 0 1 7 12 8 10 不同的肿瘤类型 9 13
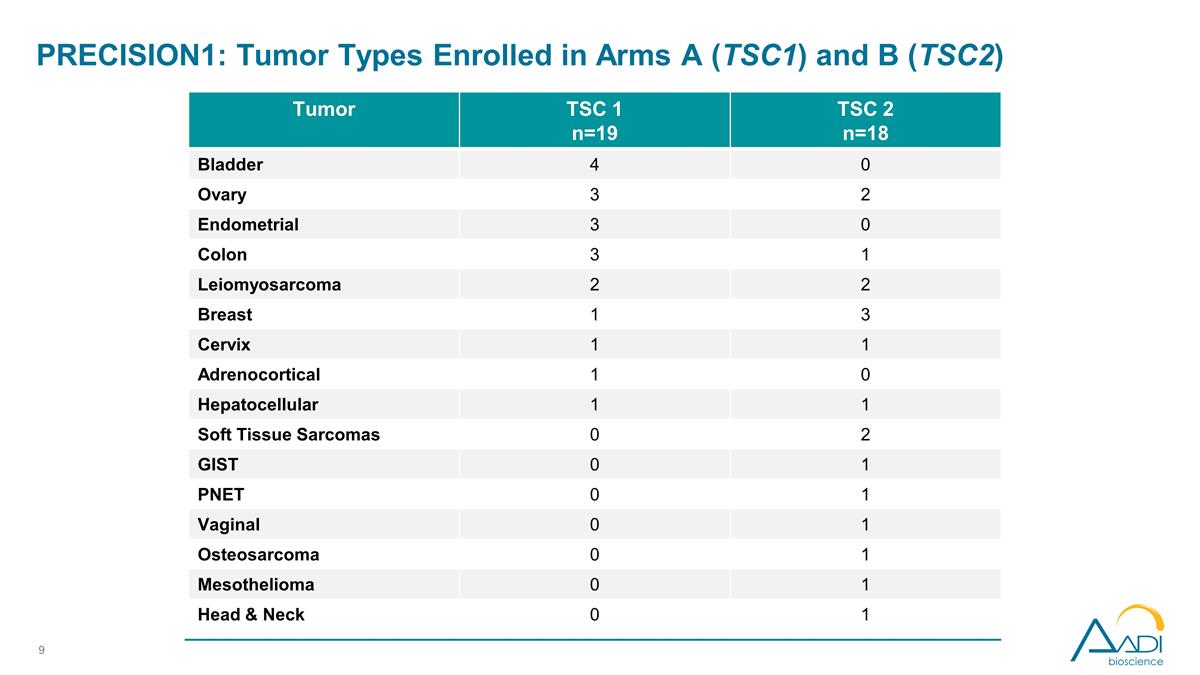
PRECISION1:登记的肿瘤类型 手臂 A (TSC1) 和 b (TSC2) 肿瘤 TSC 1 n=19 TSC 2 n=18 膀胱 4 0 卵巢 3 2 子宫内膜 3 0 结肠 3 1 平滑肌肉瘤 2 2 2 乳房 1 3 子宫颈 1 1 肾上腺皮质 1 0 0 肝细胞 1 1 软组织肉瘤 0 2 GiST 0 1 Pnet 0 1 阴道 0 1 骨肉瘤 0 1 间皮瘤 0 1 头部和颈部 0 1
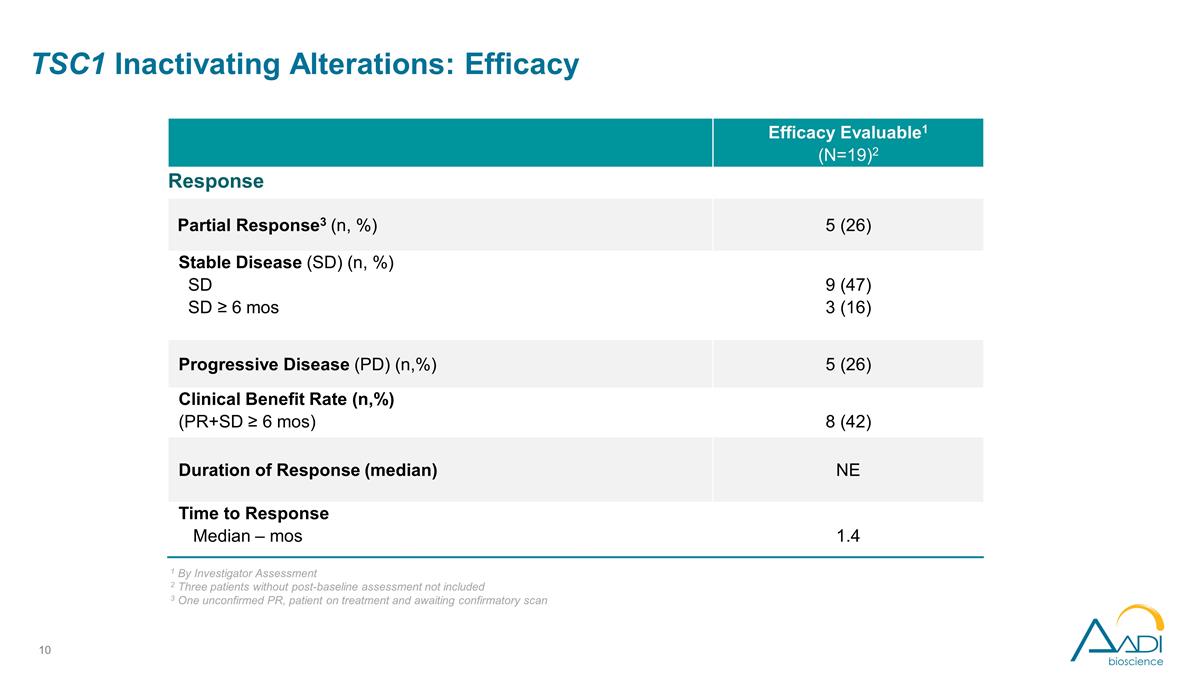
TSC1 停用改动: 疗效疗效可评估1 (N=19) 2 缓解部分反应3 (n,%) 5 (26) 稳定疾病 (SD) (n,%) SD ≥ 6 mos 9 (47) 3 (16) 进展性疾病 (PD) (n,%) 5 (26) 临床获益率 (n,%) (PR+SD ≥ 6 个月) 8 (42) 持续时间 缓解率(中位数)NE 反应时间中位数 — mos 1.4 1 根据研究者评估 2 不包括三名未进行基线后评估的患者 3 一名未经证实的 PR、正在接受治疗并等待确认扫描的患者
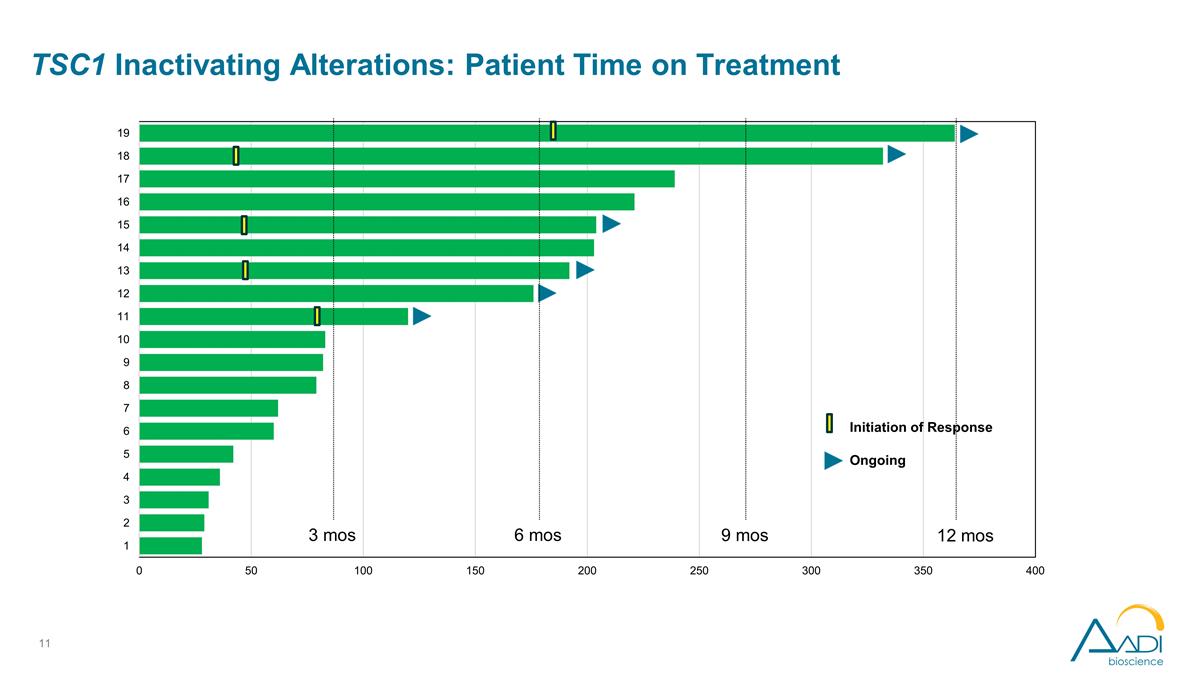
3 mos 6 mos 9 mos 12 mos 初始化 正在进行的 TSC1 失活改动:患者接受治疗的时间
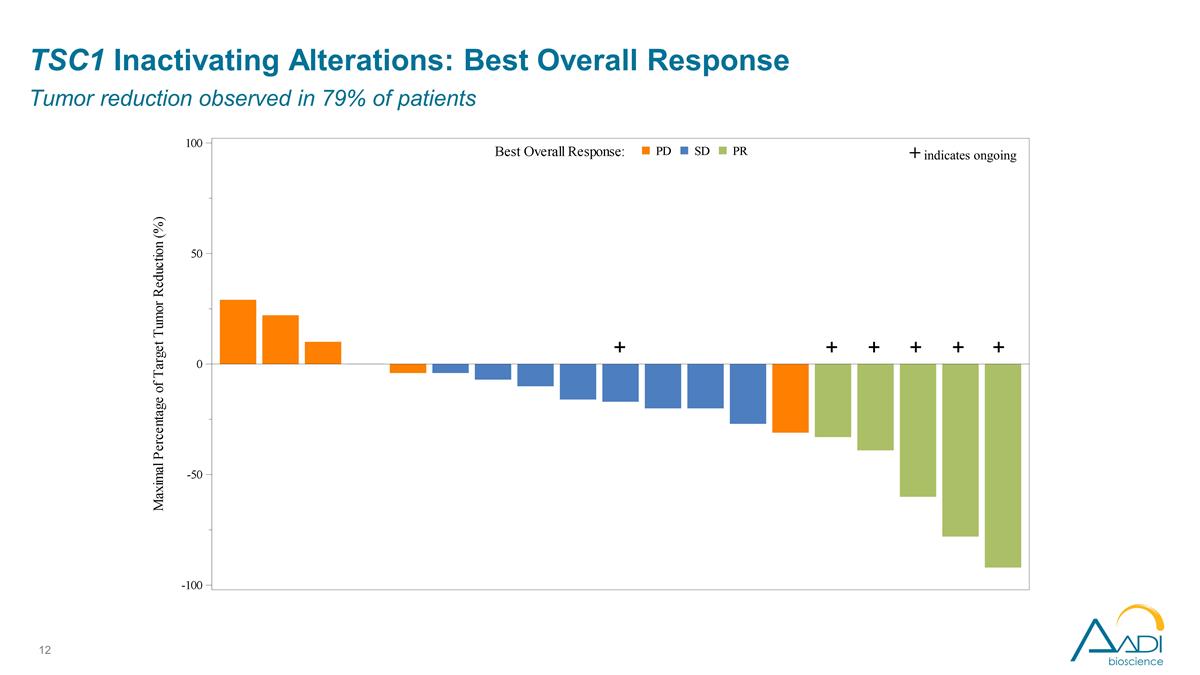
TSC1 停用改动:最佳 总体反应在 79% 的患者中观察到肿瘤减退 + + + + + + 表明正在进行中

TSC1 停用改动: 研究者评估的疗效观察结果 ORR 为 26%,令人鼓舞,在 4 种不同的上皮癌类型中出现了 5 种反应。大量预先治疗的人群中位数,先前 3 种疗法的中位数似乎是早期的、深刻的和持久的 正在进行中;超过一半的减幅超过 50%
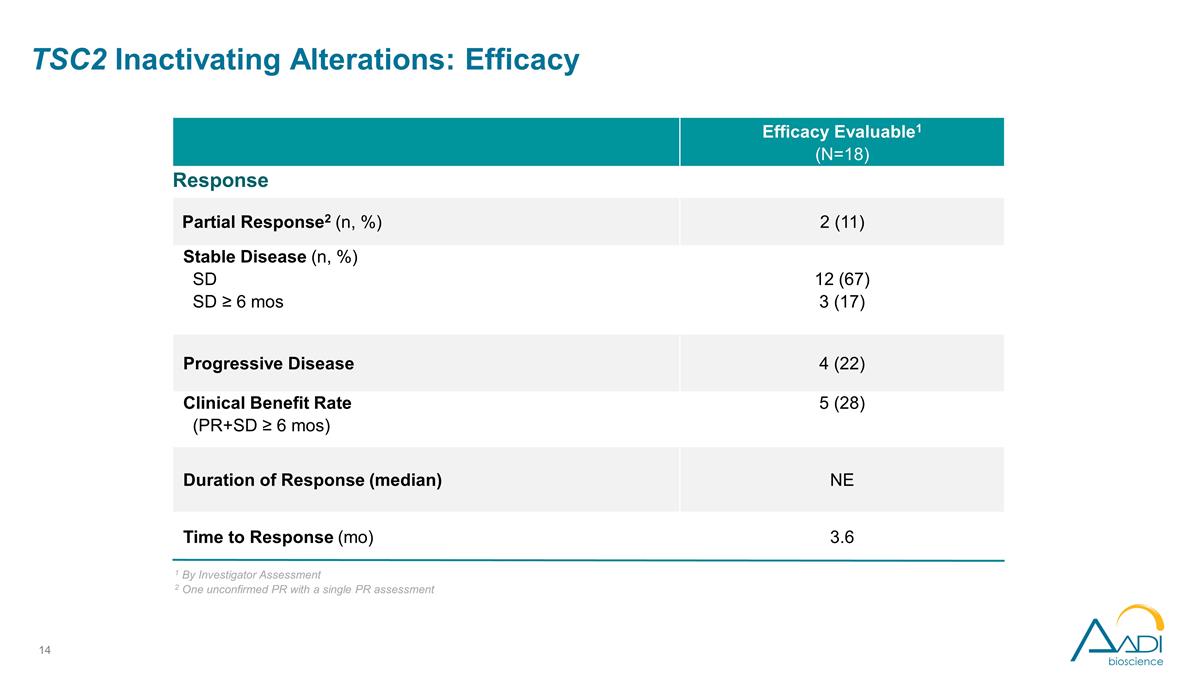
功效可评估 1 (N=18) 反应部分反应2 (n,%) 2 (11) 稳定疾病 (n,%) SD SD ≥ 6 mos 12 (67) 3 (17) 进展性疾病 4 (22) 临床获益率 (PR+SD ≥ 6 个月) 5 (28) 反应时间(中位数)NE 反应时间(mo)3.6 TSC2 失活改变:功效 1 根据研究者评估 2 一项未经证实的 PR 和单一的 PR 评估
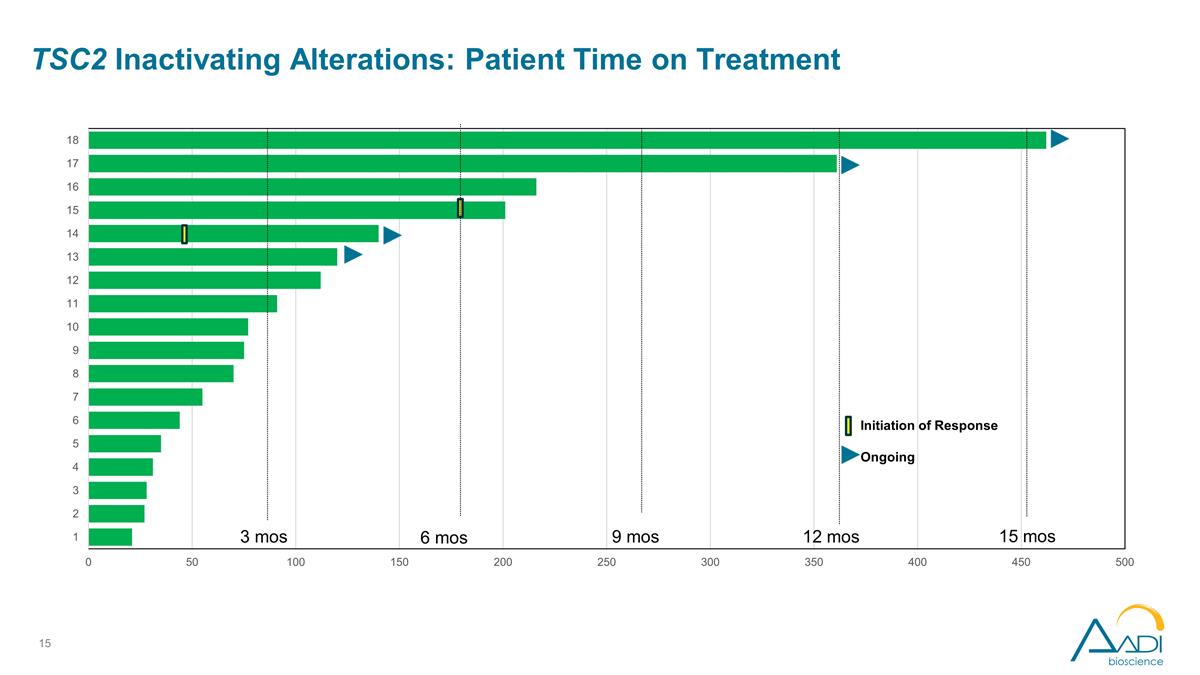
TSC2 停用改动: 患者接受治疗的时间
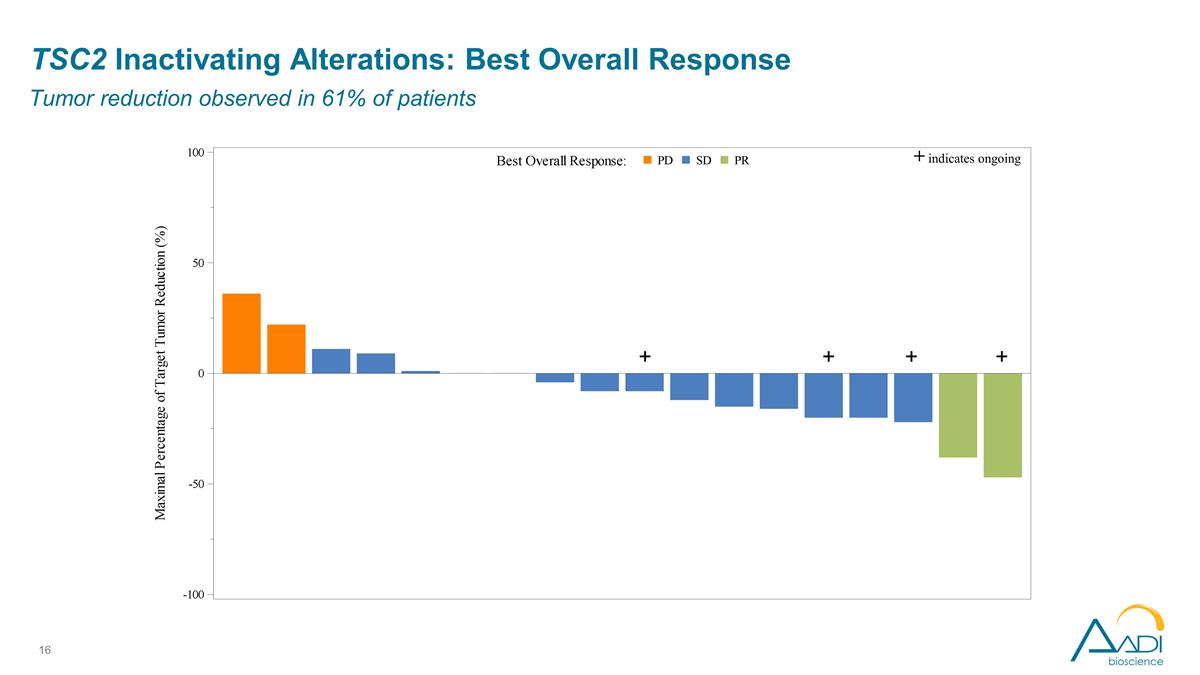
TSC2 停用改动:最佳 总体反应在 61% 的患者中观察到肿瘤减退 + + + + 表明仍在继续

TSC2 停用改动: 研究者评估的疗效观察结果 ORR 11% (2/18) 在上皮癌和肉瘤中出现的反应 CBR 28% (2 PR + 3 SD >6 mos) 接受过大量预处理的人群 9/18 为 ≥ 5 线

PRECISION1:安全结论否 新的安全信号 AE 模式与 nab-sirolimus 标签和 mTori 类一致 No 4 级 traE 或因研究药物 1 导致的死亡患者因 2 级复发性肺炎而中止研究

PRECISION1 中期分析摘要 TSC1 组的结果令人鼓舞反应率在我们预期的范围内,在经过大量预处理的人群中,反应似乎深度且持久,不同肿瘤类型的反应支持肿瘤不可知的适应症 TSC2 组 ORR 样本量小、预处理繁重,解释比较复杂 50% 的患者先前接受过 5 种或更多疗法,三分之二的 80 名患者中期入组已完成
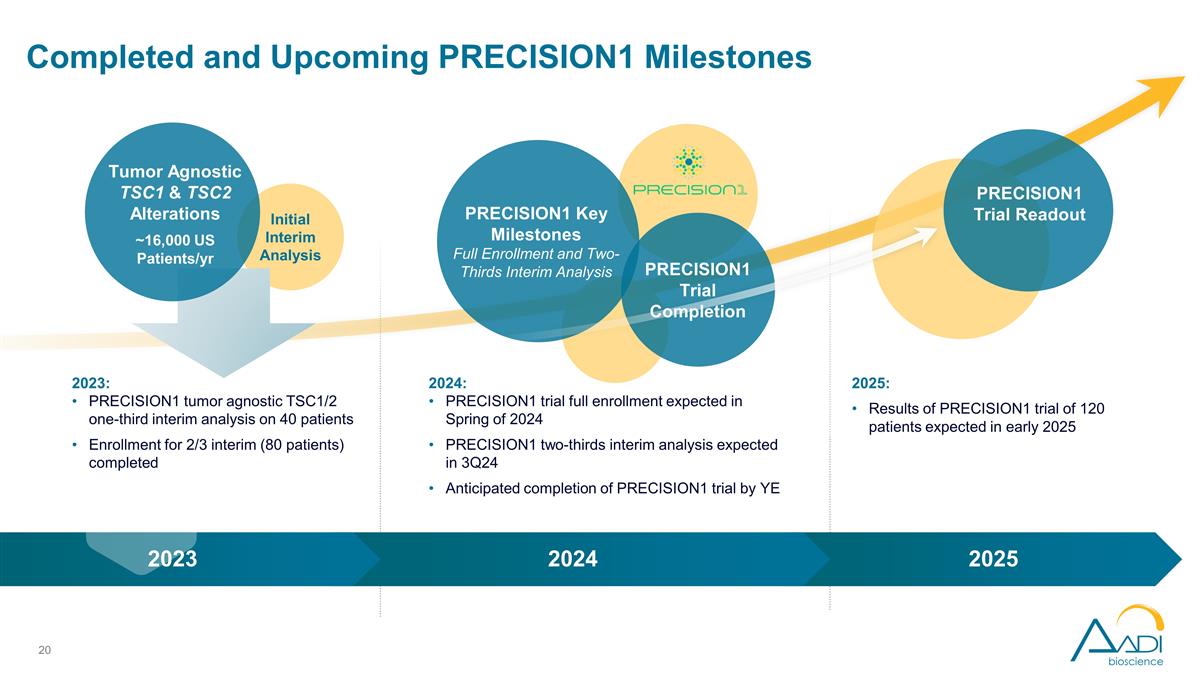
初步中期分析已完成 以及即将到来的 PRECISION1 里程碑 PRECISION1 关键里程碑全部入组和三分之二的中期分析 PRECISION1 试验完成 2024 年:PRECISION1 试验预计于 2024 年春季全部入组 PRECISION1 三分之二的中期分析 预计在 24 年第 3 季度完成 PRECISION1 试验预计在 2025 年年初完成:预计 2025 年初 2023 年 2024 年初针对 120 名患者的 PRECISION1 试验结果肿瘤无关的 TSC1 和 TSC2 变异约 16,000 名美国患者/2023 年:PRECISION1 肿瘤 不可知论者 TSC1/2 对 40 名患者的三分之一中期分析 2/3 名中期患者(80 名患者)的入组已完成 PRECISION1 试验读数

谢谢纳斯达克:AADI www.aadibio.com