| Momentum—pemviduTide 第 2 阶段 肥胖试验 第 24 周中期分析 纳斯达克:ALT M. Scott Harris,医学博士,首席医疗官 路易斯·阿隆,医学博士,首席研究员 桑福德·威尔代谢研究教授 威尔康奈尔医学院临床医学教授 2023 年 3 月 21 日 |
| 前瞻性陈述 安全港声明 本演示文稿由Altimmune, Inc.(“我们”、“我们的”、“Altimmune” 或 “公司”)编写,包括某些内容 1995年《私人证券诉讼改革法》所指的 “前瞻性陈述”,包括相关的陈述 未来的财务或业务业绩、状况、计划、前景、趋势或战略以及其他财务和业务 事项,包括但不限于我们临床资产关键里程碑的时机、2期肥胖症临床试验的时机 pemvidutide、我们的候选药物在正在进行和未来的临床试验中的表现以及监管部门批准的前景, 商业化或销售任何产品或候选药物。此外,当或如果在本新闻稿中使用 “可能”、“可以” 等字样 “应该”、“预测”、“相信”、“估计”、“期望”、“打算”、“计划”、“预测” 和类似的表达式及其变体,就像它们一样 与公司有关可能会确定前瞻性陈述。公司警告说,这些前瞻性陈述是 受众多假设、风险和不确定性的影响,这些假设、风险和不确定性会随着时间的推移而变化。可能导致实际结果的重要因素 与前瞻性陈述中讨论的结果有重大差异或历史经验包括风险和不确定性, 包括监管审查延迟, 生产和供应链中断, 临床场所准入, 入院登记等风险, 对医疗系统的不利影响和全球经济的混乱;影响对象的基线特征,包括 体重,取决于未来试验的成功;与人体安全和可能的不良反应有关的研究结果的可靠性 管理公司候选产品所产生的影响;公司进行临床试验的能力 关于预期时间表的材料;以及未来产品进展的成功,包括未来临床试验的成功。 有关可能影响公司业务、财务状况和经营业绩的因素和风险的更多信息 包含在公司向美国证券交易委员会提交的文件中,包括 “风险因素” 标题下 在公司最新的10-K表年度报告以及我们向美国证券交易委员会提交的其他文件中,这些文件可在www.sec.gov上查阅。 2 |
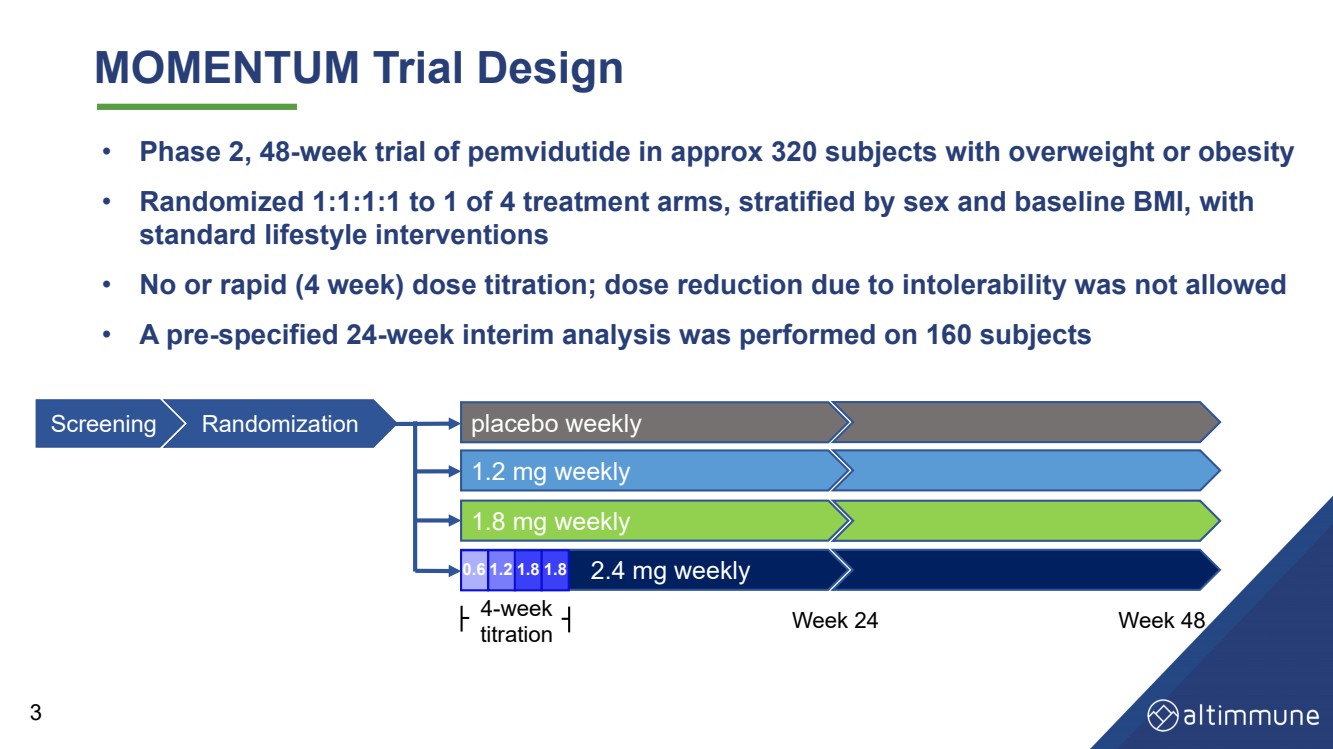
| MOMENTIM 试验设计 • 在大约 320 名超重或肥胖受试者中进行了为期 48 周的 pemvidutide 试验 • 4 个治疗组中的 1 个随机分组 1:1:1,按性别和基线 BMI 进行分层, 标准生活方式干预措施 • 无剂量滴定或快速(4 周)剂量滴定;不允许因不耐受而减少剂量 • 对160名受试者进行了预先规定的为期24周的中期分析 0。 6 1.2 1.8 1.8 安慰剂周报 每周 1.8 毫克 每周 2.4 毫克 每周 1.2 毫克 4 周 滴定第 24 周第 48 周 筛选随机化 0.6 1.2 1.8 1.8 3 |
| 研究人群——关键资格标准 • 年龄 18-75 岁的男性和女性 • BMI ≥ 30 kg/m2 或 BMI ≥ 27 kg/m2 且至少存在一种肥胖相关合并症 -心血管疾病史 -高血压 -血脂异常 -糖尿病前期 -阻塞性睡眠呼吸暂停 • 非糖尿病:HbA1c ≤ 6.5%,空腹血糖 ≤ 125 mg/dL • 至少一次减肥尝试失败 • 至少有大约 25% 的受试者是男性 4 |
| 研究终点 功效 • 主要终点: • 体重与基线相比的相对变化 (%) • 关键辅助端点: • 体重减轻≥ 5%、≥ 10% 和 ≥ 15% 的受试者比例(%) • 腰围、血清脂质、血压与基线相比的变化 安全 • 不良事件 (AE) • 严重和严重 AE • 导致停产的 AE • 胃肠道 (GI) AE • 心率 • 葡萄糖动态平衡 5 |
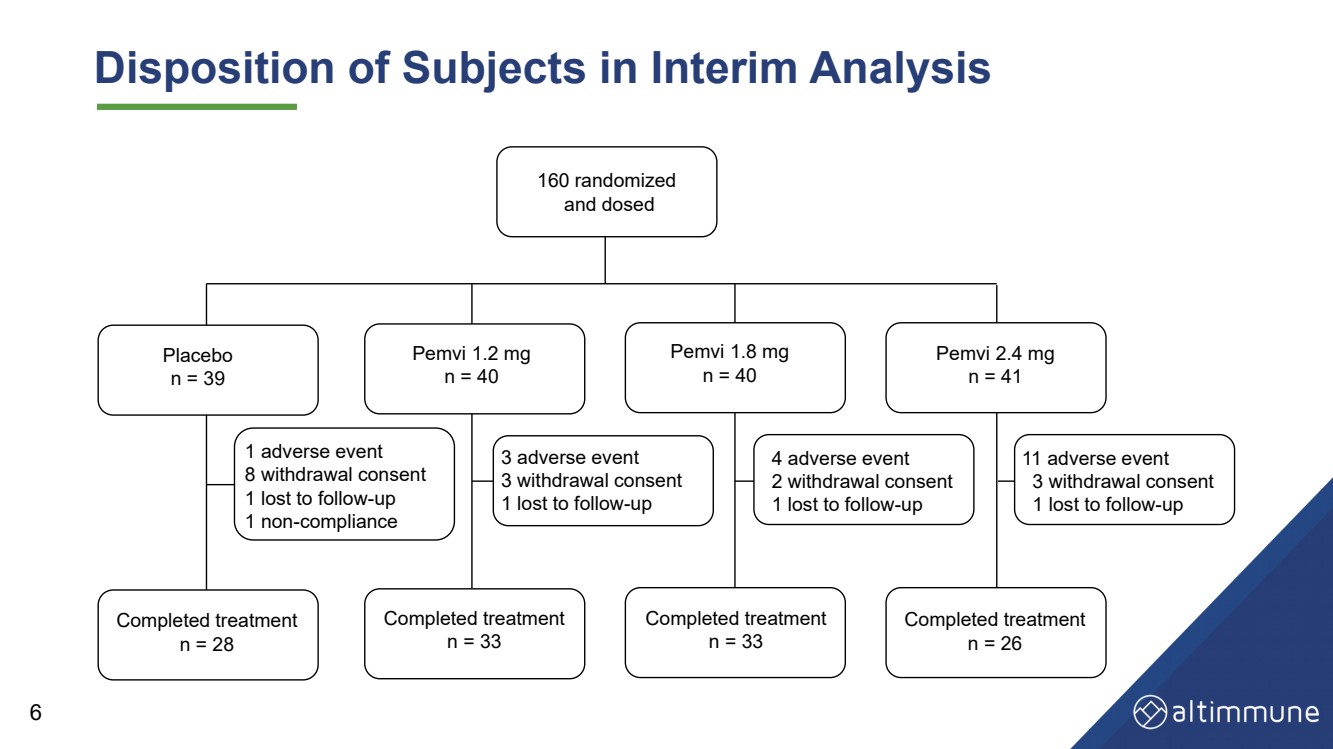
| 中期分析中受试者的处境 160 随机化 并给药 安慰剂 n = 39 Pemvi 1.2 毫克 n = 40 Pemvi 1.8 毫克 n = 40 Pemvi 2.4 毫克 n = 41 治疗已完成 n = 28 治疗已完成 n = 33 治疗已完成 n = 26 3 不良事件 3 撤回同意 1 人因后续行动而丢失 4 不良事件 2 撤回同意 1 人因后续行动而丢失 2 提款 c2 治疗已完成 n = 33 1 个不良事件 8 撤回同意 1 人因后续行动而丢失 1 违规行为 11 个不良事件 3 撤回同意 1 人因后续行动而丢失 6 |
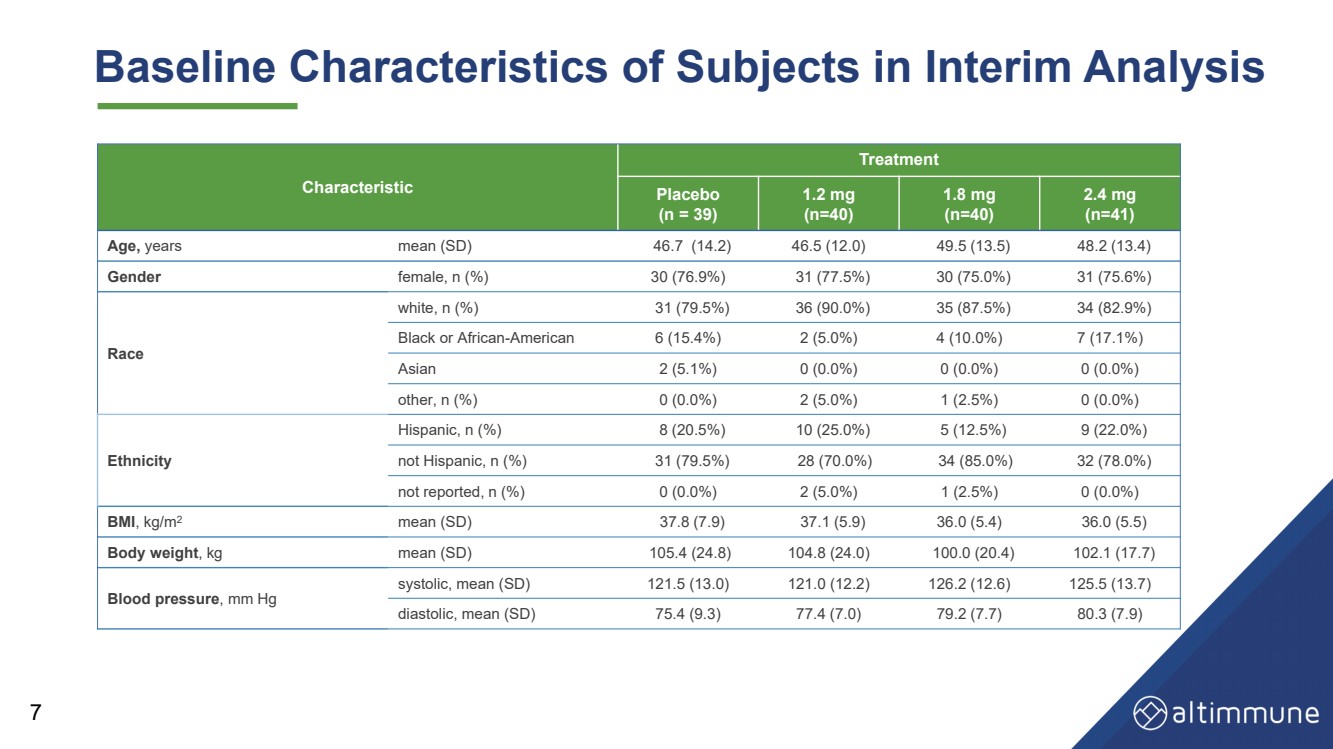
| 中期分析中受试者的基线特征 7 特征 治疗 安慰剂 (n = 39) 1.2 毫克 (n = 40) 1.8 毫克 (n = 40) 2.4 毫克 (n = 41) 年龄、年平均值 (SD) 46.7 (14.2) 46.5 (12.0) 49.5 (13.5) 48.2 (13.4) 性别女性,n (%) 30 (76.9%) 31 (77.5%) 30 (75.0%) 31 (75.6%) 种族 白色,n (%) 31 (79.5%) 36 (90.0%) 35 (87.5%) 34 (82.9%) 黑人或非裔美国人 6 (15.4%) 2 (5.0%) 4 (10.0%) 7 (17.1%) 亚洲人 2 (5.1%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 其他,n (%) 0 (0.0%) 2 (5.0%) 1 (2.5%) 0 (0.0%) 种族 西班牙裔,n (%) 8 (20.5%) 10 (25.0%) 5 (12.5%) 9 (22.0%) 不是西班牙裔,n (%) 31 (79.5%) 28 (70.0%) 34 (85.0%) 32 (78.0%) 未报告,n (%) 0 (0.0%) 2 (5.0%) 1 (2.5%) 0 (0.0%) BMI,kg/m2 平均值 (SD) 37.8 (7.9) 37.1 (5.9) 36.0 (5.4) 36.0 (5.4) 36.0 (5.5) 体重,kg 平均值 (SD) 105.4 (24.8) 104.8 (24.0) 100.0 (20.4) 102.1 (17.7) 血压,mm Hg 收缩压,平均值 (SD) 121.5 (13.0) 121.0 (12.2) 126.2 (12.6) 125.5 (13.7) 舒张,平均值 (SD) 75.4 (9.3) 77.4 (7.0) 79.2 (7.7) 80.3 (7.9) |
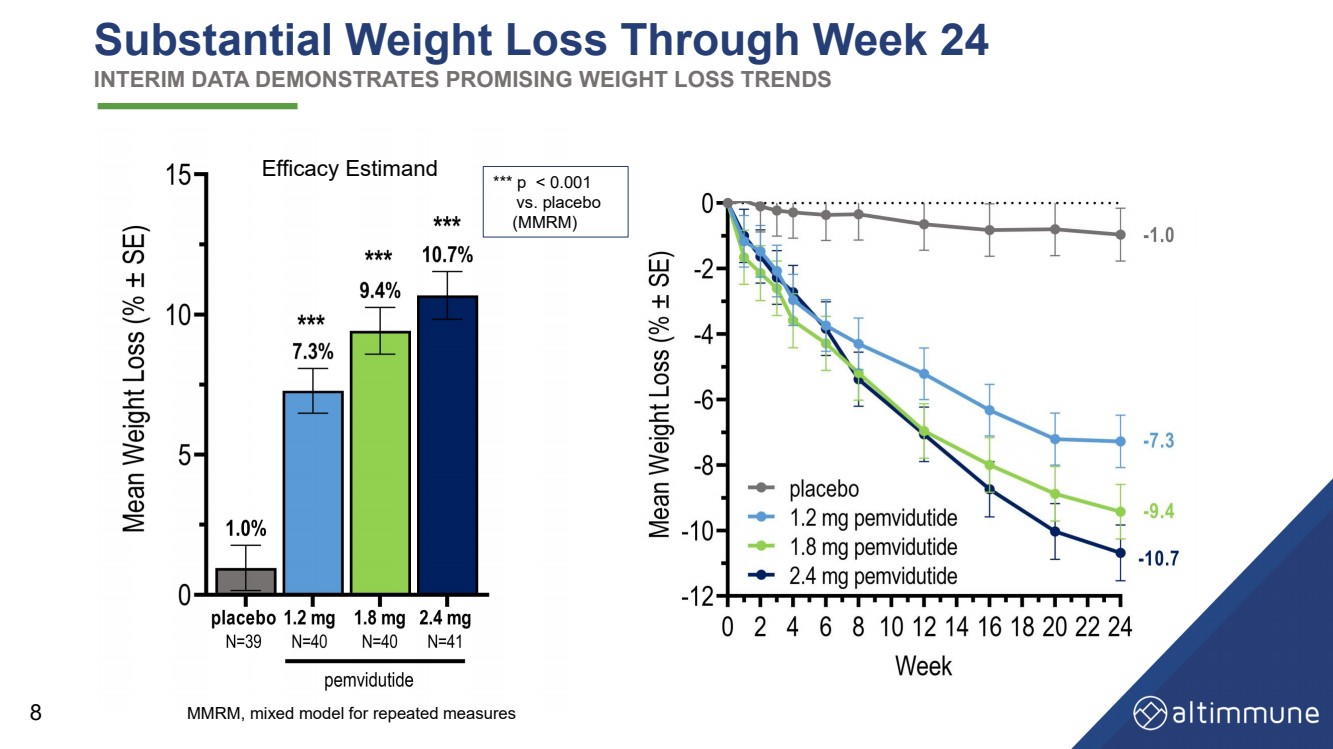
| 到第 24 周体重大幅减轻 中期数据显示出令人鼓舞的减肥趋势 8 功效估计 MMRM,重复测量的混合模型 *** p |
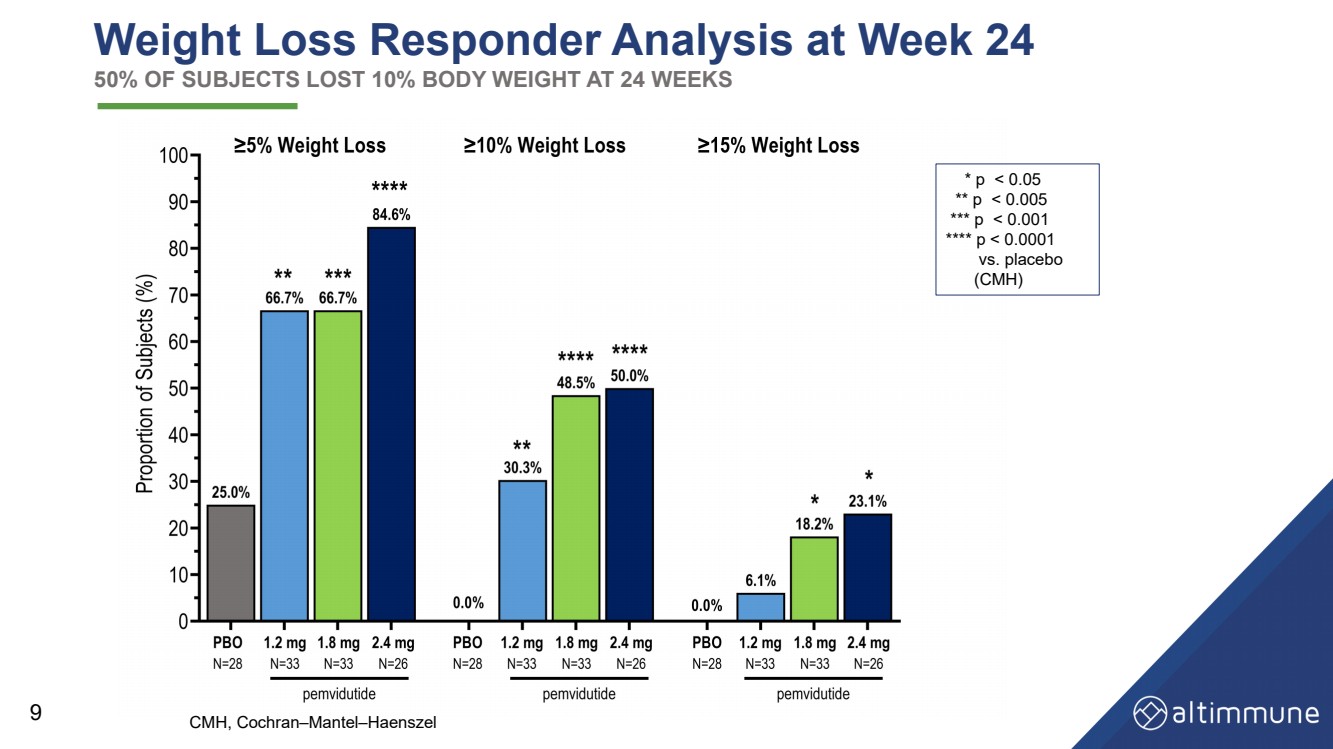
| 第 24 周的减肥响应者分析 50% 的受试者在 24 周内体重减轻了 10% 9 * p |
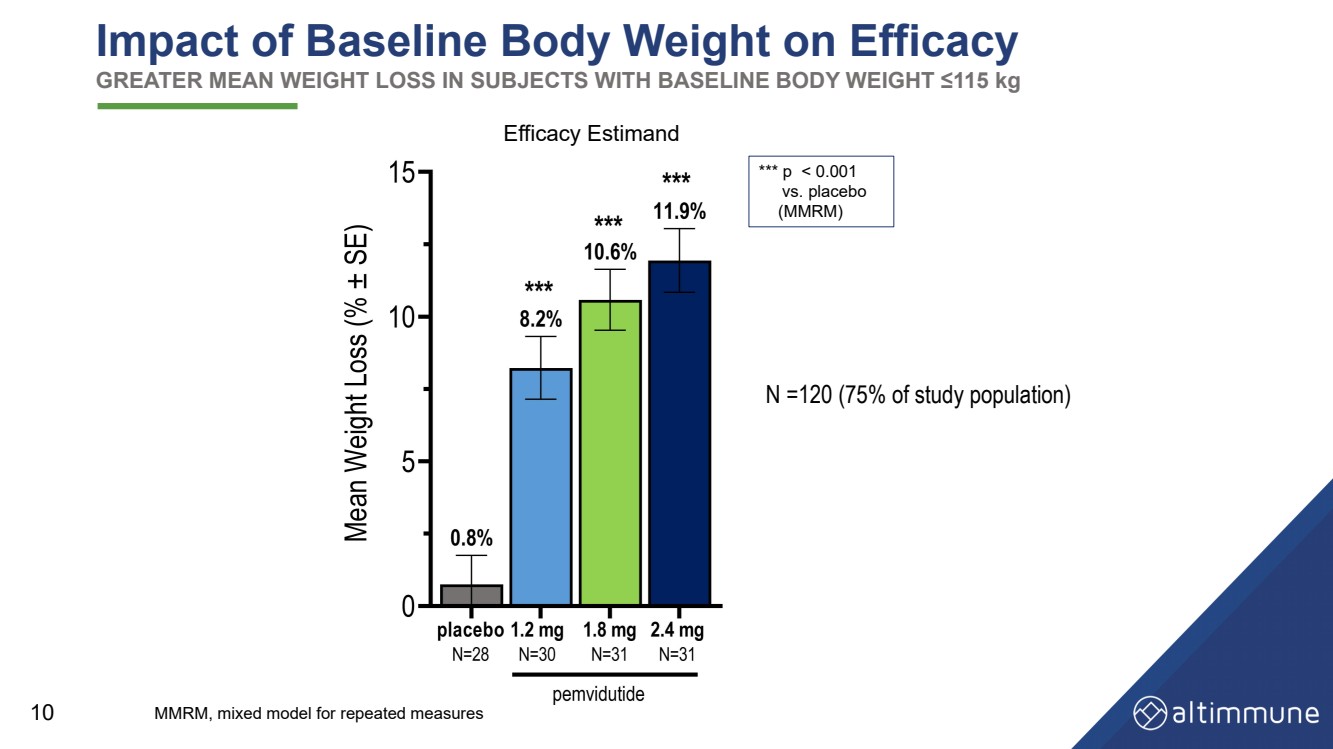
| 10 基准体重对疗效的影响 基线体重 ≤115 kg 的受试者的平均体重减轻幅度更大 功效估计 N =120(占研究人口的 75%) *** p |
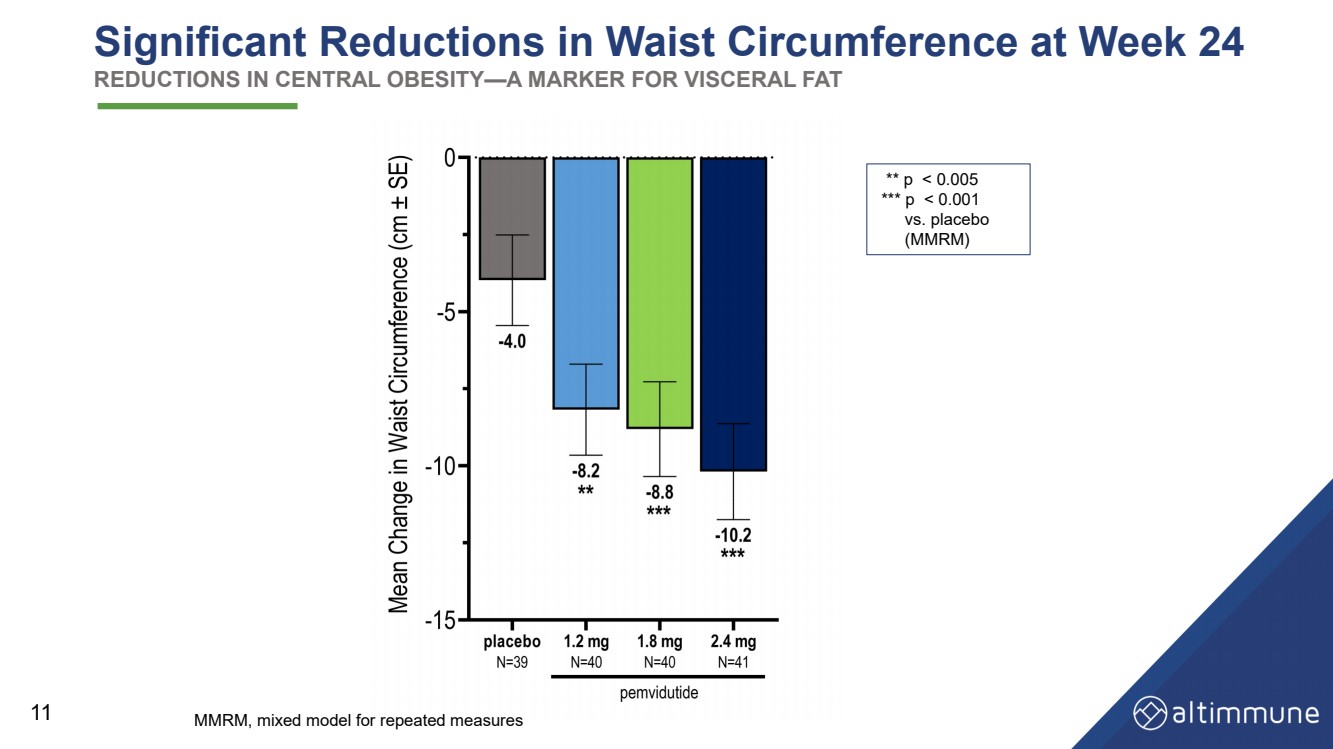
| 第 24 周腰围显著减少 减少中枢肥胖——内脏脂肪的标志 11 ** p |
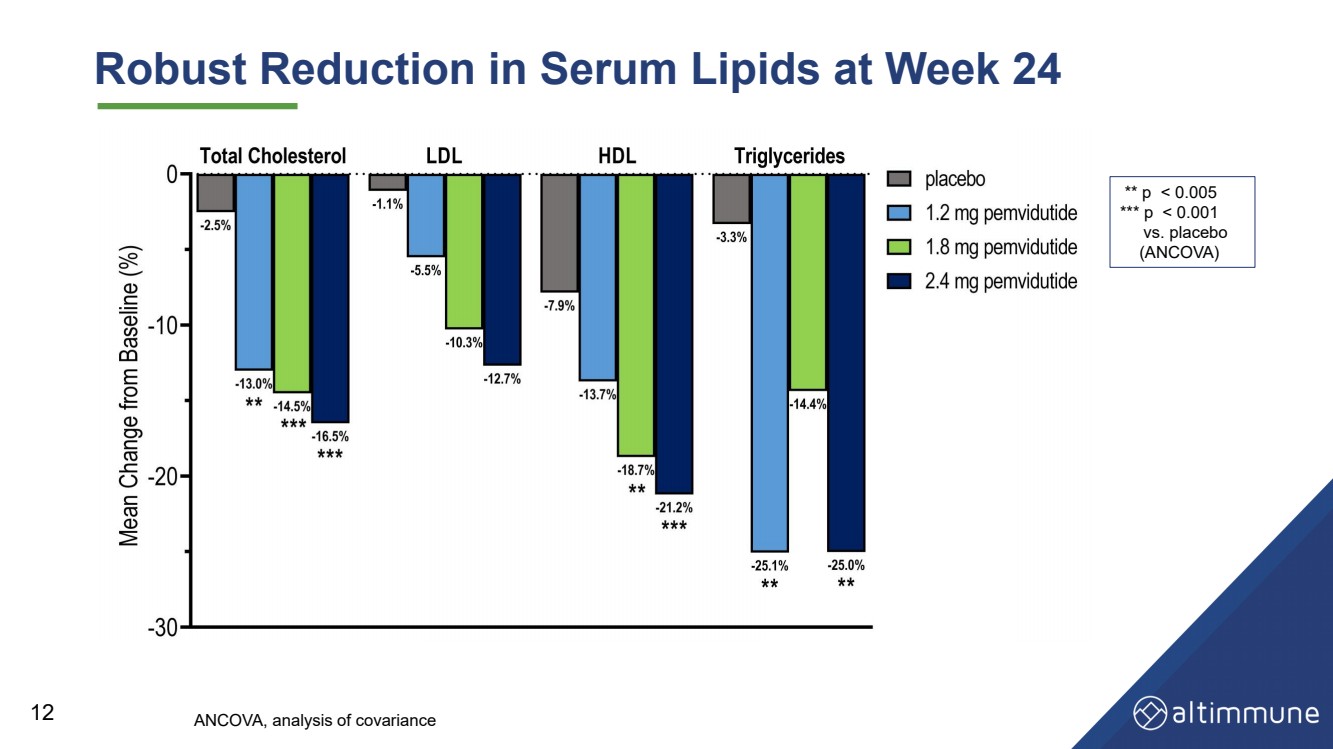
| 第 24 周血清脂质大幅减少 12 ** p |
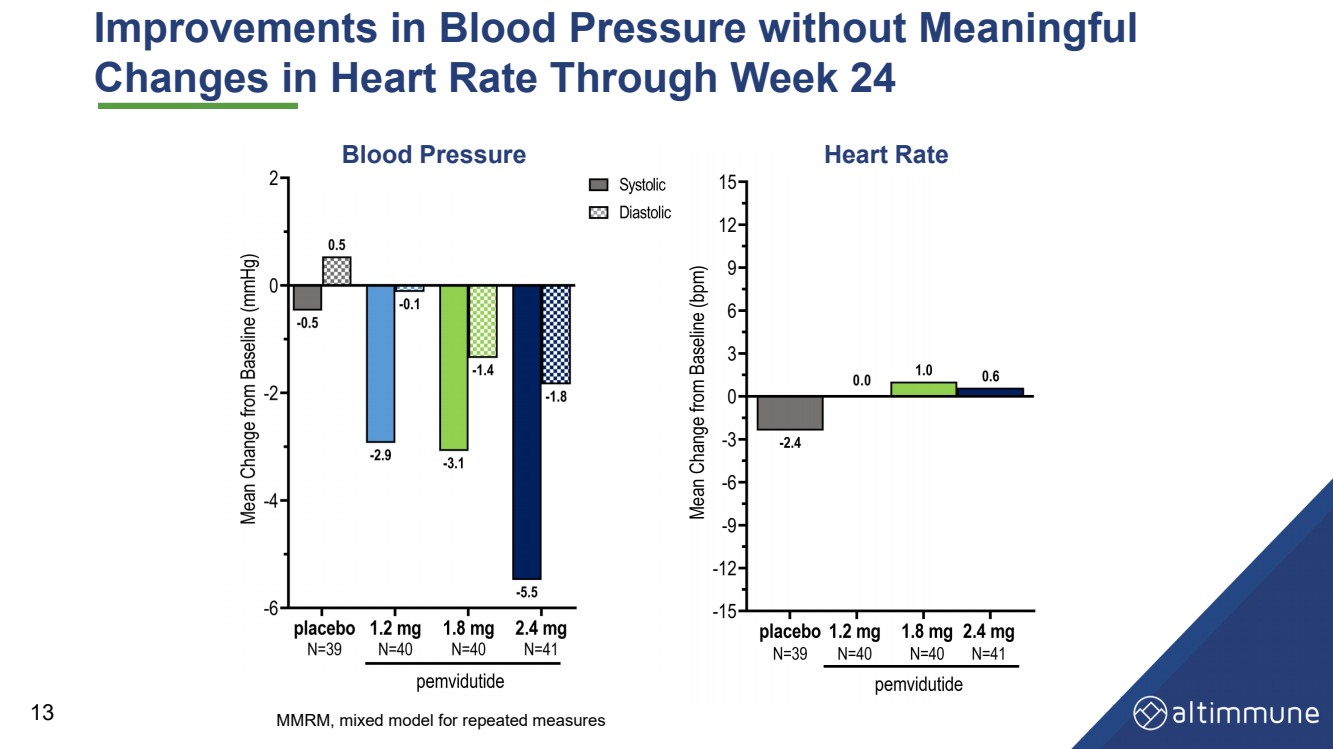
| 血压的改善毫无意义 截至第 24 周的心率变化 13 血压心率 MMRM,重复测量的混合模型 |
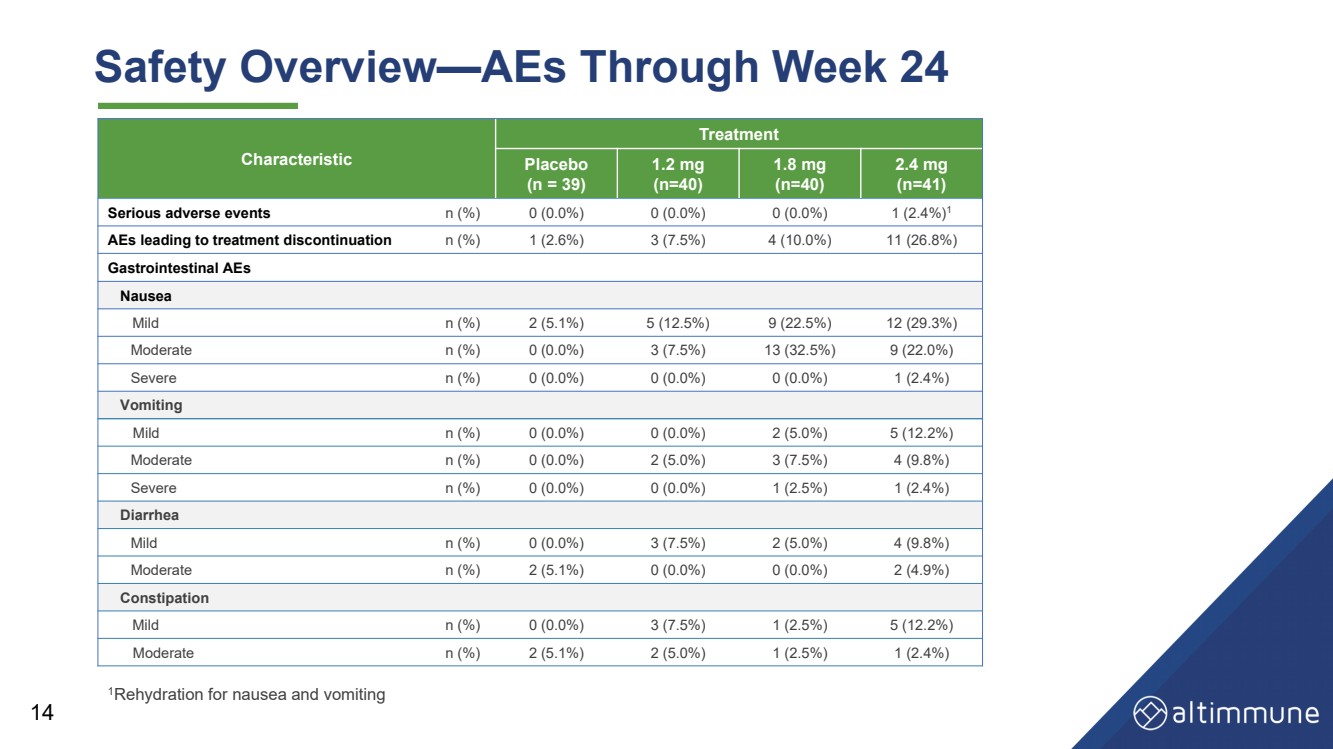
| 14 安全概述——第 24 周的 AES 1补液治疗恶心和呕吐 特征 治疗 安慰剂 (n = 39) 1.2 毫克 (n = 40) 1.8 毫克 (n = 40) 2.4 毫克 (n = 41) 严重不良事件 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (2.4%) 1 导致停止治疗的不良反应n (%) 1 (2.6%) 3 (7.5%) 4 (10.0%) 11 (26.8%) 胃肠道不良反应 恶心 轻度 n (%) 2 (5.1%) 5 (12.5%) 9 (22.5%) 12 (29.3%) 中等 n (%) 0 (0.0%) 3 (7.5%) 13 (32.5%) 9 (22.0%) 严重 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (2.4%) 呕吐 轻度 n (%) 0 (0.0%) 0 (0.0%) 2 (5.0%) 5 (12.2%) 中等 n (%) 0 (0.0%) 2 (5.0%) 3 (7.5%) 4 (9.8%) 严重 n (%) 0 (0.0%) 0 (0.0%) 1 (2.5%) 1 (2.4%) 腹泻 轻度 n (%) 0 (0.0%) 3 (7.5%) 2 (5.0%) 4 (9.8%) 中等 n (%) 2 (5.1%) 0 (0.0%) 0 (0.0%) 2 (4.9%) 便秘 轻度 n (%) 0 (0.0%) 3 (7.5%) 1 (2.5%) 5 (12.2%) 中等 n (%) 2 (5.1%) 2 (5.0%) 1 (2.5%) 1 (2.4%) |
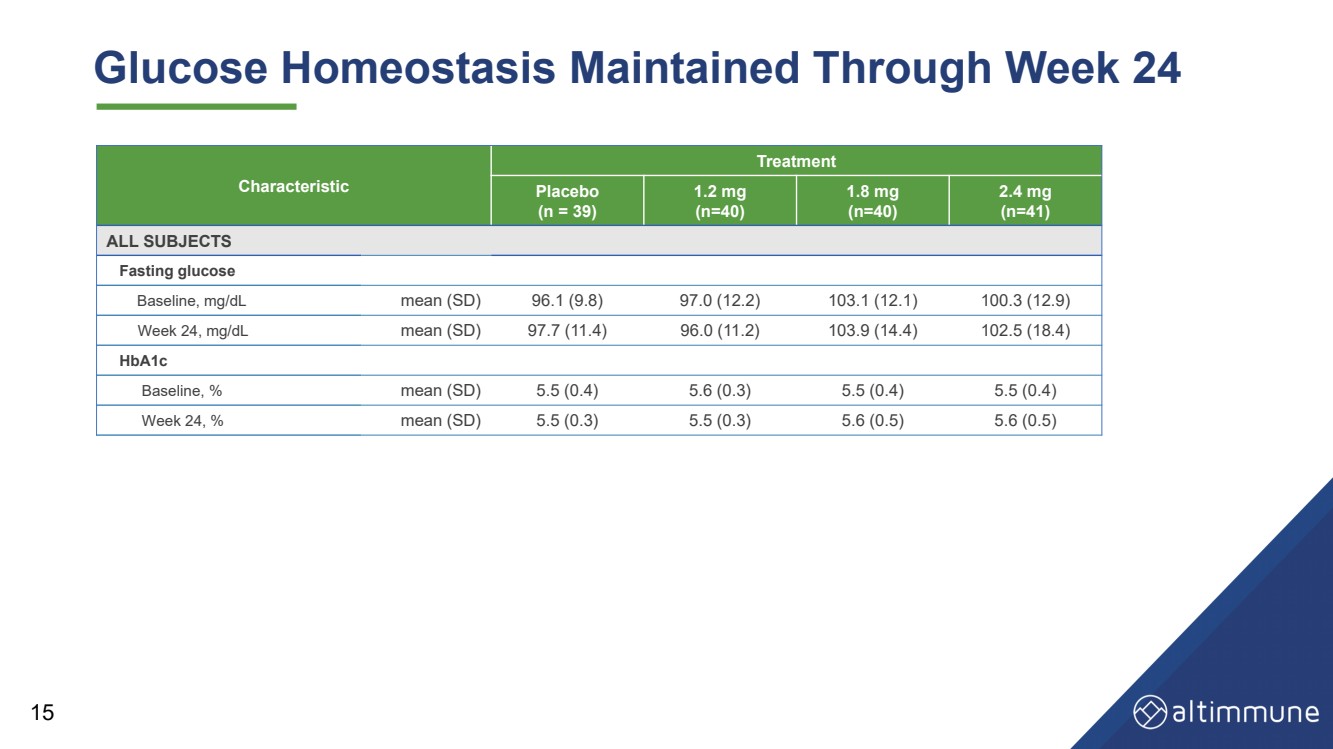
| 葡萄糖动态平衡持续到第 24 周 15 特征 治疗 安慰剂 (n = 39) 1.2 毫克 (n = 40) 1.8 毫克 (n = 40) 2.4 毫克 (n = 41) 所有科目 空腹血糖 基线,mg/dL 平均值 (SD) 96.1 (9.8) 97.0 (12.2) 103.1 (12.1) 100.3 (12.9) 第 24 周,mg/dL 平均值 (SD) 97.7 (11.4) 96.0 (11.2) 103.9 (14.4) 102.5 (18.4) HbA1c 基线,% 平均值 (SD) 5.5 (0.4) 5.6 (0.3) 5.5 (0.4) 5.5 (0.4) 5.5 (0.4) 第 24 周,% 平均值 (SD) 5.5 (0.3) 5.5 (0.3) 5.6 (0.5) 5.6 (0.5) 5.6 (0.5) |
| 摘要和结论 功效 • 截至第 24 周,2.4 mg 和 1.8 mg 的体重减轻了 10.7% 和 9.4%(经安慰剂调整:9.7% 和 8.4%) • 到第 24 周,在 2.4 mg 和 1.8 mg 时,体重减轻了 11.9% 和 10.6%(经安慰剂调整:11.1% 和 9.8%) 在基准体重 ≤ 115 kg 的受试者中 •大约50%的受试者减轻了10%或更多的体重,大约20%的受试者减轻了体重 到第 24 周,体重在 2.4 mg 和 1.8 mg 时,体重达到 15% 或以上 • 大幅减少腰围、血清脂质和血压 安全性和耐受性 • 胃肠道 AE 发生率与早期的 pemviduitide 试验和其他肠促胰岛素类药物相似 • 2.4 mg 剂量下的 AE 停药率——可能会通过减少剂量来缓解 更多延长剂量滴定 • 心率没有显著增加 • 维持葡萄糖动态平衡 16 |
| 为期 12 周的 Pemvidutide 1b 期试验 肥胖或超重和 2 型受试者 糖尿病 纳斯达克:ALT |
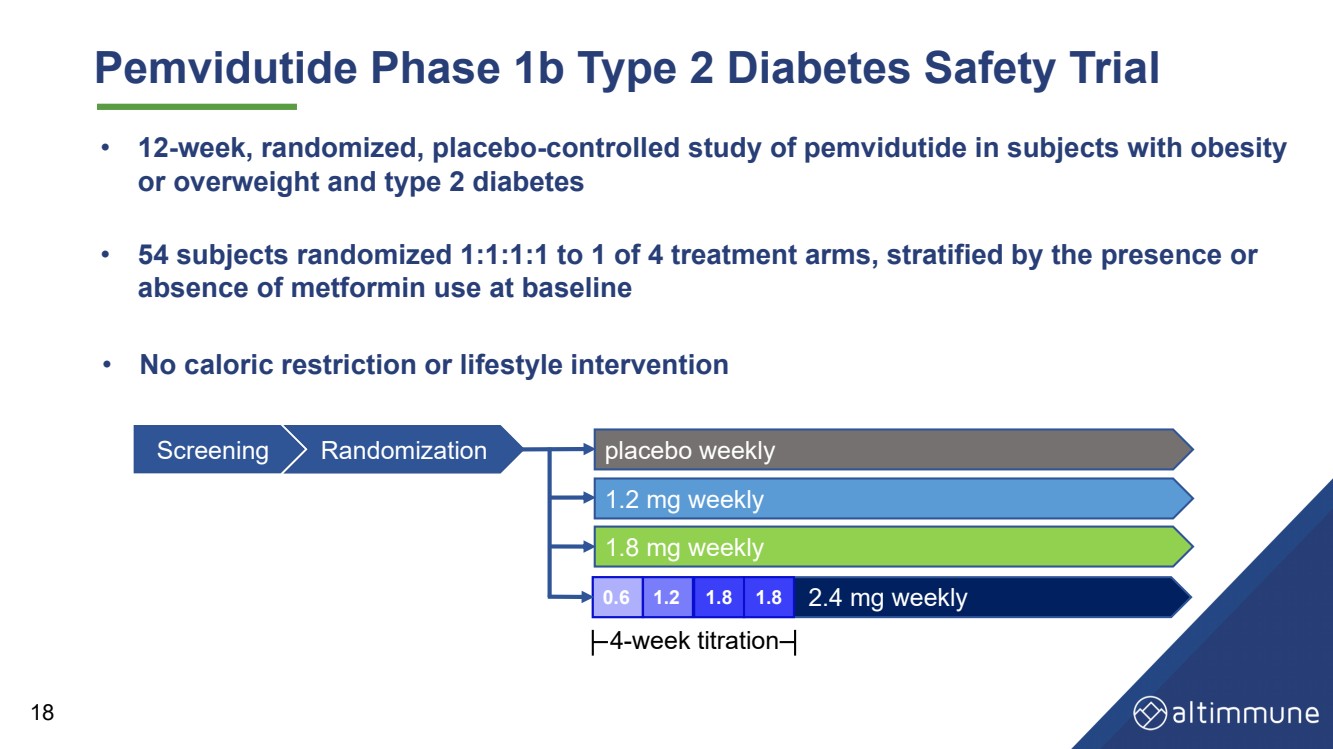
| Pemvidutide 1b 期 2 型糖尿病安全性试验 • 54 名受试者以 1:1:1 随机分配到 4 个治疗组中的 1 个,按存在或分层 基线时未使用二甲双胍 • 对肥胖受试者进行为期 12 周的随机、安慰剂对照研究 或超重和 2 型糖尿病 18 • 没有卡路里限制或生活方式干预 每周筛查随机安慰剂 每周 1.8 毫克 每周 2.4 毫克 每周 1.2 毫克 0.6 1.2 1.8 1.8 4 周滴定 |
| 研究人群——关键资格标准 • 男性和女性,年龄在 18-65 岁之间 • 体重指数 ≥ 28 kg/m2 • 在 2 型糖尿病之前至少服用 3 个月稳定的血糖控制方案 筛选 • 血糖控制方案包括以下至少一项: — 饮食和运动 — 二甲双胍无胃肠道症状或出现轻微胃肠道症状 — SGLT-2 疗法 19 |
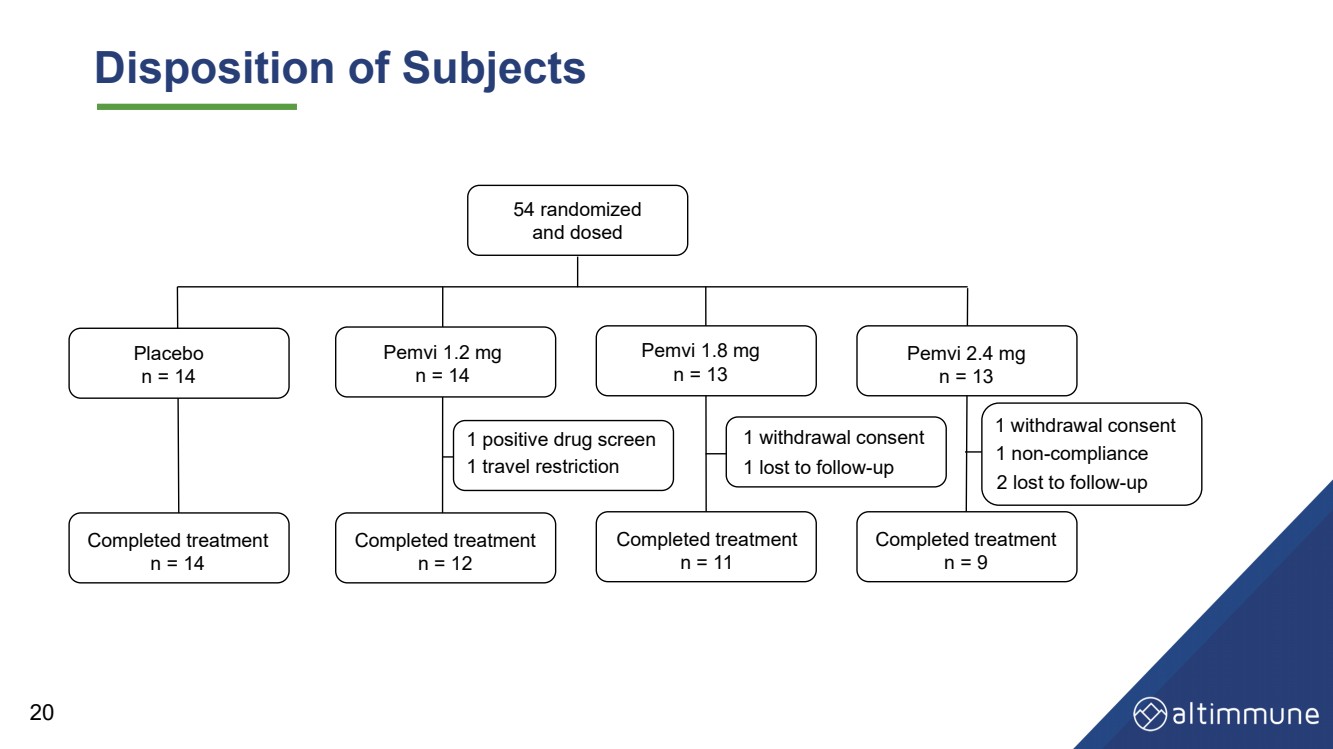
| 受试者的处置 安慰剂 n = 14 Pemvi 1.2 毫克 n = 14 Pemvi 1.8 毫克 n = 13 Pemvi 2.4 毫克 n = 13 治疗已完成 n = 14 治疗已完成 n = 12 治疗已完成 n = 9 1 份撤回同意 治疗已完成 n = 11 54 个随机化 并给药 1 份撤回同意 1 违规行为 2 人因后续行动而丢失 1 人因后续行动而丢失 1 次药物筛查阳性 20 1. 旅行限制 |
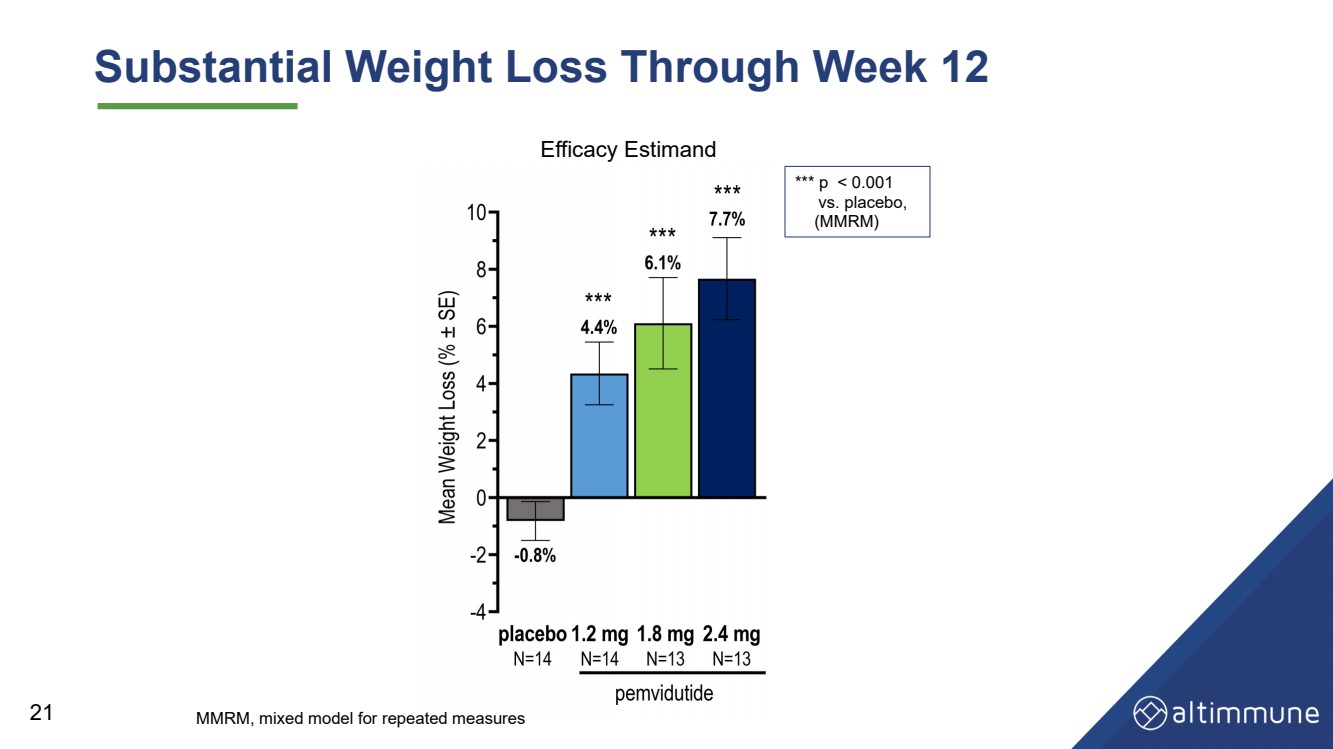
| 第12周体重大幅减轻 21 *** p |
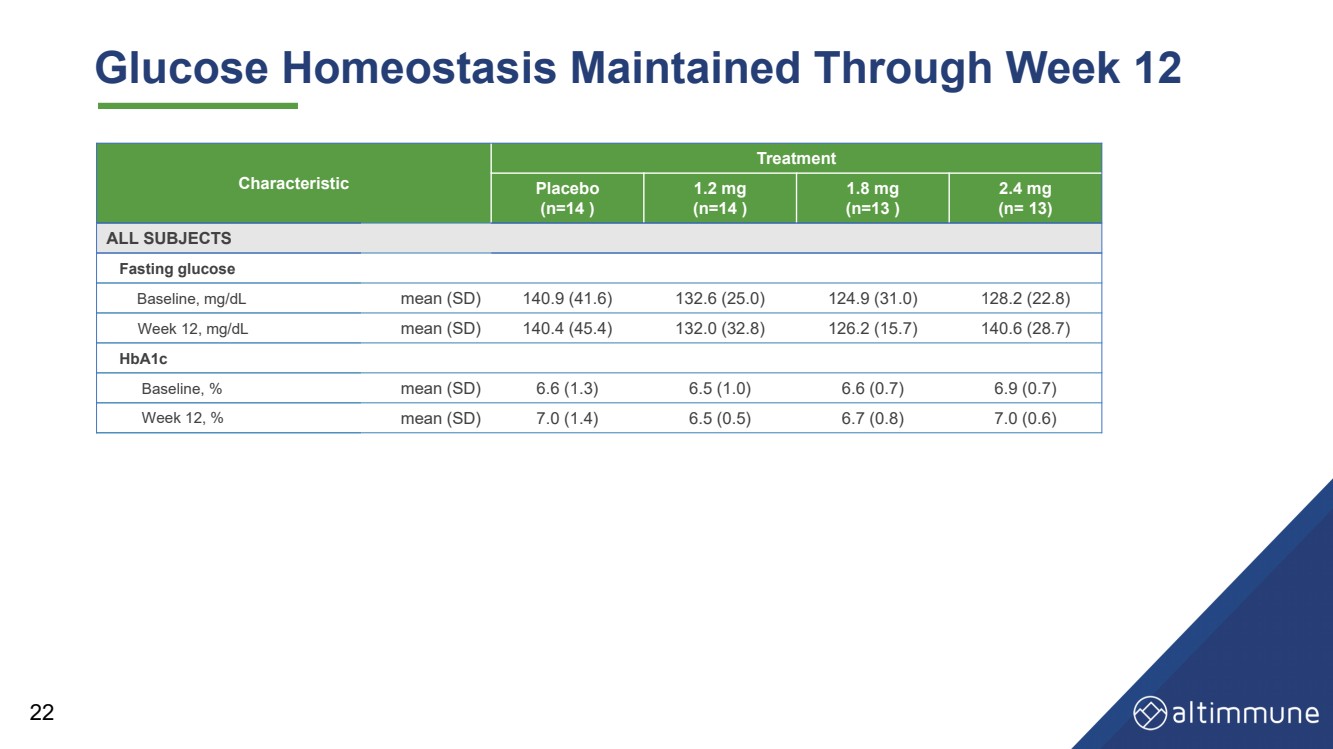
| 22 特征 治疗 安慰剂 (n = 14) 1.2 毫克 (n = 14) 1.8 毫克 (n = 13) 2.4 毫克 (n = 13) 所有科目 空腹血糖 基线,mg/dL 平均值 (SD) 140.9 (41.6) 132.6 (25.0) 124.9 (31.0) 128.2 (22.8) 第 12 周,mg/dL 平均值 (SD) 140.4 (45.4) 132.0 (32.8) 126.2 (15.7) 140.6 (28.7) HbA1c 基线,% 平均值 (SD) 6.6 (1.3) 6.5 (1.0) 6.6 (0.7) 6.9 (0.7) 6.9 (0.7) 第 12 周,% 平均值 (SD) 7.0 (1.4) 6.5 (0.5) 6.7 (0.8) 7.0 (0.6) 血糖动态平衡持续到第 12 周 |
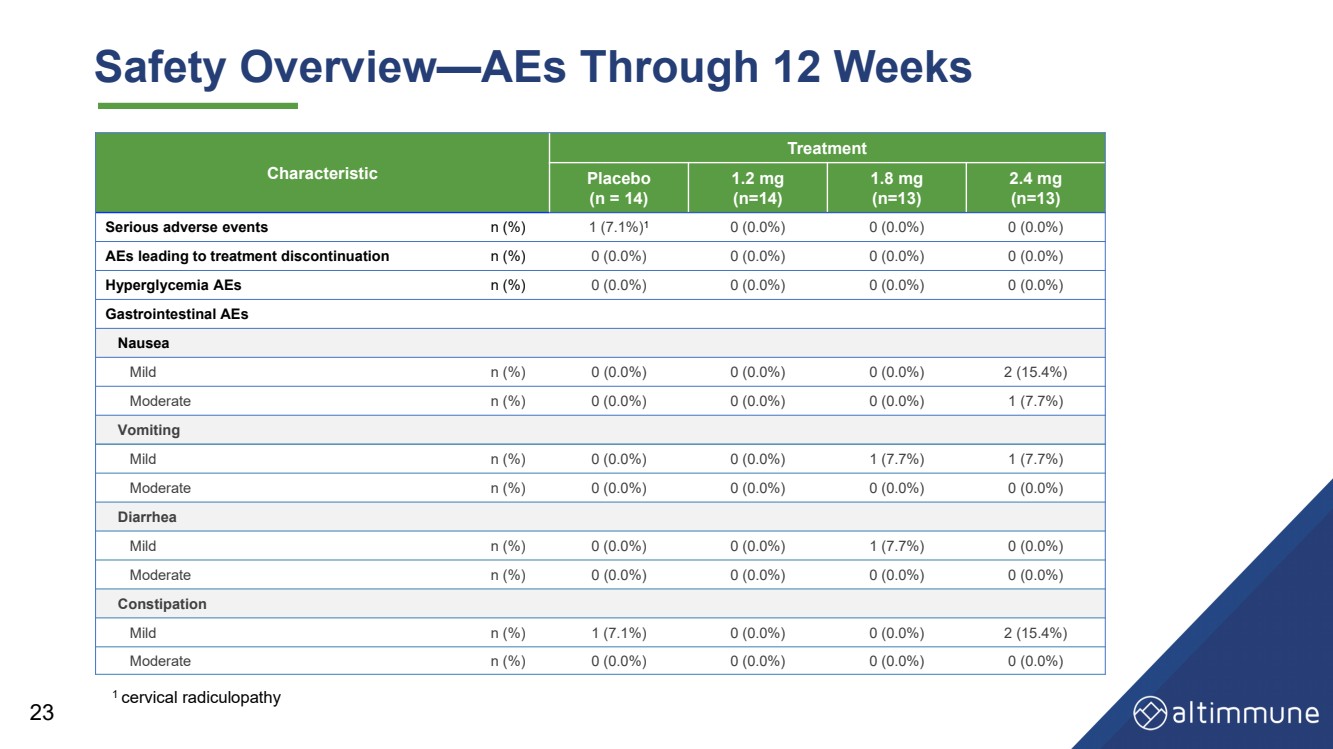
| 23 安全概述——历时 12 周的 AES 特征 治疗 安慰剂 (n = 14) 1.2 毫克 (n = 14) 1.8 毫克 (n = 13) 2.4 毫克 (n = 13) 严重不良事件 n (%) 1 (7.1%) 1 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 导致停止治疗的 AE n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 高血糖 aEs n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 胃肠道 AE 恶心 轻度 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 2 (15.4%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 呕吐 轻度 n (%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 1 (7.7%) 1 (7.7%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 腹泻 轻度 n (%) 0 (0.0%) 0 (0.0%) 1 (7.7%) 0 (0.0%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 便秘 轻度 n (%) 1 (7.1%) 0 (0.0%) 0 (0.0%) 2 (15.4%) 中等 n (%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 0 (0.0%) 1 颈神经根病 |
| 摘要和结论 安全性和耐受性 • 耐受性极佳,GI AE 率低 • 不会因 AE 而停产 24 血糖控制 • 血糖动态平衡得以维持,空腹血糖或 HbA1c 没有显著变化 第 12 周 • 无高血糖 aE 减肥 • 到第 12 周,体重减轻 7.7%(安慰剂调整后的 8.5%),体重减轻了 2.4 mg,并有可能保持强效状态 在以后的时间点减肥 |
| 纳斯达克:ALT 与本演示文稿有关的问题: 首席财务官里奇·艾森斯塔特 reisenstadt@altimmune.com |