美国
证券交易委员会
华盛顿特区,邮编:20549
表格 | |
(标记一)
截至本季度末2020年3月31日
或
从_到_的过渡期
委员会文件号: 001-38753

(注册人的确切姓名载于其章程)
(法团或组织的州或其他司法管辖区) | (税务局雇主身分证号码) | ||
(主要行政办公室地址) | (邮政编码) | ||
(617 ) 714-6500
(注册人的电话号码,包括区号)
根据该法第12(B)条登记的证券:
每个班级的标题 | 交易代码 | 注册的每个交易所的名称 |
用复选标记表示注册人(1)是否在过去12个月内(或注册人被要求提交此类报告的较短时间内)提交了1934年《证券交易法》第13条或15(D)节要求提交的所有报告,以及(2)在过去90天内是否符合此类提交要求。是 ☒ 不是o
用复选标记表示注册人是否在过去12个月内(或在注册人被要求提交此类文件的较短时间内)以电子方式提交了根据S-T规则第405条(本章232.405节)要求提交的每个交互数据文件。是 ☒ 不是o
用复选标记表示注册人是大型加速申报公司、加速申报公司、非加速申报公司、较小的报告公司或新兴成长型公司。见《交易法》第12b-2条中“大型加速申报公司”、“加速申报公司”、“较小申报公司”和“新兴成长型公司”的定义。
☒ | 加速文件管理器o | 非加速文件服务器o | 规模较小的报告公司 | |||||
新兴成长型公司 | ||||||||
如果是一家新兴的成长型公司,用复选标记表示注册人是否已选择不使用延长的过渡期来遵守根据《交易所法》第13(A)节提供的任何新的或修订的财务会计准则。o
用复选标记表示登记人是否为空壳公司(如该法第12b-2条所界定)。是☐ 不是x
截至2020年4月30日,有371,223,865 注册人的普通股,每股面值0.0001美元,已发行。
关于前瞻性陈述的特别说明
这份关于Form 10-Q(“Form 10-Q”)的季度报告,包括题为“管理层对财务状况和经营结果的讨论和分析”的章节,包含基于管理层的信念和假设以及管理层目前掌握的信息的明示或暗示的前瞻性陈述。尽管我们认为这些前瞻性陈述中反映的预期是合理的,但这些陈述涉及未来事件或我们未来的运营或财务表现,涉及已知和未知的风险、不确定性和其他因素,可能会导致我们的实际结果、业绩或成就与这些前瞻性陈述明示或暗示的任何未来结果、业绩或成就大不相同。本10-Q表格中的前瞻性陈述包括但不限于关于以下方面的陈述:
• | 我们的研究和开发计划以及我们当前和未来的临床前研究和临床试验的启动、时间、进度、结果、安全性和有效性以及成本,包括有关研究或试验和相关准备工作的开始和完成时间、试验结果将在多长时间内可用以及我们的研究和开发计划的声明; |
• | 当前冠状病毒大流行或任何其他健康流行病对我们的业务、我们的临床试验、我们的研究计划、医疗保健系统或全球经济的最终影响; |
• | 我们在针对新型冠状病毒的研究疫苗mRNA-1273方面的活动; |
• | 我们对开发候选药物和研究药物的预期下一步行动; |
• | 我们有能力确定研究重点并应用风险缓解策略,以有效地发现和开发开发候选药物和研究药物,包括将从一个项目中学到的知识应用到我们的其他项目中,并从一个模式应用到我们的其他模式中; |
• | 我们有能力和潜力成功地制造我们的药物物质、输送载体、开发候选药物和研究药物,用于临床前使用、临床试验和更大规模的商业使用(如果获得批准); |
• | 我们的第三方战略合作伙伴继续开展与我们的开发候选药物和研究药物相关的研发活动的能力和意愿; |
• | 我们有能力为我们的业务获得必要的资金,以完成我们研究药物的进一步开发和商业化; |
• | 我们获得并保持对我们的研究药物的监管批准的能力; |
• | 如果获得批准,我们将产品商业化的能力; |
• | 如果获得批准,我们的研究药物的定价和报销; |
• | 实施我们的商业模式,以及我们的业务、研究药物和技术的战略计划; |
• | 我们能够建立和维护的知识产权保护范围,包括我们的研究药物和技术; |
• | 对我们未来的支出、收入、资本需求和额外融资需求的估计; |
• | 战略协作协议的潜在好处,我们达成战略协作或安排的能力,以及我们以开发、监管和商业化专业知识吸引合作者的能力; |
• | 如果获得批准,未来与第三方就我们的研究药物商业化达成的协议; |
• | 我们研究药物市场的规模和增长潜力,以及我们为这些市场提供服务的能力; |
• | 我们的财务业绩; |
• | 我们的研究药物的市场接受率和程度; |
• | 美国和其他国家的监管动态; |
• | 我们与第三方供应商和制造商签订合同的能力以及他们充分履行合同的能力; |
• | 我们在周转时间或制造成本方面具有优势的产品或研究药物的生产能力; |
• | 已有或可能获得的竞争性疗法的成功; |
• | 我们吸引和留住关键科学或管理人员的能力; |
• | 法律法规的影响; |
• | 与我们的竞争对手和本行业有关的发展;以及 |
• | 其他风险和不确定性,包括第二部分第1A项--本表格10-Q中的风险因素中讨论的风险和不确定性。 |
在某些情况下,前瞻性陈述可以通过“可能”、“应该”、“预期”、“打算”、“计划”、“预期”、“相信”、“估计”、“预测”、“可能”、“继续”或这些术语的否定或其他类似术语来识别。这些声明只是预测。你不应该过分依赖前瞻性陈述,因为它们涉及已知和未知的风险、不确定性和其他因素,这些因素在某些情况下是我们无法控制的,可能会对结果产生重大影响。可能导致实际结果与当前预期大相径庭的因素,除其他外,包括在题为“风险因素”一节和本表格10-Q中其他部分列出的因素。如果这些风险或不确定性中的一个或多个发生,或者如果我们的基本假设被证明是不正确的,实际事件或结果可能与前瞻性陈述中明示或暗示的大不相同。任何前瞻性声明都不是对未来业绩的保证。
本10-Q表格中的前瞻性陈述代表我们截至本10-Q表格发布之日的观点。我们预计随后发生的事件和事态发展将导致我们的观点发生变化。然而,虽然我们可能会选择在未来的某个时候更新这些前瞻性陈述,但我们目前无意这样做,除非适用法律要求这样做。因此,您不应依赖这些前瞻性陈述来代表我们截至本10-Q表格日期之后的任何日期的观点。
本10-Q表格包括我们从行业出版物和研究、调查以及第三方进行的研究中获得的统计数据和其他行业和市场数据。行业出版物和第三方研究、调查和研究一般表明,他们的信息是从被认为可靠的来源获得的,尽管它们不保证此类信息的准确性或完整性。我们没有独立核实这些来源中包含的信息。
关于公司推荐人的说明
除非上下文另有要求,否则本表格10-Q中的术语“Moderna”、“公司”、“我们”和“我们的”指Moderna,Inc.及其合并子公司。
目录表
第一部分: | 页面 | |
第1项。 | 财务报表(未经审计) | 5 |
截至2020年3月31日和2019年12月31日的简明合并资产负债表 | 5 | |
截至2020年和2019年3月31日止三个月的简明合并经营报表 | 6 | |
截至2020年和2019年3月31日止三个月的简明综合全面亏损报表 | 7 | |
截至2020年和2019年3月31日止三个月的简明合并股东权益表 | 8 | |
截至2020年和2019年3月31日止三个月的简明合并现金流量表 | 9 | |
简明合并财务报表附注 | 10 | |
第二项。 | 管理层对财务状况和经营成果的探讨与分析 | 39 |
第三项。 | 关于市场风险的定量和定性披露 | 53 |
第四项。 | 控制和程序 | 53 |
第二部分。 | ||
第1项。 | 法律诉讼 | 54 |
第1A项。 | 风险因素 | 54 |
项目2 | 未登记的股权证券销售和收益的使用 | 106 |
第六项。 | 陈列品 | 106 |
签名 | ||
目录表
项目1.财务报表
Moderna公司
CONDENSED CONSOLIDATED BALANCE SHEETS
(未经审计,单位:千人,份额和每股数据除外)
3月31日, | 十二月三十一日, | ||||||
2020 | 2019 | ||||||
资产 | |||||||
流动资产: | |||||||
现金及现金等价物 | $ | $ | |||||
投资 | |||||||
应收账款 | |||||||
关联方应收账款 | |||||||
预付费用和其他流动资产 | |||||||
受限现金 | |||||||
流动资产总额 | |||||||
非流动投资 | |||||||
财产和设备,净额 | |||||||
使用权资产、经营租赁 | |||||||
受限现金,非流动现金 | |||||||
其他非流动资产 | |||||||
总资产 | $ | $ | |||||
负债与股东权益 | |||||||
流动负债: | |||||||
应付帐款 | $ | $ | |||||
应计负债 | |||||||
递延收入 | |||||||
其他流动负债 | |||||||
流动负债总额 | |||||||
递延收入,非流动 | |||||||
非流动经营租赁债务 | |||||||
非流动融资租赁负债 | |||||||
其他非流动负债 | |||||||
总负债 | |||||||
承付款和或有事项(附注8) | |||||||
股东权益: | |||||||
优先股,面值0.0001美元;截至2020年3月31日已授权162,000,000股 及2019年12月31日;截至2020年3月31日及2020年3月31日,无已发行或发行股票 2019年12月31日 | |||||||
普通股,面值0.0001美元;截至2020年3月31日和2019年12月31日授权1,600,00,000股;截至2020年3月31日和2019年12月31日已发行和发行的股票分别为370,102,805股和336,536,985股 | |||||||
额外实收资本 | |||||||
累计其他综合(亏损)收入 | ( | ) | |||||
累计赤字 | ( | ) | ( | ) | |||
股东权益总额 | |||||||
总负债和股东权益 | $ | $ | |||||
附注是这些未经审计的简明综合财务报表的组成部分。
5
目录表
Moderna公司
简明合并业务报表
(未经审计,单位:千人,份额和每股数据除外)
截至3月31日的三个月, | |||||||
2020 | 2019 (1) | ||||||
收入: | |||||||
协作收入 | $ | $ | |||||
来自关联方的协作收入 | |||||||
助学金收入 | |||||||
总收入 | |||||||
运营费用: | |||||||
研发 | |||||||
一般和行政 | |||||||
总运营支出 | |||||||
运营亏损 | ( | ) | ( | ) | |||
利息收入 | |||||||
其他费用,净额 | ( | ) | ( | ) | |||
所得税前亏损 | ( | ) | ( | ) | |||
所得税准备金(受益于) | ( | ) | |||||
净亏损 | $ | ( | ) | $ | ( | ) | |
每股基本和稀释后净亏损 | $ | ( | ) | $ | ( | ) | |
用于每股净亏损的加权平均普通股,基本和稀释 | |||||||
________
(1) 重述以符合ASC 842。请参阅随附的注释2。
附注是这些未经审计的简明综合财务报表的组成部分。
6
目录表
Moderna公司
简明综合全面损失表
(未经审计,以千计)
截至3月31日的三个月, | |||||||
2020 | 2019 (1) | ||||||
净亏损 | $ | ( | ) | $ | ( | ) | |
其他综合(亏损)收入: | |||||||
可供出售债务证券的未实现(损失)收益,分别扣除0美元和540美元的税款 | ( | ) | |||||
减:计入净损失的已实现(收益)净损失确认的金额 | ( | ) | |||||
其他综合(亏损)收入合计 | ( | ) | |||||
综合损失 | $ | ( | ) | $ | ( | ) | |
______
(1) 重述以符合ASC 842。请参阅随附的注释2。
附注是这些未经审计的简明综合财务报表的组成部分。
7
目录表
Moderna公司
简明合并股东权益报表
截至2020年3月31日和2019年3月31日的三个月
(未经审计,以千计,共享数据除外)
普通股 | 其他内容 已缴费 资本 | 累计 其他 全面 损失 | 累计 赤字 | 总 股东的 股权 | ||||||||||||||||||
股份 | 量 | |||||||||||||||||||||
2019年12月31日的余额 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||
公开发行普通股收益,扣除发行成本1,108美元 | — | — | ||||||||||||||||||||
受限制普通股单位的归属 | — | — | — | — | ||||||||||||||||||
行使购买普通股的期权,净值 | — | — | — | |||||||||||||||||||
基于股票的薪酬 | — | — | — | — | ||||||||||||||||||
有价证券未实现亏损 | — | — | — | ( | ) | — | ( | ) | ||||||||||||||
净亏损 | — | — | — | — | ( | ) | ( | ) | ||||||||||||||
2020年3月31日的余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||
普通股 | 其他内容 已缴费 资本 | 累计 其他 全面 收入 | 累计 赤字(1) | 总 股东的 权益(1) | ||||||||||||||||||
股份 | 量 | |||||||||||||||||||||
2018年12月31日的余额 | $ | $ | $ | ( | ) | $ | ( | ) | $ | |||||||||||||
受限制普通股的归属 | — | — | — | — | ||||||||||||||||||
行使购买普通股的期权,净值 | — | — | — | |||||||||||||||||||
采用ASC 606后的过渡调整 | — | — | — | — | ||||||||||||||||||
采用ASC 842后的过渡调整 | — | — | — | — | ( | ) | ( | ) | ||||||||||||||
基于股票的薪酬 | — | — | — | — | ||||||||||||||||||
有价证券的未实现收益 | — | — | — | — | ||||||||||||||||||
净亏损 | — | — | — | — | ( | ) | ( | ) | ||||||||||||||
2019年3月31日的余额 | $ | $ | $ | $ | ( | ) | $ | |||||||||||||||
_______
(1) 重述以符合ASC 842。请参阅随附的注释2。
附注是这些未经审计的简明综合财务报表的组成部分。
8
目录表
Moderna公司
简明合并现金流量表
(未经审计,以千计)
截至3月31日的三个月, | |||||||
2020 | 2019 (1) | ||||||
经营活动 | |||||||
净亏损 | $ | ( | ) | $ | ( | ) | |
对净亏损与经营活动中使用的现金净额进行的调整: | |||||||
基于股票的薪酬 | |||||||
折旧及摊销 | |||||||
摊销/增值投资 | ( | ) | |||||
财产和设备处置损失 | |||||||
资产和负债变动情况: | |||||||
应收账款 | ( | ) | |||||
关联方应收账款 | ( | ) | ( | ) | |||
预付费用和其他资产 | ( | ) | |||||
使用权资产、经营租赁 | ( | ) | |||||
应付帐款 | |||||||
应计负债 | ( | ) | ( | ) | |||
递延收入 | ( | ) | ( | ) | |||
经营租赁负债 | ( | ) | |||||
其他负债 | |||||||
用于经营活动的现金净额 | ( | ) | ( | ) | |||
投资活动 | |||||||
购买有价证券 | ( | ) | ( | ) | |||
有价证券到期日收益 | |||||||
出售有价证券所得收益 | |||||||
购置财产和设备 | ( | ) | ( | ) | |||
投资活动所用现金净额 | ( | ) | ( | ) | |||
融资活动 | |||||||
公开发行普通股所得收益,扣除发行成本 | |||||||
通过股权计划发行普通股的收益,净额 | |||||||
融资租赁义务的费用 | |||||||
融资活动提供的现金净额 | |||||||
现金、现金等价物和限制性现金净增(减) | ( | ) | |||||
现金、现金等价物和受限现金,年初 | |||||||
现金、现金等价物和受限现金,期末 | $ | $ | |||||
非现金投融资活动 | |||||||
应付账款和应计负债中所列财产和设备的购置 | $ | $ | |||||
______
(1) 重述以符合ASC 842。请参阅随附的注释2。
附注是这些未经审计的简明综合财务报表的组成部分。
9
目录表
Moderna公司
简明合并财务报表附注
(未经审计)
1. 业务描述
Moderna(统称为Moderna及其合并子公司、Moderna、我们、我们或本公司)于2016年7月22日在特拉华州注册成立。我们是Moderna有限责任公司的权益继承人,该有限责任公司于2013年根据特拉华州法律成立。我们的主要执行办公室位于马萨诸塞州剑桥市科技广场200号。
我们是一家临床阶段的生物技术公司,正在创造基于信使RNA(MRNA)的新一代变革性药物,以改善患者的生活。信使核糖核酸药物旨在引导人体细胞产生细胞内、膜或分泌的蛋白质,这些蛋白质具有治疗或预防的益处,有可能治疗广泛的疾病。我们的平台建立在基础和应用信使核糖核酸科学、递送技术和制造方面的不断进步的基础上,使我们有能力同时开发一系列强大的新开发候选者。我们正在独立并与我们的战略合作伙伴一起开发针对传染病、免疫肿瘤学、罕见疾病、自身免疫和心血管疾病的疗法和疫苗。
自成立以来,我们发生了重大的净亏损。截止日期:2020年3月31日,我们有一个累积的赤字。$1.62 十亿。我们预计在可预见的未来将继续产生巨额费用和运营亏损。此外,我们预计,在支持我们的平台研究、药物发现和临床开发、基础设施和研究引擎和早期开发引擎、数字基础设施、创建知识产权组合、向全球市场扩张以及行政支持等持续活动方面,我们的支出将大幅增加。
我们预计,除非我们成功完成临床开发并获得监管部门对我们一种或多种研究药物的批准,否则我们不会从潜在的信使核糖核酸药物的销售中获得可观的收入。如果我们寻求获得监管部门对我们的任何研究药物的批准,我们预计将产生巨额商业化费用。我们针对新型冠状病毒(mRNA-1273)的研究疫苗目前正处于临床试验阶段,已迅速开发出来,以应对全球大流行。我们正在花费大量努力来推动这种潜在疫苗的快速开发,并预计在未来12个月内继续这样做。这些努力将需要支出大量额外资金,并在世界范围内建立大量额外基础设施和伙伴关系。
因此,我们将需要大量额外资金来支持我们的持续运营和实施我们的增长战略。在我们能够从潜在的信使核糖核酸药物中产生可观的收入之前,如果有的话,我们预计将通过公共或私募股权发行、结构性融资和债务融资、政府融资安排、战略联盟以及营销、制造、分销和许可安排来为我们的业务提供资金。我们可能无法筹集更多资金或以优惠条件达成此类其他协议,或者根本无法。如果我们不能在需要的时候筹集资金或达成协议,我们可能不得不大幅推迟、缩减或停止我们一个或多个项目的开发和商业化。我们相信,截至2010年,我们的现金、现金等价物和投资2020年3月31日这将足以使我们能够在至少未来12个月内为我们的计划运营提供资金,从我们的财务报表发布起。
由于与药品开发相关的许多风险和不确定性,我们无法预测增加费用的时间或金额,也无法预测我们何时或是否能够实现或保持盈利。即使我们能够从销售我们的药品(包括mRNA-1273)中获得收入,我们也可能无法盈利。如果我们无法实现盈利或无法持续盈利,那么我们可能无法继续按计划运营,并被迫减少运营。
2. 列报依据和最新会计准则摘要
列报依据和合并原则
随附本票据的未经审核简明综合财务报表乃根据美国公认会计原则及美国证券交易委员会(美国证券交易委员会)有关中期财务报告的适用规则及规定编制,在所有重要方面均与我们在截至2019年12月31日止年度的10-K表格(2019年10-K表格)中所应用的一致。本附注中对适用指引的任何提及均指财务会计准则委员会(FASB)的《会计准则汇编》(ASC)和《会计准则更新》(ASU)中美国公认的权威会计原则。本报告应与我们2019 Form 10-K中的合并财务报表一起阅读。
10
目录表
合并财务报表包括本公司及其子公司。所有公司间交易和余额都已在合并中冲销。
预算的使用
我们作出的估计和判断影响了我们的简明综合财务报表和附注中报告的金额。我们持续评估我们的估计,包括关键会计政策或与收入确认、研发费用、所得税拨备、基于股票的薪酬、租赁和长期资产的使用寿命相关的估计。我们根据过往经验及我们认为在当时情况下合理的各种相关假设作出估计,而这些假设的结果构成对资产及负债的账面价值作出判断的基础,而该等资产及负债的账面价值并非从其他来源轻易可见。我们所经历的实际结果可能与我们的估计大不相同。编制这些财务报表时所依据的重大估计包括(但不限于)与股权奖励的公允价值、收入确认、研发费用、租赁、公允价值工具、财产和设备的使用年限、所得税以及我们对递延税项资产的估值准备有关的估计。
重大会计政策
编制该等截至三个月的简明综合财务报表所使用的主要会计政策2020年3月31日与我们的2019年Form 10-K中描述的一致,但最近采用的会计准则“下面这一节。”
从2019年12月31日起,我们失去了新兴成长型公司(EGC)地位,这加速了ASC 842(租赁会计)的采用要求。因此,我们在2019年Form 10-K中调整了之前报告的合并财务报表,从2019年1月1日起生效,不需要修改之前提交的Form 10-Q。因此,我们上期简明综合财务报表和信息,如本文所示,已重新列报,以符合新准则。
下表总结了采用ASC 842对我们截至2019年3月31日的三个月精简合并财务报表的影响(单位为千,每股数据除外):
截至2019年3月31日止三个月 | ||||||||||||
ASC 842 | ||||||||||||
之前报道的 | 调整 | 调整后的 | ||||||||||
运营费用: | ||||||||||||
研发 | $ | $ | ( | ) | $ | |||||||
一般和行政 | ( | ) | ||||||||||
总运营支出 | ( | ) | ||||||||||
运营亏损 | ( | ) | ( | ) | ||||||||
其他费用,净额 | ( | ) | ( | ) | ( | ) | ||||||
所得税前亏损 | ( | ) | ( | ) | ||||||||
净亏损 | ( | ) | ( | ) | ||||||||
普通股股东应占每股基本亏损和稀释后每股净亏损 | ( | ) | — | ( | ) | |||||||
11
目录表
截至2019年3月31日止三个月 | ||||||||||||
之前报道的 | ASC 842期内调整 | 调整后的 | ||||||||||
经营活动 | ||||||||||||
净亏损 | $ | ( | ) | $ | $ | ( | ) | |||||
折旧及摊销 | ( | ) | ||||||||||
预付费用和其他资产 | ||||||||||||
使用权资产、经营租赁 | — | |||||||||||
递延租赁债务 | ( | ) | — | |||||||||
经营租赁负债 | — | ( | ) | ( | ) | |||||||
其他负债 | ||||||||||||
用于经营活动的现金净额 | ( | ) | ( | ) | ( | ) | ||||||
融资活动 | ||||||||||||
融资租赁义务的费用 | — | |||||||||||
融资租赁义务付款 | ( | ) | — | |||||||||
融资活动提供的现金净额(用于) | ( | ) | ||||||||||
综合损失
综合损失包括本期净损失和其他综合(损失)收益。其他全面(损失)收入包括我们投资的未实现损益。所有期间的全面亏损总额已在简明综合全面亏损表中披露。
累计其他综合损失的构成 止三个月 2020年3月31日具体如下(以千为单位):
可供出售债务证券的未实现收益 | |||
2020年3月31日 | |||
累计其他综合收益,截至2019年12月31日余额 | $ | ||
其他综合损失 | ( | ) | |
累计其他综合损失,2020年3月31日余额 | $ | ( | ) |
受限现金
我们将受限现金余额计入现金、现金等价物,并将经营、投资和融资活动的受限现金调节计入简明综合现金流量表。
下表对简明综合资产负债表中的现金、现金等价物和限制性现金进行了核对,这些现金合计为简明综合现金流量表所列相同数额的总和(以千计):
截至3月31日, | ||||||||
2020 | 2019 | |||||||
现金及现金等价物 | $ | $ | ||||||
受限现金 | ||||||||
受限现金,非流动现金 | ||||||||
简明合并中显示的现金、现金等价物和限制性现金总额 *现金流量表 | $ | $ | ||||||
最近采用的会计准则
12
目录表
2016年6月,FASB发布了ASU第2016-13号,信贷损失(主题326):金融工具信贷损失的计量。这一标准改变了公司对大多数金融资产和某些其他工具的信贷损失的会计处理方式。对于应收账款、贷款和持有至到期的债务证券,公司将被要求确认信贷损失准备,而不是减少资产的账面价值。本标准中的修订应在修改后的追溯基础上适用于提出的所有期间。我们在2020年第一季度采用了本标准。根据我们的投资组合和投资政策的构成,采用这一标准并没有对我们的综合财务报表和披露产生实质性影响。
2018年8月,FASB发布ASU 2018—15, 无形资产-商誉和其他-内部使用软件(主题350):客户对作为服务合同的云计算安排中发生的实施成本的核算。*本标准要求将开发或获取内部使用软件(以及包括内部使用软件许可证的托管安排)所产生的实施成本资本化。我们在2020年第一季度使用前瞻性方法采用了这一标准。采用这一准则并未对我们的综合财务报表和披露产生实质性影响。
近期发布的会计准则
新的会计声明不时由财务会计准则委员会或其他准则制定机构发布,并在指定的生效日期被我们采纳。除非另有讨论,否则我们相信,近期发布的尚未生效的准则的影响不会对我们的综合财务报表和披露产生实质性影响。
2019年12月,FASB发布了ASU 2019-12,所得税(话题740):简化所得税会计.该标准删除了投资、期内分配和中期计算的某些例外情况,并添加了降低所得税会计复杂性的指导。该标准将于2021年1月1日对我们生效,允许提前采用。我们目前正在评估该准则在采用后可能对我们的简明综合财务报表和披露产生的潜在影响。
3. 协作协议
下表总结了所列期间我们来自战略合作伙伴的综合净收入总额(以千计):
截至三个月 3月31日, | ||||||||
战略合作者的合作收入: | 2020 | 2019 | ||||||
默克 | $ | $ | ||||||
阿斯利康 | ||||||||
顶点 | ||||||||
其他 | ||||||||
协作总收入 | $ | $ | ||||||
下表列出了年内与战略合作协议相关的应收账款和合同负债余额的变化 止三个月 2020年3月31日(单位:千):
2019年12月31日 | 添加 | 扣除额 | 2020年3月31日 | |||||||||||||
合同资产: | ||||||||||||||||
应收账款 | $ | $ | $ | ( | ) | $ | ||||||||||
合同责任: | ||||||||||||||||
递延收入 | $ | $ | $ | ( | ) | $ | ||||||||||
13
目录表
在.期间止三个月 2020年3月31日,由于与我们的合作协议相关的合同负债余额变化,我们确认了以下收入(以千计):
当期确认的收入来自: | 截至2020年3月31日的三个月 | |||
期初列入合同负债的数额(1) | $ | |||
前几个报告期已履行(或部分履行)的履约义务(2) | ||||
______
(1)我们首先将收入分配给期末未偿的个人合同负债余额,直到收入超过该余额。如果在后续期间收到这些合同的额外对价,我们假设报告期内确认的所有收入首先应用于初始合同负债。
(2)与我们未来履行义务的估计成本的变化和估计可变考虑因素有关。
自.起2020年3月31日,分配给我们的合作协议项下未履行或部分未履行的履行义务的交易价格总额为 $278.8 百万.
阿斯利康-心血管和肿瘤学方面的战略联盟
2013年选项协议以及服务和协作协议
2013年3月,我们与阿斯利康签订了期权协议,AZ期权协议,以及相关的服务和协作协议,AZ服务协议,并于2018年6月进行了修订和重述。我们将2018年修订和重述之前存在的形式的这些协议称为2013年自贸区协议。根据2013年AZ协议,我们授予阿斯利康某些独家权利和许可证,以及获得独家权利以开发和商业化针对某些治疗心血管和心脏代谢性疾病和癌症目标的潜在治疗性信使药物的选择权,并同意向阿斯利康提供相关服务。根据2013年AZ协议,阿斯利康负责所有研究、开发和商业化活动,而我们在研究和评估期内提供具体的研究和制造服务,如下所述,以根据商定的服务计划促进阿斯利康的活动。根据2013年的AZ协议,阿斯利康本可以要求我们提供额外的服务,费用由阿斯利康承担。根据授予阿斯利康的惯常“后备”供应权,我们根据2013年AZ协议独家生产(或曾经制造)用于所有研究、开发和商业化目的的mRNA,直至根据2013 AZ协议我们有权就该等产品收取收益付款的时间段届满为止。
截至2013年AZ协议生效日期,阿斯利康收购了四十 为获得针对研究和评估期间出现的特定目标而确定的开发候选对象(和相关的后备候选对象)进行临床开发和商业化的独家权利而可能行使的选项。在2013年AZ协议下的研究和评估期内,阿斯利康本可以选择指定有限数量的研究候选者作为开发候选者,以便继续对这些开发候选者(以及相关的后备候选者)进行临床前开发。从阿斯利康指定的开发候选者库中,在指定的期权行使期内,阿斯利康可以行使其期权之一,获得临床开发和商业化已确定的开发候选者(和相关的后备候选者)的独家权利。如果阿斯利康在为特定开发候选者规定的选择权行权期内没有行使其期权之一以获得临床开发和商业化特定开发候选者的独家权利,阿斯利康就该开发候选者(和相关后备候选者)行使根据2013年AZ协议授予的选择权和其他权利的权利将终止,所有开采该开发候选者(和相关后备候选者)的权利将返还给我们,阿斯利康就该开发候选者(和相关后备候选者)产生的所有数据和结果将被转让或许可给我们。在2013年AZ协议因任何原因终止和2013 AZ协议生效日期的指定周年日较早时,所有未行使的期权以及行使任何和所有期权的权利(如果之前未由阿斯利康行使)将自动终止。在逐个目标的基础上,我们和阿斯利康同意2013年AZ协议中关于该目标的信使核糖核酸药物的研究、开发和商业化的某些明确的排他性义务。
截至2013年AZ协议生效日期,阿斯利康向我们预付的现金总额为$240.0 百万。根据2013年的AZ协议,我们有权获得与任何特定计划无关的付款,最高可达$180.0 百万总而言之,为了实现三 与毒性、交付和竞争标准相关的技术里程碑。在截至2015年12月31日的年度内,我们实现了毒性和竞争里程碑。交付里程碑已过。2013年AZ下
14
目录表
协议,阿斯利康有义务向我们支付$10.0 百万对其行使期权的每个开发候选人(以及相关的后备候选人)的期权行使费。此外,在阿斯利康行使每一项选择权时,我们有资格根据特定临床、监管和商业活动的完成情况获得某些付款。对于阿斯利康选择的任何候选产品,我们有资格根据每个候选产品获得最高$100.0 百万在为实现发展里程碑支付款项方面,最高可达$100.0 百万为达到监管里程碑而支付的款项,最高可达$200.0 百万为实现商业里程碑而支付的款项。此外,根据2013年AZ协议,我们有权在逐个产品的基础上获得产品全球净销售额的赚取付款,范围从高个位数百分比到12 %,但要有一定的减幅,总的最低下限。
根据2013年AZ协议,我们从阿斯利康收到了一项期权行使付款$10.0 百万(2016年血管内皮生长因子演习)在截至2016年12月31日的年度内,以及临床里程碑付款$30.0 百万关于阿斯利康截至2018年12月31日的年度内的血管内皮生长因子-A产品(AZD8601),该产品目前正在某些领域进行第二阶段临床试验。除非早前终止,否则2013年的AZ协议将一直持续到阿斯利康的盈利和或有期权到期,并行使对可选产品候选人的付款义务。任何一方都有权在另一方对相关候选人的实质性违约行为(无论是完全违约还是在某些情况下)终止2013年自贸区协定,但须遵守规定的实质性门槛和具体的通知和补救规定。如果阿斯利康有权因我们的实质性违约而终止2013年的AZ协议,那么阿斯利康本可以选择保留2013年的AZ协议,而不是全部终止2013 AZ协议或针对这些候选者,但我们有资格获得的某些付款的减少以及对2013 AZ协议下阿斯利康义务的某些调整。阿斯利康有权在以下情况下无故全面终止2013年AZ协议90 -提前几天通知我们。
2016与阿斯利康的战略联盟 –IL-12
2016年1月,我们与阿斯利康签署了一项新的战略药物开发合作和许可协议,我们称之为2016 AZ协议,以发现、开发和商业化潜在的用于治疗一系列癌症的信使核糖核酸药物。
根据2016年AZ协议的条款,我们和阿斯利康已同意在免疫肿瘤学项目上合作,重点是在肿瘤内输送一种潜在的信使核糖核酸药物来制造IL-12蛋白。 2016年的AZ协议最初包括与第二个发现计划有关的研究活动。在有限的一段时间内,每一方都有机会提出将根据2016年亚洲区协议实施的额外发现计划。我们负责根据2016 AZ协议下商定的IL-12计划的发现计划和双方同意进行的任何其他发现计划,进行并资助2016 AZ协议下的所有发现和临床前开发活动。对于IL-12计划和双方根据2016 AZ协议同意实施的任何其他发现计划,在自2016 AZ协议(针对IL-12计划)的生效日期开始的规定的选举期内,以及在任何此类新发现计划启动时开始的规定的选举期内,阿斯利康可以选择参与根据2016 AZ协议从该计划产生的候选开发药物的临床开发。如果阿斯利康选择这样做(就像它为IL-12计划所做的那样),阿斯利康将领导全球的临床开发活动,我们将负责某些活动,包括单独负责制造活动,所有这些都符合商定的发展计划。阿斯利康将负责为所有第一阶段临床开发活动(包括与我们根据开发计划制造临床材料相关的成本)和第二阶段临床开发活动(包括与根据开发计划制造临床材料相关的成本)提供资金,最高限额为规定的美元门槛。我们和阿斯利康将平均分担超过该美元门槛的第二阶段临床开发活动的成本、所有第三阶段临床开发活动的成本以及后期临床开发活动的某些其他成本,除非我们选择不参与进一步的开发和商业化活动,而是获得如下所述的分级特许权使用费。
我们和阿斯利康将根据商定的商业化计划和预算在美国共同商业化产品,并将在逐个产品的基础上平分此类商业化所产生的美国利润或损失。尽管如此,在逐个产品的基础上,在特定产品的特定开发阶段之前,我们有权选择不参与该产品的进一步开发和商业化活动。如果我们做出这样的选择,我们有义务与阿斯利康讨论未来的财务条款,而不是参与此类产品在美国的损益分摊。如果我们无法在规定的短时间内就未来财务条款达成一致,我们有权按2016 AZ协议中规定的默认费率获得分级版税,从个位数中位数的百分比到20 %全球产品净销售额,但须有一定的减幅,并设有总最低下限。阿斯利康对所有前美国的商业化努力负有唯一和独家责任。除非我们已选择不参与进一步开发(在这种情况下,除美国外净销售额的特许权使用费将按上述默认费率计算,除非双方另有约定),否则我们有权按以下比率获得分级特许权使用费10 %至30 %产品在美国以外地区的净销售额,可按总额进行一定幅度的削减
15
目录表
最低楼层。根据授予阿斯利康的常规“后备”供应权,我们专门生产(或已经制造)用于所有开发和商业化目的的产品。我们和阿斯利康已根据2016年AZ协议就IL-12信使核糖核酸药物的开发和商业化相互同意某些明确的排他性义务。
除非我们提前终止,否则我们在2016 AZ协议下的战略联盟将继续以产品为基础:(I)如果我们没有选择不参与该产品的进一步开发和商业化,则直到双方停止开发和商业化该产品,或者(Ii)如果我们选择了不参与该产品的进一步开发和商业化的权利,则在该国家/地区的该产品的适用特许权使用费期限结束之前,如果我们选择了不参与该产品的进一步开发和商业化的权利,则将继续在该国家/地区的战略联盟。
任何一方均可在另一方实质性违约时终止2016 AZ协议,但须遵守特定的通知和补救条款。如果另一方对另一方的专利权提出质疑,双方也可以终止2016年的AZ协议,但受某些规定的例外情况的限制。阿斯利康有权在任何时候因科学、技术、监管或商业原因完全或就任何计划终止2016年AZ协议90 提前几天向我们发出书面通知。在逐个产品的基础上,如果阿斯利康在一段时间内暂停或不再进行此类产品的开发或商业化,我们有权在某些情况下终止2016 AZ协议十二连续几个月,但有特定的例外情况,包括对阿斯利康控制之外的事件收费。在逐个产品的基础上,如果2016 AZ协议就特定产品终止,阿斯利康对该产品的权利将终止,并且,在我们因阿斯利康违规、专利挑战或停止开发或阿斯利康自行终止的情况下,阿斯利康将授予我们恢复许可并采取某些其他行动,以使我们能够继续在肿瘤学领域开发和商业化该产品。
如果我们在阿斯利康自行决定终止2016 AZ协议后继续开发和商业化某一特定产品,阿斯利康有权就该产品的全球净销售额收取中位数至个位数的特许权使用费,以及我们从第三方收到的金额的高个位数百分比,在每种情况下,直到阿斯利康收回相当于阿斯利康在终止之前根据2016 AZ协议就该产品产生的特定开发成本的金额为止。这样的百分比增加一个低到中个位数的数额,只要这种终止发生在该产品达到指定的开发阶段之后。
2017年与阿斯利康的战略联盟-Relaxin
2017年10月,我们达成了一项新的合作和许可协议,我们称之为2017 AZ协议,根据该协议,阿斯利康可以在临床上开发并商业化一种开发候选药物,现在被称为AZD7970,它由我们设计的松弛蛋白的信使核糖核酸构建而成,并封装在我们的一种专有脂质纳米粒(LNP)中。在根据2017年AZ协议与阿斯利康建立战略联盟之前,我们发现并执行了AZD7970的临床前开发活动。
根据2017年AZ协议的条款,我们将通过完成IND-Enabling GLP毒理学研究为AZD7970提供资金并负责进行临床前开发活动,阿斯利康将根据商定的发现计划计划领导药理学研究。在自2017年AZ协议生效之日起的明确选举期内,阿斯利康可选择参与AZD7970的进一步开发和商业化。当选后,阿斯利康将在全球领导AZD7970的临床开发活动,我们将负责AZD7970的制造、某些监管事项以及我们同意执行的和商定的开发计划中规定的任何其他开发活动。阿斯利康将负责资助第一阶段临床开发活动(包括与根据开发计划制造临床材料相关的成本,最高可达分摊此类成本的上限),以及第二阶段临床开发活动(包括与根据开发计划制造临床材料相关的成本,最高可分摊上限),最高可达规定的美元门槛。此后,我们和阿斯利康将平均分摊超过该规定美元门槛的第二阶段临床开发活动的成本、所有第三阶段临床开发活动的成本以及后期临床开发活动的某些其他成本,除非我们选择不参与进一步的开发和共同商业化活动,而是按如下所述收取分级特许权使用费。如果开发候选者被确定为Ind-Ready,而阿斯利康没有及时选择参与AZD7970的临床开发,阿斯利康有义务偿还我们自2017年AZ协议执行以来在AZD7970的制造和开发中产生的某些费用。
我们和阿斯利康将根据商定的商业化计划和预算在美国共同商业化AZD7970,并将平分此类商业化所产生的美国利润或损失。尽管如此,在指定的
16
目录表
在AZD7970的开发阶段,我们有权选择不参与AZD7970的进一步开发和商业化活动。如果我们做出这样的选择,而不是参与美国对AZD7970的损益分摊,我们有义务与阿斯利康讨论未来的财务条款。如果我们无法在短时间内就未来的财务条款达成一致,我们有权按2017年AZ协议规定的默认费率获得分级特许权使用费,范围从中位数的百分比到阿斯利康AZD7970全球净销售额的20%,但须有一定的降幅,总的最低下限为。阿斯利康对所有前美国的商业化努力负有唯一和独家责任。除非我们选择不参与进一步开发(在这种情况下,除美国外净销售额的特许权使用费将采用上述默认费率,除非双方另有约定),否则我们有权获得以下费率的分级特许权使用费10 %至30 %AZD7970的年度不包括美国的净销售额,但要有一定的减幅,总的最低下限。根据授予阿斯利康的常规“后备”供应权,我们专门生产(或已经制造)用于所有开发和商业化目的的产品。此外,我们和阿斯利康已经同意了2017 AZ协议中关于Relaxin的信使核糖核酸药物的开发和商业化的某些明确的排他性义务。
除非提前终止,否则我们在2017年AZ协议下的战略联盟将继续(i)直至阿斯利康选举期到期,如果其不选择参与AZD 7970的临床开发,(ii)直至双方停止开发和商业化AZD 7970,且无意恢复,如果我们尚未选择不参与AZT 7970的进一步开发和商业化的权利,(iii)逐个国家,直到该国家/地区AZT 7970适用的特许权使用费期限结束,如果我们选择不参与AZT 7970的进一步开发和商业化的权利,或(iv)在完成有关AZT 7970的IND启用研究后,如果我们向阿斯利康提供书面通知,表明我们不合理地相信该产品已准备好IND。
任何一方均可在另一方实质性违约时终止2017年AZ协议,但须遵守特定的通知和补救条款。在另一方对其专利权的有效性或可执行性提出质疑的情况下,双方还可以终止2017年AZ协议,但受某些规定的例外情况的限制。阿斯利康有权随时出于科学、技术、监管或商业原因全面终止2017年AZ协议90 提前几天向我们发出书面通知。在某些情况下,如果阿斯利康暂停或不再进行AZD7970的开发或商业化,我们有权终止2017年AZ协议十二连续几个月,但有特定的例外情况,包括对阿斯利康控制之外的事件收费。如果阿斯利康没有及时选择参与AZD7970的临床开发,或协议终止,阿斯利康在AZD7970的权利将终止,如果我们因阿斯利康违规、专利挑战或停止开发或阿斯利康自行终止,阿斯利康将授予我们逆转许可证并采取某些其他行动,使我们能够继续在心血管和心脏代谢领域开发AZD7970并将其商业化。
如果我们在阿斯利康酌情终止2017年AZ协议后继续开发和商业化AZD7970,阿斯利康有权就我们AZD7970的全球净销售额收取中位数至个位数的特许权使用费,以及我们从第三方收到的金额的高个位数百分比,作为向该第三方发放使用AZD7970的许可证的代价,在每种情况下,直到阿斯利康收回相当于阿斯利康在终止AZD7970之前根据2017 AZ协议产生的指定开发成本的金额为止。这样的百分比增加一个低到中个位数的数额,只要这种终止发生在该产品达到指定的开发阶段之后。
2013年与阿斯利康达成协议,2018年修订并重述
于2018年6月,吾等与阿斯利康订立经修订及重订的期权协议及相关经修订及重订的服务及合作协议,或修订及重述2013年AZ协议的2018年应收账款协议。根据2018年A&R协议,我们授予阿斯利康某些独家权利和许可证,以研究、开发和商业化针对某些靶点的潜在治疗性信使药物,用于治疗心血管和心脏代谢性疾病和癌症,并同意向阿斯利康提供相关服务。缔约方根据2018年A&R协议将开展的活动仅限于心血管和心脏代谢领域的明确生物目标,以及癌症领域的一个明确目标。
根据2018年A&R协议,阿斯利康负责所有研究、开发和商业化活动及相关成本,而我们在研究和评估期内提供具体的研究和制造服务,如下所述,以促进阿斯利康根据商定的服务计划开展的活动。在本研究和评估期内,这些研究服务和超过指定门槛的制造服务由阿斯利康承担费用,低于指定门槛的制造服务将不向阿斯利康收取额外费用。阿斯利康可能会要求我们在研究结束后提供额外的研究和制造服务,费用由阿斯利康承担
17
目录表
评估期。根据授予阿斯利康的惯常“后备”供应权,我们独家生产(或已经制造)用于2018年A&R协议下所有研究、开发和商业化目的的mRNA,直至根据2018 A&R协议我们有权就此类产品获得收益付款的时间段届满为止。
截至2013年AZ协议生效日期,并进一步反映在2018年A&R协议中,阿斯利康收购了四十 为获得针对研究和评估期间出现的特定目标而确定的开发候选对象(和相关的后备候选对象)进行临床开发和商业化的独家权利而可能行使的选项。在研究候选者的研究和评估期内,阿斯利康可以选择指定有限数量的研究候选者作为开发候选者,以便继续对这些开发候选者(以及相关的后备候选者)进行临床前开发。从阿斯利康指定的开发候选者库中,在指定的期权行使期内,阿斯利康可以行使其选项之一,以获得在某些领域临床开发和商业化已确定的开发候选者(和相关的后备候选者)的独家权利。如果阿斯利康没有在为特定开发候选者定义的选择权行权期内行使其中一项选择权以获得对该开发候选者进行临床开发和商业化的独家权利,阿斯利康对该开发候选者(和相关后备候选者)行使期权的权利和根据2018年A&R协议授予的其他权利将终止,所有开采该开发候选者(和相关后备候选者)的权利将返还给我们,阿斯利康就该开发候选者(和相关后备候选者)产生的所有数据和结果将被转让或许可给我们。在2018年A&R协议因任何原因终止的较早日期以及2013 AZ协议生效日期的指定周年日后,所有未行使的期权以及行使任何和所有期权的权利(如果之前未由阿斯利康行使)将自动终止。
在逐个目标的基础上,我们和阿斯利康已同意2018年A&R协议中关于某些领域此类目标的信使核糖核酸药物的研究、开发和商业化的某些明确的排他性义务。此外,我们和阿斯利康已就根据2018年A&R协议开发的任何开发候选多肽的信使核糖核酸药物的研究、开发和商业化达成了某些明确的排他性义务。
除非提前终止,否则2018年的A&R协议将持续到阿斯利康的盈利和或有期权到期,并行使对可选产品候选者的付款义务。任何一方在另一方对相关候选人的实质性违约(无论是完全违约还是在特定情况下)时,均可终止2018年A&R协议,但须遵守定义的重要性门槛和指定的通知和补救条款。如果阿斯利康有权因我们的重大违规行为终止2018年A&R协议,那么阿斯利康可能会选择保留2018年A&R协议,而不是全部终止2018年A&R协议或针对这些候选者,但我们有资格获得的某些付款的减少以及对2018年A&R协议下阿斯利康义务的某些调整。阿斯利康可能会在以下情况下无故全面终止2018年的A&R协议90 提前几天通知我们。
会计处理
我们应用ASC 606(与客户的合同收入)的规定来核算这些安排,但2017 AZ协议除外,该协议在ASC 808(合作安排)项下核算。2016年8月,阿斯利康行使了根据2013年AZ协议提供的产品选择权,获得了在临床上开发和商业化VEGF-A产品(AZD8601)的独家权利。这一期权演习被称为2016年的血管内皮生长因子演习。根据ASC 606,吾等决定,由于该等协议并不互相关连或互相依存,因此2016年的全球发展策略活动及2017年的亚洲区协议应作为独立交易入账。相反,经2018年A&R协议和2016 AZ协议修订的2013年协议出于会计目的合并并被视为单一协议,因为这些协议是在相互考虑的情况下谈判达成的。我们将这笔合并交易称为2018年AZ合并协议。我们确定2018年AZ合并协议和2016年的VEGF演习的所有方面都代表与客户的交易,因此根据ASC 606进行会计处理。
2018年亚洲区合并协议
我们在2018年AZ合并协议中确定了以下业绩义务:(I)综合业绩义务,包括经2018年A&R协议修订的2013 AZ协议相关的研究许可证、研发池服务和制造义务,统称为2018年AZ协议综合业绩义务,(Ii)IL-12的临床前开发服务,(Iii)肿瘤开发目标的临床前开发服务,(Iv)IL-12的开发和商业化许可的综合业绩义务和制造义务,
18
目录表
以及(V)获得肿瘤学发展目标的开发和商业化权利以及制造服务的物质权利。
我们的结论是,研究许可证与2018年A&R协议相关的研发池服务或制造义务没有区别,因为阿斯利康在没有收到此类服务和供应的情况下无法充分利用研究许可证的价值。我们的服务和供应涉及专业知识,特别是与市场上没有的信使核糖核酸技术有关的专业知识。阿斯利康要求的任何超过协议规定的最低数量的供应都被视为客户选择,并出于会计目的作为单独的合同处理。此外,我们得出结论,阿斯利康不能在没有收到供应的情况下利用IL-12的开发和商业化许可证的价值,因为开发和商业化许可证不会向阿斯利康传达制造权利,因此将IL-12的开发和商业化许可证与制造义务合并为一项履约义务。
自.起2020年3月31日,成交总价为$399.1 百万美元,包括$240.0 百万在与2013 AZ协议有关的预付款中$159.1 百万美元的可变对价包括$38.1 估计偿还IL-12制造义务的百万美元,$1.0 百万从属许可报销和$120.0 百万里程碑付款的百分比($60.0 百万毒性里程碑和$60.0 百万竞争里程碑)。我们使用最可能的金额方法来确定要收到的IL-12制造义务的补偿金额。我们确定,与IL-12相关的任何基于销售的特许权使用费将在相关销售发生时确认,因为它们被确定为主要与授予的许可证有关,因此已被排除在交易价格之外。此外,我们有资格获得2018年A&R协议下可选产品未来商业销售的未来里程碑和特许权使用费,以及2016年协议下的未来特许权使用费;然而,根据合并的2018年协议,这些金额不被视为可变对价,因为我们只有在阿斯利康行使其期权(包括被视为重大权利的某些期权)的情况下才有资格收到该等金额。我们的结论是,根据ASC 606,行使可选产品候选者代表一项单独的交易。我们在每个报告期结束时重新评估交易价格。有一块钱2.7 截至以下三个月的成交价下跌百万2020年3月31日,由于可变考虑因素估计数的变化所致。
交易价格是根据每项履约义务的相对估计独立售价分配给履约义务的。我们主要根据与每个特定计划相关的每个许可证的预期未来现金流的概率加权现值,制定了2018年AZ协议合并履行义务中包含的许可证的估计独立销售价格,以及IL-12的开发和商业化许可证的综合履行义务以及制造义务。在制定该估计时,我们还考虑了适用的市场条件和相关实体特定的因素,包括谈判协议时考虑的因素、成功的可能性以及根据相关许可将候选产品商业化所需的时间。吾等就每项履约责任所包括的服务及/或制造及供应的估计独立售价(视乎情况而定),主要根据将提供的服务及/或将制造的货品的性质及相关成本的估计,并根据根据类似合约预期可实现的合理利润率而作出调整。获得肿瘤学开发目标的开发和商业化权利以及制造服务的材料权利的估计独立销售价格是通过估计阿斯利康在行使期权时将获得的折扣金额,并根据行使期权的可能性调整该金额而制定的。
自.起2020年3月31日,分配给每项履约义务的交易价格如下:(I)$293.2 百万2018年AZ协议的合并履约义务,(Ii)$8.1 百万用于IL-12履约义务的临床前开发服务,(Iii)$8.1 百万对临床前开发服务的肿瘤学开发目标履行义务,(四)$88.1 百万关于IL-12的开发和商业化许可证的综合履行义务和制造义务,以及(V)$1.6 百万以物质权、获得开发权和商业化权利以及为肿瘤学发展目标提供制造服务。作为将交易价格分配给每项履约义务的一部分,我们得出的结论是$60.0 百万毒性里程碑和IL-12制造成本的估计补偿可以完全分配给特定的履约义务,因为可变报酬具体涉及我们履行履约义务的努力,并且这种分配符合ASC 606的分配目标。
我们使用基于2018年AZ协议绩效义务和IL-12的临床前开发服务以及其他肿瘤学目标绩效义务的总估计成本的成本的输入法来衡量随时间推移的比例绩效。我们根据每次相关供应的供应控制权转移到阿斯利康的时间点,确认与分配给IL-12的开发和商业化许可证的综合履约义务和制造义务的金额相关的收入。
19
目录表
我们通过确定产生的努力占我们预计花费的总努力的百分比,按季度确认2018 AZ协议合并绩效义务的收入。此比例适用于分配给该合并绩效义务的交易价格。我们还估计了开发计划,包括阿斯利康的预期需求,以及这一综合履约义务的相关成本,因为我们将在履行制造服务的同时满足这一综合履约义务。管理层在制定我们的预算估计过程中应用了重大判断。这些估计数的任何变化都将在其变化期间被确认为累积追赶。
截至以下三个月2020年3月31日和2019,我们确认的合作收入 $1.6 百万和$0.8 百万分别来自2018年合并AZ协议。截至2020年3月31日止三个月确认的收入包括因期内履行业绩义务而摊销的递延收入,并被累计追赶调整额所抵消 $1.4 百万由于我们未来履行义务的估计成本发生变化。截至 2020年3月31日,分配给未履行的剩余履行义务的交易价格总额为 $106.1 百万. $96.4 百万预计将于2029年12月31日之前确认为收入, $9.7 百万预计将在2018年合并AZ协议到期或修改(以较早者为准)时确认为收入。我们的递延收入为 $72.6 百万和$73.7 百万截至2020年3月31日和2019年12月31日分别来自2018年AZ合并协议,该协议在简明综合资产负债表中根据预计提供服务或预计移交供应控制权的期间被归类为当前或非流动。
2016年血管内皮细胞生长因子演习
我们的结论是,出于会计目的,2016年的血管内皮生长因子活动应被视为一项单独的交易。我们在这项安排中确定了一项履约义务,包括开发和商业化血管内皮生长因子的独家许可以及临床用品的制造。我们的结论是,VEGF许可证与制造义务没有区别,因为阿斯利康在没有收到此类供应的情况下,无法充分利用许可证的价值。这是由于所传达的许可证所固有的限制,其中阿斯利康在协议期限内没有生产的合同权利。
截至2020年3月31日,交易总价确定为$60.3 百万由以下部分组成$40.0 百万在与固定付款有关的固定付款中$10.0 百万期权行权费和a$30.0 百万在采用ASC 606之前取得的里程碑,$2.3 百万再许可报销和$18.0 百万与临床用品的估计报销有关的可变考虑因素。根据这一安排,我们有资格获得未来的里程碑和未来商业销售的特许权使用费。我们使用最可能的金额方法来估计将收到的任何开发和监管里程碑付款,以及临床供应的估计报销金额。自.起2020年3月31日,交易价格中没有没有实现的里程碑。我们考虑了实现每个里程碑所需的开发阶段和与剩余开发相关的风险,以及实现里程碑是否超出了我们或阿斯利康的控制范围。由于不确定是否会实现任何里程碑,未支付的里程碑付款完全受到限制。我们确定,任何商业里程碑和基于销售的特许权使用费将在相关销售发生时确认,因为它们被确定为主要与授予的许可证相关,因此也被排除在交易价格之外。我们在每个报告期结束时以及不确定事件得到解决或情况发生其他变化时重新评估交易价格。当一笔里程碑式的付款计入未来的交易价格时,将根据基础履约义务的相对完成情况确认为收入。有一个$2.4 百万截至三个月内交易价格上涨 2020年3月31日,由于可变考虑因素估计数的变化所致。
我们根据每次交付相关供应时供应控制权转移给阿斯利康的时间点,确认与分配给VEGF Exercise履行义务的交易价格金额相关的收入。
截至以下三个月2020年3月31日,我们进行了累计追赶调整 $0.4 百万由于与2016年VEGF演习相关的未来绩效义务的估计成本发生变化而导致的收入减少。截至三个月,我们没有确认2016年VEGF演习的任何合作收入 2019年3月31日。自.起2020年3月31日,分配给未履行的剩余履行义务的交易价格总额为 $56.5 百万,预计将于2025年12月31日之前确认为收入。我们的递延收入为 $43.0 百万和$41.2 百万截至2020年3月31日和2019年12月31日根据预期供应控制权将移交的期间,在简明综合资产负债表中被归类为流动或非流动。
20
目录表
2017亚洲区协议
我们得出结论,2017 AZ协议属于ASC 808的范围,因为我们和阿斯利康都是开发、制造和商业化活动的积极参与者,并面临重大风险和回报,这些风险和回报取决于安排活动的商业成功。此外,我们确定开发、制造和商业化活动不是ASC 606规定的交付内容。因此,根据开发、制造和商业化活动开展的活动在所发生期间作为相关费用的一部分入账。我们在确定我们与阿斯利康之间交易的适当处理时,通过类比考虑了ASC 606中的指导方针,并得出结论,由于我们在将承诺的商品或服务转移给客户之前控制了承诺的商品或服务,因此我们被视为本金的交易的报销作为毛收入入账。
我们做到了不是 I don‘我不确认2017 AZ协议在截至三个月的两个月期间的任何收入2020年3月31日和2019.
默克公司-传染病和癌症疫苗领域的战略联盟
2015年与默克公司的战略联盟-传染病
2015年1月,我们与默克公司签订了主协作和许可协议,该协议分别在2016年1月、2016年6月和2019年5月进行了修订,我们将其称为2015年默克协议。根据2015年的默克协议,我们和默克已同意研究、开发潜在的用于预防RSV感染的信使核糖核酸药物,并将其商业化。作为2015年默克协议2019年5月修正案的一部分,我们和默克同意完成合作,因为它涉及开发潜在的针对其他病毒的mRNA药物,包括用于预防VZV感染的mRNA-1278。根据2015年默克协议,默克公司主要负责研究、开发和商业化活动以及此类研究和商业化的相关成本。我们负责设计和制造用于临床前和第一阶段和第二阶段临床开发目的的所有mRNA构建物,默克公司为此类制造向我们支付费用,我们负责与RSV疫苗候选产品(mRNA-1172)进行第一阶段临床试验相关的某些成本。制造用于晚期临床开发和商业化目的的信使核糖核酸构建物的责任将被确定。
2015年的默克协议包括三-一年时间,预计将于2022年1月12日结束,在此期间,默克公司可能会继续开发临床前和临床候选RSV疫苗产品,使用最初在最初的四-于2019年1月结束的一年研究期。默克公司可能在2022年1月12日之前选择独家开发和商业化五 RSV疫苗候选产品。
我们和默克已同意在2015年默克协议期间关于针对RSV的mRNA研究药物的某些明确的排他性义务。作为2015年默克协议2019年5月修正案的一部分,我们和默克同意对现有排他性义务的某些期望,根据这些义务,我们将不再被限制研究、开发和商业化一种用于预防特定呼吸道感染(包括呼吸道合胞病毒)的儿科人群的mRNA研究药物。
根据2015年默克协议的条款,我们收到了一份$50.0 百万预付款。我们有资格在逐个产品的基础上获得$300.0 百万在某些开发、监管和商业里程碑事件完成后,总计支付里程碑付款。到目前为止,我们已经从默克公司收到了一笔临床里程碑付款$5.0 百万关于启动默克RSV疫苗候选产品的第一阶段临床试验。此外,根据2015年默克协议的条款,我们有资格获得额外的里程碑式付款,除非默克选择不继续进一步开发mRNA-1172的临床。在逐个产品的基础上,我们也有权获得默克公司产品净销售额的特许权使用费,费率从中位数到个位数到十几岁以下,但有一定的折扣,总的最低下限。此外,在2015年签订2015年默克协议的同时,默克公司做出了$50.0 百万在我们的股权投资,并在2016年1月修改2015年默克协议的同时,我们收到了一笔预付款$10.0 百万默克公司的。
除非提前终止,否则2015年的默克协议将继续按产品和国家/地区进行,只要默克公司在给定国家/地区对给定产品支付版税即可。任何一方均可在另一方实质性违约的情况下终止2015年默克协议,无论是完全违约还是与特定计划、候选产品、产品或国家/地区有关的违约,均须遵守特定的通知和补救条款。默克公司可以在出于任何原因提前通知我们的情况下,或在默克公司确定联盟或产品不再具有商业可行性的情况下,完全终止或就特定候选产品或产品终止2015年默克协议。如果默克公司有权因我们的重大违约行为而终止2015年默克协议,无论是就整个计划、候选产品或产品而言,默克公司可以选择替代终止2015年默克公司协议
21
目录表
协议,以使2015年的默克协议继续有效,但我们有资格获得的与可终止权利有关的某些付款有所减少。在2015年默克协议终止后,授予默克有关该计划的所有许可证和其他权利将终止,候选产品和产品的继续开发和商业化将恢复到我们手中。如果2015年默克协议就某一候选产品或产品终止,则授予默克的有关该候选产品或产品的所有许可和其他权利将终止,并且,在我们因默克违约而终止的范围内,默克将根据选定的默克技术授予我们许可证,以便我们继续开发该候选产品或产品并将其商业化。
会计处理
我们确定经修订的2015年默克协议的所有方面代表与客户的交易,因此经修订的2015年默克协议根据ASC 606入账。这个四-截至2018年12月31日的年度研究期已完成,我们确认了$65.0 百万(The)$60.0 百万总计预付款和一次付款$5.0 百万(与实现发展里程碑有关的付款),因为我们得出的结论是,经修订的2015年默克协定没有未履行的履约义务。此外,我们得出的结论是,以下客户选项是营销优惠,因为这些选项不提供任何折扣或其他在安排中被视为实质性权利的权利:(I)在三--第一次审查后的一年四-一年的研究期,在此期间,默克公司可能会继续开发临床前和临床候选产品,以及(Ii)第一阶段和第二阶段的临床mRNA供应和/或初始阶段以外的非cGMP mRNA供应四-年研究期。因此,这些选项将在客户选择时作为单独的合同入账。我们使用最可能的金额方法来估计将收到的任何开发和监管里程碑付款。自.起2020年3月31日,交易价格中没有没有实现的里程碑。我们考虑了实现每个里程碑所需的开发阶段和与剩余开发相关的风险,以及里程碑的实现是否超出了我们或默克的控制。由于不确定是否会实现任何里程碑,未支付的里程碑付款完全受到限制。我们确定,任何商业里程碑和基于销售的特许权使用费将在相关销售发生时确认,因为它们被确定为主要与授予的许可证相关,因此也被排除在交易价格之外。当里程碑付款在未来的交易价格中计入时,将根据基础履约义务的相对完成情况确认为收入。
在完成初步的四-一年的研究期,作为2015年默克协议2019年5月修正案的一部分,默克公司选择建立新的RSV疫苗候选产品,并选择进行第一阶段临床试验。我们负责与进行第一阶段临床试验相关的某些费用。我们确定,根据2019年5月修正案,我们有义务向默克公司偿还与RSV疫苗第一阶段临床试验相关的某些费用,这是向客户支付的对价,并被计入交易价格的降低。对价金额根据最可能的方法确定,并在发生成本时计入抵销收入。默克公司选择继续开发RSV时的一次性付款完全受到限制,因为这取决于RSV第一阶段临床试验的完成以及默克公司在此之后继续开发的决定。我们在每个报告期结束时以及不确定事件得到解决或情况发生其他变化时重新评估交易价格。截至以下三个月2020年3月31日,有一个$2.1 百万扣除与支付给默克公司的RSV疫苗I期临床试验费用相关的交易价格。
截至2020年3月31日或2019年12月31日,我们没有来自修订后的2015年默克协议的递延收入,因为修订后的2015年协议下的所有业绩义务已于2018年12月31日完成。
我们确认的抵销收入为$2.1 百万截至2020年3月31日的三个月,与根据2019年5月修正案支付给默克的对价有关。我们确认的协作收入为$0.5 百万截至2019年3月31日止三个月,根据与默克公司就行使客户选择权购买临床信使核糖核酸供应以进一步开发初步候选产品的单独协议四-年研究期。临床信使核糖核酸供应在每次相关供应的交付时将供应控制权转移到默克公司的时间点确认为合作收入。
2016癌症疫苗战略联盟--个性化信使核糖核酸肿瘤疫苗
2016年6月,我们与默克公司签订了个性化信使核糖核酸癌症疫苗(PCV)合作和许可协议,我们称之为PCV协议,使用我们的信使核糖核酸疫苗和配方技术为个别患者开发和商业化PCV。在战略联盟下,我们识别特定患者肿瘤细胞中存在的基因突变,为这些突变合成信使核糖核酸,将信使核糖核酸封装在我们的一个专有LNP中,并为每个患者接种一种独特的信使核糖核酸癌症疫苗,该疫苗旨在针对患者自己的癌细胞专门激活患者的免疫系统。
22
目录表
根据PCV协议,我们负责设计和研究PCV,提供生产能力和制造PCV,并单独或与默克的抗PD-1药物KEYTRUDA(Pembrolizumab)联合进行PCV的第一阶段和第二阶段临床试验,所有这些都根据已商定的发展计划和预算,并在由各方平等代表组成的委员会的监督下进行。双方已就Moderna的制造和供应活动达成临床质量协议。我们收到一笔预付款$200.0 百万默克公司的。2017年11月,我们和默克公司宣布,作为联盟的一部分,我们实现了人类首次注射PCV(mRNA-4157)的一个关键里程碑。在美国进行的第一阶段开放标签、剂量递增、多中心临床试验(Keynote-603)旨在评估在已切除的实体肿瘤患者中单独使用mRNA-4157以及在无法切除的实体肿瘤患者中联合使用KEYTRUDA的安全性、耐受性和免疫原性。
在我们根据PCV协议完成PCV的第一阶段和第二阶段临床试验并向默克公司交付相关数据包后的一段规定时间内,默克公司有权选择通过以下方式参与PCV的未来开发和商业化$250.0 百万向我们支付参与费。如果默克公司行使其选举权并支付参与付款,那么双方将平等地共同资助PCV的后续临床开发,默克公司将主要负责根据共同商定的开发计划和预算开展临床开发活动。每一方还可以对共同商定的开发计划和预算中未包括的PCV进行额外的临床试验,在这种情况下,非执行方将从执行方销售此类PCV产生的未来利润份额(如果有的话)中补偿执行方此类试验总费用的一半,外加利息。默克公司将引领PCV在全球的商业化,这取决于Moderna选择在美国共同推广PCV,双方将平分全球商业化产生的利润或损失。在PCV实现盈利之前,我们可以选择推迟支付我们的商业化和相关制造成本份额,而从我们从该PCV销售产生的未来利润份额中补偿默克公司的此类成本和利息(如果有的话)。根据授予默克公司的常规“后备”供应权,我们将生产(或已经制造)用于临床前和临床用途的PCV。用于商业目的的PCV的制造将由各方根据PCV协议的条款确定。根据PCV协议,我们向默克公司授予某些许可证,以执行其合作活动。
如果默克不行使参与PCV未来开发和商业化的权利,Moderna将保留开发和商业化战略联盟期间开发的PCV的独家权利,但默克有权获得从十几岁到20%以下的百分比,但我们销售此类PCV的净利润将减少。在这种不行使之后的一段有限的时间内,默克公司有权结合KEYTRUDA对此类PCV进行临床研究,我们同意使用合理的努力来供应此类PCV。在有限的时间内,我们也有权与KEYTRUDA联合进行PCV的临床研究,默克公司同意为此采取合理的努力供应KEYTRUDA。此外,在不行使之后,默克还有权从我们销售的某些PCV的销售中获得一定比例的净利润,比例从十几岁到不到20%不等,但可以减少。
我们和默克公司已经就PCV的开发和商业化达成了某些明确的、有限的排他性义务。
2018年扩大癌症疫苗战略联盟-共享新表位癌症疫苗
2018年4月,我们和默克公司同意扩大我们的癌症疫苗战略联盟,以包括我们的KRAS疫苗开发候选产品mRNA-5671或V941的开发和商业化,以及可能共享的其他新抗原mRNA癌症疫苗(SAV)的开发和商业化。在被纳入癌症疫苗战略联盟之前,我们在临床前开发了mRNA-5671,它由我们设计的一种新的mRNA结构组成,并封装在我们的一个专有LNP中。对PCV协议进行了修订和重述,以包括新的SAV战略联盟(PCV/SAV协议)。
我们已经向默克公司授予了某些许可证,我们和默克公司已经同意了关于SAV和特定SAV计划的某些排他性义务,这些义务可能会在某些触发事件发生时终止或到期。根据PCV/SAV协议,默克公司将根据共同商定的开发计划和预算,负责进行mRNA-5671的第一阶段和第二阶段临床试验以及与该等活动相关的所有成本,我们将负责制造和供应进行该等试验所需的所有RNA-5671以及与该等制造和供应相关的所有成本和开支。根据PCV/SAV协议,我们对PCV的预算承担额增加到$243.0 百万。在根据PCV/SAV协议完成mRNA-5671的第一阶段和第二阶段临床试验以及我们向默克公司交付相关数据包后的一段规定时间结束之前,默克公司有权通过向我们支付参与付款来选择参与mRNA-5671的未来开发和商业化。如果默克公司行使其参与权
23
目录表
如果双方有权合作,那么双方将平等地共同资助随后的mRNA-5671临床开发,默克公司将主要负责根据共同商定的开发计划和预算开展临床开发活动。如果默克公司在mRNA-5671的第一阶段和第二阶段临床试验后拒绝参与未来的开发和商业化活动,那么我们将保留开发和商业化mRNA-5671的权利。如果默克公司选择参与mRNA-5671的未来开发和商业化,默克公司还可能进行不包括在共同商定的开发计划和预算中的针对mRNA-5671的额外临床试验,在这种情况下,我们将向默克公司偿还此类临床试验总开发成本的一半,外加利息,从我们销售mRNA-5671的未来利润中分得的份额(如果有的话)。如果默克公司真的对mRNA-5671进行了额外的临床试验,我们将负责制造和供应进行此类试验所需的所有mRNA-5671。默克公司将领导mRNA-5671在全球的商业化,这取决于我们在美国共同推广mRNA-5671的选择权,双方将平均分享全球商业化产生的运营利润或亏损。在mRNA-5671实现盈利之前,我们可以选择推迟支付我们应承担的商业化和相关制造成本,并从我们从销售mRNA-5671获得的未来利润中获得的份额中补偿默克公司的此类成本和利息。根据授予默克公司的“后备”供应权,我们将生产(或已经制造)用于临床前和临床用途的mRNA-5671和其他SAV。在默克公司行使其参与未来开发和商业化的权利后,我们将授予适用的开发和商业化许可证,双方有义务讨论未来制造的责任,并考虑适用的标准。
根据《PCV/SAV协定》,在规定的一段时间内,任何一方均可提议缔约方开展针对不同共同新抗原的SAV研究和开发的额外计划。如果双方同意实施任何此类计划,我们将负责开展和资助此类SAV的临床前发现和研究活动,否则这些计划将以与mRNA-5671计划基本相同的条款进行。如果我们或默克公司提议新的SAV计划,而对方不同意实施该计划,则PCV/SAV协议包括允许提议方继续进行此类开发的条款,费用由提议方承担。如果默克公司是建议方,我们将负责制造和供应此类项目的材料,费用由默克公司承担。在这种情况下,非建议方将有权在建议方承诺进行良好实验室规范(GLP)毒性研究之前的任何时间选择加入此类SAV计划。在我们根据PCV/SAV协议完成双方共同同意的任何SAV计划的第一阶段和第二阶段临床试验并向默克公司交付相关数据包后的一段规定时间结束之前,默克公司有权通过向我们支付参与付款来选择参与此类SAV的未来开发和商业化。
除非提前终止,否则PCV/SAV协议将继续逐个计划,直到默克终止参与此类计划。在任何此类终止后,我们将保留开发和商业化作为此类计划一部分开发的PCV或SAV的独家权利,但受默克保留的限制和某些有限权利的限制。
关于修订PCV协议,包括开发和商业化mRNA-5671以及可能的其他SAV,默克同时对我们的H系列可赎回可转换优先股进行了股权投资,产生了$125.0 百万,其中$13.0 百万被确定为溢价并计入递延收入。
会计处理
我们决定,PCV/SAV协议应与经修订的2015年默克协议分开核算,因为这些协议不是在考虑彼此的情况下谈判达成的,而且每个协议中的要素并不密切相关或相互依存。我们确定PCV/SAV协议的所有方面都代表与客户的交易,因此PCV/SAV协议根据ASC 606入账。此外,对我们H系列可赎回可转换优先股的股权投资与PCV/SAV协议一起被考虑,因为交易是同时执行的,相互考虑。此外,默克公司就投资H系列可赎回可转换优先股支付的购买价格不能代表购买之日的公允价值。因此,收到的超过与股权投资相关的标的股票公允价值的增量收益计入了与PCV/SAV协议相关的交易价格,默克公司购买的H系列可赎回可转换优先股的股份在发行日按各自的公允价值入账。
我们在PCV/SAV协议中确定了以下履约义务:(I)在PCV计划的概念验证(POC)期限内,研究许可证和研发服务,包括PCV的制造和供应,称为PCV履约义务;(Ii)KRAS计划的POC期限内,研究许可以及制造和供应mRNA-5671,称为KRAS履约义务。我们的结论是,在PCV计划的POC期限内,研究许可证与研发服务(包括PCV的制造和供应)没有区别,因为在没有收到此类服务和供应的情况下,默克无法充分利用许可证的价值。我们的服务和
24
目录表
供应涉及专门知识,特别是涉及市场上无法获得的信使核糖核酸技术。因此,在PCV计划的POC期限内,研究许可证已与研发服务(包括PCV的制造和供应)合并为单一的履行义务。同样,我们的结论是,在KRAS计划的POC期限内,研究许可证与制造和供应mRNA-5671没有什么不同,因为默克公司在没有收到必须由我们提供的此类供应的情况下,无法充分利用许可证的价值。这是由于所传达的许可证所固有的限制,其中默克公司在POC期限内没有生产的合同权利。因此,在KRAS项目的POC期限内,研究许可证与制造和供应mRNA-5671合并为一项履行义务。相反,我们的结论是,PCV履约义务和KRAS履约义务是不同的,因为默克公司可以充分利用每个计划的价值达到其预期目的,而不需要与另一个计划相关联的承诺。此外,我们得出的结论是,以下客户选项是营销优惠,因为此类选项不提供任何折扣或其他在协议中被视为实质性权利的权利:(I)默克参与选举许可证,涉及未来逐个计划的联合开发和商业化;(Ii)制造和供应以支持某些SAV计划和/或PCV计划;(Iii)在默克当选后不参与该计划的未来开发和商业化,以及(Iii)与某些SAV计划相关的研发服务。因此,这些选项将在客户选择时作为单独的合同入账。
自.起2020年3月31日,总成交价格确定为$213.3 百万由以下部分组成$200.0 百万与PCV协议有关的预付款,与同时出售H系列可赎回可转换优先股相关的溢价$13.0 百万,以及可变的考虑$0.3 百万与临床用品的报销有关。我们确定,截至以下日期,交易价格中不应包括其他可变对价部分2020年3月31日,因为我们有权获得的额外对价取决于默克公司选择行使被视为营销要约的客户选择权。我们在每个报告期结束时重新评估交易价格。在截至以下三个月内2020年3月31日,有一个$0.3 百万从临床用品的报销增加到交易价格。
交易价格根据每项履约义务的相对估计独立售价分配给履约义务。我们制定了每个PCV履约义务和KRAS履约义务中包含的许可证的估计独立销售价格,主要是基于与每个特定计划相关的每个许可证相关的预期未来现金流的概率加权现值。在制定该估计时,我们还考虑了适用的市场条件和相关的实体特定因素,包括在谈判协议时考虑的因素、成功的可能性以及根据相关许可证将候选开发项目商业化所需的时间。吾等根据PCV履约责任及/或KRAS履约责任(视乎适用而定)所包括的服务及/或制造及供应的估计独立售价,主要根据将提供的服务及/或将制造的货品的性质及相关成本的估计,并根据根据类似合约预期可实现的合理利润率作出调整。
自.起2020年3月31日,分配给每项履约义务的交易价格如下:(I)$206.3 百万PCV绩效义务和(ii) $7.0 百万分配给Kras绩效义务。我们将随着时间的推移确认与分配给PCV绩效义务的金额相关的收入,因为基础服务是使用比例绩效模型执行的。我们使用基于所发生的成本相对于研发工作总估计成本的输入法来衡量比例绩效。我们根据每次交付相关供应的供应控制权转移给默克的时间点,确认与分配给Kras绩效义务的金额相关的收入。
截至以下三个月2020年3月31日和2019,我们确认的合作收入 $3.1 百万和$10.2 百万分别在默克PCV/SAV协议的简明合并运营报表中。截至三个月内确认的收入 2020年3月31日包括因期内业绩满意而摊销的递延收入,并被累计追赶调整数所抵消 $3.5 百万由于我们未来履行义务的估计成本发生变化。截至 2020年3月31日,分配给未履行的剩余履行义务的交易价格总额为 $81.0 百万,预计将在2024年12月31日之前确认为收入。我们已经将收入递延了$81.0 百万和$83.8 百万,截止日期2020年3月31日和2019年12月31日分别来自默克PCV/SAV协议,该协议在简明综合资产负债表中根据预计提供服务或预计转移供应控制权的期间被归类为流动或非流动。
25
目录表
Vertex-2016囊性纤维化战略联盟
2016年7月,我们与Vertex PharmPharmticals Inc.和Vertex PharmPharmticals(Europe)Limited,以及Vertex签订了战略合作和许可协议,我们称之为Vertex协议。Vertex协议于2019年7月修订,我们称之为2019年Vertex修正案,旨在通过使囊性纤维化患者的肺细胞能够产生功能性CFTR蛋白来发现和开发潜在的治疗囊性纤维化(CF)的mRNA药物。
根据Vertex协议,我们利用我们的平台技术和mRNA交付专业知识,以及Vertex在CF生物学方面的科学经验和对CFTR的功能理解,在延长至2020年3月的初始研究期间领导发现工作。Vertex负责为战略联盟产生的候选者和产品进行开发和商业化活动,包括与此类活动相关的成本。根据授予Vertex的惯常“后备”供应权,我们独家制造(或已经制造)用于临床前、临床和商业化目的的mRNA。缔约方设立了一个联合指导委员会,以监督和协调《顶点协定》下的活动。我们和Vertex已经根据Vertex协议相互授予了某些许可证。
根据顶点协议的条款,我们收到了一份$20.0 百万来自顶点的预付款。2019年7月,Vertex选举延长了最初的三-年研究期,按六个月根据2019年顶点修正案。2020年3月,基于迄今为止产生的有希望的临床前数据,Vertex通过第一个延长的研究期限(额外的18 -一个月期限),向我们支付额外的款项。顶点有权进一步延长研究期限二 其他内容一-年限,每一年向我们支付额外费用一-延长一年。我们有资格获得最多$55.0 百万在为实现发展里程碑支付款项方面,最高可达$220.0 百万在为实现监管里程碑而支付的款项中,可能会获得额外的$3.0 百万根据顶点协议,为实现第二个监管里程碑和后续每个产品的监管里程碑支付里程碑付款。Vertex还将向我们支付战略联盟产品全球净销售额的分级特许权使用费,费率从低到高不等,但有一定的降幅,总的最低下限。在战略联盟方面,Vertex还做了一次$20.0 百万对我们的股权投资。在Vertex协议的期限内,我们和Vertex已同意Vertex协议下关于某些信使核糖核酸药物的开发和商业化的某些明确的排他性义务。
除非提前终止,否则Vertex协议将继续有效,直至所有版税条款到期。为了方便起见,Vertex可以终止Vertex协议90 三天前的书面通知,除非终止与Vertex已获得营销批准的国家/地区的产品有关,在这种情况下,Vertex必须提供180 提前几天发出书面通知。任何一方均可在另一方实质性违约时终止《顶点协议》,但须遵守特定的通知和补救条款。除某些例外情况外,如果另一方对其专利权的有效性或可执行性提出质疑,或如果另一方破产,双方也可终止Vertex协议。
会计处理
自.起2020年3月31日,2019年顶点修正案下的所有履行义务已经完成,交易总价为$4.5 百万,由$2.0 百万预付款和$2.5 百万在研发方面,与研发服务和非cGMP信使核糖核酸的供应有关的资金得到了充分认可。
第一个延长研究期限代表合同修改,并作为单独的合同入账。根据《2019年顶点修正案》,我们确定了一项履约义务,包括:(I)研究、开发和商业化许可证和(Ii)研发服务,包括制造和供应非cGMP mRNA,在18个月的第一个延长研究期限内。我们得出的结论是,许可证与研发服务没有区别,包括非cGMP mRNA的制造和供应。此外,我们得出以下客户选项为营销要约,因为该等选项不提供任何折扣或在安排中被视为重大权利的其他权利:(I)Vertex延长延长初始研究期的权利及(Ii)延长初始研究期后的临床和/或非cGMP基因供应。因此,这些选项将在客户选择时作为单独的合同入账。总成交价被确定为$35.2 百万,由$4.0 百万预付款和$31.2 百万与研发服务和提供非cGMP信使核糖核酸有关的研究和开发资金。我们使用最可能的金额方法来确定将获得的研究和开发资金的数量。自.起2020年3月31日,交易价格中没有包括里程碑。我们考虑了开发阶段和与实现每个里程碑所需的剩余开发相关的风险,以及里程碑的实现是否超出了我们或Vertex的控制。由于不确定是否会实现任何里程碑,未支付的里程碑付款完全受到限制。我们决定任何销售-
26
目录表
基于版税的使用费将在相关销售发生时确认,因为它们被确定为主要与授予的许可有关,因此也被排除在交易价格之外。我们在每个报告期结束时以及不确定事件得到解决或情况发生其他变化时重新评估交易价格。
对于Vertex协议、2019年Vertex修正案和第一个延长的研究期限,总交易价格完全分配给单一履约义务。我们确认与分配给单一履约义务的金额有关的收入,因为基础服务是使用比例业绩模型进行的。我们使用一种基于所发生的成本相对于研究和开发努力的总估计成本的投入方法来衡量成比例绩效。
截至以下三个月2020年3月31日和2019,我们确认的合作收入 $2.1 百万和$2.6 百万分别在Vertex的简明合并运营报表中。期间确认的收入 止三个月 2020年3月31日包括因期内业绩满意而摊销的递延收入。截至 2020年3月31日,分配给未履行的剩余履行义务的交易价格总额为 $35.2 百万,预计将在2021年第三季度之前确认为收入。我们的递延收入为 $4.0 百万和$0.8 百万分别自第一个延长研究期限和2019年12月31日起截至2020年3月31日和2019年12月31日,根据研究期限在简明合并资产负债表中分类为流动和非流动。
4. 赠款
生物医学高级研究与发展管理局(BARDA)
2016年9月,我们获得了高达 $125.8 百万根据BARDA(美国卫生与公众服务部(HHS)负责准备和反应的助理国务卿办公室(ASPR)的一个组成部分,BARDA的编号为HHSO 100201600029 C的协议,以帮助资助我们的寨卡疫苗计划。根据与BARDA的协议条款,初始基本奖励为 $8.2 百万支持毒理学研究、1期临床试验和相关生产活动。合同选项可用, $117.6 百万支持改进寨卡候选疫苗的额外1期研究、2期和3期临床研究以及寨卡疫苗的大规模生产。
自.起2020年3月31日, 三 的四 合同期权已被行使,导致 $117.3 百万现有资金以及额外的 $8.4 百万如果行使最终合同选择权,则可用。截至2020年3月31日和2019年3月31日的三个月,我们确认收入为 $2.8 百万和$1.5 百万分别与BARDA协议有关。
2020年4月16日,我们与BARDA签订了一项新协议(见附注13)。
比尔和梅琳达·盖茨基金会(Gates Foundation)
2016年1月,我们与盖茨基金会达成了一项全球卫生项目框架协议,以推进各种传染病的基于信使核糖核酸的开发项目。盖茨基金会承诺$20.0 百万提供赠款,以支持我们最初的项目,该项目涉及在临床前环境中评估抗体组合,以及进行一项潜在的mRNA药物的人类首个第一阶段临床试验,以帮助预防人类免疫缺陷病毒(HIV)感染。后续项目可使框架协议下的潜在供资总额达到$100.0 百万在框架协议六周年之前,可以提出并批准支持开发其他各种传染病的基于信使核糖核酸的项目(包括艾滋病毒抗体项目),但要遵守框架协议的条款,包括我们向盖茨基金会授予某些非排他性许可的义务。2019年3月,盖茨基金会提供了额外的资金承诺,最高可达$1.1 百万来支持一个后续项目。
自.起2020年3月31日最多, $21.1 百万已承诺提供资金,最高可增加$80.0 百万如果其他后续项目获得批准,则可用。我们确认的收入为$0.3 百万与截至2020年3月31日和2019年3月31日的三个月的盖茨基金会协议有关。我们已经将收入递延了$1.2 百万和$1.5 百万截至2020年3月31日和2019年12月31日分别与盖茨基金会协议有关。
27
目录表
美国国防部高级研究计划局(DARPA)
2013年10月,DARPA授予我们高达 $24.6 百万根据W 911 NF-13-1-0417号协议,随后调整为 $19.7 百万,研究和开发潜在的mRNA药物,作为DARPA“实现预防和治疗自主诊断”(ADEPT)计划的一部分,该计划的重点是协助开发技术,以快速识别和应对自然和工程疾病和毒素构成的威胁。DARPA奖项主要用于支持我们的疫苗和抗体计划,以预防基孔肯雅病毒感染。
5. 金融工具
现金和现金等价物及投资
下表按重要投资类别总结了我们的现金和可供出售证券 2020年3月31日和2019年12月31日(单位:千):
2020年3月31日 | ||||||||||||||||||||||||||||
摊销 成本 | 未实现 收益 | 未实现 损失 | 估计公允价值 | 现金和 现金 等价物 | 当前 适销对路 证券 | 非 当前 适销对路 证券 | ||||||||||||||||||||||
现金及现金等价物 | $ | $ | $ | $ | $ | $ | $ | |||||||||||||||||||||
可供销售: | ||||||||||||||||||||||||||||
第2级: | ||||||||||||||||||||||||||||
存单 | ( | ) | ||||||||||||||||||||||||||
美国国债 | ||||||||||||||||||||||||||||
美国政府机构和公司实体的债务证券 | ( | ) | ||||||||||||||||||||||||||
$ | $ | $ | ( | ) | $ | $ | $ | $ | ||||||||||||||||||||
2019年12月31日 | ||||||||||||||||||||||||||||
摊销 成本 | 未实现 收益 | 未实现 损失 | 估计公允价值 | 现金和 现金 等价物 | 当前 适销对路 证券 | 非 当前 适销对路 证券 | ||||||||||||||||||||||
现金及现金等价物 | $ | $ | $ | $ | $ | $ | $ | |||||||||||||||||||||
可供销售: | ||||||||||||||||||||||||||||
第2级: | ||||||||||||||||||||||||||||
存单 | ( | ) | ||||||||||||||||||||||||||
美国国债 | ( | ) | ||||||||||||||||||||||||||
美国政府机构和公司实体的债务证券 | ( | ) | ||||||||||||||||||||||||||
$ | $ | $ | ( | ) | $ | $ | $ | $ | ||||||||||||||||||||
28
目录表
按合同到期日计算的有价证券的摊销成本和估计公允价值 2020年3月31日具体如下(以千为单位):
2020年3月31日 | ||||||||
摊销 成本 | 估计数 公允价值 | |||||||
在一年或更短的时间内到期 | $ | $ | ||||||
应在一年至五年后到期 | ||||||||
总 | $ | $ | ||||||
根据我们的投资政策,我们将投资于具有高信用质量发行人的投资级证券,并通常限制对任何一个发行人的信用敞口。我们在每个报告期结束时评估证券的减值。减值的评估考虑了许多因素,它们的相对重要性因情况而异。考虑的因素包括公允价值下降至摊余成本基础以下是由于信贷相关因素还是非信贷相关因素、发行人的财务状况和近期前景,以及我们持有投资以实现预期公允价值回升的意图和能力。任何与信贷无关的减值都在扣除适用税项后的其他综合(亏损)收益中确认。与信贷相关的减值在资产负债表上确认为准备,并对收益进行相应的调整。我们没有确认截至三个月的任何与可供出售证券相关的信贷损失。2020年3月31日和2019.
下表按证券处于未实现亏损状态的时间长短汇总了处于未实现亏损状态的可供出售证券的未实现亏损总额和估计公允价值2020年3月31日和2019年12月31日(单位:千):
少于12个月 | 12个月或更长时间 | 总 | ||||||||||||||||||||||
未实现亏损总额 | 估计公允价值 | 未实现亏损总额 | 估计公允价值 | 未实现亏损总额 | 估计公允价值 | |||||||||||||||||||
截至2020年3月31日: | ||||||||||||||||||||||||
存单 | $ | ( | ) | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||
美国政府机构和公司实体的债务证券 | ( | ) | ( | ) | ||||||||||||||||||||
总 | $ | ( | ) | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||
截至2019年12月31日: | ||||||||||||||||||||||||
存单 | $ | ( | ) | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||
美国国债 | ( | ) | ( | ) | ||||||||||||||||||||
美国政府机构和公司实体的债务证券 | ( | ) | ( | ) | ||||||||||||||||||||
总 | $ | ( | ) | $ | $ | $ | $ | ( | ) | $ | ||||||||||||||
在…2020年3月31日和2019年12月31日,在我们的总投资组合中,我们分别持有237和19只可供出售证券,这些证券处于持续未实现亏损状态。我们既不打算出售这些投资,也不认为我们更有可能在其公允价值恢复之前出售它们。我们还相信,我们将能够在到期时收回应付我们的本金和利息。
6. 资产负债表组成部分
预付费用和其他流动资产
预付费用和其他流动资产,截至 2020年3月31日和2019年12月31日包括以下内容(以千计):
29
目录表
3月31日, | 12月31日, | |||||||
2020 | 2019 | |||||||
预付费用 | $ | $ | ||||||
租户奖励应收账款 | ||||||||
应收有价证券利息 | ||||||||
预付费用和其他流动资产 | $ | $ | ||||||
财产和设备,净额
财产和设备,净值,截至 2020年3月31日和2019年12月31日包括以下内容(以千计):
3月31日, | 12月31日, | |||||||
2020 | 2019 | |||||||
实验室设备 | $ | $ | ||||||
租赁权改进 | ||||||||
家具、固定装置和其他 | ||||||||
计算机设备和软件 | ||||||||
内部开发的软件 | ||||||||
使用权资产、融资 | ||||||||
在建工程 | ||||||||
减去:累计折旧 | ( | ) | ( | ) | ||||
财产和设备,净额 | $ | $ | ||||||
折旧和摊销费用 止三个月 2020年3月31日和2019曾经是$7.4 百万和$7.3 百万,分别为。
应计负债
应计负债,截至 2020年3月31日和2019年12月31日包括以下内容(以千计):
3月31日, | 12月31日, | |||||||
2020 | 2019 | |||||||
财产和设备 | $ | $ | ||||||
与薪酬相关 | ||||||||
对外商品和服务 | ||||||||
应计负债 | $ | $ | ||||||
7. 租契
我们已经为我们的设施和设备签订了各种长期的不可撤销租赁安排,这些设施和设备将在不同时间到期,直至2032年。其中一些安排设有免租期或逐步递增的租金支付条款,我们以直线方式在租约有效期内确认这些安排下的租赁成本。我们有二 位于马萨诸塞州的校园、我们的剑桥工厂和位于诺伍德的Moderna技术中心(MT)。
经营租约
剑桥大学设施
我们在马萨诸塞州剑桥科技广场占据了一个多建筑园区,其中包括办公室和研究实验室空间,总计约为 200,000 平方英尺我们的剑桥设施租约的有效期为2020年至2029年。
30
目录表
2019年8月,我们对租赁协议进行了修订,以整合我们位于马萨诸塞州剑桥的科技广场空间。其中包括从2020年1月开始签订一项前瞻性租赁协议,以收购约 50,000 科技广场200号的额外空间为平方英尺,包括之前根据2019年12月31日到期的转租而占用的空间。我们还将提前完全退出我们租赁的大约60,000 到2020年5月,技术广场的面积将达到500平方英尺。此外,我们目前的200科技广场租约已延长至两年 到2029年。修正案提供了额外的合计租户改善津贴$3.5 百万用于技术广场200号的改进设计和施工。
2016年5月,我们签订了一份租赁协议,124,760 位于马萨诸塞州剑桥市科技广场200号的20平方英尺的办公和实验室空间。租赁于2016年9月1日开始,基本租金可在一年内上调。11 -一年任期。从2016年9月到2020年1月,我们分六个阶段入驻。我们可以选择延长租期。二 **延长期限:五年 每一家,按基于市场的汇率计算。除了支付租金外,租约还规定我们在租赁期内支付我们按比例分摊的运营费用和税款。随着我们租赁的面积随着租赁期的延长而增加,我们以直线方式确认了每个阶段在各自租赁期内的总租金支付。租约为我们提供了最初的租户津贴。$10.00 每平方英尺产生的成本被资本化为租赁改善。2018年12月,关于2016年5月签订的协议中的空间扩展,我们签订了以下分租协议。34,268 2平方英尺,以扩大我们在200科技广场的办公和实验室空间。
2015年8月,我们签订了一项设施租赁协议。61,618 位于北京科技广场500号的10平方英尺的办公和实验室空间。租赁于2016年4月开始,基本租金在租赁期后的六年内不断攀升。这份租约提供了一个$3.1 百万承租人改善津贴,所产生的成本作为租赁改善资本化。租约还规定,我们在租赁期内支付我们按比例分摊的运营费用和税款。
Moderna技术中心北(MTC北)
2019年2月,我们签订了一份新的办公和实验室空间租赁协议,租赁面积约为200,000 平方英尺,MTC North,位于马萨诸塞州。租约于2019年第二季度开始,初始到期日为2031年。我们可以选择将租期延长到四 额外的五年任期。与此同时,我们达成了一项协议,将大约64 百分比租赁空间的所有权转让给第三方。对于第三方占用的空间,我们没有向房东支付租金的义务。第三方的所有转租款项都直接支付给房东。根据第三方的选择,转租可以在2020年5月至2021年2月之间到期。
2017年4月,我们就MTC制造设施附近的土地签订了租赁协议(见下文MTC South)。我们决定,出于会计目的,这份土地租约应与2016年8月签订的与该建筑物有关的租约分开核算。租约于2017年4月开始,基本租金在租约的前35年内不断上升。
我们以直线法记录从租赁开始之日至租赁期结束的每一份运营租赁的运营租赁成本。经营租赁成本在我们的综合经营报表中计入经营费用。
融资租赁
Moderna技术中心制造厂(南美)
2016年8月,我们签订了一份租赁协议,租期约为200,000 位于马萨诸塞州的MTC South,占地30平方英尺的办公、实验室和轻工制造空间。出于会计目的,租赁开始日期为2016年10月1日。关于这份租约,房东向租户提供了大约美元的改善津贴。$24.2 百万支付与大楼承租人改善的设计、工程和施工相关的费用。租约将于2032年9月到期。我们可以选择将期限延长至。二 **延长期限:十年 每个都是以市场为基础的租金。基本租金在租赁期内会有所增加。
根据ASC 842,MTC South租约分为建筑物租约和土地租约,使用租约开始之日的估计增量借款利率。房屋租赁被归类为融资租赁,土地租赁被归类为经营租赁。出于会计目的,租赁期限被确定为35 年份,这是租赁的不可取消期,并包括可选延长期,因为我们合理确定我们将行使延长租赁期的选择权。2019年1月1日采用ASC 842后,我们终止确认了根据ASC 840的历史定制会计记录的资产和负债,并记录了与建筑租赁相关的融资租赁负债和融资使用权资产。融资使用权资产在剩余租赁期内按直线法摊销为折旧费用。我们在综合经营报表中记录与融资租赁负债相关的利息费用。
31
目录表
截至2019年12月31日和2020年3月31日的经营和融资租赁使用权资产和租赁负债如下(单位:千):
3月31日, | 十二月三十一日, | |||||||
2020 | 2019 | |||||||
资产: | ||||||||
使用权资产,运营,净值 (1) (2) | $ | $ | ||||||
使用权资产、融资、净值 (3) (4) | ||||||||
总 | $ | $ | ||||||
负债: | ||||||||
当前: | ||||||||
经营租赁负债(5) | $ | $ | ||||||
非当前: | ||||||||
非流动经营租赁负债 | ||||||||
非流动融资租赁负债 | ||||||||
非流动租赁负债总额 | ||||||||
总 | $ | $ | ||||||
_______
(1) 这些资产是房地产相关资产,包括土地、办公室和实验室空间。
(2) 扣除累计折旧后的净额。
(3) 这些资产是与MT South租赁相关的房地产资产。
(4) 扣除累计折旧后,计入简明综合资产负债表中的物业和设备。
(5) 计入简明综合资产负债表的其他流动负债。
截至2020年和2019年3月31日止三个月的租赁成本组成如下(单位:千):
截至3月31日的三个月, | ||||||||
2020 | 2019 | |||||||
经营租赁成本 | $ | $ | ||||||
融资租赁成本: | ||||||||
使用权资产摊销、融资租赁 | ||||||||
融资租赁负债的利息费用 | ||||||||
融资租赁总成本 | ||||||||
可变租赁成本 | ||||||||
截至2020年和2019年3月31日止三个月,与我们的租赁相关的补充现金流信息如下(单位:千):
截至3月31日的三个月, | ||||||||
2020 | 2019 | |||||||
为计量租赁负债所包括的金额支付的现金: | ||||||||
经营租赁中使用的经营现金流 | $ | ( | ) | $ | ( | ) | ||
融资租赁中使用的经营现金流 | ( | ) | ( | ) | ||||
经营租赁非现金项目: | ||||||||
通过租赁修改和重新评估减少使用权资产 | ||||||||
换取经营租赁负债的使用权资产 | ||||||||
融资租赁非现金项目: | ||||||||
融资租赁义务的费用 | ||||||||
32
目录表
不可取消经营租赁协议下的未来最低租赁付款 2020年3月31日,如下(以千计):
财政年度 | 经营租约(1) | 融资租赁(1) | |||||||
2020 | (今年剩余时间) | $ | $ | ||||||
2021 | |||||||||
2022 | |||||||||
2023 | |||||||||
2024 | |||||||||
此后 | |||||||||
最低租赁付款总额 | |||||||||
减去相当于利息或推定利息的数额 | ( | ) | ( | ) | (2) | ||||
租赁负债现值 | $ | $ | |||||||
______
(1) 将可选延期包括在MT South租期中,总计 $10.3 百万和$208.5 百万分别在经营租赁和融资租赁中未贴现的未来租赁付款。
(2) 基于估算利率 17.2 %.
8. 承付款和或有事项
战略协作
根据我们的战略合作协议,我们致力于执行某些研究、开发和制造活动。作为我们与默克的PCV协议和PCV/SAV协议的一部分,我们承诺通过最初的第二阶段临床试验执行与PCV产品相关的某些研究、开发和制造活动,最高预算金额为$243.0 百万这两个时期截至2020年3月31日和12月31日,2019(见附注3)。
法律诉讼
我们目前不是任何实质性法律程序的一方。
赔偿义务
在特拉华州法律允许的情况下,我们对我们的管理人员、董事和员工在管理人员或董事应我们的要求以此类身份服务期间发生的某些事件和事件进行赔偿。赔偿的期限为该官员或董事的终身。
我们在实验室和办公空间的租约中有标准的赔偿安排,要求房东赔偿因我们租约下的某些行为、违规行为、违规行为或不履行合同而导致的任何索赔、诉讼、诉讼或费用造成的任何伤害、损失、事故或损害的责任。
截至2020年3月31日止三个月及截至2019年12月31日止年度,吾等并无任何与该等赔偿责任相关的损失,亦无重大索偿未决。我们预计不会有与这些赔偿义务有关的重大索赔,因此得出结论,这些债务的公允价值可以忽略不计,也没有建立相关的准备金。
33
目录表
采购承诺和采购订单
截至2020年3月31日,我们拥有$3.9 百万对临床服务的不可取消购买承诺,预计将在2020年至2023年支付。
除了购买承诺外,我们还与第三方就各种服务达成协议,包括与临床运营、支持和合同制造相关的服务,对于这些服务,我们不能为了方便而在合同上终止,也不能避免未来对供应商的任何和所有义务。某些协议规定了终止权,但须支付终止费或清盘费用。根据此类协议,我们有合同义务向供应商支付某些款项,主要是补偿他们在取消之前发生的无法收回的费用。在…2020年3月31日和2019年12月31日,我们有可取消的未结采购订单$133.2 百万和$105.9 百万根据此类协议,我们将分别为重要的临床操作和支持提供总计。这些金额仅代表我们对合同承诺付款的项目的估计。2020年3月31日和2019年12月31日,假设我们不会取消这些协议。根据此类协议,我们未来向供应商支付的实际金额可能与采购订单金额不同。
9. 股东权益
2018年2月28日和2018年5月7日,董事会批准了对我们公司注册证书的修正案,总共产生了:775,000,000 普通股和普通股合计股509,352,795 分别授权发行可赎回可转换优先股股份。首次公开招股完成后,我们的法定股本包括:1,600,000,000 普通股的股份,面值。$0.0001 每股收益,以及162,000,000 优先股,面值。$0.0001 每股收益,所有优先股的股份均未指定。
2018年12月11日,我们完成了IPO,据此我们出售了。26,275,993 以欧元的价格购买普通股。$23.00 每股1美元。我们从IPO收到的净收益总额为$563.0 百万,扣除承保折扣和佣金。$33.2 百万费用和报销费用分别为$8.1 百万费用由我们支付。IPO结束时,我们的可赎回可转换优先股的所有流通股均转换为。236,012,913 购买普通股的股份。
10. 基于股票的薪酬
股权计划
2013年10月,我们通过了2013年股权激励计划(2013年激励计划)和2013年单位期权和奖励计划(2013期权计划),其中规定向我们的员工、高级管理人员、董事、顾问和外部顾问授予激励单位、非合格单位期权以及限制性和非限制性单位奖励。从历史上看,我们还向任何计划之外的创始人、高管、董事和顾问授予限制性股票。
2016年8月,我们通过了2016年股票期权和授予计划(2016股权计划),取代了2013年的期权计划和2013年的激励计划。2016年股权计划,并规定向我们的员工、高管、董事、顾问和其他关键人员授予激励性股票期权、非限制性股票期权、限制性股票、非限制性股票和限制性股票单位。
关于IPO,我们于2018年11月通过了2018年股票期权和激励计划(2018年股权计划)。2018年股权计划于紧接IPO生效日期的前一天生效,并取代了我们的2016年计划。2018年股权计划为我们的薪酬委员会提供了灵活性,可以使用各种基于股权的激励奖励作为薪酬工具来激励我们的员工。我们最初已经预订了13,000,000 我们普通股的股份,用于根据2018年股权计划发行奖励。2018年股权计划规定,自2019年1月1日起,根据该计划保留和可供发行的股票数量将自动增加4 %在紧接的12月31日之前,我们的普通股已发行数量,或由我们的薪酬委员会确定的较少数量的普通股。任何奖励被没收、取消、扣留以满足行使价或预扣税款、在归属前由我们重新收购、在没有发行股票的情况下满足、到期或以其他方式支付的普通股股份
34
目录表
根据2018年股权计划和2016年计划终止(以行使以外的方式)的普通股将重新计入2018年股权计划可供发行的普通股股份。
基于股票的奖励的条款和条件由我们的董事会全权决定。我们颁发基于服务的奖励,在规定的服务期限内授予,以及基于绩效的奖励,在达到规定的条件时授予。基于服务的奖励通常授予四- 年期间,第一个 25 %以下授予的此类奖励 12个月 继续就业或服务。其余奖项归属于 十二 接下来十二个季度的季度分期付款。根据2016年股权计划授予的股票期权到期 十年 自授予之日起,行使价格必须至少等于授予之日普通股的公平市场价值。
自.起2020年3月31日,我们总共有 75.0 百万 根据我们的股权计划保留用于未来发行的股份,其中 47.1 百万股票被保留用于之前授予的股权奖励,并且 27.9 百万 根据2018年股权计划,股份可供未来授予。2016年股权计划下不会授予额外奖励,因为该计划已被2018年股权计划取代。
选项
我们一般通过2018年股权计划和2016年股权计划授予期权。 下表总结了我们在期间的期权活动 止三个月 2020年3月31日:
数量: 选项 | 加权的- 平均值 锻炼 单价 分享 | 加权的- 平均值 格兰特 约会集市 每项价值 分享 | 加权的- 平均值 剩余 合同 术语 | 集料 固有的 价值 (1) (单位:万人) | |||||||||||||
截至2019年12月31日未偿还 | $ | $ | $ | ||||||||||||||
授与 | |||||||||||||||||
已锻炼 | ( | ) | |||||||||||||||
取消/没收 | ( | ) | |||||||||||||||
2020年3月31日未完成 | |||||||||||||||||
可于2020年3月31日取消 | |||||||||||||||||
预计将于2020年3月31日归属 | |||||||||||||||||
_______
(1)总内在价值计算为标的期权的行使价与截至日期的普通股公允价值之间的差额 2020年3月31日.
为止三个月 2020年3月31日, 3.2 百万股票期权被行使。已行使期权的总内在价值为 $58.0 百万为止三个月2020年3月31日。总内在价值代表期权持有人在期内行使股票期权时收到的行使价与售价之间的差额。因股票期权行使而记录的总对价约为 $28.4 百万为止三个月 2020年3月31日.
35
目录表
受限普通股单位
我们通常通过2018年股权计划和2016年股权计划授予限制性股票单位奖励。 下表总结了我们在期间的限制性股票单位活动 止三个月 2020年3月31日:
单位 | 加权平均 公允价值 每单位 | |||||
未偿还,截至2019年12月31日未归属 | $ | |||||
已发布 | ||||||
既得 | ( | ) | ||||
取消/没收 | ( | ) | ||||
未偿还,于2020年3月31日未归属 | ||||||
2018年员工购股计划
2018年11月,我们通过了2018年员工购股计划(ESPP),该计划于2018年12月5日生效。ESPP最初保留并授权发行最多总计810,000 向参与的员工出售普通股。我们每年将根据ESPP向我们的员工提供一个或多个由一个或多个购买期组成的股票发售。课程通常每六个月开始一次,并将持续六-月期间,称为提供期间。根据ESPP出售股票的收购价将等于。85 %股票在要约期的第一个营业日或者申购期的最后一个营业日的公允市值中的较低者。员工一般有资格通过工资扣减在以下范围内参加1 %从现在到现在50 %从他们的薪酬中扣除,不得购买超过3,000 在每个购买期间或期间购买普通股$25,000 任何历年的普通股价值。我们于2019年6月1日开始发行ESPP。有几个不是于截至该三个月止三个月内根据ESPP售出的股份2020年3月31日.
计价与股权薪酬费用
根据我们的股权计划授予的期权的股票补偿使用Black-Scholes期权定价模型确定。 用于估计授予的期权公允价值的加权平均假设 止三个月 2020年3月31日和2019具体如下:
加权平均 | ||||||||
截至3月31日的三个月, | ||||||||
2020 | 2019 | |||||||
选项: | ||||||||
无风险利率 | % | % | ||||||
预期期限 | ||||||||
预期波幅 | % | % | ||||||
预期股息 | % | % | ||||||
加权平均每股公允价值 | $ | $ | ||||||
36
目录表
下表列出了基于股票的补偿费用的组成和分类 止三个月 2020年3月31日和2019具体如下(单位:千):
截至三个月 2020年3月31日 | ||||||||
2020 | 2019 | |||||||
选项 | $ | $ | ||||||
受限普通股单位 | ||||||||
ESPP | ||||||||
总 | $ | $ | ||||||
研发 | $ | $ | ||||||
一般和行政 | ||||||||
总 | $ | $ | ||||||
自.起2020年3月31日,曾经有过$243.4 百万与授予的期权和限制性股票的未归属股票补偿相关的未确认补偿成本总额。该成本预计将在加权平均期内确认 3.19 年份在…2020年3月31日.
11. 所得税
我们确认递延税项资产和负债是由于资产和负债的财务报告和计税基础之间的暂时性差异而产生的预期未来税务后果。这些差异是使用颁布的法定税率来衡量的,这些税率预计将在差异有望逆转的年份有效。当递延税项资产的预期变现不符合“很可能”的标准时,我们会提供估值免税额。我们递延税项资产的变现取决于未来应课税收入的产生,其数额和时间是不确定的。根据管理层对所有现有证据的评估,我们继续对我们所有的递延税项资产维持全额估值准备金。
在截至2020年3月31日和2019年3月31日的三个月里,没有重大的所得税拨备或优惠。
12. 每股净亏损
年度每股基本及摊薄净亏损止三个月 2020年3月31日和2019按如下方式计算(以千为单位,不包括每股和每股数据):
截至3月31日的三个月, | ||||||||
2020 | 2019 | |||||||
分子: | ||||||||
净亏损 | $ | ( | ) | $ | ( | ) | ||
分母: | ||||||||
用于每股净亏损的加权平均普通股,基本和稀释 | ||||||||
每股基本和稀释后净亏损 | $ | ( | ) | $ | ( | ) | ||
37
目录表
以下普通股等价物,基于截至2020年3月31日和2019年被排除在所述期间普通股股东每股摊薄净亏损的计算之外,因为它们被包括在内将是反稀释的:
3月31日, | |||||
2020 | 2019 | ||||
股票期权 | |||||
限制性普通股 | |||||
受限普通股单位 | |||||
13. 后续事件
2020年4月16日,我们达成了一项协议,承诺最高可达$483 百万来自美国生物医学高级研究和发展局(BARDA),这是负责准备和反应的助理秘书长办公室(BARDA)的一个部门(ASPR)在美国卫生与公众服务部(HHS)内,以加快我们针对新型冠状病毒(SARS-CoV-2)的mRNA候选疫苗(mRNA-1273)的开发。根据协议条款,BARDA将资助将mRNA-1273提升到FDA的许可。
38
目录表
项目2.管理层对财务状况和经营成果的讨论和分析
您应阅读以下对本公司财务状况和经营成果的讨论和分析,以及本公司在本10-Q表中包含的未经审计的财务信息和相关说明,以及我们的综合财务报表和相关说明以及其他财务信息,这些信息包括我们于2020年2月27日提交给美国证券交易委员会的截至2019年12月31日的10-K表年报(“2019年10-K表年报”)。本讨论和分析中包含的一些信息或本10-Q表中其他部分阐述的信息,包括与我们的业务计划和战略有关的信息,包括涉及风险和不确定性的前瞻性陈述。由于许多因素,包括第二部分第1A项--本表格10-Q中的风险因素所列的因素,我们的实际结果可能与以下讨论和分析中的前瞻性陈述所描述或暗示的结果大不相同。
概述
我们是一家临床阶段的生物技术公司,开创了信使RNA(MRNA)疗法和疫苗的先河,创造出新一代变革性药物,改善患者的生活。信使核糖核酸药物旨在引导人体细胞产生细胞内、膜或分泌的蛋白质,这些蛋白质具有治疗或预防的益处,有可能治疗广泛的疾病。我们的平台建立在基础和应用信使核糖核酸科学、递送技术和制造方面的不断进步的基础上,使我们有能力同时开发一系列强大的新开发候选者。我们正在独立并与我们的战略合作伙伴一起开发针对传染病、免疫肿瘤学、罕见疾病、自身免疫性疾病和心血管疾病的疗法和疫苗。
在我们的平台内,我们开发了能够为不同应用开发信使核糖核酸药物的技术。当我们确定我们认为可以使一组具有共同产品特征的潜在mRNA药物成为一组新的技术时,我们称这组药物为情态。“虽然一种医疗模式中的计划可能针对不同的疾病,但它们共享相似的mRNA技术、交付技术和制造工艺,以实现共享的产品功能。一种模式内的程序通常也将共享相似的药理学概况,包括期望的剂量反应、预期的剂量方案、蛋白质表达的目标组织、安全性和耐受性目标以及药物特性。一种医疗模式中的项目通常具有相关的技术风险,但由于它们追求不同的疾病,它们往往具有不相关的生物风险。到目前为止,我们已经创建了六种模式:
• | 预防性疫苗; |
• | 癌症疫苗; |
• | 瘤内免疫肿瘤学; |
• | 局部再生疗法; |
• | 系统性分泌疗法和细胞表面疗法;以及 |
• | 全身细胞内疗法。 |
2019年,我们认为,我们的传染病疫苗组合(包括我们的巨细胞病毒(CMV)、疫苗和基孔肯雅抗体计划)的第一阶段阳性数据降低了我们的预防性疫苗以及全身分泌和细胞表面治疗模式的风险,我们现在已将这些模式指定为核心模式。在这些核心模式中,我们的战略是利用我们在技术方面积累的创新、我们的过程洞察力以及我们的临床前和临床经验投资于更多的开发候选者。因此,我们在2020年初提出了五个新的开发候选方案:白细胞介素2(IL-2)、程序化死亡配体1(PD-L1)、儿科呼吸道合胞病毒(RSV)疫苗、爱泼斯坦-巴尔病毒(EBV)疫苗和SARS-CoV-2疫苗,这是我们利用我们的技术推进全球公共卫生的使命的一部分。我们的探索模式继续是推进我们的战略的关键部分,以最大限度地应用我们潜在的信使核糖核酸药物。
我们有一个多样化的开发渠道,而信使核糖核酸药物的广泛潜在应用使我们筹集了大量资金,并采取了一种平衡短期风险和长期价值创造的长期资本分配方法。自.起2020年3月31日,我们有现金、现金等价物和大约17.2亿美元。我们利用这笔资金为技术创新、药物发现和临床开发项目、基础设施和能力的运营和投资活动提供资金,以支持我们的研究引擎和早期开发引擎(包括我们的Moderna技术中心)、我们的数字基础设施、我们的知识产权组合的创建和行政支持。
自成立以来,我们遭受了重大的运营亏损。截至2019年12月31日和2018年12月31日的年度,我们的净亏损分别为5.14亿美元和3.847亿美元。我们的净亏损是1.242亿美元为止三个月 2020年3月31日。自.起2020年3月31日,我们的累积赤字是16.2亿美元.
39
目录表
在可预见的未来,我们预计将继续产生与我们正在进行的活动相关的巨额费用和运营亏损,包括:
• | 继续我们的平台研究和药物发现和开发工作; |
• | 为我们的研究药物进行临床试验; |
• | 研制临床试验材料,发展规模化制造能力; |
• | 寻求监管机构对我们的研究药物的批准; |
• | 维护、扩大和保护我们的知识产权; |
• | 雇用额外的人员来支持我们的计划开发工作,以获得监管机构的批准并确保额外的运营设施;以及 |
• | 继续作为一家上市公司运营。 |
除非我们成功完成临床开发并获得监管机构对我们一种或多种研究药物的批准,否则我们预计不会从销售潜在的信使核糖核酸药物中获得收入。如果我们寻求获得监管部门对我们的任何研究药物的批准并将其商业化,我们预计将产生巨额商业化费用。
因此,我们将需要大量额外资金来支持我们的持续运营和实施我们的增长战略。在我们能够从药品销售中获得可观的收入之前,如果有的话,我们预计将通过公共或私募股权发行、结构性融资和债务融资、政府融资安排、战略联盟以及营销、制造、分销和许可安排来为我们的运营提供资金。我们可能无法筹集更多资金或以优惠条件达成此类其他协议,或者根本无法。如果我们不能在需要的时候筹集资金或达成协议,我们可能不得不大幅推迟、缩减或停止我们一个或多个项目的开发和商业化。
由于与药品开发相关的许多风险和不确定性,我们无法预测费用的时间或金额,也无法预测我们何时或是否能够实现或保持盈利。即使我们能够从销售药品中获得收入,我们也可能无法盈利。如果我们无法实现盈利或无法持续盈利,那么我们可能无法继续按计划运营,并被迫减少运营。
为了应对全球冠状病毒的爆发,我们正在与美国国家变态反应和传染病研究所(NIAID)的疫苗研究中心和国家卫生研究院(NIH)的微生物和传染病部门合作,快速生产用于治疗SARS-CoV-2或新冠肺炎的候选疫苗。防疫创新联盟(CEPI)为疫苗初步临床批次的当前良好制造规范cGMP制造提供了资金,NIAID正在美国进行第一阶段临床试验。此外,我们已经向FDA提交了一份研究新药或IND的申请,如果得到NIH领导的第一阶段研究的安全性数据的支持,将在第二阶段和后期研究中评估mRNA-1273。
我们还承诺投入大量财力和人员开发mRNA-1273,这可能会导致我们的其他开发计划延迟或以其他方式产生负面影响。
新冠肺炎对我们业务的最终影响目前尚不清楚。2020年3月,我们宣布,基于对儿科患者及其照顾者安全和健康的特殊关注,以及新冠肺炎试验完整性的中断风险,我们决定暂停我们的罕见疾病临床试验(MMA-3704mRNA,PA-3927)和我们的儿科呼吸道疫苗年龄降级试验(hMPV/PIV3mRNA-1653)的新登记。随着新冠肺炎形势的发展,将不断对这些决定进行重新评估。我们将继续积极监测情况,并可能根据联邦、州或地方当局的要求或我们认为最符合公众健康和安全以及我们的患者社区、员工、合作伙伴、供应商和股东的最佳利益采取进一步的预防和先发制人行动。我们无法预测此类行动或新冠肺炎对全球业务运营和经济状况的影响可能对我们的业务或战略产生的影响,包括对我们正在进行和计划中的临床开发活动和前景的影响,或对我们的财务和运营业绩的影响。
我们的管道
这一部分描述了到目前为止,我们的战略、我们的平台、我们的基础设施和我们积累的资源的组合所形成的管道。
40
目录表
自从我们在2014年末提名了我们的第一个项目以来,我们和我们的战略合作伙伴同时推进了一个多元化的开发管道,目前包括我们22个项目的23个开发候选者。自2015年12月以来,已有1900多名受试者参加了我们的临床试验。我们多样化的渠道包括六种模式和广泛的治疗领域的计划。一种模式是一组具有共同产品特征的潜在的信使核糖核酸药物,以及信使核糖核酸技术、递送技术和制造工艺的相关组合。我们正在筹备中的各个方面都通过战略联盟得到了支持,包括与阿斯利康(或阿斯利康)、默克公司(或默克公司)、Vertex制药公司(或Vertex)以及政府支持的组织和专注于全球卫生倡议的私人基金会、美国生物医学高级研究与发展局(BARDA)、国防高级研究计划局(DARPA)、美国国立卫生研究院、CEPI以及比尔和梅琳达·盖茨基金会或盖茨基金会。
下面的图表显示了我们目前正在进行的22个项目的23个候选开发项目,分为几种模式-首先是我们认为我们已经降低了技术风险的两种核心模式,然后是我们继续调查信使核糖核酸药物临床使用的四种探索性模式。
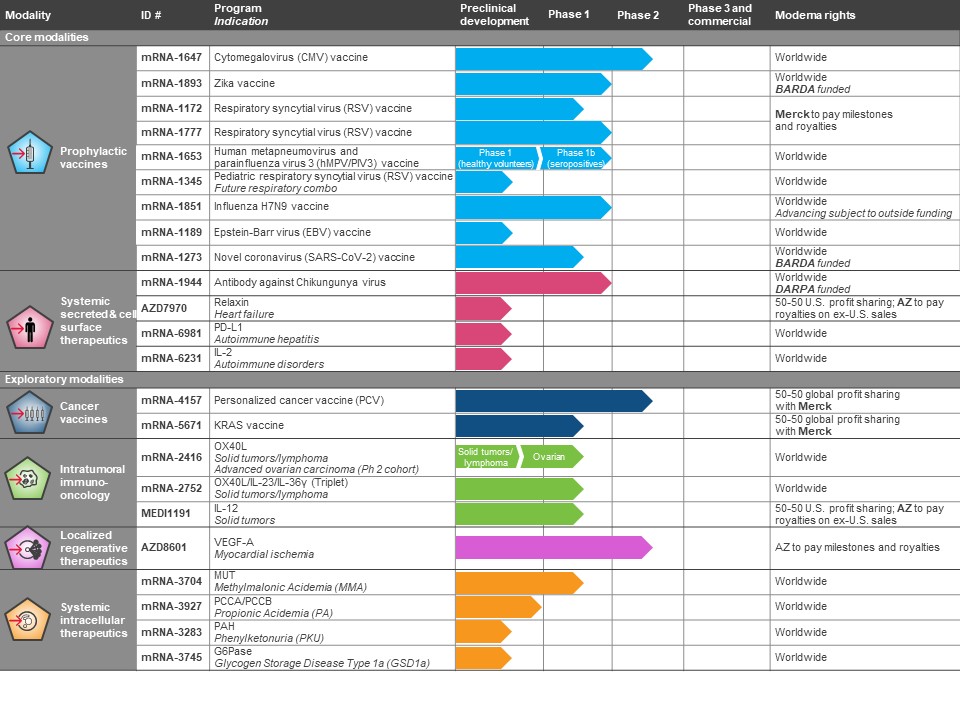
缩写:AZ,阿斯利康;G6Pase,葡萄糖6-磷酸酶;IL-12,白介素12;IL-23,白介素23;IL-36ɣ,白介素36;MUT,甲基丙二酰辅酶A变位酶;PAH,苯丙氨酸羟基酶;PCCA/PCCB,丙酰辅酶A/B亚单位;血管内皮生长因子A,血管内皮生长因子A。
41
目录表
使用mRNA技术的生物学可寻址的广度反映在我们目前22个程序的开发流水线中。它们涵盖26种不同的蛋白质或蛋白质复合体:11种不同的抗原(包括病毒样颗粒)用于传染病疫苗;两种不同的癌症疫苗,一种针对新抗原的个性化癌症疫苗,一种针对共享的癌症抗原;四种不同的免疫调节剂靶点(包括膜和系统分泌的蛋白质),用于免疫肿瘤学计划;一种分泌的局部再生因子,用于心力衰竭计划;四种不同生物的分泌或细胞表面蛋白(抗体、工程蛋白激素、分泌的细胞因子和细胞表面受体);以及四种用于罕见疾病计划的细胞内酶。在我们的开发流程中,由信使核糖核酸制成的蛋白质的多样性如下图所示。
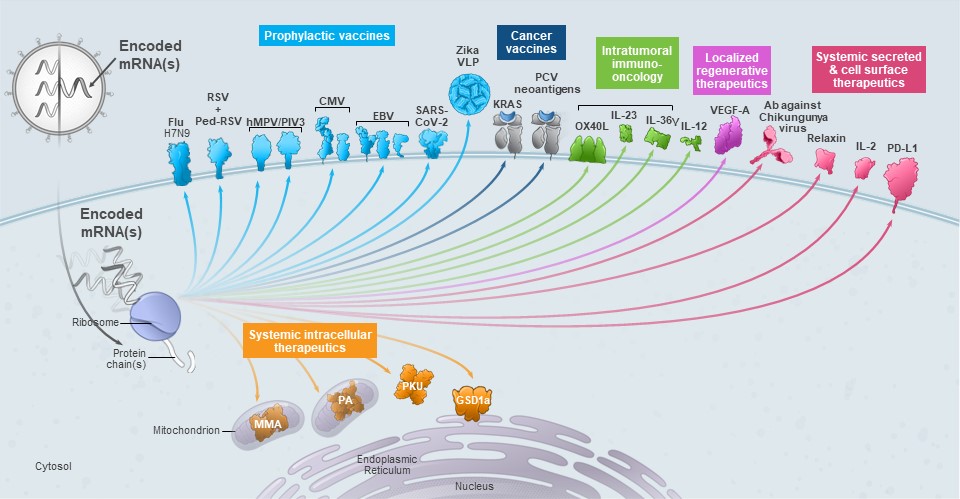
我们开发了六种模式,总结如下:
• | 预防性疫苗:我们的预防性疫苗目前包括8个项目,其中6个已进入临床试验。此外,在正在开发的八个项目中,H10N8疫苗(信使-1440)和基孔肯雅疫苗(信使-1388)是两个公共卫生项目,如果没有政府或其他资金,就不会进一步开发。在这些计划中,我们在第一阶段临床试验中以免疫原性的形式展示了所需的药理学,这些疫苗包括:H10N8疫苗(信使-1440)、H7N9疫苗(信使-1851)、呼吸道合胞病毒疫苗(信使-1777)、基孔肯雅疫苗(信使-1388)、人偏肺病毒(HMPV)/副流感病毒3型(PIV3)疫苗(信使-1653)、寨卡疫苗(信使-1893)和巨细胞病毒疫苗(信使-1647)。我们正在进行下一代寨卡疫苗(mRNA-1893)的第一阶段试验,默克公司正在进行另一种RSV疫苗(mRNA-1172)的第一阶段试验。我们的SARS-CoV-2疫苗(mRNA-1273)正处于由美国国立卫生研究院进行的第一阶段临床试验,我们已经获得FDA的批准,可以开始第二阶段的研究。 |
• | 全身性分泌疗法:我们有四个全身分泌物和细胞表面疗法的开发候选药物正在进行中。我们的分泌项目包括我们的抗基孔肯雅病毒抗体(mRNA-1944),用于治疗心力衰竭的Relaxin(AZD7970),以及用于自身免疫性疾病的IL-2(mRNA-6231)。我们针对基孔肯雅病毒(mRNA-1944)的抗体目前正在健康成年人中进行的第一阶段剂量递增研究中进行评估,该研究是随机和安慰剂对照的。Relaxin(AZD7970)和IL-2(mRNA-6231)的其余程序目前正处于临床前开发阶段。我们有一个这种形式的细胞表面治疗计划。治疗自身免疫性肝炎的PDL-1(mRNA-6981)目前正处于临床前开发阶段。 |
• | 癌症疫苗:我们目前正在我们的癌症疫苗模式中开发两个计划。我们的个性化癌症疫苗计划mRNA-4157正在与默克公司合作开发,目前处于多臂第一阶段试验和随机第二阶段试验。第二种个性化癌症疫苗NCI-4650正在与国家癌症研究所(NCI)合作开发,并处于研究人员发起的单臂第一阶段试验,该试验已经完成。两种疫苗mRNA-4157和NCI-4650在使用的新抗原选择方案上不同,但在其他方面基本上相同。我们在这种模式下的第二个程序,mRNA-5671,是一种KRAS疫苗。我们的战略合作伙伴默克公司正在进行mRNA-5671的第一阶段临床试验。 |
42
目录表
• | 肿瘤免疫肿瘤学:我们在这种模式下有三个项目。这种模式的第一个程序OX40L(mRNA-2416)旨在克服推进这种模式的技术挑战,包括设计信使RNA序列以最大限度地减少非靶标效应,利用我们的专利LNPs来增强安全性和耐受性,并展示患者的膜蛋白表达。OX40L(mRNA-2416)目前正在美国进行的第一阶段1/2试验中进行评估,并已在许多患者中证明了蛋白质的表达。来自这项正在进行的mRNA-2416研究的单一疗法分支的数据 结果表明,在所研究的所有剂量水平下,mRNA-2416都具有良好的耐受性,报告的大多数不良事件为1级和2级,没有3级不良事件报告。这一数据支持在实体瘤中使用抗PD-L1抑制剂duvalumab的肿瘤内mRNA-2416的评估,该评估在本研究的B部分进行,重点是晚期卵巢癌。我们的第二个项目,OX40L/IL-23/IL-36γ(三联体),已经在一期研究中给患者提供了治疗晚期或转移性实体瘤恶性肿瘤或淋巴瘤的剂量。我们的第三个项目IL-12(MEDI1191)正在与阿斯利康合作开发。 |
• | 本地化再生疗法:我们由阿斯利康开发的本地化血管内皮生长因子-A计划AZD8601已经完成了1a/b期试验,以描述其在糖尿病患者中的安全性、耐受性、蛋白质生产和活性。这项研究已经达到了描述安全性和耐受性的主要目标,以及展示AZD8601给药后蛋白质产生和血流变化的次要目标。在这项试验中,AZD8601被单次递增剂量皮内注射到患者的前臂皮肤。这些数据与之前在临床前模型中进行的研究一致。我们相信,这些数据为我们的mrna技术在疫苗环境之外的机制提供了临床证据。. 阿斯利康公司已经启动了一项针对血管内皮生长因子-A的AZD8601的2a期研究,用于治疗接受冠状动脉旁路移植(CABG)手术的收缩功能中度受损的患者的缺血性心脏病,试验仍在进行中。 |
• | 全身细胞内疗法:我们有四个系统细胞内疗法开发候选药物正在进行中。我们的细胞内计划针对甲基丙二酸血症,或MMA(信使-3704),丙酸血症,或PA(信使-3927),苯丙酮尿症,或蛋白尿(信使-3283),以及糖原储存障碍类型1a,或GSD1a(信使-3745)。我们已经为计划中的1/2期试验的mRNA-3704开放了IND,FDA还指定了对mRNA-3704的研究作为快速通道开发计划,用于治疗由于MMT缺乏而导致的孤立的MMA。我们有一个针对mRNA-3927的开放式IND,用于计划的1/2阶段试验,该计划也已被指定为快速通道开发计划。PKU(信使核糖核酸-3283)目前处于临床前开发阶段。 |
以下是针对我们的候选开发人员的最新关键更新:
• | 基于大流行的延迟:我们是使用基于风险的框架来逐一评估新参与者的注册和新站点的启动。我们将继续致力于我们的临床开发计划,并正在与所有利益攸关方密切合作,试图减轻大流行对我们正在进行的临床试验的影响。 基于对儿科患者及其照顾者的安全和健康的特别关注,以及新冠肺炎试验的完整性受到破坏的风险,我们决定暂停我们的罕见疾病临床试验(MMA-3704mRNA,PA-3927)和我们的儿科呼吸道疫苗年龄降级试验(HMPV/PIV3mRNA-1653)的新登记。随着新冠肺炎形势的发展,将不断对这些决定进行重新评估。 |
• | SARS-COV-2(mRNA-1273):美国国立卫生研究院(NIH)正在进行mRNA-1273的第一阶段研究。于2020年3月16日开始的第一阶段开放标签研究已经完成了原始研究的登记:45名年龄在18岁至55岁之间的健康成年志愿者分为三个剂量组(25微克、100微克和250微克)。NIH最近修改了第一阶段方案,增加了六个队列:三个老年人(56-70岁)和三个老年人(71岁及以上)。这些群体的登记工作正在进行中。2020年5月6日,我们获得FDA批准,可以在第二阶段研究中评估mRNA-1273。 |
43
目录表
• | 巨细胞病毒疫苗(MRNA1647):中国我们宣布了来自mRNA-1647第一阶段临床试验的第二个中期分析的阳性数据,该试验已经完成登记,并正在评估181名健康成年志愿者的安全性和免疫原性。临床试验人群包括那些对CMV感染天真的人(CMV血清阴性)和以前感染过CMV的人(CMV血清阳性)。参与者随机接受安慰剂或30、90、180或300微克的mRNA-1647,剂量计划分别为0、2和6个月。这项第二次计划中的中期分析评估了前三个剂量水平(30、90和180微克)在七个月(第三次接种后一个月)的安全性和免疫原性,最高剂量水平(300微克)在三个月(第二次接种后一个月)。中和抗体滴度(阻断感染的循环抗体水平)通过两种方法进行评估,分别利用上皮细胞和成纤维细胞,这两种细胞分别测量对五聚体和GB疫苗抗原的免疫反应。在第二次和第三次疫苗接种后,使用ELISpot试验测量了30、90和180微克剂量水平的CMV血清阴性参与者的Gb抗原特异性T细胞反应。五聚体特异性T细胞分析仍在开发中。将CMV血清阴性组中疫苗诱导的中和抗体反应与CMV血清阳性组中的基线中和抗体滴度进行比较,指出母亲既往CMV感染与先天性CMV感染的风险相比,先天性CMV感染的风险约为母亲原发CMV感染风险的30倍。 |
在CMV血清阴性的参与者中,在30、90和180微克剂量水平下,7个月(第三次接种后一个月):
◦ | 在上皮细胞和成纤维细胞检测中均观察到中和抗体效价随剂量的增加而增加。 |
◦ | 在第三次接种后,90和180微克剂量水平的抗上皮细胞感染中和抗体效价比90和180微克剂量水平的CMV血清阳性基线效价高10倍以上。 |
◦ | 第三次接种后,在90和180微克剂量水平下,抗成纤维细胞感染的中和抗体滴度是CMV血清阳性基线滴度的1.3~1.4倍。 |
在CMV血清阳性的参与者中,在30、90和180微克剂量水平下,7个月(第三次接种后一个月):
◦ | 在上皮细胞和成纤维细胞检测中均观察到中和抗体效价随剂量的增加而增加。 |
◦ | 第三次接种在所有剂量水平下,将针对上皮细胞感染的中和抗体滴度提高到基线滴度的22倍至40倍。 |
◦ | 在第三次接种中,在所有剂量水平下,针对成纤维细胞感染的中和抗体滴度都比基线滴度提高了大约4倍到6倍。 |
接受300微克mRNA-1647的参与者在三个月后(第二次接种后一个月)继续显示,在CMV血清阴性和CMV血清阳性组中,抗上皮细胞感染和抗成纤维细胞感染的中和抗体持续增加,呈剂量依赖关系。接受300微克信使-1647的参与者的安全性和耐受性与观察到的180微克剂量水平相当。在30、90和180微克剂量水平的CMV血清阴性参与者中,在第二次和第三次疫苗接种后,在所有剂量水平下都观察到了GB抗原特异性T细胞的激活。
安全性分析表明,该疫苗总体耐受性良好。没有出现与疫苗相关的严重不良反应。最常见的局部不良反应(AR)是注射部位疼痛。最常见的全身不良反应是头痛、疲劳、肌肉疼痛和寒战。CMV血清阴性治疗组的发热发生率为0%-55%,CMV血清阳性治疗组的发热发生率为8%-67%。总体而言,与第二次接种相比,第三次接种后出现系统性不良反应的频率较低,而与CMV血清阴性队列相比,CMV血清阳性队列中更常见。在CMV血清阳性的参与者中,3级请求的ARs更常见,并且是疲劳(给定剂量队列的0%-27%)、寒战(给定剂量队列的0%-27%)和发热(给定剂量队列的0%-33%)。正如之前的中期分析报告的那样,仅有一例4级AR孤立的实验室发现部分凝血活酶时间升高,在基线(1级)时升高,并在下一次实验室测试中自行解决,没有相关的临床表现。300微克剂量水平下的安全性和耐受性数据与180微克剂量水平下观察到的数据大致相似。
虽然小样本量限制了可以从数据中得出的结论,但这项中期分析的结果建立在第二次接种30、90和180微克剂量水平后一个月的安全性和免疫原性数据的较早中期分析的基础上。为期12个月的安全性和免疫原性中期分析正在进行中,该分析将在第三次接种疫苗后6个月内报告安全性和免疫原性结果。
• | HMPV/PIV3疫苗(MRNA1653):在mRNA-1653的1b期AGE降级临床试验中,前10名受试者已经入选,其中某些受试者已经服药。由于新冠肺炎大流行,这项试验暂停。 |
44
目录表
• | 寨卡病毒疫苗(mRNA-1893):对mRNA-1893进行的第一阶段研究的所有四个队列(10微克、30微克、100微克、250微克)都已服药。4月,我们公布了来自10微克和30微克队列的中期分析的积极数据。临床试验人群包括没有感染寨卡病毒(黄病毒血清阴性)的人和之前感染过寨卡病毒(黄病毒血清阳性)的人。参与者被随机分为安慰剂、10微克、30微克、100微克或250微克的mRNA-1893,剂量计划分别为第1天和第29天。这项首次计划的中期分析在第二次接种后28天的第57天评估了前两个剂量水平(10和30微克)的安全性和免疫原性。用鼠疫中和试验(PRNT)评估中和抗体效价(阻断感染的循环抗体水平50)和微量中和试验(MN),它们为解释中和免疫反应提供了同等的指导。 |
在黄病毒血清阴性组中:
◦ | 根据PRNT,第二次接种后的血清阳转率在10微克剂量水平达到94.4%,在30微克剂量水平达到100%50。MN数据与PRNT一致50 数据。 |
◦ | 单次接种30微克剂量水平的疫苗就足以将基线黄病毒血清阴性的参与者血清转换。然而,间隔28天服用两剂的系列药物有明显的好处。 |
在黄病毒血清阳性组中:
◦ | 参与者在以前的PRNT中实现4倍增长的百分比50根据PRNT,第二次接种后的效价在10微克剂量水平达到50%,在30微克剂量水平达到75%50。MN数据与PRNT一致50数据。 |
安全性分析表明,10微克和30微克剂量水平总体上都是耐受性良好的。没有出现与疫苗相关的严重不良反应。最常见的局部不良反应是注射部位的局部疼痛。安全性似乎没有受到第二次疫苗接种或黄病毒阳性基线血清状态的影响。一名参与者在第29天出现4级凝血酶原试验升高,没有临床表现,也不被认为与注射mRNA-1893有关。
对于10微克和30微克的队列,7个月和13个月的安全性和免疫原性的进一步分析正在进行中。100ug和250ug剂量的队列参与者在第29天接受了第二次疫苗接种,没有因新冠肺炎而导致临床试验中断;安全性和免疫原性的中期分析正在进行中。
• | 个性化癌症疫苗(PCV)(mRNA-4157):在随机第二阶段临床试验中,这些患者继续接受1毫克剂量的mRNA-4157与默克公司的pembrolizumab(KEYTRUDA)联合使用,与单独使用pembrolizumab进行辅助治疗,以辅助治疗高危切除的黑色素瘤。 |
• | OX40L(mRNA-2416):根据现有数据,我们决定将用于治疗卵巢癌患者的mRNA-2416与PD-L1抑制剂阿杜伐单抗(IMFINZI)联合使用的研究开发重点。本次1/2期临床试验的联合用药(mRNA-2416和阿杜伐单抗)的主要安全队列继续入选,随后将有晚期卵巢癌患者的2期扩大队列。我们不会在这项研究的mRNA-2416单一治疗卵巢癌分支上取得进展。 |
• | 基孔肯雅病毒抗体(mRNA-1944):我们正在进行一项在健康成年人中进行的随机和安慰剂对照的第一阶段剂量递增研究。目的是评价静脉滴注mRNA1944的安全性和耐受性,其中0.1、0.3、0.6 mg/kg剂量水平不含地塞米松,0.6 mg/kg剂量水平队列,8名受试者。此外,还有一个剂量水平队列,受试者将接受两次0.3毫克/公斤的静脉输液,一次在第一天,另一次在随后的第八天,在用药前方案中不使用地塞米松。不计划进一步增加超过0.6 mg/kg的剂量,已完成前用药方案中不加地塞米松的0.1、0.3、0.6 mg/kg剂量水平队列和前用药方案中0.6 mg/kg加地塞米松的剂量水平队列。 由于新冠肺炎的影响,该公司的基孔肯雅病毒抗体试验(MRNA1944)的更多受试者的招募已被该网站暂停。 |
• | 甲基丙二酸血症(MMA)(mRNA-3704):FDA批准了对mRNA-3704的快速追踪。此时,此研究的注册将暂停。 |
• | 丙酸血症(PA)(mRNA-3927):FDA批准了对mRNA-3927的快速跟踪指定。此时,此研究的注册将暂停。 |
45
目录表
财务运营概述
收入
到目前为止,我们还没有从销售潜在的信使核糖核酸药物中获得任何收入。我们的收入主要来自与默克、Vertex和阿斯利康的战略联盟,以及政府支持的和私人组织,包括BARDA、DARPA和盖茨基金会,以发现、开发潜在的信使核糖核酸药物并将其商业化。
年收入总额止三个月 2020年3月31日和2019曾经是840万美元和1600万美元分别,主要由我们战略联盟的协作收入组成,具体如下(以千计):
截至3月31日的三个月, | |||||||
2020 | 2019 | ||||||
协作收入: | |||||||
默克 | $ | 976 | $ | 10,687 | |||
顶点 | 2,056 | 2,614 | |||||
阿斯利康 | 1,270 | 814 | |||||
其他 | 155 | — | |||||
协作总收入 | $ | 4,457 | $ | 14,115 | |||
从战略联盟收到的现金 940万美元以及480万美元 止三个月 2020年3月31日和2019,分别。收入确认的时间与现金收款的时间并不直接相关。截至2011年,与我们的战略联盟相关的递延收入总额 2020年3月31日和2019年12月31日曾经是2.018亿美元和2.023亿美元,分别为。
为……提供收入止三个月 2020年3月31日和2019是390万美元和1.9百万美元主要来自与BARDA和盖茨基金会签订的开发信使核糖核酸药物的合同。
我们能否从销售信使核糖核酸药物中获得收入并实现盈利,取决于我们成功开发信使信使药物并将其商业化的能力。在可预见的未来,我们预计不会从产品销售中获得收入;然而,前提是我们对mRNA-1273工作的快速加速可能会给我们带来收入,无论是基于产品的直接销售还是通过合作者。此外,我们预计将继续从与巴达的新合同中获得资金,这可能会在2020年为Moderna带来可观的额外收入。就现有或潜在的未来战略联盟产生收入而言,我们的收入可能会因这些战略联盟下我们的信使核糖核酸药物开发的许多不确定因素以及其他因素而有所不同。我们预计在可预见的未来会蒙受损失,随着我们继续研发努力,我们预计这些损失还会增加。我们预计我们的计划将成熟并推进到后期临床开发,随着我们为我们的研究药物寻求监管批准并开始将任何已批准的信使核糖核酸药物商业化,我们预计费用将会增加。
研发费用
我们业务的性质和我们活动的主要重点产生了大量的研发成本。
研究和开发费用是指我们在以下方面发生的成本:
• | 开发我们平台的成本; |
• | 导致开发候选人的发现努力; |
• | 我们项目的临床前、非临床和临床开发成本; |
• | 发展我们的制造技术和基础设施的成本;以及 |
• | 数字基础设施成本。 |
46
目录表
上述费用包括以下类别:
• | 与人员有关的费用,包括工资、福利和股票薪酬费用; |
• | 根据与进行我们临床前研究和临床试验的第三方(如顾问、研究地点、合同研究组织或CRO)达成的协议以及许可安排而发生的费用; |
• | 为临床前研究和临床试验获取、开发和制造材料的成本,包括内部制造和第三方合同制造组织(CMO); |
• | 采购研发过程中使用的材料、实验室用品和非资本设备发生的费用;以及 |
• | 设施、折旧和摊销,以及因研究和开发活动而发生的其他直接和已分配的费用。 |
我们利用我们的员工和基础设施资源来推进我们的平台以及发现和开发程序。由于正在进行的项目的数量以及我们在多个项目中使用资源的能力,我们的研发项目产生的间接或共享运营成本不会根据特定项目或模式记录或维护。
下表反映了我们的研发费用,包括按模式总结的直接计划特定费用以及期间其他研发费用下总结的间接或共享运营成本 止三个月 2020年3月31日和2019(单位:千):
截至3月31日的三个月, | |||||||
2020 | 2019 | ||||||
按医疗方式分列的计划费用: | |||||||
预防性疫苗 | $ | 8,740 | $ | 20,262 | |||
癌症疫苗 | 4,467 | 10,086 | |||||
瘤内免疫肿瘤学 | 2,033 | 4,418 | |||||
本地化再生疗法 | — | 8 | |||||
分泌性系统和细胞表面治疗 | 692 | 4,633 | |||||
全身细胞内治疗学 | 7,195 | 6,743 | |||||
按医疗方式分列的特定于计划的总费用 (1) | 23,127 | 46,150 | |||||
其他研发费用: | |||||||
发现计划 | 10,498 | 12,915 | |||||
平台研究 | 21,586 | 24,497 | |||||
技术开发和未分配的制造费用 | 29,138 | 21,185 | |||||
分担发现和开发费用 | 18,752 | 14,883 | |||||
基于股票的薪酬 | 12,036 | 10,783 | |||||
研发费用总额 | $ | 115,137 | $ | 130,413 | |||
__________
(1) | 包括总共24名和21名开发候选人,2020年3月31日和2019,分别为。特定于计划的费用包括外部成本和分配的制造成本,用于mRNA供应和消耗品,并在计划内部提前开发或在开发停止时删除的期间开始时反映。 |
A“情态”指的是一组具有共同产品特征的计划,以及相关的使能信使核糖核酸技术、交付技术和制造工艺的组合。上表汇总的按医疗方式分类的计划特定费用包括我们直接归因于我们计划的费用,这些费用主要包括外部成本,如支付给外部顾问、中心实验室、研究地点和与我们的临床前研究和临床试验相关的CRO的费用,以及分配的mRNA供应和消耗品的制造成本。购买和制造用于临床前研究和临床试验的信使核糖核酸供应的成本被确认,并在发生时计入未分配的制造费用,然后在完成特定计划的生产后分配到特定计划的制造成本。将制造成本分配给特定计划的时间根据计划开发和生产计划而有所不同。我们不分配与人员相关的成本,包括基于股票的薪酬、与我们的一般平台研究、技术
47
目录表
开发,以及在特定计划基础上的其他分摊成本。因此,这些费用不包括在按方式分列的具体方案费用汇总表中。
发现计划费用是与我们计划在临床前发现阶段的研究活动相关的成本,主要包括CRO和实验室服务的外部成本,以及临床前mRNA供应和消耗品的分配制造成本。
平台研究费用主要是开发基因科学、传递科学和制造工艺设计方面的技术进步的成本。这些成本包括与人员相关的成本、计算机设备、设施、临床前mRNA供应和消耗品,以及支持我们平台研究的其他行政成本。技术开发和未分配的制造费用主要与非特定计划的制造过程开发和制造成本有关。
共享发现和开发费用是指研发成本,如人员相关成本和其他成本,否则不包括在开发计划、发现计划、平台研究、技术开发和未分配的制造费用、基于股票的薪酬和其他费用中。
从历史上看,我们总运营费用的最大组成部分是我们对研发活动的投资,包括开发我们的平台、信使核糖核酸技术和制造技术。我们承担已发生的研究和开发成本,无法合理估计完成我们目前正在开发或未来可能开发的开发候选药物和研究药物所需的性质、时间和估计成本。与此类开发候选药物和研究药物的研究和开发相关的风险和不确定性很多,包括但不限于:
• | 开发正在进行和未来开发的候选药物和研究药物的范围、进展和费用; |
• | 参加和完成相关的临床前研究; |
• | 登记并完成后续临床试验; |
• | 这些临床试验所产生的研究药物的安全性和有效性; |
• | 与正在开发的研究药物有关的法律或法规的变化; |
• | 收到所需的监管批准;以及 |
• | 商业化,包括建立制造和营销能力。 |
任何已知或未知风险和不确定性的预期或结果的变化可能会对我们预期的研究和开发支出产生重大影响。持续的研究和开发是我们业务持续活动的核心。临床开发后期的研究药物,包括信使核糖核酸-1273和信使核糖核酸1647,通常比临床开发早期的药物具有更高的开发成本,这主要是由于后期临床试验的规模和持续时间的增加。我们预计,随着我们的研究药物在开发阶段取得进展,以及我们确定和开发其他计划,我们的研发成本在未来将继续增加。然而,我们认为目前不可能通过商业化来准确预测特定计划的总费用。与我们的任何一种研究药物成功商业化相关的因素有很多,包括未来的试验设计和各种监管要求,由于我们的研究药物开发还处于早期阶段,其中许多因素目前无法准确确定。此外,我们无法控制的未来商业和监管因素将影响我们的临床开发计划和计划。
随着我们继续在研发过程中不断改进mRNA-1273,以便在当前的大流行期间发挥作用,我们预计将产生大量额外费用,包括与临床试验、扩大我们的制造能力、监管申报和相关成本、将我们的业务扩展到外国司法管辖区以及商业化和分销努力有关的费用。目前,尚不清楚这些潜在支出的数额,以及它们是否将全部或部分由第三方捐款提供资金。由于新的BARDA协议加快了mRNA-1273的开发,我们的收入和支出预计将大幅增加。BARDA的资金预计将抵消BARDA协议所涵盖的那些增加的费用,但条件是我们从BARDA获得补偿。
48
目录表
一般和行政费用
一般和行政费用主要包括与人事有关的费用,包括管理人员的股票薪酬、财务、法律、人力资源、业务发展和其他行政和业务职能,专业费用、会计和法律服务、信息技术和设施相关费用,以及与获取和维护知识产权有关的费用。这些成本与企业的运营有关,与研发职能或任何个人计划无关。
我们预计,随着我们继续扩大正在开发的项目的数量,并为可能更早在美国国内外建立商业活动做准备,一般和行政费用将会增加。此外,如果我们对我们的任何研究药物获得监管部门的批准,包括可能加速批准mRNA-1273,并且没有参与一个或多个第三方商业化合作和制造安排,我们将产生与建立监管、制造、销售和营销团队以支持药品销售、营销和分销活动相关的巨额费用。
我们拥有广泛的知识产权组合,涵盖我们的信使核糖核酸疫苗和治疗计划的开发和商业化,包括与信使核糖核酸设计、配方和制造平台技术相关的那些。我们定期提交专利申请,以保护我们的研究和开发产生的创新。我们还在美国和外国司法管辖区持有商标和商标申请。保护和保护我们的知识产权的成本在发生时计入费用,并归类为一般费用和行政费用。
一般和行政费用,包括与知识产权有关的费用24.1百万美元2730万美元用于止三个月 2020年3月31日和2019,分别为。与知识产权有关的费用,包括我们内部与人事有关的费用,分别为250万美元和280万美元止三个月 2020年3月31日和2019年。在截至本公司知识产权的三个月内,本公司并无招致与本公司知识产权有关的诉讼费用。2020年3月31日和2019.
利息收入
利息收入包括我们投资于现金和现金等价物、货币市场基金和高质量固定收益证券所产生的利息。
其他费用,净额
其他费用,净额包括利息支出、出售有价证券投资的收益(亏损)以及与我们的核心业务无关的其他收入和费用。利息支出主要来自我们与Moderna技术中心制造设施(MTC South)相关的融资租赁。
关键会计政策和重大判断和估计
我们管理层对我们的财务状况和经营结果的讨论和分析是基于我们的简明综合财务报表,这些报表是根据美国公认会计原则编制的。在编制这些精简合并财务报表时,我们需要作出判断和估计,这些判断和估计会影响我们精简合并财务报表中资产、负债、收入和费用的报告金额以及或有资产和负债的披露。我们基于历史经验、已知趋势和事件以及我们认为在当时情况下合理的各种其他因素进行估计,这些因素的结果构成了对资产和负债的账面价值作出判断的基础,而这些资产和负债的账面价值从其他来源看起来并不明显。在不同的假设或条件下,实际结果可能与这些估计值不同。在持续的基础上,我们根据环境、事实和经验的变化来评估我们的判断和估计。估计重大修订的影响(如有)自估计变动之日起在简明综合财务报表中预期反映。
于截至三个月止三个月内,在编制精简综合财务报表时,我们的主要会计政策及估计并无重大变动。2020年3月31日与我们截至2019年12月31日的Form 10-K或2019年Form 10-K年度报告中披露的内容相比。
最近发布的会计声明
吾等已审阅所有最近颁布的准则,并已确定,除本公司简明综合财务报表附注2所披露的准则外,该等准则将不会对本公司的财务报表产生重大影响,或不适用于本公司的业务。
49
目录表
行动的结果
下表总结了我们列出的每个时期的简明综合经营报表(以千计):
截至3月31日的三个月, | 2020年与2019年的变化 | ||||||||||||
2020 | 2019 | $ | % | ||||||||||
收入: | |||||||||||||
协作收入 | $ | 4,457 | $ | 14,115 | $ | (9,658 | ) | (68)% | |||||
助学金收入 | 3,932 | 1,910 | 2,022 | 106% | |||||||||
总收入 | 8,389 | 16,025 | (7,636 | ) | (48)% | ||||||||
运营费用: | |||||||||||||
研发 | 115,137 | 130,413 | (15,276 | ) | (12)% | ||||||||
一般和行政 | 24,114 | 27,253 | (3,139 | ) | (12)% | ||||||||
总运营支出 | 139,251 | 157,666 | (18,415 | ) | (12)% | ||||||||
运营亏损 | (130,862 | ) | (141,641 | ) | 10,779 | (8)% | |||||||
利息收入 | 7,852 | 10,972 | (3,120 | ) | (28)% | ||||||||
其他费用,净额 | (1,154 | ) | (1,931 | ) | 777 | (40)% | |||||||
所得税前亏损 | (124,164 | ) | (132,600 | ) | 8,436 | (6)% | |||||||
所得税准备金(受益于) | 66 | (24 | ) | 90 | (375)% | ||||||||
净亏损 | $ | (124,230 | ) | $ | (132,576 | ) | $ | 8,346 | (6)% | ||||
收入
总收入减少通过760万美元,或48%,用于止三个月 2020年3月31日与2019年同期相比,由于协作收入减少,部分被赠款收入增加所抵消。协作收入下降了 970万美元,或68%,用于止三个月 2020年3月31日与2019年同期相比,主要是由于与默克和阿斯利康的合作协议项下未来绩效义务的估计成本发生变化,导致收入的累计追赶调整,以及默克的收入减少,主要是由于履行绩效义务而摊销递延收入的时间。赠款收入增加了 2.0百万美元,或106%,或止三个月 2020年3月31日与2019年同期相比,主要是由于BARDA的收入增加。
运营费用
研发费用
研发费用减少通过15.3百万美元,或12%,用于止三个月 2020年3月31日与2019年同期相比。减少主要是由于 减少量实验室用品和材料 1520万美元, a 减少量临床试验和制造成本 450万美元,和一个减少量咨询和外部服务 100万美元.这些下降被部分抵消了 增加与人员相关的费用 310万美元,一个增加折旧和摊销 140万美元和一个增加股票补偿 130万美元.
一般和行政费用
一般和行政费用减少通过310万美元,或12%,用于止三个月 2020年3月31日与2019年同期相比。下降主要是由于 减少量法律相关费用 1.6百万美元以及一个减少量咨询和外部服务 150万美元.
利息收入
利息收入减少 310万美元,或28%,截至2020年3月31日的三个月与2019年同期相比。三个月期间我们投资有价证券的利息收入减少,主要是由于冠状病毒大流行及其对全球金融市场的影响导致的不利市场状况。
50
目录表
其他费用,净额
下表总结了每个期间的其他费用净额(以千计):
截至3月31日的三个月, | 2020年与2019年的变化 | ||||||||||||
2020 | 2019 | $ | % | ||||||||||
投资收益(亏损) | $ | 321 | $ | (3 | ) | $ | 324 | (10800)% | |||||
利息开支 | (1,666 | ) | (1,533 | ) | (133 | ) | 9% | ||||||
其他收入(费用),净额 | 191 | (395 | ) | 586 | (148)% | ||||||||
其他费用合计(净额) | $ | (1,154 | ) | $ | (1,931 | ) | $ | 777 | (40)% | ||||
其他费用总额(净)保持相对持平 止三个月 2020年3月31日与2019年同期相比。
流动资金和资本资源
历史上,我们的运营资金主要来自出售股权工具以及某些战略联盟安排和赠款协议的收益。截至 2020年3月31日,我们拥有现金、现金等值物和投资 17.2亿美元.现金、现金等值物和投资根据我们的投资政策进行投资,主要是为了流动性和资本保全。投资主要由政府和企业债务证券组成,按公允价值列账。截至 2020年3月31日,我们的流动和非流动投资约为 8.26亿美元和5.025亿美元,分别为。
我们于2016年下半年开始建设位于马萨诸塞州MTC South的制造工厂,并于2019年完成建设。2019年第二季度,我们签订了一份额外的租约,租用附近的办公和实验室空间,即MTC North。我们于2019年第四季度开始建设MTC北。我们与MTC设施相关的资本支出为620万美元,止三个月 2020年3月31日和2019,分别为。与我们的MTC设施相关的现金支出为210万美元和570万美元止三个月 2020年3月31日和2019.
现金流
下表概述所呈列各期间现金的主要来源及用途(以千计):
截至3月31日的三个月, | |||||||
2020 | 2019 | ||||||
提供的现金净额(用于): | |||||||
经营活动 | $ | (106,191 | ) | $ | (144,268 | ) | |
投资活动 | (316,018 | ) | (11,759 | ) | |||
融资活动 | 578,053 | 293 | |||||
现金、现金等价物和限制性现金净增(减) | $ | 155,844 | $ | (155,734 | ) | ||
经营活动
我们从运营中获得现金流,主要来自从某些战略联盟收集的现金。我们运营活动的现金流受到我们使用现金作为运营费用和营运资本支持业务的重大影响。由于我们在信实技术、数字基础设施、制造技术和基础设施方面的投资,我们历来经历并将继续预期经营活动带来的现金流为负。
年经营活动中使用的现金净额止三个月 2020年3月31日曾经是1.062亿美元并包括净损失 1.242亿美元和非现金调整 2850万美元,减去资产和负债净变化 1050万美元.非现金项目主要包括基于股票的薪酬 2040万美元、以及折旧和摊销 740万美元.资产和负债净变化主要是由于 增加与经营租赁相关的使用权资产 1410万美元, a 减少量应计负债 1300万美元,一个增加预付费用和其他资产 430万美元,一个增加应收账款 1.9百万美元,和一个减少量在的递延收入中 50万美元,部分抵消了 增加经营租赁负债 1520万美元,一个增加其他负债 570万美元和一个增加应付账款 230万美元.
年经营活动中使用的现金净额止三个月 2019年3月31日曾经是1.443亿美元并包括净损失 1.326亿美元和非现金调整 2,480万美元,减去资产和负债净变化 3650万美元.非现金项目主要包括基于股票的薪酬 1,850万美元、折旧和摊销 730万美元以及投资溢价和折扣的摊销 100万美元.资产和负债净变化主要是由于 减少量在……里面
51
目录表
应计负债 3260万美元, a 减少量在的递延收入中 1,560万美元以及一个减少量经营租赁负债 180万美元,部分抵消了a 减少量应收账款 600万美元,一个减少量预付费用和其他资产 340万美元,一个增加应付账款 170万美元, a 减少量使用权资产、经营租赁 1.6百万美元和一个增加其他负债 80万美元.
投资活动
我们的主要投资活动包括购买、销售和投资期限以及制造业、实验室、计算机设备和软件的资本支出。
年投资活动中使用的现金净额止三个月 2020年3月31日曾经是3.16亿美元,其中包括购买有价证券 6.213亿美元以及购买财产和设备 620万美元,部分被有价证券到期的收益所抵消 2.697亿美元以及出售有价证券的收益 4170万美元.
年投资活动中使用的现金净额止三个月 2019年3月31日曾经是1180万美元,其中包括购买有价证券 4.295亿美元,以及购买的财产和设备 760万美元,部分被有价证券到期的收益所抵消 4.039亿美元以及出售有价证券的收益 21.4百万美元.
融资活动
我们的融资活动产生现金, 5.781亿美元为止三个月 2020年3月31日主要来自股票发行的净收益 5.495亿美元以及通过我们的股权计划发行普通股的净收益 2,840万美元.
我们的融资活动微不足道 止三个月 2019年3月31日.
运作和资金需求
自成立以来,由于大量的研发费用,我们的运营出现了重大损失和负现金流。我们的累计赤字 16.2亿美元截至2020年3月31日。我们预计在可预见的未来将继续遭受重大损失,并预计我们与正在进行的活动相关的费用将增加,特别是当我们继续研究和开发我们的开发候选药物和我们的研究药物的临床活动时。我们正在进行的关于mRNA-1273的工作将需要在2020年内进行大量的额外投资,其中一些可能不会得到我们的合作伙伴或合作者的报销或支付。此外,我们预计将继续产生与上市公司运营相关的额外成本,部分原因是上市公司的合规要求提高,自2019年12月31日起,上市公司不再具有新兴成长型公司的资格。
我们受制于与新药开发和商业化有关的所有风险,我们可能会遇到不可预见的费用、困难、并发症、延误和其他未知因素,包括与正在进行的冠状病毒大流行有关的费用,这可能会对我们的业务造成不利影响。我们对我们的财政资源将在多长时间内足以支持我们的业务的预测是前瞻性陈述,涉及风险和不确定因素,实际结果可能会因多种因素而有所不同。我们基于可能被证明是错误的假设做出了这一估计,我们可以比目前预期的更快地利用我们可用的资本资源。我们相信,我们的现金、现金等价物和投资2020年3月31日,将足以使我们能够在财务报表发布后至少未来12个月内为我们预计的业务提供资金。
在我们能够从我们的计划中产生足够的收入之前,我们预计将通过公共或私募股权发行、结构性融资和债务融资、政府融资安排、潜在的未来战略联盟(我们从中获得预付费用、里程碑付款和其他形式的对价)以及营销、制造、分销和许可安排等组合来为未来的现金需求提供资金。在合理的条件下,可能无法获得额外的资本,如果有的话。如果我们无法以我们可以接受的金额或条款筹集更多资金,我们可能不得不大幅推迟、缩减或停止我们一种或多种研究药物的开发或商业化,或者放慢或停止我们一种或多种项目的工作。如果我们通过发行额外的股本或债务证券筹集更多资金,可能会导致我们现有股东的稀释或固定支付义务的增加,任何此类证券可能拥有优先于我们普通股的权利。如果我们产生债务,我们可能会受到限制我们的业务并可能损害我们的竞争力的契约的约束,例如我们产生额外债务的能力受到限制,我们获得、销售或许可知识产权的能力受到限制,以及其他可能对我们开展业务的能力产生不利影响的运营限制。如果我们通过战略联盟或与第三方的营销、分销或许可安排来筹集资金,我们可能不得不放弃对我们的技术、未来收入来源、研究项目或调查的宝贵权利。
52
目录表
药品或授予许可证的条款可能对我们不利。任何这些事件都可能严重损害我们的业务、财务状况和前景。
合同义务
自.起2020年3月31日除我们的简明综合财务报表附注8披露外,我们的合同义务和承诺与我们2019年Form 10-K中“管理层对财务状况和经营结果的讨论和分析”中描述的义务和承诺没有实质性变化。
表外安排
自.起2020年3月31日,我们没有任何如S-K条例第303(A)(4)(Ii)项所定义的表外安排。
项目3.关于市场风险的定量和定性披露
我们对市场风险的主要敞口与利率的变化有关。自.起2020年3月31日和2019年12月31日,我们有现金、现金等价物和对有价证券的投资17.2亿美元和12.6亿美元,分别为。我们的投资组合包括货币市场基金和可交易的债务证券(包括美国国债、美国政府机构和公司实体的债务证券以及商业票据)。我们的主要投资目标是保存资本和保持流动性,我们的投资政策根据机构和金融工具的质量确定允许的投资,旨在将风险敞口降至最低。我们对利率敏感性的敞口受到美国利率总体水平变化的影响。我们可供出售的证券受到利率风险的影响,如果市场利率上升,其价值将会下降。
我们通常持有可交易债务证券的投资到到期,以限制我们对利率风险的敞口。由于我们的投资期限较短,风险较低,我们预计不会有很大的利率风险敞口。如果市场利率立即统一上调100个基点,即从2020年3月31日,我们的利息敏感型有价证券的净公允价值将不会经历公允市场价值的实质性变化。
我们目前对外币的敞口不大,因为我们没有持有外汇合约、期权合约或其他外汇对冲安排。此外,我们的运营和创收活动以美元计价。我们的业务未来可能会受到外币汇率波动的影响。
通货膨胀通常通过增加我们的劳动力成本来影响我们。我们不认为通货膨胀对我们的业务、财务状况或经营结果有实质性影响。止三个月 2020年3月31日和2019.
项目4.控制和程序
披露控制和程序
我们的管理层在首席执行官和首席财务官的参与下,评估了截至2020年3月31日我们的披露控制和程序的有效性。《交易法》规则13a-15(E)和15d-15(E)中定义的术语“披露控制和程序”是指公司的控制和其他程序,旨在确保公司在根据交易法提交或提交的报告中要求披露的信息在美国证券交易委员会规则和表格指定的时间段内得到记录、处理、汇总和报告。披露控制和程序包括但不限于控制和程序,旨在确保公司根据《交易所法》提交或提交的报告中要求披露的信息得到积累,并酌情传达给公司管理层,包括其主要高管和主要财务官,以便及时做出关于要求披露的决定。管理层认识到,任何控制和程序,无论设计和操作得多么好,都只能为实现其目标提供合理的保证,管理部门在评估可能的控制和程序的成本-效益关系时必须运用其判断。根据对截至2020年3月31日我们的披露控制和程序的评估,我们的首席执行官和首席财务官得出结论,截至该日期,我们的披露控制和程序在合理保证水平下是有效的。
财务报告内部控制的变化
年内,我们对财务报告的内部控制没有变化(如《交易法》第13a-15(F)和15d-15(F)条所界定)止三个月 2020年3月31日对我们的财务报告内部控制产生了重大影响,或有合理的可能性对其产生重大影响。
53
目录表
控制措施有效性的固有限制
我们的管理层,包括我们的首席执行官和首席财务官,相信我们对财务报告的披露控制和程序以及内部控制旨在为实现其目标提供合理的保证,并在合理的保证水平下有效。然而,我们的管理层并不期望我们的披露控制和程序或我们对财务报告的内部控制将防止所有错误和所有欺诈。一个控制系统,无论构思和运作如何完善,都只能提供合理的保证,而不是绝对的保证,以确保控制系统的目标得以实现。此外,控制系统的设计必须反映这样一个事实,即存在资源限制,并且必须考虑控制的好处相对于其成本。由于所有控制系统的固有局限性,任何控制评价都不能绝对保证所有控制问题和舞弊事件都已被发现。这些固有的局限性包括这样的现实,即决策制定中的判断可能是错误的,故障可能会因为一个简单的错误或错误而发生。此外,某些人的个人行为、两个或更多人的串通或通过控制的管理凌驾,都可以规避控制。任何控制系统的设计也部分基于对未来事件可能性的某些假设,不能保证任何设计将在所有潜在的未来条件下成功地实现其所述目标;随着时间的推移,控制可能会因为条件的变化而变得不充分,或者遵守政策或程序的程度可能会恶化。由于具有成本效益的控制系统的固有限制,由于错误或欺诈而导致的错误陈述可能会发生,并且不会被发现。
第二部分
项目1.法律诉讼
我们可能不时在正常业务过程中受到法律程序和索赔的影响。我们目前没有参与任何重大法律程序。
第1A项。风险因素
我们的业务涉及重大风险,其中一些风险如下所述。你应该仔细考虑以下描述的风险和不确定因素,以及这份10-Q表格季度报告中包含的所有其他信息,包括“管理层对财务状况和经营结果的讨论和分析”,以及精简的综合财务报表和相关附注。如果实际发生以下任何风险,可能会损害我们的业务、前景、经营业绩和财务状况以及未来前景。在这种情况下,我们普通股的市场价格可能会下跌,您可能会损失全部或部分投资。我们目前不知道或我们目前认为无关紧要的其他风险和不确定性也可能损害我们的业务运营。这份Form 10-Q季度报告还包含涉及风险和不确定因素的前瞻性陈述。由于本季度报告下面和其他地方描述的因素,我们的实际结果可能与前瞻性陈述中预期的结果大不相同。
以下以“*”表示的风险因素是从我们于2020年2月27日提交给美国证券交易委员会或美国证券交易委员会的10-K表格年度报告中新添加或大幅更新的。
与我们的业务相关的风险和创造新的药品类别
*我们的业务可能会继续受到持续的冠状病毒大流行的不利影响。
导致新冠肺炎的新型冠状病毒SARS-CoV-2的爆发已经演变为一场全球大流行。新冠肺炎对我们业务和经营业绩的影响程度将取决于高度不确定和无法准确预测的未来发展,包括可能出现的关于新冠肺炎的新信息,以及遏制新冠肺炎或应对其影响的行动等。
新冠肺炎的蔓延导致了我们某些业务运营的延迟和中断。我们的许多临床试验都受到了大流行的影响。现场启动、参与者招募和登记、参与者剂量、临床试验材料的分发、研究监测和数据分析可能会暂停或延迟(或继续暂停或延迟)
由于医院或大学政策、联邦、州或地方法规或限制的变化、医院资源用于大流行工作的优先顺序、旅行限制、对大流行环境中患者安全的担忧,或与大流行相关的其他原因。正如之前披露的,我们的某些临床试验已经受到不利影响,包括暂停我们的hMPV/PIV3试验(mRNA-1653)的登记,以及暂停我们的罕见疾病临床试验的登记和新地点的启动,这些临床试验的开放研究新药(IND)申请、甲基丙二酸血症(mRNA-3704)和丙酸血症(mRNA-3927)。随着新冠肺炎的不断传播,一些参与者和临床研究人员可能无法遵守临床试验方案。例如,隔离或其他旅行限制(无论是自愿的还是必需的)已在许多国家实施,可能会阻碍参与者的行动,影响赞助者进入研究地点,或中断
54
目录表
医疗保健服务,我们可能无法进行临床试验。此外,如果新冠肺炎疫情继续蔓延,我们的运营受到不利影响,包括由于马萨诸塞州州长下令关闭马萨诸塞州的非必要业务,或非必要业务关闭,或设施爆发,我们面临现有协议下的延迟、违约和/或无法履行的风险。
与大流行相关的感染和死亡已经扰乱了并可能继续扰乱美国的医疗保健和医疗保健监管系统。此类中断可能会将医疗资源从我们的临床试验中分流出来,或实质性地推迟美国食品和药物管理局(FDA)对我们临床试验的审查和/或批准。这种干扰导致我们的临床试验的任何延长或取消优先顺序或监管审查的延迟,都可能对我们的开发候选药物的开发和研究产生重大影响。
我们目前利用第三方来制造原材料、部件、零部件和消耗品,并进行质量测试。例如,我们依赖龙沙有限公司来实现我们针对SARS-CoV-2病毒的mRNA候选疫苗(mRNA-1273)的大规模生产。我们还在我们的制造工厂生产我们的产品并提供各种服务。我们的某些第三方制造商和供应商可能会因新冠肺炎疫情而暂停运营,或者在提供服务方面遇到延误。如果我们或我们研发候选药物生产中使用的材料供应链中的任何第三方制造商或第三方受到新冠肺炎疫情导致的限制的不利影响,包括但不限于非关键业务关闭,我们的供应链可能会中断,从而限制我们生产用于临床试验和研发运营的候选产品的能力。此外,我们的战略合作伙伴因新冠肺炎疫情而经历的延误和中断可能会对此类各方履行义务的能力产生不利影响,这可能会影响共同控制下的候选产品的临床开发或监管批准。
为了应对疫情和非必要业务的关闭,我们关闭了我们的办公室,我们的行政员工继续在我们办公室以外的地方工作,现场工作人员仅限于需要履行其工作职责的基本员工。由于这一就地避难令和其他强制性的当地旅行限制,我们的某些从事非必要研发或制造活动的员工无法进入我们的实验室或制造空间,我们的核心活动可能会受到严重限制或减少,可能会持续很长一段时间。
新冠肺炎的传播已经在全球造成了广泛的影响,包括企业和政府实施的旅行限制和检疫政策,可能会对我们的业务产生实质性的经济影响。虽然疫情带来的潜在经济影响和持续时间可能很难评估或预测,但它已经造成并可能导致全球金融市场进一步严重混乱,这可能会降低我们获得资本的能力,无论是完全还是以有利的条件。此外,新冠肺炎扩散引起的经济衰退、萧条或其他持续的不利市场事件可能会对我们的业务、招股说明书、经营业绩和财务状况以及我们的普通股价值产生实质性的不利影响。
目前的大流行或任何其他卫生流行病的最终影响是高度不确定的,可能会发生变化。我们还不知道对我们的业务、我们的临床试验、我们的研究项目、医疗保健系统或全球经济的潜在延误或影响的全部程度。然而,这些影响可能会对我们的运营产生实质性影响,我们将继续密切关注情况。
*我们对SARS-CoV-2的潜在疫苗--mRNA-1273的追求还处于早期阶段。我们可能无法生产出能够及时成功治疗病毒的疫苗。
为了应对全球冠状病毒的爆发,我们正在与疫苗研究中心和国家变态反应和传染病研究所(NIAID)(国家卫生研究院(NIH)的一部分)的疫苗研究中心和微生物和传染病部门合作,进行mRNA-1273的快速制造和临床测试。流行病准备创新联盟(CEPI)为目前的良好制造规范(CGMP)提供了资金,生产疫苗的初步临床批次,NIAID正在进行研究性新药启用或IND启用研究,并正在使用这些临床批次在美国进行第一阶段开放标签临床试验。但我们的疫苗开发还处于早期阶段,我们可能无法生产出成功及时治疗病毒的疫苗,如果真的有的话。此外,我们开发有效疫苗的能力取决于我们自己和我们制造伙伴扩大的制造能力的成功,我们以前没有对其进行过测试,需要由第三方提供资金,以使我们有足够的能力应对全球卫生挑战。我们还承诺投入大量财力和人员开发mRNA-1273,包括支持扩大制造规模,以实现潜在的大流行应对,这可能会导致我们的其他发展计划延迟或以其他方式负面影响,尽管冠状病毒作为全球卫生问题的寿命和程度存在不确定性。*我们的业务可能会受到我们将包括管理和财务在内的重大资源分配给全球
55
目录表
不可预测且可能迅速消散的健康威胁,或我们的疫苗如果开发出来,可能不会部分或完全有效,最终可能被证明不成功或无利可图的健康威胁。此外,不能保证我们的疫苗将被批准包括在政府库存计划中,这可能对候选产品在美国或国外的商业成功至关重要。
尽管我们有专门的制造设施,但我们没有足够的制造基础设施来支持我们自己在全球推出mRNA-1273。例如,我们依赖龙沙有限公司来实现更大规模的mRNA-1273生产。因此,我们已经与龙沙有限公司建立了战略合作关系,并需要与第三方建立更多的合作关系,包括合同制造组织、政府和非政府组织以及其他资金和制造来源。我们以前从未推动过我们的组织进行任何产品的商业发布,在具有紧迫、关键的全球需求的大流行环境中这样做会带来额外的挑战,如分销渠道、知识产权纠纷或挑战,以及需要在全球范围内建立具有相关技能的团队。我们还可能面临寻找足够数量的原材料以支持疫苗需求的挑战。我们可能无法有效地为mRNA-1273创造一个足以支持需求的供应链。此外,当我们通过对mRNA-1273的临床研究并走向潜在的商业启动时,我们将遇到显著的额外资本需求。虽然我们与BARDA的合作将帮助我们满足这些资本要求,但额外的投资将是必要的,无论是来自我们自己的资本资源,还是通过与他人合作。我们不能保证这些新的挑战和要求中的任何一项都将及时或根本得到满足。
此外,另一方可能成功地为新冠肺炎生产出更有效的疫苗或其他治疗方法,这也可能导致政府和半政府资金从我们转向其他公司。特别是,鉴于媒体对当前新冠肺炎大流行的广泛关注,公共和私人实体正在努力尽快开发出新冠肺炎疫苗,包括强生、葛兰素史克、阿斯利康、赛诺菲和辉瑞。这些其他实体可能开发比我们开发的任何疫苗都更有效的新冠肺炎疫苗,可能开发成为护理标准的新冠肺炎疫苗,可能以比我们能够开发任何新冠肺炎疫苗更低的成本或更早的时间开发新冠肺炎疫苗,或者可能更成功地将新冠肺炎疫苗商业化。其中许多其他组织的规模比我们大得多,可以获得更大的资金池和更广泛的制造业基础设施。如果获得批准,其他实体的成功或失败,或感知到的成功或失败,可能会对我们为新冠肺炎疫苗开发努力获得未来资金或最终将我们的疫苗商业化的能力产生不利影响。此外,如果我们的候选产品不能满足政府对生物防御产品的采购要求,我们可能无法有效竞争。
*我们正在投入大量资源扩大和开发mRNA-1273,包括供美国政府和其他全球政府和商业合作伙伴使用。
我们正在通过各种美国政府机制,如扩大准入计划或紧急使用授权计划,努力实现这种潜在疫苗的大规模技术开发、制造和更大规模的部署。例如,我们得到了生物医学高级研究和发展局(BARDA)的承诺,将为我们的后期临床开发计划提供高达4.83亿美元的资金(假设NIAID的mRNA-1273第一阶段临床试验成功),并在2020年第二季度在我们自己的IND下启动mRNA-1273的第二阶段临床试验,以及在2020年扩大mRNA-1273的生产规模,以实现潜在的大流行应对。为了支持扩大规模,我们可能需要将大量资源转移到该计划,包括雇佣熟练的制造人员来扩大制造能力,聘请工程师来管理流程扩大,以及临床和监管人员来支持临床开发,这将需要从我们的其他计划转移资源。如果我们的资金协作者拥有不时分配资金承诺的自由裁量权,我们最终可能不会收到全部承诺资金,并可能面临支持我们的制造活动的额外资金的迫切需求。我们的资金协作者还可能对我们进行的临床试验、制造活动或分销活动施加限制或强制投入,这可能会在发生分歧时导致延误。此外,由于针对新冠肺炎的任何疫苗的许可途径尚不清楚,因此在我们收到上市批准之前,我们可能有一种广泛使用的疫苗在美国或其他国家流通。在这些情况下发生的意外安全问题可能会对Moderna和我们未来的技术平台造成重大声誉损害,以及其他问题,包括我们其他计划的延迟、我们临床试验的重新设计以及大量额外财政资源的需要。
*mRNA-1273的调控途径正在不断进化,可能会导致意想不到的或不可预见的挑战。
到目前为止,mRNA-1273已经迅速通过了FDA的监管程序。然而,各方为新冠肺炎创造、测试和批准疫苗的速度是非常不寻常的,FDA不断演变或改变的计划或优先事项,包括基于对新冠肺炎以及这种疾病如何影响人体的新知识,可能会显著影响
56
目录表
MRNA-1273的调控途径。临床测试的结果可能会提出新的问题,并要求我们重新设计拟议的临床试验,包括修改拟议的终点或增加新的临床试验地点或受试者队列。此外,FDA对临床数据的分析可能与我们的解释不同,FDA可能会要求我们进行额外的分析。
FDA有权授予紧急使用授权,允许未经批准的医疗产品在紧急情况下使用,以诊断、治疗或预防严重或危及生命的疾病或状况,而没有足够的、批准的和可用的替代方案。如果我们获得了mRNA-1273的紧急使用授权,我们将能够在FDA批准之前将mRNA-1273商业化。此外,FDA可以在确定基本的卫生紧急情况不再存在或需要此类授权的情况下撤销紧急使用授权,并且我们无法预测紧急使用授权将保留多久(如果有的话)。这种撤销可能会以各种方式对我们的业务产生不利影响,包括如果mRNA-1273尚未获得FDA的批准,以及如果我们和我们的制造合作伙伴已根据紧急使用授权在供应链中投资提供mRNA-1273。
*我们将需要通过融资或其他来源寻求和获得大量资金。临床数据或试验执行在我们的一个或多个计划或模式或整个管道中造成延迟、挫折或失败,可能会导致未来为公司提供资金或资金的能力受损或无法提供资金。
我们目前正在22个项目中推进23个开发候选人的管道。发现开发候选药物和开发研究药物是昂贵的,我们预计将继续花费大量资金来(i)进行基础研究、进行临床前研究并对我们当前和未来的项目进行临床试验,(ii)继续开发和扩展我们的平台和基础设施,并为临床前研究和临床试验提供适当等级的材料(包括GMP材料),(iii)为我们的研究药物寻求监管机构批准,以及(iv)推出和商业化我们获得监管机构批准的任何产品,包括建立我们自己的商业销售、营销和分销组织。此外,我们正在进行的mRNA-1273工作将需要在2020年及以后进行大量额外投资,其中一些投资可能无法由我们的合作者报销或以其他方式支付。
自.起2020年3月31日,我们有大约17.2亿美元现金、现金等价物和投资。我们预计,我们现有的现金、现金等价物和投资将足以在至少未来12个月内为我们目前的业务提供资金。然而,由于许多我们目前未知的因素,我们的运营计划可能会发生变化,包括与我们的mRNA-1273的开发、制造和商业化有关的因素,我们可能需要比计划更早地寻求额外资金,通过公共或私人股本或债务融资、结构性融资、政府或其他第三方资金、资产出售、营销和分销安排、其他合作和许可安排,或这些方法的组合。无论如何,我们将需要额外的资本来获得监管部门的批准,并将我们的研究药物商业化。即使我们认为我们目前或未来的运营计划有足够的资金,如果市场状况有利或如果我们有特定的战略考虑,我们可能会寻求额外的资本。我们的支出将根据新的和正在进行的开发和公司活动而有所不同。由于与发现开发候选药物和开发我们的研究药物相关的时间和活动的长度非常不确定,我们无法估计我们将需要多少实际资金用于开发、营销和商业化活动。我们未来的短期和长期资金需求将取决于许多因素,包括但不限于:
• | 我们开发候选药物和研究药物的临床前或非临床研究和临床试验的启动、进展、时间、成本和结果; |
• | 研究成果和我们的其他平台活动; |
• | 我们为我们的研究药物制定的临床发展计划; |
• | 与我们目前或未来的战略合作伙伴达成的任何协议的条款; |
• | 我们开发或可能获得许可的开发候选药物和研究药物的数量和特点; |
• | 满足美国食品和药物管理局(FDA)、欧洲药品管理局(EMA)和其他类似外国监管机构制定的监管要求的结果、时间和成本; |
• | 提交、起诉、辩护和执行我们的专利主张和其他知识产权或知识产权的费用,包括第三方就我们的研究药物对我们提起的专利侵权诉讼或我们挑战他人专利或知识产权的诉讼; |
• | 竞争性技术和市场发展的影响,包括可能与我们的一种或多种开发候选药物或研究药物竞争的其他产品; |
• | 临床和商业规模制造活动的完成和进一步扩展的成本和时间足以支持我们当前和未来的所有计划,无论是内部还是外包;以及 |
57
目录表
• | 在我们选择将我们的药品商业化的地区,为我们可能获得上市批准和报销的任何研究药物建立销售、营销和分销能力的成本。 |
到目前为止,我们的运营资金主要来自出售股权证券和战略联盟的收入,我们不能确定是否会以有利的条件向我们提供额外的资金,或者根本不能。在我们能够产生足够的产品或特许权使用费收入来为我们的运营提供资金之前,我们预计将通过公开或私募股权或债券发行、结构性融资、债务融资、合作、战略联盟、资产出售、许可安排以及其他营销或分销安排来为未来的现金需求提供资金。任何筹款活动都可能转移我们的管理层对他们日常活动的注意力,这可能会对我们开发研究药物和将其商业化的能力产生不利影响。此外,我们不能保证未来的融资将在适当的时间、适当的时间、以有利的条件或根本不存在。在我们的项目中或在我们的技术方面,负面的临床试验数据或挫折或感觉到的挫折可能会削弱我们以有利条件筹集额外资金的能力,或者根本不会。此外,任何融资条款可能会对我们股东的持股或权利产生不利影响,而我们发行额外证券(无论是股权或债务),或发行此类证券的可能性,可能会导致我们股票的市场价格下跌。如果我们通过公开或私募股权发行筹集更多资金,这些证券的条款可能包括清算或其他可能对我们的股东权利产生不利影响的优惠。
此外,如果我们通过出售普通股或可转换或可交换为普通股的证券来筹集额外资本,您的所有权权益将被稀释。如果我们通过债务融资筹集更多资本,我们将受到固定支付义务的约束,并可能受到限制或限制我们采取具体行动的能力的契约的限制,例如招致额外债务、进行资本支出或宣布股息。如果我们通过营销和分销安排、出售资产或其他合作、战略联盟或与第三方的许可安排来筹集额外资金,我们可能不得不将某些有价值的权利让给我们的开发候选药物和研究药物、技术、未来的收入来源或研究计划。我们还可能被要求为我们当前或未来的一种或多种研究药物寻找战略合作伙伴,而不是在其他情况下是可取的,或者放弃我们对开发候选药物、研究药物或知识产权的权利,否则我们会寻求开发或商业化自己。如果我们不能在适当的时间以优惠的条件筹集足够的额外资本,我们可能不得不大幅推迟、缩减或停止我们的一个或多个产品或研究药物的开发或商业化,或我们的一个或多个其他研究和开发计划。上述任何事件都可能严重损害我们的业务、前景、财务状况和经营结果,导致我们的普通股价格下跌,并对我们的运营融资能力产生负面影响。
我们试图将我们的技术、生物学、执行和融资风险分布在广泛的治疗领域、疾病状态、计划和技术上。然而,我们对风险的评估和方法可能不全面,也不能有效避免我们的一个或多个计划或模式中的延误或失败。我们的一个或多个计划或模式的失败可能会对我们正在筹备的其他计划或模式产生不利影响,并对我们的业务、运营结果和为我们的业务提供资金的能力产生重大不利影响。
我们正在创造一种基于信使核糖核酸的新药,以改善患者的生活。从一开始,我们就设计了我们的战略和操作,以实现mRNA在长时间范围内跨越广泛的人类疾病的全部潜在价值和影响。我们对我们的平台、基础设施和临床能力进行了投资,使我们能够建立一个庞大的开发候选管道,其中许多正在进行临床试验或拥有开放的IND。随着我们的开发候选者和研究药物的进展,我们或其他人可能会确定:我们的某些风险分配决策不正确或不充分;我们犯了平台级的技术错误;个别项目或我们的mRNA科学总体上存在未知或低估的技术或生物风险;我们对如何发展基础设施以支持我们的规模的选择将导致无法生产用于临床试验的研究药物或以其他方式损害我们的制造;或者我们分配资源的方式使大笔投资无法收回,资本分配不受快速重新定向的影响。所有这些风险可能与我们当前和未来共享类似科学(包括信使核糖核酸科学)和基础设施的项目有关,如果这些领域的重大决策被证明是不正确的或未得到优化,我们可能会对我们的业务和为我们的运营提供资金的能力产生实质性的不利影响,我们可能永远不会意识到我们所认为的信使信使的潜力。
*在这一新的潜在药物类别中,尚未批准任何信使核糖核酸药物,而且可能永远不会因为其他人或我们的努力而获得批准。由于这类新药的新颖性和史无前例的性质,信使核糖核酸药物开发具有重大的临床开发和监管风险。
作为一种潜在的新型药物,到目前为止,还没有mRNA药物获得FDA或其他监管机构的批准。我们或我们的战略合作伙伴能否成功发现和开发信使核糖核酸药物是高度不确定的,
58
目录表
取决于许多因素,其中许多因素是我们或他们无法控制的。我们已经并将继续做出一系列业务决策并承担一定的风险,以推进我们的开发努力和流水线,包括与信使核糖核酸技术、交付技术和制造流程相关的决策,根据我们、我们的战略合作伙伴或其他人的进一步工作,这些决策可能会被证明是不正确的。到目前为止,还没有以信使核糖核酸为主要活性成分的3期试验或商业化产品。然而,我们预计在短期内将分别对mRNA-1273(SARS-CoV-2)和mRNA-1647(CMV)进入第三阶段试验。我们的mRNA研究药物在开发的早期阶段看起来很有希望,但可能无法取得进展,临床上可能会遇到延误,临床上可能会遇到困难,或者由于许多原因而无法上市,包括:
• | 发现潜在的信使核糖核酸药物的努力可能不会成功; |
• | 非临床或临床前研究结果可能显示潜在的信使核糖核酸药物不如预期的有效,或者有有害的或有问题的副作用; |
• | 临床试验结果可能显示潜在的信使核糖核酸药物不如预期的有效(例如,临床试验可能无法达到一个或多个终点(S)),或者具有不可接受的副作用或毒性; |
• | 我们任何一项临床计划的不良反应或与我们的信使核糖核酸或我们的脂质纳米粒或LNP有关的不良反应,可能会导致我们的一个或多个计划的延迟或终止; |
• | 我们的翻译模型在人类身上降低风险或预测结果的能力不足,特别是考虑到我们的研究药物和开发候选药物的每个成分可能对安全性、耐受性和疗效具有依赖或独立的影响,其中可能取决于物种; |
• | 临床试验的cGMP材料制造失败或供应不足,或成本高于预期,可能会推迟或倒退临床试验,或使基于信使核糖核酸的药物在商业上失去吸引力; |
• | 我们对这类新的潜在药物的制造工艺的改进可能不足以满足我们研究药物的临床或商业需求或临床试验的法规要求; |
• | 我们为优化cGMP材料的制造、测试或配方所做的更改可能会影响我们的研究药物和开发候选药物的安全性、耐受性和有效性; |
• | 定价或报销问题或其他推迟临床试验或使任何基因药物与其他疗法相比不经济或不具竞争力的因素; |
• | 未能及时推进我们的计划或获得必要的监管批准或延迟获得此类批准,原因包括:缓慢或未能完成临床试验的登记、试验参与者退出试验、未能达到试验终点、数据分析、数据完整性问题、生物制品许可证申请或BLA或同等申请的额外时间要求、与FDA或EMA的讨论、对额外非临床或临床数据的监管请求、或安全配方或制造问题,可能导致我们无法获得足够的资金;以及 |
• | 其他人的专有权利及其相互竞争的产品和技术可能会阻止我们的mRNA药物商业化。 |
目前,FDA认为信使核糖核酸是一种基因治疗产品。与某些不可逆地改变细胞DNA并可能成为副作用来源的基因疗法不同,基于信使核糖核酸的药物的设计不会不可逆转地改变细胞DNA;然而,在基因疗法中观察到的副作用可能会对信使核糖核酸药物的感知产生负面影响,尽管机制不同。此外,由于目前还没有以信使核糖核酸为主要活性成分的产品获得批准,因此获得批准的监管途径尚不确定。批准这些类型药物所需的临床试验和临床前研究的数量和设计尚未确定,可能不同于基因治疗产品所需的数量和设计,或者可能需要像基因治疗产品一样的安全测试。此外,完成临床试验和提交上市批准申请以供监管机构做出最终决定所需的时间长度,在不同的药品之间存在很大差异,可能很难预测。
*我们自成立以来已经蒙受了重大亏损,并预计在可预见的未来还将继续蒙受重大亏损。
自2009年成立以来,我们每年都出现净亏损,包括截至2019年12月31日、2018年和2017年12月31日的年度净亏损分别为5.14亿美元、3.847亿美元和2.559亿美元。自.起2020年3月31日,我们有一个累积赤字, 16.2亿美元.
我们将大部分财务资源投入到研发中,包括我们的临床和临床前开发活动以及我们平台的开发。到目前为止,我们主要通过出售股权证券和战略联盟的收益以及政府和私人组织的赠款来为我们的业务提供资金。我们未来净亏损的数额将部分取决于我们未来支出的比率,以及我们通过股权或债务融资、出售资产、战略联盟或额外赠款获得资金的能力。我们还没有开始或完成我们在临床试验或研究药物方面的任何计划的关键临床试验,可能需要几年时间,如果有的话,我们或我们的
59
目录表
战略合作伙伴已经准备好将一种研究药物商业化。即使我们获得监管部门的批准来销售一种研究药物,我们未来的收入也将取决于我们的研究药物已获得批准的任何市场的规模,以及我们在这些市场实现足够的市场接受度、第三方付款人的补偿和足够的市场份额的能力。我们可能永远不会实现盈利。
在可预见的未来,我们预计将继续产生巨额费用和不断增加的运营亏损。我们预计我们的费用将大幅增加,如果我们:
• | 继续或扩大我们在临床前开发项目的研究或开发; |
• | 继续或扩大我们研究药物的信使核糖核酸临床试验的范围; |
• | 为我们的开发候选药物和研究药物启动其他临床前、临床或其他研究,包括根据我们的战略联盟协议; |
• | 继续投资于我们的平台,进行研究,以确定新的信使核糖核酸技术改进,包括确定信使核糖核酸传递的新方法,如脂质纳米粒,或LNPs,改善信使核糖核酸在特定组织中的分布和摄取; |
• | 改变或增加内部制造能力或能力; |
• | 变更或增加其他制造商或供应商; |
• | 为我们的质量控制和质量保证小组增加额外的基础设施,以支持我们的运营,因为我们正在将我们的研究药物推向商业化; |
• | 吸引和留住技术人才,特别是在剑桥、诺伍德、马萨诸塞州和其他我们可能在那里开展业务的全球地区; |
• | 创建额外的基础设施,以支持我们作为上市公司的运营以及我们的产品开发和计划的未来商业化努力,包括在美国和海外的新地点; |
• | 为我们的研究药物寻求上市批准和报销; |
• | 建立销售、营销和分销基础设施,以将我们可能获得营销批准的任何产品商业化; |
• | 寻求确定和验证更多的开发候选药物和研究药物; |
• | 收购或许可其他开发候选药物、研究药物和技术; |
• | 根据任何许可协议进行里程碑或其他付款; |
• | 维护、保护和扩大我们的知识产权组合;以及 |
• | 遇到任何延迟或遇到上述任何问题。 |
* 我们的季度和年度经营业绩可能会波动。因此,我们可能无法达到或超过研究分析师或投资者的预期,这可能会导致我们的股价下跌,并对我们的融资或融资能力产生负面影响,以及对我们作为独立公司存在的能力产生负面影响。
过去,我们的财务状况和经营业绩各有不同,未来由于各种因素,我们的财务状况和经营业绩将继续在季度和年度之间波动,其中许多因素是我们无法控制的。可能导致这些波动的与我们业务相关的因素包括以下因素,以及本季度报告Form 10-Q中其他部分描述的其他因素:
• | 现有的或未来开发的候选药物进入临床或临床试验的研究药物的进展延迟或失败; |
• | 开发、制造和商业化我们的程序的可行性; |
• | 我们管理自身发展的能力; |
• | 我们和我们的战略合作伙伴进行的研究计划、临床试验或其他产品开发或审批过程的结果; |
• | 我们开发或成功商业化基因药物的能力; |
• | 我们的战略合作伙伴有能力开发和成功地商业化从我们的知识产权开发的信使核糖核酸药物或其他产品; |
• | 我们与战略合作伙伴的关系以及任何相关的排他性条款; |
• | 我们的合同义务或其他义务,即提供资源以资助我们的研发候选药物和研究药物,并向我们的战略合作伙伴或战略联盟本身提供资源; |
• | 我们的业务在可预见的未来处于净亏损状态; |
• | 与我们业务的国际方面相关的风险,包括在多个地点进行临床试验以及在这些地点进行潜在的商业化; |
• | 我们始终如一地生产我们的研发候选药物和研究药物的能力; |
• | 我们有能力及时准确地报告我们的财务业绩; |
• | 我们依赖并需要吸引和留住关键管理人员和其他人员; |
60
目录表
• | 我们获得、保护和执行我们知识产权的能力; |
• | 我们防止我们的知识产权、专业知识或技术被盗或挪用的能力; |
• | 我们的竞争对手和潜在竞争对手在获得资金、获得关键知识产权权利或开发竞争技术或产品方面可能拥有的优势; |
• | 我们有能力获得扩大业务所需的额外资本; |
• | 我们的战略合作伙伴有能力根据我们的战略联盟协议获得开发和商业化产品所需的额外资本; |
• | 停电、罢工、恐怖主义行为或自然灾害等业务中断; |
• | 目前的冠状病毒大流行或任何其他健康流行病对我们的业务、我们的临床试验、我们的研究计划、医疗保健系统或全球经济的最终影响;以及 |
• | 我们能够利用我们的净营业亏损结转来抵消未来的应税收入。 |
由于这里提到的各种因素和其他因素,我们不应依赖我们之前任何季度或年度的业绩作为我们未来经营业绩的指标。
我们产生的净亏损可能会在季度与季度和年度与年度之间波动很大,因此,我们运营结果的期间比较可能不是我们未来业绩的良好指示。在任何一个或多个特定季度,我们的经营业绩都可能低于证券分析师或投资者的预期,这可能会导致我们的股价下跌。我们不控制与我们的战略合作伙伴管理的任何计划相关的任何此类里程碑的披露时间。我们的战略合作伙伴或竞争对手对被视为负面的数据或其他事件的任何披露,无论此类数据是否与我们或其他人发布的其他数据相关,都可能对我们的股价或整体估值产生重大不利影响。我们的一个或多个计划的临床试验结果出乎意料,包括报告的任何计划的不良安全事件,我们的股票价格可能会下跌。
我们的业务高度依赖于我们项目和模式的临床进步。推迟或未能推进计划或模式可能会对我们的业务产生不利影响。
利用我们的平台,我们正在开发基于信使核糖核酸的药品产品特征。随着时间的推移,我们的平台工作产生了共性,在这些共性中,mRNA技术、交付技术和制造工艺的特定组合产生了一组由多个项目共享的产品功能。这就是我们所说的“情态“我们在历史上一直利用,并预计将继续利用医疗机构中的早期计划,以了解医疗机构内的技术风险,包括制造和制药特性。即使我们在某一医疗模式中的早期计划在开发的任何阶段都是成功的,任何此类早期计划都可能在开发的较后阶段失败,而同一医疗模式中的其他计划仍可能在任何开发阶段失败,包括在该医疗模式中的早期计划成功的阶段。这可能是由于该项目独有的技术挑战,也可能是由于生物风险,这对每个项目来说都是独特的。随着我们通过临床开发推进我们的计划,可能会出现新的技术挑战,导致整个医疗模式失败。
虽然我们的目标是使用模式分离风险,但整个或部分模式中可能存在可预见和不可预见的风险。这些包括但不限于,信使核糖核酸、化学修饰和LNPs及其组分。此外,如果我们的任何一个或多个临床项目遇到安全性、耐受性或疗效问题、开发延迟、监管问题或其他问题,我们的平台方法和业务可能会受到严重损害。我们可能认为一种特定的方式已经降低了风险,但后来确定关于这种方式存在新的和不同的风险。
此外,我们大部分流水线上的生物风险代表了一种或多种批准药物没有在临床上验证的靶点和途径。虽然我们相信我们在寻求降低某些环境中的生物学风险方面取得了进展,例如对于我们和其他人已经证明中和抗体的有效性的疫苗靶点,但我们选择的靶点或途径可能无效的风险将继续适用于我们当前和未来的大多数计划。
虽然我们试图通过在每种医疗方式中开发一个或多个程序来分散我们的风险,但有一些风险是每种医疗方式独一无二的,也有适用于各种医疗方式的风险。这些风险可能会削弱我们推进一个或多个临床开发计划、获得监管批准或最终将我们的计划商业化的能力,或者导致我们在这样做的过程中遭遇重大延误,其中任何一项都可能对我们的业务造成实质性损害。
我们的候选开发药物和研究药物中的某些特征,包括与信使核糖核酸、化学修饰、表面化学、LNP及其成分相关的特征,可能会导致在我们的一些或所有模式中活跃的可预见和不可预见的风险。任何这种跨越风险的投资组合,无论是已知的还是未知的,如果在我们的任何一个计划中实现,都将对我们的其他计划和整个业务产生实质性的不利影响。
我们的某些医疗模式和我们的项目作为一个整体都存在特定的额外风险。例如,预防性疫苗通常需要在数千到数万名健康志愿者中进行临床测试,以确定可批准的益处-风险概况。在给健康人服药时,需要表现出高度的安全性和耐受性,这可能会导致罕见的甚至是虚假的
61
目录表
安全发现,在商业发射之前或之后对计划产生负面影响。虽然我们相信我们在预防性疫苗计划的早期临床试验中观察到的某些安全性、耐受性和免疫原性水平足以启动额外的试验,但不能保证我们将在批准这些计划所需的后期试验中观察到可接受的安全性或有效性。对于新抗原癌症疫苗,到目前为止,还没有分子(非基于细胞的)治疗性蛋白疫苗被证明对癌症有效,个性化药物,包括基于细胞的疗法和疫苗,在临床和制造方面存在许多挑战。这些风险包括:快速生产周转时间(以周为单位),以便在肿瘤进一步进展和突变之前向临床试验中的患者供应;制造个性化疫苗所产生的巨大成本;以及可能由于肿瘤的生物学或患者的免疫状态而导致的潜在免疫反应不足。这些风险和其他风险适用于我们的PCV和其他新表位研究医学计划。此外,由于可以输送到特定位置(如肿瘤或受损组织)的原料药的数量有限,在提供足够数量的有效药物成分或原料药(API)以提高疗效方面可能存在挑战。我们的局部注射疗法通常需要专门的技能来进行临床试验,由于局部注射疗法或肿瘤内疗法的采用不佳,这可能会推迟试验或减缓或损害经批准的研究药物的商业化。此外,从临床前动物模型(包括小鼠和非人类灵长类动物模型)到成功的临床试验结果的靶点选择的不确定可译性可能是不可能的,特别是对于免疫肿瘤学和系统疗法以及癌症疫苗。一般来说,要将信使核糖核酸转化为具有治疗活性的药物,需要几个生物学步骤。这些处理步骤可能因个体或组织不同而不同,这可能导致治疗蛋白的不同水平、不同的活性、免疫原性或不同的组织分布,以达到治疗效果。基因疗法和基于信使核糖核酸的药物可以激活针对药物产品的任何和所有成分(例如信使核糖核酸或递送载体,如LNP)以及针对编码蛋白的一种或多种免疫反应,从而引起潜在的免疫反应相关的不良事件。引发针对编码蛋白的免疫反应可能会阻碍我们在重复给药或副作用时实现药理效果的能力。这些风险适用于我们的所有计划,包括我们的全身分泌疗法和全身细胞内疗法模式。
与我们现有和未来管道的研究、开发、监管审查和批准相关的风险
临床前开发是漫长和不确定的,特别是对于像信使核糖核酸这样的新型药物,因此我们的临床前计划或开发候选项目可能会被推迟、终止或可能永远不会进入临床,其中任何一项都可能影响我们获得资金的能力,并可能对我们的平台或我们的业务产生实质性的不利影响。
我们正在进行的大部分项目都处于临床前开发阶段,这些项目可能会被推迟,也可能不会进入临床。在我们可以启动候选开发药物的临床试验之前,我们必须完成广泛的临床前研究,包括支持我们在美国计划的IND或在其他司法管辖区的类似应用的IND良好实验室实践或GLP毒理学测试。我们还必须完成关于化学、制造和控制的广泛工作,或CMC,活动(包括产率、纯度和稳定性数据)将包括在IND提交的。针对一类新药物的CMC活动,如信使核糖核酸,需要广泛的制造过程和分析开发,这是不确定和漫长的。例如,随着我们扩大生产规模,批次故障已经发生,并可能继续发生。此外,我们过去和将来可能很难确定合适的缓冲液和存储条件,以确保我们的临床前或临床开发候选批次有足够的保质期。如果我们因保质期不足而需要生产新批次的开发候选药物,可能会推迟此类开发候选药物的临床前研究或临床试验的开始或完成。例如,我们不能确定我们的临床前测试和研究的及时完成或结果,也不能预测FDA或其他监管机构是否会接受我们的临床前测试或我们建议的临床计划的结果,或者我们的临床前测试、研究和CMC活动的结果是否最终将支持我们计划的进一步发展。因此,我们不能确保我们能够在我们预期的时间表上提交IND或类似的临床前计划申请,我们也不能确保IND或类似申请的提交将导致FDA或其他监管机构允许临床试验开始。
临床开发是漫长和不确定的,特别是对于一类新的药物,如信使核糖核酸药物。我们的研究药物的临床试验可能会被推迟,某些项目可能永远不会在临床上取得进展,或者进行的成本可能比我们预期的更高,任何这些都可能影响我们获得和维持足够资金的能力,并将对我们的平台或业务产生实质性的不利影响。
临床测试既昂贵又复杂,可能需要数年时间才能完成,其结果本身也不确定。我们可能无法启动我们的研究药物的临床试验,可能会遇到延迟,或者可能不得不停止临床试验。我们和我们的战略合作伙伴还可能在我们或我们的战略合作伙伴进行的任何临床试验期间或因此而经历许多不可预见的事件,这些试验可能会推迟或阻止我们或我们的战略合作伙伴成功开发我们的研究药物,包括:
62
目录表
• | FDA、其他监管机构、机构审查委员会或伦理委员会可能出于各种原因不授权我们或我们的研究人员在预期试验地点开始临床试验或进行临床试验,包括对临床试验设计的安全性和方面的担忧; |
• | 我们可能会在与预期的试验地点和预期的CRO就优惠条款达成协议方面遇到延误或无法达成协议,这些条款可能需要进行广泛的谈判,并且可能在不同的CRO和试验地点之间存在显著差异; |
• | 我们过去已经并打算继续优化我们的生产流程,包括通过改变生产规模和地点,这可能会导致我们的临床试验设计发生潜在的重大变化,需要额外的成本和时间,并因此导致一种或多种研究药物进展计划的延迟; |
• | 我们的临床前研究和早期临床试验的结果可能不能预测后来的临床试验的成功,临床试验的中期结果也不一定能预测最终结果; |
• | 我们可能无法建立适用的监管机构认为具有临床意义的临床终点; |
• | 为了优化产品功能,我们过去已经并可能在开始研究药物的临床试验后继续对我们的研究药物进行更改,这可能需要我们重复临床测试的早期阶段或推迟研究药物的后期测试; |
• | 任何研究药物的临床试验可能无法显示安全性或有效性,或产生阴性或不确定的结果,我们可能决定或监管机构可能要求我们进行额外的非临床研究或临床试验,或者我们可能决定放弃产品开发计划; |
• | 早期临床试验和后期临床试验在试验设计上的差异使早期临床试验的结果难以推论到后期临床试验; |
• | 临床前和临床数据往往容易受到不同解释和分析的影响,许多被认为在临床前研究和临床试验中表现令人满意的研究药物仍未能获得上市批准; |
• | 我们的研究药物可能会有不良的副作用,例如LNPs或其成分的免疫原性,由mRNA产生的蛋白质的免疫原性,或降解产物,其中任何一种都可能导致严重的不良事件,或其他影响。一个或多个此类影响或事件可能导致监管机构对适用的试验实施临床搁置,或导致我们或我们的IRBs或伦理委员会暂停或终止该研究药物或我们可能正在进行临床试验的任何其他研究药物的试验; |
• | 任何研究药物的临床试验所需的试验参与者的数量可能比我们预期的多,此类试验的试验参与者的确定可能受到限制,这些临床试验的登记速度可能比我们预期的慢,因为感知到的不良反应、竞争性试验、患者群体的规模或其他原因,或者参与者可能退出临床试验或未能以高于我们预期的速度返回进行治疗后随访; |
• | 我们的第三方承包商可能未能及时遵守法规要求或履行其对我们的合同义务,或者根本不遵守,或者可能偏离临床试验方案或退出试验,这可能需要我们增加新的临床试验地点; |
• | 监管机构可以选择实施临床搁置,或者我们或我们的调查人员、IRBs或伦理委员会可能会出于各种原因选择暂停或终止临床研究或试验,包括不符合监管要求或发现参与者面临不可接受的福利风险比; |
• | 任何研究药物的临床前或非临床测试和研究以及临床试验的成本可能比我们预期的要高; |
• | 我们进行临床试验所需的研究药物或其他材料的供应或质量可能不足或不充分; |
• | 当我们进行新药的临床试验,制定有效的知情同意文件,并与IRBs和科学审查委员会(SRC)合作时,我们将考虑与我们的一种或多种研究药物有关的安全性和有效性问题,以及FDA和其他全球法规; |
• | 对我们的研究药物的安全性或有效性的担忧可能源于针对类似疾病状态的其他疗法或被认为与我们的相似的其他疗法(如基因疗法)进行的非临床或临床测试所产生的任何安全性或有效性担忧;以及 |
• | FDA或其他监管机构可能会要求我们提交额外的数据,如长期毒理学研究,或在允许我们启动临床试验之前施加其他要求。 |
如果我们、FDA或其他监管机构、伦理委员会或正在进行此类试验的机构的IRBs暂停或终止临床试验,或者如果数据安全监测委员会建议暂停或终止此类试验,我们也可能遇到延迟。我们在过去和未来可能会推迟获得FDA或其他监管机构的批准,通过实施临床暂停来启动临床试验,以应对这些监管机构对我们的临床试验设计或临床试验的其他要素提出的意见。其他药物的临床试验
63
目录表
研发基因药物的公司已被FDA临床搁置。暂停或终止可能是由于多种因素,包括未能按照监管要求或我们的临床规程进行临床试验、FDA或其他监管机构对临床试验操作或试验地点的检查导致实施临床暂停、不可预见的安全问题或不良反应,包括与我们的研究药物处于同一类别的其他研究药物所经历的副作用、未能证明使用研究药物的益处或足够的益处风险比、未能建立或实现具有临床意义的试验终点、政府法规或行政措施的变化,或缺乏足够的资金来继续临床试验。导致或导致临床试验开始或完成延迟的许多因素,最终也可能导致我们的研究药物被拒绝监管批准。我们还必须完成广泛的CMC活动,这些活动需要广泛的制造工艺和分析开发,这是不确定和漫长的。例如,随着我们扩大生产规模,批次故障已经发生,并可能继续发生。此外,我们过去和未来可能很难确定合适的缓冲液和储存条件,以使我们的临床开发候选药物或研究药物批次能够有足够的保质期。如果我们因保质期不足而被要求生产新批次的开发候选药物或研究药物,可能会推迟此类开发候选药物或研究药物临床试验的开始或完成。
此外,FDA已经表示,在为我们的计划开始后期临床试验之前,我们需要开发检测方法来测量和预测给定剂量的研究药物的效力。在开发FDA或其他监管机构可以接受的分析方法方面的任何拖延都可能推迟未来临床试验的开始。此外,FDA或其他监管机构可能不同意我们的临床试验设计和我们对临床试验数据的解释,或者即使在他们审查并评论了我们的临床试验设计后,也可能改变批准要求。我们研究药物的重大临床前或非临床测试和研究或临床试验延迟也可能使我们的竞争对手在我们之前将产品推向市场,这可能会削弱我们成功将我们的研究药物商业化的能力,并损害我们的业务和运营结果。我们研究药物开发的任何延误都可能严重损害我们的业务、财务状况和前景。
我们在确定和招募临床试验参与者方面可能会遇到延误,这将推迟我们研究药物的进展,并导致费用增加。
我们的研究药物依赖于临床试验参与者的登记。我们可能会发现很难在我们的临床试验中招募试验参与者,这可能会推迟或阻止我们的研究药物的临床试验。确定试验参与者并使其有资格参与我们的研究药物的临床试验对我们的成功至关重要。我们临床试验的时间取决于我们招募试验参与者参与测试我们的研究药物的速度。推迟登记可能会导致成本增加,或者可能会影响计划的临床试验的时间或结果,这可能会阻止这些试验的完成,并对我们推进研究药物开发的能力产生不利影响。如果试验参与者因我们的试验或类似产品的其他试验中的不良事件、或与特定治疗领域相关的不良事件或其他原因(包括针对类似患者群体的竞争性临床试验)而不愿参与我们的试验,则招募试验参与者、进行研究和获得潜在产品监管批准的时间可能会推迟。这些延迟可能会导致成本增加、延迟我们的产品开发、延迟测试我们产品的有效性,或者完全终止临床试验。
我们可能无法识别、招募和招募足够数量的试验参与者,或者那些具有所需或所需特征的试验参与者,以便在试验中实现多样性,从而及时完成我们的临床试验。患者和受试者的登记受以下因素影响:
• | 正在调查的疾病的严重程度; |
• | 学习协议的复杂性和设计; |
• | 患者群体的规模; |
• | 有问题的研究的资格标准,包括基于年龄的资格标准,将受试者登记限制为青少年或儿科人口; |
• | 预期试验参与者的临床研究地点的近似性和可用性; |
• | 竞争疗法和临床试验的可用性,包括我们自己的临床试验之间; |
• | 努力促进及时登记参加临床试验; |
• | 医生的病人转介做法; |
• | 在治疗期间和治疗后充分监测试验参与者的能力; |
• | 有能力招聘具有适当能力和经验的临床试验研究人员; |
• | 临床医生和试验参与者对正在研究的研究药物相对于其他现有疗法的潜在优势和副作用的看法,包括可能被批准用于我们正在研究的适应症的任何新药或疗法; |
64
目录表
• | 就我们的个性化癌症疫苗而言,需要等待个性化药物产品的生产;以及 |
• | 我们获得和维护参与者知情同意的能力。 |
此外,我们的临床试验将与其他临床试验争夺与我们的研究药物处于相同治疗领域的研究药物,这一竞争将减少我们可获得的试验参与者的数量和类型,因为一些可能选择参加我们的试验的试验参与者可能会转而选择参加由第三方进行的试验。由于合格临床研究人员的数量有限,我们预计将在一些竞争对手使用的相同临床试验地点进行我们的一些临床试验,这将减少在这些临床试验地点可用于我们临床试验的试验参与者的数量。此外,由于我们的研究药物在某些情况下与更传统的疾病治疗和预防方法背道而驰,潜在的试验参与者和他们的医生可能倾向于使用传统疗法或其他新疗法,而不是招募试验参与者参加任何未来涉及信使核糖核酸研究药物的临床试验。此外,如果新的研究药物,如基因编辑疗法,显示出令人鼓舞的结果,潜在的试验参与者和他们的医生可能倾向于招募试验参与者参加使用这些研究药物的临床试验。如果这些新的研究药物显示出令人沮丧的结果或其他不良的安全迹象,潜在的试验参与者和他们的医生可能不太愿意让试验参与者参加我们的临床试验。我们还加入了战略联盟,根据战略联盟,我们的战略合作伙伴控制着我们某些研究药物的开发,这可能会给我们提供有限的或没有能力影响我们临床试验的注册率。
即使我们能够招募试验参与者,也不能保证他们最终会作为临床试验的一部分或完成剂量。例如,尽管我们已经宣布,由于MUT缺乏,第一位患者已经参加了针对单纯性甲基丙二酸血症(MMA)患者的mRNA-3704的1/2期研究,但不能保证这名患者最终会作为1/2期研究的一部分或完成给药。
信使核糖核酸药物是一种新方法,对我们开发的任何研究药物的有效性、安全性或耐受性的负面看法可能会对我们开展业务、推进我们的研究药物或获得监管部门批准的能力产生不利影响。
作为一种潜在的新型药物,到目前为止,还没有mRNA药物获得FDA或其他监管机构的批准。我们的研究药物临床试验或其他开发类似产品的临床试验中的不良事件以及由此产生的宣传,以及信使核糖核酸药物领域的任何其他不良事件,或被认为与信使核糖核酸药物类似的其他产品,如与基因治疗或基因编辑相关的产品,可能会导致我们一个或多个计划的预期益处减少,加强监管审查,患者和临床试验合作者对我们的研究药物的信心下降,以及对我们可能开发的任何产品的需求减少。我们大量的候选开发药物和研究药物可能会导致更多的可报告不良事件,包括疑似意外的严重不良反应或SUSAR、其他应报告的负面临床结果、制造可报告的事件或重大临床事件,这些事件或重大临床事件可能导致临床延迟或被FDA或适用的监管机构搁置或其他临床延迟,任何这些都可能对我们一个或多个计划的认知以及我们的整体业务产生负面影响。此外,美国、州或外国政府对公众负面看法的反应可能会导致新的立法或法规,可能会限制我们开发任何研究药物或将任何经批准的产品商业化、获得或维持监管批准或以其他方式实现盈利的能力。更严格的法律制度、政府法规或负面舆论将对我们的业务、财务状况、运营结果和前景产生不利影响,并可能延迟或损害我们研究药物的开发和任何经批准的产品的商业化或对我们可能开发的任何产品的需求。
由于我们正在开发一些开发候选药物或研究药物,用于治疗几乎没有临床经验的疾病,在某些情况下,使用新的终点或方法,FDA或其他监管机构可能不会考虑我们临床试验的终点,以提供临床上有意义的结果。
目前还没有被批准的药物疗法来治疗我们目前试图解决或未来可能解决的许多疾病的根本原因。例如,对于MMA或PA,几乎没有临床试验尝试过。此外,开发治疗这些罕见疾病的药物的临床试验经验有限,我们不知道有哪一项注册试验导致了治疗这些疾病的药物的批准。有一些与其他药物的历史试验,以解决有机酸血症,可能已经利用了临床终点,而不太适用于我们的MMA和PA计划,以解决潜在的缺陷。因此,设计和进行治疗这些疾病和其他疾病的研究药物的临床试验可能需要更长的时间,成本更高,或者作为这些疾病开发的新颖性的一部分,效果较差。
65
目录表
即使FDA确实发现我们的成功标准得到了充分的验证和临床意义,在我们或我们的战略合作伙伴可能为我们的计划进行的任何关键或其他临床试验中,我们也可能无法达到预先指定的终点,达到一定程度的统计意义。此外,即使我们确实达到了预先指定的标准,我们的试验也可能产生不可预测的结果,或者与试验中更传统的疗效终点的结果不一致。FDA还可以给予其他疗效终点高于主要终点的压倒一切的权重,即使我们在该终点上取得了统计上显著的结果,如果我们没有在我们的次要疗效终点上这样做的话。FDA还会权衡产品的益处和风险,FDA可能会在安全性的背景下将疗效结果视为不支持许可。欧洲和其他国家的其他监管机构可能会对这些终端做出类似的结论。
我们的一些研究药物被FDA和EMA归类为基因疗法,FDA已表示,我们的研究药物将在其生物制品评估和研究中心(CBER)内进行审查。尽管我们的mRNA研究药物设计为具有与基因疗法不同的作用机制,但我们的研究药物与基因疗法的关联可能会导致监管负担增加,损害我们研究药物的声誉,或对我们的平台或业务产生负面影响。
基因治疗产品在美国或外国司法管辖区很少获得批准,与其测试和使用相关的重大不良事件也有大量报道。基因治疗产品具有引入新DNA的效果,并可能不可逆转地改变细胞中的DNA。相比之下,mRNA不太可能定位于细胞核,整合到DNA中,或者以其他方式对细胞DNA进行任何永久性的改变。因此,我们预计我们的研究药物将具有不同于基因疗法的潜在副作用。
基因和细胞治疗产品的监管要求已经演变,并可能在未来继续变化,对基于信使核糖核酸的治疗的影响尚不清楚。例如,FDA在CBER内设立了组织和高级治疗办公室,以整合对基因治疗和相关产品的审查,并召集细胞、组织和基因治疗咨询委员会,就其审查向CBER提供建议。在欧盟,信使核糖核酸被定性为基因治疗药物。在某些国家,信使核糖核酸疗法还没有被分类,或者我们不知道任何这样的分类,特别是在日本,药品和医疗器械厅还没有对监管分类采取立场。尽管我们的信使核糖核酸研究药物和基因疗法之间存在差异,但我们的一些信使核糖核酸研究药物在美国、欧盟以及潜在的其他国家/地区被归类为基因疗法可能会对我们开发研究药物的能力产生不利影响,并可能对我们的平台和业务产生负面影响。例如,由于不可逆转地改变细胞DNA的风险,临床上对整个领域的基因治疗产品的控制可能适用于我们的信使核糖核酸研究药物,而不管基因治疗和信使核糖核酸之间的机制差异。
报道的与基因疗法或基因组编辑疗法有关的不良事件可能会对我们的一个或多个项目产生不利影响。尽管我们的mRNA开发候选药物和研究药物旨在不对细胞DNA进行任何永久性的改变,但监管机构或其他人可能会认为,由于引入新的DNA并不可逆转地改变细胞中的DNA而导致的基因疗法产品的不良影响也可能是我们的mRNA研究疗法的风险,因此可能会推迟我们的一项或多项试验或强制进行额外的长期副作用测试。监管审查机构颁布的任何新要求和指南都可能对我们的业务产生负面影响,包括延长监管审查流程,要求我们进行额外或更大规模的研究,或增加我们的开发成本,其中任何一项都可能导致监管立场和解释的变化,推迟或阻止我们的研究药物的进步或批准和商业化,或导致重大的批准后研究、限制或限制。当我们推进我们的研究药物时,我们将被要求与这些监管机构和咨询委员会协商,并遵守适用的要求和指南。如果我们未能做到这一点,我们可能被要求推迟或停止我们的部分或全部研究药物的开发。
FDA对一种药物的突破性治疗指定或快速通道指定可能不会导致更快的开发或监管审查或批准过程,也不会增加该药物获得上市批准的可能性。
我们可能会为我们的一种或多种研究药物寻求突破性的治疗指定。突破性疗法被定义为一种旨在单独或与一种或多种其他药物联合治疗严重或危及生命的疾病或状况的药物,初步临床证据表明,该药物可能在一个或多个临床重要终点显示出比现有疗法显著的改善,例如在临床开发早期观察到的实质性治疗效果。对于被指定为突破性疗法的药物,FDA和试验赞助商之间的互动和沟通可以帮助确定临床开发的最有效途径,同时将无效对照方案中的患者数量降至最低。被FDA指定为突破性疗法的药物,如果在提交BLA时得到临床数据的支持,也有资格优先审查。
66
目录表
FDA有权将其指定为突破性疗法。因此,即使我们认为我们的一种研究药物符合被指定为突破性疗法的标准,FDA也可能不同意,而是决定不进行这种指定。在任何情况下,与根据FDA传统程序考虑批准的药物相比,收到一种药物的突破性治疗指定可能不会导致更快的开发过程、审查或批准,也不能确保FDA最终批准。即使我们在美国或其他司法管辖区的类似途径下成功获得加速批准,我们也可能面临将对我们的前景产生不利影响的要求和限制。例如,我们可能只因非常有限的适应症而获得批准,我们可能无法成功完成所需的批准后试验,此类试验可能无法确认我们药物的临床疗效,或者该药物的批准可能被撤回。此外,即使我们的一种或多种研究药物符合突破疗法的条件,FDA也可能稍后决定该研究药物不再符合资格条件,或者它可能决定不会缩短FDA审查或批准的时间段。
我们已经为我们的一些研究药物获得了快速通道资格,并可能为其他药物寻求快速通道资格。如果一种疗法的目的是治疗一种严重或危及生命的疾病,并且该疗法显示出解决这种疾病的重大未得到满足的医疗需求的潜力,药物赞助商可以申请快速通道指定。FDA拥有广泛的自由裁量权,是否授予该称号,即使我们认为某一特定的研究药物有资格获得该称号,我们也不能向您保证FDA会决定授予该称号。即使我们确实获得了快速通道认证,我们可能也不会经历比传统FDA程序更快的开发过程、审查或批准。如果FDA认为我们的临床开发项目的数据不再支持快速通道的指定,它可能会撤回该指定。仅有快速通道指定并不能保证符合FDA优先审查程序的资格。
我们可能无法从FDA获得并维护我们未来研究药物的孤儿药物指定,如果适用的话。
我们的战略包括在可用于我们的研究药物的地方申请孤儿药物称号,我们已经收到FDA和欧盟委员会针对MMA(mRNA-3704)和PA(mRNA-3927)的孤儿药物称号。根据《孤儿药品法》,FDA可以将用于治疗罕见疾病或疾病的药物或生物药物指定为孤儿药物,这种疾病或疾病的定义是,发生在美国患者人数少于20万人或患者人数超过20万人的美国,而在美国,没有合理的预期可以通过在美国的销售收回开发药物或生物药物的成本。在美国,孤儿药物指定使一方有权获得经济激励,例如为临床试验费用、税收优惠和用户费用减免提供赠款资金的机会。然而,孤儿药物指定既不会缩短药物的开发时间或监管审查时间,也不会使该药物在监管审查或批准过程中具有任何优势。如果一种具有孤儿药物指定的产品随后获得了FDA对其具有这种指定的疾病的第一次批准,该产品有权获得孤儿药物排他性,这意味着FDA可能在七年内不批准任何其他申请,包括完整的NDA或BLA,以相同的适应症销售相同的药物或生物制剂,除非在有限的情况下,例如显示出相对于具有孤儿药物排他性的产品的临床优势,或者原始制造商无法保证足够的产品数量。
此外,如果我们寻求批准比孤儿指定的适应症更广泛的适应症,在美国的独家营销权可能会受到限制,或者如果FDA后来确定指定请求存在重大缺陷,可能会失去独家营销权。此外,即使我们获得了一种产品的孤立药物排他性,这种排他性也可能无法有效地保护该产品免受竞争,因为具有不同活性部分的不同药物可能会获得并被批准用于相同的条件,并且只有第一个获得批准的申请者才会获得市场排他性的好处。即使在孤儿指定的产品获得批准后,如果FDA得出结论认为,如果后来的药物被证明更安全、更有效,或者对患者护理有重大贡献,则随后可以批准具有相同活性部分的较新药物用于相同的疾病。此外,虽然我们可能会为我们的研究药物寻求额外的孤儿药物指定,但我们可能永远不会收到这样的进一步指定。
我们的研究药物可能面临通过简化监管途径批准的生物仿制药的竞争。
《患者保护和平价医疗法案》经2010年《医疗保健和教育协调法案》修订,或统称为《ACA》,其中包括一个副标题,名为《2009年生物制品价格竞争和创新法案》,或BPCIA,它为与FDA批准的参考生物制品生物相似或可互换的生物制品创建了一个简短的批准途径。根据BPCIA,生物相似产品的申请必须在参考产品首次获得FDA批准的四年后才能提交给FDA。此外,FDA对生物相似产品的批准可能要在参考产品首次获得批准之日起12年后才能生效。在这12年的独占期内,如果FDA批准竞争产品的BLA,包含赞助商自己的临床前数据和来自充分和良好控制的临床数据的数据,另一家公司仍可能销售该参考产品的竞争版本
67
目录表
证明另一家公司产品的安全性、纯度和效力的试验。这项法律很复杂,FDA仍在解释和实施。因此,其最终影响、实施和意义都存在不确定性。
我们认为,我们的任何根据BLA被批准为生物制品的研究药物都应该有资格获得12年的专营期。然而,由于国会的行动或其他原因,这一排他性可能会缩短,或者FDA不会将我们的研究药物视为竞争产品的参考产品,这可能会比预期更早地创造仿制药竞争的机会。BPCIA的其他方面,其中一些可能会影响BPCIA的排他性条款,也是最近诉讼的主题。此外,一旦获得批准,生物相似物将在多大程度上取代我们的任何一种参考产品,其方式类似于非生物制品的传统仿制药替代,目前尚不清楚,这将取决于一些仍在发展中的市场和监管因素。
我们以无缝试验设计对我们的肿瘤相关产品进行的任何临床试验可能不会被监管机构以提交的表格接受,或者根本不能接受,这可能会推迟我们的临床开发,并限制或改变我们可以从临床试验中收集的信息类型。
我们可能会为我们的肿瘤学相关产品寻求依赖于无缝试验设计的开发计划,这与传统的三阶段开发计划相比带来了额外的风险。无缝试验设计可以通过首例人类或FIH多个扩展队列试验来实现,该试验有一个单一的方案,具有初始剂量递增阶段,还包含三个或更多具有队列特定目标的额外患者队列。FIH多重扩展队列试验旨在通过无缝地从潜在有效剂量的初始确定到具有第二阶段试验典型试验目标的单个队列来加快开发。与这种无缝试验设计相关的挑战和风险包括:在向研究人员、IRBs和监管机构及时传播新的安全信息方面存在挑战,使队列中的大量患者暴露在潜在的次优或有毒剂量的研究药物中,暴露的患者比实现队列目标所需的患者更多,以及未能对初步试验结果进行预期解释,以及可能导致临床开发延迟的计划外分析。基于使用此类设计的这些风险和其他风险,监管机构可能会发现我们的无缝试验设计不可接受。
如果我们无法获得所需的监管批准,或者如果在获得监管批准方面出现延误,我们将无法将我们可能开发的研究药物商业化,或者将推迟商业化,我们的创收能力将受到严重损害。
即使我们完成了必要的临床前研究和临床试验,上市审批过程也是昂贵、耗时和不确定的,可能会阻止我们获得任何开发候选药物和我们可能开发的研究药物的商业化批准。我们可能开发的任何信使核糖核酸药物以及与其开发和商业化相关的活动,包括设计、测试、制造、记录保存、标签、储存、批准、广告、促销、销售和分销,都受到FDA和类似的全球卫生当局的全面监管。为了获得将我们的任何研究药物商业化所需的监管批准,我们和我们的战略合作伙伴必须通过广泛的临床前研究和临床试验来证明我们的产品是安全、纯净、有效或对人类有效的,包括目标人群。成功完成临床试验是向FDA提交BLA、向EMA提交营销授权申请或MAA以及向可比的全球监管机构提交类似的营销申请的先决条件,对于每种研究药物,从而最终批准任何研究药物并进行商业营销。
未能获得研究药物的上市批准将阻止我们在特定司法管辖区将研究药物商业化。我们还没有从任何司法管辖区的监管机构获得上市任何研究药物的批准,我们的研究药物或我们未来可能寻求开发的任何研究药物都可能永远不会获得监管部门的批准。我们在提交和支持获得营销批准所需的申请方面经验有限,可能需要依赖第三方CRO或监管顾问来帮助我们完成这一过程。据我们所知,目前还没有像我们正在开发的这种基于信使核糖核酸的药物被FDA或任何其他全球监管机构批准销售的先例。尽管我们希望在美国为我们的基于信使核糖核酸的研究药物提交BLAS,但其他司法管辖区可能会认为我们的基于信使核糖核酸的研究药物是新药,而不是生物制品,需要不同的营销应用。为了获得监管部门的批准,需要向各个监管机构提交广泛的临床前和临床数据以及支持信息,以确定研究药物的安全性和有效性。要获得监管批准,还需要向相关监管机构提交有关产品制造过程的信息,并由相关监管机构检查制造设施。我们开发的任何研究药物可能没有效果,可能只有中等效果,或者可能被证明具有不良或意外的副作用、毒性或其他特征,可能会阻止我们获得上市批准,或者阻止或限制商业使用。
68
目录表
在美国和国外获得上市批准的过程都是昂贵的,如果需要额外的临床试验,可能需要很多年,如果真的获得了批准,而且可能会根据各种因素而有很大的不同,包括所涉及的研究药物的类型、复杂性和新颖性。开发期间市场审批政策的变化,附加法规或法规的变化,或对每个提交的产品申请的监管审查的变化,都可能导致申请的批准或拒绝的延迟。FDA和其他国家的类似机构在审批过程中有很大的自由裁量权,可以拒绝接受任何申请,也可以决定我们的数据不足以获得批准,需要进行额外的临床前、临床或其他研究。此外,对从临床前和临床试验中获得的数据的不同解释可能会推迟、限制或阻止研究药物的上市批准。我们最终获得的任何营销批准都可能是有限的,或者受到限制或批准后的承诺,从而使批准的产品在商业上不可行。如果FDA咨询委员会或其他监管机构建议不批准或限制批准,可能会导致额外的延迟或不批准。此外,我们可能会遇到由于未来立法或行政行动中的额外政府监管,或者在产品开发、临床试验和审查过程中监管机构政策的变化而导致的延误或拒绝。
监管机构也可以批准比要求的更少或更有限的适应症的信使核糖核酸药物,也可以根据上市后研究的表现批准。此外,监管机构可能不会批准对我们的研究药物成功商业化所必需或可取的标签声明。
FDA和其他监管机构审查监管备案文件中的CMC部分。监管机构发现的任何不令人满意的方面都可能导致临床试验和商业化的延迟。此外,监管机构在签署BLA时进行审批前检查。监管机构的任何发现和不遵守要求可能会导致批准的延迟和潜在的mRNA研究药物的商业化失败。
如果我们在获得批准方面遇到延误,或者如果我们无法获得我们可能开发的任何研究药物的批准,这些研究药物的商业前景将受到损害,我们创造收入的能力将受到实质性损害。
我们的任何研究药物可能永远无法获得EMA或其他外国监管机构的批准,即使我们获得批准,我们也可能永远无法在任何其他司法管辖区将我们的任何研究药物商业化,这将限制我们实现其全部市场潜力的能力。
即使获得美国FDA的批准,也不能确保获得其他国家或司法管辖区监管机构的批准。为了最终在任何特定的外国司法管辖区销售我们的任何研究药物,我们必须在每个司法管辖区建立和遵守关于安全性和有效性的众多和不同的监管要求。此外,在一个国家进行的临床试验可能不会被其他国家的监管机构接受,一个国家的监管批准并不能保证任何其他国家的监管批准。审批流程因国家而异,可能涉及额外的产品测试和验证以及额外的行政审查期。
寻求外国监管机构的批准可能会给我们带来困难和成本,并需要额外的临床前研究或临床试验,这可能是昂贵和耗时的。各国的监管要求可能有很大差异,可能会推迟或阻止我们的产品在这些国家推出。外国监管机构的审批过程涉及与FDA审批相关的所有风险。我们没有任何研究药物被批准在任何司法管辖区销售,包括国际市场,我们也没有在国际市场获得监管批准的经验。如果我们未能遵守国际市场的监管要求,或未能获得和保持所需的批准,或者如果国际市场的监管批准被推迟,我们的目标市场将会减少,我们实现产品全部市场潜力的能力将无法实现。
我们计划的临床试验或我们的战略合作伙伴的试验可能会揭示我们的临床前或非临床研究中未见的重大不良事件,并可能导致安全状况,可能会推迟或终止临床试验,或推迟或阻止监管部门批准或阻止我们的任何研究药物获得市场接受。
在进行临床试验的药物类别中,候选产品通常有极高的流失率。尽管这些候选产品在非临床研究和初步临床试验中取得了进展,但在临床试验的后期阶段可能无法显示出预期的安全性和有效性。生物制药行业的一些公司在后期临床试验中遭受了重大挫折,尽管在早期试验中取得了令人振奋的结果,但由于缺乏疗效或安全性状况不可接受。大多数开始临床试验的研究药物从未作为产品获得批准,也不能保证我们目前或未来的任何临床试验最终会成功或支持我们任何研究药物的进一步临床开发。
69
目录表
我们的一些研究药物是与其他开发疗法或批准的药物共同开发或打算联合使用的。例如,我们与默克公司合作的PCV研究药物(mRNA-4157)和我们的KRAS研究药物(mRNA-5671)可能与默克公司的抗PD-1疗法Pembrolizumab联合使用。我们与阿斯利康合作开发的IL-12研究药物(MEDI1191)正在与检查点抑制剂(例如,抗PD-L1、抗CTLA4)联合使用。这些组合可能会有额外的副作用。将我们的研究药物与其他疗法结合使用所产生的不确定性,可能会使我们很难在未来的临床试验中准确预测副作用。
我们的一些开发候选药物和研究药物是为十八岁以下的青少年和/或儿科患者开发或预期的。例如,我们开放了临床试验地点,并已招募了一名患者加入我们的MMA开发候选药物(mRNA-3704),在1至18岁患者中进行首次人体1/2期试验。如果成功给药,这些将是我们向十八岁或以下受试者提供的第一种研究药物,而mRNA-3704将是我们从系统性细胞内治疗模式中在人体中给药的第一种研究药物。首次向年轻人类受试者接种我们的系统性细胞内治疗模式的研究药物所产生的不确定性使得很难准确预测是否会观察到重大不良事件或其他副作用。
我们的大多数研究药物都是在LNP中配方和给药的,当给药时,可能会导致与LNP的成分相关的系统性副作用,其中一些可能以前没有在人体上进行过测试。虽然我们继续优化我们的LNPs,但不能保证我们的LNPs不会产生不良影响。我们的LNPs可以全部或部分地促进以下一种或多种反应:免疫反应、输液反应、补体反应、调理反应、抗体反应或对聚乙二醇胺的反应。我们研究药物的某些方面可能会引发来自mRNA或脂质的免疫反应,以及肝脏途径内的不良反应或mRNA或LNP的降解,其中任何一种都可能在我们的一项或多项临床试验中导致重大不良事件。许多这些类型的副作用已经在以前开发的LNPs中看到过。任何此类不良事件的根本原因都可能存在不确定性,这将使我们很难在未来的临床试验中准确预测副作用,并将导致我们的计划显著延迟。
如果在我们当前或未来的任何临床试验中观察到重大不良事件或其他副作用,我们可能难以招募任何临床试验的试验参与者,试验参与者可能会退出试验,或者我们可能被要求完全放弃一个或多个开发候选药物或研究药物的试验或我们的开发工作。我们、FDA或其他适用的监管机构,或IRB,可以出于各种原因(包括认为此类试验的参与者面临不可接受的健康风险或不良副作用),在任何时候强制暂停或暂停或终止研究药物的临床试验。生物技术行业开发的一些潜在疗法最初在早期试验中显示出治疗前景,但后来被发现会产生副作用,阻碍它们的进一步发展。即使副作用不妨碍药物获得或维持上市批准,不利的效益风险比率也可能会抑制市场对批准产品的接受,因为它与其他疗法相比具有耐受性。任何这些事态的发展都可能对我们的业务、财务状况和前景造成实质性的损害。
即使我们获得了研究药物的监管批准,我们的产品仍将受到监管审查。
即使我们获得了司法管辖区的监管批准,适用的监管机构仍可能对我们产品的指定用途或营销施加重大限制,或对可能代价高昂的审批后研究或上市后监督施加持续要求。例如,批准的BLA的持有者有义务监测和报告不良事件以及产品不符合BLA中的规格的任何故障。经批准的BLA的持有者还必须提交新的或补充的申请,并获得FDA的批准,以对经批准的产品、产品标签或制造工艺进行某些更改。除其他可能适用的联邦和州法律外,广告和促销材料必须符合FDA的规定,并接受FDA的审查。
如果在我们的任何研究药物获得批准后,我们未能遵守适用的监管要求,监管机构可以:
• | 发出警告信,声称我们违反了法律; |
• | 寻求禁制令或施加民事或刑事处罚或罚款; |
• | 暂停或撤销监管批准或吊销许可证; |
• | 暂停任何正在进行的临床试验; |
• | 拒绝批准我们提交的悬而未决的BLA或补充BLA; |
• | 扣押产品;或 |
70
目录表
• | 拒绝允许我们签订供应合同,包括政府合同。 |
政府对涉嫌违法的任何调查都可能需要我们花费大量时间和资源来回应,并可能产生负面宣传。上述任何事件或处罚的发生可能会抑制我们将任何经批准的产品商业化并创造收入的能力。
如果我们的任何研究药物引起不良副作用,可能会推迟或阻止其监管批准,限制商业潜力,或在任何潜在的上市批准后导致重大负面后果。我们可能开发的研究药物可能与免疫不良反应或其他严重不良事件、不良副作用或意想不到的特征有关。除了我们的任何一种研究药物引起的严重不良事件或副作用外,给药过程或相关程序也可能导致不良副作用。如果发生任何此类事件,我们任何研究药物的临床试验都可能被暂停或终止。
如果将来我们无法证明这些不良事件是由我们的研究药物以外的因素引起的,FDA、EMA或其他监管机构可以命令我们停止进一步开发或拒绝批准我们的任何或所有靶向适应症的任何研究药物。即使我们能够证明所有未来的严重不良事件都不是与产品相关的,此类事件也可能影响患者招募或入选试验参与者完成试验的能力。此外,如果我们选择或被要求推迟、暂停或终止我们任何研究药物的任何临床试验,这些研究药物的商业前景可能会受到损害,我们从任何这些研究药物创造产品收入的能力可能会被推迟或取消。这些事件中的任何一种都可能损害我们识别和开发研究药物的能力,并可能严重损害我们的业务、财务状况、运营结果和前景。
此外,如果我们成功地获得了研究药物的监管批准,FDA或其他监管机构可能会要求我们采用风险评估和缓解策略,以确保使用此类研究药物治疗的好处大于对每个潜在患者的风险,其中可能包括概述产品分发给患者的风险的药物指南、面向医疗从业者的沟通计划、广泛的患者监控,或高度受控、限制性较高且成本高于该行业典型的分销系统和流程。此外,如果我们或其他人后来发现我们开发的任何产品造成的不良副作用,可能会导致几个潜在的重大负面后果,包括:
• | 监管部门可以暂停、撤销对该产品的审批或者吊销许可证; |
• | 监管部门可能要求在标签上附加警告; |
• | 我们可能被要求改变产品的给药方式或进行额外的临床试验; |
• | 我们可能会因对患者及其子女造成的伤害而被起诉并承担责任;以及 |
• | 我们的声誉可能会受损。 |
这些事件中的任何一个都可能阻止我们实现或保持市场对我们可能确定和开发的任何产品的接受程度,并可能对我们的业务、财务状况、运营结果和前景产生重大不利影响。
如果我们的任何一种研究药物成功获得批准,我们将继续面临对我们产品的制造和分销的严格监管。产品制造商及其设施必须缴纳使用费,并接受FDA和其他监管机构的持续审查和定期检查,以确保遵守cGMP和遵守《BLA》中所作的承诺。如果我们或监管机构发现一种产品存在以前未知的问题,如意外严重性或频率的不良事件,或该产品的制造设施存在问题,监管机构可能会对该产品或该制造设施施加限制,包括要求将该产品召回或从市场上撤回或暂停生产。
我们创造产品收入的能力取决于我们的一个或多个候选开发药物或研究药物的成功,每一种药物都处于开发的早期阶段,在我们寻求上市批准和开始商业销售之前,将需要大量额外的开发和临床测试。
我们创造产品收入的能力高度依赖于我们或我们的战略合作伙伴开发、获得监管机构批准并成功将我们的一个或多个开发候选药物或研究药物商业化的能力。我们的开发候选药物和研究药物处于开发的早期阶段,需要在我们打算销售产品的每个司法管辖区进行额外的临床和非临床开发、监管审查和批准。此外,在我们能够从产品销售中获得任何收入之前,我们将需要大量投资、获得足够的商业制造能力以及大量的营销努力。在获得监管部门批准销售我们的研究药物之前,我们必须进行广泛的临床试验,以证明
71
目录表
研究药物在人体上的安全性和有效性。我们不能确定我们的任何研究药物在临床试验中是否会成功,即使它们在临床试验中成功,也可能得不到监管部门的批准。即使获得批准,我们的研究药物也需要证明健康经济效益,以便确定定价和报销。我们可能还需要在批准后的环境中对安全和健康结果进行额外的评估。
与我们的研发候选药物的制造、研究药物和我们未来的流水线有关的风险
我们的信使核糖核酸开发候选药物和研究药物基于新技术,而我们开发的任何开发候选药物和研究药物可能都很复杂,很难制造。我们可能会在制造、产品发布、保质期、测试、储存、供应链管理或运输方面遇到困难。如果我们或我们的任何第三方制造商遇到这样的困难,我们为临床试验或任何经批准的产品提供材料的能力可能会被推迟或停止。
我们的开发候选药物和研究药物的制造工艺是新颖和复杂的。到目前为止,还没有以这种规模商业化或生产的信使核糖核酸药物。由于这项技术的新颖性和在更大规模生产中的有限经验,我们可能会在制造、产品发布、保质期、测试、储存、供应链管理或运输方面遇到困难。这些困难可能是由许多原因造成的,包括但不限于更大规模生产的复杂性、设备故障、原材料和辅料的选择和质量、分析测试技术和产品不稳定。为了优化产品功能,我们过去已经并可能在未来对我们的开发候选药物或研究药物的生产和稳定性配方和条件进行更改。这在过去导致并可能在未来导致我们不得不为临床前或临床活动重新补给批次,当产品在储存期间稳定性不足和供应不足时。我们的开发候选药物和研究药物的稳定性或保质期不足,可能会严重推迟我们或我们的战略合作伙伴继续该开发候选药物或研究药物的临床试验的能力,或者由于需要制造额外的临床前或临床供应而需要我们开始使用新配方药物产品进行新的临床试验。
我们的创新率很高,这已经并将继续导致高度的技术变革,这可能会在临床开发期间和之后对产品的可比性产生负面影响。此外,技术变化可能会推动对新制造基础设施的更改、修改或采购的需求,或者可能对第三方关系产生不利影响。
产生包裹在LNPs中的信使核糖核酸研究药物的过程是复杂的,如果不在良好控制的条件下开发和制造,可能会对药理活性产生不利影响。此外,我们还没有商业化生产信使核糖核酸药物。我们在扩大生产过程中可能会遇到困难,从而潜在地影响临床和商业供应。
我们正在扩大我们的批量,以适应我们一些项目的临床供应需求。然而,在许多情况下,我们可能需要使用多个批次的药物物质和药物产品来满足单个临床试验的临床供应需求。我们无法扩大批次规模或任何批次的失败都可能导致我们的临床试验大幅延迟。
随着我们继续为我们的药物物质和药物产品开发新的制造工艺,我们对制造工艺的改变可能反过来影响药物产品的规格和稳定性。我们生产工艺的改变可能会导致批次失败,这可能会导致我们的临床试验大幅延迟。我们的信使核糖核酸研究药物可能被证明具有稳定性,导致最终批准的信使核糖核酸药物的货架期低于预期。这带来了供应需求、浪费库存和更高的商品成本方面的风险。
我们依赖于一些设备供应商,他们也在实施新技术。此外,我们还为我们的某些研究药物开发了自己的定制制造设备。如果此类设备发生故障或遇到意想不到的性能问题,我们可能会遇到临床和商业供应的延迟或中断。由于不同计划的数量不同,我们可能会在工厂、CRO、供应商或诊所内的产品中交叉污染,从而影响我们产品的完整性。
随着我们扩大特定项目的生产产量,我们计划通过商业发布不断提高来自IND支持研究的开发候选物的产率、纯度和药学性质,包括保质期稳定性以及制剂和原料药的溶解度性质。由于制造流程的持续改进,我们可能会在开发期间为特定程序切换流程。然而,工艺变更后,需要更多时间进行药物性质测试,例如6个月或12个月的稳定性测试。这可能需要在完成此类药物性质测试之前重新供应临床材料或生产额外的GMP批次,以满足临床试验需求。
72
目录表
我们正在利用一些原料和辅料,这些原料和辅料只有一个供应来源,对制药行业来说是新的,并且正在以一种新的方式使用。其中一些原材料和辅料尚未扩大到支持商业供应的水平,可能会遇到意想不到的制造或测试失败,或供应短缺。原料和辅料的这种问题可能会导致我们研究药物的临床和商业供应延迟或中断。
我们已经建立了一些分析化验,可能还需要建立更多的分析化验,以评估我们的信使核糖核酸研究药物的质量。我们可能会找出分析测试策略中可能阻止产品发布或可能要求产品撤回或召回的漏洞。例如,我们可能会发现对产品安全性、有效性或稳定性有影响的新杂质。这可能导致在生产或测试过程得到纠正之前无法释放mRNA研究药物。
我们的产品和产品中间体对温度非常敏感,我们可能会了解到我们的任何或所有产品的稳定性都不如预期。我们还可能发现,运输条件对产品质量有负面影响。这可能需要改变我们一种或多种研究药物的配方或制造工艺,并导致临床或商业供应的延迟或中断。此外,与这种运输服务相关的成本和有限的供应商群体也可能增加供应中断的风险。
随着我们药物开发渠道的增加和成熟,我们的设施和第三方对临床和商业供应的需求增加,可能会影响我们的运营能力。我们将需要增加我们整个供应链的产能。此外,我们依赖许多服务提供商,包括那些提供制造或测试服务的服务提供商,所有这些服务提供商的运营都存在可能对我们的运营产生不利影响的内在风险。
我们目前利用并预计将继续利用第三方来制造原材料、部件、零部件和消耗品,并进行质量测试。如果mRNA和其他核酸药物的领域继续扩大,我们可能会遇到对这些材料和服务的日益激烈的竞争。对第三方制造或测试设施的需求可能会以高于其现有产能的速度增长,这可能会扰乱我们寻找和保留能够生产足够数量的此类原材料、组件、零部件和消耗品的第三方制造商的能力,这些原材料、部件和消耗品是生产我们的mRNA研究药物所需的。使用服务提供商和供应商可能使我们面临风险,包括但不限于:
• | 终止或不续签与第三方的供应和服务协议,其方式或时间对我们造成成本或损害; |
• | 与我们的业务或运营无关的条件,包括供应商或服务提供商的破产,导致这些供应商和服务提供商的运营中断;以及 |
• | 监管机构对第三方设施的检查可能会产生负面结果,并导致他们延迟或终止满足我们要求的能力。 |
我们在内部制造设施和外部服务提供商的物理和数字基础设施方面都面临着与监管和运营相关的风险。
2018年,我们在马萨诸塞州诺伍德建成了新的制造设施-Moderna技术中心,其中包括用于生产药物和药品的cGMP。虽然该设施的设计是基于生物技术设施的现行标准,但它没有经过任何监管机构的审查或预先批准,也没有经过FDA等任何监管机构的检查。我们最近才开始在MTC生产药物物质和药物产品,供我们的临床前和临床使用。我们可能会在实施设施的全面运营状态方面出现延误,导致临床供应的延误或第三方服务提供商的延长使用,从而导致计划外费用。在建造MTC设施的过程中,我们已经产生了大量支出,预计未来在验证和运营该设施时还将产生大量额外支出。
我们设计的MTC将设备的自动化程度与几个数字系统的集成结合在一起,以提高运营效率。我们试图实现临床制造设施相对于行业标准的高水平数字化。虽然这意在提高运营效率,但由于内部或外部因素,包括但不限于设计问题、系统兼容性或潜在的网络安全漏洞,这可能会带来工艺设备故障的额外风险,甚至整个制造系统故障或停机。这可能会导致我们工厂的供应延迟或关闭。我们在MTC的制造能力的任何中断都可能导致我们的药物物质或药物产品产能的延迟,增加额外的成本,或者可能需要我们识别、鉴定和建立替代生产地点,如果发生这种情况,可能会对我们的业务、财务状况、运营结果和前景产生实质性的不利影响。
73
目录表
随着我们扩大开发和商业能力,我们可能会在MTC足迹内建立额外的制造能力,或者扩展到其他地点或地区,这可能会导致监管延迟或成本高昂。如果我们不能选择正确的地点,以有效的方式完成建设,招聘所需的人员,并总体上有效地管理我们的增长,我们的研究药物的开发和生产可能会延迟或减少。如果我们制造工艺的变化导致MTC的基础设施发生必要的变化,可能需要额外的投资。
药品生产运营中存在固有的风险,这些风险可能会影响我们的能力以及第三方制造商或代工组织满足我们的交货要求或提供足够数量材料的能力。
工艺和分析技术、原材料、耗材、设备、物理基础设施(包括洁净室环境)以及空气处理和其他公用事业的融合导致了复杂的程序和系统,这些程序和系统必须有效地工作才能生产我们的研究药物。我们的制造设施或第三方供应商的任何相关系统中的故障或工艺缺陷都可能对我们制造和供应研究药物的能力产生不利影响。
我们的研究药物对运输和储存条件天生敏感,在某些情况下,这需要冷链物流,并可能使我们的研究药物面临丢失或损坏的风险。
我们的研究药物对温度、储存和搬运条件都很敏感。如果产品或产品中间体储存或处理不当,可能会造成研究药物的损失。我们研究药物的保质期可能因产品不同而不同,不能完全量化,预计可能是可变的,而且我们的研究药物可能会因使用前过期而丢失。我们的某些研究药物需要冷链物流。如果我们没有有效地维护我们的冷链供应物流,那么我们可能会遇到数量异常的退货或过期产品。
我们或第三方未能有效维护我们的冷链供应物流,这在过去和未来都可能导致额外的制造成本,以及我们为临床试验或其他方面供应所需数量的能力的延迟。
*我们在生产我们的信使核糖核酸研究药物方面受到严格的监管。我们的制造设施或我们的第三方制造商或供应商的制造设施可能不符合监管要求。未能满足FDA、EMA和其他全球卫生当局颁布的法规中规定的cGMP要求,可能会导致我们产品的重大延误和成本。
用于临床试验或商业销售的疫苗和治疗药物的制造受到广泛的监管。经批准用于商业用途或用于临床试验的成品的成分必须按照cGMP要求生产。这些规定管理生产过程和程序,包括记录保存,以及质量体系的实施和运行,以控制和确保临床试验中使用的产品和材料的质量。对cGMP生产过程的糟糕控制可能会导致产品质量故障,从而影响我们的产品供应能力,导致成本超支和临床时间表的延误,这可能是广泛的。此类生产工艺问题包括但不限于:
• | 制造过程中的严重偏差; |
• | 设施和设备故障; |
• | 由于无效的质量控制策略导致的产品污染; |
• | 由设施和公用设施环境监测计划评估的设施污染; |
• | 工艺、设备或分析变更管理无效,导致批次放行标准不合格; |
• | 由于供应商资质无效或关键供应商的法规遵从性问题导致的原材料故障; |
• | 产品稳定性差; |
• | 未通过批次放行或设施和公用设施质量控制测试; |
• | 为纠正或避免重大偏差而采取的无效纠正措施或预防措施,这是因为我们随着规模的扩大对制造过程的理解不断加深;以及 |
• | 部件或耗材出现故障或缺陷。 |
我们必须及时提供所有必要的文件,以支持BLA或其他营销授权申请,并必须遵守FDA、EMA和其他国家/地区的cGMP要求,对于FDA来说,部分是通过其设施检查计划来执行的。
74
目录表
监管机构通常要求有代表性的制造现场检查,以评估是否符合备案文件中描述的cGMP和制造控制措施。如果我们或我们的某个第三方生产基地未能提供足够的质量保证或控制,则可能不会批准产品商业化。监管机构可以在产品开发或商业化阶段的任何时候进行检查。检查可以是针对特定产品的,也可以针对针对更广泛的cGMP检查的特定设施,或者作为监管机构可能发现的市场或开发问题的后续行动。有缺陷的检验结果可能会影响我们的第三方制造商或供应商履行其供应义务的能力,从而影响或延迟供应或延迟计划。
我们可能开发的任何产品的制造过程都要经过FDA和外国监管机构的批准程序,我们可能需要与我们认为能够持续满足适用的FDA和外国监管机构要求的制造商签订合同。如果我们或我们的第三方制造商无法可靠地生产符合FDA或其他监管机构可接受的规格的研究药物,我们或我们的战略合作伙伴可能无法获得或维持我们或他们将此类产品商业化所需的批准。即使我们或我们的战略合作伙伴对我们的任何一种信使核糖核酸药物获得监管批准,也不能保证我们或我们的合同制造组织能够按照FDA或其他监管机构可接受的规格生产批准的药物,生产足够数量的药物以满足可能推出的产品的要求,或满足未来的潜在需求。这些挑战中的任何一项都可能会推迟临床试验的完成,需要过渡临床试验或重复一项或多项临床试验,增加临床试验成本,推迟我们研究药物的批准,损害商业化努力,或增加我们的商品成本。上述任何一种情况的发生都可能对我们的业务、财务状况、经营结果和前景产生不利影响。
此外,我们可能无法直接控制我们的合同制造商保持足够的质量控制、质量保证和合格人员的能力。此外,我们所有的合同制造商都与其他公司合作,为这些公司供应或制造材料或产品,这使我们的合同制造商在生产此类材料和产品时面临监管风险。因此,如果不能满足生产这些材料和产品的监管要求,通常会影响我们合同制造商工厂的监管地位。此外,在我们依赖外国合同制造商的程度上,包括mRNA-1273,我们正在或将受到额外风险的影响,包括需要遵守进出口法规。我们或我们的第三方制造商未能遵守适用的法规,可能会导致对我们实施制裁,包括临床封存、罚款、禁令、民事处罚、延迟、暂停或撤回批准、吊销执照、没收或召回研究药物或产品、操作限制和刑事起诉,其中任何一项都可能对我们的产品和研究药物(包括我们的战略合作伙伴)的供应和我们的整体业务运营产生重大不利影响。我们未来可能依赖他人生产我们的研究药物和原材料,这可能会对我们未来的利润率和我们将任何及时和具有竞争力的获得监管批准的产品商业化的能力产生不利影响。
FDA、EMA和其他外国监管机构可能会要求我们在任何时间提交任何批次的批准产品的产品样本以及显示适用测试结果的协议。在某些情况下,FDA、EMA或其他外国监管机构可能会要求我们在相关机构授权之前不得分发大量或多个此类产品。制造过程中的偏差,包括那些影响质量属性和稳定性的偏差,可能会导致产品发生不可接受的变化,从而导致批量故障或产品召回。我们的第三方合同制造商过去曾经历过批量失败,其中一些可能经历过产品召回。过去,批次故障曾导致我们自己的工厂或第三方制造商生产的产品在未来发生批次故障或产品召回,这可能会导致我们和我们的战略合作伙伴推迟临床试验或产品发布,这可能会给我们带来高昂的成本,否则会损害我们的业务、财务状况、运营结果和前景。
我们还可能遇到雇用和留住操作我们的制造流程和运营所需的经验丰富的科学、质量控制和制造人员的问题,这可能会导致生产延迟或难以保持遵守适用的法规要求。虽然我们将针对产品和材料的适当处理对所有人员进行培训和资格认证,但我们可能无法控制或最终检测到任何员工或承包商的故意破坏或疏忽。
某些研究药物特有的风险
我们的PCV研究药物是使用新的、复杂的制造工艺为每个患者独特地制造的,我们在生产中可能会遇到困难。
我们定制设计和制造独特的PCV,并专门为每个患者量身定做。由于以下问题,制造大量独特的PCV容易造成产品损失或故障:
• | 与采集患者的肿瘤、血液或其他组织样本相关的后勤工作; |
75
目录表
• | 将这些样本运送到一个设施进行基因测序; |
• | 肿瘤基因的下一代测序; |
• | 确定适当的肿瘤特异性突变; |
• | 使用软件程序,包括专有和开源组件,托管在云中和我们研究医学的一部分,以帮助设计特定于患者的mRNA,该软件必须得到维护和保护; |
• | 有效设计编码所需新抗原的患者特异性信使核糖核酸; |
• | 由于每个患者特定批次的独特性而出现的可能未预见到的特定批次制造故障或问题; |
• | 质量控制检测不合格; |
• | 放在稳定性上的批次意外失败; |
• | 来自第三方供应商的一次性组件、耗材或关键部件的短缺或质量控制问题,必须针对每个患者特定的批次进行更换; |
• | 与个性化制造相关的巨大成本,这可能对我们继续发展的能力产生不利影响; |
• | 成功和及时地生产和发放针对患者的特定批次; |
• | 在将批次运送到病人护理现场的过程中遇到的运输问题;以及 |
• | 当每个参与者接种一种独特的疫苗时,在给定剂量下定义一致的安全概况的能力。 |
我们已经为PCV建造并安装了定制制造设备,这些设备已被纳入MTC的个性化疫苗单元。该装置目前正在运行,我们正在从我们的位置和第三方供应商的位置生产批量的PCV。该设备可能无法按设计工作,这可能会导致正在生产的药物产品出现偏差。这可能会导致更多的批次不合格,以及无法供应参加临床试验的患者。如果我们的临床开发计划扩大,由于设备和一次性使用组件的定制性质,我们可能无法在没有大量投资的情况下可靠地满足这种扩大的需求。此外,如果我们的PCV产品获得批准,我们将有相当长的时间来扩大我们的设施或建造新的设施,然后我们才能开始满足任何商业需求。这种新设施的扩建或增加还可能导致产品可比性问题,从而进一步推迟新产能的引入。
因为我们的PCV是为每个患者制造的,所以我们将被要求保持与每个患者的组织样本、从这些组织样本获得的序列数据、这些患者的基因组分析结果以及为每个患者定制的产品的身份链。维护这样的身份链是困难和复杂的,如果不这样做,在过去和未来可能会导致产品混淆、患者不良后果、产品损失或监管行动,包括从市场上撤回任何批准的产品。此外,随着我们的PCV研究药物从早期临床试验发展到后期临床试验,走向批准和商业化,我们预计复杂的收集、分析、制造和传递过程的多个方面将进行修改,以努力优化过程和结果。这些变化可能达不到预期的目标,任何这些变化都可能导致我们的PCV表现与我们预期的不同,从而潜在地影响临床试验的结果。
与我们依赖第三方相关的风险
我们过去曾与第三方结成战略联盟,未来也可能结成战略联盟,以开发研究药物。如果这些战略联盟不成功,我们的业务可能会受到不利影响。
我们进行临床手术的资源有限,还没有建立销售、营销或分销的基础设施。因此,我们已经建立了战略联盟,我们的战略合作伙伴已经并可能在未来为我们的研究药物的开发和潜在的商业化提供资金和其他资源。我们希望在未来加入更多的战略联盟,以获得更多的资金、能力和专业知识。我们现有的战略联盟以及我们未来加入的任何战略联盟都可能带来一些风险,包括:
• | 战略合作者可能未按预期履行其义务; |
• | 作为这种战略联盟的一部分进行的临床试验可能不会成功; |
• | 战略合作者不得寻求任何获得监管批准的研究药物的开发和商业化,或者可以基于临床试验结果、战略合作者重点或可用资金的变化或外部因素(如收购)选择不继续或更新开发或商业化计划; |
• | 战略合作者可以推迟临床试验,为临床试验提供足够的资金,停止临床试验,放弃一种研究药物,重复或进行新的临床试验,或要求一种用于临床测试的研究药物的新配方; |
• | 如果战略合作者认为有竞争力的产品更多,则战略合作者可以独立开发或与第三方开发与我们的研究药物直接或间接竞争的产品 |
76
目录表
有可能在比我们更具经济吸引力的条件下成功开发或商业化;
• | 与我们的战略联盟开发的研究药物可能被我们的战略合作伙伴视为与他们自己的研究药物或产品竞争,这可能导致战略合作伙伴停止为我们的研究药物的开发或商业化投入资源; |
• | 拥有我们一种或多种研究药物的营销和分发权并获得监管批准的战略合作伙伴可能没有投入足够的资源来营销和分销任何此类产品; |
• | 与战略合作伙伴的分歧,包括在专利权、合同解释或任何研究药物的首选开发过程上的分歧,可能导致此类研究药物的研究、开发或商业化的延迟或终止,可能导致我们对此类研究药物承担额外责任,或者可能导致诉讼或仲裁,其中任何一项都将是耗时和昂贵的; |
• | 战略合作伙伴可能无法正确维护或捍卫我们的知识产权,或可能以某种方式使用我们的专有信息,从而招致可能危及或使我们的知识产权或专有信息无效或使我们面临潜在诉讼的诉讼; |
• | 在根据我们的战略联盟开发的知识产权的所有权方面可能会出现争议; |
• | 战略合作者可能会侵犯第三方的知识产权,这可能会使我们面临诉讼和潜在的责任; |
• | 为了战略合作伙伴的方便,可能会终止战略联盟,如果终止,我们的研究药物的开发可能会被推迟,我们可能需要筹集额外的资金来进一步开发适用的研究药物或将其商业化; |
• | 未来的关系可能要求我们承担非经常性费用和其他费用,增加我们的近期和长期支出,发行稀释我们现有股东的证券,或扰乱我们的管理和业务; |
• | 在寻找合适的战略合作伙伴方面,我们可能面临激烈的竞争,谈判过程既耗时又复杂;以及 |
• | 通过未来的任何合作、收购或合资,我们的国际业务可能会使我们面临某些在美国没有遇到的运营、法律和其他风险。 |
如果我们的战略联盟没有导致项目的成功开发和商业化,或者如果我们的战略合作伙伴之一终止了与我们的协议,我们可能不会获得任何未来的研究资金或战略联盟项下的里程碑、收益、特许权使用费或其他或有付款。如果我们得不到根据这些协议我们预期的资金,我们的研究药物的开发可能会被推迟,我们可能需要额外的资源来开发我们的研究药物。此外,为了方便起见,我们的战略合作伙伴一般有权终止与我们的协议。一家战略合作伙伴过去曾终止与我们的协议。如果我们的一个战略合作伙伴终止了与我们的协议,我们可能会发现更难吸引新的战略合作伙伴,我们在商业和金融界的形象可能会受到不利影响。本季度报告Form 10-Q中描述的与产品开发、监管审批和商业化相关的所有风险均适用于我们的战略合作伙伴的活动。
我们的战略合作伙伴控制着我们的临床试验、监管活动和我们战略联盟的其他方面,这可能会导致我们拟议产品的开发和商业化过程中的延迟和其他障碍,并对我们的运营结果造成实质性损害。
对于一些项目,我们依赖战略合作伙伴为我们的研究药物设计和进行临床试验。因此,我们可能无法控制进行这些临床试验的方式或时间安排,这可能会对我们的业务运营产生负面影响。此外,如果我们的任何战略合作伙伴撤回对我们的一个或多个计划或提议的产品的支持,或以其他方式损害他们的发展,我们的业务可能会受到负面影响。
我们可能会寻求建立更多的战略联盟,如果我们不能以商业上合理的条件建立这些联盟,我们可能不得不改变我们的开发和商业化计划。我们的某些战略联盟协议可能会限制我们开发某些产品的能力。
我们的开发计划以及我们的开发候选药物和研究药物的潜在商业化将需要大量额外的现金来支付费用。对于我们的一些研究药物,我们可能决定与制药和生物技术公司合作,开发这些研究药物并可能实现商业化。
我们在寻找合适的战略合作伙伴方面面临着激烈的竞争。我们是否就任何额外的战略联盟达成最终协议将取决于我们对战略合作者的资源和专业知识的评估、拟议的战略联盟的条款和条件,以及拟议的战略合作者对许多因素的评估。这些因素可能包括临床试验的设计或结果、FDA批准的可能性或
77
目录表
美国以外的类似监管机构,研究对象药物的潜在市场,制造和向试验参与者提供此类研究药物的成本和复杂性,竞争药物的潜力,我们对技术所有权的不确定性,如果在不考虑挑战的是非曲直的情况下对这种所有权提出挑战,以及一般的行业和市场条件。战略合作伙伴还可以考虑可供合作的类似适应症的替代研究药物或技术,以及这样的合作是否会比我们与我们的研究医学合作更具吸引力。我们可能建立的任何额外战略联盟或其他安排的条款可能对我们不利。
根据我们现有的战略联盟协议,我们也受到限制,不能以某些条款与潜在的战略合作伙伴签订某些未来协议,以追求我们自己的其他目标。这些对靶标、多肽、给药途径和领域的工作限制可能会限制我们与未来的战略合作伙伴进行战略合作或追求某些潜在的有价值的开发候选药物或研究药物的能力。
我们可能无法在及时、有利的条件下谈判更多的战略联盟,甚至根本无法谈判。战略联盟的谈判和记录既复杂又耗时。如果我们无法谈判并达成新的战略联盟,我们可能不得不削减我们正在寻求合作的研究药物的开发,减少或推迟其开发计划或我们的一个或多个其他开发计划,推迟其潜在的商业化或缩小任何销售或营销活动的范围,或者增加我们的支出,并自费进行开发或商业化活动。如果我们选择增加我们的支出,为我们自己的开发或商业化活动提供资金,我们可能需要获得额外的资本,这些资本可能无法以优惠的条件提供给我们,或者根本无法获得。如果我们没有足够的资金,我们可能无法进一步开发我们的研究药物,或者将它们推向市场并产生产品收入。
我们依赖单一来源的供应商提供我们的开发候选药物和研究药物所使用的一些组件和材料,以及开发所需的程序。
我们目前依赖单一来源的供应商提供开发候选药物和研究药物所需的一些组件和材料,以及开发所需的制造工艺。我们不能确保这些供应商或服务提供商将继续经营,有足够的能力或供应来满足我们的需求,也不能确保它们不会被我们的竞争对手或其他不想继续与我们合作的公司购买。我们使用原材料、零部件、关键工序和成品的单一来源供应商,使我们面临几个风险,包括供应中断、价格上涨或延迟交货。一般来说,替代部件的替代供应来源相对较少。这些供应商可能无法或不愿意满足我们未来对临床试验或商业销售的需求。为这些部件、材料和工艺建立额外的或替换的供应商可能需要大量的时间,而且可能很难建立符合法规要求的替换供应商。来自任何单一来源供应商或服务提供商的任何供应中断都可能导致供应延迟或中断,这将损害我们的业务、财务状况、运营结果和前景。
如果我们不得不更换供应商,我们的研发候选药物或研究药物的制造和交付可能会中断很长一段时间,这可能会对我们的业务产生不利影响。如果需要,为我们的研究药物中使用的任何成分或工艺建立额外的或替代的供应商可能不会很快完成。如果我们能够找到替代供应商,替代供应商将需要合格,并可能需要额外的监管机构批准,这可能会导致进一步的延误。虽然我们寻求保持我们产品中使用的单一来源组件和材料的充足库存,但组件或材料供应的任何中断或延迟,或者我们无法以可接受的价格从替代来源获得组件或材料,都可能会削弱我们满足研究药物需求的能力。
此外,作为FDA批准我们的研究药物的一部分,我们还将要求FDA审查我们过程中的各个组件,其中包括我们的单一来源供应商的制造工艺和设施。
我们对这些供应商、服务提供商和制造商的依赖使我们面临一系列风险,这些风险可能损害我们的声誉、业务和财务状况,其中包括:
• | 推迟我们的开发候选药物或研究药物的开发时间表; |
• | 因供应商业务变更或中断而造成的供应中断; |
• | 因未纠正的缺陷、可靠性问题或供应商在部件上的变化而导致的产品发货延迟; |
• | 与我们的供应商缺乏关键部件的长期供应安排; |
• | 无法及时获得足够的供应,或无法以商业上合理的条件获得足够的供应; |
• | 及时为我们的部件寻找和确定替代供应商的难度和成本; |
• | 与评估和测试来自替代供应商的部件有关的生产延误,以及相应的监管资格; |
78
目录表
• | 由于我们的供应商优先考虑其他客户的订单而导致交货延迟; |
• | 供应商生产的有缺陷的部件对我们的声誉造成的损害;以及 |
• | 由于我们或其其他客户的需求变化,我们的供应商的交货量出现波动。 |
如果这些风险中的任何一个成为现实,成本可能会大幅增加,我们满足产品需求的能力可能会受到影响。
我们依赖并预计将继续依赖第三方为我们的开发候选药物或研究药物进行研究、临床前研究、方案开发和临床试验。如果这些第三方的表现不令人满意,不遵守监管要求,或在预期的最后期限内完成,我们可能无法获得监管部门对我们的研究药物的批准或将其商业化,我们的业务可能会受到实质性损害。
我们目前依赖并预计将继续依赖第三方,如CRO、临床数据管理组织、医疗机构和临床研究人员来进行我们的临床试验。我们目前依赖并预计将继续依赖第三方进行某些研究和临床前测试活动。在某些情况下,这些第三方可能会终止与我们的雇佣关系。如果我们需要达成替代安排,这将推迟我们的发现或产品开发活动。
我们对这些第三方的研发活动的依赖将减少我们对这些活动的控制,但不会解除我们的监管或合同责任。我们将负责确保我们的每一项临床前研究和临床试验都按照适用的方案、法律和法规要求以及科学标准进行。例如,我们将继续负责确保我们的每一项临床试验都按照试验的总体调查计划和方案进行。此外,FDA要求我们遵守进行、记录和报告临床试验结果的法规,通常称为GCP,以确保数据和报告的结果是可信和准确的,并保护试验参与者的权利、完整性和机密性。我们还被要求在一定的时间范围内注册正在进行的临床试验,并在政府资助的数据库ClinicalTrials.gov上公布完成的临床试验结果。不这样做可能会导致罚款、负面宣传以及民事和刑事制裁。对于我们在进行临床前研究和临床试验期间的任何违反法律和法规的行为,我们可能会受到警告信或执法行动,其中可能包括最高达刑事起诉的民事处罚。
我们和我们的CRO将被要求遵守进行、监测、记录和报告临床前研究和临床试验结果的法规,包括GCP,以确保数据和结果在科学上可信和准确,并确保试验参与者充分了解参与临床试验的潜在风险等。我们还负责确保临床试验参与者的权利得到保护。这些规定由FDA、欧洲经济区成员国的主管当局以及类似的外国监管机构对临床开发中的任何研究药物执行。FDA通过对临床试验赞助商、主要研究人员和试验地点的定期检查来执行GCP规定。如果我们或我们的CRO未能遵守适用的GCP,在我们的临床试验中产生的临床数据可能被认为是不可靠的,FDA或类似的外国监管机构可能会要求我们在批准我们的营销申请之前进行额外的临床试验。我们不能向您保证,在检查后,FDA将确定我们未来的任何临床试验是否符合GCP。此外,我们的临床试验必须使用按照cGMP法规要求生产的研究药物进行。我们的CRO未能或我们的CRO未能遵守这些规定可能需要我们重复临床试验,这将推迟监管批准过程,也可能使我们受到执法行动的影响。
尽管我们打算为我们的某些研究药物设计临床试验,但我们的战略合作伙伴将设计他们管理的临床试验(在某些情况下,使用我们的投入),对于由我们控制的临床试验,我们预计CRO将进行所有临床试验。因此,我们开发计划的许多重要方面,包括它们的实施和时机,都将不在我们的直接控制范围之内。与完全依靠我们自己的员工相比,我们对第三方进行未来临床前研究和临床试验的依赖还将导致对通过临床前研究和临床试验开发的数据管理的直接控制减少。与外部各方的沟通也可能导致错误以及协调活动的困难。外部各方可以:
• | 有人员配备困难; |
• | 不履行合同义务的; |
• | 遇到监管合规问题; |
• | 经历优先顺序的改变或陷入财务困境; |
• | 与其他实体建立关系,其中一些可能是我们的竞争对手; |
• | 有人为错误;或 |
• | 容易受到网络攻击。 |
79
目录表
这些因素可能会对第三方进行我们的临床前研究和临床试验的意愿或能力产生重大不利影响,并可能使我们面临超出我们控制范围的意外成本增加。如果CRO没有以令人满意的方式进行临床前研究和临床试验,违反他们对我们的义务或未能遵守监管要求,我们的研究药物的开发、监管批准和商业化可能会延迟,我们可能无法获得监管批准并将我们的研究药物商业化,或者我们的开发计划可能受到实质性和不可逆转的损害。如果我们无法依赖CRO收集的临床前和临床数据,我们可能需要重复、延长或增加我们进行的任何临床试验的规模,这可能会显著推迟商业化,并需要显著增加支出。
我们还希望依赖其他第三方来运输、储存和分发我们临床试验所需的材料。过去,我们的某些第三方供应商对我们的材料处理不当,导致大量材料全部或部分丢失。这些第三方的任何进一步表现失败都可能导致产品受损,并可能推迟我们可能开发的任何研究药物的临床开发或营销批准,或者如果我们的药物获得批准,则可能导致我们的药品商业化,产生额外的损失并剥夺我们潜在的产品收入,导致我们违约,导致保险无法承保的损失,并损害我们的声誉和我们产品在市场上的整体认知。
与我们的知识产权有关的风险
其他公司或组织可能会挑战我们的专利权,或可能主张阻止我们开发和商业化产品的专利权。
信使核糖核酸药物是一个相对较新的科学领域,其持续发展和潜在用途已导致寻求该领域知识产权保护的组织和个人提出了许多不同的专利和专利申请。我们已经获得了信使核糖核酸药物和我们的给药技术的专利授权和颁发。我们在美国和世界各地拥有的关键市场的已颁发专利和待批专利申请要求与信使核糖核酸药物和我们的递送技术(包括LNPs)的发现、开发、制造和商业化相关的许多不同的方法、成分和工艺。
随着信使核糖核酸疗法和疫苗领域的成熟,世界各地的国家专利局正在处理专利申请。关于哪些专利将颁发,以及如果他们颁发了专利,何时颁发,授予谁,以及要求什么,都存在不确定性。很可能会有重大的诉讼和其他诉讼,如干预、复审和异议诉讼,以及各方间根据2012年9月16日向第三方挑战者开放的《美国发明法》的条款,在与mRNA领域专利权有关的多个专利局中引入了授权后审查程序。我们预计将在欧洲专利局或EPO以及其他与我们投资组合中的专利和专利申请相关的地方提出反对意见。在许多情况下,我们或我们的对手都有上诉的可能性,可能需要数年时间才能在某些司法管辖区对这些专利做出不可上诉的最终裁决。这些和其他诉讼的时间和结果是不确定的,如果我们不能成功地捍卫我们未决和已发布的专利权利要求的专利性和范围,可能会对我们的业务产生不利影响。例如,针对我们的一项美国专利批准了第三方的复审请求,该专利与我们的传染病疫苗计划有关。我们不能确定这样的专利是否会继续存在,或者权利要求是否会保持目前的形式。此外,第三方可能会试图使我们的知识产权无效。即使我们的权利没有受到直接挑战,纠纷也可能导致我们的知识产权被削弱。我们对第三方规避或无效我们知识产权的任何企图的辩护对我们来说可能代价高昂,可能需要我们管理层投入大量时间和精力,并可能对我们的业务和我们在信使核糖核酸治疗领域成功竞争的能力产生实质性的不利影响。
有许多已颁发和正在申请的第三方专利声称寡核苷酸递送技术的某些方面是我们的mRNA治疗和疫苗候选可能需要的。还有许多已颁发的第三方专利声称针对的基因或基因的一部分可能与我们希望开发的信使核糖核酸药物相关。例如,我们知道一项针对使用信使核糖核酸治疗法布里病的方法的第三方专利。此外,可能存在已发布和未决的专利申请,这些专利申请可能会在法庭程序中或以其他方式针对我们提出,因为主张方认为我们可能需要为我们的mRNA治疗候选药物申请此类专利。因此,有可能一个或多个组织将持有我们可能需要许可的专利权,或者持有可能对我们不利的专利权。如果这些组织拒绝以合理条款授予我们此类专利权的许可,或法院裁定我们需要针对我们声称的此类专利权,而我们无法以合理条款获得许可,则我们可能无法进行此类专利所涵盖的研发或其他活动或市场产品。
如果我们卷入专利诉讼或其他与权利确定相关的诉讼,我们可能会招致巨额成本和开支,承担重大损害赔偿责任,或被要求停止我们的产品开发和商业化努力。
80
目录表
我们的商业成功在一定程度上取决于我们避免侵犯第三方的专利和专有权利。在美国国内外,涉及生物技术和制药行业的专利和其他知识产权的诉讼数量很大,包括专利侵权诉讼、干扰、反对、单方面复查,拨款后审查,以及各方间在美国专利商标局或USPTO和相应的外国专利局审查诉讼程序。在我们正在寻求开发候选者的领域中,存在着大量由第三方拥有的美国和外国颁发的专利和未决的专利申请。在某些情况下,我们已经建立,并可能在未来的研究所各方间审查针对已颁发的美国专利的程序,以及针对信使核糖核酸药物领域第三方拥有的欧洲专利的反对程序。我们正在对与RNA疫苗接种和信使核糖核酸传递相关的第三方专利提起多项诉讼。如果我们没有成功地使我们目前正在挑战的某些第三方专利无效,如果我们的某些研究药物获得监管部门的批准,这些第三方可能会试图对我们主张这些专利。随着生物技术和制药行业的扩张和更多专利的颁发,我们的开发候选者可能会受到侵犯第三方专利权的指控的风险增加。
第三方可能会声称我们在未经授权的情况下使用他们的专有技术。可能存在与使用或制造我们的研究药物相关的第三方专利或专利申请,这些专利要求材料、配方、制造方法或治疗方法。由于专利申请可能需要很多年的时间才能发布,因此可能会有当前正在处理的专利申请,这些申请可能会导致我们的研究药物可能会侵犯已颁发的专利。此外,第三方可能会在未来获得专利,并声称我们的技术侵犯了这些专利。如果有管辖权的法院持有任何第三方专利,涵盖我们的任何研究药物的制造过程、制造过程中形成的任何分子或任何最终产品本身,则任何此类专利的持有者可以获得禁令或其他衡平法救济,这可能有效地阻止我们将此类研究药物商业化,除非我们根据适用专利获得许可,或直到该等专利到期。同样,如果有管辖权的法院持有任何第三方专利,涵盖我们的配方、制造工艺或使用方法的方方面面,包括联合疗法,则任何此类专利的持有者可能能够阻止我们开发适用的研究药物并将其商业化,除非我们获得了许可证或该专利到期。在任何一种情况下,这样的许可可能都不会以商业上合理的条款或根本不存在。
对侵权和其他索赔的辩护,无论其是非曲直,都将涉及巨额诉讼费用,并将大量转移我们业务中的员工资源。如果针对我们的侵权索赔成功,我们可能必须支付大量损害赔偿,包括故意侵权的三倍损害赔偿金和律师费、支付版税、重新设计我们的侵权产品或从第三方获得一个或多个许可,这些许可可能无法以商业优惠的条款提供,或者可能需要大量的时间和费用。
此外,此类许可可能是非排他性的,因此,我们的竞争对手可能会获得授权给我们的相同技术。如果我们无法获得所需的许可,并且无法围绕专利进行设计,我们可能无法有效地营销我们的一些技术和产品,这可能会限制我们创造收入或实现盈利的能力,并可能阻止我们产生足够的收入来维持我们的运营。此外,我们预计,我们的一些合作将规定,我们的知识产权许可应支付给我们的版税可能会被我们的合作者支付给在相关领域具有竞争或更高知识产权地位的第三方的金额所抵消,这可能会导致我们通过合作开发的产品的收入大幅减少。
此外,对于某些许可和战略联盟协议,我们已同意就与知识产权或协议标的相关的诉讼所产生的某些费用对某些第三方进行赔偿。任何与知识产权有关的诉讼或其他程序对我们来说都可能是巨大的成本,即使解决方案对我们有利,而且诉讼将分散我们管理层的努力。我们的一些竞争对手可能比我们更有效地承受复杂专利诉讼的费用,因为他们拥有更多的资源。任何诉讼的发起和继续带来的不确定性可能会推迟我们的研发工作,并限制我们继续运营的能力。
我们可能无法成功地获得或维护我们开发流程所需的产品组件和制造流程的知识产权。
目前,我们拥有某些知识产权的权利,通过第三方的许可和我们拥有的专利,开发我们的开发候选药物和研究药物。由于我们的开发流程可能涉及其他候选开发项目,可能需要使用第三方持有的专有权,因此我们业务的增长可能在一定程度上取决于我们获取、授权或使用这些专有权的能力。此外,我们的开发候选药物和研究药物可能需要特定的配方才能有效和高效地发挥作用,这些权利可能由其他人持有。我们可能无法从我们确定的第三方处获取或许可任何成分、使用方法、过程或其他第三方知识产权。第三方知识产权的许可和收购是一个竞争领域,一些更成熟的公司也在
81
目录表
寻求授权或获得我们可能认为有吸引力的第三方知识产权的战略。这些老牌公司可能比我们有竞争优势,因为它们的规模、现金资源以及更强的临床开发和商业化能力。
例如,我们有时与美国和外国学术机构合作,根据与这些机构达成的书面协议,加快我们的临床前研究或开发。通常,这些机构为我们提供了一个选项,可以通过谈判获得该机构在合作中获得的任何技术权利的许可证。无论知识产权的这种第一次谈判权如何,我们可能无法在指定的时间范围内或在我们可以接受的条款下谈判许可。如果我们无法做到这一点,该机构可能会将知识产权提供给其他方,可能会阻止我们继续执行我们的计划。
此外,将我们视为竞争对手的公司可能不愿将权利转让或许可给我们。我们也可能无法以使我们的投资获得适当回报的条款许可或获得第三方知识产权。如果我们不能成功获得所需的第三方知识产权,我们的业务、财务状况和增长前景可能会受到影响。
如果我们不能为我们的发现获得并执行专利保护,我们利用我们的开发候选者进行有效竞争的能力将受到损害。
我们的成功在一定程度上取决于我们保护我们根据美国和其他国家的专利和其他知识产权法律开发的专有方法和技术的能力,以便我们能够防止其他人非法使用我们的发明和专有信息。但是,我们可能不拥有开发、制造和商业化我们提议的产品所需的某些专利的专有权。
由于某些美国专利申请在专利发布之前是保密的,例如在2000年11月29日之前提交的申请,或在该日期之后提交的不会在国外提交的申请,因此第三方可能在我们不知道这些申请的情况下为我们未决的专利申请所涵盖的技术提交了专利申请,并且我们的专利申请可能没有这些申请的优先权。由于这一原因和其他原因,我们可能无法获得所需的专利权,从而失去独家经营权。此外,我们可能需要获得第三方专利许可,才能销售我们建议的产品或进行我们的研发或其他活动。如果我们不能以优惠的条款获得许可证,我们可能无法销售受影响的产品或进行所需的活动。
我们的战略取决于我们快速识别和为我们的发现寻求专利保护的能力。此外,我们可能会依赖第三方战略合作伙伴提交与我们作为某些战略联盟的一部分共同开发的专有技术相关的专利申请。获得专利保护的过程既昂贵又耗时。如果我们现在或未来的战略合作伙伴不能以合理的成本及时提交和起诉所有必要和可取的专利申请,我们的业务可能会受到不利影响。尽管我们和我们的战略合作伙伴努力保护我们的专有权,但未经授权的各方可能能够获得和使用我们认为是专有的信息。虽然已颁发的专利被推定为有效,但这并不保证该专利将在有效性挑战中幸存下来或被认为是可强制执行的。我们已经获得或在未来获得的任何专利,都可能被试图围绕我们的知识产权进行设计的各方挑战、宣布无效、判定不可执行或规避。此外,第三方或美国专利商标局可以启动涉及我们的专利或专利申请的干扰程序。对我们的专利或专利申请提出的任何挑战、发现的不可执行性或无效或规避都将是代价高昂的,需要我们的管理层投入大量的时间和精力,可能会减少或取消第三方许可方向我们支付的使用费,并可能对我们的业务产生重大不利影响。
我们正在处理的专利申请可能不会产生已颁发的专利。包括我们在内的制药或生物技术公司的专利地位通常是不确定的,涉及复杂的法律和事实考虑。美国专利商标局及其外国同行用来授予专利的标准并不总是可预测地或统一地应用,而且可能会改变。同样,在美国和外国,包括我们的生物技术发明在内的生物技术发明将获得的最终保护程度仍然不确定,并取决于专利局、法院和立法者决定的保护范围。此外,美国国会和国际司法管辖区定期讨论修改专利法的各个方面。例如,2013年3月生效的《美国发明法》对美国的专利法进行了多项修改。如果颁布的任何变化阻止我们充分保护我们的发现,包括我们起诉专利侵权者以获得禁令救济或要求实质性损害赔偿的能力,我们的业务可能会受到不利影响。美国发明法的一项主要条款将美国的专利实践从先发明改为先申请制度。如果我们未能在竞争对手就同一发明提交申请之前提交一项发明,我们就不再有能力提供证据,证明我们在竞争对手提交申请日期之前拥有该发明,因此将无法为我们的发明获得专利保护。关于药品或生物技术专利中已授予或允许的权利要求的标的和范围,也没有统一的全球政策。例如,在某些国家,治疗人类的方法不能申请专利。
82
目录表
因此,我们不知道未来对我们的专有权的保护程度,也不知道向我们或其他人颁发的任何专利将允许的索赔范围。我们还在一定程度上依赖不受专利保护的商业秘密、技术诀窍和技术来维持我们的竞争地位。如果任何不受专利保护的商业秘密、技术诀窍或其他技术被披露给竞争对手或由竞争对手独立开发,我们的业务和财务状况可能会受到实质性的不利影响。
我们从第三方所有者那里授权专利权。如果这些所有者没有适当或成功地获得、维护或执行作为此类许可证基础的专利,我们的竞争地位和业务前景可能会受到损害。
我们是许可证的一方,这些许可证使我们有权获得对我们的业务必要或有用的第三方知识产权。特别是,我们已经从CellSCRIPT、LLC及其附属公司获得了涉及修改的信使核糖核酸化学物质的专利权,并从某些其他方获得了对我们的配方工作有用的知识产权许可证。我们可能会在未来获得第三方IP的额外许可。
我们的成功将在一定程度上取决于我们的许可方获得、维护和实施对我们许可的知识产权的专利保护的能力。我们的许可方可能无法成功起诉我们许可的专利申请。即使就这些专利申请发出专利,我们的许可人也可能无法维护这些专利,可能决定不对侵犯这些专利的其他公司提起诉讼,或者可能不如我们那样积极地提起诉讼。如果没有对我们许可的知识产权的保护,其他公司可能会提供基本上相同的产品供销售,这可能会对我们的竞争业务地位产生不利影响,并损害我们的业务前景。此外,我们还根据各种第三方许可将我们的权利再授权给我们的战略合作伙伴。对这些再许可权的任何损害都可能导致我们的战略联盟协议下的收入减少,或者导致我们的一个或多个战略合作伙伴终止协议。
如果我们未能履行从第三方获得知识产权许可的协议中的义务,或者我们与许可方的业务关系受到干扰,我们可能会失去对我们的业务非常重要的许可权。
知识产权许可对我们的业务很重要,涉及复杂的法律、商业和科学问题,而且由于我们行业科学发现的快速发展而变得复杂。我们是某些对我们的业务非常重要的知识产权许可协议的一方,并希望在未来签订更多的许可协议。我们现有的许可协议要求我们承担各种尽职调查、里程碑付款、版税和其他义务,我们预计未来的许可协议也将如此。如果我们未能履行我们在这些协议下的义务,或者我们面临破产,许可方可能有权终止许可,在这种情况下,我们将无法销售许可涵盖的产品。
在某些情况下,我们许可的技术的专利诉讼完全由许可方控制。如果我们的许可方未能从他们那里获得和维护我们许可的专有IP的专利或其他保护,我们可能会失去我们对该IP的权利,我们的竞争对手可能会使用该IP销售与之竞争的产品。在某些情况下,我们控制对许可技术产生的专利的起诉。如果我们违反与此类起诉相关的任何义务,我们可能会对我们的战略合作伙伴承担重大责任。根据许可协议,可能会出现知识产权纠纷,包括:
• | 根据许可协议授予的权利范围和其他与解释有关的问题; |
• | 我们不受许可协议约束的技术和流程侵犯许可方知识产权的程度; |
• | 根据我们的合作开发关系,对专利和其他权利进行再许可; |
• | 我们在许可协议下的尽职义务,以及哪些活动满足这些尽职义务; |
• | 我们的许可人和我们以及我们的战略合作伙伴共同创造或使用知识产权所产生的发明和专有技术的所有权;以及 |
• | 专利技术发明的优先权。 |
如果围绕我们许可的知识产权的纠纷阻碍或损害我们以有利条件维持现有许可安排的能力,我们可能无法成功开发和商业化受影响的候选开发药物或研究药物。我们通常还面临与我们许可的知识产权保护有关的所有风险,就像我们保护我们拥有的知识产权一样,这些风险如下所述。如果我们或我们的许可方不能充分保护这一知识产权,我们的产品商业化能力可能会受到影响。
如果我们不能保护我们的商业秘密的机密性,我们的商业和竞争地位将受到损害。
除专利保护外,我们严重依赖专有技术和商业秘密保护,以及与我们的员工、顾问和第三方签订的保密协议和发明转让协议,以保护我们的机密和专有信息,特别是在我们认为专利保护不合适或不可能获得的情况下。除了合同措施外,
83
目录表
我们试图使用物理和技术安全措施来保护我们专有信息的机密性。例如,在员工或拥有授权访问权限的第三方盗用商业秘密的情况下,此类措施可能不会为我们的专有信息提供足够的保护。我们的安全措施可能无法阻止员工或顾问盗用我们的商业秘密并将其提供给竞争对手,我们对此类不当行为采取的追索权可能无法提供充分的补救措施来充分保护我们的利益。强制执行一方非法披露或挪用商业秘密的主张可能是困难、昂贵和耗时的,结果是不可预测的。此外,商业秘密可能是由其他人以阻止我们进行法律追索的方式独立开发的。如果我们的任何机密或专有信息,如我们的商业秘密,被泄露或挪用,或者如果任何此类信息是由竞争对手独立开发的,我们的竞争地位可能会受到损害。
某些前雇员已经在可能被认为与我们竞争的公司或学术机构找到了工作,并在与我们相似的领域开展业务,包括在他们的商业模式、产品发现努力、基于mRNA的产品开发或配方技术方面,如我们的LNPs。本竞争可能受到合同条款的限制,我们在马萨诸塞州联邦或其他司法管辖区可能会强制执行,也可能不会强制执行。此外,我们可能要等到我们的商业秘密被披露给具有潜在竞争力的公司后,才会意识到这种竞争性的雇佣安排。
我们可能会受到以下指控的影响:我们的员工、顾问或独立承包商错误地使用或披露了第三方的机密信息,或者我们的员工错误地使用或披露了其前雇主据称的商业机密。
我们雇用的人以前曾受雇于大学或其他生物技术或制药公司,包括我们的竞争对手或潜在竞争对手。尽管我们努力确保我们的员工、顾问和独立承包商在他们的工作中不使用他人的专有信息或技术诀窍,但我们不时会受到索赔,即我们或我们的员工、顾问或独立承包商无意中或以其他方式使用或泄露了我们员工的任何前雇主或其他第三方的知识产权,包括商业秘密或其他专有信息。可能有必要提起诉讼来抗辩这些指控。如果我们未能为任何此类索赔辩护,除了支付金钱损害赔偿外,我们还可能失去宝贵的知识产权或人员,这可能会对我们的业务造成不利影响。即使我们成功地对此类索赔进行了辩护,诉讼也可能导致巨额成本,并分散管理层和其他员工的注意力。
我们可能会受到质疑我们专利和其他知识产权的发明权或所有权的索赔。
我们可能会声称前员工、合作者或其他第三方对我们的专利或其他知识产权拥有所有权权益。例如,所有权纠纷可能源于顾问或参与开发我们开发候选产品的其他人之间的相互冲突的义务。可能有必要提起诉讼来抵御这些和其他挑战发明人身份或所有权的索赔。如果我们未能为任何此类索赔辩护,除了支付金钱损失外,我们还可能会失去宝贵的知识产权,例如宝贵知识产权的独家所有权或使用权。此类结果可能会对我们的业务产生重大不利影响。即使我们成功地对此类索赔进行了辩护,诉讼也可能会导致巨额成本,并分散管理层和其他员工的注意力。
获得和维护我们的专利保护有赖于遵守政府专利机构提出的各种程序、文件提交、费用支付和其他要求,如果不符合这些要求,我们的专利保护可能会减少或取消。
定期维护费、续期费、年金费和各种其他关于专利或申请的政府费用将在专利或申请的有效期内分几个阶段支付给USPTO和美国以外的各种政府专利机构。我们有系统提醒我们支付这些费用,我们聘请了一家外部公司,并依赖我们的外部律师向非美国的专利代理机构支付这些费用。美国专利商标局和各种非政府专利机构要求在专利申请过程中遵守一些程序、文件、费用支付和其他类似条款。我们聘请了声誉良好的律师事务所和其他专业人士来帮助我们遵守,在许多情况下,疏忽可以通过支付滞纳金或通过适用规则的其他方式来纠正。但是,在某些情况下,不遵守规定可能导致专利或专利申请被放弃或失效,从而导致相关法域的专利权部分或全部丧失。在这种情况下,我们的竞争对手可能会进入市场,这种情况可能会对我们的业务产生实质性的不利影响。
84
目录表
如果在法庭上受到挑战,涉及我们的开发候选药物和研究药物的已颁发专利可能会被发现无效或不可执行。
如果我们或我们的战略合作伙伴之一对第三方提起法律诉讼,以强制执行涵盖我们的开发候选药物或研究药物之一的专利,被告可以反诉覆盖我们开发候选药物或研究药物的专利无效或不可执行。在美国的专利诉讼中,被告声称无效或不可执行的反诉很常见。有效性质疑的理由可能是据称未能满足几项法定要求中的任何一项,包括符合专利资格的主题、缺乏新颖性、明显或不能实施。不可执行性主张的理由可能是,与专利起诉有关的人在起诉期间向美国专利商标局隐瞒了相关信息,或做出了误导性声明。第三方也可以向美国或国外的行政机构提出类似的索赔,即使在诉讼范围之外也是如此。这类机制包括复审、授权后复审和外国司法管辖区的同等诉讼程序(例如反对诉讼程序)。这类诉讼可能会导致我们的专利被撤销或修改,使其不再涵盖我们的开发候选药物或研究药物。在法律上断言无效和不可执行之后的结果是不可预测的。关于有效性问题,例如,可能存在我们和专利审查员在起诉期间没有意识到的无效的现有技术。如果被告在无效和/或不可执行性的法律断言上获胜,我们将至少失去对我们的开发候选药物和研究药物的部分专利保护。这种专利保护的丧失可能会对我们的业务产生实质性的不利影响。
美国专利法的变化可能会降低专利的整体价值,从而削弱我们保护产品的能力。
与其他生物技术公司一样,我们的成功在很大程度上依赖于知识产权,特别是专利。在生物技术行业获得和实施专利既涉及技术上的复杂性,也涉及法律上的复杂性,因此获得和实施生物技术专利既昂贵又耗时,而且本质上是不确定的。此外,美国最近颁布并正在实施范围广泛的专利改革立法。美国最高法院最近的裁决缩小了某些情况下可获得的专利保护范围,并在某些情况下削弱了专利所有者的权利。除了关于我们未来获得专利的能力的不确定性增加之外,这种事件的结合也造成了关于一旦获得专利的价值的不确定性。根据美国国会、联邦法院和美国专利商标局的决定,管理专利的法律和法规可能会以不可预测的方式发生变化,从而削弱我们获得新专利或实施现有专利和未来可能获得的专利的能力。
我们可能无法在全球范围内保护我们的知识产权。
在世界所有国家申请、起诉和保护研发候选药物和研究药物的专利将是昂贵得令人望而却步的,而且我们在美国以外的一些国家的知识产权可能没有美国的知识产权广泛。此外,一些国家的法律对知识产权的保护程度不如美国的联邦和州法律。因此,我们可能无法阻止第三方在美国以外的所有国家实施我们的发明,或在美国或其他司法管辖区销售或进口使用我们的发明制造的产品。竞争对手可以在我们没有获得专利保护的司法管辖区使用我们的技术来开发自己的产品,此外,还可以将其他侵权产品出口到我们拥有专利保护的地区,但执法力度不如美国。这些产品可能会与我们的产品竞争,而我们的专利或其他知识产权可能不能有效或不足以阻止他们竞争。
许多公司在外国司法管辖区保护和捍卫知识产权时遇到了重大问题。某些国家的法律制度,特别是某些发展中国家,不支持专利、商业秘密和其他知识产权保护的执行,特别是与生物技术产品有关的知识产权保护,这可能使我们难以阻止侵犯我们专利的行为或违反我们所有权的竞争产品的营销。在外国司法管辖区强制执行我们的专利权的诉讼可能导致大量成本,并转移我们的努力和注意力,从我们的业务的其他方面,可能使我们的专利处于无效或狭义解释的风险,我们的专利申请处于无法发布的风险,并可能促使第三方对我们提出索赔。我们可能无法在我们提起的任何诉讼中获胜,并且所裁决的损害赔偿或其他补救措施(如有)可能不具有商业意义。因此,我们在世界各地执行知识产权的努力可能不足以从我们开发或许可的知识产权中获得重大的商业优势。
*我们的某些项目对政府资金和政府和半政府实体的合作的依赖增加了我们与这些项目相关的研发工作的不确定性,并可能要求增加根据这些政府资助项目开发的任何项目的开发、商业化和生产成本。
我们的寨卡疫苗(MRNA1893)、我们的基孔肯雅病毒抗体(MRNA1944)和我们的基孔肯雅疫苗(MRNA1388)的开发目前都是通过分包合同提供资金的,资金来自Biomedical
85
目录表
高级研究和发展局,或BARDA,或国防高级研究计划局,或DARPA。我们的SARS-CoV-2疫苗(mRNA-1273)正在与NIAID合作开发,NIAID计划进行IND使能研究,NIH正在美国进行mRNA-1273的第一阶段开放标签临床试验。CEPI已同意为制造初步临床批次的mRNA-1273提供资金,如果第一阶段临床试验成功,BARDA已同意为推动mRNA-1273获得FDA许可提供资金。由美国政府及其机构资助的合同和赠款,包括我们由BARDA和DARPA资助的协议以及我们与NIAID的合作,包括反映政府实质性权利和补救措施的条款,其中许多通常不在商业合同中找到,包括政府以下权力:
• | 以任何理由或不以任何理由全部或部分终止协议; |
• | 未经另一方同意,减少或修改政府在此类协议下的义务; |
• | 对根据此类协议开发的产品和数据的权利要求,包括知识产权; |
• | 审计与合同有关的费用和费用,包括分配的间接费用; |
• | 暂停承包商或受让人接收新合同,等待据称违反采购法律或条例的问题得到解决; |
• | 对包含根据此类协议构思或首次付诸实施的发明的产品实施美国制造要求; |
• | 暂停或禁止承包商或受让人今后与政府开展业务; |
• | 控制并可能禁止产品出口; |
• | 根据《虚假申报法》、《虚假陈述法》以及针对政府协议的类似补救规定寻求刑事或民事补救;以及 |
• | 将政府的财政责任限制在美国国会按财政年度拨付的金额,因此即使在项目最初阶段获得资金后,未来资金的可获得性仍存在一些不确定性。 |
我们可能无权禁止美国政府使用我们开发的某些技术,也可能无法禁止第三方公司,包括我们的竞争对手,使用这些技术向美国政府提供产品和服务。美国政府通常采取的立场是,它有权免收使用费使用根据美国政府合同开发的技术。
此外,政府合同和赠款以及在履行这些合同和赠款时授予的分包合同和分包合同通常包含额外的要求,这些要求可能会增加我们的经营成本,减少我们的利润,并使我们因未能遵守这些条款和条件而承担责任。这些要求包括,例如:
• | 政府合同和赠款所特有的专门会计制度; |
• | 强制性财务审计,以及在政府资金用完后可能承担的价格调整或退还责任; |
• | 公开披露某些合同和授予信息,使竞争对手能够深入了解我们的研究计划;以及 |
• | 强制性社会经济合规要求,包括劳工标准、非歧视和平权行动计划,以及环境合规要求。 |
此外,根据这些协议,我们必须遵守1980年《贝赫-多尔法案》或《贝赫-多尔法案》中规定的对美国政府的义务和权利。因此,美国政府可能拥有在这些政府资助计划下开发的某些发明的权利,包括为任何政府目的使用发明的非排他性、不可转让、不可撤销的全球许可证。此外,美国政府有权要求我们向第三方授予上述任何发明的独家、部分独家或非独家许可,前提是:(I)没有采取足够的步骤将发明商业化;(Ii)为了满足公共卫生或安全需求,有必要采取政府行动;或者(Iii)为了满足联邦法规对公众使用的要求,有必要采取政府行动,也称为“游行权利”。虽然美国政府很少使用这种进行权,据我们所知,这种进行权从未成功行使过,但美国政府行使这种进行权可能会损害我们的竞争地位、业务、财务状况、运营结果和前景。如果美国政府行使这种进行权,我们可能会获得美国政府认为合理的补偿,这可能低于我们在公开市场上能够获得的补偿。在政府资助的计划下产生的知识产权也受到某些报告要求的约束,遵守这一要求可能需要我们花费大量资源。
此外,美国政府要求,任何包含通过使用美国政府资金产生的任何发明的产品都必须基本上在美国制造。可以免除制造优惠要求
86
目录表
如果知识产权所有人能够证明,已作出合理但不成功的努力,以类似的条款向潜在的被许可人授予许可,而这些许可可能会在美国大量生产,或者在这种情况下,国内制造在商业上是不可行的。这种对美国制造商的偏好可能会限制我们与非美国制造商就此类知识产权涵盖的产品签订合同的能力。
作为一个组织,我们对政府合同相对较新,对此类合同所涉及的监管合规义务也是新的。如果我们未能遵守这些义务,我们可能会承担潜在的责任并终止我们的合同。
作为一家美国政府承包商,我们接受美国政府对我们的成本和合同履行情况的财务审计和其他审查,以及我们与这些合同相关的会计和一般业务做法。根据审计结果,政府可能会调整我们与合同有关的成本和费用,包括分配的间接成本。尽管过去政府审计和审查所产生的调整并未对我们的财务状况或经营结果产生重大不利影响,但我们不能向您保证未来的审计和审查不会产生这些影响。
CEPI是一个全球组织,它公开表示打算与多个全球组织合作,开发针对新型冠状病毒的潜在疫苗和疗法,包括其他致力于基于信使核糖核酸的方法的公司。在这一过程中,我们的机密信息可能会泄露给其他人,包括我们疫苗工作的细节和时间。
与我们的管道商业化相关的风险
我们没有销售、分销或营销经验,可能会投入大量的财务和管理资源来建立这些能力。如果我们无法建立这样的能力或与第三方达成协议来营销和销售我们未来的产品,如果获得批准,我们可能无法产生任何收入。
鉴于我们所处的发展阶段,我们没有销售、分销或营销经验。为了成功地将我们的开发计划带来的任何产品商业化,我们需要在美国、欧洲或其他地区发展销售和营销能力,无论是我们自己还是与其他人合作。我们可能会与其他实体结成战略联盟,以利用他们成熟的营销和分销能力,但我们可能无法以有利的条件达成营销协议,如果有的话。如果我们未来的战略合作伙伴没有投入足够的资源将我们未来的产品商业化(如果有的话),并且我们无法自行开发必要的营销能力,我们可能无法产生足够的产品收入来维持我们的业务。我们将与许多目前拥有广泛和资金充足的营销和销售业务的公司竞争。如果没有强大的内部团队或第三方的支持来执行营销和销售职能,我们可能无法成功地与这些更成熟的公司竞争。
医药市场竞争激烈。如果我们不能有效地与现有产品、新的治疗方法和新技术竞争,我们可能就不能成功地将我们开发的任何产品商业化。
医药市场竞争激烈,变化迅速。许多大型制药和生物技术公司、学术机构、政府机构和其他公共和私人研究组织正在为我们正在瞄准或期望瞄准的相同疾病开发新产品。我们的许多竞争对手都有:
• | 比我们在产品发现、开发、制造和商业化的每个阶段都拥有更多的财力、技术和人力资源; |
• | 在临床前试验、临床试验、获得监管批准以及产品制造、营销和销售方面拥有更丰富的经验; |
• | 基于先前测试或接受的技术的研究药物; |
• | 已获批准或处于后期开发阶段的产品;以及 |
• | 在我们的目标市场与领先的公司和研究机构达成合作安排。 |
我们将面临来自已获得医学界批准和接受的产品的激烈竞争,用于治疗我们可能开发产品的疾病。我们还预计将面临进入市场的新产品的竞争。目前有许多产品正在开发中,这些产品可能会在未来上市,用于治疗我们正在尝试或未来可能尝试开发产品的疾病。这些产品可能比我们开发的任何产品更有效、更安全、更便宜,或者营销和销售更有效。
87
目录表
我们预计将与世界上最大的制药公司竞争,这些公司中的许多公司目前都在传染病、免疫肿瘤学、罕见遗传病和癌症疫苗领域进行研究。其中一些公司拥有比我们目前更多的财力和人力资源。除了这些大型制药公司,我们可能会与完全整合的生物制药公司和其他专注于免疫治疗的肿瘤学公司,以及一些专注于mRNA药物或共享肿瘤抗原和新抗原疗法的公司直接竞争,其中一些公司已经与更大的制药或生物技术公司签订了合作和融资协议。
如果我们成功开发研究药物,并获得批准,我们将面临基于许多不同因素的竞争,包括:
• | 我们产品相对于替代疗法的安全性和有效性(如果有的话); |
• | 我们产品使用的容易程度,以及患者接受相对较新的给药途径的程度; |
• | 对这些产品进行监管审批的时间和范围; |
• | 制造、营销和销售能力的可用性和成本; |
• | 任何批准的信使核糖核酸药物的价格; |
• | 报销范围;以及 |
• | 专利地位。 |
我们的竞争对手可能会基于上述任何因素或其他因素,开发出比我们开发的任何产品具有显著优势的产品或将其商业化。此外,我们的竞争对手可能与较大的制药或生物技术公司发展战略联盟,或从较大的制药或生物技术公司获得资金,使他们比我们更具优势。因此,我们的竞争对手在产品商业化方面可能比我们更成功,这可能会对我们的竞争地位和业务产生不利影响。竞争产品可能会使我们开发的任何产品过时或不具竞争力,如果获得批准,我们才能收回产品开发和商业化的费用。
任何当前或未来研究药物的商业成功,如果获得批准,将取决于医生、患者、第三方付款人和医学界其他人对市场的接受程度。
对基因研究的伦理、社会和法律担忧可能会导致额外的法规限制或禁止我们可能使用的产品和过程。即使获得了必要的批准,我们产品的商业成功在一定程度上也将取决于医学界、患者和第三方或政府付款人是否普遍接受信使核糖核酸药物,特别是我们的产品,因为它们具有医疗用途、成本效益和安全性。我们向市场推出的任何产品都可能无法获得医生、试验参与者、第三方付款人和医学界其他人的市场接受。如果这些产品没有达到足够的接受度,我们可能不会产生显著的产品收入,也可能无法盈利。如果我们的研究药物获准上市,市场接受的程度将视乎多项因素而定,包括:
• | 与替代疗法相比的潜在疗效和潜在优势; |
• | 如果获得批准,能够以具有竞争力的价格提供我们的产品; |
• | 任何副作用的发生率和严重程度,包括产品批准标签中包含的任何限制或警告; |
• | 检查点抑制剂或与我们的产品联合使用的其他产品或疗法引起的任何副作用的发生率和严重程度; |
• | 相对方便和容易管理; |
• | 对我们产品与其他药物一起使用的任何限制(如果获得批准); |
• | 目标患者群体尝试新疗法的意愿以及医生开出这些疗法的意愿; |
• | 市场营销和分销支持的实力以及竞争产品进入市场的时机; |
• | 关于我们的产品或竞争产品和治疗方法的宣传;以及 |
• | 足够的第三方保险覆盖范围或补偿,以及患者在没有第三方覆盖或足够补偿的情况下自付费用的意愿。 |
即使一种潜在的产品在临床前研究和临床试验中表现出良好的疗效和安全性,市场对该产品的接受度也要在它推出后才能知道。我们教育医疗界和第三方付款人了解产品的好处的努力可能需要大量资源,而且可能永远不会成功。由于我们项目的复杂性和独特性,我们教育市场的努力可能需要比我们竞争对手销售的传统技术所需的更多的资源。
88
目录表
即使我们成功地获得了任何产品的营销批准,任何获得批准的产品的商业成功在很大程度上也将在很大程度上取决于第三方付款人(包括联邦医疗保险和医疗补助计划等政府付款人)的承保范围和足够的报销,以及进入管理型医疗组织,这可能会受到现有和未来旨在降低医疗成本的医疗改革措施的影响。第三方付款人可能要求我们进行其他研究,包括与产品成本效益相关的上市后研究,才有资格获得报销,这可能代价高昂,并转移我们的资源。如果政府和其他医疗保健支付者一旦获得批准,没有为我们的任何产品提供足够的保险和补偿水平,无论是由于医疗改革立法还是其他原因,市场接受度和商业成功都将降低。
此外,如果我们的任何产品被批准上市,我们或战略合作伙伴将在提交该产品的安全性和其他上市后信息和报告方面受到重大监管义务,并将需要继续遵守(或确保我们的第三方提供商遵守)我们或战略合作伙伴在批准后进行的任何临床试验的cGMP和当前GCP。此外,我们或战略合作伙伴或监管机构始终存在这样的风险,即我们或战略合作伙伴或监管机构可能会在产品审批后发现以前未知的问题,例如意外严重或频率较高的不良事件。遵守这些要求的成本很高,任何此类不遵守或批准后发现的研究药物的其他问题都可能对我们的业务、财务状况和运营结果产生实质性的不利影响。
我们可能会在美国以外的地方销售我们的产品,在美国以外的地方做生意也会面临风险。
由于我们计划在美国境外销售我们的产品,如果获得批准,我们的业务将面临与在美国境外开展业务相关的风险,包括我们的费用增加、我们管理层的注意力从获取或开发研究药物上转移,或放弃这些地区的有利可图的许可机会。因此,我们未来的业务和财务业绩可能会受到多种因素的不利影响,包括:
• | 努力发展国际销售、营销和分销组织; |
• | 特定国家或者地区政治文化气候或者经济条件的变化; |
• | 外国法律和监管要求的意外变化; |
• | 在地方司法管辖区有效执行合同条款的困难; |
• | 国外知识产权保护不力; |
• | 贸易保护措施,进出口许可要求,如美国商务部颁布的出口管理条例,以及罚款、处罚或暂停或撤销出口特权; |
• | 适用的外国税收结构的影响和潜在的不利税收后果;以及 |
• | 外币汇率出现重大不利变化。 |
除了美国和海外的FDA和相关法规要求外,我们还受到广泛的联邦、州和外国反贿赂法规的约束,其中包括美国《反海外腐败法》、英国《反贿赂法》以及美国以外其他国家的类似法律。我们正在制定和实施一项企业合规计划,该计划基于我们认为与我们类似的公司目前在制药行业的最佳实践,但我们不能保证我们、我们的员工、我们的顾问或我们的第三方承包商正在或将遵守所有关于贿赂和腐败的联邦、州和外国法规。此外,我们的战略合作伙伴和位于美国境外的第三方承包商可能没有足够的合规计划,或者可能无法尊重他们运营所在地区的法律和指导。即使我们没有被确定为违反了这些法律,政府对这些问题的调查通常也需要花费大量资源并产生负面宣传,这也可能对我们的业务、财务状况和运营结果产生不利影响。
新批准的产品,特别是新药类别的保险覆盖范围和报销状况尚不确定。如果不能为新产品或现有产品获得或保持足够的保险和报销,可能会限制我们营销这些产品的能力,并降低我们创造收入的能力。
政府和私人付款人的可获得性和报销范围对于大多数患者来说至关重要,才能负担得起昂贵的治疗,如我们希望开发和销售的药物。政府医疗保健计划(如联邦医疗保险和医疗补助)和商业支付者的足够覆盖和报销对于新产品的接受度至关重要。此外,由于我们的个性化癌症疫苗和肿瘤内免疫肿瘤研究药物代表了癌症治疗的新方法,我们无法准确估计这些产品将如何定价、能否获得补偿或任何潜在收入。我们的研究药物在国内外的销售将在很大程度上取决于我们的研究药物的费用将在多大程度上由健康维护、管理医疗、药房福利和类似的医疗管理组织支付,或由政府卫生行政部门报销。
89
目录表
当局、私人健康保险公司和其他第三方付款人。如果无法获得报销,或者只能获得有限的报销,我们可能无法成功地将我们的研究药物商业化。即使提供了保险,批准的报销金额也可能不足以让我们建立或保持足够的定价,以实现我们在任何产品上的投资足够的回报。
与新批准的产品(包括基因药物)的保险覆盖范围和报销有关的不确定性很大,而且覆盖范围可能比FDA或类似的外国监管机构批准该药物的目的更有限。在美国,关于新药报销的主要决定通常由医疗保险和医疗补助服务中心(CMS)做出,CMS是美国卫生与公众服务部(HHS)内的一个机构,CMS决定新药是否以及在多大程度上将在联邦医疗保险下覆盖和报销。私人支付者倾向于在很大程度上遵循CMS。很难预测CMS会对像我们这样的新产品的报销做出什么决定。欧洲的报销机构可能比CMS更保守。例如,一些抗癌药物在美国已获准报销,但在某些欧洲国家尚未获批报销。
在美国以外,某些国家,包括一些欧盟成员国,为药品或药品制定价格和补偿,这是欧盟通常所说的,营销授权持有人的参与有限。我们不能确定这样的价格和报销是否会为我们或我们的战略合作伙伴所接受。如果这些外国司法管辖区的监管机构设定的价格或报销水平对我们或我们的战略合作伙伴没有商业吸引力,我们或我们战略合作伙伴的销售收入以及我们药品在这些国家的潜在盈利能力将受到负面影响。越来越多的国家正在采取举措,试图通过将削减成本的努力集中在为其国营医疗体系提供药品方面的努力,来削减巨额预算赤字。这些国际价格控制努力对世界所有地区都产生了影响,但在欧洲联盟中影响最大。此外,一些国家要求产品的销售价格在上市前得到批准。在许多国家,定价审查期从批准营销或产品许可后开始。因此,我们可能会获得产品在特定国家/地区的营销批准,但随后可能会遇到产品报销审批的延迟或价格法规的约束,这将推迟产品的商业发布,可能会推迟很长时间,这可能会对我们能够从该特定国家/地区的产品销售中产生的收入产生负面影响。
此外,美国和国外的政府和第三方付款人加大力度限制或降低医疗成本,可能会导致这些组织限制批准的新产品的覆盖范围和报销水平,因此,它们可能无法为我们的研究药物支付或提供足够的付款。例如,美国政府最近发布了一项降低药品成本的“蓝图”或计划。这份蓝图包含了卫生和公众服务部已经在努力实施的某些措施。例如,CMS在2019年5月发布了一项最终规则,修订了Medicare Advantage和Medicare Part D处方药福利规定,以降低计划参与者的自付成本,并允许Medicare计划就某些药物的较低费率进行谈判。除其他外,最终规则现在允许Medicare Advantage计划从2020年1月1日开始选择对B部分药物使用阶梯疗法,这是一种预授权。这一最终规则编纂了CMS于2019年1月1日生效的政策变化。在州一级,立法机构越来越多地通过立法和实施旨在控制药品和生物制品定价的法规,包括价格或患者报销限制、折扣或对某些产品准入的限制,以及营销成本披露和透明度措施,在某些情况下,这些措施旨在鼓励从其他国家进口和批量购买。
我们预计,由于管理型医疗保健的趋势、健康维护组织的影响力越来越大以及额外的立法变化,我们的任何研究药物的销售都将面临定价压力。总体上,医疗成本的下行压力变得非常大,特别是处方药、外科手术和其他治疗。因此,对新产品的进入设置了越来越高的壁垒。
最近的联邦立法和州和地方政府采取的行动可能会允许将药品从外国重新进口到美国,包括那些药品销售价格低于美国的外国,这可能会对我们的经营业绩产生实质性的不利影响。
如果我们的开发候选药物获得批准,我们可能会在美国面临来自外国的疗法的竞争,这些疗法已经对药品实施了价格管制。在美国,《联邦医疗保险现代化法案》包含的条款可能会改变美国的进口法,并扩大药剂师和批发商从加拿大进口经批准的药物和竞争产品的廉价版本的能力,因为加拿大有政府的价格管制。美国进口法的这些变化不会生效,除非HHS部长证明这些变化不会对公众的健康和安全构成额外风险,并将显著降低消费者的产品成本。在……上面
90
目录表
2019年12月18日,FDA发布了一份拟议规则制定通知,如果最终敲定,将允许从加拿大进口某些处方药。卫生与公众服务部部长将在基于该提案的最终规则发布后向国会作出上述认证。FDA还发布了一份指导文件草案,概述了制造商为FDA批准的药物获得额外的国家药品代码(NDC)的潜在途径,该药物最初打算在外国销售,并被授权在该外国销售。目前尚不清楚拟议中的规则制定和指导草案的通知对监管和市场的影响。毒品重新进口的支持者可能会试图通过立法,在某些情况下直接允许再次进口。如果立法或法规允许重新进口药物,可能会降低我们可能开发的任何产品的价格,并对我们未来的收入和盈利前景产生不利影响。
医疗保健立法改革的论述和潜在的或已颁布的措施可能会对我们的业务和运营结果产生实质性的不利影响,围绕价格改革的愿望和实施的立法或政治讨论可能会对我们的业务产生不利影响。
在美国,已经并将继续有许多立法倡议来控制医疗成本。例如,2010年3月,ACA获得通过,它极大地改变了政府和私营保险公司为医疗保健提供资金的方式,并对美国制药业产生了重大影响。除其他事项外,ACA提高了制造商在医疗补助药品返点计划下应支付的最低医疗补助退税,并将退税计划扩大到登记在医疗补助管理保健组织中的个人,对某些品牌处方药的制造商建立了年费和税收,并推广了新的联邦医疗保险D部分覆盖缺口折扣计划。非加太协定的执行和影响仍然存在相当大的不确定性。
自颁布以来,ACA的某些方面受到了许多司法、行政、行政和立法方面的挑战,我们预计未来还会对ACA提出更多的挑战和修正案。例如,ACA的各个部分目前正在第五巡回法院和美国最高法院面临法律和宪法挑战,特朗普政府发布了各种行政命令,取消了成本分摊补贴和各种条款,这些条款会给各州带来财政负担,或者给个人、医疗保健提供者、健康保险公司或药品或医疗器械制造商带来成本、费用、税收、罚款或监管负担。此外,国会还提出了几项旨在大幅修改或废除ACA的立法。目前尚不清楚ACA是否会被推翻、废除、取代或进一步修改。我们无法预测ACA的进一步变化会对我们的业务产生什么影响。
此外,自ACA颁布以来,美国还提出并通过了其他立法修改。除其他外,2011年的预算控制法案为美国国会制定了削减开支的措施。一个赤字削减联合特别委员会的任务是建议在2013年至2021年期间至少削减1.2万亿美元的赤字,但该委员会无法达到所需的目标,从而触发了立法自动削减到几个政府项目。这包括每一财年向提供商支付的联邦医疗保险总额减少高达2%。除非国会采取额外行动,否则这些削减将一直有效到2029年。
此外,还提出了立法和监管建议,以扩大批准后的要求,并限制药品的销售和促销活动。我们不能确定是否会颁布更多的立法变化,或者FDA的法规、指南或解释是否会改变,或者这些变化对我们的开发候选者的上市批准(如果有的话)可能会产生什么影响。此外,美国国会对FDA审批过程的更严格审查可能会显著推迟或阻止上市审批,并使我们受到更严格的产品标签和上市后条件和其他要求的约束。
在欧洲联盟提供医疗保健,包括建立和运营保健服务以及药品的定价和报销,几乎完全是国家法律和政策的问题,而不是欧盟的法律和政策问题。在这方面,各国政府和保健服务提供者在提供保健以及产品定价和补偿方面有不同的优先事项和办法。然而,总的来说,大多数欧盟成员国的医疗预算限制导致了相关医疗服务提供商对药品定价和报销的限制。再加上欧盟和国家对那些希望开发和营销产品的人不断增加的监管负担,这可能会阻止或推迟我们的研究药物的上市批准,限制或监管批准后的活动,并影响我们将任何获得上市批准的产品商业化的能力。
我们预计,未来将通过更多的外国、州和联邦医疗改革措施或提案,其中任何一项都可能限制联邦和州政府为医疗产品和服务支付的金额,这可能会导致对我们的研究药物的需求减少或额外的定价压力。如果保健产品的定价结构,如我们正在开发的研究药物,发生实质性变化并限制对此类产品的支付
91
目录表
对于研究药物,我们的业务将受到不利影响,因为根据预期净现值,我们的产品可能不再具有商业可行性,我们可能已经在无法商业开发的产品上投入了大量资源,或者我们可能确定,已达到开发早期阶段的资产不能或将不能进一步开发,尽管它们具有临床可行性。此外,根据我们的战略合作伙伴对任何拟议、宣布或立法的定价改革的影响的评估,作为我们战略联盟一部分的开发资产或临床项目可能不再具有商业可行性。
我们无法预测未来可能会采取什么样的医疗改革举措。联邦、州和外国的立法和监管可能会进一步发展,我们预计正在进行的举措将增加药品定价的压力。此类改革可能会对我们可能成功开发并获得监管批准的研究药物的预期收入产生不利影响,并可能影响我们的整体财务状况和开发研究药物的能力。
由于我们技术的新颖性,我们面临着与这些研究药物的定价和报销相关的不确定性。
我们某些研究药物的目标患者群体可能相对较少,例如那些治疗罕见遗传疾病的药物,而我们的某些研究药物,如PCV,需要在个人规模上进行定制。因此,如果我们的研究药物获得批准,其定价和报销必须足以支持商业基础设施。如果我们不能获得足够的报销水平,我们成功营销和销售我们的研究药物的能力将受到不利影响。与我们的研究药物相关的服务(例如,给患者使用我们的产品)的报销方式和水平也很重要。此类服务的报销不足可能会导致医生抵制,并对我们营销或销售产品的能力产生不利影响。
如果我们的研发候选药物或研究药物的市场机会比我们想象的要小,我们的收入可能会受到不利影响,我们的业务可能会受到影响。由于我们一些项目的目标患者人群很少,我们必须能够成功地确定临床试验参与者,并获得显著的市场份额,以保持盈利和增长。
我们研究和产品开发活动的一个重要领域是开发严重罕见遗传病的治疗方法。我们对患有这些疾病的人数以及有可能从我们的计划治疗中受益的这些疾病患者子集的预测都是基于估计的。这些估计来自各种来源,包括科学文献、诊所调查、患者基金会或市场研究,可能被证明是不正确的。此外,新的研究可能会改变这些疾病的估计发病率或流行率。美国、欧洲和其他地区的临床试验参与者的数量可能会低于预期,潜在的临床试验参与者可能无法以其他方式接受我们的产品治疗,或者新的临床试验参与者可能变得越来越难以识别或获得访问权限,所有这些都将对我们的运营结果和业务产生不利影响。
我们的一些计划的市场机会可能仅限于那些没有资格获得或未能通过先前治疗的患者,而这些患者的市场机会可能很小。
FDA通常最初只批准复发或难治性晚期疾病患者使用的新疗法。我们希望在这方面初步寻求我们的PCV和肿瘤内免疫肿瘤研究药物的批准。随后,对于那些被证明是足够有益的产品(如果有的话),我们预计将寻求早期治疗系列的批准,并可能作为一线治疗,但不能保证我们的研究药物即使获得批准,也会被批准用于早期系列治疗,并且在任何此类批准之前,我们可能必须进行额外的临床试验。
我们对患有我们可能针对的癌症的人数以及这些癌症患者中能够接受二线或三线治疗并有可能从我们的研究药物治疗中受益的人群的预测,都是基于我们的信念和估计。这些估计来自各种来源,包括科学文献、诊所调查、患者基金会或市场研究,可能被证明是不正确的。此外,新的研究可能会改变这些癌症的估计发病率或流行率。试验参与者的人数可能会低于预期。此外,我们的研究药物的潜在可解决患者群体可能是有限的,或者可能无法接受我们的研究药物治疗。即使我们的产品获得了相当大的市场份额,如果获得批准,因为潜在的目标人群很少,如果没有获得监管部门对更多适应症的批准,我们可能永远不会实现盈利。
92
目录表
与我们的业务和运营相关的风险
*我们将需要发展和扩大我们的公司,我们在管理这种发展和扩张方面可能会遇到困难,这可能会扰乱我们的运营。
截至2020年3月31日,我们拥有约850名全职员工,随着我们管道和上市公司的增长和发展,我们预计将增加员工数量和业务范围。为了管理我们预期的发展和扩张,包括在美国以外的扩张,我们必须继续实施和改进我们的管理、运营和财务系统,扩大我们的设施,并继续招聘和培训更多合格的人员。此外,我们的管理层可能需要将不成比例的注意力从日常活动中转移出来,并将大量时间用于管理这些发展活动。
作为一家成长中的生物技术公司,我们正在许多治疗领域和广泛的疾病领域积极寻求开发候选药物和研究药物。成功开发产品并充分了解所有这些治疗领域和疾病状态的监管和制造途径需要深厚的人才、资源和公司流程,以便在多个领域同时执行。由于我们有限的资源和早期的发展阶段,我们可能无法有效地管理这种同时执行和扩大我们的业务,或招聘和培训更多的合格人员。这可能会导致我们的基础设施薄弱,导致操作错误、失去商业机会、员工流失,并降低剩余员工的生产率。我们业务的实际扩张可能会导致巨大的成本,并可能将财政资源从其他项目中转移出来,例如我们的研究药物的开发。如果我们的管理层不能有效地管理我们预期的发展和扩张,我们的费用可能会比预期的增加更多,我们创造或增加收入的能力可能会降低,我们可能无法实施我们的业务战略。我们未来的财务业绩以及我们将研究药物商业化并有效竞争的能力,将在一定程度上取决于我们有效管理公司未来发展和扩张的能力。
我们未来的成功取决于我们留住关键员工、顾问和顾问的能力,以及吸引、留住和激励合格人员的能力。我们可能无法留住拥有股票期权的员工或高管。
我们在竞争激烈的生物技术和制药行业中竞争的能力取决于我们吸引和留住高素质管理、科学和医疗人员的能力。我们高度依赖我们的管理和科学团队成员。我们的每一位高管和我们的所有员工,包括关键科学家和临床医生,都是“随意”聘用的,这意味着我们或每一位高管或员工可以随时终止雇佣关系。失去这些人的任何一项服务都可能对我们的研究、开发、融资和商业化目标的实现产生不利影响。目前,我们没有为任何一名员工投保“关键人物”保险。我们的许多关键员工,包括我们的高管团队成员,已经在我们工作了很长一段时间,并拥有宝贵的、完全授予的股票期权或其他长期股权激励。由于生物技术行业的竞争环境,特别是在马萨诸塞州剑桥市,我们可能无法留住这些员工。
此外,我们依靠顾问、承包商和顾问,包括科学和临床顾问,帮助我们制定我们的研发、监管批准和商业化战略。我们的顾问和顾问可能受雇于我们以外的雇主,并可能根据与其他实体签订的咨询或咨询合同作出承诺,这可能会限制我们获得他们的机会。失去一名或多名现有员工或顾问的服务可能会阻碍我们实现研究、开发、监管批准和商业化目标。此外,我们还通过使用承包商和兼职工人灵活地扩大了我们的劳动力。我们可能无法保留这些人员的服务,这可能会导致我们的业务运营延迟。
为我们的业务招聘和留住其他合格的员工、顾问和顾问,包括科学和技术人员,也将是我们成功的关键。对熟练人才的竞争非常激烈,包括mRNA和LNP研究、临床操作、监管事务、治疗领域管理和制造方面的竞争,而且离职率可能很高。鉴于众多制药和生物技术公司以及学术机构之间对拥有相似技能的个人的竞争,我们可能无法以有利的条件吸引和留住人才。此外,负面宣传、未能在临床前或临床试验中取得成功或申请上市批准,可能会使招聘和留住合格人员变得更具挑战性。无法招聘或失去某些高管、关键员工、顾问或顾问的服务,可能会阻碍我们的研究、开发和商业化目标的进展,并对我们的业务、财务状况、运营结果和前景产生重大不利影响。
我们的员工、首席调查人员和顾问可能从事不当行为或其他不当活动,包括不遵守监管标准和要求以及内幕交易。
93
目录表
我们面临着员工、主要调查人员和顾问的欺诈或其他不当行为的风险。这些当事人的不当行为可能包括故意不遵守FDA法规或适用于欧盟和其他司法管辖区的法规;向FDA、EMA和其他监管机构提供准确的信息;遵守美国和海外的医疗欺诈和滥用法律法规;或准确报告财务信息或数据,或向我们披露未经授权的活动。此类不当行为还可能涉及在临床试验过程中或与FDA或其他监管机构互动过程中获得的信息的不当使用,这可能导致监管制裁,并对我们的声誉造成严重损害。医疗保健行业的销售、营销和商业安排受到广泛的法律法规的约束,旨在防止欺诈、不当行为、回扣、自我交易和其他滥用行为。这些法律法规限制或禁止广泛的定价、折扣、营销和促销、销售佣金、客户激励计划等业务安排。我们已经通过了适用于所有员工的行为准则,但并不总是能够识别和阻止员工的不当行为,我们为发现和防止此类行为而采取的预防措施可能无法有效控制未知或未管理的风险或损失,或保护我们免受因未能遵守这些法律或法规而引起的政府调查或其他行动或诉讼。如果对我们采取任何此类行动,而我们未能成功地为自己辩护或维护自己的权利,这些行动可能会对我们的业务、财务状况、运营结果和前景产生重大影响,包括施加巨额罚款或其他制裁。
员工诉讼和负面宣传可能会对我们未来的业务产生负面影响。
我们的员工可能会不时地就伤害、制造敌意工作场所、歧视、工资和工时纠纷、性骚扰或其他雇佣问题对我们提起诉讼。近年来,歧视和骚扰索赔的数量总体上有所增加。再加上社交媒体平台和类似设备的扩张,使个人能够接触到广泛的受众,这些说法对一些企业产生了重大负面影响。某些面临雇佣或骚扰相关诉讼的公司不得不解雇管理层或其他关键人员,并遭受了声誉损害,对其业务产生了负面影响。如果我们面临任何与雇佣相关的索赔,我们的业务可能会受到负面影响。
我们从未从产品销售中获得任何收入,也可能永远不会盈利。
我们创造收入和实现盈利的能力取决于我们单独或与战略合作伙伴成功完成研究药物的开发并获得商业化所需的监管批准的能力。在可预见的未来,我们预计不会从产品销售中获得收入,如果有的话。我们未来从产品销售中获得收入的能力在很大程度上取决于我们在以下方面的成功:
• | 完成我们的开发候选药物和研究药物的研究、临床前和临床开发; |
• | 为我们完成临床试验的研究药物寻求并获得美国和国外的营销批准; |
• | 为我们的开发候选药物和研究药物开发可持续、稳定、一致和可转让的一个或多个制造工艺; |
• | 为我们的个性化癌症疫苗研究药物开发一个可持续的、可扩展的、一致的、对时间敏感的和可转移的制造工艺; |
• | 进一步发展我们自己的制造能力和与第三方的制造关系,以便提供足够的(在数量和质量上)产品和服务,以支持临床开发和市场对我们的研究药物的需求,如果获得批准; |
• | 使市场接受我们的研究药物作为一种治疗选择; |
• | 通过与战略合作伙伴合作,或如果独立推出,通过建立销售队伍、营销和分销基础设施,推出并商业化我们获得营销批准和报销的研究药物; |
• | 应对任何相互竞争的技术和市场发展; |
• | 实施更多的内部系统和基础设施; |
• | 在我们可能加入的任何合作、许可或其他安排中谈判有利条件; |
• | 维护、捍卫、保护和扩大我们的知识产权组合,包括专利、商业秘密和专有技术;以及 |
• | 吸引、聘用和留住合格人才。 |
即使我们开发的一种或多种研究药物获准商业化销售,我们预计也会产生与任何批准的研究药物商业化相关的巨额成本。如果FDA、EMA或其他监管机构要求我们进行临床和其他研究,或者在我们目前预期的基础上对我们的制造或质量体系进行更改,我们的费用可能会超出预期。即使我们能够产生
94
目录表
如果我们无法从销售任何经批准的产品中获得收入,我们可能无法盈利,可能需要获得额外资金才能继续运营。
我们的内部计算机系统,或我们的战略合作伙伴或其他承包商或顾问的系统,可能会出现故障或遭遇安全漏洞,这可能会导致我们的产品开发计划和制造运营受到实质性破坏。
我们的内部计算机系统以及我们当前和未来的任何战略合作伙伴、供应商以及其他承包商或顾问的计算机系统都容易受到计算机病毒、未经授权的访问、自然灾害、恐怖主义、网络安全威胁、战争以及电信和电气故障的破坏。虽然我们到目前为止还没有经历过任何此类重大系统故障、事故或安全漏洞,但如果发生此类事件并导致我们的运营中断,可能会导致我们的开发计划和业务运营发生重大中断,无论是由于我们的商业机密或其他专有信息的丢失,还是由于其他类似的中断。例如,一项或多项正在进行或已完成或未来的临床试验的临床试验数据丢失可能会导致我们的监管审批工作延迟,并显著增加我们恢复或复制数据的成本。此外,由于我们并行运行多个临床试验的方法,我们的计算机系统的任何违规都可能导致我们的许多程序在许多开发阶段丢失数据或损害数据完整性。临床试验参与者个人数据的任何此类违反、丢失或泄露也可能使我们面临民事罚款和处罚,无论是根据一般数据保护法规(GDPR)、欧盟相关成员国法律、其他外国法律、1996年联邦医疗保险可携带性和责任法(HIPAA),以及美国其他相关的州和联邦隐私法。如果任何中断或安全漏洞导致我们的数据或应用程序丢失或损坏,或不适当地披露机密或专有信息,我们可能会招致责任,我们的竞争地位可能会受到损害,我们的研究药物的进一步开发和商业化可能会被推迟。
我们可能会使用我们的财力和人力资源来追求特定的研究计划或研究药物,而不是利用可能更有利可图或成功可能性更大的计划或研究药物。
由于我们的资源有限,我们必须选择为选定的研究项目或研究药物的开发提供资金,并可能放弃或推迟追求其他项目或研究药物的机会,这些项目或研究药物稍后可能被证明具有更大的商业潜力。我们的资源分配决策,或我们根据战略联盟协议向战略合作伙伴提供资源的合同承诺,可能会导致我们无法利用可行的商业产品或有利可图的市场机会。我们在当前和未来研究药物研发计划上的支出可能不会产生任何商业上可行的产品。如果我们没有准确评估特定研究药物的商业潜力或目标市场,我们可能会通过战略联盟、许可或其他特许权使用费安排,在对我们更有利的情况下,放弃对该研究药物的宝贵权利,或者我们可能会将内部资源分配给某个治疗领域的研究药物,而在该治疗领域,加入战略联盟将更有利。
如果我们不能成功地发现、开发和商业化当前产品组合之外的其他产品,我们扩大业务和实现战略目标的能力将受到损害。
尽管我们的大量努力将集中在临床试验和对我们现有研究药物的潜在批准上,但我们战略的一个关键要素是发现、开发并可能将我们现有产品组合之外的更多产品商业化,以治疗各种疾病和各种治疗领域。我们打算通过投资于我们自己的药物发现努力,探索开发新产品的潜在战略联盟,以及许可技术来做到这一点。确定新的研究药物需要大量的技术、财政和人力资源,无论最终是否确定了任何研究药物。即使我们确定了最初显示出希望的研究药物,我们也可能因为许多原因而无法成功地开发和商业化这类产品,包括以下原因:
• | 所使用的研究方法可能不能成功地确定潜在的研究药物; |
• | 竞争对手可能会开发替代药物,使我们的研究药物过时; |
• | 尽管如此,我们开发的研究药物仍可能受到第三方专利或其他专有权的保护; |
• | 在进一步的研究中,一种研究药物可能会被证明具有有害的副作用或其他特征,表明其不太可能有效或不符合适用的监管标准; |
• | 一种研究药物可能无法以可接受的成本进行商业批量生产,或者根本无法生产;以及 |
• | 经批准的产品可能不会被试验参与者、医学界或第三方付款人接受为安全有效。 |
95
目录表
如果我们不能成功地发现和开发更多的产品,我们的增长潜力可能会受到损害。
针对我们的产品责任诉讼可能会导致我们承担重大责任,并可能限制我们可能开发的任何研究药物的商业化。
我们面临着与在临床试验中测试我们当前或未来的任何研究药物有关的固有的产品责任暴露风险,如果我们将我们可能开发的任何研究药物商业化,我们可能面临更大的风险。如果我们不能成功地为自己辩护,声称我们的研究药物造成了伤害,我们可能会招致巨大的责任。无论是非曲直或最终结果,赔偿责任可能导致:
• | 减少对我们可能开发的任何研究药物的需求; |
• | 收入损失; |
• | 给予患者、健康志愿者或他们的孩子大量的金钱奖励; |
• | 为相关诉讼辩护的重大时间和费用; |
• | 临床试验参与者的退出; |
• | 无法将我们可能开发的任何研究药物商业化(S);以及 |
• | 损害了我们的声誉和媒体的严重负面关注。 |
我们承保的产品责任保险,就我们目前的临床计划而言,我们认为是足够的;然而,我们可能无法以合理的成本或足够的金额维持保险范围,以保护我们免受责任损失。如果我们获得研究药物的上市批准,我们打算扩大我们的保险范围,将商业产品的销售包括在内;然而,我们可能无法以商业合理的条款或足够的金额获得产品责任保险。有时,在基于药物或治疗产生了意想不到的不良影响的集体诉讼中,会做出大额判决。一项成功的产品责任索赔或一系列针对我们的索赔可能会导致我们的股票价格下跌,如果判断超出了我们的保险范围,可能会对我们的运营和业务结果产生不利影响。
我们可能会直接或间接地受到联邦和州医疗欺诈和滥用法、虚假索赔法以及健康信息隐私和安全法的约束。如果我们不能遵守或没有完全遵守这些法律,我们可能会面临重大处罚。
如果我们的任何研究药物获得FDA批准,并开始在美国商业化这些产品,我们的业务将直接或间接通过我们的处方者、客户和购买者,受到各种联邦和州欺诈和滥用法律法规的约束,包括但不限于联邦医疗保健计划反回扣法规、联邦民事和刑事虚假索赔法案以及医生支付阳光法案和法规。这些法律将影响我们拟议的销售、营销和教育计划等。此外,我们可能会受到联邦政府和我们开展业务所在州颁布的患者隐私法的约束。将影响我们运营的法律包括但不限于以下内容:
• | 联邦反回扣法规,除其他事项外,禁止个人或实体直接或间接、公开或隐蔽地以现金或实物直接或间接、公开或隐蔽地索要、收受、提供或支付任何报酬(包括任何回扣、贿赂或回扣),以诱使或奖励个人,或作为回报,推荐个人购买、订购、推荐或安排购买、订购、推荐或安排根据联邦医疗保健计划(如联邦医疗保险和医疗补助计划)可报销的任何商品或服务。政府可以断言,根据联邦民事虚假索赔法或联邦民事罚款法规的目的,包括因违反联邦反回扣法规而产生的物品或服务的索赔构成虚假或欺诈性索赔。这项法规被解释为适用于一方面是药品制造商,另一方面是处方者、购买者和处方管理人员之间的安排。虽然有几个法定例外和监管安全港保护某些常见活动免受起诉,但它们的范围很窄,涉及旨在诱使开处方、购买或推荐的报酬的做法如果不符合例外或安全港的资格,可能会受到审查。ACA修改了联邦反回扣法规的意图要求,规定个人或实体不再需要实际了解该法规或违反该法规的具体意图。 |
• | 联邦民事和刑事虚假索赔法律以及民事罚款法律,包括联邦虚假索赔法案,除其他事项外,禁止个人或实体故意或导致提交虚假或欺诈性的联邦医疗保险、医疗补助或其他政府支付者的付款或批准索赔。此外,政府可以断言,根据联邦虚假申报法或联邦民事罚款的目的,包括因违反《反回扣法规》而产生的物品或服务的索赔构成虚假或欺诈性索赔。 |
96
目录表
法规。根据《虚假索赔法》,即使制造商没有直接向政府付款人提交索赔,但如果他们被认为“导致”提交虚假或欺诈性索赔,他们也会被追究责任。根据《虚假索赔法》,直接向付款人提交索赔的公司也可能对直接提交此类索赔承担责任。虚假申报法“还允许充当”告密者“的个人代表联邦政府提起诉讼,指控违反了”虚假申报法“,并分享任何金钱追回。ACA规定,最近政府针对药品和医疗器械制造商的案件支持这样一种观点,即违反联邦反回扣法规和某些营销做法,包括标签外促销,可能会牵连到虚假索赔法案。
• | 除其他事项外,反诱导法禁止向医疗保险或医疗补助受益人提供或给予报酬,其中包括但不限于向医疗保险或医疗补助受益人免费或以低于公平市场价值的价格转让物品或服务(有限的例外情况),此人知道或应该知道这些物品或服务可能会影响受益人选择可由联邦或州政府计划报销的物品或服务的特定供应商。 |
• | HIPAA及其实施条例,其中制定了新的联邦刑法,禁止任何人故意和故意执行或试图执行计划或作出虚假或欺诈性陈述来诈骗任何医疗福利计划,而无论付款人(例如,公共或私人),或通过虚假或欺诈性的借口、陈述或承诺,获得任何医疗福利计划拥有、或在其监管或控制下的任何金钱或财产,而无论付款人(例如,公共或私人),并故意和故意伪造,以任何诡计或手段隐瞒或掩盖与提供或支付与医疗事宜有关的医疗福利、项目或服务有关的重要事实或作出任何重大虚假陈述。与联邦反回扣法规类似,一个人或实体可以被判违反HIPAA,而不实际了解该法规或没有违反该法规的具体意图。 |
• | HIPAA经2009年《健康信息技术促进经济和临床健康法案》(HITECH)及其实施条例修订,对个人可识别健康信息的隐私、安全和传输提出了某些要求,未经受规则约束的实体,如健康计划、医疗保健信息交换所和医疗保健提供者及其各自的“业务伙伴”,这些实体是代表保险实体创建、接收、维护、传输或获取受保护的健康信息的独立承包商或代理人。HITECH还创建了新的民事罚款等级,修订了HIPAA,使民事和刑事处罚直接适用于商业伙伴,并赋予州总检察长新的权力,可以向联邦法院提起民事诉讼,要求损害赔偿或禁制令,以执行联邦HIPAA法律,并寻求与提起联邦民事诉讼相关的律师费和费用。 |
• | 美国联邦食品、药物和化妆品法案,其中包括禁止在药品、生物制品和医疗器械中掺假或贴错品牌。 |
• | 联邦透明度法律,包括联邦医生支付阳光法案,该法案要求披露药品、设备、生物制品和医疗用品制造商向医生(目前的定义包括医生、牙医、视光师、足科医生和脊椎按摩师)和教学医院提供的付款和其他价值转移,以及医生和其他医疗保健提供者及其直系亲属和适用的团购组织持有的所有权和投资权益。从2022年1月1日起,这些报告义务将扩大到包括向某些非医生提供者,如医生助理和护士从业人员进行的价值转移。 |
• | 上述联邦法律中每一项的州法律等价物、要求药品制造商报告与向医生和其他医疗保健提供者支付或以其他方式转移价值或营销支出有关的信息的州法律以及管理某些情况下健康信息的隐私和安全的州法律也适用于我们,其中许多法律在很大程度上彼此不同,可能不具有相同的效果,从而在某些情况下使合规工作复杂化。 |
欧洲联盟禁止向医生提供福利或利益,以诱导或鼓励医生开处方、推荐、背书、购买、供应、订购或使用医药产品。向医生提供福利或优势也受欧盟成员国国家反贿赂法律的管辖,例如英国《2010年反贿赂法》。违反这些法律可能会导致巨额罚款和监禁。
在某些欧盟成员国向医生支付的费用必须公开披露。此外,与医生的协议通常必须事先通知医生的雇主,并得到其主管部门的批准
97
目录表
专业组织或个别欧洲联盟成员国的监管当局。这些要求在适用于欧盟成员国的国家法律、行业守则或专业行为守则中作出规定。不遵守这些要求可能会导致声誉风险、公开谴责、行政处罚、罚款或监禁。
欧盟个人健康数据的收集和使用此前受数据保护指令的条款管辖,该指令已被2018年5月25日生效的GDPR取代。虽然数据保护指令不适用于总部设在欧盟以外的组织,但GDPR已将其覆盖范围扩大到任何向欧盟居民提供商品或服务的企业,无论其位置如何。这一扩展将包括我们在欧盟成员国的临床试验活动。GDPR对个人数据的控制器和处理器提出了严格的要求,包括对包括居住在欧盟的数据对象的健康和基因信息在内的“敏感信息”进行特殊保护。GDPR给予个人反对处理其个人信息的机会,允许他们在某些情况下要求删除个人信息,并向个人提供明确的权利,在个人认为其权利受到侵犯的情况下寻求法律补救。此外,GDPR对将个人数据从欧盟转移到美国或其他被认为没有提供“充分”隐私保护的地区实施了严格的规则。不遵守GDPR的要求和欧盟成员国的相关国家数据保护法,可能会略微偏离GDPR,可能会导致巨额罚款。由于GDPR的实施,我们可能需要建立额外的机制,以确保遵守新的数据保护规则。
数据保护当局寻求强制遵守GDPR的方式存在重大不确定性。例如,目前尚不清楚当局是否会对在欧盟开展业务的公司进行随机审计,或者当局是否会等待声称其权利受到侵犯的个人提出申诉。执法的不确定性和与确保GDPR合规相关的成本可能会非常繁重,并对我们的业务、财务状况、运营结果和前景产生不利影响。
如果我们不遵守环境、健康和安全法律法规,我们可能会受到罚款或处罚,或者产生可能损害我们业务的成本。
我们受到许多环境、健康和安全法律法规的约束,包括那些管理实验室程序以及危险材料和废物的处理、使用、储存、处理和处置的法律和法规。我们的行动涉及使用危险和易燃材料,包括化学品和生物材料。我们的业务还可能产生危险废物产品。我们通常与第三方签订合同,处理这些材料和废物。我们无法消除这些材料造成污染或伤害的风险。如果我们使用任何危险材料造成污染或伤害,我们可能要对由此造成的任何损害负责,任何责任都可能超出我们的资源范围。我们还可能招致与民事或刑事罚款以及不遵守此类法律和法规的惩罚相关的巨额费用。
虽然我们维持工人补偿保险,以支付因使用危险材料导致员工受伤而可能产生的成本和开支,但该保险可能不足以支付潜在的责任。我们不为可能因我们储存或处置生物或危险材料而对我们提出的环境责任或有毒侵权索赔提供保险。
此外,为了遵守当前或未来的环境、健康和安全法律法规,我们可能会产生巨额成本。这些现行或未来的法律法规可能会损害我们的研究、开发或生产努力。我们不遵守这些法律法规也可能导致巨额罚款、处罚或其他制裁。
*不利的美国或全球经济状况可能会对我们的业务、财务状况或运营结果产生不利影响。
我们的业务结果可能会受到全球经济和金融市场总体状况的不利影响,包括目前的冠状病毒大流行或任何其他卫生流行病。最近的全球金融危机造成了资本和信贷市场的剧烈波动和混乱。严重或长期的经济低迷,如最近的全球金融危机,可能会给我们的业务带来各种风险,包括对我们的研究药物的需求减弱,以及我们在需要时以有利的条件筹集额外资本的能力(如果有的话)。疲软或衰退的经济可能会给我们的供应商带来压力,可能导致供应中断,或者导致第三方付款人或我们的合作伙伴延迟支付我们的服务。上述任何一项都可能损害我们的业务,我们无法预见当前的经济气候和金融市场状况可能对我们的业务产生不利影响的所有方式。
98
目录表
*我们或我们所依赖的第三方可能受到自然灾害、卫生流行病或其他业务中断(如网络安全攻击)的不利影响,我们的业务连续性和灾难恢复计划可能无法充分保护我们免受严重灾难的影响。
自然灾害或健康流行病可能会严重扰乱我们的运营,并对我们的业务、运营结果、财务状况和前景产生实质性的不利影响。如果发生自然灾害、停电、网络安全攻击、健康流行病或其他事件,使我们无法使用全部或很大一部分总部,损坏关键基础设施,如我们的制造设施或我们第三方合同制造商的设施,限制我们访问或使用我们的数字信息系统的能力,或者以其他方式中断运营,我们可能很难,或者在某些情况下,不可能在很长一段时间内继续我们的业务。我们目前制定的灾难恢复和业务连续性计划是有限的,不太可能在发生严重灾难或类似事件时证明是足够的。网络安全责任保险很难获得,可能不包括我们因违反计算机安全协议或其他网络安全攻击而遭受的任何损害。由于我们的灾难恢复和业务连续性计划的性质有限,我们可能会产生大量费用,这可能会对我们的业务产生实质性的不利影响。
如果我们的产品受到产品召回的影响,可能会损害我们的声誉、业务和财务业绩。
FDA和类似的外国政府当局有权要求召回某些商业化产品。在FDA的情况下,要求召回生物制品的权力必须基于FDA发现一批、许多其他数量的生物制品对公众健康构成迫在眉睫的或实质性的危害。此外,外国政府机构有权要求在设计或制造方面存在实质性缺陷或缺陷的情况下召回任何研究药物。如果在产品中发现任何重大缺陷,制造商可以主动召回产品。由于制造错误、设计或标签缺陷或其他缺陷和问题,我们可能会发生政府强制或自愿召回。召回我们的任何研究药物都会转移管理和财务资源,并对我们的财务状况和运营结果产生不利影响。召回声明可能会损害我们在客户中的声誉,并对我们的销售产生负面影响(如果有的话)。
*我们的现金、现金等价物和投资的投资会受到风险的影响,这些风险可能会导致损失,并影响这些投资的流动性。
截至2020年3月31日,我们拥有约17.2亿美元的现金、现金等价物和投资。这些投资受到一般信贷、流动性、市场和利率风险的影响。我们可能会在这些投资的公允价值中实现亏损,这将对我们的合并财务报表产生负面影响。此外,如果我们的投资停止支付或减少支付给我们的利息金额,我们的利息收入将受到影响。与我们的投资组合相关的市场风险可能会对我们的运营结果、流动性和财务状况产生不利影响。
税法的变化可能会对我们的业务和财务状况产生不利影响。
涉及美国联邦、州和地方所得税的规则不断受到参与立法过程的人员以及美国国税局和美国财政部的审查。税法的变化(这些变化可能具有追溯力)可能会对我们或我们普通股的持有者产生不利影响。近年来,这样的变化已经发生了许多,而且未来可能还会继续发生变化。未来税法的变化可能会对我们的业务、现金流、财务状况或运营结果产生实质性的不利影响。我们敦促投资者就税法的潜在变化对投资我们普通股的影响咨询他们的法律和税务顾问。
如果我们在编制合并财务报表时所做的估计或我们所依赖的假设被证明是不准确的,我们的实际结果可能与我们的预测和应计项目中反映的结果不同。
我们的综合财务报表是根据美国公认会计原则编制的。在编制这些合并财务报表时,我们需要作出估计和判断,以影响我们的资产、负债、收入和费用的报告金额、我们应计的费用金额以及或有资产和负债的相关披露。我们的估计是基于历史经验和我们认为在这种情况下合理的各种其他假设。然而,我们不能向您保证,我们的估计或其背后的假设将是正确的。
我们使用净营业亏损和研发抵免来抵消未来应税收入的金额和能力可能会受到一定的限制和不确定性。
截至2019年12月31日,我们的联邦和州净运营亏损结转分别为9.818亿美元和9.788亿美元,其中一部分将于2030年开始到期。截至2019年12月31日,我们还有联邦和州研发税收抵免结转分别为4560万美元和2390万美元,将于2030年和2029年开始到期,
99
目录表
分别进行了分析。这些净营业亏损和税收抵免结转可能到期时未使用,无法用于抵消未来的所得税负债。虽然2018年12月31日之后产生的联邦净营业亏损不会到期,但任何应纳税年度的此类净营业亏损的扣除额将限制在该年度应纳税所得额的80%以内,在该年度,应纳税所得额的确定不考虑净营业亏损扣除本身。一般而言,根据《守则》第382和383条的规定,公司“所有权变更”后,其利用变更前净营业亏损、NOL、税收抵免或抵免抵扣未来应纳税所得额或税额的能力受到限制。就这些目的而言,所有权变更通常发生在一个或多个股东或持有公司至少5%股份的股东集团在规定的测试期内其所有权比其最低所有权百分比增加50个百分点以上的情况下。截至2019年12月31日,我们的任何NOL或信用不会因第382和383条而过期,然而,我们股票所有权的未来变化(其中许多不在我们的控制范围内)可能会导致根据本准则第382和383条的所有权变更,并限制我们使用我们的NOL和信用的能力。根据州法律,我们的NOL或信用也可能受损。因此,我们可能无法使用我们的NOL或信用的实质性部分。此外,与我们的各种交易相关的用于税务目的的收入和费用确认的时间规则在各个方面都是复杂和不确定的,可能会受到税务当局的挑战。如果任何此类挑战持续下去,净营业亏损可能会大幅减少,和/或我们可能会被确定为一年或多年的现金纳税人。此外,我们利用NOL或抵免的能力取决于我们的盈利能力和产生美国联邦和州的应税收入。如上所述,我们自成立以来已经发生了重大净亏损,并预计在可预见的未来我们将继续遭受重大亏损,因此,我们不知道我们是否或何时将产生利用我们的NOL或信贷结转所需的美国联邦或州应纳税收入。
如果我们从事未来的收购、合资或战略合作,这可能会增加我们的资本要求,稀释我们的股东,导致我们产生债务或承担或有负债,并使我们面临其他风险。
• | 我们可能会评估各种收购和合作,包括许可或收购互补产品、知识产权、技术或业务。任何潜在的收购、合资或协作都可能带来许多风险,包括: |
• | 业务费用和现金需求增加; |
• | 承担额外的债务或或有负债; |
• | 吸收被收购公司的业务、知识产权和产品,包括与整合新人员相关的困难; |
• | 将我们管理层的注意力从我们现有的产品计划和计划上转移到寻求这样的战略合并或收购上; |
• | 关键员工的保留,关键人员的流失,以及我们维持关键业务关系的能力的不确定性; |
• | 与此类交易的另一方有关的风险和不确定性,包括该方及其现有产品或研究药物的前景和监管批准;以及 |
• | 我们无法从收购的技术或产品中获得足够的收入,以实现我们进行收购的目标,甚至无法抵消相关的收购和维护成本。 |
此外,如果我们进行收购,我们可能会利用我们的现金,发行稀释证券,承担或产生债务,产生巨额一次性费用,并收购可能导致重大未来摊销费用的无形资产。
此外,我们可能无法找到合适的收购或战略协作机会,这可能会削弱我们发展或获得可能对我们的业务发展至关重要的技术或产品的能力。
社交媒体平台的使用越来越多,带来了新的风险和挑战。
社交媒体越来越多地被用来交流我们的研究、开发候选药物、研究药物,以及我们开发候选开发药物和研究药物用于治疗的疾病。生物制药行业的社交媒体实践在继续发展,与此类使用相关的法规并不总是明确的。这一演变带来了不确定性和不遵守适用于我们业务的法规的风险,从而可能导致针对我们的监管行动。例如,患者可以使用社交媒体渠道来评论他们在正在进行的盲目临床试验中的经历,或者报告所谓的不良事件。当此类披露发生时,存在我们无法监督和遵守适用的不良事件报告义务的风险,或者我们可能无法在社交媒体产生的政治和市场压力下捍卫我们的业务或公众的合法利益,这是因为我们对我们的开发候选药物和研究药物的言论受到限制。在任何社交网站上,也存在不适当地披露敏感信息或负面或不准确的帖子或评论的风险。如果发生任何此类事件或我们未能遵守适用的法规,我们可能会承担责任、面临监管行动或对我们的业务造成其他损害。
100
目录表
与我们普通股所有权相关的风险
* 我们普通股的价格一直波动且波动很大,这可能会导致股东遭受重大损失。
我们的股价过去和未来可能会出现大幅波动。例如,2018年12月7日(我们在纳斯达克全球精选市场交易的第一天)至2020年4月30日期间,我们的股票交易价格在每股56.38美元的高价和每股11.54美元的低价范围内。由于这种波动,我们的股东可能会遭受巨大损失。
总的来说,股票市场,特别是生物制药公司的市场,经历了极端的波动,这种波动往往与特定公司的经营业绩无关。由于这种波动,你可能无法以初始购买价格或高于初始购买价格出售你的普通股。我们普通股的市场价格可能受到许多因素的影响,包括:
• | 我们的研究药物或竞争对手的临床试验结果; |
• | 有竞争力的产品或技术的成功; |
• | 战略联盟的开始或终止; |
• | 美国和其他国家的法规或法律发展; |
• | 与专利申请、已颁发的专利或者其他专有权利有关的开发或者纠纷; |
• | 关键人员的招聘或离职; |
• | 与我们的任何研究药物或临床开发计划相关的费用水平; |
• | 我们发现、开发、获取或许可其他研究药物的努力的结果; |
• | 关于财务结果、发展时间表或证券分析师建议的估计的实际或预期变化; |
• | 我们的财务业绩或那些被认为与我们相似的公司的财务业绩差异; |
• | 改变医疗保健支付制度的结构; |
• | 制药和生物技术部门的市场状况; |
• | 一般经济、行业和市场状况; |
• | 我们正在筹备的众多计划,每个计划的发展都可能产生新闻或重大不良事件,可能影响财务业绩或证券分析师的建议;以及 |
• | 我们或我们的战略合作伙伴关于我们的候选开发进展的公开公告,或我们竞争对手的研究药物或类似的公开公告。 |
如果我们的季度或年度业绩低于投资者或证券分析师的预期,我们普通股的价格可能会大幅下降。此外,我们业绩的任何季度或年度波动都可能导致我们的股票价格大幅波动。我们认为,对我们的业绩进行逐期比较不一定有意义,也不应依赖于作为我们未来业绩的指标。
此外,我们、政府机构、媒体或其他与冠状病毒爆发有关的公开声明(包括关于开发冠状病毒疫苗的努力)在过去和未来都可能导致我们的股价大幅波动。鉴于全球对冠状病毒爆发的关注,公共舞台上关于这个话题的任何信息,无论是否准确,都可能对我们的股价产生过大的影响(无论是积极的还是消极的)。
在过去,在一家公司的证券市场价格出现波动之后,通常会对该公司提起证券集体诉讼。如果对我们提起此类诉讼,可能会导致我们支付巨额费用来为此类索赔辩护,并转移管理层的注意力和资源,这可能会严重损害我们的业务、财务状况、运营结果和前景。
我们在使用我们的现金、现金等价物和投资方面拥有广泛的自由裁量权,可能无法有效地使用它们。
我们的管理层将在运用我们的现金、现金等价物和投资方面拥有广泛的自由裁量权,并可以将收益用于不改善我们的运营结果或提高我们普通股价值的方式。如果我们的管理层未能有效地使用这些资金,可能会导致财务损失,这可能会对我们的业务产生实质性的不利影响,导致我们的普通股价格下跌,并推迟我们研究药物的开发。在使用之前,我们可能会以不产生收入或失去价值的方式投资我们的现金、现金等价物和投资。
101
目录表
作为一家上市公司,我们已经并将继续增加成本,我们的管理层需要投入大量时间来实施新的合规举措。我们受到财务报告和其他要求的约束,我们的会计和其他管理系统和资源可能没有针对这些要求做好充分准备。
作为一家上市公司,我们承担了大量的法律、会计和其他费用,这是我们作为私人公司没有发生的。此外,联邦证券法,包括2002年的《萨班斯-奥克斯利法案》以及后来由美国证券交易委员会(简称美国证券交易委员会)和纳斯达克实施的规则,对上市公司提出了各种要求,包括要求提交关于我们的业务和财务状况的年度、季度和事件驱动的报告,以及建立和保持有效的披露、财务控制和公司治理做法。我们的管理层和其他人员在这些合规倡议上投入了大量时间。此外,这些规则和法规增加了我们的法律和财务合规成本,并使一些活动更加耗时和昂贵。例如,这些规章制度可能会让我们获得董事和高级管理人员责任险的难度和成本更高。我们可能无法编制可靠的财务报表,或无法将这些财务报表作为定期报告的一部分及时提交给美国证券交易委员会,或无法遵守纳斯达克的上市要求。此外,我们可能会在财务报表中犯错误,这可能需要我们重新申报财务报表。
根据2002年萨班斯-奥克斯利法案第404节,或第404节,我们必须提交一份管理层关于我们财务报告内部控制的报告,包括我们独立注册会计师事务所出具的财务报告内部控制证明报告。然而,尽管我们是JumpStart Our Business Startups Act中定义的“新兴成长型公司”,但我们的审计师没有被要求正式证明我们对财务报告的内部控制的有效性。在截至2019年12月31日的财年结束时,我们符合《1934年证券交易法》(修订后的《证券交易法》)或《交易法》的定义,并因此不再具有新兴成长型公司的资格。因此,从截至2019年12月31日的Form 10-K年度报告开始,我们必须让我们的审计师正式证明我们根据第404条对财务报告进行的内部控制的有效性。我们遵守第404条的规定,就必须产生大量的会计费用,并花费大量的管理努力。我们将继续投入内部资源,可能聘请外部顾问,并通过一项详细的工作计划,以评估和记录财务报告内部控制的充分性,继续酌情采取步骤改进控制程序,通过测试验证控制正在发挥文件记录的作用,并实施财务报告内部控制的持续报告和改进程序。尽管我们做出了努力,但我们和我们的独立注册会计师事务所都有可能在规定的时间框架内得出结论,证明我们对财务报告的内部控制是有效的,符合第404节的要求。这可能会导致金融市场因对我们财务报表的可靠性失去信心而产生不利反应。
2010年7月,多德-弗兰克华尔街改革和消费者保护法。或《多德-弗兰克法案》颁布。多德-弗兰克法案中有重要的公司治理和高管薪酬相关条款,要求美国证券交易委员会在这些领域采取额外的规章制度,如“薪酬话语权”和代理访问。我们的管理层和其他人员将需要投入大量时间来实施这些合规倡议。
我们正处于制定有关预先审批权限的政策和实践的早期阶段,我们制定和实施的任何政策都可能导致对我们公司的负面印象,并对我们的业务产生重大不利影响。
随着我们推进我们的渠道,患者和他们的医生在获得监管部门批准之前,在赞助的临床试验之外寻求获得我们的研究药物。虽然我们将继续审查和回应这些提前获得药物的请求,但在我们开发新类别药物的现阶段,我们不会在临床试验环境之外提供我们的研究药物的获得机会。随着我们的发展项目取得进一步进展,我们将继续与患者及其家属、倡导领袖、医生和其他人就这一主题和其他主题进行对话。我们将根据监管指南发布我们的审批前访问政策。
总体而言,我们目前不打算就我们业务中里程碑的预期时间提供前瞻性指导。我们计划在追溯的基础上或根据适用于我们的美国联邦证券法的其他要求,报告我们的计划的状况,包括里程碑和相关数据的实现情况,这可能会导致对我们的前景的猜测,这可能会对我们的业务产生重大不利影响。如果我们确实就里程碑的预期时间提供前瞻性指导,我们可能无法满足这些时间表,这可能会对我们的业务产生重大不利影响。
我们认为,我们大多数投资组合的早期性质不适合就个别计划里程碑的预期时间提供前瞻性指导,特别是数据读出时间。虽然作为一般事项,我们打算定期报告我们的发展计划的状况,包括以发展计划或潜在数据读数的形式阐明预期的下一步行动,但我们目前不打算就我们的计划提供前瞻性指导
102
目录表
接下来这些步骤的时机。我们已经就我们最先进的临床计划--CMV计划中某些里程碑和临床步骤的预期时间提供了前瞻性指导。如果我们无法满足本指导中确定的时间表,我们的业务可能会受到实质性的不利影响,特别是由于CMV计划的延迟。此外,我们不控制与我们的战略合作伙伴管理的任何计划相关的任何此类里程碑的披露时间。我们的战略合作伙伴对被视为负面的数据的任何披露,无论此类数据是否与我们或其他人发布的其他数据相关,都可能对我们的股价或整体估值产生重大不利影响。如果不对计划里程碑的预期时间提供前瞻性指导,可能会导致投资者、股东、分析师和其他市场参与者以及媒体对我们的个别开发候选药物、研究药物或整个计划的进展进行猜测,这可能会对我们的股价或估值产生重大不利影响。如果我们确实选择就我们业务中预期的里程碑时间提供前瞻性指导,我们可能需要在以后更新此类里程碑时间的任何变动,包括延迟,这可能会导致投资者投机我们的股票或以其他方式对我们的业务产生重大不利影响。准确预测临床读数或临床试验进展的时间是困难的,可能会因许多因素而发生变化,其中大多数因素不是我们所能控制的,包括本招股说明书附录中包括的其他风险和不确定性。
我们的现有股东在公开市场上出售大量普通股可能会导致我们的股票价格下跌。
我们的普通股可以随时在公开市场上出售,但必须遵守下文所述的某些限制。这些出售,或者市场上认为大量股票持有者打算出售股票的看法,可能会降低我们普通股的市场价格。
持有最多6160万股我们普通股的持有者有权根据《证券法》登记其股份。根据《证券法》登记这些股份将导致这些股份在《证券法》下不受限制地自由交易,但附属公司持有的股份除外,如《证券法》第144条所界定。这些股东的任何证券出售都可能对我们普通股的交易价格产生实质性的不利影响。
此外,根据我们的2018年股票期权和激励计划,我们为发行预留的普通股股数于2020年1月1日自动增加,并将在此后每年1月1日自动增加4%,相当于紧接前一年12月31日的已发行普通股股数或我们薪酬委员会确定的较少数量的普通股。除非我们的董事会每年选择不增加可供未来授予的股票数量,否则我们的股东可能会经历额外的稀释。
此外,我们的某些员工、高管和董事已经或可能加入规则10b5-1的交易计划,规定不时出售我们的普通股。根据规则10b5-1的交易计划,经纪人根据员工、董事或高级职员在进入计划时建立的参数执行交易,而无需员工、高级职员或董事的进一步指示。在某些情况下,规则10b5-1交易计划可能会被修改或终止。我们的员工、高管和董事也可以在不掌握重大、非公开信息的情况下,购买或出售规则10b5-1交易计划之外的额外股票。
筹集额外资本可能会稀释我们现有的股东,限制我们的运营,或者要求我们放弃对我们的技术或开发候选药物或研究药物的权利。
我们可能会通过公共和私人股本发行、债务融资、战略联盟和许可安排相结合的方式寻求额外资本。在我们通过出售股权或债务证券筹集额外资本的情况下,您的所有权权益将被稀释,条款可能包括清算或其他对您作为股东的权利产生不利影响的优惠。债务的产生将导致固定支付义务的增加,并可能涉及限制性契约,例如对我们产生额外债务的能力的限制,对我们获取或许可知识产权的能力的限制,以及可能对我们开展业务的能力产生不利影响的其他运营限制。如果我们通过与第三方的合作和联盟以及许可安排或通过出售资产来筹集更多资金,我们可能不得不放弃对我们的技术或开发候选药物或研究药物的宝贵权利,或者以对我们不利的条款授予许可证。
如果证券分析师不发表关于我们业务的研究或报告,或者如果他们发表对我们股票的负面评价,我们的股票价格可能会下跌。
我们普通股的交易市场在一定程度上依赖于行业或金融分析师发布的关于我们或我们业务的研究和报告。如果报道我们的一位或多位分析师下调了我们的股票评级,或发表了不准确或不利的消息
103
目录表
对我们的业务进行研究,我们的股票价格可能会下跌。如果这些分析师中的一位或多位停止对我们的报道或未能定期发布有关我们的报告,对我们股票的需求可能会减少,这可能会导致我们的股价和交易量下降。
我们的主要股东和管理层拥有我们相当大比例的股票,并将能够对有待股东批准的事项施加重大控制。
我们的高管、董事、5%的股东及其附属公司实益拥有我们约40.8%的已发行普通股。因此,这些股东将有能力通过他们的所有权地位来影响我们。例如,这些股东共同行动,可能能够对诸如董事选举、修改我们的组织文件、批准任何合并、出售资产或其他重大公司交易等事项施加重大影响。这可能会阻止或阻止对我们普通股的主动收购提议或要约,您可能认为这些提议或要约符合您作为我们股东的最佳利益。
我们修订和重述的公司注册证书和章程中的条款,以及特拉华州法律的条款,可能会使第三方更难收购我们或增加收购我们的成本,即使这样做会使我们的股东受益或罢免我们目前的管理层。
我们修订和重述的公司注册证书、章程和特拉华州法律包含的条款可能会延迟或阻止我们控制权的变更或我们管理层的变更。我们经修订及重述的公司注册证书及经修订及重述的附例包括以下条文:
• | 授权“空白支票”优先股,可由我们的董事会发行,无需股东批准,并可能包含投票权、清算、股息和其他优于我们普通股的权利; |
• | 创建一个分类的董事会,其成员交错任职三年; |
• | 明确我们的股东特别会议只能由我们的董事会,我们的董事长,我们的首席执行官,或者我们的总裁来召集; |
• | 禁止股东在书面同意下采取行动; |
• | 为股东在年度股东大会上的批准建立一个预先通知程序,包括建议提名的董事会成员人选; |
• | 规定我们的董事只有在有理由的情况下才能被免职; |
• | 规定我们董事会的空缺只能由当时在任的大多数董事填补,即使不到法定人数; |
• | 明确规定任何股东不得在任何董事选举中累积投票权; |
• | 明确授权本公司董事会修改、更改或废除本公司经修订和重述的章程;以及 |
• | 需要我们普通股持有者的绝对多数票才能修订我们修订和重述的公司注册证书以及修订和重述的章程中的特定条款。 |
这些条款单独或一起可能会推迟或阻止敌意收购、控制权变更或我们管理层的变动。
此外,由于我们是在特拉华州注册成立的,我们受特拉华州公司法第2203节的规定管辖,该条款限制持有我们已发行有表决权股票超过15%的股东与我们合并或合并的能力。
我们修订和重述的公司注册证书或修订和重述的章程或特拉华州法律中任何具有延迟或威慑控制权变更的条款都可能限制我们的股东从他们持有的普通股获得溢价的机会,还可能影响一些投资者愿意为我们的普通股支付的价格。
我们普通股的活跃交易市场可能无法持续。
我们的普通股于2018年12月7日在纳斯达克全球精选市场开始交易。鉴于我们普通股的交易历史有限,我们股票的活跃交易市场可能无法持续,这可能会给我们普通股的市场价格带来下行压力,从而影响我们股东出售股票的能力。
由于我们预计在可预见的未来不会对我们的股本支付任何现金股息,因此资本增值(如果有的话)将是您唯一的收益来源。
我们目前不打算宣布或支付我们的股本的现金股息。我们目前打算保留我们未来的所有收益,如果有的话,为我们业务的增长和发展提供资金。此外,未来任何债务协议的条款可能会阻止我们支付股息。因此,我们普通股的资本增值(如果有的话)将是您在可预见的未来唯一的收益来源。
104
目录表
*我们修订和重述的章程指定特拉华州衡平法院或美国马萨诸塞州地区法院作为我们股东可能发起的某些诉讼的独家论坛,这可能会限制我们的股东获得有利的司法论坛处理与我们的纠纷的能力。
根据我们经修订和重述的附例,除非吾等以书面形式同意选择另一法院,否则特拉华州衡平法院是州法律索赔的唯一和独家法院,涉及(1)代表吾等提起的任何衍生诉讼或法律程序,(2)任何声称吾等任何现任或前任董事、高级职员或其他雇员违反对吾等或吾等股东所负受信责任的诉讼,(3)任何针对吾等或吾等任何现任或前任董事、高级职员、雇员、根据特拉华州一般公司法或我们修订和重述的细则的任何条款,或(4)任何主张受内部事务原则管辖的索赔的诉讼(“特拉华州论坛条款”)。特拉华论坛条款不适用于根据《证券法》或《交易法》提起的任何诉讼。我们修订和重述的附例进一步规定,美国马萨诸塞州地区法院是解决根据证券法(“联邦论坛条款”)提出的诉讼因由的任何投诉的独家论坛。我们选择美国马萨诸塞州地区法院作为此类诉讼理由的独家论坛,因为我们的主要执行办事处位于马萨诸塞州剑桥市。此外,我们修订和重述的章程规定,任何购买或以其他方式获得我们普通股股份权益的个人或实体被视为已通知并同意特拉华论坛条款和联邦论坛条款;但是,如果股东不被视为放弃遵守联邦证券法及其下的规则和法规。
2018年12月19日,在萨巴库奇诉萨尔茨贝格案,C.A.No.2017-0931-JTL(Del.特拉华州衡平法院发布了一项裁决,宣布根据《证券法》要求向联邦法院提出索赔的联邦法院选择条款根据特拉华州的法律是无效和无效的。然而,这一决定被上诉到特拉华州最高法院,并于2020年3月18日,特拉华州最高法院推翻了大法官法院,裁定根据特拉华州法律,此类联邦论坛选择条款在表面上是有效的。鉴于特拉华州最高法院的裁决,我们打算执行我们的联邦论坛条款,指定马萨诸塞州地区为证券法索赔的独家论坛。我们认识到,特拉华州论坛条款和联邦论坛条款可能会给股东在提起任何此类索赔时带来额外的诉讼成本,特别是如果股东不在特拉华州或马萨诸塞州联邦居住或居住在适用的地方或附近。此外,我们修订和重述的章程中的论坛选择条款可能会限制我们的股东在与我们或我们的董事、高管或员工的纠纷中获得有利的司法论坛的能力,这可能会阻碍对我们和我们的董事、高管和员工提起诉讼,即使诉讼成功,可能会使我们的股东受益。联邦论坛的条款还可能对声称该条款不可执行或无效的股东施加额外的诉讼费用。 特拉华州衡平法院和美国马萨诸塞州地区法院也可能做出与其他法院不同的判决或结果,包括考虑诉讼的股东可能位于或将选择提起诉讼的法院,此类判决可能或多或少对我们的股东有利。
105
目录表
第二项股权证券的未登记销售和募集资金的使用。
最近出售的未注册证券
没有。
普通股公开发行募集资金的使用
我们根据证券法第424(B)条向美国证券交易委员会提交的最终招股说明书中描述的首次公开募股所得资金的计划用途没有实质性变化。我们以现金、现金等价物和投资的形式持有净收益的余额。我们将收到的资金投资于短期、计息的投资级证券和政府债券。
项目6.展品
以下列出的附件作为本表格10-Q的一部分提交或以引用的方式纳入。
证物编号: | 展品索引 | |
31.1* | 根据依照2002年《萨班斯-奥克斯利法案》第302节通过的1934年《证券交易法》第13a-14(A)条和第15d-14(A)条颁发的首席执行官证书 | |
31.2* | 根据根据2002年《萨班斯-奥克斯利法案》第302节通过的1934年《证券交易法》第13a-14(A)条和第15d-14(A)条对首席财务官的认证 | |
32.1+ | 根据2002年《萨班斯-奥克斯利法案》第906条通过的《美国法典》第18编第1350条的认证 | |
101.INS* | XBRL实例文档 | |
101.Sch* | XBRL分类扩展架构文档 | |
101.卡尔* | XBRL分类扩展计算文档 | |
101.定义* | XBRL分类扩展定义Linkbase文档 | |
101.实验所* | XBRL分类扩展标签Linkbase文档 | |
101.前期* | XBRL分类扩展演示文稿链接文档 | |
104* | 封面交互数据文件(格式为内联XBRL,包含附件101中包含的适用分类扩展信息。*) | |
* | 随函存档 |
+ | 本文附件32.1中提供的证明被视为随附于本表格10-Q,并且不会被视为根据修订后的1934年证券交易法第18条的“已提交”。此类认证不会被视为通过引用纳入根据修订后的1933年证券法或修订后的1934年证券交易法提交的任何文件中,除非注册人特别通过引用将其纳入。 |
106
目录表
签名
根据1934年《证券交易法》第13或15(D)节的要求,注册人已正式安排由正式授权的以下签署人代表其签署本报告。
Moderna公司 | |||
日期: | 作者: | /S/史黛芬银行 | |
2020年5月7日 | |||
斯特凡纳银行 | |||
董事首席执行官兼首席执行官 | |||
(首席行政官) | |||
日期: | 作者: | /s/ Lorence Kim,医学博士 | |
2020年5月7日 | |||
洛伦斯·金,医学博士 | |||
首席财务官 | |||
(首席财务官) | |||
107