
附录 99.1

1 重新定义中枢神经系统疗法 NLS Pharmaceutics 2023 年 9 月

2 前瞻性陈述本演示文稿包含 1995 年《私人证券诉讼改革法》和其他美国联邦证券法中的明示或暗示的前瞻性陈述。例如,我们在讨论临床试验结果、未来临床试验的预期时间、收到临床试验结果和获得监管部门批准Mazindol ER时使用了前瞻性陈述;我们在2023年的战略重点;我们针对各种适应症的候选产品线;Mazindol ER的预期开发时间表;未来可能进行的拟议试验;以及我们的候选产品在改善患者医疗保健方面可能带来的潜在好处。这些前瞻性陈述及其影响仅基于我们管理层当前的预期,并受许多因素和不确定性的影响,这些因素和不确定性可能导致实际业绩与前瞻性陈述中描述的结果存在重大差异。除其他外,以下因素可能导致实际结果与前瞻性陈述中描述的结果存在重大差异:技术和市场要求的变化;我们在启动和/或成功完成临床试验时可能会遇到延迟或障碍;我们的产品可能未获得监管机构的批准,我们的技术在进一步发展过程中可能无法得到验证,其方法可能无法被科学界接受;我们可能无法留住或吸引知识至关重要的关键员工那个产品的开发;我们的工艺可能会出现不可预见的科学困难;我们的产品最终可能会比预期的更昂贵;实验室的结果在实际临床环境中可能无法转化为同样好的结果;临床前研究的结果可能与人体临床试验的结果不相关;我们的专利可能不够;我们的产品可能会伤害接受者;立法的变化可能会对我们产生不利影响;无法及时开发和引入新技术、产品和应用;市场损失竞争造成的份额和定价压力,这可能导致我们的实际业绩或业绩与此类前瞻性陈述中的设想存在重大差异。除非法律另有要求,否则我们没有义务公开发布对这些前瞻性陈述的任何修订,以反映本声明发布之日之后的事件或情况或反映意外事件的发生。有关影响我们的风险和不确定性的更多详细信息载于我们向美国证券交易委员会(SEC)提交的截至2022年12月31日的20-F表年度报告中的 “风险因素” 标题下,该报告可在美国证券交易委员会的网站www.sec.gov上查阅,也可以在我们随后向美国证券交易委员会提交的文件中查阅。本演示文稿中以引用方式使用或纳入了我们的徽标和一些商标和商品名。本演示文稿还包括属于其他组织财产的商标、商号和服务标志。仅为方便起见,本演示文稿中提及的商标、商品名和服务商标在出现时可能不带有®、TM 和 SM 符号,但这些提法无意以任何方式表明我们不会根据适用法律最大限度地维护我们或适用许可方对这些商标、商品名和服务商标的权利。我们从市场研究、公开信息和行业出版物中获得了本演示文稿中以引用方式描述的统计数据、市场数据和其他行业数据和预测。行业出版物通常表示,他们从他们认为可靠的来源获取信息,但不保证信息的准确性和完整性。同样,尽管我们认为统计数据、行业数据和预测以及市场研究是可靠的,但我们尚未独立验证这些数据,也没有对信息的准确性做出任何陈述。

一般概述

4 业务亮点 NLS 开发用于罕见和复杂中枢神经系统 (CNS) 疾病的药物疗法 • Mazindol ER 已成功完成发作性睡病治疗的 2 期试验,包括 OLE:预计到 2027 年年市场规模将达到 45 亿美元* • AMAZE 三期计划将于 2023 年下半年启动 • 美国和欧洲授予孤儿药称号 (ODD) • 一次性强知识产权保护——每日配方为止 2037 • 独特的睡眠特许经营权(包括MNE)• 产品线不断进展和扩大,主要市场的知识产权保护期已久 •针对发作性睡病和特发性睡眠过度失眠患者的命名患者计划已在欧洲各地的目标市场启动,可能还有 ROW(世界其他地区)* ResearchandMarkets.com(2022年10月)

NLS领导团队Alex Zwyer,工商管理硕士首席执行官兼联合创始人Alex Zwyer是公司的共同创始人,拥有丰富的C级制药运营经验。一位连续创业者和强有力的领导者,在 “完成交易” 方面有着良好的记录。曾在全球专业制药公司Viforpharma AG担任首席运营官。还有一位退休的瑞士陆军上尉。乔治·阿波斯托尔,医学博士,硕士首席医学官在制药研发机构工作了20多年。礼来、辉瑞、雅培、诺华、夏尔和远藤等全球研发组织在开发的早期、中期和晚期阶段拥有丰富的药物开发专业知识。获得了杰出的研发奖项,并在美国、欧盟和日本获得了多项监管批准。Elena Thyen——Pighin首席财务官埃里克·科诺法尔,医学博士,首席科学官兼合伙人——创始人一位药物猎人和公司的联合创始人,在临床和科学研究方面拥有深厚的知识和经验。他是巴黎罗伯特德布雷大学(APHP)小儿睡眠障碍中心的高级医学顾问,并曾在巴黎罗伯特德布雷大学临床药理学和药物遗传学系担任首席临床研究员。Thyen女士——Pighin女士在领导和管理职能方面拥有丰富的经验,曾担任多个行业的财务和人力资源主管。总部设在瑞士的Thyen-Pighin女士有着成功的往绩,最值得注意的是私有和上市企业的会计记录。

6 玛丽安·兰伯森,MSW 企业传播与投资者关系主管哈维·库什纳高级生物统计顾问汤姆·库什诺,工商管理硕士美国商业运营负责人比特·威德勒,博士质量主管埃尔韦·吉尔索,工商管理硕士业务开发与许可主管克里斯蒂娜·阿尔盖尔美国公认会计准则财务运营经理詹妮弗·佛朗哥科学卓越主管杰夫·沙龙伯尼尔临床运营主管谭,工商管理硕士项目管理与战略负责人包乐,管理硕士经验丰富的团队负责人安德烈亚斯Fischer 供应链负责人 Sam Salamone,理学硕士,工商管理硕士,RAC CMC 负责人 Jim Herman 毒理学负责人 Alex Zwyer,工商管理硕士首席执行官联合创始人乔治·阿波斯塔尔,医学博士,医学博士,首席科学官 Co.——创始人 Elena Thyen-Pighin 首席财务官

NLS 管道概述支持临床前化合物适应症治疗的第三阶段 2 期研究领域在 140 多个国家拥有 100 多项专利,包括发作性睡病、特发性睡眠过多症和克莱因莱文综合症 • 注意力缺陷多动症 • 伴有路易体病、帕金森氏病和/或阿尔茨海默氏病的神经系统疾病治疗 Mazindol ER Narcoldol's Epsy NT1 发作性睡病 NT2 特发性睡眠过度睡眠障碍 NLS-4 特发性睡眠增多症NLS-11 Kleine-Levin Syndrome NLS-4 CFS/ME Long COVID CNS/Immunology NLS-8 阿尔茨海默氏病神经退行性疾病 NLS-12 路易体病 NLS-1 多动症阿片类药物使用障碍精神病学/成瘾 NLS-3 注意力缺陷多动障碍自闭症谱系障碍药物使用障碍
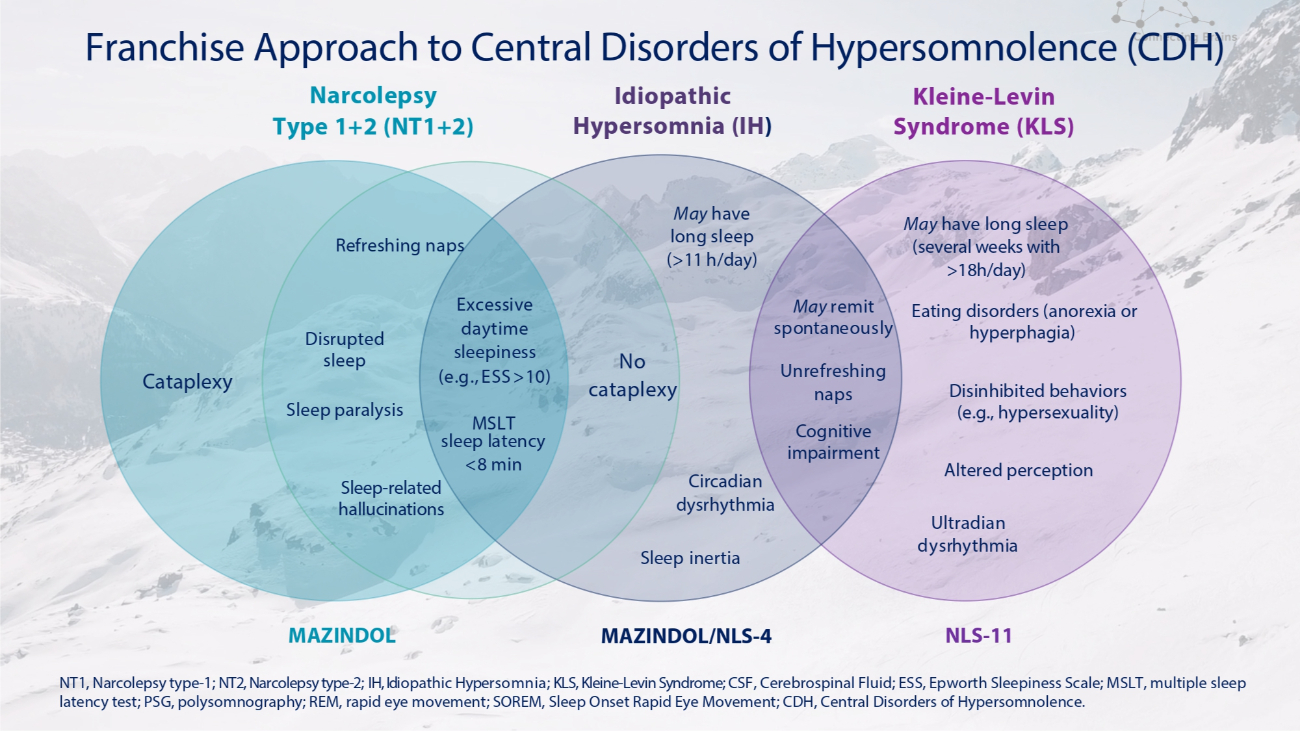
发作性睡病 1+2 型 (NT1+2) 特发性睡眠过度睡眠 (IH) 瘫痪睡眠中断睡眠麻痹睡眠相关幻觉没有瘫痪白天过度嗜睡(例如 ESS > 10)MSLT 睡眠潜伏期 11 小时/天)可能会自发地缓解昼夜节律失常知觉改变 Kleine-Levin 综合症 (KLS)) 睡得不爽认知障碍 Ultradian 心律失常可能睡眠时间长(数周,每天超过 18 小时)饮食失调(厌食症或食欲亢进)抑制行为(例如性欲亢进)MAZINDOL MAZINDOL/NLS-4 NLS-11NT1,发作性睡病类型-1;NT2,发作性睡病类型-2;IH,特发性睡眠过度;KLS,Kleine-Levin 综合症;脑脊液;ESS,爱普沃斯嗜睡量表;MSLT,多重睡眠潜伏试验;REM,快速眼动;SOREM,睡眠发作性快速眼动;CDH,中枢性疾病过度沉迷。特许经营方法治疗中枢性睡眠障碍(CDH)

发作性睡病一览

10 1. www.ncbi.nlm.nih.gov/pmc/articles/pmc/pmc6492289/ 2.北极星市场研究(2023 年 4 月)3. 2018 年全国知情发作性睡病调查。https://knownarcolepsy.com/hcp/impact 发作性睡病使人衰弱的市场;庞大且服务不足 • 全球有 300 万人患病 • 仅在美国有 20 万人被确诊 • 有 60-70,000 人被确诊 • 17,000 人服用 SXB(2022年)来源:www.narcolepsynetwork.org • 经典发作性睡病与极低或无法检测到的荷尔蒙摄取素水平有关大脑 1 • 预计到2032年,全球发作性睡病疗法市场将达到77.5亿美元(2022年:31.4亿美元),复合年增长率为9.5% 2 •没有市售的产品可以解决食欲素不足的问题;大多数患者对他们的治疗仍然不满意 3

11 12% 认为自己的发作性睡病症状已完全或基本得到控制 93% 对目前的治疗方案表示失望 94% 表示需要新的治疗方案医疗需求未得到满足的严重罕见病在 Xyrem® 的三期试验中,78%-85% 的患者需要兴奋剂治疗来控制症状。* 目前尚无治愈方法,许多患者报告他们的药物无法改善症状。资料来源:2018 年。全国知情发作性睡病调查。https://knownarcolepsy.com/hcp/impact *Xyrem 标签和在常规临床实践中长期使用羟丁酸钠治疗发作性睡病伴发作性睡病的安全性和有效性(睡眠医学 35 (2017) 80-84)
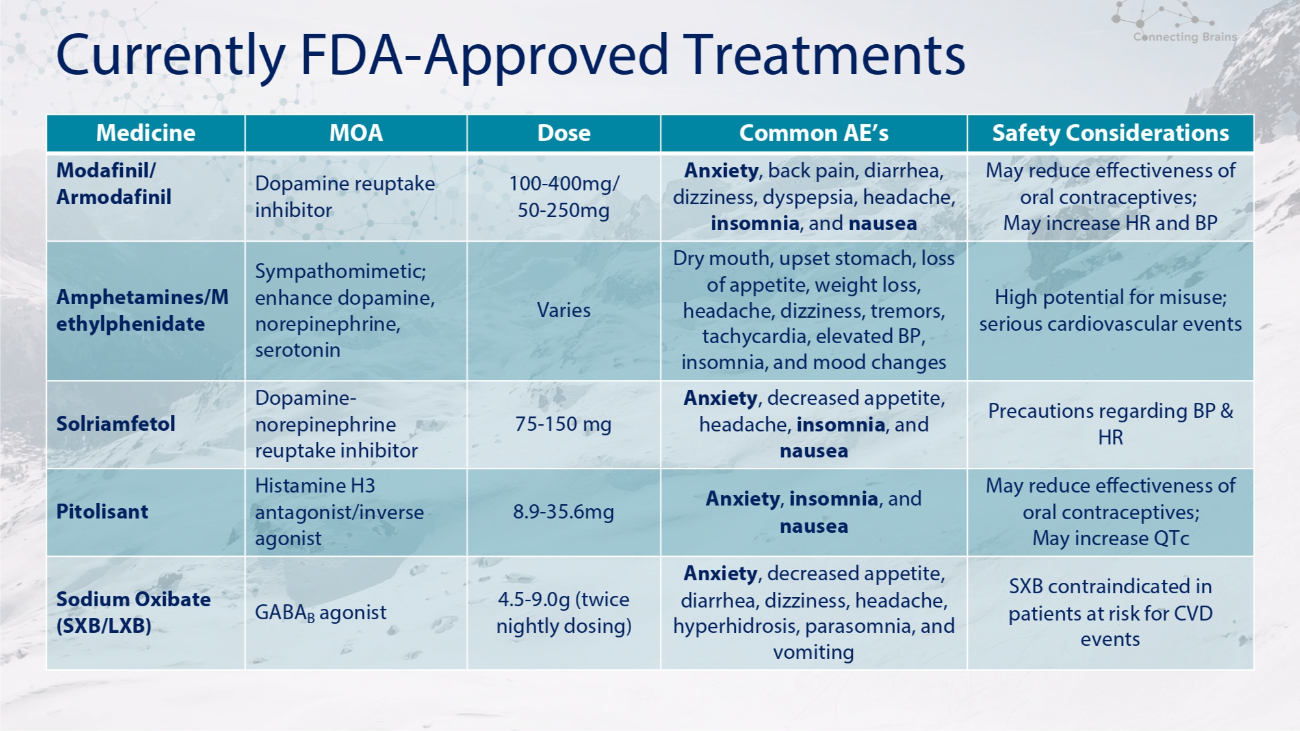
目前 FDA-批准的治疗安全注意事项 AE 的常见剂量 MOA 药物可能会降低口服避孕药的有效性;可能会增加心率和血压焦虑、背痛、腹泻、头晕、消化不良、头痛、失眠和恶心 100-400mg/ 50-250mg 多巴胺再摄取抑制剂莫达非尼/阿莫达非尼滥用的可能性很高;严重的心血管事件口干、胃部不适、食欲不振、体重减轻失落、头痛、头晕、震颤、心动过速、血压升高、失眠和情绪变化各异拟交感神经药;增强多巴胺,去甲肾上腺素、血清素苯丙胺/哌醋乙酯关于血压和心率的预防措施焦虑、食欲下降、头痛、失眠和恶心 75-150 mg 多巴胺-去甲肾上腺素再摄取抑制剂 Solriamfetol 可能会降低口服避孕药的有效性;可能会增加 qTc 焦虑、失眠和恶心 8.9-35.6mg 组胺 H3 拮抗剂/输入有心血管疾病事件风险的患者禁用逆激动剂 Pitolisant SXB 焦虑、食欲下降、腹泻、头晕、头痛、多汗症、异睡症和呕吐 4.5-9.0g(每晚给药两次)GABA B 激动剂氧化钠 (SXB/LXB)
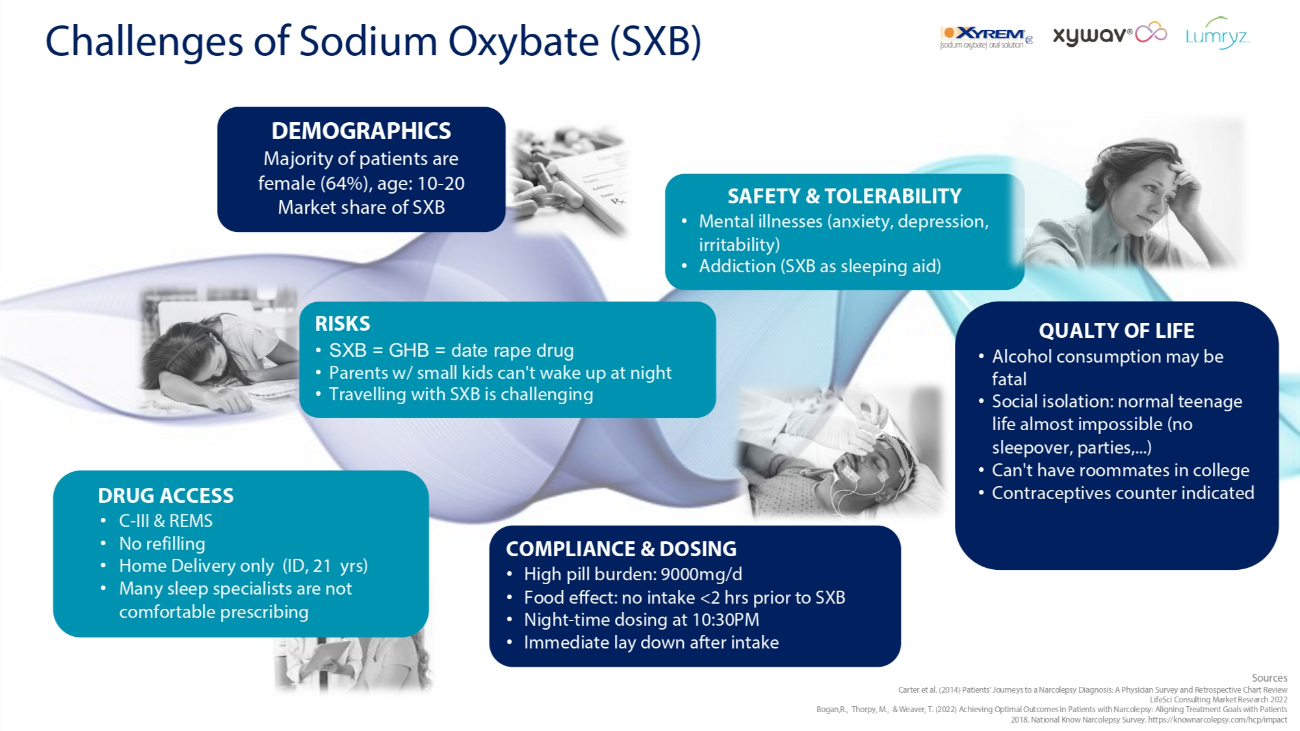
羟丁酸钠(SXB)合规性和剂量方面的挑战 • 高药丸负担:9000mg/d • 食物效应:不摄入
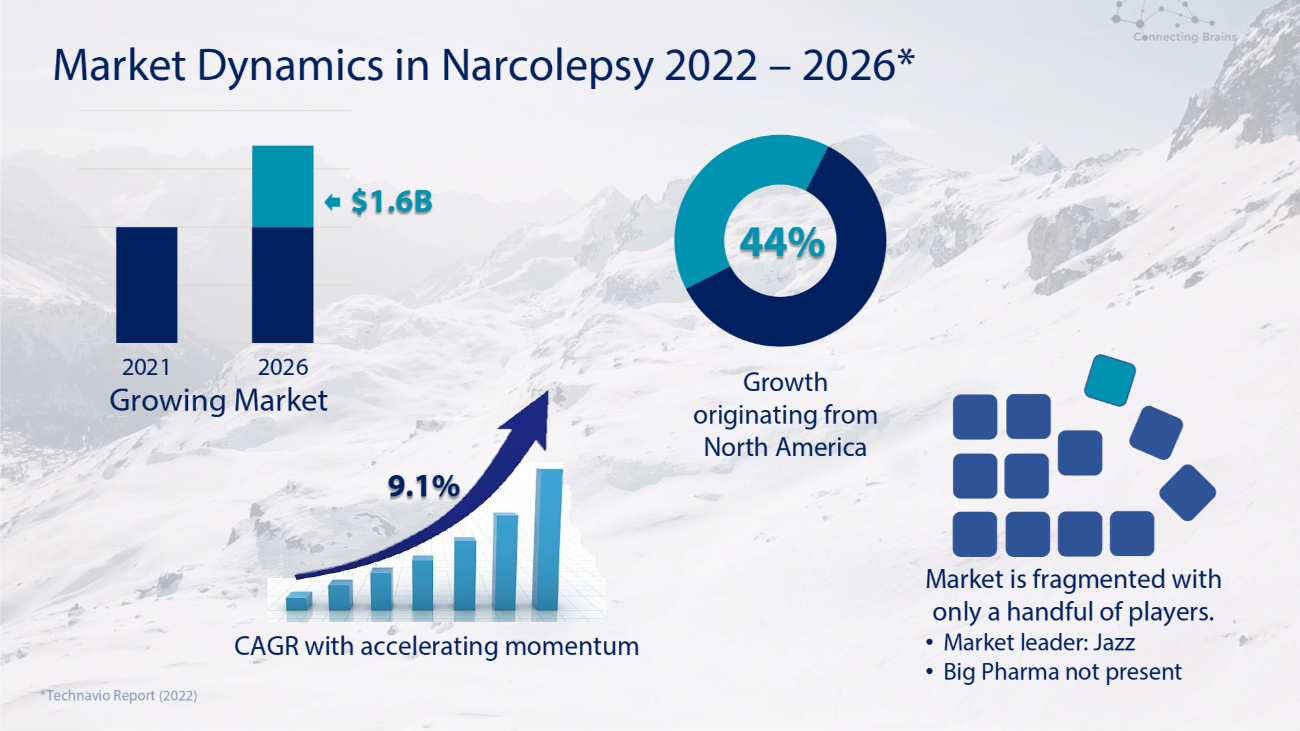
2022年至2026年发作性睡病的市场动态*增长源自北美*Technavio报告(2022年)市场分散,只有少数参与者。• 市场领导者:爵士 • 大型制药公司未公布2021年2026年增长的市场复合年增长率,势头加快 9.1% 16亿美元 44%

Mazindol ER (3mg)

• 用于治疗发作性睡病的活性成分(mazindol)的悠久历史(“同情用药” 计划)• 部分食欲素的新型双重作用机制——2 受体激活和三重单胺再摄取抑制 • 2 期阳性结果:符合大多数终点,具有很高的统计学意义和良好的安全性/耐受性 • 每日一次配方 • 快速起效 • 药物相互作用潜力低 • 低滥用可能性:IV • 有可能作为发作性睡病的单一疗法 Mazindol ER 双 SNDRI/OX2R 激动剂
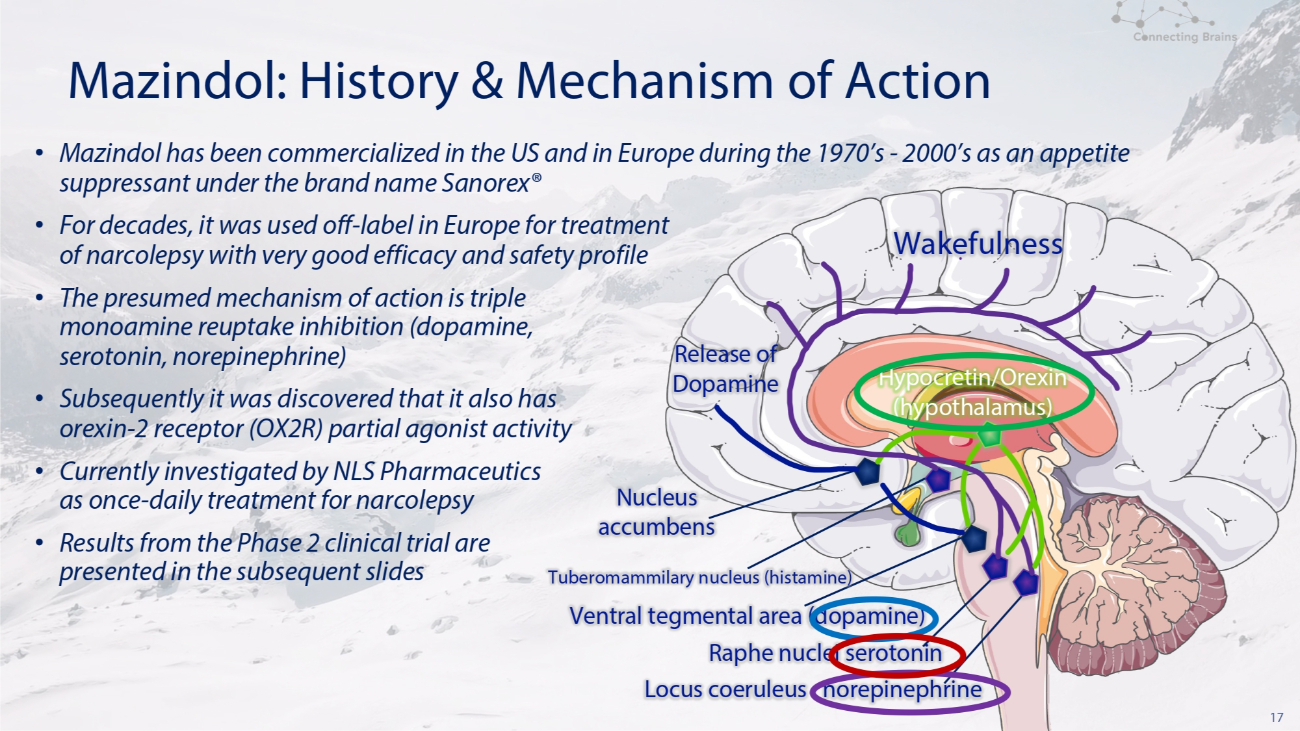
17 Mazindol:历史和作用机制觉醒性释放伏隔核结节乳腺核(组胺)腹侧包皮区(多巴胺)Raphe 核血清素去甲肾上腺素 Locus coeruleus locus coeruleus 去甲肾上腺素 • Mazindol 在 1970 年代至 2000 年代作为食欲抑制剂在美国和欧洲商业化,品牌名称为 Sanpenhren orex® • 几十年来,它在欧洲一直被不合时宜地用于治疗发作性睡病,具有非常好的疗效和安全性 • 假定的作用机制是三重单胺再摄取抑制(多巴胺,血清素、去甲肾上腺素)• 随后发现它还具有食欲素-2 受体(OX 2 R)部分激动剂活性 • NLS Pharmaceutics 目前正在研究一次——发作性睡病的每日治疗方法 • 2 期临床试验的结果见随后的幻灯片 Hypocretin/Orexin(下丘脑)

Mazindol ER 临床开发计划 POLARIS

19 POLARIS:发作性睡病的Mazindol ER开发计划POLARIS包括两项美国临床试验 • NLS-1021 第二阶段,一项为期四周的双盲、安慰剂对照、随机、美国多中心研究,对比安慰剂,每日一次(1:1)• NLS-1022 开放标签延期,一项开放标签延期(OLE)研究可供选择完成为期四周的NLS 1021研究后的个人。这项OLE研究为参与者提供了每天早上口服一次Mazindol ER的机会,持续长达六个月。
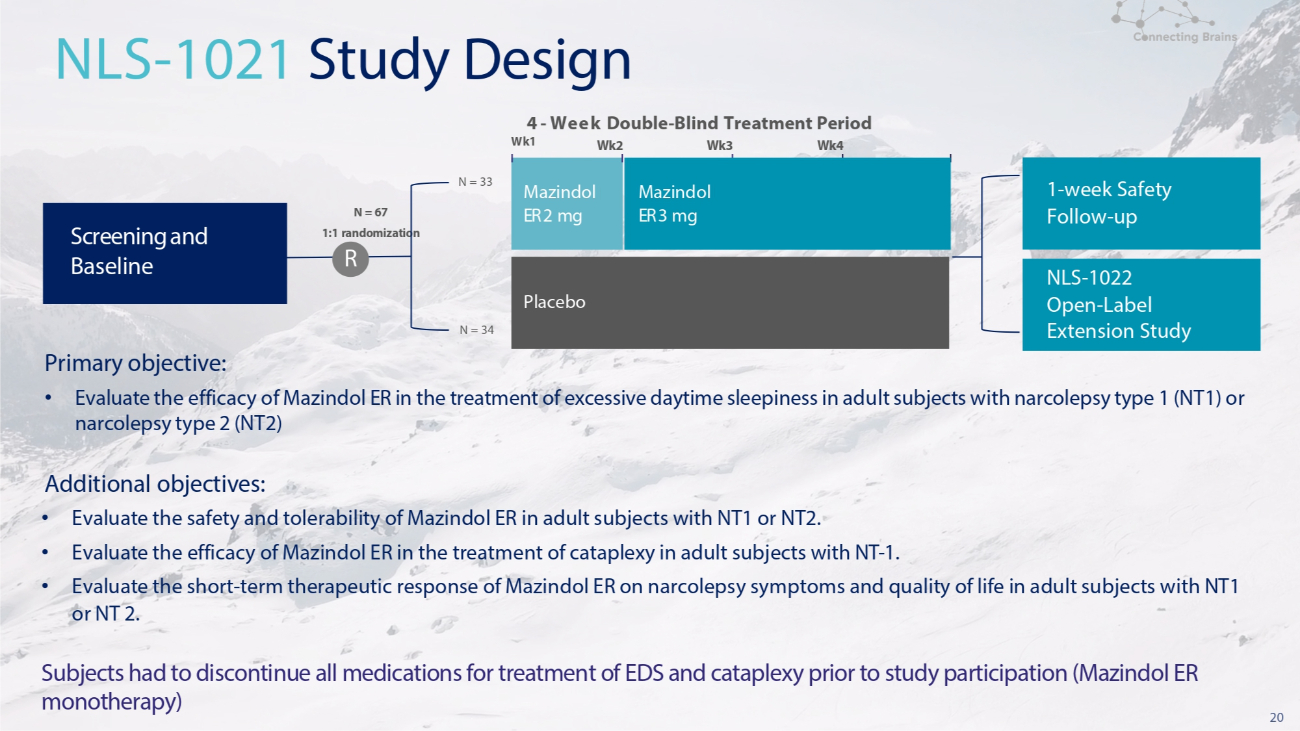
20 主要目标:• 评估 Mazindol ER 治疗 1 型发作性睡病 (NT1) 或 2 型发作性睡病 (NT2) 成人受试者日间过度嗜睡的疗效。其他目标:• 评估 Mazindol ER 对 NT1 或 NT2 成人受试者的安全性和耐受性。• 评估 Mazindol ER 治疗成人受试者瘫痪的疗效-1. • 评估 Mazindol ER 对患有 NT1 或 NT 2 的成年受试者的发作性睡病症状和生活质量的短期治疗反应。受试者在参与研究前必须停用所有用于治疗急性呼吸障碍和猝倒的药物(Mazindol ER 单一疗法)N = 33 Wk1 N = 34 4-双周——盲人治疗期 Wk2 Wk3 Wk4 NLS-1021 研究设计 Mazindol ER 2 mg 安慰剂 Mazindol ER 3 mg 筛查和基线 1 周安全随访——向上 NLS-1022 开放——标签延期研究 N = 67 1 随机化 R

第 2 阶段的主要功效导致白天过度嗜睡 (EDS)
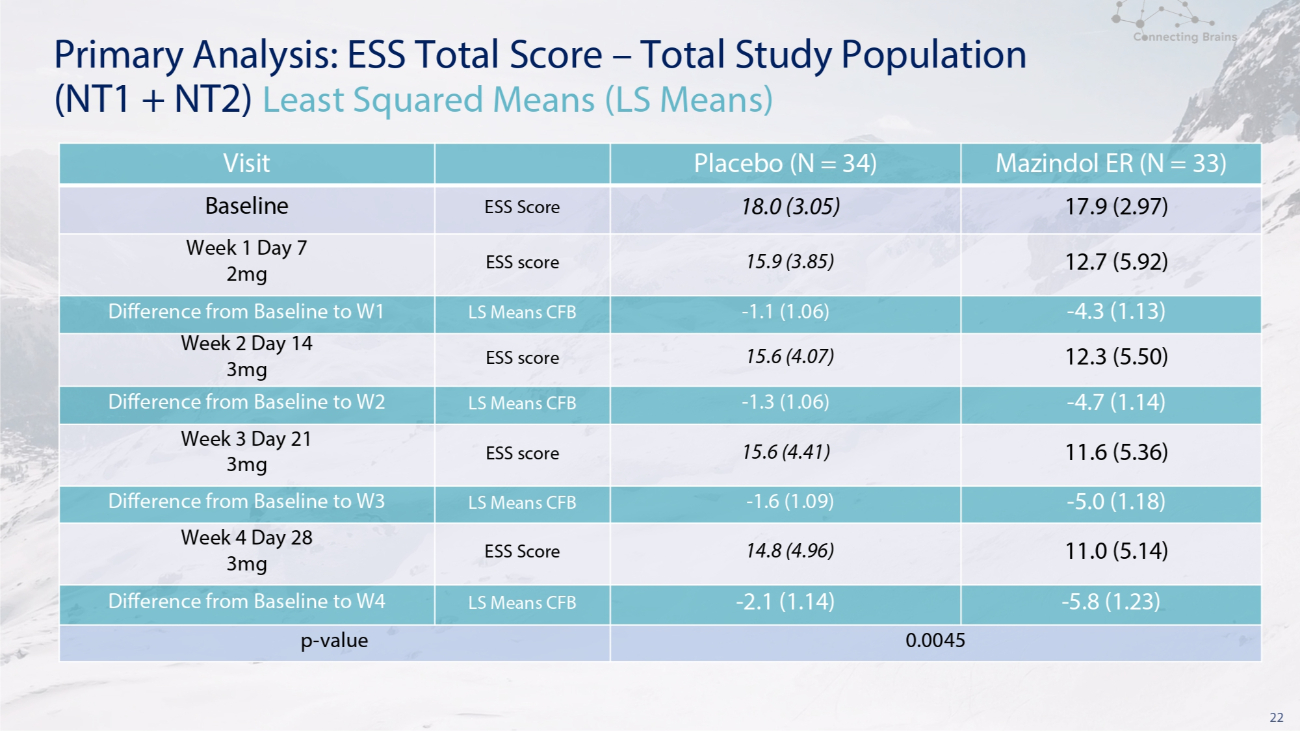
22 主要分析:ESS 总分——研究人群总数(NT1 + NT2)最小二乘均值(LS 均值)Mazindol ER(N = 33)安慰剂(N = 34)访问 17.9(2.97)18.0(3.05)ESS 分数基线 12.7(5.92)15.9(3.85)ESS 分数第 1 周第 7 天 2mg-4.3(1.13)-1.1(1.06)表示 LS CFB 差异从基线到第 1 季度 12.3 (5.50) 15.6 (4.07) ESS 分数第 2 周 14 天 3mg-4.7 (1.14)-1.3 (1.06) LS 表示从基线到 W2 的 CFB 差异 11.6 (5.36) 15.6 (4.41) ESS 分数第 3 周 21 天 3mg-5.0 (1.18)-1.6 (1.09) LS 表示从基线到 W3 的 CFB 差异 11.0 (5.14)14.8 (4.96) ESS 分数第 4 周第 28 天 3mg-5.8 (1.23)-2.1 (1.14) LS 表示基线与 W4 的 CFB 差异 0.0045 p-值
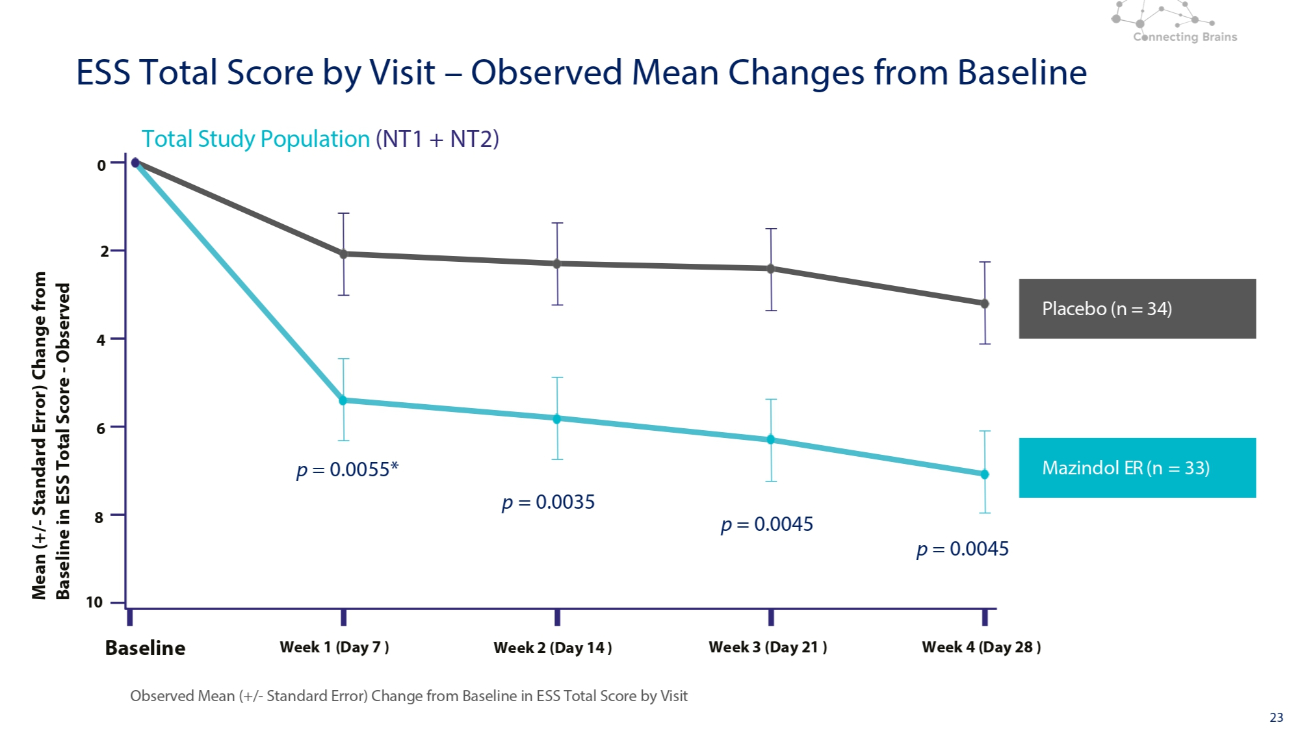
23 安慰剂(n = 34)Mazindol ER(n = 33)总研究人群(NT1 + NT2)按访问量观测到的ESS总分与基线的变化情况 0 2 4 6 8 10 基准周 1(第 7 天)第 2 周(第 14 天)第 3 周(第 21 天)第 4 周(第 28 天)ESS 总分与基线的平均值(+/-标准误差)与 ESS 总分基线相比的变化访问分数 — 观测到的与基线相比的平均变化 p = 0.0055* p = 0.0045 p = 0.0045 p = 0.0045 p = 0.0035

第 2 阶段二级疗效结果 Cataplexy
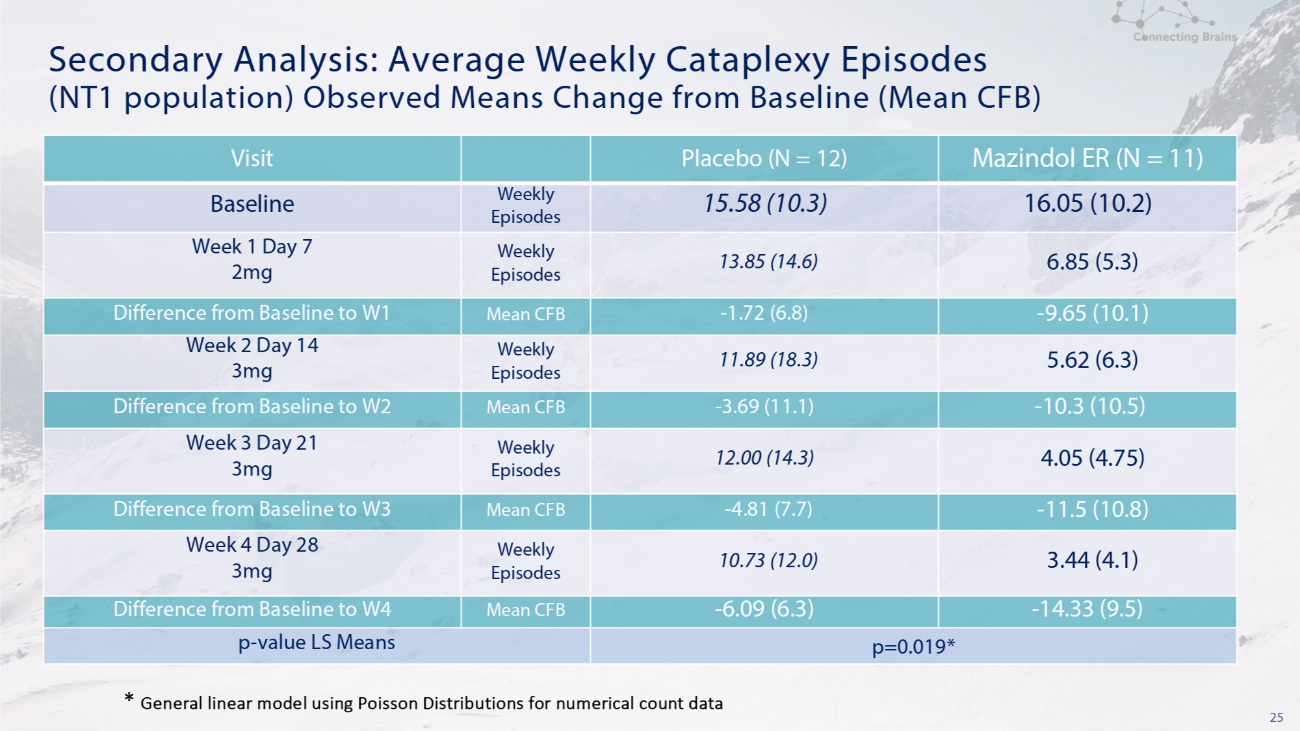
25 次要分析:观察到的每周平均脚痛发作次数(NT1 人群)是指与基线(平均CFB)相比的变化 Mazindol ER(N = 11)安慰剂(N = 12)访问 16.05(10.2)15.58(10.3)每周发作基线 6.85(5.3)13.85(14.6)每周剧集第 1 天 2mg-9.65(10.1)-1.72(6.8)平均值 CFB 差异从基线到第 1 季度 5.62 (6.3) 11.89 (18.3) 每周剧集第 2 天 14 天 3mg-10.3 (10.5)-3.69 (11.1) 基线与 W2 的平均 CFB 差 4.05 (4.75) 12.00 (14.3) 每周剧集第 3 周 21 天 3mg-11.5 (10.8)-4.81 (7.7) 平均值 CFB基线与 W3 的差异 3.44 (4.1) 10.73 (12.0) 每周剧集第 4 周 28 天 3mg-14.33 (9.5)-6.09 (6.3) 与基线与 W4 的平均 CFB 差 p=0.019* p-值 LS 均值 * 使用泊松分布作为数字计数数据的通用线性模型
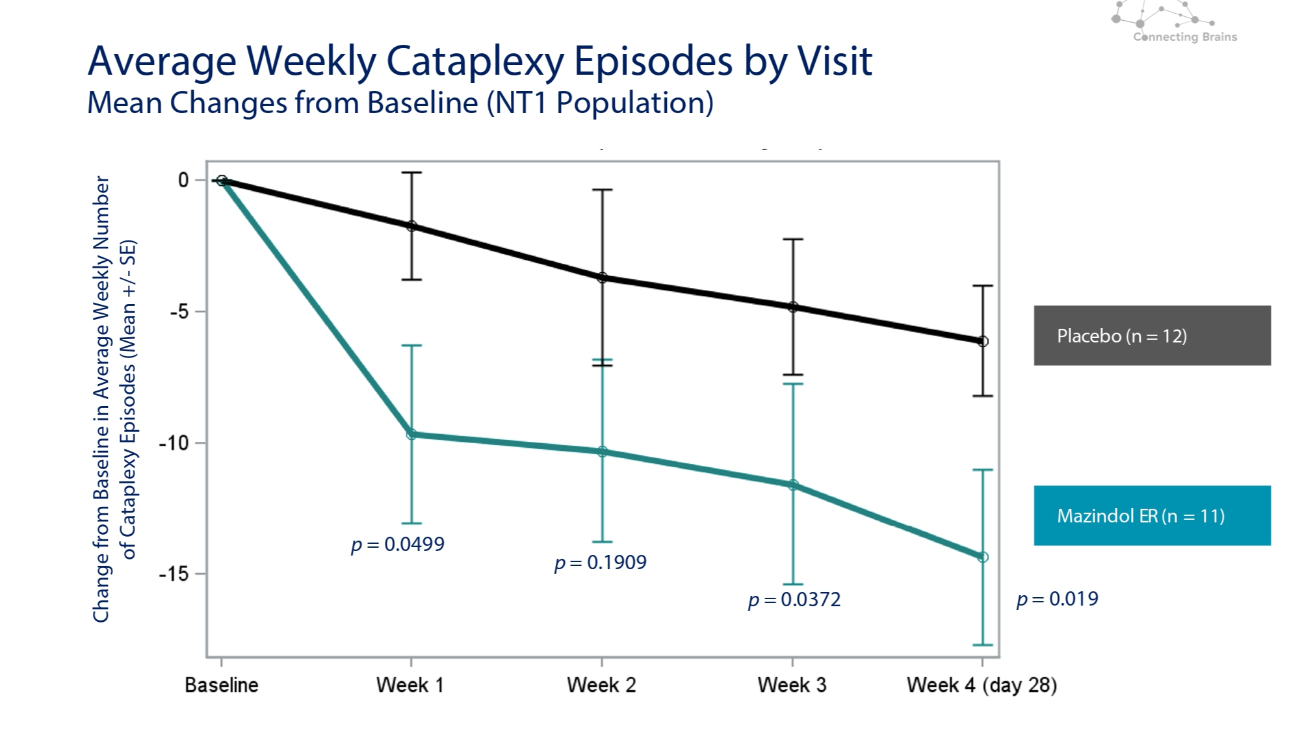
按就诊次数划分的每周平均猝倒发作次数与基线(NT1 人群)的平均变化与基线相比的变化安慰剂(n = 12)Mazindol ER(n = 11)p = 0.0499 p = 0.1909 p = 0.0372 p = 0.0372 p = 0.019
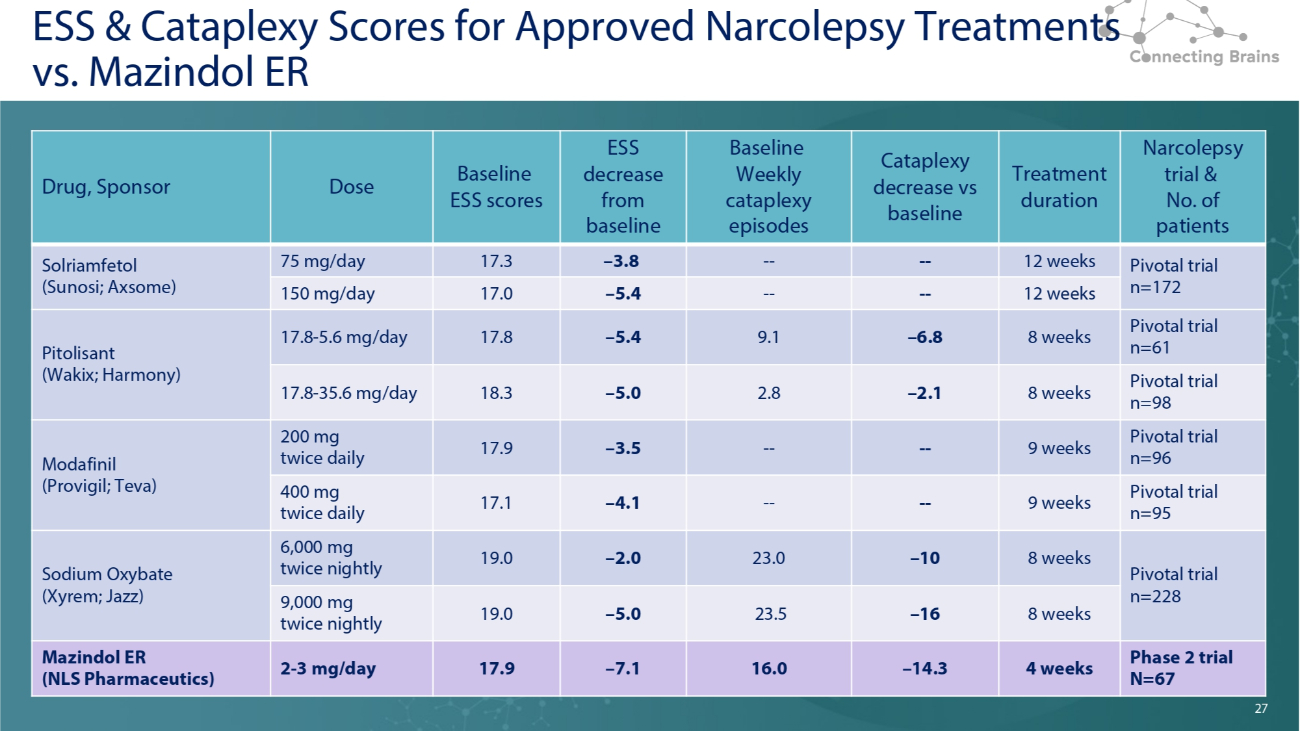
27 经批准的发作性睡病治疗的ESS和Cataplexy分数与Mazindol ER发作性睡病试验的ESS和Cataplexy分数和患者数量治疗时间与基线基线相比每周猝倒发作 ESS 低于基线基线 ESS 分数剂量药物,发起人关键试验 n=172 周---— 3.8 17.3 75 mg/天 Solriamfetol(Sunosi;Axsome)12 周----5.4 17.4 17.2 周 0 150 mg/天 Pivotal 试验 n=61 8 周 — 6.8 9.1 — 5.4 17.8 17.8-5.6 mg/天 Pitolisant(Wakix;Harmony)关键试验 n=98 8 周 — 2.1 2.8 — 5.0 18.3 17.8-35.6 mg/天关键试验 n=969 周----— 3.5 17.9 200 mg 每日两次莫达非尼(Provigil;Teva)Pivotal 试验 n=95 9 周----4.1 17.1 400 mg 每日两次 Pivotal 试验 n=228 周 — 10 23.0 — 2.0 19.0 6,000 mg 每晚两次氧苯甲酸钠(Xyrem;Jazz)8 周 — 16 23.5 — 5.0 19.0 9,000 mg 每晚两次 2 期试验 N=228 67 4 周 — 14.3 16.0 — 7.1 17.9 2-3 mg/天 Mazindol ER (NLS Pharmaceutics) 27

28 总结疗效结果 • 与安慰剂相比,在治疗4周后,睡眠和瘫痪症都有临床意义的改善 • 即使使用2 mg,也能快速起作用(1 周内)• 尽管样本量很小,但任何时间点都持续改善 EDS 和猝倒症状 • 强烈的安慰剂效应并未阻止 Mazindol ER 在评估的大多数主要和次要措施中进行有意义的分离

第 2 阶段结果安全性和耐受性
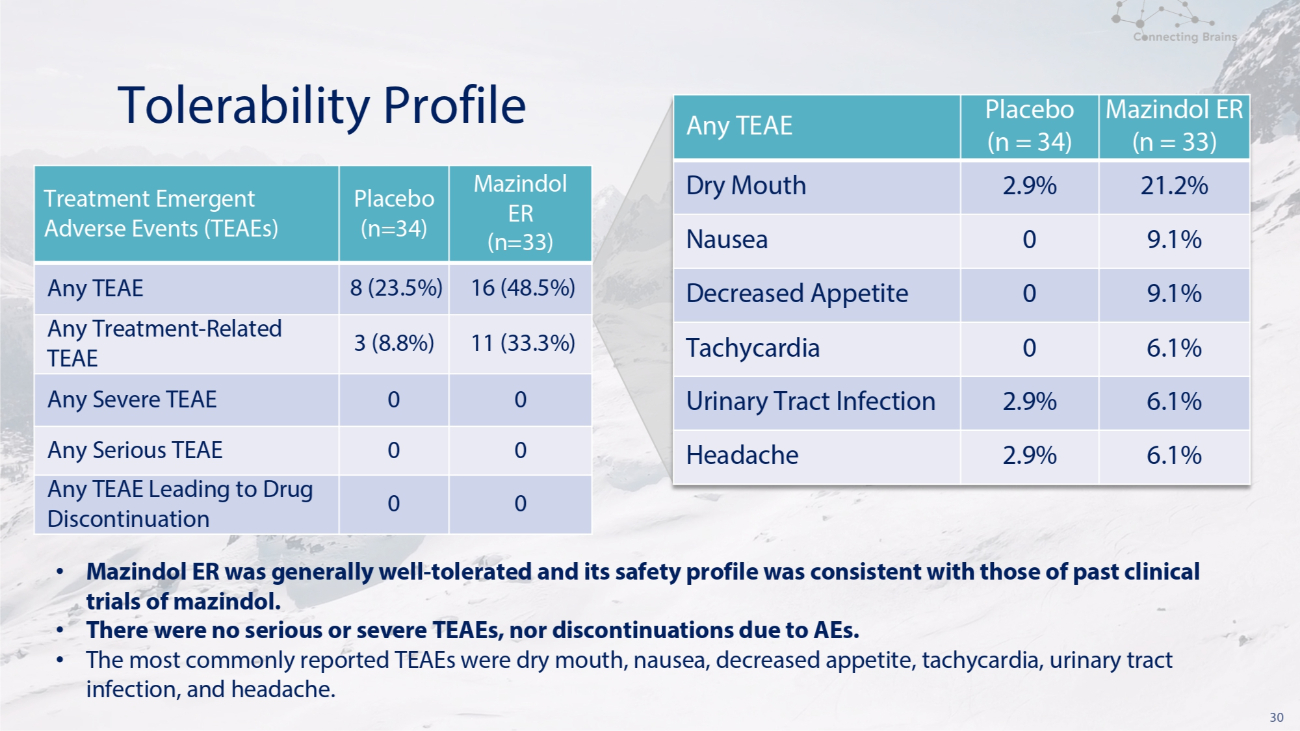
30 耐受性概况 Mazindol ER (n=33) 安慰剂 (n=34) 治疗紧急不良事件 (TEAE) 16 (48.5%) 8 (23.5%) 任何 TEAE 11 (33.3%) 3 (8.8%) 任何治疗-相关 TEAE 0 0 0 任何严重的 TEAE 0 0 任何导致停药的 TEAE (n = 33) 安慰剂 (n = 33) 安慰剂 (n = 33) = 34) 任何 TEAE 21.2% 2.9% 口干 9.1% 0 恶心 9.1% 0 食欲下降 6.1% 0 心动过速 6.1% 2.9% 尿路感染 6.1% 2.9% 头痛 • Mazindol ER 总体耐受性良好,其安全性与过去的临床试验一致mazindol。• 没有严重或严重的 TEAE,也没有因不良反应而停药。• 最常报告的 TEAE 是口干、恶心、食欲下降、心动过速、尿路感染和头痛。

31 安全结果摘要 • 没有患者因不良反应停药 • 所有不良事件均为轻度或中度 • 所有不良事件均为轻度或中度不良事件 • 大多数不良事件自发消退(无需干预)• Mazindol ER 耐受性良好,即使是最常见的不良反应(口干、恶心、食欲减退)本质上也是良性的,发生在五分之一或更少的患者身上 • mazindol 没有明显的差异在生物化学、血液学、心电图或生命体征方面对比 PBO,但增幅除外心率(约 11bpm)和体重减轻(约 1.3 千克)

开放标签扩展研究结果功效
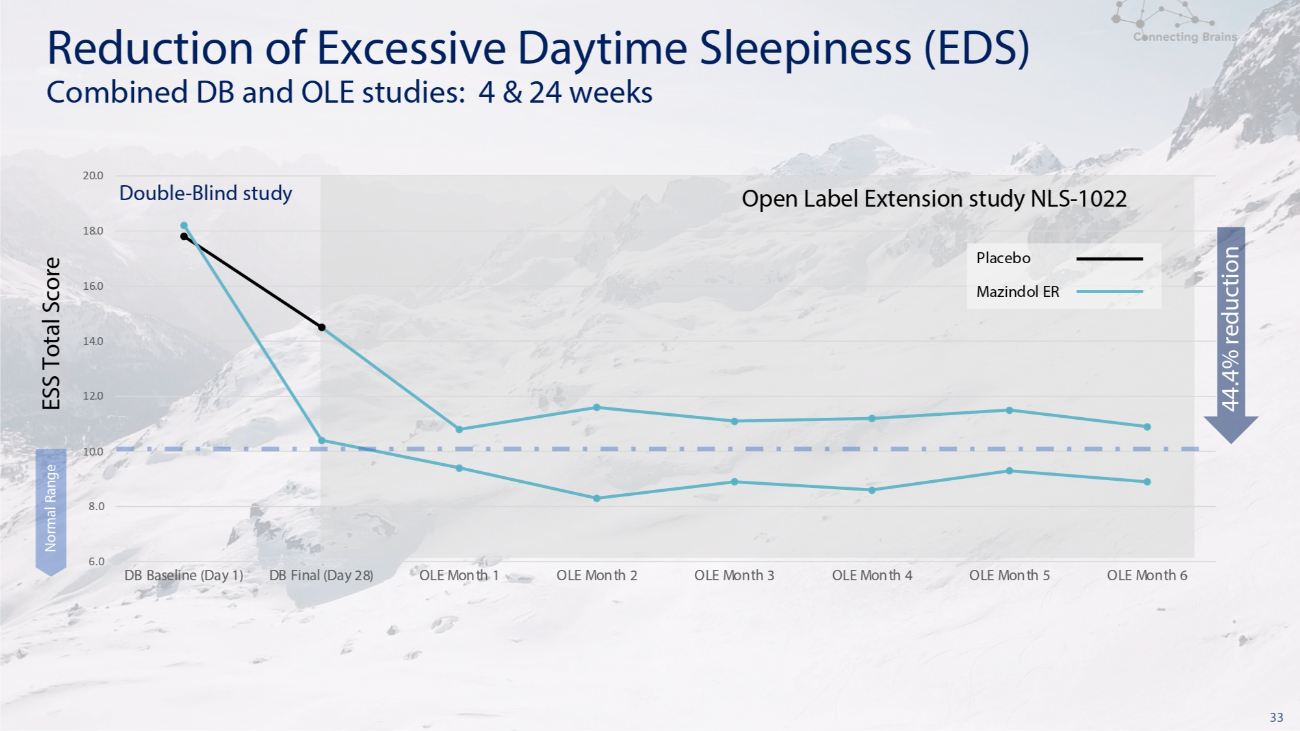
33 6.0 8.0 10.0 12.0 14.0 16.0 16.0 20.0 DB 基线(第 1 天)DB 决赛(第 28 天)OLE 第 1 个月 2 OLE 月 3 OLE 月 4 OLE 月 5 OLE 月 6 正常范围安慰剂 Mazindol ER Double-盲目研究开放标签扩展研究 NLS-1022 减少日间过度嗜睡 (EDS) DB 和 OLE 联合研究:4 和 24 周 ESS 总分降低 44.4%
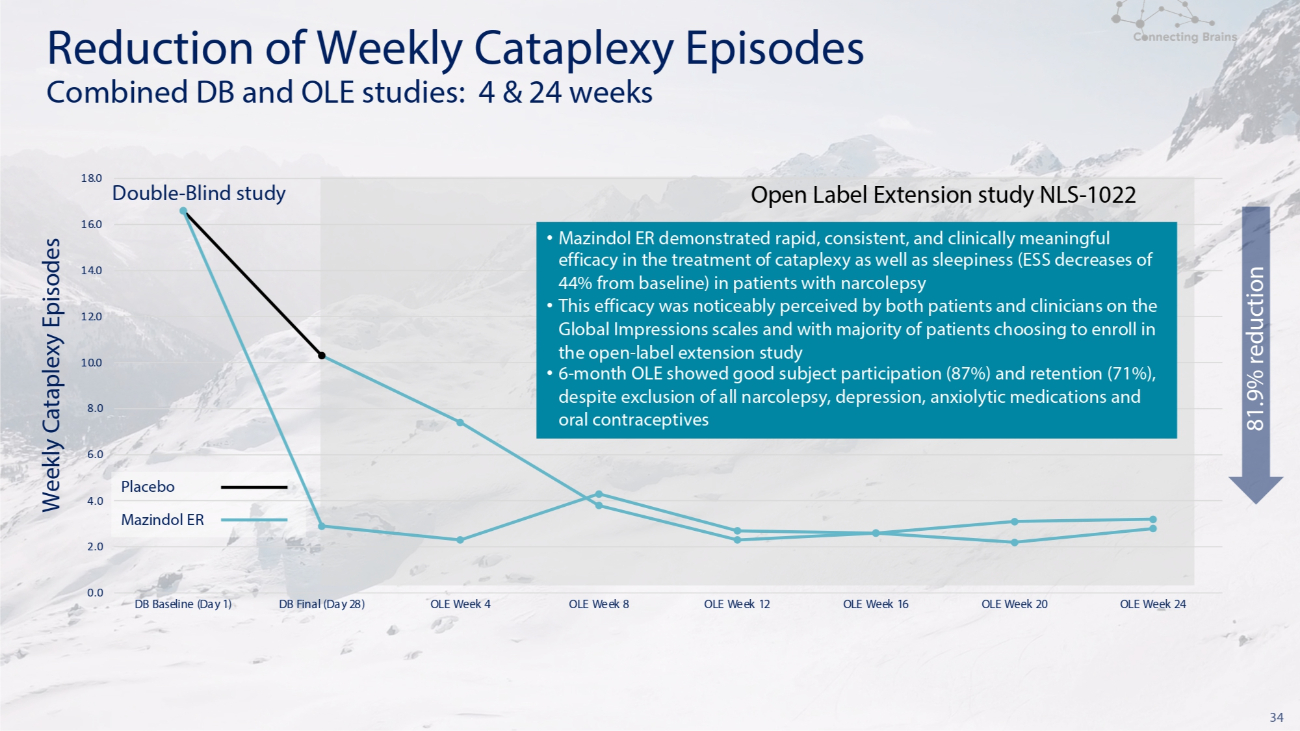
34 双盲研究开放标签扩展研究 NLS-1022 减少每周崩溃发作联合研究:4 和 24 周 6.0 安慰剂 4.0 Mazindol ER 2.0 0.0 8.0 10.0 12.0 14.0 16.0 18.0 DB 基线(第 1 天)DB 决赛(第 28 天)OLE 第 8 周 OLE 周 16 OLE 周 16 OLE 周 20 OLE 周 24 每周降低 81.9% Mazindol ER 在治疗发作性睡病患者的猝倒和困倦(ESS 比基线下降了 44%)方面显示出快速、一致且具有临床意义的疗效 • 这个根据Global Impressions量表,患者和临床医生都明显看到了疗效,大多数患者选择参加开放标签延期研究 • 尽管排除了所有发作性睡病、抑郁症、抗焦虑药物和口服避孕药,但为期6个月的OLE显示出良好的受试者参与度(87%)和保留率(71%)

35 18 16 14 12 10 8 6 4 2 0 DB 研究 20 DB BL DB W 1 DB W 2 DB W 4 W 1 W 2 W 3 W 4 W 5 W 6 W 7 W 8 W 9 W 10 W 11 W 12 W 13 W 14 W 15 W 16 W 17 W 18 W 19 W 21 W 22 W 23 W 24 总课题 1070-001 开放标签扩展研究案例研究:主题 1070-001 DB 和 OLE 联合研究 • 23 岁女性 • 1 型发作性睡病(含猝倒)• 在 DB 和 OLE 中均使用 mazindol ER 进行治疗 W1 W 2 W 3 W 4 W 5 W 6 W 7 W 8 W 9 W 10 W 11 W 12 W 13 W 14 W 15 W 16 W 17 W 18 W 19 W 20 W 21 W 22 W 23 W 24 每周瘫痪对象 1070-001 DB 研究 12 开放标签扩展研究 10 8 6 4 2 0 DB BL W 1 DB W 2 DB W 3 DB W 3 DB W 4 正常范围

Open Label 扩展研究结果安全性与耐受性
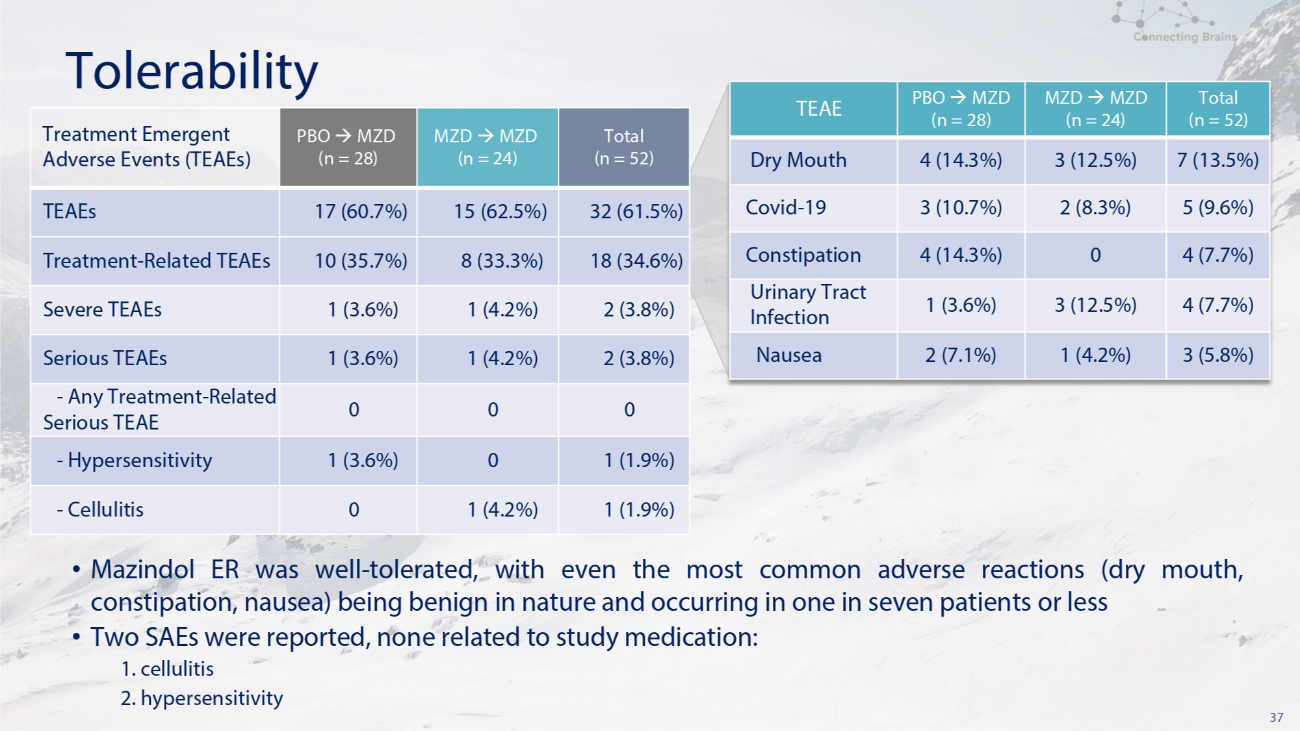
37 总耐受性 (n = 52) MZD (n = 24) PBO MZD (n = 28) TEAE 7 (13.5%) 3 (12.5%) 4 (14.3%) 4 (14.3%) 口干 5 (9.6%) 2 (8.3%) 3 (10.7%) 3 (9.6%) 3 (3.6%) Covid-19 4 (7.7%) 0 (14.3%) 便秘 4 (7.7%) 3 (12.5%) 1 (3.6%) 尿路感染 3 (5.8%) 1 (4.2%) 2 (7.1%) 总恶心 (n = 52) MZD MZD (n = 24) PBO MZD (n = 28) 治疗紧急不良事件 (TEAE) 32 (61.5%) 15 (62.5%) 17 (60.7%) 17 (60.7%) TEAES 18 (34.6%) 8 (33.3%) 10 (35.7%) 治疗相关 TEAES 2 (3.7%) 8%) 1 (4.2%) 1 (3.6%) 重度 TEAE 2 (3.8%) 1 (4.2%) 1 (3.6%) 1 (3.6%) 严重 TEAE 0 0 0-任何治疗-相关严重的 TEAE 1 (1.9%) 0 1 (3.6%)-超敏反应 1 (1.9%) 1 (4.2%) 0-蜂窝组织炎 • Mazindol ER 耐受性良好,即使是最常见的不良反应(口干、便秘、恶心)本质上也是良性的,发生在七分之一的患者中 • 报告了两例 SAE,与研究药物无关:1. 蜂窝织炎 2. 超敏反应

38 POLARIS:OLE 结论 • 这项为期 6 个月的 OLE 发作性睡病研究显示出良好的受试者参与度(87%)和保留率(71%),尤其是在排除任何发作性睡病/抑郁/抗焦虑药物的情况下 • 治疗依从性高,几乎没有药物下降——报告了滴定(11.5%)• 可靠的疗效数据证实了中期结果:• ESS 较数据库研究基线下降了44% • Cataplexy下降了82% 从数据库研究基线来看 • Mazindol 的耐受性良好,61.5% 的患者报告至少有一次 AE,34.6% 的患者报告至少接受过一次治疗-相关 AE • 最常见的不良反应是口干、便秘和恶心,发生在不到七分之一的患者中 • 报告了两例 SAE,均与研究药物(蜂窝组织炎和超敏反应)无关 • 本研究证实了先前描述的马辛多尔的心血管效应,其幅度与兴奋剂和 SNRI 的心血管效应相似

39 第 3 阶段计划 NLS-1031,NLS-1032 和 NLS-1033

40 个 3 期发作性睡病项目两项相同的安慰剂对照三期试验,调查了 Mazindol ER 与安慰剂,外加一项为期 12 个月的延期研究 NLS-1033 • 开放标签,为完成 NLS-1031 和 NLS 的参与者延长一年-1032 NLS-1032 2023 年秋季 20-25 个美国 1 型发作性睡病 (NT1) 主要参与者终点:通过电子日记辅助终端:ESS 和 PROMIS-SRI 衡量的崩溃攻击的变化
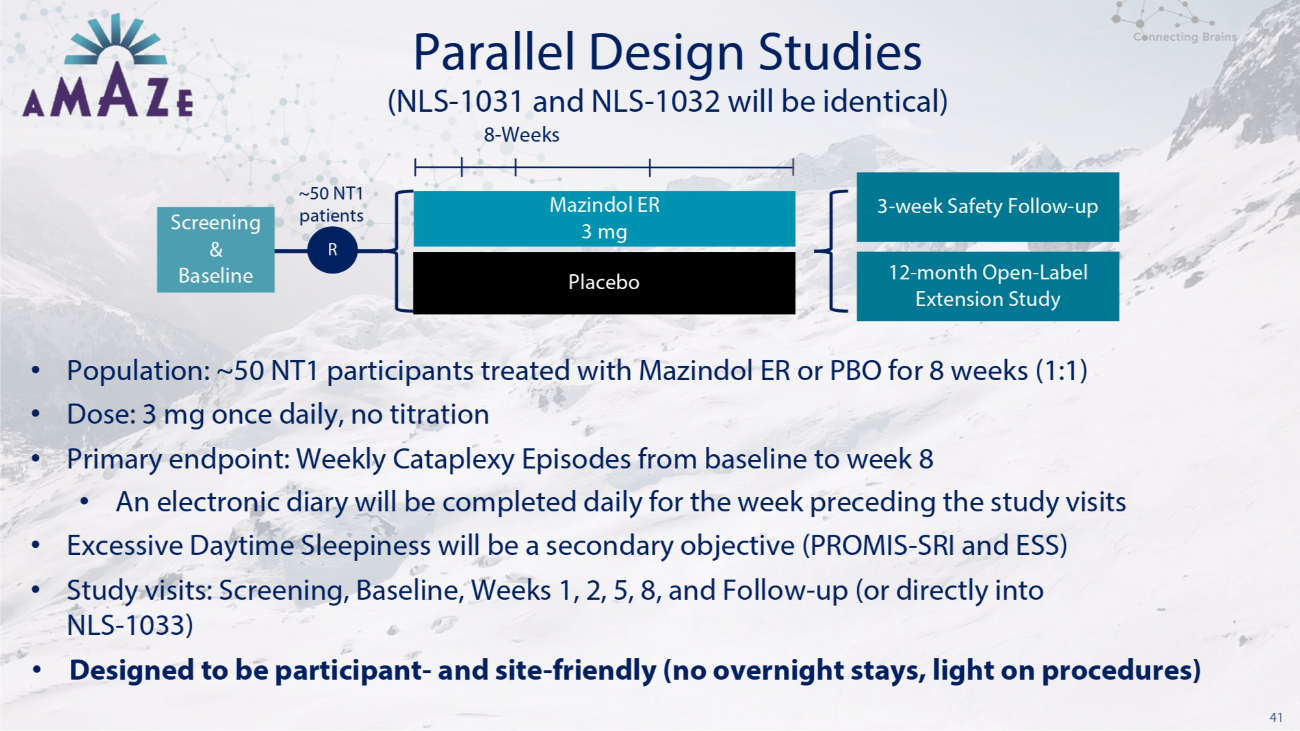
41 项平行设计研究 • 人群:约 50 名 NT1 受试者接受了 Mazindol ER 或 PBO 治疗 8 周(1:1)• 剂量:3 mg,每日一次,无需滴定 • 主要终点:从基线到第 8 周的每周一次瘫痪发作 • 研究访问前一周将每天完成电子日记 • 白天过度嗜睡将是次要目标(PROMIS-SRI 和 ESS)• 研究访问:筛查,基准,第 1、2、5、8 周和随访(或直接进入 NLS-1033)• 专为参与者和场地友好而设计(不允许过夜,光线充足)手术中)安慰剂(NLS-1031 和 NLS-1032 将相同)8 周筛查和基线 ~50 名 NT1 患者 R Mazindol ER 3 mg 3 mg 3 周安全随访——向上 12 个月开放——标签延期研究

42 12 个月 OLE 研究(NLS-1033)• 研究设计:一项为期 52 周、开放标签、多中心研究,每日一次 Mazindol ER 3 mg • 研究人群:约 100 名参与者(研究完成者来自 NLS-1031 和 NLS-1032)• 研究中允许使用急救性发作性睡病/精神药物 • 主要目标:Mazindol ER 的长期安全性和耐受性 • 次要目标:Mazindol ER在治疗Cataplexy和EDS中的长期治疗反应 • 研究访问:基线,第2、4、12、26、40、52 周,随访 NLS-1032 52-每周开放-标签治疗周期 Mazindol ER 3 mg 3 周安全随访NLS-1031 ~100 名 NT1 患者

Mazindol ER (3mg) 竞争优势

44 如果获得批准,Mazindol ER 可为发作性睡病提供便捷的每日一次单一疗法选择简单,每日一次,单一疗法,早餐前 30 分钟有效 Mazindol ER 对发作性睡病的其他症状快速起效有利的药物-药物相互作用潜力(例如避孕药)附表四:滥用、滥用和转移的可能性低 Mazindol ER 是一种可用的研究药物仅用于临床试验。3mg QD 同类首创,双重作用机制可解决主要发作性睡病症状特征明确且易于控制的安全性和耐受性概况 TMRI OX2R
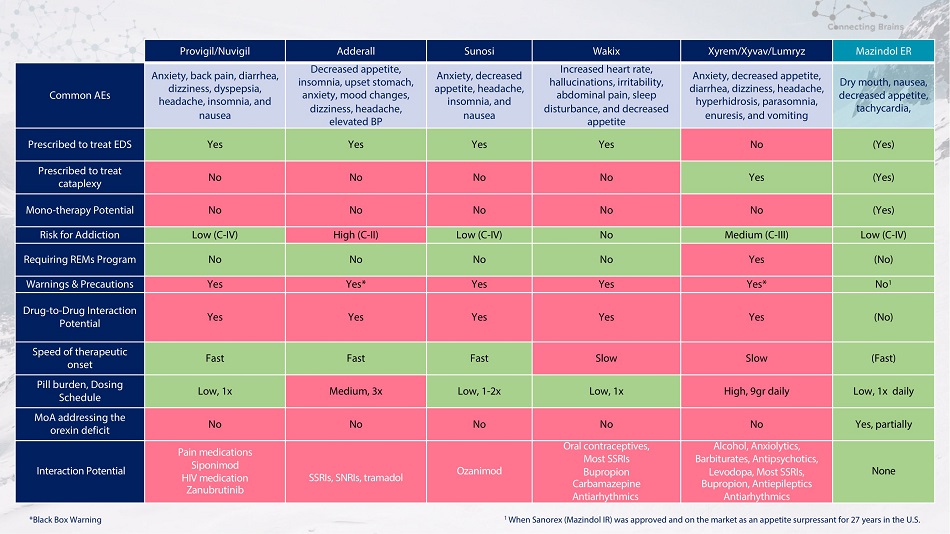
Provigil/Nuvigil Adderall Sunosi Wakix Xyrem/Xyvav/Lumryz Mazindol ER 常见病例焦虑、背痛、头晕、消化不良、头痛、失眠和恶心食欲下降、失眠、胃部不适、焦虑、情绪变化、头晕、头痛、失眠和恶心心率加快、幻觉烦躁、易怒、腹痛、睡眠障碍和食欲下降焦虑、食欲不振、腹泻、头晕、头痛、多汗症、失眠、遗尿和呕吐口干、恶心、食欲减退、心动过速、处方用于治疗 EDS 是是是否(是)处方治疗猝倒性否不是(是)单一疗法不不不不是(是)成瘾风险低(C-IV)高(C-IV)低(C-IV)低(C-IV)不中等(C-IV)低(C-IV)需要 REMS 计划否否不是(否)警告和注意事项是的*是的*不是 1 种药物相互作用潜力是是是是(否)治疗起效速度快快慢慢(快)药丸负担低,给药时间表低,1x 中等,3x 低,1-2x 低,1x 高,9gr每日低点,针对食欲素缺乏的每日一次 MoA 不不不是,部分相互作用潜在的止痛药西波尼莫德 HIV 药物 Zanubrutinib SSRI、SNRI、曲马多 Ozanimod 口服避孕药、大多数 SSRI 安非他酮卡马西平抗心律失常药酒精、抗焦虑药、巴比妥类药物、抗精神病药、左旋多巴、大多数 SSRI、Bupropia Pion,抗癫痫药抗心律失常药无 1 当Sanorex(Mazindol IR)在美国获得批准并作为食欲抑制剂上市27年时 *黑匣子警告

时间轴

47 *时间表可能会更改。无法保证任何临床试验的成功。此外,整个监管过程存在固有的风险和可变性。美国食品和药物管理局可能不予批准,或者美国食品和药物管理局可能要求的研究参数与提交的研究参数不同。预期开发时间表 * 2026 年 2025 年第二季度第四季度 2023 年第二季度第 2 季度于 2021 年 9 月商业保密协议提交 AMAZE 启动中期标题发布的 AMAZE 数据发布已在世界第二阶段试验 (LPO) 试验 (FPI) 第二阶段试验中完成第 3 阶段关键北极星数据库结果睡眠 2022 2024 2025 2026 2023 2023 年第一季度第 2 阶段结束 FDA 会议 2022 年第二季度启动抢先体验 IH 程式
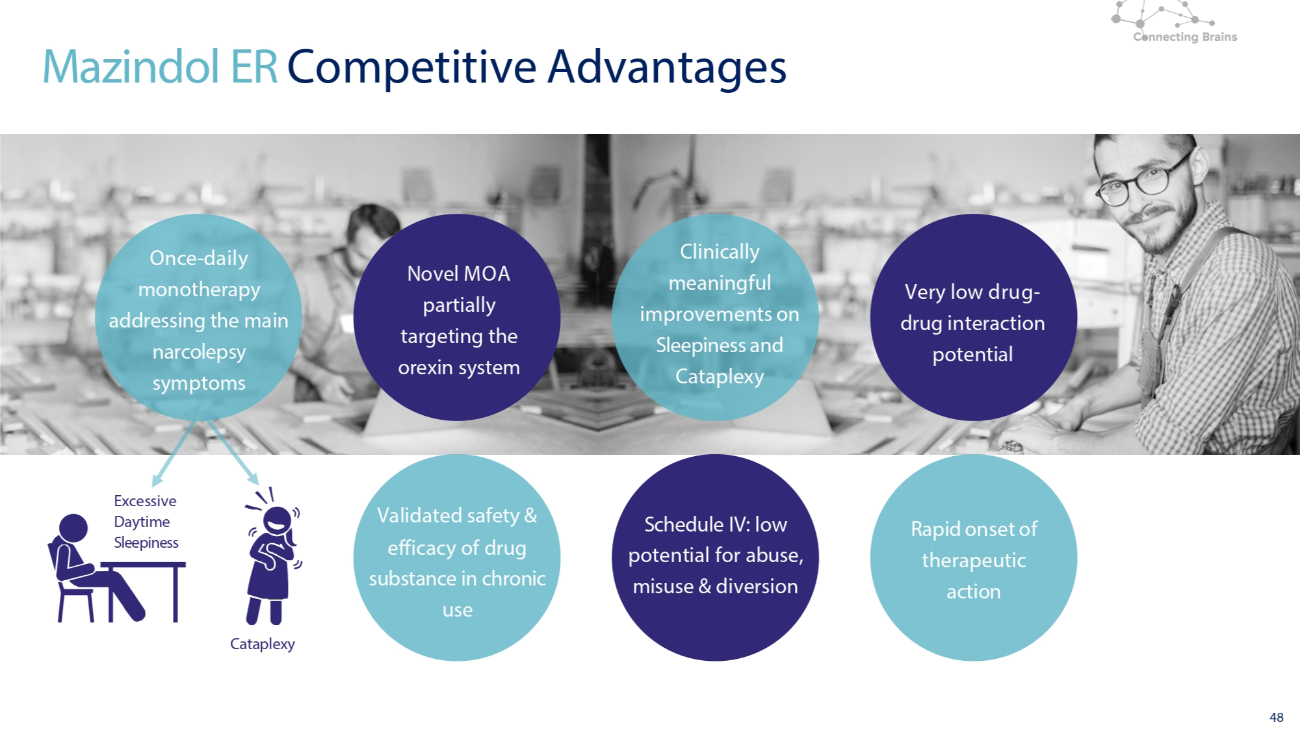
48 项新型 MOA 部分针对食欲素系统经过验证的长期使用药物的安全性和有效性临床上有意义的改善附表四:滥用、滥用和转移的可能性极低药物-药物相互作用的可能性极低 Mazindol ER 竞争优势 Cataplexy 白天过度嗜睡一次-针对主要发作性睡病症状的单一疗法

49 重新定义中枢神经系统疗法