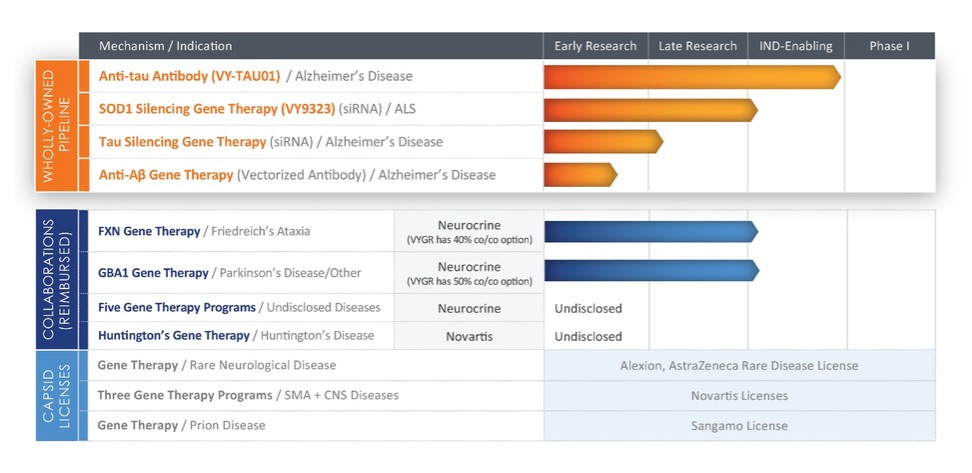
候选产品,包括用于治疗脊髓性肌萎缩的TRACER Capsids和有效载荷或诺华SMA计划,以及(b)合作开发诺华HD计划下的AAV基因疗法产品和候选产品,在每种情况下,都利用TRACER Capsids和我们控制的其他知识产权。
根据2023年诺华合作协议,诺华向我们支付了8000万美元的预付款。我们有资格获得诺华SMA计划的特定开发、监管和商业化里程碑补助金,总额最高为2亿美元,诺华HD计划总额最高为2.25亿美元,每种情况下,用于第一个实现相应里程碑的相应产品。我们还有资格获得(a)诺华SMA计划总额高达4亿美元的特定销售里程碑补助金,诺华HD计划总额最高为3.75亿美元;(b)按诺华SMA计划产品和诺华HD计划产品的年净销售额的高个位数至低的两位数百分比逐步增加特许权使用费。特许权使用费可能会受到惯例的削减,包括专利申请到期、某些第三方许可证的付款以及生物仿制药的市场渗透率,但须遵守规定的限额。有关2023年诺华合作协议的进一步描述,请参阅附注9, 重要协议,转到我们在截至2023年12月31日止年度的10-K表年度报告中包含的合并财务报表,标题为 “2023年诺华合作协议”。
2023 年诺华股票购买协议
我们和诺华还于2023年12月28日签订了股票购买协议,即2023年诺华股票购买协议,以每股9.324美元的价格向诺华出售和发行2,145,002股普通股或诺华股票,总收购价约为2,000万美元。根据2023年诺华股票购买协议的条款和条件,我们在2024年1月3日或2023年诺华投资截止日向诺华发行并出售了诺华股票。
2023 年诺华投资者协议
我们和诺华还于2023年12月28日签订了投资者协议,即2023年诺华投资者协议,该协议自2023年诺华投资截止日起生效,规定了停顿和封锁限制。
根据2023年诺华投资者协议的条款,未经我们事先书面批准并遵守特定条件,诺华同意不直接或间接收购我们已发行普通股的股份,公开寻求或提议招标或交换要约或双方合并,不征求代理人或同意对我们发行的任何有表决权证券进行投票,或采取与可能收购我们额外股权相关的其他特定行动。此外,诺华还同意在特定条件下,未经我们事先批准,不出售或转让任何诺华股份,并要求其关联公司不得出售或转让任何诺华股份。
2022年诺华期权和许可协议
在2022年3月4日或2022年诺华期权和许可生效日期,我们与诺华签订了期权和许可协议,或2022年诺华期权和许可协议。根据2022年诺华期权和许可协议,我们授予诺华期权或诺华许可期权,允许TRACER Capsids或诺华许可的Capsids与某些靶标独家使用,以开发和商业化由诺华许可的Capsids和针对此类目标的有效载荷或诺华有效载荷组成的AAV基因疗法候选药物。
根据2022年诺华期权和许可协议的条款,诺华向我们支付了5400万美元的预付款。自2023年3月1日起,诺华行使了其诺华许可期权,许可TRACER Capsids用于基因治疗项目,用于针对两个未公开的针对特定基因的计划或诺华初始目标。随着诺华对两个诺华初始目标的期权行使,我们在2023年4月收到了2,500万美元的期权行使付款,并且有资格获得相关的潜在开发、监管和商业里程碑付款,以及基于包含相应诺华Payload或包含诺华许可Capsids的产品的净销售额的中高个位数分级特许权使用费。