附录 99.1

Benitec Biopharma发布2024年第三季度财务业绩并提供最新运营情况
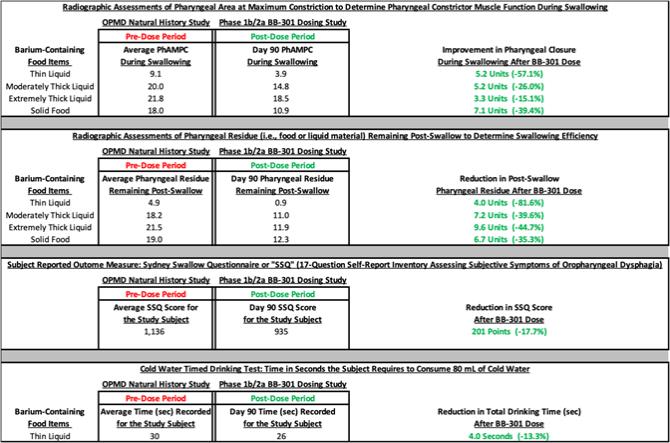
-在 4 月份报告的 1b/2a 期临床治疗研究中,首位眼咽肌萎缩症 (OPMD) 受试者服用 BB-301 的中期临床试验数据呈阳性-
-第二个 OPMD 受试者 已在 2 月份安全服用 BB-301 剂量-
-预计2024年下半年将有更多中期临床安全数据和 临床疗效数据-
-23 名 OPMD 受试者已报名参加 OPMD 自然史研究,多名受试者有资格参加 BB-301 1b/2a 期临床治疗研究-
-4月22日完成了4000万美元的超额认购私募融资 22和,Cash Runway 延长至 2025 年-
加利福尼亚州海沃德,2024年5月13日(GLOBE NEWSWIRE)贝尼特克生物制药公司(纳斯达克股票代码:BNTC)(贝尼特克或公司)是一家临床阶段、专注于基因疗法的生物技术公司,基于其专有的Silence和 取代DNA导向RNA干扰(ddrNAI)平台开发新型基因药物,今天公布了截至3月31日的第三财季财务业绩,2024。该公司已向美国证券交易委员会提交了10-Q表格的季度报告 。
贝尼特克执行主席兼首席执行官杰雷尔·班克斯医学博士、博士表示, 首位参加 BB-301 1b/2a 期临床治疗研究的受试者的中期临床试验结果显示,每个中心研究终点都出现了持续的、具有临床意义的改善,吞咽的射线照相评估以及受试者报告的关键结果指标的相应改善。我们 期待在今年晚些时候公布第一个研究对象的长期随访结果,以及其他研究受试者的累积数据。继最近的 融资之后,贝尼特克完全有能力在2025年底之前推进 BB-301 临床开发计划。