目录
在生产前和/或生产后修改此类蛋白质。治疗蛋白的工程和改性有可能通过改善生物学特性(例如糖基化、半衰期、免疫原性)来提供额外的临床益处。
我们的 Procellex 技术具有许多独特的优势,包括:生物学优化;能够处理复杂的蛋白质表达;通过效率、增强和/或快速横向放大进行改进的灵活制造;简化的生产流程;消除哺乳动物成分中病毒污染的风险;以及知识产权优势。
我们基于植物细胞培养技术开发了 Procellex,用于开发、表达和制造重组蛋白,重组蛋白是现代生物技术的重要基础。我们利用农杆菌的自然能力将DNA片段转移到植物染色体中,从而开发新的重组治疗蛋白,从而使植物细胞的基因组能够编码感兴趣的特定蛋白质。然后,农杆菌介导的转化细胞能够产生特定的蛋白质,这些蛋白质被提取和纯化,可用作治疗各种疾病的疗法。
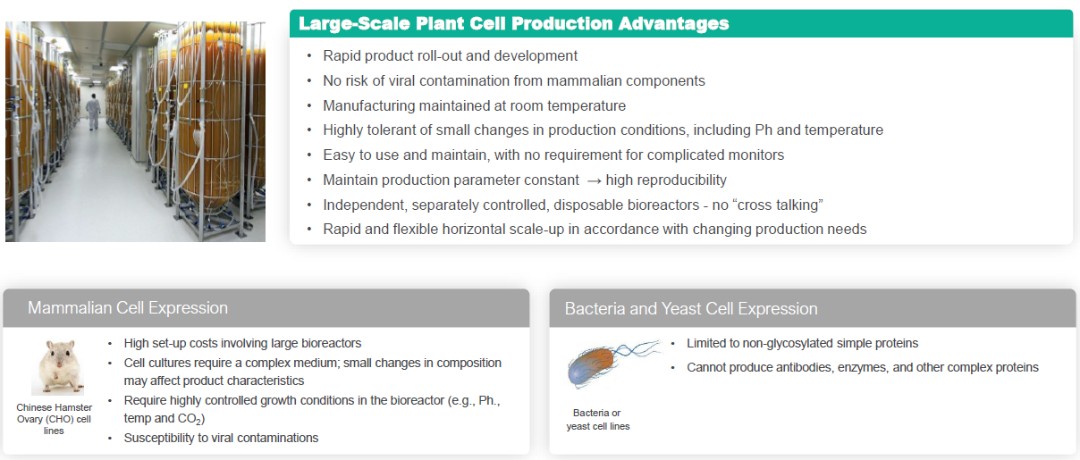
我们的 Procellex 技术可用于表达属于不同药物类别的复杂治疗蛋白,例如酶、激素、单克隆抗体、细胞因子和疫苗。从最初的核苷酸克隆到蛋白质产物的大规模生产,整个蛋白表达过程都是在符合当前良好生产规范(cGMP)的受控流程下进行的。我们的植物细胞培养技术使用细胞,例如胡萝卜和烟草(BY-2)细胞,这些细胞经过先进的基因工程和/或化学修饰,并在一次性柔性生物反应器系统中以工业规模生长。我们的系统在生产过程的任何阶段均不涉及哺乳动物或动物衍生成分或转基因田间种植或整株植物。
细胞生长,从细胞库启动放大生产步骤到大规模生产,都是在灵活、无菌、定制设计的聚乙烯生物反应器中的洁净室环境中进行的,不需要使用基于哺乳动物的系统中常用的大型不锈钢生物反应器来生产重组蛋白。Procellex 反应器易于使用和维护,可实现快速水平放大,不涉及哺乳动物病毒污染的风险。我们的生物反应器非常适合使用简单、便宜、化学定义的生长培养基促进植物细胞的生长。这些反应器针对植物细胞培养进行了定制设计和优化,需要较低的初始资本投资,并且可以以低成本快速扩展。
植物细胞生产的优势
17

