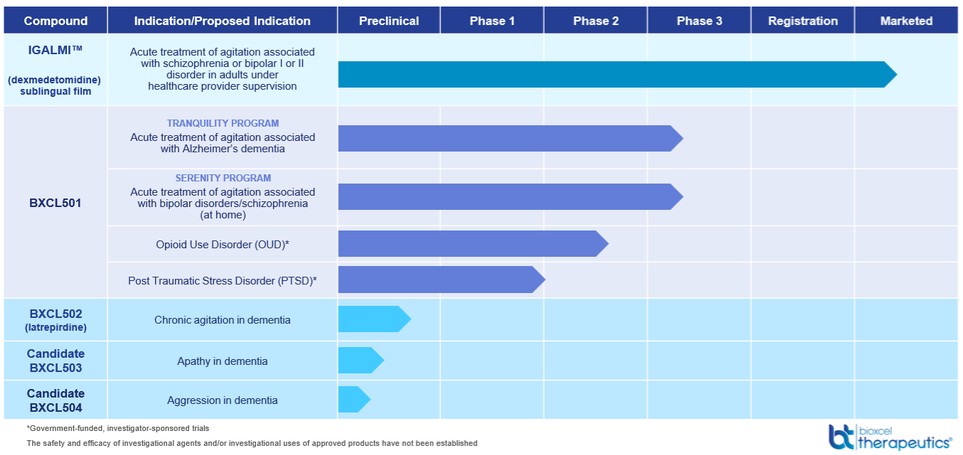
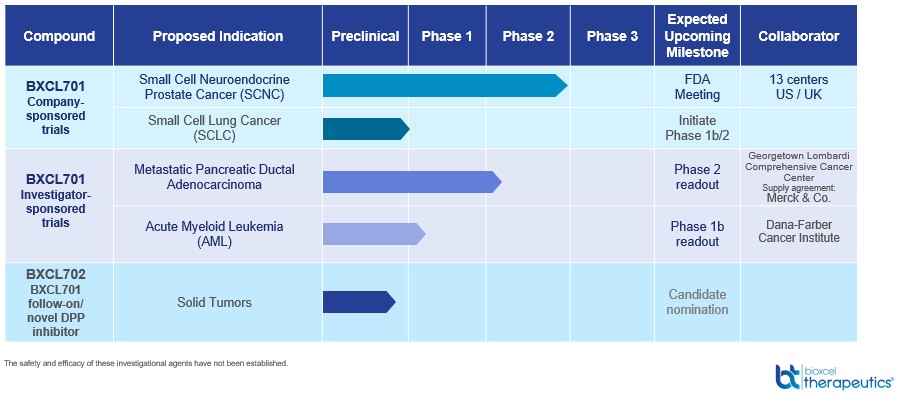
治疗躁狂、抑郁、压力和焦虑症。如果专利是从这些案件中发放的,我们预计它们将在2043年或2044年到期。
2024年4月,公司收到了美国专利商标局(USPTO)对美国专利申请第18/189,073号的补贴通知(‘073申请)’073申请要求一种治疗与精神分裂症或双相情感障碍相关的急性激越的方法,该方法存在尖端扭矩或猝死的风险。这项专利一旦发布,预计到期日为2043年1月12日。它将被提交给美国食品和药物管理局(FDA)批准的具有治疗等效性评估的药物产品(通常被称为“橙皮书”),以及目前列出的八项IGALMI™(右美托咪定)舌下膜的美国专利。
2024年4月,该公司还收到了日本专利局第2020-573042号申请的许可通知,该申请针对广泛的剂型,包括BXCL501等薄膜。该专利一旦发布,预计将不早于2039年6月26日到期。
2024年3月,该公司宣布,欧洲专利局授予了该公司的欧洲专利号3,562,486(“‘486专利”),该专利涵盖了舌下给药右美托咪定用于治疗痴呆症患者的躁动。‘486专利涵盖了广泛的剂型,包括BXCL501(舌下右美托咪定)、晶片和片剂,剂量从3微克到100微克不等。‘486专利将不早于2037年12月29日到期。
2024年2月,该公司宣布,美国专利商标局已经批准了美国专利申请第17/496,470号,该专利申请涉及一种治疗阿尔茨海默病患者躁动的方法,该方法使用60微克的右美托咪定口服水溶性剂型。广泛的权利要求包括薄膜制剂,如BXCL501(舌下含右美托咪啶)、片剂或晶片。该专利于2024年3月19日作为美国专利颁发。专利编号11,931,340,到期日为2037年12月29日,受专利期限调整(“PTA”)、专利期限延长(“PTE”)和终止免责声明的影响。
2024年2月,该公司还宣布,美国专利商标局于2024年2月6日颁发了美国专利11,890,272号(简称‘272专利)。’272专利要求通过口服约120微克至约180微克的右美托咪胺治疗与精神分裂症或躁郁症相关的躁动,患者的QT间期小于470毫秒。‘272专利的有效期为2040年7月17日,受PTA、PTE和终端免责声明的限制。’272专利已被FDA批准的具有疗效等效性评估的药物产品(通常称为“橙皮书”)接受上市。
2024年2月,本公司还收到通知,美国专利申请办公室已经允许美国专利申请第18/216,890号,涉及一种使用右美多咪定口腔粘膜制剂或其药学上可接受的盐治疗激越的方法,方法是首剂剂量60微克、80微克、90微克、120微克或180微克右旋美托咪定,在至少两小时后,在第二剂40微克、60微克、80微克或90微克的右旋美托咪定口服制剂或其药学可接受的盐中,患者的QT间期小于470毫秒。该专利一旦发布,预计到期日为2040年7月17日,受PTA、PTE和终端免责声明的限制。该公司预计,这项专利一旦发布,将与目前列出的8项IGALMI™(右旋美托咪定)舌下膜美国专利一起提交到橙皮书中上市。
个别专利的期限取决于获得专利的国家的法律术语。在包括美国在内的大多数国家,专利期为非临时专利申请最早提交之日起20年。根据FDA批准我们候选产品的时间、期限和细节,我们拥有或许可的美国专利可能有资格根据1984年的《药品价格竞争和专利期限恢复法》(也称为《哈奇-瓦克斯曼法案》)获得有限的专利期延长。该法案允许最长五年的专利恢复期限,作为对产品开发和药品审批监管审查过程中失去的专利期的补偿。然而,专利期限恢复不能延长专利的剩余期限,从产品批准之日起总共不能超过14年。专利期恢复期限一般为生效日期之间时间的一半。