
推进药品发展。解决问题。改善生活。推进药品发展。解决问题。改善生活。2024 年第一季度收益补充材料 2024 年 5 月 7 日 1

推进药品发展。解决问题。改善生活。2® 免责声明本演示文稿中的某些陈述包括1995年《私人证券诉讼改革法》所指的 “前瞻性陈述”。诸如 “相信”、“预测”、“计划”、“期望”、“估计”、“打算”、“可能”、“将” 或这些术语的否定词等词语以及类似的表述旨在识别前瞻性陈述。这些前瞻性陈述包括但不限于关于我们的候选产品Anaphylm(肾上腺素)通过临床开发和美国食品药品监督管理局(FDA)批准的进展和相关时机的陈述,包括提交Anaphylm的支持性临床研究;我们有能力在向美国食品药品监督管理局提交的Anaphylm新药申请(NDA)中提供足够的数据,以回应美国食品药品监督管理局对我们临床的反馈包括与Anaphylm儿科项目相关的试验;我们的能力发展我们的制造业务;我们的现金需求、现金资金和现金消耗;短期和长期流动性以及为业务运营提供资金的能力;我们的增长和未来的财务和经营业绩和财务状况,包括与2024年财务展望相关的财务状况;以及业务战略、市场机会和其他非历史事实的陈述。这些前瞻性陈述基于我们当前的预期和信念,存在许多风险和不确定性,可能导致实际业绩与前瞻性陈述中描述的结果存在重大差异。此类风险和不确定性包括但不限于与我们的开发工作相关的风险,包括我们的产品开发活动、临床试验和计划(包括与Anaphylm、AQST-108 和其他候选产品相关的计划)的时机、成本和成功的任何延迟或变更;与公司为Libervant开展分销工作相关的风险,包括公司分销活动的时机、成本和成功以及扩大患者市场准入的任何延迟或变化 Libervant;提起诉讼的风险第三方与克服美国食品药品管理局批准的针对2至5岁儿童癫痫患者的产品的孤儿药独家经营权有关;美国食品药品管理局延迟对Anaphylm和我们的其他候选药物的监管进展或根本未获得美国食品药品管理局批准的风险;公司有能力在药代动力学和药效学可比性提交的供FDA批准Anaphylm的药代动力学和药效学可比性报告中生成足够数据的风险;公司的风险回应美国食品药品管理局对公司未来临床试验和其他评论的能力美国食品和药物管理局C类会议纪要中提出的有关Anaphylm的问题,包括美国食品和药物管理局可能需要额外的临床研究才能批准Anaphylm的风险;任何竞争产品的成功风险;新产品商业化固有的风险和不确定性(包括技术风险、财务风险、市场风险和实施风险以及监管限制);候选产品未来商业化所需的销售和营销能力发展风险;资本和现金充足的风险资源,包括有足够的可用债务和股权融资(包括根据我们的自动柜员机融资机制和林肯公园收购协议)以及运营收入,以满足我们所有的短期和长期流动性和现金需求以及其他现金需求,包括为2至5岁儿科患者与Libervant相关的商业化活动提供资金,为Anaphylm和 AQST-108 的未来临床开发活动以及Anaphylm的商业活动提供资金和/或 AQST-108 是已获美国食品药品管理局批准;我们的制造能力足以支持美国和国外对Libervant及其许可产品的需求的风险;Suboxone® 的市场份额受到侵蚀的风险,以及作为占我们当前营业收入很大一部分的日落产品的风险;任何违约风险;与政府对Indivior的索赔相关的风险,我们许可、制造和销售Suboxone并占我们很大一部分的Suboxone 当前的营业收入;与某些销售外包相关的风险,向第三方推销及其他运营和工作人员职能;Libervant 对 2 至 5 岁癫痫患者的市场接受率和程度的风险;Anaphylm、AQST-108 和我们的其他候选产品和产品以及我们在美国和国外的许可产品;任何竞争产品(包括仿制药)的成功风险、我们产品市场规模和增长的风险;遵守所有 FDA 和其他政府和客户对我们要求的风险制造设施;与智力相关的风险与我们的产品相关的产权和侵权索赔;意外专利开发的风险;影响我们业务的立法和监管行动以及法律或法规变化的风险,包括与我们的产品和候选产品以及产品定价、报销或准入相关的法律或法规的风险;失去重要客户的风险;与索赔和法律诉讼相关的风险,包括专利侵权、证券、商业侵权、调查、产品安全或有效性以及反垄断诉讼事宜;产品召回风险和撤回;与我们的信息技术网络和系统中断相关的风险,包括网络攻击的影响;远程工作安排导致网络安全攻击增加和数据访问中断的风险;影响金融服务行业的不利事态发展的风险;与通货膨胀和利率上升相关的风险;与 COVID-19 全球疫情和其他流行病对我们业务的影响相关的风险,包括与我们的临床试验、站点启动、患者入组相关的风险以及临床试验、监管申报以及对候选产品的监管审查和批准的时间和充足性、我们的产品和候选产品中使用的药物成分和其他原材料的供应情况、我们的产品和候选产品的供应链、制造和分销;与总体经济、政治(包括乌克兰和以色列战争以及其他战争和恐怖主义行为)、商业、行业、监管、金融和市场状况以及其他不寻常项目相关的风险和不确定性;以及其他影响我们的不确定性,包括 “风险因素” 部分中描述的不确定性,以及公司向美国证券交易委员会提交的2023年10-K表年度报告、10-Q表季度报告以及8-K表最新报告中所述的不确定性。鉴于这些不确定性,读者不应过分依赖这些前瞻性陈述,这些陈述仅代表截至发布之日。本警示性陈述明确规定了随后归因于公司或任何代表公司行事的人的所有前瞻性陈述。除非适用法律要求,否则在本演示文稿发布之日之后,无论是由于新信息、未来事件还是其他原因,公司均没有义务更新前瞻性陈述、展望或指导。PharmFilm® 和 Aquestive 徽标是 Aquestive Therapeutics, Inc. 的注册商标。AQST-109 的 “Anaphylm” 商品名称已获得美国食品药品管理局的有条件批准。Anaphylm 专有名称的最终批准取决于美国食品药品管理局对候选产品 AQST-109 的批准。此处提及的所有其他注册商标均为其各自所有者的财产。© 2024 Aquestive Therapeutics, Inc.的财产

推进药品发展。解决问题。改善生活。2024年第一季度收益:关键信息 AnaphylmTM(肾上腺素)舌下胶片 ❖ 关键研究符合所有主要和次要终点 ❖ 成功完成与美国食品药品管理局的C型会议 ❖ 有望在2024年年底之前提交新药申请(NDA)LibervantTM(地西泮)Buccal Film ❖ 获得美国食品药品管理局批准 Libervant,适用于两至五岁患者已有多年历史了 ❖ 该产品可立即提供给非医疗补助患者 AQST-108(肾上腺素)局部凝胶 ❖ 首次人体(FIH)研究的阳性结果加强资产负债表 ❖ 2024年第一季度末,现金余额约为9,500万美元 ❖ 通过承销公开发行筹集了7,750万美元,普通股每股4.50美元 1 ➢ 提供足够的现金为Anaphylm计划和公司运营提供资金 ➢ 将现金流延长至2026年 1 包括于2024年4月22日结束的总配股。
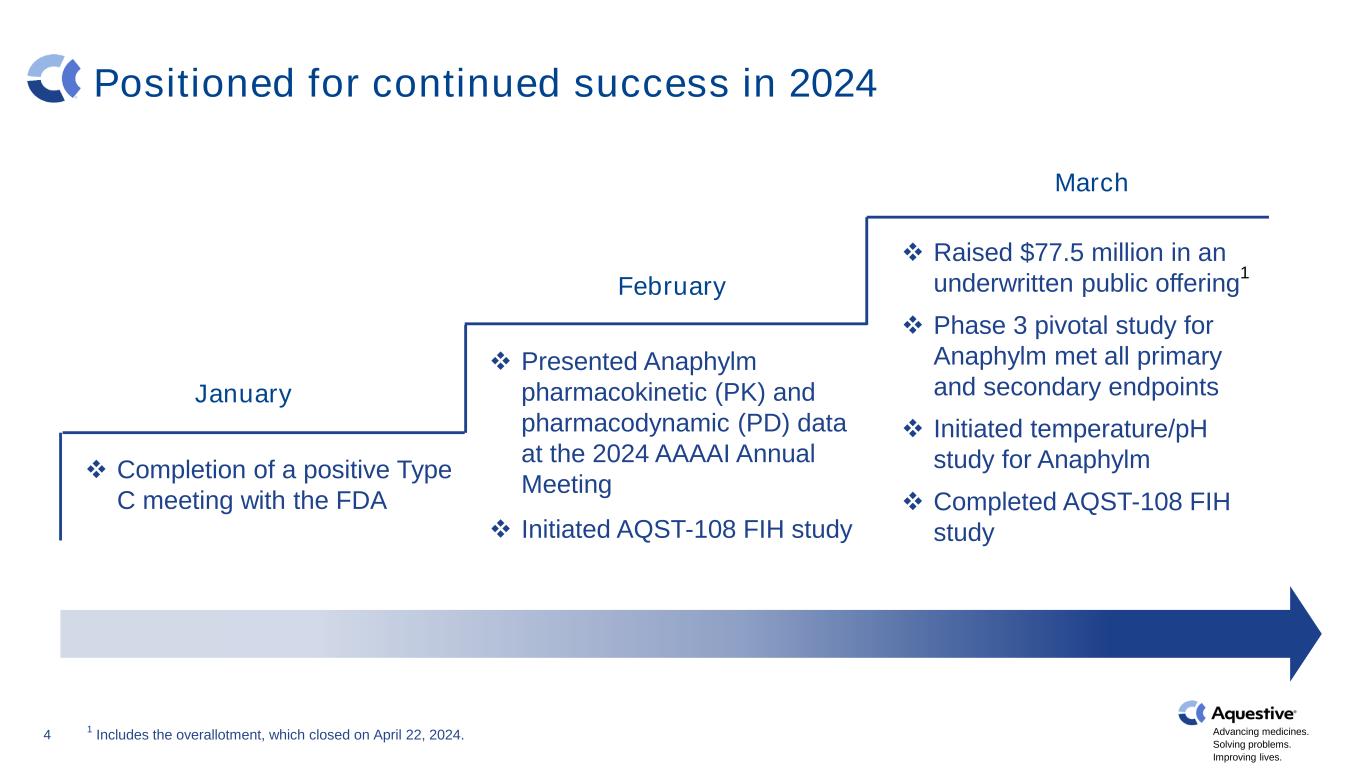
推进药品发展。解决问题。改善生活。4 有望在 2024 年继续取得成功 ❖ 完成与 FDA 的阳性 C 型会议 2 月 ❖ 在 2024 年 AAAAI 年会上提交了 Anaphylm 药代动力学 (PK) 和药效学 (PD) 数据 ❖ 1 月启动 AQST-108 FIH 研究 ❖ 通过承保公开发行筹集了 7,750 万美元 1 ❖ Anaphylm 的三期关键研究满足所有主要和次要终点 ❖ 启动的温度/pH 研究 Anaphylm ❖ 已于 3 月 1 日完成的 AQST-108 FIH 研究包括于 2024 年 4 月 22 日结束的总配股。

推进药品发展。解决问题。改善生活。Anaphylm 计划更新 5
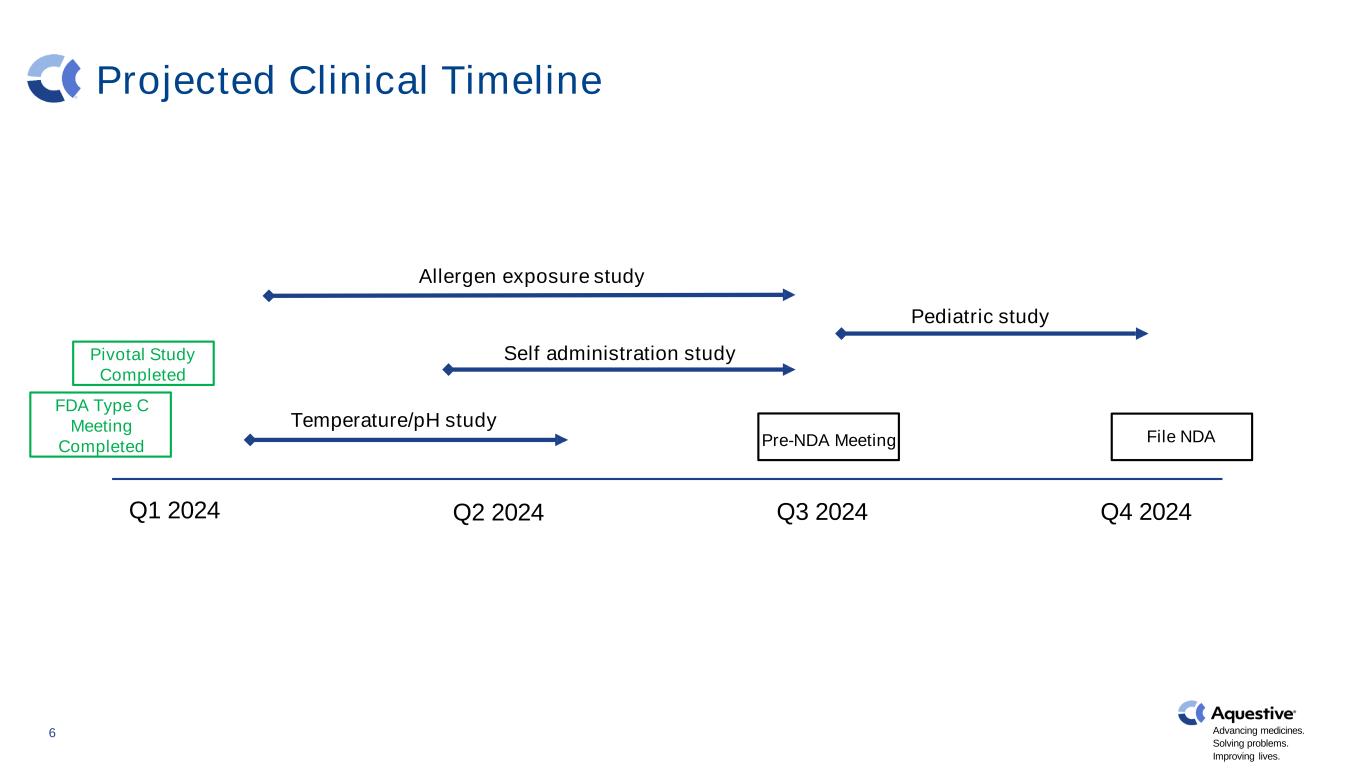
2024 年第 1 季度第 2 季度 2024 年第三季度温度/pH 值研究自我给药研究过敏原暴露研究儿科研究文件 ndaPre-NDA 会议 6 进步药物。解决问题。改善生活。关键研究已完成 FDA C 型会议已完成预计临床时间表
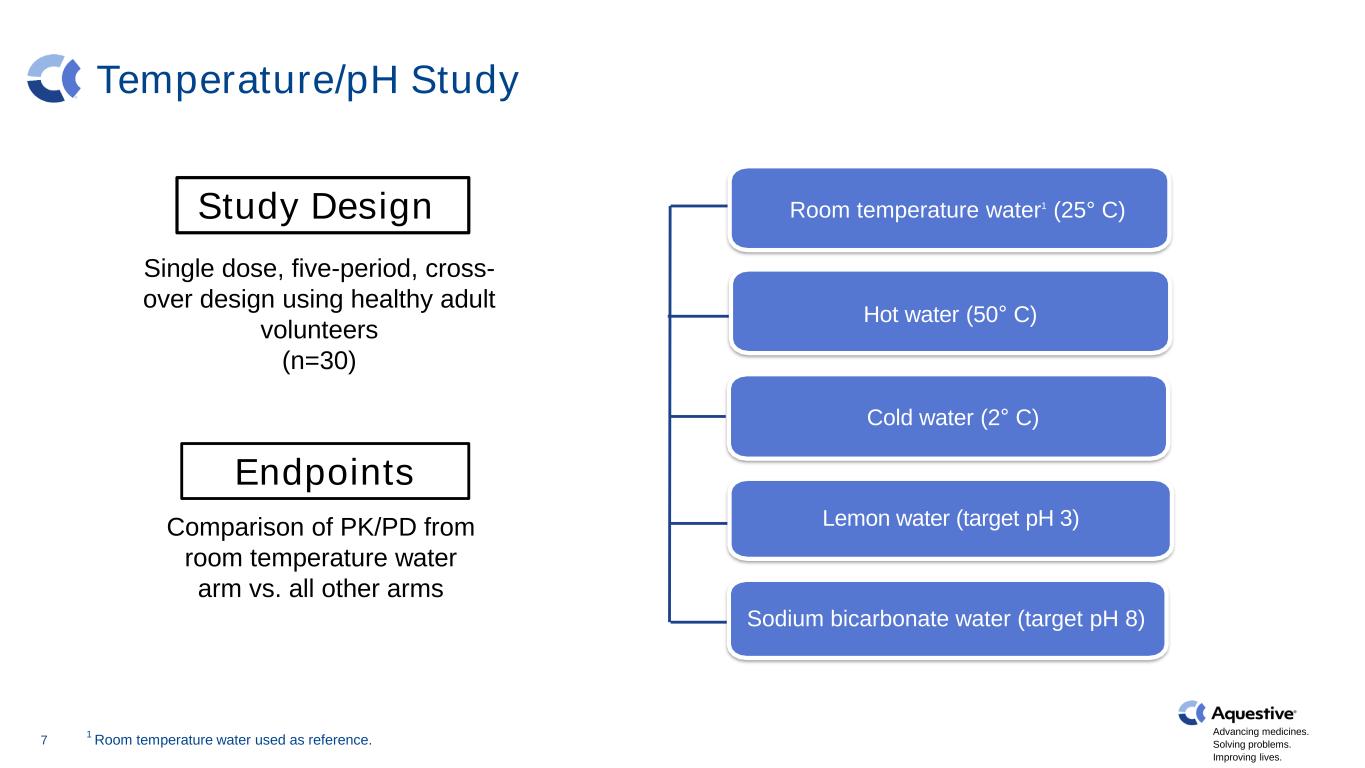
推进药品发展。解决问题。改善生活。温度/pH 研究热水(50° C)柠檬水(目标 pH 3)冷水(2° C)7 室温水1(25° C)碳酸氢钠水(目标 pH 8)研究设计 1 室温水用作参考。使用健康成年志愿者的单剂量、五周期、交叉设计(n=30)室温水臂的 PK/PD 与所有其他手臂的比较
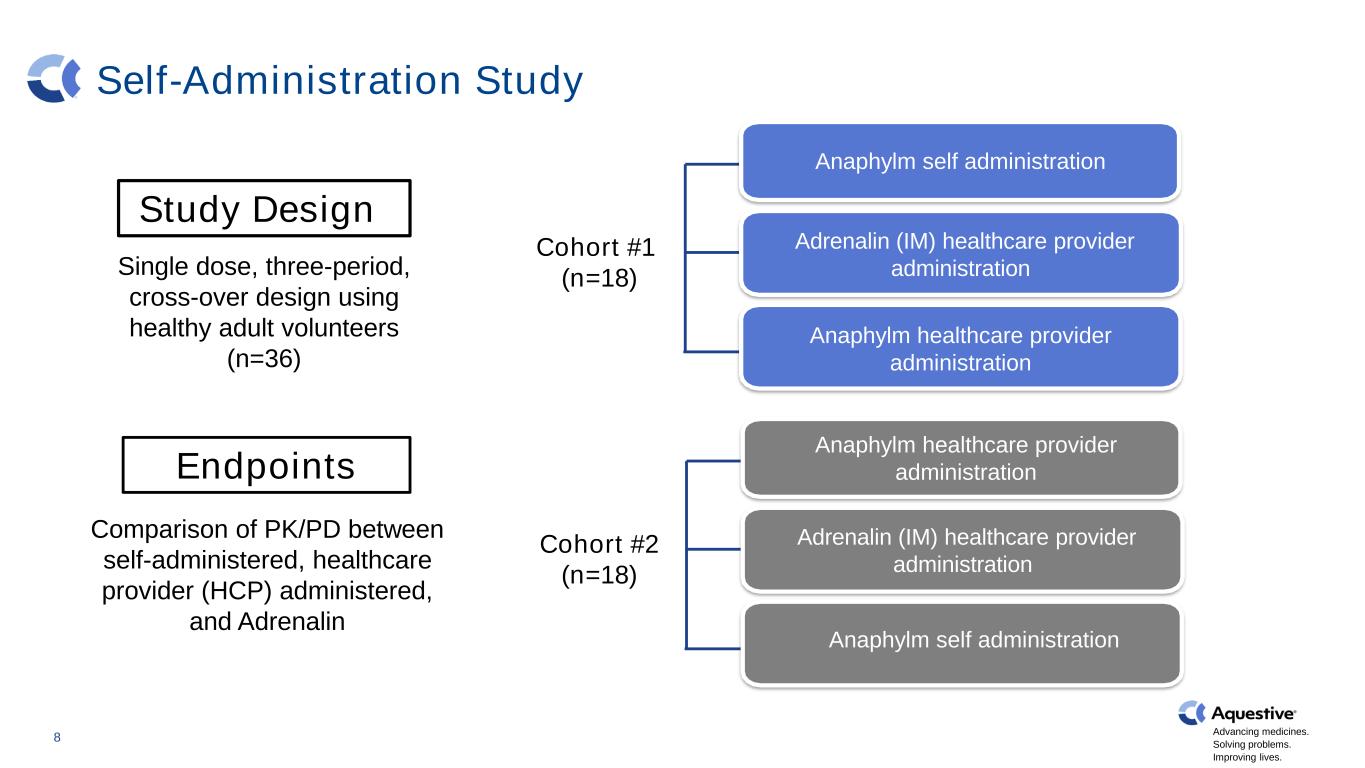
推进药品发展。解决问题。改善生活。自我管理研究健康志愿者 N=30 Adrenalin (IM) 医疗保健提供者管理 8 研究设计使用健康成人志愿者的单剂量、三周期、交叉设计 (n=36) 终点自我给药、医疗保健提供者 (HCP) 和肾上腺素 Anaphylm 自我给药肾上腺素 (IM) 医疗保健提供者管理 Anaphylm 自我给药队列 #1 (n=18) 队列 #2 (n=18) Anaphylm 医疗保健提供者管理

推进药品发展。解决问题。改善生活。过敏原暴露研究健康志愿者 N=30 (n=24) 肾上腺素 (IM) 无过敏原暴露 9 研究设计使用口服过敏原综合征 (“OAS”) 患者的单剂量、两周期、部分随机的交叉设计 (n=36) 终点过敏原暴露于肾上腺素肌肉注射 (IM) 后的 PK/PD 比较无过敏原暴露 Adrenalin (IM) 无过敏原暴露 Anaphylm 过敏原暴露后1 C hort #1 队列 #2 (n=12) 过敏原暴露后重复给药 Anaphylm 1 OAS 志愿者将面临暴露已知会触发的过敏原的挑战它们的反应(例如苹果、樱桃、芒果、哈密瓜、奇异果、芹菜、香蕉或胡萝卜)。
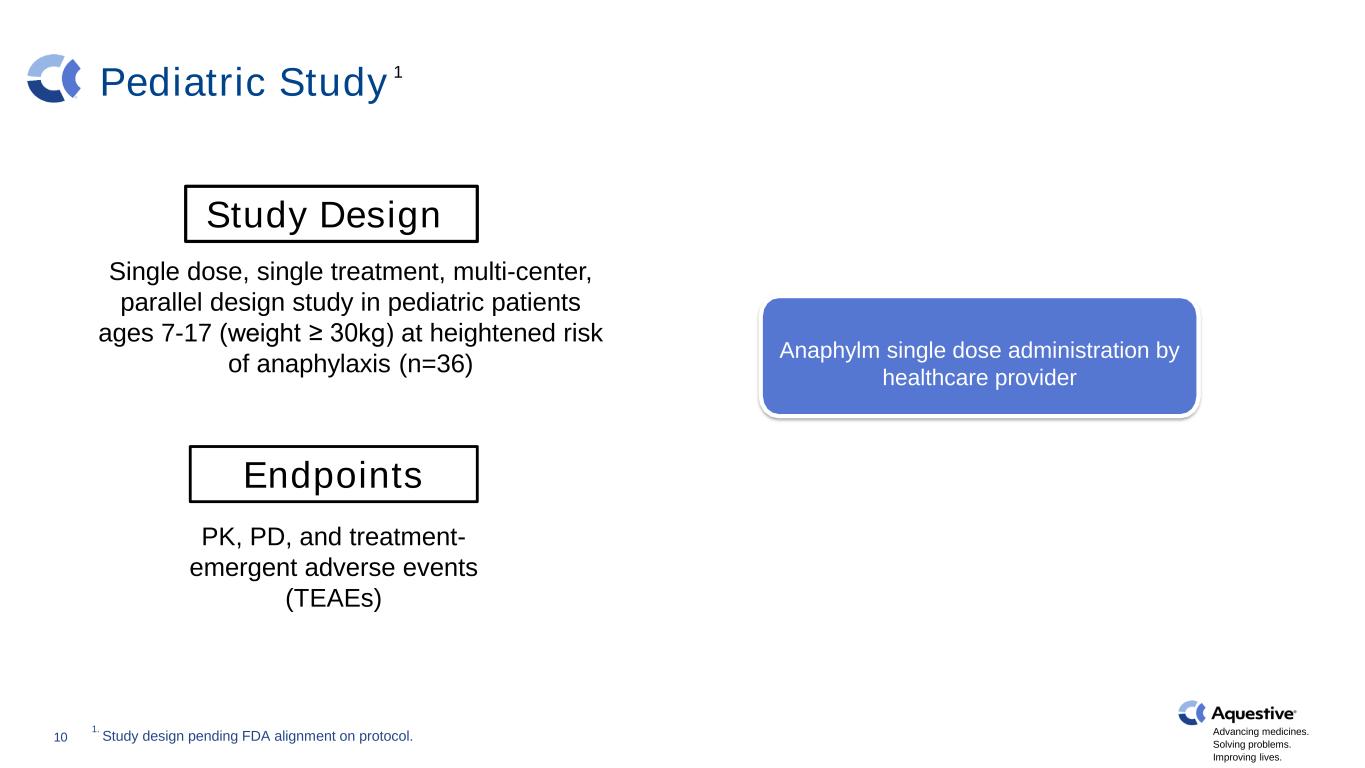
推进药品发展。解决问题。改善生活。儿科研究健康志愿者 N=30 10 研究设计单剂量、单一治疗、多中心、平行设计研究,针对过敏反应风险较高的7-17岁(体重≥30kg)的儿科患者(n=36)终点 PK、PD 和治疗-紧急不良事件(TEAEs)肾上腺素(IM)无过敏原暴露Anaphylm单剂量给药由医疗保健提供者1 1.研究设计尚待FDA对协议进行调整。

推进药品发展。解决问题。改善生活。财务业绩 11
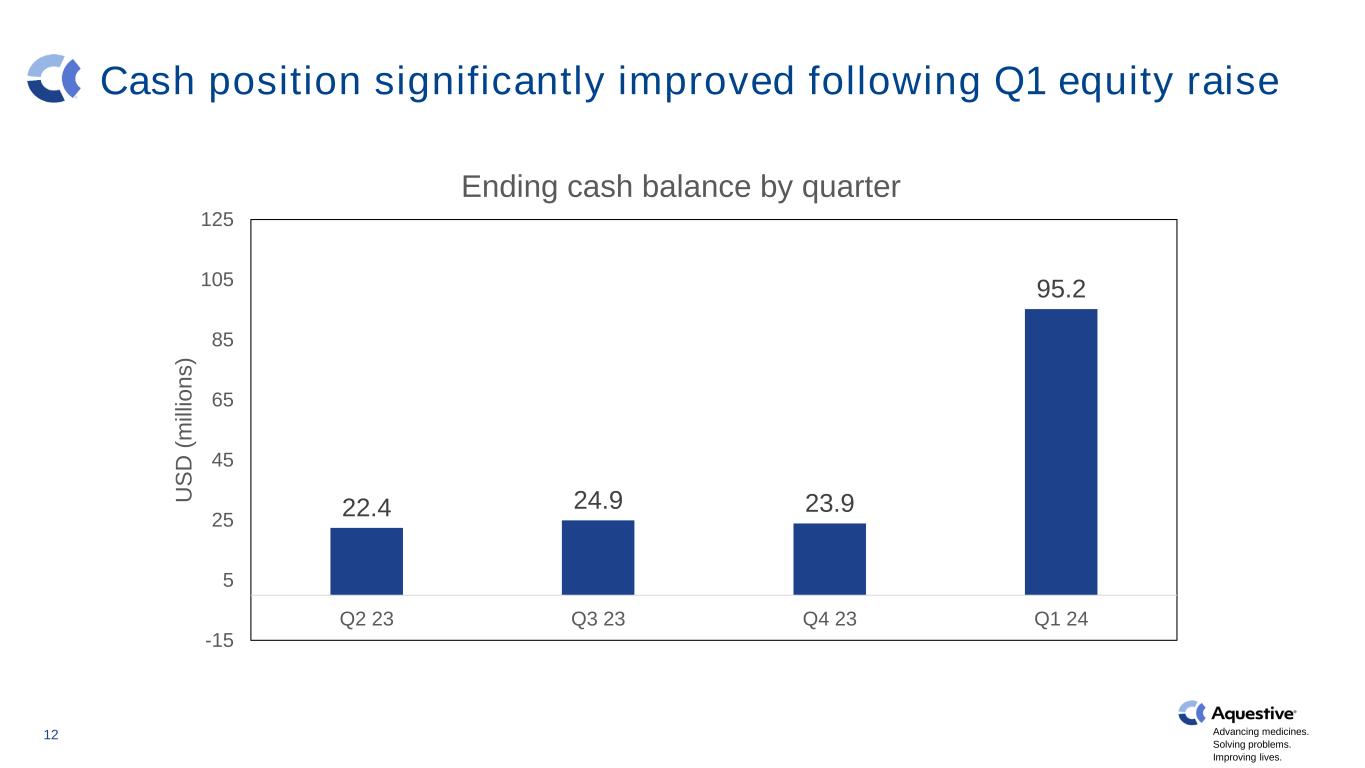
推进药品发展。解决问题。改善生活。在第一季度股权融资之后,现金状况显著改善 12 22.4 24.9 23.9 95.2 -15 5 25 45 65 85 105 125 23第三季度 23 Q4 23 Q4 23 Q1 23 Q2 24 US D(m ill io n s)按季度划分的期末现金余额
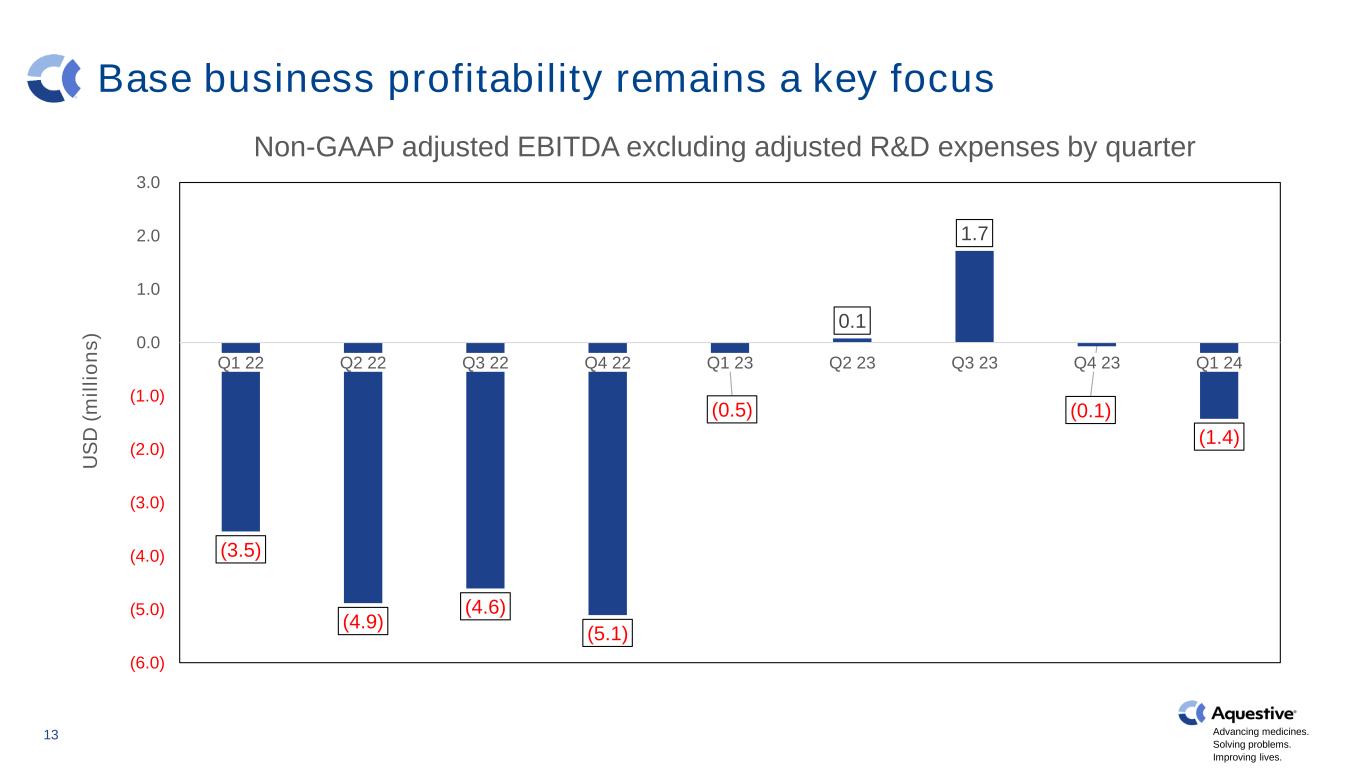
推进药品发展。解决问题。改善生活。基础业务盈利能力仍然是重点 13 (3.5) (4.9) (4.6) (5.1) (0.5) 0.1 1.7 (0.1) (1.4) (6.0) (5.0) (4.0) (2.0) (1.0) 0.0 1.0 2.0 3.0 22 第二季度 22 第二季度 22 Q4 23 Q3 23 Q4 23 Q4 24 US D (m il li o n s) 非公认会计准则调整后息税折旧摊销前利润不包括经调整的季度研发费用
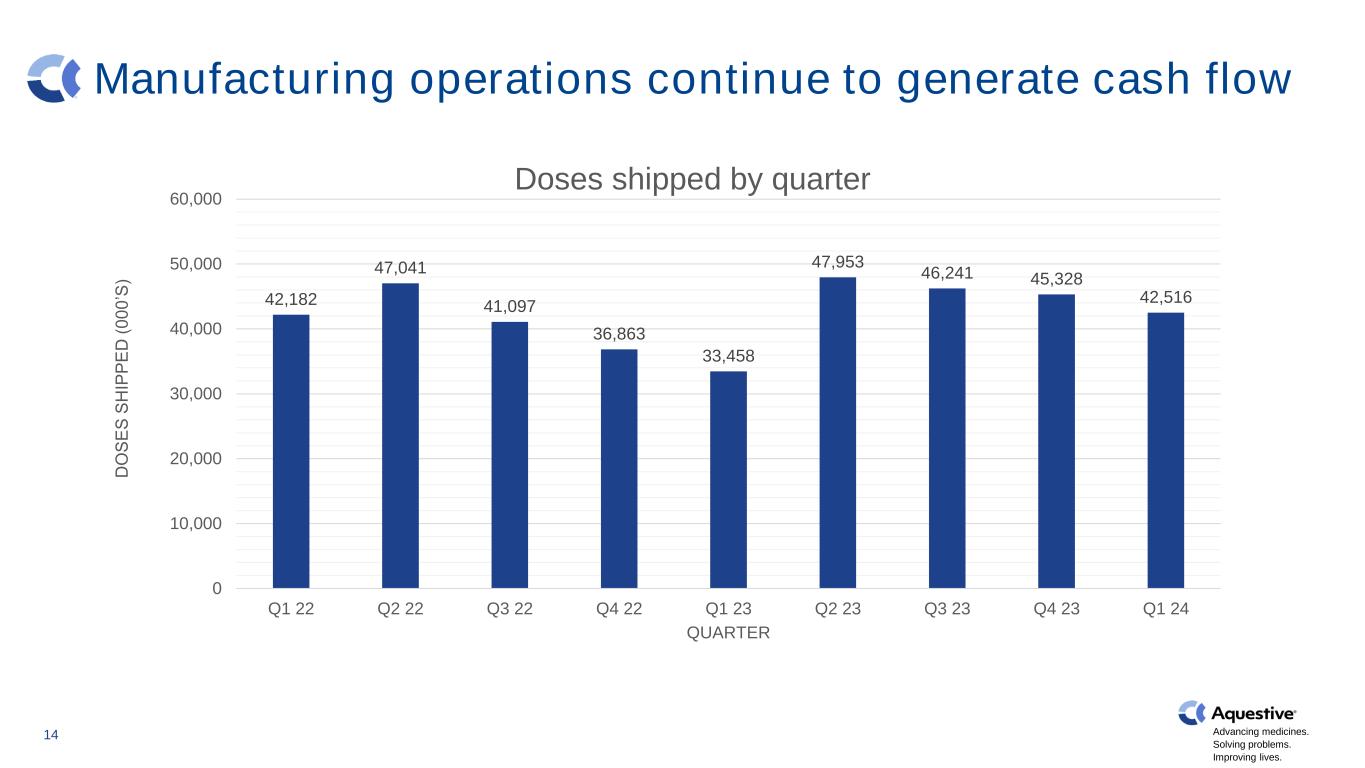
推进药品发展。解决问题。改善生活。制造业务继续产生现金流 14 42,182 47,041 41,097 36,863 33,458 47,453 46,241 45,328 42,516 0 10,000 30,000 000,000 60,000 000,000 000,000 000,000 第二季度 22 Q2 22 Q2 22 Q2 23 Q3 23 Q4 23 Q4 24 D O S E S H IP P E D (0 0 0'S) 第一季度出货量

推进药品发展。解决问题。改善生活。当前的2024年全年预期展望 • 总收入约为4,800万至5100万美元 • 非公认会计准则调整后的息税折旧摊销前利润亏损约为2,200万美元至2600万美元 15

推进药品发展。解决问题。改善生活。谢谢