目录
第 2 项。管理层对财务状况和经营业绩的讨论和分析。
以下讨论应与我们在本10-Q表季度报告中包含的未经审计的简明合并财务报表及其附注以及2023年10-K表中包含的截至2023年12月31日年度的经审计的合并财务报表及其附注一起阅读。本讨论包含前瞻性陈述,反映了我们当前的预期,涉及风险和不确定性。有关与这些陈述相关的不确定性、风险和假设的讨论,请参阅 “关于前瞻性陈述的说明”。由于重要因素和风险,包括但不限于下文 “风险因素” 和本文其他地方列出的因素和风险,以及2023年10-K表格第一部分第1A项中确定的因素和风险,我们的实际业绩和事件发生时间可能与前瞻性陈述所表达或暗示的结果和发生时间存在重大差异。
概述
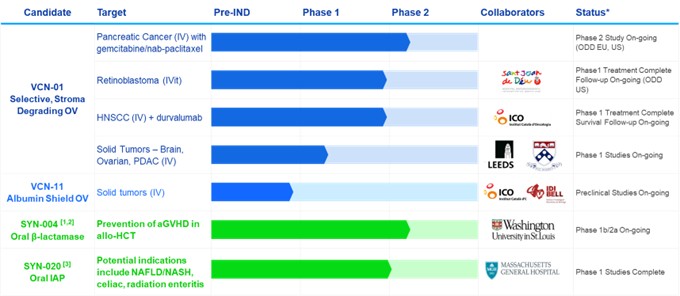
我们是一家处于临床阶段的多元化公司,正在开发旨在治疗未得到满足的高需求领域的癌症和相关疾病的疗法。由于2022年3月收购了Theriva Biologics, S.L.(“VCN”,前身为VCN Biosciences, S.L.),详情见下文(“收购”),我们通过开发专为静脉注射和玻璃体内注射触发而设计的新溶瘤腺病毒平台,开始将我们的战略重点转向肿瘤学,现在是我们的主要重点肿瘤细胞死亡,改善共同给药的癌症疗法获得肿瘤的机会,并促进患者免疫系统产生强大而持续的抗肿瘤反应。我们的主要候选产品 VCN-01 是一种临床阶段的溶瘤人类腺病毒,经过修饰后可表达一种酶 PH20 透明质酸酶,目前正在一项治疗胰腺癌的 2 期临床研究中接受评估,最近在治疗视网膜母细胞瘤的 1 期临床研究和实体瘤治疗的 1 期临床研究中用于治疗患者。此外,它还已在其他几种适应症中进行了测试,包括一项治疗头颈部鳞状细胞癌的1期临床研究。
在收购之前,我们的重点是开发旨在治疗胃肠道(GI)疾病的疗法,其中包括我们的临床开发候选药物:(1)SYN-004(ribaxamase),它旨在降解胃肠道内某些常用的静脉(IV)β-内酰胺抗生素,以防止微生物组损伤,从而防止病原生物的过度生长和感染,例如 艰难梭菌感染 (CDI) 和耐万古霉素肠球菌 (VRE),降低异基因造血细胞移植 (HCT) 接受者急性移植物抗宿主病 (AgvHD) 的发病率和严重程度,以及 (2) SYN-020,一种在 cGMP 条件下产生的肠道碱性磷酸酶 (IAP) 酶的重组口服制剂,旨在治疗局部胃肠道和全身性胃肠道疾病。作为我们向专注于肿瘤学的公司的战略转型的一部分,我们正在探索 SYN-004 和 SYN-020 资产的价值创造选项,包括外包许可或合作。
我们目前的产品管道
23